Державний заклад «Дніпропетровська медична академія
Міністерства охорони здоров’я України»
Державна установа «Інститут дерматології та венерології
Національної академії медичних наук України»
Кваліфікаційна наукова
праця на правах рукопису
СТАРОСТІНА ОЛЬГА АНАТОЛІЇВНА
УДК616.53–002–085:611.1:576.31
ДИСЕРТАЦІЯ
КОМПЛЕКСНА ТЕРАПІЯ ЖІНОК, ХВОРИХ НА РОЗАЦЕА
З УРАХУВАННЯМ ПАТОМОРФОЛОГІЧНИХ ОСОБЛИВОСТЕЙ
ТА СТАНУ СУДИННОГО РУСЛА
14.01.20 – шкірні та венеричні хвороби
Подається на здобуття наукового ступеня кандидата медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
______________________________________ О.А.Старостіна
(підпис, ініціали та прізвище здобувача)
Науковий керівник: Святенко Тетяна Вікторівна, доктор медичних наук, професор
Дніпро – 2018
АНОТАЦІЯ
Старостіна О.А. Комплексна терапія жінок, хворих на розацеа, з урахуванням патоморфологічних особливостей та стану судинного русла. – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 «Шкірні та венеричні хвороби». – Державний заклад «Дніпропетровська медична академія МОЗ України», Дніпро, 2018, Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2018.
Наукова робота присвячена підвищенню ефективності комплексної диференційованої терапії жінок, хворих на розацеа, шляхом дослідження особливостей механізму розвитку, клініко-морфологічних проявів та стану судинного русла дерматозу в динаміці лікування із застосуванням засобів та методик, що нормалізують рівень фактора судинного росту ендотелію та стан судин.
Питання ефективності лікування і реабілітації хворих на розацеа залишаються відкритими як на Україні, так і в багатьох зарубіжних країнах. Інтерес до цієї проблеми зумовлений як високою розповсюдженістю розацеа серед осіб працездатного віку, хронічним персистуючим перебігом захворювання з формуванням стійких косметичних дефектів на шкірі обличчя, що збільшує частоту психосоматичних розладів, пов’язаних із захворюванням, та знижує якість життя, так і відсутністю чіткого уявлення щодо етіології, патогенезу, тригерних факторів розвитку дерматозу у жінок, а також недостатньою ефективністю методів терапії без врахування індивідуальних імуно-морфофункціональних особливостей шкіри хворих та стану судин голови та шиї. У зв’язку з цим актуалізується питання про розкриття патогенетичних механізмів, які формують різноманіття клінічних проявів судинних форм розацеа у жінок, для індивідуалізації терапевтичних і реабілітаційних підходів щодо кожної клінічної форми захворювання та вивчення мікроскопічних змін у шкірі при різних морфологічних проявах.
Під спостереженням знаходились 100 хворих на розацеа жінок, у віці від 21 до 65 років, з них 50 пацієнток – з еритематозно-телеангіектатичною формою розацеа, 50 – з папуло-пустульозною формою розацеа. Встановлено, що характерними рисами розвитку і перебігу судинних форм розацеа у жінок є: дебют захворювання у молодому віці (до 45 років – 82 %), тривалий перебіг (5 років і більше – 62 %), обтяжливий сімейний анамнез (21 %), раптові прояви захворювання (31 %), загострення захворювання під дією тригерних факторів (надмірна інсоляція – 67 %, прийом гарячої або гострої їжі – 78 %, вживання алкоголю – 89 %, стрес або зміна температурного режиму – 42 %, робота за комп’ютером понад 3 годин – 42 %, використання косметичних засобів або процедур – 33 %), ІІ фототип шкіри (76 %), супутня патологія (84 %) з ураженням кількох систем організму (66 %), середній та важкий ступінь перебігу хвороби (76 %), здебільшого асоційований з папуло-пустульозною формою розацеа (94 %), погіршення якості життя ([20,12 ± 0,47] бала за шкалою ДІЯЖ), посилення тривожних і депресивних тенденцій (за шкалою HADS – [9,53 ± 0,27] бала), відсутність ефекту від лікування (37 %).
За даними патоморфологічного дослідження змін шкіри на різних стадіях перебігу розацеа встановлено, що загальним компонентом ранніх проявів захворювання є: великі телеангіектазії в сосочковому шарі дерми і верхній частині сітчастої дерми., набряк сосочкового шару дерми, периваскулярні інфільтрати, сонячний еластоз, відсутність змін в епідермально-дермальному з’єднанні, можлива наявність Demodex у волосяних цибулинах. Для тривалих, старих ушкоджень шкіри характерно: хронічне запалення, що має перифолікулярний та перипілярний характер, з частими ознаками гранулематозного запалення, наявністю кліща Demodex або його еозинофільних залишків, присутність ретенційних елементів, сонячний еластоз, гіперплазія сальних залоз без ушкодження їх будови.
На підставі імуногістохімічного дослідження встановлено суттєве підвищення експресії рецепторів до фактора росту ендотелію (VEGF), СD 34+ – маркеру ендотелию, рецепторів до естрогенів/андрогенів (AR, ER) у біоптатах шкіри хворих на розацеа порівняно зі здоровою шкірою (від p<0,05 до p<0,001), що дозволило розробити алгоритм прогнозування прогредієнтного перебігу розацеа у жінок для вибору адекватного терапевтичного впливу на всі ланки патогенезу.
Проведене доплерографічне дослідження стану судин голови та шиї у жінок з розацеа показало наявність дефіциту кровотоку по V4 сегменту хребцевих артерій в абсолютній більшості випадків (94,7 %), що дозволяє зробити висновок про значний вплив на перебіг розацеа супутньої патології судин голови та шиї.
Розроблено комплексну патогенетично обґрунтовану терапію хворих на різні клінічні форми розацеа з використанням засобів, які впливають на різні ланки патозенезу розацеа, і поєднаного застосування IPL терапії для досягнення вираженого клінічного ефекту та подовження періоду ремісії захворювання. Запропонований метод забезпечує підвищення ефективності терапії (повне клінічне одужання зі стійкою ремісією у 84 % хворих на еритематозно-телеангіектатичну і у 72 % хворих на папуло-пустульозну форму розацеа), вірогідне зменшення проявів тривоги і депресії (зменшення середнього бала за шкалою HADS на 40,5 % і 19,0 %), покращення показника якості життя на 68,8 % і на 39 % (р<0,001), що на 60 % (р<0,001) і 44 %(р<0,05) перевищує клінічні результати, отримані при застосуванні традиційних методів терапії (клінічне одужання у 24 % і 28 %).
Матеріали дисертаційної роботи можуть використовуватися у клінічній практиці лікарів-дерматологів спеціалізованих медичних установ та навчальних закладів.
Ключові слова: розацеа, IPL, доплерографія, імуногістохімія, VEGF, COX-2, лікування.
SUMMARY
Starostina O.A. Complex therapy of women patients with rosacea, taking into account pathomorphological features and the state of the vascular bed. – The manuscript.
The dissertation for the Scientific Degree of Candidate of Medical Sciences by specialty 14.01.20 “Skin and venereal diseases”. – State Establishment «Institute of Dermatology and Venereology of NAMS of Ukraine», Kharkiv, 2018.
The scientific work is devoted to improving the efficiency of complex differential treatment in women with vascular form of rosacea, through the study of peculiarities of the development of clinical and morphological manifestations and the state of the vascular bed dermatosis in the dynamics of treatment with the means and methods of normalizing the level of factor vascular endothelial growth and status blood vessels.
Questions of the effectiveness of treatment and rehabilitation of patients with rosacea remain open both in Ukraine and in many foreign countries. Interest in this issue is caused by a high prevalence of rosacea among people of working age, chronic persistent disease course with the formation of stable cosmetic defects on the face, increasing the frequency of psychosomatic disorders associated with the disease and reduces quality of life and lack of clear vision about etiology, pathogenesis, trigger factors in the development of dermatoses in women, as well as inadequate efficacy of therapies without taking into account individual immuno-morphofunctional especially Tay skin condition of patients and vessels of the head and neck. In this regard actualized the issue of disclosure of the pathogenic mechanisms that shape the diversity of clinical manifestations of vascular forms of rosacea in women for the individualization of therapeutic and rehabilitation approaches for each clinical form of the disease and the study of microscopic changes in skin under different morphological forms.
Under supervision, there were 100 patients with rosacea in women aged 21 to 65, of which 50 patients with erythematous-telangiectastic form of rosacea, 50 with papulo-pustular form of rosacea. It has been established that the characteristic features of the development and course of vascular forms of rosacea in women are: the debut of the disease in young age (up to 45 years old – 82 %), long course (5 years and more – 62 %), burdensome family history (21 %), sudden manifestations of the disease (31 %), exacerbation of the disease under the influence of trigger factors (excessive insolation – 67 %, hot or spit food consumption – 78 %, alcohol consumption – 89 %, stress or temperature change – 42 %, computer work above 3 hours – 42 %, use of cosmetics or procedures – 33 %), II skin phototype (7 6 %), concomitant pathology (84 %) with several systems of the body (66 %), moderate and severe disease (76 %), mostly associated with papulopustulosic rosacea (94 %), poor quality of life ([20.12 ± 0.47] points on the scale of the MEDIA), increased anxiety and depressive tendencies (on the scale of HADS – (9.53 ± 0.27) points), no effect of treatment (37 %).
According to the pathomorphological study of changes in the skin at different stages of the rosacea, it has been established that the general component of the early manifestations of the disease are: large telangiectasia in the areas of superficial and intermediate dermis, edema of the surface dermis, perivascular infiltration, sunny elastosis, lack of changes in the epidermal-dermal connection, Demodex may be present in hair follicles. For long, old typical skin lesions, chronic inflammation, which has perifollicular and peripylic character, with frequent signs of granulomatous inflammation, the presence of Demodex mites or eosinophilic residues presence of retention elements, solar elastosis, hyperplasia of the sebaceous glands without damaging their structure.
Based on immunohistochemical study found a significant increase in the expression of receptors endothelial growth factor (VEGF), CD34+- marker endotelium receptors estrogen / androgen (AR, ER) in skin biopsies of patients with rosacea compared with healthy skin (from p <0.05 to p <0.001), which made it possible to develop an algorithm for predicting the progressive flow of rosacea in women to select an adequate therapeutic effect on all pathogenesis pathways.
A study of ultrasonic doppler study of head and neck vessels in women with rosacea deficit showed the presence of blood flow in V4 segment vertebral artery in most cases (94.7 %), which suggests a significant influence on the course of rosacea comorbidity vessels of the head and neck.
The complex pathogenetically grounded treatment of patients with various clinical forms of rosacea using means that affect different parts of the pathogenic rosacea and combined use of IPL therapy to achieve a clear clinical effect due to the effect on the vascular component of the pathogenesis of rosacea, which allows an extended period of remission of the disease, has been developed. The proposed method provides an increase in the effectiveness of therapy (a complete clinical recovery with a stable remission in 84 % of patients with erythematous and telangiectastic and 72 % of patients with papulo-pustular form of rosacea), a possible decrease in the manifestations of anxiety and depression (a decrease in the mean score of 40 on the HADS scale, 5 % and 19.0 %), improvement of the quality of life indicator by 68.8 % and 39 % (p <0.001), which is 60 % (p <0.001) and 44 % (p <0.05) exceeds the clinical results , obtained with the application of traditional therapies (clinical recovery in 24 % and 28 %).
Materials of the dissertation work can be used in the clinical practice of dermatologists of specialized medical institutions and educational institutions.
Key words: rosacea, IPL, dopplerography, immunohistochemistry, VEGF, COX-2, treatment.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Старостіна О. А. Клінічні прояви інфікування Demodex folliculorum на тлі запалення різної інтенсивності та гіперплазії сальних залоз у пацієнток різного віку із судинними формами розацеа. Дерматологія та венерологія. 2018. № 1 (79). С. 76–79.
- Старостіна О. А. Визначення середніх значень кількості, периметру, площі CD34-позитивних судин та оцінка експресії VEGF в біоптатах шкіри пацієнтів з судинними формами розацеа. Медичні перспективи. 2018. № 2 (2) С. 67–70.
- Морфологічні критерії перебігу судинних форм розацеа / О. А. Старостина, Т. В. Святенко, І. С. Шпонька, О. В. Пославська. Морфологія. 2017. № 11 (2) С. 40–45. (Здобувачем особисто сформульовано мету та завдання дослідження, проведено аналіз даних та їх узагальнення).
- Святенко Т. В., Чеверда О. А., Старостина О. А. IPL-терапия в лечении сосудистых форм розацеа и других дерматозов: безопасность и эффективность (собственные наблюдения). Журнал дерматовенерології та косметології імені М.О. Торсуєва. 2017. № 2 (38). С. 112–117. (Здобувачем особисто проведено лікування хворих, проаналізовані отримані результати).
- Старостина О. А. Результаты допплерографического исследования сосудов головы и шеи у больных розацеа женщин. Experimental and Clinical Medicine. 2018, Vol. 3. P 67–70.
- Calculation of the average density indices of androgen and estrogen receptors and evaluation of expression of COX-2 in skin biopsies of patients with vascular forms of rosacea / O. A. Starostina, Т. V. Svyatenko, I. S. Shponka, O. V. Poslavska. Experimental and Clinical Medicine. 2018, Vol. 1. P 33–40. (Здобувачем особисто сформульовано мету та завдання дослідження, проведено аналіз даних та їх узагальнення).
- Святенко Т. В, Старостина О. А. Новые возможности IPL-терапии в комплексном лечении сосудистых форм розацеа. Медицинские новости Грузии. 2015. № 6 (243). С. 62. (Здобувачем особисто проведено аналіз літературних даних, проведено лікування хворих, проаналізовані отримані результати, підготовлено матеріал до друку).
- Старостина О. А. Розацеа в сочетании с хроническими дерматозами (собственные наблюдения). Международный научно-практический журнал «Дерматовенерология. Косметология» 2015. №1(01). С. 72–77.
- Пат. на корисну модель № 124614 UA, МПК G01N21/00, G01N33/00, A61B10/00. Спосіб прогнозування перебігу розацеа у жінок / О.А. Старостіна, Т.В. Святенко, І.С. Шпонька, О.В. Пославська. № u201712471; заявл. 15.12.17; опубл. 10.04.18, Бюл. № 7.
- Старостіна О. А. Применение IPL-терапии в комплексном лечении сосудистых форм розацеа: Безопасность и эффективность (собственные наблюдения). Програма та матеріали Регіональної науково-практичної конференції «Святогорські дерматовенерологичні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом». 2016. С. 34.
- Святенко Т. В., Андриуца Л. А., Старостина О. А. Комбинированная терапия розацеа в условиях лечебно-косметологического центра. Збірник робіт за матеріалами науково-практичної школи «Молоді науковці-майбутнє української дерматовенерології». 2014. С. 61. (Дисертанту належить ідея дослідження, проведено збір та узагальнення матеріалу, підготовлено тези до друку).
- Старостина О.А. Сочетание розацеа с хроническими дерматозами, локализованными на лице. Збірник тез ІХ Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання косметології та дерматології». 2015. С. 33.
- Інформаційний лист про впровадження у системі охорони здоров’я «Спосіб лікування судинних форм розацеа» / Т. В. Святенко, О. А. Старостіна, Дніпропетровська медична академія МОЗ України. К., 2017. 4 с.
ЗМІСТ
| Перелік умовних позначень …………………………………………..……… | 12 |
| Вступ ………………………………………………………………………….. | 13 |
| Розділ 1 Огляд літератури ……………………………………………………… | 20 |
| 1.1 Аспекти етіології та патогенезу розацеа…………………………… | 20 |
| 1.2 Клінічні прояви та сучасні класифікації розацеа …………………. | 23 |
| 1.3 Патогістологічні зміни при розацеа………………………………… | 25 |
| 1.4 Судинні зміни при розацеа …………………………………………. | 26 |
| 1.5 Сучасні терапевтичні підходи до лікування розацеа …………….. | 28 |
| Розділ 2 Матеріали та методи дослідження ……………………………… | 39 |
| 2.1 Загальна характеристика пацієнтів ………………………………… | 39 |
| 2.1.1 Визначення ступеня тяжкості захворювання за шкалою діагностичної оцінки розацеа……………………………………. | 42 |
| 2.2 Неінвазивні методи дослідження…………………………………. | 42 |
| 2.2.1 Дослідження осередків ураження методом дерматоскопії .….… | 42 |
| 2.2.2 Дослідження судин голови та шиї методом доплерографії……… | 43 |
| 2.3 Інвазивні методи дослідження………………………………………. | 44 |
| 2.3.1 Морфологічний метод дослідження ….…………………………… | 44 |
| 2.3.2 Імуногістохімічний метод дослідження …………………………. | 44 |
| 2.4 Методи анкетування…………………………………………………. | 47 |
| 2.4.1 Дослідження дерматологічного індексу якості життя ………….. | 47 |
| 2.4.2 Діагностика тривожних та депресивних станів ………………… | 48 |
| 2.5 Статистичні методи дослідження …………………………………. | 49 |
| Розділ 3 Клініко-анамнестичні особливості проявів дерматозу та якість життя…………………………………………………….. |
51 |
| 3.1 Клініко-анамнестичні особливості проявів розацеа у жінок……. | 51 |
| 3.2 Результати оцінки ступеня тяжкості розацеа у хворих……………. | 59 |
| 3.3 Результати дерматоскопічного дослідження морфологічних змін у шкірі хворих на розацеа………… | 60 |
| 3.4 Результати доплерографічного дослідження судин шиї та голови хворих на розацеа…………… | 62 |
| 3.5 Оцінка ступеня вираженості депресивної та тривожної симптоматики за даними скринінга у хворих на розацеа | 65 |
| 3.6 Дослідження дерматологічного індексу якості життя хворих на розацеа…………………………………………………………… | 67 |
| Розділ 4 патоморфологічна та імуногістохімічна характеристика біоптатів шкіри пацієнтів з розацеа…………………… | 69 |
| 4.1 Патоморфологічне дослідження шкіри на різних стадіях перебігу еритематозно-телеангіектатичної форми розацеа…………………. | 69 |
| 4.2 Імуногістохімічна характеристика рівнів експресії маркеру ендотелію судин CD34, фактора росту ендотелію судин (VEGF), рецепторів андрогенів/естрогенів AR/ER та циклооксигенази-2 в біоптатах шкіри пацієнтів з еритематозно-телеангіектатичною формою розацеа | 82 |
| 4.3 Результати співставлення даних морфологічних та імуногістохімічних методів дослідження з даними дерматоскопічної картини розацеа ……………………….………. | 103 |
| 4.4 Прогнозування перебігу розацеа у жінок………………………….. | 105 |
| Розділ 5 Порівняльна оцінка ефективності різних методик лікування розацеа………………………………………………… | 113 |
| Розділ 6 Аналіз та обговорення результатів ………………………………. | 125 |
| Висновки ……………………………………………………………….…….. | 140 |
| Рекомендації ………………………………………………..……………….. | 143 |
| Список використаних джерел ………………………………………………. | 145 |
| Додаток А Шкала діагностичної оцінки розацеа (ШДОР)……………….. | 166 |
| Додаток Б Дерматологічний індекс якості життя (ДІЯЖ) ………………… | 166 |
| Додаток В Госпітальна шкала тривоги та депресії (HADS)…..………… | 168 |
| Додаток Г Акти впровадження ………………………………………….….. | 170 |
| Додаток Д Список публікацій здобувача за темою дисертації та відомості про апробацію результатів дисертації…………………………… |
180 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
| ДАБ | – | 3-діамінобензидин тетрахлориду |
| ДІЯЖ | – | дерматологічний індекс якості життя |
| ЕТР | – | еритематозно-телеангіектатична форма розацеа |
| ЗСА | – | загальна сонна артерія |
| ІГХ | – | імуногістохімія |
| ППР | – | папуло-пустульозна форма розацеа |
| TLR2 | – | тол-подібний рецептор 2 |
| ХА | – | хребцева артерія |
| ШДОР | – | шкала діагностичної оцінки розацеа |
| ШКТ | – | шлунково-кишковий тракт |
| AR/ER | – | Рецептори до андрогенів/естрогенів |
| COX-2 | – | Циклооксигеназа-2 |
| C3 | – | 3-й шийний хребець |
| C4 | – | 4-й шийний хребець |
| С5 | – | 5-й шийний хребець |
| С6 | – | 6-й шийний хребець |
| IPL | – | Intense Pulsed Light – широкополосне імпульсне світлове опромінення |
| VEGF | – | фактор росту ендотелію судин |
ВСТУП
Актуальність теми. Незважаючи на різноманітність існуючих методик терапії розацеа, з використанням знань про його патогенез та етіологію, питання ефективності лікування цього патологічного стану залишаються відкритими як в Україні, так і в багатьох зарубіжних країнах [173]. Інтерес до проблеми лікування та реабілітації хворих на розацеа останнім часом помітно посилився, що зумовлено не тільки зростанням захворюваності серед осіб працездатного віку, але і підвищенням вимог до зовнішнього виду, як фактору, який грає важливу роль в особистому і професійному успіху в соціумі [103]. У результаті хронічного персистуючого перебігу запального процесу на шкірі обличчя формуються стійкі дефекти, що спотворюють зовнішність і є толерантними до більшості методів зовнішньої терапії та косметичної корекції [102, 138]. Косметичні проблеми значною мірою впливають на соціально-психологічні, міжособистісні стосунки у більшості пацієнтів, нерідко викликаючи тривогу, депресію, зниження якості життя, що робить проблему актуальною і важливою не тільки у медичному, але й у соціальному аспекті.
Незважаючи на те, що тривають дослідження, до теперішнього часу немає єдиної думки щодо концепції патогенезу розацеа [56].
Виникнення та загострення розацеа пов’язують з дією низки тригерних чинників: захворюваннями шлунково-кишкового тракту (ШКТ), жовчовивідних шляхів, гормональними дисфункціями, гіперфункцією та гіперплазією сальних залоз, зміною хімізму шкірного сала, імунологічними, біохімічними зрушеннями та іншими причинами [68, 97]. Але до теперішнього часу не вивчалися особливості тригерних факторів, перебігу та лікування розацеа у жінок. На сьогодні існує велика кількість класифікацій, заснованих на оцінці клінічної картини захворювання, в яких не відбито принцип зіставлення клінічної картини та імуноморфологічної характеристики висипань при розацеа у жінок. Лікування розацеа, здебільшого, зводиться до зовнішньої терапії. У більшості випадків препарати зовнішнього лікування призначають довготерміново та безперервно, що призводить до розвитку відповідних реакцій подразнення, які спричиняють посилення неприємних відчуттів у хворого, а також посилюють косметичні дефекти, які супроводжують це захворювання, і позитивний ефект суттєво зменшується [145].
Крім того, більшість схем лікування розацеа не враховують індивідуальні імуно-морфофункціональні особливості шкіри хворих, стан судин шиї та голови, і, з різних причин, не здатні впливати на всі механізми розвитку, наслідком чого є рецидиви захворювання в різний термін після лікування [61].
У зв’язку з цим актуалізується питання про розкриття патогенетичних механізмів, які формують різноманіття клінічних проявів розацеа у жінок, для індивідуалізації терапевтичних і реабілітаційних підходів щодо кожної клінічної форми захворювання та вивчення мікроскопічних змін у шкірі при різних морфологічних проявах [57].
З аналізу патентної та науково-технічної літератури, а також досвіду роботи місцевих медичних установ витікає, що однією з проблем підвищення клінічної ефективності лікування розацеа є відсутність об’єктивних даних про механізми розвитку захворювання у жінок. Клінічні особливості захворювання, патологічна картина, частота виявлення різної мікробної, паразитарної та грибкової флори в осередках ураження шкіри, вимагають на сучасному етапі додаткових знань.
Таким чином, актуальність цієї проблеми визначає мету та завдання дослідження.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота є частиною планової науково-дослідної роботи кафедри шкірних та венеричних хвороб ДЗ «Дніпропетровська медична академія Міністерства охорони здоров’я України»: «Таргетна терапія хворих на дерматози та інфекції, що передаються статевим шляхом, в умовах коморбідності» (№ держреєстрації 0114U000931).
Дисертантом виконано фрагмент, присвячений вивченню патоморфологічних та імуногістохімічних особливостей розвитку розацеа, удосконаленню діагностичних критеріїв захворювання, а також розробці і апробації комплексного методу лікування з урахуванням патоморфологічних особливостей та стану судинного русла при розацеа.
Мета та задачі дослідження. Мета дослідження – підвищення ефективності лікування хворих на розацеа жінок, шляхом розробки комплексної диференційованої терапії на підставі дослідження особливостей механізму розвитку розацеа, клініко-морфологічних проявів та стану судинного русла із застосуванням засобів та методик, що нормалізують рівень фактора судинного росту ендотелію та стан судин.
Для досягнення поставленої мети були поставлені наступні задачі:
1. Дослідити клініко-анамнестичні особливості проявів і перебігу розацеа у жінок та їх зв’язок із психосоматичним статусом і якістю життя хворих.
2. Визначити патоморфологічні характеристики шкіри при еритематозно-телеангіектатичній формі розацеа (ЕТР).
3. Дослідити зміни імуногістохімічних маркерів при розацеа (експресія VEGF, СD34, AR/ER, COX-2) залежно від клінічної картини захворювання та індивідуальних особливостей хворих та розробити алгоритм прогнозування прогредієнтного перебігу розацеа у жінок.
4. Оцінити стан кровотоку судин шиї і голови у хворих на розацеа жінок при різних клінічних формах захворювання.
5. Обґрунтувати комплексну патогенетичну терапію хворих на розацеа жінок залежно від ступеня клініко-морфологічних, судинних розладів та супутньої патології і порівняти її ефективність із традиційними методами терапії.
6. Надати рекомендації щодо зовнішнього лікування розацеа у жінок та запровадити в практику схему реабілітації косметичних дефектів шкіри обличчя із застосуванням терапії інтенсивного імпульсного світла (IPL).
Об¢єкт дослідження: розацеа у жінок.
Предмет дослідження: особливості клінічного перебігу, морфо-патогенетичні особливості, імуногістохімічні маркери, стан кровотоку судин шиї та голови, якість життя і психосоматичний статус, діагностика, прогнозування та результати лікування жінок, хворих на розацеа.
Методи дослідження: клінічні (постановка діагнозу, визначення ступеня тяжкості перебігу дерматозу, контроль ефективності лікування), анамнестичні (виявлення провокуючих факторів розвитку дерматозу), інструментальні – дерматоскопія, ангіографія (вивчення дерматоскопічних ознак дерматозу та змін судин голови та шії), морфологічні, імуногістохімічні, (вивчення змін патогістологічної картини шкіри при захворюванні), оцінка якості життя і психосоматичного статусу (виявлення зниження якості життя та вивчення ступеня тривожності у пацієнтів з акне), статистичні.
Наукова новизна одержаних результатів. Дисертантом доповнено дані стосовно особливостей клініко-морфологічної картини захворювання у жінок, хворих на розацеа залежно від віку, стадії захворювання, стану судин та супутньої патології. Доповнено дані стосовно розладів психоемоційного стану та зниження якості життя хворих.
Вперше, на підставі посилення експресії рецепторів до VEGF, COX-2, СD34+, AR, ER, встановлено особливості тканинних реакцій у жінок з ЕТР.
За результатами патоморфологічних та імуногістохімічних методів підтверджено стадійність і прогресуючий перебіг захворювання.
Вперше визначено залежність між рівнем експресії рецепторів до андрогенів та естрогенів (AR/ER) та тяжкістю перебігу розацеа у жінок.
Доповнено наукові дані про особливості патології судин голови та шиї, що характеризується дефіцитом кровотоку по V4 сегменту хребцевої артерії (ХА) у 94 %, та патології хребетних артерій у 84 % випадків, які дозволяють зробити висновок про значний вплив на перебіг розацеа супутньої патології судин голови та шиї.
Визначено дерматоскопічні ознаки захворювання та динаміки перебігу розацеа. Вперше встановлено судинні патерни, характерні для ЕТР та папуло-пустульозної форми розацеа (ППР).
Вперше запропоновано комплексну патогенетично обґрунтовану терапію хворих на ЕТР та ППР з використанням засобів, які впливають на різні ланки патогенезу дерматозу та використовують систему IPL, із підвищенням ефективністі терапії на 44 % та 28 % відповідно.
Доведено доцільність використання в комплексній терапії розацеа методу IPL з метою корекції локальних судинних змін у шкірі хворого.
Практичне значення результатів дослідження. Розроблено критерії прогнозування перебігу розацеа, що базуються на змінах експресії рецепторів до VEGF та естрогенів/андрогенів (AR, ER) у біоптатах шкіри (патент на корисну модель № 124614 від 10.04.2018).
Автором розроблено комплексний метод лікування та профілактики рецидивів із застосуванням IPL терапії. Доведено, що розроблений метод дозволяє, порівняно зі стандартними методами, скоротити терміни регресу клінічних ознак дерматозу, значно зменшити частоту (в 3 рази) та ступінь проявів рецидивів захворювання.
Одержані в роботі нові дані застосовуються в практичній діяльності спеціалізованих медичних установ та навчальних закладів: ТОВ «Інститут псоріазу та хронічних дерматозів» (м. Київ), ТОВ «Інститут пластичної хірургії «Віртус» (м. Одеса), Медичний центр «Асклепій» (м. Ужгород), Обласний клінічний шкірно-венерологічний диспансер (м. Ужгород), КЗ «Обласний клінічний шкірно-венерологічний диспансер» (м. Дніпро), КЗ «Дніпропетровське обласне патологоанатомічне бюро», Тернопільський обласний клінічний шкірно-венерологічний диспансер, КЗ «Косметологічна лікарня» Дніпровської міської ради.
Теоретичні положення дослідження і практичні рекомендації впроваджені в педагогічний процес кафедри дерматовенерології Національної медичної академії післядипломної освіти імені П.Л. Шупика, кафедри шкірних та венеричних хвороб з курсами патоморфології та фтизіатрії ДВНЗ «Ужгородський національний університет».
Особистий внесок здобувача. Автору належить ідея наукової роботи. Самостійно здійснено патентний пошук і аналіз даних наукової літератури за темою дисертації. Здобувачем сформовані дослідні групи, проведено клінічне обстеження, лабораторні та інструментальні дослідження, лікування 100 хворих на розацеа жінок. Самостійно проведено аналіз, статистичну обробку та узагальнення отриманих даних, написано всі розділи дисертації, сформульовано висновки. Дисертантом не запозичені результати та ідеї співавторів публікацій.
Апробація результатів дисертації. Основні положення роботи повідомлені та обговорені на ІХ Всеукраїнській науково-практичній конференції з міжнародною участю «Актуальні питання косметології та дерматології» (Запоріжжя, 2015), науково-практичній конференції «Київські дерматологічні дні: Фундаментальні аспекти загальної дерматології» (Київ, 2015), регіональній науково-практичній конференції «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом» (Святогірськ, 2016), III (X) з’їзді Української асоціації лікарів-дерматовенерологів і косметологів (Львів, 2017), науково-практичній конференції «Менеджмент якісної спеціалізованої допомоги дерматовенерологічним пацієнтам» (Дніпро, 2018), науково-практичній конференції, присвяченої 25-річчю НАМН України «Прогрес в сучасній діагностиці інфекцій, що передаються статевим шляхом, інфекційних, поширених і важких дерматозів. Досягнення в лікуванні» (Київ, 2018), науково-практичній конференції «Прикарпатські дерматовенерологічні дні 2018» (Яремче, 2018), 13-их Київських дерматологічних днях: весняний симпозіум (Київ, 2018).
Публікації. За темою дисертації опубліковано 13 наукових праць, у тому числі 4 статті (2 з них у моноавторстві) опубліковано у фахових наукових виданнях, атестованих ДАК України, 4 статті у зарубіжних журналах, (2 з них входять до міжнародної наукометричної бази Index Copernicus, Ulrich’s Periodicals Directory, ResearchBib, РІНЦ, Google Scholar), 3 тези у збірниках матеріалів науково-практичних конференцій, 1 патент України на корисну модель, 1 інформаційний лист.
Структура та обсяг дисертації. Дисертація викладена на 183 сторінках комп’ютерного тексту і складається із вступу, огляду літератури, опису матеріалів та методів досліджень, 3 розділів власних досліджень, узагальнення одержаних результатів, висновків, рекомендацій, списку використаної літератури, що містить 208 джерел: 106 – кирилицею, 102 – латиницею, а також 5 додатків. Робота ілюстрована 45 рисунками, 23 таблицями.
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУРИ
1.1 Аспекти етіології та патогенезу розацеа
Як відомо, розацеа є хронічним рецидивуючим захворюванням шкіри обличчя. Розацеа супроводжується запаленням центральної частини обличчя, має поліетіологічну природу і характеризується прогредієнтним перебігом [2, 195]. При розацеа, як правило, висипання представлені стійкою еритемою, телеангіектазіями, папулами, пустулами і фіматозними змінами. За думкою багатьох авторів, на сучасний момент розацеа відноситься до групи ангіопроліферативних хвороб, в основі яких лежить активація запалення і ангіогенезу [39, 190].
Показано, що найбільш висока захворюваність на розацеа на сучасному етапі фіксується серед індоєвропейських народів. Найвища захворюваність на розацеа відзначається в США і країнах Європи. це пов’язано з схильністю розацеа до ураження етнічно світлих фототипів. У США частка розацеа серед дерматозів становить 8-9 %, в Скандинавських країнах і Німеччині – 7-10 %. У Німеччині розацеа діагностується у 2,2 % населення, в Швеції – у 10 %, в Естонії – у 22 %. В Естонії у 22 % з 348 випадково обраних людей була присутня хоча б одна ознака розацеа [103, 167].
Серед 60 000 пацієнтів в дослідженні, проведеному у Великобританії, більшу частину складали жінки (62 %). Жінки починають хворіти на розацеа частіше в більш молодому віці, ніж чоловіки. Однак на підставі масштабного дослідження, проведеного в Греції K.P. Kyriakis, встановлено, що чоловіки і жінки страждають даним захворюванням в рівній мірі [103].
Переважна більшість дослідників сягає думки, що приблизно у 80 % пацієнтів розацеа вперше діагностується у віці 30 років і старше. У жінок захворювання починається, як правило, після 35 років [45, 171].
Універсальної теорії патогенеза розацеа не розроблено [171]. Захворювання визначається як мультифакторіальне, зі зміненою реакцією судин лиця, індукованої різноманітними екзогенними впливами на тлі певної ендогенної «схильності» [86, 138, 205].
Встановлено ряд тригерних факторів, що підвищують ризик розвитку розацеа. До них належать фототип шкіри, вплив ультрафіолетового випромінювання, часті стреси, тривале перебування в умовах високих і низьких температур, вживання гострої і гарячої їжі, косметичні засоби, фізичні навантаження та інші [48, 50, 68, 202].
На даному етапі первинну роль в патогенезі розацеа більшість дослідників відводять судинним порушенням [10, 116].
Також до основних патогенетичних чинників розвитку розацеа відносять дисфункцію ендокринної та нервової систем, порушення імунної системи, захворювання ШКТ, асоційовані з Helicobacter pylori [98, 197, 172]. Обговорюеться роль кліща Demodex folliculorum у розацеа [78, 94, 99, 109].
Згідно з дослідженнями, лабораторно частота виявлення кліщів у хворих на розацеа становить 80 % [165]. На поверхні кліщів Demodex виявлено мікроорганізми B. oleronius, здатні стимулювати запальну реакцію і зростання бактерій Streptococcus і Staphylococcus, запускаючи тим самим процес запалення і створюючи сприятливі умови для розмноження кліща [194, 164, 182]. Більшість авторів сходиться на думці, що даний фактор ускладнює перебіг захворювання, однак не спричиняє його [104, 169, 126].
Також виявлено взаємозв’язок розвитку розацеа і порушення бар’єрної функції шкіри [48, 51]. Серед причин останнього виділяють збільшення трансепідермальної втрати вологи, низький рівень вологості рогового шару, генетичну схильність, вплив ультрафіолетового випромінювання і кліщів роду Demodex [53, 69, 136]. Підвищена трансепідермальна втрата вологи активує ряд епідермальних протеаз, у тому числі серинову протеазу калікреїн-5 (трипсиноподібний фермент рогового шару), який бере участь в активації і розщепленні кателіцидину LL-37 [118, 163].
У патофізіологічній картині розацеа прийнято виділяти кілька ключових ланок, до яких відноситься реалізація вродженого імунітету, опосередкована активація тол-подібних рецепторів, патологія судин шкіри обличчя і порушення шкірного бар’єру. [86, 12, 104, 27]. Тол-подібний рецептор 2 (TLR2) відіграє ключову роль в шкірному запальному процесі при розацеа. TLR2 викликає синтез молекул кателіцидіну, калікреїну, матриксних металопротеїназ, активних форм кисню, окису азоту, цитокінів і хемокінів [30]. Зазначені фактори змінюють структуру судин, сприяють дегенерації колагену, викликають клітинну інфільтрацію і запалення [24, 74, 121, 203]. TLR2 можуть активуватися фізичними факторами (ультрафіолетовим випромінюванням, високими і низькими температурами), контактом з антигенами (хітинової оболонкою Demodex folliculorum, глікопротеїдами Bacillus oleronius), нейропептидами при стресі (нейроімунних механізмах) або формуванні вісцеро-Кута рефлексів [148, 206]. Вважається, що одним з тригерів активації TLR2 є хітин кліщів Demodex folliculorum, які прямо пропорційно корелюють з запаленням на шкірі [53, 100].
Кателіцидін LL-37, що виявляється у пацієнтів з розацеа, має відмінну структуру від того ж поліпептиду здорових людей [31]. Він взаємодіє з клітинами ендотелію, підвищує продукцію хемокінів клітинами дерми (лейкоцитами, гістіоцитами, огрядними клітинами), викликає хемотаксис імунних клітин у вогнище запалення, стимулює ангіогенез, а також модулює експресію фактора росту ендотелію судин (VEGF) [13, 39].
У декількох дослідженнях було виявлено чіткий зв’язок розацеа і мігрені, що підтверджує роль судинної патології в патогенезі даного захворювання [153, 152]. Мігрень зустрічається в 2-3 рази частіше у пацієнтів з розацеа, зокрема, серед жінок в стані перименопаузи, проте причини цього феномену не з’ясовані [12].
1.2 Клінічні прояви та сучасна класифікація розацеа
У 2002 році 17 експертів з Національного товариства розацеа США затвердили ряд стандартних діагностичних критеріїв, які діляться на первинні та вторинні [188]. Так, постановка діагнозу «розацеа» можлива при наявності наступних первинних ознак: транзиторна (періодична) або персистуюча еритема, телеангіектазії, папули і пустули [189]. Наявності одного і більше зазначених симптомів у центральних ділянках шкіри обличчя досить для встановлення діагнозу захворювання [3, 2, 4]. Крім того, виділяють вторинні критерії розацеа, до яких відносяться печіння, набряк, сухість шкіри, лущення, бляшки, офтальмологічні ознаки, ураження периферичних ділянок обличчя і шкіри за межами обличчя, фіматозні зміни [53, 63].
Деякі автори стверджують, що для встановлення діагнозу «розацеа» досить лише персистуючої еритеми в центральній зоні обличчя, тоді як інші ознаки є лише допоміжними [40,61].
Більшість авторів виділяють 4 основні форми розацеа: еритематозно-телеангіектатичну, папуло-пустульозну, фіматозну і офтальмологічну [188]. До ознак ЕТР відносять періодичну і персистуючу еритему і телеангіектазії, які проявляються, переважно, на центральних ділянках шкіри обличчя [183]. При папуло-пустульозній формі розацеа до перерахованих ознак додаються папули і пустули. Фіматозна форма розацеа характеризується потовщенням шкіри, утворенням вузлів неправильної форми [46, 70, 159].
ЕТР характеризується розвитком швидкоплинної, а потім стійкої еритеми в центральній частині обличчя. Спочатку еритема виникає від декількох хвилин до декількох годин, а далі тривалість її збільшується. Надалі, із часом формується стійка застійна еритема, інфільтрація шкіри та телеангіоектазії. Збільшується чутливість шкіри до косметичних засобів, подразнюючих впливів. Далі еритема стає більш насиченою, з’являється синюватий відтінок, який переходить на ніс, щоки, лоб, підборіддя, шию [35, 53].
ППР характеризується наявністю ізольованих або згрупованих папул і пустул на тлі еритеми в центральній частині ураження [108]. На їхній поверхні помітне незначне лущення, на поверхні пустул вміст жовтувато-зеленуватого кольору та гнійно-геморагічні кірочки, комедони відсутні. Шкіра обличчя стає набряклою, пористою [140].
При інфільтративно-продуктивній формі (ринофімі, гнатофімі, метофімі, отофімі, блефарофімі) на застійно гіперемованому фоні з набряком розвиваються запальні вузли, інфільтрати, пухлиноподібні (шишковидні) вирости та стійко розширені судини, уражена частина обличчя стає горбистою, асиметричною, та спотворена. Такі зміни зазвичай формуються у чоловіків [46].
При офтальмологічній формі розацеа розвиваються симптоми запалення очного яблука й повік. Офтальморозацеа характеризується ознаками кератиту та блефариту, запаленням мейбомієвих залоз, формуванням халазіонів і телеангіектазій країв повік. Іноді ураження очей може бути єдиною ознакою розацеа [177] .
Виділяють також особливі варіанти розацеа:
При гранулематозному варіанті розацеа в дермі формуються епітеліоїдно-клітинні гранульоми. Дана форма дерматозу, як правило, притаманна пацієнтам із ВІЧ-інфекцією та іншими імунодефіцитними станами. Клінічні прояви цього варіанту захворювання супроводжуються розвитком дрібних щільних папул, іноді одиничних вузлів, червоно-бурого кольору, із гладкою блискучою поверхнею, які мають сіро-жовтий відтінок при діаскопії, що помилково трактується як ознака туберкульозу – «ознака яблучного желе» [6, 144].
Стероїдна розацеа настає після використання у терапії зовнішніх фторованих глюкокортикостероїдних препаратів [127]. Клінічно стероїдна розацеа відчутно не відрізняється від інших форм розацеа, окрім наявності ділянок атрофії та вираженого синдрому відміни топічного кортикостероїдного препарату [185].
Конглобатна форма розацеа характеризується, окрім класичних проявів, наявністю вузлуватих елементів синювато-червоного кольору, сферичної форми, 1–2 см у діаметрі при цьому у пацієнтів нерідко спостерігається слабкість та лихоманка [13].
Фульмінантна розацеа виникає раптово на фоні загального благополуччя організму. Розвивається виражений набряк і застійна еритема, папули, пустули, вузли, нерідко із флуктуацією та бурувато-жовтими кірками на поверхні. Внаслідок злиття вузлів утворюється потужний бугристий конгломерат. Частіше процес локалізується на лобі, щоках, підборідді. Пальпаторно виявляється гіпертермія. Загальний стан, як правило, не страждає [157].
Грамнегативна розацеа розвивається як ускладнення попередньої тривалої антибактеріальної терапії, частіше препаратами тетрациклінового ряду. З’являються множинні фолікуліти, вузли та кісти, у вмісті яких виявляються грамнегативні бактерії. Така форма дерматозу розвивається, як правило, у людей із дефектами імунної системи [13].
Розацеа з солідним персистуючим набряком (хвороба Морбігана) характеризується появою щільного набряку та яскравої еритеми на верхній половині обличчя, телеангіектазії та папул. Перебіг дерматозу носить спочатку рецидивуючий, а далі персистуючий характер. Через рік від початку захворювання, набряк переходить у стійку інфільтрацію та фіброз, що є характерним саме для хвороби Морбігана [174].
1.3 Патогістологічні зміни при розацеа
Гістологічна картина розацеа залежить від стадії та форми захворювання. На початку захворювання в еритематозно-телеангіектатичній формі відзначають ознаки еластозу, дилатації судин та потовщення її стінок за рахунок проліферації клітин ендотелію [177161]. Також має місце незначна деорганізація колагенових та еластичних волокон, атрофічні зміни сально-волосяних фолікулів [176].
Гістологічно папуло-пустульозний субтип розацеа характеризується наявністю змішаної запальної інфільтрації з великою кількістю плазматичних клітин, нейтрофілів, і, в деяких випадках, еозинофілів [101, 135]. Запалення при цьому субтипі розацеа найбільш виражено, і його ознаки виявляються в сітчастому шарі дерми. Відрізнити цю картину розацеа від акне дозволяє відсутність ретенційних елементів, тобто комедонів і епідермальних кіст. Переважно зустрічаються фолікулярні пустули, проте можливо і виявлення пустул, не пов’язаних з волосяними фолікулами. [27, 82, 175, 118]. Типовою ознакою папуло-пустульозної форми розацеа є сонячний еластоз, що дозволяє судити про можливу роль ультрафіолетового випромінювання і пошкодження клітин вільними радикалами в патогенезі розацеа [109].
Гістологічними ознаками ринофіми є гіперплазія сальних залоз і фіброз. Сальні залози при фіматозних утвореннях нагадують такі при старечій гіперплазії сальних залоз, однак їх нормальна структура збережена [15]. Інфільтрат при ринофімі складається переважно з лімфоцитів і нейтрофілів і локалізується, головним чином, навколо гіпертрофованих фолікулів. [9, 26] В останніх накопичується кератин, продукти розпаду еозинофілів, кліщі роду Demodex [126, 137, 182, 207].
1.4 Судинні зміни при розацеа
Особливе значення у патогенезі розацеа віддається порушенню регуляції кровотоку по лицьовій вені. Уповільнення перерозподілу кровотоку і венозний стаз у ділянці відтоку лицьової вени найбільш часто відповідає топографії розацеа [33, 57, 186].
У ділянці відтоку лицьової вени включається також кон’юнктива, що може пояснювати часте залучення органу зору при цьому захворюванні [49].
Істотна роль у патогенезі розацеа відводиться зміни тонусу поверхневих артеріальних судин шкіри в зоні іннервації трійчастого нерву, що є наслідком впливу ряду екзогенних (інсоляція, вплив високих і низьких температур) і ендогенних факторів (патологія гемостазу та ендокринної системи, ШКТ, імунітету та ін.) [150, 151, 132]. Дослідження патології кровообігу як причини розацеа має довгу історію. Патологія капілярів шкіри може бути викликана низкою чинників, які призводять до стійкого розширення судин шкіри і в подальшому стазу крові [155, 191, 196]. Клінічно це проявляється еритемою і телеангіоектазіями. Показано, що прозапальні фактори (метаболіти триптофану, протеази, адренергічні рецептори та інші), грають істотну роль в порушенні судинної регуляції, взаємодіючи з ендотелієм судин [30, 53, 133]. Крім того, ряд чинників обумовлює нейрогенне запалення при розацеа (TRPV1, поліпептид, який активує аденілатциклазу гіпофіза) [69]. Зазначені патофізіологічні зміни можуть виявлятися вже на ранніх стадіях розацеа, в тому числі до маніфестації клінічних ознак [196, 204, 120].
Виявлена значна роль вазоактивних пептидів ШКТ (пентагастрину, вазоактивного кишкового пептиду), простагландину Е2, компонентів калікреїн-кінінової системи [76, 56, 175, 166]. Також ряд медіаторних речовин, таких як ендорфіни, брадикінін, серотонін, гістамін і субстанція Р беруть участь у механізмі підвищення проникності капілярів, розвитку еритеми і зміни тонусу судин [16, 85, 94, 162].
Вважається, що найбільш значущим пептидом у патогенезі розацеа є VEGF [13, 70, 82, 200]. Активація VEGF може бути викликана як екзогенними, так і ендогенними факторами (ендокринними порушеннями) [105, 106]. У дослідженні A.H. Gomaa et al. було показано, що експресія VEGF в патологічно зміненій дермі хворих розацеа збільшується з 55,6 % до 88,9 % в порівнянні зі здоровою шкірою [200]. Показано, що під впливом нейрогуморальних механізмів відбувається активація кровопостачання шкіри обличчя [23, 96]. Ділянки еритеми розташовуються переважно в центральній частині обличчя, що пов’язано з великою кількістю капілярів у цій ділянці і з їх більш поверхневим розташуванням порівняно з іншими ділянками [108]. Регулярна поява еритеми призводить до втрати судинного тонусу, а в подальшому – до дилатації капілярів шкіри і лімфатичних судин [162].
При розацеа спостерігаються також зміни в гістології капілярів: потовщення ендотелію, розриви базальної мембрани, порушення міжклітинної адгезії ендотеліальних клітин [62, 162].
1.5 Сучасні терапевтичні підходи до лікування розацеа
Незважаючи на численні способи лікування розацеа та на великий арсенал лікарських засобів та методів лікування, розацеа представляє складну задачу, і не завжди э ефективним при тривалому перебігу і виражених клінічних проявах захворювання [71, 61, 149].
На сучасному етапі немає методу який би приводив до повного виліковування розацеа, але в більшості випадків перебіг розацеа можна контролювати [7, 142]. Зважаючи на це, при лікуванні розацеа ставляться наступні цілі: полегшення симптомів захворювання (зменшення гіперемії лиця, кількості папул і пустул), запобігання прогресування або його відстрочка, досягнення тривалої ремісії, профілактика загострень, усунення косметичного дефекту, поліпшення якості життя пацієнта [84,178].
Ефективність лікування здебільшого залежить від вибору тактики лікування, яка враховує клінічну форму та тяжкість перебігу захворювання, наявність провокуючих факторів, соматичної патології, стать та вік хворого, переносимість лікарських засобів [123, 178] .
Багато аспектів етіології та патогенезу даного захворювання залишаються неясними до сьогоднішнього дня. Тому всі пацієнти потребують консультації суміжних спеціалістів (гастроентерологів, ендокринологів, терапевтів, офтальмологів та ін.). для виявлення і корекції супутніх захворювань та змін [112, 113, 152].
Також тактика лікування має бути направлена на усунення екзогенних та ендогенних провокуючих факторів, що має включати зміну переваг у харчуванні, корекцію дії сонячного опромінення на шкіру обличчя, високої або низької температури, усунення психоемоційних навантажень [20, 129, 153].
При лікуванні розацеа здебільшого призначають комплекс методів системної та зовнішньої терапії [71, 198, 201].
При системному лікуванні розацеа широко призначаються різні антибактеріальні і антипротозойні фармацевтичні препарати (метронідазол та тинідазол), антибіотики тетрациклінового ряду, макроліди, циклічні ретиноїди [8, 124]. У зовнішній терапії використовуються препарати, які містять метронідазол, азелаїнову кислоту, сульфацетамід натрію з додаванням сірки, кліндаміцин, ароматичні ретиноїди та ін. [20, 97, 192].
Традиційним при розацеа, особливо з рясними папуло-пустульозними елементами, стало призначення метронідазолу [74].
При суперечливих даних про роль Demodex folliculorum у розвитку та перебігу розацеа, саме метронідазолу відводять роль системного препарату, що пригнічує життедіяльність Demodex folliculorum [95]. Так зарубіжні дослідники рекомендують призначати метронідазол per os при вираженому демодекозі, але тривалість лікування при цьому рекомендовано не перевищувати 10 днів. [76].
В інших дослідженнях встановлено що метронідазол підсилює захисні та регенераторні функції слизової оболонки шлунка та кишківника та має виражену протизапальну дію, та стимулюючи адренергічні структури вегетативної нервової системи, зменшує застійні явища та еритему [178].
Відмічається бактеріостатична активність метронідазолу відносно грамнегативної анаеробної флори, яка також може підсилювати вираженість клінічних проявів папуло-пустульозної розацеа [42,177].
Зважаючи на ці данні є рекомендації застосування метронідазолу по 1-1,5 г на добу протягом 4-6 тижнів, максимально до 8 тижнів, з можливим повтором курсу через 1 місяць [32].
Також призначають тинідазол (2 г на добу, 4–7 днів) та орнідазол (по 0,5 г/добу, 9–10 днів) як похідні 5-нітроімідазолів, які легше переносяться і мають менше побічних дій на ШКТ і нервову систему.
Серед системних антибактеріальних препаратів при розацеа широко застосовуються антибіотики тетрациклінового ряду (доксициклін, міноциклін, тетрациклін) [17]. Терапевтичний ефект зазначених препаратів при папуло-пустульозній розацеа пояснюється їх здатністю накопичуватися в сальних залозах, вибірково проникати в ділянки запалення, пригнічувати ліпазу коринебактерій, що знижує рівень вільних жирних кислот у шкірному салі, підтримуючих перифолікулярне запалення [75].
Також тетрациклін і його похідні регулюють запальну відповідь шляхом пригнічення ферменту COX-2 та продукції прозапальних цитокінів, таких як інтерлейкін-1, TNF-α і активних форм кисню [19, 107].
За даними ряду авторів, системні тетрацикліни надають значний терапевтичний ефект у хворих розацеа в порівнянні з плацебо, незважаючи на те, що роль патогенних мікроорганізмів в патогенезі розацеа не до кінця з’ясована [25, 38].
Так, протизапальну дію доксицикліну було вивчено в двох рандомізованих подвійних сліпих плацебо-контрольованих дослідженнях хворих на розацеа. В обох випадках спостерігалося значне зниження кількості запальних висипань в порівнянні з групами плацебо [173,179].
Показана ефективність комбінованої терапії з використанням протизапальних доз доксицикліну і топічного метронідазолу (0,75 % лосьйону або 1 % гелю), яка перевищує ефективність монотерапії топічним метронідазолом [52].
Ряд авторів рекомендує доксициклін у протизапальних дозах (40 мг на добу) в комбінації з топічним метронідазолом або азелаїновою кислотою для лікування хворих з ППР [173].
Так у 2017 році були сформовані міжнародні рекомендації global ROSacea COnsensus (ROSCO), в яких у доповнення стандартного антибактеріального дозування 50 мг (100 мг або 200 мг на добу) рекомендовано застосування доксицикліну в протизапальній дозі – 40 мг, що має виражений терапевтичний ефект при розацеа, але не надає побічного впливу на ШКТ [125, 173].
Позитивні результати також відмічені при застосуванні антибіотиків із групи макролідів (еритроміцину, кларитроміцину, азитроміцину) [179].
Еритроміцин у дозі 250-1000 мг на день ефективний при ППР, проте його застосування обмежене внаслідок частих небажаних ефектів з боку ШКТ. Макроліди другого покоління (азитроміцин, кларитроміцин) діють швидше і рідше викликають побічні ефекти, ніж пероральні тетрацикліни та метронідазол. За даними Після 12 тижнів лікування азитроміцином з поступовим зниженням дози препарату в середньому на 75 % знизилася кількість балів за системою загальної оцінки пацієнтів розацеа і на 89 % зменшилися запальні прояви в шкірі. Проте, існує необхідність подальшого вивчення ролі макролідів другого покоління в лікуванні розацеа [179].
Повідомляється про численні сприятливі результати лікування розацеа препаратом ізотретиноїн, який належить до групи ароматичних ретиноїдів [36, 161]. Однак дані про доцільність його широкого застосування при цьому захворюванні залишаються суперечливими [77]. Висока ефективність ароматичних ретиноїдів пов’язана з їхнім впливом на процеси диференціювання та кератинізації клітин епідермісу та сальних залоз, що робить значний внесок у вирішенні висипу [43]. До даного препарату не розвивається резистентності, як до більшості антибактеріальних препаратів [78]. Проте слід зазначити широкий спектр побічних дії, які має ця група препаратів, головний з яких – тератогенний вплив, що змушує критично підходити до їх широкого застосування у жінок дітородного віку. Інші побічні ефекти теж мають сильний вплив на організм хворого, та доволі часто розвиваються в процесі лікування [83, 181].
У багатьох дослідженнях було доведено ефективність ізотретиноїну в лікуванні резистентних до інших видів терапії випадків розацеа. У пацієнтів відзначалася регресія папул, пустул, телеангіоектазій та еритеми [101, 43].
Однак у дослідженнях було відмічено, що терапевтичний ефект при лікуванні антибактеріальними препаратами досягається за більш короткий термін, ніж при лікуванні ізотретиноїном [145].
Додатковими системними засобами лікування розацеа, які впливають на стан судин, є засоби ангіопротекторного ряду (нікотинова кислота, кальцію добезилат, діосмін) [18].
У лікуванні розацеа значний позитивний вплив відмічено при додаванні препаратів на основі антиандрогену ципротерон-ацетату (діане-35, андрокур) [93]. У свою чергу є повідомлення про позитивний ефект при лікуванні розацеа у чоловіків спіронолактоном [110].
При лікуванні розацеа також застосовується вітамінотерапія: призначаються вітаміни A, B1, B6, B12, C, K, P, PP, нікотинова та фолієва кислоти, що справляють антиоксидантну та судинно-зміцнювальну дію [75]. При активації калікреїн-кінінової системи показано використання інгібіторів протеолітичних ферментів – Е-амінокапронової та мефенамінової кислот [147].
При порушенні психоемоційного стану хворих рекомендоване залучення до в схеми лікування протидепресивних препаратів, анксіолітиків [21, 22, 31].
Сучасні топічні препарати для лікування розацеа використовуються у вигляді кремів або гелів, які містять метронідазол, антибіотики, азелаїнову кислоту, бензилпероксид, адапален, сульфацетамід натрію з додаванням сірки. Їх ефективність була доведена в численних дослідженнях [7, 12, 14, 35, 54].
При еритематозній стадії можуть бути корисні примочки з 1–3 % водним розчином борної кислоти, 1–2 % розчином резорцину, відваром ромашки, шавлії, череди, звіробою, настою чаю і т. ін. [54].
Вперше можливість застосування метронідазолу при лікуванні хворих на розацеа була показана в 1980-х роках. У ряді досліджень було доведено ефективність метронідазолу [14, 42]. У 2006 році при порівнянні дії крему, гелю і лосьйону метронідазолу 0,75 % і 1 % не було виявлено суттєвих відмінностей [47, 66]. Небажані ефекти препарату розвиваються рідко і включають сухість шкіри, подразнення, свербіж. Не було виявлено суттєвих відмінностей при лікуванні гелем метронідазолу 0,75 % 1 раз на день і гелем азелаїнової кислоти 15 % 2 рази на день, обидва препарати були однаково ефективні [66]. Проте, побічні ефекти в групі метронідазолу зустрічалися не так часто [102].
Деякі автори наполягають на особливій ефективності азелаїнової кислоти в лікуванні розацеа [35]. Встановлено, що вона чинить протизапальну дію, що виражається в пригніченні проліферації, інгібуванні клітинної оксидоредуктази й утворенні гідроксильних радикалів нейтрофілами. Відомо її протизапальну та антимікробну дію щодо P. аcnes і S. еpidermidis [35, 44]. До азелаїнової кислоти не розвивається резистентності [44]. Даний препарат може викликати місцеві реакції: свербіж, печіння, проте вони мають незначний характер. 90 % пацієнтів відзначили хорошу або задовільну переносимість препарату [35].
Традиційно сульфацетамід натрію 10 % з 5 % вмістом сірки використовувався в лікуванні акне і себорейного дерматиту. Сульфацетамід має антибактеріальну дію, а сірка – протигрибкову, протикліщову і кератолітичну дію. Показано, що після 8 тижнів застосування препарату у пацієнтів з розацеа спостерігалося зменшення запальних висипань на 78 % і зниження вираженості еритеми на 83 % [54].
Також для лікування розацеа застосовується топічний напівсинтетичний антибіотик кліндаміцин, який доступний у вигляді розчину, лосьйону або гелю, що містять 1 % діючої речовини. При порівнянні 1 % гелю кліндаміцину і перорального тетрацикліну (1000 мг на добу з подальшим зниженням дози) не було виявлено суттєвої різниці в ефективності препаратів. Більш того, в групі кліндаміцину спостерігалося істотне зниження кількості пустул у пацієнтів порівняно з групою тетрацикліну. Комбінація 1 % кліндаміцину і 5 % бензоїл пероксиду протягом 12 тижнів значно знижує вираженість еритеми і запальних висипань у хворих розацеа в порівнянні з групою плацебо та ефективність даної комбінації істотно перевищує таку при монотерапії кліндаміцином [128, 199].
На сучасному етапі при лікуванні розацеа використовуються топічні ретиноїди (третиноїн, адапален, тазаротен) [43, 208]. Однак, на думку деяких авторів, немає достовірних даних, які доводять ефективність зазначених препаратів при цьому захворюванні. Пероральний ізотретиноїн у низьких дозах і топічний третиноїн у вигляді крему показали позитивний ефект при лікуванні важких і резистентних форм розацеа [170]. Проте, багато авторів вважають, що топічні ретиноїди посилюють патологію судин у шкірі обличчя. Вони можуть діяти як потенційні подразники чутливої шкіри при розацеа [77].
В останні роки в схемах лікування розацеа використовують зовнішні інгібітори кальциневрину: 1 % крем пімекролімус і 0,03 і 0,1 % мазь такролімус [23, 24, 115]. Препарати селективно пригнічують продукцію і вивільнення цитокінів і медіаторів запалення з Т-лімфоцитів і тучних клітин, а також інгібують кальциневрин, пригнічуючи місцеві імунні і запальні реакції, а також блокує вихід гістаміну з тучних клітин. Зокрема, показано, що 1 % крем пімекролімус у комплексній терапії хворих на розацеа дозволив досягти клінічної ремісії і значного поліпшення у 82 % хворих, а також подовжити міжрецидивний період і значно поліпшити якість життя пацієнтів. Небажані ефекти були короткостроковими і м’якими і включали печіння, свербіж, сухість, і поколювання в області застосування [63, 65].
У деяких зарубіжних країнах в арсеналі зовнішніх засобів з’явився препарат у вигляді гелю 0,5 % бримонідину тартрату – агоністу альфа 2-адренергічних рецепторів [59, 117, 187]. Препарат має пряму судинозвужувальну дію та вже через 30 хвилин після нанесення приводить до зменшення еритеми [193, 55].
Другим нещодавно зареєстрованим у деяких зарубіжних країнах препаратом для топічного застосування при розацеа є крем 1 % івермектину, який має протидемодекозну дію, а також протизапальні ефекти, що реалізуються шляхом пригнічення продукції запальних цитокінів [54, 130, 154, 156].
Переважна більшість авторів сходиться на думці, що потрібно уникати топічних стероїдів в лікуванні розацеа. Вони підвищують ризик розвитку фульмінантної форми розацеа, а також викликають виражений ефект відміни [208]. Однак деякі автори допускають можливість короткочасного застосування топічних стероїдів з метою зниження гострої запальної реакції [102].
Незважаючи на широкий спектр фармакологічних засобів, вони не завжди приводять до необхідного терапевтичного ефекту, нераціональна і недостатня терапія і зовсім може призводити до хронізації захворювання та психосоціальної дезадаптації хворих [29, 158, 160].
Однак усі методи зовнішньої і топічної терапії поступово втрачають свою актуальність не тільки у зв’язку з наявними побічними ефектами, але з їх низькою ефективністю порівняно з лазерним випромінюванням та інтенсивним імпульсним світлом (IPL) [64, 168].
У 1990 році M. Goldman et al. вперше розробили лампу спалаху високої інтенсивності для лікування судинних утворень шкіри, а вже з 1994 року метод IPL став широко застосовуватися в медицині [135]. У наступні роки численні модифікації приладу дозволили його більш зручне використання, підвищили безпеку, а також розширили спектр показань до застосування IPL [188].
Існує багато IPL-апаратів (Palomar Star Lux, Photonova, Quantum), які з успіхом застосовуються для фотоомолодження, фотоепіляції, корекції васкулярних і пігментних порушень [41, 137].
Системи IPL є джерелом широкосмугового поліхроматичного некогерентного світла різного спектру в діапазоні від видимого до інфрачервоного випромінювання діапазоні від 515 нм до 1200 нм, з потоком енергії 30-50 Дж/см2 [188]. У роботі апарату використовуються різні світлопоглинаючі насадки-фільтри. Принцип біологічного впливу IPL на структури шкіри полягає в абсорбції фотонів ендогенними або екзогенними хромофорами, що розташовуються в різних шарах шкіри, що призводить до локального підйому температури і деструкції структур, що містять хромофор [41]. Основними хромофорами шкіри людини є меланін, гемоглобін, колаген і вода [184, 188].
Тип шкіри пацієнта, а також різновид патології шкіри є визначальними факторами при виборі спектра світла, який регулюються спеціальними оптичними фільтрами [37, 60, 139, 184].
Зараз IPL визнаний безпечним і ефективним методом і застосовується для лікування судинних утворень, усунення небажаного волосся і пігментних плям. На думку багатьох авторів, за ефективністю IPL не поступається лазеротерапії. [38]. А за деякими даними, IPL забезпечує найбільш ефективний і тривалий результат лікування розацеа [41].
Рядом авторів було продемонстровано ефективність застосування широкосмугового імпульсного світлового випромінювання (IPL) при лікуванні хворих з еритематозним і папуло-пустульозним субтипами розацеа [37, 41, 60, 139].
Л.А. Ковальчук і В.Ю. Гончарук (2012) вивчали ефективність комплексного лікування розацеа із застосуванням системних препаратів метронідазолу та Юнідокс Солютаб, місцевої терапії метрогіл гелем, також застосовувалось IPL обладнання «Palomar» з насадкою MAX (OPL) 2-3 процедури на курс У всіх хворих відзначалася позитивна динаміка в процесі лікування вже після однієї процедури фотокоагуляції: зменшилися набряклість і гіперемія шкіри обличчя, кількість папул значно скоротилося, у деяких пацієнтів вони повністю регресували. Відмічено що після 2-3 сеансів шкіра набула здоровий колір, повністю зникли явища куперозу [34].
Системи IPL працюють у широкому спектральному діапазоні, а довжини хвиль, які вони випромінюють, можуть бути відфільтровані для отримання оптимального клінічного впливу. Таким чином, одна система IPL може використовуватися для лікування різних дерматологічних уражень, шляхом зміни фільтрів і зміни тривалості імпульсу. Сучасні системи IPL зазвичай пропонуються з кількома світлопоглинаючими насадками, кожна з яких оптимізована для різного клінічного застосування [137, 146].
У дослідженні C.A. Schroeter et al. була вивчена можливість лікування телеангіоектазій у хворих на розацеа за допомогою IPL. У результаті вираженість висипань після чотирьох сеансів знизилася на 77,8 %, а ефект зберігався протягом декількох років спостереження. Виниклі небажані ефекти були мінімальними. Автори стверджують, що IPL у лікуванні розацеа забезпечує виражений і довготривалий терапевтичний ефект [184].
A.F. Taub вивчав вплив IPL на еритему, папули і пустули у 32 хворих на розацеа. Після 1–7 курсів терапії у 83 % пацієнтів відзначили зменшення персистуючої еритеми, у 75 % хворих знизилася частота транзиторної еритеми і покращилася структура шкіри (суб’єктивно), у 64 % зменшилася кількість папульозних висипань [143].
У дослідженні S. Kawana et al. застосовувався IPL Palomar з насадкою Lux G (основний режим 550-670 нм) для лікування хворих з телеангіектатичною і папуло-пустульозною формами розацеа. У результаті значно зменшилася вираженість еритеми і кількість телеангіектазій, загальний рівень ефективності лікування склав 91,6 %. На думку авторів, цей метод найбільш ефективний у пацієнтів з ЕТР. Небажані ефекти включали в себе помірну еритему, яка мала тимчасовий характер [111].
Новим словом у лікуванні розацеа стала терапія IPL.
Системи IPL показали високу ефективність у лікуванні таких симптомів розацеа, як телеангіектазії і еритема, проте вони незначно впливають на кількість папул і пустул у хворих [60, 137, 122, 180]. Доказано що IPL достовірно знижує такі прояви розацеа, як еритема, телеангіектазії, набряк, відчуття печіння, а також покращує якість життя пацієнтів [37]. Але слід відмітити що у даних методів також є ряд побічних ефектів, які включають утворення на шкірі міхурів, виразок, рубців, порушення пігментації [114, 180].
* * *
Таким чином, лікування розацеа спрямовано на пригнічення запального процесу, усунення висипань, запобігання розвитку рецидивів і ускладнень захворювання, поліпшення якості життя пацієнтів. В даний час застосовується широкий спектр системної (антибіотики з групи тетрацикліну і макролідів, метронідазол, ізотретиноїн та інші) і зовнішньої (азелаїнова кислота, топічний метронідазол, топічні ретиноїди, пімекролімус тощо) терапії. Однак усі методи зовнішньої і місцевої терапії поступово втрачають свою актуальність не тільки в зв’язку з наявними побічними ефектами, але і з низькою ефективністю в порівнянні з лазерним випромінюванням та IPL. Системи IPL і лазери в ряді досліджень показали високу ефективність у лікуванні таких симптомів розацеа, як телеангіектазії і еритема, що робить їх особливо актуальними в терапії хворих з ЕТР.
Матеріали розділу представлені у публікаціях автора:
- Святенко Т. В, Старостина О. А. Новые возможности IPL-терапии в комплексном лечении сосудистых форм розацеа. Медицинские новости Грузии. 2015. № 6 (243). С. 62 [81].
- Старостина О. А. Розацеа в сочетании с хроническими дерматозами (собственные наблюдения). Международный научно-практический журнал «Дерматовенерология. Косметология» 2015. №1(01). С. 72–77 [89].
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Загальна характеристика пацієнтів
Під нашим спостереженням знаходилися 100 хворих на розацеа жінок, у віці від 21 до 65 років (середній вік – (40,4 ± 1,0) років), які перебували на лікуванні у медичному центрі ПП «Леномед» (м. Дніпро) в період з 2015 по 2018 рр., з них 50 пацієнток було з ЕТР, 50 – з ППР.
Діагноз встановлювався на підставі виявлення загальних та додаткових клінічних ознак розацеа, перелік яких було запропоновано в 2004 р. Wilkin і співавторами в якості критеріїв виставлення діагнозу розацеа [188].
Критерії включення пацієнтів у дослідження:
1. Жінки, хворі на розацеа, які не мають іншої шкірної патології.
2. Вік обстежуваних 18 років і старше.
3. Бажання брати участь у дослідженні, підтверджене наявністю підписаної інформованої добровільної згоди. Пацієнти, у яких було заплановано гістологічне дослідження шкіри, додатково підписували інформовану добровільну згоду на проведення панчбіопсії в ділянці обличчя.
Критерії виключення з дослідження:
1. Застосування зовнішньої або системної терапії за 1 місяць до початку дослідження.
2. Наявність в анамнезі пацієнта злоякісних захворювань.
3. Наявність у хворої супутніх хронічних захворювань в стадії декомпенсації.
4. Вагітність і період лактації.
5. Важкі інфекційні процеси (ВІЛ-інфекція, туберкульоз, сифіліс, прогресуючий перебіг вірусних гепатитів В і С).
6. Епілепсія в анамнезі.
Найбільший відсоток хворих на розацеа жінок припадав на вікову групу від 18 до 45 років (69 пацієнток – 69 %), 25 (25 %) пацієнток були у віці від 46 до 60 років, 6 (6 %) – у віці від 60 до 65 років (табл. 2.1). Це, безсумнівно, має важливе соціально-економічне значення, так як більшість пацієнток входять до групи загально-активного і працездатного населення.
Таблиця 2.1 – Розподіл хворих на розацеа за віком, абс. ( %)
| Вік, років | Всього (n=100) | Еритематозно-телеангіектатична форма розацеа (ЕТР) (n=50) | Папуло-пустульозна форма розацеа (n=50) |
| 18-25 | 7 (7 %) | 4 (8 %) | 3 (6 %) |
| 26-30 | 5 (5 %) | 3 (6 %) | 2 (4 %) |
| 31-35 | 21 (21 %) | 13 (26 %) | 8 (16 %) |
| 36-40 | 26 (26 %) | 13 (26 %) | 13 (26 %) |
| 41-45 | 10 (10 %) | 2 (4 %) | 8 (16 %) |
| 46-50 | 16 (16 %) | 6 (12 %) | 10 (20 %) |
| 51-55 | 6 (6 %) | 3 (6 %) | 3 (6 %) |
| 56-60 | 3 (3 %) | 3 (6 %) | – |
| 61-65 | 6 (6 %) | 3 (6 %) | 3 (6 %) |
| Середній вік (М±m) | 40,4±1,0 | 39,7±1,5 | 41,1±1,3 |
Примітка. p>0,05 між групами при усіх порівняннях
Тривалість захворювання варіювала від 4 місяців до 13 років. Середня тривалість захворювання склала (5,11 ± 0,37) років. Давність захворювання до 1 року спостерігалася у 19 хворих (19 %), від 1 до 5 років – у 29 (29 %), від 5 до 10 років – у 39 (39 %), понад 10 років – у 13 хворих (13 %) (табл. 2.2).
Усі хворі були рандомізовані на чотири рівнозначні групи залежно від форми розацеа і методики лікування. Основні групи пацієнток отримували терапію, запропоновану автором: І група (25 жінок) з ЕТР, ІІІ група (25 жінок) з ППР. У групах порівняння застосовувалися традиційні методики: ІІ група (25 жінок) з ЕТР, ІV група (25 жінок) з ППР.
Таблиця 2.2 – Розподіл хворих на розацеа за тривалістю захворювання, абс. ( %)
| Тривалість, років | Всього (n=100) | Еритематозно-телеангіектатична форма розацеа (n=50) | Папуло-пустульозна форма розацеа (n=50) |
| до 1 року | 19 (19 %) | 9 (18 %) | 10 (20 %) |
| 1-5 | 29 (29 %) | 17 (34 %) | 12 (24 %) |
| 5-10 | 39 (39 %) | 19 (38 %) | 20 (40 %) |
| Понад 10 | 13 (13 %) | 5 (10 %) | 8 (16 %) |
| У середньому (М±m) | 5,11±0,37 | 4,84±0,51 | 5,38±0,54 |
Примітка. p>0,05 між групами при усіх порівняннях
Виділені групи були статистично співставними (p>0,05) за віком пацієнток, давністю захворювання (табл. 2.3), а також фототипами шкіри, супутньою патологією, тяжкістю перебігу захворювання (див. розділ 5), що дозволило порівнювати ефективність обраного варіанту терапії.
Таблиця 2.3 – Порівняння виділених терапевтичних груп хворих на розацеа за віком пацієнток і тривалістю захворювання, М±m
| Показник | Еритематозно-телеангіектатична форма розацеа(n=50) | Папуло-пустульозна форма розацеа (n=50) | ||
| І група – основна (n=25) | ІІ група – порівняння (n=25) | ІІІ група – основна (n=25) | ІV група – порівняння (n=25) | |
| Вік, роки | 40,6±2,4 | 38,8±1,9 | 42,5±1,8 | 39,6±2,0 |
| Відмінності між групами | t=0,59, р=0,561 | t=1,08, р=0,286 | ||
| Тривалість захворювання, роки | 5,16±0,78 | 4,52±0,67 | 5,14±0,82 | 5,61±0,73 |
| Відмінності між групами | t=0,63, р=0,530 | t=0,43, р=0,671 | ||
Відповідно до мети і задач дослідження був використаний комплекс методів морфологічного, імуногістохімічного, морфометричного, статистичного аналізу.
2.1.1 Визначення ступеня тяжкості захворювання за шкалою діагностичної оцінки розацеа
Тяжкість перебігу розацеа оцінювалася за шкалою діагностичної оцінки розацеа (ШДОР), запропонованої В.П. Адаскевич у 2004 році, що ґрунтується на врахуванні типових ознак захворювання. Оцінювалась інтенсивність проявів розацеа за 7 ознаками: еритема, телеангіектазії, папули і / або пустули, набряк обличчя, сухість шкіри, лущення, наявність і прояви офтальморозацеа, вираженість суб’єктивних відчуттів.
Вираженість кожної ознаки оцінювалася від 0 до 3 балів: 0 балів – відсутність; 1 бал – слабка; 2 бали – помірна; 3 бали – виражена. Максимальна кількість балів – 21, мінімальна – 0.
Ступінь тяжкості до 7 балів розцінювався як легкий, від 8 до 14 балів – як середній і від 15 до 21 балів – як важкий [3].
2.2 Неінвазивні методи дослідження
2.2.1 Дослідження осередків ураження методом дерматоскопії
Для детального вивчення у хворих на розацеа змін шкіри в осередку ураження, що мали характерні клінічні прояви розацеа, застосовувався метод дерматоскопї. Дослідження проводилося за допомогою дерматоскопу Heinedelta 20 plus зі змінними контактними платами діаметром 23 мм для імерсійного і поляризаційного методу дослідження. За допомогою поляризаційної дерматоскопії визначався характер змін судин і вимірювався діаметр переважної кількості судин, для чого оцінювалося не менше трьох полів зору в осередку ураження. Далі, для виявлення додаткових ознак розацеа, використовувався імерсійний метод дерматоскопії. На шкіру в місці обстеження наносилась олія для дерматоскопії (Heine, Germany), після чого, за допомогою імерсійної контактної плати зі шкалою, обстежувалося не менше трьох полів зору в осередку ураження.
Отримана при дерматоскопії картина фіксувалася за допомогою фотоапарата Canon 600D.
У хворих з ЕТР методом дерматоскопії виявлялися такі характерні ознаки, як полігональна сітка розширених судин, наявність лінійних і розгалужених судин, одиничних фолікулярних пробок, наявність кліщів Demodex [87].
При ППР дерматологічно додатково виявлялися поодинокі мікроскопічні пустули і фолікулярні зміни – запальні явища навколо фолікулів, розширені отвори фолікулів, фолікулярні пробки, лусочки і кірки.
2.2.2 Дослідження судин голови та шиї методом доплерографії
Для дослідження особливостей кровотоку по судинах голови і шиї у хворих на розацеа і для виявлення можливої цереброваскулярної патології у хворих на розацеа проводилося дуплексне сканування судин шиї та голови. Доплерографічне дослідження проводилося в положенні хворого на спині на апараті LOGIQ C5 General Electric (США). Визначалися площа перетину і середня лінійна швидкість кровотоку по загальних сонних артеріях (ЗСА), внутрішніх сонних артеріях, хребетних артеріях, венах Розенталя за загальноприйнятими стандартними методиками з подальшим підрахунком сукупного обсягу приливу крові до голови. При дослідженні судин шиї лінійний ультразвуковий датчик з частотою 7 МГц розташовувався на кожній з бічних сторін шиї над місцями локалізації досліджуваних судин. Сканування вен виконувалося через нанесену на шкіру «гелеву подушку», занурюючи в неї датчик, але не торкаючись шкіри. Починали сканування в поперечній площині від ключиці, вимірювали площу перетину судин (см2) в ділянці нижньої цибулини, потім судини сканували в поздовжній площині, що дозволяло досліджувати просвіт судин, уточнюючи деталі і особливості кровотоку по судинах. Обчислення середньої швидкості кровотоку здійснювалося за спектром доплерівського зсуву частот в обмеженій зоні, виділеної рамкою ROI (Region of Interest). Верхню і нижню межі рамки розташовували на однаковій відстані від стінок судини. Кут ROI орієнтували відповідно напрямку кровотоку. Розрахунок середньої лінійної швидкості кровотоку (см/с) здійснювався шляхом підрахунку середніх значень швидкості протягом п’яти серцевих циклів. Об’ємна швидкість кровотоку (см3/с або мл/с) обчислювалася, отримуючи помноження площі перерізу вени на середню лінійну швидкість кровотоку.
2.3 Інвазивні методи дослідження
2.3.1 Морфологічний метод дослідження
Біопсійний матеріал шкіри хворих з розацеа занурювався в 10 % розчин нейтрального забуференного формаліну на 24 години. Після фіксації і проводки в спиртах за стандартною методикою, матеріал заливався у парафін. Парафінові зрізи товщиною 4-5 мкм, отримані на мікротомі Microm HM-340, підлягали депарафінізації і забарвленню рутинним методом (гематоксилін-еозин). Мікроскопія проводилася за допомогою світлового мікроскопу Leіca DMLS з використанням об’єктивів ×10, ×20, ×40, ×100 для оцінки ступеня тяжкості розацеа, стадії перебігу та його якості для імуногістохімічного дослідження [1, 67].
2.3.2 Імуногістохімічний метод дослідження
Фіксовані у формаліні і залиті у парафін зразки розацеа були відібрані в процесі попереднього морфологічного дослідження. Парафінові зрізи інформативних блоків наносили на спеціальні адгезивні предметні скельця SuperFrostPlus. Після депарафінізації та регідратації зрізів проводили епітопне повернення антигенів та пригнічення ендогенної пероксидази. Інкубація зрізів з первинними антитілами у вологих камерах при температурі 23 – 250С проводилась на протязі 30 хвилин. В якості первинних використовувалися моноклональні антитіла до VEGF, CD34, СОХ-2, ARiER. Титр, клон, виробник антитіл наведено в таблиці 2.4.
Таблиця 2.4 – Панель первинних антитіл
| Антитіло | Клон | Розведення | Виробник |
| VEGF
CD34 СОХ-2 AR ER |
клон Ab-1
клон Ab-1 клон sp21 клон Fremont, CA клон sp1 |
1:1000
1:600 1:100 1:250 1:400 |
Thermo scientific
Thermo scientific Thermoscientific Thermo scientific Thermo scientific |
Ідентифікація реакцій проводилася відповідно до реакцій з розчином хромогену 3-діамінобензидин тетрахлориду (ДАБ) (Quanto, LabVision) під контролем мікроскопу. Неспецифічні клітинні структури додатково забарвлювали гематоксиліном Майєра.
Рівень інтенсивності цитоплазматичної експресії маркерів VEGF та СОХ‑2 оцінювався програмою обробки цифрових зображень ImageJ (рис. 2.1). Першим етапом завдяки плагіну Colour Deconvolution, щомає вбудовану схему для аналізу забарвлень «Гематоксилін + ДАБ», ділили зображення на синій та коричневий колір (відокремлювали ДАБ від гематоксиліну). Далі за гістограмою коричневі зображення піддавалися кількісному оцінюванню в діапазоні від 0 (чорне) до 255 (біле) за стандартною шкалою яскравості.
Для з’ясування щільності судин сосочковому шарі дерми підраховували кількість судин за мембранною/субмембранною реакцією ендотелію з маркером CD34 у 3-х полях зору гарячих точок інструментом ROI Manager програми ImageJ: Analyze > Tools > ROI Manager. Додатково були оцінені середня площа та середній периметр судинного русла (рис. 2.2).
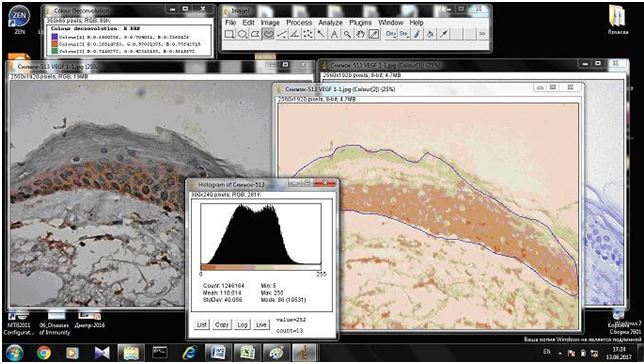
Рисунок 2.1 – Розрахунок середніх значень яскравості цитоплазматичного забарвлення програмою обробки цифрових зображень ImageJ (гістограма)
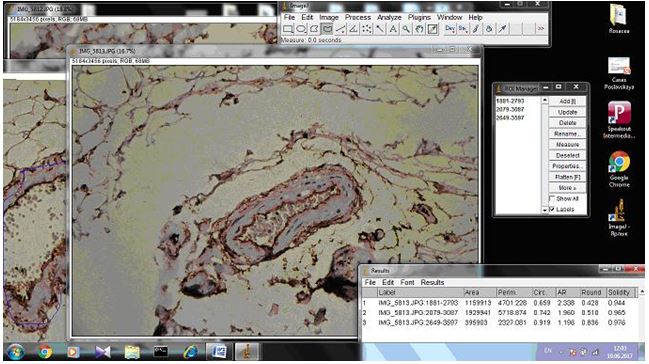
Рисунок 2.2 – Розрахунок середніх значень периметру та площі судин «гарячих точок» сосочкового шару дерми програмою обробки
цифрових зображень ImageJ
Для оцінки інтрануклеарних ІГХ реакцій з маркерами AR / ER використовували інтегрований плагін ImmunoRatio програми ImageJ: Plugins>ImmunoRatio (рис. 2.3) для розрахунку середніх значень [1, 67].
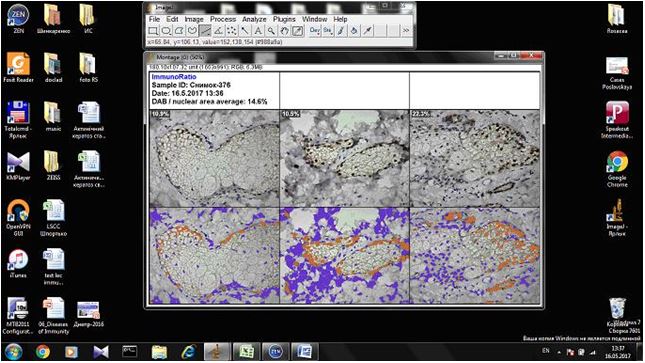
Рисунок 2.3 – Розрахунок індексів інтрануклеарної експресії маркерів сальних залоз в 3-х полях зору програмою ImageJ з визначенням середнього значення
2.4 Методи анкетування
2.4.1 Дослідження дерматологічного індексу якості життя
При оцінці якості проведеного лікування сучасна медицина відводить важливу роль якості життя пацієнтів, так як клінічні дані стану хворого не завжди відображають його суб’єктивні відчуття і психологічний стан при захворюванні. Медичне поняття якості життя, насамперед, включає в себе ті показники, які пов’язані зі станом здоров’я людини. Оцінка якості життя, яку можливо отримати від самого пацієнта, являється цінним та надійним показником його загального стану, ці дані поряд із традиційним медичним висновком, дозволяють скласти повну та об’єктивну картину захворювання.
В теперішній час у дерматології для оцінки якості життя найбільш широко використовується «Дерматологічний індекс якості життя» (ДІЯЖ) [131]. У нього включені питання, умовно поділені на шість основних критеріїв якості життя: фізичний дискомфорт, повсякденна активність, суспільне життя, особисті взаємовідносини, працездатність, зручність терапії. За даною шкалою оцінка якості життя проводиться за 6 основними параметрами, які відображають загальні аспекти зміни якості життя і характеризують перебіг дерматозу за останні 7 днів. ДІЯЖ являється простим та інформативним методом обчислення показників якості життя у дерматологічних хворих. Його перевагою є можливість застосування при багатьох захворюваннях шкіри. Опитувальник ДІЯЖ складається з 10 питань. На кожне з питань пацієнт може дати одну з чотирьох можливих відповідей. Індекс розраховується шляхом підсумовування балів по кожному питанню. Результат може варіюватися від 0 до 30 балів. Максимальне значення індексу – 30. І чим ближче показник до цієї позначки – тим більше негативно захворювання позначається на якості життя пацієнта. При трактуванні значень індексу робиться висновок про відсутність впливу дерматозу на життя хворого або незначний, помірний, сильний або дуже сильний вплив.
2.4.2 Діагностика тривожних та депресивних станів
Скринінгове тестування хворих для виявлення тривожних і депресивних станів проводилося за Госпітальною шкалою тривоги та депресії (HADS). Ця методика була розроблена Zigmond A.S. і Snaith R.P. в 1983 р. для виявлення і оцінки тяжкості депресії і тривоги у пацієнтів у практичній медицині і наукових дослідженнях у галузі медицини.
Опитувальник складено з метою виявлення двох розладів: тривоги і депресії. Він простий у використанні і може бути використаний для первинного виявлення тривоги і депресії у пацієнтів (як метод скринінгу).
Опитувальник складено так, щоб виключити симптоми тривоги і депресії, які можуть бути проявом соматичних захворювань (наприклад запаморочення, головні болі і т.п.) і відображають переважно психологічні прояви тривоги і депресії.
Госпітальна шкала тривоги і депресії містить 14 пунктів, кожному з яких відповідає 4 варіанти відповідей, що відображають ступінь наростання симптоматики.
Бланк шкали видається пацієнту для самостійного заповнення.
Шкала складена з 14 тверджень, які розділені на дві 2 підшкали:
• підшкала «тривога» (непарні пункти – 1, 3, 5, 7, 9, 11, 13)
• підшкала «депресія» (парні пункти – 2, 4, 6, 8, 10, 12, 14).
Кожному твердженню відповідають 4 варіанти відповіді, що відображають градації вираженості ознаки і кодуються за зростанням тяжкості симптому – від 0 (відсутність) до 3 (максимальна вираженість).
При інтерпретації результатів враховується сумарний показник за кожною підшкалою, при цьому виділяються 3 ділянки його значень:
• 0-7 – норма (відсутність достовірно виражених симптомів тривоги і депресії),
• 8-10 – субклінічно виражена тривога / депресія,
• 11 і вище – клінічно виражена тривога / депресія.
2.5 Статистичні методи дослідження
Статистична обробка матеріалів дослідження проводилася з використанням ліцензійного пакету програм Statistica v6.1 (Statsoft Inc. США, серійний № AGAR909E415822FA) [73]. Статистичні характеристики для кількісних ознак представлені у вигляді: середньої арифметичної (M), стандартного відхилення (SD), стандартної похибки середньої величини (m), довірчого інтервалу для середньої (95 % ДІ) або медіани (Ме) та квартилей (LQ – HQ); для якісних ознак – у вигляді відносних показників. Залежно від типу ознак, закону розподілу даних (критерій Шапіро-Уїлка), типу вибірок (зв’язані чи незв’язані) використовували параметричні і непараметричні критерії порівняння: Ст’юдента (t, Т), Манна-Уїтні (U), Вілкоксона (W), критерій відповідності Пірсона (χ2), в тому числі з поправкою Йєтса. Для оцінки взаємозв’язку між ознаками проводився кореляційний аналіз з розрахунком коефіцієнтів рангової кореляції Спірмена (r). Критичний рівень статистичної значимості (р) при перевірці статистичних гіпотез приймався £0,05 [5].
РОЗДІЛ 3
КЛІНІКО-АНАМНЕСТИЧНІ ОСОБЛИВОСТІ ПРОЯВІВ
ДЕРМАТОЗУ ТА ЯКІСТЬ ЖИТТЯ
3.1 Клініко-анамнестичні особливості проявів розацеа у жінок
Під спостереженням знаходилося 100 хворих на розацеа жінок, з них 50 пацієнток з ЕТР, 50 – з ППР.
У більшості пацієнток (82 %) перші ознаки дерматозу з’явились у віці 23–45 років. Як було зазначено у розділі 2, тільки в 19 % випадків хворі звернулися за допомогою протягом року від появи перших ознак захворювання, а в половині випадків (52 %) тривалість захворювання перевищувала 5 років.
За даними сімейного анамнезу встановлено наявність запальних дерматозів на обличчі (почервоніння та дрібні висипання) у членів родини 21 пацієнтки (21 %). Причому серед 15 обстежених родичів з такими проявами було встановлено наступні діагнози: у 10 (66,7 %) – розацеа, з них жінки становили 70 %, у 3 (20 %) – вугрова хвороба, в інших двох осіб (13,3 %) – себорейний дерматит.
При зверненні усі хворі скаржилися на почервоніння центральної ділянки обличчя, переважно на щоках – 98 (98 %) хворих, підборідді – 18 (18 %), міжбрів’ї – 7 (7 %), висипання на обличчі різної розповсюдженості та інтенсивності – 100 %.
При більш детальному опитуванні практично всі хворі (96 %) скаржилися на такі суб’єктивні відчуття як свербіння – 43 (43 %) пацієнтки, печія у вогнищах висипань – 66 (66 %) і поколювання – 63 (63 %), сухість шкіри – 57 (57 %), відчуття жару – 67 (67 %) та «приливів» до обличчя – 78 (78 %), набряк обличчя – 21 (21 %), відчуття «повзання мурашок» – 28 (28 %), стягнутість на поверхні шкіри – 22 (22 %). У більшості випадків (87 %) наявність суб’єктивних відчуттів була постійною. Тільки 4 пацієнтки вказали на повну відсутність суб’єктивних відчуттів.
Анамнестично було відмічено, що у 69 з 100 хворих (69 %) за 3-5 років до появи перших висипань спостерігалось почервоніння центральної ділянки обличчя під впливом різних провокуючих чинників: при інсоляції – у 62 хворих із 69 (90 %), при стресі або зміні температурного режиму середовища – у 42 (61 %), прийнятті алкоголю – у 46 (67 %), гарячої – у 59 (85 %), або гострої їжі – у 37 (54 %). З всіх опитаних хворих 56 (56 %) пацієнток відмітили, що з початку не звертали уваги на таку реакцію, вважали її природною, але з часом таке почервоніння виникало при більш слабких провокуючих чинниках, та ставало більш тривалим. Прогресування хвороби відзначалося появою стійкої еритеми та формуванням множинних телеангіектазій на щоках та підборідді, ці прояви й були причиною звернення до лікаря.
Також треба відзначити, що у 31 зі 100 хворих (31 %) стійка еритема в центральній ділянці обличчя маніфестувала раптово, без будь-яких попередніх інших проявів або суб’єктивних відчуттів.
При детальному опитуванні у 43 пацієнток (43 %) були встановлені можливі провокуючі фактори, після яких пацієнтки відмітили маніфестування проявів розацеа. Так, 16 хворих жінок відмітили сонячний опік як можливий фактор, що дав початок формуванню проявів розацеа, 15 пацієнток – різке емоційне перенавантаження та стреси, 7 хворих – місцеве переохолодження шкіри, 3 хворі зв’язали виникнення розацеа із початком гіпертонічної хвороби, 2 – із гіпертермічними впливами (відвідування бані або сауни).
Також хворі вказували на транзиторні зміни інтенсивності проявів захворювання при змінах температурного режиму, вживанні тієї чи іншої їжі, перебуванні на сонці, на тлі стресів і загострень соматичних хвороб. 78 з 100 (78 %) обстежених хворих свідчили про загострення захворювання після прийому гарячої або гострої їжі. Важливим причинно-значимим фактором було також вживання алкоголю (в першу чергу червоного вина) у будь-якій мінімальній дозі. На це вказали 89 (89 %) хворих. Біля третини хворих (33 жінки – 33 %) відмічали погіршення перебігу хвороби від використання косметичних засобів, впливу косметичних процедур (хімічні пілінги, масаж обличчя із застосуванням олій, механічні чистки тощо). 42 (42 %) пацієнтки відмітили виразний вплив на виникнення або загострення розацеа роботу за комп’ютером протягом 3 та більше годин.
Емоційні перевантаження та стреси, гіпертермічні впливи, вживання червоного вина достовірно не корелювали з віком (p>0,05). Водночас, провокування загострення хвороби сонячними опіками та використанням косметичних засобів, вплив косметичних процедур та загострення розацеа після роботи за комп’ютером було більш характерним для жінок у молодому віці (20-35 років).
Дослідження соціально-професійних факторів, які можуть підвищувати ризик розвитку захворювання та більш тяжкого його перебігу, показало, що 16 пацієнток (16 %) проживало у сільській місцевості, у шлюбі перебували 42 (42 %) пацієнтки, постійну роботу мали 49 (49 %) осіб, не постійну (тимчасову, сезонну) – 27 (27 %), 3 хворі були на пенсії.
При виявлені наявності провокуючих факторів в роботі і життєдіяльності досліджуваних хворих встановлено, що 14 хворих мають особливості роботи, пов’язані з гіпертермією, а саме: 1 хвора працює в склодувному цеху, 3 хворих працюють поварами. В умовах гіпертермії на робочому місці перебувають 10 хворих, ще 3 займаються спортом, зв’язаним з тривалим перебуванням на холоді.
Слід відзначити, що спектр факторів, впливових на загострення розацеа, залежав від фототипу шкіри хворих. Зокрема, сонячне опромінення частіше провокувало загострення розацеа у жінок із І та ІІ фототипом шкіри (за Фітцпатриком). При вивченні структури хворих на розацеа в залежності від фототипу шкіри встановлено, що більшість хворих мали ІІ фототип шкіри (76 хворих – 76 %). Як відомо цей фототип відрізняється від інших низьким ступенем засмаги та схильністю до опіків. Водночас люди з І фототипом шкіри (23 пацієнтки – 23 %) мають максимальну схильність до сонячних опіків та ніколи не отримують засмагу. Тільки 1 хвора з папуло-пустульозною формою розацеа мала ІІІ фототип шкіри. Хворих із четвертим та п’ятим фототипами у дослідженні не було.
Співставлення клінічних груп з різною формою захворювання за фототипом шкіри показало більший відсоток І фототипу шкіри в групі з еритематозно-телеангіектатичною формою розацеа, ніж при папуло-пустульозній формі розацеа – 30 % проти 16 % (χ2=2,77, р=0,096) (табл. 3.1).
Таблиця 3.1 – Розподіл хворих на розацеа за фототипом шкіри (за Фітцпатриком), абс. ( %)
| Фототип шкіри | Всього (n=100) | ЕТР (n=50) | ППР (n=50) |
| І | 23 (23 %) | 15 (30 %) | 8 (16 %)* |
| ІІ | 76 (76 %) | 35 (70 %) | 41 (82 %) |
| ІІІ | 1 (1 %) | – | 1 (2 %) |
Примітка. * – р=0,096 за критерієм χ2 порівняно з еритематозно-телеангіектатичною формою
За результатами анамнестичного опитування і подальшого тривалого спостереження встановлено, що найчастіше (67 хворих – 67 %) загострення захворювання мали сезонний характер та виникали навесні та восени після надмірної інсоляції.
З усіх обстежених хворих, 54 (54 %) пацієнтки раніше отримували десенсибілізуючу терапію і топічні препарати з метронідазолом, азелаїновою кислотою, 27 (27 %) хворих – системну антибактеріальну терапію препаратами тетрациклінового ряду (за 2-3 місяці до проведення дослідження), 32 (32 %) хворих – кріомасаж і різні косметичні засоби для зменшення вираженості судинної патології. Шість пацієнток (6 %) не отримували ніякого лікування раніше.
Результативність проведеного раніше лікування відзначена у 63 (63 %) пацієнток, поліпшення носило тимчасовий характер і становило в середньому 3-4 місяці. Відсутність ефекту від раніше проведеного лікування зафіксовано у 37 (37 %) хворих.
Звертає на себе увагу, що у досліджуваних хворих не завжди мала місце класична клінічна картина хвороби. Тому під час первинних звернень до лікувальних установ у 22 хворих (22 %) не був своєчасно встановлений діагноз розацеа. 20 хворих (20 %) взагалі протягом кількох місяців отримували лікування із такими діагнозами: вугрова хвороба – 6 хворих, демодекоз – 4, екзема – 4, алергічний дерматит – 3, атопічний дерматит – 1, артифіціальний дерматит – 1, червоний вовчак – 1. Це пояснює той факт, що хворі протягом довготривалого часу отримували різне лікування антибактеріальними, антигістамінними, протипаразитарними, седативними препаратами без будь-якого стійкого ефекту. Більшість пацієнток, яким було несвоєчасно встановлено діагноз, вказували на довготривале (3-6 тижнів) застосування топічних глюкокортикостероїдних засобів, що мало тимчасовий ефект, за рахунок їх протизапальної дії, а потім після відміни препарату відзначалось різке та стійке загострення захворювання.
У 50 досліджуваних хворих з ЕТР розацеа (у 42 хворих із вперше виявленою розацеа та 17 хворих із рецидивом), висипання характеризувались наявністю стійкої симетричної еритеми, розташованої у центральній ділянці обличчя, переважно щок (рис. 3.1). У більшості випадків еритема також розповсюджувалась на шкіру лоба – 12 (24 %) хворих, підборіддя – 11 (22 %), носа – 2 (4 %). На фоні еритеми чітко виділялися дрібно- або середньо-петельні телеангіектазії різної інтенсивності забарвлення від ярко-рожевих до синюшно-багряних (рис. 3.2). У деяких хворих еритема супроводжувалась вираженою інфільтрацією – 8 (16 %) хворих, була яскраво-рожевою – 10 (20 %) хворих, або із синюшним відтінком – 3 (6 %) хворих, та супроводжувалась помірно вираженим набряком обличчя – 2 (4 %) хворих.
У досліджуваних хворих з ППР захворювання (у 8 хворих із вперше виявленою розацеа та у 32 % хворих із рецидивом), висипання на обличчі були представлені ярко-рожевою еритемою, множинними телеангіектазіями та папулами рожево-червоного кольору. Патологічний шкірний процес у всіх хворих на папуло-пустульозну форму розацеа локалізувався на щоках, шкірі лоба – 18 (36 %) пацієнток, носо-губного трикутника – 19 (38 %), підборіддя – 12 (24 %), та був представлений папулами та пустулами на фоні інфільтрації та набряку вражених ділянок.
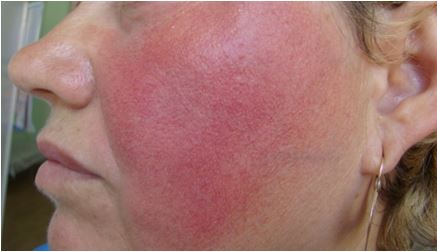
Рисунок 3.1 – Пацієнтка К, 36 років. ЕТР.
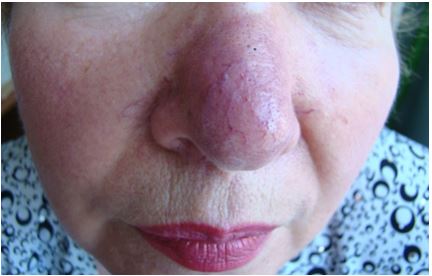
Рисунок 3.2 – Пацієнтка П, 47 років. ЕТР, великокаліберні телеангіектазії в ділянці крил і спинки носа.
Наші спостереження підтверджують той факт, що ЕТР, яка, на думку деяких авторів, є початковою у розвитку розацеа, спостерігається у більш ранньому віці.
У 5 (5 %) хворих на розацеа відзначалися наступні офтальмологічні симптоми розацеа: відчуття печіння, сльозотеча, відчуття стороннього тіла та світлобоязнь. При цьому 3 хворі пред’являли скарги на періодично загострюваний блефарит і кон’юнктивіт.
Як відомо, особливості перебігу хронічних дерматозів з ураженням обличчя можуть бути також обумовлені наявністю того чи іншого типу шкіри людини. Розацеа не є виключенням. У групі хворих на ЕТР переважав комбінований тип шкіри (68,0 % хворих), на відміну від групи хворих із ППР, у яких переважав себорейний тип – 66,0 % хворих (p<0,001). Ці особливості без сумніву мають враховуватися при розробці тактики лікування хворих на розацеа [90].
Для виявлення супутньої патології у хворих на розацея, було проаналізовано дані анамнезу життя пацієнтів та проведено комплексне обстеження у суміжних спеціалістів: терапевтів, гастроентерологів, кардіологів, ендокринологів, отоларингологів, неврологів. При цьому встановлено наявність супутніх соматичних захворювань у більшості пацієнток (84 %), в тому числі ураження кількох систем (травної, серцево-судинної тощо) мало місце в 66 % випадків.
Звертає увагу велика поширеність (як за частотою, так і за локалізацією) патології ШКТ – 44 % хворих. У 10 хворих було виявлено хронічний гастрит, у 12 – хронічний гастродуоденіт, 6 хворих мали ерозивний гастрит. У 5 пацієнток виявлено дискінезію жовчних шляхів, у 4 – хронічний панкреатит, у 8 – хронічний дуоденіт. Жовчнокам’яна хвороба була виявлена у 5 пацієнток. Виразкову хворобу шлунку в анамнезі мали 3 пацієнтки, виразкову хворобу дванадцятипалої кишки – 2, які на момент поточного дослідження знаходилися в стадії ремісії. У 3 пацієнток виявлено хронічний гепатит, у 1 – хронічний коліт, у 5 – хронічний езофагіт.
Хронічну патологію серцево-судинної системи мали 18 (18 %) хворих на розацеа, що вірогідно корелювало з віком пацієнток (r=+0,50; p<0,001). Гіпертонічну хворобу серця діагностовано у 9 з 22 хворих у віці від 37 до 42 років (41 %) та у 16 з 38 хворих віком від 43 до 65 років (42 %). Ішемічна хвороба зареєстрована у 3 хворих старше 50 років. У 7 хворих відмічено аритмії. Патологію судин виявлено у 10 пацієнток, в тому числі атеросклероз – у 4, варикозну хворобу нижніх кінцівок – у 6, тромбофлебіт нижніх кінцівок – у 2 пацієнток.
Понад третини хворих на розацеа мали хронічні захворювання органів дихання (38 осіб – 38 %), переважно хворі з ППР – 24 (48 %) проти 14 (28 %) хворих з ЕТР (χ2=4,24, р=0,039) (табл. 3.2). Серед нозологічних форм частіше виявлявся хронічний тонзиліт – у 8 пацієнток, хронічний бронхіт – у 7, хронічний фарингіт – у 3, хронічний риніт – у 4. Прояви полінозу в літньо- весняний період відмічали 5 пацієнток.
Таблиця 3.2 – Частота виявлення супутньої соматичної патології у хворих на різні клінічні форми розацеа, абс. ( %)
| Супутня патологія (система) | Всього (n=100) | ЕТР (n=50) | ППР (n=50) |
| Всього виявлено, в т.ч.: | 84 (84 %) | 41 (82 %) | 43 (86 %) |
| – ШКТ | 44 (44 %) | 20 (40 %) | 24 (48 %) |
| – серцево-судинної системи | 18 (18 %) | 20 (40 %) | 24 (48 %) |
| – органів дихання | 38 (38 %) | 14 (28 %) | 24 (48 %) * |
| – нервова | 48 (48 %) | 26 (52 %) | 22 (44 %) |
| – ендокринна | 11 (11 %) | 3 (6 %) | 8 (16 %) |
| – сечовидільна | 10 (10 %) | 7 (14 %) | 3 (6 %) |
| – жіночих статевих органів | 15 (15 %) | 8 (16 %) | 7 (14 %) |
Примітка. * – р<0,05 порівняно з ЕТР
При обстеженні зі сторони ендокринної системи у 2 пацієнток було вперше виявлено цукровий діабет другого типу. В 5 випадках мав місце гіпотиреоз, ще в 4 – автоімунний тиреоїдит.
З боку сечостатевої системи у 2 пацієнток зареєстровано хронічний гломерулонефрит, у 2 – хронічний пієлонефрит. У 6 випадках виявлена сечокам’яна хвороба.
Звертає на себе увагу висока частота порушень з боку нервової системи (48 %), зокрема у 37 хворих виявлено симптомокомплекси, характерні для вегетосудинної дистонії, при цьому ще 14 хворих відмітили наявність такого діагнозу в анамнезі. Також при опитуванні 12 хворих вказали на часті приступи мігрені, від незначних проявів, тривалістю 2-3 години – 8 хворих, до виражених приступів, що тривали 4-9 годин і супроводжувались фото- і фонофобією, нудотою і блюванням. Появу мігреней жінки відмітили після 35 років, з поступовим наростанням сили і проявів мігрені.
Треба відмітити, що 9 (18 %) хворих на ЕТР та 7 (14 %) хворих на ППР заперечили наявність супутньої патології. Ці хворі також не мали додаткових скарг, а при обстеженні спеціалістами патологічних станів не виявлено. Причому відсутність супутньої патології була притаманна хворим у молодому віці (14 з 16 хворих знаходилися у віці до 40 років), що узгоджується з даними кореляційного аналізу – коефіцієнт кореляції між віком хворих на розацеа і наявністю супутньої патології становить r=+0,32; p<0,001 [89].
3.2 Результати оцінки ступеня тяжкості розацеа у хворих
Проведене дослідження показало, що середня бальна оцінка тяжкості ураження, розрахована за методикою Адаскевича В.П. і співавт. (див. розділ 2), в групі досліджуваних хворих становила (10,25 ± 0,32) бали (медіана 10 балів) і була більш вираженою у пацієнток з ППР – (12,26 ± 0,41) бал проти (8,24 ± 0,27) балів при еритематозно-телеангіектатичній формі захворювання (p<0,001) (табл. 3.3). Тісна асоціація тяжкості хвороби з ППР підтверджена і даними кореляційного аналізу – коефіцієнт рангової кореляції r=+0,64; p<0,001).
Таблиця 3.3 – Розподіл хворих на розацеа за ступенем тяжкості захворювання (за ШДОР), абс. ( %)
| Ступінь тяжкості | Всього (n=100) | ЕТР (n=50) | ППР (n=50) |
| Легкий | 24 (24 %) | 21 (42 %) | 3 (6 %)** |
| Середній | 65 (65 %) | 29 (58 %) | 36 (72 %) |
| Важкий | 11 (11 %) | – | 11 (22 %)* |
| Середній бал за ШДОР, M±m (Ме) | 10,25 ± 0,32 (10) | 8,24 ± 0,27 (8) | 12,26 ± 0,41 (12)** |
Примітка. * – р<0,01; ** – p<0,001 порівняно еритематозно-телеангіектатичною формою
При оцінці ступеня тяжкості захворювання за ШДОР переважали хворі із середнім ступенем тяжкості – 65 (65 %) пацієнток (середній бал за ШДОР склав 10,63 ± 0,25), з легким ступенем – 24 (24 %) хворих (середній бал – 6,54 ± 0,12), з важким ступенем – 11 (11 %) хворих (середній бал – 16,09 ± 0,44).
За даними кореляційного аналізу встановлено, що тяжкість хвороби має прямий взаємозв’язок з віком хворих (r=+0,26; p<0,01), давністю захворювання (r=+0,22; p<0,05) і фототипом шкіри (r=+0,30; p<0,01).
3.3 Результати дерматоскопічного дослідження морфологічних змін у шкірі у хворих на розацеа
Методом дерматоскопії були досліджені всі хворі.
Методом поляризованої дерматоскопії у всіх хворих на ЕТР виявлено збільшення кількості судин, які поверхнево залягають в центральній частині обличчя, їх розширення і виражена гіллястість з формуванням полігональної судинної сітки в ділянці ураження.
У хворих на ППР відзначалася виражена дилатація судин з формуванням судинної сітки, проте також була тенденція до формування поодиноких більш широких гіллястих судин з наявністю широкої центральної судини і кількох судинних гілочок, що відходять від неї. При цій формі розацеа зазначалося більш виражене повнокров’я судин в ділянці папул і пустул і наявність вираженого набряку шкіри в місцях ураження.
У 32 жінок, хворих на розацеа, при імерсійній дерматоскопії в місцях ураження відзначалися незначно або помірно розширені устя волосяних фолікулів (у 31 хворої на ЕТР і 48 хворих на ППР), фолікулярні пробки (у 21 хворої на ЕТР і 43 хворих на ППР). Також у 5 хворих з ППР відзначалися значно розширені гирла сальних залоз, заповнені жовтим вмістом. У двох пацієнток з клінічною картиною ЕТР при огляді дерматоскопом були відзначені мікропустули, невиявлені при звичайному візуальному огляді. Такі елементи були характерні для пацієнтів з ППР (мікропустули були відзначені у 33 хворих), у 49 пацієнтів пустули візуалізувалися біля волосяних фолікулів з вираженою запальною реакцією навколо елементів. Наявність лусочок і кірок була характерною для ППР (у 39 пацієнток).
У 12 пацієнток (4 хворих на ЕТР і 8 хворих на ППР) при дерматоскопічному дослідженні було виявлено наявність кліщів Demodex у розширених гирлах волосяних фолікулів [87].
У ході дерматоскопічного дослідження також були отримані дані про діаметр поверхневих судин у хворих на ЕТР і ППР. Так, при ЕТР у 24 хворих переважали судини малого діаметра (0,1-0,3 мм), у 23 переважали судини середнього діаметра (0,4-0,5 мм), і тільки у 3 пацієнток визначалися судини з великим діаметром (0,6-0,7 мм), які локалізувалися переважно навколо крил носа.
У хворих на ППР переважали судини із середнім діаметром – 26 пацієнток. Варто відзначити, що у значної кількості пацієнтів (18) при цій формі розацеа на тлі яскраво-рожевої еритеми виявлялися судини з великим діаметром, які локалізувалися на щоках, підборідді, навколо крил носа. У 6 хворих превалювали судини з малим діаметром.
3.4 Результати доплерографічного дослідження кровотоку судин шиї та голови у хворих на розацеа
Доплерографічне дослідження сканування судин шиї та голови з дослідженням особливостей кровотоку було проведене у 75 хворих на розацеа жінок, в тому числі у 49 хворих на ЕТРз еритематозно-телеангіектатичною формою і у 26 хворих з папуло-пустульозною формою.
Основні показники інтенсивності кровотоку судин шиї та голови у хворих на розацеа за даними доплерографічного дослідження представлені в таблиці 3.4.
Таблиця 3.4 – Основні результати доплерографічного дослідження кровотоку судин шиї та голови у хворих на різні клінічні форми розацеа
| Показник | Всього (n=75) | Еритематозно-телеангіектатична форма розацеа(n=49) | Папуло-пустульозна форма розацеа (n=26) | |||
| М | m | М | m | М | m | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| ПЗСА d, мм | 5,88 | 0,05 | 5,87 | 0,06 | 5,90 | 0,11 |
| ЛЗСА d, мм | 5,88 | 0,06 | 5,83 | 0,06 | 5,98 | 0,12 |
| ПВСА d, мм | 4,00 | 0,04 | 4,01 | 0,04 | 3,98 | 0,07 |
| ЛВСА d, мм | 3,97 | 0,04 | 3,96 | 0,04 | 4,00 | 0,08 |
| ПХА d, мм | 3,19 | 0,07 | 3,11 | 0,08 | 3,34 | 0,13 |
| ЛХА d, мм | 3,10 | 0,07 | 3,09 | 0,08 | 3,13 | 0,14 |
| ПЗСА МСШ, см/с | 95,3 | 1,13 | 95,3 | 1,65 | 95,2 | 1,02 |
| ЛЗСА МСШ, см/с | 95,9 | 0,88 | 96,1 | 1,21 | 95,6 | 1,13 |
| ПВСА МСШ, см/с | 85,4 | 0,53 | 86,2 | 0,61 | 84,0 | 0,96 |
| ЛВСА МСШ, см/с | 84,3 | 0,57 | 84,7 | 0,66 | 83,5 | 1,08 |
Продовження таблиці 3.4
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| ПХА МСШ, см/с | 58,2 | 1,06 | 58,5 | 1,24 | 57,6 | 1,98 |
| ЛХА МСШ, см/с | 57,1 | 1,29 | 58,7 | 1,17 | 54,0 | 2,94 |
| ПЗСА Ri | 0,678 | 0,004 | 0,683 | 0,005 | 0,669 | 0,006 |
| ЛЗСА Ri | 0,677 | 0,004 | 0,680 | 0,005 | 0,669 | 0,006 |
| ПВСА Ri | 0,636 | 0,003 | 0,641 | 0,004 | 0,625* | 0,004 |
| ЛВСА Ri | 0,622 | 0,007 | 0,619 | 0,010 | 0,627 | 0,005 |
| ПХА Ri | 0,537 | 0,004 | 0,541 | 0,003 | 0,531 | 0,009 |
| ЛХА Ri | 0,519 | 0,006 | 0,534 | 0,004 | 0,490* | 0,014 |
| ПЗСА, мм | 0,753 | 0,016 | 0,758 | 0,019 | 0,745 | 0,027 |
| ЛЗСА, мм | 0,752 | 0,015 | 0,756 | 0,019 | 0,745 | 0,026 |
Примітки:
1. * – р<0,01 порівняно з еритематозною формою розацеа. 2. ЛВСА – ліва внутрішня сонна артерія. 3. ЛЗСА – ліва загальна сонна артерія. 4. ЛХА – ліва хребетна артерія. 5. МСШ – максимальна систолічна швидкість. 6. ПВСА – права внутрішня сонна артерія. 7. ПЗСА – права загальна сонна артерія. 8. ПХА – права хребетна артерія. 9. Ri – індекс резистентності.
При дослідженні судин голови та шиї у хворих на розацеа жінок звертає на себе увагу наявність дефіциту кровотоку по V4 сегменту ХА у переважній кількості пацієнток – 71 (94,7 %). У 7 хворих (9,3 %) виявлено внутрішньочерепну гіпертензію. Слід відзначити, що у хворих на ЕТР дефіцит кровотоку по V4 сегменту вірогідно частіше відзначався з обох сторін – 33 (67,3 %) хворих, в той час як при ППР такі порушення спостерігались у 10 (38,5 %) пацієнток (χ2=5,79, р=0,016) (рис. 3.3).
Середні показники швидкості кровотоку по вені Розенталя по групах дослідження наведені у таблиці 3.5.
Хребетні артерії відповідали нормі тільки в 12 випадках (16,0 %). У решти 63 хворих (84,0 %) відзначалася патологія хребетних артерій, в тому числі патологічна звивистість хребетних артерій з ознаками гемодинамічних порушень – у 54 (72,0 %). У 11 хворих патологічна звивистість відзначалася на всьому протязі хребетних артерій: у 3 хворих – справа, у 6 хворих – зліва, по обидва боки – у 2 хворих.
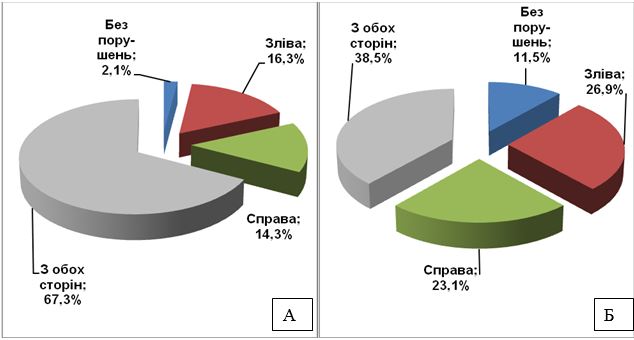
Рисунок 3.3 – Локалізація дефіциту кровотоку по V4 сегменту у хворих на розацеа. А. ЕТР. Б. ППР.
Талиця 3.5 – Середні показники швидкості венозного кровотоку у хворих на різні клінічні форми розацеаб
| Швидкість кровотоку по вені Розенталя, см/с | Всього (n=75) | ЕТР (n=49) | ППР (n=26) | |||
| М | m | М | m | М | m | |
| Ліворуч | 12,80 | 0,39 | 13,35 | 0,53 | 11,77* | 0,46 |
| Праворуч | 13,03 | 0,39 | 13,51 | 0,53 | 12,12 | 0,52 |
Примітка. * – р<0,05 порівняно з еритематозною формою розацеа
У 43 хворих патологічна звивистість відзначалася в локальному відділі на рівні 3-го шийного хребця (С3) – 4-го шийного хребця (С4) – 12 хворих, С4 – 5-го шийного хребця (С5) – 8 хворих, С5 – 6-го шийного хребця (С6) – 9 хворих, у 6 хворих патологічна звивистість спостерігалася на рівні С4–С5–С6 хребців. При цьому таке порушення реєструвалося в ділянці правої хребетної артерії – у 10 хворих, у 9 хворих – лівої, у 24 хворих – з обох сторін.
У 5 хворих виявлено S-образну звивистість ПА, у 3 пацієнтів – петлеподібну звивистість. У 3 випадках виявлено аномалію входження хребетної артерії в 6-й шийний хребець, у двох – у 5-й хребець. У 4 хворих виявлено незначну патологічну звивистість хребетних артерій без гемодинамічних порушень, при цьому у 3 хворих звивистість відзначалася справа, у 1 – з обох сторін.
При дуплексному скануванні судин шиї та голови у 6 хворих відзначалася патологічна звивистість внутрішньої сонної артерії з гемодинамічними порушеннями, у 4 – без гемодинамічних порушень. Ектазію внутрішньої яремної вени виявлено праворуч у 5 хворих, зліва – у 3 хворих, з обох сторін – у 2 хворих.
При дослідженні ЗСА виявлено ехо-ознаки наявності атеросклеротичних бляшок в місці біфуркації ЗСА у 5 хворих, з них у 4 пацієнток зазначені зміни супроводжувалися патологічними гемодинамічними порушеннями [88].
3.5 Оцінка ступеня вираженості депресивної та тривожної симптоматики за даними скринінга у хворих на розацеа
Враховуючи суттєвий вплив стресових ситуацій на розвиток і перебіг розацеа, скарги хворих на появу у них виражених психоемоційних розладів у вигляді пригніченого настрою, роздратованості, замкнутості через косметичний дефект лиця, пов’язаний з розацеа, одним із завдань дослідження стала оцінка ступеня вираженості депресивної і тривожної симптоматики у тематичних хворих. Для цього була застосована Госпітальна шкала тривоги та депресії (Hospital Anxiety and Depression Scale – HADS), яка дозволяє оцінити наявність і вираженість тяжкості симптомів тривоги і депресії в умовах загальномедичної практики.
Встановлено, що майже половина хворих на розацеа (43 – 43 %) на початку дослідження мали ознаки клінічно вираженої тривоги/депресії – загальний бал за шкалою HADS становив 12,02 ± 0,17. У третини пацієнток (34 – 34 %) встановлено граничний критерій вираженості симптомів тривоги/ депресії (від 8 до 10 балів), у середньому – (8,91 ± 0,14) балів. В інших 23 випадках констатовано відсутність достовірно виражених симптомів тривожно-депресивного стану, хоча середній бал за шкалою HADS був ближчим до верхньої межі норми (0-7 балів) – 5,78 ± 0,24.
Слід зазначити, що найчастіше показник вираженості психоемоційного стану хворих на розацеа асоціювався з тяжкістю перебігу захворювання, оціненою за ШДОР (r=+0,31; p<0,01), і ППР (r=+0,40; p<0,001). Тільки у 3 (6 %) пацієнток цієї групи показник відповідав критеріям норми (до 7 балів), а 56 % хворих мали клінічно виражену тривогу/ депресію (χ2=6,90, р=0,009 порівняно з ЕТР) (табл. 3.6).
Таблиця 3.6 – Розподіл хворих на розацеа з різними клінічними формами захворювання за ступенем вираженості ознак тривоги/ депресії (шкала HADS) на початку дослідження, абс. ( %)
| Ступінь вираженості ознак тривоги/ депресії | Всього (n=100) | ЕТР (n=50) | ППР (n=50) |
| Норма (0-7 балів) | 23 (23 %) | 20 (40 %) | 3 (6 %)** |
| Субклінічний (8-10 балів) | 34 (34 %) | 15 (30 %) | 19 (38 %) |
| Клінічно виражений | 43 (43 %) | 15 (30 %) | 28 (56 %)* |
| Середній бал, M±m (Ме) | 9,53 ± 0,27 (10,0) | 8,40 ± 0,39 (8,0) | 10,66 ± 0,29 (11,0)** |
Примітка. * – р<0,01, ** – р<0,001 порівняно з еритематозною формою розацеа
Слід зазначити відсутність достовірної кореляції між ступенем вираженості тривожно-депресивної симптоматики у хворих на розацеа і віком (r=+0,10; p>0,05), що наголошує на важливості оцінки цього стану в усіх жінок з даним захворюванням.
3.6 Дослідження дерматологічного індексу якості життя у хворих на розацеа
Як зазначалося у розділах 1 і 2, важливе місце в діагностиці і лікуванні хронічних захворювань посідає оцінка якості життя пацієнта. Для вивчення негативного впливу розацеа на різні аспекти життя хворої жінки (взаємовідносини у родині, з друзями, соціальна активність тощо) було використано опитувальник – анкету «Дерматологічний індекс якості життя» (ДІЯЖ).
Встановлено, що на початку дослідження середній показник ДІЯЖ у жінок, хворих на розацеа, дорівнював (20,12 ± 0,47) бала, що становило 67,1 % від максимального бала. При цьому не виявлено достовірних розбіжностей між показниками при різних клінічних формах захворювання: (19,62 ± 0,64) бала в групі хворих на ЕТР і 20,62 ± 0,68 бала в групі з ППР (р=0,286 за t-критерієм).
Водночас, високі показники ДІЯЖ у хворих на розацеа асоціювалися з давністю захворювання (r=+0,20; p<0,05), наявністю супутньої патології (r=+0,22; p<0,05), зокрема дихальної системи (r=+0,21; p<0,05) та індексом тривожно-депресивного стану HADS (r=+0,27; p<0,01), що свідчить про суттєве зниження якості життя пацієнток та наявність психологічних проблем, які спровокували шкірний патологічний процес.
* * *
Таким чином, встановлено наявність дефіциту кровотоку по V4 сегменту ХА в абсолютній більшості випадків (94,7 %), що дозволяє зробити висновок про значний вплив на перебіг розацеа супутньої патології судин голови та шиї. Встановлено характерними рисами розвитку і перебігу розацеа у жінок є: дебют захворювання у молодому віці (до 45 років – 82 %), тривалий перебіг (5 років і більше – 62 %), обтяжливий сімейний анамнез (21 %), раптові прояви захворювання (31 %), загострення захворювання під дією тригерних факторів (надмірна інсоляція – 67 %, прийом гарячої або гострої їжі – 78 %, вживання алкоголю – 89 %, стрес або зміна температурного режиму – 42 %, робота за комп’ютером понад 3 годин – 42 %, використання косметичних засобів або процедур – 33 %), ІІ фототип шкіри (76 %), супутня патологія (84 %) з ураженням кількох систем організму (66 %), середній та важкий ступінь перебігу хвороби (76 %), здебільшого асоційований з папуло-пустульозною формою розацеа (94 %), погіршення якості життя ([20,12 ± 0,47] бала за шкалою ДІЯЖ), посилення тривожних і депресивних тенденцій (за шкалою HADS – (9,53 ± 0,27) бала), відсутність ефекту від лікування (37 %).
Матеріали розділу 3 представлені у публікаціях автора:
- Старостіна О. А. Клінічні прояви інфікування Demodex folliculorum на тлі запалення різної інтенсивності та гіперплазії сальних залоз у пацієнток різного віку із судинними формами розацеа. Дерматологія та венерологія. 2018. № 1 (79). С. 76–79 [87].
- Старостина О. А. Розацеа в сочетании с хроническими дерматозами (собственные наблюдения). Международный научно-практический журнал «Дерматовенерология. Косметология» 2015. №1(01). С. 72–77 [89].
- Старостина О.А. Сочетание розацеа с хроническими дерматозами, локализованными на лице. Збірник тез ІХ Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання косметології та дерматології». Запоріжжя, 2015. С. 33 [90].
- Старостина О. А. Результаты допплерографического исследования сосудов головы и шеи у больных розацеа женщин. Experimental and Clinical Medicine. 2018, Vol. 3. P 67–70 [88].
РОЗДІЛ 4
ПАТОМОРФОЛОГІЧНА ТА ІМУНОГІСТОХІМІЧНА ХАРАКТЕРИСТИКА БІОПТАТІВ ШКІРИ ПАЦІЄНТІВ З РОЗАЦЕА
4.1 Патоморфологічне дослідження шкіри на різних стадіях перебігу судинних форм розацеа
Патоморфологічне дослідження трактує захворювання розацеа з різних боків як фолікуліт, порушення сальних залоз, відповідь на надмірне заселення кліща Demodex та функціональні порушення поверхневих судин дерми, що асоційовані зі значною дилатацією та підвищеною проникливістю. Останні з характеристик є найбільш частими клінічними проявами ЕТР, що стали об’єктом цього дослідження.
ЕТР є найбільш загальним варіантом цього захворювання з клінічними характеристиками, які включають почервоніння, центральну еритему обличчя і телеангіектазії. Треба відзначити, що ЕТР досить складні для морфологічної верифікації, почасти тому, що патогенез ушкодження судин до кінця не зрозумілий, й здебільшого тому, що біопсійний матеріал шкіри з ЕТР демонструє досить широкий спектр гістопатологічних змін на різних стадіях перебігу.
Аналіз випадків ЕТР (11 екземплярів), що були отримані під час панч-біопсій, показав різні морфологічні зміни, що залежали від давності ушкоджень і проявлялися комбінацією одночасно декількох характеристик.
Із ранніх змін в ЕТР можна відокремити підгрупу загальних компонентів, що мали місце у всіх зразках.
На перше місце виступають великі телеангіектазії, локалізовані в дермі: збільшені просвіти судин, їх незвичайна форма (звивисті або геометричні контури), разом із підвищеною кількістю та розміром (дилатація, що супроводжується відносно низьким числом ендотеліальних клітин) (рис. 4.1. А).
В усіх примірниках ЕТР спостерігалося також явище підвищення кількості огрядних клітин, які завжди супроводжували спотворені кровоносні судини і складали вагому частину запального інфільтрату у верхній частині сітчастої дерми, вірогідно вносячи свій вклад у процеси неоангіогенезу ЕТР (рис. 4.1. Б, В).
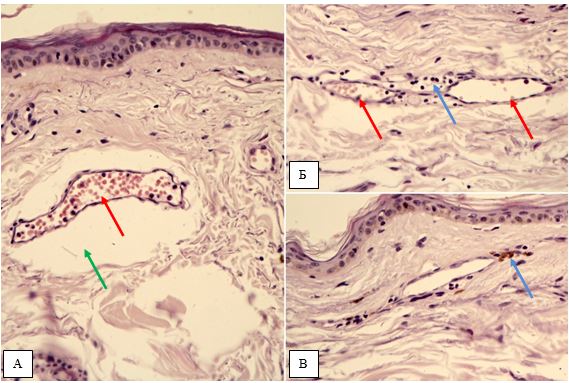
Рисунок 4.1 – ЕТР: ранні ушкодження. Телеангіектазії в сосочковому та верхній частині сітчастого шару дерми, забарвлення гематоксилін-еозин (Г-Е), (х400). А. Звивисті спотворені контури дилатованої судини, ендотеліальні клітини витончені і розтягнуті (червона стрілка), навколо судини значний периваскулярний набряк, оптично пустий простір (зелена стрілка).
Б. Формування різнорідних навколосудинних інфільтратів (синя стрілка) навколо венул (червоні стрілки) верхньої частини сітчастої дерми.
В. Накопичення огрядних клітин з гранулами (синя стрілка) в інфільтратах навколо судин
Як було зауважено, збільшені судини, в основному капіляри, часто демонстрували химерні форми, з відносно невеликою кількістю розтягнутих ендотеліальних клітин. Метод ІГХ дозволив виявити, що такі судини експресують маркер ендотеліальної диференціації CD34 (рис. 4.2), але не маркери лімфатичних судин. У ділянках ЕТР лімфатичні судини взагалі залишались маленькими і розташованими в сосочковому і верхній частині сітчастого шару дерми, з відносно нормальною кількістю.
Типовими були вуглоподібні телеангіектазії і помірний лімфоцитарний інфільтрат на ранніх етапах ЕТР. Від легкого до помірного набряку, майже завжди були зафіксовані на мікропрепаратах ЕТР, що пояснюють збільшену кількість судин, підвищену їх проникність, а також деструкцію ендотеліальних клітин.
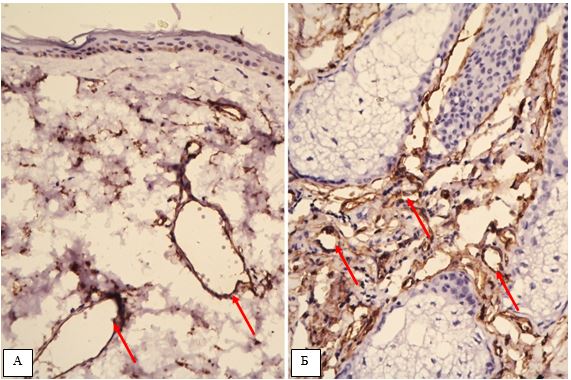
Рисунок 4.2 – ЕТР: ранні ушкодження. Розширені судини, телеангіектазії
при ЕТР (червоні стрілки), інтенсивне коричневе забарвлення маркером едотеліальних клітин CD34. А. Великі телеангіектазії з розтягнутими, витонченими ендотеліальними клітинами в ділянках в сосочковому і верхній частині сітчастого шару дерми, ІГХ метод, (х400). Б. Чисельні спотворені капіляри навколо сальних залоз в стані гіпертрофії, ІГХ метод, (х400)
Таким чином, не менш важливим загальним компонентом ранніх проявів ЕТР треба зазначити набряк поверхневої дерми: на гістологічних препаратах це виглядало як світлі смуги в папілярному і ретикулярному шарах дерми, що супроводжували запальні інфільтрати (рис. 4.1. А, рис. 4.3). В цих порожніх просторах був зазвичай відсутній муцин, що заперечило ослизнення строми при ЕТР, як вторинних дегенеративних змін сполучної тканини.
Наступним обов’язковим раннім компонентом ЕТР можна вважати периваскулярні інфільтрати, що оточують окремі розширені судини. Для них було характерно присутність в сосочковому шарі дерми і верхній частині сітчастої дерми та склад із мононуклеарних клітин (лімфоцитів, гістіоцитів, огрядних клітин і особливо плазматичних клітин, що стає ключем для морфологічної верифікації ЕТР) (рис. 4.3. А).
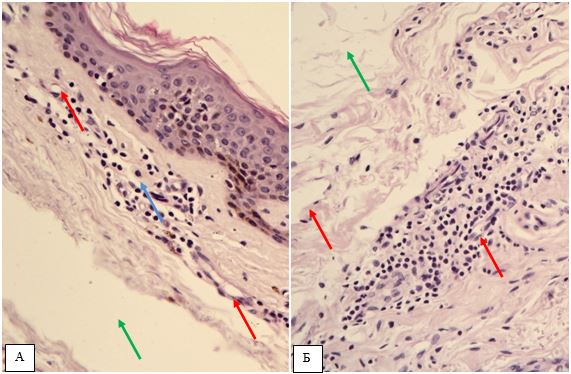 Рисунок 4.3 – ЕТР: ранні ушкодження. А. Запальний інфільтрат сосочкового шару дерми навколо невеликих звивистих судин (червоні стрілки) з наявністю плазмоцитів (синя стрілка), інтерстиційний набряк (зелена стрілка), забарвлення Г-Е, (х400). Б. Багатоклітинний запальний інфільтрат верхньої частини сітчастої дерми навколо судин (червоні стрілки), значний набряк строми (зелена стрілка), забарвлення Г-Е, (х400)
Рисунок 4.3 – ЕТР: ранні ушкодження. А. Запальний інфільтрат сосочкового шару дерми навколо невеликих звивистих судин (червоні стрілки) з наявністю плазмоцитів (синя стрілка), інтерстиційний набряк (зелена стрілка), забарвлення Г-Е, (х400). Б. Багатоклітинний запальний інфільтрат верхньої частини сітчастої дерми навколо судин (червоні стрілки), значний набряк строми (зелена стрілка), забарвлення Г-Е, (х400)
У випадках з папулами, щільність інфільтрату навколо капілярів і венул сосочкового шару дерми мала особливо сильні прояви, на контрасті із неушкодженою шкірою. Але треба зазначити, що комедони були відсутні, якщо пацієнт не мав супутніх вульгарних вугрів, і завжди відмічалися телеангіектазії. Морфологія гострого запалення при ЕТР відрізнялась змішаним запальним інфільтратом з численними плазматичними клітинами, нейтрофілами, а іноді і еозинофілами (рис. 4.4). Треба відмітити, що коли мали місце папульозоподібні ураження, запалення було набагато більш помітним на гістологічному препараті, в порівнянні з типовою картиною ЕТР.
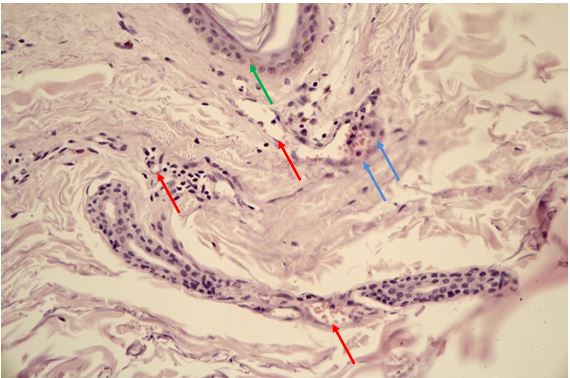
Рисунок 4.4 – ЕТР: ранні ушкодження. Запальний інфільтрат з вмістом нейтрофілів навколо капілярів і венул воронки, діапедез нейтрофілів для формування гострого інтерстиційного запалення (синя стрілка), капіляри і венули (червоні стрілки), зеленою стрілкою зазначено воронку, забарвлення Г-Е, (х400)
Невеликі екстрафолікулярні абсцеси зустрічалися доволі рідко, водночас інфільтрат на ранній стадії ніколи не уражав волосяну цибулину. На відміну від неспецифічного гострого фолікуліту, поодинокі нейтрофіли розташовувалися навколо воронки, і часто корелювали із наявністю кліща Demodex (рис. 4.5). Demodex був присутній в 3 із 11 (27 %) гістологічних зразках від хворих з ЕТР [87].
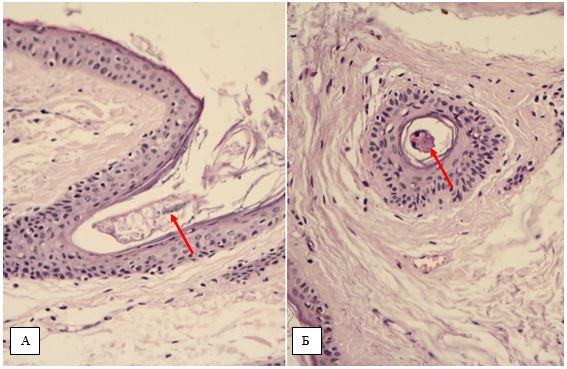 Рисунок 4.5 – ЕТР: ранні ушкодження. А., Б. Наявність кліща Demodex в фолікулярних воронках при ЕТР (червоні стрілки), забарвлення Г-Е, (х400).
Рисунок 4.5 – ЕТР: ранні ушкодження. А., Б. Наявність кліща Demodex в фолікулярних воронках при ЕТР (червоні стрілки), забарвлення Г-Е, (х400).
Сонячний еластоз також був типовим загальним гістологічним проявом, якщо навіть клінічно не очевидним (рис. 4.6). Його присутність відображає ймовірну патофізіологічну роль ультрафіолетового опромінення і пов’язаного з ним накопичення вільних радикалів в шкірі хворих на розацеа.
У випадках ЕТР з значним запаленням за результатами тільки гістології важко виключити системний червоний вовчак (lupus erythematosus), але у разі останнього, окрім інфільтрату в периваскулярних ділянках і волосяних цибулинах, завжди є зміни епідермально-дермального з’єднання (наприклад, вакуолізація базальних кератиноцитів і потовщення базальної мембрани), що не спостерігалося при ЕТР (рис. 4.7).
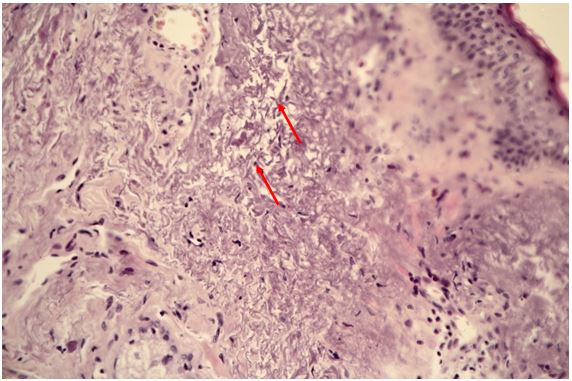
Рисунок 4.6 – ЕТР: ранні ушкодження. Сонячний еластоз (червоні стрілки), забарвлення Г-Е, (х400)
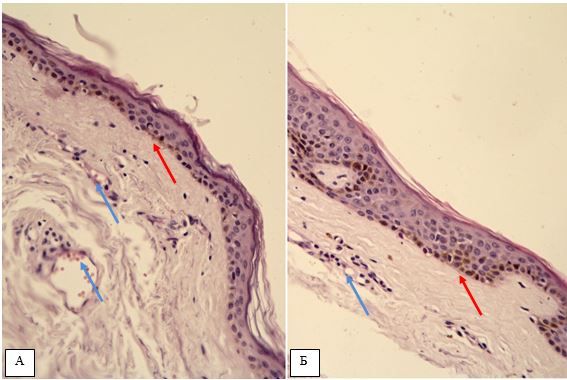 Рисунок 4.7 – ЕТР: ранні ушкодження. А, Б. Відсутність змін епідермально-дермального з’єднання (червоні стрілки), формування запального інфільтрату навколо капілярів і венул (сині стрілки), забарвлення Г-Е, (х400)
Рисунок 4.7 – ЕТР: ранні ушкодження. А, Б. Відсутність змін епідермально-дермального з’єднання (червоні стрілки), формування запального інфільтрату навколо капілярів і венул (сині стрілки), забарвлення Г-Е, (х400)
Для диференційної морфологічної діагностики, ранні гістологічні особливості при ЕТР можна впорядкувати за списком:
- телеангіектазії: збільшені, розширені капіляри і венули в сосочковому шарі і верхній частині сітчастого шару дерми, що часто мають химерні або геометричні форми;
- периваскулярні та інтерстиціальні набряки в сосочковому шарі дерми;
- переважно круглоклітинний інфільтрат з домішками плазмоцитів, при гострому запаленні з присутністю нейтрофілів, еозинофілів;
- сонячний еластоз;
- відсутність змін в епідермально-дермальному з’єднанні;
- можлива наявність Demodex у волосяних цибулинах.
Більш старі ушкодження при ЕТР також мали змішані запальні інфільтрати, але не тільки навколо окремих судин сосочкового шару дерми, а і судин, що походять із, так званого, «Pilosebaceous unit», що складається з волосини, волосяного фолікула, м’яза, що піднімає волос, і сальних залоз. Інфільтрати містили лімфоцити, гістіоцити та плазматичні клітини різної кількості. Домішки нейтрофілів, що мігрували між епітеліальними клітинами (процес екзоцитозу), зазвичай відмічалися при загостреннях (рис. 4.8).
Таким чином, старі запалення більшою мірою зосереджені на ушкодженні волосяних фолікулів. Інколи це мало форму гострого фолікуліту з формуванням фолікулярних й перифолікулярних інфільтратів, що викликало деструкцію, формування рубців і глибоких дефектів.
При старих ушкодженнях запалення, як правило, охоплювало дерму по всій глибині, але центральне вогнище запалення («макула») завжди локалізувалося в сосочковому шарі дерми. Загалом, запальний фон старих ушкоджень був одночасно периваскулярним та інтерстиціальним. В суміжних ділянках епідермісу або стінках фолікулів, на відміну від ранніх ушкоджень, відмічалися спонгіоз, екзоцитоз і «пальцеподібний» акантоз, що був характерним на всіх етапах розвитку ЕТР (рис. 4.9).
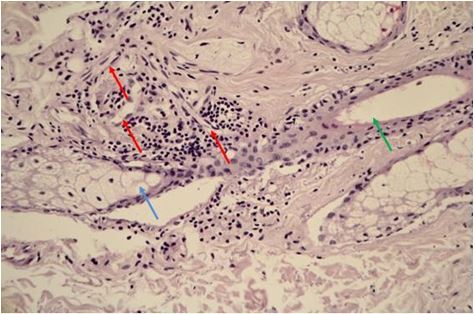
Рисунок 4.8 – ЕТР: старі ушкодження. Круглоклітинний інфільтрат верхньої частини сітчастої дерми, що оточує з одного боку скупчення спотворених звивистих судин (червоні стрілки), а з іншого – сальну залозу (синя стрілка) та волосяний фолікул (зелена стрілка), чітко видно процес екзоцитозу – міграцію запальних клітин між епітеліальними, забарвлення Г-Е (х400)
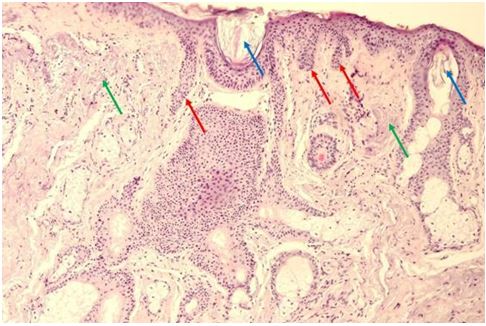
Рисунок 4.9 – ЕТР: старі ушкодження. Формування пальцеподібного
акантозу в епідермісі (червоні стрілки), дилатація фолікулів (сині стрілки), сонячний еластоз (зелені стрілки), забарвлення Г-Е, (х200)
Також загальним проявом старих ушкоджень ЕТР виявилися збільшені і розтягнуті воронки, що зазвичай заповнювалися пластинчастим кератином та еозинофільними залишками Demodex (рис. 4.10. А). Розширення воронок викликає розвиток епідермальних кіст, що з часом призводить до розривів епідермісу і викликає додаткове запалення.
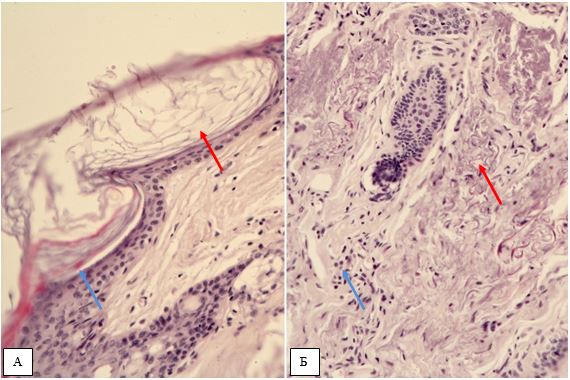 Рисунок 4.10 – ЕТР: старі ушкодження. А. Збільшена і розтягнута воронка, заповнена пластинчастим кератином
Рисунок 4.10 – ЕТР: старі ушкодження. А. Збільшена і розтягнута воронка, заповнена пластинчастим кератином
(червона стрілка) і еозинофільними залишками Demodex (синя стрілка), забарвлення Г-Е, (х400). Б. Еластолітична
гранульома: деградація еластичних волокон (червона стрілка), різнорідний запальний інфільтрат, забарвлення Г-Е, (х400)
Треба зазначити, що крім більш виражених інфільтратів, що локалізувалися перифолікулярно та перипілярно на рівні сітчастої дерми, старі ушкодження часто мали прояви гранулематозного запалення у вигляді гранульом різних типів та розмірів.
Під час співставлення клінічних та морфологічних даних виявилося, що гранульоми зазвичай спостерігалися у вигляді червоно-коричневих або жовтуватих папул, які знаходились в симетричних ділянках обличчя, заглиблюючись глибину дерми.
Гістологічно, «класичні» гранульоми ЕТР включали в себе великий, центрально-розташований порожній простір, оточений шаром нейтрофілів і численними периферійними гістіоцитами з домішкою лімфоцитів. Інші типи гранульоми, що зустрічались, були еластолітичні (рис. 4.10. Б) та так звані «дифузні», що завжди характеризувалися туберкульозо-подібною реакцією в місці ушкодженого волосяного фолікула.
Послідовні гістологічні зрізи демонстрували наявність кліща Demodex або його еозинофільні залишки в центрі накопичення тканинних макрофагів різних типів гранульом. Ці знахідки зміцнюють теорію участі кліща Demodex в розвитку ЕТР.
До постійних супутників хронічного запалення можна віднести дилатацію фолікулів, сонячний еластоз та стромальний фіброз. Відмінними рисами сонячного еластозу старих ушкоджень були більша глибина розповсюдження та обов’язкова гістіоцитарна реакція оточуючих тканин (рис. 4.11).
Візуально старі ушкодження при ЕТР характеризувалися стовщенням дерми, нерівною поверхнею з вузликами, що по суті були гіперплазією сальних залоз та фолікулярною закупоркою з формуванням ретенційних елементів (рис. 4.12). Спостерігалось збільшення об’єму сальних залоз і помірний фіброз. Сальні часточки були надзвичайно великі, як при старечій сальній гіперплазії, але структури залоз завжди відповідали нормі, що ставало ключем до верифікації ЕТР.
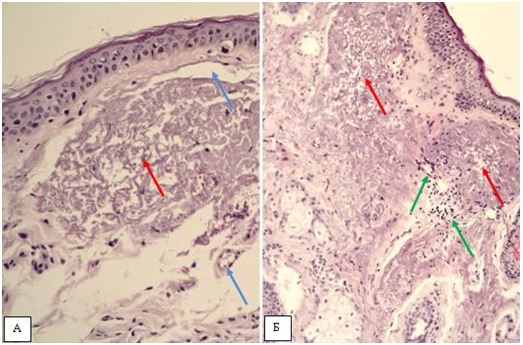
Рисунок 4.11 – ЕТР: сонячний еластоз (червоні стрілки). А. Ранні зміни – локалізація еластозу в ділянці сосочкового шару дерми, навколо розташовані дилятовані судини (сині стрілки), забарвлення Г-Е, (х400). Б. Старі ушкодження – гістіоцитарна реакція сполучної тканини навколо ділянок еластозу (зелені стрілки), забарвлення Г-Е, (х200)
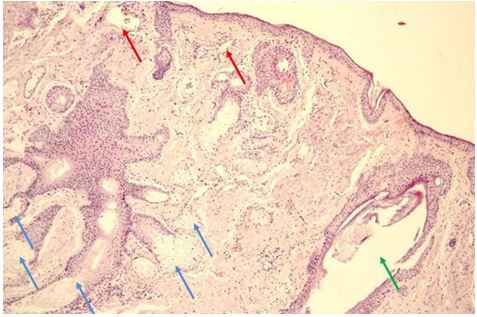
Рисунок 4.12 – ЕТР: старі ушкодження. Поверхневі телеангіектазії (червоні стрілки), гіперплазія сальних залоз (сині стрілки)
та фолікулярна закупорка з формуванням ретенційного елементу – кісти (зелена стрілка), забарвлення Г-Е, (х200)
Таким чином, морфологічні зміни при старих ушкодженнях ЕТР можна упорядкувати за пунктами:
- хронічне запалення (змішані інфільтрати з плазмоцитами), що носить перифолікулярний та перипілярний характер;
- запалення часто має ознаки гранулематозного: поряд із «класичними» гранульомами з великим центрально порожнім простором часто зустрічаються еластолітичні або дифузні типи гранульом;
- наявність кліща Demodex або його еозинофільних залишків у розтягнутих воронках;
- присутність ретенційних елементів, таких як воронкові кісти;
- сонячний еластоз з обов’язковою гістіоцитарною реакцією;
- гіперплазія сальних залоз без ушкодження їх будови.
Діагностично значущі морфологічні ознаки, що були знайдені в зразках ЕТР, та ступінь їх інтенсивності було занесено в таблицю 4.1, для аналізу можливої залежності гістологічних змін біоптатів від віку пацієнтів.
Таблиця 4.1 – Морфологічні ознаки еритематозно-телеангієктатичних форм розацеа
| № за/п | Клінічний діагноз | Вік пацієнток | Ретенційні елементи | Кліщ Demodex / або еозинофільні залишки | Інтенсивність запалення | Сонячний еластоз | Гіперплазія сальних залоз | Пальцеподібний акантоз |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1 | ЕТР | 21 | ++ | – | + | ++ | – | – |
| 2 | ЕТР | 33 | + | – | ++ | ++ | + | + |
| 3 | ЕТР | 33 | ++ | + | + | ++ | + | + |
| 4 | ЕТР | 34 | + | – | + | ++ | ++ | + |
| 5 | ЕТР | 34 | + | – | ++ | + | – | + |
Продовження таблиці 4.1
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 6 | ЕТР | 36 | + | – | + | ++ | – | + |
| 7 | ЕТР | 38 | ++ | + | + | ++ | – | + |
| 8 | ЕТР | 39 | + | – | ++ | + | – | + |
| 9 | ЕТР | 49 | – | – | + | + | – | – |
| 10 | ЕТР | 60 | + | + | ++ | ++ | + | – |
| 11 | ЕТР | 63 | – | – | ++ | ++ | ++ | + |
Примітка. За ступенем інтенсивності (-) – ознака відсутня, (+) – ознака присутня, (++) – виражені патологічні зміни.
Аналіз даних таблиці 4.1 показав незалежний розподіл морфологічних характеристик різних пацієнтів з ЕТР, що підтверджує необхідність індивідуального підходу для визначення ступеня важкості та стадії перебігу цього захворювання в кожному окремому випадку з обов’язковим гістологічним та імуногістохімічним аналізом біопсійного матеріалу.
4.2 Імуногістохімічна характеристика рівнів експресії маркеру ендотелію судин CD34, фактора росту ендотелію судин (VEGF), рецепторів андрогенів/естрогенів AR/ER та циклооксигенази-2 в біоптатах шкіри пацієнтів з еритематозно-телеангіектатичною формою розацеа
Завдяки маркеру ендотеліальної диференціації CD34 в біоптатах ЕТР, було відокремлено судини різних шарів дерми і зафіксовано значне збільшення кількості в напрямку від сосочкового до глибокої частини сітчастого шару дерми (рис. 4.13).
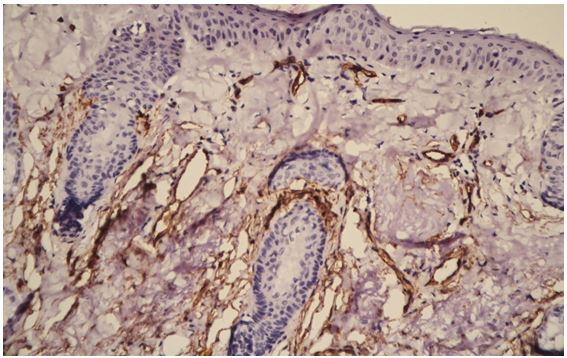
Рисунок 4.13 – Збільшення кількості судин в напрямку від сосочкового до глибокої частини сітчастого шару дерми (звертає увагу надмірне
накопичення капілярів та їх неприродна щільність сітчастому шарі дерми), ІГХ, мембранна реакція ендотелію з маркером CD34, (х200)
Розгалуження, дилатація та ущільнення капілярної сітки спостерігалися навколо сальних залоз та волосяних фолікулів. Порівняно із здоровою шкірою, треба відзначити значне збільшення площі та периметру капілярної сітки сітчастого шару дерми. Надмірне накопичення капілярів та їх неприродна щільність не дозволили оцінити кількість судин сітчастого шару дерми, на відміну від сосочкового шару дерми з великими телеангіектазіями, безпосередньо розташованої під епідермісом (рис. 4.13).
Для стандартизації результатів розрахунок середньої кількості судин, їх периметру та площі проводився в трьох полях зору (гарячих точках) тільки сосочкового шару дерми (безпосередньо під епідермісом) кожного окремого випадку при збільшені (х400) (рис. 4.14. А, Б, В).
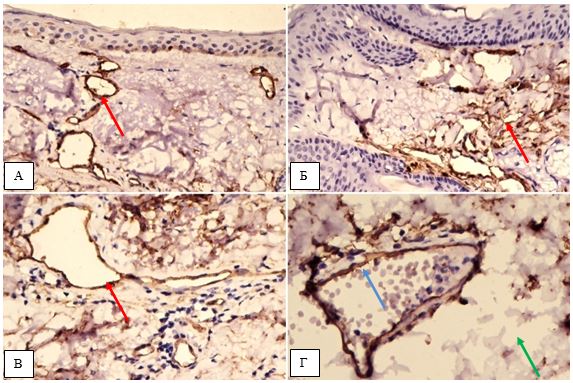
Рисунок 4.14 – ЕТР. А, Б, В. «Гарячі точки» з розтягнутими, спотвореними та дилятованними судинами, формуванням
телеангіектазій (червоні стрілки). Г. Наявність чіткого ендотеліального окантування із середини судини, як вірогідна
ознака судинного елементу (синя стрілка), на відміну від набряку строми (зелена стрілка), ІГХ, мембранна реакція ендотелію з CD34, (х400)
Враховувалися судинні елементи з наявністю чітких CD34-позитивних ендотеліальних клітин для запобігання помилково позитивних результатів через значний набряк строми (рис. 4.14. Г) або можливого тангенціального зрізу судинної стінки. Кількісне оцінювання судинного компоненту строми біоптатів проводилося в програмі обробки цифрових зображень ImageJ: Analyze>Tools>ROI Manager (рис. 4.15).
Збільшення середнього периметру судинної сітки демонструє підвищення кількості судинних елементів (капілярів, венул), порівняно із здоровою шкірою, а збільшення площі – свідчить про ступінь дилатації (розширення та повнокров’я). Результати вимірів занесені в таблицю 4.2.
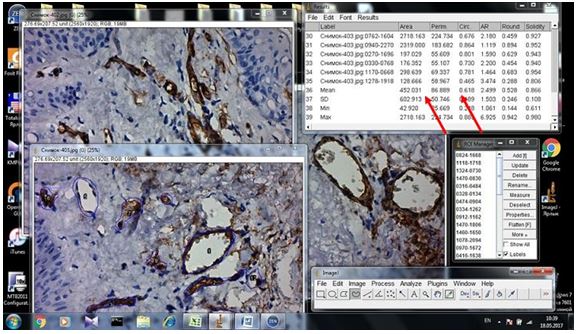
Рисунок 4.15 – Розрахунок середніх значень периметру та площі судин «гарячих точок» сосочкового шару дерми
програмою обробки цифрових зображень ImageJ (червоні стрілки вказують на визначені параметри в таблиці результатів)
Кількість судинних елементів сосочкового шару дерми в 3 «гарячих точках» всіх зразків ЕТР коливалася від 21 до 41 (медіана 31) і в середньому склала (M±m) 31,45 ± 1,95 (SD 6,47) (табл. 3.2). Для порівняння, у здоровій шкірі ці параметри склали від 7 до 12 (медіана 8), а в середньому – 7,63 ± 0,40 (1,26) (p<0,001). Процеси васкулогенезу спричинюють значне збільшення кількості судинних елементів в ЕТР, часто завдяки ростовим факторам, що активуються тригерними чинниками.
Середні площі судин досліджених випадків ЕТР коливалися від 206,13 ± 31,30 (174,27) мкм2 до 1159,92 ± 458,79 (2102,41) мкм2, і в середньому склала 549,62 ± 83,57 (277,18) мкм2, що значно перевищило показники здорової шкіри – від 32,01 ± 1,78 (5,63) мкм2 до 141,01 ± 7,87 (24,90) мкм2, а в середньому 68,62 ± 5,95 (18,81) мкм2(p<0,001). Такі дані свідчать про значну дилятацію (повнокрів’я, розтягнення) судинного русла дерми при ЕТР, порівняно із здоровою шкірою, як наслідки втрати тонусу стінок та ушкодження ендотелію.
Таблиця 4.2 – Кількісне оцінювання CD34+ судинного компоненту сосочкового шару дерми пацієнтів з ЕТР
| № за/п | Вік
(р.) |
Сумарна кількість(в 3 п/зору)
CD34+ судин (n) |
Середня площа(мкм2) | Середній периметр(мкм) | ||||
| М | SD | m | М | SD | m | |||
| 1 | 21 | 31 | 206,134 | 174,267 | 31,299 | 72,256 | 52,516 | 9,432 |
| 2 | 33 | 38 | 361,016 | 480,758 | 77,989 | 84,693 | 61,497 | 9,976 |
| 3 | 33 | 26 | 332,682 | 347,048 | 68,061 | 90,318 | 64,557 | 17,712 |
| 4 | 34 | 40 | 669,276 | 1367,878 | 216,282 | 102,515 | 65,438 | 10,346 |
| 5 | 34 | 32 | 597,006 | 971,580 | 171,754 | 114,826 | 79,296 | 14,017 |
| 6 | 36 | 29 | 282,946 | 319,808 | 52,542 | 77,115 | 58,563 | 10,875 |
| 7 | 38 | 25 | 861,017 | 1064,648 | 212,9296 | 124,095 | 90,444 | 18,088 |
| 8 | 39 | 41 | 581,098 | 662,641 | 103,489 | 110,726 | 70,208 | 10,964 |
| 9 | 49 | 21 | 1159,916 | 2102,411 | 458,791 | 130,635 | 113,759 | 24,824 |
| 10 | 60 | 28 | 542,714 | 472,108 | 89,22 | 109,458 | 66,412 | 20,685 |
| 11 | 63 | 35 | 452,031 | 602,913 | 103,415 | 86,889 | 50,746 | 8,702 |
| В серед-ньому | 31,45±1,95* | 549,62 | 277,18 | 83,57 | 100,32 | 19,34 | 5,83 | |
Примітка. * – вказано M±m.
Середній периметр судинного русла ЕТР коливався в межах від (77,12 ± 10,88) (58,56) мкм до (130,64 ± 24,82) (113,76) мкм, що в середньому становило (100,32 ± 5,83) (19,34) мкм. Це демонструє сильне розгалуження судин та активність процесів васкулогенезу в ЕТР, на відміну від здорової шкіри зі значно біднішими показниками периметрів «гарячих точок» з (25,20 ± 1,90) (6,01) мкм до (42,98 ± 2,88) (9,12) мкм, в середньому – (36,78 ± 2,49) (7,86) мкм.
Графічні відображення залежності розподілу середніх площ та периметрів зразків ЕТР від віку пацієнтів представлено на рис. 4.16 та рис. 4.17, відповідно. Маємо тенденцію до деякого підвищення показників ЕТР в проміжок з 30 до 50 років, що співпадає із загальними положеннями.
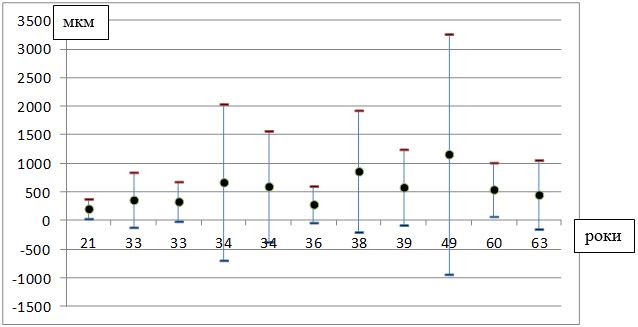
Рисунок 4.16 – Розподіл середніх площ судин сосочкового слою дерми зразків шкіри із ЕТР за віком пацієнтів
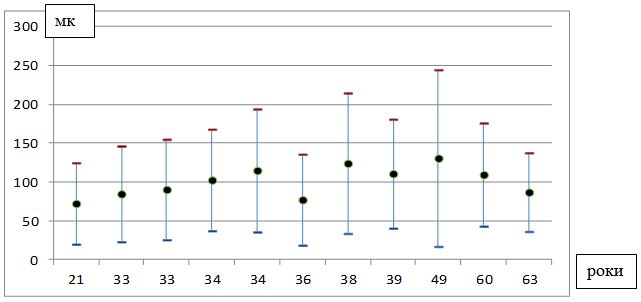 Рисунок 4.17 – Розподіл середніх периметрів судинного русла зразків ЕТР за віком пацієнтів
Рисунок 4.17 – Розподіл середніх периметрів судинного русла зразків ЕТР за віком пацієнтів
Активація процесів васкулогенезу неможлива без участі фактора росту ендотелію судин VEGF, що експресується в цитоплазмі епітеліальних, ендотеліальних та стромальних клітин. Наявність експресії цього фактора чітко корелює із щільністю судин, як показано на рис. 4.18.
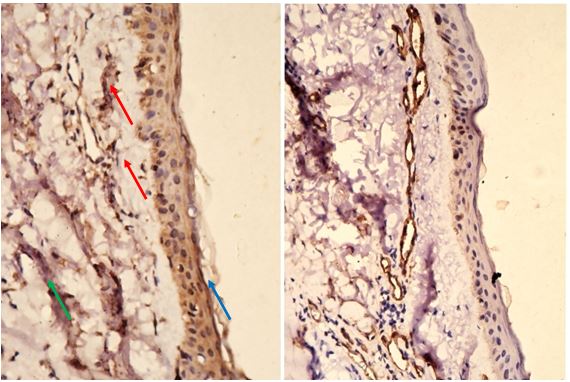
Рисунок 4.18 – ЕТР. А. Цитоплазматична експресія маркеру VEGF в ендотелії судин (червоні стрілки), поодиноких стромальних
клітинах (зелена стрілка) та епідермісі (синя стрілка), ІГХ, (х400). Б. Мембранна реакція ендотелію судин з маркером CD34, що демонструє високу щільність капілярної сітки, ІГХ, (х400)
У дослідженні оцінювалась інтенсивність забарвлення маркером VEGF в епідермісі та епітелії волосяних фолікулів/епітелії залоз біоптатів ЕТР, яка зустрічалась у вигляді слабкої (+) та помірної (++) інтенсивності (рис. 4.19). Більшість випадків демонстрували рівномірне забарвлення (рис. 4.20. А), але треба відзначити і кластерні (вогнищеві) реакції, що мали місце в акантотичних тяжах (рис. 4.20. Б).
Для стандартизації результатів дослідження, інтенсивність забарвлення оцінювали в балах яскравості тільки коричневого кольору DAB програмою обробки цифрових зображень ImageJ:
Plugins>Colourfunctions>ColourDeconvolution+ Analyze >Histogram (рис. 3.21), де біле – це 255 балів (максимальне значення), а 0 – чорне, тобто чим інтенсивність VEGF сильніша, тим кількість балів повинна бути менша. Всі дані вимірів середньої інтенсивності занесені в таблицю 4.3.
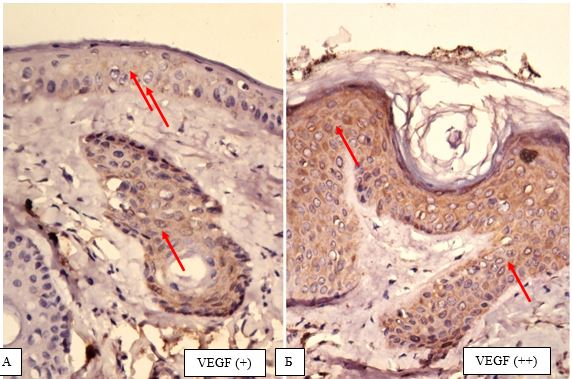
Рисунок 4.19 – ЕТР. А. Епідерміс та волосяний фолікул, цитоплазматична реакція з маркером VEGF слабкої інтенсивності (+) (червоні стрілки), ІГХ, (х400). Б. Розтягнута воронка, заповнена пластинчатим кератином, реакція епідермісу та «пальцеподібних» акантотичних тяжів помірної інтенсивності (++)(червона стрілка), ІГХ, (х400).
Середні бали інтенсивності реакції епідермісу біоптатів з ЕТР коливалися від 168,79 (SD 34,94) (найсвітліший зразок) до 54,71 (39,22) (найтемніший), і в середньому склали (M±m) 113,40 ± 9,77 (32,40). Для фолікулярного епітелію та епітелію залоз числові дані виявилися 157,77 (42,60) (найсвітліший зразок) до 93,07 (44,89) (найтемніший), в середньому – 122,70 ± 6,14 (20,36) відповідно (табл. 4.3). Для порівняння, показники здорового епідермісу складали 184,25 (28,69), а фолікулярного епітелію / епітелію залоз 193,81 (31,04), що відображає базовий рівень експресії VEGF [91].
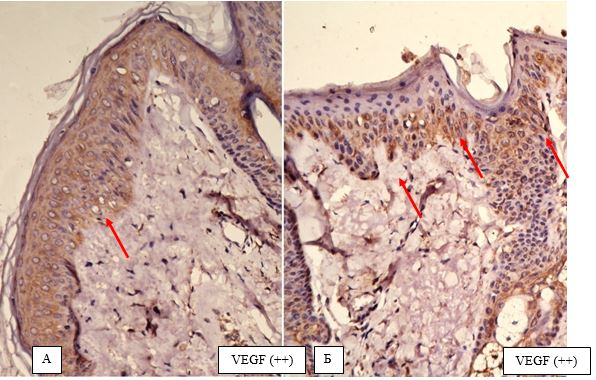
Рисунок 4.20 – ЕТР. А. Епідерміс та волосяний фолікул, рівномірна цитоплазматична реакція з маркером VEGF, що охоплює всі шари
епідермісу, крім зроговілого, ІГХ метод, (червона стрілка),(х400). Б. Кластерна (вогнищева) реакція тільки в ділянках акантотичних
тяжів та футляру волосяного фолікула (червоні стрілки), ІГХ, (х400)
Таблиця 4.3 – Інтенсивність експресії фактора росту ендотелію VEGFв ЕТР в балах яскравості за гістограмою програми ImageJ
| № за/п | Вік(р.) | Рівень експресії VEGFепідермісу шкіри | Рівень експресії VEGFфолікулярного епітелію та епітелію залоз | ||
| М | SD | М | SD | ||
| 1 | 21 | 102,664 | 41,236 | 148,721 | 45,45 |
| 2 | 33 | 72,636 | 33,212 | 118,859 | 37,646 |
| 3 | 33 | 152,013 | 36,919 | 129,826 | 41,231 |
| 4 | 34 | 106,492 | 42,2 | 129,662 | 34,393 |
Продовження таблиці 4.3
| № за/п | Вік
(р.) |
Рівень експресії VEGF
епідермісу шкіри |
Рівень експресії VEGF
фолікулярного епітелію та епітелію залоз |
||
| М | SD | М | SD | ||
| 5 | 34 | 168,789 | 34,941 | 157,767 | 42,596 |
| 6 | 36 | 100,963 | 37,521 | 107,407 | 45,358 |
| 7 | 38 | 113,122 | 40,25 | 117,77 | 34,541 |
| 8 | 39 | 54,714 | 39,217 | 93,071 | 44,892 |
| 9 | 49 | 118,822 | 30,159 | 102,664 | 45,363 |
| 10 | 60 | 132,01 | 33,236 | 139,087 | 33,557 |
| 11 | 63 | 125,137 | 34,326 | 104,832 | 32,513 |
| В середньому | 113,40±9,77* | 32,40 | 122,70±6,14* | 20,36 | |
Примітка. * – вказано M±m.
Рисунок 4.21 – Розрахунок середніх значень яскравості цитоплазматичного забарвлення маркеру VEGF програмою
обробки цифрових зображень ImageJ (гістограма – червоне коло).
Розподіл значень експресії VEGF за віком пацієнтів представлений на рис. 4.22 та рис. 4.23. Загалом, рівні інтенсивності епідермісу були нижчими, ніж фолікулярного епітелію та епітелію залоз.
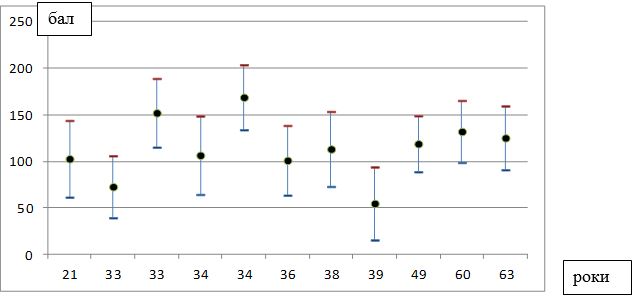
Рисунок 4.22 – Розподіл середніх значень яскравості експресіїVEGF епідермісу шкіри з ЕТР за віком пацієнтів
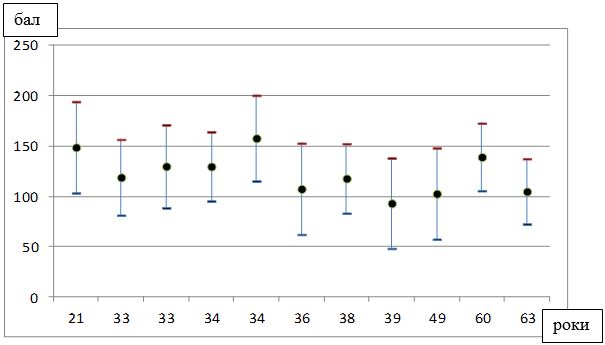
Рисунок 4.23 – Розподіл середніх значень яскравості експресії VEGF фолікулярного епітелію та епітелію залоз з ЕТР за віком пацієнтів
Рецепторний апарат, що розташований в клітинах шкіри, має великий вплив на вибір терапевтичних заходів при ЕТР. Саме підвищення андрогенових рецепторів в епідермісі та епітелії залоз з ендогенною стимуляцією наднирниками у жінок можливо призводить до гіперпластичних процесів сальних залоз та формування ретенційних елементів (рис. 4.24).
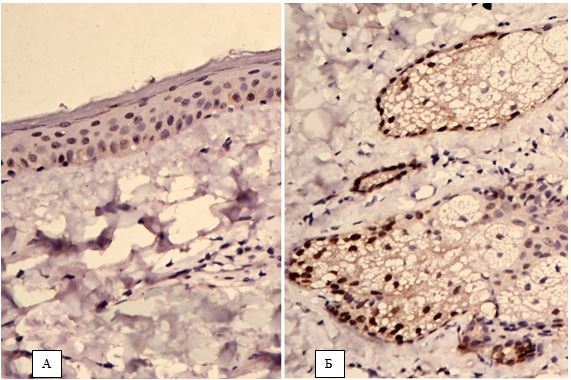 Рисунок 4.24 – ЕТР. А. Інтрануклеарна експресія AR в епідермісі, ІГХ, (х400). Б. Надмірна інтрануклеарна експресія AR в епітелії сальних залоз, ІГХ, (х400).
Рисунок 4.24 – ЕТР. А. Інтрануклеарна експресія AR в епідермісі, ІГХ, (х400). Б. Надмірна інтрануклеарна експресія AR в епітелії сальних залоз, ІГХ, (х400).
Дослідження андрогенових рецепторів в епідермісі та фолікулярному епітелії/епітелії залоз проводилося з ІГХ маркерами AR в 3 полях зору програмою обробки цифрових зображень ImageJ: Plugins>ImmunoRatio (рис. 4.25, рис. 4.26 відповідно) для розрахунку середніх значень. Дані вимірів занесені в таблицю 4.4.
Для епідермісу середні показники експресії AR коливалися в межах від 5,7 до 1,1 (медіана 2,3), і в середньому склали 2,59 ± 0,37 (1,27), що було значно менше ніж показники експресії AR сальних залоз, які більше ніж в 4 рази їх перевищили, а саме – коливалися від 23,8 до 3,5 (медіана 12,8), середнє значення 12,41 ± 1,87 (6,74) (табл. 4.4). Це пояснює глибокі патологічні зміни сальних залоз при тривалому легкому перебігу ЕТР із персистуючою еритемою без відповідного лікування.
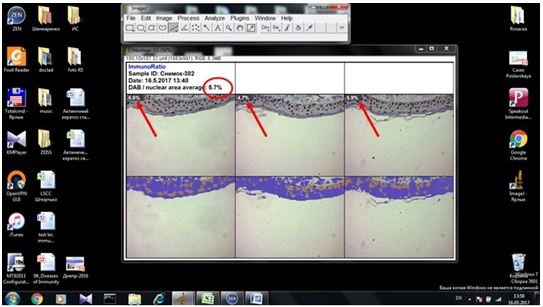
Рисунок 4.25 – Розрахунок індексів інтрануклеарної експресі маркеру AR епідермісу в 3 п/зору програмою обробки цифрових зображень
ImageJ (червоні стрілки) з визначенням середнього значення (червоне коло)
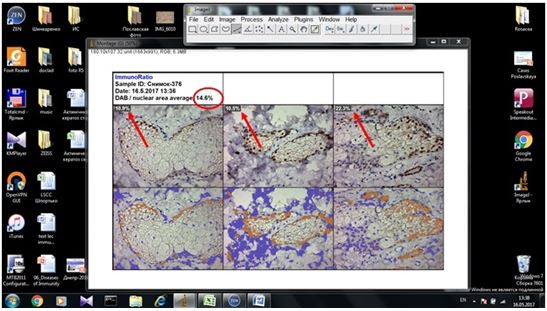
Рисунок 4.26 – Розрахунок індексів інтрануклеарної експресії AR сальних залоз в 3 п/зору програмою ImageJ з визначенням
середнього значення (червоне коло)
Таблиця 4.4 – Інтрануклеарна експресія маркеру AR в епідермісі та епітелії сальних залоз біоптатів ЕТР
| № за/п | Вік
(р.) |
Середня кількість (в 3 п/зору) AR+ ядер епідермісу (М) | Середня кількість (в 3 п/зору) AR+ ядер сальних залоз (М) |
| 1 | 21 | 3,20 | 14,60 |
| 2 | 33 | 3,20 | 8,10 |
| 3 | 33 | 2,30 | 23,80 |
| 4 | 34 | 2,40 | 5,40 |
| 5 | 34 | 2,40 | 3,50 |
| 6 | 36 | 1,10 | 11,80 |
| 7 | 38 | 2,10 | 21,30 |
| 8 | 39 | 2,30 | 12,90 |
| 9 | 49 | 2,20 | 12,80 |
| 10 | 60 | 5,70 | 14,60 |
| 11 | 63 | 1,30 | 8,20 |
| В середньому, M±m (SD) | 2,59±0,37 (1,27) | 12,41±1,87 (6,74) | |
Графічні відображення залежності розподілу середніх значень експресії AR в зразках ЕТР від віку пацієнтів представлені на рис. 4.27. Спостерігався досить рівномірний рівень експресії в епідермісі, як загальний прояв захворювання, і значний розбіг в епітелії залоз, що можливо відіграє значну роль в індивідуальній і досить непередбачувальній відповіді на терапію кожного окремого пацієнта різних вікових категорій.
Наступним кроком роботи стало дослідження естрогенових рецепторів для сумарного висновку про стан гормон-залежних структур шкіри при ЕТР. Треба зазначити, що рівень експресії ЕR був значно нижчим, ніж AR і демонстрував лише окремі поодинокі ядерні забарвлення різної сили інтенсивності як в епідермісі, так і в фолікулярному епітелії, що вносить додаткове розуміння в патогенез ЕТР (рис. 4.28) [119].
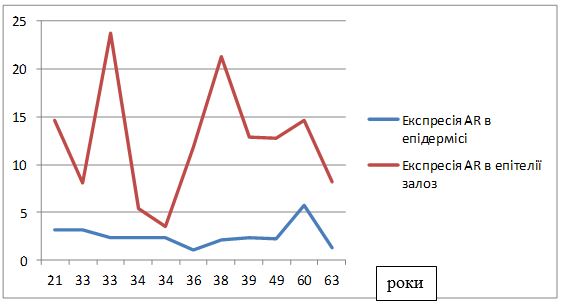
Рисунок 4.27 – Залежність експресії AR в біоптатах шкіри пацієнтів з ЕТР від віку пацієнтів
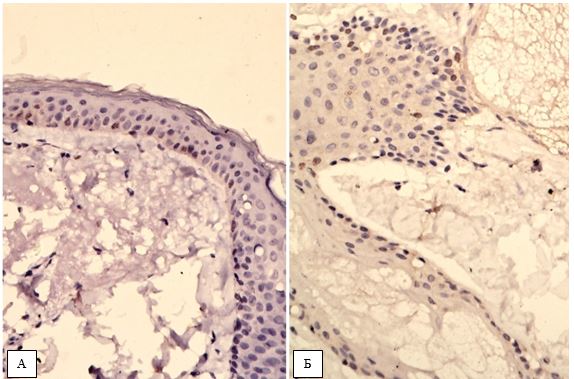
Рисунок 4.28 – ЕТР. А. Слабка інтрануклеарна експресія ЕR в епідермісі шкіри, ІГХ, (х400). Б. Поодинока інтрануклеарна
експресія ЕR в епітелії сальних залоз, ІГХ, (х400)
Для стандартизації результатів, розрахунки експресії ЕR також проводили в 3 полях зору програмою ImageJ: Plugins>ImmunoRatio (рис. 4.29, рис. 4.30 відповідно). Епітелій сальних залоз загалом мав трохи більші показники експресії ЕR, ніж епідермальні ЕR, але вірогідної різниці встановлено не було. Дані вимірів занесені в таблицю 4.5.
Рисунок 4.29 – Розрахунок індексів інтрануклеарної експресії маркеру ER сальних залоз в 3 п/зору програмою обробки цифрових
зображень ImageJ (червоні стрілки) з визначенням середнього значення (червоне коло)
Для епідермісу середні показники експресії ЕR коливалися в межах від 0,4 до 0 (медіана 0,2), і в середньому склали 0,16 ± 0,04 (0,12), показники експресії ЕR сальних залоз, які варіювали в більшому діапазоні від 2,4 до 0 (медіана 0,52), мали середнє значення 0,65 ± 0,20 (0,66) (табл. 4.5).
Графічне зображення варіантів експресії ЕR залежно від віку пацієнтів демонструє коливання значень біля нуля з поодинокими піками експресії ЕR в епітелії залоз, що не дає можливості описати будь-яку тенденцію, крім незалежного розподілу (рис. 4.31).
Рисунок 4.30 – Розрахунок індексів інтрануклеарної експресії маркеру ER сальних залоз в 3 п/зору програмою обробки цифрових
зображень ImageJ (червоні стрілки) з визначенням середнього значення (червоне коло)
Таблиця 4.5 – Інтрануклеарна експресія маркеру ЕR в епідермісі та сальних залозах біоптатів ЕТР
| № за/п | Вік
(роки) |
Середня кількість (в 3 п/зору) ЕR+ ядер епідермісу (М) | Середня кількість (в 3 п/зору) ЕR+ ядер сальних залоз (М) |
| 1 | 21 | 0,1 | 0,3 |
| 2 | 33 | 0,1 | 0,4 |
| 3 | 33 | 0,2 | 0,1 |
| 4 | 34 | 0,4 | 1 |
| 5 | 34 | 0,2 | 0,9 |
| 6 | 36 | 0,3 | 0,7 |
| 7 | 38 | 0,1 | 2,4 |
| 8 | 39 | 0 | 0 |
| 9 | 49 | 0,2 | 0,7 |
| 10 | 60 | 0,2 | 0,5 |
| 11 | 63 | 0 | 0,2 |
| В середньому, M±m (SD) | 0,16±0,04 (0,12) | 0,65±0,20 (0,66) | |
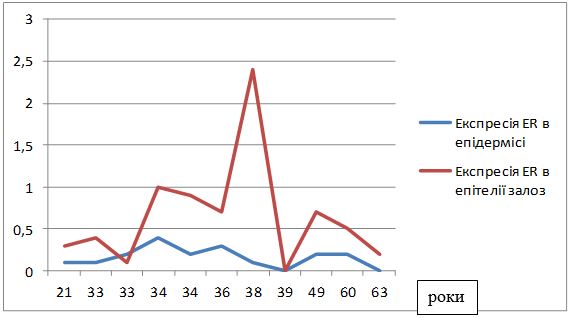
Рисунок 4.31 – Залежність експресії ЕR в біоптатах шкіри
пацієнтів з ЕТР від віку пацієнтів
Як було зазначено вище, запалення є обов’язковим і важливим компонентом патогенезу розацеа. Дослідження СОХ-2 – ферменту, що відіграє провідну роль в накопиченні прозапальних цитокінів, у роботі було проведене з однойменним маркером СОХ-2. Останній дає цитоплазматичне забарвлення в епітеліальних, стромальних та імунних клітинах, що розташовані біля ділянок запалення (рис. 4.32). Інтенсивність забарвлення СОХ-2 різних випадків варіювала, але не перевищувала (+).
Для стандартизації результатів інтенсивність забарвлення також оцінювалася в балах яскравості програмою ImageJ (рис. 4.33).
Усі дані вимірів були занесені в таблицю 4.6.
Середні бали експресії СОХ-2 епідермісу біоптатів з ЕТР коливалися від 205,05 (SD 41,29) (найсвітліший зразок) до 143,87 (40,93) (найтемніший), і в середньому склали 182,74 ± 5,02 (16,65). Показники фолікулярного епітелію та епітелію залоз варіювали від 199,37 (38,95) (найсвітліший зразок) до 162,82 (32,86) (найтемніший), і в середньому відповідно 176,99 ± 4,03 (13,38) (табл. 4.6).
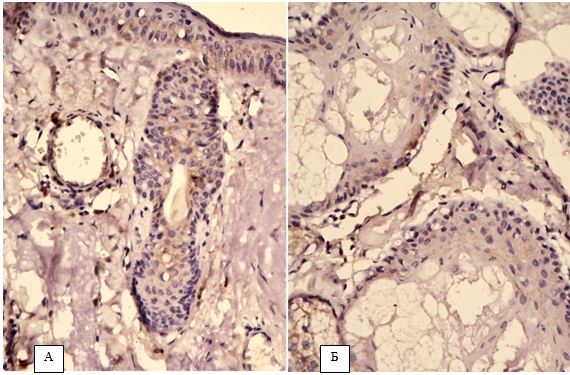
4.32. ЕТР – А. Цитоплазматична експресія СОХ-2 (+) в епідермісі та фолікулярному епітелії, ІГХ, (х400).
Б. Цитоплазматична експресія СОХ-2 (+) в епітелії залоз, ІГХ, (х400)
Рисунок 4.33 – Розрахунок середніх значень яскравості цитоплазматичного забарвлення маркеру СОХ-2 програмою
обробки цифрових зображень ImageJ (гістограма – червоне коло)
Таблиця 4.6 – Інтенсивність експресії СОХ-2в ЕТР в балах яскравості за гістограмою програми ImageJ
| №
за/п |
Вік
(роки) |
Рівень експресії СОХ-2
епідермісу шкіри |
Рівень експресії СОХ-2
фолікулярного епітелію та епітелію залоз |
||
| М | SD | М | SD | ||
| 1 | 21 | 185,69 | 35,166 | 162,821 | 32,863 |
| 2 | 33 | 181,168 | 36,056 | 174,991 | 33,119 |
| 3 | 33 | 205,041 | 33,168 | 175,368 | 35,545 |
| 4 | 34 | 182,297 | 31,921 | 174,712 | 26,475 |
| 5 | 34 | 180,154 | 32,682 | 182,25 | 40,679 |
| 6 | 36 | 205,053 | 41,29 | 199,368 | 38,953 |
| 7 | 38 | 143,866 | 40,925 | 158,598 | 42,683 |
| 8 | 39 | 170,915 | 39,202 | 177,239 | 39,457 |
| 9 | 49 | 191,152 | 41,852 | 183,116 | 29,54 |
| 10 | 60 | 186,647 | 22,097 | 160,994 | 27,532 |
| 11 | 63 | 178,149 | 38,442 | 197,421 | 28,401 |
| В середньому, M±m (SD) | 182,74±5,02 (16,65) | 176,99±4,03 (13,38) | |||
Для порівняння, середні показники здорового епідермісу складали 201,34 (43,67), а фолікулярного епітелію / епітелію залоз – 211,83 (34,90), що дає уяву про базовий рівень експресії СОХ-2. Розподіл значень експресії СОХ-2 за віком пацієнтів представлений на рис. 4.34 та рис. 4.35.
На графіках розподілу варіантів середніх значень експресії СОХ-2 епідермісу випадків ЕТР за віком пацієнтів відзначається досить однорідний масив з коливаннями в межах коридору від 150 до 200 балів, незалежно від віку, що надає експресії СОХ-2 ознаки постійної присутності при ЕТР і необхідності терапевтичного впливу на цю ланку патогенезу [119].
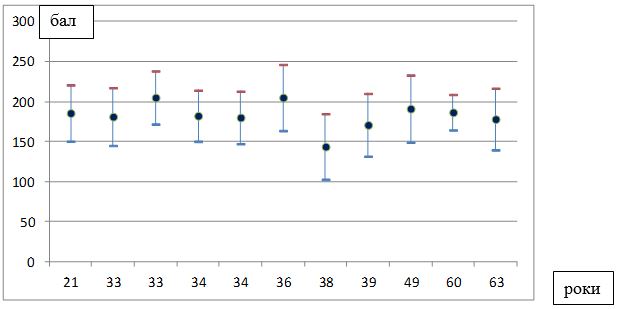 Рисунок 4.34 – Розподіл варіантів середніх значень експресії СОХ-2 епідермісу випадків ЕТР за віком пацієнтів
Рисунок 4.34 – Розподіл варіантів середніх значень експресії СОХ-2 епідермісу випадків ЕТР за віком пацієнтів
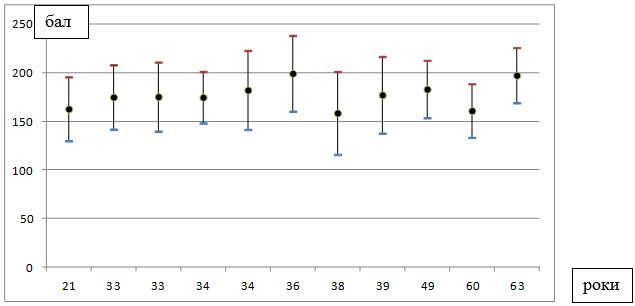
Рисунок 4.35 – Розподіл варіантів середніх значень експресії СОХ-2 фолікулярного епітелію та епітелію залоз випадків ЕТР за віком пацієнтів
Таким чином, ЕТР має широкий спектр патологічних ознак, що потребує індивідуального діагностичного підходу у вигляді обов’язкового гістологічного (встановлення типу, стадії, давності ушкодження) та імуногістохімічного (експресія маркерів CD34, VEGF, AR/ER, COX-2) досліджень для вибору адекватного терапевтичного впливу на всі ланки патогенезу.
4.3 Результати співставлення даних морфологічних та імуногістохімічних методів дослідження з даними дерматоскопічної картини розацеа
При попередньому дерматоскопічному дослідженні були виявлені зміни, які також візуалізувалися при електронній мікроскопії. При співставленні виявлених дерматоскопічних і патоморфологічних ознак були зроблені висновки.
Кисти, заповнені кератином, також візуалізуються і при дерматоскопії. При цьому при розацеа вони часто поєднуються з наявністю фолікулярних пробок (коефіцієнт кореляції r=+ 0,66; p<0,05) і мікропустул (r=+0,67; p<0,05).
Дерматоскопія дозволяє з високою ймовірністю візуалізувати запалення навколо волосяних фолікулів – r=+0,87; p<0,001 між результатами гістологічного і дерматоскопічного досліджень.
Дерматоскопія дозволяє візуалізувати початкові пустули, яких не видно неозброєним оком, тим самим бачити перехід ЕТР в ППР. При пустулізації запалення навколо фолікула (перифолікулярне) яскравіше, що чітко асоціюється з видимими при дерматоскопії мікропустулами (r=+0,74; p<0,01).
Товщина і поширеність судин корелює з рівнем експресії AR/ER рецепторів в епідермісі і фолікулах. Так, виражене розширення судин супроводжується підвищенням експресії AR рецепторів в епітелії залоз (r=+0,75; p<0,01), а гіллястість судин з формуванням полігональної судинної сітки в ділянці ураження – підвищенням експресії ЕR в епідермісі (r=+0,70; p<0,05) і сальних залозах (r=+0,60; p<0,05).
Гіперплазія сполучної тканини навколо волосяних фолікулів, яка виявляється при гістологічному дослідженні, корелює з розширенням гирл волосяних фолікулів, що візуалізуються при дерматоскопії (r=+0,74; p<0,01).
Спираючись на результати дерматоскопічного дослідження, важкий перебіг розацеа здебільшого асоціюється з виявленням запалення навколо фолікула (r=+0,98; p<0,001), великої кількості розширених гирл волосяних фолікулів (r=+0,60; p<0,05), широких гіллястих судин (r=+0,63; p<0,05) та мікропустул (r=+0,62; p<0,05).
Тому можна зробити висновок, що дерматоскопія може бути застосована в практиці лікарів дерматовенерологів як допоміжний неінвазивний та простий у застосуванні метод візуалізації змін у шкірі при розацеа та оцінки ступеня тяжкості розацеа.
4.4 Прогнозування перебігу розацеа у жінок
Враховуючи особливості розацеа, що має прогредієнтний перебіг і рефрактерність до лікування, що проводиться, терапію для цього захворювання бажано підбирати індивідуально, залежно від превалювання тієї чи іншої ланки патогенезу хвороби та враховуючи схильність до формування у хворого тих чи інших змін при розацеа. Вчасне призначення препаратів, необхідних для купірування розвитку різних ланок патогенезу, дозволяє більш ефективно лікувати хворобу та уникати формування стійких небажаних дефектів при розацеа. Тому в комплексі діагностичного обстеження вкрай важливо мати діючий спосіб прогнозування індивідуального перебігу розацеа у хворого.
Робіт, що стосуються саме прогнозу перебігу розацеа, в доступній літературі не знайдено.
Відомий спосіб моніторингу прогресії розацеа, що включає наступні стадії:
а) отримання від індивіда біологічної проби; біологічна проба може бути пробою тканини або пробою рідини, наприклад, крові, лімфи або інтерстиціальної рідини, біопсією різного розміру,
b) аналіз отриманої проби щодо рівня експресії маркера, обраного з інтерлейкіну-8, CXCL2, CXCL3, CXCL5, CXCR1-рецептора і CXCR2-рецептора, при цьому варіації в експресії щонайменше одного з маркерів є індикатором прогресії розацеа (Заявка РФ № 2012130069, «Маркеры и способы диагностики розацеа», Дата публікації заявки 27.01.2014, бюл. № 3, заявник Галдерма Ресерч Энд Девелопмент (FR), Универзитет Мюнстер (DE)).
Проте, вказаний спосіб-прототип не дозволяє визначити прогноз перебігу захворювання, а дає змогу лише моніторувати початок прогресії розацеа. Крім того, такий спосіб не дозволяє виявити початок формування незворотних змін при прогресуванні розацеа, що, в свою чергу, негативно впливає на можливість вибору адекватної терапії.
Спільними суттєвими ознаками прототипу та пропонованого методу прогнозування є наступні:
– проведення біопсії шкіри, ураженої розацеа;
– виявлення прогностичних маркерів;
– визначення рівня експресії прогностичних маркерів.
Задачею даного дослідження було розробити спосіб прогнозування перебігу розацеа у жінок шляхом визначення рецепторів андрогенів/ естрогенів AR/ER і маркеру росту ендотелію судин VEGF в біоптатах шкіри пацієнтів та інтерпретації отриманих результатів, що забезпечить можливість заздалегідь передбачити важкість перебігу хвороби та вчасно призначити виправдану індивідуалізовану терапію хворому, тим самим забезпечити підвищення ефективності лікування та уникнути поліпрагмазії.
Вибір саме цих маркерів був обумовлений наступним. Оцінка реакції на маркер росту ендотелію судин VEGF інформує про рівень васкулогенезу і запалення в епідермісі та навколо pilosebaceousunit, адже ангіогенні фактори викликають проліферацію ендотелію капілярів та підтримують неоангіогенез та клітинну інфільтрацію. Для прогнозування перебігу захворювання оцінюється інтенсивність реакції епідермісу біоптатів та окремо фолікулярного епітелію і епітелію залоз біоптатів з використанням уніфікованої шкали забарвлення (слабка +, помірна ++, сильна +++). Згідно з отриманими показниками визначається слабкий, помірний або сильний рівень васкулогенезу в шкірі при розацеа, який відповідає хронічному перебігу (+) або загостренню (++, +++) розацеа. Підвищення рівня васкулогенезу навколо pilosebaceousunit свідчить про перехід розацеа з ЕТР у ППР і початок незворотних змін структури і розмірів сальних залоз.
Відомо, що шкіра є гормон-залежним органом. Тому визначення співвідношення та можливого підвищення експресії рецепторів до андрогену AR або рецепторів до естрогену ER в гормон-залежних структурах шкіри дає змогу виявити схильність до превалювання судинного або гіпертрофічного компонентів патогенезу розацеа у конкретного індивідуума. Встановлено, що підвищення експресії ER рецепторів в епідермісі більше ніж в 2 рази або підвищенні експресії AR рецепторів не більше ніж в 2 рази порівняно зі здоровою шкірою, свідчить про сприятливий перебіг розацеа з помірним поступовим формуванням телеангіектазій і низькою вірогідністю залучення в патологічний процес фолікулярного апарату та сальних залоз. Підвищення експресії АR рецепторів в епідермісі біоптатів більш ніж в 2 рази, та при зниженні експресії ER рецепторів в епідермісі біоптатів більш ніж в 2 рази порівняно зі здоровою шкірою свідчить про тенденцію до перебігу розацеа за гіпертрофічним типом з ущільненням шкіри і формуванням стійкої вираженої дилатації судин і раннім залученням в патологічний процес структур pilosebaceousunit і формуванням папульозних елементів. Перевищення показників експресії АR в епітелії залоз та фолікулярному епітелії більш ніж в 4 рази порівняно з епидермісом шкіри хворого свідчить про несприятливий прогноз розвитку розацеа з формуванням вираженої гіпертрофії сполучної тканини та вираженої гіперплазії сальних залоз, формуванням фолікулярних кіст та ретенційних елементів. Такий перебіг клінічно виражається нерівною, бугристою поверхнею уражених ділянок шкіри, розширенням фолікулярних воронок, формуванням вузлів та кіст. Такі зміни спотворюють вигляд хворого та мало піддаються корекції.
Загальний алгоритм прогнозування перебігу розацеа у жінок полягає у наступному: шляхом проведення біопсії шкіри, ураженої розацеа, визначають в біоптаті маркери рецепторів до андрогену AR та естрогену ER і рівень васкулогенезу в шкірі за маркером росту ендотелію судин VEGF, та при підвищенні експресії ER рецепторів в епідермісі більше ніж в 2 рази або підвищенні експресії AR рецепторів не більше ніж в 2 рази порівняно зі здоровою шкірою і при слабкому рівні васкулогенезу в шкірі прогнозують сприятливий перебіг розацеа з помірним поступовим формуванням телеангіектазій і низькою вірогідністю залучення в патологічний процес фолікулярного апарату та сальних залоз; при підвищенні експресії АR рецепторів в епідермісі біоптатів більш ніж в 2 рази, та при підвищенні експресії ER рецепторів в епідермісі біоптатів не більш ніж в 2 рази порівняно зі здоровою шкірою та при помірному рівні васкулогенезу в шкірі прогнозують перебіг розацеа за гіпертрофічним типом з ущільненням шкіри і формуванням стійкої вираженої дилятації судин і раннім залученням в патологічний процес структур pilosebaceousunit і формуванням папульозних елементів; а при перевищенні показників експресії АR в епітелії залоз та фолікулярному епітелії більш ніж в 4 рази порівняно з епідермісом шкіри хворої і при сильному рівні васкулогенезу в шкірі прогнозують несприятливий прогноз розвитку розацеа з формуванням вираженої гіпертрофії сполучної тканини та вираженої гіперплазії сальних залоз, формуванням фолікулярних кіст та ретенційних елементів.
Запропонований спосіб дозволяє прогнозувати перебіг розацеа у конкретного пацієнта, тому що в його основу покладено виявлення рівня експресії рецепторів до естрогенів і андрогенів, що має сталий та індивідуальний характер та обумовлює поступове формування різних ланок патогенезу розацеа. Також даний спосіб за рахунок визначення рівня VEGF маркера в біоптатах шкіри дозволяє виявити більш ранні ознаки прогресування захворювання та початок формування незворотних змін навколо pilosebaceousunit. Перевагою способу є можливість отримання індивідуального для кожного хворого прогнозу який базується на виявленні прогностичних маркерів в біоптаті шкіри враженої розацеа. Інтерпретація отриманих результатів, дозволяє забезпечити можливість заздалегідь передбачити важкість перебігу хвороби та дає можливість своєчасно провести адекватну індивідуалізовану медикаментозну терапію з урахуванням клініко-морфологічних особливостей розвитку цієї патології у конкретного пацієнта. Такий підхід дає можливість забезпечити підвищення ефективності лікування на 64-70 % (з імовірністю безпомилкового прогнозу 95 %), та уникнути поліпрагмазії.
Приклад 1.
Хвора К. 34 років, з клінічним діагнозом: Розацеа, еритематозно-телеангіектатична форма. Клінічно на щоках, підборідді, відзначається еритема рожевого кольору з множинними телеангіектазіями.
11.08.15 у хворої брали біоптат шкіри методом панч-біопсії, який досліджували за стандартним морфологічним методом з використанням гематоксилін-еозіну та імунохімічним методом з використанням маркеру росту ендотелію судин VEGF, маркерів рецепторів к андрогену AR та естрогену ER. Імуногістохімічний статус: загальний рівень VEGF 2+, рівеньVEGF епідермісу 168,789, рівень VEGF навколо pilosebaceousunit 157,767, рівень експресії ER в епідермісі 0,2, рівень експресії ER в залозах 0,9, рівень експресії AR в епідермісі 2,40 , рівень експресії AR в залозах 3,5.
Тобто: виявлено помірний рівень васкулогенезу в епідермісі, без вираженого запалення навколо pilosebaceousunit, вміст АR та ЕR в шкірі хворої не перевищує більш ніж в два рази вміст АR та ЕR в шкірі здорової людини, рівень AR залоз не перевищує більше ніж в 4 рази рівень AR епідермісу шкіри хворої.
Висновок: Розацеа, еритематозно-телеангіектатична форма. Прогнозовано сприятливий перебіг розацеа з помірним поступовим формуванням телеангіектазії і низькою вірогідністю залучення у патологічний процес фолікулярного апарату та сальних залоз.
Приклад 2.
Хвора Д. 34 років з клінічним діагнозом розацеа, папуло-пустульозна форма, клінічно на щоках, підборідді одиничні папули, множинні телеангіектазії, на фоні ярко-рожевої еритеми.
08.09.15 у хворої брали біоптат шкіри методом панч-біопсії, який досліджували за стандартним морфологічним методом з використанням гематоксилін-еозину та імунохімічним методом з використанням маркеру росту ендотелію судин VEGF, маркерів рецепторів к андрогену AR та естрогену ER. Імуногістохімічний статус: загальний рівень VEGF 2+, рівеньVEGF епідермісу 106,492, рівень VEGF навколо pilosebaceousunit 129,6624, рівень експресії ER в епідермісі 0,4, рівень експресії ER в залозах 1,0, рівень експресії AR в епідермісі 2,40 , рівень експресії AR в залозах 5,40.
Тобто: виявлено помірний рівень васкулогенезу в епідермісі, з наявністю влучення в патологічний процес pilosebaceousunit, вміст АR в шкірі хворої перевищує більш ніж в два рази вміст АR в шкірі здорової людини, рівень AR залоз не перевищує більше ніж в 4 рази рівень AR епідерміса шкіри хворої.
Висновок: розацеа папуло-пустульозна форма, загострення. Прогнозована тенденція до перебігу розацеа за гіпертрофічним типом з помірним ущільненням шкіри і формуванням папульозних елементів, без схильності до формування вираженої гіперплазії сальних залоз та формування фолікулярних кіст та ретенційних елементів.
Приклад 3.
Хвора Д. 33 років з клінічним діагнозом розацеа, еритематозно-телеангіектатична форма. Клінічно на щоках, підборідді множинні телеангіектазії, на фоні ярко-рожевої еритеми.
02.07.15 у хворої брали біоптат шкіри методом панч-біопсії, який досліджували за стандартним морфологічним методом з використанням гематоксилін-еозіну та імунохімічним методом з використанням маркеру росту ендотелію судин VEGF, маркерів рецепторів к андрогену AR та естрогену ER. Імуногістохімічний статус: загальний рівень VEGF 2+, рівеньVEGF епідермісу 152,013, рівень VEGF навколо pilosebaceousunit 129,826, рівень експресії ER в епідермісі 0,2, рівень експресії ER в залозах 0,1, рівень експресії AR в епідермісі 2,30, рівень експресії AR в залозах 23,80.
Тобто: виявлено виражений васкулогенез в епідермісі, без залучення в запальний процес pilosebaceousunit, вміст АR в шкірі хворої перевищує більш ніж в два рази вміст АR в шкірі здорової людини, рівень AR залоз перевищує більше ніж в 4 рази рівень AR епідермісу шкіри хворої.
Висновок: розацеа еритематозно-телеангіектатична форма, загострення. Прогнозована тенденція до перебігу розацеа за гіпертрофічним типом зі схильністю до формування вираженої гіперплазії сальних залоз та формування фолікулярних кіст та ретенційних елементів.
Але для практичної охорони здоров`я ми пропонуємо спиратися на метод дерматоскопії, оскільки він є простим неінвазивним та некоштовним для хворих. Отримані кореляційні зв’язки між змінами імуногістохімічних показників, за нашим аналізом, корелюють з даними дерматоскопії. Вони полягають у наступному:
При підвищенні експресії ER рецепторів в епідермісі більше ніж в 2 рази або підвищенні експресії AR рецепторів не більше ніж в 2 рази порівняно зі здоровою шкірою і при слабкому рівні васкулогенезу в шкірі прогнозують сприятливий перебіг розацеа з помірним поступовим формуванням телеангіектазій і низькою вірогідністю залучення в патологічний процес фолікулярного апарату та сальних залоз. Це відповідає отриманим даним методом поляризаційної дерматоскопії у всіх хворих з ЕТР – виявлено збільшення кількості поверхневих судин в центральній частині обличчя, їх розширення і виражена гіллястість з формуванням полігональної судинної сітки в ділянці ураження.
При підвищенні експресії АR рецепторів в епідермісі біоптатів більш ніж в 2 рази, та при підвищенні експресії ER рецепторів в епідермісі біоптатів не більш ніж в 2 рази порівняно зі здоровою шкірою та при помірному рівні васкулогенезу в шкірі прогнозують перебіг розацеа за гіпертрофічним типом з ущільненням шкіри і формуванням стійкої вираженої дилатації судин і раннім залученням у патологічний процес структур pilosebaceousunit і формуванням папульозних елементів. Це відповідає змінам, які виявлені при дерматоскопії у пацієнтів з ППР – відзначалася виражена дилатація судин з формуванням судинної сітки, проте спостерігалась тенденція до формування одиничних більш широких гіллястих судин з наявністю широкої центральної судини і кількох судинних гілочок, що відходять від неї.
А при перевищенні показників експресії АR в епітелії залоз та фолікулярному епітелії більш ніж в 4 рази порівняно з епідермісом шкіри хворої і при сильному рівні васкулогенезу в шкірі прогнозують несприятливий прогноз розвитку розацеа з формуванням вираженої гіпертрофії сполучної тканини та вираженої гіперплазії сальних залоз, формуванням фолікулярних кіст та ретенційних елементів. Це відповідає результатам імерсійної дерматоскопії: в місцях ураження відзначалися незначно або помірно розширені устя волосяних фолікулів, фолікулярні пробки.
* * *
Таким чином, запропонований спосіб прогнозування дозволяє заздалегідь передбачити важкість перебігу хвороби та вчасно призначити виправдану індивідуалізовану терапію хворому, тим самим забезпечити підвищення ефективності лікування та уникнути поліпрагмазії.
Матеріали розділу 4 представлені у публікаціях автора:
- Старостіна О. А. Визначення середніх значень кількості, периметру, площі CD34-позитивних судин та оцінка експресії VEGF в біоптатах шкіри пацієнтів з судинними формами розацеа. Медичні перспективи. 2018. № 2 (2) С. 67–70 [91].
- Старостіна О. А. Клінічні прояви інфікування Demodex folliculorum на тлі запалення різної інтенсивності та гіперплазії сальних залоз у пацієнток різного віку із судинними формами розацеа. Дерматологія та венерологія. 2018. № 1 (79). С. 76–79 [87].
- Calculation of the average density indices of androgen and estrogen receptors and evaluation of expression of COX-2 in skin biopsies of patients with vascular forms of rosacea / O. A. Starostina, Т. V. Svyatenko, I. S. Shponka, O. V. Poslavska. Experimental and Clinical Medicine. 2018, Vol. 1. P 33–40 [119].
- Морфологічні критерії перебігу судинних форм розацеа / О. А. Старостина, Т. В. Святенко, І. С. Шпонька, О. В. Пославська. Морфологія. 2017. № 11 (2) С. 40–45 [49].
- Пат. на корисну модель № 124614 UA, МПК G01N21/00, G01N33/00, A61B10/00. Спосіб прогнозування перебігу розацеа у жінок / О. А. Старостіна, Т. В. Святенко, І. С. Шпонька, О. В. Пославська. № u201712471; заявл. 15.12.17; опубл. 10.04.18, Бюл. № 7 [58].
РОЗДІЛ 5
ПОРІВНЯЛЬНА ОЦІНКА ЕФЕКТИВНОСТІ РІЗНИХ МЕТОДИК ЛІКУВАННЯ РОЗАЦЕА
Як відомо, iснуючі методи лікування не достатньо враховують закономірності розвитку та перебігу розацеа у жінок. У результаті хронічного персистуючого перебігу запального процесу на шкірі обличчя формуються стійкі дефекти, що спотворюють зовнішність і залишаються толерантними до більшості методів зовнішньої терапії та косметичної корекції. В більшості випадків неможливо отримати виражений та стійкий регрес телеангіектатичних елементів при даній патології.
На базі кафедри шкірних та венеричних хвороб ДЗ «Дніпропетровська медична академія МОЗ України» розроблена і запропонована методика лікування ЕТР і ППР, яка забезпечує дію на ключові ланцюги патогенетичних механізмів розвитку захворювання. Клінічна апробація методу проводилася на базі Медичного центру ПП “Леномед” (м. Дніпро).
Для оцінки ефективності різних методик лікування розацеа всі 100 хворих жінок були рандомізовані на 4 рівнозначні за кількістю спостережень групи (по 25 хворих), статистично порівняних за віком пацієнток, тривалістю захворювання (див. розділ 2), фототипом шкіри, супутньою патологією, тяжкістю перебігу розацеа (табл. 5.1) і розрізнялись за клінічною формою захворювання та методикою лікування.
Основні групи пацієнток отримували запропоновану терапію: І група з судинною формою розацеа, ІІІ група з папуло-пустульозною формою розацеа. Лікувальний комплекс включав використання перорально доксицикліну у дозі 50 мг на добу протягом 6 тижнів у І групі та 100 мг двічі на добу протягом 2 тижнів у ІІІ групі. Місцево призначався у І групі гель з азелаїновою кислотою 15 %, 1 раз на добу, на ніч, протягом 8 тижнів, а також 1 % крем пімекролімус, як засіб, що пригнічує VEGF, – перші 8 тижнів – вранці, далі – 2 рази на добу до 16 тижня.
Таблиця 5.1 – Порівняння виділених терапевтичних груп хворих на розацеа за тяжкістю перебігу розацеа, фототипом шкіри, супутньою патологією, абс. (%)
| Показник | ЕРТ (n=50) | ППР (n=50) | |||
| І група – основна (n=25) | ІІ група – порівняння (n=25) | ІІІ група – основна (n=25) | ІV група – порівняння (n=25) | ||
| Ступінь тяжкості захворю-вання (за ШДОР) | Легкий | 12 (48 %) | 9 (36 %) | 1 (4 %) | 2 (8 %) |
| Середній | 13 (52 %) | 16 (64 %) | 17 (68 %) | 19 (76 %) | |
| Важкий | – | – | 7 (28 %) | 4 (16 %) | |
| Середній бал, M±m | 8,28±0,46 | 8,20±0,29 | 12,36±0,60 | 12,16±0,58 | |
| Фототип
шкіри |
І | 8 (32 %) | 7 (28 %) | 6 (24 %) | 2 (8 %) |
| ІІ | 17 (68 %) | 18 (72 %) | 18 (72 %) | 23 (92 %) | |
| ІІІ | – | – | 1 (4 %) | – | |
| Супутня патологія | Всього виявлено, в т.ч. | 22 (88 %) | 19 (76 %) | 21 (84 %) | 22 (88 %) |
| – ШКТ | 12 (48 %) | 8 (32 %) | 10 (40 %) | 14 (56 %) | |
| – серцево-судинної системи | 6 (24 %) | 4 (16 %) | 6 (24 %) | 2 (8 %) | |
| – органів дихання | 5 (20 %) | 9 (36 %) | 12 (48 %) | 12 (48 %) | |
| – нервова | 15 (60 %) | 11 (44 %) | 9 (36 %) | 13 (52 %) | |
| – ендокринна | 2 (8 %) | 1 (4 %) | 5 (20 %) | 3 (12 %) | |
| – сечовидільна | 4 (16 %) | 3 (12 %) | 3 (12 %) | – | |
| – жіночих статевих органів | 4 (16 %) | 4 (16 %) | 2 (8 %) | 5 (20 %) | |
Примітка. p>0,05 між групами при усіх порівняннях
У ІІІ групі місцево призначався гель з адапаленом та кліндаміцином, 1 раз на добу, на ніч протягом 8 тижнів та гель з метронідазолом 1раз на добу, вранці, протягом 8 тижнів, а також 1 % крем пімекролімус, як засіб, що пригнічує VEGF, з 9-го тижня лікування 2 рази на добу до 16 тижня.
Крім того, застосовувалася система інтенсивного імпульсного світла IPL з довжиною хвилі 560-1200 нм, імпульсом 22-26 Дж/см2, з проведенням процедур 1 раз на місяць, 2-4 сеанси на курс, починаючі з 7-го тижня лікування у І групі, та починаючи з 9-го тижня лікування у ІІІ групі. Середня кількість проведених процедур IPL в І групі склала 3,48±0,14, в ІІІ групі – 3,47±0,13.
Також з першого дня лікування і до 16 тижня хворим І і ІІІ досліджуваних груп призначався ангіопротектор Детралекс по 1 таблетці двічі на добу.
У групах порівняння: ІІ група з ЕТР та ІV група з ППР, застосовувалися традиційні методики.
В ІІ групі внутрішньо застосовувався доксициклін у дозі 50 мг 1 раз на добу протягом 6 тижнів, місцево призначався гель з азелаїновою кислотою 15 %, 1 раз на добу, протягом 8 тижнів, а також 1 % крем пімекролімус – перші 8 тижнів – вранці, далі – 2 рази на добу до 16 тижня.
У ІV групі доксициклін призначався по 100 мг двічі на добу протягом 2 тижнів місцево призначавя гель з адапаленом та кліндаміцином, 1 раз на добу, на ніч протягом 8 тижнів та гель з метронідазолом 1 раз на добу, вранці, протягом 8 тижнів, а також 1 % крем пімекролімус з 9-го тижня лікування, 2 рази на добу до 16 тижня.
Ефективність запропонованого комплексу оцінювалась за клінічними показниками на 8 та 16 тижнях та за динамікою змін ДІЯЖ і вираженості тривожно-депресивних симптомів (шкала HADS) порівняно з показниками до лікування. Віддалені результати оцінювались після 6 та 12 місяців спостереження.
Критеріями ефективності лікування розацеа були: кількість рецидивів транзиторної еритеми, та рецидивів розацеа з папуло-пустульозною висипкою, якість життя одразу після лікування та через 6 і 12 місяців лікування.
Клінічні результати лікування хворих, отримані на 16 тижні лікування, наведено у таблиці 5.2.
Як видно з таблиці 5.2, при лікуванні хворих за запропонованою методикою вдалося досягти клінічного одужання у 84 % жінок, хворих на еритематозно-телеангіектатичну форму розацеа. В групі порівняння таких результатів вдалося досягти лише в 6 (24 %) випадках (p<0,001 порівняно з І групою). В 7 хворих ІІ групи (28 %) відзначено значне покращання патологічного шкірного процесу, в 9 (36 %) – покращення клінічних проявів захворювання, а в 3 (12 %) випадках позитивного ефекту не спостерігали.
Таблиця 5.2 – Клінічні результати лікування хворих на розацеа за формами та групами, абс. ( %)
| Клінічна форма розацеа | Група | Клінічне одужання | Значне покра-щання | Покра-щання | Без ефекту |
| ЕТР | Основна
(І група), n=25 |
21 (84 %) | 3 (12 %) | 1 (4 %) | – |
| Порівняння (ІІ група), n=25 | 6 (24 %) | 7 (28 %) | 9 (36 %) | 3 (12 %) | |
| (р) між групами | χ2=19,3, p<0,001 | ||||
| ППР | Основна
(ІІІ група), n=25 |
18 (72 %) | 5 (20 %) | 2 (8 %) | – |
| Порівняння
(IVгрупа),n=25 |
7 (28 %) | 9 (36 %) | 8 (32 %) | 1 (4 %) | |
| (р) між групами | χ2=10,6, p=0,014 | ||||
Таким чином, на тлі порівняних вихідних даних, які впливають на перебіг захворювання (вік, тривалість захворювання, тяжкість стану тощо), у хворих на ЕТР після проведених курсів комплексного лікування з використанням IPL-терапії позитивні результати (одужання і значне покращання) отримано практично у всіх хворих (24 – 96 %), що на 44 % перевищує результати, отримані при застосуванні традиційних методів лікування ЕТР у жінок (52 %) при p<0,001.
Ефективність лікування хворих жінок з ППР також вірогідно залежала від застосованого методу терапії. Найкращих результатів було досягнуто у пацієнток ІІІ групи, де до схеми лікування було додатково включено процедури з використанням IPL. Так, клінічне одужання зі стійкою ремісією настало у 18 хворих (72 %), ще у 5 хворих (20 %) досягнуто значного покращання клінічних характеристик. Ефективність традиційних підходів до терапії ППР (IV група) підтверджена досягненням клінічного одужання у 7 (28 %) хворих та значним покращанням стану в 9 (36 %) пацієнток. У 8 випадках (32 %) відзначали покращання патологічного процесу, в однієї хворої лікування не мало ефекту.
Таким чином, незважаючи на значну частку пацієнток з важким ступенем тяжкості захворювання (за ШДОР) на початку дослідження (28 %), застосування пропонованого методу терапії даної форми розацеа у жінок дозволило отримати позитивні результати в абсолютній більшості випадків (92 %), що на 28 % краще, ніж у групі порівняння (64 %) при p<0,05.
Враховуючи визначені на початку дослідження суттєві порушення психоемоційного стану хворих на розацеа жінок та відповідне погіршення якості їх життя (див. розділ 3), цим питанням приділяли особливу увагу під час проведення комплексної терапії і динамічного спостереження.
Проведена повторна оцінка ступеня вираженості депресивної і тривожної симптоматики у тематичних хворих за шкалою HADS після закінчення основних курсів терапії. Відзначена позитивна динаміка показників в обох клінічних групах хворих жінок з ЕТР (табл. 5.3), що виявилося вірогідним зменшенням проявів тривоги і депресії. Так, серед зареєстрованих на початку дослідження клінічно виражених ознак тривожно-депресивного стану у 15 хворих (6 пацієнток з І групи і 9 – з ІІ) наприкінці дослідження у 13 хворих такі прояви відповідали критеріям субклінічного стану, у 2 – критеріям норми. Середній бал за шкалою HADS у хворих основної групи зменшився з (8,00 ± 0,56) до (4,76 ± 0,50) балів, тобто на 40,5 % (p<0,001), а в групі порівняння – з (8,80 ± 0,54) до (6,40 ± 0,46) балів (на 27,3 %, p<0,001).
Водночас, на тлі статистично порівняних вихідних рівнів показників оцінки ступеня вираженості ознак тривожно-депресивного стану за шкалою HADS в обох групах (р>0,05), динаміка показників в основній групі хворих була більш суттєвою (рис. 5.1) – середній бал за шкалою HADS після лікування був на 25,6 % менше, ніж в групі порівняння (р<0,05).
Таблиця 5.3 – Динаміка показників ступеня вираженості ознак тривоги/ депресії (шкала HADS) у хворих на ЕТР на тлі лікування, абс. ( %)
| Ступінь вираженості ознак тривоги/ депресії | До лікування | Після лікування | ||||
| І група, n=25 | ІІ група, n=25 | (р) між групами | І група, n=25 | ІІ група, n=25 | (р) між групами | |
| – норма (0-7 балів) | 11 (44 %) | 9 (36 %) | χ2=0,87 p=0,648 | 21 (84 %) | 14 (56 %) | χ2=4,67 p=0,031 |
| – субклінічний (8-10 балів) | 8 (32 %) | 7 (28 %) | 4 (16 %) | 11 (44 %) | ||
| – клінічно виражений (11 балів і вище) | 6 (24 %) | 9 (36 %) | – | – | ||
| Середній бал, M±m | 8,00±0,56 | 8,80±0,54 | t=1,03
р=0,308 |
4,76±0,50 | 6,40±0,46 | t=2,42
р=0,020 |
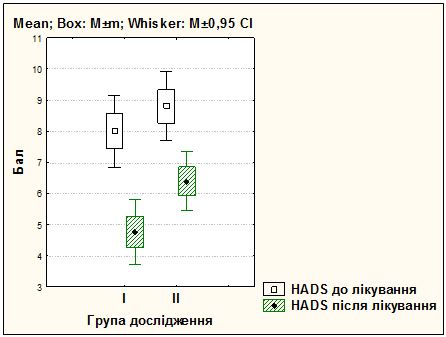
Рисунок 5.1 – Динаміка середнього балу за шкалою HADS у хворих на ЕТР на тлі лікування
Подібні результати щодо покращення психоемоційного стану пацієнток на тлі лікування досягнуто в групах хворих на ППР (табл. 5.4). Так, кількість хворих з нормалізацією стану збільшилася з 3 (6 %) до 13 (26 %), а кількість випадків клінічно вираженої тривоги/ депресії зменшилась з 28 (56 %) до 5 (10 %) при p<0,05. Причому більшість позитивних результатів було отримано у пацієнток основної групи. Таблиця 5.4 – Динаміка показників ступеня вираженості ознак тривоги/ депресії (шкала HADS) у хворих на папуло-пустульозну форму розацеа на тлі лікування, абс. ( %)
| Ступінь вираженості ознак тривоги/ депресії | До лікування | Після лікування | ||||
| ІІІ група, n=25 | IV група, n=25 | (р) між групами | ІII група, n=25 | IV група, n=25 | (р) між групами | |
| – норма (0-7 балів) | 2 (8 %) | 1 (4 %) | χ2=0,39 p=0,825 | 10 (40 %) | 3 (12 %) | χ2=6,07 p=0,048 |
| – субклінічний (8-10 балів) | 9 (36 %) | 10 (40 %) | 14 (56 %) | 18 (72 %) | ||
| – клінічно виражений (11 балів і вище) | 14 (56 %) | 14 (56 %) | 1 (4 %) | 4 (16 %) | ||
| Середній бал, M±m | 10,32±0,39 | 11,00±0,42 | t=1,17
р=0,246 |
8,36±0,43 | 9,16±0,39 | t=1,39
р=0,171 |
Середній бал за шкалою HADS у хворих ІІІ групи на тлі лікування зменшився на 19,0 % з (10,32 ± 0,39) до (8,36 ± 0,43) бали (p<0,001), а в групі порівняння – з (11,00 ± 0,42) до (9,16 ± 0,39) балів, тобто на 16,7 % (p<0,001) (рис. 5.2).
Аналіз динаміки показників якості життя у тематичних хворих після проведених курсів комплексного лікування засвідчив їх суттєве поліпшення у повній відповідності до регресу або покращення клінічних показників. Середній показник ДІЯЖ у хворих з ЕТР, які отримували запропоновану терапію (І група), зменшився з (20,00 ± 0,82) до (6,24 ±0,65) балів, тобто в 3,2 рази (на 68,8 %) при р<0,001 (табл. 5.5).
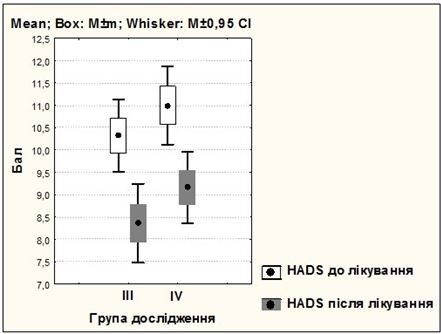
Рисунок 5.2 – Динаміка середнього балу за шкалою HADS у хворих на ППР на тлі лікування
Таблиця 5.5 – Динаміка показників якості життя (ДІЯЖ) у хворих на еритематозно-телеангіектатичну форму розацеа на тлі лікування, М±m
| Період спостереження | Клінічні групи | |||
| І група, n=25 | IІ група, n=25 | (р) між групами | ||
| До лікування | 20,00±0,82 | 19,24±0,97 | t=0,60 р=0,554 |
|
| Після лікування | 6,24±0,65 | 12,36±1,08 | t=4,84 р<0,001 |
|
| Значимість відмінностей показників в динаміці (р1) | Т=15,38, р<0,001 | Т=5,67, р<0,001 | ||
У групі порівняння, на тлі традиційної терапії розацеа, динаміка також була вірогідною (р<0,001), але менш вираженою: показник ДІЯЖ зменшився на 35,8 % з 19,24 ± 0,97 балів до 12,36 ±1,08 балів (рис. 5.3).
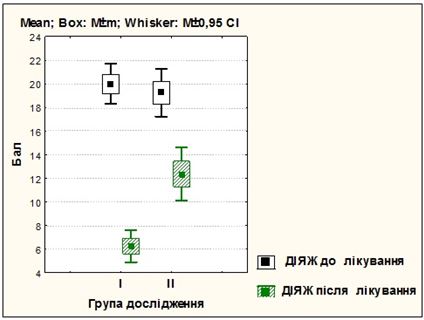 Рисунок 5.3 – Динаміка середнього балу за шкалою ДІЯЖ у хворих на ЕТР на тлі лікування
Рисунок 5.3 – Динаміка середнього балу за шкалою ДІЯЖ у хворих на ЕТР на тлі лікування
Аналіз динаміки показників якості життя (ДІЯЖ) у хворих на папуло-пустульозну форму розацеа на тлі лікування (табл. 5.6) також показав переваги запропонованого метода комплексної терапії з використанням IPL.
Таблиця 5.6 – Динаміка показників якості життя (ДІЯЖ) у хворих на ППР на тлі лікування, М±m
| Період спостереження | Клінічні групи | ||
| ІІІ група, n=25 | IV група, n=25 | (р) між групами | |
| До лікування | 21,04±1,02 | 20,20±0,82 | t=0,64
р=0,524 |
| Після лікування | 12,84±0,87 | 15,16±0,59 | t=2,20
р=0,033 |
| Значимість відмінностей показників в динаміці (р1) | Т=9,66, р<0,001 | Т=8,02, р<0,001 | |
Отже, на тлі зіставної оцінки якості життя на початку дослідження в обох групах хворих на ЕТР (р>0,05), після проведеного лікування в основній групі бальна оцінка за шкалою ДІЯЖ була вдвічі меншою (на 49,5 %), ніж у групі порівняння (р<0,001).
Середній показник ДІЯЖ у хворих основної групи (ІІІ група) зменшився з (21,04 ± 1,02) до (12,84 ± 0,87) балів, тобто на 39,0 % при р<0,001. У групі порівняння (IV група) зміни показника також були суттєвими – зменшення на 25,0 % (р<0,001), але менш вираженими порівняно з ІІІ групою (рис. 5.4).
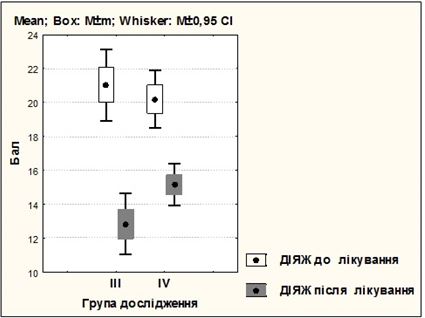
Рисунок 5.4 – Динаміка середнього балу за шкалою ДІЯЖ у хворих на папуло-пустульозну форму розацеа на тлі лікування
Таким чином, використання запропонованого способу лікування забезпечує дію на ключові ланцюги патогенетичних механізмів розвитку судинних форм розацеа, спрямоване на досягнення клінічного одужання, подовження ремісії та на покращення якості життя хворих [80].
Показання до застосування: пропонований метод може бути застосований для лікування жінок хворих на судинні форми розацеа.
Протипоказання до застосування: прийом фотосенсибілізуючих засобів (гормональних контрацептивів, тетрацикліну, ретиноїдів, фторхінолонів); схильність до утворення келоїдних рубців; інфекційні захворювання; місцеві гнійничкові висипання, епілепсія.
Спостереження за хворими, які отримували лікування за запропонованою методикою, проводилося протягом одного року. Через 12 місяців після закінчення лікування було спостережено 18 хворих із І групи, 12 хворих з ІІ, 15 хворих із ІІІ та 8 хворих IV груп. Нажаль деякі хворі не з’явилися на контрольне відвідування через 12 місяців з поважних сімейних обставин (відсутність у країні, відрядження, переїзд на інше місце проживання). У таблиці 5.7 представлені віддалені результати спостереження за хворими на різні форми розацеа [92].
Таблиця 5.7 – Результати спостереження за хворими через 12 місяців після проведеного лікування
| Результат | 1 група (n=18) | 2 група (n=12) | 3 група (n=15) | 4 група
(n=8) |
| Рецидив | 3 (16,6 %) | 7 (58,3 %) | 3 (20,0 %) | 5 (62,5 %) |
| Відсутність рецидиву | 15 (83,4 %) | 5 (41,7 %) | 12 (80,0 %) | 3 (37,5 %) |
| р між групами | c2=5,6; p=0,018 | c2=4,15; p=0,042 | ||
Дані таблиці 5.7 свідчать, що у хворих 1-ї і 3-ї групи, які лікувались за запропонованими методиками, рецидиви виникали втричі рідше, ніж у 2-ї і 4-ї (контрольних) групах (p<0,05).
Аналізуючи скарги хворих та дані об’єктивного дослідження локального статусу, можна стверджувати, що ступінь важкості загострення, площа ураження також відрізнялась у хворих 1-ї, 3-ї та 2-ї, 4-ї груп. Крім того, наявні симптоми після призначеного лікування усувалися значно скоріше та потребували більш короткого курсу терапії хворим 1-ї, 3-ї груп у порівнянні з хворими 2-ї та 4-ї групи.
Таким чином, при лікуванні за запропонованими методиками вдалося дійти висновків, що впроваджене лікування є ефективним, безпечним, має позитивну фармакоекономіку та дозволяє досягти стійкої довготривалої ремісії у 83,4 % хворих на ЕТР та 71,6 % хворих на ППР [28, 81].
* * *
Отже, доведено, що спосіб комплексного лікування жінок, хворих на судинну форму розацеа із застосуванням системи інтенсивного імпульсного світла IPL не є інвазивним, простий у застосуванні, враховує фототип шкіри пацієнта, клінічну виразність симптомів та ступінь ушкодження судин; спосіб високоефективний і може використовуватись у лікувальних дерматологічних та косметологічних установах з метою зменшення клінічних проявів та отримання стійкої ремісії після проведеної терапії.
Матеріали розділу 5 представлені у публікаціях автора:
- Святенко Т. В., Чеверда О. А., Старостина О. А. IPL-терапия в лечении сосудистых форм розацеа и других дерматозов: безопасность и эффективность (собственные наблюдения). Журнал дерматовенерології та косметології імені М.О. Торсуєва. 2017. № 2 (38). С. 112–117 [79].
- Старостіна О. А. Применение IPL-терапии в комплексном лечении сосудистых форм розацеа: Безопасность и эффективность (собственные наблюдения). Програма та матеріали Регіональної науково-практичної конференції «Святогорські дерматовенерологичні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом». 2016. С. 34 [92].
- Святенко Т. В, Старостина О. А. Новые возможности IPL-терапии в комплексном лечении сосудистых форм розацеа. Медицинские новости Грузии. 2015. № 6 (243). С. 62 [81].
- Святенко Т. В., Андриуца Л. А., Старостина О. А. Комбинированная терапия розацеа в условиях лечебно-косметологического центра. Збірник робіт за матеріалами науково-практичної школи «Молоді науковці-майбутнє української дерматовенерології». 2014. С. 61 [80].
- Інформаційний лист про впровадження у системі охорони здоров’я «Спосіб лікування судинних форм розацеа» / Т. В. Святенко, О. А. Старостіна, Дніпропетровська медична академія МОЗ України. К., 2017. 4 с [28].
РОЗДІЛ 6
АНАЛІЗ ТА ОБГОВОРЕННЯ РЕЗУЛЬТАТІВ
Питання ефективності лікування розацеа – хронічного рецидивуючого захворювання шкіри обличчя, залишаються актуальними як в Україні, так і в багатьох країнах світу [159, 206, 203]. Розацеа характеризується прогредієнтним перебігом та формуванням стійких дефектів, що спотворюють зовнішність і є толерантними до більшості методів зовнішньої терапії та косметичної корекції [153]. У більшості випадків препарати для зовнішнього лікування розацеа призначають довготерміново та безперервно, що призводить до розвитку відповідних реакцій подразнення, які спричиняють посилення неприємних відчуттів у хворого, а також посилюють косметичні дефекти, які супроводжують це захворювання, і позитивний ефект суттєво зменшується [24, 15]. Більшість схем лікування судинних форм розацеа не враховують індивідуальні імуно-морфофункціональні особливості шкіри хворих, стан судин шиї та голови, і, з різних причин, не здатні впливати на всі механізми розвитку, наслідком чого є рецидиви захворювання в різний термін після лікування [21, 103, 134]. Все це негативно позначається як на психоемоційному стані хворих, так і на зниженні якості життя, що робить проблему актуальною і важливою не тільки у медичному, але й у соціальному аспекті.
Багато аспектів етіології та патогенезу даного захворювання залишаються неясними до сьогоднішнього дня [39, 78]. Зокрема, не вивчалися особливості тригерних факторів, перебігу та лікування судинних форм розацеа у жінок, а в існуючих класифікаціях захворювання, заснованих на оцінці клінічної картини хвороби, не враховуються імуно-морфологічні характеристики висипань при різних формах розацеа [141]. Відсутні також ефективні терапевтичні методи, які б приводили до тривалої ремісії і клінічного одужання [21, 15, 52].
Тому метою дослідження стало підвищення ефективності комплексної диференційованої терапії у жінок, хворих на судинні форми розацеа, шляхом дослідження особливостей механізму розвитку, клініко-морфологічних проявів та стану судинного русла дерматозу в динаміці лікування із застосуванням засобів та методик, що нормалізують рівень фактора судинного росту ендотелію та стан судин.
Під спостереженням знаходилися 100 хворих на розацеа жінок, у віці від 21 до 65 років (середній вік 40,4 ± 1,0 роки), які перебували на лікуванні у медичному центрі ПП «Леномед» м. Дніпро в період з 2015 по 2018 рр.. З них 50 пацієнток було з еритематозно-телеангіектатичною формою розацеа, 50 – з папуло-пустульозною формою розацеа. Відповідно до мети і задач дослідження був використаний комплекс методів морфологічного, імуногістохімічного, морфометричного, статистичного аналізу.
Тяжкість перебігу розацеа оцінювали за шкалою діагностичної оцінки розацеа (ШДОР), запропонованої В.П. Адаскевич в 2004 році [3]. Для детального вивчення у хворих на розацеа змін шкіри в осередку ураження, що мають характерні клінічні прояви розацеа, застосовувався метод дерматоскопії. Для дослідження особливостей кровотоку по судинам голови і шиї та виявлення можливої цереброваскулярної патології у хворих на розацеа проводилось дуплексне сканування судин шиї та голови. Скринінгове тестування хворих для виявлення тривожних і депресивних станів проводилось за Госпітальною шкалою тривоги та депресії (HADS), а оцінка якості життя – за дерматологічним індексом якості життя (ДІЯЖ) [131].
Найбільший відсоток хворих на розацеа жінок припадав на вікову групу від 18 до 45 років (69 пацієнток – 69 %), 25 (25 %) пацієнток були у віці від 46 до 60 років, 6 (6 %) – у віці від 60 до 65 років. Це, безсумнівно, має важливе соціально-економічне значення, так як більшість пацієнток входять до групи загально-активного і працездатного населення. Середня тривалість захворювання склала 5,11±0,37 років.
За даними кореляційного аналізу встановлено, що тяжкість хвороби має прямий взаємозв’язок з віком хворих (r=+0,26; p<0,01), давністю захворювання (r=+0,22; p<0,05) і фототипом шкіри (r=+0,30; p<0,01) що також було підтверджено рядом інших авторів [4, 82, 85,159].
У групі хворих на еритематозно-телеангіектатичну форму розацеа переважав комбінований тип шкіри (68,0 % хворих), на відміну від групи хворих із папуло-пустульозною формою розацеа, у яких переважав себорейний тип – 66,0 % хворих (p<0,001).
Методом полярізаційної дерматоскопії у всіх хворих з еритематозно-телеангіектатичною формою розацеа виявлено збільшення кількості поверхневих судин в центральній частині обличчя, їх розширення і виражена гіллястість з формуванням полігональної судинної сітки в області ураження. У хворих з папуло-пустульозною формою розацеа також відзначалася виражена дилатація судин з формуванням судинної сітки, проте спостерігалась тенденція до формування одиничних більш широких гіллястих судин з наявністю широкої центральної судини і кількох судинних гілочок, що відходять від неї. У 32 жінок, хворих на розацеа, при імерсійній дерматоскопії в місцях ураження відзначалися незначно або помірно розширені устя волосяних фолікулів (у 31 хворої з еритематозно-телеангіектатичною формою розацеа розацеа і у 48 осіб з папуло-пустульозною формою розацеа), фолікулярні пробки (у 21 хворої з еритематозно-телеангіектатичною формою розацеа і у 43 хворих з папуло-пустульозною формою розацеа). Вказані дерматоскопічні зміни також спостерігались при дослідженні Кубановой А.А., Махаковой Ю.Б., що свідчить про значну роль дерматоскопічного дослідження як допоміжного неінвазивного методу диагностики розацеа [38] .
Встановлено, що майже половина хворих на розацеа (43 – 43 %) на початку дослідження мали ознаки клінічно вираженої тривоги/депресії – загальний бал за шкалою HADS становив 12,02 ± 0,17. У третини пацієнток (34 – 34 %) встановлено граничний критерій вираженості симптомів тривоги/ депресії (від 8 до 10 балів), в середньому – 8,91 ± 0,14 балів. В інших 23 випадках констатовано відсутність достовірно виражених симптомів тривожно-депресивного стану, хоча середній бал за шкалою HADS був ближче до верхньої межі норми (0-7 балів) – 5,78 ± 0,24.
Слід зазначити, що найчастіше показник вираженості психоемоційного стану хворих на розацеа асоціювався з тяжкістю перебігу захворювання, оціненою за ШДОР (r=+0,31; p<0,01), і папуло-пустульозною формою розацеа (r=+0,40; p<0,001). Тільки у 3 (6 %) пацієнток цієї групи показник відповідав критеріям норми (до 7 балів), а 56 % хворих мали клінічно виражену тривогу/ депресію (χ2=6,90, р=0,009 порівняно з еритематозно-телеангіектатичною формою захворювання).
Встановлено, що на початку дослідження середній показник ДІЯЖ у жінок, хворих на розацеа, дорівнював 20,12 ± 0,47 бала, що становить 67,1 % від максимального бала. При цьому не виявлено достовірних розбіжностей між показниками при різних клінічних формах захворювання: 19,62 ± 0,64 бала в групі хворих з еритематозно-телеангіектатичною формою захворювання і 20,62 ± 0,68 бала в групі з папуло-пустульозною формою розацеа (р=0,286 за t-критерієм). Водночас, високі показники ДІЯЖ у хворих на розацеа асоціювались з давністю захворювання (r=+0,20; p<0,05), наявністю супутньої патології (r=+0,22; p<0,05), зокрема дихальної системи (r=+0,21; p<0,05) та індексом тривожно-депресивного стану HADS(r=+0,27; p<0,01), що свідчить про суттєве зниження якості життя пацієнток та наявність психологічних проблем, які спровокував шкірний патологічний процес.
Треба відзначити, що розацеа досить складна для морфологічної верифікації, почасти тому, що патогенез ушкодження судин до кінця не зрозумілий, й здебільшого тому, що біопсійний матеріал шкіри демонструє досить широкий спектр гістопатологічних змін на різних стадіях перебігу. Вже на початку формування еритематозно-телеангіектатичної форми розацеа (ЕТР) формуються клінічні прояви, які виявляються при всіх формах розацеа, і поглиблюються та доповнюються іншими ознаками при прогресуванні дерматозу. Тому доцільно було провести морфологічне та імуногістохімічне дослідження саме шкіри при ЕТР, для розуміння патогенезу захворювання та виявлення типових ознак прогресування хвороби.
Аналіз випадків (11 примірників), що були отримані під час панч-біопсій, показав різні морфологічні зміни, що залежали від давності ушкоджень і проявлялися комбінацією одночасно декількох характеристик. Із ранніх змін в ЕТР можна відокремити підгрупу загальних компонентів, що мали місце у всіх зразках. На перше місце виступають великі телеангіектазії, що були локалізовані в сосочковому шарі дерми і верхній частині сітчастої дерми. Збільшені судини, в основному капіляри, часто демонстрували химерні форми, з відносно невеликою кількістю розтягнутих ендотеліальних клітин. Імуногістохімічний метод (ІГХ) дозволив виявити, що такі судини експресують маркер ендотеліальної диференціації CD34, але не маркери лімфатичних судин. В ділянках ЕТР лімфатичні судини взагалі залишались маленькими і розташованими в сосочковому шарі дерми і верхній частині сітчастої дерми, та мали відносно нормальну кількість.
Таким чином, не менш важливим загальним компонентом ранніх проявів ЕТР треба зазначити набряк сосочкового шару дерми. Наступним обов’язковим раннім компонентом ЕТР можна вважати периваскулярні інфільтрати, що оточують окремі розширені судини, такі дані підтверджуються дослідженням Perrigouard C., Peltre B. [162].
Більш старі ушкодження при ЕТР також мали змішані запальні інфільтрати, але не тільки навколо окремих судин сосочкового шару дерми, а і судин, що походять із, так званого, «Pilosebaceous unit», що складається з волосини, волосяного фолікула, м’яза, що піднімає волос, і сальних залоз. Інфільтрати містили лімфоцити, гістіоцити та плазматичні клітини різної кількості.
Під час співставлення клінічних та морфологічних даних виявилося, що гранульоми зазвичай спостерігалися у вигляді червоно-коричневих або жовтуватих папул, які знаходились в симетричних ділянках обличчя, та локалізовані у в сосочковому шарі дерми і верхній частині сітчастої дерми.
Завдяки маркеру ендотеліальної диференціації CD34 в біоптатах ЕТР, були відокремлені судини різних шарів дерми і зафіксовано значне збільшення кількості судин в напрямку від сосочкового до глибокої частини сітчастого шару дерми. Для стандартизації результатів розрахунок середньої кількості судин, їх периметру та площі проводився в трьох полях зору (гарячих точках) тільки сосочкового шару дерми кожного окремого випадку.
Збільшення середнього периметру судинної сітки демонструє підвищення кількості судинних елементів (капілярів, венул), порівняно із здоровою шкірою, а збільшення площі – свідчить про ступінь дилятації (розширення та повнокров’я) [67].
Кількість судинних елементів сосочкового шару дерми в 3 «гарячих точках» всіх зразків ЕТР коливалася від 21 до 41 (медіана 31) і в середньому склала (M±m) 31,45 ± 1,95 (SD 6,47). Для порівняння, в здоровій шкірі ці параметри склали від 7 до 12 (медіана 8), а в середньому 7,63 ± 0,40 (1,26) (p<0,001). За даними ряду авторів процеси васкулогенезу спричинюють значне збільшення кількості судинних елементів в ЕТР, часто завдяки ростовим факторам, що активуються тригерними чинниками [109, 190,196] .
Середні площі судин досліджених випадків ЕТР коливалися від 206,13 ± 31,30 (174,27) мкм2 до 1159,92 ± 458,79 (2102,41) мкм2, і в середньому склали 549,62 ± 83,57 (277,18) мкм2, що значно перевищило показники здорової шкіри – від 32,01 ± 1,78 (5,63) мкм2 до 141,01 ± 7,87 (24,90) мкм2, а в середньому 68,62 ± 5,95 (18,81) мкм2 (p<0,001). Такі дані свідчать про значну дилятацію (повнокров’я, розтягнення) судинного русла дерми при ЕТР, порівняно із здоровою шкірою, як наслідки втрати тонусу стінок та ушкодження ендотелію.
Активація процесів васкулогенезу неможлива без участі фактора росту ендотелію судин VEGF, що експресується в цитоплазмі епітеліальних, ендотеліальних та стромальних клітин. Наявність експресії цього фактора чітко корелює із щільністю судин що підтверджує дані інших авторів [82].
Рецепторний апарат, що розташований в клітинах шкіри, має великий вплив на вибір терапевтичних заходів при ЕТР. Саме підвищення андрогенових рецепторів в епідермісі та епітелії залоз з ендогенною стимуляцією наднирниками у жінок можливо призводить до гіперпластичних процесів сальних залоз та формування ретенційних елементів. Дослідження андрогенових рецепторів в епідермісі та фолікулярному епітелії / епітелії залоз проводилося з ІГХ маркерами AR в 3 полях зору програмою обробки цифрових зображень ImageJ: Plugins>ImmunoRatio для розрахунку середніх значень.
Для епідермісу середні показники експресії AR коливалися в межах від 5,7 до 1,1 (медіана 2,3), і в середньому склали 2,59 ± 0,37 (1,27), що було значно менше, ніж показники експресії AR сальних залоз, які більше ніж в 4 рази їх перевищили, а саме – коливалися від 23,8 до 3,5 (медіана 12,8), середнє значення 12,41 ± 1,87 (6,74). Це пояснює глибокі патологічні зміни сальних залоз при тривалому легкому перебігу ЕТР із персистуючою еритемою без відповідного лікування.
Треба зазначити, що рівень експресії ЕR був значно нижчим ніж AR і демонстрував лише окремі поодинокі ядерні забарвлення різної сили інтенсивності як в епідермісі, так і в фолікулярному епітелії, що вносить додаткове розуміння в патогенез ЕТР. Для епідермісу середні показники експресії ЕR коливалися в межах від 0,4 до 0 (медіана 0,2), і в середньому склали 0,16 ± 0,04 (0,12), показники експресії ЕR сальних залоз, які варіювали в більшому діапазоні від 2,4 до 0 (медіана 0,52), мали середнє значення 0,65 ± 0,20 (0,66). Графічне зображення варіантів експресії ЕR в залежності від віку пацієнтів демонструє коливання значень біля нуля з поодинокими піками експресії ЕR в епітелії залоз, що не дає можливості описати будь-яку тенденцію, крім незалежного розподілу.
Враховуючи особливості розацеа, що має прогредієнтний перебіг і рефрактерність до лікування, що проводиться, терапію для цього захворювання бажано підбирати індивідуально, в залежності від превалювання тієї чи іншої ланки патогенезу хвороби та враховуючи схильність до формування у хворого тих чи інших змін при розацеа. Вчасне призначення препаратів, необхідних для купірування розвитку різних ланок патогенезу, дозволяє більш ефективно лікувати хворобу та уникати формування стійких небажаних дефектів при розацеа [61]. Тому в комплексі діагностичного обстеження вкрай важливо мати діючий спосіб прогнозування індивідуального перебігу розацеа у хворого.
Загальний алгоритм прогнозування перебігу розацеа у жінок полягає у наступному: шляхом проведення біопсії шкіри, враженої розацеа, визначають в біоптаті маркери рецепторів до андрогену AR та естрогену ER і рівень васкулогенезу в шкірі за маркером росту ендотелію судин VEGF, та при підвищенні експресії ER рецепторів в епідермісі більше ніж в 2 рази або підвищенні експресії AR рецепторів не більше ніж в 2 рази порівняно зі здоровою шкірою і при слабкому рівні васкулогенезу в шкірі прогнозують сприятливий перебіг розацеа з помірним поступовим формуванням телеангіектазій і низькою вірогідністю залучення в патологічний процес фолікулярного апарату та сальних залоз; при підвищенні експресії АR рецепторів в епідермісі біоптатів більш ніж в 2 рази, та при підвищенні експресії ER рецепторів в епідермісі біоптатів не більш ніж в 2 рази порівняно зі здоровою шкірою та при помірному рівні васкулогенезу в шкірі прогнозують перебіг розацеа за гіпертрофічним типом з ущільненням шкіри і формуванням стійкої вираженої дилятації судин і раннім залученням в патологічний процес структур pilosebaceousunit і формуванням папульозних елементів; а при перевищенні показників експресії АR в епітелії залоз та фолікулярному епітелії більш ніж в 4 рази порівняно з епідермісом шкіри хворої і при сильному рівні васкулогенезу в шкірі прогнозують несприятливий прогноз розвитку розацеа з формуванням вираженої гіпертрофії сполучної тканини та вираженої гіперплазії сальних залоз, формуванням фолікулярних кіст та ретенційних елементів.
Раніше вітчизняним науковцем Возіановою С.В. досліджувались зміни судин голови та шиї та було виявлено зниження лінійних об’ємних швидкостей кровотоку в зовнішній сонній артерії, зменшення її діаметру відповідно аналогічних показників здорових людей. при ультразвуковій допплерографії лицевої вени встановлено достовірне зниження пікової систолічної швидкості кровотоку і збільшення діаметру лицевої вени, що свідчить про уповільнений венозний відтік від тканин лиця [18].
При аналізі отриманих даних доплерографічного дослідження судин голови та шиї у хворих на розацеа жінок звертає на себе увагу наявність дефіциту кровотоку по V4 сегменту ХА у переважній кількості пацієнток – 71 (94,7 %). У 7 хворих (9,3 %) виявлено внутрішньочерепну гіпертензію. Слід відзначити, що у хворих на еритематозно-телеангіектатичну форму розацеа дефіцит кровотоку по V4 сегменту вірогідно частіше відзначався з обох сторін – 33 (67,3 %) хворих, в той час як при папуло-пустульозній формі захворювання такі порушення спостерігались у 10 (38,5 %) пацієнток (χ2=5,79, р=0,016).
Хребетні артерії відповідають нормі тільки в 12 випадках (16,0 %). У решти 63 хворих (84,0 %) відзначається патологія хребетних артерій, в тому числі патологічна звивистість артерій з ознаками гемодинамічних порушень – у 54 (72,0 %). У 11 хворих патологічна звивистість відзначається на всьому протязі хребетних артерій: у 3 хворих – справа, у 6 хворих – зліва, по обидва боки – у 2 хворих.
У 43 хворих патологічна звивистість відзначається в локальному відділі на рівні С3-С4 хребців – 12 хворих, С4-С5 – 8 хворих, С5-С6 – 9 хворих, у 6 хворих патологічна звивистість спостерігається на рівні С4-С5-С6 хребців. При цьому таке порушення реєструється в області правої хребетної артерії – у 10 хворих, у 9 хворих – лівої, у 24 хворих – з обох сторін. При дуплексному скануванні судин шиї та голови у 6 хворих відзначалася патологічна звивистість внутрішньої сонної артерії з гемодинамічними порушеннями, у 4 – без гемодинамічних порушень. Ектазію внутрішньої яремної вени виявлено праворуч у 5 хворих, зліва – у 3 хворих, з обох сторін – у 2 хворих. При дослідженні загальної сонної артерії (ЗСА), виявлені ехо-ознаки наявності атеросклеротичних бляшок в місці біфуркації ЗСА у 5 хворих, з них у 4 пацієнток зазначені зміни супроводжувалися патологічними гемодинамічними порушеннями.
Отримані дані підтверджують значну роль патології магістральних судин голови та шиї при розацеа, такі висновки також підтверджуються дослідженнями інших авторів [18, 116].
Як відомо, iснуючі методи лікування не достатньо враховують закономірності розвитку та перебігу розацеа у жінок. У результаті хронічного персистуючого перебігу запального процесу на шкірі обличчя формуються стійкі дефекти, що спотворюють зовнішність і погано піддаються лікуванню засобами зовнішньої терапії та косметичної корекції. В більшості випадків неможливо отримати виражений та стійкий регрес телеангіектатичних елементів при даній патології [26, 30].
На базі кафедри шкірних та венеричних хвороб ДЗ «Дніпропетровська медична академія МОЗ України» розроблена і запропонована методика лікування еритематозно-телеангіектатичної і папуло-пустульозної форм розацеа, яка забезпечує дію на ключові ланцюги патогенетичних механізмів розвитку захворювання. Клінічна апробація методу проводилась на базі Медичного центру ПП “Леномед” (м. Дніпро).
Для оцінки ефективності різних методик лікування розацеа всі хворі були рандомізовані на 4 рівнозначні групи залежно від форми розацеа і методики лікування. Основні групи пацієнток отримували запропоновану терапію: І група – 25 жінок з еритематозно-телеангіектатичною формою розацеа, ІІІ група – 25 жінок з папуло-пустульозною формою розацеа. У групах порівняння застосовувались традиційні методики: ІІ група (25 жінок) з еритематозно-телеангіектатичною формою розацеа, ІV група (25 жінок) з папуло-пустульозною формою захворювання. Виділені групи були статистично спіставними (p>0,05) за віком пацієнток, давністю захворювання, а також фототипами шкіри, супутньою патологією, тяжкістю перебігу захворювання, що дозволило порівнювати ефективність обраного варіанту терапії.
Основні групи пацієнток отримували запропоновану терапію: І група з судинною формою розацеа, ІІІ група з папуло-пустульозною формою розацеа. Лікувальний комплекс включав використання перорально доксицикліну у дозі 50 мг на добу протягом 6 тижнів у І групі та 100 мг двічі на добу протягом 2 тижнів у ІІІ групі. Місцево призначався у І групі гель з азелаїновою кислотою 15 %, 1 раз на добу, на ніч, протягом 8 тижнів, а також 1 % крем пімекролімус, як засіб, що пригнічує VEGF, – перші 8 тижнів – вранці, далі – 2 рази на добу до 16 тижня.
У ІІІ групі місцево призначавя гель з адапаленом та кліндаміцином, 1 раз на добу, на ніч протягом 8 тижнів та гель з метронідазолом 1раз на добу, вранці, протягом 8 тижнів, а також 1 % крем пімекролімус, як засіб, що пригнічує VEGF, з 9-го тижня лікування 2 рази на добу до 16 тижня.
Крім того, застосовувалася система інтенсивного імпульсного світла IPL з довжиною хвилі 560-1200 нм, імпульсом 22-26 Дж/см2, з проведенням процедур 1 раз на місяць, 2-4 сеанси на курс, починаючі з 7-го тижня лікування у І групі, та починаючи з 9-го тижня лікування у ІІІ групі. Середня кількість проведених процедур IPL в І групі склала 3,48±0,14, в ІІІ групі – 3,47±0,13.
Також з першого дня лікування і до 16 тижня хворим І і ІІІ досліджуваних груп призначався ангіопротектор Детралекс по 1 таблетці двічі на добу.
У групах порівняння: ІІ група з еритематозно-телеангіектатичною формою розацеа та ІV група з папуло-пустульозною формою захворювання, застосовувались традиційні методики.
В ІІ групі внутрішньо застосовувався доксициклін у дозі 50 мг 1 раз на добу протягом 6 тижнів, місцево призначався гель з азелаїновою кислотою 15 %, 1 раз на добу, протягом 8 тижнів, а також 1 % крем пімекролімус – перші 8 тижнів – вранці, далі – 2 рази на добу до 16 тижня.
У ІV групі доксициклін призначався по 100 мг двічі на добу протягом 2 тижнів місцево призначавя гель з адапаленом та кліндаміцином, 1 раз на добу, на ніч протягом 8 тижнів та гель з метронідазолом 1 раз на добу, вранці, протягом 8 тижнів, а також 1 % крем пімекролімус з 9-го тижня лікування, 2 рази на добу до 16 тижня.
При лікуванні хворих за запропонованою методикою вдалося досягти клінічного одужання у 84 % жінок, хворих на еритематозно-телеангіектатичну форму розацеа. В групі порівняння таких результатів вдалося досягти лише в 6 (24 %) випадках (p<0,001 порівняно з І групою). В 7 хворих ІІ групи (28 %) відзначено значне покращання патологічного шкірного процесу, в 9 (36 %) – покращення клінічних проявів захворювання, а в 3 (12 %) випадках позитивного ефекту не спостерігали.
Таким чином, на тлі порівняних вихідних даних, які впливають на перебіг захворювання (вік, тривалість захворювання, тяжкість стану тощо), у хворих на еритематозно-телеангіектатичну форму розацеа після проведених курсів комплексного лікування з використанням IPL-терапії позитивні результати (одужання і значне покращання) отримано практично у всіх хворих (24 – 96 %), що на 44 % перевищує результати, отримані при застосуванні традиційних методів лікування еритематозно-телеангіектатичної форми розацеа у жінок (52 %) при p<0,001.
Ефективність лікування хворих жінок з папуло-пустульозною формою розацеа також вірогідно залежала від застосованого методу терапії. Найкращих результатів було досягнуто у пацієнток ІІІ групи, де до схеми лікування було додатково включено процедури з використанням IPL. Так, клінічне одужання зі стійкою ремісією настало у 18 хворих (72 %), ще у 5 хворих (20 %) досягнуто значного покращання клінічних характеристик. Ефективність традиційних підходів до терапії папуло-пустульозної форми розацеа (IV група) підтверджена досягненням клінічного одужання у 7 (28 %) хворих та значним покращанням стану в 9 (36 %) пацієнток. В 8 випадках (32 %) відзначали покращання патологічного процесу, в однієї хворої лікування не мало ефекту.
Застосування пропонованого методу терапії даної форми розацеа у жінок дозволило отримати позитивні результати в абсолютній більшості випадків (92 %), що на 28 % краще, ніж в групі порівняння (64 %) при p<0,05., незважаючи на значну частку пацієнток з важким ступенем тяжкості захворювання (за ШДОР) на початку дослідження (28 %).
Отримані результати лікування за допомогою системи IPL свідчать про значний вплив інтенсивного імпульсного світла на нормалізацію судинних змін в шкірі хворих та призводить до вираженого кліничного ефекту лікування і досягнення стійкої ремісії захворювання, що також підтверджується рядом авторів [34, 38, 184].
Враховуючи визначені на початку дослідження суттєві порушення психоемоційного стану хворих на розацеа жінок та відповідне погіршення якості їх життя, цим питанням приділяли особливу увагу під час проведення комплексної терапії і динамічного спостереження.
Проведена повторна оцінка ступеня вираженості депресивної і тривожної симптоматики у тематичних хворих за шкалою HADS після закінчення основних курсів терапії. Відзначена позитивна динаміка показників в обох клінічних групах хворих жінок з еритематозно-телеангіектатичною формою розацеа, що виявилось вірогідним зменшенням проявів тривоги і депресії. Так, серед зареєстрованих на початку дослідження клінічно виражених ознак тривожно-депресивного стану у 15 хворих (6 пацієнток з І групи і 9 – з ІІ) наприкінці дослідження у 13 хворих такі прояви відповідали критеріям субклінічного стану, у 2 – критеріям норми. Середній бал за шкалою HADS у хворих основної групи зменшився з 8,00 ± 0,56 до 4,76 ± 0,50 балів, тобто на 40,5 % (p<0,001), а в групі порівняння – з 8,80 ± 0,54 до 6,40 ± 0,46 балів (на 27,3 %, p<0,001).
Водночас, на тлі статистично порівняних вихідних рівнів показників оцінки ступеня вираженості ознак тривожно-депресивного стану за шкалою HADS в обох групах (р>0,05), динаміка показників в основній групі хворих була більш суттєвою – середній бал за шкалою HADS після лікування був на 25,6 % менше, ніж в групі порівняння (р<0,05).
Подібні результати щодо покращення психоемоційного стану пацієнток на тлі лікування досягнуто в групах хворих на папуло-пустульозну форму розацеа. Так, кількість хворих з нормалізацією стану збільшилась з 3 (6 %) до 13 (26 %), а кількість випадків клінічно вираженої тривоги/ депресії зменшилась з 28 (56 %) до 5 (10 %) при p<0,05. Причому більшість позитивних результатів було отримано у пацієнток основної групи.
Середній бал за шкалою HADS у хворих ІІІ групи на тлі лікування зменшився на 19,0 % з 10,32 ± 0,39 до 8,36 ± 0,43 бали (p<0,001), а в групі порівняння – з 11,00 ± 0,42 до 9,16 ± 0,39 балів, тобто на 16,7 % (p<0,001).
Аналіз динаміки показників якості життя у тематичних хворих після проведених курсів комплексного лікування засвідчив їх суттєве поліпшення у повній відповідності до регресу або покращення клінічних показників. Середній показник ДІЯЖ у хворих з еритематозно-телеангіектатичною формою розацеа, які отримували запропоновану терапію (І група), зменшився з 20,00±0,82 бали до 6,24 ±0,65 балів, тобто в 3,2 рази (на 68,8 %) при р<0,001.
В групі порівняння, на тлі традиційної терапії розацеа, динаміка також була вірогідною (р<0,001), але менш вираженою: показник ДІЯЖ зменшився на 35,8 % з 19,24 ± 0,97 балів до 12,36 ±1,08 балів.
Отже, на тлі зіставної оцінки якості життя на початку дослідження в обох групах хворих на еритематозно-телеангіектатичну форму розацеа (р>0,05), після проведеного лікування в основній групі бальна оцінка за шкалою ДІЯЖ була вдвічі менше (на 49,5 %), ніж в групі порівняння (р<0,001).
Аналіз динаміки показників якості життя (ДІЯЖ) у хворих на папуло-пустульозну форму розацеа на тлі лікування також показав переваги запропонованого метода комплексної терапії з використанням IPL.
Середній показник ДІЯЖ у хворих основної групи (ІІІ група) зменшився з 21,04±1,02 бали до 12,84 ±0,87 балів, тобто на 39,0 % при р<0,001. В групі порівняння (IV група) зміни показника також були суттєвими – зменшення на 25,0 % (р<0,001), але менш вираженими порівняно з ІІІ групою.
Отже, доведено, що запропоноване комплексне лікування жінок, хворих на судинні форми розацеа, із застосуванням системи інтенсивного імпульсного світла IPL забезпечує дію на ключові ланцюги патогенетичних механізмів розвитку судинних форм розацеа, спрямоване на досягнення клінічного одужання, подовження ремісії та на покращення якості життя хворих, не є інвазивним, просте у застосуванні, враховує фототип шкіри пацієнта, клінічну виразність симптомів та ступінь ушкодження судин. Спосіб є високоефективним і може використовуватись у лікувальних дерматологічних та косметологічних установах з метою зменшення клінічних проявів та отримання стійкої ремісії після проведеної терапії. Що підтверджено також результатами інших авторів Л.А. Ковальчук і В.Ю. Гончарук (2012), Кубановой А.А., Махакової Ю.Б (2014), з використанням спектру 550-670 нм і 870-1200 нм, S. Kawana et al. (2007), з використанням основного режиму 550-670 нм., A.F. Taub, C.A. Schroeter et al. (2008) [34, 41, 143, 193].
Таким чином у розвитку та перебігу розацеа значну роль грають як зміни крупних судин голови та шиї, завдяки уповільненню кровообігу та кровопостачання тканин в цілому, так і місцеві морфологічні та імуногістохімічні зміни капілярів та оточуючих їх структур в ураженій шкірі обличчя, що загалом призводить до стійкої дилятації поверхневих судин шкіри та підтримує процеси запалення навколо капілярів та «pilosebaceous unit». Тому комплексну терапію розацеа доцільно доповнювати безпосереднім впливом на змінені поверхневі капіляри методом IPL. Такий підхід дозволяє отримати більш виражений терапевтичний ефект та значно подовжити період ремісії захворювання.
ВИСНОВКИ
У дисертаційній роботі представлено теоретичне узагальнення та практичне вирішення актуального завдання дерматовенерології – підвищення ефективності комплексної диференційованої терапії у жінок, хворих на розацеа, на підставі дослідження особливостей механізму розвитку, клініко-морфологічних проявів та стану судинного русла дерматозу в динаміці лікування із застосуванням засобів та методик, що нормалізують рівень фактору судинного росту ендотелію та стан судин.
1. Враховуючи розповсюдженість розацеа переважно серед осіб працездатного віку, хронічний персистуючий перебіг захворювання з формуванням стійких косметичних дефектів на шкірі обличчя, що збільшує частоту психосоматичних розладів, пов’язаних із захворюванням, та знижує якість життя, відсутність чіткого уявлення щодо етіології, патогенезу, тригерних факторів розвитку дерматозу у жінок, а також недостатню ефективність методів терапії без врахування індивідуальних імуно-морфофункціональних особливостей шкіри хворих та стану судин голови та шиї, вивчення даної проблеми є актуальним для сучасної наукової та практичної дерматовенерології.
2. Встановлено, що характерними рисами розвитку і перебігу розацеа у жінок є: дебют захворювання у молодому віці (до 45 років – 82 %), тривалий перебіг (5 років і більше – 62 %), обтяжливий сімейний анамнез (21 %), раптові прояви захворювання (31 %), загострення захворювання під дією тригерних факторів (надмірна інсоляція – 67 %, прийом гарячої або гострої їжі – 78 %, вживання алкоголю – 89 %, стрес або зміна температурного режиму – 42 %, робота за комп’ютером понад 3 годин – 42 %, використання косметичних засобів або процедур – 33 %), ІІ фототип шкіри (76 %), супутня патологія (84 %) з ураженням кількох систем організму (66 %), середній та важкий ступінь перебігу хвороби (76 %), здебільшого асоційований з ППР (94 %), погіршення якості життя ([20,12 ± 0,47] балів за шкалою ДІЯЖ), посилення тривожних і депресивних тенденцій (за шкалою HADS – (9,53 ± 0,27) балів), відсутність ефекту від лікування (37 %).
3. За даними патоморфологічного дослідження змін шкіри на різних стадіях перебігу розацеа встановлено, що загальним компонентом ранніх проявів захворювання є: великі телеангіектазії в ділянках сосочкового і поверхневої частини сітчастого шару дерми, набряк сосочкової дерми, периваскулярні інфільтрати, сонячний еластоз, відсутність змін в епідермально-дермальному з’єднанні, можлива наявність Demodex у волосяних цибулинах (27 %). Для тривалих, старих ушкоджень шкіри характерно: хронічне запалення, що має перифолікулярний та перипілярний характер, з частими ознаками гранулематозного запалення, наявністю кліща Demodex або його еозинофільних залишків, присутність ретенційних елементів, сонячний еластоз, гіперплазія сальних залоз без ушкодження їх будови.
4. На підставі імуногістохімічного дослідження встановлено суттєве підвищення експресії рецепторів до VEGF, СD34+ – маркеру ендотелію, рецепторів до естрогенів/андрогенів (AR, ER) у біоптатах шкіри хворих на розацеа порівняно зі здоровою шкірою, що дозволило розробити алгоритм прогнозування прогредієнтного перебігу розацеа у жінок для вибору адекватного терапевтичного впливу на всі ланки патогенезу.
5. Проведене доплерографічне дослідження стану судин голови та шиї у жінок з розацеа показало наявність дефіциту кровотоку по V4 сегменту ХА в абсолютній більшості випадків (94,7 %), що дозволяє зробити висновок про значний вплив на перебіг розацеа супутньої патології судин голови та шиї.
6. Розроблено комплексну патогенетично обґрунтовану терапію хворих на різні клінічні форми розацеа з використанням засобів, які впливають на різні ланки патогенезу захворювання, і поєднаного застосування IPL терапії для досягнення вираженого клінічного ефекту та подовження періоду ремісії захворювання. Запропонований метод забезпечує підвищення ефективності терапії (повне клінічне одужання зі стійкою ремісією у 84 % хворих на ЕТР і у 72 % хворих на ППР), вірогідне зменшення проявів тривоги і депресії (зменшення середнього бала за шкалою HADS на 40,5 % і 19,0 %), покращення показника ЯЖ на 68,8 % і на 39 % перевищує клінічні результати, отримані при застосуванні традиційних методів терапії (клінічне одужання у 24 % і 28 %).
РЕКОМЕНДАЦІЇ
З метою оптимізації лікування розацеа рекомендовано дообстеження хворих у суміжних спеціалістів для виявлення супутньої патології та корекції виявлених змін. Комплексне лікування хворих має враховувати патоморфологічні особливості перебігу захворювання, впливати на судинний компонент розвитку хвороби та бути системним та індивідуальним.
Хворим на ЕТР у період загострення показано застосування:
- перорально доксициклін у дозі 50 мг на добу протягом 6 тижнів;
- місцево гель з азелаїновою кислотою 15 %, 1 раз на добу, на ніч, протягом 8 тижнів, а також 1 % крем пімекролімус, перші 8 тижнів – вранці, далі – 2 рази на добу до 16 тижня;
- починаючи з 7 тижня призначається проведення процедур з використанням системи IPL – з довжиною хвилі 560-1200 нм, з проведенням процедур 1 раз на місяць, 2–3 сеанси:
– у пацієнтів з I фототипом шкіри: енергія спалаху 22–24 Дж/см2, при необхідності, з підвищенням енергії до 26 Дж/см2 до видимої коагуляції телеангіектазій;
– у пацієнтів з II фототипом шкіри: енергія спалаху 24–26 Дж/см2, при необхідності, з підвищенням енергії до 28 Дж/см2 до видимої коагуляції телеангіектазій;
- також рекомендовано застосування ангіопротекторного препарату Детралекс з першого дня лікування і до 16 тижня.
Хворим на ППР у період загострення показано застосування:
- перорально доксициклін 100 мг двічі на добу протягом 2 тижнів;
- місцево гель з адапаленом та кліндаміцином, 1 раз на добу, на ніч протягом 8 тижнів та гель з метронідазолом 1 раз на добу, вранці, протягом 8 тижнів;
- далі 1 % крем пімекролімус з 9-го тижня лікування 2 рази на добу до 16 тижня;
- починаючи з 7 тижня призначається проведення процедур з використанням системи IPL – з довжиною хвилі 560–1200 нм) з проведенням процедур 1 раз на місяць, 2–3 сеанси:
– у пацієнтів з I фототипом шкіри: енергія спалаху 22–23 Дж/см2, при необхідності, з підвищенням енергії до 26 Дж/см2 до видимої коагуляції телеангіектазій;
– у пацієнтів з II фототипом шкіри: енергія спалаху 23–25 Дж/см2, при необхідності, з підвищенням енергії до 28 Дж/см2 до видимої коагуляції телеангіектазій;
- також рекомендовано застосування ангіопротекторного препарату Детралекс з першого дня лікування і до 16 тижня.
Для досягнення стійкої ремісії захворювання треба дотримуватися послідовності в лікуванні хворих. Комплексна діагностика повинна включати метод дерматоскопічної візуалізації осередків ураження та доплерографічне обстеження стану судин голови та шиї.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Автандилов Г. Г. Медицинская морфометрия. Руководство. М. : Медицина, 1990. С. 240–248.
- Адаскевич В. П. Акне вульгарные и розовые. М. : Медицинская книга, Н. Новгород : НГМА, 2003. 160 с.
- Адаскевич В. П. Диагностические индексы в дерматологии : руководство. Москва : Медицинская книга. 2004. 165 с.
- Акне и розацеа / Н. Н. Потекаев, Е. Р. Аравийская, Е. В. Соколовский и др.; под ред. Н. Н. Потекаева. М. : БИНОМ, 2007. 213 c.
- Антомонов М. Ю. Математическая обработка и анализ медико-биологических данных. К., 2006. 558 с.
- Арипова М. Л., Хардикова С. А. Дифференциальная диагностика розацеа и туберкулеза кожи. Бюллетень сибирской медицины. 2014. Т. 13, № 5. C. 45–49.
- Балтабаев М. К., Шакирова А. Т., Балтабаев А. М. Новые подходы в терапии acne rosacea. Вестник КРСУ. 2016. Т. 16, № 11. С. 8.
- Бахлыкова Е. А., Филимонкова Н. Н., Матусевич С. Л. Системная терапия у больных с тяжелым течением розацеа. Вестник дерматологии и венерологии. 2016. № 4. С. 68–74.
- Биткина О. А. Уровень окислительного стресса у больных розацеа и обоснование терапевтического применения озоно-кислородной смеси. Клинич. лаб. диагностика. 2010. № 4. С. 13–16.
- Биткина О. А. Этиология и патогенез розацеа. Вопросы дифференциального диагноза и терапии. Рос. журнал кожных и венерических болезней. 2010. № 1. С. 54–57.
- Бондаренко В. В. Новое в лечении розацеа: классические методы в сочетании с лазеротерапией. Косметика и медицина. 2017. № 4. С. 56–64.
- Брібеш М. Р. Сучасні погляди на етіологію, патогенез, клінічні особливості та лікування хворих на розацеа та періоральний дерматит. Дерматовенерология. Косметология. Сексопатология. 2014. № 1–4. С. 17–25.
- Бутов Ю. С. Механизмы развития, клиническое течение и терапия розацеа. Рос. мед. журнал. 2011. № 1. С. 29–32.
- Бутов Ю. С. Опыт применения крема Розамет при лечении некоторых дерматозов. Вестник дерматологии и венерологии. 2005. № 6. С. 52–54.
- Василенко А. В. Виявлення особливостей патогенетичних змін при рецидивах розацеа та їх прогнозування. Дерматовенерология Косметология. Сексопатология. 2015. № 1–2. С. 27–32.
- Василенко А. В. Комплексная дифференцированная терапия больных рецидивами розацеа с учётом изменений показателей вариабельности сердечного ритма и изменений психологического статуса. Запорожский медицинский журнал. 2015. № 4. С. 79–84.
- Верхогляд И. В. Юнидокс Солютаб в комплексной терапии розацеа. Вестник дерматологии и венерологии. 2006. № 4. С. 34–35.
- Возіанова С. В. Розацеа: патогенез, лікування та перспективи нових досліджень. Актуальные проблемы транспортной медицины. 2008. № 2 (12). С. 127–132.
- Волф К., Лоуэлл А. Дерматология Фицпатрика в клинической практике. Т. 1. М. : Изд-во Панфилова, 2012. 896 с.
- Г.И. Мавров, Г. Арвеладзе. Этиотропная терапия в комплексном лечении розацеа. Жіночий лікар. 2008. №4. С. 46.
- Давыдова А. В., Бакулев А. Л. Исследование личностных особенностей пациентов с розацеа. Саратовский научно-медицинский журнал. 2014. Т. 10, № 3. С. 28–32.
- Давыдова А. В., Бакулев А. Л. Сравнение и интерпретация шкал дерматологического индекса качества жизни и СКИНДЕКС-29 у пациентов с различными подтипами розацеа. Саратовский научно-медицинский журнал. 2015. Т. 11, № 3. С. 401–405.
- Демина О. М., Потекаев Н. Н. Современные этиопатогенетические механизмы развития розацеа и новые методы терапии. Клиническая дерматология и венерология. 2017. Т. 16, № 3. С. 42–45.
- Додина М. И. Клинические, иммунологические и морфологические взаимосвязи у больных розацеа на фоне лечения пимекроклимусом: автореф. дис. на соискание учен. степени канд. мед. наук: спец. 14.01.10 «Кожные и венерические болезни». М., 2011. 25 с.
- Запольский М., Добровольская А. Оптимизация методов лечения устойчивых форм розацеа. Дерматолог. 2016. № 4. С. 372–378.
- Ильина И. В. Патогенетическое обоснование и совершенствование лечения розацеа: автореф. дис. на соискание учен. степени канд. мед. наук: спец. 14.01.10 «Кожные и венерические болезни». М., 2012. 25 с.
- Ильина И. В. Современный взгляд на патогенез розацеа. Эксперим. и клинич. дерматокосметология. 2011. № 2. С. 18–20.
- Інформаційний лист про впровадження у системі охорони здоров’я «Спосіб лікування судинних форм розацеа» / Т. В. Святенко, О. А. Старостіна, Дніпропетровська медична академія МОЗ України. К., 2017. 4 с.
- Каиль-Горячкина М. В., Белоусова Т. А. Синдром чувствительной кожи в практике врача-дерматолога. Дерматология. Приложение к журналу Consilium Medicum. 2016. № 1. С. 22–26.
- Карпова А. В., Баткаев Э. А. Роль взаимодействия факторов, участвующих в патогенезе розацеа, с методами терапии. Дерматология. Приложение к журналу Consilium Medicum. 2015. № 4. С. 10–12.
- Карпова А. В., Баткаев Э. А. Современный взгляд на проблему этиопатогенеза и терапии розацеа. Вестник последипломного медицинского образования: науч.-практ. и информ. журн. 2015. № 2. С. 49–52.
- Кашеваров Д. Ф. Комбинированное применение метронидазола в лечении розацеа. Новая наука: От идеи к результату. 2016. № 11-4. С. 62–63.
- Ключарева С. В. Нарушение микрогемодинамики кожи лица у больных розацеа. Эксперим. и клинич. дерматокосметология. 2011. № 5. С. 6–9.
- Ковальчук Л. А., Гончарук В. Ю. Опыт лечения больных розацеа. Инновационные технологии в диагностике и лечении кожных заболеваний и инфекций урогенитального тракта : Региональная научно-практическая конференция с международным участием. Гродно, 2012. С. 64–67.
- Комплексная терапия розацеа препаратами азелаиновой кислоты / В. В. Гладько, С. А. Масюкова, И. В. Ильина и др. Вестник дерматологии и венерологии. 2016. №. 6. С. 73–78.
- Королева Ж. В., Боровиков В. М. Опыт применения препарата «Акнетин» у больных с розацеа. Український журнал дерматології, венерології, косметології. 2016. № 1 (60). С. 36–39.
- Круглова Л. С., Орлова Е. Н., Котенко К. В. Лазеротерапия и ультразвуковая терапия в лечении больных розацеа. Вестник новых медицинских технологий. Электронное издание. 2014. № 1. С. 32–36.
- Кубанова А. А., Махакова Ю. Б. Розацеа: диагностика и лечение. Вестник дерматологии и венерологии. 2015. № 4. С. 27–35.
- Кубанова А. А., Махакова Ю. Б. Розацеа: распространенность, патогенез, особенности клинических проявлений. Вестник дерматологии и венерологии. 2015. № 3. С. 36–45.
- Кубанова А. А., Махакова Ю. Б. Диагностическая значимость метода конфокальной лазерной сканирующей in vivo микроскопии. Вестник дерматологии и венерологии. 2015. № 3. С. 67–74.
- Кубанова А. А., Махакова Ю. Б. Лечение больных розацеа широкополосным импульсным световым излучением с технологиями «гладкий импульс» и «рециркуляция фотонов». Вестник дерматологии и венерологии. 2015. № 4. С. 51–59.
- Кутасевич Я. Ф., Маштакова И. А. Опыт применения метронидазола для комплексного лечения больных. Украинский журнал дерматологии, венерологии, косметологии. 2015. № 3. С. 59–62.
- Кутасевич Я. Ф., Маштакова И. А., Олейник И. А. Место системных ретиноидов в лечении розацеа. Український журнал дерматології, венерології, косметології. 2013. № 1. С. 113–117.
- Матушевская Е. В., Свирщевская Е. В. Азелаиновая кислота в практике врача-дерматолога и косметолога. Клиническая дерматология и венерология. 2014. Т. 12, № 5. С. 11–17.
- Минёнок Т. А. Современные аспекты розацеа и заболеваемость по данным клиники кожных и венерических болезней СГМУ им. В. И. Разумовского за 2014 г. Бюллетень медицинских интернет конференций. 2015. Т. 5, № 5. С. 584.
- Михнева Е. Н. Клинические особенности розацеа. Дерматовенерологія. Косметологія. Сексопатологія. 2016. № 3 (4). С. 22–26.
- Молочков А. В., Овсянникова Г. В. Метронидазол в наружном лечении розацеа. Український журнал дерматології, венерології, косметології. 2016. № 2. С. 85–88.
- Монахов С. А., Богадельникова А. Е. Лечебный уход за кожей в комплексной терапии розацеа. Клиническая дерматология и венерология. 2015. Т. 14, № 5. С. 14–18.
- Морфологічні критерії перебігу судинних форм розацеа / О. А. Старостіна, Т. В. Святенко, І. С. Шпонька, О. В. Пославська. Морфологія. 2017. Т. 11, № 2. С. 40–45.
- Низомаддинова З. А. Розацеа у жителей жаркого климата. (этиология, некоторые стороны патогенеза, клиника, терапия): автореф. дис. на соискание учен. степени канд. мед. наук: спец. 14.00.11 «Кожные и венерические болезни». Душанбе, 2005. 22 с.
- Обгольц И. А. Клинические, психоэмоциональные и терапевтические аспекты розацеа, ассоциированной с кандидозной инфекцией. автореф. дис. на соискание учен. степени канд. мед. наук: код спец. 14.00.11 «Кожные и венерические болезни». Новосибирск, 2009. 35 с.
- Обоснование эффективности метронидазола в терапии розацеа / С. Ю. Троянова, И. М. Корсунская, И. Л. Сорокина, В. В. Соболев. Клиническая дерматология и венерология. 2017. Т. 16, № 5. С. 45–48.
- Олисова О. Ю. Современные представления о патогенезе розацеа. Эксперим. и клинич. дерматокосметология. 2010. № 6. С. 18–22.
- Олисова О. Ю., Кочергин Н. Г., Смирнова Е. А. Современная наружная терапия среднетяжелых форм розацеа. Российский журнал кожных и венерических болезней. 2016. Т. 19, № 6. С. 328–334.
- Олисова О. Ю., Кочергин Н. Г., Смирнова Е. А. Инновации в наружной терапии розацеа. Рос. журн. кожн. вен. болезн. 2017. № 20 (5). С. 270–274.
- Особенности патогенеза, клиники, диагностики и терапии розацеа / Л. А. Юсупова, Е. И. Юнусова, З. Ш. Гараева, Г. И. Мавлютова. Лечащий врач. 2016. № 9. С. 81–81.
- Панкина Е. С. Нарушения микроциркуляции кожи лица при розацеа и методы их коррекции: автореф. дис. на соискание учен. степени канд. мед. наук: спец. 14.00.11 «Кожные и венерические болезни»; 14.00.16 «Патологическая физиология». СПб., 2008. 20 с.
- Пат. на корисну модель № 124614 UA, МПК G01N21/00, G01N33/00, A61B10/00. Спосіб прогнозування перебігу розацеа у жінок / О. А. Старостіна, Т. В. Святенко, І. С. Шпонька, О. В. Пославська. № u201712471; заявл. 15.12.17; опубл. 10.04.18, Бюл. № 7.
- Первый опыт применения ивермектина и бримонидина тартрата у пациентов с розацеа (клинические наблюдения) / Н. Н. Потекаев, А. Н. Львов, Е. А. Хлыстова, М. А. Кочетков. Клиническая дерматология и венерология. 2017. Т. 16, № 2. С. 117–125.
- Первый опыт применения фотодинамической терапии с фотодитазином у больных розацеа / Д. А. Шнайдер, Т. И. Малова, К. Ю. Шерстобитова, С. Р. Утц. Российский биотерапевтический журнал. 2016. Т. 15, № 1. С. 23–29.
- Перламутров Ю. Н., Сайдалиева В. Ш., Ольховская К. Б. Сравнительная оценка эффективности различных методов терапии розацеа. Вестник дерматологии и венерологии. 2011. № 3. С. 73–79.
- Петрищев Н. Н. Дисфункция эндотелия. Причины, механизмы, фармакологическая коррекция. СПб. : Изд-во СПбГМУ, 2003. 181 с.
- Пимекролимус при иммунодерматозах / Н. Г. Кочергин, Е. Е. Румянцева, Г. В. Кондрашов, Е. В. Траксель. Русский медицинский журнал. 2003. № 11. С. 953–956.
- Пинсон И. Я., Верхогляд И. В., Семочкин А. В. Современные методы лечения розацеа. Лечащий врач. 2012. № 10. С. 10–11.
- Пинсон И. Я., Верхогляд И. В., Семочкин А. В. Современные представления об этиологии и патогенезе розацеа. Экспериментальная и клиническая дерматокосметология. 2012. № 5. С. 21–24.
- Пирятинская В. А. Розамет крем – высокоэффективное средство лечения розацеа. Вестник дерматологии и венерологии. 2005. № 5. С. 40–42.
- Пославська О. В. Методологія використання програмного забезпечення для аналізу цифрових мікрофотографій на базі курсу патоморфології з метою підвищення професійного рівня студентів, аспірантів, здобувачів вищих медичних закладів. Морфологія. 2015. Т. 9, № 3. С. 122–126.
- Потекаев Н. Н. Современные представления об этиологии, клинике и терапии розацеа. Косметика и медицина. 2001. № 6. С. 15–21.
- Прохоренков В. И., Михель Д. В., Гузей Т. Н. Розацеа: современные аспекты этиологии и патогенеза. Клиническая дерматология и венерология. 2015. Т. 14, № 1. С. 4–11.
- Проценко О. А. Розацеа: этиология, патогенез, клиническая картина и лечение (лекция для врачей). Український журнал дерматології, венерології, косметології. 2014. № 4. С. 98–107.
- Пути повышения приверженности лечению пациентов с розацеа / И. Л. Соркина, Л. Р. Сакания, С. Ю. Троянова, И. М. Корсунская. Клиническая дерматология и венерология. 2017. Т. 16, № 4. С. 45–48.
- Пути повышения приверженности лечению пациентов с розацеа Соркина И. Л., Сакания Л. Р., Троянова С. Ю., Корсунская И.М. Клиническая дерматология и венерология. 2017. № 4.С.66-70.
- Реброва О. Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М. : Медиа Сфера, 2002. 312 с.
- Ридха Б. М. Современные взгляды на этиологию, патогенез, клинические особенности и лечение больных розацеа и периоральным дерматитом. Дерматовенерология. Косметология. Сексопатология. 2014. № 1. С. 43–48.
- Романенко И. М, Кулага В. В., Афонин С. Л. Лечение кожных и венерических болезней. Медицинское информационное агентство. 2015. С. 634–640.
- Россо Д. Д. Розацеа кожи: патогенез, клинические проявления, современные рекомендации по тактике ведения пациентов. Вестник дерматологии и венерологии. 2016. № 2. С. 21–31.
- Самцов А. В. Изотретиноин в лечении розацеа. Вестник дерматологии и венерологии. 2012. № 4. С. 102–104.
- Свирщевская Е. В., Матушевская Е. В., Матушевская Ю. И. Актуальные вопросы патогенеза и терапии розацеа. Клиническая дерматология и венерология. 2017. Т. 16, № 4. С. 4–13.
- Святенко Т. В., Чеверда О. А., Старостина О. А. IPL-терапия в лечении сосудистых форм розацеа и других дерматозов: безопасность и эффективность (собственные наблюдения). Журнал дерматовенерології та косметології імені М.О. Торсуєва. 2017. № 2 (38). С. 112–117.
- Святенко Т. В., Андриуца Л. А., Старостина О. А. Комбинированная терапия розацеа в условиях лечебно-косметологического центра. Збірник робіт за матеріалами науково-практичної школи «Молоді науковці – майбутнє української дерматовенерології». К., 2014. С. 61.
- Святенко Т. В., Старостина О. А. Новые возможности IPL-терапии в комплексном лечении сосудистых форм розацеа. Медицинские новости Грузии. 2015. № 6 (243). С. 62.
- Святенко Т. В., Харитонова Е. Г. Розацеа: патогенетические концепции формирования заболевания. Дерматолог. 2013. № 4. С. 70–75.
- Сергеева И. Г., Криницына Ю. М. Тактика ведения пациентов с тяжелым розацеа. Вестник дерматологии и венерологии. 2016. № 5. С. 72–78.
- Силина Л. В., Поехало А. Н., Солянина В. А. Aнализ ассортимента лекарственных средств для лечения розацеа. Инфекционные болезни как междисциплинарная проблема: Материалы Всероссийской научно-практической конференции с международным участием. Курск, 2016. С. 232–236.
- Слесаренко Н. А. Роль сосудистых нарушений в возникновении и поддержании воспаления в патогенезе розацеа. Саратов. науч.- мед. журнал. 2012. Т. 8, № 2. С. 650–654.
- Состояние перекисного окисления липидов и эндогенной интоксикации у больных папуло-пустулезной стадией розовых угрей и комплексная корригирующая терапия / Р. Ф. Айзятулов, Я. А. Полях, В. В. Юхименко и др. Журнал дерматології та косметології. М.О. Торсуєва. 2014. №. 1(2). С. 19–25.
- Старостина О. А. Клінічні прояви інфікування Demodex folliculorum на тлі запалення різної інтенсивності та гіперплазії сальних залоз у пацієнток різного віку із судинними формами розацеа. Дерматологія та венерологія. 2018. № 1 (79). С. 76–80.
- Старостина О. А. Результаты доплерографического исследования сосудов головы и шеи у больных розацеа женщин. Experimental and Clinical Medicine. 2018, Vol. 3. P. 67–70.
- Старостина О. А. Розацеа в сочетании с хроническими дерматозами (собственные наблюдения). Международный научно-практический журнал «Дерматовенерология. Косметология». 2015. № 1 (01). С. 72–77.
- Старостина О. А. Сочетание розацеа с хроническими дерматозами, локализованными на лице. Збірник тез ІХ Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання косметології та дерматології». Запоріжжя, 2015. С. 33.
- Старостіна О. А. Визначення середніх значень кількості, периметру, площі CD34-позитивних судин та оцінка експресії VEGF в біоптатах шкіри пацієнтів з судинними формами розацеа. Медичні перспективи. 2018. № 2 (2). С. 67–70.
- Старостіна О. А. Применение IPL-терапии в комплексном лечении сосудистых форм розацеа: Безопасность и эффективность (собственные наблюдения). Програма та матеріали Регіональної науково-практичної конференції «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом». Святогірськ, 2016. С. 34.
- Степаненко В.І., Клименко А.В. Акне та акнеподібні дерматози (розацеа, демодекоз): стратегія комплексної етапної терапії. Клінічна імунол., алергол., інфектол. 2010. № 1. С. 86–96.
- Тарасенко Г. Н. Роль патологии пищеварительного тракта и печени в патогенезе розацеа. Рос. журнал кожных и венерических болезней. 2010. № 1. С. 52–54.
- Терапия пациентов с розацеа, осложненным демодекозом / А. Ю. Путинцев, Л. Р. Сакания, О. О. Мельниченко, И. М. Корсунская. Эффективная фармакотерапия. 2016. № 26. С. 12–14.
- Утц С. Р. Оценка психосоматических изменений и изучение состояния вегетативной нервной системы у больных розацеа. Саратов. науч.-мед. журнал. 2012. Т. 8, № 2. С. 664–667.
- Федорич Л. Я. Досвід терапії хворих з резистентними та тяжкими формами акне та роазцеа з використанням системного ізотретиноїну Lidose. Український журнал дерматології, венерології, косметології. 2017. № 2 (65). С. 70–76.
- Хайрутдинов В. Р. Розацеа: современные представления о патогенезе, клинической картине и лечении. Эффективная фармакотерапия. 2014. Т. 3. С. 32–37.
- Халдин А. А. Розацеа у ВИЧ-инфицированнных больных. Рос. журнал кожных и венерических болезней. 2007. № 3. С. 62–64.
- Характеристика показателей цитокинового статуса при комплексном лечении розацеа / Е. С. Ярмолик, М. В. Горецкая, Д. Ф. Хворик, В. Р. Шулика. Журнал Гродненского государственного медицинского университета. 2016. № 1 (53). С. 39–43.
- Христенко Н. Е. Клиническая оценка эффективности различных методов терапии больных с папулопустулезным подтипом розацеа. Медицина третього тисячоліття : збірник тез міжвузівської конференції молодих вчених та студентів, Харків, 20 січня 2015 р. Харків, 2015. С. 348–349.
- Чеботарева Н. В. Общие принципы лечения розацеа в зависимости от стадии заболевания. Актуальные вопросы дерматовенерологии, косметологии и курортологии : сб. материалов науч.-практ. конф. Ставрополь, 2014. С. 183–189.
- Эпидемиология розацеа / Н. Н. Потекаев, И. В. Хамаганова, О. Л. Новожилова, Г. А. Лебедева. Клиническая дерматология и венерология. 2016. Т. 15, № 1. С. 4–7.
- Этиопатогенетическая роль Demodex folliculorum и B. oleronius в формировании иммунного ответа при розацеа (Обзор литературы) / Е. В. Горбакова, Н. Н. Кахишвили, С. А. Масюкова и др. Медицинский вестник МВД. 2014. № 1. С. 60–63.
- Ярмолик Е. С., Горецкая М. В., Хворик Д. Ф. Роль ангиогенеза и воспаления в патогенезе розацеа. Медицинский журнал. 2016. № 1. С. 145–148.
- Ярмолик Е. С., Шулика В. Р. Роль фактора роста эндотелия сосудов в патогенезе розацеа. Вторая белорусско-польская конференция: дерматология без границ. Гродно : ГрГМУ, 2015. С. 220–223.
- A novel mechanism of action of chemically modified tetracyclines: inhibition of COX-2-mediated prostaglandin E2 production / R. N. Patel, M. G. Attur, M. N. Dave et al. J. Immunology. 1999. Vol. 163, Iss. 6. P. 3459–3467.
- Adams H., Coven C., Grippe K. M. An Overview of Rosacea and Its Challenges. Physician Assist. Clin. 2016. Vol. 1, Iss. 2. P. 255–264.
- Addor F. A. S. Skin barrier in rosacea. An. Bras. Dermatol. 2016. Vol. 91, No. 1. P. 59–63.
- Aizawa Н., Niimura М. Oral spironolactone therapy in male patients with rosacea. J. Dermatol. 1992. Vol. 19, Iss. 5. P. 293–297.
- Alsultany H. A. R. Intensive Pulsed Light (IPL), a new hope for rosacea among iraqi patients. Journal of University of Babylon. 2016. Vol. 24, Iss. 5. P. 1544–1460.
- An empirically generated responder definition for rosacea treatment / G. Staedtler, K. Shakery, J. Endrikat et al. Clin. Cosmet. Investig. Dermatol. 2017. Vol. 10. P. 347–352.
- Assessment of the Genetic Basis of Rosacea by Genome-Wide Association Study / A. L. S. Chang, I. Raber, J. Xu et al. J. Invest. Dermatol. 2015. Vol. 135, Iss. 6. P. 1548–1555.
- Babilas P. Light-assisted therapy in dermatology: The use of intense pulsed light (IPL). Medical laser application. 2010. Vol. 25, Iss. 2. P. 61–69.
- Bamford J. T., Elliott B. A., Haller I. V. Tacrolimus effect on rosacea. Journal of the American Academy of Dermatology. 2004. Vol. 50 Iss. 1. P. 107-108.
- Belli A. A., Altun I. Assessment of Framingham risk score and systemic coronary risk evaluation in rosacea patients. Atherosclerosis. 2017. Vol. 263. P. 193–197.
- Brimonidine gel 0.33% rapidly improves patient-reported outcomes by controlling facial erythema of rosacea: a randomized, double-blind, vehicle-controlled study / A. M. Layton, M. Schaller, B. Homey et al. J. Eur. Acad. Dermatol. Venereol. 2015. Vol. 29, Iss. 12. P. 2405–2410.
- Buechner S. A. Rosacea: an update. Dermatology. 2005. Vol. 210, Iss. 2. P. 100–108.
- Calculation of the average density indices of androgen and estrogen receptors and evaluation of expression of COX-2 in skin biopsies of patients with vascular forms of rosacea / O. A. Starostina, Т. V. Svyatenko, I. S. Shponka, O. V. Poslavska. Experimental and Clinical Medicine. 2018, Vol. 1. P. 33–40.
- Clinical characteristics and epidermal barrier function of papulopustular rosacea: A comparison study with acne vulgaris / M. Zhou, H. Xie, L. Cheng, J. Li. Pak. J. Med. Sci. 2016. Vol. 32, Iss. 6. P. 1344–1348.
- Clinical, cellular, and molecular aspects in the pathophysiology of rosacea / M. Steinhoff, J. Buddenkotte, J. Aubert et al. J. Investig. Dermatol. Symp. Proc. 2011. Vol. 15, Iss. 1. P. 2–11.
- Comparative efficacy of intense pulsed light for different erythema associated with rosacea / J. Liu, J. Liu, Y. Ren et al. Cosmet. Laser Ther. 2014. Vol. 16. P. 324–327.
- Crawford G. H., Pelle M. T., James W. D. Rosacea: I. Etiology, pathogenesis, and subtype classification. Journal of the American Academy of Dermatology. 2004. Vol. 51. Iss. 3. P. 327-341.
- Del Rosso J. Multicenter, double-blind, randomized, placebo-controlled, parallel-group trial results evaluating the effects of 40 mg doxycycline monohydrate controlled-release capsules in treatment of rosacea. J. Am. Acad. Dermatol. 2006. Vol. 54, Suppl. 2. P. 30–34.
- Del Rosso J. Q. A status report on the use of subantimicrobial-dose doxycycline: a review of the biologic and antimicrobial effects of the tetracyclines. Cutis. 2004. Vol. 74, Iss. 2. P. 118–122.
- Density of Demodex folliculorum in patients receiving epidermal growth factor receptor inhibitors / P. A. Gerber, G. Kukova, B. A. Buhren, B. Homey. Dermatology. 2011. Vol. 222, Iss. 2. P. 144–147.
- Dessinioti C., Antoniou C. The “red face”: Not always rosacea. Clin. Dermatol. 2017. Vol. 35, Iss. 2. P. 201–206.
- Double-blind, randomized, vehicle-controlled clinical trial of once-daily benzoyl peroxide/clindamycin topical gel in the treatment of patients with moderate to severe rosacea / D. Breneman, R. Savin, C. VandePol et al. Int. J. Dermatol. 2004. Vol. 43, Iss. 5. P. 381–387.
- Drummond P. D., Su D. Increases in psychological stress precede flares of rosacea: A prospective study. J. Clin. Exp. Dermatol. Res. 2017. Vol. 8, Iss. 04. doi: 10.4172/2155-9554.1000408.
- Dual anti-inflammatory and anti-parasitic action of topical ivermectin 1% in papulopustular rosacea / M. Schaller, L. Gonser, K. Beige et al. JEADV. 2017. Vol. 31. P. 1907–1911.
- Finlay A. Y., Khan G. K. Dermatology Life Quality Index (DLQI) – a simple practical measure for routine clinical use. Clin. Exp. Dermatol. 1994. Vol. 19, Iss. 3. P. 210–216.
- Fowler J. F. Facial Dermatitis and Rosacea. Semin. Cutan. Med. Surg. 2016. Vol. 35, Iss. 6, Suppl. С. P. 107–109.
- Functional and Biochemical Endothelial Profiling In Vivo in a Murine Model of Endothelial Dysfunction; Comparison of Effects of 1-Methylnicotinamide and Angiotensin-converting Enzyme Inhibitor / A. Bar, M. Olkowicz, U. Tyrankiewicz et al. Front. Pharmacol. 2017. Vol. 8. P. 34–40.
- Goldberg D. J., Berlin A. Acne and rosacea: epidemiology, diagnosis and treatment. CRC Press. 2011. 31 p.
- Goldman M. P. Treatment of benign vascular lesions with the Photoderm VL high-intensity pulsed light source. Adv. Dermatol. 1997. Vol. 13. P. 503–521.
- Grivet-Seyve M., Santoro F., Lachmann N. Evaluation of a novel very high sun-protection-factor moisturizer in adults with rosacea-prone sensitive skin. Clin. Cosmet. Investig. Dermatol. 2017. Vol. 10. P. 211–219.
- Histochemical evaluation of the vessel wall destruction and selectivity after treatment with intense pulsed light in capillary malformations / E. Grillo, A. Rita Travassos, P. Boixeda et al. Actas Dermosifiliogr. 2016. Vol. 107, Iss. 3. P. 215–223.
- Holmes A. D., Steinhoff M. Integrative concepts of rosacea pathophysiology, clinical presentation and new therapeutics. Exp. Dermatol. 2017. Vol. 26, Iss. 8. P. 659–667.
- Husain Z., Alster T.S. The role of lasers and intense pulsed light technology in dermatology. Clin. Cosmet. Investig. Dermatol. 2016. Vol. 9. P. 29–40.
- Ighani A., Barankin B. Rosacea Presents With Erythematous Facial Papules and Pustules. J. Eur. Acad. Dermatol. Venereol. 2011. Vol. 25, Iss. 5. P. 544–548.
- Increased serine protease activity and cathelicidin promotes skin inflammation in rosacea. Yamasaki, K., Di Nardo, A., Bardan, A., Murakami, et al. Nature medicine. 2007. Vol 13, Iss 8. P. 975.
- Iyengar S. Development of a core outcome set for clinical trials in rosacea: study protocol for a systematic review of the literature and identification of a core outcome set using a Delphi survey. Trials. 2016. Vol. 17, Iss. 1. P. 23–29.
- Kawana S., Ochiai H., Tachihara R. Objective evaluation of the effect of intense pulsed light on rosacea and solar lentigines by spectrophotometric analysis of skin color. Dermatologic surgery. 2007. Vol. 33, Iss. 4. P. 449–454.
- Kelati A., Mernissi F. Z. Granulomatous rosacea: a case report. J. Med. Case Reports. 2017. Vol. 11. P. 56–58.
- Korting H.C., Schöllmann C. Current topical and systemic approaches to treatment of rosacea. J. Eur. Acad. Dermatol. Venereol. 2009. Vol. 23, Iss. 8. P. 876–882.
- Laser treatment of medical skin disease in women / C. LaRosa, A. Chiaravalloti, S. Jinna et al. Int. J. Womens Dermatol. 2017. Vol. 3, Iss. 3. P. 131–139.
- Layton A. M. Pharmacologic treatments for rosacea. Clin. Dermatol. 2017. Vol. 35, Iss. 2. P. 207–212.
- Major patho-physiological correlations of rosacea: a complete appraisal / R. C. Vemuri, R. Gundamaraju, S. D. Sekaran, R. Manikam. Int. J. Med. Sci. 2015. Vol. 12, Iss. 5. P. 387–396.
- Meibomian gland dysfunction and tear film abnormalities in rosacea / N. Zengin, H. Tol, K. Gündüz et al. Cornea. 1995. Vol. 14, Iss. 2. P. 144–146.
- Melnik B. C. Endoplasmic reticulum stress: key promoter of rosacea pathogenesis. Exp. Dermatol. 2014. Vol. 23, Iss. 12. P. 868–873.
- Meyer-Hoffert U., Schröder J. M. Epidermal proteases in the pathogenesis of rosacea. J. Investig. Dermatol. Symp. Proc. 2011. Vol. 15, Iss. 1. P. 16–23.
- Migraine in patients with rosacea / J. Spoendlin, C. Schneider, S. S. Jick et al. Pharmacoepidemiol. Drug Saf. 2011. Vol. 20. P. 199–200.
- Migraine, triptans, and the risk of developing rosacea: A population-based study within the United Kingdom / J. Spoendlin, J. J. Voegel, S. S. Jick, C. R. Meier. J. Am. Acad. Dermatol. 2013. Vol. 69. P. 399–406.
- Monitoring structural changes in Demodex mites under topical Ivermectin in rosacea by means of reflectance confocal microscopy: a case series / C. Ruini, E. Sattler, D. Hartmann et al. Eur. Acad. Dermatol. Venerol. 2017. Vol. 31. P. 299–301.
- Neurovascular and neuroimmune aspects in the pathophysiology of rosacea / V. D. Schwab, M. Sulk, S. Seeliger et al. J. Investig. Dermatol. Symp. Proc. 2011.Vol. 15, Iss. 1. P. 53–62.
- New developments in the treatment of rosacea – role of once-daily ivermectin cream / L. A. Cardwell, H. Alinia, S. Moradi Tuchayi, S. R. Feldman. Clin. Cosmet. Investig. Dermatol. 2016. Vol. 9. P. 71–77.
- Oge’ L. K., Muncie H. L., Phillips-Savoy A. R. Rosacea: Diagnosis and Treatment. Am. Fam. Physician. 2015. Vol. 92, Iss. 3. P. 187–196.
- Orion E., Wolf R. Psychologic factors in the development of facial dermatoses. Clin. Dermatol. 2014. Vol. 32, Iss. 6. P. 763–766.
- Pathogenesis and clinical presentation of rosacea as a key for a symptom-oriented therapy / M. Reinholz, T. Ruzicka, M. Steinhoff et al. J. Dtsch Dermatol. Ges. 2016. Vol. 14, Suppl. 6. P. 4–15.
- Patients with Rosacea Have Increased Risk of depression and Anxiety Disorders / A. Egeberg, P. Hansen, G. Gislason, J. Thyssen. A Danish Nationwide Cohort Study. Dermatology. 2016. Vol. 232, Iss. 2. P. 208–213.
- Pelle M. T., Crawford G. H., James W. D. Rosacea: II. Therapy. Journal of the American Academy of Dermatology. 2004. Vol. 51. Iss. 4. P. 499-512.
- Perrigouard C., Peltre B., Cribier B. A histological and immunohistological study of vascular and inflammatory changes in rosacea. Ann. Dermatol. Venereol. 2013. Vol. 140, Iss. 1. P. 21–29.
- Picardo M., Ottaviani M. Skin Microbiome and Skin Disease: The Example of Rosacea. J. Clin. Gastroenterol. 2014. Vol. 48. P. 45–50.
- Potential role of Demodex mites and bacteria in the induction of rosacea / S. Jarmuda, N. O’Reilly, R. Zaba et al. J. Med. Microbiol. 2012. Vol. 61, Iss. 11. P. 1504–1510.
- Potential role of Demodex mites and bacteria in the induction of rosacea / S. Jarmuda, N. O’Reilly, R. Zaba et al. J. Med. Microbiol. 2012. Vol. 61, Pt. 11. P. 1504–1510.
- Prevalence analysis of smoking in rosacea / A. L. Breton, F. Truchetet, Y. Véran et al. J. Eur. Acad. Dermatol. Venereol. 2011. Vol. 25, Iss. 9. P. 1112–1113.
- Prevalence of rosacea in the general population of Germany and Russia. The RISE study / J. Tan, H. Schöfer, E. Araviiskaia et al. J. Eur. Acad. Dermatol. Venereol. 2016. Vol. 30, Iss. 3. P. 428–434.
- Pulsed Dye Laser Treatment Combined with Oral Minocycline Reduces Recurrence Rate of Rosacea / H. S. Ko, Y. J. Suh, J. W. Byun et al. Ann. Dermatol. 2017. Vol. 29, Iss. 5. P. 543–547.
- Quantification of Demodex folliculorum by PCR in rosacea and its relationship to skin innate immune activation / C. Casas, C. Paul, M. Lahfa et al. Exp. Dermatol. 2012. Vol. 21, Iss. 12. P. 906–910.
- Rademaker M. Very low-dose isotretinoin in mild to moderate papulopustular rosacea; a retrospective review of 52 patients. The Australasian Journal Of Dermatology. 2016. Vol. 20. P. 1440–1446.
- Rainer B. M., Kang S., Chien A. L. Rosacea: Epidemiology, pathogenesis, and treatment. Dermato-endocrinology. 2017. Vol. 9, Iss. 1. P. e1361574.
- Rosacea and Helicobacter pylori: links and risks / E. Lazaridou, C. Korfitis, C. Kemanetzi et al. Clin. Cosmet. Investig. Dermatol. 2017. Vol. 10. P. 305–310.
- Rosacea treatment update: Recommendations from the global ROSaceaCOnsensus (ROSCO) panel / M. Schaller, L. Almeida, A. Bewley et al. Br. J. Dermatol. 2017. Vol. 176. P. 465–471.
- Rosacea: a Clinical Review / C. S. Mikkelsen, H. R. Holmgren, P. Kjellman et al. Dermatol. Rep. 2016. Vol. 8, Iss. 1. P. 34–40.
- Rosacea: a clinicopathological approach / K. Aroni, E. Tsagroni, A. C. Lazaris et al. Dermatology. 2004. Vol. 209. P. 177–182.
- Rosacea: molecular mechanisms and management of a chronic cutaneous inflammatory condition / Y. R. Woo, J. H. Lim, D. H. Cho, H. J. Park. Int. J. Mol. Sci. 2016. Vol. 17, Iss. 9. pii: E1562.
- Rosacea: Part I. Introduction, categorization, histology, pathogenesis, and risk factors / A. M. Two, W. Wu, R. L. Gallo, T. R. Hata. J. Am. Acad. Dermatol. 2015. Vol. 72, Iss. 5. P. 749–758.
- Rosacea: Part II. Topical and systemic therapies in the treatment of rosacea / A. M. Two, W. Wu, R. L. Gallo, T. R. Hata. J. Am. Acad. Dermatol. 2015. Vol. 72, Iss. 5. P. 761–770.
- Rosso J. Q. D. Management of cutaneous rosacea: emphasis on new medical therapies. Expert Opin. Pharmacother. 2014. Vol. 15, Iss. 14. P. 2029–2038.
- Say E. M., Gokhan O., Gökdemir G. Treatment Outcomes of Long-Pulsed Nd: YAG Laser for Two Different Subtypes of Rosacea. J. Clin. Aesthetic Dermatol. 2015. Vol. 8, Iss. 9, P. 16–20.
- Schaller M., Gonser L. A Tailored Approach to the Treatment of a Patient with a Severe Dynamic Manifestation of Rosacea: A Case Report. Drugs R. D. 2016. Vol. 16, Iss. 3. P. 279–283.
- Schmidt N. F., Gans E. H. Demodex and rosacea, II: Demodex mites and rosacea inflammation. Cosmet. Dermatol. 2004. Vol. 17. P. 575–580.
- Schmutz J.–L. Signs and symptoms of rosacea. Ann. Dermatol. Venereol. 2014. Vol. 141, Suppl. 2. P. 151–157.
- Schroeter C. A., Haaf-von Below S., Neumann H. A. Effective treatment of rosacea using intense pulsed light systems. Dermatol. Surg. 2005. Vol. 31. P. 1285–1289.
- Sharma R., Abrol S., Wani M. Misuse of topical corticosteroids on facial skin. A study of 200 patients. J. Dermatol. Case Rep. 2017. Vol. 11, Iss. 1. P. 5–8.
- Sibenge S., Gawkrodger D. J. Rosacea: a study of clinical patterns, blood flow, and the role of Demodex folliculorum. J. Am. Acad. Dermatol. 1992. Vol. 26, Iss. 4. P. 590–593.
- Spotlight on brimonidine topical gel 0.33% for facial erythema of rosacea: safety, efficacy, and patient acceptability / M. S. Anderson, A. Nadkarni, L. A. Cardwell et al. Patient Prefer. Adherence. 2017. Vol. 11. P. 1143–1150.
- Standard classification of rosacea: report of the National Rosacea Society Expert Committee on the Classification and Staging of Rosacea / J. Wilkin, M. Dahl, M. Detmar et al. J. Am. Acad. Dermatol. 2002. Vol. 46, Iss. 4. P. 584–587.
- Standard grading system for rosacea: Report of the National Rosacea Society Expert Committee on the Classification and Staging of Rosacea / J. Wilkin, M. Dahl, M. Detmar, L. Drake. J. Am. Acad. Dermatol. 2004. Vol. 50, Iss. 6. P. 907–912.
- Steinhoff M., Schauber J., Leyden J. J. New insights into rosacea pathophysiology: a review of recent findings. Journal of the American Academy of Dermatology. 2013. Vol. 69. Iss. 6. P. 15-26.
- Steinhoff M., Schmelz M., Schauber J. Facial erythema of rosacea – aetiology, different pathophysiologies and treatment options. Acta. Derm. Venereol. 2016. Vol. 96, Iss. 5. P. 579–586.
- Swiss S1 guideline for the treatment of rosacea / F. Anzengruber, J. Czemielewski, C. Conrad et al. JEADV. 2017. Vol. 31. P. 1775–1791.
- Taub A. F., DeVita E. C. Successful treatment of erythemato-telangiectatic rosacea with pulsed light and radiofrequency. J. Clin. Aesthet. Dermatol. 2008. Vol. 1, Iss. 1. P. 37–40.
- The potential role of microorganisms in the development of rosacea / E. Lazaridou, C. Giannopoulou, C. Fotiadou et al. J. Dtsch. Dermatol. Ges. 2011. Vol. 9, Iss. 1. P. 21–25.
- The quality of life impact of acne and rosacea compared to other major medical conditions / N. D. Cresce, S. A. Davis, W. W. Huang, S. R. Feldman. J. Drugs Dermatol. 2014. Vol. 13, Iss. 6. P. 692–697.
- The role of altered cutaneous immune responses in the induction and persistence of rosacea / A. Margalit, M. J. Kowalczyk, R. Zaba et al. J. Dermatol. Sci. 2016. Vol. 82. P. 3–8.
- The study of prevalence of Helicobacter pylori in patients with acne rosacea / S. Bhattarai, A. Agrawal, A. Rijal et al. Kathmandu Univ Med. J. (KUMJ). 2012. Vol. 10, Iss. 40. P. 49–52.
- Tsiskarishvili N. V., Katsitadze A. G., Tsiskarishvili Ts. I. Improvement of rosacea treatment based on the morphological and functional features of the skin. Georgian. Med. News. 2013.Vol. 223. P. 31–35.
- Use of benzoyl peroxide/clindamycin gel in the once-daily treatment of moderate rosacea / M. Gold, H. Farber, R Gilboa, E. Tschen. J. Am. Acad. Dermatol. 2005. Vol. 52, Iss. 3, Suppl. P. 25.
- Vascular endothelial growth factor signaling requires glycine to promote angiogenesis / D. Guo, C. E. Murdoch, H. Xu et al. Sci. Rep. 2017. Vol. 7. P. 43–49.
- Weinkle A. P., Doktor V., Emer J., Weinkle A. P. Update on the Management of Rosacea. Clin. Cosmet. Investig. Dermatol. 2015. Vol. 8. P. 159–177.
- Weiss E., Katta R. Diet and rosacea: the role of dietary change in the management of rosacea. Dermatol. Pract. Concept. 2017. Vol. 7, Iss. 4. P. 31–37.
- Why is rosacea considered to be an inflammatory disorder? The primary role, clinical relevance, and therapeutic correlations of abnormal innate immune response in rosacea-prone skin / J. Q. Del 203, R. L. Gallo, L. Kircik et al. J. Drugs. Dermatol. 2012. Vol. 11, Iss. 6. P. 694–700.
- Wilkin J. K. Rosacea: pathophysiology and treatment. Arch. Dermatol. 1994. Vol. 130. P. 359–362.
- Yamasaki K., Gallo R. L. The molecular pathology of rosacea. J. Dermatol. Sci. 2009. Vol. 55, Iss. 2. P. 77–81.
- Yamasaki K., Gallo R. L. Rosacea as a disease of cathelicidins and skin innate immunity. J. Investig. Dermatol. Symp. Proc. 2011. Vol. 15, Iss. 1. P. 12–15.
- Yücel A., Yilmaz M. Investigation of the prevalance of Demodex folliculorum and Demodex brevis in rosacea patients. Türkiye Parazitolojii Dergisi. 2013. Vol. 37, Iss. 3. P. 195.
- Zouboulis C. C., Katsambas A. D., Kligman A. M. Patogenesis and Treatment of Acne and Rosacea. Berlin: Springer, 2014. P. 670–682.
ДОДАТОК А
ШКАЛА ДІАГНОСТИЧНОЇ ОЦІНКИ РОЗАЦЕА (ШДОР)
(Адаскевич В.П., 2004) [3]
| Признаки | 0 | 1 | 2 | 3 |
| 1.Папули / пустули | Папули і пустули менше 10 | Папули і пустули від 11 до 20 | Папули і пустули від 21 до 30 | Папули і пустули понад 30 |
| 2.Еритема | 2.Еритема | Слабка (легка) еритема або з обмеженим ураженням в центрі, або генералізована по всьому обличчю | Помірно виражена еритема або з обмеженим ураженням в центрі, або генералізована по всьому обличчю | Важка (сильна) еритема або фіолетово-червоного кольору або з обмеженим ураженням в центрі, або генеролізована по всьому обличчю |
| 3.Телеангіектазія | Відсутня | Слабка, тонкі судини менш 0,2 мм в діаметрі, що займають менш 10 % обличчя | Помірна, кілька тонких судин і / або декілька більших діаметром понад 0,2 мм, що займають від 10 % до 30 % обличчя | Багато дрібних судин і / або великих судин, що займають більше 30 % обличчя |
| 4.Сухість шкіри | Відсутня | Слабка | Помірна з незначним лущенням | Сильна з вираженим лущенням і дерматитом |
| 5.Печіння і поколювання шкіри | Відсутнє | Слабке | Помірне | Сильне |
| 6. Набряк обличчя | відсутній | Слабкий | Помірний, м’який | Сильний, персистирующий |
| 7.Офтальморозацеа | Немає | Нерізко виражена гіперемія кон’юнктиви повік; відчуття печіння, свербіння, стороннього тіла | Кон’юнктивіт, гіперемія периорбитальної області, фоточутливість (боязнь світла) | Кератит; виразка рогівки; перикорнеальна ін’єкція судин склери; халязион |
Максимальна кількість балів, що вказує на важкий перебіг розацеа, становить 21. Мінімальна кількість балів – 0. Даний метод може бути використаний для оцінки ефективності терапії у хворих розацеа.
ДОДАТОК Б
ДЕРМАТОЛОГІЧНИЙ ІНДЕКС ЯКОСТІ ЖИТТЯ (ДІЯЖ)
(A.Y. Finlay, Khan G.K., 1992)
Будь ласка, дайте відповідь на кожне питання. При відповіді враховуйте Ваш стан протягом минулого тижня.
| 1. Чи відчували Ви свербіж, печіння або болючість минулого тижня? | Дуже сильно | ||
| Досить сильно | |||
| Незначним чином | |||
| Ні | |||
| 2. Чи відчували Ви відчуття незручності або збентеження в зв’язку зі станом Вашої шкіри? | Дуже сильно | ||
| Досить сильно | |||
| Незначним чином | |||
| Ні | |||
| 3. Як сильно Ваші проблеми зі шкірою заважали Вам займатися прибиранням будинку або покупками? | Дуже сильно | ||
| Досить сильно | |||
| Незначним чином | |||
| Ні | |||
| 4. Наскільки сильно стан Вашої шкіри впливав на вибір Вашого гардеробу минулого тижня? | Дуже сильно | ||
| Досить сильно | |||
| Незначним чином | |||
| Ні | |||
| 5. Як сильно впливав стан Вашої шкіри на Ваше дозвілля і соціальну активність минулого тижня? | Дуже сильно | ||
| Досить сильно | |||
| Незначним чином | |||
| Ні | |||
| 6. Минулого тижня стан Вашої шкіри заважав Вам займатися спортом? | Дуже сильно | ||
| Досить сильно | |||
| Незначним чином | |||
| Ні | |||
| 7. Чи пропускали Ви навчання, були відсутні на роботі через стан Вашої шкіри? | Так | ||
| Ні | |||
| Якщо Ви відповіли «ні», то наскільки сильно Вас турбував стан Вашої шкіри, коли Ви знаходились на роботі чи навчанні? | Сильно | ||
| Незначно | |||
| Не турбувало | |||
| 9. Наскільки сильно Ваші проблеми зі шкірою впливали на Вашу сексуальне життя? | Дуже сильно | ||
| Досить сильно | |||
| Незначним чином | |||
| Ні | |||
| 10. На минулому тижні наскільки сильно лікування захворювання шкіри завдавало Вам незручності, забирало час, створювало проблеми? | Дуже сильно | ||
| Досить сильно | |||
| Незначним чином | |||
| Ні |
Кожне питання оцінюється за шкалою від 0 до 3 балів
| Дуже сильно | 3 |
| Досить сильно | 2 |
| Незначним чином | 1 |
| Ні | 0 |
| Трактування відповіді на питання №7 | |
| Так | 3 |
| Ні | 0 |
Індекс розраховується шляхом підсумовування балів по кожному питанню. Результат може варіюватися від 0 до 30 балів. Максимальне значення індексу – 30. І чим ближчий показник до цієї позначки, тим більше негативно захворювання позначається на якості життя пацієнта. Також індекс може бути виражений у процентному співвідношенні до максимально можливого балу в 30.
Трактування значень індексу ДІКЖ:
| Значення індексу | Трактування |
| 0-1 | шкірне захворювання не впливає на життя пацієнта |
| 2-5 | захворювання має незначний вплив на життя пацієнта |
| 6-10 | захворювання надає помірний вплив на життя пацієнта |
| 11-20 | захворювання робить дуже сильний вплив на життя пацієнта |
| 21-30 | захворювання надає надзвичайно сильний вплив на життя пацієнта |
ДОДАТОК В
ГОСПІТАЛЬНА ШКАЛА ТРИВОГИ І ДЕПРЕСІЇ HADS
Кожному твердженню відповідають 4 варіанти відповіді, що відображають градації вираженості ознаки і кодуються по наростанню тяжкості симптому від 0 балів (відсутність) до 4 (максимальна вираженість).
Шкала супроводжується інструкцією такого змісту: «Вчені впевнені в тому, що емоції відіграють важливу роль у виникненні більшості захворювань. Якщо ваш доктор більше дізнається про ваші переживання, він зможе краще допомогти вам. Цей опитувальник розроблений для того, щоб допомогти вашому лікареві зрозуміти, як ви себе почуваєте. Не звертайте уваги на цифри і букви, поміщені в лівій частині опитувальника. Прочитайте уважно кожне твердження і в порожній графі зліва відзначте хрестиком відповідь, який найбільшою мірою відповідає тому, як ви себе почували на минулому тижні. Не міркуйте занадто довго над кожним твердженням. Ваша перша реакція завжди буде більш вірною».
Кожному твердженню відповідають 4 варіанти відповіді. Виберіть той з відповідей, який відповідає вашому стану.
| 1. Я відчуваю напруження, мені не по собі | 3 – весь час 2 – часто 1 – час від часу, іноді 0 – зовсім не відчуваю |
| 2. Те, що приносило мені велике задоволення, і зараз викликає у мене таке ж почуття | 0 – безумовно, це так 1 – напевно, це так 2 – лише в дуже малому ступені це так 3 – це зовсім не так |
| 3. Я відчуваю страх, здається, ніби щось жахливе може ось-ось статися | 3 – безумовно це так, і страх дуже великий 2 – так, це так, але страх не дуже великий 3 – іноді, але це мене не турбує 0 – зовсім не відчуваю |
| 4. Я здатний розсміятися і побачити
в тій чи іншій події смішне |
0 – безумовно це так
1 – напевно, це так 2 – лише в дуже малому ступені це так 3 – зовсім не здатний |
| 5. Неспокійні думки крутяться у мене в голові | 3 – постійно 2 – більшу частину часу 1 – час від часу і не так часто 0 – тільки іноді |
| 6. Я відчуваю бадьорість | 3 – зовсім не відчуваю 2 – дуже рідко 1 – іноді 0 – практично весь час |
| 7. Я легко можу сісти і розслабитися | 0 – безумовно, це так 1 – напевно, це так 2 – лише зрідка це так 3 – зовсім не можу |
| 8. Мені здається, що я став все робити дуже повільно | 3 – практично весь час 2 – часто 1 – іноді 0 – зовсім немає |
| 9. Я відчуваю внутрішнє напруження або тремтіння | 0 – зовсім не відчуваю 1 – іноді 2 – часто 3 – дуже часто |
| 10. Я не стежу за своєю зовнішністю | 3 – безумовно, це так 2 – я не приділяю цьому стільки часу, скільки потрібно 1 – може бути, я стала менше приділяти цьому часу 0 – я стежу за собою так само, як і раніше |
| 11. У мене немає усидливості, мені постійно потрібно рухатися | 3 – безумовно, це так 2 – напевно, це так 1 – лише в деякій мірі це так 0 – зовсім не відчуваю |
| 12. Я вважаю, що мої справи (заняття, захоплення) можуть принести мені почуття задоволення | 0 – точно так само, як і зазвичай 1 – так, але не в тій мірі, як раніше 2 – значно менше, ніж зазвичай 3 – зовсім так не вважаю |
| 13. У мене буває раптове відчуття паніки | 3 – дуже часто 2 – досить часто 1 – не так вже й часто 0 – зовсім не буває |
| 14. Я можу отримати задоволення від гарної книги, радіо- або телепрограми | 0 – часто 1 – іноді 2 – рідко 3 – дуже рідко |
Рекомендації щодо застосування шкали
Шкала складена з 14 тверджень, які обслуговують дві підшкали:
підшкала А – «тривога»: непарні пункти 1, 3, 5, 7, 9, 11, 13;
підшкала D – «депресія»: парні пункти 2, 4, 6, 8, 10, 12, 14.
Інтерпретація даних
Враховується сумарний показник по кожній підшкалі (А і D), при цьому виділяються 3 ділянки значень:
0–7 балів – норма;
8–10 балів – субклінічно виражена тривога / депресія;
11 балів і вище – клінічно виражена тривога / депресія.
ДОДАТОК Г
АКТИ ВПРОВАДЖЕННЯ









ДОДАТОК Д
СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА ЗА ТЕМОЮ ДИСЕРТАЦІЇ
ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ РЕЗУЛЬТАТІВ ДИСЕРТАЦІЇ
- Старостіна О. А. Клінічні прояви інфікування Demodex folliculorum на тлі запалення різної інтенсивності та гіперплазії сальних залоз у пацієнток різного віку із судинними формами розацеа. Дерматологія та венерологія. 2018. № 1 (79). С. 76–79.
- Старостіна О. А. Визначення середніх значень кількості, периметру, площі CD34-позитивних судин та оцінка експресії VEGF в біоптатах шкіри пацієнтів з судинними формами розацеа. Медичні перспективи. 2018. № 2 (2) С. 67–70.
- Морфологічні критерії перебігу судинних форм розацеа / О. А. Старостина, Т. В. Святенко, І. С. Шпонька, О. В. Пославська. Морфологія. 2017. № 11 (2) С. 40–45. (Здобувачем особисто сформульовано мету та завдання дослідження, проведено аналіз даних та їх узагальнення).
- Святенко Т. В., Чеверда О. А., Старостина О. А. IPL-терапия в лечении сосудистых форм розацеа и других дерматозов: безопасность и эффективность (собственные наблюдения). Журнал дерматовенерології та косметології імені М.О. Торсуєва. 2017. № 2 (38). С. 112–117. (Здобувачем особисто проведено лікування хворих, проаналізовані отримані результати).
- Старостина О. А. Результаты допплерографического исследования сосудов головы и шеи у больных розацеа женщин. Experimental and Clinical Medicine. 2018, Vol. 3. P 67–70.
- Calculation of the average density indices of androgen and estrogen receptors and evaluation of expression of COX-2 in skin biopsies of patients with vascular forms of rosacea / O. A. Starostina, Т. V. Svyatenko, I. S. Shponka, O. V. Poslavska. Experimental and Clinical Medicine. 2018, Vol. 1. P 33–40. (Здобувачем особисто сформульовано мету та завдання дослідження, проведено аналіз даних та їх узагальнення).
- Святенко Т. В, Старостина О. А. Новые возможности IPL-терапии в комплексном лечении сосудистых форм розацеа. Медицинские новости Грузии. 2015. № 6 (243). С. 62. (Здобувачем особисто проведено аналіз літературних даних, проведено лікування хворих, проаналізовані отримані результати, підготовлено матеріал до друку).
- Старостина О. А. Розацеа в сочетании с хроническими дерматозами (собственные наблюдения). Международный научно-практический журнал «Дерматовенерология. Косметология» 2015. №1(01). С. 72–77.
- Пат. на корисну модель № 124614 UA, МПК G01N21/00, G01N33/00, A61B10/00. Спосіб прогнозування перебігу розацеа у жінок / О. А. Старостіна, Т. В. Святенко, І. С. Шпонька, О. В. Пославська. № u201712471; заявл. 15.12.17; опубл. 10.04.18, Бюл. № 7.
- Старостіна О. А. Применение IPL-терапии в комплексном лечении сосудистых форм розацеа: Безопасность и эффективность (собственные наблюдения). Програма та матеріали Регіональної науково-практичної конференції «Святогорські дерматовенерологичні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом». 2016. С. 34.
- Святенко Т. В., Андриуца Л. А., Старостина О. А. Комбинированная терапия розацеа в условиях лечебно-косметологического центра. Збірник робіт за матеріалами науково-практичної школи «Молоді науковці-майбутнє української дерматовенерології». 2014. С. 61. (Дисертанту належить ідея дослідження, проведено збір та узагальнення матеріалу, підготовлено тези до друку).
- Старостина О.А. Сочетание розацеа с хроническими дерматозами, локализованными на лице. Збірник тез ІХ Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання косметології та дерматології». Запоріжжя, 2015. С. 33.
- Інформаційний лист про впровадження у системі охорони здоров’я «Спосіб лікування судинних форм розацеа» / Т. В. Святенко, О. А. Старостіна, Дніпропетровська медична академія МОЗ України. К., 2017. 4 с.
Відомості про апробацію результатів дисертації:
- ІХ Всеукраїнська науково-практична конференція з міжнародною участю «Актуальні питання косметології та дерматології», м. Запоріжжя, 23-24 квітня 2015 р., усна доповідь: Старостіна О.А. «Сосудистые формы розацеа у женщин: дифференциальная диагностика и подходы к комплексной терапии».
- Науково-практична конференція «Київські дерматологічні дні: Фундаментальні аспекти загальної дерматології», м. Київ, 22 квітня 2015 р., усна доповідь: Старостіна О.А. «Розацеа: клініко-морфологічні паралелі».
- Регіональна науково-практична конференція «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом», м. Святогірськ, 12-13 травня 2016 р., усна доповідь: Старостіна О.А. «Патоморфологічні особливості судинної форми розацеа».
- III (X) з’їзд Української асоціації лікарів-дерматовенерологів і косметологів, м. Львів, 22-23 листопада 2017 р., усна доповідь: Старостіна О.А. «Клініко-морфологічні паралелі різних форм розацеа».
- Науково-практична конференція «Менеджмент якісної спеціалізованої допомоги дерматовенерологічним пацієнтам», м. Дніпро, 30 березня 2018 р., усна доповідь: Старостіна О.А. «Сучасні підходи до лікування пацієнтів з розацеа».
- Науково-практична конференція, присвячена 25-річчю НАМН України «Прогрес в сучасній діагностиці інфекцій, що передаються статевим шляхом, інфекційних, розповсюджених та тяжких дерматозів. Досягнення у лікуванні», м. Київ, 25 квітня 2018 р., усна доповідь: Старостіна О.А. «Розацеа – сучасні підходи до ведення пацієнтів з урахуванням морфології дерматозів».
- Науково-практична конференція «Прикарпатські дерматовенерологічні дні 2018», м. Яремче, 19-20 квітня 2018 р., усна доповідь: Старостіна О.А. «Досвід лікування судинних форм розацеа з використанням IPL».
- 13-ті Київські дерматологічні дні: весняний симпозіум, м. Київ, 12-13 квітня 2018 р., усна доповідь: Старостіна О.А. «Розацеа: тактика ведення пацієнток з судинними формами».
