ДЕРЖАВНА УСТАНОВА
«ІНСТИТУТ ДЕРМАТОЛОГ11ІЇ ТА ВЕНЕРОЛОГІЇ НАМН УКРАЇНИ»
На правах рукопису
Щербакова Юлія Валеріївна
УДК [616. 97:616. 98:578.828.6]-036.2-039.71
ПОПЕРЕДЖЕННЯ ПОШИРЕННЯ ВІЛ-ІНФІКУВАННЯ ШЛЯХОМ ЗАСТОСУВАННЯ СИСТЕМИ ЛІКУВАЛЬНО-ПРОФІЛАКТИЧНИХ ЗАХОДІВ ЩОДО БОРОТЬБИ З ІНФЕКЦІЯМИ, ЯКІ ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ
14.01.20 – шкірні та венеричні хвороби
Дисертація на здобуття наукового ступеня
доктора медичних наук
Науковий консультант:
Мавров Геннадій Іванович
доктор медичних наук,
професор
Харків – 2016
ЗМІСТ
Перелік умовних позначень…………………………………………………………………….. 8
Вступ…………………………………………………………………………………………………… 9
Розділ 1 Огляд літератури………………………………………………………………………. 17
1.1 Сучасні епідеміологічні особливості урогенітальних інфекцій…… ……………..17
1.2 Сучасна характеристика епідемії ВІЛ/СНІДу…………………………………………. 20
1.3 Особливості асоціації урогенітальних захворювань та ВІЛ-інфекції …………..23
1.4 Особливості стану місцевого імунітету у осіб з інфекціями, що
передаються статевим шляхом………………………………………………………………… 32
1.5 Особливості діагностики ВІЛ-інфекції……………………………………… 34
1.6 Методи швидкої діагностики урогенітальних інфекцій……………… 36
1.7 Особливості перебігу урогенітальних інфекцій в уразливих групах населення та надання їм лікувально-діагностичної допомоги……. 39
1.8 Фактори, що підвищують ризик зараження та передачі інфекцій, що передаються статевим шляхом, та ВІЛ…………………………………….. 42
1.9 Особливості консультування представників уразливих груп…….. 48
Розділ 2 Матеріали та методи……………………………………………………………….. 52
2.1 Статистичні та соціологічні дані……………………………………………… 52
2.2 Групи осіб, які перебували під спостереженням……………………….. 52
2.3 Клінічне обстеження осіб з урогенітальними інфекціями…………… 67
2.4 Лабораторна діагностика урогенітальних інфекцій………………….. 69
2.5 Імунологічні методи обстеження…………………………………………….. 73
2.6 Характеристика методів лабораторної діагностики сифілісу…….. 76
2.7 Статистичні методи обробки результатів…………………………………. 80
Розділ 3 Розповсюдженість інфекцій, що передаються статевим шляхом, серед загального населення та уразливих груп………………………….. 82
3.1 Особливості розповсюдженості інфекцій, що передаються статевим шляхом, в різних групах населення………………………………………… 82
3.1.1 Результати обстеження загального населення……………………….. 84
3.1.2 Результати обстеження представників уразливих груп населення 87
3.2 Відміни в соціальній характеристиці ВІЛ-негативних та ВІЛ-позитивних представників уразливих груп……………………….. 98
3.3 Відміни в соціальних та епідеміологічних особливостях між особами з інфекціями, що передаються статевим шляхом, з різних популяційних груп…………………………………………………………………………………………….. 99
Розділ 4 Особливості застосування мотиваційного консультування пацієнтів з інфекціями, що передаються статевим шляхом, з метою зміни ризикованої сексуальної поведінки в бік більш безпечної…………………………….. 107
4.1 Особливості проведення мотиваційного консультування………… 107
4.2 Визначення рівня інформованості осіб з різних верств населення, поведінкових та соціальних відмінностей………………………………. 111
4.3 Визначення рівня інформованості осіб з різних верств населення …………………………………………131
Розділ 5 Оцінка особливостей стану імунітету у представників уразливих груп з інфекціями, що передаються статевим шляхом, з урахуванням ВІЛ-статусу…………………………………………………….. 144
5.1 Оцінка стану імунітету у ВІЛ-позитивних пацієнтів з ураженнями шкіри та інфекціями, що передаються статевим шляхом………………………. 144
5.1.1 Вірусне навантаження і показники імунного статусу у ВІЛ-позитивних осіб з інфекціями, що передаються статевим шляхом, та з ураженнями шкіри………………………………………………………………. 144
5.1.1.1 Клінічна характеристика осіб з ВІЛ-позитивним статусом з інфекціями, що передаються статевим шляхом, та з ураженнями шкіри…….. 145
5.1.1.2 Показники імунного статусу у ВІЛ-позитивних осіб з інфекціями, що передаються статевим шляхом, та дерматологічною патологією……………………………………………. 150
5.1.1.3 Вірусне навантаження у ВІЛ-позитивних пацієнтів з інфекціями, що передаються статевим шляхом, та дерматологічною патологією……………………………………………. 155
5.2 Вміст секреторного імуноглобуліну класу А як показник стану місцевого імунітету у осіб з різних груп населення з інфекціями, що передаються статевим шляхом………………………………………… 162
5.2.1 Клінічна характеристика пацієнтів з інфекціями, що передаються статевим шляхом, з урахуванням популяційної групи……………. 163
5.2.2 Визначення вмісту секреторного імуноглобуліну А у пацієнтів з інфекціями, що передаються статевим шляхом………………………. 166
Розділ 6 Чутливість збудників захворювань урогенітального тракту до антибактеріальних препаратів та склад біотопу у пацієнтів з інфекціями, що передаються статевим шляхом, загального населення………………………………………………………………………………. 172
6.1 Поширеність збудників інфекцій, що передаються статевим шляхом, та їх асоціацій при урогенітальній патології у представників загальної популяції……………………………………… 172
6.2 Дослідження біотопу сечостатевого тракту……………………………. 175
6.2.1 Дослідження біотопу сечостатевого тракту осіб, які належать до загальної популяції……………………………………………………………… 175
6.2.2 Дослідження біотопу сечостатевого тракту осіб, які належать до уразливих груп населення……………………………………………………. 177
6.3 Визначення чутливості штамів умовно-патогенних мікроорганізмів, вилучених у представників загальної популяції та уразливих груп населення, до антибактеріальних препаратів різних фармакотерапевтичних груп……………………………………………………………………………………. 178
Розділ 7 Вивчення частоти зустрічальності клінічних проявів та запальних захворювань урогенітального тракту у осіб з хронічними інфекціями, що передаються статевим шляхом…………………………. 184
Розділ 8 Бактеріоскопічні методи лабораторної діагностики урогенітальних інфекцій як метод вибору для груп населення, уразливих щодо зараження інфекціями, що передаються статевим шляхом, та ВІЛ……………… 190
8.1 Аналіз вітчизняних та міжнародних настанов щодо застосування сучасних бактеріоскопічного та бактеріологічного методів діагностики інфекцій, що передаються статевим шляхом……………………………………………… 190
8.1.1 Діагностика дисбіозу вагінального біотопу…………………………. 190
8.1.2 Діагностика гонококової інфекції……………………………………….. 192
8.1.3 Діагностика урогенітального кандидозу……………………………… 194
8.1.4 Діагностика трихомонадної інфекції…………………………………… 195
8.2 Оцінка ефективності застосування бактеріоскопічного та бактеріологічного методів виявлення збудників інфекцій, що передаються статевим шляхом, у пацієнтів з загального населення та уразливих груп………………………………………………… 199
Розділ 9 Визначення можливості використання швидких тестів для діагностики сифілісу для різних верств населення………………. 206
Розділ 10 Ефективність використання іміквімоду в лікуванні гострокінцевих кондилом…………………………………………………………………………….. 215
Розділ 11 Розробка організаційних заходів щодо наближення дерматовенерологічної допомоги до осіб з контингенту уразливих груп населення……………………………………………………. 224
11.1 Розробка організаційних заходів щодо підвищення рівня інформованості фахівців, які надають допомогу уразливим групам населення………………………………………………………………… 224
11.1.1 Визначення рівня інформованості та інформаційних потреб фахівців, які надають допомогу уразливим групам населення……………………. 225
11.2 Розробка методик консультування пацієнтів з інфекціями, що передаються статевим шляхом……………………………………………… 231
11.2.1 Передтестове консультування…………………………………………… 237
11.2.1.1 Оцінка індивідуальних ризиків щодо зараження інфекціями, що передаються статевим шляхом………………………………………… 237
11.2.1.2 Розробка шляхів зниження ризику інфікування………………. 241
11.2.1.3 Прийняття рішення щодо проходження тесту…………………. 243
11.2.1.4 Особливості консультування споживачів ін’єкційних наркотиків…………………………………………………………………………… 245
11.2.1.5 Особливості консультування робітників комерційного сексу ……………………………………….247
11.2.1.6 Особливості консультування чоловіків, що мають секс з чоловіками…………………………………………………………………………………………… 249
11.2.1.7 Особливості консультування пацієнтів у випадках гендерного та сексуального насильства…………………………………. 251
11.2.2 Післятестове консультування……………………………………………. 252
11.2.2.1 Первинне післятестове консультування при негативному результаті тесту…………………………………………………………………………………… 253
11.2.2.2 Первинне післятестове консультування при позитивному результаті тесту…………………………………………………………………………………… 254
11.2.2.3 Первинне післятестове консультування при невизначеному (сумнівному) результаті тесту……………………………………………….. 256
11.2.2.4 Повідомлення партнера про результати тесту та скерування взаємовідносин з ним…………………………………………………………… 257
11.2.2.5 Обговорення плану зниження ризику інфікування…………… 258
11.3 Застосування синдромного підходу як заходу підвищення доступу до дерматовенерологічної допомоги осіб з уразливих груп ……….. 262
11.3.1 Можливість застосування синдромного підходу при наданні дерматовенерологічної допомоги робітникам комерційного сексу ……..268
11.4 Стандарти лікування, діагностики та профілактики інфекцій, що передаються статевим шляхом, в групах ризику, з метою запобігання поширення ВІЛ (проект клінічного протоколу)……. 269
11.5 Практика комунікації дерматовенерологічної та наркологічної служб при наданні допомоги пацієнтам наркологічного закладу з інфекціями, що передаються статевим шляхом……………………………………………… 304
11.6 Удосконалення освіти фахівців, які надають дерматовенерологічну допомогу представникам груп, уразливих щодо зараження ВІЛ та інфекціями, що передаються статевим шляхом………………………. 327
Розділ 12 Аналіз та обговорення одержаних результатів………………………. 332
Висновки……………………………………………………………………………………………. 360
Рекомендації………………………………………………………………………………………. 365
Список використаних джерел………………………………………………………………. 367
Додаток А Навчальний план циклу тематичного удосконалення лікарів «Інфекції, що передаються статевим шляхом у групах підвищеного ризику до інфікування ВІЛ/СНІД»………………………………………………………… 397
Додаток Б Тематичний план циклу тематичного удосконалення лікарів…. 398
Додаток В Програма циклу тематичного удосконалення лікарів «Інфекції, що передаються статевим шляхом, у групах підвищеного ризику до інфікування ВІЛ/СНІД»………………………………………………………… 399
Додаток Г Анкета аналізу інформованості……………………………………………. 401
Додаток Д Анкета аналізу соціальних відмінностей різних верств населення 404
Додаток Е Анкета для осіб з інфекціями, що передаються статевим шляхом 407
Додаток Ж Акти впровадження……………………………………………………………. 409
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
АРТ – антиретровірусна терапія
ВЕБ – вірус Епштейна-Барр
ВПГ – вірус простого герпесу
ВПЛ – вірус папіломи людини
ДКТ – добровільне консультування та тестування
ЖКС – жінки комерційного сексу
ЗОЗ – заклад охорони здоров’я
ІПСШ – інфекції, що передаються статевим шляхом
ІФА – імуноферментний аналіз
ІХГ – імунохроматографічний
КСР – комплекс стандартних серологічних реакцій
ЛПЗ – лікувально-профілактичний заклад
ПЛР – полімеразна ланцюгова реакція
РЗКк – реакція зв’язування комплементу з кардіоліпіновим реагентом
РЗКт – реакція зв’язування комплементу з трепонемним реагентом
РІТ – реакція іммобілізації блідих трепонем
РІФ – реакція імунофлуоресценції
РКС – робітники комерційного сексу
РМП – реакція мікропреципітації
РПГА – реакція пасивної гемаглютинації
РПР – реакція швидкого визначення плазмових реагінів
СІН – споживачі ін’єкційних наркотиків
УПМ – умовно-патогенні мікроорганізми
ЦМВ – цитомегаловірус
ЧСЧ – чоловіки, що мають сексуальні стосунки з чоловіками
sIg A – секреторний імуноглобулін А
ВСТУП
Актуальність теми. Пройшло більше ніж 30 років після відкриття вірусу імунодефіциту людини (ВІЛ), але питання діагностики, лікування та профілактики не можна вважати вирішеними. Не дивлячись на наявність освітніх програм, досягнення антиретровірусної терапії (АРТ), покращення доступу до лікування хворим, ВІЛ-інфекція продовжує становити проблеми, як у розвинених державах, так і країнах Африки [111]. За статистичними оцінками в усьому світі, станом на 01.01.2016, близько 36,7 млн. людей живуть з ВІЛ. Щорічно фіксується 2,1 млн. нових випадків ВІЛ-інфекції. Кількість смертей від синдрому набутого імунодефіциту (СНІД) у 2015 році становила 1,1 млн. [15, 16, 27]. Щорічна кількість нових випадків ВІЛ-інфекції серед дорослих і підлітків знизилася на 50 % у 26 країнах за період 2001-2013 років. Однак серед населення України позитивна епідеміологічна динаміка не настільки виражена. Суттєвого скорочення кількості хворих на ВІЛ не спостерігається. Так, згідно даних МОЗ, у 2015 році зареєстровано 15808 нових випадків зараження ВІЛ (інтенсивний показник на 100 тис. населення – 37,2) та 8490 нових випадків діагностування СНІДу (інтенсивний показник на 100 тис. населення – 20,0).
Ці обмежені успіхи зміцнюють думку, що в даний час особливо актуальними є дослідження властивостей ВІЛ, механізмів передачі інфекції та імунної відповіді макроорганізму. Особливим питанням подальших досліджень є виявлення взаємозалежності та кореляції між інфекціями, які передаються статевим шляхом, (ІПСШ) та ВІЛ-інфекцією.
Статевий шлях передачі ВІЛ-інфекції є основним в Україні та на сьогодні складає 72,5 % [15, 85]. Існує думка, що ІПСШ (сифіліс, герпес, трихомоноз, хламідіоз) посилюють поширення ВІЛ завдяки збільшення сприйнятливості до вірусу шляхом міграції лімфоцитів і макрофагів у слизові оболонки статевих шляхів, які є клітинами-мішенями для зараження ВІЛ [53].
Проведені дослідження свідчать, що за останні роки як в світі, так й в Україні, істотно змінилась епідеміологія венеричних хвороб. Це пов’язано з такими тенденціями, як поширення ВІЛ, переважно статевий шлях передачі більшості збудників – вірусів (простого герпесу (ВПГ), папіломи людини, цитомегаловірусу [ЦМВ]), дріжджових грибків, умовно патогенних анаеробів та інших. Окрім того, значно розширився спектр ускладнень при ІПСШ – безпліддя, не виношування вагітності, хвороби плоду та новонародженого, реактивні артрити. Також з’явилися нові механізми стійкості збудників бактеріальної та вірусної природи до антибіотиків та хіміопрепаратів [2, 3, 6, 10, 29, 32, 53, 57, 115, 120, 272].
Зусилля щодо зменшення статевого шляху передачі ВІЛ та ІПСШ повинні бути спрямовані на роботу з уразливими щодо зараження ВІЛ групами населення, зокрема робітниками комерційного сексу (РКС), чоловіками, що мають статеві контакти з чоловіками (ЧСЧ), а також споживачами ін’єкційних наркотиків (СІН).
Однак ці заходи залишаються недостатніми, про що свідчать останні тенденції у поширеності ВІЛ та ІПСШ серед наведених груп [15, 39, 85]. Таким чином, існуючі реалії потребують розробки системи заходів, які спроможні мінімізувати ризики передачі та інфікування ВІЛ та ІПСШ статевим шляхом.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційне дослідження є частиною науково-дослідних робіт ДУ «Інститут дерматології та венерології НАМН України»: НДР «Дослідити медико-соціальні особливості та гендерні соматопсихічні порушення у хворих на найпоширеніші венеричні інфекції, розробити комплекс організаційно-профілактичних заходів» (2009-2011), № держреєстрації 0109U002512, НДР ДП «Дослідити біологічні та епідеміологічні чинники впливу інфекцій, що передаються статевим шляхом (ІПСШ), на розповсюдження ВІЛ» (2012-2014) № держреєстрації 0111U003683, яка виконувалася в рамках Загальнодержавної програми забезпечення профілактики ВІЛ-інфекції; НДР «Вивчити особливості інфекцій, що передаються статевим шляхом, в групах населення, уразливих щодо зараження ВІЛ, та розробити стандарти надання допомоги», № держреєстрації 0114U001385 (2014-2016). Дисертантом особисто виконано основні фрагменти наукових робіт з епідеміологічних, соціальних, поведінкових досліджень, визначення клінічних особливостей ІПСШ, розробка заходів з надання консультативної та лікувально-діагностичної допомоги особам з ІПСШ з різних груп населення.
Мета дослідження: створення ефективної системи заходів з надання медико-профілактичної допомоги хворим на інфекції, що передаються статевим шляхом, та їх соціальної реабілітації в групах, уразливих щодо зараження ВІЛ, для стримування епідемії ВІЛ/Сніду в Україні.
Задачі дослідження:
1. Провести аналіз соціальних, медичних та поведінкових чинників розповсюдження ІПСШ та ВІЛ/СНІДу в Україні з урахуванням їх взаємодії.
2. Вивчити клініко-епідеміологічні особливості ІПСШ на сучасному етапі, встановити асоціацію окремих ІПСШ (сифіліс, хламідіоз, трихомоноз, герпес, кандидоз, гонорея) та ВІЛ-інфекції, поширеність та чутливість умовно-патогенної флори до лікувальних засобів.
3. Оцінити вплив ІПСШ на розповсюдження ВІЛ та вивчити особливості клініки та патогенезу статевих інфекцій в уразливих групах та серед загального населення (визначення показників місцевого імунітету, популяцій Т‑лімфоцитів, концентрації ВІЛ у крові).
4. Встановити доцільність застосування методів експрес-діагностики ІПСШ (сифіліс, трихомоноз) в уразливих групах населення. Оцінити ефективність швидких тестів для діагностики ІПСШ серед загального населення.
5. Оптимізувати методи лікування окремих ІПСШ для представників уразливих груп та провести оцінку їх ефективності.
6. Запропонувати заходи щодо організації надання лікувально-профілактичної дерматовенерологічної допомоги для уразливих груп із залученням клінічної діагностики, швидких тестів, синдромного лікування та соціально-медичного супроводу пацієнтів.
7. Розробити систему медичного консультування представників груп ризику, пов’язану з ІПСШ та ВІЛ/СНІД, оцінити ефективність її застосування.
8. Розробити та впровадити в практичну охорону здоров’я комплекс профілактичних заходів боротьби з ІПСШ для загальної популяції та представників груп населення, уразливих щодо зараження ВІЛ.
9. Запропонувати навчальну програму (тематичне удосконалення в рамках післядипломної освіти) з надання лікувально-діагностичної допомоги представникам груп ризику з розповсюдження ВІЛ/СНІДу для лікарів дерматовенерологів та фахівців суміжних спеціальностей.
Об’єкт дослідження: ІПСШ, ВІЛ.
Предмет дослідження: клінічні та епідеміологічні особливості, показники стану імунітету, ефективність лікування і профілактики.
Методи дослідження: клінічні методи, методи епідеміологічного аналізу, імунофлуоресцентні, імуноферментні методи (виявлення антигенів та антитіл), молекулярно-біологічні (полімеразна ланцюгова реакція (ПЛР) та полімеразна ланцюгова реакція в реальному часі), біохімічні методи, імунологічні методи, бактеріоскопічне (світлова та люмінесцентна мікроскопія) та бактеріологічне дослідження, анкетування, статистичні методи дослідження.
Наукова новизна отриманих результатів. Встановлено особливості поширення урогенітальних інфекцій, ВІЛ та їх асоціації в різних гендерних та соціальних групах серед населення в Україні. Визначено соціальні, медичні й поведінкові чинники, що мають вирішальний вплив на поширення ІПСШ в різних соціальних групах населення. Розкрито закономірності формування асоціацій ІПСШ та ВІЛ. Встановлено відмінності в етіології, патогенезі, клініці, перебігу статевих інфекцій окремих ІПСШ та ВІЛ-інфекції, особливості ІПСШ у представників уразливих груп та загального населення. Доведено, що відсутність санації сифілісу негативно впливає на стан імунітету ВІЛ-позитивних осіб і сприяє підвищенню вірусного навантаження. Визначено характер порушень імунної системи, зокрема показників місцевого (слизового) імунітету, особливості запальних процесів при ІПСШ в залежності від наявності ВІЛ-інфекції та приналежності до груп ризику. Показана необхідність корекції місцевого (слизового) імунітету у представників уразливих груп, особливо у ВІЛ-позитивних осіб з ІПСШ. Підтверджено, що асоціації збудників «ВІЛ + хламідіоз» часто трапляються серед представників уразливих груп. Встановлено існування залежності між хламідіозом та приналежністю до груп ризику, або до загального населення. Встановлено, що ранній початок статевого життя сприяє інфікуванню хламідійною інфекцією. Доведена доцільність включення розроблених лікувально-профілактичних та організаційних заходів в комплекс боротьби з ІПСШ у представників груп населення, що уразливі до зараження ВІЛ.
Практичне значення отриманих результатів. Розроблено та впроваджено в практичну охорону здоров’я метод профілактики поширення ВІЛ та ІПСШ (патенти на корисну модель № 97172 UA «Спосіб обмеження поширення ВІЛ/СНІД та інфекцій, що передаються статевим шляхом, хворими груп підвищеного ризику» та № 96777 UA «Спосіб профілактики інфекцій, що передаються статевим шляхом»). Розроблено принципово нову організацію комунікації між дерматовенерологічною та наркологічною службами при наданні дерматовенерологічної допомоги пацієнтам з наркологічною залежністю та з ІПСШ. Запропоновано ефективний метод застосування іміквімоду в лікуванні осіб, хворих на інфекцію, спричинену вірусом папіломи людини (ВПЛ) з ВІЛ-позитивним статусом.
Розроблені та запропоновані рекомендації з діагностики, санації та профілактики ІПСШ серед груп, що уразливі до зараження ВІЛ. Розроблені рекомендації увійшли до національних протоколів лікування, діагностики та профілактики ІПСШ МОЗ України.
Розроблено новітні методики консультування при проведенні тестування на наявність ІПСШ у осіб з різних груп населення. Розроблено методики мотиваційного консультування осіб з ІПСШ з метою зміни ризикованої сексуальної поведінки. Вперше запропоновано для дерматовенерологічної допомоги систему медичного консультування та ведення представників груп ризику з ІПСШ із залученням клінічної діагностики, швидких тестів, одноразових схем лікування та нових форм соціально-медичного супроводу, пов’язану з ІПСШ та ВІЛ/СНІД.
На базі отриманих даних вперше розроблені комплексні навчальні програми з надання лікувально-діагностичної допомоги представникам уразливих груп та профілактики ВІЛ/СНІДу у формі фахових семінарів та циклу тематичного удосконалення післядипломної підготовки лікарів дерматовенерологів та фахівців суміжних спеціальностей.
Результати досліджень використовуються в роботі КУ „Запорізький обласний шкірно-венерологічний клінічний диспансер” Запорізької обласної ради, КЗОЗ Обласний клінічний шкірно-венерологічний диспансер № 1 (м. Харків), Полтавського обласного клінічного шкірно-венерологічного диспансеру, КУ «Одеський обласний шкірно-венерологічний диспансер», КЗОЗ «Обласний центр профілактики і боротьби зі СНІДом» (м. Харків), ДУ «Інститут дерматології та венерології НАМН України», а також у навчальному процесі кафедри дерматовенерології та ВІЛ/СНІДу Харківської медичної академії післядипломної освіти.
Особистий внесок здобувача. Здобувачем визначено дизайн, мету та задачі дослідження, розроблено план та методологію дослідження. Особисто здійснено клінічний етап дослідження, до якого входив відбір хворих на підставі критеріїв включення, комплексне клінічне обстеження, оформлена первинна медична документація, сформована електронна база даних. Здобувач самостійно проводила статистичну обробку та науковий аналіз даних дослідження, оцінювала їх динаміку під впливом лікування, особисто написала всі розділи дисертаційної роботи. На підставі отриманих даних обґрунтовані висновки і розроблені практичні рекомендації. Здобувач особисто представляла основні положення дисертації на наукових форумах, включаючи міжнародні, забезпечила впровадження результатів дисертаційної роботи в практичну роботу закладів охорони здоров’я і в навчальний процес післядипломної освіти.
Дисертантом не були використані результати та ідеї співавторів публікацій.
Апробація результатів роботи. Основні положення дисертації обговорено на Міжнародному медичному форумі «3-і Київські дерматологічні дні» та «Майстер-класі з уніфікованої методики розробки клінічних настанов уніфікованих клінічних протоколів та медичних стандартів в дерматовенерології» (Київ, 2011); 26 Європейському конгресі Міжнародної спілки проти інфекцій, що передаються статевим шляхом «Staying alert for sexual health» (Рига, 2011); науково-практичній конференції «Кроки до розробки стандартів діагностики та лікування захворювань шкіри та ІПСШ» (Київ, 2012); науково-практичній конференції «Наукові засади надання дерматовенерологічної допомоги в сучасних умовах» (Харків, 2012); круглому столі «Секс і здоров’я української нації. Медичні аспекти профілактики захворювань, що передаються статевим шляхом» (Київ, 2012); 27 конференції Міжнародної спілки проти інфекцій, що передаються статевим шляхом (Анталія, 2012); ІІІ Міжнародному медичному форумі «Інновації в медицині – здоров’я нації» (Київ, 2012); Всеукраїнській науково-практичній конференції з міжнародною участю «Структурно-організаційна перебудова дерматовенерологічної служби в умовах реформування системи охорони здоров’я України» (Чернівці, 2012); науково-практичній конференції з міжнародною участю «Наукові та практичні аспекти надання дерматовенерологічної допомоги населенню України в сучасних умовах» (Харків, 2013); IV Міжнародному медичному форумі «Інновації в медицині – здоров’я нації» (Київ, 2013); Всеукраїнській науково-практичній конференції з міжнародною участю «Мультидисциплінарний підхід до курації хворих на шкірні захворювання та інфекції, що передаються статевим шляхом» (Львів, 2013); Другій національній науково-практичній конференції з питань ВІЛ-інфекції/СНІДу «За кожне життя – разом!» (Київ, 2013); ІІІ Міжнародному медичному конгресі «Впровадження сучасних досягнень медичної науки в практику охорони здоров’я України» (Київ, 2014); науково-практичній конференції «Нові організаційні та діагностично-лікувальні технології в дерматовенерологічній практиці» в рамках VI міжнародного медичного форуму «Інновації в медицині – здоров’я нації» (Київ, 2015); семінарі викладачів медичних вузів України з міжнародною участю «Сучасні підходи до професійної освіти лікарів-наркологів для ефективного представлення ВІЛ-пов’язаних послуг» (Харків, 2015); звітно-виборній та науково-практичній конференції Української асоціації лікарів-дерматовенерологів і косметологів «Оптимізовані засади функціонування дерматовенерологічної служби в умовах розвитку страхової медицини та лікарського самоврядування в Україні» (Київ, 2015); науково-практичній конференції «Інноваційні технології в дерматовенерології. Міждисциплінарні зв’язки» (Харків, 2015); Всеукраїнській науково-практичній конференції молодих учених «Медична наука в практику охорони здоров’я» (Полтава, 2015); науково-практичній конференції «Стан та основні організаційні задачі дерматовенерологічної служби на сучасному етапі в Україні» (Київ, 2016).
Публікації. За матеріалами дисертації опубліковано 38 робіт, у тому числі 25 статей (8 – у моноавторстві), з яких 22 статті у спеціалізованих наукових виданнях, 1 стаття в закордонному друкованому виданні, 2 статті у збірнику наукових праць; 18 статей у журналах, що входять до міжнародних наукометричних баз Російський індекс наукового цитування та Index Copernicus, 2 патенти України на корисні моделі, 7 тез на наукових форумах, включаючи міжнародні, 3 методичні посібники, 1 нововведення.
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУРИ
1.1 Сучасні епідеміологічні особливості урогенітальних інфекцій
ІПСШ протягом багатьох років залишаються однією з найважливіших проблем охорони здоров’я, які є загрозою як для здоров’я населення, так й для економіки країн [6, 23, 53, 207].
За даними статистики, протягом останніх років щорічно у світі виявляється близько 498 мільйонів нових випадків ІПСШ (сифіліс, хламідіоз, гонорея, трихомоноз). Найчастіше інфекції виявляються серед осіб віком 15-49 років. За останні 5 років кількість нових випадків ІПСШ зросла на 50 мільйонів. В середньому в рік реєструється близько 106 мільйонів нових випадків хламідіозу, 106 мільйонів випадків гонореї, 276 мільйонів випадків трихомонозу, 10 мільйонів випадків сифілісу [22, 26, 165, 239, 244].
Також щорічно мільйони людей інфікуються вірусними ІПСШ. Щороку виявляється близько 530 млн осіб позитивних до ВПГ, 290 млн жінок інфікованих ВПЛ [22, 26, 244].
Згідно даних ВООЗ, у жінок з нелікованим раннім сифілісом 25% вагітностей закінчується мертвонародженням, 14% — смертю немовляти, тобто загальна перинатальна смертність становить близько 40% [22, 244].
ІПСШ є головною причиною безпліддя, якого можна запобігти. В 10-40% жінок з нелікованим хламідіозом розвиваються клінічно виражені запальні захворювання органів тазу. У жінок, що перенесли дану патологію, в 6-10 раз вище шанс позаматкової вагітності. Щорічно ВПЛ-інфекція викликає близько 500 000 випадків раку шейки матки, в наслідок чого щорічно вмирає близько 240 000 осіб [239, 244, 272].
Захворюваність ІПСШ в різних регіонах світу відрізняється. Найбільш розповсюдженою ІПСШ в усьому світі є трихомоноз. Другою по частоті зустрічаємості ІПСШ в країнах Європи, та Америці є урогенітальний хламідіоз. В Африці, Південно-Східній Азії, Західно-Тихоокеанського регіону – гонорея. Кількість нових випадків (мільйони) інфікування серед населення 15-49 років представлені на рисунку 1.1 [25, 192].
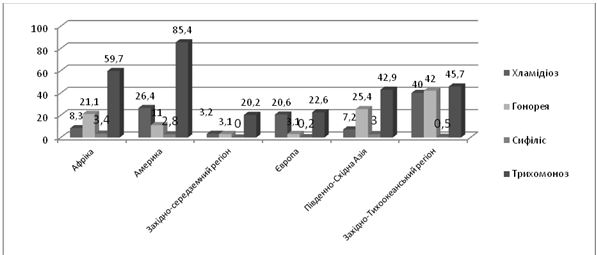
Рисунок 1.1 – Захворюваність ІПСШ в різних регіонах світу (кількість нових випадків інфікування серед населення 15-49 років, мільйони), 2014
Згідно даних спостережень, в Східноєвропейсько-Центральноазійському регіоні, куди відноситься Україна, спостерігаються більш високі щорічні показники середньої захворюваності ІПСШ, ніж в країнах західної Європи (на 1000 населення – 107,3 проти 83,7 випадків). Показники захворюваності по нозологіях – хламідіоз – 29,1 проти 25,7, гонорея – 16,2 та 5,5, трихомоноз – 63,9 проти 52,3, ВПГ-2 (40-44 річні жінки, відсоток – 25,9 проти 17,2, розповсюдженість ВІЛ в 2009 році (відсоток осіб в віці 15-49 років) – 0,8 проти 0,2), випадки смерті від ІПСШ (гонорея, сифіліс, хламідіоз, на мільйон мешканців) – 1,2 проти 0,6 [22, 26, 192].
В Україні щорічно реєструється близько 400 тисяч нових випадків статевих інфекцій. Офіційна статистка відображає, за різними оцінками, від 30% до 40% реальної кількості випадків. Це пов’язано зі зміною сучасних епідеміологічних характеристик інфекцій, особливостями реєстрації захворювань, також тим, що окремі групи населення (групи ризику) не отримують належної дерматовенерологічної допомоги [47, 119].
В Україні протягом останнього десятиріччя спостерігається зниження захворюваності трихомонозом, сифілісом, гонореєю (рис. 1.2). Показники захворюваності хламідіозом залишаються на стабільно високому рівні, щодо мікоплазмозу дані щороку зростають [80, 81, 82, 83, 84, 85, 86].
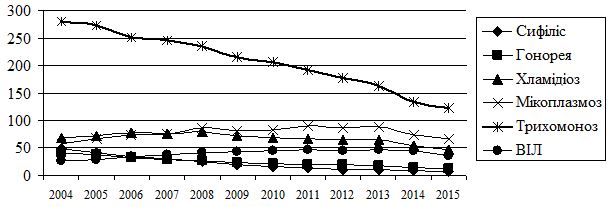
Рисунок 1.2 – Динаміка захворюваності ІПСШ в Україні в 2004-2015 роках (на 100 тисяч населення)
Згідно даних МОЗ, в 2015 році показники захворюваності на ІПСШ в Україні сягнули: сифіліс – 7,5, гонорея – 13,4, хламідіоз – 46,9, трихомоноз – 122,6, мікоплазмоз – 66,2, ВІЛ – 37,0 [86].
В Україні в останні роки відзначається зростання захворюваності пізнього, неуточненного сифілісу, відсотка раннього прихованого сифілісу навіть на тлі зниження загальної кількості випадків інфікування. В структурі захворюваності латентні форми сифілісу складають до 40%. Прихований сифіліс може виступати чинником ураження внутрішніх органів, нервової системи, викликати загибель плоду у вагітних. [29, 119, 272, 82, 83, 84, 85, 86].
В останні два роки спостерігається більш різке зниження даних захворюваності на ІПСШ в Україні серед загального населення. Дана ситуація обумовлена відсутністю даних з тимчасово окупованої території АР Крим та частини Донецької і Луганської областей.
При аналізі захворюваності даних щодо ІПСШ, як в 2014, так й в 2015 році, відсоткове співвідношення інфекцій не змінилося. Найбільший відсоток приходиться на трихомоноз (47 %), частка гонореї та сифілісу складає 3-5 %, хламідіозу – 19 %. Друга по частоті зустрічаємості ІПСШ в Україні це мікоплазмова інфекція (26 %) [85, 86]. Дані наведені на рисунку 1.3.
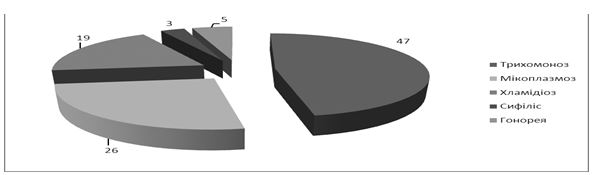
Рисунок 1.3 – Структура захворюваності ІПСШ в Україні в 2014 році, відсотки
Аналіз вікової структури хворих з ІПСШ та ВІЛ свідчить про стабільно високий рівень реєстрації захворюваності серед осіб фертильного віку. Більшість пацієнтів становлять жителі міста [15, 16, 17, 18, 19, 20, 21].
1.2 Сучасна характеристика епідемії ВІЛ/СНІДу
З моменту початку епідемії і до теперішнього часу в світі інфікувалися ВІЛ близько 78 млн. чоловік і більше 35 млн. осіб померли від захворювань, пов’язаних з ВІЛ. На сьогоднішній день в світі налічується більше 36,7 [34,0-39,8] мільйонів людей, що живуть з ВІЛ, з них 70% ВІЛ-позитивних осіб проживали в країнах Африки. За останній рік 2,1 [1,8-2,4] млн. людей інфікувалися ВІЛ,з них 420 тисяч у віці до 15 років. Протягом 2015 р. у світі 1,1 [0,94-1,3] млн. людей померли від СНІДу [16, 26, 272].
За даними ЮНЕЙДС, найбільший відсоток інфікування ВІЛ зустрічається в країнах з низьким і середнім рівнем доходів. За останнє десятиріччя (2001-2009 роки) в 35 країнах показник зараження ВІЛ скоротився більш, ніж на 25%. В 22 країнах Африки, де спостерігалася найбільш масштабна епідемія, процес стабілізувалася, або починає сповільнюватися. Декілька регіонів випадають з загальної тенденції. Показники інфікування ВІЛ виросли більш ніж на 25% в ряді країн Східної Європи. В двох країнах цього регіону (Україні та Росії) показник поширеності ВІЛ складає 1% або вище. Саме на частку цих країн припадає майже 90% всіх нових діагнозів ВІЛ регіону [26, 272].
Згідно даних спостережень, у 26 країнах світу СНІД залишається у п’ятірці причин передчасної смертності (до 65 років, за критерієм ВООЗ) та непрацездатності. До таких країн належать Колумбія, Гайана, М’янма, Росія, Україна та країни Африки на південь від Сахари [26].
За даними Українського центру профілактики і боротьби зі СНІДом, за період 1987-2016 (6 міс.) рр. в Україні офіційно зареєстровано 287 968 випадки ВІЛ-інфекції, у тому числі 88 075 випадків захворювання на СНІД та 39 885 смертей від захворювань, зумовлених СНІДом [16].
Станом на 01. 06.2016 р. під медичним наглядом у перебувало 130 410 ВІЛ-інфікованих осіб (поширеність ВІЛ-інфекції – 306,8 на 100 тисяч) та 36 476 хворих на СНІД (поширеність СНІДу – 85,8 на 100 тисяч) [16].
Найнижчі показники поширеності ВІЛ-інфекції реєструються в західних областях України, хоча кількість регіонів щорічно скорочується. Найвищі рівні поширеності спостерігаються в Одеській (851,9 на 100 тис.), Дніпропетровській (787,8), Миколаївській (699,7), Херсонській (386,2), Київській (352,4), Чернігівській (348,9) областях та у м. Києві (423,4). Дані по Харківській області становлять 130,6 на 100 тисяч населення [16].
Статистичні дані поширеності ВІЛ-інфекції в Україні збільшуються щорічно. Найвищий показник за період спостереження епідемії встановлений в 2013 році (21613 осіб) [15, 16, 17, 18, 19, 20, 21]. Дані наведені на рис. 1.4.
У 2014 та 2015 роках зниження даних захворюваності на ВІЛ (19273 та 15869 відповідно) обумовлене відсутністю даних з тимчасово окупованої території АР Крим та частини Донецької і Луганської областей [15, 16, 17, 19].
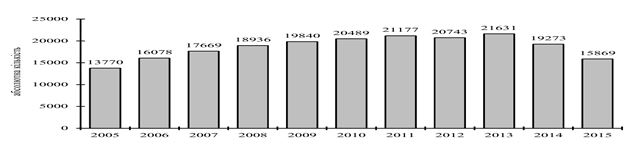
Рисунок 1.4 – Динаміка офіційно зареєстрованих нових випадків ВІЛ-інфекції серед громадян України по роках за період 2005 – 2015 рр.
На достатньо високому рівні залишається кількість випадків діагностування ВІЛ-інфекції на стадії СНІД та кількість смертей, обумовлених СНІДом (рис. 1.5) [15, 16, 17, 18, 19, 20, 21].
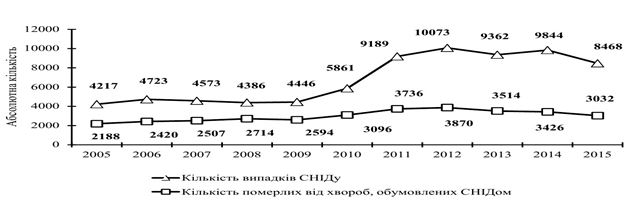
Рисунок 1.5 – Кількість нових випадків СНІДу та померлих від захворювань, обумовлених СНІДом, серед громадян України
Провідним шляхом передачі ВІЛ є статевий, що робить поширення ВІЛ-інфекції нерозривно пов’язаним з епідемією ІПСШ. Починаючи з 2008, коли дані складали 41,9 %, спостерігається невпинний зріст показника. В 2015 році статевий шлях передачі ВІЛ-інфекції сягнув 72,5 % [15, 16, 17, 18, 19, 20, 21]. Дані наведені на рисунку 1.6.
Збільшення питомої ваги статевого шляху передачі ВІЛ призводить до підвищення рівня ВІЛ-інфікованих серед вагітних, дітей та статевих партнерів хворих.
Серед громадян України, померлих від СНІДу, близько 90% відсотків становлять особи 25-49 років, тобто сексуально активного та працездатного віку. При виході епідемії за межі груп підвищеного ризику в загальне населення, що відбувається в Україні, вона завдає найбільших втрат [19, 33, 86].
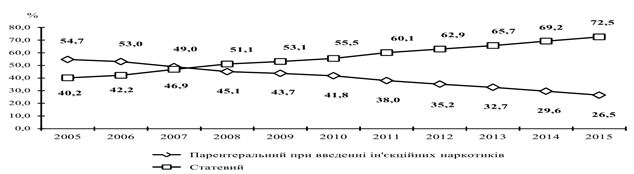
Рисунок 1.6 – Структура шляхів передачі ВІЛ вперше зареєстрованих випадків ВІЛ-інфекції в Україні, %
На поширеність ВІЛ та ІПСШ впливає низка причин. Серед них економічна криза, бідність населення, збільшення масштабів секс-індустрії та гомосексуалізму, нівелювання традиційних морально-етичних цінностей, скорочення соціальних гарантій для молоді. Значну роль відіграють широке поширення ризикованої сексуальної поведінки, зростання наркоманії, в тому числі, також масові вимушені міграції населення (війни, трудова міграція, урбанізація, туризм, активізація торгівлі) [12, 26, 136, 272].
1.3 Особливості асоціації урогенітальних захворювань та ВІЛ-інфекції
В останні роки все частіше зустрічаються випадки виникнення прихованого і безсимптомного перебігу ІПСШ, мікст-інфікування [3, 32, 42, 53].
Проведеними епідеміологічними та лабораторними дослідженнями встановлено, що ІПСШ суттєво збільшують вірогідність зараження ВІЛ через статевий контакт. Виникнення хронічного місцевого запального процесу та рецидивування інфекцій сприяють зараженню ВІЛ [24, 26, 53, 201].
Встановлено, що збудники ВІЛ та ІПСШ взаємодіють та впливають на перебіг кожного окремого захворювання. Змішане інфікування приводить до зміни біологічних властивостей збудників, підсилює їх вірулентність й тим самим обтяжує патологічний процес, викликає резистентність до терапії, сприяє виникненню рецидивів після проведеного лікування [25, 42, 49].
Останнім часом створені новітні вакцини та мікробіциди, на які покладали великі надії, щодо перешкоджання передачі ВІЛ-інфекції статевим шляхом. Проведені клінічні дослідження показали низьку ефективність створених засобів, яка складала приблизно 30% [186, 263].
У процесі розвитку інфекції, викликаної ВІЛ, відбувається суттєва зміна імунологічної реактивності організму. В значній частині випадків спостерігається поєднання інфекційного процесу з іншими захворюваннями, які накладають відбиток як на загальний стан хворого, так і на процеси, що відбуваються в імунній системі [97, 99].
Трихомонадна інфекція призводить до порушень мікробіоценозу. За даними спостережень, у вмісті дослідженого матеріалу з піхви хворих на трихомоноз часто не визначаються лактобактерії, або визначаються у незначній кількості. Це пояснюється здатністю трихомонад утилізувати лактобактерії, порушуючи мікробіоценоз піхви [58, 120, 213].
Сечостатевий трихомоноз є багато вогнищевим захворюванням, при якому збудник може виявлятися як в сечостатевих органах, так і в мигдалинах, кон’юнктиві очей, в прямій кишці [93, 114, 206].
Без лікування трихомонади не залишають організм господаря і здатні викликати появу різних ускладнень: безпліддя, патологію періодів гестації та новонародженості, включаючи вади розвитку та дитячу смертність [123, 262, 269].
Трихомоноз вважається фактором ризику передачі ВІЛ-інфекції та інших ІПСШ, оскільки стимулює інтенсивну запальну реакцію епітелію піхви і ектоцервікса з ознаками – точковими крововиливами, викликаючи порушення урогенітального епітелію, які діють як шлюз для вірусу [264].
За даними спостережень, трихомонадна інфекція у ВІЛ-інфікованих жінок пов’язана зі збільшенням передачі ВІЛ статевим шляхом. Подібно до вагінального кандидозу, у ВІЛ-інфікованих жінок поширеність трихомонозу збільшується разом зі зниженням імунної функції, що підтверджено дослідженнями кількості CD4 + Т-клітин [148, 252].
Епідеміологічні дослідження показують, показники поширеності трихомонозу серед ВІЛ-позитивних жінок спостерігаються в діапазоні від 6% до 27%, причому повторне інфікування сягає 36% [154, 181, 237].
Запальні захворювання нижніх відділів жіночих статевих шляхів є актуальною медичною проблемою, яка обумовлена високим рівнем захворюваності, хронічним перебігом, недостатньо ефективною терапією з можливими рецидивами або резідуальними проявами інфекції [52].
До виникнення інфекційного вульвовагініту у високому відсотку випадків можуть бути причетні умовно-патогенні мікроорганізми (аеробні, факультативно- та облігатно-анаеробні), які часто опиняються етіологічним фактором захворювання, як самостійно, так і у асоціації з облігатними патогенами [101].
У жінок при зсуві складових компонентів мікробіоти настає різке зниження концентрації резидентної мікрофлори, за рахунок витискування її опортуністичними збудниками, простежується чітка тенденція до збільшення вмісту факультативно-анаеробних і аеробних мікроорганізмів [107].
Порушення екологічної рівноваги мікробіоценозу зумовлює зниження колонізаційної резистентності слизових оболонок, що сприяє формуванню нових мікробних асоціацій з патогенними тенденціями. Подібні процеси можуть привести до виникнення різноманітних запальних захворювань статевої сфери. Більшою частиною подібні стани виникають при утворенні асоціацій мікрорганізмів, що обопільно посилюють свої патогенні властивості [5, 129].
Запальні захворювання органів малого тазу часто зустрічаємо патологія у ВІЛ-інфікованих жінок. Ознаки та симптоми неспецифічні та різноманітні. Але, за даними спостережень, у 70-80% випадків перебіг патології є безсимптомним [159, 184].
Згідно дослідження L. Johnson et al (2008) спостерігається підвищення рівня резистентності Escherichia coli до левофлоксацину. Надзвичай важливою проблемою є неухильно зростаюча стійкість стафілококів до β-лактамних антибіотиків [5, 157].
У багатьох країнах світу у останні роки спостерігається тенденція до значного зросту стійкості представників аеробної мікрофлори до ампіциліну, амоксиклаву та ко-тримоксазолу. Відзначається зріст штамів стафілококів з резистентністю до макролідів, що часто поширюється на споріднені з макролідами лінкозаміди (MLS-резистентність) [121].
У зв’язку з тим, що для лікування бактеріальних інфекцій, спичинених облігатними патогенами (гонорея, хламідіоз, мікоплазмоз), застосовуються антибактеріальні препарати, що ефективні по відношенню до опортуністичних агенів, необхідність постійного моніторингу рівня резистентності можливих етіологічних агентів запальних захворювань сечостатевої системи до антибактеріальних препаратів залишається актуальною.
Хламідіоз згідно спостережень, у ВІЛ-позитивних жінок збільшується ймовірність передачі вірусу статевим шляхом. Це пов’язано з особливостями місцевого імунітету, головним чином по причині ко-інфікування іншими ІПСШ. Спостерігається значний відсоток безсимптомного перебігу ІПСШ, зокрема хламідіозу. Дослідниками визначено, що у ВІЛ-позитивних осіб з ІПСШ існує двосторонній синергічний процес, в яких ВІЛ-інфекція сприяє розвитку місцевих інфекцій, а ці захворювання сприяють збільшенню локальної реплікації вірусу. Необхідно проводити постійний моніторинг щодо зараження ІПСШ [185, 191].
Захворювання, які супроводжуються появою виділень зі статевих органів, приводять к збільшенню концентрації ВІЛ в спермі та цервіковагінальних виділеннях [199].
Встановлено, що за наявності гонореї у ВІЛ-позитивних осіб значно підвищується вірогідність передачі ВІЛ статевим шляхом [211, 212].
За даними інших дослідників також підтверджено підвищення концентрації ВІЛ в цервікальному слизу у ВІЛ-позитивних жінок при наявності цервікальних інфекцій (хламідіоз, гонорея). Проведений мета-аналіз 39 досліджень відображує, що в даному випадку вище ймовірність інфікування статевого партнера та передачі інфекцій новонародженому в пологах [155, 189, 224].
За даними дослідників, у жінок на тлі імунодефіциту, викликаному ВІЛ, часто спостерігається бактеріальний вагіноз. Бактеріальний вагіноз також часто впливає на розвиток цервікальної інтраепітеліальної неоплазії та приводить до змін профілю цитокінів, що знижують здатність імунної системи до елімінації ВПЛ-інфекції. Аналіз вагінальних виділень ВІЛ-позитивних жінок продемонстрували зворотну кореляцію між вірусним навантаженням та наявністю лактобацил та позитивну кореляцію між бактеріальним вагінозом і Mycoplasma hominis [156, 163, 174, 246].
ВІЛ-інфекція вважається одним з факторів ризику розвитку симптоматичної інфекції Candida, разом з вагітністю, неконтрольованим цукровим діабетом, а також застосуванням кортикостероїдів, антибіотиків, або оральних контрацептивів з високою концентрацією естрогенів [140, 187].
Симптоми вагінального кандидозу часто зустрічаються на більш ранній стадії ВІЛ-інфекції. У пацієнток спостерігається збільшення запалення і підвищення вірулентності, часті рецидиви після лікування вагінальної інфекції, а інтервал часу їх появи корелює з тяжкістю імуносупресії [151].
Існує близько 40 генотипів ВПЛ, здатних інфікувати урогенітальний тракт. ВПЛ-інфекція є найбільш поширеною ІПСШ в світі, що призводить до появи аногенітальних пошкоджень, які більш поширені у жінок [3, 243].
Розповсюдженість ВПЛ-інфекції серед населення варіює від 4 до 35% та безпосередньо залежить від кількості статевих партнерів [58, 138, 270].
Традиційними органами-мішенями для ВПЛ є шкірні покриви й слизові оболонки аногенітальної ділянки та верхніх дихальних шляхів, рідше порожнини рота, стравоходу, прямої кишки, кон’юнктиви ока [11, 190].
Виникнення раку шийки матки майже у всіх випадках пов’язано з персистенцією ВПЛ-інфекції, зокрема типів високого ризику 16 і 18. Розповсюдженість ВПЛ високого ризику також пов’язана з появою раку вульви, статевого члена, анальної ділянки та ротоглотки [34, 142, 158, 179, 250].
Наявність ВІЛ-інфекції збільшує виявлення, персистенцію та тяжкість уражень ВПЛ. Це обумовлено імуносупресією при персистуванні ВПЛ-інфекції, наявністю типів вірусу, що можуть спричинити появу карциноми, одночасним зараженням декількома типами, реактивацією інфекції та ураженням кількох топографічних регіонів аногенітальної області [170, 178, 217].
У ВІЛ-інфікованих жінок, рак шийки рак перебігає агресивніше, з великою кількістю рецидивів та найгіршим прогнозом, навіть якщо традиційні методи лікування ефективні [226, 254].
Клінічні прояви ВПЛ у вигляді кондилом спостерігаються в 3-5% людської популяції, в 10-15% населення має місце прихований перебіг інфекції, що може виступати «резервуаром» та джерелом інфекції у разі її реактивації [11, 58, 190].
Більшість випадків кондилом аногенітальної локалізації є результатом статевого контакту. Сексуально активні чоловіки часто є носіями високого ризику типів ВПЛ. Передача ВПЛ сексуальному партнерові в одностатевих парах в 5-10 разів частіше, ніж у гетеросексуалів. Доведено, що онкогенний фрагмент геному ВПЛ присутній на сперматозоїдах [128, 183].
Негенітальна локалізація кондилом, а саме в ділянці губ, гортані, слизовій ротової порожнини найчастіше пов’язана з імуносупресією [269].
Лікування клінічних проявів ВПЛ-інфекції спрямоване на ліквідацію макроскопічно видимих уражень шкіри, та досягається різними методами, зокрема хімічною деструкцією, аблятивними методиками [229, 256].
Встановлено, що після деструкції видимих висипань вірус персистує у зовні здоровому епідермісі, призводячи до частих рецидивів (близько 30%). За даними спостережень, ефективність лікування екзофітних кондилом становить від 50 до 94%. Аблятивні техніки забезпечують зникнення висипань після одноразової обробки, але процедура травматична. Застосування цитостатичних препаратів, імунотерапії та хімічної деструкції не забезпечує моментального зникнення екзофітних висипань, однак сприяє зменшенню рецидивів (11-36%) [229, 256].
При застосуванні імуномодуляторів (імуностимулятори, імуносупресивні агенти) ефективність лікування кондилом у хворих на ВІЛ не перевищує показників при традиційних методах, напевно мобілізація місцевого імунітету в цьому випадку є проблематичною [116, 139].
У лікуванні ВПЛ-уражень шкіри та слизових міжнародними керівництвами запропонований хіміотерапевтичний засіб для місцевого застосування 5% крем іміквімоду. Це метод терапії «першої лінії», коли лікування може проводитись пацієнтом під контролем лікаря [122, 244].
Іміквімод – модифікатор імунної відповіді. Іміквімод стимулює як вроджений так і набутий імунітет, йому не притаманна пряма антивірусна активність. На реакції вродженого імунітету вплив відбувається шляхом активації Toll-подібних рецепторів, які експресовані моноцитами, макрофагами і дендритними клітинами, що індукують продукцію відповідних цитокінів та хемокінів. Відбувається стимуляція активності природних кілерів (NK-клітин). Також іміквімод спричиняє вплив на клітинний імунітет. Підсилює міграцію клітин Лангерганса в регіонарні лімфатичні вузли, що посилює презентацію антигенів T-клітинам. Цитокіни, зокрема IL-12, TNF, стимулюють секрецію IFN-g NK-клітинами та T-лімфоцитами. При гістологічному дослідженні біоптатів шкіри при лікуванні іміквімодом спостерігається лімфоцитарна інфільтрація [200, 202].
Зростання кількості звернень в клініки з приводу ІПСШ обумовлює розробку методів лікування, що сприятимуть зменшенню кількості візитів та уможливлюють застосування в амбулаторних умовах. Особливої уваги заслуговують методи, які мінімізують травматизацію тканин й сприяють тривалій ремісії з низьким рівнем рецидивів, що доцільно при наданні допомоги ВІЛ-позитивним особам.
Математичні моделі відображують, що ІПСШ відіграють все більшу роль згідно змінам фаз епідемії ВІЛ. Вплив ВПГ-2 є важливішим, оскільки вірус все більше підвищує ризик зараження з наростанням епідемії [141].
ВІЛ-інфекція збільшує передачу та частоту реактивації генітального герпесу, який, в свою чергу, підвищує концентрацію ВІЛ у плазмі крові і в статевих виділених, ризик передачі та прогресування захворювання [171, 172, 257].
Імуносупресивна терапія ВПГ-2 призводить до зниження концентрації ВІЛ в плазмі та урогенітальному тракті осіб з генітальним герпесом, частково за рахунок непрямого інгибування зворотної транскриптази ВІЛ [266].
Поєднане інфікування CD4+ Т-клітин вірусами ВІЛ і ВПГ призводить до швидкої реплікації ВІЛ, в той час як зараження, реактивація та передача ВПГ-2, полегшуються порушеннями вагінальної мікрофлори в результаті бактеріального вагінозу [133, 198].
За даними спостереження встановлено, що, незалежно від регіону (США, Велика Британія, Кенія, Південна Африка) наявність ВПГ-2, сифіліс, симптоматичні ІПСШ сприяють розповсюдженості ВІЛ (підтверджено наявністю позитивної кореляції між показниками), як й наявність більше одного статевого партнера за останній рік [194].
Асоціація сифілісу з іншими ІПСШ, особливо з урогенітальним хламідіозом, сприяють формуванню серорезистентності після лікування сифілісу [9, 100, 239].
Сифілітичні та герпетичні виразки на геніталіях збільшують ризик зараження ВІЛ. Останні патофізіологічні дослідження встановили, що інфіковані тканини мають підвищену кількість рецепторів хемокінів 5-експресуючих Т-клітин, а також кілька моделей підтверджують вірусний синергізм між ВПГ-2 та ВІЛ [255].
Встановлено, що в ІПСШ-клініках США спостерігається вища поширеність сифілісу серед ВІЛ-інфікованих осіб, у порівнянні з ВІЛ-негативними пацієнтами. Подібна тенденція серед уразливих груп спостерігається й в інших регіонах [228, 238].
Згідно даних спостережень, в США частішають випадки вродженого сифілісу. В 2014 році визначено найбільш високі дані за останні 15 років спостереження (11,6 на 100 тисяч населення). Збільшення показнику обумовлене зростанням захворюваності на сифіліс саме серед представників уразливих груп (РКС, ЧСЧ) [182].
Згідно даних математичних моделей, поширеність сифілісу в 1990-і роки передбачали приблизно 53% варіації в пік поширеності ВІЛ-інфекції. Популяції з генералізованою епідемією ВІЛ мали більш високу поширеність сифілісу в період, що передує ВІЛ. Ця знахідка дає додаткові підстави ретельно контролювати сексуальну поведінку, сексуальні мережі, а також ІПСШ в цих групах населення [253].
У результаті спостережень виявлено, що розповсюдженість сифілісу безпосередньо та розповсюдженість ВІЛ опосередковано впливають на ефективність лікування ІПСШ та клінічну картину захворювань. Щонайменше одна з чотирьох ВІЛ-інфікованих осіб з ІПСШ вказує на безсимптомність процесу [134, 193].
У ВІЛ-інфікованих осіб відзначається вищий ризик виникнення серопозитивності після проведеної повноцінної специфічної терапії первинного та вторинного сифілісу. Близько 17 % ВІЛ-позитивних пацієнтів потребують повторного лікування. У них частіше, ніж у ВІЛ-негативних осіб, спостерігається розвиток нейросифілісу. Важливо, що часто залишається невизначеним термін зараження, а значно більша кількість статевих партнерів, наявність супутніх ІПСШ ускладнюють перебіг захворювання та негативно впливають на результати лікування [238].
У осіб з порушеннями імунітету та ВІЛ-інфікованих може спостерігатися хибна позитивність реакцій на сифіліс та виявлятися хибна негативність результатів при наявності захворювання. Тимчасово негативний результат тестування іноді реєструється при вторинному сифілісі у осіб із супутньою ВІЛ-інфекцією, що виявляє наступне тестуванні [8, 26].
Показано, що у ВІЛ-інфікованих з числом лімфоцитів Т-клітин CD4 + менше 200 клітин/мкл існує більш високий ризик відсутності серологічної відповіді на сифіліс. Введення АРТ може сприяти зменшенню на 60 % відсутності серологічної реакції на сифіліс [131].
Встановлена позитивна кореляційна залежність між даними поширеності сифілісу, виділень з уретри у чоловіків і статевих виразок у чоловіків та піком поширеності ВІЛ-інфекції в Південій Африці в ранніх і пізніх стадіях розвитку епідемії ВІЛ. Цей зв’язок змінився на негативний на пізнішим етапі в епідемії ВІЛ в регіоні. Дослідники вважають, що смертність від СНІДу зіграла важливу роль у зниженні розповсюдження бактеріальних ІПСШ, зокрема сифілісу в цьому регіоні. Отже, розширення масштабів АРТ може призвести до сплеску сифілісу та інших ІПСШ, що спостерігається в країнах з високим рівнем доходів [251].
Таким чином, спостерігається складна взаємодія ВІЛ-інфекції та ІПСШ, а особливо сифілісу, що чинить негативний вплив на стан імунітету [273]. Специфічні взаємовідносини між ІПСШ, ураженнями шкіри та даними вірусного навантаження в плазмі при ВІЛ-інфекцї ще не достатньо добре описані.
1.4 Особливості стану місцевого імунітету у осіб з інфекціями, що передаються статевим шляхом
Важливо відзначити, що секреторний IgA (sIg A) є ключовим фактором місцевого імунітету, що забезпечує локальний захист від патогенів. Саме sIg A, що продукують плазматичні клітини слизової геніталій, є одним з найкращих індикаторв маніфестації імунної відповіді, яка є наслідком антигенної стимуляції, ніж циркулюючи антитіла [1, 41, 45, 105, 130].
sIg A попереджує абсорбцію вірусів, бактерій, токсинів шляхом блокування їх адгезії, коли вони на зовнішній стороні епітеліального бар’єру, IgA здатен змити шляхом рідини секрету слизової та омити епітелій [209].
Місцевий імунодефіцит, що розвивається у хворих з урогенітальною патологією, характеризується дисфункцією нейтрофілів і зменшенням продукції sIg A [36, 50, 78].
Наявність місцевого запалення, низький вміст sIg A сприяє зараженню ІПСШ [150].
У хворих з запальними захворюваннями органів малого тазу, в процесі лікування у яких відзначалося зростання sIgA, відповідно виявлялося збільшення нормальної мікрофлори піхви (лакто-і біфідобактерій) з одночасним зменшенням рівня умовно-патогенної мікрофлори. У пацієнток, в аналізах яких не спостерігалося зростання sIgA було відсутнє і збільшення рівня нормальної мікрофлори, також залишався високим рівень опортуністичної флори [117].
У пацієнток з поліпами шийки матки відзначено суттєве вірогідне зниження кількості sIgA в порівнянні зі здоровими жінками. Отримані результати демонструють виражений дисбаланс гуморальних факторів імунітету на локальному рівні, що пов’язано із запальними змінами і недостатньою захисною дією протиінфекційних агентів [130].
При наявності ІПСШ підвищення рівнів sIgA в цервікальному каналі пов’язане з тяжкістю і виразністю клінічних проявів. За даними спостережень, при гострому урогенітальному хламідіозі у жінок високі рівні вмісту імуноглобулінів розцінювали як виражену місцеву імунологічну реакцію макроорганізму, яка відображала гостроту інфекційного процесу. У цервікальному секреті зростання рівня Ig G пов’язано в основному з ексудацією через слизову сироватки крові, а виявлення sIgA обумовлено їх місцевим синтезом. При хронічному урогенітальному хламідіозі низькі рівні вмісту sIgA та інших показників імунітету у пацієнток свідчили про прояви пригноблення місцевого імунітету [106].
В інших спостереженнях, у пацієнтів з урогенітальним хламідіозом, загальною ознакою формування локального (місцевого) протиінфекційного захисту в межах слизових було підвищення рівня деяких цитокінів, лейкоцитів, Ig G та sIgA. При цьому найбільш високі рівні перерахованих показників були характерні для гострого запалення [109, 164].
Спостерігалося вірогідне підвищення вмісту sIg A в цервікальному секреті інфікованих (кандидоз, урогенітальний мікоплазмоз) жінок до початку лікування, який нормалізувався після комплексної терапії. Дослідники розцінювали це, як наслідок порушення проникності слизової оболонки шийки матки, так й як результат активної продукції антитіл у відповідь на антигенну стимуляцію лімфоїдних структур під впливом інфекційного агенту [108].
Згідно даних спостережень, Ig A в слизових геніталій відіграє визначну роль в інгибуванні передачі ВІЛ статевим шляхом при контактах ВІЛ-позитивного чоловіка та ВІЛ-негативної жінки [208].
Враховуючи різноспрямовані результати спостережень, доцільно провести порівняльне дослідження стану місцевого імунітету у осіб з ІПСШ з загальної популяції та представників уразливих груп.
1.5 Особливості діагностики ВІЛ-інфекції
ВІЛ-інфекція – трансмісивне захворювання, яке передається переважно статевим шляхом, через інфіковані продукти крові, недосконало дезінфіковані медичні інструменти, також при вагітності та пологах [168, 175].
В основі патогенезу захворювання лежить прогресуючий імунодефіцит, внаслідок чого спостерігається розвиток вторинних опортуністичних інфекцій і пухлинних процесів. Ураження імунної системи при ВІЛ-інфекції носить системний характер, проявляючись глибокою супресією Т і В-ланок імунітету, що визначає клінічну картину захворювання [146].
Значну роль грає рання і своєчасна діагностика ВІЛ-інфекції, зокрема виявлення специфічних антитіл і вірусних антигенів у сироватці або плазмі крові методом імуноферментного аналізу (ІФА) [175].
Вільний антиген р24 ВІЛ-1 з’являється в крові раніше специфічних антитіл (частіше за все на 11-14 день після інфікування), потім його концентрація знижується і знову підвищується в термінальній стадії захворювання зі зниженням рівня нейтралізуючих його антитіл [175, 221].
Антитіла до різних білків ВІЛ з’являються пізніше ( в середньому через 2-8 тижнів після інфікування). Першим синтезуються специфічні Іg М, зазвичай протягом 3 тижнів після інфікування. Специфічні Іg G з’являються, як правило, через 3-4 тижня від початку захворювання, однак залежно від особливостей імунної системи хворого термін їх появи може збільшитися до 8 й більше тижнів [232].
Для проведення скринінгових досліджень крові щодо виявлення антитіл до ВІЛ та вірусних антигенів в даний час використовують високочутливі імуноферментні тест-системи 3 і 4 покоління. У них рекомбінантні поліпептиди використані у складі твердої фази і кон’югату, що дозволяє виявити сумарні антитіла різних класів (Іg А, Іg М, Іg G) і скорочує період «сероконверсійного вікна». Тест-системи 4 покоління (комбіновані тести) дозволяють виявляти не тільки специфічні антитіла, але і антиген р24 ВІЛ-1, що досягається введенням в систему моноклональних антитіл до р24. Така конфігурація тест-системи підвищує її чутливість і дозволяє виявляти ВІЛ в більш ранні терміни, коли антитіла до вірусу ще відсутні [7].
Детекція антигену р24 у ВІЛ-інфікованих дозволяє підтвердити діагноз ВІЛ у осіб із сумнівним результатом імуноблоту, контролювати ефективність проведеної терапії та прогнозувати перебіг захворювання [35].
Кількість CD4-лімфоцитів є основним клінічним індикатором імунодефіциту у інфікованих ВІЛ. Цей показник є найважливішим критерієм у прийнятті рішення про початок АРТ, проведення профілактики опортуністичних інфекцій, а також предиктором подальшого прогресування захворювання і виживання пацієнтів, що підтверджується результатами клінічних і когортних досліджень [14].
Відносна кількість CD4-лімфоцитів, виражена у відсотках, відрізняється більшою сталістю, ніж абсолютна. Значною зміною вважають 30 % різницю між результатами двох досліджень абсолютної кількості CD4-лімфоцитів або 3% різницю відсоткового вмісту [72].
1.6 Методи швидкої діагностики урогенітальних інфекцій
Впровадження дієвих програм з діагностики та лікування ІПСШ, особливо у представників груп підвищеного ризику інфікування ІПСШ та ВІЛ, є дієвим механізмом впливу як на поширення цих інфекцій статевим шляхом в осередку груп ризику, так і переходу ВІЛ у загальну популяцію сексуально активного населення [25, 110]. Це обумовлює актуальність оптимізації клініко-лабораторної діагностики ІПСШ серед представників уразливих груп.
Згідно даних спостережень, для діагностики ІПСШ у представників уразливих груп населення актуальним є застосування мінімального пакету лабораторних досліджень – швидкі тести, скринінгова мікроскопія (мікроскопії «біля ліжка хворого» – bed-side microscopy) з метою своєчасного виявлення ІПСШ та підвищення профілактики їх розповсюдження. Питанням застосування скринінгової мікроскопії в діагностиці ІПСШ приділена увага в різноманітних клінічних протоколах і рекомендаціях [104, 124, 262].
Сучасні керівництва з лабораторної діагностики ІПСШ [112, 124, 160, 262, 271], зокрема гонореї, трихомонозу, бактеріального вагінозу, кандидозу включають наступні методи досліджень. Запропонований до широкого використання метод ампліфікації нуклеїнових кислот застосовується для діагностики вищеперерахованих інфекцій, за винятком бактеріального вагінозу. Проведення ПЛР діагностики урогенітального кандидозу здійснюється за показниками. Також існує низка різноманітних швидких тестів, які використовуються для діагностики гонореї, трихомонозу, бактеріального вагінозу за виключенням кандидозу [25, 94, 110, 112, 124, 137, 143, 167, 231, 262].
Бактеріологічний метод полягає у виділенні чистої культури збудника і визначенні чутливості до антибактеріальних, антифунгальних засобів, препаратів групи імідазолу. Бактеріологічний метод застосовується для діагностики гонореї, трихомонозу, кандидозу за виключенням бактеріального вагінозу [94, 112].
Бактеріоскопічне дослідження застосовується для вивчення препаратів біологічного матеріалу, отриманого з уретри, шийки матки і прямої кишки. Метод дає можливість виявлення збудників гонореї трихомонозу, кандидозу та флори, характерної для бактеріального вагінозу [94, 112].
Мікроскопія являє собою дієвий метод забезпечення ранньої діагностики ІПСШ з встановленням етіологічного фактора. Завдяки своєчасному виявленню інфекції досягається профілактика поширення ІПСШ та ВІЛ у популяції, також зниження частоти передачі інфекції і ризику розвитку ускладнень через відсутність лікування [58, 94, 112].
Інфікування більшістю ІПСШ (зокрема гонорея, трихомоноз, кандидоз) можливе при всіх видах статевих контактів (вагінальний, оральний, анальний). За допомогою методу бактеріоскопії можливе діагностування даних інфекцій при будь-якій локалізації ураження. Також можна виявити прояви бактеріального вагінозу, ознаки запалення, наявність іншої атипової мікрофлори [58].
Необхідно провести аналіз існуючих нормативних документів та визначити найбільш ефективний та доцільний до використання метод діагностики гонореї, трихомонозу, кандидозу та бактеріального вагінозу саме для уразливих груп населення.
Серологічні реакції займають провідне місце в діагностиці сифілісу. Вони засновані на виявленні неспецифічних (реагинів) або специфічних антитіл (Ig G, Ig M) в сироватці (плазмі) крові, рівень вмісту яких залежить від стадії інфекції. З успіхом також застосовуються прямі методи визначення Т. pallidum. Використання як нетрепонемних, так і трепонемним методів діагностики сифілісу, дозволяє збільшити ймовірність встановлення правильного діагнозу [58].
Неспецифічні або скринінгові тести мають свої плюси і мінуси. До плюсів нетрепонемних тестів можна віднести їх невисоку вартість, порівняно короткий час для отримання відповіді при постановці окремих тестів, придатність для проведення скринінгу великої кількості зразків. Деякі сучасні нетрепонемні тести випускаються вже стандартизованими. До мінусів відносять їх порівняно низьку чутливість при первинному (70-90%) і пізньому (30-50%) сифілісі, наявність феномена прозони і, в окремих випадках, появу помилково негативних або хибнопозитивних результатів при наявності надлишкової кількості антитіл в нерозведеній досліджуваній сироватці (блокування реакції антиген-антитіло), в той час як при розведенні вихідної сироватки виходять різко позитивні результати) [46].
Крім вищевказаних тестів, в клінічній практиці все частіше використовуються молекулярно-біологічні методи – виявлення ДНК, РНК блідих трепонем методом ПЛР. Даний метод ефективно застосовується в діагностиці інфекційних форм сифілісу, вродженого сифілісу, нейросифілісу [40, 46, 161].
Особливість ситуації, яка склалась протягом останнього часу в Україні, в тому числі значне зростання кількості військовослужбовців, що приймають участь в бойових діях, вимушених мігрантів, потребує особливого підходу щодо надання лікувально-діагностичної допомоги з приводу ІПСШ. За рахунок цього прошарку популяції розширився перелік уразливих щодо зараження ІПСШ та ВІЛ груп населення, доступ яких до отримання дерматовенерологічної допомоги обмежений.
За рекомендаціями ВООЗ, які відображені в міжнародних керівництвах з надання допомоги уразливим групам, для діагностики ІПСШ серед даного прошарку популяції доцільно використовувати швидкі тести [22].
В Україні застосовуються швидкі імунохроматографічні (ІХГ) тести для діагностики сифілісу [73]. Вважається доцільним визначити ефективність використання швидких тестів для діагностики сифілісу, а також окреслити групи населення та ситуації, в яких можна рекомендувати їх застосовування.
1.7 Особливості перебігу урогенітальних інфекцій в уразливих групах населення та надання їм лікувально-діагностичної допомоги
За розрахунковими даними, у світі 40-50% дорослих, які були інфіковані ВІЛ в 2015 році, асоціюються з ключовими уразливими групами населення (СІН, РКС, ЧСЧ) та їх статевими партнерами. За даними спостережень, серед 12,7 млн людей у світі, які вживають ін’єкційні наркотики, 13% мають ВІЛ-позитивний статус. Поширеність ВІЛ серед РКС у 12 разів вище, ніж серед загальної популяції, серед ЧСЧ – в 19-40 разів [16, 249].
За даними МОЗ, серед представників груп ризику позитивні результати тестів на ВІЛ та хламідіоз сягають 5-6%, сифіліс та гонорея – у 1,5-3,5%, гепатити В та С – у 5- 25 % обстежених осіб [20, 21].
Згідно даних CDC (The Centers for Disease Control), в осередку представників уразливих груп в виправних закладах спостерігаються високі показники розповсюдженості хламідіозу та гонореї, виявлені гендерні відміни. У жінок 20-35 років виявлення хламідій спостерігається в середньому в 14 % випадків. У чоловіків молодшого віку виявлення складає 6,6 %, а зростання показника до 16,6 % спостерігається к 35 рокам [236].
Сифіліс зустрічається у значно більшій кількості осіб з груп ризику, ніж серед загального населення. Характерною рисою представників груп ризику є емоційна нестабільність, імпульсивність, до якої можна віднести проміскуїтет, неконтрольоване вживання психостимулюючих засобів. Все це заважає дотриманню правил безпечного сексу [51, 54].
Дані проведеного систематичного огляду 64 наукових статей свідчать про значний відсоток прихованих ІПСШ серед представників уразливих груп, що необхідно враховувати при наданні їм дерматовенерологічної допомоги. Доцільним шагом для виявлення подібних осіб є розробка та застосування локального протоколу [135].
Зустрічається все більше ВІЛ-інфікованих осіб виявлених через наявність клінічних показань. У осіб з груп ризику часто діагностують різноманітні дерматози, які є першими проявами декомпенсації імунітету при зараженні ВІЛ. Спостерігається одночасне виявлення інфекційних та неінфекційних дерматозів, сполучення кількох клінічних різновидів мікотичної та вірусної патологій виявляється в 87 % [97].
Профілактика та лікування ІПСШ дозволяє знизити ризик передачі ВІЛ статевим шляхом, особливо серед осіб, які належать до груп ризику та мають численних статевих партнерів [132, 152, 267].
Представники груп ризику здебільшого негативно ставляться до діагностики та лікування в офіційних установах. Етіологічне діагностування ІПСШ є проблематичним як для представників уразливих груп, так й для багатьох надавачів послуг. Воно накладає обмеження на час та ресурси, збільшує вартість та зменшує доступність лікування. Також, чутливість та специфічність тестів, доступних у продажу, значно відрізняються, і це негативно впливає на достовірність лабораторного тестування з метою встановлення діагнозу ІПСШ [98, 220, 245, 261, 268].
Світова практика свідчить, що для поліпшення доступу уразливих груп до дерматовенерологічної допомоги може бути рекомендований принцип «одного візиту», коли за 30-60 хвилин проводиться консультування, діагностика інфекцій та призначається лікування. Ефективне застосування швидких методів діагностики й одноразових схем лікування (затверджених міжнародними протоколами) в умовах амбулаторії, синдромної діагностики ІПСШ [22, 125, 162, 265].
У веденні випадку ІПСШ у осіб з уразливих груп використовується синдромний підхід до діагностики та лікування. Основним завданням синдромного підходу є оздоровлення хворого, переривання епідемічного ланцюжка вже при первиннім відвідуванні лікаря й виключення можливості інфікування партнерів хворого. Він базується на визначенні постійного переліку симптомів та легко пізнаваних ознак (синдромів), на призначенні лікування, яке впливатиме на більшість, або найбільш патогенні збудники, які спричиняють ці синдроми. Це лікування недороге, просте та економічно обґрунтоване [22, 51].
Даними спостережень підтверджено, що в етіології синдромів виділень з уретри та піхви, появи виразкових елементів значну роль відіграють такі ІПСШ, як гонорея, хламідіоз, сифіліс, ВПГ [222, 234].
Показано, що програми по боротьбі з ВІЛ, які включають виявлення та лікування ІПСШ, можуть сприяти зниженню поширення ВІЛ, стримуванню епідемії [4, 222, 272].
В ході проведеного ВООЗ в Танзанії рандомізованого контрольованого дослідження встановлено, що лікування ІПСШ з використанням синдромного підходу на первинному рівні системи охорони здоров’я призвело до зниження захворюваність на ВІЛ-інфекцію на 40% через 2 роки в середовищі зі зростаючою епідемією ВІЛ [261].
У Малаві при проведенні ВООЗ дослідження було виявлено, що концентрація РНК ВІЛ-1 в рідкій частини сперми у чоловіків з уретритом в 8 разів вище, ніж без уретриту. Після проведення антимікробної терапії через 2 тижні концентрація ВІЛ в спермі знижувалася в 3-5 разів [245].
У веденні пацієнтів з ІПСШ ефективна фахова допомога. Згідно даних спостереження 1215 жінок, які належали до уразливих груп та проходили обстеження на ІПСШ (венерологічні клініки, застосування тест-систем для самостійного використання, обстеження при затриманні в разі правопорушень), виявлення трихомонадної інфекції було вищим при наданні кваліфікованої діагностичної допомоги. Часто виявлялася асоціація інфекцій – трихомоноз одночасно з хламідіозом та гонореєю [225].
У якості профілактики передачі ВІЛ ефективно застосування АРТ. Дані дослідників вказують на те, що на фоні отримання АРТ контагіозність ВІЛ-інфікованих осіб зменшується. В спостереженнях дискордантних пар при отриманні АРТ ВІЛ-позитивною особою статева передача ВІЛ не спостерігалася, при умові застосування презервативів, виключення сексуальних ризиків [126, 144, 241].
Таким чином, раннє виявлення уражень шкіри та ІПСШ у пацієнтів з уразливих груп, ефективна діагностика та своєчасне лікування, можуть сприяти зниженню поширення ВІЛ-інфекції,чим призводити до стримування епідемії.
1.8 Фактори, що підвищують ризик зараження та передачі інфекцій, що передаються статевим шляхом, та ВІЛ
В світі зростання захворюваності на ІПСШ та ВІЛ значною мірою обумовлене поширенням практики ризикованої сексуальної поведінки [28].
Головні гаранти безпечного сексу – постійний статевий партнер і використання презервативу при кожному статевому контакті. Згідно даних опитувань, більшість респондентів з різних верств населення вказали, що не використовують презерватив у відносинах з постійними партнерами, а третина з них – ніколи в сексуальних контактах з випадковими партнерами. Потрібна просвіта щодо правильного користування та зберігання презервативів та любрикантів [51, 176].
Презерватив – найбільш ефективний та доступний засіб щодо зниження передачі ВІЛ та ІПСШ. Дослідження серед дискордантних гетеросексуальних пар свідчать, що правильне та постійне використання презервативів значно знижує ризик передачі ВІЛ як від чоловіка жінці, так й навпаки [176].
Згідно даних епідеміологічного нагляду по розповсюдженню ВІЛ-інфекції в світі, основним чинником поширення є незахищений секс. Значну роль в розповсюдженні ВІЛ-інфекції відіграє поширення через незахищені гомосексуальні контакти, зокрема між чоловіками. За даними спостережень, в США гомосексуалісти складають 57% вперше інфікованих ВІЛ осіб [233].
У Вірменії серед жінок комерційного сексу (ЖКС) виявлено низький рівень знань з профілактики ВІЛ-інфікування та прихильності до використання презервативів. Дані факти негативно впливають на поширення серед жінок та їх клієнтів ВІЛ-інфекції [87].
Більш часте використання презервативів одночасно з пізнішим початком статевого життя та скороченням кількості сексуальних партнерів стало важливим фактором щодо зменшення поширеності ВІЛ в Уганді. Пропаганда використання презервативів успішно сприяла встановленню стійкого контролю над епідемією в Бразилії [176].
У Таїланді пропаганда дестигматизації презервативів, їх використання серед ЖКС та їх клієнтів привели до зменшення кількості випадків ВІЛ-інфекції у цих групах, тим самим допомогли знизити поширеність епідемії серед всього населення. В Камбоджі подібна акція допомогла значно знизити поширеність ВІЛ-інфекції серед ЖКС та стабілізувати рівень національних показників [176].
Використання жіночих презервативів також в значній мірі позитивно впливає на обмеження поширення ІПСШ та ВІЛ, небажаної вагітності. Результати спостережень свідчать про зацікавленість жінок в застосуванні фемідому не залежно від приналежності до групи населення. Але все ж частіше засіб застосовувався серед представниць уразливих груп [219].
Користувачі відмічали задоволеність безпечністю сексу, зручністю у використанні, можливістю особистого застосування, без втручання клієнта, тим самим впливом на безпечність сексу та полегшенням ситуації з переговорів з клієнтом щодо обов’язкового застосування презервативу під час сексуального контакту. Фемідом ефективно застосовувався також при рецептивних анальних контактах, про що повідомляли жінки та чоловіки з групи ЧСЧ [127, 197].
Враховуючи гарні профілактичні та бар’єрні характеристики фемідому, в теперішній час проводять розробку та апробацію нових, ще більш зручних та ефективних форм засобу [145, 219].
На можливість інфікування ІПСШ та ВІЛ статевим шляхом впливають стилі сексуального життя та форми активності (сексуальні техніки). Техніки, під час яких не відбувається пошкодження цілісності шкіри та слизових, а також контакту з виділеннями, можна визнати безпечними [207].
Згідно даних спостережень, спостерігається зміна сексуальної поведінки населення. Все більша кількість осіб практикують більш ризиковані сексуальні контакти, в тому числі анальні.
В дослідженні більшість (близько 75 %) опитуваних з 192 осіб практикували одночасно різні види сексу під час одного статевого контакту та лише низький відсоток респондентів (майже 30 %) застосовував при цьому презервативи [216].
Ризик інфікування хламідіозом та гонореєю варіює в залежності від причини виникнення незахищеного анального сексу та інших супутніх факторів, збільшуючись у разі небезпечної сексуальної поведінки [147].
Серед 2084 обстежених жінок, які мали вагінальні та анальні статеві контакти при обстеженні на гонорею та хламідіоз, в 12 % випадків виявляли урогенітальний та в 14,6 % ректальний хламідіоз, в 3,3 % та 3 % урогенітальну та ректальну гонорею. Причому близько 25 % та 19 % обстежених осіб мали лише ректальний хламідіоз та гонорею [223].
У разі випадкових сексуальних контактів підвищується ймовірність зараження ІПСШ, а при анальному сексі ризик значно зростає [177].
Бісексуальність також є фактором ризику щодо зараження та передачі ВІЛ статевим шляхом. Серед 1150 опитуваних чоловіків близько 80 % респондентів вказували на наявність сексуальних партнерів обох статей, мали більше 10 партнерів протягом року, що передував зараженню ВІЛ, або мали також бісексуальних партнерів. Виявлено, що ці особи знаходилися в центрі сексуальної соціальної сіті ВІЛ-позитивних осіб [203].
Проведені ретроспективні та когортні дослідження свідчать, що особи, які мають одностатеві та бісексуальні контакти, частіше ніж гетеросексуальні люди мають численних статевих партнерів, ризиковані статеві контакти, різноманітні психологічні проблеми, психоневрологічні розлади, такі як депресія, неврози, біполярні розлади, досвід спроб суїциду [242].
При обстеженні жінок, які мають одностатеві та бісексуальні контакти, в 1,5 рази частіше виявляють наявні ІПСШ (ВПЛ, ВПГ, запальні процеси органів малого тазу, бактеріальний вагіноз) та вказують на перенесені ІПСШ в минулому [240].
Вживання психоактивних речовин (алкоголю, наркотиків) збільшує ризик виникнення ризикованої сексуальної поведінки, тобто випадкових сексуальних контактів, більш ризикованих та травматичних видів сексу, незастосовування бар’єрних методів захисту та профілактики ІПСШ [113, 235].
Часте явище серед представників уразливих груп – надання сексуальних послуг з метою отримання грошей або в обмін на наркотики [235].
Психоактивні речовини можуть впливати:
• на сексуальну активність та здатність, фізіологічні реакції організму, пов’язані із сексуальністю;
• на пізнавальну, емоційну сфери, на прийняття рішень у питаннях, пов’язаних з сексуальною поведінкою, в тому числі зниження контролю;
• на соціальну поведінку, оскільки ситуації, пов’язані з вживанням речовин, можуть створювати можливості ризикованої сексуальної поведінки, а також сприяти виникненню сексуального проміскуїтету, проституції [113].
Дія наркотиків також на сферу сексуальної поведінки може бути пов’язана з хімічними факторами. Підвищення ризиків може бути обумовлено видом спожитої речовини (опіати, стимулятори, галюциногени, інші), розміром дози та чи була вона з чим-небудь змішаною, а також способом вживання (паління, ін’єкція, вдихання) [113].
З досліджень, що стосуються поведінки наркозалежних, випливає, що велика частина цих осіб неохоче вдається до використання презервативу. Причинами цього є залежність, іноді вплив самого наркотику, який може збільшувати сексуальне збудження і бажання реалізувати його, навіть за рахунок власної безпеки та безпеки партнера. Деякі наркотичні речовини (зокрема опіати) або тривалий час вживання речовин можуть викликати ослаблення потенції і ерекції. Застосування в такій ситуації презервативу неефективне або неможливе [28, 113, 223].
Більшість осіб, що вживають психоактивні речовини, – молоді люди репродуктивного віку, як і їх статеві партнери. Статеві партнери можуть не бути наркоманами, але їх ризик інфікування ІПСШ та ВІЛ значно вищий, ніж у представників загального населення [43, 149, 227].
Згідно даних спостережень, у жінок СІН (метамфетаміну) порівняно з жінками, які не вживають наркотики, в 10 разів частіше виявлявся партнер СІН. Ці жінки часто вступали в сексуальні стосунки з колишніми ув’язненими, випадковими партнерами, трансгендерами. У даної категорії жінок в 1,45 разів частіше виявляли ІПСШ [204].
За даними дослідників, у жінок 25 років та молодше, ректальні інфекції виявлялися частіше у випадках, коли статевий партнер був СІН, (46,5 % проти 15,5 %), або в разі сексу з ВІЛ-позитивним партнером (66,7 % проти 15,8 %) та у випадках, коли жінки були СІН (10,6 % проти 5,8 %) [223].
Спостереження свідчать, що рівні інфікування ІПСШ й ВІЛ, число сексуальних партнерів у жінок РКС, пов’язане зі специфікою роботи, багаторазово перевищує показники жінок, які не мають відношення до секс-бізнесу. Середнє число статевих партнерів за рік в середньому становить для РКС 295, проти 5,8 – дані жінок, які не працюють у цій сфері. Якщо врахувати, що з 10 статевих контактів презерватив в середньому використовується в 6,9 випадках, то стає зрозуміло, що близько 100 статевих контактів на рік у РКС являються незахищеними, що представляє широке поле для інфікування ІПСШ [25, 28, 49, 51].
РКС часто є стигматизованим та дискримінованим прошарком популяції. Згідно даних спостережень, ВІЛ-позитивні особи зустрічаються серед групи РКС в 14 разів частіше, ніж серед інших жінок в країнах з низьким та середнім рівнем економіки [205].
У Казахстані поширеність ВІЛ серед РКС складає 2,5%, в окремих регіонах сягає 8,5% При цьому 7% жінок секс-бізнесу вживає ін’єкційні наркотики [13].
Серед РКС в Московській області Російської Федерації спостерігалося зростання поширення ІПСШ (до 57 %) та ВІЛ при високому рівні небезпечної сексуальної поведінки [11].
У своїй діяльності РКС часто стикаються з різноманітними проблемами. Негативно на якість життя впливають фізичні фактори (сексуальне насильство, інші небажані події), соціальні (низький рівень соціальної підтримки, можливості використання презервативів, чому сприяє обмеженість навичок ведення переговорів з клієнтом), економічні (незахищений секс з метою отримання більшої кількості грошей) [51, 205].
Дані свідчать, що взаємодія між двома або більше факторами в несприятливих умовах, пов’язаних з фізичними, соціальними та економічними проблемами, підвищує ризик незахищеного сексу серед РКС. За даними спостереження, серед 610 РКС в Непалі показник поширеності ВІЛ становив 1%. Встановлена значна (24%) поширеність незахищеного сексу. На рішення щодо використання презервативу впливали несприятливі фактори (фізичні, соціальні, економічні). Ймовірність відмови від використання презервативів з клієнтами істотно збільшувалася при одночасному співіснуванні проблем: одна проблема – 12 %, дві проблеми – 19 %, три – п’ять проблем – 38 % [205].
Сфера секс-бізнесу часто пов’язана з вживанням алкоголю і наркотиків, які послаблюють стримуючі чинники і пов’язане з більш високим рівнем захворюваності ІПСШ. Даний факт обумовлений відмовою від використання або неправильним використанням презервативів. Також дія речовин збільшує тривалість контакту, сприяючи появі більшого числа ушкоджень слизової геніталій, а тим самим зараженню ІПСШ та ВІЛ [49].
Вживання алкоголю і наркотиків є для РКС доступним і прийнятним засобом психологічного захисту. За даними спостережень, 30 % РКС вживають алкоголь щодня, ще стільки ж – 1-3 рази на тиждень. Систематично споживає наркотики кожна десята, несистематично – кожна третя [51].
РКС що працюють на вулиці, є найбільш незахищеною групою. За даними спостережень близько 90 % вуличних РКС є СІН. Вуличні секс-працівниці, які одночасно є СІН, схильні до більшого ризику інфікування ІПСШ та ВІЛ. Кожна жінка має приблизно по 4-5 контактів на день. Це визначає їх роль в поширенні ІПСШ та ВІЛ серед чоловіків – споживачів комерційних секс-послуг [28].
1.9 Особливості консультування представників уразливих груп
В заходах, спрямованих на попередження поширення ІПСШ, дуже важливе використання різних методів інформування населення, підтримка зусиль, спрямованих на зміни моделі поведінки. Особливо важливо це в роботі з групами підвищеного поведінкового ризику [25, 30, 49, 260].
Під час консультування пацієнтів з приводу ІПСШ слід надавати інформацію про основні ІПСШ та методи тестування коротко та зрозуміло. Необхідно проводити просвітницьку роботу щоб сягнути поведінкових змін у певній групі. Основна мета просвіти – підвищити рівень знань, змінити ставлення до життя через надання інформації для вмотивованого, осмисленого переходу осіб цільової групи до здорової поведінки [49].
Важливо сприяти поширенню інформації щодо правильного використання презервативів, оволодіння необхідними навичками та усвідомленню загрози зараження та передачі ІПСШ при відсутності профілактичного заходу. Також пропаганда презервативів повинна сприяти подоланню соціальних та особистих бар’єрів щодо їх використання [153].
Мотивами, підтверджуючим необхідність інформування та просвіти з питань безпечної сексуальної поведінки осіб з груп ризику, особливо СІН, є можливість зараження ІПСШ та ВІЛ особисто, вертикальна передача інфекцій, ризики інфікування дитини під час пологів, виникнення небажаної вагітності [25, 51, 113].
Основною метою роботи з РКС є їх мотивація до менш ризикованої поведінки, пов’язаної як з їх роботою, так і з вживанням наркотиків [113, 260].
При роботі з особами, що належать до уразливих груп, з приводу зміни їх ризикованої поведінки в бік більш безпечної, доцільно застосовувати прийоми мотиваційного консультування. Мета цього заходу – мотивувати приймати рішення щодо зміни свого способу життя на більш безпечний і конструктивний [70, 77, 102, 113, 260].
Завданнями мотиваційного консультування є допомогти пацієнту проаналізувати свою поведінку, визначитися, чи готовий він щось змінити у своїй поведінці та яким чином можна і потрібно діяти, втілюючи в життя заплановані зміни [59, 62, 75, 76].
* * *
Таким чином, в результаті проведеного огляду встановлено, що дані поширення ВІЛ-інфекції продовжують щорічно зростати. Спостерігається територіальна нерівномірність поширення ВІЛ в різних областях України.
Статевий шлях є основним механізмом передачи ВІЛ-інфекції. Відзначається щорічне збільшення даних.
ВІЛ-інфекція поширена серед різних соціальних груп населення, але найбільша концентрація ІПСШ та ВІЛ залишається в групах ризику.
ІПСШ є ко-фактором зараження ВІЛ. Значне поширення ІПСШ, негативний вплив на репродуктивне здоров’я населення є актуальною медичною та соціально-економічною проблемою. Ці факти обумовлюють дослідження сучасних характеристик інфекцій, а саме визначення найчастіше зустрічаємих асоціацій збудників, спектру ускладнень, уточнення гендерних відмін. Результати спостережень демонструють необхідність моніторингу рівня резистентності етіологічних агентів запальних захворювань сечостатевої системи до антибактеріальних препаратів.
Особливості перебігу ІПСШ та їх наслідки багато в чому визначаються імунологічних станом організму. Відображенням імунологічного статусу є показники системного та локального імунітету. Особливої важливості набуває вивчення механізмів функціонування захисних систем організму, і в першу чергу – системи локального імунітету слизових, який є основним бар’єром на шляху інфекційних агентів. Доцільно провести дослідження локального імунітету у осіб з загальної популяції та груп ризику, ВІЛ-інфікованих пацієнтів з ІПСШ.
Ураження шкіри та/або ІПСШ можуть бути першою причиною звернення інфікованих ВІЛ за медичною допомогою до медичних закладів різного профілю. Тому важливо визначити вплив ІПСШ та дерматологічної патології на стан загального імунітету ВІЛ-позитивних осіб.
Доцільно визначити ефективність швидких тестів для діагностики ІПСШ в різних верствах населення. Запропонувати ефективні схеми лікування ІПСШ з урахуванням міжнародного досвіду.
У зв’язку з тим, що останнім часом відзначається значне зростання кількості звернень в клініки з приводу ВПЛ, є доцільним використовувати амбулаторні методи лікування, знизити кількості візитів до лікаря. Особливої уваги заслуговують методи лікування, що мінімізують травматизацію тканин та сприяють тривалій ремісії з низьким рівнем рецидивів, особливо у випадках надання допомоги ВІЛ-позитивним особам.
На даний час відсутні вітчизняні керівництва з надання консультативної, лікувально-діагностичної та профілактичної допомоги особам з ІПСШ. Необхідно проводити розробку подібних методологічних документів з урахуванням відмін між уразливим групами та загальною популяцією, які необхідно визначити.
З метою доступу до лікувально-діагностичної допомоги широкого загалу представників уразливих груп доцільно налагодити міжвідомчу взаємодію між службами. Необхідно полегшити доступ до методологічної інформації фахівців, які надають допомогу уразливим верстам населення.
Перераховані заходи сприятимуть зниженню поширення ВІЛ-інфекції в популяції, а тим самим призводити до стримування епідемії.
Публікації:
1. Методы диагностики и лечения поражений кожи, вызванных вирусом папилломы человека / Г.И. Мавров, Ю.В. Щербакова, Г.П. Чинов, А.Е. Нагорный // Дерматологія та венерологія. – 2010. – №2. – С. 49-62.
2. Урогенитальный трихомоноз: новые возможности топической иммуномодулирующей терапии / Г.И. Мавров, Г.М. Бондаренко, Л.В. Иващенко, И.Н. Никитенко, Ю.В. Щербакова // Дерматологія та венерологія. – 2011. – № 3 (53). – С 69-77.
3. Клинико-эпидемиологические особенности урогенитального хламидиоза на современном этапе / Г.И. Мавров, Л.В. Иващенко, Ю.В. Щербакова, К.С. Орлова // Дерматологія та венерологія. – 2014. – № 1 (63). – С. 59-68.
4. 8. Опыт применения местных средств в лечении урогенитального трихомоноза / Г.М. Бондаренко, Ю.В. Щербакова, И.Н. Никитенко, В.Б. Чирва // Репродуктивная эндокринология. – 2014. – № 2 (16). – С. 49-55.
5. Перинатальные риски: трихомоноз новорожденных / Г.М. Бондаренко, Т.В. Осинская, С.В. Унучко, Т.В. Губенко, С.К. Джораева, Н.В. Кочетова, Т.В. Федорович, Ю.В. Щербакова // Дерматологія та венерологія. – 2015. – № 1 (67). – С. 27–33.
6. Современные представления о серологической резистентности при сифилисе (обзор литературы) / Г.М. Бондаренко, А.А. Безрученко, И.Н. Никитенко, В.В. Кутовая, Ю.В. Щербакова, Т.В. Губенко // Дерматологія та венерологія. – 2015. – № 4 (70). – С. 5-16.
7. Бондаренко Г.М. Особенности лечения резистентного трихомоноза / Г.М. Бондаренко, И.Н. Никитенко, Ю.В. Щербакова // Український журнал дерматології, венерології, косметології. – 2016. – № 2 (61). – С. 79-84.
РОЗДІЛ 2
Матеріали та методи
2.1 Статистичні та соціологічні дані
Були проаналізовані звіти, бюлетені, статистичні дані захворюваності на ІПСШ в Україні та світі за 2000-2016 роки. Вивчалися дані Інформаційних бюлетеней «ВІЛ-інфекція в Україні», показники лікувально-профілактичної допомоги хворим шкірними і венеричними захворюваннями в Україні Центру медичної статистики МОЗ України, Бюлетені Українського центру профілактики та боротьби зі СНІДом МОЗ України, дані звітів та доповідей ВООЗ, ЮНЕЙДС [15–22, 25–27, 80–86, 175, 244, 260, 261, 272].
Здійснено пошук літератури, виданої з 2000 по 2016 роки, через портали «PubMed/MEDLINE», «National Center for Biotechnology Information, U.S. National Library of Medicine», «Наукова електрона бібліотека eLIBRARY.RU і «Російський індекс наукового цитування (РІНЦ)». Були розглянуті публікації та тези на англійській, український та російській мовах. Був проведений пошук всіх записів за темою дослідження, з використанням бібліотеки Cochrane.
2.2 Групи осіб, які перебували під спостереженням
За період з 2011 по 2016 роки під спостереженням перебувало загалом 4935 осіб. Всього в дослідження включено 4 групи спостереження, сформовані згідно поставлених цілей та завдань дисертаційного дослідження.
Всі пацієнти, які проходили клініко-лабораторне обстеження, консультування, анкетування, лікування, були розподілені на 3 групи. До групи 1 увійшли представники загальної популяції – 3957 осіб.
Групу 2 склали представники уразливих щодо зараження ІПСШ та ВІЛ верств населення (СІН, РКС, ЧСЧ, інші) – 592 особи.
До групи 3 увійшли 102 практично здорових особи (контрольна група).
Фахівці, анкетування яких проводилося, а саме 332 медичні та соціальні працівники, що надавали лікувально-діагностичну та консультативну допомогу представникам уразливих груп населення, склали окрему групу 4.
Кожна з досліджуваних груп була розподілена на кілька підгруп для проведення порівняльного аналізу різних даних, згідно сформульованих завдань дослідження. Кількісний склад цих підгруп частково перекривається, тобто одні й ті ж особи могли бути включені в дві і більше підгрупи, в залежності від часу проведення дослідження та характеру інформації, що аналізується. Основні групи та групи порівняння формувалися за методом рандомізації. За клінічними, анамнестичними та демографічними показниками порівнювані групи статистично не відрізнялися.
Клінічні та лабораторні дослідження проводили в ДУ «Інститут дерматології та венерології НАМН України» (Харків) та в Харківському КЗ “Обласний центр СНІДу”.
Всі дослідження виконувались відповідно до існуючих регламентуючих документів [56, 64- 69, 71, 73, 74, 89, 88, 90, 91, 94, 112, 118] та інструкцій виробників тест-систем.
З метою вивчення особливостей розповсюдженості ІПСШ серед представників уразливих груп населення в різних регіонах України проведений ретроспективний аналіз даних обстеження швидкими тестами (ІХГ швидкі тести CITO-TEST, Pharmasco) представників різних уразливих груп (СІН, РКС, ЧСЧ, інші) та їх статевих партнерів за період 2011-2016 роки. Проводилося обстеження на наявність інфекцій, що передаються переважно статевим шляхом (сифіліс, гонорея, хламідіоз, ВІЛ, гепатит В, гепатит С) в неурядових організаціях (НУО) різних регіонів України – містах Харків, Полтава, Слов’янськ, Ужгороді.
Аналіз даних по регіонах відбувався наступної кількості тестувань в уразливих групах: Харків – 16795, Полтава – 14541, Закарпатська область – 3260, Слов’янськ – 16069. Дані наведені в таблиці 2.1.
Також проводився аналіз даних за 2011-2015 роки, отриманих з Центрів СНІДу Харківської та Закарпатської області. Оцінювалися патології, в тому числі ІПСШ, з приводу яких отримували лікування представники уразливих груп населення в Харківському КЗ “Обласний центр СНІДу” та Закарпатському центру СНІДу.
З метою вивчення особливостей розповсюдженості ІПСШ серед представників загальної популяції та уразливих груп було проаналізовано клініко-епідеміологічні, анамнестичні та дані лабораторного обстеження пацієнтів.
Також з метою визначення соціальних та поведінкових відмін між ВІЛ-негативними та ВІЛ-позитивними представниками уразливих груп проводилося опитування респондентів щодо належності до окремої групи ризику (РКС, СІН, ЧСЧ), наявності сексуальних ризиків.
Таблиця 2.1 – Кількість проведених обстежень швидкими тестами на ІПСШ за 2011-2016 роки, по регіонах України, абсолютні числа
| МБФ «Благо», Харків | Слов’янська міська ГО “Наша допомога” | ПОБФ “Громадське здоров’я”, Полтава | Закарпатський обласний Центр з профілактики та боротьби зі СНІДом, ОКШВД | Всього | |
| ВІЛ | 10610 | 9971 | 5386 | 1261 | 27228 |
| Сифіліс | 1834 | 1133 | 3786 | 541 | 7294 |
| Хламідіоз | 850 | 718 | 89 | 250 | 1677 |
| Гонорея | 850 | 776 | 89 | 234 | 1149 |
| Гепатит В | 891 | 1271 | 2516 | 495 | 5173 |
| Гепатит С | 1760 | 2200 | 2675 | 479 | 7114 |
З метою проведення порівняльного аналізу соціальних та епідеміологічних особливостей різних груп населення [загальна популяція (підгрупа 1.1, 495 осіб) та уразливі групи (підгрупа 2.1, 65 осіб)] для порівняння груп та всередині групи ризику обчислювалися коефіцієнти кореляції Кенделла і Спірмена.
У дослідження увійшли загалом 650 осіб з різних верств населення, які потім були розподілені на дві підгрупи. До підгрупи 1.1 увійшли 495 осіб, які отримували лікувально-діагностичну допомогу в ДУ «ІДВ НАМНУ». Більшість осіб підгрупи 1.1 склали жінки – 274 (55,3 %). Чоловіків серед пацієнтів цієї підгрупи було 221 (44,7 %). Середній вік пацієнтів склав (32,8 ± 0,5) роки.
Пацієнти з загальної популяції проходили обстеження на наявність таких ІПСШ, як хламідіоз, уреаплазмоз, мікоплазмоз, трихомоноз, ВПЛ, а також вірусних інфекцій (гепатит В, гепатит С, ЦМВ, вірус Епштейна-Барр (ВЕБ), ВІЛ, ВПЛ, ВПГ). Дослідження проводили з використанням методів ПЛР, ІФА, бактеріоскопічного та бактеріологічного методів діагностики.
Підгрупу 2.1 склали 65 осіб, що належали до груп ризику. До підгрупи 2.1а увійшли 25 пацієнтів з ВІЛ-позитивним статусом. Підгрупа 2.1б складалася з 40 ВІЛ-негативних осіб.
Більшість підгрупи 2.1 склали жінки – 52 ([80,0 ± 4,9] %). Чоловіків серед пацієнтів цієї підгрупи було 13 ([20,0 ± 4,9] %). Середній вік пацієнтів становив (26,7 ± 1,6) року.
Дані анамнезу та клінічні прояви захворювань визначали спектр лабораторної діагностики збудників захворювань, що передаються статевим шляхом, який включав обстеження на наявність Neisseria gonorrhoeae, Chlamydia trachomatis, Virus Herpes simplex, Trichomonas vaginalis, Ureaplasma urealyticum, Treponema pallidum, ВІЛ. Заключний діагноз встановлювали на основі даних анамнезу, клінічних даних, результатів комплексного лабораторного обстеження. Для діагностики ІПСШ застосовували загальноприйнятні методи діагностики (ПЛР, ІФА, бактеріоскопічний, бактеріологічний, швидкі тести).
З метою визначення інформованості осіб з різних верств населення, поведінкових та соціальних відмінностей було проведено порівняльний аналіз рівня інформованості загального та уразливих груп населення щодо ризиків передачі та інфікування ІПСШ та ВІЛ та оцінка зв’язку приналежності до груп ризику та небезпечної сексуальної поведінки. Анкетування проведено з використанням розроблених форм (додатки Г, Д, Е).
Під спостереженням перебувало 165 осіб з ІПСШ, які належали до різних верств населення – загальна популяція та уразливі, щодо інфікування групи (РКС, СІН, ЧСЧ). Проаналізовано дані 117 осіб, що належать до загального населення, які увійшли до підгрупи 1.2, та 48 представників уразливих груп, які склали підгрупу 2.2.
Було розроблено три анкети, дві з яких заповнював респондент, в одну заносив інформацію лікар. Анкета включала лише два варіанта відповіді – «так» або «ні».
Опитування респондентів відбувалося щодо соціального та сімейного статусу, сексуального анамнезу (потреба в сексуальних контактах, характерна сексуальна активність, сексуальні практики, кількість статевих партнерів, мотиви першого статевого зв’язку), наявність ризикованої сексуальний поведінки (сексуальні контакти в першу добу знайомства, практика випадкових статевих контактів та незахищеного сексу, наявність позашлюбних контактів та причини їх виникнення,
Оцінювалося ставлення до проституції, вживання наркотичних речовин, алкоголю, практика вживання психоактивних речовин та надавання сексуальних послуг за винагороду, а також належність до уразливих груп особисто та осіб з близького оточення.
Своєчасність звертання до фахівця за лікувально-діагностичною допомогою та практики самолікування, обстеження на ІПСШ та ВІЛ, визначення джерел отримання інформації та обізнаності щодо шляхів зараження, передачі ІПСШ, та їх наслідків для репродуктивного здоров’я, методів профілактики інфікування, встановлення джерела зараження, використання засобів профілактики ІПСШ,
Фахівцем оцінювався фон настрою пацієнта, наявність психоневрологічної патології, її проявів, особливості емоційного стану, супутня інша соматична патологія.
Всі пацієнти проходили обстеження на ІПСШ: трихомоноз, мікоплазмоз, хламідіоз, сифіліс, герпес, гепатити В та С, ВІЛ за загальноприйнятими методиками.
З метою визначення рівня інформованості щодо питань ІПСШ та ВІЛ групи РКС та визначення ефективності проведення мотиваційного консультування проведено анкетування 210 осіб, що належали до групи РКС та увійшли до підгрупи 2.3.
Під час проведення консультування представникам уразливих груп була надана інформація щодо контагіозності ІПСШ, ймовірності зараження та їх передачі статевим шляхом, вертикальної трансмісії. Доводилася доцільність використання бар’єрних засобів контрацепції при всіх видах сексуальних контактів на протягом всього акту. Також проводилася оцінка усвідомленості застосування презервативів, їх використання при різних видах сексуальних контактів, та доцільності проходження періодичного обстеження на наявність ІПСШ.
При анкетуванні респондентам було запропоновано обрати вірну відповідь з наданих або зазначити, що важко відповісти. Анкетування проводилося до та після інформування респондентів.
Анкета включала питання щодо основних шляхів передачі ІПСШ, симптомів та контагіозності захворювань, видів сексуальних контактів, які сприяють передачі інфекцій, визначення захворювань, при яких з’являються виразки на геніталіях, негативних наслідків для стану здоров’я, шляхів передачі ВІЛ та ймовірність інфікування під час “періоду сероконверсійного вікна”, гендерних ризиків зараження ВІЛ та впливу ІПСШ на ризик інфікування ВІЛ.
З метою оцінки впливу хронічних дерматозів та ІПСШ на стан імунітету у осіб з ВІЛ-інфекцією, а також зміни важкості стану ВІЛ-позитивних осіб після лікування дерматовенерологічної патології було проведено наступне дослідження. Під спостереженням знаходилися 80 осіб – пацієнти, які зверталися за лікувально-діагностичною допомогою у ДУ «Інститут дерматології та венерології НАМН України» та КЗОЗ «Обласний центр профілактики та боротьби зі СНІДом» (м. Харків) та практично здорові донори. Згідно поставлених завдань пацієнти були розподілені на підгрупи.
До підгруп 2.4 і 2.5 увійшли 50 ВІЛ-позитивних пацієнтів у віці від 19 до 64 років. Більшість склали жінки – 26 пацієнток ([52,0 ± 7,1] %), чоловіки – 24 особи ([48,0 ± 7,1] %). Середній вік пацієнтів сягав (36,5 ± 1,0) року. Жителі міста представляли більшість обстежених – 90,0%.
До підгрупи 2.4 увійшли 23 пацієнти з дерматологічними захворюваннями, до підгрупи 2.5 – 27 хворих, у яких було діагностовано різноманітні ІПСШ. Всі пацієнти отримували АРТ (у вигляді комбінації препаратів [тенвір, алувія, комбівудин, невірапін, ламівудин, ківекса, трувада, віролам]). При аналізі хворих підгруп 2.4 і 2.5 можна відзначити, що особи, які належали до групи пацієнтів з дерматологічною патологією склали (46,0 ± 7,1) %, з ІПСШ – (54,0 ± 7,1) %. Середній вік хворих склав (39,8±1,7) року.
До підгрупи порівняння (підгрупа 3.1) були включені 30 осіб – умовно-здорових осіб (19 жінок та 11 чоловіків). Середній вік пацієнтів склав (37,7±1,2) року.
При обстеженні осіб визначалася загальна кількість лімфоцитів у периферичній крові, а також абсолютну та відносну кількість CD3+, CD4+, CD8+ лімфоцитів, також вірусне навантаження – до і після курсів терапії, що згідно з виділеною патологією проводили у ВІЛ-позитивних осіб.
Для порівняння груп та всередині групи ризику обчислювалися коефіцієнти кореляції Кенделла і Спірмена, визначенням достовірності показників.
Моніторинг стану системи клітинного імунітету проводився методом імунофенотипування з використанням специфічних моноклональних антитіл до поверхневих молекул CD3, CD4, CD8.
Матеріалом для дослідження слугувала венозна кров. Показники в дослідженні вимірювалися методом проточної цитофлюориметрії.
Дослідження виконувалося з використанням тест-систем та обладнання Бекмен-Культер, США (Beckman Coulter, USA) згідно інструкцій виробника.
Визначення вірусного навантаження проводилося з використанням тест-системи імуноферментної для кількісного визначення і підтвердження антигену р24 ВІЛ-1 «DIA®-HIV-p24» фірми ПрАТ «НВК ДІАПРОФ-МЕД», Україна.
Дані анамнезу та клінічні прояви захворювань визначали спектр лабораторної діагностики збудників ІПСШ, який включав обстеження на наявність Neisseria gonorrhoeae, Chlamydia trachomatis, Virus Herpes simplex, Trichomonas vaginalis, Ureaplasma urealyticum, Treponema pallidum. Заключний діагноз встановлювали на основі даних анамнезу, клінічних даних, результатів комплексного лабораторного обстеження. Для діагностики ІПСШ застосовували загальноприйнятні методи діагностики (ПЛР, ІФА, бактеріоскопічний, бактеріологічний, швидкі тести). Також визначали наявність супутньої соматичної патології.
З метою вивчення стану місцевого імунітету проводилося визначення вмісту sIg A на слизових оболонках уретри та піхви у хворих на ІПСШ з різних груп населення. Обстеження пройшла 121 особа, які належали до загальної популяції та уразливих, щодо зараження ІПСШ та ВІЛ груп населення. Обстежених осіб було розподілено на 4 підгрупи. До підгрупи 1.3 увійшли 40 пацієнтів з ІПСШ з загальної популяції. До підгрупи 2.1а увійшли 25 хворих з ІПСШ та ВІЛ-позитивним статусом, які відносяться до уразливих груп. До підгрупи 2.1б включені пацієнти (40 осіб) з ІПСШ та ВІЛ-негативним статусом, що належать до уразливих груп. Підгрупу 3.2 склали практично здорові донори (16 осіб).
Більшість представників уразливих груп склали жінки – 52 ([80,0 ± 5,0] %). Чоловіків серед пацієнтів групи спостереження було 13 ([20,0 ± 5,0] %). Середній вік пацієнтів склав (26,7 ± 1,6) року.
Пацієнти проходили обстеження на наявність таких ІПСШ, як хламідіоз, уреаплазмоз, мікоплазмоз, сифіліс, трихомоноз, ВПЛ, а також вірусних інфекцій (ЦМВ, ВІЛ, ВПГ). Дослідження проводили з використанням методів ПЛР, ІФА, бактеріоскопічного та бактеріологічного методів діагностики.
Вміст sIgА на слизових оболонках уретри та вагіни визначали методом ІФА з використанням тест-систем «sIg А» – ІФА – Бест СТРИП »ЗАТ« Вектор-Бест». Розрахунок sIgА справляли на 1 г загального білка, визначеного біуретовою реакцією, у зв’язку з можливістю значних похибок при відмірюванні необхідного обсягу відокремлюваного. Всі основні розрахунки і аналіз цифрових даних виконували з використанням набору стандартних комп’ютерних програм. Визначали середні арифметичні величини, стандартні відхилення і стандартні помилки середнього. Для виявлення статистичної значущості відмінностей використовували параметричні і непараметричні методи з обчисленням t-критеріїв Ст’юдента.
З метою оцінки чутливості збудників захворювань урогенітального тракту до антибактеріальних препаратів та визначення складу біотопу у пацієнтів з ІПСШ з різних груп населення проведено клініко-лабораторний моніторинг етіологічної структури збудників захворювань сечостатевого тракту та їх чутливості до лікарських засобів у осіб репродуктивного віку з ІПСШ. В дослідження увійшли 1140 осіб, що належали до загальної популяції і увійшли до підгрупи 1.4, віком від 18 до 40 років (середній вік – (29,5±11,5) року). Більшість склали жінки – 604 особи (53 %), кількість чоловіків, які увійшли до цієї підгрупи, сягнула 47 % (536 осіб). Всі пацієнти отримували лікувально-діагностичну допомогу в ДУ «ІДВ НАМНУ» з приводу запальних захворювань сечостатевого тракту.
Також було проведено бактеріологічне дослідження стану вагінального біотопу жінок, що належали до уразливих груп населення (РКС та СІН). Усього було обстежено 48 осіб у віці від 18 років до 41, які сформували підгрупу 2.6. Середній вік пацієнток склав (29,5±11,5) року.
За допомогою методу бактеріоскопії (світлова мікроскопія препаратів, забарвлених 1% розчином метиленового синього та за Грамом) проведено дослідження виділень з урогенітального тракту з метою діагностування бактеріального вагінозу, гонококової інфекції трихомонозу, а також стану мікроценозу нижніх відділів сечостатевого тракту.
За допомогою бактеріологічного методу проводили діагностику трихомонадної інфекції, уреаплазменої інфекції – з використанням ПЛР. Наявність хламідійної інфекції підтверджували методом прямої імунофлюоресцеції.
З використанням методів класичної бактеріології проводили вивчення мікробного складу урогенітального біотопу та визначення чутливості до антибактеріальних препаратів різних етіологічно значущих мікроорганізмів.
Для вивчення поширеності запальних захворювань органів малого тазу у пацієнтів з хронічними ІПСШ та визначення їх найбільш часто зустрічаємих клінічних проявів при моноінфекції та при мікст-інфікуванні проведено аналіз даних обстеження 1219 пацієнтів із запальними захворюваннями урогенітального тракту, які перебували на стаціонарному лікуванні у відділенні венерології в ДУ «Інститут дерматології та венерології НАМН України». Зазначені хворі склали підгрупу 1.5. Серед 1219 пацієнтів більшість ([55,5 ± 1,4] %) склали жінки – 677 пацієнток у віці від 18 до 51 року. У дослідження увійшло 542 чоловіки ([44,5 ± 1,4] %) віком від 20 до 57 років.
При мікробіологічному обстеженні проводили вивчення складу мікробного ценозу сечостатевого біотопу з використанням бактеріологічних досліджень. Клінічним матеріалом для дослідження слугували зішкряби та виділення з сечостатевих органів. Також методами бактеріоскопічного та бактеріологічного дослідження в клінічному матеріалі виявляли T. vaginalis. У всіх пацієнтів були виключені гонорейна інфекція та сифіліс, проведено обстеження на наявність хламідіозу, уреаплазмозу, мікоплазмозу із застосуванням загальноприйнятних методів діагностики.
Для визначення ефективності застосування бактеріоскопічного та бактеріологічного методів щодо виявлення збудників ІПСШ проведено аналіз даних бактеріоскопічного та бактеріологічного обстеження 388 осіб.
Визначали наявність ІПСШ в біологічному матеріалі, отриманому від осіб з загального населення та уразливих груп, що звернулися з різних приводів з метою обстеження до ДУ «ІДВ НАМНУ», та від пацієнтів з клінічними проявами урогенітальної інфекції та скаргами з загального населення, які знаходилися на стаціонарному лікування у відділенні венерології в ДУ «ІДВ НАМНУ».
Усі пацієнти були розподілені на три підгрупи (підгрупи 1.6, 1.7 і 2.6). Особи, що увійшли до підгруп 1.6 та 2.6, звернулися з метою обстеження на наявність ІПСШ з різних приводів – задля профілактичного обстеження, без скарг, перед плануванням вагітності, з періодично виникаючими скаргами та проявами (помірної інтенсивності) наявності ІПСШ, тощо.
До підгрупи 1.6 увійшли 196 пацієнтів обох статей, що відносяться до загального населення (112 жінок та 84 чоловіка – підгрупи 1.6а та 1.6б).
Підгрупу 2.6 склали 48 жінок, що належать до уразливих груп населення (РКС, СІН) віком від 18 років до 41, середній вік пацієнток склав (29,5±11,5) року.
У підгрупу 1.7 були включені 144 особи (загальна популяція) з наявними скаргами та вираженими клінічними проявами трихомонозу, які проходили лікування в ДУ «ІДВНАМНУ». Особи цієї підгрупи були розподілені за статтю (підгрупа 1.7а – 75 жінок та підгрупа 1.7б – 69 чоловіків). У дослідження увійшли пацієнти віком від 19 до 61 років. Середній вік хворих склав 40,0±21,0 роки.
Проводилося бактеріоскопічне та бактеріологічне дослідження зразків. У якості клінічного матеріалу для дослідження використовували клінічний матеріал від хворих, отриманий з різних ділянок сечостатевого тракту. Для проведення бактеріоскопічного дослідження предметні скельця з нанесеним клінічним матеріалом забарвлювали за Грамом та 1% розчином метиленового синього, при проведенні бактеріологічного дослідження застосовували поживне середовище на основі бульйону для трихомонад (HiMedia, Індія). Забір матеріалу для обох досліджень здійснювався одночасно разово, починаючи з культуральної проби.
Діагноз бактеріального вагінозу встановлювався при виявленні характерних «ключових клітин» у мазках і зішкребах, забарвлених за Грамом, і проведенні проби з 10 % КОН. Дослідження на урогенітальний кандидоз проводили за допомогою бактеріоскопічного (дослідження мазків, забарвлених за Грамом і Романовським-Гімзою).
Для визначення доцільності використання швидких тестів для діагностики сифілісу, рекомендацій щодо їх застосовування для різних верств населення проводили вивчення їх інформативності при діагностиці сифілісу, визначенні хибної позитивності та обстеженні пацієнтів соматичного стаціонару.
Було проведено тестування 662 осіб з різних контингентів населення, які пройшли обстеження на сифіліс. В дослідження увійшли представники різних груп населення, як загальної популяції, так і представники уразливих, щодо зараження ІПСШ та ВІЛ груп (РКС, СІН, ЧСЧ). Проведена порівняльна оцінка діагностичної ефективності застосування наступних методів: ІХГ аналіз, реакція швидкого визначення плазмових реагінів (РПР) (Rapid Plasma Reagin, RPR), ІФА, реакція пасивної гемаглютинації (РПГА), також комплекс стандартних серологічних реакцій (КСР), куди увійшли реакція мікропреципітації (РМП), реакція зв’язування комплементу з кардіоліпіновим (РЗКк) та трепонемним реагентом (РЗКт). При визначенні оптимальних швидких методів серодіагностики сифілісу, метод ІФА було обрано в якості стандарту, якому притаманні висока чутливість та специфічність.
Обстеження пройшли 337 хворих на сифіліс. У підгрупу 1.8 увійшли всього 284 особи. Підгрупу 1.8а склали 94 пацієнти з ранніми ([33,10±2,79] %), підгрупу 1.8б – 190 хворих з пізніми ([66,90±2,79] %) формами сифілісу. Також обстеження пройшли 53 вагітні (підгрупа 1.9). До підгрупи 1.9а увійшли 12 жінок ([22,64±5,75] %) з раннім, до підгрупи 1.9б – 41 пацієнтка ([77,36±5,75] %) з пізнім сифілісом.
Було обстежено 96 осіб з хибною позитивністю серологічних реакцій (підгрупа 1.10), серед яких було 52 вагітні жінки ([54,17±5,09] %), що склали підгрупу 1.10б. До підгрупи 1.10а увійшло 44 пацієнти із загального населення ([45,83±5,09] %).
Підгрупу порівняння (підгрупа 1.11) склали хворі з дерматологічною патологією – 173 особи. До підгрупи 3.3 (контрольна підгрупа) увійшли 56 здорових осіб.
З метою визначення ефективності застосування крему іміквімод 5 % в лікуванні гострокінцевих кондилом аногенітальної локалізації у ВІЛ-позитивних осіб було проведено наступне дослідження. Під спостереженням знаходилися 43 ВІЛ-позитивні особи з гострокінцевими кондиломами аногенітальної локалізації, які увійшли до підгрупи 2.7. Проводилося обстеження пацієнтів на наявність ІПСШ (сифіліс, трихомоноз, хламідіоз, гонорея, ВІЛ, гепатити, герпес, ВЕБ, ЦМВ тощо). Також проводилося мотиваційне консультування пацієнтів з метою визначення ризикованої статевої поведінки та зниження ризиків повторного інфікування.
Проведено оцінку стану імунітету у хворих з клінічними проявами ВПЛ шляхом визначення рівня CD4+ та вірусного навантаження.
Пацієнти були розподілені на дві підгрупи. До підгрупи 2.7а увійшли 22 ВІЛ-позитивні пацієнти з ВПЛ, які отримували в якості монотерапії крем, що містив іміквімод 5 %. Іміквімод-крем у пакетиках для одноразового застосування пацієнти застосовувався 3 рази на тиждень, наносився на кондиломи увечері за 8 годин (±2 години) перед сном, а на наступний ранок ділянка нанесення очищувалася водою і милом. Лікування тривало до повного регресу клінічних проявів (зникнення кондилом), але не довше 8 тижнів.
До підгрупи 2.7б (група порівняння) увійшли 21 ВІЛ-позитивний пацієнт з гострокінцевими кондиломами, в лікуванні яких застосовували методи абляційної терапії (кріодеструкція, електродеструкція).
Критеріями включення пацієнтів в дослідження були: письмова інформована згода пацієнта на участь в дослідженні; наявність зовнішніх гострокінцевих кондилом аногенітальної локалізації; максимальна висота одного елементу 1 см; максимальна площа ураження 20 см²; здатність пацієнта до адекватного співробітництва в процесі дослідження; відсутність уражень шкіри (подразнення, порушення цілісності, тощо) на ділянках нанесення препарату.
Критеріями виключення визначено: гіперчутливість до компонентів препарату; терапія засобом крем іміквімод 5 % в попередні 6 місяців; внутрішня локалізація гострокінцевих кондилом аногенітальної локалізації (уретра, піхва, шийка матки, анус); наявність патологічних станів: бовеноїдний папульоз, запальні ураження шкіри аногенітальної ділянки, автоімунні захворювання, онкологічні процеси, трансплантація органів в анамнезі; вагітність та період годування.

Рисунок 2.1 – Карта спостереження пацієнта з гострокінцевими кондиломами
Протягом лікування пацієнтів із гострокінцевими кондиломами проводилося їх клінічне спостереження. Оцінку ефективності проведеної терапії в обох підгрупах проводили через 1 та 3 місяці після лікування. Реєстрація побічних проявів при застосуванні методів терапії проводилася в обох підгрупах. Безпека застосування крему іміквімод проводилася на кожному візиті шляхом оцінки місцевих шкірних реакцій (еритема, набряк, ерозії, свербіж, печіння, біль) за шкалою від 0 до 3 (0 – ні, 1 – незначна, 2 – помірна, 3 – виражена). Спостереження проводилися протягом 8 тижнів із визначенням зміни кількості клінічних проявів захворювання на фоні лікування (на 20 %, 30 %, 50 %, 70 %, 100 %). Основним параметром ефективності лікування була відсутність гострокінцевих кондилом протягом всього періоду спостереження.
Всі пацієнти отримували лікування ІПСШ відповідно до встановленого діагнозу, а також АРТ.
Для визначення рівня інформованості щодо питань ІПСШ та ВІЛ та інформаційних потреб фахівців, які надають консультативну, лікувально-діагностичну, соціальну допомогу представникам уразливих груп населення було проведено анкетування 332 спеціалістів з використанням розроблених анкет. Серед фахівців, що працюють з пацієнтами з уразливих груп, були спеціалісти наркологічних закладів (лікарі-наркологи, медичні сестри), дерматовенерологи, сімейні лікарі, гінекологи, соціальні працівники (група 4).
Проаналізовано дані 32 анкет фахівців наркологічних закладів (підгрупа 4А), 67 дерматовенерологів (підгрупа 4Б), 154 сімейних лікарів (підгрупа 4В), 43 соціальних працівників (підгрупа 4Г), 36 акушерів та гінекологів (підгрупа 4Д).
Було запропоновано дати відповідь (обрати вірний варіант відповідей, які наведені в анкеті) на питання, пов’язані з ІПСШ. Визначалася інформованість фахівців щодо загальних шляхів передачі ІПСШ та ВІЛ, зокрема при сексуальних контактах, впливу ІПСШ на ймовірність зараження ВІЛ, вертикальної передачі збудників ІПСШ. Також отримані відповіді про основні клінічні симптоми ІПСШ, визначення наявності симптомів при різних патологічних станах, обізнаність про синдромний підхід у веденні пацієнтів з уразливих груп з ІПСШ. Для фахівців наркологічних закладів було запропоновано зазначити можливість переадресації пацієнтів наркологічного профілю до дерматовенерологічних закладів, встановлення діагнозу ІПСШ та призначення лікування. Всім респондентам також було запропоновано визначити найефективніші для них методи надання фахової інформації, специфіку окреслених питань.
З метою оцінки можливості застосування синдромного підходу в діагностуванні ІПСШ (встановлення клінічного діагнозу) проведено консультування 133 ЖКС у м. Харків в умовах мобільної амбулаторії, які склали підгрупу 2.8. За попередньою добровільною згодою пацієнток проводилося опитування на наявність скарг та, клінічний огляд, в який входили огляд зовнішніх статевих органів та періанальної ділянки, молочних залоз, шийки матки в дзеркалах та бімануальне дослідження. Встановлення попереднього діагнозу відбувалося на основі анамнестичних даних, об’єктивного огляду та суб’єктивних проявів захворювання. В результаті консультування групи пацієнток були встановлені клінічні діагнози. Синдромний діагноз встановлювався згідно наступних симптомів [22, 51, 196, 269, 272]: біль унизу живота у жінок, генітальні виразки, виділення з піхви.
2.3 Клінічне обстеження осіб з урогенітальними інфекціями
Всім пацієнтам, які увійшли в дослідження, було запропоновано клінічне обстеження. Проводився збір анамнестичних даних, акцентувалася увага на основних скаргах: час появи симптомів захворювання, їх характер, локалізація і форми, тривалість періоду ремісії і загострення. Також детально уточнювалося час появи нових симптомів, їх зв’язок з останнім статевим контактом. В анамнезі захворювання встановлювався характер та особливості статевого життя пацієнта, наявність шлюбу та/або позашлюбних контактів. Збиралися відомості про статевих партнерів, ймовірне джерело зараження, які ІПСШ були діагностовані раніше. У випадку перенесених ІПСШ уточнювалося, коли та яким чином відбувалося лікування, з використанням яких методів та коли проводилося обстеження, на наявність яких ІПСШ, прийом антибактеріальних та інших засобів, дози препаратів та тривалість лікування.
У жінок з’ясовувалися дані про менструальний цикл, взаємозв’язок симптомів з порушенням циклу. Збиралися відомості про вагітність, пологи та їх особливості. Також виявлялися анамнестичні дані щодо спонтанних абортів та викиднів, наявності безпліддя. Уточнювалися які методи контрацепції застосовуються.. При огляді пацієнтів зверталася увага на колір шкірних покривів і видимих слизових оболонок, наявність в області статевих органів елементів висипки, рубців, деформацій. У жінок проводили огляд зовнішніх статевих органів: стан великих і малих статевих губ, пресіння піхви, уретри, наявність виділень. Також проводили огляд шкіри промежини і області заднього проходу, пальпували пахові лімфатичні вузли. При огляді зовнішнього отвору і лакун сечовипускального каналу, звертали увагу на колір, наявність набряклості і виділень. Проводячи пальпацію сечівника через піхву, визначали ступінь чутливості уретри при натисканні, стан його стінок, наявність ущільнень. При обстеженні пресіння піхви обстежували на клітор і складки навколо нього, стан внутрішньої поверхні великих і малих статевих губ (забарвлення, набряклість, рихлість, наявність дефектів). Жінкам проводили пальпацію бартолінових залоз, оглядали їх вивідні протоки. У жінок, які жили статевим життям, проводили огляд піхви за допомогою двостулкового дзеркала Куско. При огляді піхви оцінювали стан стінок, забарвлення, наявність ерозій, виразок, інших дефектів слизової оболонки, а також на характер, колір і кількість виділень. Визначали стан вагінальної частини шийки матки, її форму, розмір, консистенцію, форму зовнішнього зіву шийного каналу матки, наявність і характер виділень, цілісність або зміну слизової оболонки (виразки, виворіт, ерозія і т. п.). Для визначення стану тіла матки і труб яєчників застосовувалося бімануальне дослідження. У жінок визначали розташування, форму, обсяг, рухливість, консистенцію і болісність матки та її придатків. За показами додатково використовувався метод ультразвукового дослідження органів малого тазу, як трансабдомінальним, так і трансвагінальним способами. Даний метод дозволяв визначити розміри матки та яєчників, товщину міометрію, наявність порожнин та кістозних утворень, наявність новоутворень.
При огляді чоловіків оцінювали стан шкірних покривів нижньої частини живота та внутрішньої поверхні стегон, наявність в області статевих органів та заднього проходу елементів висипки. Проводили огляд зовнішнього отвору уретри (діаметр, набряклість, наявність гіпо або епіспадії). Звертали увагу на наявність виділень із сечовивідного каналу, їх характер – серозні, слизові, гнійні, слизисто-гнійні, кров’янисті. При відсутності виділень проводився легкий масаж по ходу сечівника для отримання уретрального відокремлюваного. Також відбувався огляд області зовнішнього отвору сечовипускального каналу, вуздечки крайньої плоті і вінця головки статевого члена, проводили пальпацію губчастої частини сечівника та пахових лімфатичних вузлів. Досліджуючи мошонку, оцінювали її розмір, симетрію, стан шкірного покриву, складчастість, температуру, болісність. Проводячи пальпацію яєчок, їх придатків, сім’явиносних проток і решти сім’яних канатиків, визначали їх розміри, консистенцію, больову чутливість. При дослідженні передміхурової залози визначали форму залози, її розміри, консистенцію, чутливість і ставлення до навколишніх тканин. За показами додатково використовувався метод ультразвукового дослідження органів малого тазу [58].
2.4 Лабораторна діагностика урогенітальних інфекцій
Всі дослідження виконувались відповідно до існуючих регламентуючих документів та інструкцій виробників тест-систем. Обстеження на ІПСШ та ВІЛ проводилося згідно чинних нормативних документів [56, 64, 65, 66, 67, 68, 69, 71, 73, 74, 88, 89, 90, 91, 94, 112, 118].
Лабораторна діагностика хламідіозу проводилася за допомогою цитологічної діагностики препаратів, які забарвлені у реакції прямої імунофлуоресценції (ПІФ), а також ІФА і ПЛР. Використовувалися діагностичні системи: (діагностичні набори «РекомбіСлайдХламідія», («Лабдіагностика, Росія»), ХламиБест C. trachomatis – Ig G, Ig A (Вектор-Бест-Украина). Матеріалом для дослідження слугували зішкряби слизових оболонок сечостатевих органів, центрифугати першої порції ранкової сечі, сироватка крові (для дослідження на специфічні Ig G та Ig A антитіла). Для ПЛР діагностики використали тест-систему «РеалБест ДНК Chlamydia trachomatis» (ООО «Вектор-Бест-Украина»), Амплі Сенс» (НДІ епідеміології МЗ РФ, Москва, Росія).
Лабораторна діагностика герпетичної інфекції (ВПГ-1, -2, -4 (ВЕБ), -5 (ЦМВ)) проводилася з використанням ІФА (для дослідження на специфічні Ig G, Ig М, Ig A антитіла) та ПЛР. Використовувалися діагностичні системи: ІФА – діагностичні набори Векто ВПГ – Ig G, Векто ВПГ – Ig М, ВектоВЭБ-VCA – Ig G, ВектоВЭБ-VCA – Ig M, ВектоЦМВ – Ig M, ВектоЦМВ – Ig G, (ООО «Вектор-Бест-Украина»); ПЛР – РеалБест ДНК ВЭБ, РеалБест ДНК ЦМВ, РеалБест ДНК ВПГ 1,2. Матеріалом для дослідження слугували кров, зішкреби слизових оболонок сечостатевих органів або забір проводили безпосередньо з вогнища ураження (герпетичні везикули, ерозії), сироватка крові.
За допомогою методу бактеріоскопії (світлова мікроскопія препаратів, забарвлених 1 % розчином метиленового синього та за Грамом) проводилося дослідження виділень з урогенітального тракту з метою діагностування бактеріального вагінозу, гонококової інфекції трихомонозу, а також стану мікроценозу нижніх відділів сечостатевого тракту. Забір матеріалу для обох досліджень здійснювався одночасно разово, починаючи з культуральної проби.
Діагностика трихомонозу здійснювалася за допомогою мікроскопії й культурального дослідження. При проведенні бактеріологічного дослідження застосовували середовища для трихомонад («HiMedia», Індія), середовище з гідролізатом казеїну, дріжджовим автолізатом і сироваткою крові (СКДС).
Діагностика U. urealyticum та M. hominis здійснювалася за допомогою ІФА та ПЛР (ІФА – діагностичні набори Ureaplasma Urealyticum-Ig G-ИФА-БЕСТ, Ureaplasma Urealyticum-Ig A-ИФА-БЕСТ, Mycoplasma hominis-Ig G-ИФА-БЕСТ, Mycoplasma hominis-Ig А-ИФА-БЕСТ (ТОВ «Вектор-Бест-Україна»); ПЛР – РеалБест ДНК Ureaplasma Urealyticum, РеалБест ДНК Mycoplasma hominis, РеалБест ДНК Mycoplasma genitalium (ТОВ «Вектор-Бест-Україна»).
Діагностика гепатитів В, С проводилася з використанням методів ІФА та ПЛР із застосуванням тест-систем Гепатит В — ІФА — ГепаБест анти — Нвс – Іg G, Гепатит С — ІФА – БЕСТ анти-ВГС (Іg G, Ig М), ПЛР — РеалБест РНК ВГС (ТОВ «Вектор-Бест-Україна»). Матеріалом для дослідження слугувала кров.
Діагностика ВПЛ-інфекції проводилася з використанням тест-системи РеалБест ДНК ВПЧ. Матеріалом для дослідження слугували кров, зішкреби слизових оболонок сечостатевих органів.
Діагностика ВІЛ у осіб загального населення проводилася за допомогою УниБест ВИЧ-1,2 АТ. Матеріалом для дослідження слугувала кров.
З використанням методів класичної бактеріології проводили вивчення мікробного складу урогенітального біотопу та визначення чутливості до антибактеріальних препаратів різних етіологічно значущих мікроорганізмів. Досліджували вільні виділення і зішкряби слизової оболонки, які брали за допомогою жолобоватого зонду або очної ложки Фолькмана: у чоловіків – з уретри, у жінок – з бічної і задньої частини зводу піхви, каналу шийки матки і сечовипускального каналу. Перед взяттям матеріалу не рекомендувався туалет зовнішніх статевих органів. Ідентифікація аеробних грампозитивних, грамнегативних аеробних ферментуючих та неферментуючих бактерій проводили за допомогою рутинних методів на підставі морфологічних, культуральних та біохімічних властивостей збудників. Мікроорганізми визначали до виду, при неможливості – до роду. Визначення чутливості вилучених аеробних мікроорганізмів до антибактеріальних препаратів за допомогою диск-дифузійного методу.Резистентні та помірно-резистентні мікроорганізми були об’єднані до групи нечутливих штамів.
Діагностика збудників ІПСШ проводилася також із застосуванням швидких тестів (експрес-методів діагностики). При обстеженні пацієнтів застосовували ІХГ швидки тести CITO-TEST (Pharmasco). А саме:
- тест на ВІЛ – CITO-TEST HIV 1/2 – для якісного виявлення сумарних антитіл (IgG та IgM) до ВІЛ 1 та 2 типів з метою діагностики ВІЛ-інфекції;
- тест на сифіліс – CITO TEST Syphilis – для якісного виявлення антитіл IgG та IgM до Treponema pallidum у цільній крові, сироватці або плазмі;
- тест на хламідіоз – CITO TEST Chlamydia – для якісного виявлення антигенів хламідій у мазках, досліджуваний матеріал зібраний у жінок з цервікального каналу, у чоловіків – з уретри та зразки сечі;
- тест на гонорею – CITO-TEST Gonorrhea – для якісного виявлення антигену N. gonorrhoeae у мазках, зібраних у жінок з цервікального каналу та у чоловіків з уретри;
- тест на гепатит В – CITO TEST HBV COMBO – для якісного виявлення маркерів вірусу гепатиту В (антитіл та антигенів) –- HBsAg, HBsAb, HBeAg, HВeAb і HВcAb у сироватці або плазмі крові.
- тест на гепатит С – CITO TEST HCV – – для якісного виявлення антитіл до вірусу гепатиту С в цільній крові, сироватці або плазмі.
У швидких ІХГ тестах тест-касета являє собою нітроцелюлозну мембрану, заправлену у пластикову касету, на якій позначені: місце внесення зразка для дослідження (S), місце появи результатів специфічного тесту (Т), місце розташування контрольної смуги (С), назва маркеру, для виявлення якого розроблений даний швидкий тест. Тест-касета запаяна у пластиковий пакет разом з силікагелем, одноразовою піпеткою для внесення зразка або зондом, буферним розчином або реагентами, пробіркою, інструкцією.
Тест може оцінюватись, як позитивний, негативний або сумнівний. Як позитивний – при наявності двох чітких забарвлених смуг у зонах Т та С (найчастіше), або як негативний – при наявності однієї забарвленої смуги (червона контрольна смуга) у зоні С. Поява червоної контрольної смуги підтверджує також і те, що був використаний достатній об’єм досліджуваного матеріалу (зразку) та дотримані всі необхідні умови тесту. Тест може оцінюватись як сумнівний тоді, коли контрольна смуга не проявляється.
У всіх варіантах дослідження необхідно дочекатися появи червоної смуги/смуг. Результат обліковувати через 15 хвилин. Не брати до уваги результати після 20 хвилин. Дослідження проводили згідно інструкції виробника тесту та існуючих нормативних документів [73, 112, 118].
2.5 Імунологічні методи обстеження
Дослідження визначення наявності антитіл до ВІЛ, вірусного навантаження, CD4+, CD 3+. CD8 проводили у спеціалізованій акредитованій діагностичній лабораторії Харківського КЗОЗ «Обласний центр СНІДу» згідно діючих регламентуючих документів [64, 69, 71].
Визначення вірусного навантаження проводилося з використанням тест-системи імуноферментної для кількісного визначення і підтвердження антигену р24 ВІЛ-1 «DIA®-HIV-p24» фірми ПрАТ «НВК ДІАПРОФ-МЕД», Україна.
Тест-система призначена для якісного та кількісного визначення і підтвердження антигену р24 ВІЛ-1, а також підтвердження його наявності в сироватці або плазмі крові людини методом ІФА. Аналіз проводився з використанням стандартного обладнання для ІФА.
Принцип аналізу DIA®-HIV-p24 базується на методі твердофазного ІФА («сандвіч» варіант) з використанням біотин-стрептавідинового підсилення специфічного сигналу.
При внесенні в лунку кон’югату №1 та досліджуваних зразків антиген р24 ВІЛ-1, зв’язується з моноклональними антитілами до р24 ВІЛ-1 імуносорбента і біотинільованого кон’югата, утворюючи комплекси антиген-антитіло, імунні комплекси виявляються пероксидазним кон’югатом стрептавілдину (кон’югат №2). Після відмивання незв’язаних компонентів в лунки додають розчин проявника. Пероксидазну реакціцю зупиняють стоп-реагентом і вимірюють оптичну густину суміші у лунках при довжині хвилі 450/620 нм, яка пропорційна концентрації антигену р24 ВІЛ-1 у зразках.
Для підтвердження наявності антигену р24 ВІЛ-1 у зразках в реакційну суміш вносять нейтралізуючий реагент, який конкурує з кон’югатом за сайти зв’язування з антигеном р24 ВІЛ-1, що приводить до зменшення оптичної густини забарвленого розчину в лунках.
Концентрацію антигену р24 ВІЛ-1 в пг/мл в досліджуваних зразках визначали за калібрувальним графіком.
Визначення антитіл до ВІЛ проводили методом ІФА з використанням тест-системи імуноферментної для виявлення антитіл до вірусу імунодефіциту людини першого та другого типів «DIA®-HIV 1/2» фірми ПрАТ «НВК ДІАПРОФ-МЕД», Україна.
Тест-система призначена для виявлення сумарних антитіл (Ig G, Ig M, Ig A) до ВІЛ 1 та 2 типів в сироватці або плазмі крові людини методом ІФА, в тому числі на ранніх етапах ВІЛ-інфекції. Аналіз проводився з використанням стандартного обладнання для ІФА.
Принцип аналізу тест-ситеми«DIA®-HIV1/2» базується на методі твердофазного ІФА в «сандвіч»-варіанті з одночасною інкубацією сироваток і кон’югату.
При внесенні в лунки кон’югату та досліджуваних зразків ВІЛ-специфічні антитіла зв’язуються як з рекомбінантними антигенами на твердій фазі, так і з антигенами кон’югату, утворюючи комплекси антиген-антитіло. Після відмивання незв’язаних компонентів в лунки додають розчин проявника. Пероксидазну реакціцю зупиняють стоп-реагентом і вимірюють оптичну густину суміші у лунках при довжині хвилі 450/620 нм, яка пропорційна концентрації ВІЛ-специфічних антитіл у зразках.
Моніторинг стану системи клітинного імунітету проводився методом імунофенотипування лейкоцитів для визначення їх популяційного складу з використанням специфічних моноклональних антитіл до поверхневих молекул CD3, CD4, CD8.
Тест заснований на здатності моноклонального антитіла зв’язуватися з поверхнею клітин, що експресують окремі антигенні детермінанти.
Матерілом для дослідження слугувала венозна кров.
В тесті застосовувалисяя моноклональні антитіла CD3, CD4, і CD8 для ідентифікації або підрахунку зрілих Т-лімфоцитів і Т-супресорів / цитотоксичних Т-лімфоцитів за рахунок специфічного зв’язування поверхневих антитіл, загальних для Т-лімфоцитів і Т-супресорів/цитотоксичних Т-лімфоцитів, CD3 і CD4, відповідно.
Показники в дослідженні вимірювалися методом проточної цитофлюориметрії.
Дослідження виконувалося з використанням тест-систем та обладнання Бекмен-Культер, США (Beckman Coulter, USA) згідно інструкцій виробника.
Тест заснований на здатності моноклональних антитіл зв’язуватися з окремими антигенними детермінантами на поверхні клітини. Моноклональні антитіла специфічні для окремого поверхневого клітинного антигену.
Специфічне фарбування клітин здійснювалося під час інкубації цільної крові з кольоровим реагентом. Лейкоцити, які залишилися після лізису еритроцитів, аналізувалися методом проточної цитометрії з використанням гейтів лімфоцитів. Визначали процентний вміст забарвлених лімфоцитів.
Кількісне визначення sIgA проводили на слизових оболонках уретри (у чоловіків) та піхви (у жінок) у хворих на ІПСШ з різних груп населення. Матеріал у вигляді вагінального відокремлюваного та уретрального секрету вносився в пробірки Еппендорф з фізіологічним розчином NaCl (100 мкл). Після забору матеріалу зразки зберігалися при температурі мінус 20 0С. Після розморожування матеріал ретельно перемішували, за допомогою центрифугування відокремлювали осад. Для аналізу використовували наступні розведення зразків: вагінальний секрет – застосовували розведення 1/1000, уретральний секрет – в розведенні 1/500. При проведенні дослідження застосовувалася тест-система sIgA – ІФА – Бест виробництва ЗАТ «Вектор – Бест», Росія. Аналіз проводили в дві стадії. На першій стадії калібрувальні проби з відомою концентрацією sIgA та досліджені зразки інкубували в лунках стріпірованного планшета з іммобілізованими моноклональними антитілами до sIg A. Потім планшет відмивали. На другій стадії sIgA, який зв’язався, в лунках виявляли кон’югатом моноклональних антитіл до а-ланцюгу Ig A з пероксидазою хрону. Після відмивання надлишку кон’югату імунні комплекси, які утворилися, «іммобілізовані моноклональні антитіла – sIg A – кон’югат» визначали за допомогою ферментативної реакції пероксидази з перекисом водню в присутності хромогену (тетраметилбензидину). Інтенсивність забарвлення хромогену пропорційна концентрації sIgA у зразку, що аналізується. Після зупинки пероксидазної реакції стоп-реагентом результати враховували за допомогою фотометрії при довжині хвилі 450 нм. Концентрацію sIgA в нг/мл в досліджуваних зразках визначали за калібрувальним графіком. Для вираження концентрації в мг/л значення концентрації в нг/мл ділили на 1000.
2.6 Характеристика методів лабораторної діагностики сифілісу
Для лабораторної діагностики сифілісу використовувалися непрямі методи, які включали нетрепонемні тести: РЗКк; РМП; РПР (RPR). Також були застосовані трепонемні тести: РЗКт; реакція імунофлюоресценції (РІФ) в модифікаціях РІФабс, РІФ200; реакція іммобілізації блідих трепонем (РІТ). ІФА; РПГА; ІХГ метод.
Серологічне обстеження пацієнтів включало КСР, РІФ-200, РІФ-абс, РІТ. Дослідження крові включали КСР – постановку РЗКк та РЗКт (набір реагентів виробника “Біолік”, Україна, Харків) й РМП з кардіоліпіновим антигеном (“Біолік”, Україна, Харків). Також у дослідженні проводили реакцію імунофлуоресценції: РІФ-200 і з її модифікацією РІФ-абс (“ЛюмиБест антипаллидум”, РФ), РІТ, РПГА (Люис РПГА тест, РФ) та ІФА (DIA-IgG-IgM-Trep, Україна).
РЗКк проводили за кількісною методикою з розведенням сироватки крові 1:5, 1:10, і далі. Досліджували також кількісний варіант РІФ з розведеннями сироватки 1:200, 1:400, 1:800, і далі. РІТ вважали позитивною при іммобілізації вище 51%, слабоположительной – від 31 до 51%, сумнівною – від 21 до 30% і негативною – нижче 20%. Серологічні реакції проводили згідно з нині чинним Наказом МОЗ № 204 від 29.12.92 на основі «Уніфікації лабораторних досліджень із діагностики хвороб, що передаються статевим шляхом» [66, 112].
Діагностику сифілісу також проводили за допомогою наборів «Сito-test Syphilis» швидкий тест для якісного виявлення сумарних антитіл (IgG, IgM) до Treponema pallidum в цільній крові, сироватці або плазмі крові ІХГ методом (ТОВ «Фармаско», Україна).
Методики проведення серологічних досліджень на сифіліс нетрепонемними тестами.
Проводили дослідження сироваток методами РЗКк, РМП [66].
RPR проводили із застосуванням наборів для RPR «ЛЮІС-ТЕСТ» для виявлення асоційованих з сифілісом реагінових антитіл (RPR-тест) в якісному та/або в напівкількісному варіанті.
Тест RPR в якісному варіанті виконувався на спеціальних картонних або пластикових картках одноразового використання, на яких видавлені неглибокі лунки діаметром 18 мм. При додаванні до плазми або сироватки крові хворого на сифіліс суспензії стабілізованого кардіоліпінового антигену, адсорбованого на дрібнодисперсних вугільних частках, відбувається утворення комплексів антиген-антитіло, що збирають частки вугілля в більш крупні агрегати, при цьому результат реакції стає можливим враховувати неозброєним оком. За відсутності антитіл в досліджуваному зразку зовнішній вигляд реакційного середовища не змінювався, залишався гомогенним.
Показанням для виконання напівкількісного варіанта RPR були випадки, коли зразки сироватки або плазми крові показали при скринінгу позитивні і слабопозитивні результати, або якщо дані RPR розходяться з результатами інших тестів на сифіліс, а також у випадку призначення цього дослідження лікарем.
Облік проводили за стандартною методикою. Титром антитіл вважали останнє розведення, що показало позитивний результат при RPR тестуванні.
Для серологічної діагностики сифілісу з використанням трепонемних тестів застосовувалися наступні методики. Дослідження сироватки, ліквору проводилося методами РІФ у модифікаціях: РІФабс, РІФ200, РІФЦ; РІТ [66].
Також був застосований ІФА. Принцип реакції полягав у фіксації на поверхні лунок планшета полістиролу імунних комплексів, що утворюються при взаємодії антитіл хворого на сифіліс з антигенами блідої трепонеми, з подальшим виявленням їх в кольоровій реакції за допомогою специфічних кон’югатів і відповідних субстратно-хромогенних добавок. Специфічні антигени, які використовували для ІФА, мають різне походження: ультраозвучені, рекомбінантні, пептидні. Найбільшу інформативність в ІФА показали імунодомінантні ділянки білків блідої трепонеми з молекулярною масою 15 кД, 17кД і 47кД. Результати ІФА оцінювали при автоматичному обліку результатів реакції за величиною цифрових показників оптичної щільності в лунках з випробовуваними зразками у відповідності до вимог інструкції виробника. Результати ІФА залежали від чутливості та специфічності тест-системи, антигену, що використовується, концентрації кон`югату, від величини критичної оптичної щільності.
Проводили тестування на сифіліс за допомогою РПГА. При взаємодії антитрепонемних антитіл, що містяться в сироватці крові хворих на сифіліс, з антигенами блідої трепонеми, які сенсибілізовані еритроцитами тварин, спостерігалася видима неозброєним оком аглютинація еритроцитів. При оцінці результатів РПГА враховували форму і характер осаду еритроцитів на дні лунок імунологічного планшета. У лунки (осередки) імунологічного планшету для мікротитрування з U-образним дном вносили зразки досліджуваної сироватки крові (не використовувати плазму крові) і тест-еритроцити. За наявності специфічних антитіл в сироватці крові пацієнта відбувалася їх взаємодія з антигенами блідої трепонеми і утворення просторових структур імунних комплексів антитіло-антиген-еритроцит, які під дією сил тяжіння поступово опускалися вниз, розподіляючись по всій поверхні дна лунки і формували характерну картину «переверненої парасольки». Реакцію враховували візуально через 60-120 хвилин.
Залежно від кількості імунних антитіл, що містилися в досліджуваному зразку, зображення «переверненої парасольки» варіювало від максимального, що займало всю поверхню U-образного дна лунки планшета, до невеликої ділянки в центральній, найнижче розташованій його частині, з проясненням в центрі і формуванням інтенсивнішого кільця з еритроцитів, що осіли, по периферії. За відсутності в зразку біологічному матеріалі специфічних антитіл або при додаванні в реакцію інтактних (контрольних) еритроцитів утворення імунних комплексів не відбувалося, і еритроцити поступово збиралися в самій нижній точці дна лунки, формуючи фігуру у вигляді компактної плями або «ґудзичка», іноді з незначним проясненням в центрі. Оцінку напруженості гуморальної відповіді проводили за визначенням розміру осаду, що формувався в лунці і виражали в умовних одиницях (плюсах) – якісний аналіз, – або шляхом дослідження в послідовних розведеннях досліджуваного зразка патологічного матеріалу з визначенням титру антитіл (напівкількісний аналіз) [56].
ІХГ метод, так званий «аналіз за місцем лікування» (point-of-care), з використанням хроматографічних смужок для діагностики сифілісу застосовували в роботі зі зразками сироватки крові, цільної крові (з вени або пальця), плазми.
Тест-система для діагностики сифілісу працює за принципом ІХГ аналізу з візуальним обліком результатів тестування. ІХГ тест призначений для якісного виявленні сумарних антитіл (Ig G, Ig M) до Treponema pallidum у клінічних зразках. Принцип дії тесту: у місці внесення на мембрану тесту зразок крові реагує з фарбованим кон’югатом. Антитіла до Treponema pallidum, які присутні у зразку, зв’язуються з кон’югатом, утворюючи імунний комплекс. Останній, під дією капілярної сили просувається вздовж мембрани і вступає в реакцію з іммобілізованими антигенами Treponema pallidum, які були заздалегідь нанесені на тестову ділянку мембрани «Т», в результаті чого утворюється червона лінія. Наявність червоної лінії в зоні «Т» вказує на позитивний результат, в той час, як відсутність її вказує на негативний результат тестування. Червона лінія, яка буде завжди з’являтися на контрольні ділянці «С», є контролем виконання процедури. Облік результату тестування проводився через 10 хвилин після внесення зразка [74, 118].
2.7 Статистичні методи обробки результатів
Статистична обробка результатів дослідження проведена з використанням стандартних ліцензійних програм, Excel-2010 і SPSS-PC, 17-я версія і пакету Statistica for Windows, версія 6.0 (Copyright @ StatSoft, USA).
Формування основних груп і груп порівняння в клінічних дослідженнях здійснювалося на основі рандомізації за допомогою генератора випадкових чисел. Для порівняння показників різних груп і підгруп використовувалися стандартні статистичні критерії перевірки гіпотез. Для адекватного представлення числових даних попередньо проводилася перевірка розподілу на нормальність. У разі вибірки малого обсягу (n <30) для перевірки на нормальність розподілу використовувався критерій W Шапіро-Уілкі, якщо обсяг вибірки був достатнім - використовували критерій χ2. І в тому і в іншому випадку критична область розраховувалася для рівня значущості р = 0,05.
У разі, коли розподіл не відрізнявся від нормального, для представлення даних обчислювалося значення середнього арифметичного (М) і середнього квадратичного відхилення (σ), а для порівняння середніх використовувався критерій Стьюдента (одностороння критична область).
Для порівняння кількісних ознак незалежно від виду розподілу застосовувалися непараметричні методи: порівняння двох незалежних груп (U-критерій Манна-Уїтні, двухвиборочний критерій Колмогорова-Смирнова). При зіставленні частот для виявлений достовірних відмінностей використовувався метод Фішера.
Для вивчення характеру залежності (ступеня кореляції) між кількісними показниками використовувався коефіцієнт кореляції Пірсона, а між якісними показниками – сила зв’язку (ймовірність збігу) факторів (odds ratio). Для оцінки ступеня лінійного зв’язку між парою ознак використовувався коефіцієнт кореляції. У разі, коли розподіл не відрізнявся від нормального, був використаний стандартний коефіцієнт кореляції Пірсона r. Що стосується відхилення розподілу від нормального використовувався коефіцієнт рангової кореляції Кендалла τ. У разі, коли розрахункове значення коефіцієнта кореляції відрізнялося від 0 на рівні значущості р < 0,05, приймалася гіпотеза про наявність між досліджуваними ознаками лінійної кореляційної зв'язку.
У разі, коли вивчалися якісні ознаки (наявність-відсутність мікроорганізму, морфологічної ознаки і т. і.). Для опису використовувався показник частоти виникнення даної ознаки в досліджуваній вибірці, який виражався в абсолютному значенні або у відсотках (%). Так як в цьому випадку розподіл відрізнявся від нормального, то задля його нормалізації використовувався метод кутового перетворення Фішера. В цьому випадку при необхідності вказівки інтервальної оцінки частоти виникнення використовувався той же метод, інтервал розраховувався на рівні значущості р = 0,05 [44].
РОЗДІЛ 3
РОЗПОВСЮДЖЕННЯ ІНФЕКЦІЙ ЩО ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ, СЕРЕД ЗАГАЛЬНОГО НАСЕЛЕННЯ ТА УРАЗЛИВИХ ГРУП
В Україні основним шляхом передачі ВІЛ є статевий, а наявність ІПСШ значно збільшує ймовірність зараження та передачі ВІЛ. Профілактика, рання діагностика і своєчасне лікування ІПСШ, в першу чергу у представників уразливих груп населення, є дієвим механізмом впливу на поширення ІПСШ та ВІЛ статевим шляхом в середовищі груп ризику та переходу їх у загальну популяцію [16, 55]. Тому доцільно визначити розповсюдженість ІПСШ в різних популяційних верствах, їх перебіг, асоціації збудників.
3.1 Особливості розповсюдженості інфекцій, що передаються статевим шляхом, серед представників уразливих груп населення на загальної популяції
З метою вивчення особливостей розповсюдженості ІПСШ серед представників уразливих груп населення та осіб, що отримували лікувально-діагностичну допомогу з приводу ІПСШ в установах м. Харків та інших регіонах країни, було проаналізовано клініко-анамнестичні та дані лабораторного обстеження 495 осіб, які увійшли до підгрупи 1.1 і отримували лікувально-діагностичну допомогу в ДУ «ІДВНАМНУ», а також ретроспективні дані обстеження та лікування ІПСШ представників уразливих груп населення в Харківському КЗОЗ “Обласний центр профілактики та боротьби зі СНІДом”, Закарпатський обласний Центр з профілактики та боротьби зі СНІДом, ОКШВД (м. Ужгород), результати обстеження представників уразливих груп та їх статевих партнерів в МБФ «Благо» (Харків), Слов’янська міська громадська організація “Наша допомога”, ПОБФ “Громадське здоров’я” (Полтава) в 2010-2015 роках.
Більшість осіб підгрупи 1.1, які належали до загальної популяції, пройшли обстеження та лікування в ДУ “ІДВНАМНУ», склали жінки – 274 (55,3 %). Чоловіків серед пацієнтів цієї підгрупи було 221 (44,7 %). Середній вік пацієнтів склав (32,8 ± 0,5) роки.
Кількість проведених обстежень швидкими тестами на ІПСШ в м. Харків: ВІЛ – 10610, сифіліс – 1834, хламідіоз – 850, гонорея – 850, гепатит В – 891, гепатит С – 1760.
Кількість проведених обстежень швидкими тестами на ІПСШ в м. Полтава: ВІЛ – 5386, сифіліс – 3786, хламідіоз – 89, гонорея – 89, гепатит В – 2516, гепатит С – 2675.
Кількість проведених обстежень швидкими тестами на ІПСШ і в м. Слов’янск: ВІЛ – 9971, сифіліс – 1133, хламідіоз – 718, гонорея – 776, гепатит В – 1271, гепатит С – 2200.
Кількість проведених обстежень швидкими тестами на ІПСШ в Закарпатській області: сифіліс – 541, хламідіоз – 250, гонорея – 234, гепатит В – 495, гепатит С – 479 (табл. 3.1).
Таблиця 3.1 – Кількість проведених обстежень швидкими тестами на ІПСШ за 2011-2016 роки, по містах, абсолютні числа
| МБФ «Благо», Харків | Слов’янська міська ГО “Наша допомога” | ПОБФ “Громадське здоров’я”, Полтава | Закарпатський обласний Центр з профілактики та боротьби зі СНІДом, ОКШВД | Всього | |
| ВІЛ | 10610 | 9971 | 5386 | 1261 | 27228 |
| Сифіліс | 1834 | 1133 | 3786 | 541 | 7294 |
| Хламідіоз | 850 | 718 | 89 | 250 | 1677 |
| Гонорея | 850 | 776 | 89 | 234 | 1149 |
| Гепатит В | 891 | 1271 | 2516 | 495 | 5173 |
| Гепатит С | 1760 | 2200 | 2675 | 479 | 7114 |
3.1.1 Результати обстеження загального населення
Пацієнти підгрупи 1.1 проходили обстеження на наявність таких ІПСШ, як хламідіоз, уреаплазмоз, мікоплазмоз, трихомоноз, ВПЛ, а також вірусних інфекцій (гепатит В, гепатит С, ЦМВ, ВЕБ, ВІЛ, ВПЛ, ВПГ). Дослідження проводили з використанням методів ПЛР, ІФА, бактеріоскопічного та бактеріологічного методів діагностики. Результати обстеження пацієнтів підгрупи 1.1 наведено в таблиці 3.2.
Таблиця 3.2 – Результати обстеження представників загального населення на ІПСШ, розподіл за нозологіями (кількість осіб, відсотки)
| Виявлені збудники | Обстежено всього хворих | Позитивні випадки серед обстежених | ||
| Кількість осіб | % | Кількість осіб | % | |
| Trichomonas vaginalis (методи бактеріоскопічний, бактеріологічний) | 495 | 100 | 149 | 30,1 ± 2,6 |
| Ureaplasma spp, ПЛР | 232 | 46,9 ± 2,2 | 69 | 29,7 ± 3,0 |
| Ureaplasma urealyticum, ПЛР | 87 | 17,6 ± 1,7 | 3 | 3,5 ± 2,0 |
| Ureaplasma urealyticum, ІФА, Ig A. | 41 | 8,3 ± 1,2 | 7 | 17,1 ± 5,9 |
| Ureaplasma urealyticum, ІФА, Ig G | 120 | 24,2 ± 1,9 | 36 | 30,0 ± 4,2 |
| Мycoplasma genitalium, ПЛР | 187 | 37,8 ± 2,2 | 2 | 1,1 ± 0,8 |
| Мycoplasma genitalium, ІФА, Ig A | 17 | 3,4 ± 0,8 | 3 | 17,8 ± 9,3 |
| Мycoplasma genitalium, ІФА, Ig G | 70 | 14,1 ± 1,6 | 14 | 20,0 ± 4,8 |
| Мycoplasma hominis, ПЛР | 182 | 36,8 ± 2,2 | 11 | 6,0 ± 1,8 |
| Мycoplasma hominis, ІФА, Ig A | 47 | 9,5 ± 1,3 | 6 | 12,8 ± 4,9 |
| Мycoplasma hominis, ІФА, Ig G | 105 | 21,2 ± 1,8 | 18 | 17,1 ± 3,7 |
| Chlamydia trachomatis, ПЛР | 222 | 44,9 ± 2,2 | 8 | 3,6 ± 1,3 |
| Chlamydia trachomatis, ІФА, Ig A | 54 | 10,9 ± 1,4 | 6 | 11,1 ± 4,3 |
| Chlamydia trachomatis, ІФА, Ig G | 76 | 15,4 ± 1,6 | 34 | 44,7 ± 5,7 |
| ВПГ-1, 2, ІФА, Ig М | 3 | 0,6 ± 0,4 | 0 | 0 |
| ВПГ-1, 2, ІФА, Ig G | 12 | 2,4 ± 0,7 | 11 | 91,7 ± 8,0 |
| ВПЛ, ПЛР | 39 | 7,9 ± 1,2 | 18 | 46,2 ± 8,0 |
| ВІЛ, ІФА, сумарні Ig | 22 | 4,4 ± 0,9 | 1 | 4,6 ± 4,4 |
| Гепатит В, ІФА, Ig G | 22 | 4,4 ± 0,9 | 1 | 4,6 ± 4,4 |
| Гепатит С, ПЛР | 2 | 0,4 ± 0,3 | 0 | 0 |
| Гепатит С, ІФА, Ig G | 19 | 3,8 ± 0,9 | 3 | 15,8 ± 8,4 |
| ЦМВ, ІФА, Ig М | 7 | 1,4 ± 0,5 | 3 | 42,9 ± 18,7 |
| ЦМВ, ІФА, Ig G | 11 | 2,2 ± 0,7 | 8 | 72,7 ± 13,4 |
| ВЕБ, ІФА, Ig М | 6 | 1,2 ± 0,5 | 3 | 50,0 ± 20,4 |
| ВЕБ, ІФА, Ig G | 8 | 1,6 ± 0,6 | 6 | 75,0 ± 15,3 |
Згідно отриманих даних, відсоток пацієнтів, у яких з використанням бактеріоскопічного та бактеріологічного методів діагностики була виявлена трихомонадна інфекція, в середньому склав (30,1 ± 2,6) %. Серед жінок спостерігався більший відсоток виявлення трихомонад – 39,1 %, серед чоловіків – 21,2 %, що можна пояснити фізіологічними та анатомічними особливостями жіночого організму, а також відмінністю мікробіоценозу та обміну речовин. T. vaginalis – це облігатний паразит, що втратив здатність самостійно синтезувати багато макромолекул (пуринів, піримідинів, ліпіди та ін.), тому найважливіші поживні компоненти трихомонади отримують з вагінального секрету при фагоцитозі епітеліоцитів і бактеріальних клітин зі складу сімбіотної та умовно-патогенної мікрофлори сечостатевих шляхів [58].
При обстеженні пацієнтів методом ПЛР на наявність хламідійної, уреаплазмової та мікоплазмової інфекції отримані наступні результати. Урогенітальний хламідіоз виявлено у 3,6 % осіб, що пройшли обстеження, ureaplasma spp. виявлено у 29,7 %, Ureaplasma urealyticum – у 3,4 % пацієнтів.
Наявність Мycoplasma genitalium підтверджено методом ПЛР 1,1 % пацієнтів, Мycoplasma hominis – у 6,0 %. Дані наведені на рисунку 3.1.
Рисунок 3.1 – Відсоток позитивних результатів з обстежених пацієнтів представників загального населення методом ПЛР на наявність ІПСШ.
Згідно отриманих результатів, методом ІФА виявлений Ig А до Chlamydia trachomatis у 11,1% обстежених, до Ureaplasma urealyticum – 17,1 %, Мycoplasma genitalium – 17,7 %, Мycoplasma hominis – у 12,8 % пацієнтів.
Виявлено антитіла (Ig G) до Chlamydia trachomatis у 44,7 % осіб, що пройшли обстеження, до Ureaplasma urealyticum – у 30,0 %, Мycoplasma genitalium – 20,0 %, Мycoplasma hominis – 17,1 % обстежених (рисунок 3.2).
Рисунок 3.2 – Дані обстеження пацієнтів, представників загального населення на наявність ІПСШ методом ІФА (Ig G), відсоток позитивних результатів
Серед осіб, що пройшли обстеження методом ІФА (Ig G) на гепатити В та С, позитивні результати виявлені в 4,5 % та 15,8 % випадків відповідно. Дані наведені на рисунку 3.2 та в таблиці 3.2.
При обстеженні пацієнтів на наявність ЦМВ та ВЕБ отримані наступні результати. До ЦМВ підвищений вміст Ig M в крові визначений у 42,9 % обстежених, до ВЕБ – 50,0 %. Позитивність до ЦМВ (Ig G) виявлена у 72,7 %, ВЕБ – 75,0 % осіб, що пройшли обстеження. Дані наведені на рисунку 3.3.
На наявність ВІЛ методом ІФА (сумарні Ig) вирішили пройти обстеження 4,4 % пацієнтів. Позитивний результат виявлений лише у 1 особи, що склало 0,2 % від усієї підгрупи 1.1.
За даними дослідження, наявність високоонкогенних типів ВПЛ методом ПЛР виявлена у 46,2 % обстежених пацієнтів.
До ВПГ (тип 1, 2) підвищений вміст Ig G виявлено в крові 91,7 % осіб, що пройшли обстеження.
Таким чином, найбільш часто виявлялись інфекції групи системних герпесвірусів – ЦМВ та ВЕБ – близько трьох чвертей (75%), та онкогенних ВПЛ (46%) серед пацієнтів дерматовенерологічних лікувально-профілактичних закладів (ЛПЗ). Досить часто виявляються так звані «атипові» бактерії – хламідії та урогенітальні мікоплазми. Тобто переважають внутріклітинні паразити, які здатні, за даними багатьох попередніх досліджень, суттєво пошкодити імунну систему. При цьому збільшується кількість клітин–мішеней, необхідних на початкових стадіях зараження ВІЛ (макрофагів, дендритних клітин, СD+ лімфоцитів) [53, 208].
3.1.2 Результати обстеження представників уразливих груп населення
З метою визначення розповсюдженості ІПСШ та ВІЛ серед представників уразливих щодо зараження ІПСШ та ВІЛ груп населення (зокрема СІН, РКС, ЧСЧ) та їх статевих партнерів, які увійшли до групи 2, проведено аналіз даних за період 2011-2015 роки МБФ «Благо» (Харків), Слов’янської міської громадської організації “Наша допомога”, ПОБФ “Громадське здоров’я” (Полтава).
З використанням швидких ІХГ тестів проводилося обстеження в м. Харкові представників уразливих груп на наявність сифілісу, урогенітального хламідіозу, гонореї, гепатитів В та С, ВІЛ (рисунки 3.3, 3.4).
Отримані дані свідчать, що в м. Харків гепатити В та С, а також гонорея частіше зустрічаються у СІН, сифіліс – в групі РКС.
Серед представників групи ЧСЧ найбільш розповсюджені урогенітальний хламідіоз та ВІЛ-інфекція. Також у групі ЧСЧ гепатити В і С, хламідіоз та ВІЛ зустрічаються частіше, ніж серед представників РКС.
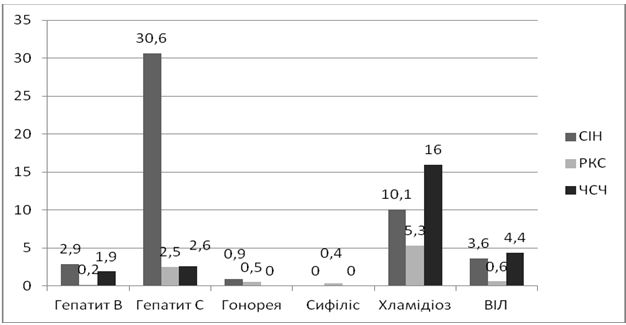
Рисунок 3.3 – Розповсюдженість ІПСШ та ВІЛ серед представників уразливих груп, обстеження швидкими тестами, м. Харків, 2012-2014 рр., %.
У середньому 4 % СІН інфіковані ІПСШ та ВІЛ, 1,7 % РКС та 5 % ЧСЧ. Антитіла до вірусних гепатитів виявляються у приблизно 17 % СІН, 1,4% РКС та в середньому у 2,3 % ЧСЧ.
З отриманих даних зрозуміло, що ІПСШ (гонорея, хламідіоз, сифіліс) виявляються в середньому у 3,7% представників уразливих груп, що пройшли обстеження з використанням швидких тестів у м. Харків.
При аналізі даних обстеження на ВІЛ швидкими тестами звертає на себе увагу розповсюдженість ВІЛ не тільки серед ін’єкційних наркоманів, але й серед групи ЧСЧ. Також високий рівень інфікування спостерігається серед статевих партнерів СІН, але не завжди ці особи проходять обстеження (дані за 2015 рік відсутні) (рисунок 3.4).
В 2015 році дані виявлення ІПСШ у представників уразливих груп відрізняються від попередніх років (рис. 3.5).
Розповсюдженість ВІЛ, сифілісу, хламідіозу в групі ЧСЧ значно вища, ніж серед групи РКС.
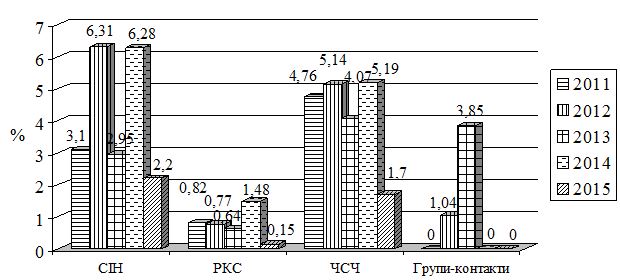
Рисунок 3.4 – Розповсюдженість ВІЛ серед представників уразливих груп населення та груп-контактів, обстеження швидкими тестами, м. Харків, 2011-2015 рр., %
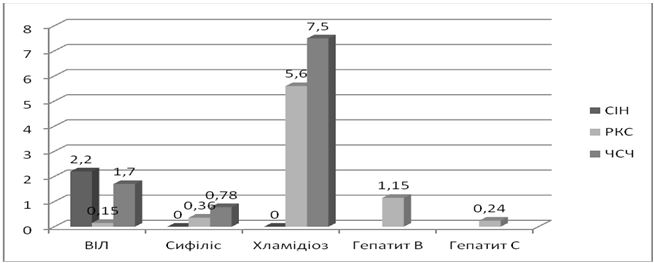
Рисунок 3.5 – Розповсюдженість ІПСШ та ВІЛ серед представників уразливих груп, дані обстеження швидкими тестами, м. Харків, 2015 р., %.
При аналізі даних, отриманих з інших регіонів України, наявні відміни в розподілі ІПСШ. При аналізі даних з м. Слов’янськ виявлено серед групи СІН високий відсоток уніфікованості ВІЛ, гонореєю, гепатитами (в середньому близько 1,3, 4,2 та 19 % відповідно). Дані наведені на рисунку 3.6.
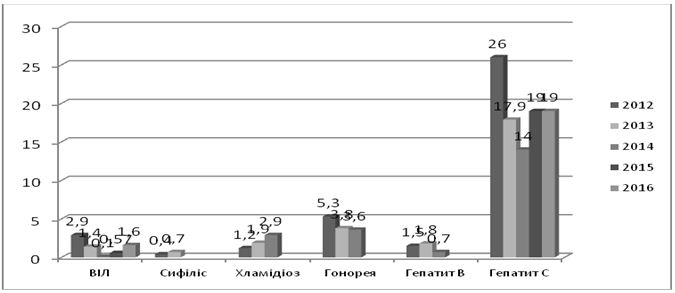
Рисунок 3.6 – Розповсюдженість ІПСШ серед СІН м. Слов’янськ, обстеження швидкими тестами, 2012-2016 рр., %.
Серед групи РКС м. Слов’янськ поширеність ВІЛ та сифілісу й хламідіозу вища за дані групи СІН (4,8 % та 2,3 % відповідно). Привертає увагу значний відсоток виявлених в 2015 р. осіб з сифілісом (3,8 %) та гонореєю (10 %). Дані наведені на рисунку 3.7.
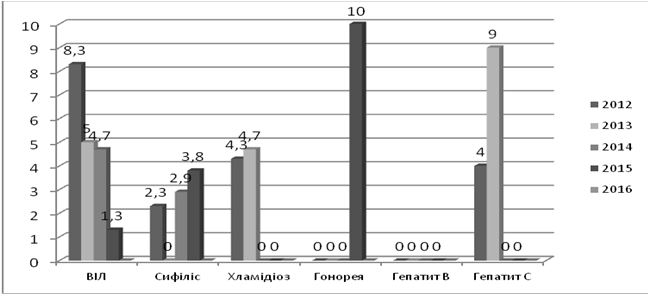
Рисунок 3.7 – Розповсюдженість ІПСШ серед РКС м. Слов’янськ, обстеження швидкими тестами, 2012-2015 рр., %
Отримані дані щодо обстеження статевих партнерів СІН свідчать про виявлення також значного відсотку (від 5 % та вище) розповсюдження сифілісу, ВІЛ та гонореї серед даного прошарку населення регіону (рисунок 3.8).
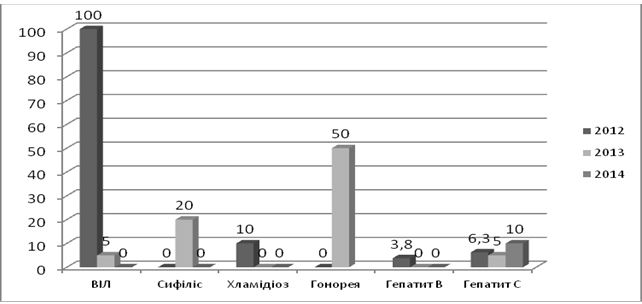
Рисунок 3.8 – Результати обстеження швидкими тестами статевих партнерів СІН м. Слов’янськ, обстеження, 2012-2014 рр., %
При аналізі даних з тестування швидкими тестами представників уразливих груп (СІН, РКС) та їх статевих партнерів в м. Полтава виявлено значне поширення гепатитів В та С серед даного контингенту населення (рисунки 3.9, 3.10).
Серед групи СІН поширення гепатиту В сягає 8,4 %, а гепатиту С – 47,8 %. Серед РКС – 4,4 % та 29,8 % відповідно. Такі високі дані розповсюдженості гепатитів серед РКС можна пов’язати з широким розповсюдження вживання наркотичних засобів, згідно даних спостережень. Дані поширення сифілісу серед РКС перевищують показники групи СІН майже в 10 разів (рисунок 3.10).
Інфікованість ВІЛ вища серед групи СІН – 2,8 %. Але як серед РКС, так й серед статевих партнерів СІН приблизно однаковий відсоток поширення ВІЛ – 0,7 % та 0,8 % відповідно. Таку поширеність інфекцій можна пов’язати з практикою незахищених сексуальних контактів та, ймовірно, належність статевих партнерів особисто до уразливих груп.
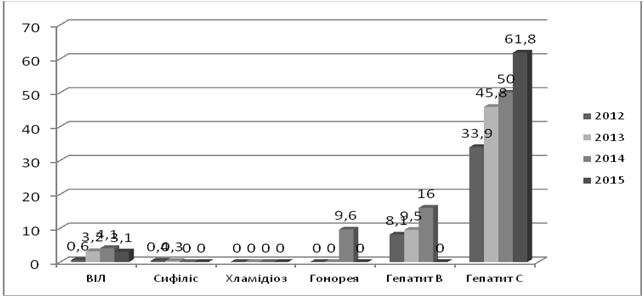
Рисунок 3.9 – Розповсюдженість ІПСШ серед СІН м. Полтава, обстеження швидкими тестами, 2012-2015 рр., %.
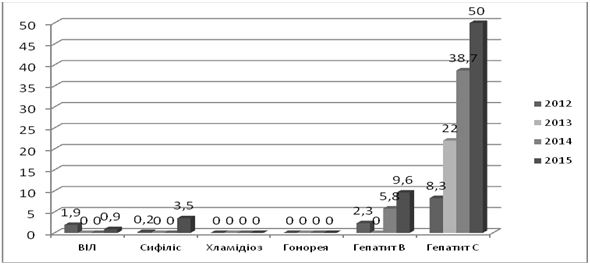
Рисунок 3.10 – Розповсюдженість ІПСШ серед РКС м. Полтава, обстеження швидкими тестами, 2012-2015 рр., %
Дані розповсюдженості гепатитів В та С серед статевих партнерів майже сягають даних групи РКС – 4,0 % та 28,1 % відповідно (рисунок 3.11).
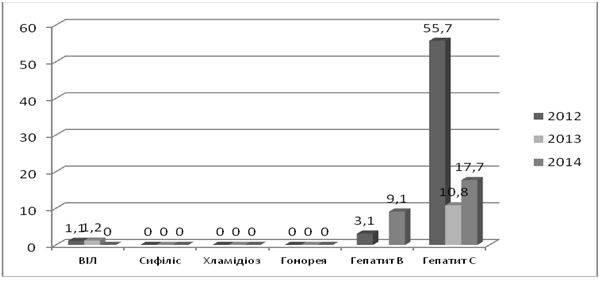
Рисунок 3.11 – Результати обстеження швидкими тестами статевих партнерів СІН м. Полтава, обстеження швидкими тестами, 2012-2014 рр., %
В Закарпатській області спостерігається зовсім інша епідеміологічна картина. Дані наведені на рисунках 3.12 та 3.13.
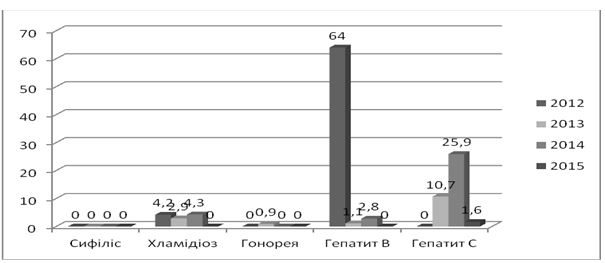
Рисунок 3.12 – Розповсюдженість ІПСШ серед СІН, Закарпатська область, обстеження швидкими тестами, 2012-2015 рр., %.
В даному регіоні за останні роки майже зовсім не спостерігаються випадки зараження ВІЛ, сифілісом та гонореєю серед груп СІН та РКС.
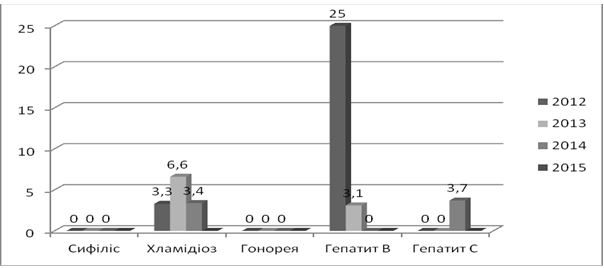
Рисунок 3.13 – Розповсюдженість ІПСШ серед РКС, Закарпатська область, обстеження швидкими тестами, 2012-2015 рр., %
Але відсоток поширення гепатитів В та С в даних групах сягає для СІН 16,9 % та 9,5 % відповідно, для РКС – 6 % та 1 %. В даних групах протягом останніх років спостерігається поширення хламідіозу на рівні близько 3 %.
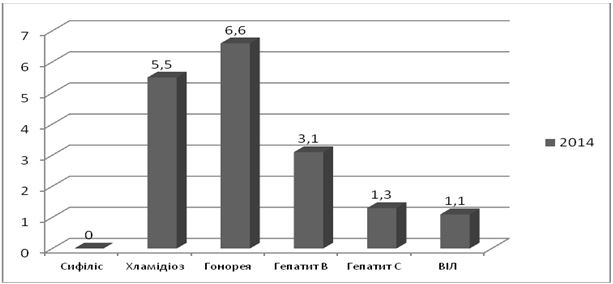
Рисунок 3.14 – Розповсюдженість ІПСШ серед ЧСЧ, Закарпатська область, обстеження швидкими тестами, 2014 р., %.
За отриманими даними, в групі ЧСЧ в кілька разів вище спостерігається розповсюдження гонореї та ВІЛ ніж в інших групах.
Проведений аналіз даних, отриманих з Центрів СНІДу м. Харкова та Закарпатської облатсі. Розповсюдженість ІПСШ серед представників уразливих груп також можна оцінити з наступних даних.
У представників уразливих груп у Харківському КЗ “Обласний центр СНІДу” були діагностовані різноманітні ІПСШ з приводу чого пацієнти отримували подальше лікування. На рисунку 3.17 наведені дані спостережень за 2010-2015 роки.
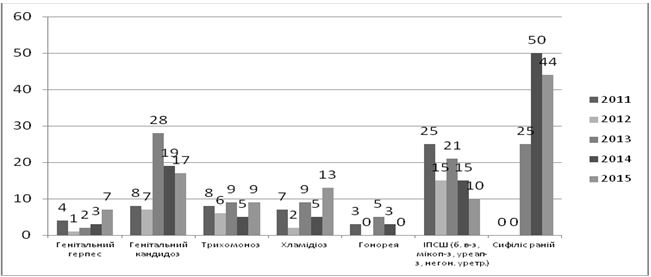
Рисунок 3.15 – ІПСШ, що діагностовані та проліковані у представників уразливих груп населення, 2010-2015 рр., Харківська область, кількість випадків.
Аналізуючи отримані дані по м. Харків та Харківській області, найчастіше виявлявся генітальний кандидоз, який спостерігався у (24,5 ± 4,3) % пацієнтів, що отримали лікувальну допомогу. Генітальний герпес траплявся у (6,0 ± 2,4) % осіб, трихомоноз та урогенітальний хламідіоз – у (9,5 ± 2,9) % та (12,0 ± 3,2) % представників уразливих груп відповідно. Гонорея склала в середньому у (1,5 ± 1,2) %. Уреаплазмоз, мікоплазмоз, бактеріальний вагіноз, негонококові уретрити у (19,5 ± 2,4) % хворих були діагностовані та проліковані. З 2013 року спостерігається зростання реєстрації нових випадків сифілісу серед представників уразливих груп. В 2013 році наявність раннього сифілісу встановлена у (17,4 ± 3,2) % пацієнтів уразливих груп, в 2015 – в (44,0 ± 4,9) % (рис. 3.16).

Рисунок 3.16 – Відсоткове співвідношення інфекцій в загальній кількості пролікованих ІПСШ у представників уразливих груп, Харківська область 2012-2015.
Також були проаналізовані дані Закарпатського центру СНІДу. Дані наведені на рисунках 3.17 та 3.18.
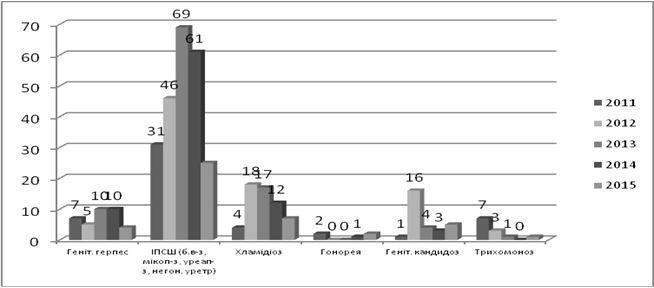
Рисунок 3.17 – ІПСШ, що діагностовані та проліковані у представників уразливих груп населення, 2010-2015 рр., Закарпатська область, кількість випадків.
Найбільш розповсюдженою патологією, з приводу якої зверталися до фахівців представники уразливих груп Закарпатської області, були бактеріальний вагіноз, мікоплазмоз, негонококові уретрити, об’єднані в одну групу. Ця патологія склала близько 65 % від загальної кількості пролікованих ІПСШ. Другою по поширенню патологією, яка потребувала лікування, був хламідіоз – 15 %. На частку генітального кандидозу прийшлося 8 %, близько 1-3 % склали гонорея, трихомоноз та генітальний герпес.
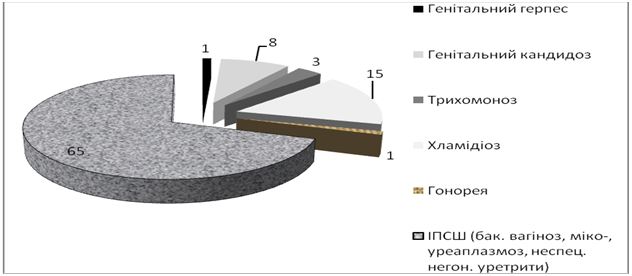
Рисунок 3.18 – Відсоткове співвідношення інфекцій в загальній кількості пролікованих ІПСШ у представників уразливих груп, Закарпатська область 2012-2015.
Таким, чином, серед, осіб з загального населення спостерігається високий відсоток виявлення збудників ІПСШ: трихомонади (30,1 %), Ureaplasma spp (29,7 %), ВПЛ (44,7 %). Зустрічається високий відсоток позитивності (ІФА, Ig G) до Ureaplasma urealyticum (30,0 %), Мycoplasma genitalium (20,0 %), Chlamydia trachomatis (44,7 %), ВПГ-1, 2 (91,7 %), гепатит С (15,8 %), ЦМВ (72,7 %), ВЕБ (75,0 %).
Найпоширенішими ІПСШ серед представників уразливих груп є урогенітальний кандидоз, хламідіоз, мікоплазмоз, бактеріальний вагіноз, у досить високому відсотку випадків спостерігається розповсюдженість ВІЛ (1-6 %) та гепатиту С (2,5-30,0 %).
Серед статевих партнерів представників уразливих груп постерігається поширення ВІЛ, гепатитів, сифілісу, гонореї на достатньо високому рівні (від 1,0 до 20 %).
Виявлення трихомонозу в уразливих групах відзначається на рівні 3-10 %, що нижче даних загального населення. Ймовірно, спостерігається недостатнє виявлення інфекції серед контингенту осіб уразливих груп.
3.2 Відміни в соціальній характеристиці ВІЛ-негативних та ВІЛ-позитивних представників уразливих груп
Для визначення відмін між загальною популяцією та уразливими групами також було проведено наступне спостереження Відбувалося опитування пацієнтів з метою визначення соціальних, епідеміологічних, поведінкових відмін, визначення клінічних особливостей перебігу ІПСШ в різних групах населення, особливостей місцевого слизового імунітету (визначення вмісту sIg A).
Під спостереженням знаходилися 65 осіб, що належали до груп ризику і склали підгрупу 2.1. До підгрупи 2.1а увійшли 25 пацієнтів з ВІЛ-позитивним статусом. Підгрупа 2.1б складалася з 40 ВІЛ-негативних осіб.
Більшість підгрупи 2.1 склали жінки – 52 ([80,0 ± 4,9] %). Чоловіків серед пацієнтів цієї підгрупи було 13 ([20,0 ± 4,9] %). Середній вік пацієнтів склав (26,7 ± 1,6) року.
При аналізі даних, отриманих при опитуванні представників уразливих груп, були виявлені певні соціальні відмінності в самій групі.
На рисунку 3.19 представлені дані розподілу пацієнтів підгрупи 2.1а згідно відношення до групи ризику. Серед ВІЛ-позитивних осіб більшість представлена СІН. На їх частку прийшлося (48,0 ± 9,9) % (12 осіб). Друга за чисельністю уразлива група – РКС, які склали (28,0 ± 8,9) % (7 осіб). ЧСЧ також увійшли до даної підгрупи, сягнувши (24,0 ± 8,5) % (6 осіб) (рис. 3.19).
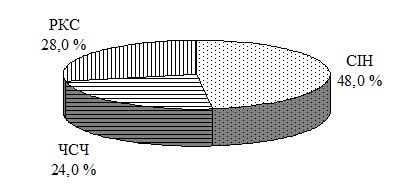
Рисунок 3.19 – Розподіл пацієнтів з ВІЛ-позитивним статусом залежно від відношення до групи ризику.
Було встановлено, що серед осіб підгрупи 2.1б більшість – (62,5 ± 7,6) % (25 осіб) склали РКС. На частку СІН прийшлося (20 ± 6,3) % випадків – 8 осіб. Група ЧСЧ становила (17,5 ± 6,1) % – 7 осіб. Дані наведені на рисунку 3.20.
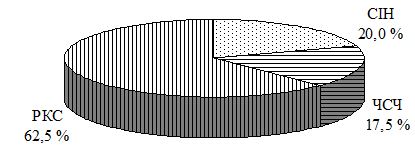
Рисунок 3.20 – Розподіл ВІЛ-негативних пацієнтів залежно від відношення до групи ризику.
3.3 Відміни в соціальних та епідеміологічних особливостях між особами з інфекціями, що передаються статевим шляхом, з різних популяційних груп
Проведено порівняльний аналіз соціальних та епідеміологічних особливостей різних груп населення [загальна популяція (підгрупа 1.1, 495 осіб) та уразливі групи (підгрупа 2.1, 65 осіб)]. Для порівняння груп (загального населення та уразливої групи) та всередині групи ризику обчислювалися коефіцієнти кореляції Кенделла і Спірмена.
Встановлено існування слабкої кореляційної залежності всередині підгрупи 2.1 між показниками «Ранній початок статевого життя» і «Хламідіоз»: коефіцієнт зв’язку Спірмена . Чим молодшим був вік особи з ІПСШ, тим частіше спостерігалося інфікування хламідіозом. Дані наведені в таблиці 3.3.
Таблиця 3.3 – Коефіцієнти кореляції між показниками «Ранній початок статевого життя» і «Хламідіоз»
| Значення коефіцієнта кореляції | |
| Кенделла
(=60) |
0,297 |
| Спірмена
(=60) |
0,354 |
Рисунок 3.21 – Коефіцієнти кореляції між показниками «Ранній початок статевого життя» і «Хламідіоз»
Виявлено існування середньої кореляції всередині підгрупи 2.1 між показниками «Хламідіоз» і «Гонорея»: коефіцієнт зв’язку Спірмена . Таке ж значення має і коефіцієнт зв’язку Кендалла . Встановлена наявна зворотня кореляція – поєднання збудників статевих інфекцій в асоціацію «Хламідіоз + Гонорея» зустрічається рідко (таблиця 3.4). Ймовірно даний показник є характерним для нашого регіону.
Таблиця 3.4 – Коефіцієнти кореляції між показниками «Гонорея» і «Хламідіоз» у представників уразливих груп
| Значення коефіцієнта кореляції | |
| Кенделла
(=60) |
-0,424 |
| Спірмена
(=60) |
-0,424 |
Рисунок 3.22 – Коефіцієнти кореляції між показниками «Гонорея» і «Хламідіоз»
Встановлено існування слабкої кореляційної залежності всередині підгрупи 2.1 між показниками «ВІЛ» і «Хламідіоз»: коефіцієнт зв’язку Спірмена . Таке ж значення має і коефіцієнт зв’язку Кенделла . Згідно даних дослідження дана асоціація збудників (ВІЛ та хламідіоз) часто зустрічається у пацієнтів підгрупи 2.1. Ймовірно таким чином підтверджується ко-факторна особливість хламідіозу – при наявності хламідійної інфекції вище можливість інфікування ВІЛ, що співпадає з даними інших дослідників [185, 191].
Таблиця 3.5 – Коефіцієнти кореляції між показниками «ВІЛ» і «Хламідіоз»
| Значення коефіцієнта кореляції | |
| Кенделла
(=60) |
0,256 |
| Спірмена
(=60) |
0,256 |
Рисунок 3.23 – Коефіцієнти кореляції між показниками «ВІЛ» і «Хламідіоз»
За даними, наведеними в таблиці 3.6, існує слабка кореляція між підгрупами 1.1 і 2.1 між показниками «Належність до групи ризику» і «Хламідіоз»: коефіцієнт зв’язку Спірмена . Таке ж значення має і коефіцієнт зв’язку Кендалла . Таким чином, встановлено, що у представників підгрупи 2.1 ймовірність зараження хламідійною інфекцією значуще вища.
Таблиця 3.6 – Коефіцієнти кореляції між показниками «Належність до групи ризику» і «Хламідіоз»
| Значення коефіцієнта кореляції | |
| Кенделла
(=305) |
0,283 |
| Спірмена
(=305) |
0,283 |
Рисунок 3.24 – Коефіцієнти кореляції між показниками «Належність до групи ризику» і «Хламідіоз»
Таким чином, встановлено:
- що ранній початок статевого життя сприяє частішому інфікуванню хламідійною інфекцією;
- що поєднання збудників статевих інфекцій в асоціацію «Хламідіоз + Гонорея» зустрічається рідко, ймовірно не є характерним для нашого регіону, визначена зворотна кореляція;
- що асоціація збудників (ВІЛ та хламідіоз) частіше зустрічається у представників уразливих груп;
- існування слабкої кореляції між групами загального населення та представниками уразливих груп між показниками «Належність до групи ризику» і «Хламідіоз». У представників груп ризику значуще вища ймовірність зараження хламідійною інфекцією.
Отримані результати підтверджуються вирахуваними значущими непараметричними показниками кореляції (коефіцієнти кореляції Кендалла і Спірмена).
* * *
Таким чином, на основі отриманих даних можна зробити такі висновки.
- Серед осіб із загального населення спостерігається високий відсоток виявлення збудників ІПСШ: трихомонади (30,1 %), Ureaplasma spp (29,7 %), ВПЛ (44,7 %). Серед осіб, що пройшли обстеження, встановлений значний відсоток позитивності (ІФА, Ig G) до Ureaplasma urealyticum (30,0 %), Мycoplasma genitalium (20,0 %), Chlamydia trachomatis (44,7 %), ВПГ-1, 2 (91,7 %), гепатит С (15,8 %), ЦМВ (72,7 %), ВЕБ (75,0 %). У пацієнтів даної групи частіше реєструються помірні клінічні прояви захворювань на тлі перебігу хронічного процесу.
- Найпоширенішими ІПСШ серед представників уразливих груп є урогенітальний кандидоз (6-14 %), хламідіоз (15-30 %), гонорея (4-12 %), генітальний герпес (19 %), у досить високому відсотку випадків спостерігається розповсюдженість ВІЛ (1-6 %) та гепатиту С (2,5-30,0 %), ускладнення перебігу ІПСШ (до 40 %). У хворих цих груп частіше виявляється мікст-інфікування ІПСШ, яке супроводжується маніфестацією клінічних проявів.
- Необхідно проводити ретельне обстеження статевих партнерів представників уразливих груп з метою виявлення прихованих ІПСШ. Дані свідчать про поширеність ВІЛ, гепатитів, сифілісу, гонореї серед статевих партнерів високого рівня (від 1,0 до 20 %).
- Відсоток виявлення трихомонозу в уразливих групах складає від 3 до 10 %, що значно нижче даних, що спостерігаються в загальній популяції. Ймовірно, поширеність інфекції в уразливих групах значно вища. Особи даного контингенту, що залишаються не виявленими, є резервуаром інфекції. Даний факт сприяє поширенню трихомонозу в популяції та виникненню хронічних запальних процесів у осіб з ІПСШ. Дане питання потребує подальшого дослідження.
- З метою своєчасного виявлення патології, попередження розповсюдження ІПСШ та ВІЛ доцільно проводити обстеження серед всіх верств населення не тільки на ВІЛ, сифіліс та найбільш розповсюджені ІПСШ, а й на наявність вірусних інфекцій (гепатити, герпесвіруси) та їх своєчасне лікування. Інфікування цими збудниками має значні наслідки для репродуктивного здоров’я, значна частина їх передається при сексуальних контактах, наявність в організмі людини впливає на стан імунітету.
- Виявлена різниця в розподілі пацієнтів з уразливих груп з ВІЛ-позитивним та ВІЛ-негативним статусом за приналежністю до окремих груп ризику. Більшість ВІЛ-негативних осіб складають РКС (64,6 %), а більшість ВІЛ-позитивних – СІН (47,1 %).
- Встановлено, що ранній початок статевого життя сприяє частішому інфікуванню хламідійною інфекцією. Встановлено, що поєднання збудників статевих інфекцій в асоціацію «Хламідіоз + Гонорея» зустрічається рідко, ймовірно не є характерним для нашого регіону. Виявлено, що асоціація збудників (ВІЛ та хламідіоз) часто зустрічаються у пацієнтів серед представників уразливих груп. Встановлено існування слабкої кореляції між підгрупами ризику та загального населення між показниками «Належність до групи ризику» і «Хламідіоз». У представників груп ризику значимо вища ймовірність зараження хламідійною інфекцією. Отримані твердження підтверджуються вирахуваними значущими непараметричними показниками кореляції (коефіцієнти кореляції Кендалла і Спірмена).
Публікації
- Щербакова Ю.В. Епідеміологічні особливості розповсюдженості ІПСШ серед загального населення та уразливих груп // Актуальні проблеми сучасної медицини: Вісник Української медичної стоматологічної академії. – 2015. – Т. 15, ч. 2, № 3 (51). – С. 186-192.
- Современные особенности инфекций, передающихся половым путем, и ВИЧ в Украине / Г.И. Мавров, Г.М. Бондаренко, Ю.В. Щербакова, А.Л. Гутнев // Материалы V съезда дерматовенерологов Республики Беларусь «Актуальные вопросы дерматовенерологии и косметологии». – Искусство медицины. – 2011. – № 15 (51). – С. 50-51.
- Мавров Г.И. Проблема ИППП и ВИЧ на Украине / Г.И. Мавров, Г.М. Бондаренко, Ю.В. Щербакова // Сборник тезисов 2-го Конгресса Евро-азиатской ассоциации дерматовенерологов, г. Москва, 21-23 марта 2012 г. – М., 2012. – С. 107.
- Mavrov G. Prevalence features of sexually transmitted infections and HIV in Ukraine / G. Mavrov, G. Bondarenko, I. Scherbakova // Abstract book of 27th IUSTI Conference “STIs and HIV: Time for protection”, Antalya (Turkey), 6-8 September 2012. – Antalya, 2012. – P. 63.
РОЗДІЛ 4
ОСОБЛИВОСТІ ЗАСТОСУВАННЯ МОТИВАЦІЙНОГО КОНСУЛЬТУВАННЯ ПАЦІЄНТІВ З ІНФЕКЦІЯМИ, ЩО ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ, З МЕТОЮ ЗМІНИ РИЗИКОВАНОЇ СЕКСУАЛЬНОЇ ПОВЕДІНКИ В БІК БІЛЬШ БЕЗПЕЧНОЇ
4.1 Особливості проведення мотиваційного консультування
Згідно з оціночними даними, все більше нових випадків інфікування ВІЛ в світі відбувається в результаті гетеросексуальних контактів. Вживання психоактивних речовин (алкоголю, наркотиків) збільшує ризик виникнення небезпечних сексуальних контактів з випадковими партнерами без використання презервативів. Часте явище серед представників уразливих груп – надання сексуальних послуг заради отримання грошей або наркотиків.
При роботі з особами, що належать до уразливих груп, з приводу зміни їх ризикованої поведінки в бік більш безпечної, доцільно застосовувати прийоми мотиваційного консультування. Мета цього заходу – мотивувати представників уразливих груп приймати рішення щодо зміни свого способу життя на більш безпечний і конструктивний [77, 102, 260].
Завданнями мотиваційного консультування є допомогти пацієнту:
- проаналізувати свою поведінку;
- визначитися в тому, чи готовий він щось змінити у своїй поведінці;
- визначитися, яким чином можна і потрібно діяти, втілюючи в життя заплановані зміни.
Під час консультування пацієнтам з приводу ІПСШ слід надавати інформацію коротко та зрозуміло про основні ІПСШ та методи тестування. Необхідно проводити просвітницьку роботу щоб сягнути поведінкових змін у певній групі. Основна мета просвіти – підвищити рівень знань, змінити ставлення до життя, через надання інформації для вмотивованого, осмисленого переходу осіб цільової групи до здорової поведінки [260].
Також доцільно нагадувати пацієнтові, що:
- загроза інфікування ІПСШ та ВІЛ не залежить від соціального стану, найвизначнішу роль грає ризикована поведінка;
- тільки знання про шляхи передачі та профілактики ІПСШ та ВІЛ та вміння конкретної людини здатні захистити його від зараження;
- більшість випадків передачі ІПСШ та ВІЛ-інфекції відбувається при статевих контактах.
На можливість інфікування ІПСШ та ВІЛ статевим шляхом впливають стилі сексуального життя та форми активності (сексуальні техніки). Техніки, під час яких не відбувається пошкодження цілісності шкіри та слизової оболонки, а також контакту з виділеннями, можна визнати безпечними.
Основними принципами безпечного сексу є:
- уникнення технік, які ушкоджують;
- захист слизової оболонки статевих органів (чоловічий чи жіночий презерватив, латексні бар’єри, що застосовуються під час орально-генітальних контактів),
- обмеження контакту із заразними виділеннями [49].
У результаті консультування виникає конфіденційний діалог між медпрацівником та пацієнтом, який допомагає пацієнту прийняти власне поінформоване рішення щодо шляху і методу вирішення своєї проблеми. Основою мотиваційного консультування з метою зміни поведінки є оцінка індивідуальних ризиків пацієнта і розробка індивідуального плану зміни поведінки в бік більш безпечної.
У кожної особи існують:
- індивідуальні ризики інфікування ІПСШ;
- індивідуальна мотивація до зниження цих ризиків ;
- індивідуальні методи зниження цих ризиків.
Провести оцінку індивідуальних ризиків пацієнта та розробити індивідуальний план зниження ризиків інфікування ІПСШ можна застосовуючи наведені нижче методики.
Методика оцінки індивідуальних ризиків пацієнта
Мета: Визначити в поведінці пацієнта індивідуальні ризики щодо можливості інфікування ІПСШ/ВІЛ та допомогти їх усвідомити.
Методика 1:
1. Запропонувати розповісти про причину інфікування та можливі або наявні ризики ІПСШ-інфікування.
2. З’ясувати причини занепокоєння щодо наявності або можливості інфікування ІПСШ;
3. час і загальні обставини останнього випадку статевої ризикованої поведінки;
4. використання презерватива (наскільки вчасно і правильно його використовували);
5. що спонукало погодитися на незахищений сексуальний контакт, якщо такий був;
6. вживання психоактивних речовин в період такого контакту.
Методика 2:
1. з’ясувати: стурбованість пацієнта щодо статевого акту з певною особою;
2. чи була б поведінка така ж, якби він знав, що це особа інфікована ІПСШ; якщо ні, то яким чином змінилася б його поведінка;
3. запитати про: те, як часто виникають ризиковані ситуації;
4. кількість статевих партнерів протягом останніх 6 місяців;
5. наявність випадкових статевих партнерів; досвід частої зміни статевих партнерів.
6. з’ясувати: частоту використання презерватива, від чого залежить рішення використовувати його;
7. мотивацію пацієнта щодо прийняття рішення використовувати або не використовувати презерватив з різними партнерами.
Методика розробки індивідуального плану зниження ризиків інфікування ІПСШ
Методика 1:
1. З’ясувати: дії пацієнта в минулому для зменшення ризику інфікування ІПСШ та захисту себе і партнера.
2. Розповісти пацієнту про заходи профілактики зараження ІПСШ/ВІЛ.
3. З’ясувати: чи практикував він безпечні статеві стосунки в минулому, якщо так, то чому; що було найбільш складним у процесі зменшення ризику інфікування ВІЛ.
4. З’ясувати: вплив вживання психоактивних речовин (наркотиків або алкоголю) на рішення пацієнта вступати в статеві контакти високого ризику; наявність і причини ситуацій або партнерів, коли пацієнтові складно забезпечити безпеку статевого зв’язку, якщо так, то чому;
5.вплив інших життєвих обставин (відсутність роботи, розрив відносин тощо) на здатність пацієнта практикувати безпечні статеві стосунки.
Методика розробки індивідуального плану зниження ризиків інфікування ІПСШ
Методика 2:
1. З’ясувати здатність пацієнта обговорювати питання ІПСШ/ВІЛ зі своїми сексуальними партнерами; зміст розмов з ними про зменшення ризику інфікування ІПСШ/ВІЛ та його почуття при цьому.
2. Попросити пацієнта: продемонструвати, як би він повідомив своєму статевому партнерові, що він бажає використовувати презерватив; розповісти, яку, на думку пацієнта, відповідь дав би його партнер, якби він попросив його пройти тестування на ІПСШ/ВІЛ.
3. З’ясувати, що саме ускладнює користування презервативом. Обговорити один-два приклади з його життя.
4. З’ясувати, що було б найлегше і найскладніше пацієнтові змінити в своїй ризикованій поведінці, обговорити чому.
5. Назвати пацієнту можливі варіанти зменшення його ризику. З’ясувати: наскільки зручно почуває себе пацієнт щодо застосування того чи іншого варіанту зменшення його ризику (наприклад, використання презервативу зі статевим партнером);
6. Обговорити і допомогти зрозуміти пацієнту існуючі протиріччя: стурбованість щодо інфікування ІПСШ та ВІЛ та небажання користуватися презервативами, страх інфікуватися і бажання мати свободу і декілька партнерів.
Одним з основних прийомів мотиваційного консультування є використання при спілкування відкритих питань, які припускають розгорнуту відповідь, викликають міркування або спонукають до розповіді. Також рекомендується задавати уточнюючі питання [70].
Консультування, спрямоване на зміну поведінки з метою профілактики ІПСШ/ВІЛ серед уразливих груп, спрямоване на вирішення таких завдань:
- перехід пацієнта до більш безпечної сексуальної поведінки;
- бути в тверезому стані під час сексу;
- завжди застосовувати презерватив (підвищити частоту використання презервативів при проникаючих сексуальних контактах);
- використовувати презерватив протягом всього статевого контакту;
- періодично проходити обстеження на ІПСШ/ВІЛ;
- не практикували проникаючий секс і т. д.;
- спонукати пацієнта більше приділяти уваги питанням власного здоров’я, і тим знизити кількість нових випадків ІПСШ/ВІЛ в певній групі.
4.2 Визначення рівня інформованості осіб з різних верств населення, поведінкових та соціальних відмінностей
Було проведено порівняльний аналіз рівня інформованості загального та уразливих груп населення щодо ризиків передачі та інфікування ІПСШ та ВІЛ та оцінка зв’язку приналежності до груп ризику та небезпечної сексуальної поведінки.
Анкетування проводилося з використанням розроблених форм (додатки Г, Д, Е) 165 осіб з ІПСШ, які належать до різних верств населення – загальна популяція та уразливі, щодо інфікування групи (РКС, СІН, ЧСЧ). Проаналізовано дані 117 осіб, що належать до загального населення, які увійшли до підгрупи 1.2, та 48 представників уразливих груп, які склали підгрупу 2.2.
Найбільший відсоток пацієнтів [підгрупа 1.2 – 85 ([72,7 ± 4,12] %), підгрупа 2.2 – 35 ([72,9 ± 6,4] %)] складали особи у віковій групі 20-39 років. Але в підгрупі 1.2 більшість пацієнтів 20-29 лет – 49 ([41,9 ± 4,6] %), а в підгрупі 2.2 – 30-39 лет – 18 ([37,5 ± 7,0] %). Пацієнтів молодше 20 більше майже в тричі в підгрупі 2.2 (7 – (6,0 ± 3,4) % проти 2 – (4,2 ± 2,9) %), а особи старше 60 років наявні тільки в підгрупі 1.2 – 3 ([2,6 ± 1,5] %).
При анкетуванні пацієнтів з ІПСШ отримана наступна інформація. Більшість пацієнтів підгрупи 1.2 склали хворі на трихомоноз (дані перевищували показники підгрупи 2.2 у 5 разів – 93 ([79,5 ± 3,7] %) проти 8 – (16,7 ± 5,4) %), мікоплазмоз (17 ([14,5 ± 3,3] %) проти 6 ([12,5 ± 4,8] %) підгрупи 2.2). Тільки серед осіб із загального населення зустрічалися хворі на пізній латентний та неуточнений сифіліс (12 – (10,3 ± 2,8) %) та ранній латентний сифіліс (1 – (0,9 ± 0,9) %). У 9 ([7,7 ± 2,5] %) хворих підгрупи 1.2 виявлено уретрити, вульвовагінити, що в 2,5-2,8 разів рідше, ніж у підгрупі 2.2.
Більшість пацієнтів підгрупи 2.2 склали хворі на хламідіоз (29 – (60,4 ± 7,1) %). Осіб з даною патологією в 4,6 разу більше, ніж у підгрупі 1.2. Кількість пацієнтів з генітальним герпесом (9 – (18,8 ± 5,6) %) перевищує дані підгрупи 1.2 у 20 разів. Гепатити виявлені у 18 ([37,5 ± 7,0] %) обстежених, себорейний дерматит – у 9 ([18,8 ± 5,6] %). Дані перевищують показники підгрупи 1.2 в 11 та 20 разів. Тільки серед осіб, що належать до уразливих груп (підгрупа 2.2), зустрічалися хворі на ВІЛ – у 17 ([35,4 ± 6,9] %), з мікозом стоп, оніхомікозом (5 – (10,4 ± 4,4) %), кандидозом слизової рота (9 – (18,8 ± 5,6) %) та баланопоститом (3 – (6,3 ± 3,5) %). Дані наведені на рисунку 4.1.
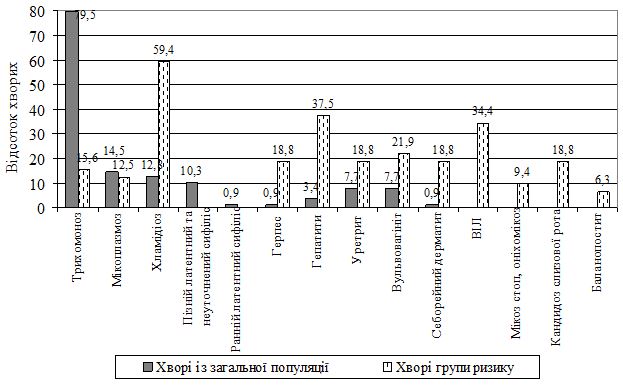
Рисунок 4.1 – Розподіл хворих із загальної популяції (підгрупа 1.2) та груп ризику (підгрупа 2.2) за виявленою патологією, %
У результаті проведеного анкетування встановлено, що самостійно за фаховою допомогою до ЛПЗ дерматовенерологічного профілю звернулась більшість пацієнтів: 83 ([70,9 ± 4,2] %) хворих підгрупи 1.2 та 30 ([62,5 ± 7,0] %) осіб з підгрупи 2.2. При профогляді виявлено майже в 10 разів більше пацієнтів підгрупи 2.2 [14 ([29,2 ± 6,6] %) проти 3 ([2,6 ± 1,5] %)], а направлено на обстеження на ІПСШ іншими фахівцями в тричі більше представників загального населення (11 – (9,4 ± 2,7) % проти 2 – (4,2 ± 2,9) %).
Ці факти свідчать про недостатнє та ймовірно пізнє виявлення пацієнтів, що належать до уразливих груп населення. Під час консультування пацієнтів необхідно проводити просвітницьку роботу, мета якої підвищення рівень знань, зміна ставлення до життя, через надання інформації для вмотивованого, осмисленого переходу осіб цільової групи до здорової поведінки. Через інформування можливо сягнути поведінкових змін у певній групі.
При опитуванні осіб підгрупи 1.2 встановлено, що джерелом зараження найчастіше були: знайомий – у 34 ([29,1 ± 4,2] %), співмешканець – у 27 ([23,1 ± 3,9] %), чоловік – у 18 ([15,4 ± 3,3] %). Випадковий знайомий та РКС лише у 9 ([7,7 ± 2,5] %) та 2 ([1,7 ± 1,2] %) випадків. Не встановлено джерело зараження у 27 ([23,1 ± 3,9] %) випадків. У підгрупі 2.2 джерелом зараження були співмешканець – у 12 ([25,0 ± 6,3] %), знайомий та випадковий знайомий – по 6 ([12,5 ± 4,8] %). Від РКС інфікувалися в 11 разів більше осіб (9 – (18,8 ± 5,6) %). Не виявлено джерело зараження у 15 ([31,3 ± 6,7] %).
Таким чином, представники уразливих груп частіше вступають в сексуальні контакти з випадковими сексуальними партнерами та РКС.
Більшість представників підгрупи 2.2 лікувалися самостійно (3 – (6,3 ± 3,5) % проти 2 – (1,7 ± 1,2) %) або не лікувалися (32 – (66,7 ± 6,8) % проти 46 – (39,3 ± 4,5) %). За фаховою допомогою до зверталися більше представників загального населення – (51 ([43,6 ± 4,6] %) проти 11 – (22,9 ± 6,1) %).
Отже, представники уразливих груп неохоче звертаються за фаховою допомогою до лікувальних закладів. В більшості випадків вони мало звертають увагу на стан здоров’я, або займаються самолікуванням, що може привести до ускладнень, хронізації процесу, розвитку репродуктивних порушень.
Характерна сексуальна активність для більшості (71 – (60,7 ± 4,5) %) підгрупи 1.2 була один раз на 2-3 дні або на тиждень (дані перевищували показники підгрупи 2.2 у 1,8 та 7,5 разів). Статеві контакти 1 раз на місяць, відсутність активності (4,3-6,0%) зустрічалися тільки в даній групі (рис. 4.2).
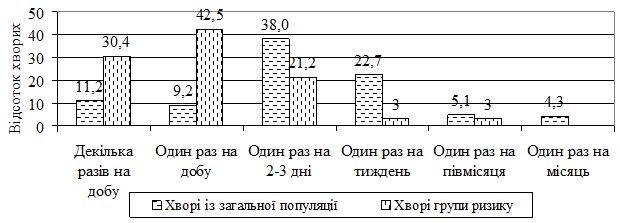
Рисунок 4.2 – Найбільш характерна сексуальна активність у групі загальної популяції та представників уразливих груп (%)
Сексуальна активність кілька разів або раз на добу була характерна для представників уразливих груп у 35 ([72,9 ± 6,4] %). Дані перевищували показники підгрупи 1.1 в 2,7 та 4,6 рази. Дані наведені на рисунку 4.2.
Найчастіше особи з підгрупи 1.2 зазначали потребу в статевих контактах раз в 2-3 дні або один раз на тиждень – 81 ([69,2 ± 4,3] %) респондентів. Дані потреби в статевому акті один раз на тиждень в даній групі переважали в 2 рази показник підгрупи 2.2. Потреба в статевих контактах кілька разів або раз на добу характерна для підгрупи 2.2 (вищі за дані підгрупи 1.2 в 2,5 та 1,14 рази).
Потреба в сексуальній активності один раз в півмісяці або місяць однакова в обох групах – близько 3 %. Відсутність потреби в сексуальних контактах у 6 ([5,1 ± 2,0] %) випадків спостерігалася тільки в підгрупі 1.2. Дані наведені на рисунку 4.3.
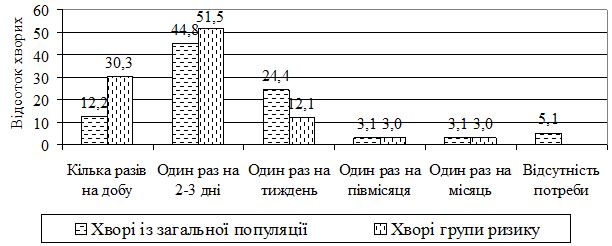
Рисунок 4.3 – Потреба у статевому акті у групі загальної популяції та представників уразливих груп (%)
Пацієнтам при консультування з приводу ІПСШ слід доводити інформацію, що для жінок сприйнятливість до зараження під час вагінального сексу значно більша, ніж у чоловіків. Крім анатомічних і фізіологічних причин (таких, як велика поверхня слизової оболонки піхви, тривалий контакт зі спермою та її поглинання), потрібно також врахувати, що ризик інфікування зростає при наявності ІПСШ, ерозії шийки матки, запаленнях слизової оболонки, під час менструації, а також при акті дефлорації.
Слід інформувати пацієнтів, що найбільш ризикованою формою сексуальної активності є анальний секс. Значно вищий ризик при даному виді сексуальних контактів існує для пасивного партнера. Це випливає з низького механічного імунітету слизової оболонки анусу, його фізіологічної функції (всмоктування) і контакту з рідиною інфікованого (сперма) [214, 228, 249].
Згідно даних опитування практикували нетрадиційні та незвичайні статеві акти 6 ([5,1 ± 2,0] %) респондентів підгрупи 1.2 та 32 ([66,7 ± 6,8] %) з підгрупи 2.2, груповий секс – тільки представники підгрупи 2.2 (5 – (10,4 ± 4,4) %).
У статевий контакт в першу добу знайомства вступали частіше особи з підгрупи 2.2 (10 – (20,8 ± 5,9) % проти 1 – (2,1 ± 2,1) %), а протягом місяця після знайомства – з підгрупи 1.2 (49 – (41,8 ± 4,6) % проти 12 – (25,0 ± 6,3) %).
Отримана при опитуванні інформація підкреслює відчутну різницю в образі життя представників загальної популяції та уразливих груп населення. Практика численних сексуальних контактів та потреба в них, девіантна поведінка – це все призводить до підвищення ризиків інфікування ІПСШ та ВІЛ представників уразливих груп.
Доцільно нагадувати пацієнтам, що на можливість зараження ІПСШ статевим шляхом впливають стилі сексуального життя та форми активності (сексуальні техніки). Їх взаємна конфігурація може збільшувати, знижувати або виключати можливість зараження цим шляхом.
Перебували у шлюбі (підгрупа 1.2) майже в 3 рази більше осіб та мали в 1,7 разу частіше одного постійного статевого партнера. За останній рік на наявність одного постійного статевого партнера вказували більшість хворих підгрупи 1.2 – в 5,4 разу частіше, ніж у підгрупі 2.2.
За останній рік 2, або від 3 до 5, або від 6 до 10 статевих партнерів мали більше в 1,4 та 5,8 та 2,5 рази відповідно представники підгрупи 2.2. Від 10, 20 та більше статевих партнерів за останній рік мали тільки представники уразливих груп у 2 ([4,2 ± 2,9] %) випадків. Точно вказати кількість статевих партнерів за рік не змогли вказати в 2,6 разу більше представників уразливих груп, ніж загального населення. Дані наведені в таблиці 4.1.
Таблиця 4.1 – Сімейний статус та кількість статевих партнерів у підгрупі загальної популяції та представників уразливих груп (%)
| Хворі із загальної популяції | Хворі групи ризику | |
| Перебували у шлюбі | 67 ([57,3 ± 4,6] %) | 9 ([18,8 ± 5,6] %) |
| Не перебували у шлюбі | 50 ([42,7 ± 4,6] %) | 39 ([81,2 ± 5,6] %) |
| Кількість постійних статевих партнерів: | ||
| Один | 93 ([79,5 ± 3,7] %) | 22 ([45,8 ± 7,2] %) |
| Два | 11 ([9,4 ± 2,7] %) | 7 ([14,6 ± 5,1] %) |
| три і більше | 5 ([4,3 ± 1,9] %) | 19 ([39,6 ± 7,1] %) |
| Кількість постійних статевих партнерів за останній рік: | ||
| Один | 79 ([67,5 ± 4,3] %) | 6 ([12,5 ± 4,8] %) |
| Два | 18 ([15,4 ± 3,3] %) | 10 ([20,8 ± 5,9] %) |
| від трьох до п’яти | 5 ([4,3 ± 1,9] %) | 12 ([25,0 ± 6,3] %) |
| від шести до десяти | 2 ([1,7 ± 1,2] %) | 2 ([4,2 ± 2,9] %) |
| від 10 до 15 | – | 2 ([4,2 ± 2,9] %) |
| понад 20 | 2 ([4,2 ± 2,9] %) | |
| не змогли вказати | 13 ([11,1 ± 2,9] %) | 14 ([29,2 ± 6,6] %) |
У порівнянні з підгрупою 1.2 в 1,9 разу більше представників підгрупи 2.2 не перебували в шлюбі, мали двох або трьох та більше статевих партнерів (в 1,6 та 9,2 рази відповідно).
Перебувають в шлюбі або мають одного постійного сексуального партнера більшість представників загальної популяції. Два та більше постійних сексуальних партнерів в наявності та протягом останнього року мають близько 45-55 % представників уразливих груп. Звертає увагу, що близько третини представників уразливих груп та майже 11 % осіб загальної популяції не змогли вказати точну кількість статевих партнерів за останній рік.
Необхідно інформувати пацієнтів, що передача ІПСШ та ВІЛ відбувається при статевих контактах. Причому інфікуватися можна при всіх видах гетеро- або гомосексуальних контактів (вагінальний, оральний, анальний). Чим більш численна кількість сексуальних партнерів, тим вища ймовірність зустрічі з партнером-носієм ІПСШ/ВІЛ.
Більшість осіб з підгрупи 1.2 перебували у першому шлюбі – 50 ([42,7 ± 4,6] %) (11 ([22,9 ± 6,1] %) – підгрупа 2.2), до якого більшість (37 – (31,6 ± 4,3) %) вступили у віці 21-25 років. У перший шлюб вступили в 20-21 рік – 12 ([10,3 ± 2,8] %), в 25-30 років – 13 ([11,1 ± 2,9] %) опитуваних. У першому шлюбі два роки та більше 20 років знаходились 4 ([3,4 ± 1,7] %) респондентів, три роки – 8 ([6,8 ± 2,3] %), 5-10 років – 16 ([13,7 ± 3,2] %), 10-20 років – 7 ([6,0 ± 2,2] %). В другому шлюбі перебували 16 ([13,7 ± 3,2] %) опитуваних підгрупи 1.2 (проти 2 ([4,2 ± 2,9] % підгрупи 2.2).
У підгрупі 2.2 вік вступу в шлюб в 16-19 років зазначили 5 ([10,4 ± 4,4] %) респондентів (проти 8 ([6,8 ± 2,3] %) в підгрупі 1.2). Два ([4,2 ± 2,9] % представників уразливих груп вступили у перший шлюб до 16 років (проти 1 ([0,9 ± 0,9] % підгрупи 1.2), в 20-21 рік та в 21-25 років. Перебування в першому шлюбі протягом двох або трьох років зазначили 3 ([6,3 ± 3,5] %) респондентів.
Більшість осіб (45 – (38,5 ± 4,5) %) з підгрупи 1.2 почали статеве життя у 18-19 років, 15-17 років – 42 ([35,9 ± 4,4] %), 20-29 років – 24 ([20,5 ± 3,7] %), до 14 – 1 ([0,9 ± 0,9] %). У підгрупі 2.2 більшість респондентів (30 – (62,5 ± 7,0) %) почали статеве життя у віці 15-17 років, до 14 – 13 ([27,1 ± 6,4] %). Знали про небезпеку раннього початку статевого життя 66 ([56,4 ± 4,6] %) осіб підгрупи 1.2 та 21 ([43,8 ± 7,2] %) – підгрупи 2.2.
Згідно отриманих даних, майже в 1,5 рази частіше (6 ([12,5 ± 4,8] %) проти 4 ([8,3 ± 4,0] %) представники уразливих груп вступали до шлюбу в достатньо молодому віці – в інтервалі від молодше 16 та до 19 років.
Більшість осіб з уразливих груп (44 – (91,7 ± 4,0) %) відмічали достатньо ранній початок статевого життя – у віці молодше 14 та до 17 років. Що стосується загальної популяції, то кількість осіб в даній групі сягає 43 ([36,8 ± 4,5] %). При чому в сексуальні відносини вступали в віці до 14 років лише (0,9 ± 0,9) % осіб загальної популяції, проти отриманих 14 ([29,2 ± 6,6] %) в уразливих групах. Про ризики раннього початку статевого життя були обізнані лише близько половини опитуваних осіб обох груп.
Доцільним в даній ситуації здається не тільки раннє інформування молоді щодо ризиків інфікування ІПСШ, їх перебігу, наслідків для репродуктивного здоров’я, небажаної вагітності, обов’язкового використання презервативів. Також необхідне підвищення рівня свідомості батьків щодо важливості обговорення цих питань в сімейному колі, толерантного ставлення до ситуації, при можливості моделювання з фахівцем подібних співбесід.
Мотивом першого статевого зв’язку в підгрупі 1.2 було кохання у 77 ([65,8 ± 4,4] %) респондентів (проти 13 ([27,1 ± 6,4] %) підгрупи 2.2), статевий потяг – у 27 ([23,1 ± 3,9] %), бажанням скоріше стати дорослим – 21 ([18,0 ± 3,6] %), цікавість – 17 ([14,5 ± 3,3] %), наполегливість партнера та вплив друзів – 5 ([4,3 ± 1,9] %) та 3 ([2,6 ± 1,5] %). У підгрупі 2.2 мотивом була цікавість в 21 ([43,8 ± 7,2] %), бажання скоріше подорослішати – 18 ([37,5 ± 7,0] %), вплив друзів та статевий потяг – 17 ([35,4 ± 6,9] %), наполегливість партнера – 7 ([14,6 ± 5,1] %), алкогольне сп’яніння – 9 ([18,8 ± 5,6] %), гроші – 1 ([2,1 ± 2,1] %).
Таким чином, для представників загальної популяції основними мотивами першого статевого зв’язку було кохання та статевий потяг (майже 89 %), а бажання подорослішати або цікавість відіграли роль в 14-17 % випадків. Для представників уразливих груп головними чинниками виступали навпаки бажання подорослішати або цікавість (близько 81 %). Значну роль в даній групі відігравав вплив друзів, в результаті чого близько 35 % осіб вирішили вступити в сексуальний зв’язок. Близько 19 % респондентів вказали, що перебували під час першого сексу в стані алкогольного сп’яніння. Тільки в групі осіб, які належать до уразливих груп, респонденти зазначили, що вступали в перший статевий контакт в обмін на грошову винагороду.
Найчастіше причинами позашлюбних зв’язків в підгрупі 1.2 були: відсутність чоловіка в 20 ([17,1 ± 3,5] %), в 17 ([14,5 ± 3,3] %) – відсутність постійного статевого партнера, у 11 ([9,4 ± 2,7] %) – статева потреба. У підгрупі 2.2 – відсутність постійного статевого партнера в 22 ([45,8 ± 7,2] %), у 7 ([14,6 ± 5,1] %) – відсутність чоловіка, статева потреба, 6 ([12,5 ± 4,8] %) – потреба в зміні партнера, нудьга, бажання розважитися.
Причинами позашлюбних зв’язків в значному відсотку випадків в обох групах виступає відсутність постійного сексуального партнера та статева потреба. Але серед представників уразливих груп звичайною ситуацією щодо виникнення випадкових контактів є нудьга та бажання розважитися, на що вказують майже 24 % опитуваних осіб.
Під час проведення консультування з приводу ІПСШ важливо звертати увагу на інформацію про причину виникнення ризикованих контактів. Зосереджуючи увагу пацієнта на чинниках виникнення ризикованої сексуальної поведінки можна попередити появу подібних ситуацій в майбутньому.
Знали свій ВІЛ-статус, підтверджений лабораторно, 43 ([36,8 ± 4,5] %) осіб з підгрупи 1.2 та 22 ([45,8 ± 7,2] %) представників підгрупи 2.2.
Цілком доцільно надавати інформацію не тільки про важливість самого обстеження на ІПСШ, але й звертати увагу пацієнтів на строки обстеження. Що стосується ВІЛ-інфекції, слід інформувати, що після ризикованого сексуального контакту термін спостереження та обстеження доцільно розширити до 6 місяців.
На статеві контакти без бар’єрних засобів контрацепції вказували 1 ([0,9 ± 0,9] %) осіб підгрупи 1.2. У підгрупі 2.2 на статеві контакти за грошову винагороду та в якості додаткового джерела доходу вказували 22 ([45,8 ± 7,2] %) опитуваних, без бар’єрних засобів контрацепції – 19 ([39,6 ± 7,1] %), з партнерами однієї статі – 12 ([25,0 ± 6,3] %), з ВІЛ-позитивними особами – 9 ([18,8 ± 5,6] %).
Незахищений та ризикований секс, що випливає з даних опитування, виникає у представників уразливих груп в значному відсотку випадків.
Вкрай важливо пояснювати пацієнтам, що в разі безпечного сексу не відбувається контакту інфікованої рідини організму (кров, генітальний секрет) зі слизовою оболонкою або кров’ю іншої людини. З метою виключення зараження слід уникати технік, які ушкоджують; проводити захист слизової оболонки статевих органів (чоловічий чи жіночий презерватив, латексні бар’єри), обмежувати контакт із заразними виділеннями.
Більшість пацієнтів володіли інформацією, що статевим шляхом передаються різноманітні інфекції (сифіліс, СНІД, гонорея, трихомоніаз, хламідіоз, мікоплазмоз, герпес, кондиломи, гепатити), але більш обізнаними були представники підгрупи 1.2 (95,9-75,5 % опитуваних) -таблиця 4.2.
Таблиця 4.2 – Інформованість про ІПСШ та їх наслідки серед загальної популяції та хворих групи ризику (%)
| Хворі із загальної популяції | Хворі групи ризику | |
| Інформованість щодо передачі ІПСШ (сифіліс, ВІЛ, гонорея, трихомоноз, хламідіоз, мікоплазмоз, герпес, ВПЛ, гепатити) | 95,9-75,5 | |
| Сифіліс, ВІЛ, гонорея | 84,9-72,7 | |
| Трихомоноз, гепатити | 22 ([45,8 ± 7,2] %) | |
| Хламідіоз | 19 ([39,6 ± 7,1] %) | |
| мікоплазмоз | 9 ([18,8 ± 5,6] %) | |
| ВПЛ | 7 ([14,6 ± 5,1] %) | |
| Наслідки ІПСШ: безпліддя | 94 (80,3 ± 3,7 %) | 15 ([31,3 ± 6,7] %) |
| уражения внутрішніх органів | 35 (72,9 ± 6,4 %) | 16 ([33,3 ± 6,8] %) |
| статеві розлади | 35 (72,9 ± 6,4 %) | 7 ([14,6 ± 5,1] %) |
| Переривання вагітності | 34 (70,8 ± 6,6 %) | 10 ([20,8 ± 5,9] %) |
| народження хворих дітей | 34 (70,8 ± 6,6 %) | 11 ([22,9 ± 6,1] %) |
| Смерть | 25 (52,1 ± 7,2 %) | 9 ([18,8 ± 5,6] %) |
| інвалідність | 25 (52,1 ± 7,2 %) | 7 ([14,6 ± 5,1] %) |
У підгрупі 2.2 про можливість передачі сифілісу, СНІДу, гонореї знали 84,9-72,7 % опитуваних. Але що стосується інших інфекцій, інформованість пацієнтів була обмеженою. Про значну контагіозність трихомонозу, гепатитів знали 22 ([45,8 ± 7,2] %) опитуваних, хламідіозу – 19 ([39,6 ± 7,1] %), мікоплазмозу – 9 ([18,8 ± 5,6] %), ВПЛ – 7 ([14,6 ± 5,1] %).
Під час консультування доцільно надавати інформацію про основні ІПСШ коротко та зрозуміло для пацієнтів. Наприклад, розповідаючи прозбудників, або опираючись на симптоми, які сричинюють ІПСШ. Слід нагадувати, що ІПСШ заразні, до них не виробляється імунітет. Існує висока ймовірність повторного зараження.
В результаті інфікування ІПСШ уражаються переважно статеві органи, але з часом може спостерігатися поширення процесу. Перебіг захворювань може бути різноманітний: з наявністю симптомів, безсимптомний. Доцільно вказувати на необхідність періодичного проходження обстеження.
Більш інформовані про можливі шляхи зараження ІПСШ представники підгрупи 1.2: вказали про статевий зв’язок без використання презерватива (113 – (96,6 ± 1,7) % проти 44 ([91,7 ± 4,0] %) підгрупи 2.2), забруднені шприци, голки (91 ([77,8 ± 3,8] %) проти 17 ([35,4 ± 6,9] %), через поцілунок, загальні предмети користування (42 ([35,9 ± 4,4] %) проти 2 ([4,2 ± 2,9] %).
Більше осіб в підгрупі 1.2 знали про те, що статеві інфекції можуть призвести до безпліддя (94 ([80,3 ± 3,7] %) проти 15 ([31,3 ± 6,7] %) підгрупи 2.2), ураження внутрішніх органів та статевих розладів [86 ([73,5 ± 4,1] %) проти 16 ([33,3 ± 6,8] %) та 7 ([14,6 ± 5,1] %)], переривання вагітності та народження хворих дітей [84 ([71,8 ± 4,2] %) проти 10 ([20,8 ± 5,9] %) та 12 ([25,0 ± 6,3] %)], смерті та інвалідності [67 ([57,3 ± 4,6] %) проти 9 ([18,8 ± 5,6] %) та 7 ([14,6 ± 5,1] %)].
Знайомі з основними ознаками статевих інфекцій були 103 ([88,0 ± 3,0] %) пацієнтів з підгрупи 1.2 та 29 ([60,4 ± 7,1] %) підгрупи 2.2. Обізнані щодо наявності ІПСШ у статевого партнера та про його ВІЛ-статус тільки 35 ([29,9 ± 4,2] %) та 26 ([22,2 ± 3,8] %) опитуваних підгрупи 1.2 та 3 ([6,3 ± 3,5] %) і 4 ([8,3 ± 4,0] %) підгрупи 2.2. Статеві контакти з партнерами, у яких були симптоми статевих інфекцій мали близько 6 % хворих з обох груп.
Отримані дані свідчать про вкрай низьке усвідомлення особами з обох груп важливості отримання інформації про стан здоров’я статевого партнера та його обстеження на наявність ІПСШ. Треба доводити пацієнтам, що ця інформація є невід’ємною складовою частиною заходів щодо збереження особистого репродуктивного здоров’я.
В підгрупі 1.2 як метод профілактики ІПСШ та ВІЛ більшість осіб зазначили наявність одного постійного статевого партнера, в підгрупі 2.2 – використання презервативу (таблиця 4.3).
Таблиця 4.3 – Заходи профілактики зараження ІПСШ та ВІЛ серед загальної популяції та у групі ризику (%)
| Хворі із загальної популяції | Хворі групи ризику | |
| Профілактика ІПСШ: | ||
| один постійний статевий партнер | 100 ([85,5 ± 3,3] %) | 6 ([12,5 ± 4,8] %) |
| презерватив | 69 ([59,0 ± 4,5] %) | 33 ([68,8 ± 6,7] %) |
| засоби профілактики | 24 ([20,5 ± 3,7] %) | 9 ([18,8 ± 5,6] %) |
| Обстеження партнера | 43 ([36,8 ± 4,5] %) | 12 ([25,0 ± 6,3] %) |
| Профілактика ВІЛ: | ||
| один постійний статевий партнер | 91 ([77,8 ± 3,8] %) | 10 ([20,8 ± 5,9] %) |
| презерватив | 66 ([56,4 ± 4,6] %) | 33 ([68,8 ± 6,7] %) |
| засоби профілактики | 18 ([15,4 ± 3,3] %) | 4 ([8,3 ± 4,0] %) |
| обстеження партнера | 36 ([30,8 ± 4,3] %) | 9 ([18,8 ± 5,6] %) |
Після статевого акту тільки 18 ([15,4 ± 3,3] %) осіб підгрупи 1.2 та 4 ([8,3 ± 4,0] %) підгрупи 2.2 проводили профілактичні заходи. Про доцільність обстеження статевого партнера замислювалися лише 36 ([30,8 ± 4,3] %) представників загальної популяції та 9 ([18,8 ± 5,6] %) уразливих груп.
Під час консультування доцільно нагадувати, що загроза зараження ІПСШ та ВІЛ не залежить від статі, або соціального статусу. Найвизначнішу роль в зараженні відіграє ризикована поведінка. Тільки знання про шляхи передачі та профілактики інфекцій та вміння здатні захистити від зараження.
Близько 33 % опитуваних представників загального населення відзначали наявність судинних дистоній, мали пригнічений фон настрою, але були досить комунікабельними.
Більшість представників підгрупи 1.2 мали рівний або підвищений фон настрою – 78 ([66,7 ± 4,4] %) випадків. Близько 22 % опитуваних охарактеризовані консультантами як недовірливі та замкнені особи, майже 11 % виказували недовіру, острах та відмічали періодичну появу головних болей. На порушення сну вказували 26 ([22,2 ± 3,8] %) респондентів (рисунок 4.4).
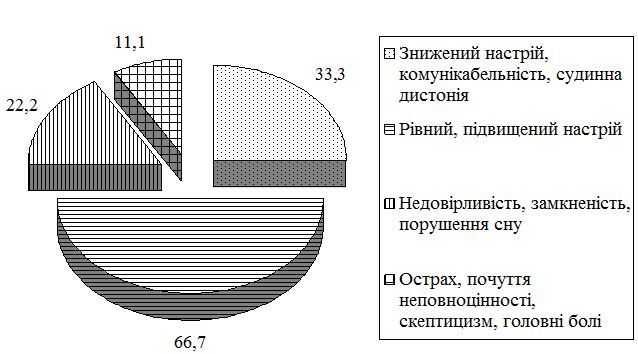
Рисунок 4.4 – Емоційний стан та порушення самопочуття у представників загального населення, підгрупа 1.2, %
Що стосується підгрупи 2.2, то більшість даного контингенту опитуваних осіб мали рівний або підвищений фон настрою майже в 60 % випадків. Наявність судинних дистоній відзначав кожний четвертий опитуваний, а порушення нормальної роботи шлунково-кишкового тракту – 12,5 % представників уразливих груп. Близько 35 % представників уразливих груп скаржилися на дратівливість та знижений фон настрою. Порушення сну, головні болі відзначав майже кожний п’ятий респондент. Такі риси характеру, як острах, замкнутість, скептицизм недовірливість були притаманні майже 10 % опитуваних осіб. (рисунок 4.5).
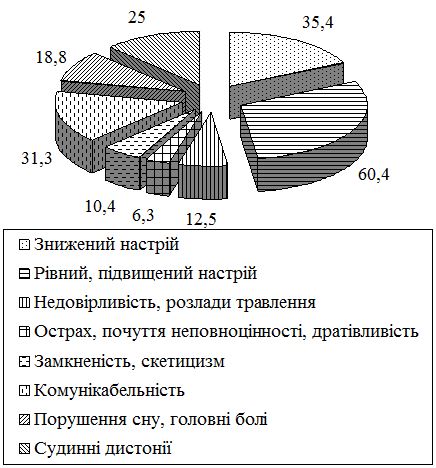
Рисунок 4.5 – Емоційний стан та порушення самопочуття у представників уразливих груп населення, підгрупа 2.2, %.
Хронізація захворювань, наявність скарг, погіршення якості статевого життя можуть привести до емоційної нестабільності, різноманітних порушень психоневрологічного стану. Психологічні проблеми, почуття самотності та невпевненості в майбутньому, наркотична залежність, особиста незахищеність на фоні асоціального способу життя та девіантної поведінки можуть привести до значного погіршення якості життя.
До дошлюбних статевих контактів позитивно та байдуже ставилися більшість респондентів з обох груп [підгрупа 1.2 – 90 ([76,9 ± 3,9] %), 2.2 – 45 ([93,8 ± 3,5] %)]. Негативно ставилися в 2,85 разу більше осіб з підгрупи 1.2.
Згідно отриманих даних, більшість респондентів обох груп толерантно ставляться до наявності дошлюбних статевих партнерів. Щодо позашлюбних контактів, то близько 57 % представників загальної популяції висказали негативні коментарі з цього приводу (дані порівняно більші в 3,9 разу). (таблиця 4.4).
Таблиця 4.4 – Ставлення до до- та позашлюбних статевих контактів, проституції ,наркоманії представників загальної популяції та групи ризику (%)
| Хворі із загальної популяції | Хворі групи ризику | |
| Ставлення до дошлюбних статевих контактів: | ||
| Негативне | 20 ([17,1 ± 3,5] %) | 3 ([6,3 ± 3,5] %) |
| Позитивне | 51 ([43,6 ± 4,6] %) | 16 ([33,3 ± 6,8] %) |
| Байдуже | 38 ([32,5 ± 4,3] %) | 29 ([60,4 ± 7,1] %) |
| Ставлення до позашлюбних статевих контактів: | ||
| Негативне | 67 ([57,3 ± 4,6] %) | 7 ([14,6 ± 5,1] %) |
| Позитивне | 22 ([18,8 ± 3,6] %) | 16 ([33,3 ± 6,8] %) |
| Байдуже | 18 ([15,4 ± 3,3] %) | 23 ([47,9 ± 7,2] %) |
| Ставлення до проституції: | ||
| Негативне | 76 ([65,0 ± 4,4] %) | 9 ([18,8 ± 5,6] %) |
| Позитивне | 5 ([4,3 ± 1,9] %) | 17 ([35,4 ± 6,9] %) |
| Байдуже | 32 ([27,4 ± 4,1] %) | 22 ([45,8 ± 7,2] %) |
| Ставлення до вживання наркотиків: | ||
| Негативне | 107 ([91,5 ± 2,6] %) | 25 ([52,1 ± 7,2] %) |
| Позитивне | 2 ([1,7 ± 1,2] %) | 10 ([20,8 ± 5,9] %) |
| Байдуже | 2 ([1,7 ± 1,2] %) | 12 ([25,0 ± 6,3] %) |
Більшість осіб уразливих груп толерантно ставилася до позашлюбних контактів (дані вищі показників підгрупи 1.2 щодо позитивного відношення в 1,8, нейтрального – в 3,1 разу). Тобто занадто толерантне ставлення до подружніх зрад спостерігається в майже 82 % випадків. Подібна поведінка сприяє виникненню випадкових статевих контактів та зараженню ІПСШ і ВІЛ.
До проституції негативно ставилися більшість осіб з підгрупи 1.2 (вище, ніж у підгрупі 2.2 в 3,5 рази). Більшість респондентів підгрупи 2.2 толерантні до надавання сексуальних послуг за винагороду (дані показників підгрупи 1.2 щодо позитивного відношення більше в 8,2 рази, нейтрального – в 1,7 рази).
До вживання наркотиків негативно ставилася більшість осіб з підгрупи 1.2 (дані порівняно більші в 1,8 рази). Більшість респондентів підгрупи 2.2 толерантно ставляться до цього виду ризикованої поведінки (дані підгрупи 1.2 щодо позитивного та відношення нейтрального більше в 11-12 разів).
За даними опитування алкоголь часто вживали 2-3 % представників підгруп 1.2 та 2.2, рідко – 86 ([73,5 ± 4,1] %) та 35 ([72,9 ± 6,4] %) відповідно. Час від часу вживали в 2,6 рази більше представників підгрупи 2.2, а ніколи – в 4 рази більше осіб з підгрупи 1.2. Більшість респондентів підгрупи 1.1 зазначили, що алкоголь пригнічує або не впливає на статеву функцію (33 – (28,2 ± 4,2) % та 51 – (43,6 ± 4,6) % відповідно, проти 2 ([4,2 ± 2,9] % та 4 ([8,3 ± 4,0] %) в підгрупі 2.2). У підгрупі 2.2 33 ([68,8 ± 6,7] %) осіб вказали, що алкоголь стимулює статеву функцію.
Не вживали наркотики 99 ([84,6 ± 3,3] %) осіб підгрупи 1.2 та 22 ([45,8 ± 7,2] %) підгрупи 2.2, пробували, але не вживали 4 ([3,4 ± 1,7] %) та 7 ([14,6 ± 5,1] %) відповідно. За даними опитування, тільки в підгрупі 2.2 4 ([8,3 ± 4,0] %) респондентів вживали наркотики раніше, застосовували постійно, 9 ([18,8 ± 5,6] %) споживали разом з ВІЛ-позитивними, чий ВІЛ-статус вони знали, також вживали епізодично.
З отриманих даних анкетування випливає, що більшість представників уразливих груп занадто толерантно ставляться до вживання психостимулюючих засобів (алкоголь, наркотичні речовини) та надання сексуальних послуг за винагороду.
Слід нагадувати пацієнтам при консультуванні з приводу ІПСШ, що під впливом психостимулюючих речовин людина може не дотримуватися правил безпеки при заняттях сексом. Найуживанішою психоактивною речовиною, яка впливає на адекватність людини під час занять сексом, є алкоголь. Під час сексу під впливом психостимулюючих речовин виникають наступні ризики: важко завершити статевий акт, виникає ризик відмови від презервативу (неадекватна оцінка ситуації щодо використання засобу , внаслідок тривалості контакту презерватив може набриднути або ушкодитися, відсутній наявний запас презервативів). При тривалому генітальному контакті пересихає природне зволоження піхви, що може привести до больового відчуття, травматизації та/або розриву презервативу. Необхідно застосовувати любрикант на водорозчинній основі. Використання засобів на жировій основі призводить до пошкодження латексу, сприяє порушенню герметичності виробу.
Інформацію про ІПСШ та статеве життя у підгрупі 1.2 отримували в найчастіше в процесі навчання, від знайомих та з друкованих видань (таблиця 4.5). У підгрупі 2.2 – від знайомих та по телебаченню. В даній групі в 6 разів більше осіб, які не були поінформовані.
Таблиця 4.5 – Джерела отримання інформації про венеричні хвороби та статеве життя представників загальної популяції та групи ризику (%)
| Хворі із загальної популяції | Хворі групи ризику | |
| Інформація про венеричні хвороби: | ||
| в школі в процесі навчання | 54 ([46,2 ± 4,6] %) | 15 ([31,3 ± 6,7] %) |
| від знайомих | 34 ([29,1 ± 4,2] %) | 30 ([62,5 ± 7,0] %) |
| від лікаря | 25 ([21,4 ± 3,8] %) | 1 ([2,1 ± 2,1] %) |
| з друкованих видань | 24 ([20,5 ± 3,7] %) | 6 ([12,5 ± 4,8] %) |
| від батьків | 23 ([19,7 ± 3,7] %) | 6 ([12,5 ± 4,8] %) |
| по телебаченню | 22 ([18,8 ± 3,6] %) | 19 ([39,6 ± 7,1] %) |
| не знали | 1 ([0,9 ± 0,9] %) | 3 ([6,3 ± 3,5] %) |
| Інформація про статеве життя: | ||
| в школі в процесі навчання | 54 ([46,2 ± 4,6] %) | 15 ([31,3 ± 6,7] %) |
| від знайомих | 34 ([29,1 ± 4,2] %) | 30 ([62,5 ± 7,0] %) |
| від лікаря | 25 ([21,4 ± 3,8] %) | 1 ([2,1 ± 2,1] %) |
| з друкованих видань | 24 ([20,5 ± 3,7] %) | 6 ([12,5 ± 4,8] %) |
| від батьків | 23 ([19,7 ± 3,7] %) | 6 ([12,5 ± 4,8] %) |
| по телебаченню | 22 ([18,8 ± 3,6] %) | 19 ([39,6 ± 7,1] %) |
| з порнографічних видань | 6 ([12,5 ± 4,8] %) | |
| не знали | 1 ([0,9 ± 0,9] %) | 3 ([6,3 ± 3,5] %) |
Отримані дані свідчать, що вкрай необхідно проводити кваліфіковане надання інформації щодо перебігу та профілактики зараження ІПСШ, здорового сексуального життя серед пацієнтів всіх груп населення. Брак інформації, некваліфіковані та суб’єктивні судження, недооцінка ризиків сприяють підвищенню ризиків зараження та передачі ІПСШ.
Безробітними та тимчасовими робітниками були частіше представники підгрупи 2.2 (19 – (39,6 ± 7,1) % та 11 ([22,9 ± 6,1] %) проти 30 ([25,6 ± 4,0] %), 10 ([8,5 ± 2,6] %) та 19 ([16,2 ± 3,4] %) відповідно в підгрупі 1.1). Постійну роботу частіше мали представники підгрупи 1.1 [55 ([47,0 ± 4,6] %) проти 12 ([25,0 ± 6,3] %)].
Більшість представників загальної популяції [71 ([60,7 ± 4,5] %) проти 6 ([12,5 ± 4,8] %)] мали вищу освіту. На наявність середньої освіти вказували 30 ([62,5 ± 7,0] %) представників підгрупи 2.2 та 46 ([39,3 ± 4,5] %) підгрупи 1.2. Наявність незакінченої середньої освіти у 12 ([25,0 ± 6,3] %) випадків спостерігалася тільки в підгрупі 2.2.
Серед представників підгрупи 1.2 найчастіше зустрічалися службовці (28 – (23,9 ± 3,9) %), кваліфіковані робітники (23 – (19,7 ± 3,7) %). Респонденти були домогосподарками – 10 ([8,5 ± 2,6] %), працівниками громадського харчування, транспорту, дитячих установ та викладачами, науковцями – 6 ([5,1 ± 2,0] %), медичними працівниками – 5 ([4,3 ± 1,9] %). Бізнесменами або студентами були 8 ([6,8 ± 2,3] %) опитуваних, військовослужбовцями, особами без певних занять – 4 ([3,4 ± 1,7] %), підсобними робітниками – 2 ([1,7 ± 1,2] %). У підгрупі 2.2 11 ([22,9 ± 6,1] %) працювали підсобними робітниками, 9 ([18,8 ± 5,6] %) – кваліфікованими робітниками. У 6 ([12,5 ± 4,8] %) випадків респонденти були студентами та особами без певних занять. У 3 ([6,3 ± 3,5] %) зустрічалися службовці, медичні працівники, працівники громадського харчування.
Групи, в яких проводилося анкетування, в значній мірі відрізняються за соціальним статусом. Більшість представників загальної популяції мали вищу освіту (71 – (60,7 ± 4,5) %), були службовцями та кваліфікованими робітниками, викладачами, медпрацівниками (62 – (53,0 ± 4,6) %). Що стосується представників уразливих груп, більшість представників (30 – (62,5 ± 7,0) %) мали середню освіту та майже в 2 рази менше осіб (12 – (25,0 ± 6,3) %) з них були кваліфікованими робітниками, медичними працівниками, службовцями.
Найчастіше представники обох груп виховувались батьком і матір’ю (підгрупа 1.2 – 94 ([80,3 ± 3,7] %) та 23 ([47,9 ± 7,2] %) – підгрупа 2.2). Однією матір’ю виховувалися в 3 рази більше представників підгрупи 2.2 – 15 ([31,3 ± 6,7] %) (проти 12 ([10,3 ± 2,8] %) підгрупи 1.2), у дитячому будинку – тільки представники підгрупи 2.2 (7 – (14,6 ± 5,1) %). Батьки в розлученні були у 23 ([47,9 ± 7,2] %) осіб підгрупи 2.2 та 15 ([12,8 ± 3,1] %) підгрупи 1.2.
При опитуванні представників уразливих груп виявлено, що в значній кількості випадків [23 ([47,9 ± 7,2] %)] вони зростали в неповних сім’ях та виховувалися в дитячому будинку, або батьки були розлучені.
На приналежність до уразливих контингентів населення (колишні ув’язнені) вказав 1 ([0,9 ± 0,9] %) опитаних підгрупи 1.2. У підгрупі 2.2, за даними опитування, РКС були 21 ([43,8 ± 7,2] %), СІН – 17 ([35,4 ± 6,9] %), ЧСЧ – 12 ([25,0 ± 6,3] %), колишніми ув’язненими – 1 ([2,1 ± 2,1] %).
У підгрупі 1.2 надавали інформацію про наявність серед близьких хворих на алкоголізм в 12 ([10,3 ± 2,8] %) випадків, про перебування в місцях позбавлення волі – в 5 ([4,3 ± 1,9] %) випадків. Близько 1,0 % опитуваних вказували на наркоманію. Серед представників підгрупи 2.2 15 ([31,3 ± 6,7] %) респондентів вказували на алкоголізм близьких, 12 ([25,0 ± 6,3] %) – на ув’язнення, 7 ([14,6 ± 5,1] %) – на ВІЛ, 6 ([12,5 ± 4,8] %) – на наркоманію.
Значну роль у вихованні особистості відіграє соціальне оточення. Дані, отримані від представників загальної популяції свідчать, що у 18 ([15,4 ± 3,3] %) випадків особи з близького оточення хворіли на алкоголізм (12 – (10,3 ± 2,8) %), перебували в місяцях позбавлення волі (5 – (4,3 ± 1,9) %), вживали наркотичні речовини (1 – (0,9 ± 0,9) %). Що стосується представників груп ризику, то відсоток представників уразливих груп серед найближчих контактів сягає 41 ([85,4 ± 5,1] %). В порівнянні з даними загальної популяції, спостерігалося в 3 рази більше хворих на алкоголізм, майже в 6 разів більше осіб, які були ув’язненими, в 12 разів більше СІН, також 7 ([14,6 ± 5,1] %) ВІЛ-інфікованих, що серед даних загальної популяції не зустрічалося.
4.3 Визначення рівня інформованості осіб з різних верств населення
Під час проведення мотиваційного консультування 210 осіб, що належать до групи РКС і увійшли до підгрупи 2.3, відбулося їх анкетування з метою визначення рівня інформованості щодо питань ІПСШ та ВІЛ. Респондентам було запропоновано заповнити розроблену анкету – дати відповіді на питання. Визначення рівня знань проводилося до інформування та після. Розроблена анкета складалася з 10 питань з різними варіантами відповідей. Зміна рівня знань оцінювалася у відсотковому співвідношенні. Оброблено 420 анкет – 210 анкет до інформування та 210 анкет після цього.
Під час проведення консультування представникам уразливих груп була надана інформація щодо контагіозності ІПСШ, ймовірності зараження та їх передачі статевим шляхом, вертикальної трансмісії. Доводилася доцільність використання бар’єрних засобів контрацепції при всіх видах сексуальних контактів на протягом всього акту. Також проводилася оцінка усвідомленості застосовування презервативів, їх використання при різних видах сексуальних контактів, та доцільності проходження періодичного обстеження на наявність ІПСШ.
Анкета включала наступні питання.
Перше питання анкети:
1. Вкажіть основні шляхи передачі ІПСШ:
□ побутовий
□ фекально-оральний
□ статевий
□ від матері до дитини під час вагітності, пологів
□ повітряно-крапельний
□ важко відповісти
Вірні відповіді: статевий, від матері до дитини під час вагітності, пологів, побутовий.
Невірні відповіді: фекально-оральний, повітряно-крапельний.
Про статевий шлях передачі ІПСШ знали 197 ([93,8 ± 1,7] %) опитуваних. Після отримання інформації відсоток обізнаності збільшився до 100 %.
Про те, що ІПСШ передаються від матері до дитини під час вагітності, пологів до інформування знали 61 ([29,0 ± 3,1] %) опитаних. Після консультування відсоток обізнаності збільшився до (90 ± 2,1) % (189 осіб), майже в 3 рази, тобто на 61 %.
До отримання інформації 42 ([20,0 ± 2,8] %) учасників вважали, що одним з основних шляхів передачі ІПСШ є побутовий. Після проведення інформування 41 ([19,5 ± 2,7] %) респондентів розцінювали побутовий шлях передачі ІПСШ одним з основних.
Фекально-оральний шлях передачі ІПСШ при першому анкетуванні як основний відзначили 17 ([8,1 ± 1,9] %) учасниць. При повторному анкетуванні даний відсоток зменшився в 3,3 рази, становив 5 ([2,4 ± 1,1] %).
На можливість передачі ІПСШ повітряно-крапельним шляхом до отримання інформації вказали 7 ([3,3 ± 1,2] %) респондентів. Після інформування ніхто з опитаних не зазначив даного варіанту.
Не змогли зазначити основні шляхи передачі ІПСШ взагалі при першому анкетуванні 11 ([5,2 ± 1,5] %) опитаних. Після інформування ніхто з респондентів не зазначив варіант «важко відповісти».
Друге питання анкети:
2. Вкажіть симптоми ІПСШ:
□ слизово-гнійні виділення зі статевих органів
□ біль в нижній частині живота
□ часте сечовипускання
□ наявність виразок в області статевих органів
□ збільшення пахових лімфовузлів
□ важко відповісти.
Вірні відповіді: все перераховане.
Про появу слизово-гнійних виділень при зараженні ІПСШ знали 154 ([73,3 ± 3,1] %) учасниць. Після отримання інформації про такий симптом знали вже 209 ([99,5 ± 0,5] %) (на 26,2 % більше).
Виявлено при першому анкетуванні, що про «біль внизу живота», як симптом ІПСШ, знали 122 ([58,1 ± 3,4] %). Після бесіди відсоток поінформованості щодо цього симптому збільшився до (92,9 ± 1,8) % (195 осіб) (зріс на 34,8 %).
Обізнані, що «часте сечовипускання» можна вірно розцінювати як симптом ІПСШ, 65 ([31,0 ± 3,2] %) респондентів. Після інформування даний відсоток збільшився до ([76,7 ± 2,9] %) (161 особа) (в 2,5 рази на 45,7 %).
«Наявність виразок в області статевих органів» при зараженні ІПСШ відзначили 64 ([30,5 ± 3,2] %) опитаних. Після спілкування з фахівцем вже 161 ([76,7 ± 2,9] %) обрали даний варіант відповіді (на 36,2 % більше).
Про збільшення пахових лімфовузлів, як про один з можливих симптомів ІПСШ, до проведення консультування знали 22 ([10,5 ± 2,1] %) опитуваних осіб. Після бесіди відсоток поінформованості щодо даного симптому ІПСШ збільшився до 108 ([51,4 ± 3,4] %) (в 4,9 разу).
Не змогли відповісти на питання про симптоми ІПСШ до інформування 23 ([11,0 ± 2,2] %) респондентів, після – лише 1 ([0,5 ± 0,5] %) (у 22 рази менше респондентів).
Третє питання анкети:
3. Виберіть вірні твердження про ІПСШ:
□ уражуються тільки статеві органи
□ до перенесених ІПСШ виробляється імунітет
□ заразні
□ завжди перебігають з наявністю симптомів
□ важко відповісти
Вірні відповіді: заразні.
Невірні відповіді: уражуються тільки статеві органи, до перенесених ІПСШ виробляється імунітет, завжди протікають з наявністю симптомів.
До інформування 69 ([32,9 ± 3,2] %) опитаних вважали, що при ІПСШ уражуються тільки статеві органи. Після бесіди даної думки притримувалися майже в 3,5 менше осіб, лише 20 ([9,5 ± 2,0] %).
При першому анкетуванні 14 ([6,7 ± 1,7] %) респондентів вказали, що до перенесених ІПСШ виробляється імунітет. При повторному опитуванні жодний з респондентів не дав подібної відповіді.
Те, що ІПСШ заразні, вказали 123 ([58,6 ± 3,4] %) опитуваних. Після інформування відсоток обізнаності з даного пункту збільшився до 98,1 % (206 осіб) (на 39,5 %).
До отримання інформації 71 ([33,8 ± 3,3] %) опитуваних вважали, що ІПСШ завжди протікають з наявністю симптомів. Після заходу відсоток осіб, які дали цю відповідь, зменшився в 7 разів, до (4,8 ± 1,5) % (10 осіб).
Не змогли відповісти на третє питання до інформування близько 35 ([16,7 ± 2,6] %) опитуваних осіб. Після отримання інформації в жодного в респондентів труднощів при визначенні вірних тверджень щодо ІПСШ не виникало.
Четверте питання анкети:
4. При яких видах сексуальних контактів можуть передаватися ІПСШ?
□ вагінальному
□ оральному
□ анальному
□ важко відповісти.
Вірні відповіді: все перераховане.
Вірні твердження щодо передачі ІПСШ при вагінальному виді сексу обрали 201 ([95,7 ± 1,4] %) опитаних. Після поповнення знань відсоток поінформованості про вагінальний шлях передачі ІПСШ збільшився до 100 %.
Про можливість зараження ІПСШ при оральних сексуальних контактах знали 121 ([57,6 ± 3,4] %) учасників. Після отримання інформації вірне твердження обрали 200 ([95,2 ± 1,5] %) респондентів (показник збільшився на 37,6 %).
Про передачу ІПСШ при анальному сексі до консультування знали 112 ([53,3 ± 3,4] %) опитаних. Після інформування відсоток обізнаних осіб з цього питання збільшився до (92,9 ± 1,8) % (195 осіб) (на 40,3 %).
Відповідь «важко відповісти» при першому анкетуванні дали 9 ([4,3 ± 1,4] %) учасників. Після отримання інформації труднощів з відповіддю на четверте питання анкети не виникало в жодному випадку.
П’яте питання анкети:
5. При яких ІПСШ можуть виникати виразки в області геніталій?
□ сифіліс
□ хламідіоз
□ герпес
□ гонорея
□ трихомоноз
□ важко відповісти.
Вірні відповіді: сифіліс, герпес.
Невірні відповіді: хламідіоз, гонорея, трихомоноз.
Про те, що при сифілісі можуть виникати виразки в області геніталій, знали 115 ([54,8 ± 3,4] %) учасників. При повторному опитуванні вірну інформацію вказали вже 200 ([95,2 ± 1,5] %) респондентів. Володіли інформацією про можливість при герпесі виникнення виразок в області геніталій 40 ([19,0 ± 2,7] %) учасників анкетування. Після інформування відсоток обізнаних осіб збільшився втричі до (57,6 ± 3,4) % (121 особа).
Невірні відповіді про те, що при хламідіозі та гонореї можуть виникати виразки в області геніталій до інформування дали 22 ([10,5 ± 2,1] %) та 34 ([16,2 ± 2,5] %) опитуваних відповідно. Після бесіди відсоток людей, які відповіли так, зменшився до відповідно (0,5 ± 0,5) % (1 особа) та (3,3 ± 1,2) % (7) опитуваних.
Невірні твердження щодо виникнення виразок на геніталіях при трихомонозі дали 29 ([13,8 ± 2,4] %) опитаних. Після інформування відсоток респондентів, що дали таку відповідь зменшився до (1,0 ± 0,7) % (2 особи), майже в 14 разів.
Відповідь «важко відповісти» на п’яте питання анкети щодо виникнення виразок при ІПСШ до проведення інформування дали 92 ([43,8 ± 3,4] %) опитаних. Після бесіди відсоток подібних осіб зменшився більш ніж в 11 разів, склавши 8 ([3,8 ± 1,3] %).
Шосте питання анкети:
6. Відзначте можливі негативні наслідки невилікованих ІПСШ:
□ алергія
□ безпліддя
□ гепатит
□ ураження внутрішніх органів і нервової системи
□ порушення потенції
□ викидень, передчасні пологи
□ важко відповісти.
Вірні відповіді: безпліддя, ураження внутрішніх органів і нервової системи, порушення потенції, викидень, передчасні пологи.
Невірні відповіді: алергія, гепатит.
Про те, що безпліддя є наслідком невилікованих ІПСШ, знали 115 ([54,8 ± 3,4] %) учасників. Після інформування вірну відповідь надали вже 192 ([91,4 ± 1,9] %) опитуваних.
До проведення інформування 19 ([9,0 ± 2,0] %) опитаних помилково вважали, що алергія є наслідком невилікованих ІПСШ. Після отримання інформації відсоток людей, які відповіли подібним чином, зменшився в 9 разів, до (1,0 ± 0,7) % (2 особи).
Невірну відповідь про те, що невиліковані ІПСШ можуть призводити до розвитку гепатиту дали 6 ([2,9 ± 1,1] %) опитаних. Після бесіди відсоток людей, які відповіли так, зменшився до (1,9 ± 0,9) % (4 особи).
Про ураження внутрішніх органів і нервової системи як про можливі наслідки відсутності лікування ІПСШ при першому опитуванні вказали 72 ([34,3 ± 3,3] %) учасників. Після інформування відсоток обізнаності збільшився майже в 2,3 рази, до (79,5 ± 2,8) % (167 осіб).
Про порушення потенції, як наслідку нелікованих ІПСШ, знали 65 ([31,0 ± 3,2] %) опитаних. При повторному опитуванні відсоток обізнаності з даного пункту збільшився майже в 2,6 рази, до (81,0 ± 2,7) % (170 осіб).
Про викидень і передчасні пологи, які можуть виникнути в наслідок відсутності лікування ІПСШ, знали 83 ([39,5 ± 3,4] %) опитаних. Після інформування відсоток обізнаності щодо цього питання зріс до (86,7 ± 2,3) % (182 особи), збільшившись вдвічі.
Твердження «важко відповісти» щодо негативних наслідків нелікованих ІПСШ при першому опитуванні обрали 54 ([25,7 ± 3,0] %) респондентів. При повторному анкетуванні труднощі з відповіддю на шосте запитання анкети виникали у 5 ([2,4 ± 1,1] %) осіб. Це майже в 10 разів менше респондентів, ніж виявлено до інформування.
Сьоме питання анкети:
7. Шляхи передачі ВІЛ інфекції:
□ статевий контакт
□ через укуси комах або тварин
□ при поцілунках
□ через кров
□ при грудному вигодовуванні
□ важко відповісти.
Вірні відповіді: статевий контакт, через кров, при грудному вигодовуванні.
Невірні відповіді: через укуси комах або тварин, при поцілунках.
Про статевий шлях передачі ВІЛ до проведення консультування були інформовані 159 осіб ([75,7 ± 3,0] %). Після отримання інформації даний шлях передачі відзначили вже 100 % опитаних.
Про те, що ВІЛ передається через кров, до проведення інформування були обізнані 168 ([80,0 ± 2,8] %) респондентів. Після проведення заходу даний шлях передачі відзначили вже 209 ([99,5 ± 0,5] %) опитаних.
До інформування невірну відповідь про те, що ВІЛ може передаватися через укуси комах або тварин дали 7 ([3,3 ± 1,2] %) опитаних. Після заняття відсоток осіб, які відповіли таким чином, зменшився до 2 ([1,0 ± 0,7] %).
Після отримання вірної інформації щодо ймовірності передачі ВІЛ при поцілунках відсоток помилкових відповідей знизився майже в 4 рази [з (11,0 ± 2,2) % (23 особи) до (2,9 ± 1,1) % (6)] опитаних.
Про шляхи передачі ВІЛ дитині при грудному вигодовуванні знали 63 ([30,0 ± 3,2] %) опитаних. Після отримання інформації відсоток обізнаності щодо даного пункту збільшився втричі, до (89,5 ± 2,1) % (188 осіб).
При першому анкетуванні на питання про шляхи передачі ВІЛ не змогли відповісти (11,0 ± 2,2) % (23) опитаних. Після отримання інформації відсоток даних осіб зменшився до 0 %.
Восьме питання анкети:
8. Під час “періоду вікна” ВІЛ-інфекції:
□ тест не визначає ВІЛ і людина поки не може інфікувати інших
□ тест не визначає ВІЛ, але людина при цьому може інфікувати інших
□ ризик інфікувати іншу людину найбільш високий
□ ризик інфікувати іншу людину найменш високий
□ важко відповісти.
Вірні відповіді: тест не визначає ВІЛ, але людина при цьому може інфікувати інших, ризик інфікувати іншу людину найбільш високий.
Невірні відповіді: тест не визначає ВІЛ і людина поки не може інфікувати інших, ризик інфікувати іншу людину найменш високий.
Невірну відповідь про те, що під час “періоду вікна” тест не визначає ВІЛ і людина поки не може інфікувати інших до проведення інформування дали 15 ([7,1 ± 1,8] %) опитаних. Після проведення кількість осіб, які відповіли таким чином зменшилася до 2 ([1,0 ± 0,7] %).
Вірна відповідь про те, що під час “періоду вікна” тест не визначає ВІЛ, але людина при цьому може інфікувати інших дали 71 ([33,8 ± 3,3] %) учасників. Після отримання інформації відсоток обізнаності з даного пункту збільшився втричі, до (95,2 ± 1,5) % (200 осіб).
Вірна відповідь про те, що під час “періоду вікна” ризик інфікувати іншу людину найбільш високий, до проведення бесіди дали 11 ([5,2 ± 1,5] %). Після проведення інформування відсоток обізнаності зріс до (34,3 ± 3,3) % (72 особи), майже в 7 разів.
Невірна відповідь про те, що під час “періоду вікна” ризик інфікувати іншу людину найменш високий до проведення консультування дали 11 ([5,2 ± 1,5] %) опитаних. Після проведення кількість подібних відповідей зменшилася майже вдвічі, до 5 ([2,4 ± 1,1] %).
До проведення інформування не змогли відповісти на восьме питання щодо “періоду вікна” ВІЛ-інфекції 113 ([53,8 ± 3,4] %) учасників. Після отримання інформації відсоток людей, які не змогли обрати жодного твердження зменшився до (3,8 ± 1,3) % (8 осіб).
Дев’яте питання анкети:
9. У якому випадку ймовірність інфікування ВІЛ при статевому контакті вище?
□ Жінка ВІЛ (+), чоловік ВІЛ (-)
□ Жінка ВІЛ (-), чоловік ВІЛ (+)
□ важко відповісти.
Вірні відповіді: Жінка ВІЛ (-), чоловік ВІЛ (+).
Невірні відповіді: Жінка ВІЛ (+), чоловік ВІЛ (-).
Помилкове твердження, що ймовірність інфікування ВІЛ при статевому контакті вище для ВІЛ-негативного чоловіка від ВІЛ-позитивної жінки, дали 53 ([25,2 ± 3,0] %) опитаних. Після проведення інформування кількість осіб, які дали подібну відповідь, зменшилася до 45 ([21,4 ± 2,8] %).
Вірна інформація, що ризик інфікування ВІЛ при статевому контакті вище для ВІЛ-негативної жінки, коли чоловік ВІЛ-позитивний, дали 37 ([17,6 ± 2,6] %) опитаних. Після отримання інформації кількість респондентів, які дали обрали подібне твердження, збільшилася до 153 ([72,9 ± 3,1] %) (зросла в 4,1 рази).
До проведення інформування не змогли обрати жодного твердження 120 ([57,1 ± 3,4] %) учасників. Після надання інформації відсоток осіб, у яких виникли труднощі з відповіддю на дев’яте питання анкети, склав (5,7 ± 1,6) % (12 осіб) (кількість осіб зменшилася в 10 разів).
Десяте питання анкети:
10. Як впливають ІПСШ на ризик інфікування ВІЛ?
□ не впливають на ризик інфікування ВІЛ
□ збільшують ризик інфікування ВІЛ
□ важко відповісти.
Вірні відповіді: збільшують ризик інфікування ВІЛ.
Невірні відповіді: не впливають на ризик інфікування ВІЛ.
До проведення інформування особи, які вважають, що ІПСШ не впливають на ризик інфікування ВІЛ, склали 24 ([11,4 ± 2,2] %). Після отримання інформації відсоток подібних відповідей зменшився до (1,0 ± 0,7) % (2 особи).
Вірне твердження при першому анкетуванні, що наявність ІПСШ збільшує ризик інфікування ВІЛ, обрали 93 ([44,3 ± 3,4] %) респондентів. Після проведення інформування відсоток обізнаності з даного пункту збільшився до (95,2 ± 1,5) % (200 осіб).
Не змогли відповісти на дане питання анкети до консультування 93 ([44,3 ± 3,4] %) респондентів. Після отримання інформації відсоток людей, які не змогли відповісти, зменшився до (3,8 ± 1,3) % (8 осіб) (в 11,6 разу).
В результаті аналізу даних, отриманих у ході анкетування (до та після надання інформації щодо ВІЛ та ІПСШ), встановлено наступне.
До отримання інформації:
75-95% респондентів обізнані, що можливо інфікуватися ІПСШ під час статевих контактів, зокрема при вагінальному сексі, ІПСШ можуть супроводжуватися слизово-гнійними виділеннями, ВІЛ передається при статевих контактах та з кров’ю.
44-58 % осіб і володіють інформацією, що наявність ІПСШ збільшує ризик зараження ВІЛ, ІПСШ заразні, існує можливість інфікуватися при оральному та анальному видах сексу, симптомами ІПСШ є біль в нижній частині живота, а поява виразка – характерна для зараження сифілісом, безпліддя є наслідком ІПСШ.
30-39 % анкетованих знають, що часте сечовипускання є одним з симптомів ІПСШ, як і виразки на геніталіях, що наслідками нелікованих ІПСШ є невиношування вагітності, зниження потенції, викидень, також що ВІЛ передається при груднім вигодовуванні, існує високий ризик передачі ВІЛ в «період вікна».
Лише 18-29 % респондентів знають, що існує побутовий шлях передачі ІПСШ, також можлива передача від матері до дитини, генітальний герпес супроводжується появою виразок, ризик інфікування ВІЛ вищий для жінки при статевому контакті з ВІЛ-позитивним партнером.
Лише 22 (10,5 ± 2,1 %) опитуваних обізнані, що при наявності ІПСШ можуть збільшуватися лімфовузли.
Невірні твердження до опитуванні були наступні:
25-32 % респондентів вважають, що перебіг ІПСШ завжди супроводжується наявністю симптомів, також ІПСШ уражують тільки статеві органи, вищий ризик зараження ВІЛ існує для чоловіка при сексуальному контакті з ВІЛ-позитивним партнером.
11-16 % опитуваних відзначили, що виразки супроводжують інфікування хламідіозом, гонореєю, трихомонозом, що ВІЛ-інфекція передається при поцілунках, а наявність ІПСШ не впливає на можливість зараження ВІЛ.
Встановлено, що значний відсоток респондентів (44-57 %) не могли дати відповіді на запитання щодо як ІПСШ впливають на можливість зараження ВІЛ, які ІПСШ супроводжуються наявністю виразок на шкірі та слизових оболонках, та найбільша кількість ([56,2 ± 3,4] %) опитуваних не володіють інформацією, що під час “періоду вікна” ВІЛ-інфекції існує висока ймовірність зараження від інфікованого партнера, та вищий ризик інфікування ВІЛ існує саме для жінки від ВІЛ-позитивного статевого партнера.
Близько 11 % респондентів не мають інформації щодо симптомів ІПСШ та шляхів передачі ВІЛ та не можуть обрати будь-які відповіді. Майже 17-26 % опитуваних взагалі не обізнані щодо особливостей перебігу ІПСШ, шляхів зараження та негативних наслідків нелікованих захворювань.
Близько 5 % опитуваних однаково вважають, що в «період вікна» ризик зараження при статевих контактах ВІЛ найвищий та найнижчий.
Після інформування виявлена наступна інформація:
87-100 % респондентів обізнані щодо шляхів передачі ІПСШ, їх наслідків для здоров’я та основних клінічних проявів, видів сексуальних контактів при яких передаються ІПСШ та ВІЛ та про ко-факторну дію ІПСШ щодо зараження ВІЛ.
(80,0 ± 2,8) % осіб інформовані, що неліковані ІПСШ можуть призводити до порушень нервової системи та потенції.
73-77 % опитуваних знають, що вищий ризик зараження ВІЛ від інфікованого партнера існує для жінки, ніж навпаки та що наявність ІПСШ може проявлятися у вигляді появи виразок на шкірі та слизових оболонках.
51-57 % відмітили, що спостерігається збільшення лімфовузлів на тлі перебігу ІПСШ, поява виразок при генітальному герпесі.
(34,3 ± 3,3) % анкетованих осіб відзначили, що існує найбільший ризик інфікування ВІЛ саме в період «негативного вікна», коли статевий партнер навіть не знає про свою позитивність.
Після інформування кількість невірних відповідей знизилася в 3-11 разів, а вірних тверджень обрано в 1,7-5 разів більше, ніж при первиннім анкетуванні.
Таким чином, при повторному анкетуванні виявлено, що інформованість пацієнтів щодо ІПСШ зросла на 30-40 % в середньому 3,5 рази. Близько 90 % опитуваних осіб зазначили, що зрозуміли важливість застосування засобів контрацепції, планують їх використання при всіх видах сексуальних контактів та усвідомили важливість проходження періодичного обстеження на наявність ІПСШ у фахівців в ЛПУ різних рівнів надання допомоги.
* * *
Таким чином, проведене дослідження показало, що уразливі групи відрізняються від загального населення:
- за соціальним статусом (більшість опитуваних мали середню та неповну середню освіту; зростали в неповних сім’ях, дитячих будинках; мають статус безробітних або тимчасових робітників),
- особливостями статевої поведінки (раннім початком, особливостями та інтенсивністю статевого життя, кількістю статевих партнерів та сексуальних контактів, їх ризикованістю, мотивами виникнення випадкових контактів, низьким рівнем інформованості щодо можливостей інфікування та передачі широкого спектру ІПСШ та ВІЛ статевим шляхом, занадто толерантним ставленням до позашлюбних контактів, комерційного сексу та вживання наркотичних засобів),
- приналежністю до уразливих груп особисто та значною кількістю представників уразливих груп в близькому оточенні.
- Позитивний, рівний настрій частіше виявлявся у представників загального населення ([67,1 ± 3,2] % проти [60,0 ± 3,4] %). Порушення сну, розлади травленні, судинні дистонії спостерігалися частіше серед представників уразливих груп.
- Використання методу мотиваційного консультування пацієнтів з ІПСШ призводить до зниження ризиків інфікування ІПСШ та змін сексуальної поведінки в бік більш безпечної. Через підвищенню рівня інформованості здійснюється вмотивований, осмислений перехід до здорової поведінки.
- Мотиваційне консультування доцільно застосовувати при роботі з представниками уразливих верств населення. Анкетування після проведеного консультування показало підвищення рівня інформованості контингенту майже на 30-40 %, усвідомлення більшістю респондентів ([89,5 ± 2,1] %) важливості періодичного обстеження на ІПСШ, застосування засобів контрацепції при всіх видах сексуальних контактів, кожному окремо та всій його тривалості.
Публікації:
- Щербакова Ю.В. Особливості застосування мотиваційного консультування пацієнтів з ІПСШ з метою зміни ризикованої сексуальної поведінки / Ю.В. Щербакова // Актуальные вопросы дерматологии, венерологии ВИЧ/СПИД-инфекции : Сборник научных трудов, посвященных 155-летию со дня рождения проф. И.Ф. Зеленева; под ред. проф. А.М. Дащука. – Харьков, 2015. – С. 129-145.
- Пат. на корисну модель 96777 UA, МПК А61В10/00. Спосіб профілактики інфекцій, що передаються статевим шляхом / Г.І. Мавров, Г.М. Бондаренко, Ю.В. Щербакова, Л.В. Іващенко; заявник і патентовласник ДУ „Інститут дерматології та венерології НАМНУ”. – № u201410808; заявл. 03.10.14; опубл. 10.02.15, Бюл. № 3.
- Особливості мотиваційного консультування осіб з інфекціями, що передаються статевим шляхом, з метою формування безпечної статевої поведінки (методичний посібник) / Ю.В. Щербакова, Г.І. Мавров, Я.Ф. Кутасевич, Г.М. Бондаренко. – Харків: НАМН України, 2016. – 42 с.
РОЗДІЛ 5
Оцінка ОСОБЛИВОСТЕЙ СТАНУ імунітету У ПРЕДСТАВНИКІВ УРАЗЛИВИХ ГРУП З ІНФЕКЦІями, що передаються статевим шляхом, З УРАХУВАННЯМ ВІЛ-СТАТУСУ
5.1 Оцінка стану імунітету у ВІЛ-позитивних пацієнтів з ураженнями шкіри та інфекціями, що передаються статевим шляхом
5.1.1 Вірусне навантаження і показники імунного статусу у ВІЛ-позитивних пацієнтів з інфекціями, що передаються статевим шляхом, та ураженнями шкіри
У процесі розвитку інфекції, викликаної ВІЛ, відбувається суттєва зміна імунологічної реактивності організму. В значній частині випадків спостерігається поєднання інфекційного процесу з іншими захворюваннями, які накладають відбиток як на загальний стан хворого, так і на процеси, що відбуваються в імунній системі [96, 99].
З метою оцінки впливу ІПСШ та уражень шкіри на стан імунітету у осіб з ВІЛ-інфекцією, а також зміни важкості стану ВІЛ-позитивних осіб після лікування дерматовенерологічної патології було проведено дослідження. Під спостереженням знаходилися 80 осіб – пацієнти, які зверталися за лікувально-діагностичною допомогою у ДУ «Інститут дерматології та венерології НАМН України» та КЗОЗ «Обласний центр профілактики та боротьби зі СНІДом» (м. Харків) та практично здорові донори.
До підгруп 2.4 і 2.5 увійшли 50 ВІЛ-позитивних пацієнтів у віці від 19 до 64 років. Більшість склали жінки – 26 пацієнток ([52,0 ± 7,1] %), чоловіки – 24 особи ([48,0 ± 7,1] %). Середній вік пацієнтів сягав (36,5 ± 1,0) року. Жителі міста представляли більшість обстежених – 90,0%.
До підгрупи 2.4 увійшли 23 пацієнти з ураженнями шкіри, до підгрупи 2.5 – 27 хворих, у яких було діагностовано різноманітні ІПСШ. Всі пацієнти отримували АРТ (у вигляді комбінації препаратів [тенвір, алувія, комбівудин, невірапін, ламівудин, ківекса, трувада, віролам]).
При аналізі хворих підгруп 2.4 і 2.5 можна відзначити, що особи, які належали до групи пацієнтів з дерматологічною патологією склали (46,0 ± 7,1) %, з ІПСШ – (54,0 ± 7,1) %. Середній вік хворих склав (39,8±1,7) року.
До підгрупи порівняння (підгрупа 3.1) були включені 30 осіб – практично здорові донори. Середній вік пацієнтів був (37,7±1,2) року.
При обстеженні осіб визначалася загальна кількість лімфоцитів у периферичній крові, а також абсолютну та відносну кількість CD3+, CD4+, CD8+ лімфоцитів, також вірусне навантаження до і після курсів терапії, що згідно з виділеною патологією проводили у ВІЛ-позитивних осіб.
5.1.1.1 Клінічна характеристика пацієнтів з ВІЛ-позитивним статусом з інфекціями, що передаються статевим шляхом, та ураженнями шкіри
До підгрупи 2.4 увійшли пацієнти з ураженнями шкіри.
Найбільший відсоток даної групи склали особи з кандидозом шкіри й великих складок та себорейним дерматитом (13 ([56,5 ± 10,3] %) та 12 ([52,2 ± 10,4] %) відповідно). У 10 ([43,5 ± 10,3] %) випадків у хворих діагностувався мікози та алергічний дерматит. Ураження шкіри вірусної етіології спостерігалися також у значної кількості пацієнтів. Herpes zoster виявляли у 7 ([30,4 ± 9,6] %) випадків, клінічні прояви ВПГ – у 4 ([17,4 ± 7,9] %). У 3 ([13,0 ± 7,0] %) пацієнтів була діагностована токсикодермія. Псоріаз та саркома Капоші виявлені у близько 10 % хворих цієї групи (рис. 5.1).
У підгрупі 2.5 більшість склали особи з хламідійною інфекцією. Дана патологія діагностована у 17 ([63,0 ± 9,3] %) пацієнтів. Урогенітальний кандидоз зустрічався майже у третини пацієнтів. Дані наведені на рисунку 5.2.
Приблизно однаковий відсоток (близько 20 %) виявлення прийшовся на кількість пацієнтів з генітальним герпесом, сифілісом та ВПЛ.
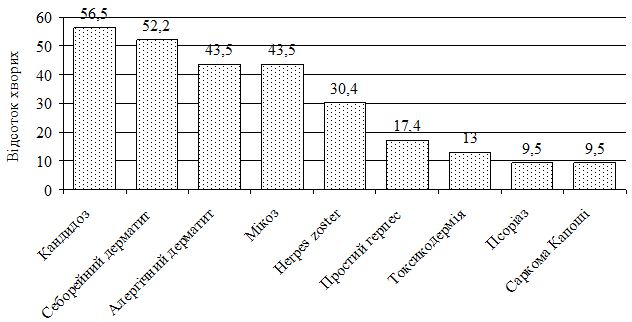
Рисунок 5.1 – Дерматологічна патологія, діагностована у пацієнтів підгрупи 2.4, %

Рисунок 5.2 – Урогенітальна патологія, діагностована у пацієнтів підгрупи 2.5, %
Трихомонадна та уреаплазмова інфекція виявлені у 3 ([11,1 ± 6,0] % хворих даної групи, у 2 ([7,4 ± 5,0] %) діагностована гонорея.
Такі патології, як простатит та уретрит були виявлені у 5 ([18,5 ± 7,5] %) та 3 ([11,1 ± 6,0] %) пацієнтів відповідно.
У пацієнтів з обох підгруп була виявлена супутня патологія. Дані наведені на рисунку 5.3.
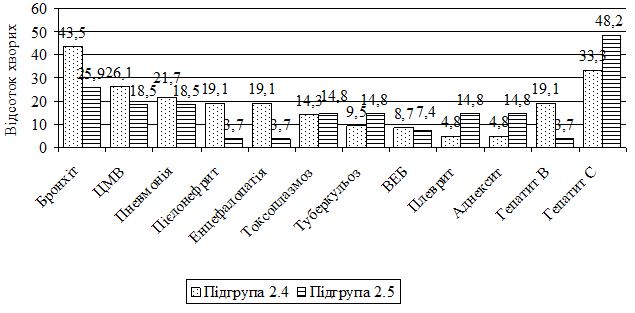
Рисунок 5.3 – Супутня патологія, діагностована у пацієнтів підгруп 2.4 та 2.5, %
У хворих дерматологічного профілю частіше, ніж у підгрупі 2.5 були діагностовані бронхіти (у 10 ([43,5 ± 10,3] %) проти 7 ([25,9 ± 8,4] %)), ЦМВ (6 – [26,1 ± 9,2] %), пневмонії (5 – [21,7 ± 8,6] %), виявлений ВЕБ (2 – [8,7 ± 5,9] %). Пієлонефрити та енцефалопатії, гепатит В, які були визначені в 19 % випадків зустрічалися майже в 5 разів частіше, ніж у осіб з ІПСШ.
У підгрупі 2.5 частіше зустрічалися випадки токсоплазмозу та туберкульозу (4 – [14,8 ± 6,8] %). Плеврити та аднексити серед пацієнтів з ІПСШ були діагностовані майже в 3 рази частіше, ніж у підгрупі 2.4.
Гепатит С був виявлений у пацієнтів обох груп, але серед пацієнтів з ІПСШ майже в 1,5 рази частіше.
Ендоцервіцит, кольпіт, ерозія шийки матки, позаматкова вагітність зустрічалися у 2,5–7 % хворих з ІПСШ, випадки піодермії, синдром Стівенса-Джонсона – у 2,5–5 % представників підгрупи 2.4.
Супутні стани та захворювання у вигляді дисбактеріозу, гепатиту, нефропатії зустрічалися у 4–6 % ВІЛ-інфікованих пацієнтів обох підгруп.
У пацієнтів обох підгруп рідко спостерігалося виявлення лише одного захворювання. Частіше одночасно зустрічалося дві або три нозології.
У пацієнтів підгрупи 2.4 зустрічалися різноманітні комбінації захворювань. Найпоширенішим був себорейний дерматит, який реєструвався в більшості випадків разом з кандидозом, алергічним дерматитом, мікозом або ЦМВ-інфекцією (близько 30 % випадків) (рисунок 5.4).
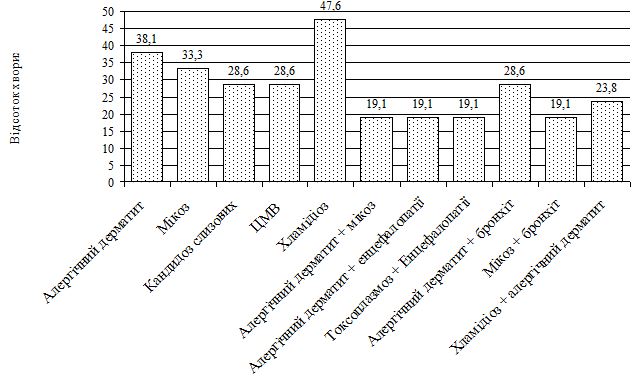
Рисунок 5.4 – Поєднання себорейного дерматиту з іншими захворювання в підгрупі 2.4, %
У 11 пацієнтів з дерматозами ([47,8 ± 10,4] %) була виявлена хламідійна інфекція. Це були хворі з себорейним дерматитом, мікозами, алергічним дерматитом. Також у пацієнтів з подвійною дерматологічною патологією себорейний дерматит та мікози, або себорейний та алергічний дерматити додатково виявляли також хламідіоз.
У хворих з алергічним дерматитом часто дерматоз асоціювався з патологією легень та гепатитом С (рисунок 5.5).
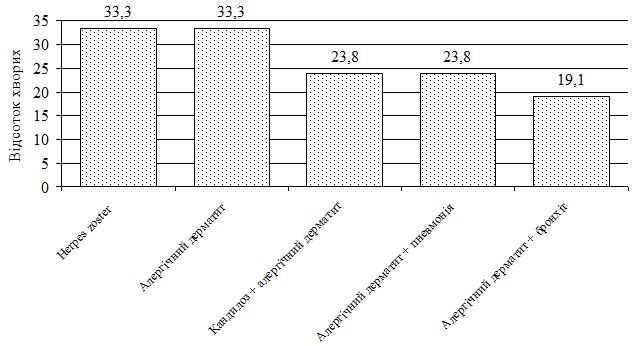
Рисунок 5.5 – Поєднання гепатиту С з іншими патологіями в підгрупі 2.4, %
Поєднання трьох захворювань найчастіше виявлялося також у пацієнтів з себорейним дерматитом. Окрім основного захворювання одночасно виявляли мікози, алергічні дерматити, токсоплазмоз, енцефалопатію, бронхіт.
У підгрупі пацієнтів з ІПСШ (підгрупа 2.5) найпоширеніший хламідіоз поєднувався в значній кількості випадків з кандидозом, трихомонозом, ВПГ, ЦМВ, бронхітом (рисунок 5.6).
У хворих на хламідіоз, кандидоз, ВПГ в значній кількості випадків спостерігали одночасно наявність гепатиту С.
При поєднанні трьох патологій у пацієнтів з хламідійною інфекцією одночасно діагностували ВПЛ, кандидоз (урогенітальний та шкіри), ВПГ (генітальний, простий та зостер), трихомоноз (рисунок 5.7).
У пацієнтів з ІПСШ одночасно в поєднанні з 3 захворюваннями виявлялися хламідіоз, гепатит С та ВПГ(генітальний та зостер) або кандидоз.
 Рисунок 5.6 – Поєднання хламідіозу з ішими патологіями в підгрупі 2.5, %
Рисунок 5.6 – Поєднання хламідіозу з ішими патологіями в підгрупі 2.5, %
5.1.1.2 Показники імунного статусу у ВІЛ-позитивних осіб з інфекціями, що передаються статевим шляхом, та дерматологічною патологією
У осіб, що перебували під спостереженням, досліджувалися загальна кількість лімфоцитів у периферичній крові, абсолютна та відносна кількість CD3+, CD4+, CD8+ лімфоцитів. Також у ВІЛ-позитивних пацієнтів визначалося вірусне навантаження до і після курсів терапії, яку вони отримували згідно з виділеною патологією. Дані наведені в таблицях 5.1 і 5.2.
Відносна кількість лімфоцитів була знижена у порівнянні з контрольною групою, після проведеного лікування це зниження ставало навіть більше вираженим, що свідчить про підвищення під впливом лікування кількості інших лейкоцитів (нейтрофілів та моноцитів) у крові. Абсолютна кількість лімфоцитів суттєво відрізнялась від контрольних показників тільки у хворих підгрупи 2.4 після лікування, до лікування відзначалася лише тенденція до зниження.
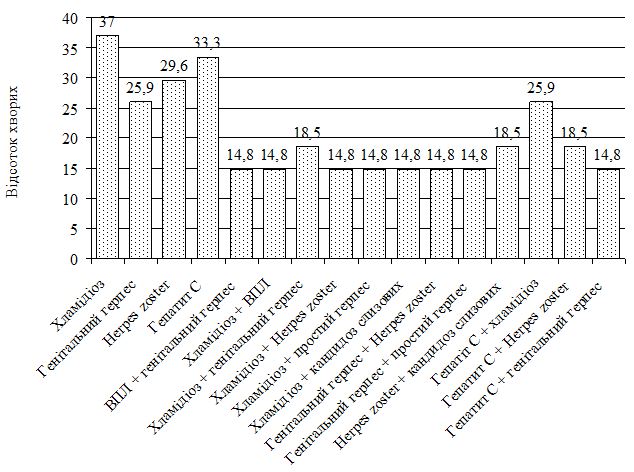
Рисунок 5.7 – Асоціація кандидозу з іншими патологіями в підгрупі 2.5, %
Абсолютна кількість Т-лімфоцитів (CD3+ клітин) суттєво не відрізнялась від показників контролю до лікування і мала тенденцію до збільшення після лікування. Відносна кількість Т-лімфоцитів до лікування була збільшена в підгрупі 2.5, а після лікування цей показник нормалізувався. Можливо, це відображало стимулюючу дію на лімфопоєз інфекційного подразника, активність якого після лікування зменшувалась. Навпаки, у підгрупі 2.4 відносна кількість Т-лімфоцитів не відрізнялась від контролю до лікування і збільшувалась після нього. Це можна вважати пов`язаним з дією ВІЛ-інфекції на Т-лімфоцити.
Таблиця 5.1 – Дані імунологічного обстеження ВІЛ-позитивних пацієнтів з дерматологічною патологією (підгрупа 2.4) та з ІПСШ (підгрупа 2.5), практично здорових осіб (підгрупа 3.1)
| CD3, абс. | CD3, % | Т-хелпери, абс. | Т-хелпери, % | Т-супресори, абс. | Т-супресори, % | Лімфоцити, абс. | Лімфоцити, % | |||||||||
| до ліку-вання | після ліку-вання | до ліку-вання | після ліку-вання | до ліку-вання | після ліку-вання | до ліку-вання | після ліку-вання | до ліку-вання | після ліку-вання | до ліку-вання | після ліку-вання | до ліку-вання | після ліку-вання | до ліку-вання | після ліку-вання | |
| Підгрупа 2.4 | 1091,2±221,2 | 1511,5±202,2 | 71,6± 4,8 | 76,2± 2,6 к | 298,2±65,7 к | 472,4± 59,7 *к | 16,8± 2,9 к | 25,4± 2,2 *к | 216,5± 3,5 к | 497,0± 73,0 * | 49,8± 3,9 к | 43,9± 17,9 к | 1559,4±322,5 | 1210,5±162,5 к | 23,5± 3,6 к | 18,0± 2,1 к |
| Підгрупа 2.5 | 1365,6±127,0 | 1446,3±111,6 | 78,3± 1,7 к | 71,2± 4,7 * | 285,7±40,5 к | 459,8± 51,8 *к | 16,3± 1,8 к | 24,4± 1,9 *к | 879,0± 192,9 1к | 730,8±101,3 1к | 58,6± 4,8 1к | 45,1± 2,1 *к | 1822,0±187,2 | 1861,5±263,5 1 | 27,5± 2,1 к | 19,9± 2,4 *к |
| Підгрупа 3.1 | 1271,7±102,9 | 70,8±1,5 | 844,7±72,7 | 45,5±1,2 | 385,64±36,8 | 20,7±0,6 | 1818,9±147,3 | 33,8±3,2 | ||||||||
Примітка. Відмінності достовірні (р < 0,05) відносно показників: * –до лікування; 1 – у підгрупі 2.4; к – у контрольній групі
Найбільш виражені зміни з боку клітин крові у досліджених хворих були з боку Т-хелперів (CD3+CD4+клітин), середні показники їх абсолютної кількості в периферичній крові у хворих обох підгруп до лікування були майже в три рази нижче контрольного рівня. Після лікування відзначалось підвищення цього показника приблизно до 60 % від контрольного рівня. Подібні зміни відображались з боку відносної кількості Т-хелперів. Виявлені зміни – відображення безпосередньої пошкоджуючої дії ВІЛ на цю клітинну популяцію, яка становить центральну ланку патогенезу ВІЛ-інфекції. Суттєвої різниці цих показників в підгрупах 2.4 та 2.5 не було відзначено.
У підгрупах до лікування абсолютна кількість Т-хелперів була знижена відносно цього показника у контрольній групі у 2,8 і 3,0 разу відповідно. У процесі лікування спостерігалася тенденція до нормалізації зазначеного показника у вигляді його достовірного підвищення в обох підгрупах у 1,6 разу.
Після проведеного лікування середнє значення показнику у підгрупах 2.4 і 2.5 зросло до (465,4 ± 38,2) кл/мм3, що як і раніше було достовірно нижче показника контрольної групи, який складав (844,7 ± 72,7) кл/мм3. Після лікування рівень абсолютної кількості Т-хелперів у обох підгрупах (2.4 і 2.5) був знижений відносно підгрупи контролю в 1,8 разу.
Аналогічну закономірність відзначено при аналізі рівня відносної кількості Т-хелперів. До лікування в обох дослідних групах цей показник був знижений у 2,7 і 2,8 разу відповідно. Незважаючи на достовірне підвищення цього параметра у 1,5 разу в обох дослідних підгрупах, рівень відносної кількості Т-хелперів залишився вірогідно зниженим відносно контрольної підгрупи у 1,8 і 1,5 разу відповідно.
У 10 ([20,0 ± 5,7] %) пацієнтів кількість СD4+ лімфоцитів була вищою за нижню межу норми, таким чином перевищувала 500 кл/мм3.
У 22 ([44,0 ± 7,0] %) хворих кількість Т-хелперів була менше 200 в мм3. В окремих хворих цей показник знаходився на дуже низькому рівні, у 14 ([28,0 ± 6,3] %) пацієнтів він був нижче 100, а у 5 ([10,0 ± 4,2] %) – нижче 20.
Можна відзначити, що хворі з вмістом Т-хелперів в периферичної крові нижче 250 були виділені в окрему групу, з піком вмісту Т-хелперів менше 100 в мм3.
Після проведеної терапії основного захворювання рівень Т-хелперів значно підвищився, середній показник по групі склав 350,3 кл/мм3, всього лише у 7 хворих ([14,0 ± 4,9] %) цей показник залишався нижче 200, 4 з них відносилися до групи хворих з дерматологічної патологією. Між значеннями показника Т-хелперів до лікування і після виявлялася достовірна позитивна кореляція (ρ = 0,70, р <0,05).
Середні показники абсолютної та відносної кількості Т-супресорів (СD8+ лімфоцитів) у підгрупах 2.4 і 2.5 підвищувались у порівнянні з контрольною підгрупою, в той же час виявлялись відміни між підгрупою 2.4 та 2.5. У підгрупі 2.4 абсолютна кількість Т-супресорів була нижче у 4,1 разу, ніж у підгрупі 2.5, та у 1,8 разу відносно цього показника у контрольній групі. У підгрупі 2.5 зазначений параметр, навпаки, був підвищеним у 2,3 разу, ніж у групі контролю. У підгрупі 2.4 у процесі лікування спостерігалося підвищення абсолютної кількості Т-супресорів у 2,3 разу і відбулася нормалізація цього показника після лікування. У підгрупі 2.5 під час лікування зазначений параметр достовірно не змінився.
До лікування відносна кількість Т-супресорів була підвищеною відносно групи контролю у 2,4 і 2,8 разу відповідно. Після лікування цей показник у підгрупі 2.4 залишився підвищеним відносно зазначеного параметра у контрольній групі у 2,1 разу. У підгрупі 2.5 відносна кількість Т-супресорів, незважаючи на його зниження у 1,3 разу, залишилася підвищеною у 2,2 разу відносно цього показника у контрольній підгрупі.
У дослідних та контрольній підгрупах абсолютна кількість Т-лімфоцитів до лікування була статистично нерозрізненою. У підгрупах 2.4 і 2.5 не відбулося достовірних змін цього показника у процесі лікування, хоча після лікування зазначений параметр у підгрупі 2.4 став достовірно нижчим у 1,5 рази, ніж у 2.5 та у підгрупі контролю (3.1).
До лікування у дослідних підгрупах відносна кількість Т-лімфоцитів була нижчою у 1,4 і 1,2 разу відповідно, ніж у підгрупі контролю. У підгрупі 2.4 зазначений показник не зазнав змін. У підгрупі 2.5 у процесі лікування відбулося достовірне зниження цього показника у 1,4 разу, тобто спостерігалося його погіршення. Після лікування відносна кількість Т‑лімфоцитів у дослідних підгрупах була зниженою у 1,9 і 1,7 разу відповідно відносно цього показника у контрольній підгрупі.
5.1.1.3 Вірусне навантаження у ВІЛ-позитивних пацієнтів з інфекціями, що передаються статевим шляхом, та дерматологічною патологією
При аналізі особливостей перебігу ВІЛ-інфекції у осіб з шкірними захворюваннями та ІПСШ в якості показника активності процесів вірусної реплікації був обраний рівень вірусного навантаження. Дані наведені в таблиці 5.2.
Таблиця 5.2 – Дані вірусного навантаження у пацієнтів з дерматологічною патологією (підгрупа 2.4) та ІПСШ (підгрупа 2.5), середні значення показника в підгрупах
| Підгрупа 2.4 | Підгрупа 2.5 | |||
| До лікування | Після лікування | До лікування | Після лікування | |
| Вірусне навантаження | 121707±
68165 |
22076±
14435 |
248628±
97699 |
9484±
4973 |
| Зниження вірусного навантаження
(до лікування/ після лікування) |
в 5,5 разу | в 26,2 разу | ||
У підгрупах 2.4 і 2.5 рівень вірусного навантаження був пов’язаний позитивною кореляцією із захворюванням на саркому Капоші (до лікування – ρ = 0,97 та після – 0,59, р < 0,05) і рядом інших захворювань, які характеризуються пригніченням імунологічної реактивності, наприклад, кандидоз слизових (ρ = 0,38, р < 0,05), їх розвиток може бути наслідком ушкодження Т-хелперів ВІЛ, з іншого боку, їх негативний вплив на імунну систему може сприяти більш активному прогресуванню ВІЛ-інфекції.
Позитивна кореляція вірусного навантаження з кількістю лімфоцитів (ρ = 0,57, р <0,05), можливо, є відображенням лімфоцитозу, супроводжуючого хронічні інфекційні процеси, що перебігають паралельно ВІЛ-інфекції. Мабуть, це більшою мірою характерно для хворих, у яких імунологічна реактивність ще в значній мірі збережена.
Негативна кореляція з кількістю Т-хелперів (ρ= –0,40, р < 0,05) – показник характерний для хворих з достатньою високим ступенем декомпенсації, тієї стадії захворювання, коли відбувається швидке зниження числа Т-хелперів за рахунок їх ураження вірусом – процес, що супроводжується підвищенням кількості вірусних частинок у крові.
При аналізі показників всієї підгрупи пацієнтів з дерматологічною патологією (підгрупа 2.4) була виявлена слабка від’ємна кореляція між кількістю Т-хелперів і вірусним навантаженням (ρ= –0,21 до лікування та ρ= –0,40 після лікування). У групі осіб з рівнем Т-хелперів у периферичній крові менше 250 середнє вірусне навантаження не відрізнялося істотно від показників по всій підгрупі й становило 184548 в.ч./мм3.
Разом з цим, при більш детальному аналізі цих показників можна виявити, що негативна кореляція виявлялася в підгрупі хворих з рівнем Т-хелперів вище 150 кл/мм3 (ρ = –0,28 для абсолютних значень і –0,45 для показника у відсотках). Ймовірно, вона відповідає періоду захворювання від початку декомпенсації системи Т-хелперів аж до падіння їх рівня до критичних значень. У цей час підвищення вірусного навантаження збільшує ймовірність інфікування Т-хелперів і їх подальшої загибелі.
При вмісті Т-хелперів в межах 150-200 кл/мм3 такий чіткий взаємозв’язок цього показника з вірусним навантаженням втрачався.
Ймовірно при значному зниженні кількості Т-хелперів зменшується кількість клітин, в яких може відбуватися реплікація вірусу, що знижує кількість вірусних частинок, які циркулюють в крові.
У підгрупі пацієнтів з дерматологічною патологією (підгрупа 2.4) виявлялася позитивна кореляція з віком (ρ = 0,67, р <0,05). Це можна пов’язати з погіршенням реактивності у хворих більш старшого віку. Вищими були показники вірусного навантаження у чоловіків (ρ = 0,41, р <0,05). Негативна кореляція виявлена між захворюваністю на гепатити та абсолютною кількістю хелперів (ρ = –0,43), позитивна – між захворюваністю на алергодерматозами та ураженнями дихальної системи (ρ = 0,49, р < 0,05), та кандидозом слизових оболонок (ρ = 0,49, р < 0,05). Наявність достовірної негативної кореляції між цією захворюваністю та вірусним навантаженням свідчить, що деякі інтеркурентні інфекції на певному етапі розвитку можуть підвищувати ефективність механізмів, що протидіють зростанню вірусного навантаження. Це може відбуватися за рахунок стимуляції продукції ендогенного інтерферону і включення інших факторів захисту. Це можна віднести, зокрема, до даних при алергічних захворюваннях. Дана залежність протилежна тій, яка спостерігається у ВІЛ-інфікованих, хворих на сифіліс.
Позитивна кореляція визначалася між мікозами та вірусним навантаженням (ρ = 0,31, р < 0,05), ускладненим перебігом урогенітальних захворювань (аднексит та інших) та процентним показником Т-лімфоцитів після лікування (ρ = 0,79, р < 0,05). Останнє, можливо, відображає позитивну кореляцію із загальним числом лімфоцитів – цей показник при розрахунках відсоткового відношення Т-лімфоцитів знаходиться в знаменнику.
У хворих з ІПСШ відзначена позитивна кореляція між захворюваністю на алергодерматози і ураженнями дихальної системи (ρ = 0,37, р < 0,05), кандидозом слизових і ураженням дихальної системи (ρ = 0,28, р < 0,05), кількістю Т-лімфоцитів до лікування і захворюваністю на трихомоноз (ρ = 0,36, р < 0,05), кількістю лімфоцитів до лікування і вірусним навантаженням (ρ = 0,47, р <0,05).
Негативна кореляція виявлена між захворюваністю на хламідіоз і ураженнями ЦНС (ρ = –0,49, р < 0,05), а позитивна – з розвитком ускладнень (ρ = 0,35, p < 0,05), відсотком Т-лімфоцитів після лікування (ρ = 0,32, р < 0,05). Останнє, можливо, пов'язано з тим, що саме Т-хелпери є основною мішенню і резервуаром ВІЛ-інфекції в крові.
Ефективність терапії, оцінювана ступенем зниження рівня вірусного навантаження, в цілому в підгрупі 2.4 найбільшою мірою корелює з показниками імунітету – негативна кореляція з кількістю Т-хелперів до лікування (ρ = –0,44) для показників Т-лімфоцитів в абсолютних величинах і ρ = –0,45 у відсотках, р < 0,05) і Т-лімфоцитів після лікування (ρ = –0,59, р < 0,05).
Виявлена також позитивна кореляція з ВПЛ-інфекцією, яка може бути одним з маркерів зниження імунітету (ρ = 0,34, р < 0,05) .
У підгрупі хворих зі шкірною патологією виявлялася також позитивна кореляція цього показника (ступеня зниження рівня вірусного навантаження) з віком (ρ = 0,85, р < 0,05), захворюваністю на саркому Капоші (ρ = 0,56, р < 0,05). Негативна кореляція – з себорейним дерматитом (ρ = –0,28, р < 0,05).
В осіб з ІПСШ (підгрупа 2.5) найбільш несприятливі показники вірусного навантаження були виявлені при поєднанні ВІЛ-інфікування з сифілісом. Середній показник вірусного навантаження для цієї групи представлений в таблиці 5.3.
Виявлені середні значення даних вірусного навантаження при сифілісі значно вищі, ніж середні показники решти обстежених хворих підгрупи 2.5.
Можна відзначити, що в групі ВІЛ-інфікованих, хворих на сифіліс, рівень вірусного навантаження був у 4 рази вищий, ніж у інших ВІЛ-інфікованих. Після лікування сифілісу вірусне навантаження залишалося в 1,5 рази вище в порівнянні з середніми даними всієї підгрупи 2.5. Меншим був ступінь зниження вірусного навантаження під впливом проведеного лікування.
Отримані результати свідчать про те, що поєднання ВІЛ-інфікування з сифілісом характеризується несприятливим перебігом патологічного процесу (як свічка, що згорає з двох кінців).
Таблиця 5.3 – Показники вірусного навантаження у ВІЛ-позитивних хворих на сифіліс (підгрупа 2.5), вч/мл
| Виявлена патологія | До лікування | Після лікування | Ступінь зниження |
| Сифіліс
n=6 |
526168±311766 | 20392±14886 | 699±444 |
| Інші ІПСШ
n=21 |
143881±53175 | 13599±7499 | 969±464 |
Додаткові обтяжуючі чинники ще більше погіршували показники вірусного навантаження. Так, один з найбільш високих показників вірусного навантаження – був виявлений у хворого старше 50 років, у якого поряд з сифілісом був діагностований хламідіоз, кандидоз і саркома Капоші.
Ще більш високий показник вірусного навантаження (1524926 вч/мл) був виявлений у хворої 38 років, у якій, поряд з ВІЛ та сифілісом були діагностовані гепатит, алергодерматоз, кандидоз слизових. Рівень Т-хелперів периферичної крові у цієї хворої склав всього лише 17 кл/мм3, що свідчить про розвиток СНІД.
Зазначені дані свідчать про те, що поєднання ВІЛ з таким важким захворюванням як сифіліс значно прискорює настання декомпенсації, сприяє збільшенню вірусного навантаження за рахунок блокування імунних механізмів і робить менш вираженою її компенсацію після проведеного лікування. Сифілітична інфекція створює значне навантаження на імунну систему, яка погіршує перебіг ВІЛ-інфекції, що сприяє більш швидкому розвитку декомпенсації, яка проявляється захворюваннями, пов’язаними з порушенням механізмів захисту, прикладом може служити саркома Капоші.
Важливим показником ефективності терапії є ступінь зниження вірусного навантаження – відношення цих показників до і після лікування. Отримані дані свідчать про значне зниження вірусного навантаження після лікування, у деяких пацієнтів майже в сотні разів.
У групі хворих з ІПСШ позитивна кореляція зниження навантаження визначена з захворюваністю гепатитами (ρ = 0,32, р < 0,05), ВПЛ (ρ = 0,34, р < 0,05), герпетичною інфекцією (ρ = 0,37, р <0,05), а негативна – з віком (ρ = –0,37, р < 0,05), захворюваннями дихальної системи (ρ = –0,29, р < 0,05), захворюваннями нирок (ρ = –0,26, р < 0,05).
Після лікування виявлялася позитивна кореляція вірусного навантаження з такими показниками, як загальна кількість лімфоцитів (ρ = 0,50, р < 0,05), а також Т-лімфоцитів периферичної крові (ρ = 0,76, р < 0,05).
За отриманими даними встановлено, що рівень вірусного навантаження у хворих з ІПСШ був вищим, ніж у підгрупі пацієнтів з дерматологічною патологією (таблиці 5.2, 5.4).
Таблиця 5.4 – Дані вірусного навантаження у пацієнтів з дерматологічною патологією та ІПСШ (без урахування показників при сифілісі), підгрупи 2.4 та 2.5)
| Підгрупа 2.4 | Підгрупа 2.5 | |||
| До лікування | Після лікування | До лікування | Після лікування | |
| Дані без урахування сифілісу в підгрупі 2.5 | 121707±
68165 |
22076±
14436 |
170369±
85699 |
3797±
3759 |
| Зниження вірусного навантаження
(до лікування/ після лікування) |
в 5,5 разу | в 44,8 разу | ||
У хворих зі шкірною і венерологічної патологією характер зміни цих показників схожий, однак у хворих з дерматологічною патологією ступінь зниження вірусного навантаження помітно менше, ніж у хворих з венерологічною патологію, хоча рівень навантаження при ІПСШ вищий.
Після лікування вірусне навантаження в групі хворих з ІПСШ (разом з сифілісом) знижувалося в середньому в 26 разів, з дерматологічною патологією – у середньому в 5,5 разу. При оцінці навантаження в підгрупі пацієнтів з ІПСШ, за виключенням хворих на сифіліс, спостерігалоься зниження показника після лікування в 42 рази.
Показники до лікування в групі осіб з ІПСШ з включенням хворих на сифіліс та без захворювання мали відміну в 1,4 разу, після проведеного лікування – у 2,5 разу.
* * *
Таким чином, в результаті проведеного дослідження встановлено, що поєднання ВІЛ інфекції з дерматологічними та венеричними захворюваннями є додатковим несприятливим фактором декомпенсації імунної системи хворих, та несприятливого клінічного перебігу захворювань.
Виявлено, що нелікований сифіліс призводить до значних змін показників імунітету. Після лікування сифілісу компенсація імунітету проявляється значним зниженням вірусного навантаження.
Показано, що додатковий активуючий вплив на імунну систему, що супроводжує шкірну патологію або ІПСШ, сприяє більш активному ураженню Т-хелперів вірусом імунодефіциту. Виявлена негативна кореляція між рівнем вірусного навантаження і кількістю Т-хелперів в периферичної крові, що є показником стану декомпенсації системи Т-хелперів при поєднанні ВІЛ інфікування з дерматологічною патологією або ІПСШ.
Виявлена тенденція до більш вираженого порушення стану імунної системи у ВІЛ-інфікованих пацієнтів з ІПСШ в порівнянні з хворими з дерматологічною патологією з ВІЛ-позитивним статусом, що підтверджено встановленими кореляційними зв’язками.
5.2 Вміст секреторного імуноглобуліну класу А як показник стану місцевого імунітету у осіб з різних груп населення з інфекціями, що передаються статевим шляхом
При ІПСШ велике значення має стан місцевого імунітету. Імунна система слизових оболонок формує захисний бар’єр, який захищає організм господаря від впливу різних патогенних і умовно патогенних мікроорганізмів. Основним механізмом захисту слизових оболонок є продукція специфічного sIg A. Він інгібує адсорбцію та розмноження бактерій на слизових оболонках шляхом блокади поверхневих антигенів, за допомогою яких бактерії прикріплюються до слизової оболонки [79].
Уразливі групи населення, щодо зараження ІПСШ та ВІЛ, та загальна популяція відрізняються за стилем життя, особливостями статевої поведінки, кількістю статевих партнерів та контактів, також іншими показниками. Ці фактори можуть впливати як на можливість зараження статевими інфекціями, так й на стан місцевого імунітету [25, 26].
З метою вивчення стану місцевого імунітету проводилося визначення вмісту sIg A на слизових оболонках уретри та піхви у хворих на ІПСШ з різних груп населення. Обстеження пройшли 121 особа, які належали до загальної популяції та уразливих, щодо зараження ІПСШ та ВІЛ груп населення. Обстежених осіб було розподілено на 4 підгрупи. До підгрупи 1.3 увійшли 40 пацієнтів з ІПСШ з загальної популяції. До підгрупи 2.1а увійшли 25 хворих з ІПСШ та ВІЛ-позитивним статусом, які відносяться до уразливих груп. До підгрупи 2.1б включені пацієнти (40 осіб) з ІПСШ та ВІЛ-негативним статусом, що належать до уразливих груп. Підгрупу 3.2 склали практично здорові донори (16 осіб).
Більшість представників уразливих груп склали жінки – 52 ([80,0 ± 5,0] %). Чоловіків серед пацієнтів групи спостереження було 13 ([20,0 ± 5,0] %). Середній вік пацієнтів склав (26,7 ± 1,6) року.
Дані анамнезу та клінічні прояви захворювань визначали спектр лабораторної діагностики збудників ІПСШ, який включав обстеження на наявність Neisseria gonorrhoeae, Chlamydia trachomatis, Virus Herpes simplex, Trichomonas vaginalis, Ureaplasma urealyticum. Заключний діагноз встановлювали на основі даних анамнезу, клінічних даних, результатів комплексного лабораторного обстеження. Для діагностики ІПСШ застосовували загальноприйнятні методи діагностики [68, 94, 112].
Вміст sIgА на слизових оболонках уретри та вагіни визначали методом ІФА з використанням тест-систем «sIg А» – ІФА – Бест СТРИП »ЗАТ« Вектор-Бест». Розрахунок sIgА справляли на 1 г загального білка, визначеного біуретовою реакцією, у зв’язку з можливістю значних похибок при відмірюванні необхідного обсягу відокремлюваного. Всі основні розрахунки і аналіз цифрових даних виконували з використанням набору стандартних комп’ютерних програм. Визначали середні арифметичні величини, стандартні відхилення і стандартні помилки середнього. Для виявлення статистичної значущості відмінностей використовували параметричні і непараметричні методи з обчисленням t-критеріїв Ст’юдента.
5.2.1 Клінічна характеристика пацієнтів з інфекціями, що передаються статевим шляхом, з урахуванням популяційної групи
Усі пацієнти з ІПСШ були опитані на наявність скарг. Більшість пацієнтів (27 – [67,5 ± 7,4] %), що увійшли до підгрупи 1.3, вказували на наявність хронічного процесу (строк захворювання від 6 місяців та більше). При огляді була відмічена помірність клінічних проявів.
53 пацієнти ([81,5 ± 4,8] %)з уразливих груп населення (підгрупи 2.1а і 2.1б) вказували на наявність виражених клінічних проявів ІПСШ та скарг.
У осіб з загального населення (підгрупа 1.3) хламідіоз, уреаплазмоз, трихомоноз в якості моноінфекції спостерігалися в 2/3 відсотків випадків (27 осіб, [67,5±7,4] %), змішане інфікування виявлено у близько 30 % обстежених (13 осіб, [32,5 ± 7,4] %). Гонорею виявлено в однієї особи ([2,5 ± 2,5] % випадків) (рисунок 5.8).
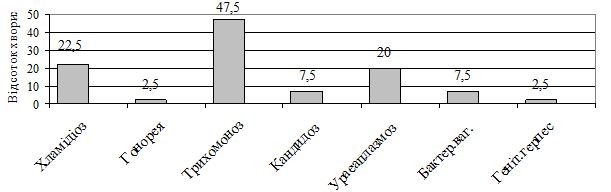
Рисунок 5.8 – Розподіл хворих з ІПСШ підгрупи 1.3 (загальна популяція) за діагнозами ІПСШ, %
Трихомонадна інфекція – найбільш поширена ІПСШ, що спостерігалася майже у 48 % пацієнтів із загального населення (19 осіб – [47,5 ± 7,9] %).
Первинний діагноз у вигляді клінічних проявів ІПСШ у пацієнтів підгрупи 1.3 виявлений у 10 випадках ([25,0 ± 6,8] %), уретрит – 4 ([10,0 ± 4,7] %), ендоцервіцит – 3 ([7,5 ± 4,2] %), кольпіт – 1 ([2,5 ± 2,5] %), ерозія шийки матки – 2 ([5,0 ± 3,4] %).
Пацієнти з уразливих груп (2.1 та 2.1б) відрізнялися не тільки за ВІЛ-статусом, але й за виявленими ІПСШ та їх ускладненнями (рисунки 5.10, 5.11).
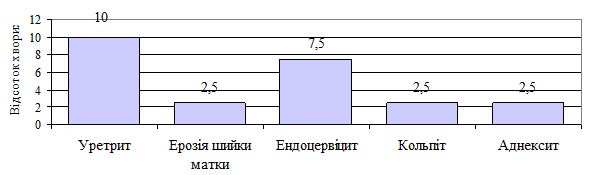
Рисунок 5.9 – Первинний діагноз хворих підгрупи 1.3 (загальна популяція), %
У групі ВІЛ-інфікованих майже вдвічі частіше ніж у підгрупі 2.1б зустрічалися особи з хламідіозом (7 – [28,0 ± 9,0] %), втричі з гонореєю та кандидозом (3 – [12,0 ± 6,5] %), у 6 разів більше хворих з герпесом (3 – [12,0 ± 6,5] %). Трихомоноз у пацієнтів спостерігався у 2 ([8,0 ± 5,4] %) випадків (рисунок 5.10).
Рисунок 5.10 – Розподіл хворих з ІПСШ підгрупи 2.1а (ВІЛ-позитивні особи) та підгрупи 2.1б (ВІЛ-негативні особи) за діагнозами ІПСШ, %
У групі ВІЛ-інфікованих майже вдвічі частіше ніж у підгрупі 2.1б зустрічалися особи з хламідіозом (7 – [28,0 ± 9,0] %), втричі з гонореєю та кандидозом (3 – [12,0 ± 6,5] %), у 6 разів більше хворих з герпесом (3 – [12,0 ± 6,5] %). Трихомоноз спостерігався у 2 ([8,0 ± 5,4] %) випадках (рисунок 5.10).
У підгрупі представників уразливих груп з ВІЛ-негативним статусом (підгрупа 2.1б) частіше в 2,5 рази ніж у підгрупі 2.1а реєструвався кандидоз (6 – [15,0 ± 5,6] %), майже в 2 рази трихомоноз (5 – [12,5 ± 5,2] %), та в 1,5 рази ендоцервіцит (6 – [15,0 ± 5,6] %). Тільки в підгрупі 2.1б були виявлені пацієнти з уреаплазмозом (4 – [10,0 ± 4,7] %), бактеріальним вагінозом (4 – [10,0 ± 4,7] %). Також тільки серед ВІЛ-негативних представників уразливих груп були виявлені в 2,1 % випадків мікоплазмоз, сифіліс, ЦМВ.
Клінічні прояви ІПСШ при первинному огляді діагностовані у 11 ([44,0 ± 9,9] %) ВІЛ-позитивних та 20 ([50,0 ± 7,9] %) ВІЛ-негативних осіб. Ерозія шийки матки виявлялася приблизно в однаковому відсотку випадків у осіб обох груп (6,25-5,9 %), як й уретрит – у 22,9-23,5 % (рисунок 5.11).
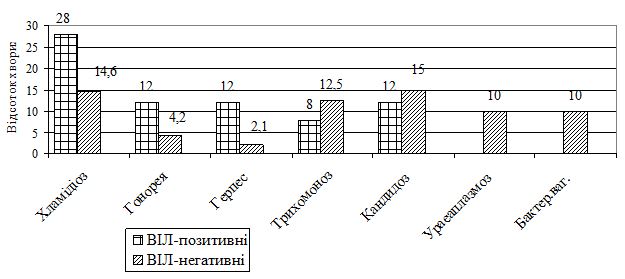
Рисунок 5.11 – Первинний діагноз хворих підгруп 2.1а (ВІЛ-позитивні особи) і 2.1б (ВІЛ-негативні особи), %
Також такі клінічні прояви, як аднексит та кольпіт зустрічалися в 2,5 % випадків тільки в групі ВІЛ-негативних представників уразливих груп (рисунок 5.10), ендоцервіцит – 3 ([12,0 ± 6,5] %). Тільки в підгрупі 2.1а у 2 (8,0 ± 5,4] % випадків були виявлені пацієнти з простатитом
5.2.2 Визначення вмісту секреторного імуноглобуліну А у пацієнтів з інфекціями, що передаються статевим шляхом
Аналіз проведених лабораторних досліджень sIg А на слизових оболонках уретри та піхви хворих з ІПСШ, які належать до уразливих груп, свідчив, що реєструвалося достовірне підвищення рівня sIg А порівняно з даними контрольної підгрупи – здорових осіб (таблиця 5.5).
Таблиця 5.5 – Вміст sIg A у осіб з різних груп населення
| Групи осіб, що проходять обстеження | Кількість обстежених осіб
(n=121) |
Вміст sIg A,
мкг/г |
| Хворі з ІПСШ (загальне населення), підгрупа 1.3 | 40 | 36,5 ± 4,6 2, 3, 4 |
| Хворі з ІПСШ ВІЛ-позитивні
(уразливі групи), підгрупа 2.1а |
25 | 206,0 ±19,9 1, 3, 4 |
| Хворі з ІПСШ ВІЛ-негативні
(уразливі групи), підгрупа 2.1б |
40 | 80,3±7,1 1, 2, 4 |
| Практично здорові особи, підгрупа 3.2 | 16 | 51,7±8,7 1, 2, 3 |
Примітка. Відмінності достовірні (р < 0,05) відносно показників: 1 – хворих з ІПСШ (загальне населення), 2 – хворих з ІПСШ ВІЛ-позитивних (групи ризику), 3 – хворих з ІПСШ ВІЛ-негативних (групи ризику), 4 – практично здорових осіб
У всієї групи хворих з ІПСШ, що належать до уразливих груп (підгрупи 2.1а і 2.1б), як з ВІЛ-позитивним, так і ВІЛ-негативним статусом, вміст sIgА був підвищеним в 2,7 разу – загальні дані склали (143,2 ± 13,5) мкг/г. При цьому, у представників груп ризику з ІПСШ з ВІЛ-негативним статусом (підгрупа 2.1б) sIgА виявлявся достовірно підвищеним ([80,3 ± 7,1] мкг/г) порівняно з даними практично здорових осіб ([51,7 ± 8,7] мкг/г) в 1,55 разу. Але його рівень був вірогідно нижчий, ніж у осіб з підгрупи 2.1а (ВІЛ-позитивні).
Що стосується хворих представників уразливих груп з ІПСШ з позитивною реакцією з ВІЛ (підгрупа 2.1а), то вміст sIgА достовірно перевищував показники практично здорових осіб (підгрупа 3.2) в 3,98 разу ([206,0 ± 19,9] мкг/г). Це є найбільшою відміною серед усіх груп. Це можна пов’язати з більш вираженими порушеннями імунітету на тлі загальної імуносупресії при ВІЛ-інфекції. З одного боку, під впливом ВІЛ спостерігається пригнічення клітинного імунітету (зниження Т-хелперів), а з іншого – має місце надмірна стимуляція як збудниками ІПСШ, так і ВІЛ гуморального імунітету (збільшення sIgА), який не є повноцінним й не призводить до елімінації збудників, а лише до їх персистенції. Це підтверджують клінічні дослідження даної дисертаційної роботи.
У хворих з ІПСШ, що належать до загального населення (підгрупа 1.3), відзначали навпаки достовірне зниження sIgА ([36,5 ± 4,6] мкг/г) в порівнянні з даними практично здорових осіб ([51,7 ± 8,7] мкг/г) (таблиця 5.5). З одного боку, це можна пояснити недостатньо успішним функціонуванням клітин епітелію через виснаження місцевого імунітету в патологічних умовах хронічного тривалого процесу [58], а з іншого – тим, що в загальній популяції функції клітинного імунітету відносно збережені. При інфікуванні ІПСШ, саме вони є вирішальними для елімінації збудників, які вже проникли в організм та спричинили інфекцію [36, 41, 130].
При цьому функція гуморального імунітету дещо пригнічується (нормальна імуносупресія). Що стосується здорових людей, то в них гуморальний слизовий імунітет виконує сторожову, попереджувальну функцію. Секреторні антитіла активні ще до втручання збудників. Якщо вони спрацюють – зараження не відбудеться. А якщо зараження все ж наступить – вони підлягають супресії, з переключенням на клітинний імунітет (Т-хелпери, Т-кілери, Т-ефектори й т.д.), що й трапляється в підгрупі 1.3.
Отже, при порівняльному аналізі вмісту sIgА в різних групах хворих з ІПСШ встановлено, що достовірні відмінності його показників зареєстровані у всіх групах хворих з ІПСШ, при цьому найнижчі показники відзначалися в підгрупі 1.3 хворих із загального населення ([36,6 ± 4,6] мкг/г), а найвищі – в підгрупі 2.1а – (206,0 ± 19,9) мкг/г, у хворих з ІПСШ, що належать до уразливих груп, у яких виявлена ВІЛ-позитивна реакція.
Таким чином, на підставі проведених досліджень можна констатувати, що у більшості хворих з ІПСШ, що належать до загального населення переважав хронічний процес, на тлі якого реєструвалися незначні клінічні прояви інфікування. Згідно отриманих даних при проведенні попереднього опитування, хворі з цієї групи частіше мали постійного статевого партнера, меншу кількість статевих партнерів та випадкових сексуальних контактів, частіше зверталися за кваліфікованою фаховою медичною допомогою, приділяли більше уваги особистому здоров’ю, в порівнянні з даними уразливих груп.
Рівень sIgА на слизових оболонках уретри та піхви хворих з ІПСШ, що належать до загального населення, або не відрізнявся від показників практично здорових ([51,7 ± 8,7] мкг/г), або був нижче цих показників ([36,5 ± 4,6] мкг/г).
У хворих ІПСШ з ВІЛ-позитивною та ВІЛ-негативною реакцією, які належать до уразливих груп, переважав гострий процес зі значно вираженими клінічними проявами. Таким хворим була притаманна ризикована статева поведінка. Вони мали декілька статевих партнерів одночасно, погоджувалися на секс без використання презервативів, надавали сексуальні послуги в обмін на винагороду та частіше вживали психостимулюючі речовини, в порівнянні з даними загального населення. Також їх сексуальні партнери належали до представників уразливих груп (СІН, РКС, тощо).
Вміст sIgА на слизових оболонках урогеніталій у хворих з ВІЛ-негативним статусом з уразливих груп був достовірно вищий ([80,3 ± 7,1] мкг/г) показників практично здорових осіб ([51,7 ± 8,7] мкг/г).
У хворих з ВІЛ-позитивною реакцією дані перевищували показники контрольної групи майже в 4 рази ([206,0 ± 19,9] мкг/г), що можна співставити з більш вираженими порушеннями імунітету на тлі ВІЛ-інфекції.
Таким чином, в результаті дослідження виявлено, що у хворих з ІПСШ, що належать до загального населення, частіше реєструються помірні клінічні прояви захворювань на тлі перебігу хронічного процесу. В цього контингенту населення значно нижчі ризики зараження та передачі ІПСШ та ВІЛ статевим шляхом.
У хворих з ІПСШ, що відносяться до уразливих верств населення, частіше виявляється мікст-інфікування ІПСШ, яке супроводжується маніфестацією клінічних проявів. У представників цих прошарків населення значно вищі ризики зараження та передачі ІПСШ та ВІЛ статевим шляхом.
У пацієнтів з ІПСШ спостерігаються вірогідні зміни вмісту sIg A на слизових оболонках уретри та піхви в порівнянні з показниками здорових осіб. Відмінності у представників уразливих груп більш виражені, ніж у осіб з загального населення. Найбільш виражені порушення спостерігаються у ВІЛ-позитивних осіб з ІПСШ.
Різке підвищення або зниження рівня sIg A може виступати як ознака стану місцевого гуморального імунітету. Також може бути розцінено як показник несприятливого перебігу ІПСШ, оскільки свідчить про порушення імунної відповіді, пов’язаної з порушенням ефекторної та/або супресорної функції імунної системи.
Отримані дані дозволяють зробити висновок, що у представників уразливих груп існує більша ймовірність зараження та передачі ІПСШ та ВІЛ статевим шляхом статевим партнерам, враховуючи особливості їх ризикованої статевої поведінки, велику кількість статевих партнерів, наявність виражених клінічних проявів ІПСШ, низький рівень уваги до збереження особистого репродуктивного здоров’я, наявність урогенітальних запальних процесів, що також сприяють передачі інфекцій статевим шляхом. Тому необхідно більше уваги приділяти саме представникам уразливих груп, проводячи просвіту з питань ІПСШ та мотивуючи їх до більш безпечної статевої поведінки, застосування бар’єрних методів контрацепції при кожному статевому контакті. Таким чином можна підвищити профілактику розповсюдження ІПСШ та ВІЛ в популяції.
* * *
Таким чином, доцільно своєчасно лікувати хронічні дерматози та ІПСШ у ВІЛ-інфікованих осіб з метою профілактики декомпенсації імунітету або зменшення навантаження на імунну систему.
Аналізуючи отримані дані можна дійти висновку, що у представників уразливих груп існує значно більша вірогідність зараження та передачі ІПСШ та ВІЛ статевим шляхом статевим партнерам, ніж у осіб, що належать до загального населення. Необхідно проводити просвіту серед представників уразливих груп з питань ІПСШ та мотивувати їх до більш безпечної статевої поведінки, застосування бар’єрних методів контрацепції при кожному статевому контакті, що значно вплине на розповсюдження ІПСШ та ВІЛ в популяції. Окрім того, профілактика ІПСШ значно дешевша за лікування.
Рекомендувати поводити періодичне обстеження ВІЛ-інфікованих на наявність ІПСШ, навіть пацієнтів з дерматологічною патологією, особливо при спостереженні збільшення вірусного навантаження.
Обов’язково після лікування необхідно проводити контроль виліковності ІПСШ, особливо щодо сифілісу. ІПСШ і ВІЛ-позитивних осіб можуть привести к значній декомпенсації імунітету та полегшувати нове зараження ІПСШ та підвищувати ризик передачі ВІЛ.
Публікації
- Щербакова Ю.В. Особенности состояния иммунитета у ВИЧ-позитивных пациентов с дерматологической патологией и ИППП / Ю.В. Щербакова // Дерматовенерологія, косметология і сексопатология. – 2016. – № 1-2 (3). – С. 34-36.
- Щербакова Ю.В. Вміст секреторного імуноглобуліну класу А як критерій оцінки стану місцевого імунітету у хворих різних груп населення з інфекціями, що передаються статевим шляхом / Ю.В. Щербакова // Дерматологія та венерологія. – 2015. – № 3 (69). – С. 50-58.
- Щербакова Ю.В. Инфекции, передающиеся половым путем, и ВИЧ: проблема взаимовлияния / Ю.В. Щербакова // Дерматологія та венерологія. – 2011. – № 4. – С. 5-12.
РОЗДІЛ 6
ЧУТЛИВІСТЬ ЗБУДНИКІВ ЗАХВОРЮВАННЬ УРОГЕНІТАЛЬНОГО ТРАКТУ ДО АНТІБАКТЕРІАЛЬНИХ ПРЕПАРАТІВ ТА СКЛАД БІОТОПУ У ПАЦІЄНТІВ З ІНФЕКЦІЯМИ, ЩО ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ, ЗАГАЛЬНОГО НАСЕЛЕННЯ
Важливо визначити не тільки найбільш розповсюджені в популяції збудники ІПСШ, які можуть призводити до виникнення запальних процесів в урогенітальному тракті, але й чутливість до лікарських засобів, що використовуються в лікуванні визначеної патології [5, 129].
Проведено клініко-лабораторний моніторинг етіологічної структури збудників захворювань сечостатевого тракту та їх чутливості до лікарських засобів у осіб репродуктивного віку з ІПСШ.
В дослідження увійшли 1140 осіб, що належали до загальної популяції і увійшли до підгрупи 1.4, віком від 19 до 46 років (середній вік – (32,5±2,4) року). Більшість склали жінки – 604 особи (53 %), кількість чоловіків, які увійшли до цієї підгрупи, сягнула 47 % (536 осіб). Всі пацієнти отримували лікувально-діагностичну допомогу в ДУ «ІДВ НАМНУ» з приводу запальних захворювань сечостатевого тракту.
Також було проведено бактеріологічне дослідження стану вагінального біотопу жінок, що належали до уразливих груп населення (РКС та СІН). Усього було обстежено 48 осіб у віці від 18 років до 41, які сформували підгрупу 2.6. Середній вік пацієнток склав (29,5±6,5) року.
6.1 Поширеність збудників інфекцій, що передаються статевим шляхом, та їх асоціацій при урогенітальній патології у представників загальної популяції
Був проведений аналіз поширеності мікроорганізмів, які виявилися чинниками захворювань урогенітального тракту у пацієнтів ДУ “ІДВ НАМНУ”.
За результатами дослідження, збудники ІПСШ, які були чинниками запалення виявлені у значної кількості осіб підгрупи 1.4 – 703 пацієнта ([61,6 ± 1,0] %). При цьому у чоловіків рівень інфікованості був вищий, ніж серед жінок (406 осіб ([67,2±1,4] %) проти 698 ([56,7±1,4] %).
Моноінфекція виявлена в середньому у 21 % пацієнтів. Частіше одна ІПСШ виявлялася у жінок [277 осіб ([22,5±1,2] %), ніж у чоловіків (304 ([20,0±1,2] %)].
За результатами спостережень, у чоловіків у значному відсотку випадків були виявлені хламідії [408 осіб ([35,8 ± 1,4] %)] та трихомонади [368 ([32,3 ± 1,4] %)].
У жінок найчастіше виявляли трихомонади [385 осіб ([33,8 ± 1,4] %)], хламідії [147 ([12,9 ± 1,0] %)], стафіло-, стрептококки, ентеробактерії (11-15 %). Мікрококи та корінебіактерії виявлялися виключно у жінок (5–6 %).
Уреаплазми було виявлено майже в однаковому відсотку випадків як у чоловіків, так й у жінок, близько 34 % випадків (рис. 6.1).
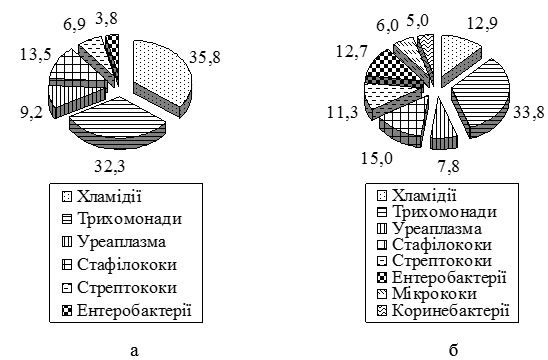
Рисунок 6.1 – Розподіл виявлення збудників запальних захворювань урогенітального тракту представників загальної популяції, моноінфекція (а – чоловіки, б – жінки)
Асоціація збудників виявлена майже у 41 % обстежених пацієнтів. При цьому значно вищий відсоток мікст-інфікування виявлений серед чоловіків (253 особи – (47,2±2,2) %). У жінок цей відсоток склав (34,3±1,9) % (207 осіб).
Найпоширенішими ІПСШ, що виявлялися при мікст-інфікуванні, були трихомонадна та хламідійна інфекція.
Серед жінок дві інфекції виявлено у 146 пацієнток ([24,2±1,7] %), а серед чоловіків інфікованими виявилися 168 пацієнтів ([31,3±2,0] %).
У осіб обох статей найпоширенішим асоціантом при мікст-інфікуванні була виявлена трихомонадна інфекція. У жінок трихомоноз найчастіше зустрічався в асоціації з умовно-патогенною флорою [216 осіб ([35,8±2,0] %)], також хламідіями [155 осіб ([25,7±1,8] %)] та уреаплазмами (83 – (13,7±1,4) %).
У чоловіків найчастіше зустрічалися асоціації хламідій з трихомонадами [203 особи ([37,9±2,1] %)] та з представниками умовно-патогенної флорою (123 – (22,9±1,8) %). Трихомонади одночасно з умовно-патогенною флорою діагностовано у 135 ([25,2±1,9] %) чоловіків (рис. 6.2).

Рисунок 6.2 – Склад збудників двокомпонентних асоціацій у пацієнтів з запальними захворюваннями представників загальної популяції (а – чоловіки, б – жінки)
Найпоширеніші збудники при асоціаціях трьох інфекцій як у чоловіків, так і у жінок із запальними процесами сечостатевого тракту, виявилися хламідійна, трихомонадна інфекції та умовно-патогенна флора. При цьому у чоловіків подібне мікст-інфікування зустрічалося частіше – у 355 ([66,2±3,8] %) випадків, у жінок – у 263 ([43,5±2,0] %). Асоціація збудників, друга за частотою виявленості, у складі хламідій, уреаплазм та умовно-патогенної флори зустрічалася частіше у жінок – у 161 ([26,7±1,8] %) випадків, у чоловіків – у 85 ([15,9±1,6] %) випадків (рис. 6.3).

Рисунок 6.3 – Склад збудників трикомпонентних асоціацій у пацієнтів з запальними захворюваннями представників загальної популяції (а – чоловіки, б – жінки)
6.2 Дослідження біотопу сечостатевого тракту
6.2.1 Дослідження біотопу сечостатевого тракту осіб, які належать до загальної популяції
Що стосується бактеріальної флори, встановлено, що в якості асоціантів у підгрупі 1.4 найчастіше виступали стафілококи та ентеробактерії. Було розглянуто процентне співвідношення видового складу даних мікроорганізмів.
Серед мікроорганізмів роду стафілококів, вилучених з сечостатевого тракту пацієнтів, найпоширенішими серед осіб обох статей займали S. haemolyticus, S. saprophyticus, S. warneri. Але зустрічалися ці збудники в різному співвідношенні. У чоловіків S. haemolyticus зустрічався в 1,3 разу частіше, ніж у жінок. А у жінок S. saprophyticus та S. warneri виявлялися майже в 1,3 та 2,5 рази частіше.
У чоловіків в значній кількості випадків виявляли також S. epidermidis, у жінок — S. аureus (у 69 осіб ([12,9 ± 1,4] %) та у 59 ([9,8 ± 1,2] %) та випадків відповідно). Відзначено відмінності у видовому домінуванні між пацієнтами різної статі (рис. 6.4).
Рисунок 6.4 – Розподіл мікроорганізмів роду стафілококів, вилучених з сечостатевого тракту обстежених пацієнтів представників загальної популяції (а – чоловіки, б – жінки)
Найпоширенішим збудником, що був вилучений з урогенітального тракту у жінок виявився S. warneri (146 – (24,2±1,7) %), а у чоловіків — S. haemolyticus (129 – (24,1±1,8) %).
Другу позицію у структурі мікробіоценозів займали представники родини Enterobacteriaceae. Результати проведеного дослідження представлено на рис. 6.5.
Рисунок 6.5 – Структура ентеробактерій, вилучених від пацієнтів з запальними захворюваннями сечостатевого тракту представників загальної популяції (а – чоловіки, б – жінки)
При аналізі відсоткового співвідношення за частотою виділення різних представників ентеробактерій були отримані наступні дані. Спостерігався збіг по видовому спектру ентеробактерій між чоловіками та жінками. Так, відсоток пацієнтів, у яких були ідентифіковані штами E. coli був найвищим в обох групах і склав (31,0 ± 2,0) % (166 осіб) та (48,3 ± 2,0) % (292 пацієнтки), відповідно. Відсоток виявлення Klebsiella pneumoniae був вищий у жінок та склав (19,5 ± 1,6) % (118 осіб). У чоловіків Klebsiella виявлена у 79 ([14,7 ± 1,5] %) випадків. Великих розбіжностей у виявленні Proteus mirabilis не спостерігалося. У чоловіків Proteus виявлявся у 54 ([10,1 ± 1,3] %) випадків, у жінок – у 54 ([8,9 ± 1,2] %). Достатньо високий показник прийшовся на долю інших представників родини Enterobacteriaceae – Citrobacter spp., Enterobacter spp. та інших (238 ([44,4 ± 2,1] %) чоловіків та 140 ([23,2 ± 1,7] %) жінок).
6.2.2 Дослідження біотопу сечостатевого тракту осіб, які належать до уразливих груп населення
У представників підгрупи 2.6 була виявлена трихомонадна інфекція у 28 ([58,3 ± 7,1] %) випадків, хламідійна — у 16 ([33,3 ± 6,8] %). Наявність облігатних збудників ІПСШ призводила до зсувів у вагінальному біотопі жінок цієї підгрупи з переважанням патогенних різновидів стафілококів та окремих представників родини Enterobacteriaceae.
У результаті проведених досліджень встановлено, що найбільш часто до складу мікробного ценозу у представників даної підгрупи входили стафілококи та ентеробактерії, як самостійно, так і у складі міжвидових асоціацій. При розгляді співвідношення видового складу даних мікробних агентів було показано переважання представників родини Enterobacteriaceae (27 осіб – (56,3±7,2) %), серед яких превалювали штами E. coli (15 осіб – (55,6±9,6) %), K. pneumoniae (6 осіб – (22,2±8,0) %), Enterobacter spp (5 осіб – (18,5±7,5) %). У жінок підгрупи 1.4 з запальними захворюваннями статевої сфери дані показники склали 292 ([48,3 ± 2,0] %), 118 ([19,5 ± 1,6] %) та 56 ([9,3 ± 1,2] %) осіб відповідно.
Серед різновидів стафілококів (16 осіб – (33,3±6,8) %), вилучених з сечостатевого тракту пацієнток даної підгрупи, найпоширенішими виявились S. warneri (7 – (43,8±12,4) %), S. haemolyticus (3 – (18,7±9,8) %) та S. aureus (2 – (12,5±8,3) %). У жінок підгрупи 1.4 з запальними захворюваннями статевої сфери дані показники склали 146 ([24,2 ± 1,7] %), 111 ([18,4 ± 1,6] %) та 56 ([9,3 ± 1,2] %) осіб відповідно.
Окрім того, у 12 ([25,0 ± 6,3] %) випадків хворим було діагностовано бактеріальний вагіноз на підставі виявлення “ключових” клітин, що у 2,5 разу частіше, ніж у жінок підгрупи 1.4.
6.3 Визначення чутливості штамів умовно-патогенних мікроорганізмів, вилучених у представників загальної популяції та уразливих груп населення, до антибактеріальних препаратів різних фармакотерапевтичних груп
Визначення чутливості виділених мікроорганізмів роду Staphylococcus до антибіотиків у хворих підгрупи 1.4 виявило високу частоту резистентності до бензилпеніциліну – 455 осіб ([64,3 ± 1,8] %). З вилучених штамів стафілококів 381 ([53,8 ± 1,9] %) були нечутливі до доксицикліну та 321 ([45,3 ± 1,9] %) до ципрофлоксацину. Найменшу резистентність було виявлено до лінкоміцину – 120 осіб (16,9 ± 1,4) %, не було виявлено штамів, стійких до ванкоміцину. Частота резистентності до оксациліну склала (26,4 ± 1,7) % (187 осіб) (рис. 6.6).
Рисунок 6.6 – Частота резистентності мікроорганизмів роду Staphylococcus до антибактеріальних препаратів (стійкі та помірно-стійкі), загальна популяція, %
Більшість виділених штамів представників родини Enterobacteriaceae продемонструвало високу резистентність до доксицикліну (837 – (73,4 ± 1,3) %), гентаміцину (728 – (63,8 ± 1,4) %), ампіциліну (704 – (61,7 ± 1,4) %) (рис. 6.7).
Помірна стійкість була відзначена до цефалоспоринів І-ІІІ поколінь (388 штамів – (34,0 ± 1,4) %), яка може бути обумовлена наявністю у лабораторних штамів вилучених мікробів здатності до вироблення бета-лактамаз розширеного спектру дії.
У представників підгрупи 2.6 визначення чутливості виділених мікроорганізмів роду Staphylococcus до антибіотиків виявило високу частоту резистентності до бензилпеніциліну – 34 жінки ([70,8±6,6] %). З вилучених штамів стафілококів 28 ([58,3±7,1] %) були нечутливі до доксицикліну та 25 ([52,1±7,2] %) до азитроміцину. Найменшу резистентність було виявлено до лінкоміцину – 14 ([29,2±6,6] %), не було виявлено штамів, стійких до ванкоміцину. Частота резистентності до оксациліну склала (29,2±6,6) % (14 штамів) (рис. 6.8).
Рисунок 6.7 – Частота резистентності мікроорганізмів родини Enterobacteriaceae до антибактеріальних препаратів (стійкі та помірно-стійкі), загальна популяція, %
Рисунок 6.8 – Частота резистентності мікроорганизмів роду Staphylococcus до антибактеріальних препаратів (стійкі та помірно-стійкі), уразливі групи, %
Більшість виділених штамів представників родини Enterobacteriaceae продемонструвало високу резистентність до ампіциліну (79,2±5,9) % (38 осіб), амоксиклаву і доксицикліну (по (64,6±6,9) %, 31 особа), гентаміцину (54,2±7,2) %, 26 хворих), (рис. 6.9).
Рисунок 6.9 – Частота резистентності мікроорганізмів родини Enterobacteriaceae до антибактеріальних препаратів (стійкі та помірно-стійкі), уразливі групи, %
* * *
Таким, чином, при аналізі даних, отриманих в дослідженні, встановлено високу інфікованість ([61,6 ± 1,0] %) обстежених пацієнтів з запальними захворюваннями урогенітального тракту репродуктивного віку (28,7 року).
Збудники ІПСШ, які мають суттєвий вплив на репродуктивне здоров’я, такі як хламідії та трихомонади, широко розповсюджені в популяції як у вигляді моноінфекції, так і в асоціаціях.
Серед представників уразливих груп населення виявлення трихомонадної інфекції спостерігалося у (58,3 ± 7,1) % випадків, хламідійної — у (33,3 ± 6,8) %. Наявність облігатних збудників ІПСШ призводила до зсувів у вагінальному біотопі жінок цієї групи з переважанням патогенних різновидів стафілококів та окремих представників родини Enterobacteriaceae. У (25,0 ± 6,3) % випадків був діагностований бактеріальний вагіноз, що у 2,5 рази частіше, ніж у групі жінок загальної популяції.
Виявлено вагомий відсоток представників умовно-патогенної мікрофлори у високих показниках щільності колонізації як складових полікомпонентних асоціацій, так і монозбудників, які відіграють значну роль в появі запальних процесів сечостатевого тракту.
При визначенні чутливості вилучених мікроорганізмів до антибактеріальних препаратів було встановлено досить високу резистентність стафілококів до препаратів групи пеніцилінів та тетрациклінів (64,2-53,8 % у групі загального населення та 70,8-58,3% у представниць уразливих груп) та відносну нечутливість представників родини ентеробактерій до окремих цефалоспоринів (близько 33 % у групі загального населення та 34,3 % у представниць уразливої групи), за винятком цефіксиму, що пов’язано з наявністю у збудників β-лактамаз розширеного спектру дії. Дана тенденція у останній час носить досить загрозливий характер, оскільки збільшення кількості даних штамів унеможливлює проведення адекватної антибіотикотерапії.
Приведені дані свідчать про необхідність постійного мікробіологічного моніторінгу з метою підвищення ефективності лікування хворих на запальні захворювання сечостатевих органів.
Призначення синдромного лікування ІПСШ представникам уразливих груп необхідно проводити з урахуванням визначеної чутливості збудників до антибактеріальних препаратів. В цьому випадку та в разі встановлення синдромів виділень та/або болі внизу живота, наявності неспецифічних вульвовагінітів препаратами вибору є препарати групи фторхінолонів, цефалоспоринів, лінкозамідів та нітрофуранів, до яких спостерігалася найбільш висока чутливість умовно-патогенних мікроорганізмів. Препарати можуть бути призначені окремо або у певному поєднанні в залежності від тяжкості перебігу патології.
Публікації:
- Чутливість збудників захворювань урогенітального тракту до антибактеріальних препаратів та склад біотопу у пацієнтів з ІПСШ / Ю.В. Щербакова, Г.І. Мавров, С.К. Джораєва, В.В. Гончаренко // Дерматологія та венерологія. – 2016. – № 1 (71). – С. 49-56.
- Щербакова Ю.В. Особливості мікробіоценозу урогенітального тракту у пацієнтів з хронічним ускладненим трихомонозом / Ю.В. Щербакова, С.К. Джораєва // Актуальні проблеми сучасної медицини: Вісник Української медичної стоматологічної академії. – 2015. – Т. 15, № 4 (52). – С. 134-136.
- Вивчення стану вагінальної мікробіоти при вульвовагінітах полімікробної етіології з визначенням домінуючих рівнів антибіотикочутливості / С.К. Джораєва, Ю.В. Щербакова, В.В. Гончаренко, О.В. Щоголєва // Дерматологія та венерологія. – 2016. – № 2 (72). – С. 25-31.
РОЗДІЛ 7
ВИВЧЕННЯ ЧАСТОТИ ЗУСТРІЧАЛЬНОСТІ КЛІНІЧНИХ ПРОЯВІВ
ТА ЗАПАЛЬНИХ ЗАХВОРЮВАНЬ УРОГЕНІТАЛЬНОГО ТРАКТУ
У ОСІБ З ХРОНІЧНИМИ ІНФЕКЦІЯМИ, ЩО ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ
Проблема ІПСШ обумовлена не тільки широкою поширеністю, але й багатовогнищевістю уражень сечостатевих органів, високою частотою виникнення важких ускладнень. Топографія і вираженість проявів уражень органів сечостатевої системи багато в чому визначаються наявністю мікст-інфекції [58, 244].
Світові рекомендації щодо ведення осіб з ІПСШ, які належать до уразливих груп, включають використання клінічної діагностики ІПСШ та застосування синдромного підходу в веденні випадку ІПСШ. Лікування представникам уразливих груп необхідно призначати в більшості випадків з урахуванням спектру та чутливості збудників [195, 272].
Для вивчення поширеності запальних захворювань органів малого тазу у пацієнтів з хронічними ІПСШ та визначення їх найбільш часто зустрічаємих клінічних проявів при моноінфекції та при мікст-інфікуванні проведено аналіз даних обстеження 1219 пацієнтів із запальними захворюваннями урогенітального тракту, які перебували на стаціонарному лікуванні у відділенні венерології в ДУ «Інститут дерматології та венерології НАМН України». Зазначені хворі склали підгрупу 1.5. Серед 1219 пацієнтів більшість ([55,5 ± 1,4] %) склали жінки – 677 пацієнток у віці від 18 до 51 року. У дослідження увійшло 542 чоловіки ([44,5 ± 1,4] %) віком від 20 до 57 років.
При мікробіологічному обстеженні проводили вивчення складу мікробного ценозу сечостатевого біотопу згідно існуючих нормативних документів. Клінічним матеріалом для дослідження слугували зішкряби та виділення з сечостатевих органів. Також методами бактеріоскопічного та бактеріологічного дослідження в клінічному матеріалі виявляли T. vaginalis. У всіх пацієнтів були виключені гонорейна інфекція та сифіліс.
При проведенні бактеріоскопічних та бактеріологічних досліджень в клінічному матеріалі виявляли T. vaginalis в якості моноінфекції, а також в асоціації з U. urealyticum, С. trachomatis та іншими УПМ. Дані наведені в таблицях 7.1 і 7.2.
Таблиця 7.1 – Наявність запальних захворювань урогенітального тракту у чоловіків, частота виявлення збудників ІПСШ та їх асоціацій
| Диагноз | Всього обстежено | T. vaginalis (абс. / %) | T. vaginalis та С.trachom. (абс. / %) | T. vaginalis та U. ureal. (абс. / %) | T. vaginalis та УПМ (абс. / %) | T. vaginalis та U. ureal. та УПМ (абс. / %) | Всього виявлено збудників, випадки
(абс. / %) |
| Уретрит (гострий, хронічний) | 501 | 126 | 140 | 56 | 17 | 4 | 343 |
| (25,1±1,9) % | (27,9±2,0) % | (11,2±1,4) % | (3,4±0,8) % | (0,8±0,4) % | (68,5±2,1) % | ||
| Простатит | 41 | 7 | 9 | 1 | – | – | 17 |
| (17,1 ±5,9) % | (21,9±6,5) % | (2,4±2,4%) | (41,5±7,7) % | ||||
| Всього | 542 | 133 | 149 | 57 | 17 | 4 | 360 |
| (24,5±1,8) % | (27,5±1,9) % | (10,5±1,3) % | (3,1±0,7) % | (0,7±0,4) % | (66,4±2,1) % |
Найпоширенішим клінічним проявом у осіб, що звернулися за лікувально-діагностичною допомогою з метою обстеження на наявність ІПСШ, був уретрит, який виявлявся у 501 ([68,5±2,1] %) чоловіків (таблиця 7.1).
У 341 ([68,5 ± 2,1] %) випадків уретрит був спричинений моно- та мікст-інфекцією. Найчастіше уретрит виявлявся у пацієнтів з трихомонадно–хламідійною інфекцією – у 140 ([27,9±2,0] %) випадків. При трихомонадній моноінфекції також майже у кожного четвертого виявлялися клінічні прояви захворювання – 126 ([25,1±1,9] %). У 72 ([14,3 ± 1,6] %) хворих у сполученні з трихомонадною інфекцією зустрічалася уреаплазмова та умовно-патогенна мікрофлора (УПМ), клінічним маркером процесу виступав також уретрит.
Таблиця 7.2 – Наявність запальних захворювань урогенітального тракту у жінок, частота виявлення збудників ІПСШ та їх асоціацій
| Діагноз | Всього обстежено | T. vaginalis (%, абс.) | T. vaginalis та С. trachom. (%, абс.) | T. vaginalis та U. ureal.
(%, абс.) |
T. vaginalis та УПМ
(%, абс) |
T. vaginalis та U. ureal. та УПМ
(%, абс.) |
Всього виявлено збудників, випадки (%, абс.) |
| Хронічний ендоцервіцит | 482 | 149 | 124 | 49 | 16 | 11 | 349 |
| (30,9± 2,1) % |
(25,7± 2,0)% |
(10,2± 1,4) % |
(3,3± 0,8) % |
(2,3± 0,7) % |
(72,4± 2,1) % |
||
| Ерозія шийки матки | 62 | 7 | 13 | 5 | 2 | 1 | 28 |
| (11,3± 4,0) % |
(20,9± 5,2)% |
(8,1± 3,5) % |
(3,2± 2,2) % |
(1,6± 1,6) % |
(45,2± 6,3) % |
||
| Кольпіт | 127 | 34 | – | 7 | 2 | 3 | 46 |
| (26,7± 3,9) % |
– | (5,5± 2,1) % |
(1,6± 1,1) % |
(2,4± 1,4) % |
(36,2± 4,3) % |
||
| Вагітність | 6 | 2 | – | 1 | – | – | 3 |
| (33,3± 19,2)% |
– | (16,7± 15,2)% |
– | – | (50,0± 20,4) % |
||
| Всього | 677 | 192 | 127 | 62 | 20 | 15 | 416 |
| (28,4± 1,7) % |
(18,6± 1,5)% |
(9,2± 1,1) % |
(3,0± 0,7) % |
(2,2± 0,6) % |
(61,5± 1,9) % |
Простатит зустрічався у 41 (7,6 ± 1,1) % хворих. Подібне ускладнення найчастіше спостерігалося при трихомонадно-хламідійній інфекції, у 9 ([21,9 ± 6,5] %) випадків. Урогенітальний трихомоноз ускладнювався простатитом у 7 ([17,1 ± 5,9] %) осіб, та у 1 ([2,4 ± 2,4] %) випадків в разі змішаного інфікування при трихомонадно-уреаплазмовій асоціації. В цілому інфекційне походження простатиту підтверджено у 17 ([41,5 ± 7,7] %) випадків діагностування стану.
Левова частка ускладнень у вигляді уретриту та простатиту припадала на випадки виявлення трихомонадної інфекції, як в монокультурі так й при мікст-інфікуванні. Дані особливості появи значного відсотку ускладнень захворювань можуть бути пов’язані зі здібністю трихомонад поглинати бактерії, та таким чином забезпечувати тривале персистування збудника в урогенітальному тракті пацієнтів при відсутності лікування [58].
Найбільш поширеними клінічними проявами ІПСШ, що спостерігали у жінок, були ендоцервіцит та кольпіт. Ендоцервіцит виявляли у 482 ([71,2 ± 1,7] %) випадків, кольпіт був діагностований у 127 ([18,8 ± 1,5] %) жінок цієї підгрупи. На частку виявлення ерозії шийки матки прийшлося 62 ([9,2 ± 1,1] %) випадків виявлених ускладнень (таблиця 7.2).
Виявлення трихомонадної моноінфекції спостерігалося частіше у жінок, ніж у чоловіків. Це може бути пов’язано з особливостями побудови сечостатевого тракту та фізіологічними особливостями жіночого організму, зокрема T. vaginalis – облігатний паразит, що втратив здатність самостійно синтезувати багато макромолекул (пуринів, піримідинів, ліпіди та ін.), тому найважливіші поживні компоненти трихомонади отримують з вагінального секрету при фагоцитозі епітеліоцитів і бактеріальних клітин зі складу сімбіотної та умовно-патогенної мікрофлори сечостатевих шляхів [58].
Найчастіше збудники ІПСШ виявлялися при ендоцервіцитах та ерозія шийки матки у жінок – в 72 та 45 % випадків. Також інфекційний агент був встановлений у 46 ([36,2 ± 4,3] %) випадків діагностування кольпітів.
Трихомонадна моноінфекція найчастіше виступала етіологічним фактором в появі ендоцервіцитів, кольпітів – в 27-31 % випадків. Комбінація трихомонадної та хламідійної інфекцій частіше призводила до появи ерозії шийки матки, ніж у випадку трихомонадної моно-інфекції у [13 ([20,9 ± 5,2] %) проти 7 ([11,3 ± 4,0] %)]. У разі виникнення хронічного ендоцервіциту мікст-інфікування також відігравало роль у 124 ([25,7 ± 2,0] %) випадків.
Поєднання трихомонадної інфекції з уреаплазмовою та УПМ відіграє провідну роль в 8-10 % випадків виникнення ерозії та ендоцервіциту. Необхідно відзначити, що в ряді випадків, дані мікроорганізми можуть виступати в якості самостійних збудників запальних захворювань урогенітального тракту.
При поєднанні хламідійної та трихомонадної інфекцій в 21-26 % випадків у жінок виявляли ендоцервіцит або ерозію шийки матки. Порушення цілісності слизових є негативним фактором, що сприяє зараженню ІПСШ та ВІЛ.
Як видно з таблиць 7.1 і 7.2, в майже 70 % випадків, як у чоловіків, так й у жінок виявляли клінічні прояви та ускладнення ІПСШ. Був діагностований у чоловіків уретрит, у жінок – ендоцервіцит.
Найчастіше ізолювали Т. vaginalis у монокультурі в 25-28 % випадків також у осіб обох статей. На другому місці по частоті виявлення перебувала асоціація Т. vaginalis та С. trachomatis у 149 ([27,5 ± 1,9] %) і 127 ([18,6 ± 1,5] %) відповідно. Асоціація Т. vaginalis з U. urealyticum та УПМ спостерігалася у майже 14 % хворих незалежно від статі.
Встановлено, що причиною появи клінічних проявів та ускладнень захворювань в 62-65 % випадків були збудники ІПСШ.
* * *
Таким чином, в результаті проведеного дослідження виявлений значний відсоток ускладнень у пацієнтів з хронічними ІПСШ.
Встановлена висока поширеність T. vaginalis в популяції населення репродуктивного віку як серед чоловіків, так і серед жінок.
Необхідно враховувати наявність умовно-патогенної мікрофлори, яка виявляється майже в 14 % випадків та призводить до розвитку хронічних рецидивуючих кольпітів та уретритів, також, ймовірно, може обтяжувати перебіг захворювання та призводити до неуспіхів в лікуванні.
У 2/3 випадків виникнення ускладнень провідну роль відіграє трихомонадна інфекція. Це необхідно враховувати при призначенні емпіричного лікування, лікування за епідеміологічними показниками, призначенні лікування з використанням синдромного підходу у веденні пацієнтів з уразливих груп населення.
При розробці нормативних документів щодо застосування синдромного підходу в Україні необхідно враховувати широке розповсюдження трихомонадної інфеції в популяції, варіативність перебігу та її значну роль у виникненні урогенітальних ускладнень.
Публікації:
- Щербакова Ю.В. Особливості мікробіоценозу урогенітального тракту у пацієнтів з хронічним ускладненим трихомонозом / Ю.В. Щербакова, С.К. Джораєва // Актуальні проблеми сучасної медицини: Вісник Української медичної стоматологічної академії. – 2015. – Т. 15, № 4 (52). – С. 134-136.
РОЗДІЛ 8
БАКТЕРІОСКОПІЧНІ МЕТОДИ ЛАБОРАТОРНОЇ ДІАГНОСТИКИ УРОГЕНІТАЛЬНИХ ІНФЕКЦІЙ ЯК МЕТОД ВИБОРУ ДЛЯ ГРУП НАСЕЛЕННЯ, УРАЗЛИВИХ ЩОДО ЗАРАЖЕННЯ ІНФЕКЦІЯМИ, ЩО ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ, ТА ВІЛ
Профілактика, рання діагностика і своєчасне лікування ІПСШ є значною частиною стратегії боротьби з ВІЛ-інфекцією. Необхідна оптимізація клініко-лабораторної діагностики ІПСШ серед представників уразливих груп.
8.1 Аналіз вітчизняних та міжнародних настанов щодо застосування сучасних бактеріоскопічного та бактеріологічного методів діагностики інфекцій, що передаються статевим шляхом
Для лабораторної діагностики гонореї в теперішній час застосовуються 4 основних методи: бактеріоскопія, культуральна діагностика, метод ампліфікації нуклеїнових кислот (МАНК) і швидкі тести. При цьому кожен з методів має свої показання до застосування, що відображено у відповідних нормативних документах, які регламентують проведення даних досліджень
8.1.1 Діагностика дисбіозу вагінального біотопу
Загальний інфекційний незапальний синдром, пов’язаний з дисбіозом вагінального біотопу і супроводжується високою концентрацією умовно-патогенних мікроорганізмів і різким зниженням або відсутністю молочнокислих бактерій у виділеннях піхви. При бактеріальному вагінозі загальна кількість бактерій зростає до астрономічних цифр (до 10 10-12 КУО/мл). Характеризується появою виділень з неприємним запахом при мінімальній запальній реакції слизових оболонок, різким зниженням кількості або відсутністю лактобацил.
В Україні діагностика бактеріального вагінозу здійснюється відповідно рекомендацій «Уніфікація лабораторних методів дослідження в діагностиці ЗПСШ” (2000) (табл. 8.1) [94].
Таблиця 8.1 – Локальні керівництва щодо діагностики бактеріального вагінозу
| Керівництва | Метод | ||
| Уніфікація лабораторних методів дослідження в діагностиці захворювань, що передаються статевим шляхом”, 2000 | European (IUSTI/WHO) Guideline on the Management of Vaginal Discharge, 2011 | Recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM), 2013 | |
| Мікроскопія нативного препарату из влагалища с 10% КОН | Виявлення «ключових» клітин, визначення рН у піхвовому секреті та проведення амінного тесту | Виявлення «ключових» клітин, визначення рН у піхвовому секреті та проведення амінного тесту | Виявлення «ключових» клітин, проведення амінного тесту |
| Мікроскопія забарвлених препаратів (1% розчином метиленового синього, за Грамом) | Виявлення «ключових» клітин | Виявлення «ключових» клітин | Виявлення «ключових» клітин. Найбільш специфічний метод для діагностики БВ, рекомендується для діагностики у вагітних з метою зниження ризику післяродового ендометриту |
| Культуральне дослідження | Виділення чистої культури збудника з застосуванням селективних середовищ | Проведення не рекомендується | Проведення не рекомендується |
Згідно European (IUSTI/WHO) Guideline on the Management of Vaginal Discharge (2011), існує низка критеріїв для визначення бактеріального вагінозу [12].
Критерії Amsel R. (1983):
- «ключові» клітини (більше 20%);
- невелика кількість лейкоцитів (1 – 2 в полі зору);
- зменшення кількості паличок Додерлейна або їх повна відсутність;
- рН> 4,5;
- кремоподібні, гомогенні виділення;
- позитивна проба з 10% КОН.
Шкала Nugent (0-10 балів). Заснована на визначенні пропорційного вмісту бактерій в мазках, пофарбованих за Грамом.
Критерії Hay Ison (ступінь 0-4). Заснована на визначенні морфотипів бактерій, кількості епітеліальних клітин і лейкоцитів.
Таким чином, основними критеріями при постановці діагнозу бактеріального вагінозу є наявність клінічних симптомів захворювання і «ключових» клітин в препараті.
8.1.2 Діагностика гонококової інфекції
В Україні на сьогоднішній день, діагностика гонококової інфекції проводиться згідно з наказами МОЗ та іншими регламентуючими документами [68, 94, 110].
Протокол лабораторної діагностики гонококової інфекції (Мавров Г.І. та ін., 2007) був розроблений для країн Центральної та Східної Європи з метою надання всеосяжної і точної інформації щодо можливостей лабораторної діагностики етіологічного агента гонореї – Neisseria gonorrhoeae. Існує низка Міжнародних рекомендації з діагностики гонореї – CDC, 2010; Східно-Європейської мережи репродуктивного здоров’я, 2008; European IUSTI/WHO, 2009; Recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM), 2013 (табл. 8.2) [124, 137, 143, 160, 231].
Таблиця 8.2 – Локальні керівництва щодо діагностики гонореї
| Локальні керівництва / / Метод | Протоколи лабораторної діагностики інфекцій, що викликані Neisseria gonorrhoeae (Україна, 2007) | Протоколи European IUSTI/WHO, 2009 | Протоколи Східно-Європейської мережи репродуктивного здоров’я, 2008 | CDC, 2010 | Recommenda-tions by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM), 2013, гонорея |
| Мікроскопія препаратів з уретри чоловіків з симптомами(забарвлення за Грамом) | Діагностика гонореї у чоловіків з симптомами
(референс – метод). |
Діагностика гонореї у чоловіків з симптомами
(референс – метод). |
Діагностика гонореї у чоловіків з симптомами (референс – метод). | Діагностика гонореї у чоловіків з симптомами (референс – метод). | Діагностика гонореї у чоловіків з симптомами (референс – метод). Специфічність методу – 95% |
| Культуральний: жінки, діти, чоловіки без симптомів та екстрагенітальні осоредки ураження (глотка, ректальні зразки, та ін.) | Встановлення діагнозу у жінок, дітей
підтверждення діагнозу у чоловіків без симптомів (референс – метод), визначення чутливості збудника до антибіотиків |
Встановлення діагнозу у жінок, дітей
підтверждення діагнозу у чоловіків без симптомів (референс – метод), визначення чутливості збудника до антибіотиків |
Встановлення діагнозу у жінок, дітей
підтверждення діагнозу у чоловіків без симптомів (референс – метод), визначення чутливості збудника до антибіотиків |
Встановлення діагнозу у жінок, дітей
підтверждення діагнозу у чолові-ків без симптомів (референс – метод), визначення чутливості збудника до антибіотиків (за винятком зразків з прямої кишки, піхви, кон’юнк-тиви та глотки ) |
Встановлення діагнозу у жінок, дітей
підтверждення діагнозу у чоловіків без симптомів (референс – метод), визначення чутливості збудника до антибіотиків |
| МАНК | Скринніг зразків (уро- та екстрагенітальних) з подальшим підтвердженням іншими методами. | Сеча, аногенітальні, фарингеальні зразки позитивний результат МАНК необхідно підтвердити МАНК з використанням іншої молекулярної мішені | Сеча, аногенітальні, фарингеальні зразки: тільки для скринінгу подальшим підтвердженням куль-туральным методом | FDA рекомендує окремі набори для кожного із зразків (сеча, генітальні,)
FDA не рекомендовано застосовувати МАНК для зразків з глотки, прямої кишки кон’юнктиви |
FDA рекомендує окремі набори для N. gonorrhoae та C. trachomatis в зразках (сеча, урогенітальні, кон’юнктиви).
Ректальні, фарингеальні зразки – необхідна лабораторна валідація тестів |
Вибір молекулярно-біологічного або культурального методу залежить від організаційних умов і якості проведення лабораторного дослідження, а також від епідеміологічної ситуації в популяції. У популяції з високим ризиком поширення захворювання бактеріологічне дослідження є методом вибору. У популяції низького ризику, для скринінгу і для дослідження неінвазивних зразків молекулярно-біологічні методи підходять більше (наприклад, дослідження сечі у чоловіків і вагінальних зразків у жінок).
Однак якщо метод використовується для дослідження популяції низького ризику і він недостатньо специфічний, то можливе отримання великої кількості хибнопозитивних результатів. МАНК-методи є оптимальними для дослідження зразків, отриманих неінвазивним способом, але їх чутливість та специфічність варіабельна. Чутливість молекулярно-біологічних методів зазвичай вища при дослідженні зразків сечі у чоловіків, у порівнянні з жіночими зразками. Для жінок при діагностиці гонореї оптимальним є дослідження вагінальних зразків. При дослідженні з метою діагностики гонореї пацієнтів без клінічних симптомів захворювання, молекулярно-біологічні методи обов’язково повинні підтверджуватися бактеріологічним методом [94].
Таким чином, при діагностики гонореї у чоловіків з симптомами методом вибору є мікроскопія препаратів з уретри, забарвлених за Грамом. В інших випадках використовується культуральне дослідження або МАНК, однак FDA не рекомендовано застосовувати МАНК для дослідження зразків із глотки, прямої кишки і кон’юнктиви. При дослідженні пацієнтів без клінічних симптомів захворювання, результати МАНК бажано підтверджувати бактеріологічним методом.
8.1.3 Діагностика урогенітального кандидозу
Кандидоз – захворювання слизових оболонок, шкіри та внутрішніх органів, викликане дріжджоподібними грибами роду Candida. Ураження сечостатевого тракту є одним з проявів кандидозу, що найбільш часто зустрічається.
Для лабораторної діагностики кандидозного вульвовагініту є доцільним застосування мікроскопічного методу, оскільки у 20% здорових жінок у піхві присутні кандиди, які також виростуть при посіві, що дасть підставу для необгрунтованого діагнозу кандидозу піхви. Культуральний метод корисний при хронічному рецидивуючому перебігу захворювання, вилучення видів non-albicans, а також при вивченні дії лікарських препаратів, при атиповому перебігу захворювання, коли виключені інші можливі збудники.
Рекомендації з діагностики урогітального кандидозу представлені в «Уніфікація лабораторних методів дослідження в діагностиці ЗПСШ”, 2000 (Україна), (European (IUSTI/WHO) Guideline on the Management of Vaginal Discharge, 2011 та Recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM), 2013 [112, 124, 160]. Дані наведені в таблиці 8.3.
Таким чином, згідно існуючих рекомендацій, діагностика урогенітального кандидозу ґрунтується на проведенні мікроскопічного дослідження і виділенні, при необхідності, культури Candida species.
8.1.4 Діагностика трихомонадної інфекції
Основними сучасними методами діагностики трихомонадної інфекції є методи бактеріоскопічний, бактеріологічний, МАНК і швидкі тести. Методи визначення антитіл до збудника трихомонозу не рекомендуються через низьку імуногенність трихомонад.
Існує низка вітчизняних та міжнародних рекомендації з діагностики трихомонозу – «Уніфікація лабораторних методів дослідження в діагностиці захворювань, що передаються статевим шляхом” (Харків, 2000 р), European (IUSTI/WHO) Guideline on the Management of Vaginal Discharge, 2011; Sexually Transmitted Infections and HIV: Diagnosis and Treatment, 2012; United Kingdom National Guideline on the Management of Trichomonas vaginalis (Clinical Effectiveness Group, British Association for Sexual Health and HIV (BASHH), 2014; Recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM), 2013 (таблиця 8.4) [112, 124, 160, 271].
Таблиця 8.3 – Локальні керівництва щодо діагностики генітального кандидозу
| Керівництва | Метод | ||
| Уніфікація лабораторних методів дослідження в діагностиці захворювань, що передаються статевим шляхом”, 2000 | European (IUSTI/WHO) Guideline on the Management of Vaginal Discharge, 2011 | Recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM), 2013 | |
| Мікроскопія нативного препарату виділень з сечостатевих органів | Виявлення дріжджової форми з наявністю або переважанням псевдоміцелію (обидві статі) | Виявлення бластоспор та/або псевдоміцелію. (Чутливість- 40-60%) у піхвовому зразку | Виявлення морфологічних елементів Candida spp. у піхвовому зразку Чутливість методу 40-80% |
| Мікроскопія забарвлених препаратів (1% розчин метиленового синього, по Граму) | Виявлення дріжджової форми з наявністю або переважанням псевдоміцелію (обидві статі) | Виявлення бластоспор та/або псевдоміцелію. Чутливість до 65% у піхвовому зразку | Відсутність даних щодо можливості застосування |
| Культуральне дослідження | Виділення та видова ідентифікація дріжджоподібних грибів | Видова ідентифікація Candida species з визначенням albicans та non–albicans видів з можливим дослідженням чутливості до антифунгальних препаратів. | Виділення культури збудника, рекомендується при негативних результатах мікроскопії |
Таблиця 8.4 – Локальні керівництва щодо діагностики трихомонозу
| Керівництва | Метод | |||
| Уніфікація лабораторних методів дослідження в діагностиці захворювань, що передаються статевим шляхом”, 2000 | European (IUSTI/WHO) Guideline on the Management of Vaginal Discharge, 2011 | United Kingdom National Guideline on the Management of Trichomonas vaginalis (Clinical Effectiveness Group, British Association for Sexual Health and HIV (BASHH), 2014 | Recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM), 2013 | |
| 1 | 2 | 3 | 4 | 5 |
| Мікроскопія нативного препарату | Виявлення рухомих трихомонад у біологічному матеріалі з сечостатевих органів | Виявлення рухомих трихомонад у біологічному матеріалі сечостатевих органів | Виявлення рухомих трихомонад у біологічному матеріалі сечостатевих органів
Специфічність методу – высока, чутливість – у жінок 45-60%. |
Виявлення рухомих трихомонад у біологічному матеріалі сечостатевих органів
Специфічність методу – высока, чутливість 60%. |
| Мікроскопія забарвленого препарату (звичайні та флюоресцентні барвники) | Забарвлення препаратів 1% розчином метиленового синього, за Грамом, за Романовським-Гімзою | Забарвлення акридин жовто-горячим (флюоресценція)
Виявлення «мертвих» трихомонад Специфічність методу – высока, чутливість 40-70%. |
Забарвлення акридин жовто-горячим (флюоресценція). Виявление «мертвих» трихомонад.
Чутливість вище, ніж у нативної мікроскопії, застосовується мало. |
Проведення не рекомендуєтся |
| Швидкі тести | Відсутність даних щодо можливості застосування | Відсутність даних щодо можливості застосування | Рекомендується – OSOM Trichomonas Rapid Test (Genzyme Diagnostics, USA – метод виявлення антигену трихомонад
Чутливість – 84-90%, специфічність – 95%. наявні хибнопозитивні |
Рекомендується – OSOM Trichomonas Rapid Test (Genzyme Diagnostics, USA метод виявлення антигену трихомонад Чутливість 62-95% у порівнянні з |
Продовження таблиці 8.5
| 1 | 2 | 3 | 4 | 5 |
| результати, особливо у популяції з низьким рівнем захворюваності | КД та МАНК, застосовується для пацієнтів з/ без симптомів захворювання | |||
| Культуральне дослідження | Виявлення рухливих трихомонад при культивуванні на селективних поживних середовищах | Виявлення рухливих трихомонад при культивуванні на селективних поживних середовищах
Чутливість 84-90%, специфічність – 95%. |
InPouch TV; BioMed Diagnostics, USA -виявлення рухливих трихомонад при культивуванні на селективних поживних середовищах
Высока чутливість і специфічність у порівнянні з мікроскопією, використовується для діагностики у чоловіків. |
InPouch TV; BioMed Diagnostics, USA. виявлення рухливих трихомонад при культивуванні на селективних поживних середовищах матеріалу з уретри та ендоцервіксу
Чутливість 70% у порівнянні з МАНК. |
| МАНК | Відсутність даних щодо можливості застосування | Виявлення ДНК збудника у клінічному матеріалі від хворих.
Чутливість і специфічність близько 100% |
APTIMA TV, Genprobe. Виявлення ДНК збудника у клінічному матеріалі, в т.ч. сечі.
Чутливість 88-97%, специфічність – 98-99%. |
FDA-cleared-APTIMA TV, Genprobe.
Виявлення ДНК збудника у клінічному матеріалі, в т.ч. сечі, ректальних и фарингальних зразках. Скринінг та діагностика трихомоніазу у жінок. Тести для чоловіків та зразків іншої локалізації -необхідна лабораторна валідація тестів |
Таким чином, при діагностиці трихомонозу доцільно використовувати комплекс діагностичних методів, що включають в себе мікроскопію нативних та/або забарвлених препаратів, культуральну діагностику і МАНК залежно від досліджуваного локусу і наявності симптомів у пацієнта.
8.2 Оцінка ефективності застосування бактеріоскопічного та бактеріологічного методів виявлення збудників інфекцій, що передаються статевим шляхом, у пацієнтів з загального населення та уразливих груп
Для визначення ефективності застосування бактеріоскопічного та бактеріологічного методів щодо виявлення збудників ІПСШ проведено аналіз даних бактеріоскопічного та бактеріологічного обстеження 388 осіб. Бактеріоскопічне та бактеріологічне дослідження проводилось згідно існуючих нормативних документів [112].
Визначали наявність ІПСШ в біологічному матеріалі, отриманому від осіб з загального населення та уразливих груп, що звернулися з різних приводів з метою обстеження до ДУ «ІДВ НАМНУ», та від пацієнтів з клінічними проявами урогенітальної інфекції та скаргами з загального населення, які знаходилися на стаціонарному лікування у відділенні венерології в ДУ «ІДВ НАМНУ».
Усі пацієнти були розподілені на три підгрупи (підгрупи 1.6, 1.7 і 2.6).
Особи, що увійшли до підгруп 1.6 та 2.6, звернулися з метою обстеження на наявність ІПСШ з різних приводів – задля профілактичного обстеження, без скарг, перед плануванням вагітності, з періодично виникаючими скаргами та проявами (помірної інтенсивності) наявності ІПСШ, тощо. До підгрупи 1.6 увійшли 196 пацієнтів обох статей, що відносяться до загального населення (112 жінок та 84 чоловіка – підгрупи 1.6а та 1.6б). Підгрупу 2.6 склали 48 жінок, що належать до уразливих груп населення (РКС, СІН) віком від 18 років до 41, середній вік пацієнток склав (29,5±6,5) року.
У підгрупу 1.7 були включені 144 особи (загальне населення) з наявними скаргами та вираженими клінічними проявами трихомонозу, які проходили лікування в ДУ «ІДВНАМНУ». Пацієнти були розподілені за статтю (підгрупа 1.7а – 75 жінок та підгрупа 1.7б – 69 чоловіків). У дослідження увійшли пацієнти віком від 19 до 61 років. Середній вік хворих склав 40,0±7,4 роки.
При опитуванні осіб, що належать до підгруп 1.6 і 2.6, виявлено, що більшість складають особи без скарг або зі скаргами на відчуття наявності ІПСШ помірної інтенсивності – 56,1 %. Особи, які виказували на наявність клінічних проявів ІПСШ, склали близько 29,9 % (табл. 8.5).
Таблиця 8.5 – Результати опитування щодо наявності скарг та клінічних проявів ІПСШ, %
| Підгрупа 1.6
(абс./%) |
Підгрупа 2.6
(абс./%) |
Підгрупа 1.7
(абс./%) |
|
| Без скарг та симптомів | 125 | 30 | 7 |
| (63,8 ± 3,4) % | (62,5 ± 7,0) % | (4,9 ± 1,8) % | |
| Свербіж | 39 | 11 | 96 |
| (19,9 ± 2,9) % | (22,9 ± 6,1) % | (66,7 ± 3,9) % | |
| Дискомфорт | 63 | 14 | 105 |
| (32,1 ± 3,3) % | (29,2 ± 6,6) % | (72,9 ± 3,7) % | |
| Дизурічні явища | 53 | 7 | 91 |
| (27,0 ± 3,2) % | (14,6 ± 5,1) % | (63,2 ± 4,0) % | |
| Підвищена кількість виділень | 59 | 14 | 112 |
| (30,1 ± 3,3) % | (29,2 ± 6,6) % | (77,8 ± 3,5) % | |
| Дискомфорт при статевих контактах | 39 | 17 | 48 |
| (19,9 ± 2,9) % | (35,4 ± 6,9) % | (33,3 ± 3,9) % | |
| Набряк слизової оболонки статевих органів | 49 | 19 | 68 |
| (25,0 ± 3,1) % | (39,6 ± 7,1) % | (47,2 ± 4,2) % | |
| Застосовують місцеві антисептичні засоби | 39 | 34 | 58 |
| (19,9 ± 2,9) % | (70,8 ± 6,6) % | (40,3 ± 4,1) % |
Серед представників підгрупи 1.7, у яких в 100 % випадків була підтверджена бактеріологічним методом трихомонадна інфекція, більшість як жінок, так й чоловіків (60-70 %) вказували на наявність скарг та клінічних проявів ІПСШ помірної та значної інтенсивності.
При обстеженні чоловіків з підгрупи 1.6б (84 особи) в мазках виявлено трихомонади у 13 ([15,5 ± 3,9] %) випадків. Методом культивування (бактеріологічне дослідження) виявлено трихомонади у 18 ([21,4 ± 4,5] %) пацієнтів. За даними власних спостережень, негативні результати обстеження (мікроскопія мазку та культивування) виявлені в середньому в (81,2 ± 2,9) % випадків (табл. 8.6).
Таблиця 8.6 – Результати обстеження бактеріоскопічними та бактеріологічними методами чоловіків загального населення (n = 84), підгрупа 1.6б
| Виявлені збудники | Бактеріоскопічне дослідження (абс./%) | Бактеріологічне дослідження (абс./%) |
| T. vaginalis | 13 | 18 |
| (15,5 ± 3,9) % | (21,4 ± 4,5) % | |
| N. gonorrhoeae | – | – |
При обстеженні жінок підгруп 1.6а та 2.6 при проведенні бактеріоскопічного та бактеріологічного обстеження були отримані наступні дані. Серед жінок загального населення трихомонадна інфекція виявлена в середньому у (34,8 ± 4,7) % випадків, у представниць уразливих груп – в (51,9 ± 6,4) %.
При застосуванні бактеріоскопічного методу дослідження T. vaginalis виявлено в підгрупі 1.6а у 34 ([30,4 ± 4,3] %) осіб. Методом культивування (бактеріологічне дослідження) підтверджено наявність трихомонадної інфекції у 44 ([39,3 ± 4,6] %) випадків. Також при бактеріоскопічному дослідженні «ключові» клітини виявлено у 12 ([10,7 ± 2,9] %) випадків, Candida spp. – у 5 ([4,5 ± 2,0] %) пацієнток (табл. 8.7).
Таблиця 8.7 – Результати обстеження жінок загального населення та уразливих груп методами бактеріоскопічного та бактеріологічного обстеження
| Підгрупа 1.6а
(жінки загального населення) |
Підгрупа 2.6
(жінки з уразливих груп) |
|
| Кількість осіб | 112 | 48 |
| Виявлена трихомонадна інфекція | (34,8 ± 4,7) % | (51,9 ± 6,4) % |
| В тому числі методом бактеріоскопічним | 34 | 22 |
| (30,4 ± 4,3) % | (45,8 ± 7,2) % | |
| В тому числі методом бактеріологічним | 44 | 28 |
| (39,3 ± 4,6) % | (58,3 ± 7,1) % | |
| Бактеріальний вагіноз | 12 | 12 |
| 10,7 ± 2,9 % | (25,0 ± 6,3) % | |
| Кандидоз урогенітальний | 5 | 2 |
| 4,5 ± 2,0 % | (4,2 ± 2,9) % |
При застосуванні бактеріоскопічного методу в підгрупі 2.6 T. vaginalis виявлено у 22 ([45,8,4 ± 7,2] %) осіб. Методом культивування підтверджено наявність трихомонадної інфекції в 28 ([58,3 ± 7,1] %) випадках. Також при бактеріоскопічному дослідженні «ключові» клітини виявлено у 12 ([25,0 ± 6,3] %) випадків, Candida spp. – у 2 ([4,2 ± 2,9] %) пацієнток
Негативний результат при обстеженні жінок без симптомів ІПСШ та з наявними проявами легкого та середнього ступеню в підгрупі 1.6а склав в середньому (65,2 ± 4,5] %) випадків, у підгрупі 2.6 – (47,9 ± 6,3) %.
Пацієнти підгрупи 1.7 були розподілені на дві підгрупи за статтю – 75 жінки (підгрупа 1.7а) та 69 чоловіків (підгрупа 1.7б) окремо. Всі пацієнти, які зверталися за лікувально-діагностичною допомогою, мали виражені ознаки наявної інфекції (гіперемія, набряк слизових оболонок, патологічні виділення з сечостатевих органів) та пред’являли скарги на печію, свербіж, дискомфорт в ділянці геніталій.
При обстеженні жінок підгрупи 1.7а із застосуванням бактеріоскопічного методу дослідження T. vaginalis виявлено у 44 ([58,7 ± 5,7] %) випадків. Методом культивування (бактеріологічне дослідження) підтверджено наявність трихомонадної інфекції у 64 ([85,3 ± 4,1] %) випадків. Також при бактеріоскопічному дослідженні «ключові» клітини виявлено у 9 ([12,0 ± 3,8] %) випадків, Candida spp. – у 4 ([5,3 ± 2,6] %) пацієнток (табл. 8.8).
Таблиця 8.8 – Результати обстеження бактеріоскопічними та бактеріологічними методами жінок з наявними симптомами ІПСШ, які звернулися за лікувально-діагностичною допомогою (n = 75), підгрупа 1.7а
| Виявлені збудники, відсотки (%) | |||
| T. vaginalis | Бактеріальний вагіноз (ключові клітини) | Candida spp. | |
| Бактеріоскопічне дослідження | 44 | 9 | 4 |
| (58,7 ± 5,7) % | (12,0 ± 3,8) % | (5,3 ± 2,6) % | |
| Бактеріологічне дослідження | 64 | – | – |
| (85,3 ± 4,1) % | – | – | |
Негативний результат склав в середньому (28,0 ± 13,3) % випадків.
При обстеженні чоловіків підгрупи 1.7б (69 осіб) в мазках виявлено трихомонади у 29 ([42,1 ± 5,9] %) випадків (таблиця 8.9).
Таблиця 8.9 – Результати обстеження бактеріоскопічними та бактеріологічними методами чоловіків з наявними симптомами ІПСШ, які звернулися за лікувально-діагностичною допомогою (n = 69), підгрупа 1.7б
| Виявлені збудники | Бактеріоскопічне дослідження, відсотки (%) | Бактеріологічне дослідження, відсотки (%) |
| T. vaginalis | 29 | 44 |
| (42,1 ± 5,9) % | (63,7 ± 5,8) % | |
| N. gonorrhoeae | 2 | – |
| (2,9 ± 2,0) % | – |
Методом культивування (бактеріологічне дослідження) виявлено трихомонади у 44 ([63,7 ± 5,8] %) випадків у пацієнтів з симптоматичною інфекцією. У 2 ([2,9 ± 2,0] %) випадків у мазках чоловіків з гострими клінічними проявами ІПСШ була виявлена гонорея. Негативні результати обстеження (мікроскопія мазку та культивування) спостерігалися у чоловіків в середньому в (47,1 ± 10,8) % випадків.
Таким чином, у жінок з симптомами інфекції спостерігається достатньо високий відсоток ([58,7 ± 5,7] %) діагностування урогенітального трихомонозу за допомогою мікроскопії. Доцільно бактеріологічну діагностику проводити у випадку неуспіху при виконанні бактеріоскопічного дослідження.
Метод культивування дає високий відсоток (до 85,3 %) діагностики трихомонозу у даних осіб. При проведенні дослідження визначаються рухливі форми збудника.
Застосування методу бактеріоскопії для діагностики трихомонозу у чоловіків ефективне при використанні у пацієнтів з симптомами. Доцільно рекомендувати проводити культивування збудника у всіх випадках діагностики у чоловіків одночасно з мікроскопією для покращення діагностики інфекції.
* * *
Таким чином, з метою пришвидшення діагностичної допомоги пацієнтам з ІПСШ, особливо особам, що належать до уразливих щодо зараження ІПСШ/ВІЛ групам населення, доцільно рекомендувати застосовувати метод бактеріоскопії для діагностики ІПСШ.
Бактеріоскопічний метод для встановлення діагнозу гонореї можливо застосовувати у чоловіків з симптомами захворювання, який є референс-методом, для якого характерний достатньо високий відсоток чутливості та специфічності.
Доцільно проводити культивування збудника у чоловіків одночасно з мікроскопією для покращення діагностики трихомонадної інфекції. Бактеріологічну діагностику у жінок доцільно проводити у випадку неуспіху при виконанні бактеріоскопічного дослідження.
Згідно отриманих даних, метод бактеріоскопії більш ефективний та інформативний у осіб з симптомами. У осіб без симптомів або з незначними проявами ІПСШ метод бактеріоскопії також дає значний відсоток виявлення трихомонадної інфекції (30,4 ± 4,3) % – загальне населення, (45,8 ± 7,2) % – уразливі групи.
Встановлено, що представники уразливих груп частіше ніж загальне населення інфіковані трихомонозом, навіть при відсутності об’єктивних симптомів та суб’єктивних ознак наявності інфекції.
Щодо представників уразливих груп, значний відсоток – близько 40-50 % осіб є не виявленими, залишаються резервуаром інфекцій, які передають статевим партнерам, не отримують своєчасного лікування, що може привести до розвитку ускладнень та поширення ІПСШ та ВІЛ в популяції.
Публікації:
- Щербакова Ю.В. Бактеріоскопічні методи лабораторної діагностики інфекцій, що передаються статевим шляхом (ІПСШ), як вибір для груп населення, уразливих щодо ІПСШ/ВІЛ (огляд вітчизняних і закордонних регламентних документів та власні дослідження) / Ю.В. Щербакова // Український журнал дерматології, венерології, косметології. – 2015. – № 3 (58). – С. 117-126.
РОЗДІЛ 9
ВИЗНАЧЕННЯ МОЖЛИВОСТІ ВИКОРИСТАННЯ ШВИДКИХ ТЕСТІВ
ДЛЯ ДІАГНОСТИКИ СИФІЛІСУ ДЛЯ РІЗНИХ ВЕРСТВ НАСЕЛЕННЯ
Сифіліс – одне з найбільш поширених венеричних захворювань у світі. В останні роки відзначається зростання захворюваності пізнього, неуточненого сифілісу, відсотка раннього прихованого сифілісу навіть на тлі зниження загальної кількості випадків інфікування [23].
Особливість ситуації, яка склалась протягом останнього часу в Україні, в тому числі значне зростання кількості військовослужбовців, що приймають участь в бойових діях, вимушених мігрантів, потребує особливого підходу щодо надання лікувально-діагностичної допомоги з приводу ІПСШ. За рахунок цього прошарку популяції розширився перелік уразливих щодо зараження ІПСШ та ВІЛ груп населення, доступ яких до отримання фахової допомоги обмежений. За рекомендаціями ВООЗ, для діагностики ІПСШ серед уразливих груп доцільно використовувати швидкі тести [48, 95, 103, 169, 188].
Для визначення доцільності використання швидких тестів для діагностики сифілісу, рекомендацій щодо їх застосовування для різних верств населення проводили вивчення їх інформативності при діагностиці сифілісу, визначенні хибної позитивності та обстеженні пацієнтів соматичного стаціонару.
Було проведено тестування 662 осіб, які пройшли обстеження на сифіліс. В дослідження увійшли представники різних груп населення, як загальної популяції, так і представники уразливих, щодо зараження ІПСШ та ВІЛ груп (РКС, СІН, ЧСЧ). Проведена порівняльна оцінка діагностичної ефективності застосування наступних методів: ІХГ аналіз, антикардіоліпіновий (реагіновий) тест (RPR – Rapid Plasma Reagin,), ІФА, РПГА, також КСР, куди увійшли РМП, РЗКк та РЗКт. При визначенні оптимальних швидких методів серодіагностики сифілісу, метод ІФА було обрано в якості стандарту, якому притаманні висока чутливість та специфічність.
Обстеження пройшли 337 хворих на сифіліс. У підгрупу 1.8 увійшли всього 284 особи. Підгрупу 1.8а склали 94 пацієнти з ранніми ([33,1±2,8] %), підгрупу 1.8б – 190 хворих з пізніми ([66,9±2,8] %) формами сифілісу. Також обстеження пройшли 53 вагітні (підгрупа 1.9). До підгрупи 1.9а увійшли 12 жінок ([22,6±5,8] %) з раннім, до підгрупи 1.9б – 41 пацієнтка ([77,4±5,8] %) з пізнім сифілісом. Дані наведено на рисунку 9.1.
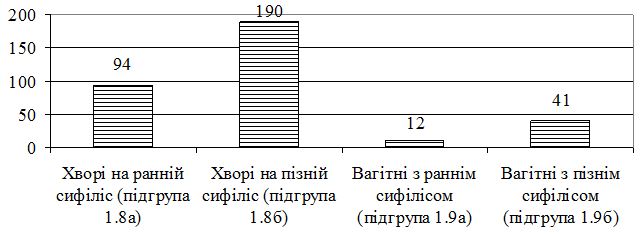
Рисунок 9.1 – Підгрупи пацієнтів зі встановленим діагнозом сифіліс (n = 337)
Було обстежено 96 осіб з хибною позитивністю серологічних реакцій (підгрупа 1.10), серед яких було 52 вагітні жінки ([54,2±5,1] %), що склали підгрупу 1.10б. До підгрупи 1.10а увійшло 44 пацієнти із загального населення ([45,8±5,1] %).
Підгрупу порівняння (підгрупа 1.11) склали хворі з дерматологічною патологією – 173 особи. До підгрупи 3.3 (контрольна підгрупа) увійшли 56 здорових осіб. Дані наведені на рисунку 9.2.
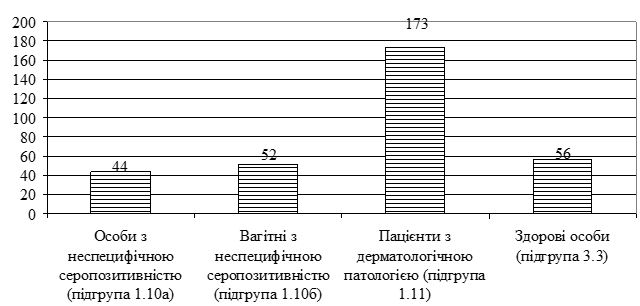
Рисунок 9.2 – Підгрупи осіб, які пройшли обстеження на сифіліс (n = 325)
При обстеженні хворих як з ранніми, так і з пізніми формами сифілісу (підгрупа 1.8) спостерігався достатньо високий відсоток (вище 95 %) виявлення хворих методами експрес-діагностики (ІХГ, РМП, RPR), які можна застосовувати для скринінгу. Але частота визначення позитивних результатів дещо варіювала. За допомогою РМП виявлено в середньому 96,3 % хворих на сифіліс (89 [94,7 ± 2,3] % хворих з раннім та 186 [97,9 ± 1,0] % з пізнім сифілісом). Частота виявлення хворих на сифіліс методом RPR була майже однаковою і склала 90 ([95,7 ± 2,1] %) для раннього і 182 ([95,8 ± 1,5] %) для пізнього сифілісу. За допомогою «швидких тестів» ІХГ було виявлено 99,5 % позитивних реакцій, при чому серед осіб з пізнім сифілісом дані склали 100 %, з раннім – 93 (98,9 ± 1,1) % (табл. 9.1).
Що стосується вагітних з ранніми та пізніми формами сифілісу (підгрупа 1.9), то при застосуванні швидких методів діагностики сифілісу (РМП, RPR, ІХГ), частота виявлення хворих дещо нижча, дані сягають в середньому 93 %. Методами РМП та RPR виявлено 11 ([91,7 ± 8,0] %) хворих з раннім та 39 ([95,1 ± 3,4] %) пацієнток з пізнім сифілісом. Методом ІХГ підтверджений сифіліс у 100 % випадків при обох формах захворювання (табл. 9.2).
Таблиця 9.1 – Частота визначення позитивних результатів (%) при обстеженні хворих на ранній та пізній сифіліс методами РМП1, РЗКк2, РЗКт3, РПР (RPR)4, ІХГ5, ІФА6, РПГА7
| Хворі на сифіліс | РМП | РЗКк | РЗКт | RPR (RPR) | ІХГ | ІФА (сумарні) | РПГА | |
| Ранній (n=94) | n | 89 | 90 | 93 | 90 | 93 | 93 | 93 |
| % | 94,7 ± 2,3 | 95,7 ± 2,1 | 98,9 ± 1,1 | 95,7 ± 2,1 |
98,9 ± 1,1 | 98,9 ± 1,1 |
98,9 ± 1,1 | |
| Пізній (n=190) | n | 186 | 182 | 190 | 182 | 190 | 190 | 190 |
| % | 97,9 ± 1,0 | 95,8 ± 1,5 | 100 | 95,8 ± 1,5 |
100 | 100 | 100 | |
| Разом (n=284) | n | 275 | 272 | 283 | 272 | 283 | 283 | 283 |
| % | 96,8 ± 1,0 | 95,8 ± 1,2 | 99,7 ± 0,4 | 95,8 ± 1,2 |
99,7 ± 0,4 | 99,7 ± 0,4 |
99,7 ± 0,4 |
Примітка. 1 – реакція мікропреципітації (РМП); 2 – реакція зв’язування комплементу з кардіоліпіновим реагентом (РЗКк); 3 – реакція зв’язування комплементу з трепонемним реагентом (РЗКт); 4 – антикардіоліпіновий (реагіновий) тест (RPR); 5 – імунохроматографічний аналіз (ІХГ); 6 – імуноферментний аналіз (ІФА); 7 – реакція пасивної гемаглютинації (РПГА)
Таблиця 9.2 – Частота визначення позитивних результатів (%) при обстеженні вагітних хворих на ранній та пізній сифіліс методами РМП1, РЗКк2, РЗКт3, RPR4, ІХГ5, ІФА6, РПГА7
| Вагітні хворі на сифіліс | РМП | РЗКк | РЗКт | RPR | ІХГ | ІФА (сумарні) | РПГА | |
| Ранній (n=12) | n | 11 | 11 | 12 | 11 | 12 | 12 | 12 |
| % | 91,7 ± 8,0 | 91,7 ± 8,0 | 100 | 91,7 ± 8,0 | 100 | 100 | 100 | |
| Пізній (n=41) | n | 39 | 39 | 41 | 39 | 41 | 41 | 41 |
| % | 95,1 ± 3,4 | 95,1 ± 3,4 | 100 | 95,1 ± 3,4 | 100 | 100 | 100 | |
| Разом (n=53) | n | 50 | 50 | 53 | 50 | 53 | 53 | 53 |
| % | 94,3 ± 3,2 | 94,3 ± 3,2 | 100 | 94,3 ± 3,2 | 100 | 100 | 100 |
Примітка. 1 – реакція мікропреципітації (РМП); 2 – реакція зв’язування комплементу з кардіоліпіновим реагентом (РЗКк); 3 – реакція зв’язування комплементу з трепонемним реагентом (РЗКт); 4 – антикардіоліпіновий (реагіновий) тест (RPR); 5 – імунохроматографічний аналіз (ІХГ); 6 – імуноферментний аналіз (ІФА); 7 – реакція пасивної гемаглютинації (РПГА)
За допомогою ІФА, РПГА та РЗКт було виявлено 100 % хворих з пізнім сифілісом (підгрупа 1.8б) та 100 % пацієнток з ранніми та пізніми формами захворювання серед вагітних (підгрупа 1.9). Для хворих з раннім сифілісом (підгрупа 1.8а) частота виявлення даними методами становила 93 ([98,9 ± 1,1] %). Таким чином, загальна частота виявлення хворих на сифіліс (підгрупа 1.8 (загальна популяція та групи ризику) та підгрупа 1.9 [вагітні]) методами ІФА, РПГА та РЗКт спостерігалася на рівні 99,5 %.
Що стосується методу РЗКк, то частота визначення позитивних результатів при обстеженні пацієнтів з сифілісом відзначалася на рівні 272 ([95,8 ± 1,2] %) для підгрупи 1.8 (загальна популяція та групи ризику) та 50 ([94,3 ± 3,2] %) – для підгрупи 1.9 (вагітні).
При обстеженні пацієнтів з неспецифічною серопозитивністю за допомогою скринінгових тестів було виявлено наступне. При застосуванні РМП та RPR в 100 % випадків, як серед представників різних верств популяції, так і серед вагітних, були виявлені позитивні результати. При використанні ІХГ позитивні результати тесту були виявлені лише у 7 ([15,9 ± 5,5] %) випадків серед представників загальної популяції з неспецифічною серопозитивністю та в 7 ([13,5 ± 4,7] %) вагітних, що були обстежені.
При проведенні діагностики сифілісу серед осіб з хибною серопозитивністю методами ІФА, РПГА та РЗКт у 7 ([15,9 ± 5,5] %) випадків була отримана позитивна відповідь серед представників різних верств населення та в 7 ([13,5 ± 4,7] %) вагітних. Що стосується РЗКк, то частота визначення позитивних результатів становила 100 % (табл. 9.3).
Таким чином, при застосуванні методів ІХГ, ІФА, РПГА та РЗКт для діагностики сифілісу значно підвищується ймовірність отримання чітких та вірогідних результатів.
При обстеженні пацієнтів з дерматологічною патологією (табл. 9.3) за допомогою методів швидкої діагностики при застосуванні РМП та RPR були отримані тільки негативні результати. Але при обстеженні цієї ж групи пацієнтів за допомогою ІХГ у 2 ([1,2 ± 0,8] %) випадків були визначені позитивні дані. У двох випадках виявлення пацієнтів був встановлений діагноз пізнього сифілісу.
Позитивні результати тестування (2 ([1,2 ± 0,8] %) обстежених осіб) були отримані також при використанні методів ІФА, РПГА та РЗКт. Що стосується РЗКк, то при обстеженні цим методом підгрупи 1.11 позитивних реакцій на сифіліс визначено не було.
Таблиця 9.3 – Частота визначення позитивних результатів (%) при обстеженні на сифіліс осіб з хибною серопозитивністю з груп загального населення та вагітних, пацієнтів з дерматологічною патологією та здорових осіб методами РМП1, РЗКк2, РЗКт3, RPR4, ІХГ5, ІФА6, РПГА7
| Групи осіб, що були обстежені | РМП | РЗКк | РЗКт | RPR | ІХГ | ІФА (сумарні) | РПГА | |
| Особи з хибною серопозитивністю (n=44) | n | 44 | 44 | 7 | 44 | 7 | 7 | 7 |
| % | 100 | 100 | 15,9 ± 5,5 | 100 | 15,9 ± 5,5 | 15,9 ± 5,5 |
15,9 ± 5,5 | |
| Вагітні з хибною серопозитивністю (n=52) | n | 52 | 52 | 7 | 52 | 7 | 7 | 7 |
| % | 100 | 100 | 13,5 ± 4,7 | 100 | 13,5 ± 4,7 | 13,5 ± 4,7 |
13,5 ± 4,7 | |
| Пацієнти з дерматологічною патологією (n=173) | n | 0 | 0 | 2 | 0 | 2 | 2 | 2 |
| % | 0 | 0 | 1,2 ± 0,8 | 0 | 1,2 ± 0,8 | 1,2 ± 0,8 |
1,2 ± 0,8 | |
| Здорові особи (n=56) | n | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| % |
Примітка. 1 – реакція мікропреципітації (РМП); 2 – реакція зв’язування комплементу з кардіоліпіновим реагентом (РЗКк); 3 – реакція зв’язування комплементу з трепонемним реагентом (РЗКт); 4 – антикардіоліпіновий (реагіновий) тест (RPR); 5 – імунохроматографічний аналіз (ІХГ); 6 – імуноферментний аналіз (ІФА); 7 – реакція пасивної гемаглютинації (РПГА)
У всіх обстежених хворих на сифіліс та вагітних з ранніми та пізніми формами сифілісу визначалися позитивні значення ІХГ, РМП, RPR та (99,7 %, 96,4 % та 94,9 % відповідно). Згідно отриманих даних, встановлено, що ці реакції є найбільш чутливими в КСР у даному випадку.
При обстеженні контрольної підгрупи 3.3 (56 здорових донорів) при застосуванні перерахованих методів діагностики жодних випадків сифілісу виявлено не було.
Враховуючи інформативність тестів у діагностиці різних сифілісу та при диференціюванні хибної серопозитивності, можна оцінити можливість їх застосування тестів в різних випадках та серед різних верств населення. Якщо оцінити 0,5 бала випадки, коли тест має заміну та може бути продубльованим та в 2 бали випадки, коли він може бути рекомендований як основний, дані можна розподілити наступним чином (таблиця 9.4).
Таблиця 9.4 – Рекомендації щодо впровадження тест-систем у діагностиці сифілісу
| Ситуації щодо застосування тестів на сифіліс | КСР | RPR | ІХГ | ІФА | РПГА | ||
| РМП | РЗКк | РЗКт | |||||
| Скринінгове обстеження населення | (+) | (+) | (+) | (+) | (+) | ||
| Скринінгове обстеження населення в популяціях з низьким рівнем превалентності інфекції | + | ||||||
| Скринінгове обстеження населення в популяціях з високим рівнем превалентності інфекції | + | (+) | (+) | ||||
| Виявлення пізніх форм сифілісу серед хворих дерматовенерологічних та соматичних стаціонарів | (+) | (+) | (+) | (+) | (+) | ||
| Оцінка стану хибної серопозитиності | (+) | (+) | (+) | (+) | |||
| Умовна оцінка використання тест-системи ( в балах) | 1,0 | 0 | 0,5 | 1,0 | 5,5 | 2,0 | 2,0 |
Примітка. (+) – має заміну (може бути продубльований); + – рекомендований як основний
Виходячи з отриманих даних, при застосуванні методів ІХГ в діагностиці сифілісу спостерігається значний відсоток отримання чітких та вірогідних результатів. Тест можна застосовувати в різних верствах населення, в різних випадках (скринінг, виявлення пізніх форм сифілісу, визначення хибної серопозитивності).
А у випадках скринінгового обстеження населення, в популяціях як з високим, так і з низьким рівнем превалентності інфекції, метод ІХГ може бути використаний як основний.
* * *
Таким чином, при обстеженні пацієнтів необхідно більш вибірково підходити до вибору методів діагностики сифілісу. У випадках несвоєчасного виявлення хворих на сифіліс, може спостерігатися не тільки погіршення стану здоров’я самих хворих, але й поширення сифілісу в популяції.
Враховуючи значну інформативність ІХГ тесту, який дає високий відсоток виявлення сифілітичної інфекції (98-100 %), доцільно рекомендувати його до застосування для визначення сифілісу. Залежно від оснащення ЛПЗ та існуючої епідемічної ситуації доцільно проводити скринінгове обстеження на сифіліс з використанням методів ІХГ або ІФА, або РПГА та за допомогою одного з нетрепонемних тестів: РМП, RPR.
Серед представників верств населення з низьким рівнем превалентності інфекції (соматичні стаціонари, поліклініки, кабінети медичних оглядів) обстеження бажано проводити переважно за допомогою трепонемного тесту ІХГ, оскільки при цьому можна відразу виділити групу хворих або пацієнтів, що у минулому перенесли сифіліс.
Скринінгове обстеження на сифіліс групи осіб з високим рівнем превалентности інфекції в популяції (РКС, ЧСЧ, СІН, ув`язнені, тощо) доцільно починати з трепонемного тесту ІХГ. Доцільно у випадках отримання позитивної відповіді для підтвердження результату проводити дослідження із застосуванням інших трепонемних тестів – РПГА, ІФА.
Враховуючи можливість виявлення хворих з пізніми формами сифілісу серед пацієнтів соматичних стаціонарів (офтальмологічних, психоневрологічних, кардіологічних, гінекологічних, урологічних, дерматовенерологічних, тощо) при обстеженні даного контингенту пацієнтів доцільно використовувати методи ІХГ, РМП або RPR, РПГА, ІФА (будь-яку з реакцій на вибір) залежно від оснащення ЛПЗ та тест-систем, що на цей час зареєстровані.
Особи без клінічних проявів захворювання, що були в статевому або побутовому контакті з хворими на сифіліс, підлягають обстеженню за допомогою РМП, або RPR, та ІФА IgM або ІФА сумарні або РПГА, ІХГ.
Публікації:
- Щербакова Ю.В. Місце швидких тестів в діагностиці сифіліса у представників різних верств населення / Ю.В. Щербакова // Журнал дерматовенерології та косметології ім. М.О. Торсуєва. – 2015. – № 1-2 (34). – С. 73-78.
- Щербакова Ю.В. Современные подходы к лабораторной диагностике сифилиса / Ю.В. Щербакова, В.В. Кутовая // Научные труды первой научно-практической международной конференции Ассоциации дерматовенерологов Армении «Ереванские дерматовенерологические чтения». – Научно-медицинский журнал. – 2015. – № 10. – С. 75-78.
- Кутовая В.В. Иммунохроматографические экспресс-тесты в серодиагностике сифилиса / В.В. Кутовая, О.Н. Белоконь, Ю.В. Щербакова // Материалы научно-практической конференции с международным участием «Международная интеграция и научные достижения украинской дерматовенерологии». – Дерматологія та венерологія. – 2014. – № 3 (65). – С. 118-119.
РОЗДІЛ 10
Ефективність використання іміквімоду в лікуванні гострокінцевих кондилом
Інфекції, що спричинені ВПЛ, належать до найбільш розповсюджених в світі інфекційних захворювань. При цьому вони охоплюють всі шари суспільства, але найбільш поширені серед осіб, що належать до уразливих груп населення щодо зараження ІПСШ та ВІЛ (які часто змінюють статевих партнерів, вживають психоактивні речовини, тощо). За даними спостережень, розповсюдженість ВПЛ-інфекції серед населення варіює від 4 до 35% та безпосередньо залежить від кількості статевих партнерів [58, 122, 270].
Згідно отриманих в дослідженні даних (розділ 5) спостерігається позитивний кореляційний зв’язок між ВПЛ та ВІЛ, причому як у групі хворих з ІПСШ так і серед пацієнтів з дерматологічною патологією, щ може виступати одним з маркерів зниження імунітету.
Хронічний перебіг ВПЛ, часте рецидивування, приєднання вторинної інфекції, збільшення ймовірності зараження іншими ІПСШ – причини з яких важливо приділяти увагу лікуванню пацієнтів з ВПЛ-інфекцією. При деструкції з’являються нові вогнища з порушенням цілісності тканин, болісність процедури, дискомфорт в період загоювання .
Для фахівця, який надає допомогу пацієнтам з ВПЛ, також існує певна небезпека – контакт з інфекційним матеріалом (кров, тканини), можливість випаровування фрагментів вірусу, ймовірність травм при проведенні деструкції. Все це обумовлює пошук нових методів лікування ВПЛ-інфекції.
Тому метою дослідження було визначення ефективності застосування крему іміквімод 5 % в лікуванні гострокінцевих кондилом аногенітальної локалізації у ВІЛ-позитивних осіб.
Під спостереженням знаходилися 43 особи з гострокінцевими кондиломами аногенітальної локалізації, які увійшли до підгрупи 2.7. Проводилося обстеження пацієнтів на наявність ІПСШ (сифіліс, трихомоноз, хламідіоз, гонорея, ВІЛ, гепатити, герпес, ВЕБ, ЦМВ тощо). Також проводилося мотиваційне консультування пацієнтів з метою визначення ризикованої статевої поведінки та зниження ризиків повторного інфікування.
Пацієнти з гострокінцевими кондиломами з ВІЛ-позитивним статусом належали до наступних груп ризику. СІН були 13 ([30,2 ± 7,0] %), особи, що проходили обстеження, як статеві партнери ВІЛ-інфікованих – 15 ([34,9 ± 7,3] %), ЧСЧ – 11 ([25,6 ± 6,7] %), РКС — 4 ([9,3 ± 4,4] %) (рис. 10.1).
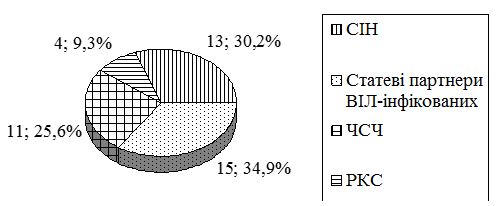
Рисунок 10.1 – Розподіл хворих за приналежністю до груп ризику
У результаті обстеження пацієнтів не було виявлено жодного випадку сифілісу, уреаплазмової інфекції, гонореї, гепатиту В. Кандидоз, гепатит С виявлені у 14 ([34,9 ± 7,3] %) обстежених, герпес – у 13 ([30,2 ± 7,0] %), хламідіоз – у 11 ([25,6 ± 6,7] %) випадків (рис. 10.2).
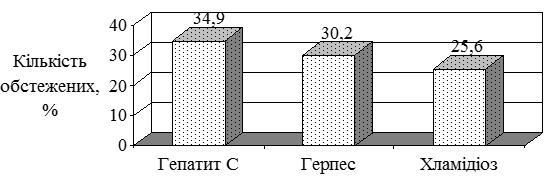
Рисунок 10.2 – Результати обстеження пацієнтів з гострокінцевими кондиломами аногенітальної локалізації
До ВЕБ виявилися позитивними близько 50 % обстежених (Ig G – 19 ([44,2 ± 7,6] %), Ig M – 2 ([4,7 ± 3,2] %). До ЦМВ позитивними були майже 95 % пацієнтів, у тому числі позитивний Ig G виявлено у 39 ([90,7 ± 4,4] %) обстежених, Ig M – у 2 ([4,7 ± 3,2] %). До токсоплазму виявилися позитивними (Ig G) 17 ([39,5 ± 7,5] %) обстежених (рис. 10.3).
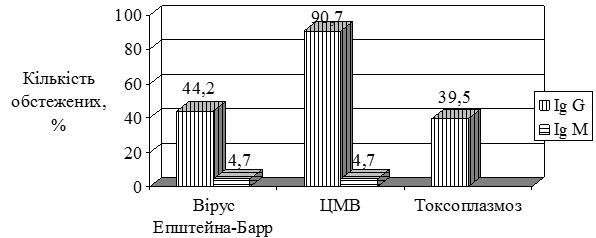
Рисунок 10.3 – Результати обстеження пацієнтів з гострокінцевими кондиломами аногенітальної локалізації
Локалізація гострокінцевих кондилом була наступна. На статевих губах висипи спостерігалися у 11 ([25,6 ± 6,7] %) обстежених, біля входу в піхву – у 9 ([20,9 ± 6,2] %), на голівці статевого члена – у 19 ([44,2 ± 7,6] %), на стовбурі – у 17 ([39,5 ± 7,5] %), у лобковій зоні – у 4 ([9,3 ± 4,4] %), у періанальній ділянці – у 11 ([25,6 ± 6,7] %) пацієнтів. Дані наведені на рисунку 10.4.

Рисунок 10.4 – Локалізація гострокінцевих кондилом у пацієнтів з гострокінцевими кондиломами аногенітальної локалізації
У більшості пацієнтів гострокінцеві кондиломи локалізувалися на декількох ділянках одночасно (27 – [62,8 ± 7,4] % хворих) – майже у 2/3 хворих.
Пацієнти були розподілені на дві підгрупи. До підгрупи 2.7а увійшли 22 ВІЛ-позитивні пацієнти з ВПЛ, які отримували в якості монотерапії крем, що містив іміквімод 5 %. Іміквімод-крем у пакетиках для одноразового застосування пацієнти використовувався 3 рази на тиждень, наносився на кондиломи увечері за 8 годин (±2 години) перед сном, а на наступний ранок ділянка нанесення очищувалася водою і милом. Лікування тривало до повного регресу клінічних проявів (зникнення кондилом), але не довше 8 тижнів.
До підгрупи 2.7б (група порівняння) увійшли 21 ВІЛ-позитивний пацієнт з гострокінцевими кондиломами, в лікуванні яких застосовували методи абляційної терапії (кріодеструкція, електродеструкція).
Критеріями включення пацієнтів в дослідження були: письмова інформована згода пацієнта на участь в дослідженні; наявність зовнішніх гострокінцевих кондилом аногенітальної локалізації; максимальна висота одного елементу 1 см; максимальна площа ураження 20 см²; здатність пацієнта до адекватного співробітництва в процесі дослідження; відсутність уражень шкіри (подразнення, порушення цілісності, тощо) на ділянках нанесення препарату.
Критеріями виключення визначено: гіперчутливість до компонентів препарату; терапія засобом крем іміквімод 5 % в попередні 6 місяців; внутрішня локалізація гострокінцевих кондилом аногенітальної локалізації (уретра, піхва, шийка матки, анус); наявність патологічних станів: бовеноїдний папульоз, запальні ураження шкіри аногенітальної ділянки, автоімунні захворювання, онкологічні процеси, трансплантація органів в анамнезі; вагітність та період годування.
Протягом лікування пацієнтів із гострокінцевими кондиломами проводилося їх клінічне спостереження. Оцінку ефективності терапії в обох підгрупах проводили через 1 та 3 місяці після лікування. Реєстрація побічних проявів при застосуванні методів терапії проводилася в обох підгрупах. Безпека застосування крему іміквімод проводилася на кожному візиті шляхом оцінки місцевих шкірних реакцій (еритема, набряк, ерозії, свербіж, печіння, біль) за шкалою від 0 до 3 (0 – ні, 1 – незначна, 2 – помірна, 3 – виражена). Спостереження проводилися протягом 8 тижнів із визначенням зміни кількості клінічних проявів захворювання на фоні лікування (на 20 %, 30 %, 50 %, 70 %, 100 %). Основним параметром ефективності лікування була відсутність гострокінцевих кондилом протягом всього періоду спостереження.
Всі пацієнти отримували лікування ІПСШ відповідно до встановленого діагнозу, а також АРТ.
Проведено оцінку стану імунітету у хворих з клінічними проявами ВПЛ. Визначено кількість CD4+, рівень вірусного навантаження (таблиці 10.1, 10.2). Спостерігався розбіг у показниках CD4+, тому пацієнти були розподілені наступним чином.
Таблиця 10.1 – Рівень CD4+ у пацієнтів з гострокінцевими кондиломами аногенітальної локалізації, підгрупа 2.7а, до лікування
| Шкала розподілу за кількістю CD4+ | Кількість пацієнтів | Абсолютна кількість CD4+ | Відносна кількість CD4+ |
| до 140 | 3 ([13,6 ± 7,3] %) | 117,0 ± 23,0 | (12,4 ± 3,4) % |
| 230-500 | 12 ([54,5 ± 10,6] %) | 309,9 ± 27,4 | (27,0 ± 2,8) % |
| Більше 500 | 7 ([31,8 ± 9,9] %) | 730,6 ± 61,0 | (32,3 ± 4,3) % |
Рівень вірусного навантаження у пацієнтів, що отримували лікування іміквімодом (підгрупа 2.7а), до лікування наведений в таблиці 10.2.
Таблиця 10.2 – Дані вірусного навантаження у пацієнтів підгрупи 2.7а до лікування
| Кількість копій | Кількість хворих | Середнє значення |
| до 50 | 8 ([36,4 ± 10,3] %) | 24,5 ± 4,5 |
| близько 200 | 2 ([9,1 ± 6,1] %) | 214 ± 25,7 |
| Значне навантаження | 3 (13,6 ± 7,3] %) | 260958,0 ± 2474,0 |
Лікування раніше проводилося у 4 ([18,2 ± 8,2] %) осіб з підгрупи 2.7а та у 6 ([28,6 ± 9,9] %) пацієнтів з підгрупи 2.7б.
Усім пацієнтам було рекомендовано консультування фахівцем статевих партнерів з метою виявлення ІПСШ, а також утримування від статевих контактів протягом лікування.
У підгрупі 2.7а при застосуванні крему іміквімод в лікуванні гострокінцевих кондилом регрес висипань спостерігався протягом 3 тижнів у 2 ([9,1 ± 6,1] %) пацієнтів, через місяць – ще у 1 ([4,5 ± 4,4] %). Більшість пацієнтів (19 – [86,4 ± 7,3] %) застосовувала іміквімод-крем протягом 8 тижнів.
Препарат пацієнти наносили самостійно. Пацієнти відзначали, що спочатку зникали невеликі поодинокі кондиломи, які нещодавно з’явилися. Застарілі та зливні виспи потребували більш тривалого застосування іміквімоду.
Більшість пацієнтів (19 – [86,4 ± 7,3] %) відзначали добру переносимість іміквімоду (рис. 10.5).
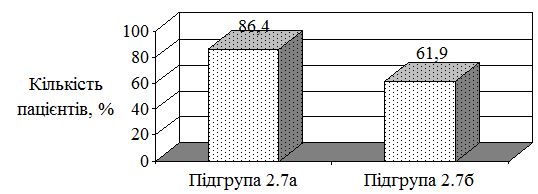
Рисунок 10.5 – Кількість пацієнтів з доброю переносимістю лікування гострокінцевих кондилом (підгрупи 2.7а та 2.7б).
У 3 ([13,6 ± 7,3] %) випадків відзначалося виникнення місцевих реакцій незначної або помірної інтенсивності в ділянці нанесення препарату у вигляді гіперемії та набряку. В 1 ([4,5 ± 4,4] %) пацієнта після зменшення кількості препарату (нанесення крему тонкішим шаром) засобу, що використовувався, побічні явища зникли.
Ще у 2 ([9,1 ± 6,1] %) пацієнтів зазначені небажані ефекти пройшли після збільшення тривалості на 1 день паузи між датами застосування препарату. Жодного разу не вважалася за необхідне відміна іміквімоду.
Зникнення аногенітальних кондилом при місцевому застосуванні іміквімоду спостерігалося через 3-8 тижнів. У 3 ([13,6 ± 7,3] %) осіб, які мали поширені висипи з тривалістю кондиломатозу близько 1 року, повного регресу висипань не було відзначено, але кількість елементів зменшилася приблизно на 70 %. Один пацієнт через тиждень самостійно за особистим бажанням перервав лікування та був виключений з дослідження.
Відсутність рецидивів гострокінцевих кондилом після терапії іміквімод-кремом через 1 місяць спостерігалася у 18 ([81,8 ± 8,2] %) пацієнтів, через 3 місяці – у 15 ([68,2 ± 9,9] %) осіб, що перебували під спостереженням у підгрупі 2.7а (рисунок 10.6).

Рисунок 10.6 – Хворі з відсутністю кондилом (клінічна ефективність методів лікування), підгрупи 2.7а та 2.7б
У підгрупі 2.7б після кріо- або електродеструкції відчуття печії, поява набряків та ерозій відзначалися у 8 ([38,1 ± 10,6] %) пацієнтів. Для проведення подібного лікування необхідно було 3-4 візити до лікаря з інтервалами 10-14 днів. Деякі пацієнти скаржилися на дискомфорт та болісність під час проведення процедури деструкції.
Клінічна ефективність застосування абляційних методів терапії в підгрупі 2.7б відзначена у 14 ([66,7 ± 10,3] %) пацієнтів. Зникнення аногенітальних кондилом спостерігалося після 2-4 процедур. В даній групі відзначалося більш часте рецидивування. У 4 ([19,0 ± 8,6] %) пацієнтів рецидиви спостерігалися вже через 2 тижні після деструкції. Відсутність рецидивів гострокінцевих кондилом через 1 місяць серед пацієнтів підгрупи 2.7б спостерігалася у 12 ([57,1 ± 10,8] %) пацієнтів, через 3 місяці – у 9 ([42,9 ± 10,8] % осіб.
Через 3 місяці у пацієнтів обох груп проводили оцінку стану імунітету шляхом визначення кількості CD4+. У підгрупі 2.7а, пацієнти якої отримували лікування із застосуванням іміквімод-крему, рівень CD4+ через 3 місяці майже не змінився (до лікування – 406,18 ± 58,72) та становив 393,5 ± 118,57 (р > 0,05).
Через 6 місяців можна було оцінити стан здоров’я близько 30 % осіб, що отримували лікування в обох підгрупах, які звернулися до фахівця з різноманітних причин (пов’язаним з лікуванням соматичних захворювань або ІПСШ). Через 6 місяців у осіб підгрупи 2.7а рівень CD4+ підвищився до 541,6 ± 70,73 (р < 0,05) і став достовірно більшим, ніж наприкінці лікування.
Наприкінці лікування в осіб підгрупи 2.7а відносна кількість CD4+ становила (26,18 ± 2,47) %. Протягом усього періоду спостереження цей показник залишився майже незмінним (через 3 місяці – [29,84 ± 5,27] %, через 6 місяців – [29,51 ± 2,94] %).
Щодо спостереження даних вірусного навантаження, отримані поодинокі дані (5 осіб – (22,7 ± 8,9) % підгрупи). Через 6 місяців спостереження у 2/3 пацієнтів (3 особи – [60,0 ± 21,9] %) підгрупи 2.7а відбулося зменшення вірусного навантаження у 3,0 рази (з 47486,45±45393,7 до 15815,17±11723,15).
Подібна тенденція відзначалася також у підгрупі 2.7б, але через 6 місяців спостереження значна кількість осіб після лікування була з незмінним вірусним навантаженням (3 особи з 4– [75,0 ± 21,6] %).
* * *
В результаті проведеного дослідження доведена ефективність використання засобів для зовнішнього застосування в лікуванні ВПЛ-інфекції. Це знижує ризики фахівця при веденні ВІЛ-інфікованих пацієнтів з ВПЛ-інфекцією, сприяє більш свідомому та відповідальному ставленню пацієнта до терапії та підвищенню уваги до особистого здоров’я.
Отримані результати дослідження свідчать про високу терапевтичну ефективність застосування крему, що містить іміквімод 5 %, при лікуванні зовнішніх аногенітальних кондилом як у чоловіків, так і у жінок.
Іміквімод-крем в якості монотерапії є ефективнішим за абляційні методи. Це проявляється у значному відсотку ([68,2 ± 9,9] %) випадків спостереження у відсутності рецидивів гострокінцевих кондилом аногенітальної локалізації, зменшенні частоти рецидивування та кількості елементів, в збільшенні міжрецидивного періоду після успішно проведеного лікування.
Іміквімод у формі крему може застосовуватися пацієнтом самостійно, з проходженням періодичного контролю ефективності лікування лікарем та відсутності побічних явищ.
Спостерігається більш значиме зниження вірусного навантаження після лікування гострокінцевих кондилом (у 3 рази протягом 6 місяців спостереження) та вірогідне підвищення рівня CD4+ на 33,3 % у пацієнтів підгрупи 2.7а.
Публікації
- Щербакова Ю.В. Ефективність використання іміквімоду в лікуванні гострокінцевих кондилом / Ю.В. Щербакова // Актуальні проблеми сучасної медицини: Вісник Української медичної стоматологічної академії. – 2016. – Т. 16, № 2 (54). – С. 202–205.
- Бондаренко Г.М. Застосування місцевих засобів терапії в лікуванні гострокінцевих кондилом (огляд) / Г.М. Бондаренко, Ю.В. Щербакова // Дерматологія та венерологія. – 2014. – № 4 (66). – С. 5–19.
РОЗДІЛ 11
РОЗРОБКА ОРГАНІЗАЦІЙНИХ ЗАХОДІВ ЩОДО НАБЛИЖЕННЯ ДЕРМАТОВЕНЕРОЛОГІЧНОЇ ДОПОМОГИ ДО ОСІБ З КОНТИНГЕНТУ УРАЗЛИВИХ ГРУП НАСЕЛЕННЯ
Згідно з оціночними даними, все більше нових випадків інфікування ВІЛ в світі відбувається в результаті гетеросексуальних контактів. Вживання психоактивних речовин (алкоголю, наркотичних засобів) збільшує ризик виникнення небезпечних сексуальних контактів з випадковими партнерами без використання презервативів. Часте явище серед представників уразливих груп – надання сексуальних послуг заради отримання грошей або наркотиків.
При діагностуванні ІПСШ доцільно застосовувати синдромний підхід, рекомендований в міжнародних настановах з надання допомоги представникам уразливих груп населення. Завданням фахівця, що надає лікувально-консультативну допомогу пацієнту з ІПСШ є визначення одного з синдромів та організація ведення хворого, з використанням відповідної схеми [22, 245, 261].
Доцільно проводити інформування спеціалістів різних фахів, що надають допомогу представникам уразливих груп населення. Необхідна розробка організаційно-методичних та лікувальних заходів по взаємодії дерматовенерологічної, наркологічної, соціальної та інших служб в Україні.
11.1 Розробка організаційних заходів щодо підвищення рівня інформованості фахівців, які надають допомогу уразливим групам населення
Програми з контролю за поширенням ІПСШ, які є важливим компонентом профілактичних програм по боротьбі з ВІЛ, являються успішними в зниженні або запобіганні росту захворюваності ВІЛ. В заходах, спрямованих на попередження поширення ІПСШ, важливе використання різних методів інформування населення, підтримка зусиль, спрямованих на зміни моделі поведінки. Особливо важливо це в роботі з групами підвищеного поведінкового ризику.
Представникам уразливих, щодо інфікування ІПСШ та ВІЛ, груп населення надають лікувально-діагностичну, соціальну допомогу широкий загал спеціалістів. Працюють з ними дерматовенерологи, наркологи, сімейні лікарі, соціальні працівники, лікарі-інфекціоністи та інші фахівці.
Консультування пацієнтів з приводу ІПСШ є невід’ємною частиною лікувального процесу. Основною метою консультування є виключення повторного зараження, передачі ІПСШ. Фахівцям необхідно проводити інформування пацієнті та просвіту з питань безпечної сексуальної поведінки, сприяти своєчасному виявленню хворих з ІПСШ.
11.1.1 Визначення рівня інформованості та інформаційних потреб фахівців, які надають допомогу уразливим групам населення
Вочевидь, фахівець, який надає допомогу пацієнтам з уразливих груп, повинен володіти інформацією, що стосується ІПСШ, а також необхідними знаннями та навичками з приводу консультування. Для визначення рівня інформованості щодо питань ІПСШ та ВІЛ фахівців, які надають консультативну, лікувально-діагностичну, соціальну допомогу представникам уразливих груп населення було проведено анкетування 332 осіб. Серед фахівців були спеціалісти наркологічних закладів (лікарі-наркологи, медичні сестри), дерматовенерологи, сімейні лікарі, гінекологи, соціальні працівники (група 4).
Проаналізовано дані 32 анкет фахівців наркологічних закладів (підгрупа 4А), 67 дерматовенерологів (підгрупа 4Б), 154 сімейних лікарів (підгрупа 4В), 43 соціальних працівників (підгрупа 4Г), 36 акушерів та гінекологів (підгрупа 4Д).
Було запропоновано дати відповідь на питання, пов’язані з ІПСШ. Визначалася інформованість фахівців щодо загальних шляхів передачі ІПСШ та ВІЛ, зокрема при сексуальних контактах, впливу ІПСШ на ймовірність зараження ВІЛ, вертикальної передачі збудників ІПСШ. Також отримані відповіді про основні клінічні симптоми ІПСШ, визначення наявності симптомів при різних патологічних станах, обізнаність про синдромний підхід у веденні пацієнтів з уразливих груп з ІПСШ. Для фахівців наркологічних закладів було запропоновано зазначити можливість переадресації пацієнтів наркологічного профілю до дерматовенерологічних закладів, встановлення діагнозу ІПСШ та призначення лікування. Всім респондентам також було запропоновано визначити найефективніші для них методи надання фахової інформації, специфіку окреслених питань.
Дані анкетування спеціалістів наркологічних закладів, дерматовенерологів, сімейних лікарів, гінекологів, та соціальних працівників наведені в таблиці 11.1.
При проведенні анкетування спеціалістів наркологічних закладів встановлено, що 14 ([43,8 ± 8,8] %) респондентів вірно відповіли, що ІПСШ можуть передаватися при статевих, трансмісивних та побутових контактах. Більшість вірних відповідей отримана від фахівців дерматовенерологів та гінекологів [44 ([65,7 ± 5,8] %) та 21 ([58,3 ± 8,2] %) відповідно]. При анкетуванні сімейних лікарів та соціальних працівників більше половини респондентів в обох групах дали вірні відповіді – 79 ([51,3 ± 4,0] %) та 23 ([53,5 ± 7,6] %). Привертає увагу, що серед соціальних працівників більше обізнаних осіб щодо ймовірності передачі ІПСШ при різних видах контактів, ніж серед сімейних лікарів. Треба підвищувати інформованість, поліпшувати рівень підготовки сімейних лікарів з питань консультування, надання лікувально-діагностичної допомоги представникам уразливих груп, тому що саме до них в першу чергу потрапляє більшість пацієнтів.
Щодо можливості застосування синдромного підходу для діагностики ІПСШ поінформовані 47-49 % наркологів, сімейних лікарів та соціальних працівників. Вищий відсоток обізнаності (60-63%) визначений серед гінекологів та дерматовенерологів.
Близько половини опитуваних фахівців наркологічної служби та соціальної (17 ([53,1 ± 8,8] %) і 23 ([53,5 ± 7,6] %) відповідно) інформовані, що зараження такими ІПСШ, як трихомоноз, хламідіоз та гонорея, можуть супроводжуватися наявністю виділень зі статевих органів.
Таблиця 11.1 – Результати опитування фахівців, які працюють з представниками уразливих груп
| Підгрупа 4А (наркологи) (абс./%) | Підгрупа 4Б (дермато-
венерологи) (абс./%) |
Підгрупа 4В (сімейні лікарі) (абс./%) | Підгрупа 4Г (соціальні працівники) (абс./%) | Підгрупа 4Д (гінекологи)
(абс./%) |
|
| 1 | 2 | 3 | 4 | 5 | 6 |
| Кількість | n=32 | n=67 | n=154 | n=43 | N=36 |
| ІПСШ можуть передаватися при статевих, трансмісивних та побутових контактах | 14 | 44 | 79 | 23 | 21 |
| (43,8 ± 8,8) % |
(65,7 ± 5,8) % |
(51,3 ± 4,0) % |
(53,5 ± 7,6) % |
(58,3 ± 8,2) % |
|
| Можливості застосування синдромного підходу для діагностики ІПСШ | 14 | 42 | 75 | 21 | 22 |
| (43,8 ± 8,8) % |
(62,7 ± 5,9) % |
(48,7 ± 4,0) % |
(48,8 ± 7,6) % |
(61,1 ± 8,1) % |
|
| Зараження ІПСШ (трихомоноз, хламідіоз, гонорея) може супроводжуватися наявністю виділень зі статевих органів | 17 | 56 | 94 | 23 | 30 |
| (53,1 ± 8,8) % |
(83,6 ± 4,5) % |
(61,0 ± 3,9) % |
(53,5 ± 7,6) % |
(83,3 ± 6,2) % |
|
| Можливість вертикальної передачі збудників сифілісу, ВІЛ, хламідіозу | 16 | 56 | 91 | 22 | 30 |
| (50,0 ± 8,8) % |
(83,6 ± 4,5) % |
(59,1 ± 4,0) % |
(51,2 ± 7,6) % |
(83,3 ± 6,2) % |
|
| Інформовані про фемідом (жіночий презерватив) та його функції | 17 | 48 | 83 | 33 | 26 |
| (53,1 ± 8,8) % |
(71,6 ± 5,5) % |
(53,9 ± 4,0) % |
(76,7 ± 6,4) % |
(72,2 ± 7,5) % |
|
| Ризик інфікування для ВІЛ-негативної жінки при статевих гетеросексуальних контактах від ВІЛ-позитивного статевого партнера вищий, ніж навпаки | 21 | 50 | 86 | 25 | 26 |
| (65,6 ± 8,4) % |
(74,6 ± 5,3) % |
(55,8 ± 4,0) % |
(58,1 ± 7,5) % |
(72,2 ± 7,5) % |
|
| Обізнаність щодо основних клінічних симптомів ІПСШ (наявність слизово-гнійних виділень з сечовивідних шляхів, болі в нижній частині | 21 | 57 | 105 | 27 | 31 |
| (65,6 ± 8,4) % |
(85,1 ± 4,4) % |
(68,2 ± 3,8) % |
(62,8 ± 7,4) % |
(86,1 ± 5,8) % |
Продовження таблиці 11.1
| 1 | 2 | 3 | 4 | 5 | 6 |
| живота, дизурії, виразок в області статевих органів, пахового лімфаденіту) | |||||
| Інформованість щодо клінічних проявів сифілісу та генітального герпесу (зокрема наявність виразкового елементу в області геніталій) | 20 | 56 | 103 | 26 | 30 |
| (62,5 ± 8,6) % |
(83,6 ± 4,5) % |
(66,9 ± 3,8) % |
(60,5 ± 7,5) % |
(83,3 ± 6,2) % |
|
| Знають, що наявність ІПСШ підвищує ризик зараження ВІЛ | 23 | 55 | 122 | 32 | 29 |
| (71,9 ± 7,9) % |
(82,1 ± 4,7) % |
(79,2 ± 3,3) % |
(74,4 ± 6,7) % |
(80,6 ± 6,6) % |
|
| Обізнані щодо можливості передачі гонореї та сифілісу при усіх видах сексуальних контактів (вагінальний, анальний, оральний) | 25 | 57 | 117 | 34 | 30 |
| (78,1 ± 7,3) % |
(85,1 ± 4,4) % |
(76,0 ± 3,4) % |
(79,1 ± 6,2) % |
(83,3 ± 6,2) % |
|
| Вірно обрані ствердження, щодо ІПСШ | 11 | 48 | 51 | 15 | 25 |
| (34,4 ± 8,4) % |
(71,6 ± 5,5) % |
(33,1 ± 3,8) % |
(34,9 ± 7,3) % |
(69,4 ± 7,7) % |
|
| Інформація щодо застосування швидких тестів щодо діагностики ІПСШ та інтерпретації отриманих результатів | 11 | 42 | 54 | 13 | 22 |
| (34,4 ± 8,4) % |
(62,7 ± 5,9) % |
(35,1 ± 3,8) % |
(30,2 ± 7,0) % |
(61,1 ± 8,1) % |
|
| Середній відсоток вірних відповідей в групі | 17 | 51 | 88 | 24 | 27 |
| (53,1 ± 8,8) % |
(76,1 ± 5,2) % |
(57,1 ± 4,0) % |
(55,8 ± 7,6) % |
(75,0 ± 7,2) % |
|
| Рівень інформованості в групі після проведення семінару | 26 | 56 | 120 | 35 | 29 |
| (81,3 ± 6,9) % |
(83,6 ± 4,5) % |
(77,9 ± 3,3) % |
(81,4 ± 5,9) % |
(80,6 ± 6,6) % |
Також майже 50 % фахівців цих служб знають, що можлива вертикальна передача збудників сифілісу, ВІЛ-інфекції та хламідіозу. Вірні твердження з цих питань вказали також 91 ([59,1 ± 4,0] %) сімейних лікарів та 83-84 % гінекологів та дерматовенерологів.
Щодо інформації про застосування фемідому (жіночого презервативу) найбільш інформованою виявилася група соціальних працівників – 33 ([76,7 ± 6,4] %) вірних відповідей. Також близько половини фахівців (53-54 %) наркологічної та сімейних лікарів володіють інформацією. Дерматовенерологи та гінекологи дали вірні відповіді в 71,6-72,2 % випадків.
Серед наркологів 21 ([65,6 ± 8,4] %) проінформовані, що вище ризик інфікування для ВІЛ-негативної жінки при статевих гетеросексуальних контактах від ВІЛ-позитивного статевого партнера, ніж навпаки. Відсоток вірних відповідей частіше надавали соціальні працівники, ніж сімейні лікарі (25 ([58,1 ± 7,5] %) та 86 ([55,8 ± 4,0] %) відповідно) та дерматовенерологи, ніж гінекологи (50 ([74,6 ± 5,3] %) та 26 ([72,2 ± 7,5] %) відповідно).
Близько 66-68 % наркологів та сімейних лікарів вірно відповіли щодо основних клінічних симптомів ІПСШ (наявність слизово-гнійних виділень з сечовивідних шляхів, болі в нижній частині живота, дизурії, виразок в області статевих органів, пахового лімфаденіту). Вірну фахову інформацію вказали 57 ([85,1 ± 4,4] %) дерматовенерологів та 31 ([86,1 ± 5,8] %) гінекологів, 27 ([62,8 ± 7,4] %) соціальних працівників.
20 ([62,5 ± 8,6] %) наркологів та 103 ([66,9 ± 3,8] %) сімейних лікарів обізнані щодо клінічних проявів (зокрема наявність виразкового елементу в області геніталій) сифілісу та генітального герпесу. Володіють цією інформацією 30 ([83,3 ± 6,2] %) гінекологів, 56 ([83,6 ± 4,5] %) дерматовенерологів, 26 ([60,5 ± 7,5] %) соціальних працівників.
Більшість фахівців (73-82 %) знають, що наявність ІПСШ підвищує ризик зараження ВІЛ.
Більше двох третин (76-79 %) наркологів, сімейних лікарів, соціальних працівників обізнані щодо можливості передачі гонореї та сифілісу при усіх видах сексуальних контактів (вагінальний, анальний, оральний). Вірну інформацію вказали 57 ([85,1 ± 4,4] %) дерматовенерологів та 30 ([83,3 ± 6,2] %) гінекологів.
Лише третина фахівців (33-35 %) наркологічної та соціальної служб, сімейних лікарів вірно обрала твердження, що стосуються ІПСШ. Більшість хибно вважає, що ІПСШ уражує тільки статеві органи, після перенесених ІПСШ розвивається стійкий імунітет, або ІПСШ завжди перебігають з наявністю симптомів. Вірні відповіді з цих питань обрали 48 ([71,6 ± 5,5] %) дерматовенерологів та 25 ([69,4 ± 7,7] %) гінекологів.
9 ([28,1 ± 7,9] %) фахівців наркологічного профілю знають, до якого ЛПЗ можлива переадресація пацієнта зі скаргами дерматовенерологічного профілю з амбулаторії обласного наркологічного диспансеру (ОНД) та щодо можливості перенаправлення пацієнта стаціонарного відділення ОНД з відповідними скаргами до ДУ «ІДВ НАМНУ» або кафедри дерматовенерології та ВІЛ/СНІДу ХМАПО. П’ята частина фахівців [6 ([18,8 ± 6,9] %)] вірно інформована з питань переадресації пацієнта зі скаргами дерматовенерологічного профілю зі стаціонарного відділення ОНД. Цілком всі респонденти (100 %) обізнані, що встановлення діагнозу дерматовенерологічного захворювання та призначення лікування виконується лише дерматовенерологом.
Таким чином, найбільш обізнаними з фахівців, які надають лікувально-діагностичну допомогу пацієнтам з ІПСШ питань ІПСШ були дерматовенерологи – (76,1 ± 5,2) % та гінекологи – (75,0 ± 7,2) %. Відсоток вірних стверджень з питань ІПСШ серед сімейних лікарів спостерігався на рівні 52–65 %. Рівень знань соціальних працівників склав (55,8 ± 7,6) %.
Формами отримання інформації з питань надання дерматовенерологічної допомоги контингенту уразливих груп респонденти визначили семінари та тренінги. На цих заходах, з точки зору фахівців, що проходили анкетування, не тільки надається інформація. Навчання на таких заходах здебільшого інтерактивне, тому залучення слухачів до процесу активне, інтрес великий.
Також фахівці зазначали, що їм необхідна актуальна інформація щодо аналізу сучасної епідемічної ситуації з ІПСШ та ВІЛ в країні та світі, питань консультування представників уразливих груп населення, надання лікувально-діагностичної дерматовенерологічної допомоги з урахуванням міжнародного досвіду. Також цікавою з практичної точки зору представлялася інформація щодо розробки організаційно-методичних заходів по покращенню доступу пацієнтів до отримання фахової допомоги, можливостей налагодження взаємодії між службами, обміну досвідом.
З метою інформування фахівців, що надають лікувально-даігностичну та консультативну допомогу представникам уразливих груп населення проводилися семінари-тренінги. На семінарах була представлена інформація щодо особливостей взаємодії дерматовенерологічної та інших служб, механізмах переадресації пацієнтів. Приділялася увага особливостям клінічної діагностики ІПСШ у осіб з уразливих груп із застосуванням синдромного підходу, як дієвого методу забезпечення ранньої діагностики інфекцій, а тим самим профілактики розповсюдження ІПСШ/ВІЛ. Також обговорювалося проведення консультування пацієнтів з метою зміни поведінки в сторону більш безпечної щодо інфікування ІПСШ й усвідомлення важливості обстеження на ІПСШ, своєчасного отримання фахової допомоги. Були розглянуті питання можливостей скринінгу ІПСШ із застосуванням швидких тестів.
По завершенню семінарів було проведено повторне тестування фахівців для визначення рівня інформованості. Оцінювалася кількість вірних відповідей на вищезазначені питання. Результати повторного тестування свідчили, що кількість вірних відповідей зростала в середньому на 20-30 %. Встановлено, що обізнаність спеціалістів наркологічного профілю зросла майже на 28 % та склала (81,3 ± 6,9) % (проти (53,1 ± 8,8) % отриманих до семінару). Рівень інформованості фахівців соціальної служби, гінекологів та дерматовенерологів після семінарів сягнув 81-84 %, а сімейних лікарів – (77,9 ± 3,3) %.
11.2 Розробка методик консультування пацієнтів з інфекціями, що передаються статевим шляхом
З метою підвищення рівня надання дерматовенерологічної допомоги представникам уразливих груп з ІПСШ, був розроблений методичний посібник для фахівців, які працюють з цим контингентом населення.
В методичному посібнику «Рекомендації з проведення добровільного консультування і тестування на наявність ІПСШ представників різних груп населення. Дотестове та післятестове консультування в практиці дерматовенеролога» висвітленні питання особливостей консультування осіб з уразливих груп з ІПСШ. Зокрема надана інформація щодо мети та завдань консультування та тестування. Наведена інформація про особливості консультування представників уразливих груп в залежності від групи ризику. Описана процедура дотестовного та післятестового консультування, розробка шляхів зниження ризику повторного інфікування ІПСШ.
Метою добровільного консультування та тестування (ДКТ) на ІПСШ є надання добровільної консультативної допомоги населенню стосовно шляхів поширення ІПСШ та профілактики інфікування, сприяння прийняттю добровільного інформованого рішення щодо тестування на ІПСШ, визначення наявності ІПСШ, мотивування пацієнта та підтримка подальшої його безпечної щодо інфікування ІПСШ поведінки, отримання своєчасної медичної допомоги. Також метою консультування є усвідомлення пацієнтом важливості своєчасного початку терапії, підвищення прихильності до лікування, рекомендації з профілактики ІПСШ, обстеження на ВІЛ та гепатити В та С, з питань репродуктивного здоров’я, послуг з планування сім’ї, підтримки, тощо.
Завданнями ДКТ є:
Зниження темпів поширення ІПСШ серед населення шляхом:
- інформування щодо шляхів поширення ІПСШ та відповідних ризиків інфікування, пов’язаних з кожним з них;
- ознайомлення із заходами та засобами зменшення ризику інфікування ІПСШ;
- оцінки індивідуального ризику інфікування ІПСШ, сприяння формуванню у пацієнта власної оцінки ступеня особистого ризику інфікування ІПСШ;
- інформування щодо процедури тестування та значення результатів;
- сприяння щодо прийняття добровільного інформованого рішення стосовно проходження тестування на ІПСШ;
- тестування на ІПСШ;
- надання психологічної та соціальної підтримки;
- інформування про існуючі державні і комунальні заклади охорони здоров’я, інші державні та комунальні установи, організації та заклади, медичні заклади інших форм власності, об’єднання громадян, що надають медичну, психологічну, юридичну, соціальну та інші види допомоги особам, які її потребують;
- сприяння підвищенню рівня здоров’я населення;
- профілактики розповсюдження ВІЛ в країні, зокрема передачі статевим шляхом.
До процедури консультування і тестування існують певні вимоги.
Добровільність – тестування для виявлення ІПСШ може бути проведено тільки після усвідомленої та добровільної згоди пацієнта. Це означає, що пацієнту надано зрозумілою для нього мовою у доступній формі достатньо інформації. На основі чого він зрозумів наслідки виявлення ІПСШ, дав письмово підтверджену згоду на проходження тестування або відмовився чи відклав своє рішення без будь-якого примусу. Добровільність передбачає також відсутність примусу щодо прийняття рішення стосовно зміни ризикованої поведінки особою, яка звернулась за послугами ДКТ.
Конфіденційність – інформація, яка стала відома консультанту чи особі, яка проводила тестування, під час надання послуг ДКТ (факт звернення особи, зміст отриманих послуг, дані про особисте життя пацієнта, контактні реквізити, результати тесту), є конфіденційною. Лише у випадках, передбачених законами України ця інформація може бути передана законним представникам неповнолітнього або недієздатного пацієнта, закладам охорони здоров’я, органам прокуратури, слідства, дізнання, суду.
Перед- та післятестове консультування, а також повідомлення про результат тесту слід здійснювати з дотриманням конфіденційності.
Анонімність. За бажанням пацієнта консультація та тестування можуть бути проведені анонімно, тобто без зазначення будь-яких даних, за якими може бути ідентифікована особа (паспортні дані, місце проживання тощо). У такому випадку ДКТ проводиться з використанням коду, який надається пацієнту для проходження консультування та тестування з отриманням його результатів.
Достовірність та повнота інформації. Кожному, хто має намір пройти тестування, необхідно запропонувати перед- та післятестове консультування, під час якого надати інформацію про мету та процедуру тестування, шляхи передачі, заходи та засоби профілактики ІПСШ, можливі результати тесту, існуючі можливості отримання медичної, в разі необхідності психологічної, соціальної допомоги. Обсяг та форма представленої інформації мають бути достатніми для прийняття усвідомленого рішення про доцільність та необхідність тестування. Пацієнтам, як з позитивним, так і з негативним результатом тесту, під час повідомлення про результат тесту в державному або комунальному закладі охорони здоров’я та післятестового консультування необхідно надати інформацію про служби медичної, психологічної, соціальної та юридичної допомоги та в разі необхідності направити до них.
Процедура консультування
Передтестове консультування – це співбесіда (з дотриманням принципів ДКТ) між консультантом та пацієнтом з метою надання інформації щодо профілактики передачі ІПСШ, допомоги у прийнятті усвідомленого рішення щодо тестування.
Метою передтестового консультування є оцінка індивідуального ризику інфікування, розробка індивідуального плану зменшення ризику інфікування та визначення наслідків наявності чи відсутності інфікованості для пацієнта.
Консультант повинен тактовно пояснити причини, на підставі яких він задає ті чи інші питання, у тому числі інтимні, запевнити про конфіденційність інформації, отриманої ним під час консультування та результатів тесту.
Консультант повинен надати інформацію про переваги та недоліки застосування методів діагностики ІПСШ (швидкі та підтверджуючи діагностичні тести). Право вибору методу надання допомоги залишається за пацієнтом. Вибір має бути виключно добровільним та інформованим.
Консультування може бути поширене на подружжя, наречених, статевих партнерів, членів родини, друзів, колег тощо лише за згодою пацієнта.
Бажано, щоб перед- та післятестове консультування проводив той самий консультант.
За бажанням пацієнта ДКТ можуть бути проведені анонімно.
Усі особи, яким пропонується пройти тестування, мають право відмовитися від нього.
Консультанту потрібно надати інформацію усім особам, які звернулись за послугами ДКТ, в тому числі тим, хто відмовився від тестування, про: шляхи передачі ІПСШ; активну профілактику ІПСШ; можливості зараження та передачі ВІЛ-інфекції та інфекційних гепатитів статевим шляхом; можливості отримання консультативної, медичної допомоги та психологічної підтримки, якщо існує або виникне така потреба в майбутньому (запобігання/попередження ІПСШ, посткоітальна профілактика, тощо ).
На проведення тестування медичний працівник державного або комунального закладу охорони здоров’я повинен отримати інформовану згоду пацієнта (“Інформована добровільна згода на проведення діагностики …” – форма № 003-6/о).
ПОРЯДОК ПЕРЕДТЕСТОВОГО КОНСУЛЬТУВАННЯ.
Метою є: досягти порозуміння з пацієнтом щодо завдань консультації.
При введення в зміст консультації, фахівець повинен пояснити про:
- добровільність, конфіденційність консультування і тестування;
- процедуру ДКТ;
- мету та завдання консультування перед тестом на ІПСШ;
- методи діагностики ІПСШ із застосуванням швидких та підтверджуючих тестів;
- можливі результати тесту, їх оцінку;
- шляхи передачі ІПСШ;
- поведінкові ризики інфікування;
- заходи щодо профілактики інфікування та передачі ІПСШ та ВІЛ статевим шляхом.
Необхідно оцінити індивідуальний ризик інфікування (поведінку, пов’язану з високим ризиком інфікування ІПСШ).
Провести розробку шляхів зниження ризику інфікування. Скласти індивідуальний план щодо зниження ризиків інфікування та профілактики передачі ІПСШ.
Надати інформацію про відповідні медичні, соціальні та інші служби.
Повідомити про джерела більш докладної інформації та можливості отримання додаткових консультацій.
Важливе сприяння прийняттю рішення щодо проходження тесту. Оцінити готовність пацієнта пройти тестування.
Обговорити з ним переваги знання свого стану здоров’я.
Обговорити інформацію щодо методів лікувально-діагностичної допомоги (етіотропний, напівсиндромний, синдромний підхід, контроль виліковності).
Оцінити наслідки з’ясування стану здоров’я для подальшого життя пацієнта (отримання лікування, зміна ризикованої поведінки, тощо).
Надати пацієнту час для обмірковування обговорених питань.
Переконатися, що пацієнт зрозумів надану інформацію. При необхідності надати додаткові пояснення.
З’ясувати бажання пацієнта щодо проходження тесту на ІПСШ.
Пропозиція пройти тестування у державному або комунальному закладі охорони здоров’я.
Пацієнту, який дав згоду на проходження тесту:
при проведенні консультування у державних та комунальних ЛПЗ медичний працівник повинен запропонувати йому заповнити форму № 003-6/о, направити до маніпуляційного кабінету для взяття клінічного матеріалу для тестування та призначити наступну зустріч.
При анонімному обстеженні форма № 003-6/о не заповнюється: при проведенні консультування у державних та комунальних медичних установах, організаціях, закладах, а також медичних закладах інших форм власності на умовах анонімності.
11.2.1 Передтестове консультування
ВВЕДЕННЯ В ЗМІСТ КОНСУЛЬТАЦІЇ
Ставлення консультанта до пацієнта має бути професійним, поважливим, доброзичливим та толерантним. Пацієнту слід допомогти відчути себе комфортно під час консультування, зрозуміти зміст консультації.
Консультування проводиться у послідовності, наведеній у табл. 11.2.
11.2.1.1 Оцінка індивідуальних ризиків щодо зараження інфекціями, що передаються статевим шляхом
Метою є: визначити в поведінці пацієнта індивідуальні ризики щодо можливості зараження ІПСШ та допомогти їх усвідомити.
Консультант повинен зрозуміти занепокоєння пацієнта щодо наявності ІПСШ та сформувати для себе чітке уявлення щодо його можливого ризику інфікування. Підхід до обговорення має бути доброзичливим та об’єктивним для сприяння розумінню пацієнтом специфіки своєї особистої поведінки.
Консультанту слід намагатися виявити фактори, що впливають на епізодичну або систематичну ризиковану поведінку пацієнта.
Етапи консультування наведено у табл. 11.3.
Таблиця 11.2 – Вміст передтестового консультування пацієнтів з ІПСШ
| Етапи консультування | Зміст етапу |
| Знайомство з пацієнтом | Представитись та описати свою роль консультанта |
| Пояснення принципу конфіденційності та можливості анонімного консультування та тестування | Поінформувати пацієнта щодо:
добровільності, конфіденційності консультування та тестування; юридичної відповідальності медичних працівників за розголошення конфіденційної інформації відповідно Кримінального кодексу України; можливості вибору пацієнтом діагностики ІПСШ за допомогою клінічного обстеження, застосуванням швидких або підтверджуючих тестів; можливості анонімного консультування та тестування; можливості присутності сторонніх осіб (в тому числі родичів) під час консультування лише за умови отримання на це згоди пацієнта; порядку отримання ним результату тесту |
| Опис процедури ДКТ | Пояснити етапність процедури ДКТ:
1) передтестове консультування; 2) тестування; 3) післятестове консультування |
| Інформування про зміст передтестового консультування | Поінформувати щодо змісту консультування, а саме: надання інформації про шляхи передачі ІПСШ; поведінкові ризики інфікування, заходи щодо профілактики інфікування ІПСШ;
оцінка індивідуального ризику інфікування ІПСШ; розробка шляхів зниження індивідуальних ризиків інфікування; визначення наявної та необхідної підтримки |
| Пояснення процедури тестування | Поінформувати пацієнта щодо:
процедури тестування; значення негативного, позитивного та невизначеного (сумнівного) результатів тесту |
| Надання відповідей на запитання пацієнта | З’ясувати зрозумілість інформації для пацієнта та відповісти на його запитання |
Таблиця 11.3 – Інформація щодо оцінки індивідуальних ризиків
| Етапи консультування | Зміст етапу |
| 1 | 2 |
| Оцінка причин звернення пацієнта за послугами | Запропонувати розповісти про причину звернення та можливі чи наявні ризики інфікування ІПСШ.
З’ясувати причини занепокоєності щодо інфікування ІПСШ. |
| Аналіз останнього випадку ризикованої статевої поведінки | З’ясувати про:
час та загальні обставини останнього випадку статевої ризикованої поведінки; використання презервативу (наскільки вчасно та правильно його використовували); що спонукало погодитись на незахищений сексуальний контакт, якщо такий був; вживання психоактивних речовин в період такого контакту |
| Оцінка рівня прийнятності ризику, пов’язаного зі статевою поведінкою пацієнта | З’ясувати:
занепокоєння пацієнта щодо статевого акту з певною особою; чи була б поведінка такою самою, якби він знав, що ця особа інфікована; якщо ні, то яким чином змінилась би його поведінка |
| Визначення ризикованої статевої поведінки пацієнта | Запитати про:
те, як часто виникають ризиковані ситуації; кількість статевих партнерів протягом останніх 6 місяців; наявність випадкових статевих партнерів; досвід частої зміни статевих партнерів. |
| З’ясування наявності мотивації щодо користування презервативами | З’ясувати:
частоту користування презервативами, від чого залежить рішення використовувати їх; мотивацію пацієнта щодо прийняття рішення використовувати чи не використовувати презерватив з різними партнерами |
| Визначення чинників та обставин, що впливають на ризик інфікування | З’ясувати, що саме з нижченаведеного і на скільки підвищує ризиковану поведінку пацієнта:
алкоголь; наркотичні речовини; секс за винагороду (гроші, їжу, житло, наркотики, тощо). З’ясувати: чи вживає пацієнт наркотичні речовини, якщо так, то які та як часто; чи користується при цьому чужими шприцами або набирає наркотик із загального посуду; наявність перенесених ІПСШ раніше, коли та яких; наявність туберкульозу у пацієнта або його партнера; наявність ВІЛ у пацієнта або його партнера Застосування методів екстреної профілактики ІПСШ та ВІЛ, застосування антибактеріальних засобів (які, як часто, коли в останнє) застосування місцевих антисептичних засобів (які, як часто) |
Продовження таблиці 11.3
| 1 | 2 |
| застосування медикаментозних засобів екстреної профілактики вагітності
наявність в минулому ІПСШ та терапевтичних засобів, які були застосовані при лікуванні наявність у статевого партнера ознак запалення статевих органів або інформації про діагностування фахівцем ерозії шийки матки, аднекситу, простатиту, тощо; інформація про лікування статевого партнера з приводу будь-яких ІПСШ переривання вагітності порушення оваріально-менструального циклу у жінок та порушення сексуальної функції у обох статей |
|
| Оцінка ризику партнера | З’ясувати:
чи знає пацієнт про наявність у його партнера статевих контактів ще з кимось; занепокоєння пацієнта щодо ризикованої поведінки партнера та їх наміри на майбутнє |
| Оцінка спілкування з партнерами | Запитати, чи обговорював пацієнт тему ризику інфікування ІПСШ / ВІЛ зі своїм партнером та чи йшла мова про можливість тестування на ІПСШ |
| Підведення підсумків та розгляд ризиків пацієнта | Підсумувати та визначити основні ризики інфікування ІПСШ, про які розповів пацієнт.
Разом з пацієнтом визначити конкретні форми його ризикованої поведінки: наявність випадкового статевого партнера; досвід частої зміни статевих партнерів; надання сексуальних послуг за плату; вживання наркотиків; вживання алкоголю; інше. Разом з пацієнтом встановити пріоритетність цих ризиків та фактори, які впливають на його поведінку. З’ясувати наявність інших питань, які слід обговорити. При наявності у теперішній час або в минулому певних форм ризикованої поведінки (вживання ін’єкційних наркотиків, надання сексуальних послуг за винагороду, одностатеві сексуальні контакти, тощо) провести консультування відповідно до розділів 11.2.1.4, 11.2.1.5, 11.2.1.6. При необхідності надати буклет з інформацією про ІПСШ/ВІЛ. |
11.2.1.2 Розробка шляхів зниження ризику інфікування
Мета: посилити мотивацію та підтримати зусилля пацієнта щодо необхідності зменшення ризику інфікування.
Виходячи з конкретних проблем пацієнта, необхідно: сприяти усвідомленню ним власного ризику; приділити увагу дисонансу (коли думки/принципи не збігаються з поведінкою) та амбівалентності (суперечливості) почуттів пацієнта щодо зменшення ризику; підвищити його впевненість у собі, віру в свої сили та здатність щось зробити; посилатися на норми, які існують в суспільстві та в тій соціальній групі, до якої належить пацієнт; вивчити та визначити ресурси для підтримки пацієнта.
Консультування проводиться у послідовності, наведеній у таблиці 11.4.
Таблиця 11.4 – Інформація щодо зниження ризику інфікування
| Етапи консультування | Зміст етапу |
| 1 | 2 |
| Розгляд попередніх спроб зменшення ризику | З’ясувати:
дії пацієнта в минулому для зменшення ризику інфікування на ІПСШ та захисту себе та партнера. Розповісти пацієнту про заходи профілактики ІПСШ |
| Визначення успішного досвіду безпечних статевих стосунків пацієнта та перешкод у зменшенні ризику | З’ясувати:
чи практикував він безпечні статеві стосунки в минулому, якщо так, то чому; що було найбільш складним у процесі зменшення ризику інфікування ІПСШ |
| Вивчення факторів / ситуацій, які підвищують вірогідність поведінки високого ризику | З’ясувати:
вплив вживання психоактивних речовин (наркотиків чи алкоголю) на рішення пацієнта вступати в статеві контакти високого ризику; наявність та причини ситуацій або партнерів, коли пацієнту складно домовитися про безпечний статевий зв’язок, якщо так, то чому; вплив інших життєвих обставин (засмученість, відсутність роботи, розрив відносин тощо) на здатність пацієнта практикувати безпечні статеві стосунки |
| Визначення здатності пацієнта обговорювати з друзями / партнерами ризик інфікування ІПСШ | З’ясувати:
здатність пацієнта обговорювати питання ІПСШ + зі своїми партнерами/друзями; зміст бесід з ними про зменшення ризику інфікування ІПСШ/ВІЛ та його почуття при цьому |
Продовження таблиці 11.4
| 1 | 2 |
| Рольова гра, формування навичок, вирішення проблем (при можливості) | Попросити пацієнта:
продемонструвати, як би він повідомив своєму статевому партнеру, що він бажає користуватись презервативом; розповісти, яку б, на думку пацієнта, відповідь дав би його партнер, якби він попросив його пройти тестування на ІПСШ |
| Відпрацювання навичок користування презервативом | З’ясувати, що саме ускладнює користування презервативом. Обговорити один-два приклади з його життя.
Запропонувати продемонструвати на муляжі, як правильно користуватись презервативом |
| Визначення всіх варіантів зменшення ризику інфікування | З’ясувати, що було б найлегше та найскладніше пацієнту змінити в своїй ризикованій поведінці, обговорити чому.
Назвати пацієнту можливі варіанти зменшення його ризику |
| Обговорення рівня ризику, який сприймається пацієнтом | З’ясувати:
наскільки зручно почуває себе пацієнт щодо застосування того чи іншого варіанта зменшення його ризику (наприклад, використання презерватива зі статевим партнером); наскільки непокоїть пацієнта те, що він може інфікуватися ІПСШ |
| Звернення уваги пацієнта, якщо думки /принципи та його поведінка не збігаються або наміри пацієнта щодо зміни поведінки є суперечливими | Обговорити та допомогти зрозуміти пацієнту існуючі протиріччя:
занепокоєння щодо ВІЛ-інфікування та небажання користуватися презервативами; страх інфікуватися та бажання мати свободу і декілька партнерів; інше |
| Обговорення можливості підтримки в соціальній групі, до якої належить пацієнт, сім’ї, оточенні (уразливі групи) | З’ясувати:
кому з рідних чи друзів довіряє пацієнт, з ким він обговорює персональні проблеми, такі як занепокоєння інфікуванням ІПСШ; що думає найближче оточення пацієнта (друзі, колеги) про необхідність захистити себе від інфікування; чи є хтось в житті пацієнта, хто міг би підтримати його, щоб уникати ризикованих ситуацій |
| Підведення підсумків щодо варіантів зменшення ризику інфікування | Назвати варіанти, коли пацієнту вдасться зменшити свій ризик інфікування.
Запитати про пропозиції пацієнта щодо додаткових варіантів. Обговорити, як можна зробити безпечну поведінку пацієнта пріоритетом для нього |
| Визначення необхідності у додатковій допомозі. Надання інформації про можливість її отримання | З’ясувати, яка додаткова допомога необхідна пацієнту для зменшення власного ризику.
Надати інформацію про існуючі медичні, психологічні та соціальні служби та можливість отримання додаткових консультацій з питань ІПСШ/ВІЛ. Направити пацієнта у разі потреби до відповідних спеціалістів та служб (надати контактні телефони та адреси) |
11.2.1.3 Прийняття рішення щодо проходження тесту
Мета: допомогти пацієнту прийняти добровільне інформоване рішення щодо тестування на ІПСШ.
Консультанту необхідно професійно і неупереджено довести пацієнту переваги знання свого стану репродуктивного здоров’я, значення і наслідки результату тесту на ІПСШ, допомогти йому прийняти добровільне свідоме рішення щодо проходження тесту. Консультування проводиться у послідовності, наведеній у таблиці 11.5.
Таблиця 11.5− Інформація щодо прийняття рішення з проходження тесту
| Етапи консультування | Зміст етапу |
| 1 | 2 |
| Обговорення попереднього досвіду тестування та зміни в поведінці після отримання результату. | З’ясувати:
проходження пацієнтом тестування на ІПСШ раніше та яким був цей досвід; які зміни з метою зменшення ризику інфікування на ІПСШ відбулися у його поведінці при негативному результаті |
| Обговорення почуттів пацієнта щодо проходження тестування | Попросити пацієнта розповісти, що він відчуває, вирішивши пройти тест на ІПСШ, та яким чином було прийнято це рішення.
З’ясувати, чи повідомляв пацієнт кого-небудь про своє рішення пройти тест на ІПСШ, чи знають про це її/його чоловік/дружина/партнер та як вони відреагували на це рішення. |
| Обговорення того, наскільки пацієнт розуміє значення позитивного та негативного результату тесту | З’ясувати, що розуміє пацієнт під позитивним чи негативним результатом тесту.
Пояснити пацієнту значення результатів тесту, якщо йому щось незрозуміло |
| Оцінка готовності пацієнта пройти тестування та прийняти результати тесту | Обговорити з пацієнтом його можливу реакцію:
на позитивний результат; на негативний результат. З’ясувати: який результат тесту очікує пацієнт; кому зможе пацієнт розказати про результат тесту та хто зможе підтримати пацієнта |
| Обговорення життя при позитивному результаті тестів на ІПСШ | Обговорити можливі зміни у житті пацієнта в разі позитивного результату.
Розповісти про особливості поведінки інфікованих ІПСШ осіб, необхідности виявлення та інформування всіх статевих партнерів, а також їх лікування, наслідки для репродуктивного здоров’я, |
Продовження таблиці 11.5
| 1 | 2 |
| якість життя.
Проінформувати про доцільність лікування за рекомендаціями лікаря; притримування рекомендацій щодо статевого життя, раціонального харчування, контролю виліковності. |
|
| Обговорення переваг знання свого стану репродуктивного здоров’я | Розповісти, що при можливому з’ясуванні позитивного тесту на ІПСШ (у майбутньому) пацієнт може:
1. Отримати лікування для збереження репродуктивного здоров’я та профілактики ускладнень, які можуть виникнути при відсутності лікування наявних ІПСШ. 2. З метою попередження виникнення репродуктивних порушень отримання та використання інформації про методи профілактики ІПСШ шляхом застосування бар’єрних та медикаментозних засобів; своєчасного інформування та обстеження статевих партнерів; обговорення скарг та порушень з боку урогенітального тракту із статевими партнерами. 2. Захистити своїх партнерів та майбутніх дітей від ІПСШ, підготуватися до здорового майбутнього своєї сім’ї. 3. При з’ясуванні негативних результатів обстеження на ІПСШ отримати додатковий стимул щодо використання необхідних засобів перестороги для попередження можливості інфікування у подальшому; періодичного профілактичного обстеження на ІПСШ, ВІЛ, тощо. |
| Обговорення труднощів, пов’язаних із знанням стану свого репродуктивного здоров’я | Запитати у пацієнта, які негативні сторони може мати для нього знання стану свого репродуктивного здоров’я.
Обговорити з ним обставини, які його непокоять у зв’язку з цим, та як на них можна вплинути. |
| Пропозиція пройти тестування у державному або комунальному закладі охорони здоров’я | З’ясувати рішення пацієнта стосовно проходження тестування. Якщо пацієнт прийняв рішення про проходження тестування, інформувати його про можливість тестування у державних та комунальних ЛПЗ.
Якщо передтестове консультування проведено у вказаних ЛПЗ, запропонувати пацієнту заповнити форму № 003-6/о та направити у маніпуляційний кабінет для забору клінічного матеріалу для дослідження. Особам, що відмовились від тестування, запропонувати повторну консультацію та провести бесіду про те, як зменшити ризик інфікування |
| Призначення наступної зустрічі | Домовитись про час та місце наступної зустрічі. |
11.2.1.4 Особливості консультування споживачів ін’єкційних наркотиків
Консультування проводиться у послідовності, наведеній у таблиці 11.6.
Таблиця 11.6 − Інформація щодо консультування СІН
| Етапи консультування | Зміст етапу |
| 1 | 2 |
| Оцінка загального стану пацієнта | Суб’єктивно оцінити наявність у пацієнта стану наркотичного або алкогольного сп’яніння, стану абстиненції.
При відсутності можливості пацієнта сприйняття інформації призначити повторну зустріч. При адекватній реакції пацієнта продовжити консультування відповідно до розділу 2.1. |
| Мотивування пацієнта на повне проходження процедури консультування та тестування | Повідомити, коли та де пацієнт зможе отримати результат цього тесту.
З’ясувати, чи буде у нього можливість зайти за результатом у цей час. Якщо ні, то пояснити, що він зможе отримати результат його тесту та пройти післятестове консультування і трохи пізніше. Пояснити що: дуже важливо, щоб він повернувся за результатом; після отримання результату він зможе обговорити з консультантом ті питання, які у нього виникнуть; при потребі щось обговорити він може сміливо прийти на додаткову консультацію |
| Обговорення переваг знання стану свого репродуктивного здоров’я з проблем ІПСШ. Проведення разом з пацієнтом аналізу можливих “за” і “проти” знання свого статусу | Пояснити, що пацієнт вже зробив дуже важливий крок, прийшовши на цю консультацію, тому що знання, які він тут отримає, зможуть допомогти йому керувати своїм життям. Обговорити переваги знання стану його репродуктивного здоров’я з проблем ІПСШ і з якими труднощами воно може бути пов’язане. Разом з ним скласти списки “за” та “проти” знання свого статусу. |
| Інформування пацієнта про можливість отримання психологічної, соціальної та інших видів підтримки для СІН | Пояснити, що при виникненні потреби у психологічній підтримці, можна звернутись за допомогою в організацію, яка займається наданням допомоги СІН. Надати контактну інформацію, вказуючи час та умови прийому цього консультанта. |
| Надання інформації про групи взаємодопомоги | Надати інформацію про групи взаємодопомоги, які об’єднують людей з проблемами, подібними до його, при можливості надати контактну інформацію. |
| Обговорення можливості екстреної профілактики у випадку сексуального насильства | Пояснити, що сексуальне насильство пов’язане з підвищеним ризиком інфікування ІПСШ та ВІЛ внаслідок травмування слизових оболонок.
Розповісти про можливості екстреної профілактики ІПСШ та ВІЛ у разі сексуального насильства. |
Продовження таблиці 11.6
| 1 | 2 |
| Проведення разом з пацієнтом оцінки індивідуальних ризиків інфікування ІПСШ у випадку надання платних сексуальних послуг.
Обговорення можливості зменшення ризиків |
З’ясувати:
користування засобами запобігання інфікування ІПСШ; про ситуації, коли не використовується презерватив, та причину цього. Разом з пацієнтом обговорити шляхи зменшення ризиків інфікування. |
| З’ясування хибних уявлень у пацієнта щодо безпечних/ небезпечних сексуальних практик | З’ясувати:
яким чином він визначає осіб, з якими статеві контакти є більш ризикованими щодо інфікування ІПСШ; чи є якісь групи осіб, з якими він не пов’язує ризик інфікування ІПСШ. Якщо так, то чому; яким чином такі міркування впливають на його вибір поведінки. |
| Обговорення ризиків інфікування ІПСШ для СІН та РКС | З’ясувати про поінформованість щодо поширеності ІПСШ серед СІН та РКС.
Пояснити фактори підвищеного ризику інфікування ІПСШ для СІН та РКС. Нагадати, що частина РКС є СІН, тобто мають подвійну загрозу інфікування. |
| Обговорення шляхів та засобів зменшення ризику інфікування | Скласти разом з пацієнтом план його захисту від інфікування ІПСШ та захисту його постійного партнера.
Пояснити: про значний вплив вживання наркотиків на стан його здоров’я; що для зменшення ризику інфікування ІПСШ, ВІЛ, вірусами гепатитів В і С йому необхідно відмовитись від ін’єкційного вживання наркотиків; що при неможливості відмови від наркотиків на даний час потрібно не користуватись чужими використаними або спільними шприцами, не давати іншим свій використаний шприц, не промивати використаний шприц у загальній ємкості з водою, для кожної ін’єкції використовувати стерильний шприц тощо; про необхідність користування якісним презервативом при кожному сексуальному контакті та протягом всього статевого акту. З’ясувати його наміри щодо першого кроку. |
| Післятестове консультування при негативному або невизначеному (сумнівному) результаті. | Провести консультування з урахуванням вимог відповідних заходів розділу 3. |
Продовження таблиці 11.6
| 1 | 2 |
| Післятестове консультування у разі позитивного результату. Планування майбутнього з деталізацією щодо зміни поведінки на менш ризиковану для поліпшення якості життя | З’ясувати стан та можливість пацієнта сприйняти інформацію, при необхідності призначити повторну зустріч.
Подальше консультування провести відповідно до заходів розділу 4. З’ясувати, чи вплине його позитивний статус на рішення щодо зменшення вживання наркотиків. Якщо так, то: яким чином та яких результатів він очікує від таких змін; |
11.2.1.5 Особливості консультування робітників комерційного сексу
Консультування проводиться у послідовності, наведеній у таблиці 11.7.
Таблиця 11.7− Інформація щодо консультування консультування РКС
| Етапи консультування | Зміст етапу |
| 1 | 2 |
| Інформування про заходи та засоби профілактики інфікування ІПСШ | З’ясувати про користування пацієнтом засобами запобігання інфікуванню ІПСШ, в тому числі якісними презервативами для орального та анального сексу, медикаментозними засобами профілактики ІПСШ (загальної, місцевої дії), тощо.
Обговорити додаткові заходи для запобігання інфікуванню. Розглянути правила застосування презервативів (використовувати при наявності демонстраційні матеріали: схеми, малюнки, презервативи, муляжі). Обговорити дії у разі, якщо презерватив розірвався. Запитати про наявність та причини випадків сексу без презерватива та власну оцінку ризику інфікування за таких обставин. Разом з особою, що консультується, визначити шляхи уникнення таких ситуацій. Розглянути можливість альтернативного непроникаючого сексу або менш ризикованих щодо зараження ІПСШ видів сексу. |
| Оцінка ризику щодо сексуального насильства. Обговорення правил поведінки для зменшення цього ризику | З’ясувати:
власну оцінку ризику РКС щодо вірогідності інфікування; поширеність сексуального насильства серед оточення РКС, з чим це може бути пов’язано; хто найчастіше виявляється насильником (клієнти чи хтось інший). |
Продовження таблиці 11.7
| 1 | 2 |
| Обговорити разом з особою, що консультується, правила його/її поведінки, що допоможуть уникнути або зменшити ризик насильства та попередити можливі конфлікти | |
| Інформування щодо екстреної профілактики інфікування у разі сексуального насильства | Роз’яснити:
причини підвищеного ризику інфікування ІПСШ та ВІЛ при сексуальному насильстві (суттєве травмування слизових оболонок тощо); щодо можливості екстреної профілактики ІПСШ у разі сексуального насильства; Надання інформації про заклади, де можна отримати профілактику ВІЛ в цьому випадку |
| Оцінка ризику, пов’язаного із вживанням психоактивних речовин | З’ясувати щодо випадків:
сексуальних контактів під впливом наркотиків (яких?) чи алкоголю; обслуговування клієнтів, які перебувають у нетверезому стані. Роз’яснити високий ризик інфікування ІПСШ під впливом наркотиків, особливо ін’єкційних. Розробити індивідуальний план зменшення ризику інфікування ІПСШ та дізнатися про наміри щодо особистого захисту |
| Обговорення принципів зменшення шкоди, якщо пацієнт вживає наркотики ін’єкційним шляхом | Обговорити можливість зменшення ризику зараження ІПСШ, якщо пацієнт вживає наркотики ін’єкційно, відповідно до розділу 2.5. |
| Визначення ризиків, пов’язаних із статевими контактами, та шляхів профілактики | З’ясувати:
наявність постійного статевого партнера/партнерів (крім клієнтів); користування партнером засобами запобігання інфікуванню ІПСШ; оцінку пацієнтом безпечності сексу з постійним партнером. Обговорити додаткові заходи щодо запобігання інфікуванню |
| Визначення факторів підвищеного ризику для РКС | Пояснити:
що при статевих контактах, які супроводжуються сильним травмуванням слизових оболонок, підвищується ризик інфікування ІПСШ; про більшу вразливість щодо інфікування ВІЛ для осіб з запальними захворюваннями статевих шляхів. Скласти з РКС план зменшення її/його ризику інфікування |
Продовження таблиці 11.7
| 1 | 2 |
| Надання інформації та визначення оптимальних профілактичних засобів | З’ясувати прийнятність, умови, переваги, недоліки та перешкоди у застосуванні профілактичних засобів |
11.2.1.6 Особливості консультування чоловіків, що мають секс з чоловіками
Консультування проводиться у послідовності, наведеній у таблиці 11.8.
Таблиця 11.8 – Інформація щодо консультування ЧСЧ
| Етапи консультування | Зміст етапу |
| 1 | 2 |
| Обговорення стилю сексуальної поведінки | З’ясувати стиль сексуальної поведінки:
ступінь бісексуальності: наявність сексуальних контактів з особою протилежної статі або зі своєю статтю; наявність постійного партнера, партнера з випадковими статевими стосунками, випадкових партнерів; наявність відносно безпечних сексуальних практик при відносинах з ЧСЧ (взаємна мастурбація, міжстегновий секс тощо) |
| Обговорення заходів та засобів профілактики інфікування статевим шляхом | З’ясувати ситуацію щодо стереотипів поведінки у разі:
використання пацієнтом та його партнером/ партнеркою засобів запобігання ІПСШ, обговорити додаткові заходи; користування пацієнтом якісними презервативами (в тому числі спеціальними для анального сексу), любрикантами та розглянути правила їх застосування |
| Надання спеціальних рекомендацій щодо їх використання | Роз’яснити з використанням демонстраційних матеріалів переваги та необхідність застосування любриканта. Пояснити, що звичайні креми не замінюють любриканти, які можна придбати в аптечній мережі, сервісних організаціях. |
| Обговорення ризиків інфікування для “активного” та “пасивного” партнерів | З’ясувати поінформованість щодо розподілу ризику інфікування між “активним” та “пасивним” партнерами та детально розглянути фактори, які збільшують ризик інфікування обох партнерів |
| Обговорення ризику інфікування при незахищеному оральному сексі | Пояснити щодо вірогідності інфікування як „активного”, так і „пасивного” партнерів при незахищеному оральному сексі, необхідності використання якісних презервативів, тощо |
| Обговорення ризиків, пов’язаних із частою зміною партнерів | З’ясувати розуміння пацієнтом залежності ризику інфікування від кількості статевих партнерів та їх сексуальних контактів. |
| 1 | 2 |
| Визначити та розглянути можливість зменшення ризику, пов’язаного із частою зміною статевих партнерів. | |
| З’ясування проходження тесту на ІПСШ в минулому та причини повторних обстежень | Обговорити ситуації, які викликають стурбованість щодо можливості інфікування ІПСШ. |
| Визначення впливу негативного результату тесту на подальшу поведінку та оцінку власних ризиків | З’ясувати щодо:
практикування безпечного сексу та його тривалості після отримання негативного результату тесту; причини повернення до незахищеного сексу. |
| З’ясування наявності інших видів ризикованої поведінки | З’ясувати про наявність досвіду вживання наркотиків, надання сексуальних послуг в обмін на гроші або наркотики. |
| Обговорення принципів зменшення шкоди, якщо пацієнт вживає наркотики ін’єкційним шляхом | Обговорити можливість зменшення ризику зараження ІПСШ, якщо пацієнт вживає наркотики ін’єкційно, відповідно до розділу 2.5. |
| Інформування щодо впливу психоактивних засобів на статеву поведінку | З’ясувати щодо досвіду сексуальних контактів у пацієнта та його партнера з партнером, що перебував під впливом психостимулюючих речовин (наркотиків чи алкоголю).
Пояснити про вплив наркотичних засобів на сексуальну поведінку, зниження критичного ставлення до можливості інфікування ІПСШ. |
| Оцінка ризику щодо
сексуального насильства |
З’ясувати:
власну оцінку щодо причин та ризику зазнати сексуального насильства; поширеність сексуального насильства серед оточення пацієнта. |
| Обговорення з пацієнтом можливості екстреної профілактики в разі сексуального насильства | Пояснити причини ризику інфікування при сексуальному насильстві.
Надати інформацію про можливість екстреної профілактики ІПСШ у разі сексуального насильства. Надання інформації про заклади, де можна отримати профілактику ВІЛ в цьому випадку. |
| Оцінка індивідуальних ризиків інфікування ІПСШ для надавачів сексуальних послуг | З’ясувати:
чи користуються пацієнт та його партнери засобами профілактики ІПСШ (якими); чи бувають ситуації, коли не використовується презерватив та чому. Обговорити шляхи зменшення ризику інфікування відповідно до розділу 2.6. |
| З’ясування хибних уявлень пацієнта щодо безпечних/ небезпечних сексуальних практик | Визначити критерії, за якими пацієнт визначає ризиковані та безпечні контакти і як це впливає на вибір його поведінки. |
| 1 | 2 |
| Обговорення з пацієнтом ризиків інфікування ІПСШ для РКС та СІН | З’ясувати поінформованість пацієнта про поширеність ІПСШ серед СІН та РКС.
Розповісти про підвищений ризик інфікування ІПСШ для РКС, з яких певна частина є СІН. |
| Підсумкове обговорення шляхів та засобів зменшення ризику інфікування | Обговорити:
можливості захисту пацієнта та його постійного партнера від інфікування ІПСШ; план зниження ризику інфікування та його перший крок |
11.2.1.7 Особливості консультування пацієнтів у випадках гендерного та сексуального насильства
Гендерне та сексуальне насильство руйнівним чином впливає на фізичні, емоційні та соціальні аспекти життя жертви. Медичні працівники зможуть запропонувати жертвам насильства більш ефективне лікування ІПСШ, якщо зрозуміють, з якими проблемами вони стикаються. У багатьох випадках жертва (найчастіше це жінка) ризикує заразитися від насильника ІПСШ. Здебільшого ІПСШ можуть бути несвоєчасно діагностовані. Жертва насильства може не звертається своєчасно до лікаря через низьку самооцінку, жорстоке поводження, соціально-економічні умови.
Тактика ведення осіб, які перенесли насильство, вимагає від медичного працівника дотримання певних умов:
• Обов’язкова оцінка можливості насильства у всіх жінок з ІПСШ (і при необхідності у чоловіків), за умови наявності фактів їх приналежності до уразливих груп.
• Вважати збереження здоров’я і благополуччя пацієнтів основним пріоритетом своєї діяльності. Керівними принципами повинні бути – «безпека перш за все» і «не нашкодь».
• Уникати питань, які можуть нанести пацієнтці/пацієнту додаткову травму і спровокувати сильну емоційну реакцію, стати причиною стресу або негативних суджень.
• Бути готовим співчувати і підтримувати пацієнтку/пацієнта.
• Бути готовим забезпечити відповідну допомогу, подальше спостереження і напрямок в служби підтримки.
• Дотримуватися конфіденційності.
• При повідомленні статевого партнера враховувати можливі наслідки для жертви, якщо саме він і виявиться насильником. Якщо таке повідомлення обов’язкове, необхідно проінформувати пацієнтку/пацієнта про наслідки розголошення до того, як пацієнтка / пацієнт назве ім’я партнера.
• Підтримувати рішення постраждалої або постраждалого від насильства пред’явити позов ґвалтівнику або винуватцю жорстокого поводження. Поважати бажання пацієнтки/пацієнта, оскільки її(його) згода на будь-які дії відносно ґвалтівника є обов’язковою. За законом виняток становлять тільки випадки насильства щодо неповнолітніх.
• Бути готовим до негайного втручання, якщо жертва або її близькі вважають, що їм загрожує небезпека.
• Забезпечити психологічну підтримку та/або направити пацієнтку/пацієнта до фахівця, який може надати таку підтримку, або, якщо необхідно, до консультанта з юридичних питань.
• Проконсультувати з питань постконтактної профілактики (попередження ІПСШ, посткоітальная контрацепція, тощо).
11.2.2 Післятестове консультування
Післятестове консультування є конфіденційним діалогом між пацієнтом та консультантом, метою якого є обговорення результатів тесту на ІПСШ, надання необхідної інформації та психологічної підтримки.
Повідомлення про результат тесту має обов’язково супроводжуватись післятестовим консультуванням. Доцільно одночасно проводити повідомлення про результат обстеження та післятестове консультування.
Бажано, щоб післятестове консультування пацієнта у ЛПЗ проводив той самий консультант, який проводив передтестове консультування. Якщо передтестове консультування проводилось в іншій установі чи іншим фахівцем, консультанту необхідно з’ясувати у пацієнта, коли та в якому обсязі воно проводилось, якою інформацією щодо ІПСШ пацієнт вже володіє.
Враховуючи, що відомості про результат тесту на ІПСШ, наявність чи відсутність ІПСШ в особи, яка пройшла медичний огляд, є конфіденційними та становлять лікарську таємницю, повідомлення про них дозволяється тільки особі, якої вони стосуються, а у випадках, передбачених законами України, також законним представникам цієї особи, закладам охорони здоров’я, органам прокуратури, слідства, дізнання та суду.
11.2.2.1 Первинне післятестове консультування при негативному результаті тесту
Мета: Привернення уваги пацієнта до необхідності застосування заходів зменшення ризику для уникнення інфікування у майбутньому.
При негативному результаті важливо обговорити заходи зниження ризику інфікування ІПСШ. Необхідно провести консультування з питань безпечної поведінки та розглянути можливості направлення в інші служби, що допомагають змінити ризикований спосіб життя на менш ризикований.
Консультант повинен повідомити про результат тесту простими словами, уникаючи специфічної термінології. Потрібно дозволити пацієнту відчути задоволення від того факту, що він не є інфікованим ІПСШ, в той же час підкреслити необхідність зміни ризикованої поведінки з тим, щоб уникнути зараження ІПСШ у майбутньому.
Необхідно тактовно переконати пацієнта у необхідності повторного тестування та обстеження статевих партнерів при наявності ризикованої поведінки протягом останніх 6 місяців.
Консультування проводиться у послідовності, наведеній у таблиці 11.9.
Таблиця 11.9 − Інформація щодо проведення післятестового консультування
| Етапи консультування | Зміст етапу |
| Повідомлення пацієнта про результат | Повідомити, що результат готовий, представити його чітко та доступно. Пояснити, що негативний результат означає, що пацієнт не інфікований ІПСШ.
Дочекатися усвідомлення пацієнтом результату тесту. Наголосити на можливості інфікування без відображення цього в результатах тесту в разі наявності ризикованої поведінки протягом останніх 6 місяців. Переконатися, що пацієнт вірно зрозумів результат тесту |
| Вивчення реакції пацієнта на результати тесту | Дізнатися про почуття пацієнта після ознайомлення з негативним результатом |
| Акцентування уваги на необхідності розгляду результату тесту у відношенні до ризику в межах періоду «серологічного вікна»” | Пояснити, що з урахуванням «серологічного вікна» цей результат може не відображати наслідки нещодавнього ризику |
| Висловлення занепокоєння та серйозності щодо можливості інфікування ІПСШ пацієнта, якщо він підлягає постійному ризику | Наголосити на можливості інфікування, якщо пацієнт не приділить уваги зменшенню ризикованої поведінки |
11.2.2.2 Первинне післятестове консультування при позитивному результаті тесту
Мета: надати ясно та точно інформацію про позитивний результат тесту, підтримати пацієнта у сприйнятті його.
Післятестове консультування при позитивному результаті тесту передбачає консультування, психологічну підтримку у сприйнятті діагнозу та допомогу у плануванні майбутнього, як найближчого, так і віддаленого.
Консультування проводиться у послідовності, наведеній у таблиці 11.10.
Таблиця 11.10 − Інформація щодо проведення післятестового консультування при позитивному результаті тесту
| Етапи консультування | Зміст етапу |
| 1 | 2 |
| Повідомлення про результат тесту | Привітатись з пацієнтом.
У зрозумілій формі повідомити про результат тесту, уникаючи специфічної термінології. Пояснити, що цей результат свідчить про інфікування ІПСШ. За вимогою пацієнта видати йому довідку про результат тесту (форма № 27/о) |
| Визначення розуміння пацієнтом результату | Запитати, як він розуміє цей результат. Переконатися, що пацієнт правильно зрозумів значення отриманого результату |
| Усвідомлення проблем, пов’язаних із сприйняттям позитивного результату, і надання необхідної підтримки. Обговорення можливих наслідків для особистого життя, сімейних і соціальних відносин | Із співчуттям віднестись до психологічного стану пацієнта, пояснити, що потрібен час щоб вилікуватися.
Поінформувати, що на даний час існує можливість лікування , що дозволяє отримати результат з високою ступеню вірогідності виліковності. Роз’яснити доцільність обстеження всіх наявних статевих партнерів (період визначається в залежності від нозології та інкубаційного терміну) та їх лікування. За необхідністю, отримати консультації суміжних фахівців, пройти додаткові обстеження. Пройти контролі виліковності (в залежності від нозології, відповідно до нормативних документів). Запитати, чи існує вірогідність того, що пацієнтка зараз вагітна (за необхідності направити до лікаря акушера-гінеколога). З’ясувати плани щодо народження дітей. Надати інформацію про те, що: є певний ризик передачі ІПСШ дитині, але існує профілактичне лікування для запобігання передачі ІПСШ від матері дитині; необхідно своєчасно стати на облік у разі вагітності для отримання доступу до цих видів лікування. Якщо пацієнт не готовий до бесіди, запропонувати йому прийти на повторні консультації та надати відповідні інформаційні матеріали |
| Надання відповідей на незрозумілі питання |
З’ясувати у пацієнта: зрозумілість інформації, яку він отримав; наявність питань, які він хотів би з’ясувати або обговорити. При потребі направити до відповідних фахівців. |
11.2.2.3 Первинне післятестове консультування при невизначеному (сумнівному) результаті тесту
Консультування проводиться у послідовності, наведеній у таблиці 11.11.
Таблиця 11.11 − Інформація щодо проведення післятестового консультування при невизначеному результаті тесту
| Етапи консультування | Зміст етапу |
| Повідомлення результату тесту та його роз’яснення | Привітатись з пацієнтом.
Повідомити, що результат його тесту на даний чаc розцінено як невизначений або сумнівний. Пояснити, що можуть бути різні причини неможливості впевнено визначити наявність ІПСШ, а саме якщо: пацієнт має іншу хронічну хворобу: ревматичний артрит, множинний склероз, системний червоний вовчак, цукровий діабет 1 типу, хвороба Адісона, анкілозуючий спондиліт, хронічний гепатит, злоякісні захворювання (особливо лімфопроліферативні злоякісні процеси), вагітність, вік понад 70 років, вакцинація що може призводити до виявлення неспецифічних антитіл; Обговорити і пояснити пацієнту можливість перебування його в стадії “серологічного вікна”: час з моменту інфікування людини до появи антитіл до збудника ІПСШ, який може тривати від 1 до 6 місяців в залежності від нозології. Пояснити про необхідність дотримуватись безпечної щодо поширення ІПСШ поведінки до моменту отримання результату повторного тесту на ІПСШ, а саме: відмовитись від донорства, відкласти заплановану вагітність, зменшити кількість статевих партнерів, використовувати презерватив під час статевих контактів, т.і.. Надати пацієнту інформаційні буклети і адреси державних, комунальних організацій та закладів, об’єднань громадян, що надають психоемоційну підтримку. Призначити дату та час наступної зустрічі з пацієнтом |
11.2.2.4 Повідомлення партнера про результати тесту та скерування взаємовідносин з ним
Мета: підготувати пацієнта до повідомлення про результат тесту партнеру/партнерам. Скласти план такого повідомлення.
Повідомлення партнера(ів) про проходження тесту на ІПСШ і його позитивний результат є важливим особистим питанням для пацієнта. Консультанту варто першому порушити це питання, щоб вирішити його разом з пацієнтом.
Консультування проводиться у послідовності, наведеній у таблиці 11.12.
Таблиця 11.12 − Інформація щодо повідомлення партнера про результати тесту та скерування взаємовідносин з ним
| Етапи консультування | Зміст етапу |
| 1 | 2 |
| Дізнатися, як пацієнт ставиться до того, щоб сповістити партнера/ів про позитивний результат обстеження на ІПСШ | Запитати, чи збирається він розповісти партнеру/рам про свій результат тесту, що його непокоїть |
| Визначення партнерів, які підлягають ризику інфікування, і яких необхідно повідомити про цей ризик | Запитати, чи є конкретні партнери, які також могли бути інфіковані ІПСШ. Запропонувати пацієнту повідомити їх про можливість інфікування та доцільність тестування на ІПСШ |
| Обговорення можливих підходів до розкриття партнеру своїх результатів обстеження на ІПСШ | З’ясувати, яким чином пацієнт збирається повідомити партнеру результат свого тесту, що б він хотів сказати, чи буде це для нього складно.
Обговорити вибір найбільш вдалого моменту для обговорення його статусу з партнером |
| Направлення на ДКТ партнера(ів) пацієнта, які не знають стану свого репродуктивного здоров’я | З’ясувати, чи знає його партнер про стану свого репродуктивного здоров’я, запитати, чи може погодитись його партнер пройти тест на ІПСШ, що для цього треба зробити |
| Очікування можливої реакції партнера | Запитати, якою, на його думку, буде реакція партнера на його повідомлення про позитивний результат, чи мали вони з партнером важкі розмови у минулому. Допомогти звести до мінімуму наслідки, що стосуються відносин з партнером.
При необхідності допомогти пацієнту повідомити партнера про результати тестів, запросивши їх за його згодою на наступну консультацію |
Продовження таблиці 11.12
| 1 | 2 |
| Практика та рольова гра щодо різних підходів до розкриття свого стану репродуктивного здоров’я (при можливості) | Дати можливість пацієнту під час рольової гри з консультантом попрактикуватись у повідомленні свого партнера про результати тесту |
| Роз’яснення необхідності дотримання пацієнтом профілактичних заходів для запобігання поширенню ІПСШ |
Роз’яснити пацієнту про необхідність дотримання профілактичних заходів, спрямованих на недопущення поширення ІПСШ, а саме про: відмову від донорства крові, тканин та органів; виключення незахищених статевих контактів та необхідність повідомлення сексуальних партнерів про позитивні результати обстеження на ІПСШ; виключення спільного використання засобів особистої гігієни, медичного інструментарію, в тому числі для нанесення татуювань, пірсінгу, приготування та вживання наркотиків ін’єкційним шляхом. Пояснити про відсутність загрози інфікування для членів сім’ї, співробітників при звичайних побутових контактах |
11.2.2.5 Обговорення плану зниження ризику інфікування
Мета: розробити конкретний, поетапний план зменшення ризику інфікування ІПСШ.
Разом з пацієнтом потрібно розробити план зниження ризику інфікування, що повинен відповідати вмінням та здібностям пацієнта, його мотивації щодо зміни певного типу поведінки.
План повинен: бути конкретним; вказувати на всі обставини та осіб (що, коли, хто, де і як), що братимуть участь у процесі зменшення ризику; представляти послідовність дій та поступовий рух пацієнта в напрямі зменшення ризику інфікування.
Не слід підтримувати плани, що носять необґрунтований або радикальний характер щодо змін в житті пацієнта.
Консультування проводиться у послідовності, наведеній у таблиці 11.13.
При консультуванні пацієнта з епізодичною чи разовою ризикованою поведінкою (одноразовий випадковий статевий контакт, тощо) план зміни поведінки повинен бути відповідно скорегований.
Таблиця 11.13 − Інформація щодо зниження ризику інфікування
| Етапи консультування | Зміст етапу |
| З’ясування форми поведінки з метою зменшення ризику інфікування | Разом з пацієнтом з’ясувати форми його поведінки/ фактори, що пов’язані з ризиком інфікування ІПСШ.
Визначити, яким чином пацієнт хотів би зменшити ризик інфікування ІПСШ. Якщо пацієнт обере зміну в поведінці зі словами “завжди” або “ніколи”, підтримати його бажання усунути ризик, звернувши увагу на те, що зміна відбувається поступово. З’ясувати, який перший крок в досягненні цієї мети він планує здійснити. |
| Визначення поступових етапів в досягненні визначеної моделі поведінки | З’ясувати, які незначні кроки пацієнт міг би зробити наступного тижня з метою зменшення ризику інфікування ІПСШ. |
| Розділення діяльності щодо зменшення ризику на конкретні кроки | З’ясувати, яким чином та коли він збирається реалізувати свої наміри. Конкретизувати їх та визначити послідовність |
| Вирішення проблем, пов’язаних з реалізацією плану | Визначити разом з пацієнтом перешкоди на шляху до реалізації плану.
Запитати пацієнта про його кроки у подоланні цих перешкод. Обговорити з пацієнтом переваги та недоліки в разі реалізації плану. Підкреслити, що зусилля будуть нелегкими, але вони насправді йому під силу і призведуть до позитивних змін. При можливості провести рольову гру для відпрацювання варіантів вирішення цих проблем . |
| Рольова гра, формування навичок, вирішення проблем (при можливості) | Попросити пацієнта:
продемонструвати, як би він повідомив своєму статевому партнеру, що бажає в подальшому (наприклад) користуватись презервативом; розповісти, яку б, на думку пацієнта, відповідь дав би його партнер, якби він попросив його в подальшому (наприклад) користуватись презервативом. |
| Погодження з пацієнтом обґрунтованості та прийнятності плану | З’ясувати, чи є план прийнятним для пацієнта |
| Вивчення почуттів пацієнта щодо реалізації свого плану | З’ясувати, чи є план комфортним для пацієнта |
Консультант та пацієнт повинні встановити терміни виконання плану.
Цей етап є важливим, оскільки при негативному результаті тесту навряд чи відбудеться другий сеанс, під час якого консультант міг би проаналізувати досвід пацієнта у виконанні плану.
Доцільно обговорити можливість і порядок отримання, при необхідності, медичної і психосоціальної допомоги у відповідних установах, організаціях та закладах, об’єднаннях громадян, особливо з метою зниження ризику інфікування у майбутньому.
При наявності показань призначити повторне консультування і/або повторне тестування на ІПСШ через 1-3 місяці.
Видати засоби індивідуального захисту та інформаційні матеріали (при наявності).
При наданні допомоги представникам уразливих груп доцільно проводити інформування про об’єднання громадян, соціальні служби. Надати у друкованому вигляді інформацію щодо закладів та організацій, де він зможе отримати допомогу з цих питань, із зазначенням їх адреси, назв, телефонів. З’ясувати, що може перешкодити отриманню цієї допомоги/послуги.
При наявності у пацієнта ознак депресії, нахилу до суїциду надати йому поради щодо подолання такого стану (наприклад, повідомити про безкоштовний телефон довіри, порекомендувати допомогу психолога чи психіатра).
Для фахівців, які надають лікувально-діагностичну допомогу особам з ІПСШ розроблений «Алгоритм проведення консультування на тестування на ІПСШ», який наведений на рисунку 11.1.
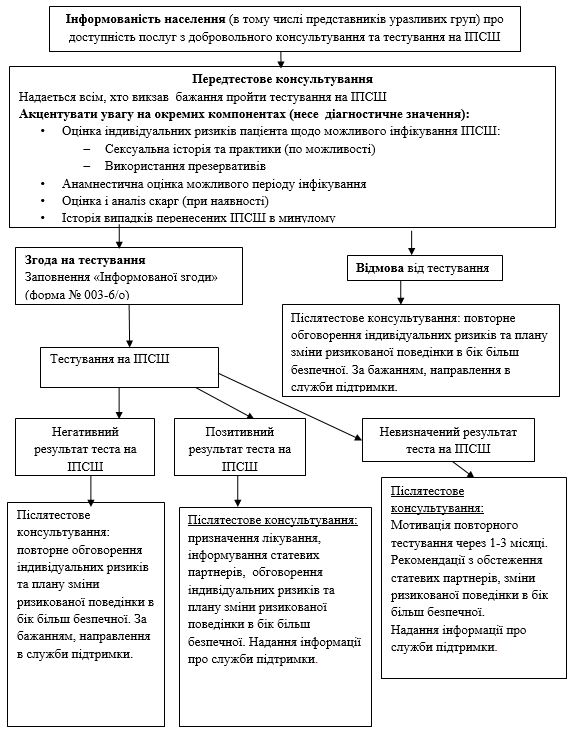
Рисунок 11.1 – Алгоритм проведення консультування на тестування на ІПСШ
11.3 Застосування синдромного підходу як заходу підвищення доступу до дерматовенерологічної допомоги осіб з уразливих груп
Представники груп ризику здебільшого негативно ставляться до діагностики та лікування в офіційних установах. У зв’язку з об’єктивними чинниками, ефективність диспансерної роботи серед таких контингентів украй низька. У разі використання методів діагностики з виявленням етіологічного фактору пацієнт одержує результат дослідження через декілька днів. У разі ж діагностування представників уразливих груп немає впевненості, що після проведення діагностики пацієнти звернуться за результатом. При цьому вони залишатимуться джерелом інфікування ІПСШ та ВІЛ [53, 55, 98].
Світовий досвід доказує ефективність застосування в такій ситуації швидких методів діагностики й одноразових схем лікування в умовах амбулаторії, синдромної діагностики, проведенні превентивного лікування та впровадженні сучасних принципів ведення випадку (кейс-менеджмент). Впровадження таких розробок підтримують ВООЗ та Глобальний фонд у програмах, пов’язаних з ВІЛ/СНІДом [22, 51, 60].
Ведення випадку ІПСШ – це догляд за людиною, яка має симптоми наявності ІПСШ або позитивний тест на одну чи більше ІПСШ.
Складовими кейс-менеджменту наступні:
- збір анамнезу,
- клінічний огляд,
- встановлення правильного діагнозу,
- раннє та ефективне лікування,
- поради стосовно сексуальної поведінки,
- пропагування та/або надання презервативів,
- інформування партнера та лікування,
- звітування про випадок та клінічне спостереження згідно існуючих норм.
Таким чином, ефективне ведення випадку складається не тільки з надання лікування та зменшення неефективності; це також комплексний підхід та увага до репродуктивного здоров’я пацієнта.
Стратегія наближення дерматовенерологічної допомоги до пацієнтів уразливих груп включає застосування простих у виконанні, але достатньо чутливих і специфічних методів лабораторної діагностики ІПСШ. Таким вимогам відповідають швидкі тести – прості у використанні діагностичні набори, які дають змогу отримати результат дослідження протягом кількох хвилин. Вони є альтернативою класичних діагностичних тест-систем, бо не потребують застосування дорогого устаткування й висококваліфікованого персоналу [222, 272].
Швидкі тести засновані на тих же принципах імунологічних реакцій, застосуванні таких же імунобіологічних продуктів, що й добре відомі класичні ІФА тест-системи.
З урахуванням існуючих вітчизняних епідеміологічних спостережень, досліджень, які проводилися в країнах СНД, пацієнтам нашого регіону доцільно проводити обов’язкове досліження на наявність Trichomonas vaginalis. Також можливо впроваджувати проведення бактеріоскопічного дослідження на робочому місці – при наданні послуг, яку може виконувати сам фахівець після курсів спеціалізованого навчання.
В веденні випадку ІПСШ у осіб з уразливих груп ефективнозастосовується синдромний підхід до лікування. Основним завданням синдромного підходу є оздоровлення хворого, переривання епідемічного ланцюжка, уже при первиннім відвідуванні лікаря й виключення можливості інфікування партнерів хворого. Він базується на визначенні постійного переліку симптомів та легко впізнаваних ознак (синдромів), а також на наданні лікування, яке впливатиме на більшість, або найбільш серйозні організми, які спричиняють ці синдроми [220, 245, 268].
За даними ВООЗ, синдромне лікування виділень з уретри у чоловіків та генітальних виразок у чоловіків і жінок довело свою як ефективність, так і прийнятність. В результаті цієї інтервенції належну терапію отримала велика кількість інфікованих осіб [222, 245].
Контингенти осіб, яким показаний синдромний підхід:
- хворі, у відношенні яких є підстава вважати, що вони не будуть виконувати лікувально-діагностичні призначення й утримуватися від статевих зв’язків до закінчення лікування – представники уразливих груп: РКС, ЧСЧ, СІН, особи без певного місця проживання, т.і.
- особи, що виразили бажання пройти лікування із застосуванням синдромного підходу.
Пацієнти, що одержують лікування із застосуванням синдромного підходу, мають право знати про наявність інших можливих методів діагностики й лікування ІПСШ, таким чином за пацієнтом залишається право вибору лікування ІПСШ без обстеження з метою виявлення етіологічного фактора або після нього. Хворі повинні бути інформованими про недоліки синдромного підходу. Знати про можливі наслідки його застосування та про порядок своєї поведінки після лікування згідно з синдромним підходом.
Перевагами синдромного підходу є:
- прискорення надання хворому медичної допомоги;
- лікування при первинному звертанні до лікаря;
- економічність за рахунок виключення дорогих лабораторних тестів;
- задоволеність і зручність для пацієнта;
- зниження частоти передачі інфекції й ризику розвитку ускладнень через відсутність лікування;
- скорочення частоти й тривалості відвідувань;
- можливість стандартизації діагностики, лікування, оповіщення партнерів і звітність за рахунок використання блок-схем по веденню ІПСШ, що дозволить удосконалити систему епіднагляду й виконання програм.
До недоліків синдромного підходу відносяться: необґрунтованість лікування в тих випадках, коли пацієнтові, у якого відсутнє захворювання або є одна інфекція, призначається кілька протимікробних препаратів; ризик виникнення побічних реакцій; можлива поява в популяції стійких збудників.
Синдромне лікування призначається за наступними симптомами:
- виділення з уретри;
- генітальні виразки;
- виділення з піхви;
- біль унизу живота у жінок;
- припухлість калитки.
У разі лікування, застосовуються схеми, розроблені для кожного симптому.
Синдромне лікування спрямоване на елімінацію основних збудників ІПСШ: N. Gonorrhoeae, C. Trachomatis, T. Pallidum, Herpes simplex, T. Vaginalis.
Протипоказаннями для застосування синдромного підходу є:
- субклінічний або безсимптомний перебіг ІПСШ;
- вагітність;
- дитячий вік та неповнолітні;
- особи декретованих професій;
- відмова пацієнта;
- множинна лікарська непереносимість в анамнезі;
- необхідність в екстреній госпіталізації (будь-яка хірургічна, акушерсько-гінекологічна й соматична патологія).
Лікарські засоби, що застосовуються для лікування ІПСШ, повинні відповідати наступним критеріям: мають бути високо ефективними (принаймні 95%), низьковартісними, з прийнятною токсичністю та переносимістю. Оптимальним режимом застосування препаратів є пероральне та разове. Засоби мають використовуватись для лікування вагітних та жінок, які годують груддю. Також препарати не повинні сприяти розвитку резистентності.
Антимікробна резистентність деяких ІПСШ, збільшувалась протягом останнього часу у багатьох частинах світу. Необхідно проводити моніторинг чутливості збудників ІПСШ до препаратів, які використовуються при лікуванні патології, ними спричиненої.
Показаннями для проведення обстеження та скринінгу на ІПСШ: симптоми або фізичні ознаки, що передбачають ймовірну наявність ІПСШ; встановлений діагноз будь-якого ІПСШ; ризикована в плані інфікування ІПСШ та ВІЛ поведінка – СІН, РКС, ЧСЧ, інші.
Конфіденційність дуже важлива для осіб, що консультуються з приводу підозри на наявність ІПСШ. Лікарям слід проводити чітку політику конфіденційності, яку повинен поділяти й підтримувати весь персонал.
Пацієнтів слід повідомити про будь-які допустимі межі конфіденційності (згідно Законодавства України, в тому числі „Закону України про захист населення від інфекційних хвороб ”,Закону України „Про запобігання захворюванню на синдром набутого імунодефіциту (СНІД) та соціальний захист населення”, тощо).
Однією з особливостей представників груп ризику є страх про розголос інформації про статус або рід їх занять. Для збереження анонімності звернення можливе використання системи присвоювання пацієнтам кодів.
Огляд, обстеження та лікування таких осіб слід проводити тільки після докладного пояснювання пацієнту всіх аспектів щодо обстеження, лікування та подальшого спостереження та отримання на це згоди пацієнта. При цьому необхідно у відповідній формі надати пацієнту інформацію про можливу користь та ризик застосування лікувальних засобів.
Огляд пацієнта повинен охопити: огляд аногенітальної області у чоловіків та жінок; обстеження жінок за допомогою дзеркал; бімануальне дослідження малого таза в жінок за наявності симптомів в області верхнього генітального тракту; проктоскопія у чоловіків та жінок за наявності показань за симптомами або сексуальному анамнезі. Також доцільно проводити огляд інших систем організму, якщо це необхідно або показано за симптомами.
Згідно міжнародних керівництв для всіх пацієнтів необхідно проводити лабораторні дослідження на наявність: Chlamydia trachomatis, Neisseriа gonorrhoeae, Treponema pallidum, ВІЛ.
При показаннях за симптомами, сексуальному анамнезі або даних огляду проводять дослідження на наявність: Candida albicans, Trichomonas vaginalis, ВПГ, вірус гепатиту В.
Однак, з урахуванням вітчизняних епідеміологічних спостережень,отриманих протягом останніх років, досліджень, які проводилися в країнах СНД, пацієнтам нашого регіону доцільно проводити обов’язкове дослідження на наявність Trichomonas vaginalis. Також можливо застосовувати мікроскопію на робочому місці – при наданні послуг, яку може проводити сам фахівець.
Лікування слід розпочати під час первинної консультації, якщо:
- лікар може поставити діагноз вже під час первинного відвідування;
- на основі клінічних проявів та симптомів та/або результатів експрес-тестів та/або лабораторного обстеження;
- встановлено діагноз у статевого партнера.
У випадках груп ризику припустимо використовувати одноразову терапію, яку проводять під контролем медичного персоналу, що найбільш оптимально забезпечує виконання приписаного режиму лікування.
Пацієнтам слід рекомендувати правильне використання презервативів при будь-яких видах контактів (генітальні, оральні, анальні, змішані).
Особливої уваги потребують вагітні жінки та матері, що годують грудьми, а також ті пацієнтки, у яких неможливо виключити наявність вагітності.
Повідомлення партнерів необхідно здійснювати в усіх випадках, коли встановлений діагноз ІПСШ. Авторами повідомлення можуть бути самі пацієнти.
Рішення лікаря про те, з ким із партнерів пацієнта необхідно контактувати, залежить від того, що відомо про можливий інкубаційний період захворювання, а також від сексуального анамнезу. Можливо призначення превентивного лікування на підставі анамнестичних даних.
11.3.1 Можливість застосування синдромного підходу при наданні дерматовенерологічної допомоги робітникам комерційного сексу
Проведено консультування 133 ЖКС, які були об’єднані до підгрупи 2.8,. в умовах мобільної амбулаторії в м. Харків. За попередньою добровільною згодою пацієнток проводилося опитування на наявність скарг та клінічний огляд (огляд зовнішніх статевих органів та перианальної ділянки, молочних залоз, шийки матки в дзеркалах та бімануальне дослідження). Встановлення попереднього (клінічного) діагнозу відбувалося на основі анамнестичних даних, об’єктивного огляду та суб’єктивних проявів захворювання.
В результаті консультування групи пацієнток були встановлені наступні діагнози (дані наведені в таблиці 11.14).
Таблиця 11.14 – Патологія, що виявлена при консультуванні ЖКС, (n=133), підгрупа 2.8
| Клінічний
попередній діагноз |
Кількість осіб | Синдромний діагноз | Кількість осіб | ||
| абс. число | % | абс. число | % | ||
| Кольпіт | 58 | 43,6±4,3 | Синдром виділень з піхви | 74 | 55,6±4,3 |
| Ендоцервіцит | 16 | 12,1±2,9 | |||
| Порушення оваріально-менструального циклу | 39 | 29,3±3,4 | Синдром болі внизу живота | 58 | 43,6±4,3 |
| Аднексит | 18 | 13,5±3,0 | |||
| Цистит | 1 | 0,8±0,8 | |||
| Дисгорманальні захворювання молочних залоз | 6 | 4,5±1,8 | |||
Найбільш поширеною патологію при огляді ЖКС був кольпіт, виявлений у майже 44 % пацієнток. Супроводжувався кольпіт зміною кількості та консистенції виділень, суб’єктивними відчуттями печії та свербежу, набряком та гіперемією слизової оболонки піхви. Порушення цілісності слизової шийки матки у вигляді ендоцервіциту виявлено у 16 (12,1±2,9) % осіб.
Більшість жінок (39 – (29,3 ± 3,4) %) скаржилися на порушення оварільно-менструального циклу (ПОМЦ). Основними проявами патології були аномальні маткові кровотечі (частіше зустрічалися скарги на рясні менструації, скорочення циклу (менше 21 дня), подовження менструацій (більше 7 днів), невпорядковані кров’яні виділення), гіпоменструальний синдром, аменорея. При огляді клінічні прояви аднекситу виявлені у 18 ([13,5 ± 3,0] %) осіб.
Дисгормональні захворювання молочних залоз виявлені у 6 ([4,5 ± 1,8] %) пацієнток. Поєднана патологія спостерігалася майже у 11 ([8,3 ± 2,4] %) жінок (кольпіт разом з ПОМЦ, мастопатією, ендоцервіцитом, циститом).
При застосовуванні синдромного підхіду при наданні лікувально-діагностичної допомоги пацієнткам даної групи РКС, діагноз синдром виділень з піхви був би визначений у 74 осіб, тобто в (55,6 ± 4,3) % випадків. Синдром болі внизу живота був би застосований до 58 жінок ([43,6±4,3] %). У частині випадків одночасно можна було би виділити два синдроми, та призначати лікування доцільно за найважчим. Лікування має бути спрямоване на ерадикацію хламідійної, трихомонадної інфекцій та гонореї.
Таким чином, близько 99 % осіб, які проходили консультування, при веденні за синдромним підходом, отримали би лікування на цьому візиті до лікаря, першому, та, здебільшого, й останньому.
11.4 Стандарти лікування, діагностики та профілактики інфекцій, що передаються статевим шляхом, в групах ризику, з метою запобігання поширення ВІЛ (проект клінічного протоколу)
Стрімке поширення епідемії ВІЛ в Україні (зростання захворюванності на ВІЛ, кількості випадків смертності від захворювань, повязаних зі СНІДом) спонукає до альтернативного ведення пацієнтів з ІПСШ в сучасних умовах [25, 28, 49].
При наданні дерматовенерологічної допомоги представникам уразливих щодо зараження ВІЛ групам населення рекомендується:
- проведення діагностики ІПСШ за допомогою швидких (сito test) тестів; при неможливості проведення діагностики – призначення лікування на підставі клінічної симптоматики захворювання; призначення превентивного лікування на підставі анамнестичних даних, даних конфронтації (наявність підтвердженої ІПСШ у статевого партнера);
- можливість застосування клінічної діагностики ІПСШ;
- призначення одноразових та скорочених схем лікування ІПСШ з метою покращення комплаєнтності.
З метою підвищення рівня надання дерматовенерологічної допомоги представникам уразливих груп з ІПСШ, був розроблений проект клінічного протоколу «Стандарти лікування, діагностики та профілактики інфекцій, що передаютьс статевим шляхом, в групах ризику, з метою запобігання поширення ВІЛ», для фахівців, які працюють з цим контингентом населення.
Мотодики діагностики та лікування увійшли в уніфіковані клінічні протоколи первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги, які в даний час розробляються МОЗ України.
СИФІЛІС
Сифіліс – хронічне венеричне захворювання, що характеризується ураженням шкіри, слизових оболонок, внутрішніх органів, кісток і нервової системи. Має хвилеподібний перебіг зі зміною періодів загострення прихованими періодами. Сифіліс розподіляється на дві групи: набутий та вроджений. Набутий сифіліс у свою чергу поділяється на ранній і пізній. Ранній сифіліс розподіляється на первинний, вторинний і ранній латентний (набутий з давністю до 2 років) Пізній сифіліс (набутий більше ніж 2 роки) включає: пізній латентний, третинний, включаючи гумозний, кардіоваскулярний і нейросифіліс
Клінічна діагностика
Інкубаційний період: 10 – 90 днів до появи шанкеру (первинний сифіліс). Антитіла до Treponema pallidum не визначаються.
Первинний сифіліс: характерною ознакою є наявність виразки (шанкеру), зазвичай із регіональною лімфаденопатією. Виразка поодинока, безболісна і щільна з чистим дном, що виділяє прозору світлу рідину, розташована в аногенітальній області. Іноді виразка може бути атиповою: множинною, болісною, гнійною, деструктивною, екстрагенітальною. Будь-яка аногенітальна виразка вважається сифілітичною, якщо не доведене інше походження. Антитіла до Treponema pallidum можуть бути визначені вже на 4-7 день після виникнення шанкеру.
Вторинний сифіліс: розвивається через 3-6 тижнів після появи шанкеру. Мультисистемне ураження внаслідок бактеріємії, що може рецидивувати аж до другого року з моменту інфікування. Спостерігаються генералізована несвербляча поліморфна висипка, що часто вражає долоні і підошви, широкі кондиломи, вогнища на слизових, генералізована лімфаденопатія. Рідше: вогнищева алопеція, передній увеїт (тобто сифіліс очей, що може також викликати склерит, ірит, ретиніт, папіліт, неврит очного нерва), менінгіт, параліч черепно-мозкових нервів, гепатит, спленомегалію, періостит і гломерулонефрит.
Латентний сифіліс: позитивні серологічні тести на сифіліс без клінічної картини трепонемної інфекції.
Пізній сифіліс включає:
- гумозний сифіліс: типові вузли, бляшки чи виразки;
- нейросифіліс: менінговаскулярний, паренхіматозний (загальний парез, tabes dorsales); безсимптомний (аномальна спинномозкова рідина – CМР);
- кардіоваскулярний сифіліс: аортит (безсимптомний), стенокардія, розширення висхідного відділу аорти, стеноз вусть коронарних артерій, аневризма аорти (головним чином грудного відділу).
Асоціація сифілісу та ВІЛ-інфекції. ІПСШ та ВІЛ-інфекція мають схожі шляхи передачі але різну тривалість інкубаційного періоду. За останніми даними сифіліс виявляється у однієї третини хворих на СНІД. За спостереженнями частини дослідників, клініка є типовою, за іншими даними – має місце злоякісний перебіг. Безперечно встановлено, що стан імунодефіциту змінює клініку сифілісу і суттєво впливає на результати лікування. У ВІЛ-інфікованих рецидиви сифілісу після лікування трапляються досить часто. Хворим на прихований сифіліс та активний сифіліс зі строком зараження більше 6 місяців, або з невстановленим строком інфікування, які також мають ВІЛ-інфекцію, показане обстеження ліквору в умовах стаціонару.
Звертають увагу на майже постійне виявлення у хворих на сифіліс збільшення потиличних, підщелепних, шийних, підкрильцових та пахових лімфатичних залоз. Вони безболісні, рухомі при пальпації, щільноеластичної консистенції, шкірні покрови над ними не змінені. Вважається, що ВІЛ-інфіковані в разі зараження сифілісом, мають підвищений ризик розвитку раннього нейросифілісу. Мають місце труднощі в діагностиці при асоціації сифілісу та ВІЛ-інфекції. Можна спостерігати серонегативність реакцій у хворих на СНІД з сифілісом. Зміна загальної патології та перебігу сифілісу при одночасному зараженні ВІЛ може стосуватись не тільки серологічних реакцій, але й клінічної картини сифілісу.
Пацієнтам, в яких на основі зібраних скарг, клінічних симптомів, анамнезу, особливостей поведінки (наявність ризикованої сексуальної поведінки, належність до груп, уразливих щодо зараження ВІЛ) була запідозрена, а потім підтверджена лабораторними методами діагностики наявність ІПСШ, призначається лікування і наступне спостереження.
Лабораторна діагностика:
- діагностика з застосуванням швидких тестів
Основним препаратам для лікування раннього сифілісу в амбулаторних умовах є бензатинбензилпеніцилін (біцилін-1, екстенцилін, ретарпен). Уводиться один раз на тиждень. При алергічній реакції до препаратів пеніцилінового ряду застосовуються антибіотики резерву: тетрацикліні, макроліди, цефалоспорини. Їх терапевтична ефективність нижча за пеніцилін, тому вони використовуються лише при абсолютній неможливості лікування препаратами пеніцилінового ряду.
Показання для призначення лікування
- Лабораторне та клінічне підтвердження сифілісу.
- Сифіліс у статевого партнера.
Превентивне лікування. Проводиться особам які мали статевий або тісний побутовий контакт з хворим на заразні форми сифілісу.
- Бензатинбензилпеніцилін одноразово в дозі 2,4 млн. ОД внутрішньом’язово.
Набутий сифіліс ранній (первинний, вторинний, ранній прихований зі строком зараження менше року):
- Бензатинбензилпеніцилін одноразово в дозі 2,4 млн. ОД внутрішньом’язово (одна ін’єкція 2,4 млн. ОД або 1,2 млн. ОД в кожну сідницю).
Набутий сифіліс пізній прихований (зі строком зараження більше року):
- Бензатинбензилпеніцилін в дозі 2,4 млн. ОД внутрішньом’язово (одна ін’єкція 2,4 млн. ОД або 1,2 млн. ОД в кожну сідницю) щотижнево на дні 1, 8 та 15.
Ранній сифіліс зі злоякісним перебігом та вісцеральними або неврологічними ураженнями, ранній нейросифіліс, природжений сифіліс у дорослих.
Лікування проводиться в умовах стаціонару. Разом зі специфічною терапією слід проводити неспецифічну патогенетичну терапію з урахуванням рекомендацій терапевта, невропатолога, офтальмолога та ін.
Резервні методи лікування хворих на сифіліс
Перед початком пеніцилінотерапії пацієнт(ка) ретельно розпитується про алергічні реакції в анамнезі. На основі ретельного опитування всі хворі поділяються на дві групи:
- Група А – без алергії на пеніцилін в анамнезі
- Група Б – з чітко встановленою наявністю алергії до пеніциліну в анамнезі
Хворим групи А проводиться провокаційні проби на переносність (уведення внутрішньошкірно 0,1 мл ізотонічного розчину, що містить пеніцилін 1 : 10 000 від терапевтичної концентрації). При позитивній внутрішньошкірній пробі призначаються резервні схеми лікування. Хворим групи Б провокаційні проби не ставляться і призначаються резервні схеми лікування.
Схеми лікування хворих на сифіліс антибіотиками резерву (еквівалентні):
- Доксициклін 200 мг один раз на добу протягом 10 діб внутрішньо;
- Азитроміцин 500 мг один раз на добу протягом 10 діб внутрішньо;
- Цефтриаксон 500 мг внутрішньом’язово один раз на добу протягом 10 діб.
ВІЛ-інфіковані пацієнти
- Серологічні тести на сифіліс у пацієнтів із супутньою ВІЛ – інфекцією звичайно надійні для постановки діагнозу сифілісу й оцінки результату лікування.
- Є повідомлення про хибнонегативні та хибно позитивні результати тестів, а також уповільнену прояву серореактивності.
- У ВІЛ-інфікованих із клінічною підозрою на сифіліс і (повторюваною) негативною серологією на сифіліс рекомендується провести інші діагностичні тести крім первинного скринінгового, наприклад, гістологічний, імунофлуоресцентний чи аналіз ПЛР із матеріалом, отриманим при біопсії з клінічно підозрілого вогнища ураження і пряму мікроскопію ексудату вогнищ раннього сифілісу на спірохети.
- ВІЛ-інфіковані пацієнти з раннім сифілісом мають підвищений ризик раннього неврологічного чи очного сифілітичного ураження і більш високий ступінь неефективності лікування бензатинпеніциліном, включаючи більш частіші серологічні рецидиви. Тому дуже важливо проводити наступний контроль.
Лікування сифілісу у пацієнтів із супутньою ВІЛ-інфекцією проводиться так само, як і для не інфікованих ВІЛ-пацієнтів
Сифіліс у поєднанні з іншими венеричними хворобами
Сифіліс як моноінфекція спостерігається не часто – приблизно в 1/3 випадків. Частіше діагностується змішана інфекція – сифіліс із хламідіозом та іншими статевими хворобами – приблизно в 2/3 випадків. Наявність суб’єктивних скарг з боку сечостатевого тракту мають менше половини хворих на сифіліс і супутньою сечостатевою інфекцію. При наявності у хворого на сифіліс хламідійної, трихомонадної інфекції, гонореї, генітального герпесу і кандидозу, лікування всіх інфекцій проводиться разом, одночасно.
Реакції на лікування
Пацієнтів варто попередити про можливі реакції організму на лікування. У приміщенні (процедурному кабінеті) для лікування повинні бути передбачені засоби невідкладної медичної допомоги.
Реакція Яриш-Герксгеймера (Jarisch-Herxheimer)
- Гостра температурна реакція (ГТР) з головним болем, міальгією та ознобом, що проходить через 24 години.
- ГТР типова для раннього сифілісу, але, як правило, не має особливого значення, за винятком випадків сифілісу з неврологічними й очними ураженнями чи при вагітності, коли вона може викликати ослаблення активності плоду і передчасні пологи.
- Нетипова ГТР для пізнього сифілісу, але може являти потенційну загрозу для життя, якщо уражені стратегічно важливі ділянки і системи організму (наприклад, коронарні судини, гортань, нервова система).
Анафілактичний шок
Повинні бути в наявності засоби для лікування анафілаксії, оскільки пеніцилін є однією з розповсюджених причин, що викликають її.
Лікування:
– епінефрин (адреналін) 1:1000 внутрішньом’язово 0,5 мл, а потім
-внутрішньом’язево/внутрішньовенно антигістамінний препарат, наприклад, хлорфенірамін 10 мг;
– внутрішньом’язово/внутрішньовенно преднізолон 120 мг.
Особливі зауваження
- Рекомендується утримуватися від статевих зносин пацієнту протягом 7-10 днів після завершення одноразової терапії, а також до моменту, поки всі статеві партнери пацієнта не отримають відповідний курс лікування.
- Дотримання пацієнтом режиму лікування залежить від надання пацієнту інформації про спосіб передачі інфекції, її наслідки, важливості для статевого партнера, діагностику та схеми лікування, а також про побічні дії лікарських препаратів.
Заходи у відношенні статевих партнерів
- Усі хворі на сифіліс повинні бути сповіщені про необхідність повідомлення партнерів (повідомлення здійснює сам пацієнт = повідомлення через пацієнта, якщо повідомлення здійснює установа охорони здоров’я = повідомлення через працівника охорони здоров’я). Серед пацієнтів необхідно провести просвітницьку роботу з профілактики поширення ІПСШ; наступне спостереження необхідне також і для контролю стану здоров’я пацієнта після лікування.
- Рецидив вторинного сифілісу може мати місце протягом перших двох років інфікування, і сифіліс може передаватися при статевому контакті в період аж до 2-х років після початку захворювання.
- Повідомлення партнерів сприяє ефективності заходів органів охорони здоров’я по зниженню рівня захворюваності, а також виконує етичні зобов’язання по попередженню осіб, що не підозрюють про загрозу можливості зараження, і, що не менш важливо, може позначити епідемічні вогнища інфекції.
- Варто повідомити партнерів пацієнтів з первинним сифілісом, з якими були контакти в останні три місяці, оскільки інкубаційний період триває до 90 днів. Тимчасові рамки повідомлення партнерів розширюються до 2-х років для пацієнтів із вторинним сифілісом при клінічному рецидиві чи з раннім латентним сифілісом.
- У пацієнтів з раннім сифілісом можуть бути інфіковані 40 – 60% статевих партнерів.
- Варто розглянути можливість негайного лікування за епідеміологічними показниками статевих партнерів, якщо партнери не можуть відвідувати регулярно клініку для проведення клінічного і серологічного обстеження з метою виключення сифілісу.
- Серологічні тести на сифіліс повинні бути проведені при першому ж відвідуванні і повторені через 6 тижнів і 3 місяці.
Подальше спостереження і контроль вилікованості
- Повідомлення про випадок сифілісу у відповідні органи (станція переливання крові, міський (або обласний, або територіальний) диспансер) обов’язкове.
- Контроль для підтвердження вилікованості і виявлення повторної інфекції чи рецидивів здійснюється за допомогою аналізу клінічних і серологічних даних.
- При ранньому сифілісі наступне спостереження включає як мінімум клінічний огляд і серологічні аналізи; наступний контроль відбувається протягом перших 3 місяців після лікування, потім через 6 і 12 місяців. Наступний контроль ВІЛ – інфікованих пацієнтів, що лікувалися з приводу раннього сифілісу, варто проводити більш часто: наприклад через 1, 2, 3, 6, 9, 12, 18, і 24 місяці .
- Ранній клінічний рецидив найчастіше спостерігається в оральній чи анальній ділянках.
- Специфічні трепонемні тести можуть залишатися позитивними протягом життя після ефективного лікування; пацієнту необхідно зберігати відповідну документацію для запобігання непотрібного повторного лікування.
- Реінфекцію чи рецидив варто повторно лікувати з використанням схем лікування під контролем медичного персоналу, щоб забезпечити виконання пацієнтом режиму лікування; крім того, необхідний повторний скринінг статевих партнерів.
ГОНОРЕЯ
Гонорея – це захворювання, що передається статевим шляхом та викликається бактерією Neisseria gonorrhoeae. Гонорея є найбільш частим захворюванням, що передається при статевому контакті, включаючи вагінальний, оральний та анальний секс. Мікроорганізми здатні при інфікуванні ушкоджувати глотку, викликаючи важкі порушення, а також анус та пряму кишку, створюючи умови для розвитку проктиту. У жінок збудник може викликати подразнення вагіни (вагініт). Інфікування уретри призводить до розвитку уретриту, що супроводжується болісним сечовипусканням та виділеннями з уретри. Жінки відмічають також вагінальні виділення, збільшення частоти сечовипускань, дискомфорт при сечовипусканні. При поширенні запального процесу на маткові труби та черевну порожнину може виникнути інтенсивний біль внизу живота та лихоманка. Інкубаційний період при зараженні гонореєю складає 2-5 днів після статевого контакту з інфікованим партнером. Однак, у деяких випадках симптоми можуть з’явитись і через 2 тижні. Попередній діагноз можна встановити при огляді пацієнта. У жінок гонорея часто є причиною розвитку внутрішньотазових запальних захворювань, що можуть перебігати з абсцедуванням, тривалим хронічним больовим синдромом внизу живота, викликати пошкодження маткових труб, створюючи умови для безпліддя та підвищення ризику виникнення ектопічної вагітності.
В залежності від інтенсивності реакції організму на проникнення гонококів, тривалості перебігу і клінічної картини гонореї виділяють її форми:
1) свіжу (гостра, підгостра, торпідна) коли з моменту захворювання пройшло не більше 2 міс.;
2) хронічну, якщо час зараження невідомий або після інфікування пройшло більш ніж 2 міс.;
3) латентну або гонококоносійство, коли у хворих відсутні клінічні ознаки захворювання, але виявляються збудники захворювання.
Клінічна діагностика
Чоловіки
- Симптоми й ознаки уретриту, що характеризуються виділеннями з уретри і печією при сечовипусканні.
- Ректальна інфекція може викликати анальні виділення чи періанальні болі.
- Гострий орхоепідидиміт спостерігається зазвичай в чоловіків старше 40 років.
- Може мати місце безсимптомна інфекція: уретри, прямої кишки, глотки.
- Дисемінована інфекція викликає підвищення температури, петехії чи пустульозну висипку на шкірі, асиметричну артралгію, септичний артрит, тендосиновіт. Дуже рідко спостерігаються менінгіт чи ендокардит.
Жінки
- Зміни характеру піхвових виділень та ознаки цервіциту (слизово-гнійні ендоцервікальні виділення, контактна кровотеча).
- Гострий біль у нижній частині живота і болісність при пальпації.
- Типова безсимптомна інфекція: шейки матки, прямої кишки, глотки.
- Дисемінована інфекція викликає підвищення температури, петехії чи пустульозну висипку на шкірі, асиметричну артралгію, септичний артрит, тендосиновіт. Дуже рідко спостерігаються менінгіт чи ендокардит.
Показання для тестування
- Симптоми чи ознаки виділень з уретри.
- Слизово-гнійний цервіцит.
- Наявність у статевого партнера інфекції, що передається статевим шляхом, чи запального захворювання органів малого тазу.
- Скринінг на ІПСШ на прохання пацієнта чи в зв’язку з недавньою появою нового сексуального партнера.
- Виділення з піхви при наявності факторів ризику ІПСШ (вік молодше 25 років, новий статевий партнер, що нещодавно з’явився).
- Гострий орхоепідидиміт у чоловіків молодше 40 років.
- Гостре запальне захворювання органів малого таза.
Лабораторна діагностика:
- діагностика з застосуванням швидких тестів
У випадках, пов’язаних з лікуванням та діагностикою ІПСШ в групах населення, уразливих щодо зараження ВІЛ-інфекцією, допустимо діагностувати гонорею на підставі тільки клінічних та анамнестичних ознак та призначати лікування захворювання.
Лікування
Рекомендовані схеми:
- Цефтриаксон 500 мг внутрішньом’язово одноразово
- Цефіксим 400 мг перорально одноразово.
Альтернативні схеми (еквівалентні):
- Спектиноміцин 2 г в/м одноразово
- Канаміцин 2 г в/м одноразово
Наявність супутніх ІПСШ є типовим для пацієнтів з гонореєю. Тому одночасно з лікуванням гонореї доцільно проводити діагностику (за можливості) та лікування інших ІПСШ, передусім – хламідіозу. Повідомлення про випадок гонореї у відповідальні органи (станція переливання крові, міський (або обласний, або територіальний) диспансер) обов’язкове, проте вимагає дотримання принципів конфіденційності.
Особливі ситуації
Гонококовий епідидиміт: поряд з антибактеріальною терапією рекомендується дотримання хворим постільного режиму, підведення та підтримка калитки, а також анальгетики.
Дисемінована гонококова інфекція: лікування проводиться в умовах стаціонару.
Особливі зауваження
- Рекомендується утримуватися від статевих зносин протягом 7-10 днів після завершення одноразової терапії, а також поки всі статеві партнери пацієнта не пройдуть відповідний курс лікування.
- Дотримання пацієнтом режиму лікування залежить від надання пацієнту інформації про спосіб передачі інфекції, її наслідки, важливість для статевого партнера, діагностиці і схеми лікування, а також про побічні дії лікарських препаратів.
Ведення статевих партнерів
- Статевих партнерів також варто лікувати від гонореї та супутньої інфекції, переважно після тестування на інфекції, набуті статевим шляхом. В лікування варто включити всіх статевих партнерів за попередні 90 днів.
Подальше спостереження
- Рекомендується повторне тестування за допомогою підтверджуючих тестів в лікувальній установі дерматовенерологічного профілю через 2 тижні після завершення терапії.
УРОГЕНІТАЛЬНИЙ ХЛАМІДІОЗ
Chlamydia trachomatis є одним з найбільш частих збудників захворювань, що передаються статевим шляхом. Вона складається з елементарних тіл (інфекційна форма) та ретикулярної структури (реплікативна форма). Chlamydia trachomatis широко розповсюджена, має високий ступінь асимптоматичного проникнення та викликає часті ускладнення у жінок та новонароджених. Ускладнення, що викликані хламідіозом приводять до виникнення цервіциту, уретриту, ендометриту, запалення жіночих статевих органів, частих ускладнень вагітності та розвитку безпліддя. Передача цього захворювання під час пологів від матері до немовляти викликає бактеріальне ускладнення у вигляді кон’юнктивітів та пневмонії.
Урогенітальний хламідіоз розподіляється на:
- Неускладнений
- Ускладнений
- Персистуючий чи носійство хламідій, коли у хворих відсутні клінічні ознаки захворювання, але лабораторними методами виявляються збудники захворювання.
Клінічна діагностика
Ознаки та симптоми обумовлені головним чином цервіцитом й уретритом, а також ускладненнями.
Жінки
Урогенітальна інфекція приблизно в 30% випадків перебігає з наступними симптомами:
- Слизово-гнійний цервіцит
- Гнійні виділення з піхви
- Біль у нижній частині живота
- Посткоітальна чи міжменструальна кровотеча
- Дизурія
- Ознаки запального захворювання органів малого таза, хронічний біль в органах малого тазу
Чоловіки
Приблизно в 75% випадків урогенітальна інфекція перебігає з наступними симптомами
- Виділення з уретри
- Дизурія
- Ознаки епідидиміту чи простатиту
Симптоми, характерні як для чоловіків, так і для жінок:
- Аноректальні виділення і дискомфорт
- Кон’юнктивіт
- Артралгія
Лабораторна діагностика:
- Діагностика з застосуванням швидких тестів
У випадках, пов’язаних з лікуванням та діагностикою ІПСШ в групах населення, уразливих щодо зараження ВІЛ-інфекцією, допустимо діагностувати урогенітальний хламідіоз на підставі тільки клінічних та анамнестичних ознак та призначати лікування.
Лікування
Рекомендовані схеми:
- Азитроміцин 1,0 г перорально, одноразово
Альтернативні схеми (еквівалентні):
- Офлоксацин по 200 мг перорально 2 рази на добу протягом 7 діб, або
- Доксициклін по 200 мг перорально раз на добу протягом 7 діб
Загальні положення
- Хворі на хламідійну інфекцію повинні бути обстежені на наявність інших ІПСШ
- Повідомлення про випадок хламідіозу у відповідальні органи (станція переливання крові, міський (або обласний, або територіальний) диспансер) обов’язкове, проте вимагає дотримання приципів конфіденційності.
Особливі зауваження
- Рекомендується утримуватися від статевих зносин протягом 7-10 днів після завершення курсу лікування, а також до того часу, поки всі статеві партнери пацієнта не пройдуть відповідний курс лікування.
- Дотримання пацієнтом режиму лікування залежить від надання пацієнту інформації про спосіб передачі хламідійної інфекції, її наслідки, важливості для статевого партнера, діагностиці і схеми лікування, а також про побічні дії лікарських препаратів.
Особливі моменти для ВІЛ-інфікованих пацієнтів
- Особи з ВІЛ-інфекцією і хламідійною інфекцією повинні одержувати таке ж лікування, що і пацієнти без ВІЛ-інфекції.
Ведення статевих партнерів
- Пацієнтів варто проінформувати про те, що їхні статеві партнери повинні бути обстежені, протестовані та проліковані.
- Необхідно обстежувати статевих партнерів, що мали контакт із даним пацієнтом протягом останніх 6 місяців; вони повинні пройти тестування і лікування.
- Партнерів, що мали ризик зараження, варто повідомити про це, запросити до лікарняного закладу або до лікаря венеролога для обстеження й запропонувати лікування за епідеміологічними показниками, навіть якщо тести на наявність хламідійної інфекції виявилися негативними.
Подальше спостереження
- Рекомендується повторне тестування за допомогою підтверджуючих тестів в лікувальній установі дерматовенерологічного профілю через 4 тижні після завершення терапії.
УРОГЕНІТАЛЬНИЙ ТРИХОМОНОЗ
Урогенітальний трихомоноз – широко розповсюджене захворювання, збудником якого є Trichomonas vaginalis. Обумовлює запальні процеси в сечостатевій системі чоловіків і жінок, перинатальні ускладнення. Як і інші ІПСШ, трихомонадна інфекція збільшує ймовірність інфікування ВІЛ. Trichomonas vaginalis можуть сприяти передачі цього вірусу, тому що обумовлюють локальне скупчення збудника ВІЛ в чутливих клітинах запального інфільтрату (лімфоцитах і макрофагах), викликаного трихомонадами.
Трихомоноз розподіляється:
1. Неускладнений
2. Ускладнений
Клінічна діагностика
Ознаки та симптоми обумовлені головним чином вагінітом й уретритом, а також ускладненнями.
Жінки
- Гнійні виділення з піхви
- Слизово-гнійний цервіцит
- Біль у нижній частині живота
- Дизурія
- Виділення з уретри
- Дизурія
- Ознаки простатиту
Чоловіки
Лабораторна діагностика:
На сьогоднішній день єдиним методом діагностики трихомонозу, що дозволяє отримати результат протягом 20-30 хвилин, є бактеріоскопічне дослідження (мікроскопія) нативного препарату. У випадках, пов’язаних з лікуванням та діагностикою ІПСШ в групах населення, уразливих щодо зараження ВІЛ-інфекцією, допустимо діагностувати урогенітальний трихомоноз на підставі тільки клінічних ознак (особливо в жінок) та призначати лікування. В сумнівних випадках, особливо в чоловіків зі змішаною урогенітальною інфекцією потрібно проводити мікроскопічне дослідження нативного препарату.
Забір зразку та приготування
При виявленні збудника трихомонозу якість отриманого зразку дуже важлива, тому процедура його забору потребує чіткого дотримання техніки, що забезпечить адекватну кількість збудників трихоманозу в мазку:
– використовувати стерильний зонд (чоловіки) або ватяні /дакронові тампони (жінки);
– у чоловіків необхідно досліджувати виділення з уретрального каналу і парауретральних ходів. Ділянку головки статевого члена в області зовнішнього отвору уретри витирають ватним тампоном, змоченим стерильним фізіологічним розчином хлористого натрію. За незначних виділень, або їх відсутності попередньо проводять масаж уретри, а потім проводять вишкріб зі слизової передньо-бокових стінок. Для цього дистальна частина статевого члена береться поміж третім та четвертим пальцями лівої руки, вказівним і великим тієї ж руки розширюють губки зовнішнього отвору уретри. Тупа ложка або тампон просувається в уретру приблизно на 3–4 см і легким масажуванням забирається матеріал. Матеріал з парауретральних ходів одержують при натискуванні на них. Маніпуляцію проводять обережно, щоб не поранити слизову.
– при обстеженні жінок обов’язково беруть мазки з уретри, цервікального каналу, піхви. Перед забором матеріалу область уретри, парауретральних ходів і шійки матки витирають сухим стерильним тампоном. Потім уретру масажують з боку піхви, притискуючи її до лобкової кістки. Беруть матеріал, вводячи інструмент в уретру на 1,5–2 см, намагаючись одержати виділення легким пошкрябуванням передньої і бокових стінок уретри. При заборі матеріалу з піхви/шийки матки необхідно ввести кінчик тампону у задній свод піхви/ендоцервікальний канал і повернути тампон на 360°С в одному напрямку (за часовою стрілкою або проти), а потім вийняти його. Маніпуляцію проводять обережно, щоб не поранити слизову.
– на предметне скельце наносять краплю стерильної дистильованої води, а потім зондом/тампоном досліджуваний матеріал рівномірно розмазують на скельці.
Рекомендовано виконувати мікроскопію зразків одразу після їх отримання.
Матеріали: 0,9 % розчин хлориду натрію; мікроскоп з освітлювачем (об’єктив 40, окуляр 7 або 10); предметні та покривні скельця; стерильний чоловічий уретральний зонд; ватяні /дакронові тампони для жінок; спиртова горілка.
Виявлення піхвової трихомонади при вивченні нативного препарату.
Принцип: збудника розпізнають за його рухливістю серед клітинних елементів та мікроорганізмів в препараті, який виготовляють ex tempore.
Реактиви: ізотонічний розчин хлориду натрію (0,9 г хлориду натрію розчиняють в 100 мл води).
Спеціальне обладнання: мікроскоп з освітлювачем, предметні та покривні скельця.
Виготовлення препарату: на трохи підігріте предметне скло наносять краплю теплого ізотонічного розчину хлориду натрію, з якою змішують клінічний матеріал. Суміш накривають покривним склом і досліджують у мікроскопі.
Мікроскопія: дослідження проводять під мікроскопом з природним або штучним освітлюванням безпосередньо після виготовлення препарату (об’єктив 40, окуляр 7 або 10).
Піхвова трихомонада розпізнається по грушовидній, округлій або овальній формі тіла, розміром трохи більша за лейкоцит, характерному штовхоподібному руху ундулюючої мембрани та джгутиків, які найкраще спостерігається при дослідженні в мікроскопі з темнопольним фазовоконтрастним конденсором.
Примітка: при дослідженні нативних препаратів за піхвову трихомонаду іноді помилково приймають джгутикових найпростіших сім. боронідів, які можуть потрапити до препарату з води, забрудненого посуду, тощо. На відміну від трихомонад бороніди мають лише 2 джгутики і дуже швидко рухаються по прямій. До помилок може привести і наявність в препараті бактерій, які рухаються. Такі бактерії прикріплюються до лейкоцитів, чим утворюється враження великої кількості трихомонад.
Лікування
Рекомендовані схеми:
- Метронідазол по 500 мг перорально 2 рази на добу протягом 5 діб, або
- Метронідазол 2 г всередину одноразово (в окремих випадках при неможливості тривалого прийому метронідазолу
Альтернативні схеми (еквівалентні):
- Орнідазол по 500 мг перорально 2 рази на добу протягом 5 діб
- Тінідазол 2,0 г перорально, одноразово
- Німоразол 2,0 г перорально, одноразово
Загальні положення
- Лікування повинно бути ефективним (> 95%), і пацієнти більш легко витримують призначений режим лікування (побічні ефекти практично відсутні, а схема прийому досить проста).
- Хворі на трихомоноз повинні бути обстежені на наявність інших ІПСШ.
- Повідомлення про випадок трихоманозу у відповідальні органи (станція переливання крові, міський (або обласний, або територіальний) диспансер) обов’язкове проте вимагає дотримання принципів конфіденційності.
Особливі зауваження
- Рекомендується утримуватися від статевих зносин протягом 5 днів після завершення одноразової терапії чи до завершення 5-денного курсу лікування, а також доти, поки всі статеві партнери пацієнта не пройдуть відповідний курс лікування.
- Дотримання пацієнтом режиму лікування залежить від надання пацієнту інформації про спосіб передачі трихомонадної інфекції, її наслідки, важливості для статевого партнера, діагностиці і схеми лікування, а також про побічні дії лікарських препаратів.
- При прийомі метронідазолу варто уникати алкоголю через можливість дисульфірам-подібної (Антабус) реакції.
Особливі моменти для ВІЛ-інфікованих пацієнтів
- Особи з ВІЛ-інфекцією і трихомонадною інфекцією повинні одержувати таке ж лікування, що і пацієнти без ВІЛ-інфекції.
Ведення статевих партнерів
- Пацієнтів варто проінформувати про те, що їхні статеві партнери повинні бути обстежені, протестовані та проліковані.
- Необхідно обстежувати статевих партнерів, що мали контакт із даним пацієнтом протягом 60 днів з моменту появи симптомів захворювання чи постановки діагнозу; вони повинні пройти тестування і лікування.
- Партнерів, що мали ризик зараження, варто повідомити про це, запросити для обстеження і запропонувати лікування за епідеміологічними показниками, навіть якщо тести на наявність трихомонадної інфекції виявилися негативними.
- Пацієнтам та їх партнерам варто порекомендувати утримуватися від статевих контактів, доки вони не завершать відповідний курс лікування (протягом 5 днів після одноразового прийому препарату чи до завершення 5-денного курсу).
Наступне спостереження
- Рекомендується повторне тестування за допомогою підтверджуючих тестів в лікувальній установі дерматовенерологічного профілю через 2 тижні після завершення терапії.
ГЕНІТАЛЬНИЙ ГЕРПЕС
Генітальний герпес – вірусне захворювання, що передається статевим шляхом. Збудник генітальної герпетичної інфекції –ВПГ II (найчастіше) та I типів. Ризик передачі інфекції найбільший при рецидиві захворювання або у продромальному періоді.
Клінічна діагностика
- Первинне інфікування (через 2-20 днів після інфікування виникає грипоподібний симптом, а через 3-4 дні з’являються везикули на статевих органах).
- Латентний перебіг.
- Хронічно-рецидивуючий перебіг.
Класично генітальний герпес може бути розпізнаний за наявністю типових папульозних висипань, що розвиваються в пухирці, що потім лопають і утворюють невеликі ерозії, що мають тенденцію до злиття. На них формується кірочка, ерозивна поверхня гоїться протягом декількох днів, не залишаючи рубця. Везикули на слизовій оболонці кірочкою не покриваються, а затягуються сіровато-жовтою плівкою. Часто спостерігається реґіонарний лімфаденіт.
Жінки
Ураження, обумовлені ВПГ, в жінок виявляються на вульві, у пахових складках, на шкірі промежини, сідницях, стегнах і в ділянці кульшових суглобів, а також на слизовій оболонці піхви, сечівника і шийки матки. Часто спостерігається реґіонарний лімфаденіт.
Чоловіки
Герпетичні ураження статевих органів звичайно розвиваються на статевому члені та внутрішній поверхні вінця головки. У деяких випадках вони розташовуються на калитці, сечівнику чи в промежині. Процес часто супроводжується місцевими болями, лихоманкою, аденопатією пахових лімфатичних вузлів.
Лабораторна діагностика:
В випадках, пов’язаних з лікуванням та діагностикою ІПСШ в групах населення, уразливих щодо зараження ВІЛ-інфекцією, допустимо діагностувати генітальний герпес і призначати лікування на підставі тільки клінічних ознак. Однак у всіх випадках з ціллю диференційної діагностики потрібно проводити тестування на сифіліс.
Диференційний діагноз
- Первинний сифіліс розвивається з папули, яка згодом перетворюється в ерозію або виразку; без болю, твердий інфільтрат, відсутнє гострого запалення, округлої форми; дно рожевого кольору, гладеньке, блискуче; спостерігаються лімфангоїт, лімфаденіт; позитивні серологічні реакції на сифіліс;
- Шанкроїд – виразка з нерівним дном, краї м’які, підриті; характерна чисельність виразок; лімфаденіт з почервонінням шкіри, болем, утворенням фістального ходу з виділенням гною; лабораторні дані.
Лікування
Перший епізод генітального герпесу та рецидив генітального герпесу
Показання для призначення терапії
Пацієнтам, що звернулися до лікаря протягом 5 днів із дня початку епізоду, чи у той час, коли ще утворюються нові вогнища, варто призначити всередину антивірусні препарати.
Рекомендована схема:
- Ацикловір по 800 мг 3 рази на добу протягом 5 діб перорально
Альтернативна схема (еквівалентна):
- Валацикловір по 500 мг 2 рази на добу протягом 5 діб перорально
Консультація й інформування пацієнтів
При проведенні консультації пацієнтів з першим епізодом чи рецидивом генітального герпесу необхідно розповісти пацієнту про можливе джерело (джерелах) інфекції, розвиток захворювання, включаючи ризик розвитку субклінічної інфекції, різні варіанти лікування, ризик передачі інфекції статевим шляхом або інших шляхів, ризик передачі інфекції від матері плоду під час вагітності, можливість повідомлення партнера про інфекцію.
Рецидивуючий генітальний герпес
Показання для призначення терапії
Рецидиви генітального герпесу носять обмежений характер і в цілому протікають з незначними симптомами. Оптимальна схема лікування визначається залежно від частоти рецидивів та ступеню клінічних проявів захворювання. Найбільш відповідна терапія для лікування окремого пацієнта може мінятися з часом в залежності від частоти рецидивів, важкості симптомів.
Епізодичне антивірусне лікування
- Ацикловір по 800 мг 3 рази на добу протягом 5 діб
Альтернативна схема (еквівалентна):
- Валацикловір по 500 мг 2 рази на добу протягом 5 діб
Особливі зауваження
- Рекомендується утримуватися від статевих зносин протягом 5 днів після завершення курсу лікування, а також доти, поки всі статеві партнери пацієнта не пройдуть відповідний курс лікування.
- Дотримання пацієнтом режиму лікування залежить від надання пацієнту інформації про спосіб передачі інфекції, її наслідки, важливості для статевого партнера, діагностики та схеми лікування, а також про побічні дії лікарських препаратів.
Особливі моменти для ВІЛ-інфікованих пацієнтів
· ВІЛ-позитивні пацієнти з першим епізодом чи рецидивом генітального герпесу повинні одержувати таке ж лікування, що і пацієнти без ВІЛ-інфекції.
Ведення статевих партнерів
Виходячи з конкретного випадку, варто запропонувати огляд партнера.
Наступне спостереження
Пацієнтам варто запропонувати повторно відвідати клініку, якщо виникне проблема рецидивів.
ГЕНІТАЛЬНИЙ КАНДИДОЗ
Генітальний кандидоз – захворювання, спричинене грибами роду Candida. Найчастіші збудники – Candida albicans, Candida krusei, Candida tropicalis. Кандидоз є ендогенною інфекцією, однак можливе зараження кандидозним баланітом / баланопостітом від статевої партнерші. Чинниками ризику розвитку кандидозу являються: цукровий діабет та інші ендокринні захворювання, порушення імунітету, ВІЛ-інфекція та СНІД, лікування кортикостероїдами та антибіотиками.
Генітальний кандидоз розподіляється на :
1. Гострий
2. Хронічний
Клінічна діагностика
Жінки
- Виділення з піхви
- Дизурія
Кандидозний вагініт / вульвіт характеризується плямистим почервонінням слизової оболонки піхви з білуватим густим сметаноподібним виділенням, іноді з крихтоподібними нальотами, що пухко сидять на гіперемованій слизовій оболонці. Хворі пред’являють скарги на біль, печію, свербіж вульви та шкіри навколо неї, неприємний запах.
Чоловіки
- Баланіт / баланопостіт
На головці статевого члена (баланіт) і крайньої плоті (баланопостіт) спочатку виникає еритема, папули червоного кольору, фліктени. Потім виникають ерозії, вкриті білою сироподібною плівкою, біль, печія.
Показання для призначення терапії
- Симптоми кандидозного баланіту / баланопоститу у чоловіків
- Симптоми кандидозного вагініту / вульвіту у жінок
Лабораторна діагностика:
У випадках, пов’язаних з лікуванням та діагностикою ІПСШ в групах населення, уразливих щодо зараження ВІЛ-інфекцією, допустимо діагностувати генітальний кандидоз на підставі тільки клінічних ознак (особливо в чоловіків) та призначати лікування. В сумнівних випадках, особливо в жінок зі змішаною урогенітальною інфекцією потрібно проводити мікроскопічне дослідження нативного препарату.
Забір зразку та приготування
Для тестування може бути використаний мазок з заднього своду піхви (жінки).
– використовувати ватяні /дакронові тампони.
– матеріалом для мікроскопічного дослідження є характерні білуваті плівки і крихтоподібний наліт зі стінок піхви, що є головним резервуаром генітального кандидозу (складаються переважно із клітин дріжджоподібних грибів, що знаходяться на різних стадіях розвитку). Необхідно повернути тампон на 360°С в одному напрямку (за часовою стрілкою або проти), а потім вийняти його.
– на предметне скельце наноситься крапля стерильної дистильованої води, а потім тампоном досліджуваний матеріал рівномірно розмазують на скельці.
Рекомендовано виконувати мікроскопію зразків одразу після їх отримання.
Матеріали: 10–20 % розчин KOH; мікроскоп з освітлювачем (об’єктив 40, окуляр 7 або 10); предметні та покривні скельця; ватяні /дакронові тампони; спиртова горілка.
Виявлення дріжджоподібних грибів у досліджуваному матеріалі при вивченні нативного препарату
Принцип: Збудника виявляють за морфологічними ознаками – великі розміри 6–8–12 мкм, клітина нагадує кулю або еліпс.
Реактиви: 10–20 % розчин лугу – KOH.
Спеціальне обладнання: Мікроскоп з освітлювачем, предметні та покривні скельця.
На предметне скло наносять краплю 20 % розчину лугу – KOH – та змішують у ньому досліджуване виділюване з вогнища захворювання. Завись накривають покривним склом і мікроскопують.
Мікроскопія: Дослідження проводять під мікроскопом зі природним або штучним освітленням.
Молоді клітини грибів роду Candida мають круглу чи яйцеподібну форму, зрілі – подовжену чи округлу. Діаметр клітин коливається від 2 до 5 мкм. Справжнього міцелію дріжджіподібні гриби не мають, а утворюють псевдоміцелій. Нитки його (довжиною 12-16 мкм) відрізняються від ниток справжнього міцелію тим, що не мають загальної оболонки і перегородок, а складаються з тонких клітин, які стикаються одна з одною вузькою основою.
Виявлення тільки дріжджової форми збудника свідчить про його сапрофітну вегетацію. Якщо переважають дріжджові клітини при одиничних нитках псевдоміцелію, то це говорить про поверхневий кандидоз. Переважання псевдоміцелію над дріжджовими клітинами є ознакою глибоких органічних уражень.
Лікування
Рекомендована схема для чоловіків:
- Флуконазол 150 мг перорально, одноразово
Альтернативні схеми для чоловіків (еквівалентні):
- Клотримазол крем 1% два рази на добу протягом 3 діб зовнішньо
Рекомендована схема для жінок:
- Флуконазол 150 мг перорально, одноразово
Альтернативні схеми для жінок (еквівалентні):
- Клотримазол у вигляді піхвових таблеток 500 мг одноразово чи 200 мг внутрішньо один раз на добу протягом 3-х діб.
- Міконазол у вигляді піхвових свічок 1200 мг одноразово чи по 400 мг внутрішньо раз на добу протягом 3 діб.
Загальні положення
- Хворі на генітальний кандидоз повинні бути обстежені на наявність інших ІПСШ.
Особливі зауваження
- Рекомендується утримуватися від статевих зносин протягом 5 днів після завершення одноразової терапії, а також доти, поки всі статеві партнери пацієнта не пройдуть відповідний курс лікування.
- Дотримання пацієнтом режиму лікування залежить від надання пацієнту інформації про спосіб передачі інфекції, її наслідки, важливості для статевого партнера, діагностиці і схеми лікування, а також про побічні дії лікарських препаратів.
- Вагінальне лікування не проводиться під час менструації.
Особливі моменти для ВІЛ-інфікованих пацієнтів
- Особи з ВІЛ-інфекцією і генітальним кандидозом повинні одержувати таке ж лікування, що і пацієнти без ВІЛ-інфекції.
Ведення статевих партнерів
- Пацієнтів варто проінформувати про те, що їхні статеві партнери повинні бути обстежені, протестовані та проліковані.
- Пацієнтам та їх партнерам варто порекомендувати утримуватися від статевих контактів, доки вони не завершать відповідний курс лікування.
Наступне спостереження
- Необхідне тільки в тому випадку, якщо симптоми не регресують, чи якщо підозрюється інша ІПСШ.
Якщо захворювання рецидивує, необхідно виключити фактори, що призводять до швидкого росту Candida albicans:
- цукровий діабет
- застосування антибіотиків широкого спектру дії
- імунодефіцит внаслідок будь-якої причини (наприклад, ВІЛ-інфекція, застосування стероїдів, хіміотерапія, інше)
- виключити реінфекцію від партнера
Особливості призначення лікування ІПСШ
Важливим компонентом нагляду за хворим, що отримує терапію, є виявлення та корекція несприятливих реакцій, які виникають у процесі лікування.
Під несприятливими реакціями маються на увазі всі негативні зміни у стані пацієнта або результатах його фізикального, лабораторного, інструментального обстеження, незалежно від того, чи пов’язані вони, на думку лікаря чи пацієнта, з проведеною терапією чи ні, оскільки цей зв’язок може бути встановлений пізніше.
Заходи, спрямовані на профілактику та корекцію несприятливих ефектів терапії:
- Перед початком терапії треба провести ретельне опитування пацієнта з щодо наявності в анамнезі алергічних реакцій. Якщо в процесі лікування виникла алергічна реакція, препарат слід відмінити і застосувати відповідні заходи (призначення антигістамінних засобів, ентеросорбентів, гіпоалергенної дієти, у важких випадках-препаратів кортикостероїдних гормонів, тощо).
- Пацієнту необхідно надати інформацію про найпоширеніші та найнебезпечніші побічні ефекти призначених йому препаратів.
- Пацієнт має отримати конкретні та зрозумілі інструкції щодо власних дій у випадку появи тих чи інших симптомів.
- Для своєчасного виявлення побічних ефектів терапії необхідне неухильне дотримання графіка систематичного спостереження та обстеження пацієнта.
- Виникнення несприятливих реакцій може слугувати підставою для позапланового чи додаткового обстеження хворого з метою з’ясування причин розвитку ускладнень.
- У випадку виникнення несприятливих реакцій на терапію слід забезпечити хворому своєчасне надання допомоги у необхідному обсязі.
- У більшості випадків достатньо провести консультування пацієнта та призначити симптоматичне лікування.
- У випадку виникнення важких і/або неприйнятних для пацієнта побічних ефектів необхідна заміна окремих препаратів або тимчасова відміна всієї схеми.
При виникненні важких ускладнень, що становлять загрозу для життя пацієнта необхідно негайно відмінити призначене лікування і госпіталізувати пацієнта для проведення патогенетичної і симптоматичної терапії.
Найчастіші несприятливі реакції при лікуванні ІПСШ (призначення антибіотиков, протитрихомонадних препаратів, антимікотиків та протигерпетичних препаратів):
- Найчастіше побічними реакціями є місцеві реакції: еритема, біль, інфільтрат в місці введення препарату.
- Алергічні реакції/шкірні прояви: висипка, свербіж, кропив’янка, мультиформна еритема, ангіоневротичний набряк, синдром Стивенса-Джонсона, токсичний епідермальний некроліз (рідко), лихоманка, анафілактичні реакції.
- Реакції з боку системи травлення: нудота, блювання, діарея, плями на зубах, випадки розвитку псевдомембранозного коліту.
- Порушення функції печінки: помірний зріст вмісту в сироватці трансаміназ, білірубіну та/або лужної фосфатази; гепатити (рідко).
- Порушення функції нирок: олігурія/анурія, поліурія, гостра ниркова недостатність. Може спостерігатися зріст рівня креатинину в сироватці крові, зміна кольору сечі.
- Сенсорні порушення: зниження слуху, зміна смакових відчуттів.
Деякі особливості призначення прискореного лікування ІПСШ в окремих випадках:
- При ВІЛ-інфекції: особи з ВІЛ-інфекцією повинні одержувати таке ж лікування, що і пацієнти без ВІЛ-інфекції.
- В період вагітності: не проводиться.
- В жінок, що годують грудьми: грудне вигодовування слід припинити.
- При патології нирок: проводиться з застереженням, забороняється лише при кліренсі креатинину менш 5 мл/1,73 м2
- При патології печінки: проводиться з застереженням.
- При туберкульозі: на фоні протитуберкульозного лікування проводиться з застереженням.
- При прийомі замісної підтримувальної терапії (метадон, бупренорфін): не слід одночасно призначати антибіотики, що метаболізуються печінковим цитохромом Р-450 (офлоксацин, доксициклін) – зниження рівня препаратів замісної терапії; одночасний прийом флуконазолу може привести до підвищення рівня препаратів замісної терапії.
- При прийомі АРТ (невірапін, ламівудин, тенофовір, диданозин, ставудин, ефавіренз, ритонавір): проводиться з застереженням у пацієнтів з захворюваннями печінки та панкреатитом.
Розроблені Алгоритми ведення пацієнтІв з симптомами ІПСШ. На рисунках 11.2, 11.3 наведені алгоритми ведення пацієнтів з клінічними проявами ІПСШ, інфекцій репродуктивного тракту та алгоритм ведення пацієнток з виділеннями з піхви. Також запропонований синдромний підхід до лікування захворювань, що викликають виразки геніталій та лікування уретритів – рисунки 11.4, 11.5.
* * *
Невпинний зріст інфікування ВІЛ статевим шляхом зумовлює необхідність інтенсифікації заходів з діагностики та лікування ІПСШ в уразливих групах населення з метою запобігання подальшого поширення ВІЛ.
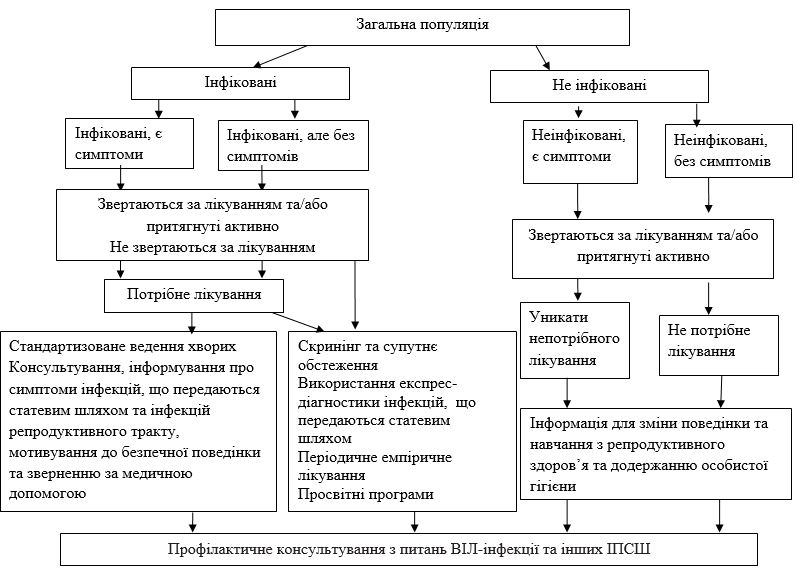
Рисунок 11.2 – Клінічні прояви ІПСШ, інфекцій репродуктивного тракту та потреба в медичній допомозі (ВООЗ
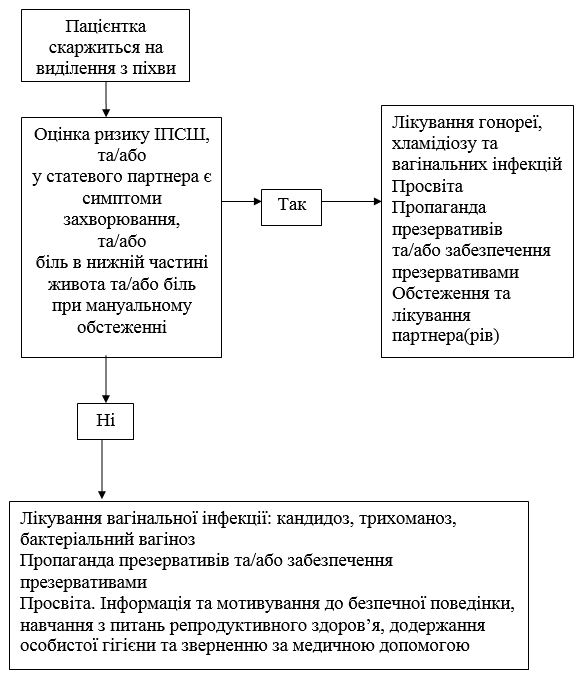
Рисунок 11.3 – Алгоритм ведення пацієнток з виділеннями з піхви
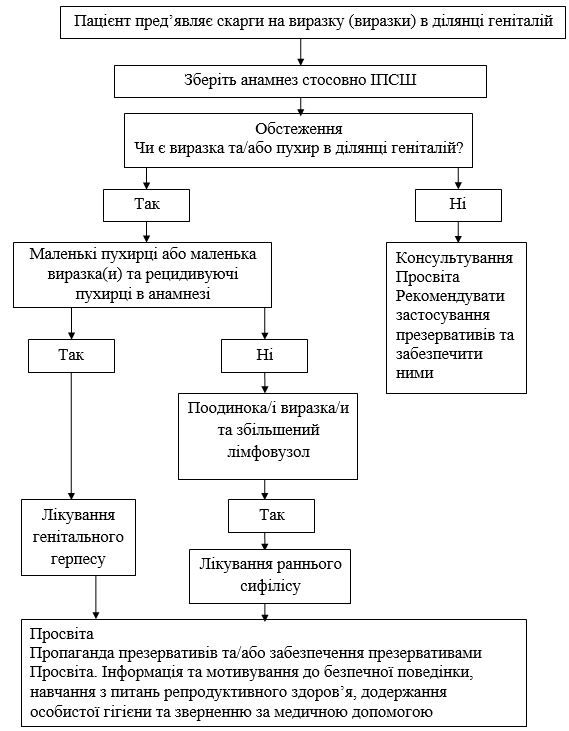
Рисунок 11.4 – Синдромне лікування захворювань, що викликають виразки геніталій
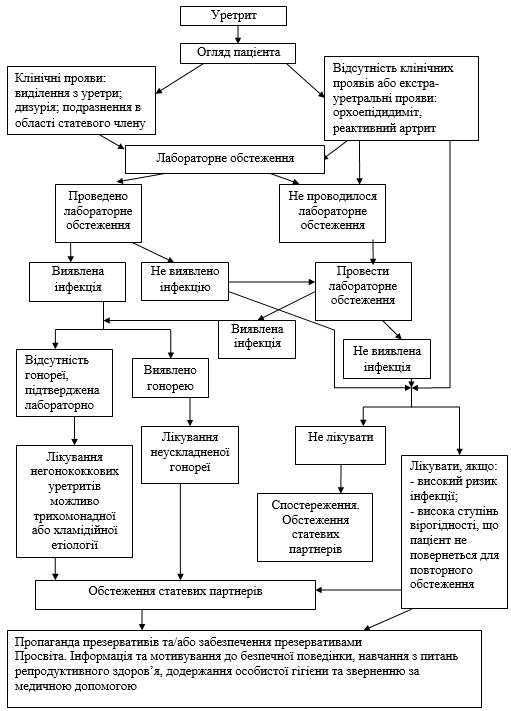
Рисунок 11.5 – Синдромне лікування уретритів
Для уразливих щодо зараження ВІЛ груп населення рекомендується проведення діагностики ІПСШ з використанням швидких тестів. Застосування швидких тестів можливе під час проведення первинного консультування. Дослідження може проводити сам консультант після пройденого фахового курсу навчання.
З урахуванням отриманих епідеміологічних даних доцільно проводити обов’язкове досліження на наявність не лише Chlamydia trachomatis, Neisseriа gonorrhoeae, Treponema pallidum,ВІЛ, але й Trichomonas vaginalis. Можливо використовувати бактеріоскопічне дослідження для діагностики тихомонозу, що має проводитися на рабочому місці (при наданні послуг) фахівцем після відповідного курсу навчання.
У разі неможливості проведення діагностики із застосуванням швидких тестів, слід призначати лікування на підставі клінічної симптоматики захворювання та анамнестичних даних.
Доцільно призначення одноразових схем лікування ІПСШ при веденні осіб з уразливих груп населення.
Можливе призначення превентивного лікування на підставі анамнестичних даних.
В усіх випадках статеві партнери пацієнта мають пройти тести на наявність ІПСШ та швидко отримати лікування на тих же умовах, що й пацієнт.
Успішне лікування ІПСШ вимагає від персоналу поважливого ставлення до пацієнтів. Клінічне обстеження має проводитись в умовах, коли можна забезпечити приватність та конфіденційність.
11.5 Практика комунікації дерматовенерологічної та наркологічної служб при наданні допомоги пацієнтам наркологічного закладу з інфекціями, що передаються статевим шляхом
На теперішній час серед уразливих груп найбільш розповсюдженою є група СІН. З урахуванням ризикованої сексуальної поведінки, можливості зараження статевих партнерів та розповсюдження ІПСШ в популяції, необхідні сумісні зусилля наркологічної та дерматовенерологічної служб, спрямовані на профілактику розповсюдження ІПСШ та ВІЛ. Одним з ефективних методів запобігання поширення ВІЛ в групах ризику є налагодження взаємодії дерматовенерологічної та наркологічної служб при наданні допомоги пацієнтам з ІПСШ наркологічного закладу.
Враховуючи важливість своєчасного виявлення пацієнтів з ІПСШ, важкі наслідки для репродуктивного здоров’я інфікованих осіб та їхніх статевих партнерів, ймовірність поширення ІПСШ та ВІЛ серед представників загального населення, значні ризики при відсутності лікування ІПСШ, в рамках проекту «Підвищення ефективності заходів органів охорони правопорядку, пенітенціарного сектору та наркологічної служби у відповідь на епідемію ВІЛ в Україні» Управлінням ООН з наркотиків і злочинності (UNODC) за підтримки Агентства США з міжнародного розвитку (USAID) було розроблено Локальний протокол «Методичне керівництво з виявлення, діагностики інфекцій, що передаються статевим шляхом, у пацієнтів із залежністю від психоактивних речовин» в м. Харків та Харківській області щодо взаємодії дерматовенерологічної та наркологічної служб з метою своєчасного виявлення та діагностики ІПСШ у пацієнтів з наркологічною патологією.
В розробці даного документу брали участь Департамент охорони здоров’я Харківської ОДА, ДУ «ІДВ НАМНУ» (зокрема директор установи, завідувачі відділів ІПСШ та ВІЛ/ІПСШ, старший науковий співробітник відділу ВІЛ/ІПСШ), головні лікарі та завідувачі служб та відділів обласних та міських наркологічних та шкірно-венерологічних диспансерів, кафедра наркології ХМАПО, ХМБФ «Благо».
Ефективна реалізація програми діагностики та лікування ІПСШ серед представників уразливих до інфікування ВІЛ груп населення, в тому числі СІН, можлива при забезпеченні доступу, прийнятності і ефективності відповідних послуг. Необхідно забезпечити наявність наступних складових:
- розвиненої системи надання допомоги з діагностики та лікування ІПСШ із необхідним матеріально-технічним та кадровим забезпеченням (медичні установи, неурядові організації, підготовлений медичний та немедичний персонал, укладені партнерські відносини та дієві механізми взаємодії);
- доступу надавачів допомоги до представників цільової групи отримувачів послуг, в тому числі шляхом активного виходу на цільову групу;
- доступ представників цільових груп до допомоги;
- матеріально-технічне забезпечення надання допомоги (наявність необхідних діагностичних тест-систем, лікарських засобів, засобів профілактики, витратних матеріалів тощо).
При організації допомоги потрібно враховувати ситуацію у регіоні та особливості поведінки СІН: “закритість” групи, низьку прихильність до ЛПЗ, діагностики та лікування, суспільну стигматизацію, чисельність, особливості наркосцени, розвиток інфраструктури організацій, що мають вихід на представників цієї групи, епідемічну ситуації з ІПСШ та ВІЛ/СНІДу.
Метою налагодження взаємодії між дерматовенерологічною та наркологічною службами в регіоні була організація системи надання дерматовенерологічної допомоги пацієнтам обласного наркологічного диспансеру (ОНД). Також важливим був розвиток системи надання інтегрованих послуг з діагностики та лікування ІПСШ із необхідним матеріально-технічним та кадровим забезпеченням (медичні установи, неурядові організації, підготовлений медичний та немедичний персонал, укладені партнерські відносини та дієві механізми взаємодії).
В таблиці 11.15 наведені дані моделі надання дерматовенерологічної допомоги пацієнтам наркологічного профілю з ІПСШ в залежності від рівня наркологічної допомоги.
Таблиця 11.15 – Алгоритм надання дерматовенерологічної допомоги та сприяння лікуванню пацієнтів наркологічного профілю з ІПСШ в залежності від рівня наркологічної допомоги.
| Необхідні дії | Терміни виконання | Виконавці (ЛПЗ, структурний підрозділ закладу) | Індикатори медичної допомоги | |
| 1 | 2 | 3 | 4 | |
| Організація надання медичної допомоги | ||||
| Організація інформування пацієнтів з питань профілактики та виявлення ІПСШ | Для амбулаторних хворих – при першому візиті.
Для стаціонарних хворих – перед госпіталізацією в стаціонар |
На амбулаторному етапі – дільнична медична сестра, психолог, соціальний працівник або дільничний лікар – нарколог.
При запровадженні замісної підтримувальної терапії (ЗПТ) – медична сестра, або лікар-нарколог В умовах наркологічного стаціонару – психолог, соц. працівник або лікар-нарколог стаціонарного відділення. |
Кількість пацієнтів, які протягом звітного періоду пройшли консультування та отримали інформацію з приводу ІПСШ | |
| Ініціювання діагностики у осіб без симптомів ІПСШ, які звернулися за медичною фаховою наркологічною допомогою | Для амбулаторних хворих – при першому візиті.
Для стаціонарних хворих – перед госпіталізацією в стаціонар |
На амбулаторному етапі – дільнична медична сестра, або дільничний лікар -нарколог.
При запровадженні ЗПТ – медична сестра, або лікар – нарколог В умовах наркологічного стаціонару – медична сестра, або лікар-нарколог стаціонарного відділення |
Кількість пацієнтів, які протягом звітного періоду пройшли
обстеження. |
|
| 1 | 2 | 3 | 4 |
| Ініціювання діагностики у осіб з симптомами ІПСШ (синдромна діагностика), які звернулися за фаховою наркологічною медичною допомогою | Для амбулаторних хворих – при першому візиті.
Для стаціонарних хворих – перед госпіталізацією в стаціонар |
На амбулаторному етапі – дільнична медична сестра, або дільничний лікар нарколог.
При запровадженні ЗПТ – медична сестра, або лікар нарколог В умовах наркологічного стаціонару – медична сестра, або лікар-нарколог стаціонарного відділення |
Кількість пацієнтів, які протягом звітного періоду пройшли
обстеження та знають результат. |
| Направлення на діагностичне тестування на ІПСШ до дерматовенеролога: пацієнтів з симптомами захворювання для визначення етіології виявлених клінічних симптомів та пацієнтів без симптомів для визначення прихованої ІПСШ | За показаннями | На амбулаторному етапі – дільничний лікар-нарколог.
При запровадженні ЗПТ – лікар – нарколог В умовах наркологічного стаціонару – лікар-нарколог стаціонарного відділення |
Кількість осіб, направлених ОНД до установ ШВД для тестування на ІПСШ.
Кількість позитивних результатів тестування, розділених за нозологіями |
| При отриманні позитивного результату при тестуванні в ШВД і підтвердженні діагнозу, фахівцем ШВД проводиться клінічне обстеження, мотиваційне консультування, призначається лікування та взяття під диспансерне спостереження | Після отримання позитивного результату тесту, підтвердженні діагнозу | Лікар дерматовенеролог ШВД | Кількість пролікованих випадків ІПСШ за нозологічними одиницям |
| 1 | 2 | 3 | 4 |
| Сприяння лікуванню | |||
| Сприяння лікуванню ІПСШ відповідно до рекомендацій лікаря – дерматовенеролога, сприяння підвищенню прихильності до лікування | Відповідно до термінів лікування ІПСШ згідно клінічних протоколів та рекомендацій дерматовенеролога ШВД. При виникненні побічних явищ або погіршення стану у випадку одночасної АРТ – терапії – консультація лікаря – інфекціоніста і дерматовенеролога негайно. | При амбулаторному лікуванні – дільнична медична сестра, психолог, соціальни1 працівник або дільничний лікар-нарколог.
При запровадженні ЗПТ – медична сестра, лікар-нарколог. В умовах наркологічного стаціонару – медична сестра, лікар-нарколог стаціонарного відділення |
Наявність висновків спеціаліста в медичних картах амбулаторного хворого |
Організація інформування представників уразливих груп населення з питань профілактики, виявлення та лікування ІПСШ.
Основними компонентами пакету послуг з метою профілактики ІПСШ є:
- надання інформації про наслідки незахищених статевих стосунків;
- мотивування пацієнтів до безпечної сексуальної поведінки;
- розповсюдження презервативів;
- мотивування до звернення за медичною допомогою;
- надання інформації щодо переліку послуг та лікувальних установ, які здійснюють діагностику та лікування ІПСШ – в тому числі до первинної ланки системи охорони здоров’я, закладів репродуктивного здоров’я, приватних лабораторій, тощо;
Організація надання послуг з діагностики та лікування ІПСШ представникам уразливих груп населення.
Діагностика, лікування та профілактика ІПСШ в групах населення, уразливих до ВІЛ, є суттєвим елементом в системі заходів, що протидіють розповсюдженню ВІЛ-інфекції в Україні.
Забезпечення доступу до лікування ІПСШ, як одного з необхідних компонентів програм з профілактики ВІЛ-інфекції і інших ІПСШ, є найскладнішим завданням для організацій, що реалізують комплексні програми профілактики серед представників уразливих до ВІЛ груп населення. Саме цьому задля проведення діагностики і лікування ІПСШ необхідно забезпечити:
1. Інформування і лікування статевого партнера.
2. Навчання щодо зниження ризиків інфікування.
3. Підвищення прихильності до лікування.
4. Забезпечення презервативами та мотивування до їх використання.
5. Конфіденційність: дотримання принципу приватності.
Ефективного контролю за поширенням ІПСШ можна досягти шляхом поєднання заходів, які складають так званий пакет послуг, відповідно до підходів охорони громадського здоров’я.
Основними компонентами пакету послуг з профілактики і контролю ІПСШ є:
- мотивування до безпечної сексуальної поведінки;
- розповсюдження презервативів;
- мотивування до звернення за медичною допомогою;
- інтеграція послуг з профілактики і лікування ІПСШ до первинної ланки системи охорони здоров’я, закладів репродуктивного здоров’я, тощо;
- комплексне ведення випадку ІПСШ;
- скринінг клінічно безсимптомних пацієнтів;
- раннє виявлення симптоматичних інфекцій.
Ведення випадку ІПСШ передбачає надання допомоги особі з синдромом, пов’язаним з ІПСШ, або позитивним результатом тестування на одну або кілька ІПСШ. Компонентами комплексного ведення випадку ІПСШ є:
- збір анамнезу,
- клінічне обстеження,
- встановлення правильного діагнозу,
- раннє та ефективне лікування,
- консультування щодо сексуальної поведінки,
- мотивування щодо використання презервативів та забезпечення ними,
- консультування щодо інформування статевого партнера та його лікування,
- подальше клінічне спостереження.
Забезпечення допомоги при ІПСШ передбачає впровадження ефективних підходів до ведення як клінічно маніфестних, так і безсимптомних випадків ІПСШ.
При веденні випадку ІПСШ лікарем дерматовенерологом в групах населення, уразливих щодо зараження ВІЛ, припустимо діагностувати урогенітальний трихомоноз, хламідіоз, генітальний герпес на підставі тільки клінічних та анамнестичних ознак. У всіх випадках генітального герпесу з метою диференційної діагностики потрібно проводити тестування на сифіліс. Особливості клінічних проявів ІПСШ наведені у додатку Е.
Незважаючи на те, що ІПСШ викликають різні патогенні мікроорганізми, деякі з них призводять до схожих клінічних проявів, відомих як ознаки і симптоми. Деякі з цих ознак і симптомів легко розпізнаються і носять стійкий характер, представляючи синдром, який свідчить про наявність одного або декількох патогенних організмів. Так, наприклад, виділення із сечовивідного каналу в чоловіків можуть бути викликані тільки однією гонорею, тільки однією хламідійною або трихомонадною інфекціями, або всіма перерахованими.
Згідно критеріям ВООЗ, основними симптомами найпоширеніших ІПСШ є:
- виділення із сечовивідного каналу;
- виразки на статевих органах;
- вагінальні виділення;
- біль внизу живота;
Збудниками, ІПСШ, які викликають появу перерахованих симптомів є Neisseria. Gonorrhoeae (гонорея), Chlamydia. Trachomatis (хламідіоз), Trichomonas. Vaginalis (трихомоноз), Treponema Pallidum (cифіліс), Herpes simplex virus (герпес)
Під час статевих контактів також передаються такі паразитарні захворювання, як короста та педикульоз.
Види тестування на ІПСШ:
Консультування та тестування пацієнтів з використанням швидких тестів на наявність сифілісу, хламідіозу, гонореї, інших інфекцій здійснюється за наявності відповідних «швидких» тест-систем на базі амбулаторних підрозділів ОНД. За необхідності отримання оперативних результатів швидкі тест-системи можуть використовуватись у стаціонарних закладах.
Діагностичне тестування може проводитись підготовленим персоналом наркологічного закладу за наявності навичок та обладнання (зокрема, навичок взяття крові при діагностиці сифілісу або роботи з біологічними рідинами при заборі патологічного матеріалу, або інших видів біологічного матеріалу для проведення тестування в залежності від типів тест-систем). Відповідальні за проведення діагностичного тестування призначаються керівником закладу або відділення.
1. Діагностичне тестування: проводиться за клінічними показаннями у осіб з маніфестними формами захворювання для визначення етіології виявлених клінічних симптомів.
2. Виявлення випадку: проведення тестування осіб без симптомів ІПСШ, які звернулися за медичною допомогою як контактні (статеві партнери пацієнтів з ІПСШ) або через інші, ніж ІПСШ, причини.
3. Скринінг: обстеження осіб без симптомів ІПСШ, які безпосередньо не звертаються за будь-якою медичною допомогою. Скринінгом можуть бути охоплені популяції поза межами ЛПЗ, залучені за допомогою аутріч-роботи (патронажні виходи, тощо). Скринінг має проводитися із дотриманням принципів конфіденційності і поваги до прав людини та може слугувати ефективним заходом виявлення безсимтомних інфекцій. Рутинному скринінгу підлягають усі пацієнти з ризиком інфікування ІПСШ.
Види лікування ІПСШ:
1. Превентивне (профілактичне) лікування призначається дерматовенерологом на підставі результатів оцінки ризику інфікування ІПСШ. Прикладом є епідеміологічне лікування статевих партнерів пацієнтів з діагнозом ІПСШ. Дозволяє забезпечити високий рівень охоплення представників уразливих груп та досягти швидкого зниження захворюваності на ІПСШ в регіонах з її високим рівнем.
2. Етіологічне лікування призначається дерматовенерологом на підставі результатів клінічного обстеження та підтверджуючих лабораторних досліджень та відрізняється високою ефективністю і специфічністю.
Лікування ІПСШ проводиться за призначенням дерматовенеролога згідно встановленого ним діагнозу на підставі результатів клінічного обстеження та підтверджуючих лабораторних досліджень.
Система «довіреного лікаря»
Форма роботи, яка здійснюється через активний вихід до пацієнтів та надання первинного комплексу діагностично-консультативних послуг медичними працівниками відповідних ЛПЗ у рамках своїх функціональних обов’язків, або залучення фахівців організаціями, що мають безпосередній вихід на представників цільової групи, у рамках відповідних угод про взаємодію або надання консультаційних послуг.
Надання допомоги фахівцями ОНД
Лікар-нарколог організовує або виконує особисто:
- опитування (згідно розробленого опитувальника) та огляд видимих шкірних покровів та видимих слизових оболонок з метою виявлення типових симптомів/синдромів ІПСШ, визначення показань до подальшого обстеження за умови добровільної згоди пацієнта;
- контроль додержання пацієнтом призначеного дерматовенерологом лікування, моніторингу побічних явищ (за умови можливості здійснення такого контролю, яке може бути застосовано, зокрема, при лікуванні пацієнтів ЗПТ);
- перенаправлення до ЛПЗ різних профілів, в тому числі ШВД, СНІД–центрів та відповідних кабінетів Довіри, за наявності відповідних медичних показань.
Медична сестра виконує наступне:
- проведення необхідних лікувальних маніпуляцій (ін’єкції препаратів, місцеві лікувальні процедури) за призначеним лікарем-дерматовенерологом планом лікування;
- сприяння появі у пацієнта прихильності до лікування ІПСШ;
- ведення відповідної медичної документації;
- проведення підготовки, реєстрації та маркування проб біологічного матеріалу, що підлягають відправці для лабораторних досліджень;
- видача пацієнтам результатів обстеження.
Патронажна сестра надає наступні послуги:
- консультування щодо методів профілактики ІПСШ та ВІЛ, зменшення ризику зараження, правильного використання презервативів та необхідності інформування статевих партнерів у разі виявлення ІПСШ; мотивування щодо звернення за медичною допомогою, перенаправлення до спеціалізованих ЛПЗ або довіреного лікаря, стимулювання прихильності до лікування;
- сприяння появі у пацієнта прихильності до лікування ІПСШ;
- ведення відповідної медичної документації;
- надання (за потреби) інформації з організаційних та соціальних питань;
- супровід (за потреби та можливості) до ШВД, перенаправлення та супровід до програм зменшення шкоди, реабілітаційних центрів, програм надання соціальної допомоги, тощо.
Соціальний працівник надає наступні послуги:
- консультування щодо методів профілактики ІПСШ та ВІЛ, зменшення ризику зараження, правильного використання презервативів та необхідності інформування статевих партнерів у разі виявлення ІПСШ; мотивування щодо звернення за медичною допомогою, перенаправлення до спеціалізованих ЛПЗ або довіреного лікаря, стимулювання прихильності до лікування;
- надання (за потреби) інформації з організаційних та соціальних питань;
- супровід (за потреби та можливості) до ШВД, пере направлення та супровід до програм зменшення шкоди, реабілітаційних центрів, програм надання соціальної допомоги, тощо.
Психолог надає наступні послуги:
- консультування щодо методів профілактики ІПСШ та ВІЛ, зменшення ризику зараження, правильного використання презервативів та необхідності інформування статевих партнерів у разі виявлення ІПСШ; мотивування щодо звернення за медичною допомогою, перенаправлення до спеціалізованих ЛПЗ або довіреного лікаря, стимулювання прихильності до лікування. Ведення як індивідуального, так і групового психологічного консультування. Робота з оточенням пацієнта ОНД;
- перенаправлення до програм зменшення шкоди, реабілітаційних центрів, програм надання соціальної допомоги, тощо.
Реалізація послуг здійснюється на базі закладів ОНД (стаціонарних та амбулаторних закладів, центрів інтегрованих послуг, тощо) та під час патронажних відвідувань пацієнтів у місцях їх перебування (містах проживання, в установах партнерів, у реабілітаційних центрах, тощо).
Дерматовенерологічна допомога (консультативна, діагностична, лікувальна, профілактична, організаційна, методологічна) надається фахівцями ШВД, ОШВД та ДУ «ІДВНАМНУ» залежно від відповідності закладу ОНД, наявності угод про співпрацю, сформованих практик взаємодії між ЛПЗ.
Надання послуг з діагностики та лікування ІПСШ:
Оскільки отримання послуг, які надаються централізовано у ШВД на основі диспансерного принципу роботи, часто є проблематичним для цільових груп, на базі ОНД може бути застосований як первинний (скринінговий) рівень клінічної діагностики ІПСШ, так і забезпечення етіологічного лікування за консультаційної підтримки лікаря дерматовенеролога у відповідності до діючих стандартів МОЗ України.
Медичні послуги з діагностики та контролю лікування ІПСШ можуть надаватися у:
- на базі стаціонарних та амбулаторних відділень;
- інших місцях знаходження пацієнтів ОНД за умов дотримання відповідних заходів безпеки та санітарно-гігієнічних норм.
Даний розділ відображає лише загальні принципи організації надання допомоги представникам уразливих груп у ЛПЗ. Більш детальна інформація щодо конкретних клінічних алгоритмів діагностики окремих ІПСШ в уразливих групах наведена у додатках та викладена у відповідних посібниках та керівництвах, затверджених МОЗ України, а саме в клінічних протоколах надання медичної допомоги хворим на дерматовенерологічні захворювання та у наказі МОЗ України від 07.06.2004 № 286 «Про удосконалення дерматовенерологічної допомоги населенню України», Методичних рекомендаціях «Особливості лікування ІПСШ в групах населення, уразливих стосовно зараженню вірусом імунодефіциту людини», погоджених МОЗ України, Академією медичних наук України та Українським центром наукової медичної інформації та патентно-ліцензійної роботи (2013).
Види діагностики ІПСШ, що виконуються лабораторією ОНД
(станом на час розробки даного документу, м. Харків)
- Серологічна діагностика сифілісу (РМП): здійснюється за призначенням лікаря; аналіз виконується 1 раз на тиждень, забір клінічного матеріалу проводить призначений в установі фахівець.
- Бактеріоскопічна діагностика ІПСШ (трихомоноз, гонорея):
здійснюється за призначенням лікаря; аналіз виконується 1 раз на тиждень, забір клінічного матеріалу проводить призначений в установі фахівець.
Також запропоновані до використання в «Методичному керівництві з виявлення, діагностики інфекцій, що передаються статевим шляхом, у пацієнтів із залежністю від психоактивних речовин» висвітлені особливості перебігу ІПСШ у представників уразливих груп населення та ризики несвоєчасного виявлення та відсутності лікування ІПСШ. Наведені дані щодо клінічної діагностики ІПСШ, зокрема сифілісу, гонореї, урогенітального хламідіозу та кандидозу, трихомонозу, генітального герпесу. Також інформація щодо клінічного перебігу корости та педикульозу та ймовірності інфікування та передачі статевим шляхом.
Приділяється увага щодо «синдромної» діагностика ІПСШ в умовах наркологічного закладу. Синдромна діагностика ІПСШ в умовах ОНД є вкрай важливою для своєчасного виявлення та ефективного перенаправлення пацієнта з передумовами наявності захворювання на консультацію до дерматовенеролога.
Синдромна діагностика ІПСШ можлива за наявності наступних симптомів (таблиця 11.16):
- виділення з уретри (трихомоноз, гонорея, хламідіоз, кандидоз);
- генітальні виразки (генітальний герпес, сифіліс);
- виділення з піхви (трихомоноз, гонорея, хламідіоз, кандидоз);
- біль унизу живота у жінок (гонорея, хламідіоз, мікст-інфекція).
Таблиця 11.16 – Симптоми та скарги, пов’язані з ІПСШ
| Симптом/синдром | Скарги | Об’єктивні ознаки | Найбільш поширені причини |
| Виділення з піхви | Виділення з піхви; свербіж у піхві; біль при сечовипусканні і під час статевого акту. | Виділення з піхви. | Трихомоніаз.
Кандидоз. Гонорея. Хламідіоз. |
| Виділення з уретри | Виділення з уретри. Дизурія, часте сечовипускання. | Виділення з уретри (вільні або при натисканні). | Гонококова інфекція.
Хламідіоз. |
| Генітальна виразка | Ерозія або виразка геніталій. | Генітальна виразка. Збільшені пахові лімфовузли. | Сифіліс.
Генітальний герпес |
| Біль внизу живота | Біль внизу живота і під час статевого акту. | Виділення з піхви. Болісність в нижній частині живота при пальпації. Температура тіла вище 38 ° С. | Гонококова інфекція. Хламідіоз.
Змішана анаеробна інфекція. |
Слід пам’ятати, що у пацієнтів на фоні зниження імунітету, можливо:
- зміна клінічної картини захворювання (маніфестація проявів або зтертість клінічної картини),
- збільшення частоти ускладнень захворювання,
- виражена тяжкість перебігу захворювання,
- збільшення частоти рецидивування,
- швидкий розвиток (прогресування) захворювання,
- сполучена патологія – асоціація з іншими збудниками,
- стійкість до терапії.
Також слід пам’ятати, що при статевих контактах ймовірна передача корости та педикульозу (таблиця 11.17).
Наведені дані щодо переваг, недоліків використання синдромного підходу в веденні пацієнтів з ІПСШ, та читко прописаних протипоказань.
Для зручності фахівця є опитувальник та реєстраційна картка, де можна розмістити інформацію про пацієнта. Розроблений опитувальник наведений в таблиці 11.18.
Таблиця 11.17 – Симптоми та скарги, пов’язані з дерматологічними захворюваннями
| Симптом/синдром | Скарги | Об’єктивні ознаки | Найбільш поширені причини |
| Висипка на шкірі кінцівок, тулуба | Свербіж шкіри, поява висипки на шкірі у вигляді везикул, папул червоного кольору. папуло-везикул, розчухів, міліарних висипів, уртикарних елементів, геморагічних кірочок, які розташовані попарно або ланцюжком | Висипка на шкірі кистей (складки кистей, бокові поверхні пальців) та/або ділянка променево-зап’ястних суглобів, особливо згинальні і бокові поверхні; передні поверхні пахвових ямок, живіт, стегна, поперекова ділянка, сідниці, молочні залози у жінок, статеві органи у чоловіків.
Кірочки, іноді гнійні, на розгинальних поверхнях ліктів. Можливі ускладнення – піодермія, лімфоплазія постскабіозна. Атипові форми – норвезька короста, малосимптомна форма захворювання. |
Короста
Слід диференціювати із свербіцем (пруріго), кропив’янкою, токсикодерміями, шкірним свербежем, тощо. |
| Висипка на шкірі тулуба, ураження воловистої частини голови | Свербіж, на шкірі голови, вух і шиї. | На шкірі зустрічаються маленькі ярко-червоні папули, плями, везикули, екскоріації з геморагічними кірочками, при хронізації процесу можливе ускладнення піодермією. Спостерігається запалення шкіри в місцях укусів у вигляді специфічних синюшних плям, пігментація, ліхенізація.
На шкірі, волосах, білизні, одязі можна знайти паразитів та/або гниди. Волосся можуть злипатися в ком, спостерігається запах гнилі. |
Педикульоз |
Увага повинна приділятися консультуванню пацієнтів наркологічних закладів з метою зміни поведінки в сторону більш безпечної щодо інфікування ІПСШ і усвідомлення важливості обстеження на ІПСШ та своєчасного отримання фахової дерматовенерологічної допомоги.
Таблиця 11.18 – Опитувальник для визначення ризиків інфікування та наявності ІПСШ
| Так (+)
1 бал |
Ні (–)
0 балів |
Бали | |
| Чи живете ви статевим життям зараз ? | |||
| Останній статевий контакт був менше 1 місяця тому? | |||
| Останній статевий контакт був без використання презервативів? | |||
| Останній статевий контакт був із випадковим партнером? | |||
| За останні 2 місяці у вас було більше 3 партнерів? | |||
| За останній рік у вас було більше 5 партнерів? | |||
| Постійного статевого партнеру немає? | |||
| Тривалість сексуальних відносин з останнім партнером менше 2-х місяців? | |||
| Симптоми, що свідчать про ймовірну наявність ІПСШ: | Так (+)
5 балів |
Ні (–)
0 балів |
|
| Є виразки на статевих органах або біля них? | |||
| Є висипи в області геніталій? | |||
| Є біль або печіння при сечовипусканні? | |||
| Є виділення з уретри або піхви? | |||
| Є біль під час статевого акту? | |||
| Чи є аналогічні скарги у вашого статевого партнера? | |||
| Загалом: | |||
Примітка. Якщо сума більше 5 балів – рекомендовано направити пацієнта на обстеження та лікування до дерматовенеролога.
Пацієнтам слід рекомендувати правильне використання презервативів при будь-яких видах сексуальних контактів (генітальний, оральний, анальний).
Наступні рекомендації можуть бути надані фахівцем особам, які мають ризиковані сексуальні контакти (СІН, РКС, ЧСЧ, тощо).
Методи зниження небезпеки при статевих контактах:
- бути тверезим під час сексуальних контактів;
- використовувати презерватив при всіх видах сексуальних контактів, з усіма статевими партнерами;
- завжди мати достатню кількість презервативів (з запасом);
- використовувати презерватив при кожному статевому контакті та протягом всій його тривалості;
- намагатися уникати контакту з статевими партнерами, якщо у них є ознаки ІПСШ;
- при неможливості відмови від ризикованих контактів – практикувати менш небезпечний секс;
- після контакту з партнером з ознаками ІПСШ необхідно провести екстрену профілактику, навіть при використанні презерватива;
- при першій можливості звернутися до фахівця для проведення екстреної медикаментозної профілактики.
Для всіх пацієнтів необхідно проводити лабораторні дослідження на наявність: Chlamydia trachomatis, Neisseriа gonorrhoeae, Treponema pallidum, ВІЛ. При показаннях за симптомами, сексуальному анамнезі або даних огляду проводять дослідження на наявність: Candida albicans, Trichomonas vaginalis, ВПГ, вірус гепатитів В та С, інших інфекцій за наявності відповідних тест-систем та лабораторного обладнання установи.
Особливої уваги потребують вагітні жінки та матері, що годують грудьми, а також ті пацієнтки, у яких неможливо виключити наявність вагітності.
Також розроблені алгоритми ведення пацієнтів наркологічних установ з синдромами «виділення з піхви» та/або «біль внизу живота у жінок», «виділення з уретри у чоловіків», «виразки геніталій» (рисунки 11.6-11.9). Був розроблений маршрут пацієнта ЛПЗ наркологічного профілю щодо надання лікувально-діагностичної допомоги з приводу ІПСШ (рис. 11.10).
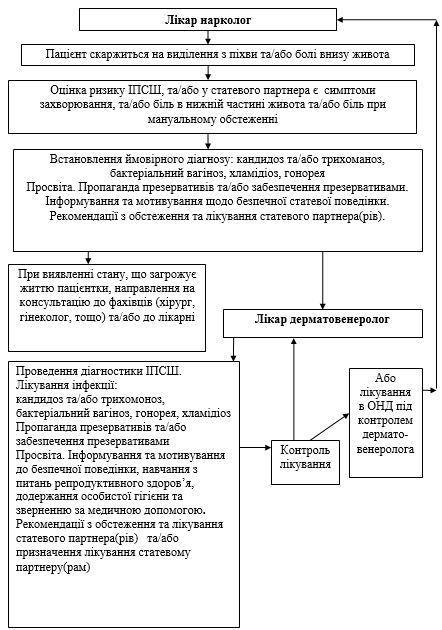
Рисунок 11.6 – Алгоритм ведення пацієнток з синдромом «виділення з піхви» та/або «біль внизу живота»
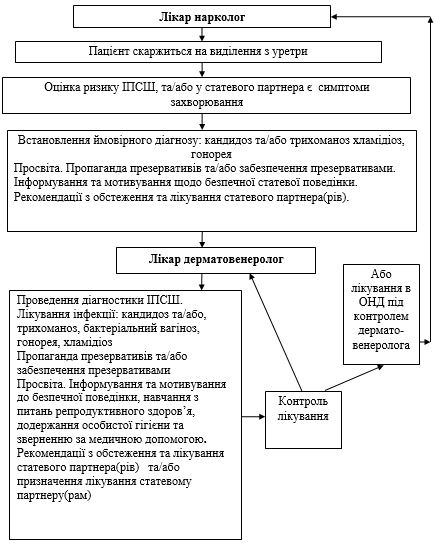
Рисунок 11.7 – Алгоритм ведення пацієнтів з синдромом «виділення з уретри»
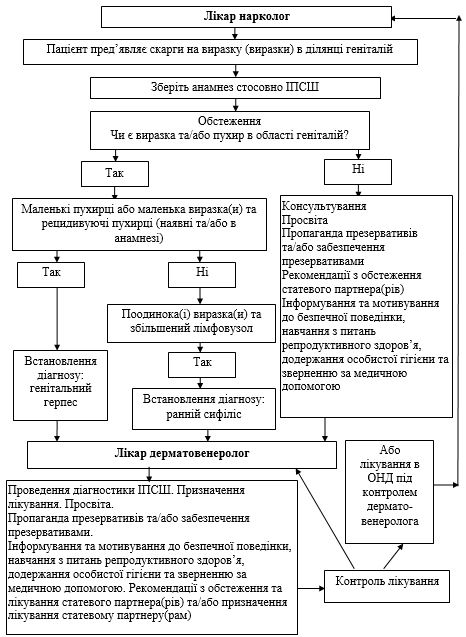
Рисунок 11.8 – Алгоритм ведення пацієнтів з синдромом «виразки геніталій»
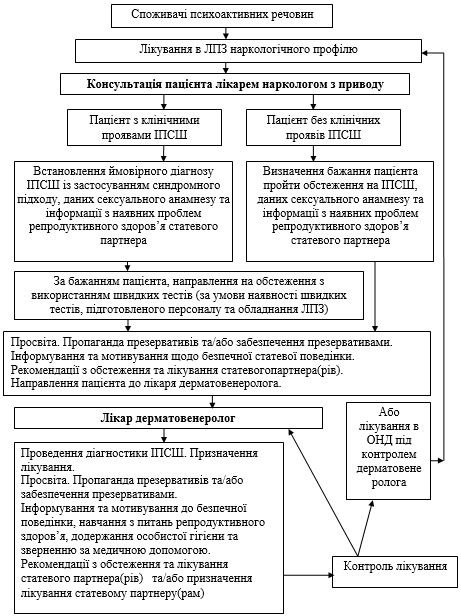
Рисунок 11.9 – Маршрут пацієнта ЛПЗ наркологічного профілю – надання лікувально-діагностичної допомоги з приводу ІПСШ
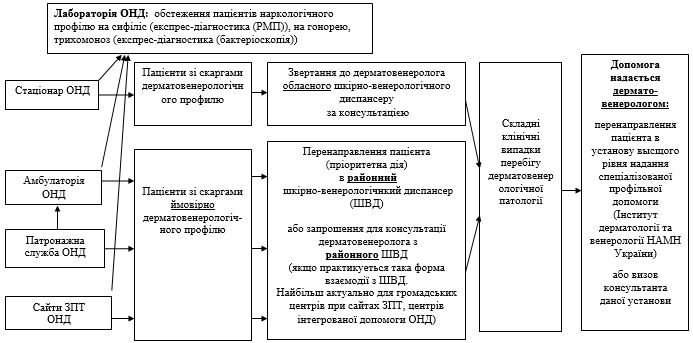
Розроблено при технічній підтримці Управління ООН по наркотикам та преступності та Агентства США з міжнародного розвитку (USAID), 2015 р
Рисунок 11.10 – Взаємодія фахівців наркологічної та дерматовенерологічної служб при наданні допомоги пацієнтам з наркологічною та дерматовенерологічною патологіями в умовах КЗОЗ «Обласний наркологічний диспансер»
11.6 Удосконалення освіти фахівців, які надають дерматовенерологічну допомогу представникам груп, уразливих щодо зараження ВІЛ та інфекціями, що передаються статевим шляхом
Представники уразливих, щодо зараження ВІЛ, груп населення відрізняються від осіб, що належать до загальної популяції. Дуже часто вони мають специфічний соціальний стан (не працюють або працюють вночі, зокрема РКС), характерні поведінкові особливості (схильність до ризикованих вчинків, девіантної поведінки, вживання наркотичних та алкогольних засоби, мають численних статевих партнерів), виражають недовіру до представників державної медицини, їм притаманна низька прихильність до лікування, дотримання призначених схем та режиму. Тому лікувально-діагностична допомога, якої вони потребують через те, що інфікування ІПСШ та ВІЛ серед них значно поширені, повинна мати особливі підходи.
Також необхідно удосконалення освіти лікарів, які працюють з представниками з груп ризику. Для надання повноцінної лікувально-діагностичної допомоги хворим цього контингенту фахівцям необхідно мати відповідні знання та навички консультування та. Тому назріла нагальна потреба в розробці циклу тематичного удосконалення лікарів.
Узагальнені дані з особливостей епідеміології, клініко-лабораторної діагностики лягли в основу розробленого Циклу тематичного удосконалення лікарів «Інфекції, що передаються статевим шляхом, а також у групах підвищеного ризику до інфікування ВІЛ/СНІД». Розроблений цикл включено до учбового процесу кафедри дерматовенерології та СНІДу Харківської академії післядипломної освіти.
Впровадження знань, що отримують лікарі на курсах тематичного удосконалення, підвищить ефективність рішення важливої проблеми – лікування та профілактики ІПСШ та ВІЛ в групах ризику, що дозволить досягти стримування розповсюдження ВІЛ/СНІДу та ІПСШ серед населення України.
Інформація, яка надається на циклі тематичного удосконалення (Навчальний план циклу, Тематичний план, Навчально-тематичні плани лекційних, семінарських занять та практичних занять на циклі тематичного удосконалення, Програма циклу тематичного удосконалення лікарів) наведені в додатках А-В.
* * *
Пацієнти, що належать до уразливих щодо зараження ІПСШ та ВІЛ груп населення (СІН, РКС, МСМ), потребують особливого підходу.
Одним з основних завдань фахівців, що працюють з даним контингентом населення, є своєчасне виявлення хворих з ІПСШ.
Необхідно проводити інформування спеціалістів, що надають допомогу представникам уразливих груп населення, зокрема лікарів сімейної практики, наркологів, гінекологів, інфекціоністів, соціальних працівників.
Доцільно проводити семінари-тренінги з метою інформування фахівців різних спеціальностей з питань ІПСШ/ВІЛ.
Фахівцям, що працюють, з особами, які належать до уразливих щодо інфікування ВІЛ та ІПСШ груп населення, доцільно проходити курси тематичного удосконалення для підвищення рівня знань з тематики, оволодіння інформацією щодо впровадження нових методів консультування, діагностики, лікування даного контингенту хворих.
Впровадження локального протоколу у формі методичного посібника представникам наркологічної служби, як дієвого засобу допомоги фахівцям, сприятиме своєчасному виявленню пацієнтів з ІПСШ серед СІН.
Для уразливих щодо зараження ВІЛ/ІПСШ груп населення рекомендується проведення діагностики ІПСШ з використанням швидких тестів. З урахуванням отриманих епідеміологічних даних доцільно проводити обов’язкове досліження на наявність Trichomonas vaginalis із застосуванням бактеріоскопічного дослідження. Дослідження доцільно проводити консультанту особисто після фахового навчання.
У разі неможливості проведення діагностики із застосуванням швидких тестів, слід призначати лікування на підставі клінічної симптоматики захворювання та анамнестичних даних.
Необхідно проводити розробку організаційно-методично-лікувальних заходів в Україні по взаємодії служб дерматовенерологічної, наркологічної, служби СНІДУ та інших, які надають допомогу представникам уразливих верств населення.
Доцільно ініціювати створення робочої групи МОЗ України з фахівців- дерматовенерологів та представників суміжних спеціальностей для розробки нормативної бази щодо впровадження синдромного підходу в Україні. Також включити методики використання синдромного підходу в лікування осіб з уразливих груп населення з ІПСШ у національні протоколи з надання дерматовенерологічної допомоги населенню України.
Публікації
- Мавров Г.І. Особливості надання дерматовенерологічної допомоги представникам груп ризику, уразливим щодо зараження ВІЛ / Г.І. Мавров, Ю.В. Щербакова // Дерматологія та венерологія. – 2012. – №1. – С. 9-18.
- Мавров Г.І. Особливості ведення пацієнтів з груп населення, уразливих щодо зараження ВІЛ / Г.І. Мавров, Г.М. Бондаренко, Ю.В. Щербакова // Дерматовенерологія. Косметологія. Сексопатологія. – 2012. – № 1-4. – С. 240-246.
- Щербакова Ю.В. Підсумки роботи навчальних семінарів для лікарів-дерматовенерологів «основні принципи синдромного підходу лікування ІПСШ у представників уразливих щодо ІПСШ/ВІЛ груп населення» з імплементацією нового посібника ВООЗ/ФНООН/ЮНЕЙДС «Реалізація комплексних програм з боротьби з ВІЛ/ІПСШ серед робітників секс-індустрії: практичні підходи на основі сучасних заходів» / Ю.В. Щербакова, І.С. Миронюк // Дерматологія та венерологія. – 2014. – № 2 (64). – С. 83-85.
- Щербакова Ю.В. Особливості взаємодії дерматовенерологічної та наркологічної служб при наданні допомоги пацієнтам наркологічного закладу з ІПСШ / Ю.В. Щербакова // Дерматологія та венерологія. – 2015. – № 2 (68). – С. 94-102.
- Мавров Г.І. Особливості діагностики та лікування інфекцій, що передаються статевим шляхом, в осіб із груп ризику, уразливих щодо інфікування вірусом імунодефіциту людини / Г.І. Мавров, Г.М. Бондаренко, Ю.В. Щербакова // Клінічна імунологія. Алергологія. Інфектологія. – 2011. – № 1. – С. 44-54.
- Пат. на корисну модель 97172 UA, МПК А61В10/00. Спосіб обмеження поширення ВІЛ/СНІД та інфекцій, що передаються статевим шляхом, хворими груп підвищеного ризику / Г.І. Мавров, Г.М. Бондаренко, Ю.В. Щербакова, Л.В. Іващенко, Л.Й. Піньковська, В.І. Миронюк; заявник і патентовласник ДУ „Інститут дерматології та венерології НАМНУ”. – № u201406144; заявл. 04.06.14; опубл. 10.03.15, Бюл. № 5.
- Сучасні заходи організації боротьби з інфекціями, що передаються статевим шляхом, та ВІЛ в Україні / Г.М. Бондаренко, Г.І. Мавров, Ю.В. Щербакова, Т.В. Губенко // Материалы научно-практической конференции «Научные и практические аспекты оказания дерматовенерологической помощи населению Украины в современных условиях», г. Харьков, 11-12 апреля 2013 г. – Дерматологія та венерологія. – 2013. – № 2 (60). – С. 85-86.
- Сучасні методи надання спеціалізованої допомоги групам населення, які уразливі щодо зараження інфекціями, що передаються статевим шляхом, і вірусом імунодефіциту людини / Г.І. Мавров, Ю.В. Щербакова, Л.В. Іващенко, І.М. Нікітенко // Матеріали науково-практичної конференції з міжнародною участю «Організація та технології медичного захисту населення в умовах проведення сучасних антитерористичних операцій», м. Дніпропетровськ, 23–24 квітня 2015 р. – Екстрена медицина: від науки до практики. – 2015. – № 2 (13). – С. 137.
- Нові підходи до діагностики та лікування ІПСШ в групах населення, уразливих щодо зараження ВІЛ (методичний посібник) / Г.І. Мавров, Г.М. Бондаренко, Ю.В. Щербакова, Л.В. Іващенко, В.І. Миронюк, Л.Й. Піньковська. – Харків : МОЗ України, НАМН України, 2013. – 48 с.
- Рекомендації з проведення добровільного консультування і тестування на наявність інфекцій, що передаються статевим шляхом, представників різних груп населення. Дотестове та післятестове консультування в практиці дерматовенеролога (методичний посібник) / Ю.В. Щербакова, Г.І. Мавров, Я.Ф. Кутасевич, Г.М. Бондаренко. – Харків : НАМН України, 2016. – 39 с.
- Спосіб обмеження поширення інфекцій, що передаються статевим шляхом, та ВІЛ хворими груп підвищеного ризику / Г.І. Мавров, Ю.В. Щербакова, Л.В. Іващенко, Г.М. Бондаренко, І.М. Нікітенко // Інформаційний бюлетень. Додаток до “Журналу Національної академії медичних наук України”. – Випуск 41. – К., 2016. – С. 31-32.
РОЗДІЛ 12
АНАЛІЗ ТА ОБГОВОРЕННЯ ОДЕРЖАНИХ РЕЗУЛЬТАТІВ
Дисертаційна робота присвячена актуальній проблемі дерматовенерології – створенню ефективної системи лікувально-профілактичних заходів з надання спеціалізованої медичної допомоги та реабілітації хворих на ІПСШ, в уразливих групах та серед загального населення з метою стримування епідемії ВІЛ/Сніду.
Згідно даних спостережень, як вітчизняних, так й закордонних науковців, ІПСШ, протягом багатьох років залишаються однією з найважливіших проблем охорони здоров’я, які є загрозою як для здоров’я населення, так й для економіки [6, 23, 53, 207].
Значна поширеність, хронічний перебіг, вагомий відсоток ускладнень, вплив на стан загального імунітету, клінічний патоморфоз та багатофокусність уражень – сучасні характеристики ІПСШ [2, 3, 6, 10, 29, 53, 57, 115, 120, 258, 272].
Статевий шлях є основним механізмом передачі ВІЛ в Україні [15, 16, 17, 19].
ІПСШ є ко-фактором зараження ВІЛ. Це пов’язано з особливостями місцевого імунітету, обумовленими ко-інфікуванням.
В свою чергу, підвищується контагіозність ВІЛ-позитивних осіб при наявності нелакованих ІПСШ. У ВІЛ-позитивних осіб з ІПСШ існує двосторонній синергічний процес, в яких ВІЛ-інфекція сприяє розвитку місцевих інфекцій, а ці захворювання сприяють збільшенню локальної реплікації вірусу. Згідно спостережень, доцільно призначати ВІЛ-позитивним особам АРТ та одночасно проводити лікування ІПСШ [53, 173, 201].
Поширеність урогенітальних патологій та ВІЛ нерівномірна в популяції. Найбільша концентрація інфекцій спостерігається в уразливих групах населення, до яких відносяться СІН, РКС, ЧСЧ [6, 55].
Світова практика підтверджує, що своєчасне виявлення та лікування ПСШ є ефективним заходом щодо профілактики поширення ВІЛ [166].
Ці факти вимагають проведення дослідження сучасних характеристик інфекцій, а саме визначення найчастіших асоціацій збудників, спектру ускладнень, уточнення гендерних відмінностей. Необхідно проводити розробку подібних методологічних документів з урахуванням соціальних, поведінкових, клініко-біологічних та інших відмін між уразливим групами та загальною популяцією, які необхідно визначити.
Для досягнення поставленої мети було заплановано провести аналіз соціальних, медичних та поведінкових чинників розповсюдження ІПСШ та ВІЛ/СНІДу в Україні з урахуванням їх взаємодії.
Доцільно було вивчити клініко-епідеміологічні особливості ІПСШ на сучасному етапі, встановити асоціацію окремих ІПСШ та ВІЛ-інфекції, поширеність та чутливість умовно-патогенної флори до лікувальних засобів. Також важливо було оцінити вплив ІПСШ на розповсюдження ВІЛ та вивчити особливості клініки та патогенезу статевих інфекцій в уразливих групах та серед загального населення.
Для поліпшення виявлення ІПСШ було заплановано встановити доцільність застосування методів експрес-діагностики ІПСШ, зокрема сифілісу та трихомонозу, в уразливих групах населення. Оцінити ефективність швидких тестів для діагностики ІПСШ серед загального населення.
Уразливі групи населення потребують специфічного підходу щодо надання лікувально-діагностичної допомоги [25, 49, 51, 260].
Тому доцільно було оптимізувати методи лікування окремих ІПСШ для представників уразливих груп та провести оцінку їх ефективності. Також важливим було запропонувати заходи щодо організації надання лікувально-профілактичної дерматовенерологічної допомоги для уразливих груп із залученням клінічної діагностики, швидких тестів, синдромного лікування та соціально-медичного супроводу пацієнтів. Потрібно було розробити систему медичного консультування представників груп ризику, пов’язану з ІПСШ та ВІЛ/СНІД, оцінити ефективність її застосування.
З урахуванням отриманих даних необхідно було розробити комплекс профілактичних заходів щодо боротьби з ІПСШ для загальної популяції та представників груп населення, уразливих щодо зараження ВІЛ. Також важливо було запропонувати для лікарів дерматовенерологів та фахівців суміжних спеціальностей навчальну програму з надання лікувально-діагностичної допомоги представникам груп ризику з розповсюдження ВІЛ/СНІДу.
В дослідженні під спостереженням перебувало 4935 осіб. До Групи 1 увійшли представники загальної популяції – 3957 осіб. Групу 2 склали представники уразливих щодо зараження ІПСШ та ВІЛ верств населення (СІН, РКС, ЧСЧ, інші) – 544 особи. Група 3 (контрольна) – 102 практично здорових особи. Також склали окрему Групу 4 склали 332 медичних та соціальних працівника, серед яких проводилося анкетування.
З метою визначення розповсюдженості ІПСШ та ВІЛ серед представників уразливих щодо зараження ІПСШ та ВІЛ груп населення (зокрема СІН, РКС, ЧСЧ) та їх статевих партнерів, які увійшли до групи 2, проведено аналіз даних за період 2011-2015 роки МБФ «Благо» (Харків), Слов’янської міської громадської організації “Наша допомога”, ПОБФ “Громадське здоров’я” (Полтава). З використанням швидких ІХГ тестів проводилося обстеження на наявність сифілісу, урогенітального хламідіозу, гонореї, гепатитів В та С, ВІЛ. Аналіз даних по регіонах відбувався наступної кількості тестувань в уразливих групах: Харків – 16795, Полтава – 14541, Закарпатська область – 3260, Слов’янськ – 16069. Також проводився аналіз даних, отриманих з Центрів СНІДу Харківської та Закарпатської області. Оцінювалися патології, в тому числі ІПСШ, з приводу яких отримували лікування представники уразливих груп населення в Харківському КЗ “Обласний центр СНІДу” та Закарпатському центру СНІДу.
В результаті дослідження встановлено, що ІПСШ поширені серед контингенту уразливих груп та їх статевих партнерів. ІПСШ (гонорея, хламідіоз, сифіліс) виявляються в середньому у 3,7% представників уразливих груп, що пройшли обстеження з використанням швидких тестів. Також спостерігається значна розповсюдженість ВІЛ (1-6 %) та гепатиту С (2,5-30,0 %).
Серед групи СІН поширені ВІЛ-інфекція, гепатит, що може бути обумовлене ін’єкційним способом вживання психостимулюючих засобів, поширеністю ризикованої сексуальної поведінки та низьким рівнем уваги до стану здоров’я.
У групі ЧСЧ хламідіоз, гонорея, сифіліс, ВІЛ зустрічаються частіше, ніж серед представників РКС, що можна пояснити практикою ризикованої сексуальної поведінки, зокрема значною кількістю статевих партнерів та незахищених сексуальних контактів [59].
Серед групи РКС частіше виявляється сифіліс, ніж серед представників інших уразливих груп, що може бути обумовлено чисельністю статевих партнерів та незахищених сексуальних контактів [51].
В регіоні з високою поширеністю ВІЛ, гепатитів В та С серед групи СІН спостерігаються також високі показники виявлення інфекцій серед їх статевих партнерів (від 1,0 до 20 %) та РКС. Також це можна пов’язати широкою розповсюдженістю вживання психостимулюючих засобів серед контингенту, що підлягав обстеженню [43, 149].
У східних областях України в останні роки, згідно отриманих даних, спостерігає реєстрація випадків сифілісу. Поширення даної патології в західних регіонах відсутнє. Даний факт може бути обумовлений регіональними епідеміологічними особливостями поширення ІПСШ, а також недостатнім обстеженням уразливого контингенту та виявленням патологій.
Представники уразливих груп часто звертаються за фаховою допомогою з приводу лікування кандидозу, хламідіозу, бактеріального вагінозу та негонорейних уретритів, генітального герпесу. В Харківській області пацієнти також отримували лікування з приводу сифілісу, виявлення нових випадків якого спостерігалося в останні роки в східних регіонах.
Звертає увагу вкрай низьке виявлення трихомонадної інфекції серед представників уразливих груп (до 10 %). Це можна пов’язати з недостатньою увагою з боку фахівців до епідемічних показників поширеності трихомонозу в країні, недостатнім обстеженням пацієнтів та відсутністю зручних швидких діагностичних тестів щодо виявлення інфекції.
Доцільно проводити постійне обстеження осіб з уразливих груп та їх статевих партнерів щодо виявлення ІПСШ, ВІЛ-інфекції, гепатитів, які є поширеними серед даного контингенту населення, з метою профілактики розповсюдження інфекцій в популяції [28].
Для виявлення поширеності ІПСШ серед загального населення було обстежено 495 осіб, які увійшли до підгрупи 1.1. Більшість осіб підгрупи 1.1, які належали до загальної популяції та пройшли обстеження і лікування в ДУ “ІДВНАМНУ», склали жінки – 274 (55,3 %). Чоловіків серед пацієнтів цієї підгрупи було 221 (44,7 %). Середній вік пацієнтів становив (32,8 ± 0,5) роки.
Серед, осіб з загального населення спостерігається високий відсоток виявлення збудників ІПСШ: трихомонади (30,1 %), Ureaplasma spp (29,7 %), ВПЛ (44,7 %). Зустрічається високий відсоток позитивності (ІФА, Ig G) до Ureaplasma urealyticum (30,0 %), Мycoplasma genitalium (20,0 %), Chlamydia trachomatis (44,7 %). Також серед пацієнтів з загальної популяції, які пройшли обстеження, часто виявлялись інфекції групи системних герпесвірусів (ЦМВ та ВЕБ), позитивність до гепатитів В та С.
Таким чином, досить часто виявляються так звані «атипові» бактерії – хламідії та урогенітальні мікоплазми. Тобто переважають внутріклітинні паразити, які здатні, за даними багатьох попередніх досліджень, суттєво пошкодити імунну систему. При цьому збільшується кількість клітин–мішеней, необхідних на початкових стадіях зараження ВІЛ (макрофагів, дендритних клітин, СD+ лімфоцитів) [53, 178, 208].
Згідно даних спостережень, ЦМВ-інфекція поширена серед осіб з низьким соціально-економічним статусом. Жінки репродуктивного віку частіше серонегативні до ЦМВ, тому існує певна загроза для них виникнення первинного інфікування під час вагітності. Первинне інфікування, реактивація та реінфекція в даній ситуації можуть привести до внутрішньоутробної передачі ЦМВ плоду, сприятиме втрати слуху та появі неврологічних порушень [141].
Також ЦМВ, ВЕБ виступають як ко-патогени й можуть сприяти прогресуванню ВІЛ-інфекції [210].
Плануючи профілактичні заходи слід рекомендувати обстеження представникам загальної популяції не тільки на ІПСШ (трихомонади, хламідії, мікоплазми), але й на наявність інших патологій (папіломавіруси, гепатити, герпесвіруси), які можуть привести до погіршення статну імунітету й передаються при статевих контактах [141, 227].
Для визначення соціальних, епідеміологічних, поведінкових відмінностей, а також особливостей перебігу ІПСШ та стану місцевого (слизового) імунітету під спостереженням знаходилися 65 осіб, що належали до груп ризику і склали підгрупу 2.1. До підгрупи 2.1а увійшли 25 пацієнтів з ВІЛ-позитивним статусом. Підгрупа 2.1б складалася з 40 ВІЛ-негативних осіб. Більшість підгрупи 2.1 склали жінки – 52 ([80,0 ± 4,9] %). Чоловіків серед пацієнтів цієї підгрупи було 13 ([20,0 ± 4,9] %).
При аналізі даних, отриманих при опитуванні представників уразливих груп, були виявлені певні соціальні відмінності в самій групі. Серед ВІЛ-позитивних осіб більшість склали СІН ((48,0 ± 9,9) % осіб). Друга за чисельністю уразлива група була представлена РКС ((28,0 ± 8,9) % ). Кількість ЧСЧ сягнула (24,0 ± 8,5) %. Серед ВІЛ-негативних представників уразливих груп більшість прийшлася на частку РКС( (62,5 ± 7,6) %). Група СІН склала (20 ± 6,3) %, ЧСЧ – (17,5 ± 6,1) %.
Проведено аналіз епідеміологічних особливостей різних груп населення – серед загальної популяції (підгрупа 1.1, 495 осіб) та уразливих груп (підгрупа 2.1, 65 осіб)]. Отримані результати підтверджені вирахуваними значущими непараметричними показниками кореляції (коефіцієнти кореляції Кендалла і Спірмена).
Встановлено, що ранній початок статевого життя сприяє частішому інфікуванню хламідійною інфекцією []. Поєднання збудників в асоціацію «хламідіоз + гонорея» не є характерним для нашого регіону – має місце зворотня кореляція [].
Встановлено, що асоціація збудників (ВІЛ та хламідіоз) частіше трапляється у представників уразливих груп []. У представників груп ризику значуще вища ймовірність зараження хламідійною інфекцією, ніж в групах загального населення [].
Ймовірно таким чином підтверджується ко-факторна особливість хламідіозу – при наявності хламідійної інфекції вище можливість інфікування ВІЛ, що співпадає з даними інших дослідників [185, 191].
Було проведено аналіз рівня інформованості щодо проблем ІПСШ та ВІЛ серед загального населення та уразливих груп. Анкетовано 165 осіб – 117 (загальне населення, підгрупа 1.2), та 48 (уразливі групи, підгрупа 2.2). Найбільший відсоток (73 %) пацієнтів складали особи віком 20-39 років.
Проведене дослідження показало, що уразливі групи відрізняються від загального населення за соціальним статусом – більшість опитуваних мали середню та неповну середню освіту; зростали в неповних сім’ях, дитячих будинках; мають статус безробітних або тимчасових робітників.
Також визначені відміни в особливостях статевої поведінки – ранній початок, особливості та інтенсивність статевого життя, кількість статевих партнерів та сексуальних контактів, їх ризикованість, мотиви виникнення випадкових контактів, низький рівень інформованості щодо можливостей інфікування та передачі широкого спектру ІПСШ та ВІЛ статевим шляхом.
При наявності скарг в анамнезі та клінічних проявів захворювань (66,7 ± 6,8) % представників уразливих груп не зверталися за фаховою допомогою, що майже в 2 рази частіше , ніж загальне населення.
В першу добу знайомства вступали в сексуальний контакт в 10 разів більше представників уразливих груп ((20,8 ± 5,9) %).
Постійного статевого партнера мали майже в 3 рази частіше представники загальної популяції (близько 70 %).
Серед представників уразливих груп на статеві контакти за грошову винагороду вказували (45,8 ± 7,2) % опитуваних, без бар’єрних засобів контрацепції – (39,6 ± 7,1) %, з партнерами однієї статі – (25,0 ± 6,3) %, з ВІЛ-позитивними особами – (18,8 ± 5,6) %.
Більшість пацієнтів обох груп володіли інформацією, що статевим шляхом передаються сифіліс, СНІД, гонорея, трихомоноз, хламідіоз. Але більш обізнаними були представники підгрупи 1.2 (95,9-75,5 % опитуваних). В підгрупі 2.2 інформованість щодо зараження ІПСШ при незахищеному сексі була обмеженою – щодо сифілісу, СНІДу, гонореї – знали 85-73 % опитуваних, трихомонозу, гепатитів , хламідіозу –46-40 %, мікоплазмозу, ВПЛ – 19-15 %.
В підгрупі 1.2 як метод профілактики ІПСШ та ВІЛ більшість осіб зазначили наявність одного постійного статевого партнера, в підгрупі 2.2 – використання презервативу.
Серед представників уразливих груп спостерігається занадто толерантне ставлення (позитивне та байдуже) до надавання сексуальних послуг за винагороду (81 %), вживання наркотиків (73 %), позашлюбних контактів (82 %), що вище даних загальної популяції в 4-12 разів.
За даними опитування, тільки в підгрупі 2.2 (8,3 ± 4,0) % респондентів вживали наркотики раніше, ще 8,5 % застосовували постійно, (18,8 ± 5,6) % споживали разом з ВІЛ-позитивними, чий ВІЛ-статус вони знали, також вживали епізодично.
Вживання алкоголю та інших психоактивних речовин призводить до виникнення ризикованої сексуальної поведінки [218].
За даними опитування більшість респондентів підгрупи 1.1 зазначили, що алкоголь пригнічує або не впливає на статеву функцію (28,2 ± 4,2) % та (43,6 ± 4,6) % відповідно. Навпаки у підгрупі 2.2 більшість осіб (68,8 ± 6,7) % респондентів вказали, що алкоголь стимулює статеву функцію. На регулярне вживання алкоголю вказує в 2,6 рази більше представників підгрупи 2.2.
Наявність хронічних ІПСШ та інші проблеми в урогенітальній сфері здоров’я впливають на психологічний стан пацієнтів всіх верст в населення. Почуття самотності та невпевненості в майбутньому, особиста незахищеність на фоні асоціального способу життя та девіантної поведінки приводили до значного погіршення якості життя. Близько 22 % опитуваних підгрупи 1.2 охарактеризовані консультантами як недовірливі та замкнені особи. На порушення сну вказували (22,2 ± 3,8) % респондентів. В підгрупі 2.2 наявність судинних дистоній відзначав кожний четвертий опитуваний, а порушення нормальної роботи шлунково-кишкового тракту – 12,5 % представників уразливих груп.
Значну роль відіграє соціальне оточення. Респонденти підгрупи 2.2 відрізнялися від загального населення приналежністю до уразливих груп особисто (РКС – (43,8 ± 7,2) %), СІН – (35,4 ± 6,9) %, ЧСЧ – (25,0 ± 6,3 %)), та наявністю значної кількості осіб з даного прошарку населення в близькому оточенні. В порівнянні з даними загальної популяції, серед родичів та друзів представників уразливих груп спостерігалося в 3 рази більше хворих на алкоголізм, в 6 разів більше осіб, які перебували в місцях позбавлення волі, в 12 разів більше СІН. Також (14,6 ± 5,1) % вказали на наявність ВІЛ-інфікованих, що серед даних загальної популяції не зустрічалося.
Використання методу мотиваційного консультування пацієнтів з ІПСШ призводить до зниження ризиків інфікування ІПСШ та зміни сексуальної поведінки в бік більш безпечної [51, 77, 102].
Під час проведення мотиваційного консультування 210 осіб, що належать до групи РКС і увійшли до підгрупи 2.3, відбулося їх анкетування з метою визначення рівня інформованості щодо питань ІПСШ та ВІЛ. Респондентам було запропоновано заповнити розроблену анкету – дати відповіді на питання. Визначення рівня знань проводилося до інформування та після. Розроблена анкета складалася з 10 питань з різними варіантами відповідей. Зміна рівня знань оцінювалася у відсотковому співвідношенні. Оброблено 420 анкет – 210 анкет до інформування та 210 анкет після цього.
Під час проведення консультування представникам уразливих груп була надана інформація щодо контагіозності ІПСШ, ймовірності зараження та їх передачі статевим шляхом, вертикальної трансмісії. Доводилася доцільність використання бар’єрних засобів контрацепції при всіх видах сексуальних контактів на протягом всього акту. Також проводилася оцінка усвідомленості застосовування презервативів, їх використання при різних видах сексуальних контактів, та доцільності проходження періодичного обстеження на наявність ІПСШ.
Анкетування після проведеного консультування показало підвищення рівня інформованості контингенту майже на 30-40 %, усвідомлення більшістю респондентів ([89,5 ± 2,1] %) важливості періодичного обстеження на ІПСШ, застосування засобів контрацепції при всіх видах сексуальних контактів, кожному окремо та всій його тривалості.
З метою оцінки впливу уражень шкіри та ІПСШ на стан імунітету у осіб з ВІЛ-інфекцією до та після лікування дерматовенерологічної патології було проведено дослідження. До підгруп 2.4 і 2.5 увійшли 50 ВІЛ-позитивних пацієнтів у віці від 19 до 64 років. Більшість склали жінки – 26 пацієнток ([52,0 ± 7,1] %), чоловіки – 24 особи ([48,0 ± 7,1] %). Середній вік пацієнтів сягав (36,5 ± 1,0) року. До підгрупи 2.4 увійшли 23 пацієнти з ураженнями шкіри, до підгрупи 2.5 – 27 хворих, у яких було діагностовано ІПСШ. До підгрупи порівняння (підгрупа 3.1) були включені 30 осіб – практично здорові донори. Середній вік пацієнтів був (37,7±1,2). Найбільший відсоток серед хворих з ураженнями шкіри склали особи з кандидозом шкіри й великих складок та себорейним дерматитом (13 ([56,5 ± 10,3] %) та 12 ([52,2 ± 10,4] %) відповідно).
В підгрупі 2.5 більшість склали особи з хламідійною інфекцією. Дана патологія діагностована у 17 ([63,0 ± 9,3] %) пацієнтів. Урогенітальний кандидоз зустрічався майже у третини пацієнтів.
У хворих з ураженнями шкіри частіше, ніж у підгрупі 2.5 були діагностовані бронхіти (у 10 ([43,5 ± 10,3] %) проти 7 ([25,9 ± 8,4] %)), ЦМВ-інфекція (6 – [26,1 ± 9,2] %), пневмонії (5 – [21,7 ± 8,6] %), виявлений ВЕБ (2 – [8,7 ± 5,9] %). Пієлонефрити та енцефалопатії, гепатит В, які були визначені в 19 % випадків зустрічалися майже в 5 разів частіше, ніж у осіб з ІПСШ. У підгрупі 2.5 частіше зустрічалися випадки токсоплазмозу та туберкульозу (4 – [14,8 ± 6,8] %). Плеврити та аднексити серед пацієнтів з ІПСШ діагностовано майже в 3 рази частіше, ніж у підгрупі 2.4. Гепатит С виявлений у пацієнтів обох груп, але серед пацієнтів з ІПСШ майже в 1,5 рази частіше. Ендоцервіцит, кольпіт, ерозія шийки матки, позаматкова вагітність зустрічалися у 2,5–7 % хворих з ІПСШ, випадки піодермії, синдром Стівенса-Джонсона – у 2,5–5 % представників підгрупи 2.4. Супутні стани та захворювання у вигляді дисбактеріозу, гепатиту, нефропатії зустрічалися у 4–6 % ВІЛ-інфікованих пацієнтів обох підгруп. У пацієнтів обох підгруп рідко спостерігалося виявлення лише одного захворювання. В підгрупі 2.4 найпоширенішим був себорейний дерматит, який реєструвався в більшості випадків разом з кандидозом, алергічним дерматитом, мікозом або ЦМВ-інфекцією (близько 30 % випадків).
Поєднання трьох захворювань найчастіше виявлялося також у пацієнтів з себорейним дерматитом. Окрім основного захворювання одночасно виявляли мікози, алергічні дерматити, токсоплазмоз, енцефалопатію, бронхіт.
В підгрупі пацієнтів з ІПСШ (підгрупа 2.5) найпоширеніший хламідіоз поєднувався в значній кількості випадків з кандидозом, трихомонозом, ВПГ, ЦМВ-інфекцією, бронхітом.
У хворих на хламідіоз, кандидоз, ВПГ в значній кількості випадків спостерігали одночасно наявність гепатиту С.
При поєднанні трьох патологій у пацієнтів з хламідійною інфекцією одночасно діагностували ВПЛ, кандидоз (урогенітальний та шкіри), ВПГ (генітальний, простий та зостер), трихомоноз.
Встановлено, що поєднання ВІЛ-інфекції з ураженнями шкіри та венеричними захворюваннями є додатковим фактором декомпенсації імунної системи хворих, несприятливого клінічного перебігу захворювань та підвищенню контагіозності ВІЛ-позитивних осіб, що спостерігається й в інших дослідженнях [191, 273].
Найбільш виражені зміни були з боку Т-хелперів (CD4+клітин), що співпадає з даними, отриманими іншими дослідниками [180, 247].
Середні показники їх абсолютної кількості в периферичній крові у хворих обох підгруп до лікування були майже втричі нижче контрольного рівня. Після лікування відзначалось підвищення цього показника приблизно до 60 % від контрольного рівня.
Подібні зміни відображались з боку відносної кількості Т-хелперів. Виявлені зміни – відображення безпосередньої дії ВІЛ на цю клітинну популяцію, яка становить центральну ланку патогенезу ВІЛ-інфекції. Суттєвої різниці цих показників в підгрупах 2.4 та 2.5 не відзначено. У підгрупах до лікування абсолютна кількість Т-хелперів була знижена відносно цього показника у контрольній групі у 2,8 і 3,0 разу відповідно. У процесі лікування спостерігалася тенденція до нормалізації зазначеного показника в обох підгрупах у 1,6 разу. Після проведеного лікування середнє значення показника у підгрупах 2.4 і 2.5 зросло до (465,4 ± 38,2) кл/мм3, що як і раніше було достовірно нижче показника контрольної групи, який складав (844,7 ± 72,7) кл/мм3. Після лікування рівень абсолютної кількості Т-хелперів у обох підгрупах (2.4 і 2.5) був знижений відносно підгрупи контролю в 1,8 разу.
У осіб з ІПСШ (підгрупа 2.5) найбільш несприятливі показники вірусного навантаження були виявлені при поєднанні ВІЛ-інфікування з сифілісом, що співпадає з даними спостережень [248, 273].
Виявлені середні значення вірусного навантаження при сифілісі значно вищі, ніж середні показники решти обстежених хворих підгрупи 2.5. Сифіліс призводить до значних змін показників імунітету. Після санації сифілісу компенсація імунітету проявляється значним зниженням вірусного навантаження. За даними інших дослідників, лікування ІПСШ, які сприяють появі геніальних язв, може привести до зниження вірусного навантаження в деяких випадках, але спостерігалося це у всіх пацієнтів [189, 218].
Показано, що додатковий активуючий вплив на імунну систему, що супроводжує шкірну патологію або ІПСШ, сприяє більш активному ураженню Т-хелперів вірусом імунодефіциту. Виявлена негативна кореляція між рівнем вірусного навантаження і кількістю Т-хелперів в периферичній крові, що є показником стану декомпенсації системи Т-хелперів при поєднанні ВІЛ-інфікування з ураженнями шкіри або ІПСШ. У хворих зі дерматологічною та венерологічною патологією характер зміни цих показників схожий, однак у хворих з ураженнями шкіри ступінь зниження вірусного навантаження помітно менше, ніж у хворих з венерологічною патологію, хоча рівень навантаження при ІПСШ вищий. Після санації сифілісу вірусне навантаження в групі хворих з ІПСШ (разом з сифілісом) знижувалося в середньому в 26 разів, з дерматологічною патологією – у середньому в 5,5 разу. При оцінці навантаження в підгрупі пацієнтів з ІПСШ, за виключенням хворих на сифіліс, спостерігалося зниження показника після лікування в 42 рази.
Визначення вмісту sIg A на слизових оболонках уретри та піхви здійснено у 121 особи, яких було розподілено на 4 підгрупи. До підгрупи 1.3 увійшли 40 пацієнтів з ІПСШ з загальної популяції. До підгрупи 2.1а увійшли 25 хворих з ІПСШ та ВІЛ-позитивним статусом, які відносяться до уразливих груп. До підгрупи 2.1б включені пацієнти (40 осіб) з ІПСШ та ВІЛ-негативним статусом, що належать до уразливих груп. Підгрупу 3.2 склали практично здорові донори (16 осіб). Більшість представників уразливих груп склали жінки – 52 ([80,0 ± 5,0] %). Чоловіків серед пацієнтів групи спостереження було 13 ([20,0 ± 5,0] %). Середній вік пацієнтів склав (26,7 ± 1,6) року.
В різних групах хворих з ІПСШ встановлені достовірні відмінності вмісту sIgА. При цьому найнижчі показники відзначалися в підгрупі 1.3 хворих із загального населення ([36,6 ± 4,6] мкг/г), а найвищі – в підгрупі 2.1а – (206,0 ± 19,9) мкг/г, у хворих з ІПСШ з ВІЛ-позитивним статусом.
У хворих з ІПСШ, що належать до загального населення (підгрупа 1.3), відзначали достовірне зниження sIgА ([36,5 ± 4,6] мкг/г) в порівнянні з даними практично здорових осіб ([51,7 ± 8,7] мкг/г). З одного боку, це можна пояснити недостатньо успішним функціонуванням клітин епітелію через виснаження місцевого імунітету в патологічних умовах хронічного тривалого процесу [58], а з іншого – тим, що в загальній популяції функції клітинного імунітету відносно збережені. При інфікуванні ІПСШ, саме вони є вирішальними для елімінації збудників, які вже проникли в організм та спричинили інфекцію, щ співпадає з думками дослідників [36, 41, 130].
При цьому функція гуморального імунітету дещо пригнічується (нормальна імуносупресія). Що стосується здорових людей, то в них гуморальний слизовий імунітет виконує сторожову, попереджувальну функцію. Секреторні антитіла активні ще до втручання збудників. Якщо вони спрацюють – зараження не відбудеться. А якщо зараження все ж наступить – вони підлягають супресії, з переключенням на клітинний імунітет (Т-хелпери, Т-кілери, Т-ефектори й т.д.), що й трапляється в підгрупі 1.3.
У більшості хворих з ІПСШ, що належали до загального населення переважав хронічний процес, на тлі якого реєструвалися незначні клінічні прояви інфікування. Зниження показників місцевого імунітету співпадає з даними інших дослідників [92, 106].
За даними спостережень, дефіцит sIg A призводить спочатку до розвитку хронічних інфекційних уражень шкіри та слизових оболонок, як наслідок, хронічний запальний процес закономірно ускладнюється [41].
Наявність місцевого запалення, низький вміст sIg A сприяє зараженню ІПСШ [150].
У пацієнтів з ІПСШ з уразливих груп спостерігаються вірогідні зміни вмісту sIg A на слизових оболонках уретри та піхви в порівнянні з показниками здорових осіб. Відмінності більш виражені, ніж у осіб з загального населення підгрупи 1.3. Найбільш виражені порушення спостерігаються у ВІЛ-позитивних осіб з ІПСШ.
У хворих з ІПСШ, що відносяться до уразливих верств населення, частіше виявлялося мікст-інфікування ІПСШ, яке супроводжувалося маніфестацією клінічних проявів, переважав гострий процес.
Вміст sIgА на слизових оболонках урогеніталій у хворих з ВІЛ-негативним статусом з уразливих груп був достовірно вищий ([80,3 ± 7,1] мкг/г) показників практично здорових осіб ([51,7 ± 8,7] мкг/г). Спостереження співпадає з даними інших дослідників, визначавших підвищення показника на фоні загострення запального процесу та на етапі гострої інфекції [108, 109, 117, 164, 209].
У хворих з ВІЛ-позитивною реакцією дані перевищували показники контрольної групи майже в 4 рази ([206,0 ± 19,9] мкг/г), що можна співставити з більш вираженими порушеннями імунітету на тлі ВІЛ-інфекції.
Різке підвищення або зниження рівня sIg А може виступати як ознака стану місцевого гуморального імунітету. Також може бути розцінено як показник несприятливого перебігу ІПСШ, оскільки свідчить про порушення імунної відповіді, пов’язаної з порушенням ефекторної та/або супресорної функції імунної системи.
Отримані дані дозволяють зробити висновок, що у представників уразливих груп існує більша вірогідність зараження та передачі ІПСШ та ВІЛ статевим шляхом статевим партнерам, враховуючи особливості їх ризикованої статевої поведінки, велику кількість статевих партнерів, наявність виражених клінічних проявів ІПСШ, низький рівень уваги до збереження особистого репродуктивного здоров’я, наявність урогенітальних запальних процесів, що також сприяють передачі інфекцій статевим шляхом. Тому необхідно більше уваги приділяти саме представникам уразливих груп, проводячи просвіту з питань ІПСШ та мотивуючи їх до більш безпечної статевої поведінки, застосування бар’єрних методів контрацепції при кожному статевому контакті. Таким чином можна підвищити профілактику розповсюдження ІПСШ та ВІЛ в популяції.
Проведено клініко-лабораторний моніторинг етіологічної структури збудників захворювань сечостатевого тракту та їх чутливості до лікарських засобів у осіб репродуктивного віку з ІПСШ. В дослідження увійшли 1140 осіб, що належали до загальної популяції і увійшли до підгрупи 1.4, віком від 19 до 46 років (середній вік – (32,5±2,4) року). Більшість склали жінки – 604 особи (53 %), кількість чоловіків, які увійшли до цієї підгрупи, сягнула 47 % (536 осіб). Всі пацієнти отримували лікувально-діагностичну допомогу в ДУ «ІДВ НАМНУ» з приводу запальних захворювань сечостатевого тракту. Також було проведено бактеріологічне дослідження стану вагінального біотопу жінок, що належали до уразливих груп населення (РКС та СІН). Усього було обстежено 48 осіб у віці від 18 років до 41, які сформували підгрупу 2.6. Середній вік пацієнтів груп склав (29,5±6,5) року.
Встановлено високу інфікованість ([61,6 ± 1,0] %) обстежених пацієнтів з запальними захворюваннями урогенітального тракту. Серед представників загальної популяції трихомонадна інфекція визначена майже в 43 % виявлених випадків (32-55 %), причому як у вигляді моноінфекції, так й в асоціаціях з іншими збудниками, хламідійна – майже у чверті випадків – (25,5±4,7) %.
Серед представників уразливих груп населення трихомонадна інфекція визначена у (58,3 ± 7,1) % випадків, хламідійна – у (33,3 ± 6,8) %. Наявність облігатних збудників ІПСШ призводила до зсувів у вагінальному біотопі жінок цієї групи з переважанням патогенних різновидів стафілококів та окремих представників родини Enterobacteriaceae. У (25,0 ± 6,3) % випадків був діагностований бактеріальний вагіноз, що у 2,5 рази частіше, ніж у групі жінок загальної популяції, що співпадає з даними інших дослідників [101].
При визначенні чутливості вилучених мікроорганізмів до антибактеріальних препаратів встановлено досить високу резистентність стафілококів до препаратів групи пеніцилінів та тетрациклінів (64,2-53,8 % у групі загального населення та 70,8-58,3% у представниць уразливих груп) та відносну нечутливість представників родини ентеробактерій до окремих цефалоспоринів (близько 33 % у групі загального населення та 34,3 % у представниць уразливої групи), за винятком цефіксиму, що пов’язано з наявністю у збудників β-лактамаз розширеного спектра дії.
У випадках призначення синдромного лікування ІПСШ представникам уразливих груп доцільно проводити терапію з урахуванням чутливості збудників до антибактеріальних препаратів.
Для вивчення запальних захворювань органів малого тазу у пацієнтів з хронічними ІПСШ та визначення їх клінічних проявів при моноінфекції та мікст-інфікуванні проведено аналіз даних обстеження 1219 пацієнтів, які увійшли до підгрупи 1.5. Серед 1219 пацієнтів більшість ([55,5 ± 1,4] %) склали жінки – 677 пацієнток у віці від 18 до 51 року. У дослідження увійшло 542 чоловіка ([44,5 ± 1,4] %) віком від 20 до 57 років. В майже 70 % випадків, як у чоловіків, так й у жінок виявляли клінічні прояви та ускладнення ІПСШ, був діагностований у чоловіків уретрит, у жінок – ендоцервіцит. Найчастіше ізолювали Т. vaginalis у монокультурі в 25-28 % випадків у осіб обох статей. На другому місці по частоті виявлення перебувала асоціація Т. vaginalis та С. trachomatis у 149 ([27,5 ± 1,9] %) і 127 ([18,6 ± 1,5] %) відповідно. Асоціація Т. vaginalis з U. urealyticum та умовно-патогенними збудниками спостерігалася у майже 14 % хворих незалежно від статі. Встановлено, що причиною появи клінічних проявів та ускладнень захворювань в середньому в 63 % випадків були збудники ІПСШ. Необхідно враховувати також наявність умовно-патогенної мікрофлори, яка виявляється майже в 14 % випадків та призводить до розвитку хронічних рецидивуючих кольпітів та уретритів. У 2/3 випадків ускладнень провідну роль відіграє трихомонадна інфекція. Це може визначати характер емпіричного лікування за епідеміологічними показниками, а також використання синдромного підходу у веденні пацієнтів з уразливих груп населення.
Впровадження дієвих програм з діагностики та лікування ІПСШ у представників груп підвищеного ризику є дієвим механізмом впливу на поширення ІПСШ та ВІЛ статевим шляхом [25, 110].
Для визначення ефективності застосування бактеріоскопічного та бактеріологічного методів щодо виявлення збудників ІПСШ проведено аналіз результатів обстежень 388 осіб. Усі пацієнти були розподілені на три підгрупи (підгрупи 1.6, 1.7 і 2.6). Особи, що увійшли до підгруп 1.6 та 2.6, звернулися з метою обстеження на наявність ІПСШ з різних приводів – задля профілактичного обстеження, без скарг, перед плануванням вагітності, з періодично виникаючими скаргами та проявами (помірної інтенсивності) наявності ІПСШ, тощо. До підгрупи 1.6 увійшли 196 пацієнтів, що відносяться до загального населення (112 жінок та 84 чоловіка – підгрупи 1.6а та 1.6б). Підгрупу 2.6 склали 48 жінок, що належать до уразливих груп населення (РКС, СІН). У підгрупу 1.7 були включені 144 особи (загальне населення) з наявними скаргами та вираженими клінічними проявами трихомонозу, які проходили лікування в ДУ «ІДВНАМНУ». Особи цієї підгрупи були розподілені за статтю (підгрупа 1.7а – 75 жінок та підгрупа 1.7б – 69 чоловіків). У дослідження увійшли пацієнти віком від 19 до 61 років. Середній вік хворих склав 40,0±7,4. Пацієнти підгрупи 1.7 були розподілені на дві підгрупи за статтю – 75 жінок (підгрупа 1.7а) та 69 чоловіків (підгрупа 1.7б) окремо. Всі пацієнти, які зверталися за лікувально-діагностичною допомогою, мали виражені ознаки наявної інфекції (гіперемія, набряк слизових оболонок, патологічні виділення з сечостатевих органів) та пред’являли скарги на печію, свербіж, дискомфорт в області геніталій.
При обстеженні жінок підгруп 1.6а та 2.6 при проведенні бактеріоскопічного та бактеріологічного обстеження були отримані наступні дані. Серед жінок загального населення трихомонадна інфекція виявлена в середньому у (34,8 ± 4,7) % випадків, у представниць уразливих груп – в (51,9 ± 6,4) % випадків. При застосуванні бактеріоскопічного методу дослідження T. vaginalis виявлено в підгрупі 1.6а у 34 ([30,4 ± 4,3] %) пацієнток. Методом культивування підтверджено наявність трихомонадної інфекції у 44 ([39,3 ± 4,6] %) осіб. Також при бактеріоскопічному дослідженні «ключові» клітини виявлено у 12 ([10,7 ± 2,9] %) випадків, Candida spp. – у 5 ([4,5 ± 2,0] %) пацієнток. При обстеженні чоловіків з підгрупи 1.6б в мазках виявлено трихомонади у 13 ([15,5 ± 3,9] %) осіб, методом культивування – у 18 ([21,4 ± 4,5] %) пацієнтів.
При обстеженні жінок підгрупи 1.7а із застосуванням бактеріоскопічного методу дослідження T. vaginalis виявлено у 44 ([58,7 ± 5,7] %) випадків. Методом культивування підтверджено наявність трихомонадної інфекції у 64 ([85,0 ± 4,1] %) випадків. Також при бактеріоскопічному дослідженні «ключові» клітини виявлено у 9 ([12,0 ± 3,8] %) випадків, Candida spp. – у 4 ([5,3 ± 2,6] %) пацієнток. Негативний результат при обстеженні пацієнток з наявними симптомами ІПСШ, які звернулися за лікувально-діагностичною допомогою, склав середньому (28,0 ± 13,3) % випадків.
При обстеженні чоловіків підгрупи 1.7б (69 осіб) в мазках виявлено трихомонади у 29 ([42,1 ± 5,9] %) випадків. Методом культивування виявлено трихомонади у 44 ([63,7 ± 5,8] %) випадків у пацієнтів з симптоматичною інфекцією. У 2 ([2,9 ± 2,0] %) випадків у мазках чоловіків з гострими клінічними проявами ІПСШ була виявлені гонококи. Негативні результати обстеження виявлені у чоловіків в середньому в (47,1 ± 10,8) % випадків.
Таким чином, у жінок спостерігається достатньо високий відсоток ([58,7 ± 5,7] %) діагностування урогенітального трихомонозу за допомогою мікроскопії. Доцільно бактеріологічну діагностику у жінок проводити у випадку неуспіху при виконанні бактеріоскопічного дослідження. Застосування методу бактеріоскопії для діагностики трихомонозу у чоловіків ефективне при використанні у пацієнтів з симптомами. Доцільно рекомендувати проводити культивування збудника у всіх випадках діагностики у чоловіків одночасно з мікроскопією для покращення діагностики інфекції.
В багатьох випадках, бактеріоскопічний метод діагностики ІПСШ може бути застосований як скринінговий метод, також як метод встановлення діагнозу. Бактеріоскопічний метод уможливлює надання лікувально-діагностичної допомоги контингентам населення з ІПСШ, у яких обмежений доступ до спеціалізованої допомоги (жителі сіл, маленьких міст, солдати строкової служби, особи у відрядженні, вимушені переселенці, військовослужбовці , які прибули на ротацію, представники уразливих груп, тощо). Проведення мікроскопії нативних та забарвлених (за Грамом і метиленовим синім) препаратів виділень з урогенітального тракту можливе безпосередньо при первиннім візиті до спеціаліста. Діагностика проводиться з незначними витратами часу фахівця, та навіть за наявності мінімального матеріально-технічного оснащення ЛПЗ. При наявності навичок та досвіду проведення бактеріоскопічного дослідження препаратів, ІПСШ можуть бути діагностовані особисто лікарем. Діагностика ІПСШ із застосуванням бактеріоскопічного методу ґрунтується на досвіді клінічної діагностики захворювань та навичок лабораторної діагностики. Це ефективний метод надання лікувально-діагностичної допомоги різним верствам населення, що відзеркалено в дослідженнях та розроблених керівництвах [38, 94, 112, 124, 160, 195, 262, 274].
Для визначення доцільності використання швидких тестів для діагностики сифілісу, рекомендацій щодо їх застосовування для різних верств населення, проводили тестування 662 осіб, в тому числі 337 хворих на сифіліс. У підгрупу 1.8 увійшли всього 284 особи. Підгрупу 1.8а склали 94 пацієнти з ранніми ([33,1±2,8] %), підгрупу 1.8б – 190 хворих з пізніми ([66,9±2,8] %) формами сифілісу. Також обстеження пройшли 53 вагітні (підгрупа 1.9). До підгрупи 1.9а увійшли 12 жінок ([22,6±5,8] %) з раннім, до підгрупи 1.9б – 41 пацієнтка ([77,4±5,8] %) з пізнім сифілісом.
Було обстежено 96 осіб з хибною позитивністю серологічних реакцій (підгрупа 1.10), серед яких було 52 вагітні жінки ([54,2±5,1] %), що склали підгрупу 1.10б. До підгрупи 1.10а увійшло 44 пацієнти із загального населення ([45,8±5,1] %). Підгрупу порівняння (підгрупа 1.11) склали хворі з дерматологічною патологією – 173 особи. До підгрупи 3.3 (контрольна підгрупа) увійшли 56 здорових осіб.
При визначенні оптимальних швидких методів серодіагностики сифілісу, метод ІФА було обрано в якості стандарту, якому притаманні висока чутливість та специфічність. При обстеженні хворих як з ранніми, так і з пізніми формами сифілісу (підгрупа 1.8) спостерігався достатньо високий відсоток (вище 95 %) виявлення хворих методами експрес-діагностики (ІХГ, РМП, RPR), які можна застосовувати для скринінгу. Але частота визначення позитивних результатів дещо варіювала. За допомогою РМП виявлено в середньому 96,3 % хворих на сифіліс (89 [94,7 ± 2,3] % хворих з раннім та 186 [97,9 ± 1,0] % з пізнім сифілісом). Частота виявлення хворих на сифіліс методом RPR була майже однаковою і склала 90 ([95,7 ± 2,1] %) для раннього і 182 ([95,8 ± 1,5] %) для пізнього сифілісу. За допомогою «швидких тестів» ІХГ було виявлено 99,5 % позитивних реакцій, при чому серед осіб з пізнім сифілісом дані склали 100 %, з раннім – 93 (98,9 ± 1,1) %. При проведенні діагностики сифілісу серед осіб з хибною серопозитивністю методами ІФА, РПГА та РЗКт у 7 ([15,9 ± 5,5] %) випадків отримана позитивна відповідь серед представників різних верств населення та в 7 ([13,5 ± 4,7] %) вагітних. Що стосується РЗКк, то частота визначення позитивних результатів становила 100 %.
Доцільно рекомендувати ІХГ тест до застосування для визначення сифілісу. Залежно від оснащення ЛПЗ та існуючої епідемічної ситуації доцільно проводити скринінгове обстеження на сифіліс з використанням методів ІХГ або ІФА, або РПГА та за допомогою одного з нетрепонемних тестів: РМП, RPR. Доцільно у випадках отримання позитивної відповіді для підтвердження результату проводити дослідження із застосуванням інших трепонемних тестів – РПГА, ІФА. Особи без клінічних проявів захворювання, що були в статевому або побутовому контакті з хворими на сифіліс, підлягають обстеженню за допомогою РМП, або RPR, та ІФА IgM або ІФА сумарні або РПГА, ІХГ.
Для визначення ефективності застосування крему іміквімод 5 % в лікуванні гострокінцевих кондилом аногенітальної локалізації у ВІЛ- позитивних осіб під спостереженням знаходилися 43 пацієнти з гострокінцевими кондиломами аногенітальної локалізації, які увійшли до підгрупи 2.7 та належали до наступних груп ризику. СІН були 13 ([30,2 ± 7,0] %), особи, що проходили обстеження, як статеві партнери ВІЛ-інфікованих – 15 ([34,9 ± 7,3] %), ЧСЧ – 11 ([25,6 ± 6,7] %), РКС — 4 ([9,3 ± 4,4] %). У результаті обстеження пацієнтів не було діагностовано жодного випадку сифілісу, уреаплазмової інфекції, гонореї, гепатиту В. Кандидоз, гепатит С виявлені у 14 ([34,9 ± 7,3] %) обстежених, герпес – у 13 ([30,2 ± 7,0] %), хламідіоз – у 11 ([25,6 ± 6,7] %) випадків, що співпадає з даними спостережень [20, 21, 26].
Локалізація гострокінцевих кондилом у пацієнтів була наступна: на статевих губах у жінок висипи спостерігалися у 11 ([25,6 ± 6,7] %) обстежених, біля входу в піхву – у 9 ([20,9 ± 6,2] %), у чоловіків на голівці статевого члена – у 19 ([44,2 ± 7,6] %), на стовбурі статевого члена – у 17 ([39,5 ± 7,5] %), у лобковій зоні – у 4 ([9,3 ± 4,4] %), у перианальній ділянці – у 11 ([25,6 ± 6,7] %) пацієнтів.
У більшості пацієнтів гострокінцеві кондиломи локалізувалися на декількох ділянках одночасно (27 – [62,8 ± 7,4] % хворих) – майже у 2/3 хворих, що також спостерігається в інших дослідженнях [63, 122, 269].
Пацієнти були розподілені на дві підгрупи. До підгрупи 2.7а увійшли 22 ВІЛ-позитивні пацієнти з ВПЛ, які отримували в якості монотерапії крем, що містив іміквімод 5 %. Іміквімод крем (у пакетиках для одноразового застосування пацієнти застосовувався 3 рази на тиждень, наносився на кондиломи увечері за 8 годин (±2 години) перед сном, а на наступний ранок ділянка нанесення очищувалася водою і милом. Лікування тривало до повного регресу клінічних проявів (зникнення кондилом), але не довше 8 тижнів. До підгрупи 2.7б (група порівняння) увійшов 21 ВІЛ-позитивний пацієнт з гострокінцевими кондиломами, в лікуванні яких застосовували методи абляційної терапії (кріодеструкція, електродеструкція).
У підгрупі 2.7а при застосуванні крему іміквімод в лікуванні гострокінцевих кондилом регрес висипів спостерігався протягом 3 тижнів у 2 ([9,1 ± 6,1] %) пацієнтів, через місяць – ще у 1 ([4,5 ± 4,4] %). Більшість пацієнтів (19 – [86,4 ± 7,3] %) застосовувала іміквімод крем протягом 8 тижнів. Більшість пацієнтів (19 – [86,4 ± 7,3] %) відзначали добру переносимість іміквімоду. У (13,6 ± 7,3) % випадків відзначалося виникнення місцевих реакцій незначної або помірної інтенсивності в ділянці нанесення препарату у вигляді гіперемії та набряку, що співпадає з даними інших досліджень [215].
Зникнення аногенітальних кондилом при місцевому застосуванні іміквімоду спостерігалося через 3-8 тижнів, зокрема через 3 тижні – у (9,1 ± 6,1) % осіб, через місяць – ще у (4,5 ± 4,4) %, через 8 тижнів – загалом у (86,4 ± 7,3) %). У (13,6 ± 7,3) % осіб, які мали поширені висипи з тривалістю кондиломатозу близько 1 року, повного регресу висипань не було відзначено, але кількість елементів зменшилася приблизно на 70 %.
Відсутність рецидивів гострокінцевих кондилом після терапії іміквімод кремом через 1 місяць спостерігалася у 18 ([81,8 ± 8,2] %) пацієнтів, через 3 місяці – у 15 ([68,2 ± 9,9] %) осіб, що перебували під спостереженням у підгрупі 2.7а.
Через 3 місяці у пацієнтів обох груп проводили оцінку стану імунітету шляхом визначення кількості CD4+. У підгрупі 2.7а, пацієнти якої отримували лікування із застосуванням іміквімод крему, рівень CD4+ через 3 місяці майже не змінився (до лікування – 406,18 ± 58,72) та становив 393,5 ± 118,57 (р > 0,05).
Встановлено, що іміквімод крем в якості монотерапії є ефективнішим за абляційні методи лікування. Це проявляється у значному відсотку ([68,2 ± 9,9] %) випадків спостереження відсутністю рецидивів гострокінцевих кондилом аногенітальної локалізації, зменшенням частоти рецидивування та кількості елементів, подовженням міжрецидивного періоду після успішно проведеного лікування, що співпадає з даними досліджень інших авторів [230].
При наданні лікувально-діагностичної допомоги особам уразливих груп з ІПСШ доцільно застосовувати синдромний підхід, рекомендований в міжнародних настановах, розроблених до використання в цих групах населення. Завданням фахівця є визначення одного з синдромів та організація ведення хворого, з використанням відповідної схеми [22, 234, 245, 261].
Синдромне лікування призначається за наступними симптомами: виділення з уретри; виділення з піхви; біль унизу живота у жінок; генітальні виразки; припухлість калитки.
Перевагами синдромного підходу є: прискорення надання хворому медичної допомоги; лікування при первинному звертанні до лікаря; економічність за рахунок виключення дорогих лабораторних тестів; зниження частоти передачі інфекції й ризику розвитку ускладнень через відсутність лікування; можливість стандартизації діагностики, лікування, оповіщення партнерів.
Проведено консультування 133 ЖКС (підгрупа 2.8) в умовах мобільної амбулаторії в м. Харків. За попередньою добровільною згодою пацієнток проводилося опитування на наявність скарг та клінічний огляд (огляд зовнішніх статевих органів та перианальної ділянки, молочних залоз, шийки матки в дзеркалах та бімануальне дослідження). Встановлення попереднього (клінічного) діагнозу відбувалося на основі анамнестичних даних, об’єктивного огляду та суб’єктивних проявів захворювання.
Найбільш поширеною патологію ( 44 %) при огляді ЖКС був кольпіт, який супроводжувався зміною кількості та консистенції виділень, суб’єктивними відчуттями печії та свербежу, набряком та гіперемією слизової оболонки піхви. Порушення цілісності слизової шийки матки у вигляді ендоцервіциту виявлено у 16 (12,1±2,9) % осіб.
Більшість жінок (39 – (29,3 ± 3,4) %) скаржилися на порушення оварільно-менструального циклу (ПОМЦ). Основними проявами були аномальні маткові кровотечі (частіше скарги на рясні менструації, скорочення циклу (менше 21 дня), подовження менструацій (більше 7 днів), невпорядковані кров’яні виділення), гіпоменструальний синдром, аменорея. Клінічні прояви аднекситу виявлені у 18 ([13,5 ± 3,0] %) осіб.
Поєднана патологія спостерігалася майже у 11 ([8,3 ± 2,4] %) жінок (кольпіт разом з ПОМЦ, мастопатією, ендоцервіцитом, циститом).
Якщо при наданні лікувально-діагностичної допомоги пацієнтам даної групи РКС застосовувати синдромний підхід, то діагноз синдром виділень з піхви був би встановлений у 74 осіб, тобто в (55,6 ± 4,3) % випадків. Синдром болі внизу живота можливо застосувати до 58 жінок ([43,6±4,3] %). У частині випадків одночасно можна було би виділити два синдроми, та призначати лікування доцільно за найважчим. Пацієнтки згідно з синдромним підходом могли отримати лікування спрямоване на ерадикацію хламідійної, трихомонадної інфекцій та гонореї.
Таким чином, близько 99 % осіб, які проходили консультування, при веденні за синдромним підходом, отримали би лікування на цьому візиті, першому, та, здебільшого, й останньому.
При застосуванні «класичного» методу ведення пацієнтів з виявленням етіологічного чиннику необхідне застосування діагностичних тестів для підтвердження попереднього клінічного діагнозу. Лікування призначується після отримання результатів тестування та при повторному візиті пацієнта. Це більш вартісна та тривала інтервенція. Згідно даних спостережень вкрай низький відсоток осіб з уразливих груп, приходять на повторний візит до лікаря, звертаючись за результатами тестування та призначенням лікування, які відтерміновані у часі [25, 28, 51]. Ймовірно, що зовсім невеликий відсоток ЖСБ з цієї групи звернуться до лікаря з метою діагностики ІПСШ.
Обладнання робочого місця фахівця, що надає допомогу представникам уразливих груп, мікроскопом сприяло би виявленню етіологічного чинника захворювання, виявленню ознак запалення та сприяло би уточненню діагностики та пришвидшило би призначення лікування [38, 195]. Тим самим пацієнтки отримали би ефективне лікування, тим самим відбувалася би профілактика ускладнень нелікованих ІПСШ, зараження статевих партнерів, а тим самим попередження появи репродуктивних порушень у пацієнтів та поширення ІПСШ в популяції.
Для визначення рівня інформованості щодо питань ІПСШ та ВІЛ фахівців, які надають консультативну, лікувально-діагностичну, соціальну допомогу представникам уразливих груп населення було проведено анкетування 332 осіб, що склали Групу 4. Проаналізовано дані анкет 32 фахівців наркологічних закладів (підгрупа 4А), 67 дерматовенерологів (підгрупа 4Б), 154 сімейних лікарів (підгрупа 4В), 43 соціальних працівників (підгрупа 4Г), 36 акушерів та гінекологів (підгрупа 4Д).
При проведенні анкетування спеціалістів наркологічних закладів встановлено, що 14 ([43,8 ± 8,8] %) опитуваних фахівців вірно відповіли, що ІПСШ можуть передаватися при статевих, трансмісивних та побутових контактах. Більшість вірних відповідей отримана від фахівців дерматовенерологічного та гінекологічного профілю (65,7 ± 5,8) % та (58,3 ± 8,2) % відповідно. При анкетуванні сімейних лікарів та соціальних працівників більше половини респондентів в обох групах дали вірні відповіді – (51,3 ± 4,0) % та (53,5 ± 7,6) %. Але привертає увагу той факт, що серед соціальних працівників більше обізнаних осіб щодо ймовірності передачі ІПСШ при різних видах контактів, ніж серед сімейних лікарів.
Доцільно підвищувати інформованість, поліпшувати рівень підготовки сімейних лікарів з питань консультування, надання лікувально-діагностичної допомоги представникам уразливих груп, тому що саме до них в першу чергу потрапляє більшість пацієнтів.
Щодо можливості застосування синдромного підходу для діагностики ІПСШ поінформовані 47-49 % наркологів, сімейних лікарів та соціальних працівників. Вищий відсоток обізнаності (60-63%) визначений серед гінекологів та дерматовенерологів. Близько половини опитуваних фахівців наркологічної служби та соціальної (53 %) інформовані, що зараження ІПСШ (зокрема трихомоноз, хламідіоз та гонорея) може супроводжуватися наявністю виділень зі статевих органів. Також майже 50 % фахівців цих служб знають, що можлива вертикальна передача збудників сифілісу, ВІЛ-інфекції та хламідіозу. Вірні твердження з цих питань вказали також 59 % сімейних лікарів та 83-84 % гінекологів та дерматовенерологів. Щодо інформації про застосування фемідому (жіночого презервативу) найбільш інформованою виявилася група соціальних працівників – 77 % вірних відповідей. Також близько половини фахівців (53-54 %) наркологічної та сімейних лікарів володіють інформацією. Дерматовенерологи та гінекологи дали вірні відповіді в 71,6-72,2 % випадків. Серед наркологів 66 % проінформовані, що вище ризик інфікування для ВІЛ-негативної жінки при статевих гетеросексуальних контактах від ВІЛ-позитивного статевого партнера, ніж навпаки. Відсоток вірних відповідей з частіше надавали соціальні працівники, ніж сімейні лікарі (58 % та 56 % відповідно) та дерматовенерологи, ніж гінекологи (75% і 72 % відповідно).
З метою інформування фахівців, що надають лікувально-даігностичну та консультативну допомогу представникам уразливих щодо зараження ІПСШ/ВІЛ груп населення проводилися семінари-тренінги. По завершенню семінарів було проведено повторне тестування фахівців для визначення рівня поінформованості. Оцінювалася кількість вірних відповідей на вищезазначені питання. Результати повторного тестування свідчили, що кількість вірних відповідей зростала в середньому на 20-30 %.
З метою підвищення рівня надання дерматовенерологічної допомоги представникам уразливих груп з ІПСШ, були розроблені методичні посібники для фахівців, які працюють з цим контингентом населення. В методичних посібниках «Рекомендації з проведення добровільного консультування і тестування на наявність ІПСШ представників різних груп населення. Дотестове та післятестове консультування в практиці дерматовенеролога» та «Особливості мотиваційного консультування осіб з інфекціями, що передаються статевим шляхом, з метою формування безпечної статевої поведінки» висвітленні питання особливостей консультування осіб з уразливих груп з ІПСШ. Зокрема надана інформація щодо мети та завдань консультування та тестування. Наведена інформація про особливості консультування представників уразливих груп в залежності від групи ризику. Описана процедура дотестовного та післятестового консультування осіб з ІПСШ, розробка шляхів зниження ризику повторного інфікування ІПСШ, розроблений алгоритм проведення консультування на тестування на ІПСШ.
Розроблений локальний протокол у формі методичного посібника представникам наркологічної служби – «Методичне керівництво з виявлення, діагностики інфекцій, що передаються статевим шляхом, у пацієнтів із залежністю від психоактивних речовин». Впровадження протоколу, як дієвого засобу допомоги фахівцям, сприятиме своєчасному виявленню пацієнтів з ІПСШ серед СІН.
Необхідно проводити удосконалення освіти лікарів, які працюють з представниками з груп ризику. Для надання повноцінної лікувально-діагностичної допомоги хворим цього контингенту фахівцям необхідно мати відповідні знання та навички консультування. Узагальнені дані з особливостей епідеміології, клініко-лабораторної діагностики лягли в основу розробленого Циклу тематичного удосконалення лікарів «Інфекції, що передаються статевим шляхом, а також у групах підвищеного ризику до інфікування ВІЛ/СНІД». Розроблений цикл включено до учбового процесу кафедри дерматовенерології та СНІДу Харківської академії післядипломної освіти.
Висновки
У роботі запропоновано теоретичне обґрунтування та нове вирішення актуальної наукової та практичної проблеми сучасної дерматовенерології, що полягає в створенні ефективної системи лікувально-профілактичних заходів з надання спеціалізованої медичної допомоги та реабілітації хворим на інфекції, що передаються статевим шляхом, в уразливих групах та серед загального населення з метою стримування епідемії ВІЛ/Сніду в Україні.
1. Значна поширеність ІПСШ в загальній популяції, хронічний перебіг, вагомий відсоток ускладнень, клінічний патоморфоз та багатофокусність уражень сечостатевого тракту – чинники, які обумовлюють необхідність досліджень з профілактики розповсюдження ІПСШ в популяції та розробки ефективних лікувально-діагностичних заходів. Епідемія ВІЛ-інфекції, статевий шлях передачі вірусу, підвищена частота виявлення збудників ІПСШ та ВІЛ серед уразливих груп, значні наслідки для здоров’я населення – важливі фактори, які обумовлюють актуальність для сучасної дерматовенерології проблеми попередження зараження ВІЛ шляхом боротьби з ІПСШ.
2. Встановлено, що серед загального населення найчастішими збудниками ІПСШ є трихомонади, хламідії, умовно-патогенні мікроорганізми (стафілококи та ентеробактерії), у 46 % осіб – онкогенні типи ВПЛ. Серед хворих з ІПСШ моноінфекція виявлена у 21 % осіб, асоціація збудників – у 41 % осіб, T. vaginalis є найпоширенішим збудником в двох- та трьохкомпонентних асоціаціях. Ідентифікована E. coli у 30,9 % чоловіків і 48,3 % жінок. Визначена висока резистентність стафілококів до препаратів групи пеніцилінів, тетрациклінів та фторхінолонів (64-45 %), відносно висока нечутливість ентеробактерій до цефалоспоринів (близько 33 %). Показано, що збудник ІПСШ є етіологічним фактором в 2/3 випадків запальних захворювань сечостатевого тракту, переважно помірного ступеня тяжкості перебігу у осіб репродуктивного віку: чоловіків – у 66,4 % (при уретриті – 68,5 %, простатиті – 41,5 %), жінок – у 61,5 % (ендоцервіцит – 72,4 %, ерозія шийки матки – 45,2 %, кольпіт – 36,2 %). Більшість ускладнень спостерігається при трихомонадній моноінфекції або при асоціації збудників (трихомонади + хламідії і трихомонади + уреаплазма). Встановлено, що у жінок частіше виявляється T. vaginalis, S. saprophyticus та S. Warneri; у чоловіків – С. trachomatis, мікст-інфікування, S. haemolyticus.
3. Визначено характерні відмінності осіб уразливих груп від загального населення за соціальним статусом (у більшості – середня та неповна середня освіта, виховання в неповних сім’ях, дитячих будинках, статус безробітних або тимчасових робітників); статевою поведінкою (ранній початок статевого життя, велика кількість статевих партнерів та сексуальних контактів, ризикована поведінка, низький рівень інформованості щодо інфікування та передачі ІПСШ та ВІЛ статевим шляхом, занадто толерантне ставлення до позашлюбних контактів, комерційного сексу та вживання наркотичних засобів). У представників уразливих груп частіше спостерігаються психосоматичні розлади з ознаками декомпенсації (порушення сну та коливання настрою, розлади травлення, судинні дистонії).
4. Показано, що найпоширенішими ІПСШ серед представників уразливих груп є урогенітальний хламідіоз, вірусні інфекції, кандидоз, мікоплазмоз, бактеріальний вагіноз, у значному відсотку випадків (до 40 %) спостерігається мікст-інфікування та ускладнення ІПСШ. Розповсюдженість ВІЛ та гепатиту С серед представників уразливих груп відповідно склала 1-6 і 3-28 %. За даними офіційної статистики, виявлення трихомонадної інвазії в уразливих групах спостерігається на нижчому рівні (6-12 %) порівняно з представниками загального населення (10-30 %). Але за даними цього дослідження, трихомоноз діагностується досить часто (до 60 %), що свідчить про наявність резервуару невиявленої інфекції в уразливих групах. Виявлена висока розповсюдженість (до 20 %) ВІЛ, гепатитів В і С, сифілісу, гонореї у статевих партнерів представників уразливих груп. Асоціація збудників (ВІЛ та хламідіоз) часто визначається серед представників уразливої групи. Між показниками «належність до групи ризику» і «хламідіоз» існує пряма залежність. У представників груп ризику вища імовірність зараження хламідійною інфекцією.
5. У пацієнтів з ІПСШ встановлено порушення місцевого імунітету, які характеризувалися різноспрямованими змінами вмісту sIgA на слизових оболонках уретри та вагіни порівняно з показниками здорових осіб та між групами. При цьому зниження в 1,4 разу рівня sIgA відбувалося у хворих із загального населення, збільшення майже в 4 рази вмісту sIgA – у хворих з уразливих груп з ІПСШ та ВІЛ-позитивним статусом, відносно показника у здорових осіб. Визначено зв’язок між рівнем sIgA та клінічним перебігом ІПСШ. Коливання рівня sIgA у хворих різних груп свідчить про порушення імунної відповіді, пов’язаної з порушенням ефекторної та/або супресорної функції імунної системи. Поєднання ВІЛ-інфекції з захворюваннями шкіри (кандидоз, себорейний та алергічний дерматит, мікоз) та ІПСШ (хламідіоз, кандидоз урогенітальний, сифіліс) є додатковим несприятливим фактором прогресування розладів імунної системи хворих, що підтверджено встановленими кореляційними зв’язками. Відсутність санації сифілісу призводить до негативних змін показників імунітету, після лікування компенсація імунітету проявляється збільшенням в 1,6 разу рівня CD4+та зниженням вірусного навантаження.
6. Для наближення дерматовенерологічної допомоги до уразливих груп, прискорення надання лікувально-діагностичної допомоги особам з ІПСШ доцільно застосовувати метод бактеріоскопії, який дозволяє ефективно та швидко виявити інфікованих осіб навіть при відсутності у них скарг та клінічних проявів. Близько 45 % представників уразливих груп інфікованих трихомонозом є невиявленими, залишаються резервуаром інфекції, що призводить до розвитку ускладнень, сприяє поширенню ІПСШ та ВІЛ в популяції. Метод бактеріоскопії більш ефективний та інформативний у осіб з симптомами (виявлення збудника до 60 %). У осіб без симптомів або з незначними клінічними проявами ІПСШ метод бактеріоскопії також є ефективним заходом виявлення трихомонадної інфекції (30 % – загальне населення, 46 % – уразливі групи). Визначена висока ефективність діагностики сифілісу (98-100 %) з використанням ІХГ тесту. Серед представників верств населення з низьким рівнем поширеності сифілісу обстеження доцільно проводити лише з використанням трепонемного тесту ІХГ. Скринінгові обстеження осіб з високим рівнем поширеності (уразливі групи) доцільно починати з трепонемного тесту ІХГ з підтвердженням із застосуванням РПГА, ІФА. Особи без клінічних проявів захворювання, що були в статевому або побутовому контакті з хворими на сифіліс, підлягають обстеженню за допомогою РМП, або RPR, та ІФА IgM або ІФА сумарні або РПГА, ІХГ.
7. В уразливих групах ВПЛ-інфекція виявлена у 18,5 % серед ВІЛ-позитивних осіб. ВПЛ в асоціації з хламідіями, кандидозом, іншими вірусними інфекціями виявлений у 15 % осіб з ІПСШ. Виявлена позитивна кореляція між вірусним навантаженням ВІЛ та ВПЛ-інфекцією, яка може виступати одним з маркерів зниження імунітету. Встановлено високу клінічну ефективність (84 %) застосування крему, що містить іміквімод 5 %, при лікуванні зовнішніх аногенітальних кондилом у ВІЛ-інфікованих осіб обох статей. Терапевтична ефективність підтверджена відсутністю рецидивів (70 %) або зменшенням їх частоти, а також більш тривалим міжрецидивним періодом після лікування. Запропонований метод більш ефективний за абляційні методи лікування за рахунок зміцнення місцевої імунної відповіді. Іміквімод крем може застосовуватися пацієнтом самостійно, з проходженням періодичного контролю лікарем та відсутності побічних явищ.
8. Діагностика, лікування та реабілітації хворих на ІПСШ, які належать до груп ризику, потребують особливого підходу. Для груп населення уразливих до зараження ВІЛ/ІПСШ рекомендується проведення діагностики ІПСШ з використанням швидких тестів, обов’язкове обстеження на наявність Trichomonas vaginalis із застосуванням бактеріоскопічного дослідження, що прискорить надання допомоги та сприятиме попередженню поширення ІПСШ та ВІЛ. У разі неможливості проведення діагностики із застосуванням швидких тестів слід призначати лікування на підставі клінічної симптоматики захворювання та анамнестичних даних (синдромний підхід). Проведення мотиваційного та інформаційного консультування осіб з уразливих груп сприятиме корекції ризикованої сексуальної поведінки та попередженню поширення ВІЛ та ІПСШ в популяції. Метод мотиваційного консультування – найефективніший захід при роботі з представниками уразливих верств населення (підвищення рівня інформованості – 30 %, усвідомлення важливості періодичного обстеження на ІПСШ, застосування засобів контрацепції при всіх видах сексуальних контактів – 90 %). Призначення синдромного лікування ІПСШ представникам уразливих груп доцільно проводити з урахуванням визначеної чутливості збудників до антибактеріальних препаратів.
9. Внесені зміни до національних протоколів діагностики, лікування та профілактики ІПСШ, з урахуванням особливостей груп, уразливих щодо зараження ВІЛ. Розроблено локальний протокол по взаємодії дерматовенерологічної служби з суміжними спеціальностями, що сприятиме своєчасному виявленню пацієнтів з ІПСШ, дозволить підвищити рівень інформованості з питань ІПСШ/ВІЛ спеціалістів, які надають допомогу представникам уразливих груп населення (лікарі сімейної практики, наркологи, гінекологи, інфекціоністи, соціальні працівники). Розроблені комплексні навчальні програми з проблем ІПСШ та ВІЛ/СНІДу серед уразливих груп втілено у формі фахових семінарів та тематичного удосконалення для післядипломної підготовки лікарів дерматовенерологів та фахівців суміжних спеціальностей.
РЕКОМЕНДАЦІЇ
- Доцільно проводити обстеження на трихомонадну інфекцію представників загальної популяції та уразливих груп. Дані дослідження свідчать про високу поширеність T. vaginalis у популяції населення репродуктивного віку значне (до 60 %) поширення трихомонозу серед представників уразливих груп та низький відсоток реального виявлення.
- Необхідно проводити обстеження статевих партнерів представників уразливих груп з метою виявлення ІПСШ, враховуючи поширеність серед них високого рівня (від 1,0 до 20 %) ВІЛ, гепатитів, сифілісу, гонореї.
- З метою попередження розповсюдження ВІЛ доцільно проводити обстеження серед всіх верств населення не тільки на ВІЛ, сифіліс та найбільш розповсюджені ІПСШ, а також на наявність вірусних інфекцій (гепатити, ВПЛ, ВПГ), хронізація яких призводить до зниження імунітету.
- Доцільно своєчасно проводити лікування хворих з ураженнями шкіри та ІПСШ ВІЛ-інфікованих осіб з метою профілактики декомпенсації імунітету, також необхідно проводити періодичне обстеження ВІЛ-інфікованих на наявність ІПСШ, включаючи пацієнтів з ураженнями шкіри, особливо при збільшенні вірусного навантаження. Необхідно після лікування ІПСШ у ВІЛ-позитивних осіб проводити контроль виліковності ІПСШ, рецидиви яких можуть привести к значному погіршенню стану імунітету.
- Необхідно проводити інформування представників уразливих груп щодо проблем ІПСШ та мотивувати їх до безпечної статевої поведінки, застосовування бар’єрних методів профілактики при кожному статевому контакті, що значно вплине на розповсюдження ІПСШ та ВІЛ в популяції. Важливо при роботі з особами з уразливих груп з ІПСШ застосовувати запропоновані методики мотиваційного консультування.
- Призначення синдромного лікування ІПСШ представникам уразливих груп необхідно проводити з урахуванням визначених збудників та їх чутливості до антибактеріальних препаратів. У випадках встановлення синдромів виділень та/або болі унизу живота, наявності неспецифічних вульвовагінітів можливо також застосування препаратів групи фторхінолонів, цефалоспоринів, лінкозамідів та нітрофуранів, до яких спостерігалася найбільш висока чутливість умовно-патогенних мікроорганізмів. Препарати можуть бути призначені окремо або у певному поєднанні в залежності від виявлених збудників та тяжкості перебігу патології. При розробці нормативних документів щодо застосування синдромного підходу в Україні необхідно враховувати широке розповсюдження трихомонадної інвазії в популяції, варіативність перебігу та значну роль у виникненні урогенітальних ускладнень.
- З метою пришвидшення діагностичної допомоги пацієнтам з ІПСШ, що належать до уразливих груп населення, доцільно рекомендувати застосування методу бактеріоскопії для діагностики ІПСШ лікарем особисто безпосередньо на робочому місці. Для покращення діагностики трихомонадної інфекції в загальній популяції доцільно: у чоловіків проводити культивування збудника одночасно з мікроскопією, у жінок бактеріологічну діагностику виконувати у випадку неуспіху бактеріоскопічного дослідження.
- Враховуючи значну інформативність ІХГ тесту (98-100 % виявлення сифілітичної інфекції), доцільно рекомендувати його до застосування: для скринінгового обстеження на сифіліс; для представників верств населення з низьким та з високим рівнем превалентності інфекції; з метою виявлення хворих з пізніми формами сифілісу серед пацієнтів соматичних стаціонарів; для осіб без клінічних проявів захворювання, що були в статевому або побутовому контакті з хворими на сифіліс.
- Для лікуванні зовнішніх аногенітальних кондилом у ВІЛ-позитивних осіб обох статей доцільно застосовувати крем іміквімод 5 % (застосовується самостійно, через день, зовнішньо увечері за 8 годин перед сном, з очищенням на ранок ділянки нанесення, до повного регресу клінічних проявів (зникнення кондилом) тривалістю не більше 8 тижнів). На відміну від абляційних методів застосування 5 % крему іміквімоду не несе ризиків професійного зараження та сприяє створенню більш свідомого ставлення до терапії з боку пацієнта.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Абрамовских О.С. Иммунологические критерии прогноза течения цервикальной патологии, ассоциированной с папилломавирусной инфекцией / О.С. Абрамовских, Л.Ф. Телешева, В.Ф. Долгушина // Иммунопатология, аллергология, инфектология. – 2015. – № 3. – С. 8–13.
- Айзятулов Р.Ф. Этиопатогенетические аспекты клиники и лечения генитального герпеса / Р.Ф. Айзятулов, В.В. Юхименко, Н.В. Ермилова // Журнал дерматовенерології та косметології ім. М.О. Торсуєва. – 2012. – № 1-2 (28). – С. 71–74.
- Айзятулов Ю.Ф. Стандарты диагностики и лечения в дерматовенерологии: ил. рук. / Ю.Ф. Айзятулов. – Донецк : Каштан, 2010. – 560 с.
- Амирджахан Наджирул Амин. Методики превентивного, профилактического, эпидемиологического лечения пациентов, контактных с больными инфекциями, передаваемыми половым путем : автореф. дисс. … канд. мед. наук : 14.01.10 / Амирджахан Наджирул Амин. – М., 2014. – 19 с.
- Аналіз динаміки поширення метицилінрезистентних штамів стафілококів у дерматовенерологічній клініці / С.К. Джораєва, В.В. Гончаренко, О.В. Щоголєва [та ін.] // Дерматологія та венерологія. – 2015. – № 3 (69). – С. 28–35.
- Андрейчин М.А. Інфекційні хвороби i демографічна криза в Україні / М.А. Андрейчин // Журнал АМН України. – 2007. – Т. 13, № 3. – С. 533–542.
- Бартлетт Дж. Клинические аспекты ВИЧ-инфекции / Дж. Бартлетт, Дж. Галант, П. Фал. – М. : Р. Валент, 2012. – 528 с.
- Баткаев Э.А. Современные проблемы венерологии / Э.А. Баткаев, Д.В. Рюмин // Российский журнал кожных и венерических болезней. – 2009. – № 3. – С. 45–52.
- Баткаева Н.В. Серорезистентность при сифилисе (обзор литературы) / Н.В. Баткаева // Российский журнал кожных и венерических болезней. – 2008. – № 6. – С. 45–52.
- Бондаренко Г.М. Урогенитальный микоплазмоз: акцент на эффективности антибиотикотерапии / Г.М. Бондаренко, Т.В. Федорович // Дерматологія та венерологія. – 2013. – №3 (61). – С. 45–50.
- Бондаренко Т.Ф. Эпиднадзор второго поколения в области ВИЧ, ИППП в группе секс-работников Москвы и Московской области / Т.Ф. Бондаренко, С.Ф. Дубовский, И.Д. Горшкова // Сборник тезисов III Конференции по вопросам ВИЧ/СПИДа в Восточной Европе и Центральной Азии. – М., 2009. – Т. 1. – С. 149–150.
- Брико Н.И. Глобализация и эпидемический процесс / Н.И. Брико, В.И. Покровский // Эпидемиология и инфекционные болезни. – 2010. – № 4. – С. 4–10.
- Васильева С.А. Оценка качества серелогического этапа дозорного эпидемиологического надзора по результатам верификационного исследования в Казахстане / С.А. Васильева, М.А. Хасанова, Н.Г. Ковтуненко // Сборник тезисов III Конференции по вопросам ВИЧ\СПИДа в Восточной Европе и Центральной Азии. – М., 2009. – Т. 1. – С. 151–152.
- Використання методики Clinical Assessment for System Strengthening (ClASS) для моніторингу діяльності закладів охорони здоров’я України в напрямку протидії ВІЛ-інфекції/СНІДу : метод. рекомендації / С. Коллінз, І. Кузін, Дж. Пеннер [та ін.]. – К. : КІМ, 2016. – 135 с.
- ВІЛ-інфекція в Україні. Інформаційний бюлетень / Н.М. Нізова, А.М. Щербінська, Л.І. Гетьман [та ін.]. – К., 2015. – № 43. – 112 с.
- ВІЛ-інфекція в Україні. Інформаційний бюлетень / Н.М. Нізова, А.М. Щербінська, Л.І. Гетьман [та ін.]. – К., 2016. – № 45. – 130 с.
- ВІЛ-інфекція в Україні. Інформаційний бюлетень / Н.М. Нізова, А.М. Щербінська, Л.І. Гетьман [та ін.]. – К., 2016. – № 46. – 38 с.
- ВІЛ-інфекція в Україні. Інформаційний бюлетень / Н.М. Нізова, А.М. Щербінська, І.О. Товкач. – К., 2013. – № 39. – 35 с.
- ВІЛ-інфекція в Україні. Інформаційний бюлетень / Під заг. ред. О.К. Толстанова. – К., 2014. – № 41. – 95 с.
- ВІЛ-інфекція в Україні. Інформаційний бюлетень / С.О. Черенько, О.Г. Єщенко, О.П. Сакальська [та ін.]. – К., 2011. – № 35. – 62 с.
- ВІЛ-інфекція в Україні. Інформаційний бюлетень / Т.А. Александріна, О.Г. Єщенко, М.В. Зеленська [та ін.]. – К., 2012. – № 37. – 82 с.
- ВОЗ. Глобальная стратегия профилактики инфекций, передаваемых половым путем, и борьбы с ними, 2006-2015 гг. // Всемирная организация здравоохранения – 2007. – 70 с.
- Волкославская В.Н. Очерк заболеваемости инфекциями, передающимися половым путем, в Украине / В.Н. Волкославская, А.Л. Гутнев // Журнал дерматовенерології та косметології ім. М.О. Торсуєва. – 2013. – № 1–2 (30). – С. 109–112.
- Волкославська В.М. Фактори, що сприяють існуванню венеричних хвороб у дітей та молоді в Україні / В.М. Волкославська, О.Л. Гутнєв, В.М. Романенко, В.Г. Радіонов // Журнал дерматовенерології, косметології ім. М.О. Торсуєва. – 2010. – № 1– 2 (20). – С. 94–97.
- Глобальная стратегия профилактики инфекций, передаваемых половым путем, и борьбы с ними, 2006–2015 гг. // Вестник дерматологии и венерологии. – 2008. – № 5. – С. 97–122.
- Глобальный доклад. Доклад ЮНЭЙДС о глобальной эпидемии СПИДа 2010. – UNAIDS, 2010. – 359 с.
- Глобальный информационный бюллетень / ЮНЭЙДС. – Женева, 2016. – 8 с.
- Грушецький А. Аналітичний звіт за результатами зв’язаного дослідження «Моніторинг поведінки та поширення ВІЛ-інфекції серед клієнтів жінок, які надають сексуальні послуги за плату, як компонент епіднагляду за ВІЛ другого покоління» / А. Грушецький. – К., 2010. – 50 с.
- Діагностичні помилки маніфестного сифілісу / С.А. Бондар, І.Н. Ляшенко, М.Р. Анфілова, Т.І. Труніна // Дерматовенерологія. Косметологія. Сексопатологія. – 2010. – № 1-2. – С. 210-213.
- Дуб Ю.М. Міжнародний досвід профілактики ВІЛ-інфекції у жіночого населення (аналітичний огляд наукової літератури) / Ю.М. Дуб // Здоровье женщины. – 2013. – № 8. – С. 48–52.
- Дубчак А.Е. Неспецифические воспалительные заболевания органов малого таза у женщин / А.Е. Дубчак // Здоровье женщины. – 2013. – № 2 (78). – С. 51–55.
- Дюдюн А.Д. Герпесвирусная инфекция. Клинико-иммунологические особенности. Клиническая лекция / А.Д. Дюдюн, Н.Н. Полион, А.Е. Нагорный // Дерматовенерология. Косметология. Сексопатология. – 2015. – № 3–4. – С. 119–142.
- Епідемія ВІЛ серед уразливих груп в Україні: огляд вторинних даних / А. Бойко, М. ДіКарло, О. Дорошенко [та ін.]. – К. : Агенство США з міжнародного розвитку, 2013. – 100 с.
- Запорожан В.М. Генітальна папіломавірусна інфекція у жінок / В.М. Запорожан, Н.М. Рожковська, О.В. Шевчук // Педіатрія, акушерство, гінекологія. – 2006. – № 6. – С. 119–121.
- Зведене керівництво з використання антиретровірусних препаратів для лікування і профілактики ВІЛ-інфекції. Рекомендації з позиції охорони здоров’я. – ВООЗ, 2013. – 273 c.
- Иммунология / Д. Мейл, Дж. Бростофф, Д.Б. Рот, А. Ройтт. – М. : Логосфера, 2007. – 555 с.
- Инфекции в акушерстве и гинекологии / Под ред. О.В. Макарова, В.А. Алешкина, Т.Н. Савченко. – М. : МЕДпрессинформ, 2007. – 464 с.
- Инфекции, передаваемые половым путем : Руководство для дерматовенерологов, акушеров-гинекологов, урологов, инфекционистов, педиатров, семейных врачей и руководителей здравоохранения / Институт здоровья семьи. – М. : Институт здоровья семьи, 2009. – 166 с.
- Инфекции, передающиеся половым путем, и социальная характеристика клиентов женщин коммерческого секса / Г.И. Мавров Ю.В. Щербакова, Л.И. Пиньковская, В.И. Миронюк // Дерматологія та венерологія. – 2013. – № 4 (62). – С. 44–55.
- Использование полугнездной полимеразной цепной реакции для выявления ДНК Treponema pallidum у больных сифилисом / О.А. Сокол, А.П. Белозоров, Е.И. Милютина и [др.] // Дерматологія та венерологія. – 2013. – № 3 (61). – С. 25-31.
- Казмирчук В.Е. Иммунодефицитная и иммунозависимая патология: проблема, причины и следствия / В.Е. Казмирчук, Л.В. Ковальчук // Клінічна імунологія. Алергологія. Інфектологія. – 2008. – № 4. – С. 15-22.
- Калюжна Л.Д. Асоціації інфекцій, що передаються статевим шляхом, у ВІЛ-інфікованих / Л.Д. Калюжна, Л.В. Гречанська // Укр. журн. дерматології, венерології, косметології. – 2004. – № 1. – С. 78–80.
- Киржанова В.В. Особенности поведения потребителей инъекционных наркотиков, связанные с риском гемоконтактных инфекций / В.В. Киржанова // Наркология. – 2008. – № 8. – С. 67–73.
- Кобзарь А.И. Прикладная математическая статистика. Для инженеров и научных работников / А.И. Кобзарь. – М. : Физматлит, 2012. – 816 с.
- Колонизационная резистентность слизистых цервикального канала как неотъемлемая составляющая местного иммунитета / А.В. Караулов, М.С. Афанасьев, В.А. Алешкин [и др.] // Иммунология. – 2011. – № 1. – С. 11–15.
- Красносельских Т.В. Современные стандарты диагностики сифилиса: сравнение российских и зарубежных клинических рекомендаций (сообщение I) / Т.В. Красносельских, Е.В. Соколовский// Вестник дерматологии и венерологии. – 2015. – № 2. – С. 11–22.
- Кузьмин В.Н. Инфекции, передаваемые половым путем, в проблеме репродуктивного здоровья женщин / В.Н. Кузьмин // Лечащий врач. – 2009. – № 11. – С. 29–31.
- Лабораторная диагностика сифилиса: вчера, сегодня, завтра / Н.В. Фриго, С.В. Ротанов, Т.В. Манукьян [и др.] // Вестник дерматологии и венерологии. – 2012. – № 4. – С. 16–23.
- Лечение и помощь при ВИЧ/СПИДе : клинич. протоколы для Европейского региона ВОЗ / Под ред. I. Eramova, S. Matic, M. Munz. – Европа : ВОЗ, 2007. – 552 с.
- Літус О.І. Поліетіологічні чинники і поліпатогенетичні механізми розвитку хронічного інфекційного простатиту. Комплексні методи діагностики та нові підходи до терапіі захворювання / О.І. Літус, В.І. Степаненко // Український журнал дерматології, венерології, косметології. – 2003. – № 1 (8). – С. 72–86.
- Лосева О.К. Особенности диагностики, лечения и профилактики ВИЧ-инфекций и инфекций, передающихся половым путем, у лиц, оказывающих сексуальные услуги за плату : рук-во для доверенных врачей в программах профилактики / О.К. Лосева, О.В. Поршина, Ю.Е. Кузнецова. – М. : РОО «СПИД инфосвязь», 2006. – 118 с.
- Мавров Г.И. Альтернативный подход к этиотропному лечению инфекционных вульвовагинитов и бактериального вагиноза (обзор литературы и собственные исследования) / Г.И. Мавров, Л.И. Пиньковская, К.С. Орлова // Дерматологія та венерологія. – 2014. – № 4 (66). – С. 21–34.
- Мавров Г.И. Инфекции, передающиеся половым путем, и проблема сексуального и репродуктивного здоровья / Г.И. Мавров, А.Е. Нагорный, Г.П. Чинов // Клінічна імунологія. Алергологія. Інфектологія. – 2010. – № 1. – С. 5–14.
- Мавров Г.И. Проституция и инфекции, передающиеся половым путем, – медицинские, социальные и правовые аспекты / Г.И. Мавров, Г.П. Чинов, А.А. Ярошенко // Дерматологія та венерологія. – 2006. – № 3 (33). – C. 3–20.
- Мавров Г.І. Інфекції, що передаються статевим шляхом, в Україні (2003–2007): епідеміологія, організація контролю, тенденції та проблеми. Інформаційний бюлетень / Г.І. Мавров. – К., 2009. – 40 с.
- Мавров Г.І. Сучасні підходи до діагностики сифілісу із застосуванням реакції пасивної гемаглютинації (РПГА): Методичні рекомендації / Г.І. Мавров, Н.В. Счисльонок. – К., 2008. – 21 с.
- Мавров И.И. Клинико-диагностическое значение лабораторных исследований в дерматологии и венерологии / И.И. Мавров // Клінічна імунологія. Алергологія. Інфектологія. – 2009. – № 1. – С. 7–10.
- Мавров И.И. Основы диагностики и лечения в дерматологии и венерологии / И.И. Мавров, Л.А. Болотная, И.М. Сербина. – Харьков : Факт, 2007. – 792 с.
- Методичні рекомендації з питань ВІЛ та ЧСЧ для працівників сфери охорони здоров’я : Методичний посібник / Л.М. Гейдар, О.І. Мостяєв, Ю.А. Саранков, А.А. Ярошенко; за ред. А.А. Ярошенко. – К., 2011. – 80 с.
- Методичні рекомендації з проведення досліджень для моніторингу відповіді країни на епідемію ВІЛ-інфекції / О.М. Балакірєва, М.Ю. Варбан, Г.В. Довбах [та ін.]; МБФ „Міжнар. Альянс з ВІЛ/СНІД в Україні”. – К., 2008. – 96 с.
- Мікробіологічний моніторинг інфекцій урогенітального тракту в умовах венерологічної клініки / В.В. Гончаренко, С.К. Джораєва, О.В. Щоголєва [та ін.] // Дерматологія та венерологія. – 2014. – № 4 (66). – С. 44–53.
- Мотивационное интервьюирование лиц, употребляющих инъекционные наркотики / Под ред. А. Храпаля. – К. : Международный Альянс по ВИЧ/СПИД в Украине, 2004. – 109 с.
- Нагорный А.Е. Современная терапия папилломавирусной инфекции половых органов у мужчин и женщин / А.Е. Нагорный, Е.Ю. Гурженко // Репродуктив. здоровье женщины. – 2008.– № 5. – С. 194– 197.
- Наказ МОЗ України № 1141 від 21.12.2010 «Про затвердження Порядку проведення тестування на ВІЛ-інфекцію та забезпечення якості досліджень, форм первинної облікової документації щодо тестування на ВІЛ-інфекцію, інструкцій щодо їх заповнення».
- Наказ МОЗ України № 167 від 05.04.2007 «Про затвердження методичних вказівок «Визначення чутливості мікроорганізмів до антибактеріальних препаратів».
- Наказ МОЗ України № 204 від 29.12.1992 «Про організацію лабораторної діагностики сифілісу в Україні».
- Наказ МОЗ України № 286 від 07.06.2004 «Про удосконалення дермато-венерологічної допомоги населенню України».
- Наказ МОЗ України № 312 від 08.05.2009 «Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання».
- Наказ МОЗ України № 388 від 11.05.2010 «Про удосконалення діагностики ВІЛ-інфекції».
- Наказ МОЗ України № 415 від 19.08.2005 «Про удосконалення добровільного консультування та тестування на ВІЛ-інфекцію».
- Наказ МОЗ України № 509 від 14.07.2009 «Про затвердження Стратегії удосконалення системи консультування та тестування на ВІЛ-інфекцію, стандартизованої лабораторної діагностики на 2009–2013 роки та плану її реалізації».
- Наказ МОЗ України № 551 від 12.07.2010 «Про затвердження клінічного протоколу антиретровірусної терапії ВІЛ-інфекції у дорослих та підлітків».
- Наказ МОЗ України № 997 від 22.11.2013 «Сучасні підходи до лабораторної діагностики сифілісу».
- Наказ МОЗ України № 467 від 23.09.2004 «Методичні рекомендації щодо застосування швидких тестів у лабораторній діагностиці інфекційних хвороб».
- Огляд існуючих навчальних ресурсів щодо консультування з питань ВІЛ-інфекції в Україні: Звіт / Підг. О. Нечосіна. – USAID, 2014. – 32 с.
- Олійник К.В. Добровільне консультування та тестування на ВІЛ-інфекцію в «Клініці, дружній до молоді» / К.В. Олійник // Медсестринство. – 2014. – № 3. – С. 19-21.
- Основи консультування військовослужбовців та співробітників правоохоронних органів України з питань профілактики ВІЛ/СНІД/ІПСШ: навчально-методичний посібник / І.С. Миронюк, О.О. Авраменко, С.І. Скляр, Л.Л. Лотоцька-Голуб. – К. : ВЦ “День печати”, 2006. – 116 с.
- Петрунин Д.Д. Врожденное звено иммунитета при урогенитальной патологии: особенности иммунопатогенеза и подходы к фармакологической коррекции / Д.Д. Петрунин // Эффективная фармакотерапия. – 2009. – № 26. – С. 18–25.
- Показатели системного иммунного ответа у женщин с хроническим сальпингоофоритом хламидийной этиологии / Е.А. Михнина, Н.И. Давыдова, А.Н. Эллиниди, Л.Б. Дрыгина // Журнал акушерства и женских болезней. – 2012. – Т. 61, вып. 1. – С. 55–60.
- Показники лікувально-профілактичної допомоги хворим шкірними і венеричними захворюваннями в Україні / Відп. за вип. М.В. Голубчиков. – К. : Центр медичної статистики МОЗ України, 2010. – 110 с.
- Показники лікувально-профілактичної допомоги хворим шкірними і венеричними захворюваннями в Україні / Відп. за вип. М.В. Голубчиков. – К. : Центр медичної статистики МОЗ України, 2011. – 112 с.
- Показники лікувально-профілактичної допомоги хворим шкірними і венеричними захворюваннями в Україні / Відп. за вип. М.В. Голубчиков. – К. : Центр медичної статистики МОЗ України, 2012. – 106 с.
- Показники лікувально-профілактичної допомоги хворим шкірними і венеричними захворюваннями в Україні / Відп. за вип. М.В. Голубчиков. – К. : Центр медичної статистики МОЗ України, 2014. – 111 с.
- Показники лікувально-профілактичної допомоги хворим шкірними і венеричними захворюваннями в Україні / Відп. за вип. М.В. Голубчиков. – К. : Центр медичної статистики МОЗ України, 2015. – 110 с.
- Показники лікувально-профілактичної допомоги хворим шкірними і венеричними захворюваннями в Україні / Відп. за вип. М.В. Голубчиков. – К. : Центр медичної статистики МОЗ України, 2016. – 107 с.
- Показники лікувально-профілактичної допомоги хворим шкірними і венеричними захворюваннями в Україні / Відп. за вип. М.В. Голубчиков. – К. : Центр медичної статистики МОЗ України, 2013. – 110 с.
- Практика рискованого поведения среди СР в возрасте 15-19 лет в Армении / В.Г. Арзаканян, С.Р. Григорян, Э.Э. Оганесян, Р.А. Оганесян // Сборник тезисов III Конференции по вопросам ВИЧ\СПИДа в Восточной Европе и Центральной Азии. – М., 2009. – Т. 1. – С. 145–146.
- Приказ № 1570 МЗ СССР от 04.12.1986 «Об улучшении выявления больных гонореей и трихомониазом в акушерских и гинекологических отделениях (палатах, кабинетах), женских консультациях и урологических кабинетах поликлиник».
- Приказ № 535 МЗ СССР от 22.04.1985 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений».
- Приказ МЗ СССР № 596 от 22.10.1986 «О мерах по организации борьбы с хламидийными, микоплазменными и урогенитальными вирусными инфекциями».
- Приказ МЗ СССР № 936 от 12.07.1985 «Об унификации лабораторных методов исследования в диагностике гонореи и трихомониаза».
- Применение комбинированных иммунобиологических препаратов в лечении вирусно-бактериальных инфекций в гинекологии / А.З.Хашукоева, Т.Н.Савченко, М.И.Ибрагимова [и др.] // Вестник РГМУ. – 2009. – № 4. – С. 117–120.
- Продукція цитокінів та рівень секреторних інгібіторів лейкоцитарних протеаз у хворих із хронічними інфекціями сечової системи / Г.М. Драннік, В.Є. Дріянська, Н.М. Степанова та ін. // Журн. АМН України. – 2007. – Т. 13, № 3. – С. 761–771.
- Протоколи лабораторної діагностики інфекцій, що спричинені Neisseria gonorrhoeae / Г.І. Мавров, Бондаренко Г.М., Кочетова Н.В. [та ін.] // Дерматологія та венерологія. – 2007. – № 1. – С. 65–90.
- Протоколи лабораторної діагностики сифілісу в країнах східної Європи / Г.І. Мавров, Г.М. Бондаренко, Н.В. Счисльонок [та ін.] // Дерматологія та венерологія. – 2008. – № 1 (39). – C. 90–116.
- Проценко О.А. ВИЧ-ассоциированные поражения кожи и слизистых оболочек / О.А. Проценко // Міжнародний медичний журнал. – 2009. – Т. 15, №3 (59). – С. 106–110.
- Проценко О.А. Менеджмент дерматомикозов кожи у ВИЧ-позитивных больных / О.А. Проценко, А.В. Борисенко // Таврический медико-биологический вестник. – 2009. – Т. 12, № 1 (45). – С. 169–173.
- Проценко О.А. Особенности консультирования по вопросам ИППП/ВИЧ/СПИДа клиентов различных категорий / О.А. Проценко // Дерматологія та венерологія. – 2006. – № 2 (32). – С. 65–71.
- Радионов В.Г. Особенности течения СПИД-ассоциированных заболеваний кожи и слизистых оболочек / В.Г. Радионов, Т.З. Когония, Е.Г. Загайнова // Український журнал дерматології, венерології, косметології. – 2012. – № 4 (47). – C. 125–131.
100. Радионов Д.В. Серерезистентность после лечения сифилиса и некоторые причины ее возникновения / Д.В. Радионов // Украінський журнал дерматології, венерології, косметології. – 2014. – № 1 (52). – С. 7–12.
101. Рахматуллина М.Р. Современные подходы к терапии вульвовагинитов, вызванных условно-патогенными микроорганизмами, с учетом антибактериальной резистентности инфекционных агентов / М.Р. Рахматуллина // Вестник дерматологии и венерологии. – 2013. – № 2. – С. 44–52.
102. Репродуктивное здоровье ВИЧ-позитивных женщин и девушек: учебно-методическое пособие / Н.В. Авраменко, С.Г. Бондаренко, Б.М. Ворник [и др.]; под ред. проф. А.М. Щербинской. – К. : ВЦ «День печати», 2008. – 148 с.
103. Ротанов С.В. Сравнительное изучение иммунохроматографических наборов для экспресс-диагностики сифилиса / С.В. Ротанов, Н.В. Фриго, В.И. Клюева // Клиническая лабораторная диагностика. – 2008. – № 2. – С. 42–45.
104. Савичева А.М. Порядок проведения микроскопического исследования мазков из урогенитального тракта / А.М. Савичева, Е.В. Соколовский, М. Домейка. – СПб. : «Издательство Н-Л», 2007. – 60 с.
105. Савченко Т.Н. Показатели локального иммунитета и микробиоценоза половых путей при полипах цервикального канала / Т.Н. Савченко, А.В. Мельников // Трудный пациент. – 2011. – Т. 9, № 8-9. – С. 18–21.
106. Связь уровней мРНК TLR-2 и TLR-4 с изменениями иммуноглобулинового профиля урогенитального тракта при урогенитальном хламидиозе у женщин / В.А. Алешкин, А.В. Караулов, А.Л. Байракова [и др.] // Иммунология. – 2009. – № 3. – С. 165–171.
107. Склад та функції мікробіоценозів різних біотопів макроорганізму та клінічна значимість їх порушень / С.К. Джораєва, В.В. Гончаренко, О.В. Щоголєва [та ін.] // Дерматологія та венерологія. – 2015. – № 2 (68). – С. 5-19.
108. Совершенствование лечебно-диагностических подходов к терапии кандидозно-микоплазменной инфекции генитального тракта женщин / О.А. Гизингер, О.И. Летяева, И.И. Долгушин, О.Р. Зиганшин // Иммунопатология, аллергология, инфектология. – 2013. – № 4. – С. 42–48.
109. Сравнительный анализ информативно-диагностических свойств показателей иммунореактивности слизистых / А.В. Караулов, Ю.В. Несвижский, С.С. Афанасьев [и др.] // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2014. – № 3. – С. 21–27.
110. Стратегии и лабораторные методы для усиления эпиднадзора за инфекциями, передаваемыми половым путем, 2012 г. / Рабочая группа ЮНЭЙДС/ВОЗ по глобальному эпиднадзору за ВИЧ/СПИДом и ИППП. – ВОЗ, 2014. – 100 с.
111. Супотницкий М.В. ВИЧ/СПИД-пандемия – проблема, требующая переосмысления к 30-летию открытия вируса иммунодефицита человека / М.В. Супотницкий // Актуальная инфектология. – 2014. – № 3 (4). – С. 80-98.
112. Уніфікація лабораторних методів досліджень в діагностиці захворювань, що передаються статевим шляхом / І.І. Мавров, О.П. Бєлозоров, Л.С. Тацька [та ін.]. – Харків : Факт, 2000. – 120 с.
113. Употребление психоактивных веществ и рискованное сексуальное поведение: руководство по экспресс-оценке и реагированию / ВОЗ. – Женева, 2002. – 69 с.
114. Урогенитальный трихомониаз: Пособие для врачей / Д.К. Ермоленко, В.А. Исаков, С.Б. Рыбалкин [и др.]. – СПб. – Великий Новгород, 2007. – 96 с.
115. Урогенітальна хламідійна інфекція. Сучасні аспекти проблеми. Клінічна лекція / А.Д. Дюдюн, С.Г. Свирид, В.В. Горбунцов [та ін.]. // Дерматовенерологія. Косметологія. Сексопатологія. – 2014. – № 1–4. – C. 88–113.
116. Федотов В.П. Очерки по иммунокоррекции в дерматовенерологии: пособие для врачей / В.П.Федотов, С.Б. Рыбалкин, М.Г. Романцов. – СПб., 2005. – 80 с.
117. Шайков К.А. Состояние локального иммунитета шейки матки при воспалительных заболеваниях органов малого таза и методы его коррекции иммуномодулятором “Кипферон” : дисс. … канд. мед. наук : 14.00.01 / К.А. Шайков. – М., 2005. – 113 с.
118. Швидкі ІХА-тести для етіологічної діагностики інфекційних захворювань людини : метод. рекомендації / Уклад.: І.В. Дзюблик, О.В. Обертинська, Я.О. Дзюблик [та ін.]. – К. : НМАПО ім. П.Л. Шупіка, 2013. – 89 с.
119. Щербакова Ю.В. Заболеваемость сифилисом в Украине / Ю.В. Щербакова // Клінічна імунологія. Алергологія. Інфектологія. – 2009. – № 1. – С. 82-85.
120. Эффективность, переносимость и комплаентность применения секнидазола в комплексном лечении больных урогенитальным трихомониазом / А. Д. Дюдюн, Н. Н. Полион, И. А. Бабюк [и др.] // Укр. журнал дерматології, венерології, косметології. – 2013. – № 4 (50). – С. 144–149.
121. Юрчишин О.І. Синергізм протимікробної дії спиртових екстрактів лікарських рослин з ерітроміцином відносно шкірних ізолятів Staphylococcus epidermidis з різними механізмами MLS-резистетності / О.І. Юрчишин, Р.В.Куцик // Tези доповідей науково-практичної конференції «Актуальні проблеми боротьби з інфекційними захворюваннями». – Харків, 2015. – С. 83.
122. 2012 European guideline for the management of anogenital warts / C.J. Lacey, S.C. Woodhall, A. Wikstrom, J. Ross // J. Eur. Acad. Dermatol. Venereol. – 2013. – Vol. 27, No. 3. – P. e263-e70.
123. 2016 European Guideline on the management of non-gonococcal urethritis / P.J. Horner, K. Blee, L. Falk [et al.] // Int. J. STD AIDS. – 2016. – Vol. 27, No. 11. – P. 928–937.
124. A Guide to Utilization of the Microbiology Laboratory for Diagnosis of Infectious Diseases: 2013 Recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM) / E.J. Baron, J.M. Miller, M. P. Weinstein [et al.] // Clin. Infect. Dis. – 2013. – Vol. 57, No. 4. – P. e22–e121.
125. A prospective study of vaginal trichomoniasis and HIV-1 shedding in women on antiretroviral therapy / L.N. Masese, S.M. Graham, R. Gitau [et al.] // BMC Infect. Dis. – 2011. – Vol. 3, No. 11. – P. 307.
126. Absence of transmission from HIV-infected individuals with HAART to their heterosexual serodiscordant partners / J. Del Romero, I. Río, J. Castilla [et al.] // Enferm. Infecc. Microbiol. Clin. – 2015. – Vol. 33, No. 10. – P. 666-672.
127. Adding the female condom to the public health agenda on prevention of HIV and other sexually transmitted infections among men and women during anal intercourse / E.A. Kelvin, R.A. Smith, J.E. Mantell, Z.A. Stein // Am. J. Public Health. – 2009. – Vol. 99. – P. 985–987.
128. Anal squamous carcinoma: a newAIDS-defining cancer? Case report and literature review / M. Corti, M.F. Villafane, E. Marona, D. Lewi // Revista do Instituto de Medicina Tropical de Sao Paulo. – 2012. – Vol. 54, No. 6. – P. 345–348.
129. Antibiotic resistance of bacterial biofilms / N. Hoiby, T. Bjarnsholt, M. Givskov [et al.] // J. Antimicrob. Agents. – 2010. – Vol. 35. – P. 322–332.
130. Anti-HIV activity in cervical-vaginal secretions from HIV-positive and –negative women correlate with innate antimicrobial levels and Ig G antibodies / M. Ghosh, J.V. Fahey, Z. Shen [et al.] // PLoS ONE. – 2010. – Vol. 5, No. 6. – Article ID: e11366.
131. Antiretroviral Therapy Is Associated with Reduced Serologic Failure Rates for Syphilis among HIV-Infected Patients / K.G. Ghanem, R.D. Moore, A.M. Rompalo [et al.] // Clin. Infect. Dis. – 2008. – Vol. 47, No. 2. – P. 258–265.
132. Aral S.O. Advances in multilevel approaches to understanding the epidemiology and prevention of sexually transmitted infections and HIV: an overview / S.O. Aral, N.S. Padian, K.K. Holmes // J. Infect. Dis. – 2005. – Vol. 191 (Suppl. 1). – P. S1–S6.
133. Association between bacterial vaginosis and Herpes simplex virus type-2 infection: implications for HIV acquisition studies / N. Nagot, A. Ouedraogo, M.‑C. Defer [et al.] // Sexually Transmitted Infections. – 2007. – Vol. 83, No. 5. – P. 365–368.
134. Asymptomatic sexually transmitted infections in HIV-infected men who have sex with men: prevalence, incidence, predictors, and screening strategies / G. Rieg, R.J. Lewis, L.G. Miller [et al.] // AIDS Patient Care STDs. – 2008. – Vol. 22, No. 12. – P. 947–954.
135. Bacterial Sexually Transmitted Disease Screening Outside the Clinic—Implications for the Modern Sexually Transmitted Disease Program / K.T. Bernstein, J.M. Chow, P. Pathela, T.L. Gift // Sex. Transm. Dis. – 2016. – Vol. 43, No. 2, Suppl. 1. – P. S42-S52.
136. Barnabas R.V. Riddle of the Sphinx revisited: the role of STDs in HIV prevention / R.V. Barnabas, J.N. Wasserheit // Sex. Transm. Dis. – 2009. – Vol. 36, No. 6. – Р. 365–367.
137. Bignell C. European Guideline on the Diagnosis and Treatment of Gonorrhoea in Adults / C. Bignell, M. Unemo // Int. J. STD AIDS. – 2013. – Vol. 24, No. 2. – P. 85–92.
138. British Association of Dermatologists’ guidelines for the management of cutaneous warts 2014 / J.C. Sterling, S. Gibbs, S.S. Haque Hussain [et al.] // British Journal of Dermatology. – 2014. – Vol. 171. – P. 696–712.
139. Brown A.J. Unsircumcised men at risk for HPV infection of glans penis / A. J. Brown // J. Infect. Dis. – 2008.– Vol. 197. – P. 783–784.
140. Candida species isolated from the vaginal mucosa of HIV-infected women in Salvador, Bahia, Brazil / P.M. Oliveira, R.E. Mascarenhas, C. Lacroix [et al.] // Braz. J. Infect. Dis. – 2011. – Vol. 15, No. 3. – P. 239–244.
141. Cannon M.J. Review of cytomegalovirus seroprevalence and demographic characteristics associated with infection / M.J. Cannon, D.S. Schmid, T.B. Hyde // Rev. Med. Virol. – 2010. – Vol. 20, No. 4. – P. 202–213.
142. Cardoso J.C. Cutaneous manifestations of human papillomaviruses: a review / J.C. Cardoso, E. Calonje // Acta Dermatovenerol Alp Panonica Adriat. – 2011. – Vol. 20, No. 3. – P. 145–154.
143. Changes in the 2010 STD Treatment Guidelines: What Adolescent Health Care Providers Should Know [Electronic resource] / G. Burstein, A. Jacobs, D. Kissin, K. Workowski. – Available at: https://www2.aap.org/sections/adolescenthealth/pdfs/STD%20Article%20Feb%202011.pdf.
144. Combined antiretroviral treatment and heterosexual transmission of HIV-1: Cross sectional and prospective cohort study / J. Del Romero, J. Castilla, V. Hernando [et al.] // Br. Med. J. – 2010. – Vol. 340. – P. c2205.
145. Comparative crossover study of the PATH Woman’s Condom and the FC female Condom® / J.L. Schwartz, K. Barnhart, M.D. Creinin [et al.] // Contraception. – 2008. – Vol. 78, No. 6. – P. 465–473.
146. Consolidated guidelines on HIV Testing services: 5Cs: Consent, Confidentiality, Counselling, Correct results and Connection 2015 / World Health Organization. – Geneva : WHO, 2015. – 192 р.
147. Contextual Factors Surrounding Anal Intercourse in Women: Implications for Sexually Transmitted Infection/HIV Prevention / S. Stahlman, A.E. Hirz, A. Stirland [et al.] // Sex. Transm. Dis. – 2015. – Vol. 42. No. 7. – P. 364–368.
148. Contribution of HIV-1 infection to acquisition of sexually transmitted disease: a 10-year prospective study / R.S. McClelland, L. Lavreys, C. Katingima [et al.] // J. Infect. Dis. – 2005. – Vol. 191, No. 3. – P. 333–338.
149. Convergence of HIV seroprevalence among injecting and non-injecting drug users in New York city / D.C. Des Jarlais, K. Arasteh, T. Perlis [et al.] // AIDS. – 2007. – Vol. 21, No. 2. – P. 231–235.
150. Curtis M. Glass’ Office Gynecology. – 7th edition / M. Curtis, L. Antoniewicz, S.T. Linares. – Alphen aan den Rijn : Wolters Kluwer Health, 2014. – 560 p.
151. Determinants of symptomatic vulvovaginal candidiasis among human immunodeficiency virus type 1 infected women in rural Kwazulu-natal, South Africa / T. Apalata, W. H. Carr, W. A. Sturm [et al.] // Infect. Dis. Obstet. Gynecol. – 2014. – Vol. 2014. – Article ID: 387070.
152. Do prevention interventions reduce HIV risk behaviours among people living with HIV? A meta-analytic review of controlled trials / N. Crepaz, C.M. Lyles, R.J. Wolitski [et al.] // AIDS. – 2006. – Vol. 20. – Р. 143–157.
153. Donor Support for Contraceptives and Condoms for STI/HIV Prevention. 2007 / UNFPA. – Geneva: UNFPA, 2007. – 31 р.
154. Early repeated infectionswith Trichomonas vaginalis among HIV-positive and HIV-negative women / P. Kissinger, W. E. Secor, J. S. Leichliter [et al.] // Clin. Infect. Dis. – 2008. – Vol. 46, No. 7. – P. 994–999.
155. Effect of acquisition and treatment of cervical infections on HIV-1 shedding in women on antiretroviral therapy / R.W. Gitau, S.M. Graham, L.N. Masese [et al.] // AIDS. – 2010. – Vol. 24, No. 17. – P. 2733–2737.
156. Effect of treatment of asymptomatic bacterial vaginosis on HIV-1 shedding in the genital tract among women on antiretroviral therapy: a pilot study / C. Moreira, K.K. Venkatesh, A. DeLong [et al.] // Clin. Infect. Dis. – 2009. – Vol. 49, No. 6. – P. 991–992.
157. Emergence of fluoroquinolone resistance in outpatient urinary Escherichia coli isolates / L. Johnson, A. Sabel, W.J. Burman [et al.] // Am. J. Med. – 2008. – Vol. 121, No. 10. – Р. 876–884.
158. Epidemiology of human papillomavirus infection in men, cancers other than cervical and benign conditions / A. R. Giuliano, G. Tortolero-Luna, E. Ferrer [et al.] // Vaccine. – 2008. – Vol. 26, suppl. 10. – P. K17–K28.
159. Estimation of the rate of pelvic inflammatory disease diagnoses: trends in England, 2000–2008 / C.E. French, G. Hughes, A. Nicholson [et al.] // Sexually Transmitted Diseases. – 2011. – Vol. 38, No. 3. – P. 158–162.
160. European (IUSTI/WHO) Guideline on the Management of Vaginal Discharge, 2011 / J. Sherrard, G. Donders, D. White, J. S. Jensen // Int. J. STD AIDS. – 2011. –Vol. 22, No. 8. – P. 421–429.
161. Evaluation of a PCR test for detection of Treponema pallidum in swabs and blood / P.A. Grange, L. Gressier, P.L. Dion [et al.] // J. Clin. Microbiol. – 2012. – Vol. 50, No. 3. – P. 546–552.
162. Evaluation of a rapid point-of-care test for the detection of gonococcal infection among female sex workers in Benin / M. Alary, C. Gbenafa-Agossa, G. Aïna [et al.] // Sex. Transm. Infect. – 2006. – Vol. 82, No. 5. – P. 29–32.
163. Female genital-tract HIV load correlates inversely with Lactobacillus species but positively with bacterial vaginosis and Mycoplasma hominis / B.E. Sha, M.R. Zariffard, Q.J. Wang [et al.] // J. Infect. Dis. – 2005. – Vol. 191, No. 1. – P. 25–32.
164. Fresse A.S. Diagnosis and follow-up of genital chlamydial infection by direct methods and by detection of serum Ig G, Ig A and secretory Ig A / A.S. Fresse, J.M. Sueur, F. Hamdad // Indian J. Med. Microbiol. – 2010. – Vol. 28, No. 4. – P. 326–331.
165. Gates W. Genital chlamydial infections: epidemiology and reproductive sequelae / W. Gates, J.N. Wasserheit // Am. J. Obstet. Gynecol. – 2006. – Vol. 164. – P. 1771–1781.
166. Global strategy for the prevention of sexually transmitted infections and control, 2006-2015 / World Health Organization. – Geneva, 2007. – 70 p.
167. Gonorrhea Treatment Guidelines / National Center for HIV/AIDS, Viral Hepatitis, STD, and TB Prevention, Centers for Disease Control and Prevention. – 2012. – 3 р.
168. Guidelines for second generation HIV surveillance: an update: know your epidemic / World Health Organization. – Geneva, 2013. – 72 p.
169. Guidelines for the laboratory diagnosis of syphilis in East-European countries / E. Sokolovskiy, N. Frigo, S. Rotanov [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2009. – Vol. 23, No. 6. – P. 623–632.
170. Hebner C.M. Human papillomaviruses: basic mechanisms of pathogenesis and oncogenicity / C.M. Hebner, L.A. Laimins // Reviews in Medical Virology. – 2006. – Vol. 16, No. 2. – P. 83–97.
171. Herpes simplex virus 2 infection increases HIV acquisition in men and women: Systematic review andmeta-analysis of longitudinal studies / E.E. Freeman, H.A. Weiss, J.R. Glynn [et al.] // AIDS. – 2006. – Vol. 20, No. 1. – P. 73–83.
172. Herpes simplex virus and HIV-1: deciphering viral synergy / P. van de Perre, M. Segondy, V. Foulongne [et al.] // Lancet Infect. Dis. – 2008. – Vol. 8, No. 8. – P. 490–497.
173. Heterosexual risk of HIV-1 infection per sexual act: systematic review and meta-analysis of observational studies / M.C. Boily, R.F. Baggaley, L. Wang [et al.] // Lancet Infect. Dis. – 2009. – Vol. 9. – P. 118–129.
174. High Mycoplasma genitalium Organism Burden Is Associated with Shedding of HIV-1 DNA from the Cervix / L.E. Manhart, S.B. Mostad, J.M. Baeten [et al.] // J. Infect. Dis. – 2008. – Vol. 197, No. 5. – P. 733-736.
175. HIV/AIDS surveillance in Europe 2014 / European Centre for Disease Prevention and Control WHO, Regional Office for Europe. – Stockholm, 2015. – 75 р.
176. Holmes K. Effectiveness of condoms in preventing sexually transmitted infections: bulletin of the WHO / K. Holmes, R. Levine, M. Weaver. – Geneva: WHO, 2004. – Jun. – Р. 454.
177. Hotton A.L. Association Between Serosorting and Bacterial Sexually Transmitted Infection Among HIV-Negative Men Who Have Sex With Men at an Urban Lesbian, Gay, Bisexual, and Transgender Health Center / A.L. Hotton, B. Gratzer, S.D. Mehta // Sex. Transm. Dis. – 2012. – Vol. 39, No. 12. – P. 959-964.
178. Human papillomavirus (HPV) infection and abnormal cervical cytopathology among human immuno-deficiency virus (HIV) positive women in Northern India / P. Pundhir, Y.M. Mala, R.Tripathi [et al.] // J. AIDS HIV Res. – 2014. – Vol. 6, No. 1. – P. 1–6.
179. Human papillomavirus infection and increased risk of HIV acquisition. A systematic review and meta-analysis / C. F. Houlihan, N. L. Larke, D. Watson-Jones [et al.] // AIDS. – 2012. – Vol. 26, No. 17. – P. 2211–2222.
180. Impact of syphilis infection on HIV viral load and CD4 cell counts in HIV-infected patients / R. Palacios, F. Jimenez-Onate, M. Aguilar [et al.] // J. Acquir. Immune Defic. Syndr. – 2007. – Vol. 44. – P. 356–359.
181. Impact of Trichomonas vaginalis transcription-mediated amplification-based analyte-specific reagent testing in a metropolitan setting of high sexually transmitted disease prevalence / E. Munson, M. Napierala, R. Olson [et al.] // J. Clin. Microbiol. – 2008. – Vol. 46. – P. 3368-3374.
182. Increase in Incidence of Congenital Syphilis – United States, 2012–2014 / V. Bowen, J. Su, E. Torrone [et al.] // Morbidity and Mortality Weekly Report. – 2015. – Vol. 64, No. 44. – P. 1241–1260.
183. Increased risk of HIV acquisition among Kenyan men with human papillomavirus infection / J.S. Smith, S. Moses, M. G. Hudgens [et al.] // J. Infect. Dis. – 2010. – Vol. 201, No. 11. – P. 1677–1685.
184. Infeccao genital por Chlamydia trachomatis em casais atendidos em ambulatório de esterilidade conjugal / C.A.S. Marques, M.L.B. Menezes, I.M.G. Coelho [et al.] // Jornal brasileiro de doencas sexualmente transmissíveis. – 2007. – Vol. 19. – P. 5-10.
185. Innate and adaptive immunity in female genital tract: cellular responses and interactions / C.R. Wira, J.V. Fahey, C.L. Sentman [et al.] // Immunol. Rev. – 2005. – Vol. 206, No. 1. – P. 306–335.
186. Innate immune activation enhances hiv acquisition in women, diminishing the effectiveness of tenofovir microbicide gel / V. Naranbhai, S.S. Abdool Karim, M. Altfeld [et al.] // J. Infect. Dis. – 2012. – Vol. 206, No. 7. – P. 993-1001.
187. Interventions for prevention and treatment of vulvovaginal candidiasis in women with HIV infection / A. Ray, S. Ray, A.T. George, N. Swaminathan // Cochrane Database of Syst. Rev. – 2011. – Vol. 10, No. 8. – Article ID: CD008739.
188. IUSTI: 2008 European Guidelines on the Management of Syphilis / P. French, M. Gomberg, M. Janier [et al.] // Int. J. STD AIDS. – 2009. – Vol. 20, No. 5. – P. 300–309.
189. Johnson L.F. The effect of genital tract infections on HIV-1 shedding in the genital tract: a systematic review and meta-analysis / L.F. Johnson, D.S. Lewis // Sex. Transm. Dis. – 2008. – Vol. 35, No. 11. – P. 946–959.
190. Juckett G. Human papillomavirus: clinical manifestations and prevention / G. Juckett, H. Hartman-Adams // Am. Fam. Physician. – 2010. – Vol. 82, No. 10. – P. 1209-1213.
191. Kalichman S.C. Prevalence of Sexually Transmitted Co-Infections in People Living with HIV/AIDS: Systematic Review with Implications for using HIV Treatments for Prevention / S.C. Kalichman, J. Pellowski, C. Turner // Sex Transm Infect. – 2011. – Vol. 87, No. 3. – P. 183–190.
192. Kenyon C. Classification of incidence and prevalence of certain sexually transmitted infections by world regions / C. Kenyon, J. Buyze, R. Colebunders // Int. J. Infect. Dis. – 2014. – Vol. 18. – P. 73–80.
193. Kenyon C.R. Strong Country Level Correlation between Syphilis and HSV-2 Prevalence / C.R. Kenyon, A. Tsoumanis, K. Osbak // J. Sex. Transm. Dis. – 2016. – Vol. 2016. – Article ID: 5959032.
194. Kenyon C.R. The Prevalence of HIV by Ethnic Group Is Correlated with HSV-2 and Syphilis Prevalence in Kenya, South Africa, the United Kingdom, and the United States / C.R. Kenyon, K. Osbak, J. Buyze // Interdiscip. Perspect. Infect. Dis. – 2014. – Vol. 2014. – Article ID: 284317.
195. Laboratory diagnosis of sexually transmitted infections, including human immunodeficiency virus / Ed. by M. Unemo, R. Ballard, C. Ison [et al.]. – Geneva : WHO, 2013. – 244 p.
196. Lazaro N. Sexually Transmitted Infections in Primary Care. Second Edition / N. Lazaro. – Royal College of General Practitioners, British Association for Sexual Health and HIV, 2013. – 146 p.
197. Level of awareness and uptake of the female condom in women aged 18 to 49 years in Bindura district, Mashonaland Central province, Zimbabwe / T. Chipfuwa, A. Manwere, M.M. Kuchenga [et al.] // African Journal of AIDS Research. – 2014. – Vol. 13, No. 1. – P. 75–80.
198. Looker K.J. An estimate of the global prevalence and incidence of herpes simplex virus type 2 infection / K.J. Looker, G.P. Garnett, G.P. Schmid // Bull. World Health Organ. – 2008. – Vol. 86, No. 10. – P. 805–812.
199. Mabey D. Epidemiology of sexually transmitted infections: worldwide / D. Mabey // Medicine. – 2014. – Vol. 42, No. 6. – P. 287–290.
200. Markers of cutaneous humanpapillomavirus infection in individuals with tumor–free skin, actinic keratoses, and squamous cell carcinoma / L. Struijk, L. Hall, E. Meijden [et al.] // Cancer Epidemiol. Biomarkers. Prev. – 2006. – Vol.15, No. 3. – P. 529–535.
201. Mayer K.H. Interactions of HIV, other sexually transmitted diseases, and genital tract inflammation facilitating local pathogen transmission and acquisition / K.H. Mayer, K.K. Venkatesh // Am. J. Reprod. Immunol. – 2011. – Vol. 65, No. 3. – P. 308-316.
202. Mecanismes de l’activite antivirale indirecte de l’imiquimod / D. Hober, L. Ajram, W. Chehadeh [et al.] // Ann. Biol. Clinique. – 2005. – Vol. 63, No. 2. – P. 155–162.
203. Men Who Have Sex With Men and Women: A Unique Risk Group for HIV Transmission on North Carolina College Campuses / L.B. Hightow, P.A. Leone, P.D. Macdonald [et al.] // Sex. Transm. Dis. – 2006. – Vol. 33, No. 10. – P. 585-593.
204. Methamphetamine Use Among Women Attending Sexually Transmitted Disease Clinics in Los Angeles County / S. Stahlman, M. Javanbakht, A. Stirland [et al.] // Sex. Transm. Dis. – 2013. – Vol. 40, No. 8. – P. 632–638.
205. Micro-level social and structural factors act synergistically to increase HIV risk among Nepalese female sex workers / K. Deuba, S. Anderson, A.M. Ekström [et al.] // Int. J. Infect. Dis. – 2016. –Vol. 49. – P. 100-106.
206. Molecular testing for Trichomonas vaginalis in women: results from a prospective U.S. clinical trial / J.R. Schwebke, M.M. Hobbs, S.N. Taylor [et al.] // J. Clin. Microbiol. – 2011. – Vol. 49, No. 12. – P. 4106-4111.
207. Mpondo B.C.T. New Biomedical Technologies and Strategies for Prevention of HIV and Other Sexually Transmitted Infections / B.C.T. Mpondo // J. Sex. Trans. Dis. – 2016. – Vol. 2016. – Article ID: 7684768.
208. Mucosal Immunity in the Female Genital Tract, HIV/AIDS / J.R. Machado, M.V. da Silva, C.L. Cavellani [et al.] // BioMed. Research International. – 2014. – Vol. 2014. – Article ID: 350195.
209. Mucosal Immunology. – 4th edition / Ed. by J. Mestecky, W. Strober, M.W. Russel [et al.]. – N.Y. : Elsevier, 2015. – 2440 p.
210. Munawwar A. Human Herpesviruses as Copathogens of HIV Infection, Their Role in HIV Transmission, and Disease Progression / A. Munawwar, S. Singh // J. Lab. Physicians. – 2016. – Vol. 8, No. 1. – P. 5-18.
211. Neisseria gonorrhoeae enhances HIV-1 infection of primary resting CD4+ T cells through TLR2 activation / J. Ding, A. Rapista, N. Teleshova [et al.] // Journal of Immunology. – 2010. – Vol. 184, No. 6. – P. 2814–2824.
212. Neisseria gonorrhoeae enhances infection of dendritic cells byHIV type 1 / J. Zhang,G. Li, A. Bafica [et al.] // J. Immunol. – 2005. – Vol. 174, No. 12. – P. 7995–8002.
213. Nye M.B. Comparison of APTIMA Trichomonas vaginalis transcription-mediated amplification to wet mount microscopy, culture, and polymerase chain reaction for diagnosis of trichomoniasis in men and women / M.B. Nye, J.R. Schwebke, B.A. Body // American Journal of Obstetrics and Gynecology. – 2009. – Vol. 200, No. 2. – P. e1-e7.
214. O’Leary A. Mediation Analysis of an Effective Sexual Risk-Reduction Intervention for Women: The Importance of Self-Efficacy / A. O’Leary, L.S. Jemmott, J. Jemmott // Health Psychology. – 2008. – Vol. 27, No. 2, Suppl. – P. S180– S184.
215. O’Mahony C. Imiquimod use in the genital area and development of lichen sclerosus and lichen planus / C. O’Mahony, P.D. Yesudian, M, Stanley // Int. J. STD & AIDS. – 2010. – Vol. 21. – P. 219–221.
216. Order of Orifices: Sequence of Condom Use and Ejaculation by Orifice During Anal Intercourse Among Women: Implications for HIV Transmission / P.M. Gorbach, H. Pines, M. Javanbakht [et al.] // J. Acquir. Immune Defic. Syndr. – 2014. – Vol. 67, No. 4. – P. 424–429.
217. Palefsky J. Human papillomavirus-related tumors in HIV / J. Palefsky // Cur. Opin. Oncol. – 2006. – Vol. 18, No. 5. – P. 463–468.
218. Patterns of drug use and HIV infection among adults in a nationally representative sample / S. Shiau, S.M. Arpadi, M.T. Yin, S.S. Martins // Addict. Behav. – 2016. – Vol. 68. – P. 39-44.
219. Performance and safety of the second-generation female condom (FC2) versus the Woman’s, the VA worn-of-women, and the Cupid female condoms: a randomised controlled non-inferiority crossover trial / M.E. Beksinska, G. Piaggio, J.A. Smit [et al.] // Lancet Global Health. – 2013. – Vol. 1, No. 3. – P. E146–E152.
220. Persisting with prevention: the importance of adherence for HIV prevention / H. Weiss, J.N. Wasserheit, R. Barnabas [et al.] // Emerg. Themes Epidemiol. – 2008. – Vol. 11. – Р. 5–8.
221. Policy brief: Сonsolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection – What’s new / WHO. – Geneva, 2015. – 20 р.
222. Population-based biomedical sexually transmitted infection control interventions for reducing HIV infection / B.E. Ng, L.M. Butler, T. Horvath, G.W. Rutherford // Cochrane Database Syst Rev. – 2011. – Vol. 16, No. 3. – P. CD001220.
223. Prevalence and Correlates of Rectal Chlamydia and Gonorrhea Among Female Clients at Sexually Transmitted Disease Clinics / M. Javanbakht, P. Gorbach, A. Stirland [et al.] // Sex. Transm. Dis. – 2012. – Vol. 39, No. 12. – P. 917–922.
224. Prevalence and determinants of Chlamydia trachomatis infection among sexually active women in Turin, Italy / M.C. Salfa, M.A. Latino,V.Regine [et al.] // Italian Journal of Public Health. – 2011. – Vol. 8, No. 3. – P. 295–301.
225. Prevalence and Factors Associated With Trichomonas vaginalis Infection Among High-Risk Women in Los Angeles / M. Javanbakht, A. Stirland, S. Stahlman [et al.] // Sex. Transm. Dis. – 2013. – Vol. 40, No. 10. – P. 804–807.
226. Prevalence of HPV in HIV-infected women in the designated AIDS center at upstate medical university and the potential benefit of vaccination regardless of age / T.D. Feola, M.B. Albert, K. Shahabi, T. Endy // J. Assoc. Nurs. AIDS Care. – 2013. – Vol. 24, No. 2. – P. 176–179.
227. Prevalence of human papillomavirus and herpes simplex virus type 2 infection in Korean commercial sex workers / H. Yun, J. Park, I. Choi [et al.] // J. Microbiol. Biotechnol. – 2008. – Vol. 18, No. 2. – P. 350–354.
228. Prevalence, correlates and trends in seroadaptive behaviours among men who have sex with men from serial cross-sectional surveillance in San Francisco, 2004–2011 / J.M. Snowden, C. Wei, W. McFarland, H.F. Raymond // Sex. Transm. Infect. – 2014. – Vol. 90. – P. 498–504.
229. Randomised controlled trial and economic evaluation of podophyllotoxin solution, podophyllotoxin cream, and podophyllin in the treatment of genital warts / C.J. Lacey, R.L. Goodall, G.R. Tennvall [et al.] // Sex. Transm. Infect. – 2003. – Vol. 79, No. 4. – P. 270–275.
230. Randomized, comparative trial on the sustained efficacy of topical imiquimod 5% cream versus conventional ablative methods in external anogenital warts / H. Schöfer, A. Van Ophoven, U. Henke [et al.] // Eur. J. Dermatol. – 2006. – Vol. 16, No. 6. – P. 642–648.
231. Recommendations for the Laboratory-Based Detection of Chlamydia trachomatis and Neisseria gonorrhoeae – 2014. Recommendations and Reports / J.R. Papp, J. Schachter, C.A. Gaydos [et al.] // MMWR. – 2014. – Vol. 63, No. RR02. – Р. 1–19.
232. Recommendations for Use of Antiretroviral Drugs in Pregnant HIV-1-Infected Women for Maternal Health and Interventions to Reduce Perinatal HIV Transmission in the United States. Last updated: August 6, 2015. [Електронний ресурс]. – Режим доступу: https://aidsinfo.nih.gov/contentfiles/lvguidelines/perinatalgl.pdf.
233. Reemergence of the HIV epidemic among men who have sex with men in North America, Western Europe, and Australia, 1996-2005. / P.S. Sullivan, О. Hamouda, V. Delpech [et al.] // Ann. Epidemiol. – 2009. – Vol. 19, No. 6. – P. 423–431.
234. Relative prevalence of STI pathogens, vaginal conditions and HIV co-infection among STI patients attending Alexandra Health Centre, Gauteng Province, South Africa (2011-2013) / N.B. Sewpershad, I. Venter, L. Gumede [et al.] // Int. J. Infect. Dis. – 2014. – Vol. 21, Suppl. 1. – P. 423.
235. Richens J. Sexually transmitted infections and HIV among travellers: a review / J. Richens // Travel Med. Infect. Dis. – 2006. – Vol. 4, No. 3–4. – P. 184–195.
236. Screening for Sexually Transmitted Diseases in Short-Term Correctional Institutions: Summary of Evidence Reviewed for the 2010 Centers for Disease Control and Prevention Sexually Transmitted Diseases Treatment Guidelines / A.C. Spaulding, J. Miller, B.G. Trigg [et al.] // Sex. Transm. Dis. – 2013. – Vol. 40, No. 9. – P. 679–684.
237. Sebitloane H.M. Pathogenic lower genital tract organisms in HIV-infected and uninfected women, and their association with postpartum infectious morbidity / H.M. Sebitloane, J. Moodley, T.M. Esterhuizen // S. Afr. Med. J. – 2011. – Vol. 101. – P. 466-469.
238. Serological response to syphilis treatment in HIV-positive and HIV-negative patients attending sexually transmitted diseases clinics / K.G. Ghanem, E.J. Erbelding, Z.S. Wiener, A.M. Rompalo // Sex. Transm. Infect. – 2007. – Vol. 83. – P. 97–101.
239. Sexual network position and risk of sexually transmitted infections / C.M. Fichtenberg, S.Q. Muth, B. Brown [et al.] // Sex. Transm. Infect. – 2009. – Vol. 85. – P. 493–498.
240. Sexual Partnership Characteristics of African American Women Who Have Sex With Women; Impact on Sexually Transmitted Infection Risk / C.A. Muzny, E.L. Austin, H.S. Harbison, E.W. Hook 3rd // Sex. Transm. Dis. – 2014. – Vol. 41, No. 10. – P. 611–617.
241. Sexual transmission of HIV according to viral load and antiretroviral therapy: Systematic review and meta-analysis / S. Attia, M. Egger, M. Müller [et al.] // AIDS. – 2009. – Vol. 23, No. 11. – P. 1397–1404.
242. Sexually Transmitted Disease (STD) Diagnoses and Mental Health Disparities Among Women Who Have Sex With Women Screened at an Urban Community Health Center, Boston, MA, 2007 / S.L. Reisner, M.J. Mimiaga, P. Case [et al.] // Sex. Transm. Dis. – 2010. – Vol. 37, No. 1. – P. 5–12.
243. Sexually Transmitted Diseases. 4th edition / K. Holmes, P. Sparling, W. Stamm [et al.]. – McGraw-Hill, 2007. – 2166 p.
244. Sexually transmitted diseases: policies and principles for prevention and care / WHO, UNAIDS. – UNAIDS, 2011. – 48 p.
245. Streuli N. Education and HIV and AIDS in Malawi: The Role of Open, Distance and Flexible Learning. SOFIE Opening Up Access Series No. 3 / N. Streuli, C. Moleni. – London: SOFIE, 2008. – 47 p.
246. Symptomatic vaginal discharge is a poor predictor of sexually transmitted infections and genital tract inflammation in high-risk women in South Africa / K. Mlisana, N. Naicker, L. Werner [et al.] // J. Infect. Dis. – 2012. – Vol. 206, No. 1. – P. 6– 14.
247. Syphilis and human immunodeficiency virus (HIV)-1 coinfection: influence on CD4 T-cell count, HIV-1 viral load, and treatment response / K. Kofoed, J. Gerstoft, L.R. Mathiesen [et al.] // Sex. Transm. Dis. – 2006. – Vol. 33. – P. 143–148.
248. Syphilis does not seem to involve virological and immunological course of concurrent HIV disease / R. Manfredi, S. Sabbatani, D. Pocaterra [et al.] // AIDS. – 2006. – Vol. 20. – P. 305–306.
249. Teng Y. The Role of Planning and Self-Efficacy in Condom Use Among Men Who Have Sex With Men: An Application of the Health Action Process Approach Model / Y. Teng, W.W. Mak // Health Psychology. – 2011. – Vol. 30, No. 1. – P. 119–128.
250. The association between cervical human papillomavirus infection and HIV acquisition among women in Zimbabwe / S.H. Averbach, P.E. Gravitt, R.G. Nowak [et al.] // AIDS. – 2010. – Vol. 24, No. 7. – P. 1035–1042.
251. The changing relationship between bacterial STIs and HIV prevalence in South Africa – an ecological study / C.R. Kenyon, K. Osbak, J. Buyze, R.M. Chico // Int. J. STD AIDS. – 2015. – Vol. 26, No. 8. – P. 556–564.
252. The occurrence of vaginal infections among HIV-infected and high-risk HIVuninfected women: longitudinal findings of the women’s interagency HIV study / D.H. Watts, G. Springer, H. Minkoff [et al.] // J. Acquir. Immune Defic. Syndr. – 2006. – Vol. 43, No. 2. – P. 161–168.
253. The Prevalence of Syphilis from the Early HIV Period is Correlated With Peak HIV Prevalence at a Country Level / K.K. Osbak, J.T. Rowley, N.J. Kassebaum, C.R. Kenyon // Sex. Transm. Dis. – 2016. – Vol. 43, No. 4. – P. 255-257.
254. Time to clearance of human papillomavirus infection by type and human immunodeficiency virus serostatus / J.E. Koshiol, J.C. Schroeder, D.J. Jamieson [et al.] // Int. J. Cancer. – 2006. – Vol. 119, No. 7. – P. 1623–1629.
255. Tobian A.A. Herpes simplex virus type 2 and syphilis infections with HIV: an evolving synergy in transmission and prevention / A.A. Tobian, T.C. Quinn // Curr. Opin. HIV AIDS. – 2009. – Vol. 4, No. 4. – P. 294–299.
256. Traitement des verrues par laser CO2 / A. Souissi, H. Marrak, S. Deghaies [et al.] // Ann. Dermatol.Venereol. – 2005. – Vol. 135. – P. 75–76.
257. Trends in herpes simplex virus type 1 and type 2 seroprevalence in the United States / F. Xu, M.R. Sternberg, B.J. Kottiri [et al.] // J. Am. Med. Assoc. – 2006. – Vol. 296, No. 8. – P. 964–973.
258. Trichomoniasis in pregnancy and mental retardation in children / J.R. Mann, S. Mcdermott, T.L. Barnes [et al.] // Ann. Epidemiol. – 2009. – Vol. 19, No. 12. – Р. 891–893.
259. Trichomoniasis in pregnancy and mental retardation in children / J.R. Mann, S. McDermott, T.L. Barnes [et al.] // Ann. Epidemiol. – 2009. – Vol. 19, No. 12. – P. 891–899.
260. UNAIDS Guidance Note on HIV and Sex Work. – Geneva : UNAIDS, 2009. – 56 p.
261. UNAIDS/WHO Policy Statement on HIV Testing / UNAIDS, WHO. – Geneva : WHO, 2004. – 3 p.
262. United Kingdom National Guideline on the Management of Trichomonas vaginalis 2014 / J. Sherrard, C. Ison, J. Moody [et al.] // Int. J. STD AIDS. – 2014. – Vol. 25, No. 8. – P. 541–549.
263. Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand / S. Rerks-Ngarm, P. Pitisuttithum, S. Nitayaphan [et al.] // N. Engl. J. Med. – 2009. – Vol. 361. – P. 2209–2220.
264. Vaginal trichomoniasis among HIV patients attending primary health care centers of Jos, Nigeria / S.I. Nwadioha, I.A. Bako, I. Onwuezobe, D.Z. Egah // Asian Pacific J. Trop. Dis. – 2012. – Vol. 2, No. 5, P. 337–341.
265. Vickerman P. Sensitivity requirements for the point of care diagnosis of Chlamydia trachomatis and Neisseria gonorrhoeae in women / P. Vickerman, C. Watts, M. Alary [et al.] // Sex. Transm. Infect. – 2003. – Vol. 79. – P. 363–367.
266. Ward H. Contribution of sexually transmitted infections to the sexual transmission of HIV / H. Ward, M. Rönn // Curr. Opin. HIV AIDS. – 2010. – Vol. 5, No. 4. – P. 305–310.
267. Ward H. Prevention strategies for sexually transmitted infections: importance of sexual network structure and epidemic phase / H. Ward // Sex. Transm. Infect. – 2007. – Vol. 83 (suppl. 1). – P. 143–149.
268. Weighing the gold in the gold standard: challenges in HIV prevention research / N.S. Padian, S.I. McCoy, J.E. Balkus, J.N. Wasserheit // AIDS. – 2010. – Vol. 24, No. 5. – Р. 621–635.
269. Workowski K.A. Sexually Transmitted Diseases Treatment Guidelines, 2010 / K.A. Workowski, S. Berman // Morbidity and Mortality Weekly Report. – 2010. – Vol. 59, № RR-12. – P. 1–116.
270. Workowski K.A. Sexually Transmitted Diseases Treatment Guidelines, 2014 / K.A. Workowski, G. Bolan. – WHO, 2014. – 270 p.
271. Workowski K.A. Sexually Transmitted Infections and HIV: Diagnosis and Treatment / K.A. Workowski // Topics in Antiviral Medicine. – 2012. – Vol 20, No. 1. – P. 11–16.
272. World Health Organization. A strategic approach to strengthening control of reproductive tract and sexually transmitted infections: use of the programme guidance tool / World Health Organization. – Geneva : WHO, 2009. – 44 p.
273. Zetola N.M. Syphilis and HIV Infection: An Update / N.M. Zetola, J.D. Klausner // Clinical Infectious Diseases. – 2007. – Vol. 44. – P. 1222–1228.
274. Zodzika J. Abnormal vaginal microflora: risk factors, bed-side diagnostic methods in pregnancy and efficiency of an alternative non-antibacterial treatment modality in pregnant and non-pregnant women : For obtaining the degree of a Doctor of Medicine, Speciality – Obstetrics and Gynaecology / J. Zodzika. – Riga, 2014. – 67 p.
Додаток А
НАВЧАЛЬНИЙ ПЛАН циклу тематичного удосконалення лікарів
«ІНФЕКЦІЇ, ЩО ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ У ГРУПАХ ПІДВИЩЕНОГО РИЗИКУ ДО ІНФІКУВАННЯ ВІЛ/СНІД»
Контингент слухачів – дерматовенерологи, урологи, акушер-гінекологи
Тривалість навчання – 1 місяць (156 учбових годин)
Мета навчання на циклі – удосконалення теоретичних знань та практичних умінь з питань клініки, діагностики, лікування, профілактики ІПСШ в групах населення, уразливих стосовно зараження вірусом імунодефіциту людини.
| Код | Найменування курсу та розділу | Кількість годин | |||
| лек. | практ. | сем. | Усього | ||
| 1. | Основи організації дерматовенерологічної
допомоги в Україні . Уразливі до зараження ВІЛ групи населення |
6 | 4 | 4 | 14 |
| 2. | Сифіліс | 6 | 12 | 4 | 22 |
| 3. | Ендемічні трепонематози | 2 | 2 | 0 | 4 |
| 4. | Гонорея | 2 | 8 | 4 | 14 |
| 5.6.7. | М’який шанкер. Донованоз. Лімфогранульоматоз
паховий. |
2 | 4 | 0 | 6 |
| 8. | Хламідіоз | 2 | 6 | 2 | 10 |
| 9. | Мікоплазмоз | 2 | 4 | 2 | 8 |
| 10. | Трихомоноз | 2 | 4 | 2 | 8 |
| 11. | Бактеріальний вагіноз | 2 | 2 | 2 | 6 |
| 12. | Герпесвірусна інфекція статевих органів | 2 | 2 | 2 | 6 |
| 13. | Інфекції сечостатевих органів, викликані
папіломавірусами людини |
2 | 2 | 2 | 6 |
| 14. | Урогенітальний кандидоз | 2 | 2 | 2 | 6 |
| 15. | Туберкульоз статевих органів | 2 | 2 | 2 | 6 |
| 16. | Лепра статевої системи | 2 | 2 | 0 | 4 |
| 17. | Невенеричні запальні захворювання статевих органів | 2 | 2 | 0 | 4 |
| 18. | ВІЛ-інфекція/СНІД | 6 | 8 | 0 | 14 |
| Всього | 44 | 66 | 28 | 138 | |
| Додаткові програми | 12 | 0 | 0 | 12 | |
| 19. | Особливо небезпечні хвороби | 6 | 0 | 0 | 6 |
| 20. | Радіаційна медицина | 6 | 0 | 0 | 6 |
| ІСПИТ | 0 | 0 | 6 | 6 | |
| ВСЬОГО | 56 | 66 | 34 | 156 | |
Додаток Б
ТЕМАТИЧНИЙ ПЛАН циклу тематичного удосконалення лікарів
| Код | Найменування курсу та розділу | Кількість годин | |||
| лек. | практ. | сем. | Усього | ||
| 1. | Основи організації дерматовенерологічної допомоги в Україні. Уразливі до зараження ВІЛ групи населення | 6 | 4 | 4 | 14 |
| 1.5. | Діагностика, лікування та профілактика ІПСШ в групах населення, уразливих стосовно зараження ВІЛ | 2 | 2 | 2 | 6 |
| 2. | Сифіліс | 6 | 12 | 4 | 22 |
| 2.4. | Діагностика сифілісу. Особливості діагностики сифілісу в уразливих групах. | 0 | 2 | 0 | 2 |
| 2.5. | Лікування сифілісу. Особливості лікування в уразливих до зараження ВІЛ групах. | 0 | 0 | 2 | 2 |
| 2.6– 2.9. | Клініко-серологічний контроль результатів лікування.Зняття з обліку хворих. Профілактика сифілісу в уразливих групах. | 0 | 2 | 0 | 2 |
| 4. | Гонорея | 2 | 8 | 4 | 14 |
| 4.4 | Діагностика гонореї. Застосування швидких тестів в уразливих до зараження ВІЛ групах. | 0 | 2 | 0 | 2 |
| 4.11-4.12 | Екстрагенітальні форми гонореї. Дисемінована гонорея. Особливості перебігу гонореї в уразливих до зараження ВІЛ групах населення. | 0 | 0 | 2 | 2 |
| 4.14- 4.15 | Лікування. Особливості лікування в уразливих до зараження ВІЛ групах.Методи визначення вилікування гонореї. Профілактика гонореї | 0 | 0 | 2 | 2 |
| 14. | Урогенітальний кандидоз | 2 | 2 | 2 | 6 |
| 14.6-14.7 | Клініка урогенітального мікозу.Діагностика.Експрес-методи діагностики | 0 | 2 | 0 | 2 |
| 14.8. | Лікування урогенітального мікозу. Особливості лікування в уразливих до зараження ВІЛ групах. Профілактика. | 0 | 0 | 2 | 2 |
| Всього | 44 | 66 | 28 | 138 | |
Навчально-тематичний план лекційних занять на циклі тематичного удосконалення
| Код | Найменування курсу та розділу | лек. |
| 1.5. | Діагностика, лікування та профілактика ІПСШ в групах населення, уразливих стосовно зараження ВІЛ | 2 |
Навчально-тематичний план семінарських занять на циклі тематичного удосконалення
| Код | Найменування курсу та розділу | сем. |
| 1.5. | Діагностика, лікування та профілактика ІПСШ в групах населення, уразливих стосовно зараження ВІЛ | 2 |
| 2.5. | Лікування сифілісу. Особливості лікування в уразливих до зараження ВІЛ групах. | 2 |
| 4.11-4.12 | Екстрагенітальні форми гонореї. Дисемінована гонорея. Особливості перебігу гонореї в уразливих до зараження ВІЛ групах населення. | 2 |
| 4.14 -4.15 | Лікування. Особливості лікування в уразливих до зараження ВІЛ групах.Методи визначення вилікування гонореї. Профілактика гонореї | 2 |
| 14.8. | Лікування урогенітального мікозу. Особливості лікування в уразливих до зараження ВІЛ групах. Профілактика. | 2 |
Навчально-тематичний план практичних занять на циклі тематичного удосконалення
| Код | Найменування курсу та розділу | практ. |
| 1.5. | Діагностика, лікування та профілактика ІПСШ в групах населення, уразливих стосовно зараження ВІЛ | 2 |
| 2.4. | Діагностика сифілісу. Особливості діагностики сифілісу в уразливих групах. | 2 |
| 2.6.– 2.9. | Клініко-серологічний контроль результатів лікування. Зняття з обліку хворих на сифіліс. Профілактика сифілісу в уразливих групах. | 2 |
| 4.4 | Діагностика гонореї. Застосування швидких тестів в уразливих до зараження ВІЛ групах. | 2 |
Додаток В
ПРОГРАМА циклу тематичного удосконалення лікарів
«ІНФЕКЦІЇ, ЩО ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ, У ГРУПАХ ПІДВИЩЕНОГО РИЗИКУ ДО ІНФІКУВАННЯ ВІЛ/СНІД»
Код Назва курсу, розділу, теми та елемента заняття
1 ОСНОВИ ОРГАНІЗАЦІЇ ДЕРМАТОВЕНЕРОЛОГІЧНОЇ ДОПОМОГИ В УКРАЇНІ
1.1.2. Реалізація національної та міжнародних програм з метою запобігання ВІЛ/СНІД в Україні.
1.1.3. Недержавні установи, що працюють з уразливими до ВІЛ группами населення.
1.2. Соціальні та медичні аспекти хвороб, що передаються статевим шляхом
1.2.1. Популяційна модель поширення ІПСШ
1.2.2.Уразливі групи – РКС, ПІН, ЧСЧ – визначення, характеристика, особливості повідінки та соціальні особливості.
1.3.1. Особливості взаємодії медичного працівника / пацієнта, НУО / пацієнта, медичного працівника / НУО у лікувально-профілактичній роботі стосовно ІПСШ та ВІЛ/СНІДу
1.3.2. Диференційована специфіка роботи з представниками уразливих групп. Консультування та збір анамнезу.
1.4.4. ІПСШ – кофактор передачі ВІЛ
1.5. Діагностика, лікування та профілактика ІПСШ в групах населення, уразливих стосовно зараження ВІЛ
1.5.1. Моделі надання допомоги представникам уразливих групп. Мобільні амбулаторії. НУО.
1.5.2. Діагностика ІПСШ за допомогою швидких тестів.
1.5.3. Лікування ІПСШ в групах населення, уразливих стосовно зараження ВІЛ
1.5.4. Профілактика ІПСШ в групах населення, уразливих стосовно зараження ВІЛ
2. СИФІЛИС
2.2.5.Шляхи передачі. Ризик передачи та інфікування ВІЛ від ВІЛ-позитивної особи при сифілісі
2.3.9. Асоціація сифілісу та ВІЛ-інфекції
2.3.10. Особливості клінічного перебігу сифілісу в уразливих до ВІЛ группах населення (ЖКС, ПІН, ЧСЧ).
2.4.Діагностика сифілісу. Особливості діагностики сифілісу в уразливих групах.
2.4.2.2.Діагностика з застосуванням швидких тестів. Мобільні амбулаторії.
2.4.2.5.Хибна позитивність серологічний реакцій на сифіліс. Роль споживання наркотичних засобів, алкоголю, антиретровірусної терапії у виникненні хибнопозитивних реакцій на сифіліс.
2.4.2.6. Особливості дотестового консультування в уразливих групах.
2.5.Лікування сифілісу. Особливості лікування в уразливих до зараження ВІЛ групах.
2.5.1.1.1.Лікування сифілісу у пацієнтів із супутньою ВІЛ-інфекцією
2.5.1.3. Особливості лікування сифілісу в уразливих до ВІЛ групах населення.
2.9.Профілактика сифілісу в уразливих групах
4. ГОНОРЕЯ
4.5. Діагностика гонореї. Застосування швидких тестів в уразливих до зараження ВІЛ групах.
4.5.6. Діагностика з застусуванням швидких тестів
4.13. Особливості перебігу гонореї в уразливих до зараження ВІЛ групах населення
4.14.2.1. Особливості лікування в уразливих до ВІЛ групах
4.15. Профілактика гонореї, у т. ч. в уразливих групах
8. ХЛАМІДІОЗИ
8.3.3. Спектр патології та розповсюдженість хламідійної інфекції, у т. ч. в уразливих до ВІЛ групах населення
8.8.7. Особливості клінічного перебігу урогенітального хламідіозу в уразливих до ВІЛ групах населення.
8.15.1.4. Особливості лікування в уразливих до ВІЛ групах
9 МІКОПЛАЗМОЗИ
9.3.1. Розповсюдженість мікоплазмозів .Розповсюдженість урогенітального мікоплазмозу серед уразливих до ВІЛ груп населення.
9.4.4. Особливості клінічного перебігу мікоплазмозів в уразливих до ВІЛ групах населення
9.7.3. Особливості лікування в уразливих до ВІЛ групах
9.9. Профілактика урогенітальних мікоплазмозів, у т. ч. в уразливих групах
10. ТРИХОМОНОЗ
10.2. Епідеміологія трихоманозу. Розповсюдженість урогенітального трихомонозу серед уразливих до ВІЛ груп населення.
10.3. Шляхи передачи трихоманозу. Урогенітальний трихомоноз як кофактор зараження ВІЛ.
10.7. Класифікація трихоманозу.Особливості клінічного перебігу урогенітального трихомонозу в уразливих до ВІЛ групах населення.
10.13.1.1. Особливості лікування в уразливих до ВІЛ групах
10.15. Профілактика, у т. ч. в уразливих до ВІЛ групах
11. БАКТЕРІАЛЬНИЙ ВАГІНОЗ
11.3 Клінічні прояви. Особливості клінічного перебігу в уразливих до ВІЛ групах населення.
11.5.4. Особливості лікування в уразливих до ВІЛ групах
12. ГЕРПЕСВІРУСНА ІНФЕКЦІЯ СТАТЕВИХ ОРГАНІВ
12.2. Епідеміологія. Розповсюдженість генітального герпесу серез представників уразливих до ВІЛ груп населення.
12.3. Шляхи передачі.Сприяття передачі ВІЛ.
12.5.6. Особливості клінічного перебігу генітального герпесу в уразливих до ВІЛ групах населення
12.7.5. Особливості лікування в уразливих до ВІЛ групах населення
13. ІНФЕКЦІЇ СЕЧОСТАТЕВИХ ОРГАНІВ, ВИКЛИКАНІ ПАПІЛОМАВІРУСАМИ ЛЮДИНИ
13.6.1.Клінічне та інструментальне обстеження хворих на ВПЛ-інфекцію. Особливості клінічного обстеження в уразливих до ВІЛ групах.
14. УРОГЕНІТАЛЬНИЙ КАНДИДОЗ
14.4.Загальна патологія урогенітального мікозу.Кандидоз та ВІЛ-інфекція.
14.7.5. Особливості діагностики кандидозу в уразливих до ВІЛ групах
14.8.3. Особливості лікування кандидозу в уразливих до ВІЛ групах.
15.ТУБЕРКУЛЬОЗ СТАТЕВИХ ОРГАНІВ
15.2.Шляхи передачі туберкульозу статевих органів,у т.ч. в уразливих групах.
18. ВІЛ-ІНФЕКЦІЯ/СНІД
18.1.8. Уразливі контингенти
18.5.1. Епідеміологічні критерії встановлення інфікованості ВІЛ, уразливі групи
18.5.4 Експрес-діагностика ВІЛ-інфекції (швидкі тести)
18.7.1.Принципи добровільного консультування та тестування на ВІЛ-інфекцію. Передтестове та післятестове консультування.
18.7.2. Передові міжнародні стратегії (кейс-менеджмент) при підході до діагностики і лікування представників уразливих груп і їх вживання при роботі з уразливими групами. Взаємодія між службами (дермато-венерологічної, акушерсько-гінекологічної, профілактики і боротьби зі СНІДом) по розширенню доступу представників уразливих груп до діагностики і лікування ІПСШ
Додаток Г
Анкета аналізу рівня інформованості
Информарованное согласие дано.
Дата ______________________________. Подпись пациента _____________________________________
ЗАПОЛНЯЕТСЯ ПАЦИЕНТОМ
ЭПИДЕМИОЛОГИЧЕСКИЕ ДАННЫЕ ЛИЦ С ИНФЕКЦИЯМИ, ПЕРЕДАЮЩИМИСЯ ПОЛОВЫМ ПУТЕМ
- Аноним № __________________( первые буквы ФИО, произвольный номер, пр.)
- Учетный номер (№ карты)________________________
| Да | Нет | |
| Пол: | ||
| женщина | ||
| мужчина | ||
| Возраст: | ||
| До 20 лет | ||
| 20-29 лет | ||
| 30-39 лет | ||
| 40-49 лет | ||
| 50-59 лет | ||
| 60 и старше | ||
| Семейное положение: | ||
| состоит ли в браке (включая гражданский) | ||
| не состоит | ||
| Количество половых партнеров постоянных | ||
| 1 | ||
| 2 | ||
| более 3 | ||
| Знаете ли Вы свой ВИЧ-статус (подтвержденный лабораторно)? | ||
| Место заражения: | ||
| в парке, на улице, сквере | ||
| в подъезде | ||
| в машине | ||
| в квартире | ||
| в поезде | ||
| в гостинице, доме отдыха, в санатории | ||
| не может указать | ||
| В момент заражения был(а) ли в состоянии опьянения? | ||
| Количество половых партнеров за последний год: | ||
| один | ||
| два | ||
| от 3 до 5 | ||
| от 6 до 10 | ||
| от 10 до- 15 | ||
| более 15 | ||
| более 20 | ||
| не может указать | ||
| В половой контакт вступил(а): | ||
| в первые сутки знакомства | ||
| после знакомства на протяжении одного месяца | ||
| не может указать | ||
| Знаете ли о том, что половым путем передаются следующие инфекции: | ||
| СПИД | ||
| сифилис | ||
| гонорея | ||
| трихомониаз | ||
| хламидиоз | ||
| микоплазмоз | ||
| герпес | ||
| кондиломы | ||
| гепатиты | ||
| Известные Вам пути заражения половыми инфекциями: | ||
| половая связь без презерватива | ||
| поцелуй | ||
| рукопожатие, общие предметы пользования | ||
| загрязненные шприцы, иглы | ||
| нахождение в общей комнате с больным | ||
| в общественном транспорте | ||
| Знакомы ли Вам основные признаки половых болезней
(специфические выделения, покраснения, дискомфорт в уретре, влагалище, нарушение менструального цикла у женщин, нарушение потенции и/или эякуляции у мужчин)? |
||
| Всегда ли Вы знаете о наличии половых инфекции у своего полового партнера? | ||
| Были ли у Вас половые контакты с партнерами с симптомами половых инфекций? | ||
| Всегда ли Вы знаете ВИЧ-статус своего полового партнера? | ||
| Знайте ли Вы, что половые инфекции могут привести к: | ||
| смерти | ||
| инвалидности | ||
| поражению внутренних органов | ||
| бесплодию | ||
| срыву беременности | ||
| рождению больных детей | ||
| половым расстройствам (импотенция) | ||
| Какой метод уберечься от половых инфекций Вы бы выбрали для себя: | ||
| один постоянный партнер | ||
| презерватив | ||
| средства профилактики | ||
| обследование партнера | ||
| Какой метод уберечься от ВИЧ/СПИДа Вы бы выбрали для себя: | ||
| один постоянный партнер | ||
| презерватив | ||
| средства профилактики | ||
| обследование партнера | ||
| Проводите ли Вы профилактические меры к себе и партнеру после полового акта | ||
| Как Вы относитесь к своему заболеванию: | ||
| это пустяк | ||
| болезнь излечима | ||
| боюсь, что наступит тяжелое осложнение | ||
| трудно перенести морально | ||
| Если Вы не обратились к врачу, то почему: | ||
| не думал(а), что у меня венерическая болезнь | ||
| решил(а), что само пройдет | ||
| стыдно было идти к врачу | ||
| боялся(лась), что узнают муж, (жена) | ||
| родственники, знакомые | ||
| считал(а), что могу вылечится сам (а) | ||
| Характерная для Вас сексуальная активность: | ||
| несколько раз в сутки | ||
| один раз в сутки | ||
| 1 раз в 2-3 дня | ||
| 1 раз в неделю | ||
| раз в полмесяца | ||
| раз в месяц | ||
| отсутствие | ||
| Потребность в половом акте: | ||
| несколько раз в сутки | ||
| 1 раз в 2-3 дня | ||
| 1 раз в неделю | ||
| раз в полмесяца | ||
| раз в месяц | ||
| отсутствие | ||
| Практикуете ли Вы изощрённые и необычные половые акты? | ||
| Практикуете ли групповой секс? | ||
| Как Вы относитесь к добрачным половым контактам: | ||
| отрицательно | ||
| положительно | ||
| безразлично | ||
| Как Вы относитесь к внебрачным половым контактам: | ||
| отрицательно | ||
| положительно | ||
| безразлично | ||
| Как Вы относитесь к проституции | ||
| отрицательно | ||
| положительно | ||
| безразлично | ||
| Как Вы относитесь к употреблению наркотиков : | ||
| отрицательно | ||
| положительно | ||
| безразлично | ||
| Алкоголь употребляете: | ||
| часто | ||
| редко | ||
| случайно | ||
| никогда | ||
| На половую функцию алкоголь воздействует: | ||
| стимулирует | ||
| угнетает | ||
| не влияет | ||
| Если Вы прибегаете к внебрачным связям, то почему: | ||
| отсутствие жены (мужа) | ||
| отсутствие постоянного партнера | ||
| половая потребность | ||
| потребность каждый раз иметь другого партнера | ||
| ссоры с женой (мужем) | ||
| половая неудовлетворенность в супружестве | ||
| употребление алкоголя | ||
| скука, желание развлечься | ||
| Употребляете ли Вы наркотикотические средства? | ||
| не употребляю | ||
| пробовал, но не употребляю | ||
| употребляю эпизодически | ||
| употребляю постоянно | ||
| употреблял ранее | ||
| инъекционные наркотики | ||
| употреблял(а) инъекционные накотические средства совместно с ВИЧ-позитивными лицами, чей ВИЧ-статус Вы знали? | ||
| Были ли к Вас половые контакты | ||
| за денежное вознаграждение? | ||
| в качестве дополнительного источника дохода? | ||
| без барьрных средств контрацепции за вознаграждение? | ||
| с партерами одного с Вами пола? | ||
| с ВИЧ-позитивными партнерами, чей статус Вы знали? | ||
| Пребывали ли Вы в местах лишения свободы? |
Додаток Д
Анкета аналізу соціальних відмінностей різних верств населення
Информарованное согласие дано.
Дата ______________________________. Подпись пациента ________ _____________________________
ЗАПОЛНЯЕТСЯ ПАЦИЕНТОМ
СОЦИАЛЬНЫЕ ДАННЫЕ ЛИЦ С ИНФЕКЦИЯМИ, ПЕРЕДАЮЩИМИСЯ ПОЛОВЫМ ПУТЕМ
- Аноним № __________________( первые буквы ФИО, произвольный номер, пр.)
- Учетный номер (№ карты)________________________
| Да | Нет | |
| Пол: | ||
| женщина | ||
| мужчина | ||
| Возраст: | ||
| До 20 лет | ||
| 20-29 лет | ||
| 30-39 лет | ||
| 40-49 лет | ||
| 50-59 лет | ||
| 60 и старше | ||
| Семейное положение: состоит в браке (включая гражданский) | ||
| Количество детей: | ||
| не имеет детей | ||
| 1 ребенок | ||
| 2 детей | ||
| 3 детей и более | ||
| Работа (учеба): | ||
| безработный | ||
| учащийся (студент) | ||
| временная работа (ИТД) | ||
| постоянная | ||
| Образование: | ||
| среднее неоконченное | ||
| среднее | ||
| высшее | ||
| Профессия: | ||
| квалифицированные рабочие | ||
| подсобные рабочие | ||
| служащие | ||
| работники общественного питания | ||
| работники транспорта | ||
| медицинские работники | ||
| преподаватели, работники детских учреждений | ||
| научные работники | ||
| учащиеся средних школ и училищ техникумов | ||
| студенты | ||
| военнослужащие | ||
| домохозяйки | ||
| бизнесмены | ||
| лица без определенных занятий | ||
| Постоянный житель | ||
| Приезжий | ||
| Житель городской | ||
| сельский | ||
| Кем Вы воспитывались в детстве: | ||
| отцом и матерью | ||
| одним отцом | ||
| одной матерью | ||
| отцом и мачехой | ||
| матерью и отчимом | ||
| бабушкой и дедушкой | ||
| близкими родственниками | ||
| в детском доме | ||
| Имел ли место распад семьи, в которой Вы воспитывались | ||
| До какого возраста Вы жили с родителями: | ||
| не жил | ||
| до 10 лет | ||
| до 12-14 | ||
| до 16-17 | ||
| до 18-19 | ||
| до 20-24 | ||
| до 25-29 лет | ||
| до 30 лет и более | ||
| На чем были основаны Ваши семейные отношения: | ||
| на любви и дружбе | ||
| на долге и обязанности | ||
| на привычке | ||
| на материальной основе | ||
| Из каких источников Вы узнали впервые о венерических болезнях: | ||
| в школе в процессе обучения | ||
| от родителей | ||
| от товарищей | ||
| от врача | ||
| по телевидению | ||
| из печати | ||
| не знал | ||
| Настоящий брак по счету: | ||
| первый | ||
| второй | ||
| третий | ||
| четвертый и более | ||
| В первый брак вступил(а): | ||
| до 16 лет | ||
| 16—19л. | ||
| 20-21 л. | ||
| 21—25 л. | ||
| 25—30 л. | ||
| 31—40 л. | ||
| 40 и старше | ||
| не вступал(а) | ||
| Основой брака были: | ||
| дружба | ||
| любовь | ||
| общие интересы | ||
| материальное благо | ||
| половая потребность | ||
| любопытство | ||
| искренность | ||
| уважение, равноправие | ||
| желание иметь семью | ||
| не могу сказать | ||
| В первом браке состоял(а): | ||
| один год или менее | ||
| два года | ||
| три года | ||
| от 5 до 10 лет | ||
| от 10 до 20 лет | ||
| более 20 лет | ||
| Причиной расторжения брака были: | ||
| разочарование в семейной жизни | ||
| отсутствие детей | ||
| любовь другого человека | ||
| отсутствие взаимного понимания | ||
| половая дисгармония | ||
| материальные затруднения | ||
| обман, лживость, измена | ||
| деспотизм | ||
| злоупотребление алкоголем | ||
| не могу сказать | ||
| Информацию о половой жизни получил(а): | ||
| до 10 лет | ||
| 11-13 л. | ||
| 14-15 л. | ||
| 16-17 л. | ||
| 18-19 л. | ||
| 25 и более | ||
| Из каких источников Вы впервые получили информацию о половой жизни: | ||
| в школе в процессе обучения | ||
| от родителей | ||
| товарищей | ||
| врача | ||
| по телевидению и кино (видео) | ||
| жены (мужа) | ||
| медицинской литературы | ||
| порнографических изданий | ||
| Знали ли об опасности ранней половой жизни? | ||
| В каком возрасте начали половую жизнь: | ||
| до 14 лет | ||
| в возрасте 15-17 лет | ||
| 18-19 л | ||
| 20-29 л. | ||
| 30 лет и старше | ||
| не может указать | ||
| Что явилось мотивом для Вашей первой половой связи: | ||
| любовь | ||
| желание скорее стать взрослым | ||
| любопытство | ||
| настойчивость партнера | ||
| половое влечение | ||
| состояние алкогольного опьянения | ||
| влияние друзей, товарищей | ||
| насилие | ||
| деньги | ||
| Кто-нибудь из ваших близких | ||
| болел ли алкоголизмом | ||
| наркоманией | ||
| ВИЧ | ||
| пребывал ли в местах лишения свободы | ||
| Относите ли Вы себя к представителям групп повышенного риска, в отношении заражения половыми инфекциями и ВИЧ, таким как | ||
| лица, оказывающие сексуальные услуги за плату | ||
| потребители инъекционных наркотиков | ||
| лица, имеющие половые контакты с представителями одного пола | ||
| лица, находящиеся в местах лишния свободы | ||
| дети улицы и другие |
Додаток Е
Анкета для осіб з інфекціями, що передаються статевим шляхом
Информарованное согласие дано.
Дата ______________________________. Подпись пациента ________ _____________________________
ЗАПОЛНЯЕТСЯ ВРАЧОМ
Анкетные ДАННЫЕ ЛИЦ С ИНФЕКЦИЯМИ, ПЕРЕДАЮЩИМИСЯ ПОЛОВЫМ ПУТЕМ
- Ф. И. О. _____________________________________(Аноним № )___________________
- Учетный номер (№ карты)________________________
- Дата заполнения анкеты__________________________
| Да | Нет | Лабораторное подтверждение | |
| Пол: | |||
| Женщина | |||
| мужчина | |||
| Возраст: | |||
| До 20 лет | |||
| 20-29 лет | |||
| 30-39 лет | |||
| 40-49 лет | |||
| 50-59 лет | |||
| 60 и старше | |||
| Окончательный диагноз: | |||
| первичный сифилис | |||
| вторичный сифилис | |||
| ранний латентный | |||
| поздний латентный и неутонченный | |||
| третичный активный | |||
| врожденный | |||
| висцеральный | |||
| сифилис нервной системы | |||
| гонорея свежая | |||
| гонорея хроническая | |||
| трихомониаз | |||
| хламидиоз | |||
| микоплазмоз | |||
| герпес | |||
| генитальные бородавки | |||
| Сочетанная патология | |||
| Клинические формы сопутствующих поражений кожи и слизистых | |||
| гепатиты | |||
| ВИЧ | |||
| микозы стоп | |||
| кистей | |||
| складок | |||
| онихомикоз | |||
| Кандидозы паронихии | |||
| паронихии | |||
| слизистой рта | |||
| уретрит | |||
| баланопостит | |||
| вульвовагинит | |||
| отрубевиднйы лишай | |||
| себорейный дерматит | |||
| герпес | |||
| Сочетанные поражения | |||
| Предположительный срок заражения | |||
| до 1 мес | |||
| 2 мес | |||
| более 3 мес | |||
| более 6 мес | |||
| более 1 г | |||
| более 2х лет | |||
| более 5 лет | |||
| Каким путем выявлен больной(ая): | |||
| обратился в венучреждение сам(а) | |||
| выявлен(а) на профосмотре | |||
| выявлен(а) как источник заражения | |||
| как контактное лицо | |||
| направлен другими специалистами | |||
| Больной(ая) обратился (ась) за мед. помощью со дня заболевания: | |||
| на 1 неделе | |||
| через две недели | |||
| через месяц | |||
| более одного месяца | |||
| Лечился(ась) больной(ая) до установления окончательного диагноза: | |||
| лечился(ась) самостоятельно | |||
| у частнопрактикующего врача | |||
| у знакомого немедицинского лица | |||
| у врача-специалиста | |||
| не лечился | |||
| Источник заражения: | |||
| супруг | |||
| сожитель | |||
| знакомый(ая) | |||
| случайный знакомый(ая) | |||
| представитель коммерческого секса | |||
| не выявлен | |||
| Основной фон настроения: | |||
| пониженный (тревожность, депрессивность) | |||
| ровный или повышенный | |||
| Аффективно-волевая сфера: | |||
| мнительность | |||
| обидчивость | |||
| застенчивость | |||
| робость | |||
| чувство неполноценности | |||
| замкнутость | |||
| общительность | |||
| навязчивые страхи | |||
| скептицизм, неверие в свое и общее будущее | |||
| раздражительность, вспыльчивость | |||
| агрессивные действия | |||
| Нарушение сна: | |||
| бессонница, сонливость | |||
| нормальный сон | |||
| Вегетативные нарушения: | |||
| головные боли | |||
| кардиалгии | |||
| боли другой локализации | |||
| сосудистые дистонии | |||
| желудочно-кишечные расстройства | |||
| потливость | |||
| дистермии (то в жар, то в холод) | |||
| Принадлежность к группе риска: | |||
| работники коммерческого секса | |||
| инъекционные наркоманы | |||
| мужчины, имеющие половые связи с мужчинами | |||
| заключенные | |||
| другие |
Додаток Ж
Акти впровадження










