Міністерство охорони здоров’я україни
Державний заклад «Дніпропетровська медична
академія Міністерства охорони здоров’я україни»
На правах рукопису
Резніченко Наталія Юріївна
УДК 616.5-036.12-055.1-08-084
Особливості клінічного перебігу та лікування хронічних дерматозів у чоловіків з урахуванням вікових розладів гомеостазу та інволютивних змін шкіри
14.01.20 – шкірні та венеричні хвороби
Дисертація на здобуття наукового ступеня
доктора медичних наук
Науковий консультант:
Дюдюн Анатолій Дмитрович
доктор медичних наук, професор
Дніпропетровськ – 2015
Зміст
| Перелік умовних скорочень | 5 |
| Вступ | 6 |
| Розділ 1 Сучасні погляди на клінічний перебіг і лікування хронічних дерматозів у чоловіків з урахуванням вікових інволютивних змін (огляд літератури) | 16 |
| 1.1 Сучасні погляди на етіологію та патогенез вікових розладів гомеостазу та інволютивних змін шкіри у чоловіків | 16 |
| 1.2. Сучасні підходи до корекції інволютивних змін шкіри та метаболізму у чоловіків | 27 |
| 1.3. Етіологія, патогенез, клінічний перебіг і лікування псоріатичної хвороби | 37 |
| 1.4. Особливості стану шкіри та гомеостазу організму у хворих на хронічні алергодерматози та їх корекція | 46 |
| Розділ 2 клінічна характеристика та методи досліджень | 51 |
| Розділ 3 Особливості стану шкіри, соціально-побутових і психологічних параметрів, гомеостазу у чоловіків різного вікових груп | 63 |
| Розділ 4 Вплив соціально-побутових і психогенних чинників на стан шкіри та гомеостаз організму у чоловіків | 90 |
| 4.1 Вплив тютюнопаління на стан шкіри та загальний стан здоров’я чоловіків | 91 |
| 4.2 Особливості стану шкіри та гомеостазу організму у чоловіків у залежності від частоти вживання алкоголю | 98 |
| 4.3 Стан шкіри та особливості гомеостазу організму чоловіків у залежності від частоти вживання овочів і фруктів | 102 |
| 4.4 Вплив недостатнього вживання кисломолочних продуктів на стан шкіри та загальний стан здоров’я чоловіків | 106 |
| 4.5 Особливості стану шкіри та гомеостазу організму у чоловіків з різним рівним ситуативної тривожності | 109 |
| 4.6 Вплив комплексу несприятливих факторів на стан шкіри та загальний стан здоров’я чоловіків | 112 |
| 4.7 Стан шкіри та загальний стан здоров’я у чоловіків у залежності від ментальних особливостей | 121 |
| 4.8 Особливості соціально-побутових, психологічних параметрів і гомеостазу у чоловіків в умовах великого промислового міста та їх вплив на стан шкіри | 124 |
| Розділ 5 шляхи медикаментозної корекції негативного впливу умов великого промислового міста на стан здоров’я чоловіків | 143 |
| 5.1 Корекція змін стану шкіри та гомеостазу організму у чоловіків віком 35-44 років з застосуванням вітамінотерапії | 144 |
| 5.2 Покращення стану шкіри та метаболізму у чоловіків віком 45-54 роки з використанням пробіотичних засобів | 149 |
| 5.3 Корекція змін стану шкіри та гомеостазу організму у чоловіків віком 45-54 років з застосуванням краталу та кверцетину | 153 |
| 5.4 Покращення стану шкіри за рахунок корекції метаболічних змін у чоловіків віком 55-64 років шляхом застосування метаболітотропних препаратів | 158 |
| 5.5 Корекція інволютивних змін шкіри та гомеостазу організму у чоловіків віком 55-64 років з використанням трібестану | 170 |
| 5.6 Комплексна корекція інволютивних змін шкіри та гомеостазу організму у чоловіків віком 55-64 років | 175 |
| Розділ 6 Особливості стану шкіри, соціально-побутових і психологічних параметрів, гомеостазу у хворих на псоріаз чоловіків | 186 |
| Розділ 7 Патогенетичне обґрунтування нових підходів до лікування хворих на псоріатичну хворобу чоловіків старших вікових груп в умовах великого промислового міста | 204 |
| Розділ 8 Особливості стану шкіри, соціально-побутових і психологічних параметрів, гомеостазу у хворих на хронічні алергодерматози чоловіків | 224 |
| Розділ 9 Патогенетично обґрунтовані нові методики лікування хворих на хронічні алергодерматози чоловіків старших вікових груп в умовах великого промислового міста | 242 |
| Розділ 10 Узагальнення результатів дослідження | 262 |
| Висновки | 295 |
| Рекомендації | 299 |
| Список використаних джерел | 300 |
| Додаток А Акти впровадження | 335 |
Перелік умовних скорочень
| А | – | адреналін |
| АОА | – | антиокислювальна активність |
| АОС | – | антиокислювальна система |
| АТФ | – | аденозинтрифосфорна кислота |
| ВАТ | – | відкрите акціонерне товариство |
| ГДК | – | гранично допустима концентрація |
| ДА | – | дофамін |
| ДАТ | – | діастолічний артеріальний тиск |
| ДОФА | – | L-діоксифенілаланін |
| І | – | інсулін |
| ІМТ | – | індекс маси тіла |
| К | – | кортизол |
| КАОЗ | – | коефіцієнт антиокислювального захисту |
| КУО | – | колонієутворююча одиниця |
| ЛГ | – | лютеїнізуючий гормон |
| НА | – | норадреналін |
| ПЖК | – | підшкірна жирова клітковина |
| ПОЛ | – | перекисне окислення ліпідів |
| ПРЛ | – | пролактин |
| САС | – | симпатоадреналова система |
| САТ | – | систолічний артеріальний тиск |
| СМ | – | середні молекули |
| Т | – | тестостерон |
| ТБК-АП | – | тіобарбітурової кислоти активні продукти |
| ТЗГ | – | тестостеронзв’язуючий глобулін |
| ФСГ | – | фолікулостимулюючий гормон |
| AMS | – | Aging Males Symptoms Scale |
| BSA | – | Body Surface Area |
| DLQI | – | Dermatology Life Quality Index |
| PASI | – | Psoriasis Area and Severity Index |
| SCORAD | – | Scoring of Atopic Dermatitis |
ВСТУП
Актуальність теми. Однією з важливих проблем сучасної дерматології є хронічні дерматози, оскільки вони посідають провідне місце у структурі захворювань шкіри [3, 6, 32, 53, 72, 137, 275, 292]. Збільшення віку пацієнта супроводжується зростанням частоти рецидивів дерматозів і формуванням резистентності до різних методів лікування [84, 129].
Збільшення тривалості життя диктує необхідність подовження його активного способу за рахунок збереження здоров’я та підвищення якості життя у людей старшого віку, в тому числі і хворих на хронічні дерматози, що обумовлює актуальність подальшого вивчення цього розділу медичної науки. Не дивлячись на велику кількість публікацій, на сьогодні остаточно не з’ясованими залишаються етіологічні чинники та патогенетичні ланки розвитку хронічних дерматозів у чоловіків.
Відомо, що поступові зміни фізіологічних функцій організму чоловіків протягом життя супроводжуються тривалим динамічним процесом функціональних і структурних змін у різних органах і системах, який розвивається задовго до приходу старості [135, 176]. На сьогодні недостатньо з’ясованими є ряд факторів, які беруть участь у формуванні змін шкіри у чоловіків у віковому аспекті, серед них – екологічні та соціальні чинники, стан метаболізму, гормональний статус, функціонування нервової та симпатоадреналової систем.
Існує багато способів лікування хронічних дерматозів і порушень стану шкірного покрову, проте висока захворюваність і частота патологічних змін шкіри серед населення обумовлює необхідність розробки нових превентивних методів і терапевтичних методик [23, 47, 142, 182, 220, 275]. Відомі способи корекції вікових змін метаболізму, гормональних порушень, змін функціонування центральної та вегетативної нервової системи, вікових психологічних особливостей і пов’язаних з ними порушень стану шкірного покрову [14, 46, 59, 166, 204]. Проте не було проведено прицільних досліджень щодо лікування хронічних дерматозів (псоріазу та хронічних алергодерматозів) з урахуванням вікових розладів гомеостазу та інволютивних змін шкіри у чоловіків.
Відсутність робіт з вивчення вікових особливостей шкіри, клінічного перебігу та лікування хронічних дерматозів у чоловіків різних вікових груп зумовлюють актуальність проведення дослідження. Необхідність вивчення клінічних особливостей стану шкіри, її кровотоку та мікробіоценозу у чоловіків різних вікових груп, з’ясування змін гомеостазу організму, які можуть спричиняти порушення стану шкірного покрову, виникнення та розвиток хронічних дерматозів, розробки методів їх лікування визначили вибір напрямку, мети та завдань дослідження.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота виконана в рамках науково-дослідних робіт кафедри шкірних та венеричних хвороб Державного закладу «Дніпропетровська медична академія МОЗ України» «Комплексна диференційована терапія хворих на дерматози та інфекції, що передаються статевим шляхом, з урахуванням порушень адаптаційних механізмів в умовах коморбідності» (№ держреєстрації 0111U002791) та «Таргетна терапія хворих на дерматози та інфекції, що передаються статевим шляхом, в умовах коморбідності» (№ держреєстрації 0114U000931). Дисертантом особисто вивчено особливості клінічного перебігу хронічних дерматозів з урахуванням порушень вікових адаптаційних механізмів у чоловіків, розроблено таргетну терапію хворих на хронічні дерматози чоловіків віком 45-64 років.
Мета та задачі дослідження. Мета – розробка алгоритмів підвищення ефективності лікування чоловіків, хворих на хронічні дерматози (псоріаз, алергодерматози), шляхом залучення до комплексного лікування індивідуалізованих терапевтичних заходів, спрямованих на уповільнення вікових розладів гомеостазу та інволютивних змін шкіри.
Задачі дослідження:
1. Вивчити клініко-функціональний стан шкіри у чоловіків різних вікових груп і оцінити взаємозв’язок інволютивних змін шкіри з основними показниками гомеостазу організму.
2. Визначити клінічні особливості стану шкіри, загального здоров’я чоловіків, які проживають у великих промислових містах, та встановити основні фактори ризику, які негативно впливають на стан шкіри.
3. Розробити індивідуалізовані методики корекції вікових розладів гомеостазу та інволютивних змін шкіри у чоловіків різного віку, які мешкають в умовах великого промислового міста.
4. Охарактеризувати особливості перебігу псоріазу у чоловіків віком 45-64 років з урахуванням стану кровообігу в шкірі, рівня ендогенної інтоксикації, активності процесів перекисного окислення ліпідів і антиокислювальної системи, стану ліпідного та вуглеводного обміну, проявів андрогенного дефіциту, функціонування симпатоадреналової та вагоінсулярної системи, психологічного статусу.
5. Розробити патогенетично обґрунтовану методику терапії псоріазу у чоловіків 45-64-річного віку та оцінити ефективність її застосування.
6. Дослідити закономірність розвитку хронічних алергодерматозів у чоловіків віком 45-64 років та її залежність від інволютивних змін шкіри, стану мікроциркуляції, мікробного пейзажу, рівня ендогенної інтоксикації, активності процесів перекисного окислення ліпідів і антиокислювальної системи, проявів андрогенного дефіциту, функціональної активності симпатоадреналової та вагоінсулярної систем, психологічного статусу.
7. Розробити нову методику лікування чоловіків 45-64-річного віку, хворих на хронічні алергодерматози, й обґрунтувати її патогенетичну та клінічну доцільність.
Об’єкт дослідження: інволютивні зміни шкіри, хронічні дерматози (псоріаз, хронічні алергічні захворювання шкіри).
Предмет дослідження: інволютивні зміни шкіри, фактори ризику виникнення інволютивних змін, клінічний перебіг псоріазу та хронічних алергодерматозів, функціональні зміни клітинних мембран, рівень ендогенної інтоксикації, функціональний стан системи пероксидації ліпідів і антиоксидантного захисту, гормональний і нейромедіаторний статус, ліпідний і вуглеводний обмін, мікробний пейзаж шкіри, слизових оболонок ротоглотки, кишечника, мікроциркуляція шкіри, психологічний стан здорових і хворих на хронічні дерматози чоловіків.
Методи дослідження: загальноклінічні (збір скарг і анамнезу, фізикальне обстеження, антропометрія); біохімічні (визначення концентрації тіобарбітурової кислоти активних продуктів, антиокислювальної активності в слині, осмотичної стійкості еритроцитів, концентрацій середніх молекул, глюкози, β-ліпопротеїдів, холестерину, тригліцеридів у крові); імуноферментні (дослідження концентрації інсуліну, кортизолу, тестостерону, тестостеронзв’язуючого глобуліну, фолікулостимулюючого гормону, лютеїнізуючого гормону, пролактину в сироватці крові; екскреції адреналіну, норадреналіну, L-діоксифенілаланіну, дофаміну з добовою сечею); мікробіологічні; інструментальні (доплерографічне ультразвукове дослідження шкіри); біомікроскопічні (дослідження кровоносних судин нігтьового ложа); соціологічні (оцінка якості життя, стану ситуативної та особистісної тривожності, невротизації, депресії, андрогенного дефіциту); статистичні.
Наукова новизна одержаних результатів. Вперше доведено особливості перебігу псоріазу та хронічних алергодерматозів у чоловіків на фоні інволютивних змін шкіри та гомеостазу організму. Доповнено наукові дані про те, що у чоловіків віком 45-54 років перебіг хронічних алергодерматозів супроводжується збільшенням порушень тургору шкіри на 25 %, зростанням бальної оцінки стану фотозахищених ділянок шкіри на 27 %, зменшенням кількості функціонуючих капілярів на 22,2 %, зростанням порушень мікроциркуляції нігтьового ложа на 29,0 %, підвищенням рівня ендогенної інтоксикації (що проявляється зростанням концентрації середніх молекул 1 на 18 % та середніх молекул 2 на 25 %) порівняно зі здоровими чоловіками аналогічного віку.
Вперше було визначено, що перебіг псоріазу та хронічних алергодерматозів у чоловіків 45-54-річного віку відбувається на фоні андрогенного дефіциту, що підтверджується зростанням бальної оцінки за Aging Males Symptoms Scale на 7,5 % (у хворих на псоріаз) і 10,5 % (у хворих на хронічні алергодерматози), зниженням концентрації тестостерону на 33,2 % (у хворих на псоріаз) і 22,3 % (у хворих на хронічні алергодерматози) порівняно зі здоровими чоловіками аналогічного віку.
Вперше встановлено, що у хворих на псоріаз і хронічні алергодерматози чоловіків віком 45-64 років мають місце виражені порушення вегетативного гомеостазу, що проявляється пригніченням активності симпатичної нервової системи і підвищенням тонусу та реактивності парасимпатичної нервової системи, високий ступінь напруження глюкокортикоїдної функції надниркових залоз.
Доповнено наукові дані про те, що перебіг псоріазу та хронічних алергодерматозів у чоловіків віком 45-54 років супроводжується помірним рівнем особистісної та високим рівнем ситуативної тривожності, невротизацією середнього ступеня тяжкості, станом субдепресії.
Розширено наукові поняття про інволютивні особливості шкіри у чоловіків різного віку, на фоні яких можуть розвиватись хронічні дерматози. Зокрема, виявлено зростання бальної оцінки стану шкіри за шкалою Yolanda R. Helfrich et al. у 46,3 рази, зменшення максимальної швидкості кровотоку в шкірі на 11 %, середньої швидкості кровотоку в шкірі на 12 %, збільшення індексів пульс-активності та резистентності – на 16 %, зростання кількості коагулазопозитивних стафілококів на шкірі з (0,2±0,17) до (1,27±0,33) Lg колонієутворюючих одиниць (КУО)/см2 у чоловіків 55-64-річного віку, порівняно з чоловіками віком 25-34 років.
Вперше встановлено, що інволютивні зміни шкіри у чоловіків виникають на фоні субкомпенсованих порушень функціонального стану симпатоадреналової та вагоінсулярної систем у чоловіків 45-54-річного віку, що проявляються синергічним підвищенням активності симпатичного та парасимпатичного відділів вегетативної нервової системи, перевищенням напруження нервової ланки симпатоадреналової системи над напругою глюкокортикоїдної функції надниркових залоз, а у чоловіків 55-64-річного віку – на фоні появи парадоксальних реакцій, декомпенсації функціонування симпатоадреналової системи та вегетативної дисфункції.
Вперше виявлено, що у чоловіків старшого віку спостерігаються порушення добової періодичності змін рівнів параметрів системи перекисного окислення ліпідів – антиоксидантної системи: у чоловіків віком 55-64 років виникає новий циркадний ритм показників коефіцієнту антиокислювального захисту, який характеризується підвищенням значень у денні години; середньодобові значення активних продуктів тіобарбітурової кислоти у слині чоловіків старшого віку значно перевищують рівні у чоловіків молодшого віку; зникає циркадний ритм коливань показників антиокислювальної активності у слині.
Уточнено наукові дані про фактори ризику погіршення стану шкіри та загального стану здоров’я чоловіків віком 45-64 років, які включають недостатнє вживання кисломолочних продуктів (менше 3 днів на тиждень), овочів і фруктів (менше 5 днів на тиждень), рівень ситуативної тривожності за шкалою Спілбергера-Ханіна більше 42 балів.
Вперше на моделі двох міст з різним антропогенним навантаженням і забрудненням довкілля встановлено підвищену ситуативну тривожність і невротизацію, зміни гомеостазу організму, що проявляються у зростанні рівня ендогенної інтоксикації (збільшенні концентрації середніх молекул на 13,1 %), превалюванні тонусу та реактивності симпатичної нервової системи над парасимпатичною, підвищенні кількості коагулазопозитивних стафілококів на шкірі у чоловіків, які проживають у великому промисловому місті з несприятливим довкіллям [(0,696±0,207) Lg КУО/см2], порівняно з мешканцями міста зі сприятливим довкіллям [(0,167±0,115) Lg КУО/см2].
Практичне значення одержаних результатів. Розроблено нову методику лікування псоріазу у чоловіків 45-64-річного віку, яка полягає у застосуванні на фоні базової терапії препарату з цитопротекторними, антиоксидантними та ноотропними властивостями, фітопрепарату на основі стероїдних сапонінів, автогенного тренінгу за методом Шульца, що забезпечує кращі результати лікування хворих порівняно з базовою терапією (індекс Psoriasis Area Severity Index менше у 1,56 рази, індекс Body Surface Area менше у 1,20 рази, індекс Dermatology Life Quality Index менше у 1,50 рази).
Запропоновано нову методику лікування хворих на хронічні алергодерматози чоловіків 45-64-річного віку з додатковим використанням препарату з цитопротекторними, антиоксидантними та ноотропними властивостями, фітопрепарату на основі стероїдних сапонінів, автогенного тренінгу за методом Шульца, що дозволяє отримати кращі результати лікування порівняно з базовою терапією (індекс Scoring of Atopic Dermatitis у 1,31 рази менший, індекс Dermatology Life Quality Index у 1,39 рази менший, вираженість свербежу у 1,24 рази менша).
Запропоновано нові методики корекції інволютивних змін шкіри та гомеостазу організму у чоловіків з використанням полівітамінних препаратів, біотину та декспантенолу у віці 35-44 років; пробіотичних засобів, краталу та кверцетину у віці 45-54 років; фітопрепарату на основі стероїдних сапонінів, ноотропного препарату з антиоксидантним і цитопротекторним ефектом у віці 55-64 років. Розроблено рекомендації з проведення профілактичних заходів серед чоловіків 45-64-річного віку щодо запобігання розвитку інволютивних змін шкіри та організму в цілому, які полягають у забезпеченні достатнього вживання кисломолочних продуктів (3 дні на тиждень і більше), овочів і фруктів (5 днів на тиждень і частіше), уникненні стресових ситуацій з підвищенням ситуативної тривожності, виключенні тютюнопаління та частого вживання алкоголю (1 раз на тиждень або частіше).
Запропоновані методики лікування впроваджено з позитивним ефектом у роботу Комунального закладу „Кіровоградський обласний шкірно-венерологічний диспансер”, Львівського обласного комунального шкірно-венерологічного диспансеру, Комунального закладу „Миколаївський обласний шкірно-венерологічний диспансер”, Комунальної установи „Одеський обласний шкірно-венерологічний диспансер”, Херсонського обласного шкірно-венерологічного диспансеру, Комунального закладу „Криворізька міська клінічна лікарня № 8 Дніпропетровської обласної ради”. Теоретичні положення, практичні рекомендації та основні результати дисертації включено в матеріали лекцій для студентів, лікарів-інтернів та лікарів-курсантів на кафедрах шкірних та венеричних хвороб Державного закладу „Дніпропетровська медична академія МОЗ України”, на кафедрі сімейної медицини з курсами дерматовенерології та психіатрії Державного закладу „Запорізька медична академія післядипломної освіти МОЗ України”.
Особистий внесок здобувача. Дисертаційна робота є самостійною працею автора. Автор особисто проаналізував вітчизняну та зарубіжну літературу щодо проблеми, яка вивчалась, особисто провів інформаційний і патентний пошук, планував мету та задачі дослідження. Клінічне обстеження пацієнтів і спостереження за ними у динаміці виконувалось автором самостійно. Лабораторні та інструментальні дослідження проведено при безпосередній участі автора. Особисто були розроблені методики корекції інволютивних змін шкіри та лікування хронічних дерматозів. Автор самостійно провів статистичну обробку отриманих результатів та їх аналіз, підготував наукові дані до публікації, написав розділи дисертації, зробив висновки, сформулював практичні рекомендації, на підставі чого були опубліковані всі наукові праці, здійснено впровадження результатів наукових досліджень у клінічну практику.
Автором спільно з Ю. Г. Резніченком, М. О. Ярцевою, співробітниками Запорізького державного медичного університету, Г. І. Резніченко, співробітником Державного закладу „Запорізька медична академія післядипломної освіти МОЗ України”, опубліковано монографію “Корекція дисбіотичних станів у мешканців індустріальних центрів”, в якій матеріали дисертації представлені в самостійно написаному розділі “Мікробіоценоз шкіри в нормі та при патології”, підрозділі “Корекція стану мікробіоценозу при хронічних дерматологічних захворюваннях”. Спільно з Ю. Г. Резніченком, І. В. Пащенко, співробітниками Запорізького державного медичного університету, Г. І. Резніченко, співробітником Державного закладу „Запорізька медична академія післядипломної освіти МОЗ України”, опубліковано монографію “Вітамінопрофілактика та вітамінотерапія мешканців промислових центрів”, в якій матеріали дисертації представлені в самостійно написаних підрозділах “Зміни перекисного окислення ліпідів і антиоксидантного захисту та їх корекція у мешканців індустріальних центрів за допомогою полівітамінних препаратів”, “Оцінка ефективності застосування вітаміну В5 та вітаміну Н у дерматологічній практиці”, “Сучасні можливості комплексної терапії хворих на класичні та атипові форми псоріазу”.
Дисертантом не запозичено результати та ідеї співавторів публікацій.
Апробація результатів дисертації. Основні положення дисертаційної роботи доповідались і обговорювались на конгресах і симпозіумах Європейської академії дерматології та венерології: 23rd EADV Congress «Building Bridges» (Амстердам, Нідерланди, 2014), 12th EADV Spring Symposium (Валенсія, Іспанія, 2015); на IV Всеукраїнській науково-практичній конференції «Актуальні питання наукової і практичної косметології» (Запоріжжя, 2012), Всеукраїнській Таврійській науково-практичній конференції «Сучасні досягнення, медико-соціальні аспекти та актуальні питання дерматовенерології та косметології» (Херсон, 2012), Всеукраїнській науково-практичній конференції з міжнародною участю «Структурно-організаційна перебудова дерматовенерологічної служби в умовах реформування системи охорони здоров’я в Україні» (Чернівці, 2012), Всеукраїнській науково-практичній конференції молодих учених «Медична наука – 2013» (Полтава, 2013), VII Всеукраїнській науково-практичній конференції з міжнародною участю «Актуальні питання естетичної медицини та зв’язок з суміжними спеціальностями» (Запоріжжя, 2013), VIII Всеукраїнській науково-практичній конференції з міжнародною участю «Актуальні питання наукової і практичної косметології» (Запоріжжя, 2014), IX Всеукраїнській науково-практичній конференції з міжнародною участю «Актуальні питання косметології та дерматології» (Запоріжжя, 2015), науково-практичній конференції «Кроки до розробки стандартів діагностики та лікування захворювань шкіри та ІПСШ» (Київ, 2012), науково-практичній конференції «Від клінічних настанов до уніфікованих протоколів діагностики та лікування в дерматовенерології» (Київ, 2013), науково-практичній конференції з міжнародною участю «Наукові та практичні аспекти надання дерматовенерологічної допомоги населенню України в сучасних умовах» (Харків, 2013), науково-практичній конференції з міжнародною участю «Актуальні проблеми дерматології, венерології та ВІЛ/СНІД-інфекції» (Харків, 2014), науково-практичній конференції з участю міжнародних спеціалістів, присвяченій дню науки «Внесок молодих спеціалістів в розвиток медичної науки і практики» (Харків, 2014), науково-практичній конференції з міжнародною участю «Міжнародна інтеграція і наукові здобутки української дерматовенерології» (Харків, 2015); засіданнях Запорізького обласного осередку Української асоціації лікарів-дерматовенерологів і косметологів (Запоріжжя, 2012, 2013, 2014, 2015).
Публікації. Основні положення дисертації викладено у 44 наукових працях, з яких 4 монографії, у тому числі 2 одноосібні, 25 статей у фахових виданнях (23 – у моноавторстві), 12 статей у журналах, які входять до міжнародної наукометричної бази Російський індекс наукового цитування, 1 стаття у журналі, що входить до наукометричної бази Google Scholar, 2 статті у вітчизняних збірниках наукових праць, 6 статей у закордонних журналах, 7 тез.
РОЗДІЛ 1
Cучасні погляди на клінічний перебіг і лікування хронічних дерматозів у чоловіків з урахуванням вікових інволютивних змін (огляд літератури)
На сучасному етапі розвитку України відбуваються суттєві економічні та соціальні перетворення, внаслідок чого спостерігаються соціальне розшарування населення, значні демографічні зміни, які характеризуються спадом народжуваності, високою смертністю, прогресивним зростанням частки населення старшої вікової групи, погіршенням стану здоров’я та зменшенням тривалості життя [34].
В Україні, як і в інших країнах світу, за умов зростання темпу життя та інтенсифікації праці постаріння населення суттєво впливає на розвиток суспільства, економічну ситуацію, структуру та функцію сім’ї, ставить важливі завдання перед охороною здоров’я стосовно подовження періоду соціальної активності людей [101]. При цьому з’являється низка нових вимог до якості життя, зокрема, до зовнішнього вигляду людини [31]. У зв’язку з цим великого значення набуває надання якісної дерматологічної допомоги населенню, своєчасної та повноцінної профілактики і корекції вікових змін шкіри [35, 101, 136].
1.1 Сучасні погляди на етіологію та патогенез вікових розладів гомеостазу та інволютивних змін шкіри у чоловіків
Не дивлячись на велику увагу, що приділяється останніми роками різноманітним проблемам патології шкіри, дослідження вік-асоційованих змін шкірного покрову залишається надзвичайно актуальним [9, 30, 94, 132, 134]. За останні 15 років в Україні поширеність дерматологічної патології зросла на 17,3 %, спостерігається подальша тенденція до її збільшення у структурі загальної захворюваності [33]. Серед найчастіших причин госпіталізації як міського, так і сільського населення є псоріаз, екзема та інші алергічні хвороби шкіри [2, 48]. Високий рівень захворюваності пов’язують з урбанізацією та негативним впливом довкілля, особливо у мешканців великих промислових міст, професійними шкідливостями, безконтрольним застосуванням антибіотиків і хіміотерапевтичних препаратів, екологічним і соціальним неблагополуччям (хронічними стресами), широким використанням людиною хімічних продуктів [104].
При цьому особливої уваги заслуговує поширення захворюваності на дерматологічну патологію серед людей літнього та старечого віку [124, 219]. Збільшення віку людини супроводжується зростанням відсотку пацієнтів з частими рецидивами дерматозів і формуванням резистентності до різних методів лікування [64, 143]. Так, дослідженнями ряду авторів показано збільшення первинної захворюваності на дерматози у людей віком понад 70 років [29].
Багато авторів приділяють значну увагу формуванню структурно-функціональних змін шкіри під впливом несприятливих екзо- й ендогенних факторів (наприклад, соматичним захворюванням) [17, 38, 189]. Зміни стану шкіри зі збільшенням віку являють собою серйозну медико-соціальну проблему, оскільки вони впливають на психоемоційний стан людей, є причиною депресії, низької самооцінки, хронічного стресу та зниження якості життя [38, 103, 113, 138, 306].
Відомо, що вікові порушення в організмі людини протягом життя обумовлені тривалим динамічним процесом функціональних і структурних змін у різних органах і системах, які розвиваються задовго до приходу старості [135]. Збільшення тривалості життя диктує необхідність подовження його активного способу за рахунок збереження здоров’я та підвищення якості життя у людей старшого віку, що обумовлює актуальність подальшого вивчення цієї проблеми та пошук шляхів запобігання передчасному старінню, в тому числі й шкіри, ще на ранніх доклінічних стадіях.
Не дивлячись на велику кількість публікацій [30, 94, 152] щодо змін шкіри у різні вікові періоди, більшість з них стосуються жіночого населення. У чоловіків, в свою чергу, відбуваються чисельні зміни функціонування різних органів і систем, що може негативно відображатися на стані їх здоров’я та якості життя, сприяти виникненню різноманітних захворювань, зниженню працездатності та інвалідизації.
Разом з тим, питанню вікових змін шкіри у чоловіків у залежності від віку приділялось недостатньо уваги. Залишаються остаточно не з’ясованими чинники вікових змін шкірного покрову та деякі ланки патогенезу хронічних дерматозів у чоловіків, особливо працездатного віку, що обумовлює актуальність подальшого вивчення цієї проблеми.
На стан здоров’я людини суттєвий вплив чинять клімато-географічні умови, такі як низькі та високі температури, підвищена вологість або сухість повітря, різкі перепади барометричного тиску, надмірне ультрафіолетове опромінення, що сприяє порушенню природних бар’єрних функцій шкіри [52]. Ці фактори також сприяють перетворенню захисного біошару з ліпідів шкіри та клітин рогового шару епідермісу з нормальною мікрофлорою у вогнище персистенції умовно-патогенних мікроорганізмів з подальшим розвитком дерматологічної патології [10].
За даними Всесвітньої організації охорони здоров’я, найбільший вплив на стан здоров’я людини мають умови та спосіб життя, спадковість, стан навколишнього середовища та якість послуг системи охорони здоров’я [104, 299].
Під впливом несприятливих зовнішніх факторів, у тому числі соціальних і психогенних, у мешканців великих промислових міст задовго до розвитку захворювань порушуються адаптаційні можливості [230]. При цьому організм людини зазнає мультифакторного пошкоджуючого впливу, при якому жоден з несприятливих чинників не є вирішальним, а захворювання частіше розвиваються внаслідок сумарної дії чисельних слабких за силою факторів.
Іншим результатом дії чинників навколишнього середовища є модифікація відповіді макроорганізму. Більшість несприятливих екологічних факторів викликають в організмі переважно неспецифічні порушення: змінюють окисно-відновні процеси, стійкість клітинних мембран, послаблюють захисно-пристосувальні механізми. Низка хвороб людини зумовлена несприятливими впливами професійно-виробничих факторів [104, 125].
Підвищений інтерес до проблеми відображений у великій кількості інформації про характер і ступінь впливу антропогенних факторів на показники популяційного здоров’я, передчасного старіння та скорочення тривалості життя. При цьому, одним з найбільш чутливих до впливу факторів навколишнього середовища органом є шкіра [3, 82, 83].
Зростання захворюваності серед мешканців великих промислових міст викликане наявністю хронічних стресів, широке поширення яких пов’язане з перетворенням звичного способу життя, високим його темпом, збільшенням обсягу інформації [125]. Постійна напруга стає компонентою популяційної норми, наслідком якої є порушення метаболічного та гормонального гомеостазу. Багато досліджень останніх років підтверджують коморбідність розладів настрою та патологічних станів шкіри [102, 147, 264, 291].
Хронічний популяційний стрес призводить до прискореного розвитку різноманітних форм вікової патології та старіння організму [83]. Стрес є провокаційним і обтяжуючим фактором перебігу захворювань шкіри, в тому числі псоріазу та хронічних алергодерматозів [127]. При цьому тривалий перебіг хронічних захворювань шкіри з чисельними рецидивами призводить до напруження реактивних сил організму [13].
Простежується взаємозв’язок між тяжкістю та поширеністю ураження шкіри і складністю психопатологічного синдрому та якості життя [93]. Це у 40-80 % випадків призводить до психосоціальної дезадаптації хворих, розвитку дисморфофобії, депресії, зниження комунікабельності, успішності, працездатності [141, 147]. Наслідком цього є самотність і безробіття. Естетичні проблеми значно поглиблюють соціально-психологічні, міжособистісні відносини та викликають зниження якості життя. Визначення показників якості життя у пацієнтів, на думку ряду авторів [138, 141], є цінним і надійним показником загального стану хворого та дає можливість проводити моніторинг ефективності лікування.
Щорічне зростання кількості хворих, несприятливий вплив дерматологічних захворювань на якість життя, недостатня ефективність терапії, відсутність робіт щодо впливу психоемоційного стресу на вікові зміни стану шкіри та перебіг хронічних дерматозів у чоловіків обумовлюють значимість цієї проблеми та спонукають до пошуку методів поліпшення ситуації.
Поглибленню патологічних процесів сприяє значне поширення шкідливих звичок серед населення [233]. Тютюнопаління та вживання алкоголю на сьогодні розглядаються Всесвітньою організацією охорони здоров’я як глобальні медико-соціальні проблеми [155, 287, 290]. Є багато наукових даних щодо несприятливого впливу шкідливих звичок на показники здоров’я [197, 199, 258, 266, 293].
Як доведено епідеміологічними дослідженнями, такі фактори ризику, як тютюнопаління, зловживання алкоголем, нераціональне харчування, гіподинамія можуть призводити до розвитку певних хвороб [153, 181, 200, 216, 218]. Тютюнопаління є чинником ризику виникнення тяжких форм чисельних соматичних хвороб, а алкоголь погіршує їх перебіг [157, 178, 207, 240, 243]. Паління є причиною розвитку хронічних обструктивних захворювань легень у 80-90 % випадків, чинником ризику розвитку церебральних інсультів – у 25 %, злоякісних новоутворень шкіри [172, 174, 249, 254]. Зловживання алкоголем спричиняє виникнення імунного дисбалансу та індукує зміни в капілярах шкіри, внаслідок чого хвороба загострюється та набуває несприятливого перебігу [302].
Однак практично не дослідженим залишається питання про вплив на стан шкіри шкідливих звичок у чоловіків у залежності від віку та перебігу у них хронічних дерматозів.
Одним із визначальних чинників здоров’я є якість харчування, різноманітність споживання продуктів. Збалансоване харчування особливо необхідне у періоди росту, значного фізичного навантаження, старшого віку, що є запорукою профілактики різних захворювань. Баланс мікроелементів підтримується переважно шляхом споживання продуктів харчування (овочів, фруктів та ін.). Потребу організму у мікроелементах, як правило, покриває добовий харчовий раціон [175]. На сьогодні у літературі відсутні дані стосовно особливостей стану шкіри та загального стану здоров’я чоловіків різного віку у залежності від характеру харчування, що має бути предметом подальших досліджень.
Таким чином, епідеміологічні дані стосовно захворюваності на хронічні дерматози, поширення дерматологічної патології серед людей старших вікових груп, зростання відсотку пацієнтів з частими рецидивами дерматозів, формування резистентності до різних методів лікування свідчать про актуальність поглибленого вивчення цього питання.
Незважаючи на велику кількість публікацій, на даний час не існує єдиних підходів до аналізу даних про вплив навколишнього середовища на стан шкіри у чоловіків різного віку та їх захворюваність на дерматологічні хвороби. Залишається багато невирішених питань стосовно комплексного впливу несприятливих факторів довкілля, соціальних і психогенних чинників, шкідливих звичок на стан шкіри та розвиток її патології у чоловіків – мешканців великих промислових міст у залежності від віку. Вищевказане обумовлює необхідність проведення поглиблених досліджень у цьому напрямі, з’ясування нових патогенетичних ланок вікових змін шкіри у чоловіків, що зможе надати підстави для наукового обґрунтування заходів первинної профілактики, спрямованих на збереження здоров’я людини.
За даними літератури, головним регулятором інтегративних реакцій організму, що забезпечує функціональний зв’язок органів і систем, збереження метаболічних процесів, взаємодію з навколишнім середовищем, є нервова система, і, у першу чергу, її вегетативний відділ [54]. Порушення регулюючої функції нервової системи, негативні психоемоційні стани впливають на макро- і мікроциркуляцію органів і систем, у тому числі шкіри [148]. Вони призводять до порушень гомеостазу та адаптації організму до різноманітних чинників зовнішнього середовища, змін мікроциркуляції, кислотності шкірного покрову, внаслідок чого створюються сприятливі умови для формування патологічного процесу у шкірі при різних дерматозах [69, 229].
Суттєву роль у старінні шкіри відіграють зміни її мікроциркуляторного русла [30]. Вірогідно, що саме зміни мікроциркуляції є однією з причин частих патологічних порушень у шкірному покрові в осіб старших вікових груп [120, 135]. Пошкоджуючий вплив на судинну стінку можуть чинити різноманітні екзо- та ендогенні чинники, серед яких важливу роль відіграють гормональні та нейрогенні фактори, несприятливе зовнішнє середовище [118, 244].
З віком у людини зменшується кількість капілярів, а при порушенні мікроциркуляції знижується товщина всіх шарів шкіри. Погіршення васкуляризації, зниження інтенсивності мікроциркуляції, наповненості мікросудин кров’ю, яке спостерігається у осіб старших вікових груп, значно впливає на ступінь гідратації шкіри [11].
Крім того, у результаті впливу на організм людини різноманітних негативних чинників порушується стан його нормальної мікрофлори, що призводить до розвитку дисбактеріозу. Організм людини та його нормальна мікрофлора є взаємопов’язаними живими системами. Якісно-кількісний склад мікрофлори залежить від багатьох чинників (ступеня аерації, кислотності шкіри та мікрофлори навколишнього середовища) й у різних ділянках організму людини контролюється за допомогою механічних, хімічних, імунних та інших факторів [12, 19].
На фоні дії різноманітних екзо- й ендогенних чинників у останні роки спостерігається зростання чисельності осіб з порушеннями мікробіоценозу шлунково-кишкового тракту та шкіри, адже саме ці системи пов’язують організм людини з зовнішнім середовищем. Порушення мікробного пейзажу може виникати у різних органах, проте частіше роль у патогенезі дерматозів відводиться мікробіоценозу шлунково-кишкового тракту. При цьому по мірі розвитку вікових інволютивних процесів в організмі відбуваються зміни у складі мікробного пейзажу кишечника: знижується кількість біфідобактерій, лактобацил, збільшується кількість грам-позитивної, гнилісної флори [13, 14]. Але до цього часу не досліджені показники мікробного пейзажу різних біотопів організму (в тому числі кишечника та шкірного покрову) у чоловіків у віковому аспекті.
Ще одним значним фактором у старінні організму людини у цілому та шкіри зокрема вважається накопичення токсичних речовин. З робіт Д. Хартмана починається активне вивчення ролі вільних радикалів й інших активних форм кисню як основних чинників пошкодження ДНК клітин з наступною стимуляцією старіння [165, 175, 184]. Накопичення продуктів ПОЛ призводить до стимуляції апоптозу, в подальшому – і органоптозу, а отже, може виступати маркером старіння організму у цілому [47].
Патологічні процеси у шкірі можуть супроводжуватися розвитком дисбалансу у системі перекисного окислення ліпідів – антиокислювальній системі (ПОЛ-АОС), зростанням рівня продуктів перекисного окислення та порушенням функціонування антиоксидантної системи, внаслідок чого виникають лавиноподібні реакції переокислення, які можуть призводити до загибелі клітини [48]. При утворенні перекисів відбувається розділення окислення та фосфорилювання, порушення аеробного окислення ув циклі Кребса. У свою чергу, порушення окислення у циклі Кребса є однією з ланок патогенезу старіння [47].
Надзвичайно важливим і невирішеним на сьогоднішній день залишається вивчення добових ритмів змін показників функціонування системи ПОЛ-АОС, клітинних мембран і рівня ендогенної інтоксикації у різних вікових групах чоловіків, що значним чином відображається на загальному стані організму та виникненні патології з боку різних органів і систем, у тому числі шкіри. Аналіз літературних джерел показав відсутність даних щодо циркадних зміну системі ПОЛ-АОС, характерних для чоловіків різних вікових груп як за наявності у них хронічних дерматозів, так і за їх відсутності.
Наслідком активації вільнорадикальних процесів може бути утворення токсичних продуктів обміну та прогресування ендотоксикозу [17, 28, 87]. Ендотоксини або молекули середньої маси є проміжними продуктами протеолізу, що накопичуються в організмі у разі пригнічення природних механізмів детоксикації та при порушеннях обміну речовин [17]. Активація ПОЛ і накопичення ендотоксинів супроводжуються ушкодженням мембран еритроцитів, руйнуванням фосфоліпідного шару клітинних мембран [66]. Незважаючи на увагу дослідників, яка приділяється вивченню ендотоксикозу, стану та функціонуванню клітинних мембран при різних патологічних станах, необхідно зазначити відсутність даних щодо їх динаміки у чоловіків різних вікових груп.
У літературі наводяться чисельні роботи щодо особливостей гормонального статусу у людей різного віку. Описані атрофічні зміни шкіри обличчя, утворення зморшок, ангіоматоз, рожеві вугрі як результат зниження рівня естрогенів у жінок клімактеричного та постклімактеричного віку, особливості шкіри у жінок репродуктивного віку [94, 118]. Проте аналогічних досліджень серед чоловічого населення проведено не було.
Доведено роль нейроендокринних порушень у формуванні інволюційних змін у жінок. Так, при гормонально обумовленій недостатності чи припиненні функціонування статевих залоз спостерігається ряд характерних змін стану шкіри у вигляді атрофії, зменшення тургору, утворення зморшок, сенільних ангіом і лентиго, себорейних кератом, папілом, телеангіектазій, рожевих вугрів [106].
Визнано, що шкіра є однією з основних ланок метаболізму статевих гормонів. Рівень статевих гормонів помітно впливає на склад шкірного сала, ріст волосся, процеси ороговіння та функціонування шкірного покрову [134]. Ряд статевих гормонів стимулюють функціонування сально-волосяного фолікула (адренокортикотропний гормон, гормони кори надниркових залоз, андрогени, прогестерон), а такі як естрогени – пригнічують.
На відміну від жінок, у чоловіків не спостерігається різкого закінчення репродуктивної функції, а відбувається поступове зниження рівня статевих гормонів, початок якого припадає на вік 30-40 років [57, 303]. У клінічній практиці такі порушення характеризуються як андрогенна недостатність або тестостерондефіцитний стан [57]. У віці 40-50 років майже у 7 % чоловіків спостерігаються прояви гіпогонадизму, у віці 60-80 років – у 20 %, у віці понад 80 років – у 35 % [65, 173]. Нерідко набута андрогенна недостатність має метаболічне походження та протікає за типом відносної чи абсолютної гіперестрогенії. У більшості випадків паралельно відбувається зниження рівня естрадіолу та збільшується рівень білків, що зв’язують статеві гормони [70, 173].
В основі зниження рівня тестостерону лежить зменшення з віком його синтезу клітинами Лейдига внаслідок погіршення кровопостачання тестикулярної тканини, зменшення на їх поверхні кількості рецепторів до лютеїнізуючого гормону [65]. У зниженні рівня тестостерону у чоловіків відіграють роль функціональні порушення в секреції гонадотропін-релізинг гормонів і гонадотропінів, оскільки з віком зменшуються розміри гіпофіза, порушується нейрорегуляторна ланка його синтезу [57].
Про функцію статевих залоз можна судити за синтезом та екскрецією фолікулостимулюючого гормону (ФСГ) і лютеїнізуючого гормону (ЛГ). Зниження секреції ФСГ може бути причиною безпліддя як у жінок, так і у чоловіків, а підвищення спостерігається при клімактерії. Зниження циркулюючого у крові чоловіків тестостерону після 40 років приводить до компенсаторного збільшення рівня ЛГ [173].
Синтез і вивільнення пролактину знаходиться під контролем ряду регуляторних центрів гіпоталамуса. Дофамін пригнічує секрецію пролактину. Окрім дофаміну інгібуючий вплив на секрецію пролактину має норадреналін, адреналін, ацетилхолін та γ-аміномасляна кислота.
Таким чином, порушення у синтезі статевих гормонів у чоловіків обумовлені розладами функціонування усієї багатоступеневої структури нейрогуморальної регуляції гіпоталамус-гіпофіз-тестикулярної формації.
Основна кількість (понад 98 %) тестостерону циркулює у плазмі у зв’язаному стані: до 58-60 % – з альбуміном, близько 40 % – з тестостеронзв’язуючим глобуліном (ТЗГ); лише 1-2 % тестостерону знаходиться у вільній формі [173, 303].
З віком рівень біологічно активного тестостерону знижується у більшому ступені, ніж рівень загального тестостерону. У свою чергу, пригнічення секреції гонадотропінів може призводити до додаткового зменшення синтезу тестикулярного тестостерону, у зв’язку з чим у багатьох чоловіків віком понад 50-60 років спостерігаються симптоми гіпогонадизму (психоемоційні, вегето-судинні, сечостатеві, соматичні та дерматологічні розлади) [57].
До цього часу у літературі немає остаточних даних щодо впливу вікових змін гормонального статусу у чоловіків на стан шкірного покрову та розвиток і особливості перебігу хронічних дерматозів. Невирішеними залишаються і питання щодо профілактики вікових змін шкіри та лікування хронічних дерматозів у чоловіків у залежності від віку, оскільки для розробки ґрунтовних лікувальних підходів необхідне розуміння головних ланок патогенетичних змін, що відбуваються в організмі чоловіків. На сьогодні суперечливими залишаються питання впливу (позитивного чи негативного) терапії андрогенами на деякі системи чоловічого організму (когнітивну функцію, передміхурову залозу, ліпідний обмін та інші).
Важливим є з’ясування взаємовідносин між симпатоадреналовою, вагоінсулярною та гіпоталамо-гіпофізарно-тестикулярною системами, яким відводиться важлива роль у забезпеченні захисно-пристосовних реакцій організму й адаптаційно-трофічних процесів у тканинах, в тому числі у шкірі у чоловіків різного віку.
У літературі є лише поодинокі повідомлення щодо стану симпатоадреналової системи при захворюваннях шкіри. Є суперечливі дані про характер змін у цій системі за умов різної патології: при запальних захворюваннях спостерігається підвищення її активності, при інших – навпаки. При високій активності вагоінсулярної системи та слабкості компенсуючих реакцій з боку симпатоадреналової системи виникають виражені вагоінсулярні кризи. І навпаки, при високій реактивності симпатоадреналової системи та слабкості компенсуючих реакцій з боку вагоінсулярної системи виникають виражені симпатоадреналові кризи. Різний характер змін у стані симпатоадреналової та вагоінсулярної систем свідчить про те, що вони специфічно залучаються до патологічного процесу, їх зміни можуть розглядатися у якості ланок патогенезу певних захворювань [46].
У літературних джерелах відсутні роботи з комплексного вивчення активності симпатоадреналової, вагоінсулярної систем і глюкокортикоїдної функції надниркових залоз при змінах шкіри у чоловіків різного віку за відсутності та наявності хронічних дерматозів. Відсутність цих даних спонукає до проведення подальших власних досліджень.
1.2 Сучасні підходи до корекції інволютивних змін шкіри та метаболізму у чоловіків
За даними літератури, здоров’я людей, у тому числі і стан шкірного покрову, пов’язане з якістю харчування – достатньою кількістю та різноманітністю їжі, а виникнення багатьох захворювань є результатом недостатнього споживання окремих продуктів і вітамінів [111, 112].
Високотехнологічний рівень сучасної науки дозволяє дослідити механізми впливу окремих вітамінів як на здоров’я у цілому, так і на стан шкіри. Доведено, що вітамінна недостатність є етіологічним чинником багатьох хвороб: дефіцит тіаміну призводить до хвороби бері-бері, вітаміну В2 – до арибофлавінозу, нікотинової кислоти – до пелагри, вітаміну С – до цинги [111].
Дослідженнями різних авторів було встановлено, що низький рівень біотину в організмі людини сприяє виникненню сухості та запальних явищ шкіри, загостренню себорейного дерматиту, псоріазу, атопічного дерматиту, іхтіозу, периорального дерматиту, призводить до дифузного випадіння волосся та дистрофії нігтьових пластин [112, 139].
Крім того, на сьогоднішній день діагностується генетично обумовлена ензимопатія, асоційована з біотином, – множинний карбоксилазний дефіцит, який має як дерматологічні (сухість шкіри, себорейний дерматит, прогресування псоріазу, загострення екземи, ламкість нігтьових пластин, алопеція), так і загальносоматичні прояви (депресія, апатія, сонливість, гіперестезії та парестезії, нудота, зростання рівня холестерину та глюкози крові, анемія, затримка росту у дітей). Дослідження, проведені А. Л. Тищенко [139], показали достовірне зниження рівня вільної та загальної форм біотину в крові у групах хворих на псоріаз та істинну екзему порівняно з групою здорових осіб. На сьогоднішній день доведено, що застосування біотину сприяє зменшенню рівня загального холестерину та β-ліпопротеїдів, знижує ризик розвитку атеросклерозу [112]. Біотин, окрім того, чинить метаболічну дію, впливаючи на продукцію глюкокінази у печінці, а також на механізми формування резистентності до інсуліну та толерантності до глюкози. Важливу роль відіграє біотин у репаративно-відновних процесах, стимулюючи оновлення шкірного покрову та попереджуючи його старіння. Таким чином, застосування біотину може розглядатись як можливий захід покращення метаболічних процесів у осіб старшого віку.
Дефіцит пантотенової кислоти призводить до змін у клітинному метаболізмі, тканинному диханні. Перш за все, недостатність пантотенової кислоти проявляє себе виникненням полінейропатій, що виражається слабкістю та парестезіями ув кінцівках, але з часом виникають і дерматологічні ознаки вітамінного дефіциту – порушення поділу клітин на рівні базального шару епідермісу, зміни процесів кератинізації, зменшення кількості фібробластів, зниження синтезу колагену, зменшення тургору шкіри, порушення її водно-ліпідного балансу, прискорене випадіння волосся та порушення його структури. Таким чином, за умов дефіциту пантотенової кислоти зменшується вік перших проявів старіння шкіри та посилюються вже наявні його ознаки. Крім того, недостатність пантотенової кислоти негативно відображається на функціонуванні кори надниркових залоз. Декспантенол стимулює синтез кортизону, має виражену протизапальну та імуномодулюючу дію, нейротропні властивості, нормалізує ліпідний обмін (стимулює ферментні системи, що розщеплюють ліпіди у крові, сприяє зниженню рівня холестерину крові) [111].
Дослідження останніх років відображають вплив вітамінного дефіциту на оксидантне пошкодження мітохондрій, що призводить до прискорення старіння організму. Основним механізмом виникнення цих змін є пригнічення біосинтезу гема у мітохондріях, що призводить до кисневої недостатності та пошкодження мітохондрій, що, в свою чергу, спричиняє пошкодження ДНК, порушень з боку нервової системи та вікових змін [165]. Серед чинників, дефіцит яких спричиняє такі порушення, найбільше значення мають вітаміни (перш за все, біотин і пантотенова кислота) [112]. Отже, корекція рівнів даних нутрієнтів сприятиме попередженню вікових змін шкіри та прогресуванню дерматологічної патології, що має бути предметом подальших досліджень, особливо у чоловіків працездатного віку.
Недостатність вітаміну А є причиною порушень кератинізації та роботи сальних залоз, виникнення фолікулярного гіперкератозу, порушень регенерації шкіри, уражень придатків шкіри у вигляді спірального завивання волосся та його витончення, дистрофії нігтьових пластин [106]. Дефіцит вітаміну С призводить до геморагічної висипки, порушень пігментації, прискорення старіння шкіри у вигляді зниження її тургору, поглиблення зморшок (оскільки вітамін С володіє антигіалуронідазною дією). Аналогічне прискорення процесів старіння шкіри спостерігається при недостатності вітаміну Р, адже він приймає активну участь у гальмуванні системи гіалуронової кислоти та гіалуронідази, стабілізації основної речовини сполучної тканини [112]. Дефіцит вітамінів групи В є причиною уражень ротової порожнини та червоної кайми губ, оскільки він провокує виникнення стоматиту й ангулярних тріщин [111].
Таким чином, вітаміни, надходячи в організм людини у мізерних кількостях, чинять надзвичайно важливі ефекти як щодо здоров’я у цілому, так і щодо профілактики дерматологічної патології та виникнення естетичних сенільних недоліків. Їх недостатність хоча і не завжди спричиняє виникнення захворювання, проте суттєво погіршує стан здоров’я людини [111].
У мешканців індустріальних центрів з високим антропогенним навантаженням спостерігаються порушення стану здоров’я, що супроводжуються змінами біотопів організму. При цьому шкіра людини та слизові оболонки порожнини рота є тонким індикатором оцінки змін системного мікробіоценозу [23].
Відомо, що порушення кількісного та якісного складу мікробного пейзажу може бути чинником у виникненні та прогресуванні певних дерматозів – серед них псоріаз і хронічні алергічні захворювання [8, 313]. Вплив на виникнення порушень стану шкіри, таких як сухість, тургор, зморшкуватість, а також появу певних дерматозів, мають не лише зміни мікробного пейзажу шкіри, але й мікробіоценозу ротоглотки та шлунково-кишкового тракту.
Багатьма дослідженнями доведено асоційованість хронічних дерматологічних захворювань (у тому числі алергодерматозів і псоріазу) з порушеннями як системного мікробіоценозу, так і окремо мікробного пейзажу шкіри, кишечнику та ротоглотки. У зв’язку з цим важливим завданням для запобігання виникненню дерматологічної патології та вікових змін шкіри є корекція системного мікробіоценозу [12].
Питання корекції дисбіотичних порушень при вікових змінах шкіри та хронічних дерматозах у чоловіків вивчено недостатньо. У пацієнтів старшого віку часто неможливо використовувати стандартні методики корекції через наявність супутньої загальносоматичної патології, що диктує необхідність пошуку нових методів.
Алгоритм корекції дисбіотичних змін при дерматологічній патології передбачає використання мікробіологічних препаратів – пробіотиків, які містять Bifidobacterium, Lactobacillus, Propionibacterium та інші [255, 313].
Таким чином, можливість корекції мікроекологічних порушень організму при різних патологічних станах шкіри вивчена недостатньо. Підбір лікарських засобів, харчових продуктів має проводитись із урахуванням патогенетичних факторів захворювання, з одного боку, і механізму дії та фармакокінетики лікарських засобів – з іншого. Особливу увагу необхідно звертати на взаємний вплив різних груп препаратів, їх синергізм, зниження активності, нівелювання ефектів. Отже, корекція мікробіоценозу має бути базисною складовою комплексної профілактики та терапії більшості захворювань шкіри. Головну роль при цьому необхідно надавати застосуванню пробіотиків.
Як зазначалося вище, у чоловіків зі збільшенням віку спостерігаються не лише зміни стану шкірного покрову, але й мікроциркуляції шкіри, певні метаболічні порушення, зміни функціонування симпатоадреналової системи, гонадотропних і статевих залоз, відзначається збільшення проявів ендотоксикозу. У хворих на деякі дерматози (наприклад, псоріаз) зі старших вікових груп встановлено наявність супутніх метаболічних розладів, пов’язаних з ожирінням, цукровим діабетом, гіпертонічною хворобою та їх предикторами (підвищенням артеріального тиску, дисліпідемією, гіперглікемією, інсулінорезистентністю, гіперінсулінемією) [131, 272, 274, 277, 281]. Це свідчить про необхідність пошуку нових підходів до їх корекції з урахуванням необхідності застосування у широкого кола чоловіків працездатного віку.
В останній час досягнуті значні успіхи у корекції гормональних розладів у жінок постменопаузального періоду шляхом застосування замісної гормональної терапії, що дозволяє значно знизити частоту розвитку захворювань серцево-судинної системи, остеопорозу, порушень стану шкіри та її придатків, поліпшити якість життя жінок відповідного віку [30]. Протягом тривалого часу питання можливості проведення андрогензамісної терапії у чоловіків не обговорювалось, а синтетичні похідні тестостерону не застосовувались через наявність великої кількості побічних дій, перш за все – пригнічення сперматогенезу. В останні ж роки все більшої поширеності у чоловіків з проявами гіпогонадизму набуває замісна терапія тестостероном, яка сприяє підвищенню лібідо, зменшенню вираженості вегето-судинних, психологічних розладів, вісцерального ожиріння, зростанню м’язової маси [57].
У літературі відсутні дані щодо особливостей впливу препаратів андрогенної дії на стан шкіри у чоловіків різного віку та перебіг хронічних дерматозів, тому великого значення набуває дослідження відповідних лікувально-профілактичних заходів серед чоловіків старших вікових груп для запобігання віковим змінам шкіри та розвитку дерматологічних захворювань.
Для покращення стану шкіри у чоловіків заслуговує на увагу можливе застосування трібестану, оскільки він має широкий спектр дії екстракту рослини Tribulus Terrestris: загальнотонізуючу та антигіпертензивну дію, вплив на рівень гормонів гіпофізарно-гонадної вісі, що особливо актуально у осіб старшого віку з наявністю метаболічного синдрому. Важливим критерієм вибору трібестану в якості профілактичного засобу є майже повна відсутність побічних дій.
Адаптація організму як цілісна реакція пристосування до постійних змін умов екосистеми має велике значення у формуванні методик профілактики та лікування різних захворювань. Для корекції напруження регуляційних механізмів в умовах змін оточуючого середовища необхідне включення до комплексу оздоровчих заходів препаратів, які нормалізують процеси обміну в організмі, зокрема краталу. До його складу входять амінокислота таурин, екстракти плодів глоду та кропиви собачої, завдяки чому кратал сприяє розширенню судин, має антиагрегантну, гіпоглікемічну й антитоксичну дію, пригнічує процеси ПОЛ, має антиоксидантний і седативний ефект.
Ряд вчених [40] дослідили застосування діаформіну та кверцетину у лікуванні хворих на дисемінований псоріаз з метаболічним синдромом і отримали позитивні результати. Кверцетин являє собою вітчизняний препарат вітаміну Р і яблучного пектину, який знижує проникність капілярів і їх ламкість, має репаративний і протизапальний ефект, спазмолітичну та сорбційну дію, що особливо важливо за наявності несприятливих чинників довкілля в умовах промислових центрів.
У літературних джерелах широко висвітлена ефективність застосування при різних дерматозах антиоксидантних препаратів різноманітних за походженням і механізмом дії, таких як бета-каротин, аскорбінова кислота, токоферолу ацетат, мідь, селен, цинк та інші [13, 14]. На сьогодні одним з найбільш ефективних препаратів є тіотриазолін, який має протиішемічні, мембраностабілізуючі, антиоксидантні й імуномодулюючі властивості [88]. Тіотриазолін широко застосовується у кардіології для лікування хворих з різними формами ішемічної хвороби серця, покращення процесів метаболізму міокарда, підвищення його скорочувальних властивостей, нормалізації серцевого ритму [49]. Ефективним є застосування тіотриазоліну для лікування захворювань печінки й інших внутрішніх органів, оскільки він має гепатопротекторну дію. Зазначені вище властивості тіотриазоліну обґрунтовують можливість його застосування з оздоровчою метою у чоловіків різного віку для попередження процесів старіння організму, в тому числі шкіри, в умовах несприятливої дії чинників довкілля та при хронічних дерматозах.
У медичній практиці в останні роки широкого розповсюдження набули ноотропні препарати, оскільки їх застосування дозволяє поліпшити інтелектуальну продуктивність, попередити розвиток різних патологічних станів (астеній, депресій, розладів адаптації й інших) [109]. Ноотропні препарати підсилюють синтез макроергічних фосфатів, білків, стабілізують пошкоджені мембрани нейронів, стимулюють окисно-відновні процеси, покращують кровообіг у головному мозку [115, 146]. Оптимізація енергетичних процесів сприяє підвищенню стійкості центральної нервової системи до різних токсичних факторів. Особливістю ноотропних препаратів є можливість їх використання в екстремальних ситуаціях, при перевтомі, природному старінні.
За рахунок покращення кровопостачання мозку, мікроциркуляції, нормалізації реологічних властивостей крові ноотропні засоби проявляють нейротрофічну, транквілізуючу, антидепресивну й антиастенічну дію, підвищують розумову та фізичну працездатність [109, 146]. Наведені вище властивості ноотропних препаратів роблять можливим їх застосування як у профілактичній медицині, так і у комплексному лікуванні хронічних дерматозів. Всіма властивостями ноотропних препаратів володіє пірацетам, який найбільш часто використовується у практичній медицині. Необхідно зазначити, що наукових робіт щодо застосування пірацетаму для запобігання розвитку вікових змін шкірного покрову у чоловіків не проводилося, що обґрунтовує доцільність подальших досліджень у цьому напрямі.
Враховуючи багатокомпонентність патофізіологічних порушень в організмі при різних патологічних станах у людей старшого віку актуальним є застосування церебропротекторів, які поєднують антиоксидантну, антиішемічну та ноотропну дію. До таких комбінованих лікарських засобів відноситься тіоцетам, складовими якого є пірацетам і тіотриазолін. Фармакологічний ефект тіоцетаму обумовлений дією його складових: тіоцетам поєднує у собі ноотропну, мнемотропну дію пірацетаму з антиоксидантним, протиішемічним, адаптогенним ефектом тіотриазоліну. За силою перерахованих фармакологічних ефектів тіоцетам значно перевищує дію пірацетаму та тіотриазоліну.
Разом з тим, застосування тіоцетаму для профілактики проявів старіння організму у цілому, вікових змін шкіри та лікування хронічних дерматозів до цього часу не розглядалося, що спонукало до проведення власних досліджень.
Не менш важливе значення, ніж застосування системної та топічної медикаментозної терапії різних дерматозів має корекція психологічного стану хворих. Це пов’язане з тим, що негативні емоційні імпульси при хронічних дерматозах дестабілізують стан центральної та вегетативної нервової системи, призводять до порушень гомеостазу організму [138].
Отже, гострі або хронічні стресові ситуації, тривале нервове перенапруження можуть провокувати розвиток або загострення псоріазу та хронічних алергодерматозів. В той же час, наявність висипань на шкірі, особливо на її відкритих ділянках (голові, верхніх кінцівках), може бути причиною психоемоційних розладів, які впливають на якість життя хворих. Таким чином формується патологічно замкнене коло, коли одна його ланка провокує погіршення іншої. Розірвання такого патологічного ланцюга є необхідним і можливе за допомогою психотропних препаратів або психотерапії.
Серед психотропних лікарських засобів виділяють антипсихотичні препарати (нейролептики), анксіолітики (транквілізатори) та снотворні засоби, нормотімічні засоби (тімоізолептики), антидепресанти (тимоаналептики) та психостимулятори [1, 115]. Але ці групи препаратів мають широкий спектр побічних дій: погрозлива життю гіпотензія, аритмії та блокади серця, шлунково-кишкові порушення, зміни терморегуляції, розвиток злоякісного нейролептичного синдрому, екстрапірамідні та антихолінергічні симптоми, пригнічення кісткового мозку, тому, перш за все, їх застосування обмежене у осіб старших вікових груп [115].
Враховуючи дані щодо можливості виникнення побічних ефектів, з нашої точки зору, найбільш перспективним у комплексному лікуванні хворих на хронічні дерматози є застосування ноотропних препаратів. Ще одним перспективним і простим у виконанні методом лікування хронічних дерматозів, на наш погляд, є використання автогенного тренінгу (концентрованої саморелаксації) за Шульцем. Його лікувальний ефект засновується на дії релаксації та ціленаправлених самонавіювань, розірванні кола симптомів, що викликають напругу [1]. Основними показаннями для його проведення є вегетативні, функціональні та психосоматичні розлади, необхідність підвищення нервово-психічної стійкості ув стресових умовах, боротьба зі шкідливими звичками, нервовою та фізичною перевтомою [78]. Зручність автогенного тренінгу за Шульцем полягає у максимальній економічності методу, можливості проведення тренувань у будь-який зручний час доби [1]. Крім того, автогенний тренінг можуть використовувати не лише хворі, але й здорові люди з профілактичною метою (в тому числі у комплексі профілактики професійних захворювань на виробництві) [1].
Таким чином, завдяки низці своїх переваг автогенний тренінг за Шульцем може використовуватись у дерматологічній практиці у комплексному лікуванні хворих на хронічні дерматози, у тому числі псоріаз і алергодерматози.
Таким чином, не дивлячись на чисельні публікації, багато питань стосовно вікових змін шкіри у чоловіків залишаються не вирішеними. Це стосується як діагностики патологічних змін на ранніх стадіях, так і вибору шляхів їх профілактики, що спонукає до необхідності подальшого поглибленого вивчення нових ланок розвитку інволютивних змін шкіри та пошуку нових раціональних лікувально-профілактичних заходів серед чоловічого населення.
До цього часу залишаються не вивченими та не систематизованими інволюційні зміни стану шкіри, особливості перебігу хронічних дерматозів у чоловіків з урахуванням віку, відсутні дані про медико-соціальну ефективність різних методик лікування, що робить надзвичайно актуальним проведення відповідних досліджень.
1.3 Етіологія, патогенез, клінічний перебіг і лікування псоріатичної хвороби
На сьогоднішній день псоріаз являє собою одну з найбільш актуальних медико-соціальних проблем [202, 237, 263, 319]. Значне зниження якості життя, непрацездатність та інвалідизація хворих, труднощі у створенні сім’ї та погіршення стосунків у родині, значний психологічний дискомфорт – все це є наслідком захворювання на псоріаз [93, 97, 204, 268].
Поширеність псоріатичної хвороби у популяції досить висока та складає, за даними різних авторів [13, 47, 232, 252], від 0,1-3 % до 10 % населення земної кулі. У загальній структурі захворюваності дерматологічними хворобами питома вага хворих на псоріаз становить 8-15 %, а серед стаціонарних хворих відділень диспансерів – від 7 до 22 % [144, 151]. Слід зазначити, що при псоріатичній хворобі відзначається високий відсоток уражень суглобів [259, 248, 256]. Частота артропатичного псоріазу, за даними літератури, коливається від 13 до 47 % [92, 149, 250].
Не дивлячись на увагу, що приділяється цій проблемі, в Україні в останні роки відзначається зростання захворюваності на псоріаз, особливо серед осіб старшого віку [29, 241]. Збільшується кількість хворих на тяжкі інвалідизуючі форми псоріатичної хвороби, резистентні до різних методів терапії [73, 160, 169, 226, 231, 284, 307].
До основних теорій виникнення та розвитку псоріатичної хвороби відносяться: генетична, нейрогенна, інфекційна, паразитарна, вірусна, ендокринно-обмінна та інші [16, 18, 121, 162, 167, 210, 260, 318]. При цьому у роботах окремих дослідників наводяться також певні тригери, які можуть спричиняти загострення псоріазу (серед них – тютюнопаління) [276, 294].
Результати досліджень, проведених рядом авторів [20, 79, 117, 158], свідчать, що гіпергомоцистеїнемія як фактор ушкодження судинного ендотелію може прискорювати розвиток атеросклерозу та підвищувати ризик серцево-судинних ускладнень у хворих на псоріаз.
Ряд авторів [8, 194, 280] показали взаємозв’язок між мікробіоценозом тіла людини та тяжкістю перебігу псоріазу. Деякі дослідники [245, 278, 297, 310] виявили, що найбільш частими супутніми псоріазу захворюваннями були фокальні інфекції органів ротоглотки та функціональна патологія органів травлення. Серед різноманіття патогенетичних факторів це також може бути обумовлене порушенням мікробіоценозу організму у цілому та порушенням мікробного пейзажу шкіри при псоріатичному ураженні [273, 308, 309].
В патогенезі псоріатичної хвороби велика увага приділяється її асоціації з метаболічним синдромом і його складовими – ожирінням, цукровим діабетом, гіпертензією [15, 21, 36, 54, 130, 277]. Так, дослідження, проведені A. D. Cohen et al. (2008) [164], показали, що хворі на псоріаз, які не отримували системної терапії, достовірно частіше мали метаболічний синдром порівняно з загальною популяцією дерматологічних пацієнтів (враховуючи статеві та вікові особливості). При розгляді окремих складових метаболічного синдрому виявилось, що при цьому спостерігається порушення обміну ліпідів і прооксидантно-антиоксидантних процесів. Дослідження, проведені Clalit Health Services (Ізраїль), продемонстрували достовірно вищий рівень загального холестерину та тригліцеридів у пацієнтів з псоріазом порівняно з контрольною групою [164]. Аналогічні дослідження показали кореляцію між псоріазом і дисліпідемією, наявність слабкої кореляції між псоріазом і маркерами інсулінорезистентності, такими як секреція інсуліну та резистин сироватки [156, 277].
Дослідженнями багатьох авторів були виявлені зв’язки між рівнями загальних ліпідів, холестерину і перебігом шкірного та суглобового процесів у хворих на псоріаз старечого віку, зокрема за тривалістю періодів загострень, скороченням ремісій, торпідністю клінічних симптомів [91, 296]. Результати дослідження Е. Н. Солошенко, Н. В. Жуковой (2012) [130], показали, що у хворих на поширений псоріаз наявні порушення ліпідного обміну, які проявляються підвищенням рівнів загальних ліпідів у прогресуючу стадію, а фосфоліпідів – як у прогресуючу, так і у стаціонарну стадію на фоні підвищення рівня інсуліноподібного фактору росту-1 більш ніж у 3 рази [151].
Ряд дослідників, які вивчали метаболічні процеси у хворих на псоріатичну хворобу, встановили підвищення рівня насичених жирних кислот і зниження показників поліненасичених – лінолевої, ліноленової й арахідонової у плазмі крові, еритроцитах, кератиноцитах, що значним чином впливає на клінічні прояви псоріазу [151, 217].
Порушення ліпідного обміну при псоріатичній хворобі може бути одним із чинників негативного впливу на стан мікроциркуляції, що має велике значення у розвитку захворювання [81, 236]. Для псоріатичної хвороби властиві виражені порушення судинної мікроциркуляції у вигляді змін внутрішньосудинної течії крові, на ступінь яких впливає тяжкість пошкоджень капілярної сітки [211, 229, 279].
Багато дослідників вважають псоріаз ангіогензалежним захворюванням, оскільки активація Т-лімфоцитів призводить до вираженого розширення капілярів пошкодженої шкіри [79, 117, 206]. Дисфункція ендотелію у пацієнтів з псоріазом і артеріальною гіпертензією імовірно обумовлена порушенням метаболізму L-аргініну та проявляється зниженням біодоступності оксиду азоту та оксидативним стресом [25, 74].
Важлива роль у розвитку псоріатичної хвороби відводиться білковому обміну. Дослідження, проведені Е. М. Солошенко, Н. В. Жуковою (2012) [131], показали, що у пацієнтів з прогресуючою та стаціонарною стадіями псоріазу був підвищеним рівень загального білка, γ-глутамілтранспептидази, сечовини на фоні зниженого рівня креатиніну, що вказує на інгібіцію катаболітних процесів, пов’язаних з трансформацією білка в організмі.
У розвитку псоріатичної хвороби важливе місце займають процеси перекисного окислення ліпідів і стан антиокислювальної системи. Так, дослідження, проведені А. М. Дащуком, Н. А. Пустовой (2009) [45], виявили у хворих на псоріаз у прогресуючій стадії інтенсифікацію процесів ПОЛ і системи антиоксидантного захисту організму, а при стаціонарній стадії – зниження активності системи антиоксидантного захисту.
У літературі наводяться дані щодо активації ПОЛ, пригнічення антиоксидантної системи (її ферментативної та неферментативної ланок) – супероксиддисмутази, каталази, глутатіонпероксидази, α-токоферолу, цистеїну, глутатіону, кармазину у хворих на псоріатичну хворобу. В узагальненому вигляді про- та антиоксидантний захист хворих на псоріаз визначається як стан функціонального напруження ферментативного ланцюга антиокислювального захисту з некомпенсованим накопиченням продуктів ПОЛ [45].
Активація ПОЛ виявляється не лише у сироватці крові, але і в шкірі хворих. Продукти ПОЛ регулюють проліферацію клітин і проникність клітинних мембран, у зв’язку з чим актуальним постає включення до комплексної терапії псоріазу антиоксидантних препаратів, які нейтралізують вплив вільних радикалів, захищають клітини від окисного стресу, сприяють нормальному функціонуванню клітин організму [149, 151].
Пошкоджуючим впливом вільних радикалів, продуктів ПОЛ на гепатоцити пояснюється наявність частих порушень (від 12 до 48 %) з боку гепатобіліарної системи у хворих на псоріатичну хворобу [149, 151].
Велике значення у розвитку загострень псоріазу приділяється змінам з боку цитокінових і антицитокінових факторів [186, 198, 235, 304]. Крім того, у патогенезі псоріазу велику роль відіграє сироваткова та тканинна експресія фактору росту [289].
Е. М. Солошенко і співавт. [129, 131] розглядають псоріаз як екологічно-обумовлену патологію, що характеризується дисбалансом мікроелементів. Баланс мікроелементів підтримується переважно за рахунок споживання продуктів харчування (овочів, фруктів), при цьому потребу організму у мікроелементах покриває добовий харчовий раціон. В останні роки у зв’язку з забрудненням довкілля вміст мікроелементів в овочах і фруктах має тенденцію до прогресивного зниження, що залежить від мінерального складу води та ґрунту. Це зумовлює розвиток патологічних процесів, які супроводжуються надлишком, дефіцитом або дисбалансом мікроелементів в організмі [104, 129, 131].
У літературі зустрічаються дані про загострення псоріатичної хвороби, у тому числі її тяжких форм у вигляді пустульозного псоріазу, на фоні неадекватного застосування деяких медикаментів (наприклад, системних кортикостероїдів) [225, 246].
Механізм розвитку запалення у шкірі та суглобах при псоріазі на сьогоднішній день неможливо уявити без урахування характеру відповіді системи адаптації хворих на вплив того чи іншого патогена-стресора [126, 285]. Ряд авторів [51, 52] у своїх роботах розглядають порушення механізмів нейроендокринної регуляції та системи імунного захисту у хворих на псоріаз. Цей процес відбувається через посередництво центральної та нейрогуморальної систем, які приймають участь в організації єдності функцій організму [50, 51].
Адаптивні механізми у хворих на псоріаз у стадії ремісії та стаціонарній стадії протягом деякого часу можуть стримувати можливий рецидив за рахунок рівнів глюко- та мінеролокортикоїдів, катехоламінів, андрогенів і естрогенів, які підтримують трофічні функції нервової системи та інших систем організму [13, 29, 46, 50]. Дослідження ряду авторів [13, 46] показали, що при загостренні псоріазу зростає синтез альдостерону, зменшуються рівні глюкокортикоїдів, естрогенів і андрогенів, що супроводжується порушенням електролітного обміну.
В окремих роботах відзначено наявність еректильної дисфункції у чоловіків, які хворіли на псоріаз [203].
Дані клінічних досліджень, проведених О. О. Сизон, В. І. Степаненко (2013) [127] підтверджують активацію стрес-системи при артропатичному псоріазі: стрес-реакція має загальний перебіг і супроводжується перенапруженням стрес-реалізаційних систем, зокрема гіпоталамо-гіпофізарно-надниркової системи.
Розвиток артропатичного псоріазу пов’язаний з генетичною схильністю та активацією Т-клітинного імунітету, супроводжується змінами апоптозу [18, 261].
Таким чином, на основі зазначеного вище видно, що псоріаз є поліетіологічним захворюванням усього організму з складним патогенезом, який потребує подальшого вивчення та впровадження нових патогенетично обґрунтованих методів лікування і профілактики.
Стандарти надання медичної допомоги хворим на псоріаз і артропатичний псоріаз затверджені наказом Міністерства охорони здоров’я України від 08.05.2009 р. №312 “Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання” [90] та включають у залежності від перебігу: дієту, седативні засоби, антистресорні адаптогени, дезінтоксикаційні засоби, вегетотропні, гіпосенсибілізуючі й антигістамінні препарати, засоби, що поліпшують периферичний кровообіг, гепатопротектори, вітаміни, цитостатики, імуносупресанти, нестероїдні протизапальні засоби, фізіотерапевтичні заходи, зовнішнє лікування кортикостероїдами та кератолітиками.
Основними технологічними напрямками для лікування псоріазу є лікувальний режим, догляд за шкірою; топічна терапія; фототерапія; системна терапія; додаткові методи лікування [4, 58, 84, 105, 201, 205]. Лікування псоріатичної хвороби починається з дотримання лікувального режиму дня, дієти, використання емолієнтів [71]. Дієтотерапія передбачає стіл № 15, проте за показаннями може призначатись стіл № 5, № 6, № 7. Емолієнти є основними засобами для догляду за шкірою хворих на псоріаз, оскільки вони сприяють відновленню та захисту рогового шару епідермісу, підтримують гідроліпідний баланс, попереджають трансепідермальну втрату води [22, 27].
Засоби для догляду за волоссям і волосистою частиною голови хворих на псоріаз включають шампуні, аерозолі, водорозчинні лосьйони, піни, гелі, що містять як пом’якшувальні та кондиціонуючі компоненти, так і субстанції лікувальної дії – саліцилову кислоту, дьоготь, молочну кислоту, сечовину, багатоатомні спирти, піритіон цинк, кетоконазол, циклопірокс оламін, інші антимікотичні, протизапальні, антисептичні та антибактеріальні засоби [150, 154].
Топічна терапія псоріазу включає: топічні засоби з кератолітичним і певною мірою кератопластичним ефектом; препарати, що містять сечовину або саліцилову кислоту; топічні глюкокортикостероїди; топічні інгібітори кальциневрину; похідні вітаміну D3; топічні ретиноїди; кам’яновугільний дьоготь; фіксовані комбінації топічних засобів або їх комбіноване застосування (похідні вітаміну D3 і топічні глюкокортикостероїди, топічні глюкокортикостероїди та кератолітики [7, 75, 212, 283, 312].
Системна терапія псоріазу включає циклоспорин та інші імунодепресанти; метотрексат, адалімумаб, інфліксимаб, устекінумаб, етанерцепт, нестероїдні протизапальні препарати, лефлуномід, системні глюкокортикостероїди; ретиноїди [44, 76, 171, 182, 195, 224, 242, 288]. Імунобіологічна терапія є основним методом лікування хворих на артропатичний псоріаз і дозволяє значним чином покращити якість життя пацієнтів [300, 314, 315].
Крім того, в лікуванні псоріазу традиційно використовують седативні засоби та транквілізатори. Використовують броміди, сибазон, феназепам, нозепам, мезапам, фенобарбітал, алкалоїди красавки, настойку коренів валеріани, трави пустирника, ново-пасит, седасен, тривалумен, адаптол [84].
Оскільки стрес відіграє значну роль у патогенезі псоріазу, Г. М. Беляев (2010) [13] говорить про доцільність призначення нооцепта, цинаризина та ніцеріума 30 Уно, які чинять позитивний вплив на перебіг патологічних процесів у центральній нервовій системі, обумовлених стресом, регулюють психоемоційні реакції, гальмують розвиток стресорних змін у центральній нервовій системі.
У прогресуючій стадії псоріазу часто використовують натрію тіосульфат, препарати кальцію, реосорбілакт, реамбірин, неогемодез, антигістамінні засоби [4, 84].
Традиційним методом лікування хворих на псоріаз є використання вітамінів групи В (В1, В2, РР, В5, В6, В12, В9, Н), вітамінів А, Е, С та мікроелементів [4, 112].
Крім наведених вище засобів у лікуванні псоріазу використовуються інгібітори фосфодіестерази, що впливають на співвідношення циклічного аденозинмонофосфату та гуанозинмонофосфату: препарати метилксантинової групи – теофілін, еуфілін, кофеїн, трентал, папаверін, АТФ, деякі антигістамінні препарати (тавегіл, фенкарол, дипразин) та імуномодулятори [44, 84, 142].
Широкого розповсюдження у лікуванні псоріазу набули препарати, що чинять цито- та гепатопротекторну дію: карсил, сілимарин, метіонін, есенціале, урсосан, гепабене, глутоксим, глутаргін, антраль, а за наявності супутньої патології жовчовивідних шляхів (дискінезій, холециститів) рекомендовані хофітол, лів-52, тиквеол, сірепар, бетаїн [4, 41, 149, 151].
Для нормалізації мікрофлори кишечника та лікування дисбактеріозу у хворих на псоріаз призначають пробіотики та пребіотики (такі як симбітер, лацидофіл і інші засоби, що містять Lactobacillus rhamnosus, Lactobacillus acidophilus, харчові волокна), а також ентеросорбенти (ентеросгель) [4, 8, 13].
У лікуванні псоріазу з успіхом використовуються препарати імуномодулюючої дії. Для лікування хворих на псоріаз запропоновано використання препаратів тимуса (оскільки у комплексній терапії частини пацієнтів вони покращували її результати, сприяли нормалізації у крові рівнів Т-лімфоцитів і їх субпопуляцій), застосування гроприназину (оскільки він підвищує проліферацію, диференціювання та функціональну активність T- і В-лімфоцитів), призначення індукторів інтерферону – аміксину, циклоферону, кагоцелу, які мають імунорегулюючу дію [4, 13].
Для лікування псоріатичної хвороби В. П. Федотовим и соавт. (2010) [143] було запропоноване використання панавіру, активною субстанцією якого є високомолекулярний рослинний біологічно активний полісахарид, який підвищує неспецифічну резистентність організму до різних інфекцій і сприяє продукції інтерферону.
О. І. Денисенко й А. В. Приймак (2010) [47] розробили комплексний метод лікування хворих на псоріаз, який передбачає призначення на тлі базової терапії хронодетермінованої (у другій половині дня) антиоксидантної терапії, у якості якої використовували препарат мелатоніну. А. М. Дащук, Н. А. Пустовая (2009) [45] у своїх роботах патогенетично обґрунтували призначення комплексу біоантиоксидантів різних груп.
О. О. Сизон, В. І. Степаненко (2012) [126] у своїй роботі рекомендують використовувати у комплексній терапії артропатичного псоріазу антиоксидантні препарати, засоби, що покращують мікроциркуляцію (пентоксифілін, дипіридамол, нікотинову кислоту), а у період ремісії – препарати репаративної дії (біостимулятори – екстракт плаценти, алое, склоподібне тіло та гомеопатичні препарати – траумель С, дискус композитум, цель-Т).
Ефективним є застосування препаратів, які покращують метаболічні процеси організму, та вазоактивних препаратів при запальному процесі у кістково-суглобових тканинах [21, 131].
Враховуючи зниження рівнів кортикостероїдних гормонів і андрогенів, виявлені у дослідженнях ряду авторів [57, 303], вчені вважають за необхідне використання низьких доз кортикостероїдів (у жінок і чоловіків), тестостерону або верошпірону (у чоловіків) – у залежності від наявності відповідних симптомів.
Доцільним є призначення препаратів кальцію та вітаміну D, а також кальцитоніну для попередження та корекції остеопорозу у хворих на артропатичний псоріаз [92, 127].
Для лікування псоріазу широко використовують фізіотерапевтичні методи: фототерапію, масаж, санаторно-курортне лікування [6, 100, 234, 282, 301]. Додатковим методом лікування хворих на псоріатичну хворобу є фітотерапія.
Хірургічне ортопедичне лікування показане хворим на тяжкий артропатичний псоріаз – проводиться артропластика, теносиновектомія та капсулосиновектомія великих і малих суглобів, усунення контрактур, ендопротезування суглобів, коригувальна остеотомія [126, 127].
При тяжких формах псоріазу використовуються ентеросорбенти, гемосорбція, плазмоферез, плазмосорбція, перитонеальний гемодіаліз, лімфоцитоферез [17, 84, 87].
Важливе місце у лікуванні хворих на псоріаз займає організація психокорекційної допомоги та соціально-психологічні тренінги [93, 141, 204].
Не дивлячись на велику кількість робіт, у яких пропонуються нові методики лікування хворих на псоріаз, залишається високим відсоток втрат працездатності, інвалідизації серед населення [39, 99, 179, 223]. Особливо великого соціального значення набуває необхідність лікування та реабілітації чоловіків працездатного віку. Одним із шляхів вирішення медико-соціальної проблеми псоріазу має стати створення методики лікування захворювання, яка базується на індивідуальних патогенетично обґрунтованих підходах з урахуванням вікових особливостей і впливу довкілля. Створення та наукове обґрунтування такої методики для чоловіків віком 45-64 років і постало однією з задач дослідження.
1.4 Особливості стану шкіри та гомеостазу організму у хворих на хронічні алергодерматози та їх корекція
Алергічні дерматози являють собою велику групу захворювань шкіри, що включають алергічний контактний дерматит, різні форми екземи, атопічний дерматит і ряд інших дерматозів, які зустрічаються рідше та у патогенезі яких провідна роль належить алергічним реакціям [77, 190, 220, 227, 292]. Алергодерматози, навіть якщо вони починаються гостро, часто набувають хронічного перебігу, а отже потребують не лише лікування у період загострення, але й постійного контролю за їх перебігом для попередження рецидивів і подовження ремісії [2, 60; 83, 116, 191, 269].
Вивчення етіології, патогенезу та клінічних особливостей хронічних алергічних захворювань шкіри, а також обґрунтований вибір їх терапії є надзвичайно актуальною проблемою сучасної медицини [159, 176, 208, 298, 320]. Це пов’язано з високим рівнем захворюваності на алергодерматози, їх постійними рецидивами, збільшенням кількості тригерних факторів, недостатньою ефективністю терапії, необхідністю комплексного лікування з урахуванням рекомендацій лікарів різних спеціальностей [61, 123, 177, 215, 251, 253].
Зростання захворюваності населення на алергодерматози у багатьох країнах світу, зокрема в Україні, пов’язане з факторами середовища, такими як забруднене відходами промислових підприємств довкілля, використання хімічних речовин у сільському господарстві та харчовій промисловості, шкідливі звички, а також порушеннями правил гігієни харчування [56,166, 183,192, 193, 295, 305].
Хронічні алергічні захворювання шкіри супроводжуються змінами функціонування системи ПОЛ – АОС, вираженою ендогенною інтоксикацією, що пов’язане, з одного боку, з екзогенними екологічними чинниками, а з іншого боку – з захворюваннями шлунково-кишкового тракту, такими як гастрити, дуоденіти, холецистити, дискінезії жовчовивідних шляхів, панкреатити, які призводять до розвитку дисбактеріозу та вимагають проведення відповідної корекції [12, 56].
Однією з важливих ланок патогенезу алергодерматозів є зміни стану імунної системи [168, 247, 271]. Не менш важливою причиною виникнення та хронізації алергічних захворювань шкіри є вітамінна недостатність, яка виникає як внаслідок нераціонального харчування, так і супутніх соматичних захворювань (у першу чергу, захворювань травної системи) [58, 270]. Дослідження, проведені А. Л. Тищенко (1998) [139], показали достовірне зниження рівня вільної та загальної форм біотину в крові у групі хворих на істинну екзему порівняно з групою здорових осіб.
В останні роки надзвичайно велика увага приділяється дослідженню мікробіоценозу та пенетрації мікроорганізмів у шкіру хворих на хронічні алергодерматози [12, 280]. Бактеріальна, мікотична та вірусна мікрофлора завдяки наявності суперантигенів може чинити алергізуючу дію на організм людини (в першу чергу, на шкірні покрови) та призводити до дебюту і прогресування алергодерматозів [60]. Крім того, тривалий перебіг хронічних алергічних захворювань з порушенням цілісності шкіри може ускладнюватись вторинною інфекцією, що спричиняє тяжкість хвороби, складність вибору оптимальної терапії та торпідність до неї [75, 238, 265]. Таким чином, своєчасні профілактика та лікування порушень цілісності шкірного покрову, усунення патогенної мікрофлори шкіри, попередження розвитку дисбактеріозу сприятимуть стабілізації алергічного процесу та тривалій ремісії дерматозу.
Не менш важливим фактором у розвитку хронічних алергодерматозів є формування сухості шкіри. Так, при атопічному дерматиті відзначається низький рівень натурального зволожуючого фактора, що призводить до зростання проникності шкірного покрову, підвищення трансепідермальної втрати вологи, виникнення сухості шкіри, зростання вираженості свербежу та прогресування захворювання [185, 209, 238, 267].
Основними принципами лікування алергодерматозів є комплексність і індивідуальний підхід, урахування основних ланок патогенезу захворювання та його клінічних проявів [5, 24, 26, 43, 62].
Комплексне лікування алергодерматозів було затверджене наказами Міністерства охорони здоров’я України від 07.06.2004 р. № 286 “Про удосконалення дерматовенерологічної допомоги населенню України” та від 08.05.2009 р. № 312 “Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання” [89, 90]; воно передбачає не лише елімінацію алергенних і не алергенних тригерів, медикаментозну системну та зовнішню терапію, але й дотримання режиму дня та дієти (виключення з харчування продуктів-алергенів і продуктів-гістамінолібераторів), усунення супутньої соматичної патології, використання фізіотерапії (електрофорезу, фонофорезу, індуктотермії, електролікування, лазеротерапії), фототерапії, санаторно-курортного лікування. Багатьма науковцями підкреслюється важливість косметологічного догляду за шкірою та санітарно-гігієнічних заходів за місцем проживання і роботи [63, 108].
Системна терапія алергодерматозів передбачає застосування антигістамінних препаратів (І-ІІІ поколінь), мембраностабілізуючих засобів, неспецифічної гіпосенсибілізуючої терапії, препаратів, які впливають на нервову систему (седативних засобів, інколи – транквілізаторів, нейролептиків, антидепресантів), засобів, що нормалізують функціонування шлунково-кишкового тракту (пробіотиків, гепатопротекторів, ферментів підшлункової залози, антигельмінтних засобів та ін.), антигомотоксичних препаратів [3, 119, 122, 187, 222]. За наявності показань виникає необхідність у призначенні антибактеріальних, противірусних або антимікотичних засобів [8, 222]. Крім того, при різних порушеннях з боку імунної системи можливе застосування імуномодулюючих або імуносупресивних препаратів [262, 317]. У разі тяжких загострень алергодерматозів можуть застосовуватись короткі курси лікування системними глюкокортикоїдами [84, 222].
Враховуючи виявлені при алергодерматозах зміни з боку систем ПОЛ-АОС О. І. Денисенко [48] рекомендує застосування хронодетермінованої антиоксидантної терапії. Багатьма науковцями підтверджена необхідність нормалізації мікробіоценозу шкіри та інших біотопів організму у хворих на хронічні алергодерматози [23, 255].
Важливе значення має застосування адекватної клінічній картині захворювання зовнішньої терапії у різних фармакологічних формах [107, 311]. У зовнішньому лікуванні алергодерматозів використовують широкий арсенал різних засобів – топічних кортикостероїдів, селективних інгібіторів кальциневрину, топічних антигістамінних препаратів, емолієнтів, кератолітичних, кератопластичних, епітелізуючих засобів, фітопрепаратів, традиційних протизапальних препаратів, таких як танін, риванол, борна кислота та ін. [98, 140, 188, 221]. Під час загострення будь-яких алергодерматозів засобом вибору зовнішньої терапії є топічні кортикостероїди [68, 110, 133]. За наявності алергодерматозів, які ускладнені вторинною інфекцією, виникає необхідність використання антимікробних засобів зовнішньої дії [26].
Широко застосовуються фото- та фізіотерапевтичні методи лікування хронічних алергодерматозів [222, 265]. Важливу роль у профілактиці загострень хронічних алергодерматозів мають відігравати поведінкові звички, організація правильного режиму дня та гіпоалергенного оточення [257].
Таким чином, лікування та профілактика алергодерматозів включає у себе усунення запальних змін шкіри та суб’єктивних відчуттів – свербежу, печії, болісності; відновлення структури та функції шкіри; використання комплексного підходу до терапії з залученням препаратів системної та зовнішньої дії, а також фізіотерапії; лікування супутніх захворювань, які можуть обтяжувати перебіг алергодерматозів.
Разом з тим, не дивлячись на велику увагу вчених до дослідження хронічних алергодерматозів, залишається високою питома вага пацієнтів з тяжкими проявами алергічних захворювань шкіри, які призводять до втрати працездатності та інвалідизації [251, 253, 269]. У зв’язку з цим великого значення набуває необхідність обґрунтованого вибору терапії та реабілітації хворих на хронічні алергодерматози чоловіків працездатного віку. Одним зі шляхів вирішення медико-соціальної проблеми хронічних алергічних захворювань шкіри має стати створення патогенетично обґрунтованої методики їх лікування з урахуванням інволютивних змін організму. Створення та наукове обґрунтування такої методики для чоловіків віком 45-64 років постало однією з задач дослідження.
Розділ 2
Клінічна характеристика та методи досліджень
Для встановлення особливостей стану шкірного покрову чоловіків і супутніх порушень гомеостазу, що сприяють виникненню дерматологічних захворювань (в тому числі, псоріазу та алергодерматозів), їх хронічному перебігу з постійними загостреннями було проведене клінічне, інструментальне та мікробіологічне обстеження шкіри, біохімічні дослідження біологічних рідин, лабораторне визначення гормонального фону, анкетування щодо соціально-побутових умов і психологічного стану.
До дослідження було включено 447 чоловіків віком від 25 до 64 років, які проживали у місті Запоріжжя і працювали у приватному акціонерному товаристві «Запорізький автомобілебудівний завод». У залежності від віку чоловіки були розподілені на 4 групи: віком 25-34 років – 122 особи, 35-44 років – 128 осіб, віком 45-54 років – 112 осіб, віком 55-64 років – 85 осіб.
Також, до дослідження було включено 212 чоловіків у віці від 35 до 54 років, які проживали у місті меншої величини з нижчим забрудненням навколишнього середовища – Мелітополі та працювали у мелітопольській філії приватного акціонерного товариства «Запорізький автомобілебудівний завод». Умови праці обстежених чоловіків, які мешкали у м. Запоріжжі та м. Мелітополі, не відрізнялись.
У здорових чоловіків віком 25-34 років, які мешкали у м. Запоріжжі, в анамнезі найчастіше відзначались захворювання респіраторного тракту (у 48,4 % осіб), дерматологічні захворювання, що не відносяться до хронічних дерматозів (у 28,7 % осіб), оториноларингологічна (у 25,4 % осіб), офтальмологічна (у 23,8 %), неврологічна патологія (у 22,1 % осіб), захворювання шлунково-кишкового тракту та гепатобіліарної системи (у 19,7 % осіб), серцево-судинної системи (у 13,9 % осіб), сечостатевої системи (у 6,6 % осіб), інфекції дитячого віку (у 4,1 % осіб), патологія ендокринної системи (у 2,5 % осіб). Серед обстежених чоловіків віком 25-34 років 9 % в анамнезі мали хірургічну патологію, яка призвела до оперативних втручань, 23,8 % мали травматичні ушкодження.
Серед здорових чоловіків віком 35-44 років, які мешкали у м. Запоріжжі, в анамнезі відмічені захворювання респіраторного тракту (у 41,4 % осіб), неврологічна (у 39,1 % осіб), офтальмологічна (у 36,7 %), оториноларингологічна патологія (у 32,0 % осіб), дерматологічні захворювання, що не відносяться до хронічних дерматозів (у 22,7 % осіб), захворювання шлунково-кишкового тракту та гепатобіліарної системи (у 19,5 % осіб), серцево-судинної системи (у 17,2 % осіб), сечостатевої системи (у 7,8 % осіб). Серед обстежених чоловіків віком 35-44 років 14,8 % в анамнезі мали хірургічну патологію, яка призвела до оперативних втручань, 50,0 % мали травматичні ушкодження.
У здорових чоловіків віком 45-54 років, які мешкали у м. Запоріжжі, в анамнезі найчастіше відзначались захворювання респіраторного тракту (у 40,2 % осіб), неврологічна (у 38,4 % осіб), оториноларингологічна (у 36,6 % осіб), офтальмологічна патологія (у 32,1 %), хвороби серцево-судинної системи (у 31,3 % осіб), дерматологічні захворювання, що не відносяться до хронічних дерматозів (у 21,4 % осіб), захворювання шлунково-кишкового тракту та гепатобіліарної системи (у 25,0 % осіб), сечостатевої системи (у 11,6 % осіб), патологія ендокринної системи (у 5,4 % осіб). Серед обстежених чоловіків віком 45-54 років 23,2 % в анамнезі мали хірургічну патологію, яка призвела до оперативних втручань, 49,1 % мали травматичні ушкодження.
Серед здорових чоловіків віком 55-64 років, які мешкали у м. Запоріжжі, в анамнезі відмічені захворювання серцево-судинної системи (у 55,3 % осіб), неврологічна (у 40,0 % осіб), офтальмологічна патологія (у 38,8 %), захворювання респіраторного тракту (у 35,3 % осіб), дерматологічні захворювання, що не відносяться до хронічних дерматозів (у 31,8 % осіб), захворювання шлунково-кишкового тракту та гепатобіліарної системи (у 24,7 % осіб), оториноларингологічні захворювання (у 20,0 % осіб), хвороби сечостатевої системи (у 15,3 % осіб). Серед обстежених чоловіків віком 55-64 років 27,1 % в анамнезі мали хірургічну патологію, яка призвела до оперативних втручань, 42,4 % мали травматичні ушкодження.
Крім того, було обстежено 110 хворих на псоріаз і 101 хворого на хронічні алергодерматози (критерієм включення до дослідження була наявність хронічної екземи та атопічного дерматиту) чоловіків віком 45-64 років. Всі хворі, які були включені до дослідження, з приводу свого захворювання проходили лікування у Комунальній установі “Запорізький обласний шкірно-венерологічний клінічний диспансер” Запорізької обласної ради.
Серед обстежених хворих на псоріатичну хворобу 76 (69,1 %) мали вульгарний бляшкоподібний псоріаз, 21 (19,1 %) – артропатичний псоріаз, 8 (7,3 %) – псоріатичну еритродермію, 2 (1,8 %) – псоріаз долоней і підошов, 2 (1,8 %) – краплеподібний псоріаз, 1 (0,9 %) – згинальний інверсний псоріаз. Серед обстежених хворих на псоріаз у 79 осіб (71,8 %) відзначено прогресуючу стадію захворювання, у 31 особи (28,1 %) – стаціонарну стадію захворювання. У 56 (50,9 %) хворих відзначено невизначений (змішаний) тип псоріазу, у 53 (48,2 %) хворих – зимовий тип псоріазу, у 1 (0,9 %) хворого – літній тип псоріазу.
У обстежених хворих на псоріаз чоловіків індекс PASI в середньому становив (26,6±1,57) балів, а індекс BSA склав (38,1±2,53) %.
Тривалість перебігу псоріазу до моменту обстеження була наступною: у 6,4 % хворих – до 1 року, у 14,5 % – від 1 до 5 років, у 15,5 % – від 6 до 10 років, 21,8 % – від 11 до 20 років, 30,0 % – від 21 до 30 років, 11,8 % – понад 30 років.
Серед причин загострення псоріазу хворі відмічали перебування на холоді – у 48,2 %, стреси – у 45,5 %, порушення дієти – у 3,6 %, травматичні ушкодження – у 3,6 %, перенесені гострі респіраторні вірусні інфекції – у 2,7 %, наявність професійних шкідливостей – у 2,7 %, контакт з хімічними речовинами – у 2,7 %, контакт з певними рослинами – у 0,9 %, перебування в умовах жаркого клімату – у 0,9 %. 10 % обстежених пацієнтів пов’язували виникнення та часті загострення псоріазу з обтяженою спадковістю (наявністю псоріатичної хвороби у родичів).
У спектрі перенесених захворювань у когорті хворих на псоріаз найчастішими були захворювання респіраторного тракту (у 38,2 % осіб), шлунково-кишкового тракту та гепатобіліарної системи (у 30,9 % осіб), серцево-судинної системи (у 30,0 % осіб), оториноларингологічна патологія (у 16,4 % осіб), інфекції дитячого віку (у 12,7 % осіб), хвороби сечостатевої системи (у 8,2 % осіб), неврологічна патологія (у 6,4 % осіб), дерматологічні захворювання, не пов’язані з псоріазом (у 5,5 % осіб), патологія ендокринної системи (у 2,7 % осіб). Серед хворих на псоріаз 20,0 % в анамнезі мали хірургічну патологію, яка призвела до оперативних втручань, 17,3 % мали травматичні ушкодження кісток і зв’язково-суглобового апарату.
Серед обстежених хворих на алергічні захворювання шкіри 7 (6,9 %) мали атопічний дерматит, 46 (45,5 %) – істинну (ідіопатичну) екзему, 48 (47,5 %) – мікробну екзему. У всіх хворих відзначений хронічний перебіг алергодерматозів.
Тривалість перебігу алергодерматозів до моменту обстеження була від 6 місяців до 50 років. У тому числі у 39,6 % – до 1 року, у 35,6 % – від 1 до 5 років, у 6,9 % – від 6 до 10 років, 6,9 % – від 11 до 20 років, 5,0 % – від 21 до 30 років, 5,9 % – понад 30 років.
Ступінь тяжкості алергодерматозів у хворих оцінювався за шкалою SCORAD: у обстежених хворих на хронічні алергодерматози чоловіків індекс SCORAD в середньому становив (47,3±0,89) балів. Інтенсивність свербежу шкіри у хворих на хронічні алергодерматози оцінювалась за 10-бальною шкалою і в середньому становила (5,95±0,22) балів.
Серед причин загострення хронічних алергодерматозів хворі відмічали травматичні ушкодження шкіри – у 31,7 %, зміну кліматичних умов – у 11,9 %, наявність професійних шкідливостей – у 10,9 %, порушення дієти – у 8,9 %, контакт з хімічними речовинами – у 6,9 %, наявність варикозної хвороби – у 6,9 %, наявність інших супутніх захворювань і застосування медикаментів з їх приводу – 5,9 %, стреси – у 5,0 %, шкідливі звички (тютюнопаління, зловживання алкоголем) – у 4,0 %, фізичні навантаження – 2,0 %, контакт з певними рослинами (амброзією) – у 1,0 %.
У спектрі перенесених захворювань у когорті хворих на хронічні алергодерматози найчастішими були хвороби серцево-судинної системи (у 38,6 % осіб), респіраторного тракту (у 35,6 % осіб), шлунково-кишкового тракту та гепатобіліарної системи (у 25,7 % осіб), оториноларингологічна патологія (у 13,9 % осіб), інфекції дитячого віку (у 12,9 % осіб), хвороби сечостатевої системи (у 10,9 % осіб), патологія ендокринної системи (у 5,0 % осіб), неврологічна патологія (у 4,0 % осіб), дерматологічні захворювання, не пов’язані з алергодерматозами (у 3,0 % осіб). Серед хворих на хронічні алергодерматози 24,8 % в анамнезі мали хірургічну патологію, яка призвела до оперативних втручань, 9,9 % мали травматичні ушкодження кісток і зв’язково-суглобового апарату.
Оскільки у ході дослідження у чоловіків віком 35-44 років, які мешкали у великому промисловому місті, були встановлені зміни стану шкірного покрову та гомеостазу організму, розглянута можливість корекції виявлених порушень за допомогою вітамінотерапії. Для проведення корекції були обрані полівітамінні засоби з мікроелементами, а також поєднане застосування біотину та декспантенолу.
Для чоловіків 45-54-річного віку розглянута можливість корекції виявлених у ході дослідження порушень за допомогою кисломолочного продукту (симбівіт), що містить пробіотики, або комплексного застосування краталу та кверцетину.
Найбільші зміни стану шкіри, мікроциркуляції у ній, порушення з боку системи ПОЛ-АОС, симпатоадреналової та вагоінсулярної системи, стану ліпідного обміну, рівнів гонадотропних і статевих гормонів були виявлені у ході дослідження у чоловіків віком 55-64 років. Тому була розглянута ефективність застосування ноотропного, антиоксидантного та цитопротекторного засобу для корекції виявлених змін у чоловіків цієї вікової групи. У якості моделі використовували тіотриазолін з антиоксидантними та цитопротекторними властивостями; пірацетам з ноотропною дією; тіоцетам з ноотропним, антиоксидантним і цитопротекторним ефектом. Крім того, була розглянута ефективність профілактичного застосування екстракту рослини Tribulus Terrestris (трібестану) для корекції змін, виявлених у чоловіків віком 55-64 років.
Отже, серед здорових чоловіків віком 35-44 років було створено 2 дослідні підгрупи: І – яка отримувала оздоровчий курс полівітамінів і мікроелементів, ІІ – яка використовувала біотин у комбінації з декспантенолом.
Серед здорових чоловіків віком 45-54 років було створено 2 дослідні підгрупи: І – яка отримувала пробіотичний засіб, ІІ – яка використовувала кратал у поєднанні з кверцетином.
Серед здорових чоловіків віком 55-64 років було створено 4 дослідні підгрупи: І – яка отримувала курс тіотриазоліну, ІІ – яка використовувала курс пірацетаму, ІІІ – яка застосовувала тіоцетам, IV – яка використовувала курс трібестану.
Чоловіки з усіх дослідних груп були обстежені до проведення оздоровчого курсу та через 3 місяці від його початку.
Враховуючи встановлені у ході дослідження зміни стану шкіри, мікроциркуляції у ній, порушення з боку системи ПОЛ-АОС, осмотичної стійкості еритроцитів, збільшення ендотоксикозу, зміни функціонування симпатоадреналової та вагоінсулярної системи, зміни гормонального статусу та психологічні особливості у хворих на псоріаз і хронічні алергодерматози чоловіків 45-64-річного віку, нами була розглянута можливість їх лікування з використанням у комплексній терапії препарату з антиоксидантними, цитопротекторними та ноотропними властивостями (тіоцетаму), екстракту рослини Tribulus Terrestris (трібестану) й автогенних тренінгів за методом Шульца.
Хворі на псоріаз були розподілені на 4 терапевтичні підгрупи у залежності від застосованого лікування: І – яка отримувала базову терапію захворювання згідно наказу Міністерства охорони здоров’я України № 312 від 08.05.2009 р. [90], ІІ – яка додатково до базової терапії використовувала тіоцетам, ІІІ – яка додатково до базової терапії практикувала автогенні тренінги за методом Шульца, IV – яка додатково до базової терапії застосовувала трібестан. Крім того, проводилась оцінка ефективності застосування у цілому розробленого нами комплексу терапевтичних заходів щодо лікування чоловіків, хворих на псоріаз віком 45-64 років (дослідна підгрупа склала 54 особи).
Хворі на хронічні алергодерматози також були розподілені на 4 терапевтичні підгрупи у залежності від застосованого лікування: І – яка отримувала базову терапію захворювання згідно наказу Міністерства охорони здоров’я України № 312 від 08.05.2009 р. [90], ІІ – яка додатково до базової терапії використовувала тіоцетам, ІІІ – яка додатково до базової терапії використовувала автогенні тренінги за методом Шульца, IV – яка додатково до базової терапії застосовувала трібестан. Проводилась оцінка ефективності застосування у цілому розробленого нами комплексу терапевтичних заходів щодо лікування чоловіків, хворих на хронічні алергодерматози віком 45-64 років (дослідна підгрупа склала 53 особи).
Всім особам, які були включені до дослідження, проводили клінічну оцінку стану шкіри. Вираженість сухості шкіри визначали за Глобальною системою градації за A. Kligman, згідно якій сухість шкіри оцінювалась у балах – від 0 до 3 [170].
Тургор шкіри визначали за допомогою ротаційно-компресійного тесту. Бальна оцінка порушень тургору шкіри проводилася за запропонованою нами шкалою з урахуванням наведених Т. В. Проценко (2010) [106] описань можливих ступенів його змін: 0 балів – при проведенні ротаційно-компресійного тесту відзначається наявність опору тиску та ротації; 1 бал – при проведенні тесту спостерігається виникнення віяла тонких зморшок, які після усунення тиску незабаром зникають; 2 бали – при проведенні тесту шкіра піддається слабкому тиску, відмічається вільна ротація й утворення дрібних зморшок при натисненні.
Зморшкуватість шкіри оцінювалася за 2 показниками: кількістю зморшок і їх вираженістю. Для оцінки кількості зморшок був проведений їх підрахунок у трьох зонах обличчя: лобній, навколовушно-жувальній, периорбітальній. У кожній з цих зон проводився підрахунок кількості статичних зморшок на ділянці площею 4 см2. Розроблений нами показник кількості зморшок являв собою їх суму у вказаних трьох зонах.
Для об’єктивної оцінки вираженості зморшок і загального стану шкіри нами також був розроблений інтегральний показник. Для оцінки вираженості зморшок і стану шкіри проводилась бальна оцінка статичних горизонтальних зморшок на лобі, позиції брів, статичних вертикальних зморшок на лобі, статичних периорбітальних зморшок, мішків під очима, повноти верхньої половини щік, повноти нижньої половини щік, носогубних складок, складок маріонетки, кісетних статичних зморшок, зморшок у кутах рота, птозу підборіддя, об’єму м’яких тканин шиї, об’єму підшкірно-жирової клітковини на кистях. Кожен з цих показників оцінювався від 0 до 4 балів, де 0 – відсутність ознаки, 1 бал – незначний ступінь прояву, 2 – середній ступінь, 3 – тяжкий; 4 – дуже тяжкий ступінь прояву. Інтегральний показник являв собою суму балів всіх показників старіння шкіри.
Для оцінки проявів природного старіння були обрані фотозахищені ділянки шкіри. Стан шкіри оцінювався згідно фотонумеричній шкалі старіння шкіри за Yolanda R. Helfrich et al. (2007) [196].
Одночасно був проведений підрахунок основних елементів висипки – маркерів старіння шкіри: визначалася кількість сенільних ангіом, сенільних лентиго, кератом, краплеподібного гіпомеланозу, телеангіектазій, папілом. Оскільки у різних чоловіків переважали різні елементи висипки – маркери старіння, для уніфікації отриманих даних ми оцінювали інтегральний показник – суму всіх елементів – маркерів старіння.
Вираженість свербежу шкіри визначалася за десятибальною нумеричною оціночною шкалою, де 0 балів – це повна відсутність свербежу, а 10 балів – максимальна його інтенсивність [163]. Крім того, була проведена оцінка об’єктивних ознак свербежу, таких як зміни нігтьових пластин і екскоріації за И. А. Бабюк и соавт. (2009) [128]. Кожна з об’єктивних ознак свербежу оцінювалася за бальною шкалою, де 0 балів – це відсутність ознаки, 1 бал – її слабка вираженість, 2 бали – помірна вираженість, 3 бали – значна вираженість.
У хворих на псоріаз, крім того, проводились оцінка площі ураження шкіри за індексом Body Surface Area (BSA); площі, тяжкості та ступеня ураження за індексом Psoriasis Area Severity Index (PASI) [95, 239]. Для оцінки ефективності лікування хворих на псоріаз визначали процентне зменшення індексу PASI (Δ PASI, %), Δ PASI-50, Δ PASI-75.
Ступінь тяжкості алергодерматозів у хворих оцінювався за шкалою Scoring of Atopic Dermatitis (SCORAD) [9, 180, 286]. Для оцінки ефективності лікування хворих на алергодерматози визначали процентне зменшення індексу SCORAD (Δ SCORAD, %).
Для оцінки товщини різних шарів шкіри у обстежених осіб і кровотоку у ній проводилося доплерографічне ультразвукове дослідження шкіри за допомогою Апарату ультразвукового діагностичного SA 8000 Live (виробник – Medison) з використанням лінійного датчика (частота 4-9 мГц). Товщину епідермісу, дерми та підшкірної жирової клітковини (ПЖК) було визначено у 4 зонах: на лобі, скроні, щоці та підборідді. Вираховувалися середні значення товщини різних шарів шкіри обличчя. Кровотік у шкірі визначали у скроневій зоні, його характеризували за максимальною та середньою швидкостями кровотоку, індексами пульс-активності та резистентності.
Стан мікроциркуляції шкіри визначали за допомогою біомікроскопії кровоносних судин нігтьового ложа четвертого пальця лівої руки. Біомікроскопія проводилася за допомогою мікроскопа біологічного МБР-1. У ході дослідження було проведено визначення кількості функціонуючих капілярів (на 1 мм2) і наявності порушень мікроциркуляції (судинних, внутрішньосудинних і позасудинних).
Усім обстеженим чоловікам проводилося вимірювання зросту та маси тіла, систолічного артеріального тиску (САТ) і діастолічного артеріального тиску (ДАТ), вираховувався індекс маси тіла (кг/м2).
Для встановлення особливостей гомеостазу організму, які могли асоціюватися зі змінами шкіри у чоловіків, проведено дослідження функціонування системи ПОЛ-АОС, осмотичної стійкості еритроцитів, концентрації середніх молекул, гормонального статусу. Про функціонування системи ПОЛ-АОС судили за кількістю тіобарбітурової кислоти активних продуктів (ТБК-АП), які визначали у реакції з 2-тіобарбітуровою кислотою, та загальною антиокислювальною активністю у слині [67]. Проводився розрахунок коефіцієнту антиокислювального захисту (КАОЗ). Крім того, був проведений добовий моніторинг (о 6, 12, 18, 24 годині) активності системи ПОЛ-АОС з наступним розглядом циркадних ритмів.
При змінах функціонування системи ПОЛ-АОС відбуваються функціональні зміни клітинних мембран. Для оцінки останніх у якості моделі вивчали осмотичну резистентність еритроцитів за ступенем гемолізу (метод Ідельсона) [55].
Активація ПОЛ, порушення функціонування клітинних мембран призводять до змін метаболізму як окремих клітин, так і організму у цілому. Порушення обміну речовин спричиняє підвищення рівня ендогенної інтоксикації, що визначається концентрацією середніх молекул. Рівень середніх молекул (СМ) досліджувався при довжині хвилі 254 нм (СМ1) та 280 нм (СМ2) методом Н. І. Габріелян, В. І. Ліпатової [37].
Для дослідження функціонування нервової системи, її вегетативної та ендокринної ланок, визначали екскрецію адреналіну (А), норадреналіну (НА), L-діоксифенілаланіну (ДОФА), дофаміну (ДА) з добовою сечею. Концентрацію інсуліну (І), кортизолу (К), тестостерону (Т), тестостеронзв’язуючого глобуліну, фолікулостимулюючого гормону, лютеїнізуючого гормону, пролактину (ПРЛ) визначали імуноферментним методом у сироватці крові з використанням стандартних наборів реактивів.
Визначення концентрації глюкози, холестерину проводили згідно інструкції до наборів “Cormay” (Польща); визначення концентрації тригліцеридів – згідно інструкції до набору “Dialab” (Австрія), визначення концентрації β-ліпопротеїдів – згідно інструкції до набору “Био-ЛА-Тест” (Чехія).
Дослідження мікробіоценозу шкіри, слизової оболонки ротоглотки та кишечника проводилося методом його прямої якісної й кількісної оцінки згідно методичних рекомендацій “Мікробіологічна діагностика дисбактеріозів: Методичні рекомендації” [86]. Мікробне обсіменіння шкіри вивчалося на зразку коагулазопозитивних і коагулазонегативних стафілококів з підрахунком загальної кількості бактерій, виражалося в Lg КУО/см2. Мікробне обсіменіння ротоглотки виражали в Lg КУО/мл, а калу – в Lg КУО/г.
Чоловікам проводили анкетування за розробленим нами опитувальником для визначення їх освіти, сімейного стану, соціально-побутових умов, ментальних особливостей.
Оцінка якості життя у хворих на псоріаз і алергодерматози проводилася за авторизованим українським перекладом Dermatology Life Quality Index (DLQI) [95]. Для оцінки ефективності лікування хворих на псоріаз і алергодерматози визначали процентне зменшення індексу DLQI (Δ DLQI, %), а також відсоток хворих, у яких індекс DLQI наприкінці лікування був меншим за 5 балів (DLQI < 5, %).
Зміни психологічного стану чоловіків виявляли за допомогою карт-опитувальників. Рівень тривожності вивчали за шкалою самооцінки Спілбергера-Ханіна [85, 145]. Рівень невротизації оцінювався за методикою діагностики Л. І. Вассермана [85]. Проводилось анкетування чоловіків за допомогою опитувальника “Шкала Бека для самооцінки тяжкості депресії” [161].
Для оцінки симптомів старіння чоловіків і андрогенного дефіциту проводилось анкетування за опитувальником Aging Males Symptoms Scale (AMS), розроблена Berlin Center for Epidemiology and Health Research [65, 228].
Статистичну обробку результатів проводили за допомогою програмного пакету STATISTICA 6.1 (StatSoftInc., серійний № AGAR909E415822FA). Для порівняння показників у різних групах застосовано парний критерій Ст’юдента з розрахунком середньої арифметичної (М) та стандартної помилки середньої арифметичної (m) або критерій знаків Вілкоксона залежно від нормальності розподілу різниць [42, 114]. Нормальність розподілу даних перевіряли за допомогою критерію Шапіро-Уілка за рівня значущості 0,01. При застосуванні усіх статистичних методів, окрім критерію Шапіро-Уілка, рівень значущості брали рівним 0,05 – різницю між даними вважали достовірною при р<0,05. Визначення необхідного обсягу вибіркової сукупності (n) проводили за формулами П. Ф. Рокицкого (1973): n=t2σ2/∆2 – при кількісній варіації; n=t2[P(1-P)/∆2] – при альтернативній варіації, де ∆ – завдана точність, Р – частка особин з визначеною кількісною ознакою. Для знаходження середньоквадратичних відхилень (σ2) використовували дані попередніх досліджень [114]. Для визначення структурних зв’язків використовували кореляційний аналіз з визначенням коефіцієнтів парної кореляції – r.
Розділ 3
Особливості стану шкіри, соціально-побутових
і психологічних параметрів, гомеостазу у чоловіків
різних вікових груп
На сьогоднішній день надзвичайно актуальним питанням медичної науки є збереження здоров’я населення. Протягом останніх десятиліть в Україні спостерігаються значні демографічні зміни, які характеризуються прогресивним зростанням частки населення старшої вікової групи. Постаріння населення впливає на розвиток суспільства, економічну ситуацію та ставить важливі завдання перед охороною здоров’я.
Для вивчення особливостей шкіри та гомеостазу організму у залежності від віку було обстежено 447 здорових чоловіків без ознак дерматологічних захворювань у віці від 25 до 64 років, які проживали у місті Запоріжжя та працювали на одному з промислових виробництв. У залежності від віку обстежені чоловіки були розподілені на 4 групи: віком 25-34 років – 122 особи, віком 35-44 років – 128 осіб, віком 45-54 років – 112 осіб, віком 55-64 років – 85 осіб.
Шляхом анкетування був визначений психологічний стан чоловіків різного віку. Як видно з табл. 3.1, у чоловіків різних вікових груп рівень особистісної тривожності був однаковим. Це пов’язано з тим, що особистісна тривожність формується в ранньому віці та має певну стабільність. Нашими дослідженнями були встановлені коливання рівня ситуативної тривожності у чоловіків різного віку. Була отримана достовірна різниця за рівнем ситуативної тривожності між групою чоловіків віком 25-34 років і 35-44 років, а також між групами чоловіків віком 45-54 років і 35-44 років. Найвищий рівень ситуативної тривожності встановлений у осіб віком 55-64 років. Отримана достовірна різниця за рівнем ситуативної тривожності не лише між групою чоловіків віком 55-64 років і 35-44 років, але й між групами чоловіків віком 55-64 років і 45-54 роки.
Таблиця 3.1 – Рівні ситуативної та особистісної тривожності, невротизації та депресії у чоловіків різних вікових груп (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | |||
| 25-34 рр. | 35-44рр. | 45-54рр. | 55-64рр. | |
| Рівень особистісної тривожності за шкалою Спілбергера-Ханіна, бали | 38,3±0,43 | 38,2±0,47 | 38,5±0,48 | 38,2±0,33 |
| Рівень ситуативної тривожності за шкалою Спілбергера-Ханіна, бали | 40,1±0,25 | 38,5±0,22* | 39,8±0,23l | 42,6±0,19*l◘ |
| Рівень невротизації за Л. І. Вассерманом, бали | 3,2±0,28 | 4,95±0,28* | 6,36±0,29*l | 7,6±0,34*l◘ |
| Рівень депресії за шкалою Бека, бали | 2,8±0,35 | 4,37±0,41* | 5,91±0,44*l | 7,68±0,43*l◘ |
Примітка. * – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 45-54 років.
У чоловіків різних вікових груп рівень невротизації загалом був низьким, проте з віком відзначалось його поступове зростання. Отримана достовірна різниця за рівнем невротизації між чоловіками всіх чотирьох дослідних груп (табл. 3.1). Це говорить про зростання з віком емоційної збудливості, в результаті чого виникають негативні переживання, такі як тривожність, напруга, подразливість, розгубленість. З віком частіше виникає іпохондрична фіксація на соматичних відчуттях і особистих недоліках, в тому числі й тих, що стосуються естетичного вигляду шкіри. Це призводить до погіршення якості життя чоловіків старшого віку.
Крім того, як видно з табл. 3.1, обстежені чоловіки в середньому не виявляли ознак депресії. При цьому середній бал оцінки за шкалою Бека зростав зі збільшенням віку і був максимальним у віці 55-64 років. Отримана достовірна різниця за бальною оцінкою депресії між чоловіками усіх чотирьох дослідних груп.
Таким чином, нами були виявлені вікові особливості психологічного стану чоловіків, які проявлялися коливаннями ситуативної тривожності, невротизації та депресії. Ці зміни можуть бути провокуючим фактором у розвитку різних дерматозів.
Крім опитування, у всіх чоловіків проводилося вимірювання зросту, маси тіла, артеріального тиску. Зі збільшенням віку у чоловіків відбувається зростання маси тіла, індексу маси тіла (ІМТ), систолічного та діастолічного артеріального тиску (табл. 3.2). ІМТ був достовірно вищим у чоловіків віком 45-54 років порівняно з групами осіб віком 25-34 років і 35-44 років. Достовірно найвищим серед усіх груп обстежених ІМТ був у 55-64-річних чоловіків.
Таблиця 3.2 – Зріст, маса тіла, ІМТ, артеріальний тиск у чоловіків різних вікових груп (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | |||
| 25-34 рр. | 35-44рр. | 45-54рр. | 55-64рр. | |
| Зріст, см | 177,2±0,70 | 176,5±0,61 | 175,9±0,65 | 175,3±0,69 |
| Маса тіла, кг | 77,5±1,28 | 78,4±1,23 | 81,0±1,13* | 84,5±1,7*l |
| ІМТ, кг/м2 | 24,6±0,35 | 25,1±0,36 | 26,1±0,3*l | 27,5±0,57*l◘ |
| САТ, мм рт. ст. | 118,2±0,64 | 120,4±0,78* | 129±0,94*l | 134,4±1,07*l◘ |
| ДАТ, мм рт. ст. | 78,2±0,47 | 77,7±0,59 | 82,0±0,73*l | 83,8±0,74*l◘ |
Примітка. * – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 45-54 років.
Достовірно вищі рівні систолічного та діастолічного тиску мали особи віком 45-54 років, порівняно з 25-34-літніми та 35-44-літніми чоловіками. Достовірно найвищі рівні систолічного та діастолічного тиску серед усіх обстежених груп відзначені у осіб віком 55-64 років. Встановлена пряма кореляційна залежність між віком і рівнем систолічного артеріального тиску (r=0,59), а також рівнем діастолічного тиску (r=0,36). Ці показники мають важливе значення, оскільки вони є складовими метаболічного синдрому, а він є обтяжуючим фактором перебігу псоріатичної хвороби у осіб старших вікових груп.
У всіх обстежених чоловіків була проведена клінічна оцінка стану шкіри. Як видно з табл. 3.3, зі збільшенням віку зростала вираженість сухості шкіри. При цьому у чоловіків віком 45-54 років встановлена достовірна різниця за вираженістю сухості шкіри порівняно як з групою осіб віком 25-34 років, так і з 35-44-річними чоловіками. Найбільш вираженою сухість шкіри була у чоловіків віком 55-64 років, за її бальною оцінкою визначена достовірна різниця порівняно з усіма групами обстежених осіб. Відзначена пряма кореляційна залежність між віком чоловіків і бальною оцінкою сухості шкіри (r=0,42).
У чоловіків з віком зростала бальна оцінка порушень тургору шкіри, яка досягала максимальних значень у віці 55-64 років (табл. 3.3). Отримана достовірна різниця за бальною оцінкою порушень тургору між усіма віковими групами чоловіків. Відзначена висока кореляційна залежність між віком і бальною оцінкою порушень тургору (r=0,79). Крім того, у чоловіків з віком відбувалося зростання кількості зморшок. При цьому отримана достовірна різниця за їх кількістю між усіма віковими групами. Відзначена висока кореляційна залежність між віком і кількістю зморшок (r=0,87). В кожній наступній віковій групі відбувалося достовірне зростання бальної оцінки вираженості зморшок. Відзначена висока кореляційна залежність між віком чоловіків і бальною оцінкою вираженості зморшок (r=0,89). Отримані дані свідчать про переважання комбінованого підтипу старіння шкіри у всіх вікових групах серед чоловічого населення.
Таблиця 3.3 – Клінічні показники стану шкіри у чоловіків різного віку (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | |||
| 25-34 рр. | 35-44рр. | 45-54рр. | 55-64рр. | |
| Сухість шкіри, бали | 0,02±0,02 | 0,06±0,02 | 0,31±0,06*l | 0,67±0,08*l◘ |
| Порушення тургору шкіри, бали | 0,1±0,03 | 0,93±0,03* | 1,16±0,03*l | 1,58±0,05*l◘ |
| Кількість зморшок (4см2х3) | 3,1±0,20 | 6,97±0,22* | 11,1±0,23*l | 12,7±0,22*l◘ |
| Оцінка вираженості зморшок і стану шкіри, бали | 3,2±0,25 | 11,3±0,64* | 22,9±0,61*l | 30,6±0,65*l◘ |
| Оцінка шкіри за шкалою Yolanda R. Helfrich et. al. | 0,098±0,03 | 1,18±0,10* | 3,08±0,10*l | 4,54±0,11*l◘ |
| Кількість ангіом | 0,3±0,17 | 2,52±0,57* | 11,4±0,87*l | 15±1,26*l◘ |
| Кількість лентиго | 3,6±1,74 | 10,7±1,34* | 21,7±1,47*l | 28,8±1,73*l◘ |
| Кількість кератом | 0,0±0,00 | 0,42±0,18* | 2,45±0,49*l | 3,95±0,67*l |
| Кількість вогнищ гіпомеланозу | 0,0±0,07 | 0,1±0 | 0,5±0,37 | 0,48±0,4 |
| Кількість телеангіектазій | 0,1±0,08 | 1,23±0,43* | 2,1±0,64* | 5,86±1,26*l◘ |
| Кількість папілом | 0,7±0,32 | 3,6±0,57* | 7,97±0,78*l | 9,7±1,26*l |
| Кількість елементів – маркерів старіння | 4,8±1,8 | 18,5±2,3* | 46,1±2,7*l | 63,9±4,1*l◘ |
Примітка. * – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 45-54 років.
З віком у чоловіків відбувалося зростання бальної оцінки стану шкіри за Yolanda R. Helfrich et al. Достовірна різниця спостерігалася між усіма віковими групами обстежених. Максимальною бальна оцінка стану шкіри була у чоловіків віком 55-64 років. Відзначена висока кореляційна залежність між віком чоловіків і оцінкою шкіри за Yolanda R. Helfrich et al. (r=0,89).
Одним із показників старіння шкіри є наявність певних висипань – сенільних ангіом і лентиго, кератом, краплеподібного гіпомеланозу, телеангіектазій і папілом. У чоловіків з віком збільшувалася кількість даних елементів (табл. 3.3). Достовірно максимальною їх кількість була серед осіб віком 55-64 років. У 25-34-річних чоловіків спостерігались поодинокі висипання – маркери старіння. Відзначена пряма кореляційна залежність між віком чоловіків і кількістю сенільних ангіом (r=0,60), сенільних лентиго (r=0,51), кератом (r=0,36), телеангіектазій (r=0,28), папілом (r=0,42), загальною кількістю елементів висипки – маркерів старіння (r=0,64).
Визначивши клінічні особливості шкіри у чоловіків різних вікових груп, ми провели аналіз результатів її ультразвукового дослідження, які надані на табл. 3.4. Отже, з віком відзначалося зменшення як загальної товщини шкіри, так і її шарів. Між групами чоловіків віком 35-44 років і 25-34 років отримана достовірна різниця за товщиною епідермісу у лобній, щічній зонах і зоні підборіддя. За товщиною дерми, а також епідермісу та дерми загалом достовірна різниця отримана між цими групами у всіх обстежених зонах. У чоловіків віком 45-54 років товщина епідермісу та дерми була достовірно меншою не лише у порівнянні з групою 25-34-річних чоловіків, але у окремих зонах – і у порівнянні з особами віком 35-44 роки. Найменша товщина епідермісу та дерми відзначена у чоловіків віком 55-64 років. Отримана достовірна різниця за товщиною дерми, дерми й епідермісу загалом у лобній, скроневій зонах і зоні підборіддя між групою чоловіків віком 55-64 років і особами віком 45-54 років. Відзначена кореляційна залежність між віком чоловіків і товщиною епідермісу (r=-0,61), товщиною дерми (r=-0,89). Зменшення товщини шарів шкіри є не лише маркером старіння організму, але й важливим патогенетичним чинником у виникненні та хронізації певних дерматозів, а отже потребує проведення відповідної корекції.
Таблиця 3.4 – Середні значення товщини шкіри у чоловіків різного віку (мм) (М±m)
| Ділянка | Товщина: | Чоловіки віком: | |||
| 25-34 рр. | 35-44 рр. | 45-54рр. | 55-64рр. | ||
| Лобна | дерми та епідермісу | 2,00±0,02 | 1,79±0,02* | 1,73±0,03* | 1,6±0,03*l◘ |
| епідермісу | 0,141±0,003 | 0,129±0,002* | 0,128±0,004* | 0,121±0,004* | |
| дерми | 1,86±0,02 | 1,66±0,02* | 1,60±0,02*l | 1,48±0,03*l◘ | |
| ПЖК | 0,91±0,02 | 0,89±0,01 | 0,90±0,02 | 0,88±0,02 | |
| Скронева | дерми та епідермісу | 2,07±0,02 | 1,71±0,02* | 1,64±0,03*l | 1,51±0,03*l◘ |
| епідермісу | 0,139±0,003 | 0,122±0,003 | 0,121±0,004* | 0,113±0,003*l | |
| дерми | 1,93±0,02 | 1,59±0,02* | 1,52±0,02*l | 1,40±0,03*l◘ | |
| ПЖК | 0,904±0,01 | 0,89±0,01 | 0,87±0,02 | 0,89±0,02 | |
| Щічна | дерми та епідермісу | 1,78±0,01 | 1,59±0,02* | 1,6±0,02* | 1,59±0,03* |
| епідермісу | 0,131±0,002 | 0,123±0,003* | 0,119±0,004* | 0,121±0,003* | |
| дерми | 1,65±0,01 | 1,47±0,02* | 1,49±0,02* | 1,47±0,02* | |
| ПЖК | 1,19±0,01 | 1,17±0,01 | 1,20±0,03 | 1,14±0,0 | |
| Підборіддя | дерми та епідермісу | 2,31±0,02 | 1,98±0,02* | 1,71±0,02*l | 1,59±0,02*l◘ |
| епідермісу | 0,144±0,003 | 0,129±0,003* | 0,121±0,003*l | 0,118±0,003*l◘ | |
| дерми | 2,16±0,01 | 1,86±0,02* | 1,59±0,02*l | 1,47±0,02*l◘ | |
| ПЖК | 0,99±0,01 | 0,98±0,01 | 0,97±0,02 | 0,99±0,03 | |
Примітка. * – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 45-54 років.
При дослідженні кровоплину у шкірі чоловіків не виявлено достовірної різниці за основними показниками між особами віком 35-44 років і 25-34 років (табл. 3.5). У чоловіків 45-54-річного віку, в порівнянні з молодшими чоловіками, відзначалася менша максимальна швидкість кровоплину і більші значення пульс-активності та резистентності. Збільшення індексів свідчить про зменшення еластичності судин. У чоловіків 55-64-річного віку у порівнянні з іншими віковими групами спостерігались найменші значення максимальної та середньої швидкості, найбільші індекси пульс-активності та резистентності. Отримана достовірна різниця за індексом пульс-активності, максимальною та середньою швидкістю кровотоку між групами чоловіків віком 55-64 років і 45-54 років. Результати, наведені в табл. 3.5, свідчать про зменшення кровоплину в шкірі чоловіків віком понад 44 років. Відзначена кореляційна залежність середнього ступеня між віком чоловіків і максимальною швидкістю кровотоку (r=-0,63), середньою швидкістю кровотоку (r=-0,61), індексом пульс-активності (r=0,57), індексом резистентності (r=0,54).
Про вікове погіршення кровоплину в шкірі свідчать і результати біомікроскопічних досліджень. Зі збільшенням віку у чоловіків відзначалося зменшення кількості функціонуючих капілярів і збільшення відсотку порушень мікроциркуляції (табл. 3.5). Збільшувалася частота як судинних, так і внутрішньосудинних змін. Відзначена кореляційна залежність між віком чоловіків і кількістю функціонуючих капілярів на 1 мм3 (r=-0,78), відсотком порушень мікроциркуляції (r=0,33).
Таким чином, результати проведеного дослідження свідчать про зменшення товщини різних шарів шкіри, погіршення мікроциркуляції та кровоплину у шкірі, які відбуваються з віком у чоловіків.
Важливу роль у збереженні цілісності та фізіологічного стану шкіри відіграє її мікробіоценоз. Зі збільшенням віку чоловіків спостерігалось зростання загальної кількості бактерій на шкірі та кількості коагулазопозитивних стафілококів (табл. 3.6). Кількість коагулазонегативних стафілококів з віком майже не змінювалась. При цьому не було отримано достовірної різниці за загальною кількістю бактерій і коагулазопозитивних стафілококів між особами віком 25-34 та 35-44 років. Починаючи з віку 45 років відзначалась поява достовірних відмінностей у мікробному обсіменінні шкіри. Відзначена кореляційна залежність між віком чоловіків і загальною кількістю бактерій на шкірі (r=0,44), кількістю коагулазопозитивних стафілококів (r=0,44). Це може говорити про формування вікового дисбіотичного стану, який може сприяти виникненню та прогресуванню дерматологічних захворювань і потребує проведення відповідної корекції.
Таблиця 3.5 – Характеристика кровоплину в шкірі чоловіків різного віку
| Показники, одиниці вимірювання | Чоловіки віком: | |||
| 25-34 рр. | 35-44 рр. | 45-54рр. | 55-64рр. | |
| Максимальна швидкість, см/с (М±m) | 6,10±0,05 | 6,14±0,02 | 5,98±0,04l | 5,51±0,05*l◘ |
| Середня швидкість, см/с (М±m) | 3,64±0,03 | 3,6±0,03 | 3,52±0,04* | 3,24±0,04*l◘ |
| Індекс пульс-активності, у. о. (М±m) | 1,55±0,02 | 1,55±0,02 | 1,69±0,03*l | 1,8±0,04*l◘ |
| Індекс резистентності, у. о. (М±m) | 0,94±0,01 | 0,91±0,01 | 1,02±0,02*l | 1,09±0,02*l |
| Кількість функціонуючих капілярів на 1 мм3 (М±m) | 42,3±0,69 | 38,4±0,71* | 34,2±0,53*l | 30,1±0,61*l◘ |
| Наявність порушень мікроциркуляції, % | 26,1 | 32,0 | 50,0 | 67,6*l |
| Судинні порушення, % | 17,4 | 24,0 | 33,3 | 52,9*l |
| Внутрішньосудинні зміни, % | 8,7 | 12,0 | 20,0 | 29,4* |
| Позасудинні зміни,% | 8,7 | 8,0 | 13,3 | 8,8 |
Примітка. * – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 45-54 років.
Таблиця 3.6 – Стан мікробного обсіменіння шкіри у чоловіків різних вікових груп (Lg КУО/см2) (М±m)
| Показники | Чоловіки віком | |||
| 25-34 рр. | 35-44 рр. | 45-54рр. | 55-64рр. | |
| Загальна кількість бактерій | 3,0±0,16 | 3,04±0,19 | 3,66±0,14*l | 3,7±0,14*l |
| Стафілококи коагулазонегативні | 1,4±0,36 | 1,28±0,34 | 1,37±0,36 | 1,63±0,32 |
| Стафілококи коагулазопозитивні | 0,2±0,17 | 0,33±0,22 | 1,06±0,32* | 1,27±0,33*l |
Примітка. * – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 45-54 років.
У ході дослідження пильна увага була приділена визначенню мікробіоценозу ротоглотки та шлунково-кишкового тракту. Результати дослідження надані в табл. 3.7, 3.8. З віком у чоловіків відзначалася тенденція до зростання кількості патогенних стрептококів (Str. pneumoniae, Str. pyogenes) у ротоглотці (табл. 3.7). Найбільша кількість патогенних стафілококів відзначалась у ротоглотці у 55-64-річних чоловіків. Крім того, була відзначена тенденція до зростання з віком загальної кількості умовно-патогенної флори. Так, отримана достовірна різниця за інтегральним показником кількості умовно патогенної флори між групами чоловіків віком 55-64 і 35-44 років. Відзначена достовірна кореляційна залежність між віком і інтегральним показником умовно-патогенної флори (r=0,29), в тому числі: кількістю патогенних стафілококів (r=0,25), кількістю гемофільних паличок (r=0,24). Як відомо, наявність вогнищ хронічної інфекції (в першу чергу, у ротоглотці) є важливим етіологічним чинником у розвитку багатьох дерматозів. Оскільки зростання кількості патогенної флори відмічається у чоловіків, починаючи з 45-річного віку, доцільним є проведення коригуючих заходів, спрямованих на нормалізацію мікробіоценозу, саме у цій віковій групі.
Таблиця 3.7 – Результати бактеріологічного дослідження вмісту ротоглотки у чоловіків різних вікових груп (Lg КУО/мл) (М±m)
| Показники | Чоловіки віком | |||
| 25-34 рр. | 35-44 рр. | 45-54 рр. | 55-64 рр. | |
| Умовно-патогенні стрептококи | 2,2±0,48 | 2,34±0,42 | 2,45±0,44 | 2,99±0,35 |
| Умовно-патогенні стафілококи | 2,3±0,51 | 2,12±0,46 | 2,37±0,43 | 3,32±0,14l◘ |
| Гемофільні палички (Haemophylus influenzaе) | 1,2±0,44 | 1,23±0,44 | 1,68±0,43 | 2,01±0,39 |
| Гриби роду Candida (albicans et nonalbicans) | 1,0±0,42 | 1,0±0,43 | 0,95±0,41 | 1,38±0,46 |
| Ентеробактерії | 0,3±0,25 | 0,23±0,23 | 0,45±0,3 | 0,38±0,26 |
| Ентерококи | 0,3±0,31 | 0,25±0,25 | 0,48±0,32 | 0,38±0,26 |
| Неферментуючі глюкозу грамнегативні палички | 0,5±0,30 | 0,45±0,3 | 0,45±0,3 | 0,65±0,35 |
| Інтегральний показник кількості умовно-патогенної флори | 7,7±1,41 | 7,61±0,90 | 8,82±1,42 | 11,1±1,1l |
Примітка. * – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 45-54 років.
Численні епідеміологічні дослідження відображають збільшення розповсюдженості у сучасних умовах низки хронічних дерматозів, для яких характерною є асоціація з різними захворюваннями шлунково-кишкового тракту і, в першу чергу, з порушеннями мікробіоценозу кишечника. Нами були проведені дослідження мікробіоценозу кишечника у залежності від віку чоловіків. Вони показали, що зі збільшенням віку відбувались порушення мікробіоценозу кишечника (табл. 3.8). У чоловіків віком 45-54 і 55-64 років встановлено достовірне зниження кількості біфідобактерій і лактобактерій порівняно з групою осіб 25-34 років. Була встановлена достовірна різниця за кількістю неферментуючої кишечної палички між тими ж групами обстежених чоловіків. Відзначені тенденції щодо зростання кількості стафілококів, протею, грибів роду Candida зі збільшенням віку чоловіків. Отже, початкові зміни мікробіоценозу кишечника, як і ротоглотки, спостерігались у чоловіків віком 45-54 років. Відзначена пряма кореляційна залежність між віком чоловіків і кількістю неферментуючої кишечної палички (r=0,38), зворотна – з кількістю біфідобактерій (r=-0,42), кількістю лактобактерій (r=-0,38). Це також доводить необхідність проведення заходів, направлених на відновлення мікробного пейзажу організму, починаючи з 45-річного віку чоловіків.
Таблиця 3.8 – Результати бактеріологічного дослідження калу у чоловіків різних вікових груп (Lg КУО/г) (М±m)
| Показники | Чоловіки віком | |||
| 25-34 рр. | 35-44 рр. | 45-54рр. | 55-64рр. | |
| Біфідобактерії | 8,9±0,11 | 8,63±0,15 | 8,35±0,14* | 8,25±0,18* |
| Лактобактерії | 6,9±0,18 | 6,71±0,18 | 6,38±0,15* | 6,37±0,16* |
| Стафілокок | 1,8±0,39 | 1,89±0,41 | 2,09±0,39 | 2,32±0,32 |
| Стрептокок | 6,7±0,19 | 6,83±0,13 | 6,83±0,2 | 6,66±0,14 |
| Кишкова паличка | 7,4±0,14 | 7,35±0,14 | 7,5±0,16 | 7,33±0,13 |
| Кишкова паличка неферментуюча | 0,5±0,26 | 0,67±0,28 | 1,53±0,34* | 1,47±0,33* |
| Протей | 0,5±0,26 | 0,5±0,26 | 0,83±0,3 | 0,85±0,28 |
| Ентеробактер | 2,3±0,13 | 2,48±0,13 | 2,26±0,11 | 2,31±0,12 |
| Гриби роду Сandida | 0,8±0,30 | 0,78±0,34 | 1,28±0,34 | 1,29±0,29 |
Примітка. * – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) у порівнянні з відповідними показниками у чоловіків 45-54 років.
У чоловіків, у яких відзначалися порушення мікробного пейзажу шкіри, також спостерігалися порушення мікробного пейзажу слизової оболонки ротоглотки та кишечника. Нами була висунута гіпотеза про системність змін біотопів шкіри та внутрішніх органів. Для обґрунтування гіпотези розглянута парна кореляція кількості мікроорганізмів на шкірі, слизовій оболонці ротоглотки та у калі чоловіків різного віку. Встановлена кореляційна залежність між загальною кількістю бактерій на шкірі та кількістю біфідобактерій кишечника (r=-0,28), лактобактерій кишечника (r=-0,35), кишечної палички неферментуючої у калі (r=0,45), грибів роду Сandida у калі (r=0,37), інтегральним показником кількості умовно-патогенної флори ротоглотки (r=0,37), кількістю патогенних стафілококів на слизовій оболонці ротоглотки (r=0,34), грибів роду Сandida на слизовій оболонці ротоглотки (r=0,36). Встановлена кореляційна залежність між кількістю біфідобактерій кишечника та кількістю коагулазопозитивних стафілококів на шкірі (r=-0,48), кількістю лактобактерій кишечника (r=0,32), кишечної палички неферментуючої у калі (r=-0,46), грибів роду Сandida у калі (r=-0,47), інтегральним показником кількості умовно-патогенної флори ротоглотки (r=-0,46), кількістю патогенних стрептококів на слизовій оболонці ротоглотки (r=-0,33), патогенних стафілококів на слизовій оболонці ротоглотки (r=-0,30), грибів роду Сandida на слизовій оболонці ротоглотки (r=-0,34). Встановлена кореляційна залежність між кількістю лактобактерій кишечника та кількістю коагулазопозитивних стафілококів на шкірі (r=-0,58), кількістю стафілококів кишечника (r=-0,38), кишечної палички неферментуючої у калі (r=-0,42), грибів роду Сandida у калі (r=-0,33), інтегральним показником кількості умовно-патогенної флори ротоглотки (r=-0,64), кількістю патогенних стрептококів на слизовій оболонці ротоглотки (r=-0,29), патогенних стафілококів на слизовій оболонці ротоглотки (r=-0,36), гемофільних паличок на слизовій оболонці ротоглотки (r=-0,58), грибів роду Сandida на слизовій оболонці ротоглотки (r=-0,32). Визначена кореляційна залежність між інтегральним показником кількості умовно-патогенної флори ротоглотки та кількістю коагулазопозитивного стафілококу на шкірі (r=0,55), кількістю стафілококів кишечника (r=0,35), кишечної палички неферментуючої у калі (r=0,40), грибів роду Сandida у калі (r=0,49). Ці дані говорять про те, що збільшення обсіменіння шкіри, особливо патогенною або умовно-патогенною флорою, відбувається на фоні зростання кількості патогенної чи умовно-патогенної флори кишечника та слизової оболонки ротоглотки при одночасному зменшенні нормальної флори кишечника. Наявність чисельних кореляційних взаємозв’язків слабкої сили між кількістю мікрофлори різних біотопів свідчить про вірогідну поліфакторність причин змін мікрофлори. Вищенаведене підтверджує гіпотезу про системність змін мікрофлори у різних біотопах організму й обґрунтовує можливість корекції патологічних змін різноманітних біотопів за рахунок корекції одного з біотопів.
Для встановлення можливих патогенетичних змін гомеостазу організму, які відбуваються з віком у чоловіків, було проведено вивчення стану системи ПОЛ-АОС, осмотичної стійкості еритроцитів, рівнів середніх молекул, гормонального фону у осіб різних вікових груп.
У чоловіків 35-44-річного віку встановлене достовірне зменшення коефіцієнта антиокислювального захисту порівняно з особами віком 25-34 років (табл. 3.9). У чоловіків віком 45-54 років відзначалась достовірна різниця за рівнями КАОЗ та ТБК-АП не лише при порівнянні з групою чоловіків віком 25-34 років, але й з групою 35-44-річних осіб. Найбільші порушення у системі ПОЛ-АОС спостерігались серед групи чоловіків віком 55-64 років. У них встановлено найвищий рівень ТБК-АП і найменший КАОЗ, що свідчить про превалювання процесів активації ПОЛ у цієї групи чоловіків. Встановлена пряма кореляційна залежність між віком чоловіків і концентрацією ТБК-АП (r=0,83), загальною антиокислювальною активністю (АОА) (r=0,41) та зворотна – з коефіцієнтом антиокислювального захисту (r=-0,81), що чітко підтверджує наявність змін у системі ПОЛ-АОС у чоловіків у віковому аспекті.
Таблиця 3.9 – Стан системи ПОЛ-АОС у чоловіків різного віку (М±m)
| Вік чоловіків | ТБК-АП, ммоль/л | Загальна АОА, % | КАОЗ |
| 25-34 рр. | 2,7±0,02 | 65,3±0,56 | 24,6±0,27 |
| 35-44 рр. | 2,73±0,03 | 64,5±0,42 | 23,7±0,22* |
| 45-54 рр. | 2,91±0,03*l | 65,1±0,51 | 22,4±0,21*l |
| 55-64 рр. | 3,18±0,03*l◘ | 67,8±0,38*l◘ | 21,4±0,27*l◘ |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 45-54 років.
Для визначення функціонування системи ПОЛ-АОС був проведений добовий моніторинг її активності (рис. 3.1). Крива добових змін ТБК-АП представляла собою синусоїду з максимальним значенням у вечірній час і мінімальним – у ранковий. У чоловіків віком 35-44 років крива змін мала вигляд більш пологої синусоїди. У чоловіків віком понад 44 років (особливо якщо їх вік перевищував 54 роки) концентрація ТБК-АП протягом доби була постійно вищою, ніж у молодших чоловіків. Причому максимальне значення концентрації ТБК-АП, як і у молодших чоловіків, залишалось у вечірні часи, а мінімальне – у ранкові. Відмічалося підвищення середньодобового рівня ТБК-АП у чоловіків старшого віку. Вірогідно, з віком зменшуються коливання активності системи ПОЛ з тенденцією до підвищення її активності.
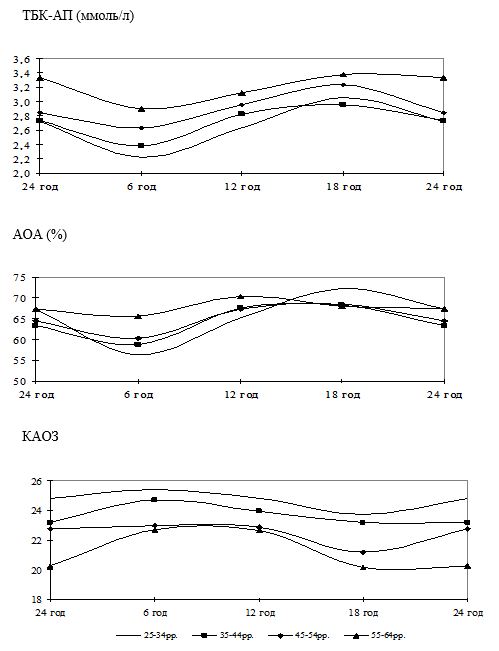
Рисунок 3.1 – Криві добових змін концентрацій ТБК-АП, АОА та КАОЗ у чоловіків різного віку
Крива добових змін загальної АОА у чоловіків 25-34 років мала вигляд синусоїди з максимальним значенням у вечірні та мінімальним значенням у ранкові години. У чоловіків 35-44 і 45-54 років загальна добова АОА майже не відрізнялась від значень, отриманих у чоловіків 25-34 років. Криві загальної АОА у чоловіків 35-44 і 45-54 років мали менші коливання, не забезпечувався адекватний антиокислювальний захист у вечірні години, коли була максимальною концентрація ТБК-АП (рис. 3.1). У чоловіків віком 55-64 років зникав синусоїдальний циркадний ритм значень загальної АОА.
Проведений розрахунок середніх добових коливань коефіцієнту антиокислювального захисту, який відображає співвідношення загальної АОА та концентрації ТБК-АП. У чоловіків 25-34-річного віку крива добового коливання КАОЗ наближалась до прямої лінії, що може свідчити про стабільні взаємовідносини у системі ПОЛ-АОС, система антиокислювального захисту адекватно реагувала на зміни в активації ПОЛ протягом доби (рис. 3.1). У чоловіків віком 35-44 і 45-54 років криві добового коливання КАОЗ знаходились нижче, ніж у чоловіків 25-34 річного віку. Це свідчить про менші можливості антиокислювального захисту у відповідь на активацію ПОЛ. Найнижчі значення добового коливання КАОЗ встановлені у групі чоловіків віком 55-64 років. Особливо низькі значення спостерігались у вечірній і нічний час, що підтверджує думку про виснаженість антиокислювального захисту в цей час доби та превалювання активації ПОЛ.
Активація ПОЛ призводить до порушення функціонування клітинних мембран. В якості моделі нами була вивчена осмотична стійкість еритроцитарних мембран у чоловіків різних вікових груп. Отримані дані показали, що при концентраціях розчинів NaCl 0,35 – 0,45 % відсоток гемолізу у чоловіків віком понад 44 роки був достовірно вищим, ніж у чоловіків віком 25-34 років (табл. 3.10). Відсоток гемолізу еритроцитів зростав зі збільшенням віку та був максимальним у чоловіків віком 55-64 років. У них спостерігалась достовірна різниця за відсотком гемолізу еритроцитів у розчинах NaCl 0,3-0,45 % при порівнянні не лише з групами чоловіків віком 25-44 років, а й з чоловіками віком 45-54 років. Була встановлена пряма кореляційна залежність між віком чоловіків і відсотком гемолізу еритроцитів у розчинах NaCl 0,35-0,45 % (r=0,74-0,54). Це свідчить про зменшення з віком стійкості еритроцитарних мембран, а відтак можна говорити і про порушення стійкості та функціонування інших клітин організму у чоловіків зі збільшенням віку.
Таблиця 3.10 – Осмотична стійкість еритроцитів і концентрація середніх молекул у чоловіків різних вікових груп (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||||
| 25-34 рр. | 35-44 рр. | 45-54 рр. | 55-64 рр. | ||
| Розчин NaCl, % | 0,5 | 1,7±0,23 | 2,1±0,17 | 2,23±0,24 | 2,39±0,19* |
| 0,45 | 21,2±0,59 | 22,4±0,48 | 25,6±0,5*l | 30,4±0,58*l◘ | |
| 0,4 | 66,5±0,63 | 68,3±0,82 | 70,3±0,77* | 74,3±0,58*l◘ | |
| 0,35 | 93,0±0,40 | 93,2±0,4 | 94,4±0,45* | 96,3±0,29*l◘ | |
| 0,3 | 97,0±0,29 | 97,0±0,28 | 97,5±0,31 | 98,2±0,15*l◘ | |
| СМ1, у. о. | 0,319±0,01 | 0,338±0,004 | 0,352±0,005*l | 0,370±0,006*l◘ | |
| СМ2, у. о. | 0,137±0,004 | 0,147±0,004 | 0,171±0,005*l | 0,183±0,005*l | |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 45-54 років.
Активація ПОЛ, порушення функціонування клітинних мембран призводять до змін метаболізму як окремих клітин, так і організму в цілому. Порушення обміну речовин спричиняє підвищення рівня ендогенної інтоксикації, що визначається концентрацією середніх молекул. Проведені дослідження показали, що у чоловіків зі збільшенням віку зростала концентрація середніх молекул, що свідчить про збільшення ендотоксикозу (табл. 3.10). У чоловіків віком понад 44 роки відзначалася достовірна різниця за рівнем СМ1 і СМ2 порівняно з групами чоловіків віком 25-34 і 35-44 років. Крім того, у чоловіків віком 55-64 років встановлена достовірна різниця за рівнем СМ1 порівняно з особами віком 45-54 років. Був визначений прямий кореляційний зв’язок середньої сили між віком чоловіків і концентрацією СМ1 (r=0,62), СМ2 (r=0,61).
Важливим питанням є з’ясування характеру взаємозв’язку між симпатоадреналовою та вагоінсулярною системами, яким відводиться значна роль як у забезпеченні захисно-пристосовних реакцій організму у випадку дії на організм надзвичайних подразників, так і у здійсненні адаптаційно-трофічних процесів у тканинах органів, які піддалися агресії. Екскреція катехоламінів з сечею, концентрація кортизолу й інсуліну у крові чоловіків різних вікових груп представлені в табл. 3.11, а співвідношення гормонів і медіаторів – на рис. 3.2.
У чоловіків 35-44 років більшість показників концентрації гормонів, медіаторів і їх співвідношення майже не відрізнялись від результатів, отриманих у чоловіків 25-34-річного віку (табл. 3.11, рис. 3.2). У чоловіків 45-54-річного віку екскреція адреналіну, норадреналіну, дофаміну та ДОФА з добовою сечею була достовірно вищою, ніж у чоловіків 25-34 і 35-44 років. У чоловіків 45-54-річного віку відзначалося зменшене співвідношення А:НА, ДА:Д і збільшене – НА:ДА (рис. 3.2).
Отримані дані свідчать про наявність у чоловіків віком 45-54 років тенденції до гальмування біосинтезу катехоламінів на етапі ДОФА-дофамін і про прискорення перетворення дофаміну у норадреналін, що можливо пов’язано зі зниженням у них активності ферменту ДОФА-декарбоксилази, а також незначну тенденцію до збільшення активності дофамін-ß-оксидази. Коефіцієнт ДОФА/ДА+НА+А був вищим у чоловіків віком 45-54 років у порівнянні з чоловіками віком 25-34 і 35-44 років.
У чоловіків 55-64-річного віку виявлені ще вищі концентрації катехоламінів і більш виражені зміни їх співвідношення, ніж у чоловіків віком 45-54 років, що свідчить про їх знижену стресостійкість.
Таблиця 3.11 – Екскреція катехоламінів з сечею, концентрація кортизолу й інсуліну в крові у чоловіків різних вікових груп (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | |||
| 25-34 рр. | 35-44 рр. | 45-54 рр. | 55-64 рр. | |
| Адреналін, нмоль/добу | 35,4±0,53 | 36±0,46 | 40,3±0,61*l | 30,6±0,45*l◘ |
| Норадреналін, нмоль/добу | 79,4±0,52 | 85,2±0,52* | 99,6±0,87*l | 84,5±0,62*l◘ |
| Дофамін, нмоль/добу | 1665,6±16,75 | 1691±18,1 | 1775±18,2*l | 1466±15,4*l◘ |
| ДОФА, нмоль/добу | 278±1,41 | 272±1,89* | 309±2,06*l | 333±2,31*l◘ |
| Кортизол, нмоль/л | 6,9±0,03 | 6,94±0,03 | 7,57±0,02*l | 6,76±0,02*l◘ |
| Інсулін, мкМО/мл | 6,9±0,03 | 6,94±0,03 | 7,57±0,02*l | 6,76±0,02*l◘ |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 45-54 років.
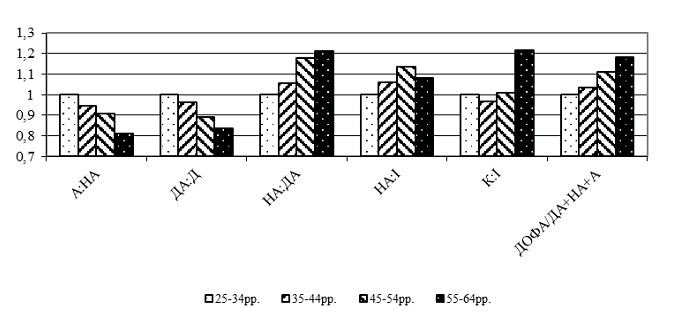
Рисунок 3.2 – Співвідношення гормонів і медіаторів у чоловіків різних вікових груп (результати, отримані у осіб віком 25-34 років, прийняті за 1).
Рівень кортизолу в крові у чоловіків 45-54-річного віку достовірно перевищував значення, отримані у чоловіків віком 25-34 і 35-44 років. Аналогічна тенденція відмічалась у них і за вмістом інсуліну. Коефіцієнт К/І, що є найбільш об’єктивним критерієм тяжкості пошкоджуючої дії стресора й активності компенсаторних процесів, які розвиваються у відповідь на пошкодження, у чоловіків 45-54-річного віку був таким, як і у чоловіків віком 25-34 і 35-44 років.
У чоловіків 55-64-річного віку на фоні подальшого підвищення рівня кортизолу відбувалося зниження рівня інсуліну. Це говорить про неадекватну реакцію організму на збільшений у цьому віці рівень глюкози у крові та вірогідну виснаженість можливостей підшлункової залози. Коефіцієнт К/І у чоловіків 55-64-річного віку був вищим, ніж у чоловіків 25-54 років.
Нами також були проведені дослідження щодо оцінки концентрації статевих і гонадотропних гормонів, ТЗГ у чоловіків різних вікових груп. Отримані результати наведені в табл. 3.12. Як видно з табл. 3.12, зі збільшенням віку чоловіків спостерігалось достовірне зменшення рівня тестостерону. Крім того, у чоловіків 45-54 років встановлена достовірно вища концентрація гонадотропних гормонів – ФСГ, ЛГ, пролактину та ТЗГ порівняно з показниками у чоловіків 35-44 років. Достовірна різниця за аналогічними показниками встановлена і між групами чоловіків 45-54 і 55-64 років. Причому вищі рівні ФСГ, ЛГ, пролактину та ТЗГ відзначались у групі 55-64-річних осіб. Був встановлений зворотній кореляційний зв’язок між віком чоловіків і концентрацією тестостерону (r=-0,60), прямий кореляційний зв’язок сильного ступеня – з концентрацією ТЗГ (r=0,80), ФСГ – (r=0,82), ЛГ (r=0,86), пролактину (r=0,77). Отже, аналіз результатів проведених досліджень показав формування вікового дисгормонального стану у чоловіків, починаючи з 45-річного віку. У чоловіків віком 55-64 років відзначався виражений дисгормональний стан, який потребував проведення відповідної корекції.
Таблиця 3.12 – Концентрація гонадотропних і статевих гормонів, ТЗГ та бальна оцінка за шкалою AMS у чоловіків різних вікових груп (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | |||
| 25-34 рр. | 35-44 рр. | 45-54 рр. | 55-64 рр. | |
| Тестостерон, нмоль/л | 18,6±0,63 | 18,2±0,6 | 15,7±0,58*l | 13,5±0,41*l◘ |
| ТЗГ, нмоль/л | 32,3±0,40 | 33,4±0,45 | 37,5±0,45*l | 50,9±0,73*l◘ |
| ФСГ, МО/л | 3,1±0,03 | 3,08±0,04 | 3,56±0,03*l | 4,54±0,04*l◘ |
| ЛГ, ОД/л | 3,0±0,03 | 3,19±0,05* | 3,53±0,03*l | 3,9±0,03*l◘ |
| ПРЛ, mMe/l | 221,5±1,75 | 221±2,0 | 242±2,52*l | 284±3,45*l◘ |
| Оцінка за шкалою AMS, бали | 24,6±0,40 | 26,6±0,29* | 28,3±0,37*l | 30,9±0,39*l◘ |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 45-54 років.
Починаючи з 35-річного віку у чоловіків відзначалася достовірна різниця за бальною оцінкою за шкалою AMS порівняно з особами віком 25-34 років, що є свідченням початку формування андрогенного дефіциту та старіння чоловіків. З віком спостерігалося поступове зростання андрогенного дефіциту, що проявлялося збільшенням бальної оцінки за шкалою AMS (максимальні її значення встановлені у групі чоловіків віком 55-64 років). Встановлений кореляційний зв’язок між віком чоловіків і бальною оцінкою за шкалою AMS (r=0,50).
У групі чоловіків віком 35-44 років відзначалися достовірно вищі рівні холестерину, β-ліпопротеїдів і тригліцеридів порівняно з особами віком 25-34 років (табл. 3.13). Між групами чоловіків віком 45-54 і 35-44 років також отримана достовірна різниця за рівнями холестерину, β-ліпопротеїдів, тригліцеридів і глюкози. Достовірно найвищі рівні холестерину, тригліцеридів, β-ліпопротеїдів і глюкози відзначались у осіб 55-64 років.
Таблиця 3.13 – Концентрація ліпідів і глюкози у крові чоловіків різного віку (М±m)
| Вік чоловіків | Холестерин, ммоль/л | β-ліпопротеїди, % | Тригліцериди, ммоль/л | Глюкоза, ммоль/л |
| 25-34 років | 3,36±0,02 | 33,9±0,49 | 1,16±0,04 | 4,71±0,07 |
| 35-44 років | 3,63±0,03* | 41,4±0,36* | 1,31±0,04* | 4,83±0,06 |
| 45-54 років | 4,35±0,02*l | 46,7±0,43*l | 1,58±0,04*l | 5,15±0,08*l |
| 55-64 років | 4,83±0,03*l◘ | 50,6±0,62*l◘ | 2,06±0,04*l◘ | 5,43±0,06*l◘ |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 25-34 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 35-44 років; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків 45-54 років.
Підсумовуючи наведені у розділі результати проведених досліджень, слід відзначити зростання бальної оцінки стану фотозахищених ділянок шкіри за шкалою Yolanda R. Helfrich et al. у 46,3 рази, загальної кількості сенільних ангіом, лентиго, кератом, вогнищ гіпомеланозу, телеангіектазій у 13,3 рази, зменшення максимальної швидкості кровотоку у шкірі на 11 %, середньої швидкості кровотоку у шкірі на 12 %, збільшення індексів пульс-активності на 16 % та резистентності – на 16 %, порушень мікроциркуляції у 2,6 рази, зниження кількості функціонуючих капілярів на 1 мм3 у 1,4 рази, зростання загальної кількості бактерій на шкірі з (3,0±0,16) до (3,7±0,14) Lg КУО/см2 та кількості коагулазопозитивних стафілококів на шкірі з (0,2±0,17) до (1,27±0,33) Lg КУО/см2 у чоловіків 55-64-річного віку порівняно з чоловіками віком 25-34 років.
Для визначення взаємозв’язку між станом шкірного покрову та гомеостазом організму у чоловіків різного віку нами були розраховані коефіцієнти парної кореляції (табл. 3.14). Був встановлений взаємозв’язок між показниками, що характеризують стан шкіри та гомеостазу організму. Стан шкірного покрову був гіршим при порушенні кровообігу у судинах шкіри, підвищенні активності перекисного окислення ліпідів, зменшенні коефіцієнту антиокислювального захисту, підвищенні концентрації середніх молекул, порушеннях синтезу та трансформації гормонів і медіаторів симпатоадреналової та вагоінсулярної системи, зниженні концентрації тестостерону, підвищенні концентрації ТЗГ, ФСГ, ЛГ, пролактину, збільшенні концентрації холестерину, β-ліпопротеїдів, тригліцеридів, глюкози. Таким чином, нами були встановлені патогенетичні зміни гомеостазу, які негативно впливають на стан шкіри чоловіків. Їх корекція сприятиме покращенню стану шкірного покрову чоловіків різних вікових груп і буде одним з запобіжних заходів виникнення хронічних дерматозів.
Таблиця 3.14 – Коефіцієнти парної кореляції основних показників стану шкіри та гомеостазу організму чоловіків
| Показники гомеостазу | Сухість шкіри, бали | Порушення тургору шкіри, бали | Кількість зморшок (4см2х3) | Оцінка вираженості зморшок, бали | Оцінка за Yolanda R. Helfrich et. al. | Кількість елементів – маркерів старіння |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Максимальна швидкість, см/с | -0,30 | -0,43 | -0,64 | -0,60 | -0,56 | -0,54 |
| Середня швидкість, см/с | -0,36 | -0,48 | -0,58 | -0,60 | -0,54 | -0,56 |
| Індекс пульс-активності, у. о. | 0,34 | 0,43 | 0,60 | 0,59 | 0,56 | 0,58 |
| Індекс резистентності, у. о. | 0,35 | 0,47 | 0,64 | 0,62 | 0,61 | 0,63 |
| Кількість функціонуючих капілярів на 1мм3 | -0,28 | -0,68 | -0,68 | -0,63 | -0,68 | -0,60 |
| ТБК-АП, ммоль/л | 0,52 | 0,69 | 0,81 | 0,72 | 0,75 | 0,77 |
| Загальна АОА, % | 0,35 | 0,26 | 0,43 | 0,28 | 0,36 | 0,47 |
Продовження таблиці 3.14
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| СМ1, у. о. | 0,29 | 0,58 | 0,58 | 0,60 | 0,57 | 0,57 |
| СМ2, у. о. | 0,25 | 0,49 | 0,57 | 0,52 | 0,57 | 0,50 |
| КАОЗ | -0,46 | -0,70 | -0,77 | -0,73 | -0,73 | -0,70 |
| Норадреналін, нмоль/добу | 0,18 | 0,33 | 0,48 | 0,46 | 0,38 | 0,30 |
| ДОФА, нмоль/добу | 0,19 | 0,38 | 0,48 | 0,46 | 0,38 | 0,25 |
| Кортизол, нмоль/л | 0,47 | 0,64 | 0,81 | 0,69 | 0,77 | 0,66 |
| Коефіцієнти:
А/НА |
-0,29 | -0,61 | -0,56 | -0,60 | -0,65 | -0,54 |
| ДА/Д | -0,39 | -0,60 | -0,63 | -0,62 | -0,66 | -0,55 |
| НА/ДА | 0,38 | 0,56 | 0,66 | 0,65 | 0,67 | 0,60 |
| НА/І | 0,20 | 0,46 | 0,53 | 0,52 | 0,48 | 0,41 |
| К/І | 0,38 | 0,53 | 0,61 | 0,50 | 0,64 | 0,57 |
| ДОФА/ДА+НА+А | 0,40 | 0,61 | 0,63 | 0,62 | 0,67 | 0,56 |
| Тестостерон, нмоль/л | -0,31 | -0,57 | -0,51 | -0,49 | -0,55 | -0,46 |
| ТЗГ, нмоль/л | 0,36 | 0,65 | 0,71 | 0,63 | 0,76 | 0,67 |
| ФСГ, МЕ/л | 0,42 | 0,63 | 0,74 | 0,67 | 0,76 | 0,72 |
| ЛГ, ЕД/л | 0,40 | 0,71 | 0,77 | 0,70 | 0,75 | 0,67 |
| ПРЛ, mMe/l | 0,31 | 0,57 | 0,69 | 0,60 | 0,67 | 0,63 |
| Холестерин, ммоль/л | 0,43 | 0,72 | 0,88 | 0,78 | 0.83 | 0,73 |
| β-ліпопротеїди, % | 0,33 | 0,72 | 0,77 | 0,74 | 0,78 | 0,66 |
| Тригліцериди, ммоль/л | 0,40 | 0,64 | 0,72 | 0,65 | 0,73 | 0,73 |
| Глюкоза, ммоль/л | 0,32 | 0,52 | 0,60 | 0,56 | 0,58 | 0,55 |
| Бальна оцінка за шкалою AMS | 0,30 | 0,45 | 0,45 | 0,48 | 0,48 | 0,36 |
* * *
Таким чином, результати аналізу отриманих даних свідчать про те, що порушення стану шкіри у чоловіків відбуваються на фоні вікового дисгормонального стану, який формується починаючи з 45-річного віку та проявляється зменшенням концентрації тестостерону на 18 %, збільшенням концентрації ФСГ на 15 %, ЛГ – на 18 %, ТЗГ – на 16 % у осіб віком 45-54 років порівняно з чоловіками 25-34-річного віку. Крім того, вікові зміни шкіри у чоловіків 45-54-річного віку виникають на фоні субкомпенсованих порушень функціонального стану симпатоадреналової та вагоінсулярної систем, що проявляються синергічним підвищенням активності симпатичного та парасимпатичного відділів вегетативної нервової системи, перевищенням напруження нервової ланки симпатоадреналової системи над напругою глюкокортикоїдної функції надниркових залоз. Був виявлений взаємозв’язок між функціонуванням системи ПОЛ-АОС та віковими змінами стану шкірного покрову у чоловіків. Встановлено, що з віком зменшується вираженість добових коливань рівня ТБК-АП і загальної АОА, спостерігається десинхронізація ритмів у вечірні години, що може призводити до виснаження АОС у чоловіків віком 55-64 років. Отже, отримані дані говорять про наявність змін гомеостазу, що відбуваються у чоловіків зі збільшенням віку та можуть бути чинниками виникнення, розвитку, хронізації та постійних загострень дерматологічних захворювань.
Наведені дані щодо стану шкіри, особливостей психологічного статусу, кровообігу та гомеостазу у чоловіків різних вікових груп свідчать про необхідність проведення профілактичних заходів, які будуть сприяти покращенню їх здоров’я, якості життя та попереджати виникнення та прогресування хронічних дерматозів.
Результати, отримані при проведенні дослідження, наведені в розділі 3, опубліковані в наступних друкованих працях:
1. Резніченко Н. Ю. Діагностика, лікування та профілактика псоріатичної хвороби у чоловіків у віковому аспекті / Н. Ю. Резніченко. – Запоріжжя : Просвіта, 2014. – 308 с.
2. Резніченко Н. Ю. Шляхи корекції змін концентрації статевих гормонів у чоловіків старшої вікової групи, хворих на псоріаз / Н. Ю. Резніченко // Медико-соціальні проблеми сім’ї. – 2013. – Т. 18, № 2. – С. 106–110.
3. Дюдюн А. Д. Особливості гормонального статусу у чоловіків різних вікових груп і можливості їх корекції / А. Д. Дюдюн, Н. Ю. Резніченко // Урологія. – 2014. – Т. 18, № 3 (70). – С. 12–16.
4. Резніченко Н. Ю. Зміни метаболізму у чоловіків різного віку та шляхи їх корекції / Н. Ю. Резніченко // Здоровье мужчины. – 2014. – № 1 (48). – С. 12–17.
5. Резніченко Н. Ю. Динаміка змін системи ПОЛ-АОС, осмотичної стійкості еритроцитарних мембран і ендотоксикозу у чоловіків різного віку / Н. Ю. Резніченко // Укр. мед. альманах. – 2013. – Т. 16, № 2. – С. 74–77.
6. Резніченко Н. Ю. Особливості зміни показників функціонування симпато-адреналової та ваго-інсулярної систем у чоловіків різного віку / Н. Ю. Резніченко // Львівський мед. часопис. – 2013. – Т. XIX, № 4. – С. 38–43.
7. Резниченко Н. Ю. Особенности состояния кожи и гомеостаза у мужчин разных возрастных групп / Н. Ю. Резниченко // Медицина. – 2014. – № 4 (87). – С. 7–11.
8. Резниченко Н. Ю. Ультразвуковые характеристики возрастных изменений кожи у мужчин и возможности их коррекции / Н. Ю. Резниченко // Медицина. – 2015. – № 2 (89). – С. 31–34.
9. Резніченко Н. Ю. Вікові зміни шарів шкіри та кровоплину в ній у чоловіків різного віку / Н. Ю. Резніченко // Проблемы старения и долголетия. – 2013. – Т. 22, № 3. –С.268–273.
10. Резниченко Н. Ю. Изменения кровотока кожи лица мужчин разного возраста и его коррекция / Н. Ю. Резниченко // Второй съезд Украинского общества эстетической медицины с участием международных делегаций, посвященный пятилетию УОЭМ : материалы науч.-практ. конф., г. Одесса, 29–31 мая 2014 г. – Одесса, 2014. – С. 59.
Розділ 4
Вплив соціально-побутових і психогенних чинників
на стан шкіри та гомеостаз організму у чоловіків
Після розгляду вікових особливостей шкіри, гомеостазу організму, ментальних і психологічних характеристик чоловіків різних вікових груп нами був проведений аналіз можливих факторів впливу на стан здоров’я чоловіків у цілому та шкірного покрову зокрема.
Для виявлення найбільш розповсюджених і значимих несприятливих факторів нами був проведений аналіз впливу різних тригерів на стан шкіри та гомеостаз організму у 447 умовно здорових чоловіків без ознак дерматологічної патології у віці від 25 до 64 років, які проживали у м. Запоріжжі та працювали у приватному акціонерному товаристві «Запорізький автомобілебудівний завод». Враховуючи виявлені у цих чоловіків вікові особливості шкіри та гомеостазу організму (розділ 3), аналіз проводився в кожній віковій групі окремо. Наявність незначних патологічних змін у чоловіків віком 25-44 років не дозволила отримати переконливих статистичних даних щодо впливу несприятливих керованих факторів на стан шкіри та гомеостаз організму у даній віковій групі. Тому в подальшому у розділі наведені дані аналізу впливу факторів у 112 чоловіків віком 45-54 років і 85 чоловіків віком 55-64 років.
Нашу увагу привернула низка найбільш поширених керованих чинників в умовах великого промислового міста, які могли сприяли погіршенню стану шкіри у чоловіків. При цьому на перший план виступали такі фактори, як тютюнопаління, часте вживання алкоголю, нераціональне харчування (у першу чергу, недостатнє використання у їжу овочів і фруктів, кисломолочних продуктів), відсутність піклування про своє здоров’я, несприятливий психологічний стан (який проявлявся зростанням ситуативної тривожності). Можливість впливу даних факторів на стан шкіри та загальний стан здоров’я чоловіків розглянута нами у наступних підрозділах (4.1-4.7).
Для встановлення впливу проживання у великому індустріальному місті на стан здоров’я чоловіків у цілому та шкірного покрову зокрема нами була вивчена захворюваність на дерматологічну патологію серед мешканців великого промислового міста – Запоріжжя та міста меншої величини – Мелітополя з нижчим рівнем забруднення оточуючого середовища. Нами були обстежені 452 чоловіки віком 35-54 років: з них 240 осіб проживали у м. Запоріжжі та 212 – у м. Мелітополі. Умови праці чоловіків у м. Запоріжжі та м. Мелітополі загалом не відрізнялись, вони працювали на різних філіях одного підприємства. Результати дослідження наведені у підрозділі 4.8.
4.1 Вплив тютюнопаління на стан шкіри та загальний стан здоров’я чоловіків
Шляхом анкетування було встановлено, що 43,8 % опитаних чоловіків у віці 45-54 років палили тютюн, а у віці 55-64 років – 43,5 % осіб. Таким чином, тютюнопаління можна вважати розповсюдженою серед чоловічого населення шкідливою звичкою. Тому нами був проведений аналіз стану шкіри та основних параметрів гомеостазу організму у чоловіків у залежності від наявності у них цієї звички.
У всіх обстежених чоловіків проводили клінічну оцінку стану шкіри, результати якої наведені в табл. 4.1. У чоловіків, які палили тютюн, віком як 45-54, так і 55-64 років були вищими бальні оцінки сухості, порушень тургору шкіри, оцінка вираженості зморшок, оцінка стану шкіри за шкалою Yolanda R. Helfrich et. al. у порівнянні з групою чоловіків аналогічного віку, які не палили тютюн (табл. 4.1). Кількість елементів – маркерів старіння була достовірно вищою у чоловіків різних вікових груп, які палили тютюн.
Більш виражені зміни шкірного покрову відзначались у курців тютюну віком 55-64 років. Чоловіки, які палили тютюн, віком 55-64 років мали достовірно більші сухість і порушення тургору шкіри порівняно з чоловіками аналогічного віку, які не палили. Крім того, у курців тютюну віком 55-64 років відзначалась достовірно більша кількість зморшок на шкірі обличчя та їх вираженість порівняно з чоловіками, які не палили. Важливим доказом згубного впливу тютюнопаління на стан шкірного покрову була достовірно вища бальна оцінка стану фотозахищених ділянок шкіри за шкалою Yolanda R. Helfrich et. al. у курців тютюну 54-64-річного віку порівняно з особами, які не палили. Крім того, курці тютюну 55-64-річного віку мали достовірно більшу кількість елементів висипки – маркерів старіння, що також є свідченням негативного впливу тютюнопаління на стан шкіри.
Таблиця 4.1 – Клінічні показники стану шкіри у чоловіків, які палили та не палили тютюн (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| не палили тютюн | палили тютюн | не палили тютюн | палили тютюн | |
| Сухість шкіри, бали | 0,458±0,099 | 0,946±0,128* | 0,222±0,073 | 0,429±0,101 |
| Порушення тургору шкіри, бали | 1,42±0,072 | 1,78±0,069* | 1,11±0,04 | 1,22±0,06 |
| Оцінка шкіри за шкалою Yolanda R. Helfrich et. al. | 4,29±0,14 | 4,87±0,16* | 2,86±0,12 | 3,37±0,16* |
| Кількість зморшок шкіри (4 см2х3) | 11,98±0,29 | 13,54±0,29* | 10,63±0,29 | 11,65±0,35* |
| Вираженість зморшок шкіри, бали | 28,54±0,86 | 33,22±0,81* | 21,76±0,80 | 24,39±0,91* |
| Кількість елементів – маркерів старіння | 54,85±4,68 | 75,54±6,85* | 36,73±2,73 | 58,22±4,57* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, які палили та не палили тютюн.
Таким чином, результати обстеження чоловіків свідчать про те, що у курців тютюну віком 45-54 років існують тенденції щодо погіршення стану шкірного покрову порівняно з особами, які не палять. Виражені патологічні зміни шкіри настають у кірців тютюну віком 55-64 років, що, з одного боку, пов’язане з більшим стажем тютюнопаління, а з іншого боку – з віковими змінами організму людини та нашаровуванням інших тригерних факторів.
Визначивши клінічні особливості шкіри у курців тютюну та чоловіків, які не мали цієї згубної звички, ми провели аналіз результатів ультразвукового дослідження, які надані на табл. 4.2. У чоловіків, які палили тютюн, відзначалось зменшення як загальної товщини шкіри, так і її шарів. Між групами чоловіків, які палили та не палили тютюн, віком 55-64 років отримана достовірна різниця за товщиною дерми, а також епідермісу та дерми загалом. Витончення даних шарів шкіри є не лише маркером старіння організму, але й важливим патогенетичним чинником у виникненні та хронізації певних дерматозів.
Таблиця 4.2 – Середні значення товщини шарів шкіри у чоловіків, які палили та не палили тютюн (мм) (М±m)
| Товщина: | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| не палили тютюн | палили тютюн | не палили тютюн | палили тютюн | |
| епідермісу | 0,120±0,002 | 0,113±0,005 | 0,127±0,003 | 0,117±0,003* |
| дерми | 1,483±0,014 | 1,393±0,028* | 1,570±0,02 | 1,527±0,027 |
| дерми +епідермісу | 1,603±0,014 | 1,506±0,03* | 1,696±0,022 | 1,644±0,03 |
| ПЖК | 0,975±0,026 | 0,973±0,015 | 0,998±0,028 | 0,971±0,024 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, які палили та не палили тютюн.
При розгляді кровоплину у шкірі чоловіків, які палили тютюн віком 45-64 років, встановлено достовірно нижчу середню швидкість кровотоку, достовірно більші значення пульс-активності та резистентності порівняно з особами, які не палили (табл. 4.3). Збільшення індексів свідчить про зменшення еластичності судин у курців тютюну.
Про погіршення кровоплину у шкірі курців тютюну свідчать і результати біомікроскопічних досліджень судин нігтьового ложа (табл. 4.3). У чоловіків, які палили тютюн, відзначалось достовірне зменшення кількості функціонуючих капілярів порівняно з особами без цієї шкідливої звички. Крім того, у групі курців тютюну віком 45-54 років встановлене достовірне збільшення відсотку порушень мікроциркуляції та відсотку її судинних порушень. У курців тютюну віком 55-64 років також був збільшеним відсоток порушень мікроциркуляції, причому збільшувалась частота судинних, внутрішньосудинних і позасудинних змін. У чоловіків, які палили тютюн, відзначався також підвищений артеріальний тиск (табл. 4.3).
Таблиця 4.3 – Характеристика кровоплину у шкірі та артеріального тиску у чоловіків, які палили та не палили тютюн
| Показники, одиниці вимірювання | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| не палили тютюн | палили тютюн | не палили тютюн | палили тютюн | |
| Середня швидкість, см/с (М±m) | 3,30±0,054 | 3,10±0,025* | 3,59±0,052 | 3,44±0,032* |
| Індекс пульс-активності, у. о. (М±m) | 1,75±0,044 | 1,92±0,025* | 1,63±0,029 | 1,75±0,034* |
| Індекс резистентності, у. о. (М±m) | 1,05±0,027 | 1,17±0,032* | 0,96±0,025 | 1,09±0,019* |
| Кількість функціонуючих капілярів на 1 мм3 (М±m) | 32,2±0,75 | 28,2±0,69* | 35,7±0,59 | 32,2±0,71* |
| Наявність порушень мікроциркуляції, % | 62,5 | 72,2 | 29,4 | 92,3* |
| Судинні порушення, % | 43,8 | 61,1 | 17,6 | 53,8* |
| САТ, мм рт. ст. (М±m) | 130,8±1,33 | 139,1±1,42* | 127,8±1,31 | 130,6±1,301 |
| ДАТ, мм рт. ст. (М±m) | 81,4±0,88 | 87,0±1,05* | 81,3±0,97 | 83,0±1,09 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, які палили та не палили тютюн.
Таким чином, результати проведеного дослідження свідчать про витончення різних шарів шкіри, погіршення мікроциркуляції та кровоплину у шкірі чоловіків, які палили тютюн.
У результаті проведених нами досліджень мікробіоценозу було встановлено формування дисбіотичного стану у курців тютюну. Так, при дослідженні мікробіоценозу ротоглотки у курців встановлено достовірно вищу кількість патогенних стрептококів і достовірно вищий інтегральний показник кількості умовно-патогенної флори порівняно з особами, які не палили тютюн. Кількість патогенного стрептококу у курців тютюну віком 45-54 років становила (3,68±0,24) Lg КУО/мл проти (1,84±0,54) Lg КУО/мл у осіб, які не палили; у курців тютюну віком 55-64 років – (3,91±0,19) Lg КУО/мл проти (2,18±0,48) Lg КУО/мл у чоловіків, які не палили. Інтегральний показник кількості умовно-патогенної флори у курців тютюну віком 45-54 років становив (12,20±1,18) Lg КУО/мл проти (7,13±1,81) Lg КУО/мл у осіб, які не палили; у курців тютюну віком 55-64 років – (14,57±1,45) Lg КУО/мл проти (8,06±0,89) Lg КУО/мл у чоловіків, які не палили. Відомо, що присутність великої кількості патогенного стрептококу та інших умовно-патогенних мікроорганізмів у ротоглотці сприяє розвитку дерматозів.
Крім того, у курців тютюну спостерігалася достовірно нижча кількість лактобактерій при дослідженні мікробіоценозу кишечника порівняно з особами, які не палили: у курців тютюну віком 45-54 років – (5,85±0,09) Lg КУО/г проти (6,64±0,15) Lg КУО/г у осіб, які не палили; у курців тютюну віком 55-64 років – (6,01±0,13) Lg КУО/г проти (6,68±0,24) Lg КУО/г. У курців віком 55-64 років встановлена достовірна різниця і за кількістю біфідобактерій при дослідженні мікробіоценозу кишечника порівняно з особами, які не палили [(7,77±0,23) Lg КУО/г проти (8,68±0,15) Lg КУО/г]. Крім того, у курців тютюну була наявною тенденція до збільшення кількості грибів роду Candida при бактеріологічному дослідженні кала. Отже, у курців тютюну відзначались системні порушення мікробіоценозу.
У чоловіків, які палили тютюн, у результаті проведеного дослідження також були встановлені зміни гомеостазу організму. Перш за все, вони стосувались стану системи ПОЛ-АОС. Як видно з табл. 4.4, у чоловіків 45-54-річного віку, які палили тютюн, мала місце тенденція до збільшення кількості ТБК-АП на фоні майже незмінної загальної АОА. Це призводило до достовірного зниження коефіцієнту антиокислювального захисту у курців тютюну віком 45-54 років порівняно з чоловіками аналогічного віку, які не палили. У курців тютюну віком 55-64 років встановлені ще більш виражені зміни у функціонуванні системи ПОЛ-АОС: достовірна різниця між групами осіб, які палили та не палили тютюн, встановлена не лише за коефіцієнтом антиокислювального захисту, але й за рівнем ТБК-АП. Це свідчить про превалювання активації ПОЛ у курців тютюну.
Таблиця 4.4 – Стан системи ПОЛ-АОС і рівні середніх молекул у чоловіків, які палили та не палили тютюн (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| не палили тютюн | палили тютюн | не палили тютюн | палили тютюн | |
| ТБК-АП, ммоль/л | 3,12±0,048 | 3,25±0,033* | 2,89±0,033 | 2,96±0,059 |
| Загальна АОА, % | 68,47±0,397 | 67,14±0,596 | 65,62±0,667 | 64,19±0,572 |
| КАОЗ | 21,97±0,32 | 20,65±0,29* | 22,69±0,22 | 21,73±0,26* |
| СМ1, у. о. | 0,359±0,006 | 0,381±0,009* | 0,346±0,007 | 0,36±0,006 |
| СМ2, у. о. | 0,169±0,006 | 0,198±0,006* | 0,17±0,008 | 0,173±0,008 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, які палили та не палили тютюн.
При вивченні осмотичної стійкості еритроцитарних мембран також були встановлені відмінності між групою курців тютюну і особами, які не мали цієї шкідливої звички. Встановлена достовірна різниця за відсотком гемолізу у 0,45 % розчині NaCl у курців тютюну віком 55-64 років (31,91±0,60) порівняно з чоловіками, які не палили (29,08±0,81). Збільшення гемолізу у курців тютюну говорить про порушення структурно-функціонального стану мембран клітин організму.
Проведені дослідження показали, що у курців тютюну віком 55-64 років рівень середніх молекул у сироватці крові був достовірно вищим, ніж у чоловіків аналогічного віку, які не палили (табл. 4.4), що говорить про підвищений рівень ендотоксикозу у курців тютюну.
Був проведений аналіз рівнів статевих і гонадотропних гормонів, ТЗГ, а також симптомів старіння та андрогенного дефіциту за шкалою AMS у чоловіків у залежності від паління ними тютюну (табл. 4.5). У чоловіків, які палили тютюн, спостерігалось зменшення рівня тестостерону. За його концентрацією у чоловіків, які палили та не палили тютюн віком 55-64 років, отримана достовірна різниця. Крім того, у курців тютюну віком 55-64 років відзначалась достовірно вища концентрація ЛГ та ТЗГ у порівнянні з показниками у чоловіків аналогічного віку, які не палили. Бальна оцінка за шкалою AMS була достовірно вищою у курців тютюну порівняно з особами, які не палили, що є свідченням більш вираженого у курців тютюну андрогенного дефіциту та старіння чоловіків.
Таблиця 4.5 – Концентрація гонадотропних і статевих гормонів, ТЗГ і бальна оцінка за шкалою AMS у чоловіків, які палили та не палили тютюн (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| не палили тютюн | палили тютюн | не палили тютюн | палили тютюн | |
| Тестостерон, нмоль/л | 14,31±0,616 | 12,54±0,415* | 16,15±0,928 | 15,18±0,62 |
| ТЗГ, нмоль/л | 48,91±0,904 | 52,99±0,76* | 37,31±0,634 | 37,74±0,645 |
| ЛГ, ОД/л | 3,82±0,039 | 3,98±0,047* | 3,55±0,044 | 3,51±0,048 |
| Оцінка за шкалою AMS, бали | 30,06±0,469 | 32,08±0,63* | 27,57±0,459 | 29,2±0,6* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, які палили та не палили тютюн.
Отримані дані свідчать про негативний вплив тютюнопаління на стан шкірного покрову та гомеостаз організму. Це підтверджує те, що тютюнопаління є одним з факторів ризику пришвидшеного старіння шкіри та фоном для виникнення дерматологічної патології.
4.2 Особливості стану шкіри та гомеостазу організму чоловіків у залежності від частоти вживання алкоголю
Окрім тютюнопаління на організм людини у цілому та шкіри зокрема значний вплив чинить інша шкідлива звичка – часте вживання алкогольних напоїв. Шляхом анкетування було встановлено, що 21,5 % опитаних чоловіків у віці 45-54 років 1 раз на тиждень і частіше вживали алкогольні напої, а у віці 55-64 років – 17,6 % осіб. Таким чином, часте вживання алкоголю можна вважати поширеною шкідливою звичкою. Отже нами був проведений аналіз стану шкіри та основних параметрів гомеостазу організму чоловіків у залежності від наявності у них цієї звички.
У чоловіків, які відносно часто вживали алкоголь, була виявлена тенденція до зростання сухості, порушень тургору шкіри, збільшення кількості елементів висипки – маркерів старіння шкіри, зростання бальних оцінок вираженості зморшок і стану шкіри за Yolanda R. Helfrich et. al. порівняно з групою чоловіків, які не вживали або рідко вживали алкоголь (табл. 4.6). У віковій групі чоловіків 45-54 років встановлена достовірна різниця за вираженістю сухості, оцінкою порушень тургору шкіри, кількістю зморшок, бальною оцінкою їх вираженості, оцінкою стану шкіри за шкалою Yolanda R. Helfrich et. al. і кількістю елементів висипки – маркерів старіння між особами, які відносно часто та нечасто вживали алкоголь.
Крім того, була доведена достовірно більша сухість шкіри, вища бальна оцінка порушень тургору шкіри у чоловіків віком 55-64 років, які щотижнево або частіше вживали алкоголь, порівняно з чоловіками аналогічного віку, які рідко вживали або зовсім не вживали спиртні напої. У осіб віком 55-64 років, які зловживали алкоголем щотижня та частіше, відзначена достовірно вища кількість зморшок на обличчі, більша їх вираженість за бальною шкалою та гірший стан шкіри за шкалою Yolanda R. Helfrich et. al.
Таблиця 4.6 – Клінічні показники стану шкіри чоловіків у залежності від частоти вживання алкоголю (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| не вживали алкоголь або вживали рідше, ніж щотижня | вживали алкоголь щотижня та частіше | не вживали алкоголь або вживали рідше, ніж щотижня | вживали алкоголь щотижня та частіше | |
| Сухість шкіри, бали | 0,5±0,081 | 1,467±0,165* | 0,205±0,056 | 0,708±0,175* |
| Порушення тургору, бали | 1,529±0,06 | 1,8±0,107* | 1,114±0,034 | 1,333±0,098* |
| Оцінка шкіри за шкалою Yolanda R. Helfrich et. al. | 4,414±0,114 | 5,133±0,256* | 2,955±0,107 | 3,542±0,225* |
| Кількість зморшок (4см2х3) | 12,4±0,25 | 13,87±0,35* | 10,821±0,252 | 12,04±0,491* |
| Вираженість зморшок, бали | 29,83±0,691 | 34,07±1,482* | 22,22±0,695 | 25,46±1,158* |
| Кількість елементів – маркерів старіння | 60,29±4,414 | 80,53±10,13 | 40,94±2,854 | 65,17±5,629* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, які вживали алкоголь щотижня та частіше, й осіб, які не вживали алкоголь або вживали рідше, ніж щотижня.
Таким чином, результати клінічного обстеження чоловіків свідчать про те, що у осіб, які порівняно часто вживали алкоголь, відзначався погіршений стан шкіри порівняно з особами, які не вживали алкогольні напої або вживали їх рідко.
У чоловіків 55-64 років, які вживали алкоголь щотижнево та частіше, відзначена тенденція до збільшення кількості патогенного стрептококу, гемофільних паличок й інтегрального показника кількості умовно-патогенної флори у ротоглотці. Крім того, у осіб віком 55-64 років, які відносно часто вживали алкоголь, спостерігалась достовірно нижча кількість лактобактерій при дослідженні мікробіоценозу кишечника порівняно з особами, які не мали даної шкідливої звички: у чоловіків, які щотижнево або частіше вживали алкоголь – (5,85±0,09) Lg КУО/г проти (6,56±0,19) Lg КУО/г у осіб, які рідко вживали спиртні напої або зовсім їх не вживали. Також у чоловіків, які відносно часто вживали алкоголь, була тенденція до зменшення кількості біфідобактерій при бактеріологічному дослідженні кала. Отже, у чоловіків, які зловживали алкоголем, відзначалася тенденція до порушення системного мікробіоценозу, що може сприяти виникненню та більш тяжкому перебігу хронічних дерматозів.
Проведені дослідження показали, що у чоловіків віком 55-64 років, які щотижнево або частіше вживали алкоголь, концентрація середніх молекул у сироватці крові була достовірно вищою, ніж у чоловіків аналогічного віку, які рідко вживали спиртні напої або зовсім їх не вживали (СМ1= (0,403±0,009) у. о. проти (0,363±0,005) у. о.; СМ2= (0,218±0,005) у. о. проти (0,176±0,005) у. о.; р<0,05). Отримані результати свідчать про підвищений рівень ендотоксикозу у чоловіків, які щотижнево та частіше вживали алкоголь.
У чоловіків, які щотижнево або частіше вживали алкогольні напої, відзначено достовірно нижчий рівень тестостерону. У осіб, які відносно часто вживали спиртні напої, віком 45-54 років рівень тестостерону у крові склав (13,72±0,56) нмоль/л, а віком 55-64 років – (11,2±0,14) нмоль/л. Концентрація тестостерону у чоловіків, які не вживали алкоголь або вживали його рідше ніж щотижня, віком 45-54 років складала (16,29±0,67) нмоль/л, а у осіб 55-64 років – (13,94±0,43) нмоль/л. Достовірна різниця отримана і за рівнем ЛГ у чоловіків віком 55-64 років: його концентрація у осіб, які щотижнево або частіше вживали алкоголь, становила (4,06±0,08) ОД/л, а у осіб, які вживали алкоголь не так часто, – (3,86±0,03) ОД/л.
У чоловіків віком 55-64 років, які щотижнево або частіше вживали алкоголь, відзначалась достовірно вища бальна оцінка за шкалою AMS [(32,87±0,83) бали] порівняно з особами, які рідше вживали спиртні напої [(30,53±0,43) бали]. У чоловіків віком 45-54 років, які порівняно часто вживали алкоголь, також відзначена тенденція до збільшення бальної оцінки за шкалою AMS. Отримані дані є свідченням більш вираженого андрогенного дефіциту та старіння чоловіків, які зловживають алкогольними напоями.
У результаті дослідження було встановлено тенденцію щодо збільшення концентрації холестерину, β-ліпопротеїдів, тригліцеридів у осіб, які відносно часто вживали алкоголь. Рівень холестерину був достовірно вищим у чоловіків, які щотижнево зловживали спиртними напоями (табл. 4.7).
Таблиця 4.7 – Концентрація ліпідів у крові чоловіків у залежності від частоти вживання алкоголю (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| не вживали алкоголь або вживали рідше, ніж щотижня | вживали алкоголь щотижня та частіше | не вживали алкоголь або вживали рідше, ніж щотижня | вживали алкоголь щотижня та частіше | |
| Холестерин, ммоль/л | 4,805±0,032 | 4,953±0,055* | 4,334±0,021 | 4,42±0,035* |
| β-ліпопротеїди, % | 50,05±0,682 | 53,0±0,913* | 46,29±0,452 | 48,0±0,949 |
| Тригліцериди, ммоль/л | 2,021±0,037 | 2,25±0,126 | 1,513±0,041 | 1,78±0,058* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, які вживали алкоголь щотижня та частіше, й осіб, які не вживали алкоголь або вживали рідше, ніж щотижня.
У віці 45-54 років встановлене достовірне збільшення систолічного [(133,3±1,80) мм рт. ст.] та діастолічного артеріального тиску [(85,21±1,46) мм рт. ст.] у чоловіків, які часто вживали алкоголь, у порівнянні з особами, які майже не вживали спиртні напої [(127,8±1,06) і (81,14±0,82) мм рт. ст. відповідно; р<0,05].
Отримані дані говорять про негативний вплив зловживання алкоголем на стан шкірного покрову та гомеостаз організму. А отже зловживання алкоголем можна розглядати як один з факторів ризику пришвидшеного старіння шкіри та виникнення дерматологічної патології. Разом з тим, зменшення вживання алкоголю може дозволити знизити частоту патологічних порушень і захворювань шкіри.
4.3 Стан шкіри та особливості гомеостазу організму у чоловіків у залежності від частоти вживання овочів і фруктів
Окрім наявності шкідливих звичок на організм людини у цілому та шкіри зокрема значний вплив чинить харчовий раціон, який в нормі повинен складатись із достатньої кількості та нормальних співвідношень білків, жирів і вуглеводів. Під час аналізу результатів опитування чоловіків звернули на себе увагу частота вживання кисломолочних продуктів, м’яса та м’ясних продуктів, риби та морепродуктів, овочів і фруктів. Встановлено, що використання у їжу овочів і фруктів було недостатнім. Так, 3-4 дні на тиждень овочі та фрукти вживали 44,1 % чоловіків, а лише 1-2 дні на тиждень – від 16,4 % до 24,1 % осіб у залежності від вікової групи. Таким чином, недостатнє вживання овочів і фруктів (1-4 дні на тиждень) є маркером нераціонального харчування та, відповідно, одним з факторів погіршення здоров’я чоловіків у цілому та стану їх шкіри зокрема. Тому був проведений аналіз стану шкіри та основних параметрів гомеостазу організму серед чоловіків у залежності від частоти використання у їх раціоні овочів і фруктів.
У чоловіків, які рідко (1-4 дні на тиждень) вживали овочі та фрукти, виявлена тенденція до зростання сухості, зменшення тургору шкіри, збільшення кількості елементів висипки, які є маркерами старіння шкіри, більшої кількості та вираженості зморшок порівняно з групою чоловіків, які часто вживали овочі та фрукти (табл. 4.8). У віковій групі чоловіків 45-54 років встановлена достовірна різниця за кількістю зморшок, бальною оцінкою їх вираженості, кількістю елементів висипки – маркерів старіння між особами, які відносно часто та нечасто вживали овочі та фрукти. Крім того, була доведена достовірно більша сухість шкіри, вищі бальні оцінки порушень тургору шкіри у чоловіків віком 55-64 років, які лише 1-4 дні на тиждень вживали овочі та фрукти, порівняно з чоловіками аналогічного віку, які часто вживали овочі та фрукти. У осіб, які рідко вживали овочі та фрукти, віком 55-64 років відзначена достовірно більша кількість зморшок на обличчі та кількість елементів висипки – маркерів старіння. Таким чином, результати клінічного обстеження чоловіків говорять про те, що у осіб, які порівняно рідко (1-4 дні на тиждень) вживали овочі та фрукти, відзначався погіршений стан шкірного покрову порівняно з особами, які вживали їх часто.
При розгляді кровоплину у шкірі чоловіків віком 55-64 років, які рідко вживали овочі та фрукти, встановлено достовірно нижчу максимальну швидкість кровотоку порівняно з особами, які майже щодня харчувались овочами та фруктами (табл. 4.9).
Результати біомікроскопічних досліджень також свідчать про погіршення кровоплину у шкірі чоловіків, які мало вживали овочів і фруктів. У чоловіків, які лише 1-4 дні на тиждень використовували у своєму раціоні овочі та фрукти, при біомікроскопії відзначалося достовірне зменшення кількості функціонуючих капілярів порівняно з особами, які 5-7 днів на тиждень вживали овочі та фрукти (табл. 4.9). Крім того, у групі чоловіків, які відносно рідко ними харчувалися, спостерігалася тенденція до збільшення відсотку порушень мікроциркуляції та відсотку її судинних порушень. Таким чином, результати проведеного дослідження свідчать про погіршення кровоплину у шкірі чоловіків, яким було властиве нераціональне харчування з недостатнім вживанням овочів і фруктів.
Таблиця 4.8 – Клінічні показники стану шкіри чоловіків у залежності від частоти вживання овочів і фруктів (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| які вживали овочі 1-4 дні на тиждень | які вживали овочі 5-7 днів на тиждень | які вживали овочі 1-4 дні на тиждень | які вживали овочі 5-7 днів на тиждень | |
| Сухість шкіри, бали | 0,857±0,117 | 0,417±0,101* | 0,366±0,077 | 0,167±0,084 |
| Порушення тургору, бали | 1,673±0,068 | 1,444±0,084* | 1,171±0,042 | 1,133±0,063 |
| Оцінка шкіри за шкалою Yolanda R. Helfrich et. al. | 4,51±0,155 | 4,583±0,146 | 3,183±0,115 | 2,80±0,491 |
| Кількість зморшок шкіри (4 см2х3) | 13,22±0,279 | 11,89±0,326* | 11,38±0,249 | 10,27±0,188* |
| Вираженість зморшок шкіри, бали | 31,12±0,88 | 29,83±0,94 | 24,01±0,65 | 19,9±1,31* |
| Кількість елементів – маркерів старіння | 72,43±5,41 | 52,19±5,87* | 51,63±2,84 | 31,1±5,68* |
Примітка: * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків, які рідше вживали овочі та фрукти.
Таблиця 4.9 – Основні показники доплерографічного ультразвукового дослідження шкіри та біомікроскопічного дослідження нігтьового ложа у чоловіків у залежності від частоти вживання овочів і фруктів
| Показники, одиниці вимірювання | Чоловіки віком 55-64 рр. | Чоловіки віком 45-54 рр. | ||
| які вживали овочі 1-4 дні на тиждень | які вживали овочі 5-7 днів на тиждень | які вживали овочі 1-4 дні на тиждень | які вживали овочі 5-7 днів на тиждень | |
| Максимальна швидкість, см/с (М±m) | 5,46±0,059 | 5,59±0,072* | 5,99±0,051 | 5,94±0,057 |
| Кількість функціонуючих капілярів на 1 мм3 (М±m) | 28,96±0,71 | 32,45±0,81* | 33,81±0,6 | 36,5±0,29* |
| Внутрішньосудинні зміни мікроциркуляції, % | 39,1 | 9,1* | 19,2 | 25,0 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків, які рідше вживали овочі та фрукти.
Як відомо, нераціональне харчування часто асоціюється з порушеннями мікробіоценозу – перш за все, мікробіоценозу кишечника. Так, нами була визначена тенденція до зниження кількості біфідобактерій і лактобактерій у чоловіків віком 55-64 років, які лише 1-4 дні на тиждень до раціону включали овочі та фрукти. Встановлено достовірне збільшення кількості неферментуючої кишечної палички при бактеріологічному дослідженні кала у чоловіків віком 55-64 років, які рідко вживали овочі та фрукти [(2,01±0,36) Lg КУО/г], порівняно з особами аналогічного віку, які майже щодня харчувались овочами та фруктами [(0,40±0,40) Lg КУО/г]. Крім того, були встановлені порушення мікробіоценозу ротоглотки у осіб, які відносно рідко вживали овочі та фрукти. Достовірно вищий інтегральний показник кількості умовно-патогенної флори у вмісті ротоглотки відзначено у чоловіків віком 55-64 років, які лише 1-4 рази на тиждень вживали овочі та фрукти [(12,67±1,42) Lg КУО/г], порівняно з особами, які 5-7 разів на тиждень мали у своєму раціоні овочі та фрукти [(7,96±1,36) Lg КУО/г].
Чоловіки, для яких характерною була наявність нераціонального харчування з недостатнім споживанням овочів і фруктів, мали більшу бальну оцінку за шкалою AMS. У результаті проведеного дослідження була встановлена достовірна різниця за оцінкою за шкалою AMS між чоловіками віком 55-64 років, які вживали овочі та фрукти 1-4 рази на тиждень (31,82±0,49), порівняно з особами аналогічного віку, які майже щодня харчувались овочами та фруктами (29,75±0,61).
Отримані дані свідчать про те, що недостатнє вживання овочів і фруктів є однією з ознак нераціонального харчування, яке може призводити до погіршення стану шкірного покрову та гомеостазу організму.
4.4 Вплив недостатнього вживання кисломолочних продуктів на стан шкіри та загальний стан здоров’я чоловіків
Ще одним важливим показником збалансованого харчування є частота вживання кисломолочних продуктів. Шляхом анкетування було встановлено, що чоловіки надто рідко вживали дані продукти харчування. Так, відсоток осіб, які рідко споживали кисломолочні продукти (лише 1-2 дні на тиждень або зовсім їх не вживали), серед чоловіків віком 45-64 років становив 74,1 %. Цей показник є свідченням поширеного серед чоловічого населення нераціонального підходу до харчування, що може призвести до порушення як здоров’я людини у цілому, так і патології шкіри. Тому був проведений аналіз стану шкірного покрову та основних показників гомеостазу у чоловіків у залежності від частоти вживання ними кисломолочних продуктів.
У чоловіків, які рідко (1-2 дні на тиждень) вживали кисломолочні продукти або зовсім їх не вживали, була виявлена тенденція до зростання сухості шкіри, бальної оцінки порушень тургору, збільшення кількості елементів висипки, які є маркерами старіння шкіри, більшої кількості та вираженості зморшок, зростання бальної оцінки стану фотозахищених зон шкіри порівняно з групою чоловіків, які часто (3 та більше днів на тиждень) вживали кисломолочні продукти (табл. 4.10). У віковій групі чоловіків 45-54 років встановлена достовірна різниця за вираженістю сухості шкіри, бальною оцінкою порушень тургору шкіри, кількістю зморшок на обличчі, бальною оцінкою стану шкіри за шкалою Yolanda R. Helfrich et. al. між особами, які відносно часто та нечасто вживали кисломолочні продукти. Крім того, була доведена достовірно більша бальна оцінка порушень тургору шкіри, кількість зморшок на обличчі та бальна оцінка їх вираженості, оцінка стану шкіри за шкалою Yolanda R. Helfrich et. al. у чоловіків віком 55-64 років, які лише 1-2 дні на тиждень вживали кисломолочні продукти, порівняно з чоловіками аналогічного віку, які часто їх вживали.
Таблиця 4.10 – Клінічні показники стану шкіри у чоловіків у залежності від частоти вживання кисломолочних продуктів (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| які вживали кисломолочні продукти 1-2 дні на тиждень | які вживали кисломолочні продукти 3-7 днів на тиждень | які вживали кисломолочні продукти 1-2 дні на тиждень | які вживали кисломолочні продукти 3-7 днів на тиждень | |
| Сухість шкіри, бали | 0,746±0,101 | 0,455±0,127 | 0,386±0,078 | 0,103±0,058* |
| Порушення тургору, бали | 1,667±0,06 | 1,318±0,102* | 1,205±0,045 | 1,034±0,034* |
| Оцінка шкіри за шкалою Yolanda R. Helfrich et. al. | 4,73±0,126 | 4,0±0,161* | 3,241±0,114 | 2,621±0,175* |
| Кількість зморшок шкіри (4 см2х3) | 12,97±0,259 | 11,77±0,383* | 11,41±0,242 | 10,14±0,513* |
| Вираженість зморшок, бали | 31,68±0,745 | 27,41±1,066* | 23,53±0,657 | 21,14±1,392 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків, які рідше вживали кисломолочні продукти.
Таким чином, результати клінічного обстеження чоловіків говорять про те, що у осіб, які порівняно рідко (1-2 дні на тиждень) вживали кисломолочні продукти, відзначався погіршений стан шкірного покрову порівняно з особами, які вживали їх часто.
Нами була встановлена тенденція до зростання загальної кількості бактерій на шкірі у чоловіків віком 55-64 років, які лише 1-2 дні на тиждень вживали кисломолочні продукти. А за рівнем коагулазопозитивних стафілококів на шкірі отримана достовірна різниця між чоловіками віком 55-64 років, які відносно рідко та часто вживали кисломолочні продукти (відповідно (1,71±0,389) Lg КУО/см2 та (0,4±0,4) Lg КУО/см2).
В результаті бактеріологічного дослідження кала була визначена тенденція до зниження кількості біфідобактерій, збільшення кількості неферментуючої кишечної палички у чоловіків віком 55-64 років, які лише 1-2 дні на тиждень до свого раціону включали кисломолочні продукти. При бактеріологічному дослідженні кала у чоловіків віком 55-64 років, які більше 2 днів на тиждень вживали кисломолочні продукти, встановлено достовірно вищу кількість лактобактерій порівняно з особами, які лише 1-2 дні на тиждень вживали кисломолочні продукти [(6,94±0,271) Lg КУО/г проти (6,08±0,137) Lg КУО/г], та достовірно меншу кількість грибів роду Candida [(0,4±0,4) Lg КУО/г проти (1,74±0,304) Lg КУО/г]. Крім того, у чоловіків віком 55-64 років, які відносно рідко вживали кисломолочні продукти, встановлено достовірно вищий інтегральний показник кількості умовно-патогенної флори на слизовій оболонці ротоглотки [(13,07±1,36) Lg КУО/мл], порівняно з особами, які більше 2 разів на тиждень мали у своєму раціоні кисломолочні продукти [(7,16±0,68) Lg КУО/мл].
Отже, у чоловіків, які рідко вживали кисломолочні продукти або зовсім їх не вживали, відзначались системні порушення мікробіоценозу, що можуть сприяти виникненню та більш тяжкому перебігу хронічних дерматозів.
У чоловіків, які відносно рідко вживали кисломолочні продукти або зовсім виключали їх з раціону, в результаті проведеного дослідження були також встановлені зміни гомеостазу організму. Перш за все, вони стосувались стану системи ПОЛ-АОС. Так, у чоловіків віком 55-64 років, які вживали кисломолочні продукти менше 3-х днів на тиждень, встановлено достовірно вищий рівень ТБК-АП [(3,24±0,03) ммоль/л] на фоні майже незмінної загальної АОА [(67,54±0,51) %] порівняно з особами аналогічного віку, які відносно часто вживали кисломолочні продукти (рівень ТБК-АП=(3,07±0,06) ммоль/л; загальна АОА=(68,46±0,45) %). Це призводило до достовірного зниження КАОЗ у чоловіків, які відносно рідко вживали кисломолочні продукти – 20,85±0,24, порівняно з особами, які більше 2 днів на тиждень вживали кисломолочні продукти – 22,36±0,4.
У результаті дослідження також було встановлено достовірно вищий рівень β-ліпопротеїдів у чоловіків віком 55-64 років, які менше 3 разів на тиждень вживали кисломолочні продукти – (51,31±0,71) %, порівняно з особами, які часто їх вживали – (48,86±1,06) %.
Таким чином, можна зробити висновок про те, що недостатнє вживання кисломолочних продуктів свідчить про нераціональне харчування чоловіків, що в подальшому може спричинити погіршення гомеостазу організму та стану шкірного покрову.
4.5 Особливості стану шкіри та гомеостазу організму у чоловіків з різним рівним ситуативної тривожності
Важливим етіологічним чинником виникнення ряду хронічних дерматозів є зміни психологічного стану людей, зростання частоти стресів, виникнення депресії, збільшення тривожності та невротизації. Психологічні зміни є основою не лише для розвитку хронічних дерматозів, але й для погіршення стану шкірного покрову, передчасних проявів старіння. Отже, у ході дослідження зацікавлення викликало визначення впливу психологічних особистостей чоловіків на стан їх шкіри та гомеостаз організму.
Шляхом опитування встановлено, що часті стреси були характерними для чоловіків віком 55-64 років, проте максимальна їх частота була властивою для віку 45-54 років. Враховуючи переважний вплив різних стресових чинників на чоловіків різного віку та неможливість якісної оцінки загального стресового впливу на організм, для визначення впливу психологічних особистостей чоловіків на стан їх шкіри та гомеостаз була обрана бальна оцінка рівня ситуативної тривожності за шкалою Спілбергера-Ханіна. Під час аналізу отриманих результатів дослідження обстежені чоловіки були розподілені на дві групи у залежності від рівня ситуативної тривожності за шкалою Спілбергера-Ханіна: 1 група з рівнем тривожності ≤ 42 балів, 2 група – з рівнем тривожності > 42 балів.
Встановлена достовірна різниця за кількістю елементів висипки – маркерів старіння, кількістю зморшок, бальною оцінкою їх вираженості, оцінкою стану шкіри за шкалою Yolanda R. Helfrich et. al. між групами чоловіків з різним рівнем ситуативної тривожності (табл. 4.11).
Таблиця 4.11 – Клінічні показники стану шкіри чоловіків у залежності від рівня їх ситуативної тривожності за шкалою Спілбергера-Ханіна (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| тест Спілбергера-Ханіна ≤42 балів | тест Спілбергера-Ханіна > 42 балів | тест Спілбергера-Ханіна ≤ 42 балів | тест Спілбергера-Ханіна > 42 балів | |
| Оцінка шкіри за шкалою Yolanda R. Helfrich et. al. | 4,25±0,16 | 4,8±0,30 | 2,99±0,10 | 3,77±0,34* |
| Кількість зморшок шкіри (4 см2х3) | 12,58±0,33 | 12,73±0,133 | 10,9±0,24 | 12,46±0,58* |
| Вираженість зморшок шкіри, бали | 28,8±1,0 | 32,1±0,8* | 22,4±0,7 | 26,9±1,5* |
| Кількість елементів – маркерів старіння | 54,1±5,7 | 72,6±5,6* | 43,1±2,8 | 68,9±7,9* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з групою чоловіків, у яких рівень ситуативної тривожності за шкалою Спілбергера-Ханіна ≤ 42 балів.
Таким чином, у осіб з рівнем ситуативної тривожності більше 42 балів за шкалою Спілбергера-Ханіна існують тенденції щодо погіршення стану шкіри порівняно з особами з нижчим рівнем реактивної тривожності.
При розгляді кровоплину у шкірі чоловіків з вищим рівнем ситуативної тривожності відзначено наявність у них тенденції до збільшення індексу пульс-активності та резистентності. У чоловіків віком 55-64 років, які мали вищий рівень реактивної тривожності, відзначено достовірно нижчі максимальну та середню швидкості кровотоку порівняно з особами з рівнем ситуативної тривожності ≤ 42 балів (табл. 4.12). Про гірший стан кровоплину у шкірі чоловіків з вищим рівнем ситуативної тривожності свідчать і результати біомікроскопічних досліджень нігтьового ложа. У чоловіків з рівнем реактивної тривожності за шкалою Спілбергера-Ханіна > 42 балів відзначена тенденція до збільшення відсотку порушень мікроциркуляції (табл. 4.12). Встановлено також достовірно вищий діастолічний артеріальний тиск у осіб з вищою ситуативною тривожністю.
Таблиця 4.12 – Характеристика кровоплину та біомікроскопічних змін у шкірі чоловіків у залежності від рівня їх ситуативної тривожності
| Показники, одиниці вимірювання: | Чоловіки віком 55-64 рр. | |
| тест Спілбергера-Ханіна ≤ 42 балів | тест Спілбергера-Ханіна > 42 балів | |
| Максимальна швидкість, см/с (М±m) | 5,62±0,054 | 5,402±0,059* |
| Середня швидкість, см/с (М±m) | 3,34±0,055 | 3,14±0,053* |
| Індекс пульс-активності, у. о. (М±m) | 1,73±0,055 | 1,87±0,039* |
| Індекс резистентності, у. о. (М±m) | 1,02±0,02 | 1,15±0,032* |
| Наявність порушень мікроциркуляції, % | 53,3 | 78,9 |
| САТ, мм рт. ст. (М±m) | 132,6±1,65 | 136,0±1,35 |
| ДАТ, мм рт. ст. (М±m) | 82,3±1,03 | 85,2±1,01* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з групою чоловіків, у яких рівень ситуативної тривожності за шкалою Спілбергера-Ханіна ≤ 42 балів.
Таким чином, результати проведеного дослідження свідчать про витончення різних шарів шкіри, погіршення кровоплину у шкірі чоловіків з рівнем ситуативної тривожності за шкалою Спілбергера-Ханіна > 42 балів.
У чоловіків віком 55-64 років з рівнем реактивної тривожності > 42 балів за шкалою Спілбергера-Ханіна було встановлено достовірне зменшення рівня тестостерону [(12,6±0,53) нмоль/л] і достовірне збільшення рівня ТЗГ [(52,22±1,02) нмоль/л] порівняно з особами з рівнем ситуативної тривожності ≤ 42 балів. Концентрація тестостерону становила (14,4±0,53) нмоль/л, а ТЗГ – (49,38±0,87) нмоль/л у чоловіків віком 55-64 років з рівнем ситуативної тривожності ≤ 42 балів.
Бальна оцінка за шкалою AMS була достовірно вищою у чоловіків з рівнем реактивної тривожності > 42 балів, що є свідченням більш вираженого у них андрогенного дефіциту та старіння порівняно з особами, у яких ситуативна тривожність була ≤ 42 балів. Так, у чоловіків з нижчим рівнем тривожності віком 45-54 років оцінка за шкалою AMS становила (28,01±0,39) балів, а у віці 55-64 роки – (30,1±0,56) балів. У той же час у чоловіків з рівнем ситуативної тривожності > 42 балів віком 45-54 років оцінка за шкалою AMS становила (30,38±1,05) балів, а у віці 55-64 років – (31,69±0,54) балів.
Крім того, у чоловіків віком 55-64 років з рівнем реактивної тривожності > 42 балів відзначалася тенденція щодо збільшення концентрації холестерину, β-ліпопротеїдів, тригліцеридів. Отримана достовірна різниця за рівнем глюкози між чоловіками віком 55-64 років з рівнем ситуативної тривожності ≤ 42 балів [(5,3±0,07) ммоль/л] та > 42 балів [(5,55±0,09) ммоль/л].
Таким чином, результати проведених досліджень, наведені в цьому підрозділі, свідчать про негативний вплив частих стресогенних ситуацій на стан шкіри, що може бути підґрунтям для формування чисельних захворювань шкіри.
4.6 Вплив комплексу несприятливих факторів на стан шкіри та загальний стан здоров’я чоловіків
Під час аналізу результатів дослідження нашу увагу привернуло те, що на частину обстежених чоловіків впливали не окремі несприятливі соціально-економічні, побутові та ментальні фактори поодинці, а сукупність чинників, які могли підсилювати дію один одного. При цьому вплив одразу декількох факторів мав більший пошкоджуючий ефект щодо стану шкіри та гомеостазу організму порівняно з окремо взятими тригерами.
Враховуючи вказані вище факти, наші зусилля були направлені на дослідження комплексного впливу несприятливих чинників на чоловіків. Серед основних пошкоджуючих факторів були виділені наступні: тютюнопаління, часте вживання алкоголю (щотижня або частіше), недостатнє вживання овочів і фруктів (менше 5 днів на тиждень), недостатнє вживання кисломолочних продуктів (менше 3 днів на тиждень), рівень ситуативної тривожності за шкалою Спілбергера-Ханіна вищий за 42 бали. Ці фактори, по-перше, чинили найбільший пошкоджуючий вплив, а по-друге, частіше за інші зустрічались у популяції серед чоловіків. Чоловіки, які зазнавали впливу багатьох несприятливих факторів, склали групу ризику щодо виникнення порушень стану шкіри та гомеостазу організму.
У такій відокремленій групі чоловіків, які зазнавали впливу чисельних несприятливих чинників, палили тютюн 96,3 % осіб віком 45-54 років і 100 % осіб віком 55-64 роківи, відносно часто вживали алкоголь 70,4 % осіб віком 45-54 років і 54,5 % осіб віком 55-64 років. У чоловіків, які склали “несприятливу” групу щодо впливу багатьох тригерних факторів, часто відзначалось нераціональне харчування. Серед чоловіків віком 45-54 років лише 3,7 % осіб вживали овочі та фрукти більше 4 днів на тиждень, лише 3,8 % осіб 5-7 днів на тиждень харчувались м’ясом і м’ясними продуктами та жоден чоловік не вживав рибу та морепродукти більше 4 днів на тиждень. При цьому з них 66,7 % осіб 5-7 днів на тиждень харчувались макаронами та картоплею. Серед чоловіків віком 55-64 років лише 9,1 % осіб вживали овочі та фрукти, м’ясо та м’ясні продукти, рибу та морепродукти більше 4 днів на тиждень. При цьому з них 63,6 % осіб 5-7 днів на тиждень харчувались макаронами та картоплею.
Набагато частіше у чоловіків із групи ризику відзначались часті стреси на роботі. Серед чоловіків, на яких впливали чисельні несприятливі фактори, відзначали наявність частих стресів на роботі 77,8 % у віці 45-54 років і 45,5 % у віці 55-64 років. При цьому серед чоловіків, які не зазнавали впливу багатьох несприятливих чинників, відзначали наявність частих стресів на роботі лише 17,6 % у віці 45-54 років та 15,9 % у віці 55-64 років.
Аналогічна тенденція спостерігалась і за частотою несприятливого психологічного клімату у сім’ях обстежених чоловіків. Серед чоловіків із групи ризику відзначали наявність несприятливого психологічного клімату у родині 55,6 % у віці 45-54 років і 50,0 % у віці 55-64 років. При цьому серед чоловіків, які не зазнавали впливу багатьох несприятливих чинників, відзначали наявність несприятливого психологічного клімату у сім’ї лише 3,6 % у віці 45-54 років і 11,1 % у віці 55-64 років.
Шляхом опитування було встановлено, що чоловіки з групи ризику менше піклувались про своє здоров’я. Серед чоловіків, на яких впливали чисельні несприятливі фактори, зовсім не піклувались про своє здоров’я 51,9 % у віці 45-54 років і 45,5 % у віці 55-64 років. А серед чоловіків, які не зазнавали впливу багатьох несприятливих чинників, зовсім не піклувались про своє здоров’я лише 8,2 % у віці 45-54 років і 7,9 % у віці 55-64 років. При цьому серед чоловіків, які не зазнавали впливу багатьох несприятливих чинників, постійну турботу про своє здоров’я виявляли 21,2 % у віці 45-54 років і 41,3 % у віці 55-64 років. Жоден з чоловіків із групи ризику постійно не піклувався про здоров’я.
Це дозволяє розглядати недостатнє піклування про своє здоров’я, несприятливий психологічний клімат у родині та часті стреси на роботі як додаткові несприятливі фактори, які можуть чинити негативний вплив на стан гомеостазу організму та шкірного покрову, сприяючи виникненню та прогресуванню дерматозів.
У чоловіків із групи ризику віком 45-54 років була виявлена тенденція до зростання сухості, бальної оцінки порушень тургору шкіри, хоча достовірної різниці за цими показниками між групами чоловіків віком 45-54 років отримано не було (табл. 4.13). Достовірно вища кількість елементів висипки, які є маркерами старіння, більша кількість зморшок, вища бальна оцінка їх вираженості, достовірно вища оцінка стану шкіри за шкалою Yolanda R. Helfrich et. al. встановлені у чоловіків із групи ризику віком 45-54 років у порівнянні з групою осіб аналогічного віку, які не зазнавали впливу чисельних пошкоджуючих чинників.
Таблиця 4.13 – Клінічні показники стану шкіри у чоловіків, які зазнали впливу різної кількості несприятливих факторів (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| на яких не впливали чисельні несприятливі фактори | на яких впливали чисельні несприятливі фактори | на яких не впливали чисельні несприятливі фактори | на яких впливали чисельні несприятливі фактори | |
| Сухість шкіри, бали | 0,52±0,09 | 1,09±0,17* | 0,24±0,06 | 0,56±0,15 |
| Порушення тургору, бали | 1,51±0,06 | 1,77±0,09* | 1,12±0,04 | 1,13±0,09 |
| Оцінка шкіри за Yolanda R. Helfrich et. al. | 4,41±0,13 | 4,91±0,19* | 2,94±0,10 | 3,52±0,24* |
| Кількість зморшок шкіри (4 см2х3) | 12,19±0,26 | 14±0,28* | 10,67±0,25 | 12,37±0,45* |
| Вираженість зморшок, бали | 29,68±0,75 | 33,14±1,12* | 21,81±0,68 | 26,37±1,13* |
| Кількість елементів – маркерів старіння | 57,4±4,52 | 82,36±8,16* | 39,81±2,81 | 66,04±5,41* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, на яких впливали або не впливали чисельні несприятливі фактори.
Більш виражені зміни шкірного покрову відзначались у чоловіків віком 55-64 років, на яких впливали чисельні несприятливі фактори. Чоловіки з групи ризику віком 55-64 років мали достовірно більшу сухість, бальну оцінку порушень тургору шкіри порівняно з чоловіками аналогічного віку, на яких не впливали чисельні несприятливі фактори. Крім того, у чоловіків із групи ризику віком 55-64 років відзначалася достовірно більша кількість зморшок на шкірі обличчя та їх вираженість порівняно з чоловіками, які не зазнавали впливу комплексу несприятливих факторів. Важливим доказом згубного комплексного впливу чисельних тригерів на стан шкіри була достовірно вища бальна оцінка її стану за шкалою Yolanda R. Helfrich et. al. у чоловіків 54-64-річного віку з групи ризику порівняно з особами аналогічного віку, які не зазнавали впливу багатьох несприятливих факторів. Крім того, чоловіки 55-64-річного віку з групи ризику мали достовірно більшу кількість елементів висипки, які є маркерами старіння.
У чоловіків із групи ризику віком 55-64 років встановлено достовірно нижчу середню швидкість кровотоку і достовірно більші значення пульс-активності та резистентності порівняно з особами, на яких не впливали чисельні пошкоджуючі чинники (табл. 4.14). Збільшення індексів пульс-активності та резистентності свідчить про зменшення еластичності судин у чоловіків, які зазнавали впливу багатьох тригерів. У чоловіків із групи ризику спостерігалось достовірне збільшення систолічного та діастолічного артеріального тиску порівняно з чоловіками, які не зазнавали дії чисельних тригерів. У чоловіків із групи ризику відзначалось достовірне зменшення кількості функціонуючих капілярів порівняно з особами без наявності комплексного впливу чисельних тригерів. І хоча не було встановлено достовірних відмінностей, проте у чоловіків із групи ризику відзначалася тенденція до збільшення відсотку порушень мікроциркуляції.
Таблиця 4.14 – Характеристика кровотоку у шкірі чоловіків, які зазнали впливу різної кількості несприятливих факторів
| Показники, одиниці вимірювання |
Чоловіки віком 55-64 рр. | |
| на яких не впливали чисельні несприятливі фактори | на яких впливали чисельні несприятливі фактори | |
| Середня швидкість, см/с (М±m) | 3,27±0,048 | 3,07±0,015* |
| Індекс пульс-активності, у. о. (М±m) | 1,78±0,038 | 1,95±0,046* |
| Індекс резистентності, у. о. (М±m) | 1,06±0,023 | 1,24±0,006* |
| Кількість функціонуючих капілярів на 1 мм3 (М±m) | 31,7±0,65 | 27,5±0,78* |
| Наявність порушень мікроциркуляції, % | 61,9 | 76,9 |
| САТ, мм рт.ст. (М±m) | 132,5±1,23 | 140±1,68* |
| ДАТ, мм рт. ст. (М±m) | 81,98±0,76 | 89,09±1,30* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, на яких впливали або не впливали чисельні несприятливі фактори.
У результаті проведених досліджень мікробіоценозу було встановлено тенденції до формування дисбіотичного стану в осіб, які зазнавали впливу чисельних несприятливих факторів. При дослідженні мікробного обсіменіння шкіри у чоловіків віком 55-64 років було встановлено, що у осіб із групи ризику кількість коагулазопозитивних стафілококів була у 2,4 рази більшою порівняно з рештою чоловіків. При дослідженні мікробіоценозу ротоглотки у чоловіків із групи ризику віком 55-64 років встановлено достовірно вищу кількість патогенного стрептококу, гемофільних паличок і достовірно вищий інтегральний показник кількості умовно-патогенної флори порівняно з особами, які не зазнавали впливу багатьох несприятливих чинників. Кількість патогенних стрептококів у чоловіків із групи ризику віком 55-64 років становила (3,95±0,22) Lg КУО/мл проти (2,34±0,45) Lg КУО/мл у осіб, які не зазнавали впливу багатьох несприятливих чинників. Кількість гемофільних паличок у чоловіків із групи ризику віком 55-64 років становила (3,07±0,2) Lg КУО/мл проти (1,3±0,52) Lg КУО/мл у осіб, які не зазнавали впливу багатьох несприятливих чинників. Інтегральний показник кількості умовно-патогенної флори у чоловіків із групи ризику віком 55-64 років становив (15,22±1,53) Lg КУО/мл проти (8,36±0,84) Lg КУО/мл у осіб, які не зазнавали впливу багатьох несприятливих чинників. Крім того, у чоловіків із групи ризику віком 55-64 років спостерігалася достовірно нижча кількість лактобактерій при дослідженні мікробіоценозу кишечника у порівнянні з особами, які не зазнавали впливу багатьох несприятливих чинників: відповідно (5,9±0,06) Lg КУО/г проти (6,68±0,22) Lg КУО/г. У чоловіків із групи ризику віком 55-64 років встановлена достовірна різниця і за кількістю біфідобактерій при дослідженні мікробіоценозу кишечника порівняно з особами, які не зазнавали впливу багатьох несприятливих чинників [(7,73±0,27) Lg КУО/г, проти (8,6±0,16) Lg КУО/г]. При дослідженні мікробіоценозу кишечника у чоловіків із групи ризику віком 55-64 років достовірно вищою була кількість грибів роду Candida [(2,23±0,15) Lg КУО/г] порівняно з особами, які не зазнавали впливу багатьох несприятливих чинників [(0,67±0,33) Lg КУО/г]. Отже, у чоловіків, на яких впливав комплекс тригерів, несприятливі дії яких нашаровувались одна на одну, відзначались системні порушення мікробіоценозу.
У чоловіків із групи ризику віком 55-64 років відзначався достовірно вищий рівень ТБК-АП [(3,26±0,04) ммоль/л] на фоні майже незмінної загальної АОА [(67,14±0,71) %] порівняно з особами, які не зазнавали впливу багатьох несприятливих чинників (рівень ТБК-АП = (3,13±0,04) ммоль/л, загальна АОА = (68,32±0,38) %). Це призводило до достовірного зменшення коефіцієнту антиокислювального захисту у чоловіків із групи ризику (20,58±0,34) порівняно з особами, які не зазнавали впливу багатьох несприятливих чинників (21,87±0,3). Це свідчить про превалювання процесів ПОЛ у чоловіків, на яких впливав комплекс тригерів.
При вивченні осмотичної стійкості еритроцитарних мембран також були відзначені відмінності між групами чоловіків, які зазнавали впливу різної кількості несприятливих факторів: була встановлена достовірна різниця за відсотком гемолізу у 0,45 % і 0,4 % розчинах NaCl (табл. 4.15). Проведені дослідження показали, що у чоловіків із групи ризику існувала тенденція до збільшення концентрації середніх молекул. Була отримана достовірна різниця за кількістю СМ2 між чоловіками віком 55-64 років, на яких впливали чисельні несприятливі фактори [(0,21±0,01) у. о.], порівняно з особами, які не зазнавали впливу багатьох несприятливих чинників [(0,17±0,01) у. о.]. Отримані результати говорять про підвищений рівень ендотоксикозу у чоловіків із групи ризику.
У чоловіків із групи ризику спостерігалося зменшення рівня тестостерону (табл. 4.16). За його концентрацією у чоловіків віком 55-64 років, які зазнавали впливу різної кількості несприятливих факторів, отримана достовірна різниця. Крім того, у чоловіків із групи ризику віком 55-64 років відзначалася достовірно вища концентрація ЛГ і ТЗГ у порівнянні з показниками у решти чоловіків аналогічного віку. Бальна оцінка за шкалою AMS була достовірно вищою у чоловіків із групи ризику порівняно з особами, які не зазнавали впливу багатьох несприятливих чинників. Це є свідченням більш вираженого андрогенного дефіциту та старіння чоловіків, на яких впливав комплекс тригерів.
Таблиця 4.15 – Осмотична стійкість еритроцитів у чоловіків, які зазнали впливу різної кількості несприятливих факторів (М±m)
| Розчини NaCl | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| на яких не впливали чисельні несприятливі фактори | на яких впливали чисельні несприятливі фактори | на яких не впливали чисельні несприятливі фактори | на яких впливали чисельні несприятливі фактори | |
| 0,45 % | 29,33±0,715 | 32,5±0,463* | 25,31±0,553 | 26,33±1,145 |
| 0,4 % | 73,33±0,715 | 76,0±0,707* | 69,31±0,884 | 72,83±1,046* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, на яких впливали або не впливали чисельні несприятливі фактори.
Таблиця 4.16 – Концентрації гонадотропних і статевих гормонів, ТЗГ і бальна оцінка за шкалою AMS у чоловіків, які зазнали впливу різної кількості несприятливих факторів (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64 рр. | Чоловіки віком 45-54 рр. | ||
| на яких не впливали чисельні несприятливі фактори | на яких впливали чисельні несприятливі фактори | на яких не впливали чисельні несприятливі фактори | на яких впливали чисельні несприятливі фактори | |
| Тестостерон, нмоль/л | 14,24±0,497 | 12,0±0,4* | 16,26±0,711 | 14,25±0,698 |
| ТЗГ, нмоль/л | 49,65±0,868 | 53,13±0,907* | 37,48±0,572 | 37,58±0,656 |
| ФСГ, МО/л | 4,499±0,041 | 4,629±0,073 | 3,526±0,039 | 3,658±0,05* |
| ЛГ, ОД/л | 3,817±0,032 | 4,043±0,041* | 3,527±0,04 | 3,54±0,057 |
| Оцінка за шкалою AMS, бали | 30,22±0,427 | 33,0±0,77* | 27,54±0,376 | 30,63±0,876* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, на яких впливали або не впливали чисельні несприятливі фактори.
У чоловіків із групи ризику відзначалось достовірне збільшення концентрації холестерину, β-ліпопротеїдів, тригліцеридів порівняно з особами, які не зазнавали впливу багатьох несприятливих чинників (табл. 4.17). У чоловіків із групи ризику віком 55-64 років була достовірно вищою концентрація глюкози у крові порівняно з особами, які не зазнавали впливу багатьох несприятливих чинників. Це може призводити до порушення обміну речовин, розвитку метаболічного синдрому у чоловіків із групи ризику.
Таблиця 4.17 – Концентрація ліпідів і глюкози у крові чоловіків, які зазнали впливу різної кількості несприятливих факторів (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64 рр. | Чоловіки віком 45-54 рр. | ||
| на яких не впливали чисельні несприятливі фактори | на яких впливали чисельні несприятливі фактори | на яких не впливали чисельні несприятливі фактори | на яких впливали чисельні несприятливі фактори | |
| Холестерин, ммоль/л | 4,767±0,032 | 4,95±0,038* | 4,324±0,02 | 4,432±0,031* |
| β-ліпопротеїди, % | 49,2±0,685 | 53,13±0,581* | 46,13±0,446 | 48,17±0,792* |
| Тригліцериди, ммоль/л | 1,973±0,036 | 2,225±0,065* | 1,5±0,041 | 1,76710,049* |
| Глюкоза, ммоль/л | 5,307±0,056 | 5,663±0,096* | 5,15±0,098 | 5,133±0,163 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, на яких впливали або не впливали чисельні несприятливі фактори.
Отримані дані говорять про те, що основні патологічні зміни шкіри та гомеостазу організму, які у подальшому можуть спричиняти виникнення хронічних дерматозів, обумовлені комплексним впливом багатьох несприятливих факторів. До них відносяться шкідливі звички (тютюнопаління, часте вживання алкоголю), нераціональне харчування (недостатнє вживання кисломолочних продуктів, овочів і фруктів), психологічні особливості (зростання ситуативної тривожності). Чоловіки, які зазнають впливу більшості вказаних вище факторів, можуть бути віднесені до групи ризику щодо виникнення патологічних змін шкіри та гомеостазу організму і потребують проведення відповідного оздоровлення.
4.7 Стан шкіри та загальний стан здоров’я у чоловіків у залежності від ментальних особливостей
Окрім впливу несприятливих соціально-економічних і психологічних чинників, важливу роль у виникненні патологічних змін шкіри відіграють певні ментальні особливості чоловіків. У результаті проведеного опитування було встановлено, що більше половини опитаних чоловіків незалежно від загального стану здоров’я та вікової групи лише час від часу проявляли турботу про своє здоров’я. Постійне піклування про своє здоров’я проявляла приблизно третина опитаних осіб у віці 55-64 років. Дещо меншим виявився відсоток чоловіків, які постійно турбувались про стан здоров’я, у віці 45-54 років. Серед чоловіків віком 45-64 років 18,2 % осіб зовсім не проявляли піклування щодо свого здоров’я.
Відсутність піклування про стан здоров’я є одним із найбільш важливих показників ментальних особливостей чоловіків, який призводить до пристрасті до шкідливих звичок, нераціонального харчування та недостатнього догляду за шкірою. Серед чоловіків віком 45-54 років, які не піклувались про стан свого здоров’я, палили тютюн 85,7 % осіб, а відносно часто (щотижня та частіше) вживали алкоголь 66,7 % осіб. Серед чоловіків віком 55-64 років за відсутності турботи про своє здоров’я відзначалась аналогічна ситуація: 86,7 % осіб палили тютюн і 60,0 % осіб відносно часто вживали алкогольні напої.
У чоловіків, які не піклувались про стан здоров’я, часто відзначалося нераціональне харчування. Серед чоловіків віком 45-54 років 9,5 % осіб вживали кисломолочні продукти більше 2 днів на тиждень, а у віці 55-64 років – лише 6,7 % опитаних. Протягом 5-7 днів на тиждень овочі та фрукти вживали 26,7 % чоловіків віком 55-64 років і 9,5 % чоловіків віком 45-54 років, які не піклувались про здоров’я. У той же час відсоток чоловіків, які майже щоденно вживали у їжу овочі та фрукти, був набагато вищим серед чоловіків, які турбувалися про здоров’я, та становив 45,7 % у віці 55-64 років і 30,8 % у віці 45-54 років. Лише 1-2 рази на тиждень вживали овочі та фрукти 40,0 % чоловіків віком 55-64 років і 61,9 % осіб віком 45-54 років, які не турбувалися про здоров’я.
Ментальні особливості чоловіків проявлялись і у їх звичних діях у випадку нездужання. Серед чоловіків, які піклувалися про стан здоров’я, у випадку захворювання за медичною допомогою звертались 52,2 % осіб віком 55-64 років і 38,5 % осіб віком 45-54 років. При цьому серед чоловіків віком 55-64 років, які не виявляли турботи про стан здоров’я, у випадку нездужання до лікаря звертались лише 6,7 % осіб. Жоден з чоловіків віком 45-54 років, який не піклувався про здоров’я, за медичною допомогою при захворюванні не звертався. Несвоєчасна медична допомога або повна її відсутність є одним із факторів виникнення та подальшого прогресування хронічних захворювань, у тому числі і хронічних дерматозів.
Недостатнє піклування про стан здоров’я призводить до його погіршення. Так, наприклад, у чоловіків, які не піклувалися про здоров’я, відзначено підвищення систолічного та діастолічного артеріального тиску порівняно з чоловіками, які проявляли турботу про здоров’я (табл. 4.18).
Були відзначені зміни стану шкіри у чоловіків, які менше уваги приділяли своєму здоров’ю. У чоловіків, які не піклувалися про стан здоров’я, була виявлена тенденція до зростання сухості, бальної оцінки порушень тургору шкіри та кількості зморшок (табл. 4.19). Отримана достовірна різниця за деякими клінічними показниками стану шкіри між групами чоловіків, які проявляли різну турботу про стан здоров’я. У чоловіків віком 45-54 років, які не проявляли піклування про стан здоров’я, встановлена достовірно вища кількість елементів висипки – маркерів старіння, достовірно більша вираженість зморшок, а також достовірно вища бальна оцінка за шкалою Yolanda R. Helfrich et. al. у порівнянні з особами, які виявляли турботу про своє здоров’я.
Таблиця 4.18 – Систолічний і діастолічний артеріальний тиск у чоловіків, які у різній мірі піклувалися про стан здоров’я (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64 рр. | Чоловіки віком 45-54 рр. | ||
| які піклувалися про здоров’я | які не піклувалися про здоров’я | які піклувалися про здоров’я | які не піклувалися про здоров’я | |
| САТ, мм рт. ст. | 133,6±1,14 | 138,3±2,70 | 128±1,01 | 133,3±2,25* |
| ДАТ, мм рт. ст. | 82,86±0,75 | 88,33±1,93* | 81,43±0,82 | 84,52±1,46 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, які піклувались і не піклувалися про стан здоров'я.
Таблиця 4.19 – Клінічні показники стану шкіри у чоловіків, які у різній мірі піклувалися про стан здоров’я (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 55-64рр. | Чоловіки віком 45-54рр. | ||
| які піклувалися про здоров’я | які не піклувалися про здоров’я | які піклувалися про здоров’я | які не піклувалися про здоров’я | |
| Сухість шкіри, бали | 0,529±0,083 | 1,333±0,187* | 0,253±0,066 | 0,571±0,148 |
| Порушення тургору, бали | 1,571±0,06 | 1,6±0,131 | 1,132±0,036 | 1,286±0,101 |
| Оцінка шкіри за шкалою Yolanda R. Helfrich et. al. | 4,471±0,116 | 4,867±0,274 | 2,967±0,109 | 3,571±0,213* |
| Кількість зморшок (4см2х3) | 12,43±0,232 | 13,73±0,589* | 10,85±0,243 | 12,1±0,577 |
| Вираженість зморшок, бали | 30,0±0,687 | 33,27±1,66 | 22,25±0,693 | 25,76±1,084* |
| Кількість елементів – маркерів старіння | 62,01±4,411 | 72,47±11,0 | 42,53±2,875 | 61,76±6,338* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників між групами чоловіків, які піклувались і не піклувалися про стан здоров'я.
Таким чином, результати клінічного дослідження говорять про те, що на фоні неналежного піклування про стан свого здоров’я у чоловіків погіршується стан шкіри та здоров’я організму у цілому.
4.8 Особливості соціально-побутових, психологічних параметрів і гомеостазу у чоловіків в умовах великого промислового міста та їх вплив на стан шкіри
Антропоекологічні проблеми промислових міст обумовлюють здоров’я їх мешканців і є одним із головних критеріїв якості навколишнього середовища [125].
Нами було проведено аналіз стану забруднення навколишнього середовища протягом останніх трьох років у великому промисловому місті Запоріжжя й екологічно менш забрудненому місті Мелітополь за даними Державного управління охорони навколишнього природного середовища у Запорізькій області та захворюваності мешканців цих міст на найбільш поширену дерматовенерологічну патологію за даними Департаменту охорони здоров’я Запорізької обласної державної адміністрації.
Запоріжжя протягом декількох останніх десятиріч відноситься до десятка міст України з найбільшим забрудненням навколишнього середовища [125]. Аналіз динаміки викидів забруднюючих речовин показав їх збільшення від стаціонарних джерел викидів у м. Запоріжжі протягом трьох років з 94,3 тис. т у 2009 році до 117,0 тис. т у 2011 році (табл.4.20).
Таблиця 4.20 – Динаміка викидів забруднюючих речовин в атмосферне повітря від стаціонарних джерел забруднення (тис. т)
| Місто | 2009 рік | 2010 рік | 2011 рік |
| Запоріжжя | 94,3 | 109,6 | 117,0 |
| Мелітополь | 0,9 | 0,7 | 0,8 |
Показники викидів у м. Запоріжжі більш ніж у 100 разів перевищують показники у м. Мелітополі. За цей період часу у м. Мелітополі спостерігалося зменшення частки викидів з 0,9 тис. т у 2009 році до 0,8 тис. т у 2011 році.
Динаміка викидів в атмосферне повітря найбільш поширених речовин стаціонарними джерелами в мм. Запоріжжі та Мелітополі наведена у табл. 4.21.
Таблиця 4.21 – Динаміка викидів стаціонарними джерелами в атмосферне повітря (тис. т)
| Місто | 2010 рік | 2011 рік | 2012 рік | ||||||||||||
| разом | в т. ч. | разом | в т. ч. | разом | в т. ч. | ||||||||||
| пил | діоксид сірки | діоксид азоту | оксид вуглецю | пил | діоксид сірки | діоксид азоту | оксид вуглецю | пил | діоксид сірки | діоксид азоту | оксид вуглецю | ||||
| Запоріжжя | 109,575 | 9,361 | 7,229 | 8,322 | 80,579 | 117,011 | 9,882 | 7,200 | 9,043 | 87,128 | 92,279 | 8,407 | 6,555 | 7,067 | 67,82 |
| Мелітополь | 0,742 | 0,261 | 0,040 | 0,136 | 0,071 | 0,825 | 0,266 | 0,046 | 0,155 | 0,097 | 0,762 | 0,216 | 0,049 | 0,154 | 0,089 |
На теперішній час концентрації шкідливих речовин не досягають екстремальних значень (у 5 разів вище гранично-припустимої та більше), що реєструвались у м. Запоріжжі до 1990 року. Однак, існуючий рівень забруднення атмосферного повітря м. Запоріжжя є критичним і може призвести до зростання числа хронічних захворювань і негативних тенденцій щодо демографічних показників населення.
Історично склалося так, що основними забруднювачами повітряного басейну м. Запоріжжя є підприємства металургії, на частку яких приходиться близько 80 % всіх промислових викидів (відкрите акціонерне товариство (ВАТ) металургійний комбінат «Запоріжсталь», ВАТ «Запорізький алюмінієвий комбінат», ВАТ «Запорізький завод феросплавів”, ВАТ «Запоріжабразив», ВАТ «Дніпроспецсталь», ВАТ «Запоріжкокс», ВАТ «Український графіт» та інші).
Для оцінки забруднення навколишнього середовища у м. Запоріжжі нами були використані результати, отримані Запорізьким обласним центром по гідрометеорології. Враховуючи особливості промисловості м. Запоріжжя особливу увагу було приділено забрудненню навколишнього середовища металами. Результати вимірів концентрацій шкідливих речовин в атмосфері трансформовані у кратність перевищення середньорічної гранично допустимої концентрації (ГДК) і надані на рис. 4.1. В останні роки в атмосфері міста перевищують ГДК концентрації бензапірену, пилу, фенолу,окисів азоту, вуглецю (рис. 4.1). Особливу небезпеку для мешканців м. Запоріжжя представляє речовина першого класу небезпеки з суттєвою канцерогенною, мутагенною дією – бензпірен. І хоча середньорічні значення концентрації в атмосфері окису сірки, формальдегіду, двоокису азоту не перевищували річну ГДК, проте дуже часто середньодобові значення перевищували ГДК. Крім того, особливе значення має поєднаний вплив різних шкідливих речовин. При аналізі ми звернули увагу на велику сумарну концентрацію окиснювачів, які постійно присутні в атмосфері м. Запоріжжя та можуть призводити до суттєвого пошкоджуючого ефекту при контакті з шкірою і слизовими оболонками.

Рисунок 4.1 – Забруднення атмосферного повітря м. Запоріжжя за 2010-2012 рр. (за даними обласного центру по гідрометеорології) у перерахунку на кратність ГДК.
При аналізі концентрацій металів в атмосфері м. Запоріжжя (рис. 4.2) не було виявлено перевищення ГДК. При порівнянні концентрації металів в атмосфері з фоновими необхідно відмітити перевищення рівня у промисловому місті на 1-2 порядки. Таким чином, концентрація металів в атмосфері промислового міста залишається вище природного фону.
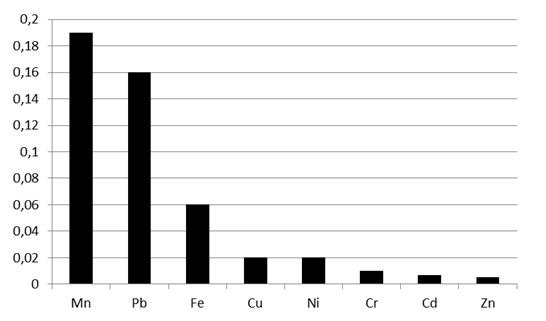
Рисунок 4.2 – Забруднення атмосферного повітря м. Запоріжжя металами за 2010-2012рр. (за даними обласного центру по гідрометеорології) у перерахунку на кратність ГДК.
Таким чином, проведений аналіз виявив чинники антропогенного забруднення великого промислового міста, які з певною вірогідністю можуть за рахунок оксидантного, канцерогенного і мутагенного ефекту впливати на мешканців міста та призводити до погіршення обміну речовин, стану здоров’я організму людини у цілому та шкіри зокрема.
Згідно офіційної статистики Департаменту охорони здоров’я Запорізької обласної державної адміністрації, на фоні несприятливої екологічної ситуації у містах Запоріжжя та Мелітополь спостерігається високий рівень захворюваності на дерматологічну патологію.
Як видно з рис. 4.3, у обох містах високою є захворюваність на екзему, псоріаз, мікози. У м. Запоріжжі захворюваність на екзему на 36,7 % вища, ніж в екологічно сприятливому м. Мелітополі (270,2 на 100 тис. населення проти 197,6 на 100 тис. відповідно); на псоріаз – на 75,4 % (147,5 на 100 тис. населення проти 84,1 на 100 тис. відповідно), що у 5,3 рази вище, ніж у цілому в Україні (28,0 на 100 тис. населення); на мікози – на 23,3 % (65,6 на 100 тис. населення проти 80,9 на 100 тис. відповідно); на алопецію – на 111,6 % (14,7 на 100 тис. населення проти 30,9 на 100 тис. відповідно). Але при цьому захворюваність на сифіліс у обох містах суттєво не відрізняється (9,4 на 100 тис. населення у м. Запоріжжі і 8,9 на 100 тис. у м. Мелітополі).
Рисунок 4.3 – Захворюваність мешканців міст Запоріжжя та Мелітополь на дерматовенерологічну патологію (на 100 тис. населення).
Таким чином, отримані дані проведеного аналізу ще раз підтверджують негативний зв’язок забруднення навколишнього середовища з захворюваністю мешканців на дерматологічну патологію.
Шляхом опитування нами було встановлено, що на стан шкіри та гомеостаз організму окрім проживання у різних умовах середовища впливали також інші фактори – соціально-побутові й економічні чинники, стан харчування. Було встановлено, що чоловіки, які проживали у м. Запоріжжі, частіше відзначали наявність частих стресів на роботі, ніж мешканці м. Мелітополя, (25,0 % проти 14,7 % відповідно, р<0,01). Несприятливий психологічний клімат у сім'ї також був більш властивим для жителів м. Запоріжжя – відзначався у 12,2 % осіб, а у м. Мелітополі – у 8,1 %. Шкідливі звички, такі як тютюнопаління та часте вживання алкогольних напоїв, зустрічалися з майже однаковою частотою у мешканців обох міст. Палили тютюн 45,3 % чоловіків, які проживали у м. Мелітополі, та 49,6 % мешканців м. Запоріжжя. Часто (1 раз на тиждень і частіше) спиртні напої вживали 25,0 % чоловіків з м. Мелітополя та 21,3 % осіб з м. Запоріжжя.
Важливе значення у формуванні змін шкіри відіграє не лише проживання у різній місцевості, а й у різних житлових умовах. Оскільки проживання у власному будинку з присадибною ділянкою зазвичай спричиняє підвищений вплив інсоляції на організм людини, а підвищена інсоляція – один з головних факторів, який викликає патологічні зміни шкіри, пришвидшує її старіння. Шляхом опитування було встановлено, що у власних будинках проживало 46,7 % мешканців м. Мелітополя та 31,7 % чоловіків з м. Запоріжжя. Отже, незважаючи на те, що мешканці м. Мелітополя зазнавали меншого антропогенного впливу, дії несприятливих екологічних умов, вони більше піддавалися впливу інсоляції, яка є значним пошкоджуючим агентом.
Однією з причин погіршення загального стану здоров’я та стану шкірного покрову можуть бути недостатні економічні можливості, які не дозволяють проводити адекватний догляд за шкірою та є перепоною до своєчасного лікування захворювань. Слід відзначити, що у м. Запоріжжі середній прибуток на одного члена родини був вищим, ніж у м. Мелітополі. Відсоток чоловіків з м. Запоріжжя, у яких середній прибуток на одного члена родини становив від 1000 до 2000 гривень на місяць, був у 1,5 рази вищим, ніж серед мешканців м. Мелітополя. Середній прибуток більше 2000 гривень на одного члена родини на місяць відзначали удвічі більше чоловіків з м. Запоріжжя порівняно з мешканцями м. Мелітополя. Менше 500 гривень середнього прибутку на одного члена родини у місяць мали у 2,7 рази більше мешканців м. Мелітополя, порівняно з м. Запоріжжя. Більш високий прибуток у мешканців м. Запоріжжя означав і більші можливості щодо рекреації, догляду за собою, проведення своєчасного лікування у випадках його необхідності.
Крім того, були проаналізовані анкетні відповіді чоловіків відносно їх харчування. Звернув на себе увагу той факт, що мешканці м. Запоріжжя частіше вживали кисломолочні продукти. 22,5 % опитаних у м. Запоріжжі чоловіків відзначили, що вони вживають кисломолочні продукти 3 і більше дні на тиждень. У мешканців м. Мелітополя цей відсоток становив лише 13,2 %. Частіше мешканці м. Запоріжжя вживали також м’ясо та м’ясні продукти: 3-4 дні на тиждень – 55,2 % і 5-7 днів на тиждень – 16,7 %. У м. Мелітополі лише 26,5 % чоловіків харчувались м’ясом та м’ясними продуктами 3-4 дні на тиждень і 10,4 % – 5-7 днів на тиждень. Відсоток осіб, які вживали м’ясо та м’ясні продукти тільки 1-2 дні на тиждень, був вищим у 2,3 рази у м. Мелітополі порівняно з м. Запоріжжя.
Проте у м. Мелітополі був вищим відсоток чоловіків, які майже щодня їли овочі та фрукти – 49,5 %, порівняно з м. Запоріжжя (32,1 %). Частіше мешканці м. Мелітополя вживали рибу та морепродукти: 3-4 дні на тиждень – 38,2 % чоловіків, 5-7 днів на тиждень – 14,6 % опитаних осіб. У той же час серед мешканців м. Запоріжжя лише 25,8 % осіб 3-4 дні на тиждень харчувались рибою, а майже щоденно її вживали 3,8 % чоловіків. Відсоток осіб, які вживали рибу та морепродукти тільки 1-2 дні на тиждень, був у 1,5 рази вищим у м. Запоріжжі порівняно з м. Мелітополем.
Отже, на мешканців великих промислових центрів негативно впливають екологічні чинники, проте на кожну особу незалежно від місця її проживання діє цілий комплекс різноманітних факторів зовнішнього середовища, які інколи можуть переважувати вплив екологічних чинників. Так, був відзначений більший вплив інсоляції на мешканців міст меншої величини з нижчим антропогенним забрудненням.
Слід сказати, що життя у сучасному великому промисловому місті постійно супроводжується чисельними психогенними впливами як на роботі та навчанні, так і у побутових умовах. Це може призводити до змін психологічного стану мешканців великих промислових центрів.
Проведені дослідження показали, що у чоловіків, які мешкали у м. Запоріжжі, рівень ситуативної тривожності за шкалою самооцінки Спілбергера-Ханіна був достовірно вищим, ніж у чоловіків, які проживали у м. Мелітополі (табл. 4.22), хоча рівень особистісної тривожності за шкалою самооцінки Спілбергера-Ханіна у мешканців обох міст був однаковим. Про зміни психогенного стану мешканців великого промислового міста свідчить також достовірно вищий рівень невротизації за методикою діагностики Л. І. Вассермана порівняно з рівнем у мешканців м. Мелітополя. Підвищений рівень невротизації свідчить про емоційну збудливість, в результаті чого виникають негативні переживання (тривожність, напруга, занепокоєння, розгубленість, подразливість), а також про егоцентричну особистісну направленість, яка призводить до іпохондричної фіксації на соматичних відчуттях і особистих недоліках. Вказані вище особливості є тим фоном, на якому значно частіше розвиваються патологічні зміни у шкірі.
Таблиця 4.22 – Рівні ситуативної та особистісної тривожності, невротизації та депресії у мешканців різних міст (М±m)
| Показники, одиниці вимірювання | Чоловіки, які проживали: | |
| у м. Мелітополі | у м. Запоріжжі | |
| Рівень особистісної тривожності за шкалою Спілбергера-Ханіна, бали | 38,37±0,34 | 38,35±0,33 |
| Рівень ситуативної тривожності за шкалою Спілбергера-Ханіна, бали | 38,53±0,19 | 39,13±0,17* |
| Рівень невротизації за Л.І. Вассерманом, бали | 4,594±0,22 | 5,604±0,21* |
| Рівень депресії за шкалою Бека, бали | 4,321±0,33 | 5,088±0,30 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників у чоловіків, які проживали у м. Мелітополі та м. Запоріжжі.
Результати власних досліджень стану шкіри у чоловіків, які мешкали в умовах різних міст, наведені в табл. 4.23. У чоловіків, які проживали у великому промисловому місті – Запоріжжі, та мешканців міста меншої величини – Мелітополя не відзначалося різниці за сухістю та тургором шкіри. Це пов’язано з тим, що на шкіру чоловіків, з одного боку, впливали шкідливі екологічні фактори зовнішньої середи, характерні для м. Запоріжжя, а з іншого боку, мешканці м. Мелітополя більше піддавалися впливу інсоляції. Крім того, велику роль у змінах стану шкіри відіграють ментальні та психологічні особливості. Кількість зморшок і їх вираженість не відрізнялись у осіб, які мешкали у різних містах. Однаковою була також оцінка стану шкіри за шкалою Yolanda R. Helfrich et. al.
Таблиця 4.23 – Клінічні показники стану шкіри у мешканців різних міст (М±m)
| Показники, одиниці вимірювання | Мешканці м. Мелітополя | Мешканці м. Запоріжжя |
| Сухість шкіри, бали | 0,17±0,03 | 0,18±0,03 |
| Порушення тургору шкіри, бали | 1,01±0,04 | 1,04±0,02 |
| Кількість зморшок (4см2х3) | 7,77±0,26 | 7,65±0,24 |
| Оцінка вираженості зморшок шкіри, бали | 16,48±0,54 | 16,70±0,58 |
| Оцінка шкіри за Yolanda R. Helfrich et. al. | 1,93±0,11 | 2,07±0,09 |
| Кількість елементів – маркерів старіння | 31,58±1,81 | 31,43±1,96 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників у чоловіків, які проживали у м. Мелітополі та м. Запоріжжі.
У чоловіків, які мешкали у великому промисловому місті та місті меншої величини, не було відзначено різниці за кількістю елементів висипки – маркерів старіння, що також може бути пояснене впливом різноманітних пошкоджуючих факторів на організм людини – екологічних, кліматичних, соціально-побутових, ментальних і психологічних.
Були відзначені відмінності у мікробіоценозі шкіри серед чоловіків, які проживали у різних містах (табл. 4.24). У чоловіків, які проживали у м. Запоріжжі, відзначаласяь вища загальна кількість бактерій і кількість коагулазопозитивних стафілококів на шкірі порівняно з мешканцями м. Мелітополя. При цьому отримана достовірна різниця за кількістю коагулазопозитивних стафілококів між групами чоловіків, які проживали у великому промисловому місті – Запоріжжі та місті меншої величини – Мелітополі, що може говорити про формування дисбіотичного стану у мешканців великих індустріальних центрів, який може сприяти виникненню та прогресуванню дерматологічних захворювань. Крім того, стан мікрофлори шкіри є відображенням загального стану здоров’я людини. Навіть невеликі відхилення у стані здоров’я змінюють відносну сталість мікрофлори шкіри. Дані порушення відбуваються ще до появи клінічних ознак ураження, що і спостерігалось у обстежених чоловіків. На фоні відносно сталого стану шкіри у осіб, які мешкали у великому промисловому місті – Запоріжжі, за даними статистики, відзначалася вища захворюваність на псоріаз, екзему, алопеції, мікози шкіри, порівняно з мешканцями міста меншої величини – Мелітополя.
Мікробіологічні відмінності у чоловіків, які мешкали в умовах різних міст, спостерігались і при проведенні бактеріологічного дослідження слизової оболонки ротоглотки. Отримана достовірна різниця за інтегральним показником кількості умовно-патогенної флори у ротоглотці між особами, які проживали у великому промисловому місті – Запоріжжі та місті меншої величини – Мелітополі (табл. 4.24). Кількість умовно-патогенної флори була вищою у мешканців м. Запоріжжя. У результаті дослідження була також відзначена достовірно вища кількість гемофільних паличок у ротоглотці чоловіків з м. Запоріжжя порівняно з мешканцями м. Мелітополя.
У чоловіків, які проживали у великому промисловому місті – Запоріжжі, встановлена достовірно нижча кількість біфідобактерій і лактобактерій, порівняно з особами, які мешкали у місті меншої величини – Мелітополі (табл. 4.24). Також була встановлена достовірна різниця за кількістю неферментуючої кишечної палички між тими ж групами обстежених чоловіків – її кількість була вищою у мешканців м. Запоріжжя. Отже, для чоловіків, які проживали в умовах великого промислового міста, характерні зміни не лише мікробіоценозу шкіри, але і ротоглотки та кишечника, що є одним із факторів розвитку патологічних дерматологічних захворювань.
Таблиця 4.24 – Стан мікробного пейзажу шкіри, слизової оболонки ротоглотки та кала у мешканців різних міст (М±m)
| Показники | Мешканці м. Мелітополя | Мешканці м. Запоріжжя |
| Загальна кількість бактерій шкіри, Lg КУО/см2 | 3,029±0,104 | 3,35±0,131 |
| Стафілококи коагулазопозитивні шкіри, Lg КУО/см2 | 0,167±0,115 | 0,696±0,207* |
| Інтегральний показник кількості умовно-патогенної флори ротоглотки, Lg КУО/мл | 4,73±0,90 | 8,21±0,83* |
| Гемофільні палички (Haemophylus influenzaе) ротоглотки, Lg КУО/мл | 0,475±0,222 | 1,45±0,303* |
| Біфідобактерії кала, Lg КУО/г | 8,93±0,13 | 8,49±0,11* |
| Лактобактерії кала, Lg КУО/г | 7,01±0,14 | 6,5420,12* |
| Кишечна паличка неферментуюча кала, Lg КУО/г | 0,46±0,19 | 1,1±0,24* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників у чоловіків, які проживали у м. Мелітополі та м. Запоріжжі.
Крім того, було проведене дослідження щодо визначення змін метаболізму у мешканців великого промислового міста. У осіб, які проживали у великому індустріальному центрі, встановлене достовірне підвищення кількості ТБК-АП при незмінній загальній АОА у порівнянні з результатами, отриманими у мешканців міста меншої величини (табл. 4.25).
Це призводило до достовірного зменшення коефіцієнта антиокислювального захисту у мешканців м. Запоріжжя, що свідчить про превалювання процесів активації ПОЛ у мешканців великого індустріального центру та неадекватну реакцію антиоксидантного захисту.
Таблиця 4.25 – Стан системи ПОЛ-АОС у мешканців різних міст (М±m)
| Показники, одиниці вимірювання | Чоловіки, які проживали | |
| у м. Мелітополі | у м. Запоріжжі | |
| ТБК-АП, ммоль/л | 2,69±0,021 | 2,82±0,028* |
| Загальна АОА, % | 65,09±0,264 | 64,83±0,205 |
| КАОЗ | 24,23±0,193 | 23,03±0,329* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників у чоловіків, які проживали у м. Мелітополі та м. Запоріжжі.
Був проведений добовий моніторинг активності системи ПОЛ-АОС у мешканців двох міст (рис. 4.4). Крива добових змін ТБК-АП представляє собою синусоїду з максимальними значеннями у вечірній час і мінімальними – у ранковий. У мешканців м. Запоріжжя концентрація ТБК-АП протягом доби була постійно вищою, ніж у мешканців м. Мелітополя. Добова крива загальної АОА також має синусоїдоподібний вигляд з максимальними значеннями у вечірній час і мінімальними – у ранкові години. У мешканців м. Запоріжжя крива має меншу амплітуду, не має такого підвищення у вечірні години у відповідь на збільшення концентрації ТБК-АП, як у мешканців м. Мелітополя. Це відображається і на кривій взаємовідносин між системами ПОЛ-АОС. Протягом усієї доби КАОЗ у мешканців м. Запоріжжя був меншим, ніж у мешканців м. Мелітополя з найменшими значеннями у вечірні години. Вищенаведене свідчить про порушення функціонування системи ПОЛ-АОС з превалюванням активності ПОЛ у вечірні години у мешканців м. Запоріжжя.
Крім того, була встановлена достовірна різниця за відсотком гемолізу у 0,45 % розчині NaCl у мешканців м. Запоріжжя (24,05±0,421) порівняно з мешканцями м. Мелітополя (22,63±0,512). Збільшення гемолізу у мешканців м. Запоріжжя свідчить про наявність тенденції до погіршеного стану клітин. Проведені дослідження показали, що у мешканців великого промислового міста Запоріжжя концентрація середніх молекул була на 13,1 % вищою, ніж у мешканців міста меншої величини – Мелітополь (табл. 4.26). Отримані результати говорять про підвищений рівень ендотоксикозу у мешканців великих індустріальних центрів, що вірогідно пов’язане з чинниками довкілля та порушеного обміну речовин в організмі.
Таблиця 4.26 – Рівні середніх молекул у мешканців різних міст (М±m)
| Показники, одиниці вимірювання | Чоловіки, які проживали | |
| у м. Мелітополі | у м. Запоріжжі | |
| СМ1, у. о. | 0,305±0,004 | 0,345±0,003* |
| СМ2, у. о. | 0,147±0,004 | 0,16±0,004* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників у чоловіків, які проживали у м. Мелітополі та м. Запоріжжі.
У мешканців м. Запоріжжя також встановлені достовірно вищі рівні адреналіну, норадреналіну, дофаміну та ДОФА у добовій сечі порівняно з мешканцями м. Мелітополя (табл. 4.27). Отримані дані вказують на підвищення функціональної активності та резервних можливостей симпатоадреналової системи у мешканців великого промислового центра.
Таблиця 4.27 – Екскреція катехоламінів з сечею, рівні кортизолу та інсуліну в крові у мешканців міст (М±m)
| Показники, одиниці вимірювання | Мешканці м. Мелітополя | Мешканці м. Запоріжжя |
| Адреналін, нмоль/добу | 35,91±0,312 | 38,23±0,503* |
| Норадреналін, нмоль/добу | 84,24±1,504 | 92,59±1,223* |
| Дофамін, нмоль/добу | 1694±11,81 | 1734±14,28* |
| ДОФА, нмоль/добу | 193,2±1,574 | 211,5±2,269* |
| Кортизол, нмоль/л | 273,5±1,249 | 290,7±3,197* |
| Інсулін, мкМО/мл | 7,15±0,031 | 7,266±0,051* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні відповідних показників двох груп.
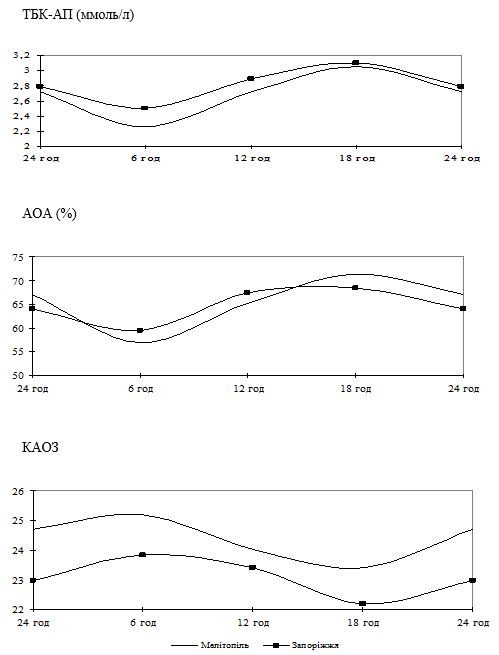
Рисунок 4.4 – Криві добових змін концентрацій ТБК-АП, АОА та КАОЗ у мешканців різних міст
У мешканців м. Запоріжжя відзначалося зменшене співвідношення А:НА, ДА:Д і збільшене – НА:ДА порівняно з результатами у мешканців м. Мелітополя (рис. 4.5). Отримані дані свідчать про наявні у мешканців м. Запоріжжя тенденції до гальмування біосинтезу катехоламінів на етапі ДОФА-дофамін і про прискорення перетворення дофаміну у норадреналін, що може бути результатом зниження у них активності ферменту ДОФА-декарбоксилази та збільшення активності дофамін-ß-оксидази.
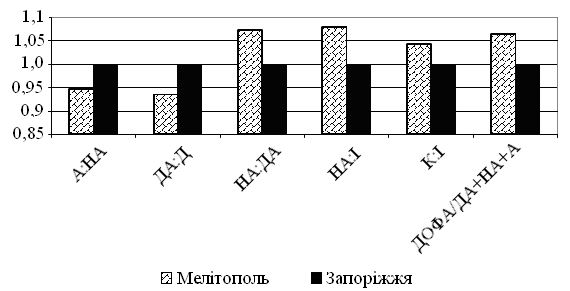
Рисунок 4.5 – Співвідношення гормонів і медіаторів у мешканців різних міст.
При різнонаправленому характері біосинтезу катехоламінів на етапах ДОФА–ДА та ДА–НА спостерігалося достовірне збільшення їх екскреції з сечею. Таке поєднання швидкостей синтезу й екскреції ДОФА, дофаміну та норадреналіну з сечею можна розглядати як результат підвищеної секреції дофаміну центральними дофамінергічними структурами, норадреналіну – центральними та периферичними утвореннями симпатичної нервової системи, а також деякого відставання швидкості синтезу дофаміну та норадреналіну від швидкості їх секреції.
Коефіцієнт ДОФА/ДА+НА+А був вищим у мешканців м. Запоріжжя порівняно з мешканцями м. Мелітополя, що свідчить про гальмування переходу ДОФА у катехоламіни.
Виявлене у мешканців м. Запоріжжя зниження коефіцієнту А:НА є наслідком більш вираженого у порівнянні з адреналіном збільшення екскреції норадреналіну, що вказує на перевагу у цих осіб тонусу та реактивності нервової ланки адренергічної системи над гормональною.
Результати вивчення екскреції та обміну катехоламінів у мешканців м. Запоріжжя дають підстави констатувати, що підвищення у них функціональної активності та резервних можливостей симпатоадреналової системи супроводжувалося дисоціацією в активності ланок (НА-тип дисоціації), порушеннями у біосинтезі катехоламінів у вигляді невідповідності швидкостей синтезу дофаміну з ДОФА та норадреналіну з дофаміну, а також превалювання швидкості секреції дофаміну та норадреналіну над швидкістю їх синтезу. Зазначені вище особливості функціонування симпатоадреналової системи вказують на її дисфункцію, неспроможність, оскільки відомо, що при збереженні системою фізіологічного стану функціональної активності спостерігається однонаправлений характер змін біосинтезу, а також динамічна рівновага між процесами біосинтезу та секреції.
Концентрації кортизолу та інсуліну в крові у мешканців м. Запоріжжя достовірно перевищували значення, отримані у мешканців м. Мелітополя. У мешканців м. Запоріжжя був вищим коефіцієнт К:І.
Дослідження функціонального стану вегетативної нервової системи виявило синергічне підвищення активності її симпатичного та парасимпатичного відділів. Разом з тим, орієнтуючись на кількісні співвідношення величини екскреції норадреналіну та рівня інсуліну у крові, а також на величину коефіцієнта НА:І, можна говорити про превалювання тонусу та реактивності симпатичної нервової системи над парасимпатичною і, відповідно, про наявні порушення вегетативного гомеостазу у мешканців м. Запоріжжя.
Отримані результати кількісного аналізу показників активності симпатоадреналової, вагоінсулярної систем і глюкокортикоїдної функції надниркових залоз вказують на однонаправлене підвищення їх активності, а також, судячи за величиною коефіцієнта К:І, підвищення активності компенсаторних процесів тяжкості тканинних пошкоджень, викликаних стресором, які розвиваються у мешканців великого промислового міста. Проте наявність функціональної неспроможності симпатоадреналової системи та вегетативної дисфункції не дозволяють оцінювати реакцію систем, що вивчаються, як адекватну силі подразника, а тому її слід розглядати як стресову, що відповідає стадії тривоги стрес-реакції, а сам подразник за його силою – як надзвичайний.
Ступінь напруги нервової ланки симпатоадреналової системи (за результатами кількісного аналізу) перевищував напруження глюкокортикоїдної функції надниркових залоз і вагоінсулярної системи та, судячи за дисоціацією в активності ланок симпатоадреналової системи та характером порушень в обміні катехоламінів, перевищував фізіологічну межу реагування.
Наведені дані дозволяють стверджувати, що активна реакція нервової ланки симпатоадреналової системи, що є необхідним елементом фізіологічної реакції захисно-пристосувальних механізмів, у даному випадку виконує не лише саногенетичну, а й патогенетичну роль і може розглядатись як важливий фактор розвитку патологічних станів, які частіше діагностуються у мешканців великих промислових міст.
Нами не було отримано достовірної різниці за рівнями статевих і гонадотропних гормонів, ТЗГ між мешканцями двох міст. У чоловіків з м. Запоріжжя виявлена достовірно вища бальна оцінка за шкалою AMS [(27,36±0,24) балів] порівняно з жителями м. Мелітополя [(25,85±0,29) балів].
Таким чином, у мешканців великого індустріального центру встановлені зміни у активності симпатоадреналової та вагоінсулярної системи, глюкокортикоїдної функції надниркових залоз, інші особливості гормонального статусу. Відзначені зміни мікробіоценозу як шкіри, так і вмісту ротоглотки та кишечнику, характерні для осіб, які проживають в умовах промислового міста. Крім того, у чоловіків, які проживають у індустріальному центрі, встановлені особливості психологічного статусу та ментальні особливості. Весь цей комплекс факторів може чинити несприятливий вплив на шкірні покрови та сприяти виникненню дерматологічної патології, що проявляється (за даними статистики) у вищій захворюваності на псоріаз, екзему та інші дерматози чоловіків, які проживають в умовах великого промислового міста.
* * *
Наведені у розділі 4 результати дослідження дозволяють говорити про негативний вплив на стан шкіри, гомеостаз організму чоловіків тютюнопаління, частого вживання алкоголю, недостатнього вживання овочів, фруктів, кисломолочних продуктів у раціоні харчування, підвищеної ситуативної тривожності, недостатнього піклування про стан свого здоров’я, проживання в умовах великого промислового міста.
Результати, отримані при проведенні дослідження, наведені в розділі 4, опубліковані в наступних друкованих працях:
1. Резніченко Н. Ю. Діагностика, лікування та профілактика псоріатичної хвороби у чоловіків у віковому аспекті / Н. Ю. Резніченко. – Запоріжжя : Просвіта, 2014. – 308 с.
2. Резніченко Н. Ю. Діагностика, лікування та профілактика алергодерматозів чоловіків у віковому аспекті / Н. Ю. Резніченко. – Запоріжжя : Просвіта, 2014. – 132 с.
3. Корекція дисбіотичних станів у мешканців індустріальних центрів / Ю. Г. Резніченко, Н. Ю. Резніченко, Г. І. Резніченко, М. О. Ярцева. – Запоріжжя : Просвіта, 2013. – 148 с.
4. Вітамінопрофілактика та вітамінотерапія мешканців промислових центрів / Н. Ю. Резніченко, Ю. Г. Резніченко, Г. І. Резніченко, І.В. Пащенко. – К.: ТОВ “Людопринт Україна”, 2013. – 108 с.
5. Резніченко Н. Ю. Вплив недостатнього вживання овочів і фруктів на стан шкіри та загальний стан здоров’я чоловіків / Н. Ю. Резніченко // Запорож. мед. журн. – 2015. – №1 (88). – С. 83–86.
6. Дюдюн А. Д. Вплив частого вживання алкоголю на стан шкіри та загальний стан здоров’я чоловіків / А. Д. Дюдюн, Н. Ю. Резніченко // Медичні перспективи. – 2015. – Т. 20, № 1. – С. 98–103.
7. Резніченко Н. Ю. Зміни симпато-адреналової та вагоінсулярної систем у мешканців гіперурбанізованих міст / Н. Ю.Резніченко // Актуальні проблеми акушерства і гінекології клінічної імунології та медичної генетики : зб. наук. праць. –К. ; Луганськ, 2013. – Вип. 26. – С. 454–463.
8. Резніченко Н. Ю. Метаболічні зміни у мешканців великих індустріальних центрів / Н. Ю. Резніченко // Актуальні проблеми сучасної медицини = Вісник Укр. мед. стомат. академії. – 2013. – Т. 13, вип. 3 (43). – С. 238–241.
9. Резніченко Н. Ю. Нормалізація біотопів за допомогою пробіотиків у жителів індустріальних центрів / Н. Ю. Резніченко // Гастроентерологія. – 2014. – № 1 (51). – С. 27–30.
10. Резніченко Н. Ю. Профілактика змін біотопів у чоловіків – мешканців великих промислових міст за допомогою пробіотиків / Н. Ю. Резніченко // Матеріали наук.-практ. конф. з участю між нар. спеціалістів, присвяч. дню науки «Внесок молодих спеціалістів в розвиток медичної науки і практики. – Х., 2014. – С. 169–170.
РОЗДІЛ 5
Шляхи медикаментозної корекції негативного впливу умов великого промислового міста на стан здоров’я чоловіків
У попередніх розділах наведені дані щодо особливостей стану шкірного покрову, мікробіоценозу, кровообігу та гомеостазу, а також ментальних і психологічних особливостей у чоловіків різного віку. Одночасно встановлено, що у мешканців великого індустріального центру відзначаються підвищені рівні тривожності та невротизації, активація симпатоадреналової системи, перекисного окислення ліпідів, погіршення мікроциркуляції у судинах. З віком порушуються взаємовідносини у симпатоадреналовій системі, системі ПОЛ-АОС з превалюванням процесів ПОЛ, значно погіршується мікроциркуляція у судинах, знижується концентрація тестостерону, підвищується концентрація у крові холестерину, тригліцеридів, ФСГ, ЛГ, пролактину, зростає бальна оцінка старіння та андрогенного дефіциту чоловіків за шкалою AMS. На фоні цих змін відбувається погіршення стану здоров’я чоловіків, у тому числі і шкіри (зменшується тургор шкіри, зростають кількість і вираженість зморшок, збільшується бальна оцінка ознак старіння фотозахищених ділянок шкіри, зростає кількість елементів висипки – маркерів старіння, спостерігається ріст частоти дерматологічних захворювань – як гострих, так і хронічних). Дані факти вимагають пошуку шляхів можливої корекції виявлених змін з метою як профілактики патологічних змін шкіри, гострих і хронічних дерматозів, так і загальносоматичних захворювань. Оздоровчі заходи мають враховувати виявлені вікові зміни у чоловіків. Оскільки у чоловіків віком 35-44 років, які мешкають у великому промисловому місті, були виявлені зміни гомеостазу, порушення обміну ліпідів, нами розглянута можливість корекції виявлених порушень за допомогою профілактичних курсів вітамінотерапії. Для чоловіків віком 45-54 років розглянута можливість корекції виявлених порушень за допомогою пробіотичного препарату або комплексного застосування краталу та вверцетину. Найбільші зміни були виявлені у чоловіків віком 55-64 років. Була розглянута ефективність застосування антиоксидантного, цитопротекторного та ноотропного препарату для корекції виявлених змін у чоловіків цієї вікової групи. Враховуючи знижену концентрацію тестостерону у чоловіків віком 55-64 років розглянута ефективність профілактичного застосування трібестану. Отримані матеріали надані нижче у цьому розділі.
5.1 Корекція змін стану шкіри та гомеостазу організму у чоловіків віком 35-44 років з застосуванням вітамінотерапії
Було проведене дослідження щодо визначення ефективності застосування оздоровчих курсів полівітамінних комплексів і комбінації біотину та декспантенолу для корекції вікових змін стану шкіри та гомеостазу організму у чоловіків віком 35-44 років. Було обстежено 128 чоловіків віком 35-44 років без ознак дерматологічних захворювань, які мешкали в умовах великого промислового міста.
Результати проведених досліджень стану шкіри у чоловіків віком 35-44 років у процесі оздоровлення комплексом полівітамінів з мікроелементами та поєднаним застосуванням біотину та декспантенолу надані на табл. 5.1. Профілактичний курс як полівітамінів, так і окремого використання біотину та декспантенолу чинив позитивний клінічний ефект на стан шкірного покрову (табл. 5.1). У чоловіків, які приймали біотин і декспантенол, по завершенню курсу їх використання відзначалася тенденція до покращення тургору шкіри. Бальна оцінка сухості шкіри після оздоровлення у них знижувалася більш, ніж у 2 рази. Крім того, отримана достовірна різниця за бальною оцінкою стану шкіри за шкалою Yolanda R. Helfrich et al. у чоловіків віком 35-44 років до та після курсу оздоровлення біотином і декспантенолом. Достовірно меншу бальну оцінку стану шкіри за шкалою Yolanda R. Helfrich et al., а також відсутність сухості шкіри встановлено у осіб, які пройшли профілактичний курс полівітамінів з мікроелементами, порівняно з аналогічними показниками у групі чоловіків до оздоровлення. Застосування полівітамінів з мікроелементами сприяло також покращенню тургору шкіри, хоча за даними показниками достовірної різниці встановлено не було.
Таблиця 5.1 – Клінічні показники стану шкіри у чоловіків віком 35-44 років у процесі оздоровлення вітамінами (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 35-44 років | ||
| до оздоровлення | після курсу полівітамінів | після курсу біотину та декспатенолу | |
| Сухість шкіри, бали | 0,063±0,022 | 0,0±0,0* | 0,029±0,029 |
| Порушення тургору, бали | 0,93±0,025 | 0,87±0,057 | 0,86±0,06 |
| Оцінка стану шкіри за Yolanda R. Helfrich et. al | 1,18±0,101 | 0,816±0,135* | 0,8±0,147* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками до оздоровлення.
Отримані дані свідчать про клінічну ефективність оздоровчих курсів вітамінів щодо стану шкірного покрову. Також було відзначено позитивний вплив вітамінів на гомеостаз організму. Як було вказано у попередніх підрозділах, у чоловіків, які проживають у великому промисловому місті, відзначалися порушення функціонування системи ПОЛ-АОС. Було доведено, що профілактичне використання полівітамінів призводило до покращення процесів у системі ПОЛ-АОС і наближення значень їх основних показників до рівнів, отриманих у чоловіків аналогічного віку, які мешкали у місті меншої величини – Мелітополі (табл. 5.2 і рис. 5.1).
Як видно з таблиці, у чоловіків віком 35-44 років, які застосовували курси полівітамінів і мікроелементів, відзначалася тенденція до зниження рівня ТБК-АП. Загальна АОА і КАОЗ після курсу оздоровлення були достовірно вищими порівняно з групою осіб до оздоровлення. Це свідчить про тенденцію до нормалізації процесів ПОЛ і покращення функціонування антиокислювальної системи на фоні використання полівітамінних комплексів.
Таблиця 5.2 – Стан системи ПОЛ-АОС у чоловіків віком 35-44 років у процесі оздоровлення вітамінами (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 35-44 років | |
| до оздоровлення | після курсу полівітамінів | |
| ТБК-АП, ммоль/л | 2,73±0,029 | 2,69±0,02 |
| Загальна АОА, % | 64,5±0,42 | 66,4±0,44* |
| КАОЗ | 23,69±0,22 | 24,73±0,16* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками до оздоровлення.
У результаті дослідження було встановлено також покращення добових ритмів коливання активності системи ПОЛ-АОС. У чоловіків віком 35-45 років після курсу застосування полівітамінів крива добових змін концентрації ТБК-АП розташовувалася нижче від добової кривої значень, отриманих до проведення оздоровлення, та наближувалася до добової кривої у осіб, які мешкали у м. Мелітополі (рис. 5.1).
Крім того, відзначалося збільшення амплітуди кривої добових змін загальної АОА після курсу вітамінопрофілактики у чоловіків віком 35-44 років порівняно з кривою добових змін у мешканців великого промислового міста до проведення оздоровлення.
Нормалізація процесів ПОЛ і покращення функціонування АОС у чоловіків після курсу вітамінопрофілактики призводили до наближення кривої добових змін КАОЗ до добової кривої у мешканців міста з меншим антропогенним навантаженням.
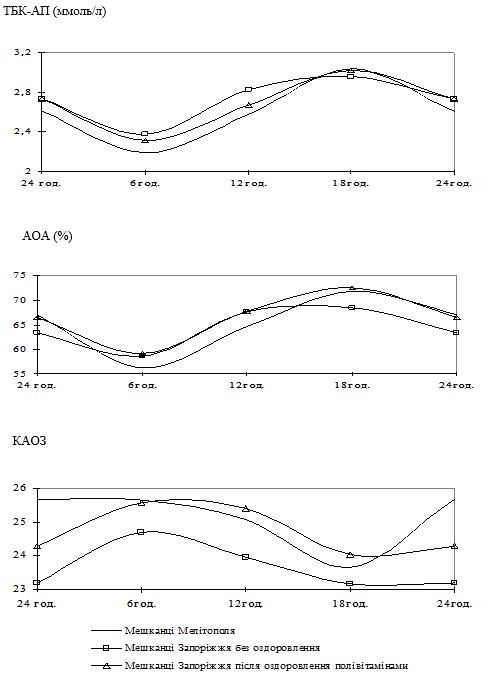
Рисунок 5.1 – Добові зміни концентрацій ТБК-АП, АОА та КАОЗ у процесі оздоровлення полівітамінами чоловіків віком 35-44 років
Також був відзначений позитивний вплив профілактичних курсів полівітамінних засобів і поєднаного застосування біотину та декспантенолу на стан ліпідного та вуглеводного обміну у чоловіків віком 35-44 років (табл. 5.3). Кращий результат щодо нормалізації ліпідного та вуглеводного обміну досягався при поєднаному застосуванні біотину та декспантенолу. Після курсу використання біотину та декспантенолу відзначена достовірно нижча концентрація холестерину, β-ліпопротеїдів і тригліцеридів порівняно з їх значеннями до оздоровчого курсу.
Таблиця 5.3 – Концентрація ліпідів і глюкози у крові чоловіків віком 35-44 років у процесі оздоровлення вітамінами (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 35-44 років | ||
| до оздоровлення | після курсу полівітамінів | після курсу біотину та декспатенолу | |
| Холестерин, ммоль/л | 3,63±0,027 | 3,55±0,038 | 3,47±0,039* |
| β-ліпопротеїди, % | 41,4±0,36 | 39,6±0,71* | 37,3±0,70* |
| Тригліцериди, ммоль/л | 1,31±0,043 | 1,27±0,034 | 1,18±0,026* |
Примітка: * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками до оздоровлення.
У осіб віком 35-44 років на фоні використання оздоровчих вітамінних курсів відзначалося також покращення бальної оцінки старіння чоловіків і андрогенного дефіциту за шкалою AMS. Оцінка за шкалою AMS у чоловіків віком 35-44 років до оздоровлення становила (26,55±0,29) балів, а після курсу полівітамінів з мікроелементами була достовірно меншою – (25,19±0,47) балів. Достовірно нижчою була оцінка за шкалою AMS і у осіб, які використовували курси біотину та декспантенолу – (25,37±0,47) балів. Ці дані свідчать про зменшення проявів старіння та андрогенного дефіциту у чоловіків як на фоні профілактичного використання полівітамінних засобів з мікроелементами, так і на тлі поєднаного застосування біотину та декспантенолу.
Отримані дані свідчать не лише про клінічну, але й біохімічну ефективність використання профілактичних курсів вітамінних засобів. При цьому було доведено вищу ефективність поєднаного застосування біотину та декспантенолу щодо нормалізації ліпідного обміну у чоловіків віком 35-44 років. Проведені дослідження дозволяють рекомендувати широке застосування вітамінопрофілактики (як комплексів полівітамінів з мікроелементами, так і поєднаного використання біотину та декспантенолу) для збереження здоров’я чоловіків віком 35-44 років і уповільнення інволютивних змін шкіри.
5.2 Покращення стану шкіри та метаболізму у чоловіків віком 45-54 років з використанням пробіотичних засобів
У попередніх розділах було показано, що у мешканців індустріальних центрів з високим антропогенним навантаженням відзначаються порушення стану здоров’я, що супроводжуються змінами біотопів організму. У ході дослідження була розглянута можливість покращення стану шкіри та нормалізації біотопів організму у чоловіків – мешканців промислового міста віком 45-54 років шляхом використання пробіотику.
Результати проведених досліджень стану шкіри у чоловіків віком 45-54 років у процесі оздоровлення пробіотиком надані на табл. 5.4. Профілактичний курс застосування пробіотику чинив позитивний клінічний ефект на стан шкіри. У чоловіків по завершенню профілактичного курсу відзначалася тенденція до зменшення сухості шкіри. Крім того, отримана достовірна різниця за бальною оцінкою стану шкіри за Yolanda R. Helfrich et al. у чоловіків віком 45-54 років до та після курсу оздоровлення пробіотиком.
У чоловіків віком 45-54 років, які застосовували пробіотик, відзначалося достовірне зменшення загальної кількості бактерій на шкірі, кишечної палички неферментуючої, протея та грибів роду Candida у калі, умовно-патогенної флори у ротоглотці; достовірне збільшення біфідо- та лактобактерій кала порівняно з групою осіб до оздоровлення (табл. 5.5).
Таблиця 5.4 – Клінічні показники стану шкіри у чоловіків віком 35-44 років у процесі оздоровлення пробіотиком (М±m)
| Показники | Мешканці м. Мелітополя віком 45-54 років | Мешканці м. Запоріжжя віком 45-54 років |
|
| до оздоровлення | після застосування пробіотику | ||
| Сухість шкіри, бали | 0,278±0,049 | 0,313±0,061 | 0,175±0,060 |
| Порушення тургору шкіри, бали | 1,11±0,04 | 1,16±0,04 | 1,16±0,06 |
| Оцінка шкіри за Yolanda R. Helfrich et. al | 2,86±0,13 | 3,08±0,10 | 2,66±0,17* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків до та після оздоровлення пробіотиком.
Основні показники стану мікробіоценозу шкіри, калу та ротоглотки у чоловіків після оздоровчого курсу пробіотику досягали рівнів здорових осіб, які мешкали у м. Мелітополі. Отже, профілактичне використання пробіотику сприяє не лише збільшенню кількості біфідо- та лактобактерій кишечника, але й зменшенню кількості умовно-патогенної флори біотопів організму.
Таким чином, результати проведених досліджень свідчать про коригуючий вплив пробіотику на зміни у біотопах мешканців промислових міст. Звертає на себе увагу нормалізація не лише біотопу кишечника, але і ротоглотки та шкіри, що ще раз доводить правильність гіпотези про системність змін мікробіоценозу організму людини. Отримані дані дозволяють рекомендувати використання пробіотику для нормалізації біотопів у мешканців великих промислових міст.
На фоні профілактичного застосування пробіотику відзначено не лише покращення мікробіоценозу організму, але і зменшення рівня ендогенної інтоксикації. У чоловіків віком 45-54 років, які застосовували профілактичні курси пробіотику, рівні середніх молекул були достовірно нижчими порівняно зі значеннями у групі чоловіків до оздоровлення (табл. 5.6). Концентрація середніх молекул у чоловіків, які мешкали у м. Запоріжжі, після використання профілактичного курсу пробіотику наближалася до значень, отриманих у мешканців м. Мелітополя. Також був відзначений позитивний вплив профілактичних курсів застосування пробіотику на стан ліпідного обміну у чоловіків віком 45-54 років. Оздоровлення пробіотиком призводило до зниження концентрації холестерину і β-ліпопротеїдів у крові чоловіків віком 45-54 років, які мешкали у м. Запоріжжі.
Таблиця 5.5 – Результати бактеріологічного дослідження шкіри, кала та ротоглотки у чоловіків віком 45-54 років у процесі оздоровлення з застосуванням пробіотику (М±m)
| Показники | Мешканці м. Мелітополя віком 45-54 років | Мешканці м. Запоріжжя віком 45-54 років |
|
| до оздоровлення | після курсу пробіотику | ||
| Загальна кількість бактерій шкіри, Lg КУО/см2 | 3,18±0,17 | 3,66±0,14 | 3,13±0,11* |
| Стафілококи коагулазопозитивні шкіри, Lg КУО/см2 | 0,167±0,167 | 1,058±0,324 | 0,133±0,133* |
| Біфідобактерії кала, Lg КУО/г | 8,79±0,17 | 8,35±0,14 | 8,73±0,12* |
| Лактобактерії, кала, Lg КУО/г | 6,88±0,20 | 6,38±0,15 | 6,86±0,12* |
| Кишечна паличка неферментуюча, кала, Lg КУО/г | 0,583±0,313 | 1,533±0,341 | 0,267±0,182* |
| Протей, кала, Lg КУО/г | 0,5±0,261 | 0,833±0,297 | 0,313±0,216* |
| Гриби роду Candida кала, Lg КУО/г | 0,892±0,323 | 1,283±0,335 | 0,313±0,216* |
| Інтегральний показник кількості умовно-патогенної флори ротоглотки, Lg КУО/мл | 4,74±1,37 | 8,82±1,42 | 4,34±0,93* |
| Гемофільні палички (Haemophylus influenzaе), ротоглотки, Lg КУО/мл | 0,475±0,321 | 1,68±0,428 | 0,38±0,259* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків до та після оздоровлення пробіотиком.
Таблиця 5.6 – Рівні середніх молекул, холестерину та β-ліпопротеїдів у чоловіків віком 45-54 років у процесі оздоровлення з застосуванням пробіотику (М±m)
| Показники, одиниці вимірювання | Мешканці м. Мелітополя віком 45-54 років | Мешканці м. Запоріжжя віком 45-54 років | |
| до оздоровлення | після курсу пробіотику | ||
| СМ1, у. о. | 0,317±0,006 | 0,352±0,005 | 0,337±0,005* |
| СМ2, у. о. | 0,158±0,005 | 0,171±0,005 | 0,155±0,005* |
| Холестерин, ммоль/л | 4,197±0,023 | 4,354±0,019 | 4,027±0,082* |
| β-ліпопротеїди, % | 45,2±0,501 | 46,68±0,428 | 42,6±1,473* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків до та після оздоровлення пробіотиком.
У осіб віком 45-54 років на фоні використання пробіотику відзначалося також покращення бальної оцінки старіння чоловіків за шкалою AMS. Оцінка за шкалою AMS у чоловіків віком 45-54 років до оздоровлення становила (28,29±0,38) балів, а після курсу пробіотику була достовірно меншою – (26,97±0,51) балів і наближалася до бальної оцінки у мешканців м. Мелітополя аналогічного віку [(26,43±0,38) балів]. Ці дані говорять про зменшення проявів старіння у чоловіків на фоні профілактичного використання пробіотику.
Наведені у даному підрозділі результати свідчать про клінічну, мікробіологічну та біохімічну ефективність використання профілактичних курсів пробіотиків. Проведені дослідження дозволяють рекомендувати широке застосування пробіотиків із профілактичною метою для збереження здоров’я та уповільнення інволютивних змін шкіри у чоловіків віком 45-54 років.
5.3 Корекція змін стану шкіри та гомеостазу організму у чоловіків віком 45-54 років з застосуванням краталу та кверцетину
Данні, наведені у попередніх розділах, свідчать про зміни стану шкірного покрову, гомеостазу, психологічного статусу, які виникають і прогресують у чоловіків зі збільшенням віку. Особливо це стосується мешканців великого промислового центру. Для корекції виявлених змін був розроблений комплекс профілактичних медикаментозних заходів з урахуванням необхідності його застосування у широкого кола чоловіків працездатного віку, починаючи з 45 років. Вибір зупинили на застосуванні краталу та кверцетину.
Результати проведених досліджень стану шкіри у чоловіків віком 45-54 років у процесі застосування профілактичних курсів краталу та кверцетину надані на табл. 5.7. Оздоровчий курс використання краталу та кверцетину чинив позитивний клінічний ефект на стан шкіри. У чоловіків віком 45-54 років по завершенню профілактичного курсу відзначалося достовірне зменшення сухості шкіри, бальної оцінки порушень тургору шкіри, бальної оцінки стану фотозахищених ділянок шкіри за шкалою Yolanda R. Helfrich et al. порівняно з показниками, отриманими у групі осіб до курсу оздоровлення.
Таблиця 5.7 – Клінічні показники стану шкіри у чоловіків віком 45-54 років у процесі застосування краталу та кверцетину (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 45-54 років: | |
| до оздоровлення | після оздоровлення краталом і кверцетином | ||
| Сухість шкіри, бали | 0,016±0,016 | 0,313±0,06 | 0,146±0,0559* |
| Порушення тургору, бали | 0,148±0,032 | 1,16±0,035 | 0,927±0,064* |
| Оцінка шкіри за шкалою Yolanda R. Helfrich et. al | 0,098±0,034 | 3,08±0,099 | 2,49±0,14* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками до оздоровлення.
Використання краталу та кверцетину, крім того, чинило позитивний ефект і щодо нормалізації мікроциркуляції шкіри. У чоловіків віком 45-54 років після поєднаного застосування краталу та кверцетину відзначалося зменшення відсотку порушень мікроциркуляції порівняно зі значеннями, отриманими до початку оздоровчого курсу (табл. 5.8). Встановлено достовірне збільшення кількості функціонуючих капілярів у чоловіків, які отримали курс поєднаного застосування краталу та кверцетину, порівняно з даним показником у чоловіків віком 45-54 років до оздоровлення.
Таблиця 5.8 – Біомікроскопічні показники у чоловіків віком 45-54 років у процесі застосування краталу та кверцетину (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 45-54 років: | |
| до оздоровлення | після оздоровлення краталом і кверцетином | ||
| Кількість функціонуючих капілярів на 1 мм3 | 42,4±0,69 | 34,2±0,55 | 38,8±0,69* |
| Наявність порушень мікроциркуляції, % | 26,1±9,4 | 56,7±11,4 | 37,0±13,2 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками до оздоровлення.
Отримані дані говорять про клінічну ефективність профілактичних курсів поєднаного застосування краталу та кверцетину щодо стану шкіри та мікроциркуляції у ній.
Було також встановлено що, застосування розробленого оздоровчого комплексу призводило до зменшення проявів ендотоксикозу у осіб віком 45-54 років, що проявлялося достовірним зниженням рівнів середніх молекул у обстежених осіб після використання краталу та кверцетину у порівнянні зі значеннями до початку оздоровлення (табл. 5.9).
Застосування запропонованого курсу краталу та кверцетину також сприяло нормалізації функціонування симпатоадреналової та вагоінсулярної систем (табл. 5.10 і рис. 5.2). Встановлено достовірне зменшення рівнів екскреції адреналіну, норадреналіну, дофаміну та ДОФА з сечею, а також достовірне зменшення концентрації кортизолу та інсуліну у крові у чоловіків віком 45-54 років після курсу поєднаного застосування краталу та кверцетину порівняно зі значеннями у чоловіків до початку оздоровлення. У процесі дослідження також було доведено нормалізацію співвідношень основних гормонів симпатоадреналової та вагоінсулярної систем (рис. 5.2). Однак, використання профілактичного курсу краталу та кверцетину не дозволяло досягти повної нормалізації діяльності симпатоадреналової та вагоінсулярної систем – основні показники їх функціонування не досягали рівнів 25-34-річних осіб.
Таблиця 5.9 – Рівень середніх молекул у чоловіків віком 45-54 років у процесі застосування краталу та кверцетину (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 45-54 років: | |
| до оздоровлення | після оздоровлення краталом і кверцетином | ||
| СМ1, у. о. | 0,319±0,01 | 0,352±0,005 | 0,332±0,006* |
| СМ2, у. о. | 0,137±0,004 | 0,171±0,01 | 0,156±0,005* |
Примітка: * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками до оздоровлення.
Також відзначений позитивний вплив поєднаного застосування краталу та кверцетину на стан ліпідного обміну у чоловіків віком 45-54 років. Встановлено достовірне зниження концентрації холестерину, β-ліпопротеїдів і тригліцеридів у крові чоловіків віком 45-54 років, які використовували кратал і кверцетин, порівняно з групою осіб аналогічного віку до початку оздоровлення (рис. 5.3).
У осіб віком 45-54 років на фоні використання профілактичних курсів краталу та кверцетину відзначалося також покращення бальної оцінки старіння та андрогенного дефіциту чоловіків за шкалою AMS. Оцінка за шкалою AMS у чоловіків віком 45-54 років до оздоровлення становила (28,29±0,38) балів, а після курсу поєднаного застосування краталу та кверцетину була достовірно меншою – (26,93±0,45) балів і наближалася до бальної оцінки у чоловіків віком 25-34 років [(24,62±0,4) балів]. Ці дані свідчать про зменшення проявів старіння та андрогенного дефіциту у чоловіків на фоні профілактичних курсів краталу та кверцетину.
Таблиця 5.10 – Екскреція катехоламінів з сечею, концентрація кортизолу та інсуліну в крові у чоловіків віком 45-54 років у процесі застосування краталу та кверцетину (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 45-54 років: | |
| до оздоровлення | після оздоровлення краталом і кверцетином | ||
| Адреналін, нмоль/добу | 35,41±0,531 | 40,32±0,61 | 38,22±0,495* |
| Норадреналін, нмоль/добу | 79,39±0,518 | 99,63±0,871 | 90,32±0,817* |
| Дофамін, нмоль/добу | 1666±16,75 | 1775±18,23 | 1655±25,55* |
| ДОФА, нмоль/добу | 187,9±1,822 | 224,3±1,1 | 210,4±1,181* |
| Кортизол, нмоль/л | 278±1,409 | 309±2,056 | 291,9±2,017* |
| Інсулін, мкМО/мл | 6,866±0,029 | 7,572±0,02 | 7,35±0,035* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками до оздоровлення.
Покращення стану шкірного покрову та стану здоров’я у цілому на фоні застосування краталу та кверцетину сприяло зниженню рівнів ситуативної тривожності, депресії та невротизації у чоловіків віком 45-54 років. Як видно з табл. 5.11, у чоловіків віком 45-54 років після застосування краталу та кверцетину рівень ситуативної тривожності та рівень невротизації були достовірно нижчими порівняно з даними показниками у чоловіків аналогічного віку до початку оздоровлення. Також було встановлено тенденцію до зменшення рівня депресії у чоловіків віком 45-54 років на фоні використання краталу та кверцетину.

Рисунок 5.2 – Співвідношення гормонів і медіаторів у чоловіків віком 45-54 років у процесі застосування краталу та кверцетину (результати, отримані у групі осіб віком 25-34 років, прийняті за 1).
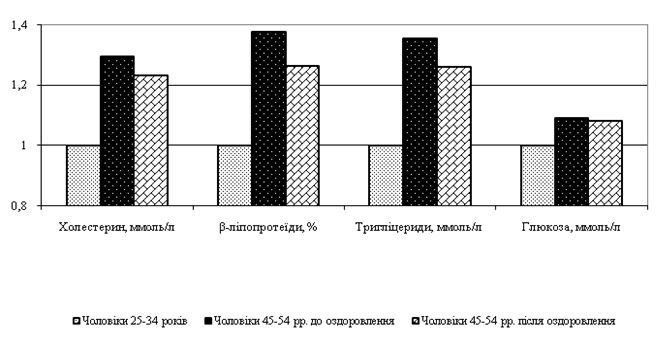
Рисунок 5.3 – Концентрація ліпідів і глюкози у крові чоловіків віком 45-54 років у процесі застосування краталу та кверцетину (результати, отримані у групі осіб віком 25-34 років, прийняті за 1).
Таблиця 5.11 – Рівні ситуативної тривожності, невротизації та депресії у чоловіків віком 45-54 років у процесі застосування краталу та кверцетину (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 45-54 років: | |
| до оздоровлення | після оздоровлення краталом і кверцетином | ||
| Рівень ситуативної тривожності за шкалою Спілбергера-Ханіна, бали | 40,12±0,25 | 39,84±0,23 | 38,71±0,46* |
| Рівень невротизації за Л. І. Вассерманом, бали | 3,16±0,28 | 6,36±0,29 | 5,20±0,45* |
| Рівень депресії за шкалою Бека, бали | 2,76±0,35 | 5,91±0,44 | 5,24±0,65 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками до оздоровлення.
Таким чином, наведені у даному підрозділі результати досліджень свідчать про клінічну, біохімічну та психогенну ефективність використання профілактичних курсів краталу та кверцетину і дозволяють рекомендувати їх широке застосування з профілактичною метою для збереження здоров’я ув цілому та шкіри зокрема у чоловіків віком 45-54 років.
5.4 Покращення стану шкіри за рахунок корекції метаболічних змін у чоловіків віком 55-64 років шляхом застосування метаболітотропних препаратів
Враховуючи описані у попередніх розділах зміни стану шкірного покрову, кровообігу у шкірі, метаболічні порушення системи ПОЛ-АОС, осмотичної стійкості еритроцитів, збільшення ендотоксикозу, порушення функціонування симпатоадреналової і вагоінсулярної системи та зміни концентрації статевих гормонів у чоловіків віком 55-64 років, нами була розглянута можливість корекції цих порушень шляхом патогенетично обґрунтованого застосування антиоксидантів-цитопротекторів, ноотропних препаратів. У якості моделі використовували тіотріазолін, пірацетам і тіоцетам.
Були створені наступні дослідні групи серед чоловіків віком 55-64 років у залежності від способу оздоровлення: І – особи, які отримували тіотриазолін, ІІ – особи, які використовували пірацетам, ІІІ – особи, які одержували тіоцетам. Чоловіки з усіх дослідних груп були обстежені до проведення оздоровчого курсу та через 3 місяці від його початку. Для порівняння використовувалися результати, отримані у групі чоловіків віком 25-34 років.
Оздоровчий курс використання тіотриазоліну, пірацетаму або тіоцетаму чинив позитивний клінічний ефект на стан шкірного покрову (табл. 5.12). У чоловіків віком 55-64 років по завершенню як профілактичного курсу тіотриазоліну, так і курсу оздоровлення тіоцетамом відзначалося достовірне зменшення сухості, бальної оцінки порушень тургору шкіри, бальної оцінки стану шкіри за шкалою Yolanda R. Helfrich et al. порівняно з показниками, отриманими у групі осіб до курсу оздоровлення. Крім того, отримана достовірна різниця за бальною оцінкою сухості шкіри та бальною оцінкою стану шкіри за шкалою Yolanda R. Helfrich et al. між групами чоловіків віком 55-64 років, які пройшли профілактичний курс тіоцетаму та курс оздоровлення пірацетамом.
У чоловіків віком 55-64 років після застосування тіотриазоліну, пірацетаму та тіоцетаму відзначалося збільшення кількості функціонуючих капілярів і зменшення відсотку порушень мікроциркуляції порівняно зі значеннями, отриманими до початку оздоровчого курсу (табл. 5.13). При цьому на фоні застосування тіотриазоліну, пірацетаму та тіоцетаму відзначено зменшення відсотку судинних і внутрішньосудинних порушень. Встановлено достовірне збільшення кількості функціонуючих капілярів, достовірне зниження відсотку порушень мікроциркуляції шкіри у цілому та судинних порушень мікроциркуляції зокрема у чоловіків, які отримали курс тіоцетаму, порівняно з даними показниками у чоловіків віком 55-64 років до оздоровлення. Після застосування тіотриазоліну та пірацетаму достовірна різниця встановлена лише за кількістю функціонуючих капілярів. Отримані дані говорять про позитивний ефект щодо стану шкірного покрову та мікроциркуляції шкіри від профілактичного використання тіотриазоліну, пірацетаму та тіоцетаму у чоловіків віком 55-64 років. Максимально виражену профілактичну ефективність мав тіоцетам.
Таблиця 5.12 – Клінічні показники стану шкіри у чоловіків віком 55-64 років у процесі застосування тіотриазоліну, пірацетаму або тіоцетаму (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 55-64 років: | |||
| до оздоровлення | після курсу тіотриазоліну | після курсу пірацетаму | після курсу тіоцетаму | ||
| Сухість шкіри, бали | 0,016±0,016 | 0,67±0,08* | 0,22±0,1● | 0,68±0,19*◘ | 0,21±0,10● |
| Порушення тургору, бали | 0,15±0,03 | 1,58±0,05* | 1,28±0,14*● | 1,53±0,12* | 1,32±0,11*● |
| Оцінка шкіри за шкалою Yolanda R. Helfrich et. al | 0,1±0,03 | 4,54±0,11* | 3,61±0,24*● | 4,53±0,18*◘ | 3,84±0,22*● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років після курсу тіоцетаму.
Результати доплерографічного ультразвукового дослідження шкіри також свідчили про ефективність профілактичного використання тіотриазоліну, пірацетаму та тіоцетаму у чоловіків віком 55-64 років (табл. 5.14). У чоловіків віком 55-64 років на фоні застосовування оздоровчих курсів тіотриазоліну, пірацетаму та тіоцетаму відбувалося збільшення максимальної та середньої швидкостей кровотоку, зменшення індексів пульс-активності та резистентності.
Таблиця 5.13 – Біомікроскопічні показники судин нігтьового ложа у чоловіків віком 55-64 років у процесі застосування тіотриазоліну, пірацетаму та тіоцетаму (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років |
Чоловіки віком 55-64 років: | |||
| до оздоровлення | після курсу тіотриазоліну | після курсу пірацетаму | після курсу тіоцетаму | ||
| Кількість функціонуючих капілярів на 1 мм3 | 42,4±0,7 | 30,1±0,6* | 32,1±0,7*● | 32,4±0,9*● | 33,8±0,7*● |
| Наявність порушень мікроциркуляції, % | 26,1±9,4 | 67,6±8,1* | 52,9±12,5 | 52,6±11,8 | 31,6±11,0● |
| Судинні порушення, % | 17,4±8,1 | 52,9±8,7* | 35,3±11,9 | 31,6±11,0 | 15,8±8,6● |
| Внутрішньосудинні зміни, % | 8,7±6,0 | 29,4±7,9* | 17,6±9,5 | 15,8±8,6 | 15,8±8,6 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення.
Отримана достовірна різниця за максимальною швидкістю кровотоку та індексом пульс-активності між групами чоловіків, які використовували профілактичні курси тіотриазоліну і пірацетаму, та групою осіб віком 55-64 років до початку оздоровлення. Чоловіки, які застосовували тіоцетам, мали достовірно вищу максимальну та середню швидкість кровотоку, а також достовірно нижчі індекси пульс-активності та резистентності порівняно з особами віком 55-64 років до початку оздоровлення. Це доводить максимальну ефективність тіоцетаму щодо корекції змін кровотоку у шкірі чоловіків старших вікових груп. Чоловіки, які застосовували тіоцетам, мали достовірно вищу максимальну швидкість кровотоку та достовірно нижчий індекс пульс-активності порівняно з особами, які отримували тіотриазолін. У чоловіків, які проходили курс оздоровлення тіоцетамом, відзначені достовірно вищі максимальну та середню швидкість кровотоку, достовірно нижчі індекси пульс-активності та резистентності порівняно з особами, які отримували пірацетам. Ці дані є ще одним підтвердженням більшої ефективності саме профілактичного використання тіоцетаму.
Таблиця 5.14 – Характеристика кровоплину у шкірі чоловіків віком 55-64 років у процесі застосування тіотриазоліну, пірацетаму та тіоцетаму (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років |
Чоловіки віком 55-64 років: | |||
| до оздоровлення | після курсу тіотриазоліну | після курсу пірацетаму | після курсу тіоцетаму | ||
| Максимальна швидкість, см/с | 6,1±0,046 | 5,51±0,047* | 5,74±0,023*●◘ | 5,81±0,042*●◘ | 5,94±0,043*● |
| Середня швидкість, см/с | 3,64±0,034 | 3,24±0,044* | 3,31±0,023* | 3,29±0,031*◘ | 3,37±0,027*● |
| Індекс пульс-активності, у. о. | 1,55±0,019 | 1,80±0,036* | 1,69±0,023*●◘ | 1,71±0,027*●◘ | 1,58±0,027● |
| Індекс резистентності, у. о. | 0,94±0,015 | 1,09±0,024* | 1,07±0,017*◘ | 1,04±0,014*◘ | 0,98±0,021● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років після курсу тіоцетаму.
Були отримані також біохімічні підтвердження ефективності застосування тіотриазоліну, пірацетаму та тіоцетаму у чоловіків віком 55-64 років (табл. 5.15). Застосування тіотріазоліну дозволяло зменшити концентрацію ТБК-АП і збільшити КАОЗ. Дещо менші позитивні зміни отримані у групі чоловіків, яка використовувала пірацетам. Найкраща нормалізація показників функціонування системи ПОЛ-АОС отримана у групі чоловіків віком 55-64 років після курсу оздоровлення тіоцетамом. Чоловіки, які отримували тіоцетам, мали достовірно нижчий рівень ТБК-АП і достовірно вищий КАОЗ порівняно з групою осіб, яка застосовувала пірацетам (табл. 5.15).
Таблиця 5.15 – Показники функціонування системи ПОЛ-АОС у чоловіків віком 55-64 років у процесі застосування тіотриазоліну, пірацетаму та тіоцетаму (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років |
Чоловіки віком 55-64 років: | |||
| до оздоровлення | після курсу тіотриазоліну | після курсу пірацетаму | після курсу тіоцетаму | ||
| ТБК-АП, ммоль/л | 2,66±0,02 | 3,18±0,03* | 2,89±0,01*● | 3,07±0,01*●◘ | 2,86±0,02*● |
| Загальна АОА, % | 65,3±0,56 | 67,8±0,38* | 68,6±0,28* | 68,4±0,29* | 68,1±0,38* |
| КАОЗ | 24,6±0,27 | 21,4±0,27* | 23,7±0,14*● | 22,2±0,12*●◘ | 23,8±0,15*● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років після курсу тіоцетаму.
Результати, представлені на рис. 5.4, також свідчать про те, що нормалізація добових коливань показників системи ПОЛ-АОС, а саме антиокислювальної системи, максимально забезпечується тіоцетамом.
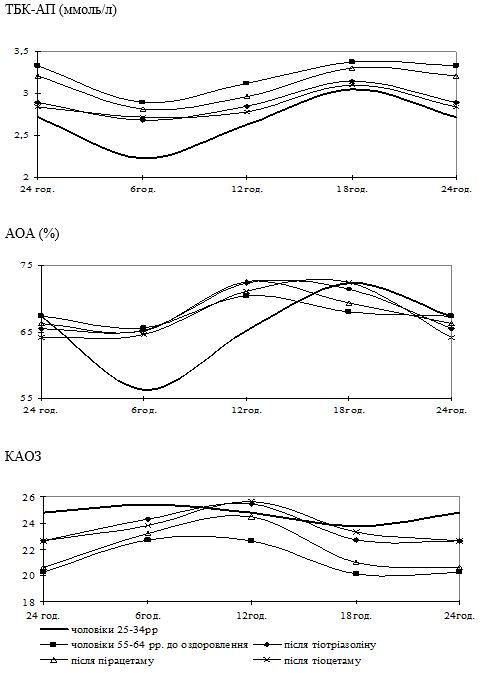
Рисунок 5.4 – Добові зміни концентрацій ТБК-АП, АОА та КАОЗ у процесі оздоровлення тіотріазоліном, пірацетамом, тіоцетамом
Крім того, у ході дослідження були встановлені зміни осмотичної стійкості еритроцитарних мембран у чоловіків віком 55-64 років, які проходили профілактичні курси тіотриазоліну, пірацетаму та тіоцетаму (табл. 5.16). Застосування оздоровчих курсів призводило до зменшення проявів ендотоксикозу, що проявлялося наявністю достовірної різниці за рівнем середніх молекул у групах після даних оздоровчих курсів і групі чоловіків віком 55-64 років до профілактичного прийому коригуючої терапії.
Таблиця 5.16 – Осмотична стійкість еритроцитів і рівні середніх молекулу у чоловіків віком 55-64 років у процесі застосування тіотриазоліну, пірацетаму та тіоцетаму (М±m)
| Показники | Чоловіки віком 25-34 років |
Чоловіки віком 55-64 років: | ||||
| до оздоровлення | після курсу тіотриазоліну | після курсу пірацетаму | після курсу тіоцетаму | |||
| Розчини NaCl, % | 0,5 | 1,67±0,23 | 2,39±0,19* | 1,83±0,2 | 2,11±0,15 | 1,84±0,16● |
| 0,45 | 21,2±0,59 | 30,4±0,58* | 28,6±0,59*●◘ | 29,5±0,58*◘ | 26,3±0,4*● | |
| 0,4 | 66,5±0,63 | 74,3±0,58* | 72,2±0,72*● | 72,5±0,52*●◘ | 70,6±0,62*● | |
| 0,35 | 93±0,4 | 96,3±0,29* | 95,6±0,38* | 95,5±0,33* | 95±0,43*● | |
| 0,3 | 97±0,29 | 98,2±0,15* | 97,7±0,2●◘ | 97,7±0,19●◘ | 96,8±0,31● | |
| СМ1, у. о. | 0,32±0,01 | 0,37±0,01* | 0,33±0,004● | 0,35±0,01*●◘ | 0,33±0,01● | |
| СМ2, у. о. | 0,14±0,004 | 0,18±0,004* | 0,16±0,004*● | 0,17±0,004*●◘ | 0,15±0,004● | |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років після курсу тіоцетаму.
Нормалізацію функціонування симпатоадреналової та вагоінсулярної системи краще забезпечувало застосування пірацетаму, ніж тіотріазоліну. Найкращі результати нормалізації рівнів гормонів і медіаторів, а також їх співвідношення відзначалися після профілактичного курсу тіоцетаму (табл. 5.17 і рис. 5.5).
Таблиця 5.17 – Екскреція катехоламінів з сечею, концентрація кортизолу й інсуліну у крові чоловіків віком 55-64 років у процесі застосування тіотриазоліну, пірацетаму та тіоцетаму (М±m)
| Показники, одиниці вимірювання | Чоловіки віком
25-34 років |
Чоловіки віком 55-64 років: | |||
| до оздоровлення | після курсу тіотриазоліну | після курсу пірацетаму | після курсу тіоцетаму | ||
| Адреналін, нмоль/добу | 35,4±0,53 | 30,6±0,45* | 32,1±0,33●◘ | 34,4±0,34*●◘ | 35,15±0,35● |
| Норадреналін, нмоль/добу | 79,4±0,52 | 84,54±0,62* | 82,44±0,51*● | 82,39±0,53*● | 81,61±0,77*● |
| Дофамін, нмоль/добу | 1666±17 | 1466±15,4* | 1524±19,5*●◘ | 1552±15,9*●◘ | 1619±14,2● |
| ДОФА, нмоль/добу | 187,9±1,8 | 197,2±1,64* | 200,3±1,4*◘ | 205,2±0,9*●◘ | 208,5±1,0*● |
| Кортизол, нмоль/л | 278±1,41 | 333,2±2,31* | 325±1,7*●◘ | 317±1,2*●◘ | 311,2±2,0*● |
| Інсулін, мкМО/мл | 6,87±0,03 | 6,76±0,02* | 6,79±0,026* | 6,76±0,02* | 6,84±0,032● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років після курсу тіоцетаму.
Була отримана достовірна різниця за рівнями екскреції адреналіну, норадреналіну, ДОФА та дофаміну з сечею, а також достовірна різниця за концентрацією кортизолу та інсуліну у крові між групами чоловіків віком 55-64 років до початку курсів оздоровлення та після застосування тіоцетаму. Хоча результати обстеження чоловіків віком 55-64 років після проведеного оздоровлення відрізнялися від результатів обстеження чоловіків віком 25-34 років, але співвідношення гормонів і медіаторів свідчили про наявність субкомпенсації симпатоадреналової та вегетативної системи.
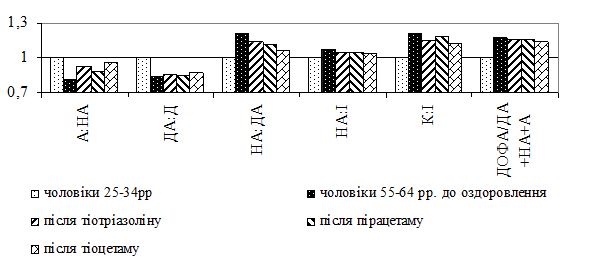
Рисунок 5.5 – Співвідношення гормонів і медіаторів у чоловіків віком 55-64 років у процесі застосування тіотриазоліну, пірацетаму та тіоцетаму (результати, отримані у чоловіків віком 25-34 років, прийняті за 1).
Значення більшості коефіцієнтів співвідношення гормонів і медіаторів у чоловіків віком 55-64 років після профілактичного курсу тіоцетаму наближались до значень, отриманих у чоловіків віком 25-34 років. Це приводило до нормалізації синтезу гонадотропних і статевих гормонів, сприяло зменшенню симптомів старіння чоловіків і андрогенного дефіциту. Для патогенетичного обґрунтування даного факту було проведено дослідження рівнів статевих і гонадотропних гормонів у чоловіків з різних терапевтичних груп.
Збільшення зниженої у чоловіків 55-64-річного віку концентрації тестостерону та зменшення підвищеної концентрації ЛГ і ФСГ, пролактину та ТЗГ відбувалося у процесі оздоровлення як пірацетамом, так і тіотриазоліном, проте більш виражений ефект відзначався після застосування ноотропного препарату. Найкращі результати отримані у групі чоловіків, яка отримала тіоцетам (табл. 5.18).
Таблиця 5.18 – Концентрації статевих і гонадотропних гормонів, ТЗГ, оцінка симптомів старіння й ознак андрогенного дефіциту згідно шкали AMS у чоловіків віком 55-64 років у процесі застосування тіотриазоліну, пірацетаму та тіоцетаму (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 55-64 років: | |||
| до оздоровлення | після курсу тіотриазоліну | після курсу пірацетаму | після курсу тіоцетаму | ||
| Тестостерон, нмоль/л | 18,57±0,63 | 13,46±0,42* | 14,27±0,33*◘ | 15,28±0,36*● | 16,35±0,39*● |
| ТЗГ, нмоль/л | 32,3±0,40 | 50,86±0,73* | 49,19±0,60*◘ | 48,22±0,64*●◘ | 45,57±0,50*● |
| ФСГ, МЕ/л | 3,08±0,034 | 4,54±0,038* | 4,31±0,05*●◘ | 4,28±0,047*●◘ | 4,1±0,034*● |
| ЛГ, ЕД/л | 2,97±0,034 | 3,90±0,034* | 3,78±0,046*◘ | 3,73±0,039*● | 3,67±0,03*● |
| ПРЛ, mMe/l | 221,5±1,75 | 283,8±3,45* | 272,3±4,54*●◘ | 277,9±3,81*◘ | 252,8±2,05*● |
| Оцінка за шкалою AMS, бали | 24,62±0,40 | 30,94±0,39* | 30,06±0,79* | 29,63±0,81* | 28,84±0,54*● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років після курсу тіоцетаму.
У чоловіків на фоні профілактичного використання тіотриазоліну, пірацетаму та тіоцетаму відбувалося зниження бальної оцінки за шкалою AMS і, відповідно, зменшення проявів андрогенного дефіциту (табл. 5.18). Найбільш ефективним виявилося профілактичне застосування тіоцетаму, який має антиоксидантну, цитопротекторну та ноотропну дію. Була отримана достовірна різниця за бальною оцінкою за шкалою AMS між групою чоловіків віком 55-64 років до початку оздоровлення та після профілактичного застосування тіоцетаму.
Також був відзначений позитивний вплив курсів оздоровлення на стан ліпідного обміну у чоловіків віком 55-64 роківи (табл. 5.19). Застосування тіотриазоліну чинило більш виражений ефект на стан ліпідного обміну порівняно з оздоровленням за допомогою пірацетаму. Отримана достовірна різниця за рівнем холестерину та тригліцеридів між групами чоловіків віком 55-64 років до початку оздоровлення та після профілактичного використання тіотриазоліну. Максимально виражений ефект щодо нормалізації ліпідного обміну виявляв тіоцетам. Чоловіки віком 55-64 років після курсу його застосування мали достовірно нижчий рівень холестерину та β-ліпопротеїдів порівняно з групами осіб, які використовували тіотриазолін і пірацетам. Також отримана достовірна різниця за концентрацією тригліцеридів між групами чоловіків, які пройшли оздоровлення за допомогою піроцетаму та тіоцетаму. Це ще раз підкреслює максимальну ефективність застосування тіоцетаму з профілактичною метою у чоловіків віком 55-64 років.
Таблиця 5.19 – Концентрація ліпідів у крові чоловіків віком 55-64 років у процесі застосування тіотриазоліну, пірацетаму та тіоцетаму (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 55-64 років: | |||
| до оздоровлення | після курсу тіотриазоліну | після курсу пірацетаму | після курсу тіоцетаму | ||
| Холестерин, ммоль/л | 3,36±0,02 | 4,83±0,03* | 4,66±0,04*●◘ | 4,76±0,03*◘ | 4,53±0,03*● |
| β-ліпопротеїди, % | 33,9±0,49 | 50,6±0,62* | 50,7±0,7*◘ | 51,9±0,69*◘ | 48,6±0,65*● |
| Тригліцериди, ммоль/л | 1,16±0,04 | 2,06±0,04* | 1,8±0,04*● | 1,97±0,03*◘ | 1,74±0,04*● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ●- достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення; ◘- достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років після курсу тіоцетаму.
Покращення стану шкіри та здоров’я у цілому на фоні профілактичного застосування тіотриазоліну, пірацетаму та тіоцетаму сприяло зниженню рівнів ситуативної тривожності, депресії та невротизації у чоловіків віком 55-64 років. Отримана достовірна різниця за бальною оцінкою ситуативної тривожності між групами чоловіків віком 55-64 років до початку оздоровлення та після використання тіотриазоліну [(42,17±0,326) балів] і пірацетаму [(41±0,35) балів]. Максимально виражений ефект щодо покращення стану тривожності виявляв тіоцетам: після курсу його застосування рівень ситуативної тривожності знижувався до (40,63±0,38) балів.
Отримані результати свідчать про позитивний вплив тіотріазоліну та пірацетаму на стан шкіри, її кровотік, нормалізацію метаболічних порушень і зменшення симптомів старіння та андрогенного дефіциту у чоловіків віком 55-64 роківи. Тіотріазолін більше впливав на систему ПОЛ-АОС, стійкість клітинних мембран, а пірацетам – на гормональний статус. Найкращі результати відзначалися після застосування тіоцетаму. Це обґрунтовує необхідність поєднаного застосування антиоксидантів і ноотропних препаратів для покращення стану шкірного покрову, кровотоку у шкірі, нормалізації метаболічних змін у чоловіків старших вікових груп і ширшого застосування тіоцетаму.
5.5 Корекція інволютивних змін шкіри та гомеостазу організму у чоловіків віком 55-64 років з використанням трібестану
Результати проведених досліджень стану шкіри у чоловіків віком 55-64 років у процесі застосування профілактичних курсів трібестану надані на табл. 5.20. Оздоровчий курс використання трібестану чинив позитивний клінічний ефект на стан шкірного покрову. У чоловіків віком 55-64 років по завершенню курсу трібестану відзначалося зменшення сухості шкіри, бальної оцінки порушень тургору шкіри, бальної оцінки стану шкіри за шкалою Yolanda R. Helfrich et al. порівняно з показниками, отриманими у групі осіб до курсу оздоровлення.
Таблиця 5.20 – Клінічні показники стану шкіри у чоловіків віком 55-64 років у процесі застосування трібестану (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 55-64 років: | |
| до оздоровлення | після оздоровлення трібестаном | ||
| Сухість шкіри, бали | 0,016±0,016 | 0,67±0,08* | 0,26±0,004● |
| Порушення тургору, бали | 0,15±0,03 | 1,58±0,05* | 1,32±0,11*● |
| Оцінка шкіри за Yolanda R. Helfrich et. al | 0,1±0,03 | 4,54±0,11* | 4,00±0,19*● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення.
Крім того, профілактичне використання трібестану у чоловіків віком 55-64 років призводило до достовірного зменшення рівня ТБК-АП тенденції до зростання загальної АОА (табл. 5.21). Це спричиняло достовірне збільшення коефіцієнту антиокислювального захисту. Отримані дані свідчать про позитивний вплив профілактичного курсу використання трібестану у чоловіків віком 55-64 років на систему ПОЛ-АОС, що виражалося зменшенням активації ПОЛ. Застосування трібестану призводило до зменшення проявів ендотоксикозу, що проявлялося наявністю достовірної різниці за рівнем СМ1 у групі чоловіків після даного оздоровчого курсу й у групі чоловіків віком 55-64 років до оздоровлення.
Таблиця 5.21 – Показники системи ПОЛ-АОС і рівні середніх молекул у чоловіків віком 55-64 років у процесі застосування трібестану (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 55-64 років: | |
| до оздоровлення | після оздоровлення трібестаном | ||
| ТБК-АП, ммоль/л | 2,66±0,02 | 3,18±0,03* | 2,97±0,014*● |
| Загальна АОА, % | 65,3±0,56 | 67,8±0,38* | 68,3±0,45* |
| КАОЗ | 24,6±0,27 | 21,4±0,27* | 23,0±0,16*● |
| СМ1, у. о. | 0,32±0,01 | 0,37±0,01* | 0,35±0,006*● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення.
Профілактичне застосування трібестану також сприяє покращенню функціонування симпатоадреналової та ваго-інсулярної систем (табл. 5.22 і рис. 5.6). Була отримана достовірна різниця за рівнями екскреції адреналіну, норадреналіну, ДОФА та дофаміну з сечею, а також достовірна різниця за концентрацією кортизолу у крові між групами чоловіків віком 55-64 років до початку курсу оздоровлення та після застосування трібестану. Значення більшості показників концентрацій гормонів і медіаторів у чоловіків віком 55-64 років після профілактичного курсу трібестану наближались до значень, отриманих у чоловіків віком 25-34 років. Співвідношення гормонів і медіаторів у чоловіків віком 55-64 років після проведеного оздоровлення свідчили про зменшення проявів функціональної неспроможності симпатоадреналової системи та вегетативної дисфункції. Це призводило до нормалізації синтезу гонадотропних і статевих гормонів, сприяло зменшенню симптомів старіння чоловіків і андрогенного дефіциту. Для патогенетичного обґрунтування даного факту було проведено дослідження концентрацій статевих і гонадотропних гормонів у чоловіків із різних терапевтичних груп.
Таблиця 5.22 – Екскреція катехоламінів з сечею, концентрація кортизолу й інсуліну у крові у чоловіків віком 55-64 років у процесі профілактичного застосування трібестану (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років |
Чоловіки віком 55-64 років: | |
| до оздоровлення | після оздоровлення трібестаном | ||
| Адреналін, нмоль/добу | 35,4±0,53 | 30,6±0,45* | 35,2±0,25● |
| Норадреналін, нмоль/добу | 79,4±0,52 | 84,5±0,62* | 80,3±0,98● |
| Дофамін, нмоль/добу | 1666±16,8 | 1466±15,4* | 1567±17,6*● |
| ДОФА, нмоль/добу | 187,9±1,8 | 197,2±1,6* | 204,2±1,1*● |
| Кортизол, нмоль/л | 278±1,4 | 333,2±2,3* | 322,7±1,9*● |
| Інсулін, мкМО/мл | 6,9±0,03 | 6,8±0,02* | 6,8±0,03 |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення.
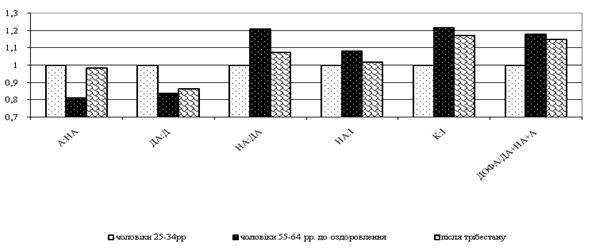
Рисунок 5.6 – Співвідношення гормонів і медіаторів у чоловіків віком 55-64 років до та після профілактичного курсу трібестану (результати, отримані у чоловіків віком 25-34 років, прийняті за 1).
Використання трібестану призводило до достовірного підвищення концентрації тестостерону, достовірного зниження концентрацій ФСГ і ТЗГ, а також до зменшення концентрацій ЛГ і пролактину (табл. 5.23). Крім того, у чоловіків на фоні використання трібестану відбувалосяь достовірне зниження бальної оцінки за шкалою AMS і, відповідно, зменшення проявів андрогенного дефіциту.
Таблиця 5.23 – Концентрації гонадотропних і статевих гормонів, ТЗГ, індекс AMS у чоловіків віком 55-64 років у процесі застосування трібестану (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 55-64 років: | |
| до оздоровлення | після оздоровлення трібестаном | ||
| Тестостерон, нмоль/л | 18,6±0,63 | 13,5±0,42* | 15,7±0,52*● |
| ТЗГ, нмоль/л | 32,3±0,40 | 50,9±0,73* | 46,7±0,67*● |
| ФСГ, МЕ/л | 3,1±0,03 | 4,5±0,04* | 4,3±0,05*● |
| ЛГ, ЕД/л | 3,0±0,03 | 3,9±0,03* | 3,8±0,04* |
| ПРЛ, mMe/l | 221,5±1,7 | 283,8±3,4* | 273,1±4,3* |
| Оцінка за шкалою AMS, бали | 24,6±0,40 | 30,9±0,39* | 29±0,66*● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення.
Також був відзначений позитивний вплив профілактичних курсів трібестану на стан ліпідного обміну у чоловіків віком 55-64 років: виявлене достовірне зниження (р<0.05) концентрації холестерину (з (4,83±0,03) до (4,69±0,036) ммоль/л) і тригліцеридів (з (2,06±0,04) до (1,91±0,06) ммоль/л).
Отримані дані свідчать не лише про клінічну, але й біохімічну ефективність використання профілактичних курсів трібестану. Проведені дослідження дозволяють рекомендувати широке застосування трібестану з профілактичною метою для збереження здоров’я у цілому та шкіри зокрема у чоловіків віком 55-64 років.
5.6 Комплексна корекція інволютивних змін шкіри та гомеостазу організму у чоловіків віком 55-64 років
Враховуючи описані у попередніх розділах зміни стану шкіри, кровообігу у ній, метаболічні порушення системи ПОЛ-АОС, зміни осмотичної стійкості еритроцитів, збільшення ендотоксикозу, порушення функціонування симпатоадреналової та вагоінсулярної системи, зміни концентрації статевих гормонів у чоловіків віком 55-64 років, була розглянута ефективність запропонованої нами корекції цих порушень шляхом індивідуалізованого призначення тіоцетаму або трібестану.
Результати проведених досліджень стану шкіри у чоловіків віком 55-64 років у процесі застосування профілактичних курсів надані на табл. 5.24. Запропоновані оздоровчі курси чинили позитивний клінічний ефект на стан шкіри. У чоловіків віком 55-64 років по їх завершенню відзначалося достовірне зменшення сухості шкіри, бальної оцінки порушень тургору шкіри, бальної оцінки стану шкіри за шкалою Yolanda R. Helfrich et al. порівняно з показниками, отриманими у групі осіб до курсу оздоровлення.
Використання оздоровчих курсів чинило позитивний ефект і щодо нормалізації мікроциркуляції шкіри. У чоловіків віком 55-64 років після застосування рекомендованих курсів відзначалося збільшення кількості функціонуючих капілярів і зменшення відсотку порушень мікроциркуляції порівняно зі значеннями, отриманими до початку оздоровчих курсів (табл. 5.25). Шляхом доплерографічного ультразвукового дослідження шкіри було доведено, що у чоловіків віком 55-64 років на фоні застосовування оздоровчих курсів відбувалося достовірне збільшення максимальної та середньої швидкостей кровотоку, достовірне зменшення індексів пульс-активності та резистентності.
Таблиця 5.24 – Клінічні показники стану шкіри у чоловіків віком 55-64 років у процесі оздоровлення (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років |
Чоловіки віком 55-64 років: | |
| до оздоровлення | після оздоровлення рекомендованим курсом | ||
| Сухість шкіри, бали | 0,02±0,02 | 0,67±0,08* | 0,24±0,07*● |
| Порушення тургору шкіри, бали | 0,1±0,03 | 1,58±0,05* | 1,32±0,08*● |
| Оцінка шкіри за Yolanda R. Helfrich et al. | 0,098±0,03 | 4,54±0,11* | 3,92±0,14*● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років;● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення.
Крім того, чоловіки, які застосовували запропоновані профілактичні курси, мали достовірно нижчий рівень ТБК-АП і достовірно вищий КАОЗ порівняно з групою осіб до початку оздоровлення (табл. 5.26). Результати проведених досліджень свідчать про те, що оздоровчі курси сприяли нормалізації добових коливань показників системи ПОЛ-АОС у чоловіків віком 55-64 років (рис. 5.7).
Були встановлені зміни осмотичної стійкості мембран еритроцитів у чоловіків віком 55-64 років, які застосовували рекомендовані профілактичні методики: відбувалася нормалізація стійкості еритроцитарних мембран (табл. 5.27). Отримана достовірна різниця за осмотичною стійкістю еритроцитарних мембран у 0,3-0,5 % розчинах хлориду натрію між групами чоловіків віком 55-64 років, які пройшли запропоновані оздоровчі курси, та чоловіками аналогічного віку до початку профілактичних заходів.
Таблиця 5.25 – Характеристика кровотоку у шкірі чоловіків віком 55–64 років у процесі оздоровлення (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 55-64 років: | |
| до оздоровлення | після оздоровлення рекомендованим курсом | ||
| Кількість функціонуючих капілярів на 1 мм3 | 42,4±0,69 | 30,1±0,61* | 33,3±0,51*● |
| Наявність порушень мікроциркуляції, % | 26,1±9,4 | 67,6±8,1* | 36,8±7,9● |
| Судинні порушення, % | 17,4±8,1 | 52,9±8,7* | 21,1±6,7● |
| Максимальна швидкість, см/с | 6,1±0,046 | 5,51±0,047* | 5,94±0,043*● |
| Середня швидкість, см/с | 3,64±0,034 | 3,24±0,044* | 3,37±0,027*● |
| Індекс пульс-активності, у. о. | 1,55±0,019 | 1,80±0,036* | 1,58±0,027● |
| Індекс резистентності, у. о. | 0,94±0,015 | 1,09±0,024* | 0,98±0,021● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з показниками у чоловіків віком 55-64 років до оздоровлення.
Таблиця 5.26 – Показники функціонування системи ПОЛ-АОС у чоловіків віком 55-64 років у процесі оздоровлення (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 55-64 років: | |
| до оздоровлення | після оздоровлення рекомендованим курсом | ||
| ТБК-АП, ммоль/л | 2,66±0,02 | 3,18±0,03* | 2,91±0,02*● |
| Загальна АОА, % | 65,3±0,56 | 67,8±0,38* | 68,2±0,29* |
| КАОЗ | 24,6±0,27 | 21,4±0,27* | 23,4±0,14*● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення.
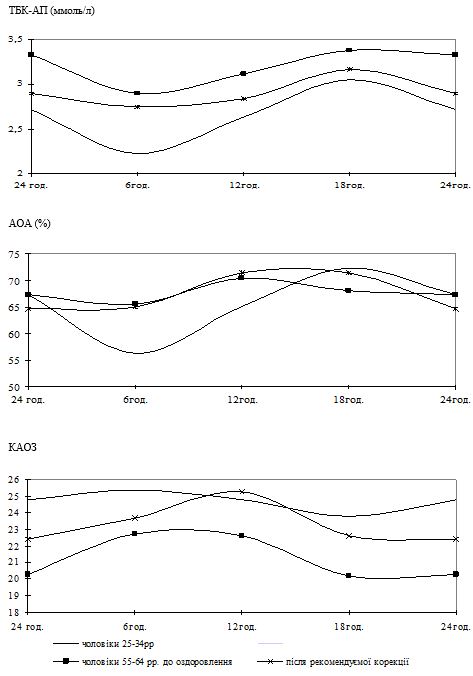
Рисунок 5.7 – Добові зміни концентрацій ТБК-АП, АОА та КАОЗ у чоловіків віком 55-64 років у процесі оздоровлення
Таблиця 5.27 – Осмотична стійкість еритроцитів і рівні середніх молекул у чоловіків віком 55-64 років у процесі оздоровлення (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років | Чоловіки віком 55-64 років: | ||
| до оздоровлення | після оздоровлення рекомендованим курсом | |||
| Розчини NaCl, % | 0,5 % | 1,67±0,23 | 2,39±0,19* | 1,87±0,13● |
| 0,45 % | 21,2±0,59 | 30,4±0,58* | 27,5±0,43*● | |
| 0,4 % | 66,5±0,63 | 74,3±0,58* | 71,8±0,55*● | |
| 0,35 % | 93,0±0,4 | 96,3±0,29* | 95,5±0,26*● | |
| 0,3 % | 97,0±0,29 | 98,2±0,15* | 97,3±0,20● | |
| СМ1, у. о. | 0,32±0,01 | 0,37±0,01* | 0,34±0,004*● | |
| СМ2, у. о. | 0,14±0,004 | 0,18±0,004* | 0,16±0,004*● | |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення.
При цьому застосування оздоровчих курсів призводило до зменшення проявів ендотоксикозу, що підтверджується достовірним зменшенням рівнів СМ1 і СМ2 у групах після даних оздоровчих курсів і групі чоловіків віком 55-64 років до початку оздоровлення.
На фоні застосування рекомендованих профілактичних курсів відзначалося також покращення функціонування симпатоадреналової та вагоінсулярної системи (табл. 5.28 і рис. 5.8). Була отримана достовірна різниця за рівнями екскреції адреналіну, норадреналіну, ДОФА та дофаміну з сечею, а також достовірна різниця за концентрацією кортизолу та інсуліну у крові між групами чоловіків віком 55-64 років до початку курсів оздоровлення та після профілактичного застосування рекомендованих курсів. Значення більшості показників рівнів гормонів і медіаторів у чоловіків віком 55-64 років після застосування профілактичних курсів наближались до значень, отриманих у чоловіків віком 25-34 років.
Таблиця 5.28 – Екскреція катехоламінів з сечею, концентрація кортизолу й інсуліну у крові чоловіків віком 55-64 років у процесі оздоровлення (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років |
Чоловіки віком 55-64 років: | |
| до оздоровлення | після оздоровлення рекомендованим курсом | ||
| Адреналін, нмоль/добу | 35,4±0,53 | 30,6±0,45* | 35,2±0,21● |
| Норадреналін, нмоль/добу | 79,4±0,52 | 84,5±0,62* | 80,9±0,623● |
| Дофамін, нмоль/добу | 1666±16,8 | 1466±15,4* | 1593±11,9*● |
| ДОФА, нмоль/добу | 187,9±1,8 | 197,2±1,6* | 206,4±0,8*● |
| Кортизол, нмоль/л | 278±1,4 | 333,2±2,3* | 317±1,7*● |
| Інсулін, мкМО/мл | 6,87±0,03 | 6,76±0,02* | 6,83±0,02● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення.
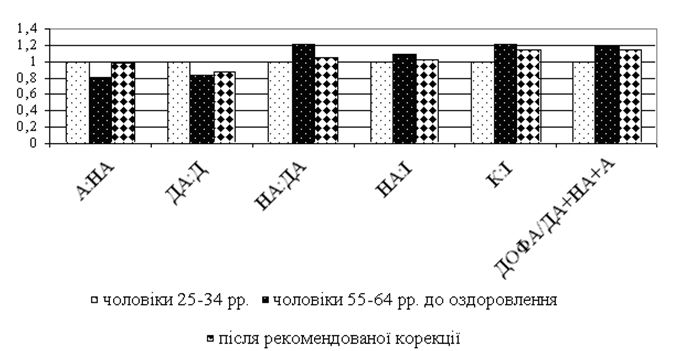
Рисунок 5.8 – Співвідношення гормонів і медіаторів у чоловіків віком 55-64 років у процесі оздоровлення (результати, отримані у чоловіків віком 25-34 років, прийняті за 1).
Співвідношення гормонів і медіаторів у чоловіків віком 55-64 років після проведеного оздоровлення говорили про наявність субкомпенсації симпатоадреналової та вегетативної систем, попередження переходу до стадії декомпенсації. Це призводило до нормалізації синтезу гонадотропних і статевих гормонів, сприяло зменшенню симптомів старіння чоловіків і андрогенного дефіциту. Для патогенетичного обґрунтування даного факту було проведено аналіз концентрацій статевих і гонадотропних гормонів у чоловіків віком 55-64 років.
У результаті дослідження було встановлено достовірне збільшення зниженої у чоловіків віком 55-64 років концентрації тестостерону та достовірне зменшення підвищених концентрацій ЛГ і ФСГ, пролактину та ТЗГ, що відбувалося у процесі оздоровлення рекомендованими профілактичними курсами (табл. 5.29). Крім того, у чоловіків на фоні застосування профілактичних курсів відбувалося достовірне зниження бальної оцінки за шкалою AMS і, відповідно, зменшення проявів андрогенного дефіциту.
Також був відзначений позитивний вплив профілактичних курсів на стан ліпідного обміну у чоловіків віком 55-64 років (табл. 5.30). У чоловіків віком 55-64 років після застосування курсів оздоровлення спостерігається достовірне зниження рівнів холестерину, β-ліпопротеїдів і тригліцеридів порівняно з групою осіб до початку профілактичних заходів.
Покращення стану шкірного покрову та стану здоров’я у цілому на фоні застосування профілактичних курсів сприяло зниженню рівнів ситуативної тривожності, депресії та невротизації у чоловіків віком 55-64 років (табл. 5.31). Була отримана достовірна різниця за бальною оцінкою рівня ситуативної тривожності за шкалою Спілбергера-Ханіна між групою чоловіків віком 55-64 років після застосування рекомендованих профілактичних курсів і особами аналогічного віку до початку оздоровлення.
Таблиця 5.29 – Концентрації статевих і гонадотропних гормонів, ТЗГ, оцінка симптомів старіння й ознак андрогенного дефіциту згідно шкали AMS у чоловіків віком 55-64 років у процесі оздоровлення (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років |
Чоловіки віком 55-64 років: | |
| до оздоровлення | після оздоровлення рекомендованим курсом | ||
| Тестостерон, нмоль/л | 18,6±0,63 | 13,5±0,42* | 16,0±0,32*● |
| ТЗГ, нмоль/л | 32,3±0,40 | 50,9±0,73* | 46,1±0,42*● |
| ФСГ, МЕ/л | 3,1±0,03 | 4,5±0,04* | 4,2±0,03*● |
| ЛГ, ЕД/л | 3,0±0,03 | 3,9±0,03* | 3,8±0,03*● |
| ПРЛ, mMe/l | 221,5±1,7 | 283,8±3,4* | 263±2,9*● |
| Оцінка за шкалою AMS, бали | 24,6±0,40 | 30,9±0,39* | 28,9±0,42*● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення.
Таблиця 5.30 – Концентрація ліпідів і глюкози у крові чоловіків віком 55-64 років у процесі оздоровлення (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років |
Чоловіки віком 55-64 років: | |
| до оздоровлення | після оздоровлення рекомендованим курсом | ||
| Холестерин, ммоль/л | 3,36±0,02 | 4,83±0,03* | 4,61±0,03*● |
| β-ліпопротеїди, % | 33,9±0,49 | 50,6±0,62* | 48,8±0,54*● |
| Тригліцериди, ммоль/л | 1,16±0,04 | 2,06±0,04* | 1,82±0,04*● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення.
Таблиця 5.31 – Рівні ситуативної тривожності, невротизації та депресії у чоловіків віком 55-64 років у процесі оздоровлення (М±m)
| Показники, одиниці вимірювання | Чоловіки віком 25-34 років |
Чоловіки віком 55-64 років: | |
| до оздоровлення | після оздоровлення рекомендованим курсом | ||
| Рівень невротизації за Л. І. Вассерманом, бали | 3,2±0,28 | 7,6±0,34* | 7,0±0,47* |
| Рівень депресії за шкалою Бека, бали | 2,8±0,35 | 7,7±0,43* | 7,1±0,42* |
| Рівень ситуативної тривожності за шкалою Спілбергера-Ханіна, бали | 40,1±0,25 | 42,6±0,19* | 41,2±0,32*● |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-34 років; ● – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 55-64 років до оздоровлення.
Отримані дані свідчать про клінічну, біохімічну та психогенну ефективність використання запропонованих профілактичних курсів. Проведені дослідження дозволяють рекомендувати широке застосування оздоровчих курсів для збереження здоров’я у цілому та шкіри зокрема у чоловіків віком 55-64 років. Проведення профілактичних курсів дозволить покращити стан здоров’я чоловіків і попередить виникнення та розвиток інволютивних змін шкіри та дерматологічної патології.
* * *
У цілому проведені дослідження ефективності використання у чоловіків різних вікових груп профілактичних курсів полівітамінних засобів з мікроелементами, біотину та декспантенолу, пробіотичних засобів, краталу та кверцетину, тіоцетаму як препарату з антиоксидантною, цитопротекторною та ноотропною дією, трібестану як фітопрепарату на основі стероїдних сапонінів довели їх патогенетичну обґрунтованість і доцільність застосування для зменшення проявів старіння шкіри та організму чоловіків у цілому. Використання розробленої оздоровчої методики з урахуванням віку чоловіків наприкінці її курсу призводило до зменшення сухості шкіри у 58,3 % осіб, зниження порушень тургору шкіри у 16,1 % осіб, зменшення бальної оцінки стану фотозахищених ділянок шкіри за шкалою Yolanda R. Helfrich et al. у 49,4 % осіб. Ефективність застосування розроблених профілактичних курсів була доведена за допомогою інструментальних методів дослідження: у 66,7 % чоловіків після використання оздоровчих методик зростала кількість функціонуючих капілярів нігтьового ложа, а у 28,1 % осіб – зменшувався відсоток порушень мікроциркуляції, що говорить про покращення кровообігу у шкірі. Розроблені профілактичні методики сприяли зменшенню проявів андрогенного дефіциту та симптомів старіння чоловіків, що проявлялося зниженням бальної оцінки за шкалою AMS у 69,1 % осіб і збільшенням концентрації тестостерону – у 60,0 % чоловіків наприкінці курсу оздоровлення. Використання профілактичних курсів тіотриазоліну як препарату з антиоксидантною та цитопротекторною дією, пірацетаму як ноотропного засобу також було ефективним, проте їх ефективність поступалась застосуванню тіоцетаму.
Таким чином, наведені у даному розділі результати досліджень дозволяють рекомендувати чоловікам – мешканцям великих промислових міст розроблені з урахуванням віку індивідуалізовані оздоровчо-лікувальні методики направлені на покращення обміну речовин, психологічного стану та стану шкіри, що у подальшому дозволить зменшити частоту патологічних станів організму та захворювань шкіри.
Результати, отримані при проведенні дослідження, наведені у розділі 5, опублікованіув наступних друкованих працях:
1. Резніченко Н. Ю. Діагностика, лікування та профілактика псоріатичної хвороби у чоловіків у віковому аспекті / Н. Ю. Резніченко. – Запоріжжя : Просвіта, 2014. – 308 с.
2. Резніченко Н. Ю. Корекція змін стану шкіри та гомеостазу організму у чоловіків, які працюють, із застосуванням курсів вітамінотерапії / Н. Ю. Резніченко // Патологія. – 2014. – № 3 (32). – С. 105–110.
3. Дюдюн А. Д. Особливості гормонального статусу у чоловіків різних вікових груп і можливості їх корекції / А. Д. Дюдюн, Н. Ю. Резніченко // Урологія. – 2014. – Т. 18, № 3 (70). – С. 12–16.
4. Резніченко Н. Ю. Зміни метаболізму у чоловіків різного віку та шляхи їх корекції / Н. Ю. Резніченко // Здоровье мужчины. – 2014. – № 1 (48). – С. 12–17.
5. Резніченко Н. Ю. Значення вітамінопрофілактики для попередження виникнення дерматологічної патології та збереження здоров’я населення / Н. Ю. Резніченко // Журн. дерматовенерології та косметології ім. М. О. Торсуєва. – 2013. – № 1-2. – С. 75–80.
6. Резніченко Н. Ю. Корекція судинних порушень у шкірі чоловіків зрілого віку / Н. Ю. Резніченко // Сучасні мед. технології. – 2014. – № 1. – С. 85–89.
7. Резниченко Н. Ю. Особенности состояния кожи и гомеостаза у мужчин разных возрастных групп / Н. Ю. Резниченко // Медицина. – 2014. – № 4 (87). – С. 7–11.
8. Резниченко Н. Ю. Коррекция нарушений метаболизма и андрогенного дефицита у мужчин зрелого возраста / Н. Ю. Резниченко // Репродуктивное здоровье. Восточная Европа. – 2014. – № 3 (33). – С. 100–109.
9. Резніченко Н. Ю. Досвід застосування профілактичних курсів краталу та кверцетину з метою корекції вікових змін шкірних покровів і загального стану організму / Н. Ю. Резніченко // Дерматовенерология. Косметология. Сексопатология. – 2014. – № 1-4. – С. 199–205.
10. Резниченко Н. Ю. Коррекция сосудистых нарушений в коже мужчин в возрастном аспекте / Н. Ю. Резниченко // Достижения и перспективы развития медицинской науки : материалы IX годичной науч.-практ. конф. молодых ученых и студентов Таджикского ГМУ им. Абуали ибни Сино и междунар. участием. – Душанбе, 2014. – С.43.
Розділ 6
Особливості стану шкіри, соціально-побутових і психологічних параметрів, гомеостазу у хворих на псоріаз чоловіків
Для встановлення патогенетичних змін при псоріазі було обстежено 110 хворих чоловіків віком від 45 до 64 років. До групи порівняння увійшли 197 чоловіків без ознак дерматологічних захворювань віком від 45 до 64 років. Контрольну групу склали 250 чоловіків віком від 25 до 44 років без ознак дерматологічних захворювань.
Шляхом опитування було встановлено, що у здорових і хворих на псоріаз чоловіків віком 45-64 років стаж роботи майже не відрізнявся. При цьому часті стреси на роботі відзначалися переважно у хворих на псоріаз чоловіків віком 45-64 років (у 42,2 %) порівняно з групою здорових чоловіків аналогічного віку (у 28,4 %) та групою здорових осіб віком 25-44 років (18,8 %).
Серед хворих на псоріаз була більшою кількість людей, які вважали свої стосунки у родині незадовільними та відзначали несприятливий психологічний клімат у сім’ї. Якщо серед здорових чоловіків віком 25-44 років психологічний клімат у родині вважали несприятливим лише 6 % чоловіків, а серед осіб віком 45-64 років – 18,5 % опитуваних, то хворі на псоріаз чоловіки віком 45-64 років у 22,7 % випадків розглядали психологічний клімат у родині як несприятливий.
Серед хворих на псоріаз чоловіків частіше, ніж у популяції у цілому зустрічалися шкідливі звички. Серед хворих на псоріаз віком 45-64 років 52,7 % палили тютюн. В той же час серед здорових чоловіків аналогічного віку тільки 43,7 % були курцями тютюну. Аналогічна тенденція відзначалась і за вживанням алкогольних напоїв. Серед хворих на псоріаз осіб віком 45-64 років 29,1 % вживали спиртні напої щотижнево або частіше. У той же час серед здорових чоловіків аналогічного віку тільки 19,8 % відносно часто вживали алкоголь.
Увага приділялася також особливостям харчування здорових і хворих на псоріаз чоловіків. У результаті опитування було встановлено, що хворі на псоріаз рідко вживали кисломолочні продукти. Лише 19,1 % хворих віком 45-64 років вживали кисломолочні продукти більше 2-х днів на тиждень. Серед здорових чоловіків віком 45-64 років відсоток осіб, які більше 2-х днів на тиждень вживали кисломолочні продукти, становив 25,9 %.
Більшість хворих на псоріаз рідко вживали рибу та морепродукти – 74,5 % їли рибу та морепродукти лише 1-2 дні на тиждень або взагалі їх не вживали. Відсоток осіб, які 5-7 днів на тиждень харчувалися рибою та морепродуктами, серед хворих на псоріаз був низьким і становив 4,5 %. У групі хворих на псоріаз віком 45-64 років спостерігався також найбільший відсоток осіб, які менше 3 днів на тиждень вживали м’ясо та м’ясні продукти, – 38,6 %. В той же час лише 26,5 % здорових чоловіків віком 45-64 років менше 3 днів на тиждень вживали м’ясо та м’ясні продукти.
У хворих на псоріаз недостатнім було і використання у їжу овочів і фруктів. 5-7 днів на тиждень овочі та фрукти вживали 38,8 % здорових чоловіків віком 25-44 років, 33,5 % здорових осіб віком 45-64 років і лише 24,5 % хворих на псоріаз. 29,1 % хворих обмежувалися 1-2 днями вживання овочів і фруктів на тиждень або взагалі їх не вживали. Відсоток таких осіб серед здорових чоловіків був нижчим і становив 21,3 % у віці 45-64 років і 17,2 % у віці 25-44 роки.
При цьому спостерігалося часте використання у їжу макаронних виробів і картоплі серед хворих на псоріаз. 60,0 % хворих 5-7 днів на тиждень вживали макарони та картоплю. Майже щоденне їх вживання відзначали 50,8 % здорових чоловіків віком 45-64 років і 44,8 % здорових осіб віком 25-44 років. Нечасте харчування макаронами та картоплею (1-2 рази на тиждень або повну відмову від них) відзначили 14,0 % здорових чоловіків віком 25-44 років, 12,2 % здорових осіб віком 45-64 років і лише 2,7 % хворих на псоріаз.
Хоча анкетуванням не можна надто ретельно охарактеризувати стан харчування, однак простежується чітка тенденція до дисбалансу у надходженні харчових інгредієнтів з превалюванням надходження вуглеводів та недостатнім вживанням білків і вітамінів у хворих на псоріаз чоловіків старших вікових груп.
Цікавим фактом виявилось те, що більше половини хворих на псоріаз лише час від часу проявляли турботу про своє здоров’я. Постійне піклування про здоров’я проявляли 32,0 % здорових чоловіків віком 25-44 років, 22,3 % здорових осіб віком 45-64 років і лише 21,8 % хворих на псоріаз. З віком спостерігалося зростання відсотка чоловіків без наявності дерматологічної патології, які зовсім не проявляли піклування про своє здоров’я: у віці 25-44 років 4,8 % чоловіків не виявляли турботи про стан здоров’я, а у віці 45-64 років – 18,3 %. Відсоток осіб, які зовсім не піклувалися про стан свого здоров’я, серед хворих на псоріаз віком 45-64 років був найвищим і становив 29,1 %.
Недостатня турбота про своє здоров’я, відсутність раціонального харчування, часті стреси на роботі, несприятливий психологічний клімат у родині, шкідливі звички можуть сприяти виникненню та розвитку псоріазу у чоловіків старших вікових груп і можуть розглядатись як фактори ризику псоріатичної хвороби. Саме тому вони потребують проведення відповідної корекції – зміни образу життя, відмови від тютюнопаління та вживання алкогольних напоїв, переходу до раціонального харчування, уникнення стресів або проведення психологічних тренінгів щодо підвищення стійкості до стресових станів.
У ході дослідження велика увага приділялася визначенню особливостей психологічного стану хворих на псоріаз чоловіків старших вікових груп. Отримані результати надані на табл. 6.1, з якої видно, що у здорових чоловіків різних вікових груп рівень особистісної тривожності був однаковим. Це пов’язано з тим, що особистісна тривожність формується у ранньому віці і має певну стабільність. У ході дослідження було встановлено, що рівень особистісної тривожності у хворих на псоріаз чоловіків віком 45-64 років достовірно перевищував її бальну оцінку у групі здорових осіб віком 25-44 років. Це свідчить про те, що сформована у ранньому дитинстві підвищена особистісна тривожність є фоном, на якому у подальшому розвивається псоріаз.
Таблиця 6.1 – Рівні ситуативної та особистісної тривожності, невротизації та депресії у здорових і хворих на псоріаз чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 роки, хворі на псоріаз | |
| Рівень особистісної тривожності за шкалою Спілбергера-Ханіна, бали | 38,2±0,32 | 38,4±0,31 | 41,7±0,27*l |
| Рівень ситуативної тривожності за шкалою Спілбергера-Ханіна, бали | 39,3±0,17 | 41±0,18* | 46,1±0,34*l |
| Рівень невротизації за Л. І. Вассерманом, бали | 4,08±0,2 | 6,89±0,23* | 12,6±0,42*l |
| Рівень депресії за шкалою Бека, бали | 3,58±0,27 | 6,68±0,32* | 10,3±0,41*l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на псоріаз чоловіків віком 45-64 років.
Якщо середнє значення інтегрального показника особистісної тривожності у хворих на псоріаз віком 45-64 років відповідало помірному рівню тривожності, то ситуативна тривожність досягала високого рівня. Реактивна тривожність у хворих на псоріаз обумовлена високою ситуативною напругою, стурбованістю, тривогою. Отже, при потраплянні у стресові ситуації хворі на псоріаз неадекватно реагують на фактори навколишнього середовища, що призводить до психічної напруги та змін у діяльності нервової системи, а також до рецидивів захворювання.
У хворих на псоріаз віком 45-64 років відзначався достовірно вищий рівень невротизації порівняно з групами здорових осіб як віком 25-44 років, так і віком 45-64 років (табл. 6.1). Якщо інтегральні показники невротизації за Л. І. Вассерманом у різних вікових групах здорових чоловіків відповідали низькому рівню, то хворі на псоріаз виявляли невротизацію середнього ступеня тяжкості. Це говорить про зростання у них емоційної збудливості, у результаті чого виникають негативні переживання, такі як тривожність, напруга, подразливість, розгубленість. Виникає іпохондрична фіксація на соматичних відчуттях і особистих недоліках, у тому числі і тих, які стосуються клінічних проявів псоріазу. Це призводить до прогресування псоріазу та погіршення якості життя хворого.
У хворих на псоріаз спостерігався також достовірно вищий рівень інтегрального показника депресії за шкалою Бека у порівнянні з групами здорових осіб віком 25-44 років і 45-64 років (табл. 6.1). Здорові чоловіки у середньому не виявляли ознак депресії. При цьому середній бал оцінки за шкалою Бека у хворих на псоріаз відповідав стану субдепресії. З одного боку, це є результатом впливу хронічного перебігу псоріазу на психологічний стан хворого, а з іншого боку, наявність стану субдепресії може бути провокуючим фактором псоріазу.
Був встановлений кореляційний зв’язок між індексом PASI та бальною оцінкою рівня ситуативної тривожності за шкалою Спілбергера-Ханіна (r=0,65), рівня невротизації за Л. І. Вассерманом (r=0,36), рівня депресії за шкалою Бека (r=0,19). Визначено кореляційний зв’язок між індексом BSA та бальною оцінкою рівня ситуативної тривожності за шкалою Спілбергера-Ханіна (r=0,58), рівня невротизації за Л. І. Вассерманом (r=0,33), рівня депресії за шкалою Бека (r=0,15).
Таким чином, відбувається формування патологічно замкненого кола, коли наявність псоріазу призводить до підвищення тривожності, невротизації та депресії хворого, а психологічні зміни є провокуючим фактором захворювання.
Крім того, всім чоловікам проводилося вимірювання зросту та маси тіла, систолічного та діастолічного артеріального тиску, вираховувався індекс маси тіла. Як видно з табл. 6.2, у хворих на псоріаз чоловіків віком 45-64 років відзначалася тенденція до зростання маси тіла, індексу маси тіла, систолічного та діастолічного артеріального тиску порівняно з групою здорових осіб аналогічного віку. Отримана достовірна різниця за масою тіла, індексом маси тіла, систолічним і діастолічним артеріальним тиском між групою хворих на псоріаз віком 45-64 років і групою здорових осіб віком 25-44 років. Встановлено достовірно вищий рівень діастолічного артеріального тиску у хворих на псоріаз чоловіків віком 45-64 років порівняно з групою здорових осіб аналогічного віку.
Таблиця 6.2 – Зріст, маса тіла, індекс маси тіла, артеріальний тиск у здорових і хворих на псоріаз чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на псоріаз | |
| Маса тіла, кг | 77,9±0,89 | 82,5±0,98* | 84,1±1,25* |
| ІМТ, кг/м2 | 24,9±0,25 | 26,7±0,3* | 27,6±0,38* |
| САТ, мм рт. ст. | 119±0,51 | 131±0,73* | 134,2±1,42* |
| ДАТ, мм рт. ст. | 77,9±0,38 | 82,8±0,52* | 85,4±0,86*l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на псоріаз чоловіків віком 45-64 років.
Ці показники мають надзвичайно важливе значення. Як відомо, підвищення індексу маси тіла та артеріального тиску є складовими метаболічного синдрому, а він обтяжує перебіг псоріазу у осіб старших вікових груп.
У всіх обстежених чоловіків проводили клінічну оцінку стану шкіри. При цьому увага приділялася визначенню сухості, тургору, зморшкуватості шкіри, наявності елементів висипань на шкірі, які є маркерами старіння. Результати досліджень стану шкіри у здорових і хворих на псоріаз чоловіків наведені на табл. 6.3. У ході дослідження не отримано достовірних змін з боку більшості показників стану шкіри у хворих на псоріаз порівняно з групою здорових осіб аналогічного віку. Відзначена достовірно більша бальна оцінка сухості шкіри у групі хворих чоловіків порівняно з групами здорових осіб як віком 25-44 років, так і 45-64 років.
Таблиця 6.3 – Клінічні показники стану шкіри у здорових і хворих на псоріаз чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на псоріаз | |
| Сухість шкіри, бали | 0,04±0,01 | 0,47±0,05* | 1,27±0,08*l |
| Порушення тургору, бали | 0,55±0,03 | 1,34±0,03* | 1,37±0,05* |
| Кількість зморшок (4см2х3) | 3,9±0,13 | 11,8±0,17* | 11,6±0,23* |
| Оцінка вираженості зморшок і стану шкіри, бали | 7,35±0,43 | 26,2±0,52* | 26,4±0,63* |
| Оцінка шкіри за шкалою Yolanda R. Helfrich et. al. | 0,65±0,06 | 3,71±0,09* | 3,73±0,12* |
| Кількість елементів – маркерів старіння | 11,8±1,51 | 53,8±2,42* | 48.5±4,22* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на псоріаз чоловіків віком 45-64 років.
Ступінь тяжкості псоріазу у хворих оцінювався за шкалою PASI, індексом BSA. У обстежених хворих на псоріаз чоловіків віком 45-64 років індекс PASI у середньому становив (26,6±1,57) бала, а індекс BSA склав (38,1±2,53) %.
У частини хворих на псоріаз при клінічному огляді були виявлені об’єктивні ознаки свербежу, такі як зміни нігтьових пластин і екскоріації. У хворих на псоріаз чоловіків віком 45-64 років бальна оцінка змін нігтьових пластин у середньому становила (0,12±0,03) балів, а бальна оцінка екскоріацій склала (0,27±0,05) балів. Крім того, хворі на псоріаз оцінювали інтенсивність свербежу шкіри за 10-бальною візуальною аналоговою шкалою, результат склав (3,5±0,21) балів.
Погіршення стану шкірного покрову у цілому, наявність патологічних висипань на шкірі, суб’єктивних ознак захворювання у вигляді свербежу призводило до зниження якості життя у хворих на псоріаз. Це спричиняло зростання індексу DLQI у хворих на псоріаз чоловіків віком 45-64 років. У середньому індекс DLQI у них становив (14,3±0,48) балів.
Були розглянуті також особливості мікроциркуляції у хворих на псоріаз чоловіків. Результати проведених біомікроскопічних досліджень судин нігтьового ложа надані на табл. 6.4. У хворих на псоріаз віком 45-64 років кількість функціонуючих капілярів була на 21,6 % меншою, а відсоток порушень мікроциркуляції – на 25,0 % більшим, ніж у здорових осіб аналогічного віку. Був встановлений кореляційний зв’язок між індексом PASI та кількістю функціонуючих капілярів на 1 мм3 (r=–0,31), відсотком позасудинних змін мікроциркуляції (r=0,42). Визначено кореляційний зв’язок між індексом BSA та кількістю функціонуючих капілярів на 1 мм3 (r=–0,20), відсотком позасудинних змін мікроциркуляції (r=0,49). Таким чином, результати проведеного дослідження свідчать про погіршення мікроциркуляції у хворих на псоріаз чоловіків 45-64-років.
Таблиця 6.4 – Біомікроскопічні показники судин нігтьового ложа у здорових і хворих на псоріаз чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на псоріаз | |
| Кількість функціонуючих капілярів на 1 мм3 | 40,3±0,57 | 32±0,48* | 25,1±0,45*l |
| Наявність порушень мікроциркуляції, % | 29,2±6,7 | 62,5±6,9* | 78,1±14,0* |
| Судинні порушення, % | 20,8±5,9 | 43,8±6,3* | 40,6±8,8* |
| Внутрішньосудинні зміни, % | 10,4±4,5 | 25,0±5,5* | 35,5±8,7* |
| Позасудинні зміни,% | 8,3±4,0 | 10,9±3,9* | 29,0±8,3* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на псоріаз чоловіків віком 45-64 років.
Важливу роль у розвитку та прогресуванні дерматологічної патології відіграє мікробіоценоз шкіри. Його склад періодично змінюється, проте кожній людині притаманний характерний мікробний пейзаж. Власними дослідженнями було встановлено, що мікрофлора шкіри у здорових і хворих на псоріаз чоловіків мала певні відмінності, представлені на табл. 6.5. Як видно з таблиці, у хворих на псоріаз віком 45-64 років відзначалася достовірно більша загальна кількість бактерій на шкірі порівняно як зі здоровими чоловіками віком 25-44 років, так і 45-64 років. Крім того, у хворих на псоріаз віком 45-64 років відзначалася тенденція до збільшення кількості коагулазопозитивних стафілококів на шкірі. Отримана достовірна різниця за кількістю коагулазопозитивних стафілококів між групою хворих на псоріаз і групою здорових чоловіків віком 25-44 років. Ці дані свідчать про наявність дисбіотичного стану у хворих на псоріаз старших вікових груп, який може сприяти прогресуванню захворювання.
Таблиця 6.5 – Стан мікробного обсіменіння шкіри у здорових і хворих на псоріаз чоловіків (Lg КУО/см2) (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на псоріаз | |
| Загальна кількість бактерій | 3,03±0,12 | 3,68±0,1* | 4,07±0,14*l |
| Стафілококи коагулазонегативні | 1,33±0,24 | 1,51±0,24 | 1,45±0,32 |
| Стафілококи коагулазопозитивні | 0,25±0,14 | 1,18±0,23 | 1,4±0,37* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на псоріаз чоловіків віком 45-64 років.
Дослідження стану системи ПОЛ-АОС у хворих на псоріаз чоловіків віком 45-64 років показало, що концентрація ТБК-АП у них була вищою, ніж у здорових чоловіків (табл. 6.6). При цьому реагування загальної антиокислювальної активності слини було неадекватним – загальна АОА була достовірно нижчою порівняно з її значенням у чоловіків віком 25-44 років. Це приводило до достовірного зменшення коефіцієнту антиокислювального захисту у хворих на псоріаз при порівнянні не лише з групою здорових чоловіків віком 25-44 років, але й з групою здорових віком 45-64 років. Був встановлений кореляційний зв’язок між індексом PASI та концентрацією ТБК-АП (r=–0,36), коефіцієнтом антиокислювального захисту (r=0,42). Визначено кореляційний зв’язок між індексом BSA та концентрацією ТБК-АП (r=–0,44), КАОЗ (r=0,43).
Для визначення циркадних ритмів функціонування системи ПОЛ-АОС у хворих на псоріаз був проведений добовий моніторинг її активності (рис. 6.1). Максимальне значення концентрації ТБК-АП, як і у молодших чоловіків, приходилося на вечірні години, а мінімальне – на ранкові. У хворих на псоріаз віком 45-64 років крива добових змін ТБК-АП мала найменшу амплітуду коливань протягом доби порівняно з іншими групами чоловіків. Крім того, дана крива у хворих на псоріаз розташовувалася вище від інших, що свідчить про високу активність ПОЛ при псоріазі. Ці дані свідчать про те, що у хворих на псоріаз чоловіків віком 45-64 років зменшувалися коливання активності системи ПОЛ на фоні її вищої активності.
Таблиця 6.6 – Показники функціонування системи ПОЛ-АОС у здорових і хворих на псоріаз чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на псоріаз | |
| ТБК-АП, ммоль/л | 2,69±0,02 | 3,06±0,03* | 3,43±0,02*l |
| Загальна АОА, % | 64,9±0,35 | 66,6±0,4* | 62,1±0,37*l |
| КАОЗ | 24,1±0,19 | 21,8±0,2* | 18,1±0,09*l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на псоріаз чоловіків віком 45-64 років.
Крива добових змін загальної антиокислювальної активності у чоловіків віком 25-44 років мала вигляд синусоїди з максимальним значенням у вечірні та мінімальним значенням у ранкові години. У чоловіків віком 45-64 років крива добової АОА також мала форму синусоїди, але з максимальним значенням в обідній час і поступовим зменшенням у другій половині доби. Вірогідно, у чоловіків віком 45-64 років не відбувалось адекватної відповіді антиокислювального захисту на зростання активності системи ПОЛ у вечірній час, що свідчить про виснаження антиокислювальних можливостей організму. У хворих на псоріаз чоловіків віком 45-64 років крива загальної АОА наближалася до прямої лінії, система антиокислювального захисту майже не реагувала на добові коливання активності ПОЛ, що свідчить про виснаженість антиокислювальної системи та є однією з патогенетичних ланок захворювання. У чоловіків, хворих на псоріаз, віком 45-64 років зникають циркадні ритми показників загальної АОА у слині протягом доби.
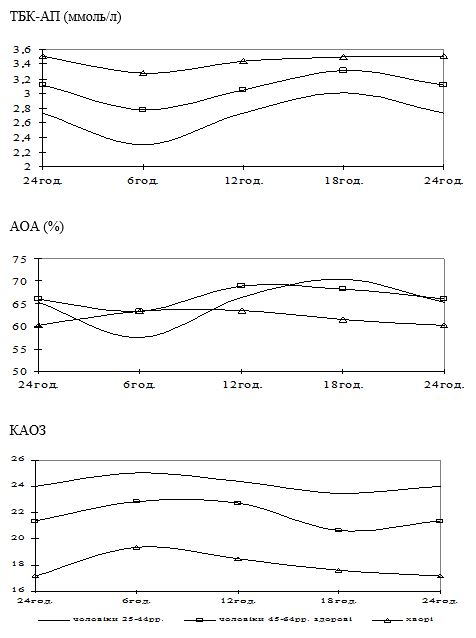
Рисунок 6.1 – Добові зміни концентрацій ТБК-АП, АОА та КАОЗ у хворих на псоріаз
Були розглянуті добові коливання коефіцієнту антиокислювального захисту, який відображає співвідношення загальної антиокислювальної активності та концентрації ТБК-АП і є інтегративним показником превалювань у функціонуванні системи ПОЛ-АОС. Як видно з рис. 6.1, у чоловіків віком 25-44 років крива добового коливання КАОЗ наближалася до прямої лінії, що свідчить про стабільні взаємовідносини у системі ПОЛ-АОС – антиокислювальна система адекватно реагувала на зміни в активації ПОЛ протягом доби. У здорових чоловіків віком 45-64 років крива добового коливання КАОЗ знаходилась нижче, ніж у чоловіків віком 25-44 роки. Це свідчить про менші можливості антиокислювального захисту у відповідь на активацію ПОЛ. Найнижче знаходилася крива добового коливання КАОЗ у групі хворих на псоріаз чоловіків віком 45-64 років. Особливо низькі значення спостерігались у вечірній і нічний час, що підтверджує думку про виснаженість антиокислювального захисту та превалювання активації ПОЛ саме у цю пору доби.
Отримані дані показали, що при концентраціях розчинів хлориду натрію 0,35 – 0,45 % відсоток гемолізу у чоловіків віком понад 44 роки був більшим, ніж у чоловіків віком 25-44 років (табл. 6.7). Відсоток гемолізу еритроцитів був максимальним у хворих на псоріаз чоловіків віком 45-64 років. Зменшення стійкості еритроцитарних мембран у хворих на псоріаз говорить про патогенетичну роль цього чинника, особливо у чоловіків старших вікових груп.
Активація ПОЛ, порушення функціонування клітинних мембран призводять до змін метаболізму як окремих клітин, так і організму у цілому. Проведені дослідження показали, що у хворих на псоріаз чоловіків віком 45-64 років відбувалося збільшення концентрації СМ1 на 24 % і СМ2 – на 35 % порівняно зі здоровими особами аналогічного віку, що свідчить про зростання рівня ендотоксикозу (табл. 6.7). На це вказує також виявлений кореляційний взаємозв’язок між СМ2 та індексом PASI (r=0,40), індексом BSA (r=0,42).
Таблиця 6.7 – Осмотична стійкість еритроцитів і концентрація середніх молекул у здорових і хворих на псоріаз чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | |||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на псоріаз | ||
| Розчини NaCl, %: | 0,45 % | 21,8±0,39 | 28,1±0,53* | 32,1±0,49*l |
| 0,4 % | 67,4±0,53 | 72,3±0,56* | 77,1±0,63*l | |
| 0,35 % | 93,1±0,28 | 95,4±0,3* | 96,6±0,25*l | |
| СМ1, у. о. | 0,33±0,004 | 0,36±0,004* | 0,45±0,005*l | |
| СМ2, у. о. | 0,14±0,003 | 0,18±0,004* | 0,24±0,004*l | |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на псоріаз чоловіків віком 45-64 років.
Аналіз концентрацій гормонів і медіаторів симпатоадреналової та вагоінсулярної систем у здорових і хворих на псоріаз чоловіків представлений на табл. 6.8, а їх співвідношення – на рис. 6.2. Екскреція адреналіну, ДОФА та дофаміну у хворих на псоріаз була достовірно нижчою, ніж у здорових чоловіків, що свідчило про зниження функціональної активності та резервних можливостей симпатоадреналової системи у хворих. Концентрація кортизолу в крові у хворих на псоріаз достовірно перевищувала рівень у здорових, як і концентрація інсуліну у крові. Коефіцієнт НА:І був майже таким самим, а коефіцієнт К:І – підвищеним у порівнянні зі здоровими.
Виявлені порушення взаємовідносин гормональної ланки симпатоадреналової системи обґрунтовують доцільність використання ноотропних препаратів у комплексній терапії хворих на псоріаз у віці 45-64 років.
У ході проведених досліджень було також встановлено, що хворі на псоріаз чоловіки віком 45-64 років мали достовірно нижчу (на 33,2 %) концентрацію тестостерону та достовірно вищу концентрацію ФСГ, ЛГ, пролактину, ТЗГ у порівнянні з групою здорових чоловіків аналогічного віку, що потребувало проведення обов’язкової корекції у комплексній терапії (табл. 6.9). Крім того, у хворих на псоріаз чоловіків віком 45-64 років спостерігалися більш виражені симптоми андрогенного дефіциту, що проявлялося достовірно вищою (на 7,5 %) бальною оцінкою за шкалою AMS порівняно з групою здорових чоловіків аналогічного віку.
Таблиця 6.8 – Екскреція катехоламінів з сечею, концентрація кортизолу та інсуліну в крові у здорових і хворих на псоріаз чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на псоріаз | |
| Адреналін, нмоль/добу | 35,7±0,35 | 35,4±0,82 | 27,2±0,28*l |
| Норадреналін, нмоль/добу | 82,3±0,58 | 91,9±1,25* | 93,5±0,89* |
| Дофамін, нмоль/добу | 1678±12,3 | 1617±26,1* | 1348±13,1*l |
| ДОФА, нмоль/добу | 193±1,49 | 210±2,27* | 162±0,96*l |
| Кортизол, нмоль/л | 275±1,26 | 321±2,38* | 410±1,38*l |
| Інсулін, мкМО/мл | 6,91±0,02 | 7,16±0,06* | 7,32±0,02*l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на псоріаз чоловіків віком 45-64 років.
Як відомо, у хворих на псоріаз старших вікових груп частою супутньою патологією є метаболічний синдром, який супроводжується збільшенням концентрації холестерину, β-ліпопротеїдів, тригліцеридів, глюкози. Проведені нами дослідження у хворих на псоріаз чоловіків відображають відповідні тенденції (табл. 6.10). У групі хворих на псоріаз чоловіків віком 45-64 років відзначалися достовірно вищі концентрації холестерину, тригліцеридів, β-ліпопротеїдів і глюкози порівняно зі здоровими особами аналогічного віку.
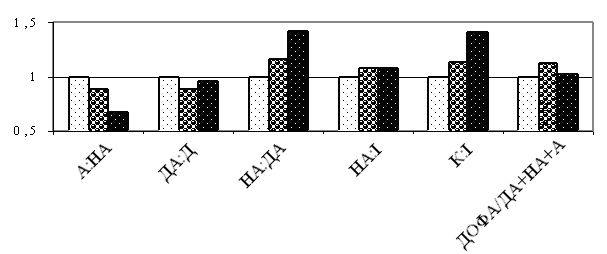
Рисунок 6.2 – Співвідношення гормонів і медіаторів у здорових і хворих на псоріаз чоловіків (результати, отримані у чоловіків віком 25-44 років, прийняті за 1).
Таблиця 6.9 – Концентрація статевих і гонадотропних гормонів, ТЗГ у крові, бальна оцінка за шкалою AMS у здорових і хворих на псоріаз чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на псоріаз | |
| Тестостерон, нмоль/л | 18,4±0,43 | 14,6±0,39* | 9,75±0,2*l |
| ТЗГ, нмоль/л | 32,9±0,31 | 44,3±1,09* | 53,4±0,39*l |
| ФСГ, МЕ/л | 3,08±0,03 | 4,06±0,08* | 4,84±0,03*l |
| ЛГ, ЕД/л | 3,08±0,03 | 3,72±0,04* | 4,17±0,07*l |
| ПРЛ, mMe/l | 221±1,31 | 263±3,82* | 305±1,93*l |
| Оцінка за шкалою AMS, бали | 25,6±0,25 | 29,4±0,29* | 31,6±0,30*l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на псоріаз чоловіків віком 45-64 років.
Таблиця 6.10 – Концентрація ліпідів і глюкози в крові у здорових і хворих на псоріаз чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на псоріаз | |
| Холестерин, ммоль/л | 3,5±0,03 | 4,6±0,04* | 5,01±0,02*l |
| β-ліпопротеїди, % | 37,7±0,66 | 48,7±0,48* | 53±0,63*l |
| Тригліцериди, ммоль/л | 1,24±0,03 | 1,83±0,05* | 2,06±0,03*l |
| Глюкоза, ммоль/л | 4,77±0,04 | 5,29±0,05* | 5,79±0,05*l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на псоріаз чоловіків віком 45-64 років.
* * *
Таким чином, наведені у розділі матеріали свідчать про наявність у хворих на псоріаз старших вікових груп змін мікроциркуляції шкіри, порушень у функціонуванні системи ПОЛ-АОС, змін стійкості еритроцитарних мембран, підвищення рівня ендотоксикозу, порушень з боку симпатоадреналової та вагоінсулярної систем, змін концентрації гонадотропних гормонів, зниження концентрації тестостерону, погіршення ліпідного обміну. Це доводить доцільність вивчення ефективності застосування у комплексній терапії псоріазу препаратів з антиокислювальними, цитопротекторними та ноотропними властивостями, фітопрепарату на основі стероїдних сапонінів і психокорекції.
Результати, отримані при проведенні дослідження, наведені в розділі 6, опубліковані у наступних друкованих працях:
1. Резніченко Н. Ю. Діагностика, лікування та профілактика псоріатичної хвороби у чоловіків у віковому аспекті / Н. Ю. Резніченко. – Запоріжжя : Просвіта, 2014. – 308 с.
2. Резніченко Н. Ю. Корекція порушень мікроциркуляції шкіри у чоловіків зрілого віку із псоріазом / Н. Ю. Резніченко // Кровообіг та гемостаз. – 2013. – № 3-4. – С. 74–77.
3. Резніченко Н. Ю. Зміни метаболізму у чоловіків зрілого віку, хворих на псоріаз / Н. Ю. Резніченко // Журн. клінічних та експерим. мед. досліджень. – 2013. – № 3. – С. 322–327.
4. Резніченко Н. Ю. Стан симпато-адреналової та ваго-інсулярної систем у чоловіків зрілого віку, хворих на псоріаз / Н. Ю. Резніченко // Biomedical and Biosocial Аnthropology. – 2013. – № 20. – С. 135–138.
5. Резниченко Н. Ю. Современные подходы к лечению и профилактике обострений псориатической болезни / Н. Ю. Резниченко // Дерматовенерология. Косметология. – 2015. – № 1 (01). – С. 116–128.
Розділ 7
Патогенетичне обґрунтування нових підходів
до лікування хворих на псоріатичну хворобу чоловіків старших вікових груп в умовах великого
промислового міста
Враховуючи описані у попередньому розділі зміни стану шкірного покрову, мікроциркуляції у шкірі, метаболічні порушення системи ПОЛ-АОС, осмотичної стійкості еритроцитів, збільшення ендотоксикозу, порушення функціонування симпатоадреналової та вагоінсулярної системи, зміни концентрації статевих гормонів і психологічні особливості у хворих на псоріаз чоловіків віком 45-64 років, нами була розглянута можливість їх лікування з патогенетично обґрунтованим застосуванням у комплексній терапії препарату з антиоксидантними, цитопротекторними та ноотропними властивостями (тіоцетаму), екстракту рослини Tribulus Terrestris (трібестану) та автогенних тренінгів за методом Шульца.
Були створені наступні дослідні групи серед хворих на псоріаз чоловіків віком 45-64 років у залежності від способу лікування: І – хворі, які проходили базове лікування псоріазу згідно наказу Міністерства охорони здоров’я України № 312 від 08.05.2009 р.; ІІ – хворі, які додатково до базової терапії отримували тіоцетам; ІІІ – хворі, які додатково проводили курси автогенних тренінгів за методом Шульца; ІV – хворі, які додатково використовували трібестан.
Результати проведених досліджень стану шкіри у хворих на псоріаз чоловіків віком 45-64 років у процесі лікування надані на табл. 7.1, з якої видно, що у процесі лікування в усіх дослідних групах відзначалося зменшення сухості шкіри. Отримана достовірна різниця за бальною оцінкою сухості шкіри між групою хворих до початку лікування та після терапії з включенням тіоцетаму. Достовірної різниці за бальною оцінкою порушень тургору шкіри, стану фотозахищених ділянок за шкалою Yolanda R. Helfrich et al. між групами хворих до та після проведеної терапії псоріазу встановлено не було. При цьому за такими показниками, як сухість і бальна оцінка стану шкіри за шкалою Yolanda R. Helfrich et al., найкращі результати (хоча і не достовірно) отримані у групі хворих, яка додатково до базової терапії отримувала тіоцетам.
Таблиця 7.1 – Клінічні показники стану шкіри у хворих на псоріаз чоловіків віком 45-64 років у процесі лікування (М±m)
| Групи чоловіків віком 45-64 років: | Сухість шкіри, бали | Порушення тургору шкіри, бали | Оцінка шкіри за шкалою Yolanda R. Helfrich et. al. | |
| здорові 45-64 років | 0,47±0,05 | 1,34±0,03 | 3,71±0,09 | |
| хворі на псоріаз | до лікування | 0,58±0,065 | 1,37±0,054 | 3,75±0,13 |
| після базової терапії |
0,46±0,10 | 1,29±0,09 | 3,6±0,24 | |
| після розробленої терапевтичної методики | 0,40±0,07 | 1,26±0,07 | 3,48±0,13 | |
| після курсу терапії з включенням тіоцетаму | 0,35±0,12 | 1,24±0,14 | 3,30±0,17l | |
| після курсу автогенних тренінгів | 0,44±0,13 | 1,31±0,12 | 3,63±0,22 | |
| після курсу терапії з включенням трібестану | 0,41±0,12 | 1,24±0,11 | 3,53±0,26 | |
Примітка. l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування.
У процесі лікування хворих на псоріаз (незалежно від терапевтичної групи) відзначалося зменшення свербежу шкіри та його об’єктивних ознак (рис. 7.1). Отримана достовірна різниця за бальною оцінкою свербежу між групою хворих до початку лікування та після його завершення у всіх дослідних групах. Достовірно меншу бальну оцінку свербежу отримано у групах хворих, які додатково застосовували розроблений нами комплекс заходів у цілому та зокрема практикували курси автогенних тренінгів, порівняно з групою пацієнтів, які отримували лише базову терапію псоріазу. Найменші бальні оцінки свербежу, вираженості екскоріацій і змін нігтьових пластин наприкінці курсу лікування встановлено у хворих, які додатково до базової терапії застосовували автогенні тренінги. Не було отримано достовірної різниці між групою хворих після проведення розробленого комплексу терапії псоріазу та його базової терапії за вираженістю об’єктивних ознак свербежу. Проте у чоловіків після застосування розробленого нами терапевтичного комплексу відзначаються менші показники як бальної оцінки вираженості екскоріацій, так і змін нігтьових пластин порівняно з пацієнтами після курсу базової терапії псоріазу.
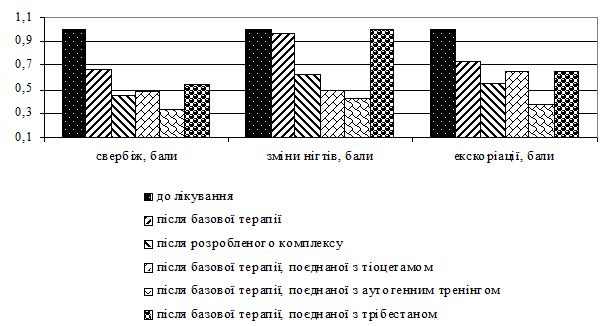
Рисунок 7.1 – Свербіж шкіри та вираженість його об’єктивних ознак у хворих на псоріаз чоловіків віком 45-64 років у процесі лікування (результати, отримані у хворих до лікування, прийняті за 1).
У хворих на псоріаз у процесі лікування змінювалась як площа ураженої шкіри, так і бальна оцінка за індексом PASI. Як видно з табл. 7.2, у хворих з усіх терапевтичних груп після проведеного лікування відзначалося достовірне зниження як індексу BSA, так і індексу PASI порівняно з групою пацієнтів до початку терапії, що говорить про покращення клінічної картини захворювання, зменшення площі ураження шкіри, регрес еритеми, інфільтрації та лущення. Слід відзначити, що індекс PASI був нижчим у хворих на псоріаз, які додатково застосовували розроблений нами комплекс заходів, порівняно з групою пацієнтів після використання лише базової терапії. Отримана достовірна різниця за Δ PASI (%) наприкінці лікування між групою хворих, які отримували лише базову терапію, та групою, яка додатково використовувала розроблений нами комплекс заходів у цілому. Показник Δ PASI (%) наприкінці лікування також був достовірно нижчим у пацієнтів після застосування базової терапії порівняно з групами хворих, які додатково у комплексній терапії псоріазу використовували тіоцетам, трібестан і автогенні тренінги за методом Шульца.
У групі хворих, які додатково застосовували розроблений нами комплекс заходів, відзначався вищий відсоток пацієнтів, які досягли PASI 50 і PASI 75 (тобто у яких індекс PASI знизився на 50 % і 75 % відповідно), у порівнянні з групою пацієнтів після базової терапії. Це свідчить про позитивний клінічний ефект додаткового використання розробленого нами комплексу заходів у лікуванні хворих на псоріаз чоловіків віком 45-64 років.
У пацієнтів з усіх терапевтичних груп на фоні проведеного лікування знижувався індекс DLQI (табл. 7.2), що свідчить про покращення якості їх життя порівняно з хворими до початку лікування. Слід відзначити, що індекс DLQI був достовірно вищим у групі хворих після базової терапії псоріазу порівняно з його значеннями у пацієнтів, які додатково застосовували розроблений нами комплекс заходів у цілому та автогенні тренінги за методом Шульца зокрема.
Таблиця 7.2 – Динаміка індексів PASI, BSA та DLQI у хворих на псоріаз чоловіків віком 45-64 років у процесі лікування
| Показники, одиниці вимірювання | Групи хворих на псоріаз віком 45-64 років: | |||||
| до лікування | після базової терапії | після розробленої терапевтичної методики | після курсу терапії з включенням тіоцетаму | після курсу автогенних тренінгів | після курсу терапії з включенням трібестану | |
| Індекс PASI (М±m) | 26,6±1,53 | 14,2±1,79* | 11,6±0,89* | 12,0±2,03* | 11,7±1,17* | 11,0±1,53* |
| Δ PASI, % (М±m) | 36,1±5,2 | 56,5±2,50l | 58,7±4,9l | 55,2±4,48l | 55,7±3,63l | |
| Δ PASI>50, % | 31,4 | 57,4 | 64,7 | 55,0 | 52,9 | |
| Δ PASI >75, % | 22,9 | 29,6 | 35,3 | 30,0 | 23,5 | |
| індекс BSA, % (М±m) | 38,1±2,53 | 24,8±2,41* | 22,1±1,63* | 22,6±3,41* | 21,75±2,47* | 22,0±2,8* |
| Індекс DLQI, бали (М±m) | 14,3±0,48 | 8,1±0,71* | 5,2±0,56*l | 5,5±1,34* | 4,4±0,63*l | 5,8±0,91* |
| Δ DLQI (М±m) | 45,2±3,0 | 67,6±2,58l | 69,3±6,35l | 70,2±3,27l | 62,9±3,54l | |
| DLQI<5, % | 40,0 | 50,0 | 52,9 | 55,0 | 41,2 | |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.
Крім того, була встановлена достовірна різниця за Δ DLQI (%) між групами пацієнтів, які отримували лише базову терапію та її комбінацію з розробленим нами комплексом заходів. Показник Δ DLQI (%) був достовірно нижчим у групі хворих після проведеної базової терапії псоріазу порівняно з групами пацієнтів, які додатково застосовували курси автогенних тренінгів за методом Шульца, тіоцетам і трібестан. Відсоток хворих, у яких по завершенню курсу лікування індекс DLQI був нижчим за 5 балів, був більшим після додаткового застосування розробленого нами комплексу заходів порівняно з групою пацієнтів, які отримували базову терапію псоріазу. Найвищий відсоток хворих, у яких наприкінці лікування індекс DLQI був нижчим за 5 балів, встановлений у чоловіків, які додатково до базової терапії псоріазу практикували автогенні тренінги за методом Шульца. Ці дані ще раз підкреслюють ефективність застосування розробленого нами комплексу заходів у цілому та автогенних тренінгів зокрема у комплексній терапії псоріазу.
Отже, включення до комплексної терапії псоріазу у чоловіків віком 45-64 роки препарату з цитопротекторними, антиоксидантними та ноотропними властивостями, фітопрепарату на основі стероїдних сапонінів, автогенного тренінгу за методом Шульца сприяло зменшенню індексів PASI на 56,5 %, BSA – на 42 %, DLQI – на 67,6 %. Розроблена терапевтична методика дала можливість отримати кращі результати лікування хворих на псоріаз, що проявлялось у менших значеннях індексу PASI у 1,56 рази, індексу BSA – у 1,20 рази, індексу DLQI – у 1,50 рази порівняно з базовою терапією.
У процесі лікування хворих на псоріаз також було вивчено динаміку змін ситуативної тривожності за шкалою Спілбергера-Ханіна, невротизації за методикою Л. І. Вассермана, депресії за шкалою Бека. Як видно з табл. 7.3, використання розробленого нами комплексу заходів щодо терапії псоріазу у чоловіків старших вікових груп сприяло зменшенню рівнів ситуативної тривожності, невротизації та депресії. За оцінкою ситуативної тривожності наприкінці лікування була отримана достовірна різниця між групою хворих, які використовували запропонований нами комплекс заходів, та групою осіб, які отримували базову терапію захворювання. Якщо значення інтегрального показника ситуативної тривожності у хворих на псоріаз до початку лікування відповідало рівню високої тривожності та висока тривожність зберігалась у пацієнтів після проведеного базового лікування, то використання розробленого нами комплексу заходів дозволяло знизити рівень ситуативної тривожності до помірних значень. За рівнем невротизації та депресії достовірна різниця отримана між групами чоловіків до початку лікування та після застосування розробленого нами комплексу.
Таблиця 7.3 – Рівні ситуативної тривожності, депресії та невротизації у хворих на псоріаз чоловіків віком 45-64 років у процесі лікування (М±m)
| Групи чоловіків віком 45-64 років: | Рівень ситуативної тривожності, бали | Рівень невротизації, бали |
Рівень депресії, бали | |
| здорові 45-64 років | 41,0±0,18 | 6,89±0,23 | 6,68±0,32 | |
| хворі на псоріаз | до лікування | 46,1±0,34* | 12,6±0,42* | 10,3±0,42* |
| після базової терапії | 45,3±0,7* | 12,0±0,65* | 9,6±0,65* | |
| після розробленої терапевтичної методики | 42,5±0,43*l◘ | 10,6±0,40*l | 8,56±0,41*l | |
| після курсу терапії з включенням тіоцетаму | 42,5±0,9l◘ | 11,0±0,66*l | 9,12±0,92* | |
| після курсу автогенних тренінгів | 42,0±0,58l◘ | 9,7±0,59*l◘ | 7,6±0,61l | |
| після курсу терапії з включенням трібестану | 43,1±0,8*l◘ | 11,4±0,79* | 9,12±0,55* | |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі здорових чоловіків; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.
Найбільш ефективними щодо покращення психологічного стану хворих на псоріаз виявились автогенні тренінги за методом Шульца. Рівень депресії у хворих, які застосовували автогенні тренінги у комплексному лікуванні псоріазу, був достовірно меншим у порівнянні з групою пацієнтів до початку лікування. Після проведеного лікування пацієнти, які практикували автогенні тренінги, мали достовірно нижчі рівні ситуативної тривожності та невротизації у порівнянні не лише з хворими до лікування, але й з групою осіб після проведеної базової терапії захворювання (табл. 7.3). Якщо значення інтегрального показника ситуативної тривожності у хворих на псоріаз до початку лікування відповідало рівню високої тривожності та висока тривожність зберігалась у пацієнтів після проведеного базового лікування, то додаткове використання автогенних тренінгів у відповідній терапевтичній групі дозволяло знизити рівень ситуативної тривожності до помірних значень. Аналогічна тенденція спостерігалась і за інтегральним показником депресії за шкалою Бека. Згідно з його рівнем у хворих до лікування спостерігався стан субдепресії. Особи, які додатково до базової терапії практикували автогенні тренінги, не мали депресивних симптомів після курсу лікування. Ці дані говорять про значний позитивний ефект від використання автогенних тренінгів за методом Шульца як щодо зменшення клінічних проявів псоріазу, так і щодо покращення якості життя, зменшення тривожності, депресії та невротизації пацієнтів.
Використання тіоцетаму, автогенних тренінгів і трібестану, крім того, чинило позитивний ефект і щодо нормалізації мікроциркуляції шкіри. Як видно з табл. 7.4, у хворих на псоріаз чоловіків віком 45-64 років після застосування розробленого нами комплексу відзначалося збільшення кількості функціонуючих капілярів і зменшення відсотку порушень мікроциркуляції порівняно зі значеннями, отриманими до початку лікування.
Таблиця 7.4 – Біомікроскопічні показники судин нігтьового ложа у чоловіків, хворих на псоріаз віком 55-64 років у процесі лікування (М±m)
| Групи чоловіків віком 45-64 років: | Кількість функціонуючих капілярів на 1 мм3 | Наявність порушень мікроциркуляції, % | Судинні порушення, % | Внутрішньо-судинні зміни, % | Позасудинні зміни,% | |
| здорові 45-64 років | 32,0±0,48 | 62,5±6,9 | 43,8±6,3 | 25,0±5,5 | 10,9±3,9 | |
| хворі на псоріаз | до лікування | 25,1±0,45* | 78,1±14,0 | 40,6±8,8 | 35,5±8,7 | 29,0±8,3 |
| після базової терапії | 28,3±0,85*l | 68,8±13,6 | 37,5±12,5 | 31,3±12,0 | 25,0±11,2 | |
| після розробленої терапевтичної методики | 30,9±0,53l◘ | 52,9±8,7 | 29,4±7,9 | 20,6±7,0 | 17,6±9,5 | |
| після курсу терапії з включенням тіоцетаму | 31,4±0,75l◘ | 52,9±12,5 | 29,4±11,4 | 17,6±9,5 | 17,6±9,5 | |
| після курсу терапії з включенням трібестану | 30,4±0,74l | 52,9±12,5 | 29,4±11,4 | 23,5±10,6 | 23,5±10,6 | |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі здорових чоловіків; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.
Була отримана достовірна різниця за кількістю функціонуючих капілярів між групою хворих до початку лікування та усіма групами пацієнтів після його закінчення. Наприкінці лікування кількість функціонуючих капілярів була достовірно нижчою у групі хворих, які отримували базову терапію псоріазу, порівняно з чоловіками, які додатково використовували розроблений нами комплекс заходів у цілому та тіоцетам зокрема. У пацієнтів, які у комплексній терапії псоріазу додатково отримували трібестан, відзначено виражену тенденцію до зростання кількості функціонуючих капілярів. При цьому на фоні додаткового застосування розробленого нами комплексу заходів спостерігалося більш виражене зменшення відсотку порушень мікроциркуляції порівняно з ефектом від базової терапії псоріазу. Було відзначено зменшення відсотку судинних, внутрішньосудинних і позасудинних порушень на фоні використання розробленого нами комплексу.
Отримані дані говорять про позитивний ефект застосування розробленого нами комплексу заходів щодо стану шкірного покрову і мікроциркуляції шкіри у хворих на псоріаз чоловіків віком 45-64 років.
У ході дослідження були отримані також біохімічні підтвердження ефективності розробленого курсу лікування хворих на псоріаз чоловіків віком 45-64 років. Як видно з табл. 7.5, застосування тіоцетаму дозволило достовірно зменшити концентрацію ТБК-АП, достовірно збільшити загальну АОА і КАОЗ у хворих на псоріаз після курсу лікування порівняно з пацієнтами до його початку. Дещо менші позитивні зміни отримані у групі хворих, яка використовувала трібестан у комплексній терапії псоріазу. Як видно з табл. 7.5, хворі на псоріаз після застосування розробленого нами комплексу лікування у цілому та додаткового використання тіоцетаму зокрема мали достовірно нижчий рівень ТБК-АП, достовірно вищі загальну АОА і КАОЗ порівняно з групою пацієнтів, яка застосовувала базову терапію псоріазу.
Таблиця 7.5 – Показники функціонування системи ПОЛ-АОС, осмотична стійкість еритроцитів і рівні середніх молекул у хворих на псоріаз чоловіків віком 45-64 років у процесі лікування (М±m)
| Показники, одиниці вимірювання | Здорові чоловіки віком 45-64 років | Групи хворих на псоріаз віком 45-64 років: | |||||
| до лікування | після базової терапії | після розробленої терапевтичної методики | після курсу терапії з включенням тіоцетаму | після курсу терапії з включенням трібестану | |||
| ТБК-АП, ммоль/л | 3,06±0,03 | 3,43±0,02* | 3,19±0,03*l | 2,94±0,02l◘ | 2,89±0,02l◘ | 2,98±0,04l◘ | |
| Загальна АОА, % | 66,6±0,4 | 62,1±0,37* | 62,1±0,41* | 63,8±0,35*l◘ | 64,2±0,42*l◘ | 63,3±0,55* | |
| КАОЗ | 21,8±0,2 | 18,1±0,09* | 19,5±0,15*l | 21,7±0,17l◘ | 22,2±0,15l◘ | 21,2±0,24l◘ | |
| Розчини NaCl, %: | 0,45 | 28,1±0,53 | 32,1±0,49* | 30,3±0,76* | 28,6±0,44l | 28,4±0,61* | 28,8±0,64l |
| 0,4 | 72,3±0,56 | 77,1±0,63* | 75,4±0,56* | 73,4±0,55l◘ | 72,6±0,65l◘ | 74,3±0,85l | |
| 0,35 | 95,4±2,01 | 96,6±0,25 | 96,1±0,26 | 95,2±0,27l◘ | 95,1±0,41l◘ | 95,4±0,35l | |
| 0,3 | 97,9±0,18 | 98,3±0,18 | 98,6±0,18 | 97,8±0,17◘ | 97,5±0,26l◘ | 98,1±0,22 | |
| СМ1, у. о. | 0,36±0,004 | 0,449±0,005* | 0,413±0,007*l | 0,381±0,005*l◘ | 0,367±0,005l◘ | 0,396±0,007*l | |
| СМ2, у. о. | 0,18±0,004 | 0,24±0,004* | 0,222±0,006*l | 0,186±0,004l◘ | 0,178±0,005l◘ | 0,194±0,005*l◘ | |
Примітки: * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі здорових чоловіків; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.
Результати, представлені на рис. 7.2, свідчать про те, що нормалізація добових коливань показників системи ПОЛ-АОС краще відбувалась у хворих на псоріаз у результаті застосування розробленого нами комплексу заходів, ніж у результаті застосування лише базової терапії захворювання.
Крім того, у ході дослідження були встановлені зміни осмотичної стійкості еритроцитарних мембран у хворих на псоріаз на фоні проведеного лікування. Результати, представлені на табл. 7.5, свідчать про те, що у хворих відбувалася нормалізація стійкості еритроцитарних мембран при додатковому застосуванні як тіоцетаму, так і трібестану. Була отримана достовірна різниця за відсотком гемолізу еритроцитів у 0,3-0,4 % розчинах хлориду натрію між групою хворих на псоріаз після курсу базової терапії та групами пацієнтів, які застосовували розроблений нами комплекс лікування у цілому та додатково використовували тіоцетам. При цьому застосування розробленого нами комплексу заходів призводило до більшого зменшення проявів ендотоксикозу порівняно з базовою терапією псоріазу. Це проявлялось наявністю достовірної різниці за рівнем СМ1 і СМ2 між групою хворих після проведення базової терапії та групами пацієнтів, які застосовували розроблений нами комплекс заходів у цілому та тіоцетам зокрема.
Нормалізацію функціонування симпатоадреналової та вагоінсулярної систем у хворих на псоріаз краще забезпечувало додаткове застосування трібестану та автогенних тренінгів за методом Шульца, ніж використання базової терапії захворювання. Найкращі результати нормалізації рівнів гормонів, медіаторів і їх співвідношення відзначались у хворих на псоріаз після додаткового застосування тіоцетаму (табл. 7.6 і рис. 7.3).
Була встановлена достовірна різниця за значеннями коефіцієнтів А:НА, НА:ДА, НА:І, К:І між групою хворих на псоріаз до початку лікування та усіма групами пацієнтів після проведеної терапії захворювання. Крім того, була отримана достовірна різниця за значенням коефіцієнту ДОФА/ДА+НА+А між групою хворих на псоріаз до початку лікування та групами пацієнтів, які ув лікуванні псоріазу використовували запропонований нами комплекс.
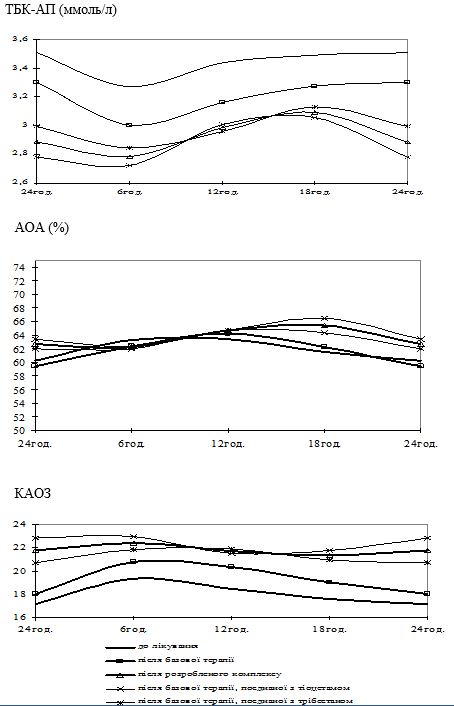
Рисунок 7.2 – Добові зміни концентрацій ТБК-АП, АОА та КАОЗ у хворих на псоріаз чоловіків віком 45-64 років у процесі лікування
Таблиця 7.6 – Екскреція катехоламінів з сечею, концентрація кортизолу й інсуліну в крові у хворих на псоріаз чоловіків віком 45-64 років у процесі лікування (М±m)
| Показники, одиниці вимірювання | Здорові чоловіки віком 45-64 років | Групи хворих на псоріаз віком 45-64 років: | |||||
| до лікування | після базової терапії | після розробленої терапевтичної методики | після курсу терапії з включенням тіоцетаму | після курсу автогенних тренінгів | після курсу терапії з включенням трібестану | ||
| Адреналін, нмоль/добу | 35,7±0,35 | 27,2±0,28* | 32,2±0,44*l | 35,3±0,25l◘ | 36,3±0,39l◘ | 35,1±0,33l◘ | 34,5±0,46l◘ |
| Норадреналін нмоль/добу | 82,3±0,58 | 93,5±0,89* | 66,2±0,77*l | 72±0,59*l◘ | 75,4±0,62*l◘ | 70,6±0,81*l◘ | 70,1±1,07*l◘ |
| Дофамін, нмоль/добу | 1678±12,3 | 1348±13* | 1446±16,7*l | 1513±10,7*l◘ | 1550±17*l◘ | 1491±18,6*l | 1495±17,6*l |
| ДОФА, нмоль/добу | 193±1,49 | 162±0,96* | 174±1,08*l | 184±1,25*l◘ | 190±1,56l◘ | 181±1,88*◘ | 181±2,28*l◘ |
| Кортизол, нмоль/л | 275±1,26 | 410±1,38* | 382±2,68*l | 359±1,36*l◘ | 354±2,37*l◘ | 361±2,44*l◘ | 361±1,99*l◘ |
| Інсулін, мкМО/мл | 6,91±0,02 | 7,32±0,02* | 7,29±0,02* | 7,31±0,01* | 7,31±0,02* | 7,32±0,02* | 7,29±0,02* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі здорових чоловіків; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.

Рисунок 7.3 – Співвідношення гормонів і медіаторів у хворих на псоріаз чоловіків віком 45-64 років у процесі лікування (результати, отримані у групі хворих до лікування, прийняті за 1).
Було проведено дослідження концентрації статевих і гонадотропних гормонів, ТЗГ у хворих на псоріаз із різних терапевтичних груп у процесі лікування (рис. 7.4). На фоні проведеного лікування у всіх терапевтичних групах хворих відбувалося достовірне зростання концентрації тестостерону та достовірне зниження концентрації ЛГ, ФСГ, пролактину та ТЗГ. Більш виражений терапевтичний ефект щодо нормалізації концентрації статевих і гонадотропних гормонів, ТЗГ відзначався на фоні застосування розробленого нами комплексу заходів щодо лікування псоріазу порівняно з його базовою терапією. Була встановлена достовірна різниця за концентраціями тестостерону, ФСГ, ЛГ, пролактину та ТЗГ між групою пацієнтів, яка використовувала базову терапію псоріазу, та групами хворих, які додатково використовували запропонований нами комплекс заходів у цілому та зокрема отримували тіоцетам. Додаткове застосування трібестану у комплексній терапії псоріазу у чоловіків призводило до достовірного зростання концентрації тестостерону та достовірного зниження концентрацій ФСГ і ЛГ порівняно зі значеннями у пацієнтів, які отримували базову терапію захворювання. Хворі на псоріаз, які ув комплексній терапії додатково використовували трібестан, наприкінці лікування мали тенденцію до зниження концентрацій пролактину та ТЗГ порівняно з особами, які отримували базову терапію захворювання.
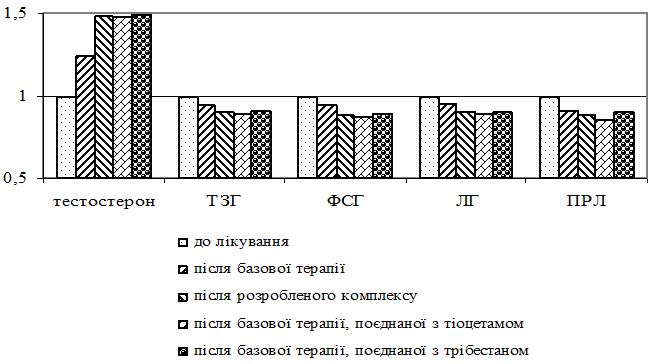
Рисунок 7.4 – Концентрації статевих і гонадотропних гормонів, ТЗГ у хворих на псоріаз чоловіків віком 45-64 років у процесі лікування (результати, отримані у групі хворих до лікування, прийняті за 1).
У ході дослідження було відзначено покращення бальної оцінки симптомів старіння чоловіків і ознак андрогенного дефіциту згідно шкали AMS у всіх групах хворих на псоріаз у процесі лікування. Якщо до початку лікування у хворих оцінка за шкалою AMS становила (31,6±0,30) балів, то у пацієнтів після базової терапії захворювання – (30,9±0,45) балів. У пацієнтів, які у лікуванні псоріазу використовували розроблений нами комплекс заходів, відбувалося достовірне зниження бальної оцінки за шкалою AMS [(30,0±0,35) балів] порівняно з групою хворих до початку лікування. При цьому найбільш ефективним виявилось додаткове застосування у комплексній терапії псоріазу трібестану та тіоцетаму. Була отримана достовірна різниця за бальною оцінкою за шкалою AMS між групою хворих до початку лікування та групами пацієнтів після додаткового застосування трібестану [(29,8±0,66) балів] і тіоцетаму [(29,8±0,58) балів]. Достовірної різниці за бальною оцінкою за шкалою AMS між групою хворих до початку лікування та після терапії з додатковим застосуванням автогенних тренінгів [(30,4±0,61) балів] отримано не було.
Застосування розробленого нами комплексу заходів чинило більш виражений ефект щодо стану ліпідного обміну порівняно з базовою терапією псоріазу (табл. 7.7). Була отримана достовірна різниця за концентрацією холестерину, β-ліпопротеїдів і тригліцеридів між групами хворих на псоріаз до початку лікування та після застосування розробленого нами комплексу заходів, а також між групою осіб після використання базової терапії захворювання та після додаткового використання розробленого комплексу. При цьому достовірно кращі показники концентрацій β-ліпопротеїдів і тригліцеридів відзначались у хворих після лікування з додатковим застосуванням тіоцетаму і трібестану порівняно з їх значеннями у групі пацієнтів до початку лікування та після використання базової терапії псоріазу.
* * *
Отримані результати свідчать про позитивний вплив розробленого комплексу заходів (застосування препаратів з антиоксидантною, цитопротекторною та ноотропною дією, препаратів на основі стероїдних сапонінів і автогенних тренінгів) на перебіг псоріазу, загальний стан шкірного покрову, мікроциркуляцію у шкірі, нормалізацію метаболічних порушень, гормональний статус пацієнтів і зменшення симптомів старіння та андрогенного дефіциту у чоловіків віком 45-64 років. Вищенаведені дані щодо розробленої методики лікування хворих на псоріаз чоловіків віком 45-64 років можуть бути основою алгоритмів для лікування хворих чоловіків старших вікових груп. Це обґрунтовує необхідність застосування розроблених заходів у комплексній терапії хворих на псоріаз чоловіків старших вікових груп.
Таблиця 7.7 – Концентрація ліпідів і глюкози в крові у хворих на псоріаз чоловіків віком 45-64 років у процесі лікування (М±m)
| Показники, одиниці вимірювання | Здорові чоловіки віком 45-64 років | Групи хворих на псоріаз чоловіків віком 45-64 років: | ||||
| до лікування | після базової терапії | після розробленої терапевтичної методики | після курсу терапії з включенням тіоцетаму | після курсу терапії з включенням трібестану | ||
| Холестерин, ммоль/л | 4,60±0,04 | 5,01±0,02* | 4,83±0,04*l | 4,67±0,035l◘ | 4,69±0,044l◘ | 4,65±0,057l |
| β-ліпопротеїди, % | 48,7±0,48 | 53±0,63* | 51,4±0,57* | 48,8±0,46l◘ | 49,5±0,62l◘ | 48,1±0,66l◘ |
| Тригліцериди, ммоль/л | 1,83±0,05 | 2,06±0,03* | 2,06±0,06* | 1,82±0,03l◘ | 1,78±0,04l◘ | 1,86±0,05l◘ |
| Глюкоза, ммоль/л | 5,29±0,05 | 5,79±0,05* | 5,56±0,08*l | 5,53±0,06*l | 5,43±0,09l | 5,64±0,08* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі здорових чоловіків; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.
Результати, отримані при проведенні дослідження, наведені у розділі 7, опубліковані у наступних друкованих працях:
1. Резніченко Н. Ю. Діагностика, лікування та профілактика псоріатичної хвороби у чоловіків у віковому аспекті / Н. Ю. Резніченко. – Запоріжжя : Просвіта, 2014. – 308 с.
2. Корекція дисбіотичних станів у мешканців індустріальних центрів / Ю. Г. Резніченко, Н. Ю. Резніченко, Г. І. Резніченко, М. О. Ярцева. – Запоріжжя : Просвіта, 2013. – 148 с.
3. Вітамінопрофілактика та вітамінотерапія мешканців промислових центрів / Н. Ю. Резніченко, Ю. Г. Резніченко, Г. І. Резніченко, І.В. Пащенко. – К.: ТОВ “Людопринт Україна”, 2013. – 108 с.
4. Резніченко Н. Ю. Шляхи корекції змін концентрації статевих гормонів у чоловіків старшої вікової групи, хворих на псоріаз / Н.Ю.Резніченко // Медико-соціальні проблеми сім’ї. – 2013. – Т. 18, № 2. – С. 106–110.
5. Резніченко Н. Ю. Корекція порушень мікроциркуляції шкіри у чоловіків зрілого віку із псоріазом / Н. Ю. Резніченко // Кровообіг та гемостаз. – 2013. – № 3-4. – С. 74–77.
6. Резніченко Н. Ю. Досвід лікування хворих на псоріаз із використанням аутогенних тренінгів як ефективного методу психокорекції / Н. Ю. Резніченко // Медична психологія. – 2014. – Т. 9, № 1 (33). – С. 99–102.
7. Резніченко Н. Ю. Досвід лікування хворих на псоріаз чоловіків старших вікових груп з урахуванням змін концентрації статевих гормонів / Н. Ю. Резніченко // Журн. дерматовенерології та косметології ім. М. О. Торсуєва. – 2014. – № 1-2 (32). – С. 78–82.
8. Резниченко Н.Ю. Опыт применения аутогенных тренингов в комплексной терапии псориаза и хронических аллергодерматозов / Н. Ю. Резниченко // Курский науч.-практ. вестник «Человек и его здоровье». – 2014. – № 2. – С. 68–72.
9. Резниченко Н. Ю. Современные подходы к лечению и профилактике обострений псориатической болезни / Н. Ю. Резниченко // Дерматовенерология. Косметология. – 2015. – № 1 (01). – С. 116–128.
10. Резніченко Н. Ю. Новий погляд на лікування хворих на псоріаз чоловіків старшого віку / Н. Ю. Резніченко // Дерматологія та венерологія. – 2014. – № 3 (65). – С. 91–92.
Розділ 8
Особливості стану шкіри, соціально-побутових
і психологічних параметрів, гомеостазу у хворих
на хронічні алергодерматози чоловіків
Особливості патогенетичних змін при хронічних алергічних захворюваннях шкіри у чоловіків вивчались шляхом обстеження 101 хворого у віці 45-64 років. До дослідження були включені чоловіки, хворі на хронічну екзему та атопічний дерматит. Групу порівняння склали 197 здорових чоловіків без ознак дерматологічних захворювань віком від 45 до 64 років. До контрольної групи увійшли 250 здорових чоловіків віком від 25 до 44 років.
Серед чоловіків, які увійшли до дослідних груп, було проведене анкетування, результати якого виявили особливості психологічного стану хворих на хронічні алергодерматози (табл. 8.1). Рівень особистісної тривожності у хворих на хронічні алергодерматози чоловіків віком 45-64 років достовірно перевищував її бальну оцінку як у групі здорових осіб віком 25-44 років, так і у групі 45-64-річних здорових чоловіків. Середнє значення інтегрального показника особистісної тривожності у хворих відповідало помірному рівню тривожності, що може розглядатись як фон для розвитку хронічних алергічних захворювань шкіри. Рівень ситуативної тривожності у хворих на хронічні алергодерматози чоловіків віком 45-64 років був високим. Отримана достовірна різниця за бальною оцінкою рівня ситуативної тривожності між групою хворих на хронічні алергодерматози віком 45-64 років і групами здорових осіб віком 25-44 та 45-64 років. Реактивна тривожність у хворих на хронічні алергодерматози обумовлена високою ситуативною напругою, стурбованістю, тривогою. Психічна напруга у подальшому призводить до хронізації та рецидивів алергодерматозів.
У хворих на хронічні алергодерматози відзначена невротизація середнього ступеня тяжкості за Л. І. Вассерманом, а у здорових чоловіків різного віку інтегральні показники невротизації відповідали низькому рівню (табл. 8.1). У пацієнтів з хронічними алергодерматозами віком 45-64 років відзначався достовірно вищий рівень невротизації порівняно з групами здорових осіб як віком 25-44 років, так і віком 45-64 років. Це свідчить про підвищений у них рівень емоційної збудливості, виникнення негативних переживань (напруги, подразливості, розгубленості), що може призводити до прогресування хронічних алергодерматозів.
Таблиця 8.1 – Рівні ситуативної та особистісної тривожності, невротизації та депресії у здорових і хворих на хронічні алергодерматози чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на хронічні алергодерматози | |
| Рівень особистісної тривожності за шкалою Спілбергера-Ханіна, бали | 38,2±0,32 | 38,4±0,31 | 43,3±0,29*l |
| Рівень ситуативної тривожності за шкалою Спілбергера-Ханіна, бали | 39,3±0,17 | 41,0±0,18* | 48,3±0,404*l |
| Рівень невротизації за Л. І. Вассерманом, бали | 4,1±0,205 | 6,9±0,23* | 14,1±0,44*l |
| Рівень депресії за шкалою Бека, бали | 3,6±0,27 | 6,7±0,32* | 11,6±0,55*l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на хронічні алергодерматози чоловіків віком 45-64 роківи.
Інтегральний показник депресії за шкалою Бека у хворих на хронічні алергодерматози чоловіків віком 45-64 років відповідав стану субдепресії (табл. 8.1). Був встановлений достовірно вищий рівень інтегрального показника депресії у хворих на хронічні алергодерматози віком 45-64 років порівняно з групами здорових осіб віком 25-34 років і 45-64 років. Наявність субдепресії, з одного боку, може бути провокуючим фактором щодо прогресування алергодерматозів, а з іншого – зростання рівня депресії є результатом впливу хронічного перебігу алергічних захворювань шкіри на психологічний стан хворих.
Визначений кореляційний зв’язок між бальною оцінкою тяжкості перебігу захворювання у чоловіків віком 45-64 років за шкалою SCORAD і бальною оцінкою рівня ситуативної тривожності за шкалою Спілбергера-Ханіна (r=0,55), рівня невротизації за Л. І. Вассерманом (r=0,24), рівня депресії за шкалою Бека (r=0,39). Таким чином, відбувається формування патологічно замкненого кола, коли наявність алергодерматозу призводить до підвищення тривожності, невротизації та депресії хворого, а це, у свою чергу, є провокуючим фактором захворювання.
Шляхом анкетування чоловіків було виявлено однаковий за тривалістю стаж роботи у здорових [(27,1±0,78) років] і хворих на хронічні алергодерматози [(27,6±1,65) років] осіб віком 45-64 років. Наявність професійних шкідливостей частіше відзначалась у хворих на хронічні алергодерматози віком 45-64 років (у 47,5 % осіб) порівняно зі здоровими чоловіками аналогічного віку (у 33,2 % осіб). Хворі на хронічні алергодерматози віком 45-64 років, крім того, відзначали більшу частоту стресів на роботі (у 38,6 % випадків), ніж здорові чоловіки аналогічного віку (у 28,4 %) та здорові особи у віці 25-44 роківи (18,8 %).
У хворих віком 45-64 років були також відзначені гірші стосунки у родині, що може бути чинником хронізації та частих рецидивів алергодерматозів. Шляхом анкетування було встановлено, що хворі на хронічні алергодерматози чоловіки віком 45-64 років у 26,7 % випадків розглядали психологічний клімат у сім’ї як несприятливий. У той же час лише 18,5 % здорових чоловіків у віці 45-64 років і 6 % здорових чоловіків у віці 25-44 років вважали свої стосунки у родині незадовільними.
Шкідливі звички, такі як паління тютюну та зловживання алкогольними напоями, були більш розповсюджені серед хворих на хронічні алергодерматози віком 45-64 років порівняно зі здоровими особами аналогічного віку. Курцями тютюну були 54,5 % хворих і 43,7 % здорових чоловіків. Щотижня або частіше вживали алкоголь 30,7 % хворих на хронічні алергодерматози та 19,8 % здорових чоловіків.
Шляхом анкетування були встановлені особливості харчування пацієнтів з хронічними алергодерматозами, які можуть бути одним з чинників прогресування захворювання. Була відзначена тенденція до дисбалансу у надходженні харчових інгредієнтів у хворих на хронічні алергодерматози чоловіків старших вікових груп. Це, перш за все, виражалось у надмірному споживанні макаронних виробів і картоплі. Майже щоденне їх вживання відзначали 59,4 % хворих у віці 45-64 років. Харчування макаронами та картоплею 1-2 рази на тиждень або повну відмову від них відзначили 14,0 % здорових чоловіків віком 25-44 років, 12,2 % здорових осіб віком 45-64 років і лише 8,9 % хворих на хронічні алергодерматози.
При цьому хворі на хронічні алергодерматози у віці 45-64 років недостатньо вживали кисломолочні продукти, м’ясо та м’ясні продукти, овочі та фрукти порівняно з групою здорових чоловіків аналогічного віку. Лише 19,8 % хворих і 25,9 % здорових чоловіків віком 45-64 років вживали кисломолочні продукти більше двох днів на тиждень. 50,5 % хворих і лише 26,5 % здорових осіб рідко (1-2 дні на тиждень) вживали або взагалі не вживали м’ясо та м’ясні продукти. 3-4 дні на тиждень м’ясом і м’ясними продуктами харчувались 32,7 % хворих на хронічні алергодерматози та 57,7 % здорових чоловіків віком 45-64 років. Овочі та фрукти 5-7 днів на тиждень вживали 33,5 % здорових осіб віком 45-64 років і лише 21,8 % хворих на хронічні алергодерматози. 46,9 % хворих обмежувались вживання овочів і фруктів 1-2 днями на тиждень або взагалі їх не вживали. Відсоток таких осіб серед здорових чоловіків був нижчим і становив 21,3 % у віці 45-64 років.
Крім того, були встановлені певні ментальні особливості хворих на хронічні алергодерматози із старших вікових груп. Перш за все, це стосувалось піклування про своє здоров’я. 29,7 % хворих у віці 45-64 років зовсім не піклувалися про стан свого здоров’я. У той же час не виявляли турботи щодо стану здоров’я 18,3 % здорових чоловіків аналогічного віку. Постійне піклування щодо свого здоров’я проявляли 22,3 % здорових осіб віком 45-64 років і лише 15,8 % хворих на хронічні алергодерматози. Отже, незважаючи на стан свого здоров’я, більшість хворих на хронічні алергодерматози лише час від часу проявляла турботу про своє здоров’я.
Таким чином, ментальні особливості, наявність частих стресів, несприятливого психологічного клімату у сім’ї, шкідливі звички та нераціональне харчування можуть розглядатися як фактори ризику хронічних алергічних захворювань шкіри. Перераховані вище чинники потребують корекції, що має полягати у зміні образу життя, відмові від шкідливих звичок, переході до раціонального харчування, підвищенні стресостійкості (наприклад, шляхом проведення психологічних тренінгів).
У ході дослідження була проведена клінічна оцінка стану шкірного покрову, результати якої надані на табл. 8.2. У хворих на хронічні алергодерматози чоловіків віком 45-64 років відзначалося достовірне зростання сухості шкіри як у порівнянні з групою здорових осіб віком 25-44 років, так і при порівнянні зі здоровими 45-64-річними чоловіками. Крім того, у хворих на хронічні алергодерматози чоловіків достовірно більшими були бальні оцінки порушень тургору шкіри порівняно з іншими дослідними групами. Відзначалася також достовірно вища бальна оцінка стану шкіри за шкалою Yolanda R. Helfrich et. al. за наявності у чоловіків віком 45-64 років хронічних алергодерматозів порівняно зі здоровими особами.
Як видно з табл. 8.2, у хворих на хронічні алергодерматози віком 45-64 років було встановлено достовірно вищу кількість зморшок і бальну оцінку їх вираженості порівняно зі здоровими чоловіками аналогічної вікової групи. Кількість елементів висипки на шкірі, які є маркерами старіння, була приблизно однаковою у хворих на алергодерматози та здорових чоловіків віком 45-64 років.
Таблиця 8.2 – Клінічні показники стану шкіри у здорових і хворих на хронічні алергодерматози чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на хронічні алергодерматози | |
| Сухість шкіри, бали | 0,04±0,01 | 0,47±0,05* | 1,45±0,10*l |
| Порушення тургору, бали | 0,55±0,03 | 1,34±0,03* | 1,68±0,05*l |
| Оцінка шкіри за шкалою Yolanda R. Helfrich et. al. | 0,65±0,06 | 3,71±0,09* | 4,7±0,15*l |
| Кількість зморшок (4см2х3) | 3,9±0,13 | 11,76±0,17* | 12,5±0,25*l |
| Вираженість зморшок, бали | 7,3±0,43 | 26,2±0,52* | 29,4±0,86*l |
| Кількість елементів – маркерів старіння | 11,8±1,51 | 53,8±2,42* | 56,0±4,47* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на хронічні алергодерматози чоловіків віком 45-64 років.
Отже, результати проведених досліджень свідчать про те, що у хворих на хронічні алергодерматози чоловіків віком 45-64 років основні об’єктивні клінічні показники стану шкіри були гіршими порівняно зі здоровими особами аналогічного віку. У чоловіків віком 45-54 років перебіг хронічних алергодерматозів супроводжувався збільшенням бальної оцінки порушень тургору шкіри на 25 % і оцінки стану шкіри за шкалою Yolanda R. Helfrich et. al. – на 27 %. Погіршення стану шкіри у хворих на алергодерматози чоловіків старших вікових груп, з одного боку, є наслідком хронічного перебігу захворювання, а з іншого боку, є одним із етіопатогенетичних чинників його прогресування. Таким чином відбувається формування патологічно замкненого кола, коли одна його ланка сприяє появі іншої. Отже, одним із напрямків лікування хворих на хронічні алергодерматози має бути розрив патологічного кола та покращення загального стану шкіри.
Ступінь тяжкості алергодерматозів у хворих оцінювався за шкалою SCORAD: у обстежених хворих на хронічні алергодерматози чоловіків віком 45-64 років індекс SCORAD у середньому становив (47,3±0,89) балів.
Інтенсивність свербежу шкіри у хворих на хронічні алергодерматози оцінювалась за 10-бальною шкалою й у середньому становила (5,95±0,22) балів. При клінічному огляді у хворих віком 45-64 років були виявлені об’єктивні ознаки свербежу: бальна оцінка змін нігтьових пластин у середньому становила (0,33±0,06) балів, бальна оцінка екскоріацій склала (1,47±0,08) балів.
Наявність патологічних висипань на шкірі та суб’єктивних ознак захворювання у пацієнтів з хронічними алергодерматозами спричиняла погіршення якості їх життя, що проявлялося зростанням індексу DLQI. У середньому індекс DLQI у хворих на хронічні алергодерматози чоловіків віком 45-64 років становив (13,3±0,4) балів.
Результати проведених біомікроскопічних досліджень судин нігтьового ложа у хворих на хронічні алергодерматози чоловіків віком 45-64 років говорять про достовірне (на 22,2 %) зменшення у них кількості функціонуючих капілярів порівняно з групою здорових осіб аналогічного віку (табл. 8.3). У хворих на хронічні алергодерматози також встановлене збільшення відсотку порушень мікроциркуляції на 29,0 % (у тому числі, внутрішньосудинних і позасудинних змін). При цьому у хворих на хронічні алергодерматози чоловіків віком 45-64 років як відсоток внутрішньосудинних порушень мікроциркуляції, так і відсоток позасудинних порушень був відповідно у 1,68 та у 2,65 разів вищим, ніж у групі здорових чоловіків аналогічного віку. Був встановлений кореляційний зв’язок між бальною оцінкою за шкалою SCORAD і кількістю функціонуючих капілярів на 1 мм3 (r=0,33).
Отже, отримані результати свідчать про погіршення мікроциркуляції шкіри у хворих на хронічні алергодерматози чоловіків віком 45-64 років, що є одним з факторів ризику щодо розвитку та прогресування хронічних алергодерматозів у старших вікових групах.
Таблиця 8.3 – Біомікроскопічні показники судин нігтьового ложа у здорових і хворих на хронічні алергодерматози чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на хронічні алергодерматози | |
| Кількість функціонуючих капілярів на 1 мм3 | 40,3±0,57 | 32±0,48* | 24,9±0,62*l |
| Наявність порушень мікроциркуляції, % | 29,2±6,7 | 62,5±6,9* | 80,6±10,8* |
| Судинні порушення, % | 20,8±5,9 | 43,8±6,3* | 45,2±9,1* |
| Внутрішньосудинні зміни, % | 10,4±4,5 | 25,0±5,5* | 41,9±9,0* |
| Позасудинні зміни, % | 8,3±4,0 | 10,9±3,9* | 29,0±8,3*l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на псоріаз чоловіків віком 45-64 років.
Одним із важливих чинників у розвитку хронічних алергодерматозів є порушення її мікробіоценозу. У результаті досліджень було встановлено, що у хворих на хронічні алергодерматози віком 45-64 роки була достовірно більшою загальна кількість бактерій на шкірі порівняно з групами здорових чоловіків віком 25-44 і 45-64 років (табл. 8.4). Відзначалася також тенденція до збільшення кількості коагулазопозитивних стафілококів на шкірі у хворих на хронічні алергодерматози. Була отримана достовірна різниця за кількістю коагулазопозитивних стафілококів між групою хворих на хронічні алергодерматози віком 45-64 років і групою здорових чоловіків віком 25-44 років. Ці дані говорять про наявність дисбіотичного стану у хворих на хронічні алергодерматози чоловіків старших вікових груп, що може сприяти прогресуванню захворювання.
При аналізі антропометричних показників і артеріального тиску у хворих на хронічні алергодерматози чоловіків віком 45-64 років було виявлено достовірне (р < 0,05) підвищення маси тіла [(86,6±1,46) кг] і діастолічного тиску [(85,7±0,99) мм рт. ст.] порівняно зі здоровими чоловіками аналогічного віку [(82,5±0,98) кг і (82,8±0,52) мм рт. ст. відповідно].
Таблиця 8.4 – Стан мікробного складу шкіри у здорових і хворих на хронічні алергодерматози чоловіків (Lg КУО/см2) (М±m)
| Показники | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на хронічні алергодерматози | |
| Загальна кількість бактерій | 3,03±0,12 | 3,68±0,01* | 4,38±0,12*l |
| Стафілококи коагулазонегативні | 1,33±0,24 | 1,51±0,24 | 1,62±0,36 |
| Стафілококи коагулазопозитивні | 0,25±0,14 | 1,18±0,23* | 1,83±0,35* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на хронічні алергодерматози чоловіків віком 45-64 років.
Проведені лабораторні дослідження виявили зміни стану системи ПОЛ-АОС у хворих на хронічні алергодерматози чоловіків віком 45-64 років (табл. 8.5). Концентрація ТБК-АП у них була достовірно вищою, а загальна АОА – достовірно нижчою порівняно з групами здорових чоловіків віком 25-44 та 45-64 років, що призводило до достовірного зменшення коефіцієнту антиокислювального захисту у хворих на хронічні алергодерматози.
Результати добового моніторингу циркадних ритмів функціонування системи ПОЛ-АОС представлені на рис. 8.1. У хворих на хронічні алергодерматози віком 45-64 років синусоїдна крива добових змін ТБК-АП мала найменшу амплітуду коливань протягом доби порівняно з іншими групами чоловіків. Крім того, дана крива розташовувалася вище від інших, що свідчить про високу активність ПОЛ при хронічних алергічних захворюваннях шкіри. Отже, у хворих на хронічні алергодерматози чоловіків віком 45-64 років зменшуються коливання активності системи ПОЛ на фоні її вищої активності. Криві добових змін ТБК-АП у хворих і у здорових чоловіків різних вікових груп відображали максимальні значення у вечірній час і мінімальні – у ранковий. На відміну від здорових чоловіків різних вікових груп, у яких крива добових змін загальної АОА мала вигляд синусоїди, у хворих на хронічні алергодерматози віком 45-64 років був відсутній добовий ритм загальної АОА. Отже, система антиокислювального захисту майже не реагувала на добові коливання активності ПОЛ, що свідчить про виснаженість антиокислювальної системи та є однією з патогенетичних ланок розвитку хронічних алергодерматозів.
Таблиця 8.5 – Показники функціонування системи ПОЛ-АОС у здорових і хворих на хронічні алергодерматози чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на хронічні алергодерматози | |
| ТБК-АП, ммоль/л | 2,69±0,02 | 3,06±0,03* | 3,33±0,02*l |
| Загальна АОА, % | 64,9±0,35 | 66,7±0,40* | 62,7±0,44*l |
| КАОЗ | 24,1±0,19 | 21,8±0,20* | 18,8±0,12*l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на хронічні алергодерматози чоловіків віком 45-64 років.
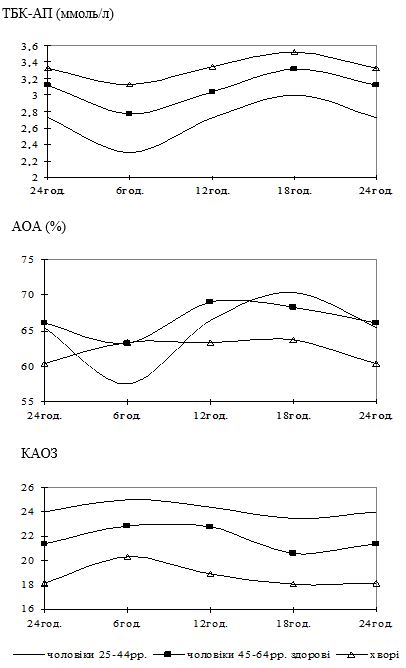
Рисунок 8.1 – Добові зміни концентрацій ТБК-АП, АОА та КАОЗ у хворих на хронічні алергодерматози
При розгляді добових коливань коефіцієнту антиокислювального захисту було відзначено, що у групі хворих на хронічні алергодерматози чоловіків віком 45-64 років крива добового коливання КАОЗ знаходилася нижче від кривих, отриманих у здорових чоловіків різних вікових груп. Особливо низькі значення спостерігались у вечірній і нічний час, що підтверджує думку про виснаженість антиокислювального захисту та превалювання активації ПОЛ саме у цю пору доби.
Отримані результати вивчення осмотичної стійкості еритроцитарних мембран показали, що при концентраціях розчинів хлориду натрію 0,3–0,45 % відсоток гемолізу у хворих на хронічні алергодерматози чоловіків віком 45-64 років був достовірно вищим порівняно з групами здорових чоловіків віком 25-44 і 45-64 років (табл. 8.6). Зменшення стійкості еритроцитарних мембран у хворих на хронічні алергодерматози свідчить про патогенетичну роль цього чинника, особливо у чоловіків старших вікових груп.
Таблиця 8.6 – Осмотична стійкість еритроцитів і концентрація середніх молекул у крові здорових і хворих на хронічні алергодерматози чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | |||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на хронічні алергодерматози | ||
| Розчини NaCl, %: | 0,45 % | 21,8±0,39 | 28,1±0,53* | 32,37±0,437*l |
| 0,4 % | 67,4±0,53 | 72,3±0,56* | 78±0,468*l | |
| 0,35 % | 93,1±0,28 | 95,4±0,3* | 96,8±0,163*l | |
| 0,3 % | 97±0,2 | 97,9±0,18* | 98,7±0,151*l | |
| СМ1, у. о. | 0,33±0,004 | 0,36±0,004* | 0,426±0,004*l | |
| СМ2, у. о. | 0,14±0,003 | 0,18±0,004* | 0,221±0,004*l | |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на хронічні алергодерматози чоловіків віком 45-64 років.
Проведені дослідження показали також збільшення проявів ендотоксикозу у хворих на хронічні алергодерматози чоловіків віком 45-64 років, що проявлялося зростанням концентрації СМ1 на 18 % і СМ2 – на 25 % порівняно зі здоровими особами аналогічного віку (табл. 8.6). Крім того, був встановлений кореляційний взаємозв’язок між бальною оцінкою тяжкості хвороби за шкалою SCORAD і СМ1 (r=-0,41).
Результати дослідження концентрацій гормонів і медіаторів симпатоадреналової та вагоінсулярної систем у здорових і хворих на хронічні алергодерматози чоловіків представлені на табл. 8.7, а їх співвідношення – на рис. 8.2. У хворих на хронічні алергодерматози екскреція адреналіну, ДОФА та дофаміну була достовірно нижчою, ніж у здорових чоловіків віком 25-44 і 45-64 років, що свідчило про зниження функціональної активності та резервних можливостей симпатоадреналової системи у хворих. При цьому мало місце прискорення синтезу катехоламінів на етапах ДОФА-дофамін і дофамін-норадреналін (коефіцієнти відносної активності синтезу НА:ДА у хворих були вищими, ніж у здорових). Активність ферментів ДОФА-декарбоксилази та дофамін-ß-оксидази у пацієнтів з хронічними алергодерматозами перевищувала активність у здорових. Знижений у порівнянні зі здоровими віком 45-64 років коефіцієнт ДОФА/ДА+НА+А свідчив про вищу швидкість переходу ДОФА у катехоламіни. Відмічалася виражена дисоціація в активності ланок симпатоадреналової системи, відзначалося превалювання тонусу нервової ланки над гормональною (коефіцієнт А:НА у хворих був значно нижчим, ніж у здорових). Прискорення біосинтезу катехоламінів на етапах ДОФА-дофамін і дофамін-норадреналін у поєднанні зі зниженою активністю та резервними можливостями симпатоадреналової системи, вірогідно, є наслідком зменшення запасів катехоламінів. Результати дослідження екскреції та біосинтезу катехоламінів дають підстави для висновку про те, що у хворих на хронічні алергодерматози зворотна реакція симпатоадреналової системи на дію стресора носить незвичайний характер і проявляє себе зниженням активності симпатоадреналової системи з перевагою тонусу нервової ланки над гормональною.
Таблиця 8.7 – Екскреція катехоламінів з сечею, концентрація кортизолу та інсуліну у крові здорових і хворих на хронічні алергодерматози чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на хронічні алергодерматози | |
| Адреналін, нмоль/добу | 35,73±0,351 | 35,35±0,821 | 29,42±0,427*l |
| Норадреналін, нмоль/добу | 82,3±0,581 | 91,92±1,253* | 91,69±0,724* |
| Дофамін, нмоль/добу | 1678±12,33 | 1617±26,11* | 1355±10,26*l |
| ДОФА, нмоль/добу | 193±1,487 | 210,5±2,268* | 170,8±1,382*l |
| Кортизол, нмоль/л | 274,8±1,265 | 321,3±2,382* | 388,6±1,727*l |
| Інсулін, мкМО/мл | 6,905±0,02 | 7,158±0,063* | 7,372±0,017*l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на хронічні алергодерматози чоловіків віком 45-64 років.
У хворих на хронічні алергодерматози концентрації кортизолу та інсуліну у крові достовірно перевищували рівні у здорових. Коефіцієнт НА:І був майже однаковим, а коефіцієнт К:І – підвищеним порівняно зі здоровими. Отримані у ході дослідження результати підтверджують високий ступінь напруження ендокринної ланки та вказують на антагоністичний характер її взаємовідносин з нервовою ланкою адренергічної системи та синергічний – з парасимпатичним відділом. Між симпатичним і парасимпатичним відділами нейрогенної ланки адаптації також існують антагоністичні взаємовідносини.
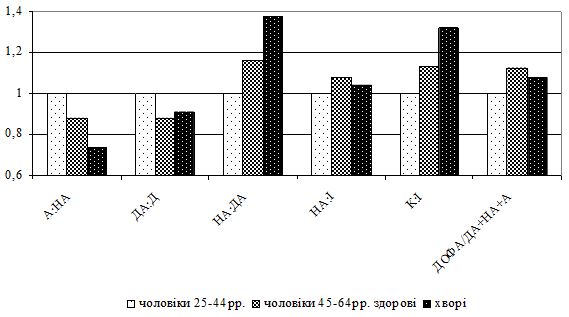
Рисунок 8.2 – Співвідношення гормонів і медіаторів у здорових і хворих на хронічні алергодерматози чоловіків (результати, отримані у чоловіків віком 25-44 років, прийняті за 1).
Отже, у хворих на хронічні алергодерматози чоловіків віком 45-64 років встановлено зниження активності та резервних можливостей симпатоадреналової системи при прискоренні біосинтезу катехоламінів на етапах перетворення ДОФА у дофамін і дофаміну у норадреналін; високий ступінь напруження глюкокортикоїдної функції надниркових залоз і підвищення активності вагоінсулярної системи, що поєднується з гальмуванням симпатоадреналової системи; виражене порушення вегетативного гомеостазу, що проявляється пригніченням активності симпатичної нервової системи, підвищенням тонусу та реактивності парасимпатичної; зниження активності компенсаторних реакцій організму.
У хворих на хронічні алергодерматози чоловіків віком 45-64 років були встановлені зміни концентрацій статевих і гонадотропних гормонів: хворі мали достовірно нижчу концентрацію тестостерону (на 22,3 %) і достовірно вищу – ФСГ, ЛГ, пролактину, ТЗГ порівняно зі здоровими чоловіками аналогічного віку (табл. 8.8). Відзначена достовірно вища бальна оцінка за шкалою AMS (на 10,5 %) у хворих на хронічні алергодерматози віком 45-64 років порівняно зі здоровими чоловіками аналогічного віку. Також був встановлений кореляційний зв’язок між бальною оцінкою тяжкості захворювання за шкалою SCORAD і оцінкою за шкалою AMS (r=0,27).
Таблиця 8.8 – Концентрація статевих і гонадотропних гормонів, ТЗГ у крові, бальна оцінка за шкалою AMS у здорових і хворих на хронічні алергодерматози чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на хронічні алергодерматози | |
| Тестостерон, нмоль/л | 18,36±0,43 | 14,56±0,387* | 11,32±0,316*l |
| ТЗГ, нмоль/л | 32,85±0,309 | 44,33±1,093* | 50,6±0,705*l |
| ФСГ, МЕ/л | 3,082±0,026 | 4,064±0,078* | 4,484±0,026*l |
| ЛГ, ЕД/л | 3,076±0,033 | 3,717±0,036* | 3,963±0,026*l |
| ПРЛ, mMe/l | 221,2±1,308 | 263,2±3,818* | 294±2,325*l |
| Оцінка за шкалою AMS, бали | 25,6±0,25 | 29,4±0,29* | 32,5±0,33*l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на хронічні алергодерматози чоловіків віком 45-64 років.
У результаті дослідження встановлені також зміни у ліпідному та вуглеводному обміні у хворих на хронічні алергодерматози чоловіків віком 45-64 років: у групі хворих отримано достовірно вищу концентрацію холестерину, β-ліпопротеїдів і глюкози порівняно зі здоровими особами аналогічного віку (табл. 8.9).
Таблиця 8.9 – Концентрація ліпідів і глюкози у крові здорових і хворих на хронічні алергодерматози чоловіків (М±m)
| Показники, одиниці вимірювання | Чоловіки віком | ||
| 25-44 років, здорові | 45-64 років, здорові | 45-64 років, хворі на хронічні алергодерматози | |
| Холестерин, ммоль/л | 3,5±0,03 | 4,6±0,04* | 4,93±0,11*l |
| β-ліпопротеїди, % | 37,7±0,66 | 48,7±0,48* | 50,9±0,54*l |
| Тригліцериди, ммоль/л | 1,24±0,03 | 1,83±0,05* | 1,92±0,03* |
| Глюкоза, ммоль/л | 4,77±0,05 | 5,29±0,05* | 5,59±0,05*l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у чоловіків віком 25-44 років; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у здорових і хворих на хронічні алергодерматози чоловіків віком 45-64 років.
* * *
Підсумовуючи наведені у розділі дані, потрібно підкреслити наявність у хворих на хронічні алергодерматози старших вікових груп порушень стану шкірного покрову, змін з боку мікроциркуляції та мікробного пейзажу шкіри, порушень у функціонуванні системи ПОЛ-АОС, змін стійкості еритроцитарних мембран, підвищення рівня ендотоксикозу, порушень з боку симпатоадреналової та вагоінсулярної систем, змін концентрації гонадотропних гормонів, зниження концентрації тестостерону, погіршення ліпідного та вуглеводного обміну. Це обґрунтовує доцільність вивчення ефективності застосування препаратів з антиоксидантними, цитопротекторними та ноотропними властивостями, фітопрепарату на основі стероїдних сапонінів і психокорекції у комплексній терапії хворих на хронічні алергодерматози.
Результати, отримані при проведенні дослідження, наведені у розділі 8, опубліковані у наступних друкованих працях:
1. Резніченко Н. Ю. Діагностика, лікування та профілактика алергодерматозів чоловіків у віковому аспекті / Н. Ю. Резніченко. – Запоріжжя : Просвіта, 2014. – 132 с.
2. Резніченко Н. Ю. Зміни метаболізму у чоловіків зрілого віку, хворих на хронічні алергічні захворювання шкіри / Н. Ю. Резніченко // Вісник наукових досліджень. – 2013. – № 3. – С. 16–20.
3. Резніченко Н. Ю. Стан симпато-адреналової та вагоінсулярної систем у чоловіків зрілого віку, хворих на алергодерматози / Н. Ю. Резніченко // Таврический медико-биологич. вестник. – 2013. – Т. 16, № 1, ч. 3 (61). – С. 233–236.
4. Резниченко Н. Ю. Изменения концентрации половых гормонов у мужчин старшей возрастной группы, страдающих аллергодерматозами, и пути их коррекции / Н. Ю. Резниченко // Репродуктивное здоровье. Восточная Европа. – 2013. – № 4 (28). – С. 94–100.
5. Reznichenko N. Yu. The state of the sympathoadrenal and vagoinsular systems in men of mature age, who suffer from allergic dermatoses / N. Yu. Reznichenko // Crimean Journal of Experimental and Clinical Medicine. – 2013. – Vol. 3, № 1-2. – P. 24–27.
Розділ 9
Патогенетично обґрунтувані нові методики лікування хворих на хронічні алергодерматози чоловіків старших вікових груп в умовах великого промислового міста
Оскільки у хворих на хронічні алергодерматози чоловіків віком 45-64 років були встановлені зміни стану шкірного покрову та мікроциркуляції у ньому, порушення функціонування системи ПОЛ-АОС, зміни осмотичної стійкості еритроцитів, збільшення ендотоксикозу, порушення з боку симпатоадреналової та вагоінсулярної систем, зміни концентрацій статевих гормонів і психологічні особливості, які були описані у попередньому розділі, нами була розглянута можливість застосування у комплексній терапії хворих препарату з антиоксидантними, цитопротекторними та ноотропними властивостями (тіоцетаму), екстракту рослини Tribulus Terrestris (трібестану) й автогенних тренінгів за методом Шульца.
У залежності від методики терапії були створені наступні дослідні групи: І група – хворі, які проходили базове лікування хронічних алергодерматозів згідно наказу Міністерства охорони здоров’я України № 312 від 08.05.2009 р.; ІІ група – хворі, які додатково до базової терапії використовували тіоцетам, ІІІ група – хворі, які додатково проводили курси автогенних тренінгів за методом Шульца, ІV група – хворі, які додатково застосовували трібестан.
Проведені клінічні дослідження стану шкіри у хворих на хронічні алергодерматози чоловіків віком 45-64 років, результати яких представлені на табл. 9.1, показали що, у процесі лікування в усіх дослідних групах відбувалося зменшення сухості, оцінки порушень тургору шкіри, оцінки шкіри за шкалою Yolanda R. Helfrich et al. У хворих на хронічні алергодерматози після застосування запропонованих нами терапевтичних заходів у цілому та використання тіоцетаму зокрема достовірно зменшилися бальні показники сухості та порушень тургору шкіри. Відзначено достовірне зниження бальної оцінки за шкалою Yolanda R. Helfrich et al. порівняно з групою пацієнтів до початку лікування. Хворі на хронічні алергодерматози, які додатково використовували запропонований нами терапевтичний комплекс у цілому та зокрема застосовували тіоцетам, мали достовірно нижчу сухість шкіри порівняно з її бальною оцінкою у пацієнтів після базового лікування. Крім того, у групі хворих, які використовували запропонований нами комплекс, отримано тенденцію до покращення бальної оцінки за шкалою Yolanda R. Helfrich et al. порівняно з особами, які використовували лише базову терапію хронічних алергодерматозів.
Таблиця 9.1 – Клінічні показники стану шкіри у хворих на хронічні алергодерматози чоловіків віком 45-64 років у процесі лікування (М±m)
| Групи чоловіків віком 45-64 років: | Сухість шкіри, бали | Порушення тургору, бали | Оцінка шкіри за Yolanda R. Helfrich et. al. | |
| Здорові | 0,47±0,05 | 1,34±0,03 | 3,71±0,09 | |
| Хворі на хронічні алергодерматози | до лікування | 1,45±0,10* | 1,68±0,05* | 4,7±0,15* |
| після базової терапії | 1,17±0,12* | 1,42±0,11l | 4,4±0,27* | |
| після розробленої терапевтичної методики | 0,83±0,10*l◘ | 1,36±0,09l | 4,1±0,19l | |
| після курсу терапії з включенням тіоцетаму | 0,68±0,13l | 1,21±0,16 | 3,9±0,27 | |
| після курсу автогенних тренінгів | 0,83±0,15*l | 1,44±0,15 | 4,3±0,33 | |
| після курсу терапії з включенням трібестану | 1,00±0,24* | 1,44±0,13 | 4,1±0,38 | |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі здорових чоловіків; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.
Незалежно від терапевтичної групи у хворих на хронічні алергодерматози у динаміці лікування спостерігалося зменшення свербежу шкіри та його об’єктивних ознак – екскоріацій і змін нігтьових пластин (рис. 9.1). Була отримана достовірна різниця за бальною оцінкою свербежу та вираженістю екскоріацій між групою хворих до початку лікування та після його завершення у всіх дослідних групах. При порівнянні між собою бальних оцінок свербежу та вираженості його об’єктивних ознак у хворих із різних терапевтичних груп після проведеного лікування було встановлено, що пацієнти, які отримували лише базову терапію, мали достовірно вищі бальні оцінки свербежу порівняно з чоловіками, які застосовували розроблений нами комплекс у цілому та зокрема використовували тіоцетам або практикували автогенні тренінги. Хворі на хронічні алергодерматози, які додатково до базового лікування практикували автогенні тренінги, наприкінці терапевтичного курсу мали достовірно нижчі бальні оцінки свербежу, вираженості змін нігтьових пластин і екскоріацій порівняно з групою осіб до початку лікування.

Рисунок 9.1 – Свербіж шкіри та вираженість його об’єктивних ознак у хворих на хронічні алергодерматози чоловіків віком 45-64 років у процесі лікування.
У всіх терапевтичних групах хворих після проведеного лікування відзначалося покращення клінічної картини захворювання, що проявлялося достовірним зменшенням бальної оцінки за шкалою SCORAD порівняно з групою осіб до початку терапії (табл. 9.2). Бальна оцінка за шкалою SCORAD була достовірно нижчою у хворих на хронічні алергодерматози, які додатково застосовували розроблений нами комплекс, порівняно з групою осіб після використання лише базової терапії.
Таблиця 9.2 – Динаміка індексів SCORAD і DLQI у хворих на хронічні алергодерматози чоловіків віком 45-64 років у процесі лікування
| Показники, одиниці вимірювання | Групи хворих на хронічні алергодерматози чоловіків віком 45-64 років: | |||||
| до лікування | після базової терапії | після розробленої терапевтич-ної методики | після курсу тіоцетаму | після курсу автоген-них тренінгів | після курсу трібестану | |
| Індекс SCORAD (М±m) | 47,3±0,94 | 23,9±1,45* | 16,5±1,00*l | 15,6±1,8*l | 16,7±1,55*l | 17,3±1,95*l |
| Δ SCORAD, % (М±m) | 49,8±2,65 | 65,4±1,86*l | 66,3±3,39l | 65,1±3,05l | 64,8±3,36l | |
| Індекс DLQI, бали (М±m) | 13,3±0,40 | 6,8±0,62* | 4,2±0,30*l | 3,8±0,46*l | 3,8±0,50*l | 4,9±0,57*l |
| Δ DLQI (М±m) | 47,6±4,43 | 66,4±2,60l | 69,74±3,40l | 67,0±5,02l | 61,8±5,15l | |
| DLQI<5, % | 47,2 | 62,3 | 68,4 | 61,1 | 62,5 | |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.
Наприкінці лікування між групою хворих, які отримували лише базову терапію, та групою з додатковим використанням розробленого нами комплексу була отримана достовірна різниця за Δ SCORAD (%). Достовірно нижчий показник Δ SCORAD (%) наприкінці лікування був відзначений у хворих після застосування базової терапії порівняно з групами чоловіків, які додатково використовували тіоцетам, трібестан і автогенні тренінги.
У пацієнтів з усіх терапевтичних груп наприкінці курсу лікування спостерігалося достовірне зниження індексу DLQI, що є ознакою покращення якості їх життя, порівняно з хворими до початку лікування (табл. 9.2). Достовірно вищим індекс DLQI був у групі чоловіків після базової терапії хронічних алергодерматозів порівняно з його значеннями у пацієнтів, які додатково застосовували розроблений нами комплекс у цілому та зокрема – автогенні тренінги, тіоцетам або трібестан. Також було встановлено, що показник Δ DLQI (%) був достовірно нижчим у пацієнтів після проведеної базової терапії хронічних алергодерматозів порівняно з групами хворих, які додатково використовували курси автогенних тренінгів, тіоцетам або трібестан. Після використання розробленого нами комплексу був більшим відсоток хворих, у яких індекс DLQI був нижчим за 5 балів, порівняно з групою пацієнтів, які отримували лише базову терапію хронічних алергодерматозів. У групі хворих, які додатково до базової терапії використовували тіоцетам, встановлений найвищий серед усіх груп відсоток пацієнтів з індексом DLQI, нижчим за 5 балів наприкінці лікування.
Отже, включення до комплексної терапії хронічних алергодерматозів у чоловіків віком 45-64 років препарату з цитопротекторними, антиоксидантними та ноотропними властивостями, фітопрепарату на основі стероїдних сапонінів, автогенного тренінгу за методом Шульца дало можливість отримати кращі результати, що виявлялось у менших значеннях індексу SCORAD у 1,31 рази, індексу DLQI – у 1,39 рази, свербежу – у 1,24 рази порівняно з базовою терапією.
Застосування розробленого нами комплексу заходів щодо терапії хронічних алергодерматозів у чоловіків віком 45-64 років призводило до зниження рівнів депресії, невротизації та ситуативної тривожності (табл. 9.3). Між групами хворих, які використовували запропонований нами комплекс і які отримували лише базову терапію захворювання, наприкінці лікування отримана достовірна різниця за рівнями невротизації та ситуативної тривожності. У пацієнтів після проведеного базового лікування хронічних алергодерматозів інтегральний показник ситуативної тривожності свідчив про її високий рівень. У той же час використання розробленого нами комплексу заходів дозволяло знизити рівень ситуативної тривожності до помірних значень. Крім того, була отримана достовірна різниця за рівнем депресії між групами хворих до початку лікування та після застосування розробленого нами комплексу.
У ході дослідження було встановлено, що найбільшу ефективність щодо покращення психологічного стану хворих на хронічні алергодерматози має застосування автогенних тренінгів за методом Шульца. Наприкінці лікування з використанням автогенних тренінгів хворі мали достовірно нижчі рівні ситуативної тривожності, депресії та невротизації порівняно як з групою хворих до початку лікування, так і з групою чоловіків після проведеної базової терапії захворювання (табл. 9.3). Показовим є те, що у групі хворих на алергодерматози до початку лікування спостерігався стан субдепресії згідно інтегрального показника за шкалою Бека, а у групі хворих після проведеної комплексної терапії з використанням автогенних тренінгів не відзначалось депресивних симптомів. Група пацієнтів, які у комплексному лікуванні хронічних алергодерматозів додатково використовували автогенні тренінги, наприкінці терапевтичного курсу мала помірні рівні ситуативної тривожності згідно шкали Спілбергера-Ханіна. У той же час інтегральний показник ситуативної тривожності у пацієнтів після проведеного базового лікування, як і до його початку, відповідав рівню високої тривожності. Отже, результати дослідження психологічного статусу хворих на хронічні алергодерматози доводять виражений позитивний ефект автогенних тренінгів за методом Шульца щодо зменшення тривожності, депресії, невротизації, покращення якості життя.
На фоні проведеного лікування з застосуванням тіоцетаму, трібестану й автогенних тренінгів відзначався позитивний ефект і щодо нормалізації мікроциркуляції шкіри. Використання розробленого нами комплексу у хворих на хронічні алергодерматози призводило до збільшення кількості функціонуючих капілярів і зменшення відсотку порушень мікроциркуляції порівняно з їх значеннями до початку лікування (табл. 9.4). Після застосування розробленого нами комплексу спостерігалося більш виражене зниження відсотку порушень мікроциркуляції порівняно з ефектом від базової терапії хронічних алергодерматозів. Відзначено зменшення відсотку судинних, внутрішньосудинних і позасудинних порушень мікроциркуляції на фоні використання розробленого нами комплексу.
Кількість функціонуючих капілярів наприкінці терапевтичного курсу була достовірно вищою у групах хворих, які додатково використовували розроблений нами комплекс заходів у цілому та тіоцетам зокрема, порівняно з чоловіками, які отримували лише базову терапію алергодерматозів. Зростання кількості функціонуючих капілярів також відзначено у хворих, які у комплексній терапії додатково використовували трібестан.
Ефективність застосування розробленого нами комплексу була також підтверджена шляхом проведення біохімічних досліджень. Хворі на хронічні алергодерматози після застосування розробленої нами методики лікування у цілому та додаткового використання тіоцетаму зокрема мали достовірно нижчий рівень ТБК-АП, достовірно вищі загальну АОА та коефіцієнт антиокислювального захисту порівняно з групою пацієнтів після застосовування базової терапії.
Таблиця 9.3 – Рівні ситуативної тривожності, депресії та невротизації у хворих на хронічні алергодерматози чоловіків віком 45-64 років у процесі лікування (М±m)
| Показники, одиниці вимірювання | Здорові чоловіки 45-64 років | Групи хворих на хронічні алергодерматози віком 45-64 років: | |||||
| до лікування | після базової терапії | після розробленої терапевтичної методики | після курсу терапії з включенням тіоцетаму | після курсу автогенних тренінгів | після курсу терапії з включенням трібестану | ||
| Рівень ситуативної тривожності, бали | 41,0±0,18 | 48,3±0,404* | 47,0±0,69* | 44,1±0,44*l◘ | 43,9±0,89*l◘ | 44,0±0,55*l◘ | 44,4±0,83*l◘ |
| Рівень невротизації, бали | 6,9±0,23 | 14,1±0,44* | 13,6±0,60* | 11,6±0,49*l◘ | 11,8±0,60*l◘ | 10,3±0,86*l◘ | 12,7±1,03* |
| Рівень депресії, бали | 6,7±0,32 | 11,6±0,55* | 11,0±0,75* | 9,4±0,41*l | 9,7±0,70*l | 8,1±0,58*l◘ | 10,4±0,78* |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі здорових чоловіків; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.
Таблиця 9.4 – Біомікроскопічні показники судин нігтьового ложа у хворих на хронічні алергодерматози чоловіків віком 55-64 років у процесі лікування (М±m)
| Групи чоловіків віком 45-64 років: | Кількість функціонуючих капілярів на 1 мм3 | Наявність порушень мікроциркуляції, % | Судинні порушення, % | Внутрішньо-судинні зміни, % | Позасудинні зміни,% | |
| Здорові 45-64 років | 32,0±0,48 | 62,5±6,9 | 43,8±6,3 | 25,0±5,5 | 10,9±3,9 | |
| Хворі на хронічні алергодерматози | до лікування | 24,9±0,62* | 80,6±10,8 | 45,2±9,1 | 41,9±9,0 | 29,0±8,3 |
| після базової терапії | 28,4±0,67*l | 63,2±11,4 | 36,8±11,4 | 31,6±11,0 | 26,3±10,4 | |
| після розробленої терапевтичної методики | 30,8±0,57l◘ | 58,8±8,6 | 32,4±8,1 | 23,5±7,4 | 17,6±6,6 | |
| після курсу терапії з включенням тіоцетаму | 31,2±0,80l◘ | 57,9±11,6 | 31,6±11,0 | 21,1±9,6 | 15,8±8,6 | |
| після курсу терапії з включенням трібестану | 30,2±0,81l | 60,0±13,1 | 33,3±12,6 | 26,7±11,8 | 20,0±10,7 | |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі здорових чоловіків; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.
Додаткове використання тіоцетаму наприкінці лікування призводило до достовірного зменшення концентрації ТБК-АП, достовірного збільшення загальної АОА та коефіцієнту антиокислювального захисту у хворих на хронічні алергодерматози порівняно з пацієнтами до його початку (табл. 9.5). Менші позитивні зміни отримані у групі хворих, які використовували трібестан у комплексній терапії.
Нормалізація добових коливань показників функціонування системи ПОЛ-АОС краще відбувалась у хворих на хронічні алергодерматози, які використовували розроблений нами комплекс, ніж у пацієнтів після застосування лише базової терапії захворювання (рис. 9.2).
Крім того, у хворих на хронічні алергодерматози на фоні додаткового застосування тіоцетаму та трібестану відбувалося покращення стійкості еритроцитарних мембран (табл. 9.6). Максимально виражений ефект щодо покращення стійкості еритроцитарних мембран відзначений після використання тіоцетаму. Достовірна різниця отримана за відсотком гемолізу еритроцитів у 0,3-0,5 % розчинах хлориду натрію між групою хворих на хронічні алергодерматози після курсу базової терапії та групою пацієнтів після додаткового застосування тіоцетаму.
У ході дослідження була також отримана достовірна різниця за рівнем середніх молекул у групі хворих після проведення базової терапії та групах пацієнтів, які застосовували розроблений нами комплекс заходів у цілому та зокрема тіоцетам і трібестан (табл. 9.6). Це свідчить про більш виражений ефект від застосування розробленого нами комплексу щодо зменшення проявів ендотоксикозу у хворих на хронічні алергодерматози порівняно з базовою терапією.
Найсуттєвіші позитивні результати щодо нормалізації концентрації гормонів і медіаторів симпатоадреналової та вагоінсулярної системи, їх співвідношення у хворих на хронічні алергодерматози відзначалися наприкінці лікування з додатковим застосуванням тіоцетаму (табл. 9.7, рис. 9.3).
Таблиця 9.5 – Показники функціонування системи ПОЛ-АОС у хворих на хронічні алергодерматози чоловіків віком 45-64 років у процесі лікування (М±m)
| Показники, одиниці вимірювання | Здорові чоловіки віком 45-64 років | Групи хворих на хронічні алергодерматози чоловіків віком 45-64 років: | ||||
| до лікування | після базової терапії | після розробленої терапевтичної методики | після курсу терапії з включенням тіоцетаму | після курсу терапії з включенням трібестану | ||
| ТБК-АП, ммоль/л | 3,06±0,03 | 3,33±0,016* | 3,01±0,027l | 2,80±0,014*l◘ | 2,78±0,016*l◘ | 2,83±0,021*l◘ |
| Загальна АОА, % | 66,6±0,4 | 62,7±0,44* | 62,2±0,40* | 63,5±0,27*◘ | 64,4±0,25*l◘ | 62,7±0,33* |
| КАОЗ | 21,8±0,2 | 18,8±0,12* | 20,7±0,14*l | 22,7±0,13*l◘ | 23,2±0,08*l◘ | 22,2±0,13l◘ |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі здорових чоловіків; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.
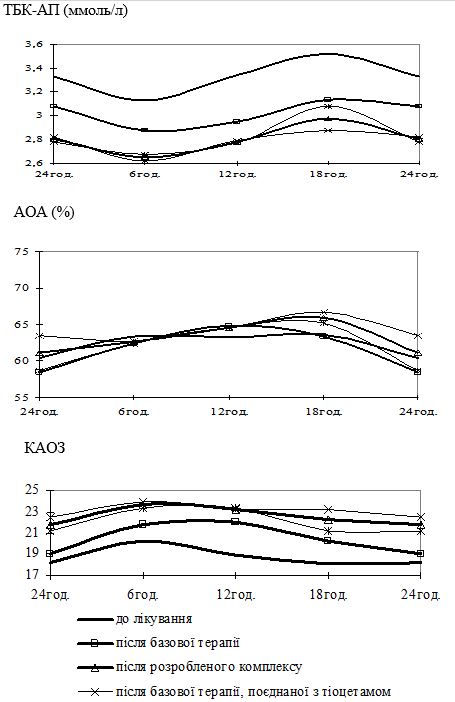
Рисунок 9.2 – Добові зміни концентрацій ТБК-АП, АОА та КАОЗ у хворих на хронічні алергодерматози чоловіків віком 45-64 років у процесі лікування.
Таблиця 9.6 – Осмотична стійкість еритроцитів і рівні середніх молекул у хворих на хронічні алергодерматози чоловіків віком 45-64 років у процесі лікування (М±m)
| Показники, одиниці вимірювання | Здорові чоловіки віком 45-64 років | Групи хворих на хронічні алергодерматози чоловіків віком 45-64 років: | |||||
| до лікування | після базової терапії | після розробленої терапевтичної методики | після курсу терапії з включенням тіоцетаму | після курсу терапії з включенням трібестану | |||
| Розчини NaCl, %: | 0,5 | 2,31±0,15 | 2,26±0,13 | 2,32±0,17 | 1,91±0,077*l◘ | 1,90±0,11*l◘ | 1,93±0,12l |
| 0,45 | 28,1±0,53 | 32,4±0,44* | 29,6±0,59l | 28,2±0,44l | 27,5±0,55l◘ | 29,0±0,67l | |
| 0,4 | 72,3±0,56 | 78,0±0,47* | 76,1±0,65*l | 73,7±0,42l◘ | 73,37±0,49l◘ | 74,2±0,74l | |
| 0,35 | 95,4±2,01 | 96,78±0,16* | 96,11±0,25l | 95,38±0,21l◘ | 95,21±0,25l◘ | 95,6±0,36l | |
| 0,3 | 97,9±0,18 | 98,67±0,15* | 98,63±0,18 | 97,91±0,16l◘ | 97,63±0,23l◘ | 98,27±0,18 | |
| СМ1, у. о. | 0,36±0,004 | 0,426±0,004* | 0,405±0,006*l | 0,377±0,004*l◘ | 0,371±0,005l◘ | 0,385±0,005*l◘ | |
| СМ2, у. о. | 0,18±0,004 | 0,221±0,004* | 0,199±0,005*l | 0,178±0,003l◘ | 0,177±0,003l◘ | 0,178±0,004l◘ | |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі здорових чоловіків; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії. Таблиця 9.7 – Екскреція катехоламінів з сечею, концентрація кортизолу й інсуліну у крові хворих на хронічні алергодерматози чоловіків віком 45-64 років у процесі лікування (М±m)
| Показники, одиниці вимірювання | Здорові чоловіки віком 45-64 років | Групи хворих на хронічні алергодерматози чоловіків віком 45-64 років: | |||||
| до лікування | після базової терапії | після розробленої терапевтичної методики | після курсу терапії з включенням тіоцетаму | після курсу автогенних тренінгів | після курсу терапії з включенням трібестану | ||
| Адреналін, нмоль/добу | 35,7±0,35 | 29,4±0,43 | 31,1±0,49l | 33,3±0,26l◘ | 34,3±0,25l◘ | 32,3±0,46l | 32,9±0,52l◘ |
| Норадреналін нмоль/добу | 82,3±0,58 | 91,7±0,72 | 65,2±0,55l | 74,1±0,54l◘ | 75,1±0,55l◘ | 70,4±0,72l◘ | 76,4±0,92l◘ |
| Дофамін, нмоль/добу | 1678±12,3 | 1355±10,3 | 1439±12,5l | 1529±9,84l◘ | 1559±11,8l◘ | 1518±19,7l◘ | 1501±18,1l◘ |
| ДОФА, нмоль/добу | 193±1,49 | 170,8±1,38 | 182,1±0,97l | 186±0,87l◘ | 189,3±1,1l◘ | 183,7±0,99l | 183,9±1,91l |
| Кортизол, нмоль/л | 275±1,26 | 388,6±1,73 | 353,5±1,89l | 341,2±1,14l◘ | 343,1±2,0l◘ | 340,2±1,9l◘ | 339,8±1,9l◘ |
| Інсулін, мкМО/мл | 6,91±0,02 | 7,37±0,017 | 7,325±0,02 | 7,42±0,015l◘ | 7,49±0,019l◘ | 7,37±0,024 | 7,40±0,024◘ |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі здорових чоловіків; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.

Рисунок 9.3 – Співвідношення гормонів і медіаторів у хворих на хронічні алергодерматози чоловіків віком 45-64 років у процесі лікування (результати, отримані у групі хворих до лікування, прийняті за 1).
За концентрацією адреналіну, норадреналіну, ДОФА та дофаміну у сечі, а також за концентрацією кортизолу та інсуліну у крові отримана достовірна різниця між групою хворих після проведеної базової терапії алергодерматозів і групами пацієнтів, які застосовували розроблену нами методику лікування у цілому та зокрема додатково отримували тіоцетам. Додаткове використання автогенних тренінгів і трібестану у комплексній терапії хворих на хронічні алергодерматози чинило більший вплив на нормалізацію функціонування симпатоадреналової та вагоінсулярної системи, ніж використання базової терапії захворювання.
Після завершення курсу лікування співвідношення гормонів і медіаторів у хворих на хронічні алергодерматози чоловіків віком 45-64 років говорили про наявність субкомпенсації, а не декомпенсації функціонування симпатоадреналової та вегетативної системи. Після використання запропонованої нами методики додаткового лікування хворих на хронічні алергодерматози чоловіків віком 45-64 років значення більшості коефіцієнтів співвідношення гормонів і медіаторів у хворих наближувалися до значень, отриманих у здорових чоловіків аналогічного віку. Достовірна різниця встановлена за коефіцієнтами А:НА, НА:ДА, НА:І, К:І між групою хворих на хронічні алергодерматози до початку лікування та всіма групами пацієнтів після проведеної терапії захворювання. Крім того, була отримана достовірна різниця за значенням коефіцієнту ДА:Д між групою хворих на хронічні алергодерматози до початку лікування та групами пацієнтів, які використовували запропонований нами комплекс у цілому та зокрема тіоцетам, трібестан і автогенні тренінги.
Наприкінці лікування також була встановлена достовірна різниця за коефіцієнтами А:НА, ДА:Д, НА:ДА, НА:І, К:І, ДОФА/ДА+НА+А між групою пацієнтів, які використовували базову терапію хронічних алергодерматозів, та групами хворих, які додатково використовували запропонований нами комплекс заходів у цілому та зокрема отримували тіоцетам.
Крім того, була отримана достовірна різниця за значеннями коефіцієнтів ДА:Д, НА:І, К:І, ДОФА/ДА+НА+А між групами хворих на хронічні алергодерматози після базового лікування та після додаткового використання автогенних тренінгів. Достовірна різниця отримана за значеннями коефіцієнтів А:НА, НА:ДА, НА:І, К:І між групами хворих на хронічні алергодерматози після базового лікування та після терапії з включенням трібестану. Отже, автогенні тренінги та трібестан чинили позитивний, хоча і менший за тіоцетам, вплив на симпатоадреналову та вагоінсулярну системи.
У всіх терапевтичних групах хворих на фоні проведеного лікування відбувалося достовірне зростання концентрації тестостерону та достовірне зниження концентрації ЛГ, ФСГ, пролактину та ТЗГ порівняно з групою пацієнтів до початку лікування (табл. 9.8). Кращий терапевтичний ефект щодо нормалізації концентрацій ТЗГ, статевих і гонадотропних гормонів відзначено після застосування розробленого нами комплексу лікування хворих на хронічні алергодерматози порівняно з їх базовою терапією. Достовірна різниця за концентраціями тестостерону, ЛГ, пролактину та ТЗГ встановлена між групою пацієнтів, які використовували базову терапію алергодерматозів, та групою хворих, які додатково використовували запропонований нами комплекс заходів у цілому та зокрема трібестан. Достовірне збільшення концентрації тестостерону та достовірне зниження концентрації ФСГ, ЛГ, пролактину та ТЗГ встановлене у хворих, які додатково використовували тіоцетам, порівняно з їх значеннями у пацієнтів, які отримували лише базову терапію алергодерматозів.
У пацієнтів, які у лікуванні хронічних алергодерматозів використовували розроблений нами комплекс, відзначалася достовірно менша бальна оцінка за шкалою AMS [(30,6±0,35) балів] і, відповідно, менші прояви андрогенного дефіциту порівняно як з групою хворих до початку лікування [(32,5±0,33) балів], так і з групою пацієнтів після застосування базової терапії захворювання [(31,7±0,40) балів]. Була отримана достовірна різниця за бальною оцінкою за шкалою AMS між групою хворих до початку лікування та групами пацієнтів після додаткового застосування курсів автогенних тренінгів, трібестану та тіоцетаму. Оцінка за шкалою AMS у групі хворих після курсу додаткового застосування тіоцетаму становила (30,5±0,66) балів, після додаткового використання трібестану – (30,6±0,69) балів, після додаткового застосування автогенних тренінгів – (30,7±0,48) балів. Ці дані свідчать про позитивний вплив розробленого нами комплексу заходів щодо зменшення симптомів старіння чоловіків і ознак андрогенного дефіциту.
Був відзначений більший позитивний вплив на стан ліпідного та вуглеводного обміну від застосування розробленого нами терапевтичного комплексу у порівнянні з базовою терапією (табл. 9.8). Достовірна різниця отримана за концентрацією холестерину, β-ліпопротеїдів, тригліцеридів і глюкози між групами хворих на хронічні алергодерматози до початку лікування та після застосування розробленого нами комплексу.
Таблиця 9.8 – Концентрації статевих і гонадотропних гормонів, ТЗГ, ліпідів і глюкози у крові хворих на хронічні алергодерматози чоловіків віком 45-64 років у процесі лікування (М±m)
| Показники, одиниці вимірювання: | Здорові чоловіки віком 45-64 років | Групи хворих на хронічні алергодерматози чоловіків віком 45-64 років: | ||||
| до лікування | після базової терапії | після розробленої терапевтичної методики | після курсу терапії з включенням тіоцетаму | після курсу терапії з включенням трібестану | ||
| Тестостерон, нмоль/л | 14,6±0,39 | 11,3±0,32* | 12,5±0,37*l | 14,7±0,26l◘ | 14,8±0,37l◘ | 14,6±0,38l◘ |
| ТЗГ, нмоль/л | 44,3±1,09 | 50,6±0,71* | 47,2±0,46*l | 44,78±0,33l◘ | 44,7±0,43l◘ | 44,8±0,54l◘ |
| ФСГ, МЕ/л | 4,1±0,08 | 4,48±0,026* | 4,28±0,03*l | 4,19±0,029l | 4,09±0,031l◘ | 4,32±0,031*l |
| ЛГ, ЕД/л | 3,7±0,04 | 3,96±0,026* | 3,87±0,034*l | 3,68±0,019l◘ | 3,67±0,022l◘ | 3,70±0,035l◘ |
| ПРЛ, mMe/l | 263,2±3,82 | 294±2,33* | 284,3±2,78*l | 264,7±2,01l◘ | 262,4±2,73l◘ | 267,5±2,91l◘ |
| Холестерин, ммоль/л | 4,60±0,04 | 4,93±0,11* | 4,88±0,16 | 4,62±0,028l | 4,67±0,028l | 4,56±0,048l |
| β-ліпопротеїди, % | 48,7±0,48 | 50,89±0,54* | 50,26±0,54* | 48,06±0,50l◘ | 48,32±0,62l◘ | 47,73±0,83l◘ |
| Тригліцериди, ммоль/л | 1,83±0,05 | 1,92±0,032 | 1,85±0,032 | 1,77±0,035l | 1,8±0,047l | 1,73±0,051l◘ |
| Глюкоза, ммоль/л | 5,29±0,05 | 5,59±0,05* | 5,38±0,06l | 5,28±0,06l | 5,28±0,10l | 5,27±0,06l |
Примітка. * – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі здорових чоловіків; l – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих до лікування; ◘ – достовірна різниця (р<0,05) при порівнянні з відповідними показниками у групі хворих після базової терапії.
У групі хворих, які додатково використовували трібестан, відзначені найкращі результати щодо нормалізації ліпідного обміну: концентрації тригліцеридів і β-ліпопротеїдів наприкінці лікування у них були достовірно нижчими, ніж у хворих після використання базової терапії хронічних алергодерматозів.
* * *
Таким чином, результати проведеного дослідження обґрунтовують необхідність застосування розробленої методики комплексної терапії хворих на хронічні алергодерматози чоловіків старших вікових груп. Отримані дані доводять виражену позитивну терапевтичну ефективність розробленого комплексу заходів з використанням препаратів з антиоксидантною, цитопротекторною та ноотропною дією, препаратів на основі стероїдних сапонінів і автогенних тренінгів щодо перебігу хронічних алергодерматозів, загального стану шкірного покрову, мікроциркуляції у шкірі, нормалізації метаболічних порушень і гормонального статусу, зменшення симптомів старіння та андрогенного дефіциту у чоловіків віком 45-64 років.
Результати, отримані при проведенні дослідження, наведені у розділі 9, опубліковані у наступних друкованих працях:
1. Резніченко Н. Ю. Діагностика, лікування та профілактика алергодерматозів чоловіків у віковому аспекті / Н. Ю. Резніченко. – Запоріжжя : Просвіта, 2014. – 132 с.
2. Корекція дисбіотичних станів у мешканців індустріальних центрів / Ю. Г. Резніченко, Н. Ю. Резніченко, Г. І. Резніченко, М. О. Ярцева. – Запоріжжя : Просвіта, 2013. – 148 с.
3. Резніченко Н. Ю. Шляхи корекції змін концентрації статевих гормонів у чоловіків старшої вікової групи, хворих на псоріаз / Н. Ю. Резніченко // Медико-соціальні проблеми сім’ї. – 2013. – Т. 18, № 2. – С. 106–110.
4. Резніченко Н. Ю. Досвід застосування психокоригуючих методик у лікуванні хворих на хронічні алергодерматози / Н. Ю. Резніченко // Медична психологія. – 2014. – № 2. – С. 94–98.
5. Резниченко Н. Ю. Изменения концентрации половых гормонов у мужчин старшей возрастной группы, страдающих аллергодерматозами, и пути их коррекции / Н. Ю. Резниченко // Репродуктивное здоровье. Восточная Европа. – 2013. – № 4 (28). – С. 94–100.
6. Резниченко Н. Ю. Опыт применения аутогенных тренингов в комплексной терапии псориаза и хронических аллергодерматозов / Н.Ю.Резниченко // Курский науч.-практ. вестник «Человек и его здоровье». – 2014. – № 2. – С. 68–72.
7. Резніченко Н. Ю. Пошук шляхів корекції метаболізму у хворих на алергодерматози осіб зрілого віку / Н. Ю. Резніченко // Дерматовенерология. Косметология. Сексопатология. – 2013. – № 1-4. – С. 63–70.
8. Резніченко Н. Ю. Пошук шляхів підвищення ефективності лікування хворих на хронічні алергодерматози старших вікових груп / Н. Ю. Резніченко // Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции:сб. науч. тр. / под ред. А. М. Дащука. – Х., 2014. – С. 159–167.
РОЗДІЛ 10
УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
Однією з важливих проблем сучасної дерматології є хронічні дерматози, такі як псоріаз і алергодерматози, оскільки вони займають провідні місця у структурі захворювань шкіри [3, 6, 32, 53, 72, 137, 275, 292]. Особливої уваги заслуговує їх поширення серед людей старших вікових груп. Збільшення віку пацієнтів супроводжується зростанням частоти рецидивів дерматозів і формуванням резистентності до різних методів лікування [84, 129].
Збільшення тривалості життя диктує необхідність подовження його активного способу за рахунок збереження здоров’я та підвищення якості життя у людей старшого віку, у тому числі і хворих на хронічні дерматози, що обумовлює актуальність подальшого вивчення цього розділу медичної науки. Не дивлячись на велику кількість публікацій, на сьогодні остаточно не з’ясованими залишаються етіологічні чинники та патогенетичні ланки розвитку хронічних дерматозів (псоріазу та алергодерматозів) у чоловіків.
Відомо, що поступові зміни фізіологічних функцій організму чоловіків протягом життя супроводжуються тривалим динамічним процесом функціональних і структурних змін у різних органах і системах, який розвивається задовго до приходу старості [135, 176]. На сьогодні недостатньо з’ясованими є ряд факторів, які приймають участь у формуванні інволютивних змін шкіри у чоловіків, серед них – екологічні та соціальні чинники, стан метаболізму, гормональний статус, функціонування нервової та симпатоадреналової систем.
Існує багато способів лікування хронічних дерматозів (псоріазу та алергодерматозів) і порушень стану шкірного покрову, проте висока захворюваність і частота патологічних змін шкіри серед населення обумовлює необхідність розробки нових терапевтичних методик [23, 47, 142, 182, 220, 275]. Відомі способи корекції вікових змін метаболізму, гормональних порушень, змін функціонування центральної та вегетативної нервової системи, вікових психологічних особливостей і пов’язаних з ними порушень стану шкіри [14, 46, 59, 166, 204]. Проте не було проведено прицільних досліджень щодо лікування хронічних дерматозів з урахуванням вікових розладів гомеостазу та інволютивних змін шкіри у чоловіків.
Відсутність робіт по вивченню інволютивних змін шкіри, клінічного перебігу та лікування хронічних дерматозів (псоріазу та алергодерматозів) у чоловіків різних вікових груп обумовлюють актуальність проведення дослідження. Необхідність вивчення клінічних особливостей стану шкіри, її кровотоку та мікробіоценозу у чоловіків різних вікових груп; з’ясування змін гомеостазу організму, що можуть спричиняти порушення стану шкірного покрову, виникнення та розвиток хронічних дерматозів; потреба у розробці методів їх лікування визначили вибір напрямку, мети та завдань дослідження.
Метою дослідження була розробка алгоритмів підвищення ефективності лікування чоловіків, хворих на хронічні дерматози (псоріаз, алергодерматози), шляхом залучення до комплексного лікування індивідуалізованих терапевтичних заходів, спрямованих на уповільнення вікових розладів гомеостазу та інволютивних змін шкіри.
Для встановлення особливостей стану шкірного покрову чоловіків і змін гомеостазу організму, які можуть сприяти виникненню дерматологічних захворювань (у тому числі, псоріазу та алергодерматозів як одних з найбільш розповсюджених захворювань, що вимагають тривалої терапії), та подальшої розробки можливих методів їх профілактики і лікування було проведено дослідження з залученням 447 здорових чоловіків у віці від 25 до 64 років, які проживали у великому промисловому місті Запоріжжя. У залежності від віку обстежені чоловіки були розподілені на 4 групи: віком 25-34 років – 122 особи, 35-44 років – 128 осіб, віком 45-54 років – 112 осіб, віком 55-64 років – 85 осіб. До дослідження також було включено 212 здорових чоловіків у віці від 35 до 54 років, які проживали у місті зі сприятливим довкіллям – Мелітополі. Для встановлення особливостей шкірного покрову та порушень гомеостазу організму, які можуть призводити до виникнення та прогресування дерматологічних захворювань, було обстежено 110 хворих на псоріаз і 101 хворого на хронічні алергодерматози чоловіків віком 45-64 років.
Усім особам, які були включені до дослідження, проводили клінічну оцінку стану шкіри. У хворих на псоріаз тяжкість захворювання оцінювалася за індексами BSA та PASI. Ступінь тяжкості алергодерматозів визначалася за шкалою SCORAD. Для оцінки товщини різних шарів шкіри у обстежених осіб і кровотоку у ній проводилося доплерографічне ультразвукове дослідження. Стан мікроциркуляції шкіри визначали за допомогою біомікроскопії кровоносних судин.
Для встановлення порушень гомеостазу організму, які могли асоціюватися зі змінами стану шкіри у чоловіків, проведено дослідження функціонування системи ПОЛ-АОС, осмотичної стійкості еритроцитів, концентрації середніх молекул, гормонального та нейромедіаторного статусу, стану ліпідного та вуглеводного обміну, мікробіоценозу шкіри, слизової оболонки ротоглотки та кишечника.
Обстеженим чоловікам проводили анкетування для визначення їх освіти, сімейного стану, соціально-побутових умов, ментальних особливостей, оцінки якості життя, рівнів тривожності, невротизації, депресії, симптомів старіння і андрогенного дефіциту.
Шляхом обстеження 447 здорових чоловіків у віці від 25 до 64 років, які проживали у м. Запоріжжі, було встановлено, що зі збільшенням віку зростала вираженість сухості шкіри та бальна оцінка порушень її тургору, які досягали максимальних значень у чоловіків віком 55-64 років. Крім того, у чоловіків з віком відбувалося достовірне збільшення кількості зморшок і бальної оцінки стану шкіри за Yolanda R. Helfrich et al. Встановлена кореляційна залежність слабкої сили (r=0,42) між віком чоловіків і бальною оцінкою сухості шкіри, а також високий кореляційний взаємозв’язок між віком і бальною оцінкою тургору шкіри (r=0,79), бальною оцінкою стану шкіри за Yolanda R. Helfrich et al. (r=0,89), кількістю зморшок (r=0,87), бальною оцінкою їх вираженості (r=0,89). Кількість сенільних ангіом, сенільних лентиго, кератом, вогнищ краплеподібного гіпомеланозу, телеангіектазій і папілом також зростала зі збільшенням віку, що дозволяє розглядати ці елементи висипки як маркери старіння шкіри. Кількість даних елементів висипки була максимальною у осіб віком 55-64 років і становила 63,9±4,1. У чоловіків віком 25-34 років спостерігалися поодинокі елементи – маркери старіння (4,8±1,8).
Методом ультразвукового дослідження було встановлено, що з віком відбувалося зменшення як загальної товщини шкіри, так і її шарів. Встановлений кореляційний зворотній взаємозв’язок між віком чоловіків і товщиною епідермісу (r= –0,61), дерми (r= –0,89). Зменшення товщини шарів шкіри є не лише маркером природного старіння організму, але й важливим патогенетичним чинником у виникненні та хронізації певних дерматозів, а отже потребує проведення відповідної корекції.
При дослідженні кровотоку у шкірі чоловіків виявлено, що починаючи з 45-річного віку, відзначалася менша максимальна швидкість кровотоку і більші значення пульс-активності та резистентності. Збільшення індексів свідчить про зменшення еластичності судин. Встановлений кореляційний зворотній взаємозв’язок середньої сили між віком чоловіків і максимальною швидкістю кровотоку (r= –0,63), середньою швидкістю кровотоку у судинах шкіри (r= –0,61), а також прямий взаємозв’язок середньої сили між віком чоловіків і індексом пуль-активності (r=0,57), індексом резистентності (r=0,54).
Зі збільшенням віку у чоловіків при біомікроскопії судин нігтьового ложа відзначалося зменшення кількості функціонуючих капілярів і збільшення відсотку порушень мікроциркуляції. Збільшувалася частота як судинних, так і внутрішньосудинних змін. Встановлений кореляційний зворотній взаємозв’язок високого ступеня між віком чоловіків і кількістю функціонуючих капілярів (r= –0,78).
Таким чином, результати проведеного дослідження свідчать про зменшення з віком у чоловіків товщини різних шарів шкіри та погіршення кровотоку у ній. Вірогідно, цим фактом пояснюється наявність частих дерматологічних захворювань у чоловіків старших вікових груп.
Важливу роль у збереженні цілісності, фізіологічного стану та функцій шкіри відіграє її мікробіоценоз. Встановлено, що зі збільшенням віку чоловіків відбувалося зростання загальної кількості бактерій на шкірі та кількості коагулазопозитивних стафілококів. Починаючи з віку 45 років відзначалася поява достовірних відмінностей у мікробному обсіменінні шкіри, що свідчить про формування вікового дисбіотичного стану, який може сприяти виникненню та прогресуванню дерматологічних захворювань і потребує проведення відповідної корекції.
З віком у чоловіків відзначалася тенденція до зростання кількості патогенних стрептококів (Str. pneumoniae, Str. pyogenes) у ротоглотці. Найбільша кількість патогенних стафілококів у ротоглотці відзначалась у чоловіків віком 55-64 років [(3,32±0,14) проти (2,37±0,43) Lg КУО/мл у осіб віком 45-54 років]. Крім того, була відзначена тенденція до зростання з віком загальної кількості умовно-патогенної флори: інтегральний показник її кількості у осіб віком 55-64 років становив (11,1±1,1) проти (7,7±1,41) Lg КУО/мл у віці 25-34 років. Наявність вогнищ хронічної інфекції у ротоглотці є важливим етіологічним чинником у розвитку багатьох дерматозів, у тому числі псоріазу та алергодерматозів.
У чоловіків віком 45-54 і 55-64 років встановлено достовірне зниження кількості біфідобактерій і лактобактерій у кишечнику порівняно з групою 25-34-річних осіб. Також була встановлена достовірна різниця за кількістю неферментуючої кишкової палички між тими ж групами обстежених чоловіків. Оскільки зростання кількості патогенної флори відмічається у чоловіків, починаючи з 45-річного віку, доцільним є проведення коригуючих заходів, спрямованих на нормалізацію мікробіоценозу, саме у цій віковій групі.
У ході дослідження було встановлено достовірне зменшення коефіцієнта антиокислювального захисту у чоловіків віком 35-44 років порівняно з особами віком 25-34 років. Найбільш значні порушення у системі ПОЛ-АОС спостерігалися серед групи чоловіків віком 55-64 років: у них встановлено найвищий рівень ТБК-АП і найменший КАОЗ, що свідчить про превалювання процесів активації перекисного окислення ліпідів у цієї групи чоловіків. Встановлений зворотній кореляційний взаємозв’язок високого ступеня між віком чоловіків і коефіцієнтом антиокислювального захисту (r = –0,81) за рахунок активації перекисного окислення ліпідів (кореляційний взаємозв’язок між віком чоловіків і ТБК-АП – 0,83).
При розгляді циркадних ритмів показників функціонування системи ПОЛ-АОС виявлено, що у чоловіків віком 25-34 років крива добового коливання КАОЗ наближалася до прямої лінії, що свідчить про стабільні взаємовідносини у системі ПОЛ-АОС, система антиокислювального захисту адекватно реагувала на зміни в активації ПОЛ протягом доби. У чоловіків віком 35-54 років криві добового коливання КАОЗ знаходилися нижче, ніж у чоловіків віком 25-34 років. Це свідчить про менші можливості антиокислювального захисту у відповідь на активацію ПОЛ. Найнижче знаходилась крива добового коливання КАОЗ у групі чоловіків віком 55-64 років. Особливо низькі значення спостерігались у вечірній і нічний час, що підтверджує думку про виснаженість антиокислювального захисту у цей час доби та превалювання активації ПОЛ.
Активація ПОЛ призводить до порушення функціонування клітинних мембран. Проведені дослідження показали, що відсоток гемолізу еритроцитів зростав зі збільшенням віку та був максимальним у чоловіків віком 55-64 років. Це свідчить про зменшення стійкості еритроцитарних мембран, а відтак можна говорити і про порушення стійкості та функціонування інших клітин організму у чоловіків зі збільшенням віку. Крім того, було встановлено, що з віком зростала концентрація середніх молекул, що свідчить про збільшення рівня ендотоксикозу. Встановлений прямий кореляційний взаємозв’язок середньої сили між віком чоловіків і концентрацією середніх молекул (r = 0,62-0,61).
Важливим питанням є з’ясування характеру взаємозв’язку між симпатоадреналовою та вагоінсулярною системами, яким відводиться значна роль як у забезпеченні захисно-пристосовних реакцій організму у випадку дії на організм надзвичайних подразників, так і здійсненні адаптаційно-трофічних процесів у тканинах органів, які піддалися агресії. Встановлено, що у чоловіків віком 35-44 років концентрації більшості гормонів, медіаторів і їх співвідношення значним чином не відрізнялися від результатів, отриманих у чоловіків віком 25-34 років. У чоловіків 45-54-річного віку екскреція адреналіну, норадреналіну, дофаміну та ДОФА з добовою сечею була достовірно вищою, ніж у чоловіків віком 25-34 та 35-44 років. Оскільки величина екскреції адреналіну та норадреналіну з сечею характеризує рівень активності симпатоадреналової системи, а ДОФА та дофаміну – її резервні можливості, отримані дані вказують на підвищення функціональної активності та резервних можливостей симпатоадреналової системи у цих групах. У чоловіків віком 45-54 років відзначалося зменшене співвідношення А:НА, ДА:Д і збільшене – НА:ДА. Отримані дані свідчать про наявність у чоловіків віком 45-54 років тенденції до гальмування біосинтезу катехоламінів на етапі ДОФА-дофамін і про прискорення перетворення дофаміну у норадреналін, що пов’язано зі зниженням у них активності ферменту ДОФА-декарбоксилази та незначною тенденцію до збільшення активності дофамін-ß-оксидази.
Коефіцієнт ДОФА/ДА+НА+А був вищим у чоловіків віком 45-54 років порівняно з чоловіками віком 25-34 та 35-44 років. Виявлене у чоловіків віком 45-54 років зниження коефіцієнту А:НА є наслідком більш вираженого порівняно з адреналіном збільшення екскреції норадреналіну, що вказує на перевагу у них тонусу та реактивності нервової ланки адренергічної системи над гормональною. Зазначені вище особливості функціонування симпатоадреналової системи вказують на її дисфункцію, неспроможність, оскільки відомо, що за умови збереження системою фізіологічного стану функціональної активності спостерігається однонаправлений характер змін біосинтезу, а також динамічна рівновага між процесами біосинтезу та секреції. У чоловіків віком 55-64 років виявлені ще вищі концентрації катехоламінів і більш виражені зміни їх співвідношення, ніж у чоловіків віком 45-54 років, що свідчить про їх знижену стресостійкість.
Рівень кортизолу у крові чоловіків віком 45-54 років достовірно перевищував значення, отримані у чоловіків віком 25-34 і 35-44 років. Така ж тенденція відмічалась у них і за концентрацією інсуліну. Коефіцієнт К:І, що є найбільш об’єктивним критерієм тяжкості ушкоджуючої дії стресора та активності компенсаторних процесів, які розвиваються у відповідь на пошкодження, у чоловіків віком 45-54 років був таким, як і у чоловіків віком 25-34 та 35-44 років.
Дослідження функціонального стану вегетативної нервової системи виявило синергічне підвищення активності як симпатичного, так і парасимпатичного її відділів. Наявність функціональної неспроможності симпатоадреналової системи та вегетативної дисфункції не дозволили оцінити реакцію систем, що вивчались, як адекватну силі подразника, а тому її слід розглядати як стресову, що відповідає стадії тривоги стрес-реакції, а сам подразник за його силою як надзвичайний. Ступінь напруги нервової ланки симпатоадреналової системи (за результатами кількісного аналізу) перевищував напруження глюкокортикоїдної функції надниркових залоз і, судячи за дисоціацією в активності ланок симпатоадреналової системи та характером порушень в обміні катехоламінів, знаходився на межі фізіологічного реагування. Наведені дані дозволяють стверджувати, що активна реакція нервової ланки симпатоадреналової системи, яка є необхідним елементом фізіологічної реакції захисно-пристосувальних механізмів, у даному випадку виконує не лише саногенетичну, а й патогенетичну роль і може розглядатись як важливий фактор розвитку патологічних станів, які частіше діагностуються у чоловіків віком 45-54 років.
У чоловіків віком 55-64 років на фоні подальшого підвищення рівня кортизолу відбувалося зниження рівня інсуліну. Це говорить про неадекватну реакцію організму на збільшений у цьому віці рівень глюкози у крові та вірогідну виснаженість можливостей підшлункової залози.
Наведені вище дані свідчать про наявність у чоловіків віком 45-54 років субкомпенсованих змін досліджених систем. Враховуючи збільшення патологічних змін у чоловіків віком 55-64 років, поява парадоксальних реакцій може свідчити про перехід стадії субкомпенсації до декомпенсації функціонування симпатоадреналової системи та вегетативної дисфункції.
Крім того, були проведені дослідження концентрації статевих і гонадотропних гормонів, ТЗГ у чоловіків різних вікових груп. Зі збільшенням віку чоловіків спостерігалося зменшення концентрації тестостерону та збільшення концентрацій ФСГ, ЛГ, пролактину та ТЗГ, що призводить до андрогенного дефіциту. Встановлений зворотній кореляційний взаємозв’язок між віком чоловіків і концентрацією тестостерону (r= –0,60); прямий – між віком чоловіків і концентрацією ФСГ (r=0,82), ЛГ (r=0,86), ПРЛ (r=0,77), ТЗГ (r=0,80). Аналіз результатів проведених досліджень показав формування вікового дисгормонального стану у чоловіків, починаючи з 45-річного віку. У чоловіків віком 55-64 років відзначався виражений дисгормональний стан, який потребував проведення відповідної корекції. Крім того, у чоловіків, починаючи з 35-річного віку, відзначалося зростання бальної оцінки за шкалою AMS, що є свідченням початку формування андрогенного дефіциту та старіння чоловіків. Максимальна бальна оцінка за шкалою AMS встановлена у групі чоловіків віком 55-64 років [(30,9±0,39) проти (24,6±0,40) балів в осіб віком 25-34 років).
У обстежених чоловіків з віком збільшувалася концентрація холестерину, β-ліпопротеїдів, тригліцеридів, глюкози, що призводить до порушення обміну речовин, розвитку атеросклерозу та метаболічного синдрому. Встановлений прямий кореляційний зворотній взаємозв’язок між віком чоловіків і концентрацією холестерину (r = 0,95), β-ліпопротеїдів (r = 0,91), тригліцеридів (r = 0,81), глюкози (r = 0,64).
Встановлена пряма кореляційна залежність між віковими змінами шкіри у чоловіків і індексом пульс-активності, індексом резистентності судин шкіри, підвищенням рівня ендогенної інтоксикації (r = 0,25 – 0,60), бальною оцінкою за шкалою AMS (r = 0,3 – 0,46), концентрацією ФСГ, ЛГ, ТЗГ і зворотна залежність – з кількістю функціонуючих капілярів нігтьового ложа (r = -0,28 – -0,68), коефіцієнтом антиокислювального захисту, концентрацією тестостерону (r = -0,31 – -0,57).
Отримані дані говорять про наявність змін гомеостазу, що відбуваються у чоловіків зі збільшенням віку та можуть бути чинниками виникнення, розвитку, хронізації та постійних загострень дерматологічних захворювань. Наведені дані щодо стану шкіри, кровообігу у ній, гомеостазу організму, особливостей психологічного статусу у чоловіків різного віку свідчать про необхідність проведення відповідних коригуючих заходів у кожній віковій групі.
Для виявлення найбільш розповсюджених і значимих чинників, які негативно впливають на стан здоров’я чоловіків у цілому та шкірного покрову зокрема, був проведений аналіз різних факторів серед 447 здорових чоловіків у віці від 25 до 64 років, які проживали у м. Запоріжжі. Отримані дані говорять про комплексний вплив багатьох несприятливих факторів на формування патологічних змін шкіри та гомеостазу організму, які у подальшому можуть спричиняти виникнення хронічних дерматозів. Визначені основні фактори ризику погіршення стану шкіри та загального стану здоров’я чоловіків віком 45-64 років: тютюнопаління, часте вживання алкоголю (один раз на тиждень або частіше), недостатнє вживання овочів і фруктів (менше 5 днів на тиждень), недостатнє вживання кисломолочних продуктів (менше 3 днів на тиждень), рівень ситуативної тривожності за шкалою Спілбергера-Ханіна більший за 42 бали.
Окремо був проаналізований стан здоров’я мешканців промислового міста Запоріжжя з великою кількістю металургійних, хімічних, машинобудівних заводів і мешканців міста меншої величини Мелітополя зі сприятливим довкіллям. Згідно офіційної статистики, в обох містах спостерігається високий рівень захворюваності на дерматологічну патологію. У місті Запоріжжя захворюваність на екзему на 36,7 % вища, на псоріаз – на 75,4 %, на мікози – на 23,3 %; на алопецію – на 111,6 %, ніж в екологічно сприятливому місті Мелітополь. Таким чином, результати проведеного аналізу підтверджують негативний зв’язок забруднення навколишнього середовища з захворюваністю мешканців на дерматологічну патологію.
Методом анкетування було встановлено, що чоловіки, які проживали у м. Запоріжжі частіше, ніж мешканці м. Мелітополя, відзначали наявність частих стресів на роботі (25,0 % проти 14,7 % відповідно, р<0,01). Несприятливий психологічний клімат у сім'ї також був більш властивим для жителів м. Запоріжжя – відзначався у 12,2 % осіб, у той час як у м. Мелітополі – у 8,1 %. Проведені дослідження показали, що у чоловіків, які мешкали у м. Запоріжжі, був вищим рівень ситуативної тривожності, рівень невротизації за Л. І. Вассерманом (на 22,0 %), рівень депресії за шкалою Бека (на 18,0 %), порівняно з мешканцями м. Мелітополя.
У чоловіків, які мешкали у великому промисловому місті та місті меншої величини, не було відзначено різниці за кількістю елементів висипки – маркерів старіння, що може бути пояснене впливом різноманітних пошкоджуючих факторів на організм людини – екологічних, кліматичних, соціально-побутових, ментальних і психологічних. У результаті дослідження були встановлені біомікроскопічні зміни судин нігтьового ложа у мешканців великого промислового міста Запоріжжя, порівняно з мешканцями міста Мелітополь.
У чоловіків, які проживали у м. Запоріжжі, порівняно з мешканцями м. Мелітополя, відзначалася вища загальна кількість бактерій [(3,4±0,1) проти (3,0±0,1) Lg КУО/см2) і кількість коагулазопозитивних стафілококів [(0,7±0,2) проти (0,2±0,1) Lg КУО/см2) на шкірі, більша кількість умовно-патогенної мікрофлори у ротоглотці [(8,2±0,8) проти (4,7±0,9) Lg КУО/мл], нижча кількість біфідобактерій [(8,5±0,1) проти (8,9±0,1) Lg КУО/г] і лактобактерій [(6,5±0,1) проти (7,0±0,1) Lg КУО/г], вища – неферментуючої кишечної палички [(1,1±0,2) проти (0,5±0,2) Lg КУО/г] при дослідженні мікробіоценозу кишечнику. Це свідчить про формування системного дисбіотичного стану у мешканців великих індустріальних центрів, який може сприяти виникненню та прогресуванню дерматологічних захворювань.
У осіб, які проживали у великому індустріальному центрі, встановлено зменшену осмотичну стійкість еритроцитарних мембран, превалювання процесів активації ПОЛ і неадекватну реакцію, не виключено і певне виснаження, антиоксидантного захисту. У мешканців м. Запоріжжя концентрація середніх молекул у сироватці крові була достовірно вищою, ніж у чоловіків з м. Мелітополя, що свідчить про підвищений рівень ендотоксикозу у мешканців великих індустріальних центрів, вірогідно пов’язаний з чинниками довкілля та порушеним обміном речовин в організмі.
Отримані результати кількісного аналізу показників активності симпатоадреналової, вагоінсулярної систем і глюкокортикоїдної функції надниркових залоз вказують на односпрямоване підвищення їх активності, а також, судячи за величиною коефіцієнта К:І, підвищення активності компенсаторних процесів тяжкості тканинних пошкоджень, викликаних стресором, які розвиваються у мешканців великого промислового міста. Проте наявність функціональної неспроможності симпатоадреналової системи та вегетативної дисфункції не дозволяють оцінювати реакцію систем, що вивчаються, як адекватну силі подразника, а тому її слід розглядати як стресову, що відповідає стадії тривоги стрес-реакції, а сам подразник за його силою – як надзвичайний.
Наведені дані дозволяють стверджувати, що активна реакція нервової ланки симпатоадреналової системи, яка є необхідним елементом фізіологічної реакції захисно-пристосувальних механізмів, у даному випадку виконує не лише саногенетичну, а й патогенетичну роль і може розглядатись як важливий фактор розвитку патологічних станів, які частіше діагностуються у мешканців великих промислових міст.
Також були проаналізовані рівні ТЗГ, статевих і гонадотропних гормонів, симптоми старіння й андрогенного дефіциту у мешканців обох міст. І хоча не було встановлено різниці за концентрацією ТЗГ, статевих і гонадотропних гормонів між мешканцями двох міст, проте у чоловіків з великого промислового міста Запоріжжя виявлена достовірно вища (р<0,05) бальна оцінка за шкалою AMS [(27,4±0,24) балів], порівняно з мешканцями м. Мелітополя [(25,8±0,29) балів].
Вищенаведене свідчить про наявність змін гомеостазу організму, особливостей психологічного статусу та ментальних характеристик у чоловіків, які проживали у великому промисловому місті. Весь цей комплекс факторів може чинити несприятливий вплив на шкірні покрови та сприяти виникненню дерматологічної патології, що проявляється у вищій захворюваності на псоріаз, екзему та інші дерматози серед чоловіків, які проживають в умовах великого промислового міста.
Враховуючи виявлені порушення стану здоров’я чоловіків великого промислового центру, зміни шкірного покрову, які виникають зі збільшенням віку, для їх корекції нами були розроблені індивідуалізовані патогенетично обґрунтовані оздоровчі методики. Оскільки у ході дослідження у чоловіків віком 35-44 років, які мешкали у великому промисловому місті, були виявлені зміни стану шкіри та гомеостазу організму, була розглянута можливість корекції даних порушень за допомогою профілактичних курсів вітамінотерапії. Для чоловіків віком 45-54 років розглянута можливість корекції виявлених у ході дослідження порушень за допомогою кисломолочного продукту з пробіотиками або поєднаного застосування краталу та кверцетину. Найбільші зміни стану шкіри, кровотоку у ній, порушення функціонування системи ПОЛ-АОС, симпатоадреналової та вагоінсулярної системи, стану ліпідного та вуглеводного обміну, концентрацій гонадотропних і статевих гормонів у ході дослідження були виявлені у чоловіків віком 55-64 років. Для їх корекції була розглянута можливість профілактичного застосування препаратів з ноотропною, антиоксидантною та цитопротекторною дією. У якості моделі використовували препарат з антиоксидантними та цитопротекторними властивостями (тіотріазолін), ноотропний препарат (пірацетам), комбінований препарат (тіоцетам). Крім того, була розглянута ефективність профілактичного застосування екстракту рослини Tribulus Terrestris (трібестан) у чоловіків віком 55-64 років.
Результати проведених досліджень стану шкіри у чоловіків віком 35-44 років у процесі оздоровлення показали, що профілактичний курс як полівітамінів, так і поєднаного використання біотину та декспантенолу чинив позитивний клінічний ефект на стан шкірних покровів. Бальна оцінка сухості шкіри у чоловіків після оздоровлення біотином і декспантенолом знижувалась у 2 рази, а бальна оцінка стану шкіри за шкалою Yolanda R. Helfrich et al. – у 1,33 рази. Меншу на 30 % бальну оцінку стану шкіри за шкалою Yolanda R. Helfrich et al., а також повну відсутність сухості шкіри встановлено у чоловіків, які пройшли профілактичний курс полівітамінів з мікроелементами, порівняно з аналогічними показниками у групі чоловіків до оздоровлення.
Профілактичне використання полівітамінів призводило до покращення процесів ПОЛ-АОС і наближення значень їх основних показників до рівнів, отриманих у чоловіків аналогічного віку, які мешкали у місті зі сприятливим довкіллям – Мелітополі. У групі чоловіків, які профілактично використовували біотин і декспантенол, відзначено зниження на 11 % концентрації β-ліпопротеїдів і тригліцеридів порівняно з їх значеннями до оздоровчого курсу.
У осіб віком 35-44 років на фоні використання профілактичних вітамінних курсів відзначалося також покращення бальної оцінки старіння чоловіків і андрогенного дефіциту за шкалою AMS. Оцінка за шкалою AMS у чоловіків віком 35-44 років до оздоровлення становила (26,55±0,29) балів, а після курсу полівітамінів з мікроелементами була достовірно меншою – (25,19±0,47) балів (р<0,05). Достовірно нижчою була оцінка за шкалою AMS і у осіб, які використовували оздоровчі курси біотином і декспантенолом – (25,37±0,47) балів (р<0,05). Ці дані свідчать про зменшення проявів старіння та андрогенного дефіциту у чоловіків як на фоні використання полівітамінних засобів з мікроелементами, так і на тлі поєднаного застосування біотину та декспантенолу.
У ході дослідження була розглянута можливість покращення стану шкіри та нормалізації біотопів організму у чоловіків – мешканців промислового міста віком 45-54 років шляхом використання пробіотичного засобу. Було встановлено, що у чоловіків по завершенню курсу пробіотику відзначалася тенденція до зменшення сухості шкіри. Крім того, отримана достовірна різниця за бальною оцінкою стану шкіри за шкалою Yolanda R. Helfrich et al. у чоловіків віком 45-54 років до та після курсу оздоровлення пробіотиком.
У чоловіків, які застосовували профілактичні курси пробіотику, відзначалося достовірне (р<0,05) зменшення загальної кількості бактерій (з (3,66±0,14) до (3,13±0,11) Lg КУО/см2) і кількості коагулазопозитивних стафілококів на шкірі (з (1,06±0,32) до (0,13±0,13) Lg КУО/см2) порівняно з групою осіб до оздоровлення. Основні показники мікробного пейзажу шкіри у чоловіків після курсу пробіотичного засобу досягали рівнів здорових осіб, які мешкали у м. Мелітополі. Також у чоловіків після застосування пробіотику відзначалася достовірно вища (р<0,05) кількість біфідобактерій при бактеріологічному дослідженні кала порівняно з групою осіб до оздоровлення [(8,73±0,12) проти (8,35±0,14) Lg КУО/г], достовірно вища (р<0,05) кількість лактобактерій [(6,86±0,12) проти (6,375±0,15) Lg КУО/г)], достовірно менша (р<0,05) кількість протею [(0,31±0,22) проти (0,83±0,3) Lg КУО/г)], неферментуючої кишечної палички [(0,27±0,18) проти (1,53±0,34) Lg КУО/г)], грибів роду Candida [(0,31±0,22) проти (1,28±0,34) Lg КУО/г)]. Після курсу пробіотичного засобу у чоловіків спостерігалося достовірне зменшення інтегрального показника кількості умовно-патогенної флори (з (8,82±1,42) до (4,34±0,93) Lg КУО/мл, р<0,05), а також кількості гемофільних паличок при бактеріологічному дослідженні слизової оболонки ротоглотки порівняно з групою чоловіків до оздоровлення. Це свідчить про коригуючий вплив пробіотичного засобу на порушення мікробного пейзажу різних біотопів мешканців промислових міст віком 45-54 років.
На фоні застосування пробіотичного засобу відзначено не лише покращення мікробіоценозу організму, але і зменшення рівня ендогенної інтоксикації. У осіб віком 45-54 років на фоні використання оздоровчих курсів пробіотику відзначалося також покращення бальної оцінки за шкалою AMS, що свідчить про зменшення проявів старіння та андрогенного дефіциту.
Для корекції виявлених патологічних змін у чоловіків віком 45-54 років запропоновано та вивчено ефективність краталу та кверцетину. Було встановлено, що застосування краталу та кверцетину чинило позитивний клінічний ефект на стан шкірного покрову, який проявлявся зменшенням бальної оцінки сухості шкіри у 2,14 рази, порушень тургору шкіри – у 1,25 рази, стану шкіри за шкалою Yolanda R. Helfriсh et al. – у 1,23 рази, порівняно з показниками, отриманими у групі осіб до курсу оздоровлення.
Після поєднаного застосування краталу та кверцетину у чоловіків відзначалося зменшення відсотку порушень мікроциркуляції у 1,35 рази порівняно зі значеннями, отриманими до початку оздоровчого курсу. При цьому на фоні використання краталу та кверцетину спостерігалося зменшення відсотку судинних, внутрішньосудинних і позасудинних порушень. Встановлено збільшення кількості функціонуючих капілярів у 1,14 рази у чоловіків, які отримали курс краталу та кверцетину, порівняно з даним показником у осіб віком 45-54 років до оздоровлення.
Крім того, застосування розробленого оздоровчого комплексу призводило до зменшення проявів ендотоксикозу у осіб віком 45-54 років: концентрація СМ2 знизилась на 10 %.
Використання запропонованого курсу краталу та кверцетину також сприяло нормалізації функціонування симпатоадреналової та вагоінсулярної систем. Встановлено достовірне зменшення рівнів екскреції адреналіну (з (40,4±0,61) до (38,2±0,49) нмоль/добу), норадреналіну (з (99,6±0,87) до (90,3±0,82) нмоль/добу), дофаміну (з (224±1,1) до (210±1,2) нмоль/добу) та ДОФА (з (1775±18) до (1655±26) нмоль/добу) з сечею, а також достовірне зменшення концентрації кортизолу (з (309±2,1) до (292±2,0) нмоль/л) та інсуліну [(7,6±0,02) до (7,3±0,04) мкМО/мл) у крові чоловіків віком 45-54 років після курсу поєднаного застосування краталу та кверцетину. У процесі дослідження було доведено нормалізацію співвідношень основних гормонів і медіаторів симпатоадреналової та вагоінсулярної систем на фоні використання краталу та кверцетину.
У осіб віком 45-54 років на фоні профілактичного використання краталу та кверцетину відзначалося зниження бальної оцінки за шкалою AMS з (28,29±0,38) до (26,93±0,45) балів, що свідчить про зменшення проявів старіння та андрогенного дефіциту у чоловіків.
Покращення стану шкірного покрову та стану здоров’я у цілому на фоні застосування краталу та кверцетину сприяло зниженню рівнів ситуативної тривожності, депресії за шкалою Бека (у 1,13 рази) та невротизації за Л. І. Вассерманом (у 1,22 рази) у чоловіків віком 45-54 років.
Отримані дані свідчать не лише про клінічну, але й біохімічну та психогенну ефективність використання оздоровчих курсів краталу та кверцетину, дозволяють рекомендувати їх широке застосування з у чоловіків віком 45-54 років для збереження здоров’я у цілому та шкіри зокрема.
Для оздоровлення чоловіків віком 55-64 років була розглянута можливість застосування антиоксидантів-цитопротекторів і ноотропних препаратів. У якості моделі використовували препарат з антиоксидантними та цитопротекторними властивостями (тіотріазолін), ноотропний препарат (пірацетам), комбінований препарат (тіоцетам).
Оздоровчий курс використання тіотриазоліну, пірацетаму або тіоцетаму чинив позитивний клінічний ефект на стан шкірного покрову. При цьому максимальну ефективність виявляв тіоцетам. Так, у чоловіків віком 55-64 років по завершенню курсу тіоцетаму відзначалося зменшення бальної оцінки сухості шкіри у 3,2 рази, порушень тургору – у 1,2 рази, стану фотозахищених ділянок шкіри за Yolanda R. Helfrich et al. – у 1,2 рази порівняно з показниками, отриманими у групі осіб до початку оздоровлення.
Використання тіотриазоліну, пірацетаму та тіоцетаму чинило позитивний ефект і щодо нормалізації кровотоку у шкірі. Максимально виражена ефективність встановлена у тіоцетаму. У чоловіків віком 55-64 років після застосування тіоцетаму відзначалося збільшення кількості функціонуючих капілярів у 1,12 рази, зменшення відсотку порушень мікроциркуляції у 2,1 рази, зменшення індексів пульс-активності у 1,14 рази та резистентності у 1,11 рази порівняно зі значеннями, отриманими до початку оздоровчого курсу.
У ході дослідження були отримані також біохімічні підтвердження ефективності застосування оздоровчих курсів тіотриазоліну, пірацетаму та тіоцетаму у чоловіків віком 55-64 років: збільшувався КАОЗ, зменшувалася концентрація ТБК-АП, нормалізувалася стійкість еритроцитарних мембран, зменшувалися прояви ендотоксикозу, покращувалося функціонування симпатоадреналової та вагоінсулярної системи, зростала концентрація тестостерону та знижувалася підвищена концентрація ЛГ, ФСГ, пролактину, ТЗГ.
Нормалізацію функціонування симпатоадреналової та вагоінсулярної системи краще забезпечувало застосування пірацетаму, ніж тіотріазоліну. Використання тіотриазоліну чинило більш виражений ефект на стан ліпідного обміну порівняно з оздоровленням за допомогою пірацетаму. Максимально ефективним щодо корекції всіх біохімічних змін виявився тіоцетам. Його застосування також найкраще забезпечувало зниження рівнів ситуативної тривожності, депресії та невротизації у чоловіків віком 55-64 років.
Це обґрунтовує необхідність поєднаного застосування ноотропних і антиоксидантних препаратів для покращення стану шкіри, кровотоку у ній, нормалізації порушених метаболічних змін у чоловіків старших вікових груп.
Аналіз ефективності використання трібестану у чоловіків віком 55-64 років показав позитивний клінічний ефект щодо стану шкірного покрову: відзначалося зменшення бальної оцінки сухості шкіри, порушень тургору у 1,20 рази, стану шкіри за шкалою Yolanda R. Helfrich et al. у 1,14 рази порівняно з показниками, отриманими у групі осіб до початку оздоровлення.
Крім того, використання трібестану призводило до достовірного зменшення рівня ТБК-АП, зменшення проявів ендотоксикозу, збільшення екскреції адреналіну (з (30,6±0,45) до (35,2±0,25) нмоль/добу), дофаміну (з (1466±15,4) до (1567±17,6) нмоль/добу), ДОФА (з (197,2±1,6) до (204,2±1,1) нмоль/добу), зменшення екскреції норадреналіну з сечею (з (84,5±0,62) до (80,3±0,98) нмоль/добу), зменшення концентрації кортизолу у крові (з (333,2±2,3) до (322,7±1,9) нмоль/л). Співвідношення гормонів і медіаторів у чоловіків віком 55-64 років після проведеного оздоровлення свідчили про зменшення проявів функціональної неспроможності симпатоадреналової системи та вегетативної дисфункції. Це призводило до нормалізації синтезу гонадотропних і статевих гормонів, сприяло зменшенню симптомів старіння чоловіків і андрогенного дефіциту. Так, на фоні прийому трібестану концентрація тестостерону зростала у 1,17 рази. Використання трібестану також призводило до достовірного зменшення (р<0,05) концентрації холестерину (з (4,83±0,03) до (4,69±0,04) ммоль/л) і тригліцеридів (з (2,06±0,04) до (1,91±0,06) ммоль/л).
Покращення стану шкірного покрову та стану здоров’я у цілому на фоні застосування трібестану сприяло зниженню рівнів ситуативної тривожності, депресії та невротизації у чоловіків віком 55-64 років. Отримані дані свідчать про клінічну та біохімічну ефективність використання профілактичних курсів трібестану.
Вищенаведене свідчить про ефективність використання запропонованих індивідуалізованих патогенетично обґрунтованих методик профілактики у чоловіків різних вікових груп.
Для встановлення патогенетичних змін при хронічних дерматозах було обстежено 110 хворих на псоріаз чоловіків і 101 хворий на хронічні алергодерматози чоловік віком від 45 до 64 років. До групи порівняння увійшли 197 здорових осіб аналогічного віку. Контрольну групу склали 250 здорових чоловіків віком від 25 до 44 років.
Шляхом опитування було встановлено, що часті стреси на роботі відзначалися переважно у хворих на хронічні дерматози чоловіків віком 45-64 років (при псоріазі – у 42,2 %, при хронічних алергодерматозах – 38,6 %, порівняно з групою здорових осіб аналогічного віку (у 28,4 %). Серед хворих на хронічні дерматози була більшою кількість людей, які вважали свої стосунки у родині незадовільними. Якщо серед здорових чоловіків віком 45-64 років психологічний клімат у родині вважали несприятливим 18,5 % опитаних, то серед хворих на псоріаз – 22,7 % осіб і серед хворих на хронічні алергодерматози – 26,7 % осіб.
У ході дослідження було встановлено, що професійні шкідливості частіше зустрічались у хворих на хронічні дерматози віком 45-64 років (у пацієнтів з алергічними захворюваннями шкіри – у 47,5 % осіб, у пацієнтів з псоріазом – у 46,5 % осіб) порівняно зі здоровими чоловіками аналогічного віку (у 33,2 % осіб).
У хворих на хронічні дерматози частіше зустрічалися шкідливі звички. 52,7 % хворих на псоріаз і 54,5 % хворих на хронічні алергічні захворювання шкіри віком 45-64 років палили тютюн. У той же час серед здорових чоловіків аналогічного віку 43,7 % були курцями тютюну. Аналогічна тенденція відзначалась і за вживанням алкогольних напоїв: 29,1 % хворих на псоріаз і 30,7 % хворих на хронічні алергодерматози віком 45-64 років вживали спиртні напої щотижнево або частіше, а серед здорових чоловіків аналогічного віку – тільки 19,8 %.
Більшість хворих на хронічні дерматози рідко вживали кисломолочні продукти, рибу та морепродукти, овочі і фрукти. Лише 19,1 % хворих на псоріаз і 19,8 % хворих на хронічні алергічні захворювання шкіри віком 45-64 років вживали кисломолочні продукти більше 2-х днів на тиждень, а серед здорових чоловіків аналогічного віку цей відсоток становив 25,9. При цьому спостерігалося часте використання у їжу макаронних виробів і картоплі.
Недостатня турбота про здоров’я, шкідливі звички, відсутність раціонального харчування, часті стреси на роботі та несприятливий психологічний клімат у родині можуть сприяти виникненню та розвитку хронічних дерматозів у чоловіків старших вікових груп, а отже, їх слід розглядати як фактори ризику. Саме тому вони потребують проведення відповідної корекції – зміни образу життя, відмови від тютюнопаління та вживання алкогольних напоїв, переходу до раціонального харчування, уникнення стресів або проведення психологічних тренінгів щодо підвищення стійкості до стресових станів.
Рівень особистісної тривожності за шкалою Спілбергера-Ханіна у хворих на хронічні дерматози чоловіків віком 45-64 років перевищував її бальну оцінку у групі здорових осіб віком 25-44 і 45-64 років. Це свідчить про те, що сформована у ранньому дитинстві підвищена особистісна тривожність є фоном, на якому у подальшому розвиваються хронічні дерматози. Середнє значення інтегрального показника особистісної тривожності у хворих на хронічні дерматози чоловіків віком 45-64 років відповідало помірному рівню тривожності, а ситуативна тривожність досягала високого рівня. Реактивна тривожність у хворих на хронічні дерматози обумовлена високою ситуативною напругою, стурбованістю, тривогою. Це означає, що при потраплянні у стресові ситуації хворі на хронічні дерматози неадекватно реагують на фактори навколишнього середовища, що призводить до психічної напруги та змін у діяльності нервової системи і, у свою чергу, до рецидивів захворювання.
У хворих на хронічні дерматози відзначався достовірно вищий рівень невротизації порівняно з групами здорових осіб. Якщо інтегральні показники невротизації за Л. І. Вассерманом у різних вікових групах здорових чоловіків відповідали низькому рівню, то хворі на хронічні дерматози виявляли невротизацію середнього ступеня тяжкості. Це говорить про зростання у них емоційної збудливості, у результаті чого виникають негативні переживання, такі як тривожність, напруга, подразливість, розгубленість. Виникає іпохондрична фіксація на соматичних відчуттях і особистих недоліках, у тому числі й тих, що стосуються клінічних проявів хронічних дерматозів. Це призводить до прогресування хронічних дерматозів і погіршення якості життя хворих.
Оцінка психологічного статусу за шкалою Бека у хворих на хронічні дерматози відповідала стану субдепресії, а у здорових чоловіків ознак депресії не спостерігалося. Субдепресія може бути результатом впливу хронічного перебігу захворювання на психологічний стан хворих, хоча наявність навіть незначних ознак депресії може призводити до прогресування та рецидивів дерматозів. У хворих спостерігається патологічно замкнене коло, у якому наявність дерматозу є причиною підвищення тривожності, невротизації та депресії, а це є провокуючим фактором захворювання.
Сухість шкіри була більш вираженою у хворих на хронічні алергодерматози віком 45-64 років. Її бальна оцінка у хворих на хронічні алергічні захворювання шкіри була у 3,1 рази вищою порівняно з групою здорових осіб аналогічного віку. Крім того, у хворих на хронічні алергодерматози були більшими бальні оцінки порушень тургору (у 1,26 рази), стану шкіри за шкалою Yolanda R. Helfrich et al. (у 1,25 рази) порівняно зі здоровими особами віком 45-64 років. Встановлено достовірно вищу кількість зморшок і бальну оцінку їх вираженості (у 1,12 рази) у хворих на хронічні алергодерматози віком 45-64 років порівняно зі здоровими чоловіками аналогічної вікової групи. Об’єктивна оцінка наведених вище показників стану шкіри у хворих на псоріаз не виявила достовірної різниці порівняно зі здоровими чоловіками аналогічного віку. Це говорить про те, що саме хронічні алергодерматози розвиваються у чоловіків старших вікових груп на фоні інволютивних змін шкіри.
У ході дослідження було встановлено, що кількість функціонуючих капілярів у хворих як на псоріаз, так і на хронічні алергодерматози віком 45-64 років була у 1,3 рази меншою при порівнянні з групою здорових чоловіків аналогічного віку, що свідчить про погіршення мікроциркуляції у шкірі хворих на хронічні дерматози. Біомікроскопічною особливістю у хворих на хронічні алергодерматози є зростання відсотку порушень мікроциркуляції: у хворих цей відсоток був у 1,25 рази більшим, ніж у здорових осіб віком 45-64 років. При цьому відсоток внутрішньосудинних порушень мікроциркуляції у хворих на хронічні алергодерматози був вищим у 1,68 рази, а позасудинних порушень – у 2,65 разів порівняно з групою здорових чоловіків віком 45-64 років.
Шляхом мікробіологічних досліджень було встановлено, що у хворих на хронічні дерматози віком 45-64 років відзначалася достовірно більша загальна кількість бактерій на шкірі [(4,1±0,14) Lg КУО/см2 – при псоріазі та (4,38±0,12) Lg КУО/см2 – при хронічних алергодерматозах] порівняно зі здоровими чоловіками аналогічного віку [(3,68±0,1) Lg КУО/см2, р<0,05], що свідчить про наявність дисбіотичного стану у хворих на хронічні дерматози старших вікових груп, який може сприяти прогресуванню захворювання.
У хворих на хронічні дерматози концентрація ТБК-АП була достовірно вищою [(3,40±0,02) ммоль/л – у хворих на псоріаз і (3,33±0,02) ммоль/л – у хворих на хронічні алергодерматози] порівняно з групою здорових аналогічного віку [(3,06±0,03 ммоль/л, р<0,05]. Реагування загальної АОА було неадекватним – її рівень у хворих на хронічні дерматози був достовірно нижчим порівняно зі здоровими чоловіками, що призводило до зменшення коефіцієнту антиокислювального захисту у 1,2 рази.
У хворих на псоріаз був встановлений кореляційний зв’язок між індексом PASI та концентрацією ТБК-АП (r=–0,36), коефіцієнтом антиокислювального захисту (r=0,42). Також визначено кореляційний зв’язок між індексом BSA та концентрацією ТБК-АП (r=–0,44), коефіцієнтом антиокислювального захисту (r=0,43) при псоріазі.
У ході дослідження були оцінені циркадні ритми коливань основних показників системи ПОЛ-АОС. У хворих як на псоріаз, так і на хронічні алергодерматози чоловіків віком 45-64 років система антиокислювального захисту майже не реагувала на добові коливання активності ПОЛ, що свідчить про виснаженість антиокислювальної системи та є однією з патогенетичних ланок захворювань. У хворих на хронічні дерматози чоловіків віком 45-64 років зникають циркадні ритми показників загальної АОА у слині протягом доби. Особливо низькі значення КАОЗ спостерігаються у вечірній і нічний час, що підтверджує думку про виснаженість антиокислювального захисту та превалювання активації ПОЛ саме у цю пору доби.
Зменшення стійкості еритроцитарних мембран і підвищення рівня ендогенної інтоксикації у хворих на хронічні дерматози свідчать про патогенетичну роль цих чинників у розвитку даних захворювань, особливо у чоловіків старших вікових груп.
Екскреція адреналіну, ДОФА та дофаміну у хворих на хронічні дерматози була достовірно нижчою, ніж у здорових чоловіків, що свідчило про зниження функціональної активності та резервних можливостей симпатоадреналової системи у хворих. При цьому мало місце прискорення синтезу катехоламінів на етапах ДОФА-дофамін і дофамін-норадреналін (коефіцієнти відносної активності синтезу НА:ДА у хворих були вищими, ніж у здорових). Активність ферментів ДОФА-декарбоксилази та дофамін-ß-оксидази у пацієнтів з хронічними дерматозами перевищувала активність у здорових. Знижений у порівнянні зі здоровими віком 45-64 років коефіцієнт ДОФА/ДА+НА+А свідчить про вищу швидкість переходу ДОФА у катехоламіни. Відмічалася виражена дисоціація в активності ланок симпатоадреналової системи, про що свідчить превалювання тонусу нервової ланки над гормональною (коефіцієнт А:НА у хворих був значно нижчим, ніж у здорових). Прискорення біосинтезу катехоламінів на етапах ДОФА-дофамін і дофамін-норадреналін у поєднанні зі зниженою активністю та резервними можливостями симпатоадреналової системи, вірогідно, є наслідком зменшення запасів катехоламінів (в першу чергу, норадреналіну) у тканинах (дія механізму зворотного зв’язку).
Результати дослідження екскреції та біосинтезу катехоламінів дають підстави для висновку про те, що у хворих на хронічні дерматози зворотна реакція симпатоадреналової системи на дію стресора носить незвичайний характер і проявляє себе зниженням активності симпатоадреналової системи з перевагою тонусу нервової ланки над гормональною.
Концентрації кортизолу та інсулінуу крові хворих на хронічні дерматози достовірно перевищували рівні у здорових. Коефіцієнт НА:І був майже таким самим, а коефіцієнт К:І – підвищеним у порівнянні зі здоровими.
Результати кількісного аналізу підтверджують високий ступінь напруження ендокринної ланки та вказують на дискоординований характер її взаємовідносин з елементами нейрогенної ланки адаптації (антагоністичний – з нервовою ланкою адренергічної системи та синергічний – з парасимпатичним відділом). Антагоністичні взаємовідносини мають місце і між елементами нейрогенної ланки адаптації (симпатичним і парасимпатичним відділами).
Таким чином, у результаті проведених досліджень у хворих на хронічні дерматози встановлено: зниження активності та резервних можливостей симпатоадреналової системи при прискоренні біосинтезу катехоламінів на етапах перетворення ДОФА у дофамін і дофаміну у норадреналін, що у певній мірі свідчить про зниження тканинних запасів катехоламінів; високий ступінь напруження глюкокортикоїдної функції надниркових залоз і підвищення активності вагоінсулярної системи, що поєднуються з гальмуванням симпатоадреналової системи; виражене порушення вегетативного гомеостазу, що проявляється пригніченням активності симпатичної нервової системи і підвищенням тонусу та реактивності парасимпатичної; зниження активності компенсаторних реакцій організму. Виявлені порушення взаємовідносин гормональної ланки симпатоадреналової системи обґрунтовують доцільність використання у комплексній терапії хворих на хронічні дерматози чоловіків у віці 45-64 років ноотропних препаратів.
У ході проведених досліджень було також встановлено, що хворі на хронічні дерматози чоловіки віком 45-64 років мали нижчу концентрацію тестостерону (у 1,49 рази – при псоріазі та у 1,29 рази – при хронічних алергодерматозах) та вищі концентрації ФСГ (у 1,19 рази – при псоріазі та у 1,10 рази – при хронічних алергодерматозах), ЛГ (у 1,12 рази та у 1,07 рази відповідно), пролактину (у 1,16 рази та у 1,12 рази відповідно), ТЗГ (у 1,20 рази та у 1,14 рази відповідно) порівняно з групою здорових чоловіків аналогічного віку. Отримані дані обґрунтовують необхідність проведення відповідної корекції у комплексній терапії. Крім того, у хворих на хронічні дерматози віком 45-64 років спостерігалися більш виражені симптоми андрогенного дефіциту, що проявлялося вищою бальною оцінкою за шкалою AMS, порівняно з групою здорових чоловіків аналогічного віку.
У хворих на псоріаз віком 45-64 років відзначалися достовірно вищі концентрації холестерину, β-ліпопротеїдів, тригліцеридів і глюкози порівняно зі здоровими особами аналогічного віку. Ці показники є складовими метаболічного синдрому, що часто супроводжує псоріатичну хворобу. Достовірних відмінностей за даними показниками між хворими на хронічні алергодерматози та здоровими чоловіками віком 45-64 років отримано не було. Це говорить про те, що зміни ліпідного обміну властиві саме хворим на псоріаз чоловікам старших вікових груп.
Таким чином, отримані у ході дослідження результати свідчать про наявність у хворих на псоріаз і на хронічні алергодерматози старших вікових груп однонаправлених вікових змін мікроциркуляції у шкірі, порушень у функціонуванні системи ПОЛ-АОС, змін стійкості еритроцитарних мембран, підвищення рівня ендотоксикозу, порушень з боку симпатоадреналової та вагоінсулярної систем, змін концентрації гонадотропних гормонів, зниження концентрації тестостерону.
Для корекції виявлених патогенетичних змін і покращення ефективності лікування хворих на хронічні дерматози (псоріаз і алергодерматози) віком 45-64 років нами було запропоновано використання у комплексній терапії препарату з антиоксидантними, цитопротекторними та ноотропними властивостями (тіоцетаму), екстракту рослини Tribulus Terrestris (трібестану) й автогенних тренінгів за методом Шульца.
У процесі лікування хворих на псоріаз (незалежно від терапевтичної групи) відзначалося зменшення свербежу шкіри та його об’єктивних ознак. У хворих, які додатково застосовували розроблений нами комплекс заходів, бальна оцінка свербежу була у 1,49 рази меншою, вираженості екскоріацій – у 1,35 рази меншою, змін нігтьових пластин – у 1,54 рази меншою порівняно з групою пацієнтів, які отримували лише базову терапію псоріазу. Найменші бальні оцінки свербежу, вираженості екскоріацій і змін нігтьових пластин наприкінці курсу лікування встановлено у хворих, які застосовували автогенні тренінги за методом Шульца.
У хворих на псоріаз у процесі лікування змінювалась як площа ураженої шкіри, так і бальна оцінка за індексом PASI. Індекс PASI був у 1,23 рази нижчим, а індекс BSA – у 1,12 рази нижчим у хворих, які додатково застосовували розроблений нами комплекс заходів, порівняно з групою пацієнтів після використання лише базової терапії. У групі хворих, які використовували розроблений нами комплекс заходів, відзначався вищий відсоток пацієнтів, які досягли PASI 50 і PASI 75, у порівнянні з групою осіб після базової терапії. Це свідчить про позитивний клінічний ефект від додаткового використання розробленого нами комплексу заходів у лікуванні хворих на псоріаз чоловіків віком 45-64 років.
Індекс DLQI був у 1,55 рази вищим у групі хворих після базової терапії псоріазу порівняно з його значенням у пацієнтів, які додатково використовували розроблений комплекс заходів. Це свідчить про позитивний вплив розробленого нами комплексу на якість життя хворих на псоріаз. Крім того, була встановлена достовірна різниця за Δ DLQI (%) між групами пацієнтів, які отримували лише базову терапію та її комбінацію з розробленим нами комплексом заходів. Відсоток хворих, у яких по завершенню курсу лікування індекс DLQI був нижчим за 5 балів, був більшим після додаткового застосування розробленого нами комплексу заходів порівняно з групою пацієнтів, які отримували базову терапію псоріазу. Найвищий відсоток хворих, у яких наприкінці лікування індекс DLQI був нижчим за 5 балів, встановлений у чоловіків, які додатково до базової терапії псоріазу практикували автогенні тренінги.
Хворі на хронічні алергодерматози, які додатково використовували запропонований нами комплекс заходів, наприкінці курсу лікування мали у 1,41 рази нижчу бальну оцінку сухості шкіри порівняно з її значенням у пацієнтів після базового лікування.
Бальна оцінка за шкалою SCORAD була у 1,45 рази нижчою у хворих на хронічні алергодерматози, які додатково застосовували розроблений нами комплекс, порівняно з групою пацієнтів після використання лише базової терапії. Була отримана достовірна різниця за Δ SCORAD (%) наприкінці лікування між групою хворих, які отримували лише базову терапію, та групою, яка додатково використовувала розроблений нами комплекс заходів у цілому.
У групі хворих після базової терапії хронічних алергодерматозів індекс DLQI був у 1,64 рази вищим порівняно з його значенням у пацієнтів, які додатково застосовували розроблений нами комплекс заходів. Отримана достовірна різниця за Δ DLQI (%) між групами пацієнтів, які отримували базову терапію та додатково використовували розроблений нами комплекс. Відсоток хворих, у яких по завершенню курсу лікування індекс DLQI був нижчим за 5 балів, був більшим після додаткового застосування розробленого нами комплексу порівняно особами, які використовували базову терапію хронічних алергодерматозів. Найвищий відсоток хворих, у яких наприкінці лікування індекс DLQI був нижчим за 5 балів, встановлений у чоловіків, які додатково до базової терапії хронічних алергодерматозів використовували тіоцетам.
Використання розробленого нами комплексу заходів щодо терапії як псоріазу, так і хронічних алергодерматозів у чоловіків старших вікових груп сприяло зменшенню рівнів ситуативної тривожності, невротизації та депресії. За оцінкою ситуативної тривожності за шкалою Спілбергера-Ханіна наприкінці лікування була встановлена достовірна різниця між групою хворих, які використовували запропонований нами комплекс заходів, і групою осіб, яка отримувала базову терапію захворювання. Якщо значення інтегрального показника ситуативної тривожності у хворих на хронічні дерматози до початку лікування відповідало рівню високої тривожності та висока тривожність зберігалась у пацієнтів після проведеного базового лікування, то використання розробленого нами комплексу заходів дозволяло знизити рівень ситуативної тривожності до помірних значень. За рівнем невротизації та депресії достовірна різниця отримана між групами чоловіків до початку лікування та після застосування розробленого нами комплексу.
Найбільш ефективними щодо покращення психологічного стану хворих на хронічні дерматози виявились автогенні тренінги за методом Шульца. Рівень депресії за шкалою Бека у хворих, які застосовували автогенні тренінги у комплексній терапії хронічних дерматозів, був достовірно меншим порівняно з групою пацієнтів до початку лікування. Після проведеного лікування пацієнти, які практикували автогенні тренінги, мали достовірно нижчі рівні ситуативної тривожності за шкалою Спілбергера-Ханіна та невротизації за Л. І. Вассерманом порівняно не лише з хворими до лікування, але й з групою осіб після проведеної базової терапії захворювання. Якщо значення інтегрального показника ситуативної тривожності у хворих на хронічні дерматози до початку лікування відповідало рівню високої тривожності та висока тривожність зберігалася у пацієнтів після проведеного базового лікування, то додаткове використання автогенних тренінгів у відповідній терапевтичній групі дозволяло знизити рівень ситуативної тривожності до помірних значень. Аналогічна тенденція спостерігалась і за інтегральним показником депресії за шкалою Бека. Згідно з його рівнем у хворих до лікування спостерігався стан субдепресії. У той же час особи, які додатково до базової терапії практикували автогенні тренінги, не мали депресивних симптомів після курсу лікування. Ці дані говорять про значний позитивний ефект від використання автогенних тренінгів за методом Шульца як щодо зменшення клінічних проявів хронічних дерматозів, так і щодо покращення якості життя, зменшення тривожності, депресії та невротизації пацієнтів.
Використання тіоцетаму, автогенних тренінгів і трібестану, крім того, чинило позитивний ефект і щодо нормалізації мікроциркуляції у шкірі. У хворих на хронічні дерматози після застосування розробленого нами комплексу відзначалася більша у 1,1 рази кількість функціонуючих капілярів порівняно зі значеннями, отриманими у пацієнтів після базової терапії. Крім того, у хворих на псоріаз після використання розробленого нами комплексу відсоток порушень мікроциркуляції був у 1,3 рази меншим порівняно зі значеннями, отриманими у пацієнтів після базової терапії.
Були отримані також біохімічні підтвердження ефективності розробленої методики лікування хворих на хронічні дерматози чоловіків віком 45-64 років. Пацієнти після застосування розробленої нами методики лікування мали в 1,1 рази нижчий рівень ТБК-АП і в 1,1 рази вищий КАОЗ порівняно з групою осіб, які використовували базову терапію. Отримані у ході дослідження результати показали, що нормалізація добових коливань показників системи ПОЛ-АОС краще відбувалась у хворих на хронічні дерматози на фоні застосування розробленого нами комплексу заходів, ніж на фоні використання базової терапії захворювання.
У хворих на хронічні дерматози відбувалася нормалізація стійкості еритроцитарних мембран при додатковому застосуванні як тіоцетаму, так і трібестану. Проте максимально виражений ефект щодо покращення стійкості еритроцитарних мембран забезпечувався тіоцетамом. Застосування розробленого нами комплексу заходів призводило до більшого зниження проявів ендотоксикозу у хворих порівняно з базовою терапією.
Нормалізацію функціонування симпатоадреналової та вагоінсулярної системи у хворих на хронічні дерматози краще забезпечувало додаткове застосування розробленого нами комплексу, ніж використання базової терапії захворювання. Найкращі результати нормалізації рівнів гормонів і медіаторів, а також їх співвідношення відзначались у хворих на хронічні дерматози після додаткового застосування тіоцетаму. Отримана достовірна різниця за рівнями екскреції адреналіну, норадреналіну, ДОФА та дофаміну з сечею, а також достовірна різниця за концентрацією кортизолу у крові між групою хворих на хронічні дерматози після проведеної базової терапії та групами пацієнтів, які застосовували розроблений нами комплекс лікування у цілому та зокрема додаткового отримували тіоцетам.
Хоча результати обстеження хворих на хронічні дерматози чоловіків віком 45-64 років після проведеного лікування з застосуванням розробленого нами комплексу відрізнялися від результатів обстеження здорових чоловіків аналогічного віку, співвідношення гормонів і медіаторів у хворих після курсу терапії свідчили про наявність субкомпенсації, а не декомпенсації функціонування симпатоадреналової та вегетативної системи. Значення більшості коефіцієнтів співвідношення гормонів і медіаторів у хворих на хронічні дерматози чоловіків віком 45-64 років після використання у терапії захворювання запропонованого нами комплексу наближалися до значень, отриманих у здорових чоловіків аналогічного віку. При порівнянні результатів, отриманих у різних терапевтичних групах хворих наприкінці лікування, було встановлено наявність достовірної різниці за значеннями коефіцієнтів НА:ДА, НА:І, К:І між групою пацієнтів, яка використовувала базову терапію хронічних дерматозів, та групами хворих, які додатково використовували запропонований нами комплекс заходів у цілому та зокрема отримували тіоцетам. Менший за тіоцетам вплив на симпатоадреналову та вагоінсулярну системи чинили автогенні тренінги за методом Шульца та трібестан. Проте була отримана достовірна різниця за значеннями коефіцієнтів НА:І та К:І між групою хворих на хронічні дерматози після базового лікування та групами пацієнтів, які у терапії хронічних дерматозів використовували трібестан і автогенні тренінги.
Застосування розробленого нами комплексу заходів щодо лікування хронічних дерматозів чинило більш виражений терапевтичний ефект щодо нормалізації концентрацій ТЗГ, статевих і гонадотропних гормонів порівняно з їх базовою терапією. Концентрація тестостерону була у 1,2 рази вищою після використання розробленого нами комплексу заходів порівняно з базовим лікуванням. Додаткове застосування трібестану у комплексній терапії хронічних дерматозів у чоловіків призводило до достовірного зростання концентрації тестостерону та достовірного зниження концентрацій ФСГ і ЛГ порівняно зі значеннями у пацієнтів після базової терапії захворювань.
У хворих на псоріаз, які використовували розроблений нами комплекс заходів, відбувалося зниження оцінки за шкалою AMS (з (30,9±0,39) до (28,9±0,42) балів), при цьому найбільш ефективним виявилось додаткове застосування у комплексній терапії псоріазу трібестану та тіоцетаму. У пацієнтів, які у лікуванні хронічних алергодерматозів використовували розроблений нами комплекс, відзначалася достовірно менша (р<0,05) бальна оцінка за шкалою AMS [(30,6±0,35) балів] і, відповідно, менші прояви андрогенного дефіциту порівняно як з групою хворих до початку лікування [(32,5±0,33) балів], так і з групою пацієнтів після застосування базової терапії захворювання [(31,7±0,40) балів].
Використання розробленого нами комплексу заходів у хворих на псоріаз чинило більш виражений ефект на стан ліпідного обміну порівняно з його базовою терапією. Була отримана достовірна різниця за концентрацією холестерину, β-ліпопротеїдів і тригліцеридів між групами хворих на псоріаз, які застосовували базову терапію захворювання, та пацієнтами після додаткового використання розробленого комплексу. При цьому достовірно кращі показники концентрацій β-ліпопротеїдів і тригліцеридів відзначались у хворих після лікування з додатковим застосуванням тіоцетаму і трібестану порівняно з їх значеннями у групі пацієнтів до початку лікування та після використання базової терапії псоріазу.
Отримані результати свідчать про позитивний вплив розробленого нами комплексу заходів (застосування препаратів з антиоксидантною, цитопротекторною та ноотропною дією, препаратів на основі стероїдних сапонінів і автогенних тренінгів) як на перебіг псоріазу, так і на перебіг хронічних алергодерматозів, загальний стан шкірного покрову, мікроциркуляцію у шкірі, нормалізацію метаболічних порушень, гормональний статус пацієнтів і зменшення симптомів старіння та андрогенного дефіциту у чоловіків віком 45-64 років.
Це обґрунтовує необхідність застосування розроблених нами заходів у комплексній терапії хворих на хронічні дерматози чоловіків старших вікових груп з інволютивними змінами шкіри та віковими порушеннями гомеостазу.
ВИСНОВКИ
У дисертації представлено теоретичне обґрунтування й нове розв’язання актуальної проблеми дерматовенерології – розробки алгоритмів підвищення ефективності лікування чоловіків, хворих на хронічні дерматози (псоріаз, алергодерматози), шляхом залучення до комплексного лікування індивідуалізованих терапевтичних заходів, спрямованих на уповільнення вікових розладів гомеостазу та інволютивних змін шкіри.
1. Збільшення віку чоловіків супроводжується формуванням патологічних змін шкіри та зростанням відсотку хворих з частими рецидивами хронічних дерматозів. Недостатньо з’ясованими є ряд факторів, які беруть участь у формуванні змін стану шкіри чоловіків, такі як вікові, екологічні, соціальні чинники, стан метаболізму, гормональний статус, функціонування нервової та симпатоадреналової систем. Отже, розширення уявлень про патогенез вікових змін шкіри та метаболічних порушень у чоловіків різних вікових груп, розробка профілактичних і терапевтичних заходів, спрямованих на вік-асоційовані патологічні зміни, у тому числі за умов наявності хронічних дерматозів, є актуальною проблемою сучасної дерматовенерології.
2. Встановлено пряму кореляційну залежність між віковими змінами шкіри у чоловіків та індексами пульс-активності, резистентності судин шкіри, підвищенням рівня ендогенної інтоксикації (r=0,3 – 0,6), бальною оцінкою за шкалою Aging Males Symptoms Scale (r=0,3 – 0,5), концентрацією фолікулостимулюючого, лютеїнізуючого гормонів, тестостеронзв’язуючого глобуліну та зворотну залежність – з кількістю функціонуючих капілярів нігтьового ложа (r=-0,3 – -0,7), коефіцієнтом антиокислювального захисту, концентрацією тестостерону (r=-0,3 – -0,6). Вікові зміни шкіри відбуваються на тлі зростання системного порушення мікробного пейзажу шкіри та інших біотопів організму, субкомпенсованих змін з боку симпатоадреналової та вагоінсулярної систем.
3. Визначено основні фактори ризику погіршення стану шкіри та загального стану здоров’я чоловіків віком 45-64 років: недостатнє вживання кисломолочних продуктів (менше 3 днів на тиждень), овочів і фруктів (менше 5 днів на тиждень), рівень ситуативної тривожності за шкалою Спілбергера-Ханіна більше 42 балів, тютюнопаління, часте вживання алкоголю (один раз на тиждень або частіше). У чоловіків, які проживають у великому промисловому місті, встановлено підвищені рівні ситуативної тривожності та невротизації, зміни гомеостазу організму, що проявляються у зростанні рівня ендогенної інтоксикації (збільшенні концентрації середніх молекул на 13,1 %), превалюванні тонусу та реактивності симпатичної нервової системи над парасимпатичною, підвищенні кількості коагулазопозитивних стафілококів на шкірі [(0,696±0,207) проти (0,167±0,115) Lg КУО/см2 у мешканців міста зі сприятливим довкіллям]. Комплекс факторів має негативний вплив на шкірні покрови та сприяє виникненню дерматологічної патології.
4. Запропоновано методики корекції вікових змін шкірного покрову та гомеостазу у чоловіків різного віку з використанням полівітамінних препаратів, біотину та декспантенолу, пробіотичних засобів, краталу та кверцетину, препарату з ноотропним, антиоксидантним і цитопротекторним ефектом, фітопрепарату на основі стероїдних сапонінів, застосування яких дає змогу зменшити сухість шкіри у 58,3 % осіб, зменшити бальну оцінку стану шкіри за шкалою Yolanda R. Helfrich et al. у 49,4 % осіб, збільшити кількість функціонуючих капілярів нігтьового ложа у 66,7 % чоловіків, знизити відсоток порушень мікроциркуляції у 28,1 % осіб, зменшити прояви андрогенного дефіциту та симптомів старіння чоловіків за шкалою Aging Males Symptoms Scale у 69,1 % чоловіків, покращити функціонування симпатоадреналової та вагоінсулярної системи.
5. Доведено, що перебіг псоріазу у чоловіків віком 45-54 років супроводжується помірним рівнем особистісної та високим рівнем ситуативної тривожності, невротизацією середнього ступеня тяжкості, станом субдепресії; зникненням циркадних ритмів показників загальної антиокислювальної активності у слині протягом доби; зменшенням кількості функціонуючих капілярів на 21,6 %, зростанням порушень мікроциркуляції нігтьового ложа на 25,0 %; наявністю проявів андрогенного дефіциту (збільшенням бальної оцінки за шкалою Aging Males Symptoms Scale на 7,5 %, зменшенням концентрації тестостерону на 33,2 %); зниженням активності та резервних можливостей симпатоадреналової системи, високим ступенем напруження глюкокортикоїдної функції надниркових залоз і підвищенням активності вагоінсулярної системи порівняно зі здоровими чоловіками аналогічного віку.
6. Включення до комплексної терапії псоріазу у чоловіків 45-64-річного віку препарату з цитопротекторними, антиоксидантними та ноотропними властивостями, фітопрепарату на основі стероїдних сапонінів, автогенного тренінгу за методом Шульца дає змогу зменшити індекси PASI на 56,5 %, BSA – на 42,0 %, DLQI – на 67,6 %, зменшити свербіж і порушення мікроциркуляції шкіри, нормалізувати процеси перекисного окислення ліпідів – антиокислювальної системи, знизити прояви ендотоксикозу, нормалізувати функціонування симпатоадреналової та вагоінсулярної системи, зменшити прояви андрогенного дефіциту, знизити рівень ситуативної тривожності.
7. Встановлено, що перебіг хронічних алергодерматозів у чоловіків віком 45-54 років супроводжується зменшенням кількості функціонуючих капілярів на 22,2 %, зростанням порушень мікроциркуляції нігтьового ложа на 29,0 %; підвищенням рівня ендогенної інтоксикації; наявністю проявів андрогенного дефіциту (зростанням бальної оцінки за шкалою АМS на 10,5 %, зниженням концентрації тестостерону на 22,3 %); відсутністю добового ритму коливань загальної антиокислювальної активності; вираженим порушенням вегетативного гомеостазу (пригніченням активності симпатичної нервової системи і підвищенням тонусу та реактивності парасимпатичної нервової системи) порівняно зі здоровими чоловіками аналогічного віку. У хворих на хронічні алергодерматози чоловіків 45-64-річного віку встановлено помірний рівень особистісної та високий рівень ситуативної тривожності, невротизацію середнього ступеня тяжкості, стан субдепресії.
8. Розроблено нову методику лікування хворих на хронічні алергодерматози чоловіків 45-64-річного віку з використанням препарату з цитопротекторними, антиоксидантними та ноотропними властивостями, фітопрепарату на основі стероїдних сапонінів, автогенного тренінгу за методом Шульца, що сприяло зменшенню індексу SCORAD на 65,4 %, індексу DLQI – на 66,4 %, свербежу шкіри – на 36,5 %, зниженню рівнів ситуативної тривожності, невротизації та депресії, зменшенню порушень мікроциркуляції шкіри, зменшенню рівня ендогенної інтоксикації, порушень вегетативного гомеостазу, проявів андрогенного дефіциту.
РЕКОМЕНДАЦІЇ
- У комплексній терапії хворих на псоріаз чоловіків 45-64-річного віку слід застосовувати препарат з цитопротекторними, антиоксидантними та ноотропними властивостями (тіоцетам), фітопрепарат на основі стероїдних сапонінів (трібестан) і автогенний тренінг за методом Шульца для підвищення ефективності лікування та покращення гомеостазу організму.
- Препарат з цитопротекторною, антиоксидантною та ноотропною дією (тіоцетам), фітопрепарат на основі стероїдних сапонінів (трібестан) і автогенний тренінг за методом Шульца необхідно включати до комплексної терапії хронічних алергодерматозів у чоловіків віком 45-64 років для підвищення ефективності лікування, нормалізації гомеостазу організму та покращення психологічного статусу пацієнтів.
- Для поліпшення стану шкірного покрову та попередження розвитку хронічних дерматозів у чоловіків рекомендується використання полівітамінних препаратів, біотину та декспантенолу у віці 35-44 років; пробіотичних засобів, краталу та кверцетину у віці 45-54 років; фітопрепарату на основі стероїдних сапонінів (трібестану), ноотропного препарату з антиоксидантними і цитопротекторним ефектом (тіоцетаму) у віці 55-64 років. Чоловікам віком 45-64 років доцільно забезпечити достатнє вживання кисломолочних продуктів (3 дні на тиждень і більше), овочів і фруктів (5 днів на тиждень і частіше), уникати стресових ситуацій, що призводять до підвищення ситуативної тривожності, виключити тютюнопаління та часте вживання алкоголю.
Список використаних джерел
- Авруцкий Г. Я. Лечение психически больных : руководство для врачей / Г. Я. Авруцкий, А. А. Недува. – М. : Медицина, 1988. – 528 с.
- Айзятулов Р. Ф. Патогенез и тактика лечения экземы / Р. Ф. Айзятулов, З. Ф. Кривенко, В. Д. Гридасова // Журн. дерматовенерології та косметології ім. М.О. Торсуєва. – 2010. – № 3/4. – С. 29–33.
- Айзятулов Ю. Ф. Современные особенности патогенеза и комплексной терапии аллергодерматозов / Ю. Ф. Айзятулов // Журн. дерматовенерології та косметології ім. М.О. Торсуєва. – 2013. – № 1-2 (30). – С. 9–12.
- Айзятулов Ю. Ф. Стандарти диагностики и лечения в дерматовенерологии. / Ю. Ф. Айзятулов. – Донецк : Каштан, 2010. – 560 с.
- Андрашко Ю. В. Клінічний досвід використання препарату “Протопік” у лікуванні хворих на атопічний дерматит / Ю. В. Андрашко, І. Г. Цідило, Т. І. Чечерська // Укр. журн. дерматології, венерології, косметології. – 2010. – № 4 (39). – С. 21–26.
- Андрашко Ю. В. Оптимальные комбинации аппаратных и медикаментозных методов лечения ладонно-подошвенных форм псориаза / Ю. В. Андрашко, Т. И. Чечерская // Укр. журн. дерматології, венерології, косметології. – 2013. – № 4 (51). – С. 166–169.
- Андрашко Ю. В. Сучасний погляд на місце кератолітика в комплексному лікуванні псоріазу / Ю. В. Андрашко, І. Й. Шаркань // Укр. журн. дерматології, венерології, косметології. – 2010. – № 3 (38). – С. 42–46.
- Асцатуров Г. Є. Мікробний пейзаж шкіри при псоріатичному ураженні / Г. Є. Асцатуров, О. О. Сизон, І. Я. Возняк // Журн. дерматовенерології та косметології ім. М.О. Торсуєва. – 2014. – № 1/2. – С. 130.
- Атопічний дерматит у дітей / М. Л. Аряєв, В. А. Клименко, А. І. Кожем’яка, В. О. Фьоклін. – К., 2006. – 88 с.
10. Беловол А. Н. Практическое значение аквапоринового механизма гидратации кожи в дерматокосметологии / А. Н. Беловол, С. Г. Ткаченко // Дерматологія та венерологія. – 2013. – № 2 (60). – С. 5–14.
11. Беловол А. Н. Состояние соединительной ткани у больных псориазом и при сопутствующей гипертонической болезни / А. Н. Беловол // Укр. науково-мед. молодіжний журн. – 2012. – № 2. – С. 49–52.
12. Белоусова Т. А. Особенности микробиоценза кожи у больных аллергодерматозами: проблема выбора наружной терапии / Т. А. Белоусова, М. А. Горячкина, Д. Г. Катранова // Клинич. дерматология и венерология. – 2013. – № 3. – С. 107–112.
13. Беляев Г. М. Современное представление о патогенезе псориатической артропатии и лечении этих больных / Г. М. Беляев // Дерматологія та венерологія. – 2012. – № 2 (56). – С. 7–26.
14. Беляев Г. М. Современные аспекты патогенеза аллергодерматозов, лечение больных этой патологией (по данным литературы и опыту автора) / Г. М. Беляев // Дерматологія та венерологія. – 2012. – № 2. – С. 7–26.
15. Біловол А. М. Активність аденілат- і гуанілатциклазної месенджерної системи у хворих на ізольовану та поєднану з гіпертензією псоріатичну хворобу / А. М. Біловол // Укр. журн. дерматології, венерології, косметології. – 2010. – № 2 (37). – С. 38–41.
16. Біловол А. М. Етіопатогенетичні фактори розвитку псоріазу / А. М. Біловол // Дерматологія та венерологія. – 2012. – № 4. – С. 5–8.
17. Біловол А. М. Роль середньомолекулярних пептидів та білків гострої фази у хворих на псоріаз та псоріаз поєднаний з артеріальною гіпертензією / А. М. Біловол, А. А. Берегова, І. М. Штиров // Дерматологія та венерологія. – 2011. – № 2. – С. 69–71.
18. Білозоров О. П. Нова субпопуляція ефекторних хелперних Т‑лімфоцитів (ТН22) і їх участь у патогенезі захворювань шкіри / О. П. Білозоров // Дерматологія та венерологія. – 2010. – № 2 (48). – С. 27–32.
19. Білозоров О. П. Показники сенсибілізації до антигенів умовно-патогенних грибів MALASSEZIA і CANDIDA у хворих на алергодерматози з мутацями гену філагрину / О. П. Білозоров, М. І. Зуєва, Т. В. Частій // Дерматологія та венерологія. – 2011. – № 4 (54). – С. 7–10.
20. Болотна Л. А. Клінічне значення гіпергомоцистеїнемії у хворих на псоріаз / Л. А. Болотна, О. І. Саріан // Дерматологія та венерологія. – 2014. – № 1. – С. 30–36.
21. Болотна Л. А. Корекція метаболічних порушень у хворих на псоріаз / Л. А. Болотна, О. І. Саріан // Журн. дерматовенерології та косметології ім. М. О. Торсуєва. – 2014. – № 1/2. – С. 131.
22. Болотная Л. А. Использование дерматокосметических средств “Ducrey” в лечении псориаза волосистой части головы / Л. А. Болотная // Дерматологія та венерологія. – 2013. – № 4. – С. 62–68.
23. Болотная Л. А. Коррекция дисбиоза у больных атопическим дерматитом / Л. А. Болотная, Т. С. Осипенко // Дерматологія та венерологія. – 2014. – № 3. – С. 67–68.
24. Болотная Л. А. Новые подходы к наружной терапии хронической экземы / Л. А. Болотная // Укр. журн. дерматології, венерології, косметології. – 2012. – № 2 (45). – С. 68–75.
25. Болотная Л. А. Патогенез псориаза: сосудистый эндотелиальный фактор роста / Л. А. Болотная, Е. И. Сариан // Дерматовенерология. Косметология. Сексопатология. – 2013. – № 1-4. – С. 34–37.
26. Болотная Л. А. Рациональный выбор средств наружной терапии осложненных дерматозов / Л. А. Болотная // Укр. журн. дерматології, венерології, косметології. – 2010. – № 3 (38). – С. 47–52.
27. Болотная Л. А. Современные возможности наружной терапии псориаза / Л. А. Болотная // Укр. журн. дерматології, венерології, косметології. – 2014. – № 1 (52). – С. 115–120.
28. Болотная Л. А. Терапевтическая коррекция эндогенной интоксикации у больных хроническими воспалительными дерматозами / Л. А. Болотная // Укр. журн. дерматології, венерології, косметології. – 2014. – № 3 (54). – С. 89–96.
29. Бурханов А. У. Особенности иммунного статуса и лечение больных псориазом пожилого и старческого возраста / А. У. Бурханов // Укр. журн. дерматології, венерології, косметології. – 2014. – № 1 (52). – С. 71–77.
30. Возіанова С. В. Патофізіологічні механізми змін мікроциркуляторного русла при передчасній інволюції шкіри / С. В. Возіанова, В. В. Верещака // Укр. мед. часопис. – 2004. – № 3 (41). – С. 108 – 111.
31. Волкославская В. Н. Обзор некоторых научных исследований по угревой болезни за последние 11 лет в Украине / В. Н. Волкославская, Т. Д. Носовская, В. Ю. Мангушева // Журн. дерматовенерологии и косметологии им. Н.А. Торсуева. – 2011. – № 3–4 (26). – С. 13–18.
32. Волкославская В. Н. Состояние заболеваемости патологией кожи и инфекциями, передающимися половым путем, населения Украины за последнее десятилетие / В. Н. Волкославская, А. Л. Гутнев // Клинич. иммунология. Аллергология. Инфектология. – 2012. – № 1. – С. 19–22.
33. Волкославська В. М. Про стан захворюваності та особливості перебігу деяких дерматозів у підлітків в Україні / В. М. Волкославська, О. Л. Гутнев // Клінічна імунологія. Алергологія. Інфектологія. – 2013. – № 1. – С. 16–21.
34. Волкославська В. М. Стан захворюваності дерматозами в Україні через 20 років після аварії на ЧАЕС / В. М. Волкославська, О. Л. Гутнєв, Н. О. Чікіна // Дерматологія та венерологія. – 2009. – № 3. – С.67–74.
35. Волкославська В. М. Трохи про шлях, що пройшла дерматовенерологічна служба за останні 20 років незалежності, та деякі міркування про майбутнє / В. М. Волкославська // Дерматологія та венерологія. – 2011. – № 3 (53). – С. 23–25.
36. Вуглеводний обмін у хворих на поширені дерматози / Е. М. Солошенко, Г. К. Кондакова, Н. В. Жукова, О. В. Ермошенко // Дерматологія та венерологія. – 2010. – № 3. – С. 86–87.
37. Габриэлян Н. И. Опыт использования показателя средних молекул в крови для диагностики нефрологических заболеваний у детей / Н. И. Габриэлян, В. И. Липатова // Лаб. дело. – 1984. – № 3. – С. 138–140.
38. Галникіна С. О. Біофізичний метод кількісної оцінки інволюційних змін шкіри обличчя / С. О. Галникіна // Дерматовенерология. Косметология. Сексопатология. – 2011. – № 1-4. – С. 5–7.
39. Галникіна С. О. Досвід оптимізації науково-дослідної і практичної роботи при наданні допомоги хворим на псоріаз / С. О. Галникіна, М. В. Козлова // Дерматовенерология. Косметология. Сексопатология. – 2011. – № 1-4. – С. 152–154.
40. Галникіна С. О. Ефективність поєднаного застосування Діаформіну та Кверцетину в лікуванні хворих на дисемінований псоріаз з метаболічним синдромом / С. О. Галникіна, М. В. Козлова // Ліки України. – 2011. – № 1 (147). – С. 82–86.
41. Гришин Р. А. Результаты анализа клинической эффективности применения препаратов цитопротективного действия в терапии распространенных форм псориаза / Р. А. Гришин, И. Н. Теличко, В. А. Заплутанов // Клинич. медицина. – 2014. – Т. 92, № 6. – С. 75–78.
42. Гублер Е. В. Вычислительные методы анализа и распознавания патологических процессов / Е. В. Гублер. – М. : Медицина, 1978. – 296 с.
43. Дащук А. М. Гипотермия в комплексной терапии пациентов с экземой / А. М. Дащук, В. А. Чипиженко, Н. А. Пустовая // Клиническая иммунология. Аллергология. Инфектология. – 2013. – № 2. – C. 87–88.
44. Дащук А. М. Динамика регресса клинических проявлений у больных псориазом при комплексной терапии нарушений обмена ингибиторов клеточного цикла / А. М. Дащук, Н. А. Пустовая // Дерматологія та венерологія. – 2013. – № 4. – С. 69–72
45. Дащук А. М. Перекисное окисление липидов и активность антиоксидантной защиты у больных псориазом / А. М. Дащук, Н. А. Пустовая // Дерматовенерология. Косметология. Сексопатология. – 2009. – № 1-2 (12). – С. 27–30.
46. Дащук А. М. Стан нейроендокринної системи у хворих на псоріаз / А. М. Дащук, Н. О. Пустова, Є. І. Добржанська // Дерматологія та венерологія. – 2010. – № 3. – С. 75.
47. Денисенко О. І. Оптимізація лікування хворих на псоріаз з використанням хронодетермінованої антиоксидантної терапії / О. І. Денисенко, А. В. Приймак // Клінічна імунологія. Алергологія. Інфектологія. – 2010. – № 8 (37). – С. 66–69.
48. Денисенко О. І. Хронодетермінована антиоксидантна та лазерна терапія алергодерматозів: патогенетичне обгрунтування, клінічна ефективність / О. І. Денисенко // Клінічна імунологія. Алергологія. Інфектологія. – 2011. – № 8 (47). – С. 54–60.
49. Дзяк Г. В. Эффективность терапии с использованием тиотриазолина в лечении пациентов ИБС и стабильной стенокардией напряжения II-III ФК / Г. В. Дзяк, А. В. Курята, В. Н. Коваленко // Запорож. мед. журн. – 2010. – Т. 12, №5. – С. 32–33.
50. Добржанська Є. І. Порушення механізмів нейроендокринної регуляції та системи імунного захисту у хворих на псоріаз / Є. І. Добржанська // Укр. журн. дерматології, венерології, косметології. – 2013. – № 4 (51). – С. 51–55.
51. Добржанська Є. І. Порушення регуляторних адаптаційних механізмів у хворих на псоріаз / Є. І. Добржанська // Дерматологія та венерологія. – 2013. – № 4. – С. 73–78.
52. Дудченко М. О. Особливості змін шкіри в осіб, які зловживають сонячним та штучним опроміненням / М. О. Дудченко, К. В. Васильєва // Дерматовенерология. Косметология. Сексопатология. – 2013. – № 1-4. – С. 241–243.
53. Дюдюн А. Д. Інтегральна роль урогенітальних інфекцій у розвитку артропатичного псоріазу / А. Д. Дюдюн, Н. М. Колева, Л. Х. Алі // Укр. журн. дерматології, венерології, косметології. – 2014. – № 1 (52). – С. 27–34.
54. Ємченко Я. О. Деякі спільні аспекти патогенезу псоріазу та метаболічного синдрому / Я. О. Ємченко, К. Є. Іщейкін // Світ медицини та біології. – 2013. – № 1. – С. 176–180.
55. Идельсон Л. И. Унифицированный метод определения осмотической резистентности эритроцитов / Л. И. Идельсон // Справочник по функциональной диагностике / под ред. И. А. Кассирского. – М. : Медицина, 1970. – С. 401–403.
56. Іщейкін К. Є. До питання уніфікації класифікації та критеріїв діагностики атопічного дерматиту й екземи дитячої / К. Є. Іщейкін, В. І. Степаненко, І. П. Крайдашев // Укр. журн. дерматології, венерології, косметології. – 2009. – № 1. – С. 61–65.
57. Калинченко С. Ю. Возрастные изменения состояния гипоталамо-гипофизарно-тестикулярной системы у мужчин старшей возрастной группы / С. Ю. Калинченко // Междунар. эндокринологич. журн. – 2007. – № 4 (10). – с. 12–15.
58. Калюжна Л. Д. Гепатопротектори в комплексній терапії при хронічних дерматозах / Л. Д. Калюжна // Укр. журн. дерматології, венерології, косметології. – 2011. – № 2 (41). – С. 65–67.
59. Калюжная Л. Д. Альтернативное решение для контроля фазы обострения при атопическом дерматите / Л. Д. Калюжная, Я. Н. Юрчик // Клінічна імунологія. Алергологія. Інфектологія. – 2014. – № 1. – С. 36–39.
60. Калюжная Л. Д. Атопический дерматит / Л. Д. Калюжная // Medix. – Antiaging. – 2011. – № 4 (22). – С. 24–27.
61. Калюжная Л. Д. Европейские рекомендации по лечению атопического дерматита 2011 года: анализ современных технологий топической терапии / Л. Д. Калюжная, Г. А. Слабкий, А. В. Горбенко // Укр. журн. дерматології, венерології, косметології. – 2012. – № 2 (45). – С. 52–60.
62. Ковальова Л. М. Оптимізація терапії хворих на екзему та атопічний дерматит у Південному регіоні України / Л. М. Ковальова, В. І. Хрущ // Дерматовенерология. Косметология. Сексопатология. – 2010. – № 1-2. – С. 253–259.
63. Коган Б. Г. Атопічний дерматит: акцент на безпечності лікування / Б. Г. Коган // Укр. журн. дерматології, венерології, косметології. – 2013. – № 1 (48). – С. 81–89.
64. Коган Б. Г. Новые европейские подходы в терапии резистентных форм аллергодерматозов / Б. Г. Коган, Е. А. Верба // Укр. журн. дерматології, венерології, косметології. – 2013. – № 1 (48). – С. 137–143.
65. Коган М. И. Распространенность андрогенодефицита в мужской популяции Дагестана / М. И. Коган, Р. Т. Савзиханов // Урология. – 2009. – № 2. – С. 56–59.
66. Кондакова Г. К. Комбінований вплив терагерцового та міліметрового випромінювання на антиоксидантний статус та осмотичний гемоліз еритроцитів invitro / Г. К. Кондакова, Г. О. Семко, Н. В. Древаль // Дерматологія та венерологія. – 2010. – № 4 (50). – С. 33–37.
67. Коробейникова Э. Н. Модификация определения продуктов перекисного окисления липидов в реакции с тиобарбитуровой кислотой / Э. Н. Коробейникова // Лаб. дело. – 1989. – № 7. – С. 8–9.
68. Короленко В. В. Клобетазолу пропіонат як препарат вибору для лікування стероїд-резистентних дерматозів / В. В. Короленко // Укр. журн. дерматології, венерології, косметології. – 2014. – № 1 (52). – С. 123–128.
69. Корольова Ж. В. Патогістологічні зміни шкіри у хворих з неуточненою інфекцією підшкірної жирової клітковини – бактеріальним целюлітом та варикозною (інфекційною) екземою / Ж. В. Корольова // Укр. журн. дерматології, венерології, косметології. – 2014. – № 2 (53). – С. 63–66.
70. Корпачева-Зінич О. В. Вікові та антропометричні особливості зміни концентрації тестостерон естрадіол-зв’язувального глобуліну у крові хворих на цукровий діабет типу 2 залежно від статі та інсулінемії / О. В. Корпачева-Зінич // Буковинський мед. вісник. – 2010. – № 4. – С. 47–50.
71. Кутасевич Я. Ф. Оптимізація зовнішньої терапії псоріазу з урахуванням клінічної стадії та ступеня тяжкості : метод. рекомендації / Я. Ф. Кутасевич, І. О. Маштакова. – К., 2010. – 20 с.
72. Кутасевич Я. Ф. Особливості лікування псоріатичної хвороби на сучасному етапі / Я. Ф. Кутасевич, І. О. Олійник // Клінічна імунологія. Алергологія. Інфектологія. Спецвип. – 2011. – № 1. – С. 31–36.
73. Кутасевич Я. Ф. Патология ногтей при хронических дерматозах / Я. Ф. Кутасевич, И. А. Олейник // Клінічна імунологія. Алергологія. Інфектологія. – 2011. – № 8 (47). – С. 8–11.
74. Кутасевич Я. Ф. Показатели метаболитов оксида азота у больных тяжелыми формами псориаза / Я. Ф. Кутасевич, И. А. Олейник, А. А. Гаврилюк // Дерматологія та венерологія. – 2014. – № 3. – С. 80–81.
75. Кутасевич Я. Ф. Рациональный выбор топического стероида / Я. Ф. Кутасевич, И. А. Маштакова // Укр. журн. дерматології, венерології, косметології. – 2012. – № 1 (44). – С. 55–58.
76. Кутасевич Я. Ф. Терапевтическая эффективность и переносимость лефлуномида в лечении кожных проявлений псориаза и псориатического артрита / Я. Ф. Кутасевич, И. А. Олейник // Укр. ревматол. журн. – 2010. – № 4. – С. 37–41.
77. Кутасевич Я. Ф. Терапевтическая эффективность производного хинуклидинов при аллергодерматозах и некоторых других дерматозах, сопровождающихся зудом / Я. Ф. Кутасевич, О. Н. Стулий // Дерматологія та венерологія. – 2014. – № 1. – С. 42– 51.
78. Лаукс Г. Психиатрия и психотерапия / Г. Лаукс, Х.-Ю. Меллер. – М. : Медпресс-информ, 2010. – 512 с.
79. Мавров Г. И. Ангиогенез при псориазе / Г. И. Мавров, Е. И. Сариан // Дерматологія та венерологія. – 2012. – № 2. – С. 36–43.
80. Мавров Г. И. Макролиды как средство этоитропной терапии в дерматовенерологии / Г. И. Мавров, М. Э. Запольский // Укр. журн. дерматології, венерології, косметології. – 2013. – № 4 (51). – С. 109–115.
81. Мавров Г. И. Факторы риска сердечно-сосудистых заболеваний у больных обычным псориазом / Г. И. Мавров, Е. И. Сариан // Дерматологія та венерологія. – 2012. – № 3. – С. 58–64.
82. Мавров И. И. Влияние антропогенных загрязнителей на уровень заболеваемости аллергодерматозами в Восточном и Западном регионах Украины / И. И. Мавров, В. Н. Волкославская, А. Л. Гутнев // Дерматологія та венерологія. – 2003. – № 2. – С. 3–7.
83. Мавров И. И. Особенности патогенеза и терапии больных аллергодерматозами жителей промышленных регионов / И. И. Мавров, В. В. Савенкова // Доктор. – 2005. – № 1. – С. 15–17.
84. Мавров И. И. Этюды к диагностике и лечению в дерматологии и венерологии / И. И. Мавров, В. А. Савоськина, Г. А. Дунаева – К. : ТОВ «Доктор-Медиа», 2009. – 432 с.
85. Методы психодиагностики индивидуально-психологических особенностей женщин в акушерко-гинекологической клинике / сост. В. М. Астахов, О.В. Бацылева, И. В. Пузь ; под общ. ред. В. М. Астахова. – Донецк : Норд-Пресс, 2010. – 199 с.
86. Мікробіологічна діагностика дисбактеріозів : метод. рекомендації / [Знаменський В. А., Дегтяр Н. В., Кузьминський С. Н. та ін.]. – К., 1986. – 28 с.
87. Мурзина Э. А. Обоснование применения энтеросорбентов в комплексной терапии хронических аллергодерматозов / Э. А. Мурзина // Мистецтво лікування. – 2013. – № 2/3. – С. 50–53.
88. Мытник З. Н. Тиотриазолин – гордость отечественной медицины и фармации / З. Н. Мытник, Ю. М. Колесник // Запорож. мед. журн. – 2010. – Т. 12, № 5. – С. 7–9.
89. Наказ МОЗ України від 07.06.2004 р. №286. Про удосконалення дерматовенерологічної допомоги населенню України. (додаток: протоколи надання медичної допомоги) [Електронний ресурс]. – Режим доступу : http://www.moz.gov.ua/ua/portal/dn_20040607_286.html.
90. Наказ МОЗ України від 08.05.2009 р. № 312. Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання [Електронний ресурс]. – Режим доступу : http://moz.gov.ua/ua/portal/dn_20090508_312.html.
91. Олійник І. О. Значення алгоритму обстеження на шляху до ранньої діагностики псоріатичного артриту / І. О. Олійник // Дерматовенерология. Косметология. Сексопатология. – 2008. – № 1-2 (11). – С. 88–92.
92. Олійник І. О. Сучасні методи лікування псоріатичного артриту / І. О. Олійник // Дерматовенерология. Косметология. Сексопатология. – 2008. – № 3-4 (11). – С. 5–11.
93. Онищенко І. В. Дослідження емоційного стану хворих на псоріаз / І. В. Онищенко // Архів психіатрії. – 2014. – Т. 20, № 2. – С. 133–135.
94. Орасмяэ Т. Улучшение микроциркуляции кожи как часть эстетической коррекции внешних проявлений старения / Т. Орасмяэ, Е. Глаголева // Эксперим. и клинич. дерматокосметология. – 2011. – № 3. – С. 43–47.
95. Особливості клінічного перебігу та удосконалення діагностики і лікування псоріазу : метод. рекомендації / [Л. Д. Калюжна, О. І. Літус, О. О. Ошивалова та ін.]. – К., 2013. – 64 с.
96. Показники лікувально-профілактичної допомоги хворим зі шкірними і венеричними захворюваннями в Україні / відповідальний за вип. М. В. Голубчиков. – К., 2010. – 131 с.
97. Покращення якості життя хворих на псоріаз при використанні крему “Карізон” / М. О. Дудченко, А. Ф. Артеменко, І. Б. Попова, К. В. Васильєва // Дерматовенерология. Косметология. Сексопатология. – 2012. – № 1-4. – С. 183–185.
98. Порівняльний аналіз профілю безпечності топічних глюкокортикостероїдів з позицій доказової медицини / В. І. Степаненко, О. Ю. Туркевич, О. О. Сизон, О. В. Горбенко // Укр. журн. дерматології, венерології, косметології. – 2010. – № 3 (38). – С. 53–63.
99. Применение препарата “Белосалик лосьон” в комплексном лечении больных псориазом с поражением волосистой части головы / А. Д. Дюдюн, Н. Н. Полион, В. В. Горбунцов [и др.] // Укр. журн. дерматології, венерології, косметології. – 2014. – № 2 (53). – С. 63–66.
100. Притуло О. А. Терапия NB-UVB (311 нм) как современный патогенетически обоснованный метод коррекции системного воспаления у больных псориазом / О. А. Притуло, В. А. Бабанин // Укр. журн. дерматології, венерології, косметології. – 2012. – № 1 (44). – С. 19–24.
101. Проблеми державного управління дерматовенерологічною службою у процесі реформування вітчизняної системи охорони здоров’я / В. В. Короленко, В. І. Степаненко, О. І. Хара [та ін.] // Укр. журн. дерматології, венерології, косметології. – 2013. – № 1 (48). – С. 9–24.
102. Прокопенко Н. А. Комплексная оценка влияния социальных и экологических факторов на состояние здоровья человека / Н. А. Прокопенко, В. В. Безруков // Проблемы старения и долголетия. – 2008. – № 1. – С. 66–74.
103. Прокопчук І. В. Особливості психоемоційного стану хворих на псоріаз / І. В. Прокопчук // Архів психіатрії. – 2013. – Т. 19, № 3. – С. 119–120.
104. Профілактична токсикологія та медична екологія: вибрані лекції / [Трахтенберг І. М., Коршун М. М., Козлов К. П. та ін.] ; під ред. І. М. Трахтенберг. – К. : Авіцена, 2010. – 247 с.
105. Проценко О. А. Особенности клиники и лечения псориаза на фоне хронической вирусной инфекции / О. А. Проценко, И. Н. Богатырева, А. Г. Заблоцкая // Укр. журн. дерматології, венерології, косметології. – 2013. – № 4 (51). – С. 141–146.
106. Проценко Т. В. Медична косметологія : навчальний посібник / Т. В. Проценко. – Донецьк, 2010. – 116 с.
107. Проценко Т. В. Оптимизация наружной терапии хронических дерматозов топическими кортикостероидами / Т. В. Проценко, О. А. Проценко // Укр. журн. дерматології, венерології, косметології. – 2014. – № 3 (54). – С. 114–118.
108. Проценко Т. В. Опыт проактивной терапии больных атопическим дерматитом / Т. В. Проценко, О. А. Проценко, А. С. Черновол // Укр. журн. дерматології, венерології, косметології. – 2013. – № 1 (48). – С. 118–122.
109. Путилина М. В. Современные представления о ноотропных препаратах / М. В. Путилина // Лечащий врач. – 2006. – № 5. – С. 10–14.
110. Радіонов В. Г. Досвід застосування мометазону фуроату при алергійних захворюваннях шкіри / В. Г. Радіонов, Т. І. Шварьова, Є. Д. Бесполудін // Укр. журн. дерматології, венерології, косметології. – 2012. – № 2 (45). – С. 61–67.
111. Рациональная витаминопрофилактика и витаминотерапия / [М. А. Андрейчин, Ю. Г. Антипкин, Г. Л. Апанасенко и др.] ; под ред. Г. В. Донченко, А. П. Викторова, О. В. Курченко. – К. : Здоров’я, 2008. – 408 с.
112. Ребров В. Г. Витамины, макро- и микроэлементы / В. Г. Ребров, О. А. Громова. – М. : ГэотарМед, 2008. – 968 с.
113. Рогов Е. И. Настольная книга практического психолога в образовании / Е. И. Рогов. – М. : ВЛАДОС, 1995. – 529 с.
114. Рокицкий П. Ф. Биологическая статистика / П. Ф. Рокицкий. – Минск : Вышейш. шк., 1973. – 320 с.
115. Руководство по рациональному использованию лекарственных средств / А. Г. Чучалин, Ю. Б. Белоусов, Р. У. Хабриев, Л. Е. Зиганшина. – М. : Издат. группа “ГЭОТАР-медиа”, 2006. – 729 с.
116. Рыжко П. П. Современные аспекты лечения аллергодерматозов / П. П. Рыжко, Л. В. Рощенюк // Журн. дерматовенерологии и косметологии им. Н.А. Торсуева. – 2009. – № 1-2 (18). – С. 77–79.
117. Сариан Е. И. Применение статинов для коррекции дисфункции эндотелия при псориазе / Е. И. Сариан // Клінічна імунологія. Алергологія. Інфектологія. – 2012. – № 8 (57). – С. 38–41.
118. Свирид С. Г. Амплітудно-частотна характеристика коливань мікроциркуляторного русла шкіри у хворих на розацеа / С. Г. Свирид, С. В. Чайка, І. Б. Руденко // Дерматовенерологія. Косметологія. Сексопатологія. – 2005. – № 3-4 (8). – С. 129–132.
120. Свирид С. Г. Оцінка стану мікроциркуляції у хворих на розацеа / С. Г. Свирид, С. В. Чайка // Укр. журн. дерматології, венерології, косметології. – 2005. – № 2. – С. 18–19.
121. Свирид С. Г. Суперантигени при псоріазі: установлені та можливі / С. Г. Свирид, І. Б. Руденко // Дерматовенерологія. Косметологія. Сексопатологія. – 2005. – № 3-4 (8). – С. 144–148.
122. Свирид С. Г. Терапія хворих на екзему: стан проблеми та можливий напрям її вирішення / С. Г. Свирид, О. В. Рощина, М. В. Гречуха // Укр. журн. дерматології, венерології, косметології. – 2007. – № 3. – С. 43–45.
123. Святенко Т. В. Аллергодерматозы: этиология, патогенез, клиника, современное лечение / Т. В. Святенко, Л. А. Андриуца // Клінічна імунологія. Алергологія. Інфектологія. – 2010. – № 8 (37). – С. 31–36.
124. Сергеева И. Г. Возрастные особенности патологии кожи / И. Г. Сергеева, А. И. Якубович. – Иркутск, 2007. – 167 с.
125. Сердюк А. М. Екологія довкілля та безпека життєдіяльності населення у промислових регіонах України / А. М. Сердюк, В. П. Стусь, В. І. Ляшенко. – Д. : Пороги, 2011. – 486 c.
126. Сизон О. О. Дискусійні питання артропатичного псоріазу як суглобового синдрому псоріатичної хвороби / О. О. Сизон, В. І. Степаненко // Укр. журн. дерматології, венерології, косметології. – 2012. – № 1 (44). – С. 25–35.
127. Сизон О. О. Роль стрес-системи у розвитку артропатичного псоріазу / О. О. Сизон, В. І. Степаненко // Укр. журн. дерматології, венерології, косметології. – 2013. – № 1 (48). – С. 33–43.
128. Синдромальное лечение больных зудящими дерматозами – возможности натуропатической медицины / И. А. Бабюк, И. В. Куценко, О. Е. Шульц [и др.] // Журн. дерматовенерології та косметології ім. М. О. Торсуєва. – 2009. – № 1-2 (18). – С. 79–83.
129. Солошенко Е. М. Алгоритм терапії поширених дерматозів з використанням інформаційних технологій / Е. М. Солошенко, А. І. Поворознюк, О. А. Поворознюк // Журн. дерматовенерологии и косметологии им. Н. А. Торсуева. – 2011. – № 3-4 (26). – С. 19–26.
130. Солошенко Е. М. Порівняльний аналіз інсуліноподібного фактору росту-1 з інтегральними показниками ліпідного обміну, перекисного окислення ліпідів, антиоксидантної системи у хворих на розповсюджений псоріаз / Е. М. Солошенко, Н. В Жукова // Журн. дерматовенерології та косметології ім. М. О. Торсуєва. – 2012. – № 1/2. – С. 19–23.
131. Солошенко Е. М. Сучасні підходи до терапії хворих на розповсюджений псоріаз з урахуванням індикаторних показників метаболічних процесів / Е. М. Солошенко, Н. В. Жукова, О. М. Стулій // Дерматологія та венерологія. – 2012. – № 3. – С. 86–94.
132. Степаненко В. І. Дослідження щільності й товщини шарів шкіри в осіб молодого віку з використанням методу ультразвукового діагностичного сканування / В. І. Степаненко, Л. Я. Федорич, Ю. В. Суховерша // Укр. журн. дерматології, венерології, косметології. – 2009. – № 4. – С. 11–15.
133. Степаненко В. І. Застосування топічного стероїду – препарату “Мометазон” у лікуванні хворих на алергодерматози / В. І. Степаненко, В. В. Короленко, С. В. Іванов // Укр. журн. дерматології, венерології, косметології. – 2010. – № 2. – С. 14–16.
134. Степаненко В. І. Комплексна етапна терапія хворих на акне та акнеподібні дерматози (розацеа, демодекоз) / В. І. Степаненко, А. В. Клименко // Укр. журн. дерматології, венерології, косметології. – 2009. – № 3 – С. 50–61.
135. Степаненко В. І. Новий погляд на проблему старіння шкіри / В. І. Степаненко, Б. Г. Коган // Укр. журн. дерматології, венерології, косметології. – 2006. – № 3. – С. 64–65.
136. Степаненко В. І. Проблеми координації та інтеграції діяльності ланок надання медичної допомоги в умовах реформування сфери охорони здоров’я України та їхнє значення у роботі дерматовенерологічної служби / В. І. Степаненко, В. В. Короленко // Укр. журн. дерматології, венерології, косметології. – 2013. – № 3 (50). – С. 10–15.
137. Степаненко В. І. Структура організації надання дерматологічної та венерологічної допомоги у провідних країнах світу в аспекті перспектив реформування дерматовенерологічної служби в Україні / В. І. Степаненко, В. В. Короленко // Укр. журн. дерматології, венерології, косметології. – 2012. – № 1. – С. 10–18.
138. Терлецкий О. В. Психологическая характеристика и терапия больных псориазом / О. В. Терлецкий // Вестн. психотерапии. – 2011. – № 39 (44). – С. 28–38.
139. Тищенко А. Л. Содержание биотина в сыворотке крови у больных экземой и псориазом / А. Л. Тищенко // Вестн. дерматологии и венерологии. – 1998. – № 5. – С. 37–40.
140. Увлажняющий крем Aqualan L в лечении больных атопическим дерматитом / А. Д. Дюдюн, В. П. Федотов, В. В. Горбунцов [и др.] // Дерматовенерология. Косметология. Сексопатология. – 2010. – № 1-2. – С. 245–248.
141. Федоренко О. Є. Клінічний досвід терапії псоріазу / О. Є. Федоренко // Укр. журн. дерматології, венерології, косметології. – 2012. – № 1 (44). – С. 59–62.
142. Федотов В. П. Использование нано-иммуномодулятора в комплексной терапии псориатической болезни у лиц с избыточным весом / В. П. Федотов, В. А. Кириенко // Дерматологія та венерологія. – 2014. – № 3. – С. 106–108.
143. Федотов В. П. Эффективность препарата Панавир в терапии больных псориатической болезнью / В. П. Федотов, А. Д. Дюдюн, Н. С. Шаленная // Дерматовенерология. Косметология. Сексопатология. – 2010. – № 1-2. – С. 198–201.
144. Форкал мазь – новый препарат для наружного лечения псориаза / Б. Т. Глухенький, А. Б. Глухенькая, Ж. С. Голяс [и др.] // Укр. журн. дерматології, венерології, косметології. – 2009. – № 2. – С. 28–30.
145. Ханин Ю. Л. Краткое руководство к применению шкалы реактивной тревожности Ч.Д. Спилбергера / Ю. Л. Ханин. – Л. : НИИ ФК. – 1976. – 18 с.
146. Харкевич Д. А. Фармакология / Д. А. Харкевич – М. : Издат. группа “ГЭОТАР-Медиа”, 2006. – 736 с.
147. Шевченко-Битенский К. В. Психодерматологические тревожные расстройства (на примере псориаза) / К. В. Шевченко-Битенский // Вісник психіатрії та психофармакотерапії. – 2013. – № 1. – С. 36–53.
148. Шуленина А. В. Роль нейро-вегетативных и метаболических нарушений в патогенезе атопического дерматита / А. В. Шуленина // Дерматологія та венерологія. – 2009. – № 1 (43). – С. 25–31.
149. Эффективность и безопасность применения препарата “Глутоксим” в комплексном лечении больных артропатическим псориазом, ассоциированным с урогенитальными инфекциями / А. Д. Дюдюн, Н. Н. Колева, Н. Н. Полион [и др.] // Дерматовенерология. Косметология. Сексопатология. – 2013. – № 1-4. – С. 179–187.
150. Эффективность и переносимость препарата “Белосалик лосьон” в комплексном лечении больных псориазом с поражением волосистой части головы / А. Д. Дюдюн, Н. Н. Полион, В. В. Горбунцов [и др.] // Дерматовенерология. Косметология. Сексопатология. – 2013. – № 1-4. – С. 244–250.
151. Эффективность применения растительного комбинированного препарата Лив.52 и Серезиса в комплексном лечении больных псориазом / А. Д. Дюдюн, Н. Н. Полион, Н. Н. Колева [и др.] // Дерматовенерология. Косметология. Сексопатология. – 2012. – № 1-4. – С. 291–296.
152. Юдін М. А. Досвід застосування сукупного методу корекції гіпермімічних зморщок та інволюційно зміненої шкіри обличчя / М. А. Юдін // Укр. журн. дерматології, венерології, косметології. – 2012. – № 1 (44). – С. 82–87.
153. A modified Delphi study of screening for fetal alcohol spectrum disorders in Australia / R. E. Watkins, E. J. Elliott, J. Halliday [et al.] // BMC Pediatrics. – 2013. – № 13. – P. 13.
154. A multicenter, randomized, double-blind study of the efficacy and safety of calcipotriene foam, 0.005 %, vs vehicle foam in the treatment of plaque-type psoriasis of the scalp / S. R. Feldman, M. Mills, T. Brundage [et al.] // J. Drugs in Dermatl. – 2013. – № 12 (3). – P. 300–306.
155. A randomized placebo-controlled clinical trial of 5 smoking cessation pharmacotherapies / M. E. Piper, S. S. Smith, T. R. Schlam [et al.] // Arch. General Psychiatry. – 2009. – № 66 (11). – P. 1253–1262.
156. Accumulation of oxidized low-density lipoprotein in psoriatic skin and changes of plasma lipid levels in psoriatic patients / N. Solak Tekin, I. O. Tekin, F. Barut, E. Y. Sipahi // Mediators of Inflammation. – 2007. – № 2007. – P. 1–5.
157. Agner T. Hand eczema and tobacco: lifting the smoke screen / T. Agner // Br. J. Dermatol. – 2014. – Vol. 171, issue 5. – P. 933–934.
158. AJC editor’s consensus: psoriasis and coronary artery disease / V. E. Friedewald, J. C. Cather, J. M. Gelfand [et al.] // Am. J. Cardiol. – 2008. – № 102 (12). – P. 1631–1643.
159. Allergy diagnostic testing: an updated practice parameter. Pt 1. / I. Lsondi, J. T. Li, D. I. Bernstein [et al.] // Ann. Allergy Asthma Immunol. – 2008. – № 100. – P. 15–66.
160. Al-Mutairi N. Onychomycosis in patients of nail psoriasis on biologic therapy: a randomized, prospective open label study comparing Etanercept, Infliximab and Adalimumab / N. Al-Mutairi, T. Nour, D. Al-Rqobah // Expert Opin. on Biol. Therapy. – 2013. – № 13 (5). – P. 625–629.
161. An Inventory for Measuring Depression / А. Т. Beck, C. H. Ward, M. Mendelson [et al.] // Arch. General Psychiatry. – 1961. – Vol. 4. – Р. 561–571.
162. An investigation of antistreptococcal antibody responses in guttate psoriasis / L. Nahary, A. Tamarkin, N. Kayam [et al.] // Arch. Dermatol. Res. – 2008. – № 300 (8). – P. 441–449.
163. Assessment of pruritus intensity: prospective study on validity and reliability of the visual analogue scale, numerical rating scale and verbal rating scale in 471 patients with chronic pruritus / P. Ngoc Quan, C. Blome, F. Fritz [et al.] // Acta Dermato-Venerologica. – 2012. – Vol. 92, № 5. – P. 502–507.
164. Association between psoriasis and the metabolic syndrome / A. D. Cohen, M. Sherf, L. Vidavsky [et al.] // Dermatology. – 2008. – № 216. – P. 152–155.
165. Atamna H. Mineral and Vitamin Deficiencies Can Accelerate the Mitochondrial Decay of Aging / H. Atamna, D. W. Killilea // Molecular Aspects of Medicine. – 2005. – № 26 (4-5). – Р. 363–378.
166. Atopic dermatitis in a high-risk cohort: natural history, associated allergic outcomes, and risk factors / C. Carlsten, H. Dimich-Ward, A. Ferguson [et al.] // Ann. Allergy Asthma Immunol. – 2013. – № 110 (1). – P. 24–28.
167. Baker B. S. A possible role for vaccination in the treatment of psoriasis? / B. S. Baker, A. V. Powles, L. Fry // Giornale Italiano di Dermatologia e Venereologia. – 2008. – № 143 (2). – P. 105–117.
168. Basophil recruitment and activation in inflammatory skin diseases / Y. Ito, T. Satoh, K. Takayama [et al.] // Allergy. – 2011. – № 66 (8). – P. 1107–1113.
169. Biologic response modifier therapy for psoriatic ocula rinflammatory disease / N. Huynh, R. A. Cervantes-Castaneda, P. Bhat [et al.] // Ocular Immunol. and Inflammation – 2008. – № 16 (3). – P. 89–93.
170. Biophysical characterization of dry facial skin / J. L. Leveque, G. Grove, J. de Rigal [et al.] // J. Soc. Cosmetic Chemists. – 1987. – № 82. – P. 171–177.
171. Brunasso A. M. G. Efalizumab for severe palmo-plantar psoriasis: an open-label pilot trial in five patients / A. M. G. Brunasso, C. Salvini, C. Massone // J. Eur. Acad. Dermatol. Venereol. – 2009. – Vol. 23, № 4. – P. 414–419.
172. Bupropion for smoking cessation in patients with acute coronary syndrome / D. Planer, I. Lev, Y. Elitzur [et al.] // Arch. Intern. Med. – 2011. – № 171 (12). – P. 1055–1060.
173. Caldwell J. D. Sex hormone binding globulin and aging / J. D. Caldwell, G. F. Jiricowski // Hormone and Metabolic Res. – 2009 – Vol. 41, № 3. – P. 173–182.
174. Case-control study of smoking and non-melanoma skin cancer / D. E. Rollison, M. R. Iannacone, J. L. Messina [et al.] // Cancer Causes Control. – 2012. – № 23 (2). – P. 245–254.
175. Chandran V. Geoepidemiology and environmental factors of psoriasis and psoriatic arthritis / V. Chandran, S. P. Raychaudhuri // J. Autoimmunity. – 2010. – Vol. 34. – P. 314–321.
176. Characterization of different courses of atopic dermatitis in adolescent and adult patients / D. Garmhausen, T. Hagemann, T. Bieber [et al.] // Allergy. – 2013. – № 68 (4). – P. 498–506.
177. Charman C. Measuring atopic dermatitis severity in randomized controlled clinical trials: what exactly are we measuring? / C. Charman, C. Chambers, H. Williams // J. Investigative Dermatol. – 2003 – № 120. – Р. 932–941.
178. Cherpitel C. J. Drug use and problem drinking associated with primary care and emergency room utilization in the US general population: data from the 2005 national alcohol survey / C. J. Cherpitel, Y. Ye // Drug and Alcohol Dependence. – 2008. – № 97 (3). – P. 226–230.
179. Clinical and demographic characteristics of patients with psoriatic arthritis in northern Israel / D. Zisman, L. Eder, M. Elias, A. Laor // Rheumatology International. – 2010. – Vol. 12, № 1. – P. 70–76.
180. Clinical validation and guidelines for the SCORAD index: consensus report of the European Task Force on Atopic Dermatitis / B. Kunz, A. P. Oranje, L. Labreze [et al.] // Dermatology. – 1997. – № 195. – P. 10–19.
181. Combination varenicline and bupropion SR for tobacco-dependence treatment in cigarette smokers: a randomized trial / J. O. Ebbert, D. K. Hatsukami, I. T. Croghan [et al.] // JAMA. – 2014. – № 311 (2). – P. 155–163.
182. Comparing treatment goals for psoriasis with treatment decisions in daily practice: results from a prospective cohort of patients with psoriasis treated with biologics: BioCAPTURE / J. Zweegers, J. M. P. A. van den Reek, P. C. M. van de Kerkhof [et al.]// Br. J. Dermatol. – 2014. – Vol. 171, issue 5. – P. 1091–1098.
183. Contact allergy to allergens of the TRUE-test (panels 1 and 2) has decreased modestly in the general population / J. P. Thyssen, A. Linneberg, T. Menne [et al.] // Br. J. Dermatol. – 2009. – № 161 (5). – P. 1124–1129.
184. Cork M. J. Skin barrier breakdown: a renaissance in emollient therapy / M. J. Cork, S. Danby // Br. J. Community Nursing. – 2009. – № 18 (14). – P. 872–877.
185. Correlation between nocturnal scratch behavior assessed by actigraphy and subjective/objective parameters in patients with atopic dermatitis / H. Fujita, M. Nagashima, Y. Takeshita, M. Aihara // Eur. J. Dermatol. – 2014. – Vol. 24, issue 1. – P. 120–122.
186. Cytokines and anticytokines in psoriasis / A. T. Pietrzak, A. Zalewska, G. Chodorowska [et al.] // Clinica Chimica Acta. – 2008. – № 394 (1-2). – P. 7–21.
187. Danby S. G. A new perspective on histamine in atopic dermatitis / S. G. Danby // Br. J. Dermatol. – 2014. – Vol. 171, issue 4. – P. 688.
188. Day I. Use of pimecrolimus cream in disorders other than atopic dermatitis / I. Day, A. N. Lin // J. Cutaneous Med. And Surg. – 2008. – № 12 (1). – P. 17–26.
189. Dermatopathology / [W. Kempf, M. Hantschke, H. Kutzner, W. H. C. Burgdorf]. – Germany : Springer, 2008. – 299 p.
190. Diagnosing chronic hand eczema by an algorithm: a tool for classification in clinical practice / S. Molin, T. L. Diepgen, T. Ruzicka [et al.] // Clin. Experim. Dermatol. – 2011. – № 36 (6). – P. 595–601.
191. Diagnostic criteria for atopic dermatitis: a systematic review / E. E. Brenninkmeijer, M. E. Schram, M. M. Leeflang [et al.] // Br. J. Dermatol. – 2008. – № 158 (4). – Р. 754–765.
192. Does age or gender influence quality of life in children with atopic dermatitis? / K. L. E. Hon, T. F. Leung, K. Y. Wong [et al.] // Clin. Exp. Dermatol. – 2008. – № 33 (6). – P. 705–709.
193. Does early life exposure to antibiotics increase the risk of eczema? A systematic review / T. Tsakok, T. M. McKeever, L. Yeo, C. Flohr // Br. J. Dermatol. – 2013. – Vol. 169, issue 5. – P. 983–991.
194. Dogan B. Antistreptococcal treatment of guttate psoriasis: a controlled study / B. Dogan, O. Karabudak, Y. Harmanyeri // Int. J. Dermatol. – 2008. – № 47 (9). – P. 950–952.
195. Efalizumab-induced guttate psoriasis. Successful management and re-treatment / A. Balato, S. LaBella, F. Gaudiello [et al.] // J. Dermatol. Treatment. – 2008. – № 19 (3). – P. 182–184.
196. Effect of Smoking on Aging of Photoprotected Skin: Evidence Gathered Using a New Photonumeric Scale / Yolanda R. Helfrich, Le Yu, Abena Ofori [et al.] // Arch. Dermatol. – 2007. – № 143 (3). – P. 397–402.
197. Effect of smoking on skin elastic fibres: morphometric and immunohistochemical analysis / M. Just, M. Ribera, E. Monso [et al.] // Br. J. Dermatol. – 2007. – № 156 (1). – P. 85–91.
198. Effective narrow-band UVB radiation therapy suppresses the IL-23/IL-17 axis in normalized psoriasis plaques / L. M. Johnson-Huang, M. Suarez-Farinas, M. Sullivan-Whalen [et al.] // J. Invest. Dermatol. – 2010. – Vol. 130. – P. 2654–2663.
199. Effects of a brief intervention for reducing violence and alcohol misuse among adolescents: a randomized controlled trial / M. A. Walton, S. T. Chermack, J. T. Shope [et al.] // J. Am. Med. Association. – 2010. – № 304 (5). – P. 527–535.
200. Effects of nicotine on sleep during consumption, withdrawal and replacement therapy / A. Jaehne, B. Loessl, Z. Bárkai [et al.] // Sleep Med. Rev. – 2009. – № 13 (5). – P. 363–377.
201. Efficacy and safety of adalimumab across subgroups of patients with moderate to severe psoriasis / A. Menter, K. B. Gordon, C. L. Leonardi [et al.] // J. Am. Acad. Dermatol. – 2010. – № 63 (3). – P. 448–456.
202. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 52-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 2) / K. A. Papp, R. G. Langley, M. Lebwohl [et al.] // Lancet. – 2008. – № 371 (9625). – P. 1675–1684.
203. Erectile dysfunction in psoriasis patients / J. Cabete, T. Torres, T. Vilarinho [et al.] // Eur. J. Dermatol. – 2014. – Vol. 24, issue 4. – P. 482–486.
204. Ersser S. J. Providing lifestyle behaviour change support for patients with psoriasis: an assessment of the existing training competencies across medical and nursing health professionals / S. J. Ersser // Br. J. Dermatol. – 2014. – Vol. 171, issue 3. – P. 450–451.
205. Evaluation of the efficacy of acitretin therapy for nail psoriasis / A. Tosti, C. Ricotti, P. Romanell [et al.] // Arch. Dermatol. – 2009. – № 145 (3). – P. 269–271.
206. Expression patterns of Th1/Th2 transcription factors in patients with guttate psoriasis / E. Vanaki, M. Ataei, M. H. Sanati [et al.] // Acta Microbiologica et Immunologica Hungarica. – 2013. – № 60 (2). – P. 163–174.
207. Ezra N. Hydroxychloroquine and smoking in patients with cutaneous lupus erythematosus / N. Ezra, J. Jorizzo // Clin. Exp. Dermatol. – 2012. – № 37 (4). – P. 327–334.
208. Feldman S. R. Adherence must always be considered: is everolimus really ineffective as a treatment for atopic dermatitis? / S. R. Feldman // J. Dermatol. Treatment. – 2009. – № 20 (6). – P. 317–318.
209. Filaggrin mutations may confer susceptibility to chronic hand eczema characterized by combined allergic and irritant contact dermatitis / S. Molin, S. Vollmer, E. H. Weiss [et al.] // Br. J. Dermatol. – 2009. – № 161 (4). – P. 801–807.
210. Fry L. Triggering psoriasis: the role of infections and medications / L. Fry, B. S.Baker // Clin. Dermatol. – 2007. – № 25 (6). – P. 606–615.
211. Gallucci F. Indications and results of videocapillaroscopy in clinical practice / F. Gallucci, R. Russo, R. Buono // Adv. Med. Sci. – 2008. – Vol. 53, № 2. – P. 149–157.
212. Generalized pustular psoriasis (von Zumbusch) following the use of calcipotriol and betamethasone dipropionate ointment: a report of two cases / A. M. Tobin, S. M. Langan, P. Collins, B. Kirby // Clin. Experim. Dermatol. – 2009. – № 34 (5). – P. 629–630.
213. Generalized pustular psoriasis induced by systemic glucocorticosteroids: four cases and recommendations for treatment / M. Brenner, S. Molin, K. Ruebsam [et al.] // Br. J. Dermatol. – 2009. – № 161 (4). – P. 964–966.
214. Genetic variations of NLRP1: susceptibility in psoriasis / A.-K. Ekman, D. Verma, M. Fredrikson [et al.] // Br. J. Dermatol. – 2014. – Vol. 171, issue 6. – P. 1517–1520.
215. Genome-wide association study identifies two new susceptibility loci for atopic dermatitis in the Chinese Han population / L. D. Sun, F. L. Xiao, Y. Li [et al.] // Nature Genetics. – 2011. – № 43 (7). – P. 690–694.
216. Gill J. F. Tobacco smoking and dermatologic surgery / J. F. Gill, S. S. Yu, I. M. Neuhaus // J. Am. Acad. Dermatol. – 2013. – № 68 (1). – P. 167–172.
217. Gisondi P. Metabolic comorbidities and psoriasis / P. Gisondi, A. Ferrazzi, G. Girolomoni // Giornale Italiano di Dermatologia e Venereologia. – 2011. – № 146 (1). – Р. 9–15.
218. Glick Z. R. Allergic contact dermatitis from cigarettes / Z. R. Glick, N. Saedi, A. Ehrlich // Dermatitis. – 2009. – № 20 (1). – P. 6–13.
219. Green C. M. Contact allergy to topical medicaments becomes more common with advancing age: an age-stratified study / C. M. Green, C. R. Holden, D. J. Gawkrodger // Contact Dermatitis. – 2007. – № 56 (4). – P. 229–231.
220. Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis / L. F. Eichenfield, W. L. Tom, S. L. Chamlin [et al.] // J. Am. Acad. Dermatol. – 2014. – № 70 (2). – P. 338–351.
221. Guidelines of care for the management of atopic dermatitis: section 2. Management and treatment of atopic dermatitis with topical therapies / L. F. Eichenfield, W. L. Tom, T. G. Berger [et al.] // J. Am. Acad. Dermatol. – 2014. – № 71 (1). – P. 116–132.
222. Guidelines of care for the management of atopic dermatitis: section 3. Management and treatment with phototherapy and systemic agents / R. Sidbury, D. M. Davis, D. E. Cohen [et al.] // J. Am. Acad. Dermatol. – 2014. – № 71 (2). – P. 327–349.
223. Guidelines of care for the management of psoriasis and psoriatic arthritis: section 4. Guidelines of care for the management and treatment of psoriasis with traditional systemic agents / A. Menter, N. J. Korman, C. A. Elmets [et al.] // J. Am. Acad. Dermatol. – 2009. – № 61 (3). – P. 451–485.
224. Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics / A. Menter, A. Gottlieb, S. R. Feldman [et al.] // J. Am. Acad. Dermatol. – 2008. – № 58 (5). – P. 826–850.
225. Guidelines of care for the management of psoriasis and psoriatic arthritis. Section 3. Guidelines of care for the management and treatment of psoriasis with topical therapies / A. Menter, N. J. Korman, C. A. Elmets [et al.] // J. Am. Acad. Dermatol. – 2009. – № 60 (4). – P. 643–659.
226. Gulliver W. Long-term prognosis in patients with psoriasis / W. Gulliver // Br. J. Dermatol. – 2008. – № 159, suppl. 2. – P. 2–9.
227. Hanifin J. Diagnostic features of atopic dermatitis / J. Hanifin, G. Rajka // Acta Dermato-Venereologica. – 1980. – № 92. – P. 44–47.
228. Heinemann L. A. J. Aging males’ symptoms: AMS scale – a standardized instrument for the practice / L. A. J. Heinemann // J. Endocrinol. Invest. – 2005. – № 28. – Р. 34–38.
229. Hern S. In vivo quantification of microvessels in clinically uninvolved psoriatic skin and in normal skin / S. Hern, P. S. Mortimer // Br. J. Dermatol. – 2007. – Vol. 156, № 6. – P. 1224–1229.
230. Hunter H. J. A. Does psychosocial stress play a role in the exacerbation of psoriasis? / H. J. A. Hunter, C. E. M. Griffiths, C. E. Kleyn // Br. J. Dermatol. – 2013. – Vol. 169, issue 5. – P. 965–974.
231. Ibrahim G. The prevalence of psoriatic arthritis in people with psoriasis / G. Ibrahim, R. Waxman, P. S. Helliwell // Arthritis and Rheumatol. – 2009. – Vol. 61. – P. 1373–1378.
232. Incidence and clinical predictors of psoriatic arthritis in patients with psoriasis: a population-based study / F. C. Wilson, M. Icen, C. S. Crowson [et al.] // Arthritis and Rheumatology. – 2009. – № 61 (2). – P. 233–239.
233. Influence of PTSD symptom clusters on smoking status among help-seeking Iraq and Afghanistan veterans / J. Cook, M. Jakupcak, R. Rosenheck [et al.] // Nicotine and Tobacco Res. – 2009. – № 11 (10). – P. 1189–1195.
234. Keaney T. C. New insights into the mechanism of narrow-band UVB therapy for psoriasis / T. C. Keaney, R. S. Kirsner // J. Invest. Dermatol. – 2010. – № 130 (11). – P. 2534.
235. Kinetics of circulating Th17 cytokines and adipokines in psoriasis patients / H. Nakajima, K. Nakajima, M. Tarutani [et al.] // Arch. Dermatol. Res. – 2011. – Vol. 303. – P. 451–455.
236. Koos E. Capillary forces in suspension rheology / E. Koos, N. Willenbacher // Science. – 2011. – Vol. 331, № 6019. – P. 897–900.
237. Kragballe K. Unmet needs in the treatment of psoriasis / K. Kragballe, P. C. M. van de Kerkhof, K. B. Gordon // Eur. J. Dermatol. – 2014. – Vol. 24, issue 5. – P. 523–532.
238. Kubo A. Epidermal barrier dysfunction and cutaneous sensitization in atopic diseases / A. Kubo, K. Nagao, M. Amagai // J. Clin. Invest. – 2012. – № 122 (2). – P. 440–447.
239. Langley R. G. Evaluating psoriasis with Psoriasis Area and Severity Index; Psoriasis Global Assessment and Lattice System Physician’s Global Assessment / R. G. Langley, C. N. Ellis // J. Am. Acad. Dermatol. – 2004. – № 51 (4). – P. 563–569.
240. Lifetime exposure to cigarette smoking and the development of adult-onset atopic dermatitis / C. H. Lee, H. Y. Chuang, C. H. Hong [et al.] // Br. J. Dermatol. – 2011. – № 164 (3). – P. 483–489.
241. Liu H. A clinical study on treatment of senile psoriasis by replenishing to activate blood – a report of 40 cases / H. Liu, Q. Tan, H. Liu // J. Traditional Chinese Med. Pharmacother. – 2009. – Vol. 24, №3. – P. 204–207.
242. Long-term etanercept in pediatric patients with plaque psoriasis / A. S. Paller, E. C. Siegfried, L. F. Eichenfield [et al.] // J. Am. Acad. Dermatol. – 2010. –№ 63 (5). – P. 762–768.
243. Lower ventral striatal activation during reward anticipation in adolescent smokers / J. Peters, U. Bromberg, S. Schneider [et al.] // Am. J. Psychiatry. – 2011. – № 168 (5). – P. 540–549.
244. Lucassen-Reynders E. H. Dilational rheology of protein films adsorbed at fluid interfaces / E. H. Lucassen-Reynders, J. Benjamins, V. B. Fainerman // J. Colloid and Interface Sci. – 2010. – Vol. 15. – P. 264–270.
245. Mallbris L. HLA-Cw 0602 associates with a twofold higher prevalence of positive strepotococcal throat swab at the onset of psoriasis: a case control study / L. Mallbris, K. Wolk, F. Sánchez // BMC Dermatol. – 2009. – № 9. – P. 5.
246. Management of imatinib-related exacerbation of psoriasis in a patient with a gastrointestinal stromal tumour / H. Cheng, D. E. Geist, M. Piperdi [et al.] // Australasian J. Dermatol. – 2009. – № 50 (1). – P. 41–43.
247. Mast cell interleukin-2 production contributes to suppression of chronic allergic dermatitis / A. Y. Hershko, R. Suzuki, N. Charles [et al.] // Immunity. – 2011. – № 35 (4). – P. 562–571.
248. Mc Gonagle D. The nail as a musculoskeletal appendage implications for an improved understanding of the link between psoriasis and arthritis / D. Mc Gonagle, A. L. Tan, M. Beniamih // Dermatol. – 2009. – № 218. – P. 97–102.
249. McBride P. Tobacco smoking and cutaneous squamous cell carcinoma: a 16-year longitudinal population-based study / P. McBride, C. M. Olsen, A. C. Gree // Cancer Epidemiol., Biomarkers and Prevention. – 2011. – № 20 (8). – P. 1778–1783.
250. Mease P. J. Alefacept with methotrexate for treatment of psoriatic arthritis: open-label extension of a randomized, double-blind, placebo-controlled study / P. J. Mease, K. Reich // J. Am. Acad. Dermatol. – 2009. – № 60 (3). – P. 402–411.
251. Meding B. Hand eczema – a chronic condition with far-reaching consequences / B. Meding // Br. J. Dermatol. – 2014. – Vol. 171, issue 6. – P. 1292–1293.
252. Meta-Analysis Confirms the LCE3C-LCE3B Deletion as a Risk Factor for Psoriasis in Several Ethnic Groups and Finds Interaction with HLA-Cw6 / E. Riveira-Munoz, S. M. He, G. Escaramís [et al.] // J. Invest. Dermatol. – 2011. – № 131 (5). – P. 1105–1109.
253. Meta-analysis of genome-wide association studies identifies three new risk loci for atopic dermatitis / L. Paternoster, M. Standl, C. M. Chen [et al.] // Nature Genetics. – 2011. – № 44 (2). – P. 187–192.
254. Metelitsa A. I. Tobacco and the skin / A. I. Metelitsa, G. J. Lauzon // Clinics in Dermatol. – 2010. – № 28 (4). – P. 384–390.
255. Michail S. The role of Probiotics in allergic diseases / S. Michail // Allergy, Asthma and Clin. Immunol. – 2009. – № 5 (1). – P. 5.
256. Michet C. J. Hip involvement in psoriatic arthritis / C. J. Michet // Ann. Rheumatic Dis. – 2009. – Vol. 60, № 1. – P. 220–221.
257. Mollerup A. Thing Knowledge, attitudes and behaviour in everyday life with chronic hand eczema: a qualitative study / A. Mollerup, J. D. Johansen, Thing L. F. // Br. J. Dermatol. – 2013. – Vol. 169, issue 5. – P. 1056–1065.
258. Morita A. Tobacco smoke causes premature skin aging / A. Morita // J. Dermatol. Sci. – 2007. – № 48 (3). – P. 169–175.
259. Nail involvement as a predictor of concomitant psoriatic arthritis in patients with psoriasis / A. Langenbruch, M. A. Radtke, M. Krensel [et al.] // Br. J. Dermatol. – 2014. – № 171 (5). – P. 1123–1128.
260. New Onset Guttate Psoriasis Following Pandemic H1N1 Influenza Vaccination / M. S. Shin, S. J. Kim, S. H. Kim [et al.] // Ann. Dermatol. – 2013. – № 25 (4). – P. 489–492.
261. Norgrales K. E. New insights into the рathogenesis and genetic of psoriatis anthritis / K. E. Norgrales, R. D. Brasington, A. M. Bowcock // Nature Clin. Pract. Rheumatol. – 2009. – № 5. – P. 83–91.
262. Omalizumab therapy in atopic dermatitis: depletion of IgE does not improve the clinical course – a randomized, placebo-controlled and double blind pilot study / P. M. Heil, D. Maurer, B. Klein [et al.] // J. Der Deuts. Dermatol. Gesellschaft. – 2010. – № 8 (12). – P. 990–998.
263. One-Year, Multicenter, Open-Label, Single-Arm Study Evaluating the Safety and Effectiveness of Etanercept for the Treatment of Moderate-to-Severe Plaque Psoriasis in a Canadian Population / R. Vender, C. Lynde, M. Gilbert [et al.] // J. Cutaneous Med. and Surg. – 2013. – № 17 (2). – P. 129–138.
264. Online video improves clinical outcomes in adults with atopic dermatitis: a randomized controlled trial / A. W. Armstrong, R. H. Kim, N. Z. Idriss [et al.] // J. Am. Acad. Dermatol. – 2011. – № 64 (3). – P. 502–507.
265. Oral vs. bath PUVA using 8-methoxypsoralen for chronic palmoplantar eczema / S. Tzaneva, H. Kittler, C. Thallinger [et al.] // Photodermatol. Photoimmunol. Photomed. – 2009. – № 25 (2). – P. 101–105.
266. Ortiz A. Smoking and the skin / A. Ortiz, S. A. Grando // Int. J. Dermatol. – 2012. – № 51 (3). – P. 250–262.
267. Osawa R. Filaggrin gene defects and the risk of developing allergic disorders / R. Osawa, M. Akiyama, H. Shimizu // Allergology. – 2011. – № 60 (1). – P. 1–9.
268. Perceived impact of psoriasis on leisure-time activities / M. Leino, A. Mustonen, K. Mattila [et al.] // Eur. J. Dermatol. – 2014. – Vol. 24, issue 2. – P. 224–228.
269. Petersen A. H. Hand eczema – prognosis and consequences: a 7-year follow-up study / A. H. Petersen, J. D. Johansen, M. Hald // Br. J. Dermatol. – 2014. – Vol. 171, issue 6. – P. 1428–1433.
270. Pompholyx with bile-coloured vesicles in a patient with jaundice: are sweat ducts involved in the development of pompholyx? / W. J. Lee, D. W. Lee, C. H. Kim [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2010. – № 24 (2). – P. 235–236.
271. Possible pathogenic role of Th17 cells for atopic dermatitis / C. Koga, K. Kabashima, N. Shiraishi [et al.] // J. Invest. Dermatol. – 2008. – № 128 (11). – P. 2625–2630.
272. Psoriasis and risk of nonfatal cardiovascular disease in U.S. women: a cohort study / W. Q. Li, J. L. Han, J. E. Manson [et al.] // Br. J. Dermatol. – 2012. – № 166 (4). – P. 811–818.
273. Psoriasis and streptococci: the natural selection of psoriasis revisited / J. P. McFadden, B. S. Baker, A. V. Powles [et al.] // Br. J. Dermatol. – 2009. – № 160 (5). – P. 929–937.
274. Psoriasis and vascular disease-risk factors and outcomes: a systematic review of the literature / R. V. Patel, M. L. Shelling, S. Prodanovich [et al.] // J. General Intern. Med. – 2011. – № 26 (9). – P. 1036–1049.
275. Psoriasis beyond the skin: a review of the literature on cardiometabolic and psychological co-morbidities of psoriasis / L. Puig, B. Kirby, L. Mallbris, R. Strohal // Eur. J. Dermatol. – 2014. – Vol. 24, issue 3. – P. 305–311.
276. Psoriasis in France and associated risk factors: results of a case-control study based on a large community survey / P. Wolkenstein, J. Revuz, J. C. Roujeau [et al.] // Dermatology. – 2009. – Vol. 218. – P. 103–109.
277. Psoriasis patients show signs of insulin resistance / S. Boehncke, D. Thaci, H. Beschmann [et al.] // Br. J. Dermatol. – 2007. – № 157. – P. 1249–1251.
278. Psoriasis, the liver, and the gastrointestinal tract / P. Gisondi, M. Del Giglio, A. Cozzi, G. Girolomoni // Acta Dermatovenerologica Croatica. – 2010. – № 18 (4). – Р. 297–304.
279. Qin J. In vivo volumetric imaging of microcirculation within human skin under psoriatic conditions using optical microangiography / J. Qin, J. Jiang, L. An // Lasers Surg. Med. – 2011. – Vol. 43, № 2. – P. 122–129.
280. Quantative culture of Malassezia species from different body sites of individuals with or without dermatoses / A. K. Gupta, Y. Kohli, R. C. Summerbell, J. Faergemann // Med. Mycology. – 2009. – Vol. 24, №3. – P. 204–207.
281. Quantifying cardiovascular disease risk factors in patients with psoriasis: a meta-analysis / I. M. Miller, T. Skaaby, C. Ellervik, G. B. E. Jemec // Br. J. Dermatol. – 2013. – Vol. 169, issue 6. – P. 1180–1187.
282. Racz E. Effective treatment of psoriasis with narrow-band UVB phototherapy is linked to suppression of the IFN and Th17 pathways / E. Ra′cz, E. P. Prens, D. Kurek // J. Invest. Dermatol. – 2011. – Vol. 131. – P. 1547–1558.
283. Recommendations for adjunctive basic skin care in patients with psoriasis / T. Luger, S. Seite, P. Humbert [et al.] // Eur. J. Dermatol. – 2014. – Vol. 24, issue 2. – P. 194–200.
284. Risk of moderate to advanced kidney disease in patients with psoriasis: population based cohort study / J. Wan, S. Wang, K. Haynes [et al.] / Br. Med. J. – 2013. – № 347. – P. 5961.
285. Ritchlin C. T. Treatment recommendations for psoriatic arthritis / C. T. Ritchlin // Ann. Rheumatic Dis. – 2009. – № 68. – Р. 1387–1394.
286. Scoring the severity of atopic dermatitis: Three Item Severity Score as a rough system for daily practice and as a pre-screening tool for studies / A. Wolkerstorfer, F. B. de Waard-van der Spek, E. J. Glazenburg [et al.] // Acta Dermato-Venereologica. – Stockholm, 1999. – № 79. – P. 356–359.
287. Secondhand Smoke Exposure and Mental Health Among Children and Adolescents / F. C. Bandiera, A. K. Richardson, D. J. Lee [et al.] // Arch. Pediatrics and Adolescent Med. – 2011. – № 165 (4). – P. 332–338.
288. Secukinumab in plaque psoriasis-results of two phase 3 trials / R. G. Langley, B. E. Elewski, M. Lebwohl [et al.] // New Engl. J. Med. – 2014. – № 371 (4). – P. 326–338.
289. Serum and tissue expression of transforming growth factor beta1 in psoriasis / H. Zaher, O. G. Shaker, M. H. M. El-Komy [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2009. – Vol. 23, № 4. – P. 406–409.
290. Severity of baseline alcohol use as a moderator of brief interventions in the emergency department / F. C. Blow, M. A. Ilgen, M. A. Walton [et al.] // Alcohol. – 2009. – № 44 (5). – P. 486–490.
291. Shenefelt P. D. Update on psychodermatological disorders / P. D. Shenefelt // Expert Rev. Dermatol. – 2010. – № 5 (1). – P. 95–107.
292. Singh Report from the third international consensus meeting to harmonise core outcome measures for atopic eczema/dermatitis clinical trials / J. R. Chalmers, J. Schmitt, C. Apfelbacher [et al.] // Br. J. Dermatol. – 2014. – Vol. 171, issue 6. – P. 1318–1325.
293. Smokeless tobacco use related to military deployment, cigarettes and mental health symptoms in a large, prospective cohort study among US service members / E. D. Hermes, T. S. Wells, B. Smith [et al.] // Addiction. – 2012. – № 107 (5). – P. 983–994.
294. Smoking and risk of incident psoriasis among women and men in the United States: a combined analysis / W. Li, J. Han, H. K. Choi [et al.] // Am. J. Epidemiol. – 2012. – № 175 (5). – P. 402–413.
295. Spergel J. M. From atopic dermatitis to asthma: the atopic march / J. M. Spergel // Ann. Allergy Asthma and Immunol. – 2010. – № 105 (2). – P. 99–106.
296. Sterry W. Obesity in psoriasis: the metabolic, clinical and therapeutic implications. Report of an interdisciplinary conference and review / W. Sterry, B. E. Strober, A. Menter // Br. J. Dermatol. – 2007. – № 157 (4). – P. 649–655.
297. Streptococcal perianal dermatitis and guttate psoriasis / M. Ledoux, V. Chazerain, P. Saiag [et al.]. // Ann. de Dermatol. et de Venereol. – 2009. – № 136 (1). – P. 37–41.
298. Stuckert J. Low-cobalt diet for dyshidrotic eczema patients / J. Stuckert, S. Nedorost // Contact Dermatitis. – 2008. – № 59 (6). – P. 361–365.
299. Substance use and mental health trends among U.S. military active duty personnel: key findings from the 2008 DoD Health Behavior Survey / R. M. Bray, M. R. Pemberton, M. E. Lane [et al.] // Military Med. – 2010. – № 175 (6). – P. 390–399.
300. Survival rate of etanercept for psoriasis in real life: a multicentre observational study / E. Herrera-Acosta, J. A. Suárez-Pérez, J. Aguilera [et al.] // Eur. J. Dermatol. – 2014. – Vol. 24, issue 5. – P. 619–620.
301. Synergism between narrowband ultraviolet B phototherapy and etanercept for the treatment of plaque-type psoriasis / P. G. Calzavara-Pinton, R. Sala, M. Arisi [et al.] // Br. J. Dermatology. – 2013. – № 169 (1). – P. 130–136.
302. Takvorian S. U. Cigarette smoking, alcohol consumption and risk of systemic lupus erythematosus / S. U. Takvorian, J. F. Merola, K. H. Costenbader // Lupus. – 2014. – № 23 (6). – P. 537–544.
303. Testosterone, sex hormone binding globulin, and frailty in older men / B. A. Moohr, S. Bhasin,V. Kupelian [et al.] // J. Am. Geriatric Soc. – 2007. – Vol. 55, № 4. – P. 548–555.
304. Th17 cytokines stimulate CCL20 expression in keratinocytes in vitro and in vivo:implications for psoriasis pathogenesis / E. G. Harper, C. Guo, H. Rizzo [et al.] // J. Invest. Dermatol. – 2009. – Vol. 129. – P. 2175–2183.
305. The association between contact sensitization and atopic disease by linkage of a clinical database and a nationwide patient registry / J. P. Thyssen, J. D. Johansen, A. Linneberg [et al.] // Allergy. – 2012. – № 67 (9). – P. 1157–1164.
306. The risk of depression, anxiety, and suicidality in patients with psoriasis: a population-based cohort study / S. K. Kurd, A. B. Troxel, P. Crits-Christoph [et al.] // Arch. Dermatol. – 2010. – № 146 (8). – P. 891–895.
307. The risk of mortality in patients with psoriasis: results from a population-based study / J. M. Gelfand, A. B. Troxel, J. D. Lewis [et al.] // Arch. Dermatol. – 2007. – № 143 (12). – P. 1493–1499.
308. To treat or not to treat? Management of guttate psoriasis and pityriasis rosea in patients with evidence of group A Streptococcal infection / K. Krishnamurthy, A. Walker, C. A. Gropper [et al.] // J. Drugs in Dermatol. – 2010. – № 9 (3). – P 241–250.
309. To treat or not to treat? Management of guttate psoriasis and pityriasis rosea in patients with evidence of group A Streptococcal infection / K. Krishnamurthy, A. Walker, C. A. Gropper [et al.] // J. Drugs in Dermatol. – 2010. – № 9 (3). – P 241–250.
310. Tonsillectomy as a treatment for psoriasis: a review / W. Wu, M. Debbaneh, H. Moslehi [et al.] // J. Dermatol. Treatment. – 2014. – № 25 (6). – P. 482–486.
311. Topical corticosteroids in atopic dermatitis and the risk of glaucoma and cataracts / I. M. Haeck, T. J. Rouwen, L. Timmer-de Mik [et al.] // J. Am. Acad. Dermatol. – 2011. – № 64 (2). – P. 275–281.
312. Treatment of nail psoriasis with a two-compound formulation of calcipotriol plus betamethasone dipropionate ointment / D. Rigopoulos, S. Gregoriou, C. R. Daniellii [et al.] // Dermatology. – 2009. – № 218 (4). – P. 338–341.
313. Treatment of Staphylococcus aureus colonization in atopic dermatitis decreases disease severity / J. T. Huang, M. Abrams, B. Tlougan [et al.] // Pediatrics.– 2009. – № 123 (5). – P. 808–814.
314. Treatment response, drug survival and predictors thereof in 764 patients with psoriatic arthritis treated with anti-tumor necrosis factor α therapy: Results from the Danish nationwide DANBIO registry / B. Glintborg, M. Ostergaard, L. Dreyer, N. S. Krogh // Arthritis and Rheumatol. – 2010. – Vol. 27, № 10. – P. 85–88.
315. Ustekinumab significantly improves symptoms of anxiety, depression, and skin-related quality of life in patients with moderate-to-severe psoriasis: Results from a randomized, double-blind, placebo-controlled phase III trial / R. G. Langley, S. R. Feldman, C. Han [et al.] // J. Am. Acad. Dermatol. – 2010. – № 63 (3). – P. 457–465.
316. van de Kerkhof. Increased prevalence of psoriasis in patients with coronary artery disease / P. C. M. van de Kerkhof // Br. J. Dermatol. – 2014. – Vol. 171, isue 3. – P. 450.
317. Van Velsen S. G. Severe atopic dermatitis treated with everolimus / S. G. Van Velsen, I. M. Haeck, C. A. Bruijnzeel-Koomen // J. Dermatol. Treatment. – 2009. – № 20 (6). – P. 365–367.
318. Veraldi S. Guttate psoriasis triggered by chickenpox / S. Veraldi, L. Lunardon, F. Dassoni // Giornale Italiano di Dermatologia e Venereologia. – 2009. –№ 144 (4). – P. 501–502.
319. Videocapillaroscopy in the differential diagnosis between psoriasis and seborrheic dermatitis of the scalp / P. Rosina, M. R. Zamperetti, A. Giovannini [et al.] // Dermatology. – 2007. – № 214. – P. 21–24.
320. Wollina U. Pompholyx: what’s new? / U. Wollina // Exp. Opin. Invest. Drugs. – 2008. – № 17 (6). – P. 897–904.














