РОЗДІЛ 6
МІКРОБІОЦЕНОЗ ТОВСТОГО КИШЕЧНИКА У ХВОРИХ
НА СЕБОРЕЙНИЙ ДЕРМАТИТ
Згідно сучасних уявлень, нормальна мікрофлора товстого кишечника людини представляє собою «екстракорпоративний орган», що складається із величезної кількості мікроорганізмів, об’єднаних в єдину екологічну систему «організм людини – нормальна мікрофлора». Вважають, що дисбаланс мікрофлори товстого кишечника є одним з можливих механізмів розвитку різних захворювань (атеросклероз, цукровий діабет, ожиріння).
Багатьма клінічними дослідженнями доведено істотний вплив порушень мікробіоценозу кишечника на перебіг деяких шкірних хвороб (атопічний дерматит, акне, мікробна екзема, вітиліго), при цьому вираженість дисбіотичних відхилень корелює з поширеністю і тяжкістю шкірного процесу. В науковій літературі є декілька робіт, у яких зміни складу мікрофлори товстого кишечника вважаються одним з факторів розвитку СД. На наш погляд, необхідно продовжити дослідження ролі дисбактеріозу для розробки методів корекції цього стану при СД, спрямованих на відновлення порушеного мікробіоценозу кишечника, що, в свою чергу, буде сприяти нормалізації функції ШКТ, імунної системи, усуненню вітамінного дефіциту.
Дослідження якісного та кількісного складу основних мікроорганізмів товстого кишечника пацієнтів з СД виявило існування змін з боку як облігатної, так і факультативної мікрофлори (табл. 6.1). Визначено достовірне зменшення середньої кількості облігатних бактерій (анаеробних – біфідобактерій і лактобактерій, аеробних E. coli типових) (р < 0,05), достовірне збільшення середньої кількості факультативних – сапрофітних (епідермальний стафілокок) та умовно патогенних бактерій (ентеробактер, цитробактер, дріжджоподібні гриби Candida) (р < 0,05), поява у деяких хворих E. coli гемолітичних (р < 0,05), E. coli лактозонегативних (р > 0,05), Proteus vulgaris (р > 0,05).
Таблиця 6.1 – Основні представники товстокишечної мікрофлори хворих на себорейний дерматит (M±m)
| Показник,
log КУО/г |
Хворі на себорейний
дерматит, n = 68 |
Контрольна група,
n = 22 |
| Bifidobacterium spp. | 6,93±1,51* | 9,15±1,87 |
| Lactobacillus spр. | 5,44±1,17* | 7,62±1,51 |
| E. coli типова | 4,79±1,10* | 7,43±1,48 |
| E. coli лактозонегативна | 3,87±0,75 | 2,78±0,56 |
| E. coli гемолітична | 1,08±0,11* | 0 |
| Enterobacter spp. | 5,63±0,86* | 1,81±0,42 |
| Citrobacter spp. | 5,02±0,71* | 1,92±0,45 |
| S. epidermidis | 4,50±0,68* | 1,94±0,49 |
| S. aureus | 0 | 0 |
| Candida spp. | 5,53±0,77* | 2,05±0,36 |
| Proteus vulgaris | 0,32±0,07* | 0 |
Примітка. * – відмінності достовірні щодо контрольної групи при р < 0,05.
Відмінностей кількісного та якісного складу мікрофлори кишківника між хворими на СД чоловіками та жінками, пацієнтами різного віку не виявлено (р > 0,05).
Більш детальний аналіз рівня основних показників мікрофлори кишечника хворих на СД дозволив установити, що у 16 (23,5%) випадках показники залишалися в межах нормальних значень (еубіоз), у 52 (76,5%) – відповідали I (26,5 %), II (36,8 %) чи III (13,2 %) ступеню дисбактеріозу (рис. 6.1).
Кількісні зміни показників мікробіоти кишечника в залежності від середньостатистичного рівня біфідобактерій і лактобацил, кишкової палички, умовно-патогенних мікроорганізмів (ентеробактер, цитробактер, гриби Candida, протей) у хворих на СД наведено в табл. 6.2.
Таблиця 6.2 – Основні представники товстокишечної мікрофлори у хворих на себорейний дерматит залежно від ступеня мікробіологічних порушень (M±m)
| Показник,
log КУО/г |
Хворі на себорейний дерматит, n=68 | Конт-
рольна група, n=22 |
|||
| еубіоз,
n=16 |
мікробіологічні порушення, ступінь | ||||
| I,
n=18 |
II,
n=25 |
III,
n=9 |
|||
| Bifidobacterium spp. | 9,44±1,81 | 7,44±1,60
* |
5,32±0,84
** |
5,89±0,88
** |
9,15±1,87 |
| Lactobacillus spр. | 7,50±1,63 | 6,35±1,51 | 4,14±0,75
* |
3,78±0,72
** |
7,62±1,51 |
| E. coli
типова |
7,44±1,56 | 5,55±0,97
* |
4,16±0,71
* |
3,92±0,80
** |
7,43±1,48 |
| E. coli лакто-зонегативна | 2,70±0,51 | 3,22±0,71 | 3,70±0,62 | 5,39±1,07
** |
2,78±0,56 |
| E. coli гемолітична | 0 | 0 | 5,43±0,86
** |
3,75±0,73
* |
0 |
| Enterobacter spp. | 1,46±0,36 | 3,15±0,63 | 5,80±0,91
* |
7,22±1,71
** |
1,81±0,42 |
| Citrobacter
spp. |
1,32±0,27 | 2,91±0,50 | 4,92±0,83
* |
6,78±1,63
** |
1,92±0,45 |
| S. epidermidis | 1,87±0,40 | 2,38±0,41 | 4,44±0,75
* |
5,82±1,17
** |
1,94±0,49 |
| Candida spp. | 1,94±0,43 | 2,62±0,55 | 4,56±0,77
* |
6,33±1,56
** |
2,05±0,36 |
| Proteus vulgaris | 0 | 0 | 0 | 2,44±0,45* | 0 |
Примітки: * – відмінності достовірні щодо контрольної групи при р < 0,05; ** – відмінності достовірні щодо контрольної групи при р < 0,01.
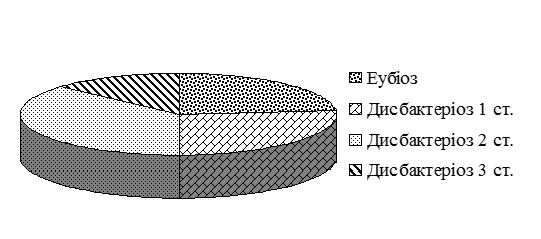
Рисунок 6.1 – Розподіл хворих на себорейний дерматит за ступенем мікробіологічних порушень флори кишечника
У 18 (26,5%) пацієнтів виявлено зменшення біфідобактерій у середньому до log (7,44±1,60) КУО/г при нормі (9,15±1,87) КУО/г, у 25 (36,8%) випадках – до найнижчих значень при II ступені дисбактеріозу (log [5,32±0,84] КУО/г), однак достовірної різниці між показником у хворих з II і III ступенем порушень (log [5,89±0,88] КУО/г) не визначено (р > 0,05). Одночасно відбувалося пониження рівня лактобацил – з log (6,35±1,51) КУО/г при I ступені до log (3,78±0,72) КУО/г при III ступені (в контрольній групі – log [7,62±1,51] КУО/г, р < 0,01). Виявлено значне пониження вмісту E. coli типових з незміненою ферментативною активністю до log (3,92±0,80) КУО/г і достовірне збільшення кількості лактозонегативних E. сoli до log (5,39±1,07) КУО/г у пацієнтів з III ступенем дисбіотичних порушень значенні в контрольній групі – відповідно log (7,43±1,48) КУО/г (р < 0,01) і log (2,78±0,56) КУО/г (р < 0,05). Поряд із зменшенням облігатної мікрофлори у хворих на СД відбувалося збільшення частки факультативних мікроорганізмів кишечника за рахунок сапрофітної (стафілокок епідермальний) та умовно-патогенної флори (дріжджоподібні гриби Candida, ентеробактер, цитробактер, протей вульгарний). У 34 (50,0%) хворих з II і III ступенем мікробіологічних порушень виявлено збільшення Enterobacter spp. в кількості 105-7 (log [5,80±0,91] КУО/г і log [7,22±1,71] КОУ/г) і Cytrobacter spp. в кількості 104-6 (log [4,92±0,83] КУО/г і log [6,78±1,63] КУО/г) при значно нижчому середньостатистичному рівні у практично здорових осіб (відповідно log [1,81±0,42] КУО/г і log [1,92±0,45] КУО/г, р < 0,01). Достовірно збільшувався ступінь контамінації S. epidermidis (log [4,44±0,75] КОЕ/г і log [5,82±1,17] КОУ/г, у контрольній групі – [log 1,94±0,49] КУО/г) і грибами роду Candida в кількості log (4,56±0,77) КУО/г і log (6,33±1,56) КУО/г (в нормі – log [2,05±0,36] КОУ/г, р < 0,01). Протей визначений тільки у хворих на СД з III ступенем дисбіотичних порушень (log [2,44±0,45] КУО/г, в нормі відсутній).
Середньостатистичні значення показників, розраховані у 68 хворих і наведені в табл. 6.1 і 6.2, некоректно відображають зміни кількісного мікробного складу товстого кишечника, тому що у ряді випадків ріст мікроорганізмів відсутній (наприклад, E. coli гемолітична висіяна тільки у 13 хворих, Proteus vulgaris – у 4 пацієнтів). Правильно розлади мікробіоти демонструють дані про частоту відхилень від норми (зменшення чи збільшення кількості мікроорганізмів) в залежності від ступеня мікробіологічних розладів (табл. 6.3).
Наведені дані вказують на зменшення кількості біфідобактерій і лактобацил майже у 100 % пацієнтів з СД і I-III ступенем мікробіологічних порушень. Пониження рівня E. coli типових визначено у 94,2 % хворих (83,3% з I ступенем, 100,0 % – II і III ступенем дисбіозу), разом з тим збільшення E. coli лактозонегативних – тільки у 9,6 % хворих (55,5 % пацієнтів з III ступенем порушень), E. coli гемолітичних – у 25,0 % хворих (28,0 % з II і 66,7 % з III ступенем мікробіологічних розладів). Підвищення кількості ентеробактер і цитробактер у складі флори кишечника відбувалося майже однаково – у 55,8 і 51,9 % хворих (80,0 і 72,0 % випадків II ступеня та 100,0 % – III ступеня порушень). Збільшення стафілокока епідермального і грибів Candida spp. установлено відповідно у 34,6 і 36,5 % пацієнтів (48,0 і 44,0 % з II ступенем, 66,7 і 77,8 % – III ступенем розладів). Протей визначений у 7,7 % випадків (44,4 % хворих, що мали III ступінь дисбіозу).
Таблиця 6.3 – Частота виявлення основних представників товстокишечної мікрофлори у хворих на себорейний дерматит з різним ступенем мікробіологічних порушень
| Мікроорганізми
кишечника, кількість |
Хворі на себорейний дерматит, n=52 | ||||
| усього | мікробіологічні порушення, ступінь | ||||
| абс. | % | I,
n=18 |
II,
n=25 |
III,
n=9 |
|
| Bifidobacterium spp.:
норма зменшення |
2
50 |
3,8
96,2 |
2
16 |
0
25 |
0
9 |
| Lactobacillus spр.:
норма зменшення |
0
52 |
0
100,0 |
0
18 |
0
25 |
0
9 |
| E. coli типова:
норма зменшення |
3
49 |
5,8
94,2 |
3
15 |
0
25 |
0
9 |
| E. coli лактозонегативна
норма збільшення |
47
5 |
90,4
9,6 |
18
0 |
25
0 |
4
5 |
| E. coli гемолітична:
норма збільшення |
39
13 |
75,0
25,0 |
18
0 |
18
7 |
3
6 |
| Enterobacter spp.:
норма збільшення |
23
29 |
44,2
55,8 |
18
0 |
5
20 |
0
9 |
| Citrobacter spp.:
норма збільшення |
25
27 |
48,1
51,9 |
18
0 |
7
18 |
0
9 |
| S. epidermidis:
норма збільшення |
34
18 |
65,4
34,6 |
18
0 |
13
12 |
3
6 |
| Candida spp:
норма збільшення |
30
19 |
63,5
36,5 |
17
1 |
14
11 |
2
7 |
| Proteus vulgaris:
норма збільшення |
48
4 |
92,3
7,7 |
18
0 |
25
0 |
5
4 |
Результати дослідження складу товстокишечної флори за наявністю відхилень від норми у хворих на різний ступінь тяжкості дерматозу представлені в табл. 6.4.
Таблиця 6.4 – Частота виявлення основних представників товстокишечної мікро-флори у хворих на себорейний дерматит різного ступеня тяжкості
| Мікроорганізми
кишечника, кількість |
Хворі на себорейний дерматит, ступінь тяжкості | ||||||
| легкий, n=21 | помірний, n=28 | тяжкий, n=19 | |||||
| абс. | % | абс. | % | абс. | % | ||
| Bifidobacterium spp.:
норма зменшення |
16
5 |
76,2
23,8 |
2
26 |
7,1
92,9 |
0
19 |
0
100,0 |
|
| Lactobacillus spр.:
норма зменшення |
13
8 |
61,9
38,1 |
1
27 |
3,6
96,4 |
0
19 |
0
100,0 |
|
| E. coli типова:
норма зменшення |
17
4 |
80,9
19,1 |
2
26 |
7,1
92,9 |
0
19 |
0
100,0 |
|
| E. coli лактозонегативна:
норма збільшення |
21
0 |
100,0
0 |
23
5 |
82,1
17,9 |
19
0 |
100,0
0 |
|
| E. coli гемолітична:
норма збільшення |
21
0 |
100,0
0 |
24
4 |
85,7
14,3 |
10
9 |
52,6
47,7 |
|
| Enterobacter spp.:
норма збільшення |
20
1 |
95,2
4,8 |
16
12 |
57,1
42,9 |
3
16 |
15,8
84,2 |
|
| Citrobacter spp.:
норма збільшення |
18
3 |
85,7
14,3 |
22
6 |
78,6
21,4 |
1
18 |
5,3
94,7 |
|
| S. epidermidis:
норма збільшення |
21
0 |
100,0 | 21
7 |
75,0
25,0 |
7
12 |
36,8
63,2 |
|
| Candida spp.:
норма збільшення |
20
1 |
95,2
4,8 |
20
8 |
60,0
40,0 |
5
14 |
26,3
73,7 |
|
| Proteus vulgaris:
норма збільшення |
0 | 0 | 0 | 0 | 15
4 |
78,9
21,1 |
|
Аналіз складу товстокишечної флори за наявністю відхилень від норми у хворих на СД з урахуванням ступеня тяжкості дерматозу виявив зменшення кількості біфідобактерій і лактобактерій приблизно у 1/3 хворих з легким ступенем тяжкості дерматозу (відповідно 23,8 і 38,1%), майже в усіх хворих з помірним і тяжким перебігом хвороби (біфідобактерій – відповідно 92,9 і 100,0 %, лактобактерій – 96,4 і 100,0 %). Зміни відбувалися і відносно рівня кишкової палички (пониження E. coli типових у 19,1 % хворих з легким ступенем тяжкості і майже у 100 % випадків помірного і тяжкого дерматозу, підвищення E. coli лактозонегативних – у 17,9 % випадків помірного ступеня тяжкості, збільшення кількості ешерихій гемолітичних – у 14,3 % випадків помірного і 47,7 % – тяжкого СД). Частота визначення підвищеного рівня ентеробактера була майже вдвічі більшою при тяжкому перебігу (84,2 %) порівняно з таким при помірному ступені тяжкості (42,9 %), цитробактера – максимальною при тяжкому дерматозі (94,7 %) і тільки у 21,4 % хворих з помірним ступенем тяжкості хвороби. При тяжкому СД кількість сапрофітного (епідермального) стафілокока і дріжджоподібних грибів Сandida виявилася збільшеною у 63,2 і 73,7 % хворих, протею – у 21,1% пацієнтів.
Виявлена залежність ступеня мікробіологічних порушень (дисбактеріозу) кишечника від ступеня тяжкості перебігу СД (табл. 6.5).
Таблиця 6.5 – Мікробіологічні порушення у хворих залежно від ступеня тяжкості себорейного дерматиту
| Хворі з різним ступенем тяжкості СД, n=68 | Ступінь мікробіологічних порушень, абс. / % |
| легкий, n=21 | еубіоз (16 / 76,2) + I ст. (5 / 23,8) |
| помірний, n=28 | I (13 / 46,4) + II (15 / 53,7) |
| тяжкий, n=19 | II (7/ 36,8) + III (12/ 63,2) |
Так, при легкому ступені тяжкості СД виявлено еубіоз у більшості (76,2 %) хворих і дисбактеріоз I ступеня – у 23,8 % пацієнтів, при помірному СД – майже порівну встановлено дисбіоз I (46,4 %) і II (53,7 %) ступеня, при тяжкому – частіше III (63,2%), ніж II (36,8 %) ступеня (рис. 6.2), тобто при збільшенні ступеня тяжкості дисбіозу кишечника відзначається більш поширене і тяжке ураження шкіри (р ˂ 0,05).
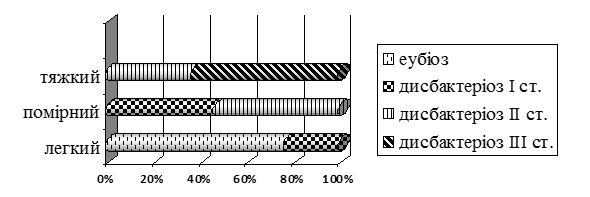
Рисунок 6.2 – Розподіл ступеня мікробіологічних порушень залежно від ступеня тяжкості себорейного дерматиту
Динаміка змін складу мікрофлори товстого кишечника у хворих з незапальним і запальним СД наведена в табл. 6.6. При запальному СД значно зменшувалася кількість не тільки біфідобактерій і лактобацил (89,6 і 93,7 %), а й E. coli типових (91,7 %) і достовірно відрізнялася від аналогічних показників у хворих з незапальним типом дерматозу (35,0, 45,0 і 25,0 %, р < 0,05). Кількість E. coli лактозонегативних та E. coli гемолітичних незначно збільшувались у хворих на запальний СД (10,4 і 22,9 %) порівняно з показниками у пацієнтів з іншим типом дерматозу (0 і 10,0 %, р < 0,05). Зміни вмісту ентеробактера і цитробактера, епідермального стафілокока не залежали від клінічного типу дерматозу, в той час як чисельність дріжджоподібних грибів Candida збільшувалось у хворих на запальний СД (37,5 % порівняно з 5,0 % при незапальному типі, р < 0,05).
Таблиця 6.6 – Частота виявлення основних представників товстокишечної мікрофлори у хворих на різні типи себорейного дерматиту
| Мікроорганізми кишечника,
кількість |
Хворі на себорейний дерматит, типи | |||
| незапальний, n=20 | запальний, n=48 | |||
| абс. | % | абс. | % | |
| Bifidobacterium spp.:
норма зменшення |
13
7 |
65,0
35,0 |
5
43 |
10,4
89,6 |
| Lactobacillus spр.:
норма зменшення |
11
9 |
55,0
45,0 |
3
45 |
6,3
93,7 |
| E. coli типова:
норма зменшення |
15
5 |
75,0
25,0 |
4
44 |
8,3
91,7 |
| E. coli лактозонегативна:
норма збільшення |
20
0 |
100,0
0 |
43
5 |
89,6
10,4 |
| E. coli гемолітична:
норма збільшення |
18
2 |
90,0
10,0 |
37
11 |
77,1
22,9 |
| Enterobacter spp.:
норма збільшення |
11
9 |
45,0
55,0 |
28
20 |
58,3
41,7 |
| Citrobacter spp.:
норма збільшення |
12
8 |
60,0
40,0 |
29
19 |
60,4
39,6 |
| S. epidermidis:
норма збільшення |
15
5 |
75,0
25,0 |
31
17 |
64,6
35,4 |
| Candida spp:
норма збільшення |
19
1 |
95,0
5,0 |
30
18 |
62,5
37,5 |
| Proteus vulgaris:
норма збільшення |
20
0 |
100,0
0 |
44
4 |
91,7
8,3 |
Зміни складу мікробіоценозу кишечника у хворих певною мірою залежали і від тривалості СД (табл. 6.7).
Таблиця 6.7 – Частота виявлення основних представників товстокишечної мікрофлори у хворих з різною тривалістю себорейного дерматиту
| Мікроорганізми
кишечника, кількість |
Хворі з різною тривалістю себорейного дерматиту, роки | ||||||
| до 5, n=18 | 5-10, n=36 | понад 10, n=14 | |||||
| абс. | % | абс. | % | абс. | % | ||
| Bifidobacterium spp.:
норма зменшення |
11
7 |
61,1
38,9 |
7
29 |
19,4
80,6 |
0
14 |
0
100,0 |
|
| Lactobacillus spр.:
норма зменшення |
10
8 |
55,5
44,5 |
7
29 |
19,4
80,6 |
1
13 |
7,1
92,9 |
|
| E. coli типова:
норма зменшення |
9
9 |
50,0
50,0 |
8
28 |
22,2
77,8 |
2
12 |
14,3
85,7 |
|
| E. coli лактозонегативна:
норма збільшення |
18
0 |
100
0 |
33
3 |
91,7
8,3 |
12
2 |
85,7
14,3 |
|
| E. coli гемолітична:
норма збільшення |
17
1 |
94,4
5,6 |
29
7 |
80,6
19,4 |
9
5 |
52,6
47,7 |
|
| Enterobacter spp.:
норма збільшення |
14
4 |
77,8
27,2 |
19
17 |
52,8
47,2 |
6
8 |
15,8
84,2 |
|
| Citrobacter spp.:
норма збільшення |
15
3 |
72,2
27,8 |
22
14 |
61,1
38,9 |
4
10 |
28,6
71,4 |
|
| S. epidermidis:
норма збільшення |
16
2 |
88,9
11,1 |
27
9 |
75,0
25,0 |
7
7 |
50,0
50,0 |
|
| Candida spp.:
норма збільшення |
16
2 |
88,9
11,1 |
29
7 |
80,6
19,4 |
4
10 |
28,6
71,4 |
|
| Proteus vulgaris:
норма збільшення |
0 | 0 | 34
2 |
94,4
5,6 |
12
2 |
85,7
14,3 |
|
Аналіз якісного складу мікрофлори товстого кишечника в залежності від давності захворювання дозволив виявити пониження кількості індигенної мікрофлори та збільшення обсіменіння умовно-патогенними мікроорганізмами з подовженням тривалості дерматозу. При терміні СД більше 10 років виявлено зменшення кількості біфідобактерій у 100,0 %, лактобактерій – у 92,9 % хворих. Пониження рівня E. coli типової визначено в усіх пацієнтів, але найчастіше (85,7 %) при давності СД понад 10 років. Збільшення кількості E. coli лактозонегативної і E. coli гемолітичної встановлено у 14,3 і 47,7 % пацієнтів, що хворіли більше 10 років. Ентеробактер і цитробактер висівалися у хворих з тривалістю СД до 5 років, від 5 до 10 років, більше 10 років, але частіш за все при терміні дерматозу понад 10 років (відповідно 84,2 і 71,4 %). Гриби роду Candida, протей також визначалися найчастіше у пацієнтів з тривалістю дерматозу понад 10 років (71,4 і 14,3 %).
Кореляційний аналіз з визначенням коефіцієнта кореляції Пірсона установив кореляційні зв’язки у хворих на СД між кількістю мікроорганізмів та рівнем кателіцидину, кальцидіолом (позитивного – r біфідобактерії–LL-37 = 0,49, r лактобактерії–LL-37 = 0,51, r лактобактерії-25(OH)D = 0,43, r біфідобактерії-25(OH)D = 0,40, р < 0,05).
Резюме. У 76,5 % хворих на СД виявлено дисбактеріоз товстого кишечника (I ступеня – у 26,5 %, II ступеня – у 36,8 % і III ступеня – у 13,2 %). Мікробіологічні порушення I ступеня характеризувалися пониженням на 1-2 порядки кількості біфідобактерій і лактобактерій, а також E. coli, II ступеня – вираженим дефіцитом біфідобактерій і лактобактерій, дисбалансом E. coli (зменшення частки типової, збільшення – лактозонегативної), збільшенням кількості представників умовно-патогенної флори (ентеробактер, цитробактер, грибів роду Candida), III ступеня – різким пониженням чисельності анаеробів (біфідобактерій 105-6, лактобактерій 104-5), при цьому кишкова паличка майже повністю представлена E. coli лактозонегативною і E. coli гемолітичною, значним збільшенням кількості умовно-патогенної флори (105-6).
Дефіцит біфідобактерій і лактобактерій у хворих на різні клінічні прояви СД вказує на важливу роль цього виду облігатної флори в патогенезі захворювання. Аналіз якісного і кількісного складу мікрофлори товстого кишечника дозволив виявити достовірну залежність ступеня тяжкості СД від ступеня мікробіологічних порушень, тривалості дерматозу – від зменшення кількості індигенної мікрофлори та збільшення обсіменіння умовно-патогенними мікроорганізмами слизової оболонки товстого кишечника. Визначення мікрофлори кишечника доцільно проводити для вибору засобу корекції цього патологічного стану.
Наведені у розділі положення відображено у публікаціях:
1. Нарожная М. В. Пробиотики в лечении себорейного дерматита. Дерматовенерологія. Косметологія і Сексопатологія. 2017. № 1-2 (5). С. 55-57 [61].
2. Нарожная М. В. Состояние микробиоценоза толстого кишечника у больных себорейным дерматитом. Міжнародний медичний журнал. 2018. Т. 24. № 1 (93). С. 73-79 [62].
3. Нарожна М. В. Показники системного імунітету та біоценозу кишечника у хворих на себорейний дерматит. Новітні тенденції лікування та профілактики дерматовенерологічних проблем у рамках доказової медицини : матеріали наук.-практ. конф., 15 квітня 2016 р. Львів, 2016. Укр. журн. дерматол., венерол., косметол. 2016. № 1 (60). С. 106 [52].
РОЗДІЛ 7
СТАТИСТИЧНИЙ АНАЛІЗ ВЗАЄМОЗВ’ЯЗКІВ КЛІНІКО-ЛАБОРАТОРНИХ ПОКАЗНИКІВ У ХВОРИХ НА СЕБОРЕЙНИЙ ДЕРМАТИТ
Проведений кореляційний аналіз дозволив виявити статистично значущі зв’язки між ступенем тяжкості СД (SDASI) і рівнем кателіцидину, 25(ОH)D, показниками фагоцитарної (ФІ і ФЧ) і функціональної активності нейтрофілів (НСТ-спонт. і НСТ-інд.). На рис. 7.1-7.6 наведено діаграми розсіювання SDASI і цих показників з коефіцієнтом парної кореляції Пірсона (r) і його статистичною значимістю (р).
Майже в усіх випадках (крім 25(ОH)D) спостерігається сильна негативна (r < - 0,72) кореляція (висока кореляція) при значимості коефіцієнтів кореляції, що і стало підставою для використання моделі множинної регресії [1].
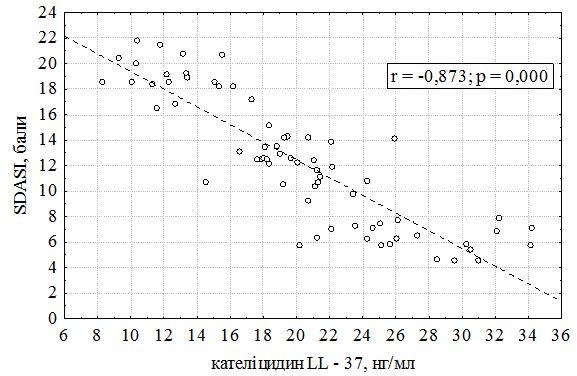
Рисунок 7.1 – Залежність SDASI від рівня кателіцидину LL-37 крові у хворих на себорейний дерматит
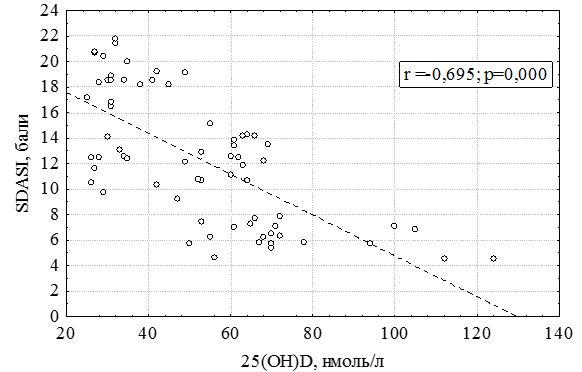
Рисунок 7.2 – Залежність SDASI від рівня 25(ОH)D у крові хворих на себорейний дерматит
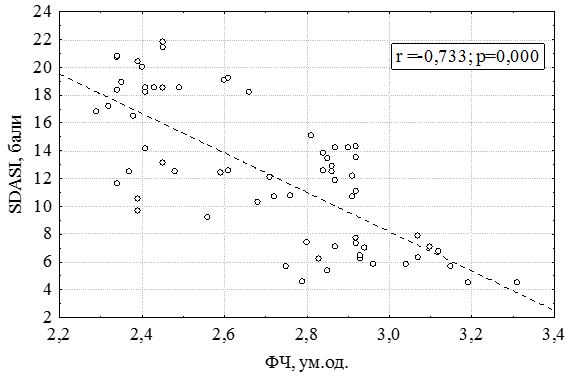
Рисунок 7.3 – Залежність SDASI від значення фагоцитарного числа у хворих на себорейний дерматит
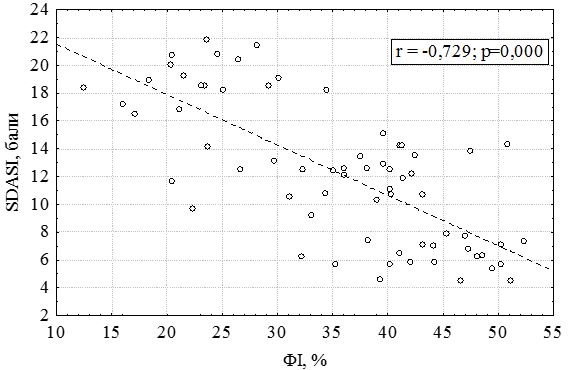
Рисунок 7.4 – Залежність SDASI від фагоцитарного індексу у хворих на себорейний дерматит
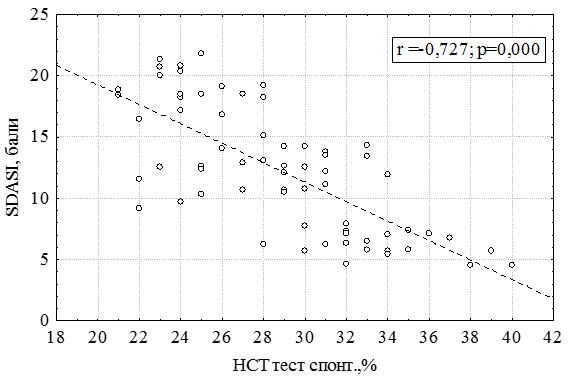
Рисунок 7.5 – Залежність SDASI від рівня функціональної активності нейтрофілів НСТ-спонт. у хворих на себорейний дерматит
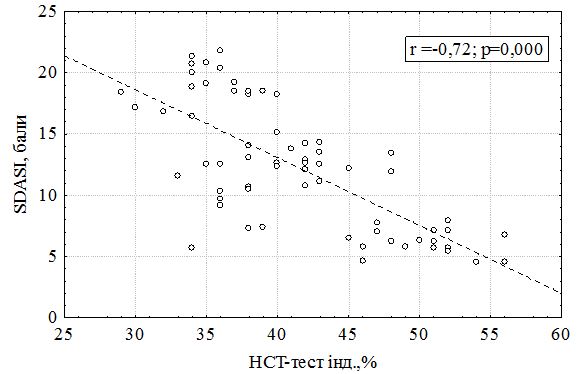
Рисунок 7.6 – Залежність SDASI від функціональної активності нейтрофілів НСТ-інд. у хворих на себорейний дерматит
В якості залежної змінної у регресійній моделі вибирався показник SDASI, а незалежними змінними (предикторами) були 6 розглянутих показників. Вибір предикторів здійснювався покроково: в модель по черзі додавалися найбільш значимі предиктори або з повної моделі виключалися найменш значимі. Значимість предикторів оцінювалась відповідно до критерію F-Фішера [29]. Таким шляхом були отримані регресійні коефіцієнти (табл. 7.1) і підсумкові статистики (табл. 7.2).
Отримане рівняння регресії (коефіцієнти В) має вигляд:
SDASI = 34 – 0,58 х «LL-37» – 3,65 х «ФЧ» (7.1),
де SDASI (бали), LL-37 (нг/мл) – кателіцидин LL-37, ФЧ (ум. од.) – фагоцитарне число. Так як всі регресійні коефіцієнти негативні, то будь-яке збільшення значень предикторів призведе до зменшення SDASI. Важливо відзначити, що всі коефіцієнти статистично значущі – при рівні значущості р < 0,05 вірна гіпотеза про те, що вони відмінні від 0.
Таблиця 7.1 – Підсумкова таблиця регресії
| Фактори | БЕТА-
коефі- цієнти |
Стандартна похибка
БЕТА-коефіцієнтів |
Коефіцєнт регресії B | Стандартна похибка
В |
t-
крите-рій |
p-
рівень |
| Вільний член | – | – | 34 | 3,67 | 9,26 | 0,000 |
| Кателіцидин
LL-37 |
-0,732 | 0,087 | -0,58 | 0,07 | -8,38 | 0,000 |
| ФЧ | -0,189 | 0,087 | -3,65 | 1,7 | -2,16 | 0,034 |
Про вклад кожного предиктора в SDASI можна судити за величиною стандартизованих коефіцієнтів БЕТА (табл. 7.1). Максимальний вклад в передбачення відгуку дає кателіцидин LL-37.
Таблиця 7.2 – Підсумкові статистики
| Показники | Значення |
| Коефіцієнт множинної кореляції R | 0,88 |
| Коефіцієнт детермінації R2 | 0,78 |
| Скоригований R2 | 0,77 |
| F (2,65) | 113,5 |
| р-рівень | 0,000 |
| Стандартна похибка оцінки | 2,45 |
Адекватність (інформативність і значимість) побудованої регресійної моделі можна оцінити за результатами підсумкової статистики (табл. 7.2). Значення коефіцієнта детермінації характеризує ступінь підгонки моделі до даних і показує, яка частина мінливості залежною змінною (SDASI) пояснюється регресійний рівнянням. R2=0,78 при значимості критерію Фішера р=0,000 відповідає хорошій адекватності моделі.
Моделювання ступеня тяжкості СД мало на меті виявлення в тому числі і впливу вітаміну D на розвиток захворювання з метою використання його для лікування. На жаль, цей предиктор виявився незначним і не увійшов до лінійної регресійної моделі в силу нелінійної залежності SDASI від 25(ОH)D. Однак виявлено дуже сильний зв’язок 25(ОH)D з одним із значущих предикторів регресійного рівняння – ФЧ, що наведено на діаграмі розсіювання (рис. 7.7).
З високою точністю залежність ФЧ від 25(ОH)D описується логарифмічною апроксимацією:
«ФЧ» = 0,62 х ln («25(ОН)D») + 0,3 (7.2),
де ФЧ (ум. од.) – фагоцитарне число, 25(OH)D (нмоль/л) – рівень 25(OH)D крові. Коеіфіцієнт детермінації для цієї моделі апроксимації виявився дуже високим: R2 = 0,893.
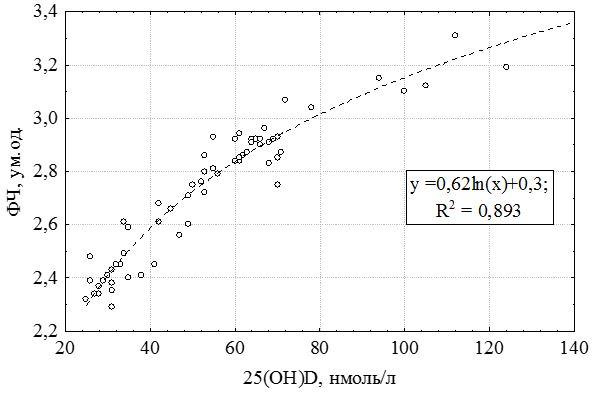
Рисунок 7.7 – Залежність показників фагоцитарної активності нейтрофілів (ФЧ) від рівня 25(OH)D.
Це дає підставу використовувати у регресійній моделі (1) замість предиктора ФЧ його апроксимацію логарифмічною залежністю (2), тобто підставляючи у формулу (1) замість ФЧ його апроксимацію (2), отримуємо наступне рівняння:
SDASI = 34 – 0,58 х «LL-37» – 3,65 х «0,62 х ln (25(ОН)D) + 0,3» (7.3).
Перевірка такої регресійної моделі підтвердила її підсумкові (заключні) статистики (R2=0,77) з невеликою зміною регресійних коефіцієнтів (табл. 7.3).
Таблиця 7.3 – Підсумкова таблиця регресії
| Фактори | БЕТА-
коефіці-єнти |
Стандартна похибка
БЕТА |
B | Стандартна похибка
В |
t-
критерій |
p-
рівень |
| Вільний член | – | – | 32,3 | 3,82 | 8,45 | 0,000 |
| Кателіцидин
LL-37 |
-0,77 | 0,087 | -0,61 | 0,07 | -8,88 | 0,000 |
| Модель ФЧ | -0,19 | 0,087 | -3,2 | 2,14 | -2,09 | 0,04 |
З урахуванням змін регресійних коефіцієнтів рівняння (3) буде:
SDASI = 32,3 – 0,61 х (LL-37) – 3,2 х (0,62 х ln (25(ОН)D) + 0,3 або
SDASI = 31,34 – 0,61 х (LL-37) – 2 х ln (25(ОН)D).
Таким чином, підсумкові моделі регресії можна надати у двох видах:
SDASI = 34 – 0,58 х (LL-37) – 3,65 х (ФЧ),
SDASI = 31,34 – 0,61 х (LL-37) – 2 х ln (25(ОН)D).
Резюме. В результаті дослідження взаємозв’язків SDASI з лабораторними показниками отримано дві регресійні моделі, що володіють однаково високим ступенем відповідності з вихідними даними (R2=0,77-0,78). Одна з моделей є лінійною комбінацією показників кателіцидіну і ФЧ, інша модель враховує лінійність зв’язку SDASI з LL-37 і нелінійність його залежності від значень 25(ОН)D. Це дозволяє легко застосовувати модель в клінічній практиці, з урахуванням змін рівня 25(ОН)D можна прогнозувати ступінь тяжкості дерматозу і результати терапії.
Наведені у розділі положення відображено у публікації:
1. Болотная Л. А., Нарожная М. В. Роль кателицидина LL-37 при себорейном дерматите. Дерматологія та венерологія. 2018. № 1 (79). С. 16-20.
РОЗДІЛ 8
ЛІКУВАННЯ ХВОРИХ НА СЕБОРЕЙНИЙ ДЕРМАТИТ
В останнє десятиліття підходи до лікування СД змінюються за рахунок впровадження нових технологій, які дозволяють досягти ремісії і швидко зменшити вираженість основних симптомів дерматозу. Незважаючи на значні успіхи, досягнуті в лікуванні дерматозу, прогноз у частини хворих залишається несприятливим, що обумовлено прогресуванням процесу, недостатньою ефективністю деяких засобів терапії.
Мета лікування пацієнтів з СД полягає у нормалізації порушень проліферації епітеліоцитів, протизапальній дії та спрямована на зменшення частоти рецидивів, максимальне подовження ремісії. Кінцевим підсумком терапії повинне бути покращення якості життя хворого і прогнозу захворювання. Дотепер при проведенні комплексного лікування не враховувалася забезпеченість організму вітаміном D, стан вродженого імунітету, важливість нормалізації функції кишечника.
8.1 Обґрунтування використання у хворих на себорейний дерматит засобів, коригуючих статус вітаміну D, фактори вродженого імунітету та дисбактеріоз кишечника
Установлені у хворих на СД деякі клініко-лабораторні особливості – загострення дерматозу в 75,9 % випадків у холодний період року, зникнення висипань чи значне покращення стану шкіри влітку у 87,5 % хворих, недостатнє споживання продуктів, багатих вітаміном D2 і D3, 63,4 % хворими, закритий одяг влітку майже у 1/3 хворих, щорічний відпочинок та засмага у 24,1 % пацієнтів, супутні захворювання органів ШКТ і гепатобіліарної системи у 42,4 %, клінічні прояви дисбактеріозу у 65,4 % хворих, пониження майже вдвічі рівня 25(ОН)D, недостатність і дефіцит вітаміну D відповідно у 61,8 і 30,9 % пацієнтів, пониження в 1,6 рази рівня LL-37 у крові та фагоцитарна дисфункція у 81,8 % пацієнтів, дисбактеріоз кишечника у 76,5 % хворих обумовлюють необхідність терапевтичної корекції статусу вітаміну D, дисбіозу кишківника і опосередковано факторів вродженого імунітету.
Виявлення протизапальної та імуносупресорної активності вітаміну D відкрило нові можливості терапевтичного застосування даної речовини та її аналогів для контролю запальних захворювань шкіри, імовірно пов’язаних з гіперпродукцією цитокінів (псоріаз, атопічний дерматит, кропив’янка, склеродермія) [5, 104, 182, 190]. Ліганди рецептора вітаміну D зменшують рівень експресії прозапальних цитокінів та надають терапевтичний ефект при багатьох запальних шкірних захворюваннях.
Останні дослідження показують, що кератиноцити мають рецептори вітаміну D, які пригнічують проліферацію і стимулюють диференціювання клітин епідермісу, дефіцит вітаміну призводить до аномального формування шкірного бар’єру, експресії АМП та дефіциту імунного захисту. За деякими даними, кератиноцити містять рецептори до 1,25(OH)2D, в зв’язку з чим активні метаболіти вітаміну D можуть пригнічувати проліферацію і стимулювати диференціювання клітин епідермісу [66]. Вітамін D оптимізує вплив на функціонування неспецифічних механізмів захисту і адаптивного імунітету. Відомо, що при рівні 25(ОН)D менш 49,9 нмоль/л, імунна відповідь на ліпополісахариди або мікобактерій туберкульозу не ініціюється [189]. Підвищення продукції 1,25(ОН)2D призводить до синтезу кателіцидіну.
Заповнення дефіциту вітаміну D за допомогою препаратів вітаміну D у даний час є практично необхідною умовою досягнення і підтримання нормальної концентрації 25(OH)D в сироватці крові. Згідно з рекомендаціями міжнародних експертів, для профілактики і лікування дефіциту вітаміну D застосовується холекальциферол, або вітамін D3, рідше використовуються препарати ергокальциферолу, вітаміну D2 [2, 90]. Препарати нативних вітамінів D2 і D3 належать до лікарських засобів, які безпечні і найкраще переносяться, їх застосування доцільно головним чином при 1-ому типі D-дефіциту. Рекомендованим препаратом для лікування дефіциту вітаміну D є холекальциферол (вітамін D3), тому що має порівняно більшу ефективність у досягненні і збереженні цільових значень 25(OH)D у сироватці крові. Холекальциферол застосовуються у пацієнтів з нормальною функцією нирок для корекції дефіциту вітаміну D.
Дорослим особам у віці 19-50 років і старше для досягнення стабільної концентрації 25(OH)D більше 30 нг/мл мінімальна добова доза вітаміну D становить 1500-2000 МО. Лікувальна тактика при підтвердженому дефіциті вітаміну D ставить за мету швидку корекцію рівня вітаміну D в крові до цільових значень більше 30 нг/мл (75 нмоль/л) і подальшу підтримуючу терапію. У терапії дефіциту вітаміну D в групі дорослих осіб рекомендовані препарати вітаміну D2 або вітаміну D3 в дозі 50 000 МО 1 раз на тиждень або 6000 МО/добу протягом 8 тижнів до досягнення концентрації 25(OH)D вище 30 нг/мл з наступним переходом на підтримуючу терапію в дозі 1500-2000 МО/добу [18, 89, 147, 213].
Вибір оптимальної дози вітаміну D залежить від вихідної концентрації 25(OH)D в сироватці крові. Розрахунок щоденної дози вітаміну D3 проводили в залежності від вихідної концентрації 25(OH)D згідно розробленій Garland з співавт. (2011) [227] схемі, при цьому дози повністю відповідали рекомендованим Міжнародним ендокринологічним товариством. Для корекції рівня вітаміну D (при недостатності) хворі на СД отримували холекальциферол по 2000 МО 1 раз на добу протягом 6 тижнів, при дефіциті вітаміну D – 3500 МО 1 раз на добу протягом 8 тижнів з переходом на 1500 МО протягом 4 тижнів для підтримки досягнутої концентрації вітаміну D у крові. Вітамін D призначали під час загострення в холодну пору року (з листопада по березень) на фоні комплексної традиційної терапії (всередину вітаміни групи В – вітамін В6, біотин, антигістамінні препарати – левоцетиризин, фенкарол, протигрибковий препарат ітраконазол у разі поширеного і резистентного до терапії перебігу, місцево – топічні кортикостероїди, топічні інгібітори кальциневрину, шампуні з антипроліферативними, протигрибковими, кератолітичними компонентами – цинку піритионат, сірка, циклопірокс, сульфід селену).
Виявлені порушення резистентності колонізації кишкового біотопу у хворих на СД, пов’язані із зміною складу постійної мікрофлори і заселенням умовно-патогенними мікроорганізмами, пов’язані з клінічними проявами та розладами вродженого імунітету, потребують терапевтичної корекції одночасно з усуненням причини дисбіозу, дотримання дієти.
Велике значення в даній ситуації набувають пробіотики. Вони нормалізують стан і баланс мікрофлори кишечника, відновлюють напруженість імунітету і нормалізують імунну відповідь. Механізм специфічних ефектів пробітиків залишається також недостатньо з’ясованим. Згідно з результатами досліджень генетичних впливів, встановлено, що дія пробіотиків пов’язано з наступними доведеними ефектами: взаємодією з місцевою (резидентної) мікрофлорою і продукцією бактеріоцинів – АМП, взаємодією з клітинами організму господаря – імуноцитами [48, 115, 195].
Висока значимість і лідуючі позиції в чисельності спільнот симбіотичних мікроорганізмів «здорових» людей усіх вікових груп лактобацил зумовили вибір для корекції дисбіотичних порушень при СД синбіотика ДермаПро. Lactobacillus rhamnosus GG (LGG), що входять до складу препарату в кількості 1,5 млрд. КУО, запобігають розмноженню патогенних мікроорганізмів в кишечнику і сприяють відновленню балансу корисної мікрофлори, усуненню дисбактеріозу і нормалізації травлення. Вони позитивно впливають не тільки на кишечник, але і на організм в цілому, нормалізують імунітет.
В останні роки проводилися рандомізовані плацебо-контрольовані дослідження, їх результати показали, що застосування мультиштамових пробіотиків, що містять LGG, сприяють: 1) посиленню активності фагоцитів завдяки експресії на поверхні цих клітин рецепторів CR1, CR3, FcyRIII і FCaR, що полегшувало розпізнавання ними патогенів; 2) підвищення продукції ІЛ-12 і ІЛ-15, які є ключовими цитокінами для дозрівання і активації природних кілерів; 3) підвищенню рівня сироваткового Ig A через вплив пробіотичної флори на лімфоїдну тканину GALT; 4) пониженню активності СД4+-лімфоцитів і продукції прозапальних цитокінів, у тому числі ФНП-α [26, 30, 222].
Бактерії LGG гальмують адгезивні властивості E. coli, пригнічують розвиток у кишечнику багатьох патогенних мікроорганізмів, зокрема Clostridium, Enterobacteriaceae, Pseudomonas, Staphylococcus; сприяють запобіганню виникнення або загострення алергічних захворювань шкіри. Бактерії LGG виживають в кислому середовищі шлунка і досягають кишечника в необхідній кількості. Фруктоолігосахариди є ідеальним живильним субстратом для корисної мікрофлори і сприяють її активному розмноженню в травному тракті.
При включенні пробіотиків у комплексну терапію алергічних та інфекційно-запальних захворювань відзначаються рання позитивна динаміка клінічних показників, скорочення тривалості лікування і позитивний вплив на імунну функцію. Це призводить до необхідності комбінування пребіотиків зі стандартною терапією при лікуванні.
ДермаПро призначали на фоні дієти залежно від ступеня дисбактеріозу (по 1 капсулі протягом 14 днів при I ступені та відсутності клінічних проявів дисбактеріозу, протягом 21 днів – II і III ступені) одночасно з вітаміном D3. При дисбіозі III ступеня за наявності одного або декількох клінічних проявів дисбактеріозу кишечника (порушення випорожнення – пронос, запор або їх чергування, тупий або переймоподібний біль в животі, болючість при пальпації різних відділів кишечника, метеоризм), за консультацією гастроентеролога для елімінації надмірного росту умовно патогенних мікроорганізмів у перші 5 днів використовували препарати наступних груп: протигрибкові (ністатин 500 000 ОД всередину 3-4 рази чи флюконазол по 200 мг на добу), антибактеріальні (ентерофурил, невіграмон), потім ДермаПро.
8.2 Клінічні результати лікування хворих на себорейний дерматит
З метою оцінки ефективності терапії проведено порівняння клінічних та лабораторних результатів після лікування розробленим і загальновизнаним методами. Залежно від застосованого методу терапії хворих на СД розподілено на дві групи: 1 група (35 хворих, з них 19 чоловіків та 16 жінок, середній вік – 35,7±2,1 роки) отримували на фоні традиційної терапії вітамін D3 та ДермаПРО і 2 група (33 хворих, з них 19 чоловіків, 14 жінок, середній вік – [39,5±2,4] роки) лікувалися загальновизнаними засобами.
Обидві групи хворих були однорідні за віком, статтю, клінічними формами, тяжкістю, змінами лабораторних показників. SDASI та інтенсивність свербежу у хворих різних груп до лікування відповідно склали: 1 – (11,3±1,7) і (1,93±0,39) бала, бала, 2 – (10,6±1,6) і (1,90±0,38) бала.
Для оцінки результатів лікування застосовано такі клінічні критерії ефективності: клінічне видужання, значне покращення, покращення, відсутність ефекту, які наведено в підрозділі 2.1.
Аналіз клінічних результатів (табл. 8.1) установив, що клінічна ремісія наставала майже вдвічі частіше у хворих 1 групи (37,1 %) порівняно з пацієнтами 2 групи (15,2 %). Значне покращення також у більшому відсотку випадків визначено у пацієнтів, яким призначалася терапія за розробленою методикою (51,5 %), ніж загальновизнаною (42,4 %). Покращення, навпаки, частіше зареєстровано в 2 групі (33,3 %), порівняно з аналогічним у хворих, яким рекомендували додаткового вітамін D3 і синбіотик (відповідно 11,4 %). Терапія виявилася неефективною тільки у пацієнтів 2 групи (9,1 %).
Позитивного результату вдалося досягти у 100,0 % хворих 1 групи та у 90,9 % пацієнтів 2 групи. Однак клінічна ремісія та значне покращення частіше визначені у хворих, які лікувалися за розробленим методом (88,6 %) порівняно з аналогічними результатами у хворих, що одержували традиційну терапію (відповідно 57,6 %).
Таблиця 8.1 – Результати лікування хворих на себорейний дерматит різними методами
| Результати
лікування |
Хворі після лікування
різними методами |
Разом | |
| 1 гр., n = 35 | 2 гр., n = 33 | ||
| абс. / % | абс. / % | абс. / % | |
| Клінічне видужання | 13 / 37,1 | 5 / 15,2 | 18 / 26,5 |
| Значне покращення | 18 / 51,5 | 14 / 42,4 | 32 / 47,1 |
| Покращення | 4 / 11,4 | 11 / 33,3 | 15 / 22,0 |
| Відсутність ефекту | – | 3 / 9,1 | 3 / 4,4 |
| Всього | 35 / 100,0 | 33 / 100,0 | 68 / 100,0 |
Регрес основних клінічних симптомів СД (свербіж, еритема, інфільтрація, лущення) під впливом терапії відбувався у різні строки (табл. 8.2).
Таблиця 8.2 – Терміни розв’язання основних симптомів себорейного дерматиту (M±m)
| Симптоми
хвороби |
Термін регресу (дні) проявів дерматозу
після лікування різними методами |
||
| 1 гр., n = 35 | 2 гр., n = 33 | p | |
| Зникнення свербежу | 4,9±0,5 | 5,2±0,8 | > 0,05 |
| Зникнення еритеми | 5,1±0,5 | 9,4±0,9 | ˂ 0,01 |
| Розв’язання інфільтрації | 6,7±1,1 | 6,9±1,2 | > 0,05 |
| Припинення лущення | 6,3±0,7 | 9,1±0,8 | ˂ 0,01 |
| SDASI, бали | 2,35±0,28 | 6,12±0,70 | ˂ 0,01 |
| Свербіж, бали | 1,25±0,28 | 1,41±0,30 | > 0,05 |
Примітка. р – рівень достовірності відмінностей показника між групами хворих.
Коротші терміни зникнення суб’єктивних і об’єктивних проявів дерматозу виявлено у пацієнтів, які отримували додатково вітамін D і пробіотик. Звертають увагу більш короткі терміни регресу еритеми та лущення у хворих 1 групи ([5,1±0,6] і [6,3±0,7] дня, р < 0,05) порівняно з аналогічними у пацієнтів 2 групи (відповідно [9,4±0,9] і [10,1±1,0] дня). Аналіз значення SDASI у пацієнтів різних терапевтичних груп (перша – [2,35±0,28] бали, друга – [6,12±0,70] бали) також дозволив виявити перевагу розробленого диференційованого методу терапії над загальновизнаним. Пониження SDASI в 4,4 рази відзначено у хворих першої групи, тоді як у другій групі – в 1,6 рази. Інтенсивність свербежу понижувалася в обох групах майже однаково (р > 0,05).
Спостереження за хворими протягом одного року після лікування виявило рецидиви захворювання у 7 (20,0 %) пацієнтів 1 групи і 18 (54,5 %) хворих 2 групи в середньому через (206,5±20,7) дня і (113,8±12,4) дня (р ˂ 0,05).
8.3 Лабораторні результати лікування хворих на себорейний дерматит
Динаміка лабораторних показників у хворих на СД обох груп під впливом терапіі наведена в табл. 8.3. Після лікувнння у хворих 1 групи відбувалося достовірне збільшення рівня 25(OH)D у сироватці крові ([96,29±7,25] нмоль/л, p < 0,05), що досягало цільового рівня (75-150 нмоль/л, згідно рекомендацій для країн Центральної Європи). У пацієнтів 2 групи вміст вітаміну D достовірно не змінювався ([63,15±5,06] нмоль/л, р > 0,05).
Позитивні зрушення відзначено й з боку факторів вродженого імунітету у пацієнтів 1 групи – рівень LL-37 і ФІ суттєво збільшилися (р ˂ 0,05), активність НСТ-тесту спонтанного та індукованого мала тенденцію до нормалізації, однак достовірно не відрізнялися від показника у хворих до лікування. У хворих 2 групи вміст АМП, а також функціональна активність фагоцитів практично не змінились відносно значень обох показників до лікування (р > 0,05).
Таблица 8.3 – Динаміка лабораторних показників у хворих на себорейний дерматит в процесі лікування (M±m)
| Показник,
од. вим. |
Хворі, група | Контрольна
група, n = 22 |
|
| перша,
n=35 |
друга,
n=33 |
||
| 25(OH)D,
нмоль/л |
53,06±4,61#
96,29±7,25* |
57,33±4,73#
63,15±5,06# |
100,59±7,72 |
| Кателіцидин,
нг/мл |
18,14±1,04#
35,31±1,85* |
19,26±1,33#
21,47±2,24 |
32,51±1,03 |
| ФІ,
% |
38,3±1,5#
60,2±4,3* |
36,9±1,7#
44,1±2,0# |
62,3±1,9
|
| ФЧ,
ум. од. |
2,71±0,33#
3,58±0,65* |
2,82±0,24#
3,11±0,29 |
3,81±0,05
|
| НСТ-тест спонт.,
% |
29,4±1,0#
25,3±0,7 |
28,3±0,8#
27,6±0,6 |
21,8±0,5 |
| НСТ-тест інд.,
% |
42,6±0,9#
50,3±1,6 |
44,1±1,0#
43,4±1,7# |
58,4±1,7 |
Примітки: в числівнику наведено показники до лікування, знаменнику – після лікування; # – відмінності достовірні щодо контрольної групи при р < 0,05; * – відмінності достовірні між показниками у хворих до і після лікування при р < 0,05.
Дослідження вмісту гідроксивітаміну D у пацієнтів 1 групи з різним ступенем тяжкості хвороби після лікування виявило позитивну динаміку, при цьому найкращі результати виявлено у хворих з легким та помірним ступенем тяжкості СД (відповідно [106,11±9,25] нмоль/л і [98,02±9,04] нмоль/л). Подібна динаміка гуморальних і клітинних факторів вродженого імунітету визначена у пацієнтів 1 групи з легким та помірним ступенем тяжкості.
Динаміка змін складу мікрофлори товстого кишечника у хворих 1 та 2 груп з СД після лікування наведена в табл. 8.4.
Таблиця 8.4 – Частота виявлення основних представників товстокишечної мікрофлори у хворих на себорейний дерматит після лікування
| Мікроорганізми кишечника, кількість | Хворі, група | |||
| перша, n=35 | друга, n=33 | |||
| абс. | % | абс. | % | |
| Біфідобактерії:
норма зменшення |
30
5 |
85,7
14,3 |
3
30 |
9,1
90,9 |
| Лактобактерії:
норма зменшення |
31
4 |
88,6
11,4 |
5
28 |
15,1
84,9 |
| E. coli типова:
норма зменшення |
29
6 |
82,9
17,1 |
9
24 |
27,3
72,7 |
| E. coli лактозонегативна:
норма збільшення |
34
1 |
97,1
2,9 |
27
6 |
81,8
18,2 |
| E. coli гемолітична:
норма збільшення |
33
2 |
94,3
5,7 |
29
4 |
87,9
12,1 |
| Ентеробактер:
норма збільшення |
29
6 |
82,9
17,1 |
17
16 |
51,5
48,8 |
| Цитробактер:
норма збільшення |
32
3 |
91,4
8,6 |
15
18 |
45,4
54,6 |
| S. epidermidis:
норма збільшення |
34
1 |
97,1
2,9 |
22
11 |
66,7
33,3 |
| Гриби роду Candida:
норма збільшення |
35
0 |
100,0
0 |
26
7 |
78,8
21,2 |
| Proteus vulgaris:
норма збільшення |
35
0 |
100,0
0 |
30
3 |
90,9
9,1 |
Серед хворих на СД 1 групи значно збільшувалася їх кількість з нормальними значеннями біфідобактерій і лактобацил (85,7 і 88,6 %), E. coli типової (82,9 %) і достовірно відрізнялася від аналогічних показників до лікування (3,8, 0,0 і 3,0 %, р < 0,01). Кількість хворих з нормальним вмістом E. coli лактозонегативних після терапії залишалася майже однаковою (97,1 % проти 90,4 %), E. coli гемолітичних збільшувались (94,3 %) порівняно з такими до терапії (75,0 %). Вміст ентеробактера, цитробактера і епідермального стафілокока визначено на рівні нормальних значень у 82,9 %, 91,4 % і 97,1 % хворих (до лікування відповідно у 44,2 %, 48,1 % і 65,4 %), тоді як кількість дріжджоподібних грибів Candida і протея нормалізувалася у 100,0 % пацієнтів, що отримували розроблену терапію (до лікування не відрізнялися від контрольної групи у 63,5 % і 92,3 % хворих). Незначно збільшилася кількість хворих 2 групи з нормальним вмістом біфідобактерій (9,1 %), достовірно лактобактерій та E. coli типових (15,1 % і 27,3 %, р ˂ 0,05) порівняно з таким до лікування. Залишалася майже без змін кількість хворих з підвищеним рівнем E. coli лактозонегативних та гемолітичних (18,2 % і 12,1 %), а також ентеробактер (48,4 %) і цитробактер (54,6 %), S. epidermidis (33,3 %) і Proteus vulgaris (90,9 %). Разом з тим, збільшилася кількість пацієнтів 2 групи з нормальним вмістом грибів роду Candida (78,8 %) відносно показника до терапії (63,5 %).
Порівняльний аналіз результатів дослідження калу на дисбактеріоз кишечника у хворих на СД після лікування (табл. 8.5) показав найбільш виражений коригуючий вплив на якісний та кількісний склад мікробіоти кишечника комплексного методу з додатковим застосуванням всередину холекальциферолу і ДермаПро. Призначення терапії з використанням вітаміну D3 і синбіотика спричиняло нормалізацію або значне покращення кількісного та якісного складу кишкової мікрофлори у більшості пацієнтів (88,6 %). Це виражалось відновленням рівня облігатної мікрофлори до референтних значень, пониженням кількості факультативних, елімінації патогенних мікроорганізмів. У хворих 2 групи у більшості випадків (72,7 %) зберігався дисбактеріоз кишечника, показники покращились або нормалізувались у 27,3 % пацієнтів з I ступенем дисбактеріозу на фоні дієти.
Таблица 8.5 – Стан мікробіоти кишечника у хворих на себорейний дерматит після лікування
| Критерії | Хворі, групи | |
| перша, n=35
абс. / % |
друга, n=33
абс. / % |
|
| Дисбактеріоз кишечника | 4 (11,4) | 24 (72,7) |
| Нормалізація біоценозу кишечника | 25 (71,4) | 3 (9,1) |
| Покращення бактеріологічних показників | 6 (17,2) | 6 (18,2) |
Резюме. Лікування хворих на СД за розробленим методом сприяло підвищенню ефективності терапії (досягнення ремісії та значного покращення) в 1,5 рази частіше порівняно з результатами традиційної терапії. Використання в комплексному лікуванні вітаміну D3 і пробітика дозволило зменшити кількість рецидивів в 2,7 рази, подовжити період ремісії в 1,8 рази порівняно з аналогічними показниками у хворих при застосуванні традиційних засобів.
Внаслідок лікування відбувається не тільки регрес клінічних проявів у більшості хворих (пониження SDASI в 4,4 рази), а й підвищення на 81 % рівня 25(ОН)D у сироватці крові, в той час як у хворих 2 групи SDASI зменшувався лише в 1,6 рази, а 25(ОН)D збільшувався на 10 %). Призначення холекальциферолу і синбіотика підтверджує модулюючий вплив на функціональний стан вродженого імунітету на підставі достовірного збільшення в 1,95 рази вмісту LL-37 та в 1,6 рази ФІ і в 1,3 рази ФЧ у хворих на СД 1 групи. У пацієнтів, що лікувалися загальновизнаними засобами вміст LL-37 підвищувався недостовірно (на 11 %), значення ФІ та ФЧ (відповідно на 19 і 10 %), активність НСТ-тесту спонтанного та індукованого не змінювалася порівняно з показниками до терапії. Призначення розробленої терапії обумовило нормалізацію кількісного та якісного складу кишкової мікрофлори у 71,4 % хворих 1 групи і у 9,1 % пацієнтів 2 групи.
Висока ефективність та доступність препаратів, відсутність побічних явищ обгрунтовують доцільність використання засобів, що покращують статус вітаміну D та нормалізують рівень LL-37, клітинних факторів вродженого імунитету, стан мікробіоти кишечника (вітамін D3, ДермаПро), в лікуванні хворих на СД і дозволяють їх рекомендувати для впровадження у практику охорони здоров’я.
Наведені у розділі положення відображено у публікаціях:
1. Bolotna L. A., Narozhna M. V., Sarian О. I. New approaches to the treatment of patients with seborrheic dermatitis. Inter Collegas. 2018. Vol. 5. No. 1. P. 50-54 [110].
2. Нарожная М. В. Обоснование применения витамина D в лечении себорейного дерматита. Дерматовенерология. Косметология. 2017. Т. 3, № 3. С. 292-299 [60].
3. Нарожная М. В. Пробиотики в лечении себорейного дерматита. Дерматовенерологія. Косметологія і Сексопатологія. 2017. № 1-2 (5). С. 55-57 [61].
4. Спосіб лікування себорейного дерматиту / Л. А. Болотна, М. В. Нарожна, О. І. Саріан: пат. на корисну модель № 122932 UA: МПК 61 А61 К 31/00. № u 2017 09841; заявл. 11.10.2017 ; опубл. 25.01.2018; Бюл № 2 [83].
5. Нарожна М. В. Особливості терапії себорейного дерматиту. Ліки – людині. Сучасні проблеми фармакотерапії і призначення лікарських засобів : матеріали XXXIII Всеукр. наук.-практ. конф. за участю міжнар. спеціалістів, 08 квітня 2016 р. Харків, 2016. С. 142 [51].
6. Нарожная М. В. Комплексное лечение себорейного дерматита. Медицина XXI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 23 листопада 2017. Харків, 2017. С. 67-68 [58].
7. Нарожная М.В. Местная терапия себорейного дерматита. Проблеми захворювань шкіри та інфекцій, що передаються статевим шляхом, у дітей та підлітків : матер. науково-практ. конф., 17-18 березня 2015 р. Київ, 2015. С. 30 [59].
РОЗДІЛ 9
АНАЛІЗ ТА УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
СД – хронічне запальне захворювання, яке характеризується свербежем, лущенням, еритематозними осередками на ділянках шкіри, багатих сальними залозами (волосиста частина голови, обличчя, верхня частина тулуба, складки). У даний час єдиної точки зору на етіологію та патогенез СД не існує. Загальновизнаними є такі патогенетичні фактори: зміни рівня гормонів (андрогенів), ліпідів шкіри, колонізації мікробіоти шкіри (Malassezia spp.), порушення імунної відповіді [10, 31, 126, 138, 204]. Виділяють фактори, що сприяють розвитку захворювання – спадковість, ендокринні розлади, інфекційні агенти, захворювання нервової системи, ШКТ, лікарські засоби та ін. [65, 77, 166, 176].
Хронічне пошкодження шкірного бар’єру призводить до порушення десквамації, погіршення гідратації, що обумовлюють епідермальну проліферацію, аномальне диференціювання кератиноцитів і дозрівання рогового шару, які є підставою появи лупи та інших симптомів СД [76, 98, 152]. Посилення функціональної активності сальних залоз під впливом різних екзогенних та ендогенних факторів супроводжується активацією дріжджоподібних ліпофільних грибів Malassezia spp. З одного боку, первинним фактором для збільшення популяції дріжджів є порушення фізичних, хімічних та імунологічних механізмів захисту хазяїна, які в нормі обмежують грибкову колонізацію шкіри. Однак існує й інші точка зору, відповідно якій первинну роль у запуску патологічного процесу грає комунікація мікроорганізмів всередині популяції, що здійснюється опосередковано «сигнальними молекулами». Припускають, коли популяція досягає певної чисельності, виникає «відчуття кворуму», що стає стартовим сигналом для активації факторів патогенності [48, 128]. З механізмом внутрішньопопуляційної комунікації мікроорганізмів пов’язано таке явище, як утворення біоплівок – надорганізменних структур, що забезпечують захисні і трофічні функції. Встановлено, що гриби роду Malassezia також здатні утворювати біоплівки на поверхнні різних субстратів [186, 221].
Дріжджі роду Malassezia можуть спричиняти неспецифічну імунну відповідь, з якої починається каскад змін шкіри при СД. Запалення обумовлює гіперпроліферацію рогового шару (лущення) і неповне диференціювання корнеоцитів, які змінюють бар’єр рогового шару та погіршують його функції, тим самим посилюють трансепідермальну втрату вологи [94, 123, 219].
Для імунних реакцій (вроджених і адаптивних) вирішальне значення має вітамін D [66]. Відомо, що більшість органів і клітин імунної системи мають рецептори вітаміну D, деякі з них володіють здібністю до метаболізму 25-гідроксивітаміну D в 1,25-дигідроксивітамін D. Рецептори вітаміну D знайдено не тільки в тканинах, що приймають участь у гомеостазі кальцію, але й на різних клітинах, в першу чергу, імунної регуляції (мононуклеари, дендритні клітини, антигенпрезентуючі клітини, активовані лімфоцити).
В останні роки накопичилась значна кількість даних, що вітамін D, поряд з впливом на скелетні функції, приймає участь у регуляції важливих фізіологічних процесів, що підтримують функціонування багатьох органів і систем. Загострення в холодний період, спонтанна ремісія захворювання влітку, висока щільність колонізації шкіри Malassezia spp., папулосквамозний і запальний характер клінічних проявів вказують на участь вітаміну D, імунних порушень у патогенезі СД.
Проведення в дисертаційній роботі комплексного дослідження з визначенням клініко-патогенетичного значення статусу вітаміну D за рівнем транспортної форми вітаміну D – 25(OH)D, факторів вродженого імунітету за рівнем LL-37 і активністю нейтрофілів, мікробіоценозу кишечника за кількістю товстокишечної мікрофлори сприятиме, на наш погляд, більш глибокому розумінню патогенезу хвороби та розробці ефективних методів терапії і профілактики.
Під спостереженням перебувало 112 хворих на СД віком 23-54 років. Серед хворих чоловіків в 1,4 рази більше, ніж жінок. Усі хворі перебували у працездатному віці, що вказує на високу соціальну значимість проблеми. Найчастіше дебют захворювання визначено у період від 31 до 40 років (40,2 % випадків). На свербіж, відчуття жару і стягування шкіри скаржилася майже 1/3 пацієнтів. СД у родичів хворих І та II ступенів споріднення встановлено у 23,2 % випадків. У більшості хворих (94,6 %) визначено I і II фототип шкіри. Серед причин загострення дерматозу 61,6 % пацієнтів відзначали зміни пори року (частіше взимку і ранньою весною, рідше восени) і кліматичних умов (кондиціонування повітря, підвищена вологість), 21,4 % – нервовий стрес, порушення сну, 17,9 % – порушення дієти та ін. Більшість хворих (87,5 %) вказували на зникнення висипань чи значне покращення стану шкіри влітку. Достатньо вживали продукти, багаті вітаміном D3, тільки 12,5 % пацієнтів, вітаміном D2 – 33,0 % хворих. Влітку носили закритий одяг 37,5 % хворих, відпочивали щороку та засмагали 24,1 % пацієнтів.
Супутні захворювання встановлено у 67,9 % хворих на СД. Найчастіше зустрічалися захворювання органів травлення (42,9 %), нирок і сечовивідних шляхів (8,9 %), опорно-рухового апарату (8,0 %), нервової системи (5,4 %).
У обстежених дорослих встановлено різноманітні клінічні прояви СД, що пов’язано з локалізацією висипів (волосиста частина голови, обличчя, тулуб та кінцівки), поширеністю шкірного процесу і характером висипань. У дорослих хворих виділяли наступні клінічні форми з урахуванням локалізації з найсильнішою інтенсивністю процесу: СД волосистої частини голови у 30,4 % хворих, СД обличчя у 44,6 % хворих, СД тулуба у 25,0 % хворих (класичний, екзематизований, складок, пітиріазиформний, фолікулярний).
Залежно від переважної локалізації СД нами виділено наступні форми: СД волосистої частини голови – у 20,5 %, СД волосистої частини голови і обличчя – у 35,7 %, СД обличчя – у 18,8 %, СД тулуба – у 25,0 % хворих. Залежно від характеру клінічних проявів виділяли СД незапальний у 20,5 % хворих і СД запальний у 79,5 % хворих.
Використовуючи класифікацію Баконіної Н. В. [4], нами визначено ступінь тяжкості СД: легкий (ізольовані, обмежені ураження чи осередки до 5 % площі чи лупа) – у 34,8 %, середньотяжкий (помірний – не більше 5 осередків з площею ураження від 5 до 15% чи ураженням волосистої частини голови за типом асбестовидного лишаю) – у 48,2 %, тяжкий (багатоосередкове ураження з площею понад 15%) – у 17,0 % хворих. При легкому ступені тяжкості SDASI склав 5,4±0,8 бала, помірному – 12,1±1,5 бала, тяжкому – 17,5±2,1 бала. У хворих з легким ступенем тяжкості інтенсивність свербежу склала 0,75±0,11 бала, помірним – 1,81±0,32 і тяжким – 2,50±0,47 бала.
Вивчення статусу вітаміну D у хворих на СД здійснювалося за рівнем 25(OH)D у крові як кращого показника статусу, поскільки відображає сумарну кількість вітаміну D, що синтезується у шкірі та отримується з продуктів харчування і харчових добавок, та має достатньо тривалий період напіврозпаду у крові. Проведене дослідження рівня 25(OH)D у 68 пацієнтів з СД визначило його суттєве зменшення (в 1,9 рази) порівняно з показником контрольної групи і свідчить про порушення статусу вітаміну D. Нормальний вміст 25(OH)D виявлено у 7,3 % хворих, недостатність вітаміну D – у 61,8 % і дефіцит вітаміну D у 30,9 % пацієнтів. У контрольній групі нормальний вміст транспортної форми вітаміну D встановлено у 63,6 % осіб, недостатність – у 27,3 % осіб і дефіцит – у 9,1 % осіб.
Дефіцит вітаміну D визначається як концентрація 25(ОН)D < 50 нмоль/л, недостатність – концентрація 25(ОН)D від 50 до 75 нмоль/л, адекватні рівні – більше 75 нмоль/л. Рекомендовані цільові значення 25(ОН)D для корекції дефіциту вітаміну D –75-150 нмоль/л [18, 147].
Численні клітини мають рецептори до вітаміну D, а в деяких тканинах присутня власна 1α-гідроксилаза для утворення активної форми D-гормону, і вони можуть локально генерувати високі внутрішньоклітинні концентрації 1,25(OH)2D для своїх власних цілей функціонування без збільшення його концентрації в загальному кровотоці. Кератиноцити експресують високий рівень 1α-гідроксилази. Продукт ферменту, кальцитріол (1,25(OH)2D), сприяє in vitro диференціюванню кератиноцитів. У мишей, які не мають цього ферменту, відбувається зниження інволюкрину, філагрину і лорикрину – маркерів диференціювання кератиноцитів, необхідних для формування шкірного бар’єру [17, 118, 121, 149, 151, 216].
Дефіцит D-вітаміну при СД грає патогенетичну роль, на що вказує зв’язок з клінічними проявами. При недостатності вітаміну D у хворих переважав СД помірного ступеня тяжкості (61,1 %), незапальні прояви (66,7 %) та залучення у процес волосистої частини голови або обличчя (83,3 %), рідше визначення грибів роду Malassezia на шкірі волосистої частини голови (16,7 %) порівняно з клінічними проявами у хворих з дефіцитом вітаміну D, при цьому визначено у більшості випадків тяжкий ступінь тяжкості (71,4 %), запальні прояви хвороби (95,2 %), ураження декількох зон – обличчя і волосистої частини голови, тулуба (100,0 %), дріжджоподібні гриби Malassezia на шкірі волосистої частини голови (57,1 %). Середнє значення SDASI у групі пацієнтів з дефіцитом вітаміну D в 4,8 раза перевищувало показник у хворих з недостатністю вітаміну D [56, 57].
У пацієнтів із запальними проявамии дерматозу вміст 25-гідроксивітаміну D понижувався в 2,3 рази, тоді як у хворих з незапальними проявами дерматозу – тільки в 1,4 рази. Зменшення рівня кальцидіолу втричі визначено при тяжкому ступені з багатоосередковим ураженням шкіри понад 15% поверхні, що майже дорівнювало такому при вираженому дефіциті вітаміну D [8, 110].
Вітамін D є важливим регулятором імунітету шкіри в доповнення до своєї ролі в гомеостазі кальцію і кісткового метаболізму. Кальцитріолом регулюється декілька функцій шкіри, серед яких проліферація кератиноцитів, інгібіція та стимуляція їх диференціювання, у тому числі проникність шкірного бар’єру, формування і стимулювання вродженого імунітету. Нещодавно показано, що вітамін D грає роль у патогенезі атопічного дерматиту через його імуномодулюючі властивості [200, 223]. Залежно від концентрації, вітамін D може стимулювати або інгібувати диференціювання кератиноцитів і стимулювати синтез білків (філагрин), необхідних для формування рогового шару. Встановлено значно понижене імунне фарбування LL-37 при гострих і хронічних проявах атопічного дерматиту порівняно з псоріатичними ураженнями шкіри [193, 229].
Відкриття рецепторів кальцитріолу у багатьох клітинах імунної системи, а також здатність мононуклеарних фагоцитів до продукції 1,25(ОН)2D є доказом участі вітаміну D у функціонуванні імунної системи. При взаємодії кальцитріолу з вітамін-D-рецепторами відбувається стимуляція експресії генів АМП. Дослідження in vitro доводять, що кальцитріол індукує в кератиноцитах експресію АМП широкого спектру дії, природніх антибіотиків, активних відносно багатьох бактерій, вірусів та грибів [10, 122, 133, 214].
Дослідження in vitro припускають, що кателіцидин грає роль у захисті шкіри від дерматофітів та M. furfur [212]. Саме тому адекватне забезпечення організму вітаміном D відіграє важливу роль в попередженні мікробної інвазії, недостатність – персистенції інфекційних агентів [189, 215].
Тепер етіологію та патогенез СД пов’язують з активацією симбіонтної грибкової, мікробної флори та її антигенною роллю [3, 66, 212]. В якості провідного етіологічного чинника розглядають дріжджоподібні ліпофільні гриби роду Malassezia, які є постійним компонентом мікрофлори шкіри більш ніж у 90 % населення. При поєднанні ряду ендогенних і екзогенних чинників організм втрачає здібність контролювати ріст дріжджоподібних грибів і утримувати їх в сапрофітному стані.
Інфекційний характер процесу при СД свідчить про порушення імунної системи, в першу, чергу вродженого імунітету, забезпечує розпізнавання і елімінацію мікроорганізмів в перші години їх вторгнення і вироблення сигналів, що обумовлюють формування адаптивного імунітету [37, 71, 131, 176]. Першу лінію захисту організму забезпечують АМП – кателіцидини, дефензини, дерміцидин та ін. [1, 2, 75, 133, 174]. АМП є неспецифічними факторами гуморального імунітету, володіють ендотоксин-нейтралізуючою та імуномодулюючою активністю, а також забезпечують захист проти широкого спектра мікроорганізмів. Результати останніх досліджень вказують на можливу роль АМП у патогенезі хронічних запальних дерматозів (атопічний дерматит, розацеа, супуративний гідраденіт) [200], однак роботи з вивчення кателіцидину крові як фактора вродженого імунітету при СД відсутні.
Проведене дослідження рівня кателіцидину у сироватці крові 68 хворих на СД визначило його зменшення в 1,6 рази у хворих порівняно з показником контрольної групи (р < 0,01). Кількісний рівень пониження кателіцидину не залежав від статі та віку хворих, локалізації процесу і тривалості дерматозу, однак виявився пов’язаним із ступенем тяжкості, локалізацією захворювання. Вміст LL-37 зменшувався в 2,6 рази при тяжкому перебігу захворювання порівняно з таким у здорових осіб та достовірно відрізнявся від значення показника у хворих з легким і помірним ступенем тяжкості СД (р < 0,05). Ступінь зменшення рівня кателіцидину крові хворих СД може бути маркером клінічного перебігу дерматозу [9, 55, 63]. При рецидивах дерматозу більше двох разів на рік вміст LL-37 понижувався в 1,86 рази у хворих порівняно з показником у пацієнтів з рецидивами двічі раз на рік.
Негативний кореляційний зв’язок кателіцидину і гідроксивітаміну D у хворих на СД підтверджує залежність синтезу АМП від дефіциту вітаміну D.
Порушення епідермального бар’єру при деяких дерматозах призводить до високої колонізації і / або вторгнення мікробних агентів, при цьому LL-37 грає роль місцевого чинника раннього захисту, оскільки у відповідь на інфекцію або ушкодження активується ген hCAP-18 [154]. Показано, що при атопічному дерматиті порушується продукція АМП кератиноцитами, що може лежати в основі персистенції інфекції, зумовленої S. aureus, Candida spp., Malassezia spp. [134]. Псоріаз і розацеа, навпаки, характеризуються надмірною експресією кателіцидину, який, як вважають, поєднує в цьому випадку ефекторні і дисрегуляторні функції [208].
Пониження рівня кателіцидину у хворих на СД, ймовірно, обумовлює надмірну колонізацію шкіри ліпофільними грибами та їх періодичний перехід з дріжджової в гіфальну форму з розвитком запалення і лущення шкіри, що відбиває наявність імунодефіцитного стану у хворих. На сьогодні недостатньо інформації про роль АМП, зокрема, LL-37, в захисті від дерматофітних інфекцій або інфекції Malassezia furfur. Висловлена гіпотеза, згідно якої грибкові інфекції шкіри у різних організмів можуть залежати від експресії АМП. Ймовірно, протигрибковий ефект кателіцидину відбувається на поверхні шкіри, на відміну від глибоких грибкових інфекцій, коли залучаються інші імунні ефектори [212].
Зниження рівня кателіцидину при СД може бути однією з причин підвищеної сприйнятливості до грибів роду Malassezia і свідчить про дефект вродженої системи імунітету, а також потребує терапевтичної корекції.
Система вродженого імунітету діє не тільки за допомогою гуморальних факторів (АМП, комплемент, хемокіни), а й клітинних (макрофаги, нейтрофіли, дендритні клітини і т. д.). Значною мірою фагоцитоз здійснюється за участю нейтрофілів. Нейтрофіли, володіючи потужним цитотоксическим потенціалом, виключної реактивністю і високою мобілізаційною готовністю, виступають в першій лінії ефекторних механізмів імунологічного гомеостазу [22].
Відомо, що основною ланкою імунодепресії при грибковій інфекції є неспроможність клітинного імунітету і, в першу чергу, нейтрофілів [35, 43]. На сьогодні, незважаючи на інтенсивне вивчення впливу змін функціонального стану імунної системи в патогенезі СД, відкритим залишається питання про участь факторів фагоцитарного ланки імунітету, а саме нейтрофілів, у формуванні дерматозу.
Фагоцитарна дисфункція визначена у 81,8 % хворих на СД проти 9,1 % осіб контрольної групи. Встановлено розлади (пониження) функціональної активності нейтрофілів з порушенням метаболічного потенціалу і функціонального резерву клітин та формування депресії нейтрофільних фагоцитів.
Достовірне одночасне пониження значень ФІ (на 70 %) та ФЧ (на 38 %) свідчить про скорочення кількості нейтрофілів з функціями фагоцитів та помірне ослаблення здібності нейтрофілів до поглинання мікроорганізмів у хворих на СД [52]. Активація спонтанного НСТ-тесту (на 35 %), імовірно, обумовлена антигенною стимуляцією поліморфноядерних лейкоцитів в умовах колонізації шкіри M. furfur, і вказує на посилення при СД кілінгової функції нейтрофілів. Основа цієї функції – кисеньзалежна цитотоксичність, пов’язана з утворенням активних форм кисню («респіраторний вибух» у клітинах). Посилення кисеньзалежного метаболізму, який забезпечує появу в клітині активних форм кисню та біоокислювачів з сильною бактерицидною дією (тобто збереження здібності нейтрофілів до завершеного фагоцитозу), відбувалося у хворих з легким ступенем тяжкості, терміном хвороби до 5 років, рецидивами один раз на рік.
Пониження на 33% індукованого НСТ-тесту в цілому у хворих є проявом помірного пригнічення активності нейтрофільноих гранулоцитів. Нейтрофіли не в змозі метаболізувати свій ефекторний потенціал за рахунок продукції активних форм кисню, мабуть, через пригнічення метаболізму імунокомпетентних клітин та їх біоенергетичних ресурсів. Одночасне зменшення показників спонтанного та індукованого НСТ-тесту у хворих з тяжким ступенем дерматозу і тривалим, часто рецидивуючим перебігом вказує на глибоке ураження бактерицидних систем фагоцитів [53, 54]. Пониження фагоцитарної активності може спричинити хронізацію запального процесу, часті рецидиви і посилену проліферацію M. furfur.
Дана статистична оцінка взаємозв’язків клініко-лабораторних показників на базі кореляційно-регресійного методу аналізу, розроблено дві регресійні моделі для прогнозування перебігу дерматозу на підставі виділення прогностично значимих клінічних (SDASI) та лабораторних показників (кателіцидин, ФЧ, 25(ОН)D).
Багатоплановість патогенезу обумовлює необхідність вивчення різних аспектів дерматозу. Значимим фактором ризику СД є патологія органів ШКТ – гастрит, дуоденіт, гастроезофагальна рефлюксна хвороба, виразкова хвороба шлунка і дванадцатипалої кишки, що супроводжуються дисбактерізом кишечника [65, 138]. Установлено, що дефіцит вітаміну D є додатковим некласичним фактором ризику розвитку дисбактеріозу (шкіри, слизових оболонок рота, кишечника, генітального тракту) [21, 97, 164].
Багатьма клінічними дослідженнями доведено істотний вплив порушень мікробіоценозу кишечника на перебіг деяких шкірних хвороб (атопічний дерматит, акне, мікробна екзема, вітиліго), при цьому вираженість дисбіотичних відхилень корелює з поширеністю і тяжкістю шкірного процесу [41, 82, 84]. В науковій літературі є декілька робіт, у яких зміни складу мікрофлори товстого кишечника вважаються одним з факторів розвитку СД [28, 65]. Досі недостатньо вивчені показники екологічної характеристики цього важливого мікробіоценозу, стан якого можна розглядати як індикатор здоров’я людини.
Мікрофлора виконує ряд важливих функцій як на місцевому, так і на системному рівнях, і можна сказати, що основна їх частина здійснюється за участю її метаболітів у різних біологічних процесах макроорганізму [48]. Нормальний склад кишкової мікрофлори може бути тільки при нормальному фізіологічному стані організму – як тільки в організмі відбуваються патологічні зміни, змінюється склад і властивості кишечної мікрофлори, порушуються її локальні і системні функції. Системна стимуляція імунітету – одна з важливих функцій мікробіоти, при її відсутності відбувається інволюція імунокомпетентних органів.
У 39,7 % пацієнтів з СД визначено клінічні прояви дисбактеріозу. Необхідно відзначити, що 65,4 % пацієнтів до обстеження не зважали на стан кишечника. Разом з тим, при проведенні цілеспрямованого опитування з’ясовані характерні клінічні прояви: дискомфорт або несильні ниючі, тупі регулярні болі у животі – у 27,9 %, метеоризм – у 16,2 %, помірні порушення випорожнення у вигляді послаблення у 14,7 % або закрепу у 22,1 %, їх чергування у 10,3 % хворих.
В результаті проведених досліджень мікробіоценозу товстого кишечника (бактеріологічного дослідження фекалій) до лікування виявлені порушення у 76,5% хворих на СД, у 23,5 % показники залишалися в межах норми (еубіоз) [62]. Дісбіотичні порушення характеризувалися зміною співвідношення між анаеробною і аеробною мікрофлорою, зниженням кількісного вмісту індигенної мікрофлори – представників як аеробних, так і анаеробних бактерій. У всіх пацієнтів відмічено зниження різної міри (на 1-3 порядки) кількості біфідобактерій і лактобактерій. Окрім цього, відмічено зниження показника висіваємості нормальної кишкової палички у 94,2 % пацієнтів.
На тлі якісного дисбалансу мікрофлори також були виявлені зміни кількісного складу: у 25,0 % обстежених виявлена кишкова паличка з гемолітичними властивостями, лактозонегативна – у 9,6 % хворих, протей вульгарний – у 7,7 %. Звертає на себе увагу частота виявлення грибів роду Candida – у 36,5 % обстежених відповідно. Отримані результати є бактеріологічними ознаками дисбактеріозу товстої кишки.
Так, дисбактеріоз I ступеня виявлено у 34,6 %, II ступеня – у 48,1%, III ступеня – у 17,3% обстежених хворих. Перший ступінь (латентна фаза) дісбіозу виявлявся лише зниженням на 1-2 порядки кількості захисної мікрофлори – біфідобактерій до 108-107 КУО/г, лактобактерій до 106-105 КУО/г, а також повноцінних (типових) кишкових паличок до 106-105 КУО/г. Останні показники відповідали фізіологічній нормі (не виявлено представників умовно-патогенної флори). Як правило, початкова фаза не викликає дисфункцій кишечника і виникає як реакція організму практично здорової людини на дію несприятливих чинників, таких як, наприклад, порушення режиму харчування і ін. Клінічних проявів дисбактеріозу у хворих не визначено.
II ступінь дисбіозу характеризувався вираженим дефіцитом біфідобактерій (до 107 КУО/г і нижче) на фоні зменшеної кількості лактобацил (до 105 КУО/г і нижче), дисбалансом у кількості і якості кишкових паличок, серед яких збільшується частка лактозонегативних варіантів. При цьому на тлі дефіциту захисних компонентів кишкового мікробіоценозу відбувається розмноження або стафілококів епідермальних, або грибів роду Candida (105-106 КУО/г). Функціональні розлади травлення виражені невиразно (періодічно рідкий стул зеленуватого кольору з неприємним запахом, інколи, навпаки, закреп).
III ступінь характеризувався пониженням вмісту біфідобактерій до 105-6 и нижче КУО/г, лактобактерій до 104-5 и нижче КУО/г, виразним наростанням вмісту агресивних мікроорганізмів, при цьому розмножуються гемолітичні ентерококи, спостерігається заміщення повноцінних ешерихій бактеріями родів Enterobacter, цитробактер та ін. Ця фаза дисбактеріозу виявляється дисфункцією кишечника з розладами моторики, секреції ферментів і всмоктування. У хворих визначається прискорений розріджений стул, часто зеленого кольору, зниження апетиту, погіршення самопочуття.
Аналіз складу товстокишечної флори за наявністю відхилень від норми у хворих на СД з урахуванням ступеня тяжкості дерматозу виявив зменшення кількості біфідобактерій і лактобактерій приблизно у 1/3 хворих з легким ступенем тяжкості дерматозу (відповідно 23,8 і 38,1%), майже в усіх хворих з помірним і тяжким перебігом хвороби (біфідобактерій – відповідно 92,9 і 100,0 %, лактобактерій – 96,4 і 100,0 %). Зміни відбувалися і відносно рівня кишкової палички (пониження E. coli типових у 19,1 % хворих з легким ступенем тяжкості і майже у 100% випадків помірного і тяжкого дерматозу, підвищення E. coli лактозонегативних – у 17,9 % випадків помірного ступеня тяжкості, збільшення кількості ешерихій гемолітичних – у 14,3 % випадків помірного і 47,7 % – тяжкого СД). Частота визначення підвищеного рівня ентеробактера була майже вдвічі більшою при тяжкому перебігу (84,2 %) порівняно з таким при помірному ступені тяжкості (42,9 %), цитробактера – максимальною при тяжкому дерматозі (94,7 %) і тільки у 21,4 % хворих з помірним ступенем тяжкості хвороби. При тяжкому СД кількість сапрофітного (епідермального) стафілокока і дріжджоподібних грибів Сandida виявилася збільшеною у 63,2 і 73,7 % хворих, протею – у 21,1% пацієнтів.
При легкому ступені тяжкості СД виявлено еубіоз у більшості (76,2 %) хворих і дисбактеріоз I ступеня – у 23,8 % пацієнтів, при помірному і тяжкому СД – майже порівну встановлено дисбіоз I (46,4 %) і II (53,7 %) ступеня, при тяжкому – частіше III (36, 8%) , ніж II (63,2 %) ступеня. Установлена достовірна залежність вираженості дисбактеріозу кишечника від ступеня тяжкості перебігу дерматозу пояснюється суттєвими загальними порушеннями мікробного балансу і гомеостазу у пацієнтів з СД.
Аналіз якісного складу мікрофлори товстого кишечника в залежності від тривалості захворювання дозволив виявити пониження кількості індигенної мікрофлори та збільшення обсіменіння умовно-патогенними мікроорганізмами з подовженням тривалості дерматозу.
Дефіцит товстокишечних біфідобактерій і лактобацил у хворих на різні клінічні прояви СД вказує на важливу роль облігатної флори в патогенезі захворювання. Аналіз якісного і кількісного складу мікрофлори кишечника дозволив виявити залежність ступеня тяжкості СД від ступеня мікробіологічних порушень, клінічної форми і тривалості дерматозу. Суттєві відхилення від норми в складі кишкової мікрофлори при СД можуть бути обумовлені стресами, негативним впливом оточуючого середовища, неправильним харчуванням, змінами загальних і місцевих захисних реакцій. Дефіцит нормофлори посилюється тим, що обтяжує СД і обумовлює тривалий, рецидивуючий перебіг, торпідность до лікування. Все це визначає значимість проблеми терапевтичної корекції змін мікробіоценозу кишечника.
Установлені у хворих на СД деякі клініко-лабораторні особливості – загострення дерматозу в 75,9 % випадків у холодний період року, зникнення висипів чи значне покращення стану шкіри влітку у 87,5 % хворих, недостатнє споживання продуктів, багатих вітаміном D2 і D3, 63,4 % хворими, закритий одяг влітку майже у 1/3 хворих, щорічний відпочинок та засмага у 24,1 % пацієнтів, супутні захворювання органів ШКТ і гепатобіліарної системи у 42,4 %, клінічні прояви дисбактеріозу у 65,4 % хворих, пониження майже вдвічі рівня 25(ОН)D, недостатність і дефіцит вітаміну D відповідно у 61,8 і 30,9 % пацієнтів, пониження в 1,6 рази рівня LL-37 у крові та фагоцитарна дисфункція у 81,8 % пацієнтів, дисбактеріоз кишечника у 76,5 % хворих обумовлюють необхідність терапевтичної корекції статусу вітаміну D, дисбіозу кишківника і опосередковано факторів вродженого імунітету.
Виявлення протизапальної та імуносупресорної активності вітаміну D відкрило нові можливості терапевтичного застосування даної речовини та її аналогів для контролю запальних захворювань шкіри, імовірно пов’язаних з гіперпродукцією цитокінів (псоріаз, атопічний дерматит, кропив’янка, склеродермія) [4, 104, 134, 170]. Ліганди рецептора вітаміну D зменшують рівень експресії прозапальних цитокінів та надають терапевтичний ефект при багатьох запальних шкірних захворюваннях.
Останні дослідження показують, що кератиноцити мають рецептори вітаміну D, які пригнічують проліферацію і стимулюють диференціювання клітин епідермісу, дефіцит вітаміну призводить до аномального формування шкірного бар’єру, експресії АМП та дефіциту імунного захисту [217]. Відомо, що при рівні 25(ОН)D менш 49,9 нмоль/л, імунна відповідь на ліпополісахариди або мікобактерій туберкульозу не ініціюється [189].
Заповнення дефіциту вітаміну D за допомогою препаратів вітаміну D у даний час є практично необхідною умовою досягнення і підтримання нормальної концентрації 25(OH)D в сироватці крові. Згідно з рекомендаціями міжнародних експертів, для профілактики і лікування дефіциту вітаміну D застосовується холекальциферол, або вітамін D3, рідше використовуються препарати ергокальциферолу, вітаміну D2 [18, 147, 227]. Препарати нативних вітамінів D2 і D3 належать до лікарських засобів, які безпечні і найкраще переносяться, їх застосування доцільно головним чином при 1-ому типі D-дефіциту. Рекомендованим препаратом для лікування дефіциту вітаміну D є холекальциферол (вітамін D3), тому що має порівняно більшу ефективність у досягненні і збереженні цільових значень 25(OH)D у сироватці крові.
Вибір оптимальної дози вітаміну D залежить від вихідної концентрації 25(OH)D в сироватці крові. Розрахунок щоденної дози вітаміну D3 проводили в залежності від вихідної концентрації 25(OH)D згідно розробленій Garland з співавт. (2011) [227] схемі, при цьому дози повністю відповідали рекомендованим Міжнародним ендокринологічним товариством. Для корекції рівня вітаміну D (при недостатності) хворі на СД отримували колекальциферол по 2000 МО 1 раз на добу протягом 6 тижнів, при дефіциті вітаміну D – 3500 МО 1 раз на добу протягом 8 тижнів з переходом на 1500 МО протягом 4 тижнів для підтримки досягнутої концентрації вітаміну D у крові. Вітамін D призначали під час загострення в холодну пору року (з листопада по березень) на фоні комплексної традиційної терапії [51, 58, 59, 60, 61, 109].
Виявлені порушення резистентності колонізації кишкового біотопу у хворих на СД, пов’язані із зміною складу постійної мікрофлори і заселенням умовно-патогенними мікроорганізмами, пов’язані з клінічними проявами та розладами вродженого імунітету, потребують терапевтичної корекції одночасно з усуненням причини дисбіозу, дотримання дієти.
Велике значення в даній ситуації набувають пробіотики, що нормалізують стан і баланс мікрофлори кишечника, відновлюють напруженість імунітету і нормалізують імунну відповідь. Згідно з результатами досліджень генетичних впливів, встановлено, що дія пробіотиків пов’язана з наступними доведеними ефектами: взаємодією з місцевою (резидентної) мікрофлорою і продукцією бактеріоцинів – АМП, взаємодією з клітинами організму господаря – імуноцитами [185, 157, 195].
Для стабілізації резистентності слизової оболонки, нормалізації імунної відповіді при СД показано включення до лікувального комплексу мікробіологічної (пробіотичної) терапії, яка підвищує можливості системи мікробіоценозу до самовідновлення, що проявляється підвищенням ступеня домінування нормофлори і пониженням значимості в екосистемі умовно-патогенної флори [19, 108, 115, 209]. Багатофакторний механізм терапевтичної ефективності пробіотиків включає, поряд з коригуючим впливом на мікробіоценоз, нормалізацію діяльності багатьох органів та систем макроорганізму, стимуляцію репаративних процесів в уражених тканинах, посилення імунореактивності і загальної неспецифічної резистентності організму.
Ефекти впливу пробіотиків на організм можна умовно розділити на три великі групи: ефекти загального характеру – синтез ферментів, вітамінів та антиоксидантів, активація MALT-системи, модуляція відповіді Th1/Th2, контроль потенційно патогенних мікробів, пониження продукції ендотоксинів; гуморальні ефекти – пригнічення синтезу Ig E, стимуляція продукції Ig A, бактеріоцинів (дефензини, кателіцидини), утворення NO, модулювання цитокінової відповіді; клітинні ефекті – стимуляція роботи макрофагів, сприяння росту і регенерації клітин, фізіологічному апоптозу [48, 112, 157, 195]. Бактерії коменсали визначають дифференціювання Т-супресорів в пейєрових бляшках, грають величезну роль у формуванні харчової толерантності, впливаючи на баланс Тh1/Th2 лімфоцитів. Причому ключову роль у даному процесі грають лактобактеріі [19, 47].
Особливе місце в дерматологічній практиці посідають пробіотики, що містять бактерію Lactobacillus rhamnosus, штам GG (LGG), зважаючи на широкий перелік позитивного впливу, добру переносимість і відсутність побічних ефектів. Lactobacillus rhamnosus на сьогоднішній день є найбільш вивченою бактерією (на основі кількості опублікованих статей в наукових джерелах) [88, 108]. Ефекти і безпека цього пробіотика доведено численними дослідженняит, проведеними у тварин, а також у людиги. LGG мають високу активність проти широкого спектра патогенних і умовно-патогенних мікроорганізмів, вірогідно підвищують колонізаційну резистентність, що включає в себе як запобігання адгезії патогенів до стінки кишечника, так і перешкоду транслокації патогенів [127, 209].
В літературі (більше 400 наукових робіт) описано цілий ряд позитивних ефектів LGG на організм людини та їхня роль у профілактиці ряду станів. Особливе місце в науковій літературі займає вивчення впливу LGG на імунну відповідь [88, 128]. В останні роки проводилися рандомізовані плацебо-контрольовані дослідження, їх результати показали, що застосування мультиштамових пробіотиків, які містять L. rhamnosus GG, сприяє: підвищенню активності фагоцитів завдяки посиленню експресії на поверхні цих клітин рецепторів CR1, CR3, FcyRIII і FCaR, що полегшує розпізнавання ними патогенів; посиленню продукції ІЛ-12 і ІЛ-15, які є ключовими цитокінами для дозрівання і активації природних кілерів; підвищенню рівня сироваткового Ig A через вплив пробіотичної флори на лімфоїдну тканину GALT; зниженню активності СД4+-лімфоцитів і продукції прозапальних цитокінів, у тому числі ФНП α [26, 30, 222].
Одним з основних механізмів дії пробіотиків вважається їхня конкурентна взаємодія з патогенною мікрофлорою, що приводить до модуляції імунної відповіді [108, 115, 164]. Бактеріоцини, що включають кателіцидін LL-37 і дефензин, перешкоджають прикріплення та інвазії бактерій через слизову оболонку ШКТ [48]. Крім безпосереднього синтезу цих сполук пробіотики посилюють експресію кателіцидіну слизовою оболонкою товстої кишки. LGG пригнічує рост деяких грампозитивних і грамнегативних бактерій шляхом синтезу молочної кислоти, перекису водню і піроглутамату [115].
Для корекції дисбіотичних порушень при СД рекомендували пацієнтам синбіотик ДермаПро, який складається з пробіотика (лактобактерії) та пребіотика (фруктоолігосахарид). LGG в кількості 1,5 млрд. КУО попереджує розмноження патогенних мікроорганізмів у кишечнику, сприяє відновленню балансу користої мікрофлори, усуненню дисбактеріозу і нормалізації травлення. Вони позитивно впливають не тільки на кишечник, але й на організм в цілому, нормалізують імунітет. Бактерії LGG гальмують адгезивні властивості E. coli, пригнічують розвиток у кишечнику багатьох патогенних мікроорганізмів, зокрема Clostridium, Enterobacteriaceae, Pseudomonas, Staphylococcus; сприяють запобіганню виникнення або загострення аллергічних захворювань шкіри. Бактерії LGG виживають в кислому середовищі шлунка і досягають кишечника в необхідній кількості.
Фруктоолігосахариди інуліну є ідеальним живильним субстратом для корисної мікрофлори і сприяють її активному розмноження в травному тракті. Інулін з хімічної точки зору відноситься до групи сполук, що іменуються фруктанами, представляють собою лінійні оліго- і полімери фруктози. Метаболічні ефекти інуліну різноманітні і пов’язані як зі стимуляцією нормальної кишечної мікрофлори, так і прямим впливом на біохімічні процеси в кишечнику [19, 26].
ДермаПро призначали на фоні дієти залежно від ступеня дисбактеріозу (по 1 капсулі протягом 14 днів при I ступені та відсутності клінічних проявів дисбактеріозу, протягом 21 дня – II і III ступені) одночасно з вітаміном D3. При дисбіозі III ступеня за наявності одного або декількох клінічних проявів дисбактеріозу кишечника і за консультацією гастроентеролога для елімінації надмірного росту умовно патогенних мікроорганізмів у перші 5 днів використовували препарати наступних груп: протигрибкові (ністатин 500 000 ОД всередину 3-4 рази чи флюконазол по 200 мг на добу), антибактеріальні (ентерофурил, невіграмон), потім ДермаПро.
Лікування хворих на СД за розробленим методом сприяло підвищенню ефективності терапії (досягнення ремісії та значного покращення) в 1,5 рази порівняно з результатами терапії у хворих, що отримували традиційну терапію. Використання в комплексному лікуванні вітаміну D3 і синбіотика дозволило зменшити кількість рецидивів в 2,7 рази, подовжити період ремісії в 1,8 рази порівняно з аналогічними показниками у хворих при застосуванні традиційних засобів.
Проведене лікування хворих на СД за розробленим і традиційним методами різною мірою сприяло нормалізації лабораторних показників. Результати дослідження свідчать, що пацієнти з СД потребують призначення вітаміну D, під впливом якого відбувається не тільки регрес клінічних проявів у більшості хворих (пониження SDASI в 4,4 рази), а й підвищення на 81 % рівня 25(ОН)D у сироватці крові, в той час як у хворих 2 групи SDASI зменшувався лише в 1,6 рази, а 25(ОН)D майже не змінювався (збільшувався на 10 %). Одним з «некласичних» ефектів D-гормону поряд з гальмуванням клітинної проліферації та ангіогенезу, антибактеріальною і протизапальною дією, є стимуляція продукції АМП. Призначення холекальциферолу і синбіотика підтверджує модулюючий вплив вітаміну D та LGG на функціональний стан вродженого імунітету на підставі достовірного збільшення в 1,95 рази вмісту LL-37 та в 1,6 рази ФІ і в 1,3 рази ФЧ у хворих на СД 1 групи. У пацієнтів, що лікувалися загальновизнаними засобами вміст LL-37 підвищувався недостовірно (на 11 %), значення ФІ та ФЧ (відповідно на 19,0 і 10,0 %), активність НСТ-тесту спонтанного та індукованого не змінювалася порівняно з показниками до терапії. Призначення розробленої терапії обумовило нормалізацію кількісного та якісного складу кишкової мікрофлори у 71,4 % хворих 1 групи і у 9,1 % пацієнтів 2 групи.
Висока ефективність та доступність препаратів, відсутність побічних явищ обгрунтовують доцільність використання засобів, що покращують статус вітаміну D та нормалізують рівень LL-37, клітинних факторів вродженого імунітету, стан мікробіоти кишечника (Аквадетрим Вітамін D3, ДермаПро), в лікуванні хворих на СД і дозволяють їх рекомендувати для впровадження у практику охорони здоров’я.
ВИСНОВКИ
У дисертації наведено теоретичне узагальнення і нове вирішення наукової задачі, що полягає у підвищенні ефективності терапії хворих на СД шляхом розробки комплексного диференційованого методу лікування на підставі вивчення статусу вітаміну D, стану вродженого імунітету та мікробіоценозу кишечника.
1. У зв’язку з високою частотою СД у працездатному віці, загостренням дерматозу у більшості пацієнтів у холодну пору року і ремісією влітку, супутньою патологією органів травлення і наявністю факторів ризику дефіциту вітаміну D майже у половини хворих, неостаточним вивченням патогенезу, актуальним є дослідження рівня 25(ОН)D, факторів вродженого імунітету, складу товстокишкової мікрофлори і розробка методів захворювання.
2. У хворих на СД встановлено порушення статусу вітаміну D за достовірним зниженням у крові рівня транспортної форми вітаміну D в 1,9 рази порівняно з показником у осіб контрольної групи. Нормальний вміст 25(OH)D визначено у 7,3 % хворих, недостатність вітаміну D – у 61,8 % і дефіцит вітаміну D – у 30,9 % пацієнтів. Визначено залежність рівня кальцидіолу від ступеня тяжкості дерматозу.
3. При недостатності вітаміну D у хворих виявлено переважання СД помірного ступеня тяжкості (61,1 %), незапальних проявів (66,7 %) та залучення у процес волосистої частини голови або обличчя (83,3 %), рідше виявлення грибів роду Malassezia на шкірі (16,7 %) порівняно з клінічними проявами у хворих з дефіцитом вітаміну D, при якому у більшості випадків встановлено тяжкий ступінь (71,4 %), запальні прояви хвороби (95,2 %), ураження декількох зон – обличчя і волосистої частини голови, тулуба (100,0 %), дріжджоподібні гриби Malassezia на шкірі (57,1 %). Середнє значення SDASI у пацієнтів з дефіцитом вітаміну D достовірно перевищувало показник у хворих з недостатністю вітаміну D.
4. Порушення вродженого імунітету у пацієнтів з СД характеризуються зменшенням рівня кателіцидину крові у 1,6 рази відносно показника у осіб контрольної групи. Рівень кателіцидину понижувався у 2,6 рази при тяжкому перебігу захворювання порівняно з таким у здорових осіб та достовірно відрізнявся від значення показника у хворих з легким і помірним ступенем тяжкості СД.
5. У хворих на СД встановлено розлади фагоцитарної та функціональної активності нейтрофілів з порушенням метаболічного потенціалу і функціонального резерву клітин, що проявлялися достовірним зменшенням ФІ (у 1,7 рази), ФЧ (у 1,4 рази) та індукованого НСТ-тесту (у 1,3 рази), підвищенням спонтанного НСТ-тесту (у 1,4 рази). Виявлено залежність активності нейтрофілів від ступеня тяжкості дерматозу.
6. У хворих на СД визначено дисбактеріоз товстого кишечника (I ступеня – у 26,5 %, II ступеня – у 36,8 % та III ступеня – у 13,2 %). Мікробіологічні порушення характеризувалися зменшенням чисельності біфідобактерій і лактобактерій, дисбалансом E. coli, збільшенням кількості умовно-патогенної флори (ентеробактер, цитробактер, стафілокок епідермальний, дріжджоподібні гриби Candida). Виявлено залежність ступеня дисбактеріозу кишечника від ступеня тяжкості дерматозу.
7. Розроблено комплексний метод лікування хворих на СД з використанням вітаміну D3 (Аквадетрим Вітамін D3) і синбіотика (ДермаПро), які забезпечують підвищення ефективності терапії (досягнення клінічної ремісії та значного покращення) відповідно у 88,6 % хворих порівняно з 57,6 % при традиційному лікуванні, зменшують кількість рецидивів у 2,7 рази, подовжують ремісію у 1,8 рази відносно аналогічних показників у хворих при застосуванні традиційних засобів. Лікування за розробленим методом дозволило нормалізувати рівень 25(ОН)D і LL-37, посилити активність нейтрофілів, досягти нормалізації або значного покращення складу кишкової мікрофлори у 88,6 % хворих. При застосуванні традиційних засобів терапії достовірно не змінювалися вміст вітаміну D і кателіцидину (збільшувалися в 1,1 рази), показники функціональної активності фагоцитів (підвищувалися ФІ у 1,2 рази, ФЧ – в 1,1 рази), показники мікробіоценозу кишечника покращились або нормалізувались у 27,3 % пацієнтів.
РЕКОМЕНДАЦІЇ
1. Для оцінки забезпеченості організму хворих на СД вітаміном D необхідно проводити визначення вмісту 25(OH)D у крові у зв’язку з наявністю факторів, що сприяють розвитку його недостатності (51-74 нмоль/л) чи дефіциту (менше 50 нмоль/л) і несприятливим впливом на перебіг дерматозу.
2. В комплексне обстеження хворих на СД доцільно включати дослідження стану мікрофлори товстого кишечника для визначення факторів, що обтяжують перебіг захворювання, а також вибору терапевтичного засобу.
3. Для корекції рівня вітаміну D хворим на СД рекомендується призначати холекальциферол по 2000 МО 1 раз на добу протягом 6 тижнів (при недостатності вітаміну D), по 3500 МО 1 раз на добу протягом 8 тижнів з переходом на 1500 МО протягом 4 тижнів (при дефіциті вітаміну D). Вітамін D доцільно застосовувати в холодну пору року (з листопада по березень) на фоні комплексної традиційної терапії.
4. Одночасно із прийомом вітаміну D3 рекомендується призначати синбіотик залежно від ступеня дисбактеріозу (ДермаПро по 1 капсулі протягом 14 днів при I ступені та відсутності клінічних проявів дисбактеріозу, протягом 21 дня – II і III ступені після елімінації надмірного росту умовно патогенних мікроорганізмів).
5. Розроблені регресійні моделі дозволяють прогнозувати ступінь тяжкості СД на підставі виділення прогностично значимих клінічних (SDASI) та лабораторних показників (кателіцидин, ФЧ, 25(ОН)D).
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
1. Абатуров А. Е., Завгородняя Н. Ю. Витамин-D-зависимая продукция антимикробных пептидов. Здоровье ребенка. 2012. № 1. С. 105-111.
2. Азимова В. Т., Потатуркина-Нестерова Н. И., Нестеров А. С. Эндогенные антимикробные пептиды человека. Современные проблемы науки и образования. 2015. № 1. URL: www.science-education.ru /121-17746.
3. Альбанова В. Малассезия: роль при себорейном дерматите и акне. Эстетическая медицина. 2017. № 4. С. 495-502.
4. Баконина Н. В. Особенности клиники, течения и иммуноморфологических показателей у больных себорейным дерматитом: автореф. дис. … канд. мед. наук: 14.00.11 / ГОУ ВПО «Московский государственный медико-стоматологический университет» Федерального агентства по здравоохранению и социальному развитию, ГУ «Центральный научно-исследовательский кожно-венерологический институт Федерального агентства по высокотехнологичной медицинской помощи». М., 2007. 19 с.
5. Бекирова Э. Ю. Влияние витамина D на синтез цитокинов, индуцированными мононуклеарными лейкоцитами у пациентов с псориазом с D-дефицитом. Таврийский медико-биологический журнал. 2013. Т. 16. С. 22-24.
6. Белоусова Т. А., Горячкина М. А., Катранова Д. Г. Себорейный дерматит волосистой части головы: современные представления об этиологии, патогенезе и терапии. Вестник дерматологии и венерологии. 2013. № 6. С. 132-138.
7. Белоусова Т. А., Горячкина М. В. Топические стероиды в современной клинической практике. Вестник дерматологии и венерологии. 2014. № 4. С. 83-88.
8. Болотна Л. А., Нарожна М. В. Статус вітаміну D у хворих на себорейний дерматит. Медицина сьогодні і завтра. 2017. № 2 (75). С. 78-83.
9. Болотная Л. А., Нарожная М. В. Роль кателицидина LL-37 при себорейном дерматите. Дерматологія та венерологія. 2018. № 1 (79). С. 16-20.
10. Болотная Л. А., Нарожная М. В. Себорейный дерматит: современные представления о патогенезе. Міжнародний медичний журнал. 2015. № 1 (81). С. 96-99.
11. Будихина А. С., Макаров Е. А., Пинегин Б. В. Применение проточной цитометрии для оценки противомикробной активности кателицидина LL-37. Иммунология. 2011. Т. 32. № 1. Р. 35-37.
12. Буравкова А. Г., Новикова Л. А., Демьянова О. Б. Современные подходы к наружной терапии себорейного дерматита. Российский журнал кожных и венерических болезней. 2012. № 2. С. 26-28.
13. Виксман М. Е., Маянский А. Н. Способ оценки функциональной активности нейтрофилов человека по реакции восстановления нитросинего тетразолия: метод. рекомендации. Казань: Казанский НИИЭМ, 1979. 11 с.
14. Витамин D и мочекаменная болезнь / С. Ю. Калинченко, Е. А. Пигарова, Д. А. Гусакова, А. В. Плещева. Consilium Medicum. 2012. Т. 14. № 12. С. 97-102.
15. Витебская А. В., Смирнова Г. Е., Ильин А. В. Витамин D и показатели кальций-фосфорного обмена у детей, проживающих в средней полосе России, в период максимальной инсоляции. Остеопороз и остеопатии. 2010. № 2. С. 4-9.
16. Галлямова Ю. А. Теоретические и практические аспекты применения препаратов серы в дерматологии. Лечащий врач. 2017. № 9. С.44-47.
17. Громова О. А., Торшин И. Ю. Витамин D – смена парадигмы. М.: ГЭОТАР-Медиа, 2017. 750 с.
18. Дефицит витамина D у взрослых: диагностика, лечение и профилактика: клинические рекомендации. М., 2015. 75 с.
19. Дисбиоз (дисбактериоз) кишечника: современное состояние проблеми, комплексная диагностика и лечебная коррекция / М. Д. Ардаматская, С. В. Бельмер, В. П. Добрица и др. Экспериментальная и клиническая гастроэнтерология. 2015. Т. 117, № 5. С. 13–50.
20. Дифференцированный подход к терапии себорейного дерматита с локализацией на волосистой части головы / Л. С. Круглова, О. В. Жукова, Е. С. Понич, А. М. Бабушкин. Клиническая дерматология и венерология. 2015. Т. 14. № 6. С. 74-80.
21. Жемела Н. И. Дефицит витамина D у женщин с угрозой прерывания беременности и бактериальным вагинозом. Международный медицинский журнал. 2015. № 2. С. 39-42.
22. Ермолаева Е. И., Виноградова Т. В., Пампура А. Н. Содержание антимикробных пептидов в сыворотке у детей с атопическим дерматитом. Российский вестник перинатологии и педиатрии. 2015. № 4. С. 89-92.
23. Значение дефицита витамина Д в развитии заболеваний человека / С. В. Реушева, Е. А. Паничева, С. Ю. Пастухова и др. Успехи современного естествознания. 2013. № 11. С. 27-31.
24. Калинина О. В., Евстафьев В. В., Альбанова В. И. Терапия себорейного дерматита волосистой части головы. Российский журнал кожных и венерических болезней. 2014. № 2. С. 48-53.
25. Камышников В. С. Клинические лабораторные тесты от А до Я и их диагностические профили. М.: МЕДпресс-информ, 2007. 320 с.
26. Карлос Лифшиц, Захарова И. Н., Дмитриева Ю. А. Влияние кишечного микробома в норме и патологии. Медицинский совет. 2017. № 1. С. 155-159.
27. Квашнина Л. В. Иммуномодулирующие эффекты витамина D у детей. Здоровье ребенка. 2013. № 7 (50). С. 134-138.
28. Клинико-патогенетическое значение и коррекция иммунологических нарушений у больных с десквамативными поражениями кожи / И. В. Полеско, Ю. С. Бутов, В. В. Малиновская, И. А. Аниховская Российский журнал кожных и венерических болезней. 2010. № 2. С. 27-30.
29. Кобзарь А. И. Прикладная математическая статистика [2-е изд., испр.]. М.: Физматлит, 2012. 816 с.
30. Корниенко Е. А., Дроздова С. Н., Серебряная Н. Б. Пробиотики как способ повышения эффективности эрадикации Helicobacter pylori у детей. Фарматека. 2005. № 7. С. 68-70.
31. Корнишова В. Г., Могилева Е. Ю. Себорейный дерматит (обзор). Проблемы медицинской микологии. 2012. № 3. С. 3-11.
32. Куваева И. Б., Ладодо К. С. Микроэкологические и иммунные нарушения у детей: диетическая коррекция. Акад. мед. наук СССР. М.: Медицина, 1991. 239 с.
33. Кузнецова Э. Э., Горохова В. Г., Богородская С. Л. Микробиота кишечника. Роль в развитии различных патологий. Клиническая лабораторная диагностика. 2016. Т. 61. № 10. С. 723-726.
34. Кулакова Е. В., Елизарова В. М., Пампура А. Н. Эндогенные антимикробные полипептиды. Российский стоматологический журнал. 2012. № 6. С. 42-45.
35. Лебедев К. А., Понякина И. Д. Иммунограмма в клинической практике. М.: Наука, 1990. 224 с.
36. Левина Ю. В., Разнатовский К. И. Вегетативно-гормональные нарушения при себорейном дерматите и их коррекция методом транскраниальной электростимуляции ствола мозга. Российский журнал кожных и венерических болезней. 2010. № 2. С. 30-32.
37. Лечение себорейного дерматита пероральным ретинола пальмитатом / О. В. Калинина, В. И. Альбанова, В. И. Белоусова и др. Вестник дерматологии и венерологии. 2014. № 6. С.149-157.
38. Линия «Скин-кап» в терапии себорейного дерматита / А. Г. Буравкова, Л. А. Новикова, О. Б. Демьянова, Т. Е. Полуэктова. Проблемы медицинской микологии. 2010. № 2. С. 69-70.
39. Липова Е. В., Яковлев А. Б. Адъювантная терапия хронических дерматозов, протекающих на фоне патологии желудочно-кишечного тракта. Клиническая дерматология и венерология. 2015. № 5. С.146-151.
40. Лущан А. А. Себорейный дерматит: современные подходы к этиопатогенезу. Дерматовенерология. Косметология. Сексопатология. 2012. № 1-4. С. 238-239.
41. Мавлянова Ш. З. Микробиологическая идентификация возбудителей кожи и ряда полых органов у больных акне с разными формами и степенью тяжести патологического процесса Клиническая дерматология и венерология. 2013. № 6. С. 104-107.
42. Майлян Э. А., Резниченко Н. А., Майлян Д. Э. Экстраскелетные эффекты витамина D: роль в патогенезе аллергических заболеваний. Научные ведомости. Серия Медицина. Фармация. 2017. № 5 (254). Выпуск 37. С. 22-33.
43. Макрофагозависимые механизмы в патологии / Д. Н. Маянский, Д. Д. Цырендоржиев, А. А. Зубахин и др. Бюл. СО РАМН. 1996. № 1. С. 98-103.
44. Махмудов Анар Вели оглы. Фототерапия синим светом угревой болезни с учетом изучения антимикробного пептида LL-37 и ультразвукового дермасканирования кожи: автореф. дис. … к. м. н. : 14.01.10 / ГБОУ ВПО Первый МГМУ им. И.М. Сеченова. Москва, 2012. 25 c.
45. Маянский Д. Н. Определение биоцидности лейкоцитов. Новосибирск: Изд-во СО РАМН, 1996. Т. 2. С. 32-35.
46. Медицинская микробиология, вирусология и иммунология: учебник / А. А. Воробьев, А. С. Быков, М. Н. Бойченко и др.; под. ред. А. А. Воробьева. М.: МИА, 2012. 702 с.
47. Микроэкологические основы коррекции «дисбиозной» микробиоты человека / И. В. Соловьева, И. В. Белова, А. Г. Точилина А. Г. и др. Медицинский альманах. 2013. № 2 (26). С. 60-65.
48. Микроэкология: фундаментальные и прикладные проблемы / Под ред. Н. Н. Плужникова, Я. А. Накатиса, О. Г. Хурцилавы. СПб.: Издательство СЗГМУ им. И. И. Мечникова, 2012. 304 с.
49. Михнева Е. Н. Этапное лечение себорейного дерматита волосистой части головы. Дерматологія та венерологія. 2012. № 2 (56). С. 44-47.
50. Монахов С. А. Современный подход к терапии себорейного дерматита. Consilium Medicum. Дерматология. 2010. № 1. С. 7-9.
51. Нарожна М. В. Особливості терапії себорейного дерматиту. Ліки – людині. Сучасні проблеми фармакотерапії і призначення лікарських засобів : матеріали XXXIII Всеукр. наук.-практ. конф. за участю міжнар. спеціалістів, 08 квітня 2016 р. Харків, 2016. С. 142.
52. Нарожна М. В. Показники системного імунітету та біоценозу кишечника у хворих на себорейний дерматит. Новітні тенденції лікування та профілактики дерматовенерологічних проблем у рамках доказової медицини : матеріали наук.-практ. конф., 15 квітня 2016 р. Львів, 2016. Укр. журн. дерматол., венерол., косметол. 2016. № 1 (60). С. 106.
53. Нарожна М. В. Фагоцитарна активність нейтрофілів периферичної крові при себорейному дерматиті. Новини і перспективи медичної науки : зб. наук. робіт XV наук. конф. студентів та молодих учених, 15-17 квітня 2015 р. Дніпропетровськ, 2015. С. 36.
54. Нарожна М. В. Фактори вродженого імунітету у хворих на себорейний дерматит. Сучасні методи діагностики та лікування коморбідної патології в дерматовенерологічній практиці на принципах доказової медицини : матеріали наук.-практ. конф. з міжнар. участю, 01-02 червня 2017 р. Чернівці, 2017. С. 91-92.
55. Нарожная М. В. Антимикробные пептиды при себорейном дерматите. Дерматовенерологія в розробках молодих науковців : матеріали наук.-практ. школи, 16-17 листопада 2017 р., м. Київ, 2017. Клінічна імунологія. Алергологія. Інфектологія. 2017. № 6 (103). С. 51.
56. Нарожная М. В. Влияние витамина D на течение себорейного дерматита : матеріали наук.-практ. конф. молодих вчених, присвяченій 25-річчю НАМН України, 23 березня 2018 р. Журнал НАМН України. Спеціальний випуск, 2018. Київ, 2018. С. 62.
57. Нарожная М. В. Клинические особенности себорейного дерматита с учетом статуса витамина D. Святогірські дерматовенерологічні дні: новітні методи діагностики і лікування в дерматовенерології та косметології : матеріали Всеукр. конф. за участю міжнар. спеціалістів, 25-26 травня 2017 р. Святогір’я, 2017. Журн. дерматовенерології та косметології імені М. О. Торсуєва. 2017. № 1 (37). С. 73.
58. Нарожная М. В. Комплексное лечение себорейного дерматита. Медицина XXI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 23 листопада 2017. Харків, 2017. С. 67-68.
59. Нарожная М. В. Местная терапия себорейного дерматита. Проблеми захворювань шкіри та інфекцій, що передаються статевим шляхом, у дітей та підлітків : матер. науково-практ. конф., 17-18 березня 2015 р. Київ, 2015. С. 30.
60. Нарожная М. В. Обоснование применения витамина D в лечении себорейного дерматита. Дерматовенерология. Косметология. 2017. Т. 3. № 3. С. 292-299.
61. Нарожная М. В. Пробиотики в лечении себорейного дерматита. Дерматовенерологія. Косметологія і Сексопатологія. 2017. № 1-2 (5). С. 55-57.
62. Нарожная М. В. Состояние микробиоценоза толстого кишечника у больных себорейным дерматитом. Міжнародний медичний журнал. 2018. Т. 24. № 1 (93). С.73-79.
63. Нарожная М. В. Уровень кателицидина у больных себорейным дерматитом. Медицина XXI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 24 листопада 2016 р. Харків, 2016. С. 69-70.
64. Олисова О. Ю., Давидович М. И. Микрофлора кишечника при себорейном дерматите. Экспериментальная клиническая дерматокосметология. 2014. № 1. С. 43-46.
65. Олисова О. Ю., Давидович М. И. Современный подход к лечению себорейного дерматита. Российский журнал кожных и венерических болезней. 2014. № 4. С. 31-35.
66. Перспективы изучения биологической роли витамина D / Семин С. Г., Волкова Л. В., Моисеев А. Б., Никитина Н. В. Педиатрия. 2012. Т. 91, № 2. – С. 122-131.
67. Пестова В. Ю. Особенности течения и терапии атопического дерматита при выявленной D-витаминной недостаточности. Вестник последипломного медицинского образования. 2015. № 1. С. 3-6.
68. Пигарова Е. А., Плещеева А. В., Дзеранова Л. К. Влияние витамина D на иммунную систему. Иммунология. 2015. Т. 36, № 1. С. 62-66
69. Плещева А. В., Пигарова Е. А., Дзеранова Л. К. Витамин D и метаболизм: факты, мифы и предубеждения. Ожирение и метаболизм. 2012. № 2. С. 33-42.
70. Поворознюк В. В., Балацька Н. І. Дефіцит вітаміну D у населення України та фактори ризику його розвитку. Боль. Суставы. Позвоночник. 2012. Т. 4. № 8. С. 24–29.
71. Полеско И. В. Этиопатогенетические механизмы десквамативных поражений кожи и обоснование терапии. Лечащий врач. 2013. №10. С. 6-11.
72. Разнатовский К.И., Баринова А.Н. Себорея, вульгарные угри. СПб.: Политехника-сервис, 2011. 159 с.
73. Рациональная терапия себорейного дерматита / В. С. Новоселов, А. Е. Богадельникова, А. В. Новоселов, В. В. Савенков Клиническая дерматология и венерология. 2011. № 2. С. 90-95.
74. Рациональная терапия себорейного дерматита / С. В. Панюкова, И. Л. Соркина, В. В. Лысенко, И. М. Корсунская. Клиническая дерматология и венерология. 2012. № 4. С. 61-65.
75. Рылова Н. В., Мальцев С. В., Жолинский А. В. Роль витамина D в регуляции иммунной системы. Практическая медицина. 2017. № 5 (106). С. 10-14.ТИКЕРИМЕНЕНИЕ ВИТАМИНА D В КЛИНИЧЕСКОЙ ПРАИКЕ
76. Сафонова Л. Себорейный дерматит. Новая аптека. 2013. № 6. С. 36-38.
77. Снарская Е. С. Роль Толл-подобных рецепторов (TLR), активаторов врожденного иммунитета в патогенезе ряда дерматозов. Российский журнал кожных и венерических болезней. 2012. № 2. С. 47-50.
78. Снарская Е. С., Кряжева С. С., Лавров А. А. Инновационный комплекс TLR2-Regul в комплексной терапии дерматозов с высоким риском инфицирования: себорейного дерматита и акне. Российский журнал кожных и венерических болезней. 2012. № 3. С. 28-30.
79. Снопов С. А. Механизмы действия витамина D на иммунную систему. Медицинская иммунология. 2014. Т. 16, № 6. С. 499-530.
80. Cовременная концепция об антимикробных пептидах как молекулярных факторах иммунитета / Г. М. Алешина, В. Н. Кокряков, О. В. Шамова и др. Медицинский академический журнал. 2010. № 4. С. 149-160.
81. Сорокина Е. В. Toll-подобные рецепторы и первичное распознавание патогена при дерматозах инфекционной и неинфекционной этиологии. Иммунопатология. Аллергология. Инфектология. 2012. № 2. С. 6-15.
82. Состав и функции микробиоценозов разичных биотопов макроорганизма и клиническая значимость их нарушений / С. К. Джораева, В. В. Гончаренко, Е. В. Щеголева и др. Дерматологія та венерологія. 2015. № 2 (68). С. 5-19.
83. Спосіб лікування себорейного дерматиту / Л. А. Болотна, М. В. Нарожна, О. І. Саріан : патент на корисну модель № 122932 UA: МПК 61 А61 К 31/00. № u 2017 09841; заявл. 11.10.2017 ; опубл. 25.01.2018 ; Бюл. № 2.
84. Ступінчаста ентеросорбція як оптимальний метод корекції мікробіоценозу кишечника у хворих на алергодерматози / Я. Ф. Кутасевич, І. О. Олійник, С. К. Джораева, В. Ю. Мангушева. Дерматологія та венерологія. 2016. С. 79-87.
85. Такролимус в терапии различных дерматозов / О. Ю. Олисова, Н. Г. Кочергин, Е. К. Мураховская, Г. М. Кескин. Российский журнал кожных и венерических болезней. 2013. № 5. С.57-61.
86. Ханова М. Н. Немоторные проявления болезни Паркинсона. Медицинские науки. 2015. Т. 10, № 9. С. 124-126.
87. Цитотоксический эффект пептида LL-37 на перевиваемые миело- и лимфобластоидные клетки человека / В. В. Кулаков, Е. А. Макаров, М. В. Пащенков и др. Иммунология. 2011. Т. 32. № 2. С. 75-77.
88. Цышкова О. Н. Современный пробиотик: новый взгляд на иммуномодуляцию. Практика педиатра. 2015. № 2. С. 32-37.
89. Шварц Г. Я. Дефицит витамина D и его фармакологическая коррекция. Русский медицинский журнал. 2009. Т. 17, № 7. С. 477-486.
90. Шепелькевич А. Р. Современные подходы к профилактике и лечению дефицита витамина D. Международные обзоры: клиническая практика. 2016. Т. 4. С. 7-22.
91. Шилин Д. Е. Витамин-гормон D в клинике XXI столетия: плейотропные эффекты и лабораторная оценка (лекция). Клин. лабораторная диагностика. 2010. № 12. С. 17-23.
92. Эпштейн-Литвак Р. В., Вильшанская Ф. А. Бактериологическая диагностика дисбактериоза кишечника. Метод. рекомендации. M., 1977. 22 с.
93. Юдина М. М. Эффективность комбинированного шампуня, содержащего 1,5% циклопироксамин и 1% пиритион цинка, при себорейном дерматите. Consilium Medicum. Дерматология (Прил.). 2015. № 4. С. 13-16.
94. A comprehensive pathophysiology of dandruff and seborrheic dermatitis – towards a more precise definition of scalp health / J. R. Schwartz, A. G. Messenger, A. Tosti et al. Acta Derm Venereol. 2013. Vol. 93. Nо. 2. P. 131-137.
95. A laboratory-based study on patients with Parkinson’s disease and seborrheic dermatitis: the presence and density of Malassezia yeasts, their different species and enzymes production / V. S. Arsic Arsenijevic, D. Milobratovic, A. M. Barac et al. BMC Dermatol. 2014. Vol. 14. Nо. 14. P. 5-11.
96. Ang-Tiu C. U., Meghrajani C. F., Maano C. C. Pimecrolimus 1% cream for the treatment of seborrheic dermatitis: a systematic review of randomized controlled trials. Expert. Rev. Clin. Pharmacol. 2012. Vol. 5. Nо. 1. Р. 91-97. doi: 10.1586/ecp.11.68.
97. Anti-inflammatory effect of vitamin D on gingivitis: a dose-response randomised control trial / V. P. Hiremath, C. B. Rao, V. Naik, K. V. Prasad. Oral. Health. Prev. Dent. 2013. Vol.11. Nо. 1. P. 61-69.
98. Aschoff R., Kempter W., Meurer M. Seborrheic dermatitis. Hautarzt. 2011. Vol. 62. Nо. 4. P. 297-307.
99. Association between pre-diagnostic circulating vitamin D concentration and risk of colorectal cancer in European populations: a nested case-control study / M. Jenab, H. B. Bueno-de-Mesquita, P. Ferrari et al BMJ. 2010. Vol. 40. P. 55-60.
100. Autoimmune diseases of the innate and adaptive immune system including atopic dermatitis, psoriasis, chronic arthritis, Lyme disease, and Alzheimer’s disease / H. B. Allen, M. S. Shaver, C. A. Etzler, G. S. Joshi. Immunochem Immunopathol. 2015. Vol. 1. Nо. 112. doi:10.4172/2469-9756.1000112.
101. Bacon R. A., Miroguchi H., Schwartz J. R. Assessing therapeutic effectiveness of scalp treatments for dandruff and seborrheic dermatitis, part 1: a reliable and relevant method based on the adherent scalp flaking score (ASFS). J Dermatolog Treat. 2014. Vol. 25. Nо. 3. P. 232-236.
102. Bakardzhiev I., Argirov A. New Insights into the etiopathogenesis of seborrheic dermatitis. Clin. Res. Dermatol. Open. Access. 2017. Vol. 4. Nо. 1. P. 1-5.
103. Beard J. A., Bearden A., Striker R. Vitamin D and the anti-viral state. J. Clin. Virol. 2011. Vol. 50. Nо. 3. Р. 194-200.
104. Bell D. S. Protean manifestations of vitamin deficiency, part 2: dificiency and its association with autoimmune disease, cancer, infection, astma, dermopathies, insulin resistans, and type 2 diabetes. South. Med. S. 2011. Vol. 104. Nо. 5. P. 335-339.
105. Bevins C. L., Salzman N. H. Paneth cells, antimicrobial peptides and maintenance of intestinal homeostasis. Nat. Rev. Microbiol. 2011. Vol. 9. P. 356-368.
106. Bhatia N. Treating seborrheic dermatitis: review of mechanisms and therapeutic options. J. Drugs. Dermatol. 2013. Vol. 112, Nо. 7. P. 796-808.
107. Bikle D. Vitamin D and immune function: Understanding Common Pathways. Curr. Osteoporos. Rep. 2009. Vol. 7. P. 58-63.
108. Binns N. Probiotics, prebiotics and the gut microbiota. ILSI Europe. 2013. 33 p.
109. Bolotna L. A., Narozhna M. V., Sarian О. I. New approaches to the treatment of patients with seborrheic dermatitis. Inter Collegas. 2018. Vol. 5. No. 1. P. 50-54.
110. Bolotnaya L. A., Narozhnaya М. Vitamin D levels in patients with seborrheic dermatitis : abstract 13th Spring Symposium of European Academy of Dermatology and Venereology, 19-22 May 2016. Athens, 2016. Abstract code P0532.
111. Borda L. J., Wikramanayake T. C. Seborrheic dermatitis and dandruff: A comprehensive review. J. Clin. Investig. Dermatol. 2015. Vol. 3. Nо. 2. P. 11-16.
112. Butel M. J. Probiotics, gut microbiota and health. Med. Mal. Infect. 2014. Vol. 44. Nо. 1. P. 1-8.
113. Burton J. L., Pye R. J. Seborrhoea is not a feature of seborrhoeic dermatitis. Br. Med. J. 1983. Vol. 286 P. 1169-1170.
114. Calcipotriol increases hCAP18 mRNA expression but inhibits extracellular LL37 peptide production in IL-17/IL-22-stimulated normal human epidermal keratinocytes / Sakabe J., Umayahara T., Hiroike M. et al. Acta Derm. Venereol. 2014. Vol. 94. P. 512-516.
115. Cani P. D., Delzene N. M. The gut microbiome as therapeutic target. Pharmacol. Therap. 2011. Vol. 130. Nо. 6. Р. 202-212.
116. Cathelicidin antimicrobial peptide LL-37 in psoriasis enables keratinocyte reactivity against TRR9 ligands / S. Morizane, K. Yamasaki, В. Muhleisen et al. J. Invest. Dermatol. 2012. Vol. 132. Nо. 8. Р. 133-143.
117. Cathepsin S, a new pruritus biomarker in clinical dandruff/seborrhoeic dermatitis evaluation / C. Viodй, O. Lejeune, V. Turlier et al. Exp. Dermatol. 2014. Vol. 23. Nо. 4. P. 274-275.
118. Characterization of the vitamin D endocrine system in human sebocytes in vitro / C. Krдmer, H. Seltmann, M. Seifert et al. J. Steroid. Biochem. Mol. Biol. 2009. Vol. 113. Nо. 1-2. P. 9-16.
119. Chesney R.W. The vitamin D and magic mountain: anti-infectious role of the vitamin. J. Pediat. 2010. Vol. 156. P. 698-703.
120. Chowdhry S., Gupta S., D’souza P. Topical antifungals used for treatment of seborrheic dermatitis. J. Bacteriol. Mycol. Open. Access. 2017. Vol. 4. Nо. 1. doi: 10.15406/jbmoa.2017.04.00076
121. Christakos S., Deluca H. Minireview: vitamin D: is there a role in extraskeletal health? Endocrinology. 2011. Vol. 152. Nо. 8. Р. 2930-2936.
122. Chromet M., Arvidson I., Karman D. The antimicrobial peptide cathelicidin protecto mice from Escherichia coli O 157: H7-mediated diseases. PLoS. 2012. Nо. 7. P. 464-476.
123. Clark G.W., Pope S. M., Jaboori K. A. Diagnosis and treatment of seborrheic dermatitis. Am. Fam. Physician. 2015. Vol. 91. Nо. 3. P. 185-190.
124. Clinical relevance of cathelicidin in infectious disease / A. Linde, G. H. Lushington, J. Abello, T. Melgarejo. J. Clin. Cell. Immunol. 2013. S13. Р.1-11.
125. Comparison of different regimens of pimecrolimus 1% cream in the treatment of facial seborrheic dermatitis / J. Zhao, W. Sun, C. Zhang C. et al. J. Cosmet. Dermatol. 2017. Vol. 7. doi:.10.1111/jocd. 12353.
126. Cook B. A., Warshaw E. M. Role of topical calcineurin inhibitors in the treatment of seborrheic dermatitis: a review of pathophysiology, safety, and efficacy. Am. J. Clin. Dermatol. 2009. Vol. 10. Nо. 2. P. 105-116.
127. Corthesy B., Gaskins H. R., Mercenier A. Cross-talk between probiotic bacteria and the host immune system. J. Nutr. 2007. Vol. 137. Nо. 3. Р. 781-790.
128. Cui L., Morris A., Ghedin E. The human mycrobiome in health and disease. J. Biomed. Biotechnol. 2013. Vol. 112. Nо. 6. P. 35-42.
129. Cutaneous fungal microbiome: Malassezia yeasts in seborrheic dermatitis scalp in a randomized, comparative and therapeutic trial / C. S. L. Kamamoto, A. S. Nishikaku, O. F. Gompertz et al. Dermato-Endocrinology. 2017. Vol. 9. Nо. 1. e1361573, DOI:10.1080/19381980.2017.1361573.
130. Dandruff ⁄ seborrhoeic dermatitis is characterized by an inflammatory genomic signature and possible immune dysfunction: transcriptional analysis of the condition and treatment effects of zinc pirithione / K. J. Mills, P. Hu, J. M. Henry et al. Br. J. Derm. 2012. Vol. 166. Suppl. 2. P. 33-40.
131. Dawson M., Iliev I. The mycobiota: interactions between commensal fungi and the host immune system. Nat. Rev. Immunol. 2014. Vol. 14. Nо. 2. P. 405-416.
132. Dawson T. L. Malassezia globosa and restricta: breakthrough understanding of the etiology and treatment of dandruf and seborrheic dermatitis through whole-genome analysis. J. Invest. Dermatol. 2007. Vol. 12. Nо. 6. P. 15-19.
133. Dean S. N., Bishop B. M., van Hoek M. L. Natural and synthetic cathelicidin peptides with antimicrobial and anti-biofilm activity against Staphylococcus aureus. BMC Microbiology. 2011. Vol. 11. P. 1-13.
134. Decreased serum LL-37 and vitamin D3 levels in atopic dermatitis: relationship between IL-31 and oncostatin M / N. Kanda, C. S. Hau, Y. Tada et al. Allergy. 2012. Vol. 67. P. 804-812.
135. De Luca C., Valacchi G. Surface lipids as multifunctional mediators of skin responses to environmental stimuli. Mediators. Inflamm. 2010. Vol. 2010. P. 321-324.
136. Del Rosso J. Q. Adult seborrheic dermatitis: a status report on practical topical management J. Clin. Aesthet. Dermatol. 2011. Vol. 4. Nо. 10. P. 32-38.
137. Del Rosso J. Q., Kim G. K. Seborrheic dermatitis and Malassezia species: how are they related? J. Clin. Aesth. Dermatol. 2009. Vol. 111. Nо. 5. P. 14-17.
138. Dessinioti C., Katsambas A. Seborrheic dermatitis: etiology, risk factors, and treatments: facts and controversies. Clin. Dermatol. 2013. Vol. 31. Nо. 4. Р. 343-351.
139. Dimitrova J. Study of the level of 25-hydroxyvitamin D in patients with seborrheic dermatitis. Scripta Scientifica Medica. 2013. Vol. 45. Nо. 1. Р. 75-78.
140. Dombrowski Y. Control of cutaneous antimicrobial peptides by vitamin D3. Arch. Dermatol. Res. 2010. Vol. 302. Nо. 6. Р. 401-408.
141. Double blind clinical trial in a series of 115 patients with seborrheic dermatitis: prevention of relapses using a topical modulator of Toll like receptor 2 / M. A. Ionescu, A. Baroni, L. Brambilla et al. G. Ital. Dermatol. Venereol. 2011. Vol. 146. P. 185-189.
142. Effects of 12 weeks high dose vitamin D3 treatment on insulin sensitivity, beta cell function, and metabolic markers in patients with type 2 diabetes and vitamin D insufficiency – a double-blind, randomized, placebo-controlled trial / U. Kampmann, L. Moseklide, C. Juhl et al. Metabolism. 2014. Vol. 63. Nо. 9. P. 1115-1124.
143. Efficacy of oral fluconazole in the treatment of seborrheic dermatitis: a placebo-controlled study / N. Cцmert, N. Bekiroglu, O. Gьrbьz, T. Ergun. Am J Clin Dermatol. 2007 Vol. 8. Nо. 4. Р. 235–238.
144. Elewski B. E., Cantrell W. C. An open-label study of the safety and efficacy of sertaconazol enitrate in the treatment of seborrheic dermatitis J. Drugs. Dermatol. 2011. Vol. 10. Nо. 8. Р. 895-899.
145. El-Hajj Fuleihan G. Vitamin D deficiency in the Middle East and its health consequences. Clin. Rev. Bone. Miner. Metab. 2009. Vol. 7. P. 77-93.
146. Epidemiologic study of Malassezia yeasts in seborrheic dermatitis patients by the analysis of 26S rDNA PCR-RFLP / B. N. Oh, Y. W. Lee, Y. B. Choe, K. J. Ahn. Ann. Dermatol. 2010. Vol. 22. P. 149-155.
147. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline / M. F. Holick, N. C. Binkley, H. A. Bischoff-Ferrari et al. J Clin. Endocrinol. Metab. 2011. Vol. 96. Nо. 7. P. 1911-1930.
148. Expression of inflammatory biomarkers from cultured sebocytes was influenced by treatment with vitamin D / W. J. Lee, Y. H. Choi, M. Y. Sohn et al. Indian J. Dermatol. 2013. Vol. 58. Nо. 4. P. 32-37.
149. Haroon M., Fitzgerald O. Vitamin D and its emerging role in immunopathology. Clin. Rheumatol. 2012. Vol. 31. Nо. 2. Р. 199-202.
150. Hay R. J. Malassezia, dandruff and seborrhoeic dermatitis: an overview. Brit. J. Dermatol. 2011. Vol. 165. Nо. 2. Р. 2-8.
151. Hewison M. Vitamin D and the immune system: new perspectives on an old theme. Endocrinol. Metab. Clin. North Am. 2010. Vol. 39. Nо. 2. P. 365-379.
152. History of seborrheic dermatitis: conceptual and clinico-pathologic evolution / A. C. A. Mameri, S. Carneiro, L. M. A. Mameri et al. Skinmed. 2017. Vol. 1. Nо. 15 (3). P. 187-194.
153. Holick M. F. The Vitamin D deficiency pandemic: a forgotten hormone important for health. Public. Health. Reviews. 2010. Vol. 32. Nо. 1. P. 267-283.
154. Human antimicrobial peptide LL-37 modulates proinflammatory responses induced by cytokine milieus and double-stranded RNA in human keratinocytes / X. Chen, T. Takai, Y. Xie et al. Biochem. Biophys. Res. Commun. 2013. Vol. 433. Nо. 4. P. 532-537.
155. Isotretinoin as monotherapy for sebaceous hyperplasia / S. M. Yu, G. Stevens, R. Liskanich, D. Horowitz. J. Drugs. Dermatol. 2010. Vol. 9. P. 699-701.
156. Itraconazole in the treatment of seborrheic dermatitis: a new treatment modality / V. Baysal, M.Yildirim, C. Ozcanli, A.M. Ceyhan. Int. J. Dermatol. 2004. Vol. 43. Nо. 1. P. 63-66.
157. Gallo R. L., Hooper L. V. Epithelial antimicrobial defence of the skin and intestine. Nature reviews. Immunology. 2012. Vol. 112. P. 503-516.
158. Goldenberg G. Optimizing treatment approaches in seborrheic dermatitis. J. Clin. Aesthe.t Dermatol. 2013. Vol. 6. Nо. 2. P. 44-49.
159. Gombart A. F. The vitamin D-antimicrobial peptide pathway and its role in protection against infection. Future. Microbiol. 2009. Vol. 4. Nо. 9. P. 1151-1165.
160. Grant W. B., Mohr S. F. Ecological studies of ultraviolet B, vitamin D and cancer since 2000. Ann. Epidemiol. 2009. Vol. 19. P. 446-454.
161. Gunville C. F., Mourani P. M., Ginde A. A. The Role of vitamin D in prevention and treatment of Infection. Inflamm. Allergy. Drug. Targets. 2013. Vol. 11. Nо. 4. P. 239-245.
162. Gupta A. K., Richardson M., Paquet M. Systematic review of oral treatments for seborrheic dermatitis. J. Eur. Acad. Dermatol. Venereol. 2014. Vol. 28. Nо. 1. P. 16-26.
163. Gupta A. K., Versteeg S. G. Topical treatment of facial seborrheic dermatitis: a systematic review. Am. L. Clin. Dermatol. 2017. Vol. 18. No. 2. P. 193-213.
164. Gut microbiota, probiotics, and vitamin D: interrelated exposures influencing allergy, asthma, and obesity? / N. P. Ly, A. Litonjua, D. R. Gold, J. C. Celedуn J. Allergy. Clin. Immunol. 2011. Vol. 12. Nо. 5. P. 1087-1094.
165. Jones A. P. Vitamin D and allergic disease: sunlight at the end of the tunnel? Nutrients. 2012. Vol. 4. Nо. 1. Р. 13-28.
166. Karakadze M. A., Hirt P. A., Wikramanavake T. C. The genetic basis of seborrhoeic dermatitis: a review. J. Eur. Acad. Venereol. 2018. Vol. 32. Nо. 4. P. 529-553.
167. Long-term safety of ketoconazole foam, 2% in the treatment of seborrheic dermatitis: results of a phase IV, open-label study / Z. D. Draelos, S. R. Feldman, V. Butners et al. J Drugs Dermatol. 2013. Vol. 12. P. 231-234.
168. Low serum 25-hydroxyvitamin D level and risk of upper respiratory tract infection in children and adolescents / M. Science, J. L. Maguire, M. L. Russell et al. Clin. Infect. Dis. 2013. Vol. 57. Nо. 3. P. 392-397.
169. Malassezia species and their associated skin diseases / K. Harada, M. Saito, T. Sugita, R. Tsuboi. J. Dermatol. 2015. Vol. 42. Nо. 3. P. 250-257.
170. Mesquita K. de C., Igreja A. C., Costa I. M. Atopic dermatitis and vitamin D: facts and controversies. Braz. Ann. Dermatol. 2013. Vol. 88. Nо. 6. P. 945-953.
171. Mesjuita K. de C., Igreja A. C., Costa I. M. Seborrheic dermatitis: is there room for systemic corticosteroids? Ann. Bras. Dermatol. 2012. Vol. 87. Nо. 3. P. 507-511.
172. Miller J., Gallo R. L. Vitamin D and innate immunity. Dermatol. Ther. 2010. Vol. 23. P. 13-22.
173. Mostafa W. Z., Hegazy R. A.Vitamin D and the skin: focus on a complex relationship: a review. J. Advanc. Research. 2015. Vol. 6. P. 793-804.
174. Multifunctional antimicrobial proteins and peptides: natural activators of immune systems / F. Niyonsaba, I. Nagayoka, H. Ogawa, K. Okumura. Curr. Pharm. Des. 2009. Vol. 15. Nо. 21. P. 2393-2413.
175. Mutgi K., Koo J. Update on the role of systemic vitamin D in atopic dermatitis. Pediatr. Dermatol. 2013. Vol. 30. P. 303-307.
176. Naldi L., Rebora A. Clinical practice. Seborrheic dermatitis. N. Engl. J. Med. 2009. Vol. 360. N. 4. Р. 387-396.
177. Norval M., Wulf H. C. Does chronic sunscreen use reduce vitamin D production to insufficient levels? Br. J. Dermatol. 2009. Vol. 161. Nо. 4. P. 732-736.
178. Palamaras I., Kyriakis K. P., Stavrianeas N. G. Seborrheic dermatitis: lifetime detection rates. J. Eur. Acad. Dermatol. Venereol. 2012. Vol. 26. P. 524-526.
179. Patterns of vitamin D analog use for the treatment of psoriasis / C. S. Ahn, F. Awadalla, K. E. Huang et al. J. Drugs Dermatol. 2013. Vol. 12. Nо. 6. P. 906-910.
180. Paulino L. C. New perspectives on dandruff and seborrheic dermatitis: lessons we learned from bacterial and fungal skin microbiota. Eur. J. Dermatol. 2017. Vol. 27. Suppl. 1. P. 1-4.
181. Photoprotection by 1-alfa, 25-dihydroxyvitamin D andanalogs further studies on mechanisms and implications for UV-damage / R. S. Mason, V. B. Segueira, K. M. Dixon et al. J. Steroid Biochem Mol Biol. 2010. Vol. 121. P. 164-168.
182. Polat M., Uzun Ц. Vitamin D in dermatology. Open Access Dermatology. 2014. Vol. 2. Nо. 1. P.9-12.
183. Positive correlation between circulating cathelicidin antimicrobial peptide (hCAP18/LL-37) and 25-hydroxyvitamin D levels in healthy adults / B. M. Dixon, T. Barker, T. McKinnon et al. BMC Res. Notes. 2012. Vol. 5. P. 575-578.
184. Presence species distribution, and density of Malassezia yeast in patients with seborrhoeic dermatitis – a community-based case-control study and review of literature / A. Barakm, M. Pekmezovic, D. Milobratovic, M. Radunovic. Mycoses. 2015. Vol. 58. Nо. 2. P. 69-75.
185. Probiotics, gut microbiota, and their influence on host health and disease / B. Sanchez, S. Delgado, A. Blanco-Mıguez et al. Mol. Nutr. Food. Res. 2017. Vol. 61. оN. 1. P. 17-32.
186. Prohic A. Distribution of Malassezia species in seborrhoeic dermatitis: correlation with patients’ cellular immune status. Mycoses. 2010. Vol. 53. Nо. 4. P. 344-349.
187. Prohic A., Kasumagic-Halilovi E. Identificationof Malassezia species from immunocompetent and immunocompromised patients with seborrheic dermatitis. Eur. Rev. Med. Pharmacol. Sci. 2010. Vol. 14. Nо. 12. Р. 1019-1023.
188. Psychiatric comorbidities and alexithymia in patients with seborrheic dermatitis: a questionnaire study in Turkey / A. Comert, B. Akbas, E. Z. Kılıc et al. Am J Clin Dermatol 2013. Vol. 14. P. 335-342.
189. PTH/PTHrP and vitamin D control antimicrobial peptide expression and susceptibility to bacterial skin infection / B. Muehleisen, D. D. Bikle, C. Aguilera et al. Science. Transl. Med. 2012. Vol. 23. Nо. 4. P. 135-166.
190. Randomized trial of vitamin D supplementation for winter-related atopic dermatitis in children / C. A. Ir. Camargo, D. Ganmaa, R. Sidbury et al. Allergy. Clinical. Immunology. 2014. Vol. 134. Nо. 4. P. 831-835.
191. Ranganathan S., Mukhopadhyay T. Dandruff: The most commercially exploited skin disease. Indian. J. Dermatol. 2010. Vol. 55. P. 130-134.
192. Reinholz M., Ruzicka T., Schauber J. Cathelicidin LL-37: an antimicrobial peptide with a role in inflammatory skin disease. Ann. Dermatol. 2012. Vol. 24. Nо. 2. Р. 126-135.
193. Roider E., Ruzicka T., Schauber J. Vitamin D, the cutaneous barrier, antimicrobial peptides and allergies: Is there a link? Allergy. Asthma. Immunol. Res. 2013. Vol. 5. Nо. 3. P. 119-128.
194. Role of sebaceous glands in inflammatory dermatoses / V. Y. Shi, M. Leo, L. Hassoun, D. S. Chahal et al. J. Am. Acad. Dermatol. 2015. Vol. 73. Nо. 5. P. 856-863.
195. Round J. L., Mazmanian S. K. The gut microbiota shapes intestinal immune responses during health and disease. Nat. Rev. Immunol. 2009. Vol. 9. Nо. 5. Р. 313-323.
196. Rovelli F., Mercuri S. R., Naldi L. Seborrheic dermatitis in clinical practice. Recenti Prog Med. 2011. Vol. 102. Nо. 3. P. 126-133.
197. Saleh H.M., Fattach N. S. Evaluation of serum 25-hydroxyvitamin D levels in vitiligo patients with abd without autoimmune diseases. Photodermatol. Photoimmunol. Photomed. 2013. Vol. 29. P. 34-40.
198. Scalp seborrheic dermatitis: prevalence and associated factors in male adolescents / J. A. Breunig, H. L. Almeida, R. D. Duquia et al. Int. J. Dermatol. 2012. Vol. 51. Nо. 1. Р. 46-49.
199. Schauber J., Gallo R. L. Antimicrobial peptides and the skin immune defense system. J. Allergy. Clin. Immunol. 2008. Vol. 122. P. 261-266.
200. Schauber J., Gallo R. The vitamin D pathway: a new target for control of the skin’s immune responses? Exp. Dermatol. 2008. Vol. 16. P. 394-400.
201. Seborrheic dermatitis / A. L. B. Sampaio, A. Mameri, T. Jeunon et al. Ann. Bras. Dermatol. 2011. Vol. 86. Nо. 6. P. 1061-1074.
202. Seborrheic dermatitis-like eruption in patients taking isotretinoin therapy for acne: retrospective study of five patients / A. Barzilai, M. David, H. Trau, E. Hodak. Am J Clin Dermatol. 2008. Vol. 9. P. 255-261.
203. Seborrheic dermatitis – an early and common skin manifestation in HIV patients. / P. Chatzikokkinou, K. Sotiropoulos, A. Katoulis et al. Acta Derm Croat 2008. Vol. 16. P. 226-230.
204. Seborrheic dermatitis: an update / Z. Bukviж Mokos, M. Kralj, A. Basta-Juzbaљiж, I. Lakoљ Jukiж. Acta Dermatovenerol. Croat. 2012. Vol. 20. No. 2. Р. 98-104.
205. Serum 25-hydroxyvitamin D concentrations and risk of prostate cancer: results from the prostate cancer prevention trial / J. M. Schenk, C. A. Till, C. M. Tangen et al. Cancer Epidemiol Biomarkers Prev. 2014. Vol. 23. No. 8. P. 1484-1493.
206. Serum concentrations of 25-OH vitamin D in patients with systemic lupus erythematosus (SLE) are inversely related to disease activity: is it time to routinely supplement patients with SLE with vitamin D? / H. Amital, Z. Szekanecz, G. Szucs, K. Danko et al. Ann Rheum Dis. 2010. Vol. 69. Nо. 3. Р. 1155-1157.
207. Serum level of the human antimicrobial cathelicidin (hCAP18/LL-37) in patients with psoriasis vulgaris / S. Pavlov, I. Ivanova, D. Gerova, T. Chervenkov, S. Balev. Scripta Scientiica Medica. 2016. Vol. 48. Nо. 2, 2016.
208. Serum levels of antimicrobial peptides and proteins do not correlate with psoriasis severity and are increased after treatment with fumaric acid esters / T. Gambichler, F. G. Bechara, N. Scola et al. Arch. Dermatol. Res. 2012. Vol. 304. No. 6. P. 471-474.
209. Skin-gut axis: The relationship between intestinal bacteria and skin health / A. R. Vaughn, M. Notay, A. K. Clark, R. K. Sivamani. World J Dermatol. 2017. Vol. 6. No. 4. P. 52-58.
210. Stefanaki I., Katsambas A. Therapeutic update on seborrheic dermatitis. Skin Ther Letter. 2010. Vol. 15. No. 1. P. 1-8.
211. T-cell cytokines differentially control human monocyte antimicrobial responses by regulating vitamin D metabolism / K. Edfeldt, P. T. Liu, R. Chun et al. Proc. Natl. Acad. Sci. U S A. 2010. Vol. 107. No. 52. P. 22593–22598.
212. Thayikkannu A.V., Kindo A. J., Veeraraghavan M. Malassezia – can it be ignored? Indian. J. Dermatol. 2015. Vol. 60. N. 4. P. 332-339.
213. The effect of 14 weeks of vitamin D3 57supplementation on antimicrobial peptides and proteins in athletes / C.-S. He, F. D. Wraser, J. Tang, J. et al. J. Sports. Sciences. 2016. Vol. 34. P. 67-74.
214. The human antimicrobial peptide LL-37 suppresses apoptosis in keratinocytes / C. J. Chamorro, G. Weber, A. Gronberg et al. J. Invest. Dermatol. 2009. Vol. 129. No. 5. P. 937-944.
215. The human cathelicidin LL-37 – a pore-forming antibacterial peptide and host-cell modulator / D. Xhindoli, S. Pacor, M. Benincasa et al. Biochim Biophys Acta. 2016. Vol. 1858. No. 3. P. 546-556.
216. The relation between sunscreen layer thickness and vitamin D production after ultraviolet B exposure: a randomized clinical trial / A. Faurschou, D. M. Beyer, A. Schmedes et al. Br. J. Dermatol. 2012. Vol. 167. No. 2. P. 391-395.
217. The role of vitamin D in the immunopathogenesis of allergic skin diseases / A. A. Benson, J. A. Toh, N. V. Vernon et al. Allergy. 2012. Vol. 67. No. 3. P. 296-301.
218. Trznadel-Grodzka E., Bіaszkowski M., Rotsztejn H. Investigations of seborrheic dermatitis. Part I. The role of selected cytokines in the pathogenesis of seborrheic dermatitis. Postepy Hig Med Dosw (online). 2012. Vol. 66. P. 843-847.
219. Trznadel-Grodzka E., Bіaszkowski M., Rotsztejn H. Investigations of seborrheic dermatitis. Part II. Influence of itraconazole on the clinical condition and the level of selected cytokines in seborrheic dermatitis. Postepy. Hig. Med. Dosw (online). 2012. Vol. 66. P. 848-854.
220. Turner G. A., Hoptroff M., Harding C. R. Stratum corneum dysfunction in dandruff. Int. J. Cosmet. Sci. 2012. Vol. 34. No. 4. P. 298-306.
221. Underhill M. D., Iliev I. D. The mycobiota: interactions between commensal fungi and the host immune system. Nat. Rev. Immunol. 2014. Vol. 14. No. 2. P. 405-416.
222. Vanderpool C., Yan F., Polk D. B. Mechanisms of probiotic action: Implications for therapeutic applications in inflammatory bowel diseases. Inflamm. Bowel. Dis. 2008. Vol. 14. No. 11. P. 1585-1596.
223. Vitamin D status and efficacy of vitamin D supplementation in atopic dermatitis: a systematic review and meta-analysis / M. J. Kim, S.-N. Kim, Y. W. Lee et al. Nutrients. 2016. Vol. 8. P. 789-799; doi: 10.3390/nu8120789
224. Vitamin D status and ill health: a systematic review / P. Autier, M. Boniol, C. Pizot et al. Lancet Diabetes Endocrinol. 2014. Vol. 2. No. 1. Р. 76-89.
225. Vitamin D status and its association with the SCORAD score and serum LL-37 level in korean adults and children with atopic dermatitis / T.Y. Han, T. S. Kong, M. H. Kim et al. Ann. Dermatol. 2015. Vol. 27, No. 1. P. 10-14.
226. Vitamin D and its role in psoriasis: an overview of the dermatologist and nutritionist / L. Barrea, M. C. Savanelli, C. D. Somma et al. Rev Endocr Metab Disord. 2017. Vol. 18. P. 195-205.
227. Vitamin D supplement doses and serum 25-hydroxyvitamin D in the range associated with cancer prevention / C. F. Garland, C. B. French, L. L. Baggerly et al. Anticancer Res. 2011. Vol. 31. No. 2. P. 607-611.
228. Wacker M., Holick M. F. Sunlight and vitamin D: a global perspective for health. Dermatoendocrinol. 2013. Vol. 1. No. 5 (1). P. 51-108.
229. Wadhwa B., Goel K.Vitamin D and skin diseases: a review. Ind. J. Dermatol. Venereol. Leprol. 2015. Vol. 81. No. 4. P. 344-355.
230. White J. H. Vitamin D as an inducer of cathelicidin antimicrobial peptide expression: past, present and future. J. Steroid. Biochem. Mol. Biol. 2010. Vol. 121. No. 1-2. P. 234-238.
231. Wцbke T. K., Sorg B. L., Steinhilber D. Vitamin D in inflammatory diseases. Front. Physiol. 2014. Vol. 2. No. 5. Р. 244-247.
232. Yamamoto T. R., Tsuboi R. Interleukin-2-induced seborrhoeic dermatitis-like eruption. J. Eur. Acad. Dermatol. Venereol. 2008. Vol. 22. P. 244-245.
233. Yin K., Agrawal D. K. Vitamin D and inflammatory diseases. J. Inflamm. Res. 2014. Vol. 29. No. 7. Р. 69-87.
234. Youssef D. A. Antimicrobial implications of vitamin D. Dermatoendocrinol. 2011. Vol. 3. No. 4. Р. 220-229.
235. Zouboulis C. C. Sebaceous gland receptors. Dermatoendocrinol. 2009. Vol. 1. No. 2. P. 77–80.
236. Zouboulis C. C. The sebaceous gland. Hautarzt. 2010. Vol. 61. |P. 467-468.
ДОДАТОК А
АКТИ ВПРОВАДЖЕННЯ









ДОДАТОК Б
Список публікацій здобувача за темою дисертації
Праці, в яких опубліковані основні наукові результати дисертації
1. Болотна Л. А., Нарожна М. В. Статус вітаміну D у хворих на себорейний дерматит. Медицина сьогодні і завтра. 2017. № 2 (75). С. 78-82.
2. Болотная Л. А., Нарожная М. В. Роль кателицидина LL-37 при себорейном дерматите. Дерматологія та венерологія. 2018. № 1 (79). С. 16-20.
3. Болотная Л. А., Нарожная М. В. Себорейный дерматит: современные представления о патогенезе. Міжнародний медичний журнал. 2015. № 1 (81). С. 96-99.
4. Нарожная М. В. Обоснование применения витамина D в лечении себорейного дерматита. Дерматовенерология. Косметология. 2017. Т. 3. № 3. С. 292-299. 5. Нарожная М. В. Пробиотики в лечении себорейного дерматита. Дерматовенерологія. Косметологія і Сексопатологія. 2017. № 1-2 (5). С. 55-57.
6. Нарожная М. В. Состояние микробиоценоза толстого кишечника у больных себорейным дерматитом. Міжнародний медичний журнал. 2018. Т. 24. № 1 (93). С. 73-79.
7. Bolotna L. A., Narozhna M. V., Sarian О. I. New approaches to the treatment of patients with seborrheic dermatitis. Inter Collegas. 2018. Vol. 5. No. 1. P. 50-54. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено узагальнення результатів).
Праці, які засвідчують апробацію матеріалів дисертації
1. Нарожна М. В. Особливості терапії себорейного дерматиту. Ліки – людині. Сучасні проблеми фармакотерапії і призначення лікарських засобів : матеріали XXXIII Всеукр. наук.-практ. конф. за участю міжнар. спеціалістів, 08 квітня 2016 р. Харків, 2016. С. 142.
2. Нарожна М. В. Показники системного імунітету та біоценозу кишечника у хворих на себорейний дерматит. Новітні тенденції лікування та профілактики дерматовенерологічних проблем у рамках доказової медицини : матеріали наук.-практ. конф., 15 квітня 2016 р. Львів, 2016. Укр. журн. дерматол., венерол., косметол. 2016. № 1 (60). С. 106.
3. Нарожна М. В. Фагоцитарна активність нейтрофілів периферичної крові при себорейному дерматиті. Новини і перспективи медичної науки : зб. наук. робіт XV наук. конф. студентів та молодих учених, 15-17 квітня 2015 р. Дніпропетровськ, 2015. С. 36.
4. Нарожна М. В. Фактори вродженого імунітету у хворих на себорейний дерматит. Сучасні методи діагностики та лікування коморбідної патології в дерматовенерологічній практиці на принципах доказової медицини : матеріали наук.-практ. конф. з міжнар. участю, 01-02 червня 2017 р. Чернівці, 2017. С. 91-92.
5. Нарожная М. В. Антимикробные пептиды при себорейном дерматите. Дерматовенерологія в розробках молодих науковців : матеріали наук.-практ. школи, 16-17 листопада 2017 р., м. Київ, 2017. Клінічна імунологія. Алергологія. Інфектологія. 2017. № 6 (103). С. 51.
6. Нарожная М. В. Влияние витамина D на течение себорейного дерматита : матеріали наук.-практ. конф. молодих вчених, присвяченої 25-річчю НАМН України, 23 березня 2018 р. Журнал НАМН України. Спеціальний випуск, 2018. Київ, 2018. С. 62.
7. Нарожная М. В. Клинические особенности себорейного дерматита с учетом статуса витамина D. Святогірські дерматовенерологічні дні: новітні методи діагностики і лікування в дерматовенерології та косметології : матеріали Всеукр. конф. за участю міжнар. спеціалістів, 25-26 травня 2017 р. Святогір’я, 2017. Журн. дерматовенерології та косметології імені М. О. Торсуєва. 2017. № 1 (37). С. 73.
8. Нарожная М. В. Комплексное лечение себорейного дерматита. Медицина XXI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 23 листопада 2017 р. Харків, 2017. С. 67-68.
9. Нарожная М. В. Местная терапия себорейного дерматита. Проблеми захворювань шкіри та інфекцій, що передаються статевим шляхом, у дітей та підлітків : матер. науково-практ. конф., 17-18 березня 2015 р. Київ, 2015. С. 30.
10. Нарожная М. В. Уровень кателицидина у больных себорейным дерматитом. Медицина XXI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 24 листопада 2016 р. Харків, 2016. С. 69-70.
11. Bolotnaya L. A., Narozhnaya М. Vitamin D levels in patients with seborrheic dermatitis : abstract 13th Spring Symposium of European Academy of Dermatology and Venereology, 19-22 May 2016. Athens, 2016. Abstract code P0532.
Праці, які додатково відображають наукові результати дисертації
1. Спосіб лікування себорейного дерматиту / Л. А. Болотна, М. В. Нарожна, О. І. Саріан: пат. на корисну модель № 122932 UA: МПК 61 А61 К 31/00. № u 2017 09841; заявл. 11.10.2017 ; опубл. 25.01.2018; Бюл № 2.
Відомості про апробацію результатів дисертації
Основні положення роботи викладено та обговорено на науково-практичних конференціях різного рівня:
1. XV наукова конференція студентів та молодих учених «Новини і перспективи медичної науки» (Дніпропетровськ, 15-17 квітня 2015 р., форма участі – публікація тез).
2. Науково-практична конференція «Проблеми захворювань шкіри та інфекцій, що передаються статевим шляхом, у дітей та підлітків» (Київ, 17-18 березня 2015 р., форма участі – публікація тез).
3. 13-ий Весняний симпозіум Європейської академії дерматології та венерології (Афіни, 19-22 травня 2016, форма участі – публікація тез).
4. Науково-практична конференція молодих вчених з міжнародною участю «Медицина XXI століття» (Харків, 24 листопада 2016 р., форма участі – публікація тез).
5. XXXIII Всеукраїнська науково-практична конференція за участю міжнародних спеціалістів «Ліки – людині. Сучасні проблеми фармакотерапії і призначення лікарських засобів» (Харків, 08 квітня 2016 р., форма участі – публікація тез).
6. Науково-практична конференція «Новітні тенденції лікування та профілактики дерматовенерологічних проблем у рамках доказової медицини» (Львів, 15 квітня 2016 р., форма участі – публікація тез).
7. Всеукраїнська конференція за участю міжнародних спеціалістів «Святогірські дерматовенерологічні дні: новітні методи діагностики і лікування в дерматовенерології та косметології» (Святогір’я, 25-26 травня 2017 р., форма участі – публікація тез).
8. Науково-практична конференція з міжнародною участю «Сучасні методи діагностики та лікування коморбідної патології в дерматовенерологічній практиці на принципах доказової медицини» (Чернівці, 01-02 червня 2017 р., форма участі – публікація тез).
9. Конференція «5-е Минские дерматологические чтения имени академика А.Я. Прокопчук» (Мінськ, 22 вересня 2017 р., форма участі – усна доповідь).
10. Конференція «12-е Киевские дерматологические дни» (Київ, 11-13 жовтня 2017 р., форма участі – усна доповідь).
11. Науково-практична школа «Дерматовенерологія в розробках молодих науковців» (Київ, 16-17 листопада 2017 р., форма участі – публікація тез).
12. Науково-практична конференція молодих вчених з міжнародною участю «Медицина XXI століття» (Харків, 23 листопада 2017 р. форма участі – публікація тез).
13. Науково-практична конференція молодих вчених інституту з міжнародною участю, присвячена 25-й річниці від дня заснування Національної академії медичних наук України «Новітні впровадження молодих вчених в сучасній дерматовенерології» (Харків, 07 лютого 2018 р., форма участі – усна доповідь).
14. Науково-практична конференція молодих вчених, присвячена 25-річчю НАМН України (Київ, 23 березня 2018 р., форма участі – публікація тез).
15. Засідання Харківського наукового товариства дерматовенерологів та косметологів «Школа нових методів дагностики, лікування та профілактики в дерматовенерології» (Харків, 10 квітня 2018 р., форма участі – усна доповідь).
