РОЗДІЛ 3
ПРОФІЛЬ ПРОЗАПАЛЬНИХ ЦИТОКІНІВ У ХВОРИХ З ПОЄДНАНОЮ ПАТОЛОГІЄЮ
На теперішній час доведено, що запальний процес при Пс розвивається і підтримується при безпосередній участі цитокінового комплексу. Детальне вивчення патофізіологічної ролі певних цитокінів у розвитку дерматозу створює передумови для більш повного розуміння тих патогенетичних механізмів, що детермінують розвиток патологічного процесу. Це також є впливовим чинником для подальшого пошуку нових напрямків діагностики, стратегій розробки сучасних методів терапії захворювання.
Питання стану цитокінового балансу у хворих на Пс, а особливо в поєднанні з ГХ, до теперішнього часу також є предметом жвавих дискусій у наукових колах і не може вважатися остаточно вирішеним. Це спонукало нас дослідити рівні цитокінів і визначити найбільш типові для цієї коморбідності показники.
Результати проведених досліджень представлено в табл. 3.1.
Таблиця 3.1 – Вміст цитокінів у обстежених осіб в цілому по групах (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Хворі на Пс (n=34) | Хворі на ГХ (n=30) | Хворі на Пс у поєднанні з ГХ (n=80) | Контрольна група (n=20) |
| IL-1β, пг/мл | 0,17±0,05 (0,06-0,27) |
0,07±0,01 (0,06-0,08)* |
0,55±0,15 (0,25-0,84)*# |
0,04±0,01 (0,02-0,06) |
| IL-1α, пг/мл | 0,46±0,07 (0,32-0,6) |
0,37±0,04 (0,29-0,44)* |
1,72±0,43 (0,86-2,58)*# |
0,21±0,11 (0,01-0,43) |
| IL-6, пг/мл | 0,77±0,11 (0,55-0,99) |
0,89±0,1 (0,69-1,09)* |
5,25±0,81 (3,63-6,87)*# |
0,63±0,13 (0,37-0,89) |
| TNF-α, пг/мл | 17,9±0,6 (16,7-19,1) |
11,6±0,43 (10,74-12,46)* |
73,52±35,32 (2,88-144,15)*# |
4,22±0,12 (3,98-4,46) |
Примітка: * – р <0,05 при порівнянні з групою хворих на Пс; # – р <0,05 при порівнянні з групою хворих на ГХ.
Встановлено, що в групі хворих на Пс рівень IL-1β збільшений у 2,43 рази (p<0,05), а в третій групі (основній) – збільшений у 7,86 раз (p<0,05) порівняно з хворими на ГХ (група 2). У третій групі (Пс в поєднанні з ГХ) рівень IL-1β збільшений у 3,24 раза порівняно з хворими лише на Пс (група 1) і достовірно перевершував показники групи 1 (Пс) і групи 2 (ГХ). Визначення рівня IL-1α свідчило, що найнижчий показник цього цитокіну – (0,37±0,04) пг/мл – зареєстровано в другій групі порівняння (хворих на ГХ). У першій групі порівняння (хворих на Пс) відзначалися більш високі показники – на 24,3 % (p<0,05), а в основній групі – значно вищі (збільшення в 4,65 разу) (p<0,05), порівняно з хворими на ГХ. У групі хворих на Пс у поєднанні з ГХ рівень IL-1α збільшився в 3,74 рази, достовірно відрізняючись від значень другої групи (ГХ). Результати досліджень викладено в роботах [52, 95].
Рівень IL-6 у хворих на Пс групи порівняння виявився вищим, ніж у хворих лише на ГХ (групи 2) на 15,6 % (p<0,05), а в групі з коморбідною патологією (група 3) – у 5,82 разу більшим (p<0,05). В основній групі рівень IL-6 був достовірно (p<0,05) в 5,9 разу вищим відносно групи пацієнтів з ГХ.
У групі хворих лише на Пс відзначалося збільшення рівня TNF-α на 54,31 % (p<0,05) щодо групи порівняння з ГХ. В основній групі хворих відзначалося прогресивне збільшення рівня TNF-α в 4,11 рази (p <0,05) щодо групи хворих на Пс, і в 6,34 рази (p <0,05) стосовно групи порівняння на ГХ [54, 94, 95].
Показники рівня цитокінів у обстежених осіб залежно від тривалості ГХ показано в табл. 3.2.
Згідно даних таблиці, найбільші значення інтерлейкінів реєструвалися в основній групі досліджуваних з більшою тривалістю АГ. У пацієнтів другої групи (з ГХ) і анамнезом АГ більше 5 років спостерігалася лише тенденція до елевації рівня IL-1β, -1α та -6. У групі хворих на поєднану патологію спостерігалася більш виразна за амплітудою відмінностей картина: концентрації IL-1β і -1α, а також TNF-α, статистично значимо виявилися вищими, так, при давності хвороби більше 5 років відмінності з групою порівняння склали 169,57 %, 95,88 % і 328,36 %, при р<0,01 в усіх випадках. Динаміка IL-6 виявилася статистично недостовірною.
Таблиця 3.2 – Вміст цитокінів у хворих другої та третьої групи залежно від тривалості ГХ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість ГХ до 5 років | Тривалість ГХ більше 5 років | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| IL-1β, пг/мл | 0,07±0,01 (0,05-0,08) | 0,08±0,01 (0,06-0,09) | 0,17±0,05 (0,06-0,27) |
| IL-1α, пг/мл | 0,33±0,04 (0,24-0,41) | 0,41±0,07 (0,28-0,54) | 0,46±0,07 (0,32-0,6) |
| IL-6, пг/мл | 0,79±0,15 (0,6-1,18) | 0,89±0,14 (0,62-1,17) | 0,77±0,11 (0,55-0,99) |
| TNF-α, пг/мл | 9,95±0,45 (9,05-10,85) | 13,63±0,53 (12,56-14,69)* | 17,9±0,6 (16,7-19,1) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| IL-1β, пг/мл | 0,23±0,08 (0,07-0,39) | 0,62±0,18 (0,27-0,98)* | 0,55±0,15 (0,25-0,84) |
| IL-1α, пг/мл | 0,97±0,06 (0,88-1,12) | 1,9±0,53 (0,83-2,96)* | 1,72±0,43 (0,86-2,58) |
| IL-6, пг/мл | 4,5±0,6 (4,01-5,2) | 5,76±0,55 (4,06-7,46) | 5,25±0,81 (3,63-6,87) |
| TNF-α, пг/мл | 20,45±0,84 (18,77-22,12) | 87,6±43,69 (0,22-174,98)* | 73,52±35,32 (2,88-144,15) |
Примітка. * – р <0,05 при порівнянні з пацієнтами з тривалістю захворювання до 5 років.
Значення цитокінів у групах хворих на Пс стосовно зростання тривалості дерматозу наведено в табл. 3.3.
З представленої таблиці видно, що достовірні та статистично значущі відмінності були отримані при порівнянні показника IL-1α в групах пацієнтів, які страждали лише на Пс з різною тривалістю хвороби: при тривалості Пс до 5 років рівень IL-1α на 50 % був вищим за аналогічний показник у пацієнтів групи з тривалістю захворювання більше 5 років (р<0,05). Протилежна динаміка зафіксована відносно показників IL-6 та TNF-α: різниця становила 17,33 % і 17,55 % у групі пацієнтів з тривалістю дерматозу більше 5 років. У пацієнтів основної групи при тривалому перебігу дерматозу статистично достовірно і значимо вище були маркери запального процесу – ІL-1α, ІL-6 і TNF-α. Так, різниця в показниках ІL-1α між групами пацієнтів з тривалістю до і більше 5 років склала 77,36 % (р<0,05), показник ІL-6 – 44,68 % (р<0,05) і TNF-α – 288,15 % (р<0,05).
Таблиця 3.3 – Вміст цитокінів у хворих першої та третьої групи залежно від тривалості Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість Пс до 5 років | Тривалість Пс більше 5 років | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| IL-1β, пг/мл | 0,17±0,06 (0,05-0,29) | 0,14±0,04 (0,06-0,22) | 0,07±0,01 (0,06-0,08) |
| IL-1α, пг/мл | 0,5±0,07 (0,35-0,65) | 0,25±0,07 (0,9-0,58)* | 0,37±0,04 (0,29-0,44) |
| IL-6, пг/мл | 0,75±0,12 (0,5-0,99) | 0,88±0,24 (0,4-1,36) | 0,89±0,1 (0,69-1,09) |
| TNF-α, пг/мл | 16,75±0,47 (15,81-17,69) | 19,69±1,51 (16,67-22,72) | 11,6±0,43 (10,74-12,46) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| IL-1β, пг/мл | 0,6±0,33 (-0,05-1,25) | 0,53±0,17 (0,19-0,87) | 0,55±0,15 (0,25-0,84) |
| IL-1α, пг/мл | 1,06±0,07 (1,06-1,06) | 1,88±0,53 (0,81-2,95)* | 1,72±0,43 (0,86-2,58) |
| IL-6, пг/мл | 5,17±0,93 (3,31-7,03) | 7,48±0,86 (5,76-9,2)* | 5,25±0,81 (3,63-6,87) |
| TNF-α, пг/мл | 22,44±1,15 (20,14-24,73) | 87,1±43,74 (37,01-174,58)* | 73,52±35,32 (2,88-144,15) |
Примітка. * – р<0,05 при порівнянні з групою пацієнтів з тривалістю захворювання до 5 років.
Оцінка вмісту цитокінів залежно від ІМТ наведена в табл. 3.4.
Отримані результати свідчать про те, що зі збільшенням ІМТ відбувається зростання рівня маркерів системного запалення, що чітко простежувалося при порівнянні пацієнтів, хворих лише на Пс, але більш яскраво виражено у пацієнтів з поєднаною патологією. Хворі на Пс мали виражену тенденцію зростання рівня цитокінів при зростанні ІМТ більше 30 кг/м2: IL-1β – на 30,77 %, IL-1α – на 131,82 % (р<0,05), IL-6 – на 60 % (р<0,05) і TNF-α – на 11,39 %, відповідно.
Аналогічні за спрямованістю, статистично значущі та достовірні зміни простежувалися і при наявності у пацієнтів коморбідної патології – зростання запальних маркерів при зростанні ІМТ більше 30 кг/м2 склало: для IL-1β – 21,28 % (р<0,05), IL-1α – 69,03 % (р<0,05), IL-6 – 25,16 % (р<0,05); найбільш виражену різницю визначено при дослідженні TNF-α , яка становила 262,53 % (р<0,05).
Таблиця 3.4 – Вміст цитокінів у хворих в залежності від ІМТ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| ІМТ до 30 кг/м2 | ІМТ более 30 кг/м2 | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| IL-1β, пг/мл | 0,06±0,01 (0,05-0,08) | 0,09±0,01 (0,07-0,1)* | 0,17±0,05 (0,06-0,27) |
| IL-1α, пг/мл | 0,29±0,04 (0,2-0,37) | 0,45±0,06 (0,33-0,56) | 0,46±0,07 (0,32-0,6) |
| IL-6, пг/мл | 0,95±0,16 (0,64-1,26) | 0,83±0,13 (0,57-1,1) | 0,77±0,11 (0,55-0,99) |
| TNF-α, пг/мл | 10,02±0,58 (8,85-11,19) | 13,25±0,44 (12,38-14,12)* | 17,9±0,6 (16,7-19,1) |
| Хворі на Пс (n=34) | |||
| IL-1β, пг/мл | 0,13±0,06 (0,01-0,25) | 0,17±0,06 (0,05-0,29) | 0,07±0,01 (0,06-0,08) |
| IL-1α, пг/мл | 0,22±0,18 (-0,14-0,58) | 0,51±0,07 (0,36-0,65)* | 0,37±0,04 (0,29-0,44) |
| IL-6, пг/мл | 0,7±0,12 (0,46-0,94) | 1,12±0,17 (0,78-1,46)* | 0,89±0,1 (0,69-1,09) |
| TNF-α, пг/мл | 15,71±1,24 (13,23-18,2) | 17,5±0,55 (16,41-18,59) | 11,6±0,43 (10,74-12,46) |
| Хворі на Пс у поєднанні із ГХ (n=80) | |||
| IL-1β, пг/мл | 0,47±0,26 (-0,06-1) | 0,57±0,18 (0,21-0,93) | 0,55±0,15 (0,25-0,84) |
| IL-1α, пг/мл | 1,13±0,12 (0,89-1,37) | 1,91±0,27 (0,78-3,05)* | 1,72±0,43 (0,86-2,58) |
| IL-6, пг/мл | 4,73±0,16 (2,41-6,05) | 5,92±0,24 (3,64-8,2)* | 5,25±0,81 (3,63-6,87) |
| TNF-α, пг/мл | 24,98±2,62 (19,75-30,22) | 90,56±46,61 (32,66-183,79)* | 73,52±35,32 (2,88-144,15) |
Примітка. * – р<0,05 при порівнянні з групою пацієнтів з ІМТ 30 кг/м2.
Показники рівня цитокінів у осіб залежно від статі наочно продемонстровано в табл. 3.5.
Як видно з таблиці, гендерних відмінностей за досліджуваними параметрами в групах порівняння не було виявлено. Більшість показників груп хворих лише на Пс або ГХ не мали статистичної достовірності (р>0,05).
При поєднаній патології гендерні відмінності були більш вагомі: у жінок IL-1β вищий на 73,17 %, IL-1α – на 11,11 %, IL-6 – на 23,12 %, а стосовно TNF-α, різниця жінок з чоловіками склала 451,33 %, будучи при цьому статистично значущою і достовірною (р<0,05), що пояснюється більшою кількістю у них артропатичного Пс.
Таблиця 3.5 – Вміст цитокінів у хворих в залежності від статі (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Чоловіки | Жінки | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| IL-1β, пг/мл | 0,07±0,01 (0,05-0,1) | 0,07±0,01 (0,06-0,08) | 0,17±0,05 (0,06-0,27) |
| IL-1α, пг/мл | 0,26±0,05 (0,15-0,36) | 0,4±0,05 (0,31-0,5)* | 0,46±0,07 (0,32-0,6) |
| IL-6, пг/мл | 0,87±0,21 (0,45-1,29) | 0,9±0,12 (0,67-1,13) | 0,77±0,11 (0,55-0,99) |
| TNF-α, пг/мл | 10,88±0,72 (9,44-12,32) | 11,86±0,52 (10,81-12,91) | 17,9±0,6 (16,7-19,1) |
| Хворі на Пс (n=34) | |||
| IL-1β, пг/мл | 0,2±0,09 (0,01-0,38) | 0,15±0,06 (0,02-0,27) | 0,07±0,01 (0,06-0,08) |
| IL-1α, пг/мл | 0,48±0,13 (0,22-0,75) | 0,45±0,08 (0,28-0,62) | 0,37±0,04 (0,29-0,44) |
| IL-6, пг/мл | 0,89±0,18 (0,53-1,26) | 0,7±0,14 (0,42-0,97) | 0,89±0,1 (0,69-1,09) |
| TNF-α, пг/мл | 17,12±0,82 (15,48-18,75) | 17,28±0,68 (15,92-18,63) | 11,6±0,43 (10,74-12,46) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| IL-1β, пг/мл | 0,41±0,12 (0,17-0,65) | 0,71±0,29 (0,13-1,29) | 0,55±0,15 (0,25-0,84) |
| IL-1α, пг/мл | 2,16±0,07 (1,02-3,3) | 2,4±0,93 (0,54-4,26) | 1,72±0,43 (0,86-2,58) |
| IL-6, пг/мл | 4,93±1,02 (2,88-6,97) | 6,07±1,35 (3,37-8,77) | 5,25±0,81 (3,63-6,87) |
| TNF-α, пг/мл | 24,47±1,4 (21,66-27,28) | 134,91±75,64
(16,37-286,19) * |
73,52±35,32
(2,88-144,15) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів чоловічої статі.
Варіабельність сироваткових концентрацій цитокінів у пацієнтів різних вікових груп показана в табл. 3.6.
У хворих лише на Пс або ГХ достовірну різницю виявлено лише в поодиноких маркерах, що не дозволяє робити висновки. Поєднана патологія характеризувалася статистично достовірною різницею в показниках IL-1β і IL-1α в різних вікових групах пацієнтів: у осіб старше 50 років IL-1β і IL-1α були вищими на 58,97 % і 43,55 % (р<0,05) відповідно відносно осіб молодше 50 років. Статистично недостовірну різницю зафіксовано відносно IL-6 та TNF-α в різних вікових групах.
Таблиця 3.6 – Вміст цитокінів у хворих в залежності від віку (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Молодше 50 років | Старше 50 років | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| IL-1β, пг/мл | 0,07±0,01 (0,05-0,08) | 0,08±0,01 (0,06-0,1) | 0,17±0,05 (0,06-0,27) |
| IL-1α, пг/мл | 0,33±0,05 (0,24-0,43) | 0,42±0,05 (0,31-0,53)* | 0,46±0,07 (0,32-0,6) |
| IL-6, пг/мл | 0,7±0,11 (0,48-0,92) | 0,99±0,14 (0,71-1,28) | 0,77±0,11 (0,55-0,99) |
| TNF-α, пг/мл | 12,19±0,78 (10,63-13,75) | 11,29±0,51 (10,26-12,32) | 17,9±0,6 (16,7-19,1) |
| Хворі на Пс (n=34) | |||
| IL-1β, пг/мл | 0,17±0,06 (0,06-0,28) | 0,15±0,07 (0,01-0,29) | 0,07±0,01 (0,06-0,08) |
| IL-1α, пг/мл | 0,48±0,07 (0,33-0,63) | 0,33±0,05 (-0,17-0,83)* | 0,37±0,04 (0,29-0,44) |
| IL-6, пг/мл | 0,73±0,12 (0,5-0,97) | 1,06±0,08 (0,5-1,62)* | 0,89±0,1 (0,69-1,09) |
| TNF-α, пг/мл | 17,1±0,56 (15,98-18,23) | 18,18±0 (18,18-18,18) | 11,6±0,43 (10,74-12,46) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| IL-1β, пг/мл | 0,39±0,03 (0,25-0,93) | 0,62±0,09 (0,24-1)* | 0,55±0,15 (0,25-0,84) |
| IL-1α, пг/мл | 1,24±0,18 (0,48-2,79) | 1,78±0,15 (0,48-3,08)* | 1,72±0,43 (0,86-2,58) |
| IL-6, пг/мл | 4,92±1,27 (2,39-7,46) | 6,07±0,12 (3,83-8,31) | 5,25±0,81 (3,63-6,87) |
| TNF-α, пг/мл | 71,31±9,02 (26,74-169,35) | 76,51±12,17 (27,83-180,85) | 73,52±35,32 (2,88-144,15) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів молодше 50 років.
Вміст цитокінів у обстежених осіб залежно від ступеня АГ представлено в таблиці 3.7.
Пацієнти другої групи (лише з ГХ) з 3-м ступенем АГ демонстрували перевищення показників IL-1β на 414,29 % (р<0,05), IL-1α на 200,00 % (р<0,05), IL-6 на 174,26 % (р<0,05) і TNF-α на 321,62 % (р<0,05) при порівнянні з групами пацієнтів на ГХ з 1-2 ступенем АГ.
У пацієнтів основної групи з 3-м ступенем АГ IL-1β перевищував аналогічний маркер запалення у осіб на Пс і ГХ з 1-2 ступенем АГ на 1820,00 % (р<0,05), IL-1α на 209,57 % (р<0,05), IL-6 на 89,95 % (р<0,05) і TNF-α на 367,13 % (р<0,05) відповідно, демонструючи тенденцію, аналогічну попереднім групам порівняння. Таким чином, поєднання дерматозу і ГХ з більшою швидкістю і силою призводить до розвитку системного ураження організму, що виражається в реєстрації в декілька разів більш високих рівней маркерів запалення.
Таблиця 3.7 – Вміст цитокінів у хворих в залежності від ступеня АГ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| 1-2 ступінь АГ | 3 ступінь АГ | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| IL-1β, пг/мл | 0,07±0,01 (0,06-0,09) | 0,36±0,08 (0,19-0,53)* | 0,17±0,05 (0,06-0,27) |
| IL-1α, пг/мл | 0,37±0,04 (0,29-0,46) | 1,11±0,24 (0,62-1,59)* | 0,46±0,07 (0,32-0,6) |
| IL-6, пг/мл | 1,01±0,13 (0,74-1,25) | 2,77±0,54 (1,69-3,86)* | 0,77±0,11 (0,55-0,99) |
| TNF-α, пг/мл | 11,01±0,47 (10,07-11,94) | 46,42±18,45 (9,53-83,31)* | 17,9±0,6 (16,7-19,1) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| IL-1β, пг/мл | 0,05±0,01 (0,02-0,09) | 0,96±0,17 (0,22-0,89)* | 0,55±0,15 (0,25-0,84) |
| IL-1α, пг/мл | 0,94±0,07 (0,8-1,08) | 2,91±0,53 (0,85-3,97)* | 1,72±0,43 (0,86-2,58) |
| IL-6, пг/мл | 3,68±1,47 (0,74-6,62) | 6,99±0,95 (4,09-7,89)* | 5,25±0,81 (3,63-6,87) |
| TNF-α, пг/мл | 20,87±1,58 (17,71-24,03) | 97,49±13,7 (31,5-164,89)* | 73,52±35,32 (2,88-144,15) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з 1-2 ступенем АГ
Оцінено також активність цитокінів залежно від типу Пс. Аналізуючи отримані дані, достовірні відмінності між рівнями цитокінів виявлено лише у пацієнтів із зимовим типом дерматозу групи порівняння, у яких визначено найвищі значення IL-1β, їх різниця по відношенню до літнього типу склала 66,67 %, а по відношенню до недиференційованого типу – 140,00 % на користь зимового. Хворі основної групи не виявили статистично значущих відмінностей.
З урахуваннях тяжкості клінічної форми Пс всіх пацієнтів було об’єднано в три групи, найбільш схожі за патогенетичними механізмами і клінічними особливостям захворювання, дані наведено в табл. 3.8.
Таблиця 3.8 – Вміст цитокінів у хворих на Пс в залежності від форми дерматозу (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Пс
вульгарний бляшковий / краплеподібний / інтертригінозний |
Пс
вульгарний бляшковий з явищами ексудації |
Пс
еритродермічний/ артропатичний/ пустульозний |
|
| Хворі на Пс (n=34) | |||
| IL-1β, пг/мл | 0,05±0,01 (0,02-0,07) | 0,07±0,05 (-0,03-0,16) | 0,23±0,07 (0,08-0,38) |
| IL-1α, пг/мл | 0,42±0,08 (0,26-0,59) | 0,47±0,24 (-0,01-0,95) | 0,58±0,17 (0,23-0,92) |
| IL-6, пг/мл | 0,65±0,11 (0,2-1,27) | 0,79±0,14 (0,52-1,06) | 0,96±0,12 (0,58-1,34)* |
| TNF-α, пг/мл | 17,37±0,73 (15,92-18,82) | 17,03±1,31 (14,41-19,65) | 26,9±0,82 (15,26-28,53)*# |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| IL-1β, пг/мл | 0,28±0,07 (0,15-0,41) | 0,34±0,12 (0,1-0,59) | 0,73±0,25 (0,23-1,23)*# |
| IL-1α, пг/мл | 1,21±0,12 (0,97-1,44) | 1,75±0,15 (0,44-3,05)* | 2,07±0,45 (0,9-4,17)*# |
| IL-6, пг/мл | 4,81±0,35 (2,06-8,06) | 5,35±0,19 (0,58-10,13)* | 6,64±0,5 (3,46-7,82)* |
| TNF-α, пг/мл | 25,84±2,98
(19,87-31,81) |
75,53±12,26 (28,98-180,04)* | 109,84±88,41
(66,98-286,66)* |
Примітка: * – р<0,05 при порівнянні з 1 підгрупою; # – р<0,05 при порівнянні з 2 підгрупою.
У хворих групи порівняння рівень IL-1β при тяжких формах Пс був вищим на 78,26 % і 69,57 % порівняно з вульгарною бляшковою / краплеподібною і бляшковою з явищами ексудації формами (р<0,05). Вміст інших цитокінів був неінформативним у цій групі через статистичну недостовірність.
Пацієнти основної групи мали аналогічну, але більш виражену тенденцію залежності від форми дерматозу, як і в групі порівняння. При еритродермічній / артропатичній / пустульозній формі рівень IL-1β визначено вище на 61,64 % і 53,42 % порівняно з вульгарною бляшковою / краплеподібною / інтертригінозною і бляшковою з явищами ексудації формами Пс (р<0,05); IL-1α був вищим при тяжких формах на 41,55 % і 15,46 % по відношенню до вульгарної бляшкової / краплеподібної / інтертригінозної і бляшкової з явищами ексудації форм дерматозу (р<0,05).
Різниця показників стосовно IL-6 була статистично недостовірною. Відзначено достовірну і статистично значущу різницю стосовно показника TNF-α між групами хворих на вульгарну бляшкову / краплеподібну / інтертригінозну і бляшкову з явищами ексудації форми з різницею в 192,30 % на користь останньої групи (р<0,05). Також тяжкі форми Пс мали більш високі значення TNF-α статистично достовірно на 76,47 % і 31,24 % відповідно по відношенню до вульгарної бляшкової / краплеподібної / інтертригінозної і бляшкової з явищами ексудації форми (р<0,05).
Вміст цитокінів у хворих на Пс залежно від стадії представлено в таблиці 3.9. Оскільки кількість хворих на Пс з регресуючою стадією була дуже мала, вони не виділялися в самостійну групу.
Таблиця 3.9 – Вміст цитокінів залежно від стадії Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
Од. виміру |
Категорії пацієнтів | ||
| Стаціонарна | Прогресуюча | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| IL-1β, пг/мл | 0,03±0,01 (0,01-0,05) | 0,2±0,06 (0,08-0,32)* | 0,07±0,01 (0,06-0,08) |
| IL-1α, пг/мл | 0,37±0,14 (0,1-0,64) | 0,49±0,08 (0,32-0,65) | 0,37±0,04 (0,29-0,44) |
| IL-6, пг/мл | 0,58±0,1 (0,11-1,05) | 0,82±0,12 (0,57-1,07)* | 0,89±0,1 (0,69-1,09) |
| TNF-α, пг/мл | 15,76±0,59 (14,58-16,93) | 17,61±0,59 (16,42-18,79)* | 11,6±0,43 (10,74-12,46) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| IL-1β, пг/мл | 0,15±0,01 (0,12-0,17) | 0,62±0,17 (0,28-0,95)* | 0,55±0,15 (0,25-0,84) |
| IL-1α, пг/мл | 0,9±0,08 (0,74-1,06) | 1,86±0,5 (0,86-2,86)* | 1,72±0,43 (0,86-2,58) |
| IL-6, пг/мл | 2,21±0,13 (1,95-2,47) | 6,05±0,87 (4,31-7,78)* | 5,25±0,81 (3,63-6,87) |
| TNF-α, пг/мл | 19,31±0,33 (18,65-19,96) | 83,85±41,21 (14,3-166,27)* | 73,52±35,32 (28,88-144,15) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів зі стаціонарною формою
У осіб, що хворіють виключно на Пс (перша група порівняння), відзначено, що IL-1β вище у осіб із прогресуючою стадією, по відношенню до стаціонарної, на 566,67 % (р<0,05), IL-1α – на 32,43 %, IL-6 – на 41,38 % (р<0,05), а TNF-α – на 11,74 % (р<0,05).
При одночасному розвитку Пс і ГХ щодо вищезазначених показників зберігалася аналогічна тенденція, але різниця була більш значущою у разі кожного показника. Так, IL-1β був вищим у осіб з прогресуючою стадією Пс відносно стаціонарної на 313,33 % (р<0,05), IL-1α – на 106,67 % (р<0,05), IL-6 – на 173,76 % (р<0,05), а TNF-α – на 334,23 % (р<0,05), відповідно.
Простежено залежність рівня маркерів запалення від тяжкості і площі ураження шкіри (показника PASI), отримані дані подано в табл. 3.10.
Таблиця 3.10 – Вміст цитокінів у хворих на Пс в залежності від показника PASI (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| PASI ≤ 10 | PASI 10-30 | PASI ≥30 | |
| Хворі на Пс (n=34) | |||
| IL-1β, пг/мл | 0,07±0,01(0,02-0,11) | 0,11±0,02(0,06-0,16)* | 0,37±0,16(0,04-0,69) * # |
| IL-1α, пг/мл | 0,26±0,1(0,06-0,46) | 0,47±0,1(0,28-0,66)* | 0,64±0,15(0,34-0,94) * # |
| IL-6, пг/мл | 0,7±0,25(0,21-1,19) | 0,71±0,14(0,44-0,99) | 0,94±0,25(0,43-1,45) * # |
| TNF-α, пг/мл | 15,1±0,34(14,42-15,78) | 17,04±0,53(15,98-18,1)* | 19,65±0,83(17,98-21,32) * # |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| IL-1β, пг/мл | 0,22±0,05(0,09-0,35) | 0,26±0,04(0,15-0,37) | 0,85±0,26(0,33-1,37)* # |
| IL-1α, пг/мл | 0,93±0,05(0,82-1,03) | 1,06±0,01(1,01-1,08)* | 2,44±0,82(0,81-4,07) * # |
| IL-6, пг/мл | 4,25±0,54(0,16-5,34) | 5,31±0,15(0,46-7,34)* | 6,26±0,41(5,44-9,08) * # |
| TNF-α, пг/мл | 19,65±0,29(19,07-20,23) | 21,24±0,39(20,47-22,02)* | 127,89±67,89(-7,88-263,67) * # |
Примітка: * – р<0,05 при порівнянні з хворими з індексом PASI менше 10; # – р<0,05 при порівнянні з хворими з індексом PASI в діапазоні 10-30.
У пацієнтів групи порівняння було визначено прогресивне зростання рівнів цитокінів при збільшенні індексу PASI. Так, при PASI ≥ 30, IL-1β перевищував аналогічні показники груп з PASI ≤ 10 на 81,08 % (р<0,05) і з PASI 10-30 на 70,27 % (р<0,05). Значення показника IL-1β у пацієнтів основної групи було істотно вищим порівняно з контрольною групою хворих на Пс. При коморбідності з PASI ≥ 30 значення IL-1β на 74,12 % і 69,41 % (р<0,05) було вищим порівняно з групами з індексом PASI ≤ 10 і 10-30.
Така ж картина простежувалася і щодо IL-1α – чим вищий індекс PASI, тим вищими були показники запалення, а коморбідність істотно ускладнювала перебіг дерматозу, демонструючи підвищення рівня IL-1α залежно від PASI. Так, показники основної групи з індексом PASI ≥ 30 перевищували аналогічний груп з індексом PASI ≤ 10 і 10-30 на 61,89 % і 56,56 % (р<0,05) відповідно. IL-1α у хворих групи порівняння був істотно нижчим, ніж в основній групі.
Рівень IL-6 в основній групі у пацієнтів з PASI ≥ 30 перевищував порівняно з PASI ≤ 10 і 10-30 на 32,11 % і 15,18 % (р<0,05) відповідно. Між собою дві останні групи відрізнялися на 24,94 % (р<0,05) на користь хворих з більш високим PASI.
Також зростали і показники TNF-α при підвищенні PASI, особливо яскраво виражена ця динаміка була при поєднаній патології. Приєднання ГХ призводило до значного зростання TNF-α, а зростання PASI також спричиняло підвищення даного показника. Так, зростання індексу PASI від 10-30 до цифр понад 30 призводило до збільшення TNF-α на 84,64 % (р<0,05) порівняно з особами цієї ж групи і PASI до 10 і понад 30 мали відмінності на рівні 83,39 % (р<0,05).
Результати парної кореляції Спірмена (Rs) між рівнями цитокінів та показниками ЯЖ представлено в табл. 3.11.
Таблиця 3.11 – Кореляційна матриця показників ЯЖ (DLQI) і рівня цитокінів у хворих на Пс
| Показник, од.виміру | Хворі на Пс (n=34) | Хворі на Пс у поєднанні з ГХ (n=80) |
| IL-1β, пг/мл | +0,51* | +0,67* |
| IL-1α, пг/мл | +0,42* | +0,63* |
| IL-6, пг/мл | +0,27 | +0,40* |
| TNF-α, пг/мл | +0,67* | +0,73* |
Примітка. * – р<0,05 для Rs.
Отримані дані свідчать про достовірний односпрямований кореляційний зв’язок між значеннями інтегрального критерію оцінки ЯЖ DIQI і вмістом цитокінів, при цьому найвищий рівень кореляції встановлено з TNF-α. Це вказує на те, що у хворих на Пс (особливо при супутній ГХ) має місце різке зниження ЯЖ при прогресуванні рівня інтерлейкінів.
При вивченні не тільки ступеня / спрямованості, але й характеру залежності, яка описує функціональний взаємозв’язок між числовими змінними, проведено на невеликій вибірці регресійний аналіз, при якому в регресійну модель в якості незалежної змінної (предиктор) включено індекс PASI, а в якості залежної змінної, схильної до впливу з боку параметра тяжкості і поширеності ураження шкіри, використовувався рівень найбільш чутливого цитокіну TNF-α, залежно від наявності або відсутності ГХ.
Як свідчать дані, отримані в ході регресійного аналізу (рис. 3.1), взаємозв’язок між величиною площі ураженої поверхні тіла / інтенсивності основних симптомів і значеннями при Пс без супутньої ГХ мав лінійний характер (r =+0,6908; p<0,005; TNF-α = 13,503 + 0,209 * PASI), в той час як у хворих на Пс в поєднанні з ГХ найбільш адекватно характеризувався експоненційною моделлю регресії такого вигляду: TNF-α = 13,79×exp (0,0146×PASI (R = 0,74, R2 = 0,548, нормований R2 = 0,53 при F = 56,12, p<0,001). Це вказує на те, що підвищення рівня цитокінів, а особливо TNF-α, є одним із патогенетичних механізмів, що лежить в основі розвитку як локальних, так і системних уражень при прогресуванні дерматозу. При коморбідному стані ці процеси ще більш виражені і залежать від тяжкості дерматозу.
Зазначені дані добре вписуються в концепцію цитокін-залежної дисфункції клітин при Пс, що проявляється, зокрема, їх проліферативним, апоптозним дисбалансом. Необхідно також підкреслити, що підвищення в системному кровотоці рівня прозапальних цитокінів (TNF-α, IL-1β і 1α, IL-6 та ін.), найважливіших маркерів запалення при Пс, особливо в поєднанні з ГХ, розцінюється як підтвердження системної запальної реакції, що підтверджує взаємопотенціювання дерматозу і ГХ. До теперішнього часу отримано досить переконливі дані про роль імунної активації і системного запалення при прогресуванні ГХ, що, можливо, є одним із факторів більш вираженої імунної реакції.
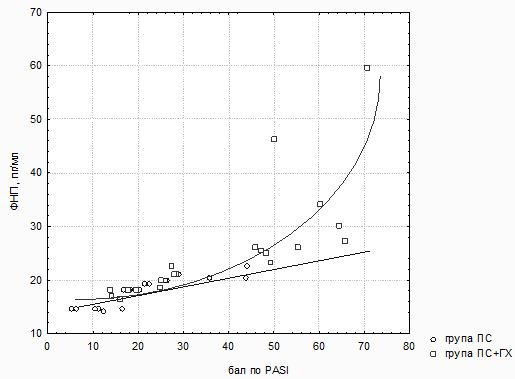
Рисунок 3.1 – Результати регресійного аналізу взаємозв’язку між концентрацією TNF-α
і показником PASI у хворих на Пс групи порівняння і основної групи
* * *
У хворих основної групи, які страждали на Пс у поєднанні з ГХ, рівень маркерів запального процесу достовірно перевищував аналогічні показники груп порівняння (хворих лише на Пс або ГХ). Концентрація IL-1β і -1α, а також TNF-α, статистично значимо виявилася більш високою за тривалості гіпертензивного синдрому або дерматозу більше 5 років як лише при ГХ, так і при коморбідній патології, але більш високі цифри визначено в останній групі хворих.
Відзначено, що зі збільшенням ІМТ > 30 кг/м2, переважно в основній групі, відбувалося збільшення маркерів системного запалення, найбільш яскраво це виражено при визначенні рівня TNF-α – на 262,53 % (р < 0,05) вище відносно хворих з нормальною вагою.
Чітких гендерних відмінностей за досліджуваними параметрами не було виявлено, крім основної групи і переважно для TNF-α, де показові значення цитокіну обумовлені наявністю значної кількості жінок з високими рівнями зазначеного показника. Це співпадало з клінічними проявами дерматозу в основній групі, де 73,9 % жінок страждали на артропатичний Пс.
При еритродермічній / артропатичній / пустульозній формах Пс було виявлено більш високі значення показників цитокінового профілю порівняно з вульгарною бляшковою / краплеподібною / інтертригінозною і бляшковою з явищами ексудації формами Пс як без ГХ, так і при їх поєднанні.
Зростання тяжкості і поширеності Пс згідно показника PASI також провокувало зростання IL-1β, IL-1α і TNF-α, меншою мірою – IL-6, а відповідно призводило до посилення системного запального процесу, що підтверджувалося формуванням тяжких форм дерматозу.
Згідно проведеного кореляційного аналізу, у хворих на Пс, особливо при супутній ГХ, мав місце статистично значущий зворотний кореляційний зв’язок між ЯЖ і вираженістю цитокінової елевації.
За даними регресійного аналізу зв’язок між традиційним параметром тяжкості Пс і показником цитокінової активації TNF-α у хворих на Пс при супутній ГХ достовірно описувався експоненційною моделлю регресії і виявився більш тісним і достовірним при зіставленні з аналогічною кривою у хворих на Пс без АГ, що може дозволити використовувати TNF-α у якості маркера тяжкості перебігу дерматозу при поєднанні з ГХ.
Матеріали даного розділу викладені в наступних роботах:
[35, 45, 49, 52, 53, 54, 94, 95, 407].
РОЗДІЛ 4
ФУНКЦІОНАЛЬНИЙ СТАН СУДИННОГО ЕНДОТЕЛІЮ
У ХВОРИХ НА ПСОРІАЗ ІЗ СУПУТНЬОЮ
ГІПЕРТОНІЧНОЮ ХВОРОБОЮ
4.1 Ангіогенез і апоптоз при псоріазі, гіпертонічній хворобі та їх поєднанні
Велика кількість експериментальних і клінічних досліджень дозволили накопичити вагомі докази того, що аномальний ангіогенез бере участь у ряді патологічних станів, у тому числі таких, як ревматоїдний артрит, Пс, дегенеративні захворювання очей та інші. Фактор росту ендотелію судин VEGF і його рецептори (VEGFRs) відіграють ключову роль як при фізіологічному, так і при патологічному ангіогенезі [153].
Загальновизнаним є той факт, що гальмування або зниження активності VEGF індукує апоптоз ендотеліальних клітин. VEGF може продукуватися різними типами клітин, в тому числі макрофагами, тромбоцитами, кератиноцитами, його активність не обмежується тільки судинною системою [205]. Цей маркер має антиапоптотичну дію, важливу роль відіграє VEGF і при ГХ, ремоделюючи судинну стінку. Виявлення його у сироватці крові при Пс є найбільш раннім маркером розвитку ЕД, ще до початку активного внутрішньосудинного запалення, проявляючи пряму залежність рівня VEGF від ступеня активності запального процесу в шкірі [299].
У свою чергу, протилежним ангіогенезу процесом є апоптоз. Апоптоз – природний морфобіохімічний процес знищення «непотрібних» клітин, урегульований механізм упорядкування якісного складу клітинної популяції. Процеси апоптозу відіграють важливу роль в процесі функціонування імунної системи, а також у будь-якій іншій системі, оскільки апоптоз – це складова частина нормального клітинного обороту. Каскад апоптозних процесів може бути або спровокований через медіатори, або запущений факторами, пов’язаними з пошкодженням клітини, токсичним впливом, або прямою дією на геном клітини. Біохімічні процеси, які супроводжують апоптоз, проявляються експресією специфічних генів і трансляцією особливих білків клітини: класичних медіаторів, нейропептидів, ростових і нейротрофічних факторів [274]. Патологічний апоптоз відіграє важливу роль в патогенезі розвитку як Пс, так і ГХ [257].
Саме тому було досліджено рівень обох цих маркерів у всіх пацієнтів.
Аналіз рівня фактора росту ендотелію судин (VEGF-А) та каспази-8 в обстежених осіб в цілому по групах показано в таблиці 4.1.
Таблиця 4.1 – Вміст VEGF-А та каспази-8 у обстежених осіб в цілому по групах (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Хворі на ГХ (n=30) | Хворі на Пс (n=34) | Хворі на Пс у поєднанні з ГХ (n=80) | Контрольна група (n=20) |
| VEGF-А, пг/мл | 182,87±18,69
(145,49-220,25) |
422,67±37,47
(347,73-497,61)* |
760,01±67,5
(625,01-895,01) *# |
21,36±3,09
(15,185-27,54) |
| Каспаза-8, нг/мл | 0,06±0,007
(0,05-0,07) |
0,10±0,01(0,08-0,11)* | 0,21±0,03(0,16-0,27) *# | 0,03±0,004
(0,022-0,04) |
Примітка. * – р <0,05 при порівнянні з хворими на Пс; # – р <0,05 при порівнянні з хворими на ГХ.
Як видно з таблиці 4.1, рівень VEGF-А у пацієнтів основної групи був на 75,94 і 44,39 % (р<0,05) вище по відношенню до хворих груп порівняння з ГХ або Пс відповідно достовірно. У той же час, різниця зазначеного показника між особами груп порівняння на Пс і ГХ склала 131,13 % на користь дерматозу (р<0,05), що свідчить про більш виразні процеси васкулонеогенезу у хворих з ураженням шкіри [34, 38, 62].
Стосовно рівня каспази-8 в основній групі, вона достовірно випереджала аналогічні показники груп порівняння хворих на Пс або на ГХ на 52,38 % і 71,43 % (р<0,05), відповідно, а хворі лише на Пс демонстрували 40,0 % елевацію цього маркеру (р<0,05) в порівнянні з хворими на ГХ. Таким чином, у пацієнтів з коморбідною патологією суттєво вище стан як новоутворення судин, так і процеси апоптозу [53].
Аналіз рівня досліджуваних показників у обстежених осіб в залежності від тривалості ГХ представлено в таблиці 4.2.
Таблиця 4.2 – Вміст VEGF-А і каспази-8 у хворих другої і третьої груп залежно від тривалості ГХ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість ГХ до 5 років | Тривалість ГХ більше 5 років | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| VEGF-А, пг/мл | 804,41±221,36(361,69-1247,12) | 748,91±68,73(611,46-886,36) | 760,01±67,5(625,01-895,01) |
| Каспаза-8, нг/мл | 0,05±0,005(0,05-0,06) | 0,07±0,01(0,06-0,08)* | 0,06±0(0,05-0,07) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| VEGF-А, пг/мл | 177,08±26,99(123,1-231,05) | 189,98±25,83(138,32-241,64) | 182,87±18,69(145,49-220,25) |
| Каспаза-8, нг/мл | 0,15±0,02(0,11-0,18) | 0,23±0,03(0,17-0,3)* | 0,21±0,03(0,16-0,27) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з тривалістю ГХ до 5 років.
Як видно з таблиці, спостерігалася лише тенденція до збільшення вмісту VEGF-А від тривалості ГХ в усіх групах хворих. Стосовно апоптозу, простежувався інший стан, відмічалося зростання рівня каспази-8 при збільшенні терміну захворювання на ГХ більше 5 років у групі контролю на 40,00 % (р<0,05). Збільшення даного показника у пацієнтів з коморбідною патологією на 53,33 % (р<0,05) при більш тривалому перебігу ГХ може свідчити про негативний вплив тривалої АГ на перебіг дерматозу.
Розглянемо значення VEGF-А і каспази-8 у хворих на Пс на тлі зростання тривалості дерматозу, які представлені в таблиці 4.3.
Діаметрально протилежні результати було отримано при вивченні VEGF-А в групах пацієнтів, хворих лише на Пс, де він підвищувався на 15,70 % при давності захворювання більше 5 років і, навпаки, у пацієнтів основної групи визначалося падіння рівня VEGF-А на 16,75 % при давності дерматозу більше 5 років. Це може свідчити про те, що формування характерної для коморбідної патології картини ураження шкіри відбувається найбільш активно в перші роки цього поєднання, тому питання своєчасної діагностики ГХ у хворих на Пс є вкрай важливим.
Таблиця 4.3 – Вміст VEGF-А і каспази-8 у хворих першої і третьої груп залежно від тривалості Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість Пс до 5 років | Тривалість Пс більше 5 років | У цілому по групі | |
| Хворі на Пс (n=34) | |||
| VEGF-А, пг/мл | 412,44±41,01(330,43-494,45) | 477,21±104,92(267,38-687,05) | 422,67±37,47(347,73-497,61) |
| Каспаза-8, нг/мл | 0,09±0,01(0,08-0,1) | 0,12±0,01(0,1-0,18)* | 0,10±0,01(0,08-0,11) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| VEGF-А, пг/мл | 877,59±199,39(478,81-1276,37) | 730,62±70,27(590,07-871,16) | 760,01±67,5(625,01-895,01) |
| Каспаза-8, нг/мл | 0,18±0,01(0,15-0,2) | 0,22±0,01(0,18-0,29)* | 0,21±0,03(0,16-0,27) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з тривалістю захворювання до 5 років.
Ініціальна каспаза апоптозу демонструвала впевнене підвищення на 33,33 % (р<0,05) пропорційно зі зростанням терміну дерматозу в групі порівняння, а при наявності коморбідної патології і тривалості дерматозу більше 5 років зростання рівня каспази-8 становило 22,22 % (р<0,05). Таким чином, процеси апоптозу не гальмуються з часом, на відміну від неоангіогенезу.
Кількісні параметри рівня VEGF-А і каспази-8 залежно від наявності надлишкової маси подано в таблиці 4.4.
Заслуговує на увагу лише приріст фактора росту судинного ендотелію VEGF-А в групі порівняння з ГХ і ІМТ більше 30 кг/м2 на 26,12 % (р<0,05) відносно пацієнтів з меншим ІМТ. Інші показники є статистично недостовірними.
Каспаза-8 демонструвала більш виражене зростання рівня (на 40 %) (р<0,05) при ІМТ більше 30 кг/м2 у групі порівняння з ГХ, у групі порівняння з Пс – лише на 25,00 % (р<0,05), а в основній групі – на 15,79 % (р<0,05).
Рівень досліджуваних маркерів у обстежених осіб в залежності від статі продемонстровано в таблиці 4.5.
Таблиця 4.4 – Вміст VEGF-А та каспази-8 у хворих залежно від ІМТ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| ІМТ до 30 кг/м2 | ІМТ вище 30 кг/м2 | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| VEGF-А, пг/мл | 162,13±25,05 (112,03-212,24) |
204,48±27,68 (149,11-259,84)* |
182,87±18,69 (145,49-220,25) |
| Каспаза-8, нг/мл | 0,05±0,005(0,05-0,06) | 0,07±0,005(0,06-0,07)* | 0,06±0(0,05-0,07) |
| Хворі на Пс (n=34) | |||
| VEGF-А, пг/мл | 417,8±82,51 (252,78-582,82) |
423,58±42,78 (338,02-509,14) |
422,67±37,47 (347,73-497,61) |
| Каспаза-8, нг/мл | 0,08±0,005(0,08-0,08) | 0,1±0,005(0,09-0,12)* | 0,10±0,01(0,08-0,11) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| VEGF-А, пг/мл | 714,1±76,29 (561,52-866,68) |
775,31±87,31 (600,69-949,94) |
760,01±67,5 (625,01-895,01) |
| Каспаза-8, нг/мл | 0,19±0,01(0,15-0,21) | 0,22±0,01(0,15-0,26)* | 0,21±0,03(0,16-0,27) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з ІМТ 30 кг/м2.
Таблиця 4.5 – Вміст VEGF-А і каспази-8 у хворих залежно від статі (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | |||
| Чоловіки | Жінки | В цілому по групі | ||
| Хворі на ГХ (n=30) | ||||
| VEGF-А, пг/мл | 205,98±38,2(129,58-282,37) | 174,53±21,54(131,45-217,61) | 182,87±18,69(145,49-220,25) | |
| Каспаза-8, нг/мл | 0,06±0,01(0,05-0,07) | 0,06±0(0,05-0,07) | 0,06±0(0,05-0,07) | |
| Хворі на Пс (n=34) | ||||
| VEGF-А, пг/мл | 409,01±63,45(282,11-535,91) | 430,64±48,39(333,87-527,41) | 422,67±37,47(347,73-497,61) | |
| Каспаза-8, нг/мл | 0,10±0,01(0,08-0,13) | 0,10±0,01(0,08-0,11) | 0,10±0,01(0,08-0,11) | |
| Хворі на Пс у поєднанні з ГХ (n=80) | ||||
| VEGF-А, пг/мл | 821,39±116,48(588,42-1054,35) | 699,02±45,16(594,68-775,31) | 760,01±67,5(625,01-895,01) | |
| Каспаза-8, нг/мл | 0,19±0,02(0,15-0,23) | 0,24±0,05(0,14-0,34) | 0,21±0,03(0,16-0,27) | |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів чоловічої статі.
Статистично достовірною була різниця між досліджуваними показниками лише у групі з коморбідною патологією. Більш високий вміст VEGF-А у сироватці чоловіків порівняно з жінками, з урахуванням особливостей клінічної картини, може пояснювати наявність вираженого неоваскулогенезу у хворих на ексудативний Пс, який у чоловіків основної групи реєструвався частіше, ніж у жінок.
Отримані дані наочно свідчать про лабораторне підтвердження особливостей клінічного перебігу дерматозу в основній групі, адже типова клініка поєднання Пс і ГХ, особливо у чоловіків – це визначено здебільшого вульгарний Пс із явищами ексудації, а значить більш запальний, інфільтрований, з великою кількістю судин, а у жінок – переважав Пс з артропатією. Таким чином, у групі з коморбідною патологією високі показники VEGF-А характерні для чоловіків, де значна частка дерматозу представлена ексудативною формою, високі значення каспази-8 спостерігалися у жінок, де переважає артропатичний Пс. У пацієнтів груп порівняння не виявлено статистично достовірної різниці відносно показників, що вивчалися.
При дослідженні маркерів неоангіогенезу та апоптозу у пацієнтів різних вікових груп не визначено достовірного впливу віку ані на рівень VEGF-А, ні на вміст каспази-8.
Рівні VEGF-А і каспази-8 в обстежених осіб залежно від ступеня АГ представлено в таблиці 4.6.
Таблиця 4.6 – Вміст VEGF-А і каспази-8 у хворих другої і третьої груп залежно від ступеня АГ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| 1-2 ступінь АГ | 3 ступінь АГ | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| VEGF-А, пг/мл | 182,92±20,81
(141,31-224,54) |
182,71±43,06(96,58-268,84) | 182,87±18,69(145,49-220,25) |
| Каспаза-8, нг/мл | 0,06±0(0,05-0,06) | 0,07±0(0,06-0,08) | 0,10±0,01(0,08-0,11) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| VEGF-А, пг/мл | 673,34±91,2
(490,95-855,73) |
781,68±81,5(618,68-944,67) | 760,01±67,5(625,01-895,01) |
| Каспаза-8, нг/мл | 0,15±0,02(0,1-0,19) | 0,23±0,03(0,17-0,3*) | 0,21±0,03(0,16-0,27) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з 1-2 ступенем АГ.
Як видно з таблиці 4.6, достовірним було лише зростання маркера апоптозу в пацієнтів з поєднаною патологією на 53,33 % при 3 ступені АГ, що свідчить про активність впливу більш вираженої ГХ на Пс і підтверджує необхідність своєчасної діагностики ГХ та раціональної її терапії у цієї групи хворих.
Було проаналізовано також рівень VEGF-А і каспази-8 залежно від типу Пс (див. табл. 4.7). Як видно з таблиці 4.7, достовірним було лише збільшення VEGF-А при недиференційованому типі Пс відносно зимового на 29,32 % (р<0,05), відповідно зимовий тип Пс мав рівні VEGF-А нижчі за літній на 29,91 % (р<0,05). Ангіогенез перебігає значно активніше в обох групах хворих на Пс у разі наявності недиференційованого типу дерматозу.
Таблиця 4.7 – Вміст VEGF-А і каспази-8 у хворих першої і третьої груп залежно від типу Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Зимовий тип Пс | Літній тип Пс | Недиференційований
тип Пс |
|
| Хворі на Пс (n=34) | |||
| VEGF-А, пг/мл | 404,69±50,68(303,32-506,06) | 371,06±117,45(136,16-605,96) | 467,9±66,77(334,37-601,44) |
| Каспаза-8, нг/мл | 0,09±0,01(0,07-0,11) | 0,10±0,02(0,06-0,14) | 0,11±0,01(0,08-0,13) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| VEGF-А, пг/мл | 597,04±49(499,05-695,03) | 775,62±74,95(625,72-925,52) | 844,65±112,28(620,08-1069,21) * |
| Каспаза-8, нг/мл | 0,19±0,05(0,09-0,28) | 0,25±0,03(0,18-0,31)* | 0,22±0,04(0,13-0,31) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з зимовим типом; # – р <0,05 при порівнянні з літнім типом.
Результати стосовно рівня каспази-8 свідчать про більш виражені процеси апоптозу у хворих з літнім типом Пс.
Рівень VEGF-А і каспази-8 у хворих на Пс залежно від форми дерматозу наведено в таблиці 4.8.
Як видно з таблиці 4.8, VEGF-А має найнижчі значення при вульгарній бляшковій / краплеподібній / інтертригінозній формах дерматозу без ГХ, найвищі рівні спостерігалися при бляшковій з явищами ексудації формі Пс в основній групі, що підтвердило нашу думку про специфічність цього показника саме для цієї форми.
Таблиця 4.8 – Вміст VEGF-А і каспази-8 у хворих першої і третьої груп залежно від форми Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Пс
вульгарний бляшковий / краплеподібний / інтертригінозний |
Пс
бляшковий з явищами ексудації |
Пс
еритродермічний / артропатичний / пустульозний |
|
| Хворі на Пс (n=34) | |||
| VEGF-А, пг/мл | 204,07±97,01(120,05-608,09) | 482,45±43,16(366,14-538,76) * | 377,28±48,25(180,77-573,78) *# |
| Каспаза-8, нг/мл | 0,09±0,01(0,08-0,1) | 0,11±0,03(0,05-0,17) | 0,12±0,01(0,08-0,14) * # |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| VEGF-А, пг/мл | 431,46±24,92(481,63-581,29) | 985,5±109,58(566,33-1204,67)* | 818,26±86,89(644,49-992,04) *# |
| Каспаза-8, нг/мл | 0,18±0,02(0,15-0,20) | 0,21±0,07(0,07-0,35) | 0,25±0,04(0,14-0,3)* # |
Примітка. * – р <0,05 при порівнянні з 1 підгрупою; # – р <0,05 при порівнянні з 2 підгрупою.
Стосовно рівня каспази-8, достовірна різниця визначалася лише в основній групі, між вульгарною бляшковою / краплеподібною / інтертригінозною і еритродермічною / артропатичною / пустульозною різниця становила 28,00 % (р<0,05). Це свідчить про те, що найбільш активні апоптотичні процеси слід очікувати в осіб з тяжкими формами дерматозу при коморбідній патології.
Рівні VEGF-А і каспази-8 в обстежених осіб залежно від стадії Пс подано в таблиці 4.9.
У пацієнтів обох груп визначено однакову тенденцію: рівень VEGF-А вищий при прогресуючій стадії дерматозу на 54,87 % (р<0,05) у групі порівняння і на 26,78 % (р<0,05) в основній групі. Рівень каспази-8 при коморбідній патології, маючи той же вектор динамічних змін, демонстрував різницю в 76,92 % (р<0,05) також на користь прогресуючої форми, що потрібно враховувати при проведенні терапії.
Аналіз рівня VEGF-А і каспази-8 залежно від індексу PASI у обстежених хворих подано в таблиці 4.10.
Таблиця 4.9 – Вміст VEGF-А і каспази-8 у хворих залежно від стадії Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Стаціонарна стадія Пс | Прогресуюча стадія Пс | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| VEGF-А, пг/мл | 294,91±60,77(173,37-416,44) | 456,74±41,01(374,72-538,76)* | 422,67±37,47(347,73-497,61) |
| Каспаза-8, нг/мл | 0,09±0,01(0,07-0,1) | 0,10±0,01(0,08-0,12) | 0,10±0,01(0,08-0,11) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| VEGF-А, пг/мл | 619,08±93,66(411,76-826,4) | 784,88±46,62(631,64-938,12)* | 760,01±67,5(625,01-895,01) |
| Каспаза-8, нг/мл | 0,13±0,01(0,1-0,15) | 0,23±0,03(0,17-0,29)* | 0,21±0,03(0,16-0,27) |
Примітка. * – р<0,05 при порівнянні з групою пацієнтів зі стаціонарною формою.
Таблиця 4.10 – Вміст VEGF-А і каспази-8 у хворих залежно від PASI (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| PASI ≤ 10 | PASI 10-30 | PASI ≥30 | |
| Хворі на Пс (n=34) | |||
| VEGF-А, пг/мл | 345,42±53,54(288,34-502,51) | 418,45±22,03(354,39-582,52)* | 575,93±26,89(422,15-629,7) * # |
| Каспаза-8, нг/мл | 0,08±0(0,08-0,09) | 0,09±0(0,08-0,09) | 0,13±0,02(0,09-0,16) * # |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| VEGF-А, пг/мл | 434,96±28,34(318,29-551,64) | 789,83±26,87(676,09-803,58)* | 1205,41±32,32(902,78-1350,04)* # |
| Каспаза-8, нг/мл | 0,14±0,01(0,12-0,16) | 0,17±0,005(0,16-0,18)* | 0,29±0,05(0,19-0,38) * # |
Примітка. * – р <0,05 при порівнянні з хворими з індексом PASI менше 10; # – р <0,05 при порівнянні з хворими з індексом PASI в діапазоні 10-30.
Посилення ангіогенезу, на що вказувало зростання VEGF-А у хворих на Пс групи порівняння, відзначено при PASI ≥ 30 на 66,73 % і на 37,63 % (р<0,05) – при порівнянні з групою хворих лише на Пс та індексом PASI ≤ 10 і 10-30. В основній групі збільшення PASI від 10 до 30 демонструвало підвищення VEGF-А на 44,93 % (р<0,05), зростання PASI від 10-30 до цифр понад 30 призводило до підвищення VEGF-А на 52,62 % (р<0,05). При порівнянні в основній групі – з індексом PASI до 10 і понад 30 балів, визначалася відмінність у 177,13 % (р<0,05).
Достовірне зростання рівня каспази-8 спостерігалося у хворих обох груп з PASI ≥30. У групі порівняння це становило 38,46 % (р<0,05). В основній групі приєднання ГХ істотно посилювало апоптотичні процеси: на 51,72 % і 41,38 % (р<0,05) порівняно з групами, що мали PASI ≤ 10 і 10-30 відповідно.
Таким чином, можна дійти висновку, що ангіогенез істотно зростає на тлі приєднання до дерматозу ГХ і формування типової для цієї коморбідності форми – вульгарного Пс з явищами ексудації, що підтверджується зростанням показників VEGF-А зі збільшенням PASI. Отже, VEGF-А є найбільш показовим маркером, який свідчить саме про стан ураження шкіри, але є менш достовірним при формуванні артропатичного Пс.
Враховуючи виражену залежність показника VEGF-А від ступеня ураження саме шкіри, методом ROC-аналізу було розраховано критичне значення рівня щодо асоціації з площею ураження шкіри, яке становило 700 пг/мл (майже 90 перцентиль). Таким чином, значення VEGF-А більше 700 пг/мл може достовірно слугувати маркером тяжкості ступеня ураження шкіри (у 92 % таких хворих PASI перевищував 30 ум. од.).
Оскільки показник апоптозу виявився більш залежним від активності ураження суглобів, з метою оцінки прогностичності фактора «рівень каспази-8» у розвитку артропатичної форми Пс здійснено уніваріантний регресійний аналіз пропорційних ризиків Кокса, в результаті якого було підтверджено статистично значуще прогностичне значення рівня каспази-8 більше 0,22 нг/мл (ВР = 3,26, 95 % ДІ = 1,62-3,93, р=0,01) для розвитку збільшення частоти випадків артропатичного Пс [35, 39].
4.2 Визначення вмісту факторів вазоконстрикції, метаболізму оксиду азоту, активності NO-синтаз та стану антиоксидантної системи
Патологічний процес у шкірі у пацієнтів, які страждають на Пс, розвивається, на думку багатьох авторів, спочатку в дермі, а потім – в епідермісі. Судинний компонент у хворих на Пс здебільшого пов’язаний з дисфункцією ендотелію, яка проявляється зниженням секреції NO і підвищенням секреції вазоконстрикторів (ендотеліну-1, пероксинітриту та ін.).
Було вивчено динаміку показників метаболізму NO у вигляді нітротирозину і ключового вазоконстриктора ендотеліального походження – ендотеліну-1, в обстежених осіб в цілому (таблиця 4.11).
Таблиця 4.11 – Вміст вазоконстрикторів у обстежених осіб в цілому по групах (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Хворі на ГХ (n=30) | Хворі на Пс (n=34) | Хворі на Пс у поєднанні з ГХ (n=80) | Контрольна група (n=20) |
| Нітротирозин, нмоль/мл | 9,28±1,05
(7,19-11,38) |
10,76±2,04
(6,67-14,85) |
17,32±6,51
(4,3-30,33) *# |
3,14±0,88
(1,38-4,9) |
| Ендотелін-1, фМоль/мл | 0,04±0,01
(0,03-0,05) |
0,11±0,02
(0,08-0,14)* |
0,35±0,15
(0,05-0,65) *# |
0,02±0,003
(0,01-0,03) |
Примітка. * – р <0,05 при порівнянні з групою хворих на Пс; # – р <0,05 при порівнянні з групою хворих на ГХ.
Аналіз рівня нітротирозину у пацієнтів в обстежених групах показав, що, аналогічно даним попередніх показників, в основній групі з поєднаною патологією відзначено максимальні з усіх груп рівні факторів вазоконстрикції, а відносно груп порівняння визначено різницю в 46,42 % і 37,88 % (р<0,05) відносно хворих тільки на ГХ або Пс відповідно. При цьому група хворих на Пс мала на 15,95 % вищі значення нітротирозину порівняно з групою хворих на ГХ.
Рівень ендотеліну-1 в сироватці крові хворих на Пс був на 175,00 % (р<0,05) вище відносно пацієнтів з ГХ. Що ж стосується порівняння основної групи хворих з групами порівняння на ГХ або Пс, то різниця склала на користь групи з коморбідною патологією: 88,57 % і 68,57 % (р<0,05) відповідно, і була статистично значущою і достовірною [51,63].
Аналіз рівня досліджуваних показників у обстежених осіб залежно від тривалості ГХ показано в таблиці 4.12.
Зростає рівень нітротирозину у хворих лише на ГХ, які хворіють понад 5 років – на 11,64 % (р<0,05). При коморбідній патології рівень нітротирозину істотно підвищувався (на 45,8 %, р<0,05) зі зростанням давності захворювання, перевищуючи аналогічні показники хворих на ГХ майже у 2 рази.
Таблиця 4.12 – Вміст вазоконстрикторів у хворих другої і третьої груп залежно від тривалості ГХ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість ГХ до 5 років | Тривалість ГХ більше 5 років | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Нітротирозин, нмоль/мл | 8,65±1,9(4,84-12,46) | 9,79±1,13(7,52-12,06) | 9,28±1,05(7,19-11,38) |
| Ендотелін-1, фМоль/мл | 0,02±0(0,02-0,03) | 0,06±0(0,05-0,07)* | 0,04±0(0,03-0,05) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Нітротирозин, нмоль/мл | 10,33±2,76(4,8-15,85) | 19,06±8,1(2,85-35,27)* | 17,32±6,51(4,3-30,33) |
| Ендотелін-1, фМоль/мл | 0,12±0,01(0,09-0,14) | 0,41±0,18(0,04-0,78)* | 0,35±0,15(0,05-0,65) |
Примітка. * – р <0,05 при порівнянні з групою хворих на ГХ з тривалістю захворювання до 5 років.
Ендотелін-1 демонстрував статистично достовірне стабільне зростання значень зі збільшенням тривалості захворювання більше 5 років як у хворих на ГХ (у 3 рази р<0,05), так і при поєднаній патології (3,4 рази при р<0,05). Мітогенні властивості ендотеліну призводять до значного вазального ремоделювання як у цілому в судинній системі, так і в судинах шкіри зокрема. Більш тривалий перебіг ГХ, як і поєднаної патології, тільки підсилює зазначені процеси, призводячи до розвитку патоморфологічних змін, що є структурною основою ураження органів-мішеней при обох досліджуваних нозологіях.
Розглянемо отримані значення факторів вазоконстрикції в групах пацієнтів з Пс на тлі зростання тривалості дерматозу, які наведено в таблиці 4.13.
Тривалий дерматоз (більше 5 років) у групі порівняння ознаменувався зниженням рівня нітротирозину на 47,32 % (р<0,05), а при наявності комбінації Пс і ГХ даний маркер нітрозуючого стресу також знизився на 42,55 % (р<0,05). Активність нітрозування молекул в організмі пацієнтів з тривалим дерматозом пропорційно знижувалася зі збільшенням давності дерматозу, а наявність ГХ збільшувала цей відсоток. Таким чином, довгостроковий перебіг як ГХ, так і дерматозу призводить до істотного і статистично достовірного зростання маркерів нітрозуючого стресу при поєднанні нозологій.
Таблиця 4.13 – Вміст вазоконстрикторів у хворих першої і третьої груп залежно від тривалості Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість Пс до 5 років | Тривалість Пс більше 5 років | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| Нітротирозин, нмоль/мл | 11,39±2,23(6,94-15,85) | 6,01±4,7(-3,4-15,4)* | 10,76±2,04(6,67-14,85) |
| Ендотелін-1, фМоль/мл | 0,11±0,02(0,07-0,15) | 0,1±0,02(0,07-0,14) | 0,11±0,02(0,08-0,14) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Нітротирозин, нмоль/мл | 26,25±2,39(-16,53-49,03) | 15,08±6,52(2,04-28,13)* | 17,32±6,51(4,3-30,33) |
| Ендотелін-1, фМоль/мл | 0,37±0,24(-0,11-0,84) | 0,35±0,18(-0,01-0,7) | 0,35±0,15(0,05-0,65) |
Примітка: * – р <0,05 при порівнянні з групою хворих на Пс з тривалістю захворювання до 5 років.
При розгляді рівня ендотеліну-1 не виявлено статистично достовірних змін на тлі тривалості Пс. Таким чином, судинне ремоделювання більше залежить від тривалості ГХ, ніж від тривалості дерматозу, що і демонструють отримані результати.
Кількісні ознаки змін метаболізму NO і ендотеліну-1 залежно від ІМТ подано в таблиці 4.14.
В основній групі визначено зростання рівня нітротирозину зі збільшенням маси тіла. Таким чином, показник активності нітрозуючого стресу зростав при поєднанні Пс і ГХ, а надлишкова маса тіла тільки посилювала даний патологічний каскад.
Таблиця 4.14 – Вміст вазоконстрикторів у хворих залежно від ІМТ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| ІМТ до 30 кг/м2 | ІМТ більше 30 кг/м2 | У цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Нітротирозин, нмоль/мл | 10,21±1,11(8-12,42) | 8,32±1,81(4,7-11,94) | 9,28±1,05(7,19-11,38) |
| Ендотелін-1, фМоль/мл | 0,03±0,005(0,02-0,04) | 0,05±0,015(0,05-0,06)* | 0,04±0(0,03-0,05) |
| Хворі на Пс (n=34) | |||
| Нітротирозин, нмоль/мл | 6,1±3,8(-1,5-13,7) | 11,76±2,31(7,14-16,38)* | 10,76±2,04(6,67-14,85) |
| Ендотелін-1, фМоль/мл | 0,1±0,02(0,06-0,14) | 0,11±0,02(0,07-0,15) | 0,11±0,02(0,08-0,14) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Нітротирозин, нмоль/мл | 8,72±2,49(3,73-13,71) | 20,18±8,59(3,01-37,35)* | 17,32±6,51(4,3-30,33) |
| Ендотелін-1, фМоль/мл | 0,19±0,07(0,05-0,34) | 0,4±0,2(0,01-0,79)* | 0,35±0,15(0,05-0,65) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з ІМТ 30 кг / м2
Ендотелін-1 зростав при збільшенні ІМТ більше 30 кг/м2 на 66,67 % (р<0,05) у хворих на ГХ групи порівняння, подібна тенденція зберігалася і в групі порівняння з Пс: зростання на 10 %. У групі з коморбідною патологією спостерігалося підвищення ендотеліну-1 на 110,53 % при ІМТ більше 30 кг/м2. Таким чином, більш значні прояви вазопресорної активності визначалися саме при наявності у пацієнтів поєднання Пс і ГХ.
Відображення вмісту нітротирозину й ендотеліну-1 в обстежених осіб залежно від статі наведено в таблиці 4.15.
Статистично достовірне підвищення маркерів вазоконстрикції визначено лише у жінок основної групи, де значення нітротирозину було більшим відносно чоловічої на 311,51 %; ендотелін-1 у жінок був більшим, ніж у чоловіків на 74 %. Отримані дані свідчать про те, що судинне ремоделювання та вазоконстрикція більш активно перебігають у жінок при Пс і супутній ГХ.
Таблиця 4.15 – Вміст вазоконстрикторів у хворих залежно від статі (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Чоловіки | Жінки | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Нітротирозин, нмоль/мл | 7,76±1,41(4,95-10,57) | 9,81±1,32(7,17-12,45) | 9,28±1,05(7,19-11,38) |
| Ендотелін-1, фМоль/мл | 0,03±0,01(0,02-0,05) | 0,04±0(0,03-0,05) | 0,04±0(0,03-0,05) |
| Хворі на Пс (n=34) | |||
| Нітротирозин, нмоль/мл | 11,52±3,89(3,73-19,3) | 10,35±2,48(5,38-15,31) | 10,76±2,04(6,67-14,85) |
| Ендотелін-1, фМоль/мл | 0,12±0,03(0,07-0,18) | 0,11±0,02(0,06-0,15) | 0,11±0,02(0,08-0,14) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Нітротирозин, нмоль/мл | 7,21±1,54(4,13-10,29) | 29,67±13,61(2,44-56,89)* | 17,32±6,51(4,3-30,33) |
| Ендотелін-1, фМоль/мл | 0,27±0,11(0,1-0,34) | 0,47±0,12(0,17-1,51)* | 0,35±0,15(0,05-0,65) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів чоловічої статі.
При дослідженні маркерів вазоконстрикції встановлено, що суттєвого впливу вік хворих на рівень нітротирозину або ендотеліну-1 не мав (р˂0,05).
Концентраційні значення нітротирозину й ендотеліну-1 в обстежених осіб залежно від ступеня АГ наведено в таблиці 4.16.
Істотно достовірно зростає рівень нітротирозину у хворих з 3 ступенем АГ у порівнянні із 1-2 ступенем АГ при коморбідній патології – на 93,49 % (р<0,05). Ендотелін-1 демонстрував статистично достовірне зростання значень при 3 ступені АГ у порівнянні з пацієнтами з 1-2 ступенем АГ лише в групі порівняння на ГХ (100,0 %; р˂0,05).
Оцінено рівень показників залежно від типу Пс, що представлено в таблиці 4.17.
Таблиця 4.16 – Маркери ЕД у хворих другої і третьої груп залежно від ступеня АГ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| 1-2 ступінь АГ | 3 ступінь АГ | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Нітротирозин, нмоль/мл | 8,95±1,27(6,42-11,48) | 10,39±1,76(6,87-13,9) | 9,28±1,05 (7,19-11,38) |
| Ендотелін-1, фМоль/мл | 0,03±0(0,03-0,04) | 0,06±0,01(0,04-0,07)* | 0,04±0,01 (0,03-0,05) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Нітротирозин, нмоль/мл | 14,59±3,57(10,5-17,73) | 28,23±5,71(5,2-49,65)* | 17,32±6,51(4,3-30,33) |
| Ендотелін-1, фМоль/мл | 0,34±0,24(-0,14-0,83) | 0,35±0,18(0-0,71) | 0,35±0,15(0,05-0,65) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з 1-2 ступенем АГ.
Таблиця 4.17 – Вміст вазоконстрикторів у хворих першої і третьої груп залежно від типу Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Зимовий тип Пс | Літній тип Пс | Недиференційований тип Пс | |
| Хворі на Пс (n=34) | |||
| Нітротирозин, нмоль/мл | 9,63±2,37(4,9-14,37) | 13,57±7,07(-0,58-27,71) | 11,1±4,46(2,18-20,02) |
| Ендотелін-1, фМоль/мл | 0,14±0,03(0,07-0,2) | 0,08±0,01(0,06-0,11)* | 0,09±0,01(0,08-0,1)* |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Нітротирозин, нмоль/мл | 6,47±1,14(4,19-8,74) | 12,83±3,18(6,48-19,19)* | 24,45±11,55(1,36-47,55) * # |
| Ендотелін-1, фМоль/мл | 0,15±0,03(0,09-0,21) | 0,17±0,05(0,06-0,27) | 0,51±0,26(-0,02-1,04) * # |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з зимовим типом; # – р <0,05 при порівнянні з літнім типом.
Найвищий показник маркера нітрозуючого стресу визначено в групі з коморбідною патологією і недиференційованим типом Пс, в цій же групі зафіксовано найвищі рівні ендотеліну-1, що свідчило про значне переважання факторів, які призводили до ЕД у хворих з поєднаною патологією.
Значення показників у обстежених осіб залежно від форми Пс наведено в таблиці 4.18.
Таблиця 4.18 Вміст вазоконстрікторів у хворих першої і третьої груп залежно від форми Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Пс
вульгарний бляшковий / краплеподібний / інтертригінозний |
Пс
вульгарний бляшковий з явищами ексудації |
Пс
еритродермічний/ артропатичний / пустульозний |
|
| Хворі на Пс (n=34) | |||
| Нітротирозин, нмоль/мл | 9,99±2,72(4,55-15,43) | 14,17±6,56(1,05-27,28) | 10,13±3,76(2,6-17,65) |
| Ендотелін-1, фМоль/мл | 0,07±0(0,06-0,08) | 0,08±0,01(0,06-0,11) | 0,13±0,02(0,08-0,18) * # |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Нітротирозин, нмоль/мл | 12,93±3,03(6,86-18,99) | 5,86±1,49(2,88-8,84) | 24,12±11,56(1-47,24) * # |
| Ендотелін-1, фМоль/мл | 0,13±0,01(0,12-0,15) | 0,15±0,04(0,08-0,23) | 0,52±0,26(-0,01-1,05)* |
Примітка. * – р <0,05 при порівнянні з 1 підгрупою; # – р <0,05 при порівнянні з 2 підгрупою.
Нітротирозин мав максимальні значення при бляшковій з явищами ексудації формі Пс групи порівняння, випереджаючи вульгарну бляшкову / краплеподібну / інтертригінозну форму на 41,84 % та еритродермічну / артропатичну / пустульозну форму Пс на 39,88 %. Поєднана патологія Пс і ГХ демонструвала найвищі рівні і нітротирозину, і ендотеліну-1 при еритродермічній / артропатичній / пустульозній формі Пс, яка перевищувала показник нітротирозину вульгарної бляшкової / краплеподібної / інтертригінозної форми на 46,39 % (р<0,05) і бляшкової з явищами ексудації форми на 75,70 % (р<0,05), показник ендотеліну-1 відносно бляшкової / краплеподібної / інтертригінозної форми Пс був більшим на 75,00 % (р<0,05), а відносно бляшкової з явищами ексудації форми - на 71,15 % (р<0,05).
При вивченні рівнів нітротирозину й ендотеліну-1 виявлено достовірне підвищення обох факторів вазоконстрикції у пацієнтів обох груп з прогресуючою стадією дерматозу: маркер нітрозуючого стресу нітротирозин демонстрував значне підвищення при поєднаній патології на 152,86 %, а ендотелін-1 – на 300,00 % (р<0,05) при порівнянні зі стаціонарною стадією.
Вміст показників нітротирозину й ендотеліну-1 залежно від PASI в обстежених осіб подано в таблиці 4.19.
Таблиця 4.19 – Вміст вазоконстрикторів у хворих першої і третьої груп залежно від показника PASI (М ± m, 95 % – довірчий інтервал)
| Показник, од. виміру | Категорії пацієнтів | ||
| PASI ≤ 10 | PASI 10-30 | PASI ≥30 | |
| Хворі на Пс (n=34) | |||
| Нітротирозин, нмоль/мл | 6,9±3,55(-0,2-14) | 10,76±1,08(6,59-11,93)* | 15,16±2,14 (10,89-21,43) * # |
| Ендотелін-1, фМоль/мл | 0,08±0,01(0,06-0,09) | 0,09±0,01(0,08-0,11) | 0,18±0,05 (0,07-0,28) * # |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Нітротирозин, нмоль/мл | 6,06±0,91(3,74-8,38) | 9,99±2,06(3,88-16,12)* | 29,51±13,62 (2,27-56,75) * # |
| Ендотелін-1, фМоль/мл | 0,10±0,01(0,09-0,14) | 0,13±0,01(0,12-0,14)* | 0,58±0,28(0,01-1,15) * # |
Примітка. * – р <0,05 при порівнянні з хворими з індексом PASI менше 10; # – р <0,05 при порівнянні з хворими з індексом PASI в діапазоні 10-30.
Вищевказані маркери ЕД демонстрували чітку тенденцію підйому при зростанні PASI і при приєднанні ГХ: особи з PASI ≥ 30 мали більш високі значення нітротирозину по відношенню до груп із PASI ≤ 10 і 10-30 балами у 2,87 та 2,95 рази (р<0,05) більше відповідно. Між групами Пс та Пс+ГХ виявлено достовірну різницю тільки для PASI ≥ 30 (48,63 %, р<0,05).
При коморбідності зі збільшенням PASI від 10 до 10-30 рівень ендотеліну-1 зростав на 23,08 % (р<0,05), різниця між PASI від 10-30 і до цифр понад 30 призводило до збільшення вмісту ендотеліну на 77,59 % (р<0,05), групи з Пс+ГХ і PASI до 10 і 10-30 мали відмінності на рівні 5,8 та 4,46 разів (р<0,05). Таким чином, більш тяжкі і розповсюджені форми ураження шкіри у хворих на Пс, особливо в поєднанні з ГХ, призводять до обтяження вільно-радикальних процесів, активації процесів нітрозування клітинних структур, розвитку ЕД.
Для оцінки взаємозв’язку рівня нітротирозину і напруженості імунітету у вигляді вмісту цитокінів проведено кореляційний ранговий аналіз за P. Spearman (R) у кожній з окремих підгруп. Розрахована оцінка ступеня взаємозв’язку між парами незалежних ознак, виражених у кількісних шкалах відповідно до поданої кореляційної матриці (табл. 4.20) і даних коефіцієнтів кореляції, виявилася найбільш тісною і статистично значущою у хворих на Пс при супутній ГХ. Вона свідчила про наявність прямої взаємозалежності активності TNF-α і рівня нітротирозину в сироватці крові у цих хворих. У двох інших групах (порівняння) взаємозалежність також була достовірною, але менш статистично значущою і менш вираженою.
Таблиця 4.20 – Кореляційна матриця залежності нітротирозину і TNF-α по групах
| Група хворих | Коефіцієнт кореляції Rs (Spearman) |
| Пс | + 0,52* |
| ГХ | + 0,33* |
| Пс+ГХ | + 0,76** |
Примітка. * – статистична значущість коефіцієнта кореляції Rs (р <0,05); ** – статистична значущість коефіцієнта кореляції Rs (р <0,01).
Для оцінки взаємозв’язку клінічних особливостей Пс і рівня нітротирозину, досліджено взаємозв’язок з індексом PASI. У відповідному дисперсійному комплексі, згідно з отриманими даними, величина нітротирозину достовірно визначала близько 43 % варіації значень інтегрального показника PASI при ηе = 0,6 і F = 24,32, вказуючи на прямий взаємозв’язок між ступенем поширеності / тяжкості Пс і показниками нітротирозину як продукту нітрування L-тирозину, що здійснюється за участю реактивних форм азоту. Оцінка тісноти зв’язку результативної і групувальної ознак за допомогою розрахунку емпіричних кореляційних відносин, яке складало для розглянутого маркера NO-залежного оксидативного стресу 0,65, вказувало на наявність досить тісного статистично значущого взаємозв’язку між досліджуваними параметрами у хворих на Пс. Отримані дані свідчили про те, що більш частий (25,9 % у підгрупі Пс+ГХ і 11,5 % у підгрупі з Пс) розвиток ексудативних форм бляшкового Пс асоціювався із закономірною активацією вільно-радикального окислення (ВРО) з підвищенням плазмової концентрації нітротирозину і паралельною подальшою зміною цитокінового «каскаду».
Оцінку асоціації між наявністю порушення когнітивних функцій (за даними DLQI) і частотою реєстрації гіпернітротирозинемії (верхній центильний діапазон – вище 90 перцентиля) проведено за допомогою критерію хі-квадрат (χ²) з аналізом таблиць спряженості. Отримані дані показали, що в підгрупі хворих з анкетними показниками DLQI більше 17 балів виявлено статистично значущу більшу кількість хворих з підвищеним рівнем нітротирозину (більше 10 нмоль/мл), ніж у підгрупі пацієнтів з менш вираженим впливом Пс на ЯЖ пацієнта, яка базувалася на його суб’єктивних відчуттях (χ² = 12,7, р <0,01), що дозволило використовувати показник гіпернітротирозинемії також в якості прогностичного предиктора фізичної, психологічної, емоційної і соціальної незадоволеності пацієнта з Пс [42, 44].
Таким чином, індукція метаболізму NO є одним із важливих патогенетичних механізмів формування та розвитку уражень при Пс, на що вказує вірогідне підвищення рівня традиційного маркера цього процесу нітротирозину сироватки крові залежно від ступеня його розвитку.
Для оцінки взаємозв’язку рівнів нітрозуючого стресу (нітротирозину) з параметрами апоптозу, цитокінового профілю і поширеністю ураження шкіри проведено кореляційний аналіз за P. Spearman (R) у кожній з окремих підгруп (рис. 4.1).
Розрахована оцінка ступеня взаємозв’язку між парами незалежних ознак, виражених у кількісній шкалі відповідно до поданої кореляційної матриці (рис. 4.1) і даних коефіцієнтів кореляції, виявилася найбільш тісною і статистично значущою у пацієнтів з Пс і супутньою ГХ і свідчила про наявність достовірної прямої взаємозалежності тяжкості перебігу дерматозу, параметрів нітрозуючого стресу, вираженості апоптозу та імунозапальної активності у цих хворих. У групі Пс без ГХ взаємозалежність також була достовірною, але менш статистично значущою і менш виразною. У пацієнтів групи порівняння з ГХ кореляційні коефіцієнти виявилися різноспрямованими в парі.
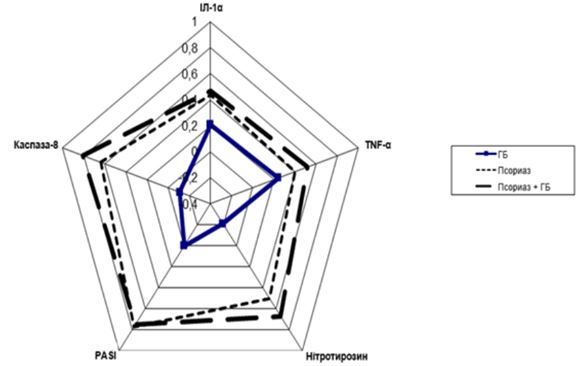
Рисунок 4.1 – Кореляційна матриця взаємозв’язку нітротирозину, цитокінів, каспази-8 зі ступенем ураження шкіри в групах хворих
NO – унікальний за своєю природою і механізмом дії вторинний месенджер у більшості клітин, залучений у безліч метаболічних і фізіологічних процесів. Він контролює судинний тонус, регулює активність гладком’язових клітин, системну і регіональну гемодинаміку, тромбоутворення і фібриноліз, виконує функції медіатора і нейромодулятора, підвищує фагоцитарну і цитотоксичну активність імунокомпетентних клітин, контролює кардіоваскулярний і нирковий гомеостаз, функцію транспорту кисню еритроцитами. Важливою основою біохімічної дії NO може бути його регуляторна дія на апоптоз клітин базального шару епідермісу, який істотно змінений при Пс. Високий рівень генерації NO при патологічних станах викликає токсичний ефект, веде до значного підвищення локальної концентрації сильного окислювача пероксинітриту, сприяючи пошкодженню мембранних структур клітини, ДНК, білків та інших біополімерів. Зміни вмісту NO досліджено при різних патологіях, в тому числі при АГ; деякі роботи присвячені вивченню цієї проблеми при Пс, тому, на наш погляд, дослідження рівня й обміну NO у пацієнтів, які страждають водночас на Пс і ГХ, є просто необхідним.
Аналіз рівня NO та вмісту нітритів в цілому по групах хворих показано в табл. 4.21.
Таблиця 4.21 – Показники метаболізму NO в обстежених осіб в цілому по групах (М ± m, 95 % – довірчий інтервал)
| Показник, од. виміру | Хворі на ГХ (n=40) | Хворі на Пс (n=50) | Хворі на Пс у поєднанні з ГХ (n=80) | Контрольна група (n=20) |
| NOS, нмоль/мг білка/хв | 5,96±0,42(5,13-6,79) | 2,03±0,47(1,1-2,96)* | 12,07±0,73(10,61-13,53)* # | 5,96±0,42(5,13-6,79) |
| Нітрити, мкмоль/л | 4,08±0,19(3,69-4,46) | 5,28±0,8(3,69-6,88) | 11,2±0,63(9,93-12,47)* # | 4,08±0,19(3,69-4,46) |
Примітка. * – р <0,05 при порівнянні з групою хворих на Пс; # – р <0,05 при порівнянні з групою хворих на ГХ.
Посилення порушень процесів метаболізму NO при поєднанні Пс і ГХ проявилося у вигляді значного підвищення рівня ключових маркерів нітрозуючого стресу – NOS і нітритів. Так, зокрема, в основній групі активність NOS становила (12,07±0,73) нмоль/мг білка/хв, статистично достовірно (р<0,05) перевищуючи аналогічні показники групи порівняння з ГХ на 102,52 %, з Пс – на 494,58 %. При ГХ активність NOS також була досить високою – (5,96±0,42) нмоль/мг білка/хв, а при наявності лише Пс зафіксовано найнижчу активність даного ферменту метаболізму NO – (2,03±0,47) нмоль/мг білка/хв (р<0,05), різниця між даними групами у відсотках становила 65,94 %.
Вміст нітритів також був достовірно вищим у групі коморбідної патології і визначався на рівні (11,2±0,63) мкмоль/л (р<0,05), достовірно (р<0,05) перевищуючи рівні показників нітритів групи порівняння з Пс на 112,12 % та з ГХ на 174,51 %. Про активність процесів нітропероксидації середнього ступеня свідчили і результати визначення вмісту нітритів групи порівняння з Пс – (5,28±0,8) мкмоль/л; мінімальні значення нітритів визначалися у пацієнтів з ГХ – (4,08±0,19) мкмоль/л, різниця між даними групами у відсотках була на рівні 29,41 %.
Оскільки динаміка цих показників при ГХ, з урахуванням тривалості захворювання, гендерних та інших особливостей, достатньо вивчена, оцінено ці показники лише у хворих на Пс та Пс у поєднанні з ГХ залежно від клінічних особливостей дерматозу. Результати дослідження рівня NOS та нітритів залежно від типу Пс наведено в табл. 4.22. Як видно з таблиці 4.22, при недиференційованому типі Пс на тлі нормальних показників АТ визначалася найвища активність NOS – (3,05±1,05) нмоль/мг білка/хв (р<0,05), яка вище на 122,63 % порівняно із зимовим типом Пс і на 91,82 % – порівняно з літнім типом Пс. Інші показники в цій групі не мали статистично достовірних відмінностей. Отже, при недиференційованому типі Пс групи порівняння визначено найвищу активність нітрозування.
Таблиця 4.22 – Показники метаболізму NO у хворих першої та третьої груп залежно від типу Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Зимовий тип Пс | Літній тип Пс | Недиференційований тип Пс | |
| Хворі на Пс (n=34) | |||
| NOS, нмоль/мг білка/хв | 1,37±0,44(0,5-2,25) | 1,59±0,67(0,25-2,93) | 3,05±1,05(0,96-5,15)* |
| Нітрити, мкмоль/л | 5,99±1,14(3,71-8,27) | 3,75±1,34(1,08-6,42) | 6,23±2,06(2,1-10,35) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| NOS, нмоль/мг білка/хв | 12,01±2,17(7,67-16,35) | 10,96±0,45(9,06-11,86) | 12,13±0,74(10,65-13,62) |
| Нітрити, мкмоль/л | 11,1±1,78(7,54-14,66) | 9,06±0,61(7,83-10,29) | 11,29±0,71(9,87-12,71) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з зимовим типом; # – р <0,05 при порівнянні з літнім типом.
При поєднаному перебігу Пс і ГХ та зимовому типі Пс рівень NOS становив (12,01±2,17) нмоль/мг білка/хв і майже дорівнював значенням активності NOS при недиференційованому типі Пс – (12,13±0,74) нмоль/мг білка/хв, різниця у відсотках щодо рівнів NOS між даними групами становила 1,00 %, не маючи статистичної значущості, проте рівень даного маркера цих груп свідчив про досить високу активність досліджуваного ферменту. При літньому типі Пс у поєднанні з ГХ вміст NOSбув дещо нижчим – (10,96±0,45) нмоль/мг білка/хв., поступаючись зимовому типу при коморбідній патології на 8,74 % та недиференційованому типу Пс – на 10,68 % відповідно і маючи найнижчі показники цього ферменту серед усіх груп з коморбідною патологією.
Особливий інтерес представляло вивчення рівня NO в обстежених осіб залежно від клінічної форми Пс, що представлено в таблиці 4.23.
Таблиця 4.23 – Показники метаболізму NO у хворих першої та третьої груп залежно від форми Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Пс
вульгарний бляшковий / краплеподібний / інтертригінозний |
Пс
бляшковий з явищами ексудації |
Пс
еритродермічний/ артропатичний / пустульозний |
|
| Хворі на Пс (n=34) | |||
| NOS, нмоль/мг білка/хв | 0,97±0,15(0,67-1,27) | 2,26±0,34(1,58-2,94)* | 5,5±1,86(1,78-9,22) * # |
| Нітрити, мкмоль/л | 1,72±0,12(1,49-1,95) | 5,9±1,9(2,1-9,7)* | 6,88±0,95(4,98-8,79) # |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| NOS, нмоль/мг білка/хв | 7,45±4,07(-0,7-15,59) | 12,3±0,25(11,81-12,8)* | 14,78±0,07(14,64-14,92) * # |
| Нітрити, мкмоль/л | 7,21±3,44(0,34-14,08) | 11,43±0,29(10,85-12,02)* | 13,44±0,17(13,11-13,77) * # |
Примітка. * – р <0,05 при порівнянні з 1 підгрупою; # – р <0,05 при порівнянні з 2 підгрупою.
Найвища активність NOS визначена у пацієнтів з еритродермічною / артропатичною / пустульозною формою Пс без супутньої ГХ – на рівні (5,5±1,86) нмоль/мг білка/хв (р<0,05), перевищуючи аналогічний показник вульгарної бляшкової / краплеподібної / інтертригінозної форми Пс групи порівняння на 467,01 % і бляшкової з явищами ексудації форми Пс – на 143,36 % (р<0,05). Рівні NOS визначалися у групі порівняння Пс з вульгарною бляшковою / краплеподібною / інтертригінозною формами як найнижчі серед усіх клінічних груп – (0,97±0,15) нмоль/мг білка/хв, а при бляшковій з явищами ексудації формі дерматозу – на середньому рівні значень – (2,26±0,34) нмоль/мг білка/хв (р<0,05), різниця між цими групами становила 132,99 % (р<0,05).
Значення нітритів також були найвищими у пацієнтів групи порівняння з Пс з еритродермічною / артропатичною / пустульозною формою – (6,88±0,95) мкмоль/л (р<0,05), рівні нітритів при вульгарній бляшковій / краплеподібній / інтертригінозній формі були нижчими на 300,00 %, а при бляшковій з явищами ексудації формі – на 16,61 % (р<0,05). Нітрити при бляшковій / краплеподібній / інтертригінозній формі становили (1,72±0,12) мкмоль/л, демонструючи найнижчі їх значення серед усіх груп, а при бляшковій з явищами ексудації формі Пс – (5,9±1,9) мкмоль/л (р<0,05), встановлено середні рівні значень; різниця у відсотках між даними групами склала 243,02 % (р<0,05).
При поєднаному перебігу дерматозу і ГХ найвищу активність NOS визначено у пацієнтів з еритродермічною / артропатичною / пустульозною формами Пс – (13,44±0,17) нмоль/мг білка/хв (р<0,05), яка перевищувала аналогічний показник бляшкової / краплеподібної / інтертригінозної форми на 98,39 % і бляшкової з явищами ексудації форми - на 20,16 % (р<0,05). Рівні NOS визначалися в основній групі з бляшковою / краплеподібною / інтертригінозною формою як найнижчі серед усіх клінічних груп – (7,45±4,07) нмоль/мг білка/хв, а при бляшковій з явищами ексудації формі Пс – на середньому рівні значень – (12,3±0,25) нмоль/мг білка/хв (р<0,05); різниця між цими групами становила 65,10 % (р<0,05).
Рівні нітритів при коморбідній патології також були найвищими у пацієнтів з еритродермічною / артропатичною / пустульозною формою Пс – (13,44±0,17) мкмоль/л (р<0,05), рівні нітритів при бляшковій / краплеподібній / інтертригінозній формі були нижчими на 86,41 %, а при бляшковій з явищами ексудації формі – на 17,59 % (р<0,05). Нітрити при бляшковій / краплеподібній / інтертригінозній формі в основній групі становили (7,21±3,44) мкмоль/л, демонструючи найнижчі значення серед усіх форм основної групи, а при бляшковій з явищами ексудації формі – (11,43±0,29) мкмоль/л (р<0,05), встановлено середні рівні значень; різниця у відсотках між даними групами склала 58,53 % (р<0,05).
Отже, виявлено такі зміни ключових маркерів нітрозуючого стресу залежно від форми Пс: при еритродермічній / артропатичній / пустульозній формі Пс значення активності NOS та рівнів нітритів найвищі як в умовах коморбідності Пс+ГХ, так і в групі порівняння. Меншою мірою нітропероксидація була виражена при бляшковій з явищами ексудації формі Пс і, особливо, при бляшковій / краплеподібній / інтертригінозній формі Пс як у поєднанні з ГХ, так і без неї. Ці результати свідчать про необхідність активного комплексного і диференційованого підходу до призначення терапії при різних клінічних формах і стадіях Пс.
Зміни метаболізму NO в обстежених осіб залежно від стадії Пс подано в таблиці 4.24.
Таблиця 4.24 – Показники дослідження метаболізму NO у хворих першої та третьої груп залежно від стадії Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Стаціонарна стадія Пс | Прогресуюча стадія Пс | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| NOS, нмоль/мг білка/хв | 0,42±0,1(0,22-0,62) | 2,46±0,54(1,38-3,53)* | 2,03±0,47(1,1-2,96) |
| Нітрити, мкмоль/л | 4,21±0,81(2,59-5,83) | 9,04±0,34(8,36-9,72)* | 5,28±0,8(3,69-6,88) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| NOS, нмоль/мг білка/хв | 7,45±4,07(-0,7-15,59) | 12,88±0,32(12,24-13,53)* | 12,07±0,73(10,61-13,53) |
| Нітрити, мкмоль/л | 7,21±3,44(0,34-14,08) | 11,9±0,31(11,29-12,52)* | 11,2±0,63(9,93-12,47) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів зі стаціонарною стадією.
Прогресуюча стадія Пс у групі порівняння характеризувалася високою активністю ферменту NOS – (2,46±0,54) нмоль/мг білка/хв (р<0,05), при стаціонарній стадії цей показник був на рівні (0,42±0,1) нмоль/мг білка/хв, а відсоткова різниця показників NOS цих груп становила 485,71 % (р<0,05). Рівень нітритів також був вищим у пацієнтів із Пс групи порівняння з прогресуючою стадією – (9,04±0,34) мкмоль/л (р<0,05), переважаючи аналогічні значення стаціонарної стадії Пс на 114,73 % ([4,21±0,81] мкмоль/л) (р<0,05).
При поєднаному перебігу Пс і ГХ у прогресуючій стадії Пс також демонстрував більш високі значення маркерів нітрозуючого стресу порівняно зі стаціонарною стадією. Так, активність NOS у хворих основної групи була на рівні (12,88±0,32) нмоль/мг білка/хв (р<0,05), при стаціонарній стадії Пс цей показник був на рівні (7,45±4,07) нмоль/мг білка/хв, а відсоткова різниця показників NOS цих груп становила 72,89 % (р<0,05). Рівень нітритів також був вищим у пацієнтів, хворих лише на Пс з прогресуючою стадією – (11,9±0,31) мкмоль/л (р<0,05), переважаючи аналогічні значення стаціонарної стадії Пс на 65,05 % ([7,21±3,44] мкмоль/л) (р<0,05).
Аналіз активності NOS та нітритів залежно від PASI в обстежених осіб наведено в табл. 4.25.
Таблиця 4.25 – Показники метаболізму NO у хворих першої та третьої груп залежно від показника PASI (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| PASI ≤ 10 | PASI 10-30 | PASI ≥30 | |
| Хворі на Пс (n=34) | |||
| NOS, нмоль/мг білка/хв | 0,7±0,15(0,39-1,01) | 2,23±0,31(1,62-2,84)* | 6,8±2,3(2,2-11,4) * # |
| Нітрити, мкмоль/л | 2,65±0,61(1,43-3,87) | 7,8±0,17(7,47-8,13)* | 8,72±0,24(8,24-9,19) * |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| NOS, нмоль/мг білка/хв | 7,45±4,07(-0,7-15,59) | 12,47±0,28(11,9-13,03)* | 14,84±0,06(14,72-14,95) * # |
| Нітрити, мкмоль/л | 7,21±3,44(0,34-14,08) | 11,54±0,29(10,96-12,12)* | 13,6±0,2(12,1-14,7) * # |
Примітка. * – р <0,05 при порівнянні з хворими з індексом PASI менше 10; # – р <0,05 при порівнянні з хворими з індексом PASI в діапазоні 10-30.
Процеси метаболізму NO істотно погіршилися при збільшенні PASI у всіх клінічних групах хворих на Пс. Так, при Пс групи порівняння зі збільшенням PASI зростала активність NOS: при PASI ≤ 10 активність NOS становила (0,7±0,15) нмоль/мг білка/хв, при PASI 10-30 – (2,23±0,31) нмоль/мг білка/хв (р<0,05), при PASI ≥30 – (6,8±2,3) нмоль/мг білка/хв (р<0,05); відсоткова різниця активності NOS із PASI ≤ 10 та 10-30 становила 218,57 %, PASI ≤ 10 та ≥30 – 871,43 %, при PASI 10-30 та ≥30 – 204,93 % (р<0,05).
Нітрити при Пс у групі порівняння залежно від площі ураження шкіри та тяжкості перебігу дерматозу були такими: при PASI ≤ 10 – (2,65±0,61) мкмоль/л, при PASI 10-30 – (7,8±0,17) мкмоль/л (р<0,05), PASI ≥30 – (8,72±0,24) мкмоль/л (р<0,05), а відсоткова різниця значень нітритів із PASI ≤ 10 та 10-30 становила 194,34 %, PASI ≤ 10 та ≥30 – 229,06 %, при PASI 10-30 та ≥30 – 11,79 % (р<0,05).
В основній групі зі збільшенням PASI також зростала активність NOS та рівня нітритів. Пацієнти з PASI ≥30 мали найвищі значення NOS – (14,84±0,06) нмоль/мг білка/хв (р<0,05), перевищуючи аналогічні показники цієї ж групи з PASI ≤ 10 на 99,19 % ([7,45±4,07] нмоль/мг білка/хв), а показники групи з PASI 10-30 - на 19,01 % ([12,47±0,28] нмоль/мг білка/хв) (р<0,05); між собою дві останні групи відрізнялися на 67,38 % (р<0,05).
При поєднанні Пс та ГХ значення PASI ≥30 було асоційоване з найвищими значеннями нітритів – (13,6±0,2) мкмоль/л (р<0,05), перевищуючи аналогічні показники групи Пс+ГХ із PASI ≤ 10 на 88,63 % ([7,21±3,44] мкмоль/л), а показники групи Пс+ГХ із PASI 10-30 - на 17,85 % ([11,54±0,29] мкмоль/л) (р<0,05). Між собою дві останні групи відрізнялися на 60,06 % стосовно значень нітритів (р<0,05).
Таким чином, простежувалася чітка динаміка прямого взаємозв’язку між поширеністю ураження шкіри, тяжкістю перебігу Пс і маркерами активності нітрозуючого стресу (NOS і нітритів). Чим активніші явища системного запального процесу, чим більша площа ураження шкіри, тим вищі активність NOS і значення нітритів при Пс як у групі порівняння, так і при поєднаному перебігу з ГХ, що вимагає раціональної адекватної терапії.
Для дослідження наявності оксидативного стресу проаналізовано вміст різних форм глутатіону як маркера цього стану. Отримані дані свідчили, що рівень ГЛУв у пацієнтів групи порівняння з Пс виявився нижче, ніж при ГХ (друга група порівняння) на 25,81 % (p<0,05), в осіб основної групи – на 40,61 % (p<0,05) нижче (таблиця 4.26). Різниця між особами основної і першої групи порівняння виявилася достовірною і склала 10,52 % (p<0,05).
Таблиця 4.26 – Показники метаболізму глутатіону в обстежених осіб (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Хворі на Пс | Хворі на ГХ (n=30) | Контрольна група (n=20) | |
| Без ГХ
(n=34) |
У поєднанні з ГХ
(n=80) |
|||
| ГЛУв, мкмоль/л | 18,44±0,49 (17,46-19,42)* | 16,5±0,48
(15,48-17,38) * # |
23,2±0,61
(16,21-26,3) |
24,36±0,57
(23,22-25,5) |
| ГЛУо, мкмоль/л | 2,79±0,06
(2,68-2,91)* |
3,23±0,06
(2,83-4,12)* |
2,48±0,06
(2,31-2,99) |
2,13±0,09
(1,95-2,31) |
| Відношення відновлені/окислені форми, у.о. | 6,79±0,23
(6,34-7,25)* |
5,1±0,26
(5,23-6,3)* |
9,36±0,19
(5,21-13,64) |
11,44±0,23
(10,98-11,9) |
| СОД,
у.о./мг білка/хв. |
32,58±1,63* | 24,21±1,44 * # | 36,84±1,09 | 44,17±3,56 |
Примітка. * – p <0,05 в порівнянні з хворими на ГХ; # – p <0,05 в порівнянні з хворими на Пс.
Рівень ГЛУо мав тенденцію до збільшення, відмінності з хворими лише на ГХ були достовірними та становили 30,24 % (p<0,05) і 11,11 % (p<0,05) відповідно в осіб основної та групи порівняння з Пс. Співвідношення ГЛУв / ГЛУо у хворих на Пс було значно нижчим, ніж при ГХ.
Різниця для пацієнтів першої контрольної групи (Пс без ГХ) становила 45,51 % (p<0,05), при наявності ГХ (основна група) – 37,87 % (p<0,05). Між хворими на Пс залежно від наявності або відсутності ГХ відносно ГЛУв / ГЛУо різниця була достовірною і склала 24,89 % (p<0,05). Таким чином, у хворих на Пс виявлено прогресуючі порушення з боку метаболізму глутатіону і подальші зміни тіол-дисульфідного балансу, які погіршувалися з наявністю ГХ. Це супроводжувалося достовірним зменшенням активності СОД при Пс без ГХ на 13,08 % (p<0,05) і на 34,28 % (p<0,05) порівняно з хворими лише на ГХ [50, 408].
КФГ є більш ранніми, а АФГ – більш пізніми маркерами ОМБ. Визначення продуктів спонтанної ОМБ дозволяє оцінити здатність організму оновлювати свій білковий фонд, що характеризує окислювальний потенціал організму. Стимульована ОМБ характеризує ступінь резервно-адаптаційних можливостей організму, наскільки АОС готова до можливих стресових пошкоджень.
Процеси карбонільного стресу в обстежених осіб було вивчено шляхом оцінки рівня альдегідних і кетонових форм фенілгідразонів (табл. 4.27).
Таблиця 4.27 – Показники процесів ОМБ в досліджених групах (М ± m, 95 % – довірчий інтервал)
| Показник,
Од. виміру |
Хворі на Пс | Хворі на ГХ (n=30) | Контрольна група (n=20) | |
| Без ГХ
(n=34) |
У поєднанні з ГХ
(n=80) |
|||
| АФГ спонт.,
умов. од. / г білка |
2,49±0,06
(2,37-2,62)* |
3,18±0,11
(2,96-3,39) * # |
2,02±0,17
(1,08-2,75) |
1,12±0,13
(0,86-1,38) |
| АФГ стимул.,
умов. од. / г білка |
3,49±0,07
(3,36-3,63)* |
4,22±0,13
(3,97-4,47) * # |
2,86±0,26
(2,34-3,38) |
1,93±0,19
(1,55-2,31) |
| КФГ спонт.,
умов. од. / г білка |
4,8±0,17
(4,46-5,15)* |
5,72±0,29
(5,13-6,31) * # |
3,86±0,31
(2,24-4,49) |
2,17±0,22
(1,73-2,61) |
| КФГ стимул.,
умов. од. / г білка |
5,8±0,21
(5,38-6,21)* |
7,42±0,4
(6,61-8,22) * # |
4,52±0,48
(3,57-5,48) |
2,86±0,31
(2,24-3,48) |
Примітки: * – p<0,05 у порівнянні з хворими на ГХ; # – p<0,05 у порівнянні з хворими на Пс.
Як спонтанні, так і стимульовані АФГ були найменшими в осіб з ГХ, у хворих на Пс при супутній ГХ досліджувані показники були вище на 57,43 % (p<0,05) і 47,55 % (p<0,05) відповідно, у пацієнтів, хворих лише на Пс – на 23,27 % (p<0,05) і 22,03 % (p<0,05) відповідно, порівняно з ГХ. Збільшення спонтанних і стимульованих КФГ також було відзначено в групах пацієнтів з Пс. При Пс без АГ зазначені показники перевищували відповідні значення осіб основної групи на 24,35 % (p<0,05) і 28,32 % (p<0,05), відповідно, при Пс і ГХ – різниця з групою лише ГХ становила 48,19 % (p<0,05) і 64,16 % (p<0,05), відповідно.
Таким чином, у хворих на Пс при наявності ГХ відзначено більш виразні зміни показників, що характеризують прогресуюче зростання процесів карбонільного стресу.
При аналізі АОС (табл. 4.28) були отримані результати, які свідчили про прогресуюче порушення антиоксидантної ланки.
Таблиця 4.28 – Стан активності АОС у обстежених осіб (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Хворі на Пс | Хворі на ГХ (n=30) | Контрольна група (n=20) | |
| Без ГХ
(n=34) |
У поєднанні з ГХ
(n=80) |
|||
| Каталаза, умов.од./мг білка/хв. | 1,89±0,1
(1,69-2,09)* |
1,19±0,11
(0,97-1,41) * # |
2,67±0,08
(1,51-2,84) * |
3,95±0,11 (3,73-4,17) |
| СОД, умов.од./мг білка/хв. | 32,58±1,63* | 24,21±1,44 * # | 36,84±1,09 | 44,17±3,56 |
Примітка. * – p <0,05 при порівнянні з хворими на ГХ ; # – p <0,05 при порівнянні з хворими на Пс.
Так, вміст каталази в осіб з одночасним перебігом Пс і ГХ на 37,04 % (p<0,05) був нижчим, ніж у пацієнтів з Пс без ГХ і на 41,27 % (p<0,05) нижчим, ніж при ГХ. Різниця між двома останніми групами обстежених осіб також була достовірною і склала 124,37 % (p<0,01). У хворих основної групи (Пс і ГХ) також відзначено достовірне зниження вмісту СОД. Різниця між значеннями осіб при Пс в поєднанні з ГХ і Пс без ГХ становила 25,69 % (p<0,05), у свою чергу, їх середні значення були на 13,08 % (p<0,05) і 52,17 % (p<0,05) відповідно нижчими, ніж при ГХ. Отже, розвиток Пс на тлі ГХ супроводжувався різноспрямованою зміною з боку активності АОС, але достовірно виявлено дефіцит активності АОС, що потребує терапевтичної корекції цього стану.
Було вивчено кореляційний зв’язок між показниками, які характеризують стан АОС, та іншими даними: станом імунного статусу, ВНС, факторами нейрогуморальної регуляції. З метою виявлення прогностичних факторів розвитку ураження шкіри при Пс використано логістичний регресійний аналіз з розрахунком регресійних коефіцієнтів, статистику Вальда, χ2 і співвідношення шансів з 95 % довірчим інтервалом (95 % ДІ). Якість одержуваних моделей оцінювалася за показником частки правильно розпізнаних випадків у таблицях класифікації, коефіцієнтів детермінації моделі, розраховувався також рівень достовірності окремо взятих коефіцієнтів. Вибиралися найбільш змістовні з клінічної точки зору моделі. Після відповідних розрахунків виявилося, що низький рівень співвідношення відновлених / окислених форм (менше 6 ум.од., відносний ризик для цієї когорти хворих склав 6,57 з 95 % ДІ [4,52; 8,71]) достовірно збільшував майже в 4,5 разу ймовірність розвитку тяжких форм Пс згідно з отриманим співвідношенням шансів, порівняно з пацієнтами, у яких зазначені показники були в межах норми, р<0,05. Оцінка тестів Бреслоу-Дея, Тарона і логарифм оцінки дозволили зберегти припущення щодо гомогенності співвідношення шансів для вагових груп (р>0,2). Оцінка загального відношення шансів Мантеля-Хенцеля асимптоматично нормально розподілена в припущенні рівності 1,0 загального ставлення шансів.
Ці факти статистично обгрунтовано вказували на той факт, що пацієнти з низьким рівнем SH-груп (менше 1 ммоль/г білка) при паралельній активації оксидативного стресу є групою ризику щодо виникнення ускладнень на фоні терапії і вимагали динамічного спостереження з індивідуальним підбором донаторів тіолів і препаратів з доведеним антиоксидантним ефектом.
Було також розраховано 50 перцентиль усіх значень співвідношення ГЛУв / ГЛУо, яке становило 6 ум.од. У таблиці 4.29 наведено дані аналізу індексу PASI і DLQI в обстежених осіб залежно від стану тіол-дисульфідного балансу.
У групі хворих із співвідношенням ГЛУв / ГЛУо нижчим 6,0 у.о. визначалося максимальне підвищення PASI, яке складало 32,4 ± 2,81, при цьому різниця з аналогічними даними осіб з більш високим співвідношенням ГЛУв / ГЛУо становила 42,1 % (p<0,05). У пацієнтів з більш високим співвідношенням ГЛУв / ГЛУо різниця показника DLQI склала 2,24 разу (p<0,05) порівняно з пацієнтами із ГЛУв / ГЛУо меншим 6,0 у.о.
Таблиця 4.29 – Показники індексів PASI і DLQI хворих на Пс залежно від вираженості порушення тіол-дисульфідного балансу
| Показник,
од.виміру |
Хворі на Пс у поєднанні з ГХ (n=80) | |
| ГЛУв/ГЛУо > 6 у.о. | ГЛУв/ГЛУо < 6 у.о. | |
| PASI, бал | 22,8±1,03 | 32,4±2,81* |
| DLQI, бал | 19,21±0,84 | 43,2±3,04* |
Примітка. * – p <0,05 при порівнянні з групою ГЛУв / ГЛУо > 6 у.о.
Таким чином, у хворих на Пс у поєднанні з ГХ при збільшенні вираженості порушень тіол-дисульфідного балансу зафіксовано більш значуще погіршення клінічної картини і зниження ЯЖ. Отримані зміни характеризують прогресування ЕД у даної категорії пацієнтів. Це дозволяє зробити висновок, що формування тяжких форм Пс статистично значуще асоціюється з низьким функціональним потенціалом глутатіонової ланки АОС і з неможливістю адекватного поповнення пулу ГЛУв (порушення метаболізму тіолів).
Проведений багатофакторний дисперсійний аналіз в рамках математичного моделювання показав, що у хворих на Пс із супутньою ГХ ступінь клінічних проявів дерматозу (PASI), ЯЖ (показники DLQI) – достовірно змінювалися в залежності від оксидативного статусу (оцінювали за співвідношенням рівня СОД до АФГ стим.) при F = 22,13 (р<0,01) і були пов'язані з тяжкістю ГХ (F = 9,61, р<0,05), ступенем порушення ВСР (F = 4,88, р<0,05) та порушенням циркадного ритму АТ (F = 4,88, р <0,05).
Таким чином, проведений аналіз отриманих результатів свідчить, що Пс слід розглядати як типове мультифакторне захворювання, яке суттєво погіршується коморбідністю з ГХ. У цих складних патогенетичних механізмах поєднаної патології важлива роль належить оксидативному стресу, як причині пошкодження і дегенерації кератоцитів.
4.3 Визначення рівня гомоцистеїну в групах дослідження
Порушення функції ендотелію – один з універсальних механізмів патогенезу імуноопосередкованих захворювань, у тому числі й Пс, призводить до прискореного розвитку ангіопатій, атеросклерозу. Не менш актуальне це питання і при ГХ, оскільки сама по собі вона також відзначається розвитком дисфункції ендотелію. Гомоцистеїн знижує утворення і чутливість тканин до NO. На тлі зазначених вище порушень формування гіпергомоцистеїнемії (ГГЦ) за рахунок наявності ГХ може призводити до потенціювання ендотелій-деструктивних медіаторів і порушення процесів коагуляції. Відомо, що ГГЦ є маркером розвитку серцево-судинних уражень. Вивчення особливостей і залежностей вмісту гомоцистеїну у хворих на Пс і ГХ водночас раніше не проводилося, тому є зрозумілим інтерес до такого дослідження.
Розглянемо залежність гомоцистеїну від епідеміологічних і клінічних чинників. Вміст його в обстежених осіб в цілому по групах подано в таблиці 4.30.
Таблиця 4.30 – Вміст гомоцистеїну у обстежених осіб в цілому по групах (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Хворі на ГХ (n=30) | Хворі на Пс (n=34) | Хворі на Пс у поєднанні з ГХ (n=80) | Контрольна група (n=20) |
| Гомоцистеїн, мкмоль/л | 10,46±0,47
(9,51-11,41) |
17,07±0,68
(15,71-18,43)* |
30,94±2,48
(25,99-35,9) *# |
4,23±0,12
(3,98-4,47) |
Примітка. * – р <0,05 при порівнянні з групою хворих на Пс; # – р <0,05 при порівнянні з групою хворих на ГХ.
У пацієнтів основної групи поєднання захворювань призводило до того, що рівень гомоцистеїну на 66,19 % і 44,83 % (р<0,05) статистично достовірно перевищував аналогічний показник груп порівняння з ГХ або Пс. У той же час, пацієнти з Пс мали більш високі значення гомоцистеїну порівняно з хворими на ГХ, різниця становила 63,19 % (р<0,05) [63].
Аналіз рівня досліджуваного показника у пацієнтів залежно від тривалості ГХ відображено в таблиці 4.31.
Таблиця 4.31 – Вміст гомоцистеїну у хворих другої та третьої груп залежно від тривалості ГХ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість ГХ до 5 років | Тривалість ГХ більше 5 років | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Гомоцистеїн, мкмоль/л | 8,73±0,61(7,51-9,95) | 12,58±0,44(11,69-13,46)* | 10,46±0,47(9,51-11,41) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Гомоцистеїн, мкмоль/л | 22,13±1,73(18,68-25,58) | 33,15±2,82(27,51-38,78)* | 30,94±2,48(25,99-35,9) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з тривалістю ГХ до 5 років.
Підйом рівня гомоцистеїну при тривалості захворювання більше 5 років зафіксовано як у пацієнтів основної групи (49,80 %, р<0,05), так і у пацієнтів групи порівняння з ГХ (44,10 %, р<0,05), що є діагностичним критерієм погіршення перебігу і прогнозу як ГХ, так і Пс, посилюючи проліферацію клітин гладких м'язів судин, перекисне окислення ліпідів і білків, формуючи основу ЕД.
Важливо розглянути показники гомоцистеїну в обстежених групах на тлі зростання тривалості дерматозу, що представлено в таблиці 4.32.
Таблиця 4.32 – Вміст гомоцистеїну у хворих першої і третьої груп залежно від тривалості Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість Пс до 5 років | Тривалість Пс більше 5 років | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| Гомоцистеїн, мкмоль/л | 16,57±0,62 (15,33-17,81) | 19,72±2,62 (14,49-24,96) | 17,07±0,68 (15,71-18,43) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Гомоцистеїн, мкмоль/л | 26,07±2,12(21,83-30,3) | 32,16±3(26,16-38,16) | 30,94±2,48(25,99-35,9) |
Примітка. * – р <0,05 при порівнянні з групою хворих на Пс з тривалістю до 5 років.
З представлених результатів видно, що зростання рівня гомоцистеїну як у групі порівняння з Пс, так і в основній групі відзначалося при тривалості дерматозу понад 5 років з різницею в 19,01 % і 23,36 % відповідно при порівнянні з пацієнтами з менш тривалим дерматозом. Взаємозв’язок гомоцистеїну і безлічі патологічних станів організму безперечна, а підйом даного маркера у групах дослідження тільки підтверджує цей факт. Приєднання ж до Пс ГХ ускладнює перебіг обох нозологій, що і виражається в більш виразному зростанні рівня гомоцистеїну у цій групі хворих при збільшенні терміну хвороби.
Досліджено також рівень гомоцистеїну залежно від ІМТ. З’ясовано, що статистично достовірна різниця між пацієнтами з ІМТ менше і більше 30 кг/м2 встановлена лише в групі хворих на ГХ – 42,10 %, у хворих на Пс не виявлено достовірної різниці залежності гомоцистеїну від ІМТ (р<0,05).
Проведено вивчення показників гомоцистеїнемії у хворих залежно від статі і доведено, що немає гендерних відмінностей стосовно рівня гомоцистеїну ні у пацієнтів, які страждають на Пс, ні у хворих на ГХ (р<0,05).
Не встановлено також різниці в рівні гомоцистеїну у досліджених осіб залежно від віку (р<0,05).
Представляє певний інтерес вивчення стану гомоцистеїнемії у хворих залежно від ступеня АГ, що наведено в таблиці 4.33.
Таблиця 4.33 – Вміст гомоцистеїну у хворих другої та третьої груп залежно від ступеня АГ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| 1-2 ступінь АГ | 3 ступінь АГ | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Гомоцистеїн, мкмоль/л | 9,89±0,56(8,77-11,01) | 12,2±0,7(10,81-13,6)* | 10,46±0,47(9,51-11,41) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Гомоцистеїн, мкмоль/л | 22,48±3,16(16,15-28,8) | 33,06±2,78(27,5-38,62)* | 30,94±2,48(25,99-35,9) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з 1-2 ступенем АГ.
Зростання рівня гомоцистеїну при 3 ступені АГ у хворих лише на ГХ порівняно з 1-2 ступенем АГ на 23,36 % (р<0,05) і у пацієнтів основної групи з 3 ступенем АГ на 47,06 % (р<0,05) є діагностичним маркером погіршення перебігу і прогнозу як ГХ, так і Пс.
Було оцінено також рівень даного похідного метіоніну залежно від типу Пс, що представлено в таблиці 4.34, і з’ясовано, що наявність коморбідної патології характеризувалася підйомом рівня гомоцистеїну у групі з літнім типом Пс відносно зимового і недиференційованого на 63,79 % і 36,94 % (р<0,05), а між собою останні дві форми мали різницю у 16,39 %. Інші показники не є статистично достовірними.
Таблиця 4.34 – Вміст гомоцистеїну у хворих залежно від типу Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Зимовий тип Пс | Літній тип Пс | Недиференційований тип Пс | |
| Хворі на Пс (n=34) | |||
| Гомоцистеїн, мкмоль/л | 17,01±0,97 (15,07-18,95) | 16,5±1,37 (13,76-19,23) | 17,38±1,36 (14,66-20,11) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Гомоцистеїн, мкмоль/л | 25,71±4,95 (15,81-35,61) | 42,11±7,89 (26,32-57,89)* | 30,75±2,49 (25,76-35,74) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів із зимовим типом; # – р <0,05 при порівнянні з літнім типом.
Рівні гомоцистеїну хворих на Пс основної і групи порівняння залежно від форми дерматозу наведено в таблиці 4.35.
Статистично значущі результати отримано лише стосовно поєднаної патології Пс і ГХ, де спостерігалися такі значення гомоцистеїну: при бляшковій / краплеподібній / інтертригінозній формах рівень амінокислоти був нижчим, ніж при бляшковій з явищами ексудації на 61,30 %, а показники еритродермічної / артропатичної / пустульозної форм Пс перевершували аналогічні при бляшковій з явищами ексудації формі Пс на 22,96 %. Різниця між бляшковою / краплеподібною / інтертригінозною та еритродермічною / артропатичною / пустульозною формами становила 98,34 %. Максимальні значення гомоцистеїну і, відповідно, запального і деструктивного процесів зафіксовано в групах з еритродермічною / артропатичною / пустульозною формами як у групі порівняння, так і в основній групі.
Таблиця 4.35 – Вміст гомоцистеїну у хворих залежно від форми Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Пс
вульгарний бляшковий / краплеподібний / інтертригінозний |
Пс
вульгарний бляшковий з явищами ексудації |
Пс еритродермічний/ артропатичний / пустульозний | |
| Хворі на Пс (n=34) | |||
| Гомоцистеїн, мкмоль/л | 15,55±0,82(13,91-17,2) | 15,94±1,51(12,91-18,97) | 17,85±0,94(15,98-19,7) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Гомоцистеїн, мкмоль/л | 20,44±3,27(13,89-26,98) | 32,97±2,86(21,25-44,69)* | 40,54±4,01(30,53-54,55)*# |
Примітка: * – р <0,05 при порівнянні з 1 підгрупою; # – р <0,05 при порівнянні з 2 підгрупою.
Вміст гомоцистеїну у хворих на Пс залежно від стадії дерматозу подано в таблиці 4.36.
Таблиця 4.36 – Вміст гомоцистеїну у хворих залежно від стадії Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Стаціонарна стадія Пс | Прогресуюча стадія Пс | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| Гомоцистеїн, мкмоль/л | 14,84±0,49 (13,85-15,82) | 17,66±0,79 (16,09-19,24) | 17,07±0,68 (15,71-18,43) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Гомоцистеїн, мкмоль/л | 19,39±0,95 (17,49-21,28) | 32,98±2,61 (27,76-38,2)* | 30,94±2,48 (25,99-35,9) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів зі стаціонарною формою.
З таблиці видно, що рівень гомоцистеїну був вищим при прогресуючій стадії Пс в групі порівняння (19,00 %) та істотно вищим при поєднанні Пс і ГХ (70,09 %, р<0,05).
Особливий інтерес викликав аналіз рівня гомоцистеїну залежно від індексу PASI у хворих на Пс, який наведено в табл. 4.37.
У хворих на Пс при коморбідності збільшення PASI від 10 до 10-30 демонструвало зростання вмісту гомоцистеїну на 22,34 % (р<0,05), який мав тенденцію до зростання при підвищенні PASI. При коморбідності виявлено більш вагомі статистичні зміни: зростання PASI від 10-30 до цифр понад 30 приводило до збільшення вмісту гомоцистеїну на 37,17 % (р<0,05), групи Пс і ГХ і з PASI до 10 і понад 30 мали відмінності на рівні 48,64 % (р<0,05).
Таблиця 4.37 – Вміст гомоцистеїну у хворих залежно від показника PASI (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| PASI ≤ 10 | PASI 10-30 | PASI ≥30 | |
| Хворі на Пс (n=34) | |||
| Гомоцистеїн, мкмоль/л | 16,69±1,77(13,16-20,22) | 15,95±0,37(15,21-16,69) | 19,46±1,51(16,43-22,48) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Гомоцистеїн, мкмоль/л | 20,23±0,73(18,76-21,69) | 24,75±0,45(23,85-25,66)* | 39,39±3,05(33,3-45,49) * # |
Примітка. * – р <0,05 при порівнянні з хворими з індексом PASI менше 10; # – р <0,05 при порівнянні з хворими з індексом PASI в діапазоні 10-30.
Отже, виражена ГГЦ, як маркер загального запального процесу і ступеня ЕД, тяжкості серцево-судинного ураження, визначалася в максимальних значеннях при зростанні PASI від 10 до 30 і вище, особливо при наявності у пацієнтів поєднаної патології (Пс і ГХ).
4.4 Дослідження ендотеліального рецептора протеїну С
Система протеїну С є природною антикоагулянтною системою організму, що забезпечує регуляцію згортання, підтримання плинного стану крові, попередження тромбозу, запобігаючи, таким чином, судинному пошкодженню і стресу. Крім антикоагулянтної активності, АПС має цитопротективний і протизапальний ефекти на судинні ендотеліальні клітини і різні клітини імунної системи людини. АПС пригнічує апоптоз і блокує запалення, змінюючи профіль експресії генів в ендотеліальних клітинах, знижує утворення прозапальних цитокінів активованими моноцитами, здійснює захист ендотеліальної бар’єрної функції. Саме тому зрозумілий інтерес до визначення стану системи захисту ендотелію у хворих на Пс, ГХ і, особливо, при їх поєднанні.
Рівні EPCR в обстежених осіб в цілому по групах хворих подано в таблиці 4.38.
Таблиця 4.38 – Рівень EPCR в обстежених осіб в цілому по групах (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Хворі на ГХ (n=30) | Хворі на Пс (n=34) | Хворі на Пс у поєднанні з ГХ (n=80) | Контрольна група (n=20), |
| EPCR, нг/мл | 1591,08±51,98
(1487,11-1695,04) |
1257,87±22,73
(1212,4-1303,33)* |
800,68±46,34
(708-893,36) *# |
1896,1±39,15
(1817,8-1974,4) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з Пс; # – р <0,05 при порівнянні з групою пацієнтів з ГХ.
У виділених групах пацієнтів максимальні значення EPCR зафіксовано в групі порівняння з ГХ, перевищуючи аналогічний показник групи порівняння хворих на Пс на 20,94 % (р<0,05) та основної групи – на 98,72 % (р<0,05), а в групі порівняння з Пс цей показник був більшим, ніж у групі Пс і ГХ на 57,10 % (р<0,05). Таким чином, мінімальна захисна дія АПС виявлена у хворих з поєднаною патологією, що проявилося в зниженні маркера EPCR, у той час, як максимальна компенсаторна активність АПС в умовах системної запальної відповіді організму зафіксована в групі хворих на ГХ, де виявлено найвищі рівні маркера EPCR.
Рівень досліджуваного показника залежно від тривалості ГХ показано в таблиці 4.39.
Таблиця 4.39 – Рівень EPCR у хворих другої та третьої груп залежно від тривалості ГХ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість ГХ до 5 років | Тривалість ГХ більше 5 років | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| EPCR, нг/мл | 1634,09±60,11(1513,88-1754,31) | 1419±31,25(1356,49-1481,51)* | 1591,08±51,98(1487,11-1695,04) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| EPCR, нг/мл | 1019,98±47,22(925,53-1114,43) | 621,99±54,7(512,6-731,39)* | 800,68±46,34(708-893,36) |
Примітка: * – р <0,05 при порівнянні з групою пацієнтів з тривалістю захворювання до 5 років.
З представлених даних видно, що рівень EPCR при ГХ знижувався на 13,16 % (р<0,05) при збільшенні тривалості захворювання більше 5 років, коли інгібуючий вплив АПС на процеси апоптозу нівелюється і запальний процес у судинній стінці вже переходить в активну фазу. Така ж тенденція спостерігалася і в пацієнтів основної групи: при тривалості коморбідної патології більше 5 років значення EPCR зменшувалося на 39,02 % (р<0,05), захист ендотеліальної бар'єрної функції падав, захисна дія АПС знижувалася і перебіг захворювань ускладнювався, провокуючи появу відповідної симптоматики у пацієнтів.
Розглянемо отримані значення EPCR в обстежених пацієнтів, які хворіють на Пс, залежно від терміну хвороби, що подано в таблиці 4.40.
Отримані дані свідчили лише про наявність вказаної тенденції зменшення досліджуваного показника з терміном захворювання, що не може бути достовірним висновком.
Рівень EPCR в обстежених осіб залежно від ІМТ наведено в таблиці 4.41.
Таблиця 4.40 – Рівень EPCR у хворих першої і третьої груп залежно від тривалості Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість Пс до 5 років | Тривалість Пс більше 5 років | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| EPCR, нг/мл | 1237,31±22,42
(1192,48-1282,14) |
1367,5±47,13
(1273,25-1461,75) |
1257,87±22,73
(1212,4-1303,33) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| EPCR, нг/мл | 1072,38±28,92
(1012,54-1130,21) |
620,75±62,8
(401,16-760,34) |
800,68±46,34
(708-893,36) |
Примітка. * – р <0,05 при порівнянні з групою хворих на Пс з тривалістю захворювання до 5 років.
Таблиця 4.41 – Рівень EPCR у хворих залежно від ІМТ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| ІМТ до 30 кг/м2 | ІМТ більш 30 кг/м2 | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| EPCR, нг/мл | 1767,1±113,61(1439,89-1894,31) | 1399,07±60,35(1278,36-1519,77)* | 1591,08±51,98(1487,11-1695,04) |
| Хворі на Пс (n=34) | |||
| EPCR, нг/мл | 1266,25±24,51(1217,24-1315,26) | 1213,17±65,17(1082,82-1343,51) | 1257,87±22,73(1212,4-1303,33) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| EPCR, нг/мл | 1003,07±38,95(925,16-1080,97)* | 606,39±61,73(482,93-729,85) | 800,68±46,34(708-893,36) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з ІМТ 30 кг/м2.
Достовірна різниця у рівнях досліджуваного маркера визначена в групі з ІМТ більше 30 кг/м2 при коморбідній патології, де зареєстровано збільшення кількості рецепторів до АПС на 65,42 % (р<0,05) відносно хворих з ІМТ менше 30 кг/м2, що свідчить про сприятливий вплив нормальної маси тіла на цитопротекцію і стабілізацію ЕД. У групі хворих лише на Пс зміна ІМТ практично не впливала на рівень EPCR.
При дослідженні EPCR у хворих залежно від статі встановлено, що не відбувалося достовірного впливу статі на показники EPCR.
Аналогічні результати отримано стосовно впливу віку на показники EPCR. Отримані результати свідчать, що вікові відмінності у рівні EPCR відсутні (р>0,05).
Рівень EPCR у пацієнтів залежно від ступеня АГ подано в таблиці 4.42.
Таблиця 4.42 – Рівень EPCR у хворих другої і третьої груп залежно від ступеня АГ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| 1-2 ступінь АГ | 3 ступінь АГ | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| EPCR, нг/мл | 1636,16±59,2
(1517,76-1754,56) |
1410,75±43,9
(1322,82-1498,68) |
1591,08±51,98
(1487,11-1695,04) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| EPCR, нг/мл | 979,54±75,93
(827,68-1131,41) |
742,67±53,28
(636,11-849,23)* |
800,68±46,34
(708-893,36) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з 1-2 ст. АГ.
Як видно з таблиці, рівень EPCR у пацієнтів з поєднаною патологією знижувався на 24,18 % (р<0,05) при 3 ступені АГ порівняно з пацієнтами з 1-2 ступенем АГ, а інгібуючий вплив АПС на процеси запалення знижувався. Аналогічна тенденція спостерігалася і в пацієнтів з ГХ групи порівняння при 3 ступені АГ відносно пацієнтів з 1-2 ступенем АГ, де значення EPCR зменшувалося на 13,78 %.
Оцінено також рівень активності EPCR залежно від типу Пс (табл. 4.43).
Достовірна різниця в рівні EPCR визначена лише при поєднаній патології, даний маркер був вищим при літньому типі Пс відносно зимового і недиференційованого на 70,69 % і 31,67 % (р<0,05), а між собою два останні типа Пс мали різницю у вигляді 16,63 % (р<0,05).
Особливий інтерес викликало вивчення значень рівня EPCR у хворих на Пс залежно від форми дерматозу, що наведено в таблиці 4.44.
У групі порівняння визначалися більш високі значення EPCR при вульгарній бляшковій / краплеподібній / інтертригінозній формах Пс, що віддзеркалилося у вигляді різниці в 10,39 % і 19,64 % (р<0,05) відповідно порівняно з бляшковою з явищами ексудації та еритродермічною / артропатичною / пустульозною формами, а сама бляшкова з явищами ексудації форма Пс превалювала над еритродермічною / артропатичною / пустульозною формою щодо EPCR на 7,22 % (р<0,05).
Таблиця 4.43 – Рівень EPCR у хворих першої і третьої груп залежно від типу Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Зимовий тип Пс | Літній тип Пс | Недиференційований тип Пс | |
| Хворі на Пс (п=34) | |||
| EPCR, нг/мл | 1228±30,44
(1167,12-1288,88) |
1250,17±81,94
(1086,29-1414,04) |
1299,57±34,28
(1231,02-1368,13) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| EPCR, нг/мл | 493,58±102,54
(288,5-698,67) |
842,5±157,5
(527,5-1157,5)* |
575,68±53,37
(468,94-682,43) # |
Примітка. * – р <0,05 при порівнянні з зимовим типом; # – р <0,05 при порівнянні з літнім типом.
Таблиця 4.44 – Рівень EPCR у хворих першої і третьої груп залежно від форми Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Пс
вульгарний бляшковий / краплеподібний / інтертригінозний |
Пс
вульгарний бляшковий з явищами ексудації |
Пс
еритродермічний/ артропатичний / пустульозний |
|
| Хворі на Пс (n=34) | |||
| EPCR, нг/мл | 1369,79±30,38(1209,02-1430,56) | 1227,5±78,96(1069,59-1385,41) | 1144,88±32,04(1080,8-1208,95) * # |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| EPCR, нг/мл | 1334,8±79,53(1180,73-1498,86) | 612,3±138,29(336,73-889,87) | 475,19±61,13(354,93-600,45) |
Примітка. * – р <0,05 при порівнянні з 1 підгрупою; # – р <0,05 при порівнянні з 2 підгрупою.
Коморбідна патологія демонструвала такі рівні EPCR: при вульгарній бляшковій / краплеподібній / інтертригінозній формі рівень EPCR був вище, ніж при бляшковій з явищами ексудації на 54,22 % або при еритродермічній / артропатичній / пустульозній формі – на 64,38 % (р<0,05), а остання форма мала менші значення EPCR порівняно з бляшковою з явищами ексудації формою на 22,19 % (р<0,05).
Варіабельність показника EPCR у хворих на Пс залежно від його стадії подано в таблиці 4.45, рівень його був статистично незначно вищим при стаціонарній стадії Пс без ГХ (5,52 %) та істотно вищим при тій же стаціонарній стадії, але при наявності супутньої ГХ (35,55 %, р<0,05).
Таблиця 4.45 – Рівень EPCR у хворих першої і третьої груп залежно від стадії Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Стаціонарна стадія Пс | Прогресуюча стадія Пс | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| EPCR, нг/мл | 1272,67±25,81(1221,05-1324,28) | 1202,38±42,1(1118,18-1286,57) | 1257,87±22,73(1212,4-1303,33) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| EPCR, нг/мл | 973,33±34,21(901,92-1038,75) | 627,28±45,95(535,38-719,19)* | 800,68±46,34(708-893,36) |
Примітка. * – р <0,05 при порівнянні зі стаціонарною стадією.
Аналіз рівня EPCR залежно від PASI у обстежених осіб наведено в таблиці 4.46.
Цитопротекторні механізми істотно знижувалися при збільшенні PASI: Пс групи порівняння характеризувався падінням значень EPCR у хворих з PASI 10-30 на 17,32 % (р<0,05) порівняно з групою хворих на Пс і PASI ≤ 10; збільшенням рівня EPCR на 28,27 % (р<0,05) порівняно з хворими з PASI більше 30. Відмінності в групі порівняння з Пс, де PASI ≤ 10 і ≥30, становили 40,70 % (р<0,05) на користь першої. Приєднання ГХ достовірно та істотно посилювало цитодеструкцію у всіх групах обстежуваних хворих порівняно з дерматозом без супутньої ГХ. Так, збільшення PASI ≥ 30 при Пс і ГХ знижувало рівні EPCR на 59,25 і 45,25 % (р<0,05) порівняно з групами, що мали PASI ≤ 10 і 10-30 відповідно, а різниця між двома останніми групами становила 25,58 % (р<0,05) на користь першої.
Таблиця 4.46 – Рівень EPCR у хворих першої і третьої груп залежно від показника PASI (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| PASI ≤ 10 | PASI 10-30 | PASI ≥30 | |
| Хворі на Пс (n=34) | |||
| EPCR, пг/мл | 1531,11±22,61(1485,89-1576,33) | 1265,94±31,69(1202,57-1329,32)* | 908±64,63(778,74-837,26) * # |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| EPCR, пг/мл | 873,3±34,39(804,51-940,09) | 649,94±32,77(574,41-705,47)* | 355,86±45,61(264,64-447,08) * # |
Примітка. * – р <0,05 при порівнянні з хворими з індексом PASI менше 10; # – р <0,05 при порівнянні з хворими з індексом PASI в діапазоні 10-30.
Цитопротекторний і антиапоптотичний ефекти АПС істотно знижувалися при зростанні PASI від 10 до 30 і вище, а також при наявності у пацієнтів коморбідної патології, що вказувало на достовірний негативний вплив ГХ на систему захисту судинного ендотелію.
* * *
Проведений аналіз результатів дослідження свідчить про достовірне зростання вмісту маркера апоптозу каспази-8 у пацієнтів з поєднаною патологією. Достовірну різницю встановлено при тривалості ГХ або дерматозу більше 5 років, 3-му ступені АГ, при ожирінні. Більш вираженим цей маркер був у жінок, при тяжких формах дерматозу, особливо – артропатичній формі; ступінь ураження шкіри також стимулювала апоптоз.
Показовим дослідженням у групі хворих на коморбідну патологію (Пс і ГХ), що свідчить про ступінь ураження шкіри, виявився рівень сигнального білка васкулогенезу (VEGF-А), який у декілька разів перевершував аналогічний показник груп порівняння. Збільшення рівня VEGF-А, як і апоптотичної активності, з ремоделюванням судинної стінки встановлено при тривалості ГХ більше 5 років та у чоловіків, переважно при наявності проявів ексудації дерматозу, що корелювало з високим показником PASI. У зв’язку з цим, методом статистичного аналізу було визначено критичне значення рівня VEGF-А. З’ясувалося, що показник VEGF-А більше 700 пг/мл може достовірно слугувати маркером формування тяжкого перебігу дерматозу (у 92 % таких хворих індекс PASI перевищував 30 ум. од.), а значення каспази-8 більше 0,22 нг/мл статистично достовірно асоціювалося із формуванням ураження суглобів при Пс.
У хворих на Пс у поєднанні з ГХ спостерігалося достовірне збільшення рівня універсального маркера нітрозуючого стресу нітротирозину, що свідчить про найбільшу окислювальну деструкцію оксиду азоту саме при коморбідній патології. Надлишкова вага при поєднаній патології, тяжкі форми дерматозу призводили до істотного зростання маркерів вазоконстрикції. У жінок значно вищим був і маркер нітрозування, і ендотелін‑1.
Аналіз результатів дисперсійного комплексу за однофакторною схемою дозволив виявити статистично значущий односпрямований кореляційний взаємозв’язок між рівнем нітротирозину і ступенем тяжкості проявів дерматозу за PASI, підкреслюючи, що прогресування інтенсивності ураження шкіри при Пс у поєднанні з ГХ достовірно асоціювалося з активацією ВРО і підвищенням сироваткової концентрації продукту нітрування тирозину.
Поєднаний перебіг Пс та ГХ найбільше сприяє активації NOS і, як результат даної активації, характеризується збільшенням рівня самих нітритів. Активність процесів нітрозуючого стресу зростає в кореляції зі ступенем і тяжкістю ураження шкіри та суглобів.
Отримані результати комплексного обстеження та динамічного спостереження за хворими свідчать про активацію оксидативного стресу при коморбідній патології, а також про складну і неоднозначну систему регулювання про- та антиоксидантної рівноваги, які проявляються збільшенням активності ВРО і зниженням фізіологічного антиоксидантного захисту. У пацієнтів з поєднаною патологією Пс і ГХ розвиваються оксидативний і карбонільний стреси, які істотно зміщують тіол-дисульфідну рівновагу в бік окислених тіолів. В основній групі низький рівень співвідношення ГЛУв/ГЛУо (менше 6 ум.од. (відносний ризик для цієї когорти хворих склав 6,57 з 95 % ДІ [4,52; 8,71]) достовірно збільшував майже в 4,5 разу ймовірність розвитку тяжких форм Пс порівняно з пацієнтами, у яких вищевказані показники були в межах норми, р<0,05.
Дослідженням гомоцистеїну встановлено, що збільшення його рівня і розвиток ЕД максимально визначено при коморбідній патології порівняно з групами порівняння; при тривалості ГХ або дерматозу більше 5 років. Найвищі його значення зафіксовано в групах з еритродермічною / артропатичною / пустульозною формами, як при Пс на тлі нормальних цифр АТ, так і при одночасній ГХ. ГГЦ, як маркер тяжкості системного ураження органів, ЕД, зростав при підвищенні PASI до 30 і вище.
У пацієнтів основної групи встановлено порушення системи захисту ендотелію у вигляді зниження рівня EPCR при тривалості ГХ більше 5 років, 3-му ступені АГ. Цитопротекторний і антиапоптотичний ефекти АПС істотно знижувалися при наявності тяжких форм дерматозу, зростанні PASI від 10 до 30 і вище.
Матеріали даного розділу опубліковані в таких роботах:
[34, 35, 38, 39, 42, 44, 45, 49, 50, 51, 53, 62, 63, 407, 408]
РОЗДІЛ 5
СТАН РЕГУЛЮЮЧИХ СИСТЕМ У ХВОРИХ НА ПСОРІАЗ
ПРИ НАЯВНОСТІ ТА ВІДСУТНОСТІ КОМОРБІДНИХ СТАНІВ
5.1 Гуморальні ефектори системи адаптації
Вплив тригерних факторів при Пс на адаптивні механізми зазвичай починається з активації симпатико-адреналової системи і зростання рівня сироваткових катехоламінів. У той же час, гіперпродукція норадреналіну з симпатичних нервових закінчень спонукає до інтенсифікації ліполізу в жировій тканині. Усі ці фактори комплексно сприяють гіперглікемії і збільшенню рівня вільних жирних кислот, що призводить до гіперсекреції інсуліну [144]. Відомо, що інсулін стимулює споживання й обмін глюкози в регуляторних клітинах, анатомічно пов’язаних з вентромедіальними ядрами гіпоталамуса. Збільшення споживання глюкози в цих нейронах веде до зменшення їх пригнічуючого впливу на стовбур головного мозку. В результаті розташовані там центри симпатичної регуляції розгальмовуються і центральна активність симпатичної нервової системи зростає [318]. Гіперактивізація симпатичної нервової системи призводить до появи АГ за рахунок симпатичної стимуляції серця, судин та нирок. Порушення вуглеводного обміну і накопичення відповідних продуктів зміненого метаболізму, в поєднанні з ангіопатіями, порушенням місцевого і загального імунітету, призводять до структурних змін у дермі, епідермісі, фолікулах і потових залозах. Ефекти інсуліну в шкірі здебільшого можна пояснити його здатністю активувати близькоспоріднений рецептор інсуліноподібного фактора росту. В результаті активується прискорена проліферація і диференціювання кератиноцитів. Гіперглікемія також активує протеїнкіназу С, що може призводити до гіперпродукції судинозвужувальних простагландинів, ендотеліну-1 та АПФ, які мають безпосередню або опосередковану шкідливу дію на судинорухову реактивність [372].
Одним із основних маркерів адаптаційних властивостей організму є кортизол / інсуліновий індекс, тому визначення вмісту цих показників у сироватці хворих різних груп дозволить оцінити стан напруження і потенціал факторів адаптації.
Сироваткові значення кортизолу та інсуліну в обстежених осіб у цілому по групах відображено в табл. 5.1.
Таблиця 5.1 – Вміст кортизолу та інсуліну в обстежених осіб у цілому по групах (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Хворі на ГХ (n=30) | Хворі на Пс (n=34) | Хворі на Пс у поєднанні з ГХ (n=80) | Контрольна група (n=20) |
| Кортизол, мкг/дл | 21,18±0,89 (19,41-22,96) | 13,75±1,09 (11,58-15,92)* | 6,26±1,13(3,99-8,53) *# | 12,72±3,36 (6,01-19,44) |
| Інсулін, Од/мл | 8,59±0,91 (6,78-10,4) | 14,38±1,61 (11,15-17,61)* | 25,77±4,01(17,75-33,79) *# | 12,39±3,09 (6,21-18,57) |
| КІІ, ум.од | 2,47±0,34 (1,79-3,15) | 0,96±0,14 (0,68-1,24)* | 0,24±0,09 (0,06-0,42) *# | 1,03±0,22 (0,59-1,47) |
Примітка. * – р <0,05 при порівнянні з групою хворих на Пс; # – р <0,05 при порівнянні з групою хворих на ГХ.
Якщо порівнювати показники кортизолу в усіх досліджених групах, то можна побачити, що найвищі його значення спостерігалися в групі порівняння на ГХ. При тривалій надлишковій продукції кортизолу відбувалося збільшення вмісту в крові реніну. Останній бере участь в утворенні ангіотензину-I, сприяє затримці натрію в організмі, підвищенню вмісту води в стінках артеріол зі зменшенням їх просвіту, підвищенню судинного тонусу, що призводить до підвищення АТ.
У пацієнтів з ГХ рівень кортизолу на 35,08 % був вищим за аналогічний показник хворих першої групи порівняння, які страждали тільки на Пс, і на 238,34 % (р<0,05) статистично достовірно вище порівняно з пацієнтами з коморбідною патологією. Якщо порівнювати вміст кортизолу у хворих на Пс з нормальним рівнем АТ і підвищеним, то різниця склала 119,65 % (р<0,05) на користь хворих без АГ. У хворих на Пс без ГХ можна визначити тенденцію до зниження сироваткового рівня кортизолу, а особливо значуще його зниження – у пацієнтів з поєднаною патологією. Таким чином, хворі на ГХ, знаходячись під впливом тригерів, можуть формувати адекватну фізіологічну відповідь на відміну від пацієнтів із Пс, які не здатні забезпечити необхідний рівень відповіді за рахунок перенапруження системи адаптації.
При трактуванні результатів дослідження рівнів інсуліну в крові хворих різних клінічних груп відзначалося зростання даного показника у пацієнтів основної групи, а різниця в значеннях цього гормону відносно груп порівняння, як до першої (тільки з Пс), так і до другої (тільки з ГХ) склала 44,20 % і 66,67 % (р<0,05) відповідно, на користь коморбідної патології. Також важливим є той факт, що у хворих на Пс першої групи порівняння рівні інсуліну були на 67,40 % (р<0,05) вищими за показники другої групи порівняння (хворих на ГХ), що свідчить про більш напружену потребу і стан у процесах обміну глюкози у хворих саме на Пс [36, 37].
Оцінка гормонального профілю і показника кортизол-інсулінового індексу (КІІ) свідчить про патологічну активацію стрес-реалізуючих систем при високому його значенні, що може бути проявом порушень психоемоційного стану у вигляді тривоги або депресії, симптому напруженості систем адаптації. І навпаки, виявлення низького показника співвідношення кортизолу та інсуліну (0,24 ум.од.), що майже в 4 рази менше, ніж у контрольній групі, свідчило про виснаження адаптаційних можливостей організму при Пс у поєднанні з гіпертензією і вказує на потенційний зрив регуляторних механізмів, наявність дезадаптаційних розладів і знижену стресостійкість. Тому логічним є використання при даному дерматозі крім традиційної системної і місцевої терапії препаратів, що підвищують адаптаційний потенціал і мають стреспротективні властивості, особливо на тлі ГХ.
При дослідженні кортизолу та інсуліну в обстежених осіб залежно від тривалості ГХ з’ясовано, що достовірного (р˂0,05) впливу терміну ГХ на показники кортизолу та інсуліну не виявлено.
Розглянемо значення досліджуваних параметрів у хворих на Пс залежно від тривалості дерматозу, які подано в таблиці 5.2.
Як видно з наведеної таблиці, достовірні та статистично значущі відмінності були отримані при порівнянні кортизолу у хворих на Пс із різною тривалістю захворювання.
Відзначено, що зі зростанням тривалості захворювання на Пс більше 5 років, рівні кортизолу знижувалися на 45,85 % (р<0,05), а при поєднаній патології даний стресовий маркер демонстрував протилежну динаміку: зростав зі збільшенням тривалості захворювання більше 5 років на 94,57 % (р<0,05).
Таблиця 5.2 – Вміст кортизолу та інсуліну у хворих першої та третьої групи залежно від тривалості Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість Пс до 5 років | Тривалість Пс більше 5 років | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| Кортизол, мкг/дл | 14,83±0,96(12,91-16,74) | 8,03±3,33(1,37-14,7)* | 13,75±1,09(11,58-15,92) |
| Інсулін, Од/мл | 14,12±1,63(10,85-17,39) | 15,78±6,35(3,07-28,49) | 14,38±1,61(11,15-17,61) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Кортизол, мкг/дл | 3,5±1,09(1,32-5,67) | 6,81±1,31(4,2-9,43)* | 6,26±1,13(3,99-8,53) |
| Інсулін, Од/мл | 34,73±16,47(1,78-67,67) | 23,53±3,2(17,14-29,93) | 25,77±4,01(17,75-33,79) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з тривалістю захворювання до 5 років.
Незначне зростання рівня інсуліну у хворих з більш давніми формами Пс у групі порівняння у вигляді 11,76 % вписується в загальну тенденцію динаміки цього маркера. Що ж стосується поєднаної патології (основна група), то в даній ситуації зміни мали протилежну спрямованість: чим довша тривалість ураження шкіри при поєднанні з ГХ, тим нижчими були рівні інсуліну (32,25 %).
Кількісні ознаки гуморального статусу залежно від ІМТ подано в табл. 5.3.
У пацієнтів основної групи рівень кортизолу зростав на 43,90 % (р<0,05) зі зростанням ІМТ понад 30 кг/м2. При вивченні показників інсуліну відзначено найбільш значуще його підвищення – на 125,21 % (р<0,05) також у групі з коморбідною патологією. Відповідно, чим більшою була маса тіла, тим більше порушувалася толерантність до глюкози у групи пацієнтів з ГХ, але в обох групах порівняння також були прояви ІР.
Результати дослідження показників у обстежених осіб залежно від статі продемонстровано в табл. 5.4.
Таблиця 5.3 – Вміст кортизолу та інсуліну у хворих залежно від ІМТ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| ІМТ до 30 кг/м2 | ІМТ більше 30 кг/м2 | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Кортизол, мкг/дл | 22,72±1,45 (19,81-25,63) | 19,58±0,92 (17,75-21,41)* | 21,18±0,89 (19,41-22,96) |
| Інсулін, Од/мл | 10,2±1,2 (7,8-12,59) | 6,85±1,3 (4,25-9,45)* | 8,59±0,91 (6,78-10,4) |
| Хворі на Пс (n=34) | |||
| Кортизол, мкг/дл | 16,78±2,38 (12,01-21,54) | 13,19±1,18 (10,82-15,55) | 13,75±1,09 (11,58-15,92) |
| Інсулін, Од/мл | 11,54±1,38 (6,77-16,31) | 14,91±1,56 (11,2-18,63)* | 14,38±1,61 (11,15-17,61) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Кортизол, мкг/дл | 4,67±1,7(1,16-8,18) | 6,72±1,07 (3,97-8,46)* | 6,26±1,13 (3,99-8,53) |
| Інсулін, Од/мл | 13,29±2,15(9-17,59) | 29,93±4,87 (20,19-39,67)* | 25,77±4,01 (17,75-33,79) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з ІМТ 30 кг/м2.
Таблиця 5.4 – Вміст кортизолу й інсуліну у хворих в залежності від статі (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Чоловіки | Жінки | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Кортизол, мкг/дл | 22,98±1,65 (19,68-26,27) | 20,54±1,04 (18,45-22,62) | 21,18±0,89 (19,41-22,96) |
| Інсулін, Од/мл | 8,24±1,77 (4,7-11,78) | 8,72±1,07 (6,58-10,86) | 8,59±0,91 (6,78-10,4) |
| Хворі на Пс (n=34) | |||
| Кортизол, мкг/дл | 14,34±1,54 (11,26-17,43) | 13,41±1,51 (10,4-16,42) | 13,75±1,09 (11,58-15,92) |
| Інсулін, Од/мл | 12,25±1,18 (9,89-14,61) | 15,63±2,43 (10,76-20,49) | 14,38±1,61 (11,15-17,61) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Кортизол, мкг/дл | 7,14±1,75 (3,64-10,64) | 4,88±0,91 (3,06-6,7) | 6,26±1,13 (3,99-8,53) |
| Інсулін, Од/мл | 21,8±2,49 (16,81-26,78) | 30,62±6,37 (13,89-47,36)* | 25,77±4,01 (17,75-33,79) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів чоловічої статі.
Як свідчать дані таблиці, виявлено досить суттєві гендерні відмінності лише в основній групі, де рівень кортизолу у чоловіків на 31,65 % був вище, ніж у жінок. Тож, велика частка розвитку системного ураження у жінок з формуванням артропатичного Пс є проявом декомпенсації адаптації у жінок з коморбідною патологією. При вивченні рівнів інсуліну виявлено зростання його в жіночій популяції в кожній групі хворих порівняно з особами чоловічої статі: при ГХ різниця становила лише 5,83 %, при Пс – 27,59 %, а при поєднанні Пс і ГХ – 40,46 % (р<0,05). І якщо при ГХ гендерні відмінності були недостатньо статистично виразними, то у пацієнтів першої групи порівняння (лише Пс) і при коморбідній патології різниця була досить суттєвою. Відповідно в осіб чоловічої статі є більша схильність до появи порушення толерантності до вуглеводів і формування діабету при хронічному системному запальному процесі.
Варіабельність сироваткових концентрацій показників кортизолу та інсуліну у пацієнтів різних вікових груп показано в табл. 5.5.
Таблиця 5.5 – Вміст кортизолу та інсуліну у хворих залежно від віку (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Молодше 50 років | Старше 50 років | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Кортизол, мкг/дл | 20,64±1,38(17,87-23,41) | 21,47±1,16(19,16-23,78) | 21,18±0,89(19,41-22,96) |
| Інсулін, Од/мл | 6,75±1,25(4,24-9,25) | 9,6±1,2(7,21-12)* | 8,59±0,91(6,78-10,4) |
| Хворі на Пс (n=34) | |||
| Кортизол, мкг/дл | 14,04±1,2(11,65-16,43) | 11,34±0,7(9,94-12,74) | 13,75±1,09(11,58-15,92) |
| Інсулін, Од/мл | 13,9±1,55(10,8-17) | 18,45±9,99(-1,53-38,43) | 14,38±1,61(11,15-17,61) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Кортизол, мкг/дл | 3,88±0,91(2,07-5,7) | 8,16±1,72(4,72-11,6)* | 6,26±1,13(3,99-8,53) |
| Інсулін, Од/мл | 30,12±8,06(14-46,25) | 22,21±3,19(15,82-28,59) | 25,77±4,01(17,75-33,79) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів молодше 50 років.
У пацієнтів старше 50 років лише при поєднаній патології була достовірна різниця стосовно рівня кортизолу, вона становила 110,31 %. Відповідно, при коморбідності організм зі збільшенням вікового показника компенсує стан системної запальної відповіді надлишковою продукцією глюкокортикостероїдів, а в групах порівняння вік не впливає на рівні стероїдних гормонів.
При визначенні рівня інсуліну відзначено його зростання при ГХ у осіб старше 50 років на 42,22 % (р<0,05), при Пс – на 32,73 %, при поєднаній патології, навпаки, зниження на 26,26 %. Таким чином, у пацієнтів з коморбідністю була більш виразною схильність до порушень толерантності до глюкози, а в групах порівняння ситуація діаметрально протилежна: рівень інсуліну зростав при збільшенні віку пацієнтів.
Концентраційні значення показників інсуліну та кортизолу в обстежених осіб залежно від ступеня АГ наведено в таблиці 5.6.
Таблиця 5.6 – Вміст кортизолу та інсуліну у хворих залежно від ступеня АГ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| 1-2 ступінь АГ | 3 ступінь АГ | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Кортизол, мкг/дл | 21,63±1,09(19,44-23,82) | 19,81±1,31(17,18-22,43) | 13,75±1,09(11,58-15,92) |
| Інсулін, Од/мл | 8,68±1,09(6,51-10,85) | 8,33±1,65(5,02-11,63) | 14,38±1,61(11,15-17,61) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Кортизол, мкг/дл | 9,36±2,36(8,64-10,08) | 5,64±1,31(3,03-8,25) | 6,26±1,13(3,99-8,53) |
| Інсулін, Од/мл | 34,6±16,09(2,41-66,79) | 23,56±3,3(16,96-30,16) | 25,77±4,01(17,75-33,79) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з 1-2 ст. АГ.
У пацієнтів другої групи порівняння з ГХ статистично значущих відмінностей відносно кортизолу відповідно до ступеня захворювання не виявлено. У той же час, коморбідна патологія сприяла тому, що рівень кортизолу істотно знижувався як раз у осіб з 3 ступенем АГ і різниця становила 39,74 % на користь пацієнтів з 1-2 ступенем АГ, що може свідчити про виснаження мобілізаційних ресурсів організму при поєднаній патології і функціональній декомпенсації стрес-лімітуючих систем організму.
Щодо інсуліну, визначено статистично незначне і недостовірне зростання його при 1-2 ступені АГ на 4,03 % порівняно з особами з 3 ступенем АГ. При наявності коморбідної патології виявлено різницю в 31,91 % на користь хворих з 1-2 ступенем АГ. Відповідно, у пацієнтів з поєднаною патологією ступінь АГ впливає на рівень інсуліну в крові, в той же час лише при ГХ істотних відмінностей залежно від ступеня АГ не виявлено.
Було оцінено також рівень досліджуваних показників залежно від типу Пс (див. табл. 5.7).
Таблиця 5.7 – Вміст кортизолу та інсуліну у хворих залежно від типу Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Зимовий тип Пс | Літній тип Пс | Недиференційований тип Пс | |
| Хворі на Пс (n=34) | |||
| Кортизол, мкг/дл | 14,78±1,2(12,39-17,18) | 15,77±3,17(9,43-22,11) | 11,57±2,09(7,38-15,76) |
| Інсулін, Од/мл | 12,91±2,66(7,58-18,24) | 14,53±2,5(9,53-19,52) | 16,21±2,67(10,88-21,55) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Кортизол, мкг/дл | 7,02±1,06(4,89-9,15) | 7,1±4,89(-2,67-16,87) | 5,48±1,69(2,1-8,86) * # |
| Інсулін, Од/мл | 28,24±6,64(14,96-41,52) | 22,16±6(10,16-34,16) | 25,41±6,39(12,62-38,19) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з зимовим типом; # – р <0,05 при порівнянні з літнім типом.
Як видно з таблиці, статистично значущі відмінності були отримані при порівнянні тільки кортизолу в осіб з різним типом Пс. Відзначено, що при літньому типі Пс рівні кортизолу були вищими порівняно з недиференційованим типом Пс на 36,30 % (р<0,05). У той же час при зимовому типі рівень даного глюкокортикоїду на 27,74 % був вищим відносно недиференційованого типу Пс. При поєднаній патології даний стероїдний маркер стресу мав нижчі показники кортизолу при недиференційованому типі відносно зимового на 28,10 % (р<0,05), а відносно літнього типу – на 29,56 % (р<0,05). Таким чином, літня форма Пс мала найвищі значення кортизолу, а при наявності коморбідної патології літня і зимова форми Пс мали однаково високі показники цього глюкокортикоїду.
Значний інтерес викликає вивчення динаміки рівня кортизолу та інсуліну в обстежених осіб залежно від форми Пс, що представлено в таблиці 5.8.
Таблиця 5.8 – Вміст кортизолу та інсуліну у хворих на Пс залежно від форми (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Пс
бляшковий вульгарний / краплеподібний / інтертригінозний |
Пс
вульгарний бляшковий з явищами ексудації |
Пс
еритродермічний/ артропатичний / пустульозний |
|
| Хворі на Пс (n=34) | |||
| Кортизол, мкг/дл | 13,46±1,53(10,4-16,51) | 14,35±2,7(8,96-19,74) | 14,2±2,01(10,18-18,23) |
| Інсулін, Од/мл | 14,13±1,65(10,83-17,44) | 11,47±2,4(6,66-16,27) | 17,32±6,02(5,28-29,36) |
| КІІ, ум.од. | 0,95±0,15 (0,65-1,25) | 1,25±0,22 (0,81-1,69) | 0,82±0,13 (0,56-1,08)* |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Кортизол, мкг/дл | 3,02±0,92(1,19-4,85) | 8,05±1,57(4,9-11,19)* | 6,34±1,8(2,74-9,94) * # |
| Інсулін, Од/мл | 17,38±3,92(9,54-25,23) | 31,47±7,45(16,57-46,36)* | 26,23±6,3(13,63-38,84) |
| КІІ, ум.од. | 0,17±0,05 (0,07-0,27) | 0,26±0,04 (0,18-0,34) | 0,24±0,06 (0,12-0,36) |
Примітка.* – р <0,05 при порівнянні з 1 підгрупою; # – р <0,05 при порівнянні з 2 підгрупою.
У хворих лише на Пс отримані результати вмісту кортизолу не дозволяють робити достовірні висновки. При поєднаній патології рівень цього гормону демонстрував різницю між бляшковою формою з явищами ексудації та вульгарною бляшковою / краплеподібною / інтертригінозною формами в 166,56 % (р<0,05), а порівняно з еритродермічною / артропатичною / пустульозною формами Пс – у 26,97 % (р<0,05) на користь бляшкової форми з явищами ексудації. При еритродермічній / артропатичній / пустульозній формі Пс рівень даного глюкокортикоїду був на 52,37 % (р<0,05) вище відносно вульгарної бляшкової / краплеподібної / інтертригінозної форми. Таким чином, вульгарна бляшкова / краплеподібна / інтертригінозна форми Пс у групі порівняння мали найвищі значення кортизолу; при наявності коморбідності даний стероїдний гормон також мав першість при аналогічних клінічних формах Пс.
При еритродермічній / артропатичній / пустульозній формі Пс у групі порівняння визначено найвищі цифри інсуліну, а різниця відносно вульгарної бляшкової / краплеподібної / інтертригінозної форм і бляшкової форми з явищами ексудації становила 18,42 % і 33,78 % відповідно. Комбінована патологія Пс і ГХ демонструвала таку картину стосовно інсуліну: бляшкова форма з явищами ексудації превалювала над вульгарною бляшковою / краплеподібною / інтертригінозною формами на 81,07 % і над еритродермічною / артропатичною / пустульозною – на 19,98 %, а дві останні форми мали різницю між собою в 33,74 % на користь тяжких форм Пс. Відповідно, значно нижчий рівень інсуліну визначено при бляшковій формі з явищами ексудації Пс на тлі нормальних цифр АТ, у групі поєднаної патології – при вульгарній бляшковій / краплеподібній / інтертригінозній формах.
При дослідженні КІІ в основній групі виявлено статистично схожі показники при тяжких формах Пс.
Вміст кортизолу та інсуліну у хворих на Пс залежно від стадії подано в таблиці 5.9.
Достовірна різниця визначена лише в основній групі, де прогрес клінічних проявів дерматозу супроводжувався зниженням рівня кортизолу, підвищенням рівня інсуліну і відповідно – зниженням КІІ.
Сироваткові значення кортизолу та інсуліну залежно від PASI в обстежених осіб наведено в табл. 5.10.
Зростання рівня PASI понад 30 при Пс в групі порівняння збільшувало значення кортизолу на 52,79 % і 21,23 % (р<0,05) порівняно з групами хворих, які мали PASI ≤ 10 і 10-30 відповідно, а різниця між двома останніми групами становила 66,86 % (р<0,05). Рівні кортизолу у хворих з коморбідністю початково були істотно нижчими, ніж у пацієнтів, які хворіли лише на Пс, але зростання його тяжкості та поширеності, виходячи з PASI, також прогресивно збільшувало даний стероїдний гормон. Так, особи з коморбідним станом і PASI ≥ 30 мали більші значення кортизолу відносно груп Пс і ГХ та PASI ≤ 10 і 10-30 на 51,38 % і 47,59 % (р<0,05) відповідно; між останніми двома групами виявлено різницю в 7,81 % (р<0,05).
Таблиця 5.9 – Вміст кортизолу та інсуліну залежно від стадії Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Стаціонарна стадія Пс | Прогресуюча стадія Пс | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| Кортизол, мкг/дл | 16,97±1,14(14,69-19,25) | 12,9±1,26(10,37-15,42)* | 13,75±1,09(11,58-15,92) |
| Інсулін, Од/мл | 12,62±2,55(7,52-17,71) | 14,85±1,95(10,96-18,75) | 14,38±1,61(11,15-17,61) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Кортизол, мкг/дл | 9,36±0,36(8,64-10,08) | 5,64±2,31(3,03-8,25)* | 6,26±1,13(3,99-8,53) |
| Інсулін, Од/мл | 18,58±2,17(14,25-22,91) | 27,04±4,66(17,73-36,35)* | 25,77±4,01(17,75-33,79) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів зі стаціонарною формою.
Таблиця 5.10 – Вміст кортизолу та інсуліну у хворих на Пс залежно від показника PASI (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| PASI ≤ 10 | PASI 10-30 | PASI ≥30 | |
| 1 | 2 | 3 | |
| Хворі на Пс (n=34) | |||
| Кортизол, мкг/дл | 8,54±1,89(4,75-12,33) | 14,25±1,1(12,05-16,44)* | 18,09±0,78(16,54-19,64) * # |
| Інсулін, Од/мл | 11,29±1,23(8,83-13,75) | 12,76±2,27(8,22-17,3) | 17±2,97(11,06-22,94) * # |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Кортизол, мкг/дл | 3,69±0,59(2,5-4,87) | 7,04±2,37(2,29-11,79)* | 7,59±1,1(5,39-9,8)* |
| Інсулін, Од/мл | 19,86±4,49(10,87-28,84) | 20,39±1,89(16,61-24,18) | 31,42±7,45(16,51-46,32) * # |
Примітка. * – р <0,05 при порівнянні з хворими з індексом PASI менше 10; # – р <0,05 при порівнянні з хворими з індексом PASI в діапазоні 10-30.
Збільшувалися і значення інсуліну при зростанні PASI, істотна різниця виявлена щодо інсуліну між групами порівняння й основною. Прогресивне збільшення значення інсуліну при Пс групи порівняння і PASI ≥ 30 порівняно з групами, де PASI ≤ 10 і 10-30 на 33,59 % і 24,94 % (р<0,05) відповідно, призводило до порушення вуглеводного обміну на тлі наростання тяжкості перебігу і ступеня ураження шкіри, а між останніми двома групами різниця в показниках інсуліну становила 13,02 % (р<0,05). При коморбідності збільшення PASI від 10-30 до цифр понад 30 призводило до збільшення інсуліну на 35,11 % (р<0,05), групи з коморбідною патологією і PASI до 10 і понад 30 мали відмінності на рівні 36,79 % (р<0,05).
Таким чином, мінливість активності регуляторів вуглеводного обміну у пацієнтів із Пс тісно пов’язана з наявністю супутньої ГХ, а також з рівнем PASI. Приєднання ГХ до Пс, збільшення площі ураження шкіри асоціювалося з високими значеннями кортизолу та інсуліну, і, відповідно, формувало фон для порушення толерантності до глюкози у таких пацієнтів і розвитку тяжких ускладнень на тлі гіперглікемії. Водночас сумарне зниження рівня кортизолу на тлі зростання інсуліну, і, відповідно, зниження КІІ, свідчило про зрив систем адаптації, особливо чітко це простежувалося у пацієнтів з артропатичною формою Пс.
5.2 Визначення рівня та значущості біогенних амінів
Серотонінергічна система вважається перспективним шляхом, який пояснює нейроімунологічний зв’язок між Пс і психологічними симптомами, дозволяє провести відповідну терапевтичну корекцію. Підставою для цього є, з одного боку, те, що в центральній нервовій системі серотонінергічні нейрони проектуються майже у всіх регіонах головного мозку і впливають на безліч фізіологічних функцій, таких, як біль, сон, рухові функції, настрій, зв’язок з ендокринною системою. Основними виробниками серотоніну є ентерохромафінні клітини кишківника і серотонінергічні нейрони мозку, проте запаси цього нейромедіатора зберігаються в багатьох типах клітин за межами центральної нервової системи, включаючи тромбоцити, лімфоцити, моноцити / макрофаги і дендритні клітини [245, 420].
Як відомо, триптофан відіграє важливу роль у механізмах формування Пс, оскільки він є найважливішою амінокислотою, яка бере участь в обміні білків, а її метаболіти (серотонін) впливають на диференціювання і проліферацію епітелію, обмін речовин у тканинах і внутрішніх органах. Поодинокі дослідження у цьому напрямку раніше проводилися [6, 9], але без детального вивчення впливових факторів саме у хворих на Пс у поєднанні з ГХ. Для вивчення стану серотонінергічної системи в обстежених хворих і непрямого визначення ключових метаболічних процесів амінокислоти триптофану проведено вивчення серотоніну в кожній групі пацієнтів.
Розглянемо отримані значення серотоніну у всіх обстежених, які наведено в таблиці 5.11.
Таблиця 5.11 – Вміст серотоніну сироватки крові у хворих у цілому по групах (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Хворі на Пс (n=34) | Хворі на ГХ (n=30) | Хворі на Пс у поєднанні з ГХ (n=80) | Контрольна група (n=20) |
| Серотонін, нг/мл | 189,33±15,79 (157,75-220,92) |
152,63±19,53 (113,57-191,69) |
378,91±40,85 (297,21-460,62) *# |
88,71±16,29 (56,13-121,29) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з Пс; # – р <0,05 при порівнянні з групою пацієнтів з ГХ.
Отримані дані свідчили про те, що у пацієнтів основної групи реєструвалися найвищі показники серотоніну, а щодо груп порівняння, різниця становила 119,65 % і 238,34 % (р<0,05) для пацієнтів із Пс і ГХ, відповідно. У той же час, хворі на Пс групи порівняння мали значно вищі цифри серотоніну відносно пацієнтів другої групи порівняння, з ГХ (35,08 %). Отже, можна зробити висновок, що при наявності коморбідної патології сироватковий рівень серотоніну в цілому значно вищий.
Аналіз рівня досліджуваного показника в обстежених осіб залежно від тривалості ГХ показано в табл. 5.12.
Відносно серотоніну і тривалості ГХ отримано такі результати: при прогресуванні ГХ у групі порівняння при наявності її більше 5 років рівень серотоніну прогресивно зростав, маючи різницю в 47,22 % (р<0,05). Та в разі поєднаної патології ГХ і Пс рівень серотоніну, навпаки, знижувався зі збільшенням тривалості захворювання більше 5 років на 42,12 % (р<0,05), демонструючи посилене зворотне захоплення і депонування серотоніну у відповідних депо – при приєднанні ГХ до дерматозу, формуючи відносний дефіцит даного біологічно активного аміну в разі тривалого перебігу патології шкіри.
Таблиця 5.12 – Вміст серотоніну сироватки крові у хворих другої та третьої групи залежно від тривалості ГХ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість ГХ до 5 років | Тривалість ГХ більше 5 років | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Серотонін, нг/мл | 108,95±14,93(79,09-138,8)* | 188,23±31,98(124,26-252,19) | 152,63±19,53(113,57-191,69) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Серотонін, нг/мл | 411,95±49,18(313,59-510,31)* | 279,81±49,09(181,62-377,99) | 378,91±40,85(297,21-460,62) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з тривалістю захворювання до 5 років.
Результати вивчення вмісту серотоніну в групах пацієнтів, які страждали на Пс, залежно від зростання терміну хвороби подано в таблиці 5.13.
Таблиця 5.13 – Вміст серотоніну сироватки крові у хворих першої та третьої групи залежно від тривалості Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Тривалість Пс до 5 років | Тривалість Пс більше 5 років | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| Серотонін, нг/мл | 173,94±13,9(146,15-201,73) | 271,42±49,94(171,55-371,3)* | 189,33±15,79(157,75-220,92) |
| Хворі на Пс у поєднанні із ГХ (n=80) | |||
| Серотонін, нг/мл | 321±56,43(208,15-433,85) | 392,28±48,64(295-489,56) | 378,91±40,85(297,21-460,62) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з тривалістю захворювання до 5 років.
З таблиці видно, що відзначалося неухильне зростання даного маркера як при наявності лише Пс, так і при поєднанні Пс і ГХ на 56,04 % і 22,21 % (р<0,05) відповідно при зростанні терміну дерматозу понад 5 років, що може свідчити про надмірну потребу в серотоніні у хворих при тривалому перебігу Пс.
Кількісні значення нейротрансмітера на тлі зростання маси тіла наведено в табл. 5.14. Як видно з таблиці 5.14, зростання маси тіла при дерматозі в групі порівняння сприяло підвищенню рівня серотоніну і ніяк не впливала на даний маркер при наявності коморбідності, а ось ожиріння на тлі ГХ спричиняло значний дефіцит цього ключового нейропептиду в організмі обстежених.
Таблиця 5.14 – Вміст серотоніну сироватки крові у хворих залежно від ІМТ (М ± m, 95 % – довірчий інтервал)
| Показник,
Од. виміру |
Категорії пацієнтів | ||
| ІМТ до 30 кг/м2 | ІМТ более 30 кг/м2 | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Серотонін, нг/мл | 204,91±33,35(138,2-271,62) | 98,17±12,78(72,6-123,74)* | 152,63±19,53(113,57-191,69) |
| Хворі на Пс (n=34) | |||
| Серотонін, нг/мл | 139,81±30,69(58,44-201,18) | 198,62±16,66(165,29-231,95)* | 189,33±15,79(157,75-220,92) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Серотонін, нг/мл | 389,21±56,62(195,97-582,46) | 375,48±46,71(282,06-468,9) | 378,91±40,85(297,21-460,62) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з ІМТ до 30 кг/м2.
Відображення рівня серотоніну залежно від статі продемонстровано в табл. 5.15.
Серотонін у групі порівняння з ГХ був істотно вище у жінок (на 26,56 %) відносно чоловіків, у групі порівняння на Пс цей біогенний амін зберігав незначну аналогічну динаміку, при поєднанні Пс і ГХ серотонін був більше у чоловіків – на 26,93 %. Дефіцитарний стан щодо серотоніну більш характерний для чоловіків, ніж для жінок у разі наявності лише дерматозу, ще більший дефіцит спостерігався в групі порівняння з ГХ. У той же час, поєднана патологія спричиняла нестачу серотоніну саме у жіночої статі і саме у жінок з поєднаною патологією спостерігалося формування тяжких, системних форм дерматозу.
Таблиця 5.15 – Рівень серотоніну сироватки крові в обстежених осіб залежно від статі (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | |||
| Чоловіки | Жінки | В цілому по групі | ||
| Хворі на ГХ (n=30) | ||||
| Серотонін, нг/мл | 127,71±25,11(77,5-177,92) | 161,63±25,01(111,62-211,64) | 152,63±19,53(113,57-191,69) | |
| Хворі на Пс (n=34) | ||||
| Серотонін, нг/мл | 180,22±21,53(137,16-223,27) | 194,65±22,18(150,29-239,01) | 189,33±15,79(157,75-220,92) | |
| Хворі на Пс у поєднанні з ГХ (n=80) | ||||
| Серотонін, нг/мл | 421,47±47,18(327,11-515,84) | 307,98±71,16(165,65-450,31) | 378,91±40,85(297,21-460,62) | |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів чоловічої статі.
Вміст серотоніну в обстежених осіб залежно від ступеня АГ наведено в таблиці 5.16.
Таблиця 5.16 – Вміст серотоніну сироватки крові у хворих залежно від ступеня АГ (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| 1-2 ступінь АГ | 3 ступінь АГ | В цілому по групі | |
| Хворі на ГХ (n=30) | |||
| Серотонін, нг/мл | 150,35±24,15(102,05-198,65) | 159,66±30,08(99,5-219,83) | 189,33±15,79(157,75-220,92) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Серотонін, нг/мл | 228,27±2,17(223,93-232,61) | 413,68±45,06(323,56-503,8)* | 378,91±40,85(297,21-460,62) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів з 1-2 ступенем АГ.
У випадку поєднаної патології рівень серотоніну при 3 ступені АГ, порівняно з пацієнтами з 1-2 ступенем АГ, істотно збільшувався, на 81,22 % (р<0,05), відповідно тяжкість самої по собі гіпертензії не впливала на рівень даного біогенного аміну, а коморбідна патологія і більш високі цифри АТ призводили до підвищення вищевказаного маркера.
При дослідженні рівня серотоніну у пацієнтів різних вікових груп встановлено, що достовірної залежності рівня серотоніну від віку не визначено.
Було оцінено також рівень активності серотоніну залежно від типу Пс (див. табл. 5.17).
Таблиця 5.17 – Вміст серотоніну сироватки крові у хворих на Пс залежно від типу (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Зимовий тип Пс | Літній тип Пс | Недиференційова-ний тип Пс | |
| 1 | 2 | 3 | |
| Хворі на Пс (n=34) | |||
| Серотонін, нг/мл | 180,95±17,54(145,87-216,03) | 145,16±41,49(62,19-228,14) | 219,04±30,93(157,19-280,89) # |
| Хворі на Пс у поєднанні із ГХ (n=80) | |||
| Серотонін, нг/мл | 314,05±70,87(172,31-455,78) | 568,88±52,3(464,29-673,48)* | 353,1±47,64(257,82-448,38) # |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів із зимовим типом; # – р <0,05 при порівнянні з літнім типом.
З таблиці видно, що відзначалося неухильне зростання даного маркера при наявності лише Пс при недиференційованому типі, різниця відносно літнього і зимового типу Пс склала 33,73 % і 17,39 % (р<0,05) відповідно. При наявності коморбідної патології літній тип випереджав зимовий за рівнем даного біогенного аміну на 81,14 % (р<0,05), а недиференційований тип – на 61,11 % (р<0,05). Таким чином, якщо у більшості хворих на Пс можна очікувати загострення дерматозу в холодну пору року, а перебування влітку на сонці приводить до покращення стану шкіри, то у пацієнтів з коморбідною патологією визначається майже протилежна ситуація: при потребі Пс в УФ-випромінюванні наявність АГ негативно впливає на стан шкіри пацієнтів при перебуванні на сонці, що потребує індивідуалізованого підходу до терапевтичної корекції цієї категорії пацієнтів.
Сироваткові значення серотоніну у пацієнтів залежно від форми Пс наведено в таблиці 5.18.
Таблиця 5.18 – Вміст серотоніну сироватки крові у хворих на Пс залежно від форми (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Пс вульгарний бляшковий / краплеподібний / інтертригінозний | Пс вульгарний бляшковий з явищами ексудації | Пс еритродермічний/ артропатичний / пустульозний | |
| Хворі на Пс (п=34) | |||
| Серотонін, нг/мл | 194,03±22,24(149,54-238,51) | 180,12±36,19(107,73-252,5) | 182,17±30,85(120,48-243,86) |
| Хворі на Пс в поєднанні з ГХ (п=80) | |||
| Серотонін, нг/мл | 309,50±112,44(204,19-653,95) | 355,51±104,09(147,34-563,68) | 372,6±50,64(271,32-473,87) |
Примітка. * – р <0,05 при порівнянні з 1 підгрупою; # – р <0,05 при порівнянні з 2 підгрупою.
Хоча в цілому визначалося статистично достовірне переважання рівнів серотоніну в групі хворих на коморбідну патологію порівняно з пацієнтами, які страждали лише на Пс, слід відзначити, що в самій основній групі показники серотоніну дуже неоднорідні. При аналізі форми і перебігу дерматозу у хворих на коморбідну патологію з рівнем серотоніну до 100 і понад 100 нг/мл виявлено таку картину: у пацієнтів з рівнем серотоніну вище 100 нг/мл у середньому спостерігалися високі цифри досліджуваного показника ([347,95 ± 73,12] нг/мл), серед пацієнтів цієї групи визначалися всі клінічні форми дерматозу, але у всіх них спостерігався класичний перебіг захворювання з адекватною реакцією на проведення терапії. Слід зазначити, що у більшості пацієнтів цієї групи виявлено кореляційний взаємозв’язок з підвищенням рівня VEGF-А, каспази‑8, гомоцистеїну. Друга група хворих на Пс у поєднанні з ГХ, але рівнем серотоніну менше 100 нг/мл, де середній показник серотоніну по групі склав 46,01 нг/мл, суттєво відрізнялася за перебігом дерматозу. У цій групі пацієнтів також спостерігалися різні клінічні форми Пс, але у 62,5 % пацієнтів дерматоз був резистентний до терапії, що змушувало призначати більш активну терапію у вигляді цитостатичних препаратів (метотрексату) [41, 65]. У цій групі пацієнтів низький показник серотоніну був пов’язаний з підвищенням рівня кортизолу, що свідчило про стимуляцію механізмів адаптації. Низькі рівні серотоніну корелювали з показниками високої тривоги та депресії (11-21), визначеними за допомогою анкетування. У переважної більшості пацієнтів основної групи з високими показниками серотоніну методом добового вимірювання АТ визначено порушення його циркадного ритму у вигляді недостатнього його зниження у вечірні і нічні години. З зазначеного вище, ця категорія пацієнтів потребує виділення в окрему клініко-терапевтичну групу і призначення терапевтичної корекції, враховуючи метаболізм серотоніну.
Рівень серотоніну сироватки крові в обстежених осіб залежно від стадії Пс подано в таблиці 5.19.
Таблиця 5.19 – Вміст серотоніну сироватки крові у хворих залежно від стадії Пс (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| Стаціонарна стадія Пс | Прогресуюча стадія Пс | В цілому по групі | |
| Хворі на Пс (n=34) | |||
| Серотонін, нг/мл | 150,87±27,36(96,16-205,58) | 199,59±18,1(163,38-235,8) | 189,33±15,79(157,75-220,92) |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Серотонін, нг/мл | 228,27±2,17(223,93-232,61) | 413,68±45,06(323,56-503,8)* | 378,91±40,85(297,21-460,62) |
Примітка. * – р <0,05 при порівнянні з групою пацієнтів зі стаціонарною стадією.
Показник серотоніну був меншим при стаціонарній стадії у групі порівняння на Пс на 32,29 % порівняно з прогресуючою і на 81,22 % (р<0,05) меншим в основній групі, що може орієнтувати на досить сприятливий рівень серотоніну для хворих на Пс – від 130 до 200 нг/мл.
Аналіз вмісту серотоніну залежно від PASI у хворих на Пс подано в табл. 5.20.
Значення рівня серотоніну істотно зростали у хворих на Пс у групі порівняння з PASI ≥ 30, на 48,69 % і 26,44 % (р<0,05), при порівнянні з хворими цієї ж групи та PASI ≤ 10 і 10-30, різниця двох останніх груп становила 43,37 % (р<0,05) на користь останньої. В основній групі на тлі поєднаної патології збільшення PASI від 10 до 10-30 демонструвало зростання даного метаболіту на 32,28 % (р<0,05), зростання PASI від 10-30 до цифр понад 30 призводило до збільшення серотоніну на 45,50 % (р<0,05); групи з коморбідною патологією та PASI до 10 і понад 30 мали відмінності на рівні 58,80 % (р<0,05).
Таблиця 5.20 – Вміст серотоніну сироватки крові у хворих на Пс залежно від показника PASI (М ± m, 95 % – довірчий інтервал)
| Показник,
од. виміру |
Категорії пацієнтів | ||
| PASI ≤ 10 | PASI 10-30 | PASI ≥30 | |
| 1 | 2 | 3 | |
| Хворі на Пс (n=34) | |||
| Серотонін, нг/мл | 130,11±18,45(93,2-167,02) | 186,54±17,8(150,94-222,13)* | 253,59±29,54(194,52-312,66) * # |
| Хворі на Пс у поєднанні з ГХ (n=80) | |||
| Серотонін, нг/мл | 230,69±1,9(226,89-234,5) | 305,16±33,54(238,09-372,24)* | 559,88±25,44(509-610,75) * # |
Примітка. * – р <0,05 при порівнянні з хворими з індексом PASI менше 10; # – р <0,05 при порівнянні з хворими з індексом PASI в діапазоні 10-30.
Максимальний рівень серотоніну визначався при зростанні PASI від 10 до 30 і вище, при наявності у пацієнтів поєднаної патології, що відображає зростання тяжкості системного запального процесу і особливості відповіді організму на коморбідний стан у поєднанні з тяжкими формами дерматозу. Знову ж таки, з цієї таблиці видно, що найбільш сприятливим рівнем серотоніну для хворих є від 130 до 200 нг/мл.
Якщо розподілити всіх пацієнтів з Пс на квартилі згідно зі вмістом серотоніну (рис. 5.1), з’ясується, що в осіб з найменшим рівнем серотоніну (I квартиль) (менше 100 нг/мл) реєструвалося істотне погіршення клінічної картини, зниження ЯЖ при зростанні рівня досліджуваного маркера, що характеризувалося достовірним підвищенням PASI і DLQI, асоційоване з елевацією TNF-α. Як видно з наведеної діаграми (рис. 5.1), рівень життєвої незадоволеності через проблеми ураження шкіри прогресивно зростав від 1 до 4 квартиля (Q25-Q75) показника серотоніну сироватки. Аналогічна динаміка реєструвалася і в параметра, який відображає поширеність патологічного процесу (PASI). Відомо, що дисбаланс сироваткового рівня серотоніну викликає значні коливання васкулярного тонусу, нейрональної активності та психоемоційного статусу. Ці дані узгоджуються з літературними результатами, де показано, що при ГХ має місце зниження активності серотоніну, що, як правило, вказує на психо-нейрогенний механізм формування АГ, найчастіше в осіб чоловічої статі. Іноді перші ознаки АГ супроводжуються порушенням узгодження аферентних та еферентних шляхів судинної регуляції за участю центрів вищої нервової діяльності і серотонінергічної системи, що відображається в низькій ефективності керованої саморегуляції параметрів ритму серця.
Рисунок 5.1 – Динаміка PASI, DLQI і TNF-α залежно від квартилей рівня
серотоніну у хворих на Пс
Слід зазначити, що дослідження рівня серотоніну проводилось і раніше науковцями. Так, Біловол А.М. (2011 рік) також виявляла підвищення рівня цього маркера в цілому у хворих на Пс й АГ, та в даній роботі вперше проведено розподіл хворих залежно від рівня серотоніну, визначено взаємозв’язок між перебігом, тяжкістю дерматозу і прогностичним значенням падіння рівня серотоніну нижче 130 нг/мл, станом тривоги та депресії, показниками ДМАТ.
Важливо зазначити, що при оцінці ступеня взаємозв’язку між вираженістю емоційних змін згідно з госпітальною шкалою тривоги / депресії та рівнем серотоніну крові виявилося, що залежність мала U-подібну форму, тому коефіцієнт кореляції був низьким (нелінійна асоціація). Також слід підкреслити, що найбільші бали за госпітальною шкалою тривоги та депресії (більше 11) найчастіше мали пацієнти з дуже низьким рівнем серотоніну. Це може свідчити про патогенетичний зв’язок між психоемоційним станом і рівнем серотоніну, необхідність фармакологічної корекції цих порушень і про важливість персоніфікації терапії з урахуванням рівня серотоніну.
5.3 Показники стану нейро-вегетативної регуляції
Вважається, що вегетативні дисфункції з розвитком синдрому вегетативної дистонії супроводжують практично всі захворювання запального, інфекційного, судинного ґенезу та ін. Порушення вегетативного балансу збільшують вірогідність несприятливих і неадекватних реакцій людини на стресові впливи. При цьому адаптаційні можливості організму забезпечуються комплексом гомеостатичних та адаптаційних реакцій, які являють собою результат взаємодії між собою чисельних структур. Безсумнівно, адаптаційні можливості організму залежать від стану механізмів його регуляції. Показана висока інформативність вивчення ВСР для оцінки стресових реакцій серцево-судинної системи та нейро-вегетативної регуляції.
Вивчення стану ВНС проводили у 90 обстежених, серед яких з 1 групи порівняння (хворих лише на Пс) – 30 пацієнтів, з основної групи (Пс і ГХ) – 36 осіб, групу контролю склали 24 практично здорових особи, що були репрезентативні за віком та статтю. Для дослідження вегетативної регуляції серцевої діяльності у пацієнтів вивчали такі показники: SDNN, частотний аналіз ВСР у діапазоні низьких частот (LF), які характеризували рівень активності симпатичної ланки, і високих частот (HF), які відображали рівень активності парасимпатичної ланки. По відношенню LF/HF судили про баланс вегетативних впливів на серцево-судинну систему.
Результати дослідження стану ВНС наведено в табл.5.21.
Таблиця 5.21 – Показники ВСР в групах дослідження (М ± m, 95 % – довірчий інтервал)
| Показник,
од.виміру |
Хворі на Пс
(n=30) |
Хворі на Пс і ГХ
(n=36) |
Контрольна група
(n=24) |
| SDNN, мс | 37,00±2,69 (15-70) | 33,53±1,78 (8-56) | 39,00±2,14 (18-62) |
| RMSSD,мс | 20,70±1,82 (7-47) | 14,06±1,18 (3-41)*# | 26,04±1,76 (9-42) |
| ТР, мс2 | 1536,2±214,47
(223-4758) |
1204,17±117,62
(66-3088)*# |
1588,17±170,83
(323-3736) |
| ІС | 2,92±0,22
(0,84-5,44)* |
10,42±0,89
(3,16-24,41)*# |
2,19±0,26
(0,56-5,46) |
| ПАРС | 4,77±0,37 (2-10) | 6,58±0,39 (2-10)* # | 3,67±0,17 (2-5) |
| VLF, мс2 | 531,10±65,66
(101-1483) |
644,33±70,72
(126-2146)* |
520,00±63,20
(119-1171) |
| LF, мс2 | 444,20±68,19
(30-1650) |
290,17±37,85
(5-1205)* # |
374,09±37,27
(69-792) |
| HF, мс2 | 401,23±57,25
(48-1189)* |
140,56±12,26
(13-300)*# |
526,92±58,15
(124-1195) |
| LF/HF | 1,19±0,10
(0,36-2,74)* |
3,00±0,30
(1,09-9,10) *# |
0,82±0,08
(0,23-2,05) |
Примітка. * – р<0,05 різниця достовірна у порівнянні зі здоровими, # – р<0,05 різниця достовірна між групами хворих на Пс з нормальним та підвищеним АТ.
У ході дослідження ВСР встановлено, що показник RMSSD і показник ТР в групі хворих на Пс у поєднанні з ГХ був достовірно (р˂0,05) більш низьким порівняно зі здоровими, що свідчить про зниження парасимпатичної регуляції. Значне підвищення ІС у хворих з коморбідною патологією (в 4,76 разів по відношенню до контрольної групи і в 3,57 разу у порівнянні з хворими лише на Пс) свідчить про переважання центрального контуру над автономним. Зростання ПАРС в основній групі є одним з показників об’єктивного підтвердження стану тривожності у пацієнтів як основної групи (в 1,79 разу вище при зіставленні з контрольною групою), так і групи порівняння на Пс (різниця з групою контролю – в 1,3 разу), в свою чергу, різниця між хворими на Пс свідчить про негативний вплив приєднання ГХ (зростання ПАРС в 1,38 разу за наявності і відсутності АГ). Показник ПАРС в межах 4-5 лише при Пс свідчить про помірну функціональну напругу ВНС, при поєднанні Пс і ГХ – про виразну напругу. Негативний вплив стану тривожності на ВНС підтверджується також рівнем VLF, який є максимальним при коморбідному стані (більше в 1,24 разу порівняно з контрольною групою) і свідчить про зростання впливу гуморальної ланки регуляції.
Зростання показників LF у хворих на Пс групи порівняння свідчить про переважання тонусу симпатичної нервової системи. Достовірне зниження показника HF при Пс (в 1,31 разу порівняно з контрольною групою) і значне падіння у пацієнтів з Пс і ГХ (в 3,75 разу порівняно з контролем) свідчить про виражений дефіцит вагусного впливу. Показник LF/HF, який свідчить про співвідношення симпатичної і парасимпатичної ланок ВНС свідчить, що у хворих лише на Пс є достовірне переважання тонусу симпатичної нервової системи, а при приєднанні ГХ – ще й зниження тонусу парасимпатичного відділу, що відображає комбіновані порушення центральних механізмів регуляції серцевого ритму [58].
Дослідження залежності показників ВСР від тяжкості дерматозу подано в рис. 5.2.
Рисунок 5.2 – Показники спектральних методів аналізу ВСР у хворих залежно від форми Пс
Як видно з діаграми (рис. 5.2), у хворих на Пс у поєднанні з ГХ у більшості випадків зареєстровано тяжкі форми дерматозу, які корелюють з більш тяжкими змінами вегетативної регуляції.
Таким чином, наявність Пс сприяє порушенню центральних механізмів регуляції серцевого ритму з дисбалансом ВНС у бік переважання симпатичних впливів, які більш виразні при наявності ГХ.
Метод ДМАТ дозволяє вивчати патогенетичні механізми ГХ, оскільки ще в середині ХХ століття вказано на низьку інформативність вимірювання офісного АТ. У 1997 році цей метод дослідження було включено до переліку діагностичних процедур пацієнтів з АГ у рекомендаціях JNC VI, ESH [198]. Перевагою методу ДМАТ є відображення АТ в умовах звичайної життєдіяльності пацієнтів. Середні значення АТ, визначені протягом доби, мають переваги перед оцінкою «офісного» АТ, оскільки максимально виключають суб’єктивний компонент дослідження. Порушення циркадного ритму, які виявлено за допомогою ДМАТ, взаємопов’язані зі змінами з боку органів-мішеней (збільшенням маси міокарда лівого шлуночка, дисфункцією лівого шлуночка, мікроальбумінурією, протеїнурією, вираженістю гіпертензивної ретинопатії). Показники ДМАТ є прогностичними факторами розвитку серцево-судинних подій [87].
Моніторування АТ протягом доби проведено у 59 хворих, серед яких 26 пацієнтів з першої групи порівняння (хворих лише на Пс) і 33 особи з основної групи. Отримані результати наведено в таблиці 5.22.
Таблиця 5.22 – Розподіл хворих згідно зі ступенем нічного зниження АТ
| Група | Хворі на Пс (n=26) | Хворі на Пс і ГХ (n=33) | ||
| абсолютна кількість | % | абсолютна кількість | % | |
| Dipper | 11 | 42,3 | 12 | 36,4 |
| Non-dipper | 9 | 34,6 | 12 | 36,4 |
| Over-dipper | – | – | 1 | 3,0 |
| night-peaker | 6 | 23,1 | 8 | 24,2 |
Серед 59 пацієнтів, які обстежені методом ДМАТ, 32 чоловіки та 27 жінок. За результатами цього дослідження виявлено, що у хворих на Пс, як з нормальним, так і з підвищеним АТ, є порушення його циркадного ритму. У популяції в цілому найбільш фізіологічною є група «dipper», недостатнє зниження АТ вночі зазвичай супроводжується більш частим ураженням органів-мішеней, наслідком чого є гіпертрофія міокарда, серцева, ниркова недостатність, ретинопатія, гломерулосклероз та ін. [87]. У проведеному дослідженні виявлено, що переважаюча кількість хворих на Пс мала порушення циркадного ритму АТ у вигляді недостатнього його зниження у вечірні та нічні години, загальна кількість таких хворих становила 57,7 % (15 випадків) у першій групі та 63,6 % (21 пацієнт) у третій групі, основній. При цьому у 3 хворих на Пс при традиційному, офісному вимірюванні АТ АГ не було виявлено, рівень його становив 140/90 мм рт.ст, підвищений рівень було виявлено лише при проведенні добового моніторування. У всіх обстежених хворих визначено взаємозв’язок між приналежністю до групи зниження АТ і формою Пс. Розподіл хворих по групах згідно з клінічними формами дерматозу наведено в таблиці 5.23.
Таблиця 5.23 – Розподіл пацієнтів по групах згідно з клінічними формами Пс
| Форма Пс | Хворі на Пс (п=26) | Хворі на Пс і ГХ (п=33) | ||
| абсолютна кількість | % | абсолютна кількість | % | |
| Вульгарний бляшковий | 18 | 69,3 % | 15 | 45,4 % |
| Вульгарний з явищами ексудації | 3 | 11,5 % | 6 | 18,2 % |
| Артропатичний | 3 | 11,5 % | 9 | 27,3 % |
| Еритродермія, пустульозний | 2 | 7,7 % | 3 | 9,1 % |
У результаті виявлено, що пацієнти з нормальним для більшості населення типом зниження АТ («dipper») представлені більш легкими формами Пс (вульгарним бляшковим). Хворі з патологічним зниженням АТ (категорії «non-dipper», «night-peaker» та «over-dipper») представлені більш тяжкими формами дерматозу (вульгарним бляшковим з явищами ексудації, де PASI>30 і DLQI>10, артропатичним, пустульозним, еритродермією) [47]. Крім того, у ¾ пацієнтів цієї групи виявлено високі, більше 200 нг/мл, рівні серотоніну.
Залежність тяжкості перебігу Пс від патологічного типу зниження АТ не є абсолютною, але однозначно ця тенденція простежувалася. Так, у групі з коморбідністю більшість пацієнтів категорії «dipper» – 9 випадків (75 %), представлена вульгарним бляшковим Пс, лише у 3 хворих визначено тяжкі форми (артропатичний, пустульозний, еритродермія). У групах категорії «non-dipper», «night-peaker» та «over-dipper» відсоток пацієнтів з вульгарним бляшковим Пс становив від 25 % (у групі «non-dipper») до 50 % (у групі «night-peaker»), а більшість хворих (75 % та 50 % відповідно) і 1 пацієнтка в групі «over-dipper» представлені тяжкими формами Пс.
Таким чином, можна простежити взаємозв’язок між ступенем тяжкості дерматозу і порушенням добового профілю у хворих, які страждають на Пс. Зміни АТ у нічний час залежать від активності ряду нейрогуморальних систем. Так, у повільну фазу сну зниження АТ обумовлено ослабленням симпатичного компонента регуляції за рахунок циркулюючих катехоламінів. У нічний час знижується чутливість барорецепторів, що також призводить до зниження АТ.
У пацієнтів з типом добового профілю «non-dipper» і «night-peaker» частіше виявляють зміни з боку артерій дрібного калібру, діастолічну дисфункцію лівого шлуночка, атеросклеротичне ураження сонних артерій, реєструється більш висока смертність від інфаркту міокарда.
З наведеного вище можна зробити висновок, що в цілому у хворих на Пс є дисбаланс ВНС у бік збільшення тонусу симпатичної нервової системи. При наявності у хворих на Пс супутньої ГХ відсоток пацієнтів з переважанням симпатичного тонусу зростав, що виражалося найбільшим відсотком патологічних форм добового зниження АТ (63,6 %), це супроводжувалося розвитком тяжких форм дерматозу у 54,6 % хворих. Крім того, слід підкреслити, що ці порушення неможливо було б виявити без допомоги ДМАТ, у зв’язку з чим слід рекомендувати використання цього методу у хворих на Пс для більш якісного визначення справжнього стану тонусу судин.
* * *
Отримані результати свідчать, що приєднання ГХ до Пс призводить до підвищення інсуліну, зниження рівня кортизолу, тобто, зниження КІІ, що є показником значного порушення в системі адаптації.
Наявність надлишкової ваги, чоловіча стать, 3-й ступінь АГ – фактори, які сприяють підвищенню рівня кортизолу. Високі рівні інсуліну визначено при збільшенні ІМТ, у хворих жіночої статі. Виявлено, що найвищі рівні кортизолу встановлено при вульгарній бляшковій формі з явищами ексудації як у групі порівняння, так і в основній групі. Значне зниження інсуліну відзначено при тяжких формах Пс в обох групах. Літній і зимовий типи Пс мають найвищі показники кортизолу, а найвищі рівні інсуліну при наявності коморбідності має зимовий тип.
Таким чином, падіння рівня кортизолу і підвищення інсуліну збігаються з тяжкими формами Пс, що формується в перші ж роки існування коморбідної патології. Наявність у чоловіків меншої кількості артропатичних форм і значна частка вульгарного Пс з явищами ексудації свідчать про більш високий потенціал до адаптації порівняно з жінками основної групи, які є більш стресовою частиною хворих на коморбідну патологію, тому й формують тяжку, системну форму ураження – артропатичну.
Динаміка регуляторів вуглеводного обміну у хворих на Пс тісно пов’язана з наявністю супутньої ГХ, площею ураження шкіри. Приєднання ГХ до дерматозу, зростання тяжкості дерматозу, що маніфестується високим показником PASI, асоціюється з високими значеннями кортизолу та інсуліну. На жаль, показник PASI не завжди є інформативним у хворих на артропатичний Пс, чим і пояснюється зворотний зв’язок між рівнем кортизолу та індексом PASI у деяких хворих на тяжкий Пс. Високий рівень інсуліну в групах з тяжким перебігом дерматозу при коморбідній патології формує також фон для порушення толерантності до глюкози у таких пацієнтів і розвитку більш тяжких системних ускладнень на тлі гіперглікемії.
Приєднання ГХ до Пс призводило до підвищення рівня сироваткового серотоніну. У той же час, у осіб основної групи, які водночас страждали на Пс і ГХ, при виявленні найменшого рівня серотоніну (менше 100 нг/мл) реєструвалося більш істотне погіршення клінічної картини, зниження ЯЖ при зростанні рівня ключового цитокіну імунологічного каскаду TNF-α, що характеризувалося достовірним підвищенням PASI і DLQI. Перебіг дерматозу у пацієнтів цієї підгрупи знаменувався формуванням резистентних до терапії форм, саме у цієї категорії хворих відзначалися високі рівні кортизолу та інсуліну на тлі зниження рівня серотоніну. При зростанні цифр серотоніну вище 200 нг/мл знов таки відзначено зростання кількості тяжких форм Пс.
Шляхом порівняння рівня серотоніну при різних формах, стадіях і типах Пс як у групах порівняння, так і в основній групі встановлено, що найбільш оптимальним для сприятливого його перебігу, зокрема при наявності супутньої ГХ, є цифри від 130 до 200 нг/мл. Зменшення або збільшення цих показників є прогностично несприятливим.
У ході визначення стану ВНС методом дослідження ВСР виявлено, що в обох групах хворих на Пс спостерігалося збільшення тонусу симпатичної нервової системи, а у пацієнтів з Пс і супутньою ГХ додатково спостерігалося зниження тонусу парасимпатичного відділу.
За результатами ДМАТ виявлено, що переважаюча кількість хворих (63,6 %) на Пс і ГХ мала порушення циркадного ритму у вигляді недостатнього його зниження вночі. Це свідчить про наявність симпатикотонії, особливо у вечірні та нічні години, у переважної кількості хворих на коморбідну патологію. Метод ДМАТ слід рекомендувати більш широко використовувати хворим на Пс для об’єктивного, своєчасного визначення стану АТ, профілактики розвитку ускладнень ГХ або контролю за якістю терапії.
Матеріали даного розділу опубліковано в таких роботах:
[36, 37, 40, 41, 47, 48, 58, 65, 67, 409]
РОЗДІЛ 6
ПАТОМОРФОЛОГІЧНІ ТА ІМУНОГІСТОХІМІЧНІ АСПЕКТИ ПОЄДНАННЯ ПСОРІАЗУ І ГІПЕРТОНІЧНОЇ ХВОРОБИ
Пс, як і ГХ, є системним процесом, ураженням різних систем і органів, а шкіра віддзеркалює стан організму в цілому і морфологічні ознаки є переломленням досліджених у попередніх розділах патофізіологічних процесів. Крім того, дотепер не проводилося ані патоморфологічного дослідження шкіри саме у хворих на Пс на тлі супутньої ГХ, ані імуногістохімічного дослідження участі NOS і безпосередньо індуцибельної її форми у розвитку і формуванні осередків ураження шкіри.
Метою патоморфологічного дослідження було визначення характеру та ступеня порушень в епідермально-дермальному з’єднанні, дермі, вивчення стану мікроциркуляторного русла як в осередках ураженої шкіри, так і на візуально здорових контрлатеральних ділянках з використанням морфометричних методів.
6.1 Стан епідермісу та епідермально-дермального з’єднання
Морфологічне дослідження стану шкіри осіб похилого віку в контрольній групі виявило типові інволютивні зміни епідермісу. Зокрема, епідерміс на поверхні згладжених сосочків був нерівномірно стоншеним. Максимальна загальна товщина базального, остистого та зернистого шарів становила (41,7 ± 5,1) мкм, мінімальна – (26,3 ± 3,6) мкм. У локусах стоншення (над верхівками сосочків) співвідношення клітин по шарах епідермісу залишалося без патологічних ознак (рис. 6.1 А).
Проліферативна активність епітеліоцитів гермінативної зони була невисокою: величина МІ дорівнювала (1,17 ± 0,16) %, фігури апоптозу виявлялися без істотних порушень. Спостерігалася обмежена синтетична активність базальних кератиноцитів з незміненими ядрами. Шипуваті кератиноцити нормальної форми складали від 4 до 7 рядів. Клітини зернистого шару мали типову ромбовидну або полігональну форму, в ділянці складок формуючи потовщення до 8-9 рядів. Кількість кератиносом була невеликою. Роговий шар виявлявся значно стоншеним, корнеоцити групувалися у фрагменти нерівномірної товщини. Базальна мембрана епідермісу була без патологічних змін і мала згладжений контур. Проявів акантозу, паракератозу та кератогіалінозу не спостерігалося (рис. 6.1 Б).
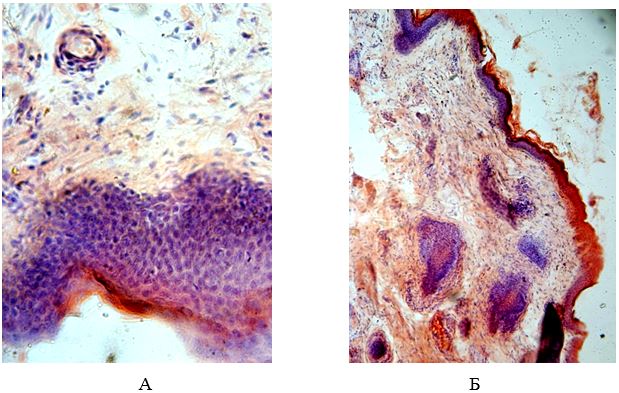
Рисунок 6.1 – А – стан епідермісу шкіри передпліччя чоловіка контрольної
групи віком 59 років. Забарвлення за Вейгертом. ×400. Б – тотальний гістологічний зріз шкіри передпліччя жінки контрольної групи віком 63 роки. Забарвлення за Ван-Гізоном. ×100.
У хворих на Пс у прогресуючій стадії захворювання патоморфологічні зміни епідермісу у псоріатично ушкоджених ділянках суттєво перебільшували за своєю інтенсивністю інволютивні перебудови шкіри в осіб контрольної групи і помітно відрізнялись від змін, що спостерігалися в неушкоджених контрлатеральних ділянках.
У біоптатах псоріатично ушкодженої шкіри спостерігалися ознаки гіпер- і паракератозу, акантоз і дистрофія клітин гермінативної зони, папіломатозна гіперплазія епідермісу. Характерним було чергування груп видовжених вузьких сосочків із сосочками згладженої конфігурації, що свідчило про поєднання загальних інволютивних перебудов зі специфічними соріатичними змінами (рис. 6.2 А). Базальні мембрани епідермісу зазнавали набряку, потовщення, фрагментації. Над верхівками високих дермальних сосочків виявлялися ознаки розшарування і відшарування епідермісу від базальної мембрани, в окремих випадках – їх повне оголення. Також у складі епідермісу псоріатично ушкоджених ділянок спостерігалися дрібноосередкові зони транссудації, помірної лейкоцитарної інфільтрації, еритродіапедезу і крововиливів (рис. 6.2 Б). Збільшені за розмірами епідермоцити базального, шипуватого і зернистого шарів набували зміненої полігональної форми внаслідок міжклітинного і внутрішньоклітинного набряку і часто містили пікноформні ядра в оточенні зони перинуклеарного спустошення цитоплазми.
Рисунок 6.2 – А – тотальний гістологічний зріз ушкодженої ділянки шкіри
плеча хворої на Пс віком 62 роки. Забарвлення конго червоним за Матсуура. ×150. Б – стан епідермісу ушкодженої ділянки шкіри передпліччя хворої на Пс віком 72 роки. Забарвлення за Масоном. ×400.
На відміну від псоріатично ушкоджених ділянок шкіри, морфологічна картина епідермісу клінічно незміненої шкіри контрлатеральних ділянок у хворих на Пс істотним чином не відрізнялася від цитоархітектоніки епідермісу в контрольній групі, віддзеркалюючи загальні інволютивні зміни шкіри пацієнтів похилого віку (рис. 6.3). Це свідчило про локальний характер суттєвих патоморфологічних перетворень будови епідермісу, що розвивалися лише в ділянках утворення елементів висипу при прогресуючій стадії Пс.
Рисунок 6.3 – А – стан епідермісу неушкодженої ділянки шкіри плеча хворої на Пс віком 62 роки. Забарвлення за Маллорі-Слінченком. ×400. Б – стан епідермісу неушкодженої ділянки шкіри передпліччя хворої на Пс віком 72 роки. Забарвлення конго червоним за Матсуура. ×400.
Морфологічний аналіз шкіри у хворих на ГХ показав, що структура епідермісу і проліферативна активність кератиноцитів загалом відповідали віковій нормі, яка спостерігалася в осіб похилого віку контрольної групи (рис. 6.4). Слід особливо підкреслити, відсутність суттєвих відрізнень дозволяє припустити, що наявність ГХ безпосередньо не впливає на будову епітеліального компоненту шкіри.
У хворих на Пс у прогресуючій стадії на тлі ГХ у псоріатично ушкоджених ділянках шкіри патоморфогенез епідермісу різко відрізнявся від спектру інволютивних змін у осіб контрольної групи і значно перевищував ступінь порушень шкіри у хворих на Пс без ГХ.
Рисунок 6.4 – А – стан епідермісу шкіри передпліччя хворого на ГХ віком 60 років. Забарвлення за Масоном. ×400. Б – стан епідермісу шкіри передпліччя хворої на ГХ віком 65 років. Забарвлення конго червоним за Матсуура. ×400.
Зокрема, у всіх хворих даного контингенту виявлялися ознаки значної гіперплазії і дистрофії кератиноцитів з акантолізом і деструкцією епідермально-дермального з’єднання, прояви гіпер- і паракератозу рогового шару у міжсосочкових просторах, атрофія клітин гермінативної зони, папіломатозна гіперплазія епідермісу. Набряклі епідермоцити базального, шипуватого і зернистого шарів були деформованими, вакуолізованими. Ядра епітеліоцитів мали ознаки пікнозу, каріорексису. Рельєф поверхні сосочків мав гетероморфний характер і містив фрагментовану, набряклу, потовщену, розпушену базальну мембрану (рис. 6.5 А). Спостерігалося відшарування епідермісу з оголенням верхівок багатьох сосочків (рис. 6.5 Б). Розшарування рогового шару і гермінативної зони епідермісу псоріатично ушкоджених ділянок було пов’язано з накопиченням значних за площею осередків транссудації, лейкоцитарної інфільтрації, еритродіапедезу, крововиливів, мікроабсцесів Мунро, фрагментів некротизованих кератиноцитів.
Рисунок 6.5 – А – стан епідермісу ушкодженої ділянки шкіри плеча хворого на Пс і ГХ віком 59 років. Забарвлення конго червоним за Матсуура. ×400. Б – тотальний гістологічний зріз ушкодженої ділянки шкіри передпліччя хворої на Пс і ГХ віком 60 років. Забарвлення за Ван-Гізоном. ×200.
Морфологічне дослідження стану епідермісу у клінічно незмінених контрлатеральних ділянках шкіри хворих на Пс і ГХ не виявило значних порушень загальної структури і тинкторіальних властивостей епідермоцитів (рис. 6.6), що свідчило про відсутність системного характеру патоморфогенезу у складі епітеліального компонента шкіри за умов поєднання активного псоріатичного процесу з ГХ.
За результатами кількісного морфологічного дослідження в ушкоджених ділянках шкіри хворих на Пс спостерігалося істотне підвищення МІ кератиноцитів (на 42,7 %; p < 0,05) порівняно з контрольними значеннями, в той час як у відповідній за локалізацією ділянці візуально незміненої шкіри проліферативна активність епідермісу не відрізнялася від значень вікової норми (табл. 6.1).
Рисунок 6.6 – А – тотальний гістологічний зріз неушкодженої ділянки шкіри плеча хворого на Пс і ГХ віком 59 років. Забарвлення конго червоним за Матсуура. ×150. Б – стан епідермісу неушкодженої ділянки шкіри передпліччя хворої на Пс і ГХ віком 60 років. Забарвлення за Масоном. ×600.
Таблиця 6.1 – Мітотичний індекс кератиноцитів, % (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 1,17 ± 0,16 | |
| Пс (n=20) | Ушкоджена ділянка | 1,67 ± 0,19 * ^ |
| Контрлатеральна ділянка | 1,06 ± 0,23 # | |
| ГХ (n=10) | 1,22 ± 0,15 # | |
| Пс+ГХ (n=18) | Ушкоджена ділянка | 1,94 ± 0,26 * ^ |
| Контрлатеральна ділянка | 1,13 ± 0,20 # | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність порівняно з хворими на Пс (p < 0,05); ^ – значуща відмінність порівняно з хворими на ГХ (p < 0,05).
У хворих на ГХ гіперплазії епітеліальних клітин не виявлялося. Найвищі значення МІ кератиноцитів відзначалися в патологічно змінених ділянках шкіри, особливо в зонах папіломатозної гіперплазії, у хворих при поєднанні ГХ з Пс у прогресуючій стадії: порівняно з групою контролю на Пс мітотична активність переважала над контрольним рівнем на 65,8 % (p < 0,05), порівняно з рівнем у групі хворих на ГХ – на 59,0 % (p < 0,05). У хворих на Пс і ГХ у контрлатеральній ділянці незміненої шкіри проліферація кератиноцитів вірогідно не відрізнялася від контрольних значень, що свідчило про локальний характер гіперплазії епідермісу ушкоджених ділянок.
При кількісному аналізі чисельної щільності ядер кератиноцитів, що відображає загальну цитоархітектоніку гермінативної зони епідермісу, порівняно з групою контролю виявлялося суттєве зниження (на 35,7 %; p < 0,05) параметра в ушкоджених ділянках шкіри поряд з явищами внутрішньо- і міжклітинного набряку. У контрлатеральних ділянках незміненої шкіри даних хворих, а також у пацієнтів з ГХ щільність ядер епідермоцитів залишалась у межах вікової норми (табл. 6.2).
У хворих з поєднаною патологією (Пс + ГХ) чисельна щільність епідермальних ядер в ушкодженій ділянці шкіри більш ніж дворазово поступалася контрольному рівню. Це обумовлено, з одного боку, збільшенням розмірів епітеліоцитів базального, остистого та зернистого шарів за рахунок внутрішньоклітинного набряку, з іншого боку – утворенням численних локусів міжклітинного набряку і розшаруванням епідермісу. Крім того, поблизу верхівок сосочків часто зустрічались осередки еритродіапедезу та крововиливів з лімфоїдною інфільтрацією або утворенням мікроабсцесів Мунро. На увагу заслуговує той факт, що у хворих на Пс і ГХ патологічні зміни досліджуваного параметра значуще перевищували аналогічні зміни у хворих на Пс без ГХ.
Таблиця 6.2 – Чисельна щільність ядер кератиноцитів, 103×мм-2 (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 1,12±0,14 | |
| Пс (n=20) | Ушкоджена ділянка | 0,72 ± 0,13 * ^ |
| Контрлатеральна ділянка | 1,09 ± 0,18 # | |
| ГХ (n=10) | 1,22 ± 0,15 # | |
| Пс+ГХ (n=18) | Ушкоджена ділянка | 0,52 ± 0,08 * # ^ |
| Контрлатеральна ділянка | 1,06 ± 0,17 # | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність від значень ушкодженої ділянки шкіри групи хворих на Пс (p < 0,05); ^ – значуща відмінність від значень групи хворих на ГХ (p < 0,05).
Кількісне визначення максимальної та мінімальної товщини гермінативної зони епідермісу (базального, остистого та зернистого шарів) дозволило з’ясувати варіабельність впливу псоріатичного процесу, ГХ та їх поєднання на патоморфогенез порушень епітеліального компоненту шкіри хворих (табл. 6.3, 6.4).
Таблиця 6.3 – Максимальна загальна товщина базального, остистого та зернистого шарів епідермісу, мкм (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 41,7 ± 5,1 | |
| Пс (n=20) | Ушкоджена ділянка | 85,7 ± 10,4 * ^ |
| Контрлатеральна ділянка | 45,4 ± 6,0 # | |
| ГХ (n=10) | 38,1 ± 4,5 # | |
| Пс + ГХ (n=18) | Ушкоджена ділянка | 135,3 ± 12,6 * # ^ |
| Контрлатеральна ділянка | 44,9 ± 6,3 # | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність від значень ушкодженої ділянки шкіри групи хворих на Пс (p < 0,05); ^ – значуща відмінність від значень групи хворих на ГХ (p < 0,05).
Таблиця 6.4 – Мінімальна загальна товщина базального, остистого та зернистого шарів епідермісу, мкм (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 26,3 ± 3,6 | |
| Пс (n=20) | Ушкоджена ділянка | 45,3 ± 5,1 * ^ |
| Контрлатеральна ділянка | 25,8 ± 3,9 # | |
| ГХ (n=10) | 23,4 ± 2,8 # | |
| Пс + ГХ (n=18) | Ушкоджена ділянка | 44,1 ± 5,0 * ^ |
| Контрлатеральна ділянка | 21,3 ± 2,5 # | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність від значень ушкодженої ділянки шкіри групи хворих на Пс (p < 0,05); ^ – значуща відмінність від значень групи хворих на ГХ (p < 0,05).
Зокрема, у хворих на Пс без ГХ спостерігалося значне збільшення максимальної товщини епідермісу в ушкоджених ділянках шкіри (на 105,5 %; p < 0,05). Поєднання Пс і ГХ призводило до ще більш різкого і значущого зростання параметра – у 3,2 разу. В той же час, у морфологічно незмінених ділянках шкіри товщина гермінативної зони епідермісу вірогідно не відрізнялася від контрольних значень, що підтверджувало локальний характер гіперплазії епідермісу в активній стадії Пс.
За результатами морфометрії, мінімальна загальна товщина базального, остистого та зернистого шарів епідермісу, що вимірювалася над верхівками розвинутих сосочків, у хворих на Пс в ушкоджених ділянках шкіри перевищувала контрольні значення на 72,2 % (p < 0,05), проте гермінативна зона була розшарованою, насиченою осередками рідини ексудатів і транссудатів, а також дрібними крововиливами. псоріатично ушкоджена шкіра пацієнтів на тлі ГХ також містила гермінативну зону епідермісу, що за товщиною на 67,7 % (p < 0,05) перебільшувала контрольний показник, але ступінь розшарування епітеліальних клітин був помітно вищим, ніж у хворих на Пс без ГХ, а вміст функціонально активних кератиноцитів, навпаки, значно меншим. Зміни параметра у складі морфологічно незміненої шкіри пацієнтів досліджуваних клінічних груп не мали статистично достовірного характеру відносно групи вікової норми.
Отже, перифокальна гіперплазія і дистрофія кератиноцитів з акантолізом і деструкцією епідермально-дермального з’єднання, включаючи фрагментацію базальної епідермальної мембрани, виступають як типові патоморфологічні ланки ушкодження епідермісу у хворих на Пс і ГХ. Означений спектр порушень має локальний характер і викликає каскад патологічних перебудов, які за своєю інтенсивністю значно перевищують ушкодження шкіри у хворих на Пс без ГХ. У хворих на ГХ загальна цитоархітектоніка епідермісу і проліферативна активність кератиноцитів відповідають характеру вікової норми. Проте в прогресуючій стадії Пс наявність ГХ поглиблює ступінь локальних ушкоджень епітеліального компонента, посилюючи розвиток гіперкератозу, паракератозу, папіломатозної гіперплазії, міжклітинного і цитоплазматичного набряку епідермоцитів, розшарування і відшарування епідермісу за рахунок транссудації, мікроабсцесів Мунро, лейкоцитарної інфільтрації, еритродіапедезу і крововиливів.
6.2 Морфологічні особливості мікроциркуляторного русла дерми
Результати морфологічного дослідження дерми показали, що мікроциркуляторне русло у вивчених ділянках шкіри осіб похилого віку в досліджуваних контрольній та основних групах містить помірно розвинену підсосочкову артеріальну сітку, систему внутрішньососочкових капілярних петель, а також поверхневі і глибокі підсосочкові венозні сплетення. У сосочковому шарі дерми в контрольній групі у складі невисоких сплощених сосочків спостерігалися гемокапіляри з незначним варіюванням просвіту вздовж мікросудин. У місці відгалуження від артеріол, тобто в основі сосочкових капілярних петель, відзначалися звуження просвітів капілярів в оточенні циркулярних фіброзних пучків. Артеріоли підсосочкового сплетення виглядали розширеними, частка мікросудин – з проявами помірного внутрішньостінкового набряку. Венули сплетінь були нерівномірно звуженими. Лімфатичні капіляри мали типову будову без ознак лімфостазу. Значення МІ клітин мікросудинної стінки свідчили про незначний ступінь їх проліферативної активності: ендотеліоцитів – (1,07 ± 0,16) %, перицитів – (2,32 ± 0,29) %, гладких міоцитів – (1,17 ± 0,13) %. Ендотеліальне вистелення судин ГМЦР мало типову будову, ознаки ушкодження ендотеліальних клітин не спостерігалися. У просвітах артеріол іноді зустрічалися дрібні тромбоцитарні агрегати без утворення щільного контакту з ендотелієм мікросудинної стінки. Загалом, стан ГМЦР шкіри в осіб контрольної групи вказував на помірні компенсовані інволютивні зміни без критичних ушкоджень мікроциркуляції в сосочковому і сітчастому шарах дерми (рис. 6.7).
У хворих на Пс у прогресуючій стадії патоморфологічні зміни ГМЦР у псоріатично ушкоджених ділянках шкіри були значно більш вираженими, ніж інволютивні перебудови мікроциркуляції дерми в осіб групи порівняння, і помітно відрізнялися від змін, що спостерігалися в контрлатеральних ділянках шкіри без елементів псоріатичної висипки. У біоптатах ушкодженої шкіри навколо артеріол і венул на межі між сосочковим і сітчастим шарами дерми спостерігалися ознаки помірної запально-клітинної інфільтрації зі вмістом мононуклеарів або нейтрофілів, в поодиноких випадках – плазмоцитів і тканинних базофілів. Клітинна інфільтрація не виходила за межі периваскулярного простору і не розповсюджувалася на сполучнотканинне мікрооточення (рис. 6.8 А).
Рисунок 6.7 – А – стан дерми шкіри передпліччя жінки контрольної групи віком 64 роки. Забарвлення за Пачіні. ×100. Б – гістологічний зріз сосочкового і сітчастого шарів дерми плеча жінки контрольної групи віком 73 роки. Забарвлення конго червоним за Матсуура. ×400.
За величиною просвіту артеріоли і венули не відрізнялися від мікросудин у дермі в контрольній групі спостережень, проте в їх стінці відзначалася надмірна проліферація ендотеліальних клітин, перицитів, гладких міоцитів. Загальна щільність мікросудин також була помітно більшою, ніж у групі контролю. Гемокапіляри внутрішньососочкових петель мали розширений просвіт, були повнокровними, часто з явищами плазморагії й еритродіапедезу, в оточенні дрібних крововиливів (рис. 6.8 Б). Ендотеліальне вистелення судин ГМЦР дерми мало ознаки ушкодження цілісності стінки, однак тромбоутворення не було характерним у більшості спостережень. У розширених лімфатичних капілярах спостерігався виражений лімфостаз.
Морфологічний аналіз шкіри без типових клінічних елементів у хворих на Пс виявив низку особливостей, пов’язаних із загальною ангіоархітектонікою дерми. З одного боку, ушкодження стінки мікросудин і виражені інфільтративно-деструктивні процеси в системі мікроциркуляції були відсутні, як і в групі порівняння. З іншого боку, щільність артеріол і венул була набагато більшою за контрольний рівень. Також була значно підвищеною проліферація клітин у складі мікросудин, за виключенням гладких міоцитів. Ці дані вказують на системний характер перебудов ГМЦР, який у хворих на Пс мав місце навіть у ділянках клінічно неушкодженої шкіри (рис. 6.9).
Рисунок 6.8 – А – тотальний гістологічний зріз ушкодженої ділянки шкіри плеча хворої на Пс віком 70 років. Забарвлення конго червоним за Вейгертом. ×150.
Б – стан дерми ушкодженої ділянки шкіри передпліччя хворої на Пс віком 59 років. Забарвлення за Масоном. ×400.
У пацієнтів з ГХ спектр перебудов мікроциркуляції шкіри значно відрізнявся від тих змін, що спостерігалися в контрольній групі і у хворих на Пс. Зокрема, щільність судин ГМЦР у сосочковому і сітчастому шарах дерми, а також діаметри мікросудин були на рівні значень вікової норми, проте мікроскопічно у стінках артеріол стабільно виявлялася суттєва гіпертрофія гладком’язових та еластичних елементів. Часто спостерігалося плазматичне просочування стінки артеріол з формуванням щільного периваскулярного набряку й артеріолосклерозу (гіалінозу). В окремих спостереженнях виявлялися ознаки еластофіброзу артеріол, що включали гіперплазію і розщеплення еластичної мембрани артеріол у відповідь на стійку АГ із вростанням в її розшарування фіброзної тканини. У просвітах артеріол часто спостерігалися різні за розмірами тромбоцитарні агрегати, які щільно контактували з ушкодженим ендотелієм мікросудинної стінки. Деякі артеріоли мали облітерований або тромбований просвіт. Найбільша кількість тромбоагрегатів й активованих тромбоцитів відзначалася у просвіті гемокапілярів, хоча загальна геометрія розташування внутрішньососочкових капілярних петель зберігалася. Також у складі гемокапілярів спостерігалися морфологічні ознаки ЕД на тлі збереженої цілісності капілярної стінки (рис. 6.10).
Рисунок 6.9 – А – тотальний гістологічний зріз неушкодженої ділянки шкіри плеча хворої на Пс віком 66 років. Забарвлення за Масоном. ×150. Б – стан дерми неушкодженої ділянки шкіри передпліччя хворої на Пс віком 59 років. Забарвлення за Ван-Гізоном. ×400.
Можливо, порушення тромбоцитарного гемостазу і функції ендотелію, що спостерігаються на рівні гемокапілярів, є прямим наслідком ушкодження циркуляції в артеріолах, які у хворих на ГХ виявляються найбільш уразливою ланкою ГМЦР у відповідь на тривалий вплив АГ.
Рисунок 6.10 – А – тотальний гістологічний зріз шкіри передпліччя хворого на ГХ віком 62 роки. Забарвлення конго червоним за Матсуура. ×200. Б – стан дерми неушкодженої ділянки шкіри передпліччя хворої на ГХ віком 71 рік. Забарвлення гематоксиліном й еозином. ×400.
Дослідження морфофункціонального стану мікроциркуляції у шкірі хворих на Пс у прогресуючій стадії і ГХ дозволило визначити коморбідний характер численних і виражених патоморфологічних змін, що супроводжують перебіг досліджуваної поєднаної патології. У біоптатах псоріатично ушкодженої шкіри відзначалася різко підвищена щільність мікросудин в обох шарах дерми. Діаметр більшості судин ГМЦР був збільшеним. Навколо артеріол і венул спостерігалися численні осередки запально-клітинної інфільтрації зі вмістом мононуклеарів, нейтрофілів, лімфоцитів і плазмоцитів. Інфільтрація від периваскулярного простору розповсюджувалася на сполучнотканинне мікрооточення, переважно у сосочковому шарі дерми (рис. 6.11 А).
У стінці мікросудин відзначалася гіперпроліферація ендотеліальних клітин, перицитів і гладких міоцитів. У стінках артеріол підсосочкової сітки виявлялася значна гіпертрофія гладком’язових й еластичних елементів. Характерним було плазматичне просочування стінки артеріол з формуванням щільного периваскулярного набряку та артеріолосклерозу (гіалінозу). Також спостерігалися артеріоли у стані еластофіброзу. У просвітах значної частки артеріол спостерігалися явища тромбозу, агрегатоутворення активованих тромбоцитів, облітерації просвітів. Слід підкреслити, що в ушкоджених ділянках шкіри хворих на Пс і ГХ ангіоархітектоніка внутрішньососочкових капілярних петель була істотно порушеною за рахунок утворення розширених деформованих просвітів і деструкції гемокапілярної стінки. Навколо повнокровних капілярів утворювалися широкі осередки лейкоцитарної інфільтрації, ексудації, транссудації, плазморагії по всьому простору сосочків з розповсюдженням за межі верхівки сосочків через ушкоджену базальну мембрану в епідерміс. Типовим патоморфологічним проявом було сладжування еритроцитів, еритродіапедез, численні крововиливи (рис. 6.11 Б). Ендотеліальне вистелення мікросудин мало морфологічні ознаки значної ЕД і розвиненої внутрішньосудинної активації тромбоцитів. Значно розширені лімфатичні капіляри сосочкового шару і колекторні лімфосудини сітчастого шару дерми мали ознаки розвинутого лімфостазу і містили гранулоцитарні запальні клітини.
Рисунок 6.11 – А – стан дерми ушкодженої ділянки шкіри плеча хворої на Пс і ГХ віком 68 років. Забарвлення за Маллорі-Слінченком. ×200. Б – тотальний гістологічний зріз ушкодженої ділянки шкіри плеча хворого на Пс і ГХ віком 61 рік. Забарвлення за Масоном. ×100.
При морфологічному дослідженні стану мікроциркуляції неураженої шкіри у хворих на Пс і ГХ виявилося, що патологічні зміни ГМЦР дерми за своїми спектром та інтенсивністю помітно поступаються тим деструктивним явищам, які спостерігались у даних хворих в ділянках псоріатично зміненої шкіри, проте певна низка структурних перебудов мікросудин мала системний характер і мала місце в ділянках візуально незміненої шкіри контрлатеральних ділянок. До цих системних мікроциркуляторних перебудов належали підвищена проліферація клітин мікросудинної стінки з активацією ангіогенезу, порушення ангіоархітектоніки артеріол і гемокапілярів з ушкодженням морфологічної будови їх стінок, інтерстиційний набряк сосочкового шару дерми. Також були характерними явища сладжування еритроцитів, ЕД з внутрішньосудинною активацією тромбоцитів (рис. 6.12).
Рисунок 6.12 – А – стан дерми неушкодженої ділянки шкіри передпліччя хворої на Пс і ГХ віком 60 років. Забарвлення за Масоном. ×200. Б – тотальний гістологічний зріз неушкодженої ділянки шкіри плеча хворої на Пс і ГХ віком 66 років. Забарвлення за Маллорі-Слінченком. ×100.
Результати кількісного морфологічного дослідження показали, що мікросудини ГМЦР сосочкового шару дерми в ушкоджених ділянках шкіри хворих на Пс за відносним об’ємом перевищували показник групи контролю на 77,5 % (p < 0,05), у морфологічно незміненій шкірі – на 52,1 % (p < 0,05), що вказує на системний характер мікросудинної проліферації у пацієнтів даного контингенту. У хворих на ГХ помірне збільшення відносного об’єму судин ГМЦР у сосочковому шарі дерми порівняно з контролем не досягало рівня статистичної значущості (табл. 6.5), проте у групі хворих на Пс із ГХ спостерігався різко підвищений вміст ГМЦР як відносно контрольного рівня (на 135,1 %; p < 0,05), так і у порівнянні з контрлатеральною ділянкою шкіри даних пацієнтів (на 53,6 %; p < 0,05).
Таблиця 6.5 – Відносний об’єм судин мікроциркуляторного русла у складі сосочкового шару дерми, % (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 4,13 ± 0,46 | |
| Пс (n=20) | Ушкоджена ділянка | 7,33 ± 0,81 * ^ |
| Контрлатеральна ділянка | 6,28 ± 0,75 * ^ | |
| ГХ (n=10) | 5,04 ± 0,43 # | |
| Пс+ГХ (n=18) | Ушкоджена ділянка | 9,71 ± 0,84 * # ^ |
| Контрлатеральна ділянка | 6,32 ± 0,58 * ^ | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність від значень ушкодженої ділянки шкіри групи хворих на Пс (p < 0,05); ^ – значуща відмінність від значень групи хворих на ГХ (p < 0,05).
Схожі за напрямком та вираженістю зміни відзначалися при вивченні відносного об’єму мікроциркуляторного русла у складі сітчастого шару дерми (табл. 6.6). У всіх досліджуваних ділянках Пс супроводжувався підвищеною проліферацією мікросудин, причому при поєднанні Пс з ГХ у патологічно змінених ділянках шкіри сітчастий шар містив найбільш розвинену сітку ГМЦР. Наведені дані свідчать про можливість існування системного механізму гіперактивації ангіогенезу у складі шкіри хворих на Пс, причому наявність АГ посилює ступінь мікросудинної проліферації як в ділянках папіломатозної гіперплазії або інших псоріатичних ушкоджень, так і в клінічно незміненій шкірі [43, 57, 60, 64].
Таблиця 6.6 – Відносний об’єм судин мікроциркуляторного русла у складі сітчастого шару дерми, % (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 5,21 ± 0,46 | |
| Пс (n=20) | Ушкоджена ділянка | 8,35 ± 0,94 * ^ |
| Контрлатеральна ділянка | 7,82 ± 3,9 * ^ | |
| ГХ (n=10) | 6,11 ± 0,81 # | |
| Пс+ГХ (n=18) | Ушкоджена ділянка | 11,85 ± 1,03 * # ^ |
| Контрлатеральна ділянка | 9,40 ± 0,87 * ^ | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність від значень ушкодженої ділянки шкіри групи хворих на Пс (p < 0,05); ^ – значуща відмінність від значень групи хворих на ГХ (p < 0,05).
Морфометричне визначення зовнішнього діаметра артеріол підсосочкової сітки дозволило оцінити характер мікросудинних перебудов, що розвиваються у складі ГМЦР шкіри досліджуваних пацієнтів (табл. 6.7). У хворих на Пс значення цього параметра не відрізнялися від контрольних величин як в ушкоджених, так і в контрлатеральних ділянках шкіри. Навпаки, у хворих на ГХ спостерігалося збільшення зовнішнього діаметра артеріол (на 34,4 %; p < 0,05) відносно групи порівняння. Розвиток поєднаної патології (Пс + ГХ) також супроводжувався підвищенням значень параметра, що було особливо вираженим у зонах шкірних псоріатичних елементів – на 75,0 % (p < 0,05) порівняно з контролем і на 30,2 % (p < 0,05) відносно значень параметра у хворих на ГХ.
Таблиця 6.7 – Зовнішній діаметр артеріол підсосочкової сітки, мкм (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 21,2 ± 3,4 | |
| Пс (n=20) | Ушкоджена ділянка | 20,3 ± 3,1 ^ |
| Контрлатеральна ділянка | 21,8 ± 2,4 ^ | |
| ГХ (n=10) | 28,5 ± 3,1 * # | |
| Пс+ГХ (n=18) | Ушкоджена ділянка | 37,1 ± 3,5 * # ^ |
| Контрлатеральна ділянка | 27,4 ± 3,0 * # | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність від значень ушкодженої ділянки шкіри групи хворих на Пс (p < 0,05); ^ – значуща відмінність від значень групи хворих на ГХ (p < 0,05).
Вивчення діаметра венул поблизу основи дермальних сосочків, на відміну від артеріол, не виявило статистично вагомих змін у порівнянні з відповідною за віком контрольною групою у хворих на Пс і у пацієнтів з ГХ (табл. 6.8), проте у хворих з досліджуваною поєднаною патологією спостерігалось значуще зменшення діаметра венул (на 34,5 %; p < 0,05) у патологічно порушених ділянках шкіри. Можливо, це обумовлено розвитком фіброзу сосочкового шару дерми і супутнім перивенулярним набряком, а також залученням розширених лімфатичних мікросудин, які частково компенсують дренажну функцію звужених і деформованих венул.
Таблиця 6.8 – Зовнішній діаметр венул підсосочкових сплетінь, мкм (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 26,4 ± 2,9 | |
| Пс (n=20) | Ушкоджена ділянка | 25,7 ± 3,0 |
| Контрлатеральна ділянка | 26,0 ± 2,7 | |
| ГХ (n=10) | 23,9 ± 3,4 | |
| Пс+ГХ (n=18) | Ушкоджена ділянка | 17,3 ± 2,2 * |
| Контрлатеральна ділянка | 22,7 ± 2,6 | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05).
Дослідження гемокапілярів сосочкових петель виявило їх суттєві структурні зміни у хворих на Пс (табл. 6.9). Зокрема, в ушкоджених ділянках шкіри дані мікросудини за діаметром на 80,1 % (p < 0,05) перебільшували контрольне значення у групах порівняння, у контрлатеральних ділянках шкіри – на 61,1 % (p < 0,05), що вказує на системний характер перебудов капілярів дерми на тлі активного псоріатичного процесу. Навпаки, у пацієнтів з ГХ зміни параметра не перевищували межі статистичної значущості. У хворих на Пс і ГХ розширення сосочкових капілярів у ділянках псоріатичного ушкодження шкіри виявлялося найвиразнішим, перевищуючи контрольний рівень на 167,4 % (p < 0,05) і рівень показника у хворих на Пс без ГХ – на 48,5 % (p < 0,05).
Таблиця 6.9 – Зовнішній діаметр внутрішньососочкових гемокапілярів, мкм (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 9,5 ± 1,7 | |
| Пс (n=20) | Ушкоджена ділянка | 17,1 ± 2,2 * ^ |
| Контрлатеральна ділянка | 15,3 ± 2,0 * | |
| ГХ (n=10) | 11,2 ± 1,5 # | |
| Пс+ГХ (n=18) | Ушкоджена ділянка | 25,4 ± 2,9 * # ^ |
| Контрлатеральна ділянка | 18,0 ± 2,1 * ^ | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність від значень ушкодженої ділянки шкіри групи хворих на Пс (p < 0,05); ^ – значуща відмінність від значень групи хворих на ГХ (p < 0,05).
Поряд із значною нерівномірністю просвітів по ходу ушкоджених і розширених гемокапілярів найбільш суттєвим порушенням їх структури у хворих на Пс ставало різке звуження основи капілярних петель за рахунок розростання оточуючого колагенового матриксу, перикапілярного набряку і навколосудинної лімфоцитарної інфільтрації (табл. 6.10).
Таблиця 6.10 – Зовнішній діаметр гемокапілярів в основі петель, мкм (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 12,3 ± 1,4 | |
| Пс (n=20) | Ушкоджена ділянка | 8,2 ± 1,1 * ^ |
| Контрлатеральна ділянка | 8,6 ± 0,9 * | |
| ГХ (n=10) | 12,9 ± 1,3 # | |
| Пс+ГХ (n=18) | Ушкоджена ділянка | 7,4 ± 0,8 * ^ |
| Контрлатеральна ділянка | 8,1 ± 1,0 * ^ | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність від значень ушкодженої ділянки шкіри групи хворих на Пс (p < 0,05); ^ – значуща відмінність від значень групи хворих на ГХ (p < 0,05).
У контрольній групі, а також у хворих на ГХ діаметр основи капілярної петлі не поступався діаметру внутрішньососочкового гемокапіляра, що створювало умови для адекватної циркуляції формених елементів і плазми крові. Навпаки, у хворих на Пс, особливо за наявності ГХ, відзначалося різке звуження основи капілярних петель (на 30,1-39,8 % відносно контролю), що призводило до різноманітних мікроциркуляторних розладів і, як наслідок, поглиблювало явища еритродіапедезу, крововиливів, транссудації, набряку, плазморагії у складі дермальних сосочків. Загальні перебудови внутрішньососочкової капілярної петлі на тлі псоріатичного ушкодження шкіри включали утворення локальних розширень гемокапілярів у внутрішньососочковому просторі, звуження початкових і кінцевих сегментів петлі у підсосочковій ділянці, що супроводжувалось порушенням циркуляції і обмеженням транскапілярного обміну.
Кількісне визначення проліферативної активності ендотеліальних клітин показало достовірне зростання МІ у всіх ділянках шкіри досліджуваних клінічних груп у порівнянні з контрольними величинами, однак ступінь гіперпроліферації в означених групах був неоднаковим (табл. 6.11). У контрлатеральних ділянках шкіри без псоріатичних елементів, а також у хворих на ГХ мітотична активність більш ніж удвічі перевищувала контрольний рівень. Найвищі значення МІ (перевищення контрольного рівня у 5,1 разу) спостерігались в ділянках псоріатичного ураження шкіри пацієнтів з прогресуючою стадією Пс і ГХ, що свідчить про суттєву коморбідну індукцію проліферативної активності ендотеліоцитів ураженої шкіри у хворих з поєднаною патологією.
Таблиця 6.11 – Мітотичний індекс ендотеліоцитів, % (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 1,07 ± 0,16 | |
| Пс (n=20) | Ушкоджена ділянка | 3,23 ± 0,46 * ^ |
| Контрлатеральна ділянка | 2,16 ± 0,28 * # | |
| ГХ (n=10) | 2,24 ± 0,25 * # | |
| Пс+ГХ (n=18) | Ушкоджена ділянка | 5,48 ± 0,43 * # ^ |
| Контрлатеральна ділянка | 2,35 ± 0,26 * # | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність від значень ушкодженої ділянки шкіри групи хворих на Пс (p < 0,05); ^ – значуща відмінність від значень групи хворих на ГХ (p < 0,05).
Аналогічна за напрямком структура змін відзначалася при вивченні проліферативної активності перицитів у складі мікросудин: достовірне зростання МІ означених клітин відбувалося у всіх ділянках шкіри досліджуваних клінічних груп у порівнянні з контрольними величинами (табл. 6.12).
Таблиця 6.12 – Мітотичний індекс перицитів, % (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 2,32 ± 0,29 | |
| Пс (n=20) | Ушкоджена ділянка | 4,90 ± 0,54 * ^ |
| Контрлатеральна ділянка | 4,08 ± 0,39 * # | |
| ГХ (n=10) | 4,27 ± 0,41 * # | |
| Пс+ГХ (n=18) | Ушкоджена ділянка | 6,11 ± 0,68 * # ^ |
| Контрлатеральна ділянка | 4,32 ± 0,50 * # | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність від значень ушкодженої ділянки шкіри групи хворих на Пс (p < 0,05); ^ – значуща відмінність від значень групи хворих на ГХ (p < 0,05).
У клінічно незмінених ділянках шкіри хворих на Пс і у пацієнтів з ГХ МІ перицитів на 75,9–86,2 % (p < 0,05) переважав рівень групи порівняння. У псоріатично ушкоджених ділянках шкіри хворих на Пс мітотична активність перевищувала контрольне значення на 111,2 % (p < 0,05), у пацієнтів з Пс у прогресуючій стадії і ГХ – у 2,6 разу (p < 0,05). Наведені результати підтверджують дані про коморбідну індукцію проліферативної активності клітин мікросудинної стінки у хворих на Пс і ГХ.
Кількісне визначення МІ гладких міоцитів у складі стінки мікросудин сосочкового і сітчастого шарів дерми хворих на Пс не виявило статистично значущих змін як у неушкоджених ділянках шкіри, так і у ділянках з елементами псоріатичної висипки (табл. 6.13). У пацієнтів з ГХ спостерігалося істотне переважання проліферативної активності міоцитів порівняно з контрольним значенням – на 80,0 % (p < 0,05). У хворих з поєднаною патологією параметр зростав ще більшою мірою: в клінічно неушкоджених ділянках шкіри – на 74,4 % (p < 0,05), у ділянках з елементами псоріатичної висипки – на 119,7 % (p < 0,05).
Таблиця 6.13 – Мітотичний індекс гладких міоцитів, % (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 1,17 ± 0,13 | |
| Пс (n=20) | Ушкоджена ділянка | 1,35 ± 0,24 ^ |
| Контрлатеральна ділянка | 1,28 ± 0,20 ^ | |
| ГХ (n=10) | 1,97 ± 0,27 * # | |
| Пс+ГХ (n=18) | Ушкоджена ділянка | 2,57 ± 0,30 * # ^ |
| Контрлатеральна ділянка | 2,04 ± 0,23 * # | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність від значень ушкодженої ділянки шкіри групи хворих на Пс (p < 0,05); ^ – значуща відмінність від значень групи хворих на ГХ (p < 0,05).
6.3 Патоморфогенез сполучнотканинного компонента дерми
Морфологічний аналіз сполучнотканинного компоненту дерми показав, що в контрольній групі в осіб похилого віку колагенові волокна сплощених, переважно низьких сосочків формували потовщені пучки, місцями фрагментовані, з порушеною орієнтацією щодо профілю базальної мембрани. Кількість еластичних волокон була різко зниженою. Спостерігалося витончення сітчастого шару дерми з ознаками гіповаскуляризаціі. Вміст колагенових волокон сітчастого шару помірно підвищений, без патологічних змін.
У хворих на Пс без супутньої ГХ у ділянках з елементами псоріатичного висипу волокнисті структури дерми були патологічно змінені як у сосочковому, так і в сітчастому шарах дерми. У складі сосочків спостерігався дифузний фіброз поряд із майже повною відсутністю еластичних волокон на тлі виражених інфільтративно-ексудативних процесів (рис. 6.13 А).
У поодиноких спостереженнях при дослідженні структури видовжених сосочків дегенеровані еластичні волокна зберігались у вигляді поперечних до базальної мембрани епідермісу тонких волокон або їх фрагментів. Більшість сосочків набувала значної висоти за рахунок проліферації судинних елементів і фібробластів в основі сосочка. Для сітчастого шару дерми було характерним поєднання фіброзу, еластозу з явищами базофільної дегенерації колагенових фібрил. Еластичний компонент був представлений волокнами у стані дистрофії: нерівномірно потовщеними, фрагментованими або сплутаними в клубки. Осередки еластозу чергувалися з ділянками еластолізису. Пучки колагенових волокон були представлені тонкими ниткоподібними структурами навколо мікросудин.
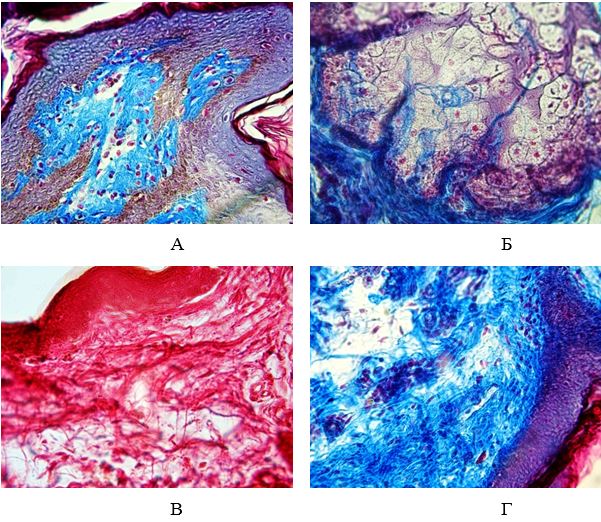
Рисунок 6.13 – Структура сосочкового шару дерми хворих досліджуваних клінічних груп. А – ушкоджена ділянка шкіри передпліччя хворої на Пс віком 63 роки. Забарвлення за Маллорі-Слінченком. ×100. Б – неушкоджена ділянка шкіри передпліччя хворої на Пс віком 63 роки.. Забарвлення за Маллорі-Слінченком. ×400. В – ушкоджена ділянка шкіри плеча хворого на Пс і ГХ віком 60 років. Забарвлення за Масоном. ×100. Г – неушкоджена ділянка шкіри плеча хворого на Пс і ГХ віком 60 років. Забарвлення за Маллорі-Слінченком. ×200.
Структура дерми візуально незмінених (контрлатеральних) ділянок шкіри хворих на Пс, а також у пацієнтів з ГХ суттєво не відрізнялась від морфологічної картини, що встановлена в контрольній групі, за винятком суттєвого зростання проліферативної активності фібробластів (рис. 6.13 Б).
У хворих на Пс у прогресуючій стадії з супутньою ГХ у ділянках псоріатично ушкодженої шкіри спостерігалися виразні патологічні зміни волокон сосочкового і сітчастого шарів дерми. У складі різних за формою і розмірами сосочків відзначався розвинений дифузний фіброз з різким переважанням колагенових волокон (рис. 6.13 В). Поодинокі еластичні волокна виглядали як фрагментовані дегенеративні структури на тлі значної лейкоцитарної інфільтрації, ексудації, крововиливів, інтерстиційного набряку. Групи згладжених сосочків перемежалися з високими витонченими сосочками, між якими відзначались ділянки найвиразніших деструктивних змін епідермісу. У сітчастому шарі дерми спостерігалися типові ознаки розвинутого фіброеластозу з дегенерацією колагенових фібрил і утворенням поліморфних комплексів еластичних фібрил на тлі чергування дрібних осередків еластозу і еластолізису. На межі між сосочковим і сітчастим шарами дерми спостерігалося утворення численних сполучнотканинних футлярів навколо основи капілярних петель, що призводило до їх значного звуження і деформації просвітів гемокапілярів.
У контрлатеральних ділянках шкіри хворих на Пс і ГХ деструктивні тканинні зміни, пов’язані з ушкодженням мікросудин (інфільтрація, ексудація, крововиливи), були відсутні, проте дифузний фіброз сосочкового шару і фіброеластоз сітчастого шару дерми виявлялися як характерні ознаки системного ушкодження шкіри (рис. 6.13 Г).
Для кількісної оцінки проліферативного потенціалу сполучнотканинного компоненту дерми у досліджуваних групах хворих був проведений розрахунок МІ фібробластів. За результатами морфометрії, у складі обох шарів дерми відзначалося статистично значуще підвищення мітотичної активності фібробластів (на 34,3-44,9 % у порівнянні з контролем) у хворих на ГХ або Пс незалежно від наявності або відсутності елементів псоріатичного ушкодження на поверхні шкіри (табл. 6.14). При поєднанні активного псоріатичного процесу з ГХ у шкірі хворих спостерігалося ще більш значне підвищення МІ фібробластів дерми відносно контрольного рівня – на 132,8 % (p < 0,05).
Отже, у хворих на Пс і ГХ гіперпроліферація клітин (ендотеліоцитів, перицитів, гладких міоцитів) у складі стінки мікросудин з розвитком гіалінозу й еластофіброзу артеріол, а також порушення ангіоархітектоніки артеріол і внутрішньососочкових гемокапілярів на тлі дифузного фіброзу сосочків являли собою системні ушкодження, які значно перевершували патологічні зміни ГМЦР у хворих на Пс без ГХ. Типовими порушеннями тканинної структури шкіри на тлі поєднаної патології були також системний фіброз сосочкового шару і фіброеластоз сітчастого шару дерми. Наслідками патоморфогенезу ушкоджень дерми при розвитку псоріатичного процесу на тлі ГХ у хворих похилого віку були значний інтерстиційний набряк сосочкового шару; перифокальна лейкоцитарна інфільтрація, ексудація, транссудація, плазморагії у складі дермальних сосочків; лімфостаз і локальне розширення лімфатичної дренажної ланки мікроциркуляції; сладжування еритроцитів, еритродіапедез, крововиливи; посилення ЕД з активацією тромбоцитарного гемостазу.
Таблиця 6.14 – Мітотичний індекс фібробластів, % (M ± m)
| Групи дослідження | Значення параметра | |
| Контрольна (n=10) | 4,61 ± 0,55 | |
| Пс (n=20) | Ушкоджена ділянка | 6,33 ± 0,59 * |
| Контрлатеральна ділянка | 6,19 ± 0,63 * | |
| ГХ (n=10) | 6,68 ± 0,70 * | |
| Пс+ГХ (n=18) | Ушкоджена ділянка | 10,73 ± 1,21 * # ^ |
| Контрлатеральна ділянка | 9,96 ± 1,04 * # ^ | |
Примітка. * – значуща відмінність від значень групи контролю (p < 0,05); # – значуща відмінність від значень ушкодженої ділянки шкіри групи хворих на Пс (p < 0,05); ^ – значуща відмінність від значень групи хворих на ГХ (p < 0,05).
6.4 Результати імуногістохімічного дослідження експресії індуцибельної синтази оксиду азоту
Імуногістохімічна ідентифікація експресії iNOS у складі клінічно ушкодженої шкіри хворих на Пс визначила велику кількість позитивно забарвлених клітин гермінативної зони епідермісу. Інтенсивність імуногістохімічної реакції мала помірний характер і розподілялася рівномірно по клітинах базального, остистого та зернистого шарів. Найвища експресія iNOS була асоційована з ядерними мембранами кератиноцитів, хоча ступінь інтрацитоплазматичної експресії значно варіював у хворих даної клінічної групи. Більшість фібробластів та імунокомпетентних клітин сосочкового шару дерми характеризувалися високою синтетичною активністю досліджуваного маркера (рис. 6.14).
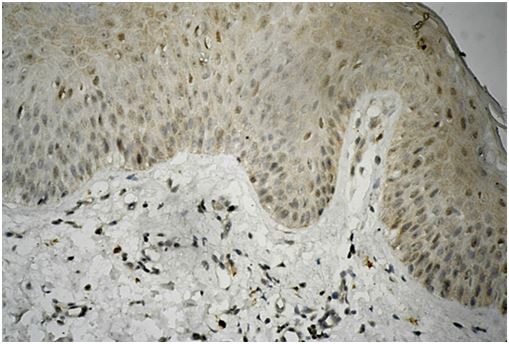
Рисунок 6.14 – Експресія iNOS в клітинах епідермісу та дерми ушкодженої ділянки шкіри плеча хворої на Пс віком 66 років. Антитіла до iNOS (клон 9242-PO), cистема візуалізації DAKO EnVision+ з діамінобензидином. ×400.
За результатами аналізу отриманих зображень епідермісу визначено, що у хворих на Пс у прогресуючій стадії в зонах псоріатичного ураження мінімальне значення коефіцієнта УОЩ Kepi становило 0,180, максимальне – 0,891, медіана дорівнювала 0,567 (0,451; 0,689). У зонах спонгіозних змін епідермісу при проведенні імуногістохімічного дослідження спостерігалася помірна або більш інтенсивна експресія iNOS з чіткою цитоплазматичною локалізацією і переважанням імуногістохімічної мітки на ядерних мембранах кератиноцитів (рис. 6.15).
При проведенні імуногістохімічнго дослідження рівня синтезу iNOS у складі сосочкового та сітчастого шарів дерми спостерігалась інтенсивна експресія у фібробластах, ендотеліальних та гладком’язових клітинах судин мікроциркуляторного русла, деяких імунокомпетентних клітинах. У клітинах дерми ушкоджених ділянок шкіри хворих на Пс загальний коефіцієнт позитивно забарвлених клітин Kderm був значно нижчим порівняно з епідермісом відповідних ділянок – від 0,108 до 0,364 з медіаною 0,179 (0,136; 0,221). Проте інтенсивність внутрішньоклітинної імуногістохімічної мітки помітно перевищувала таку, що виявлялася в кератиноцитах. На нашу думку, це можна пояснити переважанням індукованого синтезу NO у клітинах моноцитарного походження, нейтрофілах, а також ендотеліоцитах та гладких міоцитах мікросудин у складі дерми за умов активного псоріатичного процесу.
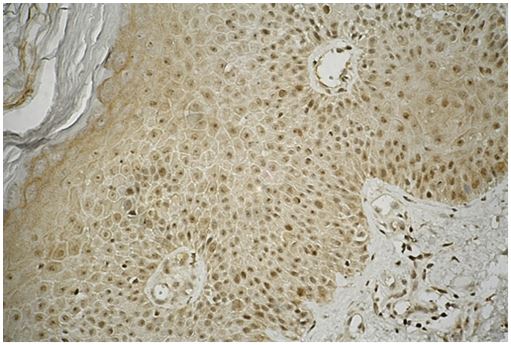
Рисунок 6.15 – Експресія iNOS в клітинах епідермісу ушкодженої ділянки шкіри передпліччя хворого на Пс віком 59 років. Антитіла до iNOS (клон 9242-PO), cистема візуалізації DAKO EnVision+ з діамінобензидином. ×400.
Імуногістохімічна картина епідермісу клінічно незміненої шкіри контрлатеральних ділянок у хворих на Пс при визначенні експресії iNOS суттєво відрізнялася від псоріатично змінених зон. Помірна позитивна реакція на iNOS спостерігалася переважно в базальному шарі (рис. 6.16).
УОЩ Kepі в клітинах нормального епідермісу становив від 0,294 до 0,296 з медіаною 0,295 (0,294; 0,296). Відповідний загальний параметр дерми клінічно неураженої шкіри УОЩ Kderm коливався на мінімальному рівні від 0,031 до 0,070 з медіаною 0,049 (0,031; 0,070). Різні клітини сосочкового та сітчастого шарів дерми не виявляли будь-якої синтетичної активності відносно iNOS, за винятком макрофагів (рис. 6.17).
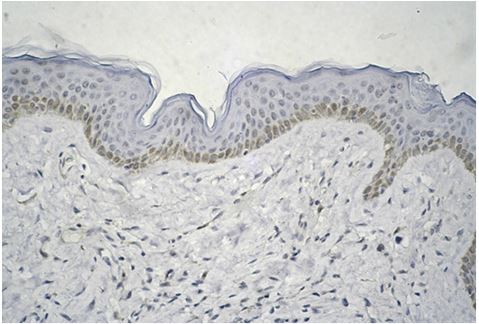
Рисунок 6.16 – Експресія iNOS у клітинах епідермісу неушкодженої ділянки шкіри плеча хворої на Пс віком 62 роки. Антитіла до iNOS (клон 9242-PO), cистема візуалізації DAKO EnVision+ з діамінобензидином. ×400.
Рисунок 6.17 – Експресія iNOS в дермі неушкодженої ділянки шкіри плеча хворої на Пс віком 59 років. Антитіла до iNOS (клон 9242-PO), cистема візуалізації DAKO EnVision+ з діамінобензидином. ×400.
При порівнянні рівня експресії іNOS з використанням U-критерію Манна-Уїтні була встановлена достовірна різниця між експресією iNOS в епідермісі при псоріатичному ураженні та в клінічно неураженому епідермісі (р=0,035) з більшою експресією у хворих на Пс (рис. 6.18). У свою чергу, в дермі шкіри хворих на Пс було виявлено достовірну розбіжність порівняно з нормою (р=0,023).
Рисунок 6.18 – Розподіл iNOS в епідермісі та дермі хворих на Пс.
Морфогенез імуногістохімічних змін епідермісу при вивченні експресії iNOS у хворих з прогресуючою стадією Пс на тлі ГХ у псоріатично ушкоджених ділянках шкіри суттєво перевищував ступінь порушень шкіри у хворих на Пс без ГХ. Зокрема, спостерігалося більш інтенсивне імуногістохімічне забарвлення в більшій кількості кератиноцитів гермінативної зони епідермісу у вигляді інтенсивних та численних інтрацитоплазматичних і навколоядерних міток (рис. 6.19), причому контрлатеральні ділянки морфологічно неушкодженої шкіри цих пацієнтів також мали ознаки підвищеної експресії iNOS (рис. 6.20), що свідчить про системний характер ушкоджень і узгоджується з результатами проведеного гістологічного дослідження.
У даній клінічній групі мінімальний коефіцієнт УОЩ досліджуваних ділянок епідермісу Kepi складав 0,492, максимальний – 0,933, медіана дорівнювала 0,721 (0,462; 0,837). У клітинах сосочкового та сітчастого шарів дерми хворих на Пс і ГХ коефіцієнт позитивно забарвлених клітин Kderm коливався від 0,181 до 0,414 з медіаною 0,293 (0,146; 0,274).
Рисунок 6.19 – Експресія iNOS в епідермісі та дермі ушкодженої ділянки шкіри передпліччя хворого на Пс і АГ віком 57 років. Антитіла до iNOS (клон 9242-PO), cистема візуалізації DAKO EnVision+ з діамінобензидином. ×400.
Рисунок 6.20 – Експресія iNOS в епідермісі та дермі неушкодженої ділянки шкіри передпліччя хворого на Пс і ГХ віком 57 років. Антитіла до iNOS (клон 9242-PO), cистема візуалізації DAKO EnVision+ з діамінобензидином. ×400.
При порівнянні рівня експресії іNOS за U-критерієм Манна-Уїтні було встановлено достовірну різницю між експресією iNOS в епідермісі при псоріатичному ураженні папулами та в епідермісі хворих на коморбідну патологію (р=0,041) з достовірно вищим рівнем експресїї у хворих останньої із зазначених клінічних груп. У дермі шкіри пацієнтів з Пс групи порівняння була виявлена достовірна розбіжність порівняно зі шкірою хворих основної групи (р=0,030). У той же час, за допомогою Т-критерію Вілкоксона була виявлена достовірна різниця в експресії iNOS в епідермісі та дермі хворих на Пс і ГХ (р=0,001) [66]; у контрольних випадках достовірної розбіжності не виявлено (див. рис. 6.18).
Проте, як і у пацієнтів із Пс без ГХ, у біоптатах псоріатично ушкодженої шкіри хворих на коморбідну патологію у складі сосочкового та сітчастого шарів дерми спостерігалась інтенсивна цитоплазматична і навколоядерна експресія iNOS у фібробластах, ендотеліальних та гладком’язових клітинах судин мікроциркуляторного русла (рис. 6.21). Можливо припустити, що у пацієнтів даного контингенту індукцію iNOS посилює активація α-адренорецепторів, яка відбувається при супутній ГХ.
Рисунок 6.21 – Експресія iNOS в дермі ушкодженої ділянки шкіри плеча хворої на Пс і ГХ віком 63 роки. Антитіла до iNOS (клон 9242-PO), cистема візуалізації DAKO EnVision+ з діамінобензидином. ×400.
* * *
Морфологічним субстратом ушкодження шкіри у хворих на Пс і ГХ є комплекс локальних і системних порушень структури епітеліального, сполучнотканинного і мікроциркуляторного компонентів, а саме: 1) перифокальна гіперплазія і дистрофія кератиноцитів з акантолізом і деструкцією епідермально-дермального з’єднання, включаючи фрагментацію базальної мембрани епідермісу; 2) гіперпроліферація клітин (ендотеліоцитів, перицитів, гладких міоцитів) у складі стінки мікросудин з розвитком гіалінозу й еластофіброзу артеріол; 3) дисеміноване порушення ангіоархітектоніки артеріол і внутрішньососочкових гемокапілярів; 4) дифузний фіброз сосочкового шару і фіброеластоз сітчастого шару дерми; 5) виражена експресія iNOS кератиноцитами та клітинами дерми.
Даний комплекс порушень зустрічається у всіх без виключення хворих на Пс у прогресуючій стадії на тлі ГХ і викликає каскад типових патоморфологічних змін, які за своєю інтенсивністю значно перевищують ушкодження шкіри у хворих на Пс без ГХ [56].
У хворих на ГХ загальна цитоархітектоніка епідермісу і проліферативна активність кератиноцитів відповідають характеру вікової норми, проте в прогресуючій стадії Пс наявність ГХ поглиблює ступінь локальних ушкоджень епідермального компонента, посилюючи розвиток гіперкератозу, паракератозу, папіломатозної гіперплазії, міжклітинного і цитоплазматичного набряку епідермоцитів, розшарування і відшарування епідермісу за рахунок транссудації, мікроабсцесів Мунро, лейкоцитарної інфільтрації, еритродіапедезу і крововиливів.
Внаслідок коморбідного патоморфогенезу ушкоджень сполучнотканинної основи шкіри у хворих на Пс і ГХ відбуваються: значний інтерстиційний набряк сосочкового шару; перифокальна лейкоцитарна інфільтрація, ексудація, транссудація, плазморагії у складі дермальних сосочків; лімфостаз і локальне розширення лімфатичної дренажної ланки мікроциркуляції; сладжування еритроцитів, еритродіапедез, крововиливи; посилення ЕД з активацією судинно-тромбоцитарного гемостазу.
Враховуючи індукований характер експресії iNOS клітинами сполучної тканини та ендотеліоцитами і міоцитами мікросудин, доцільно припустити, що на тлі поєднаної патології (Пс і ГХ) у складі морфологічно ушкодженої шкіри відбувається істотна активація синтезу аномальних форм NOS, що за своєю інтенсивністю значно перевищує таку при Пс без ГХ і може слугувати критерієм глибини структурних змін шкіри у даного контингенту хворих.
Усі зазначені зміни морфологічного субстрату ушкодження шкіри у хворих з коморбідною патологією дозволяють більш досконально й адекватно розкрити патологічні зрушення лабораторних та інструментальних попередніх досліджень. І найголовніше, вони ставлять остаточну крапку в розробці диференційованих показань і раціональної патогенетичної терапії як дерматозу, так і ГХ при їх комбінації майже у третини хворих на Пс.
Матеріали даного розділу опубліковані в таких роботах:
[56, 57, 60, 64, 66]
