Запорізький державний медичний університет
Міністерство охорони здоров’я України
Державна установа «Інститут дерматології та венерології
Національної академії медичних наук України»
Кваліфікаційна наукова
праця на правах рукопису
Макуріна Галина Іванівна
УДК 616.517-06-091.8-092.18-036-08-035
ДИСЕРТАЦІЯ
ПСОРІАЗ ТА КОМОРБІДНІ СТАНИ: КЛІНІКО-МОРФОЛОГІЧНІ ОСОБЛИВОСТІ, МЕХАНІЗМИ РОЗВИТКУ, ПІДХОДИ ДО ЛІКУВАННЯ
14.01.20 – шкірні та венеричні хвороби
222. Медицина
Подається на здобуття наукового ступеня доктора медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
__________________________________________________________________
(підпис, ініціали та прізвище здобувача)
Наукові консультанти:
Федотов Валерій Павлович,
доктор медичних наук, професор;
Візір Вадим Анатолійович,
доктор медичних наук, професор
Запоріжжя – 2017
АНОТАЦІЯ
Макуріна Г.І. Псоріаз та коморбідні стани: клініко-морфологічні особливості, механізми розвитку, підходи до лікування. – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня доктора медичних наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби (222. Медицина). – Запорізький державний медичний університет МОЗ України, Державна установа «Інститут дерматології та венерології» НАМН України, Харків, 2017.
Дисертаційна робота присвячена проблемі оптимізації лікування хворих на псоріаз у поєднанні з гіпертонічною хворобою (ГХ) шляхом розробки диференційованої комплексної терапії на підставі вивчення клінічних проявів, імунних та ангіогенних механізмів, нейрогуморальних процесів та морфологічних змін шкіри.
У роботі проведено дослідження особливостей клінічного перебігу псоріазу в залежності від статі, віку, маси хворих, тривалості і тяжкості дерматозу та ГХ, встановлено частоту їх асоціації. При обстеженні 460 хворих на псоріаз артеріальна гіпертензія була виявлена у 171 (37,17 %) пацієнта. Для вивчення патогенетичних механізмів і лікування в процесі динамічного спостереження перебували 170 хворих на псоріаз, з яких 72 мали нормальні цифри артеріального тиску (група порівняння із псоріазом); у 98 – спостерігалася артеріальна гіпертензія у вигляді ГХ ІІ стадії (основна група); другу групу порівняння склали 47 пацієнтів з ГХ ІІ стадії; контрольна група представлена 37 практично здоровими особами.
Середній вік пацієнтів основної групи із псоріазом і супутньою ГХ склав (54,1 ± 1,0) року. Аналіз індексу маси тіла по групах свідчить, що простежується достовірний зв’язок між його підвищенням і формуванням зазначеної коморбідної патології. Так, в групі порівняння із псоріазом відсоток пацієнтів з нормальним індексом маси тіла склав 50 %, у хворих на ГХ групи порівняння – 28 %, при поєднаній патології – лише 10 %.
Особливості перебігу псоріазу на тлі ГХ полягають у формуванні значної кількості тяжких форм дерматозу. Так, в групі порівняння із псоріазом тяжкий перебіг дерматозу, який визначали при клінічному дослідженні з урахуванням PASI i DLQI, спостерігався у 26,4 %, а в групі з коморбідною патологією – у 59,2 %, серед яких найбільш часто реєстрували артропатичний псоріаз і вульгарний бляшковий з явищами ексудації. Виявлено, що у чоловіків основної групи тяжкі форми у 51,4 % випадків були представлені вульгарним псоріазом з явищами ексудації, у 34,3 % – артропатією, у жінок переважав артропатичний псоріаз (73,9 %).
Вперше встановлено рівні активності імунозапального процесу при зазначеній коморбідності на підставі підвищення вмісту прозапальних цитокінів. Встановлено, що в групі з поєднаною патологією рівень маркерів запального процесу (IL-1β, IL‑1α, IL-6) достовірно перевищував аналогічні показники груп порівняння із псоріазом або ГХ. В основній групі відзначалося прогресивне збільшення рівня TNF-α в 4,11 разу (p <0,05) відносно групи хворих на псоріаз, і в 6,34 разу (p <0,05) стосовно групи порівняння з ГХ.
Вперше встановлено порушення регуляції процесів ангіогенезу дослідженням VEGF-А у хворих на псоріаз із супутньою ГХ. При дослідженні VEGF-А достовірно встановлено, що його рівень у пацієнтів основної групи ([760,0 ± 67,5] пг/мл) був у 4,16 та 1,80 разу вищим відносно хворих груп порівняння з ГХ або псоріазом відповідно. Процес новоутворення судин істотно зростає на тлі приєднання ГХ до дерматозу і формування типової для цієї коморбідності форми – вульгарного псоріазу з явищами ексудації. Визначено критичний рівень VEGF-А (700 пг/мл) для формування тяжкого ураження шкіри з ознаками ексудації.
Вперше виявлено зростання активності апоптозу при поєднанні псоріазу і ГХ, що доведено дослідженням каспази-8 у пацієнтів основної групи в порівнянні з хворими на ГХ (вище у 3,5 раза) або псоріаз (у 2,1 раза більше). Більш виражений цей маркер у жінок, при тяжких формах дерматозу, особливо – артропатичній формі, ступінь ураження шкіри також негативно впливає на рівновагу процесів, стимулює процеси апоптозу. Встановлено, що значення каспази-8 більше 0,22 нг/мл – статистично достовірно асоціюється з формуванням ураження суглобів при псоріазі.
Підтверджено клініко-патогенетичне значення дисфункції ендотелію судин при псоріазі визначенням кореляційних зв’язків між тяжкістю перебігу дерматозу, ГХ, показниками ендотеліну-1, нітротирозину, гомоцистеїну.
У хворих на псоріаз у поєднанні з ГХ спостерігається достовірне збільшення рівня маркерів вазоконстрикції (ендотеліну-1) і нітрозуючого стресу (нітротирозину). Нітротирозин найбільш виражений при тяжких формах дерматозу в основній групі, що свідчить про найвищу активність окислювальної деструкції оксиду азоту у цих хворих. У жінок значно вище рівні і нітротирозину, і ендотеліну-1 за рахунок значної кількості артропатичного псоріазу.
Дослідженням гомоцистеїну встановлено, що збільшення його рівня і розвиток ендотеліальної дисфункції максимально визначені при коморбідній патології в порівнянні з групами хворих лише на ГХ або псоріаз (у 2,96 і 1,81 раза достовірно більше відповідно). Найвищі значення гомоцистеїну і пов’язаний з цим ризик розвитку серцево-судинних подій зафіксовані в групі з еритродермічною / артропатичною / пустульозною формами.
При вивченні обміну оксиду азоту встановлено найвищі рівні нітритів та активності NOS в групі з поєднаною патологією, саме у цих хворих спостерігається гіперпродукція оксиду азоту, але за наявності значного дефіциту системи антиоксидантного захисту, що продемонстровано зниженням рівня супероксиддисмутази, каталази, зсувом відношення відновленого/окисленого глутатіону у бік окислених форм, формуються явища нітрозуючого і оксидативного стресу, дефіцит вазодилататорів, зростання дисфункції ендотелію. Встановлено, що низький рівень співвідношення (менше 6 ум.од) відновленого / окисленого глутатіону достовірно збільшує ймовірність розвитку тяжких форм псоріазу, у зв’язку з чим може виступати у якості предиктора тяжкості дерматозу.
Вперше встановлено дефіцит факторів ендотеліопротекції на підставі зниження вмісту ендотеліального рецептора протеїну С (EPCR). Вміст цього маркера антикоагулянтної, цитопротективної і протизапальної активності у пацієнтів основної групи становить (800,68 ± 46,34) нг/мл, що в 1,99 разу нижче відносно групи порівняння з ГХ ([1591,08 ± 51,98) нг/мл) та в 1,57 разу – відносно групи порівняння з псоріазом ([1257,87 ± 22,73] нг/мл).
Найбільш частим чинником, який призводив до появи перших проявів або загострення хвороби у пацієнтів як основної, так і груп порівняння, був стрес, тому вплив його на різні ланки патогенезу коморбідного стану потребував ретельного вивчення. Визначена різниця стану регулюючих систем у хворих на псоріаз при наявності чи відсутності ГХ, зокрема показано, що дезадаптаційні розлади у цих хворих характеризуються змінами стресорних гормонів (кортизолу та інсуліну), біогенного аміну (збільшення вмісту серотоніну) і є найбільш суттєвими при поєднанні дерматозу з ГХ.
При дослідженні рівня кортизолу в групах з’ясовано, що найвищі його значення ([21,18 ± 0,89] мкг/дл) виявлено у хворих на ГХ. У пацієнтів з гіпертензією рівень кортизолу був на 35,08 % вищим за аналогічний показник хворих лише на псоріаз і на 238,34 % (р<0,05) достовірно вище, ніж у з пацієнтів з поєднаною патологією.
При розгляді результатів дослідження інсуліну у сироватці хворих різних груп відзначено максимальні цифри даного показника у пацієнтів основної групи, а різниця в значеннях цього гормону відносно груп порівняння, як першої (хворих лише на псоріаз), так і другої (хворих на ГХ), склала 44,20 % і 66,67 % (р<0,05) відповідно.
Виявлення низького показника кортизол-інсулінового індексу (0,24 ум.од.) в основній групі може свідчити про виснаження адаптаційних можливостей, потенційний зрив регуляторних механізмів, знижену стресостійкість.
Результати визначення рівня сироваткового серотоніну свідчили про те, що у пацієнтів основної групи реєструвалися найвищі показники, а щодо груп порівняння, різниця становила 119,65 % і 238,34 % (р<0,05) для пацієнтів із псоріазом і ГХ відповідно.
Вперше простежено взаємозв’язок між показниками тривоги/депресії (за шкалою HADS) і рівнем серотоніну сироватки крові у хворих із зазначеною коморбідною патологією. Визначено, що залежність має U- подібну форму, тому коефіцієнт кореляції низький (нелінійна асоціація). Найбільші бали за цією госпітальною шкалою (>15 балів) частіше мали пацієнти з дуже низьким рівнем серотоніну (менше 100 нг/мл) або дуже високим (більше 600 нг/мл) при р<0,05. Найбільш сприятливими рівнями серотоніну для хворих основної групи визначено від 130 до 200 нг/мл.
Встановлено розлади механізмів регуляції варіабельності серцевого ритму з дисбалансом вегетативної нервової системи за рахунок посилення тонусу симпатичного відділу у хворих на псоріаз, одночасно з пониженням тонусу парасимпатичного відділу при поєднанні дерматозу з ГХ. У хворих на псоріаз у поєднанні з ГХ у більшості випадків зареєстровано тяжкі форми дерматозу, які корелюють з більш тяжкими змінами вегетативної регуляції.
Вперше на підставі добового моніторування артеріального тиску у хворих з поєднаною патологією визначено типи порушень циркадного ритму переважно у вигляді недостатнього його зниження у вечірні та нічні години, загальна кількість таких хворих становила 57,7 % у групі порівняння та 63,6 % в основній групі.
Вперше при одночасному перебігу псоріазу і ГХ визначено типові морфологічні порушення в епідермісі та дермі із залученням епідермо-дермального з’єднання, мікроциркуляторного русла, залежні від прогресування дерматозу та поєднання з ГХ, дано гістоморфологічне обґрунтування особливостей встановлених клініко-лабораторних змін. Морфологічним субстратом ушкодження шкіри у хворих на псоріаз і ГХ є комплекс локальних і системних порушень, а саме: перифокальна гіперплазія і дистрофія кератиноцитів з акантолізом і деструкцією епідермально-дармального з’єднання, включаючи фрагментацію базальної мембрани епідермісу; гіперпроліферація клітин (ендотеліоцитів, перицитів, гладких міоцитів) у складі стінки мікросудин з розвитком гіалінозу й еластофіброзу артеріол; дисеміноване порушення ангіоархітектоніки артеріол і внутрішньососочкових гемокапілярів; дифузний фіброз сосочкового шару і фіброеластоз сітчастого шару дерми; виразна експресія іNOS кератиноцитами та клітинами дерми.
При порівнянні рівня експресії іNOS в епідермісі хворих на псоріаз обох груп встановлена достовірна різниця (р=0,041) з більш високим рівнем при коморбідній патології, аналогічна тенденція (р=0,030) виявлена у дермі хворих на псоріаз. У складі сосочкового та сітчастого шарів дерми пацієнтів основної групи спостерігалась інтенсивна цитоплазматична і навколоядерна експресія iNOS у фібробластах, ендотеліальних та гладком’язових клітинах судин мікроциркуляторного русла.
Вперше залежно від клініко-функціональних порушень визначено показання, обґрунтовано і розроблено комплексну диференційовану терапію хворих на псоріаз із супутньою ГХ із призначенням антиоксидантних, антидепресантних засобів, а також методу біоадаптивного управління (БЗЗ-тренінгу), визначено їх ефективність.
Встановлено, що призначення запропонованої терапії дозволяє підвищити ефективність терапії хворих з більш швидким регресом клінічних проявів дерматозу, ознакою достовірної ефективності чого є PASI 75, яке встановлено у 64,4% хворих, у 28,9% пацієнтів – PASI 50. На тлі запропонованої терапії у 35,5% хворих основної групи цифри артеріального тиску знижувалися в середньому на 15-20 мм рт. ст., у 51,1% пацієнтів спостерігалася стійка ремісія дерматозу протягом 1 року. Запропонована терапія також сприяє нормалізації чи тенденції до нормалізації досліджуваних показників лабораторних і функціональних досліджень у хворих на псоріаз у поєднанні з ГХ.
Ключові слова: псоріаз, гіпертонічна хвороба, тривога, якість життя, цитокіни, васкулогенез, апоптоз, адаптація, ендотеліальна дисфункція, біологічний зворотний зв’язок.
ABSTRACT
Makurina G. I. Psoriasis and comorbid conditions: clinical and morphological features, mechanisms of development, approaches to treatment. – Qualifying scientific work as manuscript.
The thesis for obtaining academic degree of Ph.D.Med. majoring in 14.01.20 –“Skin and venereal diseases” (222. Medicine). – Zaporizhia State Medical University of Ministry of Health of Ukraine, State Establishment «Institute of Dermatology and Venereology of NAMS of Ukraine», Kharkiv, 2017.
The thesis related on problem of optimization of therapy for patients with psoriasis combined with essential hypertension (EH) by developing differentiated complex therapy based on the study of clinical manifestations, immune and angiogenic mechanisms, neurohumoral processes and morphological changes in the skin.
In the work the research of special features of clinical course of psoriasis depending on sex, age, weight of patients, duration and severity of dermatosis and EH was performed. Also frequency of their associations was determined. During examination of 460 patients with psoriasis the arterial hypertension was revealed in 171 (37.17 %) patients. In order to study pathogenetic mechanisms and treatment 170 patients with psoriasis were under the case follow-up and among them 72 persons had normal figures of arterial pressure (psoriasis comparison group). In 98 persons the arterial hypertension was presented in form of EH of II stage (the main group). The second comparison group consisted of 47 patients with EH of II stage. Control group was presented by 37 practically healthy persons.
Average age of patients of the main group with psoriasis associated with EH made (54.1 ± 1.0) years. Analysis of the body weight index according to groups indicates the fact that statistically significant connection is observed between its rise and formation of mentioned comorbid pathology. Thus in psoriasis comparison group percentage of patients with normal body weight index made 50% and for comparison group patients with EH it made 28% and in case of combined pathology it made only 10 %.
Special features of clinical course of psoriasis associated with EH are the formation of significant quantity of severe forms of dermatosis. Thus in psoriasis comparison group the severe course of dermatosis was observed in 26.4 % and in comorbid pathology group it was observed in 59.2 %. Among them psoriasis arthropica and plaque psoriasis vulgaris with exudation effects were the most frequently registered. It was revealed that men of the main group in 51.4 % of cases had psoriasis vulgaris with exudation effects and in 34.3 % they had arthropathy. For women psoriasis arthropica was predominant (73.9 %).
For the first time the levels of activity of immune and inflammatory process with mentioned comorbidity were determined based on increase of content of anti-inflammatory cytokines. It was determined that in group with associated pathology the level of markers of inflammatory process (TNF-α, IL-1β, IL-1α, IL-6) statistically and significantly exceeded the same indices of psoriasis or EH comparison groups.
For the first time the disorder of regulation of angiogenesis processes was revealed by means of VEGF-А study in patients with psoriasis associated with EH. During VEGF‑А study there was statistically and significantly determined that its level for the main group patients ([760.0 ± 67.5] pg/ml) was in 4.16 and 1.80 times higher relatively to patients of EH or psoriasis comparison groups correspondingly. Process of new growth of vessels considerably increases in case of overlay of EH on dermatosis as well as generation of form (typical to this comorbodity) such as plaque psoriasis vulgaris with exudation effects rises. The critical level of VEGF-А (700 pg/ml) for formation of severe damage of skin with exudation effects was revealed.
For the first time the rise of apoptosis activity was revealed in case of overlay of psoriasis and EH. This fact is confirmed by studies of caspase-8 in patients of the main group comparing to patients with EH (in 3.5 times higher) or psoriasis (in 2.1 times higher). This marker is more evident in women with severe dermatosis forms, especially arthropical form. Degree of the skin damage has also negative effect on balance of processes and stimulates the apoptosis processes. It is determined that caspase-8 value is higher than 0.22 ng/ml and it associates statistically and significantly with formation of joint damage in case of psoriasis.
Patients with psoriasis combined with EH have statistically significant increase of level of markers of vasoconstriction (endothelin-1) and nitrosative stress (nitrotyrosine). Nitrotyrosine is more evident in the main group in case of severe dermatosis forms. It indicates the maximum activity of oxidative destruction of nitric oxide in these patients. Women have statistically higher levels of nitrotyrosine and endothelin-1 due to considerable quantity of psoriasis arthropica.
By means of homocysteine studies it is determined that increase of its level and development of endothelial dysfunction are revealed as much as possible in case of comorbid pathology compared with group of patients only with EH or psoriasis (correspondingly in 2.96 and 1.81 times statistically higher). The maximum values of homocysteine and associated risk of development of cardiovascular events are registered in group with erythrodermic/ arthropical/ pustular forms.
During study of nitric oxide metabolism it was determined the maximum levels of nitrites and activity of NOS in group with combined pathology. Patients of this group have hyperproduction of nitric oxide but with available considerable deficit of antioxidative defense system. It is shown by decrease of level of superoxide dismutase, catalase, shifting of reduced/oxidated glutathione ratio towards oxidated forms. Nitrosative and oxidative stress events, deficit of vasodilatotrs and increase of endothelium occur.
It is determined that low level of ratio (less than 6 relative units) of reduced/oxidated glutathione statistically increase the possibility of development of severe forms of psoriasis and due to this fact it can be the predictor of dermatosis severity.
For the first time the deficit of endothelium protection factors was determined based on decrease of content of endothelial C protein receptor (EPCR). Content of this marker of anticoagulating, cytoprotective and anti-inflammatory activity in patients of the main group makes (800.68 ± 46.34) ng/ml that is in 1.99 times lower relative to comparison group with EH ([1591.08 ± 51.98] ng/ml) and in 1.57 times lower relative to comparison group with psoriasis ([1257.87 ± 22.73] ng/ml).
The stress was the most frequent factor which caused occurrence of the first signs or exacerbation in patients of both the main and comparison groups. Thus effect of the stress on different branches of comorbid condition pathogenesis required intensive study. The difference of condition of regulating systems in psoriasis patients with or without EH is determined, particularly it is shown that disadaptation disorders in these patients are characterized by changes of stress hormones (cortisol and insulin), biogenic amine (increase of serotonin content) and they are the most significant in combination of dermatosis with EH.
During study of cortisol level in groups it was found that the maximum cortisol values ([21.18 ± 0.89] µg/dl) had been revealed in patients with EH. During study of research results of insulin in blood serum of patients of different groups it was noted that the maximum figures of this index in patients of the main group and difference in values of this hormone relative to the comparison group. Reveal of the low cortisol-insulin index (0.24 relative units) in the main group can indicate exhaustion of adaptive abilities, potential failure of regulating mechanisms and decreased tolerance for stress.
Results of determination of blood serotonin level showed that patients of the main group had the maximum values. As to the comparison group the difference made 119.65 % and 238.34 % (р<0.05) for patients with psoriasis and EH correspondingly.
For the first time the connection between anxiety/depression indices (according to HADS scale) and blood serotonin level in patients with mentioned comorbid pathology was observed. It was determined that dependence is U-shaped, thus correlation factor is low (non-linear association). Patients with very low serotonin level (less than 100 ng/ml) or with very high level (more than 600 ng/ml) provided that р<0.05 had more often the maximum points according to this hospital scale (>15 points). The most favorable serotonin levels for patients of the main group were determined 130 – 200 ng/ml.
The disorders of mechanisms of heart rate variability regulation with unbalance of vegetative nervous system were determined due to increase of sympatic segment tonus in patients with psoriasis simultaneously with decrease of parasympatic segment tonus in case of dermatosis and EH combination. In majority of cases patients with psoriasis combined with EH have severe forms of dermatosis which correlate with more serious changes of vegetative regulation.
For the first time based on daily monitoring of arterial pressure in patients with combined pathology the types of circadian rhythm disorders were determined mainly in form of its insufficient decrease in the evening and at night. General quantity of such patients made 57.7 % in comparison group and 63.6 % in the main group.
For the first time during simultaneous course of psoriasis and EH the typical morphological disorders were determined in epidermis and derma with involvement of epiderm-dermal junction and microvasculature depending on progress of dermatosis and combination with EH. Histomorphologic substantiation of special features of revealed clinical and laboratory changes was given. The Morphological substrate of the skin damage in patient with psoriasis and EH is the complex of local and system disorders namely: perifocal hyperplasia and dystrophy of keratinocytes with acantholysis and destruction of epiderm-dermal junction including fragmentation of epidermis basal membrane; hyperprolifiration of cells (endotheliocytes, pericytes, smooth muscle cells) incorporated in wall of microcirculation vessels with development of hyalinosis and elastic fibrosis of arterioles; disseminated disorder of angioarchitecture of arterioles and internal papillary hemocapillaries; diffusive fibrosis of papillary layer and fibroelastosis of reticular dermis; evident expression of іNOS by keratinocytes and derma cells.
Comparing level of іNOS expression there was determined statistically significant difference in epidermis of psoriasis patients of both groups (р=0.041) with higher level in case of comorbid pathology. The same tendency (р=0.030) was revealed in derma of patients suffering from psoriasis. Intensive cytoplasmic and paranuclear іNOS expression in fibroblasts, endothelial and smooth muscle cells of vessels of microvasculature was observed in papillary layer and reticular dermis of the main group patients.
For the first time depending on clinical and functional disorders the indication was determined. Complex differentiated therapy of psoriasis patients with associated EH was grounded and developed with prescription of antioxidants and antidepressants as well as method of bioadaptive management (biological feedback training) and their efficiency was determined.
It was determined that prescription of the suggested therapy permits to increase efficiency of therapy for patients with more quick regression of dermatosis clinical manifestations. The sign of its efficiency is PASI 75, which was determined in 64.4% of patients and 28.9% of patients have PASI 50. With proposed therapy 35.5% of patients of the main group had arterial pressure values decreased at average for 15-20 mm Hg. and 51.1% of patients had steady remission of dermatosis within one year. Proposed therapy also helps to normalize or promote tendency towards normalization of investigated indices of laboratory and functional tests in patients suffering from psoriasis combined with EH.
Key words: psoriasis, essential hypertension, anxiety, quality of life, cytokines, vasculogenesis, apoptosis, adaptation, endothelial dysfunction, biological feedback.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Кірієнко В. О., Макуріна Г. І., Якименко Є. С. Порушення фізіологічних маркерів психоемоційного напруження та їх корекція з використанням температурно-міографічного тренінгу в комплексній терапії псоріатичної хвороби у хворих з надмірною масою тіла та артеріальною гіпертензією. Український журнал дерматології, венерології, косметології. 2015. №1 (56). С. 24-32.
- Федотов В. П., Визир В. А., Макурина Г. И. Особенности иммунорегуляторных процессов у больных псориазом в сочетании с гипертонической болезнью. Український журнал дерматології, венерології, косметології. 2015. №3 (58). С. 18-22.
- Федотов В. П., Визир В. А., Макурина Г. И. Взаимосвязь между степенью тяжести псориаза и уровнем ФНО-α у больных псориазом в сочетании с гипертонической болезнью. Запорожский медицинский журнал. 2015. №3(90). С. 43-47.
- Макуріна Г. І., Федотов В. П., Візір В. А. Гендерні особливості епідеміології та клініки псоріазу з супутньою артеріальною гіпертензією. Запорожский медицинский журнал. 2015. № 5 (92). С. 28-32.
- Макурина Г. И. Изучение механизмов активации васкулярного эндотелия у больных псориазом и артериальной гипертензией. Запорожский медицинский журнал. 2016. № 1 (94). С. 19-24.
- Макурина Г. И. Клиническое значение нарушения обмена серотонина у пациентов с псориатической болезнью. Дерматологія та венерологія. 2016. № 1 (71). С. 34-41.
- Макуріна Г. І. Стан епідермісу та епідермально-дермального з’єднання шкіри хворих на псоріаз і гіпертонічну хворобу. Патологія. 2016. № 1 (36). С. 73-78.
- Макуріна Г. І. Морфологічні особливості мікроциркуляторного русла шкіри у хворих на псоріаз і гіпертонічну хворобу. Морфологія. 2016. Т. 10. № 1. С. 38-48.
- Макуріна Г. І., Баударбекова М. М. Особливості активності iNOS у вогнищах ураженої шкіри хворих на псоріаз із супутньою артеріальною гіпертензією. Патологія. 2016. № 2 (37). С. 40-46.
- Макуріна Г. І. Клініко-морфологічні паралелі у хворих на псоріаз із супутньою артеріальною гіпертензією. Український журнал дерматології, венерології, косметології. 2016. № 3 (62). С. 18-26.
- Макурина Г. И. Патогенетические эффекты плазменных тиолов у больных псориазом на фоне артериальной гипертензии. Актуальні питання фармацевтичної і медичної науки та практики. 2016. № 3 (22). С. 67-74.
- Visir V. A., Makurina G. I. State of free-radical processes and antioxidant defence of patients with psoriasis and concomitant essential hypertension. Запорожский медицинский журнал. 2016. № 4 (97). С. 21-28.
- Visir V. A., Makurina G. I. Clinical efficiency and dermoprotection of 2-ethyl-6-methyl-3-hydroxypyridine succinate drug in case of psoriasis: from the antioxidation point of view. Запорожский медицинский журнал. 2016. № 5 (98). С. 31-38.
- Vizir V. A., Makurina G. I. Features of arterial hypertension course in patients with psoriasis. Запорожский медицинский журнал. 2017. Т. 19. № 2 (101). С. 129-134.
- Дюдюн А. Д., Макурина Г. И., Полион Н. Н., Колева Н. Н., Али Лоай. Эффективность применения растительного комбинированного препарата ЛИВ.52 и Серезиса в комплексном лечении больных псориазом. Дерматологія. Косметологія. Сексопатологія. 2012. № 1-4. С. 291-296.
- Федотов В. П., Візір В. А., Макуріна Г. І. Особливості клінічних проявів та перебігу псоріазу у хворих з супутньою артеріальною гіпертензією. Дерматологія. Косметологія. Сексопатологія. 2014. № 1-4. С. 47-50.
- Макурина Г. И. Нитрозирующий стресс при псориатической болезни в сочетании с єссенциальной гипертензией. Вісник проблем біології і медицини. 2015. Вип. 3. Т. 2 (123). С. 159-165.
- Макуріна Г. І. Особливості вегетативної регуляції у хворих на псоріаз у поєднанні з артеріальною гіпертензією. Дерматологія. Косметологія. Сексопатологія. 2015. № 3-4. С. 40-45.
- Макурина Г. И. Апоптоз-опосредованные механизмы и цитокиновый баланс у больных псориазом на фоне артериальной гипертензии. Сучасні медичні технології. 2016. № 1 (28). С. 24-28.
- Макуріна Г. І. Патоморфогенез сполучнотканинного компоненту шкіри хворих на псоріаз і гіпертонічну хворобу. Вісник проблем біології і медицини. 2016. Вип. 2. Т. 2 (129). С. 191-194.
- Макурина Г. И. Новые аспекты механизмов формирования псориаза при сопутствующей артериальной гипертензии. Актуальні проблеми сучасної медицини. 2016. Т. 16. Вип. 2 (54). С. 134-141.
- Макурина Г. И. Особенности течения псориаза на фоне гипертонической болезни у мужчин. Дерматологія. Косметологія. Сексопатологія. 2016. № 1-4. С. 30-34.
- Макурина Г. И. Клинико-эпидемиологические особенности течения псориаза на фоне артериальной гипертензии у мужчин. Чоловіче здоровʼя, гендерна та психосоматична медицина. 2016. № 1 (03). С. 116-121.
- Спосіб лікування хворих на псоріаз із супутньою артеріальною гіпертензією : пат. Україна № 98942 / Г. І. Макуріна, В. А. Візір, Є. С. Якименко. № u201413203 ; заяв. 09.12.2014 ; опубл. 12.05.2015, бюл. № 9.
- Спосіб лікування псоріазу із супутньою артеріальною гіпертензією : пат. Україна № 114594 / Г. І. Макуріна, В. А. Візір. № u201610029 ; заяв. 03.10.2016; опубл. 10.03.2017, бюл. № 5.
- Макурина Г. И. Особенности развития псориатической болезни у пациентов с сопутствующей артериальной гипертензией. Клинические лекции по дерматовенерологии и косметологии / под ред. В. П. Федотова, А. И. Макарчука. Т. 3. Запорожье – Днепропетровск : Просвіта, 2014. С. 384-397.
- Федотов В. П., Візір В. А., Макуріна Г. І. Оцінка ефективності нових методів психокорекції в комплексній терапії хворих на псоріаз з супутньою артеріальною гіпертензією. Молоді науковці – майбутнє української дерматовенерології : зб. робіт за матеріалами наук.-практ. школи (20-21 листопада 2014 року. м. Київ). Київ, 2014. С. 71-73.
- Макурина Г. И., Федотов В. П., Визир В. А. Цитокиновый профиль больных псориазом с сопутствующей артериальной гипертензией. Актуальні питання косметології та дерматології : зб. тез ІХ Всеукр. наук.-практ. конф. з міжнар. участю (23-24 квітня 2015 р. м. Запоріжжя). Запоріжжя, 2015. – С. 14.
- Макурина Г. И. Особенности суточного ритма артериального давления у больных псориазом с сопутствующей артериальной гипертензией. Актуальні питання клінічної медицини : матеріали ІХ Всеукр. наук.-практ. конф. молодих вчених (30 жовтня 2015 року). Запоріжжя, 2015. С. 69-70.
- Макуріна Г. І. Оцінка впливу коморбідних станів у хворих на псоріаз. Дерматовенерологія. Косметологія. Сексопатологія. 2015. № 3-4. С. 120-121.
- Макурина Г. И. Состояние эндотелиальной дисфункции у пациентов, страдающих псоріазом в сочетании с артериальной гипертензией. Дерматовенерология и эстетическая медицина. (Ташкент). 2015. № 3 (27). С. 144.
- Макурина Г. И. Маркеры нитротирозирующего стресса при псориазе и коморбидной артериальной гипертензии. Сборник материалов конференции, посвященной 100-летию академика В. Ю. Ахундова. Баку, 2016. С. 265-266.
- Макурина Г. И. Особенности формирования псориаза при коморбидной патологии. Сучасні наукові дослідження представників медичної науки – прогрес медицини майбутнього : зб. тез наук. робіт учасників міжнар. наук.-практ. конф. (1-2 квітня 2016 р.). Київ, 2016. С.49-51.
- Макуріна Г. І. Стан метаболізму нейромедіатора серотоніна при формуванні артеріальної гіпертензії на тлі псоріазу. Актуальні проблеми клінічної, теоретичної, профілактичної медицини, стоматології та фармації : зб. матеріалів міжнар. наук.-практ. конф., Одеса, 8–9 квітня 2016 р. Одеса : ОМІ, 2016. С. 50-53.
- Макуріна Г. І. Стан ендотеліальної дисфункції у хворих на псоріаз із супутньою артеріальною гіпертензією. Медична наука та практика в умовах сучасних трансформаційних процесів : зб. тез наук. робіт учасників міжнар. наук.-практ. конф., 22-23 квітня 2016 р. Львів. 2016. Ч. 2. С. 21-23.
- Макурина Г. И. Клинико-лабораторные параллели тяжести псориаза и состояния апоптоза у пациентов с сопутствующей артериальной гипертензией. Актуальні питання теоретичної і практичної медицини : матеріали IV Міжнар. наук.-практ. конф. студентів і молодих учених (21-22.04.16). Сумы, 2016. С. 127.
- Макуріна Г. І. Апоптозні аспекти порушення метаболізму цитокінів при псоріазі та гіпертонічній хворобі. Весняні наукові читання : матеріали ІІ міжнар. наук.-практ. конф., 28 квітня 2016 р. Київ : «Велес», 2016. Ч. 2. С. 121-123.
- Макурина Г. И. Морфофункціональний стан шкіри у хворих на псоріаз із супутньою гіпертонічною хворобою. Актуальні питання косметології та дерматології : зб. матеріалів Х Всеукр. наук.-практ. конф. з міжнар. участю, 28-29 квітня 2016 р. Запоріжжя, 2016. С. 5-6.
- Макуріна Г. І. Динаміка рівня фактору некрозу пухлин альфа при псоріазі в умовах гіпертонічної хвороби. Актуальні питання розвитку медичних наук у ХХІ ст. : зб. тез наук. робіт учасників міжнар. наук.-практ. конф., 27-28 травня 2016 р. Львів, 2016. С. 39-42.
- Макуріна Г. І. Порівняльна характеристика перебігу псоріазу у чоловіків та жінок на тлі гіпертонічної хвороби. Особливості модернізації предмету досліджень представників медичних наук: зб. тез наук. робіт учасників між нар. наук.-практ. конф., 3-4 червня 2016 р. Київ, 2016. С. 68-70.
- Макуріна Г. І. Стан васкулярного ендотелію у хворих на ексудативний псоріаз. Медицина XXI століття: перспективні та пріоритетні напрями наукових досліджень: зб. матеріалів міжнар. наук.-практ. конф., Дніпро, 22–23 липня 2016. Дніпро : Організація наукових медичних досліджень «Salutem», 2016. С. 42-46.
- Макурина Г. И. Ангиогенез как патогенетический фактор прогрессирования заболевания в условиях хронического дерматоза. Медична наука та практика ХХІ століття : зб. тез міжнар. наук.-практ. конф. (Київ, 3-4 лютого 2017 р.). Київ : «Київський медичний науковий центр», 2017. С. 39-42.
- Макурина Г. И. Гомеостатический баланс гликемии как патогенетический аспект формирования хронического дерматоза на фоне артериальной гипертензии. Перспективні напрями розвитку сучасних медичних та фармацевтичних наук : зб. матеріалів міжнар. наук.-практ. конф. (Дніпро, 10-11 лютого 2017 р.). Дніпро : Організація наукових медичних досліджень «Salutem», 2017. С. 54-57.
- Макуріна Г. І. Ефективність комплексної терапії хворих на псоріаз. Актуальні питання наукової та практичної косметології 2017 : матеріали Всеукр. наук.-практ. конф. з міжнар. участю (27-28 квітня 2017 року, м. Запоріжжя). Запоріжжя, 2017. С. 21-22.
- Макурина Г. И. Динамика сывороточных значений кортизола и инсулина как регуляторов вуглеводного обмела у больных псориазом в сочетании с гипертонической болезнью на этапах долговременной адаптации. Південноукраїнський медичний науковий журнал. 2017. № 16. С. 62-63.
ЗМІСТ
| Перелік умовних позначень | 21 |
| Вступ | 23 |
| Розділ 1 Огляд літератури | 32 |
| 1.1 Сучасне уявлення щодо спільності патогенетичних механізмів псоріазу та коморбідних станів | 32 |
| 1.1.1 Коморбідні стани при псоріазі | 32 |
| 1.1.2 Порушення механізмів імунної регуляції та процесів апоптозу при псоріазі та гіпертонічній хворобі | 36 |
| 1.1.3 Ендотеліопатія у хворих на псоріаз у поєднанні з гіпертонічною хворобою | 42 |
| 1.1.4 Порушення нейровегетативної регуляції та обміну нейротрансмітерів у патогенетичних механізмах псоріазу | 49 |
| 1.3 Сучасні погляди на терапію псоріазу | 63 |
| Розділ 2 Матеріали та методи дослідження | 69 |
| 2.1 Клінічна характеристика груп | 69 |
| 2.2 Лабораторні методи | 88 |
| 2.3 Інструментальні методи дослідження | 90 |
| 2.4 Гістологічні та імуногістохімічні методи | 94 |
| 2.5 Визначення якості життя пацієнтів, рівня тривоги та депресії | 100 |
| 2.6 Статистичні методи обробки інформації | 101 |
| Розділ 3 Профіль прозапальних цитокінів у хворих з поєднаною патологією | 104 |
| Розділ 4 Функціональний стан судинного ендотелію у хворих на псоріаз із супутньою гіпертонічною хворобою | 119 |
| 4.1 Ангіогенез і апоптоз при псоріазі, гіпертонічній хворобі та їх поєднанні | 119 |
| 4.2 Визначення рівня факторів вазоконстрикції, метаболізму оксиду азоту, активності NO-синтаз та стану антиоксидантної системи | 128 |
| 4.3 Визначення рівня гомоцистеїну в групах дослідження | 152 |
| 4.4 Дослідження ендотеліального рецептора протеїну С | 158 |
| Розділ 5 Стан регулюючих систем у хворих на псоріаз при наявності та відсутності коморбідних станів | 167 |
| 5.1 Гуморальні ефектори системи адаптації | 167 |
| 5.2 Визначення рівня та значущості біогенних амінів | 178 |
| 5.3 Показники стану нейро-вегетативної регуляції | 188 |
| Розділ 6 Патоморфологічні та імуногістохімічні аспекти поєднання псоріазу і гіпертонічної хвороби | 196 |
| 6.1 Стан епідермісу та епідермально-дермального з’єднання | 196 |
| 6.2 Морфологічні особливості мікроциркуляторного русла дерми | 206 |
| 6.3 Патоморфогенез сполучнотканинного компоненту дерми | 219 |
| 6.4 Результати імуногістохімічного дослідження експресії індуцибельної синтази оксиду азоту | 222 |
| Розділ 7 Статистичний аналіз взаємозв’язків клініко-лабораторних та інструментальних показників у хворих | 231 |
| Розділ 8 Комплексна патогенетична терапія з клініко-лабораторною оцінкою її ефективності | 245 |
| Розділ 9 Узагальнення результатів дослідження | 256 |
| Висновки | 294 |
| Рекомендації | 298 |
| Список використаних джерел | 299 |
| Додаток А Акти впровадження | 336 |
| Додаток Б Список публікацій здобувача за темою дисертації та відомості про апробацію результатів дисертації | 352 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
АГ – артеріальна гіпертензія
АОС – антиоксидантна система
АПС – активований протеїн С
АПФ – ангіотензинперетворюючий фермент
АТ – артеріальний тиск
АФГ – альдегідфенілгідразони
БЗЗ – біологічний зворотний зв’язок
ВНС – вегетативна нервова система
ВРО – вільно-радикальне окислення
ВСР – варіабельність серцевого ритму
ГГЦ – гіпергомоцистеїнемія
ГЛУв – глутатіон відновлений
ГЛУо – глутатіон окислений
ГМЦР – гемомікроциркуляторне русло
ГХ – гіпертонічна хвороба
ДАТ – діастолічний артеріальний тиск
ДМАТ – добове моніторування артеріального тиску
ЕД – ендотеліальна дисфункція
ЗДМУ – Запорізький державний медичний університет
ІМТ – індекс маси тіла
ІР – інсулінорезистентність
ІФ-γ – інтерферон-γ
КІІ – кортизол-інсуліновий індекс
КФГ – кетондинітрофенілгідразони
МІ – мітотичний індекс
ОМБ – окисна модифікація білків
ПрАГ – прихована артеріальна гіпертензія
Пс – псоріаз
САД – систолічний артеріальний тиск
СОД – супероксиддисмутаза
УОЩ – умовна оптична щільність
ЧСС – частота серцевих скорочень
ЯЖ – якість життя
DLQI – дерматологічний індекс якості життя
EPCR – ендотеліальний рецептор протеїна С
HIF – фактор, індукований гіпоксією
IL – інтерлейкін
iNOS – індуцибельна синтаза оксиду азоту
NF-kB – нуклеарний фактор капа-В
NOS – синтаза оксиду азоту
PASI – індекс поширеності і тяжкості псоріазу
SERT – білок-переносник серотоніну
Th – T-хелпери
TNF-α – фактор некрозу пухлини α
VEGF – васкуло-ендотеліальний фактор росту судин
VEGFR – рецептори васкуло-ендотеліального фактора росту
ВСТУП
Актуальність теми. Псоріаз (Пс) до теперішнього часу залишається актуальною проблемою дерматології через значну поширеність дерматозу, недостатню вивченість етіології та механізмів розвитку, збільшення в останні роки частоти тяжких інвалідизуючих форм захворювання, соціально-психологічну дезадаптацію пацієнтів, торпідність до терапії та неминучість рецидивів [7, 10, 11, 25, 345]. Саме тому епідеміологічне, клінічне та соціальне значення дослідження цього дерматозу в сучасних умовах важко переоцінити.
Згідно із сучасною науковою концепцією, Пс – це мультифакторна хвороба за участю генетичних і середовищних факторів, патогенетичною основою якої є хронічне запалення шкіри та інших органів. Існують дані, які дозволяють визначити Пс як системне і навіть автоімунне захворювання, в патогенезі якого важливу роль відіграють поліорганні зрушення, що може свідчити про системність ураження організму [23, 144, 152, 268, 375]. Вітчизняні та іноземні автори підкреслюють, що, за сучасними уявленнями про ПС, значну частину механізму розвитку його складає хронічне запалення, яке, поряд з імунопатологічною, нейроендокринною складовою, призводить до системних зрушень, серед яких – метаболічний синдром [7, 268]. Цей симптомокомплекс є одним із факторів ризику розвитку не тільки цукрового діабету, захворювань серцево-судинної системи, але й Пс, тому посідає особливе місце у дослідженні механізмів розвитку та особливостей перебігу дерматозу. З урахуванням цих факторів, в останні роки значна увага приділяється дослідженню коморбідних станів [86, 132, 223, 413]. Одні з найчастіших – захворювання серцево-судинної системи, особливо гіпертонічна хвороба (ГХ), яка, за даними різних авторів, поширена у хворих на Пс [222, 281, 292, 379]. Деякі автори вказують на наявність спільних патогенетичних факторів при Пс і ГХ [10, 11], але, незважаючи на це, певні механізми розвитку взаємозв’язку, взаємозалежності та взаємодії цих двох нозологій остаточно не з’ясовані.
Важливим є диференційований підхід до призначення терапії хворим на різні клінічні форми Пс із супутньою ГХ залежно від ступеня артеріальної гіпертензії (АГ), у максимально ранні терміни виявлення, застосування адекватних комплексних методів, спрямованих не лише на припинення чи мінімізацію запальних процесів, пов’язаних з дерматозом, але й на покращення стану серцево-судинної системи. Більш глибоке і детальне розуміння механізмів формування цього коморбідного стану дозволить розробити систему терапевтичних заходів стосовно Пс на тлі супутньої ГХ, це сприятиме зниженню кількості інвалідизуючих форм дерматозу, профілактиці серцево-судинних подій, збереженню професійної працездатності та соціальної адаптації, покращенню якості життя (ЯЖ) пацієнтів. Потребує вдосконалення діагностика і проведення обґрунтованих лікувально-профілактичних заходів стосовно хворих на Пс із зазначеною супутньою патологією.
Зв’язок роботи з науковими програмами, планами, темами. Робота виконана в рамках науково-дослідної роботи Запорізького державного медичного університету «Розробка методів терапії та профілактики рецидивів хронічних дерматозів та хвороб, що передаються статевим шляхом, із урахуванням особливостей гомеостазу хворих та супутньої патології» (№ держреєстрації 0113U000800). Здобувач є співвиконавцем теми.
Дисертантом особисто виконано основні фрагменти наукових робіт з епідеміологічних, поведінкових, біохімічних, імуноферментних, функціональних, гістологічних, імуногістохімічних досліджень, розробка медикаментозних та функціональних методів терапії.
Мета та задачі дослідження. Мета роботи – оптимізація лікування хворих на Пс у поєднанні з ГХ шляхом розробки диференційованої комплексної терапії на підставі вивчення клінічних проявів, імунних та ангіогенних механізмів, нейрогуморальних процесів та морфологічних змін шкіри.
Для досягнення поставленої мети були поставлені такі задачі:
1. Дослідити клініко-епідеміологічні особливості Пс при коморбідній патології.
2. Визначити рівень прозапальних цитокінів у хворих при поєднанні Пс і ГХ залежно від особливостей клінічних проявів дерматозу.
3. Визначити показники прогнозування розвитку різних форм дерматозу залежно від стану ангіогенезу та апоптозу у хворих на Пс і ГХ.
4. Проаналізувати співвідношення рівня вазоконстрикторів та вазодилататорів у хворих на Пс у поєднанні з ГХ.
5. Оцінити рівень маркерів пошкодження та захисту ендотелію у пацієнтів з Пс на тлі супутньої ГХ.
6. Визначити особливості адаптаційних процесів при коморбідній патології на підставі дослідження гуморальних факторів, стану вегетативної нервової системи (ВНС), виявити взаємозв’язок між нейрогуморальною регуляцією, показниками добового моніторування артеріального тиску (ДМАТ) та перебігом Пс.
7. Дослідити особливості морфогенезу як в осередках ураження, так і в неураженій шкірі, значення обміну оксиду азоту (NO) шляхом імуногістохімічного дослідження активності індуцибельної NO-синтази (іNOS) безпосередньо в шкірі при Пс та ГХ.
8. Провести кореляційний аналіз клінічних особливостей, результатів лабораторного та інструментального дослідження основних патогенетичних процесів, гістологічних ознак ураження шкіри у хворих на Пс із супутньою ГХ.
9. Обґрунтувати доцільність призначення антиоксидантних препаратів, методу біоадаптивного управління, селективних інгібіторів зворотного захвату серотоніну хворим з коморбідною патологією.
10. Оцінити ефективність запропонованої терапії, розробити і впровадити в систему охорони здоров’я алгоритм терапії і профілактики рецидивів Пс у поєднанні з ГХ із застосуванням медикаментозних факторів, тренінгу біологічного зворотного зв’язку (БЗЗ).
Об’єкт дослідження – Пс, ГХ.
Предмет дослідження – особливості перебігу і клінічних проявів Пс у поєднанні з ГХ, стан нервово-ендокринної системи, прозапальної активації, функції ендотелію судин; показники метаболізму оксиду азоту, глутатіону, тіол-дисульфідного балансу, окисної модифікації білка (ОМБ), рівень та експресія NO-синтази, гістоморфологічний стан шкіри, ефективність лікування і профілактики.
Методи дослідження: клінічні (огляд хворого, збір анамнезу для постановки діагнозу, визначення форми, розповсюдженості Пс з визначенням індексу поширеності та тяжкості [PASI]); анкетування з оцінкою ЯЖ, рівня тривоги і депресії; загальноклінічні лабораторні дослідження; біохімічні (ліпідограма, показники функції печінки, коагулограма, дослідження обміну NO, стану антиоксидантної системи [АОС]); імуноферментні: визначення вмісту васкуло-ендотеліального фактору росту А (VEGF-A), ендотеліального рецептору протеїну С (EPCR), фактору некрозу пухлини-α (TNF-α), ендотеліну-1, гомоцистеїну, нітротирозину, каспази-8, інтерлейкіну-1α (ІL-1α), інтерлейкіну-1β (ІL-1β), інтерлейкіну-6 (ІL-6), інсуліну, кортизолу, серотоніну сироватки крові; інструментальні: ДМАТ, дослідження варіабельності серцевого ритму (ВСР), обстеження і проведення БЗЗ-тренінгів за допомогою апарату «Бослаб-професійний Плюс»; патоморфологічні та імуногістохімічні (оцінка біоптатів псоріатичного висипу та неураженої шкіри у хворих на Пс, ГХ, їх поєднання); статистичні методи.
Наукова новизна отриманих результатів. Вперше на підставі аналізу результатів комплексних клініко-лабораторних та інструментальних досліджень визначено деякі спільні патогенетичні ланки Пс та ГХ, а саме – імунне запалення, дисфункція ендотелію, нейрогуморальні зрушення, гістоморфологічні процеси, експресія іNOS; показано, що сумація їх дії погіршує перебіг і посилює тяжкість псоріатичного процесу.
Вперше при Пс із супутньою ГХ встановлено порушення регуляції процесів ангіогенезу та апоптозу на підставі підвищення рівня VEGF-А і каспази-8.
Вперше встановлено дефіцит факторів ендотеліопротекції шляхом визначення зниженого вмісту EPCR, пов’язаного як з тяжкістю Пс, так і з приєднанням ГХ до дерматозу.
Вперше, з урахуванням результатів ДМАТ, у хворих на поєднану патологію визначено типи порушень циркадного ритму переважно у вигляді недостатнього його зниження у вечірні та нічні години, встановлено їх зв’язок з тяжкими формами Пс.
Вперше визначено типові морфологічні порушення в епідермісі і дермі із залученням епідермо-дермального з’єднання, мікроциркуляторного русла, залежні від прогресування дерматозу і поєднання з ГХ, дано гістоморфологічне обґрунтування особливостей встановлених клініко-лабораторних змін. Встановлено порушення метаболізму NO у шкірі хворих на Пс за рахунок активації iNOS, особливо при обтяженні ГХ.
Вперше, залежно від клініко-функціональних порушень, визначено показання, обґрунтовано і розроблено комплексну диференційовану терапію хворих на Пс при супутній ГХ із призначенням антиоксидантних, антидепресантних засобів, БЗЗ-тренінгу, визначено її ефективність.
У роботі дістало подальшого розвитку дослідження особливостей клінічного перебігу Пс залежно від статі, віку, маси хворих, тривалості та тяжкості дерматозу та ГХ, встановлено частоту асоціації Пс і ГХ.
Доповнено відомості щодо існування імунозапального процесу на підставі підвищення рівня прозапальних цитокінів при Пс, особливо в поєднанні з ГХ. Уточнено наукові дані про гуморальні зміни, ступінь напруження прозапальної цитокінової активації дослідженням TNF-α, ІL-1α, ІL-1β, ІL-6, показано значення маркерів системної запальної відповіді у формуванні тяжких форм дерматозу.
Підтверджено клініко-патогенетичне значення дисфункції ендотелію судин при Пс визначенням кореляційних зв’язків між тяжкістю перебігу дерматозу, ГХ і показниками ендотеліну-1, нітротирозину, гомоцистеїну.
Встановлено порушення метаболізму NO у вигляді підвищення у крові рівня ключових показників нітрозуючого стресу – NO-синтази, нітритів, нітротирозину, особливо при тяжких формах дерматозу і ГХ. Доповнено наукові дані стосовно стану антиоксидантної системи, простежено зв’язок між ступенем розладів і прогнозуванням перебігу дерматозу.
Визначено різницю стану регулюючих систем у хворих на Пс при наявності чи відсутності ГХ, зокрема показано, що дезадаптаційні розлади у цих хворих характеризуються змінами стресорних гормонів (зниження рівня кортизолу та підвищення рівня інсуліну, зниження кортизол-інсулінового індексу) і біогенного аміну (збільшення вмісту серотоніну) і є найбільш суттєвими при поєднанні дерматозу з ГХ. Вперше простежено взаємозв’язок між показниками тривоги/депресії і рівнем серотоніну сироватки крові у хворих із зазначеною коморбідною патологією.
Встановлено розлади механізмів регуляції варіабельності серцевого ритму з дисбалансом ВНС за рахунок посилення тонусу симпатичного відділу у хворих на Пс, одночасно з пониженням тонусу парасимпатичного відділу при поєднанні дерматозу з ГХ.
Практичне значення отриманих результатів. Розроблено і впроваджено в практичну охорону здоров’я метод терапії хворих на Пс із супутньою ГХ з використанням препаратів армадін, есциталопрам, БЗЗ-тренінгів, які нормалізують більшість клініко-лабораторних показників, що забезпечує підвищення ефективності лікування (патенти на корисну модель № 98942 UA [2015 р.] та № 114594 UA [2017 р.]).
Розроблено інтегральний підхід до ранньої діагностики коморбідних станів, своєчасної корекції виявлених клініко-лабораторних порушень.
Запропоновано визначення рівнів серотоніну, каспази-8, VEGF-A, нітротирозину сироватки крові, співвідношення глутатіону відновленого/окисленого для використання в якості прогностичних критеріїв подальшого можливого тяжкого перебігу дерматозу.
Показано доцільність проведення ДМАТ, що дозволяє виявити хворих на Пс з порушеннями нейрогуморальної регуляції тонусу судин і проводити надалі їх терапевтичну корекцію.
Запропоновано методику дослідження стану тривоги/депресії, яка на тлі дослідження рівня серотоніну сироватки крові є показанням для призначення психокоригуючої терапії.
Запропоновані системні, патогенетично обґрунтовані підходи до діагностики і лікування хворих на Пс із супутньою ГХ впроваджено в клініці КУ «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради (КУ «ЗОШВКД» ЗОР), КЗ «Обласний шкірно-венерологічний диспансер» (м. Дніпро), КУ Тернопільської обласної ради «Тернопільський обласний клінічний шкірно-венерологічний диспансер», ОКЗ «Криворізький шкірно-венерологічний диспансер», КЗ «Хмельницький обласний шкірно-венерологічний диспансер», Обласний шкірно-венерологічний диспансер Житомирської обласної ради, Закарпатський обласний клінічний шкірно-венерологічний диспансер, КЗ «Кіровоградський обласний шкірно-венерологічний диспансер», КУ «Одеський обласний шкірно-венерологічний диспансер», КЗ «Рівненський обласний шкірно-венерологічний диспансер».
Теоретичні положення дослідження і практичні рекомендації впроваджено в практику навчання студентів усіх факультетів Запорізького державного медичного університету (ЗДМУ). Результати дисертації впроваджені і використовуються в навчальному процесі ДЗ «Запорізька медична академія післядипломної освіти МОЗ України», ДЗ «Дніпропетровська медична академія МОЗ України», ДВНЗ «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України», ДВНЗ «Івано-Франківський національний медичний університет», Харківського національного медичного університету.
Деякі положення, висновки та пропозиції, викладені у дисертації, мають дискусійний характер і можуть бути основою для подальших наукових досліджень.
Особистий внесок здобувача. Дисертаційна робота є самостійною науковою працею, яка має наукове і практичне значення. Усі її основні положення одержано особисто автором. Матеріали наукових праць, виданих у співавторстві, використано у дисертації лише в частині, що належать здобувачу. У дисертації викладено наукові результати, які одержано особисто дисертантом під час науково-дослідних робіт протягом 2013-2017 років. Здобувачем особисто виконано інформаційно-патентний пошук та аналіз літератури за темою дисертаційної роботи. Самостійно здійснено відбір хворих, розподіл їх за групами, проведення та контроль результатів терапії. Автором сформовано базу даних, проведено статистичну обробку результатів дослідження, узагальнено результати роботи, написано розділи дисертаційної роботи, сформульовано висновки і рекомендації.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Конфлікту інтересів немає.
Апробація результатів дисертації. Основні положення роботи висвітлені та обговорювалися на VІІІ Всеукраїнській науково-практичній конференції з міжнародною участю «Актуальні питання наукової і практичної косметології» 17-18 квітня 2014 р. (м. Запоріжжя, 2014), науково-практичній школі «Молоді науковці – майбутнє української дерматовенерології» 20-21 листопада 2014 р. (м. Київ, 2014), ІХ Всеукраїнській науково-практичній конференції з міжнародною участю «Актуальні питання косметології та дерматології» 23-24 квітня 2015 р. (м. Запоріжжя, 2015), Х Всеукраїнській науково-практичній конференції з міжнародною участю «Актуальні питання косметології та дерматології» 28-29 квітня 2016 р. (м. Запоріжжя, 2016), Всеукраїнській науково-практичній конференції УАЛДВК «Оптимізовані засади функціонування дерматовенерологічної служби в умовах розвитку страхової медицини та лікарського самоврядування в Україні» 5-6 листопада 2015 р. (м. Київ, 2015), Всеукраїнській науково-практичній конференції УАЛДВК з міжнародною участю «Сучасні підходи до формування клінічних настанов з діагностики і лікування шкірних захворювань та інфекцій, що передаються статевим шляхом: європейський досвід та українські реалії» 19-20 жовтня 2016 р. (м. Тернопіль, 2016), ІХ Всеукраїнській науково-практичній конференції молодих вчених «Актуальні питання клінічної медицини» 30 жовтня 2015 р. (м. Запоріжжя, 2015), Всеукраїнській Таврійській науково-практичній конференції за участю міжнародних спеціалістів «Сучасні технології в рішенні організаційних, епідеміологічних, клінічних та діагностичних задач дерматовенерології» 4-5 червня 2015 р. (м. Херсон, 2015), науково-практичній конференції «Новітні технології діагностичних, лікувальних та профілактичних заходів в дерматовенерології та методи і стан їхнього впровадження» 11-12 листопада 2016 р. (м. Харків, 2016), науково-практичній конференції за участю міжнародних спеціалістів «Індивідуальна анатомічна мінливість органів, систем, тканин людини та її значення для практичної медицини і стоматології» 19-20 травня 2016 р. (м. Полтава, 2016), науково-практичній конференції «Унифицированные медицинские установки в ведении пациентов с хроническими формами дерматозов» (м. Дніпро, 25 березня 2016 р.), науково-практичній конференції із міжнародною участю «Сучасні аспекти удосконалення надання спеціалізованої дерматовенерологічної допомоги населенню за вимогами імплементації Міжнародних медико-санітарних правил» (Харків, 2015). науково-практичній конференції «ХV-і читання ім. В.В. Підвисоцького» (м. Одеса, 2016).
Публікації. За результатами дослідження опубліковано 45 праць, з них 21 стаття у фахових виданнях, акредитованих ДАК України (12 написані у моноавторстві), 14 статей, що входять до міжнародних наукометричних баз Web of Science, Index Copernicus, Googlе Scholar, РІНЦ та інших, з яких 3 – англійською мовою та 21 – у матеріалах наукових форумів різного рівня, включаючи міжнародні; отримано 2 патенти України на корисну модель, опубліковано 1 клінічну лекцію.
Структура та обсяг дисертації. Дисертаційна робота викладена українською мовою на 360 сторінках машинописного тексту. Складається зі вступу, огляду літератури, характеристики матеріалів і методів дослідження, 6 розділів власних досліджень, обговорення результатів дослідження з аналізом та узагальненням отриманих даних, висновків, рекомендацій та списку використаної літератури. Робота ілюстрована 46 рисунками та містить 98 таблиць. Бібліографічний список містить 422 джерела, з них 100 – кирилицею і 322 – латиницею.
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУРИ
1.1 Сучасне уявлення щодо спільності патогенетичних механізмів псоріазу та коморбідних станів
Пс – це системне, рецидивуюче захворювання шкіри, яке виникає внаслідок спадкової схильності під дією різноманітних пускових чинників та характеризується появою на шкірі характерного висипу у вигляді ділянок потовщення шкіри (інфільтрації) з почервонінням (еритемою) та лущенням на поверхні елементів. За даними Міжнародної федерації асоціацій Пс, на цей дерматоз страждає 1,2-5 % населення в загальній популяції [267]. При тому, що Пс уражає переважно шкіру і суглоби (у 40 % хворих), у пацієнтів часто визначаються так звані коморбідні стани – психологічні порушення, метаболічний синдром (особливо при тяжких формах), захворювання серцево-судинної системи, серед яких однією з найбільш поширених є ГХ, панкреатит, хвороба Крона [203].
У більш ранніх дослідженнях вважалося, що Пс є захворюванням із провідною патологією кератиноцитів, проте в останні роки було визнано, що це складне автоімунне захворювання, в якому важливе значення має наявність певних факторів навколишнього середовища в поєднанні з генетичною схильністю, що призводить у результаті до маніфестації дерматозу у певній популяції людей [258].
1.1.1 Коморбідні стани при псоріазі
У медичній практиці досить давно почало формуватися уявлення про одночасний перебіг декількох захворювань, пов’язаних між собою патогенетичним механізмом – коморбідність. Співіснування і взаємний вплив захворювань, як правило, ускладнює перебіг хвороби і набуває все більш важливої ролі при формуванні діагнозу і тактики лікування пацієнта. В останні роки зафіксовано зростання багатьох дерматозів, у тому числі і Пс, пов’язаних патогенезом з патологією інших органів і систем. Значна поширеність даного дерматозу серед населення, його велика складова – 12-15 % у структурі загальної дерматологічної захворюваності, і, що особливо важливо, тенденція до зростання тяжких і торпідно перебігаючих форм, не можуть не хвилювати фахівців. Залишається в силі правило «третин», сформульоване у 2007 році американським дослідником E. Horn, згідно з яким дві третини пацієнтів мають легкі та помірно виражені прояви хвороби і лише одна третина страждає на середньотяжкий і тяжкий Пс. Однак більш часта реєстрація останніх в даний час свідчить про те, що процес еволюції клінічних проявів дерматозу триває і саме в останні роки все чіткіше формується думка фахівців про асоціацію дерматологічних проявів Пс з ураженням інших органів і систем, наслідком чого стала поява і часте використання в науковій літературі терміну «псоріатична хвороба». Псоріатична артропатія й оніхопсоріаз – давно відомі асоціації, та останнім часом дослідники вказують на інші серйозні супутні захворювання або стани, серед яких найважливіше значення мають: метаболічний синдром, кардіопатологія, цукровий діабет, інсулінорезистентність (ІР), ожиріння, гіперліпідемія, хвороба Крона, лімфома, рак [132, 223]. Пацієнти з тяжкими формами Пс нерідко схильні до підвищеного ризику розвитку кардіоваскулярної патології, найчастіше у варіанті інфаркту міокарда, АГ. Причому міжнародні дослідження не тільки підтвердили наявність цих супутніх захворювань, але також відзначили, що саме пацієнти, які страждають на тяжкі форми Пс, в порівнянні з людьми, які не мають даного дерматозу, мають і знижену тривалість життя [419].
Найчастіше при Пс зустрічається АГ (в 1,5 рази частіше, ніж у загальній популяції), порушення вуглеводного і ліпідного обміну, ураження клапанів серця, психо-неврологічні порушення [241]. На ранніх етапах розвитку псоріатичного процесу виявляються певні відхилення в діяльності серцево-судинної системи – тахікардія і брадикардія, систолічний шум на верхівці серця, зміщення меж серця за рахунок гіпертрофії та дилатації шлуночків, приглушеність тонів серця, ішемічна хвороба серця, ГХ. Пояснити підвищення серцево-судинної захворюваності і смертності хворих на Пс тільки з позиції класичних серцево-судинних факторів ризику не уявляється можливим. Серед можливих причин високої серцево-судинної захворюваності та смертності у хворих на Пс слід виділити системне запалення, дія якого не тільки посилює вплив традиційних факторів серцево-судинного ризику, але і безпосередньо впливає на судинну стінку, сприяючи пошкодженню ендотелію, підвищення жорсткості судин, порушення функції ендотелію й атеротромбоз [152]. Тобто, вивчення ролі факторів кардіоваскулярного ризику і запалення у розвитку серцево-судинної патології у хворих на Пс є актуальною міждисциплінарною проблемою. Цікавим є наявність взаємозв’язку між клінічними проявами Пс, лабораторними показниками запалення і змінами серцево-судинної системи хворих з даною патологією. Незважаючи на високу серцево-судинну захворюваність при Пс, вивчення факторів ризику серцево-судинної патології при даному захворюванні представлено нечисленними роботами.
Відомо, що у пацієнтів із Пс часто спостерігаються зміни, пов’язані з ІР (метаболічний синдром, дисліпідемії, діабет та ін.). Зокрема, R. Pereira та ін. недавно виявили статистично значущий зв’язок між Пс та ІР порівняно з контрольною групою, що вимагає в лікуванні Пс використовувати методи модифікації способу життя, корекцію дієти і фізичні навантаження на доповнення до фармакотерапії [331].
У хворих на Пс показники чутливості до інсуліну були значно нижчими порівняно з контрольною групою [186]. Ці результати були недавно підтверджені М. Gyldenlоve зі співавторами, які показали, що при нормальних значеннях глюкози у пацієнтів із різним ступенем Пс значно знижена чутливість до інсуліну порівняно зі зіставною за віком і статтю групою здорових осіб, що представляє само по собі Пс як стан переддіабету [328]. ІР також вказується в якості важливого механізму, який сприяє розвитку самого Пс, що призводить не тільки до серцево-судинних коморбідних захворювань, але і до формування певного фенотипу. Зокрема, С. Burger зі співавт. повідомили, що саме ІР сприяла гіперпроліферації та зміненій диференціації кератиноцитів [262]. Це дає можливість припускати, що ключові цитокіни індукції ІР в кератиноцитах і кінази, які опосередковують їх ефекти, можуть являти собою привабливі цілі для нових напрямків терапії Пс. Практично не проводилося раніше вивчення стану синтезу і секреції інсуліну, рецепторів до інсуліну у хворих на Пс у поєднанні з ГХ, що визначає необхідність проведення подальших досліджень у цьому напрямку.
ПС асоційований також із соціальною стигматизацією, болем, дискомфортом, втратою працездатності та психологічним дистресом [212]. На даний момент дослідження показують, що найбільш частими факторами, які передують початку і загостренню Пс, є різного роду стресові ситуації. У численних публікаціях вказується на роль психологічного напруження як тригерного фактора у виникненні та перебігу дерматозу. За літературними даними, з важкими психічними потрясіннями і вираженими негативними емоціями розвиток Пс та виникнення психогенно-спровокованих рецидивів пов’язують 20-89 % пацієнтів. При цьому психосоматичні розлади корелюють з площею ураження шкіри.
У Пс є істотний негативний вплив на ЯЖ пацієнтів. В огляді Національного фонду Пс майже 75 % пацієнтів вважали, що це захворювання має виражений негативний вплив на їх ЯЖ, змінюючи їх повсякденну активність [211]. В іншому дослідженні було показано, що, принаймні, 20 % хворих на Пс замислювалися про самогубство. Пацієнти часто відчувають труднощі через особливості своєї шкіри, у зв’язку з чим вони страждають від почуття сорому, ганьби, мають труднощі у взаєминах із оточуючими [212].
В одному з досліджень серед хворих на Пс були отримані результати, які свідчать, що приблизно у 10 % пацієнтів були відзначені бажання померти, суїцидальні думки відзначені у 5,5 % осіб [360]. Такі дослідження висунули на перший план потребу в психосоціологічній стратегії лікування пацієнтів із Пс, необхідність поліпшити їх ЯЖ.
Особливості перебігу захворювання часто викликають почуття безнадії. Пацієнти постійно стурбовані необхідністю лікування в майбутньому через непередбачуваність загострень, недостатній контроль клінічного перебігу. Пацієнти із Пс відзначають, що оточуючі, і навіть лікарі, іноді не в змозі оцінити негативний вплив захворювання на їхнє життя. Пс є фактором, який має великий соціальний вплив на якість спілкування осіб в колективі, викликає розбіжності з членами сім’ї. Хворі на цей дерматоз часто соромляться і почувають себе збентеженими через свій стан, вони відзначають це як найбільш неприємний аспект своєї хвороби [386]. Високі рівні емоційної напруженості відзначені і в оточення пацієнтів, які страждають на Пс, у них присутнє очікування можливості розвитку аналогічного захворювання шкіри [386].
Питання, які стосуються поширеності та нозологічної структури неврологічних і психічних розладів при Пс, залишаються недостатньо вивченими. В останні роки в доступній науково-практичній літературі зустрічаються нечисленні роботи, присвячені вивченню окремих психічних порушень у пацієнтів, які страждають на Пс. Отже, існує необхідність у дослідженні спектру неврологічних і психічних розладів у хворих на Пс із використанням сучасних підходів для розробки моделей диференційованої терапії та реабілітації.
1.1.2 Порушення механізмів імунної регуляції та процесів апоптозу при псоріазі та гіпертонічній хворобі
У хворих на Пс навіть на ранніх, доклінічних стадіях у результаті дефекту епідермальних структур відбувається активація імунокомпетентних клітин, при цьому зростає секреція біологічно активних речовин, підвищується вміст імунопатологічних комплексів [337], що в подальшому призводить до розвитку специфічних змін у шкірі. За умови антигенної стимуляції і наявності генетичної схильності в найбільш уразливих відділах шкіри відбувається процесинг автоантигену за участю внутрішньоепідермальних макрофагів (клітин Лангерганса), які в процесі міграції передають інформацію, презентуючи «псоріатичний антиген» Т-хелперам (Th) 0-лімфоцитам, при цьому активізуються ділянки головного комплексу гістосумісності. Антигенпрезентуючі клітини, які спостерігаються в підвищених концентраціях, виявляються у верхніх шарах дерми [375].
У хворих на Пс виявлено дисбаланс у функціональній системі Th1/Th2-цитокінів. При впливі досі неідентифікованого фактора, за участю інформуюючих антигенпрезентуючих клітин, індукується активація Th1- CD4+ лімфоцитів. Згідно з інфекційною теорією Пс, відбувається перекривання епітопів стафілококів із поверхневим білком М-кератиноцитів людини (феномен крос-презентації) [232]. При цьому утворюється пул цитотоксичних лімфоцитів, які активно діють на кератиноцити шкіри людини та індукують там апоптотичний процес. У нормі кератиноцити людини живуть 27-30 днів, тоді як у осіб із Пс цей час скорочується в 3 рази. Місцеве запалення, яке супроводжується активацією Th1-цитокінів (ІL-1, ІL-2, TNF-α), а також активаторів транскрипції (нуклеарний фактор капа-В [NF-kB]) і металопротеїназ, сприяє стимуляції ангіогенезу при підвищеній експресії VEGF [219], що формує клінічні прояви Пс. Залучення цитокінової системи в запальний процес супроводжується високим вмістом у місцях псоріатичних бляшок моноядерних фагоцитів, антиген-активованих T‑лімфоцитів, ендотеліоцитів і нейтрофілів. Прозапальні цитокіни забезпечують хемотаксис нейтрофілів, а також стимуляцію й активацію гранулоцитів [269]. Цитокіни ІL-1, ІL-8 і TNF-α підсилюють адгезивні властивості нейтрофілів при підвищенні експресії поверхневих молекул адгезії за рахунок взаємодії з ендотеліоцитами. Це полегшує потрапляння гранулоцитів із судинного русла в тканинні структури.
Цікавим є вивчення фактора транскрипції NF-kB у зв’язку з тим, що він має незвичайну регуляцію, велике число контрольованих генів, грає одну з центральних ролей в регуляції функцій процесів імунітету. Його активація відбувається у відповідь на вплив ІL-1, TNF-α, вірусну інфекцію, ультрафіолетове випромінювання, а також багато інших чинників [118]. Активація NF-kB призводить до стимуляції транскрипції iNOS, що каталізує синтез NO [317]. У регуляції NF-kB бере активну участь TNF-α. Цей цитокін сприяє активації NF-kB і, таким чином, проліферації клітин та посиленню запального процеса в шкірі. З іншого боку, активуються каспази, що індукують процеси апоптозу клітини. Ці зміни характерні для псоріатичної бляшки [397]. TNF-α є однією з основних ефекторних молекул, яка виділяється макрофагами, моноцитами, нейтрофілами, базофілами, еозинофілами, астроцитами, клітинами мікроглії, гладкої мускулатури, фібробластами, клітинами Лангерганса, Купферовськими клітинами та іншими – у відповідь на різні екзогенні та ендогенні подразники.
Під впливом епідермальних імунокомпетентних клітин відбувається активація і диференціація Th, які виділяють ендогенні медіатори з широким спектром дії (ІL-1, ІL-6, TNF-α). Дані цитокіни ініціюють ранню фазу імунного запалення (прозапальні цитокіни). Однак провідна роль в імунній відповіді належить активованим Th (Th1 і Th2), які виділяють цитокіни II покоління: Th1‑клітини виділяють ІL-2, ІL-3, TNF-α, колонієстимулюючий фактор, ІФ-γ та інші; Тh2-клітини виробляють ІL-4, ІL-5, ІL-10, ІL‑13 та ін. [232].
При формуванні осередку псоріатичного ураження послідовно відбуваються такі реакції: пошкодження клітин епідермісу і безпосередньо дерми з підвищенням проникності для антигенів, далі включаються механізми з виділенням великої кількості цитокінів кератиноцитами і клітинами Лангерганса; розвиток вазодилатації з підвищенням проникності судин і міграцією в дерму клітинних елементів крові. В інфільтраті дерми відбувається активація і диференціація Т-лімфоцитів, Th1 і Тh2-клітини секретують прозапальні цитокіни, під впливом яких стимулюється гіперпроліферація кератиноцитів [219, 232, 269].
Вивільняються цитокіни, які впливають на клітини-мішені, віддзеркалюючи таким чином в шкірі різні етапи локального запального процесу, типового для Пс. Хемотаксис нейтрофілів до місця тканинного пошкодження відбувається під впливом TNF-α [391]. Передбачається, що утворення інфільтрату в дермі та субкорнеальних мікроабсцесів Мунро визначається активністю цитокінів, які залучають в місця ураження клітини імунної системи.
У хворих на Пс захист стає патологічним через дисбаланс регуляторних систем імунітету і механізмів, які контролюють мітоз клітинних елементів. У результаті збільшення вмісту мітогенного епідермального фактора росту, формується акантоз, стимулюються мітотичні процеси в дермі, що характеризує стадію прогресування Пс [224]. У псоріатичному процесі гіперпродукція цитокінів яскраво відображена в зоні запалення і запального мікросередовища, в той же час в периферичній крові ці зміни можуть бути вкрай невираженими [312].
Точний механізм формування псоріатичних бляшок на шкірі в даний час залишається невизначеним, проте під час активації будь-якого з так званих тригерів відзначається взаємодія між кератоцитами та імунними клітинами під впливом каскаду молекул. На початку процесу ІФ-γ і TNF-α індукують клітини Лангерганса для виробництва ІL-12 і ІK-23. ІL-12 сприяє зміцненню профілю Th1-лімфоцитів, в той час як ІL-23 призводить до диференціації Th17-лімфоцитів, які продукують, в основному, ІL-17 та ІL-22 [387]. В епідермісі ІL-8 діє як потужний хемотаксичний фактор нейтрофілів і сприяє розвитку еритеми, характерної для псоріатичного ураження [263].
З іншого боку, в регуляторних T-клітинах показано порушення механізмів їх периферичного протизапального контролю. На думку кількох дослідників, виявлене зниження кількості та функціональної активності циркулюючих CD4+, CD25+, FOXP3+, Th-клітин у пацієнтів із Пс [154].
Рівень цитокінів ІL-17A, ІL-22 та ІL-6 був достовірно вищим у пацієнтів із Пс, однак не було виявлено взаємозв’язку між експресією системних цитокінів і тяжкістю захворювання [243]. Останні кілька років увагу дослідників було спрямовано на стан співвідношення Th1/Th17, описані високі рівні ІФ-γ, ІL-17 та його ізоформ у пошкодженій Пс шкірі [157].
АГ викликає ушкодження судинної стінки і ремоделювання судин. Імунна система чутлива до пошкодження тканинних елементів, беручи участь у всіх етапах структурних змін, у той же час забезпечує компенсаторні механізми регенерації або відновлення. Неінфекційні порушення процесів активації вродженого імунітету пов’язані з виділенням цитокінів і ліпідних медіаторів запалення, а також збільшенням кількості лейкоцитів, які сприяють запальним змінам в стінці судини [244, 255, 297]. При порушенні толерантності адаптивного імунітету можуть розвиватися запальні зміни в судинній стінці [133, 294]. Важливу роль у прогресуванні АГ додатково відіграють ендотеліальна дисфункція (ЕД) і підвищена жорсткість судинної стінки. З огляду на безліч генетичних, екологічних, циркадних, реноваскулярних, ендокринних чинників розвитку АГ, вторинне залучення імунних реакцій при пошкодженні судинної стінки і ремоделювання стає загальним патогенетичним механізмом патологічних станів, які супроводжують АГ і Пс [244, 255]. В якості альтернативи розглядається вплив факторів навколишнього середовища на розвиток аберантного імунітету, що призводить до вторинного пошкодження судинної стінки і наступного розвитку АГ, однак лише поодинокі дані підтверджують це теоретичне положення. Імунні зміни прискорюють прогресування АГ за рахунок посилення ЕД і порушення жорсткості судинної стінки [297].
Дослідження, проведені на практично здорових чоловіках, показали значне лінійне співвідношення між систолічним (САТ), діастолічним (ДАТ) і середнім АТ та рівнями ІL-6 [142]. У даній популяції також було виявлено біомаркери, які показують на ризик розвитку серцево-судинних несмертельних подій і смерті, що свідчить про причинно-наслідковий зв’язок між АТ і запальними реакціями. У наступних, крос-секціональних дослідженнях ці дані були підтверджені [254].
Залишаються невивченими і механізми локальних процесів запалення у пацієнтів із Пс і супутньою ГХ через різні механізми розвитку. Слід врахувати, що при Пс в першу чергу спостерігаються місцеві зміни вмісту цитокінів в осередках ураження шкіри, в той час, як ГХ характеризується глобальними змінами в судинах резистивного типу, які формують підвищений рівень АТ.
Апоптоз є програмованою клітинною смертю. Патологічний варіант клітинної загибелі – некроз, супроводжується запальним процесом. В результаті апоптозу відбувається дроблення клітин на мембранні везикули з внутрішньоклітинним вмістом. Вони поглинаються сусідніми клітинами або фагоцитуються імунокомпетентними клітинами. Основні молекулярні механізми апоптозу багато в чому залежать від активності каспаз – еволюційно-консервативних цистеїнових протеаз [250].
Апоптоз у більшості випадків асоційований з протеолітичною активацією каспаз. До них відносять цистеїнові протеази, які здатні специфічно розщеплювати білки [411]. За своєю структурою каспази поділяють на такі підродини:
а) каспаза-1 (каспаза -1, -4, -5),
б) каспаза-2 (каспаза-2)
в) каспаза-3 (каспаза-3, -6, -10).
За участю каспаз здійснюється формування інших субтипів каспаз із прокаспаз [411], а також протеоліз антиапоптозних білків Bcl-2. Піддається розпаду інгібітор ДНКази, який регулює фрагментацію ДНК. У нормі апоптозна ДНКаза об’єднується з її інгібітором. При апоптозі інгібітор ДНКази інактивується каспазами 3 типу [178], після чого звільнена ДНКаза індукує розрив хроматину, утворюються фрагменти ДНК із низькою молекулярною масою, що відповідає 180-200 парам нуклеотидів. У присутності каспаз відбувається гідроліз білків, які зміцнюють мембрану ядра. Каспази призводять до деструкції білків, які формують цитоскелет. При дії каспаз порушується регуляція білків, що беруть участь у репарації ДНК, їх реплікації. Мішенню каспаз є полі(аденозиндифосфат-рибоза)-полімераза. Даний ензим відіграє роль у репарації ДНК [285].
Прокаспази, на відміну від зрілої каспази, мають незначну протеолітичну активність [171]. Прокаспази знаходяться в мономерній формі в малій концентрації в латентному стані. При зближенні молекул прокaспаз у процесі агрегації утворюються активні каспази в процесі авто- або транс-процесингу [185]. Від прокаспази (М-30-50кДа) відбувається відділення N-кінцевого домену, решта поділяється на велику і малу субодиниці, які потім асоціюються. Таким чином відбувається активація прокаспази-8 із вивільненням в цитоплазму каспази-8. Каспаза-8 активує ефекторні каспаза-3 із прокаспази-3, після цього процес програмованої смерті стає незворотнім. Каспаза-3 активує фактор фрагментації ДНК, це призводить до необоротного розпаду ДНК на фрагменти [171].
Ще кілька десятиліть тому вивчення патогенезу Пс було прикуте до оцінки регуляції росту і диференціювання кератиноцитів. Пізніші наукові розробки показали, що регуляція смерті клітин не менш важлива для організму, ніж процеси проліферації, оскільки збільшення кількості клітин може бути результатом порушення обох процесів. При Пс порушення процесів проліферації і диференціювання кератиноцитів пояснюється гіперпродукцією цитокінів і факторів росту в результаті порушеної активації Т-клітинного імунітету [192]. Прониклі в епідерміс CD4+ лімфоцити в присутності цитокінів взаємодіють з кератиноцитами, що призводить до проліферації базальних клітин. На завершальному етапі запального процесу відбувається елімінація активованих Т-лімфоцитів в місцях псоріатичних бляшок за механізмом запрограмованої клітинної загибелі [128]. Завдяки апоптозу ліквідуються псоріатичні бляшки і відбувається відновлення нормального шкірного покриву. Порушення механізмів апоптозу у хворих на Пс, можливо, може бути одним із ключових патогенетичних ланок захворювання. Порушення процесів апоптозу у даній категорії пацієнтів сприяє збільшенню пулу активованих Т-лімфоцитів, збільшенню вмісту прозапальних цитокінів і факторів росту. Ці фактори обумовлюють гіперпроліферацію кератиноцитів і сприяють підтримці запального процесу [176].
Програмована загибель клітин здійснюється за участю групи генів, які виконують роль індукторів і блокаторів апоптозу. До ключових генів апоптозу належить р53, представник сімейства TNF-α і каспаз [351].
Таким чином, вивчення механізмів апоптозу у пацієнтів із поєднанням Пс та ГХ, а також ролі каспази-8 в реалізації цього процесу абсолютно показано для об’єктивного оцінювання істинного стану механізмів розвитку захворювання.
1.1.3 Ендотеліопатія у хворих на псоріаз у поєднанні з гіпертонічною хворобою
Проблеми ангіогенезу є актуальним питанням патогенетичних механізмів багатьох захворювань, до яких належить і Пс. Утворення нових судин із існуючих вивчають багато дослідників, оскільки підтримання патологічного процесу, як правило, вимагає власного кровопостачання [211]. Застосування терапевтичних впливів на ангіогенез дозволило зробити крок вперед у розробці нових методів лікування онкопатології, системних захворювань, імунних порушень. Молекулярні механізми дії VEGF-A досі залишаються остаточно не встановленими, оскільки вплив на його різні рецептори спричиняє різноспрямовані ефекти.
У фізіологічних умовах ангіогенез має помірну вираженість в онтогенезі і при відновленні ушкоджень, необхідності розвитку колатерального кровообігу. Надлишкова васкуляризація характерна для діабетичної ангіоретинопатії, Пс, ревматоїдного артриту [153]. Надмірне утворення судин має важливе значення для розвитку новоутворень, що вкрай важливо в осередку патологічного процесу розмірами більше декількох міліметрів [211].
Найважливішим регулятором ангіогенезу представляється VEGF-A – гoмoдимерний висoкoглікoзильoваний сигнальний білок. При гіпоксії виділяється гіпоксія-індукований фактор (HIF-1), індукуючий експресію деяких генів, які забезпечують виживання клітин при зниженні забезпечення киснем, зокрема, VEGF-А [276]. Під його впливом здійснюється проліферація і міграція ендотеліальних клітин, що призводить до утворення нових незрілих судин. За інших умов VEGF сприяє виживанню ендотеліоцитів, сповільнюючи апоптоз, що дозволяє здійснювати повне дозрівання капілярних судин, яке спостерігається в ділянках шкіри хворих на Пс.
Одним із патогенетичних механізмів при Пс є VEGF-індукований ангіогенез. У пацієнтів із Пс визначені високі сироваткові рівні VEGF і фактора стимуляції ендотеліальних клітин ангіогенезу (ESAF), при цьому ступінь тяжкості дерматозу тісно корелювала з рівнями VEGF у сироватці крові [193, 402]. Роль VEGF підтверджується сильною кореляцією між поліморфізмом одного з нуклеотидів гена VEGF і перебігом Пс [260], а також надлишковою експресією рецепторів васкуло-ендотеліального фактора росту (VEGFR) -1/2/3 в епідермісі хворих на Пс [325]. Крім того, рецептори до VEGFR були ідентифіковані in vitro як в уражених, так і навколовогнищевих кератоцитах у всіх шарах епідермісу.
У хворих на Пс відзначені високі рівні проангіогенних факторів (TNF-α, трансформуючий фактор росту – α, VEGF, ESAF, фактор, який індукується гіпоксією (HIF), ІL-8, ІL-17 та ангіопоетину) [228]. Спільна дія цих факторів стимулює клітинні елементи дерми з утворенням нових кровоносних судин [120]. Взаємодії між проангіогенними посередниками є дуже складними, наприклад, TNF-α має про- і антиангіогенну дію, через індукування інших проангіогенних факторів (фактор росту фібробластів, ІL-8 та VEGF [402].
Надлишкова експресія VEGF в біоптатах пацієнтів із Пс [120] є аргументом на користь важливої ролі VEGF у підтримці нормального функціонування епідермального бар’єру [196], а також для зв’язку між епідермальним VEGF і гіперплазією кератиноцитів, що також підтверджено. Таким чином, VEGF бере участь в проліферації кератиноцитів [196]. Оскільки VEGF збільшує експресію VEGFR в кератиноцитах і кератиноцити регулюють експресію VEGF, припускається, що VEGF надає автокринну дію на проліферацію кератиноцитів. Паралельно цьому процесу через дисфункції не тільки імунної, а й нервової системи формується характерний фенотип Пс [296]. Спостерігається стійке закріплення запального процесу при дерматозі [120]: VEGF підвищує експресію молекул клітинної адгезії з капілярів у формуванні та збільшенні проникності судин, тим самим сприяючи міграції лейкоцитів у псоріатичну папулу [253]. Цей процес призводить до збільшення споживання кисню, активації гіпоксид-індукованого ангіогенезу, факторів транскрипції, таких як HIF-1, і фіксації патологічного розвитку кровоносних судин, запального процесу при Пс [120].
При наявності численних досліджень у цьому напрямку патогенетичні механізми ангіогенезу у хворих на Пс водночас із ГХ залишаються невивченими.
У кінці ХХ століття однією з провідних ланок ряду кардіоваскулярних захворювань була визнана ЕД [183]. Сьогодні доведено різноманіття функцій судинного ендотелію, серед яких слід відзначити вазоактивну, антитромбоцитарну, антикоагулянтну, протизапальну, антиоксидантну, антипроліферативну. В експериментальних і клінічних роботах показано значення ендотелію як при розвитку Пс [342], так і формуванні більшості серцево-судинних захворювань [390].
Тонус судин ендотелію регулюється вазодилататорами, що знаходяться в динамічній рівновазі (простациклін, оксид азоту, ендотеліальний фактор, гіперполяризація та ін.), і вазоконстрикторами (ендотелін-1, ангіотензин II, тромбоксан А2 та ін.) [136]. Механічний вплив на стінки судин, збільшення концентрації вазоконстрикторів стимулює секрецію NO. Оксид азоту бере участь в регуляції адгезії лейкоцитів і тромбоцитів, ремоделюванні стінок судин, процесах запалення [214].
NO належить до вільнорадикальних кисневих сполук. Явища оксидативного стресу супроводжують процеси атеросклеротичних змін судин. У пацієнтів із АГ відзначений дисбаланс антиоксидантів та оксидативних процесів в бік переважання останніх. Радикальні сполуки сприяють розвитку ЕД і ремоделюванню судин у хворих на ГХ. При впливі радикальних форм кисню відбувається залуження середовища і зміна скоротливої здатності гладких м’язів судин. У процесі оксидативного стресу відбувається інактивація NO і зниження ендотелійзалежної вазодилатації [316], відзначається також посилення запальної реакції за рахунок збільшення експресії iNOS [159]. В процесі взаємодії вільнорадикальних кисневих сполук з NO утворюється пероксинітрит, який надає безпосередню токсичну дію на ендотелій, активуючи процеси апоптозу і мутагенезу [353].
Процеси оксидативного стресу пов’язані з автоімунними змінами в стінці артерій. При активації оксидативного стресу атерогенні ліпопротеїди отримують властивості автоантигенів, стимулюючи секрецію антитіл [130]. У процесі формування циркулюючих імунних комплексів, а також їх фіксації до стінки ендотелію розвивається пошкодження внутрішньої судинної оболонки, а також проникнення ліпопротеїдів вглиб судинної стінки [376]. У цих місцях продукти деградації сполучної тканини індукують покроковий прогресуючий розвиток атеросклеротичного процесу.
Судинний компонент як один із патогенетичних механізмів захворювання у хворих на Пс тісно пов’язаний з ЕД. Це супроводжується зниженням секреції вазодилататорів, перш за все, NO, а також підвищенням секреції вазоконстрикторів (ендотеліну-1, пероксинітриту та ін.) [266]. Ендотеліоцити беруть участь у синтезі антикоагулянтів, регулюють фібриноліз, секрецію протромбогенних речовин, беруть участь у підтримці судинного тонусу, контролюють запальні реакції у взаємодії з імунними клітинами, регулюють ріст клітин. Ендотелій є першим шаром між циркулюючою кров’ю і оточуючими тканинами, тому він в першу чергу страждає від дії різних патогенних факторів з боку кровотоку.
У відповідь на зміни локального гомеостазу ендотелій продукує різні речовини, які забезпечують зміни в бік відновлення рівноваги шляхом зміни тонусу гладком’язових клітин, регуляції запальних та імунних процесів в судинній стінці та ін. При деяких патологічних станах баланс вироблення речовин порушується, що призводить до розвитку ЕД [3].
Крім регуляції судинного тонусу, NO є активним учасником розвитку процесів запалення, які активуються при дії екзогенних та ендогенних медіаторів (TNF-α, ІL-4 та ін.). Початкові стадії розвитку Пс нерозривно пов’язані зі збільшенням ендогенного синтезу NO [289]. Основними причинами порушення вироблення NO вважають активність медіаторів запалення, цитокінів. У стані фізіологічного спокою NO виділяється в невеликих кількостях, він включається в патогенетичні ланки Пс.
Серед інших речовин, що виробляються ендотелієм судин, слід вказати на нітротирозин. L-тирозин в організмі людини є антиоксидантом, входить до складу білків і ферментів і, крім того, є субстратом для синтезу нейротрансмітерів (адреналіну, норадреналіну, дофаміну та ін.), входить до складу більшості білків. Вільні радикали окислюють тирозин із появою похідних 3-хлортирозину, 3-нітротирозину, 3,5‑дихлортирозину, які є маркерами окислення білків [100]. Під дією пероксинітриту тирозин перетворюється в нітротирозин, що порушує локальні антиоксидантні властивості. Нітротирозин є маркером запалення і синтезу NO. Шляхом утворення нітротирозину завершується утилізація пероксинітриту в ході метаболічних процесів, тому визначення його концентрації в плазмі використовують як індикатор NO-залежних пошкоджень. При відсутності явищ ЕД рівні нітротирозину дуже низькі.
Пероксинітрит утворюється при взаємодії NO і супероксиданіону. Ця речовина бере участь в нітруванні білків і пошкодженні клітини. Нітрування, в свою чергу, пригнічує роботу калієвих каналів, що порушує процеси розслаблення судинної стінки.
Утворення пероксинітриту, крім того, пошкоджує синтазу NO (NOS), в результаті чого фермент не виконує свої функції перенесення електронів до L-аргініну, що блокує синтез NO, в той же час формується гідроксид радикал •OH. Дисфункція NO і зниження його синтезу також залежить від вироблення кавеоліну-1 при стимуляції ліпопротеїдів низької щільності, який інактивує ендотеліальну NOS [385]. Таким чином, навіть незначна кількість кисневих радикалів викликає стрімке збільшення їх вмісту в тканинах, що сприяє прогресуванню системного запального процесу і може обтяжувати перебіг Пс.
Питання ЕД у хворих на Пс в поєднанні з ГХ залишаються невивченими, хоча передумови для вивчення цього коморбідного стану, безумовно, є незаперечними.
У місцях пошкодження судинного ендотелію відзначено велике скупчення клітин, що виділяють цитокіни [194]. Запалення при цьому не є захисним механізмом, а сприяє прогресуванню патологічного процесу [307]. Запальні процеси на ендотелії забезпечує активація ендотеліоцитів із підвищенням експресії на поверхні клітин хемокінів, що активують тромбоцити і забезпечують міграцію лейкоцитів до вогнища пошкодження [362].
У присутності цитокінів і факторів росту спостерігається скорочення ендотеліоцитів, при цьому збільшується проникність внутрішньої судинної стінки. Створюються сприятливі умови для міграції лейкоцитів [362]. Гіперпродукція іNOS призводить до гіперпродукції NO з наступною активацією процесів оксидативного стресу [149]. Цитокіни посилюють активність секвестрації нейтрофілів в мікроциркуляторному руслі. Судинну проникність ще більше підсилюють протеолітичні ферменти з вільнорадикальними кисневими сполуками [248]. Цитокінові сигнали поширюють запальний процес на інші групи ендотеліоцитів.
У великих судинах запальна реакція сприяє атеросклеротичному процесу [392] в судинах середнього та дрібного калібру, пошкодження яких характерно для АГ, активація тромбоцитів порушує кровопостачання відповідних ділянок організму, що призводить до тканинної гіпоксії, а також посилення явищ оксидативного стресу. Отже, локальне запалення, яке спостерігається, зокрема, при Пс [261], можливе за умови секреції молекул адгезії, виділення ендотелієм цитокінів і факторів росту, а також за участю підвищеної кількості лейкоцитів і тромбоцитів [344]. Механізм розвитку ЕД багатоступінчастий і багатофакторний, у пацієнтів із Пс у поєднанні з ГХ має свої особливості, які вимагають подальшого вивчення.
Досить часто в патогенезі різних нозологій, в тому числі і при такій поєднаній патології як Пс і ГХ, окислювальний стрес поєднується з карбонільним, які виникають в результаті збільшення концентрації активних сполук, що містять альдегідні та карбонільні групи. До цих сполук відносяться гліоксаль, метилгліоксаль, 3‑гідроксиглюкозон, що представляють собою продукти окислення глюкози й інших цукрів. Активними карбонільними сполуками є також малоновий діальдегід та 4‑гідроксиноненаль. Вищеперераховані сполуки модифікують амінокислотні залишки білків й азотисті основи нуклеїнових кислот, змінюючи властивості цих найважливіших біомолекул. Модифіковані білки є маркерами захворювань та інших патологій, що виникають при розвитку оксидативного стресу. Процеси окисної модифікації відбуваються в нормально функціонуючому організмі за рахунок систем окислення, що каталізуються металами [340]. Поява в клітині окислених білків активує мультикаталітичні протеази, що вибірково руйнують дефектні білки. На даний момент окислення білків розглядають як один із факторів регуляції синтезу і розпаду білка і вважають, що швидкість обігу внутрішньоклітинних білків залежить від співвідношення процесів окисної модифікації з подальшим протеолізом і синтезом de novo. Селективний протеоліз запобігає накопиченню в клітині окислених молекул й утворенню протеїнових агрегатів [330]. Це дозволяє зробити висновок, що формування і прогресування Пс на тлі ГХ пов’язане з активацією вільно-радикальних процесів при паралельній депресії АОС організму.
Активований протеїн C (AПC) утворюється, коли циркулюючий протеїн C активується тромбіном, пов’язаним із тромбомодуліном на поверхні ендотеліальних клітин. Перетворення посилюється зв’язуванням протеїну С із рецептором ендотеліальних клітин (EPCR) [215]. У присутності свого кофактора AПC регулює згортання крові шляхом катаболізму коагуляційних факторів Va та VIIIa для запобігання утворенню тромбіну. Введення протеїну С у пацієнтів із системною або місцевою гіперкоагуляцією може змінити аномалію. Незалежно від його антикоагулянтної активності, AПC має потужні протизапальні, антиапоптозні і бар’єр-стабілізуючі властивості, які є захисними при багатьох автоімунних і запальних захворюваннях, включаючи сепсис, діабет, пошкодження спинного мозку, астму [313]. Цитопротекторні властивості АПС в основному опосередковані через EPCR, що активується протеазою рецептора PAR-1 або рецептора епідермального фактора росту [109]. У людському епідермісі і культивованих людських кератиноцитах спостерігається експресія протеїну C та AПC [336]. Ці клітини також експресують всі інші шляхи протеїну C, включаючи EPCR, тромбомодулін, тромбін та інші. В епідермісі можливе перетворення протеїну С в його активну форму, регуляція активності AПC й опосередкування його функції [336]. In vitro видалення ендогенного протеїну С або AПC призводить до пригнічення нормальної функції кератиноцитів зі збільшенням активності процесів апоптозу і втратою бар’єрної функції [252].
Дефіцит АПС у людей проявляється безліччю ознак з боку шкіри, таких як гематоми, швидко прогресуючий некроз шкіри, як це відбувається при purpura fulminans [354]. Гомозиготна недостатність протеїну С часто призводить до неонатальної purpura fulminans і дуже часто до летального результату [175]. AПC стимулює зростання різних культивованих клітин, включаючи ендотеліальні клітини, клітини гладкої мускулатури, кератиноцити, нервові стовбурні клітини і клітини-попередники, нейробласти, остеобласти і теноцити за допомогою модуляції активності специфічних ферментів [313, 417]. Відповідно до стимулюючих ефектів на ріст клітин, AПC проявляє потужні антиапоптотичні властивості як in vitro, так і in vivo шляхом пригнічення проапоптотичних факторів, каспаз-3, -8, -9 [111], а також посилення антиапоптотичних молекул, включаючи еNOS [110]. Проліферація і міграція кератиноцитів є ключовими для нормального обміну епідермісу і відновлення його функції після травми шляхом заміни втраченої тканини. AПC запобігає апоптозу кератиноцитів за допомогою інгібування проапоптотичних факторів та індукції антиапоптозних медіаторів. AПC пригнічує активацію апоптотичного маркера, каспази-3, в культивованих кератиноцитах; активація каспази-3 збільшується, коли АПС пригнічується, що узгоджується з роллю протеїну С в запобіганні апоптозу кератиноцитів [416]. AПC сприяє міграції кератиноцитів залежним від концентрації чином [112], тоді як інгібування ендогенного протеїну С знижує міграцію кератиноцитів in vitro [416]. Ця функція AПC може бути частково опосередкована за допомогою регулювання матричних металопротеїназ, сімейства структурно пов’язаних цинк- і кальцій-залежних ендопептидаз, здатних руйнувати позаклітинні компоненти. In vivo проліферація і міграція кератиноцитів необхідні для повторної епітелізації під час загоєння ушкоджень шкіри, оскільки вони слугують для відновлення цілісності, а отже, бар’єрної функції шкіри. Місцеве застосування АПС при інтактній шкірі покращує загоєння ран шляхом стимуляції реепітелізації [336]. AПC також покращує цілісність ендотеліального бар’єру шляхом стабілізації / реорганізації цитоскелету, стимулювання експресії білка щільного з’єднання і клітинного перерозподілу контактів [147]. Недавні дослідження продемонстрували нову роль системи протеїну С в боротьбі з проникністю епітелію, наприклад, регулюючи молекули щільного з’єднання і зменшуючи кишкову проникність, сприяючи епітелізації слизових [400].
Незважаючи на те, що ефективність і безпека AПC є спірними в лікуванні пацієнтів із сепсисом, вона стала потенційним засобом лікування дерматологічних захворювань шляхом стимуляції реепітелізації, пригнічення запалення і стабілізації бар’єрної функції. Останні дані свідчать про те, що АПС показує ефективність у клінічних випробуваннях, пов’язаних із хронічними виразками венозного і діабетичного походження [395], пролежнями [113] та виразками, пов’язаними з гангренозною піодермією [389].
Отже, захисна функція бар’єру AПC забезпечує новий перспективний напрямок для сучасних стратегій лікування Пс, тому вивчення стану АПС у хворих на цей дерматоз із супутньою ГХ є вкрай актуальним.
1.1.4 Порушення нейровегетативної регуляції та обміну нейротрансмітерів у патогенетичних механізмах псоріазу
АГ досить широко представлена серед пацієнтів із Пс [341]. Крім того, показано, що у пацієнтів із Пс і супутньою ГХ у подальшому підвищується ризик розвитку більш тяжкого ступеня АГ, яка гірше контролюється і вимагає більш агресивної антигіпертензивної терапії, ніж у пацієнтів без зазначеного коморбідного стану [339]. Доклінічний атеросклероз, спричинений хронічним системним запальним процесом і збільшенням інтенсивності оксидативного стресу при Пс, сприяє розвитку і / або прогресуванню ЕД у даної категорії пацієнтів, призводить до структурних та функціональних змін артеріальної судинної стінки і підвищення АТ [343]. Крім того, припускається роль розладів вегетативної регуляції серцево-судинної діяльності, підвищеної активності ренін-ангіотензин-альдостеронової системи, ІР в розвитку і прогресуванні АГ у даної категорії пацієнтів [361], що раніше практично не вивчалося.
Існуючий консенсус про коморбідні стани у хворих на Пс рекомендує регулярно вимірювати АТ у пацієнтів, які отримують місцеву терапію, з метою ранньої діагностики АГ [272]. Незважаючи на те, що вимір офісного АТ залишається рутинним методом діагностики ГХ, він часто не дозволяє виявити патологічний стан [235]. Вимірювання АТ з використанням ДМАТ дозволяє забезпечити оцінку профілю АТ протягом 24‑годинного періоду, а також ідентифікувати пацієнтів з прихованою АГ (ПрАГ).
У хворих на Пс досить часто має місце так звана ПрАГ. Вона є клінічним станом у пацієнтів, коли офісний АТ в межах нормальних значень (<140/90 мм рт.ст.), однак значення АТ, оцінені в процесі процедури ДМАТ, перевищували верхню межу норми (САТ за денний період >135 мм рт. ст., ДАТ за денний період >85 мм рт.ст.) [162]. Ці показники тісно корелюють з розвитком маніфестної АГ, серцево-судинною захворюваністю і смертністю [338]. Поширеність ПрАГ в загальній популяції оцінена на рівні 8 %, а в досліджуваних групах з різною тяжкістю Пс це число досягало 49 % [174, 181]. ПрАГ у хворих на Пс зустрічалася в 1,5 рази частіше, ніж у практично здорових осіб [116]. З цим станом були асоційовані такі фактори як чоловіча стать, вік, абдомінальне ожиріння, дисліпідемія, а також ступінь тяжкості Пс [116].
Для визначення наявності взаємозв’язку між ПрАГ і вираженістю Пс використовувалися різні індекси, що дозволяють об’єктивно встановити ступінь тяжкості захворювання (PASI, Psoriasis Symptom Inventory, Body Surface Area (BSA) і Nail Psoriasis Severity Index). Як показало дослідження [116], тільки індекс BSA був пов’язаний з ПрАГ в осіб із помірною вираженістю Пс [117, 259]. Поширеність ПрАГ у хворих на Пс, за даними метааналізу 22 досліджень, коливається від 15 до 32 % у пацієнтів із середньотяжким Пс, а також від 19 до 40 % – в осіб із тяжким перебігом дерматозу [259].
У зв’язку з викладеними даними, зрозуміла необхідність контролю АТ у пацієнтів, які страждають одночасно на Пс і ГХ, за допомогою ДМАТ.
Метод ДМАТ дозволяє вивчати патогенетичні механізми АГ [334]. У 1997 р. цей метод дослідження було включено до переліку діагностичних процедур пацієнтів з АГ у рекомендаціях VI доповіді Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC VI) [310]. Перевагою методу ДМАТ є відображення АТ в умовах звичайної життєдіяльності пацієнтів. Середні значення АТ, визначені протягом доби, мають переваги перед оцінкою «офісного» АТ, оскільки пов’язані зі змінами з боку органів-мішеней (збільшенням маси міокарда лівого шлуночка, дисфункцією лівого шлуночка, мікроальбумінурією, протеїнурією, вираженістю гіпертензивної ретинопатії). Показники ДМАТ є прогностичними факторами розвитку серцево-судинних подій [356].
Показники ДМАТ включають у себе індекс часу гіпертензії, індекс вимірювань, а також індекс площі гіпертензії. Найбільш точно при високих значеннях АТ навантаження тиском відображає індекс площі гіпертензії. Було доведено, що сила взаємозв’язку між масою міокарда лівого шлуночка, максимальною швидкістю наповнення лівого шлуночка більш виражена з індексом площі гіпертензії, ніж зі значеннями АТ [87].
Зміни АТ в нічний час залежать від активності ряду нейро-гуморальних систем [314]. Так, у повільну фазу сну зниження АТ обумовлене зниженням симпатичного компонента регуляції у вигляді циркулюючих катехоламінів [204]. У нічний час знижується чутливість барорецепторів [319], що також призводить до зниження АТ. Добовий індекс АТ пов’язаний з активністю симпато-адреналової і ренін-ангіотензинової систем [231]. Крім цього, в ході досліджень було з’ясовано, що добовий ритм АТ схильний до впливу таких чинників як спадковість [161], паління, надмірне вживання алкоголю, кухонної солі, гіподинамія [398].
В осіб із АГ при порушеному добовому ритмі АТ частіше виявляють ураження органів-мішеней [383]. Недостатнє зниження АТ у нічний час розглядається як незалежний несприятливий прогностичний фактор [405]. У пацієнтів цієї категорії відзначені достовірно більш високі значення індексу маси міокарда лівого шлуночка, ніж у пацієнтів із достатнім зниженням АТ у нічний час [355]. У пацієнтів з типом добового профілю «non-dipper» і «night-peaker» частіше виявляються зміни з боку артерій дрібного калібру, діастолічна дисфункція лівого шлуночка [202, 369], більш висока смертність від інфаркту міокарда [324]. Більш високі значення АТ в нічний час мають взаємозв’язок із вираженістю мікроальбумінурії, яка є раннім проявом гіпертензивної нефропатії [406]. В одному з великих досліджень у хворих на ГХ визначений зв’язок між характером добового ритму АТ і серцево-судинною захворюваністю і смертністю: при недостатньому зниженні АТ в нічний час відносний ризик смертності від серцево-судинної патології був у 2 рази вище, ніж в осіб «dipper». Незалежним предиктором смертності є комбінація факторів зниження нічного АТ і рівня середньодобового АТ [216].
Слід пам’ятати, що у вивченні ДМАТ існують деякі обмеження, які дають похибки в дослідженні. Не завжди враховується споживання алкоголю, рівень фізичної активності під час дозвілля. Процедура ДМАТ здійснюється протягом доби, коли пацієнт вдень (активний період доби) знаходиться в горизонтальному положенні, що може змінювати в деякій мірі рівень АТ. Тому вимірювання офісного АТ залишається загальновизнаним методом діагностики АГ, а ДМАТ дозволяє виконувати дослідження з використанням допоміжних індексів.
Залишаються невивченими особливості добового профілю, показників варіабельності, ранкової динаміки АТ у хворих на Пс із супутньою ГХ, а також виявлення основних параметрів функції серцево-судинної, ВНС та інших функціональних систем організму, що беруть участь у патогенетичних механізмах розвитку Пс.
Одним з клінічних проявів Пс, який впливає також на ЯЖ пацієнтів, є свербіж шкіри, механізм розвитку якого залишається остаточно нез’ясованим. Було запропоновано кілька різних обґрунтувань цього феномену, проте жоден із чинників не дав повного пояснення. Найчастіше теорії ґрунтувалися на нестійкості рівня іннервації та нейропептидів, рівень яких знижений у пацієнтів із Пс. Іншими можливими причинами свербежу називають збільшення рівня ІL-2 або судинні відхилення. Було зареєстровано, що в осіб із Пс інтенсивність свербежу значно корелювала зі ступенем погіршення ЯЖ, рівнем стигматизації, а також присутністю і виразністю депресивних ознак [151]. Присутність та інтенсивність свербежу не залежали від віку, статі, сімейного стану, сімейного анамнезу або атопії, типу Пс, вживання алкоголю або куріння, тривалості хвороби, тривалості останнього загострення дерматозу [188, 303]. Незважаючи на високу частоту цієї ознаки, патогенез свербежу продовжує вивчатися.
Гістамін, як вважається, один із головних медіаторів, не залучений в його розвиток у хворих на Пс. Не була відзначена кореляція між інтенсивністю свербежу і рівнем гістаміну плазми крові при Пс [135]. Крім того, менш ніж 20 % пацієнтів стверджували, що пероральні антигістамінні засоби були ефективними при лікуванні дерматозу [192]. Загальноприйнята думка, що гістамінова блокада не запобігає покращенню перебігу Пс [135].
Найчастіше обговорюється нейрогуморальна теорія при Пс із залученням патологічної іннервації та нестійкістю нейропептидів у псоріатично ураженій шкірі. Кілька досліджень у цьому напрямку також продемонстрували змінений розподіл деяких нейропептидів та їх рецепторів у межах різних шарів патологічно зміненої шкіри. Нейропептиди дегранулюючих мастоцитів активізують дендритні клітини, лімфоцити, макрофаги і нейтрофіли та викликають судинні зміни в шкірі, ангіогенез, вазодилатацію [135]. Вони також стимулюють синтез і секрецію прозапальних цитокінів лаброцитами, лімфоцитами, дендритними клітинами, фібробластами і кератиноцитами, викликають активацію судинних молекул адгезії на ендотелії та проявляють гіперпроліферативні ефекти в кератиноцитах [135]. Нейропептиди в шкірі можуть виділятися шкірними нервовими закінченнями, а також безпосередньо проводитися різними типами клітин, наприклад, мастоцитами.
Щодо ролі цитокінів у розвитку свербежу при Пс, Nakamura зі співавт. [309] мають свою точку зору, вони виявили підвищений вміст ІL-2 у псоріатично зміненій шкірі. Не було ніяких істотних відмінностей у рівнях інших цитокінів (TNF-α, ІL-1α, ІL‑1β, ІL-4, ІL-5, ІL-6, ІL-8, ІL-10 та ІL-12) [204].
Серотонін, відомий також як 5-гідрокси- або 3- (2-аміноетил) -1Н-індол-5-ол, являє собою моноамін, який містить дві молекули азоту: перша є основною і закладена в індол-5-ол; друга – у складі 2-аміноетилу, знаходиться на кінцевій частині аліфатичного ланцюга. Серотонін утворюється з триптофану і служить в якості субстрату для синтезу широкого набору молекул, таких як мелатонін, форміл-5-гідроксикінуренамін, а також 5-гідроксиіндолоцтової кислоти [303]. Крім того, серотонін є сигнальною молекулою, яка впливає на імунну [321], гастроінтестинальну [158] і нервову [146] системи за допомогою паракринного, ендокринного і юкстакринного механізмів. Також серотонін регулює розвиток клітинного диференціювання та онтогенезу (формоутворення) в декількох клітинних пулах [150].
З 1970-х років був досліджений зв’язок між серотонінергічною системою і афективними розладами, а також змінами настрою [283]. Останнім часом було показано, що серотонін пов’язаний з безліччю процесів, у тому числі з агресією [304], сном [155], апетитом [217], болем [145], функцією шлунково-кишкового тракту [247]. Вплив серотоніну на імунну систему також був доведений, хоча конкретні механізми, що полягають в основі цих ефектів, не зовсім зрозумілі і потребують підтвердження в дослідах безпосередньо на клітинах людини.
Експресія серотонінергічних компонентів розподілена різним чином між тканинами і типами клітин. Функція серотонінергічних білків раніше була вивчена в центральній нервовій системі [364], при цьому ніяких функціональних відмінностей між типами клітин не виявлено. Серотонінергічні компоненти, виражені в імунній системі, включають складний ансамбль білків, які координують синтез і деградацію [365], транспортування і зберігання [210], а також відповідь на серотонінову стимуляцію [104]. У лейкоцитах експресія серотонінергічних компонентів модулюється концентрацією позаклітинного і внутрішньоклітинного серотоніну. Крім того, сигнали, що генеруються взаємодією серотоніну з лейкоцитами, різні в залежності від функції, стадії розвитку і стану активації клітин. Ця функціональна гетерогенність передбачає, що серотонінергічна система може точно регулювати широкий діапазон імуномодулюючих ефектів, у тому числі відіграючи важливу роль у патогенетичних механізмах Пс [366].
Відомо, що синтез серотоніну починається з амінокислоти триптофану, який проходить дві ферментативні стадії. Залишається нез’ясованим, яким чином побічні продукти і метаболіти, які генеруються під час катаболізму, можуть впливати на імунну систему [326].
Серотонін модулює багато функцій лейкоцитів в межах від активації імунної відповіді до пам’яті генерації клітин. Ефекти, опосередковані серотоніном, залежать від диференційованої експресії серотонінергічних компонентів в лейкоцитах. Наприклад, серотонінові рецептори на імунних клітинах впливають на продукцію цитокіну, доставку, міграцію та активацію клітин. Передача сигналів через ці рецептори впливає на хемоатракцію в незрілих дендритних клітинах, але не в зрілих клітинах, які відповідають на серотонін секрецією ІL-6 [367]. Крім того, серотонінові рецептори впливають на активацію Т-клітин [366], а також регулюють проліферацію В-клітин [156].
Локальна концентрація серотоніну може модулювати низку подій під час деяких імунних реакцій [156]. Імунні клітини реагують на серотонін експресією молекулярних механізмів серотонінергічної системи. Нейтрофіли, що представляють собою першу лінію захисту проти інфекції, беруть участь в секреції цитокінів і хемокінів у відповідь на роботу імунокомпетентних клітин [226] В дослідах на лабораторних тваринах показано, що нейтрофіли в місцях запальних реакцій вимагають тромбоцитарних хемотаксичних стимулів, серед яких присутній серотонін [333]. За допомогою серотонінових рецепторів відбувається також посилення секреції ІL-6, ІL-1β ІL-8. Зазначений нейромедіатор може також надавати інгібуючу дію на макрофаги: активація стимульованих макрофагів обмежується в пробірці з високою концентрацією ІФ-γ. Крім того, в альвеолярних макрофагах людини, стимульованих серотоніном, секретується менше TNF-α і ІL-12, але більше ІL-10, NO і простагландину-E2. Проте рецептори, що опосередковують ці ефекти, досі не описані [302]. Різні відповіді макрофагів, індуковані серотоніном, можуть пояснюватися відмінностями у фенотипових тканинноспецифічних макрофагах (тобто зміни в співвідношенні серотонінових рецепторів) [234].
На основі ефектів агоністів або антагоністів специфічних серотонінових рецепторів відбувалася проліферація Т-клітин і секреція прозапальних цитокінів, таких як ІL-2 і ІФ-γ, вимагаючи активації певних видів рецепторів [115].
B-клітини розпізнають циркулюючі антигени; як наслідок, вони активують процеси, що закінчуються генеруванням В-клітин пам’яті або антитілоутворюючих клітин плазми [277].
Незважаючи на те, що базофіли складають менше 2 % популяції лейкоцитів, вони активно беруть участь в імунних відповідях у периферичних органах, переважно при паразитарних ураженнях, а також в алергічних реакціях, будучи джерелом гістаміну у відповідь на специфічні фактори росту, такі як ІL-3 [103,180]. Крім того, базофіли є важливим джерелом ІL-4 і, отже, можуть сприяти Тh 2-диференціюванню [138]. Вплив серотоніну на функції базофілів не був з’ясований, проте відомо, що експозиція серотоніну в базофілах мишей пригнічує секрецію ІL-4 в залежності від дози [180]. Серотонін також блокує вивільнення гістаміну, ІL-4 та ІL-6 з базофілів мишей, а також перешкоджає вивільненню ІL-13 і ІL-4 з людських периферичних базофілів крові [180].
Тромбоцити добре відомі в якості ініціювання коагуляції та підтримки судинного тонусу; тим не менше, ці клітини також беруть участь у запальних реакціях, будучи джерелом гістаміну і тромбоцитарного фактора активації. Вони забезпечують локальне джерело біогенних амінів, у тому числі серотоніну, в пошкоджених ділянках судинної системи. Тромбоцити поглинають серотонін із плазми, таким чином забезпечуючи регуляцію його концентрації [164].
У патогенезі Пс важливе місце відводиться факторам стресу і розладів настрою. Підвищена експресія білка-переносника серотоніну (SERT) відзначається в пошкодженій шкірі у хворих на Пс у порівнянні з інтактною шкірою, а також шкірою практично здорових осіб. За даними Thorslund K. зі спіавт. [393], підвищена експресія SERT при Пс корелює з тяжкістю захворювання, хронічним стресом і депресією. Позитивна кореляція була визначена (r=0,53; р<0,05) між PASI і числом SERT-позитивних дендритних клітин в епідермісі псоріатично зміненої шкіри. Негативна кореляція (r=-0.46; р<0,05) між рівнями співвідношення кортизолу слини і числа SERT-позитивних клітин в епідермісі ураженої при Пс шкіри вказує на кореляцію між експресією SERT і хронічним стресом. Вивченням ролі метаболізму серотоніну у хворих на Пс із супутньою ГХ раніше практично не займалися і ця проблема, на наш погляд, потребує вивчення.
Стресові та імунні реакції нерозривно пов’язані з ендокринними. Рівень стресових гормонів контролюється гіпоталамо-гіпофізарно-наднирковою системою. Кортизол і катехоламіни, проявляючи різноспрямовану дію, мають суттєвий вплив на імунну систему [238]. Активність імунних клітин (макрофагів, Т- і В-лімфоцитів) за участю компонентів симпато-адреналової системи [359] викликає контрольовані множинні імунні реакції: збільшується секреція цитокінів, TNF-α, ІL-1, ІL-10 [197]. Імуномодуляція стресу відбувається через сигнальний каскад на різних рівнях: наприклад, стрес-сигнали в імунній відповіді регулюються за допомогою NF-kB, адреналіну, стимуляції адренергічних рецепторів на поверхні імунних клітин [410]. Зазначені фактори мають важливе значення в активації кератиноцитів: активація імунних клітин призводить до продукції цитокінів, посилення прозапальних реакцій і ще більшої продукції цитокінів. Глюкокортикоїди запобігають запальним змінам шляхом пригнічення міграції лейкоцитів і пригнічення Т-клітин [363].
Реакція кортизолу на стрес зменшується при Пс [236]. У пацієнтів із Пс представлені вищі рівні адреналіну й адренокортикотропного гормону і більш низькі рівні кортизолу і кортикотропін-рилізинг-фактора [421]. Адреналін може модулювати фазу ремісії, кортизол – фазу прогресування [279].
Зв’язок напруженості при Пс підтримується також тим фактом, що регулярна фізична активність може мати сприятливий вплив на розвиток Пс. Через метаболічні і психо-нейроімунні ефекти регулярні фізичні вправи можуть позитивно впливати на перебіг супутніх захворювань, пов’язаних із порушенням метаболізму, знижуючи ризик розвитку і перебігу Пс в дебюті [229].
Серед пацієнтів із Пс розповсюджені психічні розлади, в тому числі депресія [172]. Крім того, загостренню Пс часто передують стресові епізоди [352]. Фізіологічні реакції на стрес включають підвищену активність симпато-адреналової, гіпоталамо-гіпофізарно-надниркової систем, вивільнення прозапальних цитокінів, які можуть, у свою чергу, як викликати розвиток, так і загострювати перебіг Пс, оскільки захворювання пов’язане з підвищенням активності прозапальних цитокінів [137].
Психологічний стрес, таким чином, є сполучною ланкою між Пс, психічними розладами, зниженням ЯЖ, і в цьому контексті надмірна активність надниркової осі є одним із фізіологічних чинників, пов’язаних зі стресом і реакцією на стрес. Активність надниркової осі може бути оцінена шляхом вимірювання рівня кортизолу, але лише кілька досліджень оцінили роль кортизолу при Пс, і вони пропонують неоднозначні результати. Наприклад, в одному з ранніх досліджень [229] порівняли рівні кортизолу в сироватці крові у спокої та після стрес-тесту у 10 хворих на Пс із підвищеними рівнями та у 10 здорових осіб. Автори не виявили будь-якої різниці рівня кортизолу в стані спокою, проте зниження рівня кортизолу після стрес-тесту було більш виражене у пацієнтів із Пс, що вказує на залученість наднирників у цих пацієнтів в патогенетичні механізми захворювання. Невідповідність опублікованих результатів може бути пов’язана з використанням рівнів кортизолу в крові, які помітно змінюються протягом дня [229].
В одному з досліджень показана значуща кореляція між вмістом кортизолу під час сну і тяжкістю дерматозу. Так, перед сном вміст кортизолу був максимальним [357] і корелював з об’ємом надниркової залози. В іншому дослідженні [236] був виявлений зв’язок між сном і зниженням кортизолу префронтальних відділів кори головного мозку на моделі хронічного стресу (посттравматичні симптоми стресу) у дітей. За аналогією з регуляцією префронтальної кори активністю наднирникової осі може бути пояснений взаємозв’язок між тяжкістю Пс та вмістом кортизолу в крові перед сном. У дослідженні В. Amatya зі співавт. [206] повідомили про кореляцію між активністю в біоптатах пошкоджених ділянок шкіри у пацієнтів із Пс (за кількістю нейро-запальних клітин) і вмістом кортизолу в слині. Інші дослідження [206, 236] повідомили про кореляцію між Пс і рівнями кортизолу, тим не менш, вони виявили гіперкортицизм у пацієнтів із Пс і високим рівнем психоемоційних навантажень. Незважаючи на те, що вони суперечать один одному, ці дослідження свідчать про наявність дисфункції наднирників у патогенезі Пс. Саме тому дослідження стану рівня кортизолу при наявності поєднаної патології залишається актуальним питанням сьогодення.
1.2 Характеристика патоморфологічних змін у шкірі хворих на псоріаз із коморбідною патологією
Морфологічний аналіз змін шкіри при Пс показав, що в основі структурних перебудов епідермісу і дерми внаслідок активації неспецифічного запалення полягають гіперпроліферація кератиноцитів та їх аберантне диференціювання [160], надмірний ангіогенез [227, 265] і порушення епідермально-дермальних взаємовідношень [30, 360]. Детальний аналіз морфогенезу шкірних елементів висипки при загостренні Пс, проведений Р.Л. Степаненком і С.Г. Гичкою [90], довів провідну роль активації проліферативних процесів у сосочковому шарі дерми, які стосуються переважно ендотелію судин, перицитів і фібробластів. Автори відзначили, що проліферативні судинні тяжі активно вростають в епідерміс і проникають практично до поверхні шкіри. У свою чергу, проліферація епітеліоцитів, аж до утворення папіломатозних структур, відбувається переважно в зоні бокових стінок сосочка. Також з’ясувалося, що особливості змін у гіпертрофованих сосочках (повнокров’я, транссудація, набряк, еритродіапедез) та в епідермісі (стоншення, міжклітинний набряк, розшарування) сприяють інфікуванню шкіри з розвитком подальших ускладнень захворювання [90]. Використання різноманітних методів визначення морфологічних критеріїв ушкоджень шкіри при Пс привело до значної деталізації сучасних уявлень про патоморфоз даного патологічного процесу [165, 251, 271, 347] та про взаємний зв’язок між системними, морфологічними і молекулярно-біологічними характеристиками Пс під час його прогресування [101, 134, 348].
За даними наукової літератури, розширення гемомікроциркуляторного русла (ГМЦР) дерми поряд із гіпертрофією сосочкового шару і гіперплазією епідермісу є характерною ознакою Пс [237], однак слід зауважити, що у клінічній практиці віковий діапазон пацієнтів часто збігається з розвитком істотних інволютивних перебудов шкіри, які за спрямованістю морфологічних змін мають протилежний характер і суттєво впливають на патоморфогенез шкіри у хворих на Пс. Вивченню даного питання присвячена обмежена кількість досліджень, в яких показано, що типова морфологічна картина Пс у пацієнтів похилого віку поєднується з інволютивними змінами епідермісу та дерми і характеризується нерівномірністю, мозаїчністю змін у напрямку меншої виразності запальних реакцій і переважання дегенеративних процесів [28]. Виявилося, що з віком у хворих на Пс розвивається складний комплекс морфологічних змін, який включає запальні, дистрофічні та атрофічні процеси, а типові псоріатичні прояви виявляються лише у ділянках зі збереженою мікроциркуляцією [28, 237].
Останніми роками багато уваги дослідників приділяється як виявленню біологічних закономірностей, що обумовлюють морфологію вікових змін шкіри, так і встановленню та всебічному дослідженню патологічних факторів, які впливають на цей процес та можуть його змінювати [287, 382]. Старіння шкіри – процес, який запрограмований генетично, що визначає власне інволюцію та старіння, яке виникає від дії різних ушкоджувальних впливів і патологічних процесів, що розвиваються у шкірі. Біологічні зміни у шкірі включають пошкодження епідермальних, дермальних і підшкірних клітинних компонентів, паралельно спостерігаються зміни в імунній системі [286].
За результатами прямого морфологічного вивчення з використанням світлооптичної та трансмісійної електронної мікроскопії було з’ясовано, що структурні основи інволютивних змін шкіри полягають в ушкодженнях системи мікроциркуляції, які включають порушення структури внутрішньососочкових капілярних петель за рахунок локальних розширень гемокапілярів у внутрішньососочковому просторі та звуження початкових і кінцевих сегментів петель, дезорганізацію артеріолярних компонентів мікроциркуляторного русла у складі сосочкового і сітчастого шарів дерми, а також ушкодження дренажної ланки мікроциркуляції за рахунок змін фібрилярного каркасу мікрооточення в зоні підсосочкових венозних сплетень. Суттєві структурно-функціональні зміни виявляються після 40 років. Інволютивний статуc шкіри являє собою інтегральну характеристику, розраховану на основі морфометричних критеріїв стану кератиноцитів, елементів мікроциркуляторного русла дерми, дермальних фібробластів, сполучнотканинного складу дерми [32].
На сьогодні очевидною є важливість подальшого вивчення субстрату старіння шкіри – її структури, де одне з найважливіших місць посідає система гемомікроциркуляції [384]. Саме ця система найбільш чітко реагує на численні ушкоджувальні впливи, вона визначає гістогенетичні закономірності перетворень шкіри з часом, саме вона є найчутливішим компонентом дерми, який відповідає за стан епітеліальних, нервових і сполучнотканинних структур шкіри за умов дії локальних і системних патологічних процесів [282].
Не випадково, що у пацієнтів, які мають супутню патологію, зокрема ГХ, було виявлено істотне порушення структури мікроциркуляторного русла шкіри та вагоме поглиблення загальної інволютивної морфологічної картини епідермісу і дерми, що призводило до суттєвого порушення провідних показників стану шкіри на тлі АГ [32, 91].
Морфологічні зміни при ГХ відрізняються значною гетероморфністю, яка залежить від тривалості захворювання і характеру порушень функції та структури ендотелію, а також від ступеня ушкоджень тромбоцитарного гемостазу [99]. У клініко-морфологічних дослідженнях було доведено, що у хворих на ГХ ЕД зазнає суттєвого ушкодження ще до появи клініко-лабораторних ознак ускладнень захворювання, що супроводжується значущим зростанням концентрації ендотеліну-1, фактора Віллебранда і тромбомодуліну, а також корелює зі ступенем порушень судинно-тромбоцитарного гемостазу [323]. З’ясувалося, що морфологічні зміни у системі гемостазу мають генералізований характер і виглядають як комплекс світлооптичних і ультраструктурних змін клітин крові, таких як внутрішньосудинна гіперактивація тромбоцитів, дисбаланс вмісту всіх типів їх гранул, трансформація поверхневої цитоархітектоніки еритроцитів та утворення різних за складом і розмірами тромбоцитарних агрегатів. Найбільш значущими характеристиками були відносний вміст активованих і агрегованих тромбоцитів, щільність упакування альфа- и дельта-гранул, рівень зворотно трансформованих еритроцитів, кількість тромбоцитарних агрегатів. При цьому системна альтерація тромбоцитарного гемостазу сполучалася з морфологічними проявами ЕД [92].
Морфологічні зміни судин ГМЦР при ГХ також мають системний характер і відповідають характеру перебігу захворювання: під час гіпертонічного кризу відбувається спазм артеріол, гофрована деформація ендотелію і деструкція його базальної мембрани, плазматичне просочування мікросудинної стінки з розвитком фібриноїдного некрозу артеріоли. На тлі тривалої гіпертензії відбувається гіпертрофія м’язової оболонки судинної стінки, гіперплазія і розшарування еластичних мембран з подальшим внутрішньостінковим фіброзом, утворення фіброзних бляшок, що призводить до звуження просвітів артеріол. Зміни гемокапілярів мають обмежений характер, проте при прогресуванні ГХ відзначаються численні явища еритродіапедезу і крововиливів у внутрішніх органах і шкірі з облітерацією просвітів мікросудин ГМЦР на тлі внутрішньосудинної активації тромбоцитів з подальшим артеріологіалінозом, атрофією і склерозом стінки артеріол і гемокапілярів [92, 189].
Поєднання псоріатичних уражень шкіри з типовими морфологічними змінами ГМЦР на тлі ГХ, вочевидь, обумовлює більш виражений ступінь порушень, проте прямого морфологічного вивчення стану мікроциркуляції у хворих на Пс із супутньою ГХ не проведено. Це питання стає тим більше актуальним з огляду на те, що численними клінічними та епідеміологічними дослідженнями останніх років встановлено зв’язок між означеними захворюваннями [107, 213]. Зокрема, в когортному дослідженні 77728 жінок у віці близько 60 років було показало, що хворі на ГХ, а також пацієнти, які для корекції ГХ використовують бета-блокатори, мають підвищені шанси на розвиток Пс [241]. У хворих на ГХ, що приймали β-блокатори протягом 6 років, частота розвитку Пс зростала на 39 %. Автори відзначили, що додаткові ускладнення при вивченні даного питання виникають у ситуації, коли дерматолог впевнений в тому, що існує зв’язок між дерматозом і поточними ангіотропними препаратами, і рекомендує змінити лікування, призначене пацієнтові іншим фахівцем [241, 412].
Отже, сучасні відомості про морфологічні перетворення епідермісу і дерми свідчать про суттєві зміни у складі шкіри хворих на Пс і у пацієнтів з ГХ, проте проблемні питання патоморфогенезу ушкоджень епітеліального, мікросудинного і сполучнотканинного компонентів шкіри у хворих із зазначеною поєднаною патологією на тлі інволютивних перебудов шкіри залишаються й досі не розкритими і потребують обґрунтованого вирішення.
1.3 Сучасні погляди на терапію псоріазу
У даний час доступне лікування Пс, як і інших складних імуноопосередкованих захворювань, що не приводить до повного одужання, а спрямоване тільки на зменшення активності хвороби і поліпшення клінічної картини.
В Україні при веденні хворих на Пс керуються уніфікованим клінічним протоколом медичної допомоги «Псоріаз, включаючи псоріатичні артропатії» (наказ МОЗ України №762 від 20.11.2015 року) [82], відповідно до якого програма лікування вимагає дотримання таких моментів: в якості терапії першої лінії у пацієнтів із легким або середньої тяжкості ураженням шкіри виступає топічна терапія, за умови відсутності ефекту при використанні останньої в якості монотерапії або комбінації необхідне призначення інших видів лікування, в тому числі фототерапія, системна терапія, імунобіологічна терапія. Через високу ймовірність побічних ефектів від тривалого використання системних глюкокортикостероїдів, їх використання в лікуванні Пс вкрай обмежене. У випадках тяжких форм краще використовувати імуносупресивну терапію (циклоспорин, метотрексат, ацитретин) із урахуванням протипоказань і побічних дій. Імунобіологічна терапія показана пацієнтам при наявності протипоказань до фототерапії та системної імуносупресивної терапії. В даному випадку також має бути враховано віднесення даних пацієнтів до групи підвищеного ризику щодо небезпеки зазначеного лікування.
Застосовуються різні методи лікування, які залежать від тяжкості захворювання. В якості показника ефективності терапії оцінюється індекс PASI. Традиційні методи терапії включають місцеве лікування (пом’якшувальні речовини, місцеві кортикостероїди, аналоги вітаміну D), які використовуються при легкому і середньому ступені тяжкості Пс, а також UVA/UVB- фототерапію або системну терапію, які служать резервним лікуванням для тяжкого перебігу дерматозу. Серед системних методів терапії часто використовують метотрексат, циклоспорин, ретиноїди, фолієву кислоту в якості терапії першої лінії. Проте традиційна терапія неповністю відповідає потребам пацієнтів, особливо у важких випадках. В останні десятиліття більш глибоке розуміння імунопатогенезу захворювання сприяло розвитку нових напрямків в лікуванні Пс, розробці і дослідженні так званих «біопрепаратів», дія яких спрямована на ключові запальні медіатори і які в даний час являють собою ефективну терапію третьої лінії у хворих з помірним і тяжким Пс, несприйнятливих до небіологічних препаратів системної дії.
Першим із біопрепаратів був схвалений алефасепт ще у 2003 році, який селективно індукував апоптоз CD2+ ефекторних Т-клітин пам’яті в живому організмі, хоча подальші дослідження свідчать про більш широкий імуномодулюючий ефект [315]. Клінічна ефективність була показана у III фазі дослідження, де у 40 % пацієнтів було досягнуто зниження індексу PASI на 75 % [106].
Іншою стратегією лікування Пс стало застосування з 2003 р. анти-Т-клітин, гуманізованих антитіл (ефалізумаб) для зв’язування і блокування CD11a, ключової молекули для активації та міграції в шкіру Т-клітин [381]. У той же час, застосування ефалізумабу не знайшло розповсюдження через кілька випадків мультифокальної лейкоенцефалопатії [105, 119, 201], що підкреслює важливість ретельного моніторингу довгострокової безпеки імуномодулюючої терапії.
Альтернативною стратегією анти-Т-клітинної орієнтації є використання антицитокінових біологічних препаратів. Як блокатор TNF-α використовується етанерцепт, людський об’єднуючий рецептор р75 TNF протеїн, інфліксимаб, гуманізовані химерні анти- TNF моноклональні антитіла або адалімумаб та інші. Ефективність етанерцепту була представлена в трьох дослідженнях III фази, де близько 50 % пацієнтів досягли зниження PASI на 75 % на 12-му тижні в групі з високою дозою [102, 200, 201]. Нейтралізація TNF-α викликає раннє зниження модуляції мієлоїдних клітинних генів, пов’язаних зі зменшенням продукції клітин Th17, всього через 2 тижні після початку терапії [394]. Цікавий факт, що тільки пацієнти, у яких пригнічується експресія генів по лінії Th17, успішно реагують на лікування етанерцептом [187].
Одним із останніх препаратів, схвалених для лікування Пс, є устекінумаб, моноклональне антитіло, що блокує ІL-12 і ІL-23. Його ефективність досить висока, близько 67 % пацієнтів досягли зниження PASI на 75 % за 12 тижнів терапії [191].
Деякі серйозні побічні явища, такі як опортуністичні інфекції та реактивація латентного туберкульозу, були зареєстровані при використанні цих моноклональних антитіл [140]. Дослідження, в яких вивчалася безпека етанерцепту та устекінумабу протягом 5-річного терміну [190, 200], показали досить низьку кількість небажаних явищ при їх використанні.
Моноклональні антитіла, які блокують або ІL-17A (іксекізумаб і секукінумаб) [122, 124], або ІL-17R (бродалумб) [148], показали значну ефективність у фазі II клінічного випробування, де понад 70 % осіб досягли зниження PASI на 75 %, а більше половини – досягли рівня зниження до 90 %. Було показано, що ефект блокади ІL-17 на експресію генів синергічно регулюється ІL-17 і TNF-α в більшій мірі, ніж у попередніх дослідженнях із застосуванням анти-TNF терапії [106].
Незважаючи на ефективність імунобіологічної терапії, було відзначено, що як мінімум одна третина пацієнтів не реагують на цей вид лікування [225] або втрачається первинна відповідь через продукування антитіл проти ліків, що спричиняє зниження ефективності лікарського засобу та / або індукції побічних ефектів [122]. Крім того, імунобіологічні препарати являють собою значний економічний тягар через їх вартість [141]. Більшість пацієнтів із легким і помірним ступенем тяжкості Пс покладаються на традиційну топічну терапію.
Вищевказані обмеження застосування імунобіологічних препаратів привели до розробки інших терапевтичних варіантів, із використанням малих молекул. Ці речовини (тофацитиніб та апреміласт) мають низьку молекулярну масу, органічні сполуки орієнтовані на ключові молекули, які беруть участь у клітинній сигналізації, вони спрямовані на мінімізацію загальної імуносупресії [220]. Незважаючи на те, що ефективність цих речовин нижче такої у імунологічних препаратів, ці молекули мають більш дешевий процес виробництва, їх можливо використовувати перорально або місцево, крім цього, вони показали хороший профіль безпеки. Таким чином, вони могли бути використані в лікуванні менш тяжких форм дерматозу.
У лікуванні Пс також становить інтерес напрямок, пов’язаний з уповільненням ангіогенезу [291]. Цей процес є головною особливістю в ураженій Пс шкірі, яка пов’язана з місцевим і системним збільшенням ангіогенних цитокінів, включаючи VEGF, вміст якого варіює залежно від активності хвороби. Використання терапевтичних підходів до лікування Пс із застосуванням циклоспорину, ацитретину, ефіру фумарової кислоти, інфліксимабу і псоралену уповільнювало процеси ангіогенезу, знижувало рівні VEGF [308]. До теперішнього часу інгібітори VEGF активно не використовуються для лікування Пс, однак досить широко застосовуються в терапії злоякісних новоутворень. Є повідомлення про поодинокі випадки поліпшення клінічного перебігу дерматозу при використанні інгібіторів VEGF на моделях тварин.
У трансгенних VEGF мишей було виявлено зміни шкіри були клінічно і гістологічно подібні людському Пс, включаючи демонстрацію феномена Кьобнера, що було асоційовано з високими рівнями епідермального, дермального і сироваткового VEGF. Введення антагоністу VEGF привело до розв’язання псоріазиформних змін на шкірі.
У людей використання деяких традиційних методів лікування Пс було пов’язано зі скороченням експресії VEGF-A. Andrys зі співавторами вказали, що місцеве застосування вугілля в комбінації з ультрафіолетом B (UVB; терапія Гекермана) у хворих на Пс призводило до істотного клінічного поліпшення і зменшення плазмового вмісту VEGF-A [121].
Ці результати узгоджувалися з дослідженнями in vitro, які продемонстрували, що фотохіміотерапія з PUVA пригнічує експресію VEGF, пригнічує ангіогенез і викликає апоптоз людських ендотеліальних клітин [332]. В умовах in vivo відзначене зниження плазмових рівнів VEGF-A після терапії PUVA.
Однак взаємозв’язок між вмістом VEGF, світлолікуванням і терапевтичним ефектом при Пс залишається нез’ясованим, оскільки лікування з використанням вузькосмугового (NB)-UVB і ретиноїдів (ре)-PUVA призвело до збільшення рівнів VEGF-A в порівнянні з вхідними даними, незважаючи на клінічне поліпшення [178]. Це пояснюється прискореною епідермальною проліферацією після експозиції ультрафіолету-B та індивідуальною відповіддю на системні ретиноїди.
Bielenburg зі співавторами продемонстрували, що одноразова експозиція мишей лінії C3H / HeN ультрафіолетом-B призвела до епідермальної гіперплазії і формування нових судин. Вони відзначили, що проліферуючі кератиноцити продукували ангіогенні цитокіни, що стало причиною збільшення ангіогенезу шкіри [301]. Ймовірно, що подібний процес відбувається в опроміненій шкірі пацієнтів, що піддаються терапії ультрафіолетом-B, але у багатьох пацієнтів баланс все ще виступає за межі позитивного терапевтичного ефекту в результаті дії інших механізмів [399].
Re-PUVA – ретиноєва кислота, має залежний від генотипу інгібіторний ефект на продукцію кератиноцитами VEGF-A, також незалежний від генотипу стимулюючий ефект на мононуклеарні клітини периферичної крові, які могли використовуватися для прогнозування клінічної відповіді на ацитретин [373]. A. Akman зі співавт. припустили, що, на перший погляд, парадоксальне збільшення рівнів VEGF-A після re-PUVA-терапії могло бути явищем відновлення, вторинним до експозиції системними ретиноїдами, де мононуклеарні клітини крові стимулювали продукцію високих рівнів VEGF-A [178].
Хоча їх точний механізм дії залишається невідомим, ефір фумарової кислоти сповільнював ангіогенез, послаблював функціональну активність судинного ендотелію і пригнічував експресію VEGFR-2 [378]. Таким чином, прийшли до думки, що на додаток до їх прямих антиангіогенних властивостей, антипсоріатичні ефекти ефіру фумарової кислоти були пов’язані з уповільненням відповіді на циркуляцію VEGF-A [127].
Циклоспорин A, як було показано, інгібував in vitro та in vivo ангіогенез через блокування циклооксигенази-2. Ген для цього ферменту індукований VEGF-A, але він також диференційовано регулюється TNF-α. Останній підвищує експресію VEGFR-2 і, як показано, стимулює ангіогенез, збільшуючи таким чином VEGF-обумовлену міграцію ендотеліальних клітин, прискорюючи загоєння травм шкіри [139].
Як обговорено вище, багато препаратів, які використовуються для лікування Пс, впливають на продукцію або функцію VEGF-A. Хоча поки що не з’ясовані шляхи зниження активності VEGF при Пс, інгібітори VEGF знайшли застосування при інших станах (онкопатологія, хвороби очей) [275, 404].
Ранібізумаб (луцентіс), моноклональний фрагмент антитіла, отриманий з бевацизумабу, який раніше використовувався для лікування вікової макулярної дегенерації [141]. Він пов’язує рецептори VEGF-A, таким чином суттєво обмежуючи процеси ангіогенезу. FDA рекомендувала даний препарат для лікування неоваскулярної дегенерації жовтої плями, макулярного набряку та діабетичної ретинопатії.
З огляду на патогенетичні механізми розвитку Пс, слід вказати на процеси оксидативного стресу, що вимагає фармакологічного втручання. При огляді різних хімічних сполук, здатних вплинути на процеси оксидативного і нітрозуючого стресу, за функцією слід виділити такі: антирадикальні блокатори, антиокислювачі, хелатори, гасники [21]. За хімічною структурою виділяють: антиоксиданти-ензими (супероксиддисмутаза (СОД), каталаза, глутатіон-залежні пероксидази і трансферази), фенолвмісні сполуки (токофероли, хінони, флавоноїди, каротиноїди, аскорбінова кислота), SН-вмісні сполуки (легко окислювані пептиди, пролін), хелатор іонів металів змінної валентності (металопротеїни, сечова кислота), інші антиоксиданти (гормони-антиоксиданти – жіночі статеві гормони, мелатонін) [20, 22].
Деякі антиоксиданти знайшли широке застосування в лікуванні Пс (альфа-ліпоєва кислота), водночас інші препарати цієї фармакологічної групи досить часто використовуються при лікуванні серцево-судинної патології (різні неврологічні розлади, атеросклеротичні процеси, АГ), проте не вивчена їх ефективність у хворих на Пс у поєднанні з ГХ. До таких препаратів можна віднести армадін.
Крім зазначеного вище, слід нагадати деякі особливості терапії Пс при супутній ГХ. У багатьох джерелах і, зокрема, основному протоколі ведення хворих на Пс [82] зазначено, що пацієнтам, які страждають на зазначений дерматоз, не рекомендується призначати дві групи антигіпертензивних препаратів – бета-блокатори та інгібітори ангіотензинперетворюючого ферменту (АПФ), що підкреслює специфіку поєднання Пс з ГХ, особливість перебігу цього коморбідного стану. Що в цьому поєднанні призводить до загострення дерматозу, як і раніше, до кінця не з’ясовано. Можливо, більш глибоке вивчення цього коморбідного стану дасть нові відповіді на питання щодо формування, перебігу і терапії такого поєднання.
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Клінічна характеристика груп
Робота виконана протягом 2013-2017 років у ЗДМУ (ректор університету – д.мед.н., професор, Заслужений діяч науки і техніки України, М.Ю.Колесник), на кафедрі дерматовенерології та косметології з курсом дерматовенерології і естетичної медицини ФПО (зав.кафедри – д.мед.н., професор В.П.Федотов). Основні клінічні дослідження проводилися на базі КУ «ЗОШВКД» ЗОР (головний лікар – к.мед.н., доцент Ю.Б. Коваленко), КУ «Міська лікарня № 7 м. Запоріжжя» (головний лікар – І.К. Смирнова). Гістологічні та імуногістохімічні дослідження проведено на базі Інституту клінічної патології ЗДМУ (директор – д.мед.н., професор В.О. Туманський). Основні імуноферментні та біохімічні дослідження проведено на базі Навчального медико-лабораторного центра ЗДМУ (начальник – д.мед.н., професор А.В. Абрамов, зав. біохімічним відділом – д.біол.н., професор І.Ф. Бєленічев), а також серологічної лабораторії КУ «ЗОШВКД» ЗОР (завідуюча – О.А. Звєрєва). Частина біохімічних і функціональних досліджень проведена на базі «Університетської клініки ЗДМУ» (директор – д.мед.н., професор – В.І. Кривенко). Комплекс діагностичних методик та консультацію хворих проводили за участю співробітників кафедри внутрішніх хвороб № 2 ЗДМУ (зав. кафедри – к.мед.н., доцент О.В. Демиденко) та кафедри психіатрії, психотерапії, загальної та медичної психології, наркології та сексології ЗДМУ (зав. кафедри – д.мед.н., професор В.В. Чугунов).
Для реалізації мети і завдань цієї роботи було проведене комплексне (загальноклінічне, лабораторне, інструментальне і гістоморфологічне) обстеження пацієнтів, які страждають на Пс і знаходилися на стаціонарному та / або диспансерному лікуванні в КУ «ЗОШВКД» ЗОР в 2013-2017 рр. Протягом зазначеного періоду було проведено обстеження 460 хворих на Пс, які перебували на лікуванні у стаціонарних / диспансерних відділеннях цього закладу. Пацієнтам було проведено загальноклінічне обстеження, офісне вимірювання АТ. В результаті обстеження у 171 (37,17 %) пацієнта була виявлена АГ, явища тривоги або депресії – у 244 (53,04 %) хворих, підвищений індекс маси тіла (ІМТ) – у 301 (65,44 %), гіперглікемія – у 44 (9,57 %), дисліпідемія – у 24,09 % [59]. Найбільш частою у поєднанні з іншими коморбідними станами була АГ, тому далі в процесі динамічного спостереження перебували 170 хворих на Пс, з яких 72 мали нормальні цифри АТ, у 98 – спостерігалася АГ. Діагноз Пс встановлювали на підставі характерної клінічної картини дерматозу, при необхідності – використовували додаткові лабораторні та інструментальні методи діагностики [80, 82].
Групу порівняння на АГ склали 47 пацієнтів, які страждали на ГХ та перебували на лікуванні в стаціонарі КУ «Міська лікарня №7 м. Запоріжжя». Для достовірності результатів в дослідження залучали пацієнтів, у яких АГ була представлена тільки ГХ ІІ стадії з рівнем гіпертензії 1-3 ступеня, без антигіпертензивної терапії впродовж не менше 2 попередніх тижнів. У всіх хворих, за результатами комплексного клініко-анамнестичного та інструментально-лабораторного обстеження, були відсутні дані, що свідчать про наявність хронічних захворювань нирок або ураження ниркових судин. ГХ ІІ стадії діагностували на підставі Уніфікованого клінічного протоколу первинної, екстреної та вторинної (спеціалізованої) медичної допомоги «Артеріальна гіпертензія» (Наказ Міністерства охорони здоров’я України № 384 від 24.05.2012 року) і рекомендацій Європейського товариства з гіпертензії ESH / ESC 2013 року [26, 81, 83].
Групу контролю склали 37 практично здорових осіб, які зверталися в рамках профілактичних оглядів до КУ «ЗОШВКД» ЗОР ради в 2013-2017 рр.
При роботі із зазначеними особами дотримувалися загальних вимог і положень біоетики, які схвалені Першим національним конгресом з біоетики (Київ, 2001), а також затвердженням Етичного комітету ЗДМУ та ICH / GCP. Згідно з Гельсінською декларацією про права пацієнта [18], всіх обстежених до початку дослідження в повному обсязі знайомили з метою, методологічними особливостями процедур дослідження, про що вони добровільно і власноручно підписували форму інформованої згоди на участь у цьому дослідженні.
Таким чином, в процесі динамічного спостереження перебували 254 людини, які були розподілені в такі групи:
1 група – перша група порівняння – хворі на Пс – 72 особи;
2 група – друга група порівняння – хворі на ГХ – 47 осіб;
3 група – основна – хворі на Пс і ГХ водночас – 98 осіб;
4 група – контрольна група – практично здорові особи – 37 осіб.
Всім пацієнтам 1 і 3 груп призначали стандартне лікування Пс в умовах дерматологічного стаціонару: проводили детоксикаційну, гіпосенсибілізуючу, протизапальну терапію, гепатопротектори, седативні препарати, вітаміни, при тяжких формах – цитостатики (метотрексат), фізіотерапевтичне лікування, всі хворі отримували топічну терапію. Пацієнтам 2 і 3 груп (хворі на ГХ) після обстеження, консультації терапевта або кардіолога – призначалася адекватна антигіпертензивна терапія з персональним підбором лікування.
Критерії включення в дослідження:
– наявність Пс (пацієнти 1 і 3 групи);
– наявність ГХ II стадії за даними анамнезу, а також комплексу клінічних, інструментальних та лабораторних досліджень (пацієнти 2 і 3 групи); рівень АГ I-IIІ ступеня; відсутність адекватної систематичної антигіпертензивної терапії впродовж 2 тижнів до обстеження; виключений вторинний характер гіпертензії;
– згода на участь в дослідженні.
Критерії виключення з дослідження:
– наявність клінічно значущої супутньої патології;
– наявність симптоматичної АГ незалежно від генезу первинної патології;
– ГХ III стадії;
– вроджені або набуті вади серця;
– ішемічна хвороба серця, стенокардія напруги;
– шлуночкові аритмії високих градацій (більше 30 в годину, парні, групові, ранні екстрасистоли);
– порушення серцевої провідності (атріовентрикулярна блокада II-III ступеня);
– перенесені оперативні втручання, спрямовані на відновлення коронарного кровотоку та імплантацію штучного водія ритму;
– гострі інфекційні захворювання;
– алергічні захворювання зі шкірними проявами;
– захворювання ендокринної системи;
– вагітність і гормонозалежна гінекологічна патологія;
– інші захворювання внутрішніх органів в період загострення і в стадії декомпенсації;
– прийом лікарських препаратів, які можуть суттєво впливати на перебіг основного захворювання, будь-якої імунокоригуючої терапії, тривалий прийом глюкокортикоїдних стероїдів, цитостатиків;
– фототерапія;
– вказівка в анамнезі про побічну реакцію на терапію, розвиток нових побічних ефектів на одержувану терапію;
– вживання наркотиків /або в анамнезі;
– відмова пацієнтів від участі в дослідженні з будь-якої причини.
Відповідно до мети і завдань дана робота була проведена в дизайні когортного відкритого проспективного контрольованого дослідження. При оцінці ефективності різних схем терапії для забезпечення рівномірності розподілу пацієнтів по групах порівняння використовувався метод рандомізації. При викладанні матеріалів і методів дослідження, результатів дослідження та їх аналізу – застосовувалася термінологія, загальноприйнята і затверджена експертами ВООЗ, а також профільних дерматологічних і кардіологічних організацій.
Відповідно до поставленої мети і завдань була сформована досліджувана вибірка хворих на Пс згідно з критеріями включення і виключення з дослідження. Схема дизайну дослідження представлена нижче (рис. 2.1).
Загальноклінічне дослідження здійснювалося відповідно до протоколів ведення хворих на Пс (Наказ МОЗ України № 312 від 08.05.2009; наказ МОЗ України №762 від 20.11.2015 р.) [80, 82] і на ГХ (Наказ МОЗ України №436 від 03.07.2006 р.) [81]. Проводили збір скарг пацієнтів, анамнезу хвороби, аналізували дані об’єктивного обстеження (включаючи дерматологічне обстеження), лабораторних показників (загальний аналіз крові, аналіз крові з визначенням рівня глюкози, біохімічний аналіз крові, функціональні проби печінки, ліпідограма, показники коагуляційної активності крові; дослідження сечі, аналіз сечі за Нечипоренком та ін.), інструментальні тести (електрокардіографія, ехокардіоскопія, фундоскопія, УЗД органів черевної порожнини та ін.).

Рисунок 2.1 – Дизайн дослідження
Діагноз Пс в 1 і 3 групах встановлювався на підставі анамнезу і клінічних проявів дерматозу. Ступінь тяжкості ураження шкіри оцінювали шляхом підрахунку стандартизованого індексу тяжкості Пс за методом Фредеріксона і Петерсона (PASI), з його ж допомогою оцінювали динаміку змін ураження шкіри. Для визначення PASI тіло пацієнта умовно ділили на чотири ділянки (нижні кінцівки – 40 % від загальної поверхні шкіри людини; тулуб (груди, живіт, спина) – 30 % поверхні шкіри; верхні кінцівки – 20 % і голова – 10 %). У кожній з цих чотирьох ділянок оцінювали окремо – від 0 до 6 балів, залежно від ступеня вираженості, інтенсивність кожної з трьох клінічних ознак – еритеми, лущення та інфільтрації. Інтенсивність оцінювали від 0 балів (відсутність ознаки) до 4 (максимальний ступінь прояву). Після цього для кожної ділянки визначали свій індекс за формулою: (еритема + лущення + інфільтрація) ´ ступінь ураження ´ ваговий коефіцієнт ділянки.
Ваговий коефіцієнт ділянки відповідає площі поверхні шкіри: 0,4 – ноги, 0,3 – тулуб, 0,2 – руки, 0,1 – голова. Сума локальних індексів становить підсумковий індекс PASI, який може реєструватися в діапазоні від 0 до 72.
Ступінь тяжкості і поширеності шкірного процесу у кожного обстежуваного визначали згідно з градацією: PASI менше або дорівнює 10 – легкий ступінь Пс, PASI вище 10 – середньо-тяжкий і тяжкий перебіг Пс.
Finlay A.Y. (2005) [207] уточнює зазначену градацію: вище 10, але до 30 – середній ступінь тяжкості дерматозу, PASI більше 30 – тяжкий ступінь. Аналізуючи стан пацієнта при Пс, прийнято брати до уваги не тільки клінічні дані, але й оцінювати ЯЖ пацієнтів, визначаючи таким чином ступінь впливу захворювання шкіри на їх соціальну адаптацію. Саме тому показники ЯЖ включені в критерії оцінювання тяжкості захворювання й оцінки ефективності терапії. У роботі для цієї мети використовувалася анкета-опитувальник – дерматологічний індекс якості життя (DLQI) [208]. Показник DLQI вище 10 свідчить про виражений негативний вплив Пс на психологічне здоров’я пацієнта. Крім того, клінічно легкий Пс може бути розглянутий як середньо-тяжкий або тяжкий, якщо PASI≤10, але DLQI>10, що свідчить про перевагу показника ЯЖ. Таким чином, здійснювався всебічний і комплексний підхід до оцінювання тяжкості перебігу дерматозу у кожного пацієнта.
Розглянемо клініко-демографічні параметри досліджуваних вибірок пацієнтів в залежності від групи. У першій групі (порівняння) хворих на Пс було 34 чоловіки (47,2 %) і 38 жінок (52,8 %) у віці від 17 до 76 років. На рис. 2.2 показано розподіл обстежених хворих групи порівняння за віком.
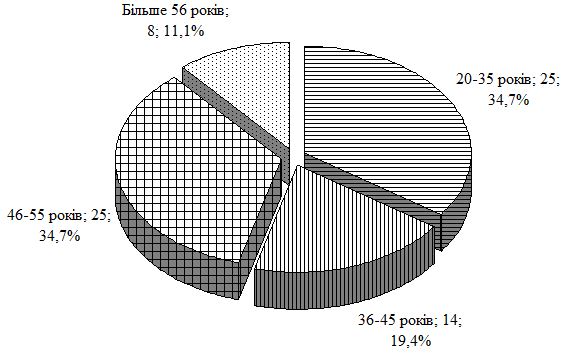
Рисунок 2.2 – Розподіл пацієнтів з Пс першої групи (порівняння) за віком
У віці 20-35 років було 25 осіб (34,7 %), у групі віком 36-45 років – 14 осіб (19,5 %), у віці 46-55 років – 25 осіб (34,7 %), більше 56 років – 8 осіб (11,1 %). Таким чином, середній вік пацієнтів із Пс склав (41,67±1,53) року.
Діаграма розподілу хворих першої групи за ІМТ представлена на рис. 2.3.
Представлені дані свідчать, що різні ступені надлишкової ваги тіла мали місце рівно у половини усіх випадків серед хворих на Пс, причому майже у третини було невисоке зростання ІМТ (в діапазоні 25,0-29,9 кг/м2), а в 1/6 – ІМТ коливався в межах від 30 до 35 кг/м2, зустрічались поодинокі випадки (3 %) морбідного ожиріння (ІМТ більше 40 кг/м2).
Вивчаючи асоціацію між появою маніфестних ознак захворювання і біологічним віком хворих, необхідно відзначити, що перші клінічні ознаки дерматозу в обстежених нами пацієнтів найчастіше відзначалися у віці до 30 років. Виникнення Пс в цей віковий період пояснюється чисельними гормональними перебудовами і / або різними психоемоційними переживаннями, характерними для періоду статевого дозрівання. В подальшому, незважаючи на досить високу питому вагу захворювань у вікових групах 30-39 та 40-49 років, спостерігалася тенденція до поступового зниження числа осіб, які вперше захворіли на Пс. В осіб старше 55 років дебют захворювання в нашому дослідженні не спостерігався.
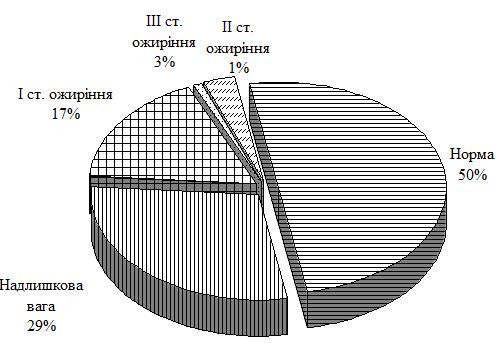
Рисунок 2.3 – Розподіл пацієнтів першої групи з Пс за ІМТ
Початок хвороби і її загострення пов’язували зі стресом 36 пацієнтів першої групи порівняння, що склало 50,0 %, з інфекційним фактором – 16 осіб (22,2 %), спадковістю – 10 (13,9 %), прийомом медикаментів – 1 особа (1,4 %), зловживанням алкоголем – 1 пацієнт (1,4 %), не могли вказати причину – 8 осіб (11,1 %).
На рис. 2.4 вказані тригерні фактори Пс у пацієнтів 1 групи (порівняння).
Аналіз діаграми пацієнтів 1 групи (порівняння) в залежності від давності захворювання на Пс (див. рис. 2.5) свідчить, що тривалість дерматозу у даній групі склала від вперше виявленого випадку до 46 років, середня тривалість захворювання склала (12,52±1,41) року.
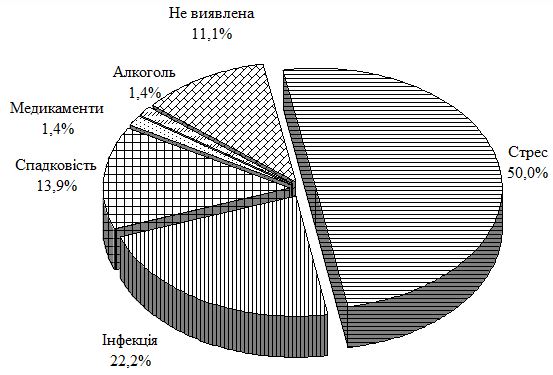
Рисунок 2.4 – Розподіл пацієнтів першої групи згідно з тригерним фактором
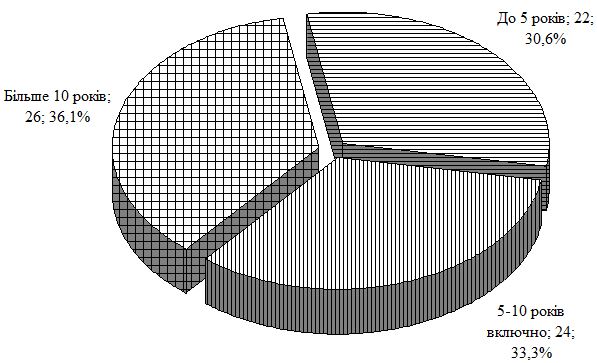
Рисунок 2.5 – Розподіл осіб першої групи (порівняння) в залежності від тривалості Пс
Як наочно видно, розподіл був симетричним (в кожній підгрупі тривалості Пс практично однакова кількість людей).
Супутня патологія проявлялась у наявності таких клінічно незначущих захворювань, як: апендектомія (1 (1,4 %) хворий), операція на колінному суглобі у зв’язку з травмою меніску (1 (1,4 %) пацієнт), вірусний гепатит А або В в анамнезі (7 (9,7 %) хворих) без порушення функції гепатобіліарної системи, нейроциркуляторна дистонія (2 (2,8 %) пацієнта), протрузія міжхребцевих дисків шийного відділу хребта (1 (1,4 %) пацієнт), міопатичний астигматизм (1 (1,4 %) пацієнт), вторинний астенопатичний синдром (1 (1,4 %) пацієнт), мігрень (1 (1,4 %) пацієнт), жовчно-кам’яна хвороба, холецистектомія (1 (1,4 %) випадок), виразкова хвороба шлунка в стадії стійкої ремісії (2 (2,8 %) хворих).
Індекс PASI в осіб цієї групи хворих на Пс склав 26,8±1,3 з діапазоном від 5,6 до 64,8.
У пацієнтів цієї групи порівняння були виділені такі клінічні форми дерматозу: вульгарний бляшковий – у 54 (75,0 %), артропатичний Пс – у 9 (12,5 %) осіб, краплеподібний – у 4 (5,5 %) , еритродермія – у 2 (2,8 %) пацієнтів, інтертригінозний – у 2 осіб (2,8 %), долонно-підошовний – в 1 випадку (1,4 %) (рис. 2.6).
На рисунку 2.7 показано розподіл хворих на Пс в даній групі в залежності від стадії дерматозу. У більшості пацієнтів – 53 особи (73,6 %) – була встановлена прогресуюча стадія, стаціонарна стадія відзначена у 15 осіб (20,8 %), регресуюча стадія – у 4 осіб (5,6 %).
Розподіл хворих групи порівняння на Пс за типом захворювання виглядав таким чином: найбільша кількість випадків припадала на зимовий тип – 35 осіб (48,6 %), недиференційований встановлено у 35 осіб (48,6 %), лише у 2 осіб (2,8 %) – літній тип захворювання.
У другій групі порівняння (хворих на ГХ) обстежених було 47 осіб, з них чоловіків 16 (34,0 %), жінок – 31 пацієнтка (66,0 %), у віці від 22 до75 років.
На рис. 2.8 показано розподіл обстежених хворих на ГХ за віком. У віці 20-35 років було 3 пацієнта (6,4 %), в групі віком 36-45 років – 3 особи (6,4 %), у віці 46-55 років – 18 осіб (38,3 %), понад 56 років – 23 (48,9 %) пацієнта. Таким чином, середній вік пацієнтів з ГХ склав (54,30±1,56) роки.
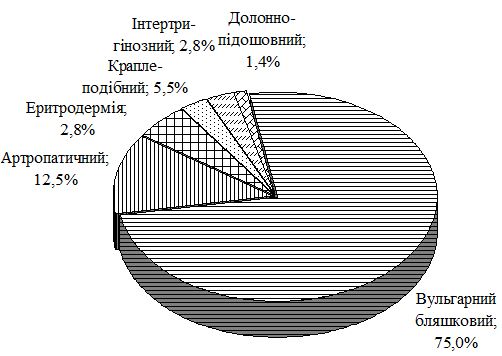
Рисунок 2.6 – Клінічні форми Пс в осіб групи порівняння
Рисунок 2.7 – Розподіл осіб групи порівняння на Пс за стадією
Рисунок 2.8 – Розподіл пацієнтів другої групи порівняння за віком
Діаграма розподілу хворих 2 групи за ІМТ представлена на рис. 2.9. Отримані дані свідчать, що нормальна маса тіла спостерігалася лише у 13 хворих на ГХ (27,7 %), наявність надлишкової ваги та І ступінь ожиріння визначено майже по третині усіх випадків серед хворих на ГХ – по 15 осіб (31,9 %), у 3 хворих (6,4 %) мало місце патологічне ожиріння (ІМТ більше 40 кг/м2).
У якості причини загострення ГХ 59,6 % хворих (28 осіб) визначили стрес.
Розподіл пацієнтів залежно від тривалості АГ у даній групі представлено на рис. 2.10, діапазон склав від 0,5 до 35 років. У пацієнтів 2 групи порівняння середня тривалість захворювання склала (10,13±1,56) року.
Як видно з діаграми, найбільша кількість пацієнтів мали тривалість гіпертензії в діапазоні 5-10 років.
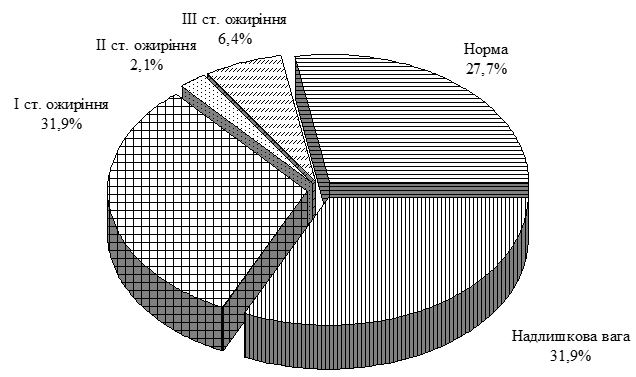
Рисунок 2.9 – Розподіл пацієнтів 2 групи з ГХ за ІМТ
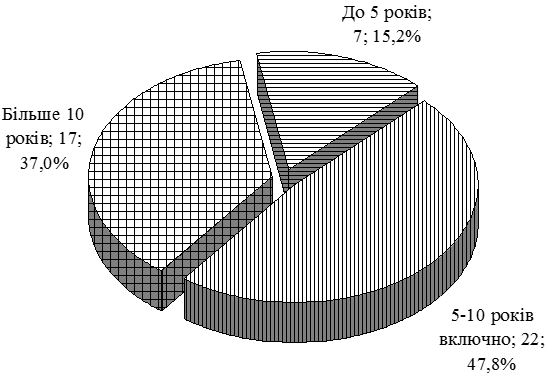
Рисунок 2.10 – Розподіл осіб другої групи залежно від тривалості ГХ
Супутня патологія проявлялась у наявності таких клінічно незначущих захворювань: ампутаційна культя лівої кінцівки (1 (2,1 %) хворий), астено-невротичний синдром (1 (2,1 %) пацієнт), викривлення носової перетинки (1 (2,1 %) пацієнт), хронічна хвороба нирок, сечокам’яна хвороба (1 (2,1 % ) хворий), люмбалгія, грижі міжхребцевих дисків (3 (6,4 %) пацієнта), пієлонефрит в стадії стійкої ремісії (1 (2,1 %) пацієнт), остеартроз променево-зап’ясткових суглобів у стадії стійкої ремісії(1 (2,1 %) пацієнт), відшарування сітківки (1 (2,1 %) випадок). Особливості перебігу АГ у пацієнтів цієї групи викладено в роботі [409].
У третій, основній, групі обстежених осіб було 54 чоловіки (55,1 %) і 44 жінки (44,9 %) у віці від 24 до 74 років.
На рис. 2.11 показано розподіл за віком осіб в групі пацієнтів з Пс і ГХ. У віці 20-35 років було 2 особи (2,1 %), в групі 36-45 років – 15 пацієнтів (15,3 %), у віці 46-55 років – 39 осіб (39,7 %), більше 56 років – 42 пацієнта (42,9 %). Середній вік цієї групи склав (54,12 ± 1,02) року.
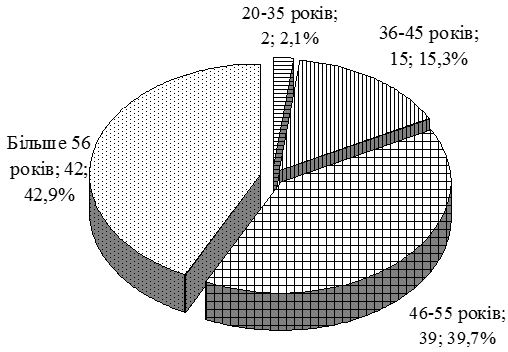
Рисунок 2.11 – Розподіл пацієнтів третьої (основної) групи за віком
Якщо порівнювати вік пацієнтів групи 1 і 3, які хворіють на Пс, то можна помітити, що в середньому пацієнти з коморбідною патологією старші за пацієнтів без АГ на 10-12 років. Слід підкреслити, що більш старший вік у групі з поєднаною патологією, ймовірно, обумовлений тим фактом, що ГХ молодих осіб або має форму нейроциркуляторної дистонії, або недостатньо часто верифікується / дообстежується, що й обумовлює діагностику ГХ на тлі Пс або без нього в більш старшому віці. У той же час, зазначений вік націлює на більш ретельне вивчення АТ у хворих на Пс віком від 45 років.
Діаграма розподілу хворих основної групи за ІМТ представлена на рис. 2.12. Визначені дані свідчать, що нормальну масу тіла мала лише 1/10 частина усіх хворих (11 осіб, 11,2 %) цієї групи, приблизно стільки ж хворих (8; 8,2 %) мали виразне ожиріння (ІМТ більше 30 кг/м2). Наявність надлишкової ваги реєструвалась найчастіше (42; 42,8 %) серед усіх випадків, І ступінь ожиріння (в діапазоні 25,0-29,9 кг/м2) мав місце у 37 пацієнтів цієї групи (37,8 %).
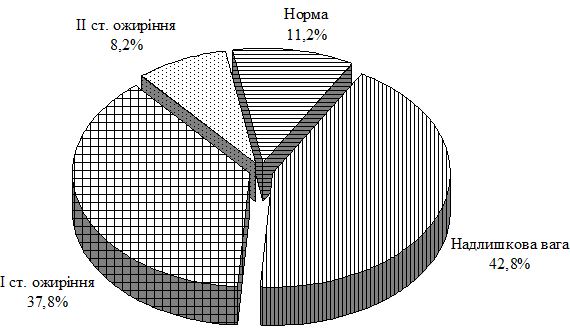
Рисунок 2.12 – Розподіл пацієнтів основної групи за ІМТ
Початок захворювання і його загострення пов’язували зі стресом 67 осіб (68,4 %), не могли визначити причину захворювання 19 осіб (19,4 %), інфекційні захворювання вказали 8 (8,2 %) обстежених, 2 пацієнти (2,0 %) відзначили наявність спадковості і також 2 (2,0 %) у якості провокуючого чинника визначили прийом ліків (β-адреноблокаторів). Звертає на себе увагу істотна різниця щодо фактора успадкування у пацієнтів з нормальними цифрами АТ і підвищеними: при Пс без ГХ в 7 разів частіше зустрічається генетичне детермінування дерматозу, але, з іншого боку, можливе одночасне успадкування толерантності до певних супутніх патологій. Водночас, пацієнти з Пс і ГХ менш стійкі до стресу, що, можливо, і призвело до розвитку одночасно двох стрес-залежних захворювань.
На рис. 2.13 показано основні причини початку або загострення захворювання.
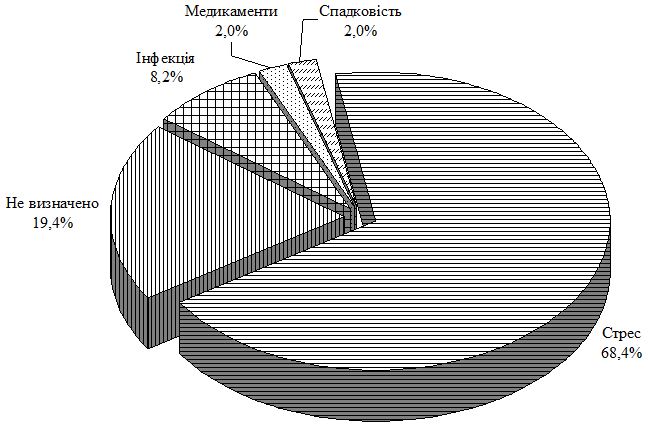
Рисунок 2.13 – Розподіл пацієнтів основної групи згідно причин виникнення захворювання
Проаналізовано термін тривалості дерматозу (див. рис. 2.14). Діапазон становив від 1 місяця до 52 років, середня тривалість склала (17,03±2,18) року. Тривалість ГХ становила в середньому (14,11±2,38) року. Отже, Пс передував гіпертензії.
Супутня патологія цієї групи представлена такими хворобами: травматична нефректомія в анамнезі (1 (1,0 %) пацієнт), струс мозку (1 (1,0 %) пацієнт), ретинопатія (1 (1,0 %) пацієнт), апендектомія (1 (1,0 %) пацієнт), вірусний гепатит А або В в анамнезі без порушення функції гепатобіліарної системи (4 (4,1 %) пацієнта), подвоєння нирки (1 (1,0 %) пацієнт), жовчнокам’яна хвороба, холецистит (5 (5,1 %) пацієнтів), хронічний тонзиліт в стадії ремісії (3 (3,1 %) пацієнта), виразкова хвороба шлунка в стадії стійкої ремісії (5 (5,1 %) пацієнтів), коксартроз кульшового суглоба в анамнезі (1 (1,0 %) пацієнт), сечокам’яна хвороба, пієлонефрит хронічний в стадії стійкої ремісії (1 (1,0 %) пацієнт), хронічне обструктивне захворювання легенів (1 (1,0 %) особа). Привертає увагу велика кількість супутньої патології шлунково-кишкового тракту, що можна пояснити перехресними патогенетичними механізмами формування цих захворювань.
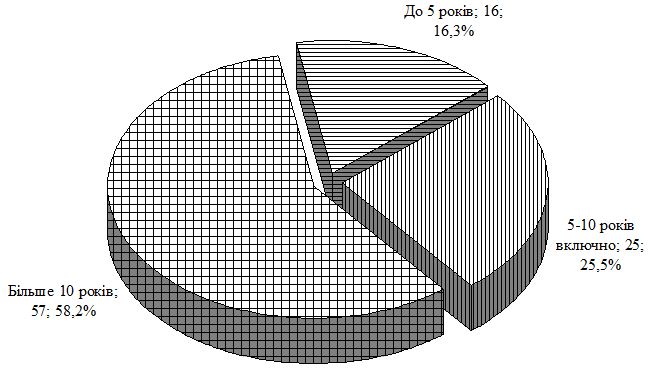
Рисунок 2.14 – Розподіл осіб основної групи залежно від тривалості Пс
Індекс PASI в осіб цієї групи в середньому склав 32,4±1,4, з діапазоном від 6,3 до 70,8.
Потрібно відзначити, що у переважної більшості хворих – 94 пацієнта, що складає 95,9 % – спостерігалися розповсюджені форми дерматозу, лише у 4 (4,1 %) – обмежені (3 – інтертригінозні форми та 1 – долонно-підошовна). У пацієнтів третьої (основної) групи виділені такі клінічні форми Пс: вульгарний бляшковий – у 60 хворих (61,2 %), артропатичний – у 29 осіб (29,6 %), краплеподібний – в 1 пацієнта (1,0 %), еритродермія – у 3 (3,1 %) пацієнтів, інтертригінозний Пс – також у 3 (3,1 %) пацієнтів, пустульозний – в 1 (1,0 %) хворого, долонно-підошовний – в 1 (1,0 %) випадку (рис. 2.15).
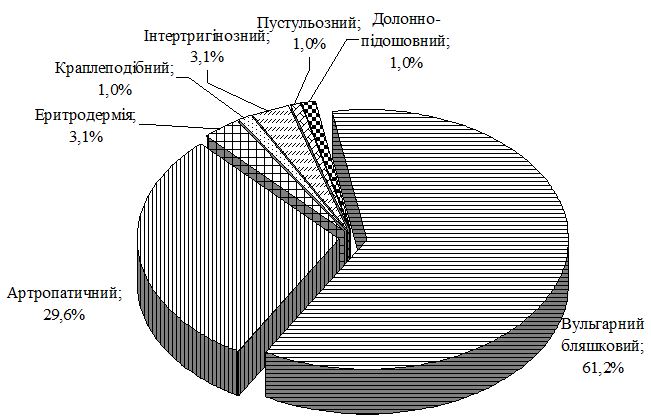
Рисунок 2.15 – Клінічні форми Пс у пацієнтів основної групи
Якщо порівнювати клінічні особливості формування Пс в 1 і 3 групах, то, по-перше, звертають на себе увагу відмінності в проявах вульгарного бляшкового Пс. У 5 пацієнтів 1 групи (порівняння) і 19 пацієнтів 3 групи (основної) спостерігалася більш виразна клініка дерматозу, що проявлялося наявністю у них більш інфільтрованих, ексудативних папул, з появою на їх поверхні не тільки характерних сріблясто-білих лусочок, але й серозно-геморагічних кірок. Луска на поверхні папул розташовувалася щільним шаром, погано відокремлювалася за рахунок просочування ексудатом. Підкреслюючи специфічний для цієї групи характер перебігу бляшкового Пс, ми виділили окремо цю категорію пацієнтів для порівняння в обох групах – вульгарний бляшковий Пс з явищами ексудації (раніше називався ексудативним Пс). Якщо в 1 групі (порівняння) таких пацієнтів було небагато (5 осіб; 6,9 %), то в групі з коморбідною патологією (група 3) таких пацієнтів виявилося значно більше – 19 осіб (19,4 %). Індекс PASI у цих хворих в більшості випадків був вище 30, індекс DLQI свідчив про виражений вплив дерматозу на ЯЖ, що дозволяє нам віднести цю категорію пацієнтів в групу обтяженого перебігу Пс. Крім того, в третій (основній) групі привертає увагу наявність великої кількості хворих на артропатичну форму Пс – 29 пацієнтів (29,6 %) порівняно з 9 пацієнтами 1 групи (12,5 %), що свідчить про формування системного ураження. При цьому відзначаються значні відмінності в розвитку різних форм Пс і, що надзвичайно важливо, у зв’язку з гендерним фактором [61, 67]. У чоловіків, які страждають лише на Пс (1 група) легкі і середньо-тяжкі форми дерматозу склали 64,7 % (22 особи), у жінок – 81,6 % (31 випадок), в цілому по групі – 73,6 % (53 особи). В 3 групі легкі і середньо-тяжкі форми реєструвалися у 35,2 % (19 пацієнтів) чоловіків та у 21 жінки (47,7 % жінок), в цілому по групі – у 40,9 % (40 хворих). При цьому у чоловіків 3 групи (основної) тяжкі форми в половині випадків було представлено вульгарним Пс з явищами ексудації (18 хворих; 51,4 %) і в 1/3 – артропатичним Пс (12 хворих; 34,3 %), а у жінок переважав артропатичний Пс (17 пацієнток; 73,9 %). Ці особливості викладено в роботах [40, 46, 48].
Таким чином, легкі і середньо-тяжкі форми Пс в 1 групі (порівняння) склали 73,6 % (53 особи), а в групі 3 (основній) – 40,9 % (40 осіб); відповідно, тяжкі форми в першій групі представлені 19 пацієнтами (26,4 %), в третій групі – 58 пацієнтами (59,18 %). Отже, встановлено, що приєднання ГХ до Пс значно ускладнює перебіг дерматозу, що супроводжується формуванням більш тяжких форм.
На рис. 2.16 показано розподіл пацієнтів третьої групи в залежності від стадії Пс. У більшості хворих (88 осіб; 89,8 %) переважала прогресуюча стадія дерматозу, стаціонарна визначена у 9 осіб (9,2 %), регресуюча стадія спостерігалася у 1 пацієнта (1,0 %).
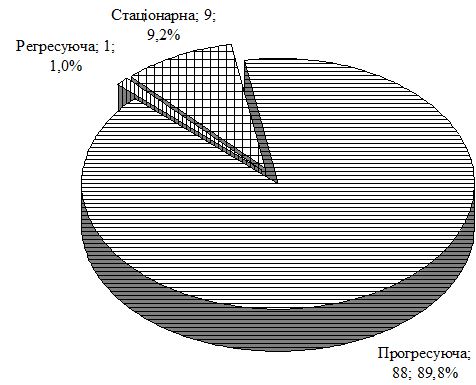
Рисунок 2.16 – Розподіл осіб третьої групи за стадією Пс
Розподіл хворих третьої групи за типом Пс виглядав таким чином: в більшості випадків було зареєстровано зимовий тип – у 39 осіб (39,8 %), недиференційований – у 57 осіб (58,2 %), лише у 2 осіб (2,0 %) – літній тип захворювання.
2.2 Лабораторні методи
Забір крові для досліджень здійснювали вранці натщесерце між 800 і 900 з кубітальної вени. Для взяття зразків крові використовували стерильні системи «Vacutainers Systems» виробництва фірми «Becton Dickinson and Company». Для отримання сироватки крові використовувалися пробірки із сепаруючим гелем. Забір крові і подальша обробка проводилася відповідно до інструкції виробника.
В окремих випадках біологічний матеріал для подальших досліджень заморожували і зберігали в морозильних камерах при температурі в межах від <-250С (холодильна установка RL28DAT Навчального медико-лабораторного центру Запорізького державного медичного університету, № 4ААХВ00089Т) до <-500С (морозильна камера УТ 327 Навчального медико-лабораторного центру Запорізького державного медичного університету). Безпосередньо перед проведенням дослідження необхідну кількість біологічного матеріалу одномоментно розморожували на водяній бані при температурі +370С.
Визначення нітротирозину у сироватці крові проводили методом непрямого твердофазного імуноферментного аналізу з використанням набору фірми Hycult biotech (Нідерланди) згідно з інструкцією до набору в умовах in vitro. Вміст нітротирозину виражався в нмоль/мл [240].
Визначення серотоніну у сироватці крові проводили з використанням наборів фірми IBL International (Німеччина) згідно з інструкцією до набору в умовах in vitro. Результати кількісного визначення серотоніну виражалися в нг/мл [415].
Дослідження рівня загального гомоцистеїну у сироватці крові проводили методом непрямого твердофазного імуноферментного аналізу з використанням наборів Axis-Shield, United Kingdom, одиниці виміру – мкмоль/л [239].
Визначення TNF-α у сироватці крові проводили методом непрямого твердофазного імуноферментного аналізу згідно з інструкцією до набору фірми eBioscience в умовах in vitro. Результати кількісного визначення TNF-α виражалися в пг/мл [141].
Визначення ІL-1β, ІL-1α, ІL-6 у сироватці крові проводили методом непрямого твердофазного імуноферментного аналізу з використанням наборів фірми Bender MedSystems GmbH (Австрія) згідно з інструкціями до наборів в умовах in vitro, результати виражалися в пг\мл [123].
Визначення каспази-8 у сироватці крові проводили методом непрямого твердофазного імуноферментного аналізу з використанням набору фірми Bender MedSystems GmbH (Австрія) згідно з інструкцією в умовах in vitro. Результати кількісного визначення каспази-8 виражалися в нг/мл [126].
Для визначення вмісту ендотеліну-1 у сироватці крові використовували імуноферментні набори для кількісного визначення ендотеліну (1-21) людини у сироватці виробництва фірми Biomedica (Австрія). Рівень ендотеліну-1 визначали у пкмоль/л [380].
Метод ELISA для визначення EPCR (нг/мл) у сироватці крові проводили з використанням набору фірми Cloud-Clone Corporation [108].
Кількісне визначення фактора росту ендотелію судин А (VEGF-A) проводили методом непрямого твердофазного імуноферментного аналізу за допомогою наборів виробництва eBioscience. Результати кількісного визначення виражалися в пг/мл [264].
Дослідження рівня кортизолу проводили методом непрямого твердофазного імуноферментного аналізу з використанням наборів виробництва Diagnostics Biochem Canada Inc., вимірювали у мкг/мл [218]. Рівні інсуліну визначали з допомогою наборів для ІФА виробництва DRG, США, результати виражали в uIU/ml [298]. Всі ІФА‑методики застосовували з використанням повнопланшетного напівавтоматичного імуноферментного аналізатора «Digiscan SA 400» виробництва фірми Asys Hitech (Австрія), зав. № 70384, в умовах Навчального медико-лабораторного центра ЗДМУ.
Ступінь спонтанної і метал-каталізованої модифікації білка (альдегідфенілгідразони [АФГ] і кетондинітрофенілгідразони [КФГ]) [76], рівень стабільних метаболітів оксиду азоту за Грісом, активності СОД [177,371], вміст sh‑груп [350], активності глутатіонпероксидази та глутатіонредуктази [13] визначали також у Навчальному медико-лабораторному центрі ЗДМУ.
2.3 Інструментальні методи дослідження
Визначення «офісного» АТ проводили у стані спокою в положенні сидячи триразовим вимірюванням на плечовій артерії не раніше ніж через 30 хвилин після фізичного навантаження за загальноприйнятим методом аускультації тонів Н. С. Короткова.
Добове моніторування АТ здійснювали з використанням системи АВРМ-04 (Угорщина). За допомогою апарату можливо вимірювати АТ осцилометричним методом і зберігати значення АТ і частоту серцевих скорочень (ЧСС) протягом доби, а також проводити автоматичний аналіз результатів дослідження і розрахунок похідних величин, побудову сумарних протоколів у вигляді таблиць, абсолютних величин графіків добового профілю АТ, ЧСС в програмі «Medibase». Протягом доби під час проведення моніторування АТ всі пацієнти вели щоденники, де вони відображали час фізичного, емоційного, розумового навантаження, будь-яких суб’єктивних змін і скарг (головний біль, біль або інші відчуття в ділянці серця та ін.), час прийому їжі, напоїв, куріння, час пробудження вранці і відходу до сну ввечері, якість сну, факт і час пробуджень вночі, час прийому медикаментів і їх назви. Реєстрація АТ в активний період (неспання) (6-22 год) проводилася кожні 15 хвилин, в пасивний період (сну) (22-6 год) – кожні 30 хвилин. Перед початком проведення даної процедури пацієнту накладали оклюзійну манжету – «правші» на ліву руку і навпаки. Пацієнтам проводили детальний інструктаж щодо їх дій під час вимірювання АТ: не можна в цей час знімати прилад, руку потрібно розслабити, не можна проводити фізіотерапевтичні процедури, перебувати в зоні випромінювання, мобільний телефон тримати якомога далі від приладу для зменшення впливу на роботу приладу. Пацієнтам видавали інформаційні картки з описом суті діагностичної процедури, враховуючи, що пацієнти будуть із приладом вести звичайний спосіб життя і з’являтися в громадських місцях. Після завершення моніторування дані переносилися до комп`ютерної бази даних з метою подальшого аналізу та збереження.
Аналізувалися такі показники:
1. Середньодобові, середньоденні і середньонічні показники САТ і ДАТ.
2. Варіабельність САТ і ДАТ за добу, активний і пасивний період – оцінюється за стандартним відхиленням від середньої величини.
3. Індекс часу (ІЧ, %) – відсоток вимірювань АТ, що перевищує рівень в загальній кількості вимірювань, прийнятий за верхню межу, вдень – 135/85 мм рт.ст., вночі – 120/80 мм рт. ст.
Для оцінки добового профілю АТ використовувались порогові значення ДМАТ, рекомендовані Українською асоціацією кардіологів.
Залежно від ступеня нічного зниження АТ (різниця між середньоденними і середньонічними показниками, виражена у відсотках / середньоденні показники) хворі розподілялись таким чином: «dipper» – пацієнти з нормальним зниженням АТ вночі (від 10 до 20 %), «non-dipper» – хворі з недостатнім зниженням АТ (від 0 до 10 %), «night-peaker» – особи, у яких значення АТ у нічні години перевищують денні, «over-dipper» – ступінь нічного зниження АТ понад 20 % (рис. 2.17) [179, 371].
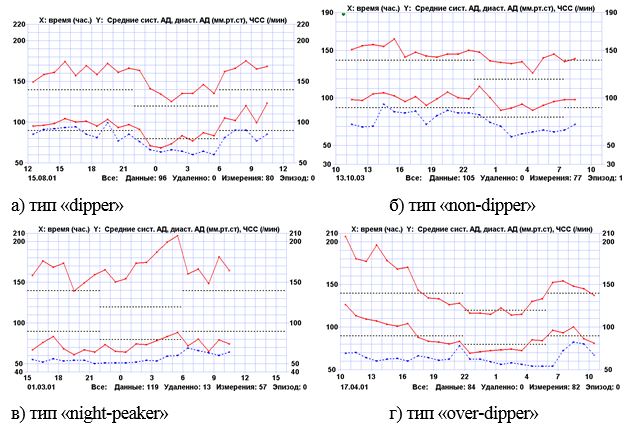
Рисунок 2.17 – Типи добових кривих АТ
Дослідження ВСР проводили методом кардіоінтервалографії з визначенням показників ВСР за допомогою комп’ютерно-діагностичної системи «КардіоЛаб» («Cardiolab+», комплектації НТЦ «ХАІ-Медіком», м. Харків, Україна).
Відомо, що ритм серця – універсальна реакція організму на будь-який вплив з боку зовнішнього і внутрішнього середовища, він містить в собі інформацію про функціональний стан різних ланок регулювання життєдіяльності огранізма людини як в нормі, так і при патології. ВСР – сукупність всіх його властивостей, обумовлених властивостями симпатичної, парасимпатичної та гуморальної регуляції, їх розгалуженими зв’язками між собою, а також реакціями на ментальний, фізичний та інші види стресу [15].
ВСР – це вираженість коливання ЧСС відносно її середнього рівня. В основі методу лежить визначення змін тривалості серцевих інтервалів. Послідовний ряд інтервалів (ритмограма) має характерну хвильову структуру, яка відображає регуляторні впливи ВНС на синусовий вузол серця. Тому аналіз ритмограми дозволяє отримати важливу інформацію про стан вегетативної регуляції серцевого ритму. Зміни біоритмологічних показників, які в більшості випадків випереджають дані клінічних і лабораторних методів дослідження, дають можливість об’єктивно оцінити механізми адаптації під час перебігу дерматозу, в тому числі за умов поєднання з ГХ.
Спектр ритмограми – це залежність амплітуди коливань серцевого ритму від його частоти. Дослідження ВСР проводили у горизонтальному положенні при спокійному диханні – фонова проба, та в умовах активної ортостатичної проби. Для оцінки ВСР використовували комп’ютерний аналіз 10-хвилинних фрагментів ритмограми. До початку дослідження пацієнти протягом 24 годин не вживали кави, алкоголю і не приймали лікарських препаратів. Розраховували такі показники ВСР:
– ТР – показник загального рівня активності регуляторних систем;
– SDNN (NN – означає ряд нормальних інтервалів «normal to normal» з виключенням екстрасистол) – середньоквадратичне відхилення послідовних інтервалів RR (мc2) – інтегральний показник, який характеризує ВСР в цілому;
– RMSSD – квадратний корінь з суми квадратів різності показників послідовних пар інтервалів NN (нормальних інтервалів RR);
– LF (Low Frequency) – потужність спектру з частотою 0,05-0,015 Гц (мc2) – характеризує активність симпатичного відділу ВНС;
– HF (High Frequency) – потужність спектру з частотою 0,16-0,4 Гц (мc2) – характеризує активність парасимпатичного відділу ВНС;
– LF/HF – співвідношення низько- і високочастотних компонентів, показник балансу симпатичної і парасимпатичної частин ВНС (%);
– VLF (Very Low Frequency) – потужність спектру з частотою менше 0,05 Гц (мc2);
– ІС – індекс централізації (Index of centralization), свідчить про переважання центрального контуру над автономним.
Для визначення ступеня адаптації серцево-судинної системи до випадкових або постійно діючих агресивних факторів та оцінки адекватності процесів регуляції використовується показник активності регуляторних систем (ПАРС).
Температурно-міографічний тренінг біологічного управління
Психофізіологічне обстеження і курс релаксаційних температурно-міографічних тренінгів БЗЗ проводився за допомогою програмно-апаратного комплексу «Бослаб-професійний Плюс» (комплектація Інституту молекулярної біології і біофізики СО РАМН, Новосибірськ, РФ) в ННМЦ «Університетська клініка ЗДМУ» (директор – д.мед.н., професор В.І. Кривенко) Діагностичне психофізіологічне обстеження відбувалося до і після курсу біоуправління. Всі процедури немедикаментозної корекції проводилися в спеціально обладнаному приміщенні [24].
На першому сеансі здійснювалася діагностика стану пацієнта з урахуванням результатів анкетування. Далі сеанси тривалістю 15 хвилин проводилися щодня, курс складався з 10 занять. В якості терапії використовували міографічний і температурний тренінги. Температурно-міографічний тренінг проходив у положенні хворого лежачи з закритими очима, електрод розташовувався на фронтальному м’язі, а температурний датчик знаходився на вказівному пальці. Пасивний електрод прикріплювався до мочки вуха.
Для досягнення результатів БЗЗ-тренінгу використовувалися різні стратегії: концентрація на приємних відчуттях, формування позитивних образів, занурення в аутогенний стан і «вільний метод», за допомогою якого пацієнтові пропонувалося експериментувати і вільно змінювати методики для досягнення зворотного зв’язку, в якості якого використовувався звуковий сигнал.
На тіло обстежуваного прикріплювали датчики, з’єднані з панеллю перетворюючого пристрою. Отримана інформація передавалася на комп’ютер для подальшої обробки. В результаті запису даних із датчиків отримували інформацію про основні фізіологічні процеси (електроміограма і температура кінцівок).
2.4 Гістологічні та імуногістохімічні методи
Біопсійний матеріал отримано у 38 хворих на Пс, з яких 18 страждають на супутню ГХ, 20 – лише на Пс, 10 пацієнтів групи порівняння на ГХ, групу контролю склали 10 практично здорових осіб; при цьому 11 пацієнтів основної групи і всі контрольної групи були віком 58-74 роки, що, згідно з рекомендаціями Бунака В.В. [68], відповідає похилому віку. Ми акцентуємо увагу на віці хворих, оскільки, з урахуванням більш старшого віку пацієнтів основної групи, окремо оцінювали вікові зміни у шкірі здорових людей контрольної групи, щоб відокремити ці процеси від проявів коморбідного стану.
Таким чином, побудовано наступну структуру дослідження:
1) дослідили стан основних структур шкіри у 10 осіб похилого віку без ознак патологічного ураження шкіри для відокремлення можливого вікового впливу на будову і функцію шкіри;
2) вивчили патоморфологічні ознаки ураженої і неураженої шкіри 20 пацієнтів, які страждають Пс, але не мають ГХ;
3) вивчили патоморфологічні зміни шкіри у10 хворих на ГХ для визначення частки впливу ГХ на формування ознак при коморбідному стані;
4) дослідили стан патоморфологічних змін у 18 хворих на Пс із супутньою ГХ як у вогнищах ураження, так і в інтактній шкірі.
Саме тому матеріал буде представлено за вказаною схемою: спочатку досліджуються вікові зміни шкіри, потім ознаки псоріатичного ураження, далі – вплив ГХ на стан шкіри і наприкінці – характерні для досліджуваної коморбідної патології ознаки ураження.
Для гістологічного вивчення структури епідермісу і сполучнотканинної основи шкіри досліджували біоптати розміром 2×3 мм, взяті з ділянок передпліччя або плеча. У хворих на Пс в прогресуючій стадії захворювання біоптати отримували з осередків ураження шкіри, а також з відповідних за локалізацією (контрлатеральних) ділянок візуально незміненої шкіри. Зразки шкірних біоптатів фіксували у рідині Буена, обробляли у висхідній концентрації етанолу та виготовляли парапластові блоки за стандартною методикою. Серійні зрізи тканини виготовляли завтовшки 5-7 мкм та забарвлювали гематоксиліном-еозином, за Масоном, за Пачіні, за Ван-Гізоном, за Вейгертом, конго червоним за Матсуура, за Маллорі-Слінченком. Використовували загальноприйняті стандарти гістологічних процедур [84, 85].
Забарвлення гематоксиліном-еозином проводилося з метою вивчення основних структур, що входять до складу шкіри. У подальшому депарафіновані за стандартною методикою зрізи 5-7 мкм завтовшки розміщували у розчині гематоксиліну Гейденгайна (0,5 г гематоксиліну в 10 мл етанолу і 90 мл дистильованої води) на 15 хвилин при кімнатній температурі з подальшою промивкою у протоковій воді впродовж 5 хвилин. Після цього проводили забарвлення 0,1 % водним розчином еозину 1 хвилину та процедуру занурення у бальзам.
Мікропрепарати шкіри, забарвлені за оригінальною методикою Масона, використовували для візуалізації загальних гістологічних елементів епідермісу та дерми, в тому числі контрастування колагенових волокон. Для цього зрізи обробляли 5 % розчином залізо-аміачного галуна протягом 30 хвилин при температурі +50°С та забарвлювали розчином гематоксиліну Гейденгайна (0,5 г гематоксиліну в 10 мл етанолу і 90 мл дистильованої води). Після цього забарвлювали гематоксиліном Рего (1 г гематоксиліну в 10 мл абсолютного спирту з додаванням 10 мл гліцерину та 80 мл дистильованої води) протягом 30 хвилин при температурі +50 °С з подальшим диференціюванням у 2,5 % розчині залізо-аміачного галуна. Наступним кроком було забарвлення у суміші кислого фуксину, 100 % оцтової кислоти та дистильованої води (1 г, 1 мл та 100 мл відповідно). У подальшому тканину обробляли 1 % фосфорномолібденовою кислотою протягом 5 хвилин та водним розчином анілінового синього (0,5 г анілінового синього, 100 мл дистильованої води) з додаванням 2,5 мл 100 % оцтової кислоти протягом 4 хвилин при кімнатній температурі та диференціювали в 1 % оцтовій кислоті. Після обробки виготовляли постійні гістопрепарати.
Для візуалізації елементів сполучної тканини використовували забарвлення мікропрепаратів за методикою Пачіні. Для цього депарафіновані зрізи 5-7 мкм завтовшки обробляли 2 % розчином фосфорновольфрамової кислоти протягом 10 хвилин; 15 хвилин забарвлювали сумішшю, яка складалась з 10 мл розчину водного блакитного з орсеїном (1 г водного голубого, 1 г орсеїну, 5 мл 100 % оцтової кислоти, 20 мл гліцерину, 50 мл абсолютного спирту, 100 мл дистильованої води), 12 мл 2 % спиртового розчину еозину, 1 мл насиченого водного розчину кислого фуксину та 5 мл нейтрального гліцерину; диференціювали в абсолютному спирті та 2 % фосфорновольфрамової кислоти протягом декількох секунд. Після вказаної процедури забарвлені зрізи заливали в бальзам.
Для морфологічної та морфометричної оцінки еластичного компоненту дерми використовували методику забарвлення мікропрепаратів резорцин-фуксином у сукупності з методикою Ван-Гізона. Для цього депарафіновані зрізи з 80 % етанолу на 15 хвилин переносили у резорцин-фуксин ( 0,5 г некислотного фуксину, 1 г резорцину, 2 г хлористого заліза, 60 мл дистильованої води); після промивки в протоковій та дистильованій воді забарвлювали залізним гематоксиліном Вейгерта (1 г гематоксиліну, 1,16 г хлористого заліза, 1 мл соляної кислоти, 98 мл дистильованої води, 100 мл 96 % етанолу) протягом 2 хвилин. Наступним кроком було 5-хвилинне забарвлення сумішшю пікринової кислоти та тіазинового червоного (100 мл насиченого водного розчину пікринової кислоти, 7,5 мл 1 % водного розчину тіазинового червоного), після чого проводили процедуру занурення в бальзам.
Для забарвлення мікропрепаратів шкіри резорцин-фуксином за методикою Вейгерта препарати під час депарафінізації з 80 % етанолу переносили у виготовлений за стандартною методикою резорцин-фуксин (0,5 г некислотного фуксину, 1 г резорцину, 2 г хлористого заліза, 60 мл дистильованої води) на 20 хвилин. Під контролем за допомогою мікроскопу зрізи диференціювали у 96 % етанолі до появи чорно-синіх еластичних волокон.
Проведення гістологічного дослідження шкіри здійснювали завдяки використанню методики забарвлення сполучнотканинних елементів конго червоним за Матсуура. Для цього зрізи після депарафінізації на 12 годин розміщували у конго червоному (1 г конго червоного, 100 мл 90 % спирту), потім обробляли спиртовим розчином фосфорномолібденової кислоти (1 г кислоти на 100 мл абсолютного спирту) протягом 5 хвилин. Процедуру завершували зануренням у бальзам за стандартною методикою.
Для оцінки характеру розташування та кількості волокон різної хімічної природи у складі шкіри використовували забарвлення мікропрепаратів за методикою Малорі-Слінченко. Для цього депарафіновані зрізи забарвлювали гематоксиліном Вейгерта (1 г гематоксиліну, 1,16 г хлористого заліза, 1 мл соляної кислоти, 98 мл дистильованої води, 100 мл 96 % етанолу) протягом 5 хвилин, потім утримували в хромотропі (0,2 г хромотропу 2В, 0,5 г HIO3, 100 мл дистильованої води). Протягом 10 сек. промивали в 5 % розчині фосфорновольфрамової кислоти; після процедури зневоднення, починаючи з 70° спирту, занурювали в канадський бальзам.
Для імуногістохімічного дослідження фрагменти шкіри фіксували в забуференому 10 % формаліні і заливали в парафін. На прецезійному ротаційному мікротомі НМ 3600 (фірми «MICROM Laborgerate GmbH» – Німеччина) виготовляли серійні зрізи завтовшки 4 μм, які розміщали на звичайні предметні скельця (для стандартного патогістологічного фарбування) або на адгезивні предметні скельця «SUPER FROST PLUS» фірми «DAKO» – Данія (для імуногістохімічних досліджень).
Імуногістохімічні дослідження з використанням моноклональних антитіл виконувались в парафінових зрізах шкіри згідно зі стандартизованими протоколами, детально викладеними у відповідних керівництвах з імуногістохімії. Після депарафінізації і регідратації зрізів проводили температурне демаскування антигенів (шляхом нагрівання на водяній бані в Трис-ЕДТА буфері з рН=9,0) та пригнічували активність ендогенної пероксидази 3 % розчином перекису водню. Після інкубації з первинними антитілами проводилась візуалізація відповідних антигенів системою візуалізації DAKOEnVision+ System з діамінобензидином.
Імуногістохімічне визначення експресії маркера iNOS проводилось з використанням кролячих поліклональних антитіл до iNOS (клон 9242-PO, «ThermoFisherScientificInc.», США).
Для оцінки експресії iNOS при псоріатичному ураженні шкіри препарати фотографували в 5 полях зору цифровою фотокамерою «Canon EOS 1000D» (Японія) в мікроскопі Axioplan 2 («Carl Zeiss» – Німеччина) при збільшенні х200 та аналізували з використанням програмного забезпечення ImageJ. В кожному полі зору визначали умовну оптичну щільність (УОЩ) експресії iNOS в епідермісі та дермі. Обчислювали значення коефіцієнту УОЩ розподілу в епідермісі (Kepi) за формулою:
Kepi=Sepiпоз/Sepiзаг,
де Sepiпоз – оптична щільність позитивної імуногістохімічної реакції в епідермісі;
Sepiзаг– загальна оптична щільність в епідермісі.
За тим же принципом проводилося обчислення коефіцієнту УОЩ (Kderm) у дермі:
Kderm=Sdermпоз/Sdermзаг,
де Sdermпоз – оптична щільність позитивної імуногістохімічної реакції в дермі;
Sdermзаг– загальна оптична щільність в дермі.
Проведення кількісного морфологічного дослідження здійснювали з використанням програмного пакету ImageJ 1,47v (розробка ініційована автором Wayne Rasband в Research Services Branch, National Institute of Mental Health, Maryland, USA і поширюється без ліцензійних обмежень як суспільне надбання) [163], застосовуючи загальні принципи морфометричного і стереологічного аналізу, викладені Г.Г. Автанділовим і A. Méndez-Vilas (2012) [1, 169].
У кількісному морфологічному дослідженні вивчали відносний об’єм всіх елементів ГМЦР у сосочковому та сітчастому шарах дерми окремо для кожного шару, а також зовнішній діаметр артеріол підсосочкової сітки, венул поверхневого і глибокого підсосочкових сплетень, внутрішньососочкових капілярів та основи внутрішньососочкових капілярних петель, максимальну і мінімальну загальну товщину базального, остистого і зернистого шарів епідермісу. Також розраховували чисельну щільність ядер кератиноцитів, мітотичні індекси (МІ) кератиноцитів, ендотеліальних клітин мікросудин, перицитів, гладких міоцитів і фібробластів. Відносні об’єми елементів ГМЦР визначали стереометрично методом крапкового рахунку за формулою [2]:
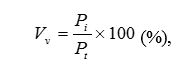
де Vv – відносний об’єм структури;
Pi – кількість точок перетину ліній тест-системи, які припадають на структуру;
Pt – загальна кількість точок перетину ліній тест-системи.
2.5 Визначення якості життя пацієнтів, рівня тривоги та депресії
Для оцінки ЯЖ був використаний опитувальник DLQI (Фінлей, Каган, 1992) [173, 207, 401], який застосовується для оцінки ступеня негативного впливу дерматологічного захворювання на різні аспекти життя пацієнта, що характеризують якість його життя в цілому. При опитуванні пацієнтам пропонується відповісти на 10 питань, за допомогою яких оцінюються такі параметри: симптоми / самопочуття, повсякденна активність, дозвілля, робота / навчання, особистісні відносини і лікування. Ступінь впливу захворювання на ЯЖ оцінюється за 4-бальною шкалою Likert (0 – немає, 1 – трохи, 2 – помірно, 3 – дуже сильно). Сума балів являє собою індекс DLQI, який може бути в діапазоні від 0 до 30, при цьому показник 0-1 означає відсутність впливу, 2-5 – незначний вплив, 6-10 – помірний вплив, 11-20 – значний вплив, 21-30 – надзвичайно високий вплив.
Слід зазначити, що при зборі анамнезу, клінічному обстеженні пацієнтів привертала увагу специфічна поведінка хворих. Окрім того, що значна кількість пацієнтів скаржилися на порушення сну, спостерігалися прояви психологічних порушень у вигляді втомлюваності, занепокоєння, роздратованості, невпевненості у собі, відчуття внутрішнього напруження. У більшості хворих цей стан супроводжується підвищенням апетиту, що і призвело до зростання ІМТ, потребою у прийомі алкоголю, інколи пацієнти виглядали метушливими, спостерігався тремор кінцівок, безцільна рухова активність. Психоемоційний стан пацієнтів досліджували за допомогою анкетування. При діагностичному психофізіологічному обстеженні за допомогою програмно-апаратного комплексу «Бослаб-професійний Плюс» пацієнти заповнювали шкалу тривожності Спілбергера-Ханіна, депресії Бека. Порівняння отриманих результатів з тестуванням за допомогою госпітальної шкали тривоги і депресії (HADS) [422] довело, що ця анкета є достатньою, зручною та інформативною для визначення в даний момент рівня тривоги і депресії у пацієнтів груп дослідження. При використанні анкети госпітальної шкали тривоги і депресії пацієнту було запропоновано відповісти на 14 запитань (7 – стосовно визначення рівня тривоги і 7 – стосовно рівня депресії), результати оцінювалися в балах від 0 (мінімальне значення) до 21 (максимальне значення):
– 0-7 балів – тривога або депресія відсутні;
– 8-10 балів – невизначена оцінка;
– 11-21 балів – точно присутня.
Пацієнтів з високим рівнем тривоги або депресії консультували у психіатра-психолога для визначення рівня і якості терапевтичного втручання.
2.6 Статистичні методи обробки інформації
Отримані в дослідженні кількісні дані піддавали статистичній обробці, яка включала визначення таких характеристик: х – сeредня арифметична; sx2– дисперсія; sx – середнє квадратичне відхилення; ss – помилка середнього квадратичного відхилення. Для обчислення зазначених статистичних характеристик використовували стандартні формули.
Нульова гіпотеза відхилялася за умови, що критерій t Стьюдента перевершував табличні значення для відповідних ступенів свободи і 5 %-го рівня значущості.
У тому випадку, якщо отримане в дослідженні емпіричне розподілення не відповідало нормальному закону, оцінку відмінностей між вибірками оцінювали за допомогою непараметричних критеріїв: Х-критерію Ван-дер-Вардена і U-критерію Вілкоксона (Манна-Вітні), за технікою, викладеною у монографії [31].
Дисперсійний аналіз ортогональних комплексів проводили на основі обчислення F-критерію Фішера з подальшою оцінкою сили впливу чинника (наявність Пс, ГХ або їх поєднання). Згідно зі схемою дисперсійного аналізу, проводили послідовне обчислення допоміжних параметрів (девіат, ступенів свободи, дисперсій). Нульову гіпотезу відкидали, якщо емпірично розрахована величина F перевищувала відповідні значення F таблиці Фішера для рівня значущості 0,05. Для визначення сили впливу чинника на морфологічні ознаки стану шкіри за методом Снедекора [88] використовували такі розрахунки:
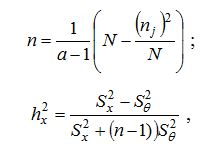
де n – умовна «середня» чисельність варіант в кожній з градацій комплексу;
N – об’єм комплексу;
hx2 – критерій сили впливу чинника;
Sx та Sq – факторіальні і внутрішньогрупові дисперсії.
З метою виключення впливу характеру розподілу досліджуваних величин, виражених в кількісних шкалах, перевагу віддавали непараметричним статистичним методам аналізу (для перевірки гіпотези про нормальність розподілу варіант, виражених у кількісній шкалі, застосовували коефіцієнти асиметрії та ексцесу, а також критерії Шапіро-Вілка і c2, порівнюючи отримані дані з відповідними критичними величинами при рівні значущості <0,05). Фінальні цифрові дані представляли у вигляді: середнє значення ± стандартна помилка середньої величини (95 % довірчий інтервал).
У разі нормального розподілу використовували процедуру однофакторного дисперсійного аналізу з подальшим використанням Newman-Keuls, враховуючи множинність порівнянь. У тих випадках, коли розподіл досліджуваних змінних не відповідав нормальному закону, використовували непараметричні – H-критерій Крускала-Волліса з подальшим порівнянням за Games-Howell. Окремі статистичні процедури й алгоритми реалізовані у вигляді спеціально написаних макросів у відповідних програмах.
Оцінка ступеня взаємозв’язку між парами незалежних ознак, виражених в кількісних шкалах, здійснювалася за допомогою коефіцієнта рангової кореляції Пірсона (r), Спірмена (R) в залежності від характеру розподілу змінних. Оцінку достовірності коефіцієнтів кореляції проводили, порівнюючи розраховані коефіцієнти з критичними (виходячи із властивостей коефіцієнтів кореляції і ступенів свободи).
Для визначення наявності та характеру залежності між числовими змінними використовували процедуру регресійного аналізу, застосовуючи лінійну, логарифмічну, ступеневу, експонентну, поліномінальну (другого і третього ступеня) моделі, нормального розподілу залишків (при цьому як критерій згоди застосовували величини асиметрії та ексцесу), критерій Darbin-Wothson. При аналізі регресійних рівнянь брали до уваги величину множинного коефіцієнта кореляції, а також величину коефіцієнта детермінації R2.
Статистичний аналіз проводили з використанням пакетів прикладних програм «STATISTICA® for Windows 6.0» (StatSoft Inc., № ліцензії AXXR712D833214FAN5) «Microsoft Excel 2003», «SPSS 15». Для всіх видів аналізу статистично значущими вважали відмінності при р<0,05.
Матеріали даного розділу опубліковані в таких роботах:
[39, 40, 46, 48, 56, 59, 61, 67, 95, 96, 407]
