МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
ЗАПОРІЗЬКИЙ ДЕРЖАВНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ
На правах рукопису
Макарчук Алла Олександрівна
УДК 617.58-001: 617.57: 616.5-022.7/.9
КОРЕКЦІЯ ІНВОЛЮТИВНИХ ЗМІН ШКІРИ ОБЛИЧЧЯ У ПАЦІЄНТІВ
З СУПУТНЬОЮ МАЛАСЕЗІЙНОЮ ІНФЕКЦІЄЮ
14.01.20 — шкірні та венеричні хвороби
Дисертація на здобуття наукового ступеня кандидата
медичних наук
Науковий керівник:
Федотов Валерій Павлович,
доктор медичних наук, професор
Запоріжжя – 2016
ЗМІСТ
| Перелік умовних позначень | 4 |
| Вступ | 5 |
| Розділ 1 Аналітичний огляд літератури | 11 |
| 1.1 Клінічні та морфологічні особливості вікових змін шкіри | 11 |
| 1.2 Маласезіоз шкіри – етіологія, діагностика | 17 |
| 1.3 Лікування маласезіозу | 23 |
| 1.4 Методи лікування інволютивних змін шкіри | 24 |
| Розділ 2 Матеріали та методи дослідження | 31 |
| 2.1 Загальні клініко-лабораторні дослідження | 31 |
| 2.2 Діагностика функціонального стану шкіри обличчя | 32 |
| 2.3 Мікроскопічні дослідження | 33 |
| 2.4 Морфологічні дослідження | 35 |
| 2.5 Математична обробка матеріалу. | 40 |
| Розділ 3 Клінічні особливості та функціональний стан шкіри у пацієнтів з інволютивними змінами та супутньою маласезійною інфекцією | 42 |
| 3.1 Особливості клінічних проявів інволютивних змін шкіри у хворих | 42 |
| 3.2 Функціональні показники шкіри у пацієнтів інволютивними змінами шкіри обличчя з супутньою маласезійною інфекцією до лікування |
50 |
| Розділ 4 Морфологічна характеристика інволютивних змін шкіри обличчя у хворих з маласезійною інфекцією до лікування | 54 |
| Розділ 5 Показання та методика комплексної терапії інволютивних змін шкіри обличчя з супутньою маласезійною інфекцією, оцінка ефективності терапії та диспансеризації хворих | 72 |
| 5.1 Обґрунтування показань та методики диференційованої комплексної терапії на першому етапі обстеження хворих | 72 |
| 5.2 Другий предопераційний етап терапії обстежених хворих | 75 |
| 5.3 Третій етап лікування – хірургічна корекція інволютивних змін шкіри обличчя | 77 |
| 5.4 Клінічна оцінка ефективності розробленої комплексної терапії з вивченням динаміки функціонального стану шкіри | 80 |
| 5.5 Динаміка морфологічних змін шкіри після лікування | 83 |
| 5.6 Диспансеризація хворих | 102 |
| Розділ 6 Аналіз та узагальнення результатів дослідження | 106 |
| Висновки | 118 |
| Рекомендації | 120 |
| Список використаних джерел | 121 |
| Додаток А Акти впровадження | 142 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
ГМЦР – гемомікроциркуляторне русло
ВСТУП
Актуальність теми. Вікові інволютивні зміни шкіри обличчя є однією з давніх і важливих медико-соціальних проблем [51, 63]. На інтенсивність змін впливає група факторів, які безпосередньо не пов’язані з віком: ендокринні розлади, психологічні травми, передозування ультрафіолетового і рентгенівського випромінювання, значні коливання маси тіла, несприятливі екологічні фактори, шкідливі умови роботи і ряд інших [57]. Внаслідок дії цих чинників формуються різноманітні гістоморфологічні та фізіологічні механізми, які впливають на характер, ступінь, швидкість розвитку інволютивних змін різних структур шкіри. Одним з важливих факторів, що безпосередньо визначає ефективність корекції інволютивних змін шкіри, є специфічна грибкова патологія шкіри, особливо у зоні проведення відновних заходів, зокрема обличчя і шиї [32, 116].
Наявність певного арсеналу методів відновлення шкіри при інволютивних змінах надає можливість вибору їх з урахуванням переваг і недоліків, а також дозволяє урахувати причину та індивідуальність обтяжуючих факторів у конкретному клінічному випадку [35]. У сучасній естетичній терапії шкіри обличчя і шиї визначальними факторами для вибору методу відновлення вважають морфологічний та функціональний стан тканин, тяжкість супутніх захворювань органів і систем, а також вплив різноманітних екзогенних та ендогенних чинників. Це обумовлює можливість і доцільність використання морфологічних даних для обгрунтування методів лікування пацієнтів з інволютивними та патологічними змінами шкіри [7, 17].
Впровадження різних методів в естетичну терапію шкіри обличчя обумовило збільшення кількості заходів та суттєве розширення контингенту жінок, що звертаються до спеціалізованих клінік. При цьому також значно зросла частка пацієнтів з різноманітною супутньою патологією, що потребує пошуку нових підходів до лікувальних технологій.
За даними літератури [28], суттєва роль у розвитку інволютивних змін шкіри надається різним інфекційним факторам, особливо — вірусній і бактеріальній інфекції, зокрема, піококам і, можливо, грибам. Участь грибної інфекції при цих процесах вивчена недостатньо.
Особливу увагу привертають дріжджоподібні ліпофільні гриби роду Malassezia, що пов’язано з надзвичайно високою поширеністю серед населення, різноманітністю проявів інфекції, зміною ставлення до цих грибів як до нормальної та умовно патогенної мікрофлори. Роль маласезійної інфекції на формування інволютивних процесів шкіри обличчя раніше не вивчалась. Питання можливого впливу грибів роду Malassezia на стан шкіри, діагностики та лікування обумовлюють актуальність даної теми і є підставою для подальшого розвитку досліджень у цьому напрямку.
Зв’язок роботи з науковими програмами, планами, темами. Робота є фрагментом науково-дослідної роботи кафедри дерматовенерології Запорізького державного медичного університету «Розробка методів терапії та профілактики хронічних дерматозів та хвороб, що передаються статевим шляхом із урахуванням особливостей гомеостазу хворих та супутньої патології» (№ держреєстрації 0113U000800). Дисертантом особисто виконано фрагменти, які присвячені вивченню патогенезу, вікових інволютивних змін шкіри обличчя із супутнім маласезіозом, мікробіоценозу шкіри, властивостей шкіри за допомогою об’єктивної діагностики стану поверхні та структури, а також розробці й апробації комплексної методики підготовчої та відновлюючої терапії хворих із диференційованим використанням етіотропних та патогенетичних препаратів, урахуванням віку пацієнтів, клінічних проявів маласезійної інфекції, характеру структурно-функціональних змін шкіри.
Мета і задачі дослідження. Мета – підвищення ефективності терапії інволютивних змін шкіри обличчя у пацієнтів з маласезійною інфекцією шляхом розробки поетапного комплексного підготовчого та основного способу терапії з урахуванням віку хворих, клініко-морфологічних особливостей стану поверхні і структури шкіри.
Задачі дослідження:
1. Виявити клінічні особливості інволютивних змін шкіри обличчя у хворих із супутньою маласезійною інфекцією.
2. Дослідити структурні компоненти шкіри обличчя на тканинному, клітинному і субклітинному рівнях до і після лікування у пацієнтів з інволютивними змінами і порівняти з такими у хворих з супутньою маласезійною інфекцією.
3. Вивчити у динаміці властивості шкіри (стан поверхні, структура) пацієнтів за допомогою об’єктивної діагностики стану поверхні та структури шкіри.
4. Розробити диференційовані показання та методику комплексної поетапної підготовчої та відновлюючої терапії з урахуванням клініко-морфологічних особливостей шкіри обличчя, віку хворих, характеру маласезійної інфекції, властивостей шкіри.
5. Оцінити клінічну ефективність розробленої комплексної терапії, динаміку морфологічних та функціональних змін шкіри, особливо при комбінації інволютивних змін і маласезійної інфекції, розробити методи диспансеризації.
Об’єкт дослідження – інволютивні зміни шкіри у пацієнтів із супутньою маласезійної інфекцією.
Предмет дослідження – динаміка структурно-функціонального стану шкіри обличчя при корекції її інволютивних змін у пацієнтів із супутньою маласезійною інфекцією.
Методи дослідження: загальноклінічні, гістологічні (загальна морфологічна оцінка стану шкіри), електронно-мікроскопічні (вивчення ультраструктурних особливостей епітеліального, сполучнотканинного та мікроциркуляторного компонентів шкіри), морфометричні (кількісна оцінка морфологічних змін), клініко-інструментальні (апаратна діагностика стану шкіри), математичні (варіаційна статистика, дисперсійний аналіз).
Наукова новизна отриманих результатів. Вперше у пацієнтів з інволютивними змінами шкіри обличчя та супутньою маласезійною інфекцією з’ясовано характер клінічних змін шкіри обличчя у різних вікових групах та у динаміці догляду.
Вперше за результатами гістологічних, електронно-мікроскопічних та морфометричних досліджень, з урахуванням віку хворих, встановлені особливості мікроциркуляторних ушкоджень, порушень гомеостазу епідермісу, які залежали від впливу маласезійної інфекції, визначено їх динаміку після лікування.
Вперше вивчено морфологію маласезій в інволютивно зміненій шкірі обличчя і відповідну тканинну реакцію організму на грибкову інфекцію.
Науково обґрунтовано показання та спосіб комплексної поетапної підготовчої та відновлюючої терапії інволютивних змін шкіри обличчя при супутній маласезійній інфекції.
Практичне значення отриманих результатів. Розроблено і впроваджено новий спосіб поетапного лікування інволютивних змін шкіри обличчя, ускладнених грибковою інфекцією роду Malassezia (патент на корисну модель № 96802 від 10.02.2015), з визначенням морфологічних, клініко-інструментальних характеристик, що дозволило досягти стійкого естетичного ефекту після корекції інволютивних змін шкіри обличчя без відповідних ускладнень, викликаних наявністю інфікування грибами роду Malassezia, а в подальшому – зменшити частоту рецидивів.
Більш детально вивчено механізми формування стійкого естетичного ефекту у пацієнтів з інволютивними змінами і маласезійною інфекцією шкіри обличчя за рахунок специфічної і неспецифічної підготовчої та відновлюючої терапії.
Основні положення дисертації впроваджено в практику роботи Комунальної установи «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради, Комунального закладу «Рівненський обласний шкірно-венерологічний диспансер» Рівненської обласної ради, Комунального закладу охорони здоров’я Обласний клінічний шкірно-венерологічний диспансер № 1 (м. Харків), Комунального закладу «Обласний шкірно-венерологічний диспансер» (м. Дніпропетровськ), Комунального закладу охорони здоров’я «Харківська міська косметологічна лікарня», Полтавського обласного клінічного шкірно-венерологічного диспансеру, Товариства з обмеженою відповідальністю «Клініка пластичної хірургії та косметології «Артмедика», Українського інституту пластичної хірургії і естетичної медицини «Віртус» (м. Одеса), Медичного центру «MEDICELL», а також у навчальний процес кафедри дерматовенерології та косметології з курсом дерматовенерології та естетичної медицини ФПО Запорізького державного медичного університету, кафедри шкірних та венеричних хвороб і кафедри гістології Державного закладу «Дніпропетровська медична академія МОЗ України», кафедри фтизіатрії зі шкірними та венеричними хворобами Вищого державного навчального закладу України «Українська медична стоматологічна академія», на кафедрі дерматовенерології Національної медичної академії післядипломної освіти ім. П.Л. Шупика.
Особистий внесок здобувача. Автором проаналізована наукова література за обраною темою, проведений інформаційний пошук. Сформульована мета і завдання дослідження, висновки, практичні рекомендації. Автором розроблено програму вирішення поставлених задач, проведено клінічне обстеження і всі види лікування, здійснено кількісне морфологічне дослідження і математичну обробку даних, інтерпретовано отримані результати, підготовлено до друку основні матеріали за результатами дисертаційної роботи. Під час проведення ультраструктурного дослідження автор отримував консультації завідувача кафедри гістології ДЗ «Дніпропетровська медична академія МОЗ України» професора Твердохліба І.В.
Автором спільно з Макарчуком О.І., Боровиком М.І., співробітниками Запорізького державного медичного університету вивчено вплив маласезійної інфекції на стан шкіри у пацієнтів різних вікових категорій.
Дисертантом не запозичені результати та ідеї співавторів публікацій.
Апробація результатів дисертації. Основні положення роботи доповідались і обговорювалися на науково-практичних конференціях: «Актуальні питання наукової і практичної косметології» (Запоріжжя, 2013), «Сучасні аспекти медицини та фармації 2013» (Запоріжжя, 2013), «Актуальні питання наукової і практичної косметології» (Київ, 2014), «Молоді вчені – майбутнє української дерматології» (Київ, 2013, 2014), «Нові підходи до відновлення здоров’я шкіри» (Одеса, 2013), ІХ Всеукраїнська науково-практична конференція з міжнародною участю, «Актуальні питання косметології та дерматології» (Запоріжжя, 2014).
Публікації. За матеріалами дисертації опубліковано 14 друкованих праць, з них 8 статей, у тому числі 6 статей у спеціалізованих наукових виданнях (5 – у моноавторстві), 2 статті у зарубіжних виданнях, 6 статей входять до міжнародних наукометричних баз Російський індекс наукового цитування та Index Copernicus, а також 4 тези доповідей у збірниках матеріалів наукових конференцій (1 – зарубіжна), 1 патент на корисну модель та 1 навчальний посібник.
РОЗДІЛ 1
АНАЛІТИЧНИЙ ОГЛЯД ЛІТЕРАТУРИ
1.1 Клінічні та морфологічні особливості вікових змін шкіри
Шкіра є характерним дзеркалом стану організму, яка відображає більшість процесів внутрішніх органів, індивідуальні, статеві та вікові особливості, а також відхилення стану здоров`я та безпосередньо захворювання. Складно переоцінити естетичне значення шкіри для зовнішності людини, почуття комфорту та самооцінки [8].
Останніми роками багато уваги дослідників приділяється як виявленню біологічних закономірностей, що обумовлюють морфологію вікових змін шкіри, так і встановленню та всебічному дослідженню факторів, які впливають на цей процес та можуть його контролювати [131, 142, 185]. Втрата з віком фізичної привабливості дуже часто призводить до зниження самооцінки та якості життя, особливо у жінок 40-60 років. Саме ця група пацієнтів найбільш зацікавлена в покращенні своєї зовнішності, а у більшості випадків причиною втрати привабливості є старіння шкіри – складного мультифакторного процесу [189].
Старіння шкіри – процес, який запрограмований генетично, що визначає власне старіння та старіння, яке виникає від дії різних пошкоджуючих впливів і патологічних процесів, що розвиваються у шкірі. Біологічні зміни у шкірі включають зменшення епідермальних, дермальних і підшкірних клітинних компонентів, паралельно спостерігаються зміни в імунній системі [26, 32, 187]. Старіння шкіри зазвичай розглядається в аспекті формування зморшок, посивіння волосся та сповільнення процесів загоєння ран. Однак, епідерміс як найбільш віддалений захисний мур, повинен залишатись непошкодженим, і тим самим гарантувати перший бар’єр протягом усього життя людини. Крім того, епідерміс – одна з небагатьох регенеративних тканин, що експресує теломеразу, рибонуклеопротеїновий комплекс, який може протидіяти теломеразній ерозії, що є одним із провідних потенціальних механізмів у процесі старіння шкіри [87]. Виходячи з цього стає очевидним, що епідерміс є одним із відповідальних компонентів шкіри за процес її фізіологічного старіння [87]. Старіння взагалі – це незворотній неперервний процес, під час якого відбувається пошкодження клітинної ДНК і тим самим порушується синтез білків. Вікове старіння шкіри, у першу чергу, проявляється збоями в процесах диференціювання кератиноцитів та порушенні синтезу нейтральних ліпідів, які є одним із найважливіших компонентів бар’єру.
У науковій літературі існує низка робіт щодо комплексної оцінки перебудови шкіри при утворенні зморшок, як основної зовнішньої прояви старіння шкіри. Витончення епідермісу та його атрофія з віком підтверджується наявністю десмоплакіну у складі міжклітинних контактів між кератиноцитами [93].
Таке витончення супроводжується зменшенням ступеня диференціювання в декількох епідермальних маркерах на дні зморшок: філагрінові, кератогіалінові гранули та трансглутамінази I, що порушують десквамацію та здатність рогового шару зберігати воду [188]. При переході епідермісу в дерму спостерігалося зменшення концентрації колагену IV і VII типів, зменшення кількості оксіталанових волокон під зморшками. Пересування еластичної тканини у дерму з перериванням цих відкладень під зморшками, атрофія шкірного колагену, більш виражена під зморшками, підвищують розмір і глибину зморшок [115]. Склад інших компонентів дерми також змінюється [184]. Спостерігається зменшення концентрації хондроїтин-сульфатів у сосочковій дермі під зморшками в поєднанні з асиметричними змінами складу глікозаміногліканів на обох гранях зморшки. Під зморшками також визначається атрофія гіподерми з посиленням волокнистого компоненту, що було причиною більшої глибини зморшок. Автори вважають, що формування зморшок відбувається у той час, коли багаточисельні модифікації у різних компонентах шкіри взаємно посилюють один одного. Таким чином, результати багатьох досліджень продемонстрували структурні зміни елементів шкіри, що відбуваються з віком і обумовлюють появу зморшок [80, 111, 131, 169].
Перебудову шкіри з віком пов`язують зі змінами у складі позаклітинних компонентів сполучної тканини, що по-різному відбуваються у шкірі чоловіків та жінок. Так, ряд досліджень був присвячений впливу статі та віку на вміст та структуру колагену у дермі [124]. У віковому інтервалі від 15 до 93 років питомий об`єм колагену та його щільність у дермі чоловіків більші.
Практично у всіх вікових процесах провідну роль грає накопичення вільних радикалів – активних форм кисню. Порушення балансу між прооксидантними та антиоксидантними системами призводить до оксидативного стресу. Баланс між активними формами кисню та антиоксидантами порушується внаслідок вікового зниження об’ємної швидкості кровообігу. Це призводить до зменшення надходження антиоксидантних речовин та скорочення термального об’єму.
У дослідженнях [142] був проведений клініко-патоморфологічний аналіз зморшок серед різних типів модифікацій рельєфу шкіри. Гістологічний аналіз епідермісу і дерми шкіри, що формували передслухові зморшки, показав нормальну морфологію шкіри, ідентичну такій, яка спостерігалась у шкірі, що була видалена поряд зі зморшкою [90, 156]. Це було особливо незвичайно для непостійних зморшок, які не були індивідуалізовані у відсутності гістологічного фарбування. Два типи зморшок включали схожі модифікації шкіри, однак у верхній частині дерми, у складі постійних зморшок спостерігалось більш виражене накопичення базофільних волокон (actinic elastosis), у порівнянні з непостійними зморшками. Таким чином, отримані дані вказують на те, що розвиток зморшок може бути вторинним по відношенню до actinic elastosis і до зникнення мікрофібрил колагенових волокон у місці переходу епідермісу в дерму [81, 156].
Група дослідників представила теорію старіння шкіри як поєднаний результат запрограмованої клітинної загибелі структурних компонентів шкіри та впливу випадкових подій на шкіру протягом життя індивідуума [107, 119]. У цьому контексті старіння може бути визначене як прогресивне порушення в гомеостазі, де апоптоз є потенціальним ключовим моментом. Дослідники продемонстрували роль апоптозу в епідермальному гомеостазі (як основному процесі у диференціюванні кератиноцитів), важливість його у процесі старіння шкіри, шляхи регулювання апоптозу у шкірі.
Давно відомий той факт, що шкіра є органом-мішенню для багатьох гормонів, у тому числі і статевих. Останні мають великий вплив на процес старіння шкіри. Зменшення синтезу статевих гормонів, таким чином, стимулює різке обмеження тих функцій шкіри, що знаходяться під гормональним контролем. Кератиноцити, клітини Лангерганса, меланоцити, сальні залози, вміст колагену та синтез гіалуронової кислоти знаходяться під гормональним впливом. Місцеве застосування естрогенів дає позитивний ефект на процес старіння шкіри, багаточисельні дослідження продемонстрували позитивний вплив системної замісної гормональної терапії на процес старіння шкіри. Як альтернативне лікування можна розглядати фітогормони, зі структурною схожістю до 17-бета-естрадіолу та естрогеноподібним ефектом. Однак, ізофлавоніди демонструють відносно низьку потенцію порівняно з синтетичними естрогенами. Хоча більшість публікацій документували позитивні ефекти статевих гормонів на процес затримки старіння шкіри, вочевидь, замісна гормональна терапія не повинна бути ізольованим методом лікування старіючої шкіри [176].
Передчасне старіння шкіри, або фотостаріння, виникає у значній мірі від повторного впливу ультрафіолетової сонячної радіації. Фотостаріння клінічно проявляється зморшками, плямистою пігментацією, грубою шкірою, а також втратою тонусу шкіри [133, 138].
Фотостаріння може спричиняти зміни у шкірі, відмінні від таких, що спостерігаються при фізіологічному старінні. Так, при фотостарінні згладжується перехід між епідермісом та дермою. Старіючі кератиноцити стають стійкими до апоптозу, тривалість їх життя збільшується, це зумовлює пошкодження ДНК та білків, що в свою чергу стає фактором ризику для карциногенезу [104, 133].
Після впливу ультрафіолетової сонячної радіації основні гістологічні зміни спостерігаються у сполучній тканині дерми. В цьому шарі шкіри порушується синтез колагенових волокон, вони стають потовщеними, без чіткої орієнтації, спостерігається також велика кількість деградованих не функціональних волокон. Порушуються міжмолекулярні колагенові зв’язки, які обов’язкові для забезпечення стабільності матриксу [128, 177].
Стійкість шкіри до ультрафіолетового випромінювання має вікові особливості. Кількість меланоцитів зменшується з віком, спостерігається дисрегуляція щільності меланоцитів, яка проявляється ластовинням, плямистими гіпомеланозами, лентігинозами. Кількість клітин Лангерганса також зменшується, як і їх макрофагальна активність [155, 157].
Фотостаріння, на відміну від природного, не є неминучим і може бути попереджене. Ультрафіолетова радіація, крім змін у шкірі, також пригнічує імунну систему. Своєю місцевою або системною дією вона може спричинити фотоімуносупресію чи фотокарциногенез [176]. Важливим патофізіологічним механізмом фотостаріння є утворення вільних радикалів та ушкодження ними ДНК. Виходячи з цього, основними принципами боротьби з фотостарінням є використання ефективного фотозахисту, профілактичне застосування альфа-гідроксікислот, ретиноєвої кислоти та антиоксидантів [98].
Найбільш змістовно комплекс основних вікових змін сформулював А.М. Боровиков, який доводив, що виражена деформація тканин в ділянці обличчя та шиї обумовлена рядом таких факторів як зниження еластичності шкіри, дистрофічні зміни підшкірно-жирової клітковини з втратою її опорної функції, порушення динамічної рівноваги різних м’язових груп, що є причиною гравітаційного опущення тканин.
На сьгодні очевидною є важливість подальшого вивчення субстрату старіння шкіри – її структури, де одне з найважливіших мість посідає система гемомікроциркуляції [171, 193]. Саме ця система найбільш чітко реагує на численні екзогенні впливи, визначає гістогенетичні закономірності перетворень шкіри з часом [141], є найчутливішим компонентом дерми, який відповідає за стан епітеліальних, нервових і сполучнотканинних структур шкіри [130]. Класичні морфологічні дослідження детально описали систему гемомікроциркуляторного русла (ГМЦР) шкіри людини та експериментальних тварин, проте відомості відносно вікових змін ГМЦР шкіри й досі залишаються фрагментарними та обмеженими щодо конкретних кількісних характеристик, що найбільшою мірою стосується проблемної ділянки обличчя.
Доцільність використання морфологічних даних для вибору методів лікування пацієнтів з інволютивними та патологічними змінами шкіри є встановленим і добре обґрунтованим фактом [71, 78, 127]. У сучасній дерматології саме морфологічні критерії виявляються найбільш адекватними для оцінки структурно-функціонального стану тканин [110]. При цьому точність такої оцінки зростає при залученні значної кількості морфологічних характеристик, особливо якщо вони квантифіковані [92, 102]. Інволютивні зміни шкіри дотепер залишаються недостатньо систематизованими, не розроблені питання індивідуальної оцінки шкірних покривів з урахуванням маласезійного ушкодження. Поодинокими залишаються ультраструктурні дослідження структури зміненої шкіри [150, 158].
Отже, у теперішній час існує досить детальна мікробіологічна характеристика грибів Malassezia та їх властивостей при взаємодії зі шкірою під час розвитку патології, проте вельми обмеженою залишається інформація про морфологічні зміни шкіри обличчя за умов маласезіозу. Фрагментарними і незавершеними виявляються відомості щодо гістологічних і ультраструктурних змін епітеліального, сполучнотканинного і мікроциркуляторного компонентів шкіри при маласезіозі. Відсутні уявлення про залежність патоморфологічних змін від вікових особливостей шкіри на тлі маласезійного ураження, а також про структурні основи компенсаторно-пристосувальних механізмів, що відбуваються протягом специфічної антимікотичної терапії з подальшим запровадженням заходів естетичної хірургії.
1.2 Маласезіоз шкіри – етіологія, діагностика
До цього часу дослідження патогенності і морфології маласезійних грибів проводилися для окремих локальних клінічних форм захворювання без урахування їхнього розвитку [4, 77, 100].
Маласезіоз шкіри – відносно нове поняття, яке об’єднує ряд захворювань шкіри та її придатків, спричинених дріжджоподібними ліпофільними грибами роду Malassezia [3, 60, 66].
Фактори патогенності грибів Malassezia та патоморфозу шкіри при маласезійній інфекції досліджені недостатньо. Відомо, що життєдіяльність Malassezia в організмі людини супроводжується значними проліферативними, імунологічними, обмінними порушеннями [16]. Зокрема, встановлено роль Malassezia у порушеннях проліферації та диференціювання епітеліоцитів, меланоцитів, імунокомпетентних клітин, у розвитку специфічної сенсибілізації та індукування ними високого рівня специфічних ІgЕ антитіл у хворих з явищами дерматиту, в активації альтернативного шляху активації комлементу; у резистентності до механізмів фагоцитарного кілінгу макрофагами [16, 65, 165].
Під час вивчення імунного статусу у 120 хворих на вугрову хворобу, пов’язаною з маласезійною інфекцією, було встановлено пригнічення функції фагоцитів, зниження показників НСТ-тесту, депресію Т-клітинної ланки імунітету, збільшення СD22+, зниження коефіцієнта СD4+/СD8+, збільшення рівня імуноглобулінів М і G, продукції інтерлейкінів-10 і -12, головним чином, у пацієнтів із супутнім маласезіозом шкіри, які залежать від тяжкості перебігу вугрової хвороби [31]. У хворих даного контингенту у серії клінічних досліджень також визначались суттєві локальні та системні розлади різноманітного характеру [14, 27, 33].
У даний час Маласезії відносять до представників нормальної мікробіоти шкіри людини і теплокровних тварин, у яких вони також викликають різні захворювання [126, 148]. Для виживання та зростання Malassezia spp. необхідні ліпіди. Більше того, вони є мезофілами, для яких оптимальна температура становить 30-35°С. Цими двома фізіологічними особливостями пояснюють, чому Malassezia spp. відомі тільки як можливі патогени шкіри людини і теплокровних тварин. Протягом тривалого часу досліджували роль М. pachydermatis як патогена інфекцій у собак. Нещодавно було повідомлено про випадки, коли M. furfur і M. obtusa були ізольовані в якості патогенів отиту зовнішнього вуха у собак, а M. sympodialis e подібних умовах – у інших ссавців [129].
Рід Malassezia складається з 13 видів зростаючої важливості для медицини. Вони асоціюються з пітиріазом, себорейним дерматитом, фолікулітом і системною інфекцією [113].
Ліпідозалежними є: M. dermatis, M. furfur, M. globosa, M. japonica, M. obtusa, M. restricta, M. slіoffiae, M. sympodialis, M. yamatoensis і нещодавно відкритий вид М. сuniculi sp. nov. M. pachydermatis – єдиний ліпідонезалежний вид цього роду. Всі інші види роду Malassezia є ліпідозалежними, не здатними заново синтезувати С14 або С16 жирні кислоти. Тому для них необхідне зовнішнє джерело ліпідів, але, точно не знаючи суті справи, дослідники багато років не могли культивувати Malassezia in vitro [129].
Рід Malassezia є одним з п’ятнадцяти родів дріжджоподібних грибів, які складають сімейство Cryptococcaceae, що входить до групи недосконалих дріжджів і відноситься до анаморфних базидіоміцетів [48, 64, 68]. Незвичайно високий вміст ліпідів на поверхні та усередині клітин Malassezia (більш, ніж 15 % загальної ваги) обумовлює ряд унікальних їх адаптаційних властивостей, що сприяють виживанню цих мікроорганізмів [112, 130].
Тепер вважається, що найбільш частим збудником захворювань у людини є М. globosa, М. sympodialis та М.restricta, причім є значна кількість досліджень про часту комбінацію збудників декількох (двох-трьох) видів [96, 116]. Більшість дослідників епідеміології маласезійноі інфекції згодні у тому, що різні види цього збудника присутні на шкірі більш, ніж 90 % усього населення [64, 105].
Malassezia spp., як і низка дріжджових мікроміцетів, виявляють диморфізм. І якщо раніше дослідники припускали, що дріжджова фаза є самостійним родом, ними названим Pityrosporum, то міцеліальна фаза отримала назву Malassezia. Факторами, що індукують конверсію фаз, є гліцин, сквален і холестерин. Однак не всі види і штами, очевидно, можуть піддаватися вищеназваній фазовій конверсії. Види Malasseziа біохімічно відносно інертні і мають порівняно потовщену клітинну стінку, оточену пластинчастим або капсулоподібним шаром, що містить ліпіди, який може бути видалений розчинниками [174, 178, 180, 194].
Встановлено, що Malasseziа spp. продукують низку метаболітів, включаючи γ-лактони. Азелаїнова кислота виступає інгібітором нейтрофілів, викликаючи знижену продукцію кисневих радикалів, і є конкурентним інгібітором тирозинази – ключового ферменту в меланогенезі, обґрунтовуючи думки про те, що дана кислота може бути важливою у змінах пігментації шкіри, що спостерігається при різнокольоровому лишаї або при інших формах маласезійного ураження шкіри [9, 195].
M. furfur має знижену чутливість до ультрафіолетового опромінення завдяки здатності синтезувати похідні триптофану. Виявилося, що даному виду притаманний триптофан-залежний синтез пігментів і флуорохромів [161]. Можливе значення цього метаболічного шляху для мікроорганізму залишається до кінця не дослідженим. Відзначимо, що пігментогенез у M. furfur індукується триптофаном в такій невеликій концентрації як 0,01 г% [9].
Оскільки у людини зовнішня частина епідермісу є природним місцем існування M. furfur, підвищена експозиція ультрафіолетового опромінення може бути для людей небезпечною внаслідок можливості розвитку Malassezia spp. Таким чином, пігментоутворюючі маласезії захищаються від опромінення завдяки синтезу пігментів типу індольних алкалоїдів [161]. З інших (крім тирозинази) ферментів маласезії утворюють також порівняно широкий їх набір – різні гідролази, оксидоредуктази, синтетази та ін. [162]. Очевидно, вірним є припущення, що активність фосфоліпази А2 у M. furfur може супроводжуватися виділенням арахідонової кислоти з 20 атомами вуглецю [103].
Крім того, представники цього роду продукують крахмалоподібні речовини, асимілюють інозит; цукру, як правило, не ферментують; брунькування серед маласезій зазвичай поширене [135]. Репродукція в поколіннях відбувається після спарювання відповідних партнерів. Міцелій товстостінний, клітинні стінки багатошарові, септи мають доліпори або прості пори. Меланін-утворюючі гриби менш чутливі до реактивних кисневих радикалів; продукція меланіну виступає одним з важливих чинників агресії. [139, 166, 167]. Альтернативні триптофану джерела амінного азоту зазвичай супресують пігментогенез. Крім того, окремі штами M. furfur можуть проявляти себе нерівноцінно щодо вироблення пігменту при 37°С. Це слід мати на увазі при роботі з різними культурами даного та інших видів Malassezia. Можливе припущення про те, що при зміні якості і кількості джерел азоту на шкірі можлива метаболічна адаптація маласезійних грибів до змінених умов, що набуває патофізіологічного значення [22, 76].
Базидіоміцетові дріжджі, до яких належать маласезії, утворюють в ході статевого розмноження спеціальні клітини – базидії, що несуть екзогенні спори (базидіоспори). Значну частину життєвого циклу займає дікаріотична фаза, представлена дікаріотичним міцелієм з пряжками. Більшість видів гетероталічні і тому багато хто з них довгий час були відомі лише в гаплофазі як недосконалі дріжджі. Життєві цикли більшості базідіоміцетових дріжджів також досить різноманітні. Дослідження життєвих циклів базидіоміцетових дріжджів показало утворення дикаріотичного міцелію, на якому формувалися структури, морфологічно подібні до хламідоспор, тобто великі клітини з сильно потовщеними оболонками і великим запасом внутрішньоклітинних ліпідів. Саме в них потім відбувалося злиття двох ядер і подальший мейоз з відновленням гаплоїдного стану [109]. Ці клітини отримали назву теліоспор. При проростанні вони утворювали проміцелій з поперечними септами, що ділять його на 4 клітини. Ці клітини відокремлюються на гаплоїдні споридії. Їх теліоспорові стадії отримали відповідно родові назви Sporidiobolus і Leucosporidium [77].
Зараз схожі повні або незавершені життєві цикли відомі для багатьох базідіоміцетових дріжджів. Вони розрізняються за формою теліоспор, характером їх проростання і морфологією базидій. Те, що базидіоспори дріжджових грибів здатні до брунькування, було відмічено мікологами досить давно, однак наявність самостійної дріжджової фази в циклі розвитку було встановлено набагато пізніше [122].
У культурах окремі базидіоспори гетероталічних видів дають початок дріжджовим стадіям. Міцелій зазвичай розвивається тільки при змішуванні штамів сумісних типів спарювання. Змішання відповідних типів спаровування призводить до швидкої реакції клітин, на що виділяються феромони; брунькування припиняється, розвиваються кон’югаційні трубки, через які клітини копулюють, відбувається плазмогамія і розвивається міцеліальна дікаріотична стадія. У багатьох видів у відповідних умовах незабаром після формування дікаріотчного міцелію починається розвиток плодових тіл. У плодових тілах утворюються 2-4-клітинні гетеробазидіі. Вивільнені базидіоспори можуть розмножуватися вегетативно брунькуванням або формуванням балістоспор [153].
Дуже часто у базідіоміцетових дріжджів, ізольованих зі шкіри людини, не вдається спостерігати повний життєвий цикл при культивуванні на лабораторних середовищах, тому їх ідентифікація викликає певні труднощі [153]. Як виявилося, групування базідіоміцетових дріжджів на основі молекулярно-біологічних ознак, зокрема нуклеотидних послідовностей рРНК, часто не збігається з характеристиками їх життєвого циклу, особливо такими, як здатність до утворення теліоспор або морфологія базидій. Тому ідентифікація базідіоміцетових дріжджів, зокрема маласезій, ще далека від завершеності і потребує подальших досліджень [91, 101].
За даними досліджень, проведених у людини та теплокровних тварин, маласезії можна візуалізувати у зроговілому шарі епідермісу за допомогою мікроскопічного дослідження зразків шкірної біопсії, хоча цей метод може виявитися і недостовірним [122]. Інші характерні риси – гіперплазія епідермісу і міжклітинний набряк, а також змішаний поверхневий периваскулярний інфільтрат з мононуклеарних клітин, нейтрофілів і/або еозинофілів [52]. У деяких випадках, спостережуваних авторами, мікробіота, ідентифікована цитологічно, не була, проте, виявлена в гістологічних зрізах – можливо, внаслідок руйнування шарів зроговілого шару під час обробки. Таким чином, ідентифікація маласезій повинна спонукати до пробної терапії, але недостатня візуалізація його в гістопатологічних зрізах теж не виключає його присутності і потенційної значущості [53].
Найпоширенішим способом діагностики Malassezia є цитологічне дослідження. Даний метод є безболісним та інформативним. Після забору проводиться мікроскопія матеріалу під іммерсійним збільшенням. M. pachydermatis характеризується наявністю монополярного зародка, об’єднаного з материнською клітиною загальною клітинною стінкою, і нагадує за формою земляний горіх. Дріжджі часто розташовуються групами, прикріпленими до кератиноцитів. Вважається, що маласезійний дерматит більш ймовірний, коли при мікроскопії під імерсійним збільшенням виявляється більше 10 організмів у 15 випадкових полях зору [52].
Біоптат ураженої шкіри у собак характеризується наявністю поверхневого дерматиту, що супроводжується паракератозним гіперкератозом, спонгіозом, екзоцитозом лімфоцитів в епідерміс, фолікулітом. Відзначається переважання клітин шкірного запалення: лімфоцитів, гістіоцитів і плазматичних клітин, еозинофілів, нейтрофілів і тканинних базофілів. У випадках супутньої бактеріальної інфекції спостерігаються гнійний епідерміт і фолікуліт. Лімфоцити і еозинофіли домінують серед інших клітин запалення [147].
Відомо, що більшість сапрофітних грибів, зокрема Malassezia pachydermatis, Alternaria spp., Aspergillus spp., Penicillum spp. можуть бути культивовані з шкіри більшості здорових теплокровних тварин, тому результат посіву в більшості випадків буде позитивним. З цієї причини даний спосіб діагностики не є достатньо інформативним, так як неможливо стверджувати, що саме даний мікроорганізм з’явився причиною захворювання шкіри [53].
1.3 Лікування маласезіозу
Етіотропна терапія займає головне місце в лікуванні маласезіозу. Як засоби етіотропної терапії, найчастіше застосовуються похідні імідазолу (iтраконазол, флуконазол). На сьогоднішній день є дуже велике різноманіття препаратів для топічної протималасезійної терапії. Вони випускаються у формах розчинів, лосьойонів, спреїв, мазей, кремів, гелів, шампунів [75, 114, 170].
Стосовно системної терапії можна сказати, що загальноприйнятих методик не має. Численність курсів лікування, тривалість терапії, дозування препаратів є предметом дискусії [2, 183].
Потрібно зазначити, що незважаючи на свою ефективність, етіотропна терапія не є вирішенням проблеми лікування маласезіозу. Патогенетична терапія є обов’язковою частиною комплексної терапії цього дерматомікозу. Тому, як відомо, жодний етіотропний препарат не може повністю усунути хронічну інфекцію та запобігти виникненню її рецидивів [192].
Таким чином, з проведеного огляду літературних джерел можна зробити висновок, що проблема досліджень клінічних проявів маласезійної інфекції має багаторічну історію. Узгодження підходів клінічної діагностики дає можливість і робить необхідним проведення нових клінічних досліджень цього захворювання. Усе це може покращити результати лікування та профілактики маласезіозу шкіри.
Доцільність використання морфологічних даних для вибору методів лікування пацієнтів з інволютивними та патологічними змінами шкіри є встановленим і добре обґрунтованим фактом [70, 134, 172, 181]. У сучасній дерматології саме морфологічні критерії виявляються найбільш адекватними для оцінки структурно-функціонального стану тканин [161]. При цьому точність такої оцінки зростає при залученні значної кількості морфологічних характеристик, особливо якщо вони квантифіковані [85, 144]. Інволютивні зміни шкіри дотепер залишаються недостатньо систематизованими, не розроблені питання індивідуальної оцінки шкірних покривів з урахуванням маласезійного ушкодження. Поодинокими залишаються ультраструктурні дослідження структури зміненої шкіри [146].
1.4 Методи лікування інволютивних змін шкіри
На сьогоднішній час розроблена і пропонується для практики значна кількість методів, спрямованих на усунення інволютивних змін шкіри.
Хімічний пілінг – метод косметологічної корекції інволютивних змін шкіри, які виникають у результаті фізіологічних змін, хронічної інсоляції, впливу антропогенних факторів навколишнього середовища. Він є високоефективним методом лікування гіперпігментацій, рубцевих змін шкіри. В основі метода полягає контрольоване пошкодження певних шарів епідермісу і у ряді випадків – верхніх шарів дерми. Кінцевими очікуваними ефектами є зміна кольору, згладжування профілю шкіри, активація репаративних та регенеративних процесів, загальне покращення структури старіючої шкіри [20, 186]. Для підвищення ефективності пілінг супроводжується допоміжними заходами – спеціальним постпілінговим доглядом, ін`єкційними та фізіотерапевтичними процедурами, прийомом харчових добавок [56], шліфуванням шкіри.
До методів глибокого і середньоглибокого відлущування шкіри відносять пілінг з використанням високих концентрацій фенолу, трихлороцтової кислоти, механічної дермабразії, лазерного перетворення шкіри [151].
Для виконання поверхневого хімічного пілінгу з мeтою корекції вікових змін шкіри використовуються природні органічні кислоти – молочна, гліколева, яблучна, лимонна, часто у пєднанні з протеолітичними ферментами – трипсином, хемотрипсином, папаїном. Сучасні комбіновані препарати мають у своєму складі суміш натуральних фруктових кислот, саліцилову, L‑ізомер аскорбінової кислоти та ретинол [15, 51, 55].
На теперішній час дуже актуальним є введення філерів на основі гіалуронової кислоти [149, 158]. При виконанні процедур можливі такі побічні ефекти як біль, еритеми, кровотеча, набряк [82, 88, 137, 140, 159].
Використання фракційного вуглекислого лазеру займає важливе місце у роботі лікарів естетичної медицини. Багато пластичних хірургів комбінують хірургічні методи лікування з лазерною шліфовкою шкіри обличчя [87, 151, 182].
Комбіновані процедури надають найкращий естетичний результат, зокрема комбінування дії ультразвуку, косметологічних процедур та лазерної дії показує кращі результати, ніж монотерапія лазером [120, 132, 191].
Слід знати, що, якщо пацієнт має грубі косметичні дефекти (глибокі зморшки, складки), то жоден з видів пілінгу не дасть позитивного косметичного результату і пацієнту потрібна пластична операція.
Регенеративні процеси шкіри обумовлені різноманітністю взаємопов’язаних факторів, що диктує проведення комплексної мультикомпонентної терапії, яка передбачує послідовне поетапне застосування різноспрямованих методів. Це внутришньошкірне введення гіалуронової кислоти для відновлення водного балансу шкіри, застосування збагаченої тромбоцитами плазми крові для стимуляції реваскуляризації та проведення абляційного фракційного фототермолізу з метою посилення регенерації шкіри. І після цього застосовуються методики, що передбачують введення аутологічних термальних фібробластів [69, 97, 108].
Алгоритм корекції змін шкіри з дисрегуляційними станами потрібно будувати виходячи із процесів старіння шкіри. Вони обумовлюють етапність та послідовність косметологічної корекції. На етапі реконструкції мікроструктури шкіри, коли створені необхідні умови функціонування фібробластів, їх введення сприяє формуванню екстрацелюлярного матриксу. Це виражається у тому числі і в виробленні нового колагену та призводить до покращення зовнішнього вигляду вікової шкіри [23].
М’які тканини обличчя підтримують зв’язочний апарат обличчя в нормальному анатомічному положенні 30-40 років, а потім наступає його вікова слабкість, що визиває косметичні дефекти в різних регіонах обличчя. Це зумовлено тим, що зв’язочний апарат зменшується в об’ємі, лицьовий жир опускається між поверхневою та глибокою фасціями обличчя, що визиває вікові стігми обличчя. Зусилля пластичних хірургів при корекції середньої зони обличчя спрямовані на покращення вигляду носо-губної ділянки, щелеп, контурів шиї та щелеп в поєднанні з підтяжкою обличчя [35, 39, 40, 49].
Не дивлячись на велику кількість хірургічних методик, що застосовуються при підтяжці обличчя, не має спільної та однозначної думки, який з цих хірургічних підходів є найбільш ефективним. Звичайно, ніколи не буде отримано категоричної відповіді на цю проблему. Це пояснюється високим ступенем суб’єктивного характеру оцінювання естетичності, від індивідуальних анатомічних та фізіологічних особливостей різних ділянок обличчя пацієнтів. Це також залежить також від професіоналізму пластичного хірурга та очікуваних результатів самих пацієнтів. Треба визначити, що всі відомі методики середнього фейсліфтінгу від простого відділення шкіри від поверхневого м’язово-фасціального шару до субперіостального втручання об’єднує обов’язкове включення такої структури як поверхневий м’язово-фасціальний шар [5, 6, 19, 37].
У даний період середній фейсліфтінг вважається корисним та ефективним методом для багатьох пацієнтів [28]. Ця процедура може бути виконана щелепно-лицьовими хірургами із-за спорідненості хірургічних методик, та ще й тому, що вона не потребує ніякої спеціалізованої техніки [11, 54]. Середній фейсліфтінг визиває швидке післяопераційне відновлення та має мінімалізовану кількість післяопераційних ускладнень.
Різко збільшилась за останнє десятиріччя популярність мінімально агресивних методів для середнього фейсліфтінгу. Група хірургів описала нову техніку при застосуванні черезшкірних поліпропіленових колючих швів, щоб запобігти старінню обличчя. Даний хірургічний підхід може бути застосований і при закритому, і при відкритому втручанні, в залежності від необхідної кількості тканини, то потребує репозиції. При проведенні ретроспективного аналізу оцінювалась ефективність чрезшкірного колючого поліпропіленового шва для підтягування середньої зони обличчя та виникнення ускладнень, що пов’язані з використанням даного шовного матеріалу [13, 173, 175].
Таким чином, використання черезшкірного колючого поліпропіленового шва забезпечувало альтернативну техніку, що може бути застосована пластичними хірургами, зокрема у пацієнтів з опущенням середньої зони обличчя [83].
Блефаропластика, як хірургічний метод, широко застосовується в пластичній хірургії для омолодження обличчя, однак часто її складність недооцінюють. Хірург повинен мати точне уявлення про обсяг та тип втручання, починаючи з адекватної оцінки стану шкіри в орбітальній ділянці та закінчуючи визначенням конкретних компонентів, що потребують хірургічної корекції у кожного індивідуума [62]. Розуміння обмежень, що викликані специфічними анатомічними особливостями даного регіону обличчя у пацієнтів і, як результат, оцінка реалістичних естетичних очікувань, – це обов’язкові складові передопераційної підготовки з метою запобігання ускладнень. Основним принципом успішної блефаропластики є розуміння потенціальннх ускладнень з розробкою методів їх запобігання, а в разі виникнення – методів їх корекції [29, 50, 144].
Вікові зміни обличчя проявляються комплексом змін, а саме прогресивним опущенням шкіри, жирової тканини, м’язів в поєднанні з резорбцією кісткової тканини та атрофією хрящової тканини. В орбітальній ділянці спостерігається утворення пустот. Звичайні хірургічні методики підтяжки обличчя коригують тільки дряблість шкіри, формування поверхневого клаптю поверхневої м’язово-фасціальної системы також забезпечує ізольовану підтяжку шкіри в середній частині обличчя, при цьому утворюється не природна лінія підборіддя.
Концепція красоти на думку пластичного хірурга обумовлює проведення додаткових хірургічних маніпуляцій одночасно з основною або через невеликий проміжок часу після її виконання [59, 74, 84]. При поєднанні різних втручань можливо досягнути основної мети ідеальної пластичної хірургії по омолодженню обличчя, яка полягає в отриманні юних, природних, динамічних, привабливих жіночих облич. Останні роки пластичні операції щодо одночасного відновлення різних косметичних дефектів обличчя набувають все більшого розвитку. Звичайно, що таке оперативне втручання більш складне в технічному плані та, внаслідок цього, потребує високої кваліфікації пластичного хірурга. Однак, бажання пацієнтів та правильний підхід хірурга досить вдало можуть вирішити цю проблему. На теперішній час існує багато комбінацій хірургічних методик по омолодженню обличчя.
Перші ознаки старіння обличчя з’являються на повіках, навколо очей та в середній частині обличчя, яка є досить рухливою. Виходячи з цього, [121] рекомендує розпочинати хірургічну корекцію в цих регіонах обличчя, починаючи з середини 30-річного віку пацієнтів. У таких пацієнтів рекомендується комбінувати блефаропластику з ритидектомією верхніх двох третин обличчя. Замість поверхневого підходу автор пропонує застосовувати хірургічне втручання на глибокому рівні [134].
Прогрес у розвитку нових комбінованих хірургічних методик в пластичній хірургії по омолодженню обличчя дозволяє отримувати високі естетичні результати в ранньому та пізньому післяопераційному періодах. Так, за даними [116], при застосуванні консервативних хірургічних методик підтяжка лоба виконується без перерізання або з перерізанням повного лобного м’яза з подальшою його підтяжкою по лобній кістці та періостальним прикріпленням галеального шолому та м’язів-антагоністів. Перерозташування цих структур значно зменшує або ліквідує зморшки, запобігає гіперфункції лобного м’яза.
Таким чином, комбінована методика, що була застосована, є безпечною в технічному плані та ефективною для отримання високих естетичних результатів та задоволення пацієнтів післяопераційними результатами.
Розширення можливостей естетичної хірургії обличчя обумовило збільшення кількості операцій та суттєве розширення контингенту пацієнтів, що обумовило зростання частки пацієнтів з різноманітною супутньою патологією. У свою чергу це викликає хірургів до пошуку нових підходів до оперативних технологій і до особливої уваги у післяопераційному періоді. У пацієнтів даного контингенту саме високий ризик інтраопераційних і післяопераційних ускладнень суттєво обмежує діапазон показань [94]. Тому попередження таких ускладнень є важливим питанням при плануванні операцій в естетичній хірургії обличчя.
Зростання популярності пластичних операцій та постійне збільшення їх кількості обумовлює важливість досліджень, пов’язаних з впливом подібних втручань на емоційні, соціальні та психологічні аспекти життя пацієнтів. Удосконалення технічних аспектів оперативних втручань в естетичній хірургії обумовило збільшення кількості операцій та суттєве розширення контингету жінок, що звертаються до спеціалізованих клінік.
Спроби застосування різноманітних теорій старіння та їх використання у практичній естетичній хірургії можна оцінювати по-різному з огляду на різнобічність проблеми. Проте, навіть враховуючи дискусивність цих теорій і концепцій, є очевидною важливість подальшого вивчення субстрату старіння шкіри – її структури, де одне з найважливіших мість посідає система гемомікроциркуляції [72]. Саме ця система найбільш чітко реагує на численні екзогенні впливи [130], вона визначає гістогенетичиі закономірності перетворень шкіри з часом, саме вона є найчутливішим компонентом дерми, який відповідає за стан епітеліальних, нервових і сполучнотканинних структур шкіри [73]. Класичні морфологічні дослідження детально описали систему ГМЦР шкіри людини та експериментальних тварин, проте відомості відносно вікових змін ГМЦР шкіри й досі залишаються фрагментарними та обмеженими щодо конкретних кількісних характеристик, що найбільшою мірою стосується проблемних ділянок – голови, обличчя та шиї.
Таким чином, інволютивні зміни шкіри дотепер залишаються недостатньо систематизованими, не розроблені питання індивідуальної оцінки шкірних покривів, не вироблені диференційований підхід і показання до певних заходів хірургічної корекції з урахуванням індивідуальних особливостей ступеня гісто-фізіологічних змін, не розроблені чіткі показання до різних за технологією видів операцій і послідовності виконання їх етапів, недостатньо відпрацьована система оцінки переваг і недоліків різних методів оперативних втручань.
Широка розповсюдженість грибів роду Malassezia серед населення, різноманіття клінічних форм роблять необхідним проведення нових досліджень, що продемонструють вплив маласезійної інфекції на структуру шкіри як ускладнюючий фактор при проведенні естетичних процедур. Результати цих досліджень дозволять розробити комплексну індивідуалізовану терапію при корекції інволютивних змін обличчя. Не дивлячись на те, що естетична медицина сьогодні дуже швидко розвивається, недостатньо уваги приділяють супутній інфекції, її профілактиці, що обумовлює значну частину ускладнень. У звязку з цим, розробку комплексної терапії, профілактики при проведенні косметологічних процедур можна вважати актуальною проблемою сучасної дерматології.
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Загальні клініко-лабораторні дослідження
Хворих з інволютивними змінами шкіри обличчя в залежності від віку розподілено на 3 вікові категорії. Першу групу складали 30 пацієнтів 33-40 років, другу – 30 осіб 40-50 років, третю – 30 пацієнтів у віці 51-57 років. Під спостереженням знаходились переважно жінки (88 осіб) та 2 чоловіки.
Згідно з поставленою метою і задачами проводились такі дослідження: фізикальні та загальноклінічні лабораторні методи; визначення гідратації епідермісу, трансепідермальної втрати вологи у пацієнтів з інволютивними змінами шкіри обличчя з супутнім маласезіозом; мікроскопічні, культуральні та кількісні мікологічні тести на наявність дріжджоподібних ліпофільних грибів роду Malassezia для підтвердження етіологічного діагнозу; дослідження стану шкіри, її структури за допомогою УЗ-сканування, вивчення pH шкіри у пацієнтів, що мали супутній маласезіоз шкіри, гістологічне вивчення структури шкіри, порівняльний аналіз у кожного обстеженого пацієнта особливостей клінічних дерматозів, результатів лабораторних та морфологічних досліджень з урахуванням супутнього маласезіозу шкіри, наукове обґрунтування показників та розробка методики раціональної диференційованої комплексної терапії з використанням протигрибкових препаратів; оцінка результатів запропонованого лікування.
При зборі анамнезу з’ясовували перенесені та супутні захворювання, першочергове розташування шкірних елементів ураження, розповсюдженість дерматозу, провокуючі фактори, лікувальні заходи, які застосовувались.
Всі пацієнти підлягали ретельному лабораторному обстеженню, яке призначалось при постановці діагнозу і подальшому диспансерному спостереженні. При первинному зверненні проводилося обстеження, яке вміщувало клінічні аналізи крові та сечі, вивчення показників вуглеводного обміну (цукор крові), функціонального стану печінки (тимолова проба), печінкові трансамінази, лужну фосфатазу, креатинфосфокіназу, коагулограму (протромбіновий індекс, час утворення фібрину, кількість фібрину, толерантність плазми до гепарину.)
При оцінці результатів клінічного аналізу дотримувалися загальноприйнятих показників з огляду на міжнародну систему одиниць.
За показаннями проводилися деякі інструментальні дослідження: електрокардіографія, рентгенологічне та ультразвукове дослідження органів черевної та грудної порожнини.
Хворі консультувалися суміжними фахівцями за показаннями: терапевтом, гінекологом, ендокринологом.
Оперативне втручання проводилося на базі ТОВ «Клініка пластичної хірургії та косметології «Артмедика»», м. Дніпропетровськ.
2.2 Діагностика функціонального стану шкіри обличчя
Вивчення структури шкіри, оцінку динаміки стану шкіри до та після пластичної операції здійснювали за допомогою проведення доплерографічного ультразвукового дослідження шкіри за допомогою ультразвукового діагностичного апарату DUB-USB Taberna Pro Medicum (Німеччина). Частота датчика становить 20-100 МГц.
Ця методика є цифровою ультразвуковою візуалізацією високого дозволення з можливістю вивчення найбільш поверхневих шарів шкіри. Товщину різних шарів шкіри визначали у чотирьох зонах – на лобі, скроні, щоці та підборідді, кровообіг шкіри – у скроневій зоні (його характеризували за максимальною та середньою швидкістю кровоплину, індексами пульсактивності та резистентності).
Для проведення діагностики типу шкіри, фототипу, типу волосся і аналізу зображень поверхні шкіри, волосся, нігтів використовували Multi Skin Test Center® MC1000. Це багатофункціональний діагностичний комбайн, що оснащений датчиками термометрії (індикатор мікроциркуляції) рН (визначення кислотно-лужного стану шкіри) і трансепідермальній втрати вологи (бар’єрні властивості шкіри).
Рівень рН вимірювали на поверхні шкіри, результати вимірювання висловлювали в одиницях. Зазвичай рН складає 5.5 од. у жінок та трохи нижче у чоловіків — біля 5 од.
Для різноманітних типів шкіри рН достатньо сильно розрізняється: 3.5 (кисле середовище) — для сухої шкіри, 5.5 — нормальної, 6 (лужне середовище) — для жирної шкіри.
Також використовували апарат для візуальної діагностики обличчя та цифрової обробки зображень. Фото обличчя виконувалося камерою високого розширення при стандартному освітленні, що дозволяло кількісно оцінити пори, зморшки, гладкість і запальні елементи. Спеціальний алгоритм обробки зображень дозволяє виявити ділянки прихованої пігментації без використання УФ-освітлення.
Фотографування проводилося в трьох основних ракурсах: анфас, фото праворуч і фото зліва.
Прилад дозволяє провести аналіз зовнішнього вигляду шкіри, вибрати до 4х зображень для порівняння одночасно і представляє результати в цифровому вигляді.
2.3 Мікроскопічні дослідження
Виявлення псевдоміцеліальної форми дріжджоподібних ліпофільних грибів роду Malassezia у досліджуваному матеріалі при вивченні нативного не зафарбованого просвітленого препарату.
У досліджуваному матеріалі збудника виявляли за морфологічними ознаками, взятому безпосередньо з ураженої шкіри у хворих. Досліджуваний матеріал розміщали на предметному склі, наносили на нього краплю 10-20 % розчину КОН, перемішували для просвітління (розчинення рогових мас), підігрівали над полум’ям спиртівки (не доводячи до кипіння), доки по периферії не з’являлися краплі білого ободку з кристалів лугу, а потім, надавлюючи, накривали покривним склом і мікроскопували при природному чи штучному освітленні – спочатку при малому (об’єктив 8 х, окуляр 7 х або 10 х), а потім при великому (об’єктив 40 х, окуляр 7 х або 10 х) збільшенні.
Мікроскопічно патогенний гриб виявлявся у псевдоміцеліальній формі — у вигляді коротких (15-40 мкм довжиною і близько 2-5 мкм товщиною) ниток міцелію (псевдоміцелію) і круглих тілець дріжджових клітин — утворень округлої чи еліпсоїдної форми розміром 3-5 мкм, з подвійним контуром), що групуються купками по 10-20 штук; така мікроскопічна картина „спагеті з м’ясними кульками“ специфічна і має діагностичне значення.
Дріжджоподібну чи псевдоміцеліальну форми збудника виявляли по морфологічних ознаках у досліджуваному матеріалі, взятому безпосередньо з місць уражень хворих. Взятий за наведеними вище правилами досліджуваний матеріал розміщали на предметному склі, знежирювали та фіксували 10-15 хвилин сумішшю Нікіфорова або 96-градусним етиловим спиртом та висушували.
Для просвітління (розчинення рогових мас) наносили на препарат 1-2 краплі концентрованої оцтової кислоти, ретельно розподіляли матеріал по поверхні предметного скла за допомогою препарувальної голки або іншого предметного скла, висушували над полум’ям. На висушений і фіксований препарат вносили 1-2 краплі 1-% водного розчину метиленового синього на З хвилини, змивали надлишки барвника водою, висушували і досліджували мікроскопічно за допомогою імерсійної системи під мікроскопом, при природному чи штучному освітленні (об’єктив 90 х, окуляр 7 х чи 10 х; імерсійна олія – кедрова).
Препарат синього кольору. У препараті дріжджові клітини і псевдо міцелій гриба зафарблюються в темно-синій колір. Мікроскопічно патогенний гриб у псевдоміцеліальній формі виявляється у вигляді коротких (15-40 мкм довжиною і близько 2-5 мкм – товщиною) ниток міцелію (псевдоміцелію) і круглих тілець (дріжджових клітин – утворень округлої чи еліпсоїдної форми розміром 3-5 мкм, з подвійним контуром), що групуються купками по 10-20 штук.
2.4 Морфологічні дослідження
Для гістологічного вивчення структури шкіри досліджували інтраопераційні біоптати розміром 2×3 мм, взяті з ділянок шкіри щічної ділянці обличчя. Зразки шкірних біоптатів фіксували у рідині Буена, обробляли у висхідній концентрації етанолу та виготовляли парапластові блоки за стандартною методикою. Серійні зрізи тканини виготовляли завтовшки 5-7 мкм та фарбували гематоксиліном-еозином, за Масоном, Пачіні, Ван-Гізон, Вейгертом, конго червоним за Матсуура, за Маллорі-Слінченком. Використовували загально прийняті стандарти гістологічних процедур [58]. Забарвлення гематоксиліном-еозином проводилося з метою вивчення основних структур, що входять до складу шкіри. У подальшому депарафіновані за стандартною методикою зрізи 5-7 мкм завтовшки розміщували у розчині гематоксиліну Гейденгайна (0,5 г гематоксиліну в 10 мл етанолу і 90 мл дистильованої води) на 15 хвилин при кімнатній температурі з подальшою промивкою у протоковій воді 5 хвилин. Після цього проводили забарвлення 0,1 % водним розчином еозину 1 хвилину та процедуру заключення у бальзам. Мікропрепарати шкіри, забарвлені за оригінальною методикою Масона, використовували для візуалізації загальних гістологічних елементів епідермісу та дерми, в тому числі контрастування колагенових волокон. Для цього зрізи обробляли 5 % розчином залізо-аміачних квасців протягом 30 хвилин при температурі +50○С та забарвлювали розчином гематоксиліну Гейденгайна (0,5 г гематоксиліну в 10 мл етанолу і 90 мл дистильованої води). Після цього забарвлювали гематоксиліном Рего (1 г гематоксиліну в 10 мл абсолютного спирту з додаванням 10 мл гліцерину та 80 мл дистильованої води) протягом 30 хвилин при температурі +50○С з подальшим диференціюванням в 2,5 % розчині залізо-аміачних квасців. Наступним кроком було забарвлення у суміші кислого фуксину, 100 % оцтової кислоти та дистильованої води (1 г, 1 мл та 100 мл відповідно). У подальшому тканину обробляли 1 % фосфорномолібденовою кислотою протягом 5 хвилин та водним розчином анілінового синього (0,5 г анілінового синього, 100 мл дистильованої води) з додаванням 2,5 мл 100 % оцтової кислоти протягом 4 хвилин при кімнатній температурі та диференціювали у 1 % оцтовій кислоті. Після обробки виготовляли постійні гістопрепарати.
Для візуалізації елементів сполучної тканини використовували забарвлення мікропрепаратів за методикою Пачіні. Для цього депарафіновані зрізи 5-7 мкм завтовшки обробляли 2 % розчином фосфорновольфрамової кислоти протягом 10 хвилин; 15 хвилин забарвлювали сумішшю, яка складалась з: 10 мл розчину водного голубого з орсеїном (1 г водного голубого, 1 г орсеїну, 5 мл 100 % оцтової кислоти, 20 мл гліцерину, 50 мл абсолютного спирту, 100 мл дистильованої води), 12 мл 2 % спиртового розчину еозину, 1 мл насиченого водного розчину кислого фуксину та 5 мл нейтрального гліцерину; диференціювали в абсолютному спирті та 2 % фосфорновольфрамової кислоти протягом декількох секунд. Після вказаної процедури забарвлені зрізи заливали в бальзам.
Для морфологічної та морфометричної оцінки еластичного компоненту дерми використовували методику забарвлення мікропрепаратів резорцин-фуксином у сукупності з методикою Ван-Гізон. Для цього депарафіновані зрізи з 80 % етанолу на 15 хвилин переносили у резорцин-фуксин (0,5 г некислотного фуксину, 1 г резорцину, 2 г хлористого заліза, 60 мл дистильованої води), виготовлений за стандартною методикою; після промивки в протоковій та дистильованій воді забарвлювали залізним гематоксиліном Вейгерта (1 г гематоксиліну, 1,16 г хлористого заліза, 1 мл соляної кислоти, 98 мл дистильованої води, 100 мл 96 % етанолу) протягом 2 хвилин. Наступним кроком було 5-хвилинне забарвлення сумішшю пікрінової кислоти та тіазинового червоного (100 мл насиченого водного розчину пікринової кислоти, 7,5 мл 1 % водного розчину тіазинового червоного), після чого проводили процедуру заключення в бальзам.
Забарвлення мікропрепаратів шкіри резорцин-фуксином за методикою Вейгерта проводилося з метою візуалізації та структурно-кількісного аналізу еластичних волокон. У зв’язку з цим препарати під час депарафінізації з 80 % етанолу переносили у виготовлений за стандартною методикою резорцин-фуксин (0,5 г некислотного фуксину, 1 г резорцину, 2 г хлористого заліза, 60 мл дистильованої води) на 20 хвилин. Під контролем за допомогою мікроскопу зрізи диференціювали у 96 % етанолі до появи чорно-синіх еластичних волокон.
Проведення гістологічного дослідження шкіри здійснювали завдяки використанню методики забарвлення сполучнотканинних елементів конго червоним за Матсуура. Для цього зрізи після депарафінізації на 12 годин розміщували у конго червоному (1 г конго червоного, 100 мл 90 % спирту), потім обробляли спиртовим розчином фосфорномолібденової кислоти (1 г кислоти на 100 мл абсолютного спирту) протягом 5 хвилин до появи синього кольору тканини. Процедуру завершували заключенням у бальзам за стандартною методикою.
Для оцінки характеру розташування та кількості волокон різної хімічної природи у складі шкіри використовували забарвлення мікропрепаратів за методикою Малорі-Слінченко. Для цього депарафіновані зрізи забарвлювали гематоксиліном Вейгерта (1 г гематоксиліну, 1,16 г хлористого заліза, 1 мл соляної кислоти, 98 мл дистильованої води, 100 мл 96 % етанолу) протягом 5 хвилин, потім тримали в хромотропі (0,2 г хромотропу 2В, 0,5 г HIO3, 100 мл дистильованої води). Протягом 10 сек промивали в 5 % розчині фосфорновольфрамової кислоти; після процедури зневоднення, починаючи з 70° спирту, заключали в канадський бальзам.
При електронно-мікроскопічному дослідженні шкіри зразки тканини щічної ділянки розміром до 1 мм3 протягом 3-4 годин фіксували при +2 оС в 2,5 %-вому розчині глютаральдегіду, виготовленому на 0,2M фосфатному буфері (рН 7,4). Подальша фіксація проводилась в 1 %-вому забуференому (рН 7,4) розчині OsO4 («SPI», США) протягом 1 години. Зневоднювали в спиртах зростаючої концентрації та в пропіленоксиді.
Для виготовлення епоксидних блоків використовували Epon 812 («SPI», США). Напівтонкі зрізи 1 мкм завтовшки підготовлювали на ультрамікротомі УМТП-6М (“SELMI”, Україна), фарбували метиленовим синім та вивчали на світлооптичному рівні. Вибрані ділянки піддавалися електронно-мікроскопічному дослідженню. Виготовлення ультратонких зрізів проводили на ультрамікротомі УМТП-6М (“SELMI”, Україна) з подальшим їх розміщенням на опорних сітках (Mesh Regular Grid 200). Подвійне контрастування проводили за стандартною методикою (методом Рейнольдса).
Дослідження проводили за допомогою трансмісійного електронного мікроскопа «ПЭМ-100-01» («SELMI», Україна) при напрузі прискорення 75-80 кВ і первинних збільшеннях від 1500 до 8000 за стандартною схемою. Електронномікроскопічні зображення були зафіксовані на монохромну плівку Agfa з подальшим відцифровуванням зображень TIFF формату сканером Canon CanoScan 9000F.
Проведення кількісного морфологічного дослідження здійснювали з використанням програмного пакету ImageJ 1,47v (розробка ініційована автором Wayne Rasband в Research Services Branch, National Institute of Mental Health, Maryland, USA та поширюється без ліцензійних обмежень як суспільне надбання) [89] та використовуючи загальні принципи морфометричного і стереологічного аналізу [1, 95].
Кількісну оцінку ультраструктурних змін проводили по відцифрованих електронограмах в програмі ImageJ 1,47v (рис. 2.1).
У кількісному морфологічному дослідженні вивчали відносний об’єм всіх елементів ГМЦР у сосочковому та сітчастому шарах дерми окремо для кожного шару, а також середній діаметр артеріол підсосочкової сітки, венул поверхневого та глибокого підсосочкових сплетень, внутрішньососочкових капілярів та основи внутрішньососочкових капілярних петель, загальну товщину базального, остистого та зернистого шарів епідермісу. Також розраховували чисельну щільність ядер кератиноцитів, чисельну щільність фібробластів та мітотичний індекс кератиноцитів. Стереологічно вивчали питомі об’єми досліджуваних структур методом крапкового рахунку за формулою:
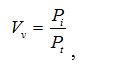 (2.1)
(2.1)
де Vv – питомий об’єм структури;
Pi – кількість точок перетину ліній тест-системи, які доводяться на структуру;
Pt – загальна кількість точок перетину ліній тест-системи.
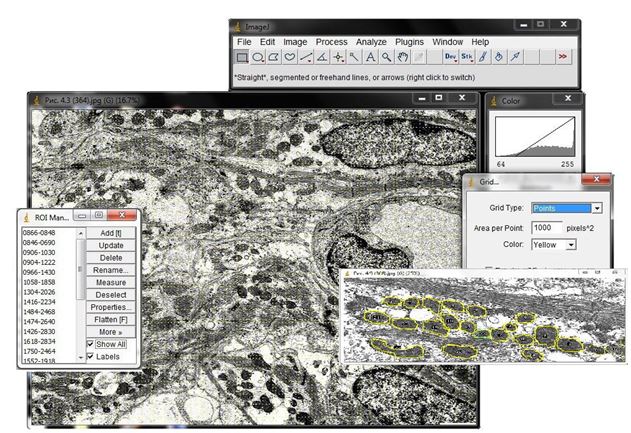
Рисунок 2.1 – Медична програма для обробки зображень ImageJ з використанням плагінів Grid, Grid_Cycloid і вбудованої гістограми
Також проводили визначення ступеня вакуолізації кератиноцитів гермінативної зони, співвідношення конденсованого і деконденсованого хроматину фібробластів, відносного об’єму колагенових та еластичних волокон.
2.5 Математична обробка матеріалу
Отримані в дослідженні кількісні дані піддавали статистичній обробці, яка включала визначення таких характеристик: х – середня арифметична; sx2 – дисперсія; sx – середнє квадратичне відхилення; ss – помилка середнього квадратичного відхилення. Для обчислення зазначених статистичних характеристик використовували стандартні формули. Визначення вірогідності розходжень між вибірками проводили з урахуванням критерію t Стьюдента, що розраховували за формулою:

де x1 і x2 – середні арифметичні порівнюваних вибірок;
ss1 і ss2 – помилки відповідних квадратичних відхилень.
Нульова гіпотеза відхилялася за умови, що критерій t Стьюдента перевершував табличні значення для відповідних ступенів свободи і 5 %-го рівня значущості.
У тому випадку, якщо отримане в дослідженні емпіричне розподілення не відповідало нормальному закону, оцінку відмінностей між вибірками оцінювали за допомогою непараметричних критеріїв: Х-критерію Ван-дер-Вардена і U-критерію Уілкоксона (Манна-Уітні) за технікою, викладеною у монографії [38]. Також цю техніку використовували для аналізу та порівняння малих за кількістю спостережень сукупностей параметрів.
Дисперсійний аналіз ортогональних комплексів проводили на основі обчислення F-критерію Фішера з подальшою оцінкою сили впливу чинника за методом Снедекора [61]. Згідно зі схемою дисперсійного аналізу, проводили послідовне обчислення допоміжних параметрів (девіат, ступенів свободи, дисперсій).
Нульову гіпотезу відкидали, якщо емпірично розрахована величина F перевищувала відповідні значення F таблиці Фішера для рівня значущості 0,05.
Для визначення сили впливу чинника на морфологічні ознаки стану шкіри за методом Снедекора використовували наступні розрахунки:
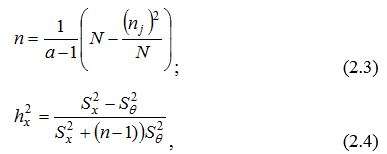
де n – умовна “середня” чисельність варіант в кожній з градацій комплексу;
N – об’єм комплексу;
hx2 – критерій сили впливу чинника;
Sx та S0 – факторіальні і внутрішньогрупові дисперсії.
При проведенні статистичної обробки отриманих квантифікованих результатів усі необхідні розрахунки виконували в оболонці електронної таблиці Excel при використанні відповідних формул і з використанням ліцензійної програми STATISTICA (версія 6.1; серійний номер AGAR 909 E415822FA).
РОЗДІЛ 3
КЛІНІЧНІ ОСОБЛИВОСТІ ТА ФУНКЦІОНАЛЬНИЙ СТАН ШКІРИ
У ПАЦІЄНТІВ З ІНВОЛЮТИВНИМИ ЗМІНАМИ ТА СУПУТНЬОЮ МАЛАСЕЗІЙНОЮ ІНФЕКЦІЄЮ
3.1 Особливості клінічних проявів інволютивних змін шкіри у хворих
Було вивчено 90 пацієнтів з інволютивними змінами шкіри обличчя. Хворих поділили в залежності від віку на 3 вікові категорії. Першу групу складали 30 пацієнтів 33-40 років, 30 осіб 40-50 років та 30 пацієнтів у віці 51-57 років. Під спостереженням знаходились переважно жінки (88 осіб) та 2 чоловіки. На обличчі та шиї сліди інволютивних змін відображаються раніше усього та наочно. У більшості випадків зовнішній вид шкіри обличчя та шиї давав можливість виділити стадію старіння (раннього або пізнього). Найчастіше вони проявлялися наявністю зморшок, зниженням еластичності, стонщенням епідермісу, ліподистрофією (75 осіб).
Хворі скаржилися на наявність зморшок, зміну текстури шкіри, наявність пігментацій. 60 % хворих відмічали підвищену жирність обличчя та волосистої частини голови, висипання на шкірі обличчя. 40 % хворих навпаки відчували сухість, зтянутість шкіри. 43 % хворих скаржилися на поганий сон, часті стреси на роботі та в родині.
Потрібно зазначити, що 56 % мали сімейну схильність до розвитку пітиріазу волосистої частини голови, тобто близькі родичі також страждають на цей шкірний процес.
Сухість шкіри та суттєве збільшення зморшок відмічали 28 пацієнтів.
Посилення висипки та жирності шкіри спостерігали після нервового стресу у 28 хворих. До звернення до пластичного хірурга вони проводили омолоджуючі процедури на обличчі у вигляді ін’єкцій нейромодуляторів та філерів, на основі гіалуронової кислоти.
При обстеженні 90 хворих клінічні прояви інволютивних змін мали певні особливості у різних пацієнтів. Характер та локалізація уражень, обумовлених дією різних факторів зовнішньої середи, залежали від анатомічних, кліматичних, статевих, культурних, релігіозних особливостей пацієнтів.
При аналізі 30 пацієнтів відносно молодого віку 33-40 років клінічно спостерігалися такі зміни текстури шкіри як наявність поверхневих зморшок на відкритих частинах тіла, незначна втрата еластичності (25 осіб), були початкові прояви атрофії, особливо в ділянці шкіри повік (19 осіб). У 22 осіб цієї групи відмічався надлишок шкіри периорбітальної ділянки, опущення зовнішніх країв брів. Колір шкіри мав природній окрас у 26 із 30 пацієнтів, порушення пігментації відмічалися у 22 з 30 осіб у вигляді наявності фотопошкодження шкіри. Гіперпігментовані плями переважно локалізовані на носі та щоках. 15 пацієнтів скаржились на підвищену чутливість шкіри до холоду, при нанесенні на шкіру очищуючих препаратів.
За допомогою дерматоскопії встановили, що волосяні фолікули, діяльність потових та сальних залоз, щільність шкіри були у нормі. Звертало на себе увагу, що у пацієнтів цієї вікової групи не була виявлена атрофія фасцій, м’язів, епідерміс мав початкові зміни атрофії у 5 хворих.
Пацієнти більш старшої вікової групи (30 осіб 40-50 років) мали більш виражені порушення шкіри у вигляді проявів атрофії шкіри (20 осіб). У всіх досліджених цієї групи хворих чітко виявили, що шкіра втратила еластичність, стала більш в’ялою, зморшки розташовані переважно в ділянці очей та рота, на щоках, в ділянці кисті та шиї, де шкіра легко збирається у повільно розправляючі складки. Більш помітною у 16 осіб стає носогубна складка. При більш поглибленому дослідженні за допомогою дерматоскопа було виявлено, що складки та надлишки шкіри між бровами та на лобі були сильно виражені у 19 пацієнтів цієї вікової групи. Характерним для цієї групи хворих було подовження верхньої губи та проміжку між носом та ротом. Губи також стали більш тонкі (порівнюючи з фото хворої 10-річної давності) у 10 хворих. Відмічаються інволютивні зміни шкіри на підборідді та мочках вух. Як правило, першими проявами у себе хворі виявляли втрату природнього окрасу шкіри. Відмічено, що вона стає більш блідою, з жовтувато-коричневатим відтінком. Привертало на себе увагу порушення пігментації та наявність телеангіоектазій (20 осіб), сухість шкіри з дрібно-пластинчатим лущенням (17 осіб), підвищеною чутливістю до холоду, очищуючим кремам. За даними анамнезу у 10 осіб відмічалося сповільнене загоєння ран, які легко проявляються навіть при незначних травмах.
У 24 осіб були виявлені доброякісні новоутворення шкіри: себорейний кератоз, ангіоми, фібропапіломи.
При поглибленому вивченні структури шкіри за допомогою ультразвукового сканування відмічалося, що колагенові волокна не мали чітких контурів, більш виражені дистрофічні зміни. Відмічається знижена концентрація води.
Такі особливості розвитку процесу інволюції як зменшення товщини дерми та підшкірно-жирової клітковини поряд із зниженням еластичних властивостей шкіри призвело до появи більш грубого малюнку шкіри.
При проведенні доплерографічного дослідження у хворих цієї групи зафіксували порушення кровотоку шкіри у вигляді зниження кількості кровоносних судин дерми та їх склерозування та розширення вен шкіри обличчя у 20 пацієнтів. Як наслідок, шкіра втратила рожевий відтінок та відмічалися телеангіоектазії на поверхні.
При вимірі чутливості шкіри булa відміченa порушення функцій нервового апарату у 8 осіб. Була знижена чутливість шкіри та підвищення больового порогу у 5 хворих.
Також потрібно зазначити, що у цієї групі пацієнтів відмічалося зменшення кількості волосяних фолікулів. Порідіння у 16 пацієнтів більше усього було виражено в тім’яній ділянці. Аналізуючи структуру волосся за допомогою дерматоскопії потрібно зазначити, що діаметр волосся зменшується, був наявний фолікулярний гіперкератоз. Волосся у цій частині пацієнтів характеризувалося тенденцією до посивіння. Відсоток сивого волосся у середньому становив 40 %.
Шкіра в захищених від сонця місцях була блідого кольору, у 12 пацієнтів з ніжними зморшками, на її поверхні відмічалися геморагії, телеангіоктазійні кератоми.
Потрібно звернути увагу, що не всі частини обличчя мають однакову ступінь ураження. Лоб, ніс та щоки мають більші ознаки фотоураження шкіри.
30 пацієнтів більш похилого віку (51-57 років) мали виражені порушення шкіри у вигляді проявів атрофії. У 20 з 30 пацієнтів цієї групи були показні інволютивні зміни обличчя та шиї, виражені зміни розміщення підшкірно-жирових тканин.
Скаржилися на сухість шкіри 25 з 30 осіб як за рахунок зниження покровної змазки, так і за рахунок зниження властивостей утримувати вологу. Привертало до себе увагу те, що у цих пацієнтів під дією сили тяжіння шкіра втратила пружність та не зберігає властивостей утримувати м’які тканини і як результат втрачає еластичність.
При аналізі особливостей клінічних проявів у цих пацієнтів відмічали що щоки “сповзають” по кістковому скелету донизу у напрямку підборіддя, де зазвичай шкіра прикріплена більш щільно. У пацієнтів наявні друге або подвійне підборіддя у вигяді шкірного “мішка” або жирової “подушки” (16 пацієнтів). Порівнюючи з пацієнтами 2 вікової категорії більш виражені носогубна та щічно-підборідочна складки, наявні складки біля кутів рота, опущені зовнішні частини брів.
Воскова прозорість шкіри та її жовтуватий окрас також були характерні для 23 пацієнтів цієї вікової категорії.
При ультразвуковому скануванні шкіри, якщо розглянути пошарово прояви інволютивних змін у цих пацієнтів, то роговий шар у 28 пацієнтів потовщується, що в свою чергу веде до появи такої скарги як злущування епітелію, зміни текстури шкіри у вигляді шороховатості при пальпації, значного зневоднення шкіри, пошкодження водно-ліпідної плівки.
У 20 пацієнтів відмічалися другорядні ознаки інволютивних змін шкіри обличчя у вигляді набряків та пастозності ділянки очей. 8 осіб мали гіпертрихоз підборіддя, ділянки над верхньою губою.
Гіперпігментація спостерігалась у 26 хворих з 30. З них було зафіксовано 10 хворих з мелазмою, 8 хворих з “віковими” плямами. У 23 хворих зафіксовано фотоураження шкіри.
Ці пацієнти відмічають зменшення секреції поту та шкірного сала. Симптом “пергаментний колір обличчя” присутній у 10 хворих. На виступаючих частинах обличчя (ніс, щоки) присутні телеангіоектазії, ангіоми (13 осіб).
Навколовушна-жувальнa ділянка залишається в основному не схильна до ознаків старіння. Накопичення жиру в ділянці шиї у 28 з 30 пацієнтів займало серединне положення та мало досить великі розміри (“шия індика”).
Аналізуючи клінічні прояви пацієнтів, можна зробити висновок, що індивідуальна вираженість підшкірно-жирового шару суттєво впливає на характер типу обличчя та тісно пов’язана з інволютивними змінами обличчя та шиї.
У всіх пацієнтів старіння шкіри відбувалося за рахунок зтонщення жирової тканини та якісних змін дерми. При цьому змінюються такі характеристики шкірного покриву як колір, текстура, пружність, кількість вологи. Інволютивні зморшки, птоз шкіри та результати дряблості та атрофії мязів представляють собою ознаку в загальній картині старіння обличчя та шиї. Шкіра з інволютивними процесами стає не тільки сухою, в’ялою, тонкою, але і погіршуються її звязки з гіподермою. Надлишкова шкіра, що проявляється утворенням крупних складок, борізд та обвисанням, є результатом скорочення м’язів та зменшення об’єму кісток.
Серед досліджених пацієнтів надлишок шкіри на повіках проявляється у вигляді нависаючої складки в ділянці верхніх повік (28 осіб). У пацієнтів більш похилого віку також дуже помітний надлишок шкіри в ділянці нижніх повік та проявляється у вигляді мішкоподібних утворень під очами (17 осіб). Надлишок шкіри в ділянці лоба призвів до опущення брів. Надлишок шкіри на щоках спричинив нависання їх з нижньої щелепи у вигляді “бульдож’їх” складок.
Аналізуючи особливості клініки, можна відмітити, що мімічні (динамічні) зморшки були наявні у пацієнтів першої вікової категорії. Проявлялися в кутах очей та на шкірі лоба. У пацієнтів другої та третьої вікових категорій динамічні зморшки більш чітко виражені, поглиблені, а також з’являються статичні зморшки. Вони проявляються крупними поглибленнями.
Часто відмічено у хворих третьї вікової категорії наявність доброякісних новоутворень шкіри як себорейния кератоз, аніоми (24 особи). Вони локалізувались переважно на обличчі та передній черевній стінці.
Волосся у пацієнтів третьої вікової категорії характеризувалося тенденцією до посивіння. Відсоток сивого волосся у середньому становив 70 %.
У 60 пацієнтів при обстеженні були встановлені прояви маласезіозу шкіри. У більшості пацієнтів була не ізольована форма, а комбінація декількох окремих клінічних форм. Найчастіше це була комбінація пітиріазу волосяної частини голови, чорних комедонів та керозу.
З цього можна зробити висновок, що маласезійна інфекція частіше проявляється як комбінація декількох кліничних форм.
Як причину появлення різних симптомів маласезіозу пацієнти відмічали стреси, прийом медикаментів, часті інфекційні захворювання.
Виникали симптоми в місцях типової локалізації (обличчя, волосиста частина голови). Об’єктивно відмічалися сальні пробки в усті волосяних фолікулів, гіпертрофія рогового шару епідермісу з тенденцією до дрібного лущення, пігментація шкіри характеризувалася темно-бурим кольором.
На волосистій частині голови відмічалося нечітко окреслене висівкоподібне лущення ділянок незапальної шкіри з нашаруванням білих, сухих або жирних лусочок.
Тому звернули увагу на широку розповсюдженість маласезійної інфекції та вирішили дослідити, чи впливає дана інфекція на інволютивні процеси у шкірі.
У плані дослідження особливостей перебігу маласезіозу у хворих з інволютивними змінами шкіри відмічено, що прояви різних клінічних форм цього захворювання мали різну динаміку виникнення висипних елементів та поширення уражень. Наприклад, прояви пітиріазу, себорейного дерматиту, різнокольорового лишаю формувалися у короткі терміни, комедони та негнійний фолікуліт протягом декількох тижнів.
Також звертало на себе увагу спільне одночасне існування на сумісних ділянках шкіри доброякісних новоутворень шкіри та поверхневих незапальних форм маласезіозу.
Також важливо відмітити, які клінічні форми маласезіозу посідають провідне місце. Відмітили, що поряд з пітиріазом у хворих часто спостерігається комедони або негнійний фолікуліт шкіри кінцівок та тулуба. Різнокольоровий лишай як окрема поверхнева запальна форма маласезіозу також супроводжується існуванням фолікулярних форм ураження шкіри.
Дослідження особливостей клінічних проявів маласезіозу шкіри показали, що окремі форми маласезійної інфекції у досліджених хворих мали виражену тенденцію до локалізації на строго визначених ділянках шкіри. Частіше за все у хворих патологічний процес локалізувався на шкірі волосистої частини голови, обличя, грудей, верхньої частини спини та плечей. Менш типовим було ураження дистальних частин кінцівок, при цьому в усіх дослідженнях прояви маласезіозу були відсутні на шкірі лодонь та підошов.
Окремим клінічним формам маласезіозу були властиві певні особливості локалізації, за якими вони відрізнялися одна від одної.
Так, наприклад, у жодного з досліджених на шкірі лоба, брів та периорбітальних ділянок не було явищ різнокольорового лишаю, на периорбітальних, носо-щічних ділянках та підборідді відсутній негнійний фолікуліт, на шкіри дистальних частин кінцівок була нетипова локалізація явищ керозу.
Значне місце у впливі на особливості локалізації окремих форм маласезіозу шкіри займав вік хворих. Так, наприклад, пітиріаз шкіри тулуба та кінцівок притаманний переважно пацієнтам зрілого та похилого віку, а наявність себорейного дерматиту обличчя була часто повязана з періодами гормональних перебудов у жінок.
На особливості локалізації окремих форм маласезіозу значний вплив надавали визначені екзогенні фізичні та хімічні фактори, а саме: дія антисептичних гігієнічних засобів, зволоження та жирність шкіри, перегрівання. Навпаки, запобігали розвитку маласезійної інфекції дія ультрафіолетового опромінення, раціональна гігієна шкіри волосся, застосування засобів, що мали протигрибкову дію.
Таким чином, у хворих з маласезіозом, інволютивні зміни шкіри обличчя характеризувалися деякими особливості:
– розвиток інволютивних процесів на шкірі значно прискорювався, що турбувало пацієнтів відносно молодого віку (33-40 років) з необхідністю звертання за консультацією до лікарів-косметологів і дерматологів.
– клінічні прояви маласезіозу обличчя, особливо кероз, сприяли погіршенню текстури шкіри, підвищенню чутливості;
– переважали ураження шкіри у вигляді телеангіектазій, кератом;
– зміна кольору шкіри за рахунок наявності телеангіоектазій та гіперпігментації;
– торпідність до терапії.
Наведені вище особливості впливу визначених факторів на можливість виникнення та розвитку досліджених форм маласезіозу шкіри можуть бути ефективно використані у профілактиці та лікуванні хворих.
3.2 Функціональні показники шкіри у пацієнтів з інволютивними змінами шкіри обличчя та маласезійною інфекцією до лікування
Ряд дослідників показали зміни pH, ступеня гідратації, трансепідермальної втрати вологи у пацієнтів з інволютивними змінами шкіри обличчя. Але не вивчалися зміни цих показників у пацієнтів з інволютивними змінами шкіри обличчя, що мали маласезіоз шкіри як супутній фактор.
У відповідності до завдань дослідження у роботі проведений аналіз функціонального стану шкіри обличчя 60 пацієнтів з інволютивними змінами та маласезіозом за допомогою апаратних методик. При виконанні роботи визначали такі показники функціонального стану шкіри як pH, гідратація епідермісу та щільність шкіри. Контрольну групу представляли 30 здорових осіб 41-50 років без проявів маласезіозу, у яких рН шкіри обличчя складав 5,25±0,02.
Дослідження пацієнта проводили о 9-10 годині ранку до водних процедур. рH шкіри визначали у 2 точках — ділянка щік та лоб.
Як видно з таблиць 3.1 і 3.2, визначення рН шкіри не виявило суттєвих відмінностей клінічно неушкодженої шкіри обличчя хворих на маласезіоз від показників контрольної групи в жодній з досліджувальних вікових груп, проте у всіх хворих на маласезіоз шкіри показало, що рН шкіри зміщується (р<0,05) відносно відповідних за віком контрольних значень.
Отримані дані свідчать про вплив маласезіозу на захисні функції шкіри.
Апаратні дані вмісту дермального колагену та еластину, у цілому, виявляли зменшення його з віком (табл. 3.1). Слід зауважити, що показники відносного вмісту колагену, варіюючи в широких у всіх вікових групах, достовірно поступалися значенням лише у пацієнток віком старше 50 років. У той же час вміст відносного колагену у хворих з супутнім маласезіозом мав також тенденцію до зменшення.
Таблиця 3.1 – Показники функціонального стану шкіри у досліджених хворих без маласезіозу (M±m)
| Дослідження | Здорові (n=30) |
Хворі, вік (роки) | ||
| 33-40 | 41-50 | 51-57 | ||
| рН шкіри (Multi Skin Test Center MC 1000) | 5,25±0,02 | 5,42±0,21* | 5,76±0,18* | 5,73±0,14* |
| Вміст колагену (Visio Face) | 20,5±4,9 | 21,6±4,8* | 20,4±6,1* | 18,5±5,3* |
| Вміст еластину (Visio Face) | 46,5±5,8 | 47,5±6,2* | 34,6±5,6* | 26,7±4,1* |
| Гідратація епідермісу (Multi Skin Test Center MC 1000) | 53,4±18,5 | 57,5±9,4* | 37,1±17,3* | 28,4±9,6* |
Примітка. * – р<0,05 – порівняння показників у хворих і здорових осіб
Таблиця 3.2 – Показники функціонального стану шкіри у досліджених хворих різного віку з маласезіозом (M±m)
| Дослідження | Здорові (n=30) |
Хворі, вік (роки) | ||
| 33-40 | 41-50 | 51-57 | ||
| рН шкіри (Multi Skin Test Center MC 1000) | 5,25±0,02 | 5,88±0,15** | 6,2±0,16** | 6,58±0,18** |
| Вміст колагену (Visio Face) | 20,5±4,9 | 20,0±2,6** | 19,8±4,2** | 18,2±2,6** |
| Вміст еластину (Visio Face) | 46,5±5,8 | 45,1±4,8** | 31,2±5,3** | 25,8±3,8** |
| Гідратація епідермісу (Multi Skin Test Center MC 1000) | 53,4±18,5 | 42,2±12,6** | 33,4±11,8** | 25,4±9,3** |
Примітки:
1. * – р<0,05 – порівняння показників у хворих і здорових осіб.
2. ** – р<0,05 – порівняння показників у хворих з маласезіозом та хворих без маласезіозу.
Напроти, відносний рівень еластину залишався незмінним лише до 40 років, а в подальшому достовірно та різко знижувався у порівнянні з показниками першої вікової групи на 31,3 % (2 група), 43,8 % (3 група). У хворих з супутнім маласезіозом, порівнюючи показники пацієнтів без супутньої інфекції, істотно не розрізнялися і не змінювалися у статистично вірогідному ступені з віком обстежуючих пацієнтів.
Дослідження стану шкіри дозволило встановити у всіх трьох групах різного віку достовірне зменшення показників гідратації епідермісу (p<0,01) у хворих з маласезійною інфекцією порівняно з показниками у пацієнтів без маласезійної інфекції. Необхідно зазначити, що у хворих всіх вікових груп порушення прогресували по мірі збільшення віку хворих. У пацієнтів, які не мали супутню патологію, показники були змінені значно в меншій ступені (р<0,01).
Ми розцінюємо ці порушення як взаємовпливаючі, що свідчать про суттєвий вплив маласезіозу на захисні функції шкіри, що ускладнює клінічні прояви інволютивних змін шкіри обличчя.
* * *
Отже, дані апаратної діагностики виявили певні тенденції вікових змін стану шкіри обличчя, проте є очевидною їх неоднакова діагностична цінність для загальної оцінки інволютивного статусу шкіри. Так, значення показників гідратації епідермісу мали достовірну залежність від вікового фактора та наявності супутньої інфекції.
Результати та підсумки, що викладені у даному розділі роботи, оприлюднені в таких публікаціях:
1. Макарчук А. О. Структурно-функціональна характеристика шкіри у різних вікових категорій жінок із супутньою патологією / А. О. Макарчук, О. І. Макарчук // Морфологія. – 2011. – № 3. – С. 54–58.
2. Макарчук А. О. Маласезіоз шкіри як ускладнювальний фактор в естетичній медицині / А. О. Макарчук // Український журнал дерматології венерології косметології. – 2014. – № 4 (55). – С. 52–56.
РОЗДІЛ 4
МОРФОЛОГІЧНА ХАРАКТЕРИСТИКА ІНВОЛЮТИВНИХ ЗМІН
ШКІРИ ОБЛИЧЧЯ У ХВОРИХ З МАЛАСЕЗІйНОЮ ІНФЕКЦІЄЮ
ДО ЛІКУВАННЯ
У відповідності до завдань даного дослідження, у роботі проведений морфологічний аналіз інволютивних змін шкіри обличчя 30 пацієнтів контрольної групи (практично здорових осіб) і 60 хворих на маласезіоз диференційовано по трьох вікових групах за допомогою світлової та трансмісійної електронної мікроскопії. На початковому етапі дослідження у віковій групі 33-40 років спостерігалося істотне зниження загальної товщини гермінативної зони епідермісу як в ушкодженій інфекцією ділянці шкіри обличчя (на 34,1 %; p<0,05), так і в клінічно здорових ділянках шкіри (на 36,4 %; p<0,05). Це свідчило про системний характер зменшення загальної товщини базального, остистого та зернистого шарів епідермісу хворих на маласезіоз незалежно від того, чи клінічно ушкодженою є досліджувана ділянка шкіри або неушкодженою (табл. 4.1).
У віковій групі 41-50 років товщина гермінативної зони епідермісу в ушкоджених ділянках шкіри не поступалася достовірно величині контрольної групи, проте у більшості спостережень відзначалися виразні явища міжклітинного набряку остистого і шипуватого шарів. Навпроти, у клінічно неушкоджених ділянках шкіри даний параметр достовірно поступався контрольному показнику (на 37,2 %; p<0,05). Аналогічні за напрямком зміни спостерігалися у хворих віком 51-57 років. Означені зміни вказують на те, що в ушкоджених кератомікозом ділянках спостерігається потовщення гермінативної зони епідермісу не завдяки наближенню клітинної маси до контрольного рівня, а за рахунок розвинутих явищ спонгіозу з переважанням міжклітинного набряку.
Визначення чисельної щільності ядер кератиноцитів гермінативних шарів епідермісу не виявило суттєвих відмінностей клінічно неушкодженої шкіри обличчя хворих на маласезіоз від значень контрольної групи в жодній з досліджуваних вікових груп (табл. 4.2), проте у всіх хворих показало достовірне знижені параметри ушкоджених ділянок шкіри відносно відповідних за віком контрольних значень: у хворих віком 33-40 років – на 27,3 % (p<0,05); у хворих віком 41-50 років – на 28,2 % (p<0,05); у пацієнтів 51-57 років – на 33,7 % (p<0,05).
Таблиця 4.1 – Загальна товщина базального, остистого та зернистого шарів епідермісу, мкм (M±m)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 53,6±5,9 | 34,1±4,4 * | 35,3±4,2 * |
| 41-50 років | 50,3±4,8 | 31,6±4,1 * | 46,7±4,3 ** |
| 51-57 років | 41,2±3,2 | 26,5±3,2 * | 35,2±3,9 ** |
Примітки:
1. * – p<0,05 у порівнянні з контрольною групою.
2. ** – p<0,05 у порівнянні між неушкодженою і ушкодженою ділянками шкіри.
Таблиця 4.2 – Чисельна щільність ядер кератиноцитів гермінативних шарів епідермісу, 103×мм-2 (M±m)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 0,77±0,09 | 0,73±0,09 | 0,56±0,12 * ** |
| 41-50 років | 0,85±0,12 | 0,83±0,11 | 0,61±0,14 * ** |
| 51-57 років | 0,98±0,17 | 0,93±0,19 | 0,65±0,15 * ** |
Примітки:
1. * – p<0,05 у порівнянні з контрольною групою.
2. ** – p<0,05 у порівнянні між неушкодженою і ушкодженою ділянками шкіри.
Аналіз мітотичної активності кератиноцитів показав, що клінічно здорові ділянки шкіри обличчя незалежно від віку пацієнтів з маласезіозом не відрізнялися статистично вагомо від показників контрольної групи (табл. 4.3), проте в ушкодженій шкірі мітотичний індекс епітелію значно поступався показникам здорової шкіри: у хворих віком 33-40 років – на 30,4 % (p<0,05); у хворих віком 41-50 років – на 48,5 % (p<0,05); у пацієнтів 51-57 років – на 49,3 % (p<0,05). Ці дані прямо свідчать про супресорний вплив маласезійної інфекції на проліферативну активність кератиноцитів.
Таблиця 4.3 – Мітотичний індекс кератиноцитів, % (M±m)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 2,63±0,32 | 2,40±0,27 | 1,67±0,23 * ** |
| 41-50 років | 2,43±0,24 | 2,35±0,31 | 1,21±0,19 * ** |
| 51-57 років | 2,07±0,21 | 2,11±0,30 | 1,07±0,22 * ** |
Примітки:
1. * – p<0,05 у порівнянні з контрольною групою.
2. ** – p<0,05 у порівнянні між неушкодженою і ушкодженою ділянками шкіри.
При застосуванні трансмісійної електронної мікроскопії в ушкоджених маласезіозом ділянках шкіри пацієнтів у складі базальних кератиноцитів спостерігалися прояви деструкції мітохондріальних крист, ознаки порушення міжклітинних контактних структур остистого і зернистого шарів епідермісу, порушення тонофіламентозної структури епідермісу, виразний міжклітинний набряк. У поодиноких випадках виявлялися апоптотично змінені кератиноцити (рис. 4.1). Ступінь ультраструктурних порушень епідермісу зростав з віком хворих (рис. 4.2, 4.3).
Рисунок 4.1 – Ділянка ушкодженої маласезіозом шкіри обличчя пацієнтки 36 років. Гермінативна зона епідермісу. Електронограма. ×5000
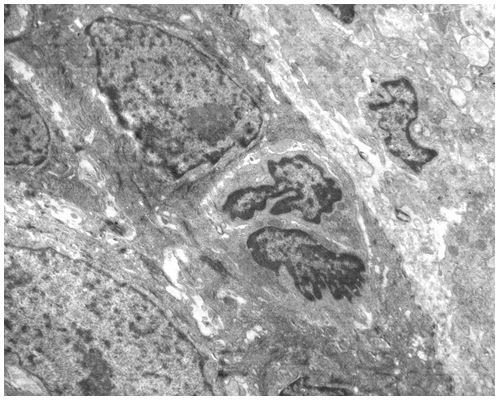
Рисунок 4.2 – Ділянка ушкодженої маласезіозом шкіри обличчя пацієнтки 44 років. Гермінативна зона епідермісу. Електронограма. ×5000
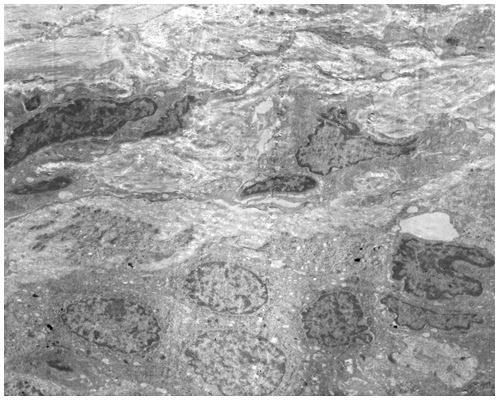
Рисунок 4.3 – Ділянка ушкодженої маласезіозом шкіри обличчя пацієнтки 55 років. Гермінативна зона епідермісу. Електронограма. ×4000
Морфометричний підрахунок клітин, що мають вакуолізовану цитоплазму, виявив закономірне їх збільшення з віком у контрольній групі осіб. У хворих на маласезіоз шкіри обличчя спостерігалося істотне переважання означених клітин як у клінічно здорових ділянках шкіри обличчя, так і в ушкоджених кератомікозом зонах (у середньому майже вдвічі). При цьому статистично вагомих відмінностей між ураженими і неураженими ділянками шкіри обличчя не спостерігалося в жодній з вікових груп, що свідчило про системний характер порушень епідермального гомеостазу внаслідок маласезійної інфекції (табл. 4.4).
Визначення відносного об’єму судин мікроциркуляторного русла у складі сосочкового шару дерми не виявило суттєвих відмінностей клінічно неушкодженої шкіри обличчя хворих на маласезіоз і їх ушкоджених ділянок від значень контрольної групи в жодній з досліджуваних вікових категорій, проте у всіх хворих показало зменшення вмісту елементів мікроциркуляції з віком (табл. 4.5).
Таблиця 4.4 – Ступінь вакуолізації кератиноцитів гермінативної зони, % (M±m)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 0,53±0,21 | 0,98±0,21 * | 1,21±0,10 * |
| 41-50 років | 2,97±0,68 | 4,22±0,57 * | 4,83±0,72 * |
| 51-57 років | 4,22±1,08 | 8,56±1,18 * | 9,32±1,32 * |
Примітки:
1. * – p<0,05 у порівнянні з контрольною групою.
2. ** – p<0,05 у порівнянні між неушкодженою і ушкодженою ділянками шкіри.
Таблиця 4.5 – Відносний об’єм судин мікроциркуляторного русла у складі сосочкового шару дерми, % (M±m)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 5,32±0,65 | 5,04±0,67 | 5,12±0,70 |
| 41-50 років | 4,29±0,53 | 4,17±0,55 | 4,12±0,49 |
| 51-57 років | 4,33±0,58 | 4,26±0,47 | 4,35±0,53 |
Подібно до сосочкового шару дерми, відносний об’єм судин мікроциркуляторного русла у складі сосочкового шару ушкоджених і неушкоджених кератомікозом ділянок від контрольних значень в жодній з досліджуваних вікових груп, причому у всіх хворих, включаючи пацієнтів контрольної групи, інволютивні зміни шкіри свідчили про виразне збільшення вмісту мікросудин сітчастого шару дерми (табл. 4.6).
Визначення діаметру артеріол підсосочкової сітки показало суттєве збільшення показника з віком у всіх досліджуваних групах пацієнтів, причому у хворих на маласезіоз достовірних відмінностей від контрольної групи не виявлялося в жодній віковій групі ні в клінічно неуражених ділянках шкіри обличчя, ні в зонах маласезійного ушкодження (табл. 4.7).
Таблиця 4.6 – Відносний об’єм судин мікроциркуляторного русла у складі сітчастого шару дерми хворих на маласезіоз, (M±m) (%)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 4,13±0,63 | 4,04±0,61 | 3,95±0,52 |
| 41-50 років | 4,19±0,54 | 3,91±0,59 | 4,01±0,53 |
| 51-57 років | 5,48±0,75 | 5,30±0,70 | 5,61±0,61 |
Таблиця 4.7 – Зовнішній діаметр артеріол підсосочкової сітки шкіри обличчя хворих на маласезіоз, (M±m, мкм)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 20,6±3,5 | 23,4±3,2 | 22,5±3,5 |
| 41-50 років | 22,5±3,9 | 25,2±4,4 | 26,6±3,9 |
| 51-57 років | 28,1±4,6 | 27,4±4,7 | 29,1±3,6 |
Морфометричне визначення зовнішнього діаметру венул підсосочкових сплетень у контрольній групі осіб виявило тенденцію до його зменшення з віком. У хворих на маласезіоз шкіри обличчя спостерігалося істотне переважання означених клітин як у клінічно здорових ділянках шкіри обличчя, так і в ушкоджених кератомікозом зонах (на 52,3-62,5 %; p<0,05). При цьому статистично вагомих відмінностей між ураженими і неураженими ділянками шкіри обличчя не спостерігалося в жодній з вікових груп, що свідчило про системний характер порушень дренажної ланки гемомікроциркуляції у хворих з маласезійною інфекцією (табл. 4.8).
Визначення зовнішнього діаметру внутрішньососочкових гемокапілярів не виявило суттєвих відмінностей клінічно неушкодженої шкіри обличчя хворих на маласезіоз і їх ушкоджених ділянок від значень контрольної групи в жодній з досліджуваних вікових категорій, проте у всіх хворих показало поступове зростання параметра з віком пацієнтів (табл. 4.9).
Таблиця 4.8 – Зовнішній діаметр венул підсосочкових сплетень шкіри обличчя хворих на маласезіоз, (M±m, мкм)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 32,3±5,2 | 48,3±6,2 * | 47,5±5,8 * |
| 41-50 років | 28,5±4,8 | 46,6±5,8 * | 43,4±5,1 * |
| 51-57 років | 25,1±4,2 | 39,7±4,1 * | 40,8±4,5 * |
Примітки:
1. * – p<0,05 у порівнянні з контрольною групою.
2. ** – p<0,05 у порівнянні між неушкодженою і ушкодженою ділянками шкіри.
Таблиця 4.9 – Зовнішній діаметр внутрішньососочкових гемокапілярів, (M±m, мкм)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 10,1±1,7 | 11,2±1,6 | 10,5±1,3 |
| 41-50 років | 10,9±1,5 | 12,5±1,5 | 11,3±1,6 |
| 51-57 років | 11,8±1,9 | 12,3±1,8 | 12,0±1,4 |
У базальних ділянках петель внутрішньососочкових гемокапілярів зовнішній діаметр дещо зменшувався з віком пацієнтів контрольної групи. У хворих на маласезіоз шкіри обличчя спостерігалося істотне звуження основи капілярних петель у клінічно здорових ділянках шкіри і в ушкоджених кератомікозом зонах у порівнянні з відповідними за віком контрольними величинами (табл. 4.10): у хворих віком 33-40 років – на 22,3 % (p<0,05); у хворих віком 41-50 років – на 24,5 % (p<0,05); у пацієнтів 51-57 років – на 21,6 % (p<0,05).
Статистично вагомих відмінностей між ураженими і неураженими ділянками шкіри обличчя не спостерігалося, що вказувало на загальну закономірність звуження базальних капілярних сегментів ураженої і неураженої шкіри обличчя у хворих даного контингенту.
Таблиця 4.10 – Зовнішній діаметр гемокапілярів в основі капілярних петель, (M±m, мкм)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 12,1±1,4 | 9,2±0,7 * | 9,4±0,9 * |
| 41-50 років | 11,0±0,9 | 8,7±0,9 * | 8,3±0,5 * |
| 51-57 років | 10,2±0,8 | 8,2±0,6 * | 8,4±0,7 * |
Примітки:
1. * – p<0,05 у порівнянні з контрольною групою.
2. ** – p<0,05 у порівнянні між неушкодженою і ушкодженою ділянками шкіри.
За даними ультраструктурного дослідження, чисельна щільність фібробластів у складі дерми пацієнтів не розрізнялася істотно між ушкодженими і неушкодженими ділянками шкіри обличчя у хворих на маласезіоз, не відрізнялася від показників контрольної групи і не змінювалася у статистично вірогідному ступені з віком обстежуваних пацієнтів (табл. 4.11).
Таблиця 4.11 – Чисельна щільність фібробластів, мм-2 (M±m)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 427±51 | 405±48 | 362±43 |
| 41-50 років | 419±64 | 411±38 | 379±55 |
| 51-57 років | 391±49 | 370±36 | 385±59 |
Співвідношення між гетерохроматином і еухроматином, яке є одним з критеріїв транскрипційної діяльності клітинних ядер фібробластів, у контрольній групі пацієнтів виявляло тенденцію до зростання по вікових групах (табл. 4.12). У хворих на маласезіоз шкіри обличчя у всіх вікових групах даний параметр достовірно поступався контрольним величинам як в ушкоджених ділянках, так і в ділянці клінічно неушкодженої шкіри. При цьому між неушкодженою і ушкодженою ділянками шкіри у пацієнтів віком 51-57 років різниця становила 42,4 % (p<0,05).
Таблиця 4.12 – Співвідношення конденсованого і деконденсованого хроматину фібробластів (M±m)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 0,194±0,027 | 0,114±0,022 * | 0,096±0,011 * |
| 41-50 років | 0,203±0,029 | 0,133±0,020 * | 0,113±0,017 * |
| 51-57 років | 0,232±0,040 | 0,144±0,027 * | 0,083±0,014 * ** |
Примітки:
1. * – p<0,05 у порівнянні з контрольною групою.
2. ** – p<0,05 у порівнянні між неушкодженою і ушкодженою ділянками шкіри.
Вміст колагенових волокон дерми не розрізнявся істотно між ушкодженими і неушкодженими ділянками шкіри обличчя у хворих на маласезіоз, не відрізнявся від показників контрольної групи і не змінювався значною мірою з віком обстежуваних пацієнтів (табл. 4.13).
На відміну від колагенових волокон, еластичні волокна дерми пацієнтів значно змінювалися за відносним об’ємом у досліджуваних вікових групах. Зокрема, у пацієнтів контрольної групи віком 41-50 років вміст еластичних фібрил на 26,8 % (p<0,05) поступався показнику осіб 33-40 років, у групі пацієнтів 51-57 років – на 42,7 % (p<0,05). Схожі за напрямком і діапазоном зміни спостерігалися при дослідженні ушкодженої і неушкодженої шкіри обличчя у хворих на маласезіоз, проте у даних хворих не виявлялося суттєвих відмінностей від показників відповідних за віком контрольних величин (табл. 4.14).
Таблиця 4.13 – Відносний об’єм колагенових волокон, % (M±m)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 65,6±6,3 | 63,4±5,3 | 61,8±8,3 |
| 41-50 років | 67,5±8,5 | 64,8±7,0 | 63,2±6,7 |
| 51-57 років | 66,8±8,0 | 61,4±7,3 | 60,1±6,4 |
Таблиця 4.14 – Відносний об’єм еластичних волокон, % (M±m)
| Вік | Контрольна група | Хворі на маласезіоз шкіри обличчя | |
| Неушкоджена ділянка | Ушкоджена ділянка | ||
| 33-40 років | 4,73±0,52 | 4,42±0,51 | 4,37±0,45 |
| 41-50 років | 3,46±0,44 | 3,51±0,38 | 3,34±0,43 |
| 51-57 років | 2,71±0,32 | 2,34±0,34 | 2,52±0,29 |
За результатами дослідження гістологічних біоптатів ушкоджених ділянок шкіри, у пацієнтів з маласезіозом ділянки обличчя віком 33-40 років найбільшою мірою були виражені явища гіперкератозу за паракератозним типом (77,8 % пацієнтів) і периваскулярна інфільтрація мікросудин дерми імунокомпетентними клітинами (66,7 % пацієнтів). Меншою мірою спостерігалися спонгіоз гермінативної зони (44,4 % спостережень), лімфоцитарна інфільтрація епідермісу (38,9 %) і гіперплазія кератиноцитів (33,3 % спостережень). У невеликої частки пацієнтів у зоні ушкодженої шкіри обличчя спостерігались прояви запальних процесів у зоні шкірних залоз, пригнічення активності макрофагів, а також ушкодження проліферації та диференціювання кератиноцитів (табл. 4.15; рис. 4.4–4.6).
Таблиця 4.15 – Частота типових потоморфологічних змін у ділянках ушкодженої шкіри обличчя хворих на маласезіоз по вікових групах
| Морфологічні ознаки | Вікові групи | ||
| 33-40 років (n=18) | 41-50 років (n=27) | 51-57 років (n=15) | |
| Гіперкератоз | 77,8 % | 55,6 % | 46,7 % |
| Спонгіоз | 44,4 % | 85,2 % | 60,0 % |
| Периваскулярна інфільтрація | 66,7 % | 51,9 % | 46,7 % |
| Епідермальна інфільтрація | 38,9 % | 74,1 % | 53,3 % |
| Фолікуліт | 16,7 % | 11,1 % | – |
| Гіперплазія епідермісу | 33,3 % | 22,2 % | – |
| Пригнічення макрофагоцитозу | 27,8 % | 48,1 % | 73,3 % |
| Ушкодження проліферації та диференціювання кератиноцитів | 16,7 % | 33,3 % | 86,7 % |
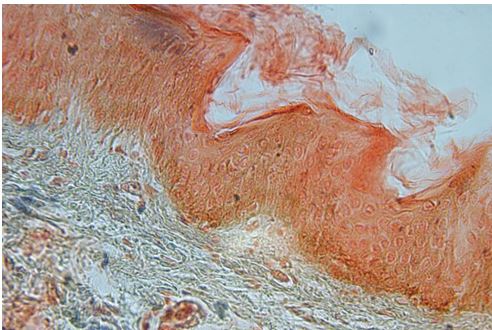
Рисунок 4.4 – Гістологічний зріз шкіри обличчя хворої на маласезіоз віком 34 роки. Епідерміс і сосочковий шар дерми. Забарвлення конго червоним за Матсуура. ×1000
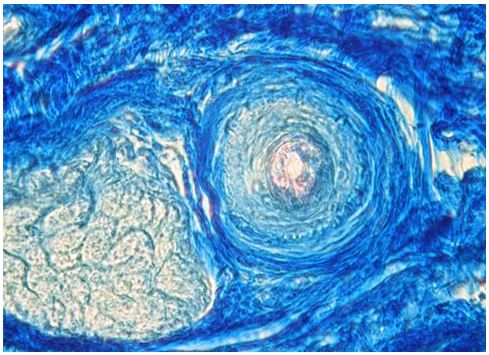
Рисунок 4.5 – Гістологічний зріз шкіри обличчя хворої на маласезіоз віком 38 років. Епітелій сальної залози і волосяного фолікула. Забарвлення за Пачіні. ×1000
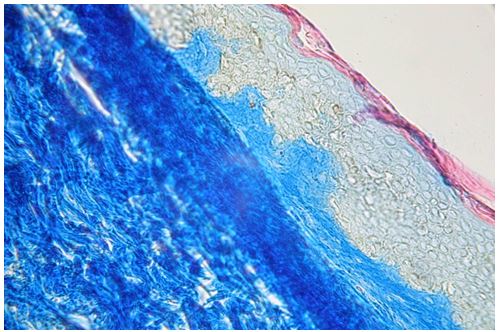
Рисунок 4.6 – Гістологічний зріз шкіри обличчя пацієнтки контрольної групи віком 35 років. Епідерміс і сосочковий шар дерми. Комбіноване забарвлення за Пачіні і Вейгертом. ×400.
У віковій групі 41-50 років явища гіперкератозу і периваскулярної інфільтрації імунокомпетентними клітинами спостерігались більш ніж у половини пацієнтів з маласезійною інфекцією, проте на перший план виступали епідермальний спонгіоз (у 85,2 % спостережень) і лімфоцитарна інфільтрація епідермісу (74,1 %). Майже у половини даного контингенту хворих (48,1 %) спостерігалося пригнічення макрофагоцитозу (рис. 4.7-4.9).
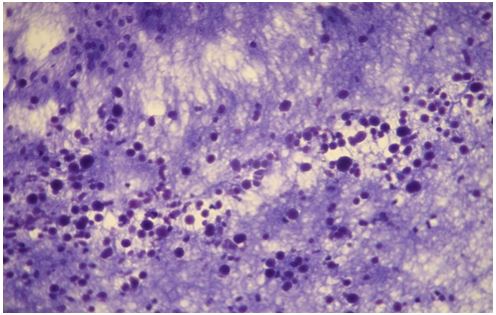
Рисунок 4.7 – Гістологічний зріз шкіри обличчя хворої на маласезіоз віком 43 роки. Лімфоцитарна інфільтрація епідермісу і розвинутий спонгіоз. Забарвлення резорцин-фуксином. ×800
У хворих на маласезіоз віком 51-57 років переважали ушкодження проліферації та диференціювання кератиноцитів (86,7 % пацієнтів), зберігалися явища спонгіозу (60,0 % спостережень), імунореактивність дерми і епідермісу знижувалась порівняно з попередньою віковою групою, прояви фолікуліту і гіперпластичних процесів епідермісу не виявлялися (рис. 4.10-4.12).
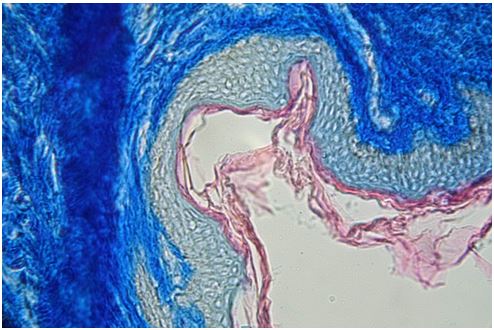
Рисунок 4.8 – Гістологічний зріз шкіри обличчя хворої на маласезіоз віком 45 років. Епідерміс і сосочковий шар дерми. Комбіноване забарвлення за Пачіні і Вейгертом. ×1000
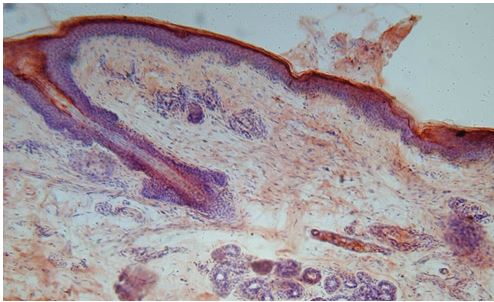
Рисунок 4.9 – Тотальний гістологічний зріз шкіри обличчя пацієнтки контрольної групи віком 45 років. Забарвлення конго червоним за Матсуура. ×200.
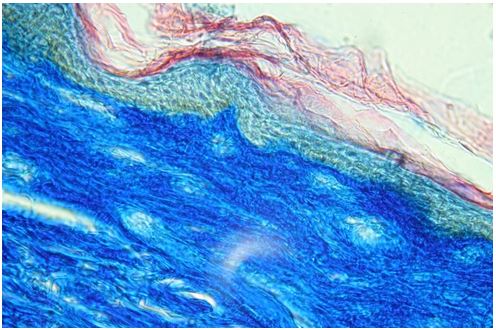
Рисунок 4.10 – Гістологічний зріз шкіри обличчя хворої на маласезіоз віком 43 роки. Епідерміс і сосочковий шар дерми. Комбіноване забарвлення за Пачіні і Вейгертом. ×1000
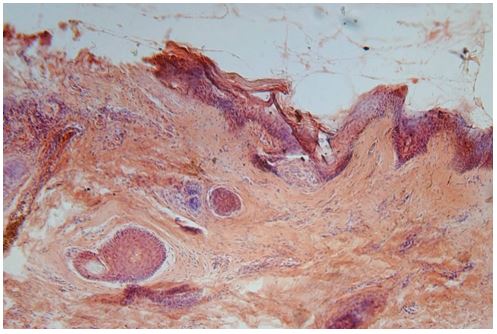
Рисунок 4.11 – Тотальний гістологічний зріз шкіри обличчя хворої на маласезіоз віком 45 років. Забарвлення конго червоним за Матсуура. ×200
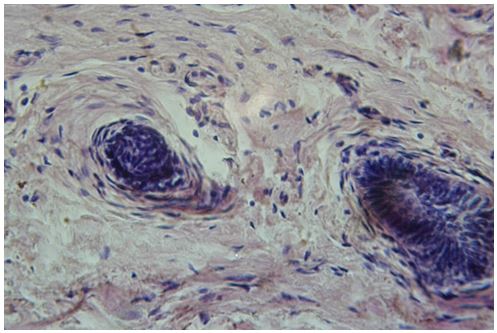
Рисунок 4.12 – Гістологічнийзріз шкіри обличчя пацієнтки контрольної групи віком 45 років. Епітелій залоз і фолікулів у складі сосочкового шару дерми. Забарвлення за Вейгертом. ×400
* * *
Таким чином, на ґрунті проведеного порівняльного морфологічного дослідження на передопераційному етапі можна заключити, що предикторами розвитку маласезіозу шкіри обличчя є мікроциркуляторні ушкодження сосочкового шару дерми за рахунок звуження базальних сегментів капілярних петель та розширення підсосочкових венул у порівнянні з відповідними за віком контрольними величинами, а також порушення гомеостазу епідермісу і структури керато-дермального з’єднання шкіри. Ці зміни мали системний характер і спостерігалися як в ушкоджених маласезійною інфекцією ділянках, так і у складі клінічно неушкодженої шкіри обличчя.
Результати та підсумки, що викладені у даному розділі роботи, оприлюднені в таких публікаціях:
1. Макарчук А. О. Структурно-функціональна характеристика шкіри у різних вікових категорій жінок із супутньою патологією / А. О. Макарчук, О. І. Макарчук // Морфологія. – 2011. – № 3. – С. 54–58.
2. Макарчук А. О. Маласезіоз шкіри як ускладнювальний фактор в естетичній медицині / А. О. Макарчук // Український журнал дерматології венерології косметології. – 2014. – № 4 (55). – С. 52–56.
3. Макарчук А. О. Динаміка морфологічних змін шкіри обличчя у хворих з маласезійною інфекцією на етапах антимікротичної та омолоджувальної терапії / А. О. Макарчук // Морфологія. – 2015. – № 1. – С. 39–46.
4. Макарчук А. О. Морфологічна характеристика інволютивних змін епідермісу у хворих з маласезійною інфекцією шкіри обличчя / А. О. Макарчук // Патологія. – 2015. – № 1 (33). – C. 90–94.
РОЗДІЛ 5
ПОКАЗАННЯ, МЕТОДИКА ТА ОЦІНКА ЕФЕКТИВНОСТІ КОМПЛЕКСНОЇ ТЕРАПІЇ ХВОРИХ НА ІНВОЛЮТИВНІ ЗМІНИ ШКІРИ ОБЛИЧЧЯ З СУПУТНЬОЮ МАЛАСЕЗІЙНОЮ ІНФЕКЦІЄЮ
ТА ДИСПАНСЕРИЗАЦІЯ ХВОРИХ
5.1 Обґрунтування показань та методики диференційованої комплексної терапії на першому етапі обстеження хворих
Результати, які отримали аналізуючи клінічні прояви інволютивних змін шкіри обличчя, показники морфологічного дослідження шкіри, щільності шкіри і корнеометрії, результати лабораторних даних хворих на маласезіоз показали, що пацієнти з інволютивними змінами шкіри обличчя з супутнім маласезіозом були клінічно і лабораторно різні.
Комплексна терапія складалася з трьох основних етапів з урахуванням клініко-морфологічних особливостей уражень шкіри, супутньої інфекції та віку хворих.
Перший етап — це боротьба з інфекцією та призначення патогенетичної терапії з метою усунення маласезіозу.
Другим етапом лікування була підготовка шкіри до операції. Результатом цього етапу лікування була корекція порушень епідермального бар’єру та відновлення шкіри.
Третім етапом лікування стало проведення оперативного втручання на шкірі обличчя.
Терапія хворих проводилась від належності хворого до однієї з чотирьох виділених груп.
Перша група (контролю) складалась з 30 пацієнтів з інволютивними змінами шкіри обличчя, але без супутнього маласезіозу.
Друга група складала 15 хворих з інволютивниим змінами шкіри обличчя, з супутнім маласезіозом. З метою порівняння етіотропна і патогенетична терапія їм не проводилась.
Третя група (30 хворих), яка виділена як основна, була аналогічна другій групі за складом, однак їм проводилась розроблена етіотропна (антимікотична) і патогенетична терапія, призначався другий етап терапії (підготовка до операції).
Препарати призначалися хворим диференційовано, в залежності від характеру і ступеня вираженості змін, використовуючи етіотропні і патогенетичні засоби. Для цього ретельно збирався анамнез, виявлялися провокуючі фактори, зверталася увага на попереднє лікування та переносимість лікарських препаратів.
Вибір методів і лікарських препаратів ґрунтувався на необхідності впливати на різні ланки патогенезу маласезіозу шкіри: етіотропна терапія включала антимікотики, патогенетична терапія передбачала призначення імуномодулюючих, гепатопротекторних препаратів, вітамінів і антиоксидантів.
При призначенні дієти пацієнтам рекомендували зменшення вживання цукру, вуглеводних страв, натурального молока, м’яса та навпаки вживання великої кількості овочів, фруктів, деяких видів круп (кіноа, вівсяна).
Хворим усіх груп на першому етапі була рекомендована терапія медикаментозна у вигляді прийому аскорбінової кислоти до 2,0 г на добу, а також Аєвіту, по 1 капс. 2 рази на добу, медобіотин по 2,5 мг щоденно протягом місяця.
Аскорбінову кислоту у високих дозах рекомендували хворим, враховуючи її виразні відновні властивості. Вона регулює ділянки запально-відновних процесів, у вуглеводному обміні, в регенерації тканин, в утворенні стероїдних гормонів. Однією з найважливіших фізіологічних функцій аскорбінової кислоти є її участь у синтезі колагену і проколагену і в нормалізації проникності капілярів. Вона позитивно впливає на ліпідний обмін.
З метою антиоксидантної дії призначався Аєвіт. Компоненти препарату приймають участь у різних фізіологічних процесах в організмі, у тому числі стимулюють розмноження епітеліальних клітин, приймають участь у регенерації тканин, впливають на білковий та ліпідний обміни, сприяють покращенню капілярного кровообігу, нормалізують проникненість стінки та трофіки тканин.
Також у якості патогенетичної терапії призначали Медобіотин, оскільки біотин як водорозчинний вітамін групи В приймає участь у обміні речовин та позитивно впливає на ріст та будову волосся, нігтів та структуру шкіри, оскільки нігті та шкіра в основному складаються із білкової частини — кератину, а біотин грає важливу роль у створенні основи кератинової субстанції.
Хворим четвертої (основної) групи додатково рекомендували розроблену комплексну терапію (ітраконазол по 100мг двічі на добу після їжі протягом 14-20 днів, тіотриазолін по 2 мл 2,5 % розчину внутрішньом’язово протягом 10 днів, а потім по 1 т. 2 рази на добу 20 днів, урсофальк за традиційною схемою (по 500 мг/добу) ввечері протягом 14 днів.
Ітраконазол має виражену дію на маласезії та інші мікроорганізми, він володіє широким спектром дій.
Також при призначенні даного препарату враховували, що антимікотики групи азолів чинять корегуючий вплив при порушенні кровообігу та володіють імуномодулюючими властивостями на деякі показники клітинного імунітету.
Тіотриазолін стимулює Т-клітинний імунітет і неспецифічні фактори захисту, надаючи одночасно гепотопротекторну, антиоксидантну, мембраностабілізуючу та протизапальну дію, нормaлізує бiлковий, вуглеводний, ліпідний і пігментний обміни. Тіотриазолін підвищує компенсаторну активацію анаеробного гліколізу, зменшує пригнічення процесів окислення в циклі Кребса із збереженням резервів. Покращує реологічні властивості крові.
Зовнішньо призначали протигрибковий лосьйон з біфоназолом на волосисту частину голови та обличчя протягом місяця.
Потрібно сказати, що призначення у цієї групи були диференційованими в залежності від віку, вираженості клінічних проявів захворювання, від чого залежала тривалість терапії, кількість курсів.
5.2 Другий предопераційний етап трерапії досліджених хворих
Анамнез та попередній аналіз перебігу дерматозів у досліджених хворих показав, що значно прискорювались клінічні прояви інволютивних змін шкіри після приєднання проявів маласезіозу. Тому, на нашу думку, недостатньо для цих пацієнтів стандартної терапії і вони потребують додаткової топічної підготовчої терапії перед проведенням пластичної операції та особливого підходу для попередження розвитку ускладнень та рецидивів.
Тому додатково до стандартної терапії рекомендували другий етап лікування у 45 пацієнтів із супутнім маласезіозом.
Результатом цього етапу лікуванням було досягнення повної клінічної ремісії маласезіозу шкіри, проведення комплексу протирецидивних засобів. У середньому, другий етап лікування досліджених хворих тривав 3-4 тижні.
Так, за місяць до проведення пластичної операції пацієнтам з інволютивними змінами шкіри обличчя з ускладненим маласезіозом призначалася підготовка шкіри, яка складалася з очищення шкіри, корекції та стимуляції епідермісу.
Підготовка шкіри включала в себе очищення шкіри, скраб (механічна ексфоліація), контроль сальної залози у пацієнтів з жирною шкірою. Для зменшення секреції сальної залози використовували препарати з саліциловою кислотою, як один з основних лікувальних елементів.
Основною задачею призначення засобів для контролю сальної секреції стала профілактика хронічного запалення шкіри, профілактика прогресії мікрокомедонів, зменшення розширених пор шкіри та покращення пенетрації топічних лікарськаих засобів.
Наступним кроком нашої терапії була корекція та стимуляція. Вони включали відновлення епідермісу шкіри та нормалізацію кольору шкіри. Досягали ефекту епідермального відновлення завдяки нанесенню на шкіру специфічного зовнішнього лікарського засоба ретинолу.
Так, активний ретинол у комбінації з антиоксидантами та пептидами забезпечує протизапальну активність, корекцію інволютивних змін шкіри обличчя, запускає синтез негативного колагену, активує синтез гіалуронової кислоти.
Стимулюючи епідерміс, досягли посилення бар’єрних функцій (толерантність до ультрафіолету, топічним агентам, контактним подразникам), завдяки яким шкіра краще протистає факторам внутрішньої та зовнішноьї середи. Оптимізуємо природну ексфоліацію за допомогою регулювання циклів кератиноциту, відновлюємо пошкоджені ДНК, нормалізуємо гідрацію, контролюємо синтез мeланіну та зупиняємо продукцію меланоцитів.
Основна мета захисту від УФ-випромінювання — попередити пошкодження шкіри УФ-променями завдяки використанню сонцезахисних кремів з фізичним або хімічним блокуванням. Без цього захисту піддання впливу УФ-випромінювання викликає чисельні шкідливі молекулярні процеси, що можна побачити гістологічно та клінічно.
Так, обстеженим пацієнтам цієї групи призначалося:
1. Гель очищуючий для обличчя для нормальної та сухої шкіри.
Він м’яко очищає, заспокоює і освіжає шкіру, готує шкіру до впливу наступних засобів. Завдяки гіалуронату натрію, пантенолу, гліцерину, содіум РСА натрієвої солі і сечовини він зволожує шкіру; алантоїн: заспокоює і пом’якшує шкіру. Ліпопептід мірістоіл пентапептид -8: впливає на синтез колагену, робить шкіру більш пружною.
Рекомендували наносити невелику кількість засобу на вологу шкіру обличчя; помасажувати шкіру; повністю змити теплою водою; застосовувати вранці та ввечері.
2. Наступним було нанесення лосьйону, який прискорює відлущення шкіри за рахунок вмісту гліколевої та молочної кислот.
Він м’яко видаляє надлишки шкірного сала та інші забруднення. Відлущує омертвілі клітини. Покращує текстуру шкіри, стимулює кровообіг і відновлює природний блиск шкіри.
Ми рекомендували наносити його на вологу шкіру обличчя. Помасажувати шкіру. Повністю змити теплою водою. Застосовувати один раз на день або 2-3 рази на тиждень в залежності від типу шкіри.
3. Наступним кроком було призначення лосьйону, до складу якого входить високоактивний вітамін А.
Пацієнти наносили щодня зранку протягом місяця.
Для більш обєктивної оцінки запропонованого комплексного методу терапії інволютивних змін шкіри обличчя з супутнім маласезіозом тільки другий етап лікування (підготовка до операції), але без етіотропного лікування проведен у 15 хворих, який був абсолютно аналогічним по складу і тривалості основній групі пацієнтів (4 група порівняння).
5.3 Третій етап лікування – хірургічна корекція інволютивних змін шкіри обличчя
Виконання класичного відкритого (традиційного) фронтліфтингу проводили з використанням фронтального та перітемпорального розрізів з метою корекції поперечних зморшок лоба, підняття лінії брів, часткового підтягнення шкіри верхніх повік. Переважно виконували розріз, який проходив від місця, де починається завиток правої вушної мушлі, до такого ж місця з лівого боку. Розріз проходив через шкіру. Додатково розрізали фасцію лобнопотиличного м’яза і підлеглу надкісницю у 4 місцях по лінії попереднього розрізу. У випадках високої лінії росту волосся розріз проводили по лінії росту для запобігання утворення надмірно високого чола. У більшості випадків розріз проводили у волосистій частині голови.
Найбільш латеральні розрізи глибоких тканин починали на відстані 6-8 см від кінця основного розрізу. Потім проводили відшарування надкісниці на протязі до 1 см та закріпляли вільний кінець нитки до окістя у першому глибокому розрізі. Закріплення лобного черевця лобно-потиличного м’язу проводили за допомогою спіральних стібків з натягненням. Цю процедуру виконували у медіальному напрямку, починаючи від вискової ділянки до ділянки брови. Після фіксації м’яких тканин верхньої повіки поверталися до основного розрізу. Для додаткових розрізів повторювали усі етапи із закріпленням нитки до надкісниці.
У залежності від індивідуальних особливостей після перетинання м’яза гордіїв тканинний клапоть натягали назад й догори, визначали і висікали його надлишки. За необхідності, бажаного рівня й контуру брів досягали за допомогою постійних фіксуючих швів, що накладалися до окістя.
Також у тих випадках, коли спостерігалися значні інволютивні зміни шкіри лоба, застосовували варіант відкритого фронтліфтингу з субперіостальним сепаруванням. Це частково дозволяло більшою мірою зберігти кровопостачання шкірного клаптя лоба та забезпечити менше ушкодження чутливості в лобно-тім’яній ділянці.
Зокрема, виконували розріз шкіри голови на межі волосистої частини на 2-2,5 см вище місця початку завитка вушної мушлі. У надочноямковій ділянці з обох сторін та в центрі лоба на відкритому лобному черевці лобнопотиличного м’яза проводили горизонтальні розрізи розміром 5-10 см, що досягали надкісниці, з урахуванням топографії глибоких гілок супраорбітального нерва. У ділянці коріння носа виконували вертикальний розріз до надкісниці та проводили піднадкісничнне сепарування до верхнього зовнiшнього і внутрішнього країв очної ямки.
При проведенні традиційного фронтліфтингу надавали увагу відтворенню латерального вектору натягнення з урахуванням тієї обставини, що його відсутність призводить до раннього послаблення естетичного ефекту за умов відсутності контрнатягнення в супрамедіальному напрямку.
Виконання ендоскопічного фронтліфтингу проводили з використанням субперіостальної дисскеції на ґрунті досвіду і загальних принципів мініінвазивних втручань. Перед операцією всі пацієнти були проінформовані про те, що під час здійснення ендоскопічного фронтліфтингу за певними хірургічними міркуваннями може виникнути необхідність виконання стандартного, традиційного розрізу на чолі.
Зону, розташовану поблизу лінії росту волосся, відшаровували через два парамедіанних розрізи (3–4 см від середньої лінії лоба). Диссекцію здійснювали забезпечуючи з’єднання із висковою.
Перед фіксацією шкіру на чолі перестилали, піднімаючи частини брів на різну висоту, щоб додати їм необхідної форми. Вектор фіксації міняли залежно від візуальної оцінки під час переміщення точки фіксації на 2–4 см від середньої лінії. Якщо кінець брови було потрібно підняти вище, точку фіксації переміщали приблизно на 5см від середньої лінії. Однак натяг направляли убік тім’я й, таким чином, увесь натяг латеральної третини брови орієнтували догори й медіально.
Первинний шов фіксації накладали на рівні скроневих отворів. Фіксація по горизонтальних швах шкірно-жирового клаптя і фісції до надкісниці окремими малотравматичними фрагментами забезпечувала рівномірно розводілене навантаження на ділянки надкісниці і надійну фіксацію підтягнутого шкірного клаптя з гіподермою і фасцією на тривалий термін із стабільним косметичним результатом. Особливу увагу під час проведення операції приділяли тому, щоб м’язова тканина лоба не травмувалася, повною мірою зберігаючи її рухливість і оригінальний мімічний малюнок обличчя пацієнта.
5.4 Клінічна оцінка ефективності розробленої комплексної диференційованої терапії з вивченням дінамики функціонального стану шкіри
Проводили оцінку ефективності розробленої комплексної терапії шляхом порівняльного аналізу клініко-морфологічних даних, які отримали у результаті лікування 30 досліджуваних хворих за запропонованою методикою, і 30, що лікувалися звичайним методом без урахування наявності маласезіозу як супутньої інфекції, а також у 30 осіб з інволютивними змінами шкіри обличчя без супутнього маласезіозу.
На період лікування у жодного досліджуваного хворого з 30 не відзначалося негативного впливу препаратів за запропонованою методикою. Початок регресу проявів захворювання шкіри у пацієнтів наступав в середньому на 7–12-й день лікування. Стабілізація процесу наступала на 12–17-й дні лікування. Виражений косметичний ефект відзначався на 20–25-му дні лікування. Загострення дерматозів в процесі лікування не спостерігали. Стосовно побічної дії препаратів, також не було зафіксовано жодних даних.
Потрібно зазначити, що загальна тривалість лікування у досліджуваних хворих, яким проводилась терапія за запропонованою методикою, не перевищувала термінів, які рекомендовані нормативами МОЗ України для таких пацієнтів.
У той же час у 30 пацієнтів, яким проводилась корекція інволютивних змін шкіри обличчя і не була проведена антималасезійна терапія, відзначались загострення маласезіозу (5 чоловік). У цих хворих спостерігались посилення гіперемії, шкіра була дуже чутлива при нанесенні топічних засобів для корекції інволютивних змін шкіри обличчя, особливо ретинолу.
Стабілізація проявів дерматозу у перші 10 днів лікування відзначалася лише у 10 з 30 пацієнтів із супутнім маласезіозом. Задовільний косметичний ефект на 20-й день лікування був досягнутий лише у 13 хворих, які лікувалися традиційним методом. У 10 пацієнтів вдалося досягти задовільнений результат лікування на 30-й день. 7 хворим рекомендувалося додаткове лікування локально і системно. Стосовно тривалості лікування потрібно зазначити, що проведена терапія перевищувала терміни, рекомендовані нормативами МОЗ України.
У хворих, яких було проліковано за розробленою методикою, при контрольному функціональному дослідженні після лікування відмічалося: визначення рН шкіри не виявило суттєвих відмінностей клінічно неушкодженої шкіри обличчя хворих на маласезіоз від показників контрольної групи в жодній з досліджувальних вікових груп, проте у всіх хворих на маласезіоз шкіри показало, що рН шкіри має тенденцію до зсування в лужну сторону (р<0,05) відносно відповідних за віком контрольних значень.
Певні особливості динаміки досліджених показників спостерігалися у відношенні вмісту дермального колагену та еластину. Апаратні дані щодо оцінки вмісту дермального колагену та еластину, у цілому, виявляли зменшення його з віком (табл. 5.1, 5.2).
Навпроти, відносний рівень еластину залишався незмінним лише до 40 років, а в подальшому достовірно та різко знижувався у порівнянні з показниками першої вікової групи. У хворих з супутнім маласезіозом, порівнюючи показники пацієнтів без супутньої інфекції, істотно не розрізнялися і не змінювалися у статистично вірогідному ступені з віком обстежуючих пацієнтів.
Найбільш суттєва динаміка у хворих, які лікувалися за запропонованою методикою, відмічалася у показниках гідратації епідермісу. Як видно з таблиці 5.1, було встановлено у всіх трьох групах різного віку достовірне зменшення показників гідратації епідермісу (p<0,01) у хворих з маласезійною інфекцією, порівнюючи з показниками пацієнтів без маласезійної інфекції. Необхідно зазначити, що у пацієнтів всіх вікових груп порушення прогресували по мірі збільшення віку хворих, але у пацієнтів, які не мали супутню патологію, показники були змінені значно в меншій ступені (р<0,01).
Таблиця 5.1 – Показники функціонального стану шкіри у досліджених хворих без маласезіозу (M±m)
| Дослідження | Здорові (n=30) |
Вік (роки) | ||
| 33-40 | 41-50 | 51-57 | ||
| рН шкіри (Multi Skin Test Center MC 1000) | 5,25±0,02 | 5,44±0,22* | 5,66±0,18* | 5,53±0,14* |
| Вміст колагену (Visio Face) | 20,5±4,9 | 22,6±4,4* | 21,2±5,0* | 18,0±5,0* |
| Вміст еластину (Visio Face) | 46,5±5,8 | 48,0±6,7* | 35,5±5,2* | 27,7±4,3* |
| Гідратація епідермісу (Multi Skin Test Center MC 1000) | 53,4±18,5 | 59,8±9,4* | 38,4±17,2* | 29,5±10,3* |
Примітка. * – р<0,05 – порівняння показників у хворих і здорових осіб.
Таблиця 5.2 – Показники функціонального стану шкіри у досліджених хворих з маласезіозом (M±m)
| Дослідження | Здорові (n=30) |
Вік (роки) | ||
| 33-40 | 41-50 | 51-57 | ||
| рН шкіри (Multi Skin Test Center MC 1000) | 5,25±0,02 | 5,86±0,15** | 6,0±0,14** | 6,6±0,13** |
| Вміст колагену (Visio Face) | 20,5±4,9 | 19,0±2,2** | 20,2±3,8** | 19,5±2,4** |
| Вміст еластину (Visio Face) | 46,5±5,8 | 45,3±4,0** | 30,2±5,0** | 25,5±3,9** |
| Гідратація епідермісу (Multi Skin Test Center MC 1000) | 53,4±18,5 | 42,2±11,3** | 34,1±11,5** | 25,6±8,4** |
Примітки:
1. * – р<0,05 – порівняння показників у хворих і здорових осіб.
2. ** – р<0,05 – порівняння показників у хворих з маласезіозом та хворих без маласезіозу.
5.5 Динаміка морфологічних змін шкіри після лікування
Дослідження морфологічних змін шкіри, що відбувалися протягом 1 місяця специфічної антимікотичної терапії у хворих на маласезіоз, показало суттєву терапевтичну ефективність лікування щодо провідних структурних компонентів ушкодженої шкіри. За даними електронної мікроскопії, чисельна щільність ядер кератиноцитів гермінативних шарів епідермісу перед втручанням в основній групі хворих віком 33-40 років (після 1 місяця антимікотичної терапії) зростала на 32,7 % (p<0,05) відносно значення на початку дослідження, досягаючи рівня контрольної групи пацієнтів. Після проведення пластичної операції щільність ядер епідермальних клітин залишалась на стабільному рівні і не відрізнялася статистично від контрольних параметрів впродовж 1 року після втручання. Навпроти, у хворих групи порівняння (без попередньої антимікотичної терапії) динаміка післяопераційного періоду виявляла поступову тенденцію до погіршення показника: наприкінці спостереження чисельна щільність ядер кератиноцитів гермінативних шарів епідермісу на 29,2 % (p<0,05) поступалася параметру основної клінічної групи за рахунок явищ спонгіозу (рис. 5.1).
У хворих на маласезіоз шкіри обличчя у старших вікових групах динаміка передопераційних і післяопераційних змін була схожою для вікової групи 33-40 років (рис. 5.2, 5.3). Через 12 місяців спостережень різниця чисельної щільності ядер кератиноцитів гермінативних шарів епідермісу між основною клінічною групою і групою порівняння у хворих 41-50 років становила 24,8 % (p<0,05), у хворих 51-57 років – 35,4 % (p<0,05).
Морфометричний аналіз динаміки змін загальної товщини базального, остистого та зернистого шарів епідермісу у хворих з маласезіозом віком 33-40 років не виявила достовірних змін протягом всього періоду спостережень в жодній досліджуваній клінічній групі (рис. 5.4). Навпроти, у хворих віком 41-50 років після 1 місяця антимікотичної терапії відбувалося значне потоншення гермінативного шару до рівня неушкодженої шкіри даних пацієнтів за рахунок редукції явищ спонгіозу, причому на всіх етапах після втручання значення показника залишались стабільними (рис. 5.5, 5.6). У відповідній за віком групі порівняння товщина гермінативної зони епідермісу на всіх етапах дослідження не відрізнялась від контрольних величин, але не за рахунок її нормалізації, а внаслідок збереження виразного набряку базального, остистого та зернистого шарів епідермісу. У хворих віком 51-57 років спостерігалася подібна тенденція змін, що свідчило про позитивний вплив специфічної антимікотичної терапії на нормалізацію структур шкіри, ушкоджених внаслідок кератомікозу, при проведенні заходів естетичної хірургії.
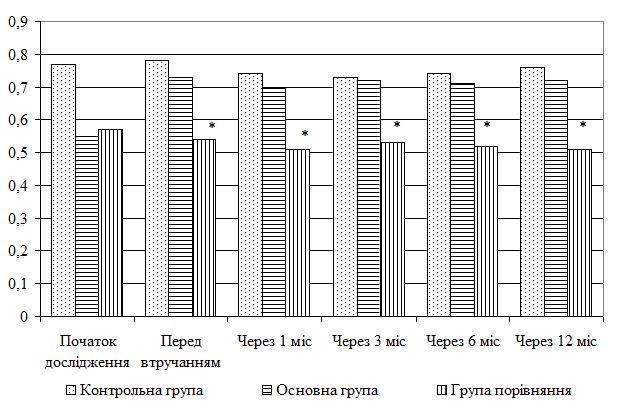
Рисунок 5.1 – Динаміка змін чисельної щільності ядер кератиноцитів гермінативних шарів епідермісу (103×мм-2) у пацієнтів віком 33-40 років. Позначки «*» вказують на достовірну відмінність між основною клінічною групою і групою порівняння
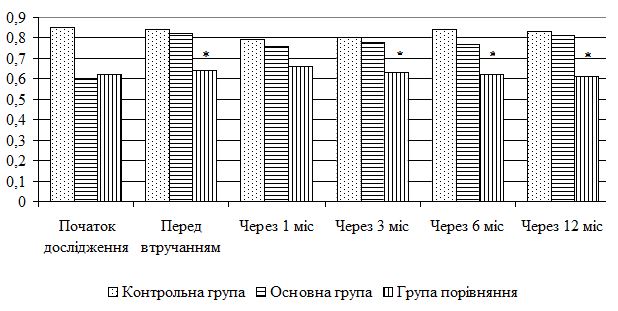
Рисунок 5.2 – Динаміка змін чисельної щільності ядер кератиноцитів гермінативних шарів епідермісу (103×мм-2) у пацієнтів віком 41-50 років. Позначки «*» вказують на достовірну відмінність між основною клінічною групою і групою порівняння

Рисунок 5.3 – Динаміка змін чисельної щільності ядер кератиноцитів гермінативних шарів епідермісу (103×мм-2) у пацієнтів віком 51-57 років. Позначки «*» вказують на достовірну відмінність між основною клінічною групою і групою порівняння
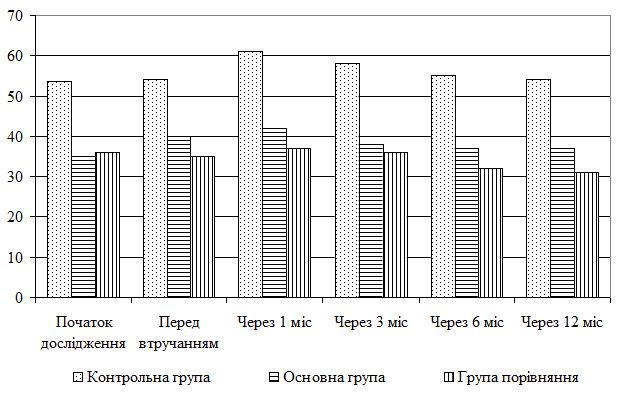
Рисунок 5.4 – Динаміка змін загальної товщини базального, остистого та зернистого шарів епідермісу (мкм) у пацієнтів віком 33-40 років
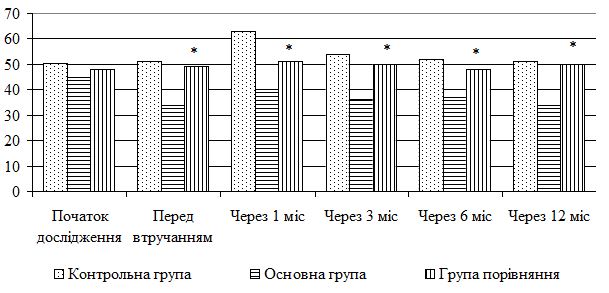
Рисунок 5.5 – Динаміка змін загальної товщини базального, остистого та зернистого шарів епідермісу (мкм) у пацієнтів віком 41-50 років. Позначки «*» вказують на достовірну відмінність між основною групою і групою порівняння
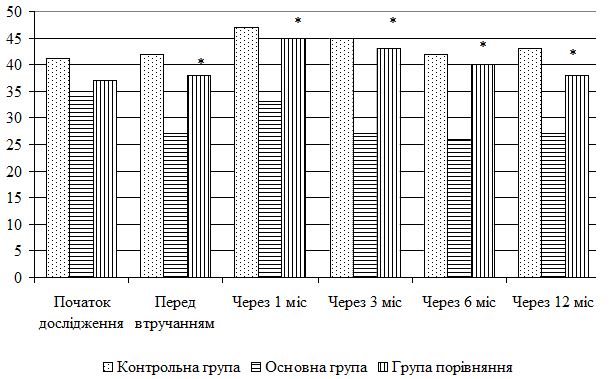
Рисунок 5.6 – Динаміка змін загальної товщини базального, остистого та зернистого шарів епідермісу (мкм) у пацієнтів віком 51-57 років. Позначки «*» вказують на достовірну відмінність між основною групою і групою порівняння (p<0,05)
Ультраструктура ушкодженої маласезіозом шкіри пацієнтів основної клінічної групи віком 33-40 років через 3 місяці після оперативного втручання свідчила про відновлення внутрішньоклітинних порушень, які спостерігалися у складі органел кератиноцитів гермінативної зони епідермісу на початку дослідження. Через 6 місяців після втручання відбувалося значне зменшення проявів міжклітинного набряку та ушкоджень контактного апарату кератиноцитів (рис. 5.7).
Через 12 місяців спостережень у всіх досліджуваних хворих основної групи віком 41-50 років і 51-57 років протягом післяопераційного періоду відзначалося збереження нормальної цитоархітектоніки епідермісу і дерми, досягнутої впродовж 1 місяця специфічної антимікотичної терапії перед омолоджуючим втручанням (рис. 5.8, 5.9).
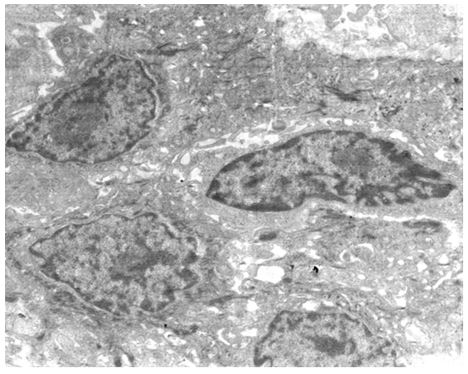
Рисунок 5.7 – Ділянка шкіри обличчя пацієнтки основної клінічної групи 38 років через 6 місяців після оперативного втручання. Гермінативна зона епідермісу. Електронограма. ×5000
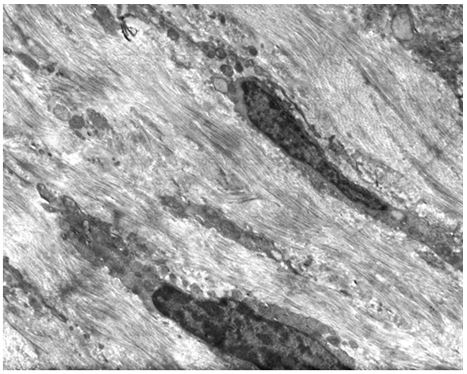
Рисунок 5.8 – Ділянка шкіри обличчя пацієнтки основної клінічної групи 48 років через 12 місяців після оперативного втручання. Сосочковий шар дерми. Електронограма. ×5000
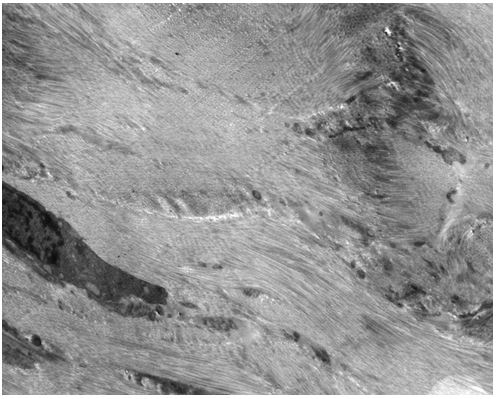
Рисунок 5.9 – Ділянка шкіри обличчя пацієнтки основної клінічної групи 54 років через 12 місяців після оперативного втручання. Сосочковий шар дерми. Електронограма. ×5000
У пацієнтів групи порівняння, яким не проводили специфічну антимікотичну терапію в передопераційному періоді, через 6 місяців після втручання спостерігалося поглиблення деструкції мітохондрій, гранулярного й агранулярного ендоплазматичного ретикулуму, ознаки блокування активності комплексу Гольджі, порушення міжклітинних контактів у складі гермінативної зони епідермісу за рахунок дисоціації десмосом, значний міжклітинний набряк. Явища апоптозу кератиноцитів зустрічалися значно частіше, ніж у передопераційному періоді (рис. 5.10).
Макрофаги, що часто зустрічалися в епідермісі хворих даного контингенту, мали ультраструктурні ознаки високої активності (рис. 5.11). Через 12 місяців після втручання виразність ультраструктурних змін епідермісу та сполучнотканинного компоненту шкіри хворих групи порівняння збільшувалась незалежно від віку пацієнтів (рис. 5.12).
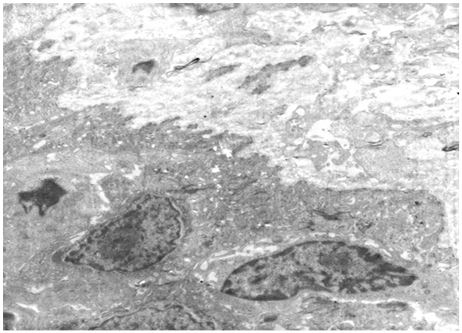
Рисунок 5.10 – Ділянка шкіри обличчя пацієнтки групи порівняння 35 років через 6 місяців після оперативного втручання. Гермінативна зона епідермісу. Електронограма. ×4000
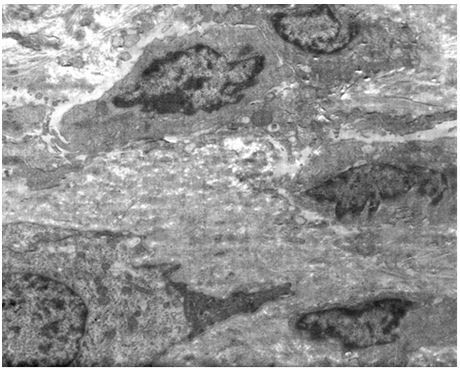
Рисунок 5.11 – Ділянка шкіри обличчя пацієнтки групи порівняння 44 років через 12 місяців після оперативного втручання. Гермінативна зона епідермісу. Електронограма. ×4000
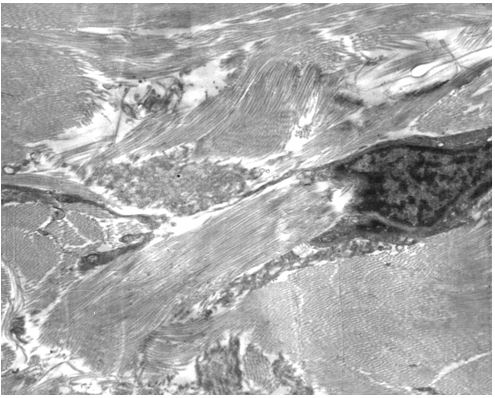
Рисунок 5.12 – Ділянка шкіри обличчя пацієнтки групи порівняння 56 років через 12 місяців після оперативного втручання. Сосочковий шар дерми. Електронограма. ×5000
Аналіз проліферативної активності кератиноцитів виявив значний оптимізуючий вплив відновлювальних заходів у контрольній групі пацієнтів віком 33-40 років і 41-50 років, а також у хворих з маласезійною інфекцією шкіри обличчя після попередньої антимікотичної терапії. Зокрема, протягом 1 місяця передопераційного лікування маласезіозу відбувалося зростання мітотичного індексу кератиноцитів у хворих віком 33-40 років на 50,2 % (p<0,05), у пацієнтів віком 41-50 років – на 83,3 % (p<0,05), у хворих 51-57 років – на 54,5 % (p<0,05) у порівнянні з початковим станом. Мітотична активність епідермісу перед відновлювальним втручанням досягала рівня контрольної групи пацієнтів і залишалася підвищеною протягом всього післяопераційного періоду протягом 1 року.
У всіх хворих групи порівняння, які не отримували антимікотичну терапію, незалежно від віку пацієнтів спостерігалася тенденція до пригнічення проліферативної активності кератиноцитів протягом 1 року після проведення відновлювальних заходів на шкірі обличчя (рис. 5.13–5.15).
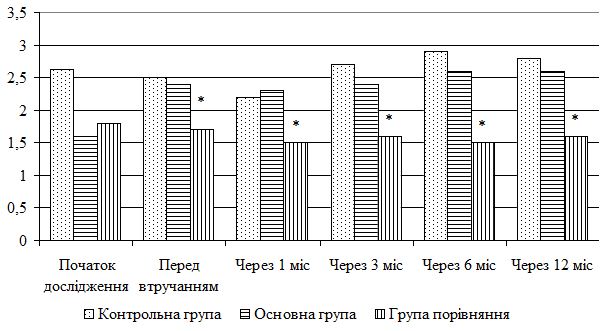
Рисунок 5.13 – Динаміка змін мітотичного індексу кератиноцитів (%) у пацієнтів віком 33-40 років. Позначки «*» вказують на достовірну відмінність між основною групою і групою порівняння
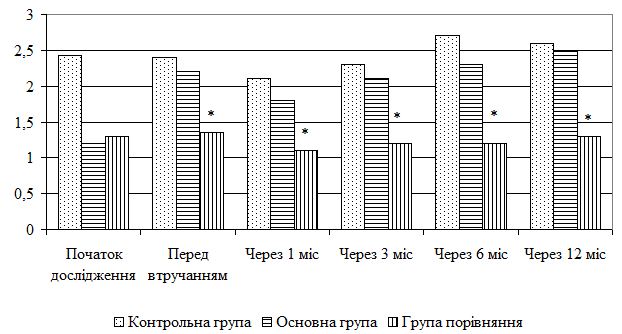
Рисунок 5.14 – Динаміка змін мітотичного індексу кератиноцитів (%) у пацієнтів віком 41-50 років. Позначки «*» вказують на достовірну відмінність між основною групою і групою порівняння
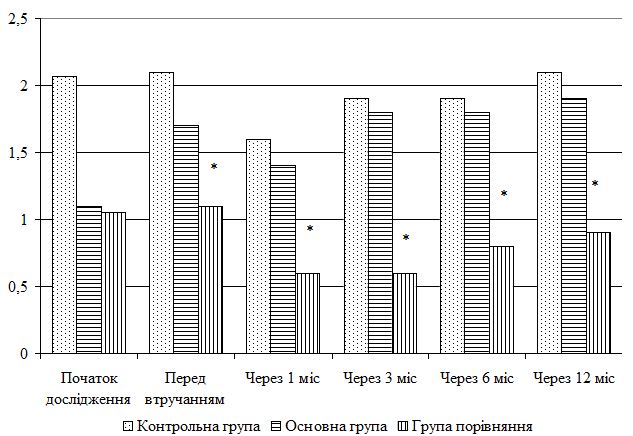
Рисунок 5.15 – Динаміка змін мітотичного індексу кератиноцитів (%) у пацієнтів віком 51-57 років. Позначки «*» вказують на достовірну відмінність між основною групою і групою порівняння
Ультраструктурне визначення ступеня вакуолізації кератиноцитів гермінативної зони вказувало на суттєвий позитивний вплив відновлювальних заходів у контрольній групі пацієнтів всіх вікових груп, а також у хворих з маласезійною інфекцією шкіри обличчя після попередньої антимікотичної терапії.
Протягом 1 місяця передопераційного лікування маласезіозу відбувалося зниження явищ вакуолізації кератиноцитів. Впродовж 1 року після проведення оперативного втручання у даних хворих спостерігалося обмеження літично-дистрофічних явищ на рівні, що був досягнутий у передопераційному періоді. Навпроти, у групі порівняння через 1 місяць після втручання відзначалося різке вакуолярне ушкодження кератиноцитів, яке у хворих віком 33-40 років перевищувало показник контрольної групи на 114,3 % (p<0,05), у пацієнтів віком 41-50 років – на 75,8 % (p<0,05), у хворих 51-57 років – на 117,7 % (p<0,05). Наприкінці спостережень (через 1 рік після операції) у всіх хворих групи порівняння, які не отримували антимікотичну терапію, незалежно від віку пацієнтів ступінь вакуолізації кератиноцитів гермінативної зони статистично вагомо перевищував відповідні за віком показники основної клінічної групи (рис. 5.16–5.18).
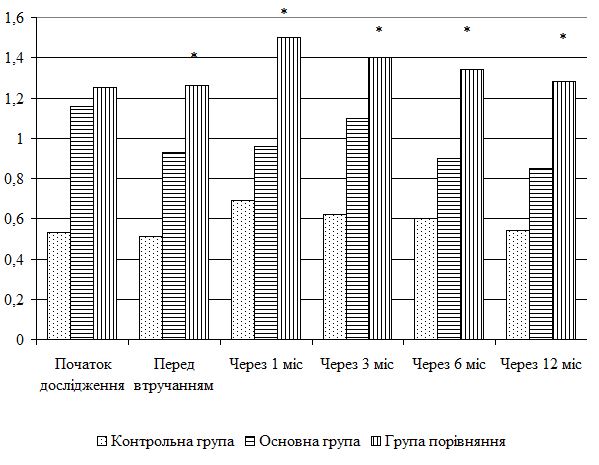
Рисунок 5.16 – Динаміка змін ступеня вакуолізації кератиноцитів гермінативної зони (%) у пацієнтів віком 33-40 років. Позначки «*» вказують на достовірну відмінність між основною групою і групою порівняння
Схожі за напрямком та діапазоном зміни спостерігалися при вивченні і ультраструктурометрії зовнішнього діаметру венул підсосочкових сплетень шкіри пацієнтів досліджуваних клінічних груп (рис. 5.19–5.21).
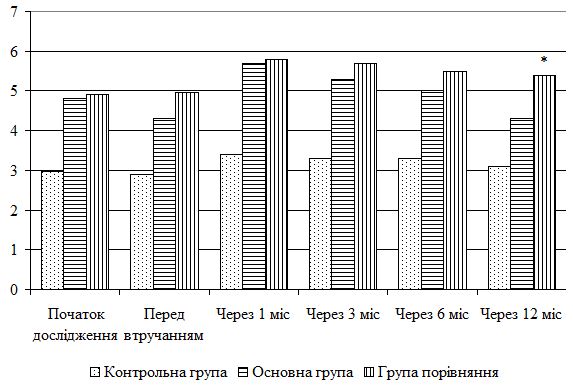
Рисунок 5.17 – Динаміка змін ступеня вакуолізації кератиноцитів гермінативної зони (%) у пацієнтів віком 41-50 років. Позначки «*» вказують на достовірну відмінність між основною групою і групою порівняння
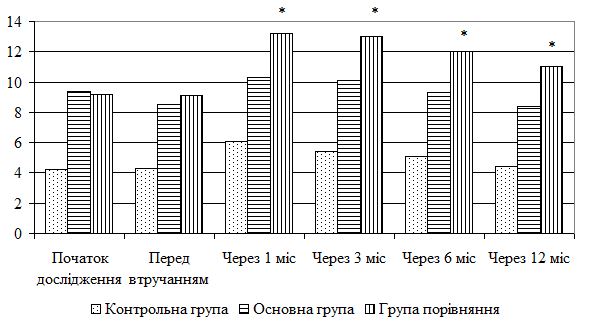
Рисунок 5.18 – Динаміка змін ступеня вакуолізації кератиноцитів гермінативної зони (%) у пацієнтів віком 51-57 років. Позначки «*» вказують на достовірну відмінність між основною групою і групою порівняння
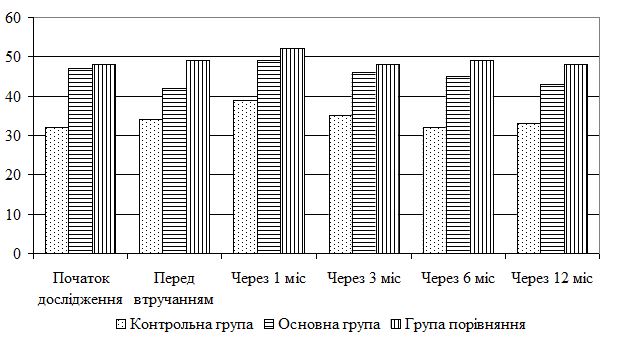
Рисунок 5.19 – Динаміка змін зовнішнього діаметру венул підсосочкових сплетень (мкм) у пацієнтів віком 33-40 років
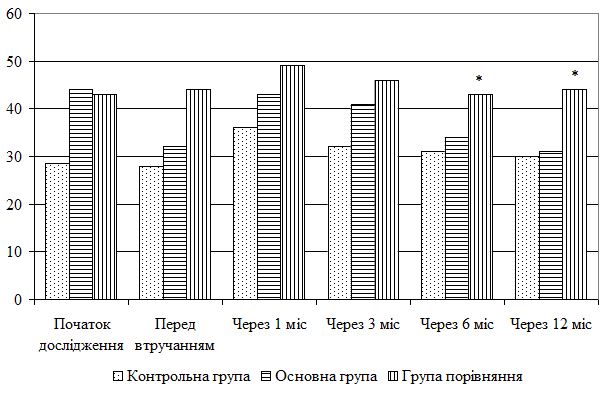
Рисунок 5.20 – Динаміка змін зовнішнього діаметру венул підсосочкових сплетень (мкм) у пацієнтів віком 41-50 років. Позначки «*» вказують на достовірну відмінність між основною групою і групою порівняння
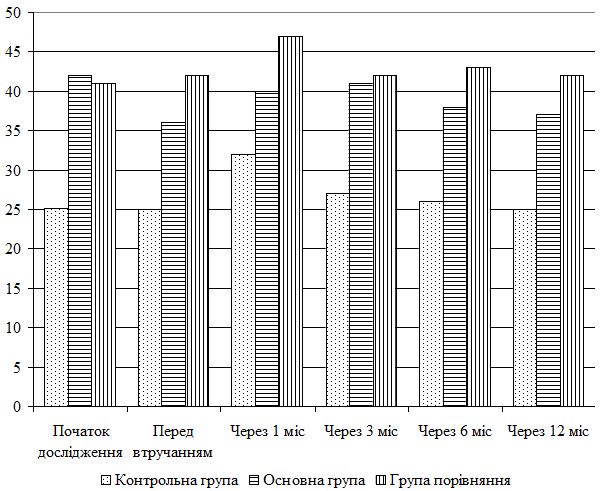
Рисунок 5.21 – Динаміка змін зовнішнього діаметру венул підсосочкових сплетень (мкм) у пацієнтів віком 51-57 років
У складі дерми пацієнтів основної клінічної групи віком 33-40 років відзначалося поступове упорядкування фіброзних структур протягом післяопераційного періоду, що наприкінці дослідження не відрізнялося від морфологічної картини пацієнтів відповідних за віком контрольних груп. Аналогічні за характером зміни відзначалися у старших вікових групах пацієнтів (рис. 5.22, 5.23).
У всіх досліджених вікових категоріях структура дерми у хворих на маласезіоз групи порівняння протягом всього післяопераційного періоду зберігала ознаки дезорієнтації фіброзних комплексів відносно епідермально-дермального з’єднання (рис. 5.24, 5.25).
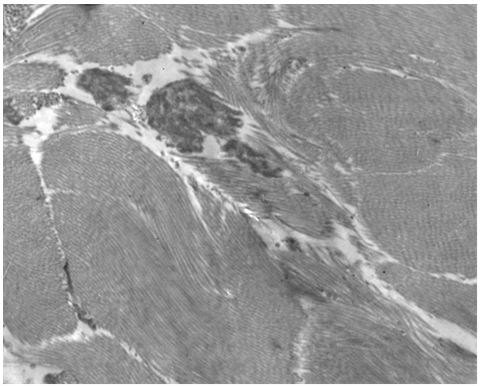
Рисунок 5.22 – Ділянка шкіри обличчя пацієнтки основної клінічної групи 45 років через 12 місяців після оперативного втручання. Сосочковий шар дерми. Електронограма. ×4000
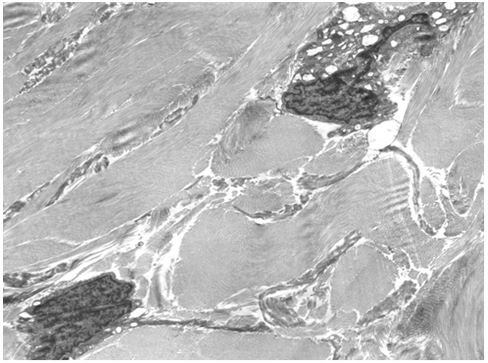
Рисунок 5.23 – Ділянка шкіри обличчя пацієнтки основної клінічної групи 45 років через 12 місяців після оперативного втручання. Сосочковий шар дерми. Електронограма. ×4000
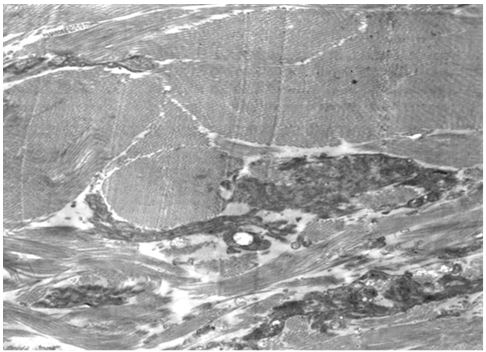
Рисунок 5.24 – Ділянка шкіри обличчя пацієнтки групи порівняння 45 років через 12 місяців після оперативного втручання. Сосочковий шар дерми. Електронограма. ×5000
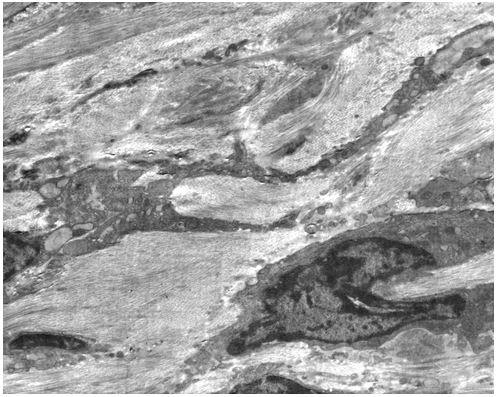
Рисунок 5.25 – Ділянка шкіри обличчя пацієнтки групи порівняння 45 років через 12 місяців після оперативного втручання. Сосочковий шар дерми. Електронограма. ×5000
Стан внутрішньососочкових гемокапілярних петель свідчив про відсутність суттєвого впливу попередньої антимікотичної терапії на діаметр базальних сегментів капілярів як до проведення оперативного втручання, так і протягом наступного післяопераційного періоду (рис. 5.26–5.28). Зокрема, у пацієнтів контрольної групи після втручання відбувалося розширення діаметру капілярів в їх основі з подальшим поступовим відновленням до висхідного рівня. У хворих з маласезіозом незалежно від вікової приналежності спостерігалась аналогічна закономірність як в основній клінічній групі, так і в групі порівняння.
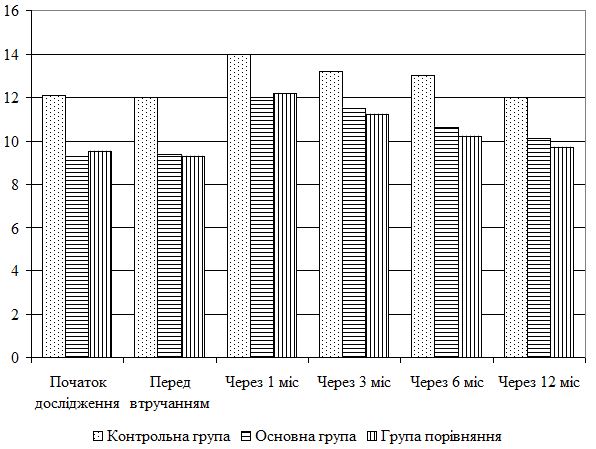
Рисунок 5.26 – Динаміка змін зовнішнього діаметру гемокапілярів в основі петель (мкм) у пацієнтів віком 33-40 років
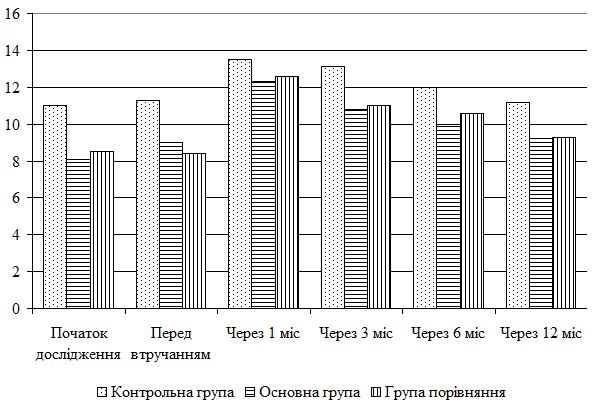
Рисунок 5.27 – Динаміка змін зовнішнього діаметру гемокапілярів в основі петель (мкм) у пацієнтів віком 41-50 років
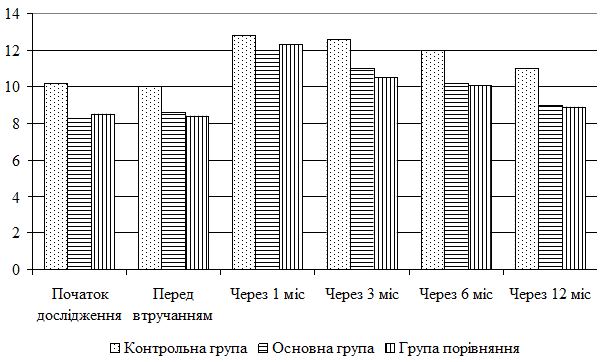
Рисунок 5.28 – Динаміка змін зовнішнього діаметру гемокапілярів в основі петель (мкм) у пацієнтів віком 51-57 років
Таким чином, на ґрунті проведеного порівняльного морфологічного дослідження на передопераційному етапі можна заключити, що предикторами розвитку маласезіозу шкіри обличчя є мікроциркуляторні ушкодження сосочкового шару дерми за рахунок звуження базальних сегментів капілярних петель та розширення підсосочкових венул у порівнянні з відповідними за віком контрольними величинами, а також порушення гомеостазу епідермісу і структури керато-дермального з’єднання шкіри. Ці зміни мали системний характер і спостерігалися як в ушкоджених маласезійною інфекцією ділянках шкіри, так і у складі клінічно неушкодженої шкіри обличчя.
Патоморфологічні зміни шкіри внаслідок маласезійного ушкодження залежали від віку пацієнтів. Зокрема, у хворих 33-40 років провідними порушеннями шкіри обличчя були паракератозний гіперкератоз і периваскулярна інфільтрація мікросудин дерми імунокомпетентними клітинами. У віковій групі 41-50 років на перший план виступали епідермальний спонгіоз і лімфоцитарна інфільтрація епідермісу. У хворих на маласезіоз віком 51-57 років переважали ушкодження проліферації та диференціювання кератиноцитів.
5.6 Диспансеризація хворих
Лікування і динамічне обстеження хворих досліджуваного контингенту показали, що специфічна антимікотична терапія протягом 1 місяця перед пластичним втручанням в ділянці обличчя забезпечувала нормалізацію структур шкіри, ушкоджених внаслідок кератомікозу, за рахунок стимуляції мітотичної активності кератиноцитів гермінативної зони та оптимізації епідермального диференціювання з обмеженням вакуолізації епітеліальних клітин. Продовження локальної та системної антимікотичної терапії впродовж 1 місяця після втручання супроводжувалось відновленням інволютивних морфологічних змін шкіри та попереджало розвиток рецидивів маласезіозу протягом 1 року.
При диспансеризації досліджуваних хворих частота спостережень визначалася індивідуально від 6 місяців до 1,5 року. Хворим з інволютивними змінами шкіри обличчя при необхідності призначали консультації терапевта, ендокринолога, акушер-гінеколога та інших фахівців.
Профілактика рецидивів проводилася методом виявлення факторів, що провокують захворювання та попередження їх.
Досліджуваним хворим рекомендувалося раціональне працевлаштування, усунення провокуючих факторів, дотримання дієти.
Дуже важливо було проводити диспансерне спостереження з приводу супутніх захворювань.
Оцінювалася ефективність запропонованої методики комплексної терапії за допомогою порівняння подальшого перебігу та клінічних проявів дерматозу після проведеного лікування.
Тривалість ремісії у середньому була протягом кожного року статистично значуща у хворих, які отримували терапію за нашою методикою.
Ні у одного з 30 пацієнтів, пролікованих традиційно, не спостерігалося ремісії тривалюсті понад 7 місяців. При цьому пацієнти, які лікувалися за запропонованою методикою, зазвичай мали ремісію тривалістю 9-12 місяців. У 30 % пацієнтів тривалість ремісії складала понад 15 місяців.
З 30 пацієнтів, які лікувалися за запропонованою методикою, у 10 зареєстрована поява лущення шкіри, негнійного фолікуліту (у 7 пацієнтів) формування комедонів. Одночасно у 5 хворих спостерігалося прогресування проявів маласезіозу у вигляді збільшення поширеності, трансформації клінічних проявів. Пацієнти відмічали локальну та загальну непереносимість медичних засобів, які раніше переносилися задовільно та мали гарний терапевтичний ефект.
Потрібно зазначити, що у пацієнтів, які отримували лікування за запропонованою методикою, не спостерігалося прогресування дерматозу та розвитку побічних явищ, терапія переносилася добре.
* * *
Отже, проведені дослідження продемонстрували, що в лікуванні хворих з інволютивними змінами шкіри обличчя, що ускладнені маласезіозом шкіри, є деякі особливості, зумовлені взаємозалежністю патологічних змін. Після проведення дослідження можна стверджувати, що група пацієнтів з інволютивними змінами шкіри обличчя з супутнім маласезіозом, є клінічно і патологічно неоднорідною, що необхідно враховувати при призначенні лікування. Завдяки проведенню дослідження змогли об’єднати хворих у три клініко-терапевтичні групи, які були науково обгрунтовані.
Ефективність запропонованої методики лікування пацієнтів з інволютивними змінами шкіри обличчя та маласезіозом була переконливо підтверджена результатами спостережень за цими хворими протягом 1,5 року: подовження ремісії, відсутність хворих з прогресуванням маласезіозу шкіри, відсутність ускладнень від проведеної терапії.
Усе це є доказом ефективності і обґрунтованості запропонованого методу лікування пацієнтів з такою поєднаною патологією. На нашу думку запропонований метод терапії необхідно рекомендувати для впровадження в практичну охорону здоров’я.
Результати та підсумки, що викладені у даному розділі роботи, оприлюднені в таких публікаціях:
1. Макарчук А. О. Маласезіоз шкіри як ускладнювальний фактор в естетичній медицині / А. О. Макарчук // Український журнал дерматології венерології косметології. – 2014. – № 4 (55). – С. 52–56.
2. Макарчук А. О. Корекція інволютивних змін шкіри обличчя, ускладнених маласезіозом / А. О. Макарчук // Дерматовенерология. Косметология. Сексопатология. – 2014. – № 1-4. – С. 168–171.
3. Макарчук А. О. Коррекция инволютивных изменений кожи лица, осложненных малассезиозом / А. О. Макарчук // Cosmomed. – 2014. – № 4 (40). – С. 18–20.
4. Макарчук А. О. Новий терапевтичний підхід до корекції інволютивних змін шкіри обличчя ускладнених маласезійною інфекцією / А. О. Макарчук // Журнал дерматології та венерології. – 2015. – № 1 (67). – C. 63–68.
РОЗДІЛ 6
АНАЛІЗ ТА УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
Аналіз літератури, який присвячений дослідженню інволютивних змін шкіри обличчя, свідчить про наявність робіт, які по змісту досить суперечливі та різнорідні по проблемі взаємозв’язку відновлення вікових змін шкіри з різноманітною супутньо пaтологією, що потребує пошуку нових підходів до лікувальних технологій. З’ясування цих факторів відіграє важливе значення у виборі методів терапії для досягнення стійкого ефекту омолодження. У літературі зустрічаються лише поодинокі роботи вивчення особливостей клінічних проявів інволютивних змін шкіри обличчя, ускладнених маласезіозом шкіри, хоча захворюваність у світі на цей мікоз досить висока (до 85 %).
Поставили за мету підвищити ефективність лікування пацієнтів з інволютивними змінами шкіри обличчя з супутнім маласезіозом шкіри, шляхом розробки показань та комплексної диференційованої терапії з урахуванням клінічних особливостей, віку, функціональних зрушень, показників морфологічного дослідження шкіри.
Задачею нашего дослідження було визначити до і після лікування функціональні та морфологічні зміни структурних компонентів шкіри обличчя у пацієнтів з інволютивними змінами з супутнім маласезіозом, та розробити показання та методику комплексної поетапної терапії і дати оцінку її ефективності.
Під спостереженням перебувало 90 пацієнтів з інволютивними змінами шкіри обличчя у віці 33-57 років. У всіх пацієнтів старіння шкіри відбувалося за рахунок зтонщення жирової тканини та якісних змін дерми. При цьому змінюються такі характеристики шкірного покриву як колір, текстура, упругість, кількість вологи. Інволютивні зморшки, птоз шкіри та результати дряблості та атрофії м’язів представляють собою ознаку в загальній картині старіння обличчя та шиї.
Серед досліджених пацієнтів надлишок шкіри на повіках проявляється у вигляді нависаючої складки в ділянці верхніх повік.
З 90 пацієнтів з інволютивними змінами шкіри обличчя маласезіоз шкіри був встановлений у 60 пацієнтів, що обумовлені M. furfur, i проявлявся у вигляді пітіріаза волосяної частини голови, кероза Дар’є, комедонів, себорейного дерматиту.
У більшості пацієнтів була не ізольована форма маласезіозу, а комбінація декількох окремих клінічних форм. Найчастіше це була комбінація пітиріазу волосяної частини голови, чорних комедонів та керозу.
Дослідження особливостей клінічних проявів маласезіозу шкіри показали, що окремі форми маласезійної інфекції у досліджених хворих мали виражену тенденцію до локалізації на строго визначених ділянках шкіри. Частіше за все у хворих патологічний процес локлізувався на шкірі волосистої частини голови, обличчя, грудей, верхньої частини спини та плечей.
У хворих шкіри обличчя з супутнім маласезіозом, характеризувались деякими особливостями інволютивних змін шкіри:
– більш прискорений розвиток інволютивних змін шкіри, навіть у молодих осіб;
– порушення текстури шкіри у вигляді гіперкератозу;
– зміна кольору шкіри зі рахунок наявності телеангіоектазій та гіперпігментації;
– часте виявлення доброякісних утоврень (себорейного кератозу, ангіом та ін.);
– торпідність до терапії.
Групу контролю складали 30 хворих з інволютивними змінами шкіри обличчя, що не мали проявів маласезіозу шкіри.
Із функціональних показників звертали увагу на рН шкіри, ступень гідратації, вміст колагену та еластину. Найбільш виразні статистично значимі зміни було видно при дослідженні показників гідратації епідермісу. Так, встановлено достовірне зменшення цих показників у хворих з маласезійною інфекцією, порівнюючи з показниками пацієнтів без мікозу. Визначення рН шкіри, вмісту колагену та еластину не виявило статистично значимих відмінностей у жодній з досліджуваних груп.
При проведенні морфологічного аналізу інволютивних змін шкіри обличчя, були виявлено, що на початковому етапі дослідження у віковій групі 33-40 років спостерігалося істотне зниження загальної товщини гермінативної зони епідермісу як в ушкодженій інфекцією ділянці шкіри обличчя (на 34,1 %; p<0,05), так і в клінічно здорових ділянках шкіри (на 36,4 %; p<0,05).
У віковій групі 41-50 років товщина гермінативної зони епідермісу в ушкоджених ділянках шкіри не поступалася достовірно величині контрольної групи, проте у більшості спостережень відзначалися виразні явища міжклітинного набряку остистого і шипуватого шарів. Навпроти, у клінічно неушкоджених ділянках шкіри даний параметр достовірно поступався контрольному показнику (на 37,2 %; p<0,05).
Визначення чисельної щільності ядер кератиноцитів гермінативних шарів епідермісу не виявило суттєвих відмінностей клінічно неушкодженої шкіри обличчя хворих на маласезіоз від значень контрольної групи в жодній з досліджуваних вікових груп (див. табл. 4.2), проте у всіх хворих показало достовірне знижені параметри ушкоджених ділянок шкіри відносно відповідних за віком контрольних значень: у хворих віком 33-40 років – на 27,3 % (p<0,05); у хворих віком 41-50 років – на 28,2 % (p<0,05); у пацієнтів 51-57 років – на 33,7 % (p<0,05).
Морфометричне визначення зовнішнього діаметру венул підсосочкових сплетень у контрольній групі осіб виявило тенденцію до його зменшення з віком. У хворих на маласезіоз шкіри обличчя спостерігалося істотне переважання означених клітин як у клінічно здорових ділянках шкіри обличчя, так і в ушкоджених кератомікозом зонах (на 52,3-62,5 %; p<0,05). При цьому статистично вагомих відмінностей між ураженими і неураженими ділянками шкіри обличчя не спостерігалося в жодній з вікових груп, що свідчило про системний характер порушень дренажної ланки гемомікроциркуляції у хворих з маласезійною інфекцією.
У хворих на маласезіоз шкіри обличчя спостерігалося істотне звуження основи капілярних петель у клінічно здорових ділянках шкіри і в ушкоджених кератомікозом зонах у порівнянні з відповідними за віком контрольними величинами: у хворих віком 33-40 років – на 22,3 % (p<0,05); у хворих віком 41-50 років – на 24,5 % (p<0,05); у пацієнтів 51-57 років – на 21,6 % (p<0,05).
Вміст колагенових волокон дерми не розрізнявся істотно між ушкодженими і неушкодженими ділянками шкіри обличчя у хворих на маласезіоз, не відрізнявся від показників контрольної групи і не змінювався значною мірою з віком обстежуваних пацієнтів.
На відміну від колагенових волокон, еластичні волокна дерми пацієнтів значно змінювалися за відносним об’ємом у досліджуваних вікових групах. Зокрема, у пацієнтів контрольної групи віком 41-50 років вміст еластичних фібрил на 26,8 % (p<0,05) поступався показнику осіб 33-40 років, у групі пацієнтів 51-57 років – на 42,7 % (p<0,05).
За результатами дослідження гістологічних біоптатів ушкоджених ділянок шкіри, у пацієнтів з маласезіозом ділянки обличчя віком 33-40 років найбільшою мірою були виражені явища гіперкератозу за паракератозним типом (77,8 % пацієнтів) і периваскулярна інфільтрація мікросудин дерми імунокомпетентними клітинами (66,7 % пацієнтів). Меншою мірою спостерігалися спонгіоз гермінативної зони (44,4 % спостережень), лімфоцитарна інфільтрація епідермісу (38,9 %) і гіперплазія кератиноцитів (33,3 % спостережень).
Все це необхідно враховувати при призначенні комплексного лікування, яке повинно бути диференційованим в залежності від знаходження хворого в тій чи іншій встановленій групі.
Ми розробили оригінальну методику у три етапи комплексної терапії пацієнтів з інволютивними змінами шкіри обличчя та супутнім маласезіозом шкіри.
Перший етап — це боротьба з інфекцією та призначення патогенетичної терапії з метою усунення маласезіозу та деяких порушень в організмі.
Другим етапом лікування була підготовка шкіри до операції. Результатом цього етапу лікування була корекція порушень епідермального бар’єру та відновлення шкіри.
Третім етапом лікування стало проведення оперативного втручання на шкірі обличчя.
Для більш об’єктивної і достовірної оцінки результатів проведеної терапії об’єднали досліджених хворих у чотири групи. Перша група (контролю) складалась з 30 пацієнтів з інволютивними змінами шкіри обличчя, але без супутнього маласезіозу. Друга група складала 15 хворих з інволютивниим змінами шкіри обличчя, з супутнім маласезіозом. З метою порівняння етіотропна і патогенетична терапія їм не проводилась. Третя група (30 хворих), яка виділена як основна, була аналогічна другій групі за складом, однак їм проводилась розроблена етіотропна (антимікотична) і патогенетична терапія, призначався другий етап терапії (підготовка до операції). Препарати на першому етапі призначалися диференційовано, в залежності від виділених груп, використовуючи етіотропні і патогенетичні засоби. Для проведення терапії проводився ретельний збір анамнезу, виявлення провокуючих факторів, всебічне обстеження хворих у виділених групах. Вибір препаратів і методів ґрунтувався на необхідності впливати на всі особливості перебігу маласезіозу: етіотропні (антимікотики), гепатопротектори, вітаміни, мембранностабілізуючи та антиоксиданти.
Хворим усіх груп на першому етапі лікування була рекомендована терапія медикаментозна. Так, з метою антиоксидантної дії призначався Аєвіт по 1 капс. 2 рази на добу, Медобіотин по 1 т на добу та аскорбінова кислота до 2.0г на добу протягом місяця.
Хворим четвертої (основної) групи додатково рекомендували розроблену комплексну терапію. Так, пацієнтам рекомендували прийом ітраконазола, тіотриазоліна та урсофалька.
Ітраконазол призналали по 1 капсулі 2 рази на день на протязі місяця.
Також хворим як гепатопротектор та з метою імуномодуляції рекомендували прийом тіотриозоліну. Призначали його по 20 мл 2,5 % розчину внутрішньом’язово протягом 10 днів, а потім по 1 т. 2 рази на добу 20 днів.
Як гепатопротектор призначали урсофальк за традиційною схемою (по 500 мг/добу) ввечері протягом 30 днів.
Зовнішня терапія полягала у втиранні 1 % пасти “Сульсена” у вологу шкіру волосистої частини голови, обличчя, шиї на 10 годин, а потім змивали водою з милом. Перші 7 днів щодня, потім через день, а надалі 2 рази на тиждень.
Другий етап лікування (підготовка шкіри до операції) включав в себе очищення шкіри, скрабування, контроль сальної залози. Корекція та стимуляція забезпечували відновлення епідермісу за рахунок нанесення на шкіру специфічного наружного лікарського засобу ретинолу. Активний ретинол у комбінації з антиоксидантами та пептидами забезпечує протизапальну активність, корекцію інволютивних змін шкіри обличчя, запускає синтез негативного колагену, активує синтез гіалуронової кислоти. Результатом цього етапу лікуванням було досягнення повної клінічної ремісії маласезіозу шкіри, проведення комплексу протирецидивних засобів.
Третім етапом лікування було виконання класичного відкритого фронтліфтингу та блефаропластики верхніх повік. Операцію проводили з використанням фронтального та перітемпорального розрізів. Виконання класичного відкритого (традиційного) фронтліфтингу проводили з використанням фронтального та перітемпорального розрізів з метою корекції поперечних зморшок лоба, підняття лінії брів, часткового підтягнення шкіри верхніх повік. У залежності від індивідуальних особливостей після перетинання м’яза гордіїв тканинний лоскут натягали назад й догори, визначали і висікали його надлишки.
У лікуванні за запропонованою методикою не було зафіксовано негативного впливу препаратів на організм в цілому, а також на перебіг дерматозів.
Стосовно тривалості лікування потрібно зазначити, що проведена терапія не перевищувала терміни, рекомендовані нормативами МОЗ України.
Оцінювалася ефективність запропонованої методики комплексної терапії за допомогою порівняння подальшого перебігу та клінічних проявів дерматозу після проведеного лікування.
Ні у одного з 30 пацієнтів, пролікованих традиційно, не спостерігалося ремісії тривалістю понад 7 місяців. При цьому пацієнти, які лікувалися за запропонованою методикою, зазвичай мали ремісію тривалістю 9-12 місяців. У 30 % пацієнтів тривалість ремісії складала понад 15 місяців.
З 30 пацієнтів, які лікувалися за традиційною методикою, у 10 зареєстрована поява лущення шкіри, негнійного фолікуліту (у 7 пацієнтів) формування комедонів.
Потрібно зазначити, що у пацієнтів, які отримували лікування за запропонованою методикою, на відміну від пацієнтів, яка лікувались традиційно, не спостерігалося прогресування дерматозу та розвитку побічних явищ, терапія переносилася добре.
Ефективність запропонованої методики лікування пацієнтів з інволютивними змінами шкіри обличчя та маласезіозом була переконливо підтверджена результатами спостережень за цими хворими протягом 1,5 року: подовження ремісії, відсутність хворих з прогресуванням маласезіозу шкіри, відсутність ускладнень від проведеної терапії.
Усе це є доказом ефективності і обґрунтованості запропонованого методу лікування пацієнтів з такою поєднаною патологією.
Функціональне дослідження стану шкіри після лікування не виявило суттєвих відмінностей клінічно неушкодженої групи в жодній з досліджуваних груп.
Результатти проведеного морфологічного аналізу виявили певні тенденції вікових змін стану шкіри обличчя у пацієнтів досліджуваного контингенту, а також вплив специфічної антимікотичної терапії на структурно-функціональні особливості епітеліального, сполучнотканинного і мікроциркуляторного компонентів шкіри. Для розмежування і визначення конкретного впливу вікового фактора, а також факторів антимікотичної терапії та хірургічної корекції інволютивних змін у даних хворих був проведений однофакторний дисперсійний аналіз за кожним означеним фактором, результати якого наведені у таблиці 6.1.
Таблиця 6.1 – Вплив вікового фактора, а також факторів антимікотичної терапії та хірургічної корекції інволютивних змін на варіювання морфологічних параметрів стану шкіри (кількісна оцінка за критерієм Снедекора, %)
| Параметри | Вплив досліджуваних факторів | ||
| Віковий | Антиміко-тичної терапії | Відновлю-вальної терапії | |
| 1 | 2 | 3 | 4 |
| 1. Загальна товщина гермінативної зони епідермісу | 76,9 ** | 25,7 | 43,5 |
| 2. Чисельна щільність ядер кератиноцитів | 33,6 | 73,1 * | 22,5 |
| 3. Мітотичний індекс кератиноцитів | 14,8 | 79,4 ** | 18,8 |
| 4. Ступінь вакуолізації кератиноцитів гермінативної зони | 70,1 * | 69,5 * | 42,1 |
| 5. Відносний об’єм судин мікроциркуляторного русла сосочкового шару дерми | 84,8 ** | 20,3 | 76,9 ** |
Продовження таблиці 6.1
| 1 | 2 | 3 | 4 |
| 6. Відносний об’єм судин мікроциркуляторного русла сітчастого шару дерми | 65,2 * | 14,8 | 70,3 * |
| 7. Зовнішній діаметр артеріол підсосочкової сітки | 71,0 * | 16,4 | 72,4 * |
| 8. Зовнішній діаметр венул підсосочкових сплетень | 70,3 * | 44,7 | 83,2 ** |
| 9. Зовнішній діаметр внутрішньососочкових гемокапілярів | 82,7 ** | 30,5 | 78,0 ** |
| 10. Зовнішній діаметр гемокапілярів в основі капілярних петель | 83,4 ** | 27,2 | 80,1 ** |
| 11. Чисельна щільність фібробластів | 36,2 | 17,9 | 40,1 |
| 12. Співвідношення конденсованого і деконденсованого хроматину фібробластів | 60,3 * | 67,3 * | 70,3 * |
| 13. Відносний об’єм колагенових волокон | 40,3 | 20,4 | 33,5 |
| 14. Відносний об’єм еластичних волокон | 81,7 ** | 59,9 * | 78,1 ** |
Примітки:
1. * – статистична достовірність при рівні значущості 0,05.
2. ** – статистична достовірність при рівні значущості 0,01.
Дисперсійний аналіз впливу вікового фактора на варіювання 14 досліджуваних морфологічних параметрів встановив, що найбільшою мірою фактор хронологічного віку пацієнтів визначав зміни загальної товщини гермінативної зони епідермісу, відносного об’єму еластичних волокон дерми, а також всього комплексу морфометричних параметрів ГМЦР шкіри – відносного об’єму мікросудин обох шарів дерми і стереологічних параметрів артеріол, венул і гемокапілярів. Меншою мірою від впливу вікового фактора залежало варіювання ступеня вакуолізації кератиноцитів, а також співвідношення видів хроматину фібробластів. Значення чисельної щільності епітеліальних ядер, мітотичний індекс кератиноцитів, чисельна щільність фібробластів і відносний об’єм колагенових волокон не мали суттєвої залежності від вікового фактора.
Поряд із даними наукової літератури, наведені результати пояснюють, чому спектр патоморфологічних змін внаслідок маласезійної інфекції залежить від віку пацієнтів і внаслідок чого у хворих 33-40 років провідними порушеннями шкіри обличчя є паракератозний гіперкератоз і периваскулярна інфільтрація мікросудин дерми імунокомпетентними клітинами, у пацієнтів 41-50 років на перший план виступають епідермальний спонгіоз і лімфоцитарна інфільтрація епідермісу, і у хворих віком 51-57 років переважають ушкодження проліферації та диференціювання кератиноцитів.
Вплив антимікотичної терапії, проведеної до оперативного втручання і протягом 1 місяця післяопераційного періоду, мав інший спектр у порівнянні з впливом вікового фактора. Зокрема, найбільш виразна залежність морфологічних змін відзначалося щодо мітотичного індексу кератиноцитів, щільності їх ядер, ступеня вакуолізації кератиноцитів гермінативної зони. Варіювання відносного об’єму еластичних волокон і співвідношення конденсованого і деконденсованого хроматину фібробластів також залежало від даного фактора у статистично вагомому ступені. Вплив антимікотичної терапії на такі параметри, як загальна товщина гермінативної зони епідермісу, відносний об’єм судин мікроциркуляторного русла сосочкового і сітчастого шарів дерми, діаметри мікросудин, чисельна щільність фібробластів і відносний об’єм колагенових волокон не був істотним.
За даними дисперсійного аналізу впливу відновлювальної терапії на досліджувані морфологічні показники, найбільш виразні величини спостерігалися відносно більшості параметрів мікроциркуляторного русла сосочкового і сітчастого шарів дерми, секреторної активності фібробластів відносного об’єму еластичних волокон у складі дерми, що вказувало на відновлення інволютивних змін шкіри у хворих досліджуваного контингенту.
Наведені дані підтверджують результати морфологічного дослідження про те, що специфічна антимікотична терапія протягом 1 місяця перед пластичним втручанням в ділянці обличчя забезпечує нормалізацію структур шкіри, ушкоджених внаслідок кератомікозу, за рахунок стимуляції мітотичної активності кератиноцитів гермінативної зони та оптимізації епідермального диференціювання з обмеженням вакуолізації епітеліальних клітин. Продовження локальної та системної антимікотичної терапії впродовж 1 місяця після втручання супроводжується відновленням інволютивних морфологічних змін шкіри та попереджає розвиток рецидивів маласезіозу.
Дослідження морфологічних змін шкіри, що відбувалися протягом 1 місяця специфічної антимікотичної терапії у хворих на маласезіоз, показало суттєву терапевтичну ефективність лікування щодо провідних структурних компонентів ушкодженої шкіри. За даними електронної мікроскопії, чисельна щільність ядер кератиноцитів гермінативних шарів епідермісу перед втручанням в основній групі хворих віком 33-40 років (після 1 місяця антимікотичної терапії) зростала на 32,7 % (p<0,05) відносно значення на початку дослідження, досягаючи рівня контрольної групи пацієнтів.
У хворих на маласезіоз шкіри обличчя у старших вікових групах динаміка передопераційних і післяопераційних змін була схожою для вікової групи 33-40 років. Через 12 місяців спостережень різниця чисельної щільності ядер кератиноцитів гермінативних шарів епідермісу між основною клінічною групою і групою порівняння у хворих 41-50 років становила 24,8 % (p<0,05), у хворих 51-57 років – 35,4 % (p<0,05).
Аналіз проліферативної активності кератиноцитів виявив значний оптимізуючий вплив відновлювальних заходів у контрольній групі пацієнтів віком 33-40 років і 41-50 років, а також у хворих з маласезійною інфекцією шкіри обличчя після попередньої антимікотичної терапії. Зокрема, протягом 1 місяця передопераційного лікування маласезіозу відбувалося зростання мітотичного індексу кератиноцитів у хворих віком 33-40 років на 50,2 % (p<0,05), у пацієнтів віком 41-50 років – на 83,3 % (p<0,05), у хворих 51-57 років – на 54,5 % (p<0,05) у порівнянні з початковим станом.
Лікування і динамічне обстеження хворих досліджуваного контингенту показали, що специфічна антимікотична терапія протягом 1 місяця перед пластичним втручанням в ділянці обличчя забезпечувала нормалізацію структур шкіри, ушкоджених внаслідок кератомікозу, за рахунок стимуляції мітотичної активності кератиноцитів гермінативної зони та оптимізації епідермального диференціювання з обмеженням вакуолізації епітеліальних клітин. Продовження локальної та системної антимікотичної терапії впродовж 1 місяця після втручання супроводжувалось відновленням інволютивних морфологічних змін шкіри та попереджало розвиток рецидивів маласезіозу протягом 1 року.
У подальшому рекомендували заходи, що перешкоджають розвитку рецидивів маласезіозу: зовнішньо лосьйону з біфоназолом, ультрафіолетове опромінювання. Рекомендовано раціональне працевлаштування, усунення провокуючих факторів, дотримання дієти.
ВИСНОВКИ
У дисертації наведено теоретичне узагальнення і нове вирішення наукового і практичного завдання – підвищення ефективності лікування хворих з інволютивними змінами шкіри обличчя та супутнім маласезіозом шкіри шляхом вивчення взаємозв’язку клінічних особливостей і механізмів розвитку цих процесів та розробки алгоритмів комплексної терапії.
1. У зв’язку з широкою розповсюдженістю як серед населення України, так й в інших країнах світу, інволютивних змін шкіри обличчя, особливо при супутньому маласезіозі шкіри, недостатньо вирішеними залишаються питання патогенезу, діагностики, профілактики і терапії цих процесів, тому актуальність ретельного вивчення цієї поєднаної патології не викликає сумніву.
2. Виявлено особливості клінічних проявів і перебігу інволютивних змін шкіри обличчя із супутнім маласезіозом різних клінічних форм (пітиріаз, комедони, кероз, себорея та ін.) у 60 з 90 досліджених: більш прискорений розвиток інволютивних змін шкіри, навіть у молодих осіб; порушення текстури шкіри у вигляді гіперкератозу; зміна кольору шкіри за рахунок наявності телеангіоектазій та гіперпігментації; часте виявлення доброякісних утворень (себорейного кератозу, ангіом); торпідність до терапії. У цих хворих незалежно від віку виявлено зміни показників рН шкіри, вмісту колагену, еластину, ступеня гідратації.
3. Вивчення структурних компонентів шкіри обличчя показали, що морфологічним субстратом і предикторами розвитку маласезіозу є мікроциркуляторні ушкодження сосочкового шару дерми за рахунок звуження базальних сегментів капілярних петель на 21,6–24,5 % та розширення підсосочкових венул на 52,3–62,5 %, а також порушення гомеостазу епідермісу і структури керато-дермального з’єднання.
4. Основними патоморфологічними порушеннями внаслідок впливу маласезійної інфекції у пацієнтів з інволютивними змінами шкіри обличчя віком 33–40 років є паракератозний гіперкератоз (77,8 % пацієнтів), периваскулярна інфільтрація мікросудин дерми імунокомпетентними клітинами (66,7 %), у віці 41–50 років – епідермальний спонгіоз (85,2 %) і лімфоцитарна інфільтрація епідермісу (74,1 %), у групі віком 51–57 років – ушкодження проліферації та диференціювання кератиноцитів (86,7 %).
5. Розроблено диференційовані показання та методику комплексної поетапної підготовчої та відновлюючої терапії з урахуванням клініко-морфологічних особливостей шкіри обличчя, віку хворих, характеру маласезійної інфекції, стану поверхні та структури шкіри, з використанням на першому етапі етіотропних та патогенетичних медикаментозних препаратів, на другому етапі – засобів підготовки шкіри до оперативного втручання, на третьому етапі – пластичної операції відкритого фронтліфтингу та блефаропластики верхніх повік.
6. Ефективність запропонованої методики лікування пацієнтів з інволютивними змінами шкіри обличчя та супутнім маласезіозом підтверджено результатами спостережень за хворими протягом 1,5 років: подовження ремісії (25 %), відсутність ускладнень від проведеної терапії, позитивні зміни функціональних та морфологічних порушень шкіри.
РЕКОМЕНДАЦІЇ
1. Пацієнти, яким буде проводитися корекція інволютивних змін шкіри обличчя, повинні бути обстежені на наявність маласезійної інфекції.
2. Запропоновані у матеріалах патенту способи діагностики та лікування доцільно використовувати для підготовки шкіри перед операцією для підвищення ефективності хірургічних втручань з приводу корекції інволютивних змін шкіри обличчя.
3. Після хірургічного втручання пацієнтам, яким проводилася антимікотична терапія, у подальшому рекомендовано заходи, що перешкоджають розвитку рецидивів маласезіозу: зовнішньо лосьйону з біфоназолом, ультрафіолетове опромінювання, раціональне працевлаштування, усунення провокуючих факторів, дотримання дієти.
4. Основні положення дисертації запропоновано для використання у педагогічному процесі при викладенні таких дисциплін, як гістологія, шкірні та венеричні хвороби, хірургія.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
1. Автандилов Г. Г. Медицинская морфометрия. Руководство / Г. Г. Автандилов. – М. : Медицина, 1990. – 384 с.
2. Адаскевич В. П. Malassezia-фолликулит: клиника, диагностика, лечение / В. П. Адаскевич, В. В. Козловская // Успехи медицинской микологии. – Т. 2. – М, 2008. – С. 405-406.
3. Аллергия и грибковые болезни. Руководство для врачей / В. В. Кулага, И. М. Романенко, С. Л. Афонин, С. М. Кулага. – Луганск: Элтон, 2005. – 520 с.
4. Дрожжеподобные грибы рода Malassezia (Pityrosporum) / В. Г. Арзуманян, М. А. Мокроносова, В. Б. Гервазиева // Вестн. Рос. акад. мед. наук. – 1998. – № 5. – С. 44-47.
5. Атаман О. В. Патологічна фізіологія в запитаннях і відповідях : навчальний посібник / О. В. Атаман. – 4-те, стереотипне. – Вінниця : Нова Книга, 2010. – 512 с.
6. Бакстон П. К. Дерматология / П. К. Бакстон. – М. : Бином, 2005. – С. 118–122.
7. Белоусов В. А. Пластическая, реконструктивная и эстетическая хирургия / Белоусов В. А. – СПб : Гиппократ, 1998. – 744 с.
8. Біловол А. М. Окислювальний гомеостаз у хворих з ізольованими та поєднаними клінічними варіантами системних дерматозів / А. М. Біловол // Дерматовенерология. Косметология. Сексопатология. – 2009. – № 1-2 (12). – С. 54-60.
9. Богданова Т. В. Морфолого-физиологические характеристики дрожжевых организмов – Malassezia species / Т. В. Богданова, Н. П. Елинов // Проблемы медицинской микологии. – 2011. – Т. 13, № 1. – С. 34-41.
10. Боровиков А. М. О методах объективизации в эстетический медицине / А. М. Боровиков // Пластическая хирургия и косметология. – 2011. -№ 4. – С. 642-647.
11. Боровиков А. М. Рецензия на книгу «Блефаропластика» (ред. Р. Л. Мой и Э. Ф. Финчер) / А. М. Боровиков // Пластическая хирургия и косметология. – 2010. – № 2. С. 78-80.
12. Боровиков А. М. Третий курс российской секции ISAPS. Омолаживающая хирургия лица / А. М. Боровиков // Пластическая хирургия и косметология. – 2011. – № 2. – С. 279-284.
13. Волкославська В. М. Стан захворюваності дерматозами в Україні через 20 років після аварії на ЧАЕС / В. М. Волкославська, О. Л. Гутнєв, Н. О. Чікіна // Дерматологія та венерологія. – 2009. – № 3. – С. 67-74.
14. Волошина Н. О. Особливості клініки та перебігу вульгарних вугрів на тлі супутньої гелікобактерної інфекції гастродуоденальної локалізації / Н. О. Волошина, О. І. Денисенко, В. Я. Васюк // Украинский журнал дерматологии, венерологии, косметологии. – 2013. – № 3 (50). – С. 16-21.
15. Гольдина О. А. Мазь Пиолизин – эффективное средство для монотерапии поражений кожи / О. А. Гольдина, Ю. В. Горбачевский // Поликлиника. – 2009. – № 2. – С. 84–87.
16. Горбунцов В. Комплексная таргетная терапия МК / В. Горбунцов // Дерматовенерология. Косметология. Сексопатология. – 2009. – № 1-2 (12). – С. 5-26.
17. Горбунцов В. Маласезиоз кожи: современные принципы определения и лечения заболевания / В. Горбунцов // Практическая медицина. – 2008. – Т. XIV, № 2. – С. 127-134.
18. Грибковые заболевания кожи / Учебное пособие под ред. проф. С. И. Данилова. – СПб. : СПбГМА им. И.И. Мечникова, 2005. – 124 с.
19. Деев А. Особенности старения кожи человека. Часть 1 / А. Деев // Косметика и медицина. – 2007. – № 4. – С. 26-36.
20. Добрякова О. Б. Наш опыт комплексного “омоложения” лица / О. Б. Добрякова, Б. С. Добряков, В. С. Гулев // Анналы пластической, реконструктивной и эстетической хирургии. – 2004. – № 4. – С. 71-72.
21. Ерофеева О. В. Эффективность применения лазеротерапии в комплексной коррекции функціонального состояния индотелия сосудов у пациенток с гипоэстрогеномическим типом кожних покровов / О. В. Ерофеева // Фотобиология та фотомедицина. – 2010. – № 1, 2. – С. 54-60.
22. Ершов П. П. Этиологическая значимость дрожжевых грибов рода Malassezia при кожных заболеваниях животных: Автореф. дисс… канд. вет. наук. – М., 2008. – 20 c.
23. Зорина А. И. Аутологичные дермальные фибробласты в коррекции возрастных и рубцовых дефектов кожи / А. И. Зорина, В. Л. Зорин, В. Р. Черкасов // Эстетическая медицина. – 2011. – Т. Х, №2. – С. 173-179.
24. Зорина А. И. Дермальные фибробласты: Разнообразие фенотипов, физиологических функций, возможности терапевтического применения / А. И. Зорина, В. Л. Зорин, В. Р. Черкасов // Косметика и медицина. – 2011. – № 2. – С. 12-24.
25. Зорин В. Л. Качественная и количественная оценка состояния кожи лица после применения аутологичных дермальных фибробластов / В. Л. Зорин, А. И. Зорина, В. Р. Черкасов // Вестник эстетической медицины. – 2011. – Т. 10, № 2. – С. 16-28.
26. Калюжная Л. Д. Старение кожи: патогенетические, клинические и лечебные аспекты / Л. Д. Калюжная, В. Е. Дзюбак // Укр. мед. часопис. – 2002. – Т. 2, № 28. – С. 63-72.
27. Караумов А. В. Клиническая иммунология в дерматовенерологии и косметологии / А. В. Караумов, А. Д. Юцковский. – Владивосток : Медицина ДВ, 2013. – 202 с.
28. Карпов Е. И. Проблема «усталого лица». Особенности контурной инъекционной пластики средней трети лица / Е. И. Карпов, Е. И. Губанова // Пластическая хирургия и косметология. – 2010. – № 1. – С. 93-99.
29. Кацамбас А. Д. Европейское руководство по лечению дерматологических заболеваний : пер. с англ. / Под ред. А. Д. Кацамбаса, Т. М. Лотти. – М. : МЕДпресс-информ, 2008. – 736 с.
30. Кетлинский С. А. Цитокины / С. А. Кетлинский, А. С. Симбирцев. – СПб: Фолиант, 2008. – 552 с.
31. Корецька О. Ю. Імунний статус у хворих на вугрову хворобу, що поєднана з маласезіозом шкіри / О. Ю. Корецька // Патологія. – 2013. – № 3 (29). – С. 90–93.
32. Королькова Т. Н. Современные теории старения человека / Т. Н. Королькова // Вестник дерматологии и венерологии. – 2001. – № 5. – С. 15-18.
33. Кочан Б. Г. Современные и наиболее безопасные подходы в комбинированном лечении акне: взгляд на проблему / Б. Г. Кочан, Е. А. Верба // Украинский журнал дерматологии, венерологии, косметологии. – 2011. – № 2 (41). – С. 82-86.
34. Кубанова А. А. Стационарозамещающие технологии в оказании специализированной медицинской помощи больным дерматозами / А. А. Кубанова, А. А. Мартынов, М. М. Бутарева // Вестник дерматологии и венерологии. – 2011. – № 2. – С. 8-12.
35. Кутасевич Я. Ф. Новые возможности лечения бактериальных инфекций кожи / Я. Ф. Кутасевич, А. Н. Огурцова // Новости медицины и фармации. – 2008. – № 7. – С. 3–4.
36. Кутасевич Я. Ф. Перспективы применения новых азолов в лечении микозов / Я. Ф. Кутасевич, И. А. Маштакова, И. А. Безрученко // Український журнал дерматології, венерології, косметології. – 2009. – № 4 (35). – С. 65-68.
37. Лабінський Р. В. Використання препарату «Дифлюзол» у лікуванні мікозів різної етіології / Р. В. Лабінський, М. О. Дашко // Укр. журн. дерматол., венерол., косметол. – 2007. – № 2. – С. 44-45.
38. Лакин Г. Ф. Биометрия: Учеб. пособие для биол. спец. вузов. / Г. Ф. Лакин. – [4-е изд., перераб. и доп.]. – М. : Высшая школа, 1990. – 352 с.
39. Липофильные дрожжи рода Malassezia при атопическом дерматите / Т. В. Соколова, А. Глушакова, И. Ю. Чернов [и др.] // Успехи медицинской микологии: Пятый всероссийский конгресс по медицинской микологии, 2007, Москва: мат. конф. – М. : Национальная академия микологии, 2007. – T. 9. – C. 132.
40. Майрер М. Новейшие достижения в лечении кожных болезней: топические и системные иммуномодуляторы / М. Майрер // Российский журнал кожных и венерических болезней. – 2008. – № 4. – С. 49-54.
41. Макарчук А. О. Структурно-функціональна характеристика шкіри у різних вікових категорій жінок із супутньою патологією / А. О. Макарчук, О. І. Макарчук // Морфологія. – 2011. – № 3. – С. 54-58.
42. Макарчук А. О. Маласезіоз шкіри як ускладнювальний фактор в естетичній медицині / А. О. Макарчук // Український журнал дерматології венерології косметології. – 2014. – № 4 (55). – С. 52-56.
43. Макарчук А. О. Корекція інволютивних змін шкіри обличчя, ускладнених маласезіозом / А. О. Макарчук // Дерматовенерология. Косметология. Сексопатология. – 2014. – № 1-4. – С. 168-171.
44. Макарчук А. О. Коррекция инволютивных изменений кожи лица, осложненных малассезиозом / А. О. Макарчук // Cosmomed. – 2014. – № 4 (40). – С. 18-20.
45. Макарчук А. О. Динаміка морфологічних змін шкіри обичччя у хворих з маласезійною інфекцією на єтапах антимікротичної та омолоджувальної терапії / А. О. Макарчук // Морфологія. – 2015. – № 1. – С. 39-46.
46. Макарчук А. О. Новий терапевтичний підхід до корекції інволютивних змін шкіри обличчя ускладнених маласезійною інфекцією / А. О. Макарчук // Журнал дерматології та венерології. – 2015. – № 1 (67). – C. 63-68.
47. Макарчук А. О. Морфологічна характеристика інволютивних змін епідермісу у хворих з маласезійною інфекцією шкіри обличчя / А. О. Макарчук // Патологія. – 2015. – № 1 (33). – C. 90-94.
48. Матушевская Е. В. Иммунный статус у больных рубромикозом ногтей / Е. В. Матушевская, Е. В. Свирщевская, В. М. Лещенко // Российский журнал кожных и венерических болезней. – 2008. – № 2. – С. 43-48.
49. Модификация SMAS-пликации / О. Б. Добрякова, Б. С. Добряков, Н. Н. Ковынцев [и др.] // Пластическая хирургия и эстетическая дерматология. – 2003. № 6. – С. 267-269.
50. Новое в систематике и номенклатуре грибов / Под ред. Ю. Т. Дьяконова, Ю. В. Сергеева. – М. : Национальная академия микологии; Медицина для всех, 2003. – 496 с.
51. Новоселов А. В. Себорейный дерматит – как малассезиоз / А. В. Новоселов, А. Е. Богадельникова, В. С. Новоселов // Успехи медицинской микологии: Второй съезд микологов России, 2008, Москва: материалы в 2-х т. – М.: Национальная академия микологии, 2008. – Т. 2. – С. 442.
52. Овчинников Р. С. Грибы рода malassezia в заболеваниях живот-ных: клинические формы, диагностика / Р. С. Овчинников, М. Г. Маноян, А. Г. Гайнуллина // VetPharma. – 2013. – № 3(14). – С. 18-22.
53. Паттерсон С. Кожные болезни собак / С. Паттерсон. – М. : Аквариум, 2011. – 176 с.
54. Пасечник В. В. Просто об эндоскопической технике омоложения лица / В. В. Пасечник. – К. : ООО «Юни Мед», 2010. – 68 с.
55. Пластическая и реконструктивная хирургия лица / под ред. А. Д. Пейпла; [Пер. с англ.]. – М. : БИНОМ. Лаборатория знаний, 2007. – 951 с.
56. Пуцев А. І. Сучасні методи профілактики грибкових захворювань у спортсменів та людей, які ведуть активний спосіб життя: метод. рекомендації / А. І. Пуцев, Н. І. Лиско, З. М. Теплюк. – Київ, 2006. – 12 с.
57. Раціональна діагностика та лікування в дерматології та венерології / ред. І. І. Маврова // Довідник лікаря „Дерматолог-Венеролог”. – К. : ТОВ Доктор-Медіа, 2007. – С. 101-108.
58. Ромейс Б. Микроскопическая техника: [пер. с нем.] / Б. Ромейс. – М. : Издательство иностр. литературы, 1953. – 718 с.
59. Святенко Т. В. Дерматозы, осложненные вторичной инфекцией: акцент на наружную терапию / Т. В. Святенко, О. С. Дудник, А. А. Франкенберг // Дерматовенерология. Косметология. Сексопатология. – 2009. – № 1-2 (12). – С. 268-272.
60. Сергеев А. Ю. Грибковые инфекции. Руководство для врачей / А. Ю. Сергеев, Ю. В. Сергеев. 2-е изд. – М. , 2008. – 480 с.
61. Снедекор Д. У. Статистические методы в применении к исследованиям в сельском хозяйстве и биологии / Д. У. Снедекор; [пер. с англ.]. – М. : Мир, 1961. – 262 с.
62. Соболев А. В. Особенности иммунореактивности у больных с микогенной аллергией: научное издание / А. В. Соболев // Проблемы мед. микологии. – 2009. – Т. 11, № 2. – С. 111-112.
63. Соколова Т. В. Особенности течения и ведения больных микробной экземой, ассоциированной с кандидозом кожи и слизистых оболочек / Т. В. Соколова, М. А. Мокроносова // Рос. аллерг. журн. – 2007, № 5. – С. 63-73.
64. Тарасенко Г. Н. Современные аспекты практической микологии / Г. Н. Тарасенко // Российский журнал кожных и венерических болезней. – 2006. – №6. – С. 49–61.
65. Федотов. В. П. Грибы как осложняющий фактор некоторых дерматозов (патогенез, клинические особенности и терапия) / В. П. Федотов, В. В. Горбунцов // Дерматовенерология. Косметология. Сексопатология. – 2008. – № 1-2 (11). – С. 295-296.
66. Федотов В. П. Основные научные достижения кафедры по проблемам медицинской микологии / В. П. Федотов // Успехи медицинской микологии. – 2006. – Т.7. – С. 326.
67. Федотов В. П. Опыт применения крема Ломексин® в наружной терапии бактериальных и грибковых заболеваний кожи / В. П. Федотов // Дерматовенерология. Косметология. Сексопатология. – 2009. – № 1-2 (12). – С. 264-267.
68. Фролова Л. И. Кандидозы: симптомы, лекарственные средства, профилактика / Л. И. Фролова // Новая аптека. – 2008. – № 3. – С. 100-103.
69. Цепколенко В. А. Современная концепция коррекции старения кожи // В. А. Цепколенко // Космомед. – 2014. – № 40. – С. 6.
70. Харьков А. Л. Клиническая эффективность комбинированных ритидэктомий в эстетической хирургии и оценка их травматичности : зб. наук, праць співробітн. НМАПО ім. П.Л.Шушка / А. Л. Харьков, В. Ф. Симонов, А. Кожан. – 2007. – Т. 16, № 4. – С. 106-113.
71. Харьков А. Л. Методический подход к оценке результатов косметических операций на лице и шее / А. Л. Харьков // Харьковская хирургическая школа. – 2006. – № 2. – С. 76-79.
72. Швырев С. П. Некоторые аспекты хирургического омоложения окологлазничной области / С. П. Швырев // Анналы пластической, реконструктивной и эстетической хирургии. – 2000. – № 1. – С. 18-25.
73. Юцковский А. Д. Грибы рода Мalassezia в этиологии угревой болезни / А. Д. Юцковский, С. Н. Рахманова, Л. И. Петрова // Успехи медицинской микологии: Второй съезд микологов России, Москва: мат. конф. – М. : Национальная академия микологии, 2008. – Т. 2. – С. 472-473.
74. Яковлев А. Б. Особенности клиники поверхностных микозов в детском возрасте / А. Б. Яковлев // Практическая медицина. – 2009. – № 37. – С. 47-55.
75. A pilot study on seborrheic dermatitis using pramiconazole as a potent oral antimalassezia agent / G. E. Pierard, J. Ausma, F. Herny [et al.] // Dermatology. – 2007. – Vol. 214, № 2. – P. 162-169.
76. Atlas of Clinical Fungi / G. S. Hoog de, J. Guarro, J. Gene, M. J. Figueras. – CBS, 2009. – 458 p.
77. A laboratory-based study on patients with Parkinson’s disease and seborrheic dermatitis: the presence and density of Malassezia yeasts, their different species and enzymes production / A. Arsenijevic, D. Milobratovic, A. M. Barac [et al.] // BMC Dermatol. – 2014. – Vol. 14. – P. 14-15.
78. Analysis of differentially expressed genes associated with tryptophan-dependent pigment synthesis in M. furfur by cDNA subtraction technology / W. Hort, S. Lang, S. Brunke [et al.] // Med. Mycol. – 2009. – Vol. 47, № 3. – P. 248-258.
79. Analysis of the temporal change in biophysical parameters after fractional laser treatments using reflectance confocal microscopy / M. K. Shin, M. J. Kim, J. H. Baek [et al.] // Skin Res Technol. – 2013. – Vol. 19(1). – P. 515-520.
80. Assessing facial wrinkles: automatic detection and quantification / G. O. Cula, P. R. Bargo, A. Nkengne, N. Kollias // Skin Res Technol. – 2013. – Vol. 19(1). – P. 243-251.
81. Automated delineation of dermal-epidermal junction in reflectance confocal microscopy image stacks of human skin / S. Kurugol, K. Kose, B. Park [et al.] // J Invest Dermatol. – 2015. – Vol. 135(3). – P. 710-717.
82. Bailey S. H. Etiology, prevention, and treatment of dermal filler complications / S. H. Bailey, J. L. Cohen, J. M. Kenkel // Aesthet. Surg. J. – 2011. – Vol. 31. – P. 110-121.
83. Bergbrant I.-M. Seborrhoeic dermatitis and Pityrosporum ovale: A cultural an mmunological study / I.-M. Bergbrant, J. Faergemann // Acta Dermato-Venerol. – 1989. – Vol. 69, № l. – P. 332-335.
84. Bikowski J. Facial seborrheic dermatitis: a report on current status and therapeutic horizons / J. Bikowski // J. Drugs Dermatol. – 2009. – Vol. 8, № 2. – P. 125-133.
85. Blanco J. L. Immune response to fungal infections / J. L. Blanco, M. E. Garcia // Vet. Immunol. Immunopathol. – 2008. – Vol. 125, № 1-2. – P. 47-70.
86. Bloom B. S. Ablative fractional resurfacing in topical drug delivery: an upate and outlook / B. S. Bloom, J. A. Brauer, R. G. Geronemus // Dermatol. Surg. 2013. – Vol. 39(6). – P. 839-848.
87. Boukamp P. Skin aging: a role for telomerase and telomere dynamics? / P. Boukamp // Curr. mol. med. – 2005. – Vol. 5, № 2. – P. 171-177.
88. Carle M. V. Cosmetic facial fillers and severe vision loss / M. V. Carle, R. Roe, R. Novack // Jama Ophthalmol. – 2014. – Vol. 132. – P. 637-639.
89. Collins T. J. ImageJ for microscopy / T. J. Collins // BioTechniques. − 2007. − № 43. − P. 25-30.
90. Comparative evaluation of wrinkle treatments / M. Ooe, T. Seki, T. Miura, A. Takada // Aesthetic Plast. Surg. – 2013. – Vol. 37(2). – P. 424-433.
91. Comparison of 5-aminolevulinic acid photodynamic therapy and red light for treatment of photoaging / J. Ji, L. L. Zhang, H. L. Ding [et al.] // Photodiagnosis Photodyn. Ther. – 2014. – Vol. 11(2). – P. 118-121.
92. Comparison of the stratum corneum thickness measured in vivo with confocal Raman spectroscopy and confocal reflectance microscopy / A. Böhling, S. Bielfeldt, A. Himmelmann [et al.] // Skin Res. Technol. – 2014. – Vol. 20(1). – P. 50-57.
93. Contet-Audonneau J. L. A histological study of human wrinkle structures: comparison between sun-exposed areas of the face, with or without wrinkles, and sun-protected areas / J. L. Contet-Audonneau, C. Jeanmaire, G. Pauly // Br. J. Dermatol. – 1999. – Vol. 140, № 6. – P. 1038-1047.
94. Crespo-Erchiga V. Malassezia yeasts and pityriasis versicolor / V. Crespo-Еrchiga, V. D. Florencio // Curr. Opin. Infect. Dis. – 2006. – Vol. 19, № 2. – P. 139-147.
95. Current microscopy contributions to advances in science and technology / A. Méndez-Vilas, N. N. Rigoglio, M. V. Mendes Silva [et al.]. – Badajoz : Formatex, 2012. – 1523 p.
96. Cutaneous hypersensitivity to Malassezia sympodialis and dust mite in adult atopic dermatitis with a textile pattern / H. M. Ramirez De Knott, T. S. McCormick, K. Kalka [et al.] // Contact Dermatitis. – 2006. – Vol. 54, № 2. – P. 92-99.
97. Dae Hun Kim. Can PlateletErich plasma be used for skin rejuvenation? Evaluationg of effects of plateletErich plasma on human dermal firborlast / Dae Hun Kim, Young Jin Je, Chang Deok Kim // Ann. Dermatol. – 2011. – Vol. 23, № 4. – P. 438-442.
98. Dangoisse C. Dermo-cosmetics and prevention of skin aging / C. Dangoisse // Rev. med. brux. – 2004. – Vol. 4. – P. 365-370.
99. Difonzo E. M. Skin diseases associated with Malassezia species in humans. Clinical features and diagnostic criteria / E. M. Difonzo, E. Faggi // Parassitologia. – 2008. – Vol. 50, № 1-2. – P. 69-71.
100. Distribution of malassezia species on the scalp in korean seborrheic dermatitis patients / Y. W. Lee, H. J. Byun, B. J. Kim [et al.] // Ann. Dermatol. – 2011. – Vol. 23(2). – P. 156-161.
101 Distribution of Malassezia species on the skin of patients with atopic dermatitis, psoriasis, and healthy volunteers assessed by conventional and molecular identification methods / T. Jagielski, E. Rup, A. Ziółkowska [et al.] // BMC Dermatol. – 2014. – Vol. – P. 14-23.
102. Does skin hydration influence keratinocyte biology? In vivo evaluation of microscopic skin changes induced by moisturizers by means of reflectance confocal microscopy / M. Manfredini, G. Mazzaglia, S. Ciardo [et al.] // Skin Res Technol. – 2013. Vol. 19(3). – P. 299-307.
103. Duarte E. R. Characterization of typical and atypical Malassezia spp. from cattle and dog by random amplified polymorphic DNA analysis / E. R. Duarte, C. P. Resende, J. S. Hamdan // Arq. Inst. Bioil. – 2009. – Vol. 76, № 2. – P. 157-164.
104. Effective blue light photodynamic therapy does not affect cutaneous langerhans cell number or oxidatively damage DNA / P. Ramaswamy, J. G. Powers, J. Bhawan [et al.] // Dermatol Surg. – 2014. – Vol. 40(9). – P. 979-987.
105. Effects of Malassezia isolates on cytokines production associated with melanogenesis by keratinocytes / F. Cui, X.D. She, X. F. Li [et al.] // Zhongguo Yi Xue Ke Xue Yuan Xue Bao. – 2007. – Vol. 29, № 2. – P. 196-200.
106. Ertam I. Malassezia furfur onychomycosis in an immunosuppressed liver transplant recipient / I. Ertam, D. Aytimur, S. Alper // Indian J. Dermatol. Venereol. Leprol. – 2007. – Vol. 73, № 6. – P. 425-426.
107. Facial changes caused by smoking: a comparison between smoking and nonsmoking identical twins / H. C. Okada, B. Alleyne, K. Varghai [et al.] // Plast Reconstr. Surg. – 2013. – Vol. 132(5). – P. 1085-1092.
108. Franco D. Protocol for obtaining plateletErich plasma and thrombin for autologous use / D. Franco, T. Franco, A. M. Schettino // Aest. plast. surgery. – 2012. – Vol. 36. – P. 1254-1259.
109. Frequency of bacteria, Candida and malassezia species in balanoposthitis / M. Alsterholm, I. Flytström, R. Leifsdottir [et al.] // Acta Derm. Venereol. – 2008. – Vol. 88, № 4. – P. 331-336.
110. Forehead wrinkles: a histological and immunohistochemical evaluation / M. El-Domyati, W. Medhat, H. M. Abdel-Wahab [et al.] // J. Cosmet. Dermatol. – 2014. – Vol. 13(3). – P. 188-194.
111. Fujimura T. Investigation of the relationship between wrinkle formation and deformation of the skin using three-dimensional motion analysis / T. Fujimura // Skin Res. Technol. – 2013. – Vol. 19(1). – P. 318-324.
112. Galuppi R. Epidemiology and variability of Malassezia spp. / R. Galuppi, M. P. Tampieri // Parassitologia. – 2008. – Vol. 50, № 1-2. – P. 73-76.
113. Genotype analysis of Malassezia restricta as the major cutaneous flora in patients with atopic dermatitis and healthy subjects / T. Sugita, M. Tajima, M. Amaya [et al.] // Microbiol. Immunol. – 2004. – Vol. 48, № 10. – P. 755-759.
114. Geria A.N. Pramiconazole, a triazole compound for the treatment of fungal infections / A. N. Geria, N. S. Scheifeld // Drugs. – 2008. – Vol. 4. – P. 661-670.
115. Girardeau-Hubert S. In vivo and in vitro approaches in understanding the differences between Caucasian and African skin types: specific involvement of the papillary dermis / S. Girardeau-Hubert, H. Pageon, D. Asselineau // Int. J. Dermatol. – 2012. – Vol. 51, Suppl 1. – P. 1-4.
116. Gola R. Recent progress in facial esthetic surgery (excluding endoscopic technics) / R. Gola // Rev. stomatol. chir. maxillofac. – 1998. – Vol. 99. – P. 38-71.
117. Guillot J. The genus Malassezia: old facts and new concepts / J. Guillot, S. Hadina, E. Gueho // Parassitologia. – 2008. – Vol. 50, № 1-2. – P. 77-79.
118. Gupta A. K. Seborrheic dermatitis / A. K. Gupta, R. Bluhm // J. EADV. – 2004. – Vol. 18, № l. – P. 13-26.
119. Haake A. R. Apoptosis: a role in skin aging? / A. R. Haake, I. Roublevskaia, M. Cooklis // J. investig. dermatol. symp. proc. – 1998. – Vol. 3, № 1. – P. 28-35.
120. Haedersal M. Enhanced uptake and photoactivation of topical methyl aminolevulinate after fractional CO2 laser pretreatment / M. Haedersal, J. Katsnelson, F. H. Sakamoto // Lasers Surg. Med. – 2011. – Vol. 43. – P. 804-813.
121. Hinderer U. T. Vertical preperiosteal rejuvenation of the frame of the eyelids and midface / U. T. Hinderer // Plast. Reconstr. Surg. – 1999. – Vol. 104, № 5. – P. 1482-1499.
122. Identification of Malassezia species in the facial lesions of Chinese seborrhoeic dermatitis patients based on DNA sequencing / C. H. Lian, L. L. Shen, Q. Y. Gao [et al.] // Mycoses. – 2014. – Vol. 57(12). – P. 759-764.
123. Identification of Malassezia species in patients with seborrheic dermatitis in China // H. Zhang, Y. Ran, Z. Xie, R. Zhang // Mycopathologia. – 2013. – Vol. 175(1-2). – P. 83-89.
124. Immediate hypersensitivity to Malassezia furfur in patients with atopic dermatitis / A. R. Khosravi, M. T. Hedayati, P. Mansouri [et al.] // Mycoses. – 2007. – Vol. 50, № 4. – P. 297-301.
125. Immunoglobulin-E-mediated reactivity to self antigens: a controversial issue / S. Zeller, A. G. Glaser, M. Vilhelmsson [et al.] // Int. Arch. Allergy Immunol. – 2008. – Vol. 145, № 2. – P. 87-93.
126. Inamadar A. C. The genus Malassezia and human disease / A. C. Inamadar, A. Palit // Indian J. Dermatol. Venereol. Leprol. 2003. – Vol. 69, № 4. – P. 265-270.
127. In vivo quantification of epidermis pigmentation and dermis papilla density with reflectance confocal microscopy: variations with age and skin phototype / S. G. Lagarrigue, J. George, E. Questel [et al.] // Exp Dermatol. – 2012. – Vol. 21(4). – P. 281-286.
128. Intracutaneous ALA photodynamic therapy: dose-dependent targeting of skin structures / F. D. Sakamoto, A. G. Doukas, W. A. Farinelli [et al.] // Lasers Surg Med. – 2011. – Vol. 43(7). – P. 621-631.
129. Isolation and expression of a Malassezia globosa lipase gene, LIPI / Y. M. Angelis de, C. W. Saunders, K. R. Johnstone [et al.] // J. Invest. Dermatol. – 2007. – Vol. 127, № 9. – 2138-2146.
130. Isse N. G. Endoscopic facial rejuvenation: endoforehead, the functional lift. Case reports / N. G. Isse // Aesth. plast. surg. – 1994. – Vol. 18. – P. 462.
131. Jiang L. I. SWIRL, a clinically validated, objective, and quantitative method for facial wrinkle assessment / L. I. Jiang, T. J. Stephens, R. Goodman // Skin Res. Technol. – 2013. – Vol. 19(4). – P. 492-498.
132. Oni G. Can fractional lasers enhance transdermal absorption of topical lidocaine in an in vivo animal model? / G. Oni. S. A. Brown, J. M. Kenkel // Lasers Surg. Med. – 2012. – Vol. 44. – P. 168-174.
133. Kang S. Photoaging: pathogenesis, prevention, and treatment / S. Kang, G. J. Fisher, J. J. Voorhees // Clin. geriatr. med. – 2001. – Vol. 4. – P. 643-659.
134. Kasraie S. Interleukin IL-31 induces pro-inflammatory cytokines in human monocytes and macrophages following stimulation with staphylococcal exotoxins / S. Kasraie, M. Niebuhr, T. Werfel // Allergy. – 2010. – Vol. 65, № 6. – P. 712-721.
135. Keratitis caused by a rare fungus, Malassezia restricta / T. Suzuki, N. Hori, T. Miyake [et al.] // Jpn. J. Ophthalmol. – 2007. – Vol. 51, № 4. – P. 292-294.
136. Kim S. N. Panophthalmoplegia and vision loss after cosmetic nasal dorsum injection / S. N. Kim, D. S. Byun, J. H. Park // J. Clin. Neurosci. – 2012. – Vol. 21. – P. 678-680.
137. Kim Y. J. Bilateral blindness after filler injection / Y. J. Kim, K. S. Choi // Plast. Reconstr. Surg. – 2013. – Vol. 131. – P. 298-299.
138. Kohl E. Photodynamic therapy for photorejuvenation and non-oncologic indications: overview and update / E. Kohl, S. Karrer // G. Ital. Dermatol. Venereol. – 2011. – Vol. 146(6). – P. 473-485.
139. Immediate hypersensitivity to Malassezia furfur in patients with atopic dermatitis / A. R. Khosravi, M. T. Hedayati, P. Mansouri [et al.] // Mycoses. – 2007. – Vol. 50, № 4. – P. 297-301.
140. Lazzeri D. Blindness following cosmetic injections of the face / D. Lazzeri, T. Agostini, M. Figus // Plast. Reconst. Surg. – 2012. – Vol. 129. – P. 995-1012.
141. Lévêque J. L. Influence of skin extension upon the epidermal morphometry, an in vivo study / J. L. Lévêque, F. Fanian, P. Humbert // Skin Res. Technol. – 2014. – Vol. 20(1). – P. 58-61.
142. Luebberding S. Quantification of age-related facial wrinkles in men and women using a three-dimensional fringe projection method and validated assessment scales / S. Luebberding, N. Krueger, M. Kerscher // Dermatol. Surg. – 2014. – Vol. 40(1). – P. 22-32.
143. Makarchuk A. Rola subpopulacji fibroblastow w strukturalnej i regeneracyjnej transformacji skory / Alla Makarchuk // Academy of Aesthetic and Anti-Aging Medicine. – 2015. – № 1. – P. 8-13.
144. Malassezia folliculitis: characteristics and therapeutic response in 26 patients / A. Levy, M. Feuilhade de Chauvin, L. Dubertret [et al.] // Ann. Dermatol. Venereol. – 2007. – Vol. 134, № 11. – P. 823-828.
145. Malassezia fungal blepharitis: a case report / M. Derbel, Z. Benzina, I. Ghorbel [et al.] // J. Fr. Ophtalmol. – 2005. – Vol. 28, № 8. – P. 862-865.
146ю Malassezia furfur in infantile seborrheic dermatitis / S. Wananukul, A. Chindampom, P. Yumyoum [et al.] // Asian Рас. J. Allergy Immunol. – 2005. –Vol. 23, № 2-3. – P. 101-105.
147. Malassezia pachydermatis in dogs with external otitis from Monterrey, Mexico / O. J. Hernandez-Escare, C. Sandoval-Coronado, J. Salinas-Melandez [et al.] // African Journal of Microbiology Research. – 2013. – Vol. 6(10). – P. 2443-2448.
148. Malassezia slooffiae-associated dermatitis in a goat / F. A. Uzal, D. Paulson, A. L. Eigenheer, R. L. Walker // Vet. Dermatol. – 2007. – Vol. 18, № 5. – P. 348-352.
149. Mancini R. Nonsurgical management of upper eyelid margin asymmetry using hyaluronic acid gel filler / R. Mancini, N. M. Khadavi, R. A. Goldberg // Ophthalm. Plast. Reconstr. Surg. – 2011. – Vol. 27. – P. 1-3.
150. Marmur E. S. Ultrastructural changes seen after ALA-IPL photorejuvenation: a pilot study / E. S. Marmur, R. Phelps, D. J. Goldberg // J. Cosmet. Laser Ther. – 2005. – Vol. 7(1). – P. 21-24.
151. Massaki A. B. Repigmentation of hypopigmented scars using an erbium-doped 1,500-nm fraction-ated laser and topical bimatorost / A. B. Massaki, S. G. Fabi, R. Fitzpatrick // Dermatol. Surg. – 2012. Vol. 38(1). – P. 995-1001.
152. Microcoding and flow cytometry as a high-throughput fungal identification system for Malassezia species / M. R. Diaz, T. Boekhout, B. Theelen [et al.] // J. Med. Microbiol. – 2006. – Vol. 55, Pt. 9. – P. 1197-1209.
153. Molecular analysis of malassezia microflora on the skin of the patients with atopic dermatitis / S. M. Yim, J. Y. Kim, J. H. Ko [et al.] // Ann Dermatol. – 2010. – Vol. 22(1). – P. 41-47.
154. Molecular analysis of Malassezia species isolated from hospitalized neonates / K. Zomorodain, H. Mirhendi, B. Tarazooie [et al.] // Pediatr. Dermatol. – 2008. – Vol. 25, № 3. – P. 312-316.
155. Morphological characterization of solar lentigines by in vivo reflectance confocal microscopy: a longitudinal approach / C. Pollefliet, H. Corstjens, S. González [et al.] // Int. J. Cosmet. Sci. – 2013. – Vol. 35(2). – P. 149-155.
156. Morphological study of the relationship between solar elastosis and the development of wrinkles on the forehead and lateral canthus / K. Tsukahara, Y. Tamatsu, Y.Sugawara, K. Shimada // Arch. Dermatol. – 2012. – Vol. 148(8). – P. 913-917.
157. Nola I. Skin photodamage and lifetime photoprotection / I. Nola, L. Kotrulja // Acta dermatovenerol. croat. – 2003. – Vol. 1. – P. 32-40.
158. Park T. H. Clinical experience with hyaluronic acid-filler complications / T. H. Park, S. W. Seo, J. K. Kim // J. Plast. Reconst. Aesthet. Surg. – 2011. – Vol. 64. – P. 892-896.
159. Park S. W. Iatrogenic retinal artery occlusion caused by caused by cosmetic facial filler injections / S. W. Park, S .J. Woo, K. H. Park // Am. J. Ophthalmol. – 2012. – Vol. 154. – P. 653-662.
160. Penile shaft involvement in pityriasis versicolor / R. K. Khaddar, F. Cherif, R. Ben Hadid [et al.] // Acta Dermatovenerol. Alp. Panonica Adriat. – 2008. – Vol. 17(2). – P. 86-89.
161. Pityriacitrin – an ultraviolet – absorbing indole alkaloid by the yeast Malassezia furfur / P. Mayser, U. Schafer, H. J. Kramer [et al.] // Arch. Dermatol. Res. – 2002. – № 294. – Р.134-138.
162. Phospholipase activity after β-endorphin exposure discriminates Malassezia strains isolated from healthy and seborrhoeic dermatitis skin / Ch. Vlachos, G. Gaitanis, E. C. Alexopoulos [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2013. – Vol. 27(12). – P. 1575-1578.
163. Photodynamic therapy for skin rejuvenation: review and summary of the literature–results of a consensus conference of an expert group for aesthetic photodynamic therapy / S. Karrer, E. Kohl, K. Feise [et al.] // J. Dtsch. Dermatol. Ges. – 2013. – Vol. 11(2). – P. 137-148.
164. Photorejuvenation with topical methyl aminolevulinate and red light: a randomized, prospective, clinical, histopathologic, and morphometric study / M. C. Issa, J. Piñeiro-Maceira, M. T. Vieira [et al.] // Dermatol. Surg. – 2010. – Vol. 36(1). – P. 39-48.
165. Prevalence of Malassezia species associated with seborrheic dermatitis lesions in patients in Argentina / M. L. Sosa, F. Rojas, M. Mangiaterra, G. Giusiano // Rev. Iberoam. Micol. – 2013. – Vol. 30(4). – P. 239-242.
166. Prevalence of pityriasis versicolor in a group of Italian pregnant women / M. R. Zampino, F. Osti, M. Corazza, A. Virgili // J. EADV. – 2007. – Vol. 21, № 9. – P. 1249-1252.
167. Prohic A. Malassezia species isolated from lesionai and non-lesional skin in patients with pityriasis versicolor / A. Prohic, L. Ozegovic // Mycoses. – 2007. –Vol. 50, № l. – P. 58-63.
168. Presence, species distribution, and density of Malassezia yeast in patients with seborrhoeic dermatitis – a community-based case-control study and review of literature / A. Barac, M. Pekmezovic, D. Milobratovic [et al.] // Mycoses. – 2015. – Vol. 58(2). – P. 69-75.
169. Relationship between the echogenicity of subcutaneous tissue and the depth of forehead wrinkles / K. Tsukahara, O. Osanai, M. Hotta [et al.] // Skin. Res. Technol. – 2011. – Vol. 17(3). – P. 353-358.
170. Rukayadi Y. In vitro anti-Malassezia activity of xanthorhizol isolated from Curcuma xanthorrhiza Roxb / Y. Rukayadi, J. K. Hwang // Lett. Appl. Microbiol. – 2007. – P. 126-130.
171. Sclafani A. P. Alternative management of the aging jawline and neck / A. P. Sclafani, E. Kwak // Facial plast. surg. – 2005. – Vol. 21, № 1. – Р. 47-54.
172. Seborrhoeic dermatitis and Pityrosporum (Malassezia) folliculitis: characterization of inflammatory cells and mediators in the skin by immunohistochemistry / J. Faergemann, I. M. Bergbrant, M. Dohse [et al.] // Br. J. Dermatol. – 2001. – Vol. 144, № 3. – P. 549-556.
173. Seborrheic dermatitis flare in a Dutch male due to commensal Malassezia furfur overgrowth / Y. Ran, X. He, H. Zhang [et al.] // Med. Mycol. – 2008. – Vol. 46, № 6. – P. 611-614.
174. Sei Y. The 50 Anniversary Educational Symposium of the Japanese Society for Medical Mycology: Dermatomycoses caused by Malassezia / Y. Sei // Nippon Ishinkin Gakkai Zasshi. – 2007. – Vol. 48, № 4. – P. 177-178.
175. Sensitization to Malassezia in infants and children with atopic dermatitis: prevalence and clinical characteristics / L. Lange, N. Alter, T. Keller, E. Rietschel // Allergy. – 2008. – Vol. 63, № 4. – P. 486-487.
176. Skin aging and sex hormones in women clinical perspectives for intervention by hormone replacement therapy / P. G. Sator, J. B. Schmidt, T. Rabe, C. C. Zouboulis // Exp. dermatol. – 2004. – Vol. 13, № 14. – P. 36-40.
177. Skin aging and natural photoprotection / H. C. Wulf, J. Sandby-Moller, T. Kobayasi, R. Gniadecki // Micron. – 2004. – Vol. 3. – P. 185-191.
178. Spector J. A. Reduction mammaplasty: a improvement at any size / J. A. Spector, N. S. Karp // Plastic and Reconstructive Surgery. – 2007. – V. 120. – P. 845-850.
179. Synthesis of fluorochromes and pigments in Malassezia furfur by use of tryptophan as the single nitrogen source / P. Mayser, G. Wille, A. Imcampe [et al.] // Mycoses. – 1998. – № 41. – Р. 265-271.
180. Sugita T. The 50th Anniversary Educational Symposium of the Japanese Society for Medical Mycology: Mycological study on Malassezia / T. Sugita // Nippon Ishinkin Gakkai Zasshi. – 2007. – Vol. 48, № 4. – P. 179-182.
181. Taylor P. R. Macrophage recep tors and immunorecognition / P. R. Taylor, L. Martinez-Pomares, M. Stacey [et al.] // Ann. Rev. Immunol. – 2005. – Vol. 23. – P. 901-944.
182. Trelles M. A. Fractional carbon dioxide laser and acoustic-pressure ultrasound for transepidermal delivery of cosmeceuticals: a novel method of facial rejuvenation / M. A. Trelles, F. M. Leclere, P. A. Martinez-Carpio // Aest. Plastic surgery. – 2013. – Vol. 6. – P. 18-24.
183. The efficacy of oral treatment with pramiconazole in pityriasis versicolor / G. Faergemann, M. Borgers // Br. J. Dermatol. – 2007. – № 6. – P. 1385-1388.
184. The importance of laminin 5 in the dermal-epidermal basement membrane / T. Nishiyama, S. Amano, M. Tsunenaga [et al.] // J. Dermatol. Sci. – 2014. – Vol. 24, Suppl. 1. – P. 51-59.
185. The anatomical basis for wrinkles / J. E. Pessa, H. Nguyen, G. B. John, P. E. Scherer // Aesthet Surg J. – 2014. – Vol. 34(2). – P. 227-234.
186. The prevalence of Malassezia yeasts in patients with atopic dermatitis, seborrhoeic dermatitis and healthy controls / F. M. H. Sandstrom, L. M. Tengvall, C. Johansson [et al.] // Acta Derm. Venereol. – 2005. – Vol. 85, № 1. – P. 17-23.
187. Therapeutic and immune effects of 5-aminolevulinic acid photodynamic therapy on UVB-induced squamous cell carcinomas in hairless mice / H. Wang, J. Li, T. Lv [et al.] // Exp. Dermatol. – 2013. – Vol. 22(5). – P. 362-363.
188. The subcutaneous fat compartments in relation to aesthetically important facial folds and rhytides / M. Gierloff, C. Stöhring, T. Buder, J. Wiltfang // J. Plast. Reconstr. Aesthet. Surg. – 2012. – Vol. 65(10). – P. 1292-1297.
189. Tsepkolenko A. V. Modern concept of correction of skin aging problems / A. V. Tsepkolenko // Aest. Medicine Journal. – 2012. – Vol. 16. – P. 6-10.
190. Ultrastructural changes in photorejuvenation induced by photodynamic therapy in a photoaged mouse model / J. Y. Park, Y. H. Jang, Y. S. Kim [et al.] // Eur. J. Dermatol. – 2013. – Vol. 23(4). – P. 471-477.
191. Waibel J. S. Treatment of hypertrophic scars using laser and laser-assisted corticosteroid delivery / J. S. Waibel, A. J. Wulkan, P. R. Shumaker // Lasers Surg. Med. – 2013. – Vol. 45. – P. 135-140.
192. Wozniak M. Rola grubow Malassezia spp. w etiopatogenezie chorob skory / M. Wozniak // Mikilogia lekarska. – 2007. – T. 14, № 4. – P. 265-269.
193. Wu X. Comparison of approaches for microscopic imaging of skin lymphatic vessels / X. Wu, Z. Yu, N. Liu // Scanning. – 2012. – Vol. 34(3). – P. 174-180.
194. Yosipovitch G. Obesity and the skin: skin physiology and skin manifestations of obesity / G. Yosipovitch // J. Am. Acad. Dermatol. – 2007. – Vol. 56(6). – P. 901-916.
195. Zarei-Mahmoudabadi A. Seborrheic dermatitis due to Malassezia species in Ahvaz, Iran / A. Zarei-Mahmoudabadi, M. Zarrin, F. Mehdinezhad // Iran J. Microbiol. – 2013. – Vol. 5(3). – P. 268-271.
Додаток А
Акти впровадження














