Державна установа «Інститут дерматології та венерології
Національної академії медичних наук України»
Кваліфікаційна наукова
праця на правах рукопису
Лопандіна Анна Олександрівна
УДК 616.517-06:616.895.4]-092-085
ДИСЕРТАЦІЯ
ПАТОГЕНЕТИЧНЕ ОБГРУНТУВАННЯ КОМПЛЕКСНОГО ЛІКУВАННЯ ХВОРИХ НА ПСОРІАЗ З УРАХУВАННЯМ ФАКТОРІВ АНГІОГЕНЕЗУ ТА ОСОБЛИВОСТЕЙ ПСИХІЧНОГО СТАНУ
14.01.20 – шкірні та венеричні хвороби
Подається на здобуття наукового ступеня кандидата медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
А. О. Лопандіна
(підпис, ініціали та прізвище здобувача)
Науковий керівник: Болотна Людмила Анатоліївна, доктор медичних наук, професор
Харків – 2019
АНОТАЦІЯ
Лопандіна А. О. Патогенетичне обгрунтування комплексного лікування хворих на псоріаз з урахуванням факторів ангіогенезу та особливостей психічного стану. – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби. – Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2019.
Дисертаційна робота присвячена підвищенню ефективності лікування хворих на псоріаз шляхом розробки комплексного методу терапії на підставі вивчення факторів ангіогенезу та психічного стану хворих.
Для вирішення поставлених завдань застосовано клінічні та імуноферментні методи, опитування (анкетування), статистичні методи дослідження. Під спостереженням перебувало 114 хворих на псоріаз віком 18-65 років. В якості контрольної групи для порівняння лабораторних показників обстежено 24 практично здорових добровольців віком 22-56 років.
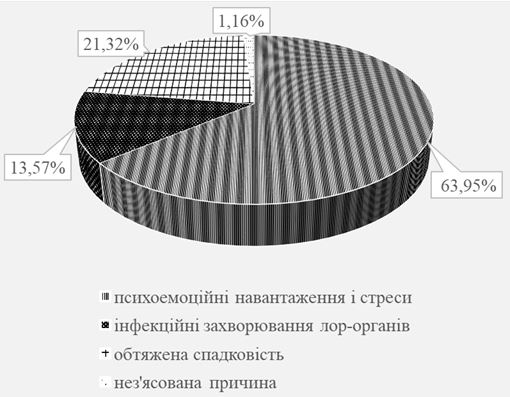
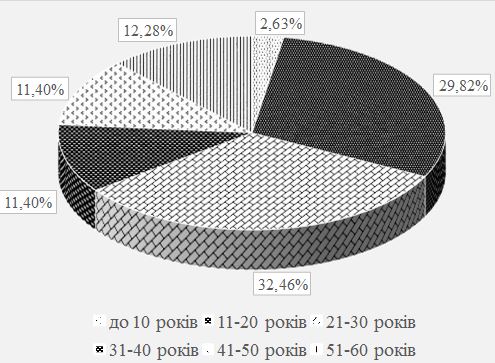
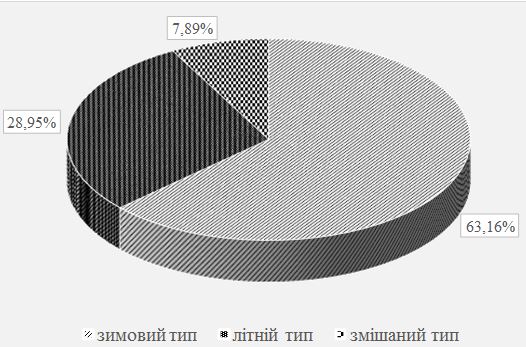
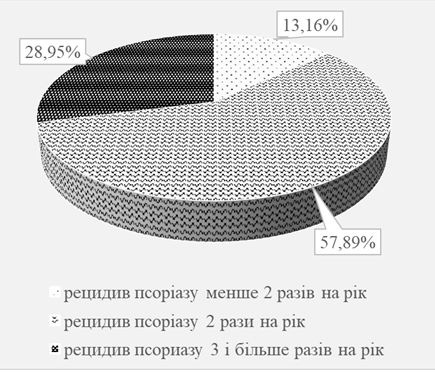
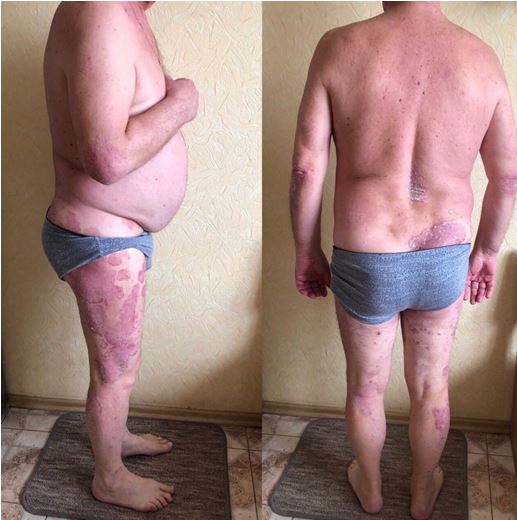
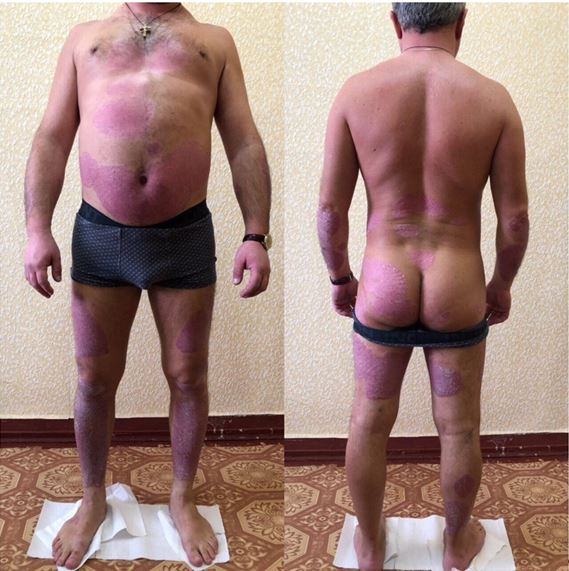
Серед хворих на псоріаз чоловіків було в 1,4 раза більше, ніж жінок. Незначно переважала кількість самотніх та розлучених осіб (56,1 %), вищу освіту мали 39,5 % пацієнтів. Найчастіше (у 62,2 % випадків) дебют захворювання визначено у віці 11-30 років, страждали на псоріаз 10 років і довше 52,6 % хворих. Серед причин загострення дерматозу 57,8 % пацієнтів відзначали психоемоційне навантаження і стреси. Звичайний псоріаз діагностовано у більшості (76,3 %) хворих, найчастіше рецидиви виникали двічі на рік (у 57,9 % випадків). Встановлено різноманітні клінічні прояви дерматозу, обумовлені локалізацією і характером висипів, тяжкістю і поширеністю процесу. Дерматоскопічна картина типової псоріатичної бляшки характеризувалася рівномірними точковими судинами на фоні еритеми, сріблястим лущенням в центрі елементу. Залежно від стадії псоріазу визначено деякі відмінності дерматоскопічної картини.
Серед коморбідних станів найчастіше зустрічалися захворювання серцево-судинної системи (39,5 %), шлунково-кишкового тракту (29,8 %). Психічні хвороби виявлено у 7,9 % хворих. Скарги на порушення уваги, настрою, підвищену тривожність, дратівливість, порушення сну та інші психоемоційні зрушення різного ступеня вираженості пред’являли 86,8 % хворих. При розладах психічного стану визначено клінічні особливості псоріазу у вигляді розповсюджених форм із ураженням відкритих частин тіла, шкіри скальпу, зовнішніх статевих органів, у стадії прогресування, з тривалим перебігом хвороби.
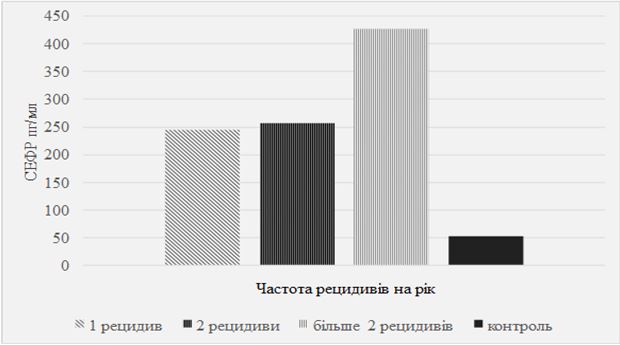
У хворих на псоріаз виявлено односпрямовані зміни факторів, що стимулюють ангіогенез – ростового проангіогенного судинного ендотеліального фактора росту (СЕФР) в 5,7 раза і цитокінів – фактора некрозу пухлини (ФНП) α (в 4,1 раза) та інтерлейкіну (ІЛ)-8 (у 1,8 раза). Відхилення цих показників залежали від клінічних проявів псоріазу з найбільш вираженим підвищенням медіаторів у хворих з важкими формами хвороби, в стадії прогресування, при рецидивах більше двох разів на рік, тривалому перебігу дерматозу. У той же час, рівень антиангіогенного фактора мелатоніну у хворих виявився зниженим (в 2,4 раза) відносного такого показника в контрольній групі, а ступінь його відхилення залежала від форми, стадії і тяжкості процесу, наявності психічної коморбідності, зокрема, порушень сну.
Вивчення психічного статусу хворих за допомогою скринінгових методик анкетування (шкала депресії Бека, оцінка суб’єктивних характеристик сну) дозволило виявити тенденцію до збільшення депресивних розладів, а також погіршення якості сну у пацієнтів з потяжчанням дерматозу, у разі рецидивів більше двох разів на рік, у пацієнтів старше 50 років. Погіршення психоемоційного стану хворих достовірно залежало від поширеності процесу і наявності висипань на відкритих ділянках тіла.
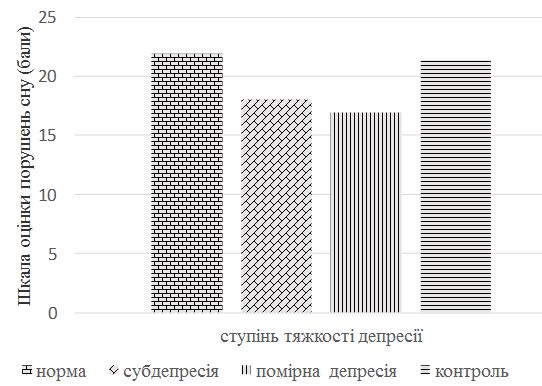
Граничні порушення сну встановлені у 53,5 % хворих, у 23,7 % були виражені відхиленнями у якості сну, у 22,8 % хворих показники відповідали нормальному сну. У пацієнтів з різними клінічними формами псоріазу виявлені зміни показників у бік погіршення якості сну при наявності важких форм (псоріатична артропатія, еритродермія). Виявлено взаємозв’язок ступеня порушення сну і вираженості депресивного стану у хворих на псоріаз.
У результаті проведених досліджень у хворих на псоріаз виявлено наявність суттєвих змін – підвищення вмісту прозапальних цитокінів, промотора неоангіогенезу СЕФР, зниження рівня протизапального і антиангіогенного фактора мелатоніну. Наявність депресивного стану (легкого ступеня у 51,8 %, помірного ступеня у 39,5 %) і порушень сну у 77,2 % хворих, дані про антиангіогенний вплив гормона епіфізу послужили підставою включення поряд із фототерапією препарату мелатонін у комплексну терапію хворих на псоріаз.
Наявні експериментальні та клінічні дані дозволяють використовувати мелатонін для корекції порушення сну, а також як адаптогена при розладах циркадіанного ритму. Спектр дії мелатоніну досить широкий: його вважають одним з найсильніших ендогенних антиоксидантів, гормон пригнічує проліферацію клітин, має протизапальну дію, здійснює антистресову дію, синхронізацію коливальних фізіологічних процесів в організмі.
Для оцінки впливу загальновизнаного (фототерапія і традиційна терапія) і розробленого методу лікування з додатковим використанням препарату мелатонін 56 хворих вульгарним псоріазом рандомізовано на дві групи, однорідні за статтю та віком, відхиленнями клінічних і лабораторних показників. Пацієнти першої групи (n=26) отримували фототерапію і традиційну терапію. Хворим другої групи (n=30) на тлі комплексної терапії додатково рекомендували мелатонін.
Мелатонін (Віта-мелатонін) призначали за 30 хвилин до сну по 1 таблетці (3 мг) на добу до відновлення фізіологічного ритму «сон-неспання» протягом 1 міс. (пат. на корисну модель № 127590 UA від 10.08.2018).
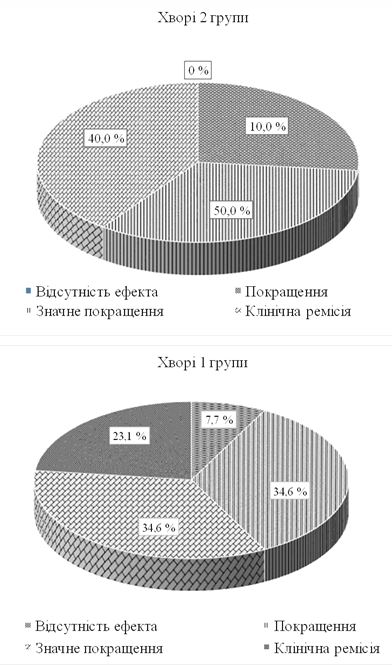
Позитивного результату (клінічна ремісія і значне поліпшення) вдалося досягти у 57,7 % пацієнтів, що отримували традиційну медикаментозну і фототерапію, і у 90,0 % хворих, в лікування яких включали мелатонін (р ˂ 0,05). При цьому клінічне вилікування настало у 23,1 % хворих 1-ї групи і 40,0 % пацієнтів 2-ї групи, значне поліпшення – відповідно у 34,6 % і 50,0 % (р ˂ 0,05). Разом з тим, поліпшення і відсутність ефекту частіше відбувалося у пацієнтів, які отримували традиційне лікування (34,6 і 10,0 %), ніж розроблене (13,3 і 0 %).
Спостереження за хворими звичайним псоріазом протягом одного року після терапії встановило рецидиви дерматозу у 18 (69,2 %) пацієнтів 1 та 10 (33,3 %) хворих 2 групи. Хворі 1 групи відзначали загострення через (172,3 ± 21,3) дня, 2 групи – через (243,5 ± 25,4) дня (р ˂ 0,05).
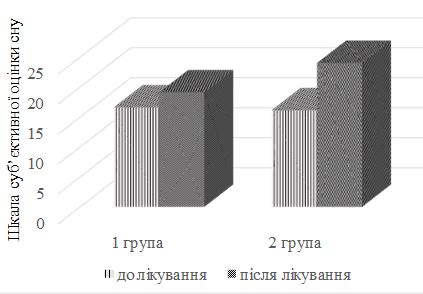
У хворих 1 групи відзначено позитивну динаміку показників під впливом фототерапії і традиційної терапії – відбувалося зменшення значення показників BSA, PASI і SAPASI після лікування відповідно в 1,9, 1,8 і 1,9 раза порівняно з таким до лікування. Включення в комплексну терапію мелатоніну дозволило отримати кращі результати – відбувалося значне зниження значення дерматологічних індексів: BSA – у 2,2 раза, PASI – у 3,0 раза і SAPASI – у 5,1 раза. Звертає на себе увагу не тільки виражене зниження BSA і PASI в 1,4 і 1,6 раза, але особливо SAPASI (в 2,7 раза) у 2 групі пацієнтів порівняно з 1 групою (р ˂ 0,05).
Чітка позитивна динаміка й інших показників під впливом терапії виявлена у хворих 2 групи – рівень СЕФР знизився в 5,2 раза, ФНП α – у 3,5 раза, ІЛ-8 – в 1,6 раза, мелатоніну збільшився в 2,2 раза щодо результатів до лікування (р < 0,05) і не відрізнявся від аналогічних параметрів у практично здорових осіб (р > 0,05). Додаткове призначення препарату мелатонін зумовило нормалізацію сну, при цьому рівень мелатоніну в крові хворих після лікування практично не відрізнявся від розрахованого у осіб контрольної групи (р > 0,05).
У хворих, які отримували традиційне лікування, також відзначена позитивна динаміка, однак повна нормалізація рівня досліджуваних лабораторних показників не відбувалася. Вміст мелатоніну та ІЛ-8 майже не змінилися (відповідно збільшилася і зменшилася в 1,2 раза, р > 0,05), при цьому рівень СЕФР і ФНП α достовірно знизилися (відповідно в 1,6 і 2,0 раза, р < 0,05).
Висока ефективність препарату, відсутність побічних явищ, доступність засобів і методів розробленого комплексу терапії обґрунтовують доцільність додаткового використання в лікуванні хворих на псоріаз препарату мелатонін, що позитивно впливає на ангіогенез, психічний статус і сон, а також дозволяють рекомендувати для впровадження в практику охорони здоров’я.
Ключові слова: псоріаз, ангіогенез, ростові фактори, цитокіни, лікування, мелатонін, ефективність.
ANNOTATION
Lopandina A.O. Pathogenetic substantiation of complex treatment of patients with psoriasis considering the factors of angiogenesis and the features of mental state. – Qualifying scientific work on the rights of the manuscript.
Thesis for a candidate degree in medical sciences in specialty 14.01.20 – dermatologic and venerologic diseases. – State Establishment “Institute of Dermatology and Venereology of National Academy of Medical Sciences of Ukraine”, Kharkiv, 2019.
The thesis is devoted to the treatment efficiency increase in patients with psoriasis by the development of the method in a complex therapy on the basis of studying the factors of angiogenesis and mental state of patients.
Clinical and immuno-enzymatic methods, questioning (questionnaires) and statistical methods of research have been used to solve the main tasks. 114 patients with psoriasis, aged 18-65 years, were under observation. 24 healthy volunteers, age range 22-56 years, served as a control group for the comparison of laboratory parameters.
Among patients with psoriasis, number of men was 1.4 times more than those of women. The number of single and divorced persons was a bit higher (56.1 %), 39.5 % of our patients had higher education. Most often (62.2 % of cases) the debut of the disease was determined at the age of 11-30 years. 52.6 % of patients suffered from psoriasis for 10 years and even longer. 57.8 % of patients noted psycho-emotional tension and stress among the causes of dermatosis exacerbation. Psoriasis vulgaris has been diagnosed in most (76.3 %) of our patients, relapses most often occur twice a year (57.9 % of the cases). Different clinical manifestations of dermatosis, caused by localization and nature of rashes, severity and prevalence of the process, have been established as well. The dermatoscopic pattern of a typical psoriatic plaque is characterized by even point vessels on the background of erythema and silver scattering in the center of the element. Some differences in the dermatoscopic pattern have been determined depending on the stage of psoriasis.
Diseases of the cardiovascular system (39.5 %) and gastrointestinal tract (29.8 %) were most common among the comorbid states. Mental diseases have been found in 7.9 % of patients. Complaints of attention and mood disorders, increased anxiety, irritability, sleep disturbances and other psycho-emotional changes of various degrees of severity have been registered in 86.8% of patients. In patients with mental disorders clinical features of psoriasis have been revealed in the form of widespread stages with lesions on the open parts of the body, the skin of the scalp, external genitalia, in the stage of development, and with a prolonged course of the disease.
Unidirectional changes have been revealed in patients with psoriasis in the factors that stimulate angiogenesis – proangiogenic vascular endothelial growth factor (VEGF) by 5.7 times, cytokines – tumor necrosis factor (TNF) α by 4.1 times, and interleukin (IL-8) by 1.8 times. Deviations of the findings depend on the clinical manifestations of psoriasis with the most pronounced increase in mediators in patients with severe forms of the disease, in the stage of development, with relapses more than twice a year, and a prolonged course of dermatosis. At the same time, the level of antiangiogenic factor of melatonin in patients has reduced (by 2.4 times) in regard to the same value in the control group. The degree of its deviation depends on the form, stage and severity of the process, the presence of mental comorbidity, sleep disturbances being among their number.
The study of the mental status of patients by the screening questionnaire techniques (Beck depression scale, assessment of the subjective sleep characters) has revealed a tendency to an increase in depressive disorders, as well as deterioration of sleep quality in patients with an aggravated dermatosis, in case of relapses more often than twice a year, and in patients over 50 years. The deterioration of the psycho-emotional state of patients depends significantly on the prevalence of the process and the presence of rashes on the open areas of the body.
Sleep boundary disorders have been registered in 53.5 % of patients: 23.7 % have deviations in sleep quality, and 22.8 % of patients have normal sleep characters. Changes in the characters related with deterioration of sleep quality in the presence of severe forms of the disease (psoriatic arthropathy and erythrodermia) have been found in patients with various clinical forms of psoriasis. The relationship between the degree of sleep disturbances and the severity of depression in patients with psoriasis has also been revealed.
Significant changes have been revealed in patients with psoriasis after our studies: an increase in the content of proinflammatory cytokines and in the promotor of neoangiogenesis of the VEGF, and reduction in the levels of anti-inflammatory and antiangiogenic factors of melatonin. The presence of a depressive state (of a mild degree in 51.8 % and a moderate degree in 39.5 % of patients) and sleep disorders in 77.2 % of patients, as well as the data on the antiangiogenic effects of the epiphysial hormone, serve as the basis for the inclusion of melatonin, together with phototherapy, into the complex therapy of patients with psoriasis.
The available experimental and clinical data make it possible to use melatonin as a corrector of sleep disturbances, as well as an adaptogen in the circadian rhythm disorders. The spectrum of melatonin action is of a broad scale: it is considered one of the strongest endogenous antioxidants, the hormone inhibits cell proliferation, has anti-inflammatory and anti-stress action, synchronizes the oscillatory physiological processes in the organism.
For the estimation of the effect of the generally recognized (phototherapy and traditional therapy) methods and the proposed worked out method of treatment with melatonin as a supplement, 56 patients with psoriasis vulgaris were randomized into two groups, similar according to the gender and age, as well as to deviations in the clinical and laboratory findings. Patients in group I (n = 26) received phototherapy and traditional therapy. Patients of group II (n = 30) were recommended to take melatonin as a supplement on the background of complex therapy.
Melatonin (Vita-melatonin) recommended dosage was 1 tablet (3 mg) per day 30 minutes before bedtime for one month, till the regulation of the physiological sleep-wakefulness cycle (the patent for the utility model No. 127590 UA).
Clinical recovery has been observed in 23.1 % of patients in group I and in 40.0 % in group II, a significant improvement has been registered in 34.6 % and 50.0 % of patients respectively (p ˂ 0.05). However, improvement and lack of effect are more characteristic of patients receiving traditional treatment (34.6 % and 10.0 %), in comparison with patients, who receive the prescribed therapy (13.3 % and 0 %). More demonstrative are the signs of clinical remission and significant improvement in patients with melatonin, included in their treatment (90.0 %), than just the traditional medication or phototherapy (57.7 %, p ˂ 0.05).
Observation of patients with common psoriasis within one year after therapy has found recurrence of dermatosis in 18 patients (69.2 %) in group I and in 10 patients (33.3 %) in group II. Patients in group I noted exacerbations after 172.3 ± 21.3 days, and in group II 243.5 ± 25.4 days (p ˂ 0.05) after the treatment.
Positive dynamics of the findings under the influence of phototherapy and traditional therapy has been established in patients of group I: a decrease in the BSA, PASI and SAPASI indices by 1.9, 1.8 and 1.9 times, respectively, after the treatment, as compared with these before treatment. Inclusion of melatonin into the complex therapy allows to get better results: a significant decrease takes place in the value of dermatological indices – BSA by 2.2 times, PASI by 3.0 times, and SAPASI by 5.1 times. Attention is drawn not only to the pronounced reduction of BSA and PASI by 1.4 and 1.6 times, but especially of SAPASI ( by 2.7 times) in group II of patients, in comparison with group 1 (p < 0,05).
A distinct positive dynamics of some other findings under the influence of therapy has been found in patients in group II: the levels of VEGF decreased by 5.2 times, TNF α – 3.5 times, and IL-8 – 1.6 times, regarding the results before treatment (p < 0,05). They did not differ from the similar parameters in the practically healthy persons (p > 0,05). Melatonin used as a supplement resulted in normalization of sleep, while its level in the blood of patients after treatment did not differ practically from the level, calculated in the patients of the control group (p > 0,05).
Positive dynamics has also been registered in patients after traditional therapy, but complete normalization of the laboratory parameters level has not occurred. Melatonin and IL-8 levels remained almost unchanged (increased or decreased by 1.2 times, respectively, p > 0.05), while the levels of VEGF and TNF-α decreased significantly (by 1.6 and 2.0 times, respectively, p < 0.05).
A high efficiency of the prescribed medicine, the absence of side effects, the accessibility of the means and methods of the developed therapy complex justify the expediency of melatonin intake as a supplement in the treatment of patients with psoriasis. Melatonin positively affects the angiogenesis, mental status and sleep, and is also recommended for introduction in the practice of health care.
Key words: psoriasis, angiogenesis, growth factors, cytokines, treatment, melatonin, efficiency.
Список публікацій здобувача за темою дисертації
- Лопандина А. А. Псориаз и психоэмоциональные расстройства. Дерматологія та венерологія. 2016. № 4 (74). С. 11–19.
- Болотная Л. А., Сариан Е. И., Лопандина А. А. Патогенетическое значение сосудистого эндотелиального фактора роста при псориазе. ScienceRise, Медичні науки. 2016. № 2/3 (19). С. 4–8. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено узагальнення результатів).
- Лопандина А. А., Болотная Л. А. Клиническое значение провоспалительных иммунных медиаторов при псориазе. Дерматологія та венерологія. 2018. № 3 (81). С. 13–16.
- Лопандина А. А. Показатели мелатонина и сосудистого эндотелиального фактора роста (VEGF) у больных псориазом с нарушением сна. Международный медицинский журнал. 2018. Т. 24. № 4 (96). С. 81–84.
- Лопандина А. А. Использование мелатонина в комплексном лечении псориаза. Дерматологія та венерологія. 2018. № 4 (81). С. 27–30.
- Болотная Л. А., Сариан Е. И., Лопандина А. А., Сидельник В. М. Кардиоваскулярный риск при иммуноопосредованных дерматозах. Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции : материалы научн. конф., посвященной 155-летию со дня рождения проф. М. В. Типцева, 18 ноября 2015 г. Харьков, 2015. С. 12–18. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено узагальнення результатів).
- Пат. на корисну модель № 127590 UA: МПК А61 К 31/00. Спосіб лікування хворих на псоріаз / Л. А. Болотна, Г. О. Лопандіна, Я. Ф. Кутасевич, О. І. Саріан. № u 2018 02708; заявл. 19.03.2018; опубл. 10.08.2018; Бюл. № 15.
- Лопандина А. А. Особенности ангиогенеза у больных псориазом. Инновационные технологии в дерматовенерологии. Междисциплинарные связи : материалы научн.-практ. конф. с участием международн. специалистов, 13-14 ноября 2015 г. Харьков, 2015. Дерматологія та венерологія. 2015. № 3 (69). С. 82.
- Лопандина А. А. Изменение психоэмоциональных показателей у больных псориазом. Медицина ХХI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 26 листопада 2015 р. Харків, 2015. С. 45.
- Саріан О. І., Лопандіна А. О. Особливості псоріазу з ураженням кистей і стоп. Новітні тенденції лікування та профілактики дерматовенерологічних проблем в рамках доказової медицини : матеріали наук.-практ. конф.,13-15 квітня 2016 р. Львів, 2016. С. 96-97. (Дисертантом проведено обстеження хворих на псоріаз).
- Сариан Е. И., Лопандина А.А. Психоэмоциональные расстройства у больных псориазом. Медицина ХХI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 24 листопада 2016 р. Харків, 2016. С. 94–95. (Дисертантом проаналізовано порушення психоемоційного стану хворих).
- Сариан Е. И., Лопандина А. А. Уровень глюкозы крови и гликированного гемоглобина у больных псориазом : матер. наук.-прак. конф. «Місце дерматовенерології в міждисциплінарному вирішенні питань діагностики та лікування хронічних захворювань», 20-21 березня 2017 р. Київ, 2017. Дерматовенерологія. Косметологія і Сексопатологія. 2017. № 1-2 (5). С. 116. (Дисертантом проведено обробку лабораторних параметрів).
- Лопандина А. А. Нарушения сна у больных псориазом. Святогірські дерматовенерологічні дні: новітні методи діагностики і лікування в дерматовенерології та косметології : матеріали Всеукр. конф. за участю міжнар. спеціалістів, 25-26 травня 2017 р. Святогір’я, 2017. Журн. дерматовенерології та косметології ім. М. О. Торсуєва. 2017. № 1 (37). С. 73.
- Лопандина А. А. Уровень провоспалительных цитокинов у больных вульгарным псориазом. Дерматовенерологія в розробках молодих науковців : матеріали наук.-практ. школи, 16-17 листопада 2017 р. Київ, 2017. Клінічна імунологія. Алергологія. Інфектологія. 2017. № 6 (103). С. 57.
- Лопандина А. А. Нарушения сна и уровень мелатонина у больных псориазом. Медицина ХIХ століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 23 листопада 2017 р. Харків, 2017. С. 55-56.
- Lopandina A. Change of psychosomatic status in patiens with psoriasis : Аbstract 13th Spring Symposium of European Academy of Dermatology and Venereology, 19-22 May 2016. Athens, 2016. Abstract code P0737.
ЗМІСТ
| Перелік умовних позначень | 15 |
| Вступ | 16 |
| Розділ 1 Огляд літератури | 22 |
| 1.1. Сучасне уявлення про етіологію та патогенез псоріазу | 22 |
| 1.2 Ангіогенез та імунне запалення у механізмі розвитку псоріазу | 25 |
| 1.3 Депресія як коморбідність у хворих на псоріаз | 33 |
| 1.4 Принципи і методи лікування псоріазу | 37 |
| Розділ 2 Матеріали та методи дослідження | 42 |
| 2.1 Методика загального обстеження хворих | 43 |
| 2.2 Методи анкетування | 48 |
| 2.3 Імуноферментні дослідження | 49 |
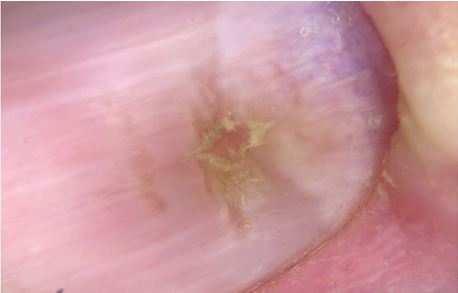
| 2.4 Дерматоскопічне дослідження | 50 |
| 2.5 Статистичні методи дослідження | 51 |
| Розділ 3 Клінічна характеристика хворих на псоріаз | 52 |
| Розділ 4 Стан ангіогенезу у хворих на псоріаз | 73 |
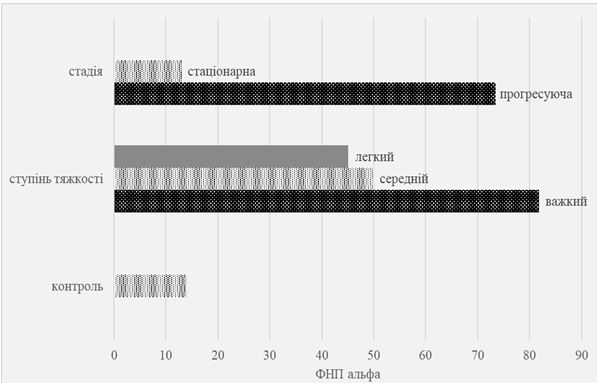
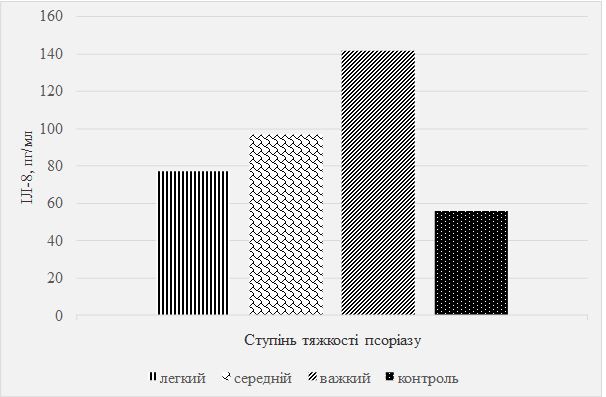
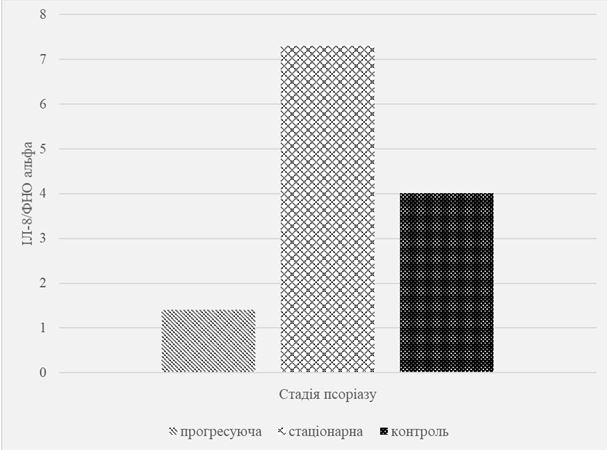
| 4.1 Характеристика проангіогенних факторів (судинного ендотеліального фактора росту, фактора некрозу пухлини α, інтерлейкіну-8) у хворих на псоріаз | 73 |
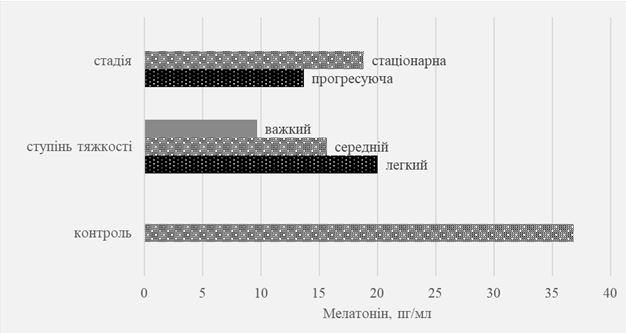
| 4.2 Рівень мелатоніну у хворих на псоріаз | 83 |
| Розділ 5 Депресивні розлади та особливості порушень сну у хворих на псоріаз | 88 |
| 5.1 Оцінка ступеня вираженості депресивної симптоматики у хворих на псоріаз | 88 |
| 5.2 Оцінка порушень сну у хворих на псоріаз | 92 |
| Розділ 6 Лікування хворих на псоріаз | 98 |
| 6.1 Обґрунтування використання у хворих на псоріаз методів та засобів, що коригують ангіогенез та порушення сну | 98 |
| 6.2 Клініко-лабораторні результати лікування хворих на звичайний псоріаз | 101 |
| Розділ 7 Аналіз та узагальнення результатів дослідження | 110 |
| Висновки | 122 |
| Рекомендації | 124 |
| Список використаних джерел | 125 |
| Додаток А Акти впровадження | 149 |
| Додаток Б Список публікацій здобувача за темою дисертації та відомості про апробацію результатів дослідження | 154 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
АП – активаторний протеїн
АФК – активні форми кисню
ГГНС – гіпоталамо-гіпофізарно-наднирникова система
ІЛ – інтерлейкін
ІФА – імуноферментний аналіз
КРГ – кортикотропін-рилізинг гормон
ММП – матриксна металопротеїназа
МС – метаболічний синдром
СЕФР – судинний ендотеліальний фактор росту
СЕФРР – судинного ендотеліального фактора росту рецептор
СНС – симпатична нервова система
С-РБ – С-реактивний білок
СХС – суб’єктивні характеристики сну
ТГКС – топічні глюкокортикостероїди
ТФР – трансформуючий фактор росту
Тх1 – Т-хелпери 1 типу
Тх17 – Т-хелпери 17 типу
УФО – ультрафіолетове опромінення
ФНП – фактор некрозу пухлини
BSA – Body Surface Area
HIF-1α – фактор 1α, що індукує гіпоксію
HLA – Human Leukocyte Antigens
PASI – Psoriasis Area and Severity Index
SAPASI – Self-Administered Psoriasis Area Severity Index
ВСТУП
Актуальність теми. Псоріаз – хронічний імуноопосередкований дерматоз багатофакторної природи з домінуючим значенням у розвитку генетичних факторів [1, 12, 23, 97, 169, 223]. Зростання захворюваності, особливо у молодому та середньому віці, рецидивуючий перебіг, нерідке залучення до процесу різних органів і систем організму, розвиток стійкості до традиційної терапії, пониження якості життя хворих визначають не тільки серйозну медичну, а й соціальну актуальність проблеми [14, 70, 122, 147]. Незважаючи на досягнуті успіхи у вивченні псоріазу, причини і патогенез залишаються багато в чому нез’ясованими, а методи лікування – недосконалими.
Порушення процесів проліферації та диференціювання кератиноцитів розглядається як наслідок надмірної продукції цитокінів, хемокінів і факторів росту активованими клітинами вродженого і набутого імунітету [10, 40, 69, 83, 231]. Гіперактивний стан клітинної ланки імунітету в каскаді взаємодій між клітинами запального інфільтрату, кровоносними судинами і кератиноцитами є ключовим моментом імунопатогенезу псоріазу, що обумовлює розвиток клінічних проявів захворювання [13, 63, 104, 207, 217].
Дослідження останніх років довели, що одним із найважливіших факторів патогенезу, пов’язаним із формуванням головного морфологічного субстрату захворювання, є надмірне зростання нових мікросудин дерми чи синовіальної оболонки [75, 213, 235], імовірно, обумовлене дисбалансом між стимуляторами та інгібіторами ангіогенезу, які подібно гормонам мають широкий спектр біологічного впливу на клітини. Кількість досліджень стану ангіогенезу при псоріазі невелика [20, 68, 86, 148].
Численні дослідження демонструють участь медіаторів запалення – фактора некрозу пухлини (ФНП) α, інтерлейкінів (ІЛ) -1, -6, -17, -23 як у патогенезі псоріазу, так і коморбідності (серцево-судинних захворювань, ожиріння, цукрового діабету, хвороби Крона тощо) [78, 91, 102, 169, 208]. Близько 80 % хворих на псоріаз вказують на негативний вплив хвороби на якість життя (психоемоційні стреси, тривога і низька самооцінка, поганий настрій, порушення сну, незадоволеність і розчарування результатами лікування). Нині представляє інтерес вивчення психічних особливостей пацієнтів, що можуть сприяти прогресуванню і хронізації захворювання.
Лікування псоріазу, незважаючи на широкий вибір зовнішніх і системних засобів, появу нових сучасних методів, залишається складною задачею, яка вимагає персоніфікованого і, у разі виявлення коморбідності – мультидисциплінарного підходу [51, 214].
Подальше вивчення ангіогенезу і психопатологічних порушень при різних формах псоріазу допоможе уточнити механізми розвитку захворювання і виявити нові мішені патогенетичної терапії.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота є фрагментом науково-дослідної роботи ДУ «Інститут дерматології та венерології НАМН України» на тему: «Вивчити клініко-біохімічні та імунологічні аспекти тяжких форм псоріазу та розробити комплексні методи лікування» (номер держреєстрації 0115U000579), в якій дисертантом проаналізовані особливості порушень ангіогенезу у хворих на різні клінічні форми, проведено аналіз психічного стану хворих, а також розроблено метод лікування хворих на звичайний псоріаз.
Мета та задачі дослідження. Мета: підвищення ефективності лікування хворих на псоріаз шляхом розробки патогенетично обгрунтованого методу терапії на підставі вивчення факторів ангіогенезу та психічного стану.
Для досягнення поставленої мети дослідження визначено задачі:
- Вивчити клініко-анамнестичні дані та соціодемографічні показники у хворих на псоріаз.
- Дослідити вміст судинного ендотеліального фактора росту (СЕФР), ФНП α, ІЛ-8 у крові хворих на псоріаз до і після лікування.
- Визначити рівень мелатоніну в крові пацієнтів із псоріазом у динаміці спостереження.
- Встановити деякі особливості психічного стану пацієнтів із псоріазом.
- Розробити комплексний метод лікування хворих на звичайний псоріаз.
- Проаналізувати ефективність комплексного методу терапії хворих на звичайний псоріаз.
Об’єкт дослідження: псоріаз.
Предмет дослідження: клінічні прояви, ангіогенез, психічний стан, терапія, ефективність.
Методи дослідження: клінічні – аналіз скарг, анамнезу життя і хвороби, об’єктивного статусу, визначення дерматологічних індексів – Psoriasis Area and Severity Index (PASI), Body Surface Area (BSA); імуноферментні – дослідження рівня СЕФР, ФНП α, ІЛ-8 та мелатоніну у крові; методи анкетування – визначення хворим площі і ступеня тяжкості псоріазу (SAPASI – Self-Administered Psoriasis Area Severity Index), рівня депресії за шкалою депресії Бека, якості сну – за бальною оцінкою суб’єктивних характеристик сну (СХС); інструментальні – дерматоскопія; статистичні – параметричні і непараметричні методи обробки даних.
Наукова новизна отриманих результатів. Вперше встановлено патогенетичне значення дисбалансу ангіогенезу при псоріазі за рахунок суттєвого збільшення у крові рівня стимулюючих факторів (СЕФР, ФНП α та ІЛ-8) та зниження вмісту пригнічуючого фактора мелатоніну. Виявлено особливості ангіогенезу залежно від форми псоріазу. Підтверджено важливу роль ангіогенезу у механізмі розвитку псоріазу.
Встановлено, що вміст ФНП α залежить від стадійності і тяжкості процесу, ІЛ-8 – клінічної форми і тяжкості псоріазу.
Вперше встановлено роль мелатоніну як фактора ангіогенезу та доведено його значення у розвитку депресивного синдрому при псоріазі.
Виявлено особливості психічного стану хворих на псоріаз у вигляді депресивних синдромів переважно слабкого і помірного ступеня тяжкості (відповідно у 51,8 і 39,5 % випадків). Підтверджено коморбідність псоріазу з порушеннями психічного стану хворих.
Визначено у 77,2 % хворих на псоріаз диссомнічні розлади у вигляді почастішання нічних пробуджень, сонливості в денний час і раннього ранкового пробудження, нічного апное.
Науково обгрунтовано комплексний метод лікування хворих на звичайний псоріаз з додатковим призначенням на фоні комплексної загальновизнаної терапії (в тому числі фототерапії) мелатоніну. Визначено вплив комплексного і розробленого методів терапії на клінічний перебіг, рівень медіаторів ангіогенезу та мелатоніну, психічний стан хворих.
Практичне значення одержаних результатів. Розроблено і впроваджено в практичну охорону здоров’я спосіб лікування хворих на звичайний псоріаз, який дозволяє нормалізувати більшість клініко-лабораторних показників, що забезпечує підвищення ефективності лікування (пат. на корисну модель № 127590 UA від 19.03.2018).
Визначено вплив комплексного і розробленого методів терапії на клінічний перебіг, рівень медіаторів ангіогенезу та мелатоніну, психічний стан хворих.
Запропоновано використовувати рівень прозапальних медіаторів (ФНО α, ІЛ-8) у якості об’єктивного критерію тяжкості псоріазу та псоріатичного артриту.
Враховуючи вплив депресії на клінічний перебіг та зв’язок депресивних розладів з соціодемографічними показниками, показано необхідність проведення скринінгу депресивних порушень у хворих (оцінку наявності депресивних розладів).
Спосіб лікування мелатоніном впроваджено в лікувальну практику ДУ «Інститут дерматології та венерології НАМН України», КНП «Обласний клінічний шкірно-венерологічний диспансер № 1» Харківської обласної ради, КП «Обласний шкірно-венерологічний клінічний диспансер» Дніпровської обласної ради, КНП «Міський шкірно-венерологічний диспансер № 4» Харківської міської ради, а також у навчальний процес кафедри дерматовенерології Харківської медичної академії післядипломної освіти МОЗ України.
Особистий внесок здобувача. Дисертаційна робота є науковою працею, виконаною автором. Здобувачем проведено аналіз літератури за темою дисертаційної роботи, сформульовано мету і задачі роботи. Самостійно проведено клінічне обстеження, лабораторні дослідження та лікування хворих на псоріаз. Самостійно проведено статистичну обробку та узагальнення отриманих результатів, написано всі розділи дисертації, сформульовано висновки та практичні рекомендації.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, у роботі використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Конфлікту інтересів немає.
Апробація результатів роботи. Основні положення роботи викладено та обговорено на науково-практичній конференції з участю міждународних спеціалістів «Инновационные технологии в дерматовенерологии. Междисциплинарные связи» (Харків, 13-14 листопада 2015 р.), науково-практичній конференції молодих вчених з міжнародною участю «Медицина ХIХ століття» (Харків, 26 листопада 2015 р.), науково-практичній конференції «Новітні тенденції лікування та профілактики дерматовенерологічних проблем в рамках доказової медицини» (Львів, 13-15 квітня 2016 р.), науково-практичній конференції молодих вчених з міжнародною участю «Медицина ХIХ століття» (Харків, 24 листопада 2016 р.), 13-му Весняному симпозіумі Європейської академії дерматології та венерології (Афіни, 19-22 травня 2016 р.), Всеукраїнській конференції за участю міжнародних спеціалістів «Святогірські дерматовенерологічні дні: новітні методи діагностики і лікування в дерматовенерології та косметології» (Святогір’я, 25-26 травня 2017 р.), науково-практичній школі «Дерматовенерологія в розробках молодих науковців» (Київ, 16-17 листопада 2017 р.), науково-практичній конференції молодих вчених з міжнародною участю «Медицина ХIХ століття» (Харків, 23 листопада 2017 р.).
Структура та обсяг дисертації. Дисертаційна робота викладена на 157 сторінках машинописного тексту, складається зі вступу, огляду літератури, опису матеріалів та методів дослідження, 4 розділів власних досліджень, аналізу та узагальнення результатів, висновків, рекомендацій, списку використаної літератури та 2 додатків. Обсяг основного тексту дисертації складає 124 сторінки друкованого тексту. Бібліографічний список містить 240 джерел, з них 106 кирилицею та 134 латиницею. Роботу ілюстровано 28 таблицями, 23 рисунками.
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУР
1.1 Сучасне уявлення про етіологію та патогенез псоріазу
Відповідно до сучасних уявлень, псоріаз є хронічним мультифакторіальним дерматозом, що проявляється гіперпроліферацією епідермісу, порушенням кератинізації й запаленням дерми із розвитком еритематозно-сквамозного висипу і, нерідко, екстракутанними патологічними змінами інших органів і систем [14, 71, 72, 125, 198, 235] Метаболічні порушення, ураження серцево-судинної й опорно-рухової систем, шлунково-кишкового тракту, психоемоційні відхилення дають можливість сучасним дерматологам-клініцистам визначати захворювання як «псоріатичну хворобу». Значна поширеність псоріазу, хронічний та нерідко важкий перебіг, відсутність ясності етіології та багатьох аспектів патогенезу, недосконалість методів лікування і профілактики рецидивів дозволяють враховувати проблему важкою та соціально значущою [6, 82, 149, 192].
У загальній структурі хронічної патології шкіри й підшкірної жирової клітковини дерматоз складає від 15 до 30 %. Згідно дослідженням Міжнародної федерації ассоціації псоріазу (2010), дерматозом хворіє приблизно 125 млн. осіб, що складає приблизно 2,2 % популяції земної кулі. Частота захворюваності неоднорідна і коливається в залежності від клімато-географічного регіону, зменшуючись у напрямку лінії екватору [138, 182]. «Ефект екватору» ще не з’ясований, можливо, причина в генетичних, середовищних чинниках або рівні вітаміну D. Так, у скандинавських країнах та у корінних жителів Крайньої Півночі відзначається висока популяційна частота псоріазу – до 4 %, а в країнах Ближнього Сходу – 0,11 %, що є самим низьким показником у світі. Поширеність в західноєвропейських країнах складає більше 2 % (в Ірландії – 5,5 %, Шотландії – 4,8%, Іспанії – 3,7 %), у той же час у США і Канаді – 3,4 % и 4,7 % відповідно [124, 149, 182]. В Україні має місце розбіжність офіційних і фактичних даних відносно поширеності хвороби – в даний час в країні близько 1,5 млн. хворих на різні форми псоріазу, хоча статистичні дані 2011 р. свідчать про 102100 пацієнтів, що вказує на відсутність об’єктивної репрезентативної статистики.
Крім географічних і кліматичних факторів, формуючих частоту зустрічємості даного захворювання, ризик його розвитку залежить від генотипу й популяційних особливостей (наприклад, афроамериканське населення, що проживає в північних широтах Північної Америки або Європи, хворіє на псоріаз значно рідше представників європеоїдної раси) [198, 235]. Міське населення хворіє на цей дерматоз частіше, ніж сільське; у дорослого населення псоріаз виявляється удвічі частіше, ніж серед дітей; чоловіки хворіють дещо частіше жінок.
Розподіл хворих на різні форми псоріазу залежно від тяжкості клінічної картини підпорядковується правилу «третин» – дві третини виявлених у даному регіоні хворих мають легку або помірну за тяжкістю і перебігом форми захворювання, одна третина – тяжкий псоріаз. Псоріатичне ураження суглобів спостерігається також у третини хворих на псоріаз [82, 124].
Появу псоріазу можуть спровокувати такі фактори, як пошкодження шкіри, хірургічні втручання, надмірне ультрафіолетове опромінення, ожиріння, надмірне вживання алкоголю і паління, різного роду екстремальні фактори, включаючи фізіологічні, холодові і психоемоційні стреси, інфекції, прийом лікарських препаратів та ін. [14, 22, 91, 159, 203]. Емоційні стреси є тригерами псоріазу у 23 % пацієнтів, лікарські препарати – у 16 %, фізичні травми – у 43 %, інфекції в цілому – у 14 % хворих [26, 131, 145, 124].
Вивчення причин виникнення псоріазу та механізмів його розвитку стало предметом численних досліджень вітчизняних і зарубіжних вчених [13, 41, 70, 98, 203, 217, 219]. Існує безліч теорій виникнення псоріазу, однак абсолютно однозначним є те, що даний дерматоз – це багатофакторна патологія.
Роль генетичної теорії псоріазу підтверджується високою частотою зустрічаємості серед родичів хворих у порівнянні із загальною популяцією. Так, якщо хворий один з батьків, ризик псоріазу у дитини становить 8 %, якщо хворі батько й мати – 41 %. У пацієнтів часто виявляють антигени головного комплексу гістосумісності (HLA) класу I: HLA-B 13, HLA-B17, HLA-Bw 57, HLA-Cw6 [24, 163, 225]. Розрізняють два типи псоріазу відповідно характеру перебігу: псоріаз I типу пов’язаний з системою HLA антигенів (HLA-Cw6, HLA-Bw57, HLA-B13, HLA-B17). Цим типом псоріазу страждає 65 % хворих, а дебют захворювання частіше припадає на молодий вік (18-25 років). Для псоріазу I типу притаманна велика площа ураження шкірного покриву та часті рецидиви. Перші прояви псоріазу I типу у 90 % хворих з’являються після маніфестації стрептококової інфекції [51, 219]. Можливо, існує еволюційний синергізм між дерматозом і стрептококовими захворюваннями. Псоріаз II типу не пов’язаний із системою HLA-антигенів і виникає в більш старшому віці, пік захворюваності на п’ятому десятиріччі. При першому типі чітко простежується асоціація зі спадковістю (44 %), тоді як при другому – зв’язок зі спадковістю становить 1 % [98, 203, 235].
Певну роль у розвитку псоріатичної хвороби займає патологія ендокринної системи (розлади гіпофізу, андрогенної, мінералокортикоїдної та глюкокортикоїдної функції наднирникових залоз, щитоподібної залози) [12, 29, 224, 230].
Змінам ліпідного обміну в патохімічних механізмах розвитку псоріазу надають особливе значення. Порушення ліпідного складу виявлено в сироватці крові, мембранах еритроцитів і лейкоцитів, роговому шарі і мітохондріях клітин шкіри [98, 223], що чинить негативний вплив на функціонування біологічних мембран, мітотичну активність клітин, має кореляційний зв’язок з активністю псоріатичного процесу, станом гуморального і клітинного імунітету [154]. Гіперхолестеринемія, гіпертригліцеридемія та дисліпопротеїнемія виявлені у переважної більшості хворих на звичайний псоріаз [87]. Важка форма псоріазу асоційована з підвищенням рівня ліпопротеїдів низької і дуже низької щільності, а збільшення в сироватці крові загального та неестерифікованого холестерину залежить від площі ураження шкіри, стадії і тривалості перебігу захворювання [84]. Однак зміни в ліпідному обміні при псоріазі деякі автори розглядають як тригерні механізми, що призводять до оксидативного стресу і активації перекисного окислення ліпідів [63, 188].
В останні роки викликає інтерес метаболізм оксиду азоту у хворих на псоріаз, який в залежності від концентрації має прооксидантний або антиоксидантний вплив та є багатофункціональною молекулою [64]. Виявлені зміни метаболічних, судинних і гемостатичних реакцій, в яких оксид азоту залучений в якості біорегулятора, можуть відігравати суттєву роль в патогенетичних механізмах розвитку і перебігу захворювання.
При оцінці здатності до автофлуоресценції шкіри хворих на псоріаз визначена червона флуоресценція тільки в області псоріатичних елементів. Це, можливо, пов’язано зі збільшенням кількості ендогенних порфіринів і порушенням нормальних механізмів транспорту та функціонування білка ABCB6 в кератиноцитах внаслідок прискореної проліферації, а також розладів функції печінки, що часто має місце у патогенезі псоріазу [37, 48].
При псоріазі особливу роль в порушеннях процесів проліферації відіграє імунна дисрегуляція за участю цитокінів, хемоатрактантів, молекул адгезії та інших регуляторних молекул, які продукуються імунокомпетентними клітинами шкіри та організму в цілому.
1.2 Ангіогенез та імунне запалення у механізмі розвитку псоріазу
За попередні роки досягнуто значного прогресу у вивченні патогенезу та морфогенезу псоріазу і псоріатичного артриту: взаємодія різних типів клітин, опосередкована цитокіновим каскадом Т-хелперами 1 (Tх1)/Tх17 типу, призводить до формування характерного псоріатичного фенотипу – акантоз з подовженням міжсосочкових епідермальних виростів, формування рогового шару з ознаками незакінченого диференціювання (паракератоз) та наявністю фокусних внутрішньорогових скупчень нейтрофілів, відсутність зернистого шару, формування лімфогістіоцитарного інфільтрату в дермі. Фактори, що виділяються кератиноцитами, впливають на активацію імунокомпетентних клітин, а продукти активованих імунокомпетентних клітин змінюють функцію кератиноцитів [171, 222]. Хоча персистенція антигену пояснює хронічну активацію імунної системи, порушення функцій різних типів регуляторних Т-клітин дає можливість припускати наявність й інших чинників, здатних активувати Т-клітини. Передбачається, що T-лімфоцити, цитокіни та інші хемокіни, а також матриксні металопротеїнази (ММП) відіграють певну роль в запальному процесі, що призводить також до деструкції суглобів [141].
Послідовні процеси формування запального осередку при псоріазі включають пошкодження епідермісу і безпосередньо дерми з підвищенням проникності для антигенів, після чого включаються механізми виділення кератиноцитами і клітинами Лангерганса великої кількості цитокінів з подальшим розвитком вазодилатації і діапедезом у тканини дерми клітинних елементів крові. У сформованому інфільтраті відбувається активація і диференціація Т-лімфоцитів, секреція прозапальних цитокінів, які, в свою чергу, стимулюють гіперпроліферацію кератиноцитів. При псоріазі процеси імунного захисту від антигену є патологічними через дисбаланс регуляторних систем імунітету і механізмів, які контролюють клітинний мітоз. Збільшення мітогенного епідермального фактора росту призводить до акантозу і прогресування псоріазу. На ранніх стадіях псоріазу, ще до початку проліферації епідермісу, ураження шкіри характеризуються дилатацією, звивистістю капілярів і набряком сосочкового шару дерми, а також наявністю периваскулярного лімфоцитарного інфільтрату.
У відповідь на антиген, природа якого ще не з’ясована, відбувається активація Tх1-лімфоцитів в результаті їх навчання антигенпрезентуючими клітинами організму. Активація CD4+ Т-лімфоцитів індукує ряд імунологічних реакцій, в тому числі активацію макрофагів, що синтезують широкий спектр прозапальних медіаторів, по-перше цитокінів, таких як ФНП α, ІЛ-1 [92, 107, 122, 160, 171, 213]. У маніфестації псоріазу значну роль відіграє порушення співвідношення ІЛ-12/ІЛ-23, а також активація антигенпрезентуючих (дендритних) клітин [124, 195, 222].
В даний час велика увага приділяється проблемі ангіогенезу при псоріазі і псоріатичному артриті, тому як не викликає сумніву той факт, що псоріатична бляшка або синовіальна проліферація не може розвиватися й рости без формування в ній розгалуженої мережі судин, які забезпечують киснем і живильними речовинами активнопроліферуючі клітини [15, 46, 185].
Ангіогенез – складний багатоклітинний феномен, що включає проліферацію капілярних ендотеліальних клітин, їх інвазію в судинний матрикс з формуванням капілярних трубок. Ангіогенез є нормальним фізіологічним процесом, характерним для неонатального росту і практично не спостерігається в сформованому здоровому організмі (винятком є репродуктивний цикл і загоєння ран) [53, 123]. Однак це явище супроводжує ряд патологічних процесів з надмірним ростом судин – атеросклероз, виразкову хворобу, діабет, пухлини, а також псоріаз. При псоріазі основною особливістю ангіогенезу є посилена проліферація ендотеліоцитів, що вистилають внутрішню поверхню посткапілярних венул [170]. Здатність ендотеліальних клітин формувати капіляроподібні структури регулюється позаклітинним матриксом, що складається з базальних мембран та інтерстиціальної сполучної тканини. Процес обумовлений активністю клітин Т-хелперів і Т-супресорів, що ініціюють розвиток запалення в дермі та активують проангіогенні чинники. При ранньому псоріатичному ураженні виявлено збільшення щільності мікросудин (CD31) з іншими гістоморфологічними параметрами (гіпогранульоз, паракератоз і мікроабсцеси Мунро). Надекспресія СЕФР супрабазальними кератиноцитами корелює зі збільшенням щільності мікросудин у папілярній дермі [21, 215].
Передбачається, що при псоріазі існує кілька механізмів і чинників індукції ангіогенезу, які можуть діяти синергічно [46]. Однозначним джерелом проангіогенних факторів є кератиноцити епідермісу. Цьому сприяють різноманітні чинники – від генетичної схильності до прозапальних цитокінів та ростових факторів: ІЛ-1, ІЛ-6, ІЛ-8, ФНП α, трансформуючий фактор росту (ТФР) α.
СЕФР є найважливішим позитивним регулятором ангіогенезу [53, 150, 206]. Це гетеродимерний глікопротеїновий ростовий фактор, що продукується різними типами клітин та існує в 5 ізоформах, які відрізняються кількістю амінокислот пептидного ланцюга. СЕФР є потенційним мітогеном для ендотеліальних клітин мікро- і макроваскулярних кровоносних і лімфатичних судин. Білки сімейства СЕФР стимулюють клітинний відгук, зв’язуючись з рецепторами з тирозинкіназною активністю на поверхні клітини [123]. Відомо три типи рецепторів: СЕФРР-1, СЕФРР-2, СЕФРР-3. Всі рецептори є трансмембранними глікопротеїдами, яким для успішного зв’язування з СЕФР необхідна взаємодія з гепариноподібними компонентами позаклітинного матриксу. Відомо, що при псоріазі рецептори 1-го та 2-го типів експресуються на поверхні ендотеліоцитів судин сосочкового шару дерми в більшій кількості, ніж у нормальних умовах [146]. Вважається, що найбільш виражені ефекти реалізуються через СЕФРР-2, незважаючи на те, що СЕФРР-1 мають найбільшу афінність до СЕФР-А ізоформи, але маючи мінімальну кіназну активність, вони практично не приймають участі в проліферації ефекторних клітин. Ангіогенез при псоріазі обумовлений високою локальної концентрацією СЕФР з переважанням ізоформи 121 [156, 242].
Встановлено підвищення рівня СЕФР в сироватці крові в 2,5-3 рази у хворих в прогресуючу стадію псоріазу в порівнянні зі стадією ремісії [16, 133, 170, 236]. Доведено, що ступінь тяжкості псоріазу тісно корелює з рівнем СЕФР у сироватці крові і підвищеною експресією СЕФР рецепторів в епідермісі хворих. Ці порушення забезпечують поліпшення трофіки псоріатичної бляшки і подальше збільшення з розвитком локального запалення, посилюючи проникність судинної стінки. Блокування СЕФР і його рецепторів моноклональними антитілами при псоріазі гальмує розвиток запалення, зменшує проліферативну активність [109]. Це означає, що протиангіогенні фактори суттєво зменшують запальну реакцію. Залучення ангіогенезу в розвиток псоріазу доведено відкриттям генного поліморфізму по відношенню до СЕФР. У пацієнтів з важкими формами дерматозу відзначено порушення системної регуляції СЕФР (запрограмованої на геномному рівні) через поліморфні варіанти рецепторів до СЕФР в активованих кератиноцитах шкіри [240].
Найбільші значення маркерів активації ендотелію (sVCAM-1 і СЕФР) верифіковані при коморбідних патологіях, їх рівень виявився найбільш високим у осіб з вульгарною формою псоріазу та стабільною стенокардією напруги функціонального класу II-III [19].
Ще один доказ важливості антиангіогенної терапії при псоріазі отримано при дослідженні ретиноїдів, ефективність яких виявлена випадково, а механізм дії тривалий час залишався неясним. Ретиноїди стають біологічно активними в результаті активації одного з двох шляхів: взаємодії зі своїми ядерними рецепторами (рецепторами ретиноєвої кислоти) або з ядерним фактором транскрипції, так званим активаторним протеїном (АП). У промоторній області гена СЕФР є чотири АП-1зв’язуючих сайти, взаємодія ретиноїдів з АП-1 блокує експресію СЕФР, тобто ретиноїди мають анти-АП-1 і відповідно анти-СЕФР активність [161]. Про важливу роль СЕФР свідчать результати лікування пухлин внутрішніх органів інгібіторами цього ростового фактора (бевалізумаб) у хворих на псоріаз (регрес висипань на шкірі, ремісія артропатії) [129].
В псоріатичній шкірі виявлені високі рівні експресії ще деяких проангіогенних чинників – ФНП α, ТФР α, фактора, індукованого гіпоксією, ІЛ-8, ІЛ-17 та ангіопоетину [206]. Комбінована дія цих чинників стимулює утворення нових дермальних кровоносних судин. Взаємодії між проангіогенними посередниками дуже складні, наприклад, ФНП α має про- і антиангіогенну дію, індукує синтез проангіогенних медіаторів – фактора росту фібробластів, ІЛ-8 і СЕФР [170].
ФНП α (багатофункціональний прозапальний цитокін) розглядається як один з ключових медіаторів у патогенезі псоріазу. У фізіологічних умовах ФНП α регулює клітинний гомеостаз, закладку органів імунної системи і апоптоз [93, 222, 233]. В умовах запальної реакції, подібно ІЛ-1 приймає участь у реалізації місцевих та системних проявів: викликає хемотаксис і проліферацію нейтрофілів, лімфоцитів і еозинофілів, дендритних клітин, підсилює експресію молекул адгезії на ендотеліоцитах, що сприяє проникненню лімфоцитів в осередки ураження [183]. Показано, що ФНП α стимулює вивільнення ММП, що руйнують сполучну тканину і спричиняють пошкодження суглобів [160]. У шкірі ФНП α продукується макрофагами, кератиноцитами, нейтрофілами, опасистими клітинами, ендотеліоцитами, фібробластами, клітинами Лангерганса. Синтез ФНП α стимулюють імунні комплекси, інтерферон (ІНФ) γ, інгібують вітамін D3 і ІЛ-6. Характер дії ФНП α залежить від вмісту: низький рівень регулює розвиток місцевої запальної реакції, в той час як високий – викликає розвиток системної запальної реакції, що супроводжується лихоманкою, лейкоцитозом, підвищенням рівня білків гострої фази [233].
ФНП α та інші цитокіни (ІЛ-1, ІЛ-8) підсилюють адгезивні властивості нейтрофілів при підвищеній експресії поверхневих молекул адгезії за рахунок взаємодії з ендотеліоцитами і забезпечують проникнення гранулоцитів з кров’яного русла в тканини. Таким чином формується локальний осередок запалення, де на першому етапі при підвищеній активності ІЛ-1 і ФНП α Т-лімфоцитами виділяється велика кількість ІЛ-2 та ІЛ-4 і активується міграція мастоцитів та еозинофілів до запального осередку [124].
Підвищення біологічної активності ФНП α і активація ендотеліоцитів відбувається в осередках ураження (переважно в субкорнеальних кератиноцитах) у хворих на псоріаз порівняно з неураженою шкірою [150, 160]. Виявлено експресію ФНП α на дендритних клітинах, локалізованих в сосочковому шарі дерми, клітинах Лангерганса, присутніх в епідермісі ураженої шкіри хворих на псоріаз. Встановлено взаємозв’язок між підвищенням рівня ФНП α в сироватці крові хворих на псоріаз і збільшенням площі висипань [63]. Показано підвищення вмісту ФНП α не тільки в сироватці крові, а й в ураженій шкірі хворих на псоріаз, відзначено взаємозв’язок експресії цитокінів з тяжкістю клінічних проявів [103]. При цьому найбільше підвищення вмісту ФНП α спостерігалося у хворих з поширеними висипаннями і важкими клінічними формами, які погано піддаються терапії. Підвищений рівень ФНП α виявлений в синовіальній рідині та синовіальній оболонці у хворих на псоріатичний артрит [93, 233].
ФНП α ініціює запуск цитокінового каскаду, стимулюючи синтез прозапальних медіаторів, вплив яких має важливе значення при псоріатичному процесі – ІЛ-1, ІЛ-2, ІЛ-6, хемокінів (ІЛ-8), активаторів транскрипції (NF-kb), ММП, інсуліноподібного фактора росту, епідермального фактора росту [63, 160]. В результаті їх спільної взаємодії форсуються процеси ангіогенезу з підвищеною експресією СЕФР.
Відомості про роль і функції ІЛ-8 при псоріазі нечисленні і суперечливі [222]. Це низькомолекулярний цитокін запалення, що є хемокінів і грає роль хемоатрактанта для нейтрофілів, макрофагів, лімфоцитів і еозинофілів, викликаючи міграцію цих клітин в осередок запалення, їх дегрануляцію і виділення супероксидного радикалу, а також стимулює ангіогенез [162]. ІЛ-8 синтезується активованими ендотеліальними клітинами, моноцитами, фібробластами, кератиноцитами, гепатоцитами та іншими клітинами. Під дією ІЛ-8 і ФНП α відбувається хемотаксис нейтрофілів і лімфоцитів до місця пошкодження тканини, що пояснює формування мікроабсцесів Мунро та інфільтрату в дермі, розвиток характерної еритеми [212]. Незважаючи на більш глибоке вивчення процесів запалення в шкірі, з певним фактом взаємодії між кератиноцитами та імунними клітинами, механізм формування псоріатичної бляшки на даний момент залишається нез’ясованим.
Ніні певна увага приділяється вивченню інгібіторів ангіогенезу, які можуть пригнічувати васкуляризацію. Одним з ендогенних протиангіогенних факторів є гормон мелатонін [127, 174].
Мелатонін, основний секреторний продукт шишкоподібної залози, і його метаболіти мають різні функції, включаючи індукцію сну, синхронізацію біологічних ритмів, вазорегуляцію і імуномодуляцію [173, 181]. Мелатонін – амфіфільна молекула, яка проявляє свої антиоксидантні властивості шляхом інактивації активних форм кисню (АФК) і підвищення активності антиоксидантних ферментів [115, 116, 173]. Паракринні, автокринні і антиоксидантні ефекти мелатоніну модулюються його рецепторами, хоча деякі з біологічних ефектів індукуються рецептор-незалежним шляхом [142, 204]. Порушення регуляції продукції мелатоніну і функції його рецепторів пов’язані з безліччю розладів, включаючи цукровий діабет 2 типу, старіння, імуноопосредованні захворювання, гіпертонію та рак [174].
Імуномодулюючі властивості мелатоніну добре відомі, гормон діє на імунну систему, регулюючи синтез цитокінів імунокомпетентними клітинами [175, 199]. Встановлено, що мелатонін призводить до зниження експресії прозапальних цитокінів, таких як ІЛ-6, ІЛ-8 і ФНП α, модифікує в крові рівні цих запальних показників, таким чином покращує клінічний перебіг імунозапальних хвороб [139]. Відомо, що важливі клітини вродженого імунітету – лаброцити, також мають мелатонінові рецептори [228]. Недавні повідомлення припускають, що антидепресанти, такі як агомелатин, новий мелатонергічний агоніст, послаблює запальні зміни при депресії, зменшуючи викид прозапальних цитокінів з активованої мікроглії, що корелює з поліпшенням функції моноамінових нейротрансмітерів [205, 226].
Мелатонін вважається найбільш важливим природним онкостатичним гормоном в організмі людини, який знижує захворюваність і ріст пухлин [172, 177, 201]. Імуномодулюючі, антипроліферативні, антиоксидантні і, можливо, антиангіогенні ефекти мелатоніну пояснюють його онкостатичну активність. Високі концентрації мелатоніну помітно пригнічували проліферацію клітин меланоми, карциноми підшлункової залози, при цьому ендогенна експресія СЕФР клітинами пригнічувалась шляхом інкубації з мелатонином [178].
Фундаментальні клінічні дослідження [120, 176, 179] показали, що індукований мелатоніном контроль пухлинного росту пов’язаний зі зниженням секреції СЕФР, що передбачає його антиангіогенну активність опосередковано через його інгібування експресії СЕФР. Мелатонін надає пряму і непряму протиангіогенну дію: безпосередньо пригнічує функцію СЕФР, побічно – пригнічує інші фактори росту і АФК [180]. Мелатонін запобігає транслокації індукованого гіпоксією фактора-1α в ядро, перешкоджаючи тим самим експресії СЕФР, а також утворенню комплексу з фосфо-STAT3 і CBP/p300, який бере участь в експресії генів, пов’язаних з ангіогенезом. Ангіостатичні властивості мелатоніну можуть бути також обумовлені його здатністю пригнічувати активацію і експресію СЕФРР2. Інші ангіостатичні механізми мелатоніну включають інгібування міграції, інвазії і формування трубочок ендотеліальних клітин [111, 174, 181, 200].
У дослідженнях показано, що мелатонін може впливати на рівень СЕФР в крові [110, 135, 181]. Потребують вивчення стимулятори та інгібіторі ангіогенезу (фактори росту, цитокіни), взаємозв’язки між різними типами медіаторів та клінічними проявами псоріазу.
1.3 Депресія як коморбідність у хворих на псоріаз
Псоріаз характеризується складністю патогенетичних запальних механізмів і має ряд загальних імунологічних ознак з іншими складними по патогенезу захворюваннями, такими як метаболічний синдром (МС), цукровий діабет, ожиріння, гіперліпідемія, хвороба Крона, лімфома, кардіопатологія, депресія, запальні захворювання суглобів [30, 74, 78, 117, 193]. Розвиток коморбідності швидше за все заснований на спільності патогенезу поєднаних захворювань і не залежить від стилю життя, доступності медичної допомоги або економічних чинників, зазвичай має тенденцію збільшуватися з віком. Майже половина хворих на псоріаз у віці старше 65 років має, принаймні, три коморбідності, а у двох третин – дві й більше [192]. Крім схожих імунологічних механізмів виявлені також гени, загальні для псоріазу і коморбідних станів.
Коморбідність МС і псоріазу полягає в загальних патогенетичних механізмах, таких як хронічне запалення, окислювальний стрес і наявність Toll-подібних рецепторів в жировій тканині [63, 119]. Часте поєднання вісцерального ожиріння, порушень вуглеводного, ліпідного обмінів, розладів дихання під час сну, артеріальної гіпертензії і наявність щільного патогенетичного зв’язку між ними стало підставою для виділення нозологічної одиниці – «метаболічний синдром».
Хронічне запалення вважається сполучною патогенетичною ланкою між псоріазом і МС [63, 64, 190]. Прозапальні маркери адипоцитів, такі як лептин, адипонектин, ФНП α та ін., мають важливе значення в розвитку інсулінорезистентності, гіпертензії та інших ускладнень МС. Дисрегуляція Т-клітинних взаємодій і надлишкова експресія прозапальних цитокінів призводить до гіперпроліферації кератиноцитів і активації нейтрофілів в епідермісі [206]. Високі рівні лептину в сироватці продемонстровано при ожирінні, гіпертонії, МС і псоріазі. Резистин також показував кореляцію зі значенням PASI [210, 211].
Гіпергомоцистеїнемія є добре відомим фактором ризику розвитку серцево-судинних захворювань. Пацієнти з псоріазом мають більш високий рівень гомоцистеїну в плазмі порівняно з контрольною групою і цей рівень корелює з тяжкістю захворювання згідно PASI [87, 232]. Нозологічна структура серцево-судинної патології у осіб з псоріазом характеризується поєднанням декількох форм ішемічної хвороби серця одночасно і представлена у 73,3 % пацієнтів стабільною стенокардією напруги функціонального класу II-III, у 40 % – постінфарктним кардіосклерозом, у 37,8 % – порушеннями ритму і провідності, у 15,6 % – гострим інфарктом міокарду [20].
Згідно результатів досліджень, психічні та психологічні розлади спостерігаються у 40-70 % дерматологічних хворих [27, 97, 152, 155, 234]. Частота випадків депресії і тривоги у пацієнтів з псоріазом значно вища, ніж у загальній популяції, порівняно з іншими дерматологічними станами, психічна захворюваність у таких пацієнтів більша, якість життя нижче [2, 3, 22, 96, 97, 164, 192, 229]. У чоловіків відзначається підвищена емоційна напруженість, нестійкість, депресивні тенденції, соматизація тривоги. Для жінок характерні аналогічні тенденції, однак більш часто реєструються аутизація, непрактичність, суб’єктивізм [36, 184].
До основних коморбідних псоріазу станів психологічного або психіатричного профілю відносяться алекситимія, тривога і депресія [27, 151, 186].
Психічні розлади у хворих на псоріаз сьогодні знаходяться в центрі уваги дослідників. Значення стресу в розвитку псоріазу незаперечно, проте механізми впливу психологічного дистресу на перебіг дерматозу (дебют, рецидиви), залишаються мало вивченими, ймовірно, запалення є об’єднуючим фактором [33, 40, 66, 81, 197, 217]. Комплексний аналіз показав, що психологічний стрес підвищує рівень запальних маркерів, таких як С-реактивний білок (C-РБ), ФНП α, деяких ІЛ, внаслідок чого збільшується прозапальний потенціал циркулюючих клітин імунної системи, що може призводити до загострення псоріазу [202]. Збільшення вмісту С-РБ, прозапальних цитокінів (ФНП α, ІЛ-1, ІЛ-2 та ІЛ-6) спостерігалося при основних депресивних розладах, продемонстровано взаємозв’язок їх рівня з тяжкістю депресії [130]. Лікування антидепресантами (селективним інгібітором зворотного захоплення серотоніну) призводить до значного зменшення не тільки симптомів депресії, але й базових рівнів C-РБ та ІЛ-6 у хворих на псоріаз [40].
У взаємозв’язок між загостреннями псоріазу та розладами настрою (депресія, тривога) можуть бути залучені різні фізіологічні шляхи. Один з цих шляхів, більш характерний для депресивних станів, включає патологічну активацію гіпоталамо-гіпофізарно-наднирникової системи (ГГНС). У осіб з депресією виявлено постійне підвищення базового рівня кортикотропін-рилізинг гормону (КРГ), адренокортикотропного гормону і кортизолу, що може бути наслідком зміни кількості і активності рецепторів кортизолу. Зменшення числа і активності глюкокортикоїдних рецепторів може призвести до зниження зворотного зв’язку кортизолу, що спричиняє гіперактивність ГГНС, яка спостерігається у хворих на депресію і запальні захворювання шкіри [143, 157].
У відповідь на стресові подразники – ультрафіолетове опромінення (УФО), вільні радикали, бактеріальні та вірусні інфекції, КРГ активує прозапальні білки, модулює транскрипцію ДНК клітин, запускаючи імунну реакцію. Кератиноцити можуть приймати участь у розвитку запалення, що підтверджується збільшенням експресії КРГ при імуногістохімічному дослідженні біоптатів шкіри хворих на псоріаз [165, 191]. Незалежно від того, продукується він локально або доставляється периферійними нервами, КРГ може бути ключовим компонентом осі «мозок – шкіра».
У формуванні запалення бере участь і симпатична нервова система (СНС). Саме тривожні стани корелюють з активацією СНС і пригніченням активності блукаючого нерва [166, 238]. Виявлено надлишкову секрецію норадреналіну у відповідь на стрес у хворих на псоріаз в порівнянні зі здоровими особами [13]. З усіх підтипів рецепторів, що беруть участь в симпатичній реакції на стрес, альфа-адренергічні рецептори (α-АР) визначені як медіатори, що обумовлюють збільшення синтезу прозапальних цитокінів [221]. Існує достатньо доказів впливу хронічного стресу на розвиток імуносупресії або імунної дисрегуляції [227]. Депресія і тривога можуть сприяти погіршенню запальних захворювань шкіри, активуючи як ГГНС, так і СНС.
Якщо розглядати зворотний зв’язок запалення і афективних розладів, можна відзначити, що індукція запального стану при псоріазі може прискорити зміну настрою, включаючи депресивні симптоми. Показано, що введення прозапальних цитокінів щурам призводило до формування «хворобливої поведінки», що включає симптоми депресії: погіршення сну, зниження апетиту і сексуальної активності [132]. Використання інгібітора ФНП α етанерцепта в лікуванні хворих на псоріаз призводить до зниження втоми і регресу депресивних симптомів [139].
Психічні порушення, супутні псоріазу, різноманітні. За даними літератури, найпоширенішими психічними відхиленнями більш ніж у 50 % пацієнтів є сексуальні розлади і порушення сну. Крім цього, поширені форми псоріазу та псоріатичний артрит можуть додатково порушувати якість сну за допомогою вираженого свербежу та больового синдрому. В рамках супутньої метаболічної симптоматики на тлі підвищення прозапальних цитокінів нічне апное є однією з найчастіших причин інсомнії при псоріазі [81, 126]. Прозапальні цитокіни не єдині біомаркери, що зв’язують депресію і псоріаз.
Депресія пов’язана з порушеннями секреції гормону сну мелатоніну, рівень якого в нормі залежить від циркадних ритмів – підвищується в нічний час, досягаючи піку між 2 і 4 годинами ранку. Відомо, що мелатонін регулює добовий цикл сну, а також модулює імунну функцію. Зменшуючи рівні ФНП α, ІЛ-6 та ІЛ-8, мелатонін теоретично може послабити вираженість запальних захворювань [175].
Дисрегуляція мелатоніну виявлена при вульгарному псоріазі у вигляді зниження екскреції гормону в нічний час [17, 214]. Зі зниженням рівня мелатоніну може бути пов’язаний феномен Кебнера, характерний для прогресуючої стадії псоріазу. Припущення виникло в експерименті з пінеалектомією у лабораторних щурів, яке призвело до уповільнення загоєння ран, а штучне відновлення мелатоніну досліджуваним тваринам покращувало регенеративні властивості шкіри [199]. В осіб із депресією пониження рівня мелатоніну і дисфункція циркадного ритму можуть сприяти виділенню меланоцит-стимулюючого гормону, який пов’язаний із запальними дерматозами. Мелатонін протизапальними властивостями може безпосередньо впливати не тільки на псоріаз, а й коморбідні стани, такі як МС [31].
Таким чином, псоріаз та психоемоційні розлади взаємопов’язані на рівні тонких патогенетичних процесів, де основною об’єднуючою ланкою виступає запалення. Важливими є різні шляхи посилення запалення при псоріазі в залежності від різновиду супутнього афективного розладу (депресія або тривога). Незважаючи на численні дослідження патогенезу псоріазу, відсутні відомості про рівень мелатоніну у пацієнтів з різними клінічними варіантами захворювання, а також психоемоційними порушеннями. Розуміння загальних причин цих станів допоможе знайти правильні терапевтичні рішення з вибором потенційних мішеней для впливу.
1.4 Принципи і методи лікування псоріазу
Проблема лікування псоріазу не втрачає актуальності і, незважаючи на появу нових сучасних методів лікування, залишається складним завданням, що вимагає персоніфікованого, а в разі виявлення коморбідних станів – мультидисциплінарного підходу [8, 48, 73, 82, 203, 207].
Сучасна системна і зовнішня патогенетична терапія псоріазу полягає в застосуванні методів, спрямованих на зниження проліферативної активності кератиноцитів і нормалізацію їх диференціювання, пригнічення Т-клітинних запальних імунних реакцій в дермі, усунення дисбалансу між про- і протизапальними цитокінами [73, 85, 94, 121]. Слід зазначити, що більшість методів лікування псоріазу мають антиангіогенну дію, навіть якщо не призначені спеціально для цього [237].
Зовнішня терапія псоріазу призводить до зменшення запальних явищ, лущення та інфільтрації шкіри. Поряд з традиційними мазями, що містять саліцилову кислоту, сірку, дьоготь, нафталан, іхтіол, сечовину, активно застосовуються топічні глюкокортикостероїди (ТГКС), які мають виражені протизапальний, протисвербіжний, імуносупресивний та антимітогенний ефекти. ТГКС – патогенетична терапія першої ланки при легкому або середньо-важкому ураженні шкіри, тільки при відсутності клінічного ефекту від монотерапії топічними засобами або їх комбінаціями розглядається можливість інших видів лікування. Численні клінічні дослідження переконливо продемонстрували високу ефективність і безпеку ТГКС останнього покоління (мометазону фуроат, метилпреднізолону ацепонат, гідрокортизону бутират тощо) при псоріазі та інших хронічних стероїдчутливих дерматозах [15, 194]. Протизапальний ефект стероїдних препаратів обумовлений зменшенням набряку та пригніченням хемотаксису запальних клітин в шкіру. Стероїди пригнічують транскрипцію генів, відповідальних за синтез запальних цитокінів (ІЛ-1, ІЛ-2, ІЛ-6, ІФН γ, ФНП α), Т-клітинну проліферацію, Т-опосередкований імунітет.
Одним з напрямків зовнішнього лікування псоріазу є препарати, що містять як діючу речовину синтетичний аналог активного метаболіту вітаміну D3 (кальципотріол або кальцитріол). Препарати гальмують проліферацію кератиноцитів, пригнічуючи синтез ДНК, стимулюють диференціювання епідермальних кератиноцитів, надають інгібуючий вплив на медіатор запальних реакцій ІЛ-1, пригнічують активацію Т-лімфоцитів, утворення ІНФ γ, ІЛ-2, ІЛ-6, СЕФР і ТФР α в епідермісі [44, 50, 112]. Дія місцевих інгібіторів кальциневрину пов’язана з блокуванням сигнальної трансдукції Т-лімфоцитів за допомогою інгібування [73, 208].
Увагу багатьох фахівців привертає можливість застосування імунокоригируючих препаратів для лікування захворювання, при цьому відзначено позитивний терапевтичний ефект як стимуляторів, так й інгібіторів Т-клітинного імунітету – леакадин, циклоферон, поліоксидоній, глутоксим [6, 44, 69].
При неефективності терапії звичайними засобами, схильності до безперервного прогресуючого перебігу, а також при артропатичному псоріазі, еритродермії є показання до застосування цитостатиків (метотрексат, азатіоприн, імуран та ін.). Механізм дії імуносупресора циклоспорину (сандімун, імуспорин) пов’язаний з пригніченням продукції і секреції лімфокінів, блокадою неактивних лімфоцитів в фазі G0 і G1 клітинного циклу, що попереджає гіперпроліферацію кератиноцитів [50, 128]. Передбачається, що дія препарату також зумовлена гальмуванням секреції ІЛ та інших лімфокінів активованими Т-лімфоцитами, що призводить до зниження активності Т-лімфоцитів і клітин запалення як в дермальному шарі, так і в епідермісі хворих на псоріаз та опосередковано впливає на стан судин, гіперпроліферацію епідермісу.
Метотрексат діє переважно на активно проліферуючі клітини, в основному лімфоїдного ряду, пригнічує активність ІЛ-1 і синтез ІЛ-6 [203]. До недоліків терапії метотрексатом відносяться можливе спотворення перебігу псоріазу і його загострення через кілька тижнів після відміни препарату, іноді більш важке, ніж попереднє (феномен «рикошету»), а також побічні ефекти, пов’язані з токсикоалергічними, цитостатичними та імуносупресивними ефектами метотрексату.
Механізм дії ароматичних ретиноїдів (ацитретин) полягає в пригніченні проліферації епідермальних кератиноцитів, нормалізації диференціювання незроговілого епітелію, зменшення зчеплення рогових клітин. Останнє призводить до більш швидкого їх злущування, запобігає утворенню рогових мас, однак приблизно у 20 % хворих терапія ретиноїдами не дає значного ефекту [91].
Принципово новим у лікуванні псоріатичного артриту і важких форм псоріазу є група препаратів біологічної терапії [76, 77, 133, 143, 157]. Імунобіологічні препарати за механізмом дії поділяються на інгібітори Т-клітинної активації і костимуляції (алефацепт, абетацепт, сиплізумаб, ефалізумаб) і блокатори ефектів цитокінів (адалімумаб, інфліксимаб, устекінумаб, етанерцепт). Ці препарати мають високу ефективність, однак, слід зазначити, що інгібітори ФНП α, як і інші біологічні препарати, протипоказані пацієнтам з інфекційними та демієлінізуючими захворюваннями, серцевою недостатністю III-IV класу, вимагають серйозного клініко-лабораторного контролю та імунологічного моніторингу [135, 206].
Особливе місце в лікуванні псоріазу належить фототерапії [32, 33]. Фототерапія має протизапальний, імуносупресивний та антипроліферативний ефекти, діючи на основні ланки псоріатичного процесу, а простота застосування робить її високо комплаєнтним методом. Позитивний ефект УФО обумовлений апоптозом Т-клітин, зниженням кількості клітин Лангерганса, зміною продукції цитокінів, факторів росту (епідермальний фактор росту, СЕФР), молекул адгезії і нейропептидів [7, 72, 193]. Ряд досліджень показали, що фототерапія впливає на цитокіновий профіль при псоріазі шляхом перемикання імунної відповіді від Тх1/Тх17-запального шляху до Тх2-напрямку [8, 113].
Для лікування псоріазу застосовують фотохіміотерапію – поєднання довгохвильового УФО і фотосенсибілізатора всередину (ПУВА-терапія); селективну фототерапію – комбінація середньохвильового (295-330 нм) і довгохвильового УФО; вузькохвильову фототерапію (довжина хвилі 311 нм) [219]. Фототерапія UVB променями спектра 311 нм має максимальну терапевтичну ефективність при мінімальній еритемі та дорівнює результатам лікування PUVA-терапією. Вузькосмугова UVB-терапія пригнічує синтез Тх1/Тх17 цитокінів у пацієнтів з помірними проявами псоріазу (зниження рівня ІЛ-12, ІЛ-17, ІЛ-20, ІЛ-22, ІЛ-23), що корелює з клінічним поліпшенням [217]. Продемонстровано, що UVB-терапія призводить до селективного апоптозу і повного виснаження Т-лімфоцитів в епідермісі, але мінімально впливає на дерму [113]. Інші дослідження показали, що вузькосмугове UVB опромінення при псоріазі призводить до апоптозу Т-лімфоцитів в епідермісі і дермі in vivo і in vitro [238], однак вплив не ангіогенез досліджено недостатньо.
Резюме. Науково-інформаційний пошук вітчизняної та зарубіжної літератури з даної проблеми показав, що недостатньо даних комплексного вивчення механізмів ангіогенезу і динаміки про- і протиангіогенних чинників в процесі клінічного спостереження за пацієнтами з різними формами псоріазу. Крім того, незважаючи на існуючі численні засоби і методи лікування дерматозу, деякі з них мають недостатню ефективність, істотними протипоказаннями є серйозні побічні дії, що обмежують їх застосування. Все це вимагає подальшого вивчення і патогенетичного обґрунтування необхідності пригнічення процесів ангіогенезу і запалення з включенням до лікувального комплексу терапевтичних засобів і вузькосмугової UVB-терапії, які мають патогенетичну дію, позбавлені побічних ефектів і економічно доступні для різних контингентів хворих.
Наведені у розділі положення відображено у наступній публікації:
- Лопандина А. А. Псориаз и психоэмоциональные расстройства. Дерматологія та венерологія. № 4 (74). С. 11–19 [59].
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
Досліджувану групу склали 114 хворих на псоріаз у віці 18-65 років, які проходили обстеження та лікування на базі ДУ «Інститут дерматології та венерології НАМН України» та КНП «Міський шкірно-венерологічний диспансер № 4» ХМР за період 2015-2018 рр. Діагноз встановлювався на підставі клініко-анамнестичних даних, результатів лабораторного обстеження згідно уніфікованого клінічного протоколу первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги «Псоріаз, включаючи псоріатичні артропатії» (2015).
Стандартне обстеження хворого на псоріаз включало збір анамнезу, огляд шкірного покриву та видимих слизових оболонок, визначення площі ураженої поверхні тіла (BSA – Body Surface Area), оцінку тяжкості і поширеності псоріазу за величиною PASI (Psoriasis Area and Severity Index), анкетування за шкалою SAPASI (Self-Administered Psoriasis Area and Severity Index), аналіз клініко-лабораторного обстеження пацієнта.
Для вирішення науково-дослідної мети проведено анкетування у 114 хворих опитувальниками якості сну і рівня депресії, імуноферментні дослідження 94 сироваток крові для визначення рівня СЕФР, ФНП α, ІЛ-8 і мелатоніну. Імуноферментний аналіз виконувався на базі центральної науково-дослідної лабораторії Харківської медичної академії післядипломної освіти до і після лікування. Контрольну групу склали 24 практично здорові особи віком 22-56 років, з них 12 чоловіків і 12 жінок.
Згідно Гельсінської декларації про права пацієнта, всіх обстежених осіб до початку дослідження в повному обсязі знайомили з метою, методологічними особливостями процедур дослідження, про що вони добровільно і власноручно підписали форму інформованої згоди на участь у цьому дослідженні. Протокол дослідження схвалено локальним етичним комітетом ДУ «Інститут дерматології та венерології НАМН України» від 31.05.2016 р.
Критерії включення пацієнта в дослідження:
- Чоловіки та жінки віком старше 18 років.
- Відсутність клінічно значущих відхилень від нормальних лабораторних показників (загальний аналіз крові, сечі, біохімічний аналіз крові).
- Діагноз: псоріаз, будь-які клінічні форми, в тому числі при наявності ураження суглобів.
- Заповнення і підпис пацієнтом інформованої угоди на участь в дослідженні, згідно Гельсінської декларації з прав пацієнта.
Критерії виключення пацієнта з дослідження:
- Загострення хронічних захворювань.
- Обтяжений онкологічний анамнез.
- Психічні захворювання – хронічні депресивні розлади, прояви
ендогенних психозів (маніакально-депресивний психоз, шизофренія), а також грубі органічні ураження центральної нервової системи, виражені зміни особистості і слабоумство.
- Непереносимість УФО і наявність захворювань, асоційованих з підвищеною чутливістю до УФО (пігментна ксеродерма, еритематоз, альбінізм, порфірії, меланома, синдром диспластичних невусів, синдром Горліна-Гольця).
Відповідно до поставленої мети і завдань сформовано вибірку хворих на псоріаз відповідно до критеріїв включення і виключення з дослідження. При оцінці ефективності різних схем терапії для забезпечення рівномірності розподілу пацієнтів по групах порівняння застосували метод рандомізації.
2.1 Методика загального обстеження хворих
Анамнестичні дані включали вік, освіту, професію, трудову діяльність, матеріальне становище, сімейний стан хворого, тривалість захворювання, сезонність, частоту рецидивів протягом року, наявність стресових подій життя, спадковий анамнез, наявність професійних шкідливих умов і негативних звичок (зловживання алкоголем, куріння), присутність супутніх захворювань і прийому препаратів.
При візуальному огляді хворого визначалася клінічна форма і стадія захворювання за допомогою оцінки (візуально, пальпаторно, методом пошкрябування) характеристик висипань: наявності епідермодермальних папул і бляшок зі сріблясто-білими лусочками на поверхні й вінчиком еритеми по периферії осередків («ободок Пильнова»), наявності або відсутності периферичного росту і злиття окремих елементів з утворенням великих осередків ураження, визначення триади класичних псоріатичних феноменів, позитивної ізоморфної реакції Кебнера, суб’єктивних симптомів (свербіж, печіння, відчуття стягування шкіри), наявності характерних змін нігтьових пластинок у вигляді точкових вдавлень (симптом «наперстка»), піднігтьового гіперкератозу, онихолізису, смугастості нігтьової пластини.
Ступінь вираженості симптомів псоріазу, тяжкість перебігу дерматозу, ефективність терапії визначали за допомогою індексів BSA та PASI. Індекс BSA (Body Surface Area) – показник відсотка площі ураженої поверхні, який обчислюється за формулою BSA (%) = 0,1*Ah + 0,2*Au + 0,3*At + 0,4*Al, де:
A – площа поверхні області тіла, ураженої псоріазом, яка розраховується за правилом «долоні», де площа долоні пацієнта становить 1% від загальної площі його шкіри; h – голова; u – верхні кінцівки; t – тулуб; l – нижні кінцівки.
Клінічна оцінка тяжкості перебігу псоріазу і ступеня вираженості ураження шкірного покриву оцінювалася шляхом підрахунку PASI – індексу поширеності і тяжкості псоріазу, що представляє собою систему оцінки площі ураження шкіри і вираженості основних симптомів псоріазу [147]. При визначенні PASI враховувалася вираженість ушкодження шкіри окремо в кожній з анатомічних областей тіла – голови, верхніх кінцівок, тулуба, нижніх кінцівок, так що загальне значення PASI представлялося як сума PASI цих чотирьох областей шкірного покриву. Розрахунки проводилися виходячи з того, що площа шкірного покриву голови становить 10 %, верхніх кінцівок – 20 %, тулуба – 30 %, нижніх кінцівок – 40 % від загальної поверхні шкіри людини. Для підрахунку індексу PASI кожної області в формулі використовувався певний коефіцієнт: 0,1 – для голови, 0,2 – для верхніх кінцівок, 0,3 – для тулуба, 0,4 – для нижніх кінцівок. При розрахунку PASI площа кожної з чотирьох областей шкірного покриву приймалася за 100 %. Площа поверхні шкіри, залученої в патологічний процес, позначалася літерою А і оцінювалась в кожній області (А голова, А тулуб, А верхні кінцівки, А нижні кінцівки) за спеціальною шкалою від 0 до 6: 0 – відсутність ураження шкіри, 0 % ураження шкіри певної області; 1 – ураження від 1 до 9 % поверхні шкіри анатомічної області; 2 – від 10 до 29 %; 3 – від 30 до 49 %; 4 – від 50 до 69 %; 5 – від 70 до 89 %; 6 – від 90 до 100 %. При визначенні поширеності ураження шкіри у хворих на псоріаз в області голови враховувалася площа ураження шкіри обличчя, волосистої частини голови і шиї, в області тулуба – площа ураження шкіри грудей, спини, пахвових складок, в області верхніх кінцівок – площа ураження шкіри кистей, передпліч, плечей, в області нижніх кінцівок – площа ураження шкіри сідниць, стегон, гомілок, стоп. Для визначення площі ураження кожної області застосовувалося правило «долоні». На шкірі голови площа ураження розміром в одну долоню приймалася рівною 10 %, тулуба – 3,3 %, верхніх кінцівок – 5 %, нижніх кінцівок – 2,5 % площі анатомічної області тіла.
Ступінь вираженості псоріатичних змін: еритеми, інфільтрації, лущення – оцінювалася за шкалою від 0 до 4, де 0 – відсутність змін, 1 – незначно виражені, 2 – помірно виражені, 3 – виражені, 4 – дуже виражені зміни. Виразність ознаки оцінювалася лікарем візуально і пальпаторно індивідуально у конкретного хворого.
Для кожної області визначався свій індекс за формулою: коефіцієнт анатомічної області × (еритема + лущення + інфільтрація) × площа ураженої шкіри. Після підрахунку індексу для кожної з чотирьох областей отримані показники підсумовують і отримують загальний сумарний індекс PASI:
PASI = 0,1 × (Е голова + І голова + Л голова) А голова + 0,3 × (Е тулуб + І тулуб + Л тулуб) А тулуб + 0,2 (Е верхні кінцівки + І верхні кінцівки + Л верхні кінцівки) × А верхні кінцівки + 0,4 × (Е нижні кінцівки + І нижні кінцівки + Л нижні кінцівки) × А нижні кінцівки,
де Е – числове значення вираженості еритеми, І – інфільтрації, Л – лущення, А – числовий показник площі ураження.
Мінімальне значення PASI становить 0, максимальне – 72. Псоріаз вважається легким, якщо значення PASI становить менше 10, середнього ступеня тяжкості – при значенні PASI від 10 до 20 і важким при значенні PASI більше 20.
Додатковим методом визначення ступеня тяжкості псоріатичного процесу стало анкетування хворих опитувальним листом SAPASI, структурно відповідним інструменту визначення площі і тяжкості псоріазу (PASI). SAPASI – індекс площі та тяжкості псоріатичних уражень, самостійно оцінюваних пацієнтом. Мінімальне значення SAPASI становить 0, максимальне – 72. Пацієнтам було запропоновано перелік питань про стан їх дерматозу без попереднього інструктажу з боку медперсоналу. Хворі повинні були оцінити колір, щільність, розмір псоріатичного ураження їх шкіри за допомогою трьох адаптованих шкал, представлених у вигляді ліній, на яких потрібно відзначити ступінь того чи іншого параметру. В даному опитувальнику, як і PASI, представлена оцінка окремих ділянок тіла, де голова, верхні кінцівки, тулуб і нижні кінцівки відповідають 10, 20, 30 і 40 % від загальної площі поверхні тіла.
Для оцінки площі ураженої поверхні пацієнтам було запропоновано умовний силует тіла людини спереду й ззаду, де було потрібно заштрихувати області, уражені псоріазом. Ступінь затемнення силуету оцінювалася від 0 до 6 балів відповідно до площі поразки від 0 до 100 % для кожної анатомічної області окремо. Розрахунку SAPASI відповідає формула:
SAPASI = [(0,1 × Ah) + (0,2 × Au) + (0,3 × At) + (0,4 × Al)] ×
[[4 × (VASe + VASi + VASs)]/ VAS length],
де Ah – площа ураження голови;
Au – площа ураження верхніх кінцівок;
At – площа ураження тулуба;
Al – площа ураження нижніх кінцівок;
VAS – візуальна аналогова шкала (e – еритема, i – інфільтрація, s – лущення), вимірюється в міліметрах (мм).
Оцінка ефективності терапії оцінювалася на підставі динаміки індексів BSA, PASI і SAPASI до і після курсу лікування. Ефективність проведеної терапії обчислювалася за такою формулою:
- (PASI до лікування – PASI після лікування) × 100 % / PASI до лікування.
Зниження індексу PASI менш ніж на 25 % – незначний ефект від проведеного лікування або його відсутність. Зниження індексу PASI % від 75 до 100 % – виражений клінічний ефект.
- (SAPASI до лікування – SAPASI після лікування) × 100 % / SAPASI до лікування.
Зниження індексу SAPASI менш ніж на 25% – незначний ефект від проведеного лікування або його відсутність. Зниження індексу SAPASI % від 75 до 100 % – виражений клінічний ефект.
Комплекс лабораторних методів проводився відповідно до загальноприйнятих стандартів в лабораторіях клінічних баз та включав: клінічне дослідження крові і сечі, проведення біохімічного дослідження крові (глюкоза крові, рівень білірубіну, холестерину, АЛТ, АСТ, загального білка, альбуміну, лужної фосфатази), ідентифікацію маркерів вірусних гепатитів В, С, обстеження пацієнта на наявність ВІЛ-інфекцію та сифілісу, дослідження калу на яйця гельмінтів. Біохімічні показники в динаміці спостереження визначали за уніфікованими методами. Оцінку одержаних лабораторних досліджень проводили згідно Міжнародної системи одиниць.
При необхідності, пацієнти проходили консультації суміжних фахівців: оториноларинголога, гастроентеролога, ендокринолога, кардіолога.
Залежно від застосованого методу терапії хворих на псоріаз поділено на дві групи: 1 група (n=30) лікувалися за розробленим методом, 2 група (n=26) – отримувала традиційну терапію.
2.2 Методи анкетування
Скринінгова оцінка психічного стану пацієнтів проводилась за допомогою шкали оцінки депресії Бека (Beck Depression Inventory, BDI), запропонованої американським психіатром Аароном Т. Беком (Aaron T. Beck) в 1961 році [117]. Ця методика розроблена на основі клінічних спостережень, дозволила виявити обмежений набір найбільш релевантних і значущих симптомів депресії та скарг, які найбільш часто висловлюють пацієнти.
Методика оцінки полягає в анкетуванні пацієнта за допомогою тест-опитувальника, що включає 21 питання – твердження про скарги, що найбільш часто зустрічаються, відпові специфічним проявам / симптомам депресії. Твердження ранжовані в міру збільшення питомої ваги симптому в загальному ступені тяжкості депресії. Кожен пункт шкали оцінюється від 0 до 3 балів відповідно до наростання тяжкості симптому. Підсумковий результат є загальною сумою балів.
Інтерпретація тесту: 0-9 – немає депресії; 10-15 – легка депресія (субдепресія); 16-19 – помірна депресія; 20-29 – виражена депресія (середня тяжкість); 30-63 – важка депресія.
Особам з ознаками депресії за скринінгом пропонувалася консультація психіатра. Пацієнти, що погодилися на консультацію, пройшли клініко-психопатологічне обстеження методом структурованого психіатричного інтерв’ювання, заснованого на ICD-10 для верифікації розладів депресивного спектру.
Хворі з виявленими розладами депресивного спектру включалися в дослідження при дотриманні основних етичних принципів – партнерства і інформованої згоди.
Оцінку порушення сну проводили за допомогою анкети бальної оцінки СХС, в якій якість сну характеризує загальна сума балів [101]: 22 бали – сон нормальний; 19-21 бали – граничні значення; менше 19 балів – порушення сну.
До суб’єктивних характеристиках сну, які пропонується оцінити пацієнтові за 5-бальною системою, відносять час засинання, тривалість сну, кількість нічних пробуджень і сновидінь, якість сну і ранкового пробудження.
Динаміку психічного стану і порушень сну у хворих на псоріаз, оцінювану методом анкетування, ми включили в критерії оцінки ефективності терапії.
2.3 Імуноферментні дослідження
Методом твердофазного імуноферментного аналізу (ІФА) за допомогою наборів «Альфа-ФНО-ИФА-БЕСТ» і «Интерлейкин-8-ИФА-БЕСТ» АТ Вектор-Бест (Новосибірськ, Росія) визначали рівень ФНП α і ІЛ-8, наборів «VEGF ELISA Kit» фірми Bender Medsystems (Австрія, Вена) – рівень СЕФР, набором «Melatonin ELISA» (IBL-International, Гамбург, Німеччина) – рівень мелатоніну в сироватці крові досліджуваної групи. Для отримання сироватки здійснювали забір венозної крові в обсязі 5-7 мл з ліктьової вени вранці натщесерце, після чого зразки відстоювали 3 години з подальшим глибоким заморожуванням до температури -18 ° С, до моменту повного укомплектування необхідної кількості проб.
ІФА є універсальним чутливим імунобіологічним методом для визначення речовин білкової природи. Серед безлічі модифікацій ІФА виділяють метод визначення за допомогою імуносорбентів, пов’язаних з ферментами (ELISA) і метод на основі фермент-імуновизначення, які є методами гетерогенного або твердофазного аналізу. Метод твердофазного аналізу заснований на двох принципах. Перший обумовлений здатністю ферментів та антитіл ковалентно або нековалентно пов’язаних з твердою основою, зберігати функціональну активність, другий – полягає у створенні кон’югату у вигляді комплексу антитіло-фермент, що зберігає біологічну активність в розчині. Сутність методу полягає у виявленні антигенів за допомогою відповідних їм антитіл, кон’югованих з ферментом-міткою (пероксидазою хрону, бета-галактозидазною або лужною фосфатазою). Після з’єднання антигену з міченою ферментом імунною сироваткою в суміш додають субстрат / хромоген. Субстрат розщеплюється ферментом і змінюється колір продукту реакції – інтенсивність забарвлення прямо пропорційна кількості зв’язаних молекул антигену і антитіл. ІФА застосовують для діагностики вірусних, бактеріальних і паразитарних хвороб, а також визначення гормонів, ферментів та інших біологічно активних речовин, що містяться в досліджуваному матеріалі в мінорних концентраціях – 1010-1012 г/л.
2.4 Дерматоскопічне дослідження
Цінним неінвазивним методом діагностики в загальній дерматології є дерматоскопія. Можливості використовуваного для діагностики обладнання при дерматоскопія дозволяють розглядати шкіру при дуже великому збільшенні (від х40 до х60).
Дерматоскопічне дослідження проводилося на відеодерматоскопі експертного класу Derm Doc при збільшенні від х20 до х40 до початку терапії (в стадії прогресування чи стаціонарній) і наприкінці лікування хворих. При дослідженні псоріатичної бляшки на осередок здійснювався мінімальний тиск лінзою відеодерматоскопа для збереження морфології судин шкіри, в якості імерсійного середовища використовувався гель для ультразвукового дослідження.
Судинні структури є найбільш важливою групою критеріїв у процесі дерматоскопічної оцінки запальних шкірних захворювань, тому адекватне знання судинного малюнка нормальної шкіри дозволяє виділити мікросудини при псоріазі, що відрізняються формою і розмірами. Під великим збільшенням (х40) в нормальній шкірі судини визначаються регулярно розсіяні по поверхні осередка червоні точки; при збільшенні х40 точки являють собою капіляри у вигляді ком, розташованих рівномірно в кожному сосочку дерми.
Однак слід враховували, що в деяких областях тіла дерматоскопічна картина судин може змінюватися, що пов’язано з особливостями їх будови (підошви, долоні, складки шкіри, деякі ділянки обличчя).
2.5 Статистичні методи дослідження
Для накопичення, зберігання, угруповання, первинного сортування, а також статистичної обробки отриманих даних використовувалися сучасні обчислювальні засоби і програмне забезпечення: пакет програм Statistica for Windows, табличний редактор Excel (Microsoft).
При нормальному розподілі кількісні показники були представлені у вигляді: середнє ± стандартна помилка (M±m). Оцінка значущості відмінності середніх значень і частоти прояву ознак в різних групах хворих проводилася за допомогою параметричного методу оцінки гіпотез t-Стьюдента. Вивчення зв’язку між якісними ознаками здійснювалося за допомогою таблиць спряженості та на їх основі непараметричного критерію c2-Пірсона та коефіцієнтів рангової кореляції Кенделла і Спірмена [41]. Відмінності вважали статистично значущими при p < 0,05.
РОЗДІЛ 3
КЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ НА ПСОРІАЗ
Під спостереженням знаходилися 114 хворих на псоріаз, з них чоловіків – 67 (58,8 %) і жінок – 47 (41,2 %). Вік пацієнтів, залучених у дослідження, варіював від 18 і до 65 років, при цьому середній вік склав (44,47 ± 1,84) років. Розподіл за статевою ознакою та віковими групами відображено в табл. 3.1.
Таблиця 3.1 – Розподіл хворих на псоріаз за статтю та віком
| Вік
(роки) |
Стать | Кількість
хворих, абс. / % |
|
| Чоловіки
абс. / % |
Жінки
абс. / % |
||
| 18-30 | 18 | 15 | 33 / 28,95 % |
| 31-40 | 8 | 7 | 15 / 13,17 % |
| 41-50 | 13 | 9 | 22 / 19,29 % |
| 51-65 | 28 | 16 | 44 / 38,59 % |
| Всього | 67 / 58,77 % | 47 /41,23 % | 114 / 100,0 % |
Серед хворих на псоріаз переважали чоловіки, причому їхня кількість в 1,4 раза перевищує частку жінок. Найбільшу частину – 44 (38,59 %) склали пацієнти старшого віку (51-65 років), найменшу – хворі 31-40 років ([15 – 13,17 %]). Кількість хворих віком від 18 до 30 років складає 33 (28,95 %) особи (18 чоловіків та 15 жінок). Таким чином, превалює кількість хворих старше за 30 років ([81 – 71,05 %]), тобто людей активного працездатного віку.
Середній вік початку захворювання склав (29,77 ± 1,61) року, при тому, що у 22 пацієнтів (19,3 %) перші ознаки маніфестації дерматозу з’явилися до 18 років, у 50 хворих (43,86 %) – від 19 та 30 років, у 42 (36,84 %) – після 30 років.
Дані «соціального» анамнезу представлено в табл. 3.2.
Таблиця 3.2 – Розподіл хворих на псоріаз з урахуванням соціальних категорій
| Соціальна категорія | Вікові групи | ||||
| 18-30 (n=33) | 31-40 (n=15) | 41-50 (n=22) | 51-65 (n=44) | ||
| Сімейний стан | У шлюбі | 13 | 8 | 15 | 14 |
| Самотні | 15 | 5 | 4 | 19 | |
| Розлучені | 5 | 2 | 3 | 11 | |
| Освіта | Вища | 6 | 11 | 17 | 11 |
| Середня | 13 | 15 | 14 | 17 | |
| Не закінчена | 5 | 3 | – | 2 | |
| Трудова
діяльність |
Працюють / навчаються | 28 | 11 | 13 | 17 |
| Утриманці / інваліди | 5 | 4 | 9 | 27 | |
| Матеріальне становище | Високий достаток | 2 | 5 | 7 | 3 |
| Середній достаток | 25 | 12 | 16 | 10 | |
| Достаток нижче середнього | 4 | 5 | 7 | 18 | |
Вивчення соціодемографічних показників у хворих на псоріаз дозволило виявити деякі особливості. Так, у шлюбі перебували 50 (43,86 %) осіб, самотніх та розлучених було 64 (56,14 %) хворих. Вищу і середню освіту мали відповідно 45 (39,47 %) і 59 (51,75 %) пацієнтів, незакінчену – 10 (8,78 %) пацієнтів. Більшість хворих ([69 – 60,52 %]) працювали чи навчалися, 45 (39,48 %) – були на утриманні чи мали інвалідність. Високий і середній матеріальний достаток відзначали відповідно 17 (14,91 %) і 63 (55,26 %) хворих, достаток нижче за середній – 34 (29,83 %) пацієнтів.
Серед хворих на псоріаз були робочі (24,56 %), службовці (15,78 %), студенти (18,42 %), пенсіонери (22,9 %), тимчасово не працюючі (18,42 %) (табл. 3.3). У 11 людей з 48 працюючих хворих (22,9 %) була робота в нічну зміну.
Таблиця 3.3 – Розподіл хворих на псоріаз за видом трудової діяльності з урахуванням вікових груп
| Вид трудової діяльності | Вік хворих на псоріаз, роки | Усього | |||
| 18-30 | 31-40 | 41-50 | 51-65 | ||
| Робочі | 4 | 4 | 9 | 11 | 28 |
| Службовці | 2 | 6 | 4 | 6 | 18 |
| Студенти | 21 | – | – | – | 21 |
| Пенсіонери | – | – | 5 | 21 | 26 |
| Тимчасово не працюючі | 6 | 5 | 4 | 6 | 21 |
Вивчення анамнезу у хворих на псоріаз, дозволило встановити різноманітні провокуючі фактори (рис. 3.1).
Рисунок 3.1 – Чинники, що провокують псоріаз
До найбільш частих тригерних факторів, пов’язаних із початком або загостренням псоріатичного процесу, відносилися психоемоційні навантаження і стреси, які було зареєстровано у 66 хворих (57,8 %), інфекційні і запальні захворювання ротової порожнини та ЛОР-органів (фарингіт, тонзиліт, гайморит) у 14 (12,28 %) пацієнтів. Тих, хто вагався із відповіддю про провокуючі причини початку псоріазу та його рецидиви, було 25 (21,93 %) (рис. 3.1).
Обтяжений спадковий анамнез виявлено у 17 (14,9 %) хворих, серед яких двоє мали обох хворих на псоріаз батьків.
За тривалістю захворювання досліджувана група пацієнтів розподілилася таким чином: тривалість псоріазу менше року – 9 (7,9 %) хворих, від 1 до 5 років – 16 (16,67 %) , від 5 до 10 років – 29 (25,44 %) хворих. Значна частина обстежених – 60 (52,63 %) хворіли на псоріаз довше 10 років (табл. 3.4).
Таблиця 3.4 –Тривалість захворювання псоріазом
| Тривалість
хвороби (роки) |
Хворі на псоріаз | |||||
| чоловіки | жінки | разом | ||||
| абс. | % | абс. | % | абс. | % | |
| до 1 | 5 | 4,39 | 4 | 3,51 | 9 | 7,9 |
| 1-5 | 9 | 7,9 | 7 | 6,14 | 16 | 16,67 |
| 5-10 | 18 | 15,78 | 11 | 9,65 | 29 | 25,44 |
| більше 10 | 35 | 30,7 | 25 | 21,93 | 60 | 52,63 |
| Всього | 67 | 58,77 | 47 | 41,23 | 114 | 100,0 |
Перші прояви захворювання починались на різних етапах життя: у 37 (32,5 %) хворих віком 21-30 років, у 34 (29,8 %) – 11-20 років. Пацієнти з початком псоріазу на 4-му, 5-му і 6-му десятиріччах життя, розподілилися приблизно по 12 %. Лише у 2,63 % початок псоріазу був у молодшому віці (рис. 3.2).
Рисунок 3.2 – Вік початку хвороби
Залежно від сезонності захворювання псоріаз поділявся на зимовий (62,9 %), літній (29,3 %) та змішаний (7,8 %) типи (рис. 3.3).
Рисунок 3.3 – Розподіл хворих на псоріаз залежно від сезонності загострень
Залежно від кількості рецидивів псоріазу на рік, у більшості – 66 (57,9 %) пацієнтів загострення дерматозу спостерігалось двічі на рік, у 33 (28,95 %) – частіше (3 і більше), тобто мало безперервно рецидивуючий перебіг, у 15 (13,67 %) хворих псоріаз рецидивував один раз на рік і рідше (рис. 3.4).
Рисунок 3.4 – Частота рецидивів на рік
Ураження шкіри представлено блідо- чи яскраво-рожевими папулами і бляшками різного розміру на обмежених ділянках шкіри або з більш поширеним розташуванням, які нерідко супроводжувалися свербежем різного ступеня інтенсивності. При огляді деяких пацієнтів звертало на себе увагу майже повне ураження шкірного покриву (еритродермія). Крім шкірних проявів у частини обстежуваних були скарги на біль і набряклість суглобів. Локальний статус дерматозу відповідав клінічній формі псоріазу.
В дослідження включено хворих на псоріаз із різними клінічними формами (табл. 3.5).
Таблиця 3.5 – Розподіл хворих за клінічними формами псоріазу
| Вік,
роки |
Стать | Клінічні форми | ||
| вульгарний псоріаз | артропатичний псоріаз | псоріатична еритродермія | ||
| 18-30 | чоловіки | 15 | 2 | 1 |
| жінки | 15 | – | 1 | |
| 31-40 | чоловіки | 7 | 1 | – |
| жінки | 3 | 2 | 2 | |
| 41-50 | чоловіки | 8 | 5 | 1 |
| жінки | 7 | 2 | – | |
| 51-65 | чоловіки | 23 | 4 | 3 |
| жінки | 11 | 3 | 2 | |
Найчисленнішу групу склали пацієнти з вульгарним псоріазом – 87 (76,32 %), серед них 30 (26,32 %) віком від 18 до 30 років, 10 (8,77 %) – від 31 до 40 років, 15 (13,16 %) – віком 41-50 років та найбільшу частку – 34 (29,83 %) склали пацієнти літньої вікової групи від 51 до 65 років. У 19 пацієнтів встановлено артропатичний псоріаз, найчастіше у віці 41-50 років. Псоріатична еритродермія діагностована у 10 хворих, частіше у чоловіків старше 50 років.
У свою чергу, серед хворих на звичайний (вульгарний) псоріаз прояви бляшкового псоріазу зустрічались у 64 (73,56 %) осіб, ознаки себорейного псоріазу виявлено у 9 (10,35 %) хворих, клінічні прояви інверсного псоріазу діагностовано у 6 (5,26 %) пацієнтів, ексудативного псоріазу – у 8 (9,2 %) хворих (рис. 3.5).
Рисунок 3.5 – Клінічні різновиди вульгарного псоріазу
Основними клінічними проявами бляшкового псоріазу були папули і бляшки з помірною або вираженою інфільтрацією, велико- і дрібнопластинчастим лущенням на поверхні різної інтенсивності. Найчастіше (75,3 % випадків) висип розташовувався на верхніх та нижніх кінцівках, в зоні розгинальної поверхні суглобів, попереково-крижової ділянки, рідше на волосистій частині голови, шкірі тулуба і сідниць (у 24,7 % хворих). Патологічний процес, як правило, мав симетричний характер. Відзначено тенденцію до злиття папул у великі осередки химерної форми. У зоні хронічної травматизації нерідко спостерігалась ізоморфна реакція Кебнера.
У хворих на себорейний псоріаз місцем переважного ураження була волосиста частина голови, «себорейна» зона грудей та спини. Висип мав менш виражену інфільтрацію, але більш рясне лущення. Крім ураження скальпу, хворі пред’являли скарги на погіршення стану волосся у вигляді стоншування.
Прояви інверсного псоріазу полягали в розташуванні псоріатичного висипу в інтертригінозних зонах: під молочними залозами, в аксилярних ямках, пахових складках, нерідко з ускладненням у вигляді мокнуття, вторинного інфікування.
Хворі на ексудативний різновид псоріазу мали висип з характерними серозними й серозно-гнійними корками. Даний клінічний перебіг псоріазу зустрічався у пацієнтів із супутнім цукровим діабетом.
У 18 (15,79 %) хворих, крім висипу на тулубі, відзначені зміни на шкірі кистей та стоп у вигляді ізольованого або синхронного ураження кінцівок, які проявляються ущільненням, сухістю аж до вираженого гіперкератозу і тріщинами на долонній та підошовній поверхнях. У таких хворих часті патологічні зміни нігтів, а також поєднання з псоріатичною артропатією.
У 33 (29,9 %) обстежених хворих до початку лікування діагностована прогресуюча стадія псоріазу, для якої характерна поява свіжих висипань, продовження росту вже існуючих дрібних папул та бляшок. Забарвлення елементів висипу відрізнялось значною яскравістю рожево-червоного кольору. Лущення зі сріблясто-білими лусочками, особливо помітними в центральній частині псоріатичного елементу, з гіперемічною облямівкою по периферії, що відповідає зоні росту (ободок Пильнова). При зішкрібанні елементів висипу з’являлась патогномонічна для псоріазу триада симптомів, визначилась ізоморфна реакція. У 81 (70,1 %) хворих діагностована стаціонарна стадія, при якій периферичний ріст бляшок зупинявся, відсутні нові висипи, змінювалися яскравість та колір бляшок, які ставали застійно-червоного відтінку. При цій стадії нерідко зустрічався блідий ободок псевдоатрофії (ободок Воронова).
Дерматоскопічна картина типового елементу відповідала умовним ознакам псоріатичної бляшки: рівномірні точкові судини на фоні еритеми, слюдяне лущення в центрі елемента висипу. Залежно від стадії псоріазу спостерігались деякі відмінності дерматоскопічної картини. Так, в прогресуючу стадію судини мали вигляд пухких клубочків на яскраво-червоному фоні, з рясним сріблястим лущенням (рис. 3.6). В стаціонарну стадію розподіл судин в полі зору був не такий щільний, клубочки були більш щільні за рахунок звуження просвіту судин, фон виглядав рожевим або блідо-рожевим з незначним або відсутнім лущенням (рис. 3.7).
Рисунок 3.6 – Дерматоскопічна картина псоріатичної бляшки (прогресуюча стадія)
Рисунок 3.7 – Дерматоскопічна картина псоріатичної бляшки (стаціонарна стадія)
У 34 (29,82 %) хворих досліджуваної групи виявлено ознаки псоріатичного уражения нігтів у вигляді поперечної і поздовжньої смугастості нігтьових пластинок, оніхошизісу, точкових вдавлень за типом «наперстка», дистального оніхолізису, піднігтьового гіперкератозу, наявність точок за типом «масляної плями» (рис. 3.8). Дослідження на дерматофіти виключало інфекційну природу оніходистрофій.
Рисунок 3.8 – Дерматоскопічна картина псоріатичного ураження нігтів
У дослідження включено пацієнтів з легкими, середніми (помірними) й важкими формами псоріазу, відповідно 18 (20,69 %), 51 (58,62 %) і 18 (20,69 %). Оцінка ступеня тяжкості дерматозу проводилась з використанням індексів BSA, PASI, SAPASI (табл. 3.6).
Таблиця 3.6 – Ступінь тяжкості вульгарного псоріазу за BSA, PASI, SAPASI
| Ступінь тяжкості | BSA, % | PASI, бали | SAPASI, бали |
| Легкий (n=18) | 8,3 ± 0,6 | 8,5 ± 0,4 | 6,9 ± 0,7 |
| Помірний (n=51) | 17,4 ± 0,9 | 15,5 ± 1,0 | 18,3 ± 0,4 |
| Тяжкий (n=18) | 43,2 ± 2,6 | 21,2 ± 1,1 | 32,4 ± 1,6 |
Розподіл хворих за ступенем тяжкості захворювання залежав від значення площі уражения (BSA), площі й вираженості уражения шкіри (PASI, SAPASI). Так, середнє значення BSA у пацієнтів з легким ступенем тяжкості псоріазу склало (8,31 ± 0,58) %, PASI – (8,50 ± 0,44) бала і SAPASI – (6,94 ± 0,69) бала; у пацієнтів з помірним псоріазом середній показник BSA (17,43 ± 1,07) %, PASI – (15,52 ± 0,99) бала і SAPASI – (18,25 ± 0,42) бала; у хворих з тяжкимм псоріазом, відповідно, BSA – (43,2 ± 2,59) %, PASI – (21,23 ± 0,57) бала, SAPASI – (32,40 ± 1,62) бала. Середне значення BSA у хворих на псоріаз в цілому склало (19,3 ± 5,25) %, PASI – (17,8 ± 5,10) бала, SAPASI – (20,4 ± 6,16) бала.
Артропатичний псоріаз виявлено у 19 (16,67 %) хворих, у 12 чоловіків і 7 жінок. Дві тритини хворих артропатичним псоріазом склали пацієнти старше 40 років. У пацієнтів, поряд з шкірними проявами, відзначалася гіперемія в ділянці суглобів, набряклість, болючість при пальпації, під час руху, ранкова скутість, обмеження рухливості, в ряді випадків деформація суглобів. Найбільш часто, у 10 (8,77 %) хворих було уражено дистальні міжфалангові суглоби кистей і стоп у вигляді оліго- і поліартритів. У 6 (5,26 %) хворих діагнастовано ураження колінних суглобів, у 3 (2,63 %) пацієнтів діагностовано ознаки ураження хребта.
Псоріатична еритродермія діагностована у 10 (8,77 %) пацієнтів, у 5 чоловіків та 5 жінок. Основними провокуючими факторами прогресування хвороби в еритродермію визначено алкогольну інтоксикацію, неадекватне самолікування пролонгованими системними стероїдами, застосування бета-блокаторів. При огляді звертали на себе увагу поширене ураження шкірного покриву у вигляді яскраво-червоної гіперемії, значної сухості та лущення. Хворі пред’являли скарги на хворобливість та відчуття печіння шкіри, а також порушення загального самопочуття, підвищення температури тіла до фебрильних цифр, озноб та слабкість.
У 96 (84,21 %) хворих виявлено супутню патологію (табл. 3.7). Переважна кількість хворих вказувала серцево-судинну патологію – 45 (39,47 %) з діагнозом артеріальна гіпертензія, ішемічна хвороба серця, захворювання периферичних судин (варикозна хвороба, тромбофлебіт). Хронічний гастродуоденіт, холецистит, виразкову хворобу дванадцятипалої кишки, хворобу Крона вказали 34 (29,8 %) хворі. Ендокринна супутня патологія (цукровий діабет, хронічний тиреоїдит, гіпотиреоз) діагностовано у 9 (7,9 %), захворювання сечостатевої системи – у 17 (14,9 %) хворих. У 12 (10,5 %) осіб визначено хвороби бронхолегеневої системи (хронічний бронхіт, емфізема, обструктивні захворювання). У 9 хворих на псоріаз (7,9 %) виявлено психічні хвороби, серед них алкогольна залежність у 5 пацієнтів різних вікових підгруп (1 жінка і 4 чоловіки), органічний емоційно-лабільний розлад особистості внаслідок закритої черепно-мозкової травми у одного пацієнта та органічний астенічний розлад особистості у 3 хворих старшої вікової групи (51-65 років).
Таблиця 3.7 – Розподіл хворих на псоріаз за наявності супутніх захворювань
| Супутні
захворювання |
Хворі на псоріаз (n=114) | Усього
абс. / % |
|||||||
| 18-30 | 31-40 | 41-50 | 51-65 | ||||||
| ч. | ж. | ч. | ж. | ч. | ж. | ч. | ж. | ||
| Серцево-судинні захворювання | – | – | 3 | 2 | 7 | 4 | 16 | 13 | 45 /
39,5 |
| Захворювання
шлунково-кишкового тракту |
2 | 7 | 6 | 5 | 2 | 3 | 5 | 4 | 34 /
29,8 |
| Ендокринні захворювання | – | 1 | 1 | 1 | – | 2 | 1 | 3 | 9 /
7,9 |
| Захворювання бронхо-легневої системи | 2 | 1 | 2 | – | 3 | 1 | 2 | 1 | 12 /
10,5 |
| Захворювання сечо-статевої системи | 1 | 3 | – | 4 | 1 | 2 | 3 | 3 | 17 /
14,9 |
| Психічні захворювання |
– | – | 1 | – | 3 | 1 | 3 | 1 | 9 /
7,9 |
Скарги на порушення уваги, настрою, підвищену тривожність, дратівливість, занижену самооцінку, порушення сну та інші психоемоційні зрушення різного ступеня вираженості пред’являли 99 (86,84 %) хворих. Ці пацієнти пред’являли скарги на інтенсивний стабільний свербіж, в тому числі в нічний час. Шкірні прояви дерматозу, як правило, носили поширений характер, з ураженням волосистої частини голови, зовнішніх статевих органів і відкритих ділянок тіла. У основної частки хворих із супутньою психосимптоматикою діагностовано прогресуючу стадію псоріазу з двома і більше рецидивами хвороби на рік. Всі хворі на псоріаз з еритродермією і артропатією мали порушення сну та інші психічні розлади.
Дві третини досліджуваної групи хворих раніше проходили лікування з приводу псоріазу. Проведена терапія включала протизапальні, гіпосенсибілізуючі, седативні, антигістамінні препарати, вітаміни групи В. Кілька хворих (9,7 %) на середньоважкий і важкий псоріаз проходили курси імуносупресивної терапії (метотрексат). П’ятеро пацієнтів проходили курс біологічної терапії (етанерцепт) з вираженою позитивною динамікою.
Попередня зовнішня терапія хворих на псоріаз включала ТГКС і кератолітичні засоби, у кількох хворих в анамнезі було використання топічних інгібіторів кальциневрину і аналогів вітаміну D3. У 17 (14,9 %) хворих в анамнезі було застосування фототерапії вузькосмуговими UVB-лампами (довжиною хвилі 311 нм). Проведене раніше лікування в тій чи іншій мірі давало позитивні зрушення в перебігу дерматозу, однак, через деякий час, у цих хворих наступав новий рецидив захворювання, часом з прогресуванням процесу.
Для оцінки впливу розробленої терапії хворих на вульгарний псоріаз було рандомізовано на дві групи. Перша група включала 26 пацієнтів у віці від 20 до 65 років, в тому числі чоловіків – 15, жінок – 11. Середній вік хворих цієї групи склав (41,0±2,6) роки. Друга група складалася з 30 хворих у віці від 18 до 55 років, з них 16 чоловіків і 14 жінок, з середнім віком пацієнтів (37,0±2,2) роки (табл. 3.8).
Таблиця 3.8 – Характеристика груп хворих на псоріаз до лікування (M±m)
| Показники | Хворі на вульгарний псоріаз | |
| 1 група (n=26) | 2 група (n=30) | |
| Віковий діапазон, роки
Середній вік, роки Співвідношення чоловіків та жінок BSA PASI SAPASI |
20 – 65
41,0 ± 2,6 14 : 12 19,6 ± 5,2 17,8 ± 5,1 20,9 ± 6,2 |
18 – 55
37,0 ± 2,2 16 : 14 18,8 ± 4,9 18,1 ± 3,9 21,2 ± 6,9 |
При лабораторному обстеженні виявлено помірні відхилення в результатах загальноклінічних аналізів: підвищення гострофазових показників (ШОЕ, С-реактивний білок) у 29 (25,4 %) пацієнтів з псоріатичною артропатією та еритродермією; зміни у біохімічних показниках (трансамінази печінки, білірубін, лужна фосфатаза) мали місце у 18 (15,8 %) хворих із супутніми захворюваннями шлунково-кишкового тракту. Рівень глюкози крові і глікованого гемоглобіну був підвищений у 23 (20,2 %) хворих на псоріаз із супутньою артеріальною гіпертензією, переважно у пацієнтів з ознаками абдомінального ожиріння.
Наводимо спостереження за хворими вульгарним псоріазом.
Клінічний випадок 1.
Хворий С., 61 рік, в минулому службовець, нині пенсіонер. Спостерігався з діагнозом вульгарний псоріаз в стадії прогресування в КНП «Міський шкірно-венерологічний диспансер № 4» Харківської міської ради. Пред’являв скарги на поширений сверблячий висип, зміна форми нігтьових пластинок кистей. Скарги на поганий сон, часту дратівливість та напади тривожності. Початок захворювання 36 років тому після психотравми. Перебіг дерматозу хронічний рецидивуючий, із періодами загострення в осінньо-зимовий період. Періодично проходив курси гіпосенсибілізуючої терапії, вітаміни, застосовував зовнішньо топічні кортикостероїдні мазі, бальнеотерапія. Відзначав помірний результат від амбулаторного лікування та гарний результат після санаторного лікування у моря.
Супутні захворювання: гіпертонічна хвороба, емфізема легенів, хронічний холецистит.
Шкідливі звички: паління.
При огляді: дерматоз носить поширений характер. На шкірі волосистої частини голови, попереку з переходом на ділянку сідниць, розгинальній поверхні верхніх та нижніх кінцівок поширений еритематозно-сквамозний висип з обідком гіперемії, який місцями (ділянка сідниць) зливається у великі фігурні бляшки. Відзначається виражене лущення по центру елементів висипу (рис. 3.9). Псоріатична триада позитивна. Нігтьові пластинки пальців кистей сплощені, на поверхні пластин візуалізуються точкові вдавлення за типом «наперстка».
При дерматоскопії псоріатичного висипу – однорідні точкові судини у вигляді пухких клубочків на яскраво-рожевому фоні, що відповідає прогресуючій стадії вульгарного псоріазу (рис. 3.10).
Діагноз: псоріаз вульгарний, зимова форма, стадія прогресування.
BSA 17 %, PASI 16 балів, SAPASI 17 балів.
Рівні СЕФР – 382 пг/мл, ІЛ-8 – 112 пг/мл, ФНП α – 51 пг/мл, мелатоніну – 17 пг/мл (до лікування).
Хворому призначено Віта-мелатонін в дозі 3 мг на добу за 30 хвилин до сну протягом 1 місяця в комплексі з традиційною терапією (внутрішньовенно реосорбілакт 200,0, внутрішньом’язово 25 % розчин сірчанокислої магнезії 10,0 мл, перорально антраль по 1 таблетці тричі на день, зовнішня терапія – мазь і лосьон, що містять бетаметазону дипропіонат і саліцилову кислоту, крем мометазону фуроат, емолієнти).
У результаті проведеного лікування наступила помітна позитивна динаміка з боку шкірних проявів (зниження індексів BSA, PASI, SAPASI від 40 до 50 %), регресував свербіж, покращилася якість сну.
Рисунок 3.9 – Хворий С., 61 рік, вульгарний псоріаз
Рисунок 3.10 – Дерматоскопічна картина псоріатичної бляшк и у стадії прогресування у хворого С., 61 року
и у стадії прогресування у хворого С., 61 року
Рівень СЕФР – 267 пг/мл, ІЛ-8 – 61 пг/мл, ФНО α – 36 пг/мл, мелатонін – 22 пг/мл (після лікування).
Клінічний випадок 2.
Хворий В., 49 років, приватний підприємець, спостерігався з діагнозом вульгарний псоріаз в стадії прогресування в КНП «Міський шкірно-венерологічний диспансер № 4» Харківської міської ради.
Скарги на поширений сверблячий висип, зміну нігтьових пластинок кистей, проявляв стурбованість своїм зовнішнім виглядом, пов’язував із цим проблеми в особистому житті. Початок захворювання 13 років тому після тривалого періоду стресів. Перебіг хронічний рецидивуючий, із загостреннями в осінньо-зимовий період. Проходив амбулаторне лікування нечасто. Терапія включала гіпосенсибілізуючі препарати, вітаміни, зовнішньо застосовував топічні кортикостероїдні мазі, зволожуючі засоби. Відзначав помірний результат від амбулаторного лікування та регрес шкірних проявів в літній період.
Шкідливі звички заперечує.
При огляді: поширений дерматоз. На шкірі голови, тулуба, кінцівок великі еритематозно-сквамозні яскраво-рожеві бляшки, вкриті сріблястим лущенням, деякі з вираженою інфільтрацією. Псоріатична триада позитивна (рис. 3.11). Нігтьові пластинки декількох пальців кистей тьмяні, є точкові зміни за типом «масляної плями» (рис. 3.12).
Діагноз: псоріаз вульгарний, зимова форма, стадія прогресування. BSA – 20 %; PASI – 20 балів; SAPASI – 21 бал.
Рівень СЕФР – 744 пг/мл, ІЛ-8 – 80 пг/мл, ФНП α – 112 пг/мл, мелатоніну – 12 пг/мл (до лікування).
Хворому призначено мелатонін в дозі 3 мг на добу за 30 хвилин до сну протягом місяця в комплексі з традиційною терапією (внутрішньовенно реосорбілакт 200,0, внутрішньом’язово 25 % розчин сірчанокислої магнезії 10,0 мл, перорально антраль по 1 таблетці тричі на день, зовнішня терапія – мазь і лосьон, що містять бетаметазону дипропіонат і саліцилову кислоту, крем мометазону фуроат, емолієнти), UVB-фототерапія за схемою.
Рисунок 3.11 – Хворий В., 49 років, вульгарний псоріаз
Рисунок 3.12 – Нігтьові пластинки хворого В., 49 років, вульгарний псоріаз
У результаті проведеного лікування настала позитивна динаміка з боку шкірних проявів (зниження індексів BSA, PASI, SAPASI до 70 %), регресував свербіж, поліпшився настрій.
Рівень СЕФР – 205 пг/мл, ІЛ-8 – 61 пг/мл, ФНП α – 25 пг/мл, мелатонін – 26 пг/мл (після лікування).
Резюме. Серед хворих на псоріаз чоловіків виявилося в 1,4 раза більше, ніж жінок. Незначно переважала кількість самотніх та розлучених хворих (56,1 %), більшість (91,1 %) пацієнтів мали вищу та середню освіту. Найчастіше (у 32,5 % випадків) дебют захворювання визначено у період 21-30 років, крім того 52,6 % хворих страждають на псоріаз 10 років і довше. Серед причин загострення дерматозу 57,8 % пацієнтів відзначали психоемоційне навантаження і стреси. Самим розповсюдженим виявився зимовий тип псоріазу (62,9 %), найчастіше рецидиви виникали двічі на рік у 57,9 % хворих. Найбільша кількість хворих (76,3 %) мала звичайний псоріаз, з перевагою бляшкової форми (73,6 %). Встановлено різноманітні клінічні прояви дерматозу, обумовлені локалізацією і характером висипів поширеністю шкірного процесу такі як себорейний, інверсний, ексудативний псоріаз.
Встановлено різноманітні клінічні прояви дерматозу, обумовлені локалізацією і характером висипів, поширеністю шкірного процесу (себорейний, інверсний, ексудативний псоріаз).
Серед коморбідних станів найчастіше зустрічалися захворювання серцево-судинної системи (39,5 %), психічні хвороби виявлено у 7,9 % хворих. Скарги на порушення уваги, настрою, підвищену тривожність, дратівливість, занижену самооцінку, порушення сну та інші психоемоційні зрушення різного ступеня вираженості визначено у 86,8 % хворих. При розладах психічного стану встановлено клінічні особливості псоріазу у вигляді розповсюджених форм із ураженням відкритих частин тіла, шкіри скальпу, зовнішніх статевих органів, в стадії прогресування у хворих з довгим (більше 10 років) терміном захворювання.
При розладах психічного стану визначено клінічні особливості псоріазу у вигляді розповсюджених форм із ураженням відкритих частин тіла, шкіри скальпу, зовнішніх статевих органів, стадії прогресування, тривалістю дерматозу більше 10 років.
Наведені у розділі положення відображено у наступних публікаціях:
- Кардиоваскулярный риск при иммуноопосредованных дерматозах / Л. А. Болотная, Е. И. Сариан, А. А. Лопандина, В. М. Сидельник. Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции: материалы научн. конф., посвященной 155-летию со дня рождения проф. М. В. Типцева, 18 ноября 2015 г. Харьков, 2015. С. 12-18 [38].
- Саріан О. І., Лопандіна А. О. Особливості псоріазу з ураженням кистей і стоп. Новітні тенденції лікування та профілактики дерматовенерологічних проблем в рамках доказової медицини : матеріали наук.-практ. конф.,13-15 квітня 2016 р. Львів, 2016. С. 96-97 [85].
- Сариан Е. И., Лопандина А. А. Уровень глюкозы крови и гликированного гемоглобина у больных псориазом. Місце дерматовенерології в міждисциплінарному вирішенні питань діагностики та лікування хронічних захворювань : матер. наук.-прак. конф., 20-21 березня 2017 р. Київ, 2017. Дерматовенерологія. Косметологія і Сексопатологія. 2017. № 1-2 (5). С. 116 [88].
РОЗДІЛ 4
СТАН АНГІОГЕНЕЗУ У ХВОРИХ НА ПСОРІАЗ
Дослідження останніх років, присвячені динаміці прогресування псоріазу, показали, що одним з найважливіших факторів патогенезу є незбалансована васкуляризація. Клітинні та молекулярні механізми, що лежать в основі патологічного ангіогенезу, інтенсивно вивчаються в дерматології (червоний плоский лишай, алопеція та ін.) [121, 234].
Головним механізмом регуляції процесів ангіогенезу є вивільнення ангіогенних факторів, під їх дією відбувається активація ендотеліоцитів і міграція за межі базальної мембрани з формуванням відгалужень основних судин. У здоровому організмі існує баланс між активаторами (СЕФР, ТФР β, ФНП α, інсуліноподібний фактор росту I, ІЛ-1, -6, -8) та інгібіторами росту (розчинні рецептори СЕФР, інтерферони α, β, γ, вазостатин, ендостатин, ангіопоетин-2 та ін.) нових кровоносних судин, при багатьох захворюваннях організм втрачає контроль над утриманням рівноваги [52, 125].
Нечисленні роботи присвячені вивченню окремих факторів ангіогенезу при звичайному псоріазі [20, 68, 86, 148], тому потребує уточнення стан ангіогенезу з вивченням регулюючих факторів при різних формах псоріазу.
4.1 Характеристика проангіогенних факторів (судинного
ендотеліального фактора росту, фактора некрозу пухлини α,
інтерлейкіну‑8) у хворих на псоріаз
Рівень СЕФР в сироватці крові хворих на псоріаз коливався від 146,7 до 812,5 пг/мл, в середньому склав (304,24 ± 32,16) пг/мл і достовірно відрізнявся від показника у практично здорових осіб ([52,17 ± 4,22] пг/мл, р < 0,01), який варіював в межах 36,57–89,05 пг/мл. Більш, ніж у 80 % хворих вміст СЕФР перевищував 200 пг/мл (більш ніж втричі відносно контрольної групи).
Результати визначення рівня СЕФР у хворих з різними клінічними формами псоріазу представлені в табл. 4.1.
Таблиця 4.1 – Вміст судинного ендотеліального фактора росту в крові хворих з різними клінічними формами псоріазу (M ± m)
| Групи обстеження | СЕФР, пг/мл | р |
| Хворі на псоріаз:
звичайний псоріаз, n=76 артропатичний псоріаз, n=13 еритродермія, n=5 |
241,53 ± 29,26
289,41 ± 35,37 722,98 ± 85,37 |
< 0,01 < 0,01 < 0,01 |
| Контрольна група, n=24 | 52,17 ± 4,22 | – |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи.
Проведені дослідження виявили підвищення вмісту СЕФР у хворих на звичайний псоріаз в 4,5 раза, еритродермію – в 13 і артропатичний псоріаз – в 5,5 раза відносно показника у практично здорових осіб. У хворих на звичайний псоріаз рівень СЕФР коливався від 150,9 до 332,16 пг/мл, в середньому був (241,53 ± 29,26) пг/мл. У пацієнтів з артропатичним псоріазом коливання СЕФР спостерігалися в межах від 146,7 до 418,42 пг/мл із середнім значенням (289,41 ± 35,37) пг/мл. У групі хворих з еритродермією коливання рівня СЕФР було від 247,16 до 812,5 пг/мл, середнє значення склало (722,98 ± 85,37) пг/мл. Дані визначення рівня СЕФР в крові хворих з урахуванням клінічних проявів звичайного (вульгарного) псоріазу представлені в табл. 4.2.
Ступінь зміни СЕФР при звичайному псоріазі залежав від стадії, поширеності, тяжкості і частоти рецидивів дерматозу. Встановлено суттєве підвищення рівня СЕФР у хворих в прогресуючу стадію дерматозу в порівнянні зі стаціонарною (р < 0,05), при поширеному псоріазі – відносно обмеженого процесу (р < 0,01). Зменшення вмісту СЕФР в 1,6 раза в стаціонарній стадії дерматозу відносно прогресуючої, ймовірно, пов’язано зі зниженням активності ангіогенезу в ураженій шкірі і зупинкою росту псоріатичних висипань. Звертає увагу істотне підвищення вмісту СЕФР в крові пацієнтів з важким ступенем тяжкості дерматозу відносно аналогічного показника при легкому (р < 0,01) і помірному (р < 0,05) ступені тяжкості хвороби. Достовірних відмінностей між показниками у пацієнтів з різною тривалістю хвороби не встановлено (р > 0,05).
Таблиця 4.2 – Вміст судинного ендотеліального фактора росту в крові хворих на звичайний псоріаз (M ± m)
| Групи обстеження | СЕФР, пг/мл | р | |
| Хворі з різними клінічними формами псоріазу | – | – | |
| Стадія | прогресуюча, n=50
стаціонарна, n=26 |
356,53 ± 41,26*
220,41 ± 26,37 |
< 0,01 < 0,01 |
| Ступінь тяжкості | легкий, n=14
помірний, n=47 тяжкий, n=15 |
180,81 ± 21,06
305,21 ± 38,11* 432,13 ± 50,48** |
< 0,05 < 0,01 < 0,01 |
| Тривалість, роки | до 5, n=21
від 5 до 10, n=20 більше 10, n=35 |
334,21 ± 39,17
262,32 ± 24,07 283,47 ± 35,28 |
< 0,01 < 0,01 < 0,01 |
| Частота рецидивів
за рік |
1 раз, n= 11
2 рази, n=46 більше 2 разів, n=29 |
245,11 ± 21,18
257,68 ± 24,61 426,20 ± 43,15* |
< 0,01 < 0,01 |
| Контрольна група, n=24 | 52,17 ± 4,22 | – | |
Примітка. Відмінності достовірні між показниками у хворих залежно від стадії, поширеності, ступеня тяжкості, тривалості і частоти рецидивів при р < 0,05 – *, при р < 0,01 – **.
Аналіз змін рівня СЕФР в залежності від частоти рецидивів дерматозу (рис. 4.1) виявив суттєве підвищення значення показника у хворих із загостреннями частіше двох разів протягом року відносно аналогічного при рецидивах один і двічі за рік (р < 0,01). Достовірної відмінності між показниками пацієнтів з частотою рецидивів один і 2 рази на рік не виявлено.
Рисунок 4.1 – Рівень СЕФР залежно від кількості рецидивів псоріазу на рік
Встановлено тісний кореляційний зв’язок СЕФР з деякими клінічними параметрами (r СЕФР–PASI = 0,78, r СЕФР–частота рецидивів = 0,71, р < 0,05).
Результати визначення рівня ФНП α у хворих з різними формами наведено в табл. 4.3.
Таблиця 4.3 – Вміст фактора некрозу пухлини α в крові хворих із різними клінічними формами псоріазу (M ± m)
| Групи обстеження | ФНП α, пг/мл | р |
| Хворі на псоріаз:
звичайний псоріаз, n=76 еритродермія, n=13 артропатичний псоріаз, n=5 |
49,50 ± 4,83
70,15 ± 5,38 81,64 ± 4,62 |
< 0,01 < 0,01 < 0,01 |
| Контрольна група, n=24 | 13,97 ± 1,16 | – |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи.
Вміст ФНП α в сироватці крові хворих на псоріаз варіював від 30,65 до 93,12 пг/мл, при цьому встановлено достовірне підвищення рівня ФНП α ([56,87 ± 6,29] пг/мл) у порівнянні з показниками в контрольній групі (відповідно ([13,97 ± 1,16] пг/мл, р < 0,05). Отримані дані свідчать про виражене (в 3,5 раза) підвищення ФНП α у хворих на вульгарний псоріаз, в 5 разів у хворих псоріатичною еритродермією і майже в 6 разів у хворих з артропатичним псоріазом в порівнянні з рівнем ФНП α у здорових осіб (р < 0,01).
Дані змін рівня ФНП α в крові хворих на вульгарний псоріаз залежно від клінічних проявів дерматозу відображені в табл. 4.4.
Таблиця 4.4 – Вміст фактора некрозу пухлини α у хворих на звичайний псоріаз (M ± m)
| Групи обстеження | ФНП α,
пг/мл |
р | |
| Хворі з різними клінічними формами псоріазу | |||
| Стадія | прогресуюча, n=50
стаціонарна, n=26 |
73,50 ± 1,84**
13,04 ± 1,14х |
< 0,01 > 0,05 |
| Ступінь
тяжкості |
легкий, n=14
середній, n=47 тяжкий, n=15 |
45,10 ± 7,38*
49,83 ± 5,03* 81,76 ± 3,07**х |
< 0,05 < 0,05 < 0,01 |
| Частота рецидивів за рік | один, n=11
два, n=36 більше двох, n=29 |
58,24 ± 9,31*
61,86 ± 4,38** 67,29 ± 4,43** |
< 0,05 < 0,01 < 0,01 |
| Тривалість,
роки |
до 5, n=21
5-10, n=20 більше 10, n=35 |
56,60 ± 6,15*
60,48 ± 7,97* 74,92 ± 3,39** |
< 0,05 < 0,05 < 0,01 |
| Контрольна група, n=24 | 13,97 ± 1,16 | – | |
Примітка. Відмінності достовірні між показниками у хворих залежно від стадії, поширеності, ступеню тяжкості, тривалості і частоти рецидивів при р < 0,05 – *, при р < 0,01 – **.
Звертає увагу відсутність змін вмісту ФНП α у хворих з дерматозом в стаціонарній стадії щодо такого у практично здорових осіб (р > 0,05). При оцінці рівня ФНП α у хворих з різним ступенем тяжкості дерматозу встановлено значне підвищення у хворих з важким псоріазом, що достовірно відрізняються від такого при легкому ступені тяжкості (р < 0,05). Різниця між рівнями ФНП α при легкому та середньому ступені тяжкості практично відсутня, але достовірно перевищує контрольний показник. Відзначено тенденцію до збільшення вмісту в крові ФНП α при тривалості псоріазу більше 10 років.
Зміни рівня ФНП α у хворих на звичайний псоріаз в залежності від ступеня тяжкості та стадії представлено на рис. 4.2.
Рисунок 4.2 – Рівень ФНП α при різних ступенях тяжкості і стадії псоріазу
Середній рівень ІЛ-8 в сироватці хворих на псоріаз склав (103,58 ± 7,44) пг/мл, коливаючись в межах від 44,9 до 114,47 пг/мл, з істотним відхиленням в бік підвищення в порівнянні з контрольною групою, де середнє значення ІЛ-8 склало (56,11 ± 1,80) пг/мл (р < 0,05) (табл. 4.5). Показники демонструють збільшення сироваткового цитокіну ІЛ-8 в порівнянні з практично здоровими особами – в 2 рази у хворих на вульгарний псоріаз і артропатичний псоріаз і майже втричі у хворих еритродермією.
Таблиця 4.5 – Вміст інтерлейкіну-8 в крові хворих на різні клінічні форми псоріазу (M ± m)
| Групи обстеження | ІЛ-8, пг/мл | р |
| Хворі на псоріаз:
звичайний псоріаз, n=76 артропатичний псоріаз, n=13 еритродермія, n=5 |
91,62 ± 5,58
97,12 ± 5,90 139,37 ± 10,97 |
< 0,05 < 0,05 < 0,01 |
| Контрольна група, n=24 | 56,11 ± 1,8 | – |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи
У хворих на важкий псоріаз рівень ІЛ-8 в 2 рази вище в порівнянні з рівнем у хворих з легким ступенем тяжкості псоріазу (рис 4.3).
Рисунок 4.3 – Рівень ІЛ-8 у хворих на псоріаз різного ступеня тяжкості
Вміст ІЛ-8 у хворих на звичайний псоріаз з урахуванням різних клінічних проявів дерматозу представлено в табл. 4.6.
Таблиця 4.6 – Вміст інтерлейкіну-8 у хворих на звичайний псоріаз (M ± m)
| Групи обстеження | ІЛ-8, пг/мл | р | |
| Хворі з різними клінічними формами псоріазу | |||
| Стадія | прогресуюча, n=50
стаціонарна, n=26 |
100,24 ± 4,19**
94,87 ± 5,03* |
< 0,01 < 0,01 |
| Ступінь
тяжкості |
легкий, n=14
середній, n=47 тяжкий, n=15 |
77,27 ± 3,89*
96,85 ± 3,57* 141,43 ± 7,48**х |
< 0,05 < 0,05 < 0,01 |
| Частота рецидивів за рік | один, n=11
два, n=36 більше двох, n=29 |
93,14 ± 6,50*
96,74 ± 18,17* 103,2 ± 6,94** |
< 0,05 < 0,05 < 0,01 |
| Тривалість,
роки |
до 5, n=21
5-10, n=20 більше 10, n=35 |
97,56 ± 5,72*
92,26 ± 11,63* 103,59 ± 4,70** |
< 0,05 < 0,05 < 0,01 |
| Контрольна група, n=24 | 56,11 ± 1,80 | – | |
Примітка. Відмінності достовірні між показниками у хворих в залежності від стадії, поширеності, ступеня тяжкості, тривалості і частоти рецидивів при р < 0,05 – *, при р < 0,01 – **.
Аналіз рівня цитокінів у хворих на псоріаз виявив зміни обох прозапальних медіаторів – підвищення рівня ФНП α та ІЛ-8 у всіх пацієнтів. При цьому максимальні значення ФНП α відзначені у хворих з псоріатичним артритом і еритродермією (р < 0,01), ІЛ-8 – еритродермією. Співвідношення ІЛ-8/ФНП α виявилося більшим при ураженні шкіри (при бляшковому псоріазі – 1,7 ± 0,3, еритродермії – 1,85 ± 0,4), ніж при ураженні суглобів – 1,38 ± 0,2), у контрольній групі – 4,0 ± 1,3, р < 0,01).
У прогресуючій стадії дерматозу рівень цитокінів в крові достовірно збільшувався порівняно з показниками контрольної групи (р < 0,01), при цьому зміст ФНП α достовірно відрізнявся від аналогічного в стаціонарній стадії процесу (р < 0,05). Звертає увагу відсутність змін змісту ФНП α у хворих з дерматозом в стаціонарній стадії щодо такого у практично здорових осіб, на відміну від збільшення рівня ІЛ-8 в цій стадії хвороби, що перевищує значення показника в контролі (р < 0,01). Відмінностей між вмістом ІЛ-8 в залежності від стадії у хворих не виявлено (р > 0,05), але чим вище був початковий рівень цього хемокіну, тим повільніше наступав регрес висипань під впливом терапії.
Співвідношення ІЛ-8/ФНП α в прогресуючій стадії склало 1,4 ± 0,2, стаціонарній стадії – 7,3 ± 1,6 (в контрольній групі – 4,01 ± 1,3, р < 0,01) (рис. 4.4).
Рисунок 4.4 – Співвідношення ІЛ-8 / ФНП α при різних стадіях псоріазу
При оцінці цитокінів у хворих з різним ступенем тяжкості дерматозу встановлено значне підвищення рівня ФНП α та ІЛ-8 при тяжкому ступеню псоріазу, достовірно відрізняються від таких при легкому ступені тяжкості (р < 0,05). Вміст обох цитокінів при легкому та помірному ступенях тяжкості псоріазу достовірно перевищували значення в контрольній групі (р < 0,05), але майже не відрізнялися між собою. Співвідношення ІЛ-8/ФНП α при легкому ступені склало (1,7 ± 0,4), помірному ступені – (1,9 ± 0,5), тяжкому ступені – (1,7 ± 0,3) та достовірно відрізнялося від розрахованого співвідношення в контрольній групі (р < 0,05).
Вміст ФНП α і ІЛ-8 в крові хворих не залежав від частоти рецидивів (р > 0,05). Співвідношення ІЛ-8/ФНП α практично не відрізнялося в групах хворих з рецидивами один (1,6 ± 0,3), два (1,6 ± 0,4) і більш ніж два рази на рік (1,5 ± 0,3) (р > 0,05).
Подібну динаміку цитокінів виявлено і при різній тривалості дерматозу. Відзначено тенденцію до збільшення вмісту в крові обох параметрів – ФНП α і ІЛ-8 при тривалості псоріазу більше 10 років. Співвідношення ІЛ-8/ФНП α виявилося найбільшим при тривалості дерматозу до 3 років (1,7 ± 0,4), майже однаковим при хвороби від 3 до 10 років (1,5 ± 0,4) і більше 10 років (1,4 ± 0,2), але було зниженим у порівнянні з показником у практично здорових осіб (р < 0,05).
Імунні маркери асоційовані з основними клінічними проявами псоріазу. Встановлено, що вміст ФНП α залежить від стадійності (прогресування) і тяжкості процесу, ІЛ-8 – клінічної форми, тяжкості перебігу псоріазу. Рівень прозапальних медіаторів (ФНП α, ІЛ-8) може бути самостійним об’єктивним критерієм тяжкості псоріазу та псоріатичного артриту.
Кореляційний аналіз встановив позитивний взаємозв’язок між клінічним перебігом (PASI) і досліджуваними лабораторними показниками: коефіцієнт кореляції за Спірменом r PASI, ІЛ-8=0,551, r PASI, ФНП α=0,475 (р < 0,05).
В результаті проведеного дослідження виявлено односпрямовані зміни ростового проангіогенного фактору та прозапальних цитокінів – збільшення вмісту СЕФР, ФНП α та ІЛ-8 у хворих на псоріаз, ступінь відхилення показників залежала від форми, стадії і тяжкості процесу. Збільшення вмісту основного ростового ангіогенного фактора в крові хворих на псоріаз свідчить про активну проліферацію судин (патологічний ангіогенез) в прогресуючу стадію дерматозу, при залученні в процес більше 10 % площі шкіри і частих рецидивах процесу.
4.2 Рівень мелатоніну у хворих на псоріаз
Рівень вмісту мелатоніну коливався в межах від 7,01 до 32,78 пг/мл (середнє значення [15,15 ± 0,88] пг/мл) з достовірним зниженням щодо показників контрольної групи (р ˂ 0,01), пропорційним співвідношенню 1: 2 (табл. 4.7).
Таблиця 4.7 – Вміст мелатоніну у хворих на різні клінічні форми псоріазу (M ± m)
| Групи обстеження | Мелатонін, пг/мл | р |
| Хворі на псоріаз:
звичайний псоріаз, n=76 артропатичний псоріаз, n=13 еритродермія, n=5 |
18,25 ± 1,27
12,43 ± 0,89 8,43 ± 0,70 |
< 0,05 < 0,01 < 0,01 |
| Контрольна група, n=24 | 36,85 ± 2,6 | – |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи.
У пацієнтів зі звичайним псоріазом показники мелатоніну коливалися в межах від 9,08 до 32,78 пг/мл, середнє значення склало (18,25 ± 1,27) пг/мл. Рівень мелатоніну у хворих з псориатичною артропатією варіював в межах від 8,02 до 17,01 пг мл, середнє значення було на рівні (12,43 ± 0,89) пг/мл. Середнє значення мелатоніну хворих на псоріатичну еритродермію склало (8,43 ± 0,70) пг/мл, при тому, що варіаційний ряд показників знаходився в межах від 7,01 до 12,71 пг/мл.
Показники мелатоніну в сироватці крові хворих на звичайний псоріаз в залежності від різних клінічних проявів представлені в таблиці 4.8.
Таблиця 4.8 – Вміст мелатоніну у хворих на звичайний псоріаз (M ± m)
| Групи обстеження | Мелатонін,
пг/мл |
р | |
| Хворі з різними клінічними формами псоріазу | |||
| Стадія | прогресуюча, n=56
стаціонарна, n=20 |
13,67 ± 1,13
18,82 ± 1,97 |
< 0,01 < 0,05 |
| Ступінь
тяжкості |
легкий, n=14
середній, n=47 тяжкий, n=15 |
20,01 ± 1,49
15,62 ± 1,37 9,65 ± 0,46 |
< 0,05 < 0,01 < 0,01 |
| Частота рецидивів за рік |
один, n=11
два, n=36 більше двох, n=29 |
16,42 ± 3,71
15,53 ± 1,12 12,51 ± 1,52 |
< 0,05 < 0,01 < 0,01 |
| Тривалість,
роки |
до 5, n=21
5-10, n=20 більше 10, n=35 |
17,09 ± 2,20
16,36 ± 2,22 13,64 ± 1,04 |
< 0,05 < 0,01 < 0,01 |
| Контрольна група, n=24 | 36,85 ± 2,60 | – | |
Примітка. Відмінності достовірні між показниками у хворих залежно від стадії, поширеності, ступеня тяжкості, тривалості і частоти рецидивів при р < 0,05 – *, при р < 0,01 – **.
Зміни вмісту мелатоніну у пацієнтів з різною стадією і ступенем тяжкості псоріазу представлені на рис. 4.5.
Вивчення рівня сироваткового мелатоніну у хворих на псоріаз, що страждають на порушення сну, встановило взаємозв’язок лабораторного показника і даного клінічного прояву. Середнє значення мелатоніну у хворих з порушеннями сну (12,8 ± 0,68) пг/мл, у хворих на псоріаз без порушень сну – (23,85 ± 2,16) пг/мл (р < 0,05). Виявлено негативний кореляційний зв'язок між наявністю порушень сну і рівнем мелатоніну. Коефіцієнт кореляції Cпірмена rпорушения сну, мелатонін= –0,555 (р < 0,01). Даний аналіз показує хоч і слабку, але значиму залежність показника від порушення сну.
Рисунок 4.5 – Рівень мелатоніну у хворих на звичайний псоріаз різного ступеня тяжкості та стадії
Аналіз вмісту сироваткового мелатоніну у хворих з різними клінічними проявами псоріазу показав, що його рівень достовірно нижчий, ніж у здорових осіб (р < 0,01). Значення цього маркера у хворих з різним ступенем тяжкості відрізняються у бік зменшення – від легкого ступеня до тяжкого (р ˂ 0,05). Виявлено зниження рівня мелатоніну в 2,1 раза у хворих важким псоріазом в порівнянні з аналогічним показником при легкому ступені тяжкості дерматозу (р ˂ 0,05). У прогресуючій стадії рівень мелатоніну також незначно нижчий, ніж у стаціонарній стадії. Практично немає відмінності в рівні мелатоніну у хворих з одним або двома рецидивами на рік, але при більш частих рецидивах псоріазу рівень мелатоніну знижується. Така ж динаміка спостерігається при аналізі цього показника в залежності від тривалості дерматозу: чим довша тривалість дерматозу, тим нижчий рівень мелатоніну.
Резюме. У хворих на псоріаз виявлено односпрямовані зміни ростового проангіогенно фактору та цитокінів (СЕФР, ФНП α і ІЛ-8). Відхилення цих показників залежали від клінічних проявів псоріазу з найбільш вираженим підвищенням всіх медіаторів у хворих на важкі формами хвороби, в стадії прогресування, з рецидуванням більше двох разів на рік і в випадках тривалого перебігу дерматозу. У той же час, рівень антиангіогенного фактору мелатоніну у хворих виявився зниженим, а ступінь його відхилення залежала від форми, стадії та тяжкості процесу, наявності психічної коморбідності, зокрема, порушень сну. Отримані результати свідчать про дисбаланс ангіогенезу з переважаючим значенням стимулюючих факторів.
Наведені у розділі положення відображено у публікаціях:
- Болотная Л. А., Сариан Е. И., Лопандина А. А. Патогенетическое значение сосудистого эндотелиального фактора роста при псориазе. ScienceRise, Медичні науки. № 2/3 (19). С. 4–8 [16].
- Лопандина А. А., Болотная Л. А. Клиническое значение провоспалительных иммунных медиаторов при псориазе. Дерматологія та венерологія. № 3 (81). С. 13–16 [61].
- Лопандина А. А. Показатели мелатонина и сосудистого эндотелиального фактора роста (VEGF) у больных псориазом с нарушением сна. Международный медицинский журнал. Т. 24. № 4 (96). С. 81–84 [58].
- Лопандина А. А. Особенности ангиогенеза у больных псориазом. Инновационные технологии в дерматовенерологии. Междисциплинарные связи : материалы научн.-практ. конф. с участием международн. специалистов, 13-14 ноября 2015 г. Харьков, 2015. Дерматологія та венерологія № 3 (69), 2015. С. 82 [57].
- Лопандина А. А. Уровень провоспалительных цитокинов у больных вульгарным псориазом. Дерматовенерологія в розробках молодих науковців : матеріали наук.-практ. школи, 16-17 листопада 2017 р. Київ, 2017. Клінічна імунологія. Алергологія. Інфектологія. 2017. № 6 (103). С. 57 [60].
- Лопандина А. А. Нарушения сна и уровень мелатонина у больных псориазом. Медицина ХIХ століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 23 листопада 2017 р. Харків, 2017. С. 55-56 [55].
РОЗДІЛ 5
ДЕПРЕСИВНІ РОЗЛАДИ ТА ОСОБЛИВОСТІ ПОРУШЕНЬ СНУ У ХВОРИХ НА ПСОРІАЗ
Депресія і порушення сну, як афективні розлади, впливають на якість життя пацієнта і посилюють тяжкість перебігу псоріазу [21, 37, 39]. На сьогоднішній день представляє великий інтерес вивчення механізмів взаємозв’язку психічних розладів і псоріазу. Відомо, що асоціація шкірних захворювань з психічними порушеннями призводить до хронізації дерматозів, скорочення тривалості ремісії, посилення об’єктивних та суб’єктивних проявів захворювання.
Залишається відкритим питання про первинну діагностику розладів настрою і якості сну у пацієнтів, які звернулися з приводу шкірного захворювання. Найбільш зручним, без істотних матеріальних і часових витрат є тестування пацієнта за допомогою анкет для характеристики рівня тривоги, депресії, порушень сну. Для визначення психічного стану використовують шкали тривоги і депресії Бека, а також анкету бальної оцінки суб’єктивних характеристик сну [101, 116].
5.1 Оцінка ступеня вираженості депресивної симптоматики у хворих на псоріаз
У досліджуваній групі 91 (79,8 %) хворих вказувало на негативний вплив хвороби на якість життя, який включає почуття, пов’язані із зовнішніми проявами захворювання, такими як розчарування, злість, тривогу, схильність до алкогольної залежності. Багато відзначали зниження самооцінки, песимістичне ставлення до навколишнього світу, необґрунтоване почуття провини, зниження сексуальної активності.
У результаті проведеного нами анкетування усіх хворих на псоріаз показник за шкалою депресії Бека знаходився в межах від 4 до 27 балів і в середньому склав (14,9 ± 0,79) бала, що достовірно перевищувало середній показник в контрольній групі ([4,54 ± 0,56] бала, р ˂ 0,01). Більшість пацієнтів – 59 осіб (51,8 %) мали ознаки легкої депресії ([13,6 ± 0,29] бала). У 45 (39,5 %) хворих виявлено ознаки помірної депресії ([17,1 ± 0,45] бала). У 2 хворих (1,8 %), згідно з анкетуванням, виявлена виражена депресія ([23,5 ± 2,12] бала), у зв’язку з чим пацієнтів було направлено на консультацію до психіатра. Серед усіх, хто звернувся, хворих на псоріаз 8 осіб (7,0 %) не скаржилися на порушення психіки депресивного характеру ([4,13 ± 1,04] бала) (табл. 5.1).
Таблиця 5.1 – Вираженість депресивного стану у хворих на псоріаз (M ± m)
| Вираженість
депресії, бали |
Хворі на псоріаз
(n=114) |
Середнє значення, |
бали
Контрольна група
(n=24)
Середнє значення, балиНорма, 0 – 984,13 ± 1,04164,5 ± 0,77Легка (субдепресія), 10 – 155913,6 ± 0,29*811,6 ± 0,67*Помірна, 16 – 194517,1 ± 0,45*^––Виражена, 20 – 29223,5 ± 2,12*^#––
Примітки:
1 * – р < 0,05 відносно показника в контрольній групі;
2 ^ – р < 0,05 відносно показника у хворих з легким депресивним станом;
3 #– р < 0,05 відносно показника у хворих з помірним депресивним станом.
У чоловіків (n=67) середній показник вираженості депресії склав (13,8 ± 0,91) бала, у жінок (n=47) – (14,02 ± 1,2) бала. Достовірних відмінностей між показниками депресії не визначено.
При поділі хворих на вікові групи (табл. 5.2), в діапазоні субдепресії виявилися пацієнти віком від 18 до 50 років. Серед хворих старше 50 років у 44 осіб (38,6 %) виявилися ознаки помірної депресії.
Таблиця 5.2 – Показники депресії з урахуванням вікових груп
| Показник вираженостідепресії, бали |
Вікові групи, роки | Контрольна група (n=24) | |||
| 18-30, n=33 | 31-40, n=15 | 41-50, n=22 | 51-65, n=44 | ||
| 15,6±3,8* | 13,03±2,8* | 12,1±2,2* | 17,5±4,1* | 4,54±0,56 | |
Примітка. * – р < 0,05 відносно показника в контрольній групі.
У 75 пацієнтів (65,8 %) з висипом на відкритих ділянках тіла: обличчі (13,3 %), волосистій частині голови (20,0 %), тильній поверхні кистей (16,0 %), зовнішніх статевих органах (10,7 %) середнє значення показника депресії склало (16,4 ± 2,9) бала, що відноситься до діапазону помірної депресії. Це на 4 бали вище середнього показника у хворих з висипом, прихованим від огляду – (12,1 ± 1,9) бала, що також відповідає діапазону помірної депресії (рис. 5.1).
Рисунок 5.1 – Показники рівня депресії у хворих на псоріаз залежно від локалізації дерматозу
При порівнянні рівня депресії хворих на псоріаз в залежності від ступеня тяжкості дерматозу виявлена позитивна кореляція посилення депресії з погіршенням тяжкості хвороби (табл. 5.3).
Таблиця 5.3 – Показники депресії з урахуванням ступеня тяжкості псоріазу
| Показник,
бали |
Ступінь тяжкості псоріазу | Контрольна група (n=24) | ||
| легкий
(n=24) (PASI 8,50) |
помірний (n=62)
(PASI 15,52) |
тяжкий (n=28)
(PASI 21,23) |
||
| Вираженість
депресії, бали |
10,4 ± 1,3* | 15,01 ± 1,6*^ | 19,6 ± 2,2*^# | 4,5 ± 0,5 |
Примітки:
- * – р < 0,05 відносно показника в контрольній групі;
- ^ – р < 0,05 відносно показника у хворих легкого ступеня тяжкості;
- # – р < 0,05 відносно показника у хворих середнього ступеня тяжкості.
Залежно від клінічної форми дерматозу анкетування показало, що сума балів у хворих на вульгарний або артропатичний псоріаз не має суттєвої різниці на відміну від показників у хворих псоріатичною еритродермією – (16,05 ± 2,1) бала, що відповідає рівню помірної депресії (табл. 5.4).
Таблиця 5.4 – Показники вираженості депресії з урахуванням клінічної форми псоріазу
| Показник вираженостідепресії, бали |
Клінічні форми псоріазу | Контрольна група (n=24) | ||
| вульгарний псоріаз
(n=86) |
артропатичний псоріаз (n=18) | псоріатична еритродермія (n=10) | ||
| 12,2 ± 1,2 | 13,4 ± 1,2 | 16,05 ± 2,1* | 4,5 ± 0,5 | |
Примітка. * – р < 0,05 відносно показника в групі вульгарного псоріазу.
У таблиці 5.5 відображені показники анкетування за шкалою Бека хворих на псоріаз з різними проявами в залежності від стадії, кількості рецидивів на рік та тривалості дерматозу.
Таблиця 5.5 – Показники депресії за шкалою Бека з урахуванням різних проявів псоріазу
| Групи обстеження | Показники
шкали Бека (бали) |
|
| Хворі з різними клінічними формами псоріазу | ||
| Стадія | прогресуюча, n=81
стаціонарна, n=33 |
16,9±2,3*
13,9±1,7* |
| Частота рецидивів
за рік |
один, n=15
два, n=66 більше двох, n=33 |
11,6±0,9*^
12,5±1,5*^ 16,6±1,3* |
| Тривалість (роки) | до 5, n=25
5-10, n=29 більше 10, n=60 |
17,1±1,1*
13,3±0,9*# 14,2±1,2*# |
| Контрольна група, n=24 | 4,54±0,56 | |
Примітки:
1 * – р < 0,05 відносно показника в контрольній групі;
2 ^ – р < 0,05 відносно показника у хворих з частотою рецидивів більше двох на рік;
3 # – р < 0,05 відносно показника у хворих на псоріаз до 5 років.
Проаналізувавши ці дані, встановлено, що більшу кількість балів набрали пацієнти в прогресуючій стадії (16,9 ± 2,3), з часто рецидивуючим перебігом – (16,6 ± 1,3) та тривалістю захворювання до 5 років (17,1 ± 1,1), що ймовірно пов’язано з відсутністю психологічної адаптації до хвороби, яка щойно почалась.
5.2 Оцінка порушень сну у хворих на псоріаз
На порушення сну вказували 88 (77,2 %) хворих на псоріаз. Пацієнти пред’являли скарги на безсоння, збільшення частоти нічних пробуджень, сонливість в денний час і ранні ранкові пробудження. Крім цього, у хворих з поширеними формами псоріазу та псоріатичним артритом якість сну додатково погіршувалася за рахунок вираженого свербежу та відчуття печіння шкіри в осередках висипання та больового синдрому в ділянці уражених суглобів. У пацієнтів із супутньою метаболічною симптоматикою (артеріальна гіпертензія, цукровий діабет, підвищена маса тіла) були присутні скарги на нічне апное, синдром неспокійних ніг. У хворих з великим ураженням шкірних покривів, в тому числі з еритродермією, проблеми із засинанням спостерігалися в 100 % випадків спостережень.
Вираженість інсомнії визначали за допомогою шкали СХС у хворих на псоріаз (табл. 5.6).
Таблиця 5.6 – Характеристика якості сну у хворих на псоріаз
| Якість сну,
бали |
Хворі на псоріаз
(n=114) |
Середнє значення,
бали |
Контрольна група
(n=24) |
Середнє значення, бали |
| Нормальний сон, > 22 | 26 | 22,02 ± 2,8 | 17 | 22,8 ± 1,6 |
| Межові (граничні)
порушення, 19-21 |
61 | 20,50 ± 2,41 | 7 | 21,03 ± 2,00 |
| Порушення сну, < 19 | 27 | 16,41 ± 1,3 | – | – |
Середнє значення за шкалою СХС у хворих склало (18,63 ± 0,62) бала, що достовірно нижче показника здорових осіб – (21,42 ± 1,10) бала (р < 0,05). В межах гранічних порушень виявлено максимальне число хворих – 61 (53,5 %) із середньою кількістю балів – (20,5 ± 2,5). У 26 (22,8 %) хворих сумарне число балів відповідало нормальному сну. Група з 27 осіб (23,68 %) мали виражені відхилення в якості сну ([16,41 ± 1,8] бала).
Аналізуючи ступінь порушення сну у хворих на псоріаз в залежності від статі та віку (рис. 5.2), виявлена достовірна різниця показника у чоловіків ([19,13 ± 1,9] бала) та жінок ([16,73 ± 1,02] бала) (p < 0,05), а також наявність достовірної зворотної кореляції між вираженістю порушень сну і віком пацієнта (r = –0,320; p = 0,0075).
Рисунок 5.2 – Порушення сну з урахуванням віку хворих на псоріаз
Розподіл досліджуваної групи хворих за ступенем тяжкості показав зворотній взаємозв’язок вираженості порушень сну і тяжкості захворювання (табл. 5.7).
Таблиця 5.7 – Показники порушення сну з урахуванням ступеня тяжкості псоріазу
| Показники шкали СХС, бали | Ступінь тяжкості псоріазу | Контрольна група (n=24) | ||
| легкий (n=24)
(PASI 8,50) |
помірний (n=62)
(PASI 15,52) |
тяжкий (n=28)
(PASI 21,23) |
||
| 20,4 ± 0,9 | 19,03 ± 1,10 | 17,9 ± 1,4 | 21,42 ± 1,10 | |
У пацієнтів з різними клінічними формами псоріазу (табл. 5.8) спостерігається зрушення показників в бік погіршення якості сну при наявності тяжких форм, таких як псоріатична артропатія ([16,2 ± 1,8] бала) і еритродермія ([15,0 ± 1,2] бала). У пацієнтів зі звичайним псоріазом ступінь порушень сну наближається до норми.
Таблиця 5.8 – Порушення сну з урахуванням клінічної форми псоріазу
| Показники шкали СХС, бали | Клінічні форми псоріазу | Контрольна група (n=24) | ||
| вульгарний псоріаз (n=86) | артропатичний псоріаз (n=18) | еритродермія (n=10) | ||
| 20,5 ± 2,0 | 16,2 ± 1,8* | 15,0 ± 1,2* | 21,42 ± 1,1 | |
Примітка. * – р < 0,05 відносно показника в групі вульгарного псоріазу.
Частота порушень сну у хворих на псоріаз із різним ступенем вираженості депресії наведена на рис. 5.3.
Рисунок 5.3 – Порушення сну у хворих на псоріаз з урахуванням ступеня тяжкості депресії
Виявлено зворотню кореляційну залежність сумарної кількості балів за шкалою СХС і суми балів за шкалою депресії Бека, що підтверджує збільшення інсомнії у людей з депресивним станом.
Резюме. У результаті вивчення психічного статусу хворих на псоріаз за допомогою скринінгових методик анкетування у 106 хворих (92,9 %) виявлено розлади депресивної спрямованості, у 88 хворих (77,2 %) були порушення сну. Крім цього виявлена тенденція до збільшення депресивних розладів, а також погіршення якості сну у пацієнтів з наростанням ступеня тяжкості дерматозу, при тяжких формах хвороби (псоріатична артропатія і еритродермія), в разі частого рецидування (більше 2 разів на рік), у пацієнтів старшої вікової групи. Погіршення психоемоційного стану хворих достовірно залежало від поширеності шкірного процесу та наявності висипань на відкритих ділянках тіла. Також виявлено взаємозв’язок наявності і ступеня порушення сну та вираженості депресивного стану у хворих на псоріаз.
Наведені у розділі положення відображено у публікаціях:
- Лопандина А. А. Изменение психоэмоциональных показателей у больных псориазом. Медицина ХIХ століття: матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 26 листопада 2015 р. Харків, 2015. С. 45 [53].
- Саріан О. І., Лопандіна А. О. Особливості псоріазу з ураженням кистей і стоп. Новітні тенденції лікування та профілактики дерматовенерологічних проблем в рамках доказової медицини : матеріали наук.-практ. конф.,13-15 квітня 2016 р. Львів, 2016. Український журнал дерматології, венерології, косметології. № 1 (60). 2016. С. 96–97 [85].
- Сариан Е. И., Лопандина А.А. Психоэмоциональные расстройства у больных псориазом. Медицина ХIХ століття: матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 24 листопада 2016 р. Харків, 2016. С. 94-95 [87].
- Лопандина А. А. Псориаз и психоэмоциональные расстройства. Дерматологія та венерологія. № 4 (74). С. 11–19 [59].
- Лопандина А. А. Нарушения сна у больных псориазом. Святогірські дерматовенерологічні дні: новітні методи діагностики і лікування в дерматовенерології та косметології: матеріали Всеукр. конф. за участю міжнар. спеціалістів, 25-26 травня 2017 р. Святогір’я, 2017. Журн. дерматовенерології та косметології ім. М. О. Торсуєва. № 1 (37). С. 73 [56].
- Лопандина А. А. Нарушения сна и уровень мелатонина у больных псориазом. Медицина ХIХ століття: матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 23 листопада 2017 р. Харків, 2017. С. 55-56 [55].
- Лопандина А.А. Показатели мелатонина и сосудистого эндотелиального фактора роста (VEGF) у больных псориазом с нарушением сна. Международный медицинский журнал. Т. 24. № 4 (96). С. 81–84 [58].
- Lopandina A. Change of psychosomatic status in patiens with psoriasis: Аbstract 13th Spring Symposium of European Academy of Dermatology and Venereology, 19-22 May 2016. Athens, 2016. Abstract code P0737 [167].
РОЗДІЛ 6
ЛІКУВАННЯ ХВОРИХ НА ЗВИЧАЙНИЙ ПСОРІАЗ
На сучасному етапі не втрачає актуальності пошук ефективного лікування псоріазу. Оптимізація лікування і розробка нових методів відбуваються з урахуванням провідної ролі імунних механізмів в патогенезі псоріазу. Важливе значення у вивченні цього питання відіграє комплексний погляд на проблему псоріазу як захворювання зі складними патогенетичними взаємозв’язками, які розмивають кордони між дерматозом та його коморбідністю, що слід враховувати при плануванні лікування.
6.1 Обґрунтування використання у хворих на псоріаз методів та засобів, що коригують ангіогенез та порушення сну
В результаті проведених досліджень у хворих на псоріаз виявлено наявність виражених змін – підвищення вмісту прозапальних цитокінів (ФНП α, ІЛ-8), промотора неоангіогенезу СЕФР, зниження рівня протизапального і антиангіогенного фактора мелатоніну. Встановлена пряма залежність характеру поширеності й тяжкості перебігу дерматозу і ступеня психоемоційних відхилень відповідно до коливань рівня досліджуваних показників у хворих на псоріаз. Наявність депресивного стану (легкого ступеня у 51,8 %, помірного ступеня у 39,5 %) і порушень сну у 77,2 % хворих, дані про антиангіогенний вплив гормону епіфіза при різних пухлинах послужили підставою включення препарату мелатоніну в терапію хворих на псоріаз.
Гормон епіфізу мелатонін є одним з найважливіших регуляторів природного чергування періодів сну і неспання, а також формування сезонних змін основних функцій людського організму [239]. За сучасними уявленнями, мелатонін виконує регулюючу функцію, пов’язану з фотоперіодичністю, впливаючи на активність різних клітин і гормональний фон. Можливо, екзогенний мелатонін за механізмом зворотного зв’язку знижує синтез ендогенного мелатоніну пінеалоцітов, і тим самим підсилює вироблення і “зміщує” за часом пік надходження в кров гормонів, відповідальних за активацію людського організму в ранкові години, зокрема, кортизолу [105]. Збільшення вмісту кортизолу, в свою чергу, здатне знижувати вираженість системної запальної реакції, пік якої припадає на нічні і ранні ранкові години.
Мелатонін наділений унікальними адаптативними можливостями. Якісні та кількісні порушення ритму його продукції можуть призводити на початковому етапі до десинхронозу і дезадаптації організму в умовах змін навколишнього середовища, в подальшому до різних патологічних станів, в тому числі виразковій хворобі, гіпертонії, депресії [34].
Спектр дії мелатоніну досить широкий: його вважають одним з найсильніших ендогенних антиоксидантів при перекисному окисленні ліпідів. Він стимулює продукцію лейкоцитами імуноглобулінів та ІЛ, які, в свою чергу, впливають на його секрецію. Цей гормон також інгібує проліферацію клітин, послаблює ефекти стресу і здійснює антистресову дію, синхронізацію коливальних процесів в організмі. Мелатонін, як один з потужних антиоксидантів організму, проявляє нейропротекторні і антирадикальні властивості in vitro та in vivo [4, 5, 42, 67].
Імуномодулюючі ефекти мелатоніну можуть бути пов’язані не тільки з його прямою або опосередкованою дією на функціі імунокомпетентних клітин, але й з відновленням хронометричні організації імунної системи і імуноендокринних взаємин [98]. Мелатонін, бере участь в регуляції неоангіогенезу і пригнічує розвиток різних типів раку, включаючи рак легенів і рак молочної залози [178].
На думку Ф.І. Комарова та співавт. [42], при багатьох хронічних захворюваннях, що характеризуються сезонними загостреннями, є порушення продукції мелатоніну та природні сезонні коливання його вироблення. Псоріаз також є хронічним захворюванням при якому досить чітко простежуються сезонні загострення. Є нечисленні дані, що у хворих на псоріаз відзначається зниження рівня мелатоніну в порівнянні зі здоровими особами, тому застосування цього екзогенного гормону може сприяти відновленню гормонального балансу в організмі, впливаючи на нейроендокринні порушення [23]. Не можна виключити, що й саме поліпшення нічного сну може опосередковано вплинути на більш позитивну суб’єктивну оцінку динаміку різних симптомів захворювання на тлі триваючої терапії.
Наявні експериментальні та клінічні дані дозволяють використовувати мелатонін для корекції порушення сну, а також як адаптоген при порушеннях циркадианного ритму. При порушеннях сну, що розвиваються на тлі депресивного розладу, показано застосування антидепресантів. Досить часто практикується призначення пацієнтам амітриптиліну, бензодіазепіну та інші, які мають холінолітичну дію і, відповідно, протипоказані при глаукомі, ризику розвитку шлуночкових тахікардій при подовженому інтервалі QT та інші. В загальнотерапевтичній практиці призначати антидепресанти слід тільки після консультації психіатра або невролога. Препарати, що містять мелатонін, зберігають фізіологічну структуру сну, вкрай рідко викликають постсомнічні розлади, компенсують вікове зниження синтезу мелатоніну і мають протитривожну і антидепресивну дію [100]. Безумовною перевагою мелатоніну є безпека, а також наявність антиоксидантної дії. Для мелатоніну не описано розвитку звикання [111].
Існує чимало експериментальних і клінічних свідчень того, що мелатонін може бути корисний для лікування раку, тому що має онкостатичні властивості. Мелатонін запобігає ініціації онкогенного шляху та здатний затримувати прогресування раку, тому є цінним доповненням стандартних методів фармакологічного і променевого лікування пухлин [118].
Посилення ангіогенезу є основною особливістю прогресування пухлини і його інгібування є важливим аспектом, за допомогою якого мелатонін уповільнює поширення пухлин. Механізми, що лежать в основі онкостатичної дії, в кінцевому підсумку призводять до зниження рівнів експресії генів, необхідних для ангіогенезу. Центральною частиною цього таргетного впливу є СЕФР [176], при цьому мелатонін може одночасно знижувати вміст ангіогенних і запальних білків в клітинній ланці різних пухлин (молочної залози, печінки, підшлункової залози) [135].
Мелатонін використовує безліч механізмів для націлювання на поживні речовини й постачання киснем ракових клітин. На рівні транскрипції фактора 1α, що індукує гіпоксію (HIF-1α) і його контролюючі гени, такі як СЕФО, є основними мішенями мелатоніну як інгібітора ангіогенезу. Мелатонін запобігає транслокації HIF-1α в ядро, перешкоджаючи тим самим СЕФР-експресії, а також запобігає утворенню комплексу HIF-1α, фосфо-STAT3 і CBP / p300, який бере участь в експресії генів, пов’язаних з ангіогенезом. Ангіостатічні властивості мелатоніну можуть бути також обумовлені його здатністю пригнічувати активацію і експресію СЕФРР2. Інші ангіостатічні механізми мелатоніну включають інгібування міграції, інвазії і утворення трубок ендотеліальних клітин [172].
Останнім часом з’явилася величезна кількість робіт, в яких описано позитивний результат застосування мелатоніну в комбінованої терапії при різних патологічних станах, у тому числі і шкіри [23].
Мелатонін (Віта-мелатонін) призначали за 30 хвилин до сну по 1 таблетці (3 мг) на добу до відновлення фізіологічного ритму «сон-неспання», але не більше 1 місяця [94].
6.2 Клініко-лабораторні результати лікування хворих на псоріаз
Для оцінки впливу загальновизнаного (фототерапія і традиційна терапія) і розробленого методу лікування з додатковим використанням препарату мелатоніну 56 хворих вульгарним псоріазом рандомізовані на дві групи, однорідні за гендерним та віковим складом, клінічним та лабораторним відхиленням. Перша група (1) включала 26 пацієнтів у віці від 20 до 65 років, в тому числі чоловіків – 15, жінок – 11. Середній вік хворих цієї групи склав (41,1 ± 2,6) років. Друга група (2) складалася з 30 хворих у віці від 18 до 55 років, з них 16 чоловіків і 14 жінок. Середній вік пацієнтів групи 2 склав (37,0 ± 2,2) років. Клінічна характеристика двох груп хворих на псоріаз до лікування представлена в таблиці 6.1.
Таблиця 6.1 – Клініко-анамнестичні дані у хворих на псоріаз до лікування (M ± m)
| Показники | Хворі на вульгарний псоріаз | |
| Група 1,
n=26 |
Група 2,
n=30 |
|
| BSA, % | 19,6 ± 5,2 | 18,8 ± 4,9 |
| PASI, бали | 17,8 ± 5,1 | 18,1 ± 3,9 |
| SAPASI, бали | 20,9 ± 6,2 | 21,2 ± 6,9 |
| Шкала депресії Бека, бали | 14,5 ± 0,3 | 15,2 ± 0,9 |
| Шкала СХС, бали | 19,01 ± 1,70 | 18,30 ± 2,63 |
Основний курс стандартного лікування призначався хворим обох груп згідно Наказу № 762 МОЗ України “Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання” від 20.11.2015 р. з урахуванням скарг, анамнезу, анкетування, фізикального огляду, наявності супутньої патології, ефективності раніше проведеного лікування, наявності непереносимості лікарських засобів.
Група 1 хворих лікувалася відповідно до традиційної схеми лікування, яка включала реосорбілакт 200,0 (внутрішньовенно крапельно № 6-8, 3-4 рази на тиждень), тіосульфат натрію (30 % розчин внутрішньовенно 10,0 1 раз на день № 10-15), хлоропіраміну гідрохлорид (20-40 мг внутрішньом’язово 1 раз в день № 10-15), тіотриазолін (4,0 внутрішньом’язово 1 раз на день № 20) або антраль (1 таблетка 3 рази на день, перорально 3 тижні); зовнішнє лікування – мазь, крем, лосьйон бетаметазона дипропіонату або валерату в «чистому» вигляді або в комбінації із саліцилової кислотою, крем мометазону фуроат, емоліенти. Крім цього, пацієнти проходили сеанси вузькосмугової середньохвильової UVB-терапії з піком емісії на довжині хвилі 311 нм в фототерапевтичної UVB-кабіні. Початкові дози системного опромінення підбиралися індивідуально в залежності від фототипу шкіри з визначенням мінімальної ерітемной дози і мінімальної фототоксичної дози. Стартова доза експозиції UVB випромінювання, при проведенні UVB-311 нм терапії в залежності від типу шкіри становила 0,1-0,2 Дж/см2. Разове збільшення дози було фіксованим 0,1 або 0,2 Дж/см2 і змінювалося в залежності від переносимості і ефективності лікування.
Група 2 додатково до традиційного курсу лікування отримувала препарат мелатонін в дозі 3 мг за 30 хвилин до сну протягом 4 тижнів.
Переносимість лікування була задовільною, місцевих і системних побічних реакцій зареєстровано не було.
Усім хворим до та після лікування проводилось клініко-лабораторне обстеження, що включало загальноклінічні дослідження крові й сечі, підрахунок індексів BSA, PASI, SAPASI, проведення анкетування хворих за допомогою опитувальників вираженості депресії Бека і суб’єктивної оцінки сну за шкалою Вейна, визначення методом імуноферментного аналізу рівня СЕФР, ФНП α, ІЛ-8, мелатоніну в сироватці крові.
Результати лікування в двох терапевтичних групах оцінювалися до і через 1 місяць після початку терапії.
При оцінці ефективності проведеного лікування критерієм клінічного одужання вважався повний регрес еритеми, інфільтрації, лущення в зоні висипань з допустимою залишковою гіпер- або гіпопігментацією, припинення суб’єктивних проявів: скарг на свербіж, печіння, дискомфорт (поліпшення на 90 % і більше). У категорію зі значним поліпшенням віднесено випадки зі зниженням клінічних проявів дерматозу на 75 %, при збереженні незначних проявів псоріазу (еритема, інфільтрація, лущення). Як поліпшення клінічної картини дерматозу вважався регрес патологічних проявів на 50 % (табл. 6.2).
Клінічне вилікування настало у 23,1 % хворих групи 1 і 40,0 % пацієнтів групи 2, значне поліпшення – відповідно у 34,6 % і 50,0 % (р ˂ 0,05). Разом з тим, поліпшення і відсутність ефекту частіше відбувалися у пацієнтів, які отримували традиційне лікування (34,6 і 10,0 %), ніж розроблене (13,3 % і 0 %). Більш показова сума випадків клінічної ремісії і значного поліпшення у хворих, у лікування яких залучали мелатонін (90,0 %), ніж тільки традиційну медикаментозну і фототерапію (57,7 %, р ˂ 0,05).
Таблиця 6.2 – Клінічна ефективність лікування хворих на псоріаз в залежності від методу терапії (M ± m)
| Результати
лікування |
Хворі на псоріаз | р | |
| Перша група,
абс. (%) |
Друга група,
абс. (%) |
||
| Клінічне одужання
Значне покращення Покращення Відсутність ефекту Разом |
6 (23,1)
9 (34,6) 9 (34,6) 2 (7,7) 26 (100,0) |
12 (40,0)
15 (50,0) 3 (10,0) 0 30 (100,0) |
˂ 0,05
˂ 0,05 ˂ 0,01 ˂ 0,05 – |
На рис. 6.1 наочно представлені переваги використання комбінованої терапії (фототерапія + мелатонін) хворим на псоріаз порівняно із загальноприйнятою (традиційна і фототерапія).
Спостереження за хворими на звичайний псоріаз протягом одного року після терапії встановило рецидиви дерматозу у 18 (69,2 %) пацієнтів першої та 10 (33,3 %) хворих другої групи. Хворі групи 2 відзначали загострення через (172,3 ± 21,3) дні, групи 1 – через (243,5 ± 25,4) дні (р ˂ 0,05).
Вплив терапії на клінічний перебіг дерматозу, що оцінюється на підставі змін дерматологічних коефіцієнтів, представлено в табл. 6.3.
Рисунок 6.1 – Клінічний ефект лікування хворих на псоріаз першої та другої груп
Таблиця 6.3 – Динаміка значень площі та ступеня тяжкості псоріазу до та після лікування (M±m)
| Показники | Хворі на вульгарний псоріаз у процесі терапії | |||||
| Група 1, n=26 | p | Група 2, n=30 | p | |||
| до | після | до | після | |||
| BSA, % | 19,6 ± 3,1 | 10,2 ± 1,7 | ˂ 0,05 | 18,8 ± 2,9 | 6,9 ± 0,9 | ˂ 0,01 |
| PASI, бали | 17,8 ± 2,1 | 9,6 ± 1,7 | ˂ 0,01 | 18,1 ± 2,5 | 6,2 ± 0,2 | ˂ 0,01 |
| SAPASI, бали | 20,9 ± 3,6 | 11,2 ± 2,5 | ˂ 0,05 | 21,2 ± 2,9 | 5,1 ± 0,5 | ˂ 0,001 |
У хворих групи 1 відзначено позитивну динаміку показників під впливом фототерапії та ад’ювантної терапії – відбувалося зменшення значення показників BSA, PASI і SAPASI після лікування відповідно в 1,87, 1,85 і 1,92 раза порівняно з таким до лікування. Додавання в комплексну терапію мелатоніну дозволило отримати кращі результати – відбувалося значне зниження значення дерматологічних індексів: BSA в 2,72 раза, PASI – в 2,95 раза та SAPASI – в 5,1 раза. Звертає на себе увагу не тільки виражене зниження BSA і PASI в 1,42 і 1,59 раза, але й особливо SAPASI (в 2,72 раза) у другій групі пацієнтів порівняно з першою групою (р ˂ 0,05).
Результати впливу терапії на психічний стан хворих в залежності від методу терапії представлені на рис. 6.2.
При порівнянні показників вираженості депресії в двох групах до і після лікування середнє значення суми балів в групі 1 зменшилося на 2,45 бала, у групі 2 – на 5,1 бала, що в 2 рази більше ніж в першій і демонструє більш інтенсивний регрес депресивного настрою у осіб які отримували терапію, що містила мелатонін.
Результати впливу терапії на стан сну у хворих в залежності від методу терапії представлені на рис. 6.3.
Рисунок 6.2 – Вираженість депресії у хворих на псоріаз першої та другої груп до і після лікування
Рисунок 6.3 – Ступінь порушень сну у хворих на псоріаз першої та другої груп до і після лікування.
Аналізуючи динаміку якості сну за результатами анкетування в обох групах до і після лікування, ми прийшли до висновку, що середні показники в групі 1 покращилися на 11,0 % (2,5 бала), у групі 2 – на 33,0 % (7,9 бала). Отже, посилення терапії препаратом мелатонін більшою мірою поліпшило якість сну хворих на псоріаз.
Результати рівня сироваткового СЕФР, цитокінів і мелатоніну у хворих на вульгарний псоріаз до і після лікування наведено в табл. 6.4.
Таблиця 6.4 – Лабораторні показники у хворих на псоріаз до і після лікування (M ± m)
| Показник | Хворі (n=56), групи | Контрольна група, n=24 | |
| Група 1, n=26 | Група 2, n=30 | ||
| Мелатонін,
пг/мл |
15,09 ± 1,01
17,51 ± 1,18 |
14,94 ± 0,89
32,28 ± 1,96* |
38,29±2,60 |
| СЕФР,
пг/мл |
549,32 ± 38,11
347,08 ± 19,05* |
513,81 ± 29,16
99,65 ± 8,73* |
52,17±4,22 |
| ФНП α,
пг/мл |
56,87 ± 4,29
28,57 ± 1,76 |
53,09 ± 4,81
15,36 ± 1,22* |
13,97±1,16 |
| ІЛ-8, пг/мл | 98,64 ± 7,82
81,24 ± 5,39* |
102,58 ± 7,94
62,83 ± 2,11* |
56,11±1,8 |
Примітка. У чисельнику вказані показники до лікування (початково), знаменнику – після лікування; відмінності достовірні між показниками в групі при р < 0,05 – *.
У групі 1 хворих із звичайним псоріазом, що отримувала лікування мелатоніном і фототерапією, виявлена позитивна динаміка у зниженні рівня СЕФР і ФНП α, незначна зміна в бік нормалізації рівня ІЛ-8 і мелатоніну в порівнянні з результатами до лікування. Більш яскрава динаміка нормалізації даних показників виявлена в групі 2 з розробленим лікуванням, що включає мелатонін (синтетичний аналог гормону епіфіза мелатоніну).
Резюме. Проведене лікування хворих на вульгарний псоріаз загальноприйнятим і розробленим методами різною мірою сприяло нормалізації клінічних і лабораторних показників. Аналіз динаміки PASI у хворих на псоріаз показав переваги розробленого методу терапії (зниження значення індексу в групі 1 в 1,8 раза, в 2-й – в 3,0 раза, BSA і SAPASI відповідно в 1,9 і 2,7 раза, 1,9 і 5,1 раза, р> 0,05).
Чітка позитивна динаміка інших показників під впливом терапії виявлена у хворих групи 2 – рівень СЕФР знизився в 5,2 раза, ФНП α – в 3,5 раза, ІЛ-8 – в 1,6 раза, мелатоніну збільшився в 2,2 рази відносно результатів до лікування (р < 0,05) і не відрізнявся від аналогічних параметрів у практично здорових осіб (р > 0,05). Додаткове призначення препарату Віта-мелатонін зумовило нормалізацію сну, при цьому рівень мелатоніну в крові хворих після лікування практично не відрізнявся від розрахованого у осіб контрольної групи (р > 0,05).
У хворих, які отримували традиційне лікування, також відзначена позитивна динаміка, однак повна нормалізація рівня досліджуваних лабораторних показників не відбувалася. Вміст мелатоніну і ІЛ-8 майже не змінився (відповідно збільшився і зменшився в 1,2 раза, р > 0,05), при цьому рівень СЕФР і ФНП α достовірно знизився (відповідно в 1,6 і 2,0 раза, р < 0,05).
Висока ефективність препаратів, відсутність побічних явищ, доступність засобів і методів розробленого комплексу терапії обґрунтовують доцільність додаткового використання в лікуванні хворих на псоріаз засобу мелатонін, який позитивно впливає на ангіогенез, психічний статус і сон, а також дозволяє рекомендувати для впровадження в практику охорони здоров’я.
Наведені у розділі положення відображено у публікаціях:
- Лопандина А. А. Использование мелатонина в комплексном лечении псориаза. Дерматологія та венерологія. № 4 (81). С. 27–30 [54].
- Спосіб лікування хворих на псоріаз / Л. А. Болотна, Г. О. Лопандіна, Я. Ф. Кутасевич, О. І. Саріан : пат. на корисну модель № 127590 UA: МПК А61 К 31/00. № u 2018 02708; заявл. 19.03.2018; опубл. 10.08.2018; Бюл № 15 [94].
РОЗДІЛ 7
АНАЛІЗ ТА УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
Псоріаз – хронічний мультифакторний дерматоз, що проявляється гіперпроліферацією епідермісу з порушенням кератинізації і запаленням шкіри, з розвитком еритематозно-сквамозного висипу і, нерідко, екстракутанними патологічними змінами в інших органах і системах [14, 70, 71, 124, 197, 234]. На сьогоднішній день немає єдиного погляду на етіопатогенез захворювання, але пріоритетними визнаються імунні механізми і фактори патогенезу. Псоріаз перестав бути виключно дерматологічним захворюванням – часті супутні йому стани: метаболічний синдром, ураження опорно-рухового апарату, запальні захворювання кишечника, психоемоційні порушення, сигналізують про наявність патогенетичної спільності псоріазу з цими станами, і цей факт дозволяє визначити псоріаз як «псоріатичну хворобу» [6, 81, 148,191].
До тригерних факторів псоріазу відносяться інфекції, надмірна вага, надмірне сонячне опромінення, шкідливі звички – куріння і алкоголізм, пошкодження шкіри внаслідок травм, хірургічного втручання, зовнішніх холодових і фізичних чинників, а також прийом лікарських засобів і психоемоційні стреси, які провокують псоріаз в 23 % випадків.
В останні роки стався значний прогрес у вивченні морфо- і патогенезу псоріазу з виділенням характерного для даного захворювання Т-хелпер опосередкованого цитокінового каскаду, що впливає на взаємодію клітин з формуванням псоріатичного фенотипу у вигляді ознак акантозу, паракератозу, запалення в дермі, абсцесів Мунро [170, 221]. В результаті пошкодження епідермісу відбувається запуск запальної реакції з включенням механізмів продукції кератиноцитами цитокінів, розвитком вазодилатації й випотіванням формених елементів крові в тканини дерми, що обумовлює виникнення інфільтрату. Збій в регуляції імунного захисту при псоріазі призводить до збільшення мітозів в кератиноцитах, з прискоренням проліферації епідермісу. Патологічні імунні процеси включають активацію макрофагів, які продукують прозапальні агенти – ІЛ-1, ФНП α. Одним з ключових елементів патогенезу псоріазу є патологічне розростання нових кровоносних судин – ангіогенез. В умовах запалення та активації гіпоксія-індукованого фактора відбувається дисрегуляція синтезу кератиноцитами СЕФР і його рецепторів – головних регуляторів судинного росту. Крім формування нових судин, при патологічному ангіогенезі відбувається синтез ендотеліоцитами хемокинів і молекул адгезії, що генерує новий виток запалення. Доведено, що тяжкість псоріазу корелює з підвищеною експресією рецепторів СЕФР і рівнем цього фактора в сироватці крові хворих, а блокування СЕФР моноклональними антитілами призводить до регресу запалення і клінічних проявів дерматозу. Поряд з СЕФР проангіогенні властивості мають ФНП α, ТФР β, ІЛ-17, ІЛ-8, ангіопоетин [123]. Шляхом складної взаємодії ці медіатори беруть участь в патологічному ангіогенезі. ФНП α ініціює запуск цитокінового каскаду, стимулюючи синтез прозапальних медіаторів, вплив яких має важливе значення при псоріатичному процесі – ІЛ-1, ІЛ-2, ІЛ-6, хемокінів (ІЛ-8), активаторів транскрипції (NF-kb), ММП, інсуліноподібного фактору росту, епідермального фактору росту [62, 208]. В результаті їх спільної взаємодії форсуються процеси ангіогенезу з підвищеною експресією СЕФР.
Важливим відкриттям в області пошуку ефективного лікування псоріазу стали результати лікування пухлин внутрішніх органів інгібіторами СЕФР у хворих на псоріаз у вигляді регресу висипки і зменшення запалення і больового синдрому при псоріатичній артропатії [128]. Інші дослідження показали анти- СЕФР ефективність ретиноїдів, що зайвий раз доводить важливість антиангіогенної терапії при псоріазі. Питання пошуку нових засобів здатних пригнічувати ангіогенез залишається відкритим.
Мелатонін – гормон епіфізу є одним з ендогенних антиангіогенних чинників і має мультипотентний вплив на імунну систему. Його имуномодулюючі, антипроліферативні, антиоксидантні і, можливо, антиангіогенні ефекти важливі і значимі в рамках пошуку нових терапевтичних засобів псоріазу.
Складний патогенез псоріазу має ряд загальних механізмів з патогенезом інших захворювань що нерідко супроводжують перебіг дерматозу (МС, цукровий діабет, ожиріння, гіперліпідемія, хвороба Крона, лімфома, депресія, запальні захворювання суглобів). Одним з основних об’єднуючих механізмів патогенезу є хронічне запалення. За результатами досліджень, частота зустрічальності психічної коморбидности (депресія, тривога, алекситимія) у хворих на псоріаз вище, ніж у загальній популяції [2, 3, 21, 95, 96, 163, 2191, 228]. Ця ситуація на сьогоднішній день під пильною увагою дослідників.
Проведення в дисертаційній роботі комплексного дослідження з визначенням рівня сироваткового СЕФР, цитокінів ФНП α і ІЛ-8, мелатоніну в сироватці крові хворих на псоріаз, вивчення залежності цих показників від ступеня тяжкості дерматозу, клінічних форм і різновидів псоріазу з урахуванням психічної коморбідності (депресивні розлади, порушення сну) допоможе, на наш погляд, краще зрозуміти механізми взаємозв’язку захворювань зі складним патогенезом і розробити ефективні методи лікування.
Під наглядом перебувало 114 хворих на псоріаз у віці 18-65 років, чоловіків – 67, жінок – 47. Частка хворих старше 30 років – осіб активного, працездатного віку склала 71 %. Середній вік початку захворювання склав 29,8 років, у 19,3 % дебют псоріазу трапився до 18 років, у 43,9 % – між 19 і 30 роками, у 36,8 % – після 31 року
За соціальним статусом група обстежуваних розподілилася таким чином: 43,9 % хворих були одружені, 18,4 % – в розлученні, інші – самотні. Вища освіта була у 39,5 % хворих, середня – у 51,8 %, не закінчена – у 8,7 %. Тих, що працюють і студентів було 60,5 %, інвалідів та утриманців – 34,5 %. Серед хворих на псоріаз були робітники, службовці, студенти, пенсіонери, які тимчасово не працюють. У 22,9 % хворих робота включала нічну зміну.
До тригерних факторів відносились психоемоційні навантаження і стреси, зафіксовані у 57,8 %, інфекційно-запальні провокатори у 11,3 % пацієнтів у вигляді запальних захворювань ЛОР-органів та одонтогенної природи. Обтяжений спадковий анамнез виявлено у 14,9 % хворих. Утруднення з визначенням провокуючих чинників початку і рецидивів захворювання виникли у 15,9% хворих на псоріаз. Найпоширенішим є зимовий тип псоріазу (62 %) з частотою рецидивів 2 рази на рік (у 58 %).
У дослідженні брали участь хворі із різними клінічними формами. З урахуванням локалізації та поширеності процесу виділено такі форми: звичайний (вульгарний) псоріаз – у 76,3 % хворих, артропатичний псоріаз – у 16,75% і псоріатична еритродермія – у 8,8 % хворих. Серед пацієнтів з вульгарним псоріазом бляшковий різновид спостерігався у 73,6 %, себорейний псоріаз – у 10,4 %, інверсний – у 5,3 %, ексудативний – у 9,2 % хворих. У 15,8 % хворих на псоріаз, крім висипань на тулубі, відзначені зміни на шкірі кистей і стоп у вигляді ізольованого або синхронного ураження кінцівок. У 29,8 % хворих виявлено дистрофічні зміни нігтів.
Прогресуюча стадія псоріазу до лікування встановлена у 29,9 % обстежених, стаціонарна стадія захворювання – у 70,1 %.
При аналізі дерматоскопічної картини елементів шкірного висипу у хворих на псоріаз відзначався типовий псоріатичний патерн у вигляді рівномірних точкових судин на фоні яскраво-червоної еритеми.
Оцінка ступеня тяжкості дерматозу проводилася з використанням індексів BSA, PASI, SAPASI. За ступенем тяжкості досліджувана група розподілилася таким чином: легкий – 17,5 %, помірний – 57,9 % і важкий – 24,6 % хворих. Середні значення коефіцієнтів ступеня тяжкості склали: BSA з легким ступенем тяжкості – (8,31±0,58) %, PASI – (8,50±0,44) бала і SAPASI – (6,94±0,69) бала; при середньо-важкому псоріазі BSA – (17,43±1,07) %, PASI – (15,52±0,99) бала і SAPASI – (18,25±0,42) бала; у хворих з важким псоріазом BSA – (43,2±2,59) %, PASI – (21,23±0,57) бала, SAPASI – (32,40±1,62) бала. Середнє значення BSA у хворих на псоріаз в цілому склало (19,3±5,2) %, PASI – (17,8±5,1) бала, SAPASI – (20,4± 6,2) бала.
Супутня патологія виявлена у 84,2 % хворих. Частота серцево-судинних захворювань склала 39,5%, захворювання шлунково-кишкового тракту у 29,8 % хворих, ендокринна патологія у 7,9 % хворих, захворювання сечостатевої системи – у 14,9 %, відхилення в бронхолегеневої системі – у 10, 5%. 86,8 % хворих пред’являли скарги на психоемоційні зрушення різного ступеня вираженості. Клінічні особливості псоріазу у цієї групи хворих полягали в наявності інтенсивного свербіння, в тому числі і в нічний час, шкірні прояви носили поширений характер, з переважним ураженням волосистої частини голови, зовнішніх статевих органів та відкритих ділянок тіла.
Вивчення рівня СЕФР в сироватці крові показало підвищення вмісту СЕФР у хворих на звичайний псоріаз в 4,5 раза, еритродермію – в 13,0 і артропатичний псоріаз – в 5,5 раза відносно показника у практично здорових осіб (р < 0,01). Більш ніж у 80% хворих зміст СЕФР перевищувало в 3 рази показники контрольної групи. Виявлено суттєве підвищення рівня СЕФР у хворих в прогресуючу стадію дерматозу в порівнянні зі стаціонарною і при поширеному псоріазі відносно обмеженого процесу. Зменшення вмісту СЕФР в 1,6 раза в стаціонарній стадії дерматозу відносно прогресуючої, вирогідно, пов'язано зі зниженням активності ангіогенезу в ураженій шкірі і зупинкою росту псоріатичних висипань.
Аналіз рівня СЕФР в залежності від ступеня тяжкості виявив значне підвищення вмісту СЕФР в крові пацієнтів з важким ступенем тяжкості дерматозу відносно аналогічного показника при легкому та помірному ступеню тяжкості хвороби (р < 0,05). Показова відмінність рівнів СЕФР в залежності від частоти загострень на рік, так рівень СЕФР значно вище у тих хворих, у яких загострення трапляються частіше двох разів протягом року (р < 0,01). Тісний кореляційний зв'язок СЕФР і тяжкості захворювання полягає в підвищенні рівня фактора з посиленням тяжкості дерматозу.
Отримані дані свідчать про активну проліферацію судин в прогресуючу стадію, при залученні в процес більше 10 % площі шкіри і частому рецидивуванні.
Вивчення рівня ФНП α в сироватці крові хворих на псоріаз виявило підвищення вмісту в 4,3 раза в порівнянні з контрольною групою. Залежно від клінічних форм визначили підвищення ФНП α в 3,5 раза у хворих на вульгарний псоріаз, у хворих на псориатичну еритродермію в 5 разів і у хворих з артропатичним псоріазом майже в 6 разів у порівнянні з рівнем ФНП α у здорових осіб (р < 0, 05).
При оцінці рівня ФНП α у хворих з різним ступенем тяжкості дерматозу встановлено значне підвищення при важкому ступені псоріазу (р < 0,01). Різниця між рівнями ФНП α при легкому та середньому ступенях тяжкості практично відсутня, але достовірно перевищує контрольний показник. Відзначено тенденцію до збільшення вмісту в крові ФНП α при тривалості псоріазу більше 10 років.
При вивченні рівня ІЛ-8 у хворих на псоріаз виявлено відхилення в бік підвищення в 2 рази в порівнянні з контрольною групою. У хворих важким псоріом рівень ІЛ-8 в 2 рази вище в порівнянні з рівнем у хворих з легким ступенем псоріазу (р < 0,05).
Аналіз показників цитокінів у хворих на псоріаз бляшковою і небляшковою формами виявив зміни обох прозапальних медіаторів – підвищення рівня ФНП α і ІЛ-8 у всіх пацієнтів. При цьому максимальні значення ФНП α відзначені у хворих з небляшковими формами захворювання – псоріатичним артритом і еритродермією (р < 0,01), ІЛ-8 – еритродермією. Співвідношення ІЛ-8/ФНП α виявилося вищим при ураженні шкіри, ніж при ураженні суглобів.
У прогресуючій стадії дерматозу рівень цитокінів в крові достовірно збільшувався в порівнянні з показниками в контрольній групі (р <0,01), при цьому вміст ФНП α достовірно відрізнявся від аналогічного в стаціонарній стадії процесу (р < 0,05). Звертає увагу відсутність змін вмісту ФНП α у хворих з дерматозом в стаціонарній стадії щодо такого у практично здорових осіб, на відміну від збільшення рівня ІЛ-8 в цій стадії хвороби, що перевищує значення показника в контролі (р < 0,01). Разом з тим, відмінностей між вмістом ІЛ-8 в залежності від стадії у хворих не виявлено (р> 0,05), але чим вище був початковий рівень цього хемокіну, тим повільніше наступав регрес висипань під впливом терапії.
Вміст ФНП α і ІЛ-8 в крові хворих не залежав від частоти рецидивів (р > 0,05). Відзначено тенденцію до збільшення вмісту в крові обох параметрів – ФНП α і ІЛ-8 при тривалості псоріазу більше 10 років.
Імунні маркери асоційовані з основними клінічними проявами псоріазу. Встановлено, що вміст ФНП α залежить від стадійності (прогресування) і тяжкості процесу, ІЛ-8 – від клінічної форми, тяжкості перебігу псоріазу. Рівень прозапальних медіаторів (ФНП α, ІЛ-8) може бути самостійним об’єктивним критерієм тяжкості псоріазу та псоріатичного артриту.
В результаті проведеного дослідження виявлено односпрямовані зміни ростового проангіогенного фактору та прозапальних цитокінів – збільшення вмісту СЕФР, ФНП α і ІЛ-8 у хворих на псоріаз, ступінь відхилення показників залежала від форми, стадії і тяжкості процесу.
За даними літератури, дисрегуляція мелатоніну виявлена при вульгарному псоріазі у вигляді зниження екскреції гормону в нічний час [213]. Проведене нами дослідження рівня мелатоніну в сироватці крові у 76 хворих на псоріаз виявило зниження показника в 2,4 раза в порівнянні з групою практично здорових осіб (р < 0,01). Значення цього маркера у хворих з різним ступенем тяжкості відрізняються в сторону зменшення – від легкого ступеня до важкого. Виявлено зниження рівня мелатоніну в 2,1 раза у хворих на важкий псоріаз в порівнянні з аналогічним показником при легкому ступені тяжкості дерматозу (р ˂ 0,05). У прогресуючій стадії рівень мелатоніну також незначно нижче, ніж у стаціонарній стадії. Практично немає відмінності в показниках мелатоніну у хворих з одним або двома рецидивами на рік, але при більш частому рецидивуванні псоріазу рівень мелатоніну знижується. Така ж динаміка спостерігається при аналізі цього показника в залежності від тривалості дерматозу: чим довше стаж дерматозу, тим нижче рівень мелатоніну.
Вивчення рівня сироваткового мелатоніну у хворих на псоріаз що страждають на порушення сну встановило взаємозв’язок лабораторного показника і даного клінічного прояву (р < 0,05). Встановлено негативний кореляційний зв'язок порушення сну і рівня мелатоніну.
Виявлені коливання мелатоніну свідчать про його зниження при важких формах захворювання, в стадії прогресування, при частому рецидивуванні (більше 2 разів на рік), тривалості дерматозу понад 10 років і за наявності психічної коморбідності, зокрема, порушення сну.
Дефіцит мелатоніну як антиангіогенного фактору у хворих на псоріаз демонструє дисбаланс ангіогенезу з переважаючим значенням стимулюючих факторів.
Важливим аспектом самопочуття пацієнта є не тільки комплекс суб’єктивних відчуттів, зовнішніх проявів хвороби, але і його психологічний стан, вплив хвороби на якість життя, самооцінку, соціальну адаптацію [65]. Існує достатньо доказів впливу хронічного стресу на розвиток імуносупресії або імунної дисрегуляції. Депресія і тривога можуть сприяти погіршенню запальних захворювань шкіри, активуючи як ГГНС, так і СНС. У наукових дослідженнях показано, що індукція запалення при псоріазі впливає на зміну настрою, включаючи депресивні симптоми. У осіб з депресією зниження рівня мелатоніну і дисфункція циркадного ритму можуть сприяти виділенню меланоцит-стимулюючого гормону, який пов’язаний із запальними дерматозами. За даними літератури, найпоширенішими психічними відхиленнями, більш ніж у 50% хворих на псоріаз, є сексуальні розлади і порушення сну. Часто супутні псоріазу депресивні порушення настрою і порушення сну впливають і на якість життя хворих і на тяжкість перебігу дерматозу [80, 125].
Для поглибленого вивчення асоціації псоріазу та психічних порушень було проведено скринінгове дослідження депресивного розладу і порушень сну за допомогою анкетування хворих шкалами депресії Бека і оцінки суб’єктивних характеристик сну. Більшість (76,6 %) обстежених відзначили негативний вплив хвороби на якість життя.
В результаті вивчення псіхічного статусу хворих на псоріаз за допомогою анкетування у 91,3 % хворих виявлено розлади депресивної спрямованості. Показник вираженості депресії у хворих на псоріаз виявився в 3,3 раза вище показника у здорових осіб (р ˂ 0,01). Ознаки легкої депресії було виявлено у 51,8 % хворих, помірної депресії – у 39,5 %, вираженої – у 1,7 %. Відсутність порушень настрою визначилися у 8,7 % хворих на псоріаз. Достовірної різниці між чоловіками і жінками виявлено не було. Ознаки помірної депресії було діагностовано у 38,6 % хворих переважно старше 50 років. У віковій групі до 50 років показник знаходився в діапазоні субдепресії. У пацієнтів з маніфестацією псоріазу на відкритих ділянках тіла і статевих органах (65,8 % хворих) середнє значення показника відповідало помірній депресії і в 1,3 раза перевищувало показник пацієнтів з висипаннями на закритих ділянках тіла. Виявлена позитивна кореляція посилення депресивного порушення від ступеня тяжкості псоріазу (р < 0,05).
Аналізуючи зміну рівня показника вираженості депресії в залежності від клінічних форм псоріазу, встановлено відхилення в діапазоні помірної депресії у хворих з псоріатичною еритродермією і перевищує норму в 3,5 раза. Значущої різниці між показниками хворих на звичайний псоріаз і артропатичний псоріаз не виявлено, середнє значення відповідало рівню легкої або субдепресії. Залежно від прогресування і частоти рецидивів псоріазу, ступінь вираженості депресії вище у хворих в прогресуючій стадії дерматозу і з частими (більше 2 разів на рік) рецидивами. Проводячи аналіз рівня депресії в залежності від тривалості захворювання, варто відзначити, що максимальна вираженість депресії виявлена у хворих з невеликим стажем псоріазу (до 5 років), що, ймовірно, пов’язано з відсутністю психологічної адаптації на початку хвороби.
Оцінюючи порушення сну у хворих на псоріаз 77,2 % всієї групи, що обстежувались вказали на наявність порушень сну у вигляді безсоння, частих нічних пробуджень, сонливості в денний час, ранкові ранні пробудження. Основними причинами пацієнти називали наявність свербежу, больового синдрому, нічного апное, синдрому неспокійних ніг, тривожних і депресивних станів.
Згідно з результатами суб’єктивної оцінки сну виявлено зниження показника у хворих на псоріаз в 1,2 раза відносно значення у практично здорових осіб (р < 0,05). Граничні порушення сну встановлені у 53,5 % хворих, у 23,7 % були виражені відхиленнями у якості сну, у 22,8 % хворих показники відповідали нормальному сну. Виявлено, що показник якості сну у чоловіків на 12,6 % краще ніж у жінок. Встановлено достовірний зворотний кореляційний зв'язок між вираженністю порушень сну і віком пацієнта, з погіршенням показника у старшій когорті хворих (51-65 років) на 34 % щодо осіб у віці 18-30 років. Порівнюючи показники порушення сну у хворих з різним ступенем тяжкості псоріазу, виявлено погіршення в 1,1 раза при важкому перебігу в порівнянні з легким перебігом і в 1,2 раза в порівнянні з контрольною групою. У пацієнтів з різними клінічними формами псоріазу виявлені зміни показників в бік погіршення якості сну при наявності важких форм (псоріатична артропатія, еритродермія). У пацієнтів зі звичайним псоріазом ступінь порушення сну наближається до норми.
З огляду на те, що порушення сну, як відхилення в психоемоційної сфері, можуть бути і причиною, і наслідком депресивних розладів, ми провели аналіз частоти порушень сну у хворих на псоріаз з різним ступенем вираженості депресії. Встановлено зворотню кореляційну залежність сумарної кількості балів за шкалою СХС і суми балів за шкалою депресії Бека, що підтверджує збільшення інсомнії у людей з депресивним станом. Погіршення психоемоційного стану хворих достовірно залежало від поширеності кожного процесу і наявності висипань на відкритих ділянках тіла. Також виявлено взаємозв’язок наявності і ступеня порушення сну і вираженості депресивного стану у хворих на псоріаз (р < 0,05).
Виявлені в ході досліджень у хворих на псоріаз відхилення у вигляді підвищення вмісту в крові прозапальних цитокінів (ФНП α, ІЛ-8), промотора неоангіогенезу СЕФР, зниження рівня протизапального і антиангіогенного фактора мелатоніну; встановлена пряма залежність характеру поширеності, тяжкості перебігу дерматозу і ступеня психоемоційних відхилень відповідно до коливань рівня досліджуваних показників у хворих на псоріаз; виявлення депресивного стану і порушень сну у більшості хворих, зумовлюють необхідність комплексного терапевтичного підходу до ведення хворих на псоріаз за допомогою корекції рівня мелатоніну та опосередкованого впливу на рівень цитокінів.
Мелатонін, будучи гормоном епіфіза, служить багатофункціональним регулятором фізіологічних циркадних і сезонних ритмів. Встановлено, що мелатонін призводить до зниження експресії прозапальних цитокінів, таких як ІЛ-6, ІЛ-8 і ФНП α, модифікує в крові рівні цих запальних показників, таким чином покращує клінічний перебіг імунозапальних хвороб [138]. Мелатонін надає пряму і непряму протиангіогенну дію: безпосередньо пригнічує функцію СЕФР, опосередковано – інші фактори росту і АФК [179].
Під час досліджень нами було виявлено підвищення вмісту прозапальних цитокінів (ФНП α, ІЛ-8), ростового фактора СЕФР, зниження рівня протизапального і антиангіогенного фактора мелатоніну у хворих на псоріаз. Встановлена пряма залежність характеру поширеності і тяжкості перебігу дерматозу і ступеня психоемоційних відхилень відповідно до коливань рівня досліджуваних показників у хворих на псоріаз.
Останнім часом з’явилася величезна кількість робіт, в яких описано позитивний результат застосування мелатоніну в комбінованій терапії при різних патологічних станах, у тому числі й шкіри [23].
На фоні комплексної терапії (в т. ч. і фототерапії) призначали мелатонін (Віта-мелатонін) за 30 хвилин до сну по 1 таблетці (3 мг) на добу до відновлення фізіологічного ритму «сон-неспання», але не більше 1 місяця.
Лікування хворих на псоріаз розробленим методом сприяло підвищенню ефективності терапії (значне поліпшення у 50,0 % і ремісія у 40,0 % хворих) в 1,8 раза, вдвічі зменшувало кількість рецидивів, в 1,4 раза подовжувало ремісію, сприяло регресу депресивного настрою на 34,0 % і покращенню якості сну на 49,0 % відносно аналогічних показників у хворих при використанні традиційної терапії.
Відбувалося значне зниження рівня дерматологічних індексів: BSA в 2,72 раза, PASI – в 2,95 раза і SAPASI – в 5,1 раза. Звертає на себе увагу не тільки виражене зниження BSA і PASI в 1,42 і 1,59 раза, але особливо SAPASI (в 2,72 раза) в групі що одержувала мелатонін в порівнянні з групою традиційного лікування (р ˂ 0,05).
Нормалізація лабораторних показників в тій чи іншій мірі наступила в наслідок лікування псоріазу звичайним і розробленим методами. За результатами дослідження, в групі із розробленим лікуванням рівень СЕФР знизився в 5,2 раза, ФНП α – в 3,5 раза, ІЛ-8 – в 1,6 раза, мелатонін збільшився в 2,2 раза відносно результатів до лікування (р < 0,05) і не відрізнявся від аналогічних параметрів у практично здорових осіб (р > 0,05). Додаткове призначення препарату мелатонін зумовило нормалізацію сну, при цьому рівень мелатоніну в крові хворих після лікування практично не відрізнявся від розрахованого у осіб контрольної групи (р > 0,05). У хворих, які отримували традиційне лікування, також відзначена позитивна динаміка, однак повна нормалізація рівня досліджуваних лабораторних показників не відбувалася.
Доцільність використання препарату мелатонін в комплексному лікуванні псоріазу обґрунтована високою ефективністю, доступністю лікарського засобу і відсутністю побічних явищ і дозволяє рекомендувати його у впровадження в практичну охорону здоров’я.
ВИСНОВКИ
У дисертації наведено теоретичне узагальнення і нове вирішення наукової задачі, що полягає у підвищенні ефективності терапії хворих на псоріаз шляхом розробки комплексного патогенетично обгрунтованого методу лікування на підставі вивчення факторів ангіогенезу та психічного стану.
- З урахуванням розповсюдженості псоріазу серед населення, значної питомої ваги у структурі шкірних захворювань, тривалого перебігу з частими рецидивами, почастішанням тяжких форм дерматозу з високою частотою психосоматичних розладів та низькою ефективністю методів терапії, вивчення даної проблеми є актуальним для оптимізації діагностики і лікування хворих на псоріаз з урахуванням патогенетичних взаємозв’язків дерматозу і коморбідних станів.
- Серед обстежених хворих на псоріаз чоловіків виявилося в 1,4 раза більше, ніж жінок. У шлюбі перебувало 43,9 % осіб, вищу освіту мали 39,5 % пацієнтів, працювали 40,3 % хворих, з них 22,9 % – у нічну зміну. Найчастіше (62,2 % випадків) дебют захворювання визначено у віці 11-30 років. Однією з причин загострення дерматозу 57,8 % пацієнтів вважали психоемоційне навантаження і стреси. Найчастіше встановлено захворювання серцево-судинної системи (39,5 %) і шлунково-кишкового тракту (29,8 %). Скарги на свербіж, порушення уваги, настрою, підвищену тривожність, дратівливість, порушення сну пред’являли 86,8 % хворих. При розладах психічного стану частіше виявлено розповсюджений процес, ураження відкритих частин тіла, шкіри скальпу, зовнішніх статевих органів, стадію прогресування і тривалість дерматозу понад 10 років.
- Встановлено односпрямовані зміни ростового проангіогенного фактора і цитокінів (збільшення вмісту СЕФР в 5,7 раза, ФНП α в 4,1 раза та ІЛ-8 в 1,85 раза) у хворих на різні форми псоріазу порівняно з такими у практично здорових осіб. Ступінь відхилення цих показників залежить від клінічних проявів псоріазу із суттєвим збільшенням усіх медіаторів у хворих на тяжкі форми захворювання, у стадії прогресування, при рецидивах більше двох разів на рік і тривалому перебігу хвороби.
- Встановлено пониження в 2,4 раза рівня антиангіогенного фактора мелатоніну у крові хворих відносно показника у здорових осіб, ступінь його відхилення залежить від форми, стадії і тяжкості процесу, наявності психічної коморбідності, зокрема порушень сну.
- У 91,3 % хворих на псоріаз визначено психічні розлади у вигляді депресивного синдрому, у 77,2 % пацієнтів – порушень сну. Ступінь вираженості розладів має прямий зв’язок з клінічними проявами дерматозу, а саме поширеністю і тяжкістю псоріазу, кількістю рецидивів на рік, віком пацієнтів. Рівень вираженості депресії корелює з наявністю висипу на відкритих ділянках шкіри.
- Розроблено комплексний метод лікування хворих на звичайний псоріаз із використанням мелатоніну, який забезпечують підвищення ефективності терапії (досягнення клінічної ремісії та значного покращення) відповідно у 90,0 % хворих порівняно з 58,0 % при традиційному лікуванні, вдвічі зменшує кількість рецидивів, в 1,4 раза подовжує ремісію, сприяє регресу депресивного настрою на 34,0 % і покращенню якості сну на 49,0 % відносно аналогічних показників у хворих при використанні традиційної терапії.
- Застосування розробленого методу лікування хворих на звичайний псоріаз сприяє нормалізації в крові рівня про- і протиангіогенних факторів (вміст СЕФР знизився в 5,2 раза, ФНП α – в 3,5 раза, ІЛ-8 – в 1,6 раза, мелатоніну збільшився в 2,2 раза), що поєднується із регресом шкірних проявів захворювання та досягненням клінічної ремісії і значного покращення у більшості хворих.
РЕКОМЕНДАЦІЇ
- В якості об’єктивного критерію тяжкості псоріазу та псоріатичного артриту необхідно визначати в крові хворих рівень прозапальних медіаторів (ФНП α та ІЛ-8).
- Враховуючи вплив депресії на клінічний перебіг псоріазу та зв’язок депресивних розладів із соціодемографічними показниками, доцільно проводити скринінг депресивних порушень у хворих.
- З метою корекції порушень сну, дисбалансу ангіогенезу хворим на звичайний псоріаз рекомендується призначати всередину мелатонін (Віта-мелатонін) по 1 таблетці (3 мг) на добу за 30 хвилин до сну до відновлення фізіологічного ритму «сон-неспання», але не більше 1 місяця.
- Корисним є застосування дерматоскопії як критерію ефективності терапії хворих на звичайний псоріаз.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Андрашко Ю. Современная модель иммунопатогенеза псориаза: пути эффективного воздействия. Дерматолог. 2011. Т. 2. № 1. С. 99–101.
- Артёменко А. Ф. Личностные особенности больных псориазом. Мед. психол. 2012. № 1. С. 37–42.
- Артёменко А. Ф. Особенности сексуальности при псориазе у мужчин. Міжнародн. мед. журн. 2011. Т. 17. № 3. С. 23–26.
- Арушанян Э. Б. Универсальные терапевтические возможности мелатонина. Клин. мед. 2013. № 2. С. 4–8.
- Арушанян Э. Б., Наумов С. С. Противовоспалительные возможности мелатонина. Клин. медицина. 2013. № 7. С. 18-22.
- Асхаков М. С. Псориаз: особенности течения и терапии. Вестн. молод. учен. 2016. № 2. С. 1–21.
- Бабанин В. А., Притуло О. А. Стратегия лечения больных бляшечным псориазом при использовании узкополосной ультрафиолет В (NB-UVB, 311 нм) терапии. Дерматол. венерол. 2013. № 1 (59). С. 45–53.
- Бакулев А. Л. Стратегия «лечение до достижения цели» при псориазе. Актуальные вопросы устойчивости к биологической терапии. Вестн. дерматол. венерол. 2016. № 5. С. 32–38.
- Беловол А. Н. Дисфункция сосудистого эндотелия у больных псориазом. Укр. журн. дерматол., венерол., косметол. 2010. № 1 (36). С. 17–21.
- Белозоров А. П. Новая субпопуляция эффекторных хелперных Т‑лимфоцитов (TH22) и ее участие в патогенезе заболеваний кожи. Дерматол. венерол. 2010. № 2 (48). С. 7–10.
- Бельтюкова А. С., Хобейш М. М., Соколовский Е. В. Уровень основных цитокинов в крови больных псориазом. Вестн. дерматол. венерол. 2015. № 5. С. 66–72.
- 12. Беляев Г. М., Рыжко П. П. Псориаз, псориатическая артропатия. 3-е изд. М. : МедПресс-информ, 2005. 290 с.
- Біловол А. М., Ніколаєва В. Б., Галузинська К. Н. Визначення стану моноамінів у хворих на розповсюджений псоріаз та при ускладненні його перебігу. Дерматол. венерол. 2016. № 1 (71). С. 16–20.
- Болотная Л. А. Псориаз: патогенез, клинические проявления, лечение. Східноєвроп. журн. внутр. сім. мед. 2015. № 1. С. 4–9.
- Болотная Л. А. Современные возможности наружной терапии псориаза. Укр. журн. дерматол., венерол., косметол. 2014. № 1 (52). С. 115–120.
- Болотная Л. А., Сариан Е. И., Лопандина А. А. Патогенетическое зна-чение сосудистого эндотелиального фактора при псориазе. ScienceRise. 2016. № 2/3 (19). С. 4–8.
- Броше Е. А., Губина-Вакулик Г.И., Горбач Т. В. Роль мелатонина в патогенезе псориаза. Вестн. дерматол. венерол. 2007. № 1. С. 20–22.
- Брынина А. В., Снежицкий В. А., Хворик Д. Ф. Стратификация риска развития атеросклероза коронарных артерий у пациентов с псориазом. Кардиология в Беларуси. 2017. Т. 9, № 1. С. 19–28.
- Брынина А. В., Хворик Д. Ф., Лискович Т. Г. Псориаз, ассоциированный с ишемической болезнью сердца: распространенность и клинико-лабораторная характеристика. Мед. панорама. 2016. № 1 (163). С. 55–59.
- Вивчення маркерів неоангіогенезу в псоріатично зміненій шкірі / І.Я.Возняк, Т. В. Святенко, О. О. Сизон, М. О. Дашко. Укр. журн. дерматол., венерол., косметол. 2016. № 1. С. 10–14.
- Владимирова И. С., Монахов К. Н., Суховская О. А. Характеристика современного течения псориаза и факторы, определяющие качество жизни пациентов. Совр. пробл. дерматовенерол., иммунол., врачебн. косметол. 2011. № 4. С. 27–34.
- Гаранян Л. Г. Применение препаратов мелатонина в дерматологической практике. Рос. журн. кожн. вен. болезн. 2015. № 18 (6). С.50–52.
- Генетические маркеры предрасположенности к псориазу / К. Баскаев, С. Шумилова, И. Корсунская и др. Врач. 2018. № 10. С. 22–24.
- Голиченков В. А., Рапопорт С. И., Молчанов А. Ю. Мелатонин: теория и практика / Под ред. Рапопорта С. И., Голиченкова В. А. М.: ИД «Медпрактика-М». 2009. 100 с.
- Головач И. Ю. Значение курения в развитии псориатического артрита и псориаза. Біль. Суглобі. Хребет. 2016. № 3 (23). С. 42–48.
- Гуменюк Л. Н, Ольшевская Н. С., Прохоров Д. В. Типология отношения к болезни у больных псориазом. Мед. психол. 2011. № 3. С. 17–18.
- Датиева В. К., Васенина Е. Е., Левин О. С. Перспективы применения мелатонина в клинической практике. Современная терапия в психиатрии и неврологии. 2013. № 1. С.47–50.
- Дащук А. М., Пустова Н. О., Добржанська Є. І. Стан ендокринної системи у хворих на псоріаз. Дерматол., венерол. 2010. № 3. С. 75–77.
- Дворянкова Е., Корсунская И., Соркина И. Метаболический синдром и псориаз. Врач. 2018. № 7. С. 30–32.
- Джериева И. С., Волкова Н. И., Рапопорт С. И. Мелатонин как регулятор метаболических процессов. Клин. мед. 2012. № 10. С. 27–30.
- Дмитрук В. С., Стрига Л. В. Влияние мелатонина на состояние иммунитета при псориазе. Бюл. Сибирск. мед. 2009. № 4. С. 148–152.
- Донцова Е. В. Особенности психоэмоционального состояния больных псориазом с метаболическим синдромом. Terra Medica. 2013. № 2. С. 39–41.
- Жилова М. Б., Чикин В. В. Клиническая эффективность ротации методов фототерапии (ПУВА-терапия и УФВ-311) у больных со среднетяжелыми формами псориаза. Вестн. дерматол. венерол. 2015. № 1. С.67–75.
- Захарчук А. И., Кадельник Л. А. Мелатонин и геронтологические аспекты сезонной структуры циркадианных ритмов неспецифического иммунитета. The journal of scientific articles “Health & education millennium”. 2013. Tom 15. № 1–4.
- Изменение психоэмоциональных показателей больных псориазом в сочетании с ишемической болезнью сердца после терапии с мексикором / Л.А.Парфенова, И. И. Бобынцев, Л. В. Силина, В. Р. Хайрутдинов. Усп. совр. естествозн. 2015. № 3. С. 65–69.
- Использование аутофлуоресцентной дерматоскопии у больных псориазом / Н. Н. Петрищев, Г. В. Папаян, А. В. Крылов и др. Biomedical Photonics. 2017. Т. 6. № 2. С. 21–26.
- Каденко О. А., Томаржевська І. В. Особливості психічного стану хворих на псоріаз, що перебувають на стаціонарному лікуванні. Укр. журн. дерматол., венерол., косметол. 2011. № 1. С. 34–39.
- Кардиоваскулярный риск при иммуноопосредованных дерматозах / Л.А. Болотная, Е. И. Сариан, А. А. Лопандина, В. М. Сидельник. Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции: матеріали научн. конф., посвященной 155-летию со дня рождения проф. М. В. Типцева, 18 ноября 2015 г. Харьков, 2015. С. 12–18.
- Кикта С. В., Дробижев М. Ю., Белоусова Т. А. Депрессии у больных псориазом. Фарматека. 2010. № 11 (205). С. 84-90.
- Клініко-патогенетична роль епідермального фактора росту при псоріазі / Я. Ф. Кутасевич, І. О. Олійник, Е. М. Солошенко, О. А. Гаврилюк. Укр. журн. дерматол., венерол., косметол. 2016. № 2. С. 27–30.
- Кобзарь А. И. Прикладная математическая статистика [2-е изд., испр.]. М.: Физматлит, 2012. 816 с.
- Комаров Ф. И., Рапопорт С. И. Хронобиология и хрономедицина. М. : Триада-Х; 2000. 488 с.
- Комплексное лечение больных псориазом / О. В. Дегтярёв, В.В.Думченко, Т. А. Ткаченко и др. Рос. журн. кожн. вен. болезн. 2014. № 5. С. 46–50.
- Коненков В. И., Климонтов В. В., Мичурина С. В. Мелатонин при сахарном диабете: от патофизиологии к перспективам лечения. Сахарный диабет. 2013 № 2. С. 11–16.
- Коротаева Т. В. Ангиогенез при псориазе и псориатическом артрите: клеточные и гуморальные механизмы, роль в патогенезе и поиск перспективных мишеней терапии. Совр. ревматол. 2014. № 2. С. 71–75.
- Котова О. В. Роль мелатонина в лечении депрессии. Неврология, нейропсихиатрия, психосоматика. 2011. Т. 3. № 2. С. 85–88.
- Кочергин Н. Г. Возможности гепатопротекторов при псориазе. Леч. врач. 2016. № 12. С. 54–57.
- Круглова Л. С., Моисеев С. В. Блокада интерлейкина-17 – новые горизонты эффективности и безопасности в лечении псориаза. Клин. фармакол. терап. 2017. № 2. С. 5–12.
- Круглова Л. С., Турбоевская С. Н. Эффективность фиксированной комбинации кальципотриола и бетаметазона в лечении пациентов с вульгарным псориазом. Фарматека. 2017. № 4. С. 29–35.
- Кубанова А. А., Катунина О. Р. Иммуноморфология и морфогенез очагов пораженной кожи при псориазе. Вестн. дерматол. венерол. 2010. № 1. С. 70–79.
- 51. Кутасевич Я. Ф., Олейник И. О., Маштакова И. А. Современные возможности наружной терапии больных псориазом. Дерматол. венерол. № 2. С. 42–45.
- Літвінова Н. Ю., Архіпова І. Г., Дубенко Д. Є. Ангіогенез: у нормі і в патології. Серце і судини. 2015. № 4. С. 95–99.
- Лопандина А. А. Изменение психоэмоциональных показателей у больных псориазом. Медицина ХХI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 26 листопада 2015 р. Харків, 2015. С. 45.
- Лопандина А. А. Использование мелатонина в комплексном лечении псориаза. Дерматол. венерол. 2018. № 4 (81). С. 27–30.
- Лопандина А. А. Нарушения сна и уровень мелатонина у больных псориазом. Медицина ХХI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 23 листопада 2017 р. Харків, 2017. С. 55-56.
- Лопандина А. А. Нарушения сна у больных псориазом. Святогірські дерматовенерологічні дні: новітні методи діагностики і лікування в дерматовенерології та косметології : матеріали Всеукр. конф. за участю міжнар. спеціалістів, 25-26 травня 2017 р. Святогір’я, 2017. Журн. дерматовенерології та косметології ім. М. О. Торсуєва. 2017. №1 (37). С. 73.
- Лопандина А. А. Особенности ангиогенеза у больных псориазом. Инновационные технологии в дерматовенерологии. Междисциплинарные связи : материалы научн.-практ. конф. с участием международн. специалистов, 13-14 ноября 2015 г. Харьков, 2015. Дерматол. венерол. 2015. № 3 (69). С. 82.
- Лопандина А. А. Показатели мелатонина и сосудистого эндотелиального фактора роста (VEGF) у больных псориазом с нарушением сна. Международн. мед. журн. 2018. Т. 24. № 4 (96). С. 81– 84.
- Лопандина А. А. Псориаз и психоэмоциональные расстройства. Дерматол. венерол. 2016. № 4 (74). С. 11–19.
- Лопандина А. А. Уровень провоспалительных цитокинов у больных вульгарным псориазом. Дерматовенерологія в розробках молодих науковців : матеріали наук.-практ. школи, 16-17 листопада 2017 р. Київ, 2017. Клін. імунол. Алергол. Інфектол. 2017. № 6 (103). С. 57.
- Лопандина А. А., Болотная Л. А. Клиническое значение провоспалительных иммунных медиаторов при псориазе. Дерматол. венерол. 2018. № 3 (81). С. 13–16.
- Лыкова С. Г., Спицына А. В., Моржанаева М. А. Метаболический синдром и псориаз как коморбидные состояния. Дальневосточный мед. журн. 2017. № 6. С. 93–98.
- Макурина Г. И. Нитрозирующий стресс при псориатической болезни в сочетании с эссенциальной гипертензией. Вісн. пробл. біол. мед. 2015. Вип. 3. Т. 2 (123). С. 159–165.
- Макуріна Г. І. Патоморфогенез сполучнотканинного компоненту шкіри хворих на псоріаз і гіпертонічну хворобу. Вісн. пробл. біол. мед. 2016. Вип. 2. Т. 2 (129). С. 191–194.
- Матюшенко В. П. Динаміка психоемоційних порушень у хворих на поширений псоріаз. Дерматол. венерол. 2018. № 2. С. 63–67.
- Мелатонин: медико-диологические функции / А. В. Наумов, Е. А. Конюх, А. Г. Опарин и др. Проблемы здоровья и экологии. 2011. № 5. С. 132–136.
- Мелатонин: возможности использования в терапии бронхиальной астмы / Л. Н. Цветикова, А. В. Будневский, Е. С. Овсянников, Е. А. Кудашова. Тер. арх. 2017. № 3. С. 112–115.
- Мурашкин Н. Н. Особенности ангиогенеза и обоснование патогенетической терапии у детей, страдающих псориазом: автореф. дис. … канд. мед. наук: 14.00.09 / ГУ «Центральный научно-исследовательский кожно-венерологический институт Федерального агентства по высокотехнологичной медицинской помощи». М., 2006. 19 с.
- Николашина О. Е., Бакулев А. Л. О взаимосвязи врожденного и адаптивного иммунитета при псориазе. Саратовский научно-мед. журн. 2015. № 11 (3). С. 421–423.
- Олійник І. О., Іщейкін К. Є.,Гаврилюк О. А. Можливості ранньої діагностики артропатичного псоріазу. Клін. імунол. Алергол. Інфектол. 2016. № 7 (96). С. 16–19.
- Олисова О. Ю. Псориаз: эпидемиология, патогенез, лечение. Consilium medicum. 2010. № 5. С. 4–37.
- Олисова О. Ю., Теплюк Н. П., Пинегин В. Б. Современные методы лечения псориаза. Рус. мед. журн. 2015. № 9. С. 483–487.
- Олисова О. Ю., Гаранян Л. Г. Коморбидности при псориазе. Рос. журн. кожн. вен. болезн. 2016. № 6. С. 346–348.
- Определение уровня 50 цитокинов в сыворотке крови больных псориазом / А. С. Бельтюкова, К. А. Сысоев, М. М. Хобейш и др. Соврем. пробл. дерматовенерол., иммунол., врач. косметол. 2011. № 2 (15). С. 9–15.
- Опыт длительного применения антицитокиновой терапии при псориазе / В. А. Ковтунова, В. В. Думченко, Э. Г. Бахмутова и др. Рос. журн. кожн. вен. болезн. 2017. № 3. С. 163–166.
- Оценка эффективности применения циклоспорина при псориазе / В.С. Круглова, Е. С. Понич, А. В. Осина, Н. В. Грязева. Сарат. научно-мед. журн. 2017. № 3. С. 673–678.
- Пинегин Б. В. Роль клеток иммунной системы и цитокинов в развитии псориаза. Рос. журн. кожн. вен. болезн. 2013. № 3. С. 19–25.
- Попова И. Б., Дудченко Н. А., Артеменко А. Ф. Некоторые аспекты влияния метаболического синдрома у больных псориазом. Украинский журнал дерматологии, венерологии, косметологии. 2013. № 2 (49). С. 48–54.
- Псоріаз, включаючи псоріатичні артропатії. Адаптована клінічна настанова, заснована на доказах. Київ, 2015. 223 с.
- Разумная Ф. Г., Капулер О. М., Зарудий Ф. С. Влияние комплексного лечения с применением психофармакологических средств на клинические проявления и тревожное состояние больных псориазом. Эксп. клин. дерматокосметол. 2013. № 8. С. 36–40.
- Разнатовский К. И., Терлецкий О. В. Псориатическая болезнь: диагностика, терапия, профилактика. М.: ГЭОТАР-Медиа, 2017. 352 с.
- Рапопорт С.И., Молчанов А.Ю., Голиченков В.А и др. Метаболический синдром и мелатонин. Клиническая медицина. 2013. № 11. С.8–14.
- Распространенный псориаз: интегральные показатели липидного обмена и инсулиноподобный фактор роста 1 / Э. Н. Солошенко, Н. В. Жукова, Т. П. Ярмак, З. М. Шевченко. Дерматовенерол. Косметол. Сексопатол. 2011. №1-4. С. 75–76.
- Роль средств лечебной косметики в повышении эффективности терапии псориаза / О. А. Сидоренко, Е. П. Опруженкова, Л. А. Анисимова, В. В. Старостенко. Клин. дерматол. венерол. 2017. № 5. С. 24–30.
- Саріан О. І., Лопандіна А. О. Особливості псоріазу з ураженням кистей і стоп. Новітні тенденції лікування та профілактики дерматовенерологічних проблем в рамках доказової медицини : матеріали наук.-практ. конф., 13-15 квітня 2016 р. Львів, 2016. С. 96–97.
- Сариан Е. И. Медиаторы повреждения эндотелия при обычном псориазе. Вісн. Сумського держ. ун-ту. 2013. Т. 2, № 2. С. 131–133.
- Сариан Е. И., Лопандина А. А. Психоэмоциональные расстройства у больных псориазом. Медицина ХХI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 24 листопада 2016 р. Харків, 2016. С. 94–95.
- Сариан Е. И., Лопандина А. А. Уровень глюкозы крови и гликированного гемоглобина у больных псориазом. Місце дерматовенерології в міждисциплінарному вирішенні питань діагностики та лікування хронічних захворювань : матер. наук.-прак. конф. 20-21 березня 2017 р. Київ, 2017. Дерматовенерол. Косметол. Сексопатол. 2017. № 1-2 (5). С. 116.
- Светозарский Н. Л., Артифексова А. А., Светозарский С. Н. Фактор роста эндотелия сосудов: биологические свойства и практическое значение. J. Siberian. Med. Sci. 2015. № 5.
- Слесаренко Н. А., Утц С. Р. Роль бактериальной инфекции в патогенезе псориаза. Вестн. дерматол. венерол. 2016. № 3. С. 29–35.
- Смирнова С. В., Смольникова М. В. Иммунопатогенез псориаза и псориатического артрита. Мед. иммунол. 2014. Т. 16. № 2. С. 127–138.
- Смольникова Н. В., Смирнова С. В., Барило А. А. Особенности иммунопатогенеза псориаза и псориатического артрита. Фундамент. исслед. 2015. № 1. С. 1443–1447.
- Современные подходы к физиотерапии и профилактике псориаза (обзор литературы) / Е. В. Донцова, В. А. Новикова, Т. М. Бахметьева, Л. Н. Борзунова. Вестн. новых мед. технол. Электронное издание. 2018. № 2. С. 54–62.
- Спосіб лікування хворих на псоріаз / Л. А. Болотна, Г. О. Лопандіна, Я. Ф. Кутасевич, О. І. Саріан : пат. на корисну модель № 127590 UA: МПК А61 К 31/00. № u 2018 02708; заявл. 19.03.2018; опубл. 10.08.2018; Бюл № 15.
- Терлецкий О. В. Психологическая характеристика и психофармакотерапия больных псориазом. Вестн. психотер. 2011. № 39 (44). С. 112–117.
- 96. Тимошкина М. В., Тюкина Т. А., Дикова О. А. Поиск новых направлений фармакологической коррекции. Здоровье – основа человеческого потенциала: проблемы и пути их решения. 2014. Т. 9. № 2. С. 796–798.
- Толмачева Н. В., Анисимова А. С. Современный взгляд на этиологию и патогенез псориаза. Фундамент. исслед. 2015. № 1. С. 2118–2121.
- Труфакин В. А., Шурлыгина А. В. Проблемы центральной регуляции биоритмов иммунной системы. Роль экзогенного и эндогенного мелатонина. Вестн. Рос. акад. мед наук. 2006. № 9-10. С. 121–127.
- Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги «Псоріаз, включаючи псоріатичні артропатії». Київ, 2015. 40 с.
- Ушакова С. Е., Будникова Н. В., Александров М. В. Коррекция расстройств сна у пациентов пожилого и старческого возраста в общетерапевтической практике. Леч. дело. 2013. № 15. С. 42–48.
- Фармакотерапия инсомний: роль имована / Я. И. Левин, Т. С. Елигулашвили, С. И. Посохов и др. В кн.: Расстройства сна. Под ред. Ю.А. Александровского, А. М. Вейна. СПб.: Медицинское информационное агентство, 1995. C. 56–61.
- Федотов В. П., Визир В. А., Макурина Г. А. Взаимосвязь между степенью тяжести псориаза и уровнем ФНО-α у больных псориазом в сочетании с гипертонической болезнью. Запорожск. мед. журн. 2015. № 3 (90). С. 43–47.
- Хайрутдинов В. Р. Роль СД11с-позитивных дендритных клеток в патогенезе псориаза. Вестн. дерматол. венерол. 2012. № 3. С. 58–64.
- Хайрутдинов В. Р., Белоусова И. Э., Самцов А. В. Иммунный патогенез псориаза. Вестн. дерматол. венерол. 2016. № 4. С. 20–26.
- Хоменко В.Г. Мелатонин – как продукт шишковидной железы в регуляции физиологических функций организма. The journal of scientific articles “Health & education millennium” (series Medicine). 2013. Tom 15. С. 1–4.
- Цитокиновый дисбаланс в иммунопатогенезе псориаза / Ф.Х.Камилов, Н. А. Муфазалова, О. М. Капулер и др. Фундамент. исслед. 2015. № 1. С. 1065–1071.
- Akman A., Yilmaz E., Mutlu H., Ozdogan M. Complete remission of psoriasis following bevacizumab therapy for colon cancer. Clin. Exp. Dermatol. 2008. 34: e202–204.
- Antiangiogenic activity of melatonin in advanced cancer patients / P. Lissoni, F. Rovelli, F. Malugani et al. Neuro. Endocrinol. Lett. 2011. Vol. 32. № 7. P. 45–48.
- Antiangiogenic effects of melatonin in endothelial cell cultures / V. Alvarez-García, A. González, C. Alonso-González et al. Microvasc. Res. 2013. Vol. 87. № 5. P. 25–33.
- Antiproliferative effects of 1α-OH-vitD3 in malignant melanoma: potential therapeutic implications / L. Spath, C. S. Johnson, R. A. Modzelewski et al. Scientific Reports. 2017. Vol. 7, Article number: 40370.
- Arendt J. Shift work: coping with the biological clock. Occup. Med. (Lond.). 2010. Vol. 60. № 1. P. 10-20.
- A review of phototherapy protocols for psoriasis treatment / W. Lapolla, B. A. Yentzer, J. Bagel et al. J. Am. Acad. Dermatol. 2011. Vol. 64. № 5. Р. 936–949.92.
- A review of the protective effect of melatonin in pesticide-induced toxicity / M. H. Asghari, M. Moloudizargari, H. Bahadar, M. Abdollahi. Expert Opin. Drug Metab. Toxicol. 2017. Vol. 13. № 5. P. 545–554.
- A review of the protective role of melatonin during phosphine-induced cardiotoxicity: focus on mitochondrial dysfunction, oxidative stress and apoptosis / M. N. Asghari, M. Abdollahi, M. R. Oliveira, S. M. Nabavi. J. Pharm. Pharmacol. 2017. Vol. 69. № 2. P. 236–243.
- Association of multiple sclerosis with psoriasis: A systematic review and meta-analysis of observational studies / C. Y. Liu, T. H. Tung, C. Y. Lee et al. Am. J. Clin. Dermatol. 2018. Oct 25. doi: 10.1007/s40257-018-0399-9.
- 116. Beck A. T., Steer R. A., Brown G. K. Manual for the Beck Depression Inventory-II. San Antonio: Psychological Corporation, 1996.
- Body mass index, abdominal fatness, weight gain and the risk of psoriasis: a systematic review and dose-response meta-analysis of prospective studies / D. Aune, I. Snekvik, S. Schlesinger et al. Eur. J. Epidemiol. 2018. Apr 21. doi: 10.1007/s10654-018-0366.
- Bondy S. C., Campbell A. Mechanisms underlying tumor suppressive properties of melatonin. Int. J. Mol. Sci. 2018. Vol. 19. № 2205. doi:10.3390/ijms19082205
- Brezinski E. A., Armstrong A. W. An evidence-based review of the mechanism of action, efficacy, and safety of biologic therapies in the treatment of psoriasis and psoriatic arthritis. Curr. Med. Chem. 2015. Vol. 22. № 4. P. 1930–1942.
- Characterization and profiling of immunomodulatory genes in resident mesenchymal stem cells reflect the Th1-Th17/Th2 imbalance of psoriasis / A.Campanati, M. Orciani, V. Consales et al. Arch. Dermatol. Res. 2014. Vol. 306, Iss. 10. P. 915–920.
- Carmeliet P., Jain R.K. Molecular mechanisms and clinical applications of angiogenesis. Nature. 2011. Vol. 473. № 7347. P. 298–307.
- Clinical and epidemiological characterization of psoriasis and psoriatic arthritis in a multidisciplinary assessment model / R. A. Lopez, G. M. Macias, E. M. Cerda, M. P. Sandoval. Int. J. Clin. Rheumatol. 2018. Vol. 13. № 3. P. 185–192.
- Comorbidities associated with psoriasis: an experience from the Middle East / N. Al-Mutairi, S. Al-Farag, A. Al-Mutairi, M. Al-Shiltawy. J Dermatol. 2010. Vol. 37. № 2. P. 146–155.
- Connor C., Liu V., Fiedorowicz J.C. Exploring the physiological link between psoriasis and mood disorders. Dermatol. Res. Pract. 2015. Article ID 409637. 11 p.
- Cook K. M., Figg W. D. Angiogenesis inhibitors: current strategies and future prospects. Cancer. J. Clin. 2010. Vol. 60. Р. 222-243.
- Cyclosporine regimens in plaque psoriasis: an overview with special emphasis on dose, duration, and old and new treatment approaches / M. Colombo, N. Cassano, G. Bellia, G. A. Vena. Scientific World Journal. 2013. Vol. 20. Р. 805705.
- Datta-Mitra A., Riar N. K., Raychaudhuri S. P. Remission of psoriasis and psoriatic arthritis during bevacizumab therapy for renal cell cancer. Indian J. Dermatol. 2014. Vol. 59. P. 632-634.
- 128. Dowlati Y., Herrmann N., Swardfageret W. A meta-analysis of cytokines in major depression. Psych. 2010. Vol. 67. № 5. P. 446-457.
- Drug induced psoriasis / V. Milavec-Puretić, M. Mance, R. Ceović. J.Lipozenčić. Acta Dermatovenerol. Croat. 2011. Vol. 19. № 1. Р. 39–42.
- 130. Dunn A. J., Swiergiel A. H., de Beaurepaire R. Cytokines as mediators of depression: what can we learn from animal studies? Neurosci. Rev. 2010. Vol. 32. № 4–5. P. 891–909.
- Effect of psoriasis activity on VEGF and its soluble receptors concentrations in serum and plaque scales / I. Flisiak, P. Zaniewski, M. Rogalska et al. Cytokine. 2010. Vol. 52. Р. 225–229.
- Effects of etanercept on the patient-perceived results (PROs) in patients with moderate-to-severe plaque psoriasis: Systematic review of the literature and meta-analysis / J. M. Carrascosa, F. Rebollo, S. Gómez, P. de la Cueva. J. Dermatolog. Treat. 2018. Vol. 19. P. 1–20.
- Effects of melatonin on HIF-1α and VEGF expression and on the invasive properties of hepatocarcinoma cells / J. Colombo, J. M. Maciel, L. C. Ferreira et al. Oncol. Lett. 2016. Vol. 12. № 5. P. 231–237.
- Efficacy and safety of systemic long-term treatments for moderate-to-severe psoriasis: A systematic review and meta-analysis / A. Nast, A. Jacobs, S. Rosumeck, R. N. Werner J. Invest. Dermatol. 2015. Vol. 135. № 11. P. 2641–2648.
- Efficacy of melatonin, IL-25 and siIL-17B in tumorigenesis-associated properties of breast cancer cell lines / G. B. Gelaleti, T. F. Borin, L. B. Maschio-Signorin et al. Life Science. 2017. Vol. 183. P. 98–109.
- Epidemiology of psoriasis and psoriatic arthritis in Italy: A systematic review / F. Prignano, V. Rogai, E. Cavallucci et al. Curr Rheumatol Rep. 2018. Vol. 20. № 7. P. 43. doi: 10.1007/s11926-018-0753-1.
- 137. Esposito E., Cuzzocrea Anti-inflammatory activity of melatoninin central nervous system. Curr. Neuropharmacol. 2010. Vol. 8. P. 228–242.
- 138. Etanercept and clinical outcomes, fatigue, and depression in psoriasis: double-blind placebo-controlled randomised phase III trial / S. Tyring, A. Gottlieb, K. Papp et al. 2006. Vol. 367. № 9504. P. 29–35.
- 139. Expression of MDC/CCL22 and its receptor CCR4 in rheumatoid arthritis, psoriatic arthritis and osteoarthritis / H. Flytlie, M. Hvid, E. Lindgreen et al. Cytokine. Vol. 49. № 1. P. 24–29.
- Expression of MT2 receptor in patients with gastric adenocarcinoma and its elationship with clinicopathological features / N. N. Nasrabadi, R. Ataee, S. Abediankenari et al. J. Gastrointest. Cancer. 2014. Vol. 45. № 4. P. 54–60.
- 141. Expression of the corticotropin-releasing hormone-proopiomelanocortin axis in the various clinical types of psoriasis / E. Kim, D. H. Cho, H. S. Kim et al. Dermatol. 2007. Vol. 16. № 2. P. 104–109.
- 142. Famenini S., Sako E. Y., Wu J. J. Effect of treating psoriasis on cardiovascular co-morbidities: focus on TNF inhibitors. J. Clin. Dermatol. 2014. Vol. 15. № 1. P. 45–50.
- 143. Farkas A., Kemény L. Psoriasis and alcohol: is cutaneous ethanol one of the missing links? J. Dermatol. 2010. Vol. 162. № 4. Р. 711–716.
- Ferrara N., Gerber H. P., Le Couter J. The biology of VEGF and its receptors. Nat. Med. 2003. Vol. 9. № 6. P. 669–676.
- Fredriksson T., Pettersson U: Severe psoriasis – oral therapy with a new retinoid. Dermatologica. 1978. Vol. 157. P. 238–244.
- Ghajarzadeh M., Ghiasi M., Kheirkhah S. Associations between skin diseases and quality of life: a comparison of psoriasis, vitiligo, and alopecia areata. Acta. Med. Iran. 2012. Vol. 50, № 7. P. 511–515.
- Global epidemiology of psoriasis: a systematic review of incidence and prevalence / R. Parisi, D. P. Symmons, C. E. Griffiths et al. J. Invest. Dermatol. 2013. Vol.133. № 2. Р. 377–385.
- Guérard S., Pouliot R. The role of angiogenesis in the pathogenesis of psoriasis: mechanisms and clinical implications. J. Clin. Exp. Dermatol. Res. 2012. S2:007. doi:10.4172/2155-9554.S2-007.
- Gul A. Experience of anxiety and depression among psoriasis patients. Asian. J. Soc. Sci. Hum. 2012. Vol. 1. № 4. Р. 158–164.
- 150. Gupta M. A., Gupta A. K. Psychiatric and psychological co-morbidity in patients with dermatologic disorders: epidemiology and management. J. Clin. Dermatol. 2013. Vol. 14. № 12. P. 833–842.
- Gupta M. A., Simpson F. C., Gupta A. K. Psoriasis and sleep disorders: A systematic review. Sleep Medicine Reviews. 2016. Vol. 29. P. 63–75.
- Han Y., Liu T., Lu L. Apolipoprotein E gene polymorphism in psoriasis: A meta-analysis. Arch Med Res. 2013. Vol. 44, № 1. P. 46–53.
- 153. Hayes J., Koo J. Psoriasis: depression, anxiety, smoking, and drinking habits. Ther. 2010. Vol. 23. № 2. P. 174–180.
- Histological and transcriptional study of angiogenesis and lymphangiogenesis in uninvolved skin, acute pinpoint lesions and established psoriasis plaques: an approach of vascular development chronology in psoriasis / A. Henno, S. Blacher, C. A. Lambert et al. J. Dermatol. Sci. 2010. Vol. 57. Р. 162–169.
- How stress gets under the skin: cortisol and stress reactivity in psoriasis / A. W. Evers, E. W. Verhoeven, F. W. Kraaimaat et al. Br. J. Dermatol. 2010. Vol. 163. № 5. P. 986–991.
- Improvements in quality of life and functional status in patients with psoriatic arthritis receiving anti-tumor necrosis factor therapies / A. A. Saad, D. M. Ashcroft, K. D. Watson et al. Arthritis. Care. Res. (Hoboken). 2010. Vol. 62. № 3. Р. 345–353.
- Induction and exacerbation of psoriasis with Interferon-alpha therapy for hepatitis C: a review and analysis of 36 cases / M. Afshar, A. D. Martinez, R. L. Gallo еt al. J. Eur. Acad. Dermatol. Venereol. 2013. Vol. 27. № 6. P. 771-778.
- Integrative responses to IL-17 and TNF-a in human keratinocytes account for key inflammatory pathogenic circuits in psoriasis integrative responses to IL-17 and TNF-a in human KCs. / A. Chiricozzi, E. Guttman-Yassky, M. Suares-Farinos et al. J. Invest. Dermatol. 2011. Vol. 131. P. 677–687.
- Interaction between genetic control of vascular endothelial growth factor production and retinoid responsiveness in psoriasis / H. S. Young, A. M. Summers, I. R. Read et al. J. Invest. Dermatol. 2006. Vol. 126. № 2. P. 453–459
- Interleukin (IL)-22, IL-17, IL-23, IL-8, vascular endothelial growth factor and tumour necrosis factor-alpha levels in patients with psoriasis before, during and after psoralen ultraviolet A and narrowband ultraviolet B therapy / S. Coimbra, H. Oliveira, F. Reis et al. Br. J. Dermatol. 2010. Vol. 163. P. 1282–1290.
- Investigation of the association between psoriasis and human leucocyte antigens A by means of meta-analysis / Y. E. Zhao, L. Hu, J. X. Ma et al. J. Eur. Acad. Dermatol. Venereol. 2014. Vol. 28. № 3. P. 355–369.
- 162. Karelson, Silm H., Kingo K. Quality of life and emotional state in vitiligo in an Estonian sample: comparison with psoriasis and healthy controls. Acta. Derm. Venereol. 2013. Vol. 93. № 4. P.446–450.
- Kolmus K., Tavernier J., Gerlo S. β2-Adrenergic receptors in immunity and inflammation: stressing NF-κB. Brain. Behav. Immun. 2015. Vol. 45. Р. 297-310.
- Kreibig S. D. Autonomic nervous system activity in emotion: a review. Biol. Psychol. 2010. Vol. 84. № 3. P. 394-421.
- Kumar V., Mattoo S. K., Handa S. Psychiatric morbidity in pemphigus and psoriasis: a comparative study from India. Asian. J. Psych. 2013.Vol. 6. № 2. P. 151-156.
- Leptin levels in patients with psoriasis: a meta-analysis /K. J. Zhu, C. Zhang, M. Li et al. Clin. Exp. Dermatol. 2013. Vol. 38, № 5. Р. 478–483.
- Lopandina A. Change of psychosomatic status in patiens with psoriasis : Аbstract 13th Spring Symposium of European Academy of Dermatology and Venereology, 19-22 May 2016. Athens, 2016. Abstract code P0737.
- Marina М. Е., Jaggar R. VEGF involvement in psoriasis. Clujul. Medical. 2015. Vol. 88. № 3. P. 247–253.
- Marzano A. V., Derlino F., Berti E. F. Pathogenesis of psoriasis: focus on autoinflammation. Dermatopathol. 2018. Vol. 5. Р. 14–15.
- Melatonin and cell death: differential actions on apoptosis in normal and cancer cells / R. M. Sainz, J. C. Mayo, C. Rodriguez et al. Cell. Mol. Life. Sci. 2009. Vol. 66. Р. 1407-1426
- Melatonin: A cutaneous perspective on its production, metabolism, and functions / A. T. Slominski, R. Hardeland, M. A. Zmijewski et al. J. Invest. Dernmatol. 2018. Vol. 138. № 3. P. 490-499. doi: 10.1016/j.jid.2017.10.025.
- Melatonin as an angiogenesis inhibitor to combat cancer: Mechanistic evidence / N. M. Goradel, M. H. Asghari, M. Moloudizargari et al. Toxicol. Appl. Pharmacol. 2017. Vol. 335. P. 56–63.
- Melatonin: buffering the immune system / A. Carrillo-Vico, P. J. Lardone, N. Alvarez-Sanchez et al. Int. J. Mol. Sci. 2013. Vol. 14. Р. 8638–8683.
- Melatonin decreases cell proliferation and induces melanogenesis in human melanoma SK-MEL-1 cells / J. Cabrera, G. Negrín, F. Estévez et al. J. Pineal. Res. 2010. Vol. 49. Р. 45–54.
- 175. Melatonin inhibits angiogenesis in SH-SY5Y human neuroblastoma cells by downregulation of VEGF / A. González, González-González, C. Alonso-González et al. Oncol. Rep. 2017. Vol. 37. P. 2433–2440.
- Melatonin inhibits the expression of vascular endothelial growth factor in pancreatic cancer cells / D. Lv, P. L. Cui, S. W. Yao et al. Chin. J. Cancer. Res. 2012. Vol. 24. № 4. Р. 316–322.
- Melatonin modulates the expression of VEGF and HIF-1 alpha induced by CoCl2 in cultured cancer cells / M. Dai, P. Cui, M. Yu et al. J. Pineal. Res. 2008. Vol. 44. P. 121–126.
- Melatonin restricts the viability and angiogenesis of vascular endothelial cells by suppressing HIF-1α/ROS/VEGF / J. Cheng, H.-L. Yang, C.-J. Gu et al. Int. J. Mol. Med. 2018. Vol. 43. Р. 945-955. DOI: 10.3892/ijmm.2018.4021.
- Melatonin suppresses tumor angiogenesis by inhibiting HIF-1α stabilization under hypoxia / S. Y. Park, W. J. Jang, E. Y. Yi et al. J. Pineal Res. 2010. Vol. 48. № 3. P. 178–184.
- Michalek I. M., Loring B., John S. M. A systematic review of worldwide epidemiology of psoriasis. J. Eur. Acad. Dermatol. Venereol. 2017. Vol. 31. № 2. Р.205–212. doi: 10.1111/jdv.13854.
- Miossec P., Kolls J. K. Targeting IL-17 and TH17 cells in chronic inflammation. Nat. Rev. Drug Discov. 2012. Vol. 11. № 7. P. 763–776.
- 182. Mizara A., Papadopoulos L., McBride S. R. Core beliefs and psychological distress in patients with psoriasis and atopic eczema attending secondary care: the role of schemas in chronic skin disease. J. Dermatol. 2012. Vol. 166, № 5. P. 986–993.
- Mohammad N.S., Elsayed N., Bassiouny R. Increased production of vascular endothelial growth factor in the lesions of psoriasis – a new target for future therapy. JMRI. 2011. Vol. 31. № 1. P. 81–86.
- 184. Moon H.-, Mizara A., McBride S. R. Psoriasis and psychodermatology. Dermatol. Ther. 2013. Vol. 3. № 2. P.117–130.
- 185. Mufaddel A., Abdelgani A. E. Psychiatric comorbidity in patients with psoriasis, vitiligo, acne, eczema and group of patients with miscellaneous dermatological diagnoses. J. Psych. 2014. Vol. 4. № 3. P. 168–175
- Nemati H. Antioxidant status in patients with psoriasis. Cell Biochem. Funct. 2014. Vol. 32. № 3. Р. 268-273.
- 187. Nestle O., Kaplan D. H., Barker J. Psoriasis. Eng. J. Med. 2009. Vol. 361. № 5. P.496–509.
- Obesity and psoriasis: inflammatory nature of obesity, relationship between psoriasis and obesity, and therapeutic implications / J. M. Carrascosa, V. Rocamora, R.-M. Fernandez-Torres et al. Actas Dermosifiliogr. 2014. Vol. 105. №1. P. 31–44.
- 189. O’Kane M., Murphy E. P., Kirby B. The role of corticotropin-releasing hormone in immune-mediated cutaneous inlammatory disease. Dermatol. 2010. Vol. 19. № 3. P. 143–153.
- Oliveira M. F., Rocha B. O., Duarte G. V. Psoriasis: classical and emerging comorbidities. An. Bras. Dermatol. 2015. Vol. 90. № 1. P. 9–20.
- Ni C., Chiu M. V. Psoriasis and comorbidities: links and risks. Clin. Cosm. Invest. Dermatol. 2014. Vol. 7. P. 119–132.
- Parrish L. Psoriasis: symptoms, treatments and its impact on quality of life. Br. J. Community. Nurs. 2012. Vol. 17. № 11. Р. 524–528.
- Pivotal roles of T-helper 17-related cytokines, IL-17, IL-22, and IL-23, in inflammatory diseases / N. Qu, M. Xu, I. Mizoguchi et al. Clin. Dev. Immunol. 2013. Vol. 13. Р. 96-99.
- Psoriasis beyond the skin: Are view of the literature on cardiometabolic and psychological co-morbidities of psoriasis / L. Puig, B. Kirby, L. Mallbris, R. Strohal. Eur. J. Dermatol. 2014. Vol. 24. № 3. Р. 305–311. doi: 10.1684/ejd.2014.2299.
- Psychological stress and psoriasis. A systematic review and meta-analysis / I. Snast, O. Reiter, L. Atzmony et al. Br. J. Dermatol. 2018. Vol. 178, № 5. P. 1044–1055.
- Puig L., Julià A., Marsal S. The pathogenesis and genetics of psoriasis. Actas Dermosifiliogr. 2014. Vol. 105. P. 535–545.
- Radogna F., Diederich M., Ghibelli L. Melatonin: a pleiotropic molecule regulating inflammation. Biochem. Pharmacol. 2010. Vol. 80. Р. 1844–1852.
- Regulation of vascular endothelial growth factor by melatonin in human breast cancer cells / V. Alvarez-García, A. González, C. Alonso-González et al. J. Pineal Res. 2013. Vol. 54. № 1. P. 373–380.
- Reiter R. J. Mechanisms of cancer inhibition by melatonin. J. Pineal. Res. 2011. Vol. 44. P. 213–214.
- Relation of depression to perceived social support: results from a randomized adolescent depression prevention trial / E. Stice, P. Rohde, J. Gau, C. Ochner. Behav. Res. Ther. 2011. Vol. 49. № 5. P. 361-366.
- Review on etiology, types and treatment of psoriasis / N. V. Shah, R. A. Maheshwari, G. U. Sailor et al. Pharmacologyonline. 2010. Vol. 1. P. 159–179.
- Role of melatonin in cancer treatment / A. Cutando, A. Lopez-Valverde, S. Arias-Santiago, J. De Vicente, R. G. De Diego. Anticancer Res. 2012. Vol. 32. № 10. P. 2747–2753.
- Role of melatonin in mood disorders and the antidepressant effects of agomelatine / V. Srinivasan, D. De Berardis, S. D. Shillcutt, A. Brzezinski. Expert. Opin. Investig. Drugs. 2012. Vol. 21. Р. 1503–1522.
- Role of VEGF receptors in normal and psoriatic human keratinocytes: evidence from irradiation with different UV sources / J.-W. Zhu, X.-J. Wu, Z.-F. Lu et al. PLoS ONE. 2013. Vol. 8. № 1: e55463. doi:10.1371/journal.pone.0055463.
- Sala M., Elaissari A., Fessi H. Advances in psoriasis physiopathology and treatments: Up to date of mechanistic insights and perspectives of novel therapies based on innovative skin drug delivery systems (ISDDS). J. Controll. Rel. 2016. Vol. 239. P. 182–202.
- Saoji V. V., Jane S. D. Comparative study of calcipotriol ointment and mometasone furoate ointment in patients of psoriasis vulgaris: A double blind study. Our Dermatol. Online. 2015. Vol. 6. № 2. Р. 135–139.
- Scanning the immunopathogenesis of psoriasis / A. Chiricozzi, P. Romanelli, E. Volpe, G. Borsellino, M. Romanelli. Int. J. Mol. Sci. 2018. Vol. 19. № 179. doi:10.3390/ijms19010179.
- Serum leptin, resistin, and adiponectin concentrations in psoriasis: A meta-analysis of observational studies / A. Kyriakou, A. Patsatsi, D. Sotiriadis, D. G. Goulis. Dermatol. 2017. Vol. 233. № 5. P. 378-389.
- Serum levels of adipokines and cytokines in psoriasis patients: a systematic review and meta-analysis / F. Bai, W. Zheng, Y. Dong et al. Oncotarget. 2017. Vol. 9. № 1. Р. 1266–1278.
- Serum levels of interleukin-8, tumor necrosis factor-a and c-interferon in Egyptian psoriatic patients and correlation with disease severity / M. L. Abdel-Hamid, D. G. Aly, N. E. Saad et al. J. Dermatol. 2011. Vol. 38. P. 442–446.
- Serun levels of TNF-α, IL-12/23h40, and IL-17 in plague psoriasis and their correlation with disease severity / A. Kyriakou, A. Patsatsi, T.-A. Vyzantiadis, D. Sotiriadis. J. Immunol. Res. 2014. Article ID 467541. 9 p.
- Serum melatonin levels in psoriasis and associated depressive symptoms / L. B. Kartha, L. Chandrashekar, M. Rajappa et al. Clin. Chem. Lab. Med. 2014. Vol. 52. № 6. P. 1–3.
- Significance of vascular endothelial growth factor and CD31 and morphometric analysis of microvessel density by CD31 receptor expression as an adjuvant tool in diagnosis of psoriatic lesions of skin / N. Chawla, S. P. Kataria, K. Aggarwal et al. Indian. Pathol. Microbiol. 2017. Vol. 60. P. 189–195.
- Skillen L. A., McKenna K. The management of moderate to severe psoriasis: a biological revolution. Ulster. Med. J. 2018. Vol. 87. № 2. P. 125.
- Stewart T.J., Tong W., Whitfeld M.J. The associations between psychological stress and psoriasis: a systematic review. Int. J. Dermatol. 2018. Vol. 57. Iss. 11. P. 1275–1282. doi: 10.1111/ijd.13956.
- Sun exposure induces rapid immunological changes in skin and peripheral blood in patients with psoriasis / E. Soyland, I. Heier, G. Rodriguez-Gallego et al. Br. J. Dermatol. 2011. Vol. 164. Р. 344–355.
- Sun L., Zhang X. The immunological and genetic aspects in psoriasis. Applied. Informatics. 2014. Vol. 1. № 3. P. 123-127.
- 218. Systemic photochemotherapy decreases the expression of IFN-γ, IL-12p40 and IL-23p19 in psoriatic plaques / Ravić-Nikolić, G. Radosavljević, I. Jovanović et al. Eur. J. Dermatol. 2011. Vol. 21. № 1. Р. 53–57.
- Targeting- and α-adrenergic receptors differentially shifts Th1, Th2, and inflammatory cytokine profiles in immune organs to attenuate adjuvant arthritis / C. L. Lubahn, D. Lorton, J. A. Schaller et al. Front. Immunol. 2014. Vol. 5. Article 346.
- Th17 and non-classic Th1 cells in chronic inflammatory disorders: two sides of the same coin / L. Cosmi, F. Liotti, E. Maggi et al. Int. Arch. Allergy. Immunol. 2014. Vol. 164. № 3. P. 171–177.
- The association between psoriasis and dyslipidemia: a systematic review / C. Ma, C. T. Harskamp, E. J. Armstrong, A. W. Armstrong. Br. J. Dermatol. 2013. Vol. 168. № 3. P. 486–495.
- The association of autoimmune thyroid disease (AITD) with psoriatic disease: A prospective cohort study, systematic review and meta-analysis / S. R. Khan, A. Bano et al. Eur. J. Endocrinol. 2017. Vol. 177. № 4. P. 347-359.
- The common CARD14 gene missense polymorphism rs11652075 is associated with psoriasis: A meta-analysis / G. Shi, S. J. Li, T. T. Wang et al. Genet. Mol. Res. 2016. Vol. 15. № 3. Р. 28–34. doi: 10.4238/gmr.15038357.
- The melatonergic system in mood and anxiety disorders and the role of agomelatine: implications for clinical practice / D. De Berardis, S. Marini, M. Fornaro et al. Int. J. Mol. Sci. 2013. Vol. 14. Р. 12458–1283.
- The neuroimmune connection interferes with tissue regeneration and chronic inflammatory disease in the skin / E. M. Peters, C. Liezmann, B. F. Klapp, J. Kruse. Ann. NY Acad. Sci. 2012. Vol. 1262. № 1. P. 1181–1126.
- Theoharides T. C. Neuroendocrinology of mast cells: challenges and controversies. Exp. Dermatol. 2017. Vol. 26. P. 751–759.
- The risk of depression, anxiety, and suicidality in patients with psoriasis: a population-based cohort study / S. K. Kurd, A. B. Troxel, P. Christoph, J. M. Gelfand. Arch. Dermatol. 2010. Vol. 146. № 8. P.891–895.
- The role of hormones in the pathogenesis of psoriasis vulgaris / I. I. Roman, A.-M. Constantin, M. E. Marina, R. I. Orasan. Clujul. Medical. 2016. Vol. 89, № 1. Р. 11–18.
- The Self-Adtninistered Psoriasis Area and Severity Index Is Valid and Reliable / S. R. Feldman, A. B. Fleischer, D. M. Reboussin et al. J. Invest. Dermatol. 1996. Vol. 106. № 1. P. 183–186.
- Tsai T. Y., Yen H., Huang Y. C. Serum homocysteine, folate, and vitamin B12 levels in patients with psoriasis: A systematic review and meta-analysis. Br. J. Dermatol. 2018. Aug 3.
- Tumor necrosis factor-alpha and the cytokine network in psoriasis / A. M. Brotas, J. M. T. Cunha, E. H. J. Lago et al. Ann. Bras. Dermatol. 2012. Vol. 87. № 5. P. 673–683.
- Ungprasert P., Wijarnpreecha K., Cheungpasitporn W. Patients with schizophrenia have a higher risk of psoriasis: A systematic review and meta-analysis. Psychiatry Res. 2018. Vol. 259. № 1. P. 422–426.
- Xu X., Zhang H.-Y. The Immunogenetics of psoriasis and implications for drug repositioning. Int. J. Mol. Sci. 2017. Vol. 18. № 2650. doi: 10.3390/ijms18122650.
- Vascular endothelial growth factor in lichen planus: an indicator of disease severity and control / A. Nofal, I. Al-Makhzangy, E. Attwa et al. J. Eur. Acad. Dermatol. Venereol. 2009. Vol. 23. P. 803–806.
- Vascular endothelial growth factor (VEGF) in the pathogenesis of psoriasis – a possible target for novel therapies? / M. Canavese, F. Altruda, T. Ruzicka, J. Schauber. J. Dermatol. Sci. 2010. Vol. 58. P. 171–176.
- Voluntary activation of the sympathetic nervous system and attenuation of the innate immune response in humans / M. Kox, L. T. van Eijk, J. Zwaag et al. Proc. Natl. Acad. Sci. USA. 2014. Vol. 111. № 20. Р. 7379–7384.
- Weatherhead S. C., Farr P. M., Reynolds N. J. Spectral effects of UV on psoriasis. Photochem. Photobiol. Sci. 2013. Vol. 12. № 1. P. 47–53.
- Wei N., Chen Z., Xue Z., Zhu Y. Polymorphism of VEGF gene in susceptibility to chronic immune-mediated inflammatory diseases: a meta-analysis. Rheumatol. Int. 2015. Vol. 35, № 8. P. 1351–1360.
- Welsh D. K., Takahashi J. S., Kay S. A. Suprachiasmatic nucleus: cell autonomy and network properties. Ann. Rev. Physiol. 2010. Vol. 72. P. 551–577.
- Zhang Y., Karaman S., Veli-Matti Leppanen V.-M., Alitalo K. Vascular endothelial growth factor signaling in developmentand disease. Development. 2018. Vol. 145. doi:10.1242/dev.151019.
ДОДАТОК А
АКТИ ВПРОВАДЖЕННЯ
ДОДАТОК Б
Список публікацій здобувача за темою дисертації
Праці, в яких опубліковані основні наукові результати дисертації
- Лопандина А. А. Псориаз и психоэмоциональные расстройства. Дерматологія та венерологія. 2016. № 4 (74). С. 11–19.
- Болотная Л. А., Сариан Е. И., Лопандина А. А. Патогенетическое значение сосудистого эндотелиального фактора роста при псориазе. ScienceRise, Медичні науки. 2016. № 2/3 (19). С. 4–8. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено узагальнення результатів).
- Лопандина А. А., Болотная Л. А. Клиническое значение провоспалительных иммунных медиаторов при псориазе. Дерматологія та венерологія. 2018. № 3 (81). С. 13–16.
- Лопандина А. А. Показатели мелатонина и сосудистого эндотелиального фактора роста (VEGF) у больных псориазом с нарушением сна. Международный медицинский журнал. 2018. Т. 24. № 4 (96). С. 81–84.
- Лопандина А. А. Использование мелатонина в комплексном лечении псориаза. Дерматологія та венерологія. 2018. № 4 (81). С. 27–30.
- Кардиоваскулярный риск при иммуноопосредованных дерматозах / Л. А. Болотная, Е. И. Сариан, А. А. Лопандина, В. М. Сидельник. Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции: материалы научн. конф., посвященной 155-летию со дня рождения проф. М. В. Типцева, 18 ноября 2015 г. Харьков, 2015. С. 12-18. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено узагальнення результатів).
Праці, які засвідчують апробацію матеріалів дисертації
- Лопандина А. А. Особенности ангиогенеза у больных псориазом. Инновационные технологии в дерматовенерологии. Междисциплинарные связи : материалы научн.-практ. конф. с участием международн. специалистов, 13-14 ноября 2015 г. Харьков, 2015. Дерматологія та венерологія. 2015. № 3 (69). С.82.
- Лопандина А. А. Изменение психоэмоциональных показателей у больных псориазом. Медицина ХХI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 26 листопада 2015 р. Харків, 2015. С. 45.
- Саріан О. І., Лопандіна А. О. Особливості псоріазу з ураженням кистей і стоп. Новітні тенденції лікування та профілактики дерматовенерологічних проблем в рамках доказової медицини : матеріали наук.-практ. конф.,13-15 квітня 2016 р. Львів, 2016. С. 96-97. (Дисертантом проведено обстеження хворих на псоріаз).
- Сариан Е. И., Лопандина А.А. Психоэмоциональные расстройства у больных псориазом. Медицина ХХI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 24 листопада 2016 р. Харків, 2016. С. 94–95. (Дисертантом проаналізовано порушення психоемоційного стану хворих).
- Сариан Е. И., Лопандина А. А. Уровень глюкозы крови и гликированного гемоглобина у больных псориазом : матер. наук.-прак. конф. «Місце дерматовенерології в міждисциплінарному вирішенні питань діагностики та лікування хронічних захворювань», 20-21 березня 2017 р. Київ, 2017. Дерматовенерологія. Косметологія і Сексопатологія. 2017. № 1-2 (5). С. 116. (Дисертантом проведено обробку лабораторних параметрів).
- Лопандина А. А. Нарушения сна у больных псориазом. Святогірські дерматовенерологічні дні: новітні методи діагностики і лікування в дерматовенерології та косметології : матеріали Всеукр. конф. за участю міжнар. спеціалістів, 25-26 травня 2017 р. Святогір’я, 2017. Журн. дерматовенерології та косметології ім. М. О. Торсуєва. 2017. № 1 (37). С. 73.
- Лопандина А. А. Уровень провоспалительных цитокинов у больных вульгарным псориазом. Дерматовенерологія в розробках молодих науковців : матеріали наук.-практ. школи, 16-17 листопада 2017 р. Київ, 2017. Клінічна імунологія. Алергологія. Інфектологія. 2017. № 6 (103). С. 57.
- Лопандина А. А. Нарушения сна и уровень мелатонина у больных псориазом. Медицина ХIХ століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 23 листопада 2017 р. Харків, 2017. С. 55-56.
- Lopandina A. Change of psychosomatic status in patiens with psoriasis : Аbstract 13th Spring Symposium of European Academy of Dermatology and Venereology, 19-22 May 2016. Athens, 2016. Abstract code P0737.
Праці, які додатково відображають наукові результати дисертації
- Спосіб лікування хворих на псоріаз / Л. А. Болотна, Г. О. Лопандіна, Я. Ф. Кутасевич, О. І. Саріан : пат. на корисну модель № 127590 UA: МПК А61 К 31/00. № u 2018 02708; заявл. 19.03.2018; опубл. 10.08.2018; Бюл № 15.
Відомості про апробацію результатів дисертації
Основні положення роботи викладено та обговорено на науково-практичних конференціях різного рівня:
- Науково-практична конференція з участю міждународних спеціалістів «Инновационные технологии в дерматовенерологии. Междисциплинарные связи» (Харків, 13-14 листопада 2015 р., форма участі – публікація тез).
- Науково-практична конференція молодих вчених з міжнародною участю «Медицина ХIХ століття» (Харків, 26 листопада 2015 р., форма участі – публікація тез).
- Науково-практична конференція «Новітні тенденції лікування та профілактики дерматовенерологічних проблем в рамках доказової медицини» (Львів, 13-15 квітня 2016 р., форма участі – публікація тез).
- Науково-практична конференція молодих вчених з міжнародною участю «Медицина ХХI століття» (Харків, 24 листопада 2016 р., форма участі – публікація тез).
- 13-ий Весняний симпозіум Європейської академії дерматології та венерології (Афіни, 19-22 травня 2016, форма участі – публікація тез).
- Науково-практична конференція «Новітні технології діагностичних, лікувальних та профілактичних заходів в дерматовенерології та методи і стан їхнього впровадження» (Харків, 11-12 листопада 2016 р., форма участі – усна доповідь).
- Всеукраїнська конференція за участю міжнародних спеціалістів «Святогірські дерматовенерологічні дні: новітні методи діагностики і лікування в дерматовенерології та косметології» (Святогір’я, 25-26 травня 2017 р.).
- Науково-практична школа «Дерматовенерологія в розробках молодих науковців» (Київ, 16-17 листопада 2017 р. – публікація тез).
- Науково-практична конференція молодих вчених з міжнародною участю «Медицина ХIХ століття» (Харків, 23 листопада 2017 р. – публікація тез).
- Науково-практична конференція молодих вчених дерматовенерологів «Розробки молодих вчених в сучасній дерматовенерології» (Харків, 9 грудня 2016 р. – усна доповідь).
- Науково-практична конференція молодих вчених інституту з міжнародною участю, присвяченої 25-річниці від дня заснування Національної академії медичних наук України «Новітні впровадження молодих вчених в сучасній дерматовенерології» (Харків, 7 лютого 2018 р. – усна доповідь).
- Науково-практична конференція з міжнародною участю «Питання профілактики, сучасна діагностика та інноваційні методи терапії в дерматовенерології» (Харків, 15-16 листопада 2018 р. – усна доповідь).