Міністерство охорони здоров’я України
Національна медична академія післядипломної освіти імені П.Л. Шупика
Державна установа «Інститут дерматології та венерології НАМН України»
Кваліфікаційна наукова
праця на правах рукопису
Літус Ірина Олександрівна
УДК 616.5-02.193-006.5-036.1-073
ДИСЕРТАЦІЯ
ОПТИМІЗАЦІЯ ТАКТИКИ ВЕДЕННЯ ПАЦІЄНТІВ
З МНОЖИННИМИ РЕЦИДИВУЮЧИМИ
ФІБРОЕПІТЕЛІАЛЬНИМИ ПОЛІПАМИ ШКІРИ
14.01.20 – шкірні та венеричні хвороби
Подається на здобуття наукового ступеня кандидата медичних наук
Дисертація містить результати власних досліджень. Використання ідей,
результатів і текстів інших авторів мають посилання на відповідне джерело
_______________ І.О. Літус
Науковий керівник:
Свистунов Ігор Ваніфатійович, доктор медичних наук, професор
Київ – 2020
АНОТАЦІЯ
Літус І.О. Оптимізація тактики ведення пацієнтів з множинними рецидивуючими фіброепітеліальними поліпами шкіри. – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби. – Національна медична академія післядипломної освіти імені П.Л. Шупика МОЗ України, м. Київ, 2020; Державна установа «Інститут дерматології та венерології НАМН України», м. Харків, 2020.
Дисертація присвячена вивченню клінічних варіантів, супутньої патології, прогнозування рецидивів, метаболічного статусу, морфологічної структури новоутворень у пацієнтів з множинними рецидивуючими фіброепітеліальними поліпами (ФЕП) шкіри для удосконалення діагностики та лікування цього захворювання.
Метою роботи стала оптимізація тактики ведення пацієнтів з множинними рецидивуючими ФЕП шкіри на основі розробки диференційованого підходу до їх обстеження, прогнозування рецидивів і лікування з урахуванням морфологічної, імуногістологічної будови, гормонального та метаболічного статусів.
У дослідження були включені 133 пацієнти, які мали більше трьох рецидивуючих ФЕП шкіри.
Дисертаційна робота складалася із семи основних етапів. 1 етап включав вивчення основних характеристик ФЕП шкіри та клініко-анамнестичних даних пацієнтів. 2 етап включав проведення дослідження «випадок-контроль» для ідентифікації зв’язку ФЕП шкіри із супутніми захворюваннями та клініко-лабораторними показниками із залученням 129 волонтерів, які склали контрольну групу. До неї увійшли особи без ФЕП шкіри, які за віком і статтю достовірно не відрізнялися від дослідної групи. 3 етап включав порівняння клінічних, лабораторних показників залежно від розподілу пацієнтів на групи з метаболічним синдромом (МС), цукровим діабетом 2 типу (ЦД2) та категорію осіб без цих захворювань. У результаті такого аналізу дослідна група була поділена на три групи: до 1-ї увійшли 62 пацієнти без МС та ЦД2; 2-ї – 49 з МС без ЦД2; 3-ї – 22 з ЦД2. 4 етап охоплював вивчення гістологічної будови, оцінку експресії триптазопозитивних опасистих клітин, циклооксигенази-2 (ЦОГ-2), васкулоендотеліального фактору росту (VEGF), мішені рапаміцину ссавців (mTOR) у межах ФЕП шкіри. На 5 етапі були проведені кореляційний і лінійний множинний регресійний аналізи для прогнозування рецидивів ФЕП шкіри. 6 етап включав проведення пілотного, відкритого, рандомізованого дослідження в паралельних групах «Вплив симвастатину на частоту рецидивів ФЕП у пацієнтів з МС» із залученням 45 осіб з МС. 7 етап включав проведення пілотного, відкритого, рандомізованого дослідження «Порівняння впливу двох комбінацій препаратів (метформін/симвастатин проти піоглітазон/симвастатин) на частоту рецидивів ФЕП шкіри в пацієнтів із ЦД2» із залученням 22 осіб із ЦД2.
Усі пацієнти та волонтери отримали та підписали добровільну інформовану згоду на участь у дослідженні. На проведення дисертаційного дослідження був отриманий дозвіл комісії з біоетики Національної медичної академії післядипломної освіти імені П.Л. Шупика.
Клініко-анамнестичний аналіз 133 пацієнтів (середній вік – (45,93 ± 11,94) року) з множинними рецидивуючими ФЕП шкіри (65 жінок і 68 чоловіків) виявив 931 поліп, що в середньому складало 7 поліпів на 1 особу. Форма поліпів була овальною (45 %) або неправильною (32 %), забарвлення – частіше блідо-коричневим (53 %) або коричневим (25 %), консистенція – переважно м’якою (30 %) або еластичною (45 %) з фіксацією на тонкій і короткій ніжці. Кількість рецидивів за останні 2 роки коливалася в діапазоні від 2 до 9 з середнім значенням (3,77 ± 2,09). Поліпи переважно локалізувалися на шиї (53 %), обличчі (10 %), тулубі (10 %), ділянках складок (15 %) з найменшою поширеністю на сідницях (1 %), статевих органах (4 %), верхніх (4 %) та нижніх (3 %) кінцівках.
Результати дослідження «випадок-контроль» з порівнянням 133 пацієнтів і 129 осіб контрольної групи, які за віком та статтю достовірно не відрізнялися (p > 0,05) між собою, встановили достовірне підвищення ризику розвитку МС (відношення шансів (ВШ) = 6,942; 95 % довірчий інтервал (ДІ) 3,328-14,480; р < 0,001), ЦД2 (ВШ = 4,915; 95 % ДІ 1,801-13,418; р = 0,002) в асоціації з порушенням ліпідного та вуглеводного обмінів. Вміст загального холестерину, тригліцеридів, ліпопротеїдів низької щільності (ЛПНЩ), ліпопротеїдів дуже низької щільності (ЛПДНЩ), коефіцієнту атерогенності, глюкози в крові, глікозильованого гемоглобіну, інсуліну, С-пептиду, індексу оцінки інсулінорезистентності на моделі гомеостазу (HOMA-IR) і лептину був достовірно вищим (р<0,05) у пацієнтів з множинними рецидивуючими ФЕП шкіри.
При дослідженні гістологічної структури ФЕП шкіри було виявлено, що у хворих на ЦД2 та МС вони мають характерні особливості будови, що виявляються в наявності ознак вираженого «папіломатозу» за рахунок зміни епідермо-дермальних взаємовідносин, виражених судинних змін і більшої інтенсивності запальної інфільтрації за рахунок клітин лімфогістіоцитарного ряду, що відображає превалювання хронічного запального процесу.
При мікроскопічному дослідженні ФЕП шкіри в пацієнтів без супутніх метаболічних порушень була визначена класична гістологічна картина: епідермо-дермальні межі формувалися присутністю невиражених вторинних сосочків дерми та гребінців епідермісу. У межах сітчастого шару визначалася щільна волокниста неоформлена сполучна тканина, в центральній частині ідентифікувалися розширені кровоносні судини, переважно неправильної форми з тонкими стінками. Сполучна тканина мала ознаки набряку та розпушення колагенових волокон, більше – в центральній частині поліпа.
Імуногістохімічне дослідження ФЕП шкіри пацієнтів з МС і ЦД2 показало їх підвищену інфільтрацію триптазопозитивними опасистими клітинами та М2 макрофагами в межах субепідермальної зони, виразною експресією ЦОГ-2 в епідермісі та клітинах дерми. Виразна експресія індукованої форми ЦОГ-2 серин-треонін протеїнової кінази й VEGF була пов’язана не тільки з виразністю запальної інфільтрації, а й з інтенсивністю проліферативних змін у зоні епідермо-дермальних взаємовідносин.
Проведений кореляційний аналіз встановив найсильніший позитивний кореляційний зв’язок між зростанням кількості ФЕП шкіри та підвищенням концентрації ЛПДНЩ (r=0,530; p<0,001), значень індексу HOMA-IR (r=0,724; p<0,00), вмісту триптазопозитивних опасистих клітин (MCT-позитивних клітин) (r=0,707; p<0,001) у субстраті поліпів.
Регресійний статистичний аналіз встановив коефіцієнт константи на рівні -0,264, стандартизовані коефіцієнти В для ЛПДНЩ склали 0,345; індексу HOMA-IR – 0,345; МСТ-позитивних клітин – 0,403. Для прогнозування рецидивів ФЕП була виведена наступна математична формула:
Y=-0,264+2,049*X1+0,061*X2+0,025*X3,
де Y – середня кількість рецидивів ФЕП шкіри за останні 2 роки;
Х1 – рівень ЛПДНЩ (ммоль/л);
Х2 – індекс НОМА-IR (%);
Х3 – кількість МСТ-позитивних клітин (клітин на 1 мм2).
Проведені кореляційний і регресійний аналізи допомогли встановити предиктори рецидивування та сформувати шкалу Score для прогнозування рецидивів ФЕП шкіри.
Результати пілотного відкритого рандомізованого дослідження в паралельних групах “Вплив симвастатину на частоту рецидивів ФЕП” з включенням 45 пацієнтів з МС свідчать про позитивний вплив препарату на частоту рецидивування та видалень ФЕП шкіри. Зниження частоти рецидивування (6-й місяць – (2,32 ± 1,31); 12-й місяць – (1,40 ± 1,29); р<0,001) і видалень ФЕП (6-й місяць – (1,64 ± 0,86); 12-й місяць – (0,88 ± 0,97); р<0,001) асоціюється зі зменшенням у крові концентрації ЛПДНЩ (день 0 – (0,95 ± 0,41); 12-й місяць – (0,41 ± 0,19) ммоль/л; р<0,001) і вмісту триптазопозитивних опасистих клітин у субстраті поліпа (день 0 – (96,61 ± 38,18); 12-й місяць – (59,19 ± 24,89) клітин на 1 мм2; р<0,001).
У результаті проведення пілотного відкритого рандомізованого дослідження «Порівняння впливу двох комбінацій препаратів (метформін/симвастатин проти піоглітазон/симвастатин) на частоту рецидивів ФЕП шкіри» з включенням 22 пацієнтів із ЦД2 було встановлено, що кількість триптазопозитивних опасистих клітин достовірно знижувалася (р<0,05) в обох групах; для групи «метформін/симвастатин» зменшення було достовірним на 6-й і 12-й місяці лікування; в групі «піоглітазон/симвастатин» достовірне зниження було зафіксоване тільки на 12-й місяць. При порівнянні груп між собою було виявлено, що в пацієнтів, які отримували комбінацію метформін/симвастатин, спостерігалося достовірне зменшення МСТ-позитивних клітин на 6-й (р=0,032) та 12-й (р=0,001) місяці порівняно з групою «піоглітазон/симвастатин».
Ключові слова: фіброепітеліальні поліпи шкіри, морфологія, імуногістохімія, метаболічний синдром, цукровий діабет 2-го типу.
SUMMARY
Litus I.O. Optimization of tactics for managing patients with skin tags. – Qualіfyіng scіentіfіc work on the rіghts of manuscrіpts.
Dissertation for a degree of Candidate of Medical Sciences (PhD) in specialty 14.01.20 – skin and Venereal Diseases. – Shupyk National Medical Academy of Postgraduate Education Ministry of Health of Ukraine, Kyiv, 2020, State Establishment «Institute of Dermatology and Venereology of NAMS of Ukraine», Kharkiv, 2020.
The dissertation is devoted to the study of clinical variants, concomitant pathology, prediction of skin tags recurrence, metabolic status, morphological structure in patients with multiple recurrent skin tags to improve the diagnosis and treatment of this disease.
The aim of the study was to optimize the management of patients with multiple recurrent skin tags based on the development of a differentiated approach to their examination, prediction of recurrence and treatment based on morphological, immunohistological structure, hormonal and metabolic status.
The study included 133 patients who had more than 3 recurrent fibroepithelial skin polyps.
The dissertation consisted of 7 main stages. Stage 1 included the study of the main characteristics of skin tags and clinical and anamnestic data of patients. Stage 2 included a case-control study to identify the association of skin tags with comorbidities and clinical and laboratory parameters involving 129 volunteers who made up the control group. The control group included volunteers without skin tags, who did not differ significantly in age and sex from the experimental group. Stage 3 included a comparison of clinical and laboratory parameters depending on the distribution of patients in the group with metabolic syndrome, type 2 diabetes and the category of patients without these diseases. As a result of this analysis, the experimental group was divided into 3 groups: 1 group included 62 patients without metabolic syndrome and type 2 diabetes; 2 groups – 49 patients with metabolic syndrome without the presence of type 2 diabetes; 3 groups – 22 patients with type 2 diabetes mellitus. Stage 4 included the study of histological structure, evaluation of the expression of tryptase-positive mast cells, COX2 VEGF mTOR within the skin tags. In stage 5, correlation and linear multiple regression analysis was performed to predict recurrence of skin tags. Stage 6 included a pilot, open-label, randomized study in parallel groups, “Effect of simvastatin on the frequency of skin tags recurrence in patients with metabolic syndrome” involving 45 patients with metabolic syndrome. Stage 7 included a pilot, open-label, randomized study “Comparison of the effects of two combinations of drugs (metformin/simvastatin versus pioglitazone/simvastatin) on the frequency of recurrence of skin tags in patients with type 2 diabetes” including 22 patients with type 2 diabetes.
All patients and volunteers received and signed a voluntary informed consent to participate in the study. Permission for the dissertation research was obtained from the commission on bioethics of Shupyk Medical Academy of Postgraduate Education.
Clinical and anamnestic analysis of 133 patients (mean age – (45,93 ± 11,94) years) with multiple recurrent skin tags (65 women and 68 men) revealed 931 polyps, which averaged 7 polyps per patient. The shape of the polyps was oval (45 %) or irregular (32 %). The color was more often pale brown (53 %) or brown (25 %). The consistency was mostly soft (30 %) or elastic (45 %) with a fixation on a thin and short leg. The number of relapses over the past 2 years ranged from 2 to 9 with an average value of (3,77 ± 2,09). Skin tags were mainly localized on the neck (53 %), face (10 %), torso (10 %), folds (15 %), with the lowest prevalence on the buttocks (1 %), genitals (4 %) and lower extremities (3 %).
The results of the case-control study comparing 133 patients and 129 subjects in the control group, who did not differ significantly in age and sex (p>0,05), found a significant increase in the risk of metabolic syndrome (odds ratio=6,942; 95 % CI 3,328-14,480; p<0,001), type 2 diabetes mellitus (odds ratio=4,915; 95 % CI 1,801-13,418; p=0,002) in association with impaired lipid and carbohydrate metabolism. The content of total cholesterol, triglycerides, low-density lipoproteins, LDL, very low-density lipoproteins, atherogenic factor, blood glucose, glycosylated hemoglobin, insulin, C-peptide, HOMA index in patients with skin tags.
Examination of the histological structure of skin tags revealed that patients with type 2 diabetes mellitus and metabolic syndrome are characterized by structural features, which are manifested in the presence of signs of pronounced “papillomatosis” due to changes in epidermo-dermal relationships, pronounced vascular changes and greater intensity of inflammatory due to the cells of the lymphohistiocytic lineage, which reflects the prevalence of chronic inflammation.
Microscopic examination of fibroepithelial skin polyps in patients without concomitant metabolic disorders revealed a classic histological picture: epidermo-dermal boundaries were formed by the presence of indistinct secondary papillae of the dermis and epidermal combs. Within the reticular layer, dense fibrous unformed connective tissue was determined, and dilated blood vessels, mostly irregularly shaped with thin walls, were identified in the central part. The connective tissue had signs of swelling and loosening of collagen fibers, more – in the central part of the polyp.
Immunohistochemical study of skin tags in patients with metabolic syndrome and type 2 diabetes showed increased infiltration by tryptase-positive mast cells and M2 macrophages within the subepidermal zone and pronounced expression of COX2 in the epidermis and cells of the dermis. The marked expression of the COX2-induced serine-threonine protein kinase mTOR and vascular endothelial growth factor VEGF was associated not only with the severity of inflammatory infiltration but also with the intensity of proliferative changes in the epidermo-dermal relationship.
The correlation analysis established the strongest positive correlation between the increase in the number of fibroepithelial skin polyps with increasing concentration of very low density lipoproteins (r=0,530; p<0,001), the values of the HOMA-IR index (r=0,724; p<0,00) and the content of MCT-positive cells (r=0,707; p<0,001) in the substrate of polyps.
Regression statistical analysis set the constant coefficient at -0,264, standardized coefficients B for very low density lipoproteins were 0,345; NOMA index – 0,345; MCT-positive cells – 0,403. To predict the recurrence of skin tags was derived mathematical formula:
Y=-0,264+2,049*X1+0,061*X2+0,025*X3,
where Y is the average number of recurrences of FEP skin over the past 2 years;
X1 – the level of very low density lipoproteins (mmol/l);
X2 – HOMA-IR index (%);
X3 – the number of MCT-positive cells (cells per 1 mm2).
Correlation and regression analysis helped us to establish predictors of recurrence and to form a scale Score for predicting recurrence of skin tags.
The results of a pilot, open-label, randomized study in parallel groups “Effect of simvastatin on the frequency of skin tags recurrence” including 45 patients with metabolic syndrome indicate a positive effect of simvastatin on the frequency of recurrence and removal of skin tags. Reduction of recurrence rate (6 months – (2,32 ± 1,31); 12 months – (1,40 ± 1,29); p<0,001) and removal of skin tags (6 months – (1,64 ± 0,86); 12 months – (0,88 ± 0,97); p<0,001) is associated with a decrease in blood concentrations of very low density lipoproteins (day 0 – (0,95 ± 0,41); 12 months – (0,41 ± 0,19) mmol/l; p<0,001) and the content of tryptase-positive mast cells (day 0 – (96,61 ± 38,18); 12 months – (59,19 ± 24,89) cells per 1 mm2; p<0,001) in the polyp substrate.
A pilot, open-label, randomized study “Comparison of the effects of two combinations of drugs (metformin/simvastatin versus pioglitazone/simvastatin) on the recurrence rate of skin tags” involving 22 patients with type 2 diabetes found that the number of tryptase-positive significantly decreased (p<0,05) in both groups; for metformin/simvastatin patients, the reduction was significant at 6 and 12 months of treatment; in the pioglitazone/simvastatin group, a significant decrease was recorded for only 12 months. When comparing the groups, it was found that patients receiving the combination of metformin/simvastatin showed a significant decrease in MCT-positive cells at 6 (p=0,032) and 12 months (p=0,001) compared with the group “pioglitazone/simvastatin”.
Key words: skin tags, morphology, immunohistochemistry, metabolic syndrome, type 2 diabetes.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Літус ІО. Експресія М2-макрофагів, mTOR-позитивних клітин та VEGF у межах фіброепітеліальних поліпів шкіри у пацієнтів із метаболічним синдромом та цукровим діабетом 2-го типу. Укр. мед. часопис. 2020;(2 Т 2):43-8.
- Літус ІО, Свістунов ІВ. Особливості гістологічної будови рецидивуючих фіброепітеліальних поліпів шкіри у хворих з метаболічним синдромом та цукровим діабетом 2-го типу. Україна. Здоров’я нації. 2020;(2):137-41.
- Літус ІО. Асоціація множинних рецидивних фіброепітеліальних поліпів шкіри з ліпідним обміном в українській популяції. Дерматологія та венерологія. 2019;(4):27-9.
- Літус ІО. Оцінка експресії опасистих клітин та СОХ2 в межах фіброепітеліальних поліпів шкіри у пацієнтів з метаболічним синдромом та цукровим діабетом 2 типу. Здоров’я суспільства. 2020; 9(1): 6-12.
- Кочет КА, Литус ИА, Свистунов ИВ, Сулаева ОН. Патология кожи при сахарном диабете: клинико-патогенетические корреляции (обзор). Georgian Med News. 2017 Dec;(273):41-6.
- Літус ІО. Оцінка експресії опасистих клітин та СОХ2 в межах фіброепітеліальних поліпів шкіри у пацієнтів з метаболічним синдромом та цукровим діабетом 2 типу. В: Зб. тез наук. робіт учасників міжнар. наук.-практ. конф. Медична наука та практика в умовах сучасних трансформаційних процесів; 2020 Квіт 24-25; Львів. Львів: ГО “Львів. мед. спільнота”; 2020. с. 46-9.
ЗМІСТ
| Перелік умовних позначень, символів, скорочень | 16 |
| Вступ | 17 |
| 1 Клінічні та патогенетичні ланки перебігу фіброепітеліальних поліпів шкіри на тлі метаболічних порушень (огляд літератури) | 24 |
| 1.1 Епідеміологія та клінічні варіанти фіброепітеліальних поліпів шкіри | 24 |
| 1.2 Механізми формування фіброепітеліальних поліпів шкіри при метаболічному синдромі та цукровому діабеті 2-го типу | 25 |
| 1.3 Роль опасистих клітин, макрофагів при формуванні метаболічних порушень і фіброепітеліальних поліпів шкіри | 31 |
| 1.4 Вплив молекул циклооксигенази-2, мішені рапаміцину ссавців і васкулоендотеліальний фактор росту при хронічному запаленні, що асоційоване з метаболічними розладами й онкогенезом | 37 |
| 2 Матеріали та методи досліджень | 43 |
| 2.1 Дизайн дослідження, характеристика груп досліджень | 43 |
| 2.2 Діагностика метаболічного синдрому та цукрового діабету 2-го типу | 44 |
| 2.3 Методи електрокоагуляції фіброепітеліальних поліпів шкіри | 44 |
| 2.4 Біохімічні дослідження | 46 |
| 2.5 Гістологічні та імуногістохімічні дослідження фіброепітеліальних поліпів | 46 |
| 2.6 Методи статистичного аналізу | 49 |
| 3 Клініко-лабораторна характеристика досліджуваних груп | 50 |
| 3.1 Характеристика фіброепітеліальних поліпів шкіри, клініко-анамнестичні дані | 50 |
| 3.2 Асоціація фіброепітеліальних поліпів шкіри з супутніми захворюваннями та клініко-лабораторними показниками | 55 |
| 3.3 Вплив метаболічного синдрому та цукрового діабету 2-го типу на клініко-лабораторні параметри при фіброепітеліальних поліпах шкіри | 64 |
| 4 Особливості морфогенезу фіброепітеліальних поліпів у пацієнтів з метаболічним синдромом і цукровим діабетом 2-го типу | 68 |
| 4.1 Особливості гістологічної будови фіброепітеліальних поліпів шкіри у хворих на метаболічний синдром і цукровий діабет 2-го типу | 68 |
| 4.2 Оцінка експресії триптазопозитивних опасистих клітин і циклооксигенази-2 в межах фіброепітеліальних поліпів у пацієнтів з метаболічним синдромом і цукровим діабетом 2-го типу | 72 |
| 4.3 Оцінка експресії васкулоендотеліального фактора росту і кількості М2-макрофагів у фіброепітеліальних поліпах пацієнтів різних груп | 79 |
| 4.4 Оцінка експресії мішені рапаміцину ссавців у фіброепітеліальних поліпах пацієнтів різних груп | 87 |
| 5 Прогнозування рецидивів фіброепітеліальних поліпів шкіри. Вплив метаболічної терапії | 91 |
| 5.1 Кореляційний і лінійний множинний регресійний аналіз як інструмент для прогнозування рецидивів фіброепітеліальних поліпів шкіри | 91 |
| 5.2 Вплив симвастатину на частоту рецидивів фіброепітеліальних поліпів у пацієнтів з метаболічним синдромом | 98 |
| 5.3 Порівняння впливу двох комбінацій препаратів (метформін/симвастатин проти піоглітазон/симвастатин) на частоту рецидивів фіброепітеліальних поліпів шкіри в пацієнтів із цукровим діабетом 2-го типу | 101 |
| 6 Аналіз та узагальнення результатів дослідження | 106 |
| Висновки | 118 |
| Рекомендації | 121 |
| Список використаних джерел | 122 |
| Додаток А Список публікацій здобувача за темою дисертації | 135 |
| Додаток Б Апробація результатів дисертації | 136 |
| Додаток В Акти впровадження | 137 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ, СИМВОЛІВ, СКОРОЧЕНЬ
| АТ | – артеріальний тиск |
| ВШ | – відношення шансів |
| ГХ | – гіпертонічна хвороба |
| ДІ | – довірчий інтервал |
| ЕФР | – епідермальний фактор росту |
| ІМТ | – індекс маси тіла |
| ІФР-1 | – інсуліноподібний фактор росту 1 |
| ЛПВЩ | – ліпопротеїди високої щільності |
| ЛПДНЩ | – ліпопротеїди дуже низької щільності |
| ЛПНЩ | – ліпопротеїди низької щільності |
| МС | – метаболічний синдром |
| СРБ | – С-реактивний білок |
| ФЕП | – фіброепітеліальні поліпи |
| ФНП-α | – фактор некрозу пухлин α |
| ЦД | – цукровий діабет |
| ЦД2 | – цукровий діабет 2-го типу |
| ЦОГ | – циклооксигеназа |
| ЦОГ-2 | – циклооксигеназа-2 |
| HbA1c | – гемоглобін A1c |
| HOMA-IR | – індекс оцінки інсулінорезистентності на моделі гомеостазу |
| MCT-позитивні клітини | – триптазопозитивні опасисті клітини |
| mTOR | – мішень рапаміцину ссавців |
| VEGF | – васкулоендотеліальний фактор росту |
ВСТУП
Обґрунтування вибору теми дослідження. Фіброепітеліальні поліпи (ФЕП) шкіри (син. акрохордон, м’яка фіброма, skin tags) – це розповсюджене доброякісне новоутворення шкіри, що представляє собою м’який поліп, частіше на ніжці, тілесного, жовтого або темно-коричневого кольору, частіше округлої або овальної форми. Однаково часто зустрічаються в чоловіків і жінок. Найчастіше з’являються в середньому та похилому віці, у вагітних і людей з надлишком ваги [29]. У віці до 70 років у 55-60 % осіб наявні ФЕП шкіри [37].
Етіологія та патогенез ФЕП шкіри досі залишаються не вивченими. Але дослідження вказують на зв’язок між ФЕП шкіри та цукровим діабетом (ЦД), метаболічним синдромом (МС), інсулінорезистентністю [79, 108].
У всьому світі понад 1,9 млрд дорослих людей мають зайву вагу, а близько 600 млн осіб страждають на ожиріння. Приблизно 382 млн людей живуть з діабетом, а 40-50 % населення мають “високий ризик” розвитку предіабету [60].
Множинні ФЕП шкіри також можуть виступати маркером високих рівнів холестерину та лептину, що прямо пропорційні рівню жирової маси [65]. Останні спостереження свідчать про те, що опасисті клітини беруть участь у виникненні резистентності до інсуліну та розвитку цукрового діабету 2-го типу (ЦД2) [44]. Результати деяких досліджень вказують на критичну роль цих клітин у патогенезі ФЕП шкіри через їх взаємодію з фібробластами [50].
При локальному запаленні ФЕП шкіри також можуть активуватися макрофаги, підвищуватися експресія циклооксигенази-2 (ЦОГ-2), епідермального фактора росту (ЕФР) та мішені рапаміцину ссавців (mTOR), що реалізують механізми формування поліпів. Препарати, як-от статини, піоглітазон і метформін, крім своїх основних фармакологічних ефектів, мають протизапальні властивості, що можуть впливати на активність опасистих клітин, макрофагів та інших елементів ФЕП [50, 68, 95, 117, 120, 121].
У роботах українських вчених-дерматовенерологів приділяється багато уваги вивченню нових підходів щодо діагностики та лікування як хронічних дерматозів у цілому, так і папіломавірусної інфекції зокрема [4, 5, 7, 8, 14]. Останніми роками значної уваги надають застосуванню статинів при захворюваннях шкіри [1]. При багатьох шкірних захворюваннях дерматологи намагаються обмежитися лише місцевою терапією, або лише хірургічним видаленням у випадку ФЕП шкіри [10-13, 15-17]. Але неврахування частої коморбідної патології у пацієнтів із шкірними захворюваннями, зокрема, цукрового діабету може призводити до невдач у лікуванні або до збільшення частоти рецидивів [26]. Наявність ФЕП на шкірі і прогресуюче збільшення їх кількості може бути джерелом психологічних проблем для пацієнтів, як відомо багато шкірних захворювань з хронічним перебігом потребують в тому числі і корекції супутніх психосоматичних розладів [9]. Лікування ФЕП шкіри проводиться виключно хірургічними методами, але їх видалення не гарантує зупинку рецидивування.
На сьогоднішній день відсутні діагностичні алгоритми прогнозування рецидивів ФЕП та їх медикаментозної корекції із системним застосуванням препаратів різних груп.
Саме вирішенню цих актуальних питань присвячене проведене дослідження.
Зв’язок роботи з науковими планами, програмами, темами. Дисертаційна робота є фрагментом планових науково-дослідної роботи кафедри дерматовенерології Національної медичної академії післядипломної освіти імені П.Л. Шупика МОЗ України «Оптимізація алгоритмів діагностики, лікування хронічних дерматозів, новоутворень шкіри та ІПСШ з урахуванням впливу фонових патологій, соціальних факторів і чинників довкілля» (№ державної реєстрації 0115U002359, термін виконання 2015-2019 рр.). Дисертант був співвиконавцем науково-дослідної роботи.
Мета дослідження: оптимізація тактики ведення пацієнтів з множинними рецидивуючими фіброепітеліальними поліпами шкіри шляхом розробки диференційованого підходу до їх обстеження, прогнозування рецидивів і лікування з урахуванням морфологічної, імуногістологічної будови поліпів та метаболічного статусу.
Завдання дослідження:
- Провести аналіз клініко-анамнестичних даних пацієнтів з множинними рецидивуючими ФЕП шкіри.
- Виконати порівняльне дослідження пацієнтів з множинними рецидивуючими ФЕП шкіри й осіб без них для ідентифікації ризику розвитку МС, ЦД2.
- Оцінити метаболічний статус (вуглеводний і ліпідний обміни) у пацієнтів з множинними рецидивуючими ФЕП шкіри.
- Провести гістологічне та імуногістохімічне дослідження ФЕП шкіри з оцінкою експресії триптазопозитивних опасистих клітин (МСТ-позитивних клітин), М2-макрофагів, ЦОГ-2, mTOR та васкулоендотеліального фактора росту (VEGF).
- Здійснити кореляційний і регресійний статистичний аналізи для ідентифікації предикторів рецидивування ФЕП шкіри.
- Оцінити вплив симвастатину на частоту рецидивів ФЕП шкіри у пацієнтів з МС.
- Дослідити вплив двох комбінацій препаратів (метформін/симвастатин проти піоглітазон/симвастатин) на частоту рецидивів ФЕП шкіри в пацієнтів із ЦД2.
Об’єкт дослідження: ФЕП шкіри (МКХ 10 – D23.9).
Предмет дослідження: клінічна характеристика ФЕП, стан ліпідного обміну, показники метаболізму глюкози, морфологічні й імуногістохімічні критерії ФЕП.
Методи дослідження: клінічні (вивчення основних характеристик ФЕП шкіри), біохімічні (діагностика МС та ЦД2), морфологічні (мікроскопічна і морфометрична оцінка ФЕП шкіри), імуногістохімічні (вивчення активності макрофагів, опасистих клітин та параметрів хронічного запалення ФЕП шкіри), статистичні (оцінка достовірності отриманих даних).
Наукова новизна отриманих результатів. Вперше в українській популяції було проведене дослідження «випадок-контроль» з порівнянням 133 пацієнтів з ФЕП шкіри та 129 осіб контрольної групи, що встановило достовірне підвищення ризику розвитку МС в асоціації з порушенням ліпідного та вуглеводного обмінів.
Вперше були виявлені особливості гістологічної структури ФЕП шкіри у хворих на ЦД2 та МС, що виявляються наявністю ознак вираженого папіломатозу за рахунок зміни епідермо-дермальних взаємовідносин, виражених судинних змін і більшої інтенсивності запальної інфільтрації клітинами лімфогістіоцитарного ряду, що відображає превалювання хронічного запального процесу.
Вперше було проведене імуногістохімічне дослідження ФЕП шкіри пацієнтів з МС і ЦД2, що показало їх підвищену інфільтрацію МСТ-позитивними клітинами та М2 макрофагами в межах субепідермальної зони, вираженою експресією ЦОГ-2 в епідермісі та клітинах дерми. Посилена експресія індукованої форми ЦОГ-2 mTOR та VEGF була пов’язана не тільки з вираженістю запальної інфільтрації, а й інтенсивністю проліферативних змін у зоні епідермо-дермальних взаємовідносин.
Вперше проведений кореляційний аналіз, що встановив найсильніший позитивний кореляційний зв’язок між зростанням кількості ФЕП шкіри та підвищенням концентрації ліпопротеїдів дуже низької щільності (ЛПДНЩ), значень індексу оцінки інсулінорезистентності на моделі гомеостазу (HOMA-IR), вмісту MCT-позитивних клітин у субстраті поліпів.
Вперше за результатами регресійного статистичного аналізу була виведена математична формула для ідентифікації предикторів рецидивування ФЕП шкіри.
Вперше було досліджено в паралельних групах «Вплив симвастатину на частоту рецидивів ФЕП» з включенням 45 пацієнтів з МС, що показало позитивний вплив симвастатину на частоту рецидивування та видалень ФЕП шкіри. Зниження частоти рецидивування асоціюється зі зменшенням у крові концентрації ЛПДНЩ і вмісту МСТ-позитивних клітин у субстраті поліпа.
Вперше було проведене дослідження впливу двох комбінацій препаратів (метформін/симвастатин проти піоглітазон/симвастатин) на частоту рецидивів ФЕП шкіри з включенням 22 пацієнтів із ЦД2, яке показало, що кількість МСТ-позитивних клітин достовірно знижувалася в обох групах; для групи «метформін/симвастатин» зменшення було достовірним на 6-му і 12-му місяці лікування; у групі «піоглітазон/симвастатин» достовірне зниження було зафіксоване тільки на 12-му місяці. Було встановлено, що в осіб, які отримували комбінацію метформін + симвастатин, спостерігалося достовірне зменшення МСТ-позитивних клітин на 6-му і 12-му місяці порівняно з групою «піоглітазон + симвастатин».
Практичне значення отриманих результатів. Встановлено, що пацієнтам з множинними рецидивуючими ФЕП шкіри необхідно проводити скринінг на МС і ЦД2 шляхом визначення клінічних параметрів (окружність талії, індекс маси тіла [ІМТ]), показників ліпідного обміну (холестерин, тригліцериди, ліпопротеїди високої щільності (ЛПВЩ), ліпопротеїди низької щільності (ЛПНЩ), ЛПДНЩ та діабетичної панелі (глюкоза в крові, глікозильований гемоглобін, інсулін, С-пептид, індекс HOMA-IR, лептин). Для прогнозування ризику розвитку рецидивів у осіб з множинними, рецидивуючими ФЕП шкіри можна використовувати шкалу “Score”, оцінка якої складається з трьох етапів: на першому необхідно визначити кількість МСТ-позитивних клітин у поліпі (від 0 до 45; від 46 до 75; від 76 до 105; від 106 до 135; від 136-165 клітин на 1 см2); другому – значення індексу НОМА (від 1,5 % до 12 %); третьому – рівень ЛПДНЩ (від 0,2 до 1,5 ммоль/л). Після встановлення даних віднайти в таблиці значення, що буде відповідати ймовірності розвитку рецидивів ФЕП шкіри в найближчі 2 роки.
Призначення симвастатину в дозі 20 мг на добу протягом 12 місяців знижує ризик рецидивування ФЕП у пацієнтів з МС. В осіб зі стабільним перебігом ЦД2 комбінація препаратів симвастатин у дозі 20 мг на добу + метформіну гідрохлорид – 500 мг три рази на добу або піоглітазону гідрохлорид – 30 мг 1 раз на добу знижує рецидивування ФЕП шкіри з більшою клінічною ефективністю при призначенні метформіну гідрохлориду.
Впровадження результатів дослідження в практику. Отримані автором результати впроваджені в практичну діяльність: КНП «Київська міська клінічна шкірно-венерологічна лікарня», Комунального некомерційного підприємства «Кіровоградський обласний шкірно-венерологічний диспансер», Тернопільського обласного шкірно-венерологічного диспансеру, ТОВ «Інститут псоріазу та хронічних дерматозів», Комунального підприємства «Рівненський обласний шкірно-венерологічний диспансер».
Результати дисертації впроваджені в педагогічний процес кафедри шкірних та венеричних хвороб Ужгородського національного університету, кафедри інфекційних хвороб з епідеміологією, шкірними та венеричними хворобами Тернопільського національного медичного університету імені І.Я. Горбачевського.
Особистий внесок здобувача. Дисертанту належіть ідея роботи. Самостійно були проведені літературний і патентний пошуки. Спільно з науковим керівником були сформульовані мета та завдання роботи. Дисертантом самостійно розроблений дизайн дослідження, сформовані групи та проведені пілотні, клінічні, лабораторні дослідження, аналіз і статистична обробка результатів. Співавтори публікацій консультували при підготовці наукових праць. Запозичень чужих ідей при написанні дисертації та наукових статей не було.
Апробація матеріалів дисертації. Основні положення роботи були представлені на: науково-практичній конференції “Дерматовенерологія в розробках молодих науковців. Наукова школа” (Київ, 2017); науково-практичній конференції “KDD 2017 12-ті Київські дерматологічні дні”; науково-практичній конференції “KDD 2018 13-ті Київські дерматологічні дні: Весняний симпозіум” (Київ, 2018); науково-практичній конференції з міжнародною участю “Актуальні питання сучасної діабетології” (Київ 2018); науково-практичній конференції “Дерматовенерологія в розробках молодих науковців” (Київ, 2018); науково-практичній конференції “Kyiv Skin Allergy Meeting 18-19” (Київ, 2018); міжнародній науково-практичній конференції “Медична наука та практика в умовах сучасних трансформаційних процесів” (Львів, 24-25 квітня 2020 р.).
Публікації. Результати дисертації опубліковані у 6 друкованих працях, з них у спеціалізованих наукових фахових виданнях України – 4, виданні наукометричної бази Scopus – 1, тезах доповідей у матеріалах науково-практичних конференцій – 1.
Структура та обсяг дисертації. Дисертація викладена українською мовою на 143 сторінках комп’ютерного тексту. Робота складається зі вступу, огляду літературних джерел, матеріалів і методів дослідження, трьох розділів власних досліджень, аналізу та узагальнення результатів дослідження, висновків, рекомендацій, списку використаних джерел і трьох додатків. Дисертація ілюстрована 25 рисунками, 33 таблицями. Список використаної літератури містить 121 джерело, зокрема 30 – кирилицею, 91 – латиницею.
1 КЛІНІЧНІ ТА ПАТОГЕНЕТИЧНІ ЛАНКИ ПЕРЕБІГУ ФІБРОЕПІТЕЛІАЛЬНИХ ПОЛІПІВ ШКІРИ НА ТЛІ МЕТАБОЛІЧНИХ ПОРУШЕНЬ (ОГЛЯД ЛІТЕРАТУРИ)
1.1 Епідеміологія та клінічні варіанти фіброепітеліальних поліпів шкіри
ФЕП шкіри, також відомі як “акрохордони”, зазвичай візуалізуються як шкірні нарости та доброякісні за своєю природою. Згідно з оцінками, майже в 50-60 % дорослих протягом життя може розвинутися хоча б один ФЕП, водночас ймовірність їх виникнення значно зростає після четвертого десятиліття життя. Проте слід зазначити, що акрохордони частіше зустрічаються в осіб, які страждають на ожиріння, діабет, МС, і в людей із сімейним анамнезом ФЕП шкіри. ФЕП однаково часто з’являються в чоловіків і жінок, частіше розташовані в пахвових ділянках і на шиї [37, 84].
Хоча ФЕП шкіри діагностуються за клінічним аспектом, для диференціальної діагностики може знадобитися гістопатологічне дослідження, при якому можуть спостерігатися себорейний кератоз, бородавки, капілярні гемангіоми, жировики, кісти, шкірні невуси, нейрофіброми, контагіозний молюск, меланома та базальноклітинний рак [43].
У дослідженні A. Rasi та співавт. (2014) [91] з включенням 168 пацієнтів було показано, що найчастішими локалізаціями шкірних ФЕП були шия та верхня частина грудної клітки (48,9 %), пахвові ділянки (33 %) та груднина (10,1 %).
В одному з досліджень було відмічено, що вірус папіломи людини 6-го й 11-го типів може бути етіологічним фактором розвитку ФЕП шкіри. У 48,6 % випадків були зафіксовані позитивні результати після проведення полімеразної ланцюгової реакції до цих вірусів [61].
Однією з основних причин розвитку ФЕП шкіри є метаболічні порушення, які насамперед пов’язані з порушенням обміну ліпідів і глюкози.
1.2 Механізми формування фіброепітеліальних поліпів шкіри при метаболічному синдромі та цукровому діабеті 2-го типу
Фактично 70-80 % хворих на ожиріння та практично кожен пацієнт із ЦД2 мають інсулінорезистентність. Резистентність до інсуліну – це добре відомий патофізіологічний фактор розвитку ЦД2, що характерно проявляється за роки до його діагностики. Шкірні прояви інсулінорезистентності (наприклад, акрохордони, акантоз, андрогенетична алопеція, вугрі, гірсутизм) можуть бути першими ознаками цього стану. Їх точне діагностування може позитивно впливати на здоров’я пацієнта, викликаючи адекватну метаболічну оцінку та призначення своєчасного лікування [60].
Ожиріння також впливає на сальні та потові залози, викликає зміни кровообігу та лімфи. До поширених шкірних проявів, пов’язаних з ожирінням, відносяться чорний акантоз, акрохордони, кератоз, целюліт і підошовний гіперкератоз. Ожиріння має метаболічні ефекти та може спричиняти розвиток гіперандрогенії та подагри, які зі свого боку зв’язані зі шкірними проявами. Крім того, ожиріння пов’язане зі збільшенням захворюваності на бактеріальні та кандидозні шкірні інфекції, а також оніхомікоз, запальні захворювання шкіри та хронічні дерматози, як-от гідраденіт, псоріаз і розацеа [64].
До одного з досліджень були включені 110 пацієнтів, які мали два чи більше акрохордонів, і 110 волонтерів, які були співставними за віком і статтю. У групі пацієнтів реєстрували локалізацію, розмір і загальну кількість акрохордонів. В основній і контрольній групах оцінювали вік, стать, ІМТ, артеріальний тиск (АТ), окружність талії, стан паління, глюкозу в плазмі натще, порушення тесту на толерантність до глюкози, інсулінорезистентність, сироваткові ліпіди та рівень ферментів печінки. АТ крові вимірювали в двох групах. Результати цього дослідження показали, що в 58 пацієнтів основної групи та 12 волонтерів контрольної був діагностований ЦД. 15 % (16/110) основної групи та 8 % (9/110) контрольної мали позитивний тест на толерантність до глюкози. Середні рівні глюкози в плазмі натще, ІМТ, інсулінорезистентності, загального холестерину, холестерину ЛПНЩ та тригліцеридів були достовірно вищими в пацієнтів порівняно з контролем. В осіб з акрохордонами спостерігався вищий систолічний і діастолічний АТ порівняно з контролем. Автори дійшли висновку, що наявність акрохордонів може асоціюватися з розвитком МС [101].
До іншого дослідження були включені 76 пацієнтів з ожирінням (ІМТ≥30) та 73 добровольців з нормальною вагою (ІМТ 18,5-24,9) з аналізом історії хвороби та шкірним обстеженням. Усіх пацієнтів вивчали на наявність МС. Результати дослідження показали, що в групі з ожирінням порівняно з контролем достовірно частіше діагностувалися стрії (Р<0,001), підошовний гіперкератоз (Р<0,001), акрохордони (Р=0,007), інтертріго (Р<0,001), чорний псевдоакантоз (P<0,001), кератоз (P=0,006), лімфедема (P=0,002) та бактеріальні інфекції (P=0,05). Також було виявлено, що наявність стрій, псевдоакантозу та бактеріальної інфекції співвідносилася зі ступенем ожиріння. Автори дійшли висновку, що догляд за шкірою людей, які страждають на ожиріння, заслуговує на особливу увагу не тільки через високу поширеність шкірних змін, але насамперед через те, що багатьом із цих порушень можна запобігти, їх можна лікувати, покращуючи якість життя пацієнта [38].
A. Rasi та співавт. [92] дослідили та порівняли поширеність діабету та порушення толерантності до глюкози в осіб з ФЕП шкіри та контрольної групи. Дослідження випадок-контроль було проведене в осіб старше 15 років. До основної групи увійшли 104 пацієнти з принаймні 3-ма ФЕП шкіри. Контроль склали 94 особи без ФЕП шкіри, які були співставними за віком, статтю та масою тіла з досліджуваною групою. Усі пацієнти пройшли стандартний 2-годинний пероральний тест на толерантність до глюкози. Результати дослідження показали, що в осіб з ФЕП шкіри спостерігалася вища частота діабету, ніж у контрольної групи (23,07 % проти 8,51 %; Р=0,005). Різниця в частоті тесту толерантності до глюкози не була достовірною (13,46 % проти 10,63 %; P=0,543). Була ідентифікована позитивна кореляція між загальною кількістю шкірних ФЕП і середнім вмістом глюкози в плазмі натще (r=0,260; P=0,031); пацієнти з понад 30 ФЕП шкіри мали високий ризик розвитку діабету (52,0 %). Не було виявлено кореляції між кількістю ФЕП шкіри й ІМТ. Автори дійшли висновку, що підвищений ризик розвитку ЦД спостерігається в пацієнтів з декількома ФЕП шкіри. Вони рекомендували в осіб з ФЕП шкіри враховувати високий рівень підозри щодо порушення вуглеводного обміну.
Хоча в іншій роботі був показаний зв’язок між ІМТ та наявністю ФЕП шкіри. В аналітичному крос-секційному дослідженні взяли участь 32 пацієнти з ФЕП шкіри та 32 волонтери, які склали контрольну групу. Діагностика ФЕП шкіри проводилася на підставі анамнезу та клінічного обстеження. Усі обстежувані пройшли фізичний огляд (зріст і вага) для визначення ІМТ. Результати дослідження показали, що середнє значення ІМТ в групі ФЕП шкіри (28,1 ± 3,9) було достовірно вищим порівняно з контрольною групою (24,1 ± 2,3 кг) [67].
Ще в одній роботі порівнювали клінічні та метаболічні параметри глюкози/інсуліну в чоловіків з множинними (8 і більше) ФЕП шкіри на шиї та контрольній групі з декількома або відсутніми ФЕП. Обидві групи були розділені на дві підгрупи за нормальними або аномальними лабораторними результатами. У дослідній підгрупі з нормальними лабораторними показниками кількість шкірних ФЕП варіювала від 8 до 33, водночас в осіб з аномальними результатами діапазон становив 9-65. 8 або більше ФЕП шкіри були пов’язаними зі статистично значущими лабораторними порушеннями глюкози/інсуліну: базальною гіперінсулінемією (р<0,002), постпрандіальною гіперінсулінемією (р<0,003) та постпрандіальною гіперглікемією (р<0,01). У групі множинних ФЕП шкіри 77 % пацієнтів мали різні лабораторні порушення, включаючи інсулінорезистентність, базальну та постпрандіальну гіперінсулінемію, непереносність глюкози або ЦД2, на відміну від контрольної групи, де лише 33 % осіб виявили лабораторні порушення [106].
В іншій роботі був показаний зв’язок лише з ожирінням. У дослідження були включені 99 хворих на ЦД2 (40 жінок і 59 чоловіків). Вищі ІМТ (p=0,04) та частота ожиріння (p=0,03) були виявлені в пацієнтів з ФЕП шкіри порівняно з особами без шкірних проявів. Вік (p=0,8), стать (p=0,6), гемоглобін A1c (HbA1c) (p=0,4) та наявність дисліпідемії (p=0,4), гіпертонії (p=0,6), макро- (p=0,2) та мікроангіопатії (p=0,9) у пацієнтів з і без шкірних ФЕП не відрізнялися. Автори дійшли висновку, що наявність ФЕП шкіри пов’язана лише з ожирінням і не може бути сильно зв’язаною з макро- та мікроангіопатіями в діабетиків 2-го типу [71].
Уніваріантний статистичний аналіз, проведений в іншому дослідженні, виявив, що більша окружність талії, високий рівень тригліцеридів і низькі ЛПВЩ у клінічних випадках достовірно відрізнялися порівняно з контролем. Поширеність діабету, гіпертонії та МС була достовірно вищою в пацієнтів з ФЕП шкіри, а ризик розвитку МС був у 11,13 раза більшим порівняно з контролем (p<0,05). Дослідники дійшли висновку, що ризик розвитку МС значно вищий у пацієнтів зі шкірними ФЕП. Серед різних компонентів МС лише шкіра з ФЕП пов’язана з великою окружністю талії та низьким рівнем ЛПВЩ в сироватці крові [71].
I.B. Putra та співавт. (2019) [87] виявили, що середній рівень лептину в сироватці крові пацієнтів з ФЕП шкіри був найвищим за типом змішаного ураження ([31,54 ± 12,85] нг/мл). Середня кількість шкірних ФЕП складала (13,6 ± 5,8). Результати дослідження встановили сильну кореляцію між рівнем лептину в сироватці крові та кількістю шкірних ФЕП (r=0,86; р<0,05).
Деякі дослідники стверджували, що існує зв’язок між ФЕП шкіри та поліпами товстої кишки, хоча патофізіологічні механізми з’ясовані недостатньо. M. Oran і співавт. (2014) дослідили співіснування аденоматозних поліпів товстої кишки та ФЕП шкіри [83]. У дослідження були включені 45 пацієнтів віком від 18 до 60 років з діагнозом аденоматозні поліпи товстої кишки та 45 осіб, які були співставними за статтю, віком, соціально-демографічними показниками та не мали поліпів. У всіх учасників визначали рівень глюкози в сироватці крові, загальний холестерин, холестерин ЛПНЩ, холестерин ЛПВЩ, рівні тригліцеридів, інсуліну, інсуліноподібного фактора росту 1 (ІФР-1), ЕФР. Результати дослідження показали, що кількість осіб з ФЕП шкіри була достовірно вищою в групі пацієнтів (відношення шансів (ВШ) = 7,067; р<0,01). Рівні ІФР-1 та ЕФР в сироватці крові достовірно не відрізнялися між групами. У підгрупах аналізів між пацієнтами з і без ФЕП не було виявлено різниці в сироватковому рівні інсуліну, ІФР-1 та ЕФР. Проте вищі рівні сироватки інсуліну й ЕФР спостерігалися в контрольних суб’єктів з ФЕП (p<0,01 і p<0,01 відповідно). Автори дійшли висновку про співіснування поліпів товстої кишки та ФЕП шкіри.
Цікаво, що рівні інсуліну й ІФР-1 можуть впливати на появу ФЕП шкіри в осіб, які не мають ЦД. Було проведене дослідження з включенням 40 пацієнтів з ФЕП шкіри, які не мали діабету, та 40 здорових волонтерів. Рівень інсуліну в осіб зі шкірними ФЕП був достовірно вищим порівняно з контролем (P=0,00), хоча рівень ІФР-1 достовірно не відрізнявся (P=0,43). Автори дійшли висновку, що збільшення рівня інсуліну в недіабетиків може впливати на розвиток ФЕП шкіри [66].
Інсулінорезистентність є переддіабетичним станом і часто спостерігається в людей з чорним акантозом та акрохордоном. У дослідження, проведене S.K. Singh і співавт. (2020) [104], були включені 70 пацієнтів з ФЕП шкіри та 70 здорових волонтерів. Інсулінорезистентність частіше спостерігалася в осіб з ФЕП (41,4 %) порівняно з контролем (17,1 %; р<0,01). Середнє значення індексу HOMA також було достовірно вищим у пацієнтів з ФЕП (4,32 ± 4,44) порівняно з контролем (2,27 ± 0,90) (p<0,05).
Цікаве дослідження було проведене в Ірландії. Автори поставили перед собою мету встановити зв’язок між наявністю шийних або пахвових ФЕП шкіри та підвищеним серцево-судинним ризиком в ірландських дорослих з ожирінням. Було проведене крос-секційне дослідження з включенням 164 пацієнтів з ІМТ≥40 або ≥35 з супутніми захворюваннями. Антропометричні та метаболічні характеристики порівнювалися з особами, які не мали ФЕП шкіри. Результати дослідження показали, що середній вік становив (53,7 ± 11,3) року (діапазон – 31,1-80). Шийні або пахвові ФЕП шкіри відмічалися у 85 пацієнтів. У групі з ФЕП шкіри були зареєстровані високі систолічний АТ ([138,0 ± 16,0] проти [125,1 ± 8,3] мм рт. ст.; p=0,003) та HbA1c ([46,5 ± 13,2] проти [36,8 ± 3,5] ммоль/моль; р=0,017). ФЕП шкіри спостерігалися в 94,6 % хворих на діабет порівняно з 79,4 % осіб без нього (p=0,039). Антигіпертензивну терапію застосовували в 45,8 % пацієнтів зі шкірними ФЕП порівняно з 13,3 % без них (р=0,018) [53].
Наявність ФЕП шкіри також може свідчити про порушення метаболізму печінкових ферментів і розвиток гіпертонії. E. Senel і співавт. (2011) провели дослідження з включенням 110 пацієнтів, які мали 2 або більше акрохордонів, і 110 контрольних осіб, співставних за віком і статтю [100]. У групі пацієнтів реєстрували локалізацію, розмір і загальну кількість акрохордонів. У пацієнтів і волонтерів вивчалися глюкоза в плазмі натще, рівень ліпідів у сироватці крові та рівень печінкових ферментів. Усі учасники пройшли стандартний 2-годинний пероральний тест на толерантність до глюкози з 75 г глюкози. ЦД і порушення переносності глюкози були діагностовані за критеріями Американської діабетичної асоціації. АТ крові вимірювали в двох групах. Результати дослідження показали, що в 56 пацієнтів основної групи та 10 – контрольної був діагностований явний діабет. У 13 % осіб основної групи та 9 % – контрольної було ідентифіковане порушення толерантності до глюкози. Середні рівні глюкози в плазмі натще, загального холестерину, холестерину ЛПНЩ, тригліцеридів, аспартатамінотрансферази, аланінамінотрансферази, гамма-глутамілтрансферази та лужної фосфатази в пацієнтів основної групи були достовірно вищими порівняно з контролем. Крім того, рівень ЛПВЩ в сироватці крові в них був меншим, ніж у контролі. У пацієнтів з акрохордонами спостерігався вищий систолічний і діастолічний АТ порівняно з контрольною групою. Автори дійшли висновку, що акрохордони можуть являти собою шкірну ознаку порушеного вуглеводного або ліпідного обміну, аномалій печінкових ферментів і гіпертонії.
Отже, такі зміни в метаболізмі ліпідів і глюкози безпосередньо впливають на формування ФЕП шкіри, в субстраті яких імунокомпетентні клітини та їхні рецептори реалізують проліферативні та запальні процеси.
1.3 Роль опасистих клітин, макрофагів при формуванні метаболічних порушень і фіброепітеліальних поліпів шкіри
Опасисті клітини є ефекторними факторами розвитку алергічних захворювань і багатьох імунних реакцій, що опосередковані імуноглобуліном Е. Ці клітини здійснюють свою фізіологічну та патологічну діяльність, вивільняючи гранули, що містять гістамін, цитокіни, хемокіни та протеази, включаючи специфічну для них хімазу та триптазу. Як макрофаги та Т-лімфоцити, опасисті клітини беруть участь у патогенезі хронічного запалення при серцево-судинних ускладненнях і порушення обміну речовин. Дані тваринних моделей довели пряму участь опасистих клітин в індукованому дієтою ожирінні та діабеті. Хоча механізми, за допомогою яких мастоцити беруть участь у цих метаболічних захворюваннях, до кінця не вивчені, була встановлена патобіологія цих клітин [44, 118].
Основні біомаркери опасистих клітин можуть впливати на розвиток МС. Z. Wang і співавт. [117] поставили перед собою мету визначити, чи є специфічні імунологічні біомаркери опасистих клітин (імуноглобулін E, хімаза та триптаза) незалежним фактором ризику МС. У цьому дослідженні взяли участь 340 осіб. 82 (24,1 %) пацієнта страждали на ЦД, 31 (9,1 %) – МС (без ЦД), 110 – МС і ЦД. Після коригування за допомогою багатоваріантності (вік, стать, паління та сімейний анамнез щодо гіпертонії) порівняно з ЦД чи групою МС (референтна) рівень високочутливого С-реактивного білка (СРБ) асоціювався з ЦД (ВШ=2,29; довірчий інтервал (ДІ) 1,15-4,57; р=0,019) і МС + ЦД (ВШ = 2,20; ДІ 1,05-4,61; р=0,036), імуноглобулін E – з МС + ЦД (ВШ = 2,38; ДІ 1,13-5,02; р=0,023). Після коригування з використанням багатоваріантності порівняно з референтною групою більшість комбінованих підвищених запальних або імунологічних біомаркерів були суттєво асоційованими з ЦД або МС з чи без ЦД.
Отже, активація та запалення з залученням опасистих клітин є важливими при ожирінні та діабеті. Z. Wang і співавт. (2011) [116] провели дослідження з включенням 340 суб’єктів віком від 55 до 75 років. Тест Крускала-Уолліса продемонстрував значні відмінності рівнів імуноглобуліну E в плазмі (p=0,008) серед груп з різним статусом толерантності до глюкози. Лінійний регресійний аналіз виявив значну кореляцію між рівнями хімази в плазмі (p=0,030) або імуноглобуліну E (p=0,022) та ЦД. Звичайний логістичний регресійний аналіз показав, що імуноглобулін E є важливим фактором ризику переддіабету та ЦД (ВШ=1,667; p=0,034). Після адаптації до загальних факторів ризику ЦД, включаючи вік, стать, гіпертонію, ІМТ, холестерин, індекс HOMA, високочутливий СРБ, хімазу та триптазу опасистих клітин, імуноглобулін E залишався достовірним фактором ризику (ВШ=1,866; p=0,015). Логістичний аналіз показав, що взаємодія між високочутливим С-реактивним протеїном та імуноглобуліном E або між імуноглобуліном E та хімазою ще сильніше збільшує ризики розвитку переддіабету та ЦД ([ВШ=2,204; р=0,044; ВШ=2,447; р=0,033] та [ВШ=2,225; р=0,040; ВШ=2,559; р=0,026]). Дослідники зробили висновок, що взаємодія імуноглобуліну E з високочутливим С-реактивним протеїном або хімазою додатково підвищує ризик переддіабету та ЦД.
Автори ще однієї роботи довели, що опасисті клітини в підшкірній жировій клітковині пацієнтів з МС без діабету та з атеросклеротичними серцево-судинними захворюваннями сприяють розвитку резистентності до інсуліну та запалення. У дослідження були включені 19 хворих на з МС і 15 осіб групи контролю. Біопсія шкіри з подальшим імуногістохімічним дослідженням була проведена для всіх суб’єктів. Результати дослідження показали, що чисельність опасистих клітин у підшкірній жировій клітковині в пацієнтів з МС була в 2,5 рази вищою (p<0,0001) порівняно з контролем. Опасисті клітини позитивно корелювали з окружністю талії, глюкозою, тригліцеридами, індексом HOMA, резистентністю до інсуліну, лептином, інтерлейкіном-1β, 6, хемерином, активністю мітоген-активованої протеїнкінази та ядерного фактора κB у циркулюючих моноцитах. Вони також значно корелювали з маркерами фіброзу й ангіогенезу. Рівень триптази опасистих клітин також був збільшеним і мав аналогічні кореляційні зв’язки [62].
Дуже цікаве експериментальне дослідження будо проведене для вивчення вмісту опасистих клітин в острівцях Лангерганса при ЦД2. Були вивчені 40 щурів із ЦД2 та 40 у контрольній групі. Результати дослідження показали, що кількість опасистих клітин в острівцях Лангерганса у тварин з діабетом була достовірно вищою (p<0,05) порівняно з контролем. Водночас спостерігалася негативна кореляція вмісту опасистих клітин з β-клітинною проліферацією та частотою неогенезу при діабеті. Це підкреслювало потенційний зв’язок між збільшеною кількістю опасистих клітин і зменшенням маси острівців Лангерганса [30].
A. Divoux і співавт. (2012) [48] поставили перед собою мету вивчити опасисті клітини в білій жировій тканині пацієнтів з ожирінням та наявністю або відсутністю ЦД2. Результати дослідження показали, що опасисті клітини активуються в жировій тканині людини та переважно локалізуються у фіброзних відкладеннях, що стимулює їхній запальний стан. Опасисті клітини з позитивною триптазою та хімазою зазвичай розташовуються вище, в жировій тканині сальника. Також були виявлені позитивні зв’язки між кількістю опасистих клітин і параметрами ожиріння, включаючи фіброз, накопичення макрофагів і запалення ендотеліальних клітин.
A. He та G.P. She (2013) [63] припустили, що інгібування хімаз і триптаз опасистих клітин може принести користь пацієнтам, які страждають на серцево-судинні й обмінні захворювання.
Миші лінії KitW-sh/W-sh мають дефіцит опасистих клітин. При харчуванні таких тварин за дієтою, багатою на холестерин, знижуються ожиріння та діабет, що підтверджує роль цих клітин у патогенезі обмінних процесів [119].
Метформін – це протидіабетичний препарат, що також має протизапальні властивості та може впливати на активність опасистих клітин. Показано, що метформін у відносно низьких дозах пригнічує опосередковану FcεR1 дегрануляцію, секрецію інтерлейкіну 13, фактор некрозу пухлин α (ФНП-α) та сфінгозин-1-фосфат в опасистих клітинах. Ці результати в сукупності свідчать про потенційну корисність метформіну в лікуванні алергічних захворювань, особливо у випадках з коморбідним ЦД2 [115].
Рівень експресії опасистих клітин у шкірі може впливати на розвиток ФЕП. O.S. El Safoury та співавт. (2009) [51] провели кількісну оцінку опасистих клітин і колагенових волокон у ФЕП і здоровій шкірі діабетиків і недіабетиків. Метою дослідження став пошук можливої кореляції між опасистими клітинами та колагеновими волокнами в патогенезі ФЕП. У роботі взяли участь 30 пацієнтів з ФЕП шкіри: 15 діабетиків і 15 недіабетиків. З однієї анатомічної ділянки були отримані три біопсії: великий ФЕП, невеликий ФЕП і сусідня нормальна шкіра. Опасисті клітини були пофарбовані за Бісмарком і підраховувалися вручну в 10-ти різних полях кожної секції зі збільшенням ×1000, а середній підрахунок співвідносився з відсотком середньої площі колагену в 5-ти полях, виконаних аналізатором зображення. Результати дослідження показали, що в обох досліджуваних групах була виявлена статистично значуща кореляція між кількістю опасистих клітин і відсотком середньої площі колагену (за винятком великих ФЕП недіабетичної групи). Автори дійшли висновку про існування позитивної кореляції між кількістю опасистих клітин і відсотком середньої площі колагену.
Ще в одному дослідженні з залученням 30 пацієнтів з ФЕП шкіри та 10 здорових волонтерів, співставних за віком і статтю, вивчалася роль опасистих клітин у патогенезі цього захворювання. Результати показали достовірну різницю між хворими на ФЕП шкіри та контрольною групою щодо щільності опасистих клітин, що була оцінена за допомогою фарбування толуїдиновим синім (p=0,003), експресії триптази (p=0,001). Показник був вищим у групі ФЕП. Концентрація опасистих клітин була достовірно більшою у ФЕП, що були розташовані на ділянках, відмінних від голови та шиї (р=0,028). Висока експресія триптази опасистих клітин була достовірно пов’язана з вираженим колагенозом (р=0,02) та наявністю еозинофілів (р=0,04) [31].
Опасисті клітини у ФЕП шкіри особливо активні при ЦД й ожирінні. Триптаза є медіатором опасистих клітин і потужним фактором росту фібробластів. Можливо, існує молекулярний зв’язок між активацією опасистих клітин і фіброзом. S.A. Salem і співавт. (2013) [96] поставили перед собою мету оцінити клінічні та лабораторні результати в пацієнтів з ФЕП шкіри, можливий зв’язок між ожирінням, дисліпідемією та вираженою експресією опасистих клітин/триптази в зонах ураження. У дослідження були включені 20 хворих на ФЕП шкіри. У всіх пацієнтів були виявлені аномально високий ІМТ та гіпертригліцеридемія з патологічними ультразвуковими ознаками жирового гепатозу в 15 осіб (75 %). Кількість ФЕП позитивно корелювала з віком пацієнтів. У ФЕП порівняно з контрольною шкірою спостерігалися достовірно вищі концентрація опасистих клітин та експресія триптази (P<0,001). У пацієнтів з ожирінням відмічалася достовірно більша концентрація опасистих клітин порівняно з особами з надмірною вагою, існувала позитивна кореляція між кількістю цих клітин і концентрацією тригліцеридів.
Макрофаги є важливими клітинами вродженої імунної системи, їх вивчення має велике значення для більшого розуміння при багатьох захворюваннях шкіри [57].
Під час загоєння шкірних ран макрофаги піддаються регульованій поляризації. Результати деяких досліджень in vivo вказують, що фенотип макрофагів змінюється під час загоєння з більш прозапального (М1) профілю на ранніх стадіях після травми до менш запального або протизапального (М2) фенотипу в пізніх фазах [70].
Фенотипи макрофагів і фактори росту, пов’язані з регенерацією шкіри, також були вивчені для оцінки основних механізмів залучення макрофагів до регенерації шкіри. Результати досліджень на щурах показали, що під час розширення шкіри відбувається перехід від M1- до M2-домінантної відповіді. Після виснаження макрофагів регенерація шкіри гальмувалася, про що свідчили менша площа розширення, тонші шкірні шари та зниження швидкості проліферації клітин, синтез колагену та васкуляризація шкіри. Секреція ЕФР, факторів росту фібробластів і судинного ендотелію при виснаженні макрофагів зменшувалася [47].
Загоєння шкірних ран – це складна проблема, особливо в пацієнтів, які старіють або страждають на діабет. L. Qing і співавт. (2019) [89] поставили мету дослідити вплив метформіну на загоєння ран і вивчити основні молекулярні механізми дії цього препарату. Він призначався місцево в моделях дефектів шкіри в щурів. Результати показали, що метформін покращив загоєння ран та ангіогенез шляхом поляризації макрофагів до фенотипу М2. Також було виявлено, що рівень білків запалення кріопірину після лікування цим препаратом помітно знизився. Крім того, блокування 5’аденозинмонофосфат-активованої протеїнкінази та активація mTOR скасовували ефекти від терапії метформіном. Авторами було висловлене припущення, що вплив лікування цим препаратом на загоєння ран здійснювався через регулювання сигналізації 5’аденозинмонофосфат-активована протеїнкіназа/mTOR/кріопірин.
M. Foks і співавт. (2019) [56] вивчили 46 випадків меланоми, розділених на чотири групи за шкалою Бреслоу. Дослідження виявило збільшення кількості CD68- і CD163-позитивних макрофагів на послідовних стадіях шкали Бреслоу, але статистично значущі відмінності спостерігалися лише між I та IV групами для CD68-, між I та III, IV групами для CD163-позитивних макрофагів. Середня кількість мікросудин у групах II, III, IV значно збільшилася порівняно з групою I. Кореляційне дослідження показало значні позитивні кореляції між середніми кількостями CD68- і CD163-позитивних макрофагів та щільністю мікросудин. Ба більше, кількість CD163-позитивних макрофагів, навпаки, була пов’язаною з часом виживання пацієнта. Результати цього дослідження можуть свідчити про те, що вища інфільтрація макрофагів, особливо CD163-позитивних клітин, зв’язана з більш розвиненими меланомами, щільністю мікросудин і гіршим прогнозом для хворого.
Велика кількість макрофагів, пов’язаних з пухлиною, та близькість цих імунних клітин до CD30-позитивних можуть свідчити про те, що асоційовані з пухлиною макрофаги мають прямий вплив на онкогенез [46].
1.4 Вплив молекул циклооксигенази-2, мішені рапаміцину ссавців і васкулоендотеліальний фактор росту при хронічному запаленні, що асоційоване з метаболічними розладами й онкогенезом
Ожиріння й інсулінорезистентність – це два основних фактори ризику розвитку МС, ЦД2 та супутніх серцево-судинних захворювань. Циклооксигеназа (ЦОГ) – фермент, що обмежує швидкість – відповідальна за біосинтез простагландинів та існує в двох ізоформах: ЦОГ-1 (конститутивна форма) та ЦОГ-2 (насамперед індукована форма). ЦОГ-2 є ключовим ферментом в ейкозаноїдних обмінах, що перетворює ейкозаноїди в низку простагландинів, включаючи PGD2, PGE2, PGF2α та простациклін (PGI2), всі вони мають різноманітні гормоноподібні ефекти за допомогою аутокринних або паракринових механізмів. Зафіксовано, що ген ЦОГ-2 й імунореактивні білки мають високу експресію в жировій тканині. Виявлено, що експресія печінкової ЦОГ-2 захищає від індукованого дієтою стеатозу, ожиріння та резистентності до інсуліну. Проте активація ЦОГ-2 в жировій тканині сильно корелює з розвитком запалення, інсулінорезистентності та жирового гепатозу [42].
ЦОГ-2 та її метаболічний продукт простагландин Е2 індукуються у відповідь на стимуляцію факторами росту, цитокінами запалення, промоторами пухлин, активованими онкогенами в шкірі в результаті дії ультрафіолетового випромінювання. Активація ЦОГ-2/простагландин Е2 шляху може призводити до онкогенезу, включаючи розвиток плоскоклітинного раку шкіри й актинічного кератозу. Нестероїдні протизапальні препарати мають протизапальну, знеболюючу та жарознижувальну дію шляхом зворотного або незворотного ацетилювання ізоформ ЦОГ, інгібуючи простагландини в нижній точці активації, можуть відігравати хіміопрофілактичну роль при злоякісних захворюваннях, включаючи рак шкіри. Показано, що місцеве лікування уражень актинічного кератозу 3 % маззю диклофенака натрію в поєднанні з 2,5 % гіалуроновою кислотою виявляється ефективним та добре переноситься, хоча механізм дії залишається не до кінця відомим [110].
ЦОГ-2 асоціюється з ініціацією та прогресуванням пухлини в багатьох типах раку. Останні дослідження надають дані, що демонструють роль ЦОГ-2 в шкірних і стравохідних злоякісних новоутвореннях, особливо в плоскоклітинних карциномах, що виникають при обох захворюваннях [80].
Ультрафіолет індукує пошкодження ДНК та може викликати мутації p53, причому при хронічній експозиції призводить до конститутивної регуляції експресії ЦОГ-2 та збільшення вироблення її первинного продукту в шкірі – простагландину Е2. Опромінення ультрафіолетом спричиняє незалежну від ліганду активацію рецептора ЕФР, подальшу активацію мітоген-активованої протеїнкінази та шляхів фосфатиділінінозитолу 3-кінази/Akt, що призводить до транскрипційної активації гена ЦОГ-2. Інгібування активності ЦОГ-2 або зменшення експресії в нокаутних мишей за ЦОГ-2 призводило до значно зниженого ультрафіолет-індукованого пухлинного генезу, водночас надмірна експресія ЦОГ-2 в трансгенних мишей посилювала розвиток пухлини, викликаної ультрафіолетом. Ці дослідження продемонстрували вирішальну роль ЦОГ-2 в розвитку ультрафіолет-індукованого немеланомоцитарного раку шкіри [94].
У шкірі людини, на відміну від мишей, експресуються дві форми ЦОГ – ЦОГ-1 і ЦОГ2. Це було продемонстровано за допомогою імуногістохімії, а також вестерн-блоттінгом білкових екстрактів з культивованих кератиноцитів людини [77].
Експресія ЦОГ-1 спостерігається в усьому епідермісі, водночас ЦОГ-2 помітніша в його диференційованих шарах [39]. Підвищена експресія ЦОГ-2 присутня в біопсіях плоскоклітинних карцином, що походять від більш диференційованих кератиноцитів. На відміну від цього, низька експресія ЦОГ-2 спостерігається в базальноклітинних карциномах, що беруть початок від найменш диференційованих базальних клітин [82].
Декілька років тому був проведений метааналіз для оцінки зв’язку між експресією ЦОГ-2 та раком шкіри. До нього були включені десять досліджень. Дані без значної статистичної неоднорідності були об’єднані за допомогою моделі фіксованого ефекту. Поєднані результати показали тісну кореляцію між експресією ЦОГ-2 та раком шкіри (ВШ=25,00; 95 % ДІ 13,40-46,64; р<0,05). Аналіз підгруп також вказав, що експресія ЦОГ-2 значно корелювала з плоскоклітинним (ВШ=31,95; 95 % ДІ 15,08-67,72; р<0,05) і базальноклітинним (ВШ=14,69; 95 % ДІ 4,80-44,94; p<0,05) раком. Автори дійшли висновку, що експресія ЦОГ-2 тісно пов’язана з ризиком розвитку раку шкіри [103].
M. Amirnia та співавт. (2014) [36] поставили мету дослідити відсоток позитивної експресії ЦОГ-2 в пухлинах шкіри, включаючи попередньо злоякісні та злоякісні пухлини. Було проведене аналітичне крос-секційне дослідження, що включало 62 зразки пухлин шкіри, серед яких 49 були злоякісними, 13 – передзлоякісними. Після вивчення для визначення патологічного виду пухлин зразки проходили імуногістохімічне дослідження на експресію ЦОГ-2. Його результати показали, що серед шкірних пухлин значна кількість експресії ЦОГ-2 була виявлена в плоскоклітинних (16 з 17; 94 %) та базальноклітинних (28 з 32; 87,5 %) карциномах, хворобі Боуена (8 з 9; 89 %), актинічному кератозі (4 з 4; 100 %).
Підвищена експресія ЦОГ-2 в різних клітинах шкіри може впливати на процеси старіння. P. Surowiak і співавт. (2014) [107] поставили мету дослідити фотостаріння шкіри як наслідок підвищеної експресії ЦОГ-2. Імуногістохімічний аналіз активності ЦОГ-2 був проведений на зразках 52 жінок, які перенесли операцію з інших причин, ніж патологія шкіри. Результати дослідження показали, що експресія ЦОГ-2 в кератиноцитах і фібробластах у зразках шкіри, уражених фотостарінням, була значно вищою, ніж у зразках, порушених ендогенним старінням або отриманих від молодих людей. Отже, ЦОГ-2 може бути залученою до патогенезу процесу фотостаріння. Пригнічення експресії або активності ферменту може знайти застосування в лікуванні фотостаріння шкіри та/або профілактиці.
Отже, активність ЦОГ-2 може бути причинним фактором старіння. Та чи можуть інгібітори ЦОГ-2 запобігти цьому. M.E. Lee та співавт. (2012) [76] вивчали вплив інгібіторів ЦОГ-2 на старіння на моделі шкіри безволосих мишей. Результати дослідження показали, що серед двох досліджуваних селективних інгібіторів ЦОГ-2 й одного неселективного інгібітора ЦОГ лише NS-398 гальмував старіння шкіри, а целекоксиб та аспірин його прискорювали. Крім того, NS-398 знижував експресію p53 та p16, водночас целекоксиб та аспірин посилювали їхню експресію. Також було виявлено, що інгібітори, що модулюють старіння, тісно пов’язані з експресією проколагену I-го типу та кавеоліну-1. Отримані результати свідчать про те, що протизапальна каталітична активність ЦОГ-2 не є причинним фактором для старіння, щонайменше на шкірі, та що інгібітори ЦОГ-2 можуть модулювати старіння шкіри, регулюючи експресію проколагену I-го типу та кавеоліну 1.
L. Kuzbicki та співавт. (2016) [75] вивчали експресію ЦОГ-2 в шкірі та 85 зразках первинної меланоми, 36 – метастазів у лімфатичні вузли, 5 – шкірних метастазів, включаючи 39 випадків парних первинних і метастатичних уражень, отриманих від одного пацієнта. Посилена експресія ЦОГ-2 при первинних меланомах є показником поганого прогнозу. Була виявлена достовірна кореляція між високою експресією ЦОГ-2 при первинних ураженнях і коротшою виживаністю. Посилення експресії ЦОГ-2 також позитивно корелювало з іншими прогностичними факторами, як-от товщина пухлини та рівень інфільтрації, виразка, високий мітотичний індекс, більш інвазивний гістологічний тип, вертикальна фаза росту та метастази в лімфатичні вузли. Загалом результати говорять про те, що внутрішньопухлинна експресія ЦОГ-2 є сильним негативним прогностичним маркером для пацієнтів з меланомою. Крім того, ця робота показала, що для отримання прогностичної інформації достатньо простого й об’єктивного імуногістохімічного алгоритму оцінювання, що включає визначення лише відсоткової частки позитивно забарвлених клітин.
Гіперекспресія рецептора ЕФР може бути результатом метаболічних порушень, а не ознакою наявності злоякісного новоутворення. В одному з досліджень було показано, що в пацієнтів із себорейною кератомою та ЦД2 ця гіперекспресія обумовлена генетично детермінованою інсулінорезистентністю, при якій порушення регуляції передачі сигналу інсуліну в клітину призводить до зміни синтезу та сигнальних шляхів інших ростових факторів, що регулюють проліферацію та ріст клітин [28].
mTOR – це серин-треонін протеїнова кіназа, що бере участь у внутрішньоклітинному обміні речовин і регулює енергетичний стан. Порушення сигналізації mTOR може сприяти розвитку ЦД2 або інсулінорезистентності [78, 114].
Інгібітори mTOR – це імуносупресори, що наразі часто використовуються як протипухлинна терапія при різних ракових захворюваннях. Вони діють на сигнальний шлях mTOR, що відіграє ключову роль у регуляції росту клітин, а також в обміні ліпідів і глюкози. Лікування інгібіторами mTOR пов’язане з високою захворюваністю на гіперглікемію та діабет, коливаючись від 13 % до 50 % у клінічних випробуваннях, в яких вони використовувалися як протиракові препарати. Швидкість вираженої гіперглікемії також збільшується та становить від 4 до 12 % в основних клінічних випробуваннях III фази. Внаслідок обмежених досліджень на людях патофізіологія гіперглікемії, викликаної інгібіторами mTOR, ще не була повністю з’ясована. Проте дані досліджень на тваринах свідчать, що механізми, відповідальні за гіперглікемію з інгібіторами mTOR, ймовірно, пов’язані з поєднанням порушеної секреції інсуліну та резистентності до нього. Через високу частоту гіперглікемії, зв’язаної з застосуванням інгібіторів mTOR, рекомендується ретельне та персональне спостереження за рівнем глюкози в крові для всіх пацієнтів [114].
Отже, аналізуючи літературні дані, отримуємо актуальні питання, вирішення яких має важливе практичне значення.
З одного боку, МС і ЦД є факторами високого ризику розвитку ФЕП шкіри в асоціації з дисліпідемією й інсулінорезистентністю, з іншого, – підвищена активність опасистих клітин, макрофагів, ЦОГ-2, ЕФР та mTOR реалізує локальні механізми формування поліпів.
Навіть з урахуванням накопичення великої кількості теоретичних даних, на сьогодні в арсеналі дерматолога відсутній діагностичний алгоритм прогнозування ризику рецидивування ФЕП шкіри. Немає інформації про медикаментозну профілактику, можливу корекцію дисліпідемії та метаболізму глюкози з урахуванням формування ФЕП шкіри.
Саме вирішенню цих завдань і присвячена дана дисертаційна робота.
Основні результати даного розділу висвітлено в наступній публікації:
- Кочет КА, Литус ИА, Свистунов ИВ, Сулаева ОН. Патология кожи при сахарном диабете: клинико-патогенетические корреляции (обзор). Georgian Med News. 2017 Dec;(273):41-6 [6].
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕНЬ
2.1 Дизайн дослідження, характеристика груп досліджень
У дослідження були включені 133 пацієнти, які мали більше трьох рецидивуючих ФЕП шкіри [65].
Діагноз ФЕП шкіри (папілома, папілома фіброепітеліальна, фібропапілома, м’яка фіброма, акрохордон) встановлювався відповідно до Міжнародної класифікації хвороб десятого перегляду (D23.9).
Критерії включення в дослідження:
- Наявність підписаної інформованої згоди.
- Дорослі чоловіки та жінки від 18 до 65 років.
- Документально встановлений діагноз ФЕП шкіри.
- Більше трьох рецидивуючих ФЕП шкіри за останні 2 роки.
Критерії виключення:
- Вагітні жінки, жінки, які годують грудьми.
- Гострі інфекційні захворювання за 1 місяць до початку дослідження.
- Непереносність або протипоказання при використанні симвастатину, метформіну та піоглітазону.
- Наявність важких і нестабільних кардіологічних, пульмонологічних, гастроентерологічних, ниркових, ендокринних та онкологічних захворювань.
Дисертаційна робота складалася із семи основних етапів.
1 етап включав вивчення основних характеристик ФЕП шкіри та клініко-анамнестичних даних пацієнтів.
2 етап включав проведення дослідження “випадок-контроль” для ідентифікації зв’язку ФЕП шкіри з супутніми захворюваннями та клініко-лабораторними показниками з залученням 129 волонтерів, які склали контрольну групу. До неї увійшли особи без ФЕП шкіри, які за віком і статтю достовірно не відрізнялися від дослідної групи.
3 етап включав порівняння клінічних, лабораторних показників залежно від розподілу пацієнтів на групи з МС, ЦД2 та категорію осіб без цих захворювань. У результаті такого аналізу дослідна група була поділена на 3 групи: до 1-ї увійшли 62 пацієнти без МС та ЦД2; 2-ї – 49 з МС без ЦД2; 3-ї – 22 з ЦД2.
4 етап охоплював вивчення гістологічної будови, оцінку експресії триптазопозитивних опасистих клітин, ЦОГ-2, VEGF, mTOR у межах ФЕП шкіри.
На 5 етапі були проведені кореляційний і лінійний множинний регресійний аналізи для прогнозування рецидивів ФЕП шкіри.
6 етап включав проведення пілотного, відкритого, рандомізованого дослідження в паралельних групах “Вплив симвастатину на частоту рецидивів ФЕП у пацієнтів з МС” із залученням 45 осіб з МС.
7 етап включав проведення пілотного, відкритого, рандомізованого дослідження “Порівняння впливу двох комбінацій препаратів (метформін/симвастатин проти піоглітазон/симвастатин) на частоту рецидивів ФЕП шкіри в пацієнтів із ЦД2” з залученням 22 осіб із ЦД2.
Усі пацієнти та волонтери отримали та підписали добровільну інформовану згоду на участь у дослідженні. На проведення дисертаційного дослідження був отриманий дозвіл комісії з біоетики Національної медичної академії післядипломної освіти імені П.Л. Шупика.
2.2 Діагностика метаболічного синдрому та цукрового діабету 2-го типу
У проведеній роботі для діагностики МС використовували критерії Міжнародної діабетичної федерації. ЦД2 діагностували з застосуванням критеріїв відповідно до наказу Міністерства охорони здоров’я № 1118 від 21.12.2012 р. “Уніфікований клінічний протокол первинної та вторинної (спеціалізованої) медичної допомоги “Цукровий діабет 2 типу”. [27]
Критерії МС, рекомендовані Міжнародною діабетичною федерацією, наступні:
- наявність ожиріння центрального типу, що визначається як окружність талії (см) з урахуванням специфіки для різних етнічних груп:
- в європейців – ≥94 см у чоловіків, ≥80 см у жінок;
- наявність будь-яких двох факторів з чотирьох нижчеперелічених:
- підвищений рівень тригліцеридів (>1,7 ммоль/л [150 мг/дл]) або проведення специфічної гіполіпідемічної терапії;
- знижений рівень холестерину ЛПВЩ (<1,03 ммоль/л (40 мг/дл) у чоловіків і <1,29 ммоль/л (50 мг/дл) у жінок) або наявність специфічної терапії з приводу дисліпідемії;
- артеріальна гіпертензія (рівень систолічного АТ >130 мм рт. ст. або рівень діастолічного АТ >85 мм рт. ст.) або проведення гіпотензивної терапії з приводу раніше діагностованої артеріальної гіпертензії;
- підвищений рівень глюкози в плазмі крові натще >5,6 ммоль/л (100 мг/дл) або раніше діагностований ЦД2. При значенні показника >5,6 ммоль/л або 100 мг/дл наполегливо рекомендується проведення перорального глюкозотолерантного тесту, проте це не є необхідним для визначення наявності синдрому [35].
2.3 Методи електрокоагуляції фіброепітеліальних поліпів шкіри
Лікування ФЕП шкіри проводилося методом електрокоаглуяції [25]. Перед початком процедури місце планованого втручання оброблялося спиртовим розчином. Потім інсуліновим шприцом під ніжку ФЕП вводився розчин анестетика (Ультракаїн Д-С). Після того, як анестетик подіяв, проводилося видалення ФЕП методом електрокоагуляції за допомогою електрокоагулятора “НАЗВА”. Високочастотний електричний струм, що створює коагулятор, викликав об’ємне термічне ураження тканини навколо місця впливу. Місце видалення обробляли аніліновим барвником. Матеріал поміщався в розчин формаліну та направлявся в лабораторію для патоморфологічного дослідження.
2.4 Біохімічні дослідження
Стан ліпідного обміну оцінювали за наступними показниками: рівні холестерину (ммоль/л), тригліцеридів (ммоль/л), ЛПВЩ (ммоль/л), ЛПНЩ (ммоль/л), ЛПДНЩ (ммоль/л) і діабетичної панелі (глюкоза в крові, (ммоль/л), глікозильований гемоглобін (%), інсулін (mIU/ml), С-пептид (нг/мл), індекс HOMA-IR (%), лептин (нг/мл) у сироватці крові за допомогою діагностичних наборів на аналізаторі Beckman Coulter AU480 в медичній лабораторії «МедЛаб», м. Київ [32].
2.5 Гістологічні та імуногістохімічні дослідження фіброепітеліальних поліпів
Морфологічні дослідження проводились в патоморфологічній лабораторії “CSD Health Care”, м. Київ.
Для мікроскопічного, імуногістохімічного та морфометричного досліджень видалені ФЕП використовувалися в повному обсязі.
Отриманий біоматеріал фіксували в 10 % розчині забуференого нейтрального формаліну. Проводку біоматеріалу (дегідратацію та просочування парафіном) здійснювали в автоматизованих гістопроцесорах (Milestone LOGOS Microwave Hybrid Tissue Processor, Milestone, Італія). Після цього виконували заливку матеріалу в парафін з виготовленням парафінових блоків на станціях заливки та виготовлення парафінових блоків Thermo Scientifiс HistoStar (Thermo Fisher Scientifiс, США) [41].
Гістологічні зрізи товщиною 4 мкм виготовляли на напівавтоматизованому ротаційному мікротомі Thermo Scientific HM 340E.
Препарати забарвлювали гематоксиліном та еозином з використанням автоматизованого коверстейнера Dako CoverStainer (Agilent, США).
При мікроскопічному дослідженні матеріалу використовували мікроскоп NIKON ECLIPSE E200 (NIKON CORPORATION, Японія) з окуляром x10, об’єктив x4, x10, x20 і x40. Аналіз зображень проводили у програмі Digital Slide Viewer Applications CaseViever 2.1 for Windows (3DHISTECH, Угорщина). Для аналізу та інтерпретації даних проводили фотофіксацію 5 полів зору в межах кожного гістологічного препарату при збільшенні 200. Аналіз зображень з оцінкою кількості клітин проводили з використанням програми ImageJ (https://imagej.nih.gov/ij/) з підрахуванням кількості клітин на 1 мм2.
Імуногістохімічні дослідження виконували в парафінових зрізах з використанням моноклональних антитіл [73]. Після депарафінізації та регідратації зрізів проводили високотемпературне демаскування антигенів нагріванням на водяній бані в Трис-ЕДТА (рН=9,0) буфері, пригнічували активність ендогенної пероксидази 3 % розчином перекису водню та наносили блокуючу сироватку. Інкубацію з первинними антитілами здійснювали відповідно до інструкцій фірм-виробників, візуалізацію імуногістохімічної реакції виконували з використанням системи детекції DAKO EnVisionи + System з діамінобензидином (“DAKO”, США). Зрізи дозабарвлювали гематоксиліном Майєра та заключали в канадський бальзам.
У роботі було проведене імуногістохімічне дослідження з використанням моноклональних антитіл до наступних клітинно-специфічних маркерів:
- CD163 (біомаркер М2-макрофагів);
- MCT (триптаза опасистих клітин).
Крім того, для вивчення механізмів морфогенезу ФЕП за умов метаболічних зрушень була здійснена оцінка експресії регуляторних молекул, включаючи VEGF, ЦОГ-2 та mTOR.
Перелік маркерів, антитіл, що були використані для оцінки їхньої експресії, та біологічна значущість представлені в табл. 2.1.
Таблиця 2.1 – Імуногістохімічні біомаркери
| Біомаркери | Використаний клон |
| VEGF | DAKO, клон VG1 |
| ЦОГ-2 | DAKO, клон CX-294 |
| Біомаркери | Використаний клон |
| CD163 | Cell Marque, клон MRQ-26 |
| mTOR | Abcam, клон EPR426(2) |
| MCT | Diagnostic Biosystems, clone AA1 |
Оцінка експресії біомаркерів. При аналізі опасистих клітин і М2-макрофагів проводили оцінку абсолютної кількості імунопозитивних клітин у межах ФЕП на 1 мм2. Водночас підрахунок кількості клітин виконували з урахуванням їх просторового розподілу. Враховуючи, що основною зоною ремоделювання шкіри при морфогенезі ФЕП є ділянка епідермо-дермальної взаємодії, обрахунок кількості опасистих клітин і М2-макрофагів проводили саме в цьому компартменті – в сосочковому шарі дерми та навколо судин поверхневого судинного сплетіння.
При імуногістохімічному дослідженні з використанням антитіл до mTOR, VEGF і ЦОГ-2 оцінку експресії здійснювали окремо в епідермісі та дермі.
При визначенні експресії маркерів у епідермісі використовували шкалу виразності експресії (total score) на основі оцінювання інтенсивності забарвлення та його розповсюдження. Інтенсивність імуногістохімічного забарвлення оцінювали напівкількісним методом як слабку (1+), помірну (2+) або виражену (3+).
Просторове розповсюдження експресії mTOR, VEGF і ЦОГ-2 в епідермісі визначали напівкількісним методом на основі встановлення відсотка позитивних клітин наступним чином:
- 0 % = негативне;
- 1-25 % = 1+;
- 26-50 % = 2+;
- 50 % = 3+.
Загальну вираженість експресії mTOR, VEGF і ЦОГ-2 в епідермісі розраховували як інтенсивність, помножену на розповсюдженість експресії, та визначали як низьку (при кількості балів <6) або високу (>6).
У межах дерми враховували інтенсивність імуногістохімічного забарвлення та кількість імунопозитивних клітин (чисельність розраховували на 1 мм2).
2.6 Методи статистичного аналізу
Застосовувалися методи статистичного аналізу [2]. Статистична обробка даних проводилася за допомогою ліцензійної програми “IBM SPSS Statistics version 24”. Критерій Колмогорова-Смірнова використовувався для перевірки даних варіаційного ряду на нормальність. Порівняння середніх двох вибірок здійснювалося з застосуванням критерію Стьюдента. При непараметричних даних використовувався критерій Манна-Уїтні. Множинні порівняння проводилися з застосуванням методу Краскола-Уоліса (Dwass-Steel-Chritchlow-Fligner) та ANOVA. У таблицях спряженості використовували критерій χ2. Кореляційний аналіз проводився з застосуванням коефіцієнта Пірсона. Регресійний аналіз виконувався за наступною формулою:
Y=-0,264+2,049*X1+0,061*X2+0,025*X3,
де Y – середня кількість рецидивів ФЕП шкіри за останні 2 роки;
Х1 – рівень ЛПДНЩ;
Х2 – індекс НОМА-IR;
Х3 – кількість МСТ-позитивних клітин.
3 КЛІНІКО-ЛАБОРАТОРНА ХАРАКТЕРИСТИКА ДОСЛІДЖУВАНИХ ГРУП
3.1 Характеристика фіброепітеліальних поліпів шкіри, клініко-анамнестичні дані
У рамках проведеної роботи були досліджені 133 пацієнти з ФЕП шкіри (65 жінок і 68 чоловіків). Середній вік хворих склав (45,93 ± 11,94) року.
Основними скаргами були наступні: болісність, що відмічалася в 42 (32 %) осіб, свербіж – 66 (50 %), печія – 26 (20 %), набряк – 16 (12 %), наявність виразки – 8 (6 %).
Давність появи першого поліпа в середньому складала (26,8 ± 4,5) місяця, причому поява ФЕП у 60 (45 %) пацієнтів була одночасною, 73 (55 %) – поступовою. 82 (62 %) особи відмічали збільшення поліпів за останні 3 місяці.
Кількість рецидивів за останні 2 роки коливалася в діапазоні від 2 до 9 з середнім значенням 3,77 ± 2,09.
При зборі анамнезу захворювання були виявлені основні причини, з якими пацієнт пов’язував появу ФЕП шкіри. Результати аналізу представлені в табл. 3.1.
Як видно з отриманих даних, основними причинами появи ФЕП шкіри були наступні: стрес (59 %), ГХ (49 %), потертість шкіри (49 %), МС (34 %), збільшення маси тіла (34 %). У 30 % випадків пацієнти не змогли ідентифікувати причину.
Також був проаналізований анамнез щодо наявності інших захворювань шкіри (табл. 3.2).
Основними супутніми захворюваннями шкіри за даними анамнезу були себорейний та актинічний кератози, невуси. У 38 % випадків захворювання шкіри були відсутніми.
Таблиця 3.1 – Причини появи ФЕП шкіри за даними анамнестичного аналізу
| Причина появи ФЕП шкіри | n | % |
| Невідома | 40 | 30 |
| Підвищена вологість | 30 | 23 |
| Потертість | 65 | 49 |
| Перегрівання | 29 | 22 |
| Переохолодження | 25 | 19 |
| Збільшення маси тіла | 45 | 34 |
| Схуднення | 20 | 15 |
| Стрес | 78 | 59 |
| Клімакс | 23 | 17 |
| ЦД | 20 | 15 |
| Інсулінорезистентність | 18 | 13,5 |
| Гіпертонічна хвороба (ГХ) | 65 | 49 |
| Ішемічна хвороба серця | 14 | 11 |
| МС | 45 | 34 |
| Захворювання щитоподібної залози | 5 | 4 |
| Гострі респіраторні вірусні інфекції | 20 | 15 |
| Оперативні втручання | 18 | 13,5 |
| Вживання ліків | 35 | 26 |
| Вживання алкоголю | 20 | 15 |
| Отруєння | 10 | 8 |
| Професійна шкідливість | 25 | 19 |
| Гастрит | 24 | 18 |
| Гепатит | 6 | 5 |
Таблиця 3.2 – Захворювання шкіри за даними анамнестичного аналізу
| Захворювання | n | % |
| Відсутні | 50 | 38 |
| Невуси | 26 | 20 |
| Дерматофіброми | 5 | 4 |
| Актинічний кератоз | 29 | 22 |
| Себорейний кератоз | 35 | 26 |
| Базально-клітинна карцинома шкіри | 6 | 5 |
| Базальноклітинний рак шкіри | 5 | 4 |
Клінічна характеристика ФЕП шкіри враховувала їхні кількість, розмір, форму, локалізацію, колір і консистенцію. Кількість поліпів і їхня характеристика представлені в табл. 3.3.
Таблиця 3.3 – Характеристика ФЕП шкіри
| Показники | n | |
| Кількість, n | 931 | |
| Розмір, мм | 0,72 ± 0,15 | |
| Показники | n | % |
| Форма округла | 30 | 23 |
| Форма овальна | 60 | 45 |
| Форма неправильна | 43 | 32 |
| Колір тілесний | 30 | 23 |
| Колір блідо-коричневий | 70 | 53 |
| Колір коричневий | 33 | 25 |
| Колір темно-коричневий | 28 | 21 |
| Консистенція м’яка | 40 | 30 |
| Консистенція еластична | 60 | 45 |
| Консистенція щільно-еластична | 35 | 26 |
Продовження таблиці 3.3
| Показники | n | % |
| Консистенція щільна | 26 | 20 |
| Ніжка товста | 19 | 14 |
| Ніжка тонка | 74 | 56 |
| Ніжка коротка | 53 | 40 |
| Ніжка довга | 29 | 22 |
Як видно з отриманих результатів, були виявлені 931 ФЕП шкіри, що в середньому складає 7 поліпів на 1-го пацієнта. Найчастіше форма ФЕП була овальною (45 %) або неправильною (32 %), забарвлення – блідо-коричневим (53 %) або коричневим (25 %), консистенція – м’якою (30 %) або еластичною (45 %). Поліпи переважно фіксувалися на тонкій і короткій ніжках.
Локалізація ФЕП шкіри має важливе практичне значення. Досить часто невидимі ділянки шкіри погано обстежуються. Результати аналізу локалізації ФЕП шкіри представлені в табл. 3.4.
Таблиця 3.4 – Локалізація ФЕП шкіри
| Анатомо-клінічна ділянка | n | % |
| Обличчя | 93 | 10 |
| Шия (загалом) | 494 | 53 |
| Передня поверхня | 211 | 23 |
| Бокова права | 45 | 5 |
| Бокова ліва | 39 | 4 |
| Задня | 199 | 21 |
| Складки (загалом) | 140 | 15 |
| Пахвова права | 35 | 4 |
| Пахвова ліва | 41 | 4 |
| Пахвинна права | 23 | 2 |
Продовження таблиці 3.4
| Анатомо-клінічна ділянка | n | % |
| Пахвинна ліва | 20 | 2 |
| Молочна права | 11 | 1 |
| Молочна ліва | 10 | 1 |
| Тулуб (загалом) | 93 | 10 |
| Передня поверхня | 67 | 7 |
| Задня поверхня | 26 | 3 |
| Статеві органи | 37 | 4 |
| Сідниці | 9 | 1 |
| Верхні кінцівки | 37 | 4 |
| Нижні кінцівки | 28 | 3 |
Згідно з отриманими даними, ФЕП шкіри (рис. 3.1, 3.2) переважно локалізувалися на шиї (53 %), обличчі (10 %), тулубі (10 %) і ділянках складок (15 %). Найменша поширеність була зафіксована на сідницях (1 %), статевих органах (4 %), верхніх (4 %) та нижніх (3 %) кінцівках.
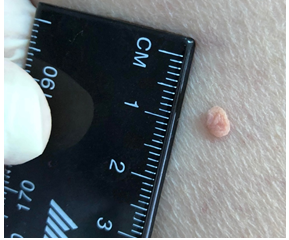 Рисунок 3.1 – У ділянці правої підпахвової впадини на незміненій шкірі виявляється одиничний фіброепітеліальний поліп. Розмір утворення 1 см, овальної форми, на товстій ніжці, тілесного кольору, щільно-еластичної консистенції.
Рисунок 3.1 – У ділянці правої підпахвової впадини на незміненій шкірі виявляється одиничний фіброепітеліальний поліп. Розмір утворення 1 см, овальної форми, на товстій ніжці, тілесного кольору, щільно-еластичної консистенції.
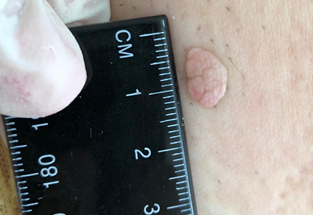 Рисунок 3.2 – У ділянці лівого боку на незміненій шкірі відмічається одиничний фіброепітеліальний поліп. Розмір утворення 0,5 см, округлої форми, на товстій ніжці, тілесного кольору, щільної консистенції.
Рисунок 3.2 – У ділянці лівого боку на незміненій шкірі відмічається одиничний фіброепітеліальний поліп. Розмір утворення 0,5 см, округлої форми, на товстій ніжці, тілесного кольору, щільної консистенції.
3.2 Асоціація фіброепітеліальних поліпів шкіри з супутніми захворюваннями та клініко-лабораторними показниками
Для проведення дослідження “випадок-контроль” були залучені 129 волонтерів, які склали контрольну групу. До неї увійшли особи без ФЕП шкіри, які за віком і статтю достовірно не відрізнялися від дослідної групи (табл. 3.5).
Таблиця 3.5 – Вік і стать у досліджуваних групах
| Параметри | Контроль (n=129) | Дослідна група (n=133) | p | ||
| Вік, роки | 43,73 ± 13,22 | 45,93 ± 11,94 | 0,16 | ||
| Стать: | N | % | n | % | p |
| чоловіча | 68 | 53 | 65 | 49 | χ2=0,248
p=0,618 |
| жіноча | 61 | 47 | 68 | 51 | |
Як видно з отриманих даних, вік і стать у дослідній і контрольній групах достовірно не відрізнялися, кількість жінок і чоловіків була майже однаковою.
Одним із завдань проведеної роботи було вивчення впливу метаболічних порушень і захворювань, які у своєму патогенезі мають хронічне запалення, на появу ФЕП шкіри. Було здійснене дослідження “випадок-контроль”, що порівнювало дві групи з включенням суб’єктів з і без ФЕП шкіри. Спочатку був проведений аналіз об’єктивного обстеження (табл. 3.6).
Таблиця 3.6 – Показники об’єктивного обстеження в дослідній і контрольній групах
| Показники | Контрольна група (n=129) | Дослідна група (n=133) | p |
| Зріст, м | 1,72 ± 0,10 | 1,71 ± 0,09 | 0,35 |
| Вага | 75,40 ± 12,46 | 79,86 ± 17,97 | 0,02 |
| ІМТ | 25,38 ± 2,72 | 26,94 ± 3,83 | <0,001 |
| Окружність талії | 86,89 ± 13,03 | 92,34 ± 16,57 | 0,003 |
| Частота серцевих скорочень | 81,04 ± 11,24 | 80,56 ± 11,07 | 0,73 |
| Частота дихання | 18,79 ± 2,09 | 19,71 ± 2,47 | 0,001 |
| Систолічний АТ | 120,66 ± 16,41 | 129,50 ± 17,03 | <0,001 |
| Діастолічний АТ | 69,47 ± 11,94 | 77,07 ± 12,16 | <0,001 |
Наведені результати свідчать про достовірне збільшення ваги, окружності талії й ІМТ в пацієнтів з ФЕП шкіри (р<0,05). Також спостерігалося достовірне підвищення АТ та частоти дихання в дослідній групі (р<0,05). Зріст і частота серцевих скорочень між двома групами достовірно не відрізнялися.
При порівнянні частоти супутніх захворювань у дослідній і контрольній групах (табл. 3.7) з використанням критерію χ2 для таблиць було встановлено, що частота ЦД2, ГХ та МС була достовірно вищою в пацієнтів з ФЕП шкіри. Порівняння частоти ішемічної хвороби серця, захворювань щитоподібної залози, гастриту, стеатозу печінки та хронічної хвороби нирок не виявило достовірних відмінностей.
Таблиця 3.7 – Супутні захворювання в дослідній і контрольній групах
| Супутні захворювання | Контрольна група (n=129) | Дослідна група (n=133) | p | ||
| n | % | n | % | ||
| ЦД2 | 5 | 3,9 | 22 | 16,5 | χ2=10,04
p=0,001 |
| ГХ | 50 | 38,8 | 70 | 52,6 | χ2=10,04
p=0,033 |
| Ішемічна хвороба серця | 10 | 7,8 | 14 | 10,5 | χ2=0,388
p=0,533 |
| МС | 10 | 7,8 | 49 | 36,8 | χ2=30,12
p<0,001 |
| Захворювання щитоподібної залози | 6 | 4,7 | 5 | 3,8 | χ2=0,003
p=0,959 |
| Гастрит | 20 | 15,5 | 24 | 18,0 | χ2=0,148
p=0,700 |
| Алкогольний стеатоз | 12 | 9,3 | 15 | 11,3 | χ2=0,104
p=0,747 |
| Стеатоз печінки | 3 | 2,3 | 4 | 3,0 | χ2=0,002
p=0,967 |
| Хронічна хвороба нирок | 3 | 2,3 | 2 | 1,5 | χ2=0,001
p=0,973 |
Наступним етапом стало порівняння показників загального аналізу крові в дослідній і контрольній групах (табл. 3.8).
Таблиця 3.8 – Показники розгорнутого аналізу крові в дослідній і контрольній групах
| Показники | Контрольна група (n=129) | Дослідна група (n=133) | p |
| Гемоглобін, г/л | 152,9 ± 20,4 | 149,9 ± 18,4 | 0,21 |
| Еритроцити, ×1012/л | 4,58 ± 0,64 | 4,75 ± 0,59 | 0,03 |
| Гематокрит, % | 44,51 ± 7,51 | 43,49 ± 4,41 | 0,18 |
| Тромбоцити, ×109/л | 253,42 ± 53,35 | 249,70 ± 53,68 | 0,57 |
| Лейкоцити, ×109/л | 6,92 ± 1,77 | 6,62 ± 1,79 | 0,17 |
| Нейтрофіли, ×109/л | 4,60 ± 1,74 | 4,44 ± 1,69 | 0,44 |
| Лімфоцити, ×109/л | 2,78 ± 1,27 | 2,70 ± 1,15 | 0,61 |
| Моноцити, ×109/л | 0,57 ± 0,31 | 0,64 ± 0,30 | 0,08 |
| Еозинофіли, ×109/л | 0,28 ± 1,56 | 0,27 ± 1,55 | 0,82 |
| Базофіли, ×109/л | 0,005 ± 0,003 | 0,008 ± 0,009 | <0,001 |
| Середній об’єм еритроцитів, fL | 89,53 ± 9,37 | 88,63 ± 10,10 | 0,46 |
| Середній об’єм гемоглобіну в еритроциті, pg/ml | 30,59 ± 3,81 | 30,25 ± 3,49 | 0,45 |
| Середня концентрація гемоглобіну в еритроцитах, g/dL | 34,22 ± 2,77 | 33,27 ± 3,26 | 0,01 |
| Ширина розподілу еритроцитів за об’ємом, коефіцієнт відхилення, % | 15,56 ± 3,18 | 12,09 ± 6,26 | <0,001 |
| Ширина розподілу еритроцитів за об’ємом, стандартне відхилення, fL | 42,01 ± 3,44 | 41,83 ± 3,23 | 0,67 |
| Середній об’єм тромбоцита, fL | 9,20 ± 1,89 | 9,53 ± 2,16 | 0,19 |
| Ширина розподілу тромбоцитів, fL | 15,52 ± 3,54 | 15,04 ± 3,71 | 0,29 |
| Відсоток великих тромбоцитів, % | 29,95 ± 9,47 | 27,23 ± 9,27 | 0,02 |
| Тромбокрит, % | 0,35 ± 0,13 | 0,31 ± 0,11 | <0,01 |
| Паличкоядерні нейтрофіли, % | 4,2 ± 2,2 | 4,1 ± 2,1 | 0,60 |
Продовження таблиці 3.8
| Показники | Контрольна група (n=129) | Дослідна група (n=133) | p |
| Сегментоядерні нейтрофіли, % | 61,85 ± 11,38 | 56,38 ± 10,08 | <0,001 |
| Лімфоцити, % | 33,01 ± 10,92 | 29,11 ± 10,31 | <0,01 |
| Моноцити, % | 6,18 ± 2,87 | 5,99 ± 2,85 | 0,56 |
| Еозинофіли, % | 2,95 ± 1,38 | 3,22 ± 1,49 | 0,13 |
| Базофіли, % | 0,53 ± 0,50 | 0,45 ± 0,49 | 0,22 |
| Швидкість зсідання еритроцитів, мм/год | 8,57 ± 4,44 | 8,78 ± 5,12 | 0,73 |
| Кольоровий показник | 0,95 ± 0,09 | 0,96 ± 0,08 | 0,88 |
При аналізі показників загального аналізу крові були виявлені достовірні відмінності між групами. Хоча рівні базофілів, середня концентрація гемоглобіну в еритроцитах, ширина розподілу еритроцитів за об’ємом, відсоток великих тромбоцитів, тромбокрит, вміст сегментоядерних нейтрофілів і лімфоцитів мали достовірні відмінності між групами, зміни цих показників не виходили за межі референтних значень.
Для розуміння роботи обмінних процесів був проведений біохімічний аналіз. Порівняння біохімічних показників представлене в табл. 3.9.
Таблиця 3.9 – Показники біохімічного дослідження в дослідній і контрольній групах
| Показники | Контрольна група (n=129) | Дослідна група (n=133) | p |
| Білірубін загальний, мкмоль/л | 13,22 ± 5,48 | 14,09 ± 5,45 | 0,20 |
| Білірубін непрямий, мкмоль/л | 11,67 ± 5,60 | 10,59 ± 6,44 | 0,16 |
| Білірубін прямий, мкмоль/л | 1,57 ± 0,96 | 1,93 ± 0,87 | <0,01 |
| Аланінамінотрансфераза, U/л | 21,74 ± 11,71 | 24,79 ± 14,07 | 0,06 |
Продовження таблиці 3.9
| Показники | Контрольна група (n=129) | Дослідна група (n=133) | p |
| Аспартатамінотрансфераза, U/л | 28,52 ± 15,86 | 27,80 ± 12,31 | 0,68 |
| Лужна фосфатаза, U/л | 82,03 ± 33,71 | 79,41 ± 27,19 | 0,49 |
| Загальний білок у сироватці, г/л | 70,13 ± 9,26 | 73,89 ± 8,03 | <0,001 |
| Креатинін, ммоль/л | 82,61 ± 19,41 | 82,56 ± 14,76 | 0,98 |
| Сечовина, ммоль/л | 5,35 ± 1,59 | 4,89 ± 1,32 | 0,01 |
| Сечова кислота, ммоль/л | 307,55 ± 76,45 | 324,89 ± 70,35 | 0,06 |
| Гамма-глутамілтранспептидаза, U/л | 33,40 ± 17,93 | 35,11 ± 40,44 | 0,66 |
Аналіз отриманих результатів свідчить про достовірні відмінності між групами за вмістом прямого білірубіну, загального білка та концентрації сечовини. Хоча треба зазначити, що вони не виходили за межі референтних значень.
Показники гормонів щитоподібної залози представлені в табл. 3.10.
Таблиця 3.10 – Показники тиреоїдної панелі в дослідній і контрольній групах
| Показники | Контрольна група (n=129) | Дослідна група (n=133) | p |
| Тироксин загальний, Т4, нмоль/л | 116,25 ± 29,02 | 118,88 ± 32,20 | 0,49 |
| Тиреотропний гормон, mIU/l | 2,53 ± 1,24 | 2,04 ± 1,13 | <0,001 |
| Антитіла до тиреоглобуліну, IU/ml | 10,74 ± 5,51 | 13,26 ± 5,41 | <0,001 |
| Антитіла до тиреопероксидази, IU/ml | 5,46 ± 2,92 | 7,09 ± 3,58 | <0,001 |
Вміст тиреотропного гормону у дослідній групі був достовірно нижчим (р<0,001) порівняно з контрольною. Водночас концентрація антитіл до тиреоглобуліну та тиреопероксидази в дослідній групі була достовірно вищою (р<0,001). Такі зміни також не виходили за межі референтних значень.
Порівняння показників ліпідного обміну в досліджуваних групах представлене в табл. 3.11.
Таблиця 3.11 – Показники ліпідного обміну в дослідній і контрольній групах
| Показники | Контрольна група (n=129) | Дослідна група (n=133) | p |
| Холестерин загальний, ммоль/л | 4,41 ± 1,02 | 5,60 ± 0,78 | <0,001 |
| Тригліцериди, ммоль/л | 1,28 ± 0,43 | 1,74 ± 0,62 | <0,001 |
| ЛПВЩ, ммоль/л | 2,12 ± 0,59 | 1,66 ± 0,42 | <0,001 |
| ЛПНЩ, ммоль/л | 2,75 ± 0,74 | 3,19 ± 0,71 | <0,001 |
| ЛПДНЩ, ммоль/л | 0,43 ± 0,17 | 0,71 ± 0,35 | <0,001 |
| Коефіцієнт атерогенності | 1,29 ± 0,98 | 2,64 ± 1,34 | <0,001 |
Аналіз отриманих результатів свідчить про значне та достовірне (<0,001) зростання всіх показників ліпідного обміну в дослідній групі порівняно з контрольною.
Останнім етапом став аналіз показників діабетичної панелі (табл. 3.12).
Таблиця 3.12 – Показники діабетичної панелі в дослідній і контрольній групах
| Показники | Контрольна група (n=129) | Дослідна група (n=133) | p |
| Глюкоза в крові, ммоль/л | 5,39 ± 0,74 | 6,05 ± 1,32 | <0,001 |
| Глікозильований гемоглобін, % | 4,31 ± 1,15 | 5,22 ± 1,31 | <0,001 |
| Інсулін, mIU/ml | 13,67 ± 6,95 | 24,52 ± 28,25 | <0,001 |
| С-пептид, нг/мл | 2,81 ± 1,19 | 3,89 ± 2,01 | <0,001 |
| Індекс HOMA-IR, % | 3,24 ± 1,67 | 7,31 ± 4,27 | <0,001 |
| Лептин, нг/мл | 5,72 ± 2,65 | 6,67 ± 3,01 | 0,007 |
Наведені результати співпадають з даними, отриманими при аналізі ліпідного обміну. Вміст глюкози в крові, глікозильованого гемоглобіну, інсуліну, С-пептиду, індексу HOMA та лептину був достовірно вищим у пацієнтів з ФЕП шкіри.
Отже, підсумовуючи результати дослідження “випадок-контроль”, можна зробити висновок про достовірне превалювання метаболічних порушень ліпідного та вуглеводного обмінів у пацієнтів з множинними рецидивуючими ФЕП шкіри.
Враховуючи отримані достовірні відмінності за частотою супутніх хвороб, необхідно було виявити ризик розвитку захворювань, як-от ЦД2, МС і ГХ в пацієнтів з ФЕП шкіри. Результати такого аналізу представлені в табл. 3.13.
Таблиця 3.13 – Абсолютний і відносний ризики розвитку ЦД2, МС та ГХ у пацієнтів з ФЕП шкіри
| Статистичні показники | ЦД2 | МС | ГХ |
| Абсолютний ризик в основній групі | 0,165 | 0,368 | 0,526 |
| Абсолютний ризик у контрольній групі | 0,039 | 0,078 | 0,388 |
| Відносний ризик | 4,268 | 4,753 | 1,358 |
| Стандартна похибка відносного ризику | 0,480 | 0,324 | 0,138 |
| Нижня межа 95 % ДІ | 1,666 | 2,517 | 1,036 |
| Верхня межа 95 % ДІ | 10,929 | 8,973 | 1,779 |
| Зниження відносного ризику | 3,268 | 3,753 | 0,358 |
| Різниця ризиків | 0,127 | 0,291 | 0,139 |
| Чутливість | 0,815 | 0,831 | 0,583 |
| Специфічність | 0,528 | 0,586 | 0,556 |
Проведений статистичний аналіз показав значне підвищення ризику розвитку ЦД2 та МС в пацієнтів з ФЕП шкіри, що підтверджувалося високим відносним ризиком, що був встановлений на рівні більше 4. Для ГХ відносний ризик склав 1,358, що свідчило про не дуже високу ймовірність превалювання даної хвороби в дослідній групі. Для повного статистичного аналізу також необхідно було обчислити ВШ щодо ризику розвитку цих захворювань. Результати представлені в табл. 3.14.
Таблиця 3.14 – Відношення шансів щодо ризику розвитку ЦД2, МС та ГХ у пацієнтів з ФЕП шкіри
| Статистичні показники | ЦД2 | МС | ГХ |
| Шанс знайти фактор ризику в основній групі | 0,198 | 0,583 | 1,111 |
| Шанс знайти фактор ризику в контрольній групі | 0,040 | 0,084 | 0,633 |
| ВШ | 4,915 | 6,942 | 1,756 |
| Стандартна похибка ВШ | 0,512 | 0,375 | 0,251 |
| Нижня межа 95 % ДІ | 1,801 | 3,328 | 1,074 |
| Верхня межа 95 % ДІ | 13,418 | 14,480 | 2,869 |
| Рівень достовірності, p | 0,002 | <0,001 | 0,025 |
ВШ щодо розвитку МС склало 6,942, ЦД2 – 4,915, ГХ – 1,756, що додатково підтвердило підвищення ризику розвитку цих захворювань у пацієнтів з ФЕП шкіри.
Отже, при проведенні дослідження «випадок-контроль» було встановлено, що в осіб з множинними рецидивуючими ФЕП шкіри спостерігалося достовірне підвищення ризику розвитку МС, ЦД2 в асоціації з порушенням ліпідного та вуглеводного обмінів.
Враховуючи отримані результати, необхідно було провести порівняння значущих клінічних і лабораторних показників залежно від розподілу пацієнтів на групи з МС, ЦД2 та категорію осіб без цих захворювань. У результаті такого аналізу дослідна група була поділена на 3 групи: до 1-ї увійшли 62 пацієнти без МС та ЦД2; 2-ї – 49 з МС без ЦД2; 3-ї – 22 з ЦД2.
Наступним етапом роботи стало порівняння клініко-лабораторних показників у 1-й, 2-й і 3-й дослідних групах.
3.3 Вплив метаболічного синдрому та цукрового діабету 2-го типу на клініко-лабораторні параметри при фіброепітеліальних поліпах шкіри
Клініко-інструментальні показники досліджуваних груп представлені в табл. 3.15.
Таблиця 3.15 – Показники об’єктивного обстеження в 1-й, 2-й, 3-й дослідних групах
| Показники | Дослідні групи | p | ||
| 1-ша (n=62) | 2-га (n=49) | 3-тя (n=22) | ||
| Кількість ФЕП | 4,00
3,00-5,00 |
5,00*
4,00-7,00 |
12,00#,&
8,95-15,05 |
<0,001 |
| Кількість рецидивів за 2 роки | 2,00
2,00-3,00 |
3,00*
3,00-4,00 |
6,00#,&
4,00-8,00 |
<0,001 |
| Зріст, м | 1,70 ± 0,10 | 1,71 ± 0,09 | 1,73 ± 0,09 | 0,649 |
| Вага, кг | 74,15 ± 10,59 | 83,78 ± 24,19* | 87,27 ± 13,29# | <0,001 |
| ІМТ | 25,51 ± 2,60 | 27,73 ± 4,48* | 29,24 ± 3,66# | <0,001 |
| Окружність талії | 83,45 ± 12,44 | 99,47 ± 15,83* | 101,50 ± 16,22# | <0,001 |
| Частота серцевих скорочень | 83,24 ± 11,74 | 75,92 ± 9,43 | 83,32 ± 9,36 | <0,001 |
| Частота дихання | 19,19 ± 1,89 | 19,67 ± 2,31 | 21,27 ± 3,51# | 0,003 |
| Систолічний АТ | 120,95 ± 17,71 | 135,76 ± 13,05* | 139,64 ± 10,37# | <0,001 |
| Діастолічний АТ | 69,61 ± 12,08 | 83,86 ± 8,11* | 82,96 ± 6,90# | <0,001 |
Примітка. * – достовірність між 1-ю та 2-ю дослідними групами p<0,05; # – достовірність між 1-ю та 3-ю дослідними групами p<0,05; & – достовірність між 2-ю та 3-ю дослідними групами p<0,05.
При множинному порівнянні було встановлено, що в пацієнтів з МС (2-га дослідна група) та ЦД2 (3-тя дослідна група) спостерігалося достовірно більше ФЕП і їхніх рецидивів порівняно з особами без метаболічних порушень (1-ша дослідна група). Крім того, в пацієнтів із ЦД2 кількість ФЕП і їхніх рецидивів була достовірно вищою (p<0,05), ніж у 2-й дослідній групі (МС). Значення ІМТ, ваги, окружності талії, систолічного та діастолічного АТ при множинному порівнянні були достовірно вищими у хворих 2-ї та 3-ї дослідних груп відносно 1-ї.
На даному етапі роботи необхідно було визначити відмінності показників ліпідного обміну в пацієнтів з МС і ЦД2 (табл. 3.16).
Таблиця 3.16 – Показники ліпідного обміну в 1-й, 2-й, 3-й дослідних групах
| Показники | Дослідні групи | p | ||
| 1-ша (n=62) | 2-га (n=49) | 3-тя (n=22) | ||
| Холестерин загальний, ммоль/л | 5,45 ± 0,56 | 5,74 ± 0,98 | 5,74 ± 0,78 | 0,103 |
| Тригліцериди, ммоль/л | 1,80 ± 0,40 | 1,66 ± 0,78 | 1,72 ± 0,73 | 0,497 |
| ЛПВЩ, ммоль/л | 1,69 ± 0,35 | 1,68 ± 0,52 | 1,55 ± 0,41 | 0,356 |
| ЛПНЩ, ммоль/л | 2,88 ± 0,66 | 3,46 ± 0,68* | 3,48 ± 0,54# | <0,001 |
| ЛПДНЩ, ммоль/л | 0,51 ± 0,22 | 0,91 ± 0,39* | 0,84 ± 0,25# | <0,001 |
| Коефіцієнт атерогенності | 2,36 ± 0,82 | 2,79 ± 1,59 | 3,09 ± 1,75 | 0,05 |
Примітка. p – достовірність при множинному порівнянні; * – достовірність між 1-ю та 2-ю дослідними групами p<0,05; # – достовірність між 1-ю та 3-ю дослідними групами p<0,05.
При проведеному статистичному аналізі було виявлено, що рівні загального холестерину, тригліцеридів, ЛПВЩ в досліджуваних групах достовірно не відрізнялися. Значення коефіцієнта атерогенності мало тенденцію до відмінності між групами, хоча було недостовірним (p=0,051). Достовірна різниця була зафіксована для ЛПНЩ та ЛПДНЩ. Концентрації цих показників були достовірно вищими в 2-й і 3-й дослідних групах порівняно з 1-ю. Відмінностей між пацієнтами з МС і ЦД2 встановлено не було.
Порівняння основних показників діабетичної панелі представлене в табл. 3.17.
Таблиця 3.17 – Показники діабетичної панелі в 1-й, 2-й, 3-й дослідних групах
| Показники | Дослідні групи | p | ||
| 1-ша (n=62) | 2-га (n=49) | 3-тя (n=22) | ||
| Глюкоза в крові, ммоль/л | 5,31 ± 0,72 | 6,48 ± 1,30* | 7,19 ± 1,46#,& | <0,001 |
| Глікозильований гемоглобін, % | 4,52 ± 1,17 | 5,82 ± 1,15* | 5,87 ± 0,98# | <0,001 |
| Інсулін, mIU/ml | 16,75
14,40-21,08 |
14,60
11,62-17,16 |
41,90#,&
24,16-52,08 |
<0,001 |
| С-пептид, нг/мл | 2,69 ± 1,18 | 4,00 ± 1,21* | 7,06 ± 1,80#,& | <0,001 |
| Індекс HOMA-IR, % | 3,92
3,46-4,89 |
3,91
3,10-5,18 |
11,87#,&
7,38-16,13 |
<0,001 |
| Лептин, нг/мл | 6,06 ± 2,44 | 7,10 ± 3,14 | 7,42 ± 3,88 | 0,083 |
Примітка. p – достовірність при множинному порівнянні; * – достовірність між 1-ю та 2-ю дослідними групами p<0,05; # – достовірність між 1-ю та 3-ю дослідними групами p<0,05; & – достовірність між 2-ю та 3-ю дослідними групами p<0,05.
При проведеному аналізі було виявлено, що рівні глюкози, глікозильованого гемоглобіну, С-пептиду в 2-й і 3-й групах були достовірно вищими порівняно з 1-ю. Рівень інсуліну та значення індексу HOMA-IR були достовірно більшими в пацієнтів із ЦД2, ніж в осіб з МС і без метаболічних порушень. Рівень лептину був вищим у пацієнтів з МС і ЦД2, проте між групами достовірно не відрізнявся (0,083).
Отже, аналіз клініко-інструментальних даних, показників ліпідного обміну та діабетичної панелі виявив наступні закономірності: в осіб з МС і ЦД2 спостерігалося збільшення кількості ФЕП шкіри та їхніх рецидивів; такі зміни були пов’язані з порушеннями ліпідного обміну та метаболізму глюкози, що проявлялися в підвищенні рівнів ЛПНЩ, ЛПДНЩ, глюкози, глікозильованого гемоглобіну та С-пептиду.
Очевидно, що встановлені зміни метаболізму на системному рівні впливали на механізми формування ФЕП шкіри, для розуміння яких на локальному рівні необхідно було провести морфологічний та імуногістохімічний аналізи ФЕП шкіри з урахуванням показників локального запалення, що може бути асоційоване з порушеннями метаболізму ліпідів і глюкози.
Наступним етапом роботи став аналіз особливостей морфогенезу ФЕП в пацієнтів з МС і ЦД2.
Основні результати даного розділу висвітлено в наступній публікації:
- Літус ІО, Свістунов ІВ. Особливості гістологічної будови рецидивуючих фіброепітеліальних поліпів шкіри у хворих з метаболічним синдромом та цукровим діабетом 2-го типу. Україна. Здоров’я нації. 2020;(2):137-41 [22].
4 ОСОБЛИВОСТІ МОРФОГЕНЕЗУ ФІБРОЕПІТЕЛІАЛЬНИХ ПОЛІПІВ У ПАЦІЄНТІВ З МЕТАБОЛІЧНИМ СИНДРОМОМ
І ЦУКРОВИМ ДІАБЕТОМ 2-ГО ТИПУ
4.1 Особливості гістологічної будови фіброепітеліальних поліпів шкіри у хворих на метаболічний синдром і цукровий діабет 2-го типу
Форма та розмір ФЕП пацієнтів 1-3-ї груп значно варіювали. Проте середній розмір ФЕП не мав статистично значущих розбіжностей у хворих досліджуваних груп і в 1-й становив (0,57 ± 0,13) см (95 % ДІ 0,23-0,90), 2-й – (0,53 ± 0,09) см (95 % ДІ 0,28-0,77), 3-й – (0,50 ± 0,06) см (95 % ДІ 0,32-0,76).
При мікроскопічному дослідженні ФЕП пацієнтів 1-ї групи була визначена класична гістологічна картина. Досліджувані утворення мали характерну поліпоподібну форму, не містили придатків шкіри (волосся та залози), отже, були утворені за рахунок інтерфолікулярного компартмента шкіри. Крім грибоподібних ФЕП, у 1-й групі визначалися варіанти поліпів витягнутої, іноді ниткоподібної, форми.
Центральна частина (стрижень) поліпів була представлена щільною волокнистою неоформленою сполучною тканиною, що містила великі, подекуди дилятовані, судини.
Поверхня ФЕП була вкрита багатошаровим плоским зроговілим епітелієм, в якому зрідка визначалися реактивні зміни. Дерма в межах ФЕП зберігала шарувату будову. Під епідермісом визначався сосочковий шар дерми, утворений пухкою волокнистою сполучною тканиною з численними судинами мікроциркуляторного русла. Здебільшого поверхня поліпа була нерівною з формуванням вторинних випинань – сосочків, які в пацієнтів 1-ї групи мали переважно похилу форму (рис. 4.1). При аналізі епідермо-дермальної межі виявлялися як ділянки формування невиразних вторинних сосочків дерми та гребінців епідермісу, так і зони згладженої епідермо-дермальної межі. У межах сітчастого шару спостерігалася щільна волокниста неоформлена сполучна тканина, в центральній частині ФЕП визначалися розширені кровоносні судини, переважно неправильної форми з тонкими стінками. Сполучна тканина мала ознаки набряку та розпушення колагенових волокон, більше – в центральній частині поліпа.
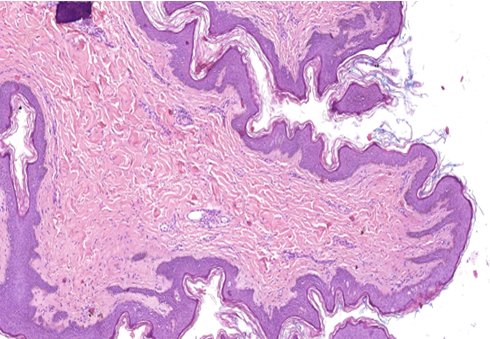 Рисунок 4.1 – Будова фіброепітеліального поліпа в пацієнтів 1-ї групи. Забарвлення гематоксиліном та еозином. Зб. ×50.
Рисунок 4.1 – Будова фіброепітеліального поліпа в пацієнтів 1-ї групи. Забарвлення гематоксиліном та еозином. Зб. ×50.
Судини поверхневого судинного сплетіння в межах ФЕП були нерівномірними за діаметром, місцями широкими та розгалуженими. В окремих випадках периваскулярна зона мала ознаки помірного набряку та слабкої лімфогістіоцитарної інфільтрації.
При порівнянні гістологічної будови ФЕП у хворих 2-ї та 3-ї груп був зафіксований значний папіломатоз поверхні поліпів за рахунок формування численних виразних розгалужених вторинних і третинних сосочків (рис. 4.2). Частина з них була грибоподібної форми, проте переважали видовжені чи конусоподібні вторинні вирости. Епідерміс мав ознаки помірного або виразного акантозу, в низці випадків визначалися риси гіперкератозу, формування рогових псевдокіст. За рахунок цих змін значно зростала площа епідермо-дермальної межі, що по суті відбиває зміну міжтканинних відносин у межах ФЕП при інсулінорезистентності та може бути наслідком посилення проліферації клітин епідермісу та сосочкового шару дерми в межах поліпів.
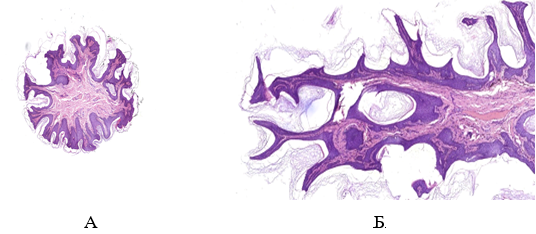 Рисунок 4.2 – Гістологічна будова фіброепітеліальних поліпів пацієнтів 2-ї (А) та 3-ї (Б) груп. “Папіломатоз” поверхні фіброепітеліального поліпа асоційований з виразними розгалуженими вторинними сосочками. Забарвлення гематоксиліном та еозином. Зб. ×20.
Рисунок 4.2 – Гістологічна будова фіброепітеліальних поліпів пацієнтів 2-ї (А) та 3-ї (Б) груп. “Папіломатоз” поверхні фіброепітеліального поліпа асоційований з виразними розгалуженими вторинними сосочками. Забарвлення гематоксиліном та еозином. Зб. ×20.
Другою особливістю будови ФЕП була значна кількість судин і наявність судинних мальформацій через переважання тонкостінних судин нерівномірного діаметру та периваскулярного набряку навколо судин поверхневого судинного сплетіння та в субепідермальній зоні. Третьою особливістю будови ФЕП у хворих на МС і ЦД2 була значно виразніша лейкоцитарна інфільтрація (рис. 4.3). Остання була помірною чи виразною та визначалася як у периваскулярній зоні, так і в сосочковому шарі дерми поліпів поблизу від епідермісу.
Водночас інфільтрати переважно були представлені клітинами лімфогістіоцитарного ряду. В одному з випадків були визначені ознаки травмування та гострої запальної інфільтрації поліпа. Цей кейс був вилучений з подальшого імуногістохімічного дослідження. Місцями ділянки лімфогістіоцитарної інфільтрації були асоційовані з менш вираженим набряком і виразним фіброзуванням строми поліпа.
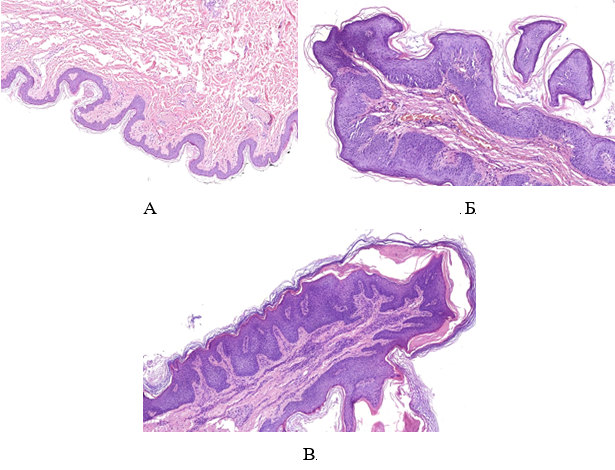 Примітка. А – 1-ша група; Б – 2-га група; В – 3-тя група.
Примітка. А – 1-ша група; Б – 2-га група; В – 3-тя група.
Рисунок 4.3 – Різна вираженість лімфогістіоцитарної інфільтрації в межах фіброепітеліального поліпа в пацієнтів різних груп.
Забарвлення гематоксиліном та еозином. Зб. ×50.
Отже, ФЕП у хворих на ЦД2 та МС мали характерні особливості будови, що полягали в наявності ознак виразного “папіломатозу” за рахунок зміни епідермо-дермальних взаємовідносин, виражених судинних змін і більшої інтенсивності запальної інфільтрації за рахунок клітин лімфогістіоцитарного ряду, що відображає превалювання хронічного запального процесу.
Враховуючи роль запалення в регуляції проліферації й ангіогенезу, наступним кроком дослідження стала оцінка експресії маркерів запалення, включаючи експресію індукованої форми ЦОГ (ЦОГ-2) та кількість опасистих клітин. Останні візуалізували за експресією клітинно-специфічного маркера – МСТ.
4.2 Оцінка експресії триптазопозитивних опасистих клітин і циклооксигенизи-2 в межах фіброепітеліальних поліпів у пацієнтів з метаболічним синдромом і цукровим діабетом 2-го типу
Дані попередніх досліджень свідчать про зростання кількості опасистих клітин у ФЕП при ожирінні й інсулінорезистентності. Проте зустрічаються публікації, що не підтверджують наявності зв’язку між ожирінням та опасистими клітинами. З іншого боку, відомо, що зростання кількості опасистих клітин асоційоване з хронічним запаленням. Отже, в межах даного розділу був проведений аналіз кількості та просторового розподілу опасистих клітин. Крім того, відомо, що морфогенетичні процеси в шкірі, пов’язані зі зміною активності кератиноцитів епідермісу, опасистих клітин, ендотелію судин і фібробластів дерми, регулюються численними біологічно активними речовинами, серед яких важливу роль відіграють ейкозаноїди (більшою мірою простагландини). Тому в даному розділі був проведений аналіз експресії ЦОГ-2, активація якої супроводжується зростанням продукції простагландинів, залучених у регуляцію численних біологічних процесів, включаючи модуляцію запальної реакції, проліферації кератиноцитів і фібробластів, ангіогенезу, ремоделювання дерми та морфогенезу опасистих клітин.
У межах ФЕП пацієнтів 1-ї групи МСТ-позитивні клітини визначалися як вздовж судин поверхневого судинного сплетіння, так і навколо судин центрального стрижня (рис. 4.4). Їхня кількість значно варіювала та більшою мірою була пов’язана з виразністю інфільтрації навколо венулярної ланки судинного русла ФЕП. Хоча в межах центральної зони ФЕП кількість опасистих клітин статистично значуще не відрізнялася між пацієнтами різних груп, їхня кількість на периферії – в зоні ремоделювання ФЕП поблизу від епідермо-дермальної межі – була дещо іншою. Враховуючи визначені особливості просторового розподілу клітин, надалі аналіз кількості МСТ-позитивних клітин проводили в двох компартментах – у межах центрального стрижня ФЕП та в субепідермальній зоні (сосочковий шар дерми ФЕП).
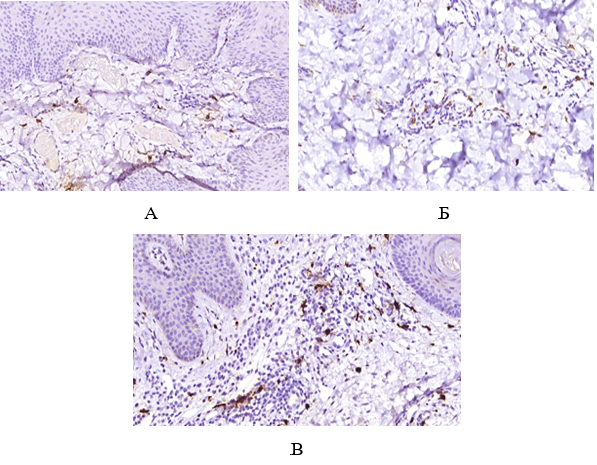 Рисунок 4.4 – Опасисті клітини в межах фіброепітеліального поліпа пацієнта 1-ї групи. Незначна кількість опасистих клітин поблизу від
Рисунок 4.4 – Опасисті клітини в межах фіброепітеліального поліпа пацієнта 1-ї групи. Незначна кількість опасистих клітин поблизу від
епідермо-дермальної межі (А) та помірна кількість МСТ-позитивних клітин у периваскулярній зоні центрального стрижня поліпа. Чисельні
МСТ-позитивні клітини у зонах лімфогістіоцитарної інфільтрації (В). Імуногістохімічне дослідження з використанням моноклональних антитіл до МСТ-позитивних клітин. А та Б – зб. ×100, В – зб. ×200.
Чисельність МСТ-позитивних клітин у сосочковому шарі дерми ФЕП пацієнтів 1-ї групи складала (65,8 ± 5,22) (95 % ДІ 55,2-76,5) на 1 мм2. Значна кількість опасистих клітин визначалася в ділянках периваскулярної лімфогістіоцитарної інфільтрації, що підтверджувало асоціацію між чисельністю опасистих клітин і хронічним запаленням.
Відмінністю ФЕП пацієнтів 2-ї та 3-ї груп було переважання опасистих клітин у межах вторинних сосочків поблизу від епідермо-дермальної межі. Водночас МСТ-позитивні клітини визначалися навколо судин сосочкового шару дерми та субепідермально. Кількість опасистих клітин у межах сосочкового шару дерми ФЕП в пацієнтів 2-ї групи була значно вищою, ніж в осіб без метаболічних порушень, і сягала (95,1 ± 7,26) (95 % ДІ 80,2-109,6) на 1 мм2 (р<0,0001). Крім того, численні опасисті клітини спостерігалися в межах лімфогістіоцитарних інфільтратів навколо судин поверхневого судинного сплетіння (рис. 4.5).
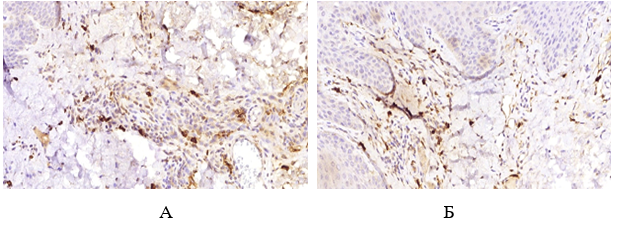 Рисунок 4.5 – Численні опасисті клітини, що визначаються у межах сосочкового шару дерми фіброепітеліального поліпа (А) та лімфогістіоцитарних інфільтратів (Б) пацієнтів з інсулінорезистентністю. Імуногістохімічне дослідження з використанням моноклональних антитіл до МСТ-позитивних клітин. Зб. ×100.
Рисунок 4.5 – Численні опасисті клітини, що визначаються у межах сосочкового шару дерми фіброепітеліального поліпа (А) та лімфогістіоцитарних інфільтратів (Б) пацієнтів з інсулінорезистентністю. Імуногістохімічне дослідження з використанням моноклональних антитіл до МСТ-позитивних клітин. Зб. ×100.
Ще більша кількість опасистих клітин спостерігалася в межах субепідермального компартмента ФЕП хворих на ЦД2, вона складала (106,8 ± 10,8) (95 % ДІ 84,0-129,5) на 1 мм2. Водночас не було встановлено статистично значущих розбіжностей з показником 2-ї групи. Як і у хворих 2-ї групи, значна кількість МСТ-позитивних клітин визначалася поблизу епідермо-дермальної межі та вздовж периваскулярних інфільтратів (рис. 4.6). Окрім кулястої, опасисті клітини набували видовженої та відростчатої форм, демонстрували різну інтенсивність імуногістохімічного забарвлення, що може бути пов’язаним з процесом дегрануляції. Як відомо, опасисті клітини можуть брати участь у різних біологічних процесах, включаючи запалення та неоваскуляризацію, шляхом вивільнення різних медіаторів, що можуть накопичуватися в гранулах або синтезуватися de novo. Через вивільнення численних біологічно активних речовин, хемокінів, цитокінів і факторів росту опасисті клітини взаємодіють з макрофагами, ендотеліальними клітинами, фібробластами, різними лейкоцитами та кератиноцитами, залучені в стимуляцію репаративних процесів і ремоделювання тканин. Наприклад, опасисті клітини можуть стимулювати ангіогенез через продукцію VEGF, а також посилюють проліферацію фібробластів через продукцію інтерлейкіну 4 й основного фактора росту фібробластів (FGFb).
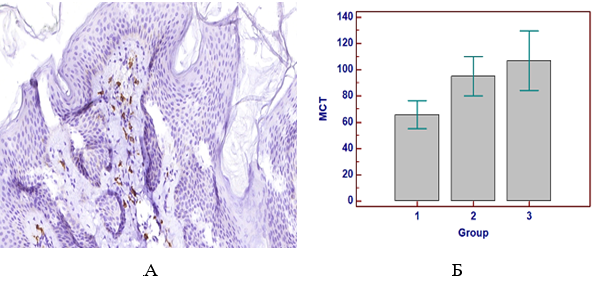 Рисунок 4.6 – Опасисті клітини у фіброепітеліальних поліпах хворих на цукровий діабет 2-го типу: А – численні МСТ-позитивні клітини в межах вторинних сосочків. Імуногістохімічне дослідження з використанням моноклональних антитіл до МСТ-позитивних клітин. Зб. ×100;
Рисунок 4.6 – Опасисті клітини у фіброепітеліальних поліпах хворих на цукровий діабет 2-го типу: А – численні МСТ-позитивні клітини в межах вторинних сосочків. Імуногістохімічне дослідження з використанням моноклональних антитіл до МСТ-позитивних клітин. Зб. ×100;
Б – порівняння кількості опасистих клітин у фіброепітеліальних поліпах пацієнтів 1-3-ї груп. За віссю абсцис – групи пацієнтів, ординат – абсолютна кількість опасистих клітин (на 1 мм2).
Збільшення кількості опасистих клітин у ФЕП за умов інсулінорезистентності можливе за рахунок їх проліферації, одним зі стимуляторів якої є простагландини. Цей факт, а також асоціація кількості опасистих клітин з хронічним запальним процесом стимулювали до визначення експресії індуцибельної форми ЦОГ (ЦОГ-2) у ФЕП пацієнтів різних груп.
При аналізі експресії ЦОГ-2 в межах ФЕП хворих 1-ї групи була встановлена помірна імунопозитивна реакція щодо експресії даного ферменту синтезу ейкозаноїдів як у межах клітин епідермісу, так і в дермі. В останній помірна експресія ЦОГ-2 визначалася в клітинах фібробластичного ряду, ендотелії судин і ділянках інфільтрації (рис. 4.7).
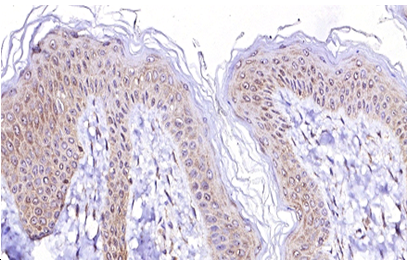 Рисунок 4.7 – Експресія ЦОГ-2 в межах фіброепітеліальних поліпів хворих 1-ї групи, що спостерігається як у межах епідермісу, так і в клітинах дерми. Імуногістохімічне дослідження з використанням моноклональних антитіл до ЦОГ-2. Зб. ×200.
Рисунок 4.7 – Експресія ЦОГ-2 в межах фіброепітеліальних поліпів хворих 1-ї групи, що спостерігається як у межах епідермісу, так і в клітинах дерми. Імуногістохімічне дослідження з використанням моноклональних антитіл до ЦОГ-2. Зб. ×200.
При аналізі у ФЕП пацієнтів 2-ї та 3-ї груп була відзначена значно вища виразність експресії ЦОГ-2 в епідермісі. Інтенсивність експресії в клітинах епідермісу варіювала від помірної до значної, охоплювала всі клітини базального, остистого та зернистого шарів (рис. 4.8). Це визначило значно вищі показники total score експресії ЦОГ-2 порівняно з 1-ю групою (рис. 4.9). Але водночас не відзначалося статистично значущих розбіжностей загального рівня експресії ЦОГ-2 між пацієнтами 2-ї та 3-ї груп. Експресія ЦОГ-2 в межах дерми ФЕП хворих 2-ї та 3-ї груп була розповсюдженою, мала помірну чи виразну інтенсивність. У дермі експресія ЦОГ-2 визначалася в клітинах інфільтратів. Крім того, помірна імунопозитивна реакція спостерігалася в клітинах судинного ендотелію, а також у численних клітинах фібробластичного ряду.
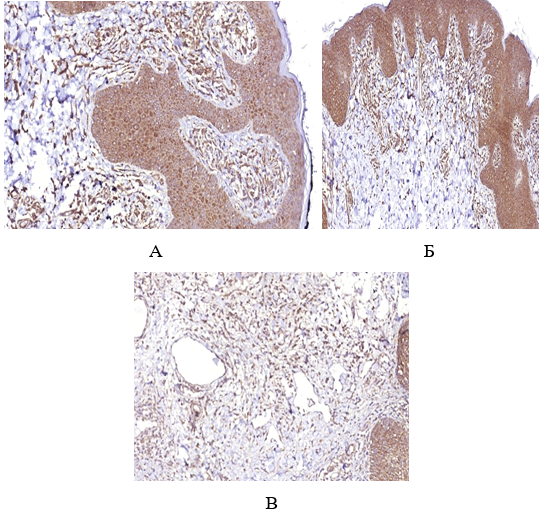 Рисунок 4.8 – Помірна (А) та виразна (Б) експресія ЦОГ-2 в пацієнтів 2-ї та 3-ї груп в епідермісі та дермі (В). Значна кількість клітин сосочкового шару дерми демонструє виразну експресію ЦОГ-2. ЦОГ-2-позитивні клітини в центральній частині ФЕП. Імуногістохімічне дослідження з використанням моноклональних антитіл до ЦОГ-2. А та Б – зб. ×100, В – зб. ×200.
Рисунок 4.8 – Помірна (А) та виразна (Б) експресія ЦОГ-2 в пацієнтів 2-ї та 3-ї груп в епідермісі та дермі (В). Значна кількість клітин сосочкового шару дерми демонструє виразну експресію ЦОГ-2. ЦОГ-2-позитивні клітини в центральній частині ФЕП. Імуногістохімічне дослідження з використанням моноклональних антитіл до ЦОГ-2. А та Б – зб. ×100, В – зб. ×200.
 Рисунок 4.9 – Вираженість експресії ЦОГ-2 в пацієнтів різних груп: А – демонструє загальну експресію ЦОГ-2 в епідермісі фіброепітеліального поліпа. За віссю абсцис – групи пацієнтів, ординат – експресія ЦОГ-2 за загальною шкалою (загальний підрахунок; в умовних одиницях); Б – демонструє кількість ЦОГ-2-позитивних клітин у дермі ФЕП. За віссю абсцис – групи пацієнтів, ординат – кількість ЦОГ-2-позитивних клітин на 1 мм2.
Рисунок 4.9 – Вираженість експресії ЦОГ-2 в пацієнтів різних груп: А – демонструє загальну експресію ЦОГ-2 в епідермісі фіброепітеліального поліпа. За віссю абсцис – групи пацієнтів, ординат – експресія ЦОГ-2 за загальною шкалою (загальний підрахунок; в умовних одиницях); Б – демонструє кількість ЦОГ-2-позитивних клітин у дермі ФЕП. За віссю абсцис – групи пацієнтів, ординат – кількість ЦОГ-2-позитивних клітин на 1 мм2.
Цікаво, що в межах сосочкового шару дерми ФЕП (у субепідермальній зоні) експресія ЦОГ-2 визначалася майже в усіх фібробластах вторинних сосочків – позитивні клітини формували щільну сітку під епідермісом. Менші інтенсивність експресії та кількість ЦОГ-2-позитивних клітин відмічалися в центральній зоні ФЕП (в ділянках фіброваскулярного стрижня).
При проведенні кореляційного аналізу спостерігався помірний кореляційний зв’язок між загальною виразністю епідермальної експресії ЦОГ-2 та кількістю МСТ-позитивних клітин у дермі (r=0,684; р<0,0001), водночас статистично значущого кореляційного зв’язку між експресією ЦОГ-2 в клітинах дерми та чисельністю МСТ-позитивних клітин визначено не було.
Крім того, був відзначений зв’язок між загальним рівнем експресії ЦОГ-2 та виразністю акантозу (r=0,712; p<001), що відбиває роль ЦОГ-2-індукованої продукції простагландину Е2 в морфогенезі ФЕП при інсулінорезистентності.
Отже, ФЕП пацієнтів з МС і ЦД2 характеризувалися більшою кількістю опасистих клітин у межах субепідермальної зони та виразною експресією ЦОГ-2 в епідермісі та клітинах дерми. Причому експресія індукованої форми ЦОГ-2 була пов’язана не тільки з виразністю запальної інфільтрації, а й з інтенсивністю проліферативних змін у зоні епідермо-дермальних взаємовідносин.
4.3 Оцінка експресії васкулоендотеліального фактора росту і кількості М2-макрофагів у фіброепітеліальних поліпах пацієнтів різних груп
Як відомо, ЦД2 та МС супроводжуються розвитком мікроангіопатії, що асоційоване з гіперпродукцією VEGF. Враховуючи описаний раніше феномен виразної васкуляризації ФЕП пацієнтів 2-3-ї груп, наступним кроком дослідження стала оцінка механізмів, пов’язаних з регуляцією ангіогенезу за участю VEGF і клітин-диригентів ремоделювання дерми, якими вважаються М2-макрофаги.
У ФЕП хворих 1-ї групи експресія VEGF в епідермісі була відсутньою, в окремих випадках визначалася слабка експресія в клітинах базального шару (рис. 4.10). Крім того, виразна експресія VEGF спостерігалася в нечисленних клітинах дерми. Вони мали відростчату форму та розташовувалися поблизу від судин. Численнішими VEGF-продукуючі клітини були в ділянках лімфогістіоцитарної інфільтрації.
У ФЕП пацієнтів 2-ї групи в більшості випадків визначалася позитивна експресія VEGF у межах епідермісу – переважно в межах базального та остистого шарів, більш виразна в ділянках акантозу. Водночас загальна інтенсивність експресії VEGF (враховуючи інтенсивність і розповсюдженість імуногістохімічної реакції) у хворих на МС була статистично значуще вищою за показник у контролі (рис. 4.11). Ще більш виразні відмінності були визначені щодо кількості VEGF-позитивних клітин у дермі (рис. 4.12).
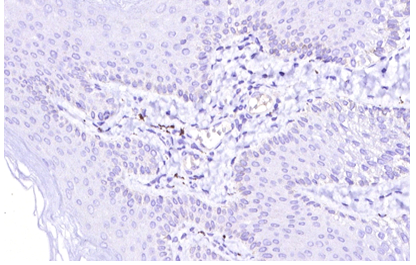 Рисунок 4.10 – Експресія VEGF у ФЕП пацієнтів 1-ї групи. Незначна кількість VEGF визначалася вздовж судин сосочкового
Рисунок 4.10 – Експресія VEGF у ФЕП пацієнтів 1-ї групи. Незначна кількість VEGF визначалася вздовж судин сосочкового
шару дерми. Імуногістохімічне дослідження з використанням моноклональних антитіл до VEGF. Зб. ×200.
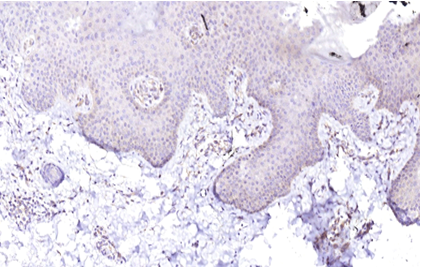 Рисунок 4.11 – Дифузійна експресія VEGF в епідермісі та численні помірно позитивні клітини в межах дерми ФЕП хворих 2-ї групи. Імуногістохімічне дослідження з використанням моноклональних антитіл до VEGF. Зб. ×200.
Рисунок 4.11 – Дифузійна експресія VEGF в епідермісі та численні помірно позитивні клітини в межах дерми ФЕП хворих 2-ї групи. Імуногістохімічне дослідження з використанням моноклональних антитіл до VEGF. Зб. ×200.
 Рисунок 4.12 – Вираженість експресії VEGF у межах епідермісу та дерми ФЕП пацієнтів різних груп: А – загальний рівень експресії VEGF
Рисунок 4.12 – Вираженість експресії VEGF у межах епідермісу та дерми ФЕП пацієнтів різних груп: А – загальний рівень експресії VEGF
в епідермісі, оцінений за її інтенсивністю та розповсюдженістю (total score). За віссю абсцис – групи пацієнтів, ординат – загальна оцінка експресії за total score (умовні одиниці); Б – кількість VEGF-позитивних клітин у дермі ФЕП. За віссю абсцис – групи пацієнтів, ординат – абсолютна кількість клітин
на 1 мм2.
При аналізі експресії VEGF у хворих 3-ї групи була визначена слабка або помірна експресія в межах епідермісу. Причому позитивна реакція визначалася переважно в кератиноцитах базального шару, як і в 2-й групі, експресія була більш вираженою в ділянках акантозу. Загальний рівень експресії VEGF у пацієнтів 3-ї групи був статистично значуще вищим, ніж у хворих 1-ї групи, проте статистично значуще не відрізнявся від показника 2-ї групи. Як і в 2-й групі, в дермі визначалася значна кількість помірно позитивних клітин, що переважали в ділянках інфільтрації вздовж кровоносних судин (рис. 4.13). Цікаво, що, на відміну від хворих 1-ї групи (де в клітинах дерми була зареєстрована інтенсивність експресії VEGF на рівні “3+”), у пацієнтів 2-ї та 3-ї груп інтенсивність експресії в клітинах дерми була помірною або слабкою, проте визначалася в значно більшій кількості клітин.
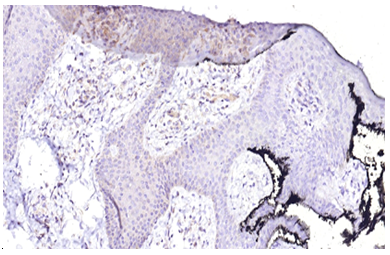 Рисунок 4.13 – Слабка експресія VEGF в епідермісі та помірна – в клітинах дерми сосочкового шару дерми ФЕП пацієнтів 3-ї групи. Імуногістохімічне дослідження з використанням моноклональних
Рисунок 4.13 – Слабка експресія VEGF в епідермісі та помірна – в клітинах дерми сосочкового шару дерми ФЕП пацієнтів 3-ї групи. Імуногістохімічне дослідження з використанням моноклональних
антитіл до VEGF. Зб. ×200.
Окрім субепідермальної зони, значна кількість VEGF-позитивних клітин визначалася в межах центральної частини ФЕП – у складі периваскулярних інфільтратів (рис. 4.14).
 Рисунок 4.14 – Численні помірно позитивні клітини в межах центральної частини ФЕП пацієнтів 3-ї групи. Імуногістохімічне забарвлення
Рисунок 4.14 – Численні помірно позитивні клітини в межах центральної частини ФЕП пацієнтів 3-ї групи. Імуногістохімічне забарвлення
з використанням моноклональних антитіл до VEGF. Зб. ×200.
Проведення кореляційного аналізу виявило наявність помірного кореляційного зв’язку між експресією VEGF та ЦОГ-2 в епідермісі (r=0,629; p<0,001). Водночас статистично значущого зв’язку між кількістю VEGF- та ЦОГ-2-позитивних клітин у дермі встановлено не було. Крім того, був відзначений помірний кореляцій зв’язок між чисельністю VEGF-позитивних клітин у дермі та кількістю опасистих клітин (r=0,403; p<0,001). Оскільки найбільш потужним джерелом продукції VEGF у дермі, крім опасистих клітин, є М2-макрофаги, наступним кроком дослідження стала оцінка їхніх кількості та просторового розподілу.
Вивчення чисельності та просторової орієнтації М2-макрофагів у пацієнтів 1-ї групи показало наявність незначної або помірної кількості CD163-позитивних клітин у межах ФЕП. У грибоподібних ФЕП М2-макрофаги переважно були розташовані навколо судин, значно менше – під епідермісом. У ФЕП, що мали ниткоподібну форму, в межах тонких виростів М2-макрофаги виявлялися не тільки навколо судин, але й уздовж епідермо-дермальної межі (рис. 4.15).
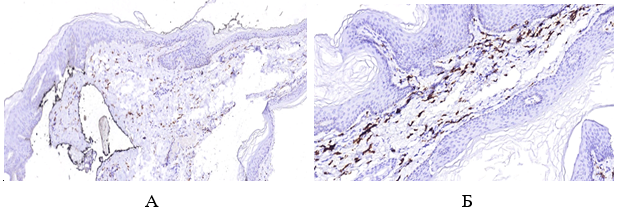 Рисунок 4.15 – Особливості просторового розподілу та чисельності М2-макрофагів у межах ФЕП пацієнтів 1-ї групи. Імуногістохімічне дослідження з використанням моноклональних антитіл до CD163. А – зб. ×100, Б – зб. ×200.
Рисунок 4.15 – Особливості просторового розподілу та чисельності М2-макрофагів у межах ФЕП пацієнтів 1-ї групи. Імуногістохімічне дослідження з використанням моноклональних антитіл до CD163. А – зб. ×100, Б – зб. ×200.
На відміну від вказаного, у хворих 2-ї групи була визначена значно більша кількість М2-макрофагів, що переважно спостерігалися в сосочковому шарі дерми, в меншій кількості – в межах центральної частини ФЕП (рис. 4.16).
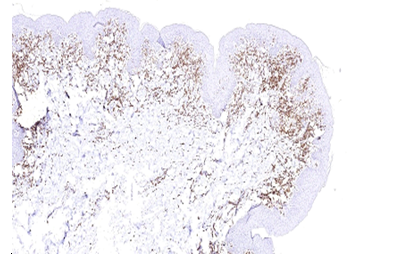 Рисунок 4.16 – Значна кількість та особливості просторового розподілу М2-макрофагів у межах ФЕП пацієнтів 2-ї групи. Імуногістохімічне дослідження з використанням моноклональних антитіл до СD163. Зб. ×50.
Рисунок 4.16 – Значна кількість та особливості просторового розподілу М2-макрофагів у межах ФЕП пацієнтів 2-ї групи. Імуногістохімічне дослідження з використанням моноклональних антитіл до СD163. Зб. ×50.
Окрім скупчень СD163-позитивних клітин у границях периваскулярних інфільтратів навколо судин поверхневого судинного сплетіння, численні М2-макрофаги виявлялися в межах вторинних сосочків дерми – безпосередньо на границі з епідермісом, а подекуди й у його межах. При достатньо високій щільності розташування клітини утворювали сітку, що об’єднувала в єдину мережу клітини периваскулярного та субепідермального пулів (рис. 4.17).
Ще чисельнішими були М2-макрофаги у ФЕП пацієнтів 3-ї групи (рис. 4.18). Їхня кількість в окремих поліпах була в 5-7 разів вищою за показник 1-ї групи та статистично значуще перевищувала дані 2-ї групи (р=0,05). Водночас М2-макрофаги були численними не тільки в субепідермальній зоні, а й у центральних ділянках поліпів (рис. 4.19).
 Рисунок 4.17 – Щільна сітка СD163-позитивних клітин у межах сосочкового шару дерми ФЕП. Імуногістохімічне дослідження з використанням моноклональних антитіл до СD163. Зб. ×100.
Рисунок 4.17 – Щільна сітка СD163-позитивних клітин у межах сосочкового шару дерми ФЕП. Імуногістохімічне дослідження з використанням моноклональних антитіл до СD163. Зб. ×100.
 Рисунок 4.18 – Кількість СD163-позитивних клітин у ФЕП пацієнтів різних груп. За віссю абсцис – групи пацієнтів, ординат – абсолютна кількість клітин на 1 мм2.
Рисунок 4.18 – Кількість СD163-позитивних клітин у ФЕП пацієнтів різних груп. За віссю абсцис – групи пацієнтів, ординат – абсолютна кількість клітин на 1 мм2.
Отже, згідно з результатами проведеного дослідження, ФЕП за умов МС та ЦД2 характеризувалися значно вищою кількістю СD163-позитивних клітин. Водночас кореляційний аналіз виявив помірний кореляційний зв’язок між кількістю М2-макрофагів та експресію ЦОГ-2 в дермі й епідермісі, чисельністю опасистих клітин та експресією VEGF (рис. 4.20).
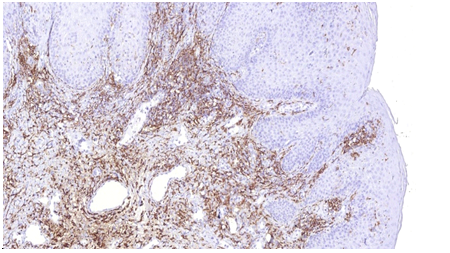 Рисунок 4.19 – Численні М2-макрофаги в межах центральної та субепідермальної зон ФЕП пацієнтів 3-ї групи. Імуногістохімічне дослідження з використанням моноклональних антитіл до СD163. Зб. ×100.
Рисунок 4.19 – Численні М2-макрофаги в межах центральної та субепідермальної зон ФЕП пацієнтів 3-ї групи. Імуногістохімічне дослідження з використанням моноклональних антитіл до СD163. Зб. ×100.
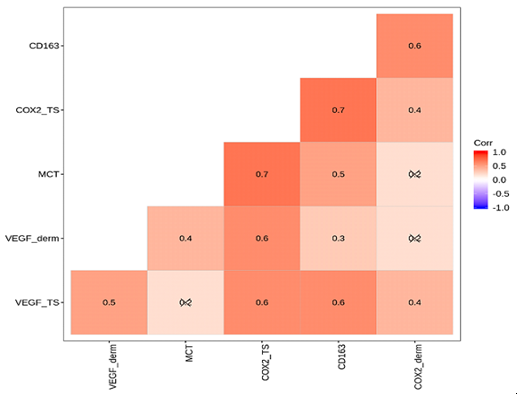 Рисунок 4.20 – Кореляційні зв’язки між чисельністю опасистих клітин, М2-макрофагів та експресією ЦОГ-2, VEGF в епідермісі та дермі ФЕП.
Рисунок 4.20 – Кореляційні зв’язки між чисельністю опасистих клітин, М2-макрофагів та експресією ЦОГ-2, VEGF в епідермісі та дермі ФЕП.
Результати проведеного дослідження свідчать про те, що формування ФЕП у пацієнтів 2-3-ї груп асоційоване з виразною активацією М2-макрофагів. Вірогідно, саме цей тип клітин відіграє провідну роль у посиленні ангіогенезу та проліферативних процесів у епідермісі та дермі.
Серед найбільш вірогідних механізмів порушення поляризації макрофагів може бути метаболічне репрограмування, яке насамперед пов’язують з підвищенням експресії mTOR. Для перевірки даної гіпотези була проведена оцінка експресії даного регулятора сигнальних шляхів у межах ФЕП шкіри в пацієнтів 1-3-ї груп.
4.4 Оцінка експресії мішені рапаміцину ссавціву фіброепітеліальних поліпах пацієнтів різних груп
Враховуючи асоціацію ФЕП з феноменом інсулінорезистентності, наступним кроком здійснили оцінку експресії mTOR у тканинах ФЕП пацієнтів різних груп. У 1-й групі вона визначила наявність слабкої позитивної реакції в межах епідермісу (рис. 4.21) – переважно в границях базального та частини остистого шару, що по суті відбиває просторову асоціацію між mTOR і процесом проліферації кератиноцитів. У межах дерми слабка позитивна реакція виявлялася в ділянках обмежених периваскулярних інфільтратів.
 Рисунок 4.21 – Експресія mTOR в епідермісі ФАП пацієнтів 1-ї групи. Імуногістохімічне дослідження з використанням моноклональних антитіл до mTOR. А – зб. ×20, Б – зб. ×100.
Рисунок 4.21 – Експресія mTOR в епідермісі ФАП пацієнтів 1-ї групи. Імуногістохімічне дослідження з використанням моноклональних антитіл до mTOR. А – зб. ×20, Б – зб. ×100.
На відміну від вказаного, у хворих 2-ї та 3-ї груп була відзначена помірна експресія mTOR в епідермісі – в межах базального остистого та зернистого шарів. Крім того, численні mTOR+ клітини визначалися в дермі, здебільшого в зонах периваскулярних інфільтратів і сосочковому шарі (рис. 4.22). Причому значна кількість mTOR+ клітин у сосочковому шарі дерми була асоційована з явищами акантозу та наявністю численних капілярів у межах сосочків поблизу від епідермо-дермальної межі.
 Рисунок 4.22 – Експресія mTOR в епідермісі та дермі ФЕП пацієнтів з МС (А, Б) і ЦД2 (В, Г). Позитивна реакція на mTOR була асоційована
Рисунок 4.22 – Експресія mTOR в епідермісі та дермі ФЕП пацієнтів з МС (А, Б) і ЦД2 (В, Г). Позитивна реакція на mTOR була асоційована
із зонами інфільтрації й активного ремоделювання дерми в зоні епідермо-дермальної межі. Імуногістохімічне дослідження
з використанням моноклональних антитіл до mTOR.
Серед mTOR-позитивних клітин визначалася слабка та помірна експресія в клітинах фібробластичного ряду. Крім того, поблизу епідермо-дермальної межі виявлялися окремі клітини з вираженою експресією mTOR.
Отже, інсулінорезистентність була асоційована зі зростанням експресії mTOR в епідермісі й up-регуляцією експресії mTOR у клітинах дерми поблизу від епідермо-дермального з’єднання. Це може відбивати роль метаболічного репрограмування клітин дерми (насамперед фібробластів) у ініціації процесів ремоделювання, асоційованих з підвищенням проліферації, ангіогенезу та запаленням.
Таким чином, проведені патогістологічні дослідження продемонстрували, що морфогенез ФЕП на тлі МС та ЦД2 має певні особливості, що передусім стосуються зміни епідермо-дермальних взаємовідносин і механізмів ремоделювання тканин, супроводжуються виразними відмінностями ангіогенезу та запальної інфільтрації. Розвиток ФЕП при МС та ЦД2 асоційований зі зростанням кількості опасистих клітин і ще більшою мірою – М2-макрофагів на тлі посилення експресії mTOR, ЦОГ-2 та VEGF.
Основні результати даного розділу висвітлено в наступних публікаціях:
- Літус ІО. Експресія М2-макрофагів, mTOR-позитивних клітин та VEGF у межах фіброепітеліальних поліпів шкіри у пацієнтів із метаболічним синдромом та цукровим діабетом 2-го типу. Укр. мед. часопис. 2020;(2 Т 2):43-8 [21].
- Літус ІО, Свістунов ІВ. Особливості гістологічної будови рецидивуючих фіброепітеліальних поліпів шкіри у хворих з метаболічним синдромом та цукровим діабетом 2-го типу. Україна. Здоров’я нації. 2020;2(59):137-41 [22].
- Літус ІО. Оцінка експресії опасистих клітин та СОХ2 в межах фіброепітеліальних поліпів шкіри у пацієнтів з метаболічним синдромом та цукровим діабетом 2 типу. В: Зб. тез наук. робіт учасників міжнар. наук.-практ. конф. Медична наука та практика в умовах сучасних трансформаційних процесів; 2020 Квіт 24-25; Львів. Львів: ГО «Львів. мед. спільнота»; 2020. С. 46-9 [23].
- Літус ІО. Оцінка експресії опасистих клітин та СОХ2 в межах фіброепітеліальних поліпів шкіри у пацієнтів з метаболічним синдромом та цукровим діабетом 2 типу. Здоров’я суспільства. 2020; 9(1): 6-12 [24].
5 ПРОГНОЗУВАННЯ РЕЦИДИВІВ ФІБРОЕПІТЕЛІАЛЬНИХ ПОЛІПІВ ШКІРИ. ВПЛИВ МЕТАБОЛІЧНОЇ ТЕРАПІЇ
5.1 Кореляційний і лінійний множинний регресійний аналіз як інструмент для прогнозування рецидивів фіброепітеліальних поліпів шкіри
Для розуміння асоціації між показниками клініко-інструментального обстеження, ліпідного обміну, метаболізму глюкози й імуногістохімічного дослідження ФЕП шкіри необхідно було провести кореляційний аналіз, що дозволить встановити причинно-наслідкові зв’язки.
Спочатку потрібно було з’ясувати зв’язок між кількістю ФЕП, рецидивами ФЕП та показниками інструментального обстеження (табл. 5.1).
Таблиця 5.1 – Кореляційний аналіз показників інструментального обстеження
| Показники | Кількість ФЕП шкіри | Кількість рецидивів ФЕП за останні 2 роки |
| Кількість ФЕП шкіри | – | 0,837
p<0,001 |
| Кількість рецидивів ФЕП за останні 2 роки | 0,837
p<0,001 |
– |
| Вік, роки | 0,081
p=0,354 |
0,079
p=0,365 |
| Вага, кг | 0,227
p=0,009 |
0,143
p=0,100 |
| ІМТ | 0,252
p=0,004 |
0,170
p=0,051 |
| Окружність талії, см | 0,258
p=0,003 |
0,190
p=0,028 |
Згідно з отриманими результатами було встановлено, що збільшення кількості ФЕП мало сильний позитивний кореляційний зв’язок (0,837; p<0,001) з кількістю рецидивів ФЕП шкіри. Зростання ваги (0,227; p=0,009), окружності талії (0,258; p=0,00) та ІМТ (0,252; p=0,004) мало позитивний кореляційний зв’язок з чисельністю ФЕП шкіри. Зі свого боку значення кількості рецидивів ФЕП за останні 2 роки позитивно корелювало тільки з показниками окружності талії (0,190; p=0,028).
Значення тригліцеридів і коефіцієнта атерогенності (табл. 5.2) мали слабкий достовірний позитивний кореляційний зв’язок з кількістю ФЕП шкіри та їхніми рецидивами. Коливання значень ЛПНЩ мали слабкий позитивний кореляційний зв’язок (0,218; p=0,012) тільки з кількістю ФЕП шкіри. Водночас рівень загального холестерину достовірно не корелював з показниками ФЕП. Зі свого боку був встановлений негативний слабкий кореляційний зв’язок між ЛПВЩ та показниками ФЕП. Цікаво, що був визначений найсильніший позитивний кореляційний зв’язок ЛПДНЩ з показниками ФЕП шкіри.
Таблиця 5.2 – Кореляційний аналіз показників ліпідного обміну
| Показники | Кількість ФЕП шкіри | Кількість рецидивів ФЕП за останні 2 роки |
| Холестерин загальний, ммоль/л | 0,160
p=0,066 |
0,092
p=0,292 |
| Тригліцериди, ммоль/л | 0,207
p=0,017 |
0,202
p=0,020 |
| ЛПВЩ, ммоль/л | -0,219
p=0,011 |
-0,254
p=0,003 |
| ЛПНЩ, ммоль/л | 0,218
p=0,012 |
0,112
p=0,198 |
| ЛПДНЩ, ммоль/л | 0,530
p<0,001 |
0,520
p<0,001 |
Продовження таблиці 5.2
| Показники | Кількість ФЕП шкіри | Кількість рецидивів ФЕП за останні 2 роки |
| Коефіцієнт атерогенності | 0,240
p=0,005 |
0,252
p=0,003 |
При проведенні кореляційного аналізу показників діабетичної панелі (табл. 5.3) було встановлено, що рівні глюкози, глікозильованого гемоглобіну, інсуліну та С-пептиду мали позитивні достовірні кореляційні зв’язки з показниками ФЕП шкіри. Для динаміки лептину достовірних кореляційних зв’язків встановлено не було. Для індексу HOMA-IR був визначений найсильніший позитивний кореляційний зв’язок як з кількістю ФЕП (0,724; p<0,001), так і з чисельністю рецидивів поліпів шкіри (0,633; p<0,001).
Таблиця 5.3 – Кореляційний аналіз показників діабетичної панелі
| Показники | Кількість ФЕП шкіри | Кількість рецидивів ФЕП за останні 2 роки |
| Глюкоза в крові, ммоль/л | 0,370
p<0,001 |
0,385
p<0,001 |
| Глікозильований гемоглобін, % | 0,244
p=0,005 |
0,235
p=0,007 |
| Інсулін, mIU/ml | 0,687
p<0,001 |
0,585
p<0,001 |
| С-пептид, нг/мл | 0,277
p=0,001 |
0,229
p=0,008 |
| Індекс HOMA-IR, % | 0,724
p<0,001 |
0,633
p<0,001 |
| Лептин, нг/мл | 0,133
p=0,128 |
0,133
p=0,197 |
Заключним етапом став кореляційний аналіз показників імуногістохімічного дослідження (табл. 5.4).
Таблиця 5.4 – Кореляційний аналіз показників імуногістохімічного дослідження
| Показники | Кількість ФЕП шкіри | Кількість рецидивів ФЕП за останні 2 роки |
| Кількість МСТ-позитивних клітин | 0,707
p<0,001 |
0,676
p<0,001 |
| Кількість СD163-позитивних клітин | 0,239
p=0,067 |
0,197
p=0,094 |
| Кількість mTOR-позитивних клітин | 0,118
p=0,114 |
0,127
p=0,219 |
| Кількість VEGF-позитивних клітин | 0,118
p=0,114 |
0,174
p=0,139 |
| Кількість ЦОГ-2-позитивних клітин | 0,195
p=0,162 |
0,137
p=0,206 |
Динаміка змін кількості СD163-, mTOR-, VEGF-, ЦОГ-2-позитивних клітин не виявила достовірного кореляційного зв’язку з показниками ФЕП шкіри. Зі свого боку збільшення чисельності МСТ-позитивних клітин позитивно корелювало з кількістю ФЕП шкіри та їхніми рецидивами.
Отже, узагальнюючи результати проведеного кореляційного аналізу, можна зробити висновок, що чисельність ФЕП і частота їхніх рецидивів тісно пов’язані з підвищенням концентрації ЛПДНЩ, значень індексу HOMA-IR і вмісту MCT-позитивних клітин у субстраті поліпів.
Встановлені сильні зв’язки між даними показниками, очевидно, можуть використовуватися для прогнозування рецидивів ФЕП шкіри. Для підтвердження таких тлумачень необхідно було провести лінійний регресійний статистичний аналіз. Він (табл. 5.5) встановив коефіцієнт константи на рівні -0,264. Водночас стандартизовані коефіцієнти В для ЛПДНЩ склали 0,345; індексу НОМА – 0,345; МСТ-позитивних клітин – 0,403.
Таблиця 5.5 – Коефіцієнти лінійної регресії. Залежна змінна – кількість рецидивів ФЕП шкіри
| Модель | Нестандарти-зовані коефіцієнти В | Помилка стандарти-зації | Стандартизо-вані коефіцієнти В | t | p | 95,0 % ДІ |
| Константа | -0,264 | 0,307 | – | -0,859 | 0,392 | -0,871-0,344 |
| ЛПДНЩ | 2,049 | 0,338 | 0,345 | 6,058 | 0,000 | 1,380-2,719 |
| Індекс HOMA | 0,061 | 0,010 | 0,330 | 5,916 | 0,000 | 0,041-0,082 |
| МСТ-позитивні клітини | 0,025 | 0,04 | 0,403 | 6,503 | 0,000 | 0,018-0,033 |
Для прогнозування рецидивів ФЕП була виведена наступна математична формула з включенням коефіцієнтів регресії:
Y=-0,264+2,049*X1+0,061*X2+0,025*X3,
де Y – середня кількість рецидивів ФЕП шкіри за останні 2 роки;
Х1 – рівень ЛПДНЩ (ммоль/л);
Х2 – індекс НОМА-IR (%);
Х3 – кількість МСТ-позитивних клітин (клітин на 1 мм2).
За допомогою шкали Score (рис. 5.1) можна прогнозувати ризик розвитку рецидивів у пацієнтів з множинними рецидивуючими ФЕП шкіри. Оцінка складається з 3-х етапів: на 1-му необхідно визначити кількість опасистих клітин у поліпі (від 0 до 45; від 46 до 75; від 76 до 105; від 106 до 135; від 136-165 клітин на см2); 2-му – значення індексу НОМА (від 1,5 до 12 %); 3-му – концентрацію ЛПДНЩ (від 0,2 до 1,5 ммоль/л). Після встановлення даних віднайти в таблиці значення, що буде відповідати ймовірності розвитку рецидивів ФЕП шкіри в найближчі 2 роки.
Наприклад, у пацієнта А за результатами аналізу було встановлено: рівень опасистих клітин – 110 на см2; індекс НОМА – 12 %; концентрація ЛПДНЩ – 1,5 ммоль/л. Відповідно до шкали Score кількість рецидивів у найближчі 2 роки буде становити 6,92, майже 7.
Отже, проведені кореляційний і регресійний аналізи допомогли встановити предиктори рецидивування ФЕП шкіри. Шкала Score для прогнозування рецидивів ФЕП шкіри може використовуватися в практиці лікаря-дерматолога, що дозволить передбачити появу нових ФЕП та оптимізувати профілактику.
Враховуючи встановлений тісний зв’язок між частотою рецидивування ФЕП шкіри та ліпідним обміном, перспективним є вивчення впливу препаратів, що здатні нормалізувати ліпідний обмін. До них відносяться інгібітори 3 гідрокси-3 метилглутарил-КоА-редуктази.
У рамках проведеної роботи дисліпідемія, виявлена в пацієнтів з ФЕП шкіри та МС, потребувала корекції. Для визначення впливу симвастатину на частоту рецидивів ФЕП було здійснене відкрите рандомізоване дослідження.
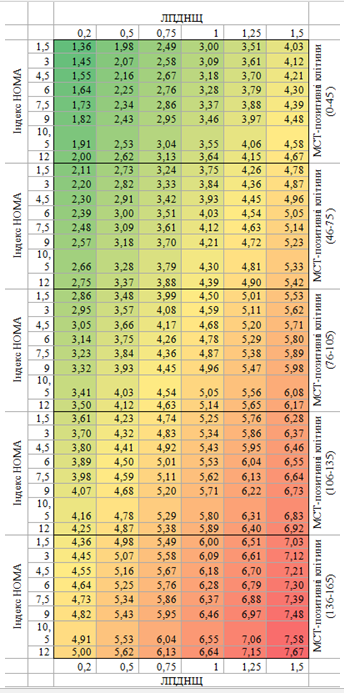 Рисунок 5.1 – Шкала Score для прогнозування рецидивів ФЕП шкіри.
Рисунок 5.1 – Шкала Score для прогнозування рецидивів ФЕП шкіри.
5.2 Вплив симвастатину на частоту рецидивів фіброепітеліальних поліпів у пацієнтів з метаболічним синдромом
На попередньому етапі роботи при проведенні кореляційного та регресійного аналізів було виявлено, що висока концентрація ЛПДНЩ, індекс НОМА та вміст MCT-позитивних клітин асоціюються зі збільшеним ризиком рецидивування ФЕП шкіри.
При проведенні відкритого рандомізованого дослідження щодо впливу симвастатину на частоту рецидивів ФЕП у пацієнтів з МС міркування були сфокусовані на порівнянні кількості рецидивів і видалень ФЕП. Додатково вивчали вплив цього препарату на динаміку показників, що були визначені при проведенні регресійного аналізу.
У дослідженні взяли участь 45 пацієнтів з МС. Учасники дослідження були рандомізовані на дві групи: до 1-ї (МС) увійшли 24 особи, які не отримували симвастатин; 2-га (МС+симвастатин) включала 25 учасників, які одержували симвастатин у дозі 20 мг на добу протягом 12 місяців.
Середній вік пацієнтів у групі МС ([48,0 ± 11,5] року) достовірно не відрізнявся (р=0,156) від групи МС + симвастатин ([42,8 ± 13,5] року). Кількість жінок і чоловіків у досліджуваних групах (МС: жінок – 13, чоловіків – 11; МС + симвастатин: жінок – 14, чоловіків – 11) достовірно не різнилася (p=0,872).
Зріз досліджуваних показників здійснювався під час рандомізації (день 0), на 6-й і 12-й місяці.
Результати, представлені в табл. 5.6, свідчать про те, що прийом симвастатину протягом 6 місяців достовірно знижує (p<0,002) кількість рецидивів ФЕП. При порівнянні досліджуваних груп на 12-й місяць була виявлена аналогічна статистична картина. Крім того, в групі МС+симвастатин кількість рецидивів достовірно знижувалася (р<0,001) у період з 6-го по 12-й місяці. Для групи МС достовірних відмінностей (р=0,207) у період дослідження виявлено не було.
Таблиця 5.6 – Кількість рецидивів ФЕП при МС
| Групи | Тривалість, місяці | ||
| 6-й місяць | 12-й місяць | p1 | |
| МС (n=24) | 3,63 ± 1,47 | 3,38 ± 1,38 | 0,207 |
| МС + симвастатин (n=25) | 2,32 ± 1,31 | 1,40 ± 1,29 | <0,001 |
| p2 | 0,002 | <0,001 | |
Примітка. p1 – порівняння середніх двох зв’язаних вибірок, критерій Стьюдента;
p2 – порівняння середніх двох незалежних вибірок, критерій Стьюдента.
Призначення симвастатину також достовірно знижувало (р<0,001) кількість видалень ФЕП шкіри (табл. 5.7). При порівнянні груп на 6-й і 12-й місяці було виявлене достовірне зменшення кількості видалень ФЕП у групі МС+симвастатин. У групі МС достовірних відмінностей за період дослідження виявлено не було (р=0,627).
Таблиця 5.7 – Кількість видалених ФЕП при МС
| Групи | Тривалість, місяці | ||
| 6-й місяць | 12-й місяць | p1 | |
| МС | 2,63 ± 1,35 | 2,71 ± 1,57 | 0,627 |
| МС + симвастатин | 1,64 ± 0,86 | 0,88 ± 0,97 | <0,001 |
| p2 | 0,004 | <0,001 | |
Примітка. p1 – порівняння середніх двох зв’язаних вибірок, критерій Стьюдента; p2 – порівняння середніх двох незалежних вибірок, критерій Стьюдента.
Вплив симвастатину на концентрацію ЛПДНЩ відповідав механізму дії препарату. Зниження ЛПДНЩ було достовірним (p<0,05) вже на 6-й місяць, хоча на 12-й воно вже не відбувалося (табл. 5.8). У групі МС достовірних відмінностей зафіксовано не було.
Динаміка індексу HOMА-IR виявилася недостовірною (табл. 5.9). Для груп МС і МС+симвастатин достовірних відмінностей у день рандомізації, на 6-й і 12-й місяці встановлено не було. Призначення симвастатину не мало впливу на метаболізм глюкози.
Таблиця 5.8 – Динаміка ЛПДНЩ при МС, ммоль/л
| Групи | День 0, рандомізація | 6-й місяць | 12-й місяць | p1 |
| МС | 0,87 ± 0,37 | 0,96 ± 0,35 | 0,91 ± 0,31 | 0,694 |
| МС + симвастатин | 0,95 ± 0,41 | 0,41 ± 0,24* | 0,41 ± 0,19# | <0,001 |
| p2 | 0,451 | <0,001 | <0,001 |
Примітка. p1 – достовірність при множинному порівнянні; p2 – достовірність між групами; * – достовірність показників у день 0 і 6-й місяць p<0,05; # – достовірність показників у день 0 і 12-й місяць p<0,05.
Таблиця 5.9 – Динаміка індексу HOMA-IR при МС, %
| Групи | День 0, рандомізація | 6-й місяць | 12-й місяць | p1 |
| МС | 3,88
2,92-5,99 |
4,31
3,26-5,39 |
4,25
2,72-5,64 |
0,979 |
| МС + симвастатин | 4,80
2,89-5,29 |
4,14
3,17-4,94 |
3,23
2,57-4,26 |
0,388 |
| p2 | 0,842 | 0,928 | 0,418 |
Примітка. p1 – достовірність при множинному порівнянні; p2 – достовірність між групами.
Кількість МСТ-позитивних клітин (табл. 5.10) достовірно знижувалася (р<0,001) у групі МС + симвастатин. Хоча на 12-й місяць вміст опасистих клітин у групі МС + симвастатин був нижчим порівняно з 6-м, ці зміни були недостовірними. Концентрація вказаних клітин (р=0,838) у динаміці спостереження в групі МС достовірно не відрізнялася.
Таблиця 5.10 – Динаміка кількості МСТ-позитивних клітин, клітин на 1 мм2
| Групи | День 0, рандомізація | 6-й місяць | 12-й місяць | p1 |
| МС | 94,99 ± 33,64 | 89,31 ± 31,59 | 91,39 ± 34,91 | 0,838 |
| МС+симвастатин | 96,61 ± 38,18 | 63,73 ± 26,05* | 59,19 ± 24,89# | <0,001 |
| p2 | 0,875 | 0,004 | 0,001 |
Примітка. p1 – достовірність при множинному порівнянні; p2 – достовірність між групами; * – достовірність показників у день 0 і 6-й місяць p<0,05; # – достовірність показників у день 0 і 12-й місяць p<0,05.
Отже, результати проведеного пілотного відкритого дослідження свідчать про позитивний вплив симвастатину на частоту рецидивування та видалень ФЕП шкіри. Зі свого боку зниження частоти рецидивування та видалень ФЕП асоціюється зі зменшенням у крові концентрації ЛПДНЩ та вмісту МСТ-позитивних клітин у субстраті поліпа.
Також було встановлено, що найбільшу кількість ФЕП шкіри та їх рецидивування мали пацієнти з ЦД2. Враховуючи виявлені позитивні ефекти симвастатину та відомі антипроліферативні властивості метформіну щодо формування поліпів шкіри, наступним етапом роботи стало порівняння впливу двох комбінацій препаратів (метформін/симвастатин проти піоглітазон/симвастатин) на частоту рецидивів ФЕП шкіри у хворих на ЦД2.
5.3 Порівняння впливу двох комбінацій препаратів (метформін/симвастатин проти піоглітазон/симвастатин) на частоту рецидивів фіброепітеліальних поліпів шкіри в пацієнтів із цукровим діабетом 2-го типу
На заключному етапі роботи було проведене пілотне відкрите рандомізоване дослідження «Порівняння впливу двох комбінацій препаратів (метформін/симвастатин проти піоглітазон/симвастатин) на частоту рецидивів ФЕП шкіри в пацієнтів із ЦД2».
У ньому взяли участь 22 хворих на ЦД2. Учасники дослідження були рандомізовані на дві групи: до 1-ї увійшли 11 пацієнтів, які отримували комбінацію метформін/симвастатин протягом 12-ти місяців; до 2-ї також були включені 11 осіб, які одержували комбінацію піоглітазон/симвастатин впродовж 12-ти місяців.
Симвастатин призначався в дозі 20 мг на добу, метформіну гідрохлорид – 500 мг 3 рази на добу, піоглітазону гідрохлорид – 30 мг 1 раз на добу.
Середній вік пацієнтів у групі метформін/симвастатин ([52,3 ± 7,9] року) достовірно не відрізнявся (р=0,728) від групи піоглітазон/симвастатин ([51,1 ± 7,8] року). Кількість жінок і чоловіків у досліджуваних групах (метформін/симвастатин: чоловіків – 5, жінок – 6; піоглітазон/симвастатин: чоловіків – 7, жінок – 4) достовірно не різнилася (р=0,669).
Досліджувані параметри оцінювали під час рандомізації (день 0), на 6-й і 12-й місяці.
У пацієнтів обох груп кількість рецидивів ФЕП достовірно зменшувалася (р<0,001) протягом 12-ти місяців лікування (табл. 5.11). При порівнянні груп між собою було встановлено, що в осіб, які приймали метформін/симвастатин, чисельність рецидивів на 6-й і 12-й місяці була достовірно меншою.
Частота видалень ФЕП у групах метформін/симвастатин і піоглітазон/симвастатин (табл. 5.12) протягом лікування достовірно не змінювалася. Хоча частота видалень у групі метформін/симвастатин на 6-й (р<0,001) і 12-й (р=0,016) місяці дослідження була достовірно нижчою.
Таблиця 5.11 – Кількість рецидивів ФЕП при ЦД2
| Групи | 6-й місяць | 12-й місяць | p1 |
| ЦД2 (метформін/симвастатин) (n=11) | 4,00 ± 1,41 | 2,36 ± 0,81 | 0,001 |
| ЦД2 (піоглітазон/симвастатин) (n=11) | 5,91 ± 1,14 | 4,55 ± 1,21 | <0,001 |
| p2 | 0,003 | <0,001 |
Таблиця 5.12 – Кількість видалених ФЕП при ЦД2
| Групи | 6-й місяць | 12-й місяць | p1 |
| ЦД2 (метформін/симвастатин) (n=11) | 2,09 ± 0,83 | 2,00 ± 1,00 | 0,724 |
| ЦД2 (піоглітазон/симвастатин) (n=11) | 3,64 ± 0,92 | 3,09 ± 0,94 | 0,052 |
| p2 | <0,001 | 0,016 |
Концентрація ЛПДНЩ (табл. 5.13) в обох групах протягом 12-ти місяців лікування достовірно знижувалася. Хоча зменшення ЛПДНЩ на 12-й місяць у групі метформін/симвастатин було достовірно нижчим (р=0,043) порівняно з групою піоглітазон/симвастатин.
Таблиця 5.13 – Динаміка ЛПДНЩ при ЦД2, ммоль/л
| Групи | День 0, рандомізація | 6-й місяць | 12-й місяць | p1 |
| ЦД2 (метформін/симвастатин) (n=11) | 0,92 ± 0,21 | 0,53 ± 0,17* | 0,32 ± 0,13#,& | <0,001 |
| ЦД2 (піоглітазон/симвастатин) (n=11) | 0,76 ± 0,27 | 0,57 ± 0,22 | 0,44 ± 0,13 | 0,005 |
| p2 | 0,141 | 0,683 | 0,043 |
Примітка. p1 – достовірність при множинному порівнянні; p2 – достовірність між групами; * – достовірність показників у день 0 і 6-й місяць p<0,05, # – достовірність показників у день 0 і 12-й місяць p<0,05; & – достовірність показників у 6-й і 12-й місяці p<0,05.
Зниження індексу HOMA-IR (табл. 5.14) було поступовим. Тільки на 12-й місяць його зменшення було достовірним як для
групи метформін/симвастатин, так і піоглітазон/симвастатин. Хоча значення індексу в групі метформін/симвастатин (4,66 ± 1,70) було достовірно нижчим (р=0,022) порівняно з піоглітазон/симвастатин (7,86 ± 3,76).
Таблиця 5.14 – Динаміка індексу HOMA-IR при ЦД2, %
| Групи | День 0, рандомізація | 6-й місяць | 12-й місяць | p1 |
| ЦД2 (метформін/симвастатин) (n=11) | 15,69 ± 14,64 | 9,84 ± 7,82 | 4,66 ± 1,70# | 0,040 |
| ЦД2 (піоглітазон/симвастатин) (n=11) | 14,60 ± 7,11 | 10,39 ± 4,43 | 7,86 ± 3,76# | 0,019 |
| p2 | 0,827 | 0,840 | 0,022 |
Примітка. p1 – достовірність при множинному порівнянні; p2 – достовірність між групами; # – достовірність показників у день 0 і 12-й місяць p<0,05.
При множинному порівнянні кількості МСТ-позитивних клітин (табл. 5.15) були виявлені наступні зміни: їхня чисельність достовірно знижувалася в обох групах; для пацієнтів групи метформін/симвастатин зменшення було достовірним на 6-й і 12-й місяці лікування; у групі піоглітазон/симвастатин достовірне зниження було зафіксоване тільки на 12-й місяць. При порівнянні груп між собою було встановлено, що у хворих, які отримували комбінацію метформін/симвастатин, спостерігалося достовірне зменшення кількості МСТ-позитивних клітин на 6-й (р=0,032) і 12-й (р=0,001) місяці порівняно з групою піоглітазон/симвастатин.
Таблиця 5.15 – Динаміка кількості МСТ-позитивних клітин при ЦД2, клітин на 1 мм2
| Групи | День 0, рандомізація | 6-й місяць | 12-й місяць | p1 |
| ЦД2 (метформін/симвастатин) (n=11) | 120,35 ± 20,44 | 50,55 ± 12,35* | 28,38 ± 7,16#,& | <0,001 |
| ЦД2 (піоглітазон/симвастатин) (n=11) | 103,93 ± 39,64 | 72,36 ± 27,69 | 54,60 ± 19,56# | 0,002 |
| p2 | 0,241 | 0,032 | 0,001 |
Примітка. p1 – достовірність при множинному порівнянні; p2 – достовірність між групами; * – достовірність показників у день 0 і 6-й місяць p<0,05, # – достовірність показників у день 0 і 12-й місяць p<0,05; & – достовірність показників у 6-й і 12-й місяці p<0,05.
Отже, аналізуючи результати проведеного дослідження, можна зробити висновок, що призначення комбінації метформін/симвастатин порівняно з піоглітазон/симвастатин значно знижує частоту рецидивування та видалень ФЕП шкіри, зменшує концентрацію ЛПДНЩ, індексу НОМА-IR і МСТ-позитивних клітин у субстраті ФЕП шкіри.
Основні результати даного розділу висвітлено в наступній публікації:
- Літус ІО. Асоціація множинних рецидивних фіброепітеліальних поліпів шкіри з ліпідним обміном в українській популяції. Дерматологія та венерологія. 2019;(4):27-9 [20].
6 АНАЛІЗ ТА УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
У дослідженні були вивчені 133 пацієнти з ФЕП шкіри, зокрема 65 жінок і 68 чоловіків. Середній вік пацієнтів складав (45,93 ± 11,94) року. Були ідентифіковані 931 ФЕП шкіри, що в середньому становило 7 поліпів на 1-го хворого. Кількість рецидивів за останні 2 роки коливалася в діапазоні від 2 до 9. ФЕП шкіри переважно локалізувалися на шиї, обличчі, тулубі та ділянках складок.
Отримані дані частково співпадають з дослідженням A. Rasi та співавт. (2014) [91] з включенням 168 пацієнтів, де результати показали найчастішу локалізацію шкірних ФЕП на ділянках шиї та верхньої частини грудної клітки, пахвових складках.
Дослідження в індійській популяції показали, що поширеність діабету, гіпертонії та МС була значно вищою у хворих на ФЕП шкіри, а ризик розвитку МС був у 11,13 раза більшим порівняно з контролем (Р<0,05). Багатоваріантний логістичний регресійний аналіз виявив високу окружність талії та низький рівень ЛПВЩ в сироватці крові, що суттєво асоціювався з ФЕП шкіри [111].
Ще в одному дослідженні реєстрували фототип і масу тіла. Зразки крові були проаналізовані на холестерин, ЛПНЩ, ЛПВЩ, тригліцериди, глюкозу та тиреотропний гормон. Результати статистичного аналізу показали, що пацієнти, які страждали на надмірну вагу зі шкірою III типу за Fitzpatrick, чорним акантозом і гіпотиреозом, мали більше шансів на наявність декількох ФЕП шкіри порівняно з особами з нормальною вагою та I фототипом шкіри. Багатоваріантний аналіз продемонстрував достовірний зв’язок між гіперхолестеринемією та ФЕП шкіри. Також більшість пацієнтів з ФЕП шкіри мали гіпотиреоз [86].
Автори іншого дослідження поставили перед собою мету оцінити частоту гіпертонії, дисліпідемії, інсулінорезистентності й ожиріння у хворих на ФЕП шкіри, порівняти пацієнтів зі здоровими особами щодо резистентності до інсуліну, концентрації сироваткових ліпідів, інсуліну, глюкози, лептину, СРБ, рівня вільних жирних кислот. Були оцінені 113 пацієнтів з ФЕП шкіри та 31 здорова людина. Дві групи порівнювали щодо ІМТ, ліпідного профілю, АТ, інсулінорезистентності, сироваткових ліпідів, інсуліну, глюкози, лептину, високочутливого СРБ, вільних жирних кислот, оцінки індексу HOMA-IR. Усього 53,9 % і 33,6 % пацієнтів зі шкірними ФЕП мали надмірну вагу й ожиріння відповідно. Частота гіпертонії була виявлена на рівні 30,1 %, дисліпідемії – 59,3 %, резистентності до інсуліну – 21,2 %. Показники HOMA-IR (p<0,001), глюкози в сироватці крові (p<0,001), інсуліну (p=0,002), високочутливого СРБ (p=0,001), сечової кислоти (p=0,001), вільних жирних кислот (p=0,002), рівня HbA1c (p<0,001), загального холестерину (p=0,018), ЛПНЩ (p=0,023), тригліцеридів (p=0,001) були вищими в пацієнтів зі шкірними ФЕП порівняно з контролем. У хворих на ФЕП шкіри спостерігалися надмірна вага й/або ожиріння, дисліпідемія, гіпертонія, резистентність до інсуліну та підвищений високочутливий СРБ [98]. Отже, шкірні ФЕП можуть бути маркером підвищеного ризику атеросклерозу та серцево-судинних захворювань. Схожі результати були отримані ще в одній роботі. До цього дослідження були залучені 192 пацієнти, які мали хоча б один ФЕП шкіри, та 104 контрольних особи. Були проаналізовані показники ІМТ, окружності талії, АТ, загального холестерину, тригліцеридів, ліпопротеїдів холестерину низької щільності та ліпопротеїдів високої щільності. Було проведене пероральне тестування на толерантність до глюкози. Кількість ФЕП шкіри була менше 10 в 77,1 % випадків. Найчастішою локалізацією була шия (72,4 %). Акрохордони менше 3 мм були в 64,1 % випадків. Гіпертонія, діабет і МС були частішими в пацієнтів з акрохордонами порівняно з контролем. Хворі на ФЕП шкіри мали більші значення ІМТ, вищі рівні холестерину, тригліцеридів і ЛПНЩ, значно нижчі рівні ЛПВЩ порівняно з контрольною групою. За даними регресійного аналізу кількість акрохордонів зростала в пацієнтів з вищими значеннями ІМТ, рівнем холестерину та ЛПНЩ, нижчим рівнем ЛПВЩ [34]. ЦД і предіабетичний стан пов’язані з низкою шкірних проявів. Результати проведеного в 2017 році системного огляду з аналізом 34 оригінальних статей вказують на зв’язок розвитку ЦД2 з появою на шкірі чорного акантозу, ФЕП і бульозного діабетикоруму [40]. ФЕП шкіри – це доброякісні новоутворення сполучної тканини, в яких ІФР-1 має мітогенну й антиапоптотичну активність. В одному з досліджень були вперше вивчені можлива роль поліморфізмів генів ІФР-1 (CA) 19, rs6214 і його тканинна імунореактивність у патогенезі ФЕП шкіри. Дослідження включало 40 пацієнтів з ФЕП шкіри та 20 волонтерів контрольної групи. Було встановлено, що імунореактивність ІФР-1 у видалених ФЕП має сильну регуляцію в епідермісі (p=0,002) та шкірних компонентах (ендотеліальні клітини (p=0,038) і фібробласти (p=0,004)) порівняно з контролем. Генотипи ТТ і СТ rs6214, його алель Т були суттєво пов’язані з ФЕП шкіри (р=0,006 і р=0,002 відповідно) [54]. Вважається, що зниження рівнів ендокринних, гормональних та інших факторів відіграє роль в еволюції ФЕП шкіри. Лептин – це гормон, що походить від адипоцитів і діє як основний регуляторний гормон для прийому їжі та гомеостазу енергії. Дефіцит або резистентність до лептину може призвести до глибокого ожиріння та діабету в людини. Автори одного з досліджень поставили завдання дослідити роль лептину в патогенезі ФЕП шкіри й уточнити, чи існує кореляція між кількістю опасистих клітин і рівнем лептину при ФЕП шкіри. У 15 пацієнтів з ФЕП шкіри були взяті 45 біопсій. У кожного хворого були отримані біопсія великого ФЕП (довжина >4 мм), невеликого поліпа (довжина <2 мм) та нормальна біопсія шкіри (як контроль). Зразки обробляли на рівень лептину. Шкірні біопсії фарбували гематоксиліном та еозином, використовували метахроматичний метод толуїдину синьо-уранілітрат нітрату для підрахунку опасистих клітин. Результати показали підвищений рівень лептину у ФЕП шкіри порівняно зі звичайною шкірою. Рівень у малих поліпів був достовірно вищим порівняно з великими (p=0,0001). Спостерігалося достовірне збільшення кількості опасистих клітин у ФЕП шкіри, що не співвідносилося з підвищенням рівня лептину [50].
Лептин також пов’язаний з диференціацією клітин, проліферацією, міграцією та виживаністю з вираженим впливом на ангіогенез, кровоток і перфузію тканин. Одна з робіт була спрямована на дослідження можливої ролі лептину в патогенезі ФЕП шкіри та співвіднесення його експресії з різними клінічними та гістопатологічними параметрами. Використовуючи імуногістохімічні методи, обстежили 90 осіб. Лептин був надмірно вираженим у ФЕП порівняно з нормальною шкірою (р<0,001). Ядерна та нуклеоцитоплазматична картини були суттєво пов’язані з випадками в епідермісі (p<0,04) та дермі (p<0,001). Вищий показник епідермального лептину був достовірно зв’язаним з жіночою статтю (р=0,004) та композицією колагену (р<0,03). Більш високий показник шкірного лептину був достовірно пов’язаним з гладенькими ФЕП (p=0,01), розширеними судинами (p=0,04), наявністю опасистих клітин (p=0,002), клітин запалення (p=0,004), випадковим розташуванням колагену (p<0,001) [99].
До подібного дослідження були включені 80 учасників: 40 хворих на ФЕП шкіри та 40 здорових. Оцінювали вік, стать, окружність талії, ІМТ, стан паління, рівні глюкози натще, інсуліну, інсулінорезистентність, а також рівні холестерину, тригліцеридів, ЛПВЩ, критерії МС та лептину. Уніваріантний статистичний аналіз показав, що рівні окружності талії, ІМТ, глюкози натще, інсуліну, резистентності до інсуліну, холестерину, тригліцеридів, ЛПВЩ та лептину були достовірно вищими у хворих на ФЕП шкіри порівняно з контролем (p<0,001). Багатофакторний статистичний аналіз компонентів МС та ФЕП шкіри показав, що лише високі рівні тригліцеридів (ВШ=1,205; 95 % ДІ 1,044-1,391; р=0,011) і низький рівень ЛПВЩ (ВШ=0,554; 95 % ДІ 0,384-0,800; р=0,002) були достовірно пов’язаними з ФЕП шкіри. Багатофакторний лінійний регресійний аналіз предикторів високого рівня лептину в плазмі крові вказав, що високий рівень тригліцеридів (ВШ=0,287; 95 % ДІ 0,410-3,56; р=0,014) і низький рівень ЛПВЩ (ВШ=0,40; 95 % ДІ -8,7-2,08; р=0,002) були прогностично значущими [52].
До одного з досліджень були включені три однаково розподілених групи пацієнтів з множинними ФЕП шкіри: 30 з нормальним ІМТ, 30 із зайвою вагою та 30 з ожирінням. Контрольні групи складалися зі здорових осіб з відповідними віком, статтю й ІМТ. Результати дослідження показали, що кількість ФЕП шкіри збільшувалася зі зростанням ІМТ. Найвищий рівень лептину був виявлений у пацієнтів з ожирінням. Він достовірно відрізнявся від показників осіб, які мали нормальний ІМТ, та пацієнтів з надмірною вагою. Значно вищий рівень лептину був виявлений в осіб з ожирінням порівняно з контрольними групами ожиріння. HOMA-IR був достовірно вищим у всіх групах пацієнтів порівняно з контролем. Кількість ФЕП шкіри, лептину та HOMA-IR була достовірно більшою у хворих на МС порівняно з особами без нього. У пацієнтів з ожирінням були виявлені позитивні кореляції між сироватковим лептином і HOMA-IR. У всіх групах також спостерігалися позитивні кореляції між кількістю шкірних ФЕП та окружністю талії [102].
До проведеного дослідження «випадок-контроль» були залучені 133 пацієнти з ФЕП та 129 волонтерів без них. За віком і статтю групи достовірно не відрізнялися. Результати показали достовірне збільшення (р<0,05) ваги, окружності талії й ІМТ в пацієнтів з ФЕП шкіри. Частота ЦД2, ГХ та МС була достовірно вищою в осіб з ФЕП шкіри. Також було зафіксоване достовірне (p<0,001) зростання загального холестерину, тригліцеридів, ЛПНЩ, ЛПДНЩ та коефіцієнту атерогенності в дослідній групі порівняно з контрольною. Рівні глюкози в крові, глікозильованого гемоглобіну, інсуліну, С-пептиду, індексу HOMA та лептину у хворих на ФЕП шкіри були достовірно вищими. Відносний ризик розвитку ЦД2 та МС в пацієнтів з ФЕП шкіри був встановлений на рівні ˃4. При проведенні множинного порівняння було виявлено, що у хворих на МС і ЦД2 було достовірно більше ФЕП і їхніх рецидивів порівняно з пацієнтами без метаболічних порушень. Крім того, у хворих на ЦД2 кількість ФЕП і їхніх рецидивів була достовірно більшою (p<0,05) порівняно з МС.
У літературі зустрічаються поодинокі описи гістологічних характеристик ФЕП, хоча результати дослідження чітко ідентифікують морфологічні патерни, що можуть використовуватися як додаткові критерії, за допомогою яких лікар-дерматолог може запідозрити наявність метаболічних порушень у пацієнта [90].
Було встановлено, що ФЕП шкіри у хворих на ЦД2 та МС мають характерні особливості будови, що полягають у наявності ознак виразного “папіломатозу” за рахунок зміни епідермо-дермальних взаємовідносин, виражених судинних змін і більшої інтенсивності запальної інфільтрації за рахунок клітин лімфогістіоцитарного ряду, що відображає превалювання хронічного запального процесу.
Опасисті клітини та макрофаги – це ключові гравці, що впливають на процеси росту та ремоделювання ФЕП шкіри.
В одній з робіт було поставлене завдання виявити щільність опасистих клітин за допомогою толуїдинового синього й імуногістохімічного фарбування триптази клітин у ФЕП шкіри порівняно зі звичайною шкірою. Це дослідження було проведене на 30 пацієнтах з ФЕП шкіри та 10 здорових особах, співставних за віком і статтю, без шкірних міток. Результати роботи показали достовірну різницю між ФЕП шкіри та контрольною групою щодо щільності опасистих клітин, оціненої за допомогою фарбування толуїдиновим синім (p=0,003) й експресією триптази опасистих клітин (p=0,001), де щільність у ФЕП шкіри була більшою порівняно з нормальною шкірою. Висока експресія триптази опасистих клітин була пов’язаною з вираженим колагенозом (р=0,02) та наявністю еозинофілів (р=0,04) [31].
Накопичення жирової тканини сприяє запальним процесам через вивільнення прозапальних адипокінів, як-от лептин і хемерин, і порушення регуляції протизапального адипонектину. Хемокіни та цитокіни, що походять від моноцитів, також змінюються та сприяють запаленню та розвитку резистентності до інсуліну. Циркулюючі запальні біомаркери, включаючи СРБ, фібриноген, сироватковий амілоїд A, цитокіни та хемокіни, також пов’язані з патогенезом МС. Опасисті клітини в підшкірній жировій клітковині сприяють як запаленню, так і розвитку фіброзу [93].
За фізіологічних умов у шкірі експресується конститутивна форма циклооксигенази (циклооксигеназа-1). Активація експресії індуцибельної ізоформи ферменту (ЦОГ-2) відбувається виключно за умов ушкодження або дії відповідних індукуючих факторів [88]. Експресія ЦОГ-2 зареєстрована в епідермісі та дермі за умов пошкодження, при запаленні або дії факторів росту та цитокінів [112]. Обидві ізоформи ферменту ЦОГ (циклооксигеназа-1 і ЦОГ-2) залучені до синтезу ейкозаноїдів – простагландинів і тромбоксанів [55]. Ключовим ейкозаноїдом у шкірі є простагландин Е2, що бере участь у підтриманні гомеостазу епідермісу та дерми, а також є активним учасником реалізації репаративних процесів. Продемонстрований стимулюючий вплив простагландину Е2 на проліферацію кератиноцитів, захист від апоптозу, розвиток гіперплазії епідермісу. Крім того, простагландин Е2 є потужним цитопротектором для ендотеліоцитів, стимулює проліферацію фібробластів та ендотеліальних клітин, активує ангіогенез [69]. Показано, що підвищення ЦОГ-2-опосередкованої продукції PGE асоційоване з розвитком 12-O-тетрадеканоїл-форбол-13-ацетат-індукованих папілом у мишей [59]. Вважається, що ЦОГ-2-залежний синтез простагландину E2 відіграє ключову роль у патогенезі тривалої гіперплазії епідермісу та туморогенезі. Водночас використання селективних інгібіторів ЦОГ-2 обмежує розвиток гіперплазії та запобігає прогресії немеланоцитарних пухлин шкіри [74].
У проведеному дослідженні було встановлено, що в пацієнтів з МС і ЦД2 порівняно з контролем у межах ФЕП шкіри спостерігалася підвищена інфільтрація субепідермальної зони опасистими клітинами та виразною експресією ЦОГ-2 в епідермісі та клітинах дерми. Підвищена експресія індукованої форми ЦОГ-2 була пов’язаною не тільки з виразністю запальної інфільтрації, а й з інтенсивністю проліферативних змін у зоні епідермо-дермальних взаємовідносин.
Раніше був продемонстрований зв’язок між ожирінням і превалюванням М1 фенотипу макрофагів [109]. Проте ці зміни були описані для жирової тканини (переважно для вісцерального жиру), вони пояснюють патогенез інсулінорезистентності за умов акумуляції вісцерального жиру та гіпертрофії адипоцитів. Відповідно до прозапальної концепції, вісцеральне ожиріння асоційоване зі зростанням кількості М1 макрофагів, що є джерелом продукції численних прозапальних цитокінів та адипокінів, включаючи інтерлейкін-6 і ФНП-α, які, крім іншого, спроможні модулювати сенситивність інсулінових рецепторів [85]. Проте розвиток інсулінорезистентності та метаболічне репрограмування (через mTOR) зі свого боку можуть призводити до зрушення механізмів поляризації макрофагів у інших тканинах та органах, включаючи шкіру, наслідком чого є порушення репаративних процесів і ремоделювання тканин. J.E. Ackerman і співавт. (2017) [33] показали, що при ожирінні та діабеті змінюються механізми поляризації макрофагів з превалюванням М2 фенотипу, що призводить до порушення репарації сухожилків і розвитку фіброзу.
Як відомо, М2 макрофаги є джерелом різноманітних факторів росту, включаючи VEGF, FGFb, TGFa тощо, що стимулюють проліферацію фібробластів, кератиноцитів, ангіогенез і продукцію компонентів позаклітинного матриксу [81]. Отже, потенціальним механізмом морфогенезу ФЕП при ожирінні та ЦД2 може бути порушення поляризації макрофагів з гіперактивацією М2-типу.
mTORС1/2 відомі як провідні регулятори метаболізму вуглеводів, ліпідів і білків. Посилення експресії mTOR за умов ожиріння асоційоване зі зростанням активності анаболічних процесів і пригніченням аутофагії. На тканинному рівні mTOR залучений у регуляцію процесів проліферації та диференціювання кератиноцитів, регуляцію ангіогенезу та модуляцію запалення [45, 97, 113].
Результати проведеного дослідження показали, що розвиток ФЕП при МС та ЦД2 був асоційований зі зростанням кількості М2 макрофагів на тлі посилення експресії mTOR і VEGF. Формування ФЕП шкіри в пацієнтів з МС і ЦД2 асоціювалося з виразною активацією М2 макрофагів на тлі посилення експресії mTOR і VEGF на локальному рівні.
Для розуміння взаємозв’язку між показниками ліпідного обміну, діабетичної панелі й імуногістохімічного дослідження був проведений кореляційний аналіз, що показав, що кількість ФЕП і частота їхніх рецидивів були тісно пов’язаними з підвищенням концентрації ЛПДНЩ, значень індексу HOMA-IR і вмісту MCT-позитивних клітин у субстраті поліпів. Такі сильні зв’язки між даними показниками спонукали провести лінійний регресійний аналіз, результати якого дозволили розробити діагностичний алгоритм прогнозування рецидивів ФЕП шкіри.
Порушення ліпідного обміну та наявність інсулінорезистентності можуть бути скореговані відповідними препаратами, які зі свого боку можуть змінити частоту рецидивування ФЕП шкіри.
Статини, що спочатку були розроблені як антимікробні препарати, загалом вважаються засобами, що знижують холестерин. Нещодавно дослідники виявили протизапальні властивості статинів. Ці препарати можуть зменшувати міграцію лімфоцитів, інгібувати експресію major histocompatibility complex class II (MHC-II), знижувати вивільнення цитокінів, інгібувати дегрануляцію опасистих клітин і продукцію інтерлейкіну 17 Th17 клітинами. На додаток до протизапальних властивостей, статини викликають апоптоз у моделях меланоми. Потенційне терапевтичне значення статинів проілюстроване в лікуванні алопеції ареата, атопічного дерматиту, псоріазу, системного червоного вовчака, шкірних Т-клітинних лімфом, шкірної меланоми, мастоцитозу тощо [49].
Статини – це добре відомі інгібітори 3-гідрокси-3-метилглутаріл-коензиму А (HMG-CoA) редуктази, що блокують мевалонатний шлях. Активність статинів не тільки знижує рівень холестерину, але й зменшує запалення та модулює імунну систему. В одній з робіт вивчали вплив симвастатину на вивільнення гістаміну за допомогою клітин базофільної лейкемії щурів (RBL-2H3) та дослідили його взаємодію з білками, що беруть участь у процесі екзоцитозу. Лікування симвастатином протягом 24 годин інгібувало вивільнення гістаміну в клітинах RBL-2H3 залежно від концентрації після стимуляції динітрофенільованим альбуміном сироватки великої рогатої худоби (DNP-BSA як антиген), іономіцином (іоном кальцію (Ca2+) іонофор) і тапсигаргіном (інгібітор Са2+-АТФази в ендоплазматичному ретикулумі) [95].
В одному з експериментів вивчали вплив симвастатину на вироблення прозапальних цитокінів мишачими опасистими клітинами. Мастоцити, що були отримані з кісткового мозку, стимулювали ліпополісахаридом за присутності або відсутності симвастатину. Продукція ФНП-α й інтерлейкіну 6 з опасистих клітин оцінювалася на рівні матричної рибонуклеїнової кислоти та білка. Результати дослідження показали, що інкубація опасистих клітин із симвастатином призводить до інгібування ліпополісахарид-індукованої продукції ФНП-α як на рівні матричної рибонуклеїнової кислоти, так і білка. Симвастатин також інгібував продукцію інтерлейкіну 6 [68].
Також було показано, що флувастатин гальмує дегрануляцію опасистих клітин, не впливаючи на цитоплазматичну реакцію Са (2+), а також не змінюючи кількість вмісту гранул і проліферацію цих клітин. Інгібуюча дія статину може бути опосередкована пригніченням геранилгеранил-трансферази через виснаження внутрішньоклітинної мевалонової кислоти [58].
Експерименти з вивільненням гістаміну були проведені на ізольованих опасистих клітинах з використанням статинів та анти-імуноглобуліну Е. Клітини культивували з фактором стовбурових клітин та інтерлейкіном 6. Результати цього експерименту показали, що попередня інкубація первинних опасистих клітин легень із церивастатином або аторвастатином (1-50 мкМ) протягом 24 годин призводить до пригнічення вивільнення гістаміну, викликаного анти-імуноглобуліном Е. Ефекти обох статинів залежали від дози. Крім того, було виявлено, що статини інгібують диференціювання опасистих клітин від їхніх попередників [72].
Рецептори γ, що активують проліферацію пероксисом (PPAR γ – Peroxisome proliferator-activated receptor gamma), мають велике значення в регуляції імунної відповіді. В одному з досліджень мастоцити, отримані з кісткового мозку миші, культивували з інтерлейкіном 3 та фактором стовбурових клітин (SCF) за присутності або відсутності агоніста PPAR γ – піоглітазону. Вивільнення гістаміну визначали шляхом вимірювання активності β-гексозамінідази. Інтерлейкін 3 та SCF необхідні для розвитку опасистих клітин in vitro. Лікування піоглітазоном додатково гальмувало утворення гранул і зменшувало експресію β-гексозамінідази. Крім того, опасисті клітини під дією піоглітазону експресували нижчий рівень протеїнази та підвищували рівень активності PPAR γ. Піоглітазон також викликав апоптоз попередників опасистих клітин [120].
Було показано, що лікування піоглітазоном може збільшувати площу поперечного перерізу адипоцитів на 18 % (р=0,01), а також щільність капілярів, не впливаючи на великі судини. Лікування піоглітазоном також зменшує загальну кількість жирових макрофагів на 26 % [105].
Нещодавно було проведене дослідження щодо впливу метформіну на неврологічну функцію й окислювальний стрес у пацієнтів із ЦД2 та гострим інсультом. Отримані результати показали, що метформін може покращити неврологічну функцію та стан окислювального стресу у хворих на гострий інсульт із ЦД2, а його механізм може бути пов’язаним із сигнальним шляхом 5’аденозинмонофосфат-активована протеїнкіназа/mTOR та окислювальним стресом [121].
У проведеному дослідженні було показано, що призначення симвастатину в дозі 20 мг на добу протягом 12 місяців знижувало ризик рецидивування ФЕП у пацієнтів з МС. У хворих зі стабільним перебігом ЦД2 комбінація препаратів симвастатин (20 мг на добу) + метформіну гідрохлорид (500 мг три рази на добу) або піоглітазону гідрохлорид (30 мг 1 раз на добу) зменшувала рецидивування ФЕП шкіри з більшою клінічною ефективністю при призначенні метформіну гідрохлориду.
Отже, узагальнюючи обговорення проведеної роботи, можна дійти висновку, що в пацієнтів з множинними рецидивуючими поліпами шкіри спостерігався підвищений ризик розвитку МС, ЦД2, АТ, що асоціювався з дисліпідемією, порушенням обміну глюкози та запаленням на локальному рівні, що реалізувалося підвищеною активністю триптазопозитивних опасистих клітин, макрофагів 2 типу, ЦОГ-2, mTOR і VEGF. Проведені кореляційний і регресійний аналізи дали змогу створити шкалу Score, за допомогою якої можливе прогнозування рецидивів ФЕП. Результати пілотних клінічних рандомізованих досліджень з вивченням впливу симвастатину, метформіну та піоглітазону надали реальний інструмент для терапевтичної інтервенції рецидивів ФЕП.
ВИСНОВКИ
У дисертаційній роботі вирішене актуальне науково-практичне завдання дерматовенерології з удосконалення диференційованого підходу до обстеження та лікування пацієнтів з множинними рецидивуючими ФЕП шкіри з урахуванням морфологічної, імуногістологічної будови поліпів, стану ліпідного та вуглеводного обмінів.
- У зв’язку із підвищеною частотою рецидивування ФЕП шкіри актуалізується питання оцінки метаболічного статусу та морфологічного дослідження для прогнозування ризику розвитку МС та ЦД2, оптимізації методів діагностики та лікування.
- Клініко-анамнестичний аналіз 133 пацієнтів (середній вік – (45,93 ± 11,94) років) з множинними рецидивуючими ФЕП шкіри (65 жінок і 68 чоловіків) виявив 931 поліп, що в середньому складало 7 поліпів на 1 особу. Форма поліпів була овальною (45 %) або неправильною (32 %), забарвлення – частіше блідо-коричневим (53 %) або коричневим (25 %), консистенція – переважно м’якою (30 %) або еластичною (45 %) з фіксацією на тонкій і короткій ніжці. Кількість рецидивів за останні 2 роки коливалася в діапазоні від 2 до 9 з середнім значенням (3,77 ± 2,09). Поліпи переважно локалізувалися на шиї (53 %), обличчі (10 %), тулубі (10 %), ділянках складок (15 %) з найменшою поширеністю на сідницях (1 %), статевих органах (4 %), верхніх (4 %) та нижніх (3 %) кінцівках.
- Встановлено достовірне підвищення ризику розвитку МС (ВШ=6,942; 95 % ДІ 3,328-14,480; р<0,001), ЦД2 (ВШ=4,915; 95 % ДІ 1,801-13,418; p=0,002) в асоціації з порушенням ліпідного та вуглеводного обмінів при порівнянні результатів дослідження 133 пацієнтів та 129 осіб контрольної групи. Вміст загального холестерину, тригліцеридів, ЛПНЩ, ЛПДНЩ, коефіцієнту атерогенності, глюкози в крові, глікозильованого гемоглобіну, інсуліну, С-пептиду, індексу HOMA-IR і лептину був достовірно вищим у пацієнтів з множинними рецидивуючими ФЕП шкіри.
- У хворих на ЦД2 та МС визначено характерні гістологічні особливості будови ФЕП, що виявляються в наявності ознак вираженого папіломатозу за рахунок зміни епідермо-дермальних взаємовідносин, виражених судинних змін і більшої інтенсивності запальної інфільтрації клітинами лімфогістіоцитарного ряду, що відображає превалювання хронічного запального процесу. У пацієнтів без супутніх метаболічних порушень визначено класичну гістологічну картину ФЕП шкіри: епідермо-дермальні межі формувалися присутністю невиражених вторинних сосочків дерми та гребінців епідермісу, у сітчастому шарі визначалася щільна волокниста неоформлена сполучна тканина, в центральній частині – розширені кровоносні судини, переважно неправильної форми з тонкими стінками. Сполучна тканина мала ознаки набряку та розпушення колагенових волокон, переважно в центральній частині поліпа.
- Визначено підвищену інфільтрацію MCT-позитивними клітинами та М2-макрофагами в межах субепідермальної зони, посилену експресію ЦОГ-2 в епідермісі та клітинах дерми ФЕП шкіри пацієнтів з МС і ЦД2. Виражена експресія індукованої форми ЦОГ-2 серин-треонін протеїнової кінази й ендотеліального фактора росту судин була пов’язана не тільки з вираженістю запальної інфільтрації, а й з інтенсивністю проліферативних змін у зоні епідермо-дермальних взаємовідносин.
- Кореляційний аналіз встановив найсильніший позитивний кореляційний зв’язок між збільшенням кількості ФЕП шкіри та підвищенням концентрації ЛПДНЩ (r=0,530; p<0,001), значенням індексу HOMA-IR (r=0,724; p<0,001), вмістом МСТ-позитивних клітин (r=0,707; p<0,001) у субстраті поліпів. Регресійний статистичний аналіз встановив коефіцієнт константи на рівні –0,264, стандартизовані коефіцієнти В для ЛПДНЩ склали 0,345; індексу HOMA-IR – 0,345; МСТ-позитивних клітин – 0,403. Для прогнозування рецидивів ФЕП було виведено наступну математичну формулу:
Y= –0,264 + 2,049 * X1 + 0,061 * X2 + 0,025 * X3,
де Y – середня кількість рецидивів ФЕП шкіри за останні 2 роки;
Х1 – рівень ЛПДНЩ;
Х2 – індекс НОМА-IR;
Х3 – кількість МСТ-позитивних клітин.
Кореляційний і регресійний аналізи дозволили встановити предиктори рецидивування та сформувати шкалу Score для прогнозування рецидивів ФЕП шкіри.
- Показано позитивний вплив симвастатину у пацієнтів з МС на частоту рецидивування та видалень ФЕП шкіри. Зниження частоти рецидивування і видалень ФЕП асоціюється зі зменшенням у крові концентрації ЛПДНЩ і вмісту MCT-позитивних клітин у субстраті поліпа.
- Встановлено, що кількість MCT-позитивних клітин у ФЕП достовірно знижувалася (p<0,05) у хворих на ЦД2 незалежно від комбінації препаратів (метформін/симвастатин чи піоглітазон/симвастатин); у пацієнтів, що лікувалися препаратами метформін/симвастатин, зменшення було достовірним на 6-му (р=0,032) і 12-му місяці лікування (р=0,001), тоді як у хворих, які приймали піоглітазон/симвастатин, достовірне зниження зафіксоване тільки на 12-й місяць.
РЕКОМЕНДАЦІЇ
- Пацієнтам з множинними рецидивуючими ФЕП шкіри необхідно проводити скринінг на МС і ЦД2 шляхом визначення клінічних параметрів (окружність талії, ІМТ), показників ліпідного обміну (холестерин, тригліцериди, ЛПВЩ, ЛПНЩ, ЛПДНЩ) та діабетичної панелі (глюкоза в крові, глікозильований гемоглобін, інсулін, С-пептид, індекс HOMA-IR, лептин).
- Для прогнозування ризику розвитку рецидивів у пацієнтів з множинними рецидивуючими ФЕП шкіри можна використовувати шкалу Score, оцінка якої складається з трьох етапів: 1)визначення кількості MCT-позитивних клітин у поліпі (від 0 до 45; від 46 до 75; від 76 до 105; від 106 до 135; від 136-165 клітин на 1 см2; 2) значення індексу HOMA-IR; 3) визначення ЛПДНЩ. Після встановлення даних віднайти в таблиці значення, що буде відповідати ймовірності розвитку рецидивів ФЕП шкіри в найближчі 2 роки.
- Призначення симвастатину в дозі 20 мг на добу протягом 12 місяців знижує ризик рецидивування ФЕП у пацієнтів з МС. У хворих зі стабільним перебігом цукрового діабету 2-го типу комбінація препаратів симвастатин у дозі 20 мг на добу + метформіну гідрохлорид – 500 мг три рази на добу або піоглітазону гідрохлорид – 30 мг 1 раз на добу зменшує рецидивування ФЕП шкіри з більшою клінічною ефективністю при призначенні метформіну гідрохлориду.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Болотна ЛА, Сідельник ВМ, Саріан ОІ. Корекція дисліпідемічних порушень у пацієнтів із хронічними запальними дерматозами. Укр. журн. дерматології, венерології, косметології. 2016;(1):110.
- Голованова ІА, Бєлікова ІВ, Ляхова НО. Основи медичної статистики: навч. посіб. для аспірантів та клін. ординаторів. Полтава; 2017. 113 с.
- Горячкина МВ, Белоусова ТА. Доброкачественные эпителиальные опухоли кожи. Дерматология. Прил. к журн. Consilium Medicum. 2014;(4):20-3.
- Іванова НМ, Кутасевич ЯФ, Маштакова ІО, Реміз ОМ. Вплив мутації rs7574865 гена STAT4 на розвиток осередкової склеродермії. Клін. імунологія. Алергологія. Інфектологія. 2014;(6-7):58-60.
- Калюжна ЛД, Мурзіна ЕО, Бардова КО. Сучасні методи діагностики шкірних захворювань. В: Зб. наук. пр. співробітників НМАПО ім. П.Л. Шупика. Київ; 2013;(22 Кн 3). с. 96-100.
- Кочет КА, Литус ИА, Свистунов ИВ, Сулаева ОН. Патология кожи при сахарном диабете: клинико-патогенетические корреляции (обзор). Georgian Med News. 2017 Dec;(273):41-6.
- Кутасевич ЯФ, Олейник ИА, Чеховская АС, Гаврилюк АА. Дифференциальная диагностика псориатической ониходистрофии с онихомикозом и подногтевого кровоизлияния с меланомой. Дерматологія та венерологія. 2014;(2):71-6.
- Кутасевич ЯФ, Олійник ІО. Досвід комплексного лікування папіломавірусної інфекції з використанням препаратів Колломак та Кагоцел. Репродуктив. здоровье женщины. 2007;(3):184-6.
- Кутасевич ЯФ, Jafferany M, Святенко ТВ, Біловол АМ, Болотна ЛА, Іщейкін КЄ та ін. Психодерматологія в Україні: сучасний погляд на проблему. Дерматологія та венерологія. 2018;4:8-12.
- Кутасевич ЯФ, Маштакова ИА, Олейник ИА, Савенкова ВВ, Пятикоп ИА. Наружное лечение при дерматозах, резистентных к топическим стероидам. Укр. журн. дерматології, венерології, косметології. 2011;(3):52-7.
- Кутасевич ЯФ, Олейник ИА, Левченко ОА. Нерациональная системная терапия глюкокортикостероидными гормонами. Клін. імунологія. Алергологія. Інфектологія. 2013;(8):51-3.
- Кутасевич ЯФ, Олейник ИА, Маштакова ИА. Современные возможности наружной терапии больных псориазом. Дерматологія та венерологія. 2017;2:42-5.
- Кутасевич ЯФ. Обоснование целесообразности использования препаратов наружного действия, содержащих фузидиевую кислоту, в педиатрической практике. Соврем. педиатрия. 2010;(1):180-4.
- Кутасевич ЯФ, Олейник ИА. Опыт комплексного лечения папилломавирусной инфекции с применением препаратов Колломак и Кагоцел. Здоровье женщины. 2007;(2):197-200.
- Кутасевич ЯФ, Маштакова ИА, Олейник ИА, Безрученко ИА, Чеховская АС. Опыт применения топических антимикотиков. Укр. журн. дерматології, венерології, косметології. 2014;(3):79-83.
- Кутасевич ЯФ, Олійник ІО, Стулій ОМ, Зюбан ІВ. Оцінка ефективності комплексного лікування хворих на атопічний дерматит і екзему з використанням фонофорезу з емолієнтом. Дерматологія та венерологія. 2019;4:18-22.
- Кутасевич ЯФ, Стулий ОН. Терапевтическая эффективность производного хинуклидинов при аллергодерматозах и некоторых других дерматозах, сопровождающихся зудом. Дерматологія та венерологія. 2014;(1):42-51.
- Ламоткин ИА. Клиническая дерматоонкология: атлас: 757 цветных иллюстраций. М.: БИНОМ. Лаб. знаний; 2011. 499 с.
- Ламоткин ИА. Онкодерматология: атлас: 1225 цветных иллюстраций: [учеб. пособие]. М.: Лаб. знаний; 2017. 878 с.
- Літус ІО. Асоціація множинних рецидивних фіброепітеліальних поліпів шкіри з ліпідним обміном в українській популяції. Дерматологія та венерологія. 2019;(4):27-9.
- Літус ІО. Експресія М2-макрофагів, mTOR-позитивних клітин та VEGF у межах фіброепітеліальних поліпів шкіри у пацієнтів із метаболічним синдромом та цукровим діабетом 2-го типу. Укр. мед. часопис. 2020;(2 Т 2):43-8.
- Літус ІО, Свістунов ІВ. Особливості гістологічної будови рецидивуючих фіброепітеліальних поліпів шкіри у хворих з метаболічним синдромом та цукровим діабетом 2-го типу. Україна. Здоров’я нації. 2020;(2):137-41.
- Літус ІО. Оцінка експресії опасистих клітин та СОХ2 в межах фіброепітеліальних поліпів шкіри у пацієнтів з метаболічним синдромом та цукровим діабетом 2 типу. В: Зб. тез наук. робіт учасників міжнар. наук.-практ. конф. Медична наука та практика в умовах сучасних трансформаційних процесів; 2020 Квіт 24-25; Львів. Львів: ГО “Львів. мед. спільнота”; 2020. с. 46-9.
- Літус ІО. Оцінка експресії опасистих клітин та СОХ2 в межах фіброепітеліальних поліпів шкіри у пацієнтів з метаболічним синдромом та цукровим діабетом 2 типу. Здоров’я суспільства. 2020; 9(1): 6-12.
- Молочков ВА, Молочков АН, Хлебникова АН, Кунцевич ЖС. Эпителиальныеопухоликожи. М.: БИНОМ; 2012. 224 с.
- Наумова ЛО, Приступюк ЛО, Конах ВМ. Шкірні ураження при цукровому діабеті: (огляд). Укр. журн. дерматології, венерології, косметології. 2017;(2):99-102.
- Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при цукровому діабеті 2 типу: наказ МОЗ України № 1118 від 21.12.2012 р. [Інтернет]. [цитовано 2020 Серп 20]. Доступно: https://zakon.rada.gov.ua/rada/show/v1118282-12#Text
- Смольянникова ВА, Александрова АК. Экспрессия рецептора эпидермального фактора роста при наличии инсулинорезистентности у пациентов с себорейными кератомами. Арх. патологии. 2017;79(4):18-21.
- Федотов ВП, Дюдюн АД, Степаненко ВІ, Башмаков ДГ, Горбунцов ВВ, Захаров ВК, та ін. Дерматовенерологія: навч. посіб. Дніпропетровськ; Київ; 2008. 599 c.
- Abdel-Hamid AAM, Firgany AEL. Increased mast cell number is associated with a decrease in beta-cell mass and regeneration in type 2 diabetic rats. Acta Histochem. 2019 May;121(4):508-15.
- Abdou AG, Maraee AH, Antar AG, Fareed S. Role of mast cells in skin tag development: an immunohistochemical study. Anal Quant Cytopathol Histpathol. 2014 Aug;36(4):222-30.
- Abebe N. Analytical evaluation of the clinical chemistry analyzer AU 480 Beckman Coulter. Eur J Clin Biomed Sci. 2016;2(6):59-62.
- Ackerman JE, Geary MB, Orner CA, Bawany F, Loiselle AE. Obesity/Type II diabetes alters macrophage polarization resulting in a fibrotic tendon healing response. PLoS One. 2017 Jul 7;12(7):e0181127.
- Akpinar F, Dervis E. Association between acrochordons and the components of metabolic syndrome. Eur J Dermatol. 2012 Jan-Feb;22(1):106-10.
- Alberti KG, Zimmet P, Shaw J. Metabolic syndrome – a new world-wide definition. A Consensus Statement from the International Diabetes Federation. Diabet Med. 2006 May;23(5):469-80.
- Amirnia M, Babaie-Ghazani A, Fakhrjou A, Khodaeiani E, Alikhah H, Naghavi-behzad M, et al. Immunohistochemical study of cyclooxygenase-2 in skin tumors. J Dermatolog Treat. 2014 Oct;25(5):380-7.
- Banik R, Lubach D. Skin tags: localization and frequencies according to sex and age. Dermatologica. 1987;174(4):180-3.
- Boza JC, Trindade EN, Peruzzo J, Sachett L, Rech L, Cestari TF. Skin manifestations of obesity: a comparative study. J Eur Acad Dermatol Venereol. 2012 Oct;26(10):1220-3.
- Buckman SY, Gresham A, Hale P, Hruza G, Anast J, Masferrer J, et al. COX-2 expression is induced by UVB exposure in human skin: implications for the development of skin cancer. Carcinogenesis. 1998 May;19(5):723-9.
- Bustan RS, Wasim D, Yderstraede KB, Bygum A. Specific skin signs as a cutaneous marker of diabetes mellitus and the prediabetic state – a systematic review. Dan Med J. 2017 Jan;64(1):A5316.
- Campora M, Bianchi R, Ferro J, Pitto F, Mastracci L, Federica G. A new fully automated processing and embedding technique for cytological cell blocks. Biomed J Sci Tech Res. 2019;17(2):12651-4.
- Chan PC, Liao MT, Hsieh PS. The Dualistic effect of COX-2-mediated signaling in obesity and insulin resistance. Int J Mol Sci. 2019 Jun 26;20(13):3115.
- Chiritescu E, Maloney ME. Acrochordons as a presenting sign of nevoid basal cell carcinoma syndrome. J Am Acad Dermatol. 2001 May;44(5):789-94.
- Conti P, Ronconi G, Kritas SK, Caraffa A, Theoharides TC. Activated mast cells mediate low-grade inflammation in type 2 diabetes: interleukin-37 could be beneficial. Can J Diabetes. 2018 Oct;42(5):568-73.
- Cornu M, Albert V, Hall MN. mTOR in aging, metabolism, and cancer. Curr Opin Genet Dev. 2013 Feb;23(1):53-62.
- De Souza A, Tinguely M, Burghart DR, Berisha A, Mertz KD, Kempf W. Characterization of the tumor microenvironment in primary cutaneous CD30-positive lymphoproliferative disorders: a predominance of CD163-positive M2 macrophages. J Cutan Pathol. 2016 Jul;43(7):579-88.
- Ding J, Lei L, Liu S, Zhang Y, Yu Z, Su Y, et al. Macrophages are necessary for skin regeneration during tissue expansion. J Transl Med. 2019 Jan 21;17(1):36.
- Divoux A, Moutel S, Poitou C, Lacasa D, Veyrie N, Aissat A, et al. Mast cells in human adipose tissue: link with morbid obesity, inflammatory status, and diabetes. J Clin Endocrinol Metab. 2012 Sep;97(9):E1677-85.
- Egesi A, Sun G, Khachemoune A, Rashid RM. Statins in skin: research and rediscovery, from psoriasis to sclerosis. J Drugs Dermatol. 2010 Aug;9(8):921-7.
- El Safoury O, Fawzi M, Abdel Hay RM, Hassan AS, El Maadawi Z, Rashed L. Increased tissue leptin hormone level and mast cell count in skin tags: a possible role of adipoimmune in the growth of benign skin growths. Indian J Dermatol Venereol Leprol. 2010 Sep-Oct;76(5):538-42.
- El Safoury OS, Fawzy MM, El Maadawa ZM, Mohamed DH. Quantitation of mast cells and collagen fibers in skin tags. Indian J Dermatol. 2009;54(4):319-22.
- El Safoury OS, Abdel Hay RM, Fawzy MM, Kadry D, Amin IM, Abu Zeid OM, et al. Skin tags, leptin, metabolic syndrome and change of the life style. Indian J Dermatol Venereol Leprol. 2011 Sep-Oct;77(5):577-80.
- Fang CEH, Crowe C, Murphy A, O’Donnell M, Finucane FM. Cross-sectional study of the association between skin tags and vascular risk factors in a bariatric clinic-based cohort of Irish adults with morbid obesity. BMC Res Notes. 2020 Mar 16;13(1):156.
- Farag AGA, Abdu Allah AMK, El-Rebey HS, Mohamed Ibraheem KI, Mohamed ASED, Labeeb AZ, et al. Role of insulin-like growth factor-1 in skin tags: a clinical, genetic and immunohistochemical study in a sample of Egyptian patients. Clin Cosmet Investig Dermatol. 2019 Apr 26;12:255-66.
- Fitzpatrick FA. Cyclooxygenase enzymes: regulation and function. Curr Pharm Des. 2004;10(6):577-88.
- Foks M, Wagrowska-Danilewicz M, Danilewicz M, Bonczysta M, Olborski B, Stasikowska-Kanicka O. The number of CD163 positive macrophages is associatedwith more advanced skin melanomas, microvessels density and patient prognosis. Pol J Pathol. 2019;70(3):217-22.
- Fuentes-Duculan J, Suarez-Farinas M, Zaba LC, Nograles KE, Pierson KC, Mitsui H, et al. A subpopulation of CD163-positive macrophages is classically activated in psoriasis. J Invest Dermatol. 2010 Oct;130(10):2412-22.
- Fujimoto M, Oka T, Murata T, Hori M, Ozaki H. Fluvastatin inhibits mast cell degranulation without changing the cytoplasmic Ca2+ level. Eur J Pharmacol. 2009 Jan 14;602(2-3):432-8.
- Futagami A, Ishizaki M, Fukuda Y, Kawana S, Yamanaka N. Wound healing involves induction of cyclooxygenase-2 expression in rat skin. Lab Invest. 2002 Nov;82(11):1503-13.
- Gonzalez-Saldivar G, Rodriguez-Gutierrez R, Ocampo-Candiani J, Gonzalez-Gonzalez JG, Gomez-Flores M. Skin manifestations of insulin resistance: from a biochemical stance to a clinical diagnosis and management. Dermatol Ther (Heidelb). 2017 Mar;7(1):37-51.
- Gupta S, Aggarwal R, Gupta S, Arora SK. Human papillomavirus and skin tags: is there any association? Indian J Dermatol Venereol Leprol. 2008 May-Jun;74(3):222-5.
- Gurung P, Moussa K, Adams-Huet B, Devaraj S, Jialal I. Increased mast cell abundance in adipose tissue of metabolic syndrome: relevance to the proinflammatory state and increased adipose tissue fibrosis. Am J Physiol Endocrinol Metab. 2019 Mar 1;316(3):E504-9.
- He A, Shi GP. Mast cell chymase and tryptase as targets for cardiovascular and metabolic diseases. Curr Pharm Des. 2013;19(6):1114-25.
- Hirt PA, Castillo DE, Yosipovitch G, Keri JE. Skin changes in the obese patient. J Am Acad Dermatol. 2019 Nov;81(5):1037-57.
- Idris S, Sunitha S. Assessment of BMI, serum leptin levels and lipid profile in patients with skin tags. J Clin Diagn Res. 2014 Sep;8(9):CC01-3.
- Jowkar F, Fallahi A, Namazi MR. Is there any relation between serum insulin and insulin-like growth factor-I in non-diabetic patients with skin tag? J Eur Acad Dermatol Venereol. 2010 Jan;24(1):73-4.
- Jusuf NK, Putra IB, Kartayana J. The Correlation between Body Mass Index with the Occurrence of Skin Tag. Open Access Maced J Med Sci. 2017 May 8;5(3):271-4.
- Kagami S, Kanari H, Suto A, Fujiwara M, Ikeda K, Hirose K, et al. HMG-CoA reductase inhibitor simvastatin inhibits proinflammatory cytokine production from murine mast cells. Int Arch Allergy Immunol. 2008;146 Suppl 1:61-6.
- Kawahara K, Hohjoh H, Inazumi T, Tsuchiya S, Sugimoto Y. Prostaglandin E2-induced inflammation: Relevance of prostaglandin E receptors. Biochim Biophys Acta. 2015 Apr;1851(4):414-21.
- Klar AS, Michalak-Micka K, Biedermann T, Simmen-Meuli C, Reichmann E, Meuli M. Characterization of M1 and M2 polarization of macrophages in vascularized human dermo-epidermal skin substitutes in vivo. Pediatr Surg Int. 2018 Feb;34(2):129-35.
- Koyuncu BU, Karaca M, Sari F, Sari R. Is skin tag associated with diabetic macro and microangiopathy? J Natl Med Assoc. 2018 Dec;110(6):574-8.
- Krauth MT, Majlesi Y, Sonneck K, Samorapoompichit P, Ghannadan M, Hauswirth AW, et al. Effects of various statins on cytokine-dependent growth and IgE-dependent release of histamine in human mast cells. Allergy. 2006 Mar;61(3):281-8.
- KumarGL, RudbeckL. Иммуногистохимическиеметоды: руководство: [пер. с англ.]. М.; 2011. 224 с.
- Kuzbicki L, Brozyna AA. Immunohistochemical detectability of cyclooxygenase-2 expression in cells of human melanocytic skin lesions: A methodological review. J Cutan Pathol. 2020 Apr;47(4):363-80.
- Kuzbicki L, Lange D, Stanek-Widera A, Chwirot BW. Intratumoral expression of cyclooxygenase-2 (COX-2) is a negative prognostic marker for patients with cutaneous melanoma. Melanoma Res. 2016 Oct;26(5):448-56.
- Lee ME, Kim SR, Lee S, Jung YJ, Choi SS, Kim WJ, et al. Cyclooxygenase-2 inhibitors modulate skin aging in a catalytic activity-independent manner. Exp Mol Med. 2012 Sep 30;44(9):536-44.
- Leong J, Hughes-Fulford M, Rakhlin N, Habib A, Maclouf J, Goldyne ME. Cyclooxygenases in human and mouse skin and cultured human keratinocytes: association of COX-2 expression with human keratinocyte differentiation. Exp Cell Res. 1996 Apr 10;224(1):79-87.
- Mao Z, Zhang W. Role of mTOR in glucose and lipid metabolism. Int J Mol Sci. 2018 Jul 13;19(7):2043.
- Mathur SK, Bhargava P. Insulin resistance and skin tags. Dermatology. 1997;195(2):184.
- Moon H, White AC, Borowsky AD. New insights into the functions of Cox-2 in skin and esophageal malignancies. Exp Mol Med. 2020 Apr;52(4):538-47.
- Morris DL. Minireview: emerging concepts in islet macrophage biology in type 2 diabetes. Mol Endocrinol. 2015 Jul;29(7):946-62.
- Muller-Decker K, Reinerth G, Krieg P, Zimmermann R, Heise H, Bayerl C, et al. Prostaglandin-H-synthase isozyme expression in normal and neoplastic human skin. Int J Cancer. 1999 Aug 27;82(5):648-56.
- Oran M, Erfan G, Mete R, Yanik ME, Yildirim O, Aydin M, et al. Association of colon adenomas and skin tags: coincidence or coexistence? Eur Rev Med Pharmacol Sci. 2014;18(7):1073-7.
- Pandey A, Sonthalia S. Skin tags [Internet]. [cited 2020 Apr 20]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK547724/
- Parisi L, Gini E, Baci D, Tremolati M, Fanuli M, Bassani B, et al. Macrophage polarization in chronic inflammatory diseases: killers or builders? J Immunol Res. 2018 Jan 14;2018:8917804.
- Platsidaki E, Vasalou V, Gerodimou M, Markantoni V, Kouris A, Vryzaki E, et al. The association of various metabolic parameters with multiple skin tags. J Clin Aesthet Dermatol. 2018 Oct;11(10):40-3.
- Putra IB, Siregar R, Jusuf NK, Ginting O, Nurhayati R. Correlation between serum leptin level with type and number of lesion skin tag. Open Access Maced J Med Sci. 2019 Jan 8;7(1):53-5.
- Qiao J, Ma L, Roth J, Li Y, Liu Y. Kinetic basis for the activation of human cyclooxygenase-2 rather than cyclooxygenase-1 by nitric oxide. Org Biomol Chem. 2018 Jan 31;16(5):765-70.
- Qing L, Fu J, Wu P, Zhou Z, Yu F, Tang J. Metformin induces the M2 macrophage polarization to accelerate the wound healing via regulating AMPK/mTOR/NLRP3 inflammasome singling pathway. Am J Transl Res. 2019 Feb 15;11(2):655-68.
- Ragunatha S, Anitha B, Inamadar AC, Palit A, Devarmani SS. Cutaneous disorders in 500 diabetic patients attending diabetic clinic. Indian J Dermatol. 2011 Mar;56(2):160-4.
- Rasi A, Faghihi A, Rahmanzadeh Y, Hassannejad H. A comparison study of lipid profile levels between skin tags affected people and normal population in Tehran, Iran. Adv Biomed Res. 2014 Mar 31;3:109.
- Rasi A, Soltani-Arabshahi R, Shahbazi N. Skin tag as a cutaneous marker for impaired carbohydrate metabolism: a case-control study. Int J Dermatol. 2007 Nov;46(11):1155-9.
- Reddy P, Lent-Schochet D, Ramakrishnan N, McLaughlin M, Jialal I. Metabolic syndrome is an inflammatory disorder: A conspiracy between adipose tissue and phagocytes. Clin Chim Acta. 2019 Sep;496:35-44.
- Rundhaug JE, Fischer SM. Cyclo-oxygenase-2 plays a critical role in UV-induced skin carcinogenesis. Photochem Photobiol. 2008 Mar-Apr;84(2):322-9.
- Sahid MNA, Liu S, Kiyoi T, Maeyama K. Inhibition of the mevalonate pathway by simvastatin interferes with mast cell degranulation by disrupting the interaction between Rab27a and double C2 alpha proteins. Eur J Pharmacol. 2017 Nov 5;814:255-63.
- Salem SA, Attia EA, Osman WM, El Gendy MA. Skin tags: a link between lesional mast cell count/tryptase expression and obesity and dyslipidemia. Indian J Dermatol. 2013 May;58(3):240.
- Samidurai A, Kukreja RC, Das A. Emerging role of mTOR signaling-related miRNAs in cardiovascular diseases. Oxid Med Cell Longev. 2018 Aug 23;2018:6141902.
- Sari R, Akman A, Alpsoy E, Balci MK. The metabolic profile in patients with skin tags. Clin Exp Med. 2010 Sep;10(3):193-7.
- Seleit I, Bakry OA, Samaka RM, Samy M. Immunohistochemical Evaluation of Leptin Role in Skin Tags. Ultrastruct Pathol. 2015;39(4):235-44.
- Senel E, Salmanoglu M, Solmazgul E, Bercik Inal B. Acrochordons as a cutaneous sign of impaired carbohydrate metabolism, hyperlipidemia, liver enzyme abnormalities and hypertension: a case-control study. J Eur Acad Dermatol Venereol. 2011 Dec 21. Epub ahead of print.
- Shah R, Jindal A, Patel N. Acrochordons as a cutaneous sign of metabolic syndrome: a case-control study. Ann Med Health Sci Res. 2014 Mar;4(2):202-5.
- Shaheen MA, Abdel Fattah NS, Sayed YA, Saad AA. Assessment of serum leptin, insulin resistance and metabolic syndrome in patients with skin tags. J Eur Acad Dermatol Venereol. 2012 Dec;26(12):1552-7.
- Shujiao L, Lilin H, Yong S. Cyclooxygenase-2 expression and association with skin cancer: A meta-analysis based on Chinese patients. J Cancer Res Ther. 2016 Dec;12(Supplement):C288-90.
- Singh SK, Agrawal NK, Vishwakarma AK. Association of acanthosis nigricans and acrochordon with insulin resistance: a cross-sectional hospital-based study from North India. Indian J Dermatol. 2020 Mar-Apr;65(2):112-7.
- Spencer M, Yang L, Adu A, Finlin BS, Zhu B, Shipp LR, et al. Pioglitazone treatment reduces adipose tissue inflammation through reduction of mast cell and macrophage number and by improving vascularity. PLoS One. 2014 Jul 10;9(7):e102190.
- Sudy E, Urbina F, Maliqueo M, Sir T. Screening of glucose/insulin metabolic alterations in men with multiple skin tags on the neck. J Dtsch Dermatol Ges. 2008 Oct;6(10):852-5, 852-6. English, German.
- Surowiak P, Gansukh T, Donizy P, Halon A, Rybak Z. Increase in cyclooxygenase-2 (COX-2) expression in keratinocytes and dermal fibroblasts in photoaged skin. J Cosmet Dermatol. 2014 Sep;13(3):195-201.
- Thappa DM. Skin tags as markers of diabetes mellitus: an epidemiological study in India. J Dermatol. 1995 Oct;22(10):729-31.
- Thomas D, Apovian C. Macrophage functions in lean and obese adipose tissue. Metabolism. 2017 Jul;72:120-43.
- Thomas GJ, Herranz P, Cruz SB, Parodi A. Treatment of actinic keratosis through inhibition of cyclooxygenase-2: Potential mechanism of action of diclofenac sodium 3% in hyaluronic acid 2.5. Dermatol Ther. 2019 May;32(3):e12800.
- Tripathy T, Singh BSTP, Kar BR. Association of skin tag with metabolic syndrome and its components: a case-control study from Eastern India. Indian Dermatol Online J. 2019 May-Jun;10(3):284-7.
- Tripp CS, Blomme EA, Chinn KS, Hardy MM, LaCelle P, Pentland AP. Epidermal COX-2 induction following ultraviolet irradiation: suggested mechanism for the role of COX-2 inhibition in photoprotection. J Invest Dermatol. 2003 Oct;121(4):853-61.
- Verges B. mTOR and cardiovascular diseases: diabetes mellitus. Transplantation. 2018 Feb;102(2S Suppl 1):S47-9.
- Verges B, Cariou B. mTOR inhibitors and diabetes. Diabetes Res Clin Pract. 2015 Nov;110(2):101-8.
- Wang HC, Huang SK. Metformin inhibits IgE- and aryl hydrocarbon receptor-mediated mast cell activation in vitro and in vivo. Eur J Immunol. 2018 Dec;48(12):1989-96.
- Wang Z, Zhang H, Shen XH, Jin KL, Ye GF, Qian L, et al. Immunoglobulin E and mast cell proteases are potential risk factors of human pre-diabetes and diabetes mellitus. PLoS One. 2011;6(12):e28962.
- Wang Z, Shen XH, Feng WM, Qiu W. Mast cell specific immunological biomarkers and metabolic syndrome among middle-aged and older Chinese adults. Endocr J. 2017 Mar 31;64(3):245-53.
- Zhang J, Shi GP. Mast cells and metabolic syndrome. Biochim Biophys Acta. 2012 Jan;1822(1):14-20.
- Zhang X, Huang Q, Wang X, Deng Z, Li J, Yan X, et al. Dietary cholesterol is essential to mast cell activation and associated obesity and diabetes in mice. Biochim Biophys Acta Mol Basis Dis. 2019 Jun 1;1865(6):1690-700.
- Zhang Y, Li X, Fang S, Zhu Z, Yao M, Ying L, et al. Peroxisome proliferator-activated receptor γ agonist suppresses mast cell maturation and induces apoptosis. Mol Med Rep. 2017 Aug;16(2):1793-800.
- Zhao M, Li XW, Chen Z, Hao F, Tao SX, Yu HY, et al. Neuro-protective role of metformin in patients with acute stroke and type 2 diabetes mellitus via AMPK/mammalian target of rapamycin (mTOR) signaling pathway and oxidative stress. Med Sci Monit. 2019 Mar 25;25:2186-94.
ДОДАТОК А
СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Літус ІО. Експресія М2-макрофагів, mTOR-позитивних клітин та VEGF у межах фіброепітеліальних поліпів шкіри у пацієнтів із метаболічним синдромом та цукровим діабетом 2-го типу. Укр. мед. часопис. 2020;(2 Т 2):43-8.
- Літус ІО, Свістунов ІВ. Особливості гістологічної будови рецидивуючих фіброепітеліальних поліпів шкіри у хворих з метаболічним синдромом та цукровим діабетом 2-го типу. Україна. Здоров’я нації. 2020;(2):137-41.
- Літус ІО. Асоціація множинних рецидивних фіброепітеліальних поліпів шкіри з ліпідним обміном в українській популяції. Дерматологія та венерологія. 2019;(4):27-9.
- Літус ІО. Оцінка експресії опасистих клітин та СОХ2 в межах фіброепітеліальних поліпів шкіри у пацієнтів з метаболічним синдромом та цукровим діабетом 2 типу. Здоров’я суспільства. 2020; 9(1): 6-12.
- Кочет КА, Литус ИА, Свистунов ИВ, Сулаева ОН. Патология кожи при сахарном диабете: клинико-патогенетические корреляции (обзор). Georgian Med News. 2017 Dec;(273):41-6.
- Літус ІО. Оцінка експресії опасистих клітин та СОХ2 в межах фіброепітеліальних поліпів шкіри у пацієнтів з метаболічним синдромом та цукровим діабетом 2 типу. В: Зб. тез наук. робіт учасників міжнар. наук.-практ. конф. Медична наука та практика в умовах сучасних трансформаційних процесів; 2020 Квіт 24-25; Львів. Львів: ГО “Львів. мед. спільнота”; 2020. с. 46-9.
ДОДАТОК Б
АПРОБАЦІЯ РЕЗУЛЬТАТІВ ДИСЕРТАЦІЇ
Основні положення роботи були представлені на: науково-практичній конференції «Дерматовенерологія в розробках молодих науковців. Наукова школа» (Київ, 2017); науково-практичній конференції «KDD 2017 12-ті Київські дерматологічні дні»; науково-практичній конференції «KDD 2018 13-ті Київські дерматологічні дні: Весняний симпозіум» (Київ, 2018); науково-практичній конференції з міжнародною участю «Актуальні питання сучасної діабетології» (Київ 2018); науково-практичній конференції «Дерматовенерологія в розробках молодих науковців» (Київ, 2018); науково-практичній конференції «Kyiv Skin Allergy Meeting 18-19 жовтня» (Київ, 2019); міжнародній науково-практичній конференції «Медична наука та практика в умовах сучасних трансформаційних процесів» (Львів, 24-25 квітня 2020 р.).
ДОДАТОК В
АКТИ ВПРОВАДЖЕННЯ







