Харківська медична академія післядипломної освіти
Державна установа «Інститут дерматології та венерології
Національної академії медичних наук України»
Кваліфікаційна наукова
праця на правах рукопису
Кравець Кіра Ігорівна
УДК 616.5-006-072-08
ДИСЕРТАЦІЯ
УДОСКОНАЛЕННЯ МЕТОДІВ ДІАГНОСТИКИ НОВОУТВОРЕНЬ ШКІРИ ІЗ ЗАЛУЧЕННЯМ МЕТОДІВ ІНСТРУМЕНТАЛЬНОЇ ДІАГНОСТИКИ ТА ВИЗНАЧЕННЯ ОПТИМІЗОВАНОЇ
ЛІКУВАЛЬНО-ДІАГНОСТИЧНОЇ ТАКТИКИ
14.01.20 – шкірні та венеричні хвороби
Подається на здобуття наукового ступеня кандидата медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
____________________________________ К.І. Кравець
(підпис, ініціали та прізвище здобувача)
Науковий керівник: Богомолець Ольга Вадимівна, доктор медичних наук, професор
Харків – 2018
АНОТАЦІЯ
Кравець К.І. Удосконалення методів діагностики новоутворень шкіри із залученням методів інструментальної діагностики та визначення оптимізованої лікувально-діагностичної тактики. – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 «Шкірні та венеричні хвороби». – Харківська медична академія післядипломної освіти, МОЗ України, Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2018.
Дисертаційна робота присвячена удосконаленню методів діагностики новоутворень шкіри із залученням дистанційної діагностики, визначенню груп новоутворень, для яких показано застосування дистанційної діагностики, лікуванню новоутворень шкіри. В роботі вивчались групи меланоцитарних новоутворень шкіри (меланоцитарні невуси та меланома шкіри) і немеланоцитарних новоутворень шкіри (себорейний кератоз та раки шкіри).
Меланоцитарні невуси. При порівнянні теледерматологічної та клінічної структури меланоцитарних невусів розміри, межі, краї, симетрія та поверхня не відрізнялись. Розбіжності були знайдені у формі та кольорі невусів. В одному випадку (0,9 %) при аналізі фотографії новоутворення, останнє було визначене як те, що має форму плями, тоді як при очному огляді лікар відмітив в анкеті форму папули. При аналізі кольорової гами при теледерматологічному огляді один колір e новоутворенні був відмічений у 41 (38,0 %) випадку, кілька кольорів – у 67 (62,0 %) випадках, при клінічному огляді один колір відмічався у 58 (53,7 %), багато кольорів – у 50 (56,3 %) випадках.
При аналізі теледерматоскопічної структури меланоцитарних невусів пігментна сітка візуалізувалась у 30 (27,8 %) випадках, тоді як при дерматоскопічному аналізі – у 51 (47,2 %) випадку. Найбільші розбіжності спостерігалися серед дрібних структур новоутворень та судинного рисунку. При теледерматоскопічному аналізі новоутворень окремі глобули у 5 (4,6 %) випадках не візуалізувались на відміну від дерматоскопічного огляду. Колір пігменту відрізнявся при теледерматоскопічному огляді, передаючи відтінок світлішим, ніж він був при дерматоскопічному огляді. У подібних випадках важливу роль відігравав анамнез. Судинний рисунок при теледерматоскопічному огляді був зафіксований у 27 (25,0 %), при дерматоскопічному огляді – у 68 (63,0 %) випадках.
Діагностика меланоцитарних невусів за допомогою теледерматології показала високу точність і склала (97,7 ± 0,5) %. На очному огляді точність діагностики виявилася вищою на 1,8 % і склала (99,5 ± 0,5) %. Верифікація проводилася на основі результатів гістологічного дослідження.
Меланома шкіри. При порівнянні теледерматологічної та клінічної структури меланоми шкіри розмір, краї, симетрія та поверхня не відрізнялись. Різниця спостерігалася серед форми новоутворень та меж. При теледерматологічному огляді новоутворення у вигляді плями були зафіксовані у 29 (61,7 %) випадках, при клінічному огляді – у 26 (55,3 %); при теледерматологічному огляді новоутворення у вигляді папули – в 13 (27,7 %) випадках, при клінічному – в 15 (31,9 %); при теледерматологічному огляді новоутворення у формі вузла – у 5 (10,6 %), при клінічному огляді – у 6 (12,7 %). Межі при теледерматологічному огляді були визначені як чіткі у 29 (61,7 %) випадках, при клінічному огляді – у 30 (63,9 %), як нечіткі при теледерматологічному огляді – у 18 (38,3 %), при клінічному огляді – у 17 (36,2 %).
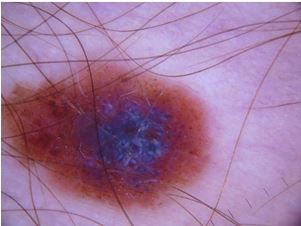
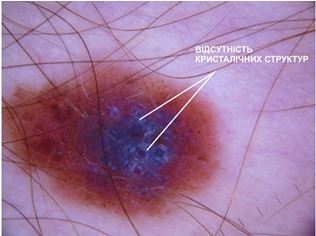
При теледерматоскопічному та дерматоскопічному оглядах новоутворень шкіри з попереднім діагнозом меланоми різниця спостерігалася серед наступних меланомоспецифічних ознак: кристалічних структур, атипових точок та глобул, біло-блакитної вуалі, структур регресу та атипових судин. Кристалічні структури при теледерматоскопічному огляді були відмічені у 26 (55,3 %) випадках, тоді як при дерматоскопічному огляді були відсутні у всіх випадках. Біло-блакитна вуаль при теледерматоскопічному огляді відзначалась у 10 (21,3 %) випадках, при дерматоскопічному огляді – у 13 (27,7 %). Структури регресу були відмічені при теледерматоскопічному огляді у 21 (44,7 %) випадку, при дерматоскопічному огляді – у 23 (48,9 %) випадках. Атипові точки і глобули при теледерматоскопічному огляді були відмічені у 4 (8,5 %) випадках, при дерматоскопічному огляді – у 5 (10,6 %). Атипові судини при теледерматоскопічному огляді були відмічені у 6 (12,7 %) випадках, при дерматоскопічному огляді – у 15 (31,9 %).
Діагностика меланоми шкіри за допомогою теледерматології показала точність у 85,1 %. На очному огляді точність діагностики була вищою на 5,8 % і склала 90,9 %. Верифікація проводилася на підставі гістологічного дослідження.
Себорейний кератоз. При аналізі теледерматологічної та клінічної структури новоутворень шкіри з попереднім діагнозом себорейного кератозу, розбіжності були виявлені серед форми, кольору, меж та поверхні. При теледерматологічному огляді 16 (16,5 %) новоутворень були відмічені у формі плями, при клінічному огляді – 14 (14,4 %); форму папули мали 69 (71,1 %) новоутворень при теледерматологічному огляді, при клінічному огляді відмічено 71 (73,2 %) випадок. Один колір у новоутворенні відмічався у 49 (50,5 %) випадках при теледерматологічному огляді і в 52 (53,6 %) при клінічному огляді. Більше двох кольорів відмічалося при теледерматологічному огляді у 48 (50,5 %), при клінічному огляді – у 49 (49,5 %) випадках. Чіткі межі в новоутвореннях при теледерматологічному огляді були відмічені у 81 (83,5 %) випадках, при клінічному огляді – у 83 (85,5 %). Нечіткі межі при теледерматологічному огляді спостерігались у 16 (16,5 %) випадках, при клінічному огляді – у 14 (14,4 %) випадках. Папіломатозна поверхня новоутворень при теледерматологічному огляді була відмічена в 17 (17,5 %) випадках, при клінічному огляді – у 18 (18,5 %) випадках; гладка поверхня при теледерматологічному огляді – у 48 (49,5 %), при клінічному огляді – у 47 (48,5 %).
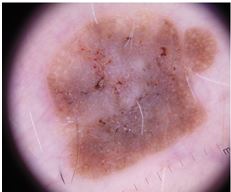
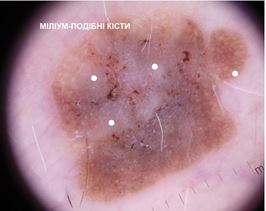
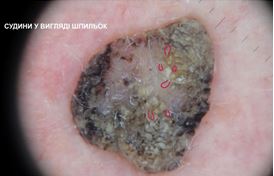
При теледерматоскопічному та дерматоскопічному оглядах різниця була відмічена серед структур: міліумподібні кісти, комедоноподібні отвори, біло-блакитна вуаль, судинний рисунок, поточений край, папіломатозні розростання, ознаки перчіння. При теледерматоскопічному огляді міліумподібні кісти відзначались у 15 (15,5 %) випадках, при дерматоскопічному огляді – у 41 (42,3 %). Комедоноподібні отвори при теледерматоскопічному огляді були описані у 35 (36,0 %) випадках, у той час як при дерматоскопічному огляді – у 36 (37,1 %). Судини у формі шпильок при теледерматоскопічному огляді відмічені у 16 (16,5 %) випадках, при дерматоскопічному огляді – у 45 (46,4 %). При теледерматоскопічному огляді ознака перчіння спостерігалась у 3 (3,0 %) випадках, при дерматоскопічному огляді – у 4 (4,1 %) випадках.
Діагностика себорейного кератозу за допомогою теледерматології показала точність у (97,4 ± 0,5) %. При очному огляді точність діагностики визначено вищою на 2,1 % і склала (99,5 ± 0,5) %.
Раки шкіри. При теледерматологічному та клінічному огляді новоутворень шкіри з попереднім діагнозом раку шкіри найбільша різниця спостерігалася серед судинного рисунку. При теледерматологічному огляді судини в новоутворенні були видимі у 28 (45,1 %) випадках, при клінічному огляді – у 33 (53,2 %) випадках. Розбіжності серед меж, країв, симетрії та поверхні незначні і складають у середньому 1,25 % при теледерматологічному та клінічному оглядах.
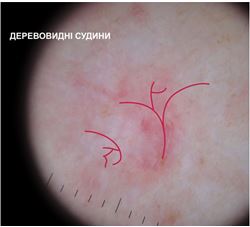
При теледерматоскопічному та дерматоскопічному оглядах різниця спостерігалася серед структур: деревовидних судин, множинних сіро-блакитних глобул, структур у вигляді спиць колеса, судинного рисунку. Множинні сіро-блакитні точки та глобули при теледерматоскопічному огляді спостерігались у 16 (25,8 %) випадках, при дерматоскопічному огляді – у 19 (30,6 %) випадках. Структури у вигляді спиць колеса при теледерматоскопічному огляді не були відмічені, при дерматоскопічному огляді – спостерігались у 1 (1,6 %) випадку. Деревовидні судини при теледерматоскопічному огляді спостерігались у 45 (72,6 %) випадках, при дерматоскопічному огляді – у 49 (79,0 %) випадках.
Точність діагностики немеланоцитарних раків шкіри за допомогою теледерматології склала (94,4 ± 5,6) %. При очному огляді точність діагностики становила (95,2 ± 4,8) % і була вищою на 0,8 %.
Лікування новоутворень шкіри. Рецидиви новоутворень шкіри після проведення лікувально-діагностичних біопсій у межах здорових тканин спостерігалися після радіохвильового та комбінованого методів і жодного разу після хірургічного методу. Після застосування комбінованого методу рецидиви новоутворень шкіри спостерігались у 3,3 %, при радіохвильовому – у 7,7 %.
Формування келоїдних рубців після діагностичної біопсії комбінованим методом становило 3,4 % протягом 12 місяців спостереження порівняно з радіохвильовим (7,7 %) та хірургічним (11,4 %) методами. Гіпертрофічні рубці спостерігались у 3,4 % після комбінованого методу і 7,4 % після радіохвильового методу. Формування найбільшої кількості нормотрофічних рубців відмічалося після комбінованого методу і склало 89,9 % порівняно з радіохвильовим (76,9 %) і хірургічним методами (88,9 %).
Наукова новизна одержаних результатів. Визначено групу новоутворень шкіри, для діагностики якої не показано застосування теледерматоскопії.
Встановлено та доведено, що методи теледерматології та теледерматоскопії є ефективними для діагностики меланоцитарних невусів, меланоми шкіри, себорейного кератозу, раків шкіри.
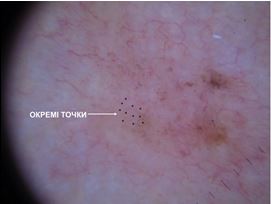
Вперше визначено різницю між структурами новоутворень шкіри при теледерматоскопічному та дерматоскопічному оглядах, яка найбільше спостерігалася серед судинного рисунку (при теледерматоскопії менше, ніж при дерматоскопії на 23,3 %), окремих точок та глобул (при теледерматоскопії менше, ніж при дерматоскопії на 4,3 %).
Доведено, що застосований комбінований метод при проведенні лікувально-діагностичної біопсії новоутворень шкіри в межах здорових тканин є ефективним при визначенні через 1 рік після втручання: рецидивів новоутворень (менше на 4,4 % ніж після радіохвильового методу), формування гіпертрофічних рубців (менше на 4,0 % ніж після радіохвильового методу), келоїдних рубців (менше на 4,4 % ніж після радіохвильового методу та на 7,7 % після хірургічного методу), нормотрофічних рубців (більше на 13,0 % ніж після радіохвильового методу та на 1 % ніж після хірургічного методу).
Результати дослідження впроваджено в науково-дослідну роботу вищих навчальних закладів та установ практичної охорони здоров’я.
Ключові слова: меланоцитарні невуси, себорейний кератоз, меланома шкіри, немеланоцитарні раки шкіри, дистанційна діагностика, лікувально-діагностична біопсія, гіпертрофічні рубці, келоїдні рубці, нормотрофічні рубці.
ABSTRACT
Kravets K.I. Improvement of skin tumour diagnostic methods with the use of instrumental diagnostic methods and determination of optimized diagnostic and treatment tactics. – Qualification scientific work with manuscript copyright.
Thesis for the Degree of Candidate of Medical Science on speciality 14.01.20 «Skin and venereal diseases». – Kharkiv Medical Academy of Postgraduate Education, Ministry of Health of Ukraine, State Establishment “Institute of Dermatology and Venereology of NAMS of Ukraine”, Kharkiv, 2018.
This dissertation discusses the improvement of skin tumour diagnostic methods with the use of remote diagnostics, determination of tumour groups for remote diagnostic application and treatment of skin neoplasms. A group of melanocytic neoplasms of the skin (melanocytic nevi and skin melanoma) and non-melanocytic skin tumours (seborrheic keratosis and skin cancers) were studied.
Melanocytic nevi. The size, boundaries, edges, symmetry and surface did not differ in the teledermatological and clinical structure of melanocytic nevi. The discrepancies were found in the shape and colour of the nevi. When analysing a photograph of tumours, in one case (0.9 %), the neoplasm was in a defined form of macula, while in the face-to-face examination, the doctor noted it was a form of a papula. When analysing the colours, teledermatological examination revealed one colour in 41 (38.0 %) cases and multiple colours in 67 (62.0 %) cases. A clinical examination revealed it was one colour in 58 cases (53.7 % ) and multiple colours in 50 (56.3 %) cases.
In the teledermascopic structure of melanocytic nevi, the pigmented network was visualized in 30 (27.8 %) cases, whereas dermoscopic analysis revealed it in 51 (47.2 %) cases. The greatest differences were observed among small structures and vascular pattern. In the teledermoscopic structure of tumours, individual globules were not visualized in 5 (4.6 %) cases in comparison with a dermoscopic examination. The colour of the pigment was different in the telemedicine examination, being lighter than it was during the dermoscopic examination. Anamnesis was important in such cases. A vascular pattern was seen in 27 (25,0 %) cases during the telemedicine examination and in 68 (63,0 %) cases during a dermoscopic examination.
The previous diagnosis of melanocytic nevi, established using teledermatology, was histologically confirmed in (97.7 ± 0.5) % cases. Face-to-face examination showed 1.8 % higher accuracy and was histologically confirmed in (99.5 ± 0.5) % cases.
Melanoma. When comparing the teledermatological and clinical structure of melanoma, the size, edges, symmetry and surface did not differ. The difference was observed among the forms of neoplasms and borders. In the teledermatological examination, neoplasms in the form of macula were registered in 29 (61.7 %) cases. During the face-to-face examination, this occurred in 26 cases (55.3 %). In the teledermatological examination, tumours in the form of papules were revealed in 13 (27.7 %) cases. During the face-to-face examination, 15 tumours in the form of papules were shown (31.9 %). In the teledermatological examination, tumours in the form of a node were revealed in 5 (10.6 %) cases, while in the face-to-face examination, 6 tumours were shown in the form of a node (12.7 %). In the teledermascopic structure of neoplasms, boundaries were defined as sharp in 29 (61.7 %) cases, while in the face-to-face examination, this occurred in 30 (63.9 %). as fuzzy when analysing teledermascopic structure – 18 (38.3 %), in face-to-face examination – in 17 (36.2 %) cases.
During teledermatological and dermatological examinations, in skin tumours with a previous diagnosis of melanoma, the difference was observed among the following melanoma-specific structures: crystalline structures, atypical dots and globules, blue–white veil, regression structures and atypical vessels. Crystalline structures were noted during teledermoscopic examination in 26 (55.3 %) cases, while in the dermoscopic examination, crystalline structures were absent in all cases. The blue–white veil was observed during the teledermoscopic examination in 10 (21.3 %) cases. The blue–white veil was observed during the dermoscopic examination in 13 (27.7 %) cases. Regression structures were noted during tele-dermatological examination in 21 (44.7 %) cases, and they were observed during the dermoscopic examination in 23 (48.9 %) cases. Atypical dots and globules were observed in 4 (8.5 %) cases in the telescopic examination and in 5 cases (10.6 %) during the dermoscopic examination. Atypical vessels were detected during the teledermoscopic examination in 6 (12.7 %) cases and during the dermoscopic examination in 15 (31.9 %) cases.
Among all skin tumours with a previous diagnosis of melanoma established by teledermatology, histological diagnoses were confirmed in 85.1 % cases. Face-to-face examination showed 5.8 % higher accuracy and was histologically established in 90.9 % cases.
Seborrheic keratosis. When analysing teledermatological and clinical structure of skin neoplasms with a preliminary diagnosis of seborrheic keratosis, discrepancies were found among forms, colours, borders and surfaces. During the teledermatological examination, 16 (16.5 %) tumours were revealed in the form of maculas. However, during the face-to-face examination, 14 (14.4 %) tumours were found in the form of maculas. During the teledermatological examination, 69 (71.1 %) tumours were in the form of papules, and during face-to-face examination 71 (73.2 %) tumours were observed in the form of papules. One colour was noted in 49 (50.5 %) cases during teledermatological examination and in 52 cases (53.6 %) during face-to-face examination. More than two colours were observed in 48 (50.5 %) cases during the teledermatological examination, and in 49 (49.5 %) cases during face-to-face examination. Clear boundaries were noted in 81 cases (83.5 %) during teledermatological examination and in 83 (85.5 %) cases during face-to-face examination. Fuzzy boundaries were observed in 16 (16.5 %) cases during teledermatological examination and in 14 (14.4 %) cases during face-to-face examination. A papillomatous surface of the tumours was noted in 17 (17.5 %) cases during teledermatological examination and in 18 (18.5 %) cases during face-to-face examination. A flat surface was observed in 48 (49.5 %) cases during teledermatological examination, and in 47 (48.5 %) during the face-to-face examination.
When analysing teledermoscopic and dermoscopic structures, differences were noted, including milia-like cysts, komedo-like openings, vascular patterns and peppering. During the teledermoscopical examination, milia-like cysts were observed in 15 (15.5 %) cases. During the dermoscopical examination, this was observed in 41 cases (42.3 %). Komedo-like openings were observed during the teledermoscopical examination in 35 (36.0 %) cases, while during the dermoscopical examination, they were observed in 36 cases (37.1 %). Hairpin vessels were noted during teledermoscopical examination in 16 (16.5 %) cases, and during the dermoscopical examination, they were observed in 45 (46.4 %) cases. During teledermoscopical examination, peppering was observed in 3 (3.0 %) cases, and during dermoscopical examination, they were observed in 4 (4.1 %) cases.
Histologically teledermatological diagnoses of seborrheic keratosis were confirmed in (97.4 ± 0.5) % cases. Face-to-face examinations howed 2.1 % higher accuracy and was histologically confirmed in (99.5 ± 0.5) % cases.
Skin cancer. When analysing teledermatological and clinical structure of skin neoplasms with a preliminary diagnosis of skin cancer, the greatest differences were observed in the vascular pattern. During teledermatological examination, vessels were observed in 28 (45.1 %) neoplasms, while during face-to-face examination, they were seen in 33 (53.2 %) cases. Differences between boundaries, edges, symmetry and surface were negligible and made up an average of 1.25 % of both teledermatological and clinical structures.
When analysing teledermoscopic and dermoscopic structures, differences were observed, including multiple blue–grey globules, spokes-wheel structures and vascular patterns. Multiple blue–grey dots and globules were detected during the teledermoscopical examination in 16 (25.8 %) cases, and during the dermatoscopical examination, they were observed in 19 (30.6 %) cases. Spokes-wheel structures were not marked during dermatoscopical examination. During the dermatoscopical examination, they were observed in 1 (1.6 %) case. Arborizing vessels were observed in the teledermoscopical examination in 45 (72.6 %) cases, and during dermatoscopical examination, they were seen in 49 (79.0 %) cases.
Among all skin tumours with a preliminary diagnosis of skin cancer established with teledermatology, histological diagnosis confirmed in (94.4 ± 5.6) % cases. Face-to-face examination showed 0,8 % higher accuracy and was histologically confirmed in (95.2 ± 4.8) % cases.
Skin tumour treatment. Recurrence of skin tumours after diagnostic biopsies within healthy tissues was observed after radiowave and combined methods, and never after the surgical method. After the application of the combined method, recurrence of skin tumours was observed in 3.3 %. After the radiowave method, this occurred in 7.7 %.
The formation of keloid scars after diagnostic biopsy with the combined method was noted in 3.4 % cases during 12 months of observation in comparison with the radiowave method (7.7 %) and surgical (11.4 %) methods. Hypertrophic scars were observed in 3.4 % cases after the combined method and 7.4 % after the radiowave method. The formation of the largest number of normotrophic scars was noted after the combined method and amounted to 89.9 % compared to the radiowave method (76.9 %) and the surgical method (88.9 %).
Scientific novelty of the results obtained. The group of skin neoplasms which is not suitable for teledermatology has been established.
It has been established and proved that methods of teledermatology and teledermoscopy are effective for diagnostics of melanocytic nevi, skin melanoma, seborrheic keratosis and skin cancers.
For the first time, the difference between structures of skin neoplastics during teledermatological and dermatological examination was found, which was most observed in the vascular pattern (23,3 % less with teledermoscopy than with dermatoscopy), some dots and globules (4,3 % less with teledermoscopy than with dermatoscopy).
It was proved that combined method, used for diagnostic and treatment biopsy of skin tumours within healthy tissues is effective at the moment of 12 months observation after the procedure. Tumour recurrence was less 4,4 % than after the radio wave method, formation of hypertrophic scars were less than 4,0 % less than the radio wave method, keloid scars were less 4,4 % than after the radio wave method. Normotrophic scars were 13,0 % more than the radio wave method and 1,0 % than after surgical treatment method.
The research results were introduced in the research work of higher educational institutions and practical health care.
It was established that the diagnosis of skin tumours with the help of remote diagnostics is effective. The use of the combined method in the treatment of skin tumours reduces the risk of tumour recurrence and the formation of pathological scarring.
Key words: melanocytic nevus, seborrheic keratosis, skin melanoma, non-melanocytic skin cancers, remote diagnostics, diagnostic biopsy, hypertrophic scars, keloid scars, normotrophic scars.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ:
- Кравець К.І., Богомолець О.В. Сучасні методи теледерматології в діагностиці новоутворень шкіри. Український журнал дерматології, венерології, косметології. 2015. № 3 (58). С.13–17 (Особистий внесок – аналіз даних, опис дослідження).
- Кравець К.І. Становлення та застосування телемедицини у світі та в Україні. Дерматологія та венерологія. 2017. № 4 (78). С. 94–98.
- Кравець К.І., Богомолець О.В. Найпоширеніші немеланомні раки шкіри. Вісник Української медичної стоматологічної академії «Актуальні проблеми сучасної медицини». 2018. Т. 18, Вип. 1 (61). С. 308–312 (Особистий внесок – аналіз літературних даних за останні роки, написання статті).
- Кравець К.І., Богомолець О.В. Порівняльна характеристика дерматоскопії та теледерматоскопії на прикладі меланоцитарних невусів та меланоми шкіри. Український журнал дерматології, венерології, косметології. 2018. № 1 (68). С. 17–22 (Особистий внесок – відбір даних для дослідження, аналіз даних, написання статті).
- Store-and-Forward Teledermatology for the Most Common Skin Neoplasms in Ukraine / K. Kravets, Z. Dranyk, O. Vasylenko, O. Bogomolets. Acta Dermatovenerologica Alpina, Pannonica et Adriatica. 2018. Iss.27. P. 79–83 (Особистий внесок – аналіз даних, написання статті).
- Застосування комбінованого методу у лікуванні новоутворень шкіри / К.І. Кравець, Ж.Н. Драник, О.В. Василенко, О.В. Богомолець. Science Rise. Medical Science. 2018. № 5 (25). С. 23–30 (Особистий внесок – відбір даних для дослідження, аналіз даних, написання статті).
- Кравець К.І., Богомолець О.В. Застосування сучасних методів у діагностиці себорейного кератозу. Дерматологія та венерологія. 2018. № 2 (80). С. 59–62.
- Teledermoscopy in the Diagnostics of Atypical Nevi: Ukrainian Experience / O. Magonia, O. Bogomolets, K. Kravets, S. Dyachuk, M. Zhuravel. EADV, Spring Symposium. Cracow, 23-26 May, 2013.
- Kravets K., Bogomolets O., Dyachuk S. The Effectiveness of Teledermatology Use in Skin Cancers Diagnosis. 5th EAAD congress “United for dermatology”, Riga, 18-20 September, 2015. P.95.
- Kravets K., Bogomolets O. Application and Study of the Effectiveness of Skin Tumours Remote Diagnostics in Ukraine. 6th World Congress of Teledermatology. London, 14th–15th October, 2016. P. 48.
- Кравець К.І., Сидоренко І.І., Богомолець О.В. Порівняльна характеристика теледерматоскопічної та дерматоскопічної діагностики немеланомних раків шкіри. Матеріали науково-практичної конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», 10–11 листопада 2017 р., м. Харків. Дерматологія та венерологія. 2017. № 3 (77). С. 103–104.
- Кравець К.І., Сидоренко І.І., Богомолець О.В. Теледерматологічна діагностика меланоми шкіри за допомогою платформи Telederm. Мат. III (X) з’їзду Української асоціації лікарів дерматовенерологів і косметологів, 22-23 листопада 2017 р., м. Львів. Український журнал дерматології, венерології, косметології. 2017. № 4 (67). С. 106.
- Кравець К.І., Богомолець О.В. Застосування методів телемедицини у діагностиці меланоми шкіри. Матеріали IX міжнародного семінару студентів та молодих вчених, присвячений Всесвітньому дню боротьби з раком, 1-2 лютого 2018 р., м. Київ. Український науково-медичний молодіжний журнал. 2017. № 2 (101). С. 45.
- Дерматоскопія. Міні-атлас. Вид. 1 / К.І. Кравець, С.Д. Дячук, І.І. Сидоренко, О.В. Магоня, Н.М. Семенюк; під ред. О.В. Богомолець. К. : ТОВ «Глянець», 2018. 75 с.
| ЗМІСТ | |
| Перелік умовних позначень | 18 |
| Вступ | 19 |
| Розділ 1 Огляд літератури | 24 |
| 1.1 Новоутворення шкіри і важливість їх своєчасної і доступної діагностики24 | 24 |
| 1.1.1 Меланоцитарні невуси | 24 |
| 1.1.2 Себорейний кератоз | 28 |
| 1.1.3 Меланома шкіри | 30 |
| 1.1.4 Немеланоцитарні раки шкіри | 37 |
| 1.2 Методи інструментальної діагностики | 45 |
| 1.2.1 Становлення та застосування телемедицини у світі та в Україні | 45 |
| 1.2.2 Теледерматологія як складова телемедицини | 54 |
| 1.2.3 Застосування теледерматології у діагностиці новоутворень шкіри | 58 |
| 1.3 Лікувально-діагностичні тактики і особливості їх застосування у лікуванні новоутворень шкіри | 60 |
| 1.3.1 Радіохвильовий метод | 60 |
| 1.3.2 Кріодеструкція | 61 |
| 1.3.3 Метод хімічної деструкції | 63 |
| 1.3.4 Електрокоагуляція | 63 |
| 1.3.5 Лазерний метод | 63 |
| 1.3.6 Хірургічний метод | 64 |
| Розділ 2 Загальна методика та методи дослідження | 66 |
| 2.1 Матеріали дослідження | 66 |
| 2.2 Загальна характеристика дослідження | 68 |
| 2.3 Методи дослідження | 69 |
| 2.3.1 Метод анамнестичного дослідження | 69 |
| 2.3.2 Методи теледерматологічної та клінічної, теледерматоскопічної та дерматоскопічної діагностики меланоцитарних невусів | 69 |
| 2.3.3 Методи теледерматологічної та клінічної, теледерматоскопічної та дерматоскопічної діагностики меланоми шкіри | 70 |
| 2.3.4 Методи теледерматологічної та клінічної, теледерматоскопічної та дерматоскопічної діагностики себорейного кератозу | 71 |
| 2.3.5 Методи теледерматологічної та клінічної, теледерматоскопічної та дерматоскопічної діагностики немеланомного раку шкіри | 72 |
| 2.4 Методи лікування новоутворень шкіри | 73 |
| 2.4.1 Радіохвильовий метод | 73 |
| 2.4.2 Комбінований метод | 74 |
| 2.4.3 Хірургічний метод | 74 |
| 2.5 Оцінка діагностичної цінності телемедичних оглядів | 74 |
| 2.5.1 Методи оцінки моральної ефективності | 74 |
| 2.5.2 Методи оцінки економічної ефективності телемедицини | 75 |
| 2.6 Статистичний аналіз даних | 75 |
| Розділ 3 Діагностика меланоцитарних новоутворень шкіри | 77 |
| 3.1 Діагностика меланоцитарних невусів | 78 |
| 3.1.1 Теледерматологічна та теледерматоскопічна діагностика меланоцитарних невусів | 78 |
| 3.1.2 Клінічна та дерматоскопічна діагностика меланоцитарних невусів | 82 |
| 3.2 Діагностика меланоми шкіри | 88 |
| 3.2.1 Теледерматологічна та теледерматоскопічна діагностика меланоми шкіри | 88 |
| 3.2.2 Клінічна та дерматоскопічна діагностика меланоми шкіри | 93 |
| Розділ 4 Діагностика немеланоцитарних новоутворень шкіри | 100 |
| 4.1 Діагностика себорейного кератозу | 100 |
| 4.1.1 Теледерматологічна та теледерматоскопічна діагностика себорейного кератозу | 100 |
| 4.1.2 Клінічна та дерматоскопічна діагностика себорейного кератозу | 103 |
| 4.2 Діагностика немеланоцитарного раку шкіри | 109 |
| 4.2.1 Теледерматологічна та теледерматоскопічна діагностика немеланоцитарного раку шкіри | 109 |
| 4.2.2 Клінічна та дерматоскопічна діагностика немеланоцитарного раку шкіри | 113 |
| Розділ 5 Лікування новоутворень шкіри | 120 |
| 5.1 Радіохвильовий метод | 121 |
| 5.2 Комбінований метод | 122 |
| 5.3 Хірургічний метод | 123 |
| Розділ 6 Діагностична цінність телемедичних оглядів | 128 |
| 6.1 Оцінка діагностичної цінності телемедичних оглядів | 128 |
| 6.1.1 Методи оцінки моральної ефективності | 128 |
| 6.1.2 Методи оцінки економічної ефективності телемедицини | 129 |
| 6.2 Статистичний аналіз даних | 130 |
| Розділ 7 Узагальнення та обговорення результатів | 133 |
| 7.1 Діагностика новоутворень шкіри | 133 |
| 7.2 Віддалені результати, після проведення лікувально-діагностичних біопсій новоутворень шкіри радіохвильовим, комбінованим та хірургічним методами | 142 |
| Висновки | 146 |
| Рекомендації | 148 |
| Список використаних джерел | 149 |
| Додаток А Анкета пацієнта | 171 |
| Додаток Б Дерматоскопічний аналіз | 174 |
| Додаток В Акти впровадження | 175 |
| Додаток Г Список публікацій здобувача за темою дисертації та відомості про апробацію результатів дисертації | 181 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
АК – актинічний кератоз
БКРШ – базально-клітинний рак шкіри
БКП – базально-клітинна папілома
ВООЗ – Всесвітня організація охорони здоров’я
КА – кератоакантома
МН – меланоцитарний невус
НМРШ – немеланоцитарні раки шкіри
ПКРШ – плоскоклітинний рак шкіри
СК – себорейний кератоз
ТД – теледерматологія
SAF – Store-and-forward
ВСТУП
Актуальність теми. Шкіра нерідко є джерелом для розвитку різних новоутворень, у тому числі злоякісних – раку шкіри, меланоми, диференціальна діагностика яких потребує особливих знань і навичок. Діагностичні помилки лікарів під час діагностики можуть відбуватися з різних причин: брак знань, нетипове розташування неоплазій, схожість новоутворень між собою, відсутність досвіду роботи лікаря в даній сфері [1, 85, 178]. Підтвердити кінцевий діагноз може лише гістологічне дослідження, але попередній діагноз є вкрай важливим для призначення діагностичної біопсії та виставляється лікарем на підставі клінічного та дерматоскопічного обстеження [96].
Одними з перших спеціалістів, до кого звертаються пацієнти з новоутвореннями шкіри є сімейні лікарі, онкологи та дерматовенерологи. Окрім наявності спеціаліста важливу роль у правильній інтерпретації отриманих при огляді даних відіграє попередній клінічний досвід лікаря в галузі дерматоонкології. Відсутність такого досвіду може призвести до діагностичної помилки, що, у свою чергу, може мати трагічні наслідки.
Проблему відсутності лікарів даної спеціалізації на місці може вирішити телемедицина, особливо підрозділи телеконсультації та теленавчання [20].
Телемедицина, в тому числі дистанційна діагностика як один з її методів, широко використовується у всьому світі. З розвитком телемедицини розвинувся її більш вузький напрямок – теледерматологія (ТД). ТД спрямована на надання високоспеціалізованої дерматологічної допомоги на відстані за допомогою засобів Інтернет зв’язку та інформаційних технологій. Вона забезпечує передачу інформації між пацієнтом і лікарем та навпаки [44, 198]. Новоутворення шкіри добре візуалізуються. А отже, використання клінічних зображень робить її ідеальним вибором для телемедицини на практиці [105].
Своєчасна діагностика і диференціальна діагностика доброякісних і злоякісних новоутворень шкіри визначає подальшу тактику лікування та прогноз щодо життя і здоров’я пацієнта. Методи лікування новоутворень шкіри мають свої показання та обмеження, здатні вплинути на кінцевий результат лікування і його ефективність.
Таким чином, впровадження та застосування ТД у діагностиці доброякісних та злоякісних новоутворень шкіри має значимий характер для пацієнтів не тільки великих міст, а і віддалених регіонів.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота є фрагментом комплексних науково-дослідних робіт «Розробити індикатори якості спеціалізованої дерматовенерологічної допомоги населенню України в медичних закладах різного рівня» (номер держреєстрації 0113U001923), в якій дисертант брав участь у розробці організаційних заходів щодо скринінгу хворих на наявність новоутворень шкіри, та «Дослідити деякі аутозапальні механізми хронічних дерматозів» (номер держреєстрації 0115U000578), в якій дисертант приймав участь у розділах щодо дослідження патогенезу новоутворень шкіри.
Мета та задачі дослідження. Мета – підвищити ефективність терапії новоутворень шкіри шляхом удосконалення діагностики із залученням сучасних інструментальних методів обстеження та розробки комбінованого методу лікувально-діагностичної біопсії.
У роботі були поставленні наступні задачі:
- Визначити перелік новоутворень, для діагностики яких можливо застосувати дистанційну діагностику.
- Визначити ефективність дистанційних методів діагностики у випадках меланоцитарних невусів (МН), меланоми шкіри, себорейного кератозу (СК) та раків шкіри.
- Визначити особливості структур МН, меланоми шкіри, СК та раків шкіри при теледерматоскопічному та дерматоскопічному оглядах.
- Визначити моральну та економічну ефективність телемедичних оглядів новоутворень шкіри.
- Вивчити ефективність комбінованого методу при проведенні діагностичної біопсії новоутворень шкіри та порівняти результати з наслідками радіохвильового та хірургічного методів.
Об’єкт дослідження – новоутворення шкіри.
Предмет дослідження – клінічна / дерматоскопічна та теледерматологічна / теледерматоскопічна структура новоутворень шкіри, результат лікування.
Методи дослідження: огляд (клінічний огляд новоутворень шкіри на очній консультації), епілюмінесцентна діагностика (огляд новоутворень шкіри за допомогою дерматоскопу), теледерматологічний метод (огляд новоутворень шкіри за макроскопічною фотографією), теледерматоскопічний метод (аналіз структури новоутворень шкіри за дерматоскопічною фотографією), анкетування (отримання письмових відповідей на запитання у спеціально розроблених бланках), статистичні (результати роботи піддавались статистичній обробці).
Наукова новизна одержаних результатів. Вперше визначено, що для новоутворень шкіри з вираженим судинним рисунком не показано застосування теледерматоскопії.
Встановлено і доведено, що методи ТД та теледерматоскопії є ефективними для діагностики МН, меланоми шкіри, СК, раків шкіри.
Вперше визначено різницю між структурами новоутворень шкіри при теледерматоскопічному та дерматоскопічному оглядах, яка найбільше спостерігалася серед судинного рисунку (при теледерматоскопії менше, ніж при дерматоскопії на 23,3 %), окремих точок та глобул (при теледерматоскопії менше, ніж при дерматоскопії на 4,3 %).
Доведено, що застосування комбінованого методу в проведенні лікувально-діагностичної біопсії новоутворень шкіри в межах здорових тканин при визначенні через рік після втручання знижує ризик появи рецидивів новоутворень шкіри та формування патологічних видів рубців.
Практичне значення одержаних результатів. Запропоновано та впроваджено в практику теледерматологічну та теледерматоскопічну діагностику МН, меланоми шкіри, СК, раків шкіри.
Впроваджено проведення лікувально-діагностичної біопсії новоутворень шкіри комбінованим методом (радіохвильовий метод та кріодеструкція основи).
Основні положення дисертації впроваджено в практичну роботу ПП «Інститут дерматокосметології доктора Богомолець» (м. Київ), Полтавського обласного клінічного шкірно-венерологічного диспансеру, КЗ «Івано-Франківський обласний клінічний шкірно-венерологічний диспансер», КНП «Міський шкірно-венерологічний диспансер № 1» Харківської міської ради, Волинського обласного шкірно-венерологічного диспансеру, КНП Харківської обласної ради «Обласний клінічний шкірно-венерологічний диспансер № 1».
Особистий внесок здобувача. Автором разом із керівником визначено тему дисертації, мету та задачі дослідження. Автор самостійно провів патентний пошук, здійснив огляд літератури за темою дисертації. Дисертант самостійно відібрав усі випадки новоутворень шкіри для аналізу, порівняв та проаналізував наявність або відсутність структур у новоутвореннях при дерматоскопічному та теледерматоскопічному оглядах, порівняв та проаналізував віддалені результати біопсій новоутворень різними методами, провів статистичний аналіз даних.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Дисертантом не були використані результати та ідеї співавторів публікацій. Конфлікту інтересів немає.
Апробація результатів дисертації. Матеріали дисертації доповідались і обговорювалися на II Національному симпозіумі з anti-age-медицини (Київ, 2015), Медичному спеціалізованому форумі (Київ, 2016), 6-му Всесвітньому конгресі з теледерматології (Лондон, 2016), науково-практичній конференції «Сучасні методи діагностики та лікування новоутворень шкіри» (Київ, 2016), III з’їзді Української асоціації лікарів-дерматовенерологів і косметологів (Львів, 2017), IX міжнародному семінарі студентів та молодих вчених, присвяченому всесвітньому дню боротьби з раком (Київ, 2018), Українському дерматоскопічному конгресі (Київ, 2018).
Публікації. За темою дисертації опубліковано 14 друкованих робіт, з них 7 статей, з яких 1 – у моноавторстві (5 – у фахових наукових журналах, 1 – у журналах, що входять до міжнародних наукометричних баз, 1 стаття – у закордонному виданні), 6 тез доповідей, 1 міні-атлас.
Структура та обсяг дисертації. Дисертаційна робота викладена на 183 сторінках машинописного тексту. Складається зі вступу, огляду літератури, опису загальної методики та методів дослідження, 4 розділів власних досліджень, обговорення результатів дослідження, висновків, рекомендацій, списку літератури та чотирьох додатків. Робота містить 20 рисунків, 40 таблиць. Бібліографічний список містить 217 джерел, з них 34 – кирилицею і 183 – латиницею.
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУРИ
1.1 Новоутворення шкіри і важливість їх своєчасної і доступної діагностики
Новоутворення шкіри поділяються на меланоцитарні та немеланоцитарні, кожна із цих груп, у свою чергу, поділяється на доброякісні та злоякісні. Враховуючи велику кількість існуючих новоутворень і станів, буває важко встановити діагноз не тільки спеціалістам суміжних спеціальностей, але і фахівцям даної сфери. Остаточний діагноз встановлює патогістологічне дослідження, але лише лікар визначає необхідність його проведення [32].
Усі новоутворення шкіри мають форму відносно рівня шкіри: субепідермальне (нижче рівня шкіри), у вигляді вузла, папули, бляшки або макули. Вони можуть бути пігментованими, тілесного кольору або червоного кольору. Для встановлення діагнозу необхідно оцінювати загальний стан пацієнта, клінічну картину новоутворень шкіри та гістологічний діагноз. Оцінка клінічної картини новоутворення базується на деталізації форми, поверхні, кольору та розміру, супутніх симптомів новоутворення та його анатомічному розташуванні. Гістологічна характеристика стосується клітинного складу та процесів у самому утворенні при мікроскопічному обстеженні [76].
1.1.1 Меланоцитарні невуси
Меланоцитарні невуси (МН) є доброякісною проліферацією меланоцитів, які мігрують з неврального гребеня під час внутрішньоутробного розвитку до вибіркових ділянок ектодерми, насамперед шкіри, а також – очей, вух та центральної нервової системи [162]. Меланоцитарні невуси (ектопічні меланоцити) були виявлені при розтині в шлунково-кишковому та сечостатевому тракті. В меланоцитах меланін виробляється меланосомами. Проліферація меланоцитів призводить до появи вроджених та набутих МН. Останні існують у вигляді плям, папул, бляшок та вузлів. Меланоцитарні утворення виникають через:
– підвищену концентрацію меланіну в епідермісі при нормальній кількості меланоцитів (ефіліди);
– збільшену кількість меланоцитів уздовж базальної мембрани епідермісу (лентиго);
– утворення гнізд меланоцитів на епідермо-дермальній межі та/або в дермі (родимки).
Не існує єдиної думки, але вважається, що генетичні чинники та сонячне випромінювання можуть впливати на зміни структури меланоцитарних новоутворень [196]. Невоїдні новоутворення необхідно спостерігати, а використання цифрового або ручного дермоскопа підвищує точність діагностики злоякісних новоутворень з 46 % до 93 %. Таким чином, дермотоскопія допомагає в спостереженні та лікуванні новоутворень [143]. Розвиток МН є багатофакторним та гетерогенним біологічним процесом, а молекулярні процеси, що призводять до появи меланоцитарних новоутворень, є різноманітними і їх лише починають вивчати. На відміну від широкомасштабних і геномних досліджень меланоми, дослідження доброякісних меланоцитарних новоутворень були обмежені мутаційним аналізом, орієнтованим на гени, класично включені в меланогенез [193].
МН можуть бути присутніми на момент народження або з’являтися протягом життя. Більшість МН розвиваються в дитячому віці, пік розвитку спостерігається в дорослому віці (третє десятиліття), потім мають тенденцію зникати [59, 91]. Більшість невусів спостерігається на обличчі, шиї та зовнішній частині верхніх кінцівок. Оскільки кількість невусів залежить від інтенсивності засмаги, це відноситься до фактору ризику розвитку меланоми шкіри.
Вроджені меланоцитрані невуси можуть існувати на момент народження або з’являються протягом першого року життя [169, 188]. Деякі автори виділяють період появи вроджених невусів до 2 років.
Існуючі класифікації:
1) залежно від розміру [75]:
– маленькі – менші, ніж 1,5 см;
– середні – від 1,5 до 20 см;
– великі або гігантські – більші, ніж 20 см.
2) удосконалена класифікація [52]:
– маленькі – <1,5 см; – середні – від 1,5 до 10 см; – великі – від 11 до 20 см; – гігантські – більші, ніж 20 см: G1 (21-30 см); G2 (31-40 см); G3 (>40 см).
3) класифікація, запропонована деякими авторами в 2013 році [115]:
– маленькі (<1.5 см); – середні (M1: 1.5-10 см, M2: >10-20 см);
– великі (L1: >20-30 см, L2: >30-40 см);
– гігантські (G1: >40-60 см, G2: >60 см);
– сателітні невуси: відсутні; 1–20; 21–50; і >50.
Клінічно вроджені меланоцитрані невуси – це плями темно- або світло-коричневого кольору з окремим ділянками чорного або темно синього кольору. З часом можуть набувати об’єму за усією площею або в окремих ділянках. Гістологічно меланоцитарна інфільтрація виявляється в глибоких шарах дерми, часто пов’язана з придатками шкіри, іноді простягається до підшкірно-жирової клітковини.
Набуті МН можуть бути поодинокими або множинними. Їх кількість більше 50 відноситься до фактору ризику. Розміри від 1–2 мм до 1 см, колір варіює від рожевого до чорного. Розрізняють гістологічні типи набутих МН, які є етапами розвитку:
1) пограничний невус [143]. Клінічно: пляма округлої або овальної форми, з чіткими межами, симетрична, світло або темно-коричневого однорідного кольору. Гістологічно гнізда МН розташовуються на епідермо-дермальній межі;
2) складний невус (змішаний невус) [87]. Клінічно: папула округлої або овальної форми, світло або темно коричневого кольору, симетрична, з чіткими межами. Гістологічно: меланоцитарні гнізда розташовуються на епідермо-дермальній межі та дермі;
3) внутрішньодермальний невус [35, 106]. Клінічно: папула або вузол округлої або овальної форми з чіткими межами, симетричний, світло- або темно-коричневого кольору, або тілесного кольору. Гістологічно: гнізда меланоцитів розташовуються в дермі, клітини втратили колір.
4) комбінований невус [194]. Клінічно: наявність ділянки блакитного невусу в структурі будь-якого невусу.
Окремо виділяють:
1) гало-невус (невус Сеттона). Клінічно: МН, оточений білим ореолом [155, 201]. Поява білого ореолу пов’язана з руйнуванням меланоцитів CD8+ Т-лімфоцитами;
2) блакитний невус [39, 63]. Клінічно: папула або вузол з гладкою поверхнею, з чіткими межами та рівними краями. Має синій колір, інколи зі стальним відтінком з домішками коричневого та білого. Гіпомеланотичний варіант блакитного невусу зустрічається дуже рідко і клінічно представляє собою депігментовану папулу з окремими ділянками блакитно-коричневого кольору [147]. Гістологічно: гнізда меланоцитів розташовуються в дермі. Розрізняють два типи блакитного невусу: звичайний та клітинний;
3) диспластичний невус (атиповий невус, невус Кларка). Клінічно: пляма з припіднятою ділянкою в центральній частині (симптом яєшні окатої). Краї нерівні, «рвані». Забарвлення нерівномірне, присутні кілька відтінків коричневого, чорний кольори [67, 152, 161]. Гістологічно: меланоцити на епідермо-дермальній межі, в папілярному шарі дерми. Термін «атиповий» стосується клінічної картини новоутворення, тоді як «диспластичний» відображає гістологічну будову;
4) невус Шпіц. Клінічно: папула рожевого кольору, швидко збільшується в розмірах. Зустрічається, в основному, серед дітей, частіше на обличчі. При наявності у дорослому віці, невус може мати структуру, подібну до меланоми, тому необхідно ретельно оцінити дерматоскопічну структуру та провести діагностичну біопсію [97]. Невусу Шпітц рідко присутній у людей похилого віку, що свідчить про можливість регресії з віком [112]. Гістологічно: веретеноподібні або епітеліоїдні невусні клітини розташовуються в епідермісі, дермі або в обох шарах, можлива наявність мітозів;
5) невус Ріда. Деякі автори вважають цей невус пігментною формою невуса Шпіц, який схожий гістологічно [150, 214]. Діагностується частіше на третьому десятилітті у жінок. В більшості випадків, це новоутворення знаходиться на кінцівках. Клінічно: інтенсивно пігментований, з чіткими межами, однорідною структурою чорного кольору, може швидко збільшуватись [160]. Гістологічно: наявні лише веретеноподібні клітини, які розташовуються в епідермісі та сосочковому шарі дерми.
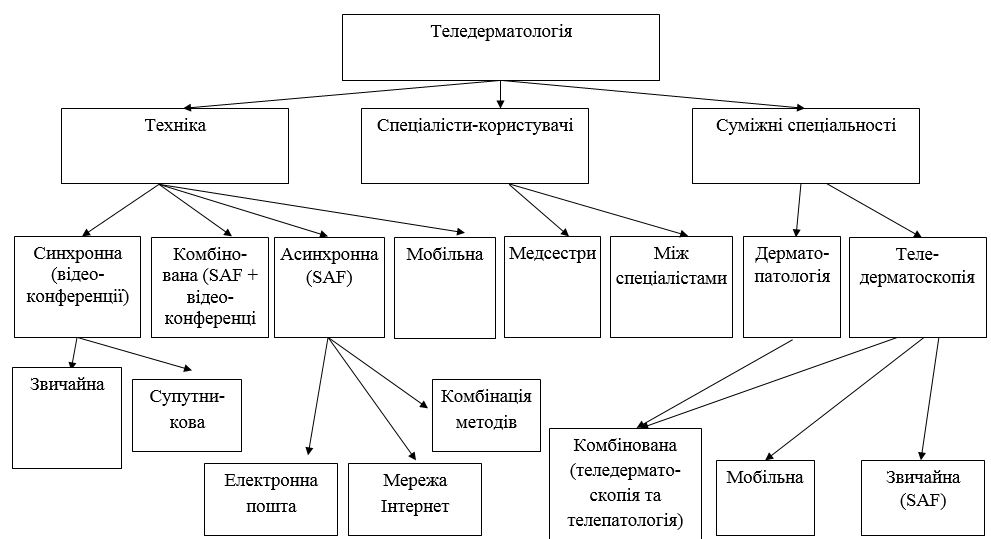
Дерматоскопічна структура МН [2, 11]:
– пігментна сітка: типова (лінії однакової товщини, комірки однакового розміру), атипова (лінії різної товщини, комірки різного розміру);
– глобули: структури діаметром 0,1 мм, симетричні, однакового кольору та розміру;
– гомогенна блакитна пігментація (однотонний блакитний колір або з наявними відтінками сірого та сіро-стального);
– судинний рисунок: у вигляді коми, точок.
1.1.2 Себорейний кератоз
СК (син.: бородавка стареча, бородавка себорейна) належить до групи епідермальних пухлин [153, 163].
Хоча СК і переважає у людей старшого віку, з’явитися може у молодому та середньому віці серед людей європеоїдної раси із сонячними опіками в анамнезі [156]. У віці 15-25 років СК зустрічається у 12 %, тоді як у віці 50 років – у 100 % випадків [211]. Зазвичай розташовується на шкірі голови та тулуба, за винятком долонь і стоп [90]. Ніколи не з’являється на слизових оболонках. Етіологія все ще обговорюється. Вірусна природа СК не була підтверджена [135]. Різка поява великої кількості кератом може бути пов’язана з наявністю онкологічного процесу в організмі і відноситись до паранеопластичного процесу [183]. СК не має злоякісного потенціалу, на відміну від актинічного кератозу (АК), який може давати початок розвитку плоскоклітинному раку [157]. Не зважаючи на відсутність злоякісного потенціалу, у 89 % випадків в новоутворенні виникає принаймні одна, а в 45 % більше, ніж одна мутація в онкогені [89, 207]. Мутації з частотою 40-85 % відбуваються у FGFR3 та з частотою 40 % – PIK3CA. Інші мутовані гени в СК включають HRAS, KRAS, EGFR та AKT1 [88, 89, 90].
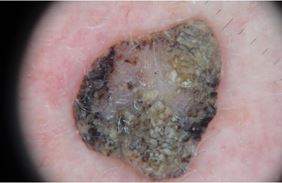
Клінічно: бляшка жовтого, коричневого або сірого кольору з гладкою або шорсткою поверхнею, межі чіткі. Здатна до швидкого росту, стає об’ємною, збільшується за площею [90]. Можлива наявність тонкої ніжки. На поверхні можуть розвиватися вегетації. Інколи СК може бути чорного кольору і нагадувати меланому. Діаметр від 1 мм і може досягати 4–6 см.
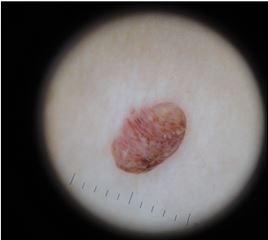
Дерматоскопічна структура СК [2, 11]:
– міліумподібні кісти – дрібні округлі структури білого кольору. Гістологічно є роговими псевдокістами, які розташовуються у верхніх шарах епідермісу. Видимі краще за допомогою стандартної дерматоскопії;
– комедоноподібні отвори – округлі структури сірого, коричневого або чорного кольору, які гістологічно є інвагінаціями епідермісу, заповненими кератином. Однаково добре видимі за допомогою стандартної та поляризаційної дерматоскопії;
– мозкоподібний рисунок – розгалужені ущелини, які зливаються і утворюють картину мозкових звивин. З’являються внаслідок заповнення інвагінацій епідермісу кератином;
– структури у вигляді відбитків пальців – тоненькі гребінці, що нагадують відбитки пальців;
– судини у вигляді шпильок – невеликі тонкі судини у формі шпильок для волосся, часто оточені білим ореолом, створеним кератином;
– поточені краї – ознака на периферії утворення, різко обірвана крайова зона;
– кератоз – суцільна щільна кірка, позбавлена дерматоскопічних ознак на поверхні утворення;
– папіломатозні розростання – поверхня утворення представлена розростаннями у вигляді скупчення дрібних папілом;
– ознака перчіння – сіро-блакитні точки на місці травмованого СК.
Гістологічно: характеризується папіломатозом, акантозом, проліферацією клітин епідермісу. Виділяють п’ять різновидів СК: 1) подразнений; 2) аденоїдний; 3) плаский; 4) з наявністю внутрішньоепідермальної епітеліоми; 5) меланоакантома [213].
1.1.3 Меланома шкіри
Меланома – злоякісне меланоцитарне новоутворення шкіри, що метастазує лімфогенно і гематогенно. В 2014 році було зареєстровано 2545 хворих на меланому шкіри, в 2015 році зареєстровано достовірне зростання захворюваності серед чоловіків на 11,9 %, серед жінок – на 8 % [25]. Меланома виникає при злоякісному перетворенні меланоцитів – меланін-продукуючих клітин шкіри, очей, слизових оболонок та оболонок головного мозку, які відповідають за пігментацію та фотозахист. Меланоцити походять із клітин-попередників нервового гребеня і їх розвиток регулюється рецептором тирозинкінази c-KIT та мікрофтальмія-асоційованим транскрипційним фактором [122].
Меланома розвивається через мутації ДНК. Найважливішим фактором ризику вважається ультрафіолетове випромінення, особливо небезпечне для людей з I фототипом шкіри, схильним до опіків, особливо у дитячому віці [41, 83, 123]. Найбільшою схильністю відрізняються люди з блакитними очима, рудим волоссям, веснянками та I фототипом шкіри. Меланома зрідка з’являється в дитячому та підлітковому віці і не часто у віці 20-30 років, але найчастіше у віці 30-50 років. Зазвичай у жінок формується на нижніх кінцівках, у чоловіків – на спині. Дуже рідко меланома формується на сідницях і на волосистій частині голови у жінок [200]. Більшість меланом виникають de novo, хоча значна частина (25-40 %) виникає на фоні невусів. Останні клінічно описані як атипові і гістологічно ідентифіковані як диспластичні невуси [164]. Разом із вродженими невусами, диспластичні невуси вже давно вважаються факторами ризику та попередниками меланоми, що вимагає їх спостереження. Велика кількість невусів є фактором ризику появи меланоми, але ще і свідчить про високу сонячну інсоляцію індивіда. При наявності більше 20 невусів на шкірі, їх профілактичне видалення не виправдане, але допустиме з косметичною метою. Гігантські вроджені невуси (> 20 см) несуть підвищений ризик розвитку меланоми і їх рекомендують при можливості видаляти [197]. В сімейному анамнезі збільшується ризик розвитку меланоми у чоловіків у 8 разів [79, 118]. У носіїв мутацій BRCA2 ризик розвитку меланоми у 2,58 рази вищий [209, 212].
Акрально-лентигінозна меланома зрідка трапляється серед людей європеоїдної раси, але це найчастіша форма меланоми серед азіатів та афро-американців. Вона виникає на долонях, підошвах, під нігтями і не асоціюється із сонячним випроміненням або невусами. Вузлова форма меланоми зустрічається частіше серед чоловіків у віці після 40 років.
Меланома метастазує лімфогенно та гематогенно до мозку, легенів, печінки, кісток та шкіри. Чим раніше виставлений діагноз меланоми, тим кращий прогноз [184]. Глибина пухлини за Бреслоу вимірюється в мм від зернистого шару епідермісу в напрямку дерми [167]. При товщині пухлини <0,76 п’ятирічна виживаність складає 100 %, у випадках товщини >3,5 – 50 % прогноз не сприятливий. Класифікація за Кларком базується на глибині інфільтрації дерми [42]. Перша та друга стадії мають сприятливіший прогноз, 3–5 стадії – не сприятливий. Меланома проходить дві фази росту: горизонтальний та вертикальний [56, 195]. Меланома типу злоякісного лентиго, поверхнево-розповсюджена форма та акрально-лентигінозна форми проходять спочатку фазу радіального росту, потім переходять у стадію вертикального росту. Меланома типу злоякісного лентиго – багато років залишається in situ і має найкращий прогноз серед усіх форм меланоми, як і поверхнево-розповсюджена форма, поки знаходиться у стадії горизонтального росту. Вузлова форма меланоми не має фази горизонтального росту і розвивається одразу у фазі вертикального росту, має найнесприятливіший прогноз.
Меланома типу злоякісного лентиго складає від 4 % до 15 % від усіх форм меланоми [117]. Розвивається на шкірі обличчя, шиї та вушних раковин. З’являється у вигляді пласкої пігментної плями, що поступово збільшується [70, 179]. Фазу радіального росту проходить дуже повільно і має назву злоякісного лентиго або веснянки Гетчинсона [121]. Діагностика меланоми типу злоякісного лентиго є складною, оскільки клінічна картина може бути різноманітною. Кольорова гама – починаючи від тілесного кольору до коричневого і чорного, інколи з відтінками червоного, синього, білого, сірого. Краї нерівні, інколи зазубрені. В зоні меланоми можливі ознаки фотопошкодження шкіри. При інвазії базальної мембрани в дерму частина новоутворення потовщується і стає вузловою. В такому стані новоутворення називається меланомою типу злоякісного лентиго. Можливе формування декількох вузлів [97]. Гістологічно злоякісне лентиго містить ознаки епідермальної атрофії та солярного еластозу. Характерним є проліферація атипових меланоцитів вздовж базальної мембрани за участю волосяних фолікулів. Інвазія мультифокальна і, в результаті, меланома типу злоякісного лентиго має веретеноподібну клітинну структуру [40, 114].
Поверхнево розповсюджена форма меланоми має вигляд плями темного кольору, яка поступово стає об’ємною і відчутною на дотик. Збільшується за площею в різні сторони, має нерівні краї. Складки шкіри зникають по мірі росту новоутворення. Меланома може бути різного кольору, зазвичай різних відтінків коричневого з окремим ділянками чорного, червоного, синього, рожевого. Прогноз сприятливий доки меланома знаходиться у фазі горизонтального росту і стає несприятливим при переході у фазу вертикального росту, що клінічно проявляється наявністю вузла [205]. Меланома може розташовуватись на будь-яких ділянках тулуба, найчастіше на нижніх кінцівках у жінок та на спині у чоловіків. Розвивається в молодому та середньому віці, превалює серед жінок. Цей тип меланоми найчастіше асоціюється з атиповими та іншими невусами [202]. На відміну від меланоми типу злоякісного лентиго, поверхнево розповсюджена форма меланоми не завжди асоціюється з актинічним пошкодженням. Атипові клітини хаотично розташовуються в межах епідермісу поодинці або скупченням і носять педжетоїдний тип розповсюдження.
Акрально-лентигінозна форма меланоми складає 2-3 % від усіх форм меланоми [37]. Клінічно – подібна до злоякісного лентиго та поверхнево розповсюдженої форми меланоми. Але інвазивний ріст, формування вузла та поява метастазів відбуваються на ранніх етапах розвитку. Асоціюється з гіршим прогнозом, ніж інші види меланоми, хоча описані суперечливі результати, які не підтримують таку думку [53, 141]. Розвивається на долонях та підошвах. Гістологічні ознаки подібні до злоякісного лентиго за винятком гіперплазії епідермісу. Атипові меланоцити розташовуються уздовж базального шару епідермісу, однак можуть залучатися інші шари, зокрема, роговий шар. Зустрічаються мітози. Меланому формують епітеліоїдні та веретеноподібні клітини.
Меланома слизових оболонок складає менше 2 % випадків. Переважає у жінок. Хоча вона може розвиватися на будь-яких слизових оболонках, переважна більшість виникає на слизових голови і шиї (від 31 % до 55 %), аноректальних (від 17 % до 24 %) та вульвовагінальних (від 18 % до 40 %) ділянках [125, 177, 186]. Рідше зустрічається на слизових оболонках глотки, гортані, сечовивідних шляхів, шийки матки, стравоходу та жовчного міхура. Клінічно – пляма з нерівномірною пігментацією та краями, яка часто діагностується на пізніх етапах розвитку. Зустрічається рідко. П’ятирічна виживаність становить 17–25 % порівняно з меланомою шкіри (80 %) [86, 125, 146].
Піднігтьова меланома зустрічається рідко і складає 3 % від усіх форм меланоми. Середній вік пацієнтів – 59–60 років, рідко розвивається в підлітковому віці. Під нігтьовою пластиною розвивається пігментація неправильної форми, яка виходить за межі пластини на нігтьовий валик (ознака Гетчінсона). Проте, ознака Гетчінсона не є ні високо специфічною, ні досить чутливою, щоб підтвердити або виключити піднігтьову меланому [189]. Ніготь деформується, тріскається та розщеплюється, що пов’язано з потовщенням пухлини. Гістологічно відбувається лентигінозне розповсюдження плеоморфних, часто дендритичних, атипових меланоцитів в базальному та надбазальних шарах. Диференціальну діагностику необхідно проводити з травмою нігтьової пластини та поздовжньою меланоніхією.
Нодулярна меланома – агресивний підтип меланоми, який не має фази горизонтального росту, а одразу розвивається за фазою вертикального росту [129]. Складає 10–30 % від усіх форм меланом, летальність складає 43 % [154]. Меланома у формі папули поступово стає вузловою, може виразкуватися, кровити та метастазувати. Зазвичай, чорного кольору, але зустрічається безпігментна форма рожевого або червоного кольору з можливим коричневим обідком з однієї сторони [100, 140]. Нодулярна форма меланоми може розвиватись на будь-яких ділянках шкіри, але зазвичай на кінцівках (жінки) та тулубі (чоловіки). Гістологічна картина фази вертикального росту відповідає типу меланоми, в якій це відбувається.
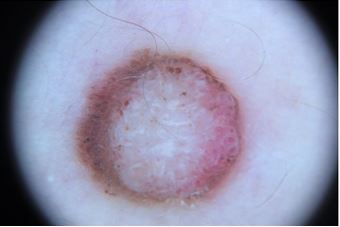
Дерматоскопічна структура меланоми шкіри [2, 11]:
– атипова пігментна сітка – характеризується різною товщиною ліній та нерівномірним кольором, різною величиною комірок. Має зовнішній вигляд «рваної»;
– лінії – лінійні структури, які розташовані у напрямку від утворення до нормальної шкіри. На цей час єдиним терміном «лінії» об’єднують поняття радіальних променів та псевдоподій. Радіальні промені – це лінійні утворення по периферії пігментного утворення без булавовидного потовщення на кінчику, псевдоподії – лінійні утворення по периферії пігментного утворення з булавоподібним потовщенням на кінчику. Обидві структури гістологічно відображають злиття пограничних гнізд пігментних меланоцитів і є ознакою периферійного росту утворення;
– негативна пігментна сітка – звивисті гіпопігментні лінії, які оточують пігментні структури неправильної форми, що нагадують видовжені та криволінійні глобули;
– кристалічні структури – короткі блискучі лінії білого кольору, які можна побачити лише за допомогою поляризаційної дерматоскопії у невусі Шпіц та в меланомі. Розташовані перпендикулярно по відношенню один до одного (утворюють прямий кут);
– атипові точки та глобули – асиметричні, округлої або овальної форми структури, які розташовуються локально на периферії утворення або в будь-якій іншій ділянці;
– атипова пігментація – гіперпігментована асиметрична ділянка на периферії утворення, можлива наявність багатьох ділянок в одному утворенні;
– біло-блакитна вуаль – осередкова, неправильної форми, розмита, зливна пігментація блакитного кольору. Може розташовуватися локально в новоутворенні або займати всю площу;
– структури регресу. До структур регресу відносяться ознака перчіння та рубцевидна депігментація. Ознака перчіння – велика кількість сіро-блакитних точок, за рахунок вільного меланіну та меланофагів у верхніх шарах дерми. Візуально нагадують розсипаний молотий чорний перець. Ознака рубцевидної депігментації – ділянка в новоутворенні білого кольору, що світліша як від самого утворення, так і від оточуючої шкіри;
– атипові судини – до атипових судин належать: ділянки світло-рожевого кольору (збільшена кількість судин в новоутворенні), судини у вигляді глобул (неоангіогенез навкруги острівців пухлини), лінійні та звивисті судини неправильної форми та різного розміру, судини у вигляді шпильок на рожевому фоні, клубочковидні та спіралевидні судини;
– коричневі безструктурні ділянки на периферії – гіпопігментні гомогенні ділянки, позбавлені дерматоскопічних ознак, які займають не менше 10 % площі новоутворення.
Для встановлення діагнозу меланоми проводиться ексцизійна біопсія у всю товщину шкіри з мінімальними відступами. Після визначення глибини пухлини за Бреслоу проводять висічення у широких межах з відступами в 0,5 см для меланоми in situ, 1 см – при глибині до 2 мм, і 2 – см при глибині більше 2 мм [60]. При розташуванні меланоми в косметично значимих зонах допускається зменшення меж висічення, але з обов’язковим проведенням мікрографічної операції. Видалення сторожевого лімфатичного вузла рекомендовано при глибині пухлини > 1 мм або при глибині >0,75 мм та наявних додаткових факторів ризику, таких як виразкування, мітотична активність [93]. При лікуванні пацієнта з меланомою з несприятливим прогнозом застосовують імунотерапію, таргетну терапію, хіміотерапію та променеву терапію.
Роль імунотерапії була відома протягом майже двох десятиліть. Показано, що висока доза інтерлейкіну-2 (HD-IL-2) є ефективною терапією при метастатичній меланомі, причому дуже малий відсоток пацієнтів проходить тривалий курс лікування. HD-IL2 має частоту відповіді близько 16 % (6 % повної відповіді та 10 % часткової) у пацієнтів з метастатичною меланомою [66, 68].
Таргетна терапія. При меланомі шкіри активується шлях мітоген-активованої протеїнкінази (шлях Ras / Raf / MEK / ERK). Драйверна мутація BRAF спостерігається приблизно у 50 % пацієнтів з метастатичною меланомою. Показано, що інгібітори BRAF є ефективними при лікуванні мутантної BRAF метастатичної меланоми як монотерапія, так і в комбінації з інгібіторами МЕК. Середній термін виживання хворих з метастатичною меланомою, які отримували тільки інгібітори BRAF, коливається від 14 до 18 місяців. У поєднанні з інгібіторами МЕК, термін виживання підвищується до більш, ніж двох років. Вторинні злоякісні новоутворення шкіри є результатом токсичності, що відзначається лише прийомом інгібіторів BRAF, і цей ризик знижується шляхом додавання інгібіторів МЕК. Висип та лихоманка – побічні ефекти цих препаратів [45, 101, 124, 158].
Хіміотерапія. Історично склалося, що хіміотерапевтичний препарат дакарбазин є стандартом лікування пацієнтів з метастатичною меланомою, яким не показаний ІЛ-2. Таксани та темозоломід – інші речовини, які впливають на меланому. Проте, з появою ефективної імунотерапії та таргетної терапії, системна хіміотерапія призначена тільки для пацієнтів, які не чутливі для обох варіантів лікування [204].
Променева терапія показана в стаціонарі пацієнтам з метастазами в головний мозок (стереотаксична радіохірургія). Стереотаксичне опромінення організму може використовуватися для лікування онкозахворювання з низькими метастатичними можливостями. В інших випадках опромінення застосовують паліативно [62, 175].
1.1.4 Немеланоцитарні раки шкіри
Згідно з Національним канцер-реєстром України в 2016 році група немеланоцитарних раків шкіри (НМРШ) посіла третє місце серед чоловіків і склала 9,9 % від усіх злоякісних новоутворень, і друге місце серед жінок і склала 12,6 % [26]. Основною причиною їх появи вважається сонячне випромінювання [47]. Данина моді та витончення озонового шару вважаються складовою проблеми. Солярне пошкодження залежить від типу шкіри, кумулятивної експозиції ультрафіолетового опромінення, її інтенсивності, сонячної експозиції в дитинстві [46, 185]. Досить важливі величина, інтенсивність та період підлягання сонячної експозиції. Солярний кератоз та плоскоклітинна карцинома виникають внаслідок хронічного сонячного опромінення. Деякі форми меланоми виникають у працівників закритих приміщень (офіси, фабрики, шахти), які потрапляють на сонце лише під час відпустки і часто згорають. Люди, які отримали сонячні опіки в дитячому віці частіше схильні до появи раку шкіри. Доведений підвищений ризик для жителів екваторіальних зон [17].
Ультрафіолетове (УФ) світло розподіляється на діапазони: УФА (315–400 нм), УФВ (280–315 нм), УФС (200–280 нм). Озоновий шар не пропускає УФ світло нижче рівня 290 нм. Тільки УФА досягає дерми, увесь інший спектр поглинається епідермісом. УФ світло викликає пошкодження на клітинному рівні. УФВ викликає мутацію гена-супресора пухлин, відіграючи головну роль у патогенезі [142]. УФ-випромінювання викликає пряме пошкодження ДНК, але також може призвести до утворення реактивних видів кисню та реактивних азотних проміжних сполук, які потім викликають непрямі окислювальні пошкодження ДНК [55]. Фотозахист шкіри необхідний для попередження цих процесів. УФ випромінення викликає місцеву та системну імуносупресію, на що вказує зменшення кількості клітин Лангерганса, зниження реакції гіперчутливості сповільненого типу до алергенів. Раки шкіри часто виникають у пацієнтів з імуносупресією, їх перебіг відзначається агресивністю [81, 120, 191, 206].
До найрозповсюдженіших варіантів раку шкіри належать плоскоклітинний (ПКРШ) та базально-клітинний раки шкіри (БКРШ). Хоча БКРШ та ПКРШ є найбільш поширеними типами, вони легко лікуються при ранньому виявлені (приблизно 95 % випадків).
ПКРШ – злоякісне новоутворення з кератиноцитів зі здатністю до метастазування у 2–3 % випадків [55, 74]. П’ятирічне виживання складає 40–50 %, виживання протягом першого року – 44–56 % [215]. Притаманний людям літнього віку, вдвічі частіше виникає у чоловіків. Серед причин виникнення виділяють УФ випромінювання, рентгенівське опромінення, смолу, дьоготь, сажу, миш’як, рубці, генетичні захворювання (альбінізм, пігментна ксеродерма), захворювання слизових оболонок (червоний плескатий лишай, склерозуючий лишай), вірус папіломи людини, PUVA-терапія, імуносупресія [64, 65, 74]. Часто розвивається на фоні АК [38, 199]. Було виявлено, що у пацієнтів після трансплантації серця та легенів ПКРШ розвивається частіше, а у пацієнтів після трансплантації печінки – рідше [71]. Виявлено також численні гени супресори пухлинного росту та онкогени, важливі для фотокарциногенезу: p53, PTCH1, RAS, BRM, GADD45, p16, c-Fos, Bcl-2, матричні металлопротеїнази та невідповідність генів репарації [92]. Найбільш важливим та найкраще вивченим геном, який асоціюється з НМРШ є ген-супресор пухлинного росту p53, який визначається у 50-100 % випадків.
Розрізняють внутрішньоепідермальний та інвазивний ПКРШ. До внутрішньоепідермальної форми належать хвороба Боуена та еритроплазія Кейра. Інвазивний ПКРШ може бути екзофітним та ендофітним.
Клінічно новоутворення з’являється у вигляді бляшки, яка збільшуючись у розмірах, набуває вузлової форми. Поверхня може бути вкрита роговими масами або виразками. Виразка часто вкривається кірочкою, під нею – гнійна основа. Краї щільні та припідняті, в порівнянні з базаліомою, часто вивернуті і нерівні. Новоутворення росте зі швидкістю кератоакантоми (КА), значно швидше за БКРШ.
ПКРШ з’являється на відкритих ділянках шкіри – на обличчі, вушних раковинах, нижній губі, тильній стороні долоней, передпліччах, гомілках. Як правило, на оточуючій шкірі є ознаки фотопошкодження. ПКРШ може метастазувати у лімфатичні вузли та мати летальні наслідки. На прогноз впливає декілька факторів: наявність новоутворень-попередників (напр., на фоні хвороби Боуена, АК ПКРШ рідко метастазує; при появі на чистій шкірі або після рентгенівського опромінення – частіше метастазує), локалізація новоутворення (на вушній раковині та червоній каймі губи – часто метастазує, також при розташуванні на зовнішніх статевих органах, перианально), прийом імуносупресантів (новоутворення агресивніші), ступінь диференціації (високодиференційовані пухлини мають кращий прогноз, ніж низькодиференційовані), глибина інвазії (більша глибина інвазії має гірший прогноз).
Дерматоскопічна структура ПКРШ [2, 11]:
– кератинові перлини – структури округлої або витягнутої форми з нечіткими межами, які можуть розташовуватись по всій площі утворення;
– структури у вигляді листя конюшини – структури білого кольору, які мають вигляд чотирьох листків і за формою нагадують листя конюшини або пелюстки троянди. Можна побачити лише за допомогою поляризаційної дерматоскопії;
– гломерулярні судини – щільно закручені у клубочок судини, які можуть займати всю площу утворення;
– судини у вигляді шпильок на білому фоні – дрібні або великі судини у вигляді шпильок для волосся. Білий фон утворює оточуючий кератин.
Гістологічна картина високодиференційованої плоскоклітинної карциноми представлена інфільтрованими острівцями пухлини з диференціацією плоских клітин зі сформованими десмосомами та гіперкератозом. Мітотична активність не збільшена, плеоморфізм мінімальний.
Низькодиференційовані пухлини характеризуються вираженим плеоморфізмом, діагноз встановлюється за наявності невеликих ділянок кератинезації та десмосом.
БКРШ – злоякісна пухлина шкіри, яка розвивається з базальних клітин епідермісу та має місцеводеструктивні властивості. Розрізняють декілька підтипів: виразкова форма, пігментована форма, кістозна форма, склеродермоподібна форма, поверхнева форма, фіброепітеліома Пінкуса, синдром Горліна.
До появи базаліом схильні особи з 1,2 фототипами шкіри, сонячними опіками в анамнезі, особи похилого віку, наявність раку шкіри в сімейному анамнезі. Ген рецептор меланокортину 1, MC1R, асоціюється зі світлою шкірою, рудим волоссям та підвищеним ризиком розвитку меланоми та немеланомних раків шкіри [61, 135, 176]. Обидва фактори, ген MC1R та засмага у приміщенні, були використані для прогнозування ризику раннього розвитку базаліоми у статистичних моделях [138]. Підвищений ризик з віком пацієнта може бути частково обумовлений зниженою здатністю відновлювати пошкодження ДНК ультрафіолетовим випромінюванням, що призводить до накопичення канцерогенних фотопродуктів [159]. Окрім УФ пошкодження, велику роль у патогенезі поодиноких базаліом відіграють мутації в гені ptc 1 (PTCH1) на хромосомі 9q22. Втрата гетерозиготності PTCH1 є найчастішою генетичною перебудовою при БКРШ, що спостерігається у 53-69 % випадків [168]. Невоїдний базальноклітинний синдром (синдром Горліна–Гольця) є аутосомно-домінантним розладом, викликаним мутаціями в гені PTCH1, що призводить до порушення активації сигналу hedgehog та підвищеного ризику розвитку БКРШ [71]. PTCH1 кодує білок, який функціонує як рецептор для лігандів сигнального шляху hedgehog, які, будучи мутованими, призводять до неконтрольованого росту клітин і пухлиногенезу БКРШ. Сигнальний шлях hedgehog є генетичною основою для розробки цілеспрямованої терапії БКРШ. Ген-супресор пухлинного росту p53 є ще одним важливим фактором в патогенезі БКРШ. P53 відіграє вирішальну роль у репарації ДНК та регуляції клітинного циклу [50]. Зазначені показники мутації p53 становлять від 44 % до 56 % в БКРШ [182].
Базаліоми частіше формуються на шкірі обличчя (у 80 %) і рідше на шкірі тулуба (20 %). Гістологічно пухлина складається з острівців базальних клітин базального шару епідермісу та аднексальних структур.
Клінічно пацієнти звертають увагу на рану, що не загоюється і періодично кровить. На базаліому часто не звертають увагу, оскільки ранка не болить і не турбує. Це притаманно особам похилого віку, можливо через нездатність добре бачити. Базаліома рідко метастазує, але наділена деструктивною здатністю та інвазивним ростом. Це надзвичайно важливо у зонах природніх отворів (очі, нас, вухо). Якщо невчасно діагностувати утворення, воно глибоко інфільтрує тканини, порушуючи роботу органів.
Виразкова форма. З’являється у вигляді папули, яка набуває нодулярної форми і в центрі формується виразка. Краї чітко окреслені, припідняті та закручені, кольору перлини. Судини розташовуються уздовж країв, через що новоутворення може набувати червоного кольору. Однак при компресії судини зникають і з’являється перлинний колір. Гістологічно пухлина складається із розрізнених острівків маленьких клітин темного кольору, однакових ядер, слабко вираженої цитоплазми. Острівки пухлини завжди асоціюються з активно проліферуючою сполучнотканинною стромою, що є невід’ємною частиною пухлини.
Пігментована форма. Має схожі клінічні ознаки з виразковою формою, але краї пігментовані темним кольором, що надає схожі ознаки з меланомою. Гістологічно характеризується відкладанням меланіну як в клітинах пухлини, так і за їх межами.
Нодулярна форма. Починає виразкуватися на пізніх етапах свого розвитку. Клінічно – це папула, яка розвивається у дольчастий вузол перлинного забарвлення з гладкою телеангіектатичною поверхнею. Часто досягає невеликих розмірів, через що можна прийняти за доброякісне новоутворення. Гістологічно в структурі відмічаються кістозні вогнища. Така структура характерна для аденоїдної форми базаліоми.
Склеродермоподібна форма. Важко діагностується. Можна сплутати з рубцем, оскільки немає структури пухлини. Клінічно виглядає як щільна бляшка з гладкою поверхнею. Важливими ознаками є телеангіектатичні судини та перлинний колір. Гнізда пухлини інфільтрують тканини за межами клінічно видимих країв бляшки, в глибину сягають дерми та підшкірно-жирової клітковини. Через це важко розпізнати межі пухлини і видалення часто неповне. Гістологічно надмірна проліферація сполучної тканини надає структурі пухлини склеродермоподібну структуру, мітотична активність присутня.
Поверхнева форма. Поодинока пляма на тулубі або кінцівках, яку часто плутають з псоріазом або екземою. Клінічно – це пляма червоного кольору з кірочками на поверхні з чіткими межами, трішки припіднята над рівнем шкіри. Можлива наявність тонкого піднятого краю. Може бути пігментованою. З часом може перетворюватись у нодулярну або виразкову форму. Гістологічно представлена поодинокими вогнищами.
Фіброепітеліома Пінкуса. Утворення у вигляді бляшки або вузла червоного кольору з бородавчатою поверхнею. Часто асоціюється з поверхневою формою або базально-клітинною папіломою (БКП) і часто неправильно діагностується. Гістологічно довгі розгалужені тяжі. Вони анастомазують та оточують фіброзну строму, формуючи складну сітчасту структуру. Рідко фіброепітеліома Пінкуса розвивається в інвазивну форму [17].
Дерматоскопічна структура БКРШ [2, 11]:
– сіро-блакитні овоїдні гнізда – великі округлі пігментовані структури з чіткими межами, що можуть зливатись між собою. Зазвичай, синього кольору;
– сіро-блакитні глобули – окремі глобули, значно менші від овоїдних гнізд, сірого, блакитного або коричневого кольору;
– листкоподібні структури – округлі структури на периферії утворення, які за формою нагадують клиновий лист. Колір від коричневого до сіро-блакитного;
– структури у вигляді спиць колеса – структури у вигляді променів, об’єднаних в центрі. За формою нагадують спиці колеса. Варіантом структур у вигляді спиць колеса є округлі структури з темною центральною частиною. Колір коричневий або чорний;
– деревоподібні судини – чітко виражені, крупні, розгалужені судини, які розташовуються на всій площі. За формою нагадують гілки дерев.
Лікування НМРШ можна поділити на хірургічне (хірургічне висічення, кріотерапія, лазерна абляція, операція за Мосом) та консервативне (медикаментозне лікування, фотодинамічна терапія).
Основою лікування НМРШ вважається хірургічне видалення пухлини, яке забезпечує непоганий косметичний результат та високу ефективність (рецидиви БКРШ протягом 5 років < 2 %) [127]. Лазери викликають коагуляційний некроз, абляцію та гіпертермію, що призводить до знищення пухлини. Багато досліджень показали, що лазери є новим, ефективним варіантом лікування НМРШ [73, 172]. Кріохірургія спричинює локальне обмороження, некроз та деструкцію тканин і застосовується серед пацієнтів з БКРШ з низьким ризиком метастазування [57]. Це швидка процедура невисокої вартості. Мікрохірургія за Мосом – це ефективна методика, що забезпечує низький рівень місцевих рецидивів НМРШ. Використання мікрохірургії за Мосом протягом останніх десяти років стало неухильно зростати у світі, при цьому дана операція становить приблизно одну третину всіх хірургічних втручань для НМРШ. Мікрохірургія за Мосом забезпечує 100 % обстеження країв резекції, що гарантує остаточне видалення пухлини, максимальне збереження здорових тканин [174, 180]. Променева терапія може успішно застосовуватись для лікування НМРШ [58]. Це альтернативне лікування НМРШ [82]. Проте, променева терапія не є лікуванням вибору для реципієнтів трансплантації органів, у яких підвищений ризик розвитку додаткових пухлини в зоні лікування. Цей метод, зазвичай, призначений для пацієнтів, яким не показано хірургічне лікування [126]. Фотодинамічна терапія використовує світову активацію фотосенсибілізатора, локалізованого в тканинах в киснезалежних процесах, який ініціює оксидантний стрес, запалення та загибель клітин. Основною перевагою є використання вузького спектру випромінювання, який може відповідати максимальному поглинанню фотосенсибілізаторів [72]. Хоча фотодинамічна терапія схвалена для лікування АК (передракового ураження ПКРШ), вона асоціюється зі значно вищими показниками рецидивів БКРШ і ПКРШ, ніж стандартні методи лікування [133].
Пероральна терапія в НМРШ застосовується у пацієнтів з високим ризиком рецидивуючих та агресивних форм. Пероральна терапія, яка показала, принаймні, часткову ефективність, включає ретиноїди (ізотретіноїн, еретинітат, ацітретин, ретиноєва кислота в комбінації з інтерфероном-α та цисплатином), 5‑фторурацил, капецитабін, нестероїдні протизапальні препарати, дифторметилорнітин, епігалокатечин галлат, силімарин, куркумін та лікопін [166]. Гальмування сигнального шляху hedgehog в лікуванні прогресуючих та метастатичних форм ПКРШ призвело до появи нового покоління фармацевтичних препаратів – візмодегіб і сонедегіб [94].
Топічна терапія – варіант лікування НМРШ. Оскільки цей метод не є інвазивним, може застосовуватись на великій площі шкіри і не викликати формування патологічних рубців. Місцеві методи лікування кращі, ніж інвазивні процедури, особливо у випадку мультифокальних уражень, нечітких країв ураження, ризику формування келоїдних рубців при локалізації в деяких зонах, таких як обличчя та декольте, оскільки косметичні результати, як правило, відмінні [137]. Топічна терапія (5-фторурацил, іміквімод) є ефективним альтернативним методом для лікування НМРШ, які обмежуються епідермісом [136].
Ще кілька років тому терапевтичний підхід до лікування пацієнтів із прогресуючими або метастатичними НМРШ був виключно представлений традиційною хіміотерапією. Зростаюча захворюваність НМРШ викликала зацікавленість, що сприяло розробці нових терапевтичних засобів. Нещодавні дослідження патогенезу НМРШ запропонували застосування молекулярно-орієнтованої терапії як альтернативи традиційній хіміотерапії [136, 173].
1.2 Методи інструментальної діагностики
1.2.1 Становлення та застосування телемедицини у світі та в Україні
Телемедицина широко використовується у всьому світі. Оскільки за результатами дослідження 2007 року було знайдено 104 визначення поняття телемедицини [181], Всесвітня організація охорони здоров’я (ВООЗ) прийняло наступне визначення: «Надання медичних послуг на відстані з використанням інформаційних і телекомунікаційних технологій усіма медичними працівниками з метою обміну достовірної інформації для діагностики, лікування і профілактики захворювань і травм, дослідження і оцінки, а також для процесу навчання працівників охорони здоров’я для покращення здоров’я фізичних осіб та громад» [203].
З історичної точки зору, телемедицина бере свій початок з 1905 року. Тоді, професор Лейдинського університету Вільгельм Ейнтховен, що винайшов електрокардіографію, зробив передачу електрокардіограми за допомогою телефонного кабелю на відстані 1,5 км із домашньої лабораторії в університетську клініку. Приставку «теле» Ейнтховен використав для визначення дистанційної медичної допомоги [6].
У 1920-х роках деякі країни, зокрема Швеція, використовуючи радіо і азбуку Морзе, надавали дистанційний медичний супровід суднам торгового морського флоту.
Після Другої світової війни інтенсивний розвиток космічних програм призвів до появи нової галузі медицини – біорадіотелеметрії (телеметрії). Необхідність постійного контролю стану організму астронавтів (а також експериментальних тварин) призвела до необхідності створення систем для дистанційного знімання та реєстрації фізіологічних параметрів [4].
Перше згадування про телемедицину в сучасному значенні цього поняття зустрічається в медичній літературі в 1974 році [130]. В більш ранніх публікаціях замість терміну «телемедицина» використовували терміни «телегнозія» (telegnosis), телепсихіатрія (telepsychiatry) або фразу «консультація за допомогою телебачення», «діагноз за допомогою телебачення» [3].
У квітні 1924 року в журналі «Radio News» з’явилась картинка лікаря, який «оглядає» пацієнта через радіо, до якого під’єднаний телевізійний монітор, хоча телебачення було винайдене лише у 1929 році. В 1957 році Альберт Ютрас почав займатись телерадіологією в Монреалі, а в 1959 році Сесіл Уіттсон в Інституті психіатрії Небраски розпочав програму теленавчання та телепсихіатрії.
На початку 60-тих років Національне управління з аеронавтики і дослідження космічного простору (НАСА) спільно з Організацією охорони здоров’я розпочали надання медичної допомоги населенню віддалених регіонів в Арізоні, застосувавши зусилля парамедиків та мобільне оснащення (ЕКГ, рентген) [77].
У 1965 році телемедична маніпуляція була проведена лікарем Michael E. De Bakeya. За допомогою супутника інтерконтинентального сполучення “Early Bird” та інтерактивних телевізійних систем лікар, знаходячись в резиденції США, підготував, слідкував за ходом та контролював операцію на відкритому серці в Швейцарії. В 1967 році була установлена повна телемедична система, яка з’єднала Бостонський аеропорт з Массачусетською лікарнею. З її допомогою дослідники довели можливість використання інтерактивного телебачення для встановлення діагнозу хворому на відстані, передачі рентгенологічних, лабораторних та інших медичних даних [3].
У США за останні 10-15 років технологія значно удосконалилась. Незважаючи на швидкий розвиток даної галузі, її послугами користуються відносно невелика кількість хворих (наприклад, в 1996 році близько 21 тисячі). Стан справ у США частково обумовлений чіткою стратегією фінансування та оплати послуг, труднощами, пов’язаними з ліцензуванням медичної діяльності, проблемами, що стосуються відповідальності лікарів і т.д [43]. Великий обсяг наукових досліджень в галузі телемедицини в США ведеться в рамках фінансової підтримки уряду. Фінансування телемедичних проектів у США особливо значне і здійснюється як з бюджетних коштів Департаменту охорони здоров’я, так і з коштів Міноборони США. Найбільш інтенсивно результати телемедичних досліджень впроваджуються в підрозділах Міноборони США. Серед проектів Міністерства оборони США можна виділити:
1) проект з високоякісної передачі відеозображень та організації відеоконференцій по IP мережах з використанням модемного зв’язку;
2) проект створення телемедичної мережі для Сухопутних військ США на базі медичних центрів в Кароліні, Техасі та ін.;
3) проект співпраці телемедичної мережі військово-морських сил США з освітньою мережею навчальних закладів та проект з діагностичної радіології, зберігання і передачі зображень;
4) проект телемедичних консультацій в глобальному масштабі з використанням ресурсів супутникової системи Інмарсат, телефонних мереж загального користування та ін. У даному проекті телемедичні послуги надавалися з території США в Хорватію, Сомалі, Македонію, Кувейт, Таїті та ін. [14].
Контингент військ Організації Північноатлантичного договору на Балканах використовує широкий спектр телемедичних послуг. Центр перспективних медичних технологій США організував автоматизовану мережу телемедичної допомоги двадцятитисячному контингенту американських військ. У мережі працюють пункти в Боснії, Угорщині, Німеччині, Великобританії, США. Для обміну даними використовується мережа Інтернет і канали супутникового зв’язку.
У військових шпиталях як термінали використовуються портативні комп’ютери, забезпечені модемом, текстовими і графічними редакторами, програмними засобами ведення баз даних. Зображення отримується за допомогою кольорової відеокамери із вбудованим жорстким магнітним диском. На більш високому рівні використовуються оптичні пристрої, що запам’ятовують, кольорові принтери і рентгенографічна апаратура.
Телемедицина давно впроваджена в приморських провінціях Канади. Компанії March Network і We Care Health Service Ink. разом із Alian Telecom, Canarie Inc. і Університетом м. Калгарі оголосили про запуск пілотної програми з домашньої телемедицини.
Метою програми є створення в провінціях Nova Scotia і Nevel Brunswick телемедичної служби для проведення моніторингу стану здоров’я пацієнтів, що знаходяться в домашніх умовах. У проекті передбачається використання інтерактивних технологій мереж передачі даних.
ВООЗ на міжнародних консультаціях з телемедицини в грудні 1997 року визначила стратегічні завдання своєї діяльності з телемедицини. Підкреслено також важливість усвідомлення керівниками охорони здоров’я нового історичного етапу розвитку медицини, просування телемедицини як технології, включаючи стандарти, якість сервісу, оцінку економічної ефективності, фінансування.
ВООЗ із Міжнародним союзом з телекомунікацій в 1995 році підписали “Меморандум Розуміння”, згідно з яким дві організації об’єднали свої зусилля в області інформаційних технологій і комунікацій для поліпшення якості медичної допомоги людям, що живуть у сільських і віддалених районах.
Японія почала працювати у напрямку телемедицини в 1984 році, сьогодні в країні здійснюється 153 проекти з телемедицини, у тому числі, 13 % з телепатологіі, 48 % – з радіології, 15 % – консультації загального характеру, 14 % – пропаганда здорового способу життя, 5 % – наукові дослідження.
Китай активізує військову телемедицину. У березні 1996 року був оголошений проект Chinese Medical Information Network, який здійснюється силами армії, Академії медичних наук, медичними центрами провідних університетів. У червні 1996 року було оголошено встановлення високошвидкісного обміну між армійськими частинами.
В Австралії до запровадження телемедицини санітарна авіація була єдиним засобом медичного обслуговування на малонаселених величезних територіях. Сьогодні можна сказати, що санавіація вже витіснена: 58 проектів з телемедицини підтримуються урядом країни. Наприклад, в одному тільки штаті Новий Південний Уельс реалізуються проекти з телемедицини на 2 млн. доларів [14].
Малайзія в рамках програми Multimedia Super Corridor реалізує чотири проекти за участю американських фахівців:
– телеконсультації;
– безперервне медичне навчання;
– ринок медичних послуг, включаючи ліки;
– здоровий спосіб життя (найбільший проект).
Лідером телемедицини в Європі є Норвегія. У 1987 році там почав реалізовуватися проект “Новий технічний розвиток на Півночі”, а в 1991-1992 рр. у трьох провінціях Норвегії були організовані телемедичні студії. У 1993 році в Університетській лікарні м. Тромсе був відкритий Телемедичний відділ, якому норвезький уряд доручив впроваджувати телемедичну технологію по всій країні. У Норвегії з 1988 р впроваджена система дистанційної діагностики і консультування з використанням засобів відеоконференцзв’язку та супутникових каналів зв’язку. Мобільні супутникові системи дозволяють надавати послуги по всій країні [69, 139, 187, 208].
У 1990 році Головне управління телекомунікаціями Іспанії виступило спонсором проекту REVISA (мережа медичних відеофонів) на Канарських островах (1,5 мільйони мешканців). Усі 7 островів та лікувально-профілактичні заклади на великих островах були забезпечені телемедичною базою, яка складалась із відеофонів з високим розрішенням та відеокамер для телеконсультацій. В 1991 році асоціація Center Advanced Technology on Analysis of Image на Канарських островах стала першою в світі, що провела кількісний аналіз ДНК на відстані. Після трьох років роботи діяльність пішла на спад через припинення фінансування проекту, оскільки останній виявився нездатним покрити витрати. В 1994 році в рамках проекту FEST (Framework for Europian Services in Telemedicine) дві Каталонські лікарні (одна в Барселоні, інша в Манресі), були об’єднані спільною мережею. До переліку телемедичних проектів, які фінансувала Європейська спільнота із залученням іспанських партнерів відносяться: проект EPIC, в якому взяли участь Політехнічний університет Мадриду та медичні пункти Андалусії; проект Teleprim, який забезпечував передачу телеелектрокардіографічних данних лікарям загальної практики в Естремадурі; проект Mobicare проводив експерименти з передачею даних від машин швидкої допомоги до лікарень за участю технічних партнерів. У 1996 році проводились експерименти з телерадіології між Мадридом (клініка Puerto de Hierra) та Collado-Villalbo на відстані 50 км. Того ж року Міністерство оборони почало проводити відеоконференції за допомогою супутникового зв’язку між військовим шпиталем в Мадриді та лінією фронту Боснії і Герцеговини. Починаючи з 1997 року предмет телемедицини викладається на Канарських островах в Університеті La Laguna на медичному факультеті та факультеті інформаційних технологій [165].
У Греції перші розробки з телемедицини належать Скевосу Зервосу (1874–1958) з медичного факультету Університету Афін. Він розробив систему, яка дозволяла обстежувати пацієнта на відстані. Огляд включав у себе дані аускультації та пульсу. Ці дані можна було передавати в будь-яку точку світу. Переваги цієї системи були продемонстровані на пленарних засіданнях медичної спільноти в Національному університеті Афін, в Національному технічному університеті Афін і в Афінській академії, під час яких сигнали передавались з кількох афінських лікарень та різних грецьких міст. Інформація про винахід професора Зурвоса був опублікований у «Літописі медичної спільноти Афін» (1946–1956). Професор пропонував застосовувати її на борту грецьких кораблів, які курсували між містами Пірей та Нью-Йорк. Але зв’язок був дорогий на той час, систему не використовували. В 1976 році кардіолог Джордж Папаконстантімоу за технічної підтримки Національного технічного університету Афін розробив систему передачі даних ЕКГ, використовуючи телефонний зв’язок. Цю систему використовують і зараз. У 1989 році лабораторія медичної фізики Університету Афін розпочала нову еру телемедичних послуг, провівши переконливу демонстрацію переваг для медичних закладів, отримуючи та передаючи дані рентгенівських знімків з лікарень та у зворотньому напрямку. В 1992 році Міністерство Охорони Здоров’я Греції встановило телемедичні термінали у 12 медичних закладах по всій країні. На цей час вони успішно використовуються для обслуговування населення віддалених регіонів. Головна лікарня Sismonaglion в Афінах є координаційним центром і отримує запити на телемедичну допомогу. Таких випадків більше 3 тис. В 1995 році лабораторія медичної фізики Університету Афін ввела в роботу телекардіологічну мережу TALOS для надання допомоги Егейському регіону [107].
В Італії перші експерименти з телемедицини проводились у Флоренції, а вперше застосували її у м. Трієст. З 1987 по 1990 рр. Інститут радіології університету Аквіла єдиний працював за стандартними протоколами, хоча і не на комерційній основі. В 1986 році Європейський комітет створив проект BICEPS, метою якого було встановити вклад телекомунікаційних технологій у розвиток системи охорони здоров’я. В 1993 році вперше Лабораторія телеробототехніки Політехнічного університету Мілана разом із лабораторією НАСА проводили експерименти із телехірургії у м. Пасадена, в Каліфорнії. В 90-х рр. Університет Удіни почав застосовувати консультації з телепатології. Між університетами та лікарнями Риму, Мілану, Анкони та Ферно існує відеозв’язок. Одним з найважливіших факторів, що спонукав до розвитку телемедицини в Італії, були дослідницькі проекти Європейського співтовариства, особливо в області медичної інформатики. Паралельно, Міністерство досліджень Італії заснувало національний план з телемедицини, який почав користуватись попитом з 1993 року. До кінця 1994 року були сформульовані завдання різним асоціаціям, які складались із дослідницьких інститутів, непрофільних організацій та комерційних компаній. На відміну від мети Європейського Союзу, ця програма повинна була прискорити попит на послуги. Деякі телекомунікаційні проекти включали медичні програми. Наприклад, в Тоскані, Флоренції, Пізі – телеконсультації, телепередачі зображень в кардіології та радіології для діагностики, телемедичне навчання, невідкладну допомогу людям з обмеженими можливостями [49].
В Україні перший випадок застосування телемедицини був зафіксований близько 1935 року у Львові, коли професор Мар’ян Франке організував постійне використання телеелектрокардіографіі (телеЕКГ). Передавальна станція була розміщена у відділі інфекційних хвороб Львівської державної загальної лікарні, а приймальня – на кафедрі загальної та експериментальної патології медичного факультету Львівського університету. Кафедру очолював професор Мар’ян Франке, відділення – професор Вітольд Ліпінський [4]. У 1972 році, в Донецьку вперше була реалізована радіотелеметрична реєстрація частоти серцевих скорочень у шахтарів під час виробничої діяльності в агресивних і вибухонебезпечних умовах вугільних шахт Донбасу. Досить ретельно були розроблені загальні підходи до проектування багатоканальних систем реєстрації результатів вимірювань [4]. У 1993 році телемедицина виділена в окрему міжнародну бібліографічну рубрику. У 1998 році була опублікована перша російськомовна монографія про телемедицину [30]. У 1999 році вийшла перша в Україні монографія про телемедицину [33], у 2001 році була видана книга «Клінічна телемедицина» [9].
В Україні у 2007 році створено Державний клінічний науково-практичний центр телемедицини МОЗ України – єдиний спеціалізований заклад охорони здоров’я, створений для впровадження та розвитку телемедицини в Україні. Постановою Кабінету Міністрів України від 01.10.2008 року № 878 його віднесено до Переліку закладів охорони здоров’я, що забезпечують виконання загальнодержавних функцій. Згідно зі Статутом, Державний центр телемедицини забезпечує надання висококваліфікованої комплексної консультативної медичної допомоги населенню із застосуванням телемедичних технологій.
З 2009 року Державним центром телемедицини реалізується проект створення телемедичної мережі України, завдяки якій започатковано телемедичне консультування та обмін досвідом лікарів на Порталі телемедицини.
Галузевим нормативним документом з застосування телемедицини в Україні є Наказ МОЗ від 26.03.2010 № 261 «Про впровадження телемедицини в закладах охорони здоров’я» та методичні рекомендації [28], Наказ МОЗ України № 681 від 19.10.2015 року «Про затвердження нормативних документів щодо застосування телемедицини у сфері охорони здоров’я» [27].
27 липня 2010 року в Україні відбулася презентація проекту «Мобільна медицина». Проект реалізувала компанія «МТС Україна» за підтримки МОЗ України та за участю представництва Організації Об’єднаних Націй в Україні. В рамках цього проекту було оснащено спеціальним обладнанням Державний клінічний науково-практичний центр телемедицини у м. Києві, МОЗ України та обласній клінічній лікарні у Донецьку та Ужгороді. Усі центри з’єднані у єдину телемедичну мережу за допомогою високошвидкісних каналів передачі даних, що мають високий ступінь надійності в експлуатації [31].
Згідно із законом України «Про підвищення доступності та якості медичного обслуговування у сільській місцевості» одним із основних напрямків розвитку охорони здоров’я у сільській місцевості є впровадження сучасних технологій з медичного обслуговування, зокрема телемедицини [14, 29].
1.2.2 Теледерматологія як складова телемедицини
З розвитком телемедицини розвинувся напрямок ТД, що спрямована на надання дерматологічної допомоги на відстані за допомогою електроніки, засобів зв’язку та інформаційних технологій. Вона забезпечує передачу інформації між пацієнтом і дерматологом та навпаки [44]. Як і радіологія, дерматологія є візуальною спеціальністю. А отже, використання клінічних та гістопатологічних зображень робить її ідеальним вибором для телемедицини на практиці [105]. Хоча існує невизначеність щодо того, коли ТД була вперше застосована, один звіт датується 1970‑ми роками, коли в прямому ефірі дерматологи використали чорно-білу трансляцію, щоб побачити співробітників аеропорту в Бостоні (Мерфі, Фіцпатрік, Хейнс, Бьорд і Шерідан, 1972). З того часу з технічним вдосконаленням програмного забезпечення і апаратури, ТД стала практичним напрямком. Між 1993 і 1998 рр., Асоціація Телемедичних Послуг задокументувала щонайменше 44 теледерматологічні програми у 30 державах (Левін, 2009). У 1998 році в США відбулись принаймні 3316 теледерматологічні зустрічі (Левін, 2009). Дослідження 2003 року показало, 62 працюючі теледерматологічні програми в 37 штатах США (ATA Survey on Teledermatology, 2003) .
Термін «теледерматологія» був вперше запропонований Perednia зі співавторами в 1995 році [151], а в 1997 році Zelickson та Homan [216] вперше продемонстрували теледерматологічні відеоконференції з будинком для літніх людей. Огляд літератури показав, що класифікація ТД базується, в основному, на засобах зв’язку та передачі даних [104]. До останнього часу класифікація ТД була представлена наступним чином:
1) за часом проведення: синхронна (відеоконференції) та асинхронна (store-and-forward (SAF);
2) за технологічними засобами:
а) відеоконференції (звичайні або супутникові);
б) SAF (за допомогою електронної пошти, в мережі Інтернет, комбінація методів);
в) комбінований метод (відеоконференції та SAF);
г) мобільна ТД.
3) за категорією спеціалістів-користовачів:
а) за участі медсестер;
б) від спеціаліста до спеціаліста (second opinion);
4) за суміжними спеціальностями, де застосовується ТД:
а) телепатологія;
б) теледерматоскопія (звичайна або мобільна [210];
в) комбінація телепатології та теледерматоскопії (рисунок 1.1).
Однак, з розвитком інформаційних технологій вдосконалювалась і класифікація ТД. Згідно з останніми публікаціями [105], ТД поділяється:
- Постійна теледерматологічна практика. Проводиться лікарями загальної практики, лікарями дерматовенерологами. Використовуються методи «SAF», відеоконференції, мобільної ТД, комбінованої ТД.
- Третинна теледерматологічна практика. Проводиться між лікарями дерматовенерологами у вигляді он-лайн дискусій.
- Суміжні спеціальності. Проводиться між лікарями-дерматовенерологами, лікарями-дерматовенерологами дитячими, лікарями-геріатрами, лікарями загальної практики. Застосовується метод “SAF”.
- Теледерматологічна практика за допомогою пацієнта. Проводиться за участі самого пацієнта. Використовуються методи “Store-and-Forward” або мобільна ТД. Останні два десятиліття, з 1990-х років, в теледерматологічній практиці застосовується дві основні моделі: SAF та відеоконференції. На цей час теледерматологічні програми існують на кожному континенті [145] (рис. 1.2).
Рисунок 1.2 – Класифікація теледерматологічної практики
Метод SAF включає в себе відправку даних та фотознімків пацієнта спеціалісту для зберігання та консультації. Фахівець розглядає данні пацієнта та висловлює свою думку з приводу діагнозу у письмовій формі лікарю, який направив інформацію або самому пацієнту. Велику кількість знімків можна проаналізувати за короткий проміжок часу [112]. Якість знімків залежить від фотокамери і є основним детермінуючим фактором точності діагнозу.
Відеоконференції дають змогу спеціалісту і пацієнту спілкуватися у режимі реального часу. Основною перевагою є повнота збору історії хвороби, прямий відеоконтакт із фахівцем, коли пацієнт може задавати питання безпосередньо. Діагностична точність відеоконференцій порівняно з очним оглядом була підтверджена різними дослідженнями [36, 102, 116].
Гібридна модель: вона поєднує в собі модель SAF і відео конференції, і є дуже корисною, оскільки дозволяє уникнути непорозумінь, заощаджує час.
Мобільна ТД проводиться з використанням мобільних телефонів та інших персональних портативних цифрових пристроїв, які дозволяють робити та надсилати фотознімки. Це дозволяє самим пацієнтам, медсестрам або лікарям самостійно періодично відправляти фотографії проблеми. За допомогою смартфонів із високоякісною відеокамерою можна робити чіткі зображення, відправляти іх через інтернет з телефонів або комп’ютерів.
Теледерматоскопія дозволяє відправляти дерматоскопічні зображення новоутворень шкіри фахівцям для отримання ще однієї точки зору.
Онлайн консиліум передбачає розгляд та обговорення важких або цікавих випадків між колегами [190].
1.2.3 Застосування теледерматології у діагностиці новоутворень шкіри
На цей час ТД широко використовується країнами світу для дистанційної діагностики новоутворень шкіри і, зокрема, раків шкіри та їх попередників [18]. Опубліковані результати незалежних медичних досліджень в галузі ТД. Так, в Австрії у 2014 році протягом 48 годин два спеціалісти теледіагностували 955 новоутворень шкіри, серед яких 20 новоутворень (2 %) виявились раками шкіри. Діагностична точність склала 94 %, чутливість – 100 % [135].
У 2014 році у США з травня по грудень було проведено 79 теледерматологічні консультації. Ефективність консультацій склала 93 % [54].
У 2016 році в Єгипті 3 лікарі оглянули 600 пацієнтів дистанційно із застосуванням методу SAF. Ефективність склала 87 % [170].
У 2017 році у Німеччині п’ять лікарів обстежили 26 пацієнтів з використанням мобільного телефону для оглядових знімків та прикріпленого до нього дерматоскопа для дерматоскопічних фотознімків. Застосовувався метод SAF. Точність діагнозів становила 92,3 % за результатами патогістологічного дослідження [217].
У 2011 році на базі ПП «Інститут дерматокосметології доктора Богомолець» за допомогою ТД протягом одного дня було оглянуто 447 новоутворень шкіри, з яких 21 новоутворення діагностували як рак шкіри. За результатами гістологічного дослідження у 13 випадках підтвердили рак шкіри, у 5 випадках – АК [112].
У 2012 році протягом одного дня на базі ПП «Інститут дерматокосметології доктора Богомолець» було дистанційно оглянуто 468 новоутворень шкіри, попередній діагноз раків шкіри був встановлений у 22 випадках (4,7 %). Гістологічне дослідження підтвердило 17 раків шкіри та 2 АК (4 %) [111].
У 2013 році протягом 7 днів на базі ПП «Інститут теледерматології доктора Богомолець» було проведено теледерматологічне та теледерматоскопічне обстеження 1480 новоутворень шкіри. В результаті було діагностовано 23 випадки (2 %) злоякісних новоутворень шкіри, з яких гістологічно підтверджено 22 випадки (96 %) [110]. В тому ж році протягом 3 днів ми обстежили дистанційно 1700 новоутворень шкіри у робітників заводу. Були встановлені діагнози 16 злоякісних новоутворень шкіри (0,94 %) та 25 передракових утворень (1,5 %). Гістологічне дослідження підтвердило 14 злоякісних нововутворень шкіри (87,5 %) та 24 передракових утворень (96 %) [133].
У 2015 році протягом 1 дня на базі ПП «Інститут теледерматології доктора Богомолець» було проведено дистанційне обстеження 379 новоутворень шкіри. Теледерматологічно встановлено 18 випадків раків шкіри. Гістологічне дослідження встановило 16 випадків раків шкіри [109].
Таким чином, аналіз літератури показав, що застосування ТД в лікарській практиці продовжує викликати зацікавленість і впроваджується у всьому світі. Оскільки рання діагностика злоякісних новоутворень впливає на подальше лікування, а спеціалісти даної сфери не завжди доступні населенню віддалених регіонів, застосування ТД є актуальним. Серед наслідків видалення новоутворень шкіри зустрічаються рецидиви та формування патологічних видів рубців, а отже, пошук нових методів лікування з метою зниження ризиків після видалення є також актуальним.
1.3 Лікувально-діагностичні тактики і особливості їх застосування
у лікуванні новоутворень шкіри
Методи видалення новоутворень шкіри, які застосовуються на амбулаторному прийомі: кріодеструкція, хімічна деструкція, висічення, видалення лазером, електрокоагуляція, радіохвильове видалення.
1.3.1 Радіохвильовий метод
Радіохвильовий метод – це найменш травматичний метод розрізу і коагуляції м’яких тканин за допомогою високочастотних хвиль. Радіохвильовий розріз виконується без фізичного мануального тиску або подрібнення клітин тканин. На кінці активного електроду генеруються високочастотні хвилі. Тканина чинить опір їх проникненню, в результаті чого виділяє тепло, під дією якого клітини випаровуються і тканини «розходяться» в сторони. Радіохвильовий розріз і коагуляція виконуються без руйнування прилеглих та підлеглих тканин, як при використанні електрохірургічних низькочастотних приладів. При роботі з приладом «Сургітрон», Cynosure, Inc.dba Ellman (США), використовуються наступні режими:
- розріз (FILTER/CUT);
- розріз і коагуляція (CUT and COAG/RECTIFIED);
- коагуляція (COAG/PART.RECTIFIED);
- фульгурація (FULGURATE);
- біполярний режим.
Режим РОЗРІЗ (FILTER/CUT) дозволяє виконувати мікроскопічно рівні розрізи з незначною коагуляцією. В режимі РОЗРІЗ І КОАГУЛЯЦІЯ (CUT and COAG/RECTIFIED) розріз відбувається одночасно з поверхневою коагуляцією розрізів. В режимі КОАГУЛЯЦІЯ (COAG/PART.RECTIFIED) проводиться контроль (зупинка) кровотечі із судин діаметром до 1,0 мм, а також непряма коагуляція за допомогою пінцетів при доволі сильних кровотечах із судин діаметром більше 1 мм. ФУЛЬГУРАЦІЯ (FULGURATE) – це припікання тканин іскрою перемінної напруги високої частоти. Фульгураційний струм чинить найпотужнішу зневоднюючу дію на тканину. БІПОЛЯРНИЙ РЕЖИМ – використовується для точкової коагуляції судин (діаметром до 2,0 мм) в будь-якому середовищі – сухому чи вологому.
1.3.2 Кріодеструкція
Кріодеструкція – локальний вплив на новоутворення хладогеном з метою його руйнування. Найчастіше для кріодеструкції використовується рідкий азот (температура кипіння – мінус 195,75 °C). Температура, необхідна для видалення новоутворень шкіри 60°C. Існує кілька способів застосування кріодеструкції: аплікація ватним тампоном, спрей-кріодеструкція за допомогою спеціальних апаратів, охолодження за допомогою тефлонового аплікатора (контактного кріозонда). Залежно від методу – різна температура в зоні «мішені» і різний очікуваний результат процедури. Вплив низької температури призводить до утворення міхура і холодового некрозу. Загоєння проходить з незначними больовими відчуттями на стадії ексудації. Тривалість загоєння і формування рубця залежить від багатьох факторів (як правило, патологічні рубці після застосування кріодеструкції практично ніколи не утворюються). Метод використовується в стандартних кріохірургічних процедурах і є ідеальним з точки зору наступних факторів: подібні результати у всіх лікарів, можливість збору даних щодо відносної чутливості різних новоутворень до заморожування, у разі не досягнення необхідного результату лікар може повторити процедуру. Тривалий час розморожування і повторні цикли заморожування-розорожування викликають більше пошкодження тканин, ніж одиночні цикли заморожування і розморожування. Між повторними циклами заморожування-розморожування зазвичай витримуються кілька хвилин. При тривалій кріодеструкції в ділянці мішені відбувається руйнування колагенового каркасу шкіри і утворення сліду / рубця. Легке заморожування веде до дермо-епідермального розшарування, що є корисним при лікуванні доброякісних епідермальних новоутворень. Більш чутливі клітини епідермісу руйнуються, в той час як дерма залишається непошкодженою. Лікування може ускладнитись явищами гіпопігментації, але дослідження і клінічний досвід показують, що відновлення пігментації часто відбуваються протягом декількох місяців за рахунок непошкоджених меланоцитів всередині волосяних фолікулів або міграції меланоцитів з країв обробленої ділянки. Проте, передбачити відновлення пігментації в кожному індивідуальному випадку неможливо. Лікування може ускладнитися алопецією.
Переваги кріохірургії: короткий час підготовки до процедури, низький ризик інфікування, мінімальний догляд за раною, немає необхідності в ін’єкційній анестезії, не потрібно знімати шви, можливість проведення процедури в амбулаторних умовах [119, 149].
Недоліки кріохірургії: іноді потрібно проведення декількох процедур – повторення процедури кріовпливу для досягнення максимальної ефективності процедури, больові відчуття, утворення пухирів в постпроцедурном періоді, гіпопігментації, алопеції, рідко – рубців.
1.3.3 Метод хімічної деструкції
Хімічна деструкція – вплив на новоутворення хімічними агентами: кислотами (коломак, ферізол, суперчістотіл, солкодерм), соком чистотілу. Хімічний опік призводить до некрозу новоутворення і прилеглих тканин з утворенням струпа [12].
Переваги: можливість проведення процедури в домашніх умовах, низькі економічні витрати на проведення процедури, простота використання методу.
Недоліки: утворення рани, яка тривалий час не загоюється із залученням до процесу перифокально розташованих тканин, утворення помітного рубця, можливості переродження новоутворення при неодноразовому застосуванні, порушення пігментації в місці впливу.
1.3.4 Електрокоагуляція
Електрокоагуляція – термічний вплив на новоутворення за рахунок генерації тепла всередині клітин із застосуванням високої частоти. Термічний опік призводить до термічного некрозу із залученням до процесу прилеглих тканин, ураження тканини навколо зони розташування утворення, яке видаляється, утворення струпа, найчастіше, – утворення грубого рубця, депігментації [12].
1.3.5 Лазерний метод
Лазерне видалення – вплив на новоутворення світловою енергією, яка трансформується в теплову, перетворюючи об’єкт впливу в опіковий струп. Наслідки впливу лазера на тканини відповідають термічному опіку 2 ступеня.
Лазерний вплив призводить до: термічного некрозу із залученням до процесу незначної ділянки прилеглих тканин, утворення опікового струпа, після видалення новоутворення не залишається тканини для гістологічного дослідження [80]. Рецидиви пухлин зустрічаються у 7–15 % випадків [24].
1.3.6 Хірургічний метод
Хірургічне висічення – висічення елемента з дотичними оточуючими тканинами у всю товщу шкіри і, як правило, з наступним накладенням швів.
Переваги: є найбільш «радикальним», практично виключає можливість рецидиву [23].
Недоліки: необхідність спостереження в післяопераційному періоді, перев’язки, необхідність зняття швів, рубець більший за видалене новоутворення.
Доцільно застосовувати: у сумнівних випадках, при видаленні деяких видів невусів (складний, комбінований, диспластичний), при наявності великих елементів (діаметром 1 см і більше), коли естетичний результат при видаленні хірургічним методом очікувано буде краще, ніж при видаленні іншими методами.
***
Таким чином, діагностика доброякісних і злоякісних новоутворень шкіри не втрачає своєї актуальності. За відсутності спеціалістів у віддалених регіонах необхідно застосовувати альтернативні методи діагностики, до яких належить теледіагностика. Використання ТД дозволяє пацієнтам отримати спеціалізовану медичну допомогу на відстані та підвищує кількість виявлених злоякісних новоутворень шкіри. Лікування новоутворень шкіри залежить від попереднього діагнозу та вимагає диференційного підходу, враховуючи показання та протипоказання.
Матеріали даного розділу опубліковані в наступних виданнях:
- Становлення та застосування телемедицини у світі та в Україні / К.І. Кравець. Дерматологія та венерологія. 2017. № 4 (78). С. 94–98 [14].
- Найпоширеніші немеланомні раки шкіри / К.І. Кравець, О.В. Богомолець. Вісник Української медичної стоматологічної академії «Актуальні проблеми сучасної медицини». 2018. Т. 18, Вип. 1 (61). С. 308–312 [17].
- Кравець К.І., Богомолець О.В. Сучасні методи теледерматології в діагностиці новоутворень шкіри. Український журнал дерматології, венерології, косметології. 2015. № 3 (58). С. 13–17 [18].
РОЗДІЛ 2
ЗАГАЛЬНА МЕТОДИКА ТА МЕТОДИ ДОСЛІДЖЕННЯ
Робота виконана згідно з планом аспірантури на кафедрі дерматовенерології та ВІЛ/СНІДу на клінічній базі ПП «Інститут дерматокосметології доктора Богомолець» в м. Києві у 2013-2017 рр.
2.1 Матеріали дослідження
Протягом 5 років, з 2013 по 2017 рр. на дистанційну діагностику через платформу Telederm під час днів масових оглядів пацієнтів звернулись 1667 осіб. Усіх пацієнтів паралельно оглядав лікар інкогніто. З усіх пацієнтів рекомендації видалення новоутворень після теледерматологічної діагностики отримали 1452 пацієнти. 519 пацієнтів звернулися на видалення. Для дослідження було обрано 314 новоутворень з попередніми діагнозами МН, меланоми шкіри, СК, раків шкіри. Аналізували макроскопічні та дерматоскопічні знімки новоутворень шкіри, анкетні дані структури новоутворень при очному огляді. Вікову групу склали пацієнти від 5 до 80 років.
На дистанційну діагностику новоутворень звернулись 26 % пацієнтів, що проживають за межами Києва (табл. 2.1).
Серед усіх 314 пацієнтів, відібраних для дослідження, жінки становили 59,2 % (186 осіб), чоловіки – 40,8 % (128 осіб) (табл. 2.2).
Усі звернення пацієнтів були розподілені в залежності від причини: фобія онкології – 170 (54,1 %), з естетичних міркувань – 116 (36,9 %), часті випадки травматизації – 22 (7,0 %), фобія меланоми – 6 (1,9 %) (табл. 2.3).
Таблиця 2.1 – Розподіл пацієнтів за населеними пунктами
| Населений пункт | Кількість звернень |
| м.Київ | 231 |
| Київська область | 21 |
| Волинська область | 3 |
| м.Черкаси | 4 |
| м.Миколаїв | 4 |
| м.Харків | 5 |
| Дніпропетровсьа область | 2 |
| Житомирська область | 7 |
| м.Луганськ | 2 |
| Луганська область | 3 |
| м.Івано-Франківськ | 6 |
| м.Кременчуг | 2 |
| м.Одеса | 6 |
| Полтавська область | 2 |
| м.Севастополь | 3 |
| Сумська область | 6 |
| м.Херсон | 4 |
| Хмельницька область | 3 |
Таблиця 2.2 – Розподіл пацієнтів за віковими групами
| 0-9 років | 10-19 років | 20-29 років | 30-39 років | 40-49 років | 50-59 років | 60-69 років | 70-79 років | 80-89 років | Всього | |
| Жінки | – | 6 | 25 | 31 | 37 | 25 | 34 | 27 | 1 | 186 (59,2 %) |
| Чоловіки | 4 | 1 | 10 | 23 | 28 | 18 | 22 | 18 | 4 | 128 (40,8 %) |
| Всього:
% |
4
1,3 |
7
2,2 |
35
11,1 |
54
17,2 |
65
20,7 |
43
13,7 |
56
17,9 |
45
14,3 |
5
1,6 |
314
100 |
Таблиця 2.3 – Розподіл пацієнтів за причинами зверненнями
| Причина звернення | Кількість пацієнтів, (%) |
| Фобія онкології | 170 (54,1 %) |
| З естетичних міркувань | 116 (37,0 %) |
| Часті випадки травматизації | 22 (7,0 %) |
| Фобія меланоми | 6 (1,9 %) |
2.2 Загальна характеристика дослідження
У роботі використані матеріали дослідження, що тривало з 2013 по 2017 роки на базі ПП «Інститут дерматокосметології доктора Богомолець» в м.Києві.
Використовувався метод SAF. Усі пацієнти звернулися на дистанційну діагностику новоутворень шкіри під час днів масових оглядів пацієнтів в період з 2013 по 2017 роки. Протоколом дослідження було визначено дати оцінку одному новоутворенню у кожного пацієнта. Були зроблені макроскопічні та дермоскопічні фотознімки новоутворень шкіри, зібрані загальна інформація (особисті дані, екзогенні та ендогенні фактори ризику) та дані, пов’язані з новоутвореннями (період існування, зміна кольору, зміна форми, швидкість росту). Для макроскопічних зображень лінійку розташовували поруч із новоутвореннями, а фотознімок робили за допомогою камери Sony Cyber-shot DSC-W560, Sony Corporation, Японія, на відстані 15 до 20 см. При фіксації дерматоскопічного зображення на новоутворення наносили олію, прикладали дерматоскоп 3Gen DLII HR3, Dermlite, США, який за допомогою перехідника приєднувався до камери Sony Cyber-shot DSC-W560, Sony Corporation, Японія. Дані та фотографії надсилали експерту через платформу Telederm за допомогою Інтернету. Експерт опрацьовував дані дистанційно через платформу Telederm і встановлював попередній діагноз. Результати обстеження та рекомендації пацієнти отримували наступного дня особисто у адміністраторів або електронною поштою, або поштою. Окрім теледерматологічної діагностики, всіх пацієнтів оглядав дерматолог інкогніто та проводив дерматоскопічний огляд за допомогою дерматоскопа Delta 20 Heine, Німеччина, та встановлював діагноз і рекомендації. Дерматоскопічні і клінічні ознаки новоутворень заносились до спеціально розробленої анкети. Залежно від медичних або косметичних показань, пацієнтам рекомендували видалити новоутворення з наступним гістологічним дослідженням. Після завершення всіх етапів дослідження, дані були зібрані та праналізовані.
Для даного дослідження було відібрано пацієнтів з теледерматологічними діагнозами МН, СК, раків шкіри та меланоми. Всі пацієнти звернулись на дистанційну діагностику, пройшли очний огляд дерматолога і всім пацієнтам було проведено діагностичну біопсію новоутворень. Під час лікувально-діагностичної біопсії були використані наступні методи: радіохвильовий, комбінований (радіохвильовий метод з кріодеструкцією основи) та хірургічний.
2.3 Методи дослідження
2.3.1 Метод анамнестичного дослідження
Метод анамнестичного дослідження базувався на аналізі відповідей пацієнтів на поставлені в анкеті питання. Вивчались дані сімейного анамнезу та анамнезу даного утворення, фенотипові ознаки пацієнта (додаток А).
2.3.2 Методи теледерматологічної та клінічної, теледерматоскопічної та дерматоскопічної діагностики меланоцитарних невусів
Метод теледерматологічної діагностики. Експерти аналізували макроскопічні ознаки новоутворень шкіри за фотографією. У всіх новоутвореннях аналізували наступні ознаки:
– форма: пляма, папула, вузол;
– колір або його відтінки: коричневий, чорний, блакитний; наявність 1-2 кольорів;
– межі: чіткі, нечіткі;
– краї: рівні, нерівні;
– поверхня: гладка, папіломатозна, бородавчаста;
Метод клінічної діагностики. Проводився візуальний огляд новоутворення, під час якого спеціаліст аналізував розміри, форму, колір, поверхню, межі, краї новоутворення і виставляв клінічний діагноз.
Метод теледерматоскопічної діагностики. Базувався на аналізі характерних ознак новоутворень за фотографією. Теледерматоскопічний діагноз МН виставлявся за наявності наступних ознак:
– пігментна сітка: типова, атипова;
– глобули: типові, атипові;
– судинний рисунок: у вигляді коми, точок, відсутній;
– лінії: симетрична ознака зіркової променистості на периферії новоутворення;
– гомогенна блакитна пігментація.
Метод дерматоскопічної діагностики. Проводили за допомогою дерматоскопу Delta 20 Heine, Німеччина. Аналізували характерні ознаки. Останні заносили до спеціально розробленої анкети (додаток Б).
2.3.3 Методи теледерматологічної та клінічної, теледерматоскопічної та дерматоскопічної діагностики меланоми шкіри
Метод теледерматологічної діагностики. Проводився аналіз макроскопічних ознак новоутворень шкіри за фотографією. У всіх новоутвореннях аналізували наступні ознаки:
– форма: пляма, папула, вузол;
– колір або їх відтінки: коричневий, чорний, блакитний; наявність 1-2 кольорів;
– межі: чіткі нечіткі;
– краї: рівні, нерівні;
– поверхня: гладка, папіломатозна, бородавчата;
Метод клінічної діагностики. Проводився візуальний огляд новоутворення, під час якого спеціаліст аналізував розміри, форму, колір, поверхню, межі, краї новоутворення і виставляв клінічний діагноз.
Метод теледерматоскопічної діагностики. Теледерматоскопічний діагноз меланоми шкіри виставлявся за наявності наступних характерних ознак:
- атипова пігментна сітка;
- негативна пігментна сітка;
- лінії (радіальні промені та псевдоподії);
- кристалічні структури;
- атипові точки та глобули;
- атипова пігментація;
- біло-блакитна вуаль;
- структури регресу;
- атипові судини;
- коричневі безструктурні ділянки на периферії;
Метод дерматоскопічної діагностики. Проводили за допомогою дерматоскопу Heine Delta 20. Аналізували характерні ознаки, які заносили до спеціально розробленої анкети (додаток Б).
2.3.4 Методи теледерматологічної та клінічної, теледерматоскопічної та дерматоскопічної діагностики себорейного кератозу
Метод теледерматологічної діагностики. Експерти аналізували наступні макроскопічні ознаки новоутворень шкіри за фотографією:
– форма: пляма, папула, вузол;
– колір або їх відтінки: коричневий, чорний, блакитний; наявність 1-2 кольорів;
– межі: чіткі нечіткі;
– краї: рівні, нерівні;
– поверхня: гладка, папіломатозна, бородавчата.
Метод клінічної діагностики. Під час візуального огляду новоутворень, спеціаліст аналізував розміри, форму, колір, поверхню, межі, краї новоутворення і виставляв клінічний діагноз.
Метод теледерматоскопічної діагностики. Теледерматоскопічний діагноз СК виставлявся за наявності наступних ознак:
– міліумподібні кісти;
– комедоноподібні отвори;
– звивини та борозни (мозкоподібний рисунок);
– структури у вигляді відбитків пальців;
– судини у вигляді шпильок;
– поточені краї.
Метод дерматоскопічної діагностики. Проводили за допомогою дерматоскопу Delta 20 Heine, Німеччина. Аналізували характерні ознаки, які заносили до спеціально розробленої анкети.
2.3.5 Методи теледерматологічної та клінічної, теледерматоскопічної та дерматоскопічної діагностики немеланомного раку шкіри
Метод теледерматологічної діагностики. Експерти аналізували макроскопічні ознаки новоутворень шкіри за фотографією. У всіх новоутвореннях аналізували наступні ознаки:
– форма: пляма, папула, вузол;
– колір або їх відтінки: коричневий, чорний, блакитний; наявність 1-2 кольорів;
– межі: чіткі, нечіткі;
– краї: рівні, нерівні;
– поверхня: гладка, папіломатозна, бородавчаста;
Метод клінічної діагностики. Проводився візуальний огляд новоутворення, під час якого спеціаліст аналізував розміри, форму, колір, поверхню, межі, краї новоутворення і виставляв клінічний діагноз.
Метод теледерматоскопічної діагностики. Теледерматоскопічний діагноз раку шкіри виставлявся за наявності наступних ознак:
- сіро-блакитні овоїдні гнізда;
- множинні сіро-блакитні глобули;
- листкоподібні структури;
- структури у вигляді спиць колеса;
- деревовидні судини;
- виразкування;
- кератинові перлини;
- структури у вигляді листя конюшини;
- гломерулярні судини;
- судини у вигляді шпильок на білому фоні.
Метод дерматоскопічної діагностики. Проводили за допомогою дерматоскопу Delta 20 Heine, Німеччина. Аналізували характерні ознаки, які заносили до спеціально розробленої анкети.
2.4 Методи лікування новоутворень шкіри
Усі новоутворення шкіри, які аналізуються в даній роботі, були видалені з подальшим гістологічним дослідженням.
2.4.1 Радіохвильовий метод
Під місцевим знеболенням проводилась діагностична біопсія новоутворень лезом, ложе оброблялось радіохвильовим апаратом «Сургітрон», Cynosure, Inc.dba Ellman (США),до візуально інтактних (чистих) тканин.
2.4.2 Комбінований метод
Під місцевим знеболенням проводилась діагностична біопсія новоутворень лезом, ложе оброблялось радіохвильовим апаратом «Сургітрон», Cynosure, Inc.dba Ellman (США), до візуально інтактних (чистих) тканин. Після цього проводилась кріодеструкція ложа за допомогою кріодеструктора з тефлоновою насадкою.
2.4.3 Хірургічний метод
Діагностична біопсія хірургічним методом проводилось під місцевим знеболенням. Після попередньої обробки оперативного поля двома розрізами, відступивши 0,2-0,3 мм від видимих меж новоутворення висікався лоскут шкіри у всю товщу. Проводився гемостаз, накладались пошарові шви на рану, здійснювалась обробка антисептиком, накладалась асептична пов’язка.
2.5 Оцінка діагностичної цінності телемедичних оглядів
Оцінювались моральна та економічна ефективність телемедичних оглядів [5].
2.5.1 Методи оцінки моральної ефективності
Було створено анкету для пацієнтів, спрямовану на дослідження ефективності роботи телемедицини в сфері діагностики новоутворень шкіри. Вона складалась з п’яти питань. Після отримання телемедичної консультації всім пацієнтам розіслано анкету з проханням відповісти на всі запитання «так» або «ні».
Чи задоволені Ви часом, витраченим на звернення до спеціаліста через Telederm?
Чи задоволені Ви швидкістю отримання відповіді через Telederm?
Чи задоволені Ви роботою адміністратора у телефонній розмові (у випадку звернення)?
Чи задоволені Ви доступністю відповіді та роз’яснень спеціаліста?
Чи задоволені Ви отриманими рекомендаціями та доступністю їх виконання?
2.5.2 Методи оцінки економічної ефективності телемедицини
Собівартість телемедичних послуг розраховувалась за формулою:
С = ЗПмп+ЗПіт+ЗПадм+СФ+ВМ+ЗВ,
де ЗПмп – зарплата медичного персоналу;
ЗПіт – зарплата інженерно-технічого персоналу;
ЗПадм – зарплата адміністративного персоналу;
СФ – відрахування у соціальні фонди;
ВМ – собівартість витратних матеріалів;
ЗВ – загальні витрати [5].
Собівартість однієї консультації розраховувалась за формулою:
F = Cp/Np,
де Cp – річні затрати на телемедицину;
Np – кількість пацієнтів, оглянутих за рік [5].
2.6. Статистичний аналіз даних
Статистичний аналіз проводили за допомогою програми IBM SPSS 23.0. Використовувалися методи описової статистики: для кількісних змінних – n, середнє арифметичне, медіана, стандартне відхилення, мінімум і максимум; для категоріальних змінних – частота і частка у відсотках [34]. Для розповсюдження даних на усю популяцію застосовувалося інтервальне оцінювання (були побудовані 95 % довірчі інтервали для часток з використанням методу Вілсона) [7]. Порівняння категоріальних змінних здійснювалося за допомогою точного критерію Фішера [8]. З метою елімінації ефекту множинних порівнянь застосовувався метод Бонферроні [51].
РОЗДІЛ 3
ДІАГНОСТИКА МЕЛАНОЦИТАРНИХ НОВОУТВОРЕНЬ ШКІРИ
Усі пацієнти, відібрані для дослідження, звернулись на дистанційну діагностику новоутворень шкіри за допомогою платформи «Telederm» під час днів масових оглядів пацієнтів в 2013 – 2017 роках, були очно оглянуті лікарями дерматологами інкогніто з проведенням дерматоскопічного обстеження та видалили новоутворення з проведенням наступного гістологічним дослідженням. У всіх пацієнтів було оглянуто тільки одне новоутворення [113].
У точці віддаленого доступу до системи здійснювався безпосередній долікарський прийом пацієнтів, заповнювались анкетні дані, фіксувались у спеціально розробленій анкеті екзогенні та ендогенні фактори ризику, робили макроскопічний та дерматоскопічний фотознімки новоутворень шкіри. В роботі використовувались камера Sony Cyber-shot DSC-W560, Sony Corporation, Японія, та поляризаційний дерматоскоп 3Gen DLII HR3, Dermlite, США. По мережі зображення разом з анкетними даними відправлялися експерту, який після ознайомлення із внесеними в базу даних параметрами дистанційно встановлював попередній діагноз. Окрім теледерматологічної діагностики, паралельно всіх пацієнтів оглядав дерматолог інкогніто та проводив дерматоскопічний огляд за допомогою дермаскопа Delta 20 Heine, Німеччина, встановлював діагноз і рекомендації. Дерматоскопічні і клінічні ознаки новоутворень заносились до спеціально розробленої анкети. Наступного дня, після обстеження пацієнти отримували висновок з попереднім діагнозом та рекомендаціями. Залежно від медичних або косметичних показань, пацієнтам рекомендували видалити новоутворення з наступним гістологічним дослідженням. Після завершення всіх етапів дослідження, дані були зібрані та проаналізовані.
Усього за 5 років на дистанційну консультацію звернулись 1667 пацієнтів. З усіх пацієнтів після теледерматологічної консультації рекомендацію видалити новоутворення отримали 1452 пацієнти. На видалення звернулись 519 пацієнтів. Для дослідження відібрані 314 пацієнтів.
Для дослідження були відібрані пацієнти, яким дистанційно були виставлені діагнози МН, СК, раку шкіри та меланоми шкіри, пройшли очний огляд дерматолога та було проведено діагностичну біопсію новоутворень [108]. Таким чином, до дослідження та аналізу було залучено: МН – 108, СК – 97, раки шкіри – 62, меланома шкіри – 47.
До групи меланоцитарних новоутворень шкіри відносяться доброякісні та злоякісні неоплазії. До доброякісних належать пігментні невуси, до злоякісних – меланома шкіри.
3.1 Діагностика меланоцитарних невусів
Згідно з МКХ 10 перегляду діагноз пігментного невусу виставляється як меланоформний невус (D22). Гістологічна класифікація ВООЗ містить значно більшу кількість нозологій.
3.1.1 Теледерматологічна та теледерматоскопічна діагностика меланоцитарних невусів
Для аналізу були відібрані 108 новоутворень шкіри (по одному новоутворенню у кожного пацієнта) з попереднім діагнозом МН. Усі пацієнти звернулись на дистанційну діагностику новоутворень [128]. Серед пацієнтів жінки становили 63 % (68 осіб), чоловіки – 37 % (40 осіб). Середній вік пацієнтів становив 33 роки і коливався в межах від 5 до 80 років. За віком пацієнти були сформовані у групи (табл. 3.1).
За локалізацією пігментні невуси були виявлені: на обличчі та волосистій частині голови – 19 (17,6 %), на тулубі – 81 (75 %), на кінцівках – 8 (7,4 %) (табл. 3.2).
Таблиця 3.1 – Розподіл пацієнтів з попереднім діагнозом МН за віковими групами
| 0-9 років | 10-19 років | 20-29 років | 30-39 років | 40-49 років | 50-59 років | 60-69 років | 70-79 років | Всього: | |
| Жінки | – | 6 | 22 | 20 | 13 | 3 | 2 | 2 | 68 (63 %) |
| Чоловіки | 4 | 1 | 6 | 16 | 10 | 2 | 1 | – | 40 (37 %) |
| Всього:
% |
4
(3,7 %) |
7
(6,5 %) |
28
(25,9 %) |
36
(33,3 %) |
23
(21,3 %) |
5
(4,6 %) |
3
(2,8 %) |
2
(1,9 %) |
108
(100 %) |
Таблиця 3.2 – Розподіл новоутворень з попереднім діагнозом МН за локалізацією
| Локалізація | Кількість (%) |
| Голова | 19 (17,6 %) |
| Тулуб | 81 (75 %) |
| Кінцівки | 8 (7,4 %) |
Теледерматологічний висновок при аналізі новоутворень шкіри базувався на аналізі макроскопічних та дерматоскопічних фотографій, отриманих експертом. Серед макроскопічних ознак проводився аналіз: розміру, форми, кольору, меж, країв та поверхні новоутворень шкіри [10].
Серед обстежених новоутворень 24 (22,2 %) мали розмір до 5 мм, 72 (66,7 %) – від 6 до 10 мм, 12 (11,1 %) – більше 10 мм. За формою невуси були: у вигляді плями – 32 (29,6 %), папули – 35 (32,4 %), вузла – 41 (38,0 %). Наявність одного кольору або його відтінків відзначалась у 41 (38,0 %) випадку невусів, серед яких домінував коричневий у 35 (32,4 %) випадках, а також відзначались чорний у 4 (3,7 %) випадках та сірий у 2 (1,9 %) випадках.
Більше двох кольорів мали 67 (62,0 %) невусів. Чіткі межі відзначались у 59 випадках (54,6 %), нечіткі – у 49 випадках (45,4 %). Краї рівні були у 53 (49,0 %) випадках, нерівні – у 55 (51,0 %) випадках. Утворення виявились симетричними у 85 (78,7 %) випадках, асиметричними – у 23 (21,3 %) випадках. Поверхня невусів у 86 (79,6 %) випадках була папіломатозною, у 22 (20,3 %) випадках – гладкою (табл. 3.3).
Таблиця 3.3 – Характерні теледерматологічні ознаки новоутворень шкіри з попереднім діагнозом МН
| Ознаки новоутворень | Кількість,шт. | ||
| Розмір невусів:
5 мм 6-10 мм >10 мм |
24 (22,2 %)
72 (66,7 %) 12 (11,1 %) |
||
| Форма невусів:
пляма папула вузол |
32 (29,6 %)
35 (32,4 %) 41 (38,0 %) |
||
| Колір | |||
| Один колір або його відтінки | Коричневий | 35 (32,4 %) | 41 (38,0 %) |
| Чорний | 4 (3,7 %) | ||
| Сірий | 2 (1,9 %) | ||
| Більше двох кольорів | Коричневий, чорний, сірий, блакитний, рожевий, тілесний, білий | 67 (62,0 %) | |
| Межі:
чіткі нечіткі |
59 (54,6 %)
49 (45,4 %) |
||
| Краї:
рівні нерівні |
53 (49,0 %)
55 (51,0 %) |
||
| Симетрія:
симетричні асиметричні |
85 (78,7 %)
23 (21,3 %) |
||
| Поверхня:
папіломатозна рівна |
86 (79,6 %)
22 (20,4 %) |
||
Теледерматоскопічна діагностика базувалася на аналізі характерних ознак. Для аналізу були відібрані основні групи ознак, які характерні для МН. Групи додаткових ознак не оцінювались. Була проаналізована наявність наступних структур:
– пігментна сітка: типова (лінії однакової товщини, комірки однакового розміру), атипова (лінії різної товщини, комірки різного розміру);
– глобули: структури діаметром 0,1 мм, симетричні, однакового кольору та розміру;
– гомогенна блакитна пігментація (однотонний блакитний колір або з наявними відтінками сірого та сіро-стального кольорів);
– судинний рисунок: у вигляді коми, звивисті судини, неспецифічні;
– меланомоспецифічні ознаки [10].
За результатами дослідження в МН були виявлені наступні ознаки (табл. 3.4): типова пігментна сітка у 8 випадках (7,4 %), атипова пігментна сітка – у 22 випадках (20,4 %); глобули – у 67 випадках (62,0 %), лінії – в 1 випадку (0,9 %). Гомогенна блакитна пігментація була визначена в 1 (0,9 %) випадку. Судинний рисунок був представлений у вигляді точкових судин у 2 (1,9 %) випадках, у вигляді коми у 14 випадках (12,9 %), був неспецифічним у 9 випадках (8,3 %). Судинний рисунок був відсутнім у 83 (76,9 %) випадках. Із меланомоспецифічних ознак була виявлена тільки атипова пігментна сітка.
У 108 (100 %) випадках експертом був встановлений попередній діагноз МН, із них у 3 (2,8 %) випадках була підозра на меланому шкіри.
Усіх пацієнтів оглядав лікар-дерматолог інкогніто, проводив клінічний огляд новоутворень та дерматоскопічний огляд за допомогою неполяризаційного дерматоскопа Delta 20 Heine, Німеччина, і заносив результати дослідження у спеціально розроблену анкету, виставляв клінічний діагноз.
Таблиця 3.4 – Характерні теледерматоскопічні ознаки новоутворень шкіри з попереднім діагнозом МН
| Теледерматоскопічні ознаки | Всього, шт. (%) |
| Пігментна сітка:
типова атипова негативна |
8 (7,4 %)
22 (20,4 %) – |
| Глобули:
типові атипові |
67 (62,0 %) |
| Гомогенна блакитна пігментація | 1 (0,9 %) |
| Судини у вигляді:
точкові коми неспецифічні |
25 (23,1 %)
2 (1,9 %) 14 (12,9 %) 9 (8,3 %) |
| Лінії (псевдоподії та радіальні промені) | 1 (0,9 %) |
| Кристалічні структури | – |
| Атипова пігментація | – |
| Біло-блакитна вуаль | – |
| Структури регресу | – |
| Безструктурні ділянки по периферії | – |
3.1.2 Клінічна та дерматоскопічна діагностика меланоцитарних невусів
Критерії оцінки клінічного та дерматоскопічного оглядів не відрізнялись від таких критеріїв при теледерматологічному та теледерматоскопічному оглядах. Клінічно лікар оцінював розмір, форму, колір, межі, краї, поверхню новоутворень та заносив данні у спеціально розроблену анкету. Анкети вкладались в амбулаторні картки пацієнтів. На всіх картках відмічалось звернення пацієнта з даним новоутворенням на дистанційну діагностику.
Розміри новоутворень на очному огляді повністю співпали з результатами теледерматологічного огляду: 24 (22,2 %) новоутворення мали розмір до 5 мм, 72 (66,7 %) – від 6 до 10 мм, 12 (11,1 %) – більше 10 мм. За формою невуси мали вигляд: плями – у 31 (28,7 %) випадку, папули – у 36 (33,3 %) випадках, вузла – у 41 (38,0 %) випадку.
Наявність одного кольору або його відтінків було виявлено у 58 (53,7 %) невусах, серед яких домінував коричневий – 51 випадок (47,2 %), та чорний – 8 випадків (7,4 %). Більше двох кольорів мали 50 (46,3 %) невусів. Чіткі межі відзначались у 59 випадках (54,6 %), нечіткі – у 49 випадках (45,4 %). Краї рівні були у 53 (49,0 %) випадках, нерівні – у 55 (51,0 %) випадках. Утворення виявились симетричними у 85 (78,7 %) випадках, асиметричними – у 23 (21,3 %) випадках. Поверхня невусів у 86 (79,6 %) випадках була папіломатозною, у 22 (20,4 %) випадках – гладкою (табл. 3.5).
Таблиця 3.5 – Характерні клінічні ознаки новоутворень шкіри з попереднім діагнозом МН
| Ознаки новоутворень | Кількість | ||
| Розмір невусів:
5 мм 6-10 мм >10 мм |
24 (22,2 %)
72 (66,7 %) 12 (11,1 %) |
||
| Форма невусів:
пляма папула вузол |
31 (28,7 %)
36 (33,3 %) 41 (38,0 %) |
||
| Колір | |||
| Один колір або його відтінки | Коричневий | 51 (47,2 %) | 58 (53,7 %) |
| Чорний | 8 (7,4 %) | ||
| Сірий | – | ||
| Більше двох кольорів | Коричневий, чорний, сірий, блакитний, рожевий, тілесний, білий | 50 (46,3 %) | |
| Межі:
чіткі нечіткі |
59 (54,6 %)
49 (45,4 %) |
||
| Краї:
рівні нерівні |
53 (49,0 %)
55 (51,0 %) |
||
| Симетрія:
симетричні асиметричні |
85 (78,7 %)
23 (21,3 %) |
||
| Поверхня:
папіломатозна рівна |
86 (79,6 %)
22 (20,4 %) |
||
Дерматоскопічно оцінювали характерні ознаки новоутворень, ідентичні при оцінці теледерматоскопічного зображення, які відмічались лікарем в анкеті. Для дослідження були проаналізовані основні ознаки: пігментна сітка (типова, атипова), глобули (типові, атипові), гомогенна блакитна пігментація; судинний рисунок; меланомоспецифічні ознаки [19].
За результатами дослідження в МН були виявлені наступні ознаки: пігментна сітка типова у 14 (13,0 %) випадках, атипова – у 37 (34,3 %); типові глобули – у 72 (66,7 %) випадках, псевдоподії та радіальні промені 2 (1,9 %). Гомогенна блакитна пігментація була визначена в 1 (0,9 %) випадку. Судинний рисунок був представлений у вигляді точок у 14 (13,0 %) випадках, у вигляді коми у 42 (38,9 %) випадках, був неспецифічним у 12 (11,1 %) випадках. Судинний рисунок був відсутнім у 40 (37,0 %) випадках. Окрім атипової пігментної сітки, інші меланомо специфічні ознаки не були виявлені (табл. 3.6).
Попередній діагноз МН був виставлений у 108 (100 %) випадках, з яких 8 (7,4 %) мали підозрілі ознаки щодо меланоми шкіри.
Залежно від структури новоутворення була рекомендована діагностична біопсія радіохвильовим або хірургічним методами. Рекомендації до проведення біопсії радіохвильовим методом отримали пацієнти з новоутвореннями коричневого кольору за наявності типової структури (типова пігментна сітка, типові глобули, типові судини). За наявності атипових структур (атипова пігментна сітка, атипові глобули, атипові судини), гомогенної блакитної пігментації або ознаки зіркової променистості, пацієнти отримували рекомендацію до біопсії хірургічним методом. Шістдесят шість (61,1 %) новоутворень шкіри були видалені радіохвильовим методом, 42 (38,9 %) – хірургічним методом.
Результати гістологічного дослідження отримували в терміни від 2 до 3 тижнів. Кожний препарат обов’язково аналізували два патогістологи незалежно один від одного. У випадках суперечливих діагнозів скельця передавались патогістологу до Національного інституту раку в м. Києві. За результатами гістологічного дослідження 108 новоутворень шкіри з попереднім діагнозом МН, останній був підтверджений обома гістологами у 105 випадках. Із 108 новоутворень шкіри з попереднім діагнозом МН перший патогістолог підтвердив діагноз МН у 106 випадках. У 2 випадках були виставлені діагнози доброякісних новоутворень шкіри. Другий патогістолог підтвердив 105 діагнозів МН, у двох випадках діагноз доброякісних новоутворень, в одному випадку – діагноз меланоми шкіри. Третьому патогістологу направили матеріали двох новоутворень шкіри, серед яких було підтверджено 1 діагноз доброякісного утворення і 1 діагноз меланоми (табл. 3.7).
Таблиця 3.6 – Характерні дерматоскопічні ознаки новоутворень шкіри з попереднім діагнозом МН
| Дерматоскопічні ознаки | Всього |
| Пігментна сітка:
типова атипова негативна |
14 (13,0 %)
37 (34,3 %) – |
| Глобули:
типові атипові |
72 (66,7 %)
– |
| Гомогенна блакитна пігментація | 1 (0,9 %) |
| Судини у вигляді:
точкові коми неспецифічні |
14 (13,0 %)
42 (38,9 %) 12 (11,1 %) |
| Лінії (псевдоподії та радіальні промені) | 2 (1,9 %) |
| Кристалічні структури | – |
| Атипова пігментація | – |
| Біло-блакитна вуаль | – |
| Структури регресу | – |
| Безструктурні ділянки по периферії | – |
Таблиця 3.7 – Результати патогістологічного дослідження новоутворень шкіри з попереднім діагнозом МН
| Теледерматоло-гічний діагноз | Клінічний діагноз | Патогіс-тологіч-ний діагноз | Патогістолог №1 | Патогістолог №2 | Патогістолог №3 | |||||
| кількість | % | кількість | % | кількість | % | |||||
| МН | 108 (100 %) | МН | 105 (97,2 %) | МН | 106 | 98,2 | 105 | 97,2 | – | – |
| СК | 1 (0,9 %) | СК | 1 | 0,9 | 1 | 0,9 | – | – | ||
| ТрФ | 2 (1,9 %) | КП | 1 | 0,9 | – | – | – | – | ||
| ТрФ | – | – | 1 | 0,9 | 1 | 0,9 | ||||
| ММ | – | – | 1 | 0,9 | 1 | 0,9 | ||||
| Всього: 108 (100 %) | 108 (100 %) | 108 | 100 | 108 | 100 | 2 | 1,8 | |||
Примітка. ТрФ – трихофолікулома; КП – кератопапілома; ММ – меланома
Як приклад аналізу МН можна розглянути наступні клінічні випадки [10].
Клінічний випадок № 1. Пацієнт К., 22 роки, звернувся на плановий огляд новоутворення шкіри. Об’єктивно новоутворення куполоподібної форми розміром 4*8 мм знаходиться на шкірі передньої черевної стінки. Теледерматоскопічно: глобули коричневого кольору, судинний рисунок не виражений (рис. 3.1). Дерматоскопічно: глобули коричневого кольору, судини у вигляді коми (рис. 3.2). Діагноз: внутрішньодермальний МН.
Клінічний випадок № 2. Пацієнт Ж., 18 років, звернувся на огляд новоутворення, на яке вперше звернув увагу тиждень тому. Об’єктивно новоутворення 3*3 мм, знаходиться на шкірі правого стегна. Теледерматоскопічно: типова пігментна сітка, гіперпігментація в центральній частині (рис. 3.3). Дерматоскопічно: типова пігментна сітка, гіперпігментація в центральній частині, окремі точки чорного кольору на лініях пігментної сітки (рис. 3.4). Діагноз: пограничний пігментний невус.
Рисунок 3.1 – Теледерматоскопічна структура
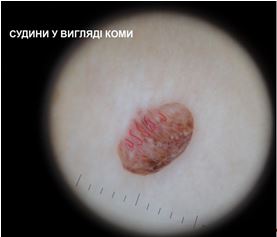
Рисунок 3.2 – Дерматоскопічна структура
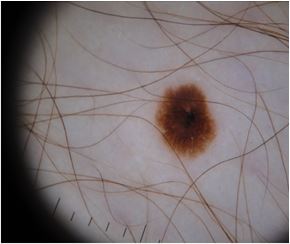
Рисунок 3.3 – Теледерматоскопічна структура

Рисунок 3.4 – Дерматоскопічна структура
3.2 Діагностика меланоми шкіри
3.2.1 Теледерматологічна та теледерматоскопічна діагностика меланоми шкіри
Для аналізу було відібрано 47 пацієнтів з попереднім діагнозом меланоми шкіри, які звернулись на дистанційну діагностику новоутворень. Після встановлення попереднього діагнозу пацієнти були направлені на очну консультацію дерматолога, який рекомендував видалення в Національному інституті раку в м. Києві [15, 21].
Пацієнтам у віці до 20 років не був встановлений попередній діагноз меланоми шкіри. У віці від 20 до 29 років 3 (6,4 %) пацієнти були направлені на консультацію та лікування до онколога, у віці від 30 до 39 років – 6 (12,8 %) пацієнтів, від 40 до 49 років – 10 (21,3 %) пацієнтів, від 50 до 59 років – 11 (23,4 %) пацієнтів, від 60 до 69 років – 11 (23,4 %) пацієнтів, від 70 до 79 років – 5 (10,6 %) пацієнтів, від 80 до 89 років – 1 (2,1 %) пацієнт. Середній вік пацієнтів становив 54 роки. Всього діагноз меланоми шкіри був виставлений 27 жінкам (57,4 %) та 20 чоловікам (42,6 %) (табл. 3.8).
Таблиця 3.8 – Розподіл пацієнтів з попереднім діагнозом меланома шкіри за віковими групами
| 0-9 років | 10-19 років | 20-29 років | 30-39 років | 40-49 років | 50-59 років | 60-69 років | 70-79 років | 80-89 років | Всього: | |
| Жінки | – | – | 2 | 4 | 6 | 5 | 7 | 3 | – | 27
57,4 % |
| Чоловіки | – | – | 1 | 2 | 4 | 6 | 4 | 2 | 1 | 20
42,6 % |
| Всього
(%): |
– | – | 3
6,4 % |
6
12,8 % |
10
21,3 % |
11
23,4 % |
11
23,4 % |
5
10,6 % |
1
2,1 % |
47
100 % |
За локалізацією 31 (66,0 %) новоутворення було розташоване на тулубі, 14 (29,7 %) – на кінцівках, 2 (4,3 %) новоутворення на обличчі (табл. 3.9).
Таблиця 3.9 – Розподіл новоутворень шкіри з попереднім діагнозом меланоми за локалізацією
| Локалізація | Кількість, (%) |
| Голова | 2 (4,3 %) |
| Тулуб | 31 (66,0 %) |
| Кінцівки | 14 (29,7 %) |
Теледерматологічний висновок з приводу новоутворень шкіри базувався на аналізі макроскопічних фотографій, отриманих експертом. Аналізувались: розмір, форма, колір, межі, краї, поверхня.
Серед обстежених новоутворень 3 (6,4 %) мали розмір до 5 мм, 8 (17,0 %) – від 6 до 10 мм, 36 (76,6 %) – більше 10 мм. За формою новоутворення у вигляді плями відмічались у 29 (61,7 %) випадках, у формі папули у 13 (27,7 %) випадках, у вигляді вузла – у 5 (10,6 %) випадках. В 2 (4,3 %) випадках відмічалась наявність одного кольору (чорний). В 45 (95,7 %) випадках були наявні більше двох кольорів. Чіткі межі відзначались у 29 (61,7 %) випадках, нечіткі – у 18 випадках (38,3 %). Краї рівні були у 5 (10,6 %) випадках, нерівні – у 42 (89,4 %) випадках. Утворення виявились симетричними у 8 (17,0 %) випадках, асиметричними – у 39 (83,0 %) випадках. Поверхня новоутворень у всіх випадках була гладкою (табл. 3.10).
Таблиця 3.10 – Характерні теледерматологічні ознаки новоутворень шкіри з попереднім діагнозом меланоми
| Ознаки новоутворень | Кількість | |
| Розмір новоутворень:
до 5 мм 6-10 мм >10 мм |
3 (6,4 %)
8 (17,0 %) 36 (76,6 %) |
|
| Форма новоутворень:
пляма папула вузол |
29 (61,7 %)
13 (27,7 %) 5 (10,6 %) |
|
| Колір | ||
| Один колір або його відтінки | Коричневий | – |
| Чорний | 2 (4,3 %) | |
| Сірий | – | |
| Більше двох кольорів | Коричневий, чорний, сірий, блакитний, рожевий, тілесний, білий | 45 (95,7 %) |
| Межі:
чіткі нечіткі |
29 (61,7 %)
18 (38,3 %) |
|
| Краї:
рівні нерівні |
5 (10,6 %)
42 (89,4 %) |
|
| Симетрія:
симетричні асиметричні |
8 (17,0 %)
39 (83,0 %) |
|
| Поверхня:
папіломатозна рівна |
–
47 (100 %) |
|
Оцінка теледерматоскопічної структури меланоми проводилась за 10 меланомоспецифічними ознаками: атипова пігментна сітка, лінії (псевдоподії та радіальні промені), негативна пігментна сітка, кристалічні структури, атипові точки та глобули, атипова пігментація, біло-блакитна вуаль, структури регресу, атипові судини, коричневі безструктурні ділянки на периферії.
Атипова пігментна сітка характеризується різною товщиною ліній та кольором, різною величиною комірок. Має зовнішній вигляд «рваної».
Лінії – лінійні структури, які розташовані у напрямі від утворення до нормальної шкіри. На цей час єдиним терміном «лінії» об’єднують поняття радіальних променів та псевдоподій.
Радіальні промені – це лінійні утворення на периферії пігментного утворення без булавовидного потовщення на кінчику, псевдоподії – лінійні утворення на периферії пігментного утворення з булавовидним потовщенням на кінчику. Обидві структури гістологічно відображають злиття пограничних гнізд пігментних меланоцитів і є ознаками периферійного росту утворення.
Негативна пігментна сітка – серпігенозні гіпопігментні лінії, які оточують пігментні структури неправильної форми, що нагадують довгасті та криволінійні глобули.
Кристалічні структури – короткі блискучі лінії білого кольору, які можна побачити лише за допомогою поляризованої дерматоскопії в невусі Шпіц та в меланомі. Розташовані перпендикулярно один стосовно одного (утворюють прямий кут).
Атипові точки та глобули – асиметричні, округлої або овальної форми структури, які розташовуються локально на периферії утворення або в будь-якій іншій ділянці.
Атипова пігментація – гіперпігментована асиметрична ділянка на периферії утворення, можлива наявність багатьох ділянок в одному утворенні.
Біло-блакитна вуаль – осередкова, неправильної форми, розмита, злита пігментація блакитного кольору. Може розташовуватися локально в новоутворенні або займати всю площу.
Структури регресу. До структур регресу відносяться ознака перчіння та рубцеподібна депігментація. Ознака перчіння – велика кількість сіро-блакитних точок за рахунок вільного меланіну та меланофагів у верхніх шарах дерми. Візуально нагадають розсипаний молотий чорний перець.
Ознака рубцеподібної депігментації – ділянка в новоутворенні білого кольору, що світліша як від самого утворення, так і від оточуючої шкіри.
Атипові судини – до атипових судин належать: ділянки світло-рожевого кольору (збільшена кількість судин в новоутворенні), судини у вигляді глобул (неоангіогенез навкруги острівків пухлини), лінійні та звивисті судини неправильної форми та різного розміру, судини у вигляді шпильок на рожевому фоні, клубочковидні та спіралеподібні судини.
Коричневі безструктурні ділянки на периферії – гіпопігментні гомогенні ділянки, позбавлені дерматоскопічних ознак, які займають не менше 10 % площі новоутворення.
Серед 47 новоутворень шкіри атипова пігментна сітка була виявлена в 29 (61,7 %) випадках, лінії (псевдоподії та радіальні промені) – у 6 випадках (12,8 %), негативна пігментна сітка – у 1 (2,1 %) випадку, кристалічні структури – у 26 (55,3 %), атипові точки та глобули – у 4 (8,5 %) випадках, атипова пігментація – у 17 (36,1 %) випадках, біло-блакитна вуаль – у 10 (21,3 %) випадках, структури регресу – у 21 (44,7 %) випадках, атипові судини – у 6 (12,8 %) випадках, безструктурні ділянки по периферії не були виявлені у жодному з випадків (табл. 3.11).
Таблиця 3.11 – Характерні теледерматоскопічні ознаки новоутворень шкіри з попереднім діагнозом меланоми
| Теледерматоскопічні ознаки | Кількість, шт. (%) |
| Пігментна сітка:
атипова негативна |
29 (61,7 %)
1 (2,1 %) |
| Лінії (псевдоподії та радіальні промені) | 6 (12,8 %) |
| Кристалічні структури | 26 (55,3 %) |
| Атипові точки та глобули | 4 (8,5 %) |
| Атипова пігментація | 17 (36,1 %) |
| Біло-блакитна вуаль | 10 (21,3 %) |
| Структури регресу | 21 (44,7 %) |
| Атипові судини: | 6 (12,8 %) |
| Безструктурні ділянки по периферії | – |
Очна консультація дерматолога складалась з клінічного огляду, проведення дерматоскопії новоутворення.
Клінічний висновок експерта базувався на тих самих принципах, що і теледерматологічний. Оцінювались розмір, форма, колір, межі, краї, поверхня новоутворень шкіри.
3.2.2 Клінічна та дерматоскопічна діагностика меланоми шкіри
Очна консультація дерматолога складалась з клінічного огляду, проведення дерматоскопії новоутворення.
Клінічний висновок експерта базувався на тих самих принципах, що і теледерматологічний. Оцінювалися розмір, форма, колір, межі, краї, поверхня новоутворень шкіри.
Розміри новоутворень шкіри не відрізнялись від таких при теледерматологічному обстеженні і становили: 3 (6,4 %) розміром до 5 мм, 8 (17,0 %) – від 6 до 10 мм, 36 (76,6 %) – більше 10 мм. За формою новоутворення у вигляді плями відмічалось у 26 (55,3 %) випадках, у формі папули у 15 (31,9 %) випадках, у вигляді вузла – у 6 (12,8 %) випадках. В 2 (4,3 %) випадках відмічалась наявність одного кольору (чорний). У 45 (95,7 %) випадках були наявні більше двох кольорів. Чіткі межі відзначались у 30 (63,8 %) випадках, нечіткі – у 17 випадках (36,1 %). Краї рівні були у 5 (10,6 %) випадках, нерівні – у 42 (89,3 %) випадках. Утворення виявились симетричними у 8 (17,0 %) випадках, асиметричними – у 39 (83,0 %) випадках. Поверхня новоутворень у всіх випадках була гладкою (табл. 3.12).
Оцінка дерматоскопічної структури меланоми шкіри, як і при теледерматоскопічній діагностиці проводилась за 10 меланомоспецифічними ознаками: атипова пігментна сітка, лінії (псевдоподії та радіальні промені), негативна пігментна сітка, кристалічні структури, атипові точки та глобули, атипова пігментація, біло-блакитна вуаль, структури регресу, атипові судини, коричневі безструктурні ділянки на периферії.
Таблиця 3.12 – Характерні клінічні ознаки новоутворень шкіри з попереднім діагнозом меланоми
| Ознаки новоутворень | Кількість | |
| Розмір новоутворень:
до 5 мм 6-10 мм >10 мм |
3 (6,4 %)
8 (17,0 %) 36 (76,6 %) |
|
| Форма новоутворень:
пляма папула вузол |
26 (55,3 %)
15 (31,9 %) 6 (12,8 %) |
|
| Колір | ||
| Один колір або його відтінки | Коричневий | – |
| Чорний | 2 (4,3 %) | |
| Сірий | – | |
| Більше двох кольорів | Коричневий, чорний, сірий, блакитний, рожевий, тілесний, білий | 45 (95,7 %) |
| Межі:
чіткі нечіткі |
30 (63,8 %)
17 (36,1 %) |
|
| Краї:
рівні нерівні |
5 (10,6 %)
42 (89,3 %) |
|
| Симетрія:
симетричні асиметричні |
8 (17,0 %)
39 (83,0 %) |
|
| Поверхня:
папіломатозна рівна |
–
47 (100 %) |
|
Серед 47 новоутворень шкіри атипова пігментна сітка була виявлена в 29 (61,7 %) випадках, лінії (псевдоподії та радіальні промені) – у 6 випадках (12,8 %), негативна пігментна сітка – у 1 (2,1 %) випадку, кристалічні структури не були виявлені в жлдному з випадків, атипові точки та глобули – у 5 (10,6 %) випадках, атипова пігментація – у 17 (36,1 %) випадках, біло-блакитна вуаль – у 13 (27,7 %) випадках, структури регресу – у 23 (48,9 %) випадках, атипові судини – у 15 (31,9 %) випадках, безструктурні ділянки по периферії не були виявлені у жодному з випадків (табл. 3.13).
Таблиця 3.13 – Характерні дерматоскопічні ознаки новоутворень шкіри з попереднім діагнозом меланоми
| Дерматоскопічні ознаки | Кількість, шт. |
| Пігментна сітка:
атипова негативна |
29 (61,7 %)
1 (2,1 %) |
| Лінії (псевдоподії та радіальні промені) | 6 (12,8 %) |
| Кристалічні структури | – |
| Атипові точки та глобули | 5 (10,6 %) |
| Атипова пігментація | 17 (36,1 %) |
| Біло-блакитна вуаль | 13 (27,7 %) |
| Структури регресу | 23 (48,9 %) |
| Атипові судини: | 15 (31,9 %) |
| Безструктурні ділянки по периферії | – |
Після огляду новоутворень, пацієнти направлялись на консультацію та лікування до онколога до Національного інституту раку шкіри в м. Києві. Діагностична біопсія всіх новоутворень проводилась хірургічним методом з наступним гістологічним дослідженням. Результати патогістологічного дослідження отримували у строки до 7 днів. Після отримання результатів проводилось висічення пухлини в широких межах.
За результатами гістологічного дослідження 47 новоутворень шкіри з попереднім діагнозом меланоми шкіри, у 40 випадках діагноз підтвердився. У 7 випадках з попереднім діагнозом меланоми шкіри гістологічно були діагностовані МН (табл. 3.14).
Як приклад аналізу МН можна розглянути наступні клінічні випадки [10].
Клінічний випадок № 3. Пацієнт Л., 29 років, звернувся на огляд декількох новоутворень шкіри. При огляді було відмічено утворення на шкірі спини (ліва надлопаткова ділянка), про існування якого пацієнт не знав. Об’єктивно новоутворення діаметром 6*6 мм у вигляді вузла коричневого та рожевого кольорів. Теледерматоскопічно: атипові глобули коричневого кольору на периферії, кристалічні структури в центральній частині, судини у вигляді глобул з правого краю вузла (рис. 3.5). Дерматоскопічно: атипові точки та глобули коричневого кольору на периферії, поліморфні судини по всій площі вузла (рис. 3.6). Діагноз: меланома, нодулярна форма.
Таблиця 3.14 – Результати патогістологічного дослідження новоутворень шкіри з попереднім діагнозом меланоми
| Теледерма-тологічний діагноз | Кіль-кість | % | Клінічний діагноз | Кіль-кість | % | Патогістоло-гічний діагноз | Кіль-кість | % |
| Меланома шкіри | 47 | 100 | Меланома | 44 | 93,6 | Меланома | 40 | 85,1 |
| МН | 3 | 6,4 | МН | 7 | 14,9 | |||
| Всього: | 47 | 100 | 47 | 100 | 47 | 100 |
Рисунок 3.5 – Теледерматоскопічна структура
Клінічний випадок №4. Пацієнт П., 54 роки, звернувся на огляд новоутворення, розвиток якого спостерігав останні 4 роки. Лікувати не намагався. Об’єктивно новоутворення розташовується на грудній клітині, розміром 12*6 мм, вузол в центральній частині. Теледерматоскопічно: атипова пігментна сітка, атипові точки на периферії, біло-блакитна вуаль, кристалічні структури в центральній частині (рис. 3.7). Дерматосокпічно: атипова пігментна сітка, атипові точки на периферії, біло-блакитна вуаль (рис. 3.8). Діагноз: меланома, нодулярна форма.
Рисунок 3.6 – Дерматоскопічна структура
Рисунок 3.7 – Теледерматоскопічна структура
Рисунок 3.8 – Дерматоскопічна структура
***
Отже, теледерматологічна діагностика МН показала високу точність вірно виставлених діагнозів, яка наближається до точності гістологічних діагнозів, і складає (97,7 ± 0,5) %. Точність дистанційної діагностики меланоми шкіри є високою і складає 85,1 % у порівнянні з патогістологічними висновками. Дані результати доводять ефективність та доцільність застосування теледіагностики для меланоцитарних новоутворень шкіри.
Результати дослідження, відображені у даному розділі, відображені в наступних публікаціях:
- Кравець К.І., Богомолець О.В. Застосування методів телемедицини у діагностиці меланоми шкіри. Матеріали IX міжнародного семінару студентів та молодих вчених, присвячений Всесвітньому дню боротьби з раком, 1-2 лютого 2018 р., м. Київ. Український науково-медичний молодіжний журнал. 2017. № 2 (101). С. 45 [15].
- Кравець К.І., Богомолець О.В. Порівняльна характеристика дерматоскопії та теледерматоскопії на прикладі меланоцитарних невусів та меланоми шкіри. Український журнал дерматології, венерології, косметології. 2018. № 1 (68). С. 17–22 [19].
- 3. Дерматоскопія. Міні-атлас. Вид. 1 / К.І. Кравець, С.Д. Дячук, І.І. Сидоренко, О.В. Магоня, Н.М. Семенюк; під ред. О.В. Богомолець. К. : ТОВ «Глянець», 2018. 75 с. [10].
- Кравець К.І., Сидоренко І.І., Богомолець О.В. Теледерматологічна діагностика меланоми шкіри за допомогою платформи Telederm. Мат. III (X) з’їзду Української асоціації лікарів дерматовенерологів і косметологів, 22-23 листопада 2017 р., м. Львів. Український журнал дерматології, венерології, косметології. 2017. № 4 (67). С. 106 [21].
- Kravets K., Bogomolets O. Application and Study of the Effectiveness of Skin Tumours Remote Diagnostics in Ukraine. 6th World Congress of Teledermatology. London, 14th–15th October, 2016. P. 48 [108].
- Kravets K., Bogomolets O., Dyachuk S. The Effectiveness of Teledermatology Use in Skin Cancers Diagnosis. 5th EAAD congress “United for dermatology”, Riga, 18-20 September, 2015. P.95 [109].
- Store-and-Forward Teledermatology for the Most Common Skin Neoplasms in Ukraine / K. Kravets, Z. Dranyk, O. Vasylenko, O. Bogomolets. Acta Dermatovenerologica Alpina, Pannonica et Adriatica. 2018. Iss.27. P. 79–83 [113].
- Teledermoscopy in the Diagnostics of Atypical Nevi: Ukrainian Experience / O. Magonia, O. Bogomolets, K. Kravets, S. Dyachuk, M. Zhuravel. EADV, Spring Symposium. Cracow, 23-26 May, 2013 [128].
РОЗДІЛ 4
ДІАГНОСТИКА НЕМЕЛАНОЦИТАРНИХ НОВОУТВОРЕНЬ ШКІРИ
Немеланоцитарні новоутворення шкіри поділяються на доброякісні та злоякісні. В даній роботі серед доброякісних новоутворень досліджувався СК, серед злоякісних новоутворень шкіри – немеланомні раки шкіри.
4.1 Діагностика себорейного кератозу
4.1.1 Теледерматологічна та теледерматоскопічна діагностика себорейного кератозу
З доброякісних немеланоцитарних новоутворень шкіри були відібрані 97 випадків з попереднім діагнозом СК. Серед пацієнтів були проаналізовані звернення 57 (58,7 %) жінок та 40 (41,2 %) чоловіків. Середній вік пацієнтів становив 57 років, коливався в межах від 23 до 86 років (табл. 4.1).
Таблиця 4.1 – Розподіл пацієнтів з попереднім діагнозом СК за віковими групами
| 0-9 років | 10-19 років | 20-29 років | 30-39 років | 40-49 років | 50-59 років | 60-69 років | 70-79 років | 80-89 років | Всього | |
| Жінки | – | – | 1 | 5 | 15 | 10 | 14 | 12 | – | 57
58,7 % |
| Чоловіки | – | – | 3 | 3 | 10 | 6 | 8 | 8 | 2 | 40
41,2 % |
| Всього
% |
– | – | 4
4,1 % |
8
8,3 % |
25
25,8 % |
16
16,5 % |
22
22,7 % |
20
20,6 % |
2
2,0 % |
97
100 % |
За локалізацією СК був діагностований: на голові 26 (26,8 %), на кінцівках 5 (5,2 %), на тулубі 66 (68,0 %) (табл.4.2).
Таблиця 4.2 – Розподіл новоутворень шкіри з попереднім діагнозом СК за локалізацією
| Локалізація | Кількість, (%) |
| Голова | 26 (26,8 %) |
| Тулуб | 66 (68,0 %) |
| Кінцівки | 5 (5,2 %) |
Теледерматологічний висновок СК базувався на результатах аналізу розміру, форми, кольору, меж, країв та поверхні [16].
Серед обстежених новоутворень 9 (9,3 %) мали розмір до 5 мм, 38 (39,2 %) – від 6 до 10 мм, 50 (51,5 %) – більше 10 мм. За формою утворення розділено на: у вигляді плями – 16 (16,5 %), папули – 69 (71,1 %), вузла – 12 (12,4 %). Наявність одного кольору відзначалась у 49 (50,5 %) кератомах, з яких домінував чорний у 18 (18,6 %) випадках та сірий у 17 (17,5 %) випадках кольорів, а також зустрічалися кератоми коричневого кольору у 7 (7,2 %) випадках, жовтого у 5 (5,2 %) випадках, тілесного у 1 (1,0 %) випадку та фіолетового у 1 (1,0 %) випадку. Більше двох кольорів мали 48 (49,5 %) утворень. Чіткі межі відзначались у 81 випадку (83,5 %), нечіткі – у 16 випадках (16,5 %). Краї рівні були у 57 (58,8 %) випадках, нерівні – у 40 (41,2 %) випадках. Утворення виявились симетричними у 76 (78,3 %) випадках, асиметричними – у 21 (21,7 %) випадку. Поверхня новоутворень у 29 (29,9 %) випадках була бородавчастою, у 3 (3,1 %) випадках – бородавчасто-папіломатозною, у 17 (17,5 %) – папіломатозною, у 48 (49,5 %) випадках – гладкою (табл. 4.3).
При аналізі теледерматоскопічної структури новоутворень шкіри оцінювалась наявність наступних характерних ознак: міліумподібні кісти, комедоноподібні отвори, звивини та борозни (мозкоподібний рисунок), структури у вигляді відбитків пальців, судини у вигляді шпильок, поточені краї, кератоз, папіломатозні розростання, ознака перчіння [16].
Таблиця 4.3 – Характерні теледерматологічні ознаки новоутворень шкіри з попереднім діагнозом СК
| Ознаки новоутворень | Кількість | ||
| Розмір:
до 5 мм 6-10 мм >10 мм |
9 (9,3 %)
38 (39,2 %) 50 (51,5 %) |
||
| Форма:
пляма папула вузол |
16 (16,5 %)
69 (71,1 %) 12 (12,4 %) |
||
| Колір | |||
| Один колір | Чорний | 18 (18,6 %) | 49 (50,5 %) |
| Сірий | 17 (17,5 %) | ||
| Коричневий | 7 (7,2 %) | ||
| Жовтий | 5 (5,2 %) | ||
| Тілесний | 1 (1,0 %) | ||
| Фіолетовий | 1 (1,0 %) | ||
| Більше двох кольорів | Коричневий, чорний, сірий, фіолетовий, рожевий, тілесний, білий | 48 (49,5 %) | |
| Межі:
чіткі нечіткі |
81 (83,5 %)
16 (16,5 %) |
||
| Краї:
рівні нерівні |
57 (58,8 %)
40 (41,2 %) |
||
| Симетрія:
симетричні асиметричні |
76 (78,3 %)
21 (21,7 %) |
||
| Поверхня:
бородавчаста папіломатозна бородавчасто-папіломатозна гладка |
29 (29,9 %)
17 (17,5 %) 3 (3,1 %) 48 (49,5 %) |
||
Міліумподібні кісти – дрібні округлі структури білого кольору. Гістологічно є роговими псевдокістами, які розташовуються у верхніх шарах епідермісу. Видимі краще за допомогою стандартної дерматоскопії.
Комедоноподібні отвори – округлі структури сірого, коричневого або чорного кольору, які гістологічно є інвагінаціями епідермісу, заповненими кератином. Однаково добре видимі за допомогою стандартної та поляризованої дерматоскопії.
Мозкоподібний рисунок – розгалужені ущелини, які зливаються і утворюють картину мозкових звивин. З’являються внаслідок заповнення інвагінацій епідермісу кератином.
Структури у вигляді відбитків пальців – тоненькі гребінці, що нагадують відбитки пальців.
Судини у вигляді шпильок – невеликі тонкі судини у формі шпильок для волосся. Часто оточені білим ореолом, створеним кератином.
Поточені краї – ознака по периферії утворення з різко обірваною крайовою зоною.
Кератоз – суцільна щільна кірка на поверхні утворення, позбавлена дерматоскопічних ознак.
Папіломатозні розростання – поверхня утворення представлена розростаннями у вигляді скупчення дрібних папілом.
Ознака перчіння – сіро-блакитні точки на місці травмованого СК.
Серед оглянутих за допомогою теледерматоскопії новоутворень шкіри міліумподібні кісти були знайдені у 15 (15,5 %) випадках, комедоноподібні отвори – у 35 (36,0 %), мозкоподібний рисунок був визначений у 18 (18,5 %), структури у вигляді відбитків пальців – у 1 (1,0 %) випадку, судини у вигляді шпильок – у 16 (16,5 %), поточені краї – у 5 (5,2 %), кератоз спостерігався у 49 (50,5 %), папіломатозні розростання – у 26 (26,8 %), ознака перчіння була визначена у 3 (3,1 %) (табл. 4.4).
4.1.2 Клінічна та дерматоскопічна діагностика себорейного кератозу
При очному огляді новоутворень всі данні заносились лікарем до спеціально розробленої анкети. Клінічний висновок СК базувався на результатах аналізу розміру, форми, кольору, меж, країв та поверхні утворень.
При аналізі дерматоскопічної структури новоутворень шкіри оцінювалась наявність характерних ознак СК: міліумподібні кісти, комедоноподібні отвори, звивини та борозни (мозкоподібний рисунок), структури у вигляді відбитків пальців, судини у вигляді шпильок, поточені краї, кератоз, папіломатозні розростання, ознака перчіння.
Таблиця 4.4 – Характерні теледерматоскопічні ознаки новоутворень шкіри з попереднім діагнозом СК
| Теледерматоскопічні ознаки | Кількість, шт. |
| Міліумподібні кісти | 15 (15,5 %) |
| Комедоноподібні отвори | 35 (36,0 %) |
| Мозкоподібний рисунок (звивини та борозни) | 18 (18,5 %) |
| Структури у вигляді відбитків пальців | 1 (1,0 %) |
| Судини у вигляді шпильок | 16 (16,5 %) |
| Поточені краї | 5 (5,2 %) |
| Кератоз | 49 (50,5 %) |
| Папіломатозні розростання | 26 (26,8 %) |
| Ознака перчіння | 3 (3,1 %) |
Серед обстежених новоутворень 9 (9,3 %) мали розмір до 5 мм, 38 (39,2 %) – від 6 до 10 мм, 50 (51,5 %) – більше 10 мм. За формою утворення: у вигляді плями – 14 (14,3 %), папули – 71 (73,2 %), вузла – 12 (12,4 %). Наявність одного кольору відзначалась у 52 (53,6 %) кератомах, з яких домінував чорний у 20 (20,6 %) випадках та сірий у 18 (18,6 %) випадках кольорів, а також зустрічались кератоми коричневого кольору у 7 (7,2 %) випадках, жовтого у 5 (5,2 %) випадках, тілесного у 1 (1,0 %) випадку та фіолетового у 1 (1,0 %) випадку. Більше двох кольорів мали 45 (46,4 %) утворень. Чіткі межі відзначались 83 (85,5 %) випадках, нечіткі – у 14 (14,4 %) випадках. Краї рівні були у 57 (58,8 %) випадках, нерівні – у 40 (41,2 %) випадках. Утворення виявились симетричними у 76 (78,4 %) випадках, асиметричними – у 21 (21,6 %) випадку. Поверхня новоутворень у 29 (29,9 %) випадках була бородавчастою, у 3 (3,1 %) випадках – бородавчасто-папіломатозною, у 18 (18,6 %) папіломатозною, у 47 (48,4 %)випадках гладкою (табл. 4.5).
Таблиця 4.5 – Характерні клінічні ознаки новоутворень шкіри з попереднім діагнозом СК
| Ознаки новоутворень | Кількість | ||
| Розмір:
до 5 мм 6-10 мм >10 мм |
9 (9,3 %)
38 (39,2 %) 50 (51,5 %) |
||
| Форма:
пляма папула вузол |
14 (14,3 %)
71 (73,2 %) 12 (12,4 %) |
||
| Колір | |||
| Один колір | Чорний | 20 (20,6 %) | 52 (53,6 %) |
| Сірий | 18 (18,6 %) | ||
| Коричневий | 7 (7,2 %) | ||
| Жовтий | 5 (5,2 %) | ||
| Тілесний | 1 (1,0 %) | ||
| Фіолетовий | 1 (1,0 %) | ||
| Більше двох кольорів | Коричневий, чорний, сірий, фіолетовий, рожевий, тілесний, білий | 45 (46,4 %) | |
| Межі:
чіткі нечіткі |
83 (85,5 %)
14 (14,4 %) |
||
| Краї:
рівні нерівні |
57 (58,8 %)
40 (41,2 %) |
||
| Симетрія:
симетричні асиметричні |
76 (78,4 %)
21 (21,6 %) |
||
| Поверхня:
бородавчаста папіломатозна бородавчасто-папіломатозна гладка |
29 (29,9 %)
18 (18,6 %) 3 (3,1 %) 47 (48,4 %) |
||
Серед оглянутих за допомогою дерматоскопії новоутворень шкіри міліумподібні кісти були відмічені у 41 (42,3 %) випадку, комедоноподібні отвори – у 36 (37,1 %) випадках, мозкоподібний рисунок був визначений у 18 (18,6 %) випадках, структури у вигляді відбитків пальців – у 1 (1,0 %) випадку, судини у вигляді шпильок – у 45 (46,4 %) випадках, поточені краї – у 5 (5,2 %) випадках, кератоз спостерігався у 49 (50,5 %) випадках, папіломатозні розростання – у 26 (26,8 %) випадках, ознака перчіння була визначена у 4 (4,1 %) випадках (табл. 4.6).
Таблиця 4.6 – Характерні дерматоскопічні ознаки новоутворень шкіри з попереднім діагнозом СК
| Теледерматоскопічні ознаки | Кількість, шт. |
| Міліумподібні кісти | 41 (42,3 %) |
| Комедоноподібні отвори | 36 (37,1 %) |
| Мозкоподібний рисунок (звивини та борозни) | 18 (18,6 %) |
| Структури у вигляді відбитків пальців | 1 (1,0 %) |
| Судини у вигляді шпильок | 45 (46,4 %) |
| Поточені краї | 5 (5,2 %) |
| Кератоз | 49 (50,5 %) |
| Папіломатозні розростання | 26 (26,8 %) |
| Ознака перчіння | 4 (4,1 %) |
Усі новоутворення були попередньо діагностовані як СК і видалені радіохвильовим апаратом. Гістологічне дослідження було проведено у всіх без винятку випадках.
За результатами гістологічного дослідження 97 новоутворень з попереднім діагнозом СК: два патогістологи підтвердили діагноз СК у 94 випадках, у 3 випадках – розбіжності, серед яких у 2 випадках всі 3 патогістологи виставили діагнози доброякісних новоутворень шкіри, в одному випадку – два діагнози доброякісних новоутворень шкіри. Третьому патогістологу був відправлений 1 випадок (табл. 4.7).
Як приклад аналізу СК можна розглянути наступні клінічні випадки [10].
Таблиця 4.7 – Результати патогістологічного дослідження новоутворень шкіри з попереднім діагнозом СК
| Теледермато-логічний діагноз | Клінічний діагноз | Патогістоло-гічний діагноз | Патогістолог № 1 | Патогістолог № 2 | Патогістолог № 3 | |||||
| кількість | % | кількість | % | кількість | % | |||||
| СК | 97 | СК | 95
(98,0 %) |
СК | 95 | 97,9 | 94 | 96,9 | ||
| МН | 1 (1,0 %) | КА | 1 | 1,0 | 1 | 1,0 | 1 | 1,0 | ||
| МН | – | – | 1 | 1,0 | – | – | ||||
| ЕН | 1 (1,0 %) | ЕН | 1 | 1,0 | 1 | 1,0 | – | – | ||
| Всього: 97 | 97 (100 %) | 97 | 100,0 | 97 | 100,0 | 2 | 2,0 | |||
Примітка. ЕН – епідермальний невус; КП – кератопапілома
Клінічний випадок № 5. Пацієнтка В., 72 роки, звернулась на огляд підозрілого новоутворення на шкірі правої бічної поверхні тулуба. Об’єктивно новоутворення 13*11 мм, світло-коричневого кольору, у формі папули. Теледерматоскопічно: комедоноподібні отвори, судини у вигляді крапок, мозковидний рисунок в центральній частині (рис. 4.1). Дерматоскопічно: комедоноподібні отвори, судини у вигляді шпильок, мозковидний рисунок в центральній частині, міліумподібні кісти (рис. 4.2). Діагноз: СК.
Рисунок 4.1 – Теледерматоскопічна структура
Клінічний випадок № 6. Пацієнтка С., 65 років, звернулась на огляд новоутворення на шкірі передньої черевної стінки, яке пам’ятає більше 15 років. Об’єктивно новоутворення 8*9 мм, сірого кольору, у формі вузла. Теледерматоскопічно: кератоз вкриває більшу частину новоутворення, судинний рисунок не виражений (рис. 4.3). Дерматоскопічно: кератоз вкриває більшу частину новоутворення, судини у вигляді шпильок (рис. 4.4). Діагноз: СК.
Рисунок 4.2 – Дерматоскопічна структура
Рисунок 4.3 – Теледерматоскопічна структура
Рисунок 4.4 – Дерматоскопічна структура
4.2 Діагностика немеланоцитарного раку шкіри
4.2.1 Теледерматологічна та теледерматоскопічна діагностика немеланоцитарного раку шкіри
Для аналізу було відібрано 62 пацієнти з новоутвореннями і попереднім діагнозом раку шкіри, які звернулись на дистанційну діагностику новоутворень. Після встановлення попереднього діагнозу пацієнти були направлені на очну консультацію дерматолога, який рекомендував видалення [22, 109, 113].
Пацієнтам у віці до 30 років попередній діагноз раку шкіри не був встановлений. У віці від 30 до 39 років 4 пацієнтам був встановлений попередній діагноз раку шкіри, у віці від 40 до 49 років – 7 пацієнтам, від 50 до 59 років – 11 пацієнтам, від 60 до 69 років – 20 пацієнтам, від 70 до 79 років – 18 пацієнту, від 80 до 89 років – 2 пацієнтам. Середній вік пацієнтів становив 59 років. Всього діагноз раку шкіри був виставлений 34 жінкам та 28 чоловікам (табл. 4.8).
Таблиця 4.8 – Розподіл пацієнтів з попереднім діагнозом раку шкіри за віковими групами
| 0-9 років | 10-19 років | 20-29 років | 30-39 років | 40-49 років | 50-59 років | 60-69 років | 70-79 років | 80-89 років | Всього: | |
| Жінки | – | – | – | 2 | 3 | 7 | 11 | 10 | 1 | 34
54,8 % |
| Чоловіки | – | – | – | 2 | 4 | 4 | 9 | 8 | 1 | 28
45,2 % |
| Всього:
% |
–
– |
–
– |
–
– |
4
6,5 % |
7
11,3 % |
11
17,7 % |
20
32,3 % |
18
29,0 % |
2
3,2 % |
62
100 % |
За локалізацією 48 (77,4 %) новоутворень були розташовані на обличчі, 10 (16,1 %) новоутворень на тулубі, 4 (6,5 %) – на кінцівках (табл. 4.9).
Таблиця 4.9 – Розподіл новоутворень з попереднім діагнозом раку шкіри за локалізацією
| Локалізація | Кількість, (%) |
| Голова | 48 (77,4 %) |
| Тулуб | 10 (16,1 %) |
| Кінцівки | 4 (6,5 %) |
Теледерматологічний висновок раку шкіри базувався на аналізі макроскопічних фотографій, отриманих експертом. Аналізувались: розмір, форма, колір, межі, краї, поверхня.
Серед обстежених новоутворень 12 (19,4 %) мали розмір до 5 мм, 28 (45,1 %) – від 6 до 10 мм, 22 (35,5 %) – більше 10 мм. За формою новоутворення у вигляді плями відмічалось у 7 (11,3 %) випадках, у формі папули у 35 (56,5 %) випадках, у вигляді вузла – у 20 (32,2 %) випадках. В 30 (48,4 %) випадках відмічалась наявність тільки рожевого кольору, у 17 (27,4 %) випадках – тілесного кольору, у 15 (24,2 %) випадках інших кольорів. Судинний рисунок був помітним без дерматоскопа у 28 (45,2 %) випадках. Чіткі межі відзначались у 39 (62,9 %) випадках, нечіткі – у 23 випадках (37,1 %). Краї рівні були у 48 (77,4 %) випадках, нерівні – у 14 (22,6 %) випадках. Утворення виявились симетричними у 50 (80,6 %) випадках, асиметричними – у 12 (19,4 %) випадках. Поверхня новоутворень була гладкою у 52 (83,9 %) випадках, бородавчастою – у 10 (16,1 %) випадках (табл. 4.10).
Оцінка теледерматоскопічної структури новоутворень проводилась за наступними ознаками: сіро-блакитні овоїдні гнізда, множинні сіро-блакитні глобули, листовидні структури, структури у вигляді спиць колеса, деревовидні судини, виразкування, кератинові перлини, структури у вигляді листя конюшини, гломерулярні судини, судини у вигляді шпильок на білому фоні, кірочка жовтого кольору.
Сіро-блакитні овоїдні гнізда – великі округлі пігментовані структури з чіткими межами, що можуть зливатись між собою. Зазвичай синього кольору.
Таблиця 4.10 – Характерні теледерматологічні ознаки новоутворень з попереднім діагнозом раку шкіри
| Ознаки новоутворень | Кількість | ||
| Розмір:
до 5 мм 6-10 мм >10 мм |
12 (19,4 %)
28 (45,1 %) 22 (35,5 %) |
||
| Форма:
пляма папула вузол |
7 (11,3 %)
35 (56,5 %) 20 (32,2 %) |
||
| Колір | |||
| Один колір | Рожевий | 30 (48,4 %) | 47 (75,8 %) |
| Тілесний | 17 (27,4 %) | ||
| Наявність інших кольорів | Коричневий, блакитний, жовтий | 15 (24,2 %) | |
| Видимий судинний рисунок | 28 (45,2 %) | ||
| Межі:
чіткі нечіткі |
39 (62,9 %)
23 (37,1 %) |
||
| Краї:
рівні нерівні |
48 (77,4 %)
14 (22,6 %) |
||
| Симетрія:
симетричні асиметричні |
50 (80,6 %)
12 (19,4 %) |
||
| Поверхня:
бородавчаста рівна |
10 (16,1 %)
52 (83,9 %) |
||
Сіро-блакитні глобули – окремі глобули, значно менші від овоїдних гнізд, сірого, блакитного або коричневого кольору.
Листкоподібні структури – округлі структури на периферії утворення, які за формою нагадують клиновий лист. Колір від коричневого до сіро-блакитного.
Структури у вигляді спиць колеса – структури у вигляді променів, об’єднаних в центрі. За формою нагадують спиці колеса. Варіантом структур у вигляді спиць колеса є округлі структури з темною центральною частиною. Колір коричневий або чорний.
Деревовидні судини – чітко виражені, крупні, розгалуженні судини, які розташовуються за всією площею. За формою нагадують гілки дерев.
Кератинові перлини – округлі або втягнутої форми структури з нечіткими межами, які можуть розташовуватись на всій площі утворення.
Структури у вигляді листя конюшини – структури білого кольору, які мають вигляд чотирьох листків і за формою нагадують листя конюшини або пелюстки троянди. Можна побачити лише за допомогою поляризованого світла у дерматоскопі.
Гломерулярні судини – щільно закручені у клубочок судини, які можуть займати всю площу утворення.
Судини у вигляді шпильок на білому фоні – дрібні або великі судини у вигляді шпильок для волосся. Білий фон утворює оточуючий кератин.
Серед 62 новоутворень шкіри з підозрою на рак шкіри, сіро-блакитні овоїдні гнізда були виявлені у 8 (12,9 %) випадках, множинні сіро-блакитні глобули – у 16 (25,8 %) випадках, листкоподібні структури – у 1 (1,6 %) випадку, деревовидні судини – у 45 (72,6 %) випадках, виразкування – у 21 (33,9 %), кератинові перлини – у 1 (1,6 %) випадку, кірочка жовтого кольору – у 3 (4,8 %) випадках. Структури у вигляді листя конюшини, гломерулярні судини, судини у вигляді шпильок на білому фоні, структури у вигляді спиць колеса не були виявлені у жодному з випадків (табл. 4.11).
Таблиця 4.11 – Характерні теледерматоскопічні ознаки новоутворень з попереднім діагнозом раку шкіри
| Теледерматоскопічні ознаки | Кількість, шт. |
| Cіро-блакитні овоїдні гнізда | 8 (12,9 %) |
| Множинні сіро-блакитні глобули | 16 (25,8 %) |
| Листкоподібні структури | 1 (1,6 %) |
| Структури у вигляді спиць колеса | – |
| Деревовидні судини | 45 (72,6 %) |
| Виразкування | 21 (33,9 %) |
| Кератинові перлини | 1 (1,6 %) |
| Структури у вигляді листя конюшини | – |
| Гломерулярні судини | – |
| Судини у вигляді шпильок на білому фоні | – |
| Кірочка жовтого кольору | 3 (4,8 %) |
4.2.2 Клінічна та дерматоскопічна діагностика немеланоцитарного раку шкіри
Дані клінічного огляду та дерматоскопії заносились до спеціально розробленої анкети.
Серед обстежених новоутворень 12 (19,4 %) мали розмір до 5 мм, 28 (45,1 %) – від 6 до 10 мм, 22 (35,5 %) – більше 10 мм. За формою новоутворення у вигляді плями відмічалось у 5 (8,0 %) випадках, у формі папули у 37 (59,7 %) випадках, у вигляді вузла – у 20 (32,3 %) випадках. В 31 (50,0 %) випадку відмічалась наявність тільки рожевого кольору, у 16 (25,8 %) випадках – тілесного кольору, у 15 (24,2 %) випадках інших кольорів. Судинний рисунок був помітним неозброєним оком у 33 (53,2 %) випадках. Чіткі межі відзначались у 42 (67,7 %) випадках, нечіткі – у 20 випадках (32,3 %). Краї рівні були у 47 (75,8 %) випадках, нерівні – у 15 (24,2 %) випадках. Утворення виявились симетричними у 49 (79,0 %) випадках, асиметричними – у 13 (21,0 %) випадках. Поверхня новоутворень була гладкою у 51 (82,3 %) випадку, бородавчастою – у 11 (17,7 %) випадках (табл. 4.12).
За результатами проведення дерматоскопічного огляду, сіро-блакитні овоїдні гнізда були виявлені у 8 (12,9 %) випадках, множинні сіро-блакитні глобули – у 19 (30,6 %) випадках, структури у вигляді спиць колеса – у 1 (1,6 %) випадку, деревовидні судини – у 49 (79,0 %) випадках, виразкування – у 21 (33,9 %), кератинові перлини – у 1 (1,6 %) випадку, кірочка жовтого кольору – у 3 (54,8 %) випадках, судини у вигляді шпильок на білому фоні – у 1 (1,6 %), листовидні структури – у 1 (1,6 %). Структури у вигляді листя конюшини і гломерулярні судини не були виявлені у жодному з випадків (табл. 4.13).
Пацієнти отримали рекомендації проведення діагностичної біопсії комбінованим методом в межах здорових тканин (радіохвильовий метод та кріодеструкція основи).
Таблиця 4.12 – Характерні клінічні ознаки новоутворень з попереднім діагнозом раку шкіри
| Ознаки новоутворень | Кількість | ||
| Розмір:
до 5 мм 6-10 мм >10 мм |
12 (19,4 %)
28 (45,1 %) 22 (35,5 %) |
||
| Форма:
пляма папула вузол |
5 (8,0 %)
37 (59,7 %) 20 (32,3 %) |
||
| Колір | |||
| Один колір | Рожевий | 31 (50,0 %) | 47 (75,8 %) |
| Тілесний | 16 (25,8 %) | ||
| Наявність інших кольорів | Коричневий, блакитний, жовтий | 15 (24,2 %) | |
| Видимий судинний рисунок | 33 (53,2 %) | ||
| Межі:
чіткі нечіткі |
42 (67,7 %)
20 (32,3 %) |
||
| Краї:
рівні нерівні |
47 (75,8 %)
15 (24,2 %) |
||
| Симетрія:
симетричні асиметричні |
49 (79,0 %)
13 (21,0 %) |
||
| Поверхня:
бородавчаста рівна |
11 (17,7 %)
51 (82,3 %) |
||
Таблиця 4.13 – Характерні дерматоскопічні ознаки новоутворень з попереднім діагнозом раку шкіри
| Теледерматоскопічні ознаки | Кількість, шт. |
| Cіро-блакитні овоїдні гнізда | 8 (12,9 %) |
| Множинні сіро-блакитні глобули | 19 (30,6 %) |
| Листкоподібні структури | 1 (1,6 %) |
| Структури у вигляді спиць колеса | 1 (1,6 %) |
| Деревовидні судини | 49 (79,0 %) |
| Виразкування | 21 (33,9 %) |
| Кератинові перлини | 1 (1,6 %) |
| Структури у вигляді листя конюшини | – |
| Гломерулярні судини | – |
| Судини у вигляді шпильок на білому фоні | 1 (1,6 %) |
| Кірочка жовтого кольору | 3 (4,8 %) |
За результатами гістологічного дослідження 62 новоутворень шкіри з теледерматологічним діагнозом раку шкіри, перший патогістолог встановив 59 діагнозів БКРШ, 3 діагнози ПКРШ; другий патогістолог встановив 55 діагнозів раку шкіри та 7 діагнозів доброякісних новоутворень; третій патогістолог із 9 оглянутих препаратів встановив 4 діагнози БКРШ, 2 діагнози БКП, 2 діагнози КА, 1 діагноз СК (табл. 4.14).
Таблиця 4.14 – Результати патогістологічного дослідження новоутворень шкіри з попереднім діагнозом раку шкіри
| Теледерматоло-гічний діагноз | Клінічний діагноз | Патогісто-логічний діагноз | Патогістолог №1 | Патогістолог №2 | Патогістолог №3 | ||||||
| БКРШ | 59 | БКРШ | 53 | БКРШ | 59 | 95,2 % | 53 | 85,5 % | 4 | 6,5 % | |
| 85,5 % | АК | – | – | 6 | 9,7 % | – | – | ||||
| 95,2 % | АК | 4 | БКП | – | – | – | – | 2 | 3,2 % | ||
| 6,5 % | |||||||||||
| ПКРШ | 3 | ПКРШ | 3 | ПКРШ | 3 | 4,8 % | 2 | 3,2 % | – | – | |
| 4,8 % | 4,8 % | КА | – | – | 1 | 1,6 % | 2 | 3,2 % | |||
| СК | – | – | – | – | 1 | 1,6 % | |||||
| КА | 2 | ||||||||||
| 3,2 % | |||||||||||
| Всього: 62 (100 %) | 62 | 100 % | 62 | 100 % | 62 | 100 % | 9 | 14,5 % | |||
Як приклад аналізу НМРШ можна розглянути наступні клінічні випадки [10].
Клінічний випадок № 7. Пацієнтка Х., 69 років, звернулась на огляд новоутворення на шкірі правої щоки, яке існує останні 3–4 роки. Об’єктивно новоутворення рожевого кольору 11*6 мм у вигляді плями. Теледерматоскопічно: деревовидні судини, сіро-блакитні глобули, включення пігменту. Оточуюча шкіра – купероз (рис. 4.5). Дерматоскопічно: деревовидні судини, сіро-блакитні точки та глобули, включення пігменту. Оточуюча шкіра – купероз (рис. 4.6). Діагноз: БКРШ.
Рисунок 4.5 – Теледерматоскопічна структура
Рисунок 4.6 – Дерматоскопічна структура
Клінічний випадок № 8. Пацієнт Р., 72 роки, звернувся на огляд новоутворення на шкірі лівої підщелепної ділянки, яке з’явилось 3 місяці назад та швидко збільшувалось у розмірах. Об’єктивно нвоутворення білого кольору 3*3 мм у вигляді вузла. Теледерматоскопічно: кератинові перлини, слабко виражений судинний рисунок (рис. 4.7). Дерматоскопічно: кератинові перлини, судини у вигляді шпильок на білому фоні (рис. 4.8). Діагноз: ПКРШ.
Клінічний випадок № 9. Пацієнтка Ф., 59 років, звернулась на огляд новоутворення на шкірі лоба, яке помітила місяць тому. Об’єктивно новоутворення рожевого кольору, 8*7 мм, у вигляді плями. Теледерматоскопічно: ділянки виразкування (бурштинові кірочки), рожевий фон (рис. 4.9). Дерматоскопічно: ділянки виразкування (бурштинові кірочки), деревовидні судини, рожевий фон (рис. 4.10). Діагноз: БКРШ.
Рисунок 4.7 – Теледерматоскопічна структура
Рисунок 4.8 – Дерматоскопічна структура
Рисунок 4.9 – Теледерматоскопічна структура
Рисунок 4.10 – Дерматоскопічна структура
***
Отже, теледерматологічна діагностика СК показала високу точність, що наближається до точності гістологічних діагнозів, і складає (97,4 ± 0,5) %. Точність дистанційної діагностики НМРШ є високою, і становить (94,4 ± 5,6) %, що наближається до точності гістологічних висновків експертів. Застосування ТД в діагностиці немеланоцитарних новоутворень шкіри є ефективним і може бути впровадженим в практику для пацієнтів з віддалених регіонів.
Результати дослідження, відображені у даному розділі, відображені в наступних публікаціях:
- Кравець К.І., Богомолець О.В. Застосування сучасних методів у діагностиці себорейного кератозу. Дерматологія та венерологія. 2018. № 2 (80). С. 59–62 [16].
- Дерматоскопія. Міні-атлас. Вид. 1 / К.І. Кравець, С.Д. Дячук, І.І. Сидоренко, О.В. Магоня, Н.М. Семенюк; під ред. О.В. Богомолець. К. : ТОВ «Глянець», 2018. 75 с. [10].
- Кравець К.І., Сидоренко І.І., Богомолець О.В. Порівняльна характеристика теледерматоскопічної та дерматоскопічної діагностики немеланомних раків шкіри. Матеріали науково-практичної конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», 10–11 листопада 2017 р., м. Харків. Дерматологія та венерологія. 2017. № 3 (77). С. 103–104 [22].
- Kravets K., Bogomolets O., Dyachuk S. The Effectiveness of Teledermatology Use in Skin Cancers Diagnosis. 5th EAAD congress “United for dermatology”, Riga, 18-20 September, 2015. P.95 [109].
- Store-and-Forward Teledermatology for the Most Common Skin Neoplasms in Ukraine / K. Kravets, Z. Dranyk, O. Vasylenko, O. Bogomolets. Acta Dermatovenerologica Alpina, Pannonica et Adriatica. 2018. Iss.27. P. 79–83 [113].
РОЗДІЛ 5
ЛІКУВАННЯ НОВОУТВОРЕНЬ ШКІРИ
При проведенні лікувально-діагностичної біопсії в межах здорових тканин були використані наступні методи: радіохвильовий, комбінований (радіохвильове видалення з кріодеструкцією основи), хірургічний [13].
Меланоцитарні невуси. Залежно від структури новоутворення з попереднім діагнозом МН був рекомендований радіохвильовий або хірургічний методи видалення. Рекомендації до видалення радіохвильовим методом отримали пацієнти з новоутвореннями коричневого кольору за наявності типової теледерматоскопічної та дерматоскопічної структури (типові пігментна сітка, глобули, судини). За наявності атипових структур (атипові пігментна сітка, глобули, судини), гомогенної блакитної пігментації або ознаки зіркової променистості, пацієнти отримували рекомендацію до видалення новоутворень хірургічним методом.
Меланома шкіри. Після очного та дерматоскопічного огляду новоутворень пацієнти направлялись на консультацію та лікування до онколога до Національного інституту раку в м. Києві. Діагностична біопсія всіх новоутворень проводилась хірургічним методом.
СК. Усі новоутворення були видалені радіохвильовим методом з наступним гістологічним дослідженням.
Раки шкіри. Всі новоутворення були видалені комбінованим методом (радіохвильове видалення та кріодеструкція основи) та відправлені на гістологічне дослідження.
Результати гістологічного дослідження отримували в терміни від 2 до 3 тижнів. Кожний препарат обов’язково аналізували два патогістологи, незалежно один від одного. У випадках суперечливих діагнозів скло надсилали третьому патогістологу до Національного інституту раку в м.Києві.
Огляди дерматолога рекомендували через 3, 6, 12 місяців після видалення незалежно від методу для спостереження за віддаленими наслідками (табл. 5.1).
Таблиця 5.1 – Кількість видалень новоутворень шкіри в залежності від розміру та локалізації
| Локалізація | Розмір | Радіохвильовий метод | Комбінований метод | Хірургічний метод | Всього | ||||
| кількість | % | кількість | % | кількість | % | кількість | % | ||
| Голова та шия | < 5 мм | 11 | 6,8 | 10 | 16,1 | 2 | 4,8 | 23 | 8,6 |
| 6-10 мм | 24 | 14,7 | 21 | 33,9 | 2 | 4,8 | 47 | 17,6 | |
| > 11 мм | 6 | 3,7 | 17 | 27,4 | – | – | 23 | 8,6 | |
| Тулуб | < 5 мм | 13 | 8,0 | 2 | 3,2 | 3 | 7,1 | 18 | 6,7 |
| 6-10 мм | 53 | 32,5 | 6 | 9,7 | 25 | 59,5 | 84 | 31,5 | |
| > 11 мм | 48 | 29,4 | 2 | 3,2 | 5 | 11,9 | 55 | 20,6 | |
| Кінцівки | < 5 мм | 3 | 1,8 | – | – | 1 | 2,3 | 4 | 1,5 |
| 6-10 мм | 4 | 2,5 | 1 | 1,6 | 2 | 4,8 | 7 | 2,6 | |
| > 11 мм | 1 | 0,6 | 3 | 4,9 | 2 | 4,8 | 6 | 2,3 | |
| Всього | 163 | 100 | 62 | 100 | 42 | 100 | 267 | 100 | |
5.1 Радіохвильовий метод
Це найменш травматичний метод розрізу і коагуляції м’яких тканин за допомогою високочастотних хвиль.
Під місцевим знеболенням 1 % розчином лідокаїну або ультракаїну, або убістезину проводилась діагностична біопсія МН та СК лезом, з метою найменшого пошкодження країв новоутворень. Препарат заливався 10 % розчином формаліну і направлявся до лабораторії на патогістологічне дослідження. Ложе оброблялось радіохвильовим апаратом «Сургітрон», Cynosure, Inc. dba Ellman (США), до візуально інтактних (чистих) тканин. Глибина видалення визначалась візуально в процесі видалення і проводилась в межах епідермісу або дерми. Вибір режиму видалення залежав від попереднього діагнозу, локалізації новоутворень та загального стану пацієнта (наявність артеріальної гіпертензії або судини великого калібру в основі новоутворення). Пацієнтам було рекомендовано прийти на огляд на 3, 7, 10, 15, 21 добу після видалення.
Радіохвильовим методом була проведена діагностична біопсія у межах візуально інтактних тканин 163 новоутворень шкіри. У 66 випадках був встановлений теледерматологічний діагноз МН, у 97 випадках – СК. На першому режимі (розріз – CUT) була проведена діагностична біопсія у повному обсязі 153 новоутворень шкіри. На другому режимі (CUT and COAG/RECTIFIED) була проведена діагностична біопсія 10 новоутворень шкіри.
5.2 Комбінований метод
Комбінований метод застосовувався для видалення новоутворень з попереднім діагнозом раку шкіри [13]. Під місцевим знеболенням 1 % розчином лідокаїну з епінефрином, ультракаїну або убістезину проводилась діагностична біопсія лезом з метою найменшого пошкодження країв новоутворень. Ложе оброблялось радіохвильовим апаратом «Сургітрон», Cynosure, Inc. dba Ellman (США), на другому режимі (розріз та коагуляція) з переходом на третій режим (коагуляція) в окремих випадках. Третій режим застосовувався у випадках сильної кровотечі. Глибина видалення – до візуально інтактних (чистих) тканин. Після радіохвильового видалення, з метою видалення патологічно змінених тканин, непомітних оком, проводилася кріодеструкція ложа за допомогою кріодеструктора з тефлоновою насадкою за діаметром більше на 2-3 мм від видимих меж. Тривалість експозиції та кількість кріоциклів визначались індивідуально в залежності від глибини залягання новоутворення, що визначалось в процесі видалення. Рана оброблялась антисептиком, накладалась асептична пов’язка, пацієнту надавали рекомендації та роз’яснення. Пацієнтів оглядали на 3, 7, 10, 15, 21, 27, 35, 50 добу після видалення.
Комбінованим методом було видалено 62 новоутворення шкіри з попереднім діагнозом раку шкіри. На першому режимі було проведено видалення 7 новоутворень, на першому режимі з переходом на другий режим було видалено 48 новоутворень, на першому режимі з переходом на третій було видалено 7 новоутворень шкіри. Контактна кріодеструкція проводилась в 4 кріоцикли. У 5 випадках експозиція кріодеструкції тривала по 10-12 с, у 37 випадках – по 15–20 с, у 20 випадках – по 20–25 с (табл. 5.2).
Таблиця 5.2 – Результати кількості, параметрів та тривалості проведення процедури радіохвильового та комбінованого видалення новоутворень шкіри
| Радіохвильове видалення | Комбіноване видалення | ||||
| режим | кількість | Радіохвильове видалення, кількість новоутворень | Кріодеструкція | ||
| кількість новоутворень | кількість кріоциклів | тривалість експозиції, секунди | |||
| I (CUT) | 153 | 7 | 5 | 4 | 10-12 |
| II (CUT and COAG) | 10 | 48 | 37 | 4 | 15-20 |
| III (COAG) | 7 | 20 | 4 | 20-25 | |
| Всього: | 163 | 62 | 62 | ||
5.3 Хірургічний метод
Лікувально-діагностична біопсія хірургічним методом застосовувалась у випадках наявності чорного або синього кольорів (ознака проліферації невусів), гіпертрихозу або наявності атипових структур в новоутвореннях з попереднім діагнозом МН, попереднього діагнозу меланоми шкіри.
Діагностична біопсія хірургічним методом новоутворень з попередньо встановленим діагнозом МН проводилось на базі ПП «Інститут дерматокосметології доктора Богомолець» у м. Києві. Під місцевим знеболенням 1 % розчином лідокаїну з епінефрином або ультракаїну, або убістезину, після попередньої обробки оперативного поля двома розрізами, відступивши 0,2–0,3 мм від видимих меж новоутворення висікався лоскут шкіри у всю товщу. Проводився гемостаз, накладались пошарові шви на рану, обробка антисептиком, накладалась асептична пов’язка. Перев’язка проводилась на 7, 15 та 21 (за необхідності) день після видалення. При розташуванні новоутворення на обличчі, передній поверхні тулуба, верхніх кінцівках, внутрішній поверхні стегон шви знімались на 12-16 добу, на спині і попереку – на 16-20 добу.
Діагностична біопсія хірургічним методом новоутворень, з попередньо встановленим діагнозом меланоми шкіри, проводилось на базі Національного інституту раку в м.Києві. Під місцевим знеболенням проводилась діагностична біопсія з мінімальними відступами у всю товщу з підшкірно-жировою клітковиною. Результати патогістологічного дослідження отримували у терміни 7-10 днів. При підтвердженні діагнозу меланоми шкіри проводилось широке висічення. Відступи залежали від глибини за Бреслоу. За відсутності можливості слідкувати за загоєнням ран, контроль останніх не проводився.
Усього було проведено 89 лікувально-діагностичних біопсій хірургічним методом, з яких попередній теледерматологічний діагноз МН був встановлений у 42 випадках, меланоми шкіри – у 47 випадках.
У післяопераційний період, після проведення біопсій радіохвильовим методом в рекомендовані дні огляду прийшли 29 пацієнтів із 163, комбінованим методом – 60 пацієнтів із 62, хірургічним методом – 41 із 42. При аналізі враховувались дані пацієнтів, які прийшли у всі назначені дні контрольного огляду або перев’язки (130 пацієнтів).
Після проведення біопсій радіохвильовим методом 89,7 % ран загоїлись на 10 добу після видалення, на 15 добу – 96,6 %. На 21 добу після видалення всі рани загоїлись. Після видалення новоутворень комбінованим методом 90 % ран загоїлось на 35 добу після видалення, 100 % – на 50 добу. Після хірургічного видалення новоутворень шкіри у 97,6 % шви були зняті до 15–19 доби після видалення, у 2,4 % при наявності ускладнень шви зняли на 27 добу (табл. 5.3).
Таблиця 5.3 – Тривалість загоєння ран після видалення новоутворень шкіри
| День після видалення | Радіохвильове видалення | Комбіноване видалення | Хірургічне видалення | |||
| 3 | 28 (96,6 %) | суха кірочка | 2 (3,3 %) | суха кірочка | 40 (97,6 %) | п/о рана без ускладнень |
| 1 (3,4 %) | волога рана | 58 (96,7 %) | волога рана | 1 (2,4 %) | перифокальне запалення | |
| 7 | 28 (96,6 %) | суха кірочка | 5 (8,3 %) | суха кірочка | 40 (97,6 %) | п/о рана без ускладнень |
| 1 (3,4 %) | волога рана | 55 (91,7 %) | волога рана | 1 (2,4 %) | нагноєння, перифокальне запалення | |
| 10 | 26 (89,7 %) | рана загоїлась | 30 (50 %) | суха кірочка | 40 (97,6 %) | рана загоюється первинним натягом |
| 3 (10,3 %) | суха кірочка | 30 (50 %) | волога рана | 1 (2,4 %) | рана очищується | |
| 15 | 28 (96,6 %) | рана загоїлась | 54 (90 %) | суха кірочка | 40 (97,6 %) | рана загоїлась первинним натягом |
| 1 (3,4 %) | суха кірочка | 6 (10 %) | волога рана | 1 (2,4 %) | рана очищується, гранулює | |
| 21 | 29 (100 %) | рубець | 9 (15 %) | рана загоїлась | 40 (97,6 %) | рубець |
| 51 (85 %) | суха кірочка | 1 (2,4 %) | вторинні шви | |||
| 27 | 29 (100 %) | рубець | 22 (36,7 %) | рана загоїлась | 41 (100 %) | рубець |
| 38 (63,3 %) | суха кірочка | |||||
| 35 | 29 (100 %) | рубець | 54 (90 %) | рана загоїлась | 41 (100 %) | рубець |
| 6 (10 %) | суха кірочка | |||||
| 50 | 29 (100 %) | рубець | 60 (100 %) | рана загоїлась | 41 (100 %) | рубець |
| Всього: | 29 (100 %) | 60 (100 %) | 41 (100 %) | |||
Після проведення біопсій всім пацієнтам було рекомендовано звернутися на консультацію через 3, 6, 12 місяців. За результатами огляду оцінювалися наявність рецидиву новоутворення (РН) не залежно від виду рубця, формування гіпертрофічного рубця (ГР), келоїдного рубця (КР), нормотрофічного рубця (НР) (табл. 5.4). Оскільки атрофічний рубець не сформувався в жодному з випадків, ці данні не вносились до таблиць.
Таблиця 5.4 – Віддалені результати видалення новоутворень шкіри радіохвильовим, комбінованим та хірургічним методами
| Місяць огляду після видалення | Локалі-зація | Рецидив новоутворень | Гіпертро-
фічні рубці |
Келоїдні рубці | Нормотро-
фічні рубці |
Всього | |||||||||||
| кільк | % | кільк | % | кільк | % | кільк | % | кільк | % | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | ||||||
| Радіохвильовий метод | |||||||||||||||||
| 3 | Голова та шия | 1 | 1,2 % | 2 | 2,3 % | – | – | 24 | 28,2 % | 27 | 85 | 100 | |||||
| Тулуб | 5 | 5,9 % | 1 | 1,2 % | 1 | 1.2 % | 48 | 56,5 % | 55 | ||||||||
| Кінцівки | 1 | 1,2 % | – | – | – | – | 2 | 2,3 % | 3 | ||||||||
| 6 | Голова та шия | 1 | 1,6 % | 1 | 1,6 % | 1 | 1,6 % | 13 | 21,0 % | 16 | 62 | 100 | |||||
| Тулуб | 6 | 9,7 % | 1 | 1,6 % | 3 | 4,8 % | 35 | 56,5 % | 45 | ||||||||
| Кінцівки | – | – | – | – | – | – | 1 | 1,6 % | 1 | ||||||||
| 12 | Голова та шия | – | – | 1 | 3,85 % | 1 | 3,85 % | 9 | 34,6 % | 11 | 26 | 100 | |||||
| Тулуб | 2 | 7,7 % | 1 | 3,85 % | 1 | 3,85 % | 11 | 42,3 % | 15 | ||||||||
| Кінцівки | – | – | – | – | – | – | – | – | – | ||||||||
| Комбінований метод | |||||||||||||||||
| 3 | Голова та шия | 1 | 1,7 % | 2 | 3,4 % | – | – | 43 | 72,9 % | 46 | 59 | 100 | |||||
| Тулуб | – | – | 1 | 1,7 % | – | – | 9 | 15,2 % | 10 | ||||||||
| Кінцівки | – | – | 1 | 1,7 % | – | – | 2 | 3,4 % | 3 | ||||||||
| 6 | Голова та шия | 2 | 3,3 % | 1 | 1,7 % | 1 | 1,7 % | 43 | 71,6 % | 47 | 60 | 100 | |||||
| Тулуб | – | – | 1 | 1,7 % | 1 | 1,7 % | 8 | 13,3 % | 10 | ||||||||
| Кінцівки | – | – | – | – | – | – | 3 | 5,0 % | 3 | ||||||||
| 12 | Голова та шия | 2 | 3,3 % | 1 | 1,7 % | 1 | 1,7 % | 43 | 71,6 % | 47 | 60 | 100 | |||||
| Тулуб | – | – | 1 | 1,7 % | 1 | 1,7 % | 7 | 11,7 % | 9 | ||||||||
| Кінцівки | – | – | – | – | – | – | 4 | 6,6 % | 4 | ||||||||
Продовження таблиці 5.4
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |||
| Хірургічний метод | ||||||||||||||
| 3 | Голова та шия | – | – | – | – | – | – | 3 | 8,8 % | 3 | 34 | 100 | ||
| Тулуб | – | – | 3 | 8,8 % | – | – | 26 | 76,5 % | 29 | |||||
| Кінцівки | – | – | – | – | – | – | 2 | 5,9 % | 2 | |||||
| 6 | Голова та шия | – | – | – | – | – | – | 1 | 4,3 % | 1 | 23 | 100 | ||
| Тулуб | – | – | 2 | 8,8 % | 2 | 8,8 % | 18 | 78,3 % | 22 | |||||
| Кінцівки | – | – | – | – | – | – | – | – | – | |||||
| 12 | Голова та шия | – | – | – | – | – | – | – | – | – | 9 | 100 | ||
| Тулуб | – | – | – | – | 1 | 11,1 % | 8 | 88,9 % | 9 | |||||
| Кінцівки | – | – | – | – | – | – | – | – | – | |||||
***
Отже, при застосуванні комбінованого методу у проведенні лікувально-діагностичних біопсій в межах здорових тканин загоєння ран відбувається в двічі довше, ніж при радіохвильовому та хірургічному методах. Але незважаючи на цей факт, при використанні комбінованого методу відмічається клінічно істотна тенденція до формування більшої кількості нормотрофічних рубців, меншої кількості рецидивів новоутворень шкіри, формування меншої кількості гіпертрофічних та келоїдних рубців.
Результати дослідження, відображені у даному розділі, відображені в наступних публікаціях:
- Застосування комбінованого методу у лікуванні новоутворень шкіри / К.І. Кравець, Ж.Н. Драник, О.В. Василенко, О.В. Богомолець. Science Rise. Medical Science. 2018. № 5 (25). С. 23–30 [13].
РОЗДІЛ 6
ДІАГНОСТИЧНА ЦІННІСТЬ ТЕЛЕМЕДИЧНИХ ОГЛЯДІВ
6.1 Оцінка діагностичної цінності телемедичних оглядів
При оцінці діагностичної цінності телемедичних оглядів розглядались моральна та економічна сторони [5].
6.1.1 Методи оцінки моральної ефективності
Було створено анкету для пацієнтів, спрямовану на дослідження ефективності роботи телемедицини в сфері діагностики новоутворень шкіри. Вона складалась з 5 питань. Після отримання телемедичної консультації всім пацієнтам розіслано анкету з проханням відповісти на всі запитання «так» або «ні».
Чи задоволені Ви часом звернення до спеціаліста через Telederm?
Чи задоволені Ви швидкістю отримання відповіді через Telederm?
Чи задоволені Ви роботою адміністратора в телефонній розмові (у випадку звернення)?
Чи задоволені Ви доступністю відповіді та роз’яснень спеціаліста?
Чи задоволені Ви отриманими рекомендаціями та доступністю їх виконання?
Із 314 пацієнтів, відібраних для дослідження, на всі питання відповіли 211 пацієнтів, серед яких 194 (91,9 %) пацієнтів відповіли позитивно на всі 5 запитань.
6.1.2 Методи оцінки економічної ефективності телемедицини
Собівартість телемедичних послуг розраховувалась за формулою:
С = ЗПмп+ЗПіт+ЗПадм+СФ+ВМ+ЗВ,
де ЗПмп – зарплата медичного персоналу;
ЗПіт – зарплата інженерно-технічого персоналу;
ЗПадм – зарплата адміністративного персоналу;
СФ – відрахування у соціальні фонди;
ВМ – собівартість витратних матеріалів;
ЗВ – загальні витрати [5].
C = 6000 грн + 3000 грн + 16000 грн + 10375 грн + 400 грн + 3300 грн = 39075 грн/міс,
де 6000 грн – зарплата лікаря консультанта,
3000 грн – зарплата інженера-програміста,
16000 грн – зарплата директора та адміністраторів,
10375 грн – загальна сума відрахування у соціальні фонди,
400 грн – вартість витратних матеріалів,
3300 грн – загальні витрати (аренда приміщення, комунальні послуги, зв’язок, аренда хостінга)
Собівартість однієї консультації розраховувалась за формулою:
F = Cp/Np,
де Cp – річні затрати на телемедицину,
Np – кількість пацієнтів, оглянутих за рік [5].
F = 468900 грн / 4217 = 111,20 грн.
6.2 Статистичний аналіз даних
Статистичний аналіз проводився за допомогою програми IBM SPSS 23.0. Використовувалися методи описової статистики: для кількісних змінних – n, середнє арифметичне, медіана, стандартне відхилення, мінімум і максимум; для категоріальних змінних – частота і частка у відсотках [34]. Для розповсюдження даних на усю популяцію застосовувалося інтервальне оцінювання (були побудовані 95 % довірчі інтервали для часток з використанням методу Вілсона) (табл. 6.1) [7]. Порівняння категоріальних змінних здійснювалося за допомогою точного критерію Фішера [8]. З метою елімінації ефекту множинних порівнянь застосовувався метод Бонферроні [51].
Таблиця 6.1 – Результати статистичної обробки даних теледерматологічних та гістологічних діагнозів
| Метод діагностики | МН | СК | Раки шкіри | Меланома шкіри |
| Теледерматологічний та теледерматоскопічний діагнози | 108 | 97 | 62 | 47 |
| Гістологічні діагнози | 106 | 95 | 55 | 40 |
| Точність у порівнянні з гістологічними діагнозами | 98,15 | 97,90 | 88,71 | 85,11 |
| Нижня межа для 95 % CI, % | 93,47 | 93,39 | 78,11 | 71,69 |
| Верхня межа для 95 % CI, % | 99,77 | 98,91 | 95,34 | 93,80 |
Спостерігалася клінічно істотна тенденція до зменшення кількості формування гіпертрофічних рубців після комбінованого методу видалення, у порівнянні з хірургічним методом після 3 місяців (6,7 %; 95 % ДІ: 2,7 % – 16,2 % і 8,8 %; 95 % ДІ: 3,0 % – 23,0 % відповідно) та 6 місяців (3,3 %; 95 % ДІ: 0,9 % – 11,4 % і 8,7 %; 95 % ДІ: 2,4 % – 26,8 % відповідно) після видалення. Відмінності між групами були статистично неістотними.
Спостерігалася клінічно істотна тенденція до зменшення кількості формування келоїдних рубців після комбінованого методу видалення у порівнянні з радіохвильовим та хірургічним методом після 6 місяців (3,3 %, 95 % ДІ: 0,9 % — 11,4 %; 6,5 %; 95 % ДІ: 2,5 % — 15,4 % та 8,7 %; 95 % ДІ: 2,4 % — 28,8 % відповідно) та 12 місяців (3,3 %, 95 % ДІ: 0,9 % — 11,4 %; 7,7 %; 95 % ДІ: 2,1 % — 24,1 % та 11,1 %; 95 % ДІ: 2,0 % — 43,5 % відповідно) після видалення. Відмінності між групами були статистично неістотними.
Встановлено клінічно істотну тенденцію до збільшення кількості формування нормотрофічних рубців після комбінованого методу видалення у порівнянні з радіохвильовим та хірургічним методом після 3 місяців (91,5 %, 95 % ДІ: 81,6 % — 96,3 %; 87,1 %; 95 % ДІ: 78,3 % — 92,6 % та 91,2 %; 95 % ДІ: 77,0 % — 97,0 % відповідно), 6 місяців (90,0 %, 95 % ДІ: 79,9 % — 95,3 %; 79,0 %; 95 % ДІ: 67,4 % — 87,3 % та 82,6 %; 95 % ДІ: 62,9 % — 93,0 % відповідно) та 12 місяців (90,0 %, 95 % ДІ: 79,9 % — 95,3 %; 76,9 %; 95 % ДІ: 57,9 % — 89,0 % та 88,9 %; 95 % ДІ: 56,5 % — 98,0 % відповідно) після видалення. Відмінності між групами були статистично неістотними.
***
У ході дослідження було встановлено, що більшість пацієнтів позитивно оцінюють результати отриманих послуг. Вартість отриманих послуг для пацієнтів є меншою, в порівнянні з очною консультацією. В результаті статистичної обробки даних було доведено, що теледіагностика новоутворень шкіри є ефективною, а її точність наближається до точності гістологічних діагнозів. Кількість формування нормотрофічних рубців після застосування комбінованого методу є вищою, у порівнянні радіохвильовим та хірургічним методами, а кількість появи рецидивів новоутворень та формування гіпертрофічних і келоїдних рубців є меншою у порівнянні радіохвильовим та хірургічним методами.
Результати дослідження, відображені у даному розділі, відображені в наступних публікаціях:
- Store-and-Forward Teledermatology for the Most Common Skin Neoplasms in Ukraine / K. Kravets, Z. Dranyk, O. Vasylenko, O. Bogomolets. Acta Dermatovenerologica Alpina, Pannonica et Adriatica. 2018. Iss.27. P. 79–83 [113].
- Застосування комбінованого методу у лікуванні новоутворень шкіри / К.І. Кравець, Ж.Н. Драник, О.В. Василенко, О.В. Богомолець. Science Rise. Medical Science. 2018. № 5 (25). С. 23–30 [13].
РОЗДІЛ 7
УЗАГАЛЬНЕННЯ ТА ОБГОВОРЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
7.1 Діагностика новоутворень шкіри
Діагностика новоутворень шкіри є актуальною проблемою для лікарів дерматовенерологів та онкологів, оскільки рівень захворюваності на меланому та немеланомні раки шкіри зростає з кожним роком. Помилки в діагностиці призводять до зайвих втручань, неправильно обраних методів лікування. Як результат, – рецидиви новоутворень, формування патологічних видів рубців. Найпоширенішими новоутвореннями шкіри, з якими пацієнти звертаються на консультацію до онколога або дерматолога є МН і СК. Найнебезпечнішими є меланома шкіри та група немеланомних раків шкіри. Клінічний огляд дозволяє встановити точний діагноз з вірогідністю 33,3 – 72,7 %, застосування дерматоскопії підвищує діагностику на 20–40 % [95]. Велике значення має досвід роботи лікаря в даній області. За відсутності спеціалістів у багатьох населених пунктах, застосування телемедицини забезпечує ефективне надання необхідної медичної допомоги.
Мета роботи – підвищити ефективність терапії новоутворень шкіри шляхом удосконалення діагностики із залученням сучасних інструментальних методів обстеження та розробити комбінований метод лікувально-діагностичної біопсії.
При проведенні дослідження було відібрано 314 обстежених новоутворень шкіри, по одному новоутворенню у одного пацієнта, серед хворих було 186 жінок та 128 чоловіків у віковій групі від 5 до 80 років. Серед новоутворень шкіри було залучено до дослідження та аналізу: 108 МН, 97 себорейних кератом, 47 меланом шкіри, 62 немеланомних раків шкіри. Огляд пацієнтів проводився на базі ПП «Інститут дерматокосметології доктора Богомолець» у м. Києві.
У роботі були застосовані наступні методи: огляд (клінічний огляд новоутворень шкіри на очній консультації), епілюмінісцентна діагностика (огляд новоутворень шкіри за допомогою дерматоскопу), теледерматологічний метод (огляд новоутворень шкіри за макроскопічною фотографією), теледерматоскопічний метод (аналіз структури новоутворень шкіри за дерматоскопічною фотографією), анкетування (отримання письмових відповідей на запитання у спеціально розроблених бланках), статистичні (результати роботи піддавались статистичній обробці).
Всі новоутворення шкіри були оглянуті теледерматологічно та теледерматоскопічно, а також клінічно та дерматоскопічно. Нозології відбирались за теледерматологічним та теледерматоскопічним діагнозами та видалені з подальшим патогістологічним дослідженням. Всі препарати були досліджені двома патогістологами незалежно один від одного, у випадках суперечливих ситуацій скло та блоки відправляли третьому гістологу до Національного інституту раку.
Меланоцитарні невуси. Діагностика МН за допомогою ТД показала високу точність і склала (97,7 ± 0,5) %. На очному огляді точність діагностики виявилась вищою на 1,8 %, і склала (99,5 ± 0,5) %. Верифікація проводилась на основі результатів гістологічного дослідження. В одному випадку, при наявності двох доброякісних діагнозів, третій гістолог встановив діагноз меланоми шкіри.
При порівнянні теледерматологічної та клінічної структури невусів розміри, межі, краї, симетрія та поверхня не відрізнялись (табл. 7.1). Розбіжності були знайдені у формі та кольорі невусів. В одному випадку (0,9 %) при аналізі фотографії новоутворення, останнє було визначене як те, що має форму плями, тоді як при очному огляді лікар відмітив в анкеті форму папули. При аналізі кольорової гами, при теледерматологічному огляді один колір в новоутворенні був відмічений у 41 (38,0 %) випадках, кілька кольорів – у 67 (62,0 %) випадках, при клінічному огляді один колір відмічався у 58 (53,7 %), багато кольорів – у 50 (56,3 %) випадках. При аналізі теледерматоскопічної структури пігментна сітка візуалізувалась в 30 (27,8 %) випадках, тоді як при дерматоскопічному аналізі – у 51 (47,2 %) випадках. Найбільші розбіжності спостерігались серед дрібних структур новоутворень та судинного рисунку. При теледерматоскопічному аналізі новоутворень окремі глобули у 5 (4,6 %) випадках не візуалізувались у порівнянні з дерматоскопічним оглядом, створюючи складнощі при діагностиці беспігментних невусів. Колір пігменту відрізнявся при теледерматоскопічному огляді, передаючи відтінок світлішим, ніж він був при дерматоскопічному огляді. В подібних випадках важливу роль відігравав анамнез.
Таблиця 7.1 – Порівняльна характеристика теледерматологічних / теледерматоскопічних ознак та клінічних / дерматоскопічних ознак МН
| Ознака | Теледерматологічний/
теледерматоскопічний огляд |
Клінічний/ дерматоскопічний огляд |
| Форма:
пляма папула |
32 (29,6 %)
35 (32,4 %) |
31 (28,7 %)
36 (33,3 %) |
| Колір:
один кілька |
41 (38,0 %)
67 (62,0 %) |
58 (53,7 %)
50 (46,3 %) |
| Пігментна сітка | 30 (27,8 %) | 51 (47,2 %) |
| Глобули | 67 (62,0 %) | 72 (66,7 %) |
| Судинний рисунок | 27 (25,0 %) | 68 (63,0 %) |
Судинний рисунок при теледерматоскопічному огляді був зафіксований у 27 (25,0 %), при дерматоскопічному огляді – у 68 (63,0 %) випадках. Це пояснюється, в першу чергу, калібром судин. Дрібні судини у вигляді крапок (ознака меланоцитарного новоутворення) не передавались фотографією. Оскільки дерматоскопія дозволяє роздивлятись новоутворення у горизонтальній площі, судини, які розташовуються паралельно шкірі, візуалізуються як лінії, а при розташуванні їх перпендикулярно – у вигляді точок та шпильок. Судини, розташовані в дермі, як правило, рожевого кольору і не попадають в поле зору неполяризаційного дерматоскопа через вплив дисперсії світла крізь дерму. Ті, що знаходяться ближче до поверхні (під епідермісом) навпаки, яскраво-червоного кольору і чіткі. Судинний рисунок був зафіксований лікарем на очному огляді у більшій кількості, аніж при теледерматоскопічному огляді. Це пояснюється надмірною силою притискання дерматоскопа до новоутворення, що стає причиною зникнення судин з поля зору [132].
Меланома. Діагностика меланоми шкіри за допомогою ТД показала точність у 85,1 %. На очному огляді точність діагностики була вищою на 5,8 %, і склала 90,9 %. Верифікація проводилась на основі гістологічного дослідження.
Розмір, краї, симетрія та поверхня не відрізнялись при теледерматологічному та клінічному оглядах. Різниця спостерігалась серед форми новоутворень та меж (табл. 7.2). При ТД огляді новоутворення у вигляді плями були зафіксовані у 29 (61,7 %) випадках, при клінічному огляді – у 26 (55,3 %); при ТД огляді новоутворення у вигляді папули – в 13 (27,7 %) випадках, при клінічному – 15 (31,9 %); при ТД огляді новоутворення у формі вузла у 5 (10,6 %), при клінічному огляді – 6 (12,7 %). Така різниця у формі може спостерігатися за рахунок оптичного обману при фотофіксації зображення та при неправильно обраному ракурсі. Межі при ТД огляді були визначені як чіткі у 29 (61,7 %) випадках, при клінічному огляді – у 30 (63,9 %), як нечіткі при ТД огляді – у 18 (38,3 %), при клінічному огляді – у 17 (36,2 %). Різниця пов’язана з викривленням фотозображення.
При теледерматоскопічному та дерматоскопічному оглядах новоутворень шкіри з попереднім діагнозом меланоми, різниця спостерігалась серед наступних меланомоспецифічних ознак: кристалічних структур, атипових точок та глобул, біло-блакитної вуалі, структур регресу та атипових судин. Кристалічні структури при теледерматоскопічному огляді були відмічені у 26 (55,3 %) випадках, тоді як при дерматоскопічному огляді були відсутні у всіх випадках. Кристалічні структури гістологічно є колагеном, який можна побачити тільки за допомогою поляризаційного дерматоскопа. Оскільки дерматоскопічний огляд проводився неполяризаційним дерматоскопом Delta 20 Heine, Німеччина, кристалічні структури були невидимі, на відміну від фотофіксації за допомогою поляризаційного дерматоскопу 3Gen DLII HR3, Dermlite, США. Біло-блакитна вуаль при теледерматоскопічному огляді відзначалась у 10 (21,3 %) випадках, при дерматоскопічному огляді – у 13 (27,7 %). Біло-блакитна вуаль гістологічно є компактним ортокератозом, що формується на рівні верхніх шарів епідермісу. Для поляризаційного дерматоскопа це сліпа зона, яку неможливо продивитись. Тому при фотофіксації біло-блакитна вуаль виглядала слабко вираженою блакитною імглою, не у всіх випадках була помітна, тоді як при дерматоскопічному огляді неполяризаційним дерматоскопом виглядала яскраво вираженою структурою.
Таблиця 7.2 – Порівняльна характеристика теледерматологічних/ клінічних та теледерматоскопічних/дерматоскопічних ознак меланоми шкіри
| Ознака | Теледерматологічний/
Теледерматоскопічний огляд |
Клінічний/ дерматоскопічний огляд |
| Форма:
пляма папула вузол |
29 (61,7 %)
13 (27,7 %) 5 (10,6 %) |
26 (55,3 %)
15 (31,9 %) 6 (12,7 %) |
| Межі:
чіткі нечіткі |
29 (61,7 %)
18 (38,3 %) |
30 (63,9 %)
17 (36,2 %) |
| Кристалічні структури | 26 (55,3 %) | – |
| Атипові точки та глобули | 4 (8,5 %) | 5 (10,6 %) |
| Біло-блакитна вуаль | 10 (21,3 %) | 13 (27,7 %) |
| Структури регресу | 21 (44,7 %) | 23 (48,9 %) |
| Атипові судини | 6 (12,7 %) | 15 (31,9 %) |
Структури регресу були відмічені при теледерматоскопічному огляді у 21 (44,7 %) випадку, при дерматоскопічному огляді у 23 (48,9 %) випадках. Різниця серед структур регресу виражена за рахунок ознаки перчіння. Дрібні сіро-блакитні точки, за рахунок яких формується ознака печіння, не передаються фотоапаратом, тому в кількох випадках замість ознаки перчіння можна було спостерігати ділянку сіро-блакитного кольору. Атипові точки і глобули при теледерматоскопічному огляді були відмічені у 4 (8,5 %) випадках, при дерматоскопічному огляді – у 5 (10,6 %). Окремі точки та глобули не візуалізуються у зв’язку з дрібними розмірами останніх. Атипові судини при теледерматоскопічному огляді були відмічені у 6 (12,7 %) випадках, при дерматоскопічному огляді – у 15 (31,9 %). Різниця між атиповими точками і глобулами, а також судинним рисунком не відрізняється від таких при МН.
СК. Діагностика СК за допомогою ТД показала точність у (97,4 ± 0,5) %. При очному огляді точність діагностики визначено вищою на 2,1 % і склала (99,5 ± 0,5) %. Верифікація проводилась на основі гістологічного дослідження.
При аналізі теледерматологічної та клінічної структури новоутворень шкіри з попереднім діагнозом СК, розбіжності були виявлені серед форми, кольору, меж та поверхні (табл. 7.3). При ТД огляді 16 (16,5 %) новоутворень були відмічені у формі плями, при клінічному огляді – 14 (14,4 %); форму папули мали 69 (71,1 %) новоутворень при ТД огляді, при клінічному огляді відмічено 71 (73,2 %) випадок. Один колір в новоутворенні відмічався у 49 (50,5 %) випадках при ТД огляді і в 52 (53,6 %) при клінічному огляді. Більше двох кольорів відмічались при ТД огляді у 48 (50,5 %), при клінічному огляді – у 49 (49,5 %) випадках. Чіткі межі в новоутвореннях при ТД огляді були відмічені у 81 (83,5 %) випадках, при клінічному огляді – у 83 (85,5 %). Нечіткі межі при ТД огляді спостерігались у 16 (16,5 %) випадках, при клінічному огляді – у 14 (14,4 %) випадках. Папіломатозна поверхня новоутворень при ТД огляді була відмічена в 17 (17,5 %) випадках, при клінічному огляді – у 18 (18,5 %) випадках; гладка поверхня при ТД огляді у 48 (49,5 %), при клінічному огляді – у 47 (48,5 %). Такі незначні розбіжності серед форми, кольору, меж та поверхні пояснюються можливостями фототехніки та якістю фотографій.
Таблиця 7.3 – Порівняльна характеристика теледерматологічних/ клінічних та теледерматоскопічних/дерматоскопічних ознак СК
| Ознака | Теледерматологічний/
Теледерматоскопічний огляд |
Клінічний/ дерматоскопічний огляд |
| Форма:
пляма папула |
16 (16,5 %)
69 (71,1 %) |
14 (14,4 %)
71 (73,2 %) |
| Межі:
чіткі нечіткі |
81 (83,5 %)
16 (16,5 %) |
83 (85,5 %)
14 (14,4 %) |
| Колір:
один > двох |
49 (50,5 %)
48 (49,5 %) |
52 (53,6 %)
45 (46 %) |
| Поверхня:
папіломатозна гладка |
17 (17,5 %)
48 (49,5 %) |
18 (18,5 %)
47 (48,5 %) |
| Міліумподібні кісти | 15 (15,5 %) | 41 (42,3 %) |
| Комедоноподібні отвори | 35 (36,0 %) | 36 (37,1 %) |
| Судини у вигляді шпильок | 16 (16,5 %) | 45 (46,4 %) |
| Ознака перчіння | 3 (3,0 %) | 4 (4,1 %) |
При теледерматоскопічному та дерматоскопічному оглядах різниця була відмічена серед структур: міліумподібні кісти, комедоноподібні отвори, біло-блакитна вуаль, судинний рисунок, поточені краї, папіломатозні розростання, ознаки перчіння. При теледерматоскопічному огляді міліумподібні кісти відзначались у 15 (15,5 %) випадках, при дерматоскопічному огляді – у 41 (42,3 %). Така різниця пояснюється гістологічною будовою структур та типом дерматоскопів, які застосовувались в роботі. Міліумподібні кісти є роговими псевдокістами, які залягають у верхніх шарах епідермісу. Світло поляризаційного дерматоскопа (в даному випадку, насадка для фотофіксації – 3Gen DLII HR3, Dermlite, США) проникає глибше в шкіру і верхні 0,01 мм епідермісу залишаються сліпою зоною для нього. Тому при аналізі дерматоскопічних зображень ці структури були рідко помітними. Неполяризаційний дерматоскоп (в даному випадку, – Delta 20 Heine, Німеччина) дозволяє роздивитись структури у верхніх шарах епідермісу, але його світло не здатне проникати глибоко в шкіру для аналізу деяких структур.
Комедоноподібні отвори є інвагінаціями поверхні, заповненими кератином. Розташовуються вони в епідермісі і їх не завжди можна побачити поляризаційним дерматоскопом. Комедоноподібні отвори при теледерматоскопічному огляді були описані у 35 (36,0 %) випадках, в той час як при дерматоскопічному огляді – у 36 (37,1 %). Судини у формі шпильок при теледерматоскопічному огляді відмічені у 16 (16,5 %) випадках, при дерматоскопічному огляді – у 45 (46,4 %). Це пояснюється тиском дерматоскопа на новоутворення і зникненням судин з поля зору. Ознака перчіння в СК подібна ознаці в структурі меланоми шкіри. При теледерматоскопічному огляді спостерігались у 3 (3,0 %) випадках, при дерматоскопічному огляді – у 4 (4,1 %) випадках. Фотоапарат не передав дрібні структури у вигляді точок в одному випадку.
Рак шкіри. Точність діагностики НМРШ за допомогою ТД склала (94,4 ± 5,6) %. При очному огляді точність діагностики встановлено вищою на 0,8 % і склала (95,2 ± 4,8) %. Верифікація проводилась на підставі гістологічного дослідження.
При теледерматологічному та клінічному оглядах найбільша різниця спостерігалась серед судинного рисунку (табл. 7.4). При теледерматологічному огяді судини в новоутворенні були видимі у 28 (45,1 %) випадках, при клінічному огляді – у 33 (53,2 %) випадках. Розбіжності серед меж, країв, симетрії та поверхні незначні і складають в середньому 1,25 % при теледерматологічному та клінічному оглядах.
Таблиця 7.4 – Порівняльна характеристика теледерматологічних/ клінічних та теледерматоскопічних/дерматоскопічних ознак раків шкіри
| Ознака | Теледерматологічний/
Теледерматоскопічний огляд |
Клінічний/ дерматоскопічний огляд |
| Видимий судинний рисунок | 28 (45,1 %) | 33 (53,2 %) |
| Межі:
чіткі нечіткі |
39 (62,9 %)
23 (37,1 %) |
42 (67,7 %)
20 (32,3 %) |
| Краї:
рівні нерівні |
48 (77,4 %)
14 (22,6 %) |
47 (75,8 %)
15 (24,2 %) |
| Симетрія:
симетричні асиметричні |
50 (80,6 %)
12 (19,4 %) |
49 (79,0 %)
13 (21,0 %) |
| Поверхня:
бородавчаста рівна |
10 (16,1 %)
52 (83,9 %) |
11 (17,7 %)
51 (82,3 %) |
| Множинні сіро-блакитні глобули | 16 (25,8 %) | 19 (30,6 %) |
| Структури у вигляді спиць колеса | – | 1 (1,6 %) |
| Деревовидні судини | 45 (72,6 %) | 49 (79,0 %) |
| Судини у вигляді шпильок на білому оні | – | 1 (1,6 %) |
При теледерматоскопічному та дерматоскопічному оглядах різниця спостерігалась серед структур: деревовидних судин, множинних сіро-блакитних глобул, структур у вигляді спиць колеса, судинного рисунку. Множинні сіро-блакитні точки та глобули при теледерматоскопічному огляді спостерігались у 16 (25,8 %) випадках, при дерматоскопічному огляді – у 19 (30,6 %) випадках. Структури у вигляді спиць колеса при теледерматоскопічному огляді не були відмічені, при дерматоскопічному огляді – спостерігались у 1 (1,6 %) випадку. При теледерматоскопічному огляді дана структура мала вигляд глобули великого розміру з темнішою центральною частиною. Така різниця пов’язана з нездатністю фотопередачі найдрібніших структур. Деревовидні судини при теледерматоскопічному огляді спостерігались у 45 (72,6 %) випадках, при дерматоскопічному огляді – у 49 (79,0 %) випадках. При теледерматоскопічному аналізі судини були відсутніми у центральній частині новоутворень (місце найбільшого тиску дерматоскопа на утворення) і видимі на периферії.
7.2 Віддалені результати, після проведення лікувально-діагностичних біопсій новоутворень шкіри радіохвильовим, комбінованим та хірургічним методами
Радіохвильовим методом була проведена діагностична біопсія у повному обсязі 163 новоутворень шкіри. У 66 випадках був встановлений теледерматологічний діагноз МН, у 97 випадках – СК. На першому режимі (розріз – CUT) була проведена діагностична біопсія у повному обсязі 153 новоутворень шкіри. На другому режимі (CUT and COAG/RECTIFIED) було проведена діагностична біопсія 10 новоутворень шкіри. Радіохвильове видалення новоутворень шкіри на I режимі проводилось за відсутності небхідності у коагуляції. Видалення новоутворень на II режимі пов’язано з наявністю судин великого калібру в структурі або в основі новоутворень. Найшвидше загоєння ран спостерігалось після видалення новоутворень радіохвильовим методом. В залежності від розміру новоутворень та місця розташування, рани після видалення загоювались від 10 до 21 дня. В таких випадках процес загоєння ран проходив шляхом суцільної та острівкової епітелізації [103]. Загоєння на шкірі обличчя проходило швидше, аніж на тулубі. Діаметр рубця відповідав діаметру утворення, яке видаляли.
Комбінованим методом було проведено 62 діагностичні біопсії в межах здорових тканин з попереднім діагнозом новоутворень – рак шкіри. На першому режимі було проведено 7 біопсій, на першому режимі з переходом на другий режим було проведено 48 біосій, на першому режимі з переходом на третій було проведено 7 біопсій. Контактна кріодеструкція проводилась в 4 кріоцикли. В 5 випадках експозиції кріодеструкції тривали по 10–12 с, у 37 випадках – по 15–20 с, в 20 випадках – по 20–25 с. При застосуванні комбінованого методу, режим радіохвильового апарату виставлявся в залежності від калібру судин в основі новоутворень. На I режимі радіохвильового апарата проводились біопсії новоутворення шкіри з попереднім діагнозом раку шкіри без об’єму з гладкою поверхнею (поверхнева форма), що можна пояснити наявністю судин дрібного калібру за відсутності агресивної проліферації зі сторони строми. На II режимі було проведено біопсії новоутворень шкіри при наявності підвищеного тиску у пацієнтів, судин великого калібру в основі новоутворень, розташування в зонах гарного кровопостачання, виразки на поверхні новоутворень. У випадку виразкової форми БКРШ в новоутворень присутня активна проліферуюча сполучнотканинна строма або агресивна інфільтрація з проростанням епітелію в підлеглу сполучну тканину та за межі видимих країв утворення в поєднанні із судинами великого калібру [144]. На III режим переходили у випадках необхідності коагуляції судин великого калібру та при відсутності необхідного ефекту на II режимі. При комбінованому методі загоєння ран тривало найдовше, 21 – 50 днів. Тривалість загоєння пояснюється тим, що після даного методу видалення загоєння відбувається за рахунок крайової епітелізації. При застосуванні комбінованого методу руйнується базальний шар шкіри з придатками, що робить неможливим проходженням суцільної острівкової епітелізації. На обличчі (в зоні повік, лоба, носа, підборіддя) загоєння проходило з найвираженішою ексудацією, а на спині, задній поверхні шиї та волосистій частині голови загоєння проходило майже без ексудації, що пов’язано з різною товщиною шкіри і різною кількістю сальних залоз на одиницю площі. Рубець після видалення залишався у всіх випадках, діаметр його перевищував діаметр новоутворень на 2-3 мм, що пов’язано із необхідністю відступів від новоутворень (рак шкіри) у межах здорових тканин.
Усього хірургічним методом було проведено 89 лікувально-діагностичних біопсій в межах здорових тканин, з яких попередній теледерматологічний діагноз МН був встановлений у 42 випадках, меланоми шкіри – у 47 випадках. Після застосування хірургічного методу при розташуванні новоутворення на передній поверхні тулуба, верхніх кінцівках, внутрішній поверхні стегон шви знімались раніше (на 12-16 добу), оскільки шкіра в цих зонах тонша та рухливіша відносно підшкірно-жирової клітковини (ПЖК). Естетичний результат задовольняв пацієнтів. На спині і попереку шви знімались пізніше (на 16-21 добу) через меншу еластичність та рухливість шкіри. На гомілках і стегнах у пацієнтів з надмірною вагою або спортсменів шви знімались пізніше, – через надмірне натягнення шкіри в цих ділянках. Пацієнти отримували рекомендації фіксувати рубець, що формується, пластирною пов’язкою при фізичних навантаженнях.
МН з гіпертрихозом не були рекомендовані до видалення радіохвильовим методом через високу вірогідність рецидиву новоутворень [78]. Пацієнтам з такими невусами було рекомендовано проведення висікаючої біопсії хірургічним методом.
Розроблений метод лікування, що поєднує в собі радіохвильовий метод та кріодеструкцію, показав зменшення кількості рецидивів новоутворень шкіри та формування меншої кількості патологічних видів рубців. Після застосування комбінованого методу рецидиви новоутворень шкіри спостерігались в 3,3 %, при радіохвильовому – в 7,7 %. Попередні дослідження видалення немеланомних раків шкіри надають дані в 4-20 % рецидивів після хірургічного методу [99, 171]. Найважче піддаються лікуванню келоїдні рубці. Їх формування після діагностичної біопсії комбінованим методом складає 3,4 % на 12 місяць спостереження у порівнянні з радіохвильовим методом – 7,7 % та хірургічним методом – 11,4 %. Гіпертрофічні рубці спостерігались у 3,4 % після комбінованого методу і 7,4 % після радіохвильового методу. Формування найбільшої кількості нормотрофічних рубців відмічалось після комбінованого методу і склало 89,9 %, тоді як при використанні радіохвильового методу – 76,9 % і хірургічного методу – 88,9 %.
ВИСНОВКИ
У дисертаційній роботі наведено теоретичне узагальнення та практичне вирішення актуального завдання дерматовенерології, що полягає у підвищенні ефективності терапії новоутворень шкіри шляхом удосконалення діагностики із залученням сучасних інструментальних методів обстеження та розробці комбінованого методу лікувально-діагностичної біопсії.
- Збільшення з кожним роком кількості випадків меланоми та НМРШ робить підвищення якості діагностики новоутворень однією з найактуальніших завдань дерматології. Окрім переваг та недоліків існуючих методів діагностики, пошук можливостей підвищити ефективність лікування новоутворень шкіри шляхом залученням сучасних інструментальних методів обстеження продовжує викликати інтерес серед науковців. Незважаючи на існуючі методи діагностики, недостатньо уваги приділяється вивченню застосування теледіагностики новоутворень шкіри та безпосереднього впливу ранньої і своєчасної діагностики на результати лікування.
- Визначено, що для діагностики МН, СК, меланоми шкіри та НМРШ можна застосовувати дистанційну діагностику, що дає можливість пацієнтам якомога раніше отримати консультацію та рекомендації спеціаліста на відстані. Виявлення злоякісних новоутворень на ранніх стадіях захворювання дозволяє зберегти життя пацієнтів.
- Теледіагностика новоутворень шкіри показала високу точність, яка наближається до точності гістологічного дослідження, і складає: у випадках МН – 98,1 %, у випадках СК – 97,9 %, у випадках меланоми шкіри – 85,1 %, у випадках раків шкіри – 88,7 %.
- Виявлено найбільші розбіжності у теледерматоскопічній та дерматоскопічній структурах новоутворень шкіри серед судинного рисунку (при теледерматоскопії менше, ніж при дерматоскопії на 23,3 %), окремих точок та глобул (при теледерматоскопії менше, ніж при дерматоскопії на 4,3 %).
- Застосування дистанційної діагностики новоутворень шкіри дозволило оцінити задоволеність пацієнтів після отриманої послуги та економічну ефективність теледіагностики. Серед пацієнтів 91,9 % дали позитивні відгуки. Собівартість однієї консультації в 10–12 разів менша порівняно з розвинутими країнами.
- Застосування комбінованого методу у проведенні лікувально-діагностичних біопсій показало клінічно істотну тенденцію до формування більшої кількості нормотрофічних рубців (більше на 13,0 %, ніж після радіохвильового методу та на 1 %, ніж після хірургічного методу), клінічно істотну тенденцію до формування меншої кількості рецидивів новоутворень шкіри (менше на 4,4 %, ніж після радіохвильового методу), клінічно істотну тенденцію до формування меншої кількості гіпертрофічних рубців (менше на 4,0 %, ніж після радіохвильового методу) та келоїдних рубців (менше на 4,4 %, ніж після радіохвильового методу та на 7,7 % після хірургічного методу).
РЕКОМЕНДАЦІЇ
При застосуванні теледерматоскопії для діагностики новоутворень шкіри з вираженим судинним рисунком рекомендовано проводити діагностичну біопсію для верифікації діагнозу, оскільки судинні структури є ненадійними при даному виді діагностики.
Під час проведення лікувально-діагностичної біопсії радіохвильовим або комбінованим методами забір матеріалу для гістологічного дослідження слід проводити лезом з метою найменшого ушкодження країв.
Під час застосування комбінованого методу при проведенні лікувально-діагностичної біопсії слід застосовувати кріодеструкцію ложа у 3–4 кріоцикли по 10–30 с.
Після проведення лікувально-діагностичної біопсії комбінованим методом рекомендовано обробити рану 5–10 % розчином KMnО4. З другої доби обробляти рану 1–2 рази/добу настоянкою календули протягом 2–3 тижнів для підтримання сухої кірочки на поверхні. З 2–3 тижня наносити на рану гелі або мазі на гідрофільній основі, що сприяють пришвидшенню епітелізації рани.
Під час процесу загоєння рекомендовано не мочити рану водою. Після повного загоєння рекомендовано утримуватися від інсоляції для запобігання появи вторинної пігментації.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Білинський Б. Т. Медичні помилки в онкології : монографія / Відп. ред. Я. В. Шпарик. Львів : Афіша, 2013. 324 с.
- Боулинг Дж. Диагностическая дерматоскопия. Иллюстрированное руководство/пер.с англ. Под ред. А.А.Кубановой. М.: издательство Панфилова; БИНОМ.Лаборатория знаний, 2013. 160 с.
- Владзимирский А.В. Телемедицина [монография]. Донецк : ООО “Цифровая типография”, 2011. 437 с.
- Владзимирський А.В. Телемедицина в системі організації таменеджмента охорони здоров’я. Навчальний посібник. Донецьк : ООО «Цифрова друкарня», 2012. 468 с.
- Владзимирский А.В. Оценка эффективности телемедицины. Донецк ООО «Цифровая типография», 2007. 63 с.
- Владзимирский А.В., Стадник О.Н., Карлинська М. Марьян Франке и Витольд Липинский – основоположники телемедицины в Украине (неизвестные факты истории). Новини медицини та фармації. 2013. №5 (449). URL: http://www.mif-ua.com/archive/article/35482.
- Грауэр Л.В., Архипова О.А. Лекция 5. Доверительные интервалы CS Center Санкт-Петербург, 2014. URL: https://compscicenter.ru/media/slides/ math_stat_2014_spring/2014_03_17_math_stat_2014_spring_1.pdf.
- Грауэр Л.В., Архипова О.А. Лекция 8. Непараметрические критерии независимости. Корреляционный анализ. Грауэр Л.В., Архипова О.А. CS Center Санкт-Петербург, 2014 https://compscicenter.ru/media/slides/ math_stat_2014_spring/2014_03_28_math_stat_2014_spring_1.pdf.
- Григорьев А.И., Орлов О.И., Логинов В.А. Клиническая телемедицина. М.: “Слово”, 2001. 144 с.
- 10. Дерматоскопія. Міні-атлас. Вид. 1 / К.І. Кравець, С.Д. Дячук, І.І. Сидоренко, О.В. Магоня, Н.М. Семенюк; під ред. О.В. Богомолець. К. : ТОВ «Глянець», 2018. 75 с.
- 11. Джор Р., Соер Х., Ардженциано Дж. Дерматоскопия /пер. с англ. под. ред. Л.В.Демидова. М.: ООО «Рид Элсивер», 2010. 244 с.:
- 12. Дубенский В.В., Редько Р.В., Гармонов A.A. Новообразования кожи в практике дерматовенеролога / под ред. В.В.Дубенского. Тверь : ООО Изд-во «Триада», 2002. 148 c.
- 13. Застосування комбінованого методу у лікуванні новоутворень шкіри / К.І. Кравець, Ж.Н. Драник, О.В. Василенко, О.В. Богомолець. Science Rise. Medical Science. 2018. № 5 (25). С. 23–30.
- Кравець К.І.Становлення та застосування телемедицини у світі та в Україні. Дерматологія та венерологія. 2017. № 4 (78). С. 94–98.
- Кравець К.І., Богомолець О.В. Застосування методів телемедицини у діагностиці меланоми шкіри. Матеріали IX міжнародного семінару студентів та молодих вчених, присвячений Всесвітньому дню боротьби з раком, 1-2 лютого 2018 р., м.Київ. Український науково-медичний молодіжний журнал. 2017. №2 (101). С. 45.
- 16.Кравець К.І., Богомолець О.В. Застосування сучасних методів у діагностиці себорейного кератозу. Дерматологія та венерологія. 2018. №2 (80). С. 59–62.
- Кравець К.І., Богомолець О.В. Найпоширеніші немеланомні раки шкіри. Вісник Української медичної стоматологічної академії «Актуальні проблеми сучасної медицини». 2018. Т. 18, Вип. 1 (61). С. 308–312.
- Кравець К.І., Богомолець О.В. Сучасні методи теледерматології в діагностиці новоутворень шкіри. Український журнал дерматології, венерології, косметології. 2015. № 3 (58). С.13–17.
- Кравець К.І., Богомолець О.В. Порівняльна характеристика дерматоскопії та теледерматоскопії на прикладі меланоцитарних невусів та меланоми шкіри. Український журнал дерматології, венерології, косметології. 2018. № 1 (68). С. 17–22.
- Кравець К.І., Канчалаба І.О., Богомолець О.В. Застосування методу теленавчання для слухачів курсу дерматоскопії. Дерматологія та венерологія. 2018. № 1 (79). С. 83–85.
- Кравець К.І., Сидоренко І.І., Богомолець О.В. Теледерматологічна діагностика меланоми шкіри за допомогою платформи Telederm. Мат. III (X) з’їзду Української асоціації лікарів дерматовенерологів і косметологів, 22-23 листопада 2017 р., м. Львів. Український журнал дерматології, венерології, косметології. 2017. № 4 (67). С. 106.
- Кравець К.І., Сидоренко І.І., Богомолець О.В. Порівняльна характеристика теледерматоскопічної та дерматоскопічної діагностики немеланомних раків шкіри. Матеріали науково-практичної конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», 10–11 листопада 2017 р., м. Харків. Дерматологія та венерологія. 2017. № 3 (77). С. 103–104.
- Меллетт Д.Р. Хирургия по Мохсу. Секреты дерматологии / Под ред. Д.Е.Фитцпатрика, Д.Л.Элинга: Пер. с англ. М.-СПб. : Изд-во «Бином» – «Невский Диалект», 1999. С. 397–400.
- Москалик К.Г., Козлов А.П. Современное состояние и перспективы применения лазеров в онкологии. Вопросы онкологии. 1987. № 2. С. 3–11.
- Національний канцер-реєстр України. Захворюваність та смертність від злоякісних новоутворень. Стан онкологічної допомоги населенню України у 2015-2016 рр. URL: http://www.ncru.inf.ua/publications/BULL_18/PDF/03-06-vstyp.pdf.
- Національний канцер-реєстр України. Структура контингентів хворих на ЗН у 2016 році. URL: http://www.ncru.inf.ua/publications/BULL_18/PDF/ str_kont.pdf.
- Про затвердження нормативних документів щодо застосування телемедицини у сфері охорони здоров’я: Наказ МОЗ України від 19.10.2015 №681. URL: http://zakon2.rada.gov.ua/laws/show/z1400-15.
- Про впровадження телемедицини в закладах охорони здоров’я: Наказ МОЗ України від 26.03.2010 № 261. URL: http://consultant.parus.ua/?doc= 06E4E18F16.
- Про підвищення доступності та якості медичного обслуговування у сільській місцевості. Закон України від 14.11.2017 № 2206-VIII. Відомості Верховної Ради України (ВВР). 2018. №5. Ст.32.
- Телемедицина. Новые информационные технолоии на пороге XXI века / под ред. проф. Р.М.Юсупова, проф. Р.И.Полонникова. СПб. : ТОО Издательство “Анатолия”, 1998. 488 с.
- Устінов О. В Україні закладені основи національної телемедичної мережі. Український медичний часопис. 2010. № 4 (78). С. 16.
- Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги. Наказ Міністерства охорони здоров’я України від 27.11.2015 № 784.
- Лях Ю.Е., Владзимирский А.В. Введение в телемедицину. Серия: Очерки биологической и медицинской информатики. Донецк : ООО Лебедь, 1999. 102 с.
- Чубуков Ж. А., Угольник Т. С. Описательная статистика: учебно-методическое пособие для студентов всех факультетов медицинских вузов, аспирантов, магистрантов, соискателей и преподавателей. Гомель : учреждение образования «Гомельский государственный медицинский университет», 2012. 28 с.
- Atlas of pathology. Website. Screen index: intradermal melanocytic nevus. Last updated 2015. Available from: http://www.pathologyatlas.ro/intradermal-melanocytic-nevus.php
- Armstrong AW, Kwong MW, Ledo L, Nesbitt TS, Shewry SL. Practice Models and Challenges in Teledermatology: A Study of Collective Experiences from Teledermatologists. PLoS One. [Internet]. 2011; 6(12): e28687. Available from: http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0028687
- Asgari MM, Shen L, Sokil MM, Yeh I, Jorgenson E. Prognostics factors and survival in acral lentiginous melanoma. Br J Dermatol. [Internet]. 2017 Apr 22; Available from: https://www.ncbi.nlm.nih.gov/pubmed/28432682
- Askew DA, Mickan SM, Soyer HP, Wilkinson D: Effectiveness of 5-fluorouracil treatment for actinic keratosis – a systematic review of randomized controlled trials. Int J Dermatol 2009;48:453-463.
- Baderca F, Mateş I, Solovan C. Unusual variant of blue nevus associated with dermatofibromas. Rom J Morphol Embryol. 2013;54(2):413-7.
- Baird DS, Ioffreda MD, Helm K, Chung CG, Ferguson S.Lentigo Maligna Melanoma With Local andDistant Blue Nevus-like Metastases.Am J Dermatopathol. 2015 Oct;37(10):e126-8. doi: 10.1097/DAD.0000000000000292.
- Bald T, Quast T, Landsberg J, Rogava M, Glodde N, Lopez-Ramos D, et al.Ultraviolet-radiation-induced inflammation promotes angiotropism and metastasis in melanoma. Nature. 2014; 6;507(7490):109-13.
- Balch CM, Gershenwald JE, Soong SJ et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol 2009; 27:6199–206.
- Bashshur RL, Shannon G, Krupinski EA, Grigsby J. Sustaining and realizing the promise of telemedicine. Telemed J E Health. 2013; 19(5): 339–345.
- Bashshur RL, Shannon GW, Tejasvi T, Kvedar JC, Gates M. The empirical foundations of teledermatology: a review of the research evidence. Telemed J E Health. 2015; 21(12): 953–979.
- Bastian BC. The molecular pathology of melanoma: an integrated taxonomy of melanocytic neoplasia. Annu Rev Pathol (2014) 9:239–71.
- Battie C, Jitsukawa S, Bernerd F, Del Bino S, Marionnet C, Verschoore M. New insights in photoaging, UVA induced damage and skin types.Exp Dermatol. 2014 ;23 Suppl 1:7-12.
- Bauer A, Diepgen TL, Schmitt J. Is occupational solar ultraviolet irradiation a relevant risk factor for basal cell carcinoma? A systematic review and meta-analysis of the epidemiological literature. Br J Dermatol. 2011;165(3):612–25.
- Becker W. Critical evaluation of the so-called “ junction nevus” J Invest Dermatol. 1954 Mar;22(3):217-23
- Bernetti L, Nuzzaco G, Muscia F, Gamboni A, Zedde M, Eusebi P, et al. Stroke networks and telemedicine: An Italian national survey Neurol Int. 2018. 30; 10(1): 7599.
- Bieging KT, Mello SS, Attardi LD. Unravelling mechanisms of p53-mediated tumour suppression. Nat Rev Cancer. 2014;14(5):359–70.
- Bland JM, Altman DG. Multiple significance tests: the Bonferroni method. BMJ. 1995 Jan 21; 310(6973): 170.
- Bolognia J, Jorizzo J, Schaffer J. Dermatology. 3rd ed. Elsevier Saunders; 2012. p. 1871-6
- Bradford PT, Goldstein AM, McMaster ML, Tucker MA. Acral lentiginous melanoma:incidence and survival patterns in the United States 1986-2005. Arch Dermatol. 2009;145(4):427–34. https://doi.org/10.1001/archdermatol.2008.609 PMid:19380664 PMCid:PMC2735055
- Carter ZA, Goldman S, Anderson K, Li X, Hynan LS, Chong BF, Dominguez AR. Creation of an Internal Teledermatology Store-and-Forward System in an Existing Electronic Health Record: A Pilot Study in a Safety-Net Public Health and Hospital System. JAMA Dermatol. 2017 Jul 1;153(7):644-650. doi: 10.1001/jamadermatol.2017.0204.
- Chen AC, Halliday GM, Damian DL. Non-melanoma skin cancer: carcinogenesis and chemoprevention. Pathology 2013;45:331-341.
- Ciarletta P, Foret L, Amar BM. The radial growth phase of malignant melanoma: multi-phase modelling, numerical simulations and linear stability analysis. J R Soc Interface. 2011 Mar 6; 8(56): 345–368.
- Cockerell CJ, Tran KT, Carucci J, Tierney E, Lang P, Maize Sr JC, Rigel DS. Basal cell carcinoma; Cancer of the Skin. Philadelphia, Elsevier Saunders, 2011, pp 99-124.
- Cognetta AB, Howard BM, Heaton HP, Stoddard ER, Hong HG, Green WH: Superficial X-ray in the treatment of basal and squamous cell carcinomas: a viable option in select patients. J Am Acad Dermatol 2012;67:1235-1241.
- Cohen B. To biopsy or not to biopsy changing moles in children and adolescentes: are we removing too many pigmented nevi in this age group? Comment on “Variables predicting change in benign melanocytic nevi undergoing short-term dermoscopic imaging”. Arch Dermatol. 2011;147:659–660.
- Coit DG, Thompson JA, Algazi A, Andtbacka R, Bichakjian CK, Carson WE 3rd, et al. Melanoma, Version 2.2016, NCCN Clinical Practice Guidelines in Oncology.J Natl Compr Canc Netw. 2016;14(4):450-73.
- Cust AE, Goumas C, Vuong K, Davies JR, Barrett JH, Holland EA, Schmid H,et al. : MC1R genotype as a predictor of early-onset melanoma, compared with self-reported and physician-measured traditional risk factors: an Australian case-control-family study. BMC Cancer. 2013;13:406.
- Dewan MZ, Galloway AE, Kawashima N, Dewyngaert JK, Babb JS, Formenti SC, Demaria S. Fractionated but not single-dose radiotherapy induces an immune-mediated abscopal effect when combined with anti-CTLA-4 antibody. Clin Cancer Res. 2009;15(17):5379–5388.
- Di Cesare A, Sera F, Gulia A. The spectrum of dermatoscopic patterns in blue nevi. J Am Acad Dermatol. 2012;67:199–205.
- Di Giovanna JJ. Retinoid chemoprevention in patients at high risk for skin cancer. Med Pediatr Oncol 2001;36:564-567.
- D’Orazio J, Jarrett S, Amaro-Ortiz A, Scott T: UV radiation and the skin. Int J Mol Sci 2013;14:12222-12248.
- Drake CG, Lipson EJ, Brahmer JR. Breathing new life into immunotherapy: review of melanoma, lung and kidney cancer. Nat Rev Clin Oncol (2014) 11(1):24–37.
- Duffy K, Grossman D. The dysplastic nevus: from historical perspective to management in the modern era: part I. Historical, histologic, and clinical aspects. J Am Acad Dermatol. 2012;67(1) :1.e1-1.e16.13. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3621132/
- Eggermont AMM, Spatz A, Robert C. Cutaneous melanoma. Lancet (2014) 383(9919):816–27. doi:10.1016/S0140-6736(13)60802-8
- Ekeland AG, Bowes A, Flottorp S. Effectiveness of telemedicine: a systematic review of reviews. Int J Med Inform. 2010;79(11):736–71. doi: 10.1016/j.ijmedinf.2010.08.006.
- Elsner P, Diepgen TL, Schliemann S.Lentigo maligna and lentigo maligna melanoma as occupational skin diseases in a forestry worker with long-standing occupational UV-exposure.J Dtsch Dermatol Ges. 2014;12(10):915-7.
- Epstein EH. Basal cell carcinomas: attack of the hedgehog. Nat Rev Cancer. 2008;8(10):743–54.
- Erkiert-Polguj A, Halbina A, Polak-Pacholczyk I, Rotsztejn H: Light-emitting diodes in photodynamic therapy in non-melanoma skin cancers – own observations and literature review. J Cosmet Laser Ther 2016;18:105-110. doi: 10.3109/14764172.2015.1114635.
- Fanjul-Vélez F, Salas-García I, Arce-Diego JL. Analysis of laser surgery in non-melanoma skin cancer for optimal tissue removal. Laser Phys 2014;25:025606. Available from: https://repositorio.unican.es/xmlui/bitstream/handle/10902/10238/AnalysisofLaserSurgery.pdf?sequence=3
- Feller L, Khammissa RA, Kramer B, Altini M, Lemmer J: Basal cell carcinoma, squamous cell carcinoma and melanoma of the head and face. Head Face Med 2016;12:11.
- Fernandes NC, Machado JL.Clinical study of the congenital melanocytic naevi in the child and adolescent.An Bras Dermatol. 2009 Mar-Apr;84(2):129-35.
- Ferrara G, Improta G.The histopathological diagnosis and reporting of melanoma: a new look at an old challenge. Austin J Dermatolog. 2016. Vol 3, Is 1. file:///C:/Documents%20and%20Settings/Admin/%D0 %9C%D0 %BE%D0 %B8 %20 %D0 %B4 %D0 %BE%D0 %BA%D1 %83 %D0 %BC%D0 %B5 %D0 %BD%D1 %82 %D1 %8B/Downloads/fulltext-ajd-v3-id1044.pdf
- Ferrer-Rocca O, Marcelo Sosa-Iudicissa. Handbook of telemedicine. IOS press. Netherlands; 2002. 297 p.
- Flanagan M. The physiology of wound healing. JWC. – 2000. – Vol.9, Issue 6. – P.299-300.
- Florell SR, Boucher KM, Garibotti G, Astle J, Kerber R, Mineau G, Wiggins C, et al. Population-based analysis of prognostic factors and survival in familial melanoma. J Clin Oncol. 2005;23:7168–77.
- Fornaini C, Merigo E, Sozzi M, Rocca J-P, Poli F, Stefano Selleri S, Cucinotta A. Four different diode lasers comparison on soft tissues surgery: a preliminary ex vivo study. Laser Ther. 2016; 25(2): 105–114.
- Forchetti G, Suppa M, Del Marmol V: Overview on non-melanoma skin cancers in solid organ transplant recipients. G Ital Dermatol Venereol. 2014;149(4):383–7.
- Fort M, Guet S, Husheng S, Calitchi E, Belkacemi Y: Role of radiation therapy in melanomas: systematic review and best practice in 2016. Crit Rev Oncol Hematol 2016;99:362-375.
- Garibyan L, Fisher DE. How sunlight causes melanoma. Curr Oncol Rep. 2010;12:319–326.
- Geissler EK. Skin cancer in solid organ transplant recipients: are mTOR inhibitors a game changer? Transplant Res. 2015;4:1.
- Grażyna K-W, Placek W. The most common mistakes on dermatoscopy of melanocytic lesions. Postepy Dermatol Alergol. 2015 Feb; 32(1): 33–39. doi: 10.5114/pdia.2014.44029
- Gru AA, Becker N, Dehner LP, Pfeifer JD. Mucosal melanoma: correlation of clinicopathologic, prognostic, and molecular features. Melanoma Res. 2014;24(4):360-70.
- Gupta PC, Ram J, Akella M, Jinagal J. Compound nevus simulating a conjunctival melanoma. J Ophthalmic Vis Res. 2018; 13(1): 81–82.
- Hafner C, Hartmann A, van Oers JM, Stoehr R, Zwarthoff EC, Hofstaedter F, Landthaler M, et al. FGFR3 mutations in seborrheic keratoses are already present in flat lesions and associated with age and localization. Mod Pathol. 2007;20:895–903.
- Hafner C, Toll A, Fernandez-Casado A, Earl J, Marques M, Acquadro F, Mendez-Pertuz M, et al. Multiple oncogenic mutations and clonal relationship in spatially distinct benign human epidermal tumors. Proc Natl Acad Sci U S A. 2010;107:20780–20785. Available from: http://www.pnas.org/content/107/48/20780
- Hafner C, Vogt T. Seborrheic keratosis. J Dtsch Dermatol Ges 2008;6:664–77.
- Haliasos EC, Kerner M, Jaimes N, Zalaudek I, Malvehy J, Hofmann-Wellenhof R, Braun RP et al. Dermoscopy for the pediatric dermatologist part III: dermoscopy of melanocytic lesions. Pediatr Dermatol. 2013;30:281–293.
- Halliday GM, Bock VL, Moloney FJ, Lyons JG. SWI/SNF: a chromatin-remodelling complex with a role in carcinogenesis. Int J Biochem Cell Biol 2009;24:141-146.
- Han D, Zager JS, Shyr Y, Chen H, Berry LD, Iyengar S, Djulbegovic M, et al. Clinicopathologic predictors of sentinel lymph node metastasis in thin melanoma. J Clin Oncol 2013; 31: 4387–4393.
- Hanna A, Shevde LA. Hedgehog signaling: modulation of cancer properties and tumor mircroenvironment. Mol Cancer 2016;15:24, 35.
- Heal CF, Raasch BA, Buettner PG, Weedon D. Accuracy of clinical diagnosis of skin lesions. Br J Dermatol. 2008 Sep;159(3):661-8. doi: 10.1111/j.1365-2133.2008.08715.x.
- Heal CF, Weedon D, Raasch BA, Hill BT, Buettner PG. Agreement between histological diagnosis of skin lesions by histopathologists and a dermato-histopathologist. Int J Dermatol. 2009 Dec;48(12):1366-9. doi: 10.1111/j.1365-4632.2009.04185.x.
- Honda R, Iino Y, Ito S, Tanaka M. Verrucous Spitz nevus in a Japanese female. Case Rep Dermatol. 2013;5:304–308.
- Huilgol SC, Selva D, Chen C, Hill DC, James CL, Gramp A, Malhotra R. Surgical margins for lentigo maligna and lentigo maligna melanoma: The technique of mapped serial excision. Arch Dermatol 2004;140:1087–92. Available from: https://jamanetwork.com/journals/jamadermatology/fullarticle/480769.
- Immerman S, Scanlon E, Christ M, Knox K. Recurrent squamous cell carcinoma of the skin. Cancer. 1983. Vol.51, Issue 8. P.1537-1540. Available from: https://onlinelibrary.wiley.com/doi/pdf/10.1002/1097-0142 %2819830415 %2951 %3A8 %3C1537 %3A%3AAID-CNCR2820510830 %3E3.0.CO%3B2-E
- Jaimes N, Braun RP, Thomas L, Marghoob AA. Clinical and dermoscopic characteristics of amelanotic melanomas that are not of the nodular subtype. J Eur Acad Dermatol Venereol. 2012;26(5):591-6.
- Johnson DB, Sosman JA. Therapeutic advances and treatment options in metastatic melanoma. JAMA Oncol (2015) 1(3):380–6.
- Johnson M.N., Armstrong A.W. Technologies in dermatology: teledermatology review. G Ital Dermatol Venereol. 2011 Apr; 146(2):143-53
- Kaliyadan, F, Ventkitakrishnan S. Teledermatology: clinical case profiles and practical issues. Indian J Dermatol Venerol Leprol. 2009. Vol.75, Issue 1. P.32-35.
- Kanthraj GR.Classification and design of teledermatology practice: What dermatoses? Which technology to apply?J Eur Acad Dermatol Venereol 2009;23:865-75.
- Kanthraj GR.Patient-assisted teledermatology practice: What is it? When, where, and how it is applied? IJDVL. 2015;81:2, P.136-143
- Kim HS, Lee SH, Moon HS, Kim YW. Intradermal melanocytic nevus with lymphatic nevus cell embolus: a case report. Oncol Lett. 2014; 7(2): 331–333.
- Kouskoukis M-N, Botsaris C. Cost benefit analysis of telemedicine systems/units in greek remote areas. Pharmacoecon Open. 2017 Jun; 1(2): 117–121.
- Kravets K, Bogomolets O. Application and study of the effectiveness of skin tumours remote diagnostics in Ukraine. 6th World Congress of Teledermatology. London, 14th-15th October, 2016. P. 48.
- Kravets K, O. Bogomolets, S. Dyachuk. The Effectiveness of Teledermatology Use in Skin Cancers Diagnosis. 5th EAAD congress “united for dermatology”, Riga, 18-20 September, 2015, p.95.
- Kravets K, Bogomolets O, Magonia O. The future of teledermatology and remote consulting in beauty salons. Abstract. WCOCD, Athens, 2013 (disc).
- Kravets K, Bogomolets O, Magonia O. Teledermoscopy in Ukraine. Early diagnostics of non-melanoma skin cancers. Abstract. PALD, Jordan, 2012 (disc).
- Kravets K, Bogomolets O, Magonia O, Dyachuk S, Zhuravel M.Comparison of the effectiveness of clinical, dermoscopic and teledermoscopic diagnosis of skin cancers. Abstract. EADV. Cracow. 2013 (disc).
- Kravets K, Dranyk Z, Vasylenko O, Bogomolets O. Store-and-Forward Teledermatology for the Most Common Skin Neoplasms in Ukraine. – Acta Dermatovenerologica Alpina, Pannonica et Adriatica. 2018. №27. P.79-83. doi: 10.15570/actaapa.2018.18
- Kraft S, Granter SR. Molecular pathology of skin neoplasms of the head and neck. Arch Pathol Lab Med. 2014;138(6):759–87 Available from: http://www.archivesofpathology.org/doi/10.5858/arpa.2013-0157 RA?url_ver=Z39.882003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dpubmed&code=coap-site
- Krengel S, Scope A, Dusza SW, Vonthein R, Marghoob AA. New recommendations for the categorization of cutaneous features of congenital melanocytic nevi. J Am Acad Dermatol. 2013 Mar;68(3):441-51
- Krupinski EA, Antoniotti N, Bernard J. Utilization of the American Telemedicine Association’s Clinical Practice Guidelines. Telemed J E Health. 2013 November; 19(11): 846-851.
- Kvaskoff M, Siskind V, Green AC. Risk factors for lentigo maligna melanoma compared with superficial spreading melanoma:a case-control study in Australia. Arch Dermatol. 2012;148(2):164–170.
- Larson AA, Leachman SA, Eliason MJ, et al. Population-based assessment of non-melanoma cancer risk in relatives of cutaneous melanoma probands. J Invest Dermatol. 2007;127:183–8.
- Lee CN, Pan SC, Lee JYY, Wong TW. Successful treatment of cutaneous squamous cell carcinoma with intralesional cryosurgery Medicine (Baltimore). 2016; 95(39): e4991.
- Lens M, Medenica L. Systemic retinoids in chemoprevention of non-melanoma skin cancer. Expert Opin Pharmacother 2008;9:1363-1374.
- Li FZ, Dhillon AS, Anderson RL, McArthur G, Ferrao PT. Phenotype switching in melanoma: implications for progression and therapy. Front Oncol, 2015, 5:31.
- Lin JY, Fisher DE. Melanocyte biology and skin pigmentation. Nature. 2007;445:843–850.
- Lindqvist PG, Epstein E, Landin-Olsson M, Ingvar C, Nielsen K, Stenbeck M, Olsson H. Avoidance of sun exposure is a risk factor for all-cause mortality: results from the Melanoma in Southern Sweden cohort. J Intern Med. 2014;276(1):77-86.
- Liu Y, Sheikh MS. Melanoma: molecular pathogenesis and therapeutic management. Mol Cell Pharmacol. 2014; 6(3):228.
- Lourenço SV, Fernandes JD, Hsieh R, Coutinho-Camillo CM, Bologna S, Sangueza M, Nico MM. Head and neck mucosal melanoma: a review. Am J Dermatopathol. 2014;36(7):578-87.
- McPartlin AJ, Slevin NJ, Sykes AJ, Rembielak A.Radiotherapy treatment of non-melanoma skin cancer: a survey of current UK practice and commentary.Br J Radiol. 2014;87(1043):20140501
- Madan V, Lear JT, Szeimies R-M. Non-melanoma skin cancer. Lancet 2010;375:673-685.
- Magonia O, Bogomolets O, Kravets K, Dyachuk S, Zhuravel M. Teledermoscopy in the diagnostics of atypical nevi: ukrainian experience. EADV, Spring Symposium. Cracow, 23-26 May, 2013 (disc).
- Mar V, Roberts H, Wolfe R, English DR, Kelly JW. Nodular melanoma: a distinct clinical entity and the largest contributor to melanoma deaths in Victoria, Australia. J Am Acad Dermatol. 2013;68(4):568–575.
- Mark RG. Telemedicine system: the missing link between homes and hospital? Mod. Nurs. Home. 1974; 32(2):39-42.
- Marmur ES, Schmults CD, Goldberg DJ. A review of laser and photodynamic therapy for the treatment of nonmelanoma skin cancer. Dermatol Surg 2004;30:264-271.
- Martin JM, Bella–Navarro R, Jorda E. Vascular Patterns in Dermoscopy/ Actas Dermosifiliogr. 2012; 103:357-75.
- Mass screening of skin cancers in Ukraine. Kravets K, Bogomolets O, Magonia O. Abstract. EADV.Istanbul.2013.
- Massone C, Maak D, Hofmann-Wellenhof R, Soyer HP, Frühauf J. Teledermatology for skin cancer prevention: an experience on 690 Austrian patients. J E A D V. 2014; 28(8):1103–1108.
- Meibodi NT, Nahidi Y, Meshkat Z, Esmaili H, Gharib M, Gholoobi A. No evidence of human papillomaviruses in non-genital seborrheic keratosis. Indian J Dermatol. 2013 Jul-Aug; 58(4): 326.
- Micali C, Lacarrubba F, Nasca MR, Schwartz RA. Topical pharmacotherapy for skin cancer: Part I. Pharmacology. J Am Acad Dermatol 2014;70:965.e1-e12.
- Micali G, Lacarrubba F, Bhatt K, Nasca MR. Medical approaches to non-melanoma skin cancer. Expert Rev Anticancer Ther 2013;13:1409-1421.
- Molinaro AM, Ferrucci LM, Cartmel B, Loftfield E, Leffell DJ, Bale AE, Maynel ST. Indoor tanning and the MC1R genotype: risk prediction for basal cell carcinoma risk in young people. Am J Epidemiol. 2015;181(11):908–16.
- Mistry H. Systematic review of studies of the cost-effectiveness of telemedicine and telecare. Changes in the economic evidence over twenty years. J Telemed Telecare. 2012;18(1):1–6
- Nalamwar R, Kharkar V, Mahajan S, Chikhalkar S, Khopkar U. Nodular amelanotic melanoma. Indian J Dermatol Venereol Leprol. 2010;76(3):273-5.
- Nam KW, Bae YC, Nam SB, Kim JH, Kim HS, Choi YJ. Characteristics and Treatment of Cutaneous Melanoma of the Foot. Arch Plast Surg. 2016;43(1):59–65.
- Narayanan DL, Saladi RN, Fox JL. Ultraviolet radiation and skin cancer. Int J Dermatol. 2010;49(9):978–86.
- NCI Dictionary of Cancer Terms. Screen index: Junctional nevus. Review 2018. Available from https://www.cancer.gov/publications/dictionaries/cancer-terms/def/junctional-nevus
- Nelson C, Takeshita J, Wanat K, Bream K, Holmes J, Koenig H, Roth RR, et al. Impact of store-and-forward (SAF) teledermatology on outpatient dermatologic care: A prospective study in an underserved urban primary care setting. J Am Acad Dermatol. 2016;74(3): 484-490.
- Nouri K. Skin cancer. Miami; 2008.709 p.
- O’Regan K, Breen M, Ramaiya N, Jagannathan J, DiPiro PJ, Hodi FS, Van den Abbeele AD. Metastatic mucosal melanoma: imaging patterns of metastasis and recurrence. Cancer Imaging. 2013;13(4):626-32.
- Panse G, Yeh I, McCalmont TH.Hypomelanotic blue nevi lack fingerprint CD34 immunopositivity. Am J Dermatopathol. 2012;34(3):342-3.
- Papp T, Pemsel H, Rollwitz I, Schipper H, Weiss DG, Schiffmann D, Zimmermann R. Mutational analysis of N-ras, p53, CDKN2A (p16(INK4a)), p14(ARF), CDK4, and MC1R genes in human dysplastic melanocytic naevi. Journal of medical genetics. 2003;40:E14.
- Park TH, Cho HJ, Lee JW, Kim CW, Chong Y, Chang CH, Park K-S. Could −79 °C spray-type cryotherapy be an effective monotherapy for the treatment of keloid? Int J Mol Sci. 2017 ; 18(12): 2536.
- Pedrosa AF, Lopes JM, Azevedo F, Mota A.Spitz/Reed nevi: a review of clinical-dermatoscopic and histological correlation.Dermatol Pract Concept. 2016;6(2):37-41.
- Perednia DA, Allen A. Telemedicine technology and clinical applications. JAMA. 1995;273:483–8.
- Perkins A, Duffy RL. Atypical moles: diagnosis and management. Am Fam Physician. 2015 Jun 1;91(11):762-7.
- Perkins W, Quinn AG. Non-melanoma skin cancer and other epidermal skin tumours. In: Burns T, Breathnach S, Cox N, Griffiths C, editors. Rook’s Textbook of Dermatology. 8th ed. Oxford: Blackwell Publishing; 2010. pp. 521–48.
- Pizzichetta MA, Kittler H, Stanganelli I, Bono R, Cavicchini S, De Giorgi V, et al. Pigmented nodular melanoma: the predictive value of dermoscopic features using multivariate analysis.Br J Dermatol. 2015;173(1):106-14.
- Pustisek N, Sikanic-Dugic N, Hirsl-Hecej V, Domljan ML. “Halo nevi” and UV radiation. Coll Antropol. 2010;34(2):295–7.
- Rajesh G, Thappa DM, Jaisankar TJ, Chandrashekar L. Spectrum of seborrheic keratoses in South Indians: A clinical and dermoscopic study. Indian J Dermatol Venereol Leprol. 2011;77:483–8.
- Ratushny V, Gober MD, Hick R, Ridky TW, Seykora JT. From keratinocyte to cancer: the pathogenesis and modeling of cutaneous squamous cell carcinoma. The Journal of clinical investigation. 2012;122:464–472.
- Reddy BY, Miller DM, Tsao H. Somatic driver mutations in melanoma. Cancer. 2017; 123(11):2104–17.
- Reichrath J, Rass K.Ultraviolet damage, DNA repair and vitamin D in nonmelanoma skin cancer and in malignant melanoma: an update. Adv Exp Med Biol. 2014;810:208-33.
- Requena C, Requena L, Sanchez-Yus E, Kutzner H, Llombart B, Sanmartín O. Hypopigmented Reed nevus. J Cutan Pathol. 2008;35:87–89.
- Rigel DS, Russak J, Friedman R. The evolution of melanoma diagnosis: 25 years beyond the ABCDs. CA Cancer J Clin. 2010;60 (5):301-316
- Roh MR, Eliades P, Gupta S, Tsao H.Genetics of melanocytic nevi.Pigment Cell Melanoma Res. 2015 Nov;28(6):661-72.
- Roh NK, Hahn HJ, Lee YW, Choe YB, Ahn KJ. Clinical and Histopathological Investigation of Seborrheic Keratosis. Annals of dermatology. 2016;28:152–158.
- Rosendahl CO, Grant-Kels JM, Que SK.Dysplastic nevus: Fact and fiction. .J Am Acad Dermatol. 2015;73(3):507-12.
- Rubí JS , Anglarill JG, Fondevill RR, Rubió FS, Luque LF. POSTER ABSTRACT. Prospective analysis of the implementation of healthcare telemedicinebetween prisons in the area of Catalonia (Spain). 16th International Conference on Integrated Care, Barcelona 23-25 May 2016. International Journal of Integrated Care, 16(6): A53, pp. 1-8.
- Rudnick EW, Thareja S, Cherpelis B. Oral therapy for nonmelanoma skin cancer in patients with advanced disease and large tumor burden: a review of the literature with focus on a new generation of targeted therapies. Int J Dermatol 2016;55:249-258.
- Saco M, Thigpen J. A retrospective comparison between preoperative and postoperative Breslow depth in primary cutaneous melanoma: how preoperative shave biopsies affect surgical management. J Drugs Dermatol. 2014;13(5):531-6.
- Saito T, Mitomi H, Imamhasan A, Hayashi T, Kurisaki-Arakawa A, et al. PTCH1 mutation is a frequent event in oesophageal basaloid squamous cell carcinoma. Mutagenesis. 2015;30(2):297-301.
- Sakamoto M, Morimoto N, Jinno C, Mahara A, Ogino S, Suzuki S, Kusumoto K, Yamaoka T. Melanin pigments in the melanocytic nevus regress spontaneously after inactivation by high hydrostatic pressure. PLoS One. 2017; 12(11).
- Saleh N, Abdel HR, Hegazy R, Hussein M, Gomaa D. Can teledermatology be a useful diagnostic tool in dermatology practice in remote areas? An Egyptian experience with 600 patients. J Telemed Telecare. 2017 Feb;23(2):233-238.
- Sartore L, Lancerotto L, Salmaso M, Giatsidis G, Paccagnella O, Alaibac M, Bassetto F. Facial basal cell carcinoma: analysis of recurrence and follow-up strategies. Oncol Rep. 2011;26(6):1423-1429.
- Savas JA, Ledon JA, Franca K, Chacon AH, Nouri K. Lasers for non-melanoma skin cancers; in Nouri K (ed): Handbook of Lasers in Dermatology. London, Springer; 2014. 293-306 pp.
- Savoia P, Cremona O, Fava P: New perspectives in the pharmacological treatment of non-melanoma skin cancer. Curr Drug Targets 2016;17:353-374.
- Sayer HP, Rigel DS, Wurm EMT. Actinic keratosis, basal cell carcinoma and squamous cell carcinoma; in Bolognia JL, Jorizzo JL, Schaffer J (eds): Dermatology. Philadelphia, Elsevier Saunders; 2012, vol 2. 1773-1795 pp.
- Schaue D, Ratikan JA, Iwamoto KS, McBride WH. Maximizing tumor immunity with fractionated radiation. Int J Radiat Oncol Biol Phys. 2012;83(4):1306–1310.
- Scherer D, Bermejo JL, Rudnai P, Gurzau E, Koppova K, Hemminki K, Kumar R. MC1R variants associated susceptibility to basal cell carcinoma of skin: interaction with host factors and XRCC3 polymorphism. Int J Cancer. 2008;122(8):1787–93.
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017. CA Cancer J Clin. 2017; 67: 7-30.
- Simionescu O, Blum A, Grigore M, Costache M, Avram A, Testori A. Learning from mistakes: errors in approaches to melanoma and the urgent need for updated national guidelines. Int J Dermatol. 2016 Sep; 55 (9): 970-6.
- Situm M, Buljan M, Kolić M, Vučić M. Melanoma–clinical, dermatoscopical, and histopathological morphological characteristics. Acta Dermatovenerol Croat. 2014; 22 (1): 1-12.
- Snow SN, Gunkel J. Mohs surgery; in Bolognia JL, Jorizzo JL, Schaffer J (eds): Dermatology. Philadelphia, Elsevier Saunders; 2012, vol 2. 2445-2459 pp.
- Sood SP, Negash S, Mbarika VW, Kifle M, Prakash N. Differences in public and private sector adoption of telemedicine: Indian case study for sectoral adoption. Studies in Health Technology and Informatics, 2007, 130:257–268.
- Stamatelli A, Saetta AA, Bei T, Kavantzas N, Michalopoulos NV, Patsouris E, Aroni K. B-Raf mutations, microsatellite instability and p53 protein expression in sporadic basal cell carcinomas. Pathol Oncol Res. 2011; 17 (3): 633–637.
- Storer M, Duncan LM, Kourosh AS.Eruptive inflamed seborrheic keratoses in the setting of endometrial adenocarcinoma.Int J Womens Dermatol. 2015;1(3):155-156.
- Sundararajan S, Badri T. Cancer, Melanoma, Metastatic. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2017 Dec 18.
- Svobodová A, Vostálová J. Solar radiation induced skin damage: review of protective and preventive options.Int J Radiat Biol. 2010;86(12):999-1030.
- Tacastacas JD, Bray J, Cohen YK, Arbesman J, Kim J, Koon HB, et al. Update on primary mucosal melanoma. J Am Acad Dermatol. 2014; 71 (2):
366–375. - Taylor J, Coates E, Wessels B, Mountain G, Hawley MS. Implementing solutions to improve and expand telehealth adoption: participatory action research in four community healthcare settings. BMC Health Serv Res. 2015;15(1):529.
- Tchernev G, Chokoeva AA, Terziev I, Grigorov Y, Lotti T, Wollina U, et al. Small dysplastic congenital melanocytic nevi in childhood as possible melanoma imitators. J Med Sci. 2018; 6(1): 149–151.
- Tchernev G, Chokoeva AA, Wollina U, Lotti T. Persistent subungual and periungual hematoma versus melanoma:to cut it or to leave it? Dermatol Ther. 2016;29:150–151.
- Telstantin M-M, Raducan A, Poenaru E, Constantin T. Teledermatology: concepts and applications in medicine. Revista Medicala Romana. 2015; LXII (2).
- Tessari G, Girolomoni G. Nonmelanoma skin cancer in solid organ transplant recipients: update on epidemiology, risk factors, and management. Dermatol Surg. 2012;38(10):1622–30.
- Thompson JF, Scolyer RA, Kefford RF. Cutaneous melanoma. Lancet. 2005; 365:687–701.
- Toricelli M, Melo FH, Peres GB, Silva DC, Jasiulionis MG.Timp1 interacts with beta-1 integrin and CD63 along melanoma genesis and confers anoikis resistance by activating PI3-K signaling pathway independently of Akt phosphorylation. Mol Cancer. 2013;12:22.
- Tzu J, Goldman C, Perry AE, Meehan SA. Combined blue nevus-smooth muscle hamartoma: a series of 12 cases.J Cutan Pathol. 2013 Oct;40(10):879-83.
- Urso С. Are growth phases exclusive to cutaneous melanoma? J Clin Pathol. 2004; 57(5): 560. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1770294/.
- Vallarellil AF, Harrison SL, Souza EM. Melanocytic nevi in a Brazilian community of predominantly Dutch descent (1999-2007). An Bras Dermatol. 2010;85:469–477.
- Viana AC, Gontijo B, Bittencourt FV.Giant congenital melanocytic nevus. An Bras Dermatol. 2013;88(6):863-78.
- Vyas KS, Hambrick HR, Shakir A, Morrison SD, Tran DC, Pearson K, et al. A Systematic Review of the Use of Telemedicine in Plastic and Reconstructive Surgery and Dermatology. Ann Plast Surg. 2017;78(6):736-768.
- Weinberg JM. Topical therapy for actinic keratoses: current and evolving therapies. Rev Recent Clin Trials 2006;1:53-60.
- Westerdahl J, Ingvar C, Masback A, Jonsson N, Olsson H. Risk of cutaneous malignant melanoma in relation to use of sunbeds: further evidence for UV-A carcinogenicity. Br J Cancer. 2000;82:1593–9.
- Weyant GW, Chung CG, Helm KF. Halo nevus: review of the literature and clinicopathologic findings. Int J Dermatol. 2015 Oct;54(10):e433-5.
- Whiteman DC, Pavan WJ, Bastian BC. The melanomas: A synthesis of epidemiological, clinical, histopathological, genetic, and biological aspects, supporting distinct subtypes, causal pathways, and cells of origin. Pigment Cell Melanoma Res. 2011;24:879–97.
- WHO. A health telematics policy in support of WHO’s Health-For-All strategy for global health development: report of the WHO group consultation on health telematics, 11–16 December, Geneva, 1997. Geneva, World Health Organization, 1998.
- Wilson MA, Schuchter LM. Chemotherapy for Melanoma.Cancer Treat Res. 2016;167:209-29.
- Wisco OJ, Sober AJ. Prognostic factors for melanoma. Dermatol Clin. 2012;30:469–485.
- Wisgerhof HC, Edelbroek JR, de Fijter JW, Haasnoot GW,Claas FH,Willemze R, Bavinck JN. Subsequent squamous- and basal-cell carcinomas in kidney-transplant recipients after the first skin cancer: cumulative incidence and risk factors. Transplantation. 2010;89(10):1231–8.
- Woodman SE, Mills GB. Are oncogenes sufficient to cause human cancer? Proceedings of the National Academy of Sciences of the United States of America. 2010;107:20599–20600. URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2996413/.
- Wootton R. Twenty years of telemedicine in chronic disease management–an evidence synthesis. J Telemed Telecare. 2012;18(4):211–220.
- Wu S.Do mutations in BRCA1/BRCA2 confer a higher risk of skin cancer?Br J Dermatol. 2015 ;172 (6): 1473.
- Wurm ETM, Terri MC, Soyer HP. Teledermatology: how to start a new teaching and diagnostic era in medicine. Dermatol Clin 2008, 26, 295-300.
- Yeatman JM, Kilkenny M, Marks R. The prevalence of seborrhoeic keratoses in an Australian population: Does exposure to sunlight play a part in their frequency? Br J Dermatol. 1997;137:411–4.
- Yin J, Liu H, Liu Z, Wang LE, Chen WV, Zhu D, et al. Genetic variants in fanconi anemia pathway genes BRCA2 and FANCA predict melanoma survival. J Invest Dermatol. 2015 Feb;135(2):542-550.
- Yoshimi N, Imai Y, Kakuno A, Tsubura A, Yamanishi K, Kurokawa I. Epithelial keratin and filaggrin expression in seborrheic keratosis: evaluation based on histopathological classification.Int J Dermatol. 2014 Jun;53(6):707-13.
- Yoradjian A, Enokihara MM, Paschoal FM. Spitz nevus and Reed nevus. An Bras Dermatol. 2012 May-Jun;87(3):349-57.
- Yu X, Li Z. The role of miRNAs in cutaneous squamous cell carcinoma. J Cell Mol Med 2016;20:3-9.
- Zelickson BD, Homan L. Teledermatology in the nursing home. Arch Dermatol. 1997;133:171–4.
- Zink A, Kolbinger A, Leibl M, Leon Suarez I, Gloning J, Merkel C, Winkler J, et al. Teledermoscopy by mobile phones : Reliable help in the diagnosis of skin lesions? Hautarzt. 2017; 68 (11): 890-895.
ДОДАТОК А
АНКЕТА ПАЦІЄНТА
ДОДАТОК Б
ДЕРМАТОСКОПІЧНИЙ АНАЛІЗ
ДОДАТОК Г
СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА ЗА ТЕМОЮ ДИСЕРТАЦІЇ
ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ РЕЗУЛЬТАТІВ ДИСЕРТАЦІЇ
Публікації:
- Кравець К.І., Богомолець О.В. Сучасні методи теледерматології в діагностиці новоутворень шкіри. Український журнал дерматології, венерології, косметології. 2015. № 3 (58). С.13–17 (Особистий внесок – аналіз даних, опис дослідження).
- Крвець К.І. Становлення та застосування телемедицини у світі та в Україні. Дерматологія та венерологія. 2017. № 4 (78). С. 94–98.
- Кравець К.І., Богомолець О.В. Найпоширеніші немеланомні раки шкіри. Вісник Української медичної стоматологічної академії «Актуальні проблеми сучасної медицини». 2018. Т. 18, Вип. 1 (61). С. 308–312 (Особистий внесок – аналіз літературних даних за останні роки, написання статті).
- Кравець К.І., Богомолець О.В. Порівняльна характеристика дерматоскопії та теледерматоскопії на прикладі меланоцитарних невусів та меланоми шкіри. Український журнал дерматології, венерології, косметології. 2018. № 1 (68). С. 17–22 (Особистий внесок – відбір даних для дослідження, аналіз даних, написання статті).
- Store-and-Forward Teledermatology for the Most Common Skin Neoplasms in Ukraine / K. Kravets, Z. Dranyk, O. Vasylenko, O. Bogomolets. Acta Dermatovenerologica Alpina, Pannonica et Adriatica. 2018. Iss.27. P. 79–83 (Особистий внесок – аналіз даних, написання статті).
- Застосування комбінованого методу у лікуванні новоутворень шкіри / К.І. Кравець, Ж.Н. Драник, О.В. Василенко, О.В. Богомолець. Science Rise. Medical Science. 2018. № 5 (25). С. 23–30 (Особистий внесок – відбір даних для дослідження, аналіз даних, написання статті).
- Кравець К.І., Богомолець О.В. Застосування сучасних методів у діагностиці себорейного кератозу. Дерматологія та венерологія. 2018. № 2 (80). С. 59–62.
- Teledermoscopy in the Diagnostics of Atypical Nevi: Ukrainian Experience / O. Magonia, O. Bogomolets, K. Kravets, S. Dyachuk, M. Zhuravel. EADV, Spring Symposium. Cracow, 23-26 May, 2013.
- Kravets K., Bogomolets O., Dyachuk S. The Effectiveness of Teledermatology Use in Skin Cancers Diagnosis. 5th EAAD congress “United for dermatology”, Riga, 18-20 September, 2015. P.95.
- Kravets K., Bogomolets O. Application and Study of the Effectiveness of Skin Tumours Remote Diagnostics in Ukraine. 6th World Congress of Teledermatology. London, 14th–15th October, 2016. P. 48.
- Кравець К.І., Сидоренко І.І., Богомолець О.В. Порівняльна характеристика теледерматоскопічної та дерматоскопічної діагностики немеланомних раків шкіри. Матеріали науково-практичної конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», 10–11 листопада 2017 р., м. Харків. Дерматологія та венерологія. 2017. № 3 (77). С. 103–104.
- Кравець К.І., Сидоренко І.І., Богомолець О.В. Теледерматологічна діагностика меланоми шкіри за допомогою платформи Telederm. Мат. III (X) з’їзду Української асоціації лікарів дерматовенерологів і косметологів, 22-23 листопада 2017 р., м. Львів. Український журнал дерматології, венерології, косметології. 2017. № 4 (67). С. 106.
- Кравець К.І., Богомолець О.В. Застосування методів телемедицини у діагностиці меланоми шкіри. Матеріали IX міжнародного семінару студентів та молодих вчених, присвячений Всесвітньому дню боротьби з раком, 1-2 лютого 2018 р., м. Київ. Український науково-медичний молодіжний журнал. 2017. № 2 (101). С. 45.
- Дерматоскопія. Міні-атлас. Вид. 1 / К.І. Кравець, С.Д. Дячук, І.І. Сидоренко, О.В. Магоня, Н.М. Семенюк; під ред. О.В. Богомолець. К. : ТОВ «Глянець», 2018. 75 с.
Виступи:
- Другий національний симпозіум по anti-age медицині, 3-4 грудня 2015 року, м. Київ. Усна доповідь: Кравець К.І. «Классификация, этиология, дифференциальная диагностика возраст-ассоциированных доброкачественных новообразований кожи и раков кожи. Современные методы диагностики. Интерактивная работа с аудиторией».
- Медичний спеціалізований форум. Науково-практична сесія «Доброякісні і злоякісні новоутворення шкіри у дітей і дорослих», 23-25 березня 2016 p., м. Київ. Усна доповідь: Кравець К.І., Богомолець О.В. «Застосування методів телемедицини в діагностиці новоутворень шкіри».
- XI Всесвітній Конгрес з Теледерматології, 14-15 жовтня 2016 р., Лондон. Усна доповідь: Кравець К.І. «Application and study of the effectiveness of skin tumours remote diagnostics in Ukraine».
- Науково-практична конференція «Сучасні методи діагностики та лікування новоутворень шкіри». 25 листопада 2016 р., м. Київ. Усна доповідь: Кравець К.І., Семенюк Н.М. «Використання теледерматології при ранній діагностиці меланоми та раку шкіри».
- III (X) з’їзд Української асоціації лікарів-дерматовенерологів і косметологів, 22-23 листопада 2017 р., м. Львів. Усна доповідь: Кравець К.І. «Уроджені та набуті новоутворення шкіри у дітей.Теледіагностика».
- IX міжнародний семінар студентів та молодих вчених, присвячений Всесвітньому дню боротьби з раком, 1-2 лютого 2018 р., м. Київ. Усна доповідь: Кравець К.І. «Застосування методів телемедицини у діагностиці меланоми шкіри».
- Український дерматоскопічний конгрес, 2 березня 2018 р, м. Київ. Усна доповідь: Кравець К.І., Богомолець О.В. «Немеланоцитарні доброякісні новоутворення шкіри».