РОЗДІЛ 4
АНАЛІЗ ГІСТОЛОГІЧНИХ ТА ІМУНОГІСТОХІМІЧНИХ ХАРАКТЕРИСТИК ШКІРИ ПРИ АКТИНІЧНОМУ КЕРАТОЗІ
4.1 Оцінка морфологічних характеристик шкіри при передраковому стані – актинічному кератозі, порівняно із себорейним кератозом
Під час дослідження 24 випадків шкірних новоутворень (15 – АК та 9 – СК), були виявлені такі загальні характеристики, як ушкодження епідермісу, дерми та придатків шкіри. Для поетапного диференціального алгоритму вони будуть надані в цьому підрозділі відповідним чином.
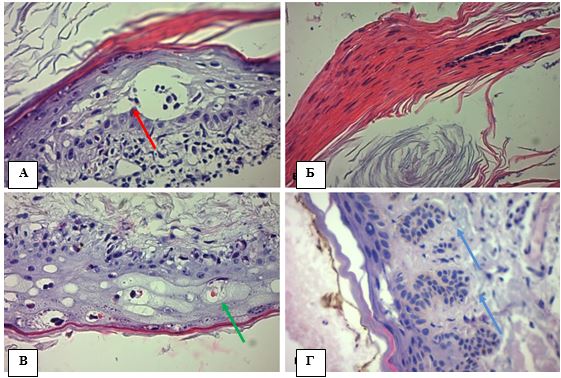
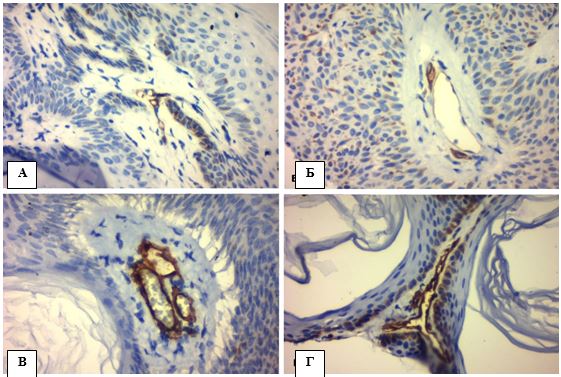
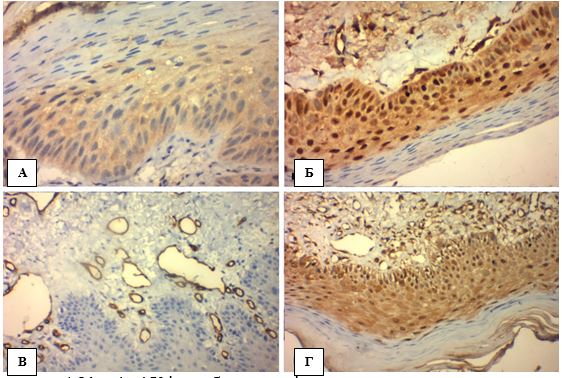
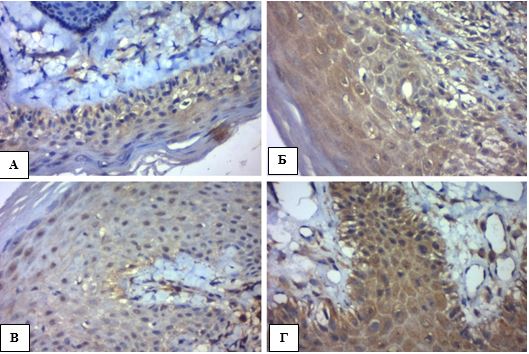
Ушкодження епідермісу. Випадки АК характеризувалися клітинною атипією різного ступеня важкості, що включала в себе спотворення дозрівання базальних клітин, плеоморфізм ядер кератиноцитів, порушення стратифікації, часткову або повну втрату зернистого шару, гіперкератоз (надмірне зроговіння), наявність ділянок пара- і дискератозу (частина зроговілих клітин має ядра (паракератоз), місцями кератин утворюється в кератиноцитах, які ще знаходяться у шипуватому шарі (дискератоз)), збільшення кількості мітотичних фігур базального та навіть парабазального шарів, розширення міжклітинних просторів та прояви апоптозу (вакуолярні зміни базальних кератиноцитів, зменшення клітин із формуванням пікнотичних ядер – Civatte bodies). Взагалі загальна товщина клітинного патерну епідермісу випадків АК зменшувалась (справжня атрофія) і мала тенденцію до розщеплення між базальним та парабазальним шарами (акантоліз), але інтенсивність наведених патогістологічних ознак варіювала в залежності від клінічної форми (рис. 4.1, табл. 4.1).
Загальними характеристиками гіпертрофічної форми АК (3 спостереження) виявились надмірний гіперкератоз з частим утворенням на поверхні епідермісу багатоповерхових гіпереозинофільних без’ядерних лусок, помірні паракератоз та акантоз із ознаками клітинної атипії та незначним накопиченням меланіну базальними кератиноцитами. Пігментну форму АК (2 спостереження) відрізняло навпаки інтенсивне накопичення меланіну в епідермісі з переважно помірним гіперкератозом та акантозом, незначним паракератозом та незначною або помірною клітинною атипією. Проліферативна форма АК (10 випадків) характеризувалась вираженим акантозом з утворенням широких акантотичних тяжів з тенденцією до брунькування, помірним гіперкератозом та різною клітинною атипією, незначними були прояви паракератозу та інтраепідермального накопичення меланіну. Актинічний хейліт не ввійшов у дослідження.
Рисунок 4.1 – АК: морфологічні ознаки ушкодження епідермісу, забарвлення гематоксилін-еозин (Г-Е), (х400). А. Порушення дозрівання кератиноцитів – плеоморфні ядра, відсутність нормальної стратифікації плоского епітелію, розщеплення між базальним і парабазальним шарами епідермісу (червона стрілка). Б. Паракератоз – більшість зроговілих клітин має ядра. В. Дискератоз – краплини кератину в шипуватому шарі (зелена стрілка). Г. Акантоз у вигляді брунькування, дисплазія базальних кератиноцитів (сині стрілки)
Таблиця 4.1 – Наявність патогістологічних змін шкіри в залежності від клінічної форми та ступеня важкості АК, порівняно з СК (n)
| Клінічна форма | Гістологічна стадія важкості | n (15) | Гіперкератоз | Атрофія
епідермісу |
Паракератоз | Дискератоз | Акантоліз | Апоптоз | Брунькування / акантоз | Втрата гранулярного шару | Накопичення
меланіну |
Еластоз | Запалення | Амілоїдоз | Дисплазія епітелію вол.
фол. |
Дисплазія
себоцитів |
Рогові кісти |
| Гіпертрофічна | АК ІІ | 3 | 3 | 2 і 1 вогнищ | 2 | 2 | 2 | 2 | 2 | 1 і 2 вогнищ | 0 | 1 | 3, із них
3 + |
0 | 3 | 1 | 2 |
| Всього: | 3 | 3 | 2 і 1 вогнищ | 2 | 2 | 2 | 2 | 2 | 1 і 2 вогнищ | 0 | 1 | 3 | 0 | 3 | 1 | 2 | |
| Пігментна | АК ІІ | 2 | 2 | 1 вогнищ | 2 | 1 | 0 | 1 | 0 | 1 і 1 вогнищ | 1 | 1 | 2, із них
1+, 1++ |
0 | 2 | 2 | 0 |
| Всього: | 2 | 2 | 1 вогнищ | 2 | 1 | 0 | 1 | 0 | 1 і 1 вогнищ | 1 | 1 | 2 | 0 | 2 | 2 | 0 | |
| Проліферативна | АК І | 1 | 1 | 0 | 0 | 1 вог-нищ | 0 | 1 | 1 | 0 | 0 | 0 | 1, із них:
1++ |
0 | 0 | 0 | 0 |
| Проліферативна | АК II | 6 | 3 | 5 | 0 | 0 | 0 | 2 | 3 | 1 і 5 вогнищ | 2 і 1 вогнищ | 3 | 6, із них:
1 +, 5 ++ |
1 | 6 | 5 | 1 |
| Проліферативна | АК ІІІ | 3 | 1 і 1 вог-нищ | 2 і 1 вог-нищ | 1 вог-нищ | 1 | 1 | 3 | 1 | 1 вогнищ | 2 | 1 | 3, із них:
1 +, 1++, 1+++ |
1 | 3 | 0 | 1 |
| Всього: | 10 | 5 і 1 вог-нищ | 7 і 1 вог-нищ | 1 вог-нищ | 1 і 1 вог-нищ | 1 | 6 | 5 | 1 і 6 вогнищ | 4 і 1 вогнищ | 4 | 10 | 2 | 9 | 5 | 2 | |
| Загальна кількість позитивних АК: | 15 | 10 і 1 вог-нищ | 9 і 3 вог-нищ | 4 і 1 вог-нищ | 4 і 1 вог-нищ | 3 | 9 | 7 | 3 і 9 вогнищ | 5 і 1 вогнищ | 6 | 15, із них:
6 +, 8++, 1+++ |
2 | 14 | 8 | 4 | |
| СК | 9 | 9 | 0 | 0 | 0 | 0 | 2 | 9 акантоз | 0 | 7 і 2 вогнищ. | 1 | 6, із них:
4 +, 2++ |
0 | 0 | 0 | 9 | |
Примітки: вогнищ. – вогнищевий розподіл ознаки, + – слабке запалення, ++ – помірне, +++ – надмірне, вол. фол. – волосяний фолікул.
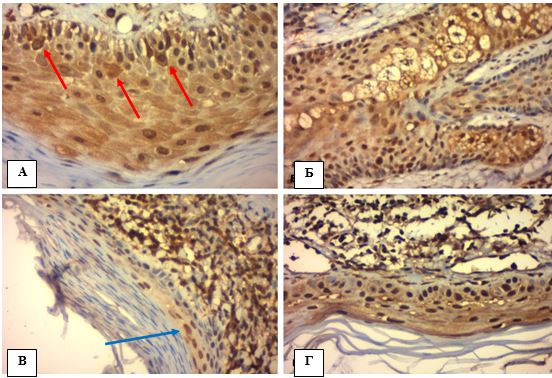
Ушкодження дерми. Випадки АК характеризувалися актинічним еластозом, хронічним запальним інфільтратом та зміною стану судин поверхневого шару дерми (рис. 4.2). Амілоїдоз строми визначався в 2 із 15 випадків (табл. 4.1). Додатково треба відзначити, що знаходження масивного запального інфільтрату під базальним шаром епідермісу, що мав прояви ушкодження (вакуольну дистрофію як ознаки апоптозу), багатьма авторами розглядається як спроба самоелімінації диспластичних клітин АК та імунологічна регресія пухлини, що формується [39].
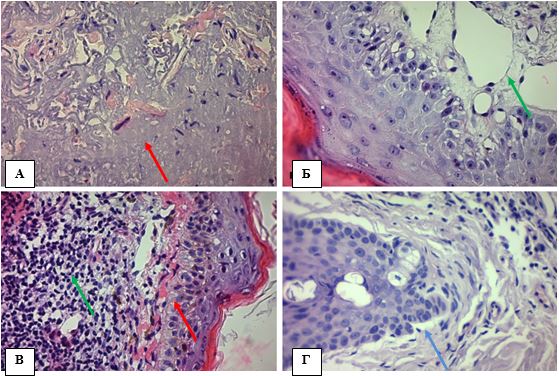
Рисунок 4.2 – АК: морфологічні ознаки ушкодження дерми та придатків шкіри, забарвлення Г-Е, (х400). А. Актинічний еластоз дерми (червона стрілка).
Б. Спотворені розтягнуті судини поверхневої дерми (зелена стрілка). В. Амілоїдоз (червона стрілка) та інтенсивне запалення – накопичення круглоклітинного інфільтрату (зелена стріла). Г. Клітинна атипія епітелію волосяного фолікулу (синя стрілка)
Ушкодження придатків шкіри. У панч-біопсійному матеріалі були присутні поверхнево розташовані частини придаткової системи шкіри: фрагменти сальних залоз та волосяних фолікулів. Сальні залози побудовані з скупчення кубічно-полігональних клітин-себоцитів з пінистою цитоплазмою та пікнотичними ядрами. Не дивлячись на наявність ознак хронічного запалення, яке спостерігалось в оточуючій дермі, інфільтрати не проникали у сальні залози, а ось клітинна атипія охоплювала воронкову порцію волосяних фолікулів та окремі себоцити (рис. 4.2 Г) і характеризувалась усіма ознаками, наведеними для епідермісу.
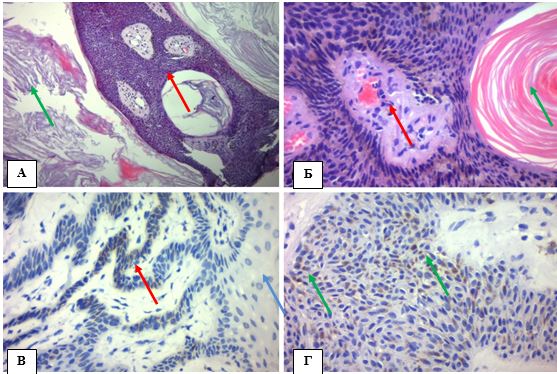
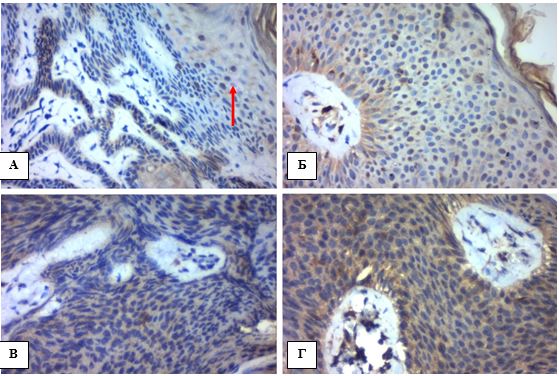
Висота диспластичних змін епідермісу (1/3, 2/3 або 3/3) дозволила розділити всі випадки АК за ступенем важкості або підтипами: АК І, АК ІІ, АК ІІІ (рис. 4.3), згідно класифікаціям за Rowert-Huber, 2007 та Cockerell, 2000 [40].
Рисунок 4.3 – АК: висота диспластичних змін епідермісу, Г-Е, (х400). А. 1/3, ранній ПКРШ in situ, АК І ступеня. Б. 1/3 – 2/3, ранній ПКРШ in situ, АК І-ІІ ступеня. В. 2/3, ранній ПКРШ in situ, АК ІІ ступеня. Г. 3/3, ПКРШ in situ, АК ІІІ ступеня або «бовеноїдний» тип
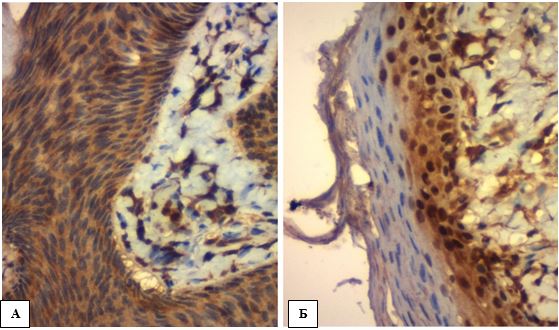
Для розуміння морфології обох груп порівняння треба зазначити, що СК – чітко обмежена доброякісна пухлина, що може мати ендофітний чи екзофітний зріст. Вона складається з базалоїдних клітин з різними варіаціями домішок плоских клітин. Заповнені кератином інвагінації та кісти (рогові за походженням) є характерними проявами. Гнізда плоских клітин (плоскоклітинні коловороти) здебільшого присутні в роздратованому (ушкодженому) типі СК. У дослідженні визначилися 4 чіткі гістологічні типи СК за будовою: акантотичний (твердий, однорідний), ретикулярний або сітчастий (аденоїдний, залозистий), гіперкератозний (папіломатозний) та роздратований (ушкоджений).
Акантотичний тип складався з широких колон або листків базалоїдних клітин із вставленими роговими кістами (рис. 4.4 А, Б). Сітчастий (аденоїдний) тип мав переплетення тонких ниток (тяжів) базалоїдних клітин, часто пігментованих з вкладеними малими роговими кістами (рис. 4.4 В). За літературними джерелами, саме цей варіант часто розвивається з сонячного лентіго [37, 39]. Гіперкератотичний тип відрізнявся виключно екзофітним зростом з різним ступенем гіперкератозу, папіломатозу, акантозу та демонстрував обидва типи клітин: базалоїдні та плоскі, що дещо ускладнювало диференційну діагностику із АК. Приблизно дві третини СК на зрізах забарвлених Г-Е виглядали гіперпігментованими через меланін (рис. 4.4 Г).
Але найбільш складним під час діагностичного пошуку виявився роздратований (ушкоджений) варіант перебігу СК, що мав масивний запальний інфільтрат з ліхеноїдними ознаками в поверхневій дермі, характерними для багатьох шкірних захворювань, в тому числі і для АК. Апоптотичні зміни клітин в базальному відділі з підвищенням проліферативної активності кератиноцитів навколо часто були присутніми саме в зонах плоскоклітинної диференціації СК. В 2 спостереженнях СК круглоклітинний запальний інфільтрат рясно наповнювали нейтрофіли; це може розглядатися як справжній запальний варіант СК, але такі прояви зазвичай є типовими для роздратованих варіантів інших новоутворень шкіри [40].
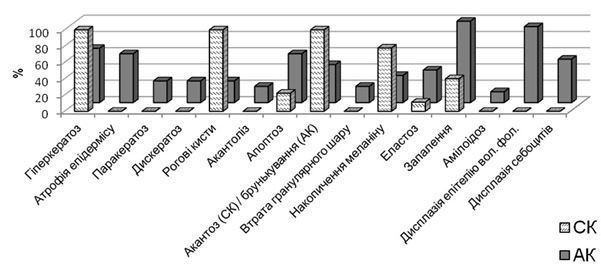
Таким чином, аналізуючи у відсотковому співвідношенні морфологічні ознаки АК та СК, можна сказати що на відміну від АК, де завжди на першому місці виступала клітинна атипія з порушенням стратифікації, головними проявами гістології СК виявились гіперкератоз, акантоз (з симетричним розташуванням «хвостів» – можна провести пряму лінію), рогові кісти та інтенсивна пігментація базального шару (табл. 4.1, рис. 4.5).
Рисунок 4.4 – СК: морфологічні ознаки підтипів, Г-Е. А. Акантотичний тип СК (темні однорідні базалоїдні клітини без атипії (червона
стрілка) та надмірний гіперкератоз (зелена стрілка)), (х100). Б. Акантоз з формуванням стромальних васкуляризованих сосочків
(червона стрілка), кератинові кісти (зелена стрілка), (х400). В. Сітчастий (аденоїдний) тип СК формує переплетення тонких
ниток (тяжів) базалоїдних клітин, часто досить пігментованих (червона стрілка), інша частина пухлини має плоскоклітинний
патерн диференціювання (синя стрілка), що може ускладнити диференційну діагностику із АК, (х200). Г. Дифузне накопичення
меланіну серед базальних кератиноцитів СК (зелені стрілки), (х400)
Найбільш значущими гістопатологічними особливостями, що були виявлені в АК (окрім дисплазії І-ІІІ епітеліальних клітин) впродовж дослідження, виявились: запалення – круглоклітинний інфільтрат строми (100 %), дисплазія епітелію волосяних фолікулів (93,3 %), гіперкератоз (66,7 %), атрофія епідермісу (60,0 %), апоптоз базальних кератиноцитів (65,2 %), дисплазія себоцитів (53,3 %) та акантотичне брунькування (46,7 %) (рис. 4.5).
Рисунок 4.5 – Відсоткове співвідношення морфологічних ознак
АК та СК з метою диференціальної діагностики
4.2 Оцінка експресії імуногістохімічних маркерів онкогенної трансформації (р53) та проліферативної активності (Kі-67, cyclin D1) при актинічному кератозі, порівняно із себорейним кератозом
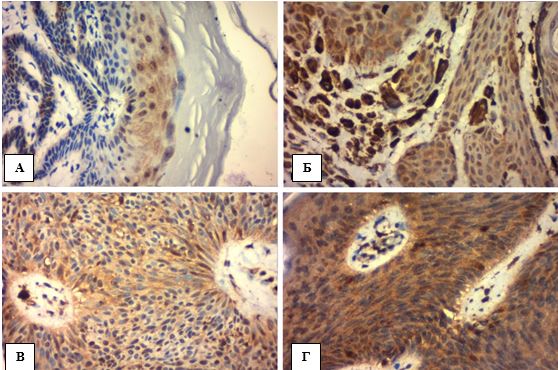
Онкогенна трансформація епітелію із мутацією онкопротеїну р53, що відповідає за активацію проапоптотичних білків, має важливе значення в канцерогенезі плоскоклітинногого раку різних локалізацій (гортані, ротоглотки, шийки матки, тощо). В основі диспластичних змін епідермісу шкіри також в 75% лежить мутація р53 [18, 26, 31], що може бути визначена однойменним ІГХ маркером (рис. 4.6).
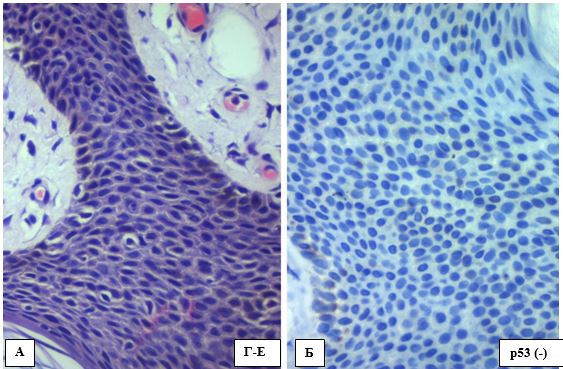
Позитивною вважалася тільки інтрануклеарна мітка хромогеном ДАБ клітин епідермісу (рис. 4.7 А-В) та фолікулярного епітелію (4.7. Г) коричневого кольору (для запобігання помилково-позитивних результатів меланосоми пов’язані із мембраною або розташовані у міжклітинному просторі не враховувались). Відсоток забарвлених клітин розраховувався на 100 подібних кератиноцитів в трьох полях зору під збільшенням (х400) як середнє арифметичне для кожного випадку.
Рисунок 4.6 – А. ПР in situ, АК ІІІ ступеня, забарвлення гематоксилін-еозин, (х400). Б. Інтрануклеарна експресія р53 більшості шарів епідермісу, що демонструє накопичення мутантного протеїну без виконання функції активації апоптозу, ІГХ з гематоксиліном Майєра, (х400)
Рисунок 4.7 – Варіанти експресії р53 в кератиноцитах епідермісу при АК, ІГХ з гематоксиліном Майєра, (х400). А. Позитивна експресія р53 до 10%. Б. Позитивна експресія на рівні 10%. В. Позитивна експресія р53 більше ніж 10%). Г. Позитивна експресія р53 в епітелії волосяного фолікулу
Цікавим виявився факт наявності експресії тільки в зразках АК (випадки СК характеризувалися 100 % негативним результатом експресії р53 незалежно від його морфологічної форми або індексу проліферації (ІП) (рис. 4.8).
Рисунок 4.8 – А. СК, акантотичний тип, забарвлення Г-Е, (х400). Б. Негативна експресія р53 клітин епідермісу, ІГХ метод,
додаткове забарвлення гематоксиліном Майєра, (х400)
У біоптатах АК експресію р53 було підтверджено в 10 із 15 спостережень (66,7 %), таким чином значення позитивної експресії р 53 коливалось від 9,2% до 56,9 % і у середньому склало (M ± SD) – 34,98 ± 19,31% (медіана 29,90%).
Для статистичної обробки даних спостереження обох вибірок (АК та СК) були розподілені на дві групи (табл. 4.2):
- до 10% клітин із експресією р53 (всі зразки СК увійшли до цієї підгрупи);
- 10 % та більше клітин з позитивною міткою р53.
За мету ставили порівняння між собою окремих клінічних варіантів АК (гіпертрофічний, пігментний, проліферативний); порівняння між собою гістологічних стадій важкості (АК І, АК ІІ, АК ІІІ) та загальне порівняння всіх зразків АК із контрольною групою СК (табл. 4.2).
Таблиця 4.2 – Розподіл значень експресії маркеру р53 при АК та СК (n)
| Клінічна форма | Гістологічна
стадія важкості |
N | до 10% клітин із експресією р53 | 10 % та більше клітин із експресією р53 | р (r) |
| Гіпертрофічна | АК ІІ | 3 | 0 | 3 | р1= 0,327 |
| Всього: | 3 | 0 | 3 | ||
| Пігментна | АК ІІ | 2 | 1 | 1 | |
| Всього: | 2 | 1 | 1 | ||
| Проліферативна | АК І | 1 | 1 | 0 | |
| Проліферативна | АК II | 6 | 3 | 3 | |
| Проліферативна | АК ІІІ | 3 | 1 | 2 | |
| Всього: | 10 | 5 | 5 | ||
| АК | 15 | 6 | 9 | р2=0,007,
(r=0,600) |
|
| СК | 9 | 9 | 0 | ||
| Загальна кількість випадків | 24 | 15 | 9 | ||
Примітки: р1 – різниця між клінічними формами АК (за критерієм χ2 Пірсона), р2 – різниця між групами АК та СК (за ТКФ), r – коефіцієнт кореляції Спірмена.
Експресію р53 на рівні 10% і більше мали 9 із 15 випадків АК (60 %), із них 5 припало на проліферативну форму, 1 на пігментну та 3 на гіпертрофічну. Розподіл гістологічних ступенів важкості продемонстрував тенденцію збільшення експресії р53 із погіршенням ступеня важкості (АК І 0 із 1, АК ІІ 7 із 11 (63,6 %), АК ІІІ 2 із 3 (66,7 %)).
Аналіз взаємозв’язку показників експресії р53 із клінічною формою перебігу АК не показав статистичної значущості (р1= 0,327), як і зв’язку із гістологічним ступенем важкості (р3= 0,723) (табл. 4.3). Але різниця між двома вибірками АК та СК за експресією онкопротеїну р53 цілком очевидна та статистично підтверджена точним тестом Фішера (р2=0,007) (табл. 4.2). За коефіцієнтом рангової кореляції Спірмена знайдено помірний кореляційний зв’язок (r=0,60).
Таблиця 4.3 – Розподіл значень експресії маркеру р53 при АК залежно від гістологічного ступеня важкості (n)
| Гістологічна стадія важкості | n | до 10% клітин із експресією р53 | 10 % та більше клітин із експресією р53 | р (r) |
| АК І | 1 | 1 | 0 | р3= 0,723
(r= 0,068) |
| АК ІІ | 11 | 4 | 7 | |
| АК ІІІ | 3 | 1 | 2 | |
| Всього: | 15 | 6 | 9 |
Примітка. Рівень значимості різниці показників між групами (р3) вказаний за критерієм χ2 Пірсона.
Проліферація клітин характеризує активність процесів регенерації, а також може свідчити про морфологічний атипізм клітин, властивий для неоплазій при надмірній інсоляції. Проведено аналіз проліферативної активності клітин у біопсійному матеріалі шкіри, ураженої АК та СК для порівняння, за допомогою антитіл до універсального маркеру проліферації – білку Ki-67, а також до ко-ферменту сyclin D1, що у зв’язку із залежними кіназами бере активну участь в ініціації мітотичного циклу [20].
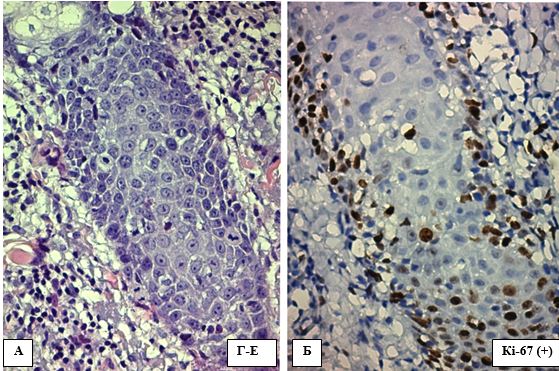
У клітинах, експресуючих Кі-67, відмічалось гомогенне, рідше – крапкове забарвлення виключно ядер коричневого кольору хромогеном ДАБ (рис. 4.9). Інтенсивність забарвлення залежала від фази мітотичного циклу та активності пухлинної клітини. Відсоток експресії або ІП Кі-67 розраховувався в трьох полях зору (гарячих точках) із збільшенням (х400), як відношення забарвлених ядер до всіх подібних (забарвлені + незабарвлені ядра), що обмежені полем зору.
У зразках АК експресія Кі-67 мала досить великий розбіг від 8,30 % до 65,30 % (медіана – 45,87 %), і середнє склало (41,47±19,11) %. Для порівняння показники ІП біоптатів СК були значно нижчими: від 1,4 % до 19,77 % (медіана – 4,0 %), середнє (6,24±5,82) %, з найменшими показниками в акантотичних варіантах перебігу (рис. 4.10) і найбільшими ІП в роздратованих варіантах СК, які ускладнювали диференційну діагностику із АК.
Рисунок 4.9 – А. АК ІІ ступеня, ушкодження епітелію волосяного фолікулу, забарвлення Г-Е, (х400). Б. Інтрануклеарна експресія Кі-67 різної інтенсивності, ІГХ з гематоксиліном Майєра, (х400)
Рисунок 4.10 – А. СК, акантотичний тип, забарвлення Г-Е, (х400).Б. Поодинока інтрануклеарна експресія Кі-67 (червоні стрілки), ІГХ
з гематоксиліном Майєра, (х400)
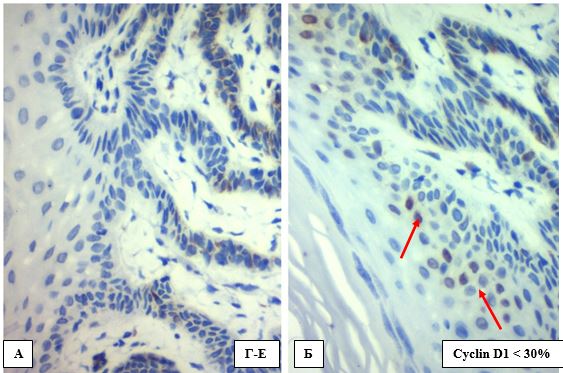
Для можливості аналізу розподілу варіантів експресії Кі-67 за клінічними групами та гістологічними стадіями важкості спостереження обох вибірок (АК та СК) були розподілені на дві підгрупи: до 30 % ядер із експресією Кі-67 (всі зразки СК увійшли до цієї підгрупи); 30 % та більше клітин з позитивною міткою Кі-67.
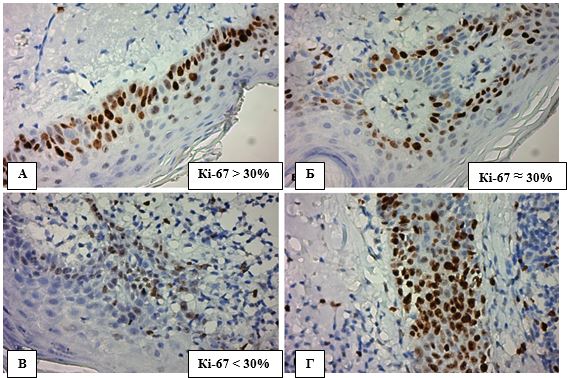
Варіанти експресії Кі-67 в АК представлено на рис. 4.11, дані розподілу занесені в таблицю 4.4.
Рисунок 4.11 – Варіанти експресії Кі-67 в кератиноцитах епідермісупри АК, ІГХ з гематоксиліном Майєра, (х400). А. Позитивна експресія
Кі-67 більше 30%. Б. Позитивна експресія на рівні 30%. В. Позитивна експресія Кі-67 менше ніж 30%. Г. Надмірна експресія Кі-67
в епітелії волосяного фолікулу
ІП на рівні 30 % і більше мали 10 із 15 випадків АК (66,7 %), із них 3 припало на гіпертрофічну форму, 2 на пігментну та 5 на проліферативну. Розподіл гістологічних ступенів важкості збігається із тенденцію розподілу позитивних випадків експресії р53 (збільшення експресії із погіршенням ступеня важкості): АК І 0 із 1, АК ІІ 7 із 11 (63,6 %), АК ІІІ 3 із 3 (100 %)), що доводить більшу агресивність «мутантних клітин», але статистичний аналіз взаємозв’язку ІП за Кі-67 із клінічною формою перебігу АК та гістологічною стадією важкості статистичної значущості не показав (р1=0,201, р3=0,187 відповідно) (табл. 4.4, табл. 4.5.).
Таблиця 4.4 – ІП за експресією Ki-67 спостережень АК та СК, (n)
| Клінічна форма | Гістологічна
стадія |
n | до 30% клітин із експресією Кi-67 | 30 % та більше клітин із експресією Ki-67 | р (r) |
| Гіпертрофічна | АК ІІ | 3 | 0 | 3 | р1= 0,201 |
| Всього: | 3 | 0 | 3 | ||
| Пігментна | АК ІІ | 2 | 0 | 2 | |
| Всього: | 2 | 0 | 2 | ||
| Проліферативна | АК І | 1 | 1 | 0 | |
| Проліферативна | АК II | 6 | 4 | 2 | |
| Проліферативна | АК ІІІ | 3 | 0 | 3 | |
| Всього: | 10 | 5 | 5 | ||
| АК | 15 | 5 | 10 | р2=0,002,
(r=0,655) |
|
| СК | 9 | 9 | 0 | ||
| Загальна кількість випадків | 24 | 14 | 10 | ||
Примітки: р1 – різниця між клінічними формами АК (за критерієм χ2 Пірсона), р2 – різниця між групами АК та СК (за ТКФ), r – коефіцієнт кореляції Спірмена.
Таблиця 4.5 – Розподіл значень експресії маркеру Кі-67 при АК залежно від гістологічного ступеня важкості (n)
| Гістологічна стадія важкості | N | до 30% клітин із експресією Кі-67 | 30 % та більше клітин із експресією Кі-67 | р |
| АК І | 1 | 1 | 0 | р3=0,187 |
| АК ІІ | 11 | 4 | 7 | |
| АК ІІІ | 3 | 0 | 3 | |
| Всього: | 15 | 5 | 10 |
Примітка. р3 – різниця між гістологічними стадіями важкості АК.
Коридори коливання ІП груп СК та АК сильно відрізняються: різниця між ними статистично вірогідна (р2=0,002), знайдено помірний кореляційний зв’язок (r=0,655) (табл. 4.4).
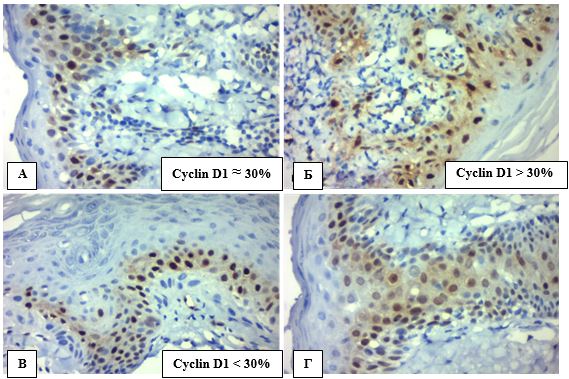
Проліферація АК та СК оцінена за маркером cyclin D1 мала деякі відмінності від ІП за Кі-67. Якщо в цілком доброякісних випадках СК маркер cyclin D1 демонстрував виключно інтрануклеарну експресію поодиноких базальних кератиноцитів, якісно подібну до Кі-67 (рис. 4.12), але трохи нижчу за кількісним рівнем: коливання показників відбувалось від 0,30 % до 7,90 % (медіана 4,70 %), середнє склало 4,13±3,19 %. То в зразках АК експресія cyclin D1 набувала змішаного ядерно-цитоплазматичного характеру, особливо в акантотичних тяжах та ділянках значної атипії (рис. 4.13), що можливо пов’язано із набуванням агресивного фенотипу.
Рисунок 4.12 – А. СК, ретикулярний тип, забарвлення Г-Е, (х400). Б. Строго інтрануклеарна експресія cyclin D1 (на рівні менше 30%)
(червоні стрілки), ІГХ з гематоксиліном Майєра, (х400)
Рисунок 4.13 – Варіанти експресії cyclin D1 в кератиноцитахепідермісу при АК, ІГХ з гематоксиліном Майєра, (х400).
А. Змішана ядерно-цитоплазматична експресія cyclin D1 більше 30%.
Б. Змішана експресія на рівні 30%. В. Змішана експресія cyclin D1
менше ніж 30%. Г. Змішана експресія cyclin D1 в частині клітин
епітелію волосяного фолікулу
Таке контрастне забарвлення передракових клітин АК акантотичних тяжів дозволило більш точно визначити висоту клітинної атипії для верифікації гістологічної стадії важкості, оцінити цілісність базальної мембрани та межі розповсюдження АК для виявлення можливої початкової інвазії плоскоклітинної карциноми. Показники експресії cyclin D1 в АК становили від 8,27 % до 74,78 % (медіана 26,29 %), середнє (30,39±16,19) %. Для подальшого статистичного аналізу всі спостереження було поділено на дві підгрупи відповідним чином (табл. 4.6, табл. 4.7): до 30% ядер із експресією cyclin D1 (всі зразки СК увійшли до цієї підгрупи); 30 % та більше клітин з позитивною міткою cyclin D1.
Таблиця 4.6 – Розподіл варіантів експресії cyclin D1 в спостереженнях АК та СК (n)
| Клінічна форма | Гістологічна
стадія важкості |
N | до 30% клітин із експресією cyclin D1 | 30 % та більше клітин із експресією cyclin D1 | р (r) |
| Гіпертрофічна | АК ІІ | 3 | 1 | 2 | р1=0,411 |
| Всього | 3 | 1 | 2 | ||
| Пігментна | АК ІІ | 2 | 2 | 0 | |
| Всього | 2 | 2 | 0 | ||
| Проліферативна | АК І | 1 | 1 | 0 | |
| Проліферативна | АК II | 6 | 5 | 1 | |
| Проліферативна | АК ІІІ | 3 | 1 | 2 | |
| Всього | 10 | 7 | 3 | ||
| АК | 15 | 10 | 5 | р2=0,118
(r=0,39) |
|
| СК | 9 | 9 | 0 | ||
| Загальна кількість випадків | 24 | 19 | 5 | ||
Примітки: р1 – різниця між клінічними формами АК (за критерієм χ2 Пірсона), р2 – різниця між групами АК та СК (за ТКФ), r – коефіцієнт кореляції Спірмена.
Таблиця 4.7 – Розподіл значень експресії маркеру cyclin D1 при АК залежно від гістологічного ступеня важкості (n)
| Гістологічна стадія важкості | N | до 30% клітин із експресією cyclin D1 | 30 % та більше клітин із експресією cyclin D1 | р |
| АК І | 1 | 1 | 0 | р3 = 0,670 |
| АК ІІ | 11 | 8 | 3 | |
| АК ІІІ | 3 | 1 | 2 | |
| Всього: | 15 | 10 | 5 |
Примітка. р3 – різниця між гістологічними стадіями важкості АК.
Не зважаючи на демонстрацію якісної відмінності експресії cyclin D1 у вибірках АК та СК, статистичний аналіз не показав вірогідної різниці в жодній із груп порівняння, всі р>0,05 (р1=0,411, р2=0,118, р3 = 0,670) (див. табл. 4.6, табл. 4.7).
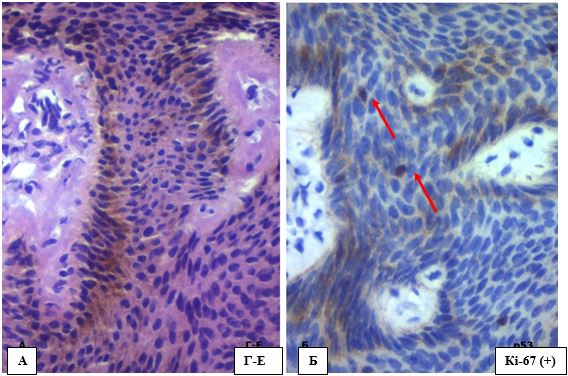
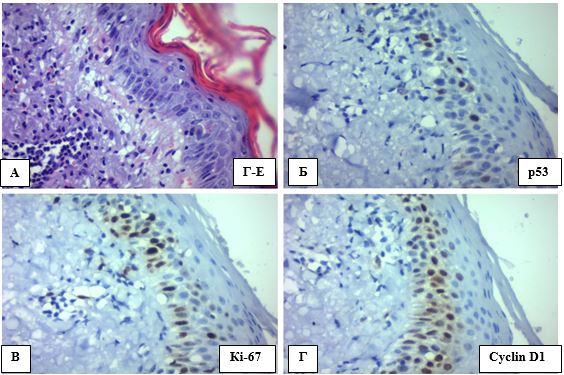
Таким чином, аналізуючи ІГХ профіль зразків АК, можна відокремити наступні особливості: АК здебільшого р53 позитивний (66,7 % випадків р53 (+), а 60 % продемонстрували експресію р53 на рівні більше 10 %), з активною проліферацією в базальних та парабазальних шарах епідермісу незрілих атипових клітин (66,7 % зразків мали ІП більше 30%) та помірною змішаною ядерно-цитоплазматичною експресією cyclin D1 (33,3 % випадків мали експресію вище 30%) (рис. 4.14). До того ж при АК ці зміни зазвичай розповсюджуються на епітелій волосяних фолікулів (рис. 4.15) та себоцити.
Рисунок 4.14 – А. АК ІІ, забарвлення Г-Е, (х400). Б. р53(+), ІГХ з гематоксиліном Майєра, (х400). В. ІП за Кі-67 на рівні до 30%,
ІГХ з гематоксиліном Майєра, (х400). Г. Ядерно-цитоплазматична експресія cyclin D1, ІГХ з гематоксиліном Майєра, (х400)
Додатково були визначені тенденції збільшення сили експресії маркерів р53 та Кі-67 із підвищенням гістологічного ступеня важкості (від АК І до АК ІІІ).
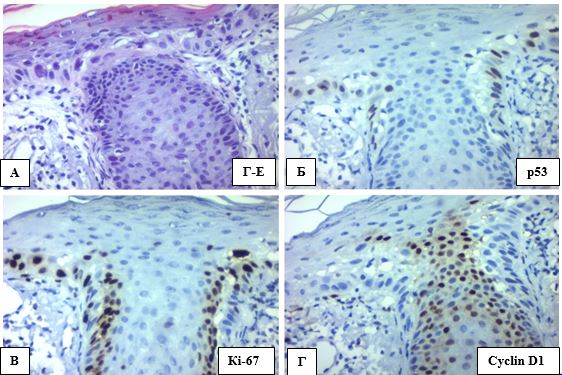
Рисунок 4.15 – А. Епітелій волосяного фолікулу, АК ІІ, забарвлення Г-Е, (х400). Б. р53 (+), ІГХ з гематоксиліном Майєра, (х400).
В. Експресія Кі-67 базальних та парабазальних клітин, ІГХ з гематоксиліном Майєра, (х400). Г. Змішана експресія cyclin D1,
ІГХ з гематоксиліном Майєра, (х400)
На відміну від АК, в зразках СК спостерігається виключно негативна р53 реакція (100 % спостережень), рівень проліферативної активності рідко досягає більше 10% (частіше в роздратованих варіантах перебігу – 2 спостереження із 9), експресія маркеру cyclin D1 низька і носить виключно інтрануклеарний характер (рис. 4.16). Аналіз подібності сукупностей АК та СК за точним тестом Фішера показав різницю за експресією маркерів р53 та Кі-67 (рр53=0,007 (r=0,60), ркі-67=0,002, (r=0,655) відповідно).
Рисунок 4.16 – А. СК, акантотичний тип, забарвлення Г-Е, (х400). Б. Негативна експресія мутантного р53, ІГХ з гематоксиліном Майєра, (х400). В. Поодинока експресія маркеру Кі-67, ІГХ з гематоксиліном Майєра, (х400). Г. Виключно ядерна експресія cyclin D1, ІГХ з гематоксиліном Майєра, (х400)
4.3 Оцінка експресії імуногістохімічних маркерів васкуляризації (CD34) та стромальної деградації (матриксної металопротеїнази 9 типу, маркера тканинного інгібітора протеїнази – 1) при актинічному
і себорейному кератозах
Кількість судин новоутворення шкіри характеризують стан трофіки, демонструють напрямок подальшого розвитку у зв’язку із можливим метастазуванням. За результатами досліджень інших авторів із підвищенням ступеня атипії кількість судин підвищується [2, 14, 15, 27, 35, 114], тому теоретично АК, як облігатний передрак, повинен мати певні переваги перед СК, як доброякісним новоутворенням, в кількості судин поверхневої дерми. ІГХ маркер загальної ендотеліальної диференціації CD34 дозволяє візуалізувати судинну стінку і оцінити кількість та якість цього компоненту дерми для підтвердження чи спростування висунутої гіпотези.
Для кількісної оцінки судинного компоненту дерми ми підраховували середню кількість судин в полі зору при збільшені х400 із 3 гарячих точок поверхневих відділів дерми безпосередньо під диспластичним епідермісом (для АК) / в дермальних сосочках (для СК). Для якісної оцінки стану судин (спазм або дилятація) розраховувались середні діаметри судин (в мкм) з використанням мірної шкали мікроскопу кожної із підгруп порівняння.
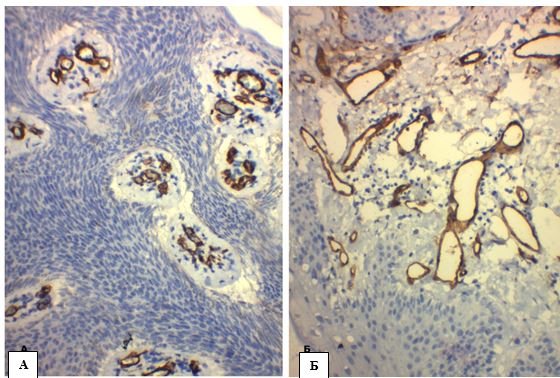
Стосовно васкуляризації СК, треба зазначити, що акантоз, який був притаманний всім випадкам цього новоутворення, формував сосочки дерми (рис. 4.17) з розгалуженою сіткою капілярів та венул. Але більш глибокі шари дерми мали звичайний вигляд без патологічних змін. Таким чином, CD34 – позитивна ангіоархітектоника СК (при збільшенні х400), за даними цього дослідження, характеризувалася скупченнями судин від 2 до 8 в п/з (медіана 4, середнє M±SD – 4,22±1,85), діаметром від 53,537 мкм до 86,368 мкм (медіана 72,729 мкм, середнє – (70,743±12,928) мкм).
Рисунок 4.17 – А. СК, ретикулярний тип, мембрана експресія СD34 капілярів малих діаметрів, ІГХ з гематоксиліном Майєра, (х400). Б. СК, акантотичний тип, мембрана експресія СD34 дилятованих венул, ІГХ з гематоксиліном Майєра, (х400). В. СК: скупчення судин середніх діаметрів в сосочках дерми, мембрана реакція з СD34, ІГХ з гематоксиліном Майєра, (х400). Г. СК: деформована судина між кератиновими кістами, мембрана експресія СD34,
ІГХ з гематоксиліном Майєра, (х400)
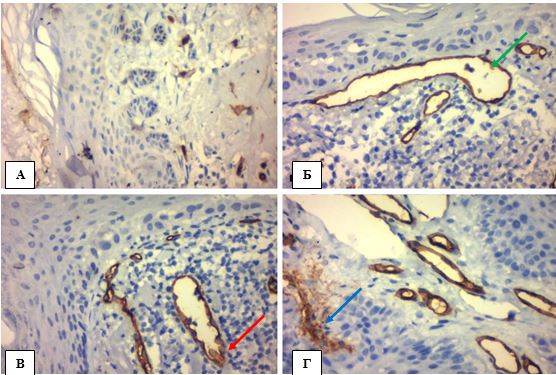
На відміну від СК розташування судин в зразках АК мало інші структурні орієнтири (рис. 4.18). Акантоз АК у вигляді брунькування мав незначний вплив на розташування основної маси капілярів та венул (рис. 4.19 А), більшою мірою кількість судин з химерними формами збільшувалась безпосередньо під диспластичним базальним шаром епідермісу. Судини знаходились в стані дилятації, спазму або навіть формували патологічну капілярну сітку синусоїдного типу, що в деяких випадках унеможливлювало підрахунок їх кількості (рис. 4.19 Б-Г).
Рисунок 4.18 – А. СК, експресія CD34 ендотелію скупчених судин сосочків дерми, ІГХ з гематоксиліном Майєра (х400). Б. АК ІІ тип,
реакція CD34 ендотелію хаотично розташованих судин поверхневої дерми, ІГХ з гематоксиліном Майєра (х400)
До того ж при АК щільність мікросудин (ЩМС) значно збільшувалась в ділянках запалення і акантотичного еластозу поверхневої дерми (рис. 4.20 А, Б). Ангіоархітектоніка більш глибоких шарів дерми також набувала патологічних змін за рахунок формування сітки із спотворених капілярів синусоїдного типу навколо диспластичного епітелію волосяних фолікулів та сальних залоз (рис. 4.20 В, Г). Треба зазначити, що така структурна перебудова судинного компоненту дерми при АК значно ускладнює диференційну діагностику з іншими ангіопроліферативними захворюваннями шкіри, такими як розацеа та гемангіоми.
Рисунок 4.19 – АК: мембранна реакція ендотелію судин з СD34, ІГХ з гематоксиліном Майєра, (х400). А. Акантотичні тяжі у вигляді «брунькування» з невеликими судинами навколо. Б. Дилятовані судини безпосередньо під диспластичним епідермісом (зелена стрілка). В. Зморщені судини – ендотелій частоколом (червона стрілка). Г. Сітка капілярів синусоїдного типу (синя стрілка)
Аналіз CD34 – позитивної васкуляризації в зразках АК (при збільшенні х400) виявив кількість судин від 4 до 15 в п/з (медіана 7, середнє – 7,33±2,49), діаметром від 76,225 мкм до 262,481 мкм (медіана 140,415 мкм, середнє – (138,98±47,46) мкм). Для подальшої статистичної обробки даних, враховуючи значення медіани для АК (7 судин в п/з), всі спостереження були розподілені на дві підгрупи: з ЩМС (< 7 в п/з): 6 спостережень АК та більшість СК (8 із 9); з високою ЩМС (≥ 7 в п/з), один випадок СК також потрапив в цю групу.
Рисунок 4.20 – АК: мембранна реакція ендотелію судин з СD34, ІГХ з гематоксиліном Майєра, (х400). А. Судини в ділянці
акантотичного еластозу (червона стрілка). Б. Розширені судини неправильної форми в місцях запалення. В. Сітка тонких капілярів
навколо волосяного фолікулу. Г. Сітка капілярів навколо сальної залози
Дані розподілу занесені в таблиці 4.8 та 4.9. Знайдено вірогідний кореляційний зв’язок середньої сили (r=0,480) між збільшенням ЩМС і наявністю діагнозу АК, порівняно із СК (р2<0,05). Але між клінічними варіантами та гістологічними стадіями важкості АК вірогідної різниці знайдено не було (р1>0,05, р3>0,05 відповідно) (табл. 4.8, табл. 4.9).
Діаметри судин за експресією маркеру CD34 в зразках СК коливались від 53,534 мкм до 86,368 мкм (медіана 72,729 мкм, середнє – (70,74 ± 12,93) мкм). Порівнюючи стан судин при СК і АК, виявилося суттєве (в 1,96 разу) збільшення діаметрів в останній групі, за рахунок кавернозно-подібних новоутворених судин (р<0,001 за t-критерієм Стьюдента).
Таблиця 4.8 – Щільність мікросудин в зразках АК та СК (n)
| Клінічна форма | Гістологічна стадія | N | ЩМС < 7 в п/з | ЩМС ≥ 7 в п/з | р (r) |
| Гіпертрофічна | АК ІІ | 3 | 1 | 2 | р1=0,748 |
| Всього | 3 | 1 | 2 | ||
| Пігментна | АК ІІ | 2 | 0 | 2 | |
| Всього | 2 | 0 | 2 | ||
| Проліферативна | АК І | 1 | 0 | 1 | |
| Проліферативна | АК II | 6 | 2 | 4 | |
| Проліферативна | АК ІІІ | 3 | 3 | 0 | |
| Всього | 10 | 5 | 5 | ||
| АК | 15 | 6 | 9 | р2=0,033,
(r=0,480) |
|
| СК | 9 | 8 | 1 | ||
| Загальна кількість випадків | 24 | 14 | 10 | ||
Примітки: р1 – різниця між клінічними формами АК (за критерієм χ2 Пірсона), р2 – різниця між групами АК та СК (за ТКФ), r – коефіцієнт кореляції Спірмена.
Таблиця 4.9 – Розподіл кількості судин за експресією маркеру CD34 при АК залежно від гістологічного ступеня важкості, враховуючи значення медіани (n)
| Гістологічна стадія
важкості |
n | ЩМС < 7 в п/з | ЩМС ≥ 7 в п/з | р |
| АК І | 1 | 0 | 1 | р3=0,440 |
| АК ІІ | 11 | 3 | 8 | |
| АК ІІІ | 3 | 3 | 0 | |
| Всього: | 15 | 6 | 9 |
Примітка. р3 – різниця між гістологічними стадіями важкості АК .
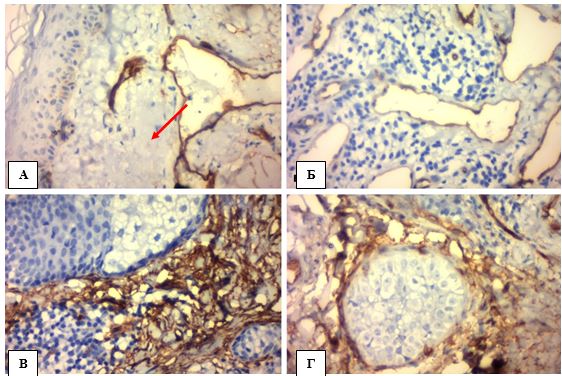
Патологічна надекспресія маркеру стромальної деградації ММР-9 або желатінази В здебільшого описана для злоякісних пухлин як показник порушення колагенового компоненту базальної мембрани з можливою інвазією [23, 33]. АК розглядається як потенційний Ca in situ і потребує ретельної диференційної діагностики із інвазивною плоскоклітинною карциномою. Рівень експресії ферменту ММР-9 в атипових кератиноцитах можна визначити завдяки однойменному ІГХ маркеру, який в нормальному епідермісі демонструє виключно цитоплазматичну експресію слабкої інтенсивності всіх шарів окрім рогового і звичайно підвищує інтенсивність експресії в «гарячих точках» васкуляризації. Подібну тенденцію можна спостерігати в зразках АК із слабкою дисплазією, але із збільшенням важкості клітинної атипії кератиноцитів сильніше проявляється аберрантне ядерно-цитоплазматичне забарвлення епідермісу (рис. 4.21).
Рисунок 4.21 – А. АК із слабкою атипією – виключно цитоплазматична експресія ММР-9 базальних та парабазальних клітин з відсутністю ІГХ міток в роговому шарі навіть при наявності паракератозу, ІГХ з гематоксиліном Майєра, (х400). Б. Помірне (++) цитоплазматичне забарвлення і інтенсивна ядерна реакція з ММР-9 атипових кератиноцитів в АК ІІ ступеня, ІГХ з гематоксиліном Майєра, (х400). В. «Гаряча точка» із CD34 (+) тонких капілярів навколо диспластичного епітелію, ІГХ з гематоксиліном Майєра, (х400). Г. Помірна (++) змішана реакція з ММР-9 в епідермісі навколо ділянки «гарячої точки», ІГХ з гематоксиліном Майєра, (х400)
Окрім аберрантної ІГХ реакції, експресія ММР-9 в АК мала ще декілька характерних відмінностей. По-перше, привертали увагу, так звані, «кластери» більш інтенсивного цитоплазматичного забарвлення, як прояви «мутантного фенотипу» кератиноцитів; далі, в ділянках атрофії епідермісу взагалі атипові клітини можна було знайти за ядерним фарбуванням, що значно перевищувало слабке (+) цитоплазматичне забарвлення; до того ж, реакція ММР-9 в ядрах атипових клітин за інтенсивністю співпадала із запальним інфільтратом, що рясно супроводжував ділянки дисплазії; і нарешті, всі ці зміни звичайно розповсюджувались на фолікулярний епітелій та себоцити (рис. 4.22).
Рисунок 4.22 – АК: варіанти експресії ММР-9, ІГХ з гематоксиліном Майєра, (х400). А. Кластерна експресія ММР-9 від ++ до +++ «мутантних» кератиноцитів (червоні стрілки). Б. Змішана ядерно-цитоплазматична експресія ММР-9 в епітелії волосяного фолікулу та себоцитах. В. Атрофія епідермісу – ядерна реакція ММР-9 атипових клітин і її відсутність в роговому шарі (синя стрілка). Г. Надмірна (+++)
експресія ММР-9 ядер і запального інфільтрату поверхневих шарів дерми
Експресія ММР-9 в АК загалом продемонструвала три варіанти: слабка цитоплазматична (+) без ядер (3 із 15), слабка (+) цитоплазматична з надмірно (+++) забарвленими ядрами (5 із 15) та помірна цитоплазматична (++) із надмірною (+++) реакцією ядер (7 із 15), більшість із останньої групи стали АК ІІ ступеня важкості. Всі варіанти експресії ММР-9 були занесені в таблицю 4.10.
Таблиця 4.10 – Варіанти експресії ММР-9 в зразках АК та СК (n)
| Клінічна
форма |
Гістологічна стадія | n | Варіанти експресії ММР-9 | р (r) | |||
| Слабка (+)
цитоплазматична |
Помірна (++)
цитоплазматична |
Слабка (+)
цитоплазматична з забарвленням ядер |
Помірна (++)
цитоплазматична з забарвленням ядер |
||||
| Гіпертрофічна | АК ІІ | 3 | 1 | 2 | р1=0,400 | ||
| Всього | 3 | 1 | 0 | 0 | 2 | ||
| Пігментна | АК ІІ | 2 | 1 | 1 | |||
| Всього | 2 | 1 | 0 | 1 | 0 | ||
| Проліферативна | АК І | 1 | 1 | ||||
| Проліферативна | АК II | 6 | 2 | 4 | |||
| Проліферативна | АК ІІІ | 3 | 2 | 1 | |||
| Всього | 10 | 1 | 0 | 4 | 5 | ||
| АК | 15 | 3 | 0 | 5 | 7 | р2=0,002,
(r=0,721) |
|
| СК | 9 | 4 | 4 | 1 | 0 | ||
| Загальна кількість випадків | 24 | 8 | 4 | 6 | 7 | ||
Примітки: р1 – різниця між клінічними формами АК (за критерієм χ2 Пірсона), р2 – різниця між групами АК та СК (за критерієм χ2 Пірсона), r – коефіцієнт кореляції Спірмена.
Для порівняння, підгрупа СК, більшою мірою, мала звичайне рівномірне цитоплазматичне забарвлення ММР-9 (рис. 4.23), окрім одного випадку з підвищеною проліферативною активністю (ІП за Кі-67 для випадку становив 19,77 %) та деякою клітинною атипією (рис. 4.24 А). 8 інших спостережень СК із цитоплазматичною реакцією ММР-9 за інтенсивністю розподілилися порівну: 4 випадки (+) та 4 (++) (табл. 4.10). Треба відзначити, що наявність пігменту базального шару, в стромі або дифузно розташованого в зразках СК, іноді заважала правильно оцінити градацію реакції ММР-9, тому інтенсивність пігментного забарвлення бралась до уваги на зрізах із Г-Е та оцінюванню підлягали безпігментні ділянки (рис. 4.24 Б-Г).
Рисунок 4.23 – Помірна (++) рівномірна цитоплазматична реакція ММР-9 в базалоїдних кератиноцитах СК, ІГХ з гематоксиліном Майєра,
(х400). А. Аберрантна ядерно-цитоплазматична реакція ММР-9 у ділянці атрофії при АК, ІГХ з гематоксиліном Майєра, (х400)
Таким чином експресія ММР-9 в СК також мала три варіанти: слабка цитоплазматична (+) без ядер (4 із 9), помірна цитоплазматична (++) без ядер (4 із 9) і слабка (+) цитоплазматична з помірно (++) забарвленими ядрами (1 із 9).
Аналізуючи дані розподілу варіантів експресії ММР-9 в АК за трьома вказаними клінічними формами різниці виявлено не було (р1=0,400), як і за гістологічними стадіями важкості (р3=0,385) (табл. 4.11); але при порівнянні підгруп АК та СК визначено відносно сильний кореляційний зв’язок (р2=0,002, r=0,721), що доводить незалежну діагностичну вагомість маркеру ММР-9 стосовно АК, порівняно із СК (табл. 4.10). Наявність аберрантної експресії маркеру ММР-9 в ядрах кератиноцитів додатково говорить про наявність клітинної атипії і служить надійним прогностичним показником підвищення проліферативної активності.
Рисунок 4.24 – CК: варіанти експресії ММР-9, ІГХ з гематоксиліном Майєра, (х400). А. Поодинока помірна (++) ядерна реакція на тлі слабкої (+) цитоплазматичної експресії ММР-9. Б. Слабка (+) цитоплазматична експресія, в базальному шарі та стромі багато пігменту, що не береться до уваги. В. Слабка (+) цитоплазматична реакція, дифузно розташований пігмент ускладнює інтерпретацію результату. Г. Помірна (++) цитоплазматична реакції із ММР-9
Таблиця 4.11 – Варіанти експресії ММР-9 в залежності від гістологічної стадії важкості АК (n)
| Гістологічна стадія важкості | n | Варіанти експресії ММР-9 | Р | |||
| Слабка (+)
цитоплазма-тична |
Помірна (++)
цитоплазма-тична |
Слабка (+)
цитоплазма-тична з над-мірною (+++) ядерною |
Помірна (++)
цитоплазматична з надмірною (+++) ядерною |
|||
| АК І | 1 | 1 | 0 | 0 | 0 | р3=0,385 |
| АК ІІ | 11 | 2 | 0 | 3 | 6 | |
| АК ІІІ | 3 | 0 | 0 | 2 | 1 | |
| Всього: | 15 | 3 | 0 | 5 | 7 | |
Примітка. р3 – різниця між гістологічними стадіями важкості АК.
Порушення базальної мембрани, як початковий етап реконструкції стромального компоненту новоутворення шкіри та його трансформації в інвазивну форму, вірогідно пов’язане із дисбалансом експресій матриксних металопротеїназ (ММП) та їх інгібіторів (TIMР). За даними літератури, атипові кератиноцити в інвазивних ПР, що експресують різні ММР з високою інтенсивністю, повністю втрачають їх антагоністів TIMР [97, 145, 161]. Для перевірки порушення/втрати експресії ТІМР-1 в зразках АК (в порівнянні із СК) було проведене ІГХ дослідження з однойменним маркером, експресія якого також оцінювалась візуальним напівкількісним методом за інтенсивністю забарвлення з урахуванням субклітинної локалізації ІГХ мітки.
Для АК мали місце 5 градацій експресії ТІМР-1: відсутність реакції (-), дуже слабка кластерна цитоплазматична експресія окремих клітин (+/-), слабка цитоплазматична (+), помірна цитоплазматична (++), слабка цитоплазматична (+) із залученням ядер (рис. 4.25). Дані розподілу за клінічним формами та стадіями гістологічної важкості занесені в таблиці 4.12 та 4.13 відповідно.
У біоптатах СК інтенсивність експресії ТІМР-1 не перевищувала (+) слабкої (рис. 4.26), але 1 випадок, що показав аберрантну експресію ММР-9, мав також і ядерно-цитоплазматичне забарвлення ТІМР-1 (табл. 4.12).
Аналіз розподілу варіантів експресії ТІМР-1 в АК за клінічними формами, гістологічними стадіями важкості різниці між підгрупами не виявив (р1=0,691, р3= 0,492 відповідно). При порівнянні когорт АК та СК за експресією ТІМР-1 статистично вірогідного зв’язку не знайдено (р2=0,305), але виявлено, що наявність аберрантної експресії маркеру ТІМР-1 часто співпадає із подібним явищем при ММР-9.
Рисунок 4.25 – АК: варіанти експресії ТІМР-1 в кератиноцитах, ІГХ з гематоксиліном Майєра, (х400). А. Дуже слабка кластерна
цитоплазматична експресія окремих клітин (+/-). Б. Слабка рівномірна цитоплазматична (+) реакція. В. Слабка змішана ядерно-цитоплазматична (+) реакція. Г. Помірна інтенсивність (++) цитоплазматичної реакції
Таблиця 4.12 – Варіанти експресії ТІМР-1 в зразках АК та СК (n)
| Клінічна
форма |
Гістологічна стадія
АК |
n | Варіанти експресії ТІМР-1 | Р | ||||
| Негативна
(-) |
Дуже слабка
кластерна (+/-) |
Слабка (+)
цитоплазма-тична |
Помірна (++)
цитоплазма-тична |
Слабка (+)
цитоплазма-тична з забарвлен-ням ядер |
||||
| Гіпертрофічна | АК ІІ | 3 | 1 | 1 | 1 | р1=0,691 | ||
| Всього | 3 | 1 | 0 | 0 | 1 | 1 | ||
| Пігментна | АК ІІ | 2 | 1 | 1 | ||||
| Всього | 2 | 1 | 0 | 0 | 0 | 1 | ||
| Проліферативна | АК І | 1 | 1 | |||||
| Проліферативна | АК II | 6 | 2 | 2 | 2 | |||
| Проліферативна | АК ІІІ | 3 | 1 | 2 | ||||
| Всього | 10 | 2 | 3 | 0 | 0 | 4 | ||
| АК | 15 | 4 | 3 | 1 | 1 | 6 | р2=0,305 | |
| СК | 9 | 2 | 3 | 3 | 0 | 1 | ||
| Загальна кількість випадків | 24 | 6 | 6 | 4 | 1 | 7 | ||
Таблиця 4.13 – Варіанти експресії ТІМР-1 в залежності від гістологічної стадії важкості АК (n)
| Гістологічна стадія важкості АК | n | Варіанти експресії ММР-9 | Р | ||||
| Негативна
(-) |
Дуже слабка
кластерна (+/-) |
Слабка (+)
цитоплазма-тична |
Помірна (++)
цитоплазма-тична |
Слабка (+)
цитоплазма-тична з над-мірною (+++) ядерною |
|||
| АК І | 1 | 1 | р3= 0,492 | ||||
| АК ІІ | 11 | 4 | 2 | 1 | 1 | 4 | |
| АК ІІІ | 3 | 1 | 2 | ||||
| Всього: | 15 | 4 | 3 | 1 | 1 | 6 | |
Примітка. р3 – різниця між гістологічними стадіями важкості АК.
Рисунок 4.26 – СК: варіанти експресії ТІМР-1, ІГХ з гематоксиліном Майєра, (х400). А. Поодинока помірна (++) ядерна реакція на тлі
слабкої (+) цитоплазматичної експресії ММР-9. Б. Дуже слабка кластерна цитоплазматична експресія окремих клітин (+/-) на тлі
дифузно розташованого. В. Слабка рівномірна цитоплазматична (+) реакція. Г. Помірна інтенсивність (++) цитоплазматичної реакції
* * *
Аналіз васкуляризації груп дослідження, що включав розрахунок щільності мікросудин «гарячих точок» та середніх діаметрів при збільшенні (х400) виявив вірогідне збільшення кількості судин в АК, порівняно із СК (р2=0,033, r=0,480), а також подвійне збільшення діаметрів судин в групі АК, пов’язане з формуванням спотворених кавернозно-подібних новоутворених судин навколо ділянок дисплазії епідермісу (р<0,001).
При оцінюванні протеолітичної активності в зразках АК та СК за експресією матриксної металопротеїнази 9 типу та її антагоністу ТІМР-1, визначено тільки відносно сильний кореляційний зв’язок за експресією ММР-9 (р2=0,002, r=0,721), але наявність аберрантної експресії маркеру ММР-9 та ТІМР-1 в обох підгрупах додатково говорить про наявність клітинної атипії і служить надійним прогностичним показником підвищення проліферативної активності.
Матеріали розділу опубліковані у наступних виданнях:
- Оцінка стану проліферативної активності та експресії онкомаркеру p53 в зразках актинічного кератозу / В. С. Глушок, Т. В. Святенко, І. С. Шпонька, О. В. Пославська. Морфологія. 2017. Т. 11, № 3. С. 6–12 [28].
- Глушок В. С. Аналіз процесів васкуляризації та деградації позаклітинного матриксу при актинічному кератозі. Український журнал дерматології, венерології, косметології. 2017. № 4 (67). С. 22–27 [5].
- Глушок В. С., Святенко Т. В., Шпонька І. І., Пославська О. В. Спосіб діагностики актинічного кератозу: пат. 125617 Україна: МПК (2018.01), GO1N21/00; заявл. 22.01.2018; опубл. 10.05.2018, Бюл. № 9 [10].
- Mixed nuclear-cytoplasmic immunostaining for cyclin D1, MMP-9, TIMP-1 in actinic keratosis and correlation with cellular proliferation / V. S. Hlushok, T. V. Sviatenko, I. Shponka, O. V. Poslavska. Derma 3. Tisícročia. 2018. T. XVIII, № 1-2. P. 16–24 [134].
РОЗДІЛ 5
Обгрунтування алгоритму лікування пацієнтів
з актинічним кератозом
5.1 Комбінована послідовна терапія актинічного кератозу
Лікування АК залишається актуальною проблемою в дерматології, оскільки на даний час не існує єдиних рекомендацій чи алгоритмів, немає клінічного протоколу в Україні, які б давали можливість практикуючим лікарям вибрати найбільш адекватне лікування. Необхідність проведення ефективного лікування пояснюється клінічною значимістю АК і, в першу чергу, можливістю його трансформації у ПКРШ. Важливе значення для вибору лікувальної тактики має і факт формування видимого косметичного дефекту з розвитком вогнищ АК і у подальшому, після проведення їх лікування.
Вибираючи з багаточисельних методів, які довготривало застосовуються у практиці в різних країнах світу для лікування АК, було враховано, що за даними груп експертів, ефективність методики слід оцінювати щонайменше за трьома показниками: ступенем розрішення вогнищ АК, частотою виникнення рецидивів, профілем побічної дії. При формуванні терапевтичної стратегії для комбінованого лікування, крім вищевказаних показників, ще приймали до уваги механізм дії кожного методу, прогнозовану тривалість курсу лікування, вартість процедур, доступність для пацієнтів, їх індивідуальні потреби, від яких залежить прихильність (комплаєнтність) пацієнтів до лікування. Патогенетичне обґрунтування запропонованого комбінованого лікування базувалось на результатах власних патоморфологічних і ІГХ досліджень, які підтверджують високий проліферативний потенціал у вогнищах АК, в т.ч. за рахунок судинного компоненту, який завжди демонструє стан трофіки новоутворення і можливості метастазування.
Традиційною методикою, яка найчастіше застосовується для лікування АК, є кріодеструкція вогнищ, тому було розглянуто її застосування в комбінованій терапії АК. Перевагами цього методу є доступність, простота, низька потреба в анестезії. Недоліки – виникнення болю в час виконання процедури і деякий час після неї, виникнення таких побічних ефектів після лікування, як утворення міхурів або ерозій, які вкриваються кірочками, часте формування таких косметичних дефектів після лікування, як депігментації і рубці [56, 82, 102, 113].
При визначенні тривалості кріодеструкції у комбінованій терапії пацієнтів з АК, ми керувались даними літератури про те, що тривалість кріовпливу на вогнища знаходиться у прямій залежності як із ступенем розрішення патологічно змінених ділянок шкіри, уражених АК, так і з вираженістю таких побічних явищ, як депігментація і рубцювання. Так, при заморожуванні вогнища і 1мм шкіри навколо менше 5 сек., повна деструкція є очікуваною лише у 39 % випадків, при збільшенні тривалості заморожування від 6 до 20 сек. – у 69 %, а при заморожуванні довше 20 сек., відповідно у 83 % [85, 107, 113]. Емпірично було визначено оптимальну тривалість заморожування у комбінованій терапії в інтервалі 10-15 сек., розраховуючи на максимальний позитивний ефект і мінімальні побічні впливи. Оскільки вогнища з вираженим гіперкератозом потребують більш тривалого заморожування, для відшарування гіперкератотичних нашарувань застосували 5 % саліцилову мазь напередодні кріотерапії.
Серед останніх сучасних методів, які знайшли своє застосування в лікуванні АК, нас зацікавила IPL-терапія. Дані про спроби використання цієї методики в лікуванні АК з’явились порівняно недавно, а перші отримані результати дозволили припустити, що IPL може бути ефективною як при самостійному використанні, так і в комбінації з іншими методами, що потребує проведення подальших досліджень. Важливими є безпечність цих процедур, здатність попереджувати рубцювання, викликати оклюзію стінок патологічних судин шляхом фотокоагуляції при збереженні цілісності і неушкодженні епідермісу. В час процедури здійснюється вплив короткочасними світловими спалахами на приблизно 5 см2 поверхні шкіри, який, за даними літератури, є позитивним для процесу регенерації фотоушкодженої шкіри, що має місце при АК [61, 74, 124].
З урахуванням вищезазначеного, розроблено трьохетапний алгоритм комбінованої терапії, спрямований на послідовне видалення ділянок атипових проліфератів кератиноцитів, на зниження васкуляризації у наявних осередках АК і у потенційно можливих нових, ще невидимих, утвореннях на прилягаючих ділянках шкіри, а також на покращення стану фотоушкодженої шкіри, на якій можуть виникати і прогресувати нові осередки АК. Видалення проводили шляхом попереднього нанесення кератолітичного засобу – 5 % саліцилової мазі двічі щодня впродовж 5-7 днів до відшарування лусочок і кірочок з наступними сеансами ІРL (з довжиною хвилі 560-1200 нм, імпульсом 22-26 Дж/см2) № 3-5 у режимі, відповідному до фототипу шкіри пацієнта, 1 раз у 7-10 днів, в залежності від вираженості місцевої реакції в зоні впливу. Наступним у комбінованій терапії було проведення кріодеструкції спреєм рідкого азоту тривалістю 10-15 сек одноразово, з допомогою Brymill’s Cry-Ac®. Курс лікування тривав 1-2 місяці.
5.2 Порівняльна оцінка ефективності різних методик лікування актинічного кератозу
З метою проведення порівняльного оцінювання результатів ефективності запропонованої комбінованої послідовної терапії пацієнтів було рандомізовано на дві групи. Пацієнти, які ввійшли до 1-ої групи (58 осіб), отримували комбіновану терапію, пацієнтам 2-ї групи (32 особи), було проведено лише кріодеструкцію рідким азотом (методика монотерапії). Як було показано у розділі 2, обидві терапевтичні групи були статистично спіставними (p>0,05) за віком, статтю і місцем проживання пацієнтів (див. табл. 2.3), а також за клінічними формами АК, ступенем важкості АК, фототипами шкіри (табл. 5.1).
Таблиця 5.1 – Порівняння терапевтичних груп хворих на АК за ступенем важкості, фототипом шкіри і клінічним варіантом АК, абс. (%)
| Показник | 1-а група (комбінована терапія) (n=58) | 2-а група (монотерапія)
(n=32) |
Значимість різниці між групами (р) | |
| Ступінь важкості АК | І | 12 (20,7 %) | 11 (34,4 %) | 0,207 |
| ІІ | 29 (50,0 %) | 12 (37,5 %) | 0,278 | |
| ІІІ | 17 (29,3 %) | 9 (28,1 %) | 1,00 | |
| Фототип шкіри | І | 1 (1,7 %) | 2 (6,3 %) | 0,287 |
| ІІ | 42 (72,4 %) | 24 (75,0 %) | 1,00 | |
| ІІІ | 15 (25,9 %) | 6 (18,8 %) | 0,604 | |
| Клінічний варіант АК | пігментний | 17 (29,3 %) | 6 (18,8 %) | 0,321 |
| проліферативний | 35 (60,3 %) | 24 (75,0 %) | 0,175 | |
| гіпертрофічний | 5 (8,6 %) | 2 (6,3 %) | 1,00 | |
Примітка. Рівень значимості різниці показників між групами (р) вказаний за ТКФ
Результати проведеного лікування простежені в усіх пацієнтів обох груп та ґрунтувались на даних суб’єктивних оцінок відчуттів, а також на даних розширеного аналізу і порівняльної оцінки всієї суб’єктивної та об’єктивної симптоматики АК за оцінкою клінічних проявів візуально і проведенням дерматоскопії через 3 місяці і 1 рік від початку лікування.
5.2.1 Динаміка регресу клінічних проявів захворювання після проведеної монотерапії
З використанням методики монотерапії (кріодеструкції рідким азотом) проліковано 32 пацієнтів. У 8 пацієнтів (25,0 %) було виявлено одне вогнище АК, у 19 (59,4 %) – два, у 5 (15,6 %) – три вогнища ураження. У 6 пацієнтів (18,8 %) було встановлено проліферативний клінічний варіант АК, у 2 (6,3 %) – гіпертрофічний, у 6 (18,8 %) – пігментний.
Аналіз динаміки скарг пацієнтів показав, що через 3 місяці після проведення кріодеструкції вірогідно (p<0,05) зменшився відсоток пацієнтів, які мали скаргу на свербіж, сухість, почервоніння і шорсткість шкіри (табл. 5.2). Жоден з пацієнтів через 3 місяці не висловлював скарг на наявність кірочок і кровоточивість.
Таблиця 5.2 – Динаміка скарг хворих на АК на тлі монотерапії
| Скарга | До початку терапії | Через 3 місяці | Через 12 місяців |
| Свербіж | 13 (40,6 %) | 6 (18,8 %)* | 7 (21,9 %) |
| Сухість | 16 (50,0 %) | 6 (18,8 %)** | – *** |
| Почервоніння | 27 (84,4 %) | 6 (18,8 %)*** | 2 (6,3 %)*** |
| Шорсткість | 32 (100,0 %) | 15 (46,9 %)*** | 9 (28,1 %)*** |
| Наявність кірочок | 18 (56,3 %) | – *** | 9 (28,1 %)* |
| Кровоточивість | 3 (9,4 %) | – | – |
Примітка. * – p<0,05; ** – p<0,01; *** – p<0,001 порівняно з початковим рівнем
Через 12 місяців жоден пацієнт не мав скарги на сухість шкіри і на кровоточивість, лише двох (6,3 %) турбувало почервоніння, тоді як до початку лікування цю скаргу висловлювали 27 (84,4 %) пацієнтів. На свербіж і шорсткість мали скарги відповідно 7 (21,9 %) і 9 (28,1 %). Через 12 місяців у 9 (28,1 %) знову появилась скарга на наявність кірочок на шкірі.
У жодного з 32 пацієнтів поверхня шкіри до проведення монотерапії не була гладкою. Як видно з даних таблиці 5.3, методом монотерапії досягнуто часткової позитивної динаміки: гладкість шкіри відмічалась у 40,6 % пацієнтів через 3 місяці і у 59,4 % пацієнтів через 12 місяців. Злегка шорсткою була шкіра у 15 (46,9 %) пацієнтів після терапії через 3 місяці, тоді як до лікування лише у 12 (37,5 %) пацієнтів шкіра була злегка шорсткою. Через 12 місяців відсоток пацієнтів, котрі мали таку оцінку поверхні шкіри, зменшився до 9,4 % (p<0,01). Якщо через 3 місяці значимо зменшилась частка пацієнтів з шорсткою шкірою (з 59,4 % до 12,5 %), то через 12 місяців кількість пацієнтів, у яких шкіра була шорсткою, збільшилась до 25,0 %. Колюча при пальпації до лікування була поверхня шкіри у 8 (25,0 %) пацієнтів, через 3 місяці – у жодного, а через 12 місяців у 2 (6,3 %) пацієнтів шкіра знову стала колючою у вогнищах АК.
Таблиця 5.3 – Динаміка характеристик поверхні шкіри у хворих на АК на тлі монотерапії
| Характеристика поверхні шкіри | До початку терапії | Через 3 місяці | Через 12 місяців |
| Гладка | 0 (0,0 %) | 13 (40,6 %)*** | 19 (59,4 %)*** |
| Злегка шорстка | 12 (37,5 %) | 15 (46,9 %) | 3 (9,4 %)** |
| Шорстка | 19 (59,4 %) | 4 (12,5 %)*** | 8 (25,0 %)** |
| Колюча | 8 (25,0 %) | –** | 2 (6,3 %)* |
Примітка. * – p<0,05; ** – p<0,01; *** – p<0,001 порівняно з початковим рівнем
До початку лікування маркери фотоушкодження були виявлені у 20 (62,5 %) пацієнтів з АК, яким проведено монотерапію, через 3 місяці після лікування – у 19 (59,4 %), через 12 місяців – у 17 (53,1 %) при p>0,05.
Ефективність проведеної монотерапії також оцінювали за ступенем очищення шкіри від вогнищ ураження АК. Через 3 місяці повне очищення спостерігали у 12 (37,5 %) пацієнтів, часткове – у 20 (62,5 %). Рецидивуючих уражень через 3 місяці не виявили. Через 12 місяців повне очищення встановлено у 18 (56,3 %) пацієнтів, рецидивуючі ураження виявлено у 14 (43,8 %) пацієнтів.
Динаміку загальної оцінки дерматоскопічної картини подано у табл. 5.4, з якої видно, що через 12 міс. після проведення монотерапії методом кріодеструкції дерматоскопічні ознаки АК виявлялись у 40,6 % пацієнтів.
Важливим показником ефективності терапії і одночасно прихильності пацієнтів до даної методики є отриманий косметичний ефект після проведення лікування. Як видно із табл. 5.5, без косметичних дефектів через 3 місяці після проведеної кріодеструкції було 40,6 % пацієнтів; через 12 місяців їх відсоток склав 50 (16 пацієнтів). У жодного пацієнта через 3 місяці і через 12 місяців не виявлено рубців і атрофії.
Таблиця 5.4 – Динаміка виявлення дерматоскопічних ознак захворювання у хворих на АК на тлі монотерапії
| Показник | Через 3 місяці | Через 12 місяців |
| Ознаки наявні | 5 (15,6 %) | 13 (40,6 %)* |
| Ознаки відсутні | 6 (18,8 %) | 18 (56,3 %)** |
| Ознаки менш виражені | 21 (65,6 %) | 1 (3,1 %)*** |
| Наявні нові ознаки | – | – |
Примітка. * – p<0,05; ** – p<0,01; *** – p<0,001 порівняно з показниками через 3 місяці
Таблиця 5.5 – Динаміка результатів отриманого косметичного ефекту у хворих на АК на тлі монотерапії
| Косметичні дефекти | Через 3 місяці | Через 12 місяців |
| Без косметичних дефектів | 13 (40,6 %) | 16 (50,0 %) |
| Гіпопігментація | 8 (25,0 %) | 7 (21,9 %) |
| Гіперпігментація | 6 (18,8 %) | 2 (6,3 %) |
| Диспігментація | 5 (15,6 %) | 1 (3,1 %) |
| Рубці, атрофія | – | – |
Гіпопігментація була виявлена у 25,0 % пацієнтів через 3 місяці і у 21,9 % пацієнтів через 12 місяців. Гіперпігментація – у меншого відсотку пацієнтів: у 18,8 % через 3 місяці і у 6,3 % через 12 місяців. Ще меншою була частка пацієнтів з диспігментацією: 15,6 % через 3 місяці і 3,1 % через 12 місяців. Отримані косметичні результати після проведеної кріодеструкції рідким азотом у дослідних пацієнтів були задовільними.
Параметри безпеки проведеної монотерапії оцінювали через 3 місяці у відповідності з оцінкою пацієнтами переносимості процедури, відчуття болю, наявності і вираженості запальних змін в місці проведеної кріодеструкції, наявності чи відсутності вторинного інфікування.
Добра переносимість процедури була у 24 (75,0 %) пацієнтів, задовільна – у 8 (25,0 %). Відсутнім біль був у 3 (9,4 %) пацієнтів, 17 (53,1 %) оцінили його незначно вираженим (1 бал), помірним (2 бали) оцінили 12 (37,5 %) пацієнтів.
У балах проводили оцінку вираженості запальних змін після проведення процедури. Запальні зміни незначно вираженими вважали 24 (75,0 %) пацієнтів, помірними – 8 (25,0 %). Вторинного інфікування не було в жодного пацієнта.
5.2.2 Динаміка регресу клінічних проявів захворювання після проведеної комбінованої терапії
З використанням запропонованої методики комбінованої терапії АК було проведено лікування 58 пацієнтів. У 17 (29,3 %) пацієнтів було виявлено 1 вогнище ураження, у 24 (41,4 %) – два вогнища, у 8 (13,8 %) – три вогнища, у 5(8,6 %) – чотири вогнища, у 4 (6,9 %) – п’ять вогнищ ураження.
У 17 (29,3 %) пацієнтів було встановлено пігментний АК, у 35 (60,3 %) – проліферативний, у 5 (8,6 %) – гіпертрофічний, у 1 (1,7 %) – шкірний ріг.
Скарги, які висловлювали пацієнти основної групи, яким проводили комбіновану терапію АК, оцінювали через 3 і через 12 місяців після проведеного лікування. Як видно з даних табл. 5.6, через 3 і 12 місяців у пацієнтів не було скарг на сухість шкіри і кровоточивість. Значно зменшилась частка пацієнтів, які мали скарги на почервоніння: з 67,2 % до 3,4 % через 3 місяці і до 1,7 % через 12 місяців (p<0,001). На наявність утворення кірочок через 3 місяці після проведеної терапії не висловлював скарг жоден з пацієнтів, однак через 12 місяців ця скарга була у 4 (6,9 %) пацієнтів.
Вірогідно зменшилось число скарг на свербіж: з 36,2 % до 19,0 % через 3 місяці (p<0,05) і до 13,8 % через 12 місяців (p<0,01). Шорсткість шкіри в місцях ураження АК, яка фіксувалась у всіх хворих до початку терапії, через 3 і 12 місяців після проведеного лікування визначалась лише у 19,0 % і 17,2 % пацієнтів (p<0,001).
Дані таблиці 5.7 демонструють переконливу позитивну динаміку характеристик поверхні ураженої шкіри. Так, поверхня шкіри через 3 місяці після проведеної комбінованої терапії стала гладкою у 77,6 % (до початку лікування була лише у 1,7 %), а через 12 місяців у 79,3 % пацієнтів (p<0,001). Значно знизилась частка пацієнтів із колючою поверхнею: з 22,4 % до 1,7 % через 3 і 12 місяців (p<0,001). Кількість випадків шорсткої шкіри майже в 10 разів зменшилась після проведення комбінованої терапії через 3 місяці, однак через 12 місяців вона визначалась у 19,0 % пацієнтів.
Таблиця 5.6 – Динаміка скарг хворих на АК на тлі комбінованої терапії
| Скарга | До початку терапії | Через 3 місяці | Через 12 місяців |
| Свербіж | 21 (36,2 %) | 11 (19,0 %)* | 8 (13,8 %)** |
| Сухість | 25 (43,1 %) | –*** | –*** |
| Почервоніння | 39 (67,2 %) | 2 (3,4 %)*** | 1 (1,7 %)*** |
| Шорсткість | 58 (100,0 %) | 11 (19,0 %)*** | 10 (17,2 %)*** |
| Наявність кірочок | 41 (70,7 %) | –*** | 4 (6,9 %)*** |
| Кровоточивість | 3 (5,2 %) | – | – |
Примітка. * – p<0,05; ** – p<0,01; *** – p<0,001 порівняно з початковим рівнем
Таблиця 5.7 – Динаміка характеристик поверхні шкіри у хворих на АК на тлі комбінованої терапії
| Характеристика поверхні шкіри | До початку лікування | Через 3 місяці | Через 12 місяців |
| Гладка | 1 (1,7 %) | 45 (77,6 %)*** | 46 (79,3 %)*** |
| Злегка шорстка | 14 (24,1 %) | 9 (15,5 %) | –*** |
| Шорстка | 39 (67,2 %) | 4 (6,9 %)*** | 11 (19,0 %)*** |
| Колюча | 13 (22,4 %) | 1 (1,7 %)*** | 1 ( 1,7 %)*** |
Примітка. * – p<0,05; ** – p<0,01; *** – p<0,001 порівняно з початковим рівнем
Маркери фотоушкодження до початку проведення комбінованої терапії були виявлені у 33 пацієнтів (56,9 %), через 3 місяці вони виявлялись у 20 (34,5 %) пацієнтів (p<0,05), а через 12 місяців – у 10 (17,2 %) (p<0,001).
Загальна оцінка очищення шкіри від вогнищ АК на тлі комбінованої терапії показала, що через 3 місяці повне очищення шкіри було у 49 (84,5 %) пацієнтів, часткове у 9 (15,5 %); рецидивуючих уражень не виявлено. Через 12 місяців повне очищення було у 44 (75,9 %), рецидивуючі ураження виявлено у 13 (22,4 %) пацієнтів.
Показники динаміки загальної оцінки дерматоскопічних даних після проведеної терапії подані у табл. 5.8.
Таблиця 5.8 – Динаміка виявлення дерматоскопічних ознак захворювання у хворих на АК на тлі комбінованої терапії
| Показник | Через 3 місяці | Через 12 місяців |
| Ознаки наявні | 11 (19,0 %) | 12 (20,7 %) |
| Ознаки відсутні | 12 (20,7 %) | 40 (69,0 %) * |
| Ознаки менш виражені | 35 (60,3 %) | 5 (8,6 %) * |
| Наявні нові ознаки | 1 (1,7 %) | – |
Примітка. * – p<0,001 порівняно з показниками через 3 місяці
Як видно з табл. 5.8, відмічається позитивна динаміка даних дерматоскопій після проведення комбінованої терапії зі збільшенням кількості пацієнтів з відсутністю дерматоскопічних ознак АК через 12 місяців після закінчення лікування до 69,0 % (p<0,001).
Дані таблиці 5.9 демонструють позитивний косметичний результат у 67,2 % пацієнтів через 3 місяці і у 87,9 % через 12 місяців після проведення комбінованої терапії. Частки пацієнтів з гіпо-, гіпер- і диспігментаціями є доволі малими через 3 місяці і ще меншими через 12 місяців. У 1 пацієнта виявлено поверхневу атрофію у вогнищі АК, що ймовірно пояснюється індивідуальними особливостями шкіри.
Добра переносимість процедур кріодеструкції відзначена у 44 (75,9 %) пацієнтів, задовільна – у 14 (24,1 %). Біль був відсутнім у 10 (17,2 %) пацієнтів, 31 (53,4 %) оцінили його незначно вираженим (1 бал), помірним – оцінили 17 (29,3 %) пацієнтів.
Таблиця 5.9 – Динаміка результатів отриманого косметичного ефекту у хворих на АК на тлі комбінованої терапії
| Косметичні дефекти | Через 3 місяці | Через 12 місяців |
| Без косметичних дефектів | 39 (67,0 %) | 51 (87,9 %) |
| Гіпопігментація | 10 (17,2 %) | 5 (8,6 %) |
| Гіперпігментація | 2 (3,4 %) | – |
| Диспігментація | 6 (10,3 %) | 1 (1,7 %) |
| Рубці | – | – |
| Атрофія | 1 (1,7 %) | 1 (1,7 %) |
Запальні зміни незначно вираженими вважали 36 (62,1 %) пацієнтів, помірними – 6 (10,3 %), в інших випадках (27,6 %) запальних процесів після процедур не спостерігалось. Вторинного інфікування не було в жодного пацієнта.
5.2.3 Порівняльна оцінка основних параметрів ефективності комбінованої і монотерапії актинічного кератозу
Як видно з даних таблиці 5,10, на тлі порівняних вихідних даних до початку терапії в обох групах (р>0,05 між групами при усіх порівняннях) після проведення комбінованої терапії більший відсоток пацієнтів не мали скарг через 3 і 12 місяців постлікувального моніторингу.
Результати порівняльного аналізу характеристик поверхні шкіри у вогнищах ураження також підтверджують більшу ефективність комбінованої терапії (табл. 5.11). Так, через 3 місяці після проведення комбінованої терапії гладкою поверхня шкіри була у 77,6 % пацієнтів, через 12 місяців – у 79,3 % пацієнтів. У пацієнтів, які отримали монотерапію через 3 місяці гладка поверхня шкіри була у 40,6 % (p<0,001), через 12 місяців – у 59,4 % (р=0,043).
Таблиця 5.10 – Порівняльний аналіз динаміки частоти відсутності скарг у хворих на АК на тлі різних методик лікування
| Скарги | 1-а група (комбінована терапія) (n=58) | 2-а група (монотерапія)
(n=32) |
||||
| До початку терапії | Через 3 місяці | Через 12 місяців | До початку терапії | Через 3 місяці | Через 12 місяців | |
| Свербіж | 63,8 % | 81,0 % | 86,2 % | 59,4 % | 81,3 % | 78,1 % |
| Сухість шкіри | 56,9 % | 100 % | 100 % | 50,0 % | 81,3 % ** | 100 % |
| Почервоніння | 32,8 % | 96,6 % | 98,3 % | 15,6 % | 81,3 % * | 93,8 % |
| Шорсткість | 0,0 % | 81,0 % | 82,8 % | 0,0% | 53,1 % ** | 71,9 % |
| Наявність кірочок | 29,3 % | 100 % | 93,1 % | 43,8 % | 100 % | 71,9 % * |
| Кровоточивість | 94,8 % | 100 % | 100 % | 90,6 % | 100 % | 100 % |
Примітка. * – p<0,05; ** – p<0,01 порівняно з відповідним показником у 1-й групі
Таблиця 5.11 – Порівняльний аналіз динаміки характеристик поверхні шкіри у хворих на АК на тлі різних методик лікування
| Характеристика поверхні шкіри | 1-а група (комбінована терапія) (n=58) | 2-а група (монотерапія)
(n=32) |
||||
| До початку терапії | Через 3 місяці | Через 12 місяців | До початку терапії | Через 3 місяці | Через 12 місяців | |
| Гладка | 1,7% | 77,6% | 79,3% | 0,0% | 40,6%*** | 59,4%* |
| Злегка шорстка | 24,1% | 15,5% | – | 37,5% | 46,9%** | 9,4%* |
| Шорстка | 67,2% | 6,9 % | 19,0% | 59,4% | 12,5% | 25,0% |
| Колюча | 22,4% | 1,7 % | 1,7 % | 25,0% | – | 6,3% |
Примітка. * – p<0,05; ** – p<0,01; ** – p<0,001 порівняно з відповідним показником у 1-й групі
Аналіз даних таблиці 5.12 свідчить про більшу ефективність комбінованої терапії за показником повного очищення шкіри і частотою виникнення рецидивів через 3 і 12 місяців після проведеного лікування.
Таблиця 5.12 – Порівняльна оцінка ступенів очищення шкіри у хворих на АК на тлі різних методик лікування
| 1-а група (комбінована терапія) (n=58) | 2-а група (монотерапія)
(n=32) |
|||
| Через 3 місяці | Через 12 місяців | Через 3 місяці | Через 12 місяців | |
| Повне очищення | 84,5 % | 75,9 % | 37,5 % ** | 56,3 % |
| Часткове очищення | 15,5 % | 1,7 % | 62,5 % ** | 0 % |
| Рецидивуючі ураження | Немає | 22,4 % | Немає | 43,8 % * |
Примітка. * – p<0,05; ** – p<0,001 порівняно з відповідним показником у 1-й групі
Проаналізовано різні фактори, які можуть сприяти появі рецидивів АК після проведення курсів терапії з використанням різних методик. Встановлено, що частіше рецидиви мали місце у пацієнтів з гіпертрофічним клінічним варіантом АК – 71,4 % (5 з 7 пацієнтів з даною формою АК), в той час як у пацієнтів з пігментною формою частота рецидивів складала 26,1 %, з проліферативною – 27,1 % (p<0,001 порівняно з гіпертрофічним варіантом). Серед випадків рецидивування АК переважали ураження ІІІ ступеня важкості – 69,2 % (18 з 26 пацієнтів), тоді як при І ступені важкості АК рецидиви фіксувалися в 8,7 % випадків (2 з 23), при ІІ ступені – у 17,1 % (7 з 41) пацієнтів.
Слід відзначити, що в обох терапевтичних групах частота рецидивів вірогідно не відрізнялась за вищезазначеними показниками важкості і клінічного варіанту АК (p>0,05 при усіх порівняннях відповідних показників). Серед 13 пацієнтів з рецидивами АК із 1-ї групи (комбінована терапія) було 7 (53,8 %) хворих з проліферативною формою АК, 3 (23,1 %) – з пігментною, 3 (23,1 %) – з гіпертрофічною. За ступенем важкості АК вони розподілились наступним чином: ІІ ступінь – 4 (30,8 %), ІІІ ступінь – 9 (69,2 %). В групі порівняння (монотерапія) проліферативний варіант АК визначався у 9 (64,3 %) пацієнтів з рецидивами, пігментний – у 3 (21,4 %), гіпертрофічний – у 2 (14,3 %). При цьому, І і ІІ ступінь важкості АК реєструвався у 5 (35,7 %) пацієнтів, ІІІ ступінь – у 9 (64,3 %). Водночас, в групі комбінованої терапії середня кількість вогнищ ураження у пацієнтів з рецидивами вдвічі перевищувала таку у пацієнтів, що отримали монотерапію, – (3,36 ± 0,29) вогнищ проти (1,69 ± 0,17) вогнищ (p<0,001).
При проведенні постлікувального моніторингу через 3 місяці маркери фотоушкодження шкіри виявлялись у 34,5 % пацієнтів, які отримали комбіновану терапію і у 59,4 %, яким проведено монотерапію (p=0,028). Через 12 місяців у хворих після проведення комбінованої терапії маркери фотоушкодження було виявлено у 17,2 % пацієнтів і у 53,1 % після проведення монотерапії (p<0,001).
Встановлено позитивну динаміку дерматоскопічної картини у хворих на АК через один рік після проведення комбінованої терапії в порівнянні з монотерапією (табл. 5.13).
Таблиця 5.13 – Порівняльна оцінка динаміки показників дерматоскопії у хворих на АК на тлі різних методик лікування
| Дерматоскопічні ознаки | 1-а група (комбінована терапія) (n=58) | 2-а група (монотерапія)
(n=32) |
||
| Через 3 місяці | Через 12 місяців | Через 3 місяці | Через 12 місяців | |
| Наявні (без динаміки) | 19,0 % | 20,7 % | 15,6 % | 40,6 % * |
| Відсутні | 20,7 % | 69,0 % | 18,8 % | 56,3 % |
| Менш виражені | 60,3 % | 8,6 % | 65,6 % | 3,1 % |
Примітка. * – p<0,05 порівняно з відповідним показником у 1-й групі
Комбінована терапія АК дозволила отримати кращі косметичні результати порівняно з монотерапією (рис. 5.1).
Примітка. * – p<0,05; ** – p<0,001 порівняно з відповідним показником у групі комбінованої терапії. Рисунок 5.1 – Порівняння частоти виявлення косметичних дефектів у хворих на АК на тлі різних методик лікування
Через 3 місяці відсутність косметичних дефектів відзначена у 67,0 % пацієнтів основної групи і лише у 40,6 % пацієнтів групи порівняння (р=0,025). Пост-лікувальний моніторинг, проведений через 12 місяців, збільшив ці показники до 87,9 % в групі комбінованої терапії і до 50,0 % – після проведення кріодеструкції рідким азотом (p<0,001).
Клінічні випадки з результатами проведеної пацієнтам комбінованої послідовної терапії продемонстровані на рис. 5.2 і 5.3.
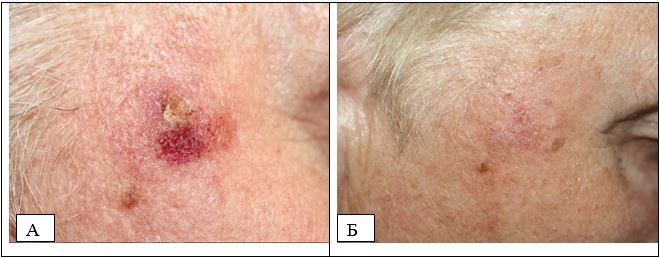
Рисунок 5.2 – АК, проліферативний варіант. А. До лікування. Б. Через 12 місяців після комбінованої терапії
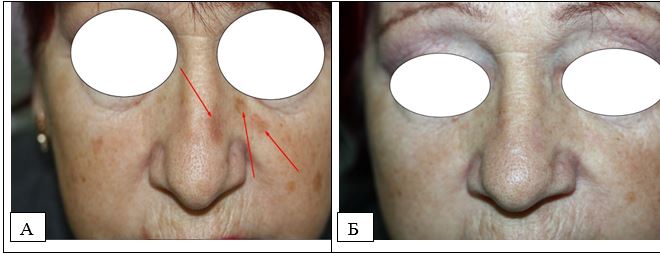
Рисунок 5.3 – АК, пігментний варіант. А. До лікування. Б. Через 12 місяців після комбінованої терапії
Таким чином, результати дослідження свідчать, що комбінована терапія із застосуванням кератолітичного засобу – 5 % саліцилової мазі, процедур інтенсивного імпульсного світла ІРL і кріодеструкції рідким азотом має кращі клінічні, дерматоскопічні і косметичні результати порівняно з монотерапією (кріодеструкція рідким азотом) і може бути застосована для лікування пацієнтів на АК.
Протипоказання до застосування: системні захворювання сполучної тканини, схильність до утворення колоїдів, захворювання крові, пов’язані з порушенням згортання, наявність серцевого стимулятора, епілепсія, підвищена фоточутливість. Тимчасові протипоказання: пошкодження шкіри, гнійничкові та гострі інфекційні захворювання, свіжа засмага (загар), прийом антибіотиків тетрациклінового ряду, фторхінолонів, ретиноїдів.
* * *
При аналізі скарг до і після проведеної терапії в 2-х групах пацієнтів виявлено їх зменшення в порівнянні з висловленими до лікування у 82,8-100 % пацієнтів основної групи і у 71,9-100 % пацієнтів групи порівняння.
Через 3 міс. після лікування повне очищення шкіри відзначено у 84,5 % пацієнтів основної групи проти 37,5 % – в групі порівняння (p<0,001). За частотою рецидивів через 12 міс. продемонстровано переваги комбінованої послідовної терапії – 22,4 % проти 43,8 % (p<0,05), на тлі вдвічі більшої кількості вогнищ ураження, ніж в групі порівняння.
За показником відсутності косметичних дефектів ефективність є значно вищою у пацієнтів, яким проведено комбіновану терапію – 87,9 % проти 50,0 % через 12 міс. після лікування (p<0,001);
Відзначено більш виражені позитивні зміни щодо маркерів фотоушкодження шкіри при застосуванні комбінованої терапії: зменшення частоти фотоушкодження шкіри з 56,9 % до 17,2 % в основній групі (p<0,001) і з 62,5 % до 53,1 % у пацієнтів групи порівняння (p>0,05).
Вірогідно частіше рецидиви мали місце у пацієнтів з гіпертрофічним клінічним варіантом АК (71,4 %), ураженнями ІІІ ступеня важкості (69,2 %) та значною кількістю вогнищ АК.
Таким чином, за результатами проведених досліджень встановлено переваги комбінованої терапії АК, яка поєднує послідовне застосування кератолітичного засобу – 5 % саліцилової мазі, процедур інтенсивного імпульсного світла ІРL і кріодеструкції рідким азотом у досягненні клінічного ефекту і зменшенні частоти виникнення рецидивів. Окрім того, запропонована комбінована терапія є малоінвазивною, простою у застосуванні, не довготривалою і доступною для пацієнтів в Україні.
Матеріали розділу опубліковані у наступних виданнях:
- Глушок В. С., Святенко Т. В. Власний досвід комбінованої послідовної терапії актинічного кератозу. Дерматологія та венерологія.2018. № 1 (79). С. 39–42 [11].
- Святенко Т. В., Глушок В. С. Комбінована терапія актинічного кератозу з врахуванням морфофенотипування. Інформаційний лист. Київ, 2018. № 31, вип. 2: Дерматологія та венерологія [38].
РОЗДІЛ 6
Профілактика виникнення, прогресування і рецидивування АКТИНІЧНОГО КЕРАТОЗУ
Пріоритетність профілактики над лікуванням захворювань є очевидною. Вивчення етіопатогенезу АК дає підстави стверджувати, що основним чинником у виникненні цього захворювання є тривала надмірна інсоляція [159]. Це є підґрунтям для формування і реалізації патогенетично обґрунтованої профілактики даного захворювання.
На даний час є очевидною необхідність забезпечення захисту організму людини в цілому від впливу UV. Вона базується на сучасних знаннях про ефекти, які спричиняють UV промені на здоров’я людини в цілому, біологічні і фізіологічні процеси в організмі і в тому числі на карциногенез [154]. Ступінь вираженості патологічних змін у шкірі, спричинених UV випроміненням, крім інших факторів, обумовлюється кумулятивним ефектом UV, отриманим впродовж життя і типом фоточутливості шкіри людини [118, 156].
Відомо, що у шкірі людини є природні захисні системи, які забезпечують захист від пошкоджуючого впливу сонячних променів, тому людина може деякий час перебувати на сонці без шкоди для здоров’я. Наскільки активними є ці захисні фактори, залежить від віку, фототипу шкіри, загального стану здоров’я. Оскільки шкіра є першим і основним органом, який постійно піддається впливу UV, тому дуже важливим є її ефективний захист від надмірної інсоляції.
Є припущення, що пропагуючи необхідність використання СЗЗ кожною людиною зокрема і навчаючи все населення розумінню потреби захищати тіло від надмірної інсоляції з одночасним переконанням фундаментально змінювати поведінку і спосіб життя стосовно перебування на сонці, можна досягнути значного зменшення навантаження UV на організм, чим в кінцевому результаті можна досягнути зниження захворюваності на АК і на рак шкіри [130, 156].
На даний час ще немає аргументованих детальних практичних рекомендацій щодо дотримання фоторежиму, допустимої тривалості і інтенсивності природної і штучної інсоляції з врахуванням регіону проживання чи відпочинку, сезону року, індивідуальних особливостей шкіри, віку, стану здоров’я при АК і неоплазіях шкіри. Однак у всіх доступних джерелах літератури застосування СЗЗ рекомендується як обов’язковий профілактичний захід при АК [63, 130, 167].
6.1 Методика мотиваційного консультування у пацієнтів з актинічним кератозом
Проведене дослідження показало низький рівень обізнаності пацієнтів з АК щодо шкідливості гіперінсоляції (32,2 %), знань правил перебування на сонці (13,3 %) та необхідності фотозахисту (28,9 %), а також наявність вираженого кореляційного зв’язку між хронічною гіперінсоляцією в анамнезі та клінічними і морфологічними проявами захворювання (див. розділ 3). Тому важливим завданням роботи було проведення мотиваційного консультування досліджуваних пацієнтів, як невід’ємної і дуже важливої частини менеджменту АК, яке буде забезпечувати отримання знань щодо необхідності постійного застосування СЗЗ та емолієнтів впродовж життя. Проведення такого консультування передбачає активну участь пацієнта і його персональний вибір своєї подальшої долі в аспекті збереження здоров’я і попередження утворення неоплазій шкіри.
Враховувалися дані літературних джерел про те, що в даний час розробляються нові підходи, спрямовані на попередження раку шкіри і передракових станів, спрямовані на вплив на сигнальні шляхи. UV має вплив, як відомо, на всі важливі ключові ланки в розвитку раку шкіри: на репарації ДНК, на апоптоз, на передачу сигналів в клітинах. Тому зменшення навантаження UV опромінення на шкіру буде мати як короткочасний, так і віддалений позитивний вплив на шкіру, на попередження прогресування АК. Є передбачення науковців про те, що найважливішу роль в зменшенні (мінімізації) частоти розвитку раку шкіри в майбутньому належить освітньому і поведінковому підходам [79, 91, 99, 138, 139]. Виходячи з цього, завдання лікаря полягатиме здебільшого в проведенні профілактичних заходів, а не в проведенні лікування. Разом з тим, проведення профілактичних заходів саме при АК має забезпечувати попередження прогресування і утворення нових вогнищ з субклінічних уражень, клінічно діагностувати які не є можливим на даний час.
Було розроблено і складено програму мотиваційного консультування пацієнтів, з врахуванням даних анкетування 1756 пацієнтів, які звертались на прийом до дерматолога, а також даних 110 досліджуваних пацієнтів, включених у основну і в групу порівняння. Програма консультування складається з двох частин: інформативної і рекомендаційної.
В інформативну частину включено основні наукові дані про вплив UV на організм людини, і на шкіру, перш за все. Пацієнту роз’яснювали:
1) позитивні і негативні впливи UV на організм людини;
2) шкідливість і небезпечні наслідки для здоров’я хронічної сонячної інсоляції, гіперінсоляції;
3) необхідність застосування всіх методів захисту від впливу UV: одягу, сонцезахисних окулярів, капелюхів з широкими крисами, СЗЗ впродовж життя;
4) навчали правил перебування на відкритому сонці впродовж дня, з врахуванням періодів максимального випромінення UVB;
5) навчали правил нанесення СЗЗ;
6) роз’яснювали про необхідність постійного нанесення емолієнтів з метою попередження сухості шкіри;
7) роз’яснювали про необхідність постійного самостійного моніторування стану шкіри, а також дотримання кратності консультування дерматологом.
Рекомендаційна частина програми включала:
- донесення інформації про те, що пацієнт не повинен перебувати на відкритому сонці з 10 до 16 години;
- що необхідно щоденно двічі (зранку і ввечері) наносити тоненьким шаром на попередньо очищену водою шкіру емолієнти;
- що потрібно щоденно у сонячні дні наносити СЗЗ у дозі 2,5 одиниці на кінчику пальця на всю поверхню обличчя і шиї, і проводити повторні нанесення через кожних 2-2,5 години перебування на відкритому сонці.
6.2 Комплаєнтність хворих у період постлікувального моніторингу
Проведений аналіз анамнестичних даних усіх досліджуваних пацієнтів виявив, що жодний із пацієнтів не наносив ССЗ, згідно правил, через кожних 3 години, 4,4 % (4 пацієнти) наносили їх зрідка, в сонячні дні, 30,0 % (27 пацієнтів) застосовували під час відпочинку. При цьому практика застосування ССЗ зворотно корелювала з віком пацієнтів – r=–0,49; p<0,001, та рівнем поінформованості щодо шкідливості гіперінсоляції – r=–0,51; p<0,001. З метою зволоження шкіри емолієнти щоденно наносили на суху шкіру лише 2,2 % пацієнтів, зрідка – 22,2 % (20 пацієнтів). Нехтування емолієнтами також асоціювалось з більш старшим віком пацієнтів (r=–0,23; p=0,032) та низькою обізнаністю щодо факторів ризику (r=–0,44; p<0,001).
В постлікувальному моніторингу при обстеженні пацієнтів через 12 місяців після проведення терапії ми оцінювали їх прихильність до застосування СЗЗ і емолієнтів. Встановлено, що частка пацієнтів, які наносили СЗЗ щоденно, через кожних 3 години, як було рекомендовано, склала 62 (68,9 %); наносили нерегулярно – 16 (17,8 %); 2,2 % (2 пацієнти) не застосовували СЗЗ, не дивлячись, що отримали рекомендацію. Щоденне використання СЗЗ зворотно корелювало зі ступенем важкості АК (r=–0,30; p=0,004) і віком пацієнтів
(r=–0,45; p<0,001), проте вже не асоціювалось з рівнем поінформованості про шкідливість UV.
Емолієнти від початку лікування і перебування під спостереженням застосовували щоденно двічі 73 (81,1 %) пацієнти; 17 (18,9 %) пацієнтів використовували такі засоби нерегулярно.
Отримані результати свідчать про високу прихильність досліджуваних пацієнтів до застосування СЗЗ і емолієнтів, позитивний вплив яких на стан шкіри можна підтвердити позитивною динамікою характеристик поверхні шкіри.
До початку регулярного застосування емолієнтів і СЗЗ гладкою поверхня шкіри була лише в 1 пацієнта (1,1 %); через 12 місяців – у 65 (72,2 %). Злегка шорсткою шкіра до початку лікування була у 26 (28,9 %), через 12 місяців у 3,3 % (3 пацієнти). Шорстка поверхня шкіри до лікування встановлена у 58 (64,4 %), через 12 місяців – у 21,1 % (19 пацієнтів). Колюча поверхня шкіри до лікування відзначалась у 21 (23,3 %) пацієнтів, через 12 місяців – у 3,3 % пацієнтів. В усіх випадках зміни кількості прихильників рекомендацій лікаря в постлікувальному періоді були статистично значимими (p<0,001).
Одночасно ми порівняли кількість пацієнтів, які висловлювали скаргу на сухість шкіри до початку лікування і через 12 місяців. Виявилось, що до початку лікування 41 (45,6 %) пацієнтів скаржилися на сухість шкіри, через 12 місяців таких скарг не зафіксовано.
На шорсткість шкіри до початку лікування мали скаргу 100 % пацієнтів, а через 12 місяців – 19 (21,1 %) із загальної когорти, в тому числі 9 (28,1 %) пацієнтів, які отримали монотерапію, 10 (17,2 %) пацієнтів, яким проведено комбіновану терапію. Нерегулярне застосування емолієнтів мало прямий взаємозв’язок помірної сили зі збереженням скарг на шорсткість шкіри у пост-лікувальному періоді – r=+0,52; p<0,001.
Аналіз взаємозв’язку між застосуванням СЗЗ і виявленням маркерів фотоушкодження шкіри показав зворотну кореляцію між наявністю ознак фотоушкодження шкіри і застосуванням ССЗ як до, так і після лікування – r=-0,21; p=0,050. Крім того, як було показано у розділі 5, позитивна динаміка фотоушкодженої шкіри відмічається у більшої частини пацієнтів, яким проведено комбіновану терапію в поєднанні із застосуванням СЗЗ.
* * *
Таким чином, результати проведеного дослідження показали суттєве підвищення показників комплаєнтності пацієнтів щодо застосування СЗЗ і емолієнтів після проведеного консультування та їх призначення (86,7 % і 81,1 %, відповідно), що безпосередньо позитивно позначилось на кінцевих клінічних результатах лікування і профілактики рецидивів.
Матеріали розділу опубліковані у наступних виданнях:
- Hlushok V. S. A part of a prophylaxis of skin neoplasias in the region. Matherial of 2nd International transcaucasus congress on photodermatology and skin cancer. (Tbilisi, 27-29 october 2016). Tbilisi, 2016. 43–47 [110].
- Hlushok V., Sviatenko T. The use of the sunscreens as a part of actinic keratosis management. Journal Experimental and Clinical Medicine. 2018. № 1. P. 43–47 [109].
РОЗДІЛ 7
АНАЛІЗ ТА УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
Питання підвищення ефективності ранньої діагностики і комплексної терапії АК – неоплазії в епідермальному шарі шкіри, утвореної проліфератами цитологічно аберантних кератиноцитів, індукованих тривалим впливом УФ випромінення, залишаються актуальними в багатьох країнах світу, включно з Україною. Погляди провідних дерматологів світу на АК різняться, проте більшістю з них вчасно нелікований АК розглядається як ініціальне утворення, яке може прогресувати в ПКРШ [17, 32, 39, 123, 167].
За даними сучасної літератури, клінічна значимість АК пояснюється не тільки можливістю його перетворення в ПКРШ, але і тим, що АК є потужним предиктором виникнення меланоми або НМРШ [17, 104, 128], а на тлі зростання захворюваності і поширеності останніх пацієнти з АК є безпосередніми кандидатами для ретельного спостереження з метою профілактики і раннього ефективного лікування.
Медико-соціальна значимість АК зумовлена «омолодженням» контингенту пацієнтів з даною патологією, локалізацією утворень (шкіра обличчя, скальпу, шиї, розгинальних поверхонь кистей), що у більшості випадків спричиняє видимий косметичний дефект, обумовлює часткову соціальну дезадаптацію хворих.
Незважаючи на те, що вивченню АК присвячено багато наукових досліджень і клінічних спостережень за кордоном, в Україні проблеми діагностики, лікування і профілактики цього захворювання вивчались мало [84]. Бракує даних щодо епідеміології АК в Україні, про захворюваність і поширеність АК як на державному рівні, так і в окремих регіонах. Низький відсоток виявлення патології лікарями-онкологами свідчить про відсутність настороженості щодо даної патології, а також про відсутність знань у фахівців клінічної симптоматики АК.
Проблема своєчасного ефективного лікування АК продиктована відсутністю на даний час єдиних рекомендацій, алгоритмів, клінічних протоколів в Україні, які б давали можливість практикуючим лікарям вибрати найбільш адекватне лікування для запобігання його трансформації у ПКРШ, профілактики розвитку косметичних дефектів і рецидиву захворювання. Традиційною методикою, яка найчастіше застосовується для лікування АК, є кріодеструкція вогнищ. Поряд з перевагами (доступність, простота, низька потреба в анестезії) метод має ряд недоліків: виникнення болю в час виконання процедури і деякий час після неї, виникнення таких побічних ефектів після лікування, як утворення міхурів або ерозій, які вкриваються кірочками, часте формування таких косметичних дефектів після лікування, як депігментації і рубці.
Тому метою дослідження обрано підвищення ефективності комплексної терапії АК шляхом обґрунтування вибору методики лікування захворювання з урахуванням результатів клінічних, дерматоскопічних, патоморфологічних та ІГХ досліджень.
Серед основних задач було виділено: дослідження клініко-анамнестичних особливостей проявів і перебігу АК з урахуванням соціально-демографічних характеристик пацієнтів, оцінки суб’єктивних і об’єктивних симптомів захворювання; визначення патоморфологічних характеристик шкіри у пацієнтів з різними клінічними варіантами і ступенями важкості АК за даними дерматоскопічного дослідження; патогістологічну характеристику шкіри при різних клінічних варіантах АК у порівнянні з СК; оцінку змін ІГХ маркерів онкогенної трансформації (р53), проліферативної активності (Kі-67, cyclin D1), васкуляризації (CD34) та стромальної деградації (ММР-9, ТІМР-1) при АК і СК; обґрунтування методики комбінованої патогенетичної терапії АК з урахуванням результатів патогістологічних та ІГХ досліджень і порівняти її ефективність з монотерапією (кріодеструкція рідким азотом); розробку і запровадження методики мотиваційного консультування пацієнтів з АК, з метою підвищення ефективності лікування, покращення комплаєнтності хворих, попередження прогресування і рецидивування захворювання.
Під спостереженням знаходилися 110 пацієнтів, у віці від 51 до 90 років (середній вік – (70,1 ± 0,9) років), з них 76 (69,1 %) жінок і 34 (30,9 %) чоловіків. З них 90 пацієнтів були з АК (основна група), 20 – із СК (група порівняння). Дослідження проводилося з 2015 по 2017 роки на кафедрі інфекційних хвороб з епідеміологією, шкірними та венеричними хворобами ДВНЗ «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України» на базі поліклінічного відділення Комунальної установи Тернопільської обласної ради «Тернопільський обласний клінічний шкірно-венерологічний диспансер».
Діагноз усім пацієнтам було встановлено на підставі оцінки клінічних проявів на шкірі, дерматоскопічних даних, з врахуванням скарг і даних анамнезу.
Понад 85 % хворих були старше 60 років (95 – 86,4 %), в тому числі 88,9 % пацієнтів з АК і 75 % – з СК (р=0,144 між групами). Найбільший відсоток хворих на АК припадав на вікові групи 61-70 років (37,8 %) і 71-80 років (36,7 %), а серед пацієнтів з СК найбільш представленою була вікова група 61-70 років (40,0%). Це узгоджується з даними багатьох досліджень про високий рівень захворюваності на кератози, особливо на АК, серед осіб похилого і старечого віку.
Дві третини обстежених пацієнтів складали жінки (69,1 %), в тому числі 67,8 % в основній групі і 75,0 % – в групі порівняння (р=0,603). Частка сільських мешканців серед хворих на АК і СК складала 41,1 % (37 пацієнтів) і 25,0 % (5 пацієнтів), відповідно (р=0,212 між групами).
Усі пацієнти з встановленим діагнозом АК (90 осіб – 100 %) скаржилися на висипання на шкірі переважно обличчя або інших ділянок голови та шорсткість шкіри. Сухість шкіри в місцях ураження відзначали 45,6 % хворих, утворення лусочок – 65,6 %; їх турбували також почервоніння шкіри (73,3 %), свербіж (37,8 %), рідко – кровоточивість (6,7 %). На свербіж частіше скаржились хворі на АК чоловічої статі – 55,2 % (16 пацієнтів з 29) проти 29,5 % (18 з 61) жінок (р=0,022); на сухість шкіри – пацієнти, які мешкають у сільській місцевості – 62,2 % (23 з 37) проти 34,0 % (18 з 53) жителів міст (р=0,010), та особи старшого віку – 53,4 % (31 з 58) хворих на АК старші 65 років проти 31,3 % (10 з 32) пацієнтів віком до 65 років (р=0,050).
На відміну від АК, при СК кількість та спектр скарг були суттєво меншими. Зокрема, наявність висипань на шкірі турбувало лише половину хворих на СК (55,0 %), шорсткість і утворення лусочок відзначали 15-20 % пацієнтів, почервоніння шкіри в місцях ураження не спостерігалось в жодному випадку (р<0,001 порівняно з АК).
На гіперінсоляцію в анамнезі вказали 67 (74,4 %) хворих на АК. З них у більшості випадків (40 пацієнтів – 44,4 %) вона була викликана необхідністю тривалого перебування на сонці у зв’язку з родом діяльності/ професією, в інших випадках – під час дозвілля/ відпочинку (27 – 30,0 %). Встановлена пряма асоціація надмірної інсоляції, пов’язаної з родом діяльності, у жителів сільської місцевості порівняно з мешканцями міст (r=+0,43; p<0,001), а також в осіб більш старшого віку (r=+0,35; p<0,001).
При дослідженні структури хворих на кератози в залежності від фототипу шкіри (за Фітцпатриком) встановлено, що більшість з них (70,9 %) мали ІІ тип фоточутливості шкіри, в тому числі 66 (73,3 %) хворих на АК і 12 (60,0 %) пацієнтів з СК (р=0,279). Кількість пацієнтів з І фототипом шкіри була вищою у групі порівняння – 5 (25,0 %) пацієнтів з СК проти 3 (3,3 %) хворих на АК (р=0,005). ІІІ фототип шкіри мали 21 (23,3 %) хворих на АК і 3 (15,0 %) пацієнтів з СК (р=0,556).
Маркери фотоушкодження (сухість, дряблість, зморшкуватість, нерівномірність пігментації, стоншення або атрофія шкіри, телеангіектазії, ефеліди) при АК виявлялись майже втричі частіше ніж у пацієнтів з СК – 58,9 % проти 20,0 % при р=0,002, і вірогідно асоціювались з надмірною інсоляцією в минулому (r=+0,44; p<0,001). Відзначена тенденція до зменшення частоти фотоушкодження шкіри у пацієнтів з ІІІ типом фоточутливості порівняно з І-ІІ типами (р=0,128).
У найбільшої частини пацієнтів з АК було виявлено два (47,8 %) або одне (27,8 %) вогнище ураження, що можна оцінювати як показник раннього звернення пацієнтів за медичною допомогою до дерматолога у регіоні. Розміри вогнищ коливались від 2 мм до 15 мм, середній розмір всіх вогнищ – 6,19 ± 0,23 мм (медіана – 6 мм). Встановлено, що збільшення кількості вогнищ ураження АК на шкірі обличчя асоціювалось з різними проявами фотоушкодження шкіри (r=+0,24; p=0,024), ІІІ фототипом шкіри (r=+0,21; p=0,050) та надмірною інсоляцією в минулому (r=+0,25; p=0,022).
Найчастішою локалізацією уражень у загальній когорті пацієнтів з АК були щоки (78,9 %), шкіра носа (51,1 %) і чола (24,4 %). При цьому локалізація уражень на скальпі у чоловіків виявлена у 13,8 % випадків (4 пацієнти), у жінок – 1,6 % (1 випадок) при р=0,036; на вушних раковинах – у 13,8 %, у жінок – жодного випадку (р=0,009), що, ймовірно, пов’язано з більшою відкритістю зазначених зон голови у чоловіків порівняно з жінками.
Ідентифікація морфологічних елементів на ураженій шкірі в обстежених хворих показала їх різноманітність при АК – папули (57,8 % випадків), плями (54,4 %), ерозії (10,0 %), шкірний ріг (7,8 %), і переважно папули – при СК (75,0 %). Ще в 25,0 % випадків себорейні кератоми мали плямистий вигляд (р=0,025 порівняно з АК).
Колір шкіри у вогнищах ураження АК у більшості випадків був рожевим (65,6 %), у третині випадків – світло-коричневим (31,1 %), в 14,4 % випадків – не зміненим (колір нормальної шкіри). При СК більшість кератом мали коричневий колір (75,0 %), в окремих випадках – жовто-коричневий (25,0 %). Встановлено, що у хворих на АК з ІІІ фототипом основним морфологічним елементом були плями (95,2 %) та світло-коричневий колір поверхні (100,0 %), з ІІ фототипом – папули (68,2 %) та переважно рожевий колір вогнища ураження (81,8 %). Ерозію виявили лише у 8 (12,1 %) пацієнтів з ІІ фототипом шкіри і у одного пацієнта з І типом.
Поверхня шкіри у вогнищах ураження АК і СК при пальпації переважно була шорсткою – 64,4 % і 65,0 % випадків (р=1,00 між групами). Злегка шорстка поверхня ураженої шкіри визначалась у 28,9 % і 35,0 % пацієнтів, відповідно (р=0,598). Колюча поверхня уражень була характерною тільки для АК – 23,3 % випадків (р=0,012).
В обстежених пацієнтів найчастіше діагностували проліферативний АК – 59 (65,6 %) пацієнтів, який переважно характеризувався плоскими, шорсткими папулами (67,8 %), із середніми розмірами 6,30 ± 0,28 мм, з лусочками на поверхні, гіперемією в основі папул (81,4 %). У 23 (25,5 %) пацієнтів встановлено пігментний варіант АК, для якого властивими були переважно плямисті ураження (100,0 %), розміром 6,08 ± 0,43 мм, з шорсткою поверхнею (78,3 %), світло-коричневого кольору (100,0 %). Гіпертрофічний варіант АК діагностували лише у 7 (7,8 %) досліджених пацієнтів. В усіх пацієнтів з гіпертрофічним варіантом були виявлені товсті шорсткі папули тілесного кольору або еритематозні, вкриті лусочками чи кірками, з часто колючою поверхнею (85,7 %). Середній розмір вогнищ 5,36 ± 0,82 мм. У одного пацієнта виявлено шкірний ріг, розміром 12 мм, який розглядається як особливий реактивний стан, що є різновидом гіпертрофічного АК.
Не відмічено вірогідних відмінностей щодо локалізації уражень при різних клінічних варіантах АК, а також зв’язку між перебігом активного процесу в епідермісі і дермі та соціально-демографічними характеристиками хворих (статтю, віком, місцем проживання пацієнтів). Водночас, встановлено взаємозв’язок між різними клінічними варіантами АК і фототипом шкіри, наявністю маркерів фотоушкодження та вираженістю скарг. Зокрема, проліферативний і гіпертрофічний варіанти АК вірогідно частіше (р<0,001) виявлялись у осіб з ІІ типом фоточутливості шкіри (93,2 % і 100,0 %), в той час як пігментний варіант – з ІІІ фототипом (87,0 %). Частота виявлення характерних проявів фотоушкодження на прилеглих до вогнищ ділянках шкіри обличчя була найменшою при пігментному АК (39,1 %) і найбільшою – при гіпертрофічному варіанті (85,7 %) при р<0,05. На свербіж скаржились всі пацієнти з гіпертрофічною формою АК (100,0 %), 40,7 % хворих з проліферативним варіантом захворювання і менше 10 % пацієнтів з пігментним АК. Почервоніння шкіри також було характерною ознакою проліферативного (93,2 %) і гіпертрофічного (71,4 %) варіантів АК.
Серед 90 хворих на АК І ступінь важкості встановлено у 23 (25,5 %) пацієнтів, ІІ ступінь – у 41 (45,6 %), ІІІ ступінь важкості – у 26 (28,9 %) пацієнтів. Встановлено, що у пацієнтів жіночої статі частіше виявляли АК ІІ ступеню важкості (52,5 %), а у чоловіків – ІІІ ступеня. АК І ступеню важкості діагностували однаково часто – у 24,1 % чоловіків і 26,2 % жінок (р=1,00). Вірогідного зв’язку між важкістю захворювання і місцем проживання пацієнтів не виявлено (p>0,05). Проте у пацієнтів більш старшого віку перебіг АК був важчим: середній вік пацієнтів з ІІІ ступенем важкості АК складав 74,6 ± 1,9 років, з ІІ ступенем – 69,4 ± 1,2 роки, з І ступенем – 69,1 ± 1,8 років (р=0,020 і р=0,046 порівняно з ІІІ ступенем).
Результати досліджень показали відсутність вірогідного зв’язку між важкістю АК і кількістю утворень, їх розміром та локалізацією уражень. Важкий перебіг захворювання здебільшого визначався тривалою кумулятивною дією UV на ділянки шкіри, що піддаються інсоляції (коефіцієнт кореляції r=+0,32; p=0,002), наявністю характерних маркерів фотоушкодження шкіри (r=+0,22; p=0,034), а також спостерігався при гіпертрофічній формі АК (r=+0,33; p=0,002). Так, кумулятивне тривале перебування на сонці в 2,7 разів збільшує відносний ризик важкого перебігу АК (ІІІ ступеню) порівняно з відсутністю випадків надмірної інсоляції в минулому – 43,9 % випадків проти 16,3 % (р=0,005). За наявності проявів фотоушкодження шкіри відсоток хворих з ІІІ ступенем важкості АК в 2,9 разу перевищує рівень; якщо зазначені ознаки фотоушкодження відсутні – 39,6 % проти 13,5 % випадків (р=0,009).
Аналіз показників ступеню важкості АК при різних клінічних варіантах захворювання показав, що для пігментного АК більш характерним виявився ІІ ступінь важкості (73,9 %), для гіпертрофічного – ІІІ ступінь (85,7 %). При проліферативному АК різні ступені важкості захворювання верифікували майже з однаковою частотою (від 25,4 % до 39,0 %).
За даними дерматоскопічного дослідження у обстежених пацієнтів з АК найчастіше виявляли лусочки (77,8 %), мішенеподібні фолікули (74,4 %), тонкі хвилясті судини (67,8 %) і еритему / псевдосітку (65,6 %). Виразні фолікули діагностували у 47,8 % пацієнтів. Рідше виявляли білі круги (32,2 %) і сірі ромбовидні структури (25,6 %). Встановлено, що характерними для АК І ступеню є 3 дерматоскопічні ознаки: еритема/псевдосітка, тонкі хвилясті судини і лусочки. Для АК ІІ ступеню важкості характернішим є виявлення мішенеподібних фолікулів і лусочек. Для АК ІІІ ступеню важкості характерними були мішенеподібні фолікули, лусочки і виражені фолікули.
Отримані результати проведеної дерматоскопії пацієнтам з різними клінічними варіантами АК дали підстави зробити висновки, для що пігментного АК характерними є виразні фолікули, сірі ромбовидні структури, мішенеподібні фолікули і білі круги; для проліферативного варіанту – еритема/рожева псевдосітка, лусочки і тонкі хвилясті судини; для гіпертрофічного варіанту – поєднання трьох дерматоскопічних ознак: мішенеподібних і виразних фолікулів і лусочок, які були виявлені в усіх 100 % пацієнтів з цим клінічним варіантом АК.
Для АК у пацієнтів з ІІ фототипом шкіри характерною виявилась комбінація трьох ознак: лусочок, еритеми/псевдосітки і тонких хвилястих судин. Мішенеподібні фолікули траплялись лише у 69,7 % випадків. Характерним для АК з ІІІ фототипом виявлено поєднання чотирьох дерматоскопічних ознак: виразних фолікулів, сірих ромбовидних структур, мішенеподібних фолікулів, білих кругів.
Імуногістологічні та ІГХ дослідження проведенні у ДЗ «Дніпропетровська державна медична академія МОЗ України» на базі Діагностичного центру ТОВ «Аптеки медичної академії» (м. Дніпропетровськ).
Під час гістологічного дослідження панч-біопсійного матеріалу ураженої шкіри АК (15 випадків) і СК (9 випадків) встановлено, що випадки АК характеризувалися клітинною атипією різного ступеня важкості, що включала в себе спотворення дозрівання базальних клітин, плеоморфізм ядер кератиноцитів, порушення стратифікації, часткову або повну втрату зернистого шару, гіперкератоз (надмірне зроговіння), наявність ділянок пара- і дискератозу (частина зроговілих клітин має ядра (паракератоз), місцями кератин утворюється в кератиноцитах, які ще знаходяться у шипуватому шарі (дискератоз), збільшення кількості мітотичних фігур базального та навіть парабазального шарів, розширення міжклітинних просторів та прояви апоптозу (вакуолярні зміни базальних кератиноцитів, зменшення клітин із формуванням пікнотичних ядер – Civatte bodies). Загальними характеристиками гіпертрофічної форми АК (3 спостереження) виявились надмірний гіперкератоз з частим утворенням на поверхні епідермісу багатоповерхових гіпереозинофільних без’ядерних лусок, помірні паракератоз та акантоз із ознаками клітинної атипії та незначним накопиченням меланіну базальними кератиноцитами. Пігментну форму АК (2 спостереження) відрізняло навпаки інтенсивне накопичення меланіну в епідермісі з переважно помірним гіперкератозом та акантозом, незначним паракератозом та незначною або помірною клітинною атипією. Проліферативна форма АК (10 випадків) характеризувалась вираженим акантозом з утворенням широких акантотичних тяжів з тенденцією до брунькування, помірним гіперкератозом та різною клітинною атипією, незначними були прояви паракератозу та інтраепідермального накопичення меланіну.
Визначено чотири чіткі гістологічні типи СК за будовою: акантотичний (твердий, однорідний), ретикулярний або сітчастий (аденоїдний, залозистий), гіперкератозний (папіломатозний) та роздратований (ушкоджений). На відміну від АК, де завжди на першому місці виступала клітинна атипія з порушенням стратифікації, головними проявами гістології СК виявились гіперкератоз, акантоз, рогові кісти та інтенсивна пігментація базального шару.
Найбільш значущими гістопатологічними особливостями, що були виявлені в АК (окрім дисплазії І-ІІІ епітеліальних клітин) впродовж дослідження, виявились: запалення – круглоклітинний інфільтрат строми (100 %), дисплазія епітелію волосяних фолікулів (93,3 %), гіперкератоз (66,7 %), атрофія епідермісу (60,0 %), апоптоз базальних кератиноцитів (65,2 %), дисплазія себоцитів (53,3 %) та акантотичне брунькування (46,7 %).
Аналізуючи ІГХ профіль зразків АК, можна відокремити наступні особливості: АК здебільшого р53 позитивний (66,7 % випадків р53 (+), а 60 % продемонстрували експресію р53 на рівні більше 10 %), з активною проліферацією в базальних та парабазальних шарах епідермісу незрілих атипових клітин (66,7 % зразків мали ІП більше 30%) та помірною змішаною ядерно-цитоплазматичною експресією cyclin D1 (33,3 % випадків мали експресію вище 30%). До того ж при АК ці зміни зазвичай розповсюджуються на епітелій волосяних фолікулів та себоцити.
Додатково були визначені тенденції збільшення сили експресії маркерів р53 та Кі-67 із підвищенням гістологічного ступеня важкості (від АК І до АК ІІІ).
На відміну від АК, в зразках СК спостерігається виключно негативна р53 реакція (100 % спостережень), рівень проліферативної активності рідко досягає більше 10% (частіше в роздратованих варіантах перебігу – 2 спостереження із 9), експресія маркеру cyclin D1 низька і носить виключно інтрануклеарний характер. Аналіз подібності сукупностей АК та СК за точним тестом Фішера показав різницю за експресією маркерів р53 та Кі-67 (рр53=0,007 (r=0,60), ркі-67=0,002, (r=0,655) відповідно).
Аналіз процесів васкуляризації, що включав розрахунок щільності мікросудин «гарячих точок» та середніх діаметрів при збільшенні (х400) виявив вірогідне збільшення кількості судин при АК, порівняно із СК (р2=0,033, r=0,480), а також подвійне збільшення діаметрів судин в групі АК, пов’язане з формуванням спотворених кавернозно-подібних новоутворених судин навколо ділянок дисплазії епідермісу (р<0,001).
При оцінюванні протеолітичної активності в зразках АК та СК за експресією матриксної металопротеїнази 9 типу та її антагоністу ТІМР-1, визначено тільки відносно сильний кореляційний зв’язок за експресією ММР-9 (р2=0,002, r=0,721), але наявність аберрантної експресії маркеру ММР-9 та ТІМР-1 в обох підгрупах додатково говорить про наявність клітинної атипії і служить надійним прогностичним показником підвищення проліферативної активності.
Розроблено і впроваджено комбіновану методику терапії АК з врахуванням даних проведених ІГХ досліджень про можливість активної проліферації і злоякісної трансформації, спрямовану на радикальне видалення осередків АК, що попереджує інвазивний ріст.
Пацієнтам основної групи спостереження (58 пацієнтів) призначали 5 % саліцилову мазь з метою кератолітичного ефекту; наносили локально на вогнища двічі щодня впродовж 5-7 днів. Після відшарування гіперкератотичних утворень з поверхні вогнищ, проводили 3-5 сеансів IPL, у режимі відповідному до фототипу шкіри пацієнта, 1 раз у 7-10 днів, в залежності від вираженості місцевої реакції в зоні впливу. Контроль стану шкіри після IPL проводили візуально і методом дерматоскопії. Наступним у комбінованій терапії було проведення кріодеструкції спреєм, одноразово, тривалістю 10-15 сек. Курс лікування тривав 1-2 місяці. Пацієнтам групи порівняння (32 пацієнти) проводили 1 процедуру кріодеструкції спреєм тривалістю 10 секунд (монотерапія).
За результатами порівняльного аналізу продемонстровано, що серед пацієнтів основної групи, які отримали комбіновану терапію, було достовірно більше хворих, у яких відбулось значне покращення стану шкіри вже через 3 місяці і через 12 місяців. Так, через 3 місяці після проведення комбінованої терапії гладкою поверхня шкіри була у 77,6 % пацієнтів, через 12 місяців – у 79,3 % пацієнтів. У пацієнтів, які отримали монотерапію через 3 місяці гладка поверхня шкіри була у 40,6 % (p<0,001), через 12 місяців – у 59,4 % (р=0,043).
Встановлено, що серед пацієнтів, які отримали комбіновану терапію, через 3 місяці повне очищення було у 84,5 %, у пацієнтів, які отримали лише кріодеструкцію рідким азотом, у 37,5 %. Через 12 місяців повне очищення після проведення комбінованої терапії було у 75,9 % і у 56,3 % пацієнтів після проведення кріодеструкції. Рецидиви через 3 місяці після проведеного лікування не були виявлені у жодного пацієнта двох груп; через 12 місяців у основній групі рецидивів було 22,4 %, а в групі порівняння 43,8 % (р=0,035). Вірогідно частіше рецидиви мали місце у пацієнтів з гіпертрофічним клінічним варіантом АК (71,4 %), ураженнями ІІІ ступеня важкості (69,2 %) та значною кількістю вогнищ АК.
При проведенні постлікувального моніторингу через 3 місяці маркери фотоушкодження шкіри виявлялись у 34,5 % пацієнтів, які отримали комбіновану терапію і у 59,4 %, яким проведено монотерапію (p=0,028). Через 12 місяців у хворих після проведення комбінованої терапії маркери фотоушкодження було виявлено у 17,2 % пацієнтів і у 53,1 % після проведення монотерапії (p<0,001).
Призначення хворим на АК комбінованої терапії із застосуванням кератолітичного засобу, IPL – процедур і кріодеструкції рідким азотом дозволяє підвищити ефективність лікування, що підтверджено більш швидким повним регресом клінічних проявів, меншою кількістю рецидивів і досягненням кращого косметичного ефекту. Через 3 місяці відсутність косметичних дефектів відзначена у 67,0 % пацієнтів основної групи і лише у 40,6 % пацієнтів групи порівняння (р=0,025). У постлікувальному моніторингу, проведеному через 12 місяців, виявлено збільшення цих показників до 87,9 % в групі комбінованої терапії і до 50,0 % – після проведення кріодеструкції рідким азотом (p<0,001).
Враховуючи низький рівень обізнаності пацієнтів з АК щодо шкідливості гіперінсоляції (32,2 %), знань правил перебування на сонці (13,3 %) та необхідності фотозахисту (28,9 %), а також наявність вираженого кореляційного зв’язку між хронічною гіперінсоляцією в анамнезі та клінічними і морфологічними проявами захворювання важливим завданням роботи було проведення мотиваційного консультування досліджуваних пацієнтів, як невід’ємної і дуже важливої частини менеджменту АК, яка забезпечила отримання знань щодо необхідності постійного застосування СЗЗ та емолієнтів впродовж життя. Було розроблено методику мотиваційного консультування пацієнтів, що складається з двох частин: інформативної і рекомендаційної.
Постлікувальний моніторинг прихильності пацієнтів з АК до отриманих знань щодо факторів ризику, пов’язаних з надмірною інсоляцією, і відповідних рекомендацій по застосуванню СЗЗ і емолієнтів, показав суттєве покращення цього показника. Так, частка пацієнтів, які наносили СЗЗ щоденно, через кожних 3 години, як було рекомендовано, склала 62 (68,9 %); наносили нерегулярно – 16 (17,8 %); 2,2 % (2 пацієнти) не застосовували СЗЗ, не дивлячись, що отримали рекомендацію. Щоденне використання СЗЗ зворотно корелювало зі ступенем важкості АК (r=-0,30; p=0,004) і віком пацієнтів (r=-0,45; p<0,001), проте вже не асоціювалось з рівнем поінформованості про шкідливість UV. Емолієнти від початку лікування і перебування під спостереженням застосовували щоденно двічі 73 (81,1 %) пацієнти; 17 (18,9 %) пацієнтів використовували такі засоби нерегулярно.
Отримані результати свідчать про високу прихильність досліджуваних пацієнтів до застосування СЗЗ і емолієнтів, що безпосередньо позитивно позначилось на кінцевих клінічних результатах лікування і профілактики рецидивів АК.
Таким чином, використання запропонованого способу лікування забезпечує вплив на основні ланки патогенетичних механізмів розвитку АК, спрямований на досягнення клінічного одужання, подовження ремісії та досягнення максимально хорошого косметичного ефекту.
Висновки
У дисертаційній роботі проведено теоретичне обґрунтування і нове науково-практичне вирішення актуального завдання сучасної дерматовенерології – покращення діагностики і підвищення ефективності комплексної терапії АК шляхом вивчення механізму розвитку дерматозу, клінічних особливостей, розробки алгоритму діагностики з урахуванням результатів клінічних, дерматоскопічних, патоморфологічних та ІГХ досліджень і в поєднанні з профілактичними заходами.
- Враховуючи постійне зростання рівня захворюваності та поширеності АК, можливість його активної проліферації, прогресування і злоякісної трансформації в інвазивний рак, недостатню вивченість окремих ланок патогенезу захворювання, триваючі наукові дискусії (АК є передраковим станом чи інтраепітеліальним ПКРШ на ранній стадії свого розвитку), актуальним є пошук нових методів сучасної діагностики, поглиблене вивчення окремих ланок патогенезу і розробка удосконаленої комбінованої терапії.
- Встановлено, що переважними клініко-анамнестичними ознаками проявів і перебігу АК є: похилий і старечий вік пацієнтів (88,9 % старше 60 років), скарги на шорсткість (100 %) і почервоніння (73,3 %) шкіри з утворенням лусочок (65,6 %) у місцях ураження, ІІ тип фоточутливості шкіри (73,3 %), кумулятивна надмірна інсоляція в анамнезі (74,4 %), наявність маркерів фотоушкодження шкіри (58,9 %). Найчастішими морфологічними елементами в осередках ураження є папули (57,8 %) і плями (54,4 %) рожевого (65,6 %) або світло-коричневого кольору (31,1 %), здебільшого асоційовані з проліферативною формою АК (65,6 %), ІІ (45,6 %) і ІІІ ступенем (28,9 %) важкості дерматозу.
- За даними дерматоскопічного дослідження встановлено, що основними ознаками пігментного АК є виражені фолікули (100 %), сірі ромбовидні структури (100 %), мішенеподібні фолікули і білі круги (91,3 %); для проліферативного АК характерні – еритеми / рожева псевдосітка (94,9 %), лусочки (94,9 %), тонкі хвилясті судини (93,2 %); для гіпертрофічного клінічного варіанту – поєднання трьох дерматоскопічних ознак: мішенеподібних і виражених фолікулів та лусочок (100 %).
- За даними гістологічного дослідження встановлено, що основними морфологічними ознаками АК є клітинна атипія з вираженими явищами запалення, дисплазії епітелію волосяних фолікулів та себоцитів, атрофії епідермісу та апоптозу базальних кератиноцитів – від 53,3 % до 100 % випадків, порівняно із СК – від 0 % до 22,2 %.
- Імуногістохімічний профіль ураженої шкіри при АК свідчить, що це захворювання є здебільшого р53 позитивним, з активною проліферацією в базальних та парабазальних шарах епідермісу незрілих атипових клітин; характеризується вірогідним збільшенням щільності мікросудин та їхніх діаметрів за експресією маркеру CD34 (в 1,8-2 рази), підвищенням експресії маркеру ММР‑9 і аберантним ядерно-цитоплазматичним забарвленням епідермісу, що додатково свідчить про наявність клітинної атипії і підвищення проліферативної активності.
- Розроблено і впроваджено комбіновану методику терапії АК із застосуванням кератолітичного засобу, IPL-процедур і кріодеструкції рідким азотом, спрямовану на радикальне видалення осередків АК і попередження інвазивного росту, що забезпечує значне покращення стану шкіри з повним її очищенням у 84,5 % і 75,9 % пацієнтів через 3 і 12 місяців терапії, на відміну від монотерапії методом кріодеструкції рідким азотом з аналогічними результатами у 37,5 % і 56,3 % пацієнтів; швидкий повний регрес клінічних проявів захворювання; меншу кількість рецидивів (22,4 % проти 43,8 %); досягнення кращого косметичного ефекту (87,9 % проти 50,0 % пацієнтів).
- Встановлено низький рівень обізнаності хворих на АК щодо шкідливості гіперінсоляції (32,2 %), знань правил перебування на сонці (13,3 %) та необхідності фотозахисту (28,9 %) на первинному прийомі. Розробка і впровадження методики мотиваційного консультування пацієнтів сприяли підвищенню показників комплаєнтності до застосування СЗЗ (до 86,7 %) і емолієнтів (81,1 %), що безпосередньо позитивно позначилося на кінцевих клінічних результатах лікування і профілактики рецидивів АК.
РЕКОМЕНДАЦІЇ
- При встановленні діагнозу АК слід враховувати особливості клінічних і дерматоскопічних ознак дерматозу залежно від ступеня тяжкості і клініко-морфологічних варіантів захворювання.
- З метою покращення ранньої діагностики та своєчасного адекватного лікування АК доцільно дотримуватися двоетапного діагностичного алгоритму. Перший етап діагностики здійснюється на первинному (сімейними лікарями) і на вторинному (дерматологи багатопрофільних поліклінік) рівнях надання медичної допомоги і передбачає вивчення даних анамнезу щодо тривалості впливу сонячного випромінення, попередньої цитостатичної терапії, зловживання солярієм і т.ін.; визначення фототипу шкіри; оцінку клінічної візуальної симптоматики і локалізації патологічних змін на шкірі; проведення диференційної діагностики (з СК, хворобою Боуена, поверхневою базально-клітинною карциномою). Другий етап передбачає проведення дерматоскопічних (поляризаційна і неполяризаційна дерматоскопія) та ІГХ досліджень спеціалістами (дерматолог, дерматоонколог) третинного рівня.
- Для підвищення ефективності лікування хворих на АК рекомендується проведення комбінованої послідовної трьохетапної терапії із застосуванням кератолітичного засобу – 5 % саліцилової мазі двічі щодня впродовж 5–7 днів до відшарування лусочок і кірочок з наступними сеансами ІРL (з довжиною хвилі 560–1200 нм, імпульсом 22–26 Дж/см2) № 3-5 у режимі, відповідному до фототипу шкіри пацієнта, 1 раз на 7–10 днів залежно від вираженості місцевої реакції в зоні впливу; проведенням на заключному етапі кріодеструкції спреєм рідкого азоту тривалістю 10–15 с одноразово. Курс лікування – 1–2 місяці.
- З метою підвищення комплаєнтності пацієнтів до лікування і профілактики рецидивів АК важливо проводити мотиваційне консультування пацієнтів інформаційного і рекомендаційного характеру щодо шкідливості гіперінсоляції, знань правил перебування на сонці та необхідності фотозахисту.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Актинический кератоз: обзор литературы. Вестник дерматологии и венерологии. № 5. С. 42–52.
- Возможности конфокальной лазерной сканирующей микроскопии в неинвазивной диагностике развития злокачественных эпителиальных опухолей кожи в процессе прогрессирования дерматогелиоза / Е.С. Снарская, С. Б. Ткаченко, Е. В. Кузнецова, А. С. Апленова. Вестник дерматологии и венерологии. 2016. № 3. С. 75–82.
- Возрастные изменения структурно-функциональных показателей кожи / Г. В Золотенкова, Ю. Е. Морозов, С. Б. Ткаченко, Ю. И. Пиголкин. Вестник Балтийского федерального университета им. И. Канта. 2014. Вып. 1. С. 132–139.
- Галченко В. М., Галченко Л. И. Комплексное лечение актинического хейлита. Актуальные проблемы и перспективы развития стоматологии в условиях севера: сб. ст. межрегион. науч.-практ. конф. с междунар. участием, посвящен. 60-летию мед. ин-та Северо-Восточ. федерал. ун-та им. М.К. Амосова. 2017. С. 51–54.
- Глушок В. С. Аналіз процесів васкуляризації та деградації позаклітинного матриксу при актинічному кератозі. Український журнал дерматології, венерології, косметології. 2017. № 4 (67). С. 22–27.
- Глушок В. С. Основні патофізіологічні механізми розвитку і прогресування актинічного кератозу. Журнал дерматовенерології та косметології імені М. О. Торсуєва. 2017. № 2 (38). С. 101–108.
- Глушок В. С. Попередні результати скринінгових обстежень на актинічний кератоз. Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування та профілактики дерматозів та інфекцій, що передаються статевим шляхом : матеріали регіональн. наук.-практ. конф. (м.Святогірськ, 12-13 травня 2016 р.). Святогірськ, 2016. С. 14–15.
- Глушок В. С. Себорейний кератоз: аспекти диференціальної діагностики з актинічним кератозом. Журнал дерматовенерології та косметології імені М.О. Торсуєва. № 1 (39). С. 94–95.
- Глушок В. С., Святенко Т. В. Можливості дерматоскопії в діагностиці актинічного кератозу. Здобутки клінічної і експериментальної медицини. 2018. № 2 (34). С. 37–41.
- Глушок В. С., Святенко Т. В., Шпонька І. І., Пославська О. В. Спосіб діагностики актинічного кератозу: пат. 125617 Україна: МПК (2018.01), GO1N21/00; заявл. 22.01.2018; опубл. 10.05.2018, Бюл. № 9.
- Глушок В. С., Святенко Т. В. Власний досвід комбінованої послідовної терапії актинічного кератозу. Дерматологія та венерологія. № 1 (79). С. 39–42.
- ГлушокВ. С., Хара А. И. К вопросу о менеджменте дерматоонкологической помощи пациентам с актиническим кератозом. Дерматовенерология и эстетическая медицина. 2015. № 3 (27). С. 121.
- Дерматоскопия как способ оценки эффективности 5% крема имиквимод у пациентов с базально-клеточной карциномой кожи / М. В. Жучков Д. Б. Сонин, М. А. Тарасова, С. А. Косорукова. Вестник дерматологии и венерологии. 2017. № 3. С. 32–41.
- Диагностика актинического кератоза методом дерматоскопии / А.Н. Хлебникова, К. В. Обыденова, Т. Г. Седова, В. В. Андрюхина. Вестник дерматологии и венерологии. 2017. № 2. С. 45–52.
- Диагностическая значимость метода конфокальной лазерной сканирующей in vivo микроскопии / А. А. Кубанова, А.А. Кубанов, В. А. Смольянникова и др. Вестник дерматологии и венерологии. №3. С. 67–74.
- Елькин В. Д, Митрюковский Л. С., Лысов А. Ю. Практическая дерматоонкология: иллюстрированное справочное руководство по опухолям кожи, опухолеподобным заболеваниям и связанным с ними синдромами. М. : Практ. медицина, 2014. 480 с.
- Жилова М. Б., Смольянникова В. А. Плоскоклеточный рак кожи у больного псориазом, получавшего многокурсовую фототерапию. Вестник дерматологии и венерологии. № 1. С. 92–98.
- Инновации в дерматологии – заболевания, ассоциированные днк вирусом впч (актинический кератоз (АК), базальноклеточный рак кожи (БКРК), остроконечные кондиломы (ОК) – возможности терапии 5% кремом имиквимод / С. В. Ключарёва, О. С. Нечаева, Е. А. Белова и др. Боткинские чтения: Всерос. науч.-практ. конф. (Санкт-Петербург, 11-12 мая). Санкт-Петербург, С.124–126.
- Кобзарь А. И. Прикладная математическая статистика. Для инженеров и научных работников / А. И. Кобзарь. – М. : Физматлит, 2012. – 816 с.
- Кубанов А. А., Жилова М. Б., Кубанова А. А. Фотостарение кожи: механизмы развития, особенности клинических проявлений. Вестник дерматологии и венерологии. № 5. С. 53–59.
- Кузнецов В. В. Применение лазерных технологий в отечественной дерматоонкологии (обзор литературы). Радиация и риск. 2015. Т. 24, № 1. С.132–144.
- Лазеро-светолечение / под ред. Дэйвида Дж. Голдберга; пер. с англ. под общей ред. В. А. Виссарионова. Москва : ООО «Рид Элсивер», 2010. Т. 1. 187 с.
- Левончук Е. А. Ультрафиолетовое облучение и актинический кератоз. Дерматовенерология. Косметология. № 1. С. 105–108.
- Могут ли поражения, вызванные актиническим кератозом, стать загадкой для дерматологов? Результаты открытого перспективного исследования / Э. Буйнаускайте, С. Рубинс, А. Рубинс и др. Вестник дерматологии и венерологии. 2017. № 2. С. 53–59.
- Молочков А. В., Молочкова Ю. В. Дерматоонкология. Атлас. Москва : Изд-во Бином, 2015. 362 с.
- Обыденова К. В., Хлебникова А. Н., Седова Т. Г. Факторы, ассоциированные с актиническим кератозом. Вестник последипломного медицинского образования. № 3. С. 37–40.
- Особенности пролиферации и межклеточной адгезии в предраковых и злокачественных эпителиальных опухолях кожи / А.Н. Хлебникова, Л. Е. Гуревич, Е. В. Селезнева, К. В. Обыденова. Альманах клинической медицины. Т. 44, № 1. С. 58–63.
- Оцінка стану проліферативної активності та експресії онкомаркеру p53 в зразках актинічного кератозу / В. С. Глушок, Т. В. Святенко, І. С. Шпонька, О. В. Пославська. Морфологія. 2017. Т. 11, № 3. С. 6–12.
- Ошивалова О. О. Дерматоскопічні особливості актинічного кератозу. Клінічна імунологія. Алергологія. Інфектологія. 2017. Спец. вип. : Дерматовенерологія в контексті загальномедичної практики : конф. С. 16–17.
- Ошивалова О. О. Диференційна діагностика актинічного кератозу. Клінічна імунологія. Алергологія. Інфектологія. № 3 (92). С. 16–19.
- Ошивалова О. О. Клинический маршрут пациэнта с предонкологической патологией кожи. Український журнал дерматології, венерології, косметології. 2016. № 3(62). С. 64–68.
- Ошивалова О. О. Пацієнт орієнтований підхід в лікуванні пухлин шкіри. Вісник проблем біології і медицини. Вип. 4, т. 1. 232–239.
- Ошивалова О. О. Профілактика раку шкіри. Клиническая онкология. № 2. С. 22–24.
- Ошивалова О. О. Раціональний підхід в лікуванні епітеліальних пухлин шкіри. Дерматологія та венерологія. № 3. С. 110–111.
- Ошивалова О. О. Судинний компонент як диференційно-діагностичний показник епідермальних дисплазій шкіри. Дерматовенерологія. Косметологія. Сексопатологія. № 3/4(4). С. 5–10.
- Ошивалова О. О., Калюжна Л. Д, Кропельницький В. О. Клініко-гістологічні паралелі актинічного кератозу. Дерматологія та венерологія. 2017. № 2. С. 27–32.
- Рівень обізнаності лікарів-дерматовенерологів з актуальних питань профілактики раку шкіри / О. О. Ошивалова, Л. Д. Калюжна, О. Л. Зюков, О. І.Літус. Дерматологія та венерологія. 2017. № 1. С. 60–63.
- Святенко Т. В., Глушок В. С. Комбінована терапія актинічного кератозу з врахуванням морфофенотипування. Інформаційний лист. К., 2018. №31, вип. 2: Дерматологія та венерологія.
- Скринінгові програми в онкології / Ю. Б. Ященко, О. О. Ошивалова, М. В. Шевченко, Н. Ю. Кондратюк. Український медичний часопис. 2015. № 3. С. 29–31.
- Снарская Е. С, Ткаченко С. Б., Кузнецова Е. В. Дерматогелиоз как предиктор развития эпителиальных новообразований кожи. Российский журнал кожных и венерических болезней. Т. 17, № 4. С. 12–17.
- Сравнительные исследования эффективности фотодинамической терапии и криодеструкции в лечении актинического кератоза / Т. Е. Сухова, К. А. Чанглян, А. В. Молочков и др. Biomedical Photonics. Т. 5, № 3. С.19–29.
- Толстихина Н. Б., Кузнецов С. Р, Гузей Т. Н. Современный взгляд на актинический кератоз: актуальные вопросы дерматовенерологии и косметологии: сб. науч. трудов регион. конф. дерматовенерол. и косметологов, посвящён. памяти проф. В. И. Прохоренкова. 2016. Красноярск. С. 219–223.
- Шляхтунов Е. А. Рак кожи: современное состояние проблемы. Вестник Витебского государственного медицинского университета. 2014. Т.13, № 3. С. 20–28.
- Эпителиальные опухоли кожи / В. А. Молочков, А. В. Молочков, А. Н. Хлебникова, Ж. С. Кунцевич. Москва : Изд-во Бином, 2012. 224 с.
- A comparison of dermoscopic features among lentigo senilis/initial seborrheic keratosis, seborrheic keratosis, lentigo maligna and lentigo maligna melanoma on the face / M. T. Sahin, S. Oztürkcan, A. T. Ermertcan, A. T. Güneş. J Dermatol. Vol. 31, Iss. 11. Р. 884–889.
- A consensus approach to improving patient adherence and persistence with topical treatment for actinic keratosis / Stockfleth, K. Peris, C. Guillen et al. Int J Dermatol. 2015. Vol. 54, Iss. 5. P. 509–515.
- A proposed scoring system for assessing the severity of actinic keratosis on the head: actinic keratosis area and severity index / T. Dirschka, G. Pellacani, G. Micali et al. J Eur Acad Dermatol Venereol. Vol. 31, Iss. 8. P. 1295–1302.
- A prospective randomized exploratory study comparing the efficacy of once-daily topical 0.5% 5-fluorouracil in combination with 10.0% salicylic acid (5-FU/SA) vs. cryosurgery for the treatment of hyperkeratotic actinic keratosis / J. С.Simon, R. Dominicus, L. Karl et al. J Eur Acad Dermatol Venereol. 2015. Vol. 29, Iss. 5. P. 881–889.
- A randomized, double-blind, placebo-controlled clinical trial evaluating Dermytol cream for the treatment of actinic keratosis / Evans, D. Kalman, P. Alvarez et al. Clin Cosmet Investig Dermatol. 2014. Vol. 7. P. 215–224.
- Acantholytic squamous cell carcinoma is usually associated with hair follicles, not acantholytic actinic keratosis, and is not «high risk»: diagnosis, management, and clinical outcomes in a series of 115 cases / T. Ogawa, M. Kiuru, T. H. Konia, M. A. Fung. J Am Acad Dermatol. 2017. Vol. 76, Iss. 2. P. 327–333.
- Actinic Keratosis Clinical Practice Guidelines: An Appraisal of Quality / J. S. Kirby, T. Scharnitz, E. V. Seiverling et al. Dermatol Res Pract. Vol. 2015. Article ID 456071.
- Actinic keratosis modelling in mice: A translational study / Pillon, B. Gomes, I. Vandenberghe et al. PLoS One. 2017. Vol. 12, Iss. 6. Article ID e0179991.
- Actinic keratosis with atypical basal cells (AK I) is the most common lesion associated with invasive squamous cell carcinoma of the skin / M.T. Fernández-Figueras, C. Carrato, X. Saenz et al. J Eur Acad Dermatol Venereol. 2015. Vol. 29, Iss. 5. Р. 991–997.
- Actinic keratosis: a cross-sectional study of disease characteristics and treatment patterns in Danish dermatology clinics / A. M. Erlendsson, H. Egekvist, H. F. Lorentzen et al. Inter J Dermatology. Vol. 55, Iss. 3. P. 309–316.
- Actinic keratosis: correlation between clinical and histological classification systems / L. Schmitz, P. Kahl, Majores et al. J Eur Acad Dermatol Venereol. 2016. Vol. 30, Iss. 8. P. 1303–1307.
- Afsar F. S., Erkan C. D., Karaca S.. Clinical practice trends in cryosurgery: a retrospective study of cutaneous lesions. Postepy Dermatol Alergol. 2015. Vol. 32, Iss. 2. P. 88–93.
- Aktaş H., Ergin C., Özge Keseroğlu H. Diclofenac gel may be a new treatment option for seborrheic keratosis. Indian Dermatology Online Journal. Vol. 7, Iss. 3. P. 211–212.
- Alapatt G.F., Sukumar D., Bhat M.R. A Clinic pathological and Dermoscopic Correlation of Seborrheic Keratosis. Indian J Dermatol. Vol. 61, Iss. 6. Р. 622–627.
- Angiogenesis in the progression of cutaneous squamous cell carcinoma: an immunohistochemical study of endothelial markers / M. E. Florence, J. Y. Massuda, E. B. Bröcker et al. Clinics (Sao Paulo). Vol. 66, Iss. 3. Р. 465–468.
- Ankad B. S., Shah S. D., Adya K. A. White rosettes in discoid lupus erythematosus: a new dermoscopic observation. Dermatol Pract Concept. 2017. Vol. 7, Iss. 4. P. 9–11.
- Application of intense pulsed light in the treatment of dermatologic disease: a systematic review / H. Wat, D. C. Wu, J. Rao, M. P. Goldman. Dermatologic Surgery. Vol. 40, Iss. 4. P. 359–377.
- Automated Detection of Actinic Keratoses in Clinical Photographs / S. Hames, S. Sinnya, J.-M. Tan et al. PLoS One. 2015. Vol. 10, Iss. 1. Article ID e0112447.
- Berner A. Actinic keratosis and development of cutaneous squamous cell carcinoma. Tidsskr Nor Laegeforen. 2005. Vol. 125, Iss. 12. Р. 1653–1654.
- Berry, Butt M., Kirby J. S. Influence of Information Framing on Patient Decisions to Treat Actinic Keratosis. JAMA Dermatol. 2017. Vol. 153, Iss. 5. P. 421–426.
- British Association of Dermatologists’ guidelines for the care of patients with actinic keratosis 2017 / D. de Berker, J. M. McGregor, M. F. Mohd Mustapa et al. Br J Dermatol. Vol. 176, Iss. 1. Р. 20–43.
- Brodsky J. Management of benign skin lesions commonly affecting the face: actinic keratosis, seborrheic keratosis and rosacea. Curr Opin Otolaryngol Head Neck Surg. Vol. 17, Iss. 4. Р. 315–320.
- Bubna A. K. Imiquimod – Its role in the treatment of cutaneous malignancies. Indian J Pharmacol. 2015. Vol. 47, Iss. 4. P. 354–359.
- Butani A. K., Arbesfeld D. M., Schwartz R. A. Premalignant and early squamous cell carcinoma. Clin Plast Surg. 2005. Vol. 32, Iss. 2. Р. 223–
- CD8+ and FoxP3+ T-cell infiltration in actinic cheilitis / I. G. Rojas, M. L. Spencer, P. A. Zapata et al. J. Dermatology. 2017. Vol. 56, Iss. 1. P. 54–62.
- Chaplin S. Topical agents for preventing and treating actinic keratosis. Prescriber. 2016. April. P. 32–40.
- Chetty P., Choi F., Mitchell T. Primary Care Review of Actinic Keratosis and Its Therapeutic Options: A Global Perspective. Dermatol Ther (Heidelb). 2015. Vol. 5, Iss. 1. P. 19–35.
- Clinical and Histopathological Investigation of Seborrheic Keratosis / N. K. Roh, H. J. Hahn, Y. W. Lee et al. Ann Dermatol. Vol. 28, Iss. 2. P. 152–158.
- Clinical and pathological study of 328 cases of actinic keratosis in eastern chinese patients / Y. M. Han, L. J. Chen, X. Dou, Q. P. Yang. 2013. Vol. 227, Iss. 4. Р. 316–320.
- Clinical Study. Unconventional Use of Intense Pulsed Light / D. Piccolo, D.Di Marcantonio, G. Crisman et al. Biomed Res Int. Vol. 2014. Article ID 618206.
- Collision skin lesions—results of a multicenter study of the International Dermoscopy Society (IDS) / A. Blum, G. Siggs, A. A. Marghoob et al. Dermatol Pract Concept. 2017. Vol. 7, Iss. 4. P. 51–62.
- Combined CSL and p53 downregulation promotes cancer-associated fibroblast activation / M.-G. Procopio, C. Laszlo, D. Al Labban et al. Nat Cell Biol. Vol. 17, Iss. 9. P. 1193–1204.
- Community-Based Practice Variations in Topical Treatment of Actinic Keratoses / M. Storer, Z. Zhu, M. Sokil et al. JAMA Dermatol. 2017. Vol. 153, Iss. 5. P. 468–470.
- Comparative study of actinic keratosis treatment with 3% diclofenac sodium and 5% 5-fluorouracil / M. M. Segatto, S. I. T. Dornelles, V. B. Silveira, G.de Oliveira Frantz. An Bras Dermatol. 2013 Vol. 88, Iss. 5. P. 732–738.
- Cost-utility of first-line actinic keratosis treatments in Finland / E. J. Soini, T. Hallinen, A. L. Sokka, K. Saarinen. 2015. Vol. 32, Iss. 5. P. 455–476.
- Cutaneous Horn in Premalignant and Malignant Conditions / H. Park, W. Kim, H. Kim, H. Yeo. Arch Craniofac Surg. 2016. Vol. 17, Iss. 1. P. 25–27.
- Cyclin A and beta-catenin expression in actinic keratosis, Bowen’s disease and invasive squamous cell carcinoma of the skin / D. Brasanac, I. Boricic, V. Todorovic et al. J Dermatol. 2005. Vol. 153, Iss. 6. Р. 1166–1175.
- Daylight photodynamic therapy versus cryosurgery for the treatment and prophylaxis of actinic keratoses of the face – protocol of a multicenter, prospective, randomized, controlled, two-armed study / E. Kohl, M. Koller, F. Zeman et al. BMS 2017. Vol. 17. Article ID 29070025.
- de Vries K., Prens E. P. Laser Treatment and Its Implications for Photodamaged Skin and Actinic Keratosis. Curr Probl Dermatol. 2015. Vol. 46. P. 129–135.
- Defining the actinic keratosis field: a literature review and discussion / I. Figueras Nart, R. Cerio, T. Dirschka et al. J Eur Acad Dermatol Venereol. Vol. 32, Iss. 4. P. 544–563.
- Deonizio J., Werner B., Mulinari-Brenner F. A. Histological Comparison of Two Cryopeeling Methods for Photodamaged. ISRN Dermatol. 2 Vol. 2014. Article ID 950754.
- Dermoscopic characteristics of nodular squamous cell carcinoma and keratoacanthoma / M. J. Lin, Y. Pan, C. Jalilian, J. W. Kelly. Dermatol Pract Concept. 2014. Vol. 4, Iss. 2. P. 9–15.
- Dermoscopic clues to differentiate facial lentigo maligna from pigmented actinic keratosis / A. Lallas, P. Tschandl, A. Kyrgidis et al. J. Dermatol. 2016. Vol. 174, Iss. 5. Р. 1079–1085.
- Dermoscopic features of actinic keratosis and follow up with dermoscopy: a pilot study / J. H. Lee, C. Y. Won, G. M. Kim, S. Y. Kim. J Dermatol. 2014. Vol. 41, Iss. 6. Р. 487–493.
- Dermoscopic features of facial pigmented skin lesions / Y. Goncharova, E. A. S. Attia, K. Souid, I. V. Vasilenko. ISRN Dermatol. Vol. 2013. Article ID 546813.
- Dermoscopy and Reflectance Confocal Microscopy for Monitoring the Treatment of Actinic Keratosis with Ingenol Mebutate Gel: Report of Two Cases / C.Longo, S. Borsari, E. Benati, et al. Dermatol Ther (Heidelb). 2016. Vol. 6, Iss. 1. P. 81–87.
- Dodds A., Chia A., Shumack S. Actinic Keratosis: Rationale and Management. Dermatol Ther (Heidelb). Vol. 4, Iss. 1. P. 11–31.
- Du Thanh A., Guillot B. Actinic keratosis: when is a skin biopsy necessary? Eur Dermatol. Vol. 22, Iss. 1. Р. 13–16.
- Effect of a Pre-Treatment Educational Video in Improving Patient Satisfaction with 5-Fluorouracil Treatment for Actinic Keratoses: A Randomized Controlled Trial / O. N. Agbai, P. Davari, J. Johnson et al. Dermatol Ther (Heidelb). Vol. 6, Iss. 4. P. 675–681.
- Efficacy and Safety of 5-Fluorouracil 0.5%/Salicylic Acid 10% in the Field-Directed Treatment of Actinic Keratosis: A Phase III, Randomized, Double-Blind, Vehicle-Controlled / E. Stockfleth, R. von Kiedrowski, R. Dominicus et al. Dermatol Ther (Heidelb). 2017. Vol. 7, Iss. 1. P. 81–96.
- Elizabeth E. Uhlenhake Optimal treatment of actinic keratoses. Clin Interv Aging. 2013. Vol. 8. P. 29–35.
- Expression of cell proliferation and apoptosis biomarkers in skin spinocellular carcinoma and actinic keratosis / M. T. Dornelas, M. F. Rodrigues, D. C. Machado et.al. An Bras Dermatol. Vol. 84, Iss. 5. Р. 469–475.
- Expression of G1/S-cyclins and cyclin-dependent kinase inhibitors in actinic keratosis and squamous cell carcinoma / D. Brasanac, J. Stojkovic-Filipovic, M. Bosic et al. J Cutan Pathol. Vol. 43, Iss. 3. Р. 200–210.
- Eyelid tumours and pseudotumours in Hong Kong: a ten-year experience / M. Ho, D.T.L. Liu, K.K.l. Chong et al. Hong Kong Med J. Vol. 19, Iss. 2. Р.150–155.
- Feldman S. R., Fleischer A. B. Jr. Progression of actinic keratosis to squamous cell carcinoma revisited: clinical and treatment implications. 2015. Vol. 87, 4. Р. 201–207.
- Genetic alterations in seborrheic keratosis / B. Heidenreich, E. Denisova, S. Rachakonda et al. Oncotarget. 2017. Vol. 8, Iss. 22. May 30. P. 36639–36649.
- Goldenberg G. Optimal treatment of actinic keratosis. Clin Interv Aging. 2014. Vol. 9. P. 15–16.
- Goldenberg G., Berman B. Assessment of local skin reactions with a sequential regimen of cryosurgery followed by ingenol mebutate gel, 0.015%, in patients with actinic keratosis. Clin Cosmet Investig Dermatol. 2015. Vol. 8. P. 1–8.
- Goldenberg G., Perl M. Actinic Keratosis: Update on Field Therapy. J Clin Aesthet Dermatol. Vol. 7, Iss. 10. P. 28–31.
- Griffin L. L., Lear J. T. Photodynamic Therapy and Non-Melanoma Skin. Cancer. Cancers (Basel). Vol. 8, Iss. 10. P. 98.
- Health related quality of life in patients with actinic keratosis – an observational study of patients treated in dermatology specialist care in Denmark / G. Tennvall, J. M. Norlin, I. Malmberg et al. Qual Life Outcomes. 2015. Vol. 13. P. 111.
- Histology of Non-Melanoma Skin Cancers: An Update / G. Paolino, M. Donati, D. Didona et al. 2017. Vol. 5, Iss. 4. P. 71.
- Histopathological analysis of the therapeutic response to cryotherapy with liquid nitrogen in patients with multiple actinic keratosis / M. C. de Oliveira, F. Trevisan, C. A. L. Pinto et al. An Bras Dermatol. 2015. Vol. 90, Iss. 3. P. 384–389.
- Hlushok V. S., Sviatenko T.V. New approach to the diagnostics of actinic keratosis in Ukraine. International Journal of Dermatology. 2017. Vol. 56. P. 1315–1316.
- Hlushok V., Sviatenko T. The use of the sunscreens as a part of actinic keratosis management. Journal Experimental and Clinical Medicine. 2018. № 1. P. 43–47.
- Hlushok V. S. A part of a prophylaxis of skin neoplasias in the region. Matherial of 2nd International transcaucasus congress on photodermatology and skin cancer. (Tbilisi, 27-29 october 2016). Tbilisi, 2016. 43–47.
- How to treat actinic keratosis? An update / C. Costa, M. Scalvenzi, F. Ayala et al. J Dermatol Case Rep. 2015. Vol. 9, Iss. 2. P. 29–35.
- Hufbauer M., Akgül Molecular Mechanisms of Human Papillomavirus Induced Skin Carcinogenesis. Viruses. 2017. Vol. 9, Iss. 7. P. 187.
- Ianhez M., Miot A. H., Bagatin E. Liquid nitrogen for the treatment of actinic keratosis: a longitudinal assessment. 2014. Vol. 69, Iss. 1, P.140–143.
- Imaging Blood Vessel Morphology in Skin: Dynamic Optical Coherence Tomography as a Novel Potential Diagnostic Tool in Dermatology / S. Schuh, J.Holmes, M. Ulrich et al. Dermatol Ther (Heidelb). Vol. 7, Iss. 2. P. 187–202.
- Immunohistochemical analysis of TIMP-3 and MMP-9 in actinic keratosis, squamous cell carcinoma of the skin, and basal cell carcinoma / F. O. Poswar, C. A. Fraga, L. C. Farias et al. Pathol Res Pract. 2013. 209, Iss. 11. Р. 705–709.
- Immunohistochemical expression of matrix metalloproteinase‐1, matrix metalloproteinase‐2 and matrix metalloproteinase‐9, myofibroblasts and Ki‐67 in actinic cheilitis and lip squamous cell carcinoma / C. Bianco, F. M.Scotti, D. S. C. Vieira et al. Int. J Exp Pathol. 2015. Vol. 96, Iss. 5. P. 311–318.
- Inner gray halo, a novel dermoscopic feature for the diagnosis of pigmented actinic keratosis: clues for the differential diagnosis with lentigo maligna / M. M. Nascimento, D. Shitara, M. M. Enokihara et al. J Am Acad Dermatol. 2014. Vol. 71, Iss. 4. Р. 708–
- Irani S. Pre-Cancerous Lesions in the Oral and Maxillofacial Region: A Literature Review with Special Focus on Etiopathogenesis. J Pathol. 2016. Vol. 11, Iss. 4. P. 303–322.
- Kalegowda I.Y., Böer-Auer A. Clonal Seborrheic Keratosis Versus Pagetoid Bowen Disease: Histopathology and Role of Adjunctive Markers. J. Dermatopathol. 2015. Vol. 39, Iss. 6. Р. 433–439.
- Kallini J. R., Hamed N., Khachemoune A. Squamous cell carcinoma of the skin: epidemiology, classification, management, and novel trend. J. Dermatol. 2015. Vol. 54, Iss. 2. P. 130–140.
- Karagece Y.U., Seçkın S. The expression of p53 and COX-2 in basal cell carcinoma, squamous cell carcinoma and actinic keratosis cases. Turk Patoloji Derg. Vol. 28, Iss. 2. Р. 119–127.
- Kim M., Jung H. Y., Park H. J. Topical PDT in the Treatment of Benign Skin Diseases: Principles and New Applications. J Mol Sci. 2015. Vol. 16, Iss.10. P. 23259–23278.
- Kopera D., Kerl H. Visualization and Treatment of Subclinical Actinic Keratoses with Topical Imiquimod 5% Cream: An Observational Study. Bio Med Research International. Vol. 2014. Article ID 135916.
- Lasers and intense pulsed light (IPL) association with cancerous lesions / С. Ash, G. Town, R. Whittall et al. Lasers Med Sci. Vol. 32, Iss. 8. P. 1927–1933.
- Leiter , Eigentler T., Garbe C. Epidemiology of 9 skin cancer. Advancesin Experimental Medicine and Biology. 2014. Vol. 810, Iss. 120. P.40–43.
- Lumican as a novel marker for differential diagnosis of Bowen disease and actinic keratosis / R. Takayama, T. Ishiwata, S. Ansai et al. Am J Dermatopathol. 2013. Vol. 35, Iss. 8. P. 827–832.
- Majores M., Bierhoff E. Actinic keratosis, Bowen’s disease, keratoacanthoma and squamous cell carcinoma of the skin. 2015. Vol. 36, Iss. 1. Р. 16–29.
- MAL Daylight Photodynamic Therapy for Actinic Keratosis: Clinical and Imaging Evaluation by 3D Camera / C. Cantisani, G. Paolino, G. Pellacani et al. Int J Mol Sci. Vol. 17, Iss. 7. P. 1108.
- Malvehy J. A new vision of actinic keratosis beyond visible clinical lesions. J Eur Acad Dermatol Venereol. Vol. 29, Suppl. 1. P. 3–8.
- Management of actinic keratosis: a practical report and treatment algorithm from AKTeam™ expert clinicians / Dréno, J. M. Amici, N. Basset-Seguin et al. J Eur Acad Dermatol Venereol.2014. Vol. 28, Iss. 9. P. 1141–1149.
- Methods and Results Report – Evidence and consensus-based (S3) Guidelines for the Treatment of Actinic Keratosis –International League of Dermatological Societies in cooperation with the European Dermatology Forum / R. Werner, A. Jacobs, S. Rosumeck et al. J Eur Acad Dermatol Venereol. 2015. Vol. 29, Iss. 11. P. e1–e66.
- Mihailovici M.S., Teleman S., Ungureanu C. The prognostic molecular factors in precancerous lesions and nonmelanotic skin carcinoma. Rev Med Chir Soc Med Nat Iasi. 2003. Vol. 107, Iss. 3. Р. 494–501.
- Minagawa A. Dermoscopy-pathology relationship in seborrheic keratosis. J Dermatol. Vol. 44, Iss. 5. Р. 518–524.
- Mixed nuclear-cytoplasmic immunostaining for cyclin D1, MMP-9, TIMP-1 in actinic keratosis and correlation with cellular proliferation / V. S. Hlushok, T. V. Sviatenko, I. Shponka, O. V. Poslavska. Derma 3. Tisícročia. 2018. Vol.XVIII, 1-2. P. 16–24.
- Mucin1 expression in focal epidermal dysplasia of actinic keratosis / E. Arciniegas, L. M. Carrillo, H. Rojas et al. Ann Transl Med. Vol. 3, Iss. 17. P.245.
- Nair P. A., Chaudhary A. H., Mehta M. J. Actinic keratosis underlying cutaneous horn at an unusual site – a case report cancer medical science. ecancer. 2013. Vol. 7. P. 376.
- P53 immunoexpression in stepwise progression of cutaneous squamous cell carcinoma and correlation with angiogenesis and cellular proliferation / M. E.Florence, J. Y. Massuda, T. C. Soares et al. Pathol Res Pract. Vol. 211, Iss. 10. Р. 782–788.
- Patient satisfaction and reported outcomes on the management of actinic keratosis / R. Khanna, A. Bakshi, Y. Amir, G. Goldenberg. Clin Cosmet Investig Dermatol. 2017. Vol. 10. P. 179–184.
- Perera E., McGuigan S., Sinclair R. Cost for the treatment of actinic keratosis on the rise in Australia. F1000Res. 2014. Vol. 3. P. 184.
- Peris K., Fargnoli M. C. Conventional Treatment of Actinic Keratosis Curr Probl Dermatol. Vol. 46. P. 108–114.
- Physician perceptions and experience of current treatment in actinic keratosis / E. Stockfleth, K. Peris, C. Guillen et al. J Eur Acad Dermatol Venereol. 2015. Vol. 29, Iss. 2. P. 298–306.
- Poulopoulos A. K., Andreadis D., Markopoulos K. Expression of matrix metalloproteinases 9 and 12 in actinic cheilitis. World J Exp Med. 2013. Vol. 3, Iss. 3. P. 43–49.
- Prevalence of actinic keratosis among dermatology outpatients in Austria / J. Eder, K. Prillinger, A. Korn et al. Br J Dermatol. 2014. Vol. 171, Iss. 6. P. 1415–1421.
- Proliferation, apoptosis, and survivin expression in keratinocytic neoplasms and hyperplasias / A. R. Bowen, A. N. Hanks, K. J. Murphy et al. Am J Dermatopathol. 2004. Vol. 26, Iss. Р. 177–181.
- Protein expression of MMP-2 and MT1-MMP in actinic keratosis, squamous cell carcinoma of the skin, and basal cell carcinoma / F. de Oliveira Poswar, C. A. de Carvalho Fraga, E. S. Gomes et al. J Surg Pathol. Vol. 23, Iss. 1. Р. 20–25.
- Pyne J., Sapkota D., Wong J. C. Cutaneous horns: clues to invasive squamous cell carcinoma being present in the horn base. Dermatol Pract Concept. Vol. 3, Iss. 2. P. 3–7.
- Recent advances in dermoscopy / T. Russo, V. Piccolo, A. Lallas, G. Argenziano. F1000Res. 2016. Vol. 17. P. 5.
- Reduced P53 Staining in Actinic Keratosis is Associated with Squamous Cell Carcinoma: A Preliminary Study / D. R. N. Pimentel, M. M. A. Alchorne, N. S. Michalany et al. Indian J Dermatol. 2013. Vol. 58, Iss. 4. P. 325.
- Retinoids for prevention and treatment of actinic keratosis / M. Ianhez, L. F. F. Fleury Jr, H. A. Miot, E. Bagatin. Anais Brasileiros de Dermatologia. 2013. Vol. 88, Iss. 4. P. 585–593.
- Rigel D. S., Stein Gold L. F. The importance of early diagnosis and treatment of actinic keratosis. J Am Acad Dermatol. 2013. Vol. 68, Iss. 1, Suppl. 1. P. S20–S27.
- Schmitt J., Miot H. Oral acetylsalicylic acid and prevalence of actinic keratosis. Assoc. Med. Bras. 2014. Vol. 60, Iss. 2. P. 131–138.
- Scotti E., Deledda S., Milani M. Efficacy of a Film-Forming Medical Device Containing Piroxicam and Sun Filters in the Treatment of Multiple Actinic Keratosis Lesions in a Subject with a History of Kaposi Sarcoma. Case Rep Dermatol. 2016. Vol. 8, Iss. 3. P. 254–261.
- Shergill B., Zokaie S., Carr A. J. Non-adherence to topical treatments for actinic keratosis. Patient Prefer Adherence. 2013. Vol. 8. P. 35–41.
- Skin Cancer: Epidemiology, Disease Burden, Pathophysiology, Diagnosis, and Therapeutic Approaches / Z. Apalla, D. Nashan, R. B. Weller, X. Castellsagué. Dermatology and Therapy. Vol. 7. P. 5–19.
- Standardization of terminology in dermoscopy/dermatoscopy: Results of the third consensus conference of the International Society of Dermoscopy / Н. Kittler, A. A. Marghoob, G. Argenziano et al. J Am Acad Dermatol. 2016. 74, Iss. 6. Р. 1093–1106.
- Sunscreening Agents / S. Latha, J. Martis, V. Shobha et al. J Clin Aesthet Dermatol. 2013. Vol. 6, Iss. 1. P. 16–26.
- The clinical and dermoscopic features of invasive cutaneous squamous cell carcinoma depend on the histopathological grade of differentiation / A. Lallas, J. Pyne, A. Kyrgidis et al. J. Dermatology. 2015. Vol. 172, Iss. 5. Р. 1308–1315.
- The effects of continuous application of sunscreen on photoaged skin in Japanese elderly people – the relationship with the usage / M. Mizuno, K. Kunimoto, E. Naru et al. Clin Cosmet Investig Dermatol. 2016. Vol. 2016, Iss. 9. P. 95–105.
- The influence of painful sunburns and lifetime sun exposure on the risk of actinic keratoses, seborrheic warts, melanocytic nevi, atypical nevi, and skin cancer / C. Kennedy, C. D. Bajdik, R. Willemze et al. J Invest Dermatol. 2003. Vol.120, Iss. 6. Р. 1087–1093.
- The role of immunosuppression in squamous cell carcinomas arising in seborrheic keratosis / R. Z. Conic, K. Napekoski, H. Schuetz et al. J Am Acad Dermatol. Vol. 76, Iss. 6. Р. 1146–1150.
- The Role of p16, p21, p27, p53 and Ki-67 Expression in the Differential Diagnosis of Cutaneous Squamous Cell Carcinomas and Keratoacanthomas: An Immunohistochemical Study / R. Bedir, H. Güçer, I. Şehitoğlu et al. Med J. 2016. Vol. 33, Iss. 2. P. 121–127.
- The Rotterdam Study: 2018 update on objectives, design and main results / M. A. Ikram, G. G. O. Brusselle, S. D. Murad et al. European Journal of Epidemiology. Vol. 32, Iss. 9. P. 807–850.
- Thickness of Actinic Keratosis Does Not Predict Dysplasia Severity or P53 Expression / I. M. Heerfordt, C. V. Nissen, T. Poulsen et al. Scientific Reports. 2016. Vol. 6. Article ID 33952.
- Thomas G. J., Morton C. A. Cyclooxygenase in Cancer Prevention and Treatments for Actinic Keratosis. Dermatol Ther (Heidelb). Vol. 7, Suppl. 1. P.21–29.
- Topical 5-Fluorouracil associated skin reaction / K. Chughtai, R. Gupta, S. Upadhaya, S. Al Hadidi. Oxf Med Case Reports. 2017. Vol. 2017, Iss. 8. Article ID omx043.
- Topical Colchicine Gel versus Diclofenac Sodium Gel for the Treatment of Actinic Keratoses: A Randomized, Double-Blind Study / G. Faghihi, A. Elahipoor, F. Iraji et al. Adv Med. 2016. Vol. 2016. Article ID 5918393.
- Treatment of Multiple Actinic Keratosis and Field of Cancerization with Topical Piroxicam 0.8% and Sunscreen 50+ in Organ Transplant Recipients: A Series of 10 Cases Case / Garofalo, A. Ventura, S. Mazzilli et al. Case Rep Dermatol. 2017. Vol. 9, Iss. 3. P. 211–216.
- Triage amalgamated dermoscopic algorithm (TADA) for skin cancer screening / T. Roger, M. Marino, S. W. Dusza et al. Dermatol Pract Concept. 2017. Vol. 7, Iss. 2. Р. 39–
- Tschandl P., Rosendahl C., Kittler H. Dermatoscopy of flat pigmented facial lesions. J Eur Acad Dermatol Venereol. 2015. Vol. 29, Iss. 1. Р. 120–127.
- Updates on the Management of Non-Melanoma Skin Cancer (NMSC) / A. Fahradyan, A. C. Howell, E. M. Wolfswinkel et al. Healthcare Basel. Vol.5, Iss. 4. P. E82.
- Vegter S., Tolley K. A Network Meta-Analysis of the Relative Efficacy of Treatments for Actinic Keratosis of the Face or Scalp in Europe. PLoS One. Vol. 9, Iss. 6. Article ID e96829.
- Weedon D. Skin Pathology. China : Churchill Livingstone, 2002. 1158
- What’s new in dermoscopy of Bowen’s disease: two new dermoscopic signs and its differential diagnosis / Y. Yang, J. Lin, S. Fang et al. Inter J Dermatology. 2017. Vol. 56, Iss. 10. Р. 1022–1025.
- World Health Organization of tumours: pathology and genetics of skin tumours / P. E. LeBoit, G. Burg, D. Weedon, A. Sarasin. Lyon : IARC Press, 2006. 357 p.
- Yamazato S., Nakai N., Katoh N. A Case of Cutaneous Squamous Cell Carcinoma Arising in an Actinic Keratosis on the Face in a Centenarian Woman Successfully Treated with Surgery. J Dermatol. 2014. Vol. 59, Iss. 3. P. 304–306.
- Zalaudek , Argenziano G. Dermoscopy of actinic keratosis, intraepidermal carcinoma and squamous cell carcinoma. Curr Probl Dermatol. 2015. Vol. 46. Р. 70–76.
ДОДАТОК А
АКТИ ВПРОВАДЖЕННЯ
ДОДАТОК Б
СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА ЗА ТЕМОЮ ДИСЕРТАЦІЇ ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ РЕЗУЛЬТАТІВ ДИСЕРТАЦІЇ
- Глушок В. С. Аналіз процесів васкуляризації та деградації позаклітинного матриксу при актинічному кератозі. Український журнал дерматології, венерології, косметології. 2017. № 4 (67). С. 22–27.
- Глушок В. С., Святенко Т. В. Можливості дерматоскопії в діагностиці актинічного кератозу. Здобутки клінічної і експериментальної медицини. 2018. № 2 (34). С. 37–41.
- Глушок В. С., Святенко Т. В. Власний досвід комбінованої послідовної терапії актинічного кератозу. Дерматологія та венерологія. № 1 (79). С. 39–42.
- Оцінка стану проліферативної активності та експресії онкомаркеру p53 в зразках актинічного кератозу / В. С. Глушок, Т. В. Святенко, І. С. Шпонька, О. В. Пославська. Морфологія. 2017. Т. 11, № 3. С. 6–12. (Здобувачем особисто сформульовано мету і завдання дослідження, проведено аналіз отриманих даних і їх узагальнення).
- Глушок В. С. Основні патофізіологічні механізми розвитку і прогресування актинічного кератозу. Журнал дерматовенерології та косметології імені М. О. Торсуєва. 2017. № 2 (38). С. 101–108.
- Hlushok V., Sviatenko T. The use of the sunscreens as a part of actinic keratosis management. Journal Experimental and Clinical Medicine. 2018. № 1. P. 43–47.
- Mixed nuclear-cytoplasmic immunostaining for cyclin D1, MMP-9, TIMP-1 in actinic keratosis and correlation with cellular proliferation / V. S. Hlushok, T. V. Sviatenko, I. Shponka, O. V. Poslavska. Derma 3. Tisícročia. 2018. T. XVIII, № 1-2. P. 16–24. (Здобувач особисто сформулював мету і завдання дослідження, провів аналіз отриманих даних і їх узагальнив).
- Глушок В. С., Святенко Т. В., Шпонька І. І., Пославська О. В. Спосіб діагностики актинічного кератозу: пат. 125617 Україна: МПК (2018.01), GO1N21/00; заявл. 22.01.2018; опубл. 10.05.2018, Бюл. № 9.
- Глушок В. С. Себорейний кератоз: аспекти диференціальної діагностики з актинічним кератозом. Журнал дерматовенерології та косметології імені М.О. Торсуєва. № 1 (39). С. 94–95.
- Hlushok V. S. A part of a prophylaxis of skin neoplasias in the region. Matherial of 2nd International transcaucasus congress on photodermatology and skin cancer. (Tbilisi, 27-29 october 2016). Tbilisi, 2016. 43–47.
- Hlushok V. S., Sviatenko T.V. New approach to the diagnostics of actinic keratosis in Ukraine. International Journal of Dermatology. 2017. Vol. 56. P. 1315–1316.
- ГлушокВ. С., Хара А. И. К вопросу о менеджменте дерматоонкологической помощи пациентам с актиническим кератозом. Дерматовенерология и эстетическая медицина. 2015. № 3 (27). С. 121. (Дисертанту належить ідея дослідження, самостійне проведення збору та узагальнення матеріалів, підготовка матеріалу до друку).
- Глушок В. С. Попередні результати скринінгових обстежень на актинічний кератоз. Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування та профілактики дерматозів та інфекцій, що передаються статевим шляхом : матеріали регіональн. наук.-практ. конф. (м.Святогірськ, 12-13 травня 2016 р.). Святогірськ, 2016. С. 14–15.
- Святенко Т. В., Глушок В. С. Комбінована терапія актинічного кератозу з врахуванням морфофенотипування. Інформаційний лист. Київ, 2018. № 31, вип. 2: Дерматологія та венерологія.
Відомості про апробацію результатів дисертації:
- Регіональна науково-практична конференція «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом», м. Святогірськ, 12-13 травня 2016р., усна доповідь: Глушок В.С. «Механізми розвитку і прогресування актинічного кератозу».
- Міжнародний конгрес «XII International Congress of Dermatology», м. Буенос-Айрес, 18-22 квітня 2017р., стендова доповідь: Sviatenko T., Hlushok V. «New approach to the diagnostics of actinic keratosis in Ukraine».
- 3. Науково-практична конференція «12-е Киевские Дерматологические Дни», м. Київ, 11–13 жовтня 2017 р., усна доповідь: Святенко Т.В., Глушок В.С. «Возможности иммуногистохимических исследований в прогнозировании течения актинического кератоза».
- ІІІ (Х) з’їзд Української асоціації лікарів-дерматовенерологів і косметологів, м. Львів, 22–23 листопада 2017 р., усна доповідь: Глушок В.С. «Актинічний кератоз як прекурсор плоскоклітинного раку шкіри».
- Науково-практична конференція «Менеджмент якісної спеціалізованої допомоги дерматовенерологічним пацієнтам», м. Дніпро, 30 березня 2018 р., усна доповідь: Святенко Т.В., Глушок В.С. «Актинічний кератоз: сучасні погляди на механізм розвитку, терапію та профілактику».
- Науково-практична конференція «13-ті Київські Дерматологічні Дні: Весняний симпозіум», м. Київ, 12–13 квітня 2018 р., усна доповідь: Глушок В.С., Святенко Т.В. «Актинічний кератоз: сучасні погляди на механізми розвитку, терапію та профілактику».
- Науково-практична конференція: «Прикарпатські дерматовенерологічні дні 2018», м. Яремче, 19–20 квітня 2018 р., усна доповідь: Глушок В.С. «Комплексна терапія актинічного кератозу з використанням джерела імпульсного світла».
- Науково-практичній конференції, присвяченої 25-річчю НАМН України «Прогресс в современной диагностике инфекций, передаваемых половым путем, инфекционных, распространенных и тяжелых дерматозов. Достижения в лечении», м. Київ, 25–27 квітня 2018 р., усна доповідь: Глушок В.С. «Актинической кератоз – ведение пациентов с учетом клинико-морфологической характеристики формы заболевания».
- Переривчасті курси для дерматовенерологів Тернопільської області, м.Тернопіль, жовтень 2015 р., усна доповідь: Глушок В.С. «Актинічний кератоз – важлива проблема дерматоонкології».
- Переривчасті курси для дерматовенерологів Тернопільської області, м.Тернопіль, жовтень 2016 р., усна доповідь: Глушок В.С. «Доброякісні та злоякісні пухлини шкіри».
- Переривчасті курси для дерматовенерологів Тернопільської області, м.Тернопіль, березень 2018 р., усна доповідь: Глушок В.С. «Сучасний підхід і нові можливості в лікуванні актинічного кератозу».
- Тематична науково-практична міжрегіональна конференція «Інновації медичної науки – в практику сімейного лікаря», м. Тернопіль, 17 травня 2018 р., усна доповідь: Глушок В.С. «Рання діагностика актинічного кератозу і інших передракових хвороб шкіри – важливий аспект профілактики раків».