Державний вищий навчальний заклад «Тернопільський державний медичний університет імені І. Я. Горбачевського Міністерства охорони здоров’я України»
Державна установа «Інститут дерматології та венерології
Національної академії медичних наук України»
Кваліфікаційна наукова
праця на правах рукопису
ГЛУШОК ВІТАЛІЙ СТЕПАНОВИЧ
УДК 616.5-003.871-002.828:615.831.4]-08
ДИСЕРТАЦІЯ
СУЧАСНІ ПІДХОДИ І ПАТОМОРФОЛОГІЧНЕ ОБГРУНТУВАННЯ КОМПЛЕКСНОЇ ТЕРАПІЇ АКТИНІЧНОГО КЕРАТОЗУ
14.01.20 – шкірні та венеричні хвороби
Подається на здобуття наукового ступеня кандидата медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
___________________________ В.С. Глушок
(підпис, ініціали та прізвище здобувача)
Науковий керівник: Святенко Тетяна Вікторівна, доктор медичних наук, професор
Тернопіль – 2018
АНОТАЦІЯ
Глушок В.С. Сучасні підходи і патоморфологічне обґрунтування комплексної терапії актинічного кератозу. – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 «Шкірні та венеричні хвороби». –Державний вищий навчальний заклад «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України», Тернопіль, 2018, Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2018.
Наукова робота присвячена вирішенню актуального завдання сучасної дерматології – удосконаленню діагностики і оптимізації терапії актинічного кератозу шляхом вивчення окремих механізмів розвитку цього дерматозу та розробки на цій основі удосконаленого способу діагностики і патогенетично обґрунтованої комбінованої терапії в поєднанні з засобами профілактики.
Науковий і практичний інтерес до цієї проблеми зумовлений її медико- соціальною значимістю: постійним зростанням рівня захворюваності і поширеності раку шкіри, високим рівнем захворюваності на актинічний кератоз, можливістю його проліферації, прогресування і злоякісної трансформації у інвазивний рак, « омолодженням» контингенту пацієнтів з цим дерматозом, локалізацією уражень на косметично значимих ділянках шкіри, що часто спричиняє часткову соціальну дезадаптацію пацієнтів, а також недостатньою вивченістю окремих ланок патогенезу захворювання, що є причиною триваючих наукових дискусій щодо питання, є актинічний кератоз передраковим станом чи інтраепітеліальним плоскоклітинним раком шкіри на ранній стадії свого розвитку.
Вдосконалення діагностики шляхом поглиблення знань про морфологічні зміни в ураженій актинічним кератозом шкірі, визначення потенціалу проліферації має важливе значення у виборі терапевтичної тактики.
Було обстежено 110 пацієнтів у віці від 51 до 90 років (середній вік – 70,1±0,9 років), з них 76 (69,1 %) жінок і 34 (30,9 %) чоловіків. Під спостереженням знаходились 90 пацієнтів з діагнозом актинічний кератоз (основна група) і 20 пацієнтів з діагнозом себорейний кератоз (група порівняння).
Діагноз усім пацієнтам було встановлено на підставі оцінки клінічних проявів на шкірі, дерматоскопічних даних, з врахуванням скарг і даних анамнезу.
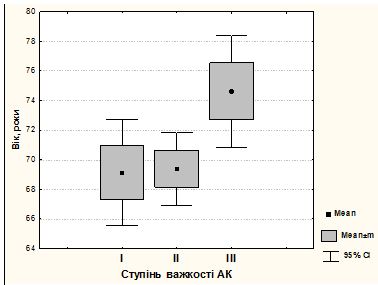
Аналіз демографічних показників, котрі віднесені до факторів ризику розвитку і прогресування дерматозу чи обумовлюють більш важкий перебіг захворювання виявив, що понад 85 % хворих були старше 60 років (95 – 86,4 %), в тому числі 88,9 % пацієнтів, хворих на АК і 75 % – хворі на СК. Найбільший відсоток хворих на АК припадав на вікові групи 61-70 років (37,8 %) і 71-80 років (36,7 %), а серед пацієнтів, хворих на СК найбільш представленою була вікова група 61-70 років (40,0 %), що узгоджується з даними багатьох досліджень про високий рівень захворюваності на кератози, особливо на АК, серед осіб похилого і старечого віку.
Дві трентини обстежених пацієнтів складали жінки (69,1 %), в тому числі 67, 8 % в основній групі і 75,0 % – в групі порівняння.
Встановлено пряму асоціацію надмірної інсоляції, пов’язаної з родом діяльності, у жителів сільської місцевості порівняно з мешканцями міст, а також в осіб більш старшого віку. Навпроти, гіперінсоляція, отримана під час дозвілля/відпочинку, була більш характерною для жителів міст та молодших пацієнтів. Так, мешканці сільської місцевості в 2,7 разу частіше, ніж жителі міст перебувають на відкритому повітрі і піддаються надмірної інсоляції – 70,3 % проти 26,4 %.
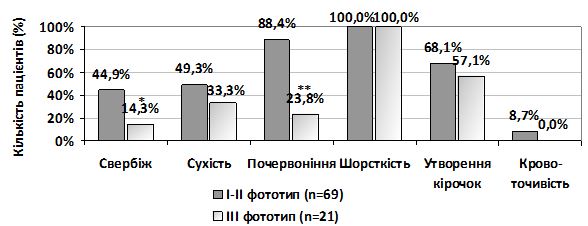
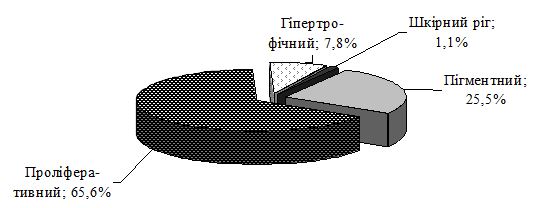
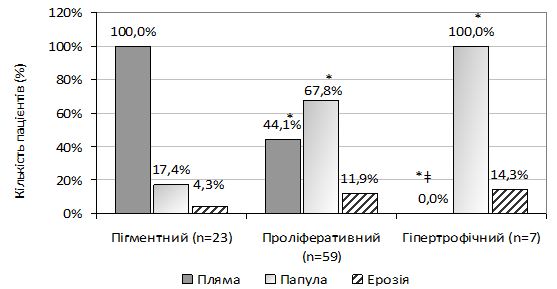
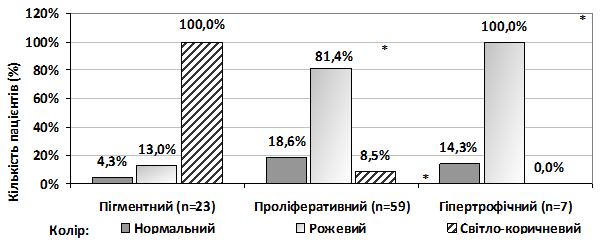
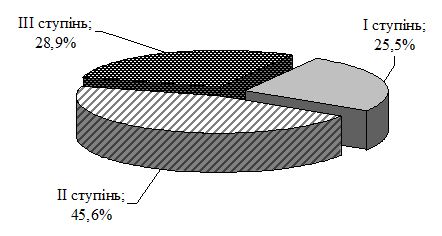
При вивченні і проведенні оцінки клінічної симптоматики було встановлено, що переважними клініко-анамнестичними ознаками актинічного кератозу (АК) є: похилий і старечий вік пацієнтів (88,9 % старше 60 років), скарги на шорсткість (100 %) і почервоніння (73,3 %) шкіри з утворенням лусочок (65,6 %) в місцях ураження, ІІ тип фоточутливості шкіри (73,3 %), кумулятивна надмірна інсоляція в анамнезі (74,4 %), наявність маркерів фотоушкодження шкіри (58,9 %), 1-2 вогнища ураження на обличчі (75,6 %), розміром близько 6 мм з переважною локалізацію в зоні щік (78,9 %) і носа (51,1 %) та шорсткою поверхнею ураженої шкіри при пальпації (64,4 %). Найчастішими морфологічними елементами у вогнищах ураження є папули (57,8 %) і плями (54,4 %), рожевого (65,6 %) або світло-коричневого кольору (31,1 %), здебільшого асоційовані з проліферативною формою АК (65,6 %), ІІ (45,6 %) і ІІІ ступенем (28,9 %) важкості дерматозу.
При обстеженні пацієнтів встановлювали наявність діагностично значимих при АК симптомів фотоушкодження: сухість шкіри, лущення, зморшки, дисхромію. За їх наявністю і вираженістю оцінювали важкість фотоушкодження. Маркери фотоушкодження було виявлено у 58,9 % пацієнтів, хворих на АК.
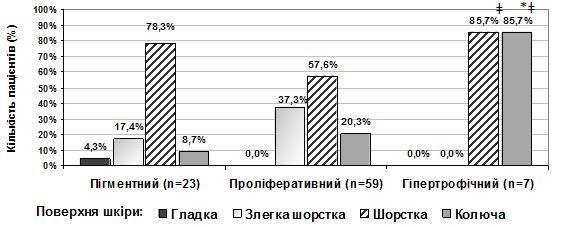
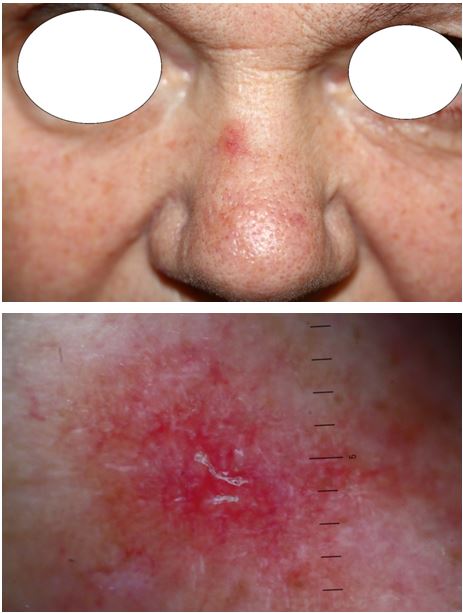
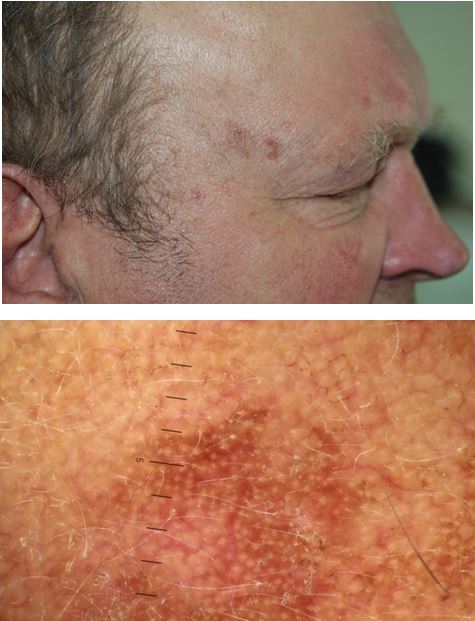
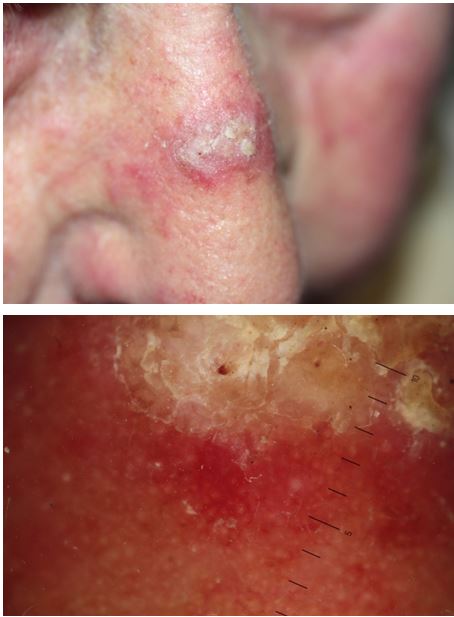
За результатами проведених дерматоскопічних досліджень виявлено, що для пігментного АК характерними є виразні фолікули (100 %), сірі ромбовидні структури (100 %), мішенеподібні фолікули і білі круги (91,3 %); для проліферативного АК – еритема / рожева псевдосітка (94,9 %), лусочки (94,9 %), тонкі хвилясті судини (93,2 %); для гіпертрофічного клінічного варіанту – поєднання 3-х дерматоскопічних ознак: мішенеподібних і виразних фолікулів та лусочок (100 %). Аналіз дерматоскопічних даних проводили і у періоді постлікувального моніторингу.
Проведеними гістологічними дослідженнями панч-біопсійного матеріалу ураженої АК шкіри виявлено, що першою морфологічною ознакою АК є клітинна атипія з порушенням стратифікації. Значущими гістопатологічними особливостями АК (окрім дисплазії І-ІІІ епітеліальних клітин) є: запалення – круглоклітинний інфільтрат строми (100 %), дисплазія епітелію волосяних фолікулів (93,3 %), гіперкератоз (66,7 %), атрофія епідермісу (60,0 %), апоптоз базальних кератиноцитів (65,2 %), дисплазія себоцитів (53,3 %) та акантотичне брунькування (46,7 %).
Аналіз імуногістохімічного профілю панч-біопсійного матеріалу ураженої АК шкіри свідчить, що АК є здебільшого р53 позитивним, з активною проліферацією в базальних та парабазальних шарах епідермісу незрілих атипових клітин та помірною змішаною ядерно-цитоплазматичною експресією cyclin D1. Виявлено також тенденції збільшення експресії маркерів р53 та Кі-67 із підвищенням гістологічного ступеня важкості (від АК І до АК ІІІ). Аналіз процесів васкуляризації за експресією маркеру CD34 виявив вірогідне збільшення кількості судин при АК, порівняно із СК (r=+0,480; р=0,033), а також удвічі збільшені діаметри судин в групі АК, пов’язане з формуванням спотворених кавернозно-подібних новоутворених судин навколо ділянок дисплазії епідермісу (р<0,001). При оцінюванні протеолітичної активності в зразках АК та СК визначено сильний кореляційний зв'язок за експресією ММР-9 (r=+0,721; р=0,002) та наявність аберрантної експресії маркеру ММР-9 та ТІМР-1 в обох підгрупах, що додатково свідчить про наявність клітинної атипії і служить надійним прогностичним показником підвищення проліферативної активності.
Розроблено, клінічно апробовано і впроваджено в практику комбіновану методику терапії АК з врахуванням даних проведених імуногістохімічних досліджень про можливість активної проліферації і злоякісної трансформації, спрямовану на радикальне видалення вогнищ АК, що попереджує інвазивний ріст. Запропонований метод забезпечує значне покращення стану шкіри з повним її очищенням у 84,5 % і 75,9 % пацієнтів через 3 і 12 місяців терапії, на відміну від монотерапії методом кріодеструкції рідким азотом з аналогічними результатами у 37,5 % і 56,3 % пацієнтів. Призначення хворим на АК комбінованої терапії із застосуванням традиційного кератолітичного засобу, IPL- процедур і кріодеструкції рідким азотом дозволяє підвищити ефективність лікування, що підтверджено більш швидким повним регресом клінічних проявів, меншою кількістю рецидивів (22,4 % проти 43,8 %; р=0,035) і досягненням кращого косметичного ефекту – через 12 місяців після лікування : відсутність косметичних дефектів відзначена у 87,9 % пацієнтів в групі комбінованої терапії і у 50,0 % – після проведення кріодеструкції (p<0,001).
При обстеженні пацієнтів на первинному прийомі було виявлено низький рівень обізнаності пацієнтів з АК щодо шкідливості гіперінсоляції (32,2 %), знань правил перебування на сонці (13,3 %) та необхідності фотозахисту (28,9 %), що зумовило розробку і впровадження мотиваційного консультування пацієнтів, яке сприяло підвищенню показників комплаєнтності до застосування сонцезахисних засобів і емолієнтів після проведеного консультування (до 86,7 % і 81,1 % відповідно), що безпосередньо позитивно позначилось на кінцевих клінічних результатах лікування і профілактики рецидивів АК.
Матеріали дисертаційної роботи можуть використовуватися у клінічній практиці лікарів дерматовенерологів спеціалізованих медичних установ та медичних навчальних закладів.
Ключові слова: актинічний кератоз, імуногістохімія, кріодеструкція, IPL, маркери p53, cyclin D1, CD34, Ki-67, MMP-9, TIMP-1.
ANNOTATION
Hlushok V.S. Modern approaches and pathomorphological reasoning of the complex actinic keratosis therapy. – Qualificational scientific work on the rights of the manuscript.
The dissertation for the Scientific Degree of Candidate of Medical Sciences on the Specialty 14.01.20 “Skin and Venereal diseases”. – State Higher Educational Establishment “Ternopil State Medical University by the name of I.J. Horbachevsky of MHC of Ukraine”, Ternopil, 2018, State Establishment “Institute of Dermatology and Venerology of NAMS of Ukraine”, Kharkiv, 2018.
The scientific work is devoted to the solving of the current problem of modern dermatology – the improvement of the diagnosis and optimization of actinic keratosis therapy by the studying of the particular mechanisms of this dermatosis progress and the development of an advanced diagnostic method and pathogenetically grounded combination therapy together with preventive measures on this basis.
Scientific and practical interest to this problem is caused by its medical and social significance: the constant increase of the morbidity level and prevalence of skin cancer, high rate of actinic keratosis morbidity level, the possibility of its proliferation, progression and malignant transformation into invasive cancer, the “rejuvenation” of the contingent of patients with this dermatosis, the localization of lesions on cosmetically significant areas of the skin, that often causes partial social maladaptation of the patients, as well as the insufficient knowledge of some pathogenesis links of the disease that is the reason for the ongoing scientific discussions on the issue, whether actinic keratosis is the precancerous state or the intraepithelial SCC in the early stage of its development.
The improvement of the diagnosis by deepening of knowledge about morphological changes in the skin, affected by an actinic keratosis, the determination of the potential for proliferation are important in the therapeutic tactics choice.
110 patients aged from 51 to 90 years old were examined (average age (70.1± 0.9) y.o.), 76 from them were women (69.1%) and 34 of them were men (30.9%). 90 patients with diagnosed actinic keratosis (main group) and 20 patients with a diagnosis of seborrheic keratosis (comparative group) have been under the observation.
All the patients were diagnosed on the basis of evaluation of skin clinical signs, dermoscopy data, considering complaints and anamnesis data.
The analysis of dermographic indicators, which are referenced to the risk factors of dermatosis development and progression or cause more severe course of the disease revealed, that more than 85% of patients were older than 60 years old (95 – 86.4 %), including 88.9% of patients with AK and 75% – patients with SK. The biggest percent of patients with AK was in the age groups of 61-70 years old (37.8%) and 71-80 years old (36.7%), and among the patients with SK the group of 61-70 years old (40%) was most represented, that correlates with the data of many investigations about the high rate of keratosis morbidity, especially AK, among the aged and senile persons.
The two thirds of the examined patients were women (69.1%), including 67.8% in the main group and 75.0% – in the comparative group.
The direct association of an excessive insolation, connected with the occupation, in rural areas residents in comparison with urban areas residents, and in elderly people as well, was found. On the contrary, the hiperinsolation, got during leisure/vacations, was more characteristic for urban areas residents and younger patients. Rural areas residents in 2.7 times more often, than urban areas residents, are on the open air and submit to excessive insolation – 70.3% versus 26.4%.
While studying and conducting an assessment of clinical symptoms, it was found that the predominant clinical and anamnestic signs of actinic keratosis are: old and senile age of the patients (88.9 % were over the age of 60), complaints on skin roughness (100%) and redness (73.3 %) with scaling (65.6 %) in places of lesions, II type of the skin photosensitivity (73.3 %), cumulative excessive insolation in the past (74.4 %), presence of markers of skin photolesions (58.9 %), 1-2 focal lesions on the face (75.6 %), about 6 mm in size with predominant localization in the cheek zone (78.9 %) and nose (51.1 %), and palpation roughness of the surface of the affected skin (64.4 %). The most frequent morphological elements in the lesions are papules (57.8 %) and spots (54.4 %) of pink (65.6 %) or light brown color (31.1 %), mostly associated with the proliferative form of AK (65 , 6 %), ІІ (45.6 %) and ІІІ degree (28.9 %) of the severity of dermatosis.
During patients examination, the diagnostically significant to AK photodamage symptoms were found: skin dryness, scaling, wrinkles, dyschromia. The severity of photodamage was estimated by their presence and expressiveness. The photodamage markers were found in 58.9% of patients with AK.
According to the results of conducted dermatological researches, it was revealed that evident follicles (100 %), gray rhomboidal structures (100 %), targetoid follicles and white circles (91.3 %) are typical for pigmentary actinic keratosis; for proliferative AK erythema / pink pseudonetwork (94.9 %), scales (94.9 %), fine wavy vessels (93.2 %) are typical; for a hypertrophic clinical variant – a combination of 3 dermatoscopic features: targetoid and evident follicles and scales (100 %).
The conducted histological studies of punch-biopsy material of the skin, affected by AK, helped to reveal, that the first morphological characteristic of AK is the cellular atypia with violation of stratification. Significant histopathological features of AK (except for the dysplasia of the I-III epithelial cells) are: inflammation – circulatory stromal infiltration (100 %), dysplasia of epithelium of hair follicles (93.3 %), hyperkeratosis (66.7 %), epidermis atrophy (60.0 %), apoptosis of basal keratinocytes (65.2 %), dysplasia of sebocytes (53.3 %) and acanthous budding (46.7 %).
An analysis of the immunohistochemical profile of the punch-biopsy material of the skin, affected by AK, indicates that AK is mostly p53 positive, with active proliferation in the basal and parabasal layers of the epidermis of immature atypical cells and moderate mixed nucleic-cytoplasmic expression of cyclin D1. The tendencies to the increasing of the expression of markers p53 and Ki-67 were also revealed with an increased histological severity level (from AK I to AK III). The analysis of the vascularization of the study groups revealed a probable increase of the number of vessels in AK, in comparison with the SK (r=+0.480; p=0.033), as well as doubly enlarged vascular diameters in the AK group, associated with the formation of distorted cavernous neoplastic vessels around the areas of epidermis dysplasia (p<0.001). The assessment of the proteolytic activity in AK and SK samples determined a strong correlation between MMP-9 expression (r=+0.721; p=0.002) and the presence of aberrant expression of the MMP-9 and TIMP-1 markers in both subgroups, which further indicates the presence of cellular atypia and serves as a reliable prognostic indicator of increasing proliferative activity.
The combined therapy of AK with the data of conducted immunohistochemical studies of the possibility of active proliferation and malignant transformation, aimed on radical removal of focal AK lesions, that prevents the invasive growth, has been developed, clinically tested and implemented into practice. The proposed method provides a significant improvement in the skin condition with its complete purification in 84.5 % and 75.9 % of patients after 3 and 12 months of therapy, in contrast to monotherapy by liquid nitrogen cryodestruction with the same results in 37.5 % and 56.3 % of patients. An appointment to patients with AK of the combined therapy with the use of traditional keratolytic agent, IPL procedures and liquid nitrogen cryodestruction gives the possibility to increase the effectiveness of treatment, which is confirmed by more rapid complete regression of clinical manifestations, less quantity of recurrense (22.4 % vs. 43.8 %, p=0.035 ) and the achievement of a better cosmetic effect – 12 months after treatment, the absence of cosmetic defects was noted in 87.9 % of patients in the combination therapy group and 50.0 % after the cryodestruction (p<0.001).
During the examination of patients on the initial visit, low level of awareness of patients with AK about the hyperinsolation harmfulness (32.2 %), knowledge of the rules of staying in the sun (13.3 %) and the need of photo protection (28.9 %) were found, which resulted in the development and implementation of motivational counseling of the patients, that contributed to the increasing of compliance to the application of sunscreens and emolients after counseling (up to 86.7 % and 81.1 % respectively), which had a direct positive effect on the clinical outcomes of treatment and prophylaxis of AK recurrence.
Key words: actinic keratosis, immunohistochemistry, cryodestruction, IPL, p53 markers, cyclin D1, CD34, Ki-67, MMP-9, TIMP-1.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Глушок В. С. Аналіз процесів васкуляризації та деградації позаклітинного матриксу при актинічному кератозі. Український журнал дерматології, венерології, косметології. 2017. № 4 (67). С. 22–27.
- Глушок В. С., Святенко Т. В. Можливості дерматоскопії в діагностиці актинічного кератозу. Здобутки клінічної і експериментальної медицини. 2018. № 2 (34). С. 37–41.
- Глушок В. С., Святенко Т. В. Власний досвід комбінованої послідовної терапії актинічного кератозу. Дерматологія та венерологія. № 1 (79). С. 39–42.
- Оцінка стану проліферативної активності та експресії онкомаркеру p53 в зразках актинічного кератозу / В. С. Глушок, Т. В. Святенко, І. С. Шпонька, О. В. Пославська. Морфологія. 2017. Т. 11, № 3. С. 6–12. (Здобувачем особисто сформульовано мету і завдання дослідження, проведено аналіз отриманих даних і їх узагальнення).
- Глушок В. С. Основні патофізіологічні механізми розвитку і прогресування актинічного кератозу. Журнал дерматовенерології та косметології імені М. О. Торсуєва. 2017. № 2 (38). С. 101–108.
- Hlushok V., Sviatenko T. The use of the sunscreens as a part of actinic keratosis management. Journal Experimental and Clinical Medicine. 2018. № 1. P. 43–47.
- Mixed nuclear-cytoplasmic immunostaining for cyclin D1, MMP-9, TIMP-1 in actinic keratosis and correlation with cellular proliferation / V. S. Hlushok, T. V. Sviatenko, I. Shponka, O. V. Poslavska. Derma 3. Tisícročia. 2018. T. XVIII, № 1-2. P. 16–24. (Здобувач особисто сформулював мету і завдання дослідження, провів аналіз отриманих даних і їх узагальнив).
- Глушок В. С., Святенко Т. В., Шпонька І. І., Пославська О. В. Спосіб діагностики актинічного кератозу: пат. 125617 Україна: МПК (2018.01), GO1N21/00; заявл. 22.01.2018; опубл. 10.05.2018, Бюл. № 9.
- Глушок В. С. Себорейний кератоз: аспекти диференціальної діагностики з актинічним кератозом. Журнал дерматовенерології та косметології імені М.О. Торсуєва. № 1 (39). С. 94–95.
- Hlushok V. S. A part of a prophylaxis of skin neoplasias in the region. Matherial of 2nd International transcaucasus congress on photodermatology and skin cancer. (Tbilisi, 27-29 october 2016). Tbilisi, 2016. 43–47.
- Hlushok V. S., Sviatenko T.V. New approach to the diagnostics of actinic keratosis in Ukraine. International Journal of Dermatology. 2017. Vol. 56. P. 1315–1316.
- ГлушокВ. С., Хара А. И. К вопросу о менеджменте дерматоонкологической помощи пациентам с актиническим кератозом. Дерматовенерология и эстетическая медицина. 2015. № 3 (27). С. 121. (Дисертанту належить ідея дослідження, самостійне проведення збору та узагальнення матеріалів, підготовка матеріалу до друку).
- Глушок В. С. Попередні результати скринінгових обстежень на актинічний кератоз. Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування та профілактики дерматозів та інфекцій, що передаються статевим шляхом : матеріали регіональн. наук.-практ. конф. (м.Святогірськ, 12-13 травня 2016 р.). Святогірськ, 2016. С. 14–15.
- Святенко Т. В., Глушок В. С. Комбінована терапія актинічного кератозу з врахуванням морфофенотипування. Інформаційний лист. Київ, 2018. № 31, вип. 2: Дерматологія та венерологія.
ЗМІСТ
| Перелік умовних позначень | 15 |
| Вступ | 16 |
| Розділ 1 Сучасні підходи до діагностики і лікування актинічного кератозу (аналітичний огляд літератури) | 23 |
| 1.1 Сучасний стан проблеми актинічного кератозу | 23 |
| 1.2 Діагностика актинічного кератозу | 31 |
| 1.3 Огляд сучасних методик лікування актинічного кератозу | 33 |
| Розділ 2 Матеріали та методи дослідження | 46 |
| 2.1 Матеріали і дизайн дослідження | 46 |
| 2.2 Методи дослідження | 50 |
| 2.2.1 Методи клінічного дослідження | 50 |
| 2.2.2 Дерматоскопічний метод дослідження | 52 |
| 2.2.3 Гістологічні та імуногістохімічні методи дослідження | 53 |
| 2.3 Статистичні методи дослідження | 56 |
| Розділ 3 Клініко-анамнестичні особливості перебігу кератозів | 57 |
| 3.1 Аналіз скарг, анамнезу і даних об’єктивного обстеження | 57 |
| 3.2 Особливості клінічних проявів у пацієнтів з різними клінічними варіантами та ступенями важкості актинічного кератозу | 66 |
| 3.3 Результати дерматоскопічного дослідження морфологічних змін у шкірі у хворих на кератози | 77 |
| Розділ 4 Аналіз гістологічних та імуногістохімічних характеристик шкіри при актинічному кератозі | 85 |
| 4.1 Оцінка морфологічних характеристик шкіри при передраковому стані – актинічному кератозі, порівняно із себорейним кератозом | 85 |
| 4.2 Оцінка експресії імуногістохімічних маркерів онкогенної трансформації (р53) та проліферативної активності (Kі-67, cyclin D1) при актинічному кератозі, порівняно із себорейним кератозом |
92 |
| 4.3 Оцінка експресії імуногістохімічних маркерів васкуляризації (CD34) та стромальної деградації (матриксної металопротеїнази 9 типу, маркера тканинного інгібітора протеїнази – 1) при актинічному і себорейному кератозах | 105 |
| Розділ 5 Обґрунтування алгоритму лікування пацієнтів з актинічним кератозом | 120 |
| 5.1 Комбінована послідовна терапія актинічного кератозу | 120 |
| 5.2 Порівняльна оцінка ефективності різних методик лікування актинічного кератозу | 122 |
| 5.2.1 Динаміка регресу клінічних проявів захворювання після проведеної монотерапії | 123 |
| 5.2.2 Динаміка регресу клінічних проявів захворювання після проведеної комбінованої терапії | 127 |
| 5.2.3 Порівняльна оцінка основних параметрів ефективності комбінованої і монотерапії актинічного кератозу | 130 |
| Розділ 6 Профілактика виникнення, прогресування і рецидивування актинічного кератозу | 137 |
| 6.1 Методика мотиваційного консультування у пацієнтів з актинічним кератозом | 138 |
| 6.2 Комплаєнтність хворих у період постлікувального моніторингу | 140 |
| Розділ 7 Аналіз та узагальнення результатів дослідження | 143 |
| Висновки | 156 |
| Рекомендації | 158 |
| Список використаних джерел | 159 |
| Додаток А Акти впровадження | 177 |
| Додаток Б Список публікацій здобувача за темою дисертації та відомостіпро апробацію результатів дисертації | 185 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
| АК | – | актинічний кератоз |
| ІГХ | – | імуногістохімічний |
| ІП | – | індекс проліферації |
| МЕД | – | мінімальна еритемна доза |
| ММП | – | матриксна металопротеїназа |
| НМРШ | – | немеланомний рак шкіри |
| ПКРШ | – | плоскоклітинний рак шкіри |
| СЗЗ | – | сонцезахисні засоби |
| СК | – | себорейний кератоз |
| ТКФ | – | точний критерій Фішера |
| ЩМС | – | щільність мікросудин |
| IPL | – | інтенсивне імпульсне світло |
| Ki-67 | – | маркер проліферативної активності пухлинної клітини |
| MMP-9 | – | матриксна металопротеїназа 9 типу |
| p53 | – | маркер апоптозу (антионкоген) |
| SPF | – | фактор захисту від сонячного опіку (sunburn protection factor) |
| TIMP1 | – | маркер тканинного інгібітора протеїнази-1 |
| UV | – | ультрафіолетове випромінення |
| UVA | – | ультрафіолетове випромінення спектру А |
| UVB | – | ультрафіолетове випромінення спектру B |
ВСТУП
Актуальність теми. Актинічний кератоз (АК) – як шкірна неоплазія і передраковий стан є клінічно значимим дерматозом у медичному і соціальному аспектах. Значимість АК обумовлена, перш за все, рівнем його поширеності. Згідно з даними Національного дослідження амбулаторної медичної допомоги, проведеному у США з 1990 до 1999 рр., АК був діагностований більш ніж на 47 млн. лікарських візитів у 14 % пацієнтів, які зверталися до дерматологів [1, 162].
Більшістю провідних дерматологів світу АК розглядається як передраковий процес, однак впродовж останніх років були спроби перегляду цих наукових уявлень щодо віднесення АК до власне злоякісних новоутворень. Згідно з цими даними, АК є все-таки інтраепітеліальним плоскоклітинним раком шкіри (ПКРШ) на ранніх стадіях розвитку. Отже, вчасно не лікований АК розглядається як ініціальне утворення, яке може прогресувати в ПКРШ [16, 24, 25, 26, 27, 31, 42, 51, 68].
За даними сучасної літератури, клінічна значимість АК пояснюється не тільки можливістю його перетворення в ПКРШ, але і тим, що АК є потужним предиктором виникнення меланоми або немеланомного раку шкіри (НМРШ) [32, 33, 75, 106, 148].
На тлі зростання захворюваності і поширеності меланоми і НМРШ пацієнти з АК є безпосередніми кандидатами для ретельного спостереження з метою профілактики і раннього ефективного лікування.
Медико-соціальна значимість АК пояснюється також «омолодженням» контингенту пацієнтів з даною патологією, локалізацією утворень (шкіра обличчя, скальпу, шиї, розгинальних поверхонь кистей), що у більшості випадків спричиняє видимий косметичний дефект, обумовлює часткову соціальну дезадаптацію хворих.
На сьогодні існують різні класифікації АК за клінічною симптоматикою. Найбільш зручним є поділ АК на такі клінічні варіанти: еритематозний, запальний, гіпертрофічний, шкірний ріг, актинічний хейліт, пігментований АК, який поширюється, проліферативний, АК кон’юнктиви.
Попри наявність великої кількості методик лікування АК на даний час, немає, і зокрема в Україні, єдиних рекомендацій чи алгоритмів, які б визначали вибір того чи іншого методу лікування, як найбільш адекватного при визначеному клінічному варіанті хвороби [1, 4, 21, 23, 31, 34, 37, 91]. Існуючі складнощі у виборі методу лікування АК пояснюється і тим, що немає критеріїв, які б дозволили передбачати тривалість персистування вогнища неоплазії, злоякісну трансформацію у ПКРШ чи ймовірність спонтанного зворотнього розвитку [2, 14, 15, 39, 40, 86, 90, 136, 138, 146].
Очікуваним ідеальним методом лікування для пацієнтів і дерматологів мав би бути такий, який приводить до стійкого результату з усуненням всіх клінічних і субклінічних проявів АК, забезпечує стійкий позитивний близький і віддалений результат і хороший косметичний ефект, тобто усуває ймовірність перетворення АК у ПКРШ. Цей метод одночасно повинен бути простим в застосуванні лікарем і/або пацієнтом, зручним, не довготривалим, доступним економічно [18, 22, 41, 128, 138, 149].
Виходячи з цього, існує необхідність продовження вивчення як патоморфологічних особливостей окремих клінічних варіантів АК, так і подальшого розкриття патогенетичних механізмів цього дерматозу, які впливають на різноманітність клінічних варіантів. Отримані нові знання дозволять на основі сучасних наукових даних сформувати алгоритм лікування пацієнтів з різними клінічними варіантами АК, а також узагальнити і підготувати єдині рекомендації щодо його лікування.
Актуальність цієї сучасної проблеми визначає мету і завдання наукового дослідження.
Зв’язок роботи з науковими програмами, планами, темами. Тема дисертаційного дослідження входить до НДР ДВНЗ «Тернопiльський державний медичний університет імені I.Я. Горбачeвського МОЗ України»: «Патогенетичні закономірності та інформаційні моделі розвитку патологічних процесів за умов дії надзвичайних факторів на організм та їх корекція» (номер держреєстрації 0113U001239) і «Оцінка клінічного перебігу метаболічних та імунних порушень, змін функції органів та систем при внутрішніх захворюваннях за умови коморбідних станів» (номер держреєстрації №0113U001244), в яких здобувач був співвиконавцем і досліджував клінічні та патоморфологічні особливості перебігу і комплексної терапії АК.
Мета та задачі дослідження. Мета роботи – підвищення ефективності комплексної терапії АК шляхом обґрунтування методики лікування захворювання з урахуванням результатів клінічних, дерматоскопічних, патоморфологічних та імуногістохімічних досліджень.
Задачі дослідження:
- Дослідити клініко-анамнестичні особливості проявів і перебігу АК з урахуванням соціально-демографічних характеристик пацієнтів, оцінки суб’єктивних і об’єктивних симптомів захворювання.
- Визначити патоморфологічні характеристики шкіри у пацієнтів з різними клінічними варіантами і ступенем тяжкості АК за даними дерматоскопічного дослідження.
- Надати патогістологічну характеристику шкіри при різних клінічних варіантах АК у порівнянні з себорейним кератозом (СК).
- Оцінити зміни імуногістохімічних (ІГХ) маркерів онкогенної трансформації (р53), проліферативної активності (Kі-67, cyclin D1), васкуляризації (CD34) та стромальної деградації (матриксної металопротеїнази 9 типу (ММР-9), маркера тканинного інгібітора протеїнази – 1 [ТІМР-1]) при АК і СК.
- Обґрунтувати методику комбінованої патогенетичної терапії АК з урахуванням результатів патогістологічних та ІГХ досліджень і порівняти її ефективність з монотерапією (кріодеструкція рідким азотом).
- Розробити і запровадити методику мотиваційного консультування пацієнтів, хворих на АК, з метою підвищення ефективності лікування, профілактики прогресування і попередження рецидивів.
Об¢єкт дослідження: актинічний кератоз.
Предмет дослідження: клінічні, морфологічні зміни в осередках АК, проліферативна активність, імуногістохімічні маркери, діагностика, терапія і профілактика АК.
Методи дослідження: клінічні: вивчення скарг, анамнезу життя та хвороби, оцінка і аналіз суб’єктивних і об’єктивних ознак ураження шкіри, локалізації патологічних змін (для виявлення провокуючих факторів виникнення, розвитку і прогресування захворювання, встановлення діагнозу, проведення диференційної діагностики клінічних проявів, оцінки ефективності лікування); дерматоскопія (вивчення дерматоскопічних ознак в осередках ураження), морфологічні та ІГХ (для вивчення патогістологічних порушень в уражених ділянках шкіри, проведення диференціальної патогістологічної діагностики); статистичні (для підтвердження вірогідності результатів).
Наукова новизна одержаних результатів. Вперше в Україні визначено клінічні прояви і дерматоскопічні ознаки АК при різних ступенях тяжкості і різних клінічних варіантах у взаємозалежності з фототипами шкіри і проявами фотоушкодження.
Вперше визначено потенціал онкогенної трансформації, проліферативні властивості, васкуляризацію та стромальну деградацію при АК на підставі розширених ІГХ досліджень панч-біоптатів ураженої шкіри.
Вперше в Україні обґрунтовано і запропоновано комбіновану методику лікування АК, спрямовану на основні відомі ланки патогенезу захворювання, і порівняно її ефективність з традиційним методом кріодеструкції рідким азотом.
Обґрунтовано важливість і необхідність мотиваційного консультування пацієнтів для підвищення ефективності лікування, покращення комплаєнтності хворих щодо методів і засобів профілактики прогресування і виникнення рецидивів АК.
Практичне значення одержаних результатів полягає у розробці і впровадженні в практику способу діагностики і методики лікування пацієнтів, хворих на АК (патент України на корисну модель № 125617 від 10.05.2018 р., інформаційний лист № 31-2018). Доведено, що розроблена методика комбінованої послідовної терапії пацієнтів, хворих на АК із застосуванням кератолітичного засобу – 5% саліцилової мазі, кріодеструкції рідким азотом і процедури інтенсивного імпульсного світла (IPL) є малоінвазивною, простою в застосуванні, враховує фототип шкіри пацієнта, клінічну вираженість в осередках АК і забезпечує розрішення осередків АК в оптимальному часовому періоді та збільшення тривалості клінічної ремісії, порівняно з монотерапією кріодеструкцією. Методика високоефективна і може використовуватись у лікувально-профілактичних закладах дерматологічного профілю, косметологічних установах з метою отримання стійкої ремісії та косметичного ефекту.
Розроблено і складено методику мотиваційного консультування пацієнтів, хворих на АК, що складається з інформаційної і рекомендаційної частин; доведено її позитивний вплив на кінцеві клінічні результати лікування і профілактику рецидивів АК.
Розроблені автором методики діагностики і лікування пацієнтів, хворих на АК, впроваджені в навчальний процес на кафедрі дерматовенерології Національної медичної академії післядипломної освіти імені П.Л. Шупика, кафедрі інфекційних хвороб, епідеміології, шкірних та венеричних хвороб ДВНЗ «Тернопільський медичний університет імені І.Я. Горбачевського МОЗ України», кафедрі шкірних та венеричних хвороб з курсами патоморфології та фтизіатрії ДВНЗ «Ужгородський національний університет», кафедрі дерматології та венерології ДВНЗ «Івано-Франківський національний медичний університет», а також у практичну роботу Комунального закладу «Рівненський обласний шкірно-венерологічний диспансер» Рівненської обласної ради, ТОВ «Інститут псоріазу та хронічних дерматозів», Комунальної установи Тернопільської обласної ради «Тернопільський обласний клінічний шкірно-венерологічний диспансер» і Комунальної установи Тернопільської обласної ради «Тернопільський обласний клінічний онкологічний диспансер».
Особистий внесок здобувача. Дисертація є самостійною науковою працею здобувача. Дисертантом самостійно проведено аналіз наукової і патентної літератури з обраної проблеми, на підставі чого розроблені основні завдання та методологія дослідження. Самостійно проведено відбір хворих та клінічне спостереження за ними, здійснено статистичну обробку матеріалу, проаналізовані результати досліджень, їх теоретичне узагальнення та практичне застосування. Дисертантом систематизовано накопичений матеріал, написані всі розділи дисертації, сформульовані висновки й запропоновані практичні рекомендації. Основні публікації за темою мають оригінальний характер.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Конфлікту інтересів немає.
Апробація результатів дисертації. Основні положення роботи доповідались на: науково-практичній конференції «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом» (Святогірськ, 2016), міжнародному конгресі «XII International Congress of Dermatology» (Буенос-Айрес, Аргентина, 2017), науково-практичній конференції «12-е Киевские Дерматологические Дни» (Київ, 2017), ІІІ (Х) з’їзді Української асоціації лікарів-дерматовенерологів і косметологів (Львів, 2017), науково-практичній конференції «Менеджмент якісної спеціалізованої допомоги дерматовенерологічним пацієнтам» (Дніпро, 2018), науково-практичній конференції «13-ті Київські Дерматологічні Дні: Весняний симпозіум» (Київ, 2018), науково-практичній конференції: «Прикарпатські дерматовенерологічні дні 2018» (Яремче, 2018), науково-практичній конференції, присвяченої 25-річчю НАМН України «Прогресс в современной диагностике инфекций, передаваемых половым путем, инфекционных, распространенных и тяжелых дерматозов. Достижения в лечении» (Київ, 2018). На регіональному рівні: на переривчастих курсах для дерматовенерологів Тернопільської області (Тернопіль, 2015, 2016, 2018), на тематичній науково-практичній міжрегіональній конференції «Інновації медичної науки – в практику сімейного лікаря» (Тернопіль, 2018).
Публікації. За матеріалами дисертації опубліковано 14 друкованих праць, у тому числі 7 статей, з яких 4 – у журналах, що індексуються в міжнародних наукометричних базах даних, 2 – у зарубіжних журналах; 5 тез доповідей у матеріалах наукових форумів, 1 патент на корисну модель, 1 інформаційний лист.
Структура і обсяг дисертації. Дисертаційна робота викладена на 188 сторінках комп’ютерного тексту; складається зі вступу, огляду літератури, матеріалів і методів дослідження, 4 розділів власних досліджень, узагальнення результатів дослідження, висновків, рекомендацій, двох додатків; ілюстрована 40 таблицями і 44 рисунками. Список джерел містить 175 найменувань, з них 43 – кирилицею, 132 – латиницею.
РОЗДІЛ 1
СУЧАСНІ ПІДХОДИ ДО ДІАГНОСТИКИ І ЛІКУВАННЯ АКТИНІЧНОГО КЕРАТОЗУ (АНАЛІТИЧНИЙ ОГЛЯД ЛІТЕРАТУРИ)
1.1 Сучасний стан проблеми актинічного кератозу
АК – неоплазія в епідермальному шарі шкіри, утворена проліфератами цитологічно аберантних кератиноцитів, індукованих тривалим впливом ультрафіолетового випромінення (UV), яка має відомий потенціал прогресування до інвазивного раку шкіри [1, 3, 18, 20, 24, 26, 51].
Концепцію про АК як преканцероз підтверджували своїми спостереженнями і науковими висновками ряд вчених [43, 44, 118, 130, 150, 154]. Однак швидкий розвиток дерматоонкології впродовж останніх десятиліть дає переконливі дані про те, що АК з високою ймовірністю можна вважати первинною неоплазією епідермального шару шкіри [16, 27, 36, 44, 80, 129, 154].
При АК, як і при ПКРШ іn situ, виявляють зміни полярності і збільшення розмірів ядер в клітинах епідермісу, мітози. У частини пацієнтів з АК виявляють мутації хромосоми р53, яка є присутньою у 90% осіб з ПКРШ [76, 163]. Відома відмінність між АК і ПКРШ полягає в тому, що атипові клітини при АК локалізуються у вигляді гнізд; при карциномі – поширюються на всю товщину епідермісу, а також на епітелій придатків і на дерму [16, 17, 29, 35, 50, 62].
Процес прогресування АК до інвазивного раку є довготривалим; його вважають аналогічним до загальновизнаної багатостадійної моделі фотоканцерогенезу, яка була запропонована у 1997 році J.P.Gallen. З отриманням нових даних про патобіологію і патогенез АК пропонувались нові назви для АК, такі як «сонячна кератотична інтраепідермальна плоскоклітинна карцинома», «кератиноцитарна інтраепідермальна злоякісна неоплазія» [1, 24, 155]. Vantsos в свій час запропонував назвати АК «внутрідермальною неоплазією», вказуючи на три ступені еволюції патологічного процесу від АК до ПКРШ.
Поряд з науковими твердженнями про те, що АК є інтраепітеліальним ПКРШ вже на ранній стадії свого розвитку, той факт, що у більшості випадків спостерігається невизначено довготривалий доброякісний перебіг, а також дані про низький відсоток пацієнтів з трансформацією АК у ПКРШ, який коливається від 1 % до 8-20 %, дає підстави для продовження наукових досліджень з метою отримання нових доказів, можливо, на користь припущень щодо доброякісності АК [1, 30, 60, 84, 135].
В літературних джерелах є дані про результати проведених в останні роки досліджень, що підтверджують прогресування АК у ПКРШ: частка таких пацієнтів складає 10%. В цих же дослідженнях є дані про діагностування інвазивної форми ПКРШ у 10-20 % пацієнтів з множинними вогнищами АК [53, 84].
Відомо, що клінічна значимість АК полягає також і в тому, що він є потужним предиктором виникнення меланоми або НМРШ, захворюваність і поширеність яких постійно зростає [16, 21, 24, 25, 120].
Встановлено, що проблематичнішим є АК у пацієнтів із високою схильністю до малігнізації шкіри, зокрема у хворих з імунодефіцитними станами, оскільки частота трансформацій у ПКРШ у них значно зростає [65, 112].
Епідеміологія. За даними джерел зарубіжної літератури захворюваність і поширеність АК є дуже високою. Це захворювання є другим за частотою серед причин звернення до дерматологів [31, 32, 84, 127]. Згідно з отриманими результатами Національного дослідження амбулаторно-медичної допомоги, яке проводилось у США з 1990 до 1999 рр., впродовж 10 років АК було діагностовано більш ніж на 47 млн. візитів у 14 % пацієнтів, які звернулись до дерматологів [162].
Найчастіше зустрічається АК у сонячних країнах, в яких впродовж всього календарного року високий рівень інсоляції: Австралії, окремих штатах США (Каліфорнія), країнах Південної Європи (Італія, Франція, Іспанія) та ін., що теж підтверджує головну роль хронічного впливу UV у виникненні захворювання.
Показники рівнів захворюваності на АК, які подані в наукових публікаціях і інших літературних джерелах, дуже коливаються; але однозначно вони є помітно вищими у осіб похилого (літнього) і старечого віку, осіб чоловічої статі, у жителів країн в сонячних регіонах [20, 130]. У країнах північної півкулі 11-25 % дорослого населення мають прояви АК, в Австралії – 40-60 % осіб, старших 40 років, а в сьомому десятиріччі показник сягає 80 %. У США АК виявляється у 26,5 % чоловіків, у жінок – 10,2 %, у Великобританії – у 15 % чоловіків і у 6 % жінок, в Австралії – у 55 % і 37 % відповідно. У молодому віці АК виявляється значно рідше. Проте є повідомлення американських вчених про ураженість АК 11 % двадцятилітніх і 25 % тридцятилітніх. В країнах Європи АК виявляється у 10 % пацієнтів віком 20-29 років [84].
Значний вплив на рівень захворюваності на преканцерози, рак і АК, спричиняє навколишнє середовище і, в першу чергу, інтенсивність сонячного опромінення. Хоча преканцерози і пухлини частіше виникають у похилому віці, частота виникнення цієї патології залежить від дози UV опромінення спектру B (UVB), яку людина отримала ще в молодому віці.
У сучасний період у зв’язку із виснаженням стратосферного озону і відповідно збільшенням інтенсивності випромінювання є прогнозованим ріст раку шкіри у 2060 році приблизно на 10 % в порівнянні з сьогоднішнім часом [20, 24, 44, 154].
Зважаючи на важливість проблеми, створені наукові моделі, які дають можливість встановлення кількісної залежності фотоканцерогенезу від виснаження озонового шару атмосфери. Проведеними відповідними розрахунками встановлено, що зменшення озонового шару на 1 % викликає збільшення НМРШ на 2 % [1, 20, 25, 33, 156]. Пряма залежність між виснаженням озонового шару і зростанням онкологічної захворюваності шкіри ґрунтується на наукових припущеннях про те, що навіть невеликі зміни концентрації озону значно впливають на пенетрацію UVB [159].
На рівень захворюваності на рак шкіри впливають ятрогенні джерела, зокрема ПУВА-терапія псоріазу. Є дані про те, що ця методика фототерапії псоріазу сприяє зростанню ризику розвитку ПКРШ у 8 разів, а частоту розвитку меланоми в окремих групах пацієнтів збільшує більш ніж у 14 разів [17, 125].
Опублікованих даних про захворюваність і поширеність АК в Україні загалом і в окремих регіонах немає. Є лише поодинокі роботи і дослідження, в яких вивчалися епідеміологічні, морфологічні, молекулярно-біологічні і клінічні аспекти цієї патології.
В майбутньому прогнозується зростання захворюваності на АК у населення в різних кліматичних районах і широтах в результаті постаріння населення, «омолодження» преканцерозів і раку шкіри, виснаження озонового шару стратосфери і зростання активності сонячної енергії, впливу ятрогенних джерел електромагнітних хвиль і інших причин.
Фактори ризику. Пусковим механізмом і основним фактором ризику щодо АК і раку шкіри є кумулятивний вплив UV [20, 51, 158]. Причому, виникнення і розвиток неопластичних процесів у шкірі корелює із збільшенням експозиції UVB. Докази цього твердо встановлені в експериментах на тваринах і підтверджуються спостереженнями за статистикою виникнення раку шкіри в людини [52, 120, 154]. Початок індукції неопластичних процесів в шкірі пов’язаний із пригнічуючим імунітет впливом UV-випромінення.
У багатьох публікаціях подається інформація про вплив UV-променів на окремі компоненти клітин, на біохімічні процеси, які відбуваються у клітинах і міжклітинному просторі. Доведено, що UV-випромінення може модифікувати структуру і/або функції таких важливих біоорганічних сполук, як білки, ліпіди і нуклеїнові кислоти. UV-випромінення інгібує клітинний імунітет і послаблює імунологічний нагляд за трансформованими під його впливом епідермальними клітинами [52, 113].
Підтвердженням впливу хронічного UV-опромінення, як основного патогенетичного чинника, на формування осередків АК в шкірі є локалізація уражень. Згідно літературних даних, 80 % всіх патологічних змін при АК виявляється на голові, зокрема на скальпі у лисих чоловіків, на вухах, на бокових поверхнях шиї, передпліччях, розгинальних поверхнях кистей, тобто на тих ділянках тіла, які є постійно максимально відкритими для дії UV [20, 25, 118, 156]. Як доказ, значення імунного нагляду у розвитку UV-індукованого неопластичного процесу в шкірі служать дані про 10-20 кратне збільшення частоти розвитку АК і ПКРШ на ділянках шкіри, які в минулому піддавалися дії сонячного світла у реципієнтів трансплантатів, котрі постійно отримують імуносупресивну терапію [36, 51, 65, 151, 160].
Як зазначалося вище, переважаючою кількістю пацієнтів з АК є особи похилого віку із світлою веснянкуватою шкірою, що пояснюється кумулятивним ефектом UV-променів, отриманих впродовж життя і типом світлочутливості шкіри [51, 82, 83, 89]. Одночасно, є припущення про те, що початок розвитку АК залежить від досягнення певної кумулятивної дози, яка може бути отримана вже в молодому віці; тому все частіше виявляють цю патологію у пацієнтів відносно молодого віку [1, 3, 129].
Крім вищезазначених, таких як хронічне UV-опромінення, похилий вік, чоловіча стать, світла шкіра, русяве або руде волосся, світлі очі (І-ІІ фототипи), імуносупресія, до факторів ризику щодо АК відносять наявність у пацієнтів деяких генетичних синдромів, пов’язаних з порушенням репарації ДНК, чи з дефіцитом біосинтезу меланіну, або із збільшенням вразливості до UV-ушкодження. До цих синдромів відносять альбінізм, синдроми Ротмунда-Томсона, Коккейна, Блума, пігментну ксеродерму. Описані випадки АК у вогнищах вітіліго. Також відомо, що у темношкірих ця патологія практично не зустрічається [1, 65].
Зростанню ризиків захворіти на неоплазію шкіри і АК сприяє користування соляріями. Є публікації про те, що у пацієнтів, які отримали перший сеанс в молодому віці, або отримували процедури тривало і часто, ризик виникнення меланоми підвищується в 70 разів [1, 20, 125].
Патофізіологія. Багаторічними дослідженнями встановлено, що ініціатором, основним патогенетичним фактором і промотором у виникненні АК, як і ряду інших неоплазій шкіри, є хронічний кумулятивний і переривчастий вплив UVB. Відомо, що UV опромінення спектру А (UVА), інші форми електромагнітного випромінення, зокрема, в ПУВА-терапії, іонізуюче і інфрачервоне теж можуть викликати АК, але їх ефект розцінюється як додатковий [20, 104, 125 ].
Ключова роль цього чинника знайшла своє відображення у назві дерматозу («актинічний», з посиланням на випромінювання). В назві – синонімі, яка використовувалася в минулому – «синильний» кератоз – відображено один із давно відомих факторів ризику – похилий (старечий) вік. Хоча на даний час доведено, що не настільки вік, як довготривалість впродовж 10-20 і більше років хронічної інсоляції є важливою у виникненні АК. Тому не дивлячись на те, що близько 50 % фотопошкоджень шкіри накопичується вже до 18 років, клінічні прояви їх з’являються у значно старшому віці [3, 20, 129].
Хронічний вплив UVB на ДНК і РНК кератиноцитів викликає утворення тимідин-димерів, які, в свою чергу, викликають мутації. Мутації ініціюють неопластичну трансформацію кератиноцитів. Однак при нормальному стані організму генетичні зміни кератиноцитів блокуються антипухлинними факторами, а пошкоджені мутаціями клітини знищуються шляхом апоптозу. Неконтрольована проліферація запускається лише при недостатності цих механізмів [69, 144]. Відомо, що UVB у фізіологічних дозах викликає апоптоз і диференціацію в нормальних клітинах, але не забезпечує цих процесів у трансформованих кератиноцитах, що дає їм можливість продовжувати клонально розмножуватися [157, 132, 169].
Основним механізмом у підтримці клітинного циклу є геномна стабільність. Важливу роль в цих молекулярних процесах відіграє ген-супресор пухлинного росту р53. Доведено, що у нормальних умовах експресія цього гена забезпечує індукування апоптозу у пошкоджених клітинах, а у патологічних умовах, навпаки призводить до індукування клітинної проліферації. Експресія р53 корелює з експресією фактора росту ендотелію судин, інших генів і молекулярних маркерів Bcl2, C-erbB2, p16, значення яких у малігнізації клітин є в процесі подальшого вивчення [45, 81, 121, 173].
Мутації гена р53 виявляють у 40 % випадків різних форм раку, причому при кожній з них є характерний індивідуальний спектр мутацій, що пояснюється різною чутливістю клітин даної тканини [76, 92].
Ряд авторів вважає, що викликані UVB мутації гена-супресора пухлинного росту р53, відіграють ключову роль у виникненні АК, а також в його прогресуванні у ПКРШ. Це підтверджується даними про виявлення цієї мутації більше ніж у 90 % пацієнтів з ПКРШ і у 75 % хворих на АК [76, 163]. Білок р53 вважають і фактором транскрипції, який контролює гени, котрі приймають участь у клітинному циклі, апоптозі і репарації ДНК. Доведено і про його безпосередню дію на білок апоптозу [76, 126, 137, 144, 163].
Особливості мутацій при АК вказують на клональність диспластичного процесу. У пацієнтів з множинними вогнищами, мутації є різними в кожному з них, а подібність їх при АК і ПКРШ є підтвердженням ролі АК як предиктора ПКРШ [1, 24, 42, 144].
Відомо, що канцерогенний ефект UV в шкірі здійснюється також і шляхом впливу на фоточутливі білки, їх структуру і функціональну активність. До таких білкових молекул, які мають фоточутливість, відноситься TsPO (18 кД translocator protein), раніше відомий як периферичний бензодіазепіновий рецептор. TsPO приймає участь у регуляції проліферації клітин, апоптозі, а також в синтезі стероїдних гормонів. TsPO експресується в шкірі в кератиноцитах, меланоцитах, в дермальних ендотеліоцитах і фібробластах [96].
В індукції канцерогенезу, особливо в шкірі, важливого значення надається ролі активних форм кисню, які утворюються також і через поглинання UVА випромінення хромофорами шкіри. Відомо, що активні форми кисню мають мутагенний вплив на диперимідинові ділянки ДНК генів ras і р53. Цей процес визнається також одним з ключових у розвитку ПКРШ.
Деякі дослідники вважають, що про біологічні особливості пухлинного росту можна судити і за експресією показника активності ядерцевих організаторів, яка є не тільки показником проліферації клітин, а і одночасно відображає рівень їх диференціювання і метаболізму [36, 43, 73].
Важливе значення в розвитку і прогресуванні всіх пухлин має ангіогенез. Від його інтенсивності в злоякісному новоутворенні прямо залежить швидкість росту і метастазування пухлини. Доведено, що UVB викликає розвиток нових судин в шкірі шляхом стимулювання секреції ендотеліального фактора росту [114].
В багатьох наукових працях наведені висновки про важливість у патогенезі АК і його можливій малігнізації, порушень контролю росту через клітинно-клітинні, клітинно-матричні взаємодії, експресію матриксних металопротеїназ (ММП), дефектність імунологічного «пухлинного нагляду» («tumor surveillance») [142]. Достатньо вивченою є роль ММП у деструкції компонентів позаклітинного матриксу, звідки випливає їх роль в патогенезі багатьох новоутворень.
Особливе значення має ММП-2, яка відіграє важливу роль у здатності клітин пухлини до інвазії. Визначення рівнів експресії ММП-2 і ММП-9 дозволяє оцінювати і прогнозувати інвазивну здатність пухлин, оскільки вони корелюють з такими морфологічними і клінічними характеристиками як розмір пухлини, наявність метастазів, низька клітинна диференціація пухлини, що дуже важливо для оцінки злоякісного потенціалу пухлин. У вивченні патогенезу різних неоплазій і для прогнозування важливе значення має також характер розподілення локалізації ММП-2 в тканині пухлин, чому раніше не надавали належного значення [59, 142, 157].
Дослідженнями останніх років доведено важливу роль у виникненні і наступному прогресуванні пухлин не тільки порушень контролю клітинного циклу, а і регуляції процесів апоптозу і активації шляхів внутріклітинної передачі мітогенного сигналу, міжклітинних взаємодій. Доведено, що міжклітинні взаємодії впливають на неналежну проліферацію патологічних клітин, попереджуючи її.
Пригнічуючий вплив на трасформовані кератиноцити мають і дермальні фібробласти. Вони секретують фактор росту-β, який індукує диференціацію в плоскоклітинний епітелій [3, 25, 114]. Як доведено в сучасних наукових дослідженнях, пригнічуючий вплив спричиняють також нормальні кератиноцити на прилягаючих ділянках шкіри. Цей процес здійснюється елімінацією кератиноцитів з мутаціями по р53 і HRAS шляхом індукції «арешту» клітинного циклу, а також диференціації [121, 137].
1.2 Діагностика актинічного кератозу
Поширеність і високий рівень захворюваності на АК, асоційованість з ризиком прогресування у інвазивну плоскоклітинну карциному, дані про те, що АК є прекурсором ПКРШ і маркером НМРШ, на тлі постійного зростання захворюваності на рак шкіри у багатьох країнах світу і в Україні в тому числі, диктують необхідність покращення діагностики даного дерматозу.
Довготривало діагностика дерматозів, а також новоутворень шкіри, базувалась тільки на даних клінічного обстеження; при необхідності проводились патогістологічні дослідження. Однак клінічне розпізнання не завжди може забезпечити повну верифікацію клінічного діагнозу, тому виникла потреба в інструментальних (апаратних) дослідженнях.
В останні десятиліття широко використовується дерматоскопія – інноваційний спеціальний метод обстеження, за допомогою якого можна удосконалити діагностичний процес при ряді шкірних захворювань. Дерматоскопія – неінвазивна діагностична процедура, яка дозволяє швидко, in vivo оцінити кольори і мікроструктури епідермісу, дермо-епідермального з’єднання, папілярної дерми, які не видно неозброєним оком. Ці структури специфічно корелюють з гістологічними особливостями. Цей метод є зручним для лікаря і пацієнта, не має протипоказів до проведення.
У практиці дерматологів дерматоскопія вже стала невід’ємною діагностичною процедурою, без проведення якої неможливо провести кваліфіковане консультування пацієнтів з новоутвореннями шкіри. Тривалість цієї діагностичної процедури при виконанні досвідченим фахівцем триває хвилини, а іноді й секунди. Чутливість методу дерматоскопії в досвідчених спеціалістів за даними різних авторів складає від 89 до 98 %, а специфічність 79-98% [13, 72, 117, 133, 176].
Термін «дерматоскопія» (dermatoscopy) впровадив у 1920 році німецький вчений Йоган Сафір (Johann Saphier). Прототипом першої дерматоскопії було обстеження бінокулярним мікродерматоскопом із слабим боковим джерелом освітлення у хворих з патологією шкіри. У сучасному вигляді метод застосовується з 1970 року.
Інструментом для проведення дерматоскопії є дерматоскоп – ручний міні-мікроскоп, який складається з лінзи, джерела світла, тримача. Є три види дерматоскопів: неполяризовані (контактні), поляризовані і гібридні. Обстеження контактним дерматоскопом проводиться з використанням імерсійної олії, яка потрібна, як зв’язуюче середовище, для зведення до мінімуму заломлення світла на межі шкіри і повітря. Перевагою поляризаційного дерматоскопа є можливість безконтактного обстеження, що значно швидше і зручніше у виконанні. Гібридні дерматоскопи мають два режими: поляризаційний і неполяризаційний.
У методиці дерматоскопії використовується оптичне збільшення у 10-16 разів, що дає можливість виявляти ті морфологічні структури, які не видно неозброєним оком: плоске загальне зображення епідермісу і верхнього шару дерми, а також оцінювати особливості цих структур, їх колір. В основі ефекту є принцип відбивання підведеного світла, яке, проникаючи в шари шкіри, відбивається від них під збільшенням, створюючи реальну картину структури пухлини. Це дослідження подібне до огляду під лупою великого збільшення, але різниться значно вищою деталізацією отриманого зображення.
В сучасних джерелах літератури виділяють і описано 4 основні дерматоскопічні ознаки непігментованих варіантів АК: еритему, рожево-червону псевдосітку, тонкі хвилясті судини, мішенеподібні волосяні фолікули, і 3 ознаки, які характерні для пігментованого АК: виразні фолікули, білі круги, сірі ромбовидні структури [2, 13, 14, 29, 88].
Таким чином, застосування і продовження вивчення можливостей дерматоскопії, як сучасного, високоінформативного, високоспецифічного і чутливого методу неінвазивної діагностики новоутворень шкіри, в т.ч. передракових захворювань, і АК, зокрема, дасть можливість встановлювати клінічний діагноз з високим ступенем достовірності вже на етапі консультування пацієнтів.
1.3 Огляд сучасних методик лікування актинічного кератозу
Необхідність проведення своєчасного ефективного лікування АК пояснюється неможливістю передбачення прогнозу і виключення найменших ризиків прогресування у ПКРШ.
Довготривалі спостереження за перебігом АК дали підстави зробити висновки, що є три варіанти розвитку клінічних проявів АК: спонтанний регрес (за клінічними проявами), персистування без прогресування у інвазивний ПКРШ, прогресування у інвазивний ПКРШ [16, 25, 129]. На даний час немає чіткого клінічного чи гістологічного критерію, який би можна було використовувати у прогнозуванні перебігу АК у пацієнтів, хоча й відомо, що більш схильними до малігнізації є гіперкератотичні вогнища [55]. Тому зростає важливість проведення своєчасної ефективної і адекватної терапії хворим на АК, необхідність перебування їх під ретельним спостереженням з метою раннього і своєчасного лікування нових вогнищ, запобігання малігнізації [64].
Лікування АК, вибір найефективніших методів були і є в даний час предметом численних наукових досліджень у різних країнах, проте залишаються актуальною проблемою в сучасній дерматології [1, 4, 18, 49, 57, 64, 95]. В Україні немає клінічного протоколу діагностики і лікування АК. Європейські клінічні настанови потребують адаптації до індивідуальних вимог і пристосування до реалізації на національному і регіональному рівнях.
Основною метою лікування АК, з урахуванням переконливих даних про можливість активної проліферації і злоякісної трансформації, є радикальне видалення вогнищ на ранніх стадіях, що дасть змогу запобігти інвазивному росту [13, 21, 41, 71, 95]. В даний час з метою елімінації осередків АК застосовується досить велика кількість методів терапії [21, 22, 57, 95, 111, 149, 166]. Але бажана й очікувана ефективність лікування залишається недостатньою, оскільки більшість застосовуваних у практиці методик не можуть забезпечити запобігання розвитку рецидивів захворювання, часто погано переносяться пацієнтами, призводять до виникнення рубців, гіпопігментацій, є довготривалими, що знижує прихильність пацієнтів до лікування.
Необхідність проведення ефективного лікування АК диктується не лише тим, що АК посідає особливе місце серед захворювань, які спричиняють підвищений ризик розвитку ПКРШ, а і його негативним впливом на якість життя пацієнтів [1, 25, 34, 37, 64], оскільки локалізація переважно в косметично значимих зонах спричиняє серйозні косметичні вади.
При виборі методу терапії також необхідно враховувати, що на ранніх етапах своєї еволюції прояви АК є клінічно не видимими: атипові кератиноцити, які вже наявні в епідермісі, розсіяні в межах ушкодженої сонцем шкіри, але перебувають нижче умовного рівня клінічного виявлення. Лише з часом при таких ситуаціях розвинеться більш виражена і доступна для клінічного виявлення симптоматика [46]. А при проведенні лікування важливо видаляти не тільки клінічно видимі вогнища АК, а й чинити вплив на оточуючу шкіру з ознаками хронічного фотоушкодження і еластозу. З огляду на це, відповідним було б лікування, яке позитивно впливає на всю ушкоджену сонцем шкіру, але наразі такі методи не мають широкого застосування в практиці, за виключенням окремих випадків проведення ротаційної терапії [95, 140].
Для лікування фотоушкодження шкіри і множинних вогнищ АК («полів канцеризації») з сучасних методик може застосовуватись фотодинамічна терапія, яка впливає на основні ланки розвитку новоутворень: активує апоптоз, руйнує стромальні елементи, судини, котрі живлять пухлини, чинить безпосередню цитотоксичну дію на пухлинні клітини [82, 122]. Проведення раннього лікування уражених ділянок при АК з метою запобігання розвитку злоякісної пухлини чи локального рецидиву повинно забезпечуватись локально-спрямованим лікувальним підходом. Персоніфіковане локально-спрямоване лікування (candidate field-directed treatment) потребує механізму дій, сумісного з впливом на локальну канцеризацію, невідкладної та довготривалої ефективності на видимі ураження і ефективності щодо субклінічного АК [32, 101]. Прикладом такого лікування (candidate field-directed treatment) є топічна терапія гелем 3 % диклофенаку натрію у 2,5 % гіалуроновій кислоті. Застосування цього препарату ґрунтується на його впливі на основні патофізіологічні механізми розвитку АК, включаючи індукцію апоптозу, інгібування ангіогенезу та зменшення запалення [70, 78, 81]. Лікування зазначеним топічним гелем впливає також на локальну канцеризацію: забезпечує довготривалу ефективність на видимих ураженнях і субклінічних проявах АК [78, 103].
Очікуваного результату – очищення видимих полів канцеризації – безпечно можна досягнути впродовж 90-денного курсу лікування у пацієнтів з площею ураження до 50 см2, що асоціюється з принаймні 75 % зменшенням кількості уражень, на які була направлена терапія, у 85 % і 91 % пацієнтів, відповідно через 30 днів і 1 рік після лікування [70].
При проведенні тривалої топічної терапії АК дуже важливим є досягнути максимізації комплаєнсу в пацієнтів, які отримують таке лікування. За підсумками 45-хвилинного огляду онлайн, який був виконаний і завершений лікарями у 8 країнах, топічна локальна терапія є суттєвою і співвідноситься з тривалістю лікування та місцевими реакціями шкіри [32, 101]. Однак, більше ніж 90 % лікарів надавали б перевагу призначенню найкоротшого лікування для таких пацієнтів. Коротка тривалість лікування та швидке очищення шкірних реакцій є основним фактором, який враховується лікарями. Такі висновки повинні враховуватись для випрацювання рекомендацій для покращення ефективної топічної терапії з селективним впливом на аномальні клітини [37, 153]. Крім 3 % диклофенаку, за рекомендаціями Американської академії дерматології, першою лінією топічних препаратів для лікування АК є 5 % 5-фторурацилова мазь, 5 % іміквімод та інгенолу мебутат.
Французькі дерматологи забезпечені стратегією менеджменту та практичним лікувальним алгоритмом для щоденної практики щодо АК, складеними групою з 6 експертів – дерматологів. Цей практичний лікувальний алгоритм ґрунтується на кількості осередків АК, їх клінічних проявах та включає кріотерапію, кюретаж, електрокоагуляцію, застосування 5 % 5-фторурацилу, 3 % диклофенаку натрію, 5 % іміквімоду, інгенолу мебутату, лазера, фотодинамічну терапію і хірургічних методів [13, 18, 67, 93, 94, 123, 141, 152, 172, 175].
До найбільш поширених традиційних методик лікування АК за кордоном відносять також кріодеструкцію, лазерне шліфування, тангенціальне висікання, електродісекацію. Неінвазивними методиками, що використовують найчастіше, є хімічні пілінги, аплікації 5-фторурацилу. Останніми роками широко почали застосовувати топічну терапію імуномодулюючим препаратом іміквімодом [67, 123]. Загалом вважається, що ефективність зовнішніх хімічних препаратів в залежності від конкретного методу складає 50-75 %. Результати проведених рандомізованих порівняльних досліджень ефективності щоденного одноразового застосування 0,5 % 5-фторурацилу в комбінації з 10 % саліциловою кислотою порівняно з кріохірургією переконливо свідчать про більше гістологічне очищення і нижчий рівень рецидивування при гіперкератотичних АК 2 і 3 ст., ніж після кріохірургії. Частота виникнення побічних реакцій, які були загалом м’якими або помірними при обох видах лікування, була відносно низькою [48, 77, 165].
Недоліками всіх вищевказаних методів є їх неспецифічність і розвиток рецидивів, перш за все, а також виникнення місцевих транзиторних реакцій – еритеми і набряку.
Профілактика. Необхідність забезпечення захисту організму людини від впливу UV випромінення є очевидною. Вона обґрунтована сучасними знаннями про ефекти, які чинять UV промені на здоров’я, на біологічні і фізіологічні процеси в організмі, а також на карциногенез [150, 158, 159]. Шкіра є першим і основним органом, який постійно піддається впливу УФ. Захищаючи шкіру від надмірної інсоляції, можна запобігти виникненню, загостренню і рецидивам ряду захворювань, в тому числі і АК [143].
Є припущення, що пропагуючи необхідність використання сонцезахисних засобів (СЗЗ) кожною людиною зокрема, а також навчаючи все населення розумінню потреби захищати тіло від надмірної інсоляції з одночасним переконанням фундаментально змінювати поведінку і спосіб життя стосовно перебування на сонці, можна досягнути значного зменшення навантаження УФ випромінення на організм, чим в кінцевому результаті можна досягнути зниження захворюваності на АК і рак шкіри [66, 159].
Аргументованих детальних практичних рекомендацій щодо дотримання фоторежиму, допустимої тривалості та інтенсивності природньої і штучної інсоляції з врахуванням регіону проживання чи відпочинку, сезону року, індивідуальних особливостей шкіри, віку, стану здоров’я при АК і неоплазіях шкіри наразі немає. Однак у всіх доступних джерелах літератури застосування СЗЗ рекомендується як обов’язковий захід профілактики АК і відповідно попередження виникнення ПКРШ [168, 174].
Основні позитивні і негативні біологічні ефекти сонячного світла описав на початку 1990 років лауреат Нобелівської премії Нільс Фінсен. За останні 20 років знання про біологічну дію UV значно розширились. При контакті з шкірою енергія сонячного випромінення або перетворюється у теплову енергію, або витрачається на фотохімічні перетворення біологічних молекул. В процесі цих фотохімічних реакцій у шкірі утворюються вільні радикали, відбувається перекисне окислення ліпідів, проходить фотосинтез вітаміну Д3, інші біохімічні процеси, а також формується засмага. Який виникне ефект при опроміненні (позитивний чи негативний), залежить від дози UV впливу (інтенсивності, тривалості, періодичності), а також від діапазону хвиль, що обумовлено різними енергетичними рівнями і різною проникністю UVA і UVB променів. Хоча енергетичний рівень UVA випромінення у 100 разів вищий від енергетичного рівня UVB променів, більше пошкодження шкіри можуть викликати UVB-промені. Короткочасне опромінення UVA не викликає пігментації, а лише негайну сірувату засмагу відразу після опромінення. А проникаючи в дерму і сполучну тканину, ці промені викликають утворення і накопичення аномального еластину, який є прискорювачем процесу старіння. Хоча UV-промені проникають в шкіру лише на глибину десятих часток мм, дія їх не обмежується місцевими змінами, а поширюється на весь організм [159].
UVB-промені чинять вплив лише на епідерміс, викликають засмагу, потовщення епідермісу, сонячні опіки. У відповідь на дію UVB формується коричнева засмага, якій передує еритема. Засмага є захисною реакцією організму на фотопошкодження, а не ознакою здоров’я.
У шкірі людини є природні захисні системи, які оберігають організм від пошкоджуючого впливу сонячних променів, тому людина може деякий час перебувати на сонці без шкоди для здоров’я. Основні сонцезахисні механізми шкіри наступні: процес активації меланоцитів, синтез меланіну, утворення засмаги, ущільнення епідермісу, активація антирадикальних ферментних систем, активація репаративних ферментних систем (є дуже важливою, оскільки приводить до відновлення різних порушень), утворення уроканінової кислоти. Наскільки активними є всі ці системи і кожна, зокрема, залежить від фототипу шкіри, віку і загального стану здоров’я людини [84, 156, 158, 170].
Фотобіологічні реакції може викликати лише світло, яке поглинається хромофорами шкіри. Відомо, що безпосередній вплив на хромофори мають UVB промені, а UVA – запускають і стимулюють продукцію вільних радикалів, в т.ч. активних форм кисню в опроміненій шкірі. Внаслідок фотохімічних реакцій хромофори перетворюються в нові молекули – фотопродукти, які стимулюють процеси передачі клітинного сигналу в ході біохімічних змін, кінцевим результатом яких є проліферація, секреція цитокінів і апоптоз. У світовій літературі є багато робіт, в яких описано вплив UV променів на окремі компоненти клітин і на біохімічні реакції, які відбуваються у клітинах і міжклітинному просторі. Клітини, опромінені надто високою дозою UV, можуть втрачати здатність комунікувати з сусідніми клітинами, а також здатність до апоптозу [156, 158].
Відомо, що UV випромінення непрямим шляхом індукує розвиток пухлин, стимулюючи секрецію ендотеліального фактора росту, провокує розвиток нових пухлин в шкірі. Збільшення судинної сітки і кровотоку призводить до поширення пухлинних клітин і росту власне пухлини. Окрім вищевказаного, UVB випромінення з довжиною хвилі до 320 нм викликає пошкодження ДНК, пригнічує клітинний імунітет і послаблює імунологічний нагляд за трансформованими епідермальними клітинами, ініціюючи розвиток пре- і непластичних процесів у шкірі людини на клітинно-біологічному рівнях [172].
Ступінь вираженості патологічних змін у шкірі, спричинених UV-випроміненням, крім інших факторів, обумовлюється кумулятивним ефектом UV, отриманим впродовж життя і типом фоточутливості людини. Результати молекулярних досліджень, проведених в останні роки, дали нові знання про патогенез багатьох фотодерматозів, допомогли удосконалити діагностичні і прогностичні критерії, що в свою чергу дало нові можливості для розробки ефективних профілактичних заходів [54].
Сонцезахисну косметику почали застосовувати в 20-х роках минулого століття. Першим кремом, до складу якого входили UV-фільтри, був Delial. На ринок вийшов у 1934 році. Широке застосування ФЗЗ почалося з 50-60 років. На даний час асортимент фотозахисної продукції є дуже широким. Постійно проводяться дослідження, спрямовані на покращення якості UV захисту і на розробку нових ефективних фільтрів. Запит на СЗЗ постійно зростає не тільки у південних країнах – традиційних споживачах СЗЗ, але і у північних регіонах, що можна пояснити зростанням рівня обізнаності про UV випромінення і його вплив на організм людини.
Базується створення СЗЗ на знаннях впливу UV на шкіру людини. Всі сполуки, які мають сонцезахисні властивості, за механізмом їх дії поділяють на три основних групи: хімічні UV-фільтри, фізичні екрани (пігменти), антиоксиданти.
До хімічних UV-фільтрів відносять речовини, які поглинають UV-випромінення. Найбільш популярними хімічними UV-фільтрами є наступні: Phenylbenzimidazole Sulphonic Acid, Benzophenone-4, Benzylidene Camphor Sulfonic Acid, Octyl Salicylate, Homosalate, Octyl Methoxycinnamate, Isoamyl p-Methoxycinnamate, Octocrylene, Methyl Anthranilate, 4-Methylbenzylidene Camphor, Benzophenone-3, Butyl Methoxydibenzoylmethane, Avobenzone.
Фізичні фільтри (екрани) працюють за принципом “відбивання”. Вони мають широкий спектр дії і не чинять фотосенсибілізуючого ефекту. До основних протекторів неорганічного походження належать діоксид титану і оксид цинку. Ефективність фізичних фільтрів є нижчою, ніж хімічних, але на відміну від останніх фізичні можна включати в рецептуру у високих концентраціях. Оксид цинку досить широко використовується у СЗЗ; він є прозорішим в порівнянні з діоксидом титану, дія його є синергічною з органічними фільтрами. Найбільш ефективним оксид цинку є в діапазоні UVA, а діоксид титану – в діапазоні UVB. Для розширення ефективності можна їх комбінувати. Найважливішою перевагою фізичних фільтрів є їх безпечність при хорошій ефективності. Фізичні фільтри не проникають в шкіру, є хімічно і біологічно інертними, тобто не викликають подразнення, фототоксичних чи фотоалергічних реакцій. Фізичні фільтри виконують свою сонцезахисну функцію відразу ж після нанесення на шкіру, в той час як активність хімічних фільтрів проявляється в середньому через 30 хвилин. Фізичні фільтри щоразу ширше використовуються для часткової або повної заміни хімічних фільтрів. У європейських вимогах до косметичних засобів немає обмежень щодо концентрації фізичних фільтрів, але є обмеження для хімічних. Основний недолік цих фільтрів – зафарбування шкіри в білий колір [156].
Важливу роль у сонцезахисних процесах відіграють також антиоксиданти; їх називають ще активними речовинами «другого» плану. Вони нейтралізують та інактивують вільні радикали і активні форми кисню, які утворюються в шкірі внаслідок UV. Антиоксиданти, введені до складу СЗЗ, перешкоджають розвитку окислювальних і вільнорадикальних процесів як у шкірі, так і у СЗЗ, допомагають власним антиоксидантам клітин шкіри виконувати їх функцію, чим нівелюють негативні наслідки UV-опромінення. Найчастіше використовуються з цією метою вітаміни Е і С, мікроелементи селен і цинк, біофлавоноїди рослинного походження [131].
На ефективність СЗЗ впливають також інші складники, зокрема емолієнти і емульгатори. Емолієнти вводять до складу СЗЗ для пом’якшення дії, кращого розчинення кристалічних UV-фільтрів, попередження агрегації мікронізованих частиночок як при виготовленні, так і в готовій до використання формі. Емульгатори необхідні для забезпечення стабільності, стійкості до впливу сонячних променів, високої температури, води [156].
Сучасні СЗЗ, які здатні забезпечити ефективний захист від широкого спектру UV-випромінення, містять декілька різних фільтрів. У 2000 р. перелік дозволених UVA-фільтрів поповнився новими сполуками із максимом поглинання при 355 нм (водорозчинний фільтр), 343 нм (жиророзчинний фільтр) і 359 нм (новий) клас UV-сорбентів – органічні мікрочастинки з діаметром менше 20 нм.
Первинно до сонцезахисних кремів ставились лише такі вимоги: прозорість, сприяння красивій засмазі, захист шкіри. Ці критерії вимог залишаються важливими і в даний час. Але з середини 80-х рр., коли з’явились перші повідомлення про озонові діри, все ширшим ставало розуміння негативного впливу UV на організм. І вже з початку 90-х рр.. на перший план почали виходити аспекти безпеки і здоров’я. З розширенням знань про бажані і небажані ефекти, які спричиняє UV-випромінення на організм людини, розширюється спектр показів до застосування СЗЗ [125].
Вимоги, яким повинні відповідати сучасні СЗЗ: поглинати промені в широкому діапазоні, бути стійкими до світла, нагрівання, води: мати низьку проникаючу здатність (не проникати через роговий шар шкіри), бути безпечними: не мати токсичності, не викликати подразнення, зокрема під дією UV, не мати сенсибілізуючих властивостей, не мати генотоксичності, канцерогенності, в т.ч. під дією UV, не впливати на репродуктивну систему, ефективно попереджувати видимі і невидимі ефекти UV-випромінення, в т.ч. віддалені, а не лише сонячні опіки [156].
Про важливість контролю безпечності свідчить той факт, що у США з 1972 р. СЗЗ переведені з категорії косметичних засобів в категорію безрецептурних лікарських засобів.
Тривають наукові дискусії щодо можливості UV-фільтрів ефективно попереджувати імуносупресію. Цей аспект дії CЗЗ є дуже важливим, оскільки зниження імунітету шкіри є передумовою до розвитку онкологічних захворювань шкіри і інших захворювань, в патогенезі яких UV-випромінення відіграє важливу роль. Результати проведених експериментів щодо впливу UV на імунну систему шкіри дещо відрізняються. Але є підстави вважати, що фактор імунного захисту є нижчим, ніж SPF (фактор захисту від сонячного опіку) і є кореляція між ними. Це дає можливість орієнтуватись на здатність препарату захищати шкіру від імуносупресивної дії UV-випромінення по його SPF.
Ефективність захисної дії UV-фільтрів в протипухлинному процесі підтверджена в проведених дослідженнях на культурах клітин людини і тварин. Доведено, що нанесення UV-фільтрів оберігає ген-онкосупресор, який кодує білок р53, від пошкоджень і попереджує UV-індуковану імуносупресію. Є дані про те, що використання CЗЗ є профілактикою від утворення передракових захворювань, зокрема АК. Додатковою позитивною дією UV-фільтрів є запобігання виникненню фотодерматозів і передчасного старіння.
Разом з тим є припущення, що CЗЗ, які зменшують еритемну реакцію на UV-випромінення, не забезпечують захист від тривалих імуносупресивних наслідків UV, оскільки не відомо, чи факт блокування ознак еритеми CЗЗ-фільтрами знижує UV-індуковану схильність до росту пухлин [154].
Ступінь захисту шкіри і організму від UV-випромінення оцінюється показником SPF. SPF був вперше визначений Францем Грейтером (Franz Greiter) у 1962 р., а впроваджений в практику Управлінням FDA у 1978 р.. За наступні роки він переконливо ввійшов у косметичну практику і залишається основною характеристикою CЗЗ, оскільки попередження сонячних опіків в час перебування на сонці залишається найбільш бажаним ефектом для споживання CЗЗ. SPF вказує наскільки мінімальна еритемна доза (МЕД) з нанесеним на шкіру CЗЗ є більшою від МЕД незахищеної шкіри. МЕД слугує для кількісної характеристики еритеми і відповідає дозі опромінення, яка викликає мінімальне видиме оком почервоніння за певний проміжок часу (зазвичай через 24 години). SPF і МЕД розроблялись в той час, коли СЗЗ були необхідними лише для попередження сонячних опіків [156].
В даний час, враховуючи рівень сучасних знань, SPF правильніше було б називати «еритемним захисним фактором» (erythemal protectional factor) або «фактором захисту від сонячного опіку» (sunburn protection factor), тому що через 24 години можна оцінити тільки гострий вплив UV-опромінення і не можливо оцінити наслідки хронічного впливу (імуносупресію, старіння шкіри, рак) [125, 156]. Необхідно також враховувати, що в різних країнах візуальні оцінки еритеми є різними, різним є «поріг еритеми», тому і визначення SPF різняться. Визначення SPF проводиться у відповідності до вимог протоколів COLIPA, FDA.
Хоча у більшості СЗЗ пропонується максимальний захист від UVB-променів, ці засоби захищають і від UVA-випромінення, хоча вимірювального еквіваленту не існує. Вважається, що чим вищий SPF, тим більшою є ймовірність ступеню захисту від UVA-випромінення цього засобу. Необхідність фотозахисту від опромінення діапазону UVA було визнано у 1990 році.
Захист від широкого спектру in vivo досягається доповненням складу СЗЗ октилметоксицинаматам і оксидом цинку. Ще більшого ступеню захисту можна досягнути використанням октокрилену і парсалу 1789 [164].
Всі CЗЗ за ступенем захисту класифікуються у 5 категоріях: з низьким SPF – 2-6, середнім – 8-12, високим – 15-20, дуже високим – 25-30, ультра високим SPF – вище 50. Вважається, що засоби з SPF 15 і вище затримують 93 % променів UVB. З більш високим індексом захисту CЗЗ призначені для застосування в особливих ситуаціях в умовах підвищеної інсоляції, при прийомі медикаментів, які підсилюють фоточутливість шкіри.
Товариство онкологів США запропонувало критерії для захисту шкіри людей від шкідливого впливу UV-випромінення у відповідності до фототипу шкіри. Для кожного фототипу передбачається свій ступінь захисту, що виражається в SPF-одиницях [51].
Поверхневий захист, ступінь вираженості якого відображає SPF, дає можливість збільшити тривалість безпечного UV-опромінення, але не може повністю блокувати вплив UV, і не може знизити ризик від довготривалої пошкоджуючої дії UV. Для оцінки захисту молекули ДНК від впливу UV існує показник DNA Protection Factor. В експериментах доведено, що він перевищує показник SPF і що надійний захист ДНК здійснюється СЗЗ з SPF˃15 [159].
Сучасні UV-фільтри вважаються безпечними, оскільки показники пенетрацї через шкіру, випадки виникнення подразнень трапляються дуже рідко.
СЗЗ мають застосовуватися в концентрації 2 мг/см2. Така концентрація СЗЗ (2 мг/см2) при тестуванні на SPF є еквівалентною 30 мл СЗЗ для покриття всієї поверхні тіла.
Таким чином, застосування CЗЗ є необхідними для здорових людей, а також для хворих на фотозалежні дерматози, оскільки є одним із доступних шляхів зміни впливу шкідливих факторів навколишнього середовища у більш безпечному напрямку. Оскільки CЗЗ мають здатність попереджувати розвиток більшості негативних наслідків UV-випромінення, а саме – сонячного опіку, пошкоджень генетичного апарату клітин, UV-індукованої імуносупресії, фотостаріння шкіри, застосування їх слід вважати важливим розділом профілактичної дерматології. Реалізація концепції розуміння необхідності захисту від надмірної інсоляції, в т.ч. шляхом використання CЗЗ, повинна здійснюватись дерматологами, онкологами, сімейними лікарями, середніми медичними працівниками, проведенням дієвих саносвітніх заходів і при консультуванні пацієнтів.
* * *
Узагальнюючи аналіз літератури, можна зробити такі висновки:
Аналіз даних з доступної літератури підтверджує, що провідне значення в патогенезі АК відводиться концепції фотоканцерогенезу.
Ключову роль у виникненні і розвитку АК відіграє UVB-випромінення. Його канцерогенний ефект реалізовується через пригнічуючий вплив на клітинний імунітет, послаблення імунологічного нагляду за трансформованими епідермальними клітинами, через вплив на окремі компоненти клітин і біохімічні реакції, які відбуваються у клітинах і міжклітинному просторі, вплив на фоточутливі білки, їх структуру і функціональну активність, на секрецію ендотеліального фактора росту, на процес апоптозу. UVB-випромінення викликає підвищення рівня активних форм кисню в шкірі і спонукає клітини функціонувати в умовах домінування окислювальних процесів, які призводять до незворотних порушень механізмів росту і диференціації клітин.
Не дивлячись на наявність достатньо великої кількості наукових даних в розумінні молекулярних і клітинних механізмів розвитку АК, є необхідність продовження вивчення патогенезу даного захворювання.
Подальші поглиблені дослідження в цьому напрямку будуть сприяти отриманню нових даних для прогнозування перебігу захворювання, ймовірності малігнізації, причин виникнення рецидивів, а також оцінки передбачуваної ефективності терапії.
Матеріали розділу опубліковані у наступних виданнях:
- Глушок В. С. Основні патофізіологічні механізми розвитку і прогресування актинічного кератозу. Журнал дерматовенерології та косметології імені М. О. Торсуєва. 2017. № 2 (38). С. 101–108 [6].
РОЗДІЛ 2
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Матеріали і дизайн дослідження
Дослідження проводилось з 2015 по 2017 роки на кафедрі інфекційних хвороб з епідеміологією, шкірними та венеричними хворобами ДВНЗ «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України» на базі поліклінічного відділення Комунальної установи Тернопільської обласної ради «Тернопільський обласний клінічний шкірно-венерологічний диспансер». У цей період було обстежено 110 пацієнтів, у віці від 51 до 90 років (середній вік – (70,1 ± 0,9) років), з них 76 (69,1 %) жінок і 34 (30,9 %) чоловіків. З них 90 пацієнтів були з АК (основна група), 20 – із СК (група порівняння).
Перед початком дослідження всіх пацієнтів було інформовано про характер і особливості їх участі для оцінки стану їх здоров’я, переносимості лікування з метою проведення наукового аналізу і отримання наукових висновків. У всіх пацієнтів було отримано добровільну згоду на участь у відповідності до положень Гельсінської Декларації Всесвітньої Медичної Асоціації та правил якісної медичної практики (ICH GCP).
Відбір пацієнтів для участі в науковому дослідженні проводили відповідно до попередньо розроблених критеріїв добору.
Критеріями включення були:
– встановлений діагноз АК (СК – для групи порівняння);
– добровільна згода пацієнта, що підтверджується підписаними пацієнтами інформованими згодами на участь в дослідженні, проведенні необхідних обстежень і лікування.
Критерії виключення з дослідження:
– наявність важкої супутньої патології у стадії суб- та декомпенсації;
– неможливість чи небажання виконувати рекомендації щодо лікування і профілактики, дотримуватись плану обстеження, наступного періоду спостереження;
– наявність супутніх дерматологічних захворювань, які могли б перешкоджати встановленню діагнозу АК, оцінці ефективності проведеного лікування.
Діагноз усім пацієнтам було встановлено на підставі оцінки клінічних проявів на шкірі, дерматоскопічних даних, з врахуванням скарг і даних анамнезу.
Вивчали демографічні показники, які можуть бути віднесені до факторів ризику розвитку і прогресування дерматозу чи обумовлювати більш важкий перебіг захворювання. Понад 85 % хворих були старше 60 років (95 – 86,4 %), в тому числі 88,9 % пацієнтів з АК і 75 % – з СК (р=0,144 між групами). Найбільший відсоток хворих на АК припадав на вікові групи 61-70 років (37,8 %) і 71-80 років (36,7 %), а серед пацієнтів з СК найбільш представленою була вікова група 61-70 років (40,0 %) (табл. 2.1). Це узгоджується з даними багатьох досліджень про високий рівень захворюваності на кератози, особливо на АК, серед осіб похилого і старечого віку [1, 3, 20, 24, 39, 51, 54, 65, 66, 73].
Таблиця 2.1 – Розподіл хворих на кератози за віком, абс. ( %)
| Вік, років | Всі пацієнти (n=110) | АК – основна група (n=90) | СК – група порівняння (n=20) |
| 51-60 | 15 (13,6 %) | 10 (11,1 %) | 5 (25,0 %) |
| 61-70 | 42 (38,2 %) | 34 (37,8 %) | 8 (40,0 %) |
| 71-80 | 38 (34,6 %) | 33 (36,7 %) | 5 (25,0 %) |
| Понад 80 | 15 (13,6 %) | 13 (14,4 %) | 2 (10,0 %) |
| Середній вік (М±m) | 70,1±0,9 | 70,8±1,0 | 67,1±2,0 |
Примітка. p>0,05 між групами при усіх порівняннях за ТКФ і t-критерієм Стьюдента
Дві третини обстежених пацієнтів складали жінки (69,1 %), в том числі 67,8 % в основній групі і 75,0 % – в групі порівняння (р=0,603) (табл. 2.2). Переважну кількість жінок серед хворих на зазначені кератози можна пояснити більшою їх увагою, в порівнянні з чоловіками, до власного здоров’я та косметичних дефектів на видимих ділянках шкіри, в зв’язку з чим вони частіше звертаються за медичною допомогою.
Таблиця 2.2 – Віко-статева характеристика хворих на кератози
| Стать | Показник | Всі пацієнти (n=110) | АК – основна група (n=90) | СК – група порівняння (n=20) |
| Жіноча | абс. (%) | 76 (69,1 %) | 61 (67,8 %) | 15 (75,0 %) |
| Середній вік (М±m) | 70,3±1,1 | 71,0±1,2 | 67,4±2,2 | |
| Чоловіча | абс. (%) | 34 (30,9 %) | 29 (32,2 %) | 5 (25,0 %) |
| Середній вік (М±m) | 69,6±1,6 | 70,2±1,6 | 66,0±4,8 |
Примітка. p>0,05 між групами при усіх порівняннях за ТКФ і t-критерієм Стьюдента
Враховуючи особливості життя людей, пов’язаних з часом перебування на сонці, одним з врахованих факторів, що впливає на розвиток і перебіг захворювання, було місце постійного проживання хворих (міська чи сільська місцевість). Частка сільських мешканців серед хворих на АК і СК складала 41,1 % (37 пацієнтів) і 25,0 % (5 пацієнтів), відповідно (р=0,212 між групами) (рис. 2.1). Той факт, що серед пацієнтів з кератозами переважають жителі міст, можна пояснити їх більшою поінформованістю про необхідність діагностики новоутворень на шкірі і більшою доступністю жителів міст до спеціалізованої медичної допомоги.
Слід зазначити, що виділені групи хворих на АК і СК були статистично порівняними за віком, статтю і місцем проживання пацієнтів (р>0,05), що дозволило провести коректне порівняння клінічних і морфологічних особливостей розвитку і перебігу даних дерматозів.
Відповідно до мети і задач проведеного дослідження, усі хворі на АК були рандомізовані на дві групи залежно від методики лікування. 1-а група (основна): хворі на АК (58 осіб), лікування котрим було проведено комбінованою послідовною терапією; 2-а група (порівняння ): хворі на АК (32 особи), котрим проведено кріодеструкцію рідким азотом (методика монотерапії).
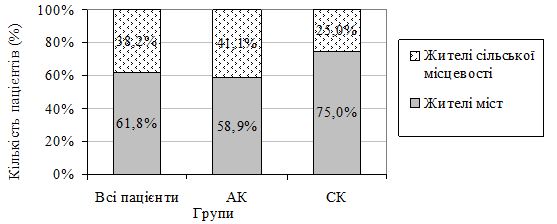 Рисунок 2.1 – Розподіл обстежених хворих за місцем
Рисунок 2.1 – Розподіл обстежених хворих за місцем
постійного проживання
Обидві терапевтичні групи були статистично спіставними (p>0,05) за віком, статтю і місцем проживання пацієнтів (табл. 2.3), а також за клінічними формами АК, ступенем важкості клінічних проявів захворювання, фототипами шкіри (див. розділ 5), що дозволило порівнювати ефективність обраної схеми терапії.
Таблиця 2.3 – Порівняння виділених терапевтичних груп хворих на АК за віком, статтю і місцем проживання пацієнтів
| Показник | 1-а група (комбінована терапія) (n=58) | 2-а група (монотерапія)
(n=32) |
Значимість різниці між групами (р) | |
| Вік, роки (M±m) | 70,1±1,1 | 71,9±1,8 | 0,367 * | |
| Стать,
абс. (%) |
жіноча | 39 (67,2 %) | 22 (68,8%) | 1,00 |
| чоловіча | 19 (32,8 %) | 10 (31,2 %) | ||
| Місце проживання абс. (%) | місто | 34 (58,6 %) | 19 (59,4 %) | 1,00 |
| сільська місцевість | 24 (41,4 %) | 13 (40,6 %) | ||
Примітка. Рівень значимості різниці показників між групами (р) вказаний за ТКФ і t-критерієм Стьюдента (*)
Для досягнення мети і виконання завдань наукової роботи були використані методи клінічної, інструментальної діагностики, комплекс методів гістологічного, ІГХ, морфометричного досліджень і статистичний аналіз.
2.2 Методи дослідження
2.2.1 Методи клінічного дослідження
Загальний об’єктивний статус пацієнтів оцінювали шляхом короткого терапевтичного обстеження з врахуванням показників загально-клінічних лабораторних аналізів. При обстеженні всіх 110 пацієнтів вивчали скарги, анамнез захворювання і життя.
Діагностично значимими для АК є скарги на свербіж або частіше його відсутність, сухість, почервоніння, шорсткість шкіри, утворення кірочок, кровоточивість.
При вивченні анамнезу враховували дані про давність процесу, його поширеність, перебіг захворювання, динаміку розвитку симптомів АК, наявність рецидивів, їх причину, обсяг попередньої терапії, якщо така проводилась, її ефективність, наявність чи відсутність ускладнень проведеного лікування, наявність імуносупресивних станів, спадковість щодо шкірних захворювань, перенесені онкологічні захворювання; з’ясовували професійний і алергоанамнез, шкідливі звички. Важливим було також виявити у пацієнтів наявність в анамнезі факторів ризику, які зумовлюють схильність до виникнення АК, а саме: перенесену трансплантацію органів з наступною постійною імуносупресивною терапією, вплив шкірних канцерогенів, перенесену фототерапію, наявність тих захворювань чи синдромів, які відносять до факторів ризику щодо АК, зокрема пігментну ксеродерму, синдром Блума, синдром Ротмунда-Томсона, а також рак шкіри в минулому.
Встановлення вищевказаних факторів ризику було б розцінено як критерій виключення пацієнтів із даного наукового дослідження, оскільки діагностика і проведення терапії пацієнтам з АК і супутніми імуносупресивними станами і генетичними синдромами не було метою роботи.
Оцінка локального дерматологічного статусу пацієнтів передбачала:
– визначення фототипу шкіри за класифікацією Фіцпатріка;
– підрахунок осередків АК і визначення їх розмірів;
– встановлення локалізації уражень за зонами: 1 – скальп, 2 – чоло, 3 – ніс, 4 – щоки, 5 – вушні раковини;
– ідентифікацію морфологічних елементів: пляма, папула, ерозія, шкірний ріг;
– визначення кольору осередків АК: нормальний – незмінений колір оточуючої шкіри, рожевий, світло-коричневий; для СК: нормальний, рожевий, коричневий, жовто-коричневий;
– характеристику поверхні шкіри в місцях ураження: гладка, злегка шорстка, шорстка, колюча;
– виявлення маркерів фотоушкодження: сухість, дряблість, зморшкуватість, нерівномірність пігментації, стоншення або атрофія шкіри, телеангіектазії, ефеліди.
Важливість визначення фототипу шкіри полягає в тому, що особи із світлою шкірою, яка легко обгоряє на сонці і схильна до утворення веснянок, особи з русявим або рудим волоссям і світлими очима (1 і 2 фототипи за Фіцпатріком) мають індивідуальну генетичну схильність до АК.
При встановленні клінічного діагнозу АК використовували класифікацію, в якій виділяють наступні клінічні форми дерматозу [47, 55]:
- гіпертрофічний (вогнища досить товсті, основа гіперемована, поширюється за межі гіперкератозу; лусочки на поверхні товсті, білі або жовто- коричневі;
- проліферативний (вогнища переважно більші 1 см в діаметрі, можуть мати на поверхні мікровиразки);
- шкірний ріг – як варіант гіпертрофічного АК (при ньому наявні на поверхні вирости конічної форми);
- пігментований (нерівномірно пігментовані плями, частіше на фото- ушкодженій шкірі, супроводжується ділянками різноманітного кератотичного лущення; типовий діаметр більше 1,5 см);
- актинічний хейліт (проявляється шорсткістю, лущенням, почервонінням на губах; може проявлятись також біло- сірими бляшками; з часом з’являються тріщинки, звиразкування).
Важкість клінічних проявів встановлювали за класифікацією Olsen. При цьому виділяли три стадії за вираженістю клінічних проявів. При 1 стадії на шкірі з’являється обмежена ділянка гіперемії без чітких контурів, можуть з’являтись також телеангіектазії. При прогресуванні процесу через деякий час вогнища стають більш чітко відмежованими від оточуючої шкіри, на їх поверхні з’являються ніжні прозорі або жовтуваті кірочки, які щільно прилягають до поверхні шкіри. Такі клінічні прояви легше виявляються пальпаторно, ніж візуально. Вказані зміни є характерними для 2 стадії. При подальшому прогресуванні захворювання лусочки стають товстішими, набувають більш інтенсивного жовтого забарвлення. Поступове накопичування лусочок призводить до утворення видимих кератинових структур, іноді – шкірного рогу. Такі прояви є характерними для 3 стадії АК, вони чітко виявляються при клінічному огляді.
Діагностично значимим для діагностики АК є стан оточуючої вогнища ураження шкіри, оскільки частіше прояви АК виявляють на фотоушкодженій шкірі. Тому при обстеженні пацієнтів встановлювали наявність симптомів фотоушкодження (сухість шкіри, лущення, зморшки, дисхромія), а за їх наявністю і вираженістю оцінювали важкість фотоушкодження.
2.2.2 Дерматоскопічний метод дослідження
Довготривало діагностика АК базувалась лише на даних клінічного обстеження, яке і в даний час залишається пріоритетним. Однак, лише клінічне розпізнання не завжди може забезпечити повну верифікацію клінічного діагнозу.
Для удосконалення діагностичних процедур, звуження спектру диференційного діагнозу було застосовано дерматоскопію – сучасну інформативну неінвазивну методику з високими показниками чутливості і специфічності, за допомогою якої покращується візуалізація структур шкіри, розміщених глибше рогового шару, розпізнавання особливостей будови уражень , оцінка патологічних змін в шкірі в цілому.
Дерматоскопічна оцінка патологічних змін на шкірі передбачала виявлення наступних дерматоскопічних ознак, характерних для АК: еритеми, рожевої псевдосітки, лусочок, тонких хвилястих судин, мішенеподібних волосяних фолікулів, виразних фолікулів, білих кругів, сірих ромбовидних структур. Характерними ознаками СК є: міліумподібні кісти, псевдофолікулярні отвори, різкий обрив краю, «з’їдений міллю край», пігментна сітка, судини по типу шпильок, тріщини.
Аналіз дерматоскопічних зображень застосовували і при проведенні пост-лікувального моніторингу.
Дослідження проводили за допомогою дерматоскопу Heine delta 20T (Німеччина), результати дерматоскопії архівували шляхом фотодокументування приладом Canon 450 D (Японія).
2.2.3 Гістологічні та імуногістохімічні методи дослідження
Імуногістологічні та ІГХ дослідження проведенні у ДЗ «Дніпропетровська державна медична академія МОЗ України» на базі Діагностичного центру ТОВ «Аптеки медичної академії» (м. Дніпропетровськ).
З метою виявлення комплексу гістологічних і ІГХ характеристик різних клініко-морфологічних форм та стадій важкості АК, порівняно з СК, для розробки диференціально-діагностичних критеріїв проводили ІГХ дослідження. 1 група: хворі на АК (15 осіб), яким було проведено панч-біопсію з наступним гістологічним та ІГХ дослідженням біоптатів; 2 група – порівняння: хворі на СК (9 осіб), яким теж було проведено панч-біопсію і аналогічні дослідження.
Гістологічний метод дослідження. Отримані при пункційній панч-біопсії шматочки фіксували в 10% розчині нейтрального забуференного формаліну на протязі однієї доби, що дозволяло зберегти антигенні детермінанти для подальшого ІГХ дослідження. Після фіксації матеріал зневоднювали проведенням крізь батарею розчинів етилового спирту з підвищенням концентрації: 70 % – 80 % – 90 % – 96 % – 100 %-1 – 100 %-2. Після зневоднення зразки витримували у суміші 100 % спирт + хлороформ (1:1), у 3 змінах чистого хлороформу, після цього занурювали у двох змінах суміші хлороформу + парафіну (у співвідношенні 1:1). Першу зміну витримували при температурі 37 °С, другу – при температурі 56 °С по 0,5 год. У кінці зразки заливалися парафіном та витримувалися по 1 годині при температурі 56 °С. Потім форми із зразками в парафіні поступово охолоджували при кімнатній температурі протягом 5 хв., при +4 °С – 10 хв., при -20 °С – 10 хв. Поступове охолодження блоків дозволяло уникнути утворення тріщин у парафіні. Парафінові зрізи товщиною 5-6 мкм, отримані на мікротомі Microm HM-340 зі станцією прийому зрізів з температурою води +37 °С, де вони розправлялися. Також використання станції корисне для виготовлення серійних зрізів, що дозволяє порівнювати подібні ділянки при забарвленні гематоксиліном-еозином та різноманітними ІГХ маркерами. Потім зрізи переносили на адгезоване предметне скло та залишали у термостаті при 37 °С протягом 5–10 хвилин.
Після депарафінізації у ксилолі та регідратації у батареї розчину етанолу (100 %-1, 100 %-2, 96 %, 90 %, 80 %, 70 %) зрізи промивалися дистильованою водою та забарвлювалися за допомогою гематоксиліну Майєра 5 хв. (забарвлення ядер) з наступним промиванням у проточній воді з метою диференціювання тканин та розчином еозину протягом 1 хв. (забарвлення цитоплазми) згідно зі стандартним протоколом. Забарвлені зрізи знову дегідратували за вищевказаною схемою та заключали у бальзам або полістирол та накривали покровним склом.
Світлова мікроскопія проводилася за допомогою світлового мікроскопу Zeiss Primo Star з використанням об’єктивів ×10, ×20, ×40 для оцінки якості зразків та ретельного.
ІГХ метод дослідження. Використання цього методу дозволяє виявляти різноманітні білкові молекули, які входять до складу цитоплазматичних мембран, цитоплазми, ядер клітин або міжклітинного простору за допомогою спеціальних моно- і поліклональних антитіл з наступною візуалізацією комплексу протеїн-антитіло вторинними антитілами, які зв’язані з численними молекулами пероксидази.
З парафінових блоків, виготовлених за вищенаведеною методикою, були зроблені зрізи товщиною 4–6 мкм, які були нанесені на спеціально оброблені адгезивні скельця SuperFrost Plus, депарафінозовані відповідно до стандарту. У зв’язку з порушенням антигенних детермінант при фіксації у формаліні проведена теплова індукція епітопного звороту, що допомагало відновити їх структуру та збільшити імуногенність до первинних антитіл. Далі використовували нагрівання в цитратному буфері з слабо кислою реакцією pH=6 в автоклаві (7 хвилин при температурі +1200С).
Відомості про ІГХ маркери (клон, розведення, виробник, країна): маркери проліферації Ki-67 (клон SP6, 1:350, Thermo Scientific, США) та Cyclin D1 (клон SP4, 1:150, Thermo Scientific, США), маркер апоптозу p53 (клон SP5, 1:200, Thermo Scientific, США), маркер ендотелію CD34 (клон Ab-1, 1:600, Thermo Scientific, США), маркер протеолітичної активності MMP-9 (клон RB 9234PO, 1:200, Thermo Scientific, США) і TIMP1 (клон 102D1, 1:100, Thermo Scientific, США). Для кожного маркеру проводилися контрольні дослідження, які дозволяли виключити помилково позитивні і помилково негативні результати.
Зрізи інкубували з первинними антитілами у вологих камерах при температурі 23-26 0С на протязі 30 хвилин. Титр первинних антитіл був підібраний для кожного маркеру. У якості розчинника використаний спеціальний розчин antibody diluent (Thermo Scientific, США). Подальший етап проводився за технологією Thermo Scientific, використовуючи систему візуалізації UltraVision Quanto (Thermo Scientific, США). Вторинні антитіла з приєднаними молекулами пероксидази хрону, наносили на зрізи та інкубували у вологих камерах протягом 30 хвилин з наступним промиванням у ТРИС-буферному розчині протягом 10 хвилин.
Морфометричний метод. Для аналізу цифрових фотографій були отримані зображення за допомогою камери ZEISS Axiocam 105 color на мікроскопі Axio Scope.A1 на збільшенні об’єктиву 10Х. Кожний зразок був ілюстрований зображеннями.
Дослідження включало підрахунок кількості позитивно забарвлених ядер клітин (як відсоток з + міткою на 100 подібних клітин при збільшені х400) [7, 11, 17]; оцінку щільності судин (кількість в 3 гарячих точках при збільшенні х400) та розрахунок діаметрів за мірною сіткою Chalkley (поле 0,041 мм2)) [3]; напівкількісний аналіз інтенсивності цитоплазматичного забарвлення за градаціями (-) – не має реакції, (+/-) – слабка кластерна, (+) – слабка, (++) – помірна [115, 116].
2.3 Статистичні методи дослідження
Статистичний аналіз був проведений за допомогою програм R version 3.4.1 (2017-06-30) – “Single Candle” Copyright (C) 2017; The R Foundation for Statistical Computing Platform: x86_64-w64-mingw32/x64 (64-bit) та EXCEL-2003 (MicroSoft). Основні статистичні характеристики включали: кількість спостережень (n), середню арифметичну (M), стандартну похибку середньої величини (m), стандартне відхилення (SD), 95 % довірчий інтервал для середньої величини (95% СІ), відносні показники, виражені у відсотках. Порівняння статистичних характеристик в різних групах спостереження проводилось для кількісних ознак з використанням критерію Стьюдента (t) і однофакторного дисперсійного аналізу ANOVA, відносних показників – за критерієм відповідності Пірсона (c2) і двостороннім точним критерієм Фішера (ТКФ). Для визначення взаємозв’язку між ознаками виконувався кореляційний аналіз з розрахунком коефіцієнтів рангової кореляції Спірмена (r). Значення p<0,05 було прийнято статистично значущим [19].
РОЗДІЛ 3
КЛІНІКО-АНАМНЕСТИЧНІ ОСОБЛИВОСТІ ПЕРЕБІГУ КЕРАТОЗІВ
3.1 Аналіз скарг, анамнезу і даних об’єктивного обстеження
Під спостереженням перебувало 90 пацієнтів з верифікованим діагнозом АК (основна група), у віці від 52 до 91 року, середній вік – (70,8 ± 1,0) року. Серед обстежених було 29 (32,2 %) чоловіків і 61 (67,8 %) жінка, 53 (58,9 %) мешканців міст і 37 (41,1 %) – жителів сільської місцевості.
Група порівняння складалася з 20 пацієнтів з верифікованим діагнозом СК, у віці від 51 до 81 року, середній вік – (67,1 ± 2,0) року. З них було 5 (25,0 %) чоловіків і 15 (75,0 %) жінок, 15 (75,0 %) і 5 (25,0 %) – жителів міської і сільської місцевості, відповідно. Як було показано у розділі 2, обидві групи були статистично порівняними за соціально-демографічними показниками (p>0,05).
Усі пацієнти з встановленим діагнозом АК (90 осіб – 100 %) скаржилися на висипання на шкірі переважно обличчя або інших ділянок голови та шорсткість шкіри. Сухість шкіри в місцях ураження відзначали 45,6 % хворих, утворення лусочок – 65,6 %; турбували також почервоніння шкіри (73,3 %), свербіж (37,8 %), рідко – кровоточивість (6,7 %) (табл. 3.1). Слід відзначити, що шорсткість шкіри в місцях ураження АК, на яку скаржилися всі (100 %) пацієнти, і котра виявлялась при об’єктивному клінічному обстеженні, є першим проявом АК згідно даних літературних джерел [1, 24, 42, 51, 65]. Цей симптом шорсткої шкіри на ранніх стадіях порівнюють з відчуттям піску на папері, а при наступному прогресуванні – з наждачним папером.
На свербіж частіше скаржилися хворі на АК чоловічої статі – 55,2 % (16 пацієнтів з 29) проти 29,5 % (18 з 61) жінок (р=0,022); на сухість шкіри – пацієнти, які мешкають у сільської місцевості – 62,2 % (23 з 37) проти 34,0 % (18 з 53) жителів міст (р=0,010), та особи старшого віку – 53,4 % (31 з 58) хворих на АК старше 65 років проти 31,3 % (10 з 32) пацієнтів віком до 65 років (р=0,050).
Таблиця 3.1 – Частота основних скарг хворих на кератози при первинному обстеженні
| Скарга | АК – основна група (n=90) | СК – група порівняння (n=20) | Значимість різниці між групами (р) | ||
| Абс | % | абс | % | ||
| Наявність скарг | 90 | 100 | 11 | 55,0 | <0,001 |
| Свербіж | 34 | 37,8 | 6 | 30,0 | 0,612 |
| Сухість шкіри | 41 | 45,6 | 5 | 25,0 | 0,132 |
| Почервоніння | 66 | 73,3 | – | – | <0,001 |
| Шорсткість | 90 | 100 | 4 | 20,0 | <0,001 |
| Утворення кірочок | 59 | 65,6 | 3 | 15,0 | <0,001 |
| Кровоточивість | 6 | 6,7 | – | – | 0,590 |
Примітка. Рівень значимості різниці показників між групами (р) вказаний за ТКФ
На відміну від АК, при СК кількість та спектр скарг були суттєво нижчими (див. табл. 3.1). Зокрема, наявність висипань на шкірі турбувало лише половину хворих на СК (55,0 %), шорсткість і утворення лусочок відзначали 15-20 % пацієнтів, почервоніння шкіри в місцях ураження не спостерігалось в жодному випадку (р<0,001 порівняно з АК).
При вивченні анамнезу звертали увагу на наявність гіперінсоляції в минулому, поінформованість про шкідливість надмірної інсоляції, знання правил перебування на сонці, поінформованість про необхідність застосування СЗЗ, з’ясовували, чи застосовували ці засоби під час перебування на сонці.
На гіперінсоляцію в анамнезі вказали 67 (74,4 %) хворих на АК. З них більшість випадків (40 пацієнтів – 44,4 %) було викликано необхідністю тривалого перебування на сонці у зв’язку з родом діяльності/ професією, в інших випадках – під час дозвілля/ відпочинку (27 – 30,0 %).
Встановлена пряма асоціація надмірної інсоляції, пов’язаної з родом діяльності, у жителів сільської місцевості порівняно з мешканцями міст (коефіцієнт рангової кореляції Спірмена r=+0,43; p<0,001), а також в осіб більш старшого віку (r=+0,35; p<0,001). Навпроти, гіперінсоляція, отримана під час дозвілля/ відпочинку, була більш характерною для жителів міст (r=+0,30; p=0,004) та молодших пацієнтів (r=-0,32; p=0,002). Так, мешканці сільської місцевості в 2,7 разу частіше ніж жителі міст перебувають на відкритому повітрі і піддаються надмірної інсоляції – 70,3 % проти 26,4 %; р<0,001 (табл. 3.2).
Таблиця 3.2 – Характеристика випадків гіперінсоляції в анамнезі у хворих на АК, абс. (%) або (М±m)
| Показник | Гіперінсоляція отримана | ||
| у зв’язку з родом діяльності/ професією | під час дозвілля/ відпочинку | ||
| Місце проживання | місто (n=53) | 14 (26,4 %) | 22 (41,5 %) |
| село (n=37) | 26 (70,3 %) | 5 (13,5 %) | |
| значимість різниці між групами (р) | <0,001 | 0,005 | |
| Стать | чоловіча (n=29) | 14 (48,3 %) | 9 (31,0 %) |
| жіноча (n=61) | 26 (42,6 %) | 18 (29,5 %) | |
| значимість різниці між групами (р) | 0,655 | 1,00 | |
| Середній вік пацієнтів, роки | випадків гіперінсоляції
не було |
68,0±1,1 | 72,6±1,2 |
| були випадки гіперінсоля-ції в анамнезі | 74,2±1,5 | 66,4±1,4 | |
| значимість різниці між групами (р) | <0,001 * | 0,003 * | |
Примітка. * – Рівень значимості різниці показників між групами (р) вказаний за ТКФ і t‑критерієм Стьюдента
Передбачуваною виявилась низька обізнаність пацієнтів з АК щодо шкідливості гіперінсоляції (20 осіб – 32,2 %), знання правил перебування на сонці (12 – 13,3 %) та необхідності фотозахисту (26 – 28,9 %). Нижчими виявились серед жителів сільської місцевості порівняно з мешканцями міст: поінформованість щодо шкідливості гіперінсоляції – 21,6 % пацієнтів проти 39,6 % (р=0,108), щодо правил перебування на сонці – 2,7 % проти 20,8 % (р=0,013), щодо фотозахисту – 16,2 % проти 37,7 % (р=0,034).
Жодний із пацієнтів не наносив ССЗ, згідно правил, через кожних 3 години, 4,4 % (4 пацієнти) наносили їх зрідка, в сонячні дні, 30,0 % (27 пацієнтів) застосовували під час відпочинку. При зборі анамнезу проводили опитування про те, чи застосовували пацієнти з метою зволоження шкіри емолієнти. Виявлено, що щоденно їх наносили на суху шкіру лише 2,2 % пацієнтів, зрідка – 22,3 %.
Даних про онкопатологію шкіри в минулому, імуносупресію, про вплив канцерогенів у хворих на АК не виявлено в жодному випадку. У обстежених пацієнтів не було проявів алергії в минулому, в т.ч. на вплив UV.
У комплекс клінічного дерматологічного обстеження шкіри було включено: визначення фототипу шкіри, наявність маркерів фотоушкодження на прилягаючих до осередків ділянках шкіри обличчя, підрахунок кількості осередків АК, вимірювання їх розмірів у мм, локалізацію, колір, характеристику поверхні ураженої шкіри, ідентифікацію первинних морфологічних елементів.
Така система показників для діагностики АК була складена за даними зарубіжних літературних джерел, а також Європейських і британських протоколів, в яких є опис клінічних проявів АК [51, 65, 130].
При дослідженні структури хворих на кератози в залежності від фототипу шкіри (за Фітцпатриком) встановлено, що більшість з них (70,9 %) мали ІІ тип фоточутливості шкіри (78 хворих з 110), в тому числі 66 (73,3 %) хворих на АК і 12 (60,0 %) пацієнтів з СК (р=0,279) (табл. 3.3). Кількість пацієнтів з І фототипом шкіри була вищою у групі порівняння – 5 (25,0 %) пацієнтів з СК проти 3 (3,3 %) хворих на АК (р=0,005). При цьому, не дивлячись на те, що люди з І фототипом є більш вразливими до впливу UV, вікові коливання у пацієнтів з АК з І-ІІІ фототипами за даними дослідження виявилися несуттєвими (р=0,939 за дисперсійним аналізом ANOVA). Однак, той факт, що у дослідженні з І фототипом шкіри було лише 3 пацієнти з АК, віком 53, 76 і 87 років, не дозволяє висновок вважати достовірним. Водночас, при СК встановлена вірогідна асоціація фоточутливості шкіри з віком (r=+0,64; p=0,002).
Таблиця 3.3 – Розподіл хворих на кератози за фототипом шкіри (за Фітцпатриком), абс. (%) або (М±m)
| Фото-тип шкіри | Показник | АК – основна група (n=90) | СК – група порівняння (n=20) | Значимість різниці між групами (р) |
| І | Кількість пацієнтів | 3 (3,3 %) | 5 (25,0 %) | 0,005 |
| Середній вік | 72,0±10,0 | 58,0±2,6 | 0,135 * | |
| ІІ | Кількість пацієнтів | 66 (73,3 %) | 12 (60,0 %) | 0,279 |
| Середній вік | 70,7±1,1 | 69,2±2,3 | 0,587 * | |
| ІІІ | Кількість пацієнтів | 21 (23,3 %) | 3 (15,0 %) | 0,556 |
| Середній вік | 71,3±2,0 | 74,0±4,4 | 0,627 * |
Примітка. * – рівень значимості різниці показників між групами (р) вказаний за ТКФ і t-критерієм Стьюдента
Дослідження показало, що від фототипу шкіри у хворих на АК залежить вираженість скарг (рис. 3.1), зокрема таких як свербіж (r = –0,24; p=0,022) і почервоніння шкіри в місцях ураження (r = –0,56; p<0,001). Так, скарги на свербіж відзначали 44,9 % пацієнтів з І-ІІ фототипом шкіри (31 пацієнт з 69) і лише 14,3 % осіб з ІІІ фототипом (р=0,011 за ТКФ), а скарги на почервоніння шкіри – 88,4 % і 23,8 % пацієнтів, відповідно (р<0,001).
Маркери фотоушкодження (сухість, дряблість, зморшкуватість, нерівномірність пігментації, стоншення або атрофія шкіри, телеангіектазії, ефеліди) виявлено у 57 пацієнтів з кератозами (51,8 %). Причому при АК зазначені ознаки виявлялись майже втричі частіше ніж у пацієнтів з СК – 58,9 % (53 пацієнти) проти 20,0 % (4 пацієнти) при р=0,002, і вірогідно асоціювались з надмірною інсоляцією в минулому (r = +0,44; p<0,001). Серед пацієнтів з І фототипом шкіри частка з виявленими маркерами фотоушкодження склала 66,7 % (2 пацієнти), з ІІ фототипом – 63,6 % (42 пацієнти), з ІІІ фототипом – 42,9 % (9 пацієнтів). Тобто відзначена тенденція до зменшення частоти фотоушкодження шкіри у пацієнтів з ІІІ типом фоточутливості порівняно з І-ІІ типами (р=0,128).
Примітка. * – p<0,05; ** – p<0,001 порівняно з І-ІІ фототипом шкіри. Рисунок 3.1 – Співвідношення скарг у хворих на АК з різними фототипами шкіри
При клінічному обстеженні хворих на АК звертали увагу на розміри і кількість вогнищ на шкірі обличчя. Кількість їх коливалась від 1 до 5, в середньому – 2,11 ± 0,11 (медіана – 2). Пацієнтів із більшою кількістю вогнищ АК ми не включали у дослідження, оскільки такі випадки розцінювали як «поля канцеризації», а діагностика і лікування пацієнтів з наявними полями канцеризації не були метою роботи. У найбільшої частини пацієнтів було виявлено два (43 пацієнти – 47,8 %) або одне (25 – 27,8 %) вогнище ураження, що можна оцінювати як показник раннього звернення пацієнтів за медичною допомогою до дерматолога у нашому регіоні. Розміри вогнищ коливались від 2 мм до 15 мм, середній розмір усіх осередків – (6,19 ± 0,23) мм (медіана – 6 мм).
За даними кореляційного аналізу встановлено, що збільшення кількості вогнищ ураження АК на шкірі обличчя асоціювалось з різними проявами фотоушкодження шкіри (r=+0,24; p=0,024), ІІІ фототипом шкіри (r=+0,21; p=0,050) та надмірною інсоляцією в минулому (r=+0,25; p=0,022). Так, середня кількість вогнищ ураження склала 2,28 ± 0,14 при наявності маркерів фотоушкодження на прилеглих до вогнищ ділянках шкіри обличчя і (1,86 ± 0,16) осередків – при відсутності таких ознак (р=0,050 за t-критерієм); (2,48 ± 0,22) і (1,98 ± 0,12) вогнищ при ІІ і ІІІ типах фоточутливості шкіри, відповідно (р=0,050); (2,34 ± 0,16) вогнищ ураження шкіри обличчя за умови тривалого перебування на сонці в анамнезі проти 1,92 ± 0,14 кератом при відсутності цього чинника ризику (р=0,049).
Враховуючи діагностичну і лікувальну значимість локалізації вогнищ при АК, цим ознакам також приділяли увагу. В усіх досліджуваних пацієнтів прояви АК локалізувались на шкірі голови, яку умовно поділяли на 5 зон: 1 – скальп; 2 – чоло; 3 – ніс; 4 – щоки; 5 – вушні раковини.
Найчастішою локалізацією уражень в загальній когорті пацієнтів з АК були щоки (71 пацієнт – 78,9 %), шкіра носа (46 – 51,1 %) і чола (22 – 24,4 %). У незначного відсотку пацієнтів виявлено вогнища АК на шкірі скальпу (5,6 %) і вушних раковин (4,4 %). Не встановлено переважаючої локалізації вогнища ураження залежно від статі пацієнтів. Проте, локалізація уражень на скальпі у чоловіків виявлена у 13,8 % випадків (4 пацієнти), у жінок – 1,6 % (1 випадок) при р=0,036; на вушних раковинах – у 13,8 %, у жінок – жодного випадку (р=0,009), що, ймовірно, пов’язано з більшою відкритістю зазначених зон голови у чоловіків порівняно з жінками.
Ідентифікація морфологічних елементів в ділянках ураження в обстежених хворих показала їх різноманітність при АК – папула (57,8 % випадків), пляма (54,4 %), ерозія (10,0 %), шкірний ріг (7,8 %), і переважання папул – при СК (75,0 %). Ще в 25,0 % випадків себорейні кератоми мали плямистий вигляд (р=0,025 порівняно з АК).
Колір шкіри у вогнищах ураження АК у більшості випадків був рожевим (65,6 %), у третині випадків – світло-коричневим (31,1 %), в 14,4 % випадків – незміненим (колір нормальної шкіри) (рис. 3.2). При СК більшість кератом мали коричневий колір (75,0 %), в інших випадках – жовто-коричневий (25,0 %) (рис. 3.3).
Відзначено взаємозв’язок вищезазначених характеристик вогнищ ураження АК (морфологічний елемент, колір) з фототипом шкіри. У пацієнтів з ІІІ фототипом основним морфологічним елементом були плями (95,2 %) та світло-коричневий колір поверхні кератоми (100,0 %), з ІІ фототипом – папули (68,2 %) та переважно рожевий колір вогнища ураження (81,8 %). Ерозію виявили лише у 8 (12,1 %) пацієнтів з ІІ фототипом шкіри і одного пацієнта з І типом.
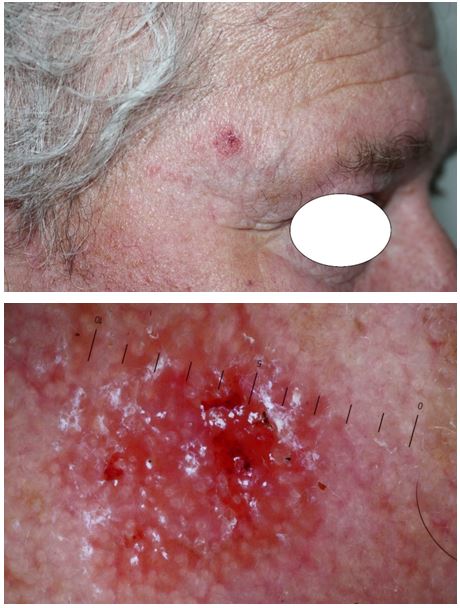 Примітка. Вогнище ураження у формі папули рожевого кольору, круглої форми, з відносно чіткими межами, розмірами 1 см локалізується на відкритій ділянці шкірного покриву – на шкірі чола; на поверхні папули є тонкі лусочки. Дерматоскопічна картина: еритема, рожева псевдосітка, мішенеподібні фолікули.
Примітка. Вогнище ураження у формі папули рожевого кольору, круглої форми, з відносно чіткими межами, розмірами 1 см локалізується на відкритій ділянці шкірного покриву – на шкірі чола; на поверхні папули є тонкі лусочки. Дерматоскопічна картина: еритема, рожева псевдосітка, мішенеподібні фолікули.
Рисунок 3.2 – Пацієнт А., 76 років. АК, проліферативний варіант
Примітка. Ущільнена папула, чітко відмежована від здорової шкіри, коричневого кольору, має бородавчастий вигляд. Дерматоскопічна картина: гомогенна пігментація, чітка межа по периметру, чисельні оранжеві глибки, комедоноподібні отвори, міліумподібні кісти, товсті зігнуті лінії.
Рисунок 3.3 – Пацієнт Б., 78 років. СК
Поверхня шкіри у вогнищах ураження АК і СК при пальпації переважно була шорсткою – 64,4 % і 65,0 % випадків (р=1,00 між групами). Злегка шорстка поверхня ураженої шкіри визначалась у 28,9 % і 35,0 % пацієнтів, відповідно (р=0,598). Колюча поверхня кератоми була характерною тільки для АК – 23,3 % випадків (р=0,012).
Таким чином, основними клінічними ознаками, що відрізняють АК від СК, є: почервоніння і шорсткість вогнища ураження з утворенням кірочок, колюча поверхня шкіри при пальпації, наявність маркерів фотоушкодження на прилягаючих до вогнищ ділянках шкіри, рожевий або світло-коричневий колір вогнища, різноманітність морфологічних елементів (табл. 3.4).
Таблиця 3.4 – Основні клінічні ознаки диференційної діагностики АК і СК
| Показник | АК | СК | |
| Скарги | – почервоніння | часто (73,3 %) | – |
| – шорсткість | дуже часто (100 %) | рідко (20,0 %) | |
| – утворення кірочок | часто (65,6 %) | рідко (15,0 %) | |
| Маркери фотоушкодження шкіри | часто (58,9 %) | рідко (20,0 %) | |
| Морфологічний елемент | папула (57,8 %),
пляма (54,4 %), ерозія (10,0 %) |
переважно папула (75,0 %) | |
| Колір вогнища | рожевий (65,6 %),
світло-коричневий (31,1 %), незмінений колір шкіри (14,4 %) |
коричневий (75,0 %),
жовто-коричневий (25,0 %) |
|
| Поверхня шкіри при пальпації | – колюча | відзначається (23,3 %) | – |
3.2 Особливості клінічних проявів у пацієнтів з різними клінічними варіантами та ступенями важкості актинічного кератозу
Принцип встановлення діагнозу АК передбачав визначення клінічного варіанту і ступеню важкості перебігу захворювання, що згідно класифікації відповідає стадійності розвитку АК, відповідно до сучасних клінічних класифікацій [55].
Класифікація АК по локалізації активного процесу в епідермісі і дермі дозволила виділити наступні клінічні варіанти кератозу: проліферативний, пігментний, гіпертрофічний, шкірний ріг (як різновид гіпертрофічного) (рис. 3.4).
Рисунок 3.4 – Розподіл хворих за клінічними варіантами АК
Основні характеристики клінічних варіантів АК наведені на рис. 3.5–3.7.
Примітка. * – p<0,001 порівняно з пігментним варіантом; ǂ – p<0,05 порівняно з проліферативним варіантом АК.
Рисунок 3.5 – Морфологічні елементи вогнища ураження
при різних клінічних варіантах АК
В обстежених пацієнтів найчастіше діагностували проліферативний АК – 59 (65,6 %) пацієнтів, який переважно характеризувався плоскими, шорсткими папулами (67,8 %), з середніми розмірами 6,30 ± 0,28 мм, з лусочками на поверхні, гіперемією в основі папул, рожевого кольору (81,4 %) (рис. 3.8).
Примітка. * – p<0,001 порівняно з пігментним варіантом АК.
Рисунок 3.6 – Оцінка кольору поверхні вогнищ при різних
клінічних варіантах АК
Примітка. * – p<0,001 порівняно з пігментним варіантом; ǂ – p<0,01 порівняно з проліферативним варіантом АК.
Рисунок 3.7 – Характер поверхні шкіри у вогнищах ураження
при різних клінічних варіантах АК
У 23 (25,5 %) пацієнтів встановлено пігментний варіант АК, для якого властивими були переважно плямисті ураження (100,0 %), розміром 6,08 ± 0,43 мм, з шорсткою поверхнею (78,3 %), світло-коричневого кольору (100,0 %) (рис. 3.9).
Примітка. Процес локалізується на відкритій ділянці шкірного покриву – на шкірі носа. Це пляма рожевого кольору, округлої форми , розмірами 1 см, з нечіткими межами, з телеангіектазіями на поверхні і лусочками. На шкірі інших ділянок обличчя обличчя є глибокі статичні зморшки. Дані дерматоскопії: наявна еритема – рожева псевдосітка, лусочки, тонкі хвилясті судини, мішенеподібні волосяні фолікули.
Рисунок 3.8 – Пацієнтка Б., 66 років. АК, проліферативний варіант
Гіпертрофічний варіант АК діагностували лише у 7 (7,8 %) досліджених пацієнтів. В усіх пацієнтів з гіпертрофічним варіантом були виявлені товсті папули рожевого кольору або еритематозні, вкриті лусочками або кірками, з часто шорсткою і колючою поверхнею (85,7 %) (рис. 3.10). Середній розмір осередків (5,36 ± 0,82) мм.
Примітка. Вогнище АК у формі плями коричневого кольору локалізується на відкритій ділянці шкірного покриву – на шкірі носа; без чітких контурів. Дані дерматоскопії: наявні сірі ромбовидні структури, виразні фолікули.
Рисунок 3.9 – Пацієнт В., 70 років. АК, пігментний варіант
У одного пацієнта виявлено шкірний ріг, розміром 12 мм, який розглядається як особливий реактивний стан, що є різновидом гіпертрофічного АК. Він характеризувався як конічний гіпертрофічний виступ, що значно підвищується на еритематозній чи кольору шкіри папульозній основі (рис. 3.11).
Примітка. Вогнище АК у формі товстої шорсткої папули рожевого кольору, розмірами 1,2*1,5 см, локалізується на відкритій ділянці шкірного покриву – на шкірі носа; на поверхні папули є нашарування товстих лусочок і кірочок, в основі папули – гіперемія, інфільтрація. Дані дерматоскопії: наявна еритема, виразні фолікули, лусочки.
Рисунок 3.10 – Пацієнтка Г., 85 років. Д-з: АК, гіпертрофічний варіант
Таким чином, для проліферативного і гіпертрофічного варіантів АК характерними були папули у більшості випадків з рожевим кольором поверхні, для пігментного – плями світло-коричневого кольору (р<0,001).
Рисунок 3.11 – Пацієнтка Д., 80 років, з 2 фототипом АК, гіпертрофічний варіант. Шкірний ріг
Не відмічено вірогідних відмінностей щодо локалізації уражень при різних клінічних варіантах АК, а також зв’язку між перебігом активного процесу в епідермісі і дермі та соціально-демографічними характеристиками хворих (статтю, віком, місцем проживання пацієнтів). Водночас, встановлено взаємозв’язок між різними клінічними варіантами АК і фототипом шкіри, наявністю маркерів фотоушкодження та вираженістю скарг.
Як свідчать дані табл. 3.5, проліферативний і гіпертрофічний варіанти АК вірогідно частіше (р<0,001) виявлялись у осіб з ІІ типом фоточутливості шкіри (93,2 % і 100,0 %), в той час як пігментний варіант – з ІІІ фототипом (87,0 %). Частота виявлення характерних проявів фотоушкодження на прилеглих до вогнищ ділянках шкіри обличчя була найменшою при пігментному АК (39,1 %) і найбільшою – при гіпертрофічному варіанті (85,7 %) при р<0,05.
Таблиця 3.5 – Співвідношення фототипів і маркерів фотоушкодження шкіри з різними клінічними варіантами АК
| Показник | Пігментний (n=23) | Проліферативний (n=59) | Гіпертрофічний (n=7) | ||||
| абс. | % | абс. | % | абс. | % | ||
| Фототип шкіри | І | – | – | 3 | 5,1 | – | – |
| ІІ | 3 | 13,0 | 55 | 93,2** | 7 | 100,0** | |
| ІІІ | 20 | 87,0 | 1 | 1,7** | – | –** | |
| Наявність маркерів фотоушкодження шкіри | 9 | 39,1 | 37 | 62,7 | 6 | 85,7* | |
Примітка. * – p<0,05; ** – p<0,001 порівняно з пігментним варіантом АК.
За результатами опитування з’ясовано, що на свербіж скаржились всі пацієнти з гіпертрофічною формою АК (100,0 %), 40,7 % хворих з проліферативним варіантом захворювання і менше 10 % пацієнтів з пігментним АК (табл. 3.6). Почервоніння шкіри також було характерною ознакою проліферативного (93,2 %) і гіпертрофічного (71,4 %) варіантів АК. Відмінності між частотою скарг на сухість шкіри і утворення кірочок між різними клінічними варіантами АК були статистично незначними (p>0,05).
Середня кількість вогнищ ураження при різних клінічних варіантах АК була статистично порівняною – (2,30 ± 0,22) вогнищ при пігментній формі, 2,02 ±0,12 – при проліферативній і 2,43 ± 0,57 – при гіпертрофічній АК (р=0,374 між групами за ANOVA). Середні розміри виявлених утворень також відповідали вищезазначеним тенденціям у загальній когорті пацієнтів (близько 6 мм) без вірогідних відмінностей між різними варіантами АК (р=0,857 за ANOVA).
Таблиця 3.6 – Частота вираженості скарг при різних клінічних варіантах АК
| Скарги | Пігментний (n=23) | Проліфера-тивний (n=59) | Гіпертрофіч-ний (n=7) | Значимість різниці між групами в цілому(р) | |||
| абс. | % | абс. | % | абс. | % | ||
| Свербіж | 2 | 8,7 | 24 | 40,7 | 7 | 100,0 | <0,001 |
| Сухість | 7 | 30,4 | 29 | 49,2 | 4 | 57,1 | 0,247 |
| Почервоніння | 5 | 21,7 | 55 | 93,2 | 5 | 71,4 | <0,001 |
| Утворення кірочок | 14 | 60,9 | 37 | 62,7 | 7 | 100,0 | 0,130 |
| Кровоточи-вість | – | – | 6 | 10,2 | – | – | 0,195 |
Примітка. Рівень значимості різниці показників між групами (р) вказаний за критерієм χ2 Пірсона
Важливе значення для діагностики і лікування АК має оцінка ступеню важкості захворювання. І ступінь тяжкості встановлювали пацієнтам з мінімально вираженими симптомами АК: ледь відчутною шорсткістю і гіперемією, ніжними тонкими лусочками на поверхні цих змін. ІІ ступеню тяжкості відповідали вогнища потовщеної шкіри, тонкі папули, легко відчутні при пальпації, на помірно вираженій гіперемованій шкірі, з шаром лусочок на поверхні. У пацієнтів з встановленим ІІІ ступенем тяжкості виявляли товсті гіперкератотичні вогнища, чітко видимі при огляді і пальпації, з лусочко-кірками на їх поверхні. При визначенні ступеню важкості враховували також дерматоскопічні ознаки патологічних змін шкіри, оцінка яких подана в підрозділі 3.3.
Серед 90 хворих на АК І ступінь тяжкості встановлено у 23 (25,5 %) пацієнтів, ІІ ступінь – у 41 (45,6 %), ІІІ ступінь тяжкості – у 26 (28,9 %) пацієнтів (рис. 3.12).
За результатами оцінки ступеня важкості АК залежно від соціально-демографічних характеристик пацієнтів встановлено, що у пацієнтів жіночої статі частіше виявляли АК ІІ ступеня тяжкості (52,5 %), а у чоловіків – ІІІ ступеня (табл. 3.7). АК І ступеня тяжкості діагностували однаково часто – у 24,1 % чоловіків і 26,2 % жінок (р=1,00).
Рисунок 3.12 – Розподіл хворих на АК за ступенем тяжкості
перебігу захворювання
Таблиця 3.7 – Розподіл пацієнтів з АК залежно від статі, місця проживання і ступеню важкості захворювання, абс. (%)
| Ступінь важкості АК | Стать | Значимість
різниці між групами (р) |
Місце проживання | Значимість
різниці між групами (р) |
||
| чоловіча (n=29) | жіноча (n=61) | місто (n=53) | сіло (n=37) | |||
| І | 7 (24,2%) | 16 (26,2%) | 1,00 | 16 (30,2%) | 7 (18,9%) | 0,326 |
| ІІ | 9 (31,0%) | 32 (52,5%) | 0,072 | 23 (43,4%) | 18 (48,6%) | 0,671 |
| ІІІ | 13 (44,8%) | 13 (21,3%) | 0,027 | 14 (26,4%) | 12 (32,4%) | 0,638 |
Примітка. Рівень значимості різниці показників між групами (р) вказаний за ТКФ
Вірогідного зв’язку між важкістю захворювання і місцем проживання пацієнтів не виявлено (p>0,05). Проте у пацієнтів більш старшого віку перебіг АК був важчим: середній вік пацієнтів з ІІІ ступенем важкості АК складав (74,6 ± 1,9) років, з ІІ ступенем – (69,4 ± 1,2) роки, з І ступенем – (69,1 ± 1,8) років (р=0,020 і р=0,046 порівняно з ІІІ ступенем) (рис. 3.13).
Результати досліджень показали відсутність вірогідного зв’язку між важкістю АК і кількістю утворень, їх розміром та локалізацією уражень. Важкий перебіг захворювання здебільшого визначався тривалою кумулятивною дією UV на ділянки шкіри, що піддаються інсоляції (коефіцієнт кореляції r=+0,32; p=0,002), наявністю характерних маркерів фотоушкодження шкіри (r=+0,22; p=0,034), а також при гіпертрофічній формі АК (r=+0,33; p=0,002).
Рисунок 3.13 – Середній вік хворих на АК при різних ступенях
тяжкості захворювання
Як видно з таблиці 3.8, кумулятивне тривале перебування на сонці в 2,7 разу збільшує відносний ризик важкого перебігу АК (ІІІ ступінь) порівняно з відсутністю випадків надмірної інсоляції в минулому – 43,9 % випадків проти 16,3 % (р=0,005).
Таблиця 3.8 – Співвідношення між ступенем важкості АК і показниками надмірної дії УФ, абс. (%)
| Ступінь важкості АК | Гіперінсоляція в анамнезі | Значимість
різниці між групами (р) |
Маркери фотоушкод-ження шкіри | Значимість
різниці між групами (р) |
||
| немає (n=49) | є (n=41) | немає (n=37) | є (n=53) | |||
| І | 17 (34,7%) | 6 (14,6%) | 0,051 | 11 (29,7%) | 12 (22,6%) | 0,471 |
| ІІ | 24 (49,0%) | 17 (41,5%) | 0,528 | 21 (56,8%) | 20 (37,7%) | 0,088 |
| ІІІ | 8 (16,3%) | 18 (43,9%) | 0,005 | 5 (13,5%) | 21 (39,6%) | 0,009 |
Примітка. Рівень значимості різниці показників між групами (р) вказаний за ТКФ
За наявності проявів фотоушкодження шкіри відсоток хворих з ІІІ ступенем важкості АК в 2,9 разу перевищує рівень, якщо зазначені ознаки фотоушкодження відсутні – 39,6 % проти 13,5 % випадків (р=0,009).
Аналіз показників ступеню важкості АК при різних клінічних варіантах захворювання показав, що для пігментної форми АК характерним є ІІ ступінь важкості (73,9 %), для гіпертрофічної – ІІІ ступінь (85,7 %). При проліферативному АК різний ступінь важкості захворювання верифікували майже з однаковою частотою (рис. 3.14).
Примітка. * – p<0,05; ** – p<0,01 порівняно з пігментним варіантом; ǂ – p<0,01 порівняно з проліферативним варіантом АК.
Рисунок 3.14 – Співвідношення між ступенем важкості і клінічними варіантами АК
Таким чином, аналіз скарг, анамнезу життя та об’єктивних ознак ураження шкіри свідчить, що ступінь патологічних зрушень при АК визначається як індивідуальними особливостями людини (літній і старечий вік, чоловіча стать, хронічна надмірна інсоляція, І-ІІ фототип шкіри), так і прогресуванням захворювання.
3.3 Результати дерматоскопічного дослідження морфологічних змін
у шкірі у хворих на кератози
Дерматоскопія була включена в діагностичний алгоритм АК як сучасний неінвазивний високочутливий і високоспецифічний метод діагностики при АК. Чутливість і специфічність його сягає 95-98 %. Для оцінки дерматоскопічної картини було обрано комплекс патернів, які за літературними даними є найбільш характерними для АК: еритема/псевдосітка, лусочки, тонкі хвилясті судини, мішенеподібні волосяні фолікули, виразні фолікули, білі круги, сірі ромбовидні структури.
Проведено аналіз дерматоскопічних даних у загальній когорті пацієнтів, а також порівняльний аналіз в залежності від клінічного варіанту АК, ступеню важкості, фототипу шкіри, статі. У обстежених пацієнтів найчастіше виявляли лусочки (77,8 %), мішенеподібні фолікули (74,4 %), тонкі хвилясті судини (67,8 %) і еритеми/ псевдосітку (65,6 %) (табл. 3.9). Виразні фолікули діагностували у 47,8 % пацієнтів. Рідше виявляли білі круги (32,2 %) і сірі ромбовидні структури (25,6 %).
Таблиця 3.9 – Порівняльні дані дерматоскопій у пацієнтів з І-ІІІ ступенями важкості АК, абс. (%)
| Дерматоско-пічна ознака | Всі пацієнти (n=90) | Ступінь важкості АК | Значимість
різниці між групами (р) |
||
| І (n=23) | ІІ (n=41) | ІІІ (n=26) | |||
| Еритема /псевдосітка | 59 (65,6%) | 22 (95,7%) | 23 (56,1%) | 14 (53,8%) | 0,002 |
| Лусочки | 70 (77,8%) | 20 (87,0%) | 26 (63,4%) | 24 (92,3%) | 0,010 |
| Тонкі хвилясті судини | 61 (67,8%) | 21 (91,3%) | 23 (56,1%) | 17 (65,4%) | 0,015 |
| Мішенеподібні фолікули | 67 (74,4%) | 5 (21,7%) | 36 (87,8%) | 26 (100%) | <0,001 |
| Виразні фолікули | 43 (47,8%) | 2 (8,7%) | 20 (48,8%) | 21 (80,8%) | <0,001 |
| Білі круги | 29 (32,2%) | 1 (4,3%) | 19 (46,3%) | 9 (34,6%) | 0,002 |
| Сірі ромбовид-ні структури | 23 (25,6%) | 2 (8,7%) | 17 (41,5%) | 4 (15,4%) | 0,006 |
Примітка. Рівень значимості різниці показників між групами (р) вказаний за критерієм χ2 Пірсона
Як видно з даних табл. 3.9, простежується досить чітка асоціація виявлених дерматоскопічних ознак патологічних змін шкіри зі ступенем важкості АК. Так, майже в усіх вогнищах ураження АК І ступеню важкості виявляли еритему/псевдосітку (95,7 %) і тонкі хвилясті судини (91,3 %). Частим було виявлення лусочок (87,0 %), лише у 21,7 % випадків виявлено мішенеподібні фолікули. Випадки виявлення виразних фолікулів, сірих ромбовидних структур або білих кругів були поодинокими (1–2).
При ІІ ступені важкості АК найчастішою дерматоскопічною ознакою були мішенеподібні фолікули (87,8 %). У понад половини випадків виявили лусочки (63,4 %), еритему/рожеву псевдосітку (56,1 %) і тонкі хвилясті судини (56,1 %). Виразні фолікули, білі круги і сірі ромбовидні структури визначались від 40 до 50 % випадків.
В усіх 100 % пацієнтів з встановленим АК ІІІ ступеню важкості було виявлено мішенеподібні фолікули, у 92,3 % – лусочки. Виразні фолікули були у 80,8 % пацієнтів, тонкі хвилясті судини – у 65,4 %, еритема/псевдосітка – у 53,8 %. Рідше (у 34,6 %) виявлені білі круги і ще рідше (15,4 %) – сірі ромбовидні структури.
Отже, за результатами проведених дерматоскопічних досліджень, встановлено, що характерним для АК І ступеня є 3 дерматоскопічні ознаки: еритема/псевдосітка, тонкі хвилясті судини і лусочки. Для АК ІІ ступеня важкості характернішими виявились мішенеподібні фолікули і лусочки. Для АК ІІІ ступеню важкості характерними є мішенеподібні фолікули, лусочки і виразні фолікули.
Отримані результати проведеної дерматоскопії пацієнтам з різними клінічними варіантами АК (табл. 3.10) дали підстави зробити висновки, для що пігментного АК характерними є виразні фолікули, сірі ромбовидні структури, мішенеподібні фолікули і білі круги (рис. 3.9).
Для проліферативного варіанту характерними виявились еритема/рожева псевдосітка, лусочки і тонкі хвилясті судини (табл. 3.10, рис. 3.8).
Таблиця 3.10 – Порівняльні дані дерматоскопій клінічних варіантів АК, абс. (%)
| Дерматоскопічна ознака | Клінічний варіант АК | Значимість
різниці між групами (р) |
||
| Пігментний (n=23) | Проліфера-тивний (n=59) | Гіпертрофіч-ний (n=7) | ||
| Еритема /псевдосітка | 1 (4,3%) | 56 (94,9%) | 2 (28,6%) | <0,001 |
| Лусочки | 6 (26,1%) | 56 (94,9%) | 7 (100%) | <0,001 |
| Тонкі хвилясті судини | 2 (8,7%) | 55 (93,2%) | 3 (42,9%) | <0,001 |
| Мішенеподібні фолікули | 21 (91,3%) | 38 (64,4%) | 7 (100%) | 0,012 |
| Виразні фолікули | 23 (100%) | 12 (20,3%) | 7 (100%) | <0,001 |
| Білі круги | 21 (91,3%) | 5 (8,5%) | 3 (42,9%) | <0,001 |
| Сірі ромбовидні структури | 23 (100%) | – | – | <0,001 |
Примітка. Рівень значимості різниці показників між групами (р) вказаний за критерієм χ2 Пірсона
Для гіпертрофічного варіанту характерним виявилось поєднання трьох дерматоскопічних ознак: мішенеподібних і виразних фолікулів і лусочок, які були виявлені в усіх 100 % пацієнтів з цим клінічним варіантом АК (табл. 3.10, рис. 3.10).
Враховуючи значущість фоточутливості шкіри у патогенезі АК, проведено порівняльну оцінку дерматоскопічних даних у пацієнтів з різними фототипами шкіри (табл. 3.11).
Як видно з даних таблиці 3.11, у пацієнтів з І фототипом шкіри виявлено дерматоскопічні ознаки майже усіх типів, але мала кількість спостережень у цій групі не дає можливості зробити вірогідні висновки.
Для АК у пацієнтів з ІІ фототипом шкіри характерною є комбінація трьох ознак: лусочок, еритеми/псевдосітки і тонких хвилястих судин. Мішенеподібні фолікули траплялись лише у 69,7 % випадків.
Таблиця 3.11 – Дані дерматоскопій у пацієнтів з І-ІІІ фототипами шкіри
| Дерматоскопічна ознака | І фототип (n=3) | ІІ фототип (n=66) | ІІІ фототип (n=21) | Значимість
різниці між групами (р) |
| Еритема /псевдосітка | 2 (66,7%) | 56 (84,8%) | 1 (4,8%) | <0,001 |
| Лусочки | 3 (100%) | 62 (93,9%) | 5 (23,8%) | <0,001 |
| Тонкі хвилясті судини | 2 (66,7%) | 57 (86,4%) | 2 (9,5%) | <0,001 |
| Мішенеподібні фолікули | 2 (66,7%) | 46 (69,7%) | 19 (90,5%) | 0,156 |
| Виразні фолікули | 1 (33,3%) | 21 (31,8%) | 21 (100,0%) | <0,001 |
| Білі круги | 1 (33,3%) | 10 (15,2%) | 18 (85,7%) | <0,001 |
| Сірі ромбовидні структури | – | 3 (4,5%) | 20 (95,2%) | <0,001 |
Примітка. Рівень значимості різниці показників між групами (р) вказаний за критерієм χ2 Пірсона
Характерним для АК з ІІІ фототипом виявлено поєднання чотирьох дерматоскопічних ознак: виразних фолікулів, сірих ромбовидних структур, мішенеподібних фолікулів, білих кругів.
Таким чином, результати дослідження продемонстрували високу діагностичну значущість дерматоскопії, яка дозволяє швидко, in vivo, оцінити основні морфологічні структури епідермісу, яких не видно неозброєним оком. Цю методику було включено у складений діагностичний алгоритм, який став частиною менеджменту АК на регіональному рівні і використовувався при первинному обстеженні пацієнтів, яких включали для участі у науковому дослідженні, а також при скринінгових обстеженнях, які проводили з метою вивчення епідеміології АК у регіоні.
Необхідність у розробці діагностичного алгоритму АК і впровадження його у практичну діяльність лікарів-дерматологів та інших спеціалістів продиктована наступними викликами часу. Незважаючи на те, що вивченню АК присвячено багато наукових досліджень і клінічних спостережень за кордоном, в Україні проблеми діагностики, лікування і профілактики цього захворювання вивчались мало [84]. У доступних вітчизняних джерелах немає даних щодо епідеміології АК в Україні, відсутні дані про захворюваність і поширеність АК як на державному рівні, так і в окремих регіонах. Той факт, що у Тернопільській області за період 2013-2015 рр. не виявлено жодного випадку АК онкологами і лише 17 випадків виявлено дерматологами шкірвендиспансеру, свідчить про відсутність настороженості щодо даної патології, а також про відсутність знань у фахівців клінічної симптоматики АК.
Вищевказані дані спонукали до потреби створення уніфікованого регіонального діагностичного алгоритму АК, який в подальшому буде основою для укладання локального клінічного протоколу діагностики і лікування АК.
Діагностика АК у нашому регіоні може бути забезпечена в два етапи: на первинному і вторинному рівнях надання медичної допомоги (сімейні лікарі і дерматологи багатопрофільних поліклінік) і на третинному (дерматолог клінічного облшкірвендиспансеру).
При складанні діагностичного алгоритму виходили з того, що на даний час діагностика АК ґрунтується на оцінці скарг, даних анамнезу, клінічних проявів патологічних уражень в шкірі, а також на даних дерматоскопії, яка все ширше застосовується в діагностиці АК та інших захворюваннях шкіри.
1 етап діагностики передбачає:
– вивчення даних анамнезу щодо тривалості впливу сонячного випромінення, попередньої цитостатичної терапіі, зловживання солярієм і т.ін.;
– визначення фототипу шкіри, що є важливим у виборі методик лікування, складанні прогнозу;
– оцінка клінічної візуальної симптоматики, локалізації патологічних змін на шкірі;
– проведення диференційної діагностики (із СК, хворобою Боуена, поверхневою базально-клітинною карциномою).
2 етап передбачає проведення дерматоскопії (поляризаційної і неполяризаційної) та ІГХ досліджень.
Впровадження запропонованого двохетапного діагностичного алгоритму АК є важливою складовою менеджменту пацієнтів з АК у регіоні, що додасть нових знань в епідеміологію даної патології в регіоні і в Україні, а також забезпечить своєчасне виявлення пацієнтів з преканцерозними станами і попередження малігнізації у них. Менеджмент АК буде включати, крім діагностичного алгоритму, лікувальний, консультативний і алгоритм динамічного диспансерного спостереження.
З використанням складеного алгоритму було сплановано і проведено скринінгові обстеження окремих контингентів пацієнтів, у яких за даними вивчених зарубіжних джерел літератури спостерігається найвищий рівень захворюваності на АК. Цим алгоритмом були забезпечені всі дерматовенерологи нашого регіону, а також дерматологи – косметологи і сімейні лікарі, з метою покращення ранньої діагностики та своєчасного адекватного лікування АК.
* * *
Таким чином, аналіз проведеного клінічного обстеження пацієнтів, хворих на АК, що включав оцінку скарг, даних анамнезу життя та хвороби, об’єктивних ознак ураження шкіри, показав, що ступінь патологічних зрушень при АК визначається як індивідуальними особливостями пацієнта (літній і старечий вік, хронічна надмірна інсоляція, І-ІІ фототип шкіри), так і прогресуванням захворювання. Важчий перебіг захворювання здебільшого визначався тривалою кумулятивною дією ультрафіолетового опромінення на ділянки шкіри, що піддаються інсоляції (коефіцієнт кореляції r=+0,32; p=0,002), наявністю характерних маркерів фотоушкодження (r=+0,22; p=0,034), а також спостерігався при гіпертрофічній формі АК (r=+0,33; p=0,002). Встановлено взаємозв’язок між різними клінічними варіантами АК і фототипом шкіри, між наявністю маркерів фотоушкодження та вираженістю скарг, даних характеристик осередків ураження АК (морфологічні елементи, колір) з фототипом шкіри. За даними кореляційного аналізу виявлено, що збільшення кількості осередків ураження АК асоціювалося з різними проявами фотоушкодження шкіри (r=+0,24; p=0,024).
Результати дерматоскопічних досліджень продемонстрували високу діагностичну значущість цієї методики. Встановлено, що основними дерматоскопічними ознаками пігментного актинічного кератозу є виражені фолікули (100 %), сірі ромбовидні структури (100 %), мішенеподібні фолікули і білі круги (91,3 %); для проліферативного АК – еритеми / рожева псевдосітка (94,9 %), лусочки (94,9 %), тонкі хвилясті судини (93,2 %); для гіпертрофічного клінічного варіанту – поєднання трьох дерматоскопічних ознак: мішенеподібних і виражених фолікулів та лусочок (100 %).
Матеріали розділу опубліковані у наступних виданнях:
- ГлушокВ. С., Хара А. И. К вопросу о менеджменте дерматоонкологической помощи пациентам с актиническим кератозом. Дерматовенерология и эстетическая медицина. 2015. № 3 (27). С. 121 [12].
- Глушок В. С. Попередні результати скринінгових обстежень на актинічний кератоз. Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування та профілактики дерматозів та інфекцій, що передаються статевим шляхом : матеріали регіональн. наук.-практ. конф. (м.Святогірськ, 12-13 травня 2016 р.). Святогірськ, 2016. С. 14–15 [7].
- Hlushok V. S., Sviatenko T.V. New approach to the diagnostics of actinic keratosis in Ukraine. International Journal of Dermatology. 2017. Vol. 56. P. 1315–1316 [108].
- Глушок В. С., Святенко Т. В. Можливості дерматоскопії в діагностиці актинічного кератозу. Здобутки клінічної і експериментальної медицини. 2018. № 2 (34). С. 37–41 [9].
- Глушок В. С. Себорейний кератоз: аспекти диференціальної діагностики з актинічним кератозом. Журнал дерматовенерології та косметології імені М.О. Торсуєва. 2018. № 1 (39). С. 94–95 [8].