Державна установа
«Інститут дерматології та венерології НАМН України»
Мангушева Вікторія Юріївна
УДК 616.5-021.5-092-008.87-085.26+615.246.2+615.281.9
ПАТОГЕНЕТИЧНЕ ЗНАЧЕННЯ ПОРУШЕНЬ БІОЦЕНОЗУ ШКІРИ
ТА ЇХ КОРЕКЦІЯ У ХВОРИХ НА АЛЕРГОДЕРМАТОЗИ
14.01.20 – шкірні та венеричні хвороби
Автореферат
дисертації на здобуття наукового ступеня
кандидата медичних наук
Харків – 2019
Дисертацією є рукопис.
Робота виконана у Державній установі «Інститут дерматології та венерології НАМН України».
Науковий керівник:
доктор медичних наук, професор
Кутасевич Яніна Францівна,
ДУ «Інститут дерматології та венерології НАМН
України», директор.
Офіційні опоненти:
доктор медичних наук, професор,
Дудченко Микола Олексійович,
Українська медична стоматологічна академія
МОЗ України, професор кафедри внутрішніх хвороб
та медицини невідкладних станів з шкірними та венеричними хворобами;
кандидат медичних наук, доцент
Савоськіна Вікторія Олександрівна,
Харківська медична академія післядипломної освіти МОЗ
України, доцент кафедри дерматовенерології
та ВІЛ/СНІДу.
Захист відбудеться «27» березня 2019 р. об 11:00 год. на засіданні спеціалізованої вченої ради Д 64.603.01 при ДУ «Інститут дерматології та венерології НАМН України» за адресою: 61057, м. Харків, вул. Чернишевська, 7/9.
З дисертацією можна ознайомитись у бібліотеці ДУ «Інститут дерматології та венерології НАМН України» (61057, м. Харків, вул. Чернишевська, 7/9).
Автореферат розісланий «25» лютого 2019 р.
Вчений секретар
спеціалізованої вченої ради,
доктор медичних наук Щербакова Ю.В.
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Протягом останніх десятиліть у всьому світі спостерігається значне зростання захворюваності на алергічні захворювання, серед яких найбільш розповсюдженою патологією є алергодерматози. За даними епідеміологічних досліджень, розповсюдженість атопічного дерматиту (АД) серед дітей сягає 20 %, серед дорослих – 3 %, при цьому в окремих країнах вона зросла у 2–3 рази. Це стосується й інших алергічних захворювань шкіри (I. Brüske et al., 2014; S. C. Dharmage et al., 2014; S. Nutten, 2015; A. J. Sybilski et al., 2015; S. Kapur et al., 2018). Неухильне зростання поширеності алергодерматозів спостерігається й в Україні (В.М. Волкославська та співавт., 2013, 2016; Л.Д. Калюжна, Л.В. Гречанська, 2016), при цьому, завдяки несвоєчасній діагностиці алергодерматозів, дані офіційної статистики значно менші, ніж справжня розповсюдженість цієї патології (Б.М. Пухлик, 2013).
У патогенезі алергодерматозів провідне місце посідають порушення бар’єрної функції шкіри та імунопатологічні реакції (И. В. Попов, 2014; А. О. Резнікова, 2015; К. С. Шмелькова, 2016; K. H. Kim, 2013; T. L. Berents et al. 2015; T. Werfel et al., 2016). Значну роль в їх виникненні та розвитку відіграють порушення мікробіоценозу шкіри та інших біотопів організму людини (О. Е. Фалова, 2013; Е. С. Михайлова и соавт., 2014; Н. Ю. Резніченко, 2014; Л. А. Болотна, 2015; С. К. Джораєва та співавт., 2015; О. І. Літус та співавт., 2017; G. Baviera et al., 2014). Співіснування макроорганізму та мікробіоти забезпечується різноманітними місцевими та системними механізмами. В останні десятиріччя їх вивченню присвячено багато досліджень (I. Wanke et al., 2011; M. Johannessen et al., 2012; L. Mijouin et al., 2013; M. Simanski et al., 2016). Зокрема, встановлено участь у розвитку імунопатологічних реакцій у хворих на алергодерматози прозапальних та протизапальних цитокінів (Е. И. Стукова и соавт., 2013; Е. М. Солошенко та співавт., 2015; J. Lee et al., 2012; C. M. Bonefeld et al., 2016), а також значення толл-подібних рецепторів (TLR) у первинній детекції патогенних мікроорганізмів з наступною реалізацію ранніх механізмів вродженого імунітету (Е. С. Снарская и соавт., 2012; Е. В. Сорокина и соавт., 2011; M. Johannessen et al., 2012). Вроджені дефекти генів цих систем відіграють роль у розвитку алергодерматозів (Г. Ф. Гималова и соавт., 2012; V. Madhok et al., 2015).
Але багато питань про взаємодію коменсальної та патогенної мікрофлори з окремими ланками імунної системи людини, тактика лікування алергодерматозів залежно від цих факторів залишаються не вирішеними та потребують подальшого вивчення (Л. А. Болотна, Т. С. Осипенко 2014; Л. Д. Калюжна, 2016). Розуміння цих механізмів патогенезу алергодерматозів дозволить покращити вибір тактики лікування та його ефективність.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота є фрагментом науково-дослідної роботи ДУ «Інститут дерматології та венерології НАМН України» на тему: «Вивчити роль мутацій гену філагрину в порушенні епідермального бар’єру у хворих на хронічні дерматози і розробити методи корекції виявлених проявів» (номер держреєстрації 0117U000983), в якій дисертантом проаналізовані біологічні особливості мікрофлори, виявленої у хворих на алергодерматози, проведено аналіз молекулярно-генетичних складових патогенезу, а також розроблено методи лікування у хворих на алергодерматози.
Мета дослідження: підвищення ефективності лікування хворих на алергодерматози шляхом розробки комплексного методу терапії на підставі вивчення змін біоценозу шкіри та кишечника та імунного статусу.
Завдання дослідження:
- Вивчити особливості біоценозу шкіри у хворих на алергодерматози.
- Вивчити біологічні особливості мікрофлори, виявленої у хворих на алергодерматози. Визначити властивості та ферментативні особливості флори, що колонізує шкіру хворих на алергодерматози.
- Вивчити поліморфізм генів TLR, а також сироватковий рівень прозапального цитокіну інтерлейкін-17А (ІЛ-17А). З’ясувати їх участь у розвитку запалення у хворих на алергодерматози.
- Вивчити можливості та вдосконалити методи корекції порушень мікробіоценозу шкіри і кишечника шляхом ступінчастої сорбційної терапії у складі традиційного лікування.
- Вивчити динаміку біоценозу шкіри при використанні комбінованих зовнішніх препаратів і монопрепаратів, що містять кортикостероїди та протимікробні засоби. Розробити рекомендації щодо альтернативного методу комплексного зовнішнього лікування.
Об’єкт дослідження – алергодерматози (істинна екзема (ІЕ) та мікробна екзема (МЕ), атопічний дерматит).
Предмет дослідження – стан мікробіоценозу шкіри, кишечника та верхніх дихальних шляхів, поліморфізм гену TLR 1- I602S, рівень IL-17A, тяжкість захворювання за шкалою SCORAD у хворих на АД та EASI у хворих на екзему.
Методи дослідження: загальноклінічні (постановка діагнозу, визначення ступеня тяжкості перебігу дерматозу, контроль ефективності лікування), імуноферментні (визначення рівня IL-17А методом твердофазного аналізу за допомогою імуноферментного аналізатора), бактеріологічні (комплексна мікроскопічна та культуральна оцінка мікробіоценозу кишечнику, шкіри та верхніх дихальних шляхів), генетичні (визначення та аналіз поліморфізму гена TLR 1-I602S за методом поліморфізму довжини рестрикційних фрагментів за Johnson C. M.), статистичні (параметричні та непараметричні методи з використанням критеріїв Колмагорова-Смирнова, Ст’юдента і Фішера).
Наукова новизна отриманих результатів. Вперше встановлено особливості поліморфізму гену TLR1-I602S у хворих на алергодерматози. Зокрема визначено превалювання неактивних та малоактивних генотипів у хворих на АД та ІЕ, за виключенням хворих на МЕ при тяжкому її перебігу.
Показано, що вміст IL-17A в сироватці крові можна використовувати як маркер загострення алергодерматозів, а також він може слугувати показником оцінки ефективності терапії.
Доповнено уявлення про особливості біоценозу шкіри при різних алергодерматозах та дано характеристику біологічних особливостей і чутливості виділеної мікрофлори до антибактеріальних засобів на сучасному етапі.
Вперше вивчено динаміку біоценозу шкіри у хворих на алергодерматози в умовах проведення ступінчастої ентеросорбції.
Встановлено більш виражений вплив на розв’язання клінічних ознак захворювання та нормалізацію біоценозу шкіри при проведенні етапного зовнішнього лікування з використанням засобів антибактеріальної дії та топічних стероїдів порівняно з використанням комбінованих препаратів зовнішньої дії (фіксованих комбінацій подібного складу).
Практична значимість отриманих результатів. Розроблено ступінчастий метод ентеросорбції з використанням ентеросорбентів з різними властивостями, що дозволяє підвищити ефективність комплексної терапії хворих на алергодерматози.
Розроблено метод етапної зовнішньої терапії з використанням антибактеріальних засобів та топічних стероїдів.
Запропоновано використовувати рівень IL-17A в якості маркера загострення алергодерматозів і показника ефективності лікування.
Наукові результати дисертаційної роботи використовуються в практичній охороні здоров’я клініки ДУ «Інститут дерматології та венерології НАМН України», КНП «Харківський міський шкірно-венерологічний диспансер № 1» Харківської міської ради, КНП «Харківський міський шкірно-венерологічний диспансер № 2» Харківської міської ради, КЗОЗ Обласний клінічний шкірно-венерологічний диспансер № 1 (м. Харків), КУ «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради, Полтавського обласного клінічного шкірно-венерологічного диспансеру, а також у навчальний процес кафедри дерматології та венерології Одеського національного медичного університету. Назви установ наведені на момент отримання актів впровадження.
Особистий внесок здобувача. Автором самостійно проведено патентний пошук і виконаний огляд вітчизняної та зарубіжної літератури за тематикою дисертаційного дослідження, обґрунтовано актуальність дослідження, виконано формулювання мети дослідження і його завдань, розроблено дизайн дослідження, проведені аналіз і статистична обробка отриманих результатів, сформульовані висновки дисертаційної роботи. Дисертант особисто брав участь в обстеженні та лікуванні хворих, що увійшли у дослідження.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Дисертантом не були використані результати та ідеї співавторів публікацій. Конфлікту інтересів немає.
Апробація результатів роботи. Основні положення дисертаційної роботи були повідомлені та обговорювалися на науково-практичній конференції з міжнародною участю «Інноваційні технології в дерматовенерології. Міждисциплінарні зв’язки» (Харків, 2015), науково-практичній конференції «Стан та основні організаційні задачі дерматовенерологічної служби на сучасному етапі в Україні» (Київ, 2016), науково-практичній конференції «Новітні технології діагностичних, лікувальних та профілактичних заходів в дерматовенерології та методи і стан їхнього впровадження» (Харків, 2016), науково-практичній конференції молодих вчених дерматовенерологів «Розробки молодих вчених в сучасній дерматовенерології» (Харків, 2016), науково-практичній конференції VI міжнародного медичного конгресу «Інноваційні досягнення в діагностиці інфекцій, що передаються статевим шляхом, інфекційних і грибкових захворювань та поширених дерматозів. Прогрес у лікуванні» (Київ, 2017), науково-практичній конференції з участю міжнародних спеціалістів, присвяченій Дню науки «Медична наука на перетині спеціальностей: сьогодення та майбутнє» (Харків, 2017), науково-практичній конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом» (Харків, 2017), науково-практичній конференції молодих вчених інституту з міжнародною участю, присвяченій 25 річниці від дня заснування НАМН України «Новітні впровадження молодих вчених в сучасній дерматовенерології» (Харків, 2018), науково-практичній конференції молодих вчених НАМН України, присвяченій 25-рiччю Національної академії медичних наук України (Київ, 2018).
Публікації за темою дисертації. За темою дисертації опубліковано 16 друкованих праць, з них 6 – статті в наукових фахових журналах України (1 – в моноавторстві), 6 статей входять до міжнародних наукометричних баз Index Copernicus, Google Scholar, Ulrich’s Periodicals Directory, ResearchBib, Erih Plus, SIS, IIJIF, ROAD, «Наукова періодика України» Національної бібліотеки України ім. В.І. Вернадського, РІНЦ, 2 статті у закордонних виданнях, 7 тез доповідей. Одержано 1 патент України на корисну модель.
Структура і обсяг роботи. Дисертація викладена на 189 сторінках, складається зі вступу, огляду літератури, опису матеріалів та методів дослідження, 5 розділів власних досліджень, аналізу та обговорення отриманих результатів, висновків, рекомендацій, списку літератури, що містить 183 джерела (94 – кирилицею і 89 – латиницею), та двох додатків. Текст дисертаційної роботи ілюстрований 23 таблицями та 29 рисунками.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріал та методи дослідження. Дисертаційне дослідження виконано на базі ДУ «Інститут дерматології та венерології НАМН України» протягом 2015–2018 рр. У дослідженні брали участь 154 хворих на алергодерматози, які знаходилися на стаціонарному лікуванні у відділенні дерматології, інфекційних та паразитарних захворювань шкіри, у тому числі: 50 (32,5 %) хворих на АД; 52 (33,8 %) – на ІЕ; 52 (33,8 %) – на МЕ.
До початку лікування у всіх хворих проводилось анамнестичне та загально-клінічне дослідження. Кількісне визначення тяжкості перебігу дерматозу при первинному огляді й у динаміці спостереження за хворими проводилося за системою бальної оцінки ступеня тяжкості АД (індекс SCORAD). Клінічна картина тяжкості ІЕ та МЕ оцінювалася за допомогою індексу тяжкості захворювання і площі ураження при екземі (EASI – Eczema area and severity index).
Оцінка за шкалою SCORAD (у хворих на АД) та за шкалою EASI (у хворих на ІЕ або МЕ) виконувалася на початку дослідження (до призначення лікування), під час лікування (на 7 добу від початку терапії) та наприкінці лікування (на 14 добу від початку лікування). Оцінка перебігу захворювання здійснювалася за динамікою загальної оцінки за шкалою SCORAD або EASI та за їх окремими показниками в абсолютному значенні та у відсотках до попереднього терміну визначення.
Бактеріологічні дослідження були проведені на базі лабораторії мікробіології ДУ «Інститут дерматології та венерології НАМН України» з ідентифікацією бактерій шкіри, верхніх дихальних шляхів та кишечника за допомогою методів класичної бактеріології на підставі вивчення морфологічних, культуральних та біохімічних властивостей з визначенням чутливості мікроорганізмів до антибактеріальних препаратів за допомогою диск-дифузійного методу. Інтерпретацію отриманих результатів проводили згідно міжнародних протоколів та нормативних документів МОЗ України. Ступінь дисбіотичних порушень кишечника було оцінено згідно уніфікованої робочої класифікації Куваєвої – Ладодо на базі ДУ «Харківський обласний лабораторний центр Держсанепідслужби України».
Рівень IL-17А досліджувався методом твердофазного аналізу із застосуванням набору реагентів «ИФА-IL-17А» (виробник ТОВ «Цитокін»), що містить моноклональні антитіла до IL-17А. Визначення здійснювалося згідно інструкції виробника у лабораторії алергології ДУ «Інститут дерматології та венерології НАМН України» з використанням імуноферментного аналізатора АИФ-Ц-01С. Дослідження виконувалося на початку лікування та після курсу терапії (за абсолютною величиною та у відсотках порівняно з початковою величиною).
Аналіз поліморфізму гена TLR1-I602S проводився за методом поліморфізму довжини рестрикційних фрагментів за Johnson C. M. Для проведення дослідження використовувалася ДНК, виділена з крові. Результати аналізувалися візуально на трансілюмінаторі «Біоком» при довжині збуджуючого світла 310 нм.
Отримані результати були опрацьовані методами математичної статистики з використанням пакету PSРР (програмне забезпечення з вільним доступом, що не потребує ліцензії) з урахуванням рекомендацій до медико-біологічних досліджень. Кількісні показники були перевірені на нормальність розподілу за допомогою критерію Колмагорова-Смирнова. Для порівняння кількісних показників був використаний t-критерій (Ст’юдента) для незалежних вибірок та парний критерій Ст’юдента для залежних вибірок (в окремій групі під час лікування). Для порівняння якісних показників використано таблиці спряженості з визначенням критерію χ2 (при малих вибірках – з поправкою Йєтса) або критерію Фішера. Відмінності вважалися значущими при ймовірності нульової гіпотези менше 5 % (р<0,05).
Результати та їх обговорення.
Порівняльний аналіз між групами пацієнтів залежно від основного діагнозу виявив окремі особливості. Зокрема, менша кількість пацієнтів у віці від 18 до 44 років, хворих на АД та ІЕ порівняно з МЕ, зі збільшенням у хворих на МЕ пацієнтів віком від 60 до 74 років. Крім цього, при АД та ІЕ відмічався більш ранній початок захворювання та його більша тривалість із загостреннями частіше навесні та восени, у той час як при МЕ відмічалося збільшення частоти загострень незалежно від сезону. Також для хворих на АД та ІЕ більш характерна можлива спадковість захворювання та наявність супутньої патології, особливо з боку органів травної системи. Однак слід зазначити, що у всіх хворих, незалежно від діагнозу, зустрічалися всі варіації показників, що аналізувалися, хоча і з різною частотою. Це є непрямим доказом загальних ланок патогенезу цих захворювань та свідчить про можливість уніфікації окремих методів лікування цих хворих.
Найбільш важким проявом АД були ліхеніфікації, що спостерігалися у 98 % хворих, причому у 32 % випадків їх вираженість була два бали та у 60 % – три бали. У всіх хворих спостерігалися екскоріації. Вираженість цього симптому у 54 % хворих була оцінена в два бали та у 46 % в три. Не менш частим проявом була еритема, яка спостерігалась у всіх хворих, а її вираженість лише в одного хворого була оцінена в один бал, у 42 % – у два бали та у 56 % – в три. Серед клінічних проявів ІЕ найважчими проявами була еритема, вираженість якої у 36,5 % хворих була оцінена в три бали та у 40,4 % – у два бали. Вираженість інфільтрації, папулоутворення та набряку у 28,9 % була оцінена в три бали, а у 44,2 % – у два бали. Екскоріації та ліхеніфікації, які були оцінені у три бали, відмічалися у 23,1 % пацієнтів, у два бали – у 40,4 %. Важливою клінічною ознакою ІЕ є наявність різної кількості везикул та мокнуття різної інтенсивності в осередках ураження. У 9 (17,3 %) осіб дана ознака була оцінена в один бал, у 20 (38,5 %) осіб – у два та у 23 (44,2 %) осіб – у три бали.
Більш виражені клінічні прояви виявлялися у хворих на МЕ. Найбільш важким клінічним проявом у цих хворих була еритема. Вираженість еритеми була оцінена в три бали у 59,6 % пацієнтів, інфільтрації, папулоутворення та набряку – у 48,1 %, екскоріацій та ліхеніфікацій – у 46,2 % хворих. Вираженість цих симптомів у два бали спостерігалась у 34,6 %, 42,3 % та 34,6 % пацієнтів відповідно. Вираженість везикуляції та мокнуття у 38,5 % хворих оцінено в три бали, у 36,5 % – два, та 21,2 % – один бал.
У хворих на АД загальна тяжкість захворювання за шкалою SCORAD при надходженні на лікування у середньому складала (50,8 ± 18,2) бала, у тому числі у 5 (10,0 %) – менше 20 балів (легкий перебіг), у 8 (16,0 %) – перебіг середньої тяжкості та у 37 (74,0 %) – тяжкий перебіг захворювання. У хворих на ІЕ загальна тяжкість захворювання за шкалою EASI на початку лікування складала у середньому (43,2 ± 16,7) бала, у тому числі хворих із легким перебігом (до 20 балів за шкалою EASI) було 4 (7,7 %), середньої тяжкості – 18 (34,6 %) (від 20 до 40 балів за шкалою EASI) та з тяжким перебігом (більше 40 балів за шкалою EASI) – 30 (57,7 %). Загальна тяжкість захворювання за шкалою EASI у хворих на МЕ на початку лікування складала у середньому (54,2 ± 15,3) бала (95 % ДІ 49,9–58,5 бала), у тому числі у 2 (3,8 %) – перебіг оцінено як легкий, у 7 (13,5 %) – середньої тяжкості та у 43 (82,7 %) – як тяжкий.
Таким чином, у більшості хворих на початку лікування вираженість окремих клінічних проявів та тяжкість перебігу захворювання оцінювалась як тяжка, рідше – середньої тяжкості.
При бактеріологічному дослідженні виділень зіву пацієнтів усіх груп у період загострення, до лікування, у більшості випадків не виявлено значимих порушень як у кількісному, так і якісному складі мікроорганізмів. Лише у п’яти пацієнтів були виявлені представники умовно-патогенної мікрофлори з вираженим патогенним потенціалом у складі ценозу зіву – К. pneumoniae, K. ozaenae та S. pyogenes. Ступінь загального мікробного обсіменіння склала від 1х104 до 1х107 КУО/мл. При дослідженні виділень носу пацієнтів даних груп було вилучено 82 лабораторних штами стафілококів, серед яких переважну більшість склали S. еpidermidis – 32,9 %, S. aureus – 17,1 %, S. haemolyticus – 17,1 %. Ступінь загального мікробного обсіменіння коливався від 1х103 до 1х106 КУО/мл. Важливо зауважити, що найчастіше S. aureus вилучався від хворих на АД, при цьому у 19,4 % обстежених (6 з 31 особи) збудник було виявлено паралельно в носових ходах і на шкірі.
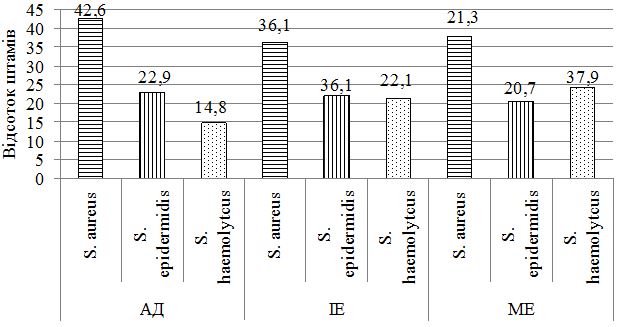
При дослідженні складу шкірного біотопу хворих до лікування було отримано 212 лабораторних штамів мікроорганізмів із переважанням стафілококової складової (85,8 %) (рис. 1).
Ступінь загального мікробного обсіменіння коливався від 1х104 до 1х108 КУО/мл. Серед вилучених різновидів стафілококів у ценозі шкіри переважали S. aureus, S. haemolyticus та S. еpidermidis (рис. 1). У хворих на екзему та АД спостерігався зсув у складі шкірної біоти з переважанням найбільш агресивних видів, питома вага яких склала 60,8 %, з домінуванням S. aureus (42,6 % лабораторних штами) у хворих на АД та 36,1 % і 37,9 % відповідно у хворих на ІЕ та МЕ. Важливо зауважити, що саме у групі пацієнтів з АД відмічалися більш виражені порушення у складі біотопу верхніх дихальних шляхів з ізоляцією лабораторних штамів S. aureus, які мали однаковий профіль антибіотикорезистентності зі шкірними різновидами збудника, що може свідчити про персистенцію збудника у різних екотопах вегетування макроорганізму.
У результаті проведених досліджень встановлено, що стафілококи виявили високу резистентність до пеніциліну та макролідів (73,3 % та 52,5 % відповідно), помірну до аміноглікозидів, тетрациклінів та лінкозамідів (51,7 %, 48,0 % та 32,5 % відповідно). Найбільшу чутливість штами показали до фузидієвої кислоти (93,3 % штамів). Загальна кількість штамів, резистентних до оксациліну (MRSA + MR–CNS), становила 27,2 % (49 штамів). Важливо зауважити, що серед метицилінрезистентних штамів 12 (24,5 %) мали ознаки MLS-резистентності (резистентність до макролідів, що часто поширюється на споріднені з макролідами лінкозаміди та стрептограмін В), а 2 штами мали екстенсивну резистентність, при цьому переважну більшість цих штамів було ізольовано від хворих на АД.
Рисунок 1 – Видовий розподіл стафілококів, вилучених з осередків
ураження хворих на АД, ІЕ та МЕ
Порушення мікробіоценозу товстого кишечника було виявлено у всіх 30 обстежених пацієнтів з алергодерматозами. Так, дисбактеріоз І ступеня було виявлено у 3 (10,0 %), ІІ ступеня – у 16 (53,3 %) обстежених, ІІІ ступеня – 11 (36,7 %). Дисбіотичні порушення характеризувалися зниженням кількісного вмісту індигенної мікрофлори, що стосувалось аеробних та анаеробних бактерій. Найчастіше виявлялося зниження біфідобактерій – у 9 осіб (30,0 %), зниження показників висіваності лактобактерій виявлено у 4 хворих (10,5 %). Вміст у кишечнику нормальної кишкової палички було знижено у 3 (13,3 %) обстежених. Також у 25 (83,3 %) хворих було виявлено зростання кількості умовно-патогенних бактерій (H. alvei, K. pneumoniae, Proteus spp., E. aerogenes). На тлі кількісного дисбалансу мікрофлори виявлялися зміни у якісному складі: у 9 (30,0 %) обстежених виявлялася кишкова паличка з гемолітичними властивостями, у 6 (20,0 %) пацієнтів – лактозонегативна та у 2 (6,7 %) хворих – кишкова паличка зі зниженою ферментативною активністю. Звертала на себе увагу частота виявлення грибів роду Candida. Дані гриби було ізольовано у 22 (73,3 %) обстежених. Також у 13,3 % випадків було вилучено S. aureus. Крім того, у 2 хворих було виявлено патогенні ентеробактерії (S. enteritidis), а у 3 (10,0 %) пацієнтів – мікроорганізми роду Clostridium.
Дослідження вмісту IL-17А виконано у 33 хворих на АД, у 39 хворих на ІЕ, у 36 хворих на МЕ та у 23 практично здорових людей (контрольна група) (табл. 1). Перш за все, привертало увагу, що незалежно від діагнозу вміст IL‑17А у середньому був достовірно більшим, ніж у контрольній групі (p<0,05 за t-критерієм). Найбільші значення відмічено у хворих на АД, дещо менші – у хворих на МЕ та на ІЕ (різниця рівня IL-17А між хворими залежно від діагнозу статистично не значима – p>0,05 за t-критерієм).
Таблиця 1 – Рівень IL-17А в сироватці крові обстежених хворих на початку дослідження
| Діагноз | Рівень IL-17А (пг/мл) | ||
| M ± SD | 95 % ДІ | ||
| Нижня границя | Верхня границя | ||
| АД (n=33) | 113,7 ± 60,6 | 96,4 | 130,9 |
| ІЕ (n=39) | 86,8 ± 48,6 | 73,3 | 100,3 |
| МЕ (n=36) | 99,9 ± 40,2 | 88,7 | 111,1 |
| Контрольна група (n=23) | 13,0 ± 8,9 | 9,1 | 16,9 |
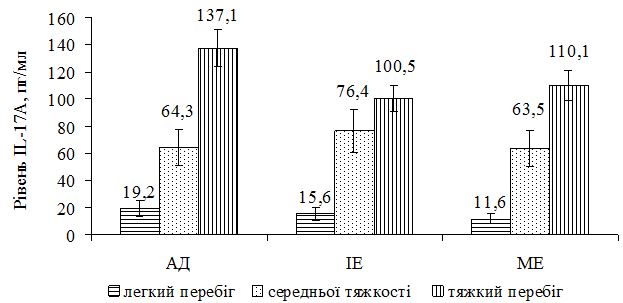
За даними кореляційного аналізу було виявлено пряму залежність вмісту IL-17А та тяжкістю захворювання: у хворих на АД – rP = 0,681 (p<0,001) та – rP = 0,722 (p<0,001) з величиною SCORAD; у хворих на ІЕ – rP = 0,400 (p=0,003) та – rP = 0,423 (p=0,002) з величиною EASI; у хворих на МЕ – rP = 0,613 (p<0,001) та – rP = 0,613 (p<0,001) з величиною EASI. Така залежність також підтверджувалася розподілом середніх значень рівня IL-17А залежно від тяжкості алергодерматозу (рис. 2).
При легкому перебігу АД вміст IL-17А становив у середньому (19,2 ± 5,1) пг/мл, що майже не відрізнявся від аналогічного показника в контрольній групі (р=0,079 за t-критерієм). При середньо-важкому перебігу він зростав до (64,3 ± 25,1) пг/мл, а при важкому сягав (137,1 ± 50,2) пг/мл (p<0,001 за t-критерієм з контрольною групою та з хворими з легким перебігом захворювання). У хворих на ІЕ при легкому перебігу захворювання рівень IL‑17А склав у середньому (15,6 ± 6,1) пг/мл, не відрізняючись від аналогічного показника контрольної групи (р=0,782 за t-критерієм). При середньо-важкому перебігу він зростав до (76,4 ± 37,5) пг/мл, при важкому – (100,5 ± 50,4) пг/мл (p<0,001 за t-критерієм з контрольною групою та з хворими з легким перебігом). У хворих на МЕ ці показники становили (11,6 ± 1,9), (63,5 ± 29,6) та (110,1 ± 33,1) пг/мл у відповідні терміни з аналогічними результатами порівняння з контрольною групою (рис. 2).
Дослідження поліморфізму гена TLR 1-I602S виконано у 39 хворих, у тому числі у 9 хворих на АД, у 11 хворих на ІЕ та у 19 хворих на МЕ. Контрольну групу становила 41 практично здорова особа.
Генотип SS виявлено у 12 (30,8 %) хворих на алергодерматози, генотип IS – у 23 (59,0 %) випадках, а генотип ІІ – 4 (10,2 %) випадках, тобто превалювали менш активні варіанти генотипу TLR1-I602S. У контрольній групі переважав активний генотип ІІ – 27 (65,8 %) випадків; найменш активний генотип SS виявлено у 5 (12,2 %), а генотип IS – у 9 (22,0 %) випадках (різниця статистично достовірна – χ2=26,038, р<0,001).
Рисунок 2 – Рівень IL-17А у хворих на алергодерматози
залежно від тяжкості захворювання до початку лікування
У хворих на АД активного генотипу гена TLR1-I602S ІІ не було, генотип IS виявлено у 7 (77,8 %) випадках, а генотип SS – у 2 (22,2 %) випадках. При ІЕ активного генотипу також не було, при цьому значно збільшилася частота малоактивного генотипу SS – 6 (54,5 %) хворих, генотип ІS виявлений у 5 (45,5 %) випадках. При МЕ генотип ІІ та SS виявлялися з однаковою частотою – по 4 (21,1 %) хворих, а генотип ІS – у 11 (57,9 %) хворих (різниця між групами залежно від діагнозу статично не значима – p>0,05 за критерієм χ2 у всіх порівняннях). При цьому зберігається статистично значима різниця розподілу генотипів гена TLR1-I602S незалежно від діагнозу порівняно з контролем АД – χ2=13,645, р=0,002; ІЕ – χ216,377, р<0,001; МЕ – χ2=10,755, р=0,005.
При додатковому аналізі поліморфізму гена TLR1-I602S залежно від тяжкості захворювання статистично значимих закономірностей не виявлено, але у хворих на МЕ активний генотип гена TLR1-I602S переважно виявлявся у хворих з тяжким перебігом захворювання (з оцінкою за ЕASI більш 40 балів) – в 3 випадках (75 %) із загальної кількості з таким генотипом.
З урахуванням виявлених порушень запропоновано нові методи диференційованої терапії. Метод системної терапії – ступінчаста ентеросорбція (прийом атоксілу по 1 флакону на день протягом 3 днів з наступним прийомом еліміналь гелю по 1 стик-пакету 3 рази на день протягом 14 днів). Групу порівняння становили хворі, у яких ентеросорбція не проводилася. Встановлено, що застосування ступінчастої сорбційної терапії призводить до більш швидкого покращення стану пацієнтів – на 7 та 14 добу лікування. Cпостерігалося більш значне зниження тяжкості захворювання та частоти виявлення найбільш тяжких окремих клінічних симптомів порівняно з групою пацієнтів, які отримували традиційну терапію без ентеросорбції. Крім цього, застосування ступінчастої сорбційної терапії у хворих на алергодерматози сприяло нормалізації мікробіоценозу кишечника та шкіри: кількість штамів S. aureus знизилася з 42,6 % до 35,7 % та 30,0 % відповідно у хворих на АД, з 36,1 % до 30,7 % та 23,1 % відповідно у хворих на ІЕ. Частота вилучення штамів S. еpidermidis зросла з 22,9 % до 40,0 % у хворих на АД, з 22,1 % до 38,4 % у хворих на ІЕ та з 20,7 % до 33,3 % у пацієнтів з МЕ. Спостерігалася нормалізація основних показників мікроценозу кишечника: збільшилася кількість біфідо- та лактобактерій, були відсутні S. aureus, умовно-патогенні ентеробактерії, лактонегативні кишкові палички та варіанти зі зниженою ферментативною активністю. Ступінчаста сорбційна терапія була більш ефективною у хворих на АД.
Був застосований метод етапної зовнішньої терапії: на першому етапі використовувався препарат фузидієвої кислоти у вигляді мазі або крему 2 рази на день протягом 7 днів, чергуючи із застосуванням топічного стероїду у вигляді мазі або крему. На другому етапі застосовувався тільки топічний стероїд протягом 7 днів за схемою відповідно до інструкції виробника. Групу порівняння складали хворі, яким для зовнішньої терапії застосовано комбінований препарат (протимікробний інгредієнт та топічний стероїд) згідно інструкції виробника. При порівнянні ефективності двох підходів до зовнішньої терапії за результатами аналізу динаміки клінічних проявів алергодерматозів встановлено, що незалежно від діагнозу застосування етапної зовнішньої терапії призводить до більш швидкого та значного зниження тяжкості захворювання та регресу клінічних симптомів порівняно з групою пацієнтів, які отримували лікування комбінованим топічним препаратом. Застосування етапної зовнішньої терапії також сприяло нормалізації мікробіоценозу шкіри: кількість штамів S. aureus знизилася з 48,8 % до 17,6 % у пацієнтів з АД, з 18,7 % до 13,3 % у хворих на ІЕ та з 21,4 % до 6,7 % у хворих на МЕ, проти з 50,0 % до 35,7 % у пацієнтів з АД, з 11,1 % до 9,7 % у хворих на ІЕ та з 14,8 % до 8,7 % у хворих на МЕ при лікуванні комбінованим місцевим засобом. Частота вилучення штамів S. еpidermidis зросла з 24,4 % до 52,9 % у хворих на АД, з 26,6 % до 33,3 % у хворих на ІЕ при застосуванні етапної зовнішньої терапії проти з 18,8 % до 28,6 % у хворих на АД та з 13,9 % до 19,4 % у хворих на ІЕ при лікуванні комбінованим місцевим засобом. Найбільш ефективною етапна зовнішня терапія виявилась у хворих на МЕ.
Таким чином, можна стверджувати, що застосування запропонованих методів лікування (ступінчастої ентеросорбції та етапної зовнішньої терапії) призводить до більш швидкого покращення стану пацієнтів, нормалізації мікробіоценозу та імунного статусу.
ВИСНОВКИ
У дисертаційній роботі наведено теоретичне обґрунтування та нове вирішення наукового завдання, яке полягає у підвищенні ефективності лікування хворих на алергодерматози (атопічного дерматиту, істинної та мікробної екземи) шляхом удосконалення комплексу терапії із застосуванням ступінчастої сорбційної терапії та етапної зовнішньої терапії.
- У зв’язку з широкою розповсюдженістю алергодерматозів як серед населення світу, так і в Україні, неухильним зростанням тяжких форм захворювання, складністю патогенезу, актуальним залишається поглиблене вивчення взаємодії коменсальної та патогенної мікрофлори з окремими ланками імунної системи людини. Розуміння цих механізмів патогенезу алергодерматозів дозволить удосконалити схеми комплексної терапії, тим самим покращити вибір тактики лікування та його ефективності.
- Встановлено, що у складі мікробіоценозу шкіри хворих на екзему та АД у період загострення до початку лікування спостерігався зсув з переважанням найбільш агресивних видів, питома вага яких склала 60,8 %, з домінуванням S. aureus (42,6 % лабораторних штамів) у хворих на АД та 36,1 % і 37,9 % відповідно у хворих на ІЕ та МЕ.
- У хворих на алергодерматози під час загострення захворювання спостерігається значне збільшення рівня IL-17А в сироватці крові. Це збільшення має сильну значиму пряму кореляцію з тяжкістю перебігу захворювання та вираженістю порушень мікробіоценозу, що свідчить про важливість імунного механізму в патогенезі захворювання та ролі прозапальних цитокінів. У результаті застосування етапної зовнішньої терапії у хворих на АД рівень IL-17A на 14 добу лікування знизився на (82,2 ± 19,8) % до (18,9 ± 7,8) пг/мл, при застосуванні комбінованого препарату – на (85,8 ± 15,6) % до (15,3 ± 7,9) % пг/мл; у хворих на ІЕ – на (59,5 ± 6,4) % та (62,4 ± 7,3) % відповідно та у хворих на МЕ на (80,7 ± 13,8) % та на (70,3 ± 10,6) % відповідно.
- Аналіз поліморфізму гена TLR 1-I602S у хворих на алергодерматози виявив превалювання неактивних та малоактивних генотипів у хворих на АД та ІЕ. Активний генотип зустрічався тільки у хворих на МЕ, причому переважно при важкому перебігу захворювання.
- Застосування ступінчастої сорбційної терапії у хворих на алергодерматози сприяло нормалізації мікробіоценозу кишечника та шкіри. Кількість штамів S. aureus знизилася з 42,6 % до 35,7 % та 30,0 % відповідно у хворих на АД, з 36,1 % до 30,7 % та 23,1 % відповідно у хворих на ІЕ. Частота вилучення штамів S. еpidermidis мала зворотну залежність, так кількість вилучень зросла з 22,9 % до 40,0 % у хворих на АД, з 22,1 % до 38,4 % у хворих на ІЕ та з 20,7 % до 33,3 % у пацієнтів з МЕ. Також спостерігалася нормалізація основних показників мікроценозу кишечника: збільшилася кількість біфідо- та лактобактерій, були відсутні S. aureus, умовно-патогенні ентеробактерії, лактонегативні кишкові палички та варіанти зі зниженою ферментативною активністю.
- Застосування етапної зовнішньої терапії сприяло нормалізації мікробіоценозу шкіри у хворих на алергодерматози. Кількість штамів S. aureus знизилася з 48,8 % до 17,6 % у пацієнтів на АД, з 18,7 до 13,3 % у хворих на ІЕ та з 21,4 % до 6,7 % у хворих на МЕ, проти з 50,0 % до 35,7 % у пацієнтів з АД, з 11,1 % до 9,7 % у хворих на ІЕ та з 14,8 % до 8,7 % у хворих на МЕ при лікуванні комбінованим місцевим засобом. Частота вилучення штамів S. еpidermidis мала зворотну залежність, так кількість вилучень зросла з 24,4 % до 52,9 % у хворих на АД, з 26,6 % до 33,3 % у хворих на ІЕ при застосуванні етапної зовнішньої терапії проти з 18,8 % до 28,6 % у хворих на АД та з 13,9 % до 19,4 % у хворих на ІЕ при лікування комбінованим місцевим засобом, що свідчить про ефективність розробленого методу.
РЕКОМЕНДАЦІЇ
- Хворим на алергодерматози з порушенням мікробіоценозу в різних біотопах рекомендується проводити дослідження вмісту прозапального IL-17A в сироватці крові, як маркера загострення алергодерматозів. Таке обстеження з урахуванням виявлених патологічних змін дозволить прогнозувати подальший перебіг дерматозу та може слугувати показником ефективності терапії.
- Аналіз поліморфізму гена TLR 1-I602S дозволяє прогнозувати подальший перебіг дерматозу і здійснювати диференційований підхід до призначення комплексного лікування хворим на алергодерматози.
- Хворим на алергодерматози до комплексної терапії з метою корекції мікрофлори шкіри та кишечника, показників імунного статусу, при відсутності протипоказань до призначення (індивідуальної чутливості до компонентів, виразкової хвороби шлунку та дванадцятипалої кишки у стадії загострення, шлункових та кишкових кровотеч, кишкової непрохідності, хворим на фенілкетонурію) рекомендується спосіб ступінчастої ентеросорбції, який передбачає прийом атоксілу по 1 флакону на день протягом 3 днів з наступним прийомом еліміналь гелю по 1 стик-пакету 3 рази на день протягом 14 днів.
- Хворим на алергодерматози особливо з дефектом вродженого імунітету, наявністю малоактивних та, особливо, неактивних генотипів TLR1-I602S з метою корекції мікрофлори шкіри, показників імунного статусу, більш швидкого усунення ознак загострення алергодерматозів до комплексної терапії доцільно призначати етапну зовнішню терапію: на першому етапі застосовувати препарат фузидієвої кислоти у вигляді мазі або крему 2 рази на день протягом 7 днів, чергуючи із застосуванням топічного стероїду у вигляді мазі або крему. На другому етапі застосовувати тільки топічний стероїд протягом 7 днів за схемою відповідно до інструкції виробника.
СПИСОК ПРАЦЬ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Корекція мікробіоценозу кишечника методом ступінчастої елімінаційної терапії у хворих на алергодерматози / Я.Ф. Кутасевич, І.О. Олійник, С.К. Джораєва, В.Ю. Мангушева. Медицина сьогодні і завтра. 2017. № 3-4 (76-77). С. 109–115. (Дисертантом здійснено відбір хворих, їх обстеження та обробку матеріалу)
- Диференційований підхід до діагностики та зовнішньої терапії екземи / Я.Ф.Кутасевич, К.Є. Іщейкін, І.В. Зюбан, В.Ю. Мангушева. Дерматологія та венерологія. 2018. № 1 (79). С. 50–55. (Дисертантом розроблено диференційований підхід до діагностики та зовнішньої терапії хворих на екзему)
- Кутасевич Я.Ф., Джораева С.К., Мангушева В.Ю. Исследование состава микробиоты кожи и анализ ее антибиотикорезистентности у больных аллергодерматозами. Експериментальна і клінічна медицина. 2018. № 1 (78). С. 101–107. (Дисертантом проведено дослідження складу мікробіоти шкіри та проаналізовано її антибіотикорезистентність у хворих на алергодерматози)
- Особливості клінічних проявів атопічного дерматиту у пацієнтів з мутацією 2282del14 в гені філагрину / К.Є. Іщейкін, І.О. Олійник, С.К. Джораєва, І.В. Зюбан, В.Ю. Мангушева. Дерматологія та венерологія. 2018. № 2 (80). С. 19–25. (Дисертантом зроблено набір клінічного матеріалу та спостереження за хворими)
- Мангушева В.Ю. Дослідження вмісту інтерлейкіну-17А у хворих на алергодерматози. Дерматологія та венерологія. 2018. № 3 (81). С. 17–21.
- Кутасевич Я.Ф., Білозоров О.П., Мангушева В.Ю. Дослідження поліморфізму гену тол-подібного рецептору 1 TLR-1-I602S у хворих на алергодерматози. Art of Medicine. 2018. Т. 3, № 7. С. 63–65. (Дисертантом проведено збір, статистичну обробку клінічного матеріалу та підготовку статті до друку)
- Кутасевич Я.Ф., Мангушева В.Ю. Оптимизация наружной терапии больных экземой. World Science. 2017. 4, Іss. 11 (27): С. 33–37.
- Research of certain pathogenic characteristics of clinical isolates of staphylococcus of skin biome / Y. Kutasevych, S. Dzhoraeva, V. Goncharenko, V. Mangusheva, Y. Sherbakova, N. Sobol, H. Shegoleva. EURECA: Нealth Science. 2018. № 2. С. 23– (Дисертантом проведено збір, статистичну обробку клінічного матеріалу та підготовку статті до друку)
- Пат. на корисну модель № 120805 UA, МПК A61K45/08, A61P17/00, A61P37/08. Спосіб лікування хворих на алергодерматози з порушенням мікробіоценозу кишечнику / Я.Ф. Кутасевич, І.О. Олійник, С.К. Джораєва, В.Ю. Мангушева. № u201701825; заявл. 27.02.17; опубл. 27.11.17, Бюл. № 22.
- Эффективность эфферентной терапии больных в лечении хронической экземы / Я.Ф. Кутасевич, И.А. Олейник, И.А. Маштакова, Р.К. Попова, В.Ю. Мангушева. Збірник робіт за матеріалами науково-практичної конференції «Дерматовенерологія в розробках молодих науковців», 19-20 листопада 2015 року, м. Київ. Дерматовенерологія. Косметологія. Сексопатологія. 2015. № 3–4 (2). С. 118–119. (Дисертантом проаналізована ефективність еферентної терапії в лікуванні хворих на хронічну екзему)
- Кутасевич Я.Ф., Олійник І.О., Мангушева В.Ю. Східчаста ентеросорбція в лікуванні хворих на поширені алергодерматози. Збірник робіт по матеріалам науково-практичної конференції «Сімейна медицина. Перспективи та шляхи подальшого розвитку». м. Львів, 13-15 квітня 2016 р. Львів, 2016. С. 84. (Дисертантом оптимізована схема лікування хворих на поширені алергодерматози)
- Особливості складу ценозів кишечника та шкіри у хворих на алергодерматози / Я.Ф. Кутасевич, І.О. Маштакова, С.К. Джораєва, В.Ю. Мангушева. Матеріали V ювілейного міжнар. мед. конгресу «Впровадження сучасних досягнень медичної науки у практику охорони здоров’я України», м. Київ, 19–21 квітня 2016 р. К., 2016. С. 84. (Дисертантом виявлені особливості складу ценозів кишечника та шкіри у хворих на алергодерматози)
- Мангушева В.Ю. Аналіз супутньої соматичної патології у хворих на хронічну екзему. Збірник робіт по матеріалам наук.-практ. конф. «Інноваційні досягнення в діагностиці інфекцій, що передаються статевим шляхом, інфекційних і грибкових захворювань та поширених дерматозів. Прогрес у лікуванні» VI міжнародного медичного конгресу, м. Київ, 25–27 квітня 2017 р. К., 2017, С. 163.
- Мангушева В.Ю., Джораева С.Н., Супрун К.Г. Особенности видового состава биотопа кожи у больных распространенными аллергодерматозами. Матеріали наук.-практ. конф. з участю міжнар. спеціалістів, присвяченого дню науки «Медична наука на перетині спеціальностей: сьогодення і майбутнє», м. Харків, 19 травня 2017 р. Харків, 2017. С. 71. (Дисертантом виявлено та проаналізовано особливості видового складу біотопу шкіри у хворих на розповсюджені алергодерматози)
- Мангушева В.Ю. Особенности клинических проявлений микробной экземы в области нижних конечностей. Матеріали науково-практичної конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», м. Харків, 10–11 листопада 2017 р. Дерматологія та венерологія. 2017. № 3 (77). С. 107.
- Мангушева В.Ю., Зюбан И.В. Особенности клинических проявлений атопического дерматита у пациентов с мутациями гена филаггрина. Наук.-практ. конф. молодих вчених, присвячена 25-рiччю Національної академії медичних наук України. Журнал Національної академії медичних наук України. 2018. Спеціальний випуск. С. 60. (Дисертантом особисто проведено збір та обробку даних, підготовлено статтю до друку)
АНОТАЦІЯ
Мангушева В.Ю. Патогенетичне значення порушень біоценозу шкіри та їх корекція у хворих на алергодерматози. – На правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби. – Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2019.
Дисертаційне дослідження присвячено підвищенню ефективності лікування хворих на алергодерматози шляхом розробки комплексного методу терапії на підставі вивчення змін біоценозу шкіри та кишечника й імунного статусу. Встановлено, що у складі мікробіоценозу шкіри хворих на алергодерматози в період загострення до початку лікування переважають найбільш агресивні мікроорганізмів види, питома вага яких становила 60,8 %, з домінуванням S. aureus, спостерігається значне збільшення рівня інтерлейкіну‑17А в сироватці крові, яке корелює з тяжкістю перебігу захворювання та вираженістю порушень мікробіоценозу. Виявлено превалювання неактивних та малоактивних генотипів гена TLR 1-I602S у хворих на атопічний дерматит та істину екзему. Запропоновано ступінчасту сорбційну та етапну зовнішню терапію.
Ключові слова: алергодерматози, біоценоз, поліморфізм гену TLR1-I602S, інтерлейкін-17А, ентеросорбція, зовнішня терапія.
АННОТАЦИЯ
Мангушева В.Ю. Патогенетическое значение нарушений биоценоза кожи и их коррекция у больных аллергодерматозами. – На правах рукописи.
Диссертация на соискание ученой степени кандидата медицинских наук по специальности 14.01.20 «кожные и венерические болезни». – Государственное учреждение «Институт дерматологии и венерологии НАМН Украины», Харьков, 2019.
Диссертационное исследование посвящено повышению эффективности лечения больных аллергодерматозами путем разработки комплексного метода терапии на основании изучения изменений биоценоза кожи и кишечника и иммунного статуса. Установлено, что в составе микробиоценоза кожи больных аллергодерматозами в период обострения до начала лечения преобладают наиболее агрессивные виды микроорганизмов, удельный вес которых составил 60,8 %, с доминированием S. aureus, наблюдается значительное увеличение уровня интерлейкина-17А в сыворотке крови, которое коррелирует с тяжестью течения заболевания и выраженностью нарушений микробиоценоза. Выявлено преобладание неактивных и малоактивных генотипов гена TLR 1-I602S у больных атопическим дерматитом и истинной экземой. Предложена ступенчатая сорбционная и этапная наружная терапия.
Ключевые слова: аллергодерматозы, биоценоз, полиморфизм гена TLR1-I602S, интерлейкин-17А, энтеросорбция, наружная терапия.
SUMMARY
Mangusheva V.Yu. Pathogenetic value of skin biocenosis disorders and their correction in patients with allergic dermatitis. – The manuscript.
Thesis for the degree of a candidate of medical sciences in specialty 14.01.20 «Skin and venereal diseases». – State Establishment «Institute of Dermatology and Venereology of NAMS of Ukraine», Kharkiv, 2019.
The dissertation was carried out on the basis of the State Establishment “Institute of Dermatology and Venereology of the Academy of Medical Sciences of Ukraine” during 2015-2018 and dedicated to improving the effectiveness of treatment of patients with allergic dermatosis by developing a complex method of therapy based on the study of changes in the biocenosis of the skin and intestine and immune status. 154 patients examined, including 50 (32.5 %) patients were with atopic dermatitis; 52 (33.8 %) patients had true eczema and 52 (33.8 %) patients suffered from microbial eczema.
Bacteriological investigation of pharyngeal secretions in patients of all groups has not revealed in most cases any significant disorders either in the quantitative or in the qualitative content of microorganisms. In the study of nasal discharge of patients of the groups, 82 laboratory strains of staphylococci have been obtained, whith prevailing findings S. epidermidis – 32.9 %, S. aureus – 17.1 %, S. haemolyticus – 17.1 %. On investigation of the skin biotope composition of patients for treatment, 212 laboratory strains of microorganisms have been obtained with a predominance of the staphylococcal component (85.8%). S. aureus prevailed in the skin cenosis (42.6 % of laboratory strains) of patients with AD, 36.1 % and 37.9 % of them, respectively, have been registered in patients with true and microbial eczema. Disoders of the intestinal microbiota have been revealed in all patients: a decrease in bifidobacteria (30.0 %), lactobacilli (10.5 %) and normal E. coli (13.3 %) contens. An increase in the amount of conditionally pathogenic bacteria (H. alvei, K. pneumoniae, Proteus spp., and E. aerogenes) has been observed in 83.3% of patients. In 30.0 % of the examined, E. coli with hemolytic properties was detected, in 20.0 % of patients – lactose-negative, and in 6.7 % of patients – E. coli with reduced enzymatic activity. S. aureus have been found in 13.3% of the cases, pathogenic enterobacteria (S. enteritidis) – in 6.7%, and microorganisms Clostridium in 10.0% of the patients.
The study of the IL-17A content makes it possible to establish that, regardless of the diagnosis, the level of IL-17A was on average significantly higher than that in the control group (p <0.05 by t-criterion). Direct dependence of the IL-17A content on the severity of the disease has been revealed according to the correlation analysis data.
In the study of TLR 1-I602S gene polymorphism, it has been established that in patients with allergic dermatosis the SS genotype has been determined in 12 (30.8 %) cases, the IS genotype in 23 (59.0 %) cases, and genotype II in 4 (10.2 %) cases, hence the less active variants of the TLR1-I602S genotype prevail. In the control group, active genotype II prevailed – 27 (65.8 %) cases; the least active SS genotype been found in 5 (12.2 %), and the IS genotype in 9 (22.0 %) cases (χ2 = 26.038, p <0.001). In patients with AD, there is no active genotype, the IS genotype has been registered in 7 (77.8 %) cases, and the SS genotype in 2 (22.2 %) cases. No active genotype has been revealed in the cases of true eczema, while the frequency of a low activity SS genotype has significantly increased -6 patients (54.5%), and the IS genotype was found in 5 (45.5%) cases. In microbial eczema, genotypes II and SS have been determined with the same frequency - each of them has been found in 4 (21.1 %) patients, and IS genotype - in 11 (57.9 %) patients (p <0.05 by the χ2 criterion in all comparisons). There is a statistically significant difference in the distribution of the genotypes of the TLR1-I602S gene, regardless of the diagnosis as compared with the control of blood pressure – χ2 = 13.645, p = 0.002; IE – χ2 = 16.377, p <0.001; IU – χ2 = 10.755, p = 0.005).
In view of the revealed violations, new methods of differentiated therapy were proposed. Step enterosorption (taking Atoxil for 3 days followed by taking the Eliminal gel for 14 days). Second method as well as stage external therapy: at the first stage, the fusidic acid remedy of an ointment or cream applied at the first stage 2 times a day for 7 days, alternating with use of GCS in as an ointment or cream. Only topical steroid is used within 7 days at the second stage. It has been proved that the use of the proposed stepped sorption and stage external therapy leads to a more rapid improvement of the patients’ state, normalization of the intestinal microbiocenosis and skin, as well as to a decrease in the serum IL 17A level.
Key words: allergic dermatosis, biocenosis, TLR1-I602S gene polymorphism, interleukin-17A, enterosorbtion, external therapy.