Державна установа
«Інститут дерматології та венерології НАМН України»
Ата Мохамед Аббас Мохамед
УДК 616.5-004.1-031.84-073.082.6-074-08
ОПТИМІЗАЦІЯ ДІАГНОСТИКИ І ЛІКУВАННЯ ОБМЕЖЕНОЇ СКЛЕРОДЕРМІЇ З УРАХУВАННЯМ КЛІНІКО-ПАТОГЕНЕТИЧНОЇ РОЛІ МЕТАБОЛІЧНИХ ТА ІМУННИХ ПОРУШЕНЬ
14.01.20 – шкірні та венеричні хвороби
Автореферат
дисертації на здобуття наукового ступеня
кандидата медичних наук
Харків – 2019
Дисертацією є рукопис.
Робота виконана у Державній установі «Інститут дерматології та венерології НАМН України».
Науковий керівник:
доктор медичних наук, професор
Кутасевич Яніна Францівна,
ДУ «Інститут дерматології та венерології НАМН України», директор.
Офіційні опоненти:
доктор медичних наук, професор
Біловол Алла Миколаївна,
Харківський національний медичний університет МОЗ України, завідуюча кафедрою дерматології, венерології та медичної косметології;
доктор медичних наук, доцент
Резніченко Наталія Юріївна,
Запорізький державний медичний університет МОЗ України, професор кафедри дерматовенерології
та косметології з курсом дерматовенерології і естетичної медицини факультету післядипломної освіти.
Захист відбудеться «03» липня 2019 р. об 11:00 год. на засіданні спеціалізованої вченої ради Д 64.603.01 при ДУ «Інститут дерматології та венерології НАМН України» за адресою: 61057, м. Харків, вул. Чернишевська, 7/9.
З дисертацією можна ознайомитись у бібліотеці ДУ «Інститут дерматології та венерології НАМН України» (61057, м. Харків, вул. Чернишевська, 7/9).
Автореферат розісланий «31» травня 2019 р.
Вчений секретар
спеціалізованої вченої ради, доктор медичних наук Ю. В. Щербакова
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Обґрунтування вибору теми дослідження. Обмежена склеродермія (ОСД) – хронічне захворювання сполучної тканини (СТ), яке характеризується ущільненням шкіри й підшкірної жирової клітковини внаслідок модифікації та підвищення щільності колагену (Л.А. Болотна, Я.Ф. Кутасевич, 2014; Я.Ф. Кутасевич, В.В. Савенкова, 2010), є одним з найбільш частих захворювань шкіри і, за даними багатьох дослідників, залишається однією з актуальних проблем сучасної дерматології.
За даними ВООЗ, у всіх індустріально розвинених країнах світу 400 000 з 10 000 000 людей страждають на ОСД (Е. С. Снарская, А. С. Ромашкина, 2011; N. A. Anbiaee, Z. Tafakhori, 2012; C. Tomiyoshi, A.S. Wojcik et al., 2010).
За даними МОЗ України, тільки за останні 4 роки захворюваність на ОСД у середньому збільшилася з 405,2 до 460,3 хворих на 100 000 населення і до 2013 року становила 455,8 випадку на 100 000 населення (В.В. Савенкова, 2012; К.В. Романенко, 2013). В останні роки намітився певний прогрес у розвитку питань клініко-патофізіологічної оцінки ОСД (Н.Ю. Резніченко, 2016; П.Н. Шараев та ін., 2009).
Однак, незважаючи на опубліковані останнім часом монографії (E. Grimes, 2008; М. Rocken et al., 2008) і дисертаційні роботи (В.В. Савенкова, 2011; К.В. Романенко, 2013), в яких сформульовано основні положення даної проблеми, низка важливих аспектів діагностики та лікування ОСД залишається невирішеною або вирішеною частково, оскільки роботи мають принципово описовий характер і лише частково розкривають особливості діагностичної та лікувальної тактики.
Сучасний стан проблеми характеризується невирішеністю питань та недостатнім відображенням у літературі даних про специфіку ранньої діагностики, лікування хворих на ОСД, недоліками і недосконалістю схем раціональної лікувально-діагностичної тактики.
Стає очевидним пошук шляхів оцінки стану осередків ураження – шкіри хворих на ОСД за допомогою термографії. Актуальним є пошук нових патогенетично обумовлених методів лікування ОСД, що нормалізують гомеостаз на клітинному рівні.
Одним із таких методів є новий метод терапії з використанням сучасних препаратів, патогенетичний ефект якої визначається високим відновним потенціалом, що призводить до утворення та синтезу біологічно активних речовин, посилення активності імунокомпетентних клітин, стимуляції репаративних процесів та ін.
Оптимізація та підвищення ефективності лікування хворих цієї категорії може бути досягнута лише при комплексному, об’єктивно обґрунтованому підході до вибору лікувальної тактики, орієнтованої на клініко-патогенетичні особливості з урахуванням метаболічних та імунних порушень і застосуванням нової схеми комплексного лікування.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота за обраним напрямком досліджень входить до тематичних планів і виконана відповідно до плану науково-дослідних робіт ДУ «Інститут дерматології та венерології НАМН України» і є фрагментом НДР «Розробити методи патогенетичної терапії хворих на обмежену склеродермію та хронічний червоний вовчак з урахуванням морфологічних змін шкіри, стану імунної системи і метаболізму сполучної тканини» (№ держреєстрації 0112U000007), у якій здобувач був співвиконавцем. Дисертантом особисто уточнено основні ланки етіопатогенезу ОСД, визначено алгоритм обстеження й розроблено комплексні лікувально-профілактичні методи.
Мета дослідження: підвищити ефективність діагностики та комплексного лікування хворих на ОСД на підставі вивчення показників мікроциркуляторного русла шкіри у ділянках ураження, імунологічних та біохімічних порушень.
Завдання дослідження:
- Вивчити клініко-епідеміологічні аспекти ОСД на сучасному етапі.
- Провести комплексну діагностику з обґрунтуванням застосування сучасних біохімічних та імунологічних методів дослідження для подальшого вивчення показників імунного та біохімічного гомеостазу у хворих на ОСД.
- Оцінити стан мікроциркуляції ділянок ураження за тепловізійною картиною.
- На підставі оцінки стану метаболічних порушень і динаміки показників імунного статусу хворих у період прогресуючої стадії захворювання розробити алгоритм лікувально-профілактичної тактики при ОСД.
- Провести порівняльну оцінку ефективності результатів застосування різних схем терапії з використанням традиційних лікувальних підходів на основі традиційної базової терапії та запропонованої схеми комплексного лікування хворих на ОСД.
Об`єкт дослідження: ОСД.
Предмет дослідження: патогенетичні й клінічні особливості, діагностика, імунний статус, лікування, профілактика та тактика ведення хворих на ОСД.
Методи дослідження: клінічні (постановка діагнозу, визначення ступеня тяжкості перебігу дерматозу, контроль ефективності лікування); інструментальні (тепловізійна візуалізація осередків); біохімічні (визначення глікозоаміногліканів (ГАГ) у сироватці крові, оцінка колагенолітичної активності (КЛА), дослідження еластази у сироватці крові); імунологічні (визначення вмісту автоімунних антитіл, визначення концентрації та константи циркулюючих імунних комплексів (ЦІК), визначення рівня субпопуляцій лімфоцитів); статистичні.
Наукова новизна отриманих результатів. Вперше дано тепловізійну оцінку стадій ОСД.
Доведена можливість діагностики прогресуючої стадії захворювання на доклінічному етапі.
Оцінено стан метаболічних порушень у хворих на ОСД у період прогресуючої стадії захворювання, а також надано характеристику динаміки показників імунного статусу у процесі лікування.
Обґрунтовано доцільність включення у терапевтичний комплекс засобів, що поліпшують реологічні властивості крові, неоколагеногенез та мають антигіпоксичну та антиоксидантну дію.
Доведено можливість оцінки ефективності лікування хворих на різні форми та стадії ОСД шляхом визначення в сироватці крові активності еластази, КЛА та накопичення ГАГ.
Практична значимість отриманих результатів. Розроблено метод комплексного лікування хворих на ОСД, що включає поряд із базовою терапією цитофлавін, який є природнім метаболітом організму, стимулює тканинне дихання та є метаболічним енергокоректором, а також тіотриазолін з антиоксидантною та мембраностабілізуючою дією.
Розроблено метод тепловізійної діагностики загострень ОСД на доклінічному етапі, а також метод оцінки ефективності лікування.
Запропоновано спосіб оцінки ефективності лікування, в основу якого покладено визначення кореляційних зв’язків між динамікою активності еластази, КЛА (за оксипроліном) та вмістом ГАГ у сироватці крові при ОСД (патент України на корисну модель № 109591 від 25.08.2016).
Основні положення дисертації впроваджено в практичну роботу КНП «Міський шкірно-венерологічний диспансер № 2» Харківської міської ради, КНП «Міський шкірно-венерологічний диспансер № 1» Харківської міської ради, КНП Харківської обласної ради «Обласний клінічний шкірно-венерологічний диспансер №1», КП «Рівненський обласний шкірно-венерологічний диспансер» Рівненської обласної ради, а також у навчальний процес кафедри дерматовенерології та ВІЛ/СНІДу Харківської медичної академії післядипломної освіти.
Особистий внесок здобувача. Ідея дисертаційної роботи, обґрунтування мети, завдань і способів їх вирішення належать автору. Автором особисто проведено аналіз вітчизняної та зарубіжної літератури з проблеми, інформаційний пошук, набір клінічного матеріалу, вибір і обґрунтування методів дослідження, статистичну обробку отриманих даних.
Автор самостійно провів обстеження, лікування, проаналізував і систематизував отримані результати, розробив і впровадив способи і пристрої для діагностики та лікування хворих зазначеної категорії.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Дисертантом не були використані результати та ідеї співавторів публікацій. Конфлікту інтересів немає.
Апробація результатів дисертації. Основні положення дисертації повідомлені та обговорені на XIII Міжнародній науковій конференції студентів та молодих вчених «Актуальні питання сучасної медицини» (Харків, 2016); науково-практичній конференції молодих вчених з міжнародною участю, присвяченій 25 річниці від заснування Національної академії медичних наук України «Новітні впровадження молодих вчених в сучасній дерматовенерології» (Харків, 2018); науково-практичній конференції лікарів дерматовенерологів та косметологів Харківської області з міжнародною участю «Актуальні питання дерматології, дерматовенерології, косметології, венерології, ІПСШ та інших соціально-небезпечних хвороб» (Харків, 2018); науково-практичній конференції з міжнародною участю «Питання профілактики, сучасна діагностика та інноваційні методи терапії в дерматовенерології» (Харків, 2018).
Публікації. За темою дисертації опубліковано 10 наукових праць, з них у виданнях, що рекомендовані ДАК України – 6 (5 – самостійно); серед них 6 – у виданнях, які входять до міжнародних наукометричних баз даних, 1 – у науковій монографії, тез – 2, отримано 1 патент України на корисну модель.
Структура і обсяг дисертації. Дисертація складається зі вступу, огляду літератури, чотирьох розділів власних досліджень, аналізу та обговорення отриманих результатів, висновків, рекомендацій і двох додатків. Робота, яку викладено на 197 сторінках тексту комп’ютерного набору, містить 38 рисунків і 33 таблиці. Список використаних джерел включає 215 джерел, з них 62 – кирилицею і 153 – латиницею.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріал та методи. Під спостереженням перебувало 107 хворих на ОСД, що знаходилися на стаціонарному лікуванні у відділенні дерматології ДУ «Інститут дерматології та венерології НАМН України» з 2014 по 2018 рр., у тому числі 21 (19,58 %) чоловіків та 86 (80,41 %) жінок, віком 21–70 років. Найбільша кількість хворих на ОСД відзначалася у віковій групі 31–50 років.
Усі хворі надходили до стаціонару у період маніфестації або прогресування захворювання. Анамнестичні дані включали відомості про давність і причини захворювання, проведене раніше лікування, дані про попередні і супутні захворювання.
Критеріями включення в дослідження стали: наявність ОСД у хворих із встановленим діагнозом, тобто, як типова картина захворювання в стадії еритеми (набряку) і/або ущільнення, так і відсутність ознак системності процесу, вік від 25 до 70 років, отримання інформованої згоди пацієнта.
Критерії виключення пацієнта з дослідження (що планувалося використовувати): прояви небажаних явищ, що пов’язані з терапією або невиконанням режиму призначеної схеми терапії, але хворих, виключених із дослідження у зв’язку з небажаними явищами, пов’язаними з розробленою терапією, не було.
З метою вивчення ефективності комбінованого використання традиційної терапії та нових методів лікування ОСД, які включали препарати тіотриазолін і цитофлавін, усіх пацієнтів було розподілено на три зіставні за всіма параметрами групи випадковим чином. Групи довільно формувалися з хворих, що відповідали критеріям включення.
В основну групу увійшли 36 (34,01 %) хворих ОСД, що отримали комплексне лікування за схемою, методику якої було розроблено у клініці інституту: базове лікування (базове лікування (пеніцилін G – по 5,0 млн на 100,0 фізіологічного розчину внутрішньовенно краплинно протягом 10–12 діб; аскорбінова кислота 10,0 % – по 2,0 мл внутрішньом’язово протягом 10–15 діб; нікотинова кислота 1 % – по 1,0 мл внутрішньом’язово протягом 10 діб; зовнішнє лікування – траумель С мазь і аплікації з розчином димексиду 1:4 (згідно стандартам терапії ОСД), а також додатково тіотриазолін 2,5 % по 4,0 мл внутрішньом’язово протягом 10–15 діб та цитофлавін по 10,0 мл на 200,0 фізіологічного розчину внутрішньовенно краплинно протягом 10 діб із подальшим переходом на таблетовану форму препарату по 2 таблетки 2 рази на добу протягом 25 діб.
До І групи порівняння було включено 38 (35,05 %) пацієнтів, які отримували терапію, що включала тільки базисне лікування.
У ІІ групу порівняння увійшли 33 (30,92 %) хворих, які одержували лікування за схемою, що включала базове лікування з додаванням тіотриазоліну 2,5 % по 4,0 мл внутрішньом’язово протягом 10-15 діб.
Для проведення порівняльного аналізу та отримання більш достовірних результатів дослідження додатково було введено контрольну групу, що складалася з 25 умовно-здорових обстежених добровольців, мешканців Харківського регіону.
Групи пацієнтів були репрезентативними за статтю, віком, вихідними клініко-лабораторними показниками.
Усі клінічні дослідження проводилися в клінічній лабораторії ДУ «Інститут дерматології та венерології НАМН України». Імуноферментні дослідження виконували на базі діагностичної лабораторії молекулярних і клітинних технологій з імуноферментним і імунофлюоресцентним аналізом ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України» за допомогою сучасного мікроскопа Olympus BX-i53 (Japan) та програмного забезпечення.
Біохімічні дослідження проводилися на базі кафедри біологічної хімії Харківського національного медичного університету.
Тепловізійна візуалізація склеродермічних осередків та здорових тканин шкіри проводилася на базі ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України» з використанням матричного тепловізора марки ТК-1, виготовленим у Фізико-технічному інституті низьких температур ім. Б. І. Вєркіна НАН України (Харків, Україна).
Статистична обробка результатів дослідження здійснена з використанням непараметричного методу порівняння незалежних груп за Манна-Уітні, а також за допомогою стандартного пакета прикладних програм R, Microsoft Excel 2000 і STATISTICA 7.0. Усі дані оброблені методом варіаційної статистики з використанням критерію Стьюдента. Для вибору найбільш інформативних показників використаний кореляційний, системний багатофакторний і регресивний аналіз.
Результати та їх обговорення. З метою визначення впливу порівнюваних методів лікування на порушення біохімічних та імунологічних показників, які були виявлені до лікування у хворих на ОСД, вважалося за доцільне порівняти динаміку цих показників у основній групі та групах порівняння І і ІІ.
До проведення лікування у 90 (87,3 %) хворих відзначалися різного роду скарги, серед яких переважали: підвищена дратівливість, стомлюваність, порушення ритму нічного сну, зниження працездатності, тобто суб’єктивні симптоми, які свідчать про погіршення загального стану хворих на ОСД.
Найбільш виражене зниження суб’єктивної симптоматики у пацієнтів із ОСД було відзначено у пацієнтів основної групи, які отримували комбіновану терапію з включенням сучасних схем лікування, де у більшості хворих відзначався значний регрес (на 51,3 %) скарг, що спостерігалися в початковому стані. У І групі порівняння до кінця лікування скарги хворих були менш вираженими, але знизилися в середньому на 21 %, а у ІІ групі порівняння зниження відмічено всього на 16,5 %.
Деяким пацієнтам з ОСД, які знаходилися на лікуванні у клініці ДУ «Інститут дерматології та венерології НАМН України», за «сліпою» вибіркою проведено термометричне дослідження.
У групу дослідження увійшли 26 хворих на ОСД у віці від 17 до 65 років, з них 24 (92,3 %) – жінки, 2 (7,7 %) – чоловіки. При дистанційній термографії в проекції склеродермічних осередків до проведення лікування у 24 (92,3 %) пацієнтів досліджуваної групи у прогресуючій стадії (наявність віночка лілового, рожево-синюшного кольору з фіолетовим відтінком, який переходив в незмінену шкіру, що по суті й було критерієм активності процесу) були виявлені ділянки гіпертермії, що свідчило про наявність запалення в зазначених осередках (рис. 1). Як правило, найвищі значення температури у хворих у прогресуючій стадії до проведення лікування фіксувалися ексцентрично, з їх максимумом у зонах, розташованих трохи нижче склерозованого осередку.
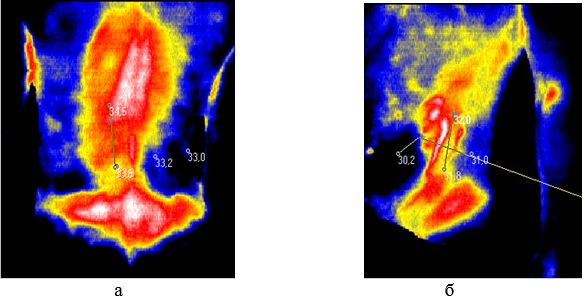 Рисунок 1 – Термограми хворих на ОСД у прогресуючій стадії:
Рисунок 1 – Термограми хворих на ОСД у прогресуючій стадії:
а – хвора Г., 57 років; б – хвора М., 22 років, до проведення лікування
У 2 (7,7 %) пацієнтів у стадії атрофії шкіри, в проекції склеродермічних осередків при дистанційній термографії були виявлені ділянки гіпотермії, що свідчило про наявність процесів склерозування в даних осередках.
При комплексному обстеженні хворих було встановлено пряму залежність між клінічними проявами, лабораторними змінами і ділянками гіпертермії у 15 пацієнтів обстежуваної групи (57,7 %). Також пряму залежність між клінічними проявами та ділянками гіпертермії було виявлено у 11 обстежуваних хворих, що становило 42,3 %. У 2 пацієнтів (7,7 %) встановлено пряму залежність між клінічними проявами у вигляді атрофії шкіри в осередках ураження і ділянками гіпотермії на термограмах.
Серед обстежених хворих методом дистанційної термографії у 4 були відсутні клінічні ознаки прогресування процесу. При цьому були виявлені ділянки гіпертермії навколо зони атрофії та ущільнення шкіри в осередках ураження.
Подальше спостереження за цими хворими виявило клінічні ознаки прогресування хвороби, що дало можливість зробити висновок про виникнення гіпертермії в ділянках прогресування захворювання раніше за появу клінічних ознак останнього. Тобто цей метод може бути використаний для діагностики прогресування захворювання на доклінічному етапі та відповідно дає можливість максимально рано призначити відповідне лікування, а в разі збереження гіпертермії після стандартного лікування слугувати обґрунтуванням для подовження курсу базової терапії.
З метою удосконалення методів лікування ОСД вважалося за доцільне доповнити базовий метод лікування лікарськими засобами, що передбачає застосування антифіброзних, дезінтоксикаційних, вазоактивних, нестероїдних протизапальних препаратів, гепатопротекторів, вітамінів за стандартними методиками.
Розроблено спосіб оцінки ефективності лікування хворих на ОСД (патент України на корисну модель № 109591 від 25.08.2016). В основу даного способу поставлено завдання розширення арсеналу способів оцінки ефективності лікування хворих на ОСД шляхом оцінки в сироватці крові активності еластази, КЛА та накопичення ГАГ.
Від стану СТ в організмі залежить ймовірність розвитку різних стадій ОСД, у зв’язку з чим було проведено дослідження з виявлення особливостей структурно-метаболічного стану СТ у хворих на ОСД усіх досліджуваних груп. Найбільший рівень еластази виявлено у групі хворих на ОСД до лікування –(45,5 ± 11,6) пг/мл. Після проведеного лікування у хворих на ОСД І та ІІ груп порівняння виявлено високу активність рівнів еластази ([40,6 ± 4,2] і [39,4 ± 3,7] пг/мл), що перевищували показники групи умовно-здорових донорів, відповідно в 1,5 і 1,4 раза. У хворих основної групи після лікування цей показник був збільшеним лише в 1,3 раза порівняно з референтними значеннями умовно-здорових донорів (табл. 1).
Вміст ГАГ був підвищеним у всіх досліджуваних групах. Максимальне збільшення вмісту ГАГ виявлено в групі хворих на ОСД до лікування – (48,5 ± 5,4) мкмоль/л. Після проведеного лікування у хворих на ОСД групи порівняння цей показник перевищував рівень референтних значень групи умовно-здорових донорів у середньому в 1,4 раза. При цьому в основній групі вміст ГАГ перевищував рівень референтних значень групи умовно-здорових донорів усього на 18 %. КЛА плазми крові мала схожу динаміку, не залежала від статі та добре корелювала з показниками активності еластази (табл. 2).
Таблиця 1 – Вміст ГАГ і активність еластази в плазмі крові хворих на ОСД до лікування і залежно від одержуваної терапії
| Досліджувані групи | Показники, М ± m | |
| Еластаза, пг/мл | ГАГ, мкмоль/л | |
| Контрольна група (здорові донори) | 27,3 ± 1,8 | 35,8 ± 1,2 |
| Хворі на ОСД до лікування | 45,5 ± 11,6 | 48,5 ± 5,4 |
| Хворі на ОСД після лікування | ||
| Основна група | 36,8 ± 6,4 | 44,1 ± 2,5 |
| І група порівняння | 40,6 ± 4,2 | 47,6 ± 8,4 |
| ІІ група порівняння | 39,4 ± 3,7 | 45,6 ± 4,3 |
Примітка. * – вірогідність відмінностей р < 0,05
Таблиця 2 – Динаміка рівня КЛА плазми крові (за оксипроліном) у хворих на ОСД до і після лікування
| Стадія патологічного процесу | КЛА крові, М±m (мкмоль оксипроліну/л·г) |
| Контрольна группа (умовно-здорові донори) | 7,4 ±0,6 |
| Хворі на ОСД до лікування | 34,3 ± 3,6* |
| Хворі на ОСД після лікування | |
| Основна група | 16,8 ± 6,4 |
| І група порівняння | 31,8 ± 4,3* |
| ІІ група порівняння | 28,4 ± 3,5 |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
Найбільш високі значення оксипроліну виявилися у пацієнтів із ОСД до лікування – (34,3 ± 3,6) мкмоль оксипроліна/л∙г, а також після лікування в І та ІІ групах порівняння ([31,8 ± 4,3] і [28,4 ± 3,5] мкмоль оксипроліну/л∙г). При цьому в основній групі зафіксовано значне зниження цього показника майже вдвічі – (16,8 ± 6,4) мкмоль оксипроліну/л∙г порівняно з показниками хворих на ОСД до лікування. Однак ці рівні після лікування були значно нижчими, ніж показники у пацієнтів І і ІІ груп порівняння. Рівні КЛА плазми крові у пацієнтів із ОСД до лікування перевищували дані умовно-здорових пацієнтів, що забезпечує цьому показнику важливе діагностичне і прогностичне значення при визначенні ступеня вираженості та локалізації осередків.
Таким чином, результати проведеного дослідження виявили низку особливостей біохімічних показників і свідчать, що ОСД у прогресуючій стадії супроводжувалася порушеннями метаболічного обміну СТ, які пов’язані з активацією протеїназ і накопиченням у сироватці крові ГАГ. Високий кореляційний зв`язок між динамікою активності еластази, КЛА (за оксипроліном) та вмістом ГАГ сироватки крові при ОСД дозволяє використовувати ці показники для диференційної діагностики й вибору комплексної терапії, як прогностично значущі в динаміці патогенетичного лікування, що забезпечує підвищення ефективності його проведення.
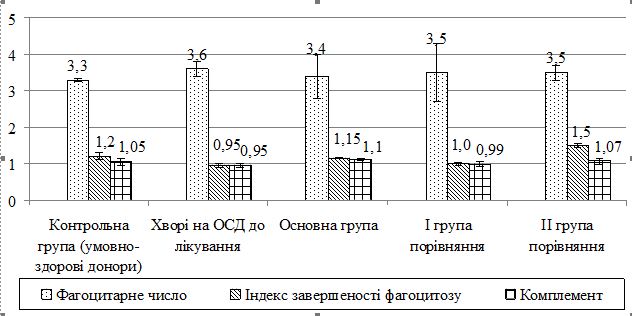
В аналізованих групах хворих виявлено незначні зміни за показниками неспецифічної резистентності. В основній групі пацієнтів після лікування фагоцитарний індекс був на 5 % нижчим, ніж у групах порівняння і становив (75,5 ± 6,0) %. Фагоцитарне число, що відображає середню кількість захоплених частинок фагоцитом в основній групі становило 3,4 ± 0,6. Перетравлювальна активність нейтрофілів (індекс завершеності фагоцитозу) в основній групі пацієнтів була вищою, ніж у групі пацієнтів із ОСД до лікування на 13 % і становила 1,1 ± 0,03 (рис. 2).
Рисунок 2 – Показники неспецифічної резистентності у хворих
на ОСД досліджуваних груп після лікування
В основній досліджуваній групі після проведеного лікування також виявлено незначну активацію системи комплементу. У даній групі активність комплементу була на 6 % вищою порівняно з групами порівняння і на 13 % вищою, ніж у групі пацієнтів із ОСД до лікування. У досліджуваних хворих на ОСД після проведення лікування виявлено тенденцію до нормалізації середніх показників гуморальної ланки імунітету.
Концентрація пептидів середньої молекулярної маси (ПСММ) у пацієнтів основної групи після лікування знаходилася на рівні (0,264 ± 0,020) ум. од., що була в 1,1 раза нижчою порівняно з групою пацієнтів із ОСД до лікування.
З огляду на високу біологічну активність ПСММ, у пацієнтів досліджуваних груп можливі прояви їх нейротоксичної дії, пригнічення процесів біосинтезу білка, пригнічення активності ряду ферментів (роз’єднання процесів окислення і фосфорилювання), виникнення станів вторинної імунодепресії, токсична дія на еритропоез. У пацієнтів І групи порівняння при загостренні захворювання середній рівень автоімунних антитіл у тесті лімфоцитотоксичності перевищував референтні значення показника в середньому в 1,2 раза. У пацієнтів основної групи після проведеного лікування відзначено зниження на 15 % рівня лімфоцитотоксичності щодо показників І групи порівняння.
Також у пацієнтів I групи порівняння після лікування спостерігалося підвищення (на 13 %) рівня ЦІК до (113,2 ± 11,9) ум. од. Е при контрольному значенні показника – (98,3 ± 21,1) ум. од. Е (р < 0,05). В основній групі після лікування виявлено мінімальний рівень концентрації ЦІК порівняно з досліджуваними групами ([102,21 ± 15,1] ум. од. Е). Рівень константи ЦІК, що характеризує молекулярну масу ЦІК, в основній групі після лікування був на 8 % нижчим, ніж у контролі. Що стосується оцінки концентрації антитіл до нативної ДНК, то були виявлені достовірні зміни концентрації специфічних антитіл до нативної ДНК методом імуноферментного аналізу у хворих двох досліджуваних груп порівняно з референтними значеннями. У хворих І і II груп порівняння після лікування виявлено більш високу концентрацію антитіл до подвійної спіралі ДНК (до (1,6 ± 0,06) од. Е) порівняно з хворими основної групи, в яких антитіла становили в середньому (1,2 ± 0, 04) од. Е (р < 0,05). Отже, збільшення концентрації антитіл до нативної ДНК достовірно взаємопов'язане з перебігом захворювання і свідчить про збереження автоімунного компонента у хворих І і II груп порівняння, навіть після проведеної комплексної терапії.
У всіх хворих основної групи після лікування спостерігалося незначне пригнічення показників Т-клітинного імунітету. У ході дослідження встановлено незначне зниження відносної кількості найбільш функціонально значущої лімфоїдної субпопуляції CD3+ загальних Т-лімфоцитів – на 3 % щодо референтних значень показника (р ≤ 0,05). Відносні величини, що характеризують експресію диференційованих маркерів CD на Т-хелперній субпопуляції (CD4+), в основній групі були на рівні референтних значень. Експресія Т-кілерної (CD8+) субпопуляції Т-лімфоцитів була зниженою на 6 % відносно референтних значень. Виявлено підвищення експресії диференційованого маркера CD2+ активних Т-лімфоцитів, що беруть участь у стимуляції В-клітин, на 2,5 % порівняно з контрольною групою здорових донорів.
У пацієнтів І і II груп порівняння, на відміну від хворих основної групи, після лікування виявлено зниження (в середньому в 1,3 раза) абсолютної кількості CD2+, CD3+ і CD8+ субпопуляцій Т-лімфоцитів. Імунорегуляторний індекс CD4+/CD8+ в основній групі після лікування був на рівні референтних значень.
Виходячи з мети досліджень, яка полягала в дослідженні параметрів імунореактивності у хворих на ОСД до і після лікування, вдалося виявити індивідуальні значущі імунно-фізіологічні параметри, які в подальшому можуть бути використані для оцінки стану, прогнозу перебігу захворювання, вибору патогенетичної терапії та оцінки її ефективності.
Наприклад, дослідження рівня ЦІК показало, що у хворих в основній групі після проведеного лікування цей показник перевищував величини в контрольній групі лише в 1,05 раза, а в І і II групах порівняння – в 1,2 раза. Константа ЦІК у хворих в обох групах порівняння після лікування була зниженою і свідчила про низькі розміри цих комплексів.
Дослідження концентрації ПСММ свідчило про те, що цей показник значно перевищував референтні значення в обох досліджуваних групах порівняння. Таким хворим показано проведення заходів, спрямованих на зниження рівня ендогенної інтоксикації.
Виявлена висока лімфоцитотоксичність сироватки крові і в основній групі, і в І та ІІ групах порівняння після проведеного лікування свідчить про розвиток у пацієнтів із ОСД автоімунних реакцій. Так, при дослідженні сироватки крові у пацієнтів в основній групі і пацієнтів в І та ІІ групах порівняння методом імуноферментного аналізу виявили наявність антитіл до нативної та денатуруючої ДНК. При цьому в І та ІІ групах порівняння концентрація автоантитіл достовірно відрізнялася від показників основної групи після лікування, що відбивалося на стані таких хворих та також свідчило про перевагу методу лікування, що пропонується (основна група).
Аналіз результатів обстеження пацієнтів основної групи після проведеного лікування показав, що найбільш значущими з усього масиву досліджуваних параметрів, що характеризують функціональну активність імунокомпетентних клітин, є диференціювальні маркери СD3+, CD4+ і CD8+. Проведені дослідження субпопуляційного складу Т-лімфоцитів у хворих основної групи після проведеного лікування показали зниження рівня CD3+, CD4+ і CD8+ Т-лімфоцитів порівняно з референтними значеннями.
Максимальне зниження експресії маркерів диференціювання CD3+ і CD4+ спостерігалося після лікування і в І та ІІ групах порівняння, що свідчило про збереження у таких пацієнтів імунодефіцитних станів Т-клітинної ланки імунітету. Регуляторні тимічні пептиди здійснюють дистанційне керування клітинами периферичної імунної системи, спричиняючи стимуляцію їх диференціювання і дозрівання. Активовані лімфоїдні клітини периферичної імунної системи продукують цитокіни, які ініціюють проліферацію й дозрівання Т- і В-лімфоцитів. При цьому знижені показники підвищуються, а гіперактивні процеси в окремих субпопуляціях Т-лімфоцитів повертаються до значень, близьких до нормального рівня.
Вивчення вмісту в сироватці крові медіаторів імунної системи до та після проведеного лікування виявило динамічні зміни всіх досліджуваних цитокінів і неоднозначну їх спрямованість у різних досліджуваних групах. Так, у І і ІІ групах порівняння виявлено статистично достовірне збільшення концентрації всіх досліджуваних цитокінів, крім ІЛ-4 і ІЛ-10, які були знижені в другій групі порівняння на 30% щодо референтних значень групи умовно-здорових донорів. У середньому відзначали зростання концентрації про- і антизапальних цитокінів від 2 до 7 разів. Максимальний рівень ІЛ-10, який склав 67,6 ± 14,3 пкг / мл, виявили в першій групі порівняння.
В основній групі концентрація прозапальних цитокінів була виявленою на рівні референтних значень групи умовно здорових донорів. Концентрація протизапальних цитокінів інтерлейкінів (ІЛ) -4 і -10 в основній групі перевищувала рівень референтних показників групи умовно-здорових донорів в 1,1 і 1,3 раза відповідно.
Дослідження вказують, що у хворих на ОСД у всіх досліджуваних групах зберігався фактор некрозу пухлини – α (ФНП-α), що може вказувати на активацію макрофагів, моноцитів, посилення цитотоксичної дії, індукцію секреції цитокінів. Дія ФНП-α може супроводжуватися посиленням проліферації та диференціюванням нейтрофілів, фібробластів, Т- і В-лімфоцитів, а також посиленням транскрипції прозапальних цитокінів – ІЛ-6, ІЛ-8 та ІЛ-1β.
Підвищення ІЛ-8 у сироватці крові хворих на ОСД вказує на посилення активності широкого спектру імунокомпетентних клітин (моноцитів, макрофагів, нейтрофілів, фібробластів, ендотеліальних клітин та ін.), яка супроводжується стимуляцією хемотаксису нейтрофілів, субпопуляцій Т‑лімфоцитів і базофілів. ІЛ-8 активує нейтрофіли до викиду ферментів лізосомами («дихальний вибух» і дегрануляція), підвищує спорідненість нейтрофілів до ендотеліальних клітин, індукуючи вихід лейкотрієна В4 з нейтрофілів і підвищує спорідненість моноцитів до клітин ендотелію. Це створює метаболічні умови для руйнування клітин шкіри.
Підвищення вмісту ІЛ-4 і -10 у хворих на ОСД І групи порівняння після лікування вказувало на активацію NK-клітин і Тh2-клітин, яка супроводжувалася посиленням функції Т-хелперів, розмноженням активних В-клітин, опасистих і гемопоетичних клітин, пригніченням цитокінової продукції, в тому числі Т‑лімфоцитів первинного типу (Тh1-клітинами), пригніченням активності макрофагів, продукції моноцитами і макрофагами прозапальних цитокінів, на тлі підвищення проліферації В-лімфоцитів і секреції імуноглобулінів. Це свідчило про те, що у хворих на ОСД порушені центральні механізми розвитку і реалізації імунних реакцій, пов’язаних з пригніченням клітинної та гуморальної ланок імунної системи.
Таким чином, аналіз отриманих результатів дає підставу вважати, що в основній групі хворих на ОСД після проведеного лікування за сучасною розробленою схемою, значно активувалася продукція анти- і прозапальних медіаторів імунної системи, тоді як у І та ІІ групах порівняння хворих на ОСД зберігалося пригнічення секреції антизапальних цитокінів на тлі підвищення прозапальних медіаторів, що може мати прогностичне значення для подальшої оптимізації патогенетичної терапії у хворих цих груп.
Отримані в дослідженні суперечливі дані лише підтверджують маловивчені та складні механізми функціонування деяких прозапальних цитокінів при автоімунних процесах. Розроблена терапія ОСД справляє позитивний вплив на основні показники гомеостазу у пацієнтів, сприяє зниженню прозапальних ІЛ-1 і ФНП-α, а також редукції клінічних проявів.
Результати проведених досліджень свідчать про патогенетичну спрямованість комплексного застосування терапії на підставі розробленої схеми патогенетичного лікування, включно із застосуванням 2,5 % розчину тіотриазоліну і цитофлавіну на тлі традиційної терапії у пацієнтів з ОСД, що супроводжується швидким і вираженим регресом основних клінічних проявів дерматозу, і полягає в основі високого терапевтичного ефекту нового сучасного розробленого способу лікування.
ВИСНОВКИ
У дисертації наведено теоретичне обґрунтування необхідності та нове вирішення наукового завдання, що полягає в підвищенні ефективності діагностики та лікування хворих на ОСД шляхом розробки комплексного методу терапії з урахуванням клініко-патогенетичної ролі метаболічних та імунних порушень.
- Враховуючи розповсюдженість ОСД, хронічний персистуючий перебіг захворювання з формуванням стійких осередків атрофії та ущільнення шкіри, а також недостатню ефективність існуючої терапії та невирішеність питань діагностики прогресування захворювання, розв’язання цієї проблеми є актуальним для сучасної та практичної дерматології.
- За результатами комплексного обстеження хворих на ОСД залежно від стану було виявлено підвищення рівня ендогенної інтоксикації (на 20 %), що відбувалося на тлі зниження експресії антигенних маркерів CD3+ (на 29 %) та CD8+ (на 19 %). У декількох хворих (4 пацієнти) виявлено наявність антитіл до нативної ДНК, що підкреслювало наявність автоімунного компоненту. Збільшення концентрації СРБ (у 4 рази) вказувало на перебіг гострої фази запального процесу. Зміна вмісту білкових і ліпідних фракцій розглядалась як додаткові фактори порушення регуляторних і регенеративних функцій на рівні структурної організації клітинних мембран. Значне збільшення рівня еластази (на 35 %), ГАГ (на 27 %), КЛА плазми крові за оксипроліном (на 57 %) вказувало на незадовільний структурно-метаболічний стан СТ.
- При оцінці мікроциркуляційного стану уражених ділянок за допомогою тепловізійного дослідження у пацієнтів враховувалася стадійність та особливості осередку при ОСД. Найбільші значення температури фіксувались ексцентрично, за їх максимумом у зонах, розташованих у периферичних ділянках склеродермічного осередку. При комплексному обстеженні хворих на ОСД з використанням дистанційної термографії було виявлено пряму залежність між ділянками гіпертермії, запальними клінічними проявами та лабораторними змінами у 15 пацієнтів (57,7 %), між ділянками гіпертермії та запальними клінічними проявами в 11 осіб (42,3 %). Встановлено пряму залежність між ділянками гіпотермії на термограмах та клінічними проявами у вигляді атрофії шкіри в осередках ураження у 2 пацієнтів (7,7 %).
- Метод дистанційної термографії дозволяє судити про активність сполучнотканинного запалення або процесів склерозування в осередках ураження у пацієнтів з ОСД та надає можливість застосування дистанційної термографії як неінвазійного метода діагностики рецидивів у хворих з автоімунними захворюваннями СТ на доклінічному етапі.
- Розроблено алгоритм лікувально-діагностичної тактики для пацієнтів з ОСД, який базувався на процесах уповільнення прогресування хвороби, максимальної стабілізації процесу та регресу клінічної картини. Комплекс лікувальних заходів включав застосування медикаментозної терапії (антифіброзні, дезінтоксикаційні, судинні, метаболічні, мембраностабілізуючі препарати, цитопротектори, вітаміни, антиоксиданти), яка активувала дихання й енергоутворення у клітинах, поліпшувала процеси утилізації кисню тканинами, відновлювала активність ферментів антиоксидантного захисту, що підтверджувалося нормалізацією рівнів показників структурно-метаболічних порушень у СТ (еластази, КЛА, вмісту ГАГ), збільшенням рівнів протизапальних цитокінів ІЛ-4 й ІЛ-10 та вказувало на активацію механізмів, спрямованих на згасання патологічного процесу.
- Комбінована терапія з використанням розроблених схем лікування (у тому числі застосування 2,5 % розчину тіотриазоліну та субстратного антигіпоксанту цитофлавіну) у хворих на ОСД має більш високу терапевтичну ефективність: значне поліпшення у 68,2 % хворих порівняно із традиційною (46,3 %), та супроводжувалося нормалізацією імунологічних і біохімічних показників, а також маркерів структурно-метаболічного стану СТ.
РЕКОМЕНДАЦІЇ
У період маніфестації та прогресування ОСД необхідно проводити комплексне лікування: пеніцилін G – по 5,0 млн на 100,0 фізіологічного розчину внутрішньовенно краплинно протягом 10–12 діб; аскорбінова кислота 10,0 % – по 2,0 мл в/м протягом 10–15 діб; зовнішнє лікування – траумель С мазь і аплікації з розчином димексиду 1:4 (згідно стандартам терапії ОСД), а також додатково тіотриазолін 2,5 % по 4,0 мл внутрішньом’язово протягом 10–15 діб та цитофлавін по 10,0 мл на 200,0 фізіологічного розчину внутрішньовенно краплинно протягом 10 діб із подальшим переходом на таблетовану форму препарату по 2 таблетки 2 рази на добу протягом 25 діб.
В якості способу оцінки ефективності лікування доцільно визначати вміст ГАГ, активність ферментів еластази та КЛА сироватки крові за сумарною кількістю вільного та пептидно-зв’язаного оксипроліну.
Метод дистанційної термографії можливо використовувати для виявлення наявності прогресування захворювання (у ряді випадків навіть на доклінічній стадії).
СПИСОК НАУКОВИХ ПРАЦЬ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Ата М. А. Дистанционное термометрическое исследование измененных кожных покровов у больных очаговой склеродермией. Дерматологія та венерологія. № 2 (80). С. 50–53.
- Ата М. А. Лечение очаговой склеродермии с применением современных методов. Дерматологія та венерологія. 2018. № 3 (81). С. 22–24.
- Ата М. А. Особенности активности эластазы, коллагенолитической активности и содержания гликозаминогликанов у больных ограниченной склеродермией. Дерматологія та венерологія. 2018. № 4 (82). С. 23–26.
- Кутасевич Я.Ф., Ата М.А. Особенности формирования синдрома иммуно-эндокринной дисфункции у больных очаговой склеродермией в стадии обострения. Международный медицинский журнал. 2019. № 1. С. 75–79.
- Ата М. А. Прогнозирование развития иммунной дисфункции у больных очаговой склеродермией по состоянию некоторых звеньев иммунного ответа. Дерматологія та венерологія. 2019. № 1 (82). С. 14–
- Ата М. А. Особенности биохимических изменений у больных ограниченной склеродермией. ScienceRise: Medical Science. 2019. № 1 (28). С. 20–24.
- Применение современных способов диагностики очаговой склеродермии / Я. Ф. Кутасевич, И. А. Олейник, М. А. Ата, П. Н. Замятин, К. В. Дубровский. Spatial aspects of socio-economic systems development: the economy, education and health care. Monograph. Opole, Poland : Publishing House WSZiA, 2015. P. 258–265 (Автором проведено статистичну обробку, визначено інформативність методики для виявлення ускладнень та моніторингу лікування).
- Пат. на корисну модель 109591 Україна, МПК 7 G01N33/49 (2006.01). Спосіб оцінки ефективності лікування хворих на вогнищеву склеродермію / М.А. Ата, Я. Ф. Кутасевич, В. І. Жуков. № u201602567; заявл. 16.03.2016; опубл. 25.08.2016, Бюл. № 16.
- Ата М. А. Оцінка ефективності лікування хворих на вогнищеву склеродермію. Мат. ХІІІ Міжнародної конференції студентів та молодих вчених «Актуальні питання сучасної медицини», м. Харків, 14-15 квітня 2016 р. Харків : ХНУ ім. В.Н. Каразіна, 2016. С. 31.
- Олійник І.О., Ата М.А., Кордон Т.В. Стан мікроциркуляторного русла шкіри при обмеженої склеродермії. Матеріали науково-практичної конф. з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», м. Харків, 10-11 листопада 2017. Дерматологія та венерологія. 2017. № 3 (77). С. 109 (Автором здійснено добір та аналіз літератури, обробка й узагальнення результатів досліджень).
АНОТАЦІЯ
Ата Мохамед Аббас Мохамед. Оптимізація діагностики і лікування обмеженої склеродермії з урахуванням клініко-патогенетичної ролі метаболічних та імунних порушень. – На правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби. – ДУ «Інститут дерматології та венерології НАМН України», Харків, 2019.
Дисертація присвячена проблемі підвищення ефективності діагностики і терапії обмеженої склеродермії (ОСД) на основі оптимізації діагностичної та лікувальної тактики. У дисертації на підставі комплексного клінічного дослідження і аналізу причинно-наслідкових чинників розвитку ОСД доповнено наукові дані про особливості клінічної картини, конкретизовано зміни гомеостазу, які характерні для перебігу даного захворювання. Доведено можливість оцінки ефективності лікування хворих на різні форми та стадії ОСД шляхом визначення в сироватці крові активності еластази, колагенолітичної активності та накопичення глікозаміногліканів. Вперше дано тепловізійну оцінку стадій ОСД. Доведена можливість діагностики прогресуючої стадії захворювання на доклінічному етапі. Розроблено метод комплексного лікування хворих на ОСД, що включає поряд із базовою терапією цитофлавін і тіотриазолін.
Ключові слова: обмежена склеродермія, сучасна діагностика, комплексне лікування.
АННОТАЦИЯ
Ата Мохамед Аббас Мохамед. Оптимизация диагностики и лечения ограниченной склеродермии с учетом клинико-патогенетической роли метаболических и иммунных нарушений. – На правах рукописи.
Диссертация на соискание научной степени кандидата медицинских наук по специальности 14.01.20 – кожные и венерические болезни. – ДУ «Институт дерматологии и венерологии НАМН Украины», Харьков, 2019.
Диссертация посвящена проблеме повышения эффективности диагностики и терапии ограниченной склеродермии (ОСД) на основе оптимизации диагностической и лечебной тактики. В диссертации на основании комплексного клинического исследования и анализа причинно-следственных факторов развития ОСД дополнены научные данные об особенностях клинической картины, конкретизированы изменения гомеостаза, характерные для течения данного заболевания. Доказана возможность оценки эффективности лечения больных с различными формами и стадиями ОСД с помощью определения в сыворотке крови активности эластазы, коллагенолитической активности и накопления гликозаминогликанов. Впервые дана тепловизионная оценка стадий ОСД. Доказана возможность диагностики прогрессирующей стадии заболевания на доклиническом этапе. Разработан метод комплексного лечения больных с ОСД, включающий, наряду с базовой терапией, цитофлавин и тиотриазолин.
Ключевые слова: ограниченная склеродермия, современная диагностика, комплексное лечение.
SUMMARY
Atа Мokhamed Abbas Mokhamed. Optimization of diagnosis and treatment of limited scleroderma, taking into account the clinical and pathogenetic role of metabolic and immune disorders. – The manuscript.
The dissertation for the degree of candidate of medical sciences in specialty 14.01.20 – skin and venereal diseases. – SE “Institute of Dermatology and Venereology of NAMS of Ukraine”, Kharkiv, 2019.
The dissertation is devoted to the problem of increasing the effectiveness of diagnosis and treatment of localized scleroderma, on the basis of optimization of diagnostic and therapeutic tactics.
In the thesis, on the basis of a comprehensive clinical study and analysis of causal factors for the development of localized scleroderma, scientific data on the clinical picture features are specified, changes in homeostasis characteristic of the course of the disease are specified.
The possibility of evaluating the effectiveness of treatment of patients with various forms and stages of localized scleroderma has been proved by determining the activity of elastase, collagenolytic activity and accumulation of glikozamіnoglіkans in serum.
In the work, for the first time, the method of thermal imaging diagnostics of exacerbations of localized scleroderma has been developed, which allows to judge the activity of connective tissue inflammation or the processes of sclerosis in the cells of the lesion in patients with limited scleroderma and provides the possibility of using remote thermography as a non-invasive method for the diagnosis of relapses in patients with autoimmune connective tissue diseases at the preclinical stage. The study established a direct relationship between clinical manifestations, changes in laboratory parameters and hyperthermia. The performed statistical determination, namely, the comparison of the obtained values of temperatures with each other by the Dana method, allowed to substantiate the temperature reaction to the defeat and its dependence on the degree of distribution of the skin, which can serve as a prerequisite for improving the diagnosis and the appointment of adequate therapeutic therapy or prevention of this type of dermatosis. The method makes it possible to judge the activity of connective tissue inflammation or the processes of sclerosis in the lesion’s cells in patients with limited scleroderma and allows the use of remote thermography as a non-invasive method for the diagnosis of relapses in patients with autoimmune connective tissue diseases at the preclinical stage.
The results of the conducted research indicate the pathogenetic orientation of the complex application of therapy on the basis of the developed scheme of pathogenetic treatment, including the use of 2.5% solution of Thiotriazoline and Citoflavin against the background of traditional therapy in patients with focal scleroderma, accompanied by a rapid and severe regression of the main clinical criteria for dermatosis, and is the basis of the high therapeutic effect of a new modern developed method of treatment.
The developed combination method of treatment is pathogenetically grounded, highly effective method of therapy and prevention of limited scleroderma. The pathogenetic effect is determined by high restorative potential, which leads to the formation and synthesis of biologically active substances, enhancement of the activity of immunocompetent cells, stimulation of reparative processes, renewal of antioxidant defense enzymes activity. Safe use, the availability of such therapy justifies the feasibility of using drugs that improve the connective tissue in the treatment of patients with localized scleroderma and can recommend them for implementation in the practice of health care. Implementation of the results of the conducted research into practice allowed to optimize the results of treatment for patients with localized scleroderma, contributed to reducing the bed-day and improving the quality of their life in the future.
The method of assessing the effectiveness of treatment for patients with limited scleroderma is developed (the Ukrainian Patent for Utility Model No. 109591), which is based on the task of expanding the arsenal of methods for assessing the effectiveness of treatment for patients with limited scleroderma by assessing the activity of elastase in blood serum, collagenolytic activity and accumulation glycosoaminoglycans in patients with localized scleroderma. The possibility of evaluating the effectiveness of treating patients with different forms and stages of localized scleroderma by the determination of elastase activity, collagenolithic activity and accumulation of glycosaminoglycans in blood serum was proved.
A method of complex treatment of patients with localized scleroderma has been developed, including, along with basic therapy, cytoflavin, which is a natural body metabolite, stimulates tissue respiration and is a metabolic energy regulator, as well as thiotriazolin with antioxidant and membrane stabilizing effects.
Keywords: limited scleroderma, modern diagnostics, complex treatment.