Запорізький державний медичний університет Міністерство охорони здоров’я України
Державна установа «Інститут дерматології та венерології Національної академії медичних наук України»
Кваліфікаційна наукова праця на правах рукопису
Веретельник Ксенія Олександрівна
УДК 616.517 – 06: 616.5 – 002.828] – 039 – 085
ДИСЕРТАЦІЯ ОСОБЛИВОСТІ КЛІНІЧНИХ ПРОЯВІВ ПСОРІАЗУ З СУПУТНІМ МАЛАСЕЗІОЗОМ ШКІРИ ТА МЕТОДИ КОМПЛЕКСНОЇ ДИФЕРЕНЦІЙОВАНОЇ ТЕРАПІЇ
14.01.20 – шкірні та венеричні хвороби
Подається на здобуття наукового ступеня кандидата медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
_______________________________________________Веретельник К.О.
(підпис, ініціали та прізвище здобувача)
Науковий керівник: Федотов Валерій Павлович, доктор медичних наук, професор
Запоріжжя – 2017
АНОТАЦІЯ
Веретельник К.О. Особливості клінічних проявів псоріазу з супутнім маласезіозом шкіри та методи комплексної диференційованої терапії. – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби. – Запорізький державний медичний університет МОЗ України, Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2017.
Дисертація присвячена рішенню актуальної наукової задачі – підвищення ефективності лікування хворих на псоріаз шляхом розробки комплексної диференційованої терапії з використанням етіотропних та патогенетичних препаратів з урахуванням показників психоемоційного статусу, імунних зрушень, стану деяких регулюючих систем гомеостазу, біохімічних показників та стану функції печінки.
У дисертації встановлено пряму залежність стану імунного статусу, показників окислювальної модифікації білків, NO-синтази, біохімічних даних та печінкових тестів від особливостей клінічних проявів і перебігу ускладнених форм псоріазу.
Під спостереженням знаходилося 110 хворих на псоріаз (чоловіків – 65, жінок – 45) та 34 практично здорових осіб. Давність захворювання складала 3–8 років. Більшість хворих була у віці 25–46 років. Більшість хворих були мешканці міст, знаходились у шлюбі. Осінньо-зимовий тип встановлено у 81 хворого, весняно-літній – у 20 і змішаний – у 9. Прогресуючу стадію встановлено у 35 хворих, стаціонарну – у 75.
Вульгарний або бляшковий псоріаз діагностовано у 106, краплеподібний – у 2, інтертригінозний – у 2. Псоріатична оніходистрофія була у 48 пацієнтів. Фактор спадковості спостерігався у 25 хворих. Передували виникненню і загостренню псоріазу у 75 % жінок нервові стреси, перевантаження, психоемоційні фактори, у 71 % чоловіків – гострі респіраторні захворювання, грип, ангіни, гайморит, грибкові та вірусні інфекції, інфекції, що передаються переважно статевим шляхом, та ін.
У 80 пацієнтів зі 110 встановлено маласезіоз, обумовлений М. furfur, M. pahidermatis, M. obtuses. У них діагностовано простий пітиріаз, ксероз Дар’є, гнійний фолікуліт, себорейний дерматит, різнокольоровий лишай, нерідко – комбінація декілька нозологій.
У хворих на псоріаз із супутнім маласезіозом виявлено особливості перебігу дерматозу:
– частіше реєструвалися загострення процесу; – швидше розповсюджувався дерматоз; – більш тяжкий перебіг захворювання; – частіше зустрічалася розповсюджена форма дерматозу; – укорочення ремісії; – торпідність до терапії.
Індекс PASI у хворих на псоріаз із супутнім маласезіозом складав 28,21±2,15, а без маласезіозу – 24,41±2,01.
При вивченні психологічного статусу за допомогою шкали Зунга і тесту Шихана встановлено помірну та тяжку депресії у 59 % хворих на псоріаз, особливо при супутньому маласезіозі, а також при розповсюджених формах дерматозу. Встановлено аномальний рівень тривожності, особливо у групі хворих із більшою поширеністю процесу, переважно з супутнім маласезіозом. При вивченні показника якості життя за шкалою РDІ встановлено найбільш виражені зміни цього показника у хворих на розповсюджений псоріаз із давністю дерматозу більше 10 років і при супутньому маласезіозі.
В обстежених хворих на псоріаз, особливо при супутньому маласезіозі, виявлено пригнічення функції фагоцитів (зниження ФП, ФЧ, НСТ-тесту), що було статистично достовірно. Встановлено зниження кількості CD3+, CD4+, індексу CD4+/CD8+, підвищення CD8+,CD16+, CD22+, CD25+, що є проявом вторинного імунодефіциту, збільшення рівнів імуноглобулінів G та M у цих хворих, особливо при супутньому маласезіозі, що є показником прогресування псоріазу і наявності імунопатологічних змін під впливом грибкової інфекції. Також встановлено достовірне підвищення продукції фактора некрозу пухлини – α, інтерлейкіну-1β та -4, більш виражене у хворих із наявністю маласезіозу. Рівень інтерлейкіну-4 може слугувати прогностичним показником можливого загострення псоріазу і появи його рецидиву.
При аналізі показників окислювальної модифікації білків виявлено їх вірогідне збільшення вмісту в обстежених хворих (альдегідфенілгідразонів та кетондинітрофенілгідразонів як спонтанного, так і стимульованого), у порівнянні з контролем, що свідчить про вплив ендогенної інтоксикації на розвиток системних процесів і формування ускладнених форм псоріазу. Було відмічено більш показне зростання цих показників, особливо рівню спонтанних альдегідфенілгідразонів і стимульованих кетондинітрофенілгідразонів у хворих на псоріаз із супутнім маласезіозом.
При вивченні рівня NO-синтази відмічено зростання показників у обстежених хворих, особливо у хворих із розповсюдженими формами псоріазу і при наявності маласезіозу.
При проведенні біохімічних досліджень встановлено у хворих на псоріаз із супутнім маласезіозом статистично достовірне зниження загального білку, збільшення аспартатамінотрансферази, аланінамінотрансферази, холестерину ліпопротеїдів низької щільності, тригліцеридів, а у хворих без маласезіозу – збільшення тільки аспартатамінотрансферази, холестерину ліпопротеїдів низької щільності, особливо при розповсюджених формах дерматозу у прогресуючій стадії. Це розцінено як негативний вплив грибкової інфекції на патогенез псоріазу, що ускладнює перебіг процесу і спонукає до проведення протигрибкової та патогенетичної терапії.
Проведений зіставний аналіз клінічних особливостей і перебігу псоріазу і всіх вивчених лабораторних показників, тестів дозволив об’єднати хворих у дві клініко-терапевтичні групи. Першу групу склали 50 хворих на псоріаз із локалізованими формами дерматозу в стаціонарній стадії, з поверхневими формами маласезіозу, з незначними психоемоційними розладами, індекс PASI – 23,45±2,0. Відмічено незначні порушення імунного статусу, біохімічних показників, печінкових тестів, окислювальної модифікації білків, NO-синтази.
Друга група складалася з 30 хворих розповсюдженими формами псоріазу в стадії прогресування з проявами більш тяжких форм маласезіозу, з переважанням депресивних реакцій, індекс PASI був 29,4±2,1. Відмічено більш суттєві порушення імунного статусу, біохімічних показників, печінкових тестів, окислювальної модифікації білків, NO-синтази.
30 хворих на псоріаз без маласезіозу і 20 хворих із супутнім маласезіозом (перша і друга група порівняння) проліковані традиційно (дієта, Нейровітан, глюконат кальцію, Аєвіт, Адаптол, Алерон, зовнішньо – Бетасалік).
40 хворим першої клініко-терапевтичної групи рекомендувалося додатково до традиційної терапії прийом ітраконазолу, Тіотриазоліну, Атараксу, Еліміналь-гелю, зовнішня терапія – паста Сульсена 1 % за розробленою методикою.
20 хворим другої клініко-терапевтичної групи рекомендували прийом ітраконазолу, Еліміналь-гелю у більш високих дозах і тривалий час, Оверін, Міасер, зовнішньо – як і в першій групі.
Повна ремісія в кінці курсу лікування досягнута у 12 з 50 пацієнтів в обох групах порівняння, значне покращення – у 14 з 50. У той же час у хворих двох основних груп (60 пацієнтів) повна ремісія зареєстрована у 22 хворих, значне покращення – у 26 і покращення – у 12.
Відмічено повний регрес проявів маласезіозу в двох основних групах.
Ремісію менше 1 року відмічено у 25 з 50 хворих груп порівняння і у 2 з 60 хворих основних груп; ремісію до двох років, відповідно, – у 14 з 50, і у 35 з 60; а ремісію більше двох років – у 6 з 50 і у 23 з 60.
У хворих, які отримували рекомендовану терапію, значно покращувався загальний психоемоційний стан, більш показово регресували елементи висипу. Зменшувався індекс PASI, з (28,21±2,15) балів до лікування і до (7,5±0,52) балів після лікування (редукція індексу PASI – 73,41 %). У групах порівняння PASI зменшувався з (24,41±1,14) до (12,2±0,68) балів (редукція індексу PASI – 50 %), що було статистично достовірно (р<0,05).
Індекс недієздатності при псоріазі зменшувався у пацієнтів основної групи з 14,14±1,08 до лікування до 6,32±0,52 після лікування, а у пацієнтів груп порівняння з 13,2±1,04 до лікування 8,38±0,81 після лікування (р<0,05).
Після лікування, особливо у двох основних групах, значно покращувалися показники імунного статусу, окислювальної модифікації білків, NO-синтази, біохімічні дані.
Усім дослідженим після закінчення терапії рекомендовано профілактичні заходи (виявлення тригер-факторів, дієта, раціональне працевлаштування, періодичний прийом лікарських засобів, зовнішня терапія, консультації суміжних фахівців та ін.).
Ключові слова: псоріаз, маласезіоз, шкіра, біохімія, імунітет, лікування, гомеостаз.
SUMMARY
Veretelnyk K.O. Features of clinical manifestations of psoriasis with concomitant malasseziosis of the skin and methods of complex differentiated therapy. – Qualifying scientific work on the rights of manuscripts.
Dissertation for obtaining a candidate degree in medical sciences, specialty 14.01.20 – Skin and Venereal Diseases. – Zaporizhzhya State Medical University of Ministry of Health of Ukraine, State Establishment “Institute of Dermatology and Venereology” of the National Academy of Medical Sciences of Ukraine, Kharkiv, 2018.
The dissertation is devoted to the solution of the actual scientific problem – to increase the efficiency of treatment of patients with psoriasis by developing a complex differentiated therapy with the use of etiotropic and pathogenetic medications, taking into account psychoemotional status, immune changes, the state of some homeostasis regulatory systems and biochemical parameters.
The direct dependence of the state of immune status, indicators of oxidative modification of proteins, NO-synthase, biochemical data and liver tests on the features of clinical manifestations and course of complicated forms of psoriasis was established in the dissertation. 110 patients with psoriasis (men – 59 %, women – 41 %) and 34 practically healthy persons were under supervision. The disease was 3-8 years old. Most of the patients were aged 25-46 years. Most of the patients were city dwellers and were married. The autumn-winter type was established in 73.6 % of patients, spring-summer type – in 18.2% and mixed type – in 8.2 %. Progressive stage was established in 31.8 % of patients, stationary stage – in 68.2 %. Vulgar or plaque psoriasis was diagnosed in 96.4 % of patients, psoriasis guttata – in 3.6 %, intertriginous psoriasis – in 3.6 %. Onihodystrophy was fixed in 43.6 %. Heredity predisposition was observed in 22.7 % of patients. Nervous stress, overload, psycho-emotional factors preceded the onset and exacerbation of psoriasis in 75 % of women; acute respiratory infections, flu, tonsillitis, sinusitis, fungal and viral infections, sexually transmitted infections, etc. preceded the onset and exacerbation of psoriasis in 71 % of men. Malasseziosis was detected in 80 patients among 110 patients. It was caused by M. furfur, M. pachydermatis, M. obtuses. Patients were diagnosed with a simple pytiriasis, Darier xerosis, purulent folliculitis, seborrheic dermatitis, lichen versicolor and frequently – with a combination of several nosologies. Such features of the course of dermatosis were revealed in patients with psoriasis and concomitant malassezosis: – more frequent registration of the aggravation of the process; – more rapid spreading of dermatosis; – a more severe course of the disease; – the disseminated form of dermatosis was more frequent; – shortening of remission; – torpidity to therapy.
PASI index in psoriasis patients with concomitant malasseziosis was 28.21 ± 2.15, and it was 24.41 ± 2.01 in patients without malasseziosis.
Psychological status examination with the use of Zung scale and Sheehan test showed moderate and severe depression in 59 % of patients with psoriasis, especially those, who suffered from concomitant malasseziosis as well as ones with widespread forms of dermatosis. An abnormal level of anxiety was fixed, especially in a group of patients with a greater dissemination of the process and mainly in patients with concomitant malasseziosis. In studying the quality of life on PDI scale, the most significant changes in this index were found in patients with disseminated psoriasis, with a history of dermatosis for more than 10 years and with concomitant malasseziosis.
Statistically significant suppression of the function of phagocytes (reduction of phagocytic index, phagocytic number, HCT-test) was found in the examined patients with psoriasis, especially in patients with concomitant malasseziosis. The decrease in the number of CD3+, CD4+ levels, CD4+/CD8+ index, the increase in CD8+, CD16+, CD22+, CD25+ levels, which was a manifestation of secondary immunodeficiency, as well as the increase in immune globulins G and M levels was fixed in these patients, especially in patients with with concomitant malasseziosis, which was an indicator of the progression of psoriasis and the presence of immunopathological changes under the influence of fungal infection. A significant increase in the production of tumor necrosis factor – α, interleukin (IL) -1β, -4, was also more pronounced in patients with malasseziosis. The level of IL-4 may serve as a prognostic indicator of possible exacerbation of psoriasis and its recurrence. In the analysis of the indexes of oxidative modification of proteins, their reliable increase was found in the examined patients (spontaneous and stimulated levels of aldehydephenylhydrazones (APG) and ketonophenylhydrazones (CPG)), compared with the control, which indicated the influence of endogenous intoxication on the development of systemic processes and the formation of complicated forms of psoriasis. There was a marked increase in these parameters, APG (spontaneous) and CPG (stimulated) in particular, in patients with psoriasis and concomitant malasseziosis. In studying the level of NO-synthase, the growth rates were noted in the examined patients, especially in patients with disseminated forms of psoriasis andmalasseziosis.
In conducting biochemical studies it was shown that patients with psoriasis and concomitant malasseziosis had a statistically significant reduction in total protein, an increase in aspartate aminotransferase (ASAT), alanine aminotransferase (ALT), cholesterol, low density lipoproteins (LDL), triglycerides. Only increase in AsAT, cholesterol, LDL-C was established in patients without malasseziosis, especially in cases of widespread forms of dermatosis in the progressive stage. This was considered as a negative effect of fungal infection on the pathogenesis of psoriasis, which complicated the course of the process and needed the prescription of antifungal and pathogenetic therapy.
The conducted comparative analysis of clinical features and the course of psoriasis, as well as all the studied laboratory parameters, tests permitted to combine patients into two clinical and therapeutic groups. The first group consisted of 50 patients with psoriasis with localized forms of dermatosis in the stationary phase with concomitant superficial forms of malasseziosis, with minor psycho-emotional disorders (PASI index was 23.45 ± 2.0). Insignificant violations of immune status, biochemical parameters, liver tests, oxidative modification of proteins, level of NO-synthase were noted.
The second group consisted of 30 patients with disseminated forms of psoriasis in progressive stage with manifestations of more severe forms of malasseziosis, with predominance of depressive reactions (PASI index was 29.4 ± 2.1). Significant violations of immune status, biochemical parameters, liver tests, oxidative modification of proteins, level of NO-synthase were noted. 30 patients with psoriasis without malasseziosis and 20 patients with concomitant malasseziosis (first and second comparison groups) were treated traditionally (diet, Neurovitan, calcium gluconate, Aevit, Adaptol, Aleron, topically – Moleskin C). Itraconazole, Thiotriazoline, Atarax, Eliminal gel, 1% Sulsen paste as topical treatment according to the developed method was recommended in addition to traditional therapy for 40 patients from first clinical-therapeutic group. Itraconazole and Eliminal gel were recommended in higher doses and for a long time for 20 patients in the second clinic-therapeutic group, as well as Overin, Miasser, and the same topical treatment as in the first group. A complete remission at the end of treatment was achieved in 24 % of patients in both groups of comparison, a significant improvement was fixed in 28 %. At the same time complete remission was registered in 36.7 % of patients, a significant improvement – in 43.3 % and improvement – in 20 % of patients from two main groups (60 patients). A complete regression of manifestations of malasseziosis was noted in two main groups. Remission less than 1 year was noted in 50 % of patients in comparison groups, and in 3.3 % of patients in major groups; and remission to 2 years was fixed in 28 % and 58.3 %; and remission for more than 2 years – at 12 % and 38.3 %. respectively. The general psycho-emotional state significantly improved, the elements of the rash regressed better in patients, who were receiving the recommended therapy. The PASI index decreased from 28,21 ± 2,15 points before treatment to 7,5 ± 0,52 points after treatment (reduction of PASI index was 73.41 %). In the comparison groups PASI decreased from 24.41 ± 1.14 to 12.2 ± 0.68 points (PASI index reduction was 50 %), which was statistically significant (p<0.05). Psoriasis Disability Index decreased from 14.14 ± 1.08 before treatment to 6.32 ± 0.52 after treatment in patients from the main group, and from 13.2±1.04 before treatment to 8.38 ± 0.81 after treatment in patients from comparison groups (p<0,05). The indicators of immune status, oxidative modification of proteins, NO-synthase and biochemical data significantly improved after treatment, especially in two main groups. Prophylactic measures (detection of trigger factors, diet, rational employment, periodic medication, topical therapy, consultations of related professionals, etc.) were recommended to all patients after the end of the therapy. Key words: psoriasis, malasseziosis, skin, biochemistry, immunity, treatment, homeostasis.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Веретельник К.А. Новые наружные средства в терапии псориатической болезни, осложнённой малассезиозом кожи. Дерматовенерология. Косметология. Сексопатология. 2013. № 1–4. С. 188–190.
- Веретельник К.А. Современные подходы к топической терапии малассезиоза кожи. Дерматовенерология. Косметология. Сексопатология. 2014. № 1–4. С. 212–214.
- Веретельник К.А. Применение антигистаминного препарата «Фексофаст–180» в комплексном лечении псориатической болезни, осложнённой малассезиозом кожи. Дерматовенерология. Косметология. Сексопатология. 2015. № 3–4. С. 209–211.
- Веретельник К.О. Імунний статус у хворих па псоріаз із супутньою маласезійною інфекцією. Запорізький медичний журнал. 2017. Т. 19, № 3. С. 363–368.
- Веретельник К.А., Федотов В.П. Состояние вегетативной нервной системы у больных псориазом, осложнённым малассезиозом кожи. Дерматовенерология. Косметология. Сексопатология. 2016. № 1–4. С. 243–245.
- Веретельник К.А. Новые методы иммунокоррекции у больных псориазом с сопутствующим малассезиозом. Дерматовенерология. Косметология. Сексопатология. 2017. № 1–2 (5). С. 47–50.
- Веретельник К.О. Показники ендогенної інтоксикації та метаболізму NO у хворих на псоріаз с супутнім маласезіозом інфекцією. Сучасні медичні технології. 2017. № 3. С. 58–63.
- Федотов В.П., Веретельник К.А., Корецкая Е.Ю. Новые подходы к диагностике и терапии микозов, как осложняющего фактора при ряде дерматозов. Дальневосточный вестник дерматовенерологии, косметологии и пластической хирургии. 2013. № 1 (13). С. 9–14.
- Веретельник К.А., Корецкая Е.Ю. Современное понимание и подходы к диагностике и терапии микозов, как осложняющего фактора при ряде дерматозов. Сборник научных трудов, посвящённый 90-летию со дня рождения профессора Б.А. Задорожного «Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции». Харьков, 2013. С. 64–75.
- Веретельник К.О. Сучасна топічна терапія псоріатичної хвороби, ускладненої маласезіозом шкіри. Збірка тез доповідей II Регіональної науково-практичної конференції студентiв, аспірантiв та молодих вчених «Актуальні проблеми та перспективи розвитку медичних, фармацевтичних та природних наук – 2013», м. Запоріжжя, 21 грудня 2013 р. Запоріжжя, 2013. С. 61.
- Веретельник К.А. Обоснование комплексного лечения больных псориазом с сопутствующим малассезиозом кожи. Материалы научной конференции, посвящённой 125-летию со дня рождения профессора И.С. Попова «Актуальные вопросы дерматологии и ВИЧ/СПИД инфекции». Харьков, 2016. С. 35–39.
- Веретельник К.О. Нові підходи до комплексної терапії хворих на псоріаз із супутнім маласезіозом шкіри. Збірник тез ІІ Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання косметології та дерматології», м. Запоріжжя, 28–29 квітня 2017 р. Запоріжжя, 2017. С. 8–9.
- Веретельник К.О., Федотов В.П. Оптимізація комплексної диференційованої терапії хворих на псоріаз із супутньою маласезійною інфекцією. Матеріали науково-практичної конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», 10–11 листопада 2017 р., м. Харків. Дерматологія та венерологія. 2017. № 3. С. 96–97.
ЗМІСТ
Перелік умовних скорочень………………………………………………………………….. 16
Вступ…………………………………………………………………………………………………… 17
Розділ 1 Огляд літератури…………………………………………………………………….. 24
1.1 Етіологія та патогенез псоріазу………………………………………………. 24
1.2 Сучасні підходи до терапії псоріазу………………………………………… 32
Розділ 2 Матеріали та методи дослідження…………………………………………….. 36
2.1 Матеріали та методи дослідження……………………………………………. 36
2.2 Методи дослідження……………………………………………………………….. 36
2.2.1 Загальні клініко-лабораторні методи…………………………………….. 36
2.2.2 Діагностика маласезіозу шкіри……………………………………………… 37
2.2.3 Імунологічні методи…………………………………………………………….. 39
2.2.4 Визначення тяжкості перебігу псоріазу…………………………………. 41
2.2.5 Психофізіологічні методи…………………………………………………….. 42
2.2.6 Методика визначення ступеня окислювальної модифікації білків у біологічних зразках……………………………………………………………. 43
2.2.7 Метод визначення активності NO-синтази……………………………… 44
2.2.8 Статистична обробка отриманих результатів…………………………. 45
2.3 Клінічна характеристика хворих……………………………………………… 45
2.4 Психологічний статус хворих на псоріаз………………………………….. 52
Розділ 3 Імунний статус у хворих на псоріаз з супутнім маласезіозом……… 55
3.1 Дослідження популяцій та субпопуляцій лімфоцитів у хворих на псоріаз з супутнім маласезіозом………………………………………….. 56
3.2 Цитокіновий статус у хворих………………………………………………….. 60
3.3 Фагоцитарна активність клітин у досліджених хворих……………… 62
3.4 Показники гуморального імунітету у досліджених хворих……….. 64
Розділ 4 Стан регулюючих систем гомеостазу і роль їх у патогенезі псоріазу з супутнім маласезіозом……………………………………………………………. 67
Розділ 5 Диференційовані показники і методика комплексної терапії хворих
на псоріаз із супутнім маласезіозом шкіри з оцінкою ефективності. 82
5.1 Обґрунтування і методика об’єднання досліджених хворих у клініко-терапевтичні групи………………………………………………….. 82
5.2 Методика диференційованої комплексної терапії хворих, що знаходились під спостереженням……………………………………….. 84
5.3 Клініко-лабораторна оцінка ефективності розробленої комплексної диференційованої терапії……………………………………………………….. 89
Розділ 6 Узагальнення отриманих результатів……………………………………….. 95
Висновки……………………………………………………………………………………………. 111
Рекомендації………………………………………………………………………………………. 114
Список використаних джерел………………………………………………………………. 116
Додаток А Акти впровадження……………………………………………………………. 136
Додаток Б Список публікацій здобувача за темою дисертації та відомості про апробацію результатів дисертації…………………………………… 142
ПЕРЕЛІК УМОВНИХ СКОРОЧЕНЬ
АлАТ – аланінамінотрансфераза АсАТ – аспартатамінотрансфераза АФГ – альдегідфенілгідразони КФГ – кетондинітрофенілгідразони НСТ-тест – тест тетразолію нітросинього ЛПВЩ – ліпопротеїди високої щільності ЛПНЩ – ліпопротеїди низької щільності ОМБ – окисна модифікація білків РД – рівень депресії РНСММ – речовини низької і середньої молекулярної маси ФНП-α – фактор некрозу пухлин – α ФП – фагоцитарний показник ФЧ – фагоцитарне число цАМФ – циклічний аденозинмонофосфат Ig – імуноглобулін IL – інтерлейкін PASI – індекс поширеності і тяжкості псоріазу PDI – індекс недієздатності при псоріазі
ВСТУП
Актуальність теми. Псоріаз відносять до найбільш поширених дерматозів у світі. На цю хворобу страждають до 3 % населення земної кулі, частіше у віці 20-50 років [15, 48]. Він розвивається приблизно з однаковою частотою у чоловіків та жінок [50, 71, 145, 147]. Це захворювання посідає перше місце в структурі дерматологічної патології (до 12-15 % хворих), по даним чисельних літературних повідомлень [18, 22, 56]. Зацікавленість цією хворобою пояснюється не тільки високою питомою вагою псоріазу серед інших дерматозів, але і ростом захворюваності цим дерматозом в останній час, збільшенням випадків тяжких форм псоріазу (артропатичний, еритродермія, ексудативний та пустульозний, розповсюджений бляшковий з резистентністю до терапії), які приводять до інвалідизації [59, 79, 96, 100, 128]. Незважаючи на те, що існує достатня кількість досліджень, присвячених вивченню різноманітних аспектів проблеми псоріазу, багато його сторін залишаються не з’ясованими, однією з основних гіпотез розвитку псоріазу вважають спадкову. Захворюваність в значній мірі залежить від раси та національності, саме які, можливо, і впливають на неї, тому що спроби пояснити феномен виникнення псоріазу різноманітністю клімату та дієти були невдалі. Великий інтерес складає обстеження сімей, в яких псоріаз відстежується на протязі 3-4 поколінь. Показник фенотипічної конкордатності при цій патології у гомозиготних близнюків дорівнює 60-70 %, що в декілька разів вище, ніж гетерозиготних [12, 52, 54, 186].
В останній час вказують на розвиток розладів функціонального стану імунної системи при псоріазі. Зокрема, виявлено зміни і імунологічної реактивності в організмі цих хворих, що характеризуються недостатністю клітинної ланки імунітету на фоні гіперреактивності гуморальної її ланки у вигляді недостатності хелперної, підвищення супресорної активності, зниженням захопної і травної фагоцитарної активності нейтрофілів. Крім того, при цьому дерматозі реєструється підвищення рівнів циркулюючих імунних комплексів, різних варіантів гіперімуноглобулінемії М і G [44, 106, 130, 134, 162]. Зміни мікробіоти шкіри у хворих на псоріаз можуть свідчити про стан напруженості неспецифічної резистентності організму, що призводить до послаблення спроможності шкіри до самостерилізації. У той же час, порушення неспецифічної резистентності та бактерицидної функції шкіри можуть залежить від порушень регуляторних та трофічних функцій нервово-ендокринної системи, нераціонального використання антибіотиків, патології органів травлення [118, 161, 189]. Бактерицидні властивості шкіри в значній мірі залежать від функціонального стану імунної системи шкіри, дріжджоподібних ліпофільних грибів роду Malassezia, але комплексних досліджень клініко-патогенетичних взаємозв’язків маласезійної інфекції шкіри та псоріазу на сьогодні не проводилось [47, 121, 143, 164]. Між тим, прояви маласезіозу широко розповсюджені серед населення та можуть вважатись пандемічними [3, 7, 46].
У механізмах розвитку псоріазу суттєве значення приділяється імунним змінам, патології нервової та ендокринної системи, обмінним зсувам та ін. [11, 52, 69, 78]. На розвиток та перебіг псоріазу негативно впливають супутні патології внутрішніх органів та різні інфекційні фактори (віруси, гриби, піококи та ін.). Дуже розповсюдженою є грибкова інфекція – маласезіоз, яка спричиняється дріжджоподібними ліпофільними грибами [39, 136, 165, 191].
Існують різні методи терапії псоріазу. Так, рекомендовано застосовувати препарати гепатопротекторної і детоксикаційної дії, а також – імуномодулятори [23, 36, 38, 45, 68]. Окремі дослідження з урахуванням встановленого патогенетичного значення дисбіозу кишечнику на клінічний перебіг псоріазу рекомендують включати пробіотики, антимікотики та ферментні препарати в комплексну терапію хворих на тяжкі форми цього дерматозу [40, 75, 93, 96].
Ефективність методів терапії псоріазу залежить від багатьох чинників, а тому лікування цього захворювання є одним з важливих та складних завдань сучасної дерматовенерології. Лікування псоріазу насамперед визначається його стадією та індивідуальними особливостями пацієнтів, а також патогенністю мікробіоти, що є одним із чинників розвитку хвороби [101, 107, 128, 143].
Подальше дослідження перебігу псоріазу, що ускладняється маласезіозом шкіри необхідне у зв’язку з тим, що запропоновані на сьогодні численні методи і засоби для лікування псоріазу часто є недостатньо ефективними і це потребує розроблення нових підходів до терапії та реабілітації хворих на цей дерматоз.
Таким чином, на підставі аналізу вітчизняної та зарубіжної літератури саме вищезазначені обставини диктують необхідність розробляти нові методи лікування хворих на псоріаз з урахуванням ролі грибів Malassezia, використовуючи коригуючу етіопатогенетичну терапію, а широка розповсюдженість псоріазу серед населення свідчить про актуальність подальших досліджень цього захворювання.
Зв’язок роботи з науковими програмами, планами, темами. Робота є фрагментом комплексної НДР Запорізького державного медичного університету: «Розробка методів терапії та профілактики рецидивів хронічних дерматозів та хвороб, що передаються статевим шляхом із урахуванням особливостей гомеостазу хворих та супутньої патології (№ держреєстрації 0113U000800).
Дисертантом особисто виконано фрагменти, які присвячені вивченню ряду ланок патогенезу псоріазу з супутнім маласезіозом, удосконаленню діагностики, а також розроблено метод комплексного лікування хворих, проведено статистичну обробку даних.
Мета і задачі дослідження. Мета – підвищення ефективності лікування хворих на псоріаз з супутнім маласезіозом з урахуванням показників імунної відповіді організму, стану окислювальної модифікації білків (ОМБ), рівня NO-синтази та психоемоційного стану, біохімічних досліджень.
Задачі дослідження:
- Встановити особливості клінічних проявів і перебігу псоріазу з супутнім маласезіозом, а також – психоемоційний стан.
- Вивчити у динаміці спостереження імунний статус у досліджених хворих (Т- і В-ланок імунітету, неспецифічні фактори захисту, рівень цитокінів інтерлейкіну (IL) -4, -1β).
- Вивчити до і після лікування стан ендогенної інтоксикації організму, рівень NO-синтази та печінкових тестів у хворих на псоріаз з супутнім маласезіозом.
- Провести зіставний аналіз клінічних особливостей, перебігу псоріазу з супутнім маласезіозом і всіх лабораторних показників для встановлення рівнів клініко-лабораторних порушень, що дозволить розробити диференційовану методику лікування цих хворих з поетапним використанням етіотропних і патогенетичних препаратів.
- З’ясувати механізм впливу розробленого методу терапії на клінічну картину, перебіг дерматозів, біохімічні показники, імунний статус, вивчити найближчі та віддалені результати лікування, дати їх клініко-лабораторну оцінку.
Об’єкт дослідження: псоріаз з супутнім маласезіозом.
Предмет дослідження: імунний статус, біохімічні дослідження, мікроскопічні та мікологічні методи, психофізіологічні показники, рівень NO-синтази та ОМБ.
Методи дослідження: клінічні (аналіз суб’єктивних та об’єктивних даних обстеження, постановка діагнозу, контроль ефективності лікування), загальнолабораторні (клінічні аналізи крові, сечі, калу), дані опитувальників стану психоемоційної сфери, мікроскопічні та культуральні, біохімічні ((аланінамінотрансфераза (АлАТ), аспартатамінотрансфераза (АсАТ), холестерин ліпопротеїдів високої щільності (ЛПВЩ), холестерин ліпопротеїдів низької щільності (ЛПНЩ), тригліцериди, білок, глюкоза, NO‑синтаза, ОМБ), імунологічні (HCT-тест, фагоцитоз, IL-4, IL-1β, імуноглобуліни (Ig) A, M, G, CD3+, CD4+, CD8+, CD16+, CD22+, CD25+), статистичні.
Наукова новизна отриманих результатів. Вперше у хворих на псоріаз з супутнім маласезіозом, на відміну від хворих без маласезіозу, з’ясовано особливості клінічних проявів, перебіг дерматозів, а також психоемоційний стан.
Вперше показано роль порушень рівня NO-синтази, ОМБ у патогенезі псоріазу з супутнім маласезіозом та встановлено взаємозв’язок змін з особливостями клінічних проявів.
У хворих на псоріаз з супутнім маласезіозом доповнено дані про стан імунного статусу, біохімічних показників і порушень психоемоційної сфери.
Вперше науково обґрунтовано метод диференційованого поетапного лікування хворих з використанням лікарських засобів з фунгіцидною дією, імуномодуляторів, седативних та дезінтоксикаційних засобів.
Практичне значення отриманих результатів. Практичним лікарям запропоновано доступні об’єктивні методи різних рівнів визначення клініко-лабораторних порушень та показань до призначення та проведення комплексної індивідуалізованої терапії хворих на псоріаз з супутнім маласезіозом.
Розроблено оригінальну диференційовану методику раціональної поетапної комплексної терапії хворих на псоріаз із супутнім маласезіозом шляхом призначення на фоні традиційної терапії сучасних вітчизняних засобів, що впливають на імунний і психоемоційний стан, ОМБ, протимікотичних (ітраконазол) засобів, що дозволило підвищити її ефективність за рахунок скорочення терміну лікування, підвищення кількості хворих з повною клінічною ремісією, подовження міжрецидивного періоду.
Основні положення дисертації впроваджено в практику роботи КЗ «Обласний шкірно-венерологічний диспансер» (м. Дніпро), Полтавського обласного клінічного шкірно-венерологічного диспансеру, КЗОЗ Обласний клінічний шкірно-венерологічний диспансер № 1 (м. Харків) та КЗ «Херсонський обласний шкірно-венерологічний диспансер», КЗ «Рівненський обласний клінічний шкірно-венерологічний диспансер» Рівненської обласної ради, а також у педагогічний процес кафедри шкірних та венеричних хвороб ДЗ «Дніпропетровська медична академія МОЗ України».
Особистий внесок здобувача. Дисертантом разом з науковим керівником визначено мету і завдання роботи. Самостійно здійснено патентний пошук і аналіз даних літератури, проведено клінічне обстеження та лікування 110 хворих на псоріаз, а також більшість лабораторних досліджень, виконано облік та оцінку результатів обстеження, здійснено статистичну обробку даних, написано всі розділи дисертації, сформульовано висновки і практичні рекомендації.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Конфлікту інтересів немає.
Апробація результатів дисертації. Основні положення роботи доповідались і обговорювалися на науково-практичних конференціях: науково-практична конференція з міжнародною участю «Актуальні проблеми дерматовенерології», присвячена 90-річчю з дня народження професора Б.А. Задорожного (Харків, 2013); IХ Всеукраїнська науково-практична конференція з міжнародною участю «Актуальні питання косметології та дерматології» (Запоріжжя, 2015); 24-му Конгресі Європейської асоціації дерматологів та венерологів (Копенгаген, 2015); Науково-практична конференція з міжнародною участю «Актуальні проблеми дерматології, венерології та ВІЛ/СНІД-інфекції», присвяченої 155-річчю професора Тіпцева М.В. (Харків, 2015); ХI Всеукраїнська науково-практична конференція з міжнародною участю «Актуальні питання косметології та дерматології» (Запоріжжя, 2017).
Публікації. За матеріалами дисертації опубліковано 13 друкованих праць, у тому числі 10 статей, з яких 6 статей у спеціалізованих виданнях (у моноавторстві – 6), 2 – у журналах, що входять міжнародних наукометричних баз Web of Science, Index Copernicus, Російський індекс наукового цитування, 1 стаття надрукована закордоном, 3 – у збірнику наукових праць, 4 тези матеріалів науково-практичних конференцій.
Структура та обсяг дисертації. Дисертаційна робота викладена на 144 сторінках, з яких 16 сторінок займає список використаних джерел, і складається зі вступу, огляду літератури, 3 розділів власних досліджень, узагальнення отриманих результатів, висновків, рекомендацій, списку використаних джерел, що включає 203 роботи, з яких 115 робіт кирилицею і 88 – латиницею, та двох додатків. Роботу ілюстровано 18 таблицями.
РОЗДІЛ 1 ОГЛЯД ЛІТЕРАТУРИ
1.1 Етіологія та патогенез псоріазу
Псоріаз – хронічний папуло-сквамозний дерматоз мультифакторіальної природи, який є одним із найбільш поширених дерматозів, представляє актуальну медико-соціальну проблему, яка приводить до значного погіршення якості життя, непрацездатності, інвалідизації хворих, створює проблеми в утворенні сім’ї і погіршення відносин в сім’ї. Доля псоріазу в структурі дерматологічної патології сягає 10-12 %, а серед хворих дерматологічних стаціонарів – 27 % [9, 10, 12, 14, 56].
Псоріаз – хронічний дерматоз з частими рецидивами, які уражують шкіру, опорно-руховий апарат, внутрішні органи [52, 54, 62].
Останнім часом переважає погляд на псоріаз як на системний процес, тому все частіше в літературі з’являється термін «псоріатична хвороба», який мабуть найповніше відображає стан хворих, оскільки прояви на шкірі це незначне відображення тих процесів які відбуваються в організмі хворого [53, 95]. У цих роботах автори підкреслюють важливу роль системних пошкоджень при псоріатичній хворобі, таких як вади серця, кардит, неспецифічний реактивний гепатит, цироз печінки, дифузний гломерулонефрит, поліаденіт, трофічні порушення, амілоідоз шкіри та внутрішніх органів, ураження очей та інші прояви [12, 14, 70, 76, 95].
Псоріаз часто призводить до інвалідизації хворого, погіршуючи якість життя [37]. Розповсюдженість псоріазу в популяції достатньо висока, тому цей фактор, а також хронічний перебіг, розвиток тяжких резистентних форм з подальшою непрацездатністю пояснює важливість проблеми її вивчення [41, 82, 97, 110].
На сьогоднішній день питання про походження псоріазу є дискутабельним і не існує єдиної загальноприйнятої концепції щодо етіології псоріазу [132, 159, 175].
Для дерматозу типово не тільки ураження шкіри, але й патологічні зміни в багатьох органах і системах організму, важлива роль серед яких відводиться автоімунним, імунологічним, метаболічним порушенням і особливо змінам в ліпідному обміні [41, 53, 63, 79, 82, 98].
Численні теорії виникнення псоріазу не можуть повністю дати відповідь на основну причину його виникнення. До основних теорій псоріазу відноситься інфекційна, генетична, паразитарна, вірусна, ендокринно-обмінна та інші.
Генетична теорія займає найголовніше місце у розвитку дерматозу. Мультифакторіальну модель ускладнення довели багато науковців, але тип успадкування залишається предметом дискусій. Дослідження в популяції хворих на псоріаз виявили часті випадки захворювання серед родичів з часткою генетичного компоненту 60-70 % [21, 126, 153, 184, 195].
Псоріаз поділяється на два типи:
– псоріаз І типу характеризується раннім початком захворювання (у віці до 40 років), обтяженим сімейним анамнезом, асоціацією з HLAC та HLA-DR7;
– псоріаз ІІ типу характеризується пізнім початком захворювання (у віці після 40 років), необтяженим сімейним анамнезом, відсутністю асоціації з HLA [148, 201]. Якщо хворий один з батьків, ризик псоріазу у дитини становить 8 %, якщо хворі батько і мати – 41 %.
Багато авторів пов’язують розвиток псоріазу з дією інфекційних факторів. Так, особливу роль приділяють стрептококу, з яким пов’язують краплеподібну форму псоріазу [198]. У підтвердження цього служить те, що більшість рецидивів приходиться на осінньо-зимовий та весняний періоди, коли спостерігається найбільша кількість випадків гострих респіраторно-вірусних інфекцій, тонзилітів, фарингітів [72, 159].
Найчастіше рецидив псоріазу відбувається після загострення тонзиліту. Механізм, який призводить до рецидиву псоріазу при гострій або хронічній інфекції включає імпульси, які надходять в вегетативний відділ центральної нервової системи, що, в свою чергу, змінює імунобіологічну реактивність організму [79, 144]. Деякі автори вважають, що пошкодження захисних систем організму відбувається під впливом токсинів. Особлива роль в цій ланці відводиться вірусам, згідно з якою віруси вбудовуються в геном та порушують код спадкової інформації, створюючи новий геном трансформованих клітин із іншими спадковими властивостями [54, 113, 114, 160].
Багатьма дослідженнями були виявлені зв’язки між вмістом загальних ліпідів, холестерину і перебігом шкірного процесу та запаленням суглобів у хворих на псоріаз та скороченням ремісій, тривалістю періодів загострень, торпідністю клінічних симптомів.
Дослідження Е.М. Солошенко та співавт. (2012) показали, що поширений псоріаз проявляється підвищенням рівня загальних ліпідів у прогресуючій і стаціонарній стадії на фоні зростання інсуліноподібного фактору росту – 1, більш як у 3 рази [98].
Інші дослідження встановили підвищення рівня насичених жирних кислот і зниження показників поліненасичених – лінолевої, ліноленової та арахідонової кислоти в плазмі крові, мембранах еритроцитів, у кератиноцитах шиповидного та рогового шарів, що відображається на перебігу псоріазу [166, 179].
Дуже важливу роль у розвитку псоріазу відіграють провокуючі фактори, такі як нервово-психічні розлади (психоемоційні порушення, стреси). Психосоціальні чинники розглядають як пусковий механізм захворювання [80, 94, 104, 181, 185, 192]. При наявності висипів хворі на псоріаз відчувають невпевненість в собі та спілкуванні з оточуючими, уникають міжособистісних контактів. Дуже часто у хворих на псоріаз спостерігається наявність тривоги, депресії та астеновегетативні порушення. У пацієнтів, які страждають на тяжкий перебіг дерматозу посилюється депресія і виникають думки про самогубство. Нейропептиди, які виділяються з нервової тканини, активують імунокомпетентні клітини та медіатори запалення, які призводять до посилення проникності судин і вазодилатації, сприяючи ізоморфній реакції.
Підтвердженням нейрогенної теорії є той факт, що при застосуванні седативних препаратів, а також після гіпно- та рефлексотерапії відмічається позитивний терапевтичний ефект у хворих на псоріаз. Шкіра представляє собою один із найбільших органів організму людини, що приймає участь у взаємодії імунної, нервової та ендокринної систем, а також відіграє роль у синтезі біологічно активних речовин. У зв’язку з цим шкіра може розглядатися як один із головних органів, що відіграє важливу роль у реакції організму на стрес та розвиток стану тривоги [133, 141, 172].
Деякі автори в своїх роботах висловлюють думку, що порушення нервової системи у хворих на псоріаз є вторинними, як наслідок дерматозу [66].
Так як і стрес може бути причиною загострення псоріазу, як і тяжких форм псоріазу, можуть слугувати розлади депресивно-тривожного характеру. При псоріазі симптоми невротичного характеру виявляються у 60 % хворих. Тривожно-депресивні розлади та імунозапальний процес призводять до зриву адаптації [13, 15, 154, 157, 171], у результаті чого активується гіпоталамо-гіпофізарно-надниркова система, що призводить до розладу вегетативної нервової системи, яка є основним регулятором гомеостазу [80, 94, 104, 181, 185, 192].
У сучасній літературі багато уваги приділяється імунному компоненту у розвитку псоріазу [6, 14, 22, 63, 86, 99, 125].
Багато авторів відзначають роль суперантигенів у патогенезі псоріазу і інших дерматозів [200]. Механізм участі у розвитку та підтриманні алергічного запалення полягає в тому, що бактеріальні, грибкові та інші антигени, що знаходяться на поверхні шкіри, проникають через шкіру, бар’єрна функція якої порушена запаленням, після чого відбувається активація здатності клітин Лангерганса чи макрофагів до локальної продукції різних протизапальних медіаторів.
Імунне запалення є головним чинником в патологічному процесі при псоріазі, що супроводжується активацією Т-лімфоцитів, надмірною продукцією медіаторів імунної відповіді – цитокінів (інтерферону-γ, фактора некрозу пухлини – α (ФНП-α), IL-1, 2, 4, 6, 8, 10, 12, 17, 18, 19, 20, 23 [14, 99].
Щодо показників інтерферону-γ при псоріазі, то більшість вчених стверджують, що інтерферон-γ синтезується локально, а не надходить з системного кровотоку. Інтерферон-γ сприяє збільшенню кількості різних протизапальних факторів – IL-1, -6, -8, -12, -15, ФНП-α, інтерфероніндукованого білка – 10, індукованої NO-синтази, каспази-1, а також спричиняє цитотоксичну активність Т-лімфоцитів, макрофагів та натуральних кілерів і, таким чином, проявляє антипроліферативну дію [10, 51].
У розвитку запальної реакції при псоріазі та деструкції суглобових поверхонь, як доведено дослідженнями, важливу роль відіграє експресія ФНП‑α, яка активує лімфоцити та проліферацію фібробластів, стимулює синтез простагландинів і матриксних металопротеїназ (колагенази, простагландіну Е2) регулює продукцію багатьох хемокінів [141].
Кератиноцити продукують IL-1α і-1β, які зберігаються у шкірі, в ділянках, уражених псоріазом. Підвищений рівень IL-1β, а рівень IL-1α знижений порівняно зі здоровою шкірою [99].
Центральна роль в імунних порушеннях надається гіперактивації підсистеми Т-лімфоцитів [22, 169].
Гіперактивний стан Т-хелперів при псоріазі розглядають як головний механізм, що призводить до епідермальної проліферації, порушенням диференціювання кератиноцитів, проліферації і кумуляції нейтрофілів і Т-лімфоцитів [127, 197, 152, 154]. Ця активація Т-клітин є основною ланкою у взаємодії кератиноцитів, клітин запального інфільтрату і кровоносних судин [142, 177, 196].
Завдяки методам молекулярної біології було встановлено, що Т-супресорна недостатність є ведучою ланкою в патогенезі псоріазу [60, 64, 180].
Про участь в патогенезі псоріазу автоімунного компоненту свідчить низький рівень Т-лімфоцитів-супресорів, які асоціюються з підвищеним рівнем патологічних імунних комплексів, вміст яких за даними багатьох авторів прямо пропорційно залежить від активності, ступеня важкості і перебігу дерматозу [94].
Дослідженнями встановлено, що недостатність Т-супресорів обумовлює зниження толерантності до особистих антигенів і, як результат, дефіцит супресорного впливу дозволяє В-клітинам продукувати антитіла в значно більшій кількості [94].
За дослідженнями різних авторів, участь В-ланки імунітету в патогенезі псоріазу дуже суперечлива. Згідно з дослідженнями, були виявлені виражені порушення в В-ланці імунітету. Активація В-лімфоцитарної системи особливо відмічались у хворих з тяжкими формами захворювання і залежала від давнини захворювання.
Мітотичний цикл в клітинах епідермісу хворих на псоріаз дуже прискорений і становить 37,5 годин, в той час у здорових людей він становить 150 годин.
Диференціювання клітин від базального шару до рогового у здорової людини становить 27-28 днів, у хворих на псоріаз він становить всього 3-4 дні [44].
У хворих на псоріаз спостерігається суттєвий дисбаланс цитокінів в крові та в шкірі [200].
У псоріатичних висипках поряд з Т-лімфоцитами виявляються також клітини Лангерганса та клітини моноцитарно-макрофагального ряду (CDα1a+ клітини), які відповідальні за розвиток реакцій сповільненої гіперчутливості [79, 94, 200].
Важлива роль належить клітинам Лангерганса в активації Т-лімфоцитів, а також в синтезі цитокінів – ІL-1; пухлино-некротизуючого фактору [177, 199, 200].
Доведено, що Т-хелпери першого порядку виробляють ІL-2 та гама-інтерферон (IFN-γ), які відносяться до цитокінів з протизапальною активністю.
Підвищене утворення ІL-2 в шкірі призводить до проліферації кератиноцитів і збільшення синтезу гама-інтерферону до активації ендотеліоцитів з кератиноцитами за рахунок експресії на них молекул HLA-D2антигену. В дермальних інфільтратах виявлено присутність Т-лімфоцитів, експресуючих як HLA-D2антиген, так і ІL-2-рецептор у дермальних інфільтратах, що свідчить про присутність активованих імуноцитів в ділянках шкіри з псоріатичним висипками.
Шкіра є високоорганізованим органом імунної системи і часто уражається при різних імунопатологічних станах [20, 63, 92, 91, 129]. У літературі зустрічається багато даних про зміни в різних популяціях імунокомпетентних клітин при псоріазі, як в клітинній, так і гуморальній ланці імунітету [44, 63].
Т-лімфоцити-хелпери другого порядку в шкірі синтезують ІL-4, ІL-5, ІL-6 та ІL-10. Вважається, що ІL-6 є одним із ключових цитокінів, що бере участь в розвитку псоріатичного запалення [199].
Механізм дії пов’язують з його властивостями підсилювати проліферацію кератиноцитів, а також стимуляцією В-лімфоцитів значним підвищенням цитотоксичної активності ЕК-клітин, а також продукцією ІL-2 моноцитами/макрофагами [164, 194].
ІL-8 володіє потужною хемотоксичною активністю для нейтрофільних гранулоцитів та лімфоцитів, він теж виробляється кератиноцитами, чим і пояснюється скупчення нейтрофілів у верхніх відділах епідермісу та утворення мікроабсцесів Мунро у хворих на псоріаз [164, 194].
У літературі багато уваги приділяється дослідженню ІL-12 стосовно його участі в імунологічних реакціях в патогенезі псоріазу [194].
Синтезується ІL-12 переважно моноцитами/макрофагами, а також поліморфно-ядерними лейкоцитами та кератиноцитами в дослідженнях in vitro. ІL-12 здійснює плейотропну дію на NK-клітини та Т-лімфоцити, які, головним чином сприяють утворенню інтерферону-γ. При проведенні імуногістохімічних досліджень було доведено, що спостерігається значне збільшення ІL-12 в псоріатичних висипках. ІL-12 локалізується переважно в сосочковому шарі дерми в цитоплазмі мононуклеарних клітин та нейтрофілах. Поява моноцитів/макрофагів та DC-клітин одночасно з Т-лімфоцитами трактується як початковий розвиток порушень перед появою псоріатичних уражень [123, 130].
Псоріаз починається з появи дрібних папул рожево-червоного кольору, які потім вкриваються сріблясто-білими лусочками. Збільшуючись у розмірі, папули утворюють бляшки різних розмірів. В залежності від локалізації та клінічних проявів псоріаз розподіляється на: ексудативний, пустульозний, інверсний, артропатичний, псоріатичну еритродермію. Виділяють також папіломатозно-бородавчату, себорейну, рупіоїдну, екзематоїдну, фолікулярну клінічні форми і псоріаз слизових оболонок, але найбільш частіше зустрічається вульгарний псоріаз [123, 124, 143].
Псоріаз може локалізуватися на будь-яких частинах тіла, але найбільш типові місця локалізації висипок – це розгинальні поверхні кінцівок, на ділянках ліктьових і колінних суглобів, волосистої частини голови, часто охоплює шкіру лобу («псоріатична корона»), ділянки крижі та сідниць. Часто в патологічний процес залучаються нігті і дуже рідко – слизові оболонки та червона облямівка губ.
У перебігу псоріазу розрізняють три стадії: прогресуючу, стаціонарну та регресуючу. Прогресуюча стадія характеризується збільшенням у розмірі папул, які місцями зливаються, утворюючи бляшки з чіткими контурами, а також появою нових елементів, позитивний феномен Кьобнера – у місцях травматизації шкіри з’являються нові елементи висипки [157], навколо папул спостерігається яскраво-червоний обідок Пільнова. Для прогресуючої стадії характерним є наявність тріади симптомів: феномен стеаринової плями, термінальної плівки, симптом «Ауспітца» – феномен кров’яної роси. Стаціонарна стадія характеризується припиненням появи нових висипань, зникненням обідка Пільнова, ущільненням та фрагментацією бляшок. Папули та бляшки повністю вкриті лусочками. Регресуюча стадія характеризується появою псевдоатрофічного обідка Воронова навколо бляшок і їх регресом.
При псоріазі різко зменшується швидкість клітинного циклу: час перетворення базальних кератиноцитів у рогові лусочки зменшується і складає 4 доби замість 28.
Швидкість мітозу клітин в епідермісі регулюють дві системи пригнічуюча (кейлон) та стимулююча (епітехіальний фактор росту). Кейлон – це тканиноспецифічна речовина, яка активна лише по відношенню до епідермісу; як активний інгібітор клітинного мітозу діє слабо і стає активним лише у поєднанні з адреналіном. Комплекс кейлон+адреналін потенціюється гормонами кори наднирників через універсальний регулятор внутрішньоклітинних процесів циклічний аденозинмонофосфат (цАМФ), який залежить від двох ферментів: аденілатциклази (сприяє синтезу цАМФ) та фосфодієстерази. Комплекс кейлон+адреналін підвищує активність аденілатциклази, тим самим підвищує вміст у клітині цАМФ. Фосфодіестераза інактивує цАМФ [155, 156].
Епітеліальний фактор росту стимулює мітоз клітин епідермісу. Специфічна дія епідермального фактору росту відбувається при умовах зниження кейлону адреналіну, глюкокортикоїдів і цАМФ, при збільшенні вмісту гістаміну та інших біологічно активних речовин, тому відбувається посилання клітинної проліферації епідермісу [56, 120].
При псоріазі зменшується активність аденілатциклази, блокування комплексу адреналін-кейлон, що призводить до інактивації цАМФ, і мітоз клітин посилюється. Гістамін викликає стимуляцію мітозу клітин епідермісу і підвищує активність гуанілатциклази, яка підвищує вміст цАМФ [163, 173, 191].
1.2 Сучасні підходи до терапії псоріазу
Для правильного вибору метода лікування хворих на псоріаз необхідно враховувати індивідуальні особливості пацієнта, стадію захворювання, площу ураження шкіри, тяжкість псоріатичного процесу, вік, стать, наявність супутньої патології, протипоказань до лікування та можливі ускладнення [48, 62, 93, 99].
Лікування псоріазу повинно бути комплексним та направленим на усунення клінічних симптомів захворювання, зменшення частоти рецидивів [36, 58].
Вся сучасна патогенетична терапія псоріазу направлена на пригнічення Т-клітинних запальних імунних реакцій, зниження проліферації кератиноцитів і нормалізацію їх диференціювання. Комплексне лікування повинно включати системну та місцеву терапію. Основна мета при проведенні місцевої терапії – це зменшення запальних явищ, лущення та інфільтрації шкіри. Для цього призначають кератопластичні та протизапальні засоби [87, 103, 118, 202].
Щодо дії топічних глюкокортикоїдів, то вони володіють вираженою протизапальною, імуносупресивною та протисвербіжною діями, зменшують набряк та інгібують хемотаксис запальних клітин у шкіру.
Топічні стероїди інгібують транскрипцію генів, що відповідають за синтез запальних цитокінів, Т-клітинну проліферацію, Т-опосередкований імунітет. Але завжди потрібно пам’ятати, що не контрольоване використання топічних глюкокортикостероїдів може привести до атрофії шкіри, до більш тяжкого перебігу псоріазу, виникненню місцевої інфекції [2, 8, 19, 18, 62, 66, 168].
Для топічного лікування також використовують засоби – аналоги вітаміну D у вигляді мазей, кремів, лосьйонів – кальципотріол, кальцитріол. Ці засоби зменшують синтез ДНК, гальмують диференціювання епідермальних кератиноцитів. Слід пам’ятати, що тривале використання аналогів вітаміну D3 може привести до гіперкальціємії та подразненню шкіри, підвищенню всмоктування кальцію в кишечнику. В останні роки серед системних засобів в терапії псоріазу привертають увагу засоби, які діють на імунну систему. Доцільним є використання імуносупресивних засобів, враховуючи сучасні аспекти псоріазу, серед яких потрібно відмітити цитостатичні препарати (метотрексат), імунодепресанти (циклоспорин А, сандімун), синтетичні ретіноїди (ацетрин), системні глюкокортикостероїди, ПУВА-терапію, моноклональні антитіла до ФПН-α [135, 174, 183].
Метотрексат – препарат, який діє на активно проліферуючі клітини, являється антагоністом фолієвої кислоти. Слід пам’ятати, що цей препарат має недоліки, такі як більш тяжке загострення псоріазу через декілька тижнів після закінчення прийому метотрексату; а також побічні ефекти: токсико-алергічні реакції, імуносупресивну і цитостатичну дії [117].
Іншим препаратом імуносупресорної дії, який впливає на процеси клітинного росту, пригнічує залежне від Т-лімфоцитів вироблення антитіл є циклоспорин, який використовується в лікуванні псоріазу.
Циклоспорин також пригнічує секрецію інтерлейкінів та інших лімфокінів, що призводить до зниження активності Т-лімфоцитів і клітин запалення в дермі і епідермісі у хворих на псоріаз. Але циклоспорин має і негативні наслідки, такі як гіпертензія, нефротоксичність [181].
При ускладнених формах псоріазу, псоріатичної еритродермії, пустульозному псоріазі використовують ароматичні ретиноїди. Механізм їх дії полягає в пригніченні проліферації епідермальних кератиноцитів, в нормалізації та диференціюванні епітеліального покриву.
Ароматичні ретиноїди в лікуванні хворих на псоріаз використовують місцево у вигляді мазей або внутрішньо. Ці препарати найбільш ефективні при використанні в комплексі з ПУВА-терапією. Але і ці препарати мають побічні ефекти у вигляді тератогенності і гепатотоксичності. При артропатичному псоріазі використовують глюкокортикоїдні препарати. Але вони теж мають негативні наслідки, при різкій відміні препарату або різкому зменшенню дози відбувається рецидив захворювання. Глюкокортикоїди також призводять до змін вуглеводного, білкового та ліпідного обмінів, тому їх застосування обмежене. Для зменшення ризику гепатотоксичності цих препаратів використовують гепатопротектори: карсил, есенціале, гептрал, енерлів та ін. [61, 110, 115].
Найбільш сучасними препаратами в лікуванні тяжких форм псоріазу та псоріатичного артриту є імунобіологічні препарати – інфліксимаб, адалімумаб, устекінумаб, алефасент, ефалізумаб. Механізм дії біологічних препаратів поділяється на інгібітори Т-клітинної активності і костимулятори, а також блокатори ефектів цитокінів [23, 38]. Ці препарати високоефективні, але також мають побічні ефекти [1, 5, 51, 67, 68, 116, 135, 174, 183].
При тяжких поширених формах псоріазу рекомендують фотохіміотерапію, при якій призначають довгохвильове УФ-випромінювання, фотосенсибілізатори з ДНК з утворенням моно- і біфункціональних зв’язків, що призводять до гальмування клітинної проліферації. Фотохіміотерапія має імуномодулюючий ефект з нормалізацією клітинної ланки імунітету впливом на імунокомпетентні клітини у шкірі, впливає на біосинтез та метаболізм простагландинів [79, 83, 88, 101].
Таким чином, псоріаз – хронічне захворювання шкіри, яке зустрічається у 2 % популяції. Псоріаз суттєво знижує якість життя, формуючи у хворих почуття неповноцінності, а у ряді випадків викликає депресію і суїцидальні ідеї. На сьогоднішній день більшість пацієнтів не задоволено лікуванням, що пов’язано з дорожнечею і поганою переносимістю. Малоефективні підходи не дають бажаного результату. Тому пошуки нових методів терапії є актуальною задачею.
Результати цих досліджень були опубліковані в наступних публікаціях:
1. Веретельник К.А., Корецкая Е.Ю. Современное понимание и подходы к диагностике и терапии микозов, как осложняющего фактора при ряде дерматозов. Сборник научных трудов, посвящённый 90-летию со дня рождения профессора Б.А. Задорожного «Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции». Харьков, 2013. С. 64–75 [29].
РОЗДІЛ 2 МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Матеріали дослідження
Згідно з метою і задачами, для вирішення дисертаційних завдань протягом 2014 – 2017 рр. у хворих на псоріаз проведено комплекс загально-клінічних, імунологічних, біохімічних, психофізіологічних та статистичних досліджень.
Під спостереженням знаходилося 110 хворих на псоріаз (45 жінок і 65 чоловіків) у віці від 24 до 46 років. Весь об’єм діагностичних заходів для хворих проводили згідно з Наказом МОЗ України № 762 від 20.11.2015р.
Усі дослідження проводилися на клінічній базі кафедри дерматовенерології та косметології з курсом дерматовенерології і естетичної медицини факультету післядипломної освіти Запорізького державного медичного університету в Комунальній установі «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради. Групу контролю склали 34 практично здорових осіб.
У роботі з хворими дотримувалися загальних вимог та положень щодо біоетики, які схвалені Першим національним конгресом з біоетики (Київ, 2001), а також з узгодженням Етичного комітету Запорізького державного медичного університету.
2.2 Методи дослідження
2.2.1 Загальні клініко-лабораторні методи
Клінічне дослідження складалося зі збору скарг, анамнезу захворювання, анамнезу життя, об’єктивного дослідження.
При опитуванні пацієнтів і збору анамнестичних даних особлива увага приділялась скаргам, характеру перебігу захворювання, можливим причинам виникнення псоріазу та його загострень, наявності соматичних захворювань, а також стресовим ситуаціям. Зверталася увага на попередню терапію псоріазу у даних хворих, її ефективність.
Загальні клініко-лабораторні дослідження включали: проведення клінічного аналізу крові та сечі, аналіз крові та сечі з визначенням глюкози, аналіз калу на яйця гельмінтів, постановку комплексу серологічних реакцій на сифіліс; флюорографічне дослідження органів грудної клітини. Усі дослідження виконувалися згідно з клінічними протоколами надання медичної допомоги хворим на дерматовенерологічні захворювання. Вивчалися основні біохімічні показники: загальний білок, рівень глюкози, АлАТ, АсАТ, холестерин, холестерин ЛПВЩ, холестерин ЛПНЩ, триглицеріди.
Загальноклінічне дослідження проводилося по загальноприйнятим методикам у всіх спостережених хворих. При вивченні клінічних проявів псоріазу зверталася увага на локалізацію, розповсюдженість і характер патологічного процесу, ураження нігтьових пластин, а також вивчення РАSІ, теста «Шкала Зунга» для самооцінці депресії, теста Шихана для визначення тривожності та індексу недієздатності при псоріазі (PDІ).
У разі необхідності хворим були проведені консультації лікарів суміжних спеціальностей – терапевта, ендокринолога, гастроентеролога, оториноларинголога, психіатра, невролога, стоматолога [137, 158].
2.2.2 Діагностика маласезіозу шкіри
Діагноз маласезіоз досліджуваним встановлювався на підставі:
– характерних клінічних проявів маласезіозу шкіри;
– мікроскопічних: в лусочках ураженої шкіри та в гною пустул знаходили клітини ліпофільних дріжджоподібних грибів;
– верифікації роду у результаті посіву на середовище Сабуро під шар оливкового масла.
Перед початком дослідження на гриби у хворих виключалися хімічні та фізичні системні і локальні впливи, які володіють протигрибковою дією.
Мікроскопічне та культуральне дослідження проводилися за традиційними методиками, затвердженими Наказом МОЗ СРСР № 535 від 22.04.1985 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений».
Для лабораторного дослідження забір патологічного матеріалу проводився з вогнищ, що сформувалися, а саме – з їх периферії, зішкрібаючи лусочки скальпелем. Для накопичення матеріалу в окремих випадках використовувався метод оклюзії вогнища ураження під липкий пластир.
Забір матеріалу проводився для дослідження в гирлі залоз шкіри, при фолікулярних формах склад гирла ураженого фолікулу вишкрібався і видавлювався.
Мікроскопічне дослідження проводилося для виявлення псевдоміцеліальної форми дріжджоподібних ліпофільних грибів роду Malassezia в матеріалі, що досліджувався, при вивченні нативного та забарвленого просвітленого препарату. Матеріал розміщувався на предметне скло, наносилася на нього крапля 10-20 % розчину КОН, перемішувалася для просвітління, підігрівалася над полум’ям спиртівки (не доводячи до кипіння), до появи по периферії крапель білої облямівки з кристалів лугу, а потім, надавлюючи, покривалася покривним склом та мікроскопіювалася при малому, а потім – при великому збільшенні.
Виявлявся патогенний гриб у вигляді коротких (15–40 мм довжиною та близько 2–5 мм товщиною) ниток міцелію (псевдоміцелій) та округлих тілець (дріжджоподібних клітин округлої чи еліпсоподібної форми розміром 3-5 мкм, з подвійним контуром), які групувалися по 15-20 штук.
Дріжджоподібні ліпофільні гриби роду Маlassezia виявлялися в матеріалі, що досліджувався при вивченні препарату, забарвленого водним розчином метиленового синього. Після обробки сумішшю Нікіфорова або 960 етиловим спиртом для просвітлення на препарат наносилася концентрована оцтова кислота та висушувалася над спиртівкою. Після цього наносилися 1–2 краплі 1 % водного розчину метиленового синього на 3 хвилини та змивалися водою.
Препарат, після висушування, вивчався під імерсійною системою, виявляючи дріжджові клітини та псевдоміцелій грибу темно-синього кольору у картині, що описана вище (нитки псевдоміцелію та округлі тільця дріжджоподібних клітин).
Спостерігалися в дріжджоподібній формі інтенсивно зафарбовані сферичної форми клітини з товстою стінкою до 3-5 мкм, інколи у формі пляшки. Деякі клітини мали відпочкування, нерідко розташовуючись у вигляді грон винограду. Інколи зустрічалися утворення псевдоміцелію довжиною до 20 мкм з сферичних організмів, які одночасно формували росткові трубки, почки та смужки з 3-5 клітин.
При мікологічному дослідженні виявлялися та ідентифікувалися дріжджоподібні ліпофільні гриби роду Маlassezia. Досліджувальний матеріал (лусочки, вміст фолікулів, гній) наносився стерильною мікологічною лопаткою на середовище Сабуро. Потім додавали 5,0 мл стерильного оливкового масла таким чином, щоб воно покрило всю поверхню середовища.
2.2.3 Імунологічні методи
Оцінка імунного статусу досліджених хворих проводилася на підставі аналізу результатів загальноприйнятого комплексу відомих стандартних тестів, передбачених діючим Наказом МОЗ України № 422 від 19.11.2002 [66] та клінічними протоколами [74]. Визначення загальної та відносної кількості лейкоцитів проводилося уніфікованим методом підрахунку в розрахунковій камері.
Дослідження лейкоцитарної формули проводилося уніфікованим методом морфологічного дослідження формених елементів крові з диференційним підрахунком лейкоцитарної формули в сухих фіксованих і забарвлених мазках крові.
Імунофенотипування лейкоцитів для визначення їх популяційного складу відіграє важливе значення в оцінці імунного статусу при імунодефіцитах. Фенотипування лейкоцитів проводилося методом імунофенотипування клітин крові по диференційованим антигенам (СD-рецепторам) за допомогою моноклональних антитіл набору «Клоноспектр», Росія. Непряма реакція поверхневої імунофлуоресценції виконувалася на цільній крові досліджених пацієнтів; дослідження проводилося згідно з інструкцією. Облік результатів реакції проводився за допомогою методу флюоресцентної мікроскопії. Використовувалися моноклональні антитіла до відповідних антигенів:
СD3+ – Т-загальні зрілі лімфоцити;
СD4+ – Т-хелпери;
СD8+ – Т-супресори (цитотоксичні лімфоцити);
СD4+/СD8+ – імунорегуляторний індекс, співвідношення Т-хелперів і Т-супресорів, який дозволяє оцінювати інтенсивність імунної відповіді;
СD16+ – натуральні кілери;
СD19+ – зрілі В-лімфоцити;
СD25+ – низькоафінний рецептор до IL-2;
СD95+ – рецептор апоптозу.
Визначення вмісту Ig А, М, G проводилося за допомогою класичного методу радіальної імунодифузії. Принцип методу полягає в тому, що при зустрічі антигенів і антитіл у зоні еквівалентності утворюються нерозчинні преципітати у вигляді кілець, діаметр яких залежить від концентрації Ig у дослідженому матеріалі.
Неспецифічні фактори захисту організму досліджувалися методом оцінки фагоцитарної активності нейтрофілів периферичної крові за загальноприйнятою методикою з визначенням:
– фагоцитарного числа (ФЧ) – середня кількість мікробів, поглинутих одним нейтрофілом крові;
– фагоцитарного показника (ФП) – процент нейтрофілів, які приймають участь у фагоцитозі.
Бактерицидна активність нейтрофілів визначалася за допомогою тесту відновлення нитросинього тетразолію (НСТ-тесту). Принцип методу полягає у відновленні поглинутого фагоцитом розчинного барвника нитросинього тетразолію в нерозчинний диформазан під впливом супероксиддисмутази, який переходить в НАДФН-оксидазну реакцію, стимулюючи процес активації фагоциту. За інтенсивністю реакції можливо судити про активацію кисеньзалежних механізмів бактерицидності. Для оцінки тесту підраховувалися 100 нейтрофілів і оцінювався відсоток позитивних клітин (нейтрофіли, які вміщують гранули диформазану, забарвлені у темно-синій колір).
Рівень цитокінів у сироватці крові визначався за допомогою імуноферментного аналізу. Активність ферментативної реакції визначали на автоматичному фотометрі для мікропланшетів StatFax 2100 (США). Визначали рівень ІL-4, ІL-1β, ФНП-α.
2.2.4 Визначення тяжкості перебігу псоріазу
Тяжкість захворювання оцінювалася шляхом визначення індексу поширеності і тяжкості псоріазу (PASI), який є основним інструментом для визначення тяжкості перебігу псоріазу [122]. Для визначення цього індексу тіло пацієнта умовно поділяли на чотири ділянки (ноги – 40 % від загальної поверхні шкіри людини, тулуб (груди, живіт, спина) – 30 % поверхні шкіри, руки – 20 % і голова – 10 %). Кожна з цих чотирьох ділянок оцінювалася окремо – від 0 до 6 балів залежно від ступеня ураження. Далі для кожної ділянки оцінювалася інтенсивність кожної з трьох клінічних ознак – еритема, інтенсивність лущення та інфільтрації. Інтенсивність оцінювалася від 0 (відсутність ознаки) до 4 (максимальна ступінь прояву). Після цього для кожної ділянки визначався свій індекс за формулою: (еритема+лущення+інфільтрація) х ступінь ураження х ваговий коефіцієнт ділянки. Ваговий коефіцієнт області відповідає площі поверхні шкіри: 0,4 – ноги, 0,3 – тулуб, 0,2 – руки, 0,1 – голова. Після підрахунку індексу для кожної з чотирьох ділянок підсумовувалися отримані показники і отримувався загальний сумарний індекс РАSІ, представлений числом від 0 (відсутність хвороби) до 72 (найважчий перебіг).
При оцінці результатів, в залежності від ступеня тяжкості дерматозу, виділялися групу із середньо-тяжким (10<РАSІ≤30) і тяжким (30<РАSІ) перебігом захворювання.
2.2.5 Психофізіологічні методи
З метою оцінки психологічного статусу у хворих на псоріаз використовувалися опитувальники. У дослідженні застосовувалися:
1) Тест «Шкала Зунга» для самооцінки депресії.
Опитувальник розроблено для диференційної діагностики депресивних станів і станів, близьких до депресії, для скринінг-діагностики при масових дослідженнях і з метою попередньої, долікарської діагностики. Тест адаптований Т.І. Балашовою [203]. Повне тестування з обробкою займає 20-30 хвилин, при цьому пацієнт зазначає відповіді на бланку. Обробка результатів: рівень депресії (РД) розраховується за формулою: РД=Sпр + Sзвор, де Sпр – сума закреслених цифр по «прямим» висловлюванням: № 1, 3, 4, 7, 8, 9, 10, 13, 15, 19; а Sзвор – сума цифр, «зворотних» закреслень, до висловлювань: № 2, 5, 6, 11, 12, 14, 16, 17, 18, 20.
Наприклад: у висловлюванні № 2 закреслена цифра 1, ми ставимо в суму 4 бали; у висловлювання № 5 закреслено відповідь 2 – ставимо в суму 3 бали; у висловлювання № 6 закреслено відповідь 3 – ставимо в суму 2 бали; у висловлюванні № 11 закреслено відповідь 4 – ставимо в суму один бал і т.д. В результаті отримували РД, який коливався від 20 до 80 балів. Якщо РД – не більше 50 балів, то діагностували стан без депресії. Якщо РД – більше 50 і менше 59 балів, то робили висновок про легку депресію ситуативного чи невротичного генезу. Показник РД від 60 до 69 балів – субдепресивний стан або маскована депресія. Справжній депресивний стан діагностувався при РД більше 70 балів.
2) Тест Шихана з визначенням показників тривожності.
Опитувальник Шихана (Sheehan Patient-Rated Anxiety Scale, SPRAS), розроблений у 1983 році Девідом Шиханом, використовується для діагностики тривожних розладів в клінічній практиці [188]. Вираженість симптомів ранжується від 0 до 4 в залежності від їх оцінки пацієнтами: 0 – «ні», 1 – «слабо», 2 – «середньо», 3 – «сильно», 4 – «дуже сильно». Загальний бал дорівнює сумі всіх балів і може мати значення від 0 до 140. При інтерпретації даних виділялися наступні рівні значень: 0-30 – відсутність клінічно вираженої тривоги, 30-80 – клінічно виражена тривога, 80 і більше – тяжкий тривожний розлад.
3) Опитувальник РDІ:
Ступінь порушень оцінювалася за допомогою опитувальника РDІ – індекс недієздатності при псоріазі. Даний опитувальник містить 15 питань, максимальна сума балів – 45, мінімальна – 0. Чим більшу кількість балів набрав пацієнт, тим нижче рівень життя.
2.2.6 Методика визначення ступеня окислювальної модифікації білків у біологічних зразках
Дослідження проводилося за методикою В.Halliwell (1999) [150]. Принцип методу заснований на реакції взаємодії окислених амінокислотних залишків з 2,4-динітрофенілгідразіном з утворенням 2,4-динітрофенілгідразонів. Для ініціації ОМБ використовувалося середовище Фентона (1 мМFe2+, 0,3 мМ Н2O2). Ступінь ОМБ вивчали як у спонтанній, так і в метал-індукованій пробі (в середовищі Фентона).
До 0,1 мл від центрифугованої сироватки крові додавався 0,1 мл 2,8 % розчину FeSO4 і 0,1 мл 4 % розчин Н2О2, які готувалися ех tempore (в разі метал-індукованоокисної модифікації білка) або 0,2 мл фізіологічного розчину (в разі спонтанної модифікації). Інкубувалися 1 годину при t=37 0С. Потім білки облягали додаванням 0,1 мл 20 % трихлороцтової кислоти, після чого проби центрифугувалися 30 хвилин при 3000 об / хв.
До осаду додавалися 1 мл 2,2 % розчину 2,4-динітрофенілгідразіну на 2 М НСl, інкубували 15 хв. І центрифугували при 3000 об/хв. Надосадок зливався, а осад промивався 3мл етилацетату. Потім осадок висихав і доливалися до нього 3,0 мл 2 М сечовини і 1 мл 2 М НСl. Проби спектрофотометрувалися при довжині хвилі 270 нм (аліфатичні альдегіди основних амінокислотних залишків) і 363 нм (карбонільні групи основних амінокислотних залишків).
Ступінь ОМБ висловлювалася в одиницях оптичної щільності, віднесених до 1 г білка:
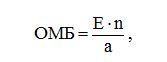 де Е – екстенція проби;
де Е – екстенція проби;
n – розведення (800 разів);
а – вміст загального білка (г/л).
2.2.7 Метод визначення активності NО-синтази
Дослідження проводилося за методикою Гріса (2005). Принцип методу: NО-синтази – група ферментів, які каталізують утворення оксиду азоту та цитрулина з аргініну, кисню і нікотинамідаденіндинуклеотидфосфату. Спад останнього еквівалентний кількості утворення NО, яку реєструють спектрофотометрично при довжині хвилі 340 нм.
До 0,2 мл сироватки крові додавалися 2,0 мл депротеїнізатора (750 мл ZnSO4 + 100 мл NaОН до 100 мл Н2О) та інкубувалися 15 хв. при t=27-300С, потім проби центрифугувалися при 1500 об/хв протягом 20 хв. Надосад кількісно переносився в чисту пробірку і додавався 1 мл реактиву Гріса (10 г у 90 мл 12,5 % оцтової кислоти). Проби залишалися на 15 хв. при кімнатній температурі, після чого спектрофотометрувалися при довжині хвилі 540 нм. Контролем слугували 2 мл дистильованої води і 1 мл реактиву Гріса. Концентрація NО розраховувалася за калібровочною кривою з перерахунком на загальний білок і представлялася в нмоль/г білка/хв [150].
2.2.8 Статистична обробка отриманих результатів
Отримані дані оброблювалися з використанням програм Microsoft Excel. Статистична значимість порівнюваних показників з нормальним розподілом встановлювалася з використанням t-критерію Ст’юдента для середніх величин і F–критерію Фішера для дисперсії. Аналізовані дані представлені як «середнє±стандартне відхилення (М±s)», рівень значущості р=0,05.
Виділення клініко-терапевтичних груп проводилося методом кластерного аналізу. Для концентрації ключового для кластерного аналізу поняття «близькості» або «відстані» між точками в багатовимірному просторі, що містить досліджувану вибірку, використано метрику, що спирається на об’єктивно існуючу кореляційну залежність між випадковими змінними. У якості показника цієї залежності застосовано вибіркові коефіцієнти кореляції; багатовибірний кореляційний аналіз досліджених даних проведено за методикою обчислення вибіркових коефіцієнтів кореляції [22].
2.3 Клінічна характеристика хворих
Під спостереженням перебувало 110 хворих на псоріаз, які знаходилися на стаціонарному лікуванні, з них – 65 чоловіків, 45 жінок та 34 практично здорових осіб без відповідної патології. Обстеження пацієнтів проводилося згідно з Наказом МОЗ України № 762 від 20.11.2015р., який передбачав аналіз скарг, анамнезів захворювання, життя, загального і локального статусів.
У 110 хворих на псоріаз, що перебували під спостереженням, проведені клініко-лабораторні дослідження на наявність маласезіозу шкіри, оскільки необхідно було встановити вплив маласезіозу на перебіг псоріазу. В літературі цей взаємозв’язок і можливий взаємовплив цих дерматозів був висвітлений недостатньо, а окремі дані дуже неповні і суперечливі.
Основними даними для діагнозу маласезіозу шкіри слугували клінічні прояви мікозу та виявлення мікроскопічно і культурально достатньої кількості (не менш 8х105 колонієутворюючих одиниць на 1 см2) маласезій.
З 110 досліджених хворих на псоріаз маласезіоз шкіри встановлений у 80 пацієнтів, що обумовлений М. furfur, М. pachidermatis, М. obtuses. У цих хворих діагностовано пітиріаз волосистої частини голови, ксероз Дар’є, гнійний фолікуліт, різнокольоровий лишай, себорейний дерматит.
Простий пітиріаз волосистої частини голови виявлений у 46 з 80 хворих (57 %), який проявлявся нечітко відмежованим дрібним висівкоподібним лущенням ділянок незапальної шкіри волосистої частини голови, з нашаруванням білих чи жовтуватих, сухих чи жирних лусочок.
Ксероз Дар’є відмічено у 62 з 80 хворих на псоріаз (80 %) і він характеризувався гіпертрофією рогового шару з дрібним лущенням, брудно-жовтим, темно-бурим та сіруватим забарвленням шкіри, зіянням отворів сальних залоз, зміною кількості та хімізму шкірного жиру.
Гнійний фолікуліт діагностовано у 53 (66 %) хворих і він характеризувався появою акнеподібних фолікулярних пустул.
Себорейний дерматит встановлено у 36 хворих (45 %) і був представлений хронічним дерматозом в себорейних зонах та характеризувався обмеженими вогнищами запалення, поверхня яких була з жирними лусочками та ексудативним компонентом.
Різнокольоровий лишай у 15 хворих (20 %) характеризувався появою на шкірі шиї, тулуба та плеч жовтувато-рожевих та коричнюватих плям, які лущилися.
Таким чином, маласезійна інфекція була представлена не однією клінічною формою, а у вигляді комбінації двох, трьох і,навіть,- чотирьох нозологій.
Тривалість існування проявів маласезіозу у досліджених хворих часто перевищувала тривалість існування псоріазу.
Хворі на псоріаз із супутнім маласезіозом розподілялися по групам з урахуванням статі, стадії, форми, тривалості захворювання, віку, соціального стану, супровідних і перенесених захворювань.
Давність захворювання складала 3 – 14 років. Захворювання на псоріаз частіше виникало у віці 12 – 35 років, рідше – після 40 років.
Більшість хворих (таблиця 2.1) були у віці 25-46 років, з майже однаковим співвідношенням чоловіків та жінок в вікових групах.
Таблиця 2.1 – Розподіл хворих по віковим групам
| Вік | Усього хворих | Чоловіки | Жінки |
| 24-29 років | 42 | 24 | 18 |
| 30-39 років | 33 | 18 | 15 |
| 40-45 років | 35 | 23 | 12 |
| Разом | 110 | 65 | 45 |
У структурі захворюваності (таблиця 2.2) переважали мешканці міст над сільськими мешканцями, як серед чоловіків, так і жінок.
Таблиця 2.2 – Розподіл хворих в залежності від їх місця мешкання
| Місце мешкання | Усього хворих | Чоловіки | Жінки |
| Мешканці міста | 75 | 41 | 34 |
| Мешканці сільської місцевості | 35 | 24 | 11 |
| Разом | 110 | 65 | 45 |
Як видно з таблиці 2.3, більшість хворих на псоріаз з супутнім маласезіозом були у шлюбі, переважали жінки.
Працівниками розумової праці були 18 %, з них службовців – 13 %, учнів – 5 %. Працюючих в сфері фізичної праці було 34 %, з них працівників промпідприємств – 16 %, сільського господарства – 18 %, осіб без конкретних занять та ін. – 46 %.
Таблиця 2.3 – Розподіл хворих у залежності від сімейного стану
| Сімейний стан | Усього хворих | Чоловіки | Жінки |
| У шлюбі | 84 | 43 | 26 |
| Не у шлюбі | 26 | 22 | 19 |
| Разом | 110 | 65 | 45 |
Хворі були у віці 24 – 46 років, які знаходилися на стаціонарному лікуванні у чоловічому та жіночому шкірних відділеннях у Комунальній установі «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради. Осінньо-зимовий псоріаз відмічався у 81 хворого, весняно-літній – у 20 і змішаного типу – у 9. Прогресуюча стадія встановлювалася у 35 хворих, стаціонарна – у 75.
У 110 обстежених хворих на псоріаз переважав вульгарний або бляшковий псоріаз, він спостерігався у 106 хворих, краплеподібний – у 2, інтертригінозний – у 2.
У 48 хворих встановлена псоріатична оніходистрофія.
Фактор спадковості спостерігався у 25 з 110 хворих, з однаковою частотою як у чоловіків, так і жінок. Фактори, які передували виникненню псоріазу та його загострень, досліджувалися за допомогою анамнестичних даних.
Так, у 75 % хворих жіночої статі з супутнім маласезіозом передували різні психо-емоційні фактори, нервові стреси (хвороби і смерть близьких, перевантаження на роботі та ін.), щодо чоловіків хворих на псоріаз з супутнім маласезіозом, то 71 % передували різні інфекційні фактори (ОРЗ, грип, гайморит, фронтит, ангіна, холецистит, грибкові та вірусні інфекції та ін.).
Комбіновані фактори, як психо-емоційні, так і інфекційні, спостерігались у 38 % хворих. Також, у 11 % хворих причинні фактори не вдалося виявити.
Хворі на псоріаз з супутнім маласезіозом (таблиця 2.4) страждали однаково часто, як чоловіки, так і жінки, на захворювання печінки, шлунка, кишечника, підшлункової залози, дихальної системи, серцево-судинної системи. Зловживання алкоголем було відмічено більше у хворих на псоріаз з супутнім маласезіозом чоловіків (65 випадків), а психічні і нервові захворювання – у жінок (24 випадки); мікотичні інфекції (15).
Таблиця 2.4 – Супутні захворювання у хворих на псоріаз
| Супутнє захворювання | Хворі на псоріаз із супутнім маласезіозом (n=80) | Хворі на псоріаз без супутнього маласезіозу (n=30) | Усього (n=110) |
| Захворювання дихальної системи (хронічний бронхіт) | 9 | 12 | 21 |
| Захворювання печінки і підшлункової залози | 6 | 5 | 11 |
| Захворювання шлунку та кишечнику | 24 | 21 | 45 |
| Захворювання серцево-судинної системи (гіпертензія, стенокардія) | 12 | 14 | 26 |
| Зловживання алкоголем | 61 | 24 | 85 |
| Сечостатеві інфекції | 15 | 16 | 31 |
| Вірусні інфекції | 4 | 3 | 7 |
| Гнійно-запальні захворювання (хронічний тонзиліт, гайморит, пієлонефрит) | 9 | 8 | 17 |
| Грибкові інфекції | 15 | 8 | 23 |
| Нервові і психічні захворювання | 24 | 12 | 36 |
З таблиці 2.5 видно, що перенесені захворювання частіше реєструвалися у хворих на псоріаз із супутнім маласезіозом, особливо у хворих з фокальною інфекцією, застудами, травмами, шкірними хворобами.
Таблиця 2.5 – Перенесені захворювання у хворих на псоріаз
| Перенесені захворювання | Хворі на псоріаз із супутнім маласезіозом (n=80) | Хворі на псоріаз без супутнього маласезіозу (n=30) | Усього (n=110) |
| Застудні захворювання | 21 | 18 | 39 |
| Гнійно-запальні процеси | 18 | 6 | 24 |
| Дитячі інфекції | 32 | 36 | 68 |
| Урогенітальні інфекції та простатит | 15 | 10 | 25 |
| Травми, операції, переломи | 10 | 4 | 14 |
| Шкірні хвороби (дерматит, короста та ін.) | 12 | 4 | 16 |
| Інші хвороби | 34 | 41 | 75 |
Бляшковий псоріаз відмічений у 106 хворих, який проявлявся висипами на шкірі ліктьових, колінних суглобів, волосистої частини голови, тулуба. Як правило, хворі відмічали початок дерматозу з появи невеликих папул червоно-рожевого кольору, розміром 2-3 мм у діаметрі, які потім збільшувалися у розмірі, зливалися до поодиноких бляшок, а потім утворювали зливні бляшки, вкриті сріблясто-білими лусочками з вінчиком червоного кольору по периферії. При пошкрябуванні папули відмічалася позитивна псоріатична тріада. У 21 хворого з 110 хворих в місцях подразнення в прогресуючий стадії відмічався симптом Кьобнера.
Псоріаз краплеподібної форми, який ми діагностували у 2-х хворих характеризувався гострим висипом с краплеподібними папулами (0,5 – 1,0 см), які покривали майже всю поверхню шкіри.
У 2 хворих встановлений інтертригінозний псоріаз, клінічна картина у них характеризувалась характерними ураженнями пахових западин, складок на животі, ділянок під грудними залозами, пахових та періоральних ділянок.
Оніходистрофія псоріатичного походження була у 41 хворого з 110 хворих, що проявлялася точковим заглибленням, піднігтьовим гіперкератозом та дистрофією нігтьової пластини.
У 75 % пацієнтів була уражена волосиста частини голови, як у хворих на псоріаз з супутнім маласезіозом, так і без нього.
Дослідження клінічних особливостей перебігу псоріазу з супутнім маласезіозом показало більш ускладнене захворювання у цих хворих, при порівнянні з хворими без супутнього маласезіозу. Так, індекс PASI становив 28,21±2,15 в хворих на псоріаз з супутнім маласезіозом та 24,41±2,01 – у хворих на псоріаз без супутнього маласезіозу (р<0,05).
Для оцінки тяжкості перебігу оцінювалася частота рецидивів псоріазу у хворих на псоріаз із супутнім і без супутнього маласезіозу.
У хворих на псоріаз із супутнім маласезіозом спостерігалося по 1 загостренню протягом року – 10,5 %, по 2-3 – у 83,4 % і більше 3 – у 6,1 % хворих.
У хворих на псоріаз без супутнього маласезіозу одне загострення протягом року відмічалося в 70,61 % хворих, по 2-3 загострення – в 27,5 % та більше 3 загострень – в 2,11 %.
Таким чином, відмічалось достовірно вища кількість загострень у хворих на псоріаз з супутнім маласезіозом (р<0,05).
При зборі анамнезу зверталася увага на особливості клінічних проявів (перебігу) рецидивів псоріазу, що дало можливість виділити різні терміни розповсюдження дерматозу. Короткі терміни перебігу (від декілька днів до 3-4 тижнів), що розцінювали як швидке розповсюдження; поступове розповсюдження (від 2-3 місяців до 1 року); повільне розповсюдження (більше 1 року). У більшості досліджених хворих відмічено (68 %) поступове розповсюдження, але у хворих на псоріаз з супутнім маласезіозом частіше зустрічалось (32 %) швидке розповсюдження.
В анамнезі також зверталася увага на тривалість ремісії. У 34 % досліджених хворих ремісії були до 1 року, переважно з супутнім маласезіозом.
Таким чином, досліджено 110 хворих на псоріаз, 65 чоловіків і 45 жінок. Більшість хворих були у віці 24-46 років, переважали мешканці міст, що перебували у шлюбі, працюючих було 36 %, пенсіонерів – 54 %. Вульгарний (бляшковий) псоріаз був у 106 хворих, краплеподібний – у 2, інтертригінозний – у 2. Псоріатична оніходистрофія встановлена у 41 із 110 хворих, спадкові фактори – у 25 [57, 182, 193].
У 75 % хворих жіночої статі з супутнім маласезіозом передували виникненню і загостренню різні психо-емоційні фактори, в 71 % чоловіків з супутнім маласезіозом – інфекційні фактори. Щодо супутніх захворювань у чоловіків хворих на псоріаз з супутнім маласезізом, частіше зустрічалися алкоголізм, запальні захворювання, травми, шкірні хвороби, а у жінок – нервові і психічні захворювання. При аналізі клінічних особливостей перебігу псоріазу з супутнім маласезіозом встановлено, що він був більш тяжким, частіше зустрічались розповсюджені форми псоріазу. Відмічено також більш часті рецидиви у хворих на псоріаз з супутнім маласезіозом з нестійкими ремісіями.
2.4 Психологічний статус хворих на псоріаз
Як відомо, психогенні фактори при псоріазі виступають як тригери і можуть призвести до виникнення та загострення дерматозу у взаємозв`язку з іншими патогенетичними факторами. Цьому сприяють довготривалий перебіг дерматозу, неминучість рецидивів, ураження відкритих ділянок шкіри, що викликає негативну реакцію серед оточуючих як вдома, так і на роботі, можливість «інфікування». Тому хворі нерідко відмовляються від спорту, улюблених занять і, навіть, залишають роботу. Психологічний профіль у хворих на псоріаз характеризується схильністю все ускладнювати, переважно, з приводу невдач. У 20-30 % хворих формуються тривожно-депресивні стани, що спричиняє порушення адаптації.
З метою оцінки психологічного статусу хворих на псоріаз, вивчалися показники депресії (за шкалою Зунга) та показники тривожності (за шкалою Шихана).
При оцінці показників депресії та тривожності в загальній групі хворих на псоріаз з супутнім маласезіозом і без мікозу показник шкали депресії відповідав помірно вираженій депресії. При цьому показник менше 5 балів був у 6 % (7 пацієнтів), від 50 до 59 балів – у 40 % (44 хворих), від 60 до 69 балів (помірна депресія) – у 46 % (50 хворих), 10 балів та вище (тяжка депресія) – у 8 % (9 хворих). Таким чином, помірна та тяжка депресія відмічені більш ніж у половини хворих (59 %), особливо при супутньому маласезіозі.
У групі хворих з обмеженими формами псоріатичного процесу відмічалася помірна мінімальна депресія, а при ураженні більше 50 % шкіри, особливо при наявності маласезіозу – тяжка депресія (різниця між групами достовірна – р<0,05).
У хворих з меншою площею ураження встановлено нормальний рівень тривожності, а з більшою поширеністю – аномальний рівень (р<0,05), що обумовлено переважанням у першій групі пацієнтів із середнім рівнем тривожності.
Дуже важливим є оцінка впливу недієздатності на якість життя пацієнтів, оскільки псоріаз відбивається на всіх аспектах життя, соціальній сфері, кар`єру, сімейних стосунках. Тому цей вплив вивчався за допомогою опитувальника PDI.
Даний опитувальник містив 15 питань, максимальна сума балів – 45, мінімальна – 0. Чим більшу кількість балів набирали пацієнти, тим нижче оцінювали рівень життя.
При оцінці PDI в загальній групі хворих середній показник проведеної фізичної активності складав (9,00±0,36) балів, робота, навчання – 3,00±0,23, персональні питання – 3,40±0,24, вільні питання – 4,30±0,32, лікування – 0,80±0,11.
Індекс недієздатності при псоріазі зменшувався у пацієнтів основної групи з 14,14±1,08 до лікування до 6,32±0,52 після лікування, а у пацієнтів груп порівняння з 13,2±1,04 до лікування до 8,38±0,81 після лікування (р<0,05).
При порівнянні показників PDI у хворих ускладненими формами (включно і маласезіоз) і неускладненими формами відмічені достовірно більш високі значення по всіх розділах при ускладнених формах, що вказує на більш суттєве вплив недієздатності на рівень життя.
Найбільш виражені зміни показника PDI (щоденна активність, лікування, якість життя, тяжкість захворювання) відмічено у хворих на псоріаз з давністю дерматозу більше 10 років.
Найбільш виражений вплив на показники PDI відмічався у хворих при ураженні більше 50 % шкірного покриву.
При дослідженні психологічного статусу у хворих на псоріаз, помірна або тяжка депресія встановлена в половини пацієнтів, особливо при розповсюджених формах дерматозу, переважно з супутнім маласезіозом. Аномальний рівень тривожності виявлений у 28 % досліджених, також при дифузних формах дерматозу і наявності маласезіозу. При вивченні показника якості життя за шкалою РDІ було встановлено найбільш виражені зміни цього показника (щоденна активність, лікування, якість життя, тяжкість захворювання) у хворих на псоріаз з давністю дерматозу більше 10 років, а також – при ураженні більше 50 % шкірного покрову і при наявності ускладнень (маласезіоз та ін.).
РОЗДІЛ 3
ІМУННИЙ СТАТУС У ХВОРИХ НА ПСОРІАЗ З СУПУТНІМ МАЛАСЕЗІОЗОМ
Досліджувався імунний статус хворих на псоріаз з супутнім маласезіозом шкіри для вивчення патогенезу цих дерматозів, а також оцінки стану захисних сил організму, розробки показань та раціональної терапії, диспансеризації хворих. Імунна система є однією з провідних ланок організму людини, яка бере участь в захисних механізмах людини, формуючи відповідь на несприятливі фактори як зовнішнього, так і внутрішнього середовища. Комплексний підхід у вивченні імунних реакцій необхідний для повноцінного розуміння механізмів як неспецифічних ланок імунітету, так і клітинних і гуморальних показників імунітету.
В літературі зустрічається значна кількість робіт, в яких досліджується імунна система у хворих на псоріаз, але є лише поодинокі роботи, в яких досліджуються показники імунітету у хворих на псоріаз з супутнім маласезіозом [17, 138, 178].
Враховуючи особливості патогенезу та клінічних проявів псоріазу с супутнім маласезіозом, безумовно, мають місце відмінності в імунному статусі цих хворих.
Ці дані необхідні для розробки раціонального диференційованого лікування пацієнтів, а також методів профілактики та прогнозування рецидивів псоріазу [42, 43, 65].
Ми провели порівняльний аналіз специфічних факторів захисту, Т- і В-ланок імунітету у хворих на псоріаз без маласезіозу і хворих на псоріаз з супутнім маласезіозом, а також – IL, що відіграють значну роль у формуванні запальних реакцій при псоріазі. Результати, які отримали, порівнювали з даними досліджень 34 практично здорових осіб групи контролю.
3.1 Дослідження популяцій та субпопуляцій лімфоцитів у хворих на псоріаз з супутнім маласезіозом
По даним літератури, псоріаз є Т-клітинно-опосередкованим захворюванням, що характеризується автоімунним механізмом з активацією клітинної ланки імунітету з Тh1-цитокіновим профілем, тому вивчення цих показників у цих хворих з супутнім маласезіозом є важливою ланкою в пізнанні особливостей патогенезу дерматозу.
Як видно з таблиці 3.1, пригнічення утворення Т-клітин у хворих на псоріаз відбувалося за рахунок статистично достовірного зменшення (р<0,01) вмісту Т-хелперів (СD4+) на тлі незначного статистично недостовірного підвищення (р>0,05) кількості цитотоксичних лімфоцитів (СD8+).
Виражені зміни у хворих на псоріаз були пов’язані з супутнім маласезіозом. В оцінці імунного статусу приділялася особлива увага співвідношенню Т-хелперів і Т-супресорів, так як від цього залежить інтенсивність імунної відповіді організму.
У досліджених хворих на псоріаз з супутнім маласезіозом (див. табл. 3.1) виявлено статистично значиме зниження імунорегуляторного індексу (СD4+/СD8+), у порівнянні з контролем (р<0,01).
На тлі підвищення активності Т-супресорів при такому співвідношенні субпопуляції немає змоги розвинутися адекватній імунній відповіді, у зв’язку з чим переважають автоімунні процеси, які і є наслідком вторинного імунодефіцитного стану.
Значна увага приділялася вивченню кількості натуральних кілерів (СD16+) у сироватці крові хворих.
Як видно з таблиці 3.1, виявлялося підвищення абсолютної та відносної кількості натуральних кілерів (СD16+) у сироватці крові хворих на псоріаз з супутнім маласезіозом.
Таблиця 3.1 – Кількість популяцій та субпопуляцій лімфоцитів у досліджених хворих на псоріаз
| Показники | Здорові люди (n=34) | Хворі на псоріаз з супутнім маласезіозом (основна група) (n=80) | Хворі на псоріаз без маласезіозу (група порівняння) (n=30) | |
| Лімфоцити | 109/л | 2,42±0,08 | 2,12±0,08 | 1,98±0,09 |
| % | 36,4±0,9 | 28,8±1,68 | 29,8±1,6 | |
| СD3+ | 109/л | 1,46±0,07 | 0,9±0,03* | 1,2±0,8* ** |
| % | 58,3±1,2 | 44,2±0,8* | 48,4±1,1* | |
| СD4+ | 109/л | 0,78±0,05 | 0,52±0,02* | 0,57±0,04* |
| % | 37,2±1,1 | 27,2±0,8* | 29,6±0,8* | |
| СD8+ | 109/л | 0,37±0,03 | 0,42±0,02 | 0,34±0,01 ** |
| % | 21,5±0,9 | 18,2±0,3 | 21,9±0,38 ** | |
| СD16+ | 109/л | 0,2±0,02 | 0,38±0,02* | 0,28±0,01* |
| % | 16,9±1,18 | 24,2±1,62* | 22,1±1,12* | |
| СD22+ | 109/л | 0,28±0,01 | 0,38±0,01* | 0,27±0,02 |
| % | 16,2±1,1 | 18,8±0,7* | 16,3±1,06 | |
| СD25+ | 109/л | 0,28±0,01 | 0,48±0,04* | 0,32±0,02 ** |
| % | 17,2±1,4 | 29,2±2,4* | 18,16±1,84 ** | |
| СD4+/СD8+ | 2,1±0,04 | 1,36±0,02* | 1,5±0,03* ** | |
Примітки:
* – р<0,05 – достовірно при порівнянні з групою контролю;
**-р<0,05 – достовірно при порівнянні даних груп хворих на псоріаз.
Натуральні кілери здійснюють антиген-специфічну ефекторну імунну реакцію антитілозалежної клітинної цитотоксичності, що відіграє певну роль в патогенезі псоріазу. В нормі, при контакті з клітинами рецептори на NК‑клітинах здатні зв’язувати молекули МНС-1, (головний комплекс гістосумісності) власних клітин, і, якщо вони не знаходять достатньої кількості своїх клітин МНС-1, то відносно цих клітин розвивається цитотоксичний ефект.
При визначенні загальної кількості В-лімфоцитів (СD22+) встановлено, що їх абсолютна кількість у хворих на псоріаз з супутнім маласезіозом статистично достовірно (р<0,05) була вищою, ніж у здорових людей і хворих на псоріаз без супутнього маласезіозу (див. табл. 3.1). Підвищення кількості В-лімфоцитів у хворих на псоріаз з супутнім маласезіозом можна пояснювати впливом інфекційних чинників на перебіг псоріазу.
Наступним дуже важливим показником рівня стимуляції антитіло- утворення до цитотоксичності є вміст Т-лімфоцитів з рецепторами до IL-2 (СD25+) в крові.
Т-лімфоцити активуються в результаті взаємодії дендритних клітин, що представляють антиген до інтенсивно мігруючих Т-лімфоцитів в лімфатичних вузлах. Якщо в цей період відбуваються необхідні і достатні взаємодії з антигенпрезентуючою клітиною, то Т-лімфоцит отримує активований сигнал, в результаті якого виникає клон специфічних для антигену диференційованих Т-лімфоцитів. Вони вже будуть називатися лімфоцитами-ефекторами, ідентифікаційним маркером яких є СD25+.
Цей показник відображає здатність лімфоцитів до проліферації і диференціювання за допомогою утворення цитокінів, одним з яких є IL-6.
При дослідженні виявлено статистично значиме підвищення абсолютного і відносного вмісту СD25+-активованих Т-лімфоцитів в групі хворих на псоріаз з супутнім маласезіозом, як в порівнянні з здоровими особами (р<0,05), так і в групі хворих на псоріаз без маласезіозу (р<0,05).
Зміни числа СD25+ свідчать про гіперактивність клітинного імунітету, обумовлену інфекційними чинниками (грибами), стимулюючими антитілоутворення і цитотоксичність Т-лімфоцитів, і це ще раз підкреслює негативний вплив маласезійної інфекції на перебіг псоріазу і необхідність її усунення при лікуванні дерматозу.
Таким чином, аналіз отриманих результатів вивчення лімфоцитарних реакцій дозволив виявити зміни складу основних клітинних популяцій лімфоцитів периферичної крові хворих на псоріаз з супутнім маласезіозом. У дослідженнях відмічено статистично достовірне зниження пулу Т-клітин (СD3+) в групі хворих на псоріаз з супутнім маласезіозом, у порівнянні з групою контролю.
Відбувалося це за рахунок зниження в периферичній крові абсолютного і відносного вмісту Т-хелперів (СD4+), в порівнянні з незначним зростанням кількості цитотоксичних Т-лімфоцитів і зниженням імунорегуляторного індексу.
В дослідженні звертає на себе увагу зростання натуральних кілерів (СD16+) в сироватці крові у чоловіків, що характеризує клітинну цитотоксичність. Щодо рівня СD19+, то він був значно вище у хворих на псоріаз з супутнім маласезіозом, в порівнянні з хворими на псоріаз без супутнього маласезіозу.
Також було виявлено збільшення рівня СD25+, що ми розцінюємо як прояв гіперактивності клітинного імунітету, обумовлений інфекційним фактором, що стимулює антитілоутворення, цитотоксичність Т-лімфоцитів.
Усі ці дані свідчать про значне розходження стану клітинного і гуморального імунітету, функції лімфоцитів у хворих на псоріаз з супутнім маласезіозом.
Було виявлено більш глибокі зрушення рівня популяцій і субпопуляцій лімфоцитів у хворих на псоріаз з супутнім маласезіозом, що пояснювалося особливостями патогенезу псоріазу у них і значенням інфекційного фактору у розвитку дерматозу і його перебігу, що підтверджується даними анамнезу та наявністю супутньої патології.
3.2 Цитокіновий статус у хворих
Оцінка цитокінового статусу є важливим доповненням до розуміння патогенезу захворювання, тяжкості запального процесу, прогнозу та перебігу захворювання.
Імунологічні механізми розвитку псоріазу полягають в активації антиген-презентуючих клітин, що мігрують в реґіонарні лімфатичні вузли, де і відбувається запуск реакцій з наступною активацією і проліферацією клітин імунної системи. До активації клітин антиген предоставляють клітинам і лімфоцитам, на появу патогену реагують кератіноцити, тканинні базофіли, макрофаги, ендотеліоцити судин, в результаті чого продукуються різноманітні медіатори (цитокіни).
Цитокіни є одним з основних регуляторів міжклітинної взаємодії що беруть участь в реалізації імунної відповіді, запальних реакціях.
З факторів, які відіграють роль у розвитку псоріазу є порушення регуляції імунної відповіді за допомогою Т-лімфоцитів. Цитокіни Т-хелперів типів 4 і 1β призводять до гіперсекреції прозапальних медіаторів з послідуючою активацією кератиноцитів, мастоцитів, нейтрофілів, ендотеліоцитів, що в кінцевому підсумку проявляється персистуючим хронічним запаленням.
За даними літератури, запалення в шкірі супроводжується не тільки локальним синтезом цитокінів, а й підвищенням їх концентрації в крові.
Попередні дослідження показали, що у хворих на псоріаз високі рівні в сироватці крові ІL-4, ІL-1β, ФНП-α.
Щодо ІL–1β, то він продукується макрофагальними клітинами, лімфоцитами, фібробластами. Він сприяє тому, що Т-лімфоцити – хелпери починають продукувати ІL-2. ІL-1β ініціює і реагує на запальні, імунні процеси, активує нейтрофіли, Т- і В-лімфоцити, а також стимулює синтез цитокінів (ІL-4, ФНП-α), простогландинів. Також IL-1β підвищує хемотаксис, фагоцитоз, гемопоез, проникність судинної стінки, цитотоксичну і бактеріальну активність. ІL-4 продукується Т-клітинами (Т-хелперами ІІ типу) і є фактором для диференціювання Т- і В-лімфоцитів.
IL-4 обмежує синтез макрофагами прозапальних ІL-19, -6, -8, -12, ФНП‑α.
Крім того, ІL-4 активує проліферацію В-лімфоцитів, підсилює протипухлинну активність макрофагів, модулює запальні реакції, активує Т-хелпери.
Патогенетичне значення при псоріазі мають як Тh1-типу запальні реакції, так і ФНП-α-керований дерматоз [148]. ІL-1β і ІL-4 діють на кератиноцити і призводять до епідермальної гіперплазії, акантозу і гіперкератозу. Дермальні Тh-1-лімфоцити активуються дермальними дендритними клітинами і продукують ФНП-α і інтереферон-g. Фібробласти під впливом ФНП-α починають синтезувати фактор росту кератиноцитів. Це призводить до гіперпроліферації кератиноцитів, які в свою чергу активують імунокомпетентні клітини, міграцію нейтрофілів, плазмоцитарні дендритні клітини і фактор росту ендотелію судин. Це спричиняє підвищену секрецію сироваткового рівня ФНП-α.
У хворих на псоріаз із супутнім маласезіозом відзначено різке зростання рівня ІL-1β, ІL-4 і ФНП-α, що було при порівнянні з рівнем їх у здорових людей і хворих на псоріаз без маласезіозу статистично значимо (р<0,01) (табл. 3.2). Підвищення цитокінів, отримане в дослідженнях, узгоджується з даними літератури про синергізм між їх збільшенням. Привертає на себе увагу, що більш виражене збільшення концентрації цих цитокінів відзначено у хворих на псоріаз із супутнім маласезіозом.
ІL-1β є основним медіатором загострення псоріазу, тому збільшення його рівня в сироватці крові має значення в його розвитку. В експериментальних моделях морфологічні ознаки псоріазу більш виражені при стимулюванні ІL-1β, ніж ІL-12. Щодо ІL-1β і ІL-4 необхідно відзначити, що вони інтегрують патологічні шляхи із залученням Т-хелперів типу 1, цитотоксичних Т-лімфоцитів типу 1 і дендритних клітин, які є основними ланками в розвитку псоріазу. Необхідно відмітити, що рівень цитокінів, які вивчалися, особливо ІL-1β, залежали від показників РАSІ і наявності чи відсутності маласезійної інфекції. Підвищення показників було у хворих на псоріаз з наявністю осередків хронічної інфекції.
Таблиця 3.2 – Рівень інтерлейкінів у хворих на псоріаз і псоріаз з супутнім маласезіозом
| Показники (nг/мл) | Група контролю (n=34) | Хворі на псоріаз з супутнім маласезіозом (n=80) | Хворі на псоріаз без маласезіозу (n=30) |
| ФНП-α | 8,2±1,2 | 23,2±2,2* | 37,1±3,2* ** |
| IL-1β | 15,2±1,3 | 30,2±3,8* | 38,4±2,9* ** |
| IL-4 | 2,3±0,11 | 2,42±0,05 | 5,6±0,25* ** |
Примітки:
* – р<0,05 – різниця зі здоровими достовірна;
**- р<0,05 – різниця показників у хворих на псоріаз різних груп достовірна.
Можливо, рівень цих медіаторів, може слугувати прогностичним показником в подальшому загостренні псоріазу і появі його рецидивів. Все це дає можливість провести профілактичне лікування і попередити рецидив дерматозу, що має важливе значення в дерматології, сприяє покращенню якості життя хворих на псоріаз.
3.3 Фагоцитарна активність клітин у досліджених
Кількість нейтрофілів, моноцитів у крові та фагоцитарний показник (таблиця 3.3), статистично значимо не відрізнялися в обох групах хворих на псоріаз без супутнього маласезіозу і з супутнім маласезіозом. У хворих на псоріаз відмічено статистично достовірне зниження (р<0,01) порівняно з групою контролю фагоцитарного числа та НСТ-тесту, більш виражене у хворих на псоріаз з супутнім маласезіозом.
Таблиця 3.3 – Функціональна активність фагоцитарних клітин у хворих на псоріаз
| Показники | Здорові люди ( n=34) | Хворі на псоріаз з маласезіозом (основна група) (n=80) | Хворі на псоріаз без маласезіозу (група порівняння) (n= 30) |
| Нейтрофіли 109/л | 4,89±0,68 | 4,92±0,2 | 4,96±0,42 |
| Фагоцитарний показник | 65,42±0,86 | 59,49±2,2 | 62,6±2,4 |
| ФЧ | 5,47±0,29 | 3,14±0,28* | 3,48±0,32* |
| НСТ-тест спонтанний % | 4,12±0,2 | 2,46±0,11* | 3,27±0,24* |
| Моноцити 109/л | 0,41±0,02 | 0,36±0,01 | 0,34±0,02 |
Примітки:
* – р<0,05 при порівнянні хворих з групою контролю достовірна;
** – р<0,05 достовірно при порівнянні двох груп хворих на псоріаз.
Таким чином, при вивченні фагоцитарних реакцій у хворих на псоріаз з супутнім маласезіозом відмічено пригнічення функціональної активності нейтрофілів та фагоцитозу, тобто факторів неспецифічного захисту організму. Зниження цих показників слід трактувати як вторинний імунодефіцит, що характерно для псоріазу. Макрофаги, які взаємодіють з антитілами, не дозволяють антигенчутливим Т- і В-клітинам дати максимальну відповідь на порогові дози антигену, вони локалізують антигени у фолікулах лімфоїдних тканин. Внаслідок імунних порушень при псоріазі, особливо у хворих на псоріаз з супутнім маласезіозом знижується здатність організму виявляти антигени, що веде до порушення ефективності імунного нагляду.
3.4 Показники гуморального імунітету досліджених
Іg G складає основну масу імуноглобулінів (до 80 %) людини, і є важливим показником гуморального імунітету.
Як видно з таблиці 3.4, відмічено суттєве підвищення продукції Іg G в обох групах хворих (р<0,05), більш виразне у пацієнтів на псоріаз з супутнім маласезіозом, що співпадає з даними літератури про підвищення його рівня при гострих та хронічних бактеріальних та грибкових інфекціях. Будучи важливим фактором гуморального імунітету, Іg G здійснює захисну функцію, завдяки токсинонейтралізуючої, опсонізуючої та бактеріальної активності.
Таблиця 3.4 – Показники гуморального імунітету у досліджених хворих
| Показники г/л | Група контролю n=34 | Хворі на псоріаз з супутнім маласезіозом (n=80) | Хворі на псоріаз без маласезіозу (n=30) |
| Ig G | 12,1±1,0 | 17,8±1,2* | 15,1±0,7* |
| Ig A | 2,4±0,2 | 2,6±0,2 | 2,4±0,2 |
| Ig M | 1,2±0,16 | 2,5±1,12* ** | 1,2±0,16 |
Примітка:
* – р<0,05 при порівнянні хворих з групою контролю;
** – р<0,05 при порівнянні двох груп.
Відмічено також зростання Іg М у хворих на псоріаз з супутнім маласезіозом (р<0,05). Це свідчить про те, що Іg М продукується першим, як відповідь на присутню інфекцію, яка є супутньою у цих хворих.
* * *
Таким чином, дані, які були отримані при вивченні імунного статусу у досліджених хворих на псоріаз, вказали на суттєві відмінності показників імунітету у хворих на псоріаз з супутнім маласезіозом, в порівнянні з хворими на псоріаз без супутнього маласезіозу.
Відмічено статистично достовірне зниження СD3+ та СD4+, на тлі незначного статистично недостовірного підвищення СD8+. Співвідношення СD4+/СD8+ (імунорегуляторний індекс) було статистично достовірно зниженим, але більш зменшеним при наявності супутнього маласезіозу, що свідчить про наявність вторинного імунодефіцитного стану у цих хворих.
Рівень СD16+, а також загальна кількість В-лімфоцитів (СD19+) були збільшеними у хворих на псоріаз, причому вищими вони були у хворих на псоріаз із супутнім маласезіозом.
Значне збільшення кількості СD25+ свідчить про наявність придбаного імунодефіциту і гіперреактивність клітинного імунітету з стимуляцією антитілоутворення і цитотоксичності Т-лімфоцитів.
Суттєві зміни в популяціях і субпопуляціях лімфоцитів були відмічені у хворих на псоріаз з супутнім маласезіозом, що пов’язувалося з дією інфекційних факторів в розвитку дерматозу та його загострень.
Зростання показників – цитокінів загального запалення (ІL-1β, ІL-4 та ФНП-α) у хворих на псоріаз залежно від тяжкості перебігу дерматозу було більше у хворих на псоріаз з супутнім маласезіозом, що можно пояснити наявністю інфекційних факторів.
Дослідження неспецифічних факторів захисту організму та рівня Ig показало зниження фагоцитарного числа (ФЧ) та НСТ-тесту, більше у хворих на псоріаз із супутнім маласезіозом, а також зростання кількості Іg G та Іg М у зазначених хворих. Це характеризує особливий стан активності фагоцитуючих клітин та нейтрофілів, що відображалось у їх пригніченні, особливо у хворих на псоріаз з супутнім маласезіозом. Щодо збільшення Іg М у хворих зазначеної дослідженої групи, то це розцінювалося як значні порушення гуморального імунітету, більш виражені у хворих на псоріаз з супутнім маласезіозом, що потребує особливих підходів до індивідуалізованої диференційованої терапії.
Результати цих досліджень були опубліковані в наступних публікаціях:
1. Веретельник К.О. Імунний статус у хворих на псоріаз із супутньою маласезійною інфекцією. Запорізький медичний журнал. 2017. Т. 19, № 3. С. 363–368 [31].
РОЗДІЛ 4
СТАН РЕГУЛЮЮЧИХ СИСТЕМ ГОМЕОСТАЗУ І РОЛЬ ЇХ У ПАТОГЕНЕЗІ ПСОРІАЗУ З СУПУТНІМ МАЛАСЕЗІОЗОМ
У патогенезі псоріазу значне місце займають біохімічні зрушення: обмінні процеси, стан білків, жирів і вуглеводів, шлунково-кишкового тракту. В цьому напрямку виконані багаточисельні роботи різних як вітчизняних, так і закордонних авторів, але відсутні дослідження цих показників у хворих на псоріаз з супутньою грибковою інфекцією – маласезіозом. Ці дослідження необхідні для того, щоб, знаючи характер біохімічних порушень, розробити раціональні методи комплексної терапії цих хворих з комбінованою патологією [149, 170, 187].
Особливу увагу викликало вивчення стану ОМБ, рівень NO-синтази, загального білку, глюкози, печінкових тестів.
В останні роки суттєву роль в механізмах розвитку більшості захворювань відводиться синдрому ендогенної інтоксикації, яку ми оцінюємо за станом ОМБ [111, 150].
Згідно з уявленням, що склалося, ендогенна інтоксикація – це стан, обумовлений деструктивними процесами, в результаті яких в рідинах і тканинах організму накопичуються в нефізіологічних концентраціях проміжні і кінцеві продукти нормального обміну речовин і порушеного метаболізму. Вони мають токсичний потенціал і викликають дисфункцію різних органів і систем. Останнім часом для об’єктивної оцінки наявності ендогенної інтоксикації зазвичай використовується метод визначення речовин низької і середньої молекулярної маси (РНСММ). Концентрація цих речовин є інтегральним і об’єктивним показником токсичності певного середовища організму, незалежно від етіопатогенетичних особливостей того або іншого захворювання. Існує думка про те, що рівень РНСММ передусім відбиває міру патологічного білкового метаболізму і корелює з основними клінічними і лабораторними прогностичними критеріями обмінних порушень. Встановлений тісний зв’язок між концентрацією РНСММ і посиленням вільно-радикальних процесів в організмі, які призводять до утворення продуктів перекісного окислення ліпідів і білків. Зі свого боку ОМБ викликає як мінімум три типи змін фізико-хімічних властивостей білкової молекули: фрагментацію, агрегацію і схильність до протеолізу. В результаті відбувається або утворення продуктів з високою функціональною активністю, або інактивація активних центрів ферментів, або модифікація білкових молекул, що сприяє посилюванню клінічної картини основного патологічного стану [81].
При хронічних захворюваннях, до яких відноситься і псоріаз, особливо ускладнених формах дерматозу, ендогенна інтоксикація не має чітких клінічних ознак. Тому особливе значення мають пошуки більш інформативних, зокрема лабораторних, критеріїв оцінки ендогенної інтоксикації [49, 191].
Як видно з таблиці 4.1, аналіз показників ОМБ у хворих на псоріаз виявив суттєві відмінності інтенсивності ендогенної інтоксикації між основною групою і групою контролю. Найбільш суттєві зміни відмічені у хворих на псоріаз, який був тяжкий і ускладнений. У хворих на псоріаз до лікування зареєстровано вірогідне збільшення спонтанної і стимульованої величини рівня альдегідфенілгідразонів (АФГ), а також – кетондинітрофенілгідразонів (КФГ), які у випадку спонтанної ОМБ характеризують збільшення ступеню окислювальної деструкції білкової молекули, а при стимульованій ОМБ свідчать про потенційні резервні можливості організму до значного нівелювання проявів оксидативного стану.
Слід відмітити, що ці показники, особливо КФГ (спонтанна та стимульована), були більш високі у хворих на псоріаз з більш тяжким перебігом дерматозу (p<0,05) та з ускладненими формами псоріазу, що ми розцінюємо як показник впливу ендогенної інтоксикації на перебіг шкірного процесу. У цих хворих ендогенна інтоксикація індукувала розвиток системних процесів і формування ускладнених форм псоріазу.
Таблиця 4.1 – Показники ОМБ у досліджуваних хворих до лікування
| Показники (один.оптич.щ.) | Контрольна група (n=34) | Хворі на псоріаз | |
| Обмежені бляшкові форми переважно в стаціонарній стадії (n=85) | Розповсюджені форми переважно в прогресивній стадії (n=25) | ||
| АФГ спонтанна | 4,491±0,252 | 5,624±0,284* | 6,420±0,322* |
| АФГ стимульована | 7,205±0,843 | 12,482±0,634* | 14,284±0,704* |
| КФГ спонтанна | 3,069±0,184 | 3,842±0,310* | 4,104±0,324* ×× |
| КФГ стимульована | 5,532±0,304 | 8,205±0,422* | 11,234±0,482* ×× |
Примітки:
* – р<0,05 – різниця вірогідна при порівнянні хворих з контрольною групою;
×× – р<0,05 – різниця вірогідна при порівнянні груп хворих
Певний інтерес викликало вивчення показників ендогенної інтоксикації у хворих на псоріаз з супутнім маласезіозом з метою встановлення впливу грибкової інфекції на перебіг псоріазу.
Як видно з таблиці 4.2, у хворих на псоріаз, як без маласезіозу, так і при наявності маласезіозу, зареєстровано вірогідне збільшення як спонтанної, так і стимульованої АФГ та КФГ. Відмічено більш показне зростання цих показників у хворих на псоріаз з супутнім маласезіозом, що було статистично достовірно при вивченні АФГ спонтанної і КФГ стимульованої. Це розцінено як вплив грибкової інфекції на перебіг псоріазу і поглиблення явища ендогенної інтоксикації, що необхідно враховувати при призначенні комплексної терапії хворих на псоріаз з метою ліквідації грибкової патології.
Таблиця 4.2 – Показники ОМБ у досліджуваних хворих на псоріаз з супутньою маласезійною інфекцією
| Показники (один.оптич.щ.) | Контрольна Група (n = 34) | Хворі на псоріаз | |
| Без маласезіозу (n = 30) | З супутнім маласезіозом (n = 80) | ||
| АФГ спонтанна | 4,491±0,252 | 5,522±0,355* | 6,906±0,234* ×× |
| АФГ стимульована | 7,205±0,843 | 12,314±0,637* | 14,450±0,696* |
| КФГ спонтанна | 3,069±0,184 | 3,743±0,318* | 3,944±0,386* |
| КФГ стимульована | 5,532±0,304 | 8,158±0,550* | 11,280±0,462* ×× |
Примітки:
* – р<0,05 – різниця вірогідна при порівнянні хворих з контрольною групою;
×× – р<0,05 – різниця вірогідна при порівнянні груп хворих
Як видно з таблиці 4.3, статистично достовірне зниження проявів ендогенної інтоксикації після лікування відмічалося тільки у хворих на псоріаз з супутнім маласезіозом, які отримували рекомендовану терапію. В той же час у хворих першої і другої груп порівняння, яким рекомендована традиційна терапія, показники АФГ та КФГ лише мали тенденцію до зниження, але це було недостовірно.
Таким чином, у хворих на псоріаз встановлено наявність синдрому ендогенної інтоксикації, яка характеризується підвищенням рівня загальної ОМБ. Це обумовлює накопичення у крові патологічних ендотоксинів і приводить до необхідності призначення лікарських препаратів дезінтоксикаційного впливу. Слід відмітити, що ендогенна інтоксикація була досить високою у хворих на псоріаз з ускладненнями і більш тяжким перебігом. Вперше встановлено високі показники АФГ і КФГ, як спонтанного характеру, так і стимульованого типу, у хворих на псоріаз з супутнім маласезіозом, що свідчить про небажаний патологічний вплив грибів на стан ОМБ, що треба враховувати при призначенні комплексної терапії.
Таблиця 4.3 – Показники ОМБ досліджуваних хворих на псоріаз з супутнім маласезіозом до і після лікування
| Показники в нмоль/г білка/хв | Контроль-на група (n=34) | Хворі на псоріаз | |||
| до лікування (n=110) | без маласезіозу після лікування традиц. методами (І група порівняння) (n=30) | з маласезіозом після лікування | |||
| традиційними методами (ІІ група порівняння) (n=20) | запропоно-ваними методами (основна група) (n=60) | ||||
| АФГ спонтанна | 4,491± 0,252 | 6,044± 0,318 ×× | 5,9±0,204 | 5,828± 0,214 | 4,632±0,124* |
| АФГ стимульована | 7,205± 0,843 | 13,382± 0,669 ×× | 13,2±0,502 ×× | 12,892± 0,562 ×× | 8,324±0,622* |
| КФГ спонтанна | 3,069± 0,184 | 3,972±0,317 ×× | 3,78±0,2 | 3,638± 0,210 | 3,104±0,101* |
| КФГ стимульована | 5,532± 0,304 | 6,868±0,452 ×× | 6,72±0,21 ×× | 6,632± 0,318 | 5,724±0,236* |
Примітки:
* – р<0,05 – різниця вірогідна при порівнянні до і після лікування;
– ×× р<0,05 – різниця вірогідна при порівнянні даних у хворих і контрольної групи
Вивчення кількості АФГ і КФГ після проведення лікування показало, що ці показники статистично достовірно знижувалися лише у хворих на псоріаз, які отримували рекомендовану терапію. При проведенні традиційної терапії відмічено лише тенденцію до нормалізації АФГ і КФГ. Таким чином, вивчення ОМБ показало, що ендогенна інтоксикація характеризується підвищенням рівня окислюваності білкових молекул, що пов’язано з деструктивними процесами, обумовленими ендотоксинами.
Увагу дослідження привернув оксид азоту (NO), оскільки біосинтез і метаболізм його в організмі є актуальною проблемою теоретичної і практичної медицини. На сьогоднішній день він визнаний найважливішим медіатором, опосередуючим широкий діапазон різноманітних фізіологічних і патофізіологічних процесів. Оксид азоту регулює тонус дрібних і середніх кровоносних судин, сприяючи розслабленню гладкої мускулатури, володіє антикоагуляційними властивостями, пригнічуючи активацію тромбоцитів, опосередковує імунну відповідь і нейротрансмісію. Продукцію оксиду азоту в організмі каталізують три ізоформи ферменту NO-синтази, дві з яких – постійно функціонуючі ферменти: нейрональна та ендотеліальна NO-синтаза. Зниження рівня NO вважають однією з причин дисфункції ендотелію при дісліпідемії, гіперхолестеринемії, цукровому діабеті 2 типу, артеріальній гіпертензії, серцевій недостатності та ін. NO, що продукується в макрофагах, опосередковує цитотоксичну та цитостатичну дію на пухлинні і бактеріальні клітини. Вплив цього ферменту і відповідна продукція оксиду азоту підвищується при серцевій недостатності, кардіоміопатії, міокардиті та ін. Концентрація NO є головним чинником, що обумовлює його біологічний ефект. Високі концентрації даного метаболіту беруть участь в протипухлинному, антимікробному захисті, впливають на еозинофільне запалення та утворення вільних радикалів, а також індукують перекісне окислення ліпідів, пошкоджуючи ланцюг ДНК. Підвищення експресії індуцибельної NO-синтази відзначається в різних клітинах шкіри під впливом ФНП-a, інтерферону-γ, ліпополісахаридів, ІL-8 і ІL-1β при різних патологічних процесах шкіри (псоріаз, атопічний дерматит, контактний дерматит та ін.), пухлинному процесі, при загоєнні ран. Інгібіторами транскрипції індуцибельної NO-синтази є циклоспорини, такролімус, пімекролімус, глюкокортикоїди, ретиноїди, простагландини, ІL-4 і ІL-10.
Таким чином, біологічні ефекти оксиду азоту в значній мірі визначаються його біодоступністю, тобто тонкою рівновагою між його продукцією під дією NO-синтази, з одного боку, і його утилізацією в тканинах або інактивацією за участю супероксид радикалів, окислених ЛПНЩ і подібних з’єднань, з іншого – недостатня продукція оксиду азоту пов’язана з розвитком порушень в серцево-судинній та інших системах організму. Разом з тим, його надлишкова продукція, за рахунок якої забезпечується антимікробний ефект при запаленні, може перетворитися з ланки адаптації в ланку патогенезу і стати не менш небезпечним фактором, що уражує організм, ніж дефіцит NO. Тому становить певний інтерес вивчення рівня NO у хворих на псоріаз з супутнім маласезіозом і його роль у патогенезі, а також зміна рівня оксиду азоту в процесі терапії. Це дозволить розробити методи раціональної коригуючої терапії.
Як видно з таблиці 4.4, посилення процесів метаболізму NO-синтази проявлялося у вигляді значного підвищення рівня NO-синтази у хворих на псоріаз, що було статистично достовірно (р<0,05). Слід відмітити, що рівень NO-синтази не залежав від віку і статі хворих.
Встановлено, що більш високі показники NO-синтази зареєстровані у хворих на псоріаз з ускладненим перебігом, особливо з супутньою артеріальною гіпертензією (до (16,9±0,8) нмоль/мг білка/хв.). Можливо, що високі показники NO-синтази грають значну роль в патогенезі псоріазу, викликають розвиток ускладнених і тяжких форм дерматозу.
Як видно з таблиці 4.5, відмічено значне зростання показників NO-синтази у хворих на псоріаз з супутнім маласезіозом, що розцінювалося як показник негативного впливу мікотичної інфекції на перебіг дерматозу. Цей факт свідчить про те, що в комплексній терапії псоріазу необхідно враховувати наявність супутньої інфекції і проводити адекватну терапію антимікотичними препаратами.
Таблиця 4.4 – Вираженість процесів метаболізму NO у обстежених хворих на псоріаз
| Показник в нмоль/мг білка/хв | Здорові особи (n=34) | Хворі на псоріаз | |
| Обмежені і інтертригінозні форми переважно в стаціонарній стадії (n=85) | Розповсюджені форми ,переважно в стадії прогресування (n=25) | ||
| NO-синтаза | 0,42±0,07 | 12,1±0,06* | 14,6±0,07* ×× |
Примітки:
* – р<0,01 – значення вірогідне при порівнянні показників у хворих на псоріаз зі здоровими особами;
×× – р<0,05 – значення вірогідне при порівнянні між групами.
Таблиця 4.5 – Рівень NO-синтази у хворих на псоріаз з супутнім маласезіозом
| Показник в нмоль/г білка/хв | Здорові особи (n=34) | Хворі на псоріаз | |
| без маласезіозу (n = 30) | з маласезіозом (n = 80) | ||
| NO-синтаза | 0,42±0,07 | 11,4±0,06* | 15,3±0,12* ×× |
Примітки:
* – р<0,01 – значення вірогідне при порівнянні показників у хворих на псоріаз зі здоровими особами;
×× – р<0,05 – значення вірогідне при порівнянні між групами.
Як видно з таблиці 4.6, після проведеної терапії рівень NO-синтази статистично вірогідно знижувався в усіх групах, але більш показово в групі хворих на псоріаз з супутнім маласезіозом, які отримували рекомендований комплекс препаратів. Слід відмітити, що це позитивно впливало на усунення клінічних проявів псоріазу.
Таблиця 4.6 – Рівень NO-синтази у хворих на псоріаз до і після терапії
| Показник в нмоль/мг білка/хв | Конт-рольна група (n=34) | Хворі на псоріаз до лікування (n=80) | Хворі на псоріаз без маласезіозу після лікування традиційними методами (І група порівняння) (n=30) | Хворі на псоріаз з маласезіозом після лікування | |
| Традиц. методами (ІІ група порівняння) (n=20) | Рекомендо-ваними методами (n=60) | ||||
| NO-синтаза | 0,42±0,07 | 13,35±0,06 ×× | 12,2±0,01 ×× | 10,4±0,03* ×× | 6,42±0,04* ×× |
Примітки:
* – р<0,05 – різниця вірогідна при порівнянні до і після лікування;
×× – р<0,01 – різниця вірогідна при порівнянні даних у хворих і контрольної групи.
Таким чином, оксид азоту є універсальною молекулою, яка бере участь в регуляції численних процесів в шкірі людини. Він стимулює утворення різних концентрацій його в різних умовах різними типами клітин. Складність механізмів, що реалізують дію NO, полягає в різнонаправлених змінах вмісту оксиду азоту при псоріазі, особливо при ускладненні маласезіозом. Значно ускладнюється перебіг псоріазу при високих показниках NO-синтази, що формує більш тяжкі і ускладнені форми дерматозу. Регулюючим фактором є діяльність NO-синтази, яка знаходиться в складних взаємодіях з різними клітинами і цитокінами, що викликає патологічну дію NO. Терапія цих хворих, особливо рекомендованими препаратами, сприяла зниженню рівня NO-синтази. При вивченні цих показників після терапії, встановлено, що в усіх досліджених групах відмічена суттєва тенденція до нормалізації NO-синтази, але вона була вище, ніж у здорових осіб. Найбільш показна, статистично достовірна нормалізація відмічалася при проведенні рекомендованої терапії.
Для більш повного поняття деяких механізмів розвитку особливостей псоріазу при наявності супутнього маласезіозу вивчався комплекс біохімічних показників, які представлені в таблиці 4.7.
Таблиця 4.7 – Комплекс біохімічних показників у хворих на псоріаз до лікування
| Показники | Контроль (здорові люди) (n=34) | Хворі на псоріаз | |
| Обмежені і інтертригінозні форми, переважно в стаціонарній стадії (n=85) | Розповсюджені форми, переважно в стадії прогресування (n=25) | ||
| Загальний білок, г/л | 54,2±0,31 | 48,4±0,4 | 46,2±0,3* |
| Глюкоза, ммоль/л | 5,2±0,35 | 5,4±0,24 | 6,1±0,2* |
| АлАТ, од/л | 24,6±2,1 | 28,1±1,8 ×× | 43,2±3,1* |
| АсАТ, од/л | 17,2±3,1 | 24,6±2,1* ×× | 38,2±3,1* |
| Холестерин, мкмоль/л | 4,5±0,28 | 4,8±0,3 ×× | 6,4±0,2* |
| Холестерин ЛПВЩ, мкмоль/л | 1,26±0,3 | 1,25±0,16 | 1,27±0,3 |
| Холестерин ЛПНЩ, мкмоль/л | 2,51±0,18 | 4,2±0,3* | 4,83±0,4* |
| Тригліцериди, ммоль/л | 1,28±0,16 | 1,6±0,3* ×× | 1,9±0,1* |
Примітки:
* – р<0,05 – достовірні показники до лікування, при порівнянні з групою контролю;
×× – р<0,05 – достовірні показники, при порівнянні їх при різних формах псоріазу.
Як видно з таблиці 4.7, відмічено у хворих на псоріаз до лікування статистично достовірне зростання середніх показників АсАТ, АлАТ, холестерину ЛПНЩ, тригліцеридів, зниження загального білку у хворих обох груп, але більш виразне при ускладнених формах дерматозу. У цих хворих також були збільшені показники глюкози, холестерину. Це розцінено як показник серйозних порушень обмінних процесів, печінкових тестів, що свідчить про системність патологічних процесів при псоріазі.
Звертають на себе увагу більш суттєві зміни показників у хворих з ускладненими формами псоріазу, що закономірно, оскільки це є проявом системності псоріатичних уражень організму і потребує проведення комплексної патогенетичної терапії з використанням коригуючих препаратів. Як видно з таблиці 4.8, значно порушується функціонування печінки, тому використання гепатопротекторів при лікуванні хворих на псоріаз є край необхідним. Вибір препарату залежить від віку хворих, особливостей клінічних проявів і результатів лабораторних досліджень, як і адекватні дози, і термін використання.
Як видно з таблиці 4.8, у хворих на псоріаз без маласезіозу статистично достовірне зниження загального білку і тенденція до підвищення інших показників, але достовірність встановлена тільки у відношенні АсАТ, холестерину, холестерину ЛПНЩ. В той же час, у хворих на псоріаз при наявності маласезіозу відмічено статистично вірогідно зниження загального білку і підвищення інших показників, окрім глюкози, холестерину ЛПВЩ.
Слід відзначити, що ці показники у хворих на псоріаз з супутнім маласезіозом розцінені, як негативний вплив грибкової інфекції на патогенетичні механізми псоріазу, що ускладнює перебіг псоріазу і, можливо, спонукає до протигрибкової терапії маласезіозу. Тому не підтримується думка деяких авторів про те, що маласезії – це сапрофіти, які паразитують на шкірі, не викликаючи суттєвих зрушень в організмі хворих, не діють на інші захворювання шкіри і функцію різних органів і систем.
Таблиця 4.8 – Особливості біохімічних зрушень у хворих на псоріаз з супутнім маласезіозом
| Показники | Контроль (здорові люди) (n=34) | Хворі на псоріаз | |
| Без маласезіозу (n = 30) | З маласезіозом (n = 80) | ||
| Загальний білок, г/л | 54,2±0,31 | 49,4±0,21 | 45,3±0,16* |
| Глюкоза, ммоль/л | 5,2±0,35 | 5,4±0,18 | 6,1±0,21 |
| АлАТ, од/л | 24,6±2,1 | 28,1±1,9 | 45,2±2,85* ×× |
| АсАТ, од/л | 17,2±3,1 | 21,6±2,2* | 41,2±3,2* ×× |
| Холестерин, мкмоль/л | 4,52±0,3 | 4,9±0,21 | 6,3±0,28* ×× |
| Холестерин ЛПВЩ, мкмоль/л | 1,26±0,3 | 1,27±0,21 | 1,25±0,11 |
| Холестерин ЛПНЩ, мкмоль/л | 2,51±0,18 | 3,8±0,21* | 5,13±0,3* ×× |
| Тригліцериди, ммоль/л | 1,28±0,16 | 1,4±0,28 | 2,1±0,13* ×× |
Примітки:
* – р<0,05 – достовірні показники до лікування при порівнянні з групою контролю;
×× – р<0,05 – достовірні показники, при порівнянні їх у хворих з наявністю маласезіозу і без маласезіозу.
Як видно з таблиці 4.9, після традиційного лікування 30 хворих на псоріаз без супутнього маласезіозу (перша група порівняння) і 20 хворих на псоріаз з супутнім маласезіозом (друга група порівняння) відмічена тенденція до нормалізації біохімічних показників, але статистично достовірно змінювались лише загальний білок, АлАТ, АсАТ, холестерин ЛПНЩ. В той же час, у хворих на псоріаз, які отримували рекомендовану терапію, статистично достовірно зростав загальний білок, знижувався рівень АлАТ, АсАТ, холестерину, холестерину ЛПНЩ, тригліцеридів, але досягали нормального рівня у здорових осіб лише загальний білок та глюкоза. Інші показники, як у основній групі, так і обох груп порівняння хоча і мали тенденцію до нормалізації, але статистично достовірні відрізнялися від показників у здорових осіб. Цей факт розцінено як показник неповної нормалізації біохімічних показників після стаціонарної терапії. Тому рекомендовано у подальшому після виписки із стаціонару продовжувати терапію з метою профілактики рецидивів псоріазу.
Таблиця 4.9 – Особливості біохімічних зрушень у хворих на псоріаз з супутнім маласезіозом до і після терапії
| Показники в нмоль/г білка/хв | Контрольна група (n=34) | Хворі на псоріаз | |||
| до лікування (n=110) | без маласезіозу після лікування традицій-ними методами (І група порівняння) (n=30) | з маласезіозом після лікування | |||
| традицій-ними методами (ІІ група порівнян-ня) (n=20) | запропо-нованими методами (основна група) (n=60) | ||||
| Загальний білок, г/л | 54,2±0,31 | 45,3±0,16 ×× | 46,4±0,13 ×× | 47,4±0,12 ×× | 52,4±0,24* |
| Глюкоза, ммоль/л | 5,2±0,35 | 6,1±0,21 ×× | 5,9±0,16 | 6,0±0,18 ×× | 5,4±0,31 |
| АлАТ, од/л | 24,6±2,1 | 45,2±2,85* ×× | 39,6±1,6* ×× | 38,4±1,8*×× | 32,8±1,6* ×× |
| АсАТ, од/л | 17,2±3,1 | 41,2±3,2 ×× | 37,4±2,6* ×× | 38,1±2,6* ×× | 29,4±2,2* ×× |
| Холестерин, мкмоль/л | 4,52±0,3 | 6,3±0,28* ×× | 5,95±0,24 ×× | 6,1±0,24 ×× | 5,8±0,18* ×× |
| Холестерин ЛПВЩ, мкмоль/л | 1,26±0,3 | 1,25±0,11 | 1,26±0,13 | 1,24±0,12 | 1,25±0,14 |
| Холестерин ЛПНЩ, мкмоль/л | 2,51±0,18 | 5,13±0,3* ×× | 4,9±0,18* ×× | 4,88±0,19* ×× | 3,28±0,09* ×× |
| Тригліцериди, ммоль/л | 1,28±0,16 | 2,1±0,13* ×× | 1,96±0,15 ×× | 1,94±0,14 ×× | 1,65±0,12* ×× |
Примітки:
* – р<0,05 – достовірні показники до лікування при порівнянні з групою контролю;
×× – р<0,05 – достовірні показники при порівнянні їх при наявності мікозу і без маласезіозу.
Слід відзначити, що вивчення деяких біохімічних показників у хворих на псоріаз з супутнім маласезіозом показало значні зміни при ускладнених формах псоріазу, особливо в прогресуючій стадії і у хворих з супутнім маласезіозом, які мали тенденцію до нормалізації після проведеного лікування, особливо в основній групі, яка отримувала рекомендовану комплексну терапію.
Зіставний аналіз цих показників у взаємозв’язку з клінічними особливостями і перебігом дерматозу, імунологічним статусом буде представлено в останньому розділі при виділенні клініко-терапевтичних груп хворих на псоріаз.
Отже, при вивченні стану ОМБ у хворих на псоріаз встановлена наявність синдрому ендогенної інтоксикації, що пов’язано з накопиченням у крові патологічних ендотоксинів. Слід відмітити, що ендогенна інтоксикація була досить високою у хворих на псоріаз з більш тяжким перебігом дерматозу, особливо в прогресуючій стадії. Високі показники АФГ і КФГ, як спонтанного, так і стимульованого типу, відмічені у хворих на псоріаз з супутнім маласезіозом, що розцінювалося як патологічний вплив грибів на стан ОМБ. При вивченні цих показників після лікування відмічено зниження їх лише у хворих на псоріаз, які отримували рекомендовану терапію, на відміну від хворих, які отримували традиційну терапію, у яких лише була тенденція до нормалізації, що було статистично недостовірно. Таким чином, ендогенна інтоксикація характеризується підвищенням рівня окислюваємості білкових молекул, що пов’язано з деструктивними процесами, обумовленими ендотоксинами. Встановлено, що у хворих на псоріаз різко зростає рівень NO-синтази, особливо у пацієнтів з більш тяжким перебігом дерматозу, особливо в прогресуючій стадії, а також у хворих з супутнім маласезіозом. Терапія хворих, особливо при призначенні рекомендованих препаратів, сприяла зниженню рівня NO-синтази у досліджених пацієнтів.
* * *
Таким чином, біохімічні дослідження показали суттєві зрушення цих показників у хворих на псоріаз, особливо при ускладнених формах дерматозу, а також при наявності супутнього маласезіозу. Це розцінено як показник серйозних порушень обмінних процесів, функції печінки, що свідчить про системність патологічних процесів при псоріазі, а також про негативний вплив грибкової інфекції на його патогенетичні механізми. У зв’язку з цим, рекомендовано в терапії псоріазу використовувати патогенетичні засоби для корекції печінкових тестів і обмінних процесів. Також необхідне проведення протигрибкової терапії з використанням системних препаратів, тому що, як видно з цих досліджень, маласезія не є сапрофітом, який паразитує на шкірі та не спричиняє зрушень в організмі, як стверджують деякі автори. Після лікування відмічена загальна тенденція до нормалізації біохімічних показників, але більш показні і статистично достовірні зміни відмічені у хворих, які отримували рекомендовану терапію. У хворих як з маласезіозом, так і без маласезіозу нормалізація біохімічних показників була незначна (загальний білок, АлАТ, АсАТ). Але повної нормалізації цих показників не відмічено, вони ще суттєво відрізнялися від показників у здорових осіб, тому рекомендовано продовжувати терапію амбулаторно після виписки з стаціонару, проводити протирецидивні курси лікування.
Результати цих досліджень були опубліковані в наступних публікаціях:
1. Веретельник К.О. Показники ендогенної інтоксикації та метаболізму NO у хворих на псоріаз з супутньою маласезійною інфекцією. Сучасні медичні технології. 2017. № 3. С. 58–63 [33].
2. Веретельник К.А., Федотов В.П. Состояние вегетативной нервной системы у больных псориазом, осложнённым малассезиозом кожи. Дерматовенерология. Косметология. Сексопатология. 2016. № 1–4. С. 243–245 [30].
РОЗДІЛ 5
ДИФЕРЕНЦІЙОВАНІ ПОКАЗНИКИ І МЕТОДИКА КОМПЛЕКСНОЇ ТЕРАПІЇ ХВОРИХ НА ПСОРІАЗ З СУПУТНІМ МАЛАСЕЗІОЗОМ ШКІРИ З ОЦІНКОЮ ЕФЕКТИВНОСТІ
5.1 Обґрунтування і методика об’єднання досліджених хворих у клініко-терапевтичні групи.
Отримані результати аналізу клінічних особливостей і перебігу псоріазу з супутнім маласезіозом, вивчення імунного статусу і ряду регулюючих систем гомеостазу показали, що хворі на псоріаз з наявністю маласезіозу були клінічно і лабораторно різні. Тому виникла необхідність проведення кластерного аналізу всіх отриманих даних. Підсумки цього аналізу показали, що у хворих на псоріаз з супутнім маласезіозом шкіри виявлені статистично достовірно різні рівні клініко-лабораторних зрушень. Отримані дані дали можливість в залежності від встановлених рівнів зрушень об’єднати хворих у дві клініко-терапевтичні групи, що проявлялося відмінностями скарг, аналізу, особливостями клінічних проявів як псоріазу, так і маласезіозу, виразністю змін показників імунного статусу, мікробіоценозу шкіри, біохімічних змін.
Ці показники в групах корелювали між собою з високим ступенем статистичної достовірності (р<0,01), ніж при розподілі груп за стадіями псоріазу, що об’єктивно показує наявність виразного клініко-лабораторного взаємозв’язку і взаємообумовленості псоріазу і супутнього маласезіозу шкіри.
Першу групу склали 50 хворих на псоріаз, в основному з локалізованими формами бляшкового і інтертригінозного дерматозу в стаціонарній стадії захворювання. У цих хворих діагностовано незапальні поверхневі форми маласезіозу (простий пітиріаз волосистої частини голови, гнейс, себорейний дерматит, екзематид Дар’є), негнійний фолікулярний маласезіоз (негнійний фолікуліт), які були обумовлені в основному М. furfur, M. pachidermatis, індекс PАSI – 23,45±2,0. У психологічному статусі переважали незначні психоемоційні розлади. В імунному стані у хворих першої групи відзначені : ФІ – 53,2±3,43; ФЧ – 5,9±0,39; нейтрофіли – 5,2±0,29; НСТ-тест – (17,4±1,2) %; лейкоцити – (5,86±0,38) ∙ 109/л; лімфоцити – (1,21±0,12) ∙ 109/л; СD3+ – (0,86±0,06) ∙ 109/л; СD4+ – (0,43±0,04) ∙ 109/л; СD8+ – (0,32±0,02) ∙ 109/л; СD16+ – (0,31±0,02) ∙ 109/л; СD22+ – (0,3±0,01) ∙ 109/л; СD4/СD8+ – 1,29±0,02; Ig G – (16,4±1,2) г/л та Ig М – (1,8±0,12) г/л; IL-1β – (28,4±2,4) пг/мл; IL-4 – (5,1±0,21) пг/мл; ФНП-α – (24,2±2,4) пг/мл.
АФГ (спонтанна) – (5,2±0,28) од.опт.щ.; АФГ (стимульована) – (12,4±0,52) од.опт.щ.; КФГ (спонтанна) – (3,81±0,24) од.опт.щ.; КФГ (стимульована) – (8,12±0,34) од.опт.щ.; NO-синтаза – (11,8±0,05) нмоль/мг білка/хв.; загальний білок – (47,2±0,3) г/л; глюкоза – (5,3±0,18) ммоль/л; АлАТ – (27,8±1,6) од/л; АсАТ – (22,4±2,2) од/л; холестерин – (4,7±0,2) мкмоль/л; холестерин ЛПВЩ – (1,24±0,14) мкмоль/л; холестерин ЛПНЩ – (4,1±0,2) мкмоль/л; тригліцериди – (1,5±0,2) ммоль/л.
Друга група складалася з 30 хворих на псоріаз в основному з розповсюдженими формами бляшкового псоріазу в стадії прогресування. Прояви маласезіозу були у вигляді маласезійного пустульозу, різнокольрового лишаю, комедонів, що обумовлені М. furfur, М. globosa. Індекс PАSI був 29,4±2,1. У психологічному стані переважали депресивні реакції. В імунному статусі у хворих другої групи спостерігалось: : ФІ – 42,3±4,4; ФЧ – 40,8±4,6; нейтрофіли – (4,81±0,22) ∙ 109/л; НСТ-тест – (14,8±1,64) %; лейкоцити – (4,86±0,4) ∙ 109/л; лімфоцити – (0,96±0,12) ∙ 109/л; СD3+ – (0,64±0,02) ∙ 109/л; СD4+ – (0,39±0,03) ∙ 109/л; СD8+ – (0,29±0,02) ∙ 109/л; СD16+ – (0,26±0,02) ∙ 109/л; СD22+ – (0,44±0,02) ∙ 109/л; СD4/СD8+ – 1,12±0,01; Ig G – (19,1±0,7) г/л та Ig М – (2,7±1,3) г/л; IL-1β – (35,4±3,1) пг/мл; IL-4 – (6,1±0,18) пг/мл; ФНП-α – (36,4±4,1) пг/мл.
АФГ (спонтанна) – (6,5±0,31) од.опт.щ.; АФГ (стимульована) – (15,1±0,6) од.опт.щ.; КФГ (спонтанна) – (4,2±0,24) од.опт.щ.; КФГ (стимульована) – (12,2±0,38) од.опт.щ.; NO-синтаза – (14,8±0,06) нмоль/мг білка/хв.; загальний білок – (45,4±0,2) г/л; глюкоза – (6,2±0,1) ммоль/л; АлАТ – (44,4±2,8) од/л; АсАТ – (39,2±2,8) од/л; холестерин – (6,5±0,18) мкмоль/л; холестерин ЛПВЩ – (1,29±0,2) мкмоль/л; холестерин ЛПНЩ – (4,92±0,3) мкмоль/л; тригліцериди – (2,1±0,1) ммоль/л.
Таким чином, проведені порівняльні дослідження показали, що хворі на псоріаз, який ускладнений маласезіозом шкіри, можуть бути науково-обґрунтовано розподілені на дві клініко-терапевтичні групи, які статистично значимо відрізнялися за характером клінічних проявів, перебігом псоріазу і маласезіозу шкіри, зміною імунного статусу і біохімічних показників, психоемоційного стану.
Відмінності показників цих груп визначаються особливостями клініки та перебігу псоріазу і маласезіозу, що свідчить про суттєвий клініко-патогенетичний взаємозв’язок і взаємозалежність цих патологічних станів шкіри.
Основні відмінності виділених груп можуть бути встановлені лікарями практичної охорони здоров’я адекватно за допомогою уніфікованих загальнодоступних клініко-лабораторних методів дослідження. Все це необхідно враховувати при призначенні комплексного лікування, яке повинно бути диференційованим в залежності від належності хворого до тієї чи іншої клініко-терапевтичної групи.
5.2 Методика диференційованої комплексної терапії хворих, що знаходились під спостереженням
Розроблено оригінальну методику комплексної терапії хворих на псоріаз з супутнім маласезіозом шкіри з диференційованим призначенням препаратів як етіологічної, так патогенетичної і симптоматичної дії, зовнішніх засобів.
Враховуючи досить складні механізми розвитку псоріазу, ефект можна отримати лише при комплексному індивідуальному лікуванні з використанням сучасних засобів і методів. При цьому усувалися фактори ризику, побутові та професійні шкідливості, супутні захворювання, які в цьому дослідженні представлені маласезіозом шкіри.
У комплексній терапії хворих на псоріаз з супутнім маласезіозом шкіри використовувалися препарати, дія яких була спрямована на усунення виявлених патогенетичних змін, загальних для обох дерматозів, у тому числі імунного статусу, деяких регулюючих систем гомеостазу, печінкових тестів, біохімічних зрушень та ін.
Препарати призначалися диференційовано, в залежності від клініко-терапевтичних груп, використовуючи етіотропні і патогенетичні засоби. Для проведення терапії проводився ретельний збір анамнезу, виявлення провокуючих факторів, всебічне обстеження хворих у виділених групах. Зверталася увага на попереднє лікування і переносимість лікувальних засобів.
Патогенетична терапія призначалася досліджуваним хворим у всіх групах відповідно до загальноприйнятих рекомендацій з лікування псоріазу.
Вибір лікарських препаратів і методів ґрунтувався на необхідності вплинути на різні ланки патогенезу псоріазу. Серед усіх препаратів виділялися кілька основних груп: етіотропні, імуномодулюючі, гепатопротектори, гіпосенсибілізуючі, антиоксиданти, ентеросорбенти, седативні.
З препаратів, що володіють імуномодулюючою дією, ми призначали вітчизняний препарат Тіотриазолін, виробник «Галичфарм, Україна». Препарат має стимулюючий вплив на Т-клітинний імунітет і неспецифічні фактори захисту, має гепатопротекторну, антиоксидантну, мембраностабілізуючу та протизапальну дію. Нормалізує білковий, вуглеводний, ліпідний та пігментний обміни. Тіотриазолін підвищує компенсаторну активацію анаеробного гліколізу, зменшує пригнічення процесів окислення в циклі Кребса, з збереженням резервів АТФ. Препарат активує антиоксидантну систему і гальмує процеси окислення ліпідів в ішемізованих ділянках міокарду, знижує чутливість м’язів серця до катехоламінів, має виражену кардіопротекторну дію. Також покращує реологічні властивості крові за рахунок активації фібрінолітичної системи. Тіотриазолін призначався всередину по 1 пігулці 2 рази на добу і по 2,0 мл. 2,5 % розчину внутрішньом’язово протягом 1 місяця.
Також використовувався Ітраконазол, системний антимікотик, як найбільш ефективний при лікуванні широкого спектра збудників мікозів, в тому числі і Malassezia. Ітраконазол належить до нової «генерації» азолових препаратів. Механізм дії препарату пов’язаний з пригніченням синтезу ергостеролу – важливого компоненту клітинної стінки гриба, проте діє більш вибірково до цитохрому грибів. Спектр дії ітраконазолу – досить широкий і включає дерматоміцети, дріжджоподібні та плісняві гриби. Призначався ітраконазол по 0,1 г 2 рази на добу протягом 2 місяців, або у вигляді «пульс-терапії» по 0,2 г 2 рази на день протягом 7 днів, а потім 3 тижні – перерва.
Використовувався препарат Атаракс (діюча речовина – гідроксизину гідрохлорид, похідне дифенілметану, який коригує показники вегетативної нервовї системи). Він має виразну седативну та помірну анксіолітичну дію за рахунок пригнічення активності деяких субкортикальних структур центральної нервової системи, крім того, блокує центральні М-холіно- та Н1-гістамінові рецептори. Седативний ефект звичайно відмічається через 30-45 хвилин після прийому всередину, антигістамінний – через 1 годину після прийому. Препарат призначали по 1 пігулці 2 рази на добу, 1-2 місяці.
З метою антиоксидантної терапії призначався Аєвіт. Компоненти препарату приймають участь у різних фізіологічних процесах в організмі, у тому числі стимулюють розмноження епітеліальних клітин, приймають участь у регенерації тканин, впливають на білковий та ліпідний обміни, сприяють покращенню капілярного кровообігу, нормалізують проникність стінки та трофіки тканин, нормалізує ОМБ. Препарат призначали по 2 пігулки двічі на добу протягом 1 місяця.
Антидепресивний препарат Міасер з групи піперазино-азепінових сполук – з вираженою антидепресивною і анксіолітичною дією. Міасер сприятливо впливає на сон, приймати його треба ввечері. Препарат добре переноситься пацієнтами, не порушує функціонування серцево-судинної системи. Міасер зменшує частоту і тяжкість вегетативних кризів, стабілізує артеріальний тиск, зменшує тривогу. Препарат блокує периферичні альфа-адренорецептори. Міасер призначався по 10 мг о 8 годині вечора, протягом двох місяців.
Для виведення токсинів і нормалізації фізіологічної мікрофлори кишечника призначався Еліміналь гель. Препарат містить силіцію оксид і лактулозу, яка є пребіотиком. Прийом цього препарату сприяє зв’язуванню вірусів, бактерій, грибів, токсинів, алергенів і подальшого їх виведення з організму. Препарат відновлює баланс корисної мікрофлори в кишечнику, поліпшує зростання біфідобактерій і лактобактерій. В результаті припиняється утворення патогенних і умовно-патогенних мікроорганізмів, це призводить до зменшення кількості токсинів, полегшує функцію виділення шкіри, сприяє її очищенню і поліпшенню стану. Препарат призначався по 1 пакетику 3 рази на день за 1,5 години до, або після їжі. Тривалість лікування – 12 днів. Виробник – Україна.
З імуномодуляторів використовувався новий препарат Оверін (виробник – Україна). Препарат застосовується для лікування вірусних і хламідійних інфекцій, він підвищує концентрацію ендогенних інтерферонів, особливо інтерферону альфа. Оверін активізує стовбурові клітини кісткового мозку, Т-лімфоцити і макрофаги. Оверін проявляє імуномодулюючу активність, нормалізує баланс між субпопуляціями Т-хелперних і Т-супресорних клітин. Препарат здатний знизити продукування ФНП-a та активізувати природні кілерні клітини. Має виражений стимулюючий ефект на активність системи поліморфноядерних лейкоцитів. Препарат вводиться внутрішньом’язово по 250 мг через 48 годин, тривалість – 8–12 днів.
В якості основного засобу зовнішньої протигрибкової терапії був обраний дисульфід селену, як ефективний топічний препарат, який найбільше відповідає поставленій меті. Використовувався вітчизняний оригінальний лікувально-профілактичний засіб паста Сульсена 1 % і 2 %. Можливо використання шампуню Нізорал виробництва «Janssen-Cilag» (Бельгія), або Dercos проти лупи фірми «Vichy» (Франція).
30 хворих на псоріаз без мікозу і 20 хворих з супутнім маласезіозом (перша і друга групи порівняння) проліковані традиційно. Рекомендувалася дієта, прийом Нейровітану по 1 пігулці 3 рази на добу; ін’єкції глюконату кальцію 10 % по 5-10 мл, внутрішньом’язово, №10; Аєвіт по 1 капсулі 2 рази на добу 3 тижні; Адаптол по 1 таблетці 3 рази на добу 20 днів; Алерон по 1 таблетці ввечері, 20 днів, зовнішньо – Бетасалік.
40 хворим першої клініко-терапевтичної групи рекомендувався додатково до традиційної терапії прийом ітраконазолу по 100 мг двічі на добу після їжі протягом 14 днів, а потім препарат призначали у вигляді пульс-терапії по 200 мг двічі на добу протягом 7 днів, потім – інтервал 3 тижні. Також хворим призначали з метою імуномодуляції Тіотриазолін по 2,0 мл – 2,5 % розчину внутрішньом’язово протягом 10 днів, а потім – по 1 пігулці 2 рази на добу 10 днів. Хворі першої групи отримували Атаракс, який має виражену седативну та анксіолітичну дію, по 1 таблетці 2 рази на добу 1-2 місяці, а також – Еліміналь гель для виведення токсинів і нормалізації мікрофлори кишечника, по 1 пакетику 3 рази на день за 1,5 години до їжі, № 12.
Зовнішня терапія полягала у втиранні 1 % пасти Сульсена у вологу шкіру волосистої частини голови, обличчя, шиї та інших ділянок псоріатичного висипу, на 10-12 годин, а потім змивали водою з милом. Перші 7 днів щодня, 7 днів – через день, а надалі – 2 рази на тиждень, 1-2 місяці.
Одночасно на ділянки псоріатичного висипу – Бетасалік у виді мазі, а на волосисту частину голови – у виді лосьйону.
20 хворим другої клініко-терапевтичної групи рекомендувався прийом ітраконазолу, але протягом двох місяців, на відміну від хворих першої групи. З метою усунення ендогенної інтоксикації призначався Аєвіт по 2 пігулки двічі на день, 3 тижні, а також – Еліміналь гель, як і хворим першої групи, але двома курсами. З метою імуномодулюючого впливу використовувався новий вітчизняний препарат Оверін (м. Харків), внутрішньом’язово, по 250 мг через 48 годин, 12 днів. Також цим хворим з метою усунення депресивних компонентів, а також нормалізації функції вегетативної нервової системи рекомендувався прийом Міасеру, по 10 мг ввечері. Зовнішня терапія була аналогічна препаратам, які використовували для лікування хворих на псоріаз першої групи.
5.3 Клініко-лабораторна оцінка ефективності розробленої комплексної диференційованої терапії
Оцінка ефективності розробленої диференційованої терапії проводилася шляхом порівняльного аналізу клініко-лабораторних даних, отриманих в результаті лікування 60 досліджуваних хворих. Негативного впливу препаратів не відзначалося в жодному випадку. Стабілізація і початок регресу проявів захворювання у пацієнтів наступали в середньому на 6-10-й дні лікування у хворих першої клініко-терапевтичної групи і – на 11-14-й день у хворих другої групи. У хворих груп порівняння ефект загальноприйнятої терапії відмічено на 15-18 дні. Позитивний клінічний ефект в основних групах хворих був отриманий на 18-22 день лікування, а у хворих груп порівняння – на 24-28 день. Термін лікування (втрата працездатності) у хворих двох основних груп не перевищував терміни, які рекомендовані нормативами МОЗ України. В той же час у 5 з 50 хворих групи порівняння ефект терапії був відсутній і навіть відмічена поява свіжих папул, синдром Кьобнера, що потребувало додаткової терапії.
Повна ремісія в кінці курсу лікування досягнута у 12 з 50 пацієнтів групи порівняння, значне покращення – у 16 з 50, покращення – у 8 з 50. В той же час, у хворих основної групи, яка складалася з 60 пацієнтів, повна клінічна ремісія зареєстрована у 22 хворих, значне покращення – у 26 і покращення – у 12.
При аналізі віддалених результатів лікування відмічена значна різниця у групах порівняння і основних групах при розвитку рецидивів. Так, ремісія менш 1 року відмічена у 25 з 50 хворих груп порівняння і тільки у 2 з 60 хворих основних груп, які отримували рекомендовані засоби.
Ремісія до двох років відмічена у 35 з 60 хворих основних груп і у 14 з 50 хворих груп порівняння. Ремісія більш двох років відмічена у 23 з 60 хворих основних груп і в 6 з 50 хворих груп порівняння.
У хворих, які отримували рекомендовану терапію, значно покращувався загальний психоемоційний статус, більш показово регресували елементи висипу, зменшувалось запалення та індекс PASI з (28,21±2,15) бала до лікування до 7,5±0,52 бала після лікування (редукція індексу PASI – 73,41 %). В той же час, у групі порівняння PASI зменшувався з (24,41±1,14) бала до (12,2±0,68) бала (редукція індексу PASI – 50,0 %), що було статистично достовірно (р<0,05). РDI зменшувався у пацієнтів основних груп з 14,4±1,08 до 6,32±0,52, а у осіб груп порівняння – з 13,2±1,04 до лікування до 8,38±0,81 після лікування, що було статистично достовірно (р<0,05).
Після проведеної терапії відмічалися зміни активності фагоцитів, особливо у хворих, які отримували рекомендовану терапію (основні групи – 60 пацієнтів) на відміну від 50 хворих пролікованих традиційно (групи порівняння). Так, ФІ статистично достовірно зростав в основній групі до 82,4±1,48 (до лікування – 36,4±3,81), ФЧ – 7,1±0,11 (до лікування – 3,36±0,48), НСТ-тест – 19,8±1,8 % (до лікування – 15,1±1,68 %). У хворих на псоріаз (групи порівняння) після традиційної терапії зростав незначно лише ФІ – до 6,42±2,8 (до лікування – 36,4±3,81), ФЧ та НСТ-тест лише мав тенденцію до росту, але статистично невірогідно (р<0,05). Рівень нейтрофілів у всіх досліджених хворих на псоріаз залишався без змін після лікування різними методиками.
Після лікування хворих основних груп статистично достовірно знижувався рівень Ig G до (13,2±1,1) г/л (до лікування – (17,2±1,1) г/л), Ig М – до (1,8±0,6) г/л (до лікування – (2,5±1,0) г/л). У хворих груп порівняння ці показники також зменшувалися, але статистично недостовірно. Рівень Ig А у всіх досліджуваних хворих на псоріаз залишався без змін після лікування.
У хворих основних груп після проведеної терапії, на відміну від хворих груп порівняння, які отримували традиційну терапію, відмічено статистично достовірне зростання абсолютної кількості CD3+ (з (0,46±0,02) до (0,67±0,03) ∙ 109/л), CD4+ (з (0,32±0,001) до (0,52±0,02) ∙ 109/л), при зниженні CD25+ (з (0,46±0,04) до (0,31±0,02) ∙ 109/л), CD95+ (з (0,38±0,02) до (0,28±0,01) ∙ 109/л). Звертає на себе увагу зростання індексу CD4+/CD8+ після лікування (з 0,9±0,02 до 1,7±0,03). У хворих на псоріаз з супутнім маласезіозом, які лікувалися традиційно (група порівняння) ці показники також змінювалися в позитивний бік, але вони були статистично недостовірні.
На відміну від хворих груп порівняння, після лікування спостерігалися позитивні зміни у хворих основної групи в цитокіновому статусі. Так, знижувався рівень ФНП-α (з (36,2±4,2) до (20,8±1,6) нг/мл); рівень IL-1β (з (34,6±2,8) до (26,2±2,1) пг/мл); рівень IL-4 (з (5,9±0,1) до (3,82±0,2) пг/мл), які були статистично достовірні тільки у хворих, які отримували рекомендовані препарати.
Після лікування, особливо у хворих основних груп, які отримували рекомендовану терапію, відмічені позитивні зрушення рівня NO-синтази і показники ОМБ, але ці дані представлені в третьому розділі.
З урахуванням наявної залежності перебігу та клініко-патогенетичних поєднаних проявів псоріазу і маласезіозу шкіри, а також взаємозалежності прогресування та загострень цих дерматозів, комплекс заходів з профілактики рецидивів псоріазу у досліджуваних хворих було доповнено заходами, що перешкоджають розвитку рецидивів маласезіозу. Так, всім дослідженим, які отримували пропонований комплекс, додатково рекомендувалося нанесення 1 % пасти Сульсена на вологу шкіру голови, обличчя, шиї та верхньої половини тулуба на 8-10 годин щотижня, а також – призначення УФО в суберитемних дозах, 2-3 рази на тиждень, №10.
При диспансеризації досліджуваних хворих частота спостережень визначалася індивідуально 4-5 разів на рік. Хворим на псоріаз при необхідності призначалися консультації терапевта, окуліста, ендокринолога, акушер-гінеколога, отоларинголога, стоматолога та інших фахівців.
Профілактика рецидивів псоріазу проводилася методом виявлення факторів, що провокують загострення захворювання, та попередження їх.
Досліджуваним хворим рекомендувалося раціональне працевлаштування, усунення провокуючих факторів, дотримання дієти, періодичний прийом, при необхідності, седативних і антибактеріальних засобів, препаратів, регулюючих функцію шлунково-кишкового тракту.
Надзвичайно важливо проводити планомірне лікування та диспансерне спостереження з приводу супутніх захворювань.
* * *
Отже, проведені дослідження показали, що в лікуванні хворих на псоріаз з супутнім маласезіозом шкіри є деякі особливості, зумовлені взаємозалежністю і взаємовпливом патологічних змін, характерних для цих двох дерматозів. Дослідження показали, що при призначенні лікування таким хворим необхідно враховувати особливості клінічних проявів і показники імунного статусу, а також – інших лабораторних тестів. На підставі проведених досліджень можна стверджувати, що група хворих на псоріаз, що поєднується з маласезіозом шкіри, є клінічно і патогенетино неоднорідною, що необхідно враховувати при призначенні лікування. Результати кластерного аналізу особливостей клініки та перебігу дерматозів, клініко-лабораторних змін дозволили об`єднати хворих у 2 клініко-терапевтичні групи, що було патогенетично і науково обґрунтовано. Ефективність запропонованої терапії та профілактики рецидивів псоріазу і маласезіозу були підтверджені віддаленими результатами спостережень за цими хворими на протязі 1,5 років. В основній групі відзначено зниження частоти рецидивів, подовження ремісій, відсутність хворих з прогресуванням псоріазу і маласезіозу шкіри, відсутність ускладнень від проведеної терапії. Все це є переконливим доказом обґрунтованості і більш високої ефективності запропонованого диференційного методу лікування хворих з такою поєднаною патологією. Запропонований метод індивідуалізованої терапії необхідно рекомендувати для впровадження в практичну охорону здоров’я [74, 77, 84].
Результати цих досліджень були опубліковані в наступних публікаціях:
1. Веретельник К.А. Новые наружные средства в терапии псориатической болезни, осложнённой малассезиозом кожи. Дерматовенерология. Косметология. Сексопатология. 2013. № 1–4. С. 188–190 [25].
2. Федотов В.П., Веретельник К.А., Корецкая Е.Ю. Новые подходы к диагностике и терапии микозов, как осложняющего фактора при ряде дерматозов. Дальневосточный вестник дерматовенерологии, косметологии и пластической хирургии. 2013. № 1 (13). С. 9–14 [109].
3. Веретельник К.А., Корецкая Е.Ю. Современное понимание и подходы к диагностике и терапии микозов, как осложняющего фактора при ряде дерматозов. Сборник научных трудов, посвящённый 90-летию со дня рождения профессора Б.А. Задорожного «Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции». Харьков, 2013. С. 64–75 [29].
4. Веретельник К.О. Сучасна топічна терапія псоріатичної хвороби, ускладненої маласезіозом шкіри. Збірка тез доповідей II Регіональної науково-практичної конференції студентiв, аспірантiв та молодих вчених «Актуальні проблеми та перспективи розвитку медичних, фармацевтичних та природних наук – 2013», м. Запоріжжя, 21 грудня 2013 р. Запоріжжя, 2013. С. 61 [34].
5. Веретельник К.А. Современные подходы к топической терапии малассезиоза кожи. Дерматовенерология. Косметология. Сексопатология. 2014. № 1–4. С. 212–214 [28].
6. Веретельник К.А. Применение антигистаминного препарата «Фексофаст–180» в комплексном лечении псориатической болезни, осложнённой малассезиозом кожи. Дерматовенерология. Косметология. Сексопатология. 2015. № 3–4. С. 209–211 [27].
7. Веретельник К.А. Новые методы иммунокоррекции у больных псориазом с сопутствующим малассезиозом. Дерматовенерология. Косметология. Сексопатология. 2017. № 1–2 (5). С. 47–50 [24].
8. Веретельник К.А. Обоснование комплексного лечения больных псориазом с сопутствующим малассезиозом кожи. Материалы научной конференции, посвящённой 125-летию со дня рождения профессора И.С. Попова «Актуальные вопросы дерматологии и ВИЧ/СПИД инфекции». Харьков, 2016. С. 35–39 [26].
9. Веретельник К.О. Нові підходи до комплексної терапії хворих на псоріаз із супутнім маласезіозом шкіри. Збірник тез ІІ Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання косметології та дерматології», м. Запоріжжя, 28–29 квітня 2017 р. Запоріжжя, 2017. С. 8–9 [32].
10. Веретельник К.О., Федотов В.П. Оптимізація комплексної диференційованої терапії хворих на псоріаз із супутньою маласезійною інфекцією. Матеріали науково-практичної конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», 10–11 листопада 2017 р., м. Харків. Дерматологія та венерологія. 2017. № 3. С. 96–97 [35].
РОЗДІЛ 6 УЗАГАЛЬНЕННЯ ОТРИМАНИХ РЕЗУЛЬТАТІВ
Псоріаз відносять до найбільш поширених дерматозів у світі. Цією хворобою страждають до 3 % населення земної кулі, частіше у віці 20-50 років. Це захворіння посідає перше місце в структурі дерматологічної патології (її виявляють у 12-15 хворих). Підвищений інтерес до цієї хвороби пояснюється не тільки високою питомою вагою псоріазу серед інших хвороб шкіри, але й ростом захворюваності цим дерматозом в останні роки, збільшенням випадків тяжких форм псоріазу, які призводять до інвалідизації, з виразною резистентністю до терапії.
Незважаючи на те, що існує велика кількість досліджень, присвячених вивченню різноманітних аспектів проблеми псоріазу, багато її сторін залишаються не з’ясованими. Однією з основних гіпотез розвитку псоріазу вважають спадкову. Показник фенотипічної конкордатності при цій патології у гомозиготних близнюків дорівнює 60-70 %, що в декілька разів вище, ніж у гетерозиготних.
Останнім часом вказують на розвиток розладів функціонального стану імунної системи при псоріазі у вигляді недостатності клітинної ланки імунітету на тлі гіперреактивності гуморальної її ланки.
Встановлена недостатність хелперної системи при підвищенні супресорної активності, зниження захопної і травної фагоцитарної активності нейтрофілів. Крім того, при цьому дерматозі реєстрували підвищення рівнів циркулюючих імунних комплексів, різних варіантів гіперімуноглобулінемій М і G. Зміни мікробіоти шкіри у хворих на цю патологію можуть свідчити про стан напруженості неспецифічної резистентності організму і є показником можливого рецидиву псоріазу. Бактерицидні властивості шкіри в значній мірі залежать від функціонального стану імунної системи, наявності дріжджоподібних ліпофільних грибів роду Malassezia. Хоча прояви маласезіозу широко розповсюджені серед населення і навіть можуть вважатися пандемічними, комплексних досліджень клініко-патологічних взаємозв’язків маласезійної інфекції шкіри та псоріазу на сьогодні не проводилися.
У механізмах розвитку псоріазу суттєве значення приділяється патології нервової і ендокринної систем, обмінним зсувом та ін. На розвиток і перебіг псоріазу негативно впливають супутні патології внутрішніх органів та різні інфекційні фактори (віруси, гриби, піококи та ін.). Увагу привабила дуже розповсюджена грибкова інфекція – маласезіоз.
Ефективність методів терапії псоріазу залежить від багатьох чинників, а тому лікування цього захворювання є одним з важливих та складних завдань сучасної дерматовенерології. Лікування псоріазу, насамперед, визначається його стадією і індивідуальними особливостями пацієнта, а також патогенністю мікробіоти, що є одним з важливих чинників захворювання. Подальше дослідження перебігу псоріазу, що ускладнюється маласезіозом необхідне у зв’язку з тим, що запропоновані на сьогодні численні методи і засоби для лікування дерматозу часто є недостатньо ефективними і це потребує розроблення нових підходів до терапії.
Таким чином, на підставі аналізу вітчизняної та зарубіжної літератури встановлено, що значна розповсюдженість псоріазу серед населення свідчить про актуальність подальших досліджень цього захворювання, що потребує необхідність розробки нових методів лікування хворих на псоріаз з урахуванням ролі грибів Malassezia, використовуючи коригуючу етіологічну та патогенетичну терапію.
Під спостереженням знаходилось 110 хворих на псоріаз (45 жінок і 65 чоловіків) у віці від 24 до 46 років та 34 практично здорових осіб. Захворювання на псоріаз частіше виникало у віці 12-35 років, рідко-після 40 років. Переважали серед хворих мешканці міст, більшість хворих були у шлюбі. Працівників розумової праці було 23 % хворих, фізичної праці – 34 %, без конкретних занять-43 %.
Осінньо-зимовий псоріаз відмічався у 81 хворого, весняно-літній – у 20, недиференційований – у 9. Прогресуюча стадія встановлена у 35 хворих, стаціонарна – у 75.
З 110 досліджених хворих на псоріаз маласезіоз шкіри встановлений у 80 пацієнтів, обумовлений М. furfur, M. pachidermatis, M. obtuses, і був представлений пітиріазом волосистої частини голови, ксерозом Дар’є, гнійним фолікулітом, себорейним дерматитом і різнокольоровим лишаєм. Клініка маласезіозу була типова і була представлена двома, трьома нозологіями.
Давність захворювання на псоріаз складала від 3 до 14 років. Дерматоз частіше виникав у віці 12-35 років і рідко-після 40 років, при наявності вже маласезіозу, якій нерідко передував псоріазу.
Вульгарний або бляшковий псоріаз переважав і складав – 106 з 110 досліджених, краплеподібний – у 2, інтертригінозний – у 2. У 48 хворих встановлена оніходистрофія. Фактор спадковості спостерігався у 25 з 110 хворих.
У 25 % хворих жіночої статі передували різні психоемоційні фактори, нервові стреси, а у 71 % хворих на псоріаз чоловічої статі передували різні інфекційні фактори. Комбіновані фактори спостерігалися у 38 % хворих, а у 11 хворих не вдалося виявити причинні фактори.
При вивченні супутніх захворювань, як зі слів пацієнтів, так і при консультації відповідних фахівців, у хворих на псоріаз без супутнього маласезіозу, переважали хвороби дихальної системи, серцево-судинні. У хворих з супутнім маласезіозом реєструвались значно частіше захворювання шлунково-кишкового тракту, зловживання алкоголем, нервово-психічна патологія, грибкові інфекції.
Із перенесених захворювань у хворих на псоріаз з супутнім маласезіозом переважали гнійно-запальні процеси, урогенітальні і застудні захворювання, травми, операції, шкірні хвороби.
Клініка бляшкового, краплеподібного і інтертригінозного псоріазу була типовою, як і характер змін нігтів, волосистої частини голови.
Індекс РАSІ у хворих на псоріаз з супутнім маласезіозом складав 28,21±2,15, а без маласезіозу – 24,41±2,01.
У хворих на псоріаз з супутнім маласезіозом частіше реєструвалися загострення процесу, а також швидке розповсюдження дерматозу.
При аналізі клінічних особливостей перебігу псоріазу встановлено, що при псоріазі з супутнім маласезіозом – більш тяжкий перебіг захворювання, частіше зустрічалися розповсюджена форма псоріазу, загострення псоріазу, вкорочені ремісії, відмічена торпідність до терапії.
При вивченні психологічного статусу за допомогою шкали Зунга і Шихана встановлена помірна та тяжка депресія у 59 % хворих на псоріаз, особливо при супутньому маласезіозі, а також при розповсюджених формах дерматозу. Встановлений аномальний рівень тривожності, особливо у групі хворих з більшою поширеністю процесу (у 28 %), переважно з супутнім маласезіозом. При вивченні показника якості життя за шкалою PDI встановлені найбільш виражені зміни цього показника (щоденна активність, лікування, якість життя, тяжкість захворювання) у хворих на псоріаз з давністю дерматозу більше 10 років, а також при ураженні більш 50 % шкірного покрову і при наявності ускладнень (маласезіоз та ін.).
При вивченні імунного статусу проведено порівняльний аналіз специфічних факторів захисту, Т- і В-ланок імунітету у хворих на псоріаз без мікозу і з супутнім маласезіозом, а також інтерлейкінів, які відіграють значну роль у формуванні запальних реакцій при цій патології.
Дослідження популяцій та субпопуляцій лімфоцитів показало, що кількість лімфоцитів в обох групах досліджених (хворих на псоріаз з супутнім маласезіозом і без маласезіозу) було на рівні їх у здорових осіб – (2,12±0,08) і (1,98±0,09) ∙ 109/л ([2,42±0,08] ∙ 109/л у здорових). У той же час кількість СD3+ було статистично достовірно зниженою ([0,9±0,03] і [1,2±0,8] ∙ 109/л при нормі (1,46±0,07) ∙ 109/л), але вірогідно нижче у хворих з мікозом (р<0,05). Відмічено також зниження кількості Т-хелперів (СD4+) в обох групах ([0,52±0,02] і [0,57±0,04] ∙ 109/л).
СD8+ був підвищений до (0,42±0,02) ∙ 109/л у хворих з маласезіозом на відміну хворих без маласезіозу ([0,34±0,01] ∙ 109/л), але ці показники статистично достовірно не відрізнялись від показання у здорових осіб.
Імунорегуляторний індекс (СD4+/СD8+) був статистично достовірно (р<0,05) зниженим в обох групах (1,36±0,02 і 1,5±0,03), на відміну від здорових осіб (2,1±0,04). Більш показне пригнічення індексу було статистично вірогідне у хворих на псоріаз із супутнім маласезіозом.
Ці показники рівня Т-хелперів і Т-супресорів свідчать про негативне їх співвідношення, що не дає змогу розвинутися адекватній імунній відповіді і свідчать про вторинний імунодефіцит, особливо у хворих на псоріаз з супутнім маласезіозом.
Особливий інтерес викликало статистично достовірне (р<0,05), збільшення кількості натуральних кілерів (СD16+) у хворих обох груп, але більше показне у хворих з супутнім маласезіозом ([0,38±0,03] ∙ 109/л). Це розцінено як показник антиген-специфічної ефекторної імунної дії натуральних кілерів, яка викликає реакцію антитіло залежної клітинної цитотоксичності, що відіграє певну роль в патогенезі псоріазу.
При визначенні загальної кількості В-лімфоцитів (СD22+) встановлено підвищення їх рівня тільки у хворих на псоріаз з супутнім маласезіозом до (0,38±0,01) ∙ 109/л при показниках у здорових осіб – (0,28±0,01) ∙ 109/л (у хворих без мікозу – (0,27±0,02) ∙ 109/л).
Виявлено статистично значиме (р<0,05) підвищення вмісту СD25+-активованих Т-лімфоцитів в групі хворих на псоріаз з супутнім маласезіозом ([0,48±0,04] ∙ 109/л проти [0,32±0,02] ∙ 109/л у хворих без мікозу і [0,28±0,01] ∙ 109/л у здорових осіб). Зміни числа СD25+ свідчать, можливо, про гіперактивність клітинного імунітету, обумовлену інфекційними чинниками (грибами), стимулюючими антитілоутворення і цитотоксичність Т-лімфоцитів і це ще раз вказує на негативний вплив грибкових антигенів на перебіг псоріазу і необхідність її усунення при лікуванні псоріазу.
Таким чином, виявлені більш глибокі зрушення рівня популяцій і субпопуляцій лімфоцитів у хворих на псоріаз з супутнім маласезіозом, що трактується особливостями патогенезу псоріазу у них і значенню ролі інфекційного фактору у розвитку дерматозу і його перебігу [113, 115, 168].
Оцінка цитокінового статусу є важливим доповненням до розуміння патогенезу захворювання, тяжкості запального процесу, прогнозу та перебігу захворювання. З проведеного дослідження у хворих на псоріаз відзначено різке статистично достовірне збільшення рівня ФНП-α в обох групах ([23,2±2,2] пг/мл у хворих без маласезіозу і [37,1±3,2] пг/мл – у хворих з мікозом), при рівні (8,2±1,2) пг/мл у здорових осіб. ІL-1β також був підвищеним в обох групах, відповідно, (30,2±3,8) і (33,4±2,9) пг/мл при нормі (15,2±1,3) пг/мл. ІL-4 був підвищеним тільки у хворих на псоріаз з супутнім маласезіозом – до (5,6±0,25) пг/мл (при (2,42±0,05) пг/мл у хворих без мікозу і (2,3±0,11) пг/мл у здорових осіб). Підвищення цитокінів, отримане в цьому дослідженні, узгоджується з даними літератури про синергізм – між їх збільшенням [51, 100, 140].
Привертає на себе увагу, що більш виражена статистично достовірне збільшення концентрації ФНП-α та ІL-1β відзначено у хворих на псоріаз з супутнім маласезіозом. Необхідно відмітити, що рівень цитокінів, які вивчались, особливо ІL-1β, залежали від показників РАSІ і наявності чи відсутності маласезійної інфекції.
Підвищення показників було у хворих на псоріаз з наявністю вогнищ хронічної грибкової інфекції. На наш погляд, рівень ІL-4 може слугувати прогностичним показником в подальшому загостренні псоріазу і появи його рецидивів. Все це дає можливість провести профілактичне лікування і попередити рецидив дерматозу, що має важливе значення в дерматології, сприяє покращенню якості життя хворих на псоріаз [36, 152].
При вивченні функціональної активності фагоцитів було встановлено, що кількість нейтрофілів – (4,92±0,2) ∙ 109/л (при нормі (4,89±0,68) ∙ 109/л), моноцитів – (0,36±0,01) ∙ 109/л (при нормі (0,41±0,02) ∙ 109/л) та фагоцитарний показник (ФП) – 59,49±2,2 (при нормі – 65,42±0,86) статистично значимо не відрізнялись в обох групах хворих на псоріаз. У хворих на псоріаз відмічено статистично достовірне зниження (р<0,01) фагоцитарного числа – 3,14±0,28 і 3,41±0,32 (при нормі – 5,47±0,29), а також НСТ-тесту – до (2,46±0,11) % і (3,27±0,24) % (при нормі – (4,12±0,2) %) в обох групах, у порівнянні з контролем, більш виразно у хворих з супутнім маласезіозом.
Таким чином, виявлене пригнічення функціональної активності фагоцитів вважалося проявом вторинного імунодефіциту. Тому макрофаги не дозволяють антиген чутливим Т- і В-клітинам дати максимальну відповідь на порогові дози антигену, вони локалізують антигени у фолікулах лімфоїдних тканин [9].
При вивченні гуморального імунітету у хворих на псоріаз відмічено підвищення продукції ІgG в обох групах хворих – (17,8±1,2) і (15,1±0,7) г/л (при нормі (12,1±1,0) г/л), що було статистично значимо (р<0,05). Це співпадає з даними літератури при підвищенні його рівня при хронічних грибкових та бактеріальних інфекціях, в даному випадку – маласезійної інфекції, бо ІgG збільшує захисну функцію, завдяки токсинонейтралізуючої, оксонізуючої та бактеріальної активності. Відмічено також зростання ІgМ, у порівнянні з контролем, тільки у хворих на псоріаз з супутнім маласезіозом – (2,5±1,12) г/л (при нормі – (1,2±0,16) г/л), що свідчить про першу важливу відповідь організму на присутню інфекцію при псоріазі [63, 71, 191].
У патогенезі псоріазу значне місце займають біохімічні зрушення: обмінні процеси, стан білків, жирів, вуглеводів, функція печінки, шлунково-кишкового тракту. В цьому напрямку виконані багато чисельні роботи різних авторів, але відсутні дослідження цих показників у хворих на псоріаз, який ускладнений грибковою інфекцією – маласезіозом.
Особливу увагу викликали вивчення при такому коморбідному стані ОМБ, як показник ендогенної інтоксикації, рівень NO-синтази, як показник стану оксиду азоту, який є найважливішим медіатором, що опосередковує широкий діапазон різноманітних фізіологічних і патофізіологічних процесів. Також представляло значний інтерес вивчення у цих хворих рівень загального білку, глюкози, функції печінки.
При аналізі показників ОМБ виявлено їх вірогідне збільшення (р<0,05) їх рівня у хворих на псоріаз, як при обмежених формах в стаціонарній стадії: АФГ (спонтанної) до (5,624±0,284) од.опт.щ., так і розповсюджених формах у прогресуючій стадії – (6,420±0,322) од.опт.щ. (при нормі – (4,491±0,252) од.опт.щ.). Таким чином змінювалися показники АФГ (стимульованої), відповідно: (12,482±0,634), (14,284±0,704) од.опт.щ. і у нормі – (7,205±0,843) од.опт.щ., що було статистично достовірно (р<0,05) у порівнянні зі здоровими особами.
КФГ (спонтанне) також зростала у досліджених хворих, відповідно-(3,842±0,310), (4,404±0,3244) од.опт.щ. і у контролі – (3,069±0,184) од.опт.щ. КФГ (стимульована) – (8,205±0,422), (11,234±0,482) од.опт.щ. при нормі – (5,532±0,304) од.опт.щ., що також було статистично значимо, при порівнянні з цими показниками у здорових осіб.
Збільшення спонтанної величини АФГ, а також КФГ, які характеризують збільшення ступеня ОМБ характеризують збільшення ступеня окислювальної деструкції білкової молекули, а також стимульованої форми АФГ і КФГ, що свідчить про потенційні резервні можливості організму до значного нівелювання проявів оксидативного стану, було більш показне у хворих на псоріаз з більш тяжким перебігом процесу. Це можна трактувати як можливу індукцію ендогенної інтоксикації на розвиток системних процесів і формування ускладнених форм псоріазу.
У хворих на псоріаз зареєстровано вирогідне збільшення як спонтанної, так і стимульованої АФГ та КФГ, і при ускладненні мікозом і без маласезіозу. Так, АФГ (спонтанне) у хворих без маласезіозу складала (5,522±0,355) од.опт.щ., а з супутнім маласезіозом – (6,906±0,234) од.опт.щ. (при нормі – (4,491±0,252) од.опт.щ.), АФГ (стимульована) була також підвищеним, відповідно – (12,314±0,637), (14,450±0,696) од.опт.щ. при нормі – (7,205±843) од.опт.щ., КФГ (спонтанна) була, відповідно – (3,743±0,318), (3,944±0,386) од.опт.щ. при нормі (3,069±0,184) од.опт.щ.; а КФГ (стимульована) – (8,158±0,550), (11,280±0,462) і (5,532±0,304) од.опт.щ., що було статистично значиме (р<0,05) у порівнянні зі здоровими особами.
Таким чином, було відмічено більш показне зростання цих показників, особливо АФГ (спонтанна) і КФГ (стимульована), у хворих на псоріаз з супутнім маласезіозом, що розцінено як вплив грибкової інфекції на перебіг псоріазу і поглиблення у них явищ ендогенної інтоксикації.
При вивченні рівня NO-синтази відмічено посилання метаболізму NO у хворих на псоріаз, як при обмежених формах у стаціонарній стадії – (12,1±0,06) нмоль/мг білка/хв.), так і розповсюджених форм у прогресуючій стадії – (14,6±0,07) нмоль/мг білки/хв. (у нормі – (0,42±0,07) нмоль/мг білка/хв.), що було статистично достовірно (р<0,05). Можливо високі показники NO-синтази відіграють значну роль у патогенезі псоріазу, викликають розвиток ускладнених і тяжких форм, особливо розповсюджених форм.
У хворих на псоріаз без супутнього мікозу рівень NO-синтази складав (11,4±0,06) нмоль/мг білка/хв., а з наявністю маласезіозу – (15,3±0,12) нмоль/мг білка/хв. (при нормі – (0,42±0,07) нмоль/мг білка/хв.). Відмічено значне зростання рівня NO-синтази у хворих на псоріаз із супутнім маласезіозом, що було статистично достовірно (р<0,05) і це розцінено як показник негативного впливу мікотичної інфекції на перебіг дерматозу.
При проведенні біохімічних досліджень встановлено статистично-достовірне зниження загального білку до (46,2±0,3) г/л (при нормі – (54,2±0,31) г/л), підвищення рівня глюкози до (6,1±0,2) ммоль/л (при нормі (5,2±0,35) г/л), показники АлАт до (43,2±3,1) од/л (при нормі – (24,6±2,1) од/л), АсАт до (38,2±3,1) од/л (при нормі – (17,2±3,1) од/л), холестерину до (6,4±0,2) ммоль/л (при нормі – (4,5±0,28) ммоль/л), холестерину ЛПНЩ до (4,83±0,4) мкмоль/л (при нормі – (2,51±0,18) мкмоль/л), тригліцерідів до (1,9±0,1) ммоль/л (при нормі – (1,28±0,16) мкмоль/л) у хворих на розповсюджені форми псоріазу у прогресуючій стадії. В той же час у хворих обмеженими формами псоріазу в стаціонарній стадії статистично значимо був підвищеним рівень АлАт до (28,1±1,8) од/л., АсАт до (24,6±2,1) од/л, холестерин ЛПНЩ до (4,2±0,3) мкмоль/л і триглицерідів до (1,6±0,3) ммоль/л.
Звертає на себе увагу більш суттєві зміни показників у хворих на псоріаз ускладненими формами, що розцінено як показник серйозних порушень обмінних процесів, печінкові тести, що свідчить про системність патологічних процесів, особливо в прогресуючій стадії при розповсюджених висипках.
У хворих на псоріаз з супутнім маласезіозом було встановлено статистично значиме зниження загального білку до (45,3±0,16) г/л, збільшення АлАт до (45,2±2,85) од/л, АсАт до (41,2±3,2) од/л, холестерину до (6,3±0,28) ммоль/л, холестерину ЛПНЩ до (5,13±0,3) мкмоль/л, триглицеридів до (2,1±0,13) ммоль/л. В той час у хворих на псоріаз без мікозу статистично вірогідно був збільшеним тільки АсАт до (21,6±2,2) од/л, холестерин ЛПНЩ до (3,8±0,21) мкмоль/л. Більш виразні зміни, особливо АлАт, АсАт, холестерину, холестерину ЛПНЩ, тригліцерідів (при р<0,05) відмічені у хворих на псоріаз із супутнім маласезіозом, що розцінено як негативний вплив грибкової інфекції на патогенетичні механізми дерматозу, що ускладнює перебіг процесу і спонукають до проведення протигрибкової терапії, тому що маласезії не «спокійні» паразити, як висловлюються деякі автори, а паразити шкіри, які викликають суттєві зрушення в організмі хворих, впливаючи на інші захворювання шкіри і функцію різних органів і систем [61, 98].
Отримані результати кластерного аналізу клінічних особливостей і перебігу псоріазу, вивчення імунного статусу і ряду регулюючих систем гомеостазу показали різні рівні клініко-лабораторних зрушень, що дозволило об’єднати хворих у дві клініко-терапевтичні групи, які корелювали між собою з високим ступенем статистичної достовірності (р<0,01).
Першу групу склали 50 хворих на псоріаз в основному з локалізованими формами бляшкового і інтертригінозного дерматозу в стаціонарній стадії захворювання з наявністю супутнього маласезіозу у вигляді простого пітиріазу волосистої частини голови, себорейного дерматиту, екзематиду Дар’є, негнійного фолікуліту, обумовлені М. furfur, M. pachidermatis, індекс PASI=23,45±2,0. У психологічному статусі переважали незначні психоемоційні розлади. В імунному статусі відзначені: ФІ – 53,2±2,43; ФЧ – 5,9±0,39; нейтрофіли – (5,2±0,29) ∙ 109/л; НСТ-тест – (12,4±1,2) %; лейкоцити – (5,86±0,38) ∙ 109/л; лімфоцити – (1,21±0,12) ∙ 109/л; CD3+ – (0,86±0,06) 109/л; CD4+ – (0,43±0,04) ∙ 109/л; CD8+ – (0,32±0,02) ∙ 109/л; CD16+ – (0,31±0,02) ∙ 109/л; CD22+ – (0,33±0,01) ∙ 109/л; CD4+/CD8+ – 1,29±0,02; Ig G – (16,4±1,2) г/л; Ig M – (1,8±0,12) г/л; IL-1β – (28,4±2,4) пг/мл; IL-4 – (5,1±0,21) пг/мл; ФНП-α – (24,2±2,4) пг/мл.
АФГ (спонтанна) – (5,2±0,28) од.опт.щ.; АФГ (стимульована) – (12,4±0,52) од.опт.щ.; КФГ (спонтанна) – (3,81±0,24) од.опт.щ.; КФГ (стимульована) – (8,12±0,34) од.опт.щ.; NO-синтаза – (11,8±0,05) нмоль/мг білка/хв.; АсАт – (22,4±2,2) од/л; АлАт – (27,8±1,6) од/л; загальний білок – (47,2±0,3) г/л; глюкоза – (5,3±0,18) ммоль/л; глюкоза – (5,3±0,18) ммоль/л; холестерин – (4,7±0,2) ммоль/л; холестерин ЛПВЩ – (1,24±0,14) мкмоль/л; ЛПНЩ – (4,1±0,2) мкмоль/л; тригліцериди – (1,5±0,2) ммоль/л.
Друга група складалася з 30 хворих в основному розповсюдженими формами бляшкового псоріазу в стадії прогресування. Прояви маласезіозу були у вигляді маласезійного пустульозу, різнобарвного лишаю, що обумовлений M. furfur, M. globosa, індекс PASI був 29,4±2,1. У психологічному стані переважали депресивні реакції. В імунному статусі спостерігалися: ФІ – 42,3±4,4; ФЧ – 40,8±4,6; нейтрофіли – (4,81±0,22) ∙ 109/л; НСТ-тест – (14,8±1,64) %; лейкоцити – (4,86±0,4) ∙ 109/л; лімфоцити – (0,96±0,12) ∙ 109/л; CD3+ – (0,64±0,02) ∙ 109/л; CD4+ – (0,39±0,03) ∙ 109/л; CD8+ – (0,29±0,02) ∙ 109/л; CD16+ – (0,26±0,02) ∙ 109/л; CD22+ – (0,44±0,02) ∙ 109/л; CD4+/CD8+ – 1,12±0,01; Ig G – (19,1±0,2) г/л; Ig M – (2,7±1,3) г/л; IL-1β – (35,4±3,1) пг/мл; IL-4 – (6,1±0,18) пг/мл; ФНП-α – (36,4±4,1) пг/мл.
АФГ (спонтанна) – (6,5±0,31) од.опт.щ.; АФГ (стимульована) – (15,1±0,6) од.опт.щ.; КФГ (спонтанна) – (4,2±0,24) од.опт.щ.; КФГ (стимульована) – (12,2±0,38) од.опт.щ.; NO-синтаза – (14,8±0,06) нмоль/мг білка/хв.; АсАт – (39,2±2,8) од/л; АлАт – (44,4±2,8) од/л; загальний білок – (45,4±0,2) г/л; холестерин – (6,5±0,18) ммоль/л; холестерин ЛПВЩ – (1,29±0,2) мкмоль/л; холестерин ЛПНЩ – (4,92±0,3) мкмоль/л; тригліцериди – (2,1±0,1) ммоль/л.
Розроблена оригінальна методика комплексної терапії хворих на псоріаз з супутнім маласезіозом з диференційованим призначенням як етіологічних, та і патогенетичних і симптоматичних препаратів. Вибір лікарських препаратів і методів ґрунтувався на необхідності вплинули на різні ланки порушень патогенезу псоріазу. Серед усіх препаратів виділено кілька основних груп: етіотропні, імуномоделюючі, гепатопротектори, гіпосенсибілізуючі, антиоксиданти, ентеросорбенти.
30 хворих на псоріаз без мікозу і 20 хворих з супутнім маласезіозом (перша і друга групи порівняння) проліковані традиційно (дієта, нейровітан, глюконат кальцію внутрішньом’язово, аєвіт, адаптол, фексофаст, зовнішньо – бетасалік).
40 хворим першої клініко-терапевтичної групи рекомендували додатково до традиційної терапії прийом ітраконазолу по 100 мг двічі на добу, 14 діб, а потім пульс-терапія – 1 курс. З метою імуномодуляції призначали тіотриазолін по 2,0 мл 2,5 % розчину внутрішньом’язово, 10 діб, а потім по 1 таблетці 2 рази на добу – 10 діб; атаракс по 1 таблетці 2 рази на добу; еліміналь-гель по 1 капсулі 2 рази на добу до їжі, № 12. Зовнішня терапія полягала у втиранні 1 % пасти Сульсена на 10–12 годин, що потім змивалася водою з милом (Dove). Перші 7 діб щодня, потім 7 діб – через добу, а надалі 2 рази на тиждень, 1 місяць, а також бетасалік.
20 хворих другої клініко-терапевтичної групи рекомендували прийом ітраконазолу – 2 місяці, аєвіт по 2 таблетці 2 рази на добу, еліміналь-гель – 2 курси, з метою імуномодуляції використовували оверін внутрішньом’язово по 250 мг через 48 годин, 12 діб; рекомендували міасер по 10 мг ввечері. Зовнішня терапія була аналогічна методиці в першій групі хворих.
Негативного впливу препаратів не встановлено. Стабілізація і початок регресу проявів захворювання у пацієнтів наступали в середньому на 6-10-й дні лікування у хворих першої групи і на 11-14 день – у хворих другої групи, в групах порівняння – на 15-18 дні.
Позитивний ефект в основних групах хворих був отриманий на 18-22 добу лікування, а у хворих груп порівняння на 24-28 добу. Термін лікування у хворих (втрата працездатності) в основних групах не перевищував терміни, рекомендовані нормативами МОЗ України. В той же час у 5 з 50 хворих груп порівняння ефект терапії був відсутній і навіть відмічена поява свіжих папул, симптому Кьобнера.
Повна ремісія в кінці курсу лікування досягнута у 12 з 50 пацієнтів2 груп порівняння, значне покращення – у 16 з 50, покращення – у 8 з 50, без ефекту – 14. В той же час у хворих двох основних груп, які складали 60 пацієнтів, повна ремісія зареєстрована у 22 хворих, значне покращення – у 26 і покращення – у 12. Відмічена повна регресія проявів маласезіозу у всіх досліджених двох основних груп.
При аналізі віддалених результатів лікування відмічена значна різниця у групах порівняння і основних групах при розвитку рецидивів. Так, ремісія менш 1 року відмічена у 25 з 50 хворих груп порівняння і тільки у 2 з 60 хворих основних груп, які отримували рекомендовані засоби.
Ремісія до двох років відмічена у 35 з 60 хворих основних груп і у 14 з 50 хворих груп порівняння. Ремісія більше двох років відмічена у 23 з 60 хворих основних груп і у 6 з 50 хворих груп порівняння.
У хворих, які отримували рекомендовану терапію, значно покращувався загальний психоемоційний статус, більш показово регресували елементи висипу, зменшувалось запалення та індекс РАSI з (28,21±2,15) бали до лікування і до (7,5±0,52) бала після лікування (редукція індексу PASI – 73,41 %). У той же час у групах порівняння PASI зменшувалося з (24,41±1,14) до (12,2±0,68) бала (редукція індексу PASI – 50,0 %). Різниця в порівнянні показників до лікування і після лікування була статистично достовірна (р<0,05).
Індекс недієздатності при псоріазі зменшувався у пацієнтів основної групи з 14,14±1,08 до лікування до 6,32±0,52 після лікування, а у пацієнтів груп порівняння з 13,2±1,04 до лікування 8,38±0,81 після лікування (р<0,05).
Після проведеної терапії ФІ статистично достовірно (р<0,05) зростав в основній групі до 82,4±1,48, а в групі порівняння – до 64,2±2,8 (до лікування-36,4±3,81). ФЧ, НСТ-тест та рівень нейтрофілів достовірно не змінювалися після лікування. Після лікування у хворих основної групи статистично значимо (р<0,05) знижувався рівень Ig G до (13,2±1,1) г/л (до лікування – (17,2±1,1) г/л); Ig M до (1,8±0,6) г/л (до лікування – (2,5±1,0) г/л), у хворих груп порівняння вони були статистично недостовірними (р>0,05).
У хворих основної групи після проведеної терапії відмічено статистично достовірне (р<0,05) зростання абсолютної кількості CD3+ (з (0,46±0,02) до (0,67±0,03) ∙ 109/л); CD4+ (з (0,32±0,001) до (0,52±0,02) ∙ 109/л, при зниженні CD25+ (з (0,46±0,04) до (0,31±0,02) ∙ 109/л); CD95+ (з (0,38±0,02) до (0,28±0,01) ∙ 109/л). Звертає на себе увагу зростання індексу CD4+/CD8+ після лікування (з 0,9±0,02 до 1,7±0,03). У хворих груп порівняння ці показники змінювались статистично не достовірно (р>0,05).
На відміну від груп порівняння, після лікування спостерігалося зниження рівня ФНП-α з (36,2±4,2) до (20,8±1,6) пг/мл, рівня IL-1β з (34,6±2,8) до (26,2±2,1) пг/мл; рівня IL-4 з (5,9±0,1) до (3,82±0,2) пг/мл, які були статистично достовірні тільки у хворих, які отримували рекомендовані препарати.
При вивченні показників ОМБ після проведеного лікування відмічено статистично достовірне (р<0,05) зниження їх тільки у хворих, які отримували рекомендовану терапію (основна група). Так, АФГ (спонтанна) знизилася до (4,632±0,124) од.опт.щ. після лікування ([6,044±0,31] од.опт.щ. до лікування); АФГ (стимульована) до (8,324±0,6) од.опт.щ. (до лікування – (13,382±0,669) од.опт.щ.); КФГ (спонтанна) до (3,104±0,1) од.опт.щ. (до лікування – (3,972±0,0317) од.опт.щ.); КФГ (стимульована) до (5,724±0,2) од.опт.щ. (до лікування – (6,868±0,45) од.опт.щ.). У той же час у хворих груп порівняння, яким рекомендована традиційна терапія, показники АФГ та КФГ лише мали тенденцію до зниження, але статистично не вірогідно (р>0,05).
Після проведеної терапії рівень NO-синтази у хворих основної групи статистично значимо (р<0,05) знижувався з (13,35±0,06) нмоль/мг білка/хв. до (6,42±0,04) нмоль/мг білка/хв., а у хворих груп порівняння до (12,2±0,01) і (10,4±0,03) нмоль/мг білка/хв. Таким чином, більш показове зниження NO‑синтази відмічено у хворих, які отримували рекомендовану терапію.
Після проведеної терапії хворим на псоріаз із супутнім маласезіозом, які отримували рекомендовану терапію статистично значимо зростали загальний білок з (45,3±0,16) до (47,4±0,12) г/л, знижувався рівень АлАт з (45,2±2,8) до (38,4±1,8) од/л, АсАт – з (41,2±3,2) до (38,1±2,6) од/л, холестерин – з (6,3±0,28) до (5,1±0,24) ммоль/л, холестерин ЛПНЩ – з (5,15±0,3) до (4,88±0,19) мкмоль/л, тригліцериди з (2,1±0,13) до (1,94±0,14) мкмоль/л, але досягали рівня у здорових осіб лише загальний білок. Інші показники в основній групі, хоча і мали тенденцію до нормалізації, але були статистично не достовірні (р>0,05).
У групах порівняння статистично достовірно змінювалися після традиційної терапії лише АлАт, АсАт, холестерин ЛПНЩ.
Повної нормалізації біохімічних показників після терапії у стаціонарі не відбулося, тому рекомендовано у подальшому після виписки із клініки продовжувати терапію з метою профілактики рецидивів псоріазу і маласезіозу.
З урахуванням наявної залежності клінічних проявів псоріазу і його перебігу, маласезіозу шкіри, а також можливостей прогресування та загострень цих дерматозів, доповнено комплекс заходів з профілактики рецидивів псоріазу. Так, усім дослідженим додатково рекомендували нанесення 1 % пасти Сульсена на вологу шкіру голови, обличчя, шиї і верхньої половини тулуба на 8-10 годин щотижня, а також УФО, 2 рази на тиждень, №10, щомісячно.
При диспансеризації досліджували хворих 4 рази на рік, при необхідності призначались консультації суміжних фахівців.
Профілактика рецидивів проводилася методом виявлення тригер-факторів, що провокують загострення захворювання та попередження їх. Дослідженим хворим рекомендували раціональне працевлаштування, усунення провокуючих факторів, дотримання дієти, періодичний прийом при необхідності седативних і антибактеріальних засобів, препаратів регулюючих імунний статус, печінкові тести та ін. надзвичайно важливо проводити планомірне лікування та диспансерне спостереження з приводу супутніх захворювань. Запропонований метод індивідуалізованої терапії і профілактики необхідно рекомендувати для впровадження в практичну охорону здоров’я.
ВИСНОВКИ
У дисертації наведено теоретичне узагальнення і нове вирішення наукового і практичного завдання з підвищення ефективності лікування хворих на псоріаз із супутнім маласезіозом шляхом вивчення у взаємозв’язку і взаємозалежності клінічних особливостей і механізмів розвитку цих дерматозів та розробки на цій основі алгоритмів комплексної диференційованої терапії і профілактики рецидивів.
- Зростання захворюваності населення на псоріаз, хронічний перебіг з неминучими рецидивами, недостатність інформації у літературних джерелах про особливості патогенетичних змін у хворих на цей дерматоз із супутнім маласезіозом свідчить про необхідність досконального вивчення на сучасному етапі клінічних проявів, перебігу та особливостей механізмів розвитку псоріазу при такому поєднаному стані дерматозів і розробки диференційованих показань та методики комплексного лікування цих патологій шкіри.
- Встановлено, що зі 110 досліджених хворих на псоріаз (40,9 % жінок і 59,1 % чоловіків у віці 25-46 років) маласезіоз діагностовано у 72,8 %, який проявлявся пітиріазом волосистої частини голови, ксерозом Дар’є, гнійним фолікулітом, себорейним дерматитом, різнокольоровим лишаєм; у 18 % хворих передували різні психоемоційні фактори, нервові стреси, а у 39 % – різні інфекційні фактори; у хворих на псоріаз із супутнім маласезіозом відмічено особливості перебігу псоріазу – розповсюджені й атипові форми, нестійкі ремісії, часті рецидиви, швидке розповсюдження процесу, торпідність до терапії; при дослідженні психологічного статусу помірну або тяжку депресію встановлено у 50 % пацієнтів, аномальний рівень тривожності – у 28 %, зміни якості життя – особливо у хворих із супутнім маласезіозом.
- Встановлено порушення імунного статусу, більш виражені у хворих на розповсюджені форми псоріазу з супутнім маласезіозом, на відміну від хворих з локалізованими формами без маласезіозу: кількісні зміни популяцій та субпопуляцій лімфоцитів (зниження CD3+: у хворих із супутнім маласезіозом –на 25 % порівняно з хворими без маласезіозу, на 20 % порівняно з контролем; CD4+ відповідно: на 8,7 % та 33,3 %; співвідношення CD4+/CD8+ відповідно: на 9,3 % та 35 %; на фоні збільшення вмісту CD16+ відповідно: на 26,3 % та 47,4 %; та збільшення вмісту CD25+ відповідно: на 33,3 % та 41,7 %; збільшення показників цитокінів (IL-1β відповідно: на 9,6 % та 49,7 %; IL‑4 відповідно: на 56,8 % та 5 %; зростання показників ФНП-α відповідно: на 37,5 % та 77,9 %; підвищення рівня Ig G відповідно: на 15,2 % та 32 % ; та Ig M відповідно: на 52 % та 52 %; пригнічення функції фагоцитів – зниження ФЧ та НСТ-тесту (ФЧ відповідно: на 9,8 % та 42,6 %; НСТ-тест відповідно: на 24,8 % та 40,3 %), які свідчать про негативний вплив інфекційного фактору на виникнення та перебіг псоріазу.
- Визначено за даними рівня показників окислювальної модифікації білків у хворих на псоріаз, особливо при розповсюджених формах дерматозу у прогресуючій стадії при наявності маласезіозу, значне накопичення патологічних ендотоксинів (високі рівні АФГ і КФГ, як спонтанного так і стимульованого типу), різке зростання рівня NO-синтази, а також суттєві зрушення показників обмінних процесів, які мали тенденцію до нормалізації після проведеної рекомендованої терапії, на відміну від хворих двох груп порівняння, які отримували традиційну терапію.
- Залежно від виявлених різних рівнів клініко-лабораторних порушень у хворих на псоріаз основної групи рекомендувалося диференційовано 40 хворим на локалізований псоріаз у стаціонарній стадії, з поверхневими формами маласезіозу і незначними лабораторними змінами призначення на першому етапі терапії ітраконазолу, морфолінієвої солі тіазотної кислоти, кремнію діоксиду, на другому етапі – традиційна терапія (вітаміни групи В, глюконат кальцію, вітаміни А та Е, левоцетиризину дигідрохлорид – 5 мг) і, додатково, гідроксизину дигідрохлорид – 25 мг; 20 хворим на розповсюджений псоріаз у стадії прогресування, із запальними формами маласезіозу, з проявами депресії і більш суттєвими лабораторними змінами призначався на першому етапі терапії ітраконазол, 2 місяці, 2 курси кремнію діоксид в гелі, натрію оксодигідроакридинілацетат, а на другому етапі – традиційна терапія і, додатково, міансерину гідрохлорид – 10 мг; зовнішньо – паста і шампунь дисульфіду селену, мазь бетаметазону та саліцилової кислоти.
- Розроблені і впроваджені алгоритми лікування при відсутності ускладнень і небажаних ефектів дозволили одержати у хворих основних груп, на відміну від хворих, які лікувалися традиційно, стабілізацію і початок регресу висипу на 6–10 добу лікування у хворих першої основної групи і на 11–14 добу – другої основної групи (у групах порівняння – на 15–18 добу); позитивний клінічний ефект отримано на 18–22 добу лікування в основній групі, і на 24–28 добу – в групах порівняння. У хворих основних груп значно подовжувався термін ремісії, зменшувалася кількість рецидивів, суттєво покращувалися показники PASI та PDI (індекс PASI знижувався з 28,21 ± 2,15 до 7,5 ± 0,52 –редукція індексу – 73,41 %; індексу PDI – на 55,4 %), лабораторні дослідження, на відміну від хворих груп порівняння, які отримували традиційну терапію (відповідно: 24,41 ± 1,14; 12,2 ± 0,68 – 50 %; і на 37 %).
РЕКОМЕНДАЦІЇ
І. Рекомендовано визначати рівень клініко-лабораторних порушень з урахуванням клінічних особливостей псоріазу і маласезіозу (форма дерматозу, розповсюдженість процесу, супутня патологія, термін перебігу), наявність маласезіозу, печінкових тестів, показників імунного статусу та психоемоційного стану.
ІІ. 1. Для хворих з локалізованими формами бляшкового псоріазу в стаціонарній стадії, з маласезіозом (пітиріаз волосистої частини голови, себорейний дерматит, ксероз Дар`є), з симптомами тривожності, у яких були нерізко виражені зміни імунного статусу та біохімічних показників, на першому етапі слід призначати: а) ітраконазол – по 100 мг двічі на добу 14 днів, а потім – 1 курс пульс-терапії по 200 мг двічі на добу 7 днів, потім інтервал – 3 тижні;
б) морфолінієва сіль тіазотної кислоти – по 2,0 мл 2,5 % розчину внутрішньом’язово 10 діб, а потім – по 1 таблетці 2 рази на добу 10 днів;
в) кремнію діоксид в гелі – по 1 пакетику 3 рази на добу за 1,5 години до їжі № 12;
На другому етапі: традиційна терапія і додатково гідроксизину дигідрохлорид – по 1 таблетці 2 рази на добу протягом одного місяця.
2. Для хворих з розповсюдженими формами бляшкового псоріазу в прогресуючій стадії з маласезіозом (маласезійний пустульоз, різнокольоровий лишай), на першому етапі:
а) ітраконазол – по 100 мг двічі на добу протягом одного місяця;
б) кремнію діоксид у гелі – по 1 п. х 3 рази на добу, 15 діб, 2 курси;
в) натрію оксодигідроакридинілацетат – внутрішньом’язово, по 250 мг, через 48 годин, 12 діб;
На другому етапі: традиційна терапія і додатково міансерину гідрохлорид по 10 мг ввечері.
ІІІ. Зовнішня терапія на першому етапі: втирання 1 % пасти дисульфіду селену у шкіру волосистої частини голови, обличчя, шиї та всіх ділянок псоріатичного висипу на 10-12 годин, потім змивати водою з милом. Перші 7 діб – щодня, потім – 7 діб через добу, а надалі – 2 рази на тиждень, 1-2 місяці.
Одночасно на ділянки псоріатичного висипу наноситься бетасалік мазь.
На другому етапі зовнішньо – шампунь дисульфіду селену, ввечері, на 10–15 хвилин, на ті ж ділянки, як і паста, щоденно, 7–10 днів, а потім через день, 15–20 діб.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Айзятулов Ю.Ф. Принципы общей терапии при лечении кожних больных (лекція). Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2013. № 1-2 (30). С. 145–158.
- Аль Касем Амін. Вплив системної терапії ожиріння на синтез ФНП-α кератиноцитами у хворих на псоріаз. Дерматологія та венерологія. 2013. № 2 (60). С. 45–49.
- Аналіз показників експресії, імуногістохімічних маркерів проліферації, васкулярізацї, базальноклітинної гіперплазії, стромальної деградації, CD3+ і CD8+ мононуклеарної інфільтрації та клітин Лангерганса в залежності від форми та важкості перебігу псоріазу / І.Я. Возняк, І.С. Шпонька, Т.В. Святенко, О.В. Пославська. Морфологія. 2013. Т. 7, № 3. С. 117–126.
- Антагонистическая активность Malassezia spp. к другим клинически значимым родам дрожжей / В. Г. Арзуманян, А. Ю. Сергеев, О. В. Шелемех и др. Бюллетень экспериментальной биологии и медицины. 2009. Т. 147, № 9. С. 298–303.
- Антицитокиновая терапия тяжелых форм псориаза / Е. Н. Тарасенко, С. А. Белякин, Н. Н. Рожман, Ю. В. Кузьмина. Российский журнал кожных и венерических болезней. 2013. № 1. С. 30–33.
- Бакулев А. Л., Кравченя С. С. Об эффективности и безопасности применения клобетазола пропионата коротким курсом у больных псориазом в фазе прогрессирования. Вестник дерматологии и венерологии. 2012. № 3. С. 121–125.
- Бекірова Е.Ю. Патогенетичне обґрунтування D-дефіцит-опосередкованого механізму прогресування псоріаза в осінньо-зимовий період. Дерматологія та венерологія. 2013. № 2 (60). С. 21–25.
- Беловол А. Н. Дисфункция сосудистого эндотелия у больных псориазом. Український журнал дерматології, косметології. 2010. № 1 (36). С. 17–21.
- Белозоров А. П. Новая субпопуляция эффекторных хелперных Т- лимфоцитов (Тh22) и ее участие в патогенезе заболеваний кожи. Дерматологія та венерологія. 2010. № 2 (48). С. 7–10.
- Беляев Г.М. Современное представление о патогенезе псориатической артропатии и лечении этих больных. Дерматологія та венерологія. 2010. № 1 (47). С. 7–30.
- Біловол А. М. Патогенез і терапія псоріазу з різним ступенем тяжкості ендогенної інтоксикації та артеріальної гіпертензії: автореф. дис. на здобуття наукового ступеня д.мед.н.: 14.01.20 / Національний медичний ун-т ім. О.О. Богомольця. К., 2011. 30 с.
- Біловол А.М., Ніколаєва В.Б., Галузинська Л.В. Визначення стану моно амінів у хворих на розповсюджений псоріаз та при ускладненні його перебігу. Дерматологія та венерологія. 2016. № 1 (71). С. 16–22.
- Біловол А.М., Ніколаєва В.Б., Галузинська Л.В. Стан реактивності сполучної тканини у хворих на поширений псоріаз. Український журнал дерматології, венерології, косметології. 2017. № 1 (64). С. 14–17.
- Біловол А.М., Ткаченко С.Г., Татузян Е.Г. Клінічні особливості перебігу псоріазу, асоційованого з артеріальною гіпертензією. Дерматологія та венерологія. 2017. № 3 (77). С. 54–56.
- Біловол А.М., Ткаченко С.Г., Татузян Е.Г. Проблематика терапії псоріазу, асоційованого з артеріальною гіпертензією. Дерматологія та венерологія. 2017. № 2 (76). С. 12–15.
- Богданова Т. В. Морфолого-физиологические характеристики дрожжевых организмов – Malassezia species (Malassez, 1874) Baillon, 1889 (обзор). Проблемы медицинской микологии. 2011. Т. 13, № 1. С. 3–13.
- Болотна Л.А., Саріан О.І. Корекція метаболічних порушень у хворих на псоріаз. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2014. № 1/2. C. 131.
- Болотная Л. А. Опыт применения дерматокосметических средств DUCRAY в лечении псориаза волосистой части головы. Клінічна імунологія. Алергологія. Інфектологія. 2013. № 8. С. 34–37.
- Болотная Л.А., Шмелькова Е.С., Сариан Е.С. Место «Ламикона» в терапии дерматофитий. Український журнал дерматології, венерології, косметології. 2012. № 1 (44). С. 88–93.
- Болотов П.Б., Захарова Р.Р. Состояние цитокинового профиля у больных псориазом. Мед. вести Башкортостана. 2010. Т. 5, № 2. С. 23–26.
- Бурханова Н.Р. Оптимизация терапии больных псориазом на основании оценки клинических, биохимических и иммунологических показателей: автореферат дисс. … канд.. мед. наук: 14.01.10. Екатеринбург, 2014. 25 с.
- Ван дер Варден Б.Л. Математическая статистика. М. : Изд-во иностр. лит., 1960. 434 с.
- Вантюх Н.В., Лмко О.І. Особливості вісцеральної патології при псоріатичній хворобі. Наук. вісн. Ужгород. ун-ту. Сер. Медицина. 2015. № 1. С. 222–226.
- Веретельник К.А. Новые методы иммунокоррекции у больных псориазом с сопутствующим малассезиозом. Дерматовенерология. Косметология. Сексопатология. 2017. № 1–2 (5). С. 47–50.
- Веретельник К.А. Новые наружные средства в терапии псориатической болезни, осложнённой малассезиозом кожи. Дерматовенерология. Косметология. Сексопатология. 2013. № 1–4. С. 188–190.
- Веретельник К.А. Обоснование комплексного лечения больных псориазом с сопутствующим малассезиозом кожи. Материалы научной конференции, посвящённой 125-летию со дня рождения профессора И.С. Попова «Актуальные вопросы дерматологии и ВИЧ/СПИД инфекции». Харьков, 2016. С. 35–39.
- Веретельник К.А. Применение антигистаминного препарата «Фексофаст–180» в комплексном лечении псориатической болезни, осложнённой малассезиозом кожи. Дерматовенерология. Косметология. Сексопатология. 2015. № 3–4. С. 209–211.
- Веретельник К.А. Современные подходы к топической терапии малассезиоза кожи. Дерматовенерология. Косметология. Сексопатология. 2014. № 1–4. С. 212–214.
- Веретельник К.А., Корецкая Е.Ю. Современное понимание и подходы к диагностике и терапии микозов, как осложняющего фактора при ряде дерматозов. Сборник научных трудов, посвящённый 90-летию со дня рождения профессора Б.А. Задорожного «Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции». Харьков, 2013. С. 64–75.
- Веретельник К.А., Федотов В.П. Состояние вегетативной нервной системы у больных псориазом, осложнённым малассезиозом кожи. Дерматовенерология. Косметология. Сексопатология. 2016. № 1–4. С. 243–245.
- Веретельник К.О. Імунний статус у хворих на псоріаз із супутньою маласезійною інфекцією. Запорізький медичний журнал. 2017. Т. 19, № 3. С. 363–368.
- Веретельник К.О. Нові підходи до комплексної терапії хворих на псоріаз із супутнім маласезіозом шкіри. Збірник тез ІІ Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання косметології та дерматології», м. Запоріжжя, 28–29 квітня 2017 р. Запоріжжя, 2017. С. 8–9.
- Веретельник К.О. Показники ендогенної інтоксикації та метаболізму NO у хворих на псоріаз з супутньою маласезійною інфекцією. Сучасні медичні технології. 2017. № 3. С. 58–63.
- Веретельник К.О. Сучасна топічна терапія псоріатичної хвороби, ускладненої маласезіозом шкіри. Збірка тез доповідей II Регіональної науково-практичної конференції студентiв, аспірантiв та молодих вчених «Актуальні проблеми та перспективи розвитку медичних, фармацевтичних та природних наук – 2013», м. Запоріжжя, 21 грудня 2013 р. Запоріжжя, 2013. С. 61.
- Веретельник К.О., Федотов В.П. Оптимізація комплексної диференційованої терапії хворих на псоріаз із супутньою маласезійною інфекцією. Матеріали науково-практичної конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», 10–11 листопада 2017 р., м. Харків. Дерматологія та венерологія. 2017. № 3. С. 96–97.
- Вірстюк В.Г., Волошинович М.С. Вплив інтерлейкіну-23 на перебіг псоріазу залежно від змін функціонального стану печінки. Український журнал дерматології, венерології, косметології. 2013. № 4 (51). С. 67–71.
- Владимиров И.С., Монахов К.Н., Суховская О.А. Характеристика современного течения псориаза и факторы, определяющие качество жизни пациентов. Совр. пробл. дерматовен., иммунол. и врачеб. косметол. 2011. № 4. С. 27–34.
- Галникіна С. О., Козлова М. В. Ефективність поєднаного застосування Діаформіну та Кверцетину в лікуванні хворих на дисемінований псоріаз з метаболічним синдромом. Ліки України. 2011. № 1. C. 82–86.
- Горбунцов В. В. Комплексна таргетна терапія маласезіозу шкіри: Дис. … д-ра мед. наук за спеціальністю 14.01.20. К. : Національний медичний університет ім. О. О. Богомольця МОЗ України, 2009. 336 с.
- Дащук А.М., Пустова Н.В., Добржанська Є.І. Комплексна терапія хворих на псоріаз з використанням вузько смугової фототерапії на довжині хвилі 311 нм. Український журнал дерматології, венерології, косметології. 2015. № 4 (59). С. 25–29.
- Дерматовенерология, 2010. Клинические рекомендации / Под ред. А. А. Кубановой. М. : ДЭКС-Пресс, 2010. 428 с.
- Дерматовенерология. Учебное пособие / Под ред. В. П. Федотова, А. Д. Дюдюна, В. И. Степаненко. Изд-е 2-е, рус. Днепропетровск-Киев : Изд-во «Свидлер А. Л.», 2011. 652 с.
- Дерматология, венерология. Учебник / Под ред. В. И. Степаненко. К. : КИМ, 2012. 904 с.
- Добржанська Є.І. Порушення механізмів нейроендокринної регуляції та системи імунного захисту у хворих на псоріаз. Український журнал дерматології, венерології, косметології. 2013. № 4 (51). С. 51–56.
- Дюдюн А.Д., Колева Н.М., Алі Л.Х. Інтегральна роль урогенітальних інфекцій у розвитку артропатичного псоріазу. Український журнал дерматології, венерології, косметології. 2014. № 1 (52). С. 27–34.
- Дюдюн С. А., Горбунцов В. В. Маласезійна інфекція геніталій: нові можливості підвищення ефективності лікування хворих з ІПСШ. Дерматовенерологія. Косметологія. Сексопатологія. 2010. № 3–4. С. 109–124.
- Дюдюн С. А., Горбунцов В. В. Особливості клінічних проявів та перебігу ІПСШ у хворих чоловіків з маласезійною інфекцією статевих органів. Дерматовенерологія. Косметологія. Сексопатологія. 2012. № 1–4. С. 49–62.
- Дядык Е.А., Жданова И.О. Влияние узкополосной (311 нм) ультрафиолетовой терапии на клинико-морфологическую структуру кожи больных вульгарным псориазом. Український журнал дерматології, венерології, косметології. 2015. № 4 (59). С. 44–50.
- Захворюваність на поширені дерматози за даними звертання в лікувальні заклади шкірно-венерологічногота алергологічного профілю м.Харкова / Е.М. Солошенко, О.М. Стулій, Л.В. Рощенюк та ін. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2014. № 1–2 (32). С. 36–40.
- Згура Ю. А., Харьков Е. И., Шапиро Л. А. Гендерные особенности течения псориаза с нарушением всасывающей функции тонкой кишки. Сибирское медицинское обозрение. 2013. № 5. С. 6–15.
- Знаменская Л.Ф. Препараты ингибиторов фактора некроза опухолей альфа в терапии больных псориазом. Вестник дерматологии и венерологии. 2010. № 6. С. 7–15.
- Изменения гормонального статуса у пациентов с очаговым вульгарным псориазом / А.Г. Васильев, Д.В. Заславский, A.П. Трашков и др. Вестник дерматологии и венерологии. 2011. № 5. С. 88–90.
- Іваніщева І.А., Свирид С.Г. Етіологія, патогенез та клінічний перебіг мікозу стоп в осіб юнацького та молодого зрілого віку. Український журнал дерматології, венерології, косметології. 2013. № 4 (51). С. 25–29.
- Кауд Дія. Рівень активності ендотеліна-1 в плазмі крові у хворих псоріазом на тлі метаболічного синдрому. Дерматологія та венерологія. 2013. № 2 (60). С. 27–33.
- Кірієнко В.О., Макуріна Г.І., Якименко Є.С. Порушення фізіологічних маркерів психоемоційного напруження та їх корекція з використанням температурно-міографічного тренінгу в комплексній терапії псоріатичної хвороби з надмірною масою тіла та артеріальною гіпертензією. Український журнал дерматології, венерології, косметології. 2015. № 1 (56). С. 24–32.
- Кобзарь А. И. Прикладная математическая статистика. Для инженеров и научных работников. М. : Физматлит, 2012. 816 с.
- Коган Б.Г. Инновационные подходы в комбинированном лечении онихо- и дерматомикозов у пациентов разных возрастных групп. Новый опит клинического применения препаратов в практике врача-дерматовенеролога. Український журнал дерматології, венерології, косметології. 2017. № 3 (66). С. 63–68.
- Коган Б.Г., Верба Е.А. Современный взгляд на проблему онихомикоза. Анализ рынка местных противогрибковых средств. Український журнал дерматології, венерології, косметології. 2017. № 3 (66). С. 47–53.
- Коркава Ю. Л. Псориаз и псориатический артрит: актуальные вопросы. Соврем. ревматол. 2012. № 3. С. 28–32.
- Королёва М.В. Этиология, клиника и оптимизация терапии при микозе стоп. Український журнал дерматології, венерології, косметології. 2013. № 2 (49). С. 171–175.
- Коррекция нарушений липидного обмена у больных псориазом / А.И. Якубович, Л.С. Салдамаева, В.С. Новоселова и др. Российский журнал кожных и венерических болезней. 2011. № 6. С. 29–32.
- Кочергин Н. Г. Псориаз, приверженность к лечению и кальципотриол + бетаметазона дипропионат. Клин. дерматология и венерология. 2010. № 3. С. 42–46.
- Кубанова А. А. Иммунные механизмы псориаза. Вестник дерматологии и венерологии. 2010. № 1. С. 35–47.
- Кубанова А. А., Катунина О. Р. Иммуноморфология и морфогенез очагов пораженной кожи при псориазе. Вестник дерматологии и венерологии. 2010. № 1. С. 70–79.
- Кунгуров Н.В., Кохан М.М., Кениксфест Ю.В. Биологическая терапия больных тяжелыми формами псориаза. Вестник дерматологии и венерологии. 2012. № 4. С. 91–95.
- Кутасевич Я. Ф., Маштакова І. О. Оптимізація зовнішньої терапії псоріазу з урахуванням клінічної стадії та ступеня тяжкості; методичні рекомендації. К., 2010. 20 с.
- Кутасевич Я.Ф., Олейник И.А., Гаврилюк А.А. Показатели метаболитов оксида азота у больных тяжёлыми формами псориаза. Дерматологія та венерологія. 2014. № 3. С. 80–81.
- Кутасевич Я.Ф., Олійник І.О. Особливості лікування псоріатичної хвороби на сучасному етапі. Клін. імунологія. Алергол. Інфектол. Спецвип. 2011. № 1. С. 31–36.
- Куц Л.В. Сучасні аспекти «нейрогенного» компоненту запалення при псоріазі. Вісник проблем біології і медицини: науково-практичний журнал. 2012. Т. 2, № 4. С. 96–98.
- Макуріна Г. І., Федотов В. П., Візір В. А. Гендерні особливості епідеміології та клініки псоріазу з супутньою артеріальною гіпертензією. Запорожский медицинский журнал. 2015. № 5 (92). С. 28–32.
- Мамманов А.М., Бабабекова Н.Б., Хаитов К.Н. Иммунологичекие и клинические особенноститечения псориаза у детей. Врач-аспирант. 2011. № 4 (47). 2011. С. 667–675.
- Маштакова І.О. Випадок генералізованого пустульозного псоріазу. Дерматологія та венерологія. 2014. № 3 (65). С. 64–66.
- Наказ МОЗ України № 312 від 08.05.2009 р. «Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання». К. : МОЗ України, 2009.
- Наказ МОЗ України №422 від 19.11.2002 р. «Про подальший розвиток клінічної імунології в Україні». К. : МОЗ України, 2002. 22 с.
- Нечипоренко Н.М. Клінічна ефективність застосування препарату «Аєвіт» у комплексному лікуванні шкірних захворювань. Український журнал дерматології, венерології, косметології. 2015. № 4 (59). С. 66–72.
- Пат. на корисну модель 13132 UA, МПК C12N9/06, G01N33/52, C12Q1/26. Спосіб визначення активності ферменту NO-синтази в гомогенатах тканин / Ю.М. Колесник, І.Ф. Бєленічев, А.В. Абрамов та ін.; заявник і патентовласник Запорізький державний медичний університет. № u200509119; заявл. 27.09.05; опубл. 15.03.06, Бюл. № 3.
- Повханич-Грицяк Т.М. Вплив генетичного поліморфізму на перебіг псоріазу. Український журнал дерматології, венерології, косметології. 2015. № 1 (56). С. 33–39.
- Практичний погляд на застосування топічних глюкокортикостероїдів для лікування стероїдчутливих дерматозів / К. В. Семенуха, О. В. Горбенко, О. А. Ковальська та ін. Український журнал дерматології, венерології, косметології. 2010. № 3 (38). С. 71–76.
- Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання [електронний ресурс] і [дод. до наказа МОЗ №312 від 08.05.2009]. Стандарти надання медичної допомоги в України / МОЗ України. К., 2009. URL: http://www.moz.gov.ua/ua/portal/dn20090508312.html.
- Про затвердження клінічних протоколів надання медичної допомоги хворим з імунними захворюваннями [електронний ресурс] і [дод. до наказа МОЗ №626 від 08.10.2007]. Стандарти надання медичної допомоги в України / МОЗ України. К., 2007. URL: http://www.moz.gov.ua/ua/portal/dn 20071008 626.html.
- Прохоров Д.В., Гуменюк Л.Н., Ольшевская Н.С. Анализ некоторых личностных характеристик. Український журнал дерматології, венерології, косметології. 2013. № 1 (48). С. 50–52.
- Проценко О.А., Богатырева И.Н., Заблоцкая А.Г. Особенности клиники и лечения псориаза на фоне хронической вирусной инфекции. Український журнал дерматології, венерології, косметології. 2013. № 4 (51). С. 141–145.
- Псориаз / В. И. Степаненко, О. О. Сызон, Н. М. Шупенько и др. Дерматология, венерология: [учебник / под ред. В. И. Степаненко]. К. : КИМ, 2012. – С. 167–197.
- Псориаз. Дифференциальная диагностика. Принципы лечения / В.А. Пирятинская, Л.А. Карякина, А.Б. Пирятинская и др. Клиническая дерматология и венерология. 2011. № 1. С. 83–90.
- Резніченко Н.Ю. Діагностика, лікування та профілактика псоріатичної хвороби у чоловіків у віковому аспекті. Запоріжжя : Просвіта, 2014. 308 с.
- Резніченко Н.Ю. Стан симпатоадреналової та ваго-інсулярної систем у чоловіків зрілого віку, хворих на псоріаз. Biomedical and Biosocial Anthropology. 2013. № 20. С. 135–138.
- Резніченко Н.Ю. Сучасні підходи до лікування чоловіків, хворих на псоріаз з урахуванням особливостей гормонального статусу. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2016. № 1–2 (36). С. 21–27.
- Роль интерлейкинов в патогенезе псориаза / B.В. Соболев, Н.Л. Стародубцева, А.Г. Соболева и др. Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. 2010. Т. 5, № 5. С. 79–84.
- Романенко И.М., Кулага В.В., Афонин С.Л. Лечение кожных и венерических болезней. Руководство для врачей: В 2 т. М. : ООО «Медицинское информационное агентство», 2006. Т. 2. С. 576–603.
- Рудакова А. В., Кубанов А. А. Фармакоэкономические аспекты терапии псориаза биологическими препаратами. Вестник дерматологии и венерологии. 2012. № 2. С. 26–31.
- Сизон О.О. Артропатичний псоріаз з урахуванням сучасних даних з патогенезу та особливостей клінічного перебігу дерматозу. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2016. № 1–2 (36). С. 13–20.
- Сизон О.О. Артропатичний псоріаз: особливості патогенезу та клінічного перебігу. Український журнал дерматології, венерології, косметології. 2017. № 3 (66). С. 38–43.
- Сизон О.О. Комплексний підхід до діагностики хворих на артропатичний псоріаз. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2014. № 1–2 (32). С. 55–60.
- Сизон О.О. Характеристика змін деяких показників клініко-лабораторного обстеження хворих при артропатичному псоріазі. Львів. мед. часопис. 2014. Т. 10, № 3–4. – С.56–60.
- Сизон О.О., Степаненко В.І. Роль стрес-систем у розвитку артропатичного псоріазу. Український журнал дерматології, венерології, косметології. 2013. № 1 (48). С. 33–43.
- Скрипкин Ю.К., Кубанова А.А., Акимов В.Г. Кожные и венерические болезни. М. : ГЭОТАР-Медиа, 2012. 544 с.
- Содержание Т-регуляторных клеток в периферической крови больных псориазом / В.Р. Хайрутдинов, Л.С. Яковлева, А.В. Апчел и др. Вестник Российской военно-медицинской академии. 2012. № 1. С. 71–75.
- Солошенко Е.М., Жукова Н.В., Стулій О.М. Сучасні підходи до терапії хворих на розповсюджений псоріаз з урахуванням індикаторних показників метаболічних процесів. Дерматологія та венерологія. 2012. № 3. С. 86–93.
- Степаненко Р. Л. Патогенетична роль імунних факторів у формуванні запального процесу при псоріазі. Укр. журнал дерматол., венерол., косметол. 2013. № 4 (51). С. 84–92.
- Степаненко Р.Л. Дослідження показників цитокінового профілю імунного статусу організму (ФНП-α, ІЛ-17, ІЛ-23) хворих на псоріаз та визначення їхньої ролі у патогенезі цього дерматозу. Український журнал дерматології, венерології, косметології. 2016. № 1 (60). С. 26–29.
- Степаненко Р.Л. Значення кількості CD68-макрофагів у шкірі хворих на псоріаз для прогнозування термінів ремісії дерматозу. Український журнал дерматології, венерології, косметології. 2015. № 4 (59). С. 39–43.
- Степаненко Р.Л. Патогенетична роль імунних факторів у формуванні запального процесу при псоріазі. Український журнал дерматології, венерології, косметології. 2013. № 4 (51). С. 84–92.
- Степаненко Р.Л. Стан показників імунної системи організму у хворих на псоріаз у динаміці лікування. Український журнал дерматології, венерології, косметології. 2017. № 2 (65). С. 15–21.
- Степаненко Р.Л., Свирид С.Г. Дослідження значення імуногістохімічної експресії толл-подібних рецепторів та мікробного компонента в шкірі в патогенезі псоріазу. Український журнал дерматології, венерології, косметології. 2016. № 4 (63). С. 13–19.
- Терлецкий О. В. Психологическая характеристика и терапия больных псориазом. Вестник психотерапии. 2011. № 39 (44). С. 28–38.
- Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги. Псоріаз, включаючи псоріатичні артропатії. К., 2015. 54 с.
- Федоренко О.Є. Клінічний досвід терапії псоріазу. Український журнал дерматології, венерології, косметології. 2012. № 1 (44). С. 59–62.
- Федотов В.П. Актуальные проблемы кандидоза (размышления миколога-дерматовенеролога – по данным литературы и собственных исследований). Дерматовенерология. Косметология. Сексопатология. 2012. № 1–4. С. 103–127.
- Федотов В.П., Веретельник К.А., Корецкая Е.Ю. Новые подходы к диагностике и терапии микозов, как осложняющего фактора при ряде дерматозов. Дальневосточный вестник дерматовенерологии, косметологии и пластической хирургии. 2013. № 1 (13). С. 9–14.
- Федотов В.П., Визир В.А., Макурина Г.И. Особенности иммунорегуляторных процессов у больных псориазом в сочетании с гипертонической болезнью. Український журнал дерматології, венерології, косметології. 2015. № 3 (58). С. 18–21.
- Филимонкова Н. Н., Кащеева Я.В., Чуверова К.А. Дерматотропные средства в комплексной терапии псориаза. Клиническая дерматология и венерология. 2010. № 1. С. 35–38.
- Хрущ В.И. Оптимизация наружной терапии мокнущих форм микоза стоп. Український журнал дерматології, венерології, косметології. 2015. № 1 (56). С. 66–70.
- Цепколенко Г.В. Імунна система і регенеративний потенціал шкіри. Дерматологія та венерологія. 2017. № 3 (77). С. 27–37.
- Цераидис Г.С., Бавыкина Е.В. Вегетативная нервная система, энергетическое и пластическое обеспечение кожи при псориазе. Вестн. дермат. и венер. 1974. № 12. С. 14–18.
- Яссер Халед Карим Масадех. Особенности экспрессии CD68 макрофагов в коже и слизистой 12-перстной кишки у больных псориазом, ассоциированным с глютеновой энтеропатией. Дерматовенерология. Косметология. Сексопатология. 2014. № 1–4. С. 26–29.
- A review of phototherapy protocols for psoriasis treatment / W.A. Lapolla, B.A. Bagel J., C.R. Halvorson, S.R. Feldman. J. Am. Acad. Dermatol. 2011. Vol. 64, Iss. 5. P. 936–949.
- A subpopulation of СD 163-positive macrophages is classically activated in psoriasis / J. Fuentes-Duculan, M. Suarez-FarTas, F. C. Zaba et al. Journal of Investigative Dermatology. 2010. Vol. 130, Iss. 10. P. 2412–2422.
- Alcohol consumption and psoriasis: a systematic literature review / E. Brenaut, C. Horreau, C. Pouplard et al. J. Eur. Acad. Dermatol. Venereol. 2013. Vol. 27. P. 30–35.
- Al-Hoquail I. A. Personalized medicine in psoriasis: concept and applications. Current Vascular Pharmacology. 2010. Vol. 8, Iss. 3. P. 432–436.
- Alsufyani M.A., Golant A.K., Lepwohl M. Psoriasis and the metabolic syndrome. Dermatol. Therapy. 2010. Vol. 23, Iss. 2. P. 137–143.
- Ashbee H. R., Bignell E. M. Pathogenic Yeasts (The Yeast Handbook). Springer, 2009. 365 p.
- Baker H. Psoriasis – clinical features. Br. Med. J. 1994. Vol. 3. P. 231–233.
- Berth-Jones J. Psoriasis. Medicine. 2013. Vol. 46, Iss. 6. P. 334–340.
- Bluett J., Barton A. What have genome-wide studies told us about psoriatic arthritis?. Curr. Rheumatol. Rep. 2012. Vol. 14. P. 364–368.
- Cafarchia C., Otranto D. The pathogenesis of Malassezia yeasts. Parassitologia. 2008. Vol. 50, Iss. 1–2. P. 65–67.
- Cai Y., Fleming C., Yan J. New insights of T cells in the pathogenesis of psoriasis. Cellular & Molecular Immunology. 2012. Vol. 9, Iss. 4. P. 302–311.
- Circulating Thl7, Th22 and Thl cells are increased in psoriasis / S. Kagami, H. L. Rizzo, J. J. Ice et al. J. Invest. Dermatol. 2010. Vol. 130. P. 1373–1383.
- Clark L., Lebwohl M. The effect of weight on the efficacy of biologic therapy in patients with psoriasis. J. Am. Acad. Dermatol. 2008. Vol. 58. P. 443–446.
- Conrad C., Meller S., Gilliet M. Plasmacytoid dendritic cells in the skin: to sense or not to sense nucleic acids. Semin. Immunol. 2009. Vol. 21. P. 101–109.
- Cutaneous immunosurveillance by self-renewing dermal gammadelta T cells / N. Sumaria, B. Roediger, L.G. Ng et al. J. Exp. Med. 2011. Vol. 208. P. 505–518.
- Cytokines and anticytokines in psoriasis / A.T. Pietrzak, A. Zalewska, G. Chodorowska et al. Clin. Chim. Acta. 2008. Vol. 394, Iss. 1–2. P. 7–21.
- Das R. P., Jain A. R., Ramesh V. Current concepts in the pathogenesis of psoriasis. Indian J. Dermatol. 2009. Vol. 54. P. 7–12.
- DiMeglio P., Westle F. O. The role of IL-23 in the immunopathogenesis of psoriasis. F1000 Biology Reports. 2010. Vol. 2. P. 40.
- Discovery and structure-activity study of a novel benzoxaborole anti-inflammatory agent (an2728) for the potential topical treatment of psoriasis and atopic dermatitis / T. Akama, S. J. Baker, Y. K. Zhang et al. Bioorganic & Medicinal Chemistry Letters. 2009. Vol. 19, Iss. 8. P. 2129–2132.
- Efficacy and safety of adalimumab across subgroups of patients with moderate to severe psoriasis / A. Menter, К. B. Gordon, C. L. Leonardi et al. J. Am. Acad. Dermatol. 2010. Vol. 63. P. 448–456.
- Elevation of serum epidermal growth factor and interleleukin 1 receptor in active psoriasis vulgaris / K.S. Anderson, S. Petersson, J. Weg et al. Brit. J. Dermatol. 2010. Vol. 163, Iss. 5. P. 1085–1089.
- Evaluation of psoriatic patients with HCV infection / M. D. Howell, R. L. Gallo, M. Boguniewicz et al. J. Dermatol. 2005. Vol. 32, Iss. 9. P. 769–770.
- Expression of p 53 in lesions and unaffected skin of patients with plaque-type / A.C. Yazici, F.F. Karabulut, O. Ozen et al. J. Dermatol. 2007. Vol. 34. Iss. 6. P. 367–374.
- Expression of the FOSL1 gene in psoriasis and atherosclerosis / V. V. Sobolev, A. D. Zolotarenko, A. G. Soboleva et al. Russian Journal of Genetics. 2010. Vol. 46, Iss. 1. P. 93–98.
- Expression of Thl and Th2 cytokine-associated transcription factors, T-bet and GATA-3, in peripherial blood mononuclear cells and skin lesions of patients with psoriasis vulgaris / K. Zhu, J. Ye, M. Wu, H. Cheng. Arch Dermatol. Res. 2010. Vol. 302. P. 517–523.
- Fay N.S., Larson E.S., Jameson J.M. Chronic Inflammation and γδ T Cells. Front Immunol. 2016. Vol. 7. P. 210.
- Foxp 3+ regulatory T cells and related cytokines differentially expressed in plaque vs guttate psoriasis vulgaris / K.X. Yan, X. Fang, L. Han et al. Brit. J. Dermatol. 2010. Vol. 163. P. 48–56.
- Frequency of bacteria, Candida and malassezia species in balanopostitis / M. Alsterholm, I. Flytsrom, R. Leifsdottir et al. Acta Derm. Venerol. 2008. Vol. 88, Iss. 4. P. 331–336.
- Fry L., Baker B. S. Triggering psoriasis: the role of infections and medications. Clin. Dermatol. 2007. Vol. 25, Iss. 6. P. 606–615.
- Gender aspects in skin diseases / W. Chen, M. Mempel, C.Traidl-Hofmann et al. J. Eur. Acad. Dermatol. Venereol. 2010. Vol. 24. P. 1378–1385.
- Gender difference in disease expression, radiographic damage and disability among patients with psoriatic arthritis / L. Eder, A. Thavaneswaran, V. Chandran et al. Ann Rheum Dis. 2013. Vol. 72. P. 578–582.
- Gender medicine and psoriasis / D. Colombo, N. Cassano, G. Bellia, G.A. Vena. World J. Dermatol. 2014. Vol. 3, Iss. 3. P. 36–44.
- Giacomoni P.U., Mammone T., Teri M. Gender-linked differences in human skin. J. Dermatol. Sci. 2009. Vol. 55. P. 144–149.
- Gorhik H.L., Creager M.A. Arginine and endothelial and vascular health. J. Nutz. 2004. Vol. 134. P. 2880–2887.
- Halliwell B., Gutteridge J. Free radicals in biology and medicine. NY : Oxford Univ. Press, 1999. 320 p.
- Heidenreich R., Röcken M., Ghoreschi K. Angiogenesis: the new potential target for the therapy of psoriasis?. Drug News and Perspectives. 2008. Vol. 21, Iss. 2. P. 97–105.
- IL-22 producing T22 T cell account for upregulated IL22 in atopic dermatitis despite reduced IL17-produced IL-17 producing T(H) 17 T cells / H. E. Wograles, L. C. Zaba, A. Shemer et al. J. Allergy Clin. Immunol. 2009. Vol. 123. P. 1244–1252.
- Integrated network analysis of transcriptomic and proteomic data in psoriasis / E. Pimzian, S. Bruskin, A. Ishkin et al. BMC Systems Biology. 2010. Vol. 4, Iss. 1. P. 41.
- Interleukin-22, a T (H) 17 cytokine, mediates IL-23 – induced. Dermal inflammation and acantosis / Y. Zheng, D. M. Danilenteo, P. Valdez et al. Nature. 2007. Vol. 445. P. 648–651.
- Ionov I. D. Self-sustaining pathological processes in skin psoriasis. Medical Hypotheses. 2009. Vol. 72, Iss. 2. P. 171–173.
- Julien D. Pathogenesis of psoriasis. Ann. Dermatol. Venereol. 2012. Vol. 139, Suppl. 2. P. 68–72.
- Kalayciyan A., Aydemir E. H., Kotogyan A. Experimental Koebner phenomenon in patients with psoriasis. Dermatology. 2007. Vol. 215, Iss. 2. P. 114–117.
- Kashem S.W., Hannifa M., Kaplan D.H. Antigen-Presenting Cells. Annu Rev Immunol. 2017. Vol. 35. P. 197–216.
- Khaitov K., Mannanov A., Turakhodjaeva F. Clinical analysis of psoriasis course in children. Medical Health and Science Journal. 2010. Vol. 1, Iss. 1. P. 48–50.
- Krueger J. G. Hiding under the skin: a welcome surprise in psoriasis. Nat. Med. 2012. Vol. 18. P. 1750–1751.
- Kvetnansky R., Aguilera G., Goldstein D. Stress, Neurotransmitters and Hormones. Neuroendocrine and Genetic Mechanism. Annals of the New York Academy of Sciences. 2008. Vol. 109. P. 450–456.
- Lima E.A., Lima M.A. Reviewing concepts in the immunopathogenesis of psoriasis. An. Bras. Dermatol. 2011. Vol. 86, Iss. 6. P. 1151–1158.
- Lowes M. A., Bowcock A. M., Krueger J. G. Pathogenesis and therapy of psoriasis. Nature. 2007. Vol. 445, Iss. 7130. P. 866–887.
- Malassezia and the Skin – Science and Clinician Practice / T. Boekhout, E. Gueho-Kellermann, P. Mayser, A. Velegraki. Springer, 2010. 250 p.
- Malassezia furfur colonising therespiration tract of mechanically ventillated neonates / A. W. Flemmer, E. Yilmaz, R. Mittal et al. Z. Geburtshife Neomatol. 2008. Vol. 212, Iss. 1. P. 22–26.
- Mansouri B., Patel M., Mentez A. Biological therapies for psoriasis. Exp. Opin. Biol. Therapy. 2013. Vol. 13, Iss. 12. P. 1715–1730.
- MDP and other muropeptides – direct and synergistic effects on the immune system / S. Traub, S. von Aulock, T. Hartung, C. Hermann J. Endotoxin Res. 2006. Vol. 12, Iss. 2. P. 69–85.
- Mesenchymal stromal cells impair the differentiationof CD14(++) CD16(-) CD64(+) classical monocytes into CD14(++) CD16(+) CD64(++) activate monocytes [Text] / B. Du Rocher , A.L. Mencalha, B.E. Gomes, E. Abdelhay. Cytotherapy. 2012. Vol. 14, Iss. 1. – P. 119–128.
- Miossec P., Korn T., Kuchroo V. Interleukin-17 and type 17 helper T-cell. N. Engl. J. Med. 2009. Vol. 361. P. 888–898.
- Modifiable lifestyle factors associated with metabolic syndrome in patients with psoriasis / J. Ahdout, J. Kotlerman, D. Elashoff et al. Clin. Exp. Dermatol. 2012. Vol. 37. P. 477–483.
- More than skin deep: atherosclerosis as a systemic manifestation of psoriasis / A. B. Alexandroff, M. Pauriah, C. C. Lang et al. British Journal of Dermatology. 2009. Vol. 161, Iss. l. P. 1–7.
- Nature of cell kinetics in psoriatic epydermis / F.K. Doger, E. Dikicioglu, F. Ergin et al. J. Cutan. Pathol. 2007. Vol. 34, Iss. 3. P. 257–263.
- Nestle F. O., Kaplan D. H., Barker J. N. Psoriasis. N. Engl. J. Med. 2009. Vol. 361. P. 496–509.
- Nograles К. E., Davidovici B., Krueger J. G. New insights in the immunologic basis of psoriasis. Semin Cutan Med Surg. 2010. Vol. 29. P. 3–9.
- Pattern recognition receptors in infectious skin diseases / H.D. de Koning, A. Simon, P.L. Zeeuwen, J. Schalkwijk. Microbes and infections. 2012; Vol. 14, Iss. 11. P. 881–893.
- Pennell L. M., Galligan C. L., Fish E. N. Sex affects immunity. J. Autoimmun. 2012. Vol. 38. P. 282–291.
- Pharmacodynamics of TNF-inhibitors in psoriasis (Review) / T. Vergan, A.E. Moustou, P. Sfikakis et al. Expert Review of Clinical Pharmacology. 2011. Vol. 4, Iss. 4. P. 515–538.
- Plasmacytoid dendritic cells: a new cutaneals dendritic cell subset with distinet role in inflamatory skin diseases / A. Wollenberg, M. Wagner, S. Gunther et al. J. Invest. Dermatol. 2002. Vol. 119. P. 1096–1102.
- Psoriasis and serum lipid abnormalities / A. Pietrzak, G. Chodorowska, D. Krasowska et al. Dermatologic Therapy. 2010. Vol. 23, Iss. 2. P. 160–173.
- Psoriasis: dysregulation of innate immunity / J. D. Bos, M. A. De Rie, M. B. Teunissen, G. Piskin. Br. J. Dermatol. 2005. Vol. 152. P. 1098–1107.
- Psychological treatment of depression: Results of a series of meta-analyses / P. Cuijpers, G. Andersson, T. Donker, A. van Straten. Nordic Journal of Psychiatry. 2011. Vol. 65, Iss. 6. P. 354–364.
- Raho G., Vena R.G., Bizzoca A. Influence of infliximab on kératinocyte apoptosis in psoriasis patients. Immunopharmacology & Immunotoxicology. 2011. Vol. 33, Iss. 1. P. 227–258.
- Review: Skin and the Immune System / E.R. Mann, K.M. Smith, D. Bernardo et al. J. Clin. Exp. Dermatol. Res. 2012. S:2:003. doi: 10.4172/2155-955. S2-003.
- Rodriguez-Crespo I., Gerber N.C., Ortiz de Montellano P.R. Endothelial nitric-oxide synthase expression in Escherichia coli, spectroscopic characterization, and role of tetrahydrobiopterin in dimer formation. J. Biol. Chem. 1996. Vol. 271. P. 11462–11467.
- Sarah E.C., Doud K., Korman N.J. Comorbidities of psoriasis. Exp. Rev. Dermatol. 2013. Vol. 8, Iss. 3. P. 277–290.
- Schafer T. Epidemiology of psoriasis. Review and the German perspective. Dermatology. 2006. Vol. 212, Iss. 4. P. 327–337.
- Setty A. R., Curhan G., Choi H. K. Obesity, waist circumference, weight change, and the risk of psoriasis in women: Nurses’Health Study II. Arch. Int. Med. 2007. Vol. 167. P. 1670–1675.
- Sheehan D.V. The Anxiety Disease. New York : Charles Scribner & Sons, 1983. 151 p.
- Straub R. H. The complex role of estrogens in inflammation. Endocr. Rev. 2007. Vol. 28. P. 521–574.
- Sugiyama H., Gyulai R., Toichi E. Dysfunctional blood and target tissue CD4+CD25+high regulatory T cell in psoriasis: mechanism underlying urrestrained pathogenic effector T cell proliferation. J. Immunol. 2005. Vol. 174. P. 164–173.
- The pathogenic role of tissue-resident immune cells in psoriasis / O. Boyman, C. Conrad, G. Tonel et al. Trends Immunol. 2007. Vol. 28, Iss. 2. P. 51–57.
- The psychosocial burden of psoriasis / A. B. Kimball, C. Jacobson, S. Weiss et al. Am. J. Clin. Dermatol. 2005. Vol. 6. P. 383–392.
- The risk of stroke in patients with psoriasis / J. Gelfand, E. Dommasch, D.B. Shin et al. Invest. Dermatol. 2009. Vol. 129. P. 2411–2418.
- The roles of cells and cytokines in the pathogenesis of psoriasis. [Review] / S. Coimbra, A. Figueiredo, E. Castro et al. International Journal of Dermatology. 2012. Vol. 51, Iss. 4. P. 389–484.
- Transcription factor AP-1 components as psoriasis candidate genes / E. S. Piruzian, T. A. Nikolskaya, S. A. Brouskin, R. M. Abdeev. Molecular Biology. 2007. Vol. 41, Iss. 6. P. 974–985.
- Veale D.J., Ritchlin C., FitzGerald O. Immunopathology of psoriasis and psoriatic arthritis. Ann. Rheum. Dis. 2005. Vol. 64. P. 26–29.
- Vitamin D analog calcipotriol suppresses the Thl7 cytokine- induced proinflammatory SI00 “alarmins” psoriasin (S100A7) and koebnerisin (S100A15) in psoriasis / Z. Hegyi, S. Zwicker, D. Bureik et al. J. Invest. Dermatol. 2012. Vol. 132, Iss.. 5. P. 1416–1440.
- Weisenseel P., Laumbacher B., Besgen P. Streptococcal infection distinguishes different types of psoriasis. J. Med. Genet. 2002. Vol. 39, Iss. 10. P. 767–768.
- Zaba L. C., Fuentes-Duculan J., Eungdamrong N. J. Psoriasis is Characterized by Accumulation of Immunostimulatory and Thl/Thl7 Cell-Polarizing Myeloid Dendritic Cells. J. Invest Dermatol. 2009. Vol. 129, Iss. l. P. 79–88.
- Zalewska A., Pietrzak A. Cytokines in psoriasis. Giomale Italiano di Dermatologia e Venereologia. 2007. Vol. 142, Iss. 5. P. 449–466.
- Zibert J. R., Skov L., Thyssen J. P. Significance of the S100A4 protein in psoriasis. J. Invest. Dermatol. 2010. Vol. 130, Iss. l. P. 150–160.
- Zivkovich A. H., Feldman S. R. Are ointments better than other vehicles for corticosteroid treatment of psoriasis?. J. Drugs Dermatol. 2009. Vol. 8. P. 570–572.
- Zung W.W.K. A Self-rating Depression Scale. Arch Gen Psychiatry. 1965. Vol. 12, Iss. 1. P. 63–70.
ДОДАТОК А АКТИ ВПРОВАДЖЕННЯ






ДОДАТОК Б СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА ЗА ТЕМОЮ ДИСЕРТАЦІЇ ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ РЕЗУЛЬТАТІВ ДИСЕРТАЦІЇ
- Веретельник К.А. Новые наружные средства в терапии псориатической болезни, осложнённой малассезиозом кожи. Дерматовенерология. Косметология. Сексопатология. 2013. № 1–4. С. 188–190.
- Веретельник К.А. Современные подходы к топической терапии малассезиоза кожи. Дерматовенерология. Косметология. Сексопатология. 2014. № 1–4. С. 212–214.
- Веретельник К.А. Применение антигистаминного препарата «Фексофаст–180» в комплексном лечении псориатической болезни, осложнённой малассезиозом кожи. Дерматовенерология. Косметология. Сексопатология. 2015. № 3–4. С. 209–211.
- Веретельник К.О. Імунний статус у хворих па псоріаз із супутньою маласезійною інфекцією. Запорізький медичний журнал. 2017. Т. 19, № 3. С. 363–368.
- Веретельник К.А., Федотов В.П. Состояние вегетативной нервной системы у больных псориазом, осложнённым малассезиозом кожи. Дерматовенерология. Косметология. Сексопатология. 2016. № 1–4. С. 243–245.
- Веретельник К.А. Новые методы иммунокоррекции у больных псориазом с сопутствующим малассезиозом. Дерматовенерология. Косметология. Сексопатология. 2017. № 1–2 (5). С. 47–50.
- Веретельник К.О. Показники ендогенної інтоксикації та метаболізму NO у хворих на псоріаз с супутнім маласезіозом інфекцією. Сучасні медичні технології. 2017. № 3. С. 58–63.
- Федотов В.П., Веретельник К.А., Корецкая Е.Ю. Новые подходы к диагностике и терапии микозов, как осложняющего фактора при ряде дерматозов. Дальневосточный вестник дерматовенерологии, косметологии и пластической хирургии. 2013. № 1 (13). С. 9–14.
- Веретельник К.А., Корецкая Е.Ю. Современное понимание и подходы к диагностике и терапии микозов, как осложняющего фактора при ряде дерматозов. Сборник научных трудов, посвящённый 90-летию со дня рождения профессора Б.А. Задорожного «Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции». Харьков, 2013. С. 64–75.
- Веретельник К.О. Сучасна топічна терапія псоріатичної хвороби, ускладненої маласезіозом шкіри. Збірка тез доповідей II Регіональної науково-практичної конференції студентiв, аспірантiв та молодих вчених «Актуальні проблеми та перспективи розвитку медичних, фармацевтичних та природних наук – 2013», м. Запоріжжя, 21 грудня 2013 р. Запоріжжя, 2013. С. 61.
- Веретельник К.А. Обоснование комплексного лечения больных псориазом с сопутствующим малассезиозом кожи. Материалы научной конференции, посвящённой 125-летию со дня рождения профессора И.С. Попова «Актуальные вопросы дерматологии и ВИЧ/СПИД инфекции». Харьков, 2016. С. 35–39.
- Веретельник К.О. Нові підходи до комплексної терапії хворих на псоріаз із супутнім маласезіозом шкіри. Збірник тез ІІ Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання косметології та дерматології», м. Запоріжжя, 28–29 квітня 2017 р. Запоріжжя, 2017. С. 8–9.
- Веретельник К.О., Федотов В.П. Оптимізація комплексної диференційованої терапії хворих на псоріаз із супутньою маласезійною інфекцією. Матеріали науково-практичної конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», 10–11 листопада 2017 р., м. Харків. Дерматологія та венерологія. 2017. № 3. С. 96–97.
Відомості про апробацію результатів дисертації:
1. Науково-практична конференція з міжнародною участю «Актуальні проблеми дерматовенерології», присвячена 90-річчю з дня народження професора Б.А. Задорожного, м. Харків, 18 червня 2013 р., усна доповідь: Веретельник К.О. «Современное понимание и подходы к диагностике и терапии микозов, как осложняющего фактора при ряде дерматозов».
2. IХ Всеукраїнська науково-практична конференція з міжнародною участю «Актуальні питання косметології та дерматології», м. Запоріжжя, 23-24 квітня 2015 р., усна доповідь: Веретельник К.О. «Сучасні підходи до лікування псоріатичної хвороби».
3. 24th EADV Congress, Copengagen (Denmark), October 7-11, 2015. Veretelnyk K.O. «Treatment of mycotic infection in patients suffering from psoriasis».
4. Науково-практична конференція з міжнародною участю «Актуальні проблеми дерматології, венерології та ВІЛ/СНІД-інфекції», присвяченої 155-річчю професора Тіпцева М.В., м. Харків, 18 листопада 2015 р., усна доповідь: Веретельник К.А. «Комбинированный препарат наружного действия в комплексном лечении псориатической болезни, осложнённой малассезиозом кожи».
5. ХI Всеукраїнська науково-практична конференція з міжнародною участю «Актуальні питання косметології та дерматології», м. Запоріжжя, 28–29 квітня 2017 р., усна доповідь: Веретельник К.О. «Нові підходи до комплексної терапії хворих на псоріаз із супутнім маласезіозом шкіри».
