Міністерство охорони здоров’я України
Запорізький державний медичний університет
На правах рукопису
Василенко Анна Василівна
УДК 616-53-002.282-036.87-092-07-037-084/-085
ОПТИМІЗАЦІЯ ТЕРАПІЇ, ПРОГНОЗУВАННЯ І ПРОФІЛАКТИКИ РЕЦИДИВІВ РОЗАЦЕА З УРАХУВАННЯМ ПОРУШЕНЬ МІКРОБІОЦЕНОЗУ ШКІРИ, ІМУНІТЕТУ, ВЕГЕТАТИВНОЇ РЕГУЛЯЦІЇ ТА ПСИХОЕМОЦІЙНОГО СТАНУ
14.01.20 – шкірні та венеричні хвороби
Дисертація на здобуття наукового ступеня
кандидата медичних наук
Науковий керівник:
Федотов Валерій Павлович
доктор медичних наук,
професор
Запоріжжя – 2015
ЗМІСТ
| Перелік умовних позначень | 4 |
| Вступ | 5 |
| Розділ 1 Огляд літератури | 11 |
| 1.1 Сучасний погляд на етіологію та патогенез розацеа | 11 |
| 1.2 Прояви та діагностика розацеа | 23 |
| 1.3 Методи лікування розацеа | 28 |
| Розділ 2 Матеріали та методи дослідження | 37 |
| 2.1 Матеріали дослідження | 37 |
| 2.2 Загальні клініко-лабораторні дослідження | 38 |
| 2.3 Біохімічні дослідження | 40 |
| 2.4 Методика дослідження на наявність Demodex folliculorum | 41 |
| 2.5 Методика мікроскопічного та культурального дослідження мікрофлори уражених ділянок шкіри | 42 |
| 2.6 Імунологічні дослідження | 43 |
| 2.7 Методи дослідження психологічного статусу хворих | 45 |
| 2.8 Дослідження варіабельності серцевого ритму | 50 |
| 2.9 Статистична обробка отриманих результатів | 51 |
| Розділ 3 Клінічна характеристика хворих на розацеа | 52 |
| 3.1 Дані клінічних проявів, перебігу та загальних клініко-лабораторних досліджень | 52 |
| Розділ 4 Особливості патогенетичних порушень у хворих із рецидивом розацеа | 64 |
| 4.1 Показники біохімічного дослідження у хворих із рецидивом розацеа до лікування | 64 |
| 4.2 Мікробіоценоз ураженої шкіри у хворих при рецидиві розацеа | 64 |
| 4.3 Результати дослідження на Demodex folliculorum у хворих на розацеа | 68 |
| 4.4 Дослідження психологічного стану у хворих при рецидивах розацеа | 68 |
| 4.5 Стан вегетативної нервової регуляції у обстежених хворих до лікування | 70 |
| 4.6 Імунний статус обстежених хворих до лікування | 73 |
| 4.6.1 Аналіз дослідження функціональної активності фагоцитуючих клітин | 73 |
| 4.6.2 Результати дослідження основних популяцій та субпопуляцій лімфоцитів у досліджених хворих | 74 |
| 4.6.3 Дослідження гуморального імунітету (рівня імуноглобулінів крові) у хворих на розацеа | 76 |
| 4.6.4 Цитокіновий статус у досліджених хворих на розацеа | 77 |
| Розділ 5 Диференційовані показання до лікування і спосіб комплексної терапії хворих на розацеа. Профілактика та прогнозування рецидивів дерматозу | 83 |
| 5.1 Обґрунтування та розробка способу раціональної комплексної терапії хворих із рецидивом розацеа | 88 |
| 5.2 Клініко-лабораторна оцінка розробленої диференційованої комплексної терапії та порівняння її ефективності зі стандартними методами лікування | 100 |
| 5.3 Обґрунтування прогностичних критеріїв та розробка профілактичних заходів розвитку рецидивів розацеа | 110 |
| Розділ 6 Узагальнення результатів дослідження | 125 |
| Висновки | 128 |
| Список використаних джерел | 149 |
| Додаток А Акти впровадження | 142 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
АлАТ – аланінамінотрансфераза
АсАТ – аспартатамінотрансфераза
ВНС – вегетативна нервова система
ВСР – варіабельність серцевого ритму
ЕКГ – електрокардіограма
КУО – колонієутворюючі одиниці
ЛПВЩ – ліпопротеїди високої щільності
ЛПНЩ – ліпопротеїди низької щільності
НСТ-тест – нітросиній-тетразолієвий тест
УФО – ультрафіолетове опромінення
ФІ – фагоцитарний індекс
ФЧ – фагоцитарне число
ШДЗ – шкала депресії Зунге
ШОЕ – швидкість осідання еритроцитів
ШТГ – шкала тривоги Гамільтона
ШДОР – шкала діагностичної оцінки розацеа
Ig – імуноглобулін
ІL – інтерлейкін
VEGF – фактор росту судинного ендотелію
ВСТУП
Актуальність теми. Розацеа – одне з найбільш розповсюджених захворювань, що уражує від 10 до 20 % осіб у віці від 30 до 60 років [2, 34, 51, 68, 83]. Високий рівень захворюваності та зростання кількості хворих на дерматоз в останні десятиліття, збільшення частоти резистентних до терапії форм та виникнення рецидивів захворювання роблять цю проблему однією із найактуальніших.
Хвороба спричиняє відчутний дискомфорт для хворих, насамперед через естетичний дефект, тому що ураженню підлягає переважно шкіра обличчя [32, 105]. Торпідність перебігу, повільні позитивні зміни на краще під час проведення лікування, нетривалі ремісії, неефективне та витратне лікування, формування стійких спотворюючих косметичних дефектів, що супроводжують захворювання – усе це призводить до пригнічення настрою, спричиняє появу у хворих психоемоційного дистресу й погіршення якості життя [4, 50, 151].
За останні роки відомі вітчизняні та зарубіжні дослідники активно розглядали проблему розацеа, зокрема причини та механізми розвитку захворювання [110, 158]. Значне місце в патогенезі розацеа, який розглядається як ангіоневроз, посідали дослідження стану вегетативної нервової системи (ВНС). Особливе значення має вивчення при рецидивах також мікробіоти шкіри хворих, на яку впливають різноманітні екзо – та ендогенні фактори [5, 63, 101, 160]. Між тим робіт, присвячених вивченню при розацеа взаємозв’язків імунітету з клінічною формою та супутньою патологією [9, 28, 104, 169], мікробіоценозом шкіри, а також станом ВНС, недостатньо. У той же час, вплив на ці системи дозволив би здійснити диференційований підхід до лікування розацеа та їх рецидивів, прогнозування перебігу, контроль за ефективністю проведеної терапії [62, 82, 97].
Поліетіологічний характер захворювання, прогредієнтний перебіг, розвиток різноманітних імунних, алергічних запальних процесів, порушення функції ВНС ускладнюють перебіг розацеа, призводять до рецидивів дерматозу, що спонукає до пошуку нових варіантів у вирішенні питань оптимізації лікування [91, 87, 197]. Фактично, розробка нового ефективного методу комплексного науково обґрунтованого лікування, прогнозування та профілактики рецидивів розацеа набуває важливого медико-соціального значення [93, 161]. В той же час дотепер немає робіт із комплексного дослідження рецидивів розацеа, їх причин, прогнозування та здійснення диференційованого підходу до лікування і профілактики [8, 34, 59, 71, 112, 167].
Зв’язок роботи з науковими програмами, планами, темами. Робота є фрагментом комплексної науково-дослідної роботи Запорізького державного медичного університету: «Розробка методів терапії та профілактики рецидивів хронічних дерматозів та хвороб, що передаються статевим шляхом із урахуванням особливостей гомеостазу хворих та супутньої патології» (№ держреєстрації 0103U000800). Дисертантом особисто виконано фрагменти, присвячені вивченню патогенезу рецидивів розацеа, розробці та апробації методик діагностичних і прогностичних критеріїв, комплексного методу лікування та профілактики дерматозу.
Мета і задачі дослідження. Метою проведеного дослідження є підвищення ефективності комплексного лікування, прогнозування та профілактики рецидивів розацеа на підставі вивчення клінічних особливостей та перебігу дерматозу, психоемоційного статусу, стану ВНС, імунного статусу та мікробіоценозу шкіри хворих.
Для досягнення мети були поставлені наступні задачі:
1. Вивчити та проаналізувати особливості клінічних проявів та перебігу рецидивів розацеа, показники імунного статусу до і після лікування та його особливості при рецидивах розацеа.
2. Дослідити в динаміці психологічний статус та стан ВНС у хворих на розацеа та виявити їх особливості при рецидивах дерматозу.
3. Провести аналіз біохімічних показників, якісного та кількісного складу мікробіоти ураженої та здорової шкіри.
4. Розробити та обґрунтувати прогностичні критерії загострення дерматозу на підставі аналізу клінічних особливостей і перебігу рецидивів розацеа, а також лабораторних та функціональних досліджень.
5. Розробити й впровадити диференційовані показання та методику комплексної терапії хворих із рецидивами розацеа, оцінити найближчі та віддалені результати лікування та профілактики рецидивів дерматозу.
Об’єкт дослідження: розацеа.
Предмет дослідження: особливості клінічних проявів та перебігу рецидивів розацеа, показники мікробіоценозу шкіри, стану ВНС, психологічного статусу, імунної системи, результати лікування, прогнозування та профілактики рецидивів.
Методи дослідження:
1. Клінічні: з’ясування скарг, аналіз анамнезу, об’єктивних даних, постановка діагнозу, контроль ефективності лікування.
2. Загальні лабораторні обстеження: загальний аналіз крові та сечі, копрограма, серологічні та біохімічні дослідження.
3. Імунологічні дослідження.
4. Мікроскопічні та культуральні дослідження мікробіоти шкіри обличчя.
5. Психологічне анкетування.
6. Функціональне дослідження ВНС за допомогою електрокардіографа «Cardiolab».
7. Статистична обробка отриманих результатів.
Наукова новизна одержаних результатів. Вперше у хворих з рецидивами розацеа, на відміну від дебюту дерматозу, встановлено особливості психоемоційного статусу (помірна тривожність та деякі депресивні симптоми), зміни у ВНС при вивченні варіабельності серцевого ритму (ВРС) (зниження потужності основних часових та спектральних показників на фоні підвищення індексу вегетативного балансу в бік переважання симпатичної регуляції).
Вперше у хворих із рецидивом розацеа встановлено наукові дані про особливості мікробного пейзажу шкіри (збільшення патогенної флори на фоні значного дисбалансу та різкого зниження кількості непатогенних мікроорганізмів, інтенсивності колонізації проб шкіри, асоціацій мікроорганізмів) та імунного статусу (пригнічення функції фагоцитів, зниження рівня CD4+, CD8+, коефіцієнта CD4+/CD8+ на фоні збільшення вмісту CD16+ та CD22+, збільшення рівня імуноглобулінів (Ig) класів G та M і підвищення продукції інтерлейкінів (IL) -10 та -12).
Вперше розроблено методику прогнозування рецидивів розацеа на підставі результатів вивчення мікробіоценозу шкіри, імунного та вегетативного статусу в комплексі з клінічними особливостями дерматозу.
Науково обгрунтовано доцільність використання в комплексній терапії пацієнтів із рецидивами розацеа мебікару та есцину, які покращують у хворих психоемоційний стан та судинний тонус.
Практичне значення одержаних результатів. Розроблено та обґрунтовано комплекс показників: клінічних (суб’єктивних та об’єктивних), психологічних, функціональних та лабораторних (загальнолабораторних, показників біохімічного дослідження крові, імунологічних, якісно-кількісного складу мікробного пейзажу), застосування яких дозволяє прогнозувати рецидиви розацеа.
Розроблено комплексний метод лікування та профілактики рецидивів із застосуванням патогенетичних засобів (ангіопротектора, анксіолітика, гепатопротектора та імуномодулятора), що дозволяє, порівняно зі стандартними методами, скоротити терміни регресу клінічних ознак захворювання, значно зменшити частоту та ступінь проявів рецидивів захворювання (патент на корисну модель № 86374 UA від 25.12.2013).
Результати дослідження впроваджено в практику роботи Комунальної установи «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради, Комунальної установи «Одеський обласний шкірно-венерологічний диспансер», Комунальної установи Тернопільської обласної ради «Тернопільський обласний клінічний шкірно-венерологічний диспансер». Матеріали також використовуються в педагогічному процесі на кафедрі дерматології, венерології та медичної косметології Харківського національного медичного університету, на кафедрі дерматовенерології Вищого державного навчального закладу України „Буковинський державний медичний університет”, на кафедрі дерматовенерології та косметології з курсом дерматовенерології і естетичної медицини факультету післядипломної освіти Запорізького державного медичного університету.
Особистий внесок здобувача. Дисертантом разом із керівником визначено мету й завдання роботи. Самостійно здійснено аналіз літератури, клінічне обстеження та лікування 80 хворих на розацеа, більшість інструментальних та лабораторних досліджень до та після лікування різними методами, проведено облік та оцінку показників результатів обстеження, статистичну обробку даних, патентний пошук, підготовлено до друку наукові публікації, написано всі розділи дисертації, сформульовано основні положення, висновки. Розроблено оптимальний метод комплексного лікування хворих із рецидивами розацеа.
Автором спільно з О.Ю. Корецькою, Г.В. Пугач, А.В. Веретельником, А.В. Головкіним, Н.Ю. Резніченко (співробітниками Запорізького державного медичного університету), В.Є. Гладчуком (співробітником Донецького національного медичного університету ім. М. Горького), Д.В. Масло (співробітником Комунальної установи «Бердянський шкірно-венерологічний диспансер»), вивчено особливості змін мікробіоценозу ураженої шкіри при дерматозах. Дисертантом не були запозичені результати та ідеї співавторів публікацій.
Апробація результатів дисертації. Матеріали виконаної роботи обговорено на науково-практичних конференціях: «Сучасні аспекти медицини та фармації – 2011» (Запоріжжя, 2011), «Фармакологія: сучасні тенденції розвитку та ретроспектива» (Одеса, 2012), «Сучасні аспекти медицини та фармації – 2013» (Запоріжжя, 2013), «Актуальні проблеми дерматовенерології» (Харків, 2013), «Актуальні питання наукової і практичної косметології» (Запоріжжя, 2014), «Сучасні технології в рішенні організаційних, епідеміологічних, клінічних та діагностичних задач дерматовенерології» (Херсон, 2015), «Актуальні питання косметології та дерматології» (Запоріжжя, 2015), «Актуальні проблеми дерматології, венерології та ВІЛ/СНІД-інфекції» (Харків, 2015).
Публікації. За матеріалами дисертації опубліковано 17 друкованих праць, з них 7 (у моноавторстві) статей, у тому числі 5 статей у спеціалізованих наукових виданнях України, з яких 1 – у журналі, що входить до міжнародної наукометричної бази даних Google Scholar та Російський індекс наукового цитування, 2 статті у збірниках матеріалів наукової конференції; у 1 монографії 1 розділ, 8 тез доповідей у збірниках матеріалів наукових конференцій, 1 патент України на корисну модель.
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУРИ
1.1 Сучасний погляд на етіологію та патогенез розацеа
Розацеа (рожеві вугрі) посідає суттєве місце серед хронічних дерматозів людини і є однією з актуальних проблем сучасної дерматовенерології та косметології [14, 40, 142]. Встановлено, що питома вага цього захворювання досягає до 12 % від усіх хворих на дерматози [82, 111, 162]. Захворюваність розацеа посідає сьоме місце за частотою в патології шкіри. Пік захворюваності припадає на 40-50 років [83]. В умовах дерматологічного прийому лікар практично щодня зустрічаються з пацієнтами хворими на розацеа. За останні роки значно збільшилась кількість людей, які страждають на розацеа [96]. Наявність у цих пацієнтів супутньої соматичної патології (захворювання ендокринних залоз, шлунково-кишкового тракту та серцево-судинної системи), значно ускладнює перебіг шкірного процесу [36, 70]. Порушення імунітету, хімізація побуту, погіршення екологічної ситуації, проживання в геомагнітних зонах, використання в терапії різних захворювань великої кількості фармакологічних препаратів – усе це пояснює зростання інтересу фахівців різного профілю (дерматологів, гастроентерологів, невропатологів, ендокринологів) до цієї актуальної проблеми [130, 151]. Найчастіше на це захворювання страждають люди зі світлою шкірою (I та II фототипу за Фіцпатриком), але можуть хворіти також азіати та афроамериканці [82]. На частоту захворювання впливають і гендерні відмінності: співвідношення жінок і чоловіків, хворих на розацеа 1,5 – 2,0:1,0 [97]. Існує думка, що чоловіки менш вимогливі до себе, тому рідше звертаються до лікарів [105]. У чоловіків розацеа може протікати більш агресивно, призводячи до запуску проліферативних процесів, з формуванням таких тяжких форм захворювання, як рінофіми та ін. [120, 162]. Ряд авторів відзначають генетичну схильність до захворювання [2, 30]. В останні роки зафіксовано збільшення захворюваності на розацеа, особливо серед молоді, зростання частоти ускладнених, торпідних до терапії, часто рецидивуючих, інвалідизуючих та спотворюючих форм, що істотно погіршує якість життя пацієнтів [91, 133, 154, 183].
Розацеа – це розповсюджене хронічне запальне рецидивуюче захворювання, яке має поліетіологічне походження та характеризується стадійним і прогредієнтним перебігом [5, 84]. Вражаючи переважно шкіру обличчя, дерматоз завдає пацієнтам поряд з фізичними ще й психосоціальні проблеми, викликаючи стресову реакцію та емоційні розлади. Досить повільні зміни позитивного характеру, під час лікування, часті рецидиви хвороби в поєднанні з вираженим косметичним дефектом призводять до проблем психологічного плану: зниження самооцінки, труднощів у міжособистісному спілкуванні, порушення адаптації в суспільстві, дратівливості або замкнутості, психоастенічних станів, неврозів [43, 157]. Розацеа зустрічається у людей працездатного віку, що нерідко призводить до дезадаптації та психологічних розладів, тому цей дерматоз можна віднести до соціально значущих захворювань. [58, 134, 187].
Незважаючи на те, що багато робіт вітчизняних та зарубіжних дослідників присвячувались вивченню розацеа, на сьогодні етіологія цього захворювання не встановлена, а механізми її формування до кінця не зрозумілі і є дискусійними питаннями [36, 84, 163]. Вивченню етіології та патогенезу розацеа надають великої уваги у всьому світі, тому що від цього залежить правильна тактика лікування [143, 174]. Гіпотези, що стосуються виникнення та перебігу цього дерматозу, численні та нерідко суперечливі. Таким чином, на дотепер чіткого розуміння механізмів розвитку розацеа не існує [46, 67, 179]. Розглядаючи сучасні погляди на теорію патогенезу розацеа, можна зрозуміти, що більшість дослідників тримаються мультифакторної теорії розвитку цієї хвороби [41, 57, 146]. За даними літератури, розвиток та хронічний перебіг захворювання зумовлено багатьма чинниками, перелік яких досить численний. Обговорюється роль екзогенних (аліментарних, інсоляції, метеорологічних, екологічних, фізичних) та ендогенних (генетичних, інфекційних – Helicobacter pylori, паразитарних – кліщ Demodex folliculorum, порушень функції травного тракту та печінки, патології ендокринної та імунної систем, психовегетативних та гемостатичних порушень, взаємозв’язоку з іншими захворюваннями) факторів, які сприяють Т-клітинній проліферації й формуванню запальних елементів, а в подальшому торпідно протікаючому запальному процесу в шкіри [14, 46, 112, 167].
На думку науковців, у патогенезі розацеа особливу увагу приділяють зовнішнім провокуючим факторам (тригер-факторам, що сприяють рефлекторному розширенню кровоносних судин шкіри обличчя, викликаючи розвиток або загострення розацеа). До них відносять аліментарні фактори – алкоголь, гострі та пряні блюда, гарячі напої (ретельні дослідження показали, що припливи крові до шкіри викликають страви з температурою понад 60ºС). Вважається, що розширення кровоносних судин відбувається у відповідь на рефлекторну дію цих факторів на слизову оболонку шлунка, що призводить до вивільнення катехоламінів з ентероендокринних клітин. Екзогенні причини також впливають на розвиток розацеа. До них відносять: інсоляцію та тривале перебування у приміщеннях із високою температурою, надто вологим або сухим повітрям, швидка зміна температурних режимів, значні фізичні навантаження, стреси, механічне подразнення шкіри, нераціональне використання кортикостероїдних мазей і лікарських препаратів, які вміщують нітрогліцерин, кофеїн, рифампіцин, етанол [47, 54, 83, 102, 118].
Збільшується кількість доказів існування генетичної схильності до розацеа. У 30-40 % пацієнтів з розацеа на дане захворювання страждав один із родичів [75]. Але існування генетичних маркерів розацеа, таких як НLA, поки що не доведене. Епідеміологічні характеристики розацеа вважаються недостовірними [124, 157].
За даними літератури, розацеа відносять до ангіоневрозів [75], обумовлених функціональною недостатністю периферичного кровообігу у вигляді спазму судин та зниження тонусу вен, унаслідок порушення іннервації судин шкіри обличчя, викликаної найрізноманітнішими причинами на тлі зміненої реактивності організму [94, 154]. Деякі вчені констатували підвищення тонусу симпатичної нервової системи, результат, якого – спазм артеріол та зниження тонусу вен із подальшим розвитком порушень мікроциркуляції як патогенетичного фактора розвитку розацеа [58, 148].
При розацеа вражається переважно центральна частина обличчя, що, ймовірно, пов’язано з високою щільністю сальних залоз, фізіологією нервових волокон та анатомічними особливостями судин цієї зони [32, 77]. Хоча в даний час більшість дослідників провідним механізмом у розвитку розацеа визнають судинний компонент [54, 87, 146], гістологічні дослідження підтверджують лише те, що розацеа є запальним захворюванням, у результаті якого відбувається розширення судин і ангіогенез [11, 127]. На сучасному етапі в патогенезі цього дерматозу важливу роль відіграють зміни периферійного кровообігу, рефлекторного спазму артеріол та зниження тонусу поверхневих вен шкіри (ангіоневроз) в зоні іннервації трійчастого нерву [87, 139], унаслідок порушень нейроендокринної регуляції судин, що обумовлена впливом екзогенних та ендогенних факторів [54, 87]. Але лише цим не можна пояснити багато проявів цієї хвороби [6]. Також вивчаючи судинні зміни при розацеа, учені дійшли висновку, що безпосередньо й самі генералізовані судинні припливи відіграють значну роль у етіології та патогенезі цього дерматозу [34, 67, 143], провокуючи стійкий набряк шкіри обличчя, де розвиваються клінічні прояви розацеа з наступною гіпертрофією та фіброзом сполучної тканини [26, 141]. Також виявлено, що у хворих на розацеа уповільнюється перерозподіл кровообігу та виникає венозний стаз і недостатність у ділянці відтоку venae facialis sive angulsris, що відповідає найбільш частій топографії при цьому захворюванні [45, 87, 134]. У ділянку відтоку лицевої вени входить також і кон’юнктива, що пояснює часте ураження очей при розацеа [77]. При проведенні ультразвукової доплерографії судин голови та шиї у хворих на розацеа, встановлено зміни у кровообігу в зовнішній сонній артерії, що свідчить про недостатність кровопостачання в ділянках шкіри обличчя [44, 114]. Однією із причин порушення реґіонарного кровопостачання є ендотеліальна дисфункція, яка може призводити до спазму судин, посиленому тромбоутворенню та посиленої адгезії лейкоцитів до ендотелію [35, 78, 128]. Біткіна О. А. (2010) виявила аномалії ендотелію капілярів при розацеа, у вигляді його потовщення, розривів базальної мембрани та недостатньо щільних зв’язків клітин ендотеліального шару [6].
На сучасному етапі в генезі дерматозу встановлена роль фактора росту судинного ендотелію (VEGF), який є активатором ангіогенезу [6, 57, 74]. Під впливом прозапальних цитокинів кератиноцити синтезують VEGF [77, 165], через що посилюється проникність судин та розвивається вазодилятація, що у свою чергу, призводить до розвитку стійкої еритеми, відчуття печіння, поколювання та свербежу [87, 175]. Тривала дилатація судин викликає ослаблення стінок капілярів, призводячи до накопичення в дермі нейтрофілів та прозапальних цитокинів. Через це починає накопичуватися екстраваскулярна рідина, яка поступово здавлює лімфатичні судини, викликаючи набряк [97].
Потєкаєв М. М. (2007) встановив патогенетичне значення стану згортуючої системи крові в розвитку розацеа [82]. У більшості хворих при обстеженні виявлено зсув функціональної активності згортаючої системи крові у бік гіперкоагуляції. Відмічається зниження протромбінового індексу та зменшення фібрінолітичної активності крові [54, 145]. Одні автори вважають, що ці відхилення гомеостазу спричиняються гіперпродукцією комплементів каллікреїн-кінінової системи, яка є комплексом гуморальних факторів, що беруть участь у регуляції кров’яного тиску, мікроциркуляції та судинного тонусу. Вазоактивна направленість кінінів, їхня здатність у дуже малих концентраціях змінювати тонус судин і підвищувати проникність капілярів викликає характерні для розацеа судинні зміни [49, 51]. Інші ж автори дотримуються протилежної думки про те, що активація згортання крові у хворих на цей дерматоз є зворотною реакцією організму на тривалу дилатацію судин та пошкодження їх стінок [92].
Встановлено, що шкірний запальний процес грає ключову роль у патогенезі розацеа та ініціюється за участю TLR2 (Toll-like receptor, Толл-подібні рецептори) кератиноцитів [87, 189], які мають здатність активуватися фізичними факторами (ультрафіолетове опромінення (УФО), високими і низькими температурами), хітиновою оболонкою D. folliculorum, нейропептидами при стресі або при формуванні вісцеро-кутанних рефлексів [10]. Подальший розвиток запалення обумовлено секрецією кератиноцитами запальних протеаз (матричні металопротеїнази, калікреїнкінази) й антимікробних пептидів (альфа-, бета-дефензини і кателіцидин LL-37) [185]. Останніми роками у розвитку розацеа значна роль відводиться саме кателіцидину LL-37, який є антимікробним поліпептидом шкіри, належить до сімейства калікреїн-кініну, а продукція його посилюється під впливом УФО, високих і низьких температур, інфекційних агентів [201]. Yamasaki K. та співавторами (2011) встановлено, що в ураженій розацеа шкірі, його рівень значно вищий [203]. Кателіцидин LL-37 підвищує продукцію хемокінів лейкоцитами, гістіоцитами, тучними клітинами, клітинами дерми, викликає посилення проліферації ендотелію судин і ангіогенезу за рахунок збільшення секреції фактора росту ендотелію судин. Таким чином, порушуються архітектура міжклітинного матриксу, неоангіогенез і регуляція нейросудинних зв’язків у шкірі та формуються стійка еритема і телеангіектазії – основні ознаки розацеа [184, 188 ].
Сонячне випромінювання активує ендогенні фотосенсибілізатори – порфірини, які містяться у підвищеній кількості в секреті сальних залоз. Підвищення вмісту порфіринів у поєднанні із рядом інших факторів може призводити до фотодинамічного ураження структурних елементів шкіри. Ряд авторів вказує, що внаслідок надмірної інсоляції пошкоджується сполучна тканина шкіри, що визиває виникнення актинічного еластозу [87], що призводить до пасивного розширення судин та застою в них крові. Далі через уражені стінки судин, у периваскулярний простір починають потрапляти різні медіатори запалення, які сприяють формуванню папул і пустул [143]. З іншого боку, ряд дослідників не підтримують гіпотезу впливу сонячного випромінювання на розвиток розацеа, пояснюючи це тим, що приблизно у третини хворих на розацеа УФО не викликає загострення клінічних проявів дерматозу, а іноді навіть сприяє його клінічній ремісії [74, 183]. Таким чином, дія інсоляції в патогенезі розацеа останніми роками повністю не з’ясована.
Багато дослідників є прихильниками того, що розацеа виникає у осіб, які мають проблеми в діяльності шлунково-кишкового тракту [86]. У результаті численних досліджень відомо, що у багатьох хворих на розацеа виявлені клінічні та гістологічні ознаки гастриту, виразкової хвороби шлунка та дванадцятипалої кишки, патологічні зміни кишечника, хронічного персистуючого гепатиту та хронічного гепато-холециститу [25, 85, 138]. Патогенетичну залежність розацеа та виявлених захворювань пов’язують із гіперпродукцією при них медіаторів вазодилятації. Найбільш часто виявляється в крові у великих концентраціях простагландин Е2, який має властивість викликати приливи [99, 126, 170]. У деяких роботах вказується на залежність розвитку розацеа від заселення гастроінтестінального тракту бактеріями Helicobacter Pуlori. Кузіна З. А. та співавт. (2011) вважають, що ці бактеріїї індукують утворення клітинами слизової оболонки шлунково-кишкового тракту вазодилататорів: вазоактивних пептидів (вазоактивний інтестинальний пептид, пентагастину, VEGF), медіаторних речовин (брадикінину, серотоніну, гістаміну, ендорфіну, субстанції Р та ін.) і токсинів, які сприяють виникненню реакції приливів, що є важливим механізмом розвитку розацеа [57]. Також Н. pylori стимулює утворення антитіл, які вступають у перехресну реакцію з людськими антигенами антрального відділу шлунка. Це веде до гіпергастринемії, впливу соляної кислоти на незахищену муцином слизову оболонку й підтримує антигенну стимуляцію [86]. Персистування Н. pylori в слизовій оболонці шлунка і дванадцятипалої кишки сприяє вазодилатації, активує імунокомпетентні клітини, формуя хронічне запалення [12, 13]. Абрагамович Л. Є. та соавт. (2005) повідомяють про дослідження160 хворих на розацеа, серед яких у 134 було підтвердження инфекції H. pylori дихальним тестом з сечовиною [1]. Інші автори не підтверджують часту наявність хелікобактерної інфекції у хворих на розацеа [53, 81,135], тому що у деяких роботах показано, що ерадикаційна терапія не позбавляє хворих від розацеа та не покращує її перебіг [45, 124]. Деякими авторами було встановлено кореляційний зв’язок розацеа із порушеннями в печінці та жовчному міхурі [72, 92]. Також є дані про наявність у більшості хворих на розацеа порушень білкового обміну та порушень обміну у печінці [35]. Одночасно, достатньо високий рівень захворюваності на гастрит та іншу патологію шлунково-кишкового тракту спостерігається й у людей, не уражених розацеа [82]. Крім того, є дані досліджень, що відхилень у функціональному стані печінки у хворих на розацеа не виявилено [58]. Таким чином, гіпотеза можливості опосередкованого впливу захворювань шлунково-кишкового тракту на виникнення й розвиток розацеа потребує подальшого детального дослідження.
В останні десятиліття чимало дослідників вивчали вплив на виникнення розацеа ендокринної патології, серед якої превалюють порушення функцій щитовидної залози, статевих залоз та гіпофізу [53, 75, 84, 132, 149]. Описані випадки виникнення розацеа як у період вагітності або клімаксу, так і перед менструацією. Досить цікавим є те, що можливий впливу статевих гормонів на розвиток популяцій кліщів-демодицид [49, 50]. Цукровий діабет та зниження секреції ліпази виявляється у багатьох хворих на розацеа, але разом з тим, у конторольних дослідженнях значущою частоти ендокринної недостатності підшлункової залози не виявлено [54]. Потєкаєв М. М. (2007) вважає, що патологія ендокринної системи може сприяти обтяженню перебігу розацеа але, разом з цим, він вважає ендокринопатії не можна вважати основними патогенетичними причинами розвитку дерматозу [82]. Інші ж автори, такі як Кузіна З. А. та соавт. (2011) навпаки, вважають, що дисфункція статевих залоз є першочерговою причиною в розвитку розацеа [57]. Подальше вивчення гормонального стану у хворих на розацеа сприятиме розширенню уявлень про патогенез цього дерматозу та удосконаленню лікування.
Аналіз літературних джерел свідчить, що велика увага приділяється вивченню участі імунного механізму в патогенезі розацеа. На думку багатьох авторів, шкіра є не тільки органом специфічного захисту, а й бере активну участь у імуногенезі [67]. Встановлено, що при цьому дерматозі першочергову роль відіграють зміни гуморального та клітинного ланцюгів імунітету, а саме: підвищується рівень циркулюючих імунних комплексів [73]. Самцов О. В. та соавт. (2009) відзначали значне зниження фагоцитарної активності лейкоцитів [97]. Спостерігається депресія всіх Т-клітинних елементів, змінюється абсолютний та відносний вміст В-лімфоцитів [45, 56, 77]. За даними Потєкаєва М. М. (2007), достовірно змінюються показники Ig, у вигляді підвищення всіх трьох класів: A, M, G [82]. Але під час дослідження не вдалося виявити залежність між кількісними показниками імуноноглобулінів та стадією і перебігом захворювання. Відомі зміни про- і протизапальних цитокінів [87]. Отже, виявлені зміни обумовлюють необхідність подальшого вивчення а також підбору імунокоригуючих засобів. У цьому аспекті на особливу увагу заслуговує необхідість дослідження характеру імунологічних порушень при різних клінічних формах та перебігу розацеа.
За сучасними уявленнями K. Yamasaki та соавт. (2009) повідомляють, що ключова роль у патогенезі розацеа відводиться тісному взаємозв’язку тригерних факторів та вродженого імунітету [204], що здійснюється на фоні підвищеної кількості в шкірі хворих на розацеа антимікробного пептиду кателіцидину, який активується калікреїном-5. За даними R. Gallo, K. Yamasaki (2011), у пацієнтів з розацеа завдяки тригерним факторам опосередковано через TLRs підвищується кількість цитокінів, матриксних металопротеїназ, посилюється вироблення активних форм кисню і оксиду азоту, що призводить до подальших морфологічних змін в шкірі, і таким чином пояснює різноманітність клінічних форм розацеа [155].
Деякі вчені висловлюють думку про інфекційне походження розацеа (наявність пустул, ефект від антибактеріальних препаратів), але вміст пустул переважно стерильний, а грамнегативні мікроорганізми виявляють тільки при тяжких формах – грамнегативна розацеа [78, 85]. Між тим, мікрофлора шкіри є важливим чинником, який слід враховувати в патогенезі розацеа. У своїх дослідженнях Самцов О. В. та співав. (2009) повідомляють, що серед запальних елементів хворих на розацеа домінує Staphуlococcus aureus [97]. Whitfeld M. та співавт. (2011) у своїх дослідженнях значну патогенетичну роль відводять Staphуlococcus epidermіdis [199]. У ролі етіопатогенетичних факторів розацеа досліджувались також дріжджоподібні гриби роду Candida та Malassezia, що також дозволило в певній мірі розширити розуміння дерматозу [42, 44]. Буває, що прояви розацеа (еритема, папули, пустули, проліферативні зміни залоз шкіри) клінічно настільки схожі з проявами маласезіозу шкіри, що диференціальна діагностика їх неможлива без сучасних методів етіологічної лабораторної діагностики [102, 108, 138, 153]. Таким чином, дослідження мікрофлори ураженої шкіри внесли багато нових даних у патогенез розацеа, але немає робіт, присвячених висвітленню її особливостей при рецидивах розацеа.
На сучасному етапі не залишається з’ясованою роль кліща Demodex folliculorum, який часто знахідять при розацеа. Його вважають фізіологічним представником мікрофлори шкіри [57]. Але ряд авторів виділяють інфікованість кліщами роду Demodex як одну з причин та обтяжуючих факторів розацеа, а за деяких ситуацій гострий демодекоз стимулює розвиток розацеа, провокуючи запальні та алергічні реакції [87, 134]. Деякі науковці-дерматовенерологи ототожнюють демодекоз із розацеа. Одні вчені вказують на те, що у відповідь на життєдіяльність кліщів розвиваються захисні реакції організму [93]. Інші вважають, що демодекс може існувати на шкірі, не провокуючи патологічних змін [19, 73]. Також є думки з приводу того, що D. folliculirum проводить кокову та вірусну флору у більш глибокі шари шкіри [147]. Встановлено, що в результаті подразнення рецепторів шкіри продуктами метаболізму кліща розвивається параліч вазомоторів, який призводить до порушення тонусу судин, викликаючи посилення проникності судинної стінки, що надалі призводить до порушення трофіки дерми й запалення [45]. Також до патологічних властивостей цих кліщів відносять їх спроможність механічно руйнувати епітеліальні клітини, а також ініціювати формування в дермі запальні інфільтрати [87]. Показано, що D. folliculorum може брати участь у розвитку захворювання коли його чисельність не перевищує 5 екземплярів на см2 [87]. Ряд дослідників висловлюють думку, що клінічні характеристики розацеа залежать не від щільності заселення шкіри кліщами, а від виразної запальної реакції у відповідь на присутність цих паразитів [75]. Є відомості про випадкове виявлення кліщів демодицид у 20-30 % біоптатів зі шкіри обличчя практично здорових людей, що ставить під сумнів патогенетичне значення кліщів у розвитку розацеа [145]. Підтвердженням значення кліщів Demodex у етіопатогенезі розацеа є виявленя деякими дослідниками підвищення ефективності комплексного лікування хворих на цей дерматоз протидемодекозними препаратами [79]. Але, за даними Потєкаєва М. М. (2007) досягнення клінічного ефекту від лікування у хворих на розацеа, без використання протидемодекозних препаратів свідчить про непричетність кліща Demodex folicullorum у виникненні розацеа [82]. Тож питання про ступінь патогенності кліщів у хворих на розацеа продовжує дискутуватися.
Поряд із вищезазначеними факторами, велику патогенетичну роль мають і психогенні зміни, які часто лежать в основі всіх шкірних захворювань. Взаємозвязок між центральною нервовою системою та шкірою обумовлена їхнім загальним ембріональним походженням. На сучасному етапі розвитку цивілізації ритм життя є дуже стрімким, збільшене емоційне навантаження, а можливість адаптуватися у людини знижена, у наслідок чого збільшується рівень захворюваності хронічними дерматозами [66, 154]. Так, навіть незначні емоційні стреси у хворих на розацеа викликають чітку вазодилятацію, що пов’язана з підвищеною психореактивністю судин шкіри обличчя, та впливають на інтенсивність запалення шкіри та свербіжу. Відомо, що будь-який стрес супроводжується викидом ,,гормонів стресу”. До таких гормонів належать кортиколіберин, адренокортикотропний гормон, гормон росту, андрогени, глюкокортикоїди та ін., які впливають і на шкіру, стимулюючи меланогенез, маючи імуносупресивну дію на імунні клітини дерми, стимулюють потовиділення, викликають дегрануляцію тучних клітин і вивільнення гістаміну, чим індукують появу свербіжу, набряку та почервоніння шкіри [56]. Встановлено, що різноманітні психоемоційні фактори можуть сприяти погіршенню перебігу та виникненню рецидивів розацеа, а це в свою чергу викликає невротичні реакції, які погіршують перебіг захворювання. Відчуття тривоги та депресії є найбільш частою реакцією, якщо патологічний процес знаходиться на обличчі [87, 145]. У той же час ряд авторів наголошує на тому, що психовегетативні порушення не можна розглядати в якості основної причини виникнення розацеа [75, 91]. Та разом з цим недооцінка психоемоційного стану пацієнтів часто не приводить до очікуваного ефекту від терапії [124]. Таким чином, питання відносно визначення психосоматичних порушень як причини або наслідку розацеа є на часі не повністю з’ясованими.
У літературі останніх років зустрічаються повідомлення про оцінку стану ВНС за допомогою аналізу ВСР. Однак на сучасному етапі немає даних стосовно дослідження змін статусу ВНС при рецидивах розацеа.
У ролі аргументів на користь алергічної теорії патогенезу розацеа свідчить зв’язок погіршення клінічної картини із вживанням деяких продуктів, нерідко супутні кропив’янка та зуд, регрес проявів після прийому антигістамінних препаратів. Однак ця теорія не знаходить підтримки у зв’язку з неуспішним досвідом використання глюкокортикостероїдних препаратів [75].
З’ясуванню етіології, патогенезу, підвищенню ефективності лікування розацеа присвячено роботи багатьох дослідників, але відсутня загальна концепція, яка б охоплювала та пояснювала якомога більше положень проблеми. Проблемою розацеа є також хронічний рецидивуючий перебіг захворювання, оскільки рецидиви розацеа мають особливості, які потрібно своєчасно виявити для їх попередження та прогнозування, що є необхідною умовою курації таких хворих. Але в літературі немає достатньо фактів, які б охоплювали ці питання. Не розроблені рекомендації по веденню хворих з рецидивами розацеа, що ми вважаємо суттєвим недоліком в дерматологічній практиці.
1.2 Прояви та діагностика розацеа
На сучасному етапі не існує чітких критеріїв стосовно діагностики захворювання на розацеа, бо, виходячи з вищесказаного, причини виникнення та механізми розвитку даної патології залишаються недостатньо з’ясованими. Проведення загальних лабораторних та спеціальних методів дослідження (зокрема, дослідження на Demodex folliculorum та визначення pH шлунка), а також рекомендовані інші обстеження (флюорографія, функціональні проби печінки, консультації суміжних спеціалістів) носять загальний характер, підтверджуючи при цьому наявні порушення з боку шлунково-кишкової та імунно-ендокринної систем, що діагностуються у багатьох хворих на розацеа, але вони не є специфічними й не можуть виступати в ролі абсолютних критеріїв діагностики [56, 94].
Клініко-морфологічні прояви розацеа досить різноманітні (центрофациальна, транзиторна та потім стійка еритема, набряк, телеангіоектазії, папульозний і пустульозний висипи, наявність осередків гіперплазії сальних залоз, проліферативні зміни та розростання сполучної тканини), та саме за ними встановлюють стадію та клінічну форму захворювання [6, 57, 65, 89], що є необхідним для вибору тактики курації хворих та методів лікування. Висипання при розацеа локалізуються на шкірі обличчя, переважно щік, носа, лоба та підборідді, іноді в зоні декольте. Суб’єктивно хворих турбують печіння, свербіж, при гострому перебігу захворювання виникає виражений набряк. Ураження очей зустрічається більше ніж у 50 % пацієнтів з розацеа. Діагностика в більшості випадків не викликає труднощів [57, 79, 145].
Диференціюють розацеа з вульгарними акне, периоральним дерматитом, себорейним дерматитом, червоною вовчанкою, руброфітією обличчя, грибоподібним мікозом, фолікулітами, дрібновузелковим саркоїдозом, синдромом Рандю-Ослера, червоною зернистістю носа, карциноїдом, туберкульозним вовчаком Беньє-Тенессона та ін. [45, 77, 93, 165].
Адаскевич В. П. (2005) виділяє основні та другорядні діагностичні ознаки розацеа. До основних відносять транзиторну або постійну еритему, папули і пустули, телеангіоектазії, до вторинних – печіння та поколювання шкіри, бляшки у центральній частині обличчя, сухість шкіри, набряк, офтальморозацеа, фіматозні зміни. Для постановки діагнозу необхідна наявність як мінімум однієї основнї та однієї другоряднї ознаки [2].
Складний патогенетичний механізм розацеа, а також різноманіття клінічних форм дерматозу пояснюють відсутністю єдиної класифікації розацеа. Сьогодні Національне товариство розацеа виділяє 4 основні форми захворювання: еритемо-телеангіоектатичну; папульозно-пустульозну; інфільтративно-продуктивну (фіматозну); офтальморозацеа [66]. Окремі автори з урахуванням клінічної картини розацеа розрізняють такі форми цього дерматозу: еритематозна, папульозно-пустульозна та гіпертрофічна форма (рінофіма) [87]. Але в Європі та США на сьогодні користуються класифікацією G. Plewing, Th. Jansen, A.M. Kligman: I стадія – еритематозно-телеангіоектатична; II стадія – папуло-пустульозна; III стадія – пустульозно-вузлова (гіпертрофічна). Також виділяють особливі форми розацеа, які мають своєрідні клінічні прояви та потребують іншого підходу до терапії. До них відносяться: стероїдна, гранулематозна (або люпоїдна), грамнегативна, конглобатна, фульмінантна, хвороба Морбігана (розацеа з персистуючим набряком), офтальморозацеа, ринофіма і «-фіми» інших локалізацій: гнатофіма – підборіддя, метафіма – лоб, отофіма – вухо, блефарофіма – повіки [134].
Еритематозно-телеангіектатична розацеа характеризується розвитком швидкоплинної, а потім стійкої еритеми в центральній частині обличчя (носа, щік, середньої частини лоба, зони декольте) з наявністю телеангіоектазій у відповідь на провокуючі фактори [87]. Спочатку еритема виникає від декількох хвилин до декількох годин, а далі тривалість її збільшується. Надалі, із часом формується стійка застійна еритема, інфільтрація шкіри та телеангіоектазії, лущення. Стрімко збільшується чутливість шкіри до косметичних засобів, мила, механічних травм. Зазвичай переорбітальні області залишаються вільними від висипань. Далі еритема стає більш насиченою, з’являється синюватий відтінок, який переходить на ніс, щоки, лоб, підборіддя, шию. Але розацеа не завжди починається з стрімкої еритеми [45].
Папуло-пустульозна стадія характеризується наявністю ізольованих або згрупованих папул і пустул на тлі еритеми в центральній частині ураження [61]. Частіше вони локалізуються в ділянці шкіри щік, лоба, підборіддя, іноді над верхньою губою. На їхній поверхні помітне незначне лущення, на поверхні пустул вміст жовтувато-зеленуватого кольору та гнійно-геморагічні кірочки. Крупні папульозні елементи внаслідок групування утворюють бляшки синюватого відтінку без чітких меж. Після загоєння папуло-пустульозних елементів, як правило, рубців не спостерігається, комедони відсутні. Шкіра обличчя стає набряклою, пористою. З часом стійкий папуло-пустульозний висип займає всю поверхню обличчя, з’являючись на волосистій частині голови, шиї, в завушних складках, центральній частині грудей. Ця форма захворювання може розвиватися самостійно, після I стадії або одночасно з нею [87].
При інфільтративно-продуктивній формі (ринофімі) на застійно гіперемованому фоні з набряком розвиваються запальні вузли, інфільтрати, пухлиноподібні (шишковидні) вирости та стійко розширені судини, потовщення епидермісу. Ринофіма формується тільки у чоловіків. В основі цього процесу лежить переважно дифузна гіперплазія сполучної тканини, розширення судин, гіперплазія фолікулів і сальних залоз. При цьому розміри носа, щік збільшуються, форма стає горбистою, асиметричною, створюючи спотворюючий дефект. Виділяють наступні форми рінофіми: залозна – розростання шкіри носа за рахунок гіперплазії сальних залоз; фіброзна – значне розростання сполучної тканини та рівномірне збільшення розмірів носа, коли гіперплазія сальних залоз не виражена; фіброзно-ангіоектатична – розростання та набряк сполучної тканини, при цьому мережа венозних телеангіоектазій робить колір носа мідно-червоним [75, 94, 145].
При офтальмологічній розацеа розвиваються симптоми запалення очного яблука й повік. При ураженні очей з’являється сухість, відчуття стороннього тіла, свербіж, печіння, світлобоязнь, набряк, гіперемія й телеангіектазії кон’юнктиви, нечіткий зір, кератит. Пораження очей (блефарит) характеризується гіперемічними плямами та періорбітальною еритемою, набряком, сухістю, лущенням шкіри повік, запаленням мейбомієвих залоз, формуванням халазіонів і телеангіоектазій країв повік. Перераховані симптоми офтальмічного субтипу розацеа виявляються спільно з офтальмологами (при проведенні огляду хворого у щілинній лампі). Іноді ураження очей може бути єдиною знакою розацеа [87, 145].
При гранулематозному варіанті розацеа в дермі формуються епітеліоїдно-клітинні гранульоми. Дана форма дерматозу, як правило, притаманна пацієнтам із ВІЧ-інфекцією та іншими імунодефіцитними станами. Клінічні прояви цього варіанту захворювання супроводжуються розвитком дрібних щільних папул, іноді одиничних вузлів, червоно-бурого кольору, напівсферичної або плоскої форми із гладкою блискучою поверхнею, головним чином, у переорбітальній та переоральній областях, які мають сіро-жовтий відтінок при діаскопії, що помилково трактується як ознака туберкульозу – «ознака яблучного желе» [15].
Стероїдна розацеа настає після використання у терапії зовнішніх високоактивих глюкокортикостероїдних препаратів, особливо тих, які містять фтор. Клінічно стероїдна розацеа відчутно не відрізняється від інших форм розацеа, окрім наявності ділянок атрофії та вираженого синдрому відміни топічного кортикостероїдного препарату [45, 75, 96].
Конглобатна форма розацеа характеризується, окрім класичних проявів, наявністю вузлуватих елементів синювато-червоного кольору, сферичної форми, 1-2 см в диаметрі. Запальні елементи формуються в місцях існуючого висипу. Причини трансформації захворювання не відомі. Нерідко у пацієнтів спостерігається слабкість та лихоманка [64].
Фульмінантна розацеа виникає раптово на фоні загального благополуччя організму. Розвивається виражений набряк і застійна еритема, папули, пустули, вузли, нерідко із флуктуацією та буровато-жовтими кірками на поверхні. Внаслідок злиття вузлів утворюється потужний бугристий конгломерат. Частіше процес локалізується на лобі, щоках, підборідді. Пальпаторно виявляється гіпертермія. Загальний стан, як правило, не страждає. При відсутності адекватної терапії фульмінантна розацеа спонтанно регресує впродовж 1,5 років або приймає форму хронічного запального процесу [45, 87, 142].
Дерматоз трансформується в грамнегативну розацеа при попередній тривалій антибактеріальній терапії, частіше тетрациклінового ряду, що є ускладненням нераціональної терапії. З’являються множинні фолікуліти, вузли та кісти, у вмісті яких виявляються грамнегативні бактерії груп Pseudomonadis, Proteus, Klebsiella, Acinetobacter та мікроорганізмами групи кишкової палички – Enterobacteriaceae (Esherichia coli, Enterobacter). Захворювання часто розвивається у людей із дефектами імунної системи та, головним чином, тільки у чоловіків. Пустули можуть з’являтися на шкірі волосистої частини голови та на грудях [64].
Розацеа з солідним персистуючим набряком (хвороба Морбігана) характеризується появою щільного набряку та яскравої еритеми на верхній половині обличчя, телеангіоектазії та папул. Перебіг носить спочатку рецидивуючий, а далі персистуючий характер. Суб’єктивні відчуття у хворих відсутні. Через рік від початку захворювання набряк переходить у стійку інфільтрацію та фіброз, що є характерним саме для хвороби Морбігана [64].
Гістологічна картина розацеа залежить від стадії та форми захворювання. На початку захворювання в еритематозно-телеангіоектатичній формі відзначають ознаки еластозу, ділятації судин та потовщення ії стінок за рахунок проліферації клітин ендотелію. Також має місце незначна деорганізація колагенових та еластичних волокон, атрофічні зміни сально-волосяних фолікулів. При розвитку папульозних елементів виявляються лімфогістіоцитарні та перефолікулярні інфільтрати, зрідка епітеліоїдні гранульоми з клітинами Пирогова-Лангханса. У період виникнення пустул у шкірі з’являються інтрафолікулярні скупчення нейтрофілів та плазматичних клітин. При дисемінації процесу в екстрафациальних елементах зустрічаються скупчення моноцитів і явища васкуліту. Фіматозна розацеа характеризується дифузними порушеннями з гіперплазією з боку сполучних елементів та сальних залоз із подовженням, розширенням та деформуванням протоків [87, 154, 176].
1.3. Методи лікування розацеа
Згідно з даними літератури, багато досліджень спрямовані на пошук шляхів удосконалення терапії розацеа. Вибір тактики лікування та ефективність терапії розацеа залежать від клінічної форми захворювання, важкості, тривалості лікування, переносимості препаратів, наявності супутньої соматичної патології, віку, полу, психоемоційних особливостей пацієнта [6, 42, 57, 154]. Серед багатьох методик лікування розацеа не вдалося знайти жодної, що направлена на усунення проявів та лікування рецидивів розацеа.
Загалом лікування розацеа спрямоване на усунення провокуючих факторів, дотримання дієти та фотопротекцію, пригнічення запального процесу, регрес висипань. Дієта повинна виключати з раціону дуже горячу їжу (>60 0C) алкогольні напої, пряні та консервовані страви [75, 154].
За даними Sheinfled N. та співавт. (2010), класична терапія розацеа містить антибіотики, метронідазол, вітамінотерапію та зовнішню терапію [185]. У період вираженого загострення приєднують антигістамінні препарати. Однак, до цього часу основними препаратами терапії розацеа є антибіотики, переважно тетрациклінового ряду (тетрациклін, доксициклін) та групи макролідів (еритроміцин, кларитроміцин) [6, 14, 42, 45]. Досі тетрацикліни залишаються найбільш ефективними антибактеріальними препаратами в терапії розацеа [56, 88, 176]. Терапевтичний ефект тетрациклінів зумовлений властивістю накопичуватися в сальних залозах, вибірково проникати до ділянок запалення, знижувати вміст вільних жирних кислот у шкірному салі, які підтримують перифолікулярне запалення. Початкова доза тетрацикліну й окситетрацикліну залежно від маси тіла і становить 1000-1500 мг/добу, які приймаються 3-4 рази на добу, а потім доза повільно знижується до підтримуючої 250-500 мг/добу. Лікування тетрациклінами, як правило, тривале – до 12 тижнів, що підвищує ризик розвитку побічних явищ. Можливі порушення шлунково-кишкового тракту, алергічні реакції, фотосенсибілізація [75, 165]. Доксициклін (за класичними схемами) призначаєтся в дозі 200 мг на добу, а підтримуюча доза 100 мг/добу [75, 98]. На сучасному етапі лікування розацеа антибіотиками в малих дозах дозволяє досягти потужного протизапального ефекту без спричинення антимікробної дії. Останнім часом з’являються відомості про ефективність використання антибіотиків групи макролідів. Bakar O. та співав. (2007) встановлено пригнічуючий вплив макролідів на секрецію протеїнкіназ [121]. Так, еритроміцин застосовують у дозі 500-1500 мг на добу, кларитроміцин призначають у початковій дозі 500 мг на добу з поступовим її зниженням до 250 мг на добу (тривалість лікування 8-12 тижнів); азітроміцин – у початковій дозі – 500 мг на добу (поступово знижуючи до 250 мг на добу); джозаміцин (вільпрафен) – по 1000 мг на добу [77, 123, 176].
Також одними із основних препаратів для загальної та місцевої терапії є препарати – похідні нітромідазолу (метронідазол, орнізол) [14, 42, 57, 173, 185]. Метронідазол приймають по 1,0–1,5 г на добу, курс – 4-8 тижнів. На думку зарубіжних дослідників, показанням до призначення pеr os метронідазолу є лише виражений демодекоз, але й у цьому разі тривалість лікування не повинно перевищувати 10 днів [56, 98]. Ефективність препарату пов’язана з його антимікробною активністю, спрямованою на придушення життєдіяльності D. folliculorum, має бактеріостатичну дію відносно грамнегативної анаеробної флори [56, 82]. Не дивлячись на суперечливе питання про етіологічну роль Demodex folliculorum у патогенезі розацеа, прийом метронідазолу всередину є невід’ємною частиною терапії розацеа [14, 56]. Встановлено, що метронідазол підсилює захисні та регенераторні функції слизової оболонки шлунка та кишківника, має виражену протинабрякову дію і бактеріостатичний ефект. Крім того, метронідазол, впливаючи на ВНС та стимулюючи її адренергічні структури, зменшує застійні явища та еритему. З успіхом застосовують також інші похідні імідазолу, які призначають хворим на запальні форми розацеа по 500 мг на добу протягом 10 днів [75, 93, 168].
Останнім часом для лікування важких форм розацеа використовують синтетичні ретиноїди (ізотретионін, третионін). Висока ефективність цих препаратів пов’язана з їхнім впливом на процеси диференціювання та кератинізацію клітин епідермісу та сальних залоз. Тривалість лікування ретиноїдами складає в середньому 4-6 місяців. Ізотретиноїн призначають у малих дозах (0,2–1,0 мг/кг на добу). Для лікування жінок можлива комбінація ізотритеоніну з антиандрогенними препаратами, які пригнічують функцію сальних залоз. Дана група препаратів володіє побічними ефектами, головний із яких – тератогенний вплив, що змушує критично підходити до їх широкого призначення. Забороняється одночасно приймати ретиноїди та антибіотики тетрациклінового ряду. Системні ретиноїди впливають на процеси диференціювання та кератинізацію клітин епідерміса й сальних залоз, що призводить до зменшення їх розмірів та активності, зниження експресії патоген-асоційованих рецепторів – TLRs, чим спричиняється протизапальна та імуномодулююча дія [64, 87].
Показанням до перорального прийому глюкокортикоїдів є лише rosacea fulminans [42, 57, 105, 114, 180].
У зв’язку з порушенням місцевого та загального імунітету у хворих на розацеа особливо із тяжким перебігом захворювання рекомендується поєднувати традиційну терапію з імуномодуляторами [54, 86, 91, 134].
У лікуванні розацеа використовують гормональну терапію із значним позитивним ефектом. У свою чергу, є повідомлення Поткаєва М. М. про позитивний ефект лікування 13 чоловіків із захворюванням на розацеа спіронолактоном [82, 145].
Важливим моментом у лікуванні розацеа є вітамінотерапія із використанням вітамінів A, B1, B6, B12, C, K, P, PP, нікотинової та фолієвої кислот, що справляють антиоксидантну та судинно-зміцнювальну дію [45, 87, 123].
За наявність активації калікреїн-кінінової системи показано використання інгібіторів протеолітичних ферментів – Е-амінокапронової та мефенамінової кислот [75].
До додаткових системних засобів лікування розацеа належить ангіопротектори. Нікотинову кислоту в дозі 0,05–0,1 г тричі на добу застосовують у комбінації з кальцію добезилатом 0,5 г двічі на добу, курс –1,0–1,5 місяця, оскільки одночасне призначення цих препаратів сприяє нормалізації тонусу судин шкіри обличчя, зникненню еритеми [54, 98].
Недооцінка психоемоційного стану пацієнтів часто не призводить до очікуваного ефекту від проведеної і, здавалося б, адекватної терапії. Ефективне лікування 40 % дерматологічних хворих неможливе, якщо ігнорувати роль емоційних чинників у розвитку дерматозів [7]. З урахуванням сучасних поглядів на основні патогенетичні механізми хронічних дерматозів фармакотерапія даних станів передбачає залучення до в схеми лікування протидепресивних препаратів, анксіолітиків [64, 76, 87].
Традиційно місцева терапія розацеа складається із холодних примочок з антисептичними розчинами (1-3 % розчин борної кислоти, 1-2 % розчин резорцину, відвар ромашки, шавлії, череди, звіробою, настою чаю і т.ін.), мазей, паст або кремів із протизапальною та протидемодекозною дією [1, 3]. Сучасні топічні препарати використовуються у вигляді кремів або гелів, які містять антибіотики, азелаїнову кислоту, метронідазол, бензилпероксид, адапален [4, 45, 96, 165, 174].
Деякі автори наполягають на особливій ефективності азелаїнової кислоти в лікуванні розацеа. Встановлено, що вона чинить протизапальну дію, що виражається в пригніченні проліферації, інгібуванні клітинної оксидоредуктази й утворенні гідроксильних радикалів нейтрофілами. Відомо її протизапальну та антимікробну дію щодо P. аcnes і S. еpidermidis. Так само припускають, що азелаїнова кислота чинить інгібуючу дію й на кліщів [57, 134, 176]. Ефективність препарату підтверджена Батиршиною С. В. та співавт. (2005), які досліджувавши 450 паціентів на розацеа [115].
Одним із найважливіших сучасних зовнішніх препаратів є метронідазол, що чинить активну протидемодексну та бактеріостатичну дію. Більшість авторів вважають, що місцеве використання препаратів метронідазолу конкурує за ефективністю із пероральними антибіотиками [32, 63, 175]. Але у роботі van Zuuren E.J. та співавт., (2011) повідомляється про ефективність зовнішньої терапії метронідазолом тільки в 3 із 58 досліджень [165].
Опубліковані дані про застосування ретиноїдів (препаратів ізотритеноїну, адапалену, ретиноївої кислоти) у пацієнтів з розацеа. Місцеве використання ретиноїдів виключає розвиток їхніх системних побічних дій, однак викликає сухість шкіри, лущення та свербіння [2, 82, 176]. Препарат пригнічує активність сальних залоз, впливаючи на процеси диференціювання клітин, зменшує запалення, регулює процеси кератинізації фолікулів, має імуномодулюючу дію. Але разом з тим, ці препарати мають і недоліки, що лімітує їхнє застосування. По-перше, вони можуть викликати значну еритему та підсилювати сухість чутливої шкіри пацієнтів, викликаючи дерматит обличчя. По-друге, можуть спричиняти утворення нових, значно розширених поверхневих судин із подальшим розвитком розацеа [132]. Тому використання топічних кретиноїдів у лікуванні розацеа викликає дискусію.
Місцеве лікування розацеа передбачає застосування антибактеріальних засобів: 1 % гелю кліндаміцину, еритроміцину, дія яких спрямована на пригнічення росту бактерій на поверхні шкіри [45, 97, 125].
Широко використовується місцева акарицидна терапія для лікування демодекозу, що ускладнює перебіг розацеа. Протидемодекозні властивості мають такі препарати, як 10-20 % суспензія бензил-бензоату, ,,Спрегаль”, мазь Вількінсона, препарати сірки, дьогтю, мазі й креми з трихополом. Але разом з тим ці препарати мають досить агресивну подразнювальну дію на шкіру, що є недопустимим для чутливої шкіри хворих на розацеа, оскільки це може призвести до загострення процесу [75, 95].
У зв’язку зі змінами в імунній системі доцільне призначення імунокоригуючих засобів. Недавні повідомлення констатують ефективність 1 % крема пімекролімуса в лікуванні папуло-пустульозної форми розацеа. Цей крем є похідним макролактама аскоміцину, селективно інгібує продукцію і вивільнення цитокинів і медіаторів з Т-лімфоцитів і тучних клітин. Однак питання місцевої імунокорекції при даному стані залишається актуальним і ще вивчається, оскільки більшість сучасних дерматологів вважають, що призначатися такі засоби повинні з великою обережністю [49, 95, 165].
На сучасному етапі місцеві глюкокортикоїди не рекомендуються для терапії розацеа, оскільки тривале використання кортикостероїдних мазей, особливо фторованих, призводить до трансформації дерматозу у стероїдну форму. Вийняток становлять лише тяжкі варіанти захворювання, при яких короткочасне застосування (до двох тижнів) необхідне для усунення гострого запального процесу [64, 92, 125, 176].
Так само доцільне призначення лосьйонів і гелей, що містять сірку й цинк, які забезпечують протизапальну й антибактеріальну дію [47, 87].
Окрім медикаментозних методів терапії розацеа, велику увагу приділяють методам фізіотерапії: кріотерапія, електрофорез, мікрострумова терапія, деструктивні методики [15, 51, 56, 158]. Кріотерапію проводять через день або щоденно до глибокого відшаровування. Метод рекомендовано хворим незалежно від стадії захворювання. Кріотерапія надає протизапальну, судинозвужуючу та антипаразитарну дію [61, 94]. Рекомендується також електрофорез (10-30 % розчином іхтіолу 2-3 разина тиждень з лідазою 2-3 рази на тиждень, 10-15 сеансів), лазеротерапія, імпульсне світло високої інтенсивності [34, 83, 145]. Адаскевич В. П. (2005), стверджує, що електрокоагуляція має лише одну мету – руйнування телеангіоектазії за допомогою струму високої частоти [2]. Склеротерапія препаратами колагену викликає склероз та обтурацію телеангіоектазій, і показана при наявності великих розширених судин [64]. Панкіна Е. С. (2008) обгрунтувала використання мікрострумової терапії на всіх стадіях розацеа із значним позитивним ефектом [74]. Багато дослідників наголошують на терапевтичному ефекті при використанні судинних лазерів проти еритеми та телеангіоектазій [66, 93, 176].
У лікуванні папуло-пустульозної, кістозної та вузлової форм розацеа показані деструктивні методики, такі як дермабразія. Цей метод націлено на руйнування телеагіоектазій та відновлення епідермісу. Але дані методи, на жаль, мають ряд недоліків: післяопераційне інфікування, лейкодерма, формування епідермальних кіст та рубців [87, 176].
Позитивні результати отримані під час використання озонотерапії. Озонокиснева суміш вводиться до просвіту судини, що призводить до склеювання мембран ендотеліоцитів та зникнення телеангіоектазій [58, 96].
Лікування ринофіми зводиться, як правило, до хірургічного видалення гіпертрофірованих тканин [36, 92].
Офтальмо-розацеа лікується спільно з офтальмологами. Призначають системні препарати: доксициклін 100-200 мг на добу (курс – 6-12 тижнів) і омега-3 ненасичені жирні кислоти, які підвищують секрецію мейбомієвих залоз. Місцево застосовують зволожуючі очні краплі (Штучна сльоза, Візин, Опти Фрі), очні краплі, що містять циклоспорин 0,05 %, дексаметазон 0,1 %, мазі з антибіотиками (еритроміцин, тетрациклін, Дексу-гентаміцин) [14].
З метою профілактики рецидивів розацеа рекомендують правильний догляд за чутливою шкірою та призначення фотопротекторних засобів, які знижують синтез вітаміну D, секрецію антимікробних пептидів і запобігають розвитку запалення в шкірі [45, 87]. Але Аравійська О. Р. (2008) вважає, що через підвищену чутливість шкіри хворих на розацеа, не всі засоби догляду можуть добре переноситися [3].
Отже, актуальність вирішення питання етіології, патогенезу, діагностики та лікування розацеа визначається достатньо високою питомою вагою цього дерматозу в структурі дерматологічних захворювань і потребує пошуку оптимальних діагностичних критеріїв та розробки комплексної терапії вищезазначеного захворювання. Тривалість лікування, частий розвиток рецидивів, недовготривалість ремісій та прогресування захворювання свідчать про недостатню ефективність терапії розацеа [8, 67, 81]. Підводячи підсумок аналізу літературних даних, можна зробити висновок, що незважаючи на різноманіття існуючих методів, терапія розацеа являє собою складне завдання, оскільки відомі засоби не завжди ефективно долають симптоми захворювання, а в деяких випадках погіршують його перебіг, супроводжуються рядом побічних ефектів і не позбавляють від рецидивів дерматозу [1, 46, 85]. Не має відомостей щодо досліджень особливостей клінічних проявів та перебігу рецидивів розацеа, діагностики та їх прогнозування. Враховуючи багатофакторність механізмів, що беруть участь у патогенезі розацеа, широку розповсюдженість дерматозу та часті рецидиви, актуальним є вивчення особливостей мікробіоценозу шкіри, імунного статусу і функції всіх органів і систем при даному захворюванні, що може допомогти здійснити підбір більш ефективної тактики лікування та профілактики, прогнозування рецидивів захворювання, а також досягти стійких ремісій.
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Матеріали дослідження
У період 2011-2015 рр. на базі кафедри дерматовенерології та косметології з курсом дерматовенерології та естетичної медицини ФПО Запорізького державного медичного університету в Запорізькому обласному клінічному шкірно-венерологічному диспансері нами було обстежено 80 хворих на розацеа у віці від 29 до 72 років, із яких 20 – хворі на вперше виявлений епізод розацеа, а 60 – хворі із рецидивом розацеа. Також дослідили 20 практично здорових людей, які склали контрольну групу, віком від 18 до 69 років. Перед початком дослідження всі хворі дали інформовану згоду на участь у проведеному дослідженні. Згідно із рекомендаціями діагностики й лікування розацеа та наказом МОЗ України № 312 від 08.05.2009 р., пацієнтам були проведені загальноклінічні, біохімічні, та мікроскопічні дослідження.
При роботі з хворими було чітко дотримано загальні вимоги та положення щодо біоетики, схвалені Першим національним конгресом з біоетики (Київ, 2001), а також за узгодженням Етичного комітету Запорізького державного медичного університету. Діагноз дерматологічного захворювання встановлювався у відповідності до рекомендованих стандартів, затверджених МОЗ України на підставі даних клінічного обстеження та показників загальних лабораторних досліджень.
У дослідження залучалися хворі з наявністю проявів, характерних для розацеа (транзиторна еритема, постійна еритема, телеангіектазії, папули, пустули, набряк, сухість шкіри, відчуття свербежу й печіння, офтальморозацеа, фіматозні зміни), зі згодою на участь у дослідженні [22, 42, 48, 63, 110].
Вилучалися з дослідження пацієнти, що одночасно брали участь в інших клінічних дослідженнях, хворі із тяжкими проявами супутньої патології у стадії декомпенсації, вагітні й годуючі, пацієнти із психічними захворюваннями, туберкульозом, ВІЛ-інфекцією.
2.2 Загальні клініко-лабораторні дослідження
У хворих на розацеа проводилися наступні дослідження, які рекомендовані нормативним актом МОЗ України. Вивчалися скарги, анамнез захворювання та життя, сімейний анамнез, проводилося об’єктивне дослідження. При зборі анамнезу виявлявся перебіг захворювання, розповсюдженість та давність процесу. Досліджувалася динаміка розвитку та регресування проявів, характеру дерматозу, рецидування, сезонності, характеру попередньої терапії та її ефективність, наявності ускладнень. З’ясовували алергоанамнез, перенесені та супутні захворювання, професійна діяльність, можливі причини виникнення та рецидивування. Також з’ясовували стан дихальної, серцево-судинної, шлунково-кишкової, сечостатевої та опорнорухової систем. Вивчали показники стану рогового шару, фолікулів, придатків шкіри. При загальному клінічному дослідженні хворих проводили моніторинг функціонального стану ВНС, а саме: реактивність адренергічних та холінергічних структур за допомогою вимірювання артеріального тиску, підрахування швидкості пульсу, місцевого та рефлекторного дермографізму, пітливості. Виявляли наявність жалоб на відчуття приливів, головний біль, оніміння, ознобу, парестезій, порушення сну. Вивчали функціональний стан симпатичної та парасимпатичного відділів ВНС, через яку реалізує свій вплив на периферії центральної нервовї системи. При дослідженні клінічних проявів особливу увагу приділяли локалізації, поширеності та характеру патологічного процесу [48].
Ступінь важкості дерматозу оцінювали методом шкали діагностичної оцінки розацеа (ШДОР), запропонований В.П. Адаскевичем (2004), що ґрунтується на врахуванні типових ознак розацеа (папул та пустул,еритеми, телеангіоектазій, сухості шкіри, печії та поколювання шкіри, набряку обличчя, офтальморозацеа) [2]. Висипи й ознаки підраховували та оцінювали разом за чотирьохбальною шкалою до та через місяць після початку лікування. Оцінюючи еритему враховували її вираженість: відсутність – 0; легка – 1; помірна – 2; тяжка – 3. Оцінюючи телеангіоектазії враховували їх відсутність – 0; слабку (присутність тонких судин менших від 0,2 мм, які займають менше 10 % обличчя) – 1; помірну (декілька тонких судин та/або декілька більш крупних діаметром більше від 0,2 мм, які займають від 10 до 30 % обличчя) – 2; виражена – безліч дрібних судин та/або крупних судин, які займають більше 30 % обличчя – 3. Кількість папул і пустул (менше 10 – 0; від 11 до 20 – 1; від 21 до 30 – 2; понад 30 – 3). Набряк обличчя: наявність, слабка, помірна, м’яка, сильна, персистуюча вираженість. Сухість шкіри та лущення: відсутність – 0; слабка – 1; помірна – 2; сильна – 3. Офтальморозацеа: відсутня – 0; гіперемія кон’юнктиви повік, відчуття печії, свербіжу, чужорідного тіла – 1; кон’юнктивіт, гіперемія периорбітальної ділянки – 2; кератіт, виразка роговиці, перикорнеальна ін’єкція судин склери, халазіон – 3. Максимальна кількість балів, що вказуює на тяжкий перебіг розацеа, становила 21. Пацієнти із середнім ступенем тяжкості захворювання мали від 13 балів, а при важкому ступені – від 18 балів.
До та після лікування були проведені такі лабораторні дослідження: загально-клінічний аналіз крові, сечі, аналіз калу на яйця гельмінтів, основні біохімічні (загальний білок, альбумін, білкові фракції, глюкоза, білірубін, тимолова проба, аланінамінотрансфераза (АлАТ), аспартатамінотрансфераза (АсАТ), загальний холестерин, холестерин ЛПВЩ, холестерин ЛПНЩ, тригліцериди) та серологічні (реакція мікропреципітації та Вассермана) аналізи крові, флюорографічне дослідження. При інтерпретації результатів загально лабораторних досліджень за міжнародною системою СІ, за норму приймали: рівень гемоглобіну – 120–170 г/л, кількість еритроцитів – 3,4–5,8×1012/л, кольоровий показник – 0,9–1,05, кількість лейкоцитів – 3,9–10×109/л, швидкість осідання еритроцитів – <10–15 мм/год; показники лейкоцитарної формули: мієлоцити – 0 %, нейтрофіли паличкоядерні – 1-6 %, нейтрофіли сегментоядерні – 50-70 %, еозинофіли – 0-5 %, базофіли – 0-1 %, лімфоцити – 17-40 %, моноцити – 3-9 %, загальний білок – 65-83г/л, альбумін – 38-54 г/л, глобулін – 20-30 г/л, альбуміно-глобуліновий коефіцієнт – 1,2-2,0; глюкоза крові – 3-6 ммоль/л; білірубін загальний – 8,5-22,5 мкмоль/л, тимолова проба – 0-4 Sh, γ-глутамілтранспептидаза – 7-32 (жінки)/11-50 (чоловіки); АлАТ – 3-42 Од/л, АсАТ 8-37 Од/л; загальний холестерин – 3,9-6,2 ммоль/л; холестерин ЛПВЩ – 1,04-1,55 мкмоль/л, холестерин ЛПНЩ – 0-2,59 мкмоль/л, тригліцериди – 0–1,7 мкмоль/л.
При дослідженні гомеостазу проводили підрахунок тромбоцитів у мазках крові за загальноприйнятими методиками із використанням гематологічного аналізатора Кулмера [7, 108].
При наявності офтальморозацеа хворі були консультовані офтальмологом. За необхідністю, хворі направлялися на консультацію до суміжних спеціалістів (терапевта, ендокринолога, гастроентеролога, гінеколога, отоларинголога, невропатолога та інших фахівців) з метою виявлення та лікування патології інших органів та систем. Отримані результати обстеження були підставою для об’єктивної порівняльної оцінки наявності супутньої патології у хворих.
Дерматоз діагностували на підставі аналізу результатів, отриманих при з’ясуванні скарг, анамнезу захворювання та життя, клінічних проявів та лабораторних обстежень хворих. При з’ясуванні анамнестичних даних особливу увагу приділяли вивченню питань стосовно шкідливих звичок, можливих особливостей спадковості, а також алергологічного анамнезу.
2.3 Біохімічні дослідження
Редуктометричним методом за Хагедорном-Йенсеном було вивчено рівень глюкози крові; за методом Райтмана та Френкеля – показники активності ферментів АсАТ та АлАТ; за методом Єндрашика – загальний білірубін; загальний білок за біуретовою реакцією; за методом електрофорезу на папері білковы фракції; за методом Маклагана – тимолової проби; за методом Бурштейна та Самай – ліпопротеїди [7, 108].
2.4 Методика дослідження на наявність Demodex folliculorum
У всіх хворих проводили мікроскопічне дослідження патологічного матеріалу, взятого з ділянок запального процесу на наявність паразитів – D. folliculorum та D. brevis. При цьому залежно від клінічної форми дерматозу матеріалом для дослідження були лусочки, гній пустул, кірки, вміст вивідних протоків сальних залоз шкіри в ділянках запального процесу. Треба відмітити, що не існує загальноприйнятої методології забору патологічного матеріалу та проведення мікроскопічного дослідження на виявлення кліщів роду Demodex.
У лабораторії попередньо для розрихлення епідермісу на ділянку ураженої шкіри обличчя наносили суміш із 5 % розчину саліцилової кислоти, 20 % розчину димексиду та 25 % розчину молочної кислоти в гліцерині. Далі приклеювали шматочок липкої стрічки, а через 5 хвилин його відривали й під мікроскопом визначали кількість кліщів на ділянці ураженої шкіри, площа якої становить 1 см2. Крім того, враховуючи паразитування кліщів у сально-волосяних фолікулах, для отримання матеріалу з вивідних протоків сальних залоз застосовували ложечку Фолькмана. Виявлення кліщів при мікроскопічному дослідженні у чисельності 5 і більше осіб на 1 см2 вважали визначальним діагностичним критерієм для встановлення супутнього діагнозу демодекоз. При цьому враховували як зрілі паразити так, і наявність їх яєць, личинок та німф.
2.5 Методика мікроскопічного та культурального дослідження мікрофлори уражених ділянок шкіри
Мікроскопічне та культуральне дослідження для виявлення бактерій та грибів проводили у всіх досліджуваних хворих за загальноприйнятими методиками, згідно наказу № 535 МОЗ від 22.04.1985 “Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений”. Перед проведенням лабораторного мікробіологічного дослідження хворим рекомендували не використовувати системних препаратів та місцевих дезінфікуючих засобів, які мають антисептичні властивості.
Матеріалом для дослідження мікробіоценозу шкіри були лусочки, вміст папул та пустул, вміст вивідних протоків сальних залоз з ураженої ділянки шкіри. Взяття матеріалу проводилось при дотриманні правил асептики. Лусочки шкіри зішкрібали скальпелем. Посіви в контрольній групі й у тих пацієнтів, у яких були відсутні пустули в ділянці обличчя, бралися з ділянок клінічно здорової шкіри. Узятий матеріал розміщували на предметне скло, наносили на нього краплю 10-20 % розчину їдкого лугу (КОН), та після просвітлення мікроскопіювали при малому та великому збільшенні.
Методом відбитків, кількісним культуральним дослідженням вивчали склад мікрофлори ураженої шкіри. Матеріал дослідження (лусочки, папули та пустули) збирали стерильним ватним тампоном круговими рухами від центру до периферії ураженої ділянки шкіри. Використовували тампон із агар-гелем – транспортним середовищем лабораторного виготовлення, який упродовж 24 годин доставлявся в лабораторію у спеціальних металевих контейнерах для транспортування. У лабораторії матеріал культивували в аеробних та анаеробних умовах при температурі 37ºС протягом 48-72 годин, використовуючи стандартні мікробіологічні тести для визначення наявності бактеріальних організмів й диференціювання стафілококів, мікрококів і пов’язаних з ними видів. Для визначення видів мікроорганізмів проводили пересів на біохімічні тестові середовища. Висівання для дослідження грибів проводили на середовище Сабуро, яка містить глюкозу (з додаванням хлортетрацикліну гідрохлориду або левоміцетину 100 ОД на 1 мл середовища) чи агар Диксона (під пласт 0,5-5,0 мл стерильної оливкової олії таким чином, щоб вона рівномірно розподілялася по поверхні засіву). Розміщували пробірки під нахилом і інкубували в такому положенні при t=+35–37 0С впродовж 5 днів з ідентифікацією отриманих культур загальноприйнятими методами. Підрахунок колоній виявленого росту на чашці Петрі по методу Голду дозволив отримати кількісний вміст мікроорганізмів. Обчислення проводили за наступними критеріями: I- норма; II – слабкий ріст (<104/см2); III – помірний ріст (104-106/см2); IV – сильний ріст (>106/см2). Діагностично значущим вважали виявлення у хворих досить високого (не менш 8×105) рівня колонієутворюючих одиниць (КУО) на см2.
Відмічали, чи ростуть мікроорганізми у вигляді монокультури або в асоціації. При виявленні асоціації на щільному поживному середовищі відмічали перевагу росту представника асоціації.
Стандартизовані тести чутливості до антибіотиків проводилися після завершення видового визначення патогенів, інтерпретацію отриманих результатів проводили згідно наказу № 167 МОЗ України від 05.04.2007 Про затвердження методичних вказівок “Визначення чутливості мікроорганізмів до антибактеріальних препаратів”.
За формою 209/0 після виконання всіх маніпуляцій, до журналу заносилися результати, а також інші дані.
2.6 Імунологічні дослідження
Визначення імунного стану хворих проводили на основі аналізу результатів імунологічних тестів, у яких визначали загальну та відносну кількість лейкоцитів, лейкоцитарну формулу, фенотип лімфоцитів (абсолютне число та відносна кількість), функціональну активність В-лімфоцитів (вміст сироваткових Ig A, M, G), фагоцитуючих клітин [фагоцитарна активність нейтрофілів, нітросиній-тетразолієвий тест (НСТ‑тест)], а також IL-10 та IL-12.
Уніфікованим методом підрахунку в рахунковій камері проводили дослідження загальної та відносної кількості лейкоцитів; уніфікованим методом морфологічного дослідження формених елементів крові в мазках крові – дослідження лейкоцитарної формули; методом імунофенотипування клітин крові по диференціювальним агентам (так званим CD-рецепторам – сlaster of differentiation receptors) за допомогою моноклональних антитіл антитіл набору «Клоноспектр» (виробництва Росії) – фенотипування лімфоцитів. Непряма реакція поверхневої імунофлюоресценції виконувалася безпосередньо на цільній крові (100 мл). Дослідження проводили згідно інструкції з використанням наборів. Обчислення результатів реакції проводили за допомогою методу флуоресцентної мікроскопії [29]. По відносній кількості визначали: вміст лімфоцитів з Т-хелперною функцією (CD4+); вміст лімфоцитів з супресорною функцією – Т-цитотоксичних клітин (CD8+); вміст лімфоцитів з кілерною функцією (CD16+); вміст В-лімфоцитів (CD22+); індекс CD4+/CD8+ (дозволяв оцінювати вплив імуноадгезивних властивостей мембран регулюючих субпопуляцій Т-лімфоцитів на формування імунної відповіді – регуляторні властивості ланки Т-лімфоцитів).
Шляхом оцінювання фагоцитарної активності поліморфно-ядерних лейкоцитів периферичної крові й бактерицидної активності фагоцитуючих клітин за відновленням у них безколірного тетразолію нітросинього в фармазан – НСТ-тест, досліджували функціональну активність поліморфно-ядерних лейкоцитів:
а) за рівнем захоплення поліморфно-ядерними лейкоцитами фіксованих клітин пекарських дріжджів (0,05 % суспензії у розчині Хенкса) мікрометодом за загальноприйнятою методикою із встановленням: фагоцитарного індексу (ФІ) – відсотка клітин, які вступили до фагоцитозу; фагоцитарного числа (ФЧ) – середнього числа фагоцитованних клітин у фагоциті оцінювали фагоцитарну активність нейтрофілів периферичної крові;
б) за допомогою НСТ-тесту (мікрометод за загальноприйнятою методикою) виявляли бактерицидну активність фагоцитуючих клітин. Оцінювали число фагоцитів, які вміщують гранули диформазану в забарвлених метиленовим синім препаратах (НСТ-позитивних клітин) [49].
Шляхом встановлення складу Ig A, M, G у сироватці крові досліджували функціональну активність В-лімфоцитів. Загальний вміст Ig A, M, G визначали методом прямої радіальної імунодифузії в гелі за допомогою моноспецифічних діагностичних сироваток до Ig цих класів (виробництва Росії) відносно контрольної людської сироватки крові із відомим вмістом Ig за методом Манчині [29, 37, 38].
Концентрацію IL-10 і IL-12 аналізували в сироватці крові кількісно, методом твердофазного імуноферментного аналізу [43] за допомогою стандартних наборів реагентів (IL-10 – фірми «Bender MedSystems Gmbh», Австрія, (ТОВ «ДИАМЕБ», Україна); (IL-12 – фірми «Invitrogen», США (ТОВ «ДИАМЕБ», ТОВ «БиоТехЛаб-С», Україна). Контрольну групу для визначення IL складали дані 12 практично здорових осіб (за референтні значення приймалися: IL-10 – 0,39-25,0 пг/мл, середній рівень складав 6,60 пг/мл при стандартному відхиленні 3,20 пг/мл; IL-12 – 7,80-502,00 пг/мл, середня рівень складав 71,27 пг/мл при стандартному відхиленні 28,4 пг/мл).
2.7 Методи дослідження психологічного статусу хворих
Для встановлення у пацієнтів симптомів тривожності та невротичних розладів при визначенні психологічного статусу, використовували стандартизовані оціночні тести-опитувальники, які містять твердження, що дозволяють дослідити ступень вираженості й клінічні особливості психологічних порушень.
Психологічний стан у хворих на розацеа досліджували за допомогою тестів за шкалою тривоги Гамільтона (ШТГ) HARS (Hamilton Anxiety Rating Scale) та за шкалою депресії Зунге (ШДЗ) – адаптація Т. І. Балашової [74, 91, 95].
ШТГ розроблена для об’єктивної оцінки наявності та вираженості тривожності та психоемоційної напруги пацієнта, яка характеризується емоціями занепокоєння, нервозності, що супроводжується активацією ВНС. Шкала складалася з 14 питань. При тестуванні пацієнт повинен був відповісти на перелік питань, оцінюючи кожний пункт шкали за наступними критеріями: 0 – відсутність, 1 – в слабкій мірі, 2 – помірні, 3 – в тяжкому ступені, 4 – в дуже тяжкому ступені (табл. 2.1).
Таблиця 2.1 – Шкала тривоги Гамільтона
| № | Питання | Відповідь |
| 1 | 2 | 3 |
| 1 | Тривожний настрій (заклопотаність, очікування найгіршого, тривожні переживання, побоювання, дратівливість) | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 2 | Напруга (відчуття напруги, здригання, легко виникає плаксивісь, тремтіння, відчуття занепокоєння, нездатність розслабитися) | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 3 | Страхи (темряви, незнайомців, самотності, тварин, натовпу, транспорту) | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 4 | Інсомнія (труднощі засинання, переривчастий сон, що не приносить відпочинку, відчуття разбитості і слабкості при пробужденні, кошмарні сни). | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 5 | Інтелектуальні порушення (труднощі концентрації уваги, погіршення пам’яті) | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 6 | Депресивний настрій (втрата звичних інтересів, відчуття задоволення від хобі, подавленість, вранішнє пробудження, добові коливання настрою) | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 7 | Соматичні мязові симптоми (болі, посмикування, напруга, судоми клонічні, скрипіння зубами, зривається голос, підвищений м’язовий тонус) | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 8 | Соматичні сенсорні симптоми (дзвін у вухах, нечіткість зору, приливи жару і холоду, відчуття слабкості, поколювання). | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 9 | Серцево-судинні симптоми (тахікардія, сердцебиття, біль у грудях, пульсація в судинах, часті зітхання) | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 10 | Респіраторні симптоми (тиск і стиснення в грудях, задуха, часті зітхання) | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 11 | Гастроінтестінальні симптоми (затруднене ковтання, метеоризм, болі в животі, ізжога, відчуття переповненого шлунка, нудота, блювота, гурчання у животі, діарея, закрепи, знижение ваги тіла) | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 12 | Статеві симптоми (прискорене сечовипускання, сильні позиви на сечовипускання, аменорея, менорагія, фригідність, передчасна еякуляція, втрата лібідо, імпотенція). | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 13 | Вегетативні симптоми (сухість у роті, почервоніння або блідість шкіри, пітливість, головні болі з відчуттям напруги). | Відсутність У слабкій мірі Помірні У тяжкій мірі |
| 14 | Поведінка при огляді (совання на стільці, неспокійна жестикуляція й хода, тремор, нахмурювання особи, напружений вираз обличчя, зітхання або прискорене дихання, часте ковтання слини) | Відсутність У слабкій мірі Помірні У тяжкій мірі |
Оцінювання результатів: 0-7 балів – відсутність тривоги; 8-19 балів – помірна тривожність; більше 20 балів – виражений тривожний стан.
ШДЗ використовували для оцінки наявності та вираженості депресії, за якою пацієнт відповідав на перелік питань, які оцінювались від 1 до 4 балів (табл. 2.2).
Таблиця 2.2 – Шкала депресії Зунге
| № | Питання | Ніколи | Інколи | Часто | Постійно |
| 1 | 2 | 3 | 4 | 5 | 6 |
| 1 | Я відчуваю пригніченість | 1 | 2 | 3 | 4 |
| 2 | Вранці я відчуваю себе найкраще | 4 | 3 | 2 | 1 |
| 3 | У мене бувають періоди плачу або близькості до сліз | 1 | 2 | 3 | 4 |
| 4 | У мене поганий нічний сон | 1 | 2 | 3 | 4 |
| 5 | Апетит у мене не гірший звичайного | 4 | 3 | 2 | 1 |
| 6 | Мені приємно спілкуватися з привабливими особами протилежної статі | 4 | 3 | 2 | 1 |
| 7 | Я помічаю, що втрачаю вагу | 1 | 2 | 3 | 4 |
| 8 | Мене турбують закрепи | 1 | 2 | 3 | 4 |
| 9 | Серце б’ється швидше, ніж зазвичай | 1 | 2 | 3 | 4 |
| 10 | Я втомлююся без всяких причин | 1 | 2 | 3 | 4 |
| 11 | Я мислю так само ясно, як завжди | 4 | 3 | 2 | 1 |
| 12 | Мені легко робити те, що я вмію | 4 | 3 | 2 | 1 |
| 13 | Відчуваю неспокій і не можу всидіти на місці | 1 | 2 | 3 | 4 |
| 14 | У мене є надії на майбутнє | 4 | 3 | 2 | 1 |
| 15 | Я більш дратівливий, ніж зазвичай | 1 | 2 | 3 | 4 |
| 16 | Мені легко приймати рішення | 4 | 3 | 2 | 1 |
| 17 | Я відчуваю, що корисний і необхідний людям | 4 | 3 | 2 | 1 |
| 18 | Я живу досить повним життям | 4 | 3 | 2 | 1 |
| 19 | Я відчуваю, що іншим людям стане краще, якщо я помру | 1 | 2 | 3 | 4 |
| 20 | Мене досі радує те, що тішило завжди | 4 | 3 | 2 | 1 |
Результати оцінки поділяли на чотири числові діапазони: 20-49 – нормальний стан, 50-59 – стан легкої депресії, 60-69 – помірний депресивний стан, 70 и вище – тяжка форма депресії.
За наявність невротичних розладів свідчили дані, отримані за допомогою тестування за ШТГ ≥ 8 та за ШДЗ ≥ 50.
2.8 Дослідження варіабельності серцевого ритму
Вивчення ВСР здійснювали за використанням системи компютерної кардіографії «Cardiolab» комплектації НТЦ «ХАІ-Медіком» (м. Харків). Протягом 24 годин до початку дослідження пацієнти не вживали кави, алкоголю і не приймали лікарських препаратів. На екрані монітору відображалася електрокардіограма (ЕКГ), яка реєструвалася у трьох стандартних відведеннях, потім вибиралася активна ЕКГ по одному відведенню. У якості активного відведення вибиралося відведення з максимальною амплітудою R-піка й мінімальним рівнем перешкод. З метою дослідження вегетативного забезпечення діяльності та вегетативної реактивності організму проводили реєстрацію ЕКГ протягом 10 хвилин у розслабленому стані й лежачому положенні хворого після 15-хвилинної адаптації та в активній кліноортостатичній пробі. Також за спеціальною програмою проводили подальшу обробку даних [82]. Так, стан вегетативної регуляції серцево-судинної системи оцінювали за показниками: ВАР – варіаційний розмах RR інтервалів (мс); АМо – амплітуда моди (%); Мо – мода (с); ІН – індекс напруги регуляторних систем (ум. од.). Аналіз та оцінку частотних компонентів серцевого ритму проводили шляхом дослідження спектральних показників ВСР: SDNN – середнє квадратичне відхилення інтервалів RR (мс), TP – загальна потужність спектра 0,000-0,400 Гц (мс²), VLF – потужність у діапазоні дуже низьких частот 0,02-0,05 Гц (мс²), LF – потужність в диапазоні низьких частот, біля 0,1 Гц (амплітуда яких залежить від рівня як парасимпатичних, так і симпатичних впливів на серце); HF – потужність у діапазоні високих частот (мс²), що обумовлена модуляцією тонусу вагуса під час дихання, а їх амплітуда залежить від рівня тонічних парасимпатичних впливів; LF/HF – індекс вегетативного балансу (ум. од.) [11, 103].
2.9 Статистична обробка отриманих результатів
Отримані результати аналізували за допомогою комп’ютерних програм з використанням сучасних методів варіаційної статистики із використанням ліцензійної програми «Statistica for Windows 6,0» (StatSoft Inc., №AXXR712D833214FAN5), із урахуванням сучасних вимог до статистичної обробки медичної інформації із використанням непарного t-крітерія Стюдента, із визначенням М (середньої арифметичної) та m (стандартної похибки середньої арифметичної), що дозволило визначити ступінь, достовірність показників, кореляційні зв’язки результатів обстеження хворих різних груп. Різниця вважалась статистично вірогідною при p<0,05. Достовірність непараметричних показників виявляли методом Шеллінга- Вольфейля, за допомогою підрахунку c2 [80].
РОЗДІЛ 3
КЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ НА РОЗАЦЕА
3.1 Дані клінічних проявів, перебігу та загальних клініко-лабораторних досліджень
Досліджено 80 хворих на розацеа у віці від 29 до 72 років, середній вік – (41,1±16,4) років. Серед них було 54 жінки (67,5 %) та 26 чоловіків (32,5 %). Серед досліджуваних 20 пацієнтів (13 жінок та 7 чоловіків) була із вперше виявленою розацеа та 60 пацієнтів (41 жінок та 19 чоловіків) із рецидивами розацеа. Контрольна група складалася із 20 осіб (10 чоловіків та 10 жінок), які були практично здорові, не мали в анамнезі дерматологічної чи супутньої патології. За віком і демографічними показниками вони не відрізнялись від пацієнтів основної досліджувальної групи та були співставні за статевим та віковим складом із порівняльними групами.
При аналізі проведених досліджень було встановлено, що на розацеа хворіють переважно у віці старше 40 років (66 з 80 хворих – 82,5 %). Захворювання частіше реєстрували у пацієнтів жіночої статті, що співпадає з численними літературними даними (табл. 3.1, 3.2).
Таблиця 3.1 – Розподіл хворих на розацеа за статтю та віком
| Хворі на розацеа | Вік, роки | ||||||
| 21-30 | 31-40 | 41-50 | 51-60 | ˃60 | Разом | ||
| Чоловіки | абс. | 1 | 3 | 10 | 6 | 6 | 26 |
| % | 1,25 | 3,75 | 12,5 | 7,5 | 7,5 | 32,5 | |
| Жінки | абс. | 3 | 7 | 18 | 14 | 12 | 54 |
| % | 3,75 | 8,75 | 22,5 | 17,5 | 15 | 67,5 | |
| Всього | абс. | 4 | 10 | 28 | 20 | 18 | 80 |
| % | 5 | 12,5 | 35 | 25 | 22,5 | 100 | |
Таблиця 3.2 – Розподіл хворих на розацеа за статтю та віком та перебігом дерматозу
| Вік | Хворі | |||||||||||
| Вперше встановлений діагноз розацеа
(n=20) |
Рецидив розацеа
(n=60) |
|||||||||||
| Чоловіки | Жінки | Разом | Чоловіки | Жінки | Разом | |||||||
| абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | |
| 21-30 | – | – | 1 | 5 | 1 | 5 | 1 | 1,6 | 2 | 3,3 | 3 | 4,9 |
| 31-40 | 1 | 5 | 3 | 15 | 4 | 20 | 2 | 3,3 | 4 | 6,6 | 6 | 9,9 |
| 41-50 | 3 | 15 | 2 | 10 | 5 | 25 | 7 | 11,7 | 16 | 26,7 | 32 | 38,4 |
| 51-60 | 2 | 10 | 4 | 20 | 6 | 30 | 4 | 6,6 | 10 | 16,8 | 14 | 23,4 |
| >60 | 1 | 5 | 3 | 15 | 4 | 20 | 5 | 8,4 | 9 | 15 | 12 | 23,4 |
| Разом | 7 | 35 | 13 | 65 | 20 | 100 | 19 | 31,6 | 41 | 68,4 | 60 | 100 |
Усі хворі на розацеа скаржилися на висип у ділянці обличчя. У 5 з 20 хворих (25 %) з вперше виявленою розацеа та у 52 з 60 хворих (86,6 %) на рецидиви розацеа були суб’єктивні відчуття такі, як свербіння, печіння і поколювання, сухість шкіри із лущенням, відчуття приливів до обличчя, набряк обличчя, відчуття повзання мурашок, оніміння та стягнутість на поверхні ураженої шкіри, косметичний дефект, що, в свою чергу, викликали психоемоційні розлади у вигляді пригніченості настрою, роздратованості, замкнутості, неадекватності поведінки, конфліктності, безсоння, головного болю, які були більш [c2=5,2 (р<0,05)] суттєві у хворих із рецидивом дерматозу.
При об’єктивному дослідженні, у більшості [c2=4,3 (p<0,05)] хворих із рецидивом розацеа, на відміну від хворих із вперше встановленим діагнозом виявили коливання артеріального тиску (у 56 %), зміни швидкості пульсу (у 37 %), зміни місцевого та рефлекторного дермографізму (у 48 %), підвищену пітливість долоней і підошв (у 69 %), що є показниками функціональних порушень регулювань ВНС.
Клінічні прояви та перебіг розацеа характеризувався різноманітними особливостями, облік яких допомагав при призначенні терапії. Для аналізу клінічних особливостей була взята класифікація, що використовується у Європі та США, в основі якої лежить клініко-морфологічний принцип, згідно якого передбачається виділення еритематозно-телеангіоектатичної (судинної), папуло-пустульозної, інфільтративно-продуктивної форми та офтальморозацеа.
Як видно з табл. 3.3, серед досліджених пацієнтів у 18 (27,5 %) була діагностована еритематозна форма, у 53 (72,5 %) – папуло-пустульозна форма розацеа, у 4 (5 %) – інфільтративно-продуктивна форма розацеа та у 5 (6,25 %) – офтальморозацеа. У хворих з первинним епізодом розацеа частіше відзначалася судинна форма, а при рецидивах розацеа переважала папуло-пустульозна форма розацеа.
Таблиця 3.3 – Розподіл хворих за формою та перебігом розацеа
| Перебіг розацеа | Форма розацеа | Разом | ||||
| Судинна | Папуло-пусту-льозна | Інфільтра-тивно-продуктивна | Офтальмо-розацеа | |||
| Вперше встановлений діагноз розацеа
(n=20) |
абс. | 13 | 7 | 0 | 0 | 20 |
| % | 65 | 35 | 0 | 0 | 100 | |
| Рецидив розацеа
(n=60) |
абс. | 6 | 45 | 4 | 5 | 60 |
| % | 10 | 75 | 6,7 | 8,3 | 100 | |
Клінічні прояви у хворих розацеа характеризувалися появою центрофаціальної еритеми від рожевого до застійно-синюшного кольору, телеангіоектазій, папул і пустул, розташованими переважно на обличчі.
Еритематозно-телеангіоектатична (судинна) форма розацеа у 13 хворих (65 %) із вперше виявленою розацеа та у 6 хворих (10 %) із рецидивом, характеризувалася наявністю стійкої застійної еритеми різної інтенсивності забарвлення, локалізація якої у частини пацієнтів обмежувалася центральною частиною обличчя, а в більшості хворих була також на щоках, лобі та підборідді. При цьому хворі відмічали, що спочатку в них відмічалася епізодична еритема тривалістю від кількох хвилин до кількох годин, яка супроводжувалася відчуттям печіння, тепла, свербежу. Причину появи еритеми пацієнти пов’язували з прийомом гарячої їжі, алкоголю, а також з періодами емоційних збуджень. З часом еритема переходила в стійку, у зонах ураження утворювалася інфільтрація та виникали капілярні телеангіоектазії.
Папуло-пустульозна форма розацеа у (30 %) хворих із вперше виявленою розацеа та у (75 %) хворих із рецидивом, характеризувалася наявністю на обличчі персистуючої еритеми, телеангіоектазій, папул та пустул. Папули були напівсферичної форми, діаметром 3-5 мм, рожево-червоного кольору, з гладкою поверхнею, вкриті тонкими лусочками та мали щільно-еластичну консистенцію. Пустули були розміром 1-5 мм і були заповнені вмістом жовтуватого кольору. Висипні елементи мали схильність до групування, особливо в ділянці носа, лоба та підборіддя. При цьому утворювалися бляшки темно-червоного та синюшного кольору, на поверхні яких спостерігалися висипні елементи а також незначне лущення та гнійні або кров’янисто-гнійні кірки. Практично всі хворі скаржилися на відчуття печіння, свербежу у зоні локалізації запалення. Зливні папули й пустули реєструвалися у 26 (32,5 %) хворих, що в основному визначало тяжкість перебігу і спостерігалося при рецидивах захворювання.
Інфільтративно-продуктивна форма розацеа була діагностована лише у 4 хворих (6,7 %) із рецидивом дерматозу. При цій формі крім наявності еритеми, телеангіоектазії, папул, пустул спостерігалися також вузловаті елементи висипів, які мали запальний характер та локалізувалися переважно в ділянках носо-щічних зморшок, носа та підборіддя.
У хворих з ринофімою, крім запальних змін на шкірі обличчя, були виявлені зміни ділянки носа у вигляді асиметрії носа через бугристі розростання м’якої консистенції, синюшно-червоного кольору, а у ділянці носа спостерігалися численні телеангіоектазії та розширені устя сальних залоз.
Як видно з табл. 3.4 та 3.5, патологічний процес найчастіше локалізувався в ділянці щік та носо-губного трикутника. Еритема, телеангіоектазії та папули зустрічалися в різних ділянках обличчя, а пустули та вузли – переважали на щоках та носо-губному трикутнику. У 14 (17,5 %) хворих із рецидивом розацеа відзначалося ураження всієї шкіри обличчя та шкіри волосистої частини голови. Встановлено, що у досліджуваних хворих при рецидиві розацеа патологічний процес був більш (c2=9,4, р<0,01) виражений та поширений.
При аналізі тяжкості розацеа по ШДОР було встановлено, що серед хворих із рецидивом розацеа переважали пацієнти із середнім ступенем тяжкості (середній бал становив 10,4 ±1,5 у 49 (81,6 %) пацієнтів) та важким ступенем (середній бал – 17,2±1,8 у 7 (11,6 %) пацієнтів). У хворих із вперше встановленим епізодом розацеа частіше було виявлено легкий ступінь (середній бал – 5,4±1,1 у 17 (85 %) пацієнтів).
Перед тим, як хворі із рецидивом розацеа потрапили до нашого дослідження, вони попередньо проходили лікування, яке часто включало застосування традиційних схем терапії (переважно місцевої). Антибіотики системно приймали 31 (51,6 %) пацієнтів, місцево – 43 (71,6 %) пацієнтів, топічні місцеві кортикостероїди 18 (30 %) хворих. Метронідазол системно приймали 13 (21,6 %), а місцево 21 (35 %) пацієнтів. Разом з тим терапевтичний ефект після проведення відповідного лікування призводив до виникнення рецидивів та подальшого посилення тяжкості клінічних проявів, тобто був короткочасним або недостатнім. Перебіг розацеа у досліджених хворих частіше (c2=5,4, p<0,05) відмічався як прогредієнтно прогресуючий та рецидивуючий. Спонтанних ремісій в пацієнтів не було. Ремісії тривали в середньому 1-3 місяці та починалися тільки внаслідок проведення лікування.
Таблиця 3.4 – Розподіл хворих із вперше виявленою розацеа за проявами та локалізацією шкірного процесу (n=20)
| Локалізація | Клінічні прояви | |||||||||
| Еритема | Телеангіо-ектазії | Папули | Пустули | Вузли | ||||||
| абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | |
| Лоб | 6 | 30 | 4 | 20 | – | – | – | – | – | – |
| Периорбітальна ділянка | 5 | 25 | 1 | 5 | – | – | – | – | – | – |
| Щоки | 18 | 90 | 16 | 80 | 5 | 25 | – | – | – | – |
| Носогубний трикутник | 20 | 100 | 20 | 100 | 6 | 30 | – | – | – | – |
| Волосиста частина голови, вуха, шия | 2 | 10 | – | – | – | – | – | – | – | – |
Вивчали демографічні показники, які можуть бути віднесені до групи ризику розвитку захворювання та викликати більш тяжкий перебіг захворювання. Так, було встановлено, що 26 (25 %) пацієнтів проживали у сільський місцевості, 54 (67,5 %) – жили у місті; у шлюбі були 42 (52,5 %) пацієнта; постійну роботу мали 37 (46,2 %) чоловік, не постійну роботу 27 – (33,8 %) пацієнта; 6 (7,5 %) пацієнтів було у пошуках роботи; 18 (22,5 %) людей – пенсіонери.
Таблиця 3.5 – Розподіл хворих із рецидивом розацеа за проявами та локалізацією шкірного процесу
| Локалізація | Клінічні прояви | |||||||||
| Еритема | Телеангіо-ектазії | Папули | Пустули | Вузли | ||||||
| абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | |
| Лоб | 33 | 55 | 16 | 26,6 | 16 | 26,6 | 12 | 20 | 2 | 3,3 |
| Периорбітальна ділянка | 23 | 38,3 | 8 | 13,3 | 19 | 31,6 | 6 | 10 | – | – |
| Щоки | 56 | 93,3 | 60 | 100 | 60 | 100 | 51 | 85 | 4 | 6,6 |
| Носогубний трикутник | 60 | 100 | 60 | 100 | 60 | 100 | 54 | 90 | 4 | 6,6 |
| Волосиста частина голови, вуха, шия | 12 | 20 | 36 | 60 | 38 | 63,3 | 12 | 20 | 2 | 3,3 |
Вивчали фактори, що могли провокувати загострення чи рецидив дерматозу. Деякі хворі пов’язували розвиток чи загострення дерматозу з певною причиною (триггерними факторами), а саме: інтенсивна фізична активність (спостерігалась у 15 хворих – 19 %); стрес (у 46 пацієнтів – 58 %); використання косметичних або медикаментозних засобів (у 32 пациента – 40 %); тривала інсоляція (у 16 пациентів – 20 %), гостра їжа та алкоголь (у 27 пациентов – 34 %); горячі ванни, сауна (у 12 пациентов – 15 %). Ні з чим не пов’язують розвиток чи загострення розацеа 22 хворих (28 %). Хворі із рецидивом розацеа відмічали (c2=7,6, p<0,05) наявність водночас декількох факторів, що провокували захворювання. Основна маса обстежених (44 особи – 55 %) вказувала на сезонність загострень, переважно в літній період. У решти пацієнтів (36 людини – 45 %) чіткого зв'язку загострень з порами року простежити не вдалося.
При проведенні клінічного обстеження хворих на розацеа була виявлена супутня патологія, що представлена у табл. 3.6.
Таблиця 3.6 – Виявлення супутньої патології у досліджуваних хворих
| Супутні захворювання | Вперше виявленим епізодом розацеа (n=20) |
Рецидив розацеа
(n=60) |
Всього
(n=80) |
|||
| абс. | % | абс. | % | абс. | % | |
| Захворювання органів дихальної системи | 4 | 20 | 27 | 45 | 31 | 38,8 |
| Захворювання органів травлення | 7 | 35 | 34 | 56,7 | 41 | 51,3 |
| Захворювання органів сечостатевої системи | 3 | 15 | 16 | 26,6 | 19 | 23,8 |
| Захворювання органів серцево-судинної системи | 5 | 25 | 32 | 53,3 | 37 | 46,25 |
| Захворювання ендокринної системи | 2 | 10 | 13 | 21,6 | 17 | 21,6 |
| Захворювання нервової системи | 5 | 25 | 31 | 50 | 36 | 45 |
| Інші захворювання | 6 | 30 | 40 | 66,6 | 43 | 53,8 |
Як бачимо із таблиці 3.6, у хворих на розацеа, супутня патологія найчастіше супроводжувалась захворюваннями шлунково-кишкового тракту: хронічними гастритами, виразковою хворобою, хронічними холециститами, дискінезією жовчовивідних шляхів, колітами, гепатитом, панкреатитом, жировою дистрофією печінки; серцево-судинними захворюваннями – вегето-судинної дистонією, ішемічною хворобою серця, гіпертонічною хворобою, варикозною хворобою; захворюваннями дихальної системи – хронічними тонзилітами, бронхітами; захворюваннями сечостатевої системи – хронічними пієлонефритами, простатитами, аденомами передміхурової залози; гінекологічними захворюваннями; ендокринними порушеннями – проявами клімактеричного синдрому, аліментарним ожирінням, цукровим діабетом, тиріоедітом; захворюваннями нервової системи – вертеброневрологічними ураження, неврозами, депресивними станами; іншіми захворюваннями – оніхомікозом, мікозом гладкої шкіри, псоріазом, екземою, піодерміями. Отже видно, що у пацієнтів із рецидивами розацеа, захворюваність супутньою патологією була значно вищою та частішою (c2=7,8, p<0,05), ніж у пацієнтів із вперше виявленим епізодом розацеа.
З приводу супутніх захворювань більшість пацієнтів перебували на диспансерному обліку у суміжних фахівців та періодично, за показаннями, проходила рекомендовані ними курси лікування. Крім того, виявлення у значної частини хворих досить високого рівня супутньої патології диктувала на доцільність запровадження комплексного обстеження пацієнтів, із проведенням додаткових клініко-лабораторних досліджень та обов’язковими консультаціями лікарів суміжних спеціальностей. Адже своєчасне виявлення супутньої патології у хворих на розацеа є важливим у плані її значення у патогенезі та клінічному перебігу, а також має враховуватися при розробці тактики комплексного лікування та профілактики захворювання.
У 68 з 80 хворих серед перенесеної в минулому патології виявлялись інфекційні захворювання (грип, гострі респіраторні захворювання, дизентерія), дитячі інфекції (вітряна віспа, кір, скарлатина), запальні захворювання (тонзиліт, ангіна фурункульоз, апендицит) та захворювання шлунково-кишкового тракту (гастрит, виразкова хвороба, гепатит, холецистит, панкреатит). Виявлено, що саме хворі із рецидивами розацеа найбільш часто (c2=6,7, p<0,05) відзначали вищеперераховані раніше перенесені захворювання.
У 23 (28,7 %) хворих на розацеа страждали родичі. При генеалогічному дослідженні, встановлено, що у більшості пацієнтів з розацеа не спостерігалася наявність цього дерматозу у близьких родичів, що співпадає з даними сучасної медичної літератури. Але при більш глибокому аналізі, виявилось, що у багатьох рідних спостерігалося періодичне почервоніння обличчя та чутливісь шкіри, на що вони рідко звертали увагу.
При вивченні загальних аналізів крові виявлені незначні зміни у 8 хворих (10 %): гемоглобін був знижений у 7 хворих, лейкоцитоз – у 2 хворих, зниження еритроцитів – у 6, еозинофілія – у 6 хворих, підвищена швидкість осідання еритроцитів – у 10, що пов’язується з супутньою патологією. Загальний аналіз сечі у всіх пацієнтів був в межах норми. З боку інших загальних аналізів змін виявлено не було.
***
Отже, при порівняльному аналізі даних анамнезу та клінічних проявів досліджених хворих, встановлено, що у хворих із рецидивом розацеа виявлені особливості, які проявляються більш тяжким, прогредієнтним перебігом, резистентністю до стандартної терапії, нетривалими ремісіями та схильністю до повторного рецидивування, наявністю супутньої патології та порушень режиму і дієти.
Встановлено, що у 86,6 % хворих при рецидивах розацеа були суб’єктивні відчуття (свербіння, печіння і поколювання, стягнутість, сухість шкіри із лущенням, відчуття приливів до обличчя, набряк обличчя, відчуття повзання мурашок, оніміння) що, в свою чергу, викликали більш (c2=5,2, p<0,05) суттєві психоемоційні розлади, ніж у хворих з вперше виявленим епізодом розацеа.
При об’єктивному дослідженні, у більшості (c2=4,3, p<0,05) хворих із рецидивом розацеа, на відміну від хворих із вперше встановленим діагнозом, виявили коливання артеріального тиску (у 56 %), зміни швидкості пульсу (у 37 %), зміни місцевого та рефлекторного дермографізму (у 48 %), підвищену пітливість долоней і підошв (у 69 %), що є показниками функціональних порушень регулювань ВНС.
Більшість хворих (75 %) із рецидивом розацеа страждали на папуло-пустульозну форму, на відміну від того, що у 65 % хворих із вперше виявленою розацеа була встановлена еритематозно-телеангіоектатична форма.
У досліджених хворих із рецидивом розацеа патологічний процес був більш виражений та поширений, переважали пацієнти із середнім ступенем тяжкості за ШДОР (середній бал становив 10,4 ±1,5) у 49 (81,6 %) пацієнтів, а у хворих із вперше встановленим епізодом розацеа частіше виявляли легкий ступінь (середній бал – 5,4±1,1) у 17 (85 %) пацієнтів). У 14 (17,5 %) хворих при рецидиві розацеа відзначали ураження всієї шкіри обличчя та шкіри волосистої частини голови, що не відзначалося у хворих із уперше виявленою розацеа.
Ефект від попереднього лікування хворих із рецидивом розацеа відмічався як короткочасний або недостатній. Перебіг дерматозу був частіше (c2=5,46, p<0,05) прогредієнтно прогресуючий та рецидивуючий. Спонтанних ремісій у пацієнтів не було. Ремісії тривали в середньому 1-3 місяці та починалися тільки після проведення лікування.
У хворих із рецидивом розацеа захворюваність супутньою патологією була значно вищою, ніж у пацієнтів із вперше виявленим епізодом розацеа, та найчастіше (c2=7,8, p<0,05) супроводжувалася захворюваннями шлунково-кишкового тракту та серцево-судинною і інфекційною патологією. Лише хворі із рецидивом розацеа відмічали наявність (c2=7,6, p<0,05) водночас декількох факторів, що провокували захворювання та найчастіше (c2=6,7, p<0,05) вказували на раніше перенесені захворювання.
Таким чином, можна наголошувати на певних особливих відмінностях, що спостерігалися у хворих при рецидивах розацеа за даними клінічних проявів і перебігу, на які потрібно опиратися при виборі тактики лікування, та які можуть допомогти при прогнозуванні виникнення повторного рецидиву хвороби.
Результати цих досліджень були опубліковані в наступних публікаціях:
1. Василенко А.В. Особенности клинических проявлений, течения и лечение розацеа с учетом психоэмоционального состояния больных с использованием транквилизаторов / А.В. Василенко // Дерматовенерологія. Косметологія. Сексопатологія. – 2012. – № 1-4. – С. 230–234.
2. Корецкая Е. Ю. Угревая болезнь и розацеозы / Е. Ю. Корецкая, А. В. Василенко, В. А. Бочаров // Воспалительно-репаративный процесс при дерматозах: монография / под ред. В. А. Бочарова. – Запорожье: «Просвіта», 2011. – С. 143–155.
3. Взаємний вплив метаболітів мікробного походження та клітин організму в розвитку запалення / О. Ю. Корецька, В. Є. Гладчук, Г. В. Пугач, А. В. Василенко, Д. В. Масло // Актуальні проблеми клініки, профілактики ВІЛ-інфекції і захворювань з парентеральним шляхом передачі: матеріали науково-практичної конференції з міжнародною участю, м. Харків, 20–21 жовтня 2011 р. – Харків, 2011. – С. 157–158.
4. Особенности развития инфекционных процессов при поражениях кожи / В. П. Федотов, А. В. Веретельник, А. В. Головкин, Н. Ю. Резниченко, Е. Ю. Корецкая, А. В. Пугач,А. В. Василенко [и др.] // Фармакологія: сучасні тенденції розвитку та ретроспективи: матеріали науково-практичної конференції, м. Одеса, 14 вересня 2012 р. – Одеса, 2012. – С. 44–48.
РОЗДІЛ 4
ОСОБЛИВОВОСТІ ПАТОГЕНЕТИЧНИХ ПОРУШЕНЬ У ХВОРИХ
ІЗ РЕЦИДИВОМ РОЗАЦЕА
Для вивчення особливостей порушень деяких патогенетичних механізмів рецидивів у хворих на розацеа були проведені основні функціональні та лабораторні дослідження.
4.1 Показники біохімічного дослідження у хворих із рецидивом розацеа до лікування
Результати проведеного біохімічного дослідження у хворих із рецидивом розацеа представлені в таблиці 4.1.
Як свідчать дані таблиці 4.1, у хворих на розацеа, на відміну від здорових осіб, порушення виявлялись значно частіше. В основній групі з рецидивами розацеа порушення були ще більш (c2=5,2, p<0,05) показні, а саме: зниження рівня загального білка (у 34 (56,6 %) хворих), збільшення загального білірубіну (у 12 (20 %) хворих), зміни активності ферментів АлАТ та АсАТ (у 28 (46,6 %) хворих). У цих хворих було виявлено зміни у ліпідному обміні, зокрема показники холестерину ЛПНЩ були достовірно (р<0,05) вищими майже у 58 (96,6 %) хворих рецидивами розацеа. Рівень тригліцеридів також був підвищен у 32 (53,3 %) хворих із рецидивом розацеа.
4.2 Мікробіоценоз ураженої шкіри у хворих при рецидиві розацеа
Вивчено мікробний пейзаж шкіри обличчя у 80 хворих на розацеа з вогнищ ураження шкіри до лікування. Контрольну групу складали 20 практично здорових осіб. У хворих групи контролю матеріал для аналізу брали з тих самих ділянок шкіри, що й у хворих на розацеа.
Таблиця 4.1 – Біохімічні показники у хворих на розацеа на початку дослідження
| Показники | Хворі з первинним епізодом розацеа
(n=20) |
Хворі із рецидивом розацеа
(n=60) |
Контрольна група – практично здорові люди
(n=20) |
| Загальний білок (65-83 г/л) | 72,6±3,2 | 62,3±2,4* | 74,3±4,8 |
| Альбумін (38-54 г/л) | 41,1±4,2 | 37,6±3,5 | 43,2±4,2 |
| Глобулін (20-30 г/л) | 21,3±2,4 | 21,1±2,6 | 24,4±3,2 |
| Глюкоза (3-6 ммоль/л) | 5,7±1,2 | 6,6±1,8* | 5,2±0,4 |
| Білірубін загальний
(8,5-25,5 мкмоль/л) |
17,4±1,2 | 19,3±2,4 | 16,7±1,4 |
| Тимолова проба (0-4 Sh) | 0,86±0,3 | 0,93±0,4 | 0,84±0,4 |
| АлАТ (3-42 Од/л) | 31,4±2,5* | 43,2±3,4*, ** | 24,5±2,3 |
| АсАТ (8-37 Од/л) | 24,2±3,4* | 38,3±3,2*, ** | 17,3±3,6 |
| Холестерин (3,9-6,2 ммоль/л) | 6,8±0,2 | 6,4±0,2* | 4,52±0,3 |
| Холестерин ЛПВЩ
(1,04-1,55 мкмоль/л) |
1,14±0,3 | 1,25±0,4 | 1,27±0,4 |
| Холестерин ЛПНЩ
(0-2,59 мкмоль/л) |
3,21±0,2 | 4,83±0,4*, ** | 2,52±0,2 |
| Тригліцериди (0-1,7 ммоль/л) | 1,4±0,2 | 1,9±0,1*, ** | 1,3±0,2 |
Примітки:
* – p<0,05 при порівнянні з групою контролю;
** – р<0,05 при порівнянні з групою з уперше виявленим дерматозом
У людей групи контролю мікрофлора шкіри обличчя складалася із 47 штамів мікроорганізмів з 6 родів та 11 видів. Найбільш численними представниками мікрофлори шкіри цієї ділянки були коки: сімейство Micrococcaceae [(56,3±6,4) %]: рід Staphylococcus [(32,4±4,1) %] – 21 штам, який був представлен S. aureus, S. saprophiticus, S. еpidermidis та ін. Рід Streptococcus був представлен негемолітичним стрептококом [(6,4±2,1) %] – 5 штамів. Рід Mіcrococcus представлен 8 штамами [(12,4±1,2) %], Рід Corinebacterium [(14,2±1,4) %] – 6 штамів, дріжжеподібні гриби [(12,4±1,8) %] – 7 штамів: рід Malassezia – M. furfur [(9,6±0,5) %] – 5 штамів, а також рід Candida – C. albicans [(5,2±0,3) %] – 2 штами. Інтенсивність колонізації мікроорганізмів у пробах шкіри складала 101-103 КУО/см2. Стерильні посіви були у (43,6±5,2) % досліджених. Асоціації мікроорганізмів виявлено у 11,3±7,4 % обстежених.
При дослідженні мікробіоценозу ураженої шкіри обличчя хворих первинним епізодом розацеа, було виявлено 80 штамів мікроорганізмів, який складався з 6 родів та 12 видів. Рід Staphylococcus [(36,1±2,3) %] – 32 штами (S. aureus [(9,6±2,4) %] – 5 штамів, S. epidermidis [(4,7±3,2) %] – 11 штамів, S. haemolyticus [(3,4±1,3) %] – 16 штамів). Рід Streptococcus представлено S. haemoliticus [(4,2±2,5) %] – 12 штамів]; Грамнегативні палички, рід Enterococcus [(4,7±3,4) %] – 8 штамів]. Дріжджеподібні гриби роду Malassezia складали 11 штамів (55,2±4,2)%; гриби году Сandida [(9,3±4,2) % – 4 штами]. Інтенсивність колонізації проб шкіри була у 103-106 КУО/см2. Стерильних посівів було (16,4±2,3) %. Асоціації мікроорганізмів виявлено у 23,4±5,3 %.
Під час рецидивів розацеа було виявлено 113 штам мікроорганізмів, який складався з 7 родів та 12 видів. Рід Staphylococcus [(56,8±4,5) %] – 58 штами, у який входили S. aureus [(15,3±4,6) %] – 28 штамів, S. epidermidis [(10,5±4,8) %] – 14 штамів та S. haemolyticus [(7,5±4,7) % – 16 штамів. Рід Streptococcus представлено S. haemoliticus [(6,5±4,7) % – 9 штамів]. Рід Micrococcae становив (61,4±6,3) % – 8 штамів; грамнегативні палички, рід Enterococcus [(8,3±2,5) % – 7 штамів]. Рід Corinebacterium становив [(15,4±2,3 %) – 12 штамів]. Дріжджеподібні гриби роду Malassezia складали [13 штамів (75,3±3,7)%]; гриби году Сandida [(12,4±2,1) % – 6 штамів]. Інтенсивність колонізації проб шкіри складала 107-109 КУО/см2. Стерильні посіви були виявлені у (11,2±3,1) % обстежених. Асоціації мікроорганізмів виявлено у (33,2±6,1) % хворих.
Виявлено, що, як правило, збудники висівалися мікробними асоціаціями (94,7±1,2) %, в яких у асоціаціях із коковою флорою найчастіше участь брали M. furfur [(71,2±8,4) %] та C. albicans [(52,1±12,4) %].
При вивченні чутливості до антибіотиків мікрофлори шкіри обличчя при розацеа визначалися рівні чутливості штамів з проміжними та резистентними значеннями. У представників кокової флори резистентність до еритроміцину та кліндаміцину варіювала від (75,6±7,3) % до (82,3±2,5) %; у ентеробактерій – від (54,3±5,6) % до (89,5±5,3) %. Усі види Сandida були резистентними до ністатину. Чутливість до тетрацикліну, фторхінолонів, азітроміцину у кокової флори та ентеробактерій досягала 100 %. M. furfur були чутливі до клотримазолу у (89,4±3,5) %, C. albicans були чутливі до ітраконазолу у 100 %.
При мікробіологічних дослідженнях неураженої шкіри у хворих на розацеа у більшості обстежених були виявлені мікроорганізми родів Staphylococcus spp., Malassezia spp., які склали (41,4±6,2) %. Частота виявлення S. epidermidis, S. haemoliticus та дріжджоподібних грибів не відрізнялали у здорових людей та у хворих на розацеа. S. aureus відзначали тільки у (51,4±3,7) % хворих на розацеа.
Таким чином, у хворих на рецидиви розацеа на ураженій шкірі визначено різноманіття штамів мікроорганізмів, збільшення патогенної мікрофлори та часті асоціації. Патогенні коки були виявлені майже в усіх хворих із рецидивами (92 %), у той час як у хворих із уперше виявленою розацеа – у 16 %, (в контрольній групі у практично здорових людей – тільки у 5 %). Супутня патологія, зниження загальної резистентності організму – це ті фактори, які найчастіше спостерігалися у хворих із рецидивом розацеа, що створює сприятливі умови для розвитку сапрофітуючих організмів та переходу їх в патогенну флору.
4.3 Результати дослідження на Demodex folliculorum у хворих на розацеа
Підставою для встановлення патогенної кількості кліщів D. folliculorum були результати клінічного обстеження та позитивні результати мікроскопічного дослідження зішкрябків із вогнищ ураження на наявність більше 5 кліщів на 1 см2.
Для клінічної картини запального процесу, характерного при наявності демодексу, був досить широкий спектр морфологічних елементів висипки, зокрема еритематозні плями, лущення, фолікулярні папули, папуло- пустули, кірки, а також вогнищеві або дифузні інфільтрації.
У результаті проведених мікроскопічних досліджень було виявлено, що кліщі Demodex foliculorum у різній кількості знаходяться в зішкрябках усіх обстежених. Так, у пацієнтів контрольної групи (практично здорових осіб) вони виявлені у 62 %, а у хворих на розацеа – у 71 (89 %) з 80 обстежених. У 21 пацієнта кількість кліщів була більше 5 шт. на 1 см2 ураженої шкіри, із них 18 (30 %) пацієнтів були із рецидивом розацеа та 3 (15 %) пацієнта були із уперше встановленим діагнозом розацеа (рис. 4.1). У 9 (11,25 %) хворих кліщі роду Dеmodex були виявлені у віях, при цьому у даних пацієнтів спостерігалися різні ознаки блефароконьюнктивіту. В інших хворих кон’юнктива на впродовж усього періоду спостереження була інтактною.
4.4 Дослідження психологічного стану у хворих при рецидивах розацеа
Відомо, що розвиток значних психічних розладів є наслідком дерматозів, особливо які локалізуються на обличчі і виступають інвалідизуючими фактором у житті хворих, що в значній мірі погіршує якість їх життя. Значну роль у формуванні змін у психологічному статусі пацієнтів відіграє комплекс несприятливих факторів. Одним з найважливіших факторів є часті рецидивування захворювання після нетривалої ремісії, які викликають у пацієнтів стан психологічної напруги, роздратованості та невпевненості в собі, зневіру в можливість повного виліковування, що з однієї сторони значно знижує якість життя, а з іншої сторони – стресові ситуації є провокуючими факторами розвитку дерматозу.
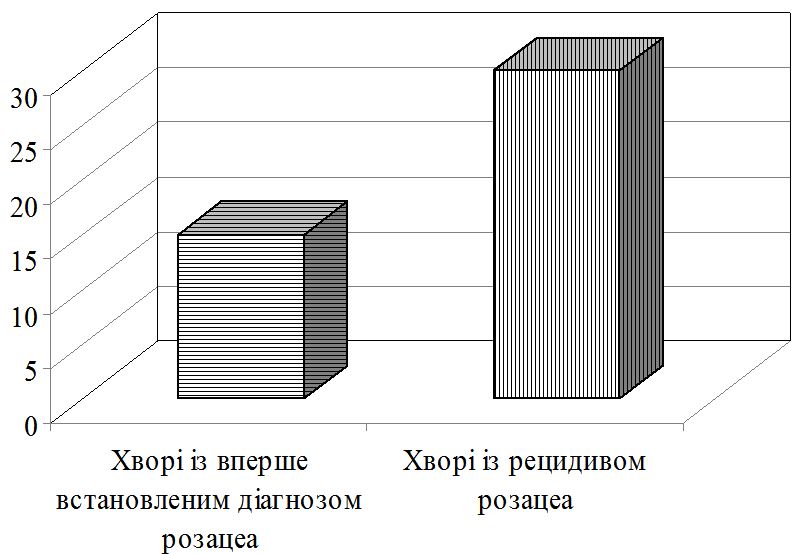
Рисунок 4.1 Порівняльний аналіз виявлення демодекозу у хворих на розацеа різних досліджених груп
У всіх обстежених хворих при дослідженні психологічного стану були виявлені різні ступені його розладів.
За ШТГ середній показник оцінювання симптомів тривоги підвищувався у 70 % (56 пацієнтів з 80) та був статистично вищим у хворих із рецидивом розацеа у порівнянні з вперше виявленим епізодом розацеа (у 15 % досліджених).
За ШДЗ показник депресивних симптомів був підвищений у 32 (40 %) хворих, серед яких 30 були із рецидивом розацеа та 2 – із первинним епізодом. Показники психологічного статусу обстежених хворих представлені на рисунку 4.2.
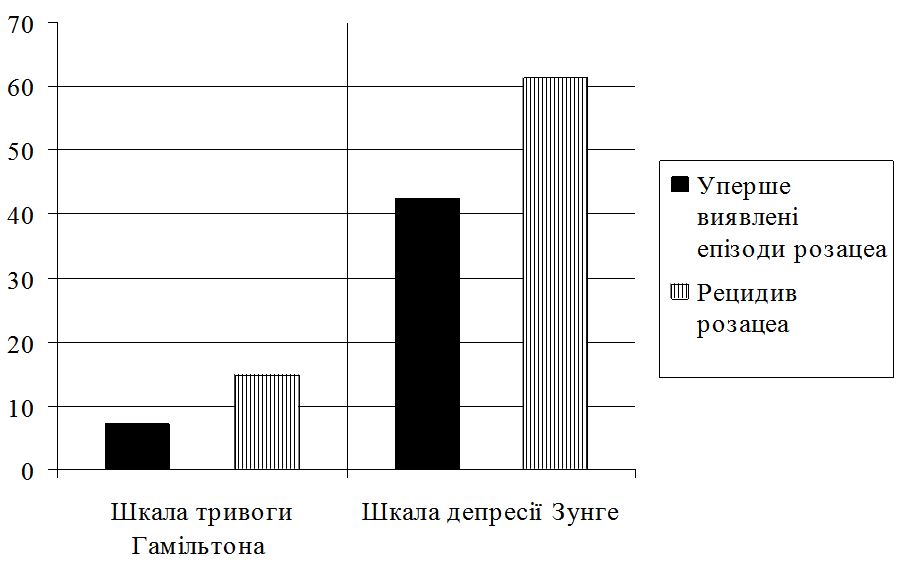
Рисунок 4.2 – Показники психологічного статусу обстежуваних хворих
Як видно з рисунка 4.2, середній бал по ШТГ складав 7,2±2,4 – у хворих із вперше виявленою розацеа, та 14,8±2,8 – у хворих із рецидивом дерматозу. Середній бал по ШДЗ складав 42,4±7,2 та 61,2±10,4 у хворих із уперше виявленою розацеа та у хворих із рецидивом відповідно.
4.5 Стан вегетативної нервової регуляції у обстежених хворих до лікування
Відомо, що в патогенезі розацеа значну роль мають порушення нейрогуморальної та нервової регуляції [11, 62, 103]. Ритм життя сучасної людини стрімкий та наповнений значними нервово-психічними навантаженнями, які через кору головного мозку, підкіркові структури та гіпоталамо-гіпофізарну систему дестабілізують основні регуляторні системи організму, чим викликають розвиток вегетативної дисфункції та порушення діяльності ВНС, що, в свою чергу, має вплив на перебіг та прогноз захворювання.
ВНС має здатність регулювати ритм серця, впливаючи на симпатичну ланку, яка стимулює діяльність серця, або на парасимпатичну, яка її пригнічує. Вплив обох відділів ВНС урівноважений у стані спокою називається вегетативним балансом. Активність симпатичної ланки і зниження парасимпатичної зростає у стані стресу та фізичного навантаження.
З метою аналізу хвильової структури ритму серця та показників динаміки серцевого ритму у обстежених, використовували систему кардіографії «Сardiolab». Фактично, з використанням цієї методики, ми досліджували стан вегетативної регуляції серцевої діяльності. У більшості пацієнтів з розацеа на початку дослідження ВСР встановлені порушення центральних механізмів регуляції з дисбалансом ВНС у бік переважання симпатичної ланки, які проявлялися достовірними (р<0,05) змінами показників (табл. 4.2).
Таблиця 4.2 – Показники ВСР у хворих на розацеа
| Показник | Хворі з уперше виявленою розацеа
(n=20) |
Хворі з рецидивом розацеа
(n=60) |
Контрольна група
(n=20) |
| SDNN, мс² | 48,6±2,1 | 32,4±2,4* | 54,6±3,7 |
| ВАР, мс | 204,4±86,4 | 179,5±65,4* | 264,7±121,5 |
| Мо, мс | 816,5±124,3 | 843,2±84,2* | 786,7±68,4 |
| АМо, % | 48,4±29,3 | 52,4±24,1* | 36,8±26,4 |
| ІН, % | 157,4±121,3* | 185,2±146,4*, ** | 112,3±104,2 |
| ТР, мс² | 1952,3±327,7* | 1423,4±211,6*, ** | 2634,2±424,6 |
| VLF, мс² | 476,2±173,3* | 310,4±212,5*, ** | 769,4±264,6 |
| LF, мс² | 384,6±157,4* | 298,2±124,5*, ** | 598,4±121,3 |
| HF, мс² | 648,4±152,3* | 453,7±254,2*,** | 1022,4±258,5 |
| LF/HF, % | 2,03±0,04* | 2,24±0,12*, ** | 1,52±0,16 |
Примітки:
* – p<0,05 при порівнянні з групою контролю;
** – р<0,05 при порівнянні з групою з уперше виявленим дерматозом
Як видно із таблиці 4.2, у хворих виявлено дисбаланс основних параметрів нейрогуморальної регуляції у вигляді змін загальної потужності основних часових та спектральних показників.
Аналізуючи показник SDNN, виявлено, що середнє значення у хворих із первинним епізодом розацеа та рецидивом розацеа було достовірно (р<0,05) нижчим [(48,6±2,1) та (32,4±2,4) мс2] порівняно з групою контролю – (54,6±3,7) мс2.
При аналізі показника загальної потужності (TP) виявлено, що у всіх хворих середнє значення його було достовірно (р<0,05) нижчим [(1952,3±327,7) та (1423,4±211,6) мс2] порівняно з групою контролю – (2634,2±424,6) мс2.
Значення показника потужності спектру впливу гуморальних систем (VLF) у хворих із первинним епізодом розацеа та рецидивом розацеа було достовірно нижчим [(476,2±173,3) та (310,4±212,5) мс2] порівняно з контрольною групою – (769,4±264,6) мс2.
Маркер активності симпатичного відділу ВНС – показник потужності спектра низькочастотних коливань (LF) був достовірно нижчим [(384,6±157,4) та (298,2±124,5) мс2] у хворих із первинним епізодом розацеа та рецидивом розацеа, порівняно із групою контролю – (598,4±121,3) мс2.
Показник потужності спектра високочастотних коливань (НF), який вказує на зміни парасимпатичної регуляції у хворих із первинним епізодом розацеа та рецидивом розацеа, був достовірно нижчим [(648,4±152,3) та (453,7±254,2) мс2] порівняно із групою контролю – (1022,4±258,5) мс2.
Достовірне (р<0,05) підвищення показника вегетативного балансу LF/HF відзначали у всіх досліджених хворих із первинним епізодом розацеа та рецидивом розацеа відповідно [(2,03±0,04) % та (2,24±0,12) %) порівняно з контрольною групою – (1,52±0,16) %.
Виявлено, що дисбаланс між показниками основної групи із рецидивами розацеа та порівняльної групи із вперше виявленою розацеа був статистично достовірним (р<0,05), що свідчило про більш значні патологічні зміни вегетативного балансу у бік симпатикотонії, які треба враховувати при виборі тактики комплексного лікування пацієнтів та при прогнозуванні перебігу захворювання.
4.6 Імунний статус обстежених хворих до лікування
4.6.1 Аналіз дослідження функціональної активності фагоцитуючих клітин
Для захисту організму серед неспецифічних клітинних факторів імунітету найбільшу значимість мають фагоцити від мікробних мікроорганізмів, які колонізують уражену шкіру. Взаємодія фагоцита з мікробним агентом носить, як правило, характер прямого контакту із поглинанням та внутрішньоклітинним переварюванням останнього. Нейтрофільні поліморфно-ядерні фагоцити є провідним клітинним фактором захисту. Кількісні чи якісні дефекти популяції нейтрофільних лейкоцитів є найбільш частим фактором, що сприяє розвитку масивної колонізації патогенної мікрофлори.
При аналізі функціональної активності фагоцитуючих клітин у хворих різного перебігу розацеа, були отримані наступні результати: кількість нейтрофілів статистично достовірно не відрізнялась у пацієнтів порівняльних груп. У пацієнтів на рецидиви розацеа, на відміну від хворих із вперше виявленим епізодом розацеа відмічали тенденцію до статистично значущого зменшення таких показників, як час ФІ, ФЧ та НСТ-тест.
Як видно з таблиці 4.3, результати дослідження свідчать про достовірно значуще (р<0,05) зменшення активності фагоцитарних клітин у хворих із рецидивом розацеа. У деяких хворих, у яких був вперше встановлено епізод розацеа, спостерігали пригнічення функціональної активності фагоцитів. При подальшому дослідженні у цих пацієнтів було встановлено рецидив захворювання. Пригнічення функції фагоцитів залежало від імунодефіцитних станів: інфекційного процесу в організмі та супутньої патології у хворих, клімаксу, стресу.
Таблиця 4.3 – Функціональна активність фагоцитуючих клітин у хворих на розацеа до лікування
| Показники | Хворі з первинним епізодом розацеа
(n=20) |
Хворі з рецидивом розацеа
(n=60) |
Контрольна група – практично здорові люди
(n=20) |
| Нейтрофіли (1-6×109/л) | 4,63±0,37 | 4,81±0,34 | 4,74±0,35 |
| Фагоцитарний індекс (60-80 %) | 63,8±4,23٭ | 35,2±2,57*, ** | 82,6±2,24 |
| Фагоцитарне число (5-10 %) | 6,84±0,76٭ | 3,21±0,23*, ** | 8,26±0,81 |
| НСТ-тест (12-26 %) | 18,4±2,1٭ | 11,2±1,34*, ** | 21,8±1,92 |
Примітки:
* – p<0,05 при порівнянні з групою контролю;
** – р<0,05 при порівнянні з групою з уперше виявленим дерматозом
Таким чином, виникненню рецидивів розацеа сприяє дефектність неспецифічних механізмів імунітету, особливо фагоцитозу.
4.6.2 Результати дослідження основних популяцій та субпопуляцій лімфоцитів у досліджених хворих
Основний процес імунного захисту при розацеа включається ініціацією імунної відповіді при взаємодії антиген-розпізнавальних лімфоцитів з допоміжними антиген-презентуючими клітинами. Далі мононуклеарні фагоцити внутрішньоклітинно руйнують корпускулярні антигени патогенної мікрофлори, здійснюють їх ферментну переробку та виводять продукти на мембрану для розпізнавання лімфоцитами.
Дані отриманих результатів дослідження популяцій та субпопуляцій лімфоцитів у хворих на розацеа представлені у таблиці 4.4.
Таблиця 4.4 – Кількісний склад популяцій та субпопуляцій лімфоцитів у хворих на розацеа до лікування
| Показники | Хворі із первинним епізодом розацеа
(n=20) |
Хворі із рецидивом розацеа
(n=60) |
Контрольна група – практично здорові люди
(n=20) |
|
| Лейкоцити, 109/л | 6,34±0,16 | 5,32±0,34 * | 6,43±0,56 | |
| Лімфоцити, 109/л | 1,71±0,14 | 1,67±0,17* | 1,78±0,16 | |
| CD4+ | 109/л | 0,71±0,04* | 0,47±0,05*, ** | 0,67±0,06 |
| % | 49,4±2,74 | 30,2±3,14*, ** | 41,2±2,35 | |
| CD8+ | 109/л | 0,49±0,03 | 0,25±0,04*, ** | 0,48±0,05 |
| % | 29,4±1,54 | 14,23±3,21*, ** | 28,4±1,27 | |
| CD4+/CD8+ | 1,54±0,07* | 1,46±0,02*, ** | 1,52±0,04 | |
| CD16+ | 109/л | 0,21±0,04* | 0,38±0,05*, ** | 0,18±0,07 |
| % | 14,3±1,24* | 17,4±1,42*, ** | 13,6±1,42 | |
| CD22+ | 109/л | 0,28±0,04* | 0,35±0,06*, ** | 0,26±0,02 |
| % | 16,2±1,32 | 18,8±1,53*, ** | 15,4±1,12 | |
Примітки:
* – p<0,05 при порівнянні з групою контролю;
** – р<0,05 при порівнянні з групою з уперше виявленим дерматозом
Як свідчать дані таблиці 4.4, у хворих на розацеа відзначається виразна статистично достовірна (р<0,05) зміна кількісного складу основних популяцій та субпопуляцій лімфоцитів.
У хворих з уперше виявленим епізодом розацеа, на відміну від контрольної групи встановлено, збільшення числа CD4+, СD16+, CD22+ та коефіцієнта CD4+/CD8+, а також незначне зниження числа CD8+. Отриманні дані співпадають з багатьма даними сучасної літератури та говорять про порушення імунітету у хворих на розацеа.
У основної групи хворих із рецидивом розацеа встановлено зменшення числа лейкоцитів та лімфоцитів, зниження абсолютного та відносного числа CD4+ (Т-хелперів), CD8+ (Т-супресорів) та коефіцієнта CD4+/CD8+ у порівнянні з групою контролю. Збільшення таких показників як, CD16+ (лімфоцитів з кілерною функцією) і СD22 (В-лімфоцитів), свідчить про суттєві імунопатологічні зміни та, можливо, ознаки імунодефіциту, що є наслідком імунодефіцитного стану, обумовленого впливом патогенетичних змін та супутньої патології.
Таким чином, при дослідженні у хворих із рецидивом розацеа виявлено порушення імунного статусу у вигляді Т-клітинної недостатності та імуносупресії з ознаками загальної недостатності В-клітинного ланцюга імунітету при відносній гіперфункції В-лімфоцитів.
4.6.3 Дослідження гуморального імунітету (рівня імуноглобулінів крові) у хворих на розацеа
Як видно з таблиці 4.5, рівень Ig G та Ig M статистично достовірно (р<0,05 та р<0,01) підвищено у хворих на розацеа у порівнянні із контрольною групою, що відповідає даним сучасної літератури. Не було виявлено статистично достовірних змін рівня Ig A. Також при порівнянні показників хворих основної групи з групою хворих порівняння, встановлено, що у хворих із рецидивом дерматозу відзначався статистично достовірно вищій рівень (p<0,05) Ig G та (р<0,01) Ig M.
Таблиця 4.5 – Рівень імуноглобулінів у хворих на розацеа
| Показники | Хворі з первинним епізодом розацеа
(n=20) |
Хворі з рецидивом розацеа
(n=60) |
Контрольна група – практично здорові люди
(n=20) |
| Ig G, г/л | 14,8±2,36* | 17,4±3,24*, ** | 13,4±1,08 |
| Ig A, г/л | 2,07±0,04 | 2,05±0,02 | 2,07±0,09 |
| Ig M, г/л | 1,73±0,02 | 2,3±1,12º, ºº | 1,32±0,05 |
Примітки:
º – p<0,01 при порівнянні з групою контролю;
ºº – р<0,01 при порівнянні з групою з уперше виявленим дерматозом;
* – p<0,05 при порівнянні з групою контролю;
** – р<0,05 при порівнянні з групою з уперше виявленим дерматозом
Таким чином, у хворих при рецидиві розацеа, на відміну від хворих з уперше виявленим епізодом розацеа, порушення гуморального імунітету були більш суттєвими, що вказує на те, що при рецидивуванні перебіг розацеа значно ускладнюється та має більш глибокі порушення, особливо в імунному стані.
4.6.4 Цитокіновий статус у досліджених хворих на розацеа
Як відомо, цитокіни IL-10 належать до числа протизапальних цитокінів, які регулюють гальмування клітинної імунної відповіді. IL-10 є продуктом Т-хелперів II типу, тому його активація сприяє зниженню протибактеріального потенціалу імунної системи. Він інгібує продукцію макрофагами всіх прозапальних цитокінів та експресію рецепторів IL-12 на епітеліальні клітини.
Доведено, що IL-12, що належить до прозапальних цитокінів і є головним цитокіном, який підсилює клітинно-опосередковану імунну відповідь та ініціює протиінфекційний захист. Його продукують макрофаги, здійснюючи фагоцитоз патогенних мікроорганізмів. Також макрофаги продукують та декретують послідовно прозапальні цитокіни, а потім і протизапальні. Відомо, коли продукція IL-10 різко підсилюється, то це призводить до зниження протиінфекційного захисту та розвитку хронізації процесу [28, 35, 43].
Як видно з табл. 4.6, при дослідженні рівнів цитокінів IL-10 та IL-12 виявлено статистично достовірне (р<0,001 та р<0,01) підвищення їх вмісту в сироватці крові, переважно у хворих із рецидивом розацеа. А от у хворих із вперше виявленим епізодом розацеа зміни цитокінів були не достовірні (р>0,05).
Таблиця 4.6 – Рівень імуноглобулінів у хворих на розацеа
| Показники
(n2/мл) |
Хворі з первинним епізодом розацеа
(n=20) |
Хворі з рецидивом розацеа
(n=60) |
Контрольна група – практично здорові люди
(n=20) |
| IL-10 | 6,9±2,5 | 24,3±6,2٭٭ ,٭ | 6,6±3,2 |
| IL-12 | 78,46±15,6 | 198,62±20,3٭٭ ,٭ | 71,27±28,4 |
Примітки:
* – p<0,001 при порівнянні з групою контролю;
** – р<0,001 при порівнянні з групою з уперше виявленим дерматозом
При аналізі рівня цитокінів в залежності від перебігу захворювання, встановлено, що збільшення синтезу досліджуваних інтерлейкінів, особливо у хворих із рецидивами розацеа, свідчить про гіпереактивацію про- та протизапальних механізмів, що сприяє збільшенню патогенної мікрофлори та ускладненню процесу.
* * *
Таким чином, аналіз проведених досліджень дозволив виявити у хворих на рецидиви розацеа певні особливості. Так, встановлено за даними біохімічних досліджень, що у хворих із рецидивом розацеа, на відміну від здорових осіб і у пацієнтів із вперше виявленим епізодом розацеа, значно частіше (c2=5,2, p<0,05) виявлялись порушення, які проявлялися зниженням рівня загального білка, збільшенням загального білірубіну, змінами активності ферментів АлАТ та АсАТ. Підвищення показників холестерину ЛПНЩ та тригліцеридів пояснюється, ймовірно, супутньою патологією, яка має вплив на зміну вищезазначених показників та обтяжує перебіг захворювання, провокуючи розвиток рецидивування дерматозу.
Встановлено особливості та якісно-кількісні зміни мікробного пейзажу шкіри при рецидивах розацеа. Перебіг захворювання ускладнюється різноманіттям штамів мікроорганізмів, високою інтенсивністю мікробної колонізації шкіри, збільшенням патогенних видів та переважанням їх асоціацій, що, як наслідок, ускладнювало перебіг дерматозу, який набував більш виразний запальний характер та прогредієнтний перебіг. Із стафілококами та ентеробактеріями відзначено синергізм M. furfur, а C. albicans зі всіма видами мікроорганізмів. Найбільш часто у хворих на розацеа висівався S. аureus та S. epidermidis. Чутливість мікрофлори до антибіотиків залежала від видів мікроорганізмів та коливалась у широкому діапазоні.
Керуючись результатами досліджень, можна зробити висновок, що патогенна мікрофлора викликала загострення дерматозу та його рецидив, що дозволило стверджувати, по-перше, про етіологічний зв’язок між ступенем обсіменіння шкіри мікроорганізмами та тяжкістю перебігу розацеа, а по-друге – врахування виявлених особливостей важливо при підборі способів раціональної ефективної терапії.
При дослідженні на наявність D. folliculorum, виявлено, що у хворих при рецидиві розацеа достовірно вищі показники у порівнянні з іншими групами хворих. Але разом з тим, виявлення кліща на шкірі здорових людей контрольної групи доводить те, що він відноситься до сапрофітів. Під впливом різних чинників та обтяжуючих факторів кількість демодексу на шкірі збільшується, що можна розцінювати як критерій патогенетичних змін.
При вивченні показників психоемоційного стану хворих із рецидивом розацеа виявлено, що за ШТГ і ШДЗ вони коливалися в межах помірної тривожності та депресивних симптомів середнього ступеня й були достовірно вищими ніж у хворих із груп порівняння. Для проведення лікування велике значення мало раннє виявлення психологічної напруги, що допомагало здійснити корекцію виявлених порушень, запобігти розвитку рецидивів та прогнозувати перебіг захворювання.
При дослідженні вегетативної регуляції серцевої діяльності у хворих із рецидивом розацеа у порівнянні з групою хворих із вперше виявленим епізодом розацеа та показниками практично здорових людей, виявлені більш виражені, статистично достовірні (р<0,05) порушення у вигляді зниження потужності основних часових (SDNN, ВАР) та спектральних (ТР, VLF, LF, HF) показників ВСР на фоні підвищення показників Мо, АМо, ІН та індексу вегетативного балансу в бік переважання симпатичної регуляції, що вказувало на залежність між параметрами ВСР та характером перебігу розацеа.
За даними імунологічного дослідження у хворих із рецидивами розацеа встановлені особливості патологічних змін у вигляді пригнічення функції фагоцитів, зміни кількісного складу основних популяцій та субпопуляцій лімфоцитів, що характеризуються Т-клітинною недостатністю, а саме: зниженням рівнів CD4+, CD8+, коефіцієнта CD4+/CD8+ на фоні збільшення вмістуCD16+ та CD22+, збільшення рівня Ig G та Ig M та підвищення продукції інтерлейкінів-10 та -12, що свідчать про стан імунної недостатності і більш глибокий рівень порушень та потребують своєчасної діагностики, вибору адекватної раціональної терапії і імунної корекції.
Встановлено виражений взаємозв’язок ступеня вираженості імунологічних змін зі ступенем клінічних проявів дерматозу та супутніх захворювань.
Отже, проведені дослідження підтверджують, що виявлені порушення при рецидивах розацеа більш виражені, ймовірно зв’язані із наявністю супутньої патології, що призводить до торпідного перебігу захворювання, неефективного лікування та частого подальшого рецидивування. Виявлені клінічні і лабораторні особливості у хворих дозволяють прогнозувати розвиток появи рецидивів. Важливим кроком для комплексного підходу до лікування та прогнозування захворювання є врахування цих особливостей під час вибору способів лікування та профілактики рецидивів розацеа.
Результати цих досліджень були представлені в наступних публікаціях:
- Василенко А.В. Діагностика клініко-імунологічного стану у хворих на розацеа до і після терапії / А.В. Василенко // Дерматовенерологія. Косметологія. Сексопатологія. – 2013. – № 1-4. – С. 107–110.
- Василенко А.В. Оцінка вегетативної дисфункції із вивченням варіабельності серцевого ритму у хворих рецидивами розацеа / А.В. Василенко // Журнал дерматовенерології та косметології ім. М.О. Торсуєва. – 2015. – № 1-2 (34). – С. 44–47.
- Василенко А.В. Різні клінічні форми розацеа поєднані з маласезійною інфекцією на сучасному етапі / А. В. Василенко // Набуття молодих вчених дерматовенерології: матеріали регіональної науково-практичної школи, м. Київ, 23 листопада 2012 р. – К., 2012. – С. 9.
- Василенко А. В. Вивчення імунологічного стану у хворих розацеа до та після лікування / А. В. Василенко // Досягнення молодих вчених дерматовенерологів: матеріали науково-практичної конференції, м. Київ, 21-22 листопада 2013 р. – К., 2013. – С.17-18.
- Василенко А. В. Вивчення змін імунологічного стану у хворих на різні форми розацеа та диференційований підхід до лікування / А. В. Василенко // Міжнародна інтеграція та наукові досягнення української дерматовенерології: матеріали науково-практичної конференції з міжнародною участю (м. Харків). – Дерматологія та венерологія. – 2014. – № 3 (65). – С. 70–72.
- Василенко А. В. Сучасний погляд на роль мікробного пейзажу шкіри у хворих рецидивами розацеа / А. В. Василенко // Актуальні питання дерматології, венерології та ВІЛ/СНІД-інфекції: матеріали науково-практичної конференції, м. Харків, 18-19 червня 2015 р. – Харків, 2015. – С. 24–27.
РОЗДІЛ 5
ДИФЕРЕНЦІЙОВАНІ ПОКАЗАННЯ ДО ЛІКУВАННЯ І СПОСІБ КОМПЛЕКСНОЇ ТЕРАПІЇ ХВОРИХ НА РОЗАЦЕА. ПРОФІЛАКТИКА
ТА ПРОГНОЗУВАННЯ РЕЦИДИВІВ ДЕРМАТОЗУ
5.1 Обґрунтування та розробка способу раціональної комплексної терапії хворих із рецидивом розацеа
Для вивчення особливостей перебігу та лікування рецидивів розацеа досліджені пацієнти були розділені на 2 групи: перша група – 20 пацієнтів (13 жінок та 7 чоловіків) із уперше виявленою розацеа та друга група – 60 (41 жінка та 19 чоловіків) досліджених із рецидивами розацеа, які були співставні за статевим та віковим складом. Другу групу ми також поділили на дві підгрупи (по 30 осіб у кожній) для порівняння об’єктивної оцінки ефективності методик лікування. Таким чином, була виділена основна група хворих із рецидивом розацеа, яка отримувала рекомендовану нами терапію і дві групи порівняння.
Розроблено комплексну науково обґрунтовану терапію хворих із рецидивами розацеа з призначенням патогенетичних та симптоматичних препаратів, а також засобів для зовнішнього лікування. Вибір тактики лікування та виражений позитивний ефект від нього залежав від клінічної форми, психоемоційних та лабораторних особливостей пацієнта, перебігу захворювання, супутньої патології.
Для лікування та запобігання рецидивів у майбутньому ми виявляли та рекомендували повністю усунути провокуючі фактори розвитку захворювання, що допомогло контролювати перебіг захворювання. Враховуючи індивідуальні особливості, рекомендували також хворим розумно організувати спосіб життя, а саме: вилучити гарячі страви, прянощі, гостре, солоне (особливо йодовану сіль), оцет, соуси з приправами, смажене, копчене, екстрактивні речовини, консервовані продукти, тваринні жири, алкогольні напої, солодощі. Також радили не приймати ванни з гарячою водою, обмежити відвідування лазні; уникати інсоляцію, перепади температур, вітряну погоду, тривале перебування на холоді; позбавитися хронічного нервового перевантаження, стресів; не приймати лікарські препарати, такі як вітамін D, естрогени, антагоністи кальцію, нікотинова кислота, інгібітори АПФ, системні та топічні глюкокортикостероїди.
Хворі на розацеа, які обстежувались у основній та порівняльних групах з урахуванням загальноприйнятих рекомендацій, отримували стандартну терапію, яка включала в себе:
- Загальну терапію:
– Антибіотик: доксициклін по 100 мг 1-2 рази на добу від 2 до 6-8 тижнів. При виявлені протипоказань призначення антибактеріальних препаратів цього ряду, призначали макроліди (еритроміцин 500-1000 мг в 2 прийоми, 1-4 тижні, або кларитроміцин 500 мг на добу – 2-4 тижні);
– Метронідазол по 250 мг 2-4 рази на добу 2-4 тижні;
– Вітамінотерапія: аскорбінова кислота 500 мг 2 рази на добу – 14 днів; Аєвіт по 1 капсулі 2 рази на добу – 1 місяць;
– Йогурт по 1 капсулі 3 рази на день;
– Гепатопротектор (Карсил) по 1 таблетці 3 рази на добу;
Зовнішня терапія:
– Метронідазол 1 % гель або крем на уражені ділянки – 2 рази на добу;
– Азелаїнова кислота, крем 15 % – 2 рази на добу, по показанням.
Для комплексної терапії хворих із рецидивом розацеа розроблено спосіб, особливостями якого є додаткове використання препаратів, які впливають на більшість факторів патогенезу, направлені на усунення всіх виявлених патогенетичних порушень та в комплексі надають посилений вплив на стабілізацію всього організму в цілому.
Так, хворі першої групи порівняння з уперше встановленим діагнозом розацеа та половина другої групи порівняння із рецидивом розацеа отримували тільки стандартну терапію. Основні обстежені другої групи з рецидивом розацеа отримували запропоновану методику лікування, як доповнення стандартної терапії (ангіопротектор, анксіолітик та метаболічний препарат із гепатопротекторними та імуномодулюючими властивостями).
Із системних ангіопротекторів ми обрали препарат Аесцин, (діюча речовина – альфа-есцин, виробник «Polfa» Kutno Pharmaceutical Company, Польща), що являє собою основний сапонін, отриманий із плодів кінського каштана. Призначення саме цього препарату пояснюється тим, що серед усіх венотонічних препаратів лише аесцин діє на судинну систему шкіри. Препарат також має протизапальну та аналгезуючу дію за рахунок впливу таких компонентів, як сапоніни, які підвищують рівень простагландину F2α; діетіламін саліцилат, який знижує кількість лейкотрієнів; метаболіти та магній, які стабілізують рівень цитокінів та нейромедіаторів. Також препарат знижує проникність капілярів, виявляє протинабрякову дію, покращує мікроциркуляцію, і тим самим сприяючи репарації органів і тканин. Ще препарат має антиоксидантну дію (за рахунок гальмування пероксидації ліпідів) та помірну імунокоригуючу (зменшуючи міграцію лейкоцитів). Пацієнти приймали препарат по 1 таблетці (20 мг) тричі на день, після прийому їжі, запиваючи великою кількістю води, упродовж 1 місяця. Далі препарат приймали 20 днів по 1 таблетці двічі на день, та потім упродовж 1 місяця по 1 таблетці 1 раз на день.
Оскільки, за даними наших досліджень, захворювання пов’язано з психоемоційними факторами та порушеннями вегетативної нервової регуляції судинного тонусу, нами рекомендовано проводити патогенетичне лікування анксіолітиком Мебікар ІС, який регулює стан ВНС й викликає слабкий загальний антипсихотичний та протитривожний ефект. Це препарат з діючою речовиною мебікар є синтетичною сполукою, похідного біциклічних бісечовин (виробник ТДВ «Інтерхім», м. Одеса, Україна). Препарат має помірну транквілізуючу та анксіолітичну дію, сприяє зниженню почуття тривоги, занепокоєння, страху, зменшує дратівливість та внутрішнє емоційне напруження, нормалізує перебіг сну у випадку його порушення. Препарат належить до групи денних транквілізаторів та не викликає сонливості. Він має виражену ноотропну дію, сприяє нормалізації стану при стресах та розумових перенавантаженнях. Крім того, препарат володіє нормастенічними властивостями, сприяє нормалізації ліпідного обміну за рахунок змін відношення ЛПНЩ й ЛПВЩ, призводить до зниження рівня холестерину в крові. Він покращує трофіку міокарда, за рахунок збільшення коронарного кровотоку знижує внутришньосудинну агрегацію еритроцитів. Серед анксіолітиків лише Мебікар додатково впливає на проникність судинної стінки та знижує в’язкість крові, що добре доповнює терапію саме при розацеа. Мебікар хворі приймали по 1 таблетці (0,3 г) тричі на день, незалежно від прийому їжі, запиваючи великою кількістю води. Тривалість прийому анксіолітика корегувалась індивідуально для кожного хворого, складала від 20 до 45 днів.
Для усунення патогенетичних імунних та супутніх порушень ми використовували препарат метаболічної дії Тіотриазолін (виробник «Галичфарм», Україна), який володіє гепатопротекторними, імуномодулючими, мембраностабілізуючими, противоішемічними та антиоксидантними властивостями. Він підвищує фагоцитарну активність лейкоцитів, нормалізує вміст Т-лімфоцитів, знижує вміст циркулюючих імунних комплексів в крові, сприяє регенерації гепатоцитів, попереджаючи їх загибель, нормалізує білковий, вуглеводний, ліпідний та пігментний обміни. Препарат знижує пригнічення процесів окислення в циклі Кребса зі збереженням внутрішньоклітинного фонду АТФ, посилює компенсаторну активацію анаеробного гліколізу, активує антиоксидантну систему і гальмує процеси окислення ліпідів в ішемізованих ділянках міокарда, зменшує чутливість міокарда до катехоламінів, запобігає прогресивне пригнічення скорочувальної функції серця, стабілізує і зменшує відповідно зони некрозу та ішемії міокарда. Лікарський засіб покращує реологічні властивості крові, призводить до активації фібринолітичної системи. Призначали препарат по 1 таблетці (100 мг) тричі на день – 30 днів.
Зовнішньо призначали лікарську форму препарату Аесцин у вигляді гелю, який наносили двічі на день на уражену ділянку шкіри. Тривалість лікування залежала від характеру патологічного процесу. Гепарин та диетиламіна саліцилат, що знаходяться у складі гелю, надають протитромботичну, протизапальну та анальгізуючу дію.
Жінки з порушенням менструального циклу були консультовані гінекологом. Хворі із супутніми шлунково-кишковими та іншими розладами направлялися на консультацію до суміжного спеціаліста. При проявах офтальморозацеа лікування проводили разом із офтальмологом.
Під час лікування та для профілактики розвитку рецидивів розацеа усім хворим роз’яснювали принципи раціонального догляду за шкірою. Зважаючи на те, що шкіра у хворих на розацеа дуже чутлива та реактивна, радили організувати правильний гігієнічний та косметичний догляд за шкірою, оскільки надто обережний догляд запобігає появі почервоніння, подразнень і відчуття стягнутості. Не рекомендували використовувати водостійку косметику та тонуючі засоби. Для вмивання рекомендували уникати води із хлором та мила, не вмиватися дуже холодною чи гарячою водою. Радили використовувати спеціальні очищуючи засоби або міцелярні розчини; проводити повноцінне зволоження шкіри, при цьому зволожуючий крем наносити після використання зовнішніх лікарських засобів, дочекавшись їхнього повного вбирання; підібрати одноразовий, не травмуючий шкіру рушник. Для гоління чоловікам радили замість лез використовувати електробритви. Рекомендували придбати косметичні засоби для чутливої або дитячої шкіри, які не містять спирту, ацетону, олій, лауріл сульфату натрію, ментолу, камфори, гранул абразивних речовин. Не рекомендували наносити косметичні маски, у яких використовуютья судинорозширюючі компоненти як мед, бодяга та ін.
5.2 Клініко-лабораторна оцінка розробленої диференційованої комплексної терапії та порівняння її ефективності зі стандартними методами лікування
До та після проведених лікувальних заходів проводили оцінку ефективності стандартної та розробленої за нашою методикою терапії рецидивів розацеа шляхом порівняння клінічних та лабораторних показників.
Так, після початку лікування у хворих, які отримували терапію за рекомендованою нами методикою стабілізація стану та початок регресу проявів захворювання зареєстровані в середньому на 8-10 день. У хворих групи порівняння, з рецидивом дерматозу, які отримали тільки стандартну терапію, стабілізація стану виявилась тільки на 21-24-й дні лікування та мала дуже слабку динаміку. У хворих з уперше виявленим епізодом розацеа прояви стабілізації стану проявлялися в середньому на 14-20-й день лікування.
У результаті лікування, через 1 місяць, у першої порівняльної групи хворих (з уперше виявленою розацеа), які отримували стандартний метод терапії, покращення клініко-лабораторних показників спостерігалось у 46 % досліджених. У хворих другої групи (з рецидивами розацеа), які також лікувалися за стандартною схемою, регрес висипання на обличчі спостерігався у 21 % обстежених або взагалі не відзначалося позитивної динаміки від лікування, що обумовлене більш тяжкими патогенетичними змінами при рецидивах та більш тяжким перебігом дерматозу. А от у хворих другої групи з рецидивами розацеа, які були проліковані за схемою терапії, запропонованою нами, відзначали статистично достовірне покращення клініко-лабораторних показників у 78 % хворих.
У 61 % пацієнтів першої групи з уперше виявленою розацеа, повне одужання спостерігали через 3 місяці після початку лікування. Лише у 32 % паціентів другої групи, які лікувались за стандартною терапією, повне одужання відзначали через 5 місяців лікування, а у решти (зберігалися ознаки запалення, інфільтрації, приєднання вторинної інфекції) спостерігали резистентність до терапії. У 87 % пацієнтів другої групи, які отримували лікування за рекомендованою схемою, повний регрес висипань дерматозу відзначався вже на другому місяці лікування.
Проведені дослідження підтверджують, що патогенетичні зміни при рецидивах розацеа більш виражені та зв’язані із наявністю супутньої патології, що призводить до торпідного перебігу захворювання, неефективного лікування та частого подальшого рецидивування.
При дослідженні таких суб’єктивних ознак як свербіння, печіння, поколювання, сухість, набряк, оніміння, стягнутість шкіри обличчя, відчуття повзання мурашок, головний біль – після проведеної терапії за нашою методикою у всіх хворих другої групи з рецидивами розацеа не виявлялися. У другій групі хворих з рецидивами розацеа, пролікованих лише стандартною терапією, суб’єктивні ознаки виявляли у 23 із 30 пацієнтів. У першій групі з вперше виявленим епізодом розацеа, після лікування стандартною терапією суб’єктивні признаки виявляли у 4 з 20 пацієнтів.
При об’єктивному дослідженні після лікування такі прояви вегето-судинних порушень, як підвищення артеріального тиску, лівідність пульсу, зміни місцевого та рефлекторного дермографізму, гіпергідроз долоней та підошв виявляли у 24 із 30 хворих другої групи з рецидивами розацеа, лікованих за стандартною терапією та у 12 із 20 пацієнтів першої групи з вперше виявленим епізодом розацеа також лікованих за стандартною терапією. У хворих же другої групи із рецидивом розацеа, які отримували терапію за нашою методикою, об’єктивні прояви порушень функціонального стану ВНС виявили лише у 6 з 30 хворих і вони характеризувалися значно меншими проявами.
Виявлені зміни біохімічних показників при терапії хворих за нашою методикою наведені в таблиці 5.1.
Таблиця 5.1 – Порівняння біохімічних показників досліджуваних хворих до та після лікування
| Показники | Хворі з первинним епізодом розацеа
(n=20) |
Хворі з рецидивом розацеа
(n=60) |
Конт-рольна група
(n=20) |
|||
| До лікуван-ня | Після стандарт-ної терапії | До лікуван-ня
(n=60) |
Після стандарт-ної терапії
(n=30) |
Після запропо-нованої методики
(n=30) |
||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Загальний білок
(65-83 г/л) |
72,6±3,2 | 73,4±3,6 | 62,3±2,4 | 63,4±3,6 | 71,3±5,4* | 74,3±4,8 |
| Альбумін (38-54 г/л) | 41,1±4,2 | 42,3±3,4 | 37,6±3,5 | 38,1±4,1 | 42,8±3,6* | 43,2±4,2 |
| Глобулін
(20-30 г/л) |
21,3±2,4 | 22,6±2,8 | 21,1±2,6 | 21,4±2,4 | 24,1±2,3 | 24,4±3,2 |
| Глюкоза
(3-6 ммоль/л) |
5,7±1,2 | 5,7±1,4 | 6,6±1,8 | 6,2±2,1 | 5,4±1,2 | 5,2±0,4 |
| Білірубін загальний (8,5-25,5 мкмоль/л) | 17,4±1,2 | 16,3±3,1 | 19,3±2,4 | 19,1±2,2 | 17,4±2,1* | 16,7±1,4 |
| Тимолова проба (0-4 Sh) | 0,86±0,3 | 0,86±0,4 | 0,93±0,4 | 0,91±0,6 | 0,85±0,2 | 0,84±0,4 |
| АлАТ
(3-42 Од/л) |
31,4±2,5 | 30,2±3,6 | 43,2±3,4 | 40,4±2,3 | 28,3±3,2* | 24,5±2,3 |
| АсАТ
(8-37 Од/л) |
24,2±3,4 | 21,2±4,6 | 39,3±3,2 | 37,5±4,1 | 21,1±3,4* | 17,3±3,6 |
Продовження таблиці 5.1
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Холестерин (3,9-6,2 ммоль/л) | 6,8±0,2 | 5,7±0,1 | 7,4±0,2 | 6,2±0,4 | 5,3±0,2* | 4,52±0,3 |
| Холестерин ЛПВЩ (1,04-1,55 мкмоль/л) | 1,14±0,3 | 1,18±0,4 | 1,12±0,4 | 1,25±0,3 | 1,24±0,2 | 1,27±0,4 |
| Холестерин ЛПНЩ (0-2,59 мкмоль/л) | 3,21±0,2 | 3,07±0,1 | 4,83±0,4 | 4,71±0,2 | 3,01±0,3* | 2,52±0,2 |
| Тригліцериди (0-1,7 ммоль/л) | 1,5±0,2 | 1,5±0,1 | 1,9±0,1 | 1,8±0,2 | 1,4±0,1 | 1,3±0,2 |
Примітка. * – p<0,05 при порівнянні до та після лікування
Як видно з таблиці 5.1, у хворих із уперше виявленою розацеа після лікування за стандартною схемою, нормалізація біохімічних показників була статистично незначною (р>0,05). У хворих із рецидивом розацеа, які отримували стандартну терапію, показники біохімічного дослідження крові були найгірші, із дуже слабкою тенденцією до нормалізації. Відсутність статистично значимих змін дослідження обумовлене наявністю хронічної супутньої патології, яка не піддавалася корекції. У хворих із рецидивом розацеа, які отримували лікування за нашою схемою на базі стандартної терапії, середні дані біохімічних показників мали статистично достовірну (р<0,05) тенденцію до відновлення у 17 (56,6 %) хворих. Так, у цих хворих виявлено тенденцію до нормалізації білкового обміну – підвищення рівня загального білка [(71,3±5,4) г/л]; коригування рівня вуглеводного обміну – зменшення рівня глюкози крові до нормальних показників; тенденцію до нормалізації показників активності ферментів – зниження рівня АлАт [(28,3±3,2) Од/л] та АлАТ [(21,1±3,4) Од/л]; тенденцію до нормалізації ліпідного обміну – зменшення показників ЛПНЩ [(1,24±0,2) мкмоль/л] та ЛПВЩ [(3,01±0,3) мкмоль/л]. У хворих із вперше встановленим діагнозом розацеа, які отримали стандартну терапію, покращення результатів спостерігали лише у 4 (20 %) досліджених. У хворих з рецидивом розацеа, лікованих стандартною терапією, нормалізація показників була відзначена тільки у 4 (13,3 %) (рис. 5.1).
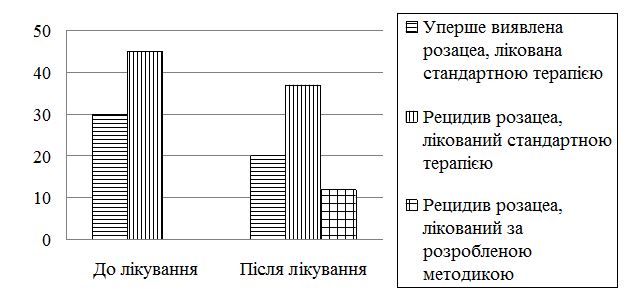
Рисунок 5.1 – Динаміка порушень показників біохімічних досліджень у хворих до та після лікування різними способами
Після проведеної терапії за рекомендованою схемою у 89 % хворих із рецидивами розацеа спостерігали усунення дисбалансу мікробного пейзажу ураженої шкіри обличчя. Зменшувалась кількість та інтенсивність колонізації патогенних мікроорганізмів та їх асоціацій. Наявність непатогенних бактерій та деяких дріжджоподібних грибів після проведеного лікування відзначалася з такою ж частотою, як і у здорових осіб. У 82 % хворих із рецидивом розацеа, які отримували лише стандартну терапію та у 78 % хворих із уперше виявленим епізодом розацеа мікрофлора шкіри після лікування суттєво не змінювала характеристик (рис. 5.2).
Після проведеного лікування відзначили коригування рівня кліщів демодекс у всіх досліджених хворих до кількості не більше 5 кліщів на 1 см2. Так, згідно результатів, достовірно статистичної різниці між порівняльними групами знайти не вдалося (рис. 5.3).
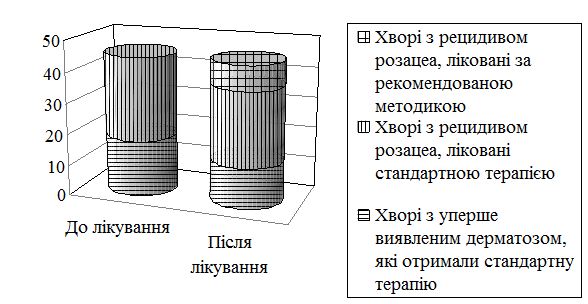
Рисунок 5.2 – Динаміка показників мікрофлори у хворих до та після лікування стандартною та розробленою терапією
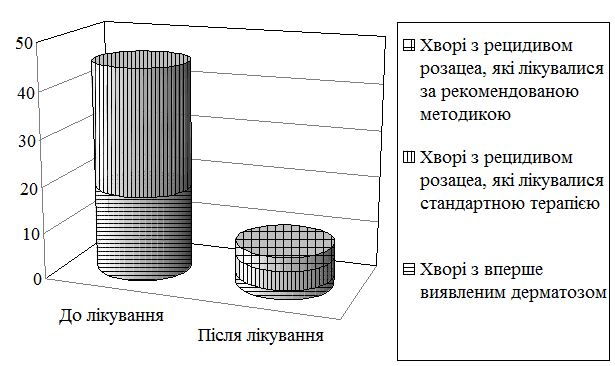
Рисунок 5.3 – Динаміка показників дослідження на демодекс у хворих до та після лікування
Показники психоемоційного стану за ШТГ та за ШДЗ були значно вищими у хворих із рецидивом розацеа (симптоми помірної тривожності та депресивних епізодів легкого ступеня). Після застосування розробленої нами терапії спостерігали зниження сумарних балів більше, ніж на 50 %, що було критерієм ефективності терапії. У групах порівняння, де хворі лікувалися тільки стандартною терапією, вираженість тривожних/депресивних симптомів залишалася практично в незмінених межах (рис. 5.4).
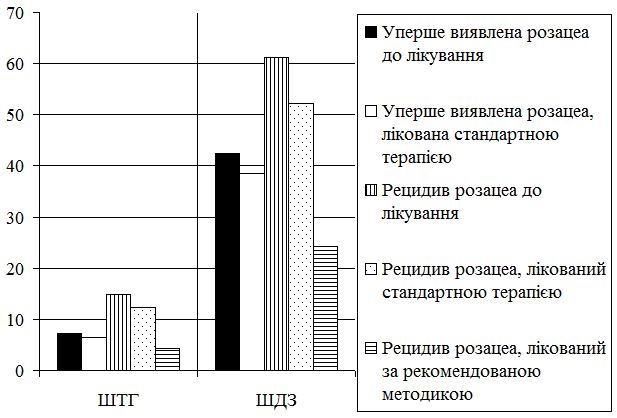
Рисунок 5.4 – Динаміка показників психологічного статусу досліджуваних хворих до та після лікування
Як видно з рисунка 5.4, після проведеної стандартної терапії середній бал за ШТГ складав 7,1±1,9 – у хворих першої групи (з уперше виявленим епізодом розацеа), та 14,7±2,6 – у хворих другої групи порівняння із рецидивом дерматозу, в той час, як у хворих другої групи порівняння із рецидивом розацеа, які отримували терапію за рекомендованою методикою, середній бал становив 5,4±3,1. Середній бал за ШДЗ після стандартної терапії становив 41,2±5,8 у хворих з уперше виявленою розацеа та 57,4±9,4 у хворихіз рецидивом дерматозу. У хворих же з рецидивом розацеа, які отримували терапію, запропоновану нами, бал симптомів тривоги статистично достовірно знизився та становив 24,3±5,2.
У хворих із рецидивом розацеа після терапії за рекомендованою методикою, виявлені ознаки регресу вегетативних порушень у вигляді позитивної динаміки показників ВСР. Так, зареєстровано статистично достовірне (р<0,05) підвищення показників SDNN, BАP, TP,VLF, LF, HF і нормалізація показників Мо, АМо та індексу вегетативного балансу порівняно з групою, яка лікувалася тільки за стандартною терапією (табл. 5.2).
Таблиця 5.2 – Показники ВСР в обстежених після отриманої терапії
| Показник | Здорові люди
(n=20) |
Хворі з первинним епізодом розацеа, які отримували стандартну терапію
(n=20) |
Хворі з рецидивом розацеа
(n=60) |
|
| Які отримували стандартну терапію
(n=30) |
Які отримували запропоновану терапію
(n=30) |
|||
| SDNN, мс² | 53,5±2,8 | 48,6±3,4 | 36,7±3,5 | 47,3±2,3* |
| ВАР, мс | 259,3±132,2 | 214,5±75,7 | 193,4±53,2 | 221,3±47,3* |
| Мо, мс | 786,6±58,2 | 793,2±47,3 | 821,3±79,4 | 764,2±47,4* |
| АМо, % | 37,4±25,3 | 42,7±28,4 | 50,1±23,2 | 42,4±23,4* |
| ІН, % | 111,6±94,2 | 167,2±112,4 | 176,2±124,3 | 125,2±76,3* |
| ТР, мс² | 2634,2±424,6 | 1952,3±327,7 | 1624,3±256,4 | 2172,2±161,3* |
| VLF, мс² | 763,5±262,4 | 635,2±112,3 | 427,2±194,1 | 672,3±68,4* |
| LF, мс² | 574,3±104,5 | 452,1±147,2 | 342,4±117,3 | 474,1±134,4* |
| HF, мс² | 1028,3±246,2 | 998,3±142,3 | 483,5±284,3 | 914,2±84,6* |
| LF/HF, % | 1,48±0,15 | 1,93±0,24 | 2,19±0,22 | 1,79±0,15* |
Примітка. * – p<0,05 при порівнянні до та після лікування
Як видно з таблиці 5.2, дослідження ВСР після лікування в обстежених групах дозволяє відзначити, що встановлені до терапії порушення мають тенденцію до змін показників у бік фізіологічних норм. У більшості ж пацієнтів, які отимували лише стандартну терапію (у 76 % з уперше встановленим діагнозом та у 92 % з рецидивом дерматозу) відмічали збереження ознак вегетативних розладів. Що ж до хворих з рецидивом розацеа, які отримували розроблену терапію, позитивна динаміка мала статистично достовірно (р<0,05) більш виражений характер у 72 % пацієнтів, порівняно з результатами хворих із рецидивами розацеа, які отримували стандартну терапію (рис. 5.5).
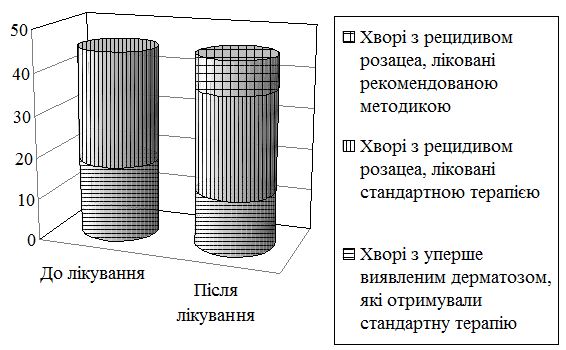
Рисунок 5.5 – Динаміка показників ВСР у хворих до та після лікування
Корекція суб’єктивних, клінічних та функціональних ознак вегетативної дисфункції здійснювалася за рахунок використання анксіолітика Мебікар.
Результати досліджень імунного статусу хворих із рецидивами розацеа (функціональна активність фагоцитуючих клітин, кількісний склад популяцій лімфоцитів, рівні імуноглобулінів та інтерлейкінів) після отриманого лікування представлені в таблиці 5.3.
Таблиця 5.3 – Показники імунного статусу хворих до та після лікування
| Показники | Хворі з первинним епізодом розацеа
(n=20) |
Хворі з рецидивом розацеа
(n=60) |
Конт-рольна група
(n=20) |
|||
| До лікуван-ня | Після стан-дартної терапії | До лікуван-ня
(n=60) |
Після стан-дартної терапії
(n=30) |
Після терапії за запропо-нованою методикою
(n=30) |
||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Нейтрофіли (1-6×109/л) | 4,63±
0,37 |
4,66±
0,4 |
4,81±
0,4 |
4,61±
0,3 |
4,62±
0,4 |
4,74±
0,35 |
| ФІ
(60-80 %) |
63,8±
4,2 |
68,3±
3,2 |
35,2±
2,5 |
38,1±
3,5 |
72,6±
3,4* |
82,6±
2,24 |
| ФЧ
(5-10 %) |
6,84±
0,76 |
7,36±
0,4 |
3,21±
0,2 |
4,35±
0,3 |
7,21±
0,6* |
8,26±
0,8 |
| НСТ-тест
(12-26 %) |
18,4±
2,1 |
18,9±
2,3 |
11,2±
1,3 |
14,1±
1,8 |
20,3±
2,2* |
21,8±
1,9 |
| Лейкоцити,
абс. |
6,34±
0,16 |
6,37±
0,21 |
5,32±
0,34 |
5,86±
0,32 |
6,21±
0,43 |
6,43±
0,56 |
| Лімфоцити,
абс. |
1,71±
0,14 |
1,73±
0,12 |
1,67±
0,17 |
1,69±
0,16 |
1,75±
0,13 |
1,78±
0,16 |
| CD4+, абс. | 0,71±
0,04 |
0,70±
0,04 |
0,47±
0,05 |
0,49±
0,04 |
0,61±
0,05* |
0,67±
0,06 |
| CD4+, % | 49,4±
2,74 |
46,8±
2,82 |
30,2±
3,14 |
34,1±
2,53 |
39,6±
2,42* |
41,2±
2,35 |
Продовження таблиці 5.3
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CD8+, абс. | 0,52±
0,03 |
0,50±
0,06 |
0,25±
0,04 |
0,27±
0,03 |
0,46±
0,04* |
0,48±
0,05 |
| CD8+, % | 31,4±
1,54 |
29,8±
2,34 |
14,3±
3,21 |
16,1±
2,46 |
27,2±
2,12* |
28,4±
1,27 |
| CD4+/CD8+ | 1,54±
0,07 |
1,54±
0,02 |
1,46±
0,02 |
1,49±
0,03 |
1,50±
0,02* |
1,52±
0,04 |
| CD16+, абс. | 0,21±
0,04 |
0,20±
0,02 |
0,38±
0,05 |
0,35±
0,06 |
0,24±
0,03 |
0,18±
0,07 |
| CD16+, % | 14,3±
1,24 |
14,0±
1,12 |
17,4±
1,42 |
16,2±
1,34 |
14,0±
1,02 |
13,6±
1,42 |
| CD22+, абс. | 0,31±
0,04 |
0,29±
0,03 |
0,35±
0,06 |
0,33±
0,04 |
0,28±
0,03* |
0,26±
0,02 |
| CD22+, % | 16,2±
1,32 |
16,0±
1,09 |
18,8±
1,53 |
17,5±
1,46 |
15,9±
1,45* |
15,4±
1,12 |
| IgG, г/л | 15,8± 2,36 | 14,7± 2,24 | 17,4± 3,24 | 17,2± 3,12 | 14,3± 2,43* | 13,4± 1,08 |
| IgA, г/л | 2,07± 0,04 | 2,07± 0,02 | 2,05± 0,02 | 2,05± 0,01 | 2,07± 1,14 | 2,07± 0,09 |
| IgM, г/л | 1,73± 0,02 | 1,67± 0,04 | 2,34± 1,12 | 2,12± 0,24 | 1,53±
1,09º |
1,32± 0,05 |
| IL-10 | 6,9±2,5 | 6,7±0,4 | 24,3±6,2 | 21,4±3,1 | 6,7±
6,4*** |
6,6± 3,2 |
| IL-12 | 78,46±15,6 | 74,3±
13,7 |
198,62±20,3 | 174,3±
17,6 |
89,5±
18,8** |
71,27±
28,4 |
Примітки:
*** – p<0,001 при порівнянні до та після лікування;
** – p<0,01 при порівнянні до та після лікування;
* – p<0,05 при порівнянні до та після лікування
Як видно з таблиці 5.3, найбільші зміни в імунологічному статусі виявлено в групі з рецидивами розацеа. У групі хворих після терапії, проведеної за рекомендованою методикою, спостерігали статистично значиму (p<0,05) тенденцію до нормалізації показників дослідження. Так, показники функціональної активності фагоцитів (рівень нейтрофілів, ФІ, ФЧ, НСТ-тесту) мали тенденцію до збільшення до рівня контрольної групи у 61 % пацієнтів. Позитивно змінилась кількість популяцій та субпопуляцій лімфоцитів (рівень СD4+, CD8+ та індекс СD4+/CD8+статистично достовірно збільшився; рівень СD16+ до та після лікування статистично не відрізнявся від контрольної групи; рівень CD22+ статистично значимо знижувався) у 71 % пацієнтів. Також статистично достовірно (р<0,05 та р<0,01) знижувались рівні Ig G та M у 54 % хворих та показники рівня IL-10 і -12 у 62 % хворих.
У групі хворих із рецидивами розацеа, які отримали лише стандартну терапію, нормалізації імунологічних показників майже не відмічали. Лише у 8 % хворих дещо збільшилися показники функціональної активності фагоцитів. Показники кількості популяцій та субпопуляцій лімфоцитів змінилися у 11 % хворих. Показники рівнів Ig G, M та рівня інтерлейкінів достовірно статистично знижувались у 13 % та 8 % хворих, відповідно.
У хворих з уперше виявленою розацеа, які лікувалися стандартною терапією, у деяких випадках спостерігалася тенденція до нормалізації імунологічних показників (збільшилися показники функціональної активності фагоцитів – у 26 % хворих; показники кількості популяцій та субпопуляцій лімфоцитів змінилися у 22 % хворих; показники рівнів Ig G та M статистично достовірно знизились у 34 % хворих), в той час як у решти хворих цієї групи, з більш глибокими порушеннями, нормалізації показників виявлено не було.
На рис. 5.6, показано динаміку імунних показників у обстежених хворих до та після лікування.
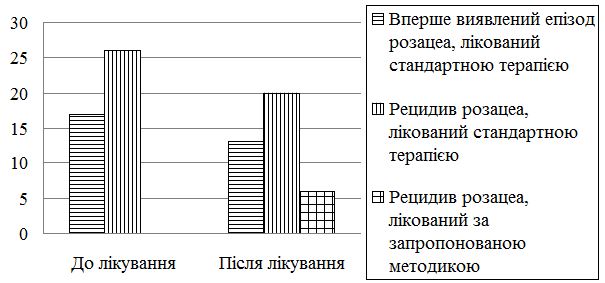
Рисунок 5.6 – Порівняння показників імунного статусу хворих до та після лікування
5.3 Обґрунтування прогностичних критеріїв та розробка профілактичних заходів розвитку рецидивів розацеа
За хворими, після проведення терапії, спостерігали тричі на рік, упродовж 18 місяців. У цей час усім хворим рекомендували проводити комплексне клінічне та функціонально-лабораторне обстеження для вчасного виявлення початку патогенетичних змін та їх корекції.
Врахування результатів власних досліджень дозволяє говорити про значну їх роль у визначені патогенезу рецидивів розацеа, змогу спостереження за ефективністю лікування в динаміці, а також про можливість прогнозування перебігу, щодо можливих ускладнень та рецидивування захворювання. Фактично, поява змін суб’єктивних, об’єктивних, функціональних та лабораторних показників були першими ознаками наближення початку рецидиву розацеа.
За нашими даними, характерними ознаками наближення розвитку рецидиву розацеа була поява при дослідженні суб’єктивних (відчуття зуду, печіння, стягнутості шкіри, приливів до обличчя) та об’єктивних (зміни артеріального тиску, пульсу, зміни дермографізму, поява гіпергідрозу долоней чи підошв) проявів вегето-судинних порушень.
Характерною ознакою появи рецидиву була зміна лабораторних показників (зменшення кількості лейкоцитів та лімфоцитів, прискорення швидкості осідання еритроцитів (ШОЕ), збільшення показників активності ферментів у сироватці крові). Критеріями появи рецидиву були зміни показників імунного статусу: тенденція до зменшення в НСТ-тесту, СD4+, CD8+ та індексу CD4+/CD8+. Отримані дані, ймовірно, свідчили про початок декомпенсації супутньої патології, яка, в свою чергу, впливає на перебіг розацеа.
Ще одним з критеріїв наближення рецидиву являлася якісно-кількісна зміна мікробного пейзажу шкіри (превалювання патогенної мікрофлори; збільшення кількості малассезій, кандіди, кишкової палички, протею на фоні значного дисбалансу та різкого зниження непатогенної флори – коринебактерій, непатогенних піококів; збільшення інтенсивності колонізації більше 105 КУО/см2 та асоціацій мікроорганізмів).
При оцінюванні результатів вивчення психоемоційного стану за даними опитувальників, ознакою появи рецидиву являлося збільшення симптомів стривоженості вище помірного рівня.
Зміна показників ВСР (дослідження за допомогою «Cardiolab») також була прогностичним критерієм стосовно розвитку рецидиву розацеа. Особливу увагу ми приділяли вивченню показника потужності спектру впливу гуморальних систем (VLF), показника потужності спектра низькочастотних коливань (LF) – маркера змін симпатичної ланки ВНС, показника потужності спектру високочастотних коливань (HF) – маркера змін парасимпатичної регуляції. Відмічали збільшення показника вегетативного балансу LF/HF при ознаках розвитку рецидиву.
Цей комплекс діагностичних критеріїв ми використовували як критерії можливого рецидиву розацеа.
З метою попередження виникнення рецидиву, у випадку виявлення початку змін досліджених діагностичних критеріїв, рекомендували профілактичне лікування, що складалося з профілактичного курсу прийому Аесцину по 1 таблетці 2 рази на день та Мебікару по 1 таблетці 2 рази на день, впродовж трьох тижнів.
З метою профілактики розвитку рецидивів розацеа рекомендували також використовувати спеціальні засоби медичної косметики для догляду. Так хворі після закінчення курсу основної терапії переходили на спеціальний медичний догляд за чутливою, схильною до почервоніння шкірою, та спеціальні засоби – влітку сонцезахисні креми з фільтром SPF більше 30, взимку – жирні креми та пудри для захисту від морозу фірми «La Roche-Posay» виробництва Франції. Рекомендували використовувати догляд лінії Rosaliac AR INTENS, основними інгредієнтами якої є амофенол, який зменшує товщину та зміцнює судинну стінку, зменшує прояви телеангіоектазій, нейросенсин – зменшую шкірну реактивність та почервоніння, та антиіритант, на основі термальної води – зменшує суб’єктивні відчуття дискомфорту на обличчі. Пацієнти наносили засіб 2 рази на день на очищену шкіру обличчя. Для зволоження, заспокоєння та пом’якшення шкіри впродовж дня використовували термальну воду, у склад якої входять мінеральні солі та мікроелементи з високим вмістом селену.
Одночасно в комплекс профілактичних заходів з метою своєчасного попередження розвитку рецидивів розацеа також входили рекомендації щодо виявлення та попередження провокуючих факторів індивідуально для кожного хворого, раціональне працевлаштування, дотримання дієти, консультації суміжних фахівців для контролю загального стану організму пацієнтів та своєчасного лікування.
Результати порівняння подальшого перебігу та клінічних проявів дерматозу після проведеного лікування свідчили на користь ефективності запропонованої нами методики комплексної терапії та профілактики розвитку рецидивів у хворих на розацеа.
При дослідженні нами віддалених результатів спостереження (терміном до 18 місяців) було виявлено, що у пацієнтів першої групи зафіксовано 6 (30 %) випадків виникнення рецидиву, у хворих другої групи, які отримали тільки стандартну терапію – 28 (93,2 %) випадків рецидивування, частина з яких реєструвалася вже на другому місяці спостереження, а у хворих другої групи, які отримали лікування та профілактичні заходи за рекомендованою методикою виявлено лише 2 (6,6 %) випадки виникнення рецидиву (які до того ж перебігали в досить м’якій формі).
У 6 хворих першої групи із вперше встановленим діагнозом розацеа, у яких при обстеженні були виявлені більш значні порушення – при подальшому спостереженні встановлено рецидив дерматозу, що підтверджувало достовірність розроблених нами критеріїв прогнозування.
Отже, при вивченні віддалених результатів виявлено, що у хворих із рецидивами розацеа, які отримували терапію та профілактичні заходи за розробленою методикою ремісія була достовірно тривалішою. Ефективність терапії у цих хворих також була достовірно вищою.
Дані, надані вище, свідчать про доцільність раннього виявлення критеріїв прогнозування перебігу захворювання, проведення лікування, направленого на корекцію виявлених порушень та запобігання розвитку рецидивів. Раціональне лікування з подальшим призначенням профілактичної терапії та лікувального догляду за шкірою є ключовим моментом у профілактиці розвитку рецидивів розацеа і підтверджує обґрунтованість та ефективність нашої методики лікування, профілактики та прогнозування рецидивів.
Наведено приклади клінічного перебігу рецидивів розацеа та доцільність вибору комплексної терапії.
1. Хвора Я., 39 років, історія хвороби № 239 поступила в жіноче шкірне відділення Запорізького обласного клінічного шкірно-венерологічного диспансеру з діагнозом: розацеа, папуло-пустульозна форма, рецидив. Супутні захворювання: гіпертонічна хвороба, хронічний гастрит, хронічний холецистит. При надходженні до лікарні були скарги на висипання на шкірі обличчя, шиї, грудей. Суб’єктивно: сухість шкіри, свербіж і печіння в місцях висипань, відчуття приливів до обличчя, часті головні болі. З анамнезу захворювання: вважає себе хворою протягом трьох років, з моменту появи плям рожевого кольору на шкірі щік. Захворювання пов’язує з сильним емоційним перенапруженням. Відзначає погіршення стану після прийому гострої та гарячої їжі. Проходила лікування у дерматолога, амбулаторно за місцем проживання 4 рази. Отримувала тетрациклінову мазь, антиботик еритроміцин. Ефект від лікування був нетривалий: через 1-2 місяці відзначала рецидив процесу. Місцево: патологічний шкірний процес, поширений, симетричний, локалізований на шкірі обличчя, шиї, грудей, представлений еритемою яскравого рожевого кольору, телеангіоектазіями, папулопустулезним висипом розміром від 0,1 до 0,3 см, місцями згрупованим, з незначним лущенням на поверхні. Об’єктивно: артеріальний тиск – 160/90 мм. рт. ст., пульс – 96 уд/хв., білий дермографізм, гіпергідроз долоней. Консультована терапевтом, ендокринологом, з призначенням терапії супутньої патології.
Загальноклінічний аналіз крові виявив зниження лейкоцитів. Аналіз сечі – без відхилень. При біохімічному аналізі крові виявлено: підвищення цукру крові (6,5 ммоль/л), підвищення активності ферментів АлАТ (18 Од/л) та АсАТ (34 Од/л), збільшення показників загального холестерину (6,7 ммоль/л), ЛПНЩ (3,24 мкмоль/л), підвищення рівня тригліцеридів (1,8 мкмоль/л).
Дослідження мікрофлори виявило ріст Staphylococcus еpidermidis, S. saprophiticus, S. aureus, S. haemolyticus, дріжжеподібні гриби, інтенсивність колонізації мікроорганізмів не перевищувала 107 КУО/см2.
При мікроскопічному дослідженні зішкрябку на демодекс виявлено Demodex foliculorum не більше 5 кліщів на 1 см2.
Дослідження психологічного статусу виявило ознаки помірної тривожності (за ШТГ – 17 балів) та помірних депресивних симптомів (за ШДЗ – 62 бали).
Результати дослідження ВНС виявили дисбаланс із перевагою симпатичної регуляції.
При аналізі імунного статусу виявлено пригнічення функції фагоцитів (НСТ-тест 10,3 %), зміни кількісного складу основних популяцій та субпопуляцій лімфоцитів – зниження CD4+ (0,46·109/л), CD8+ (0,28·109/л), коефіцієнту СD4+/СD8+ (1,43), збільшення СD16+ (1,34·109/л) та CD22+ (0,32·109/л); збільшення рівня імуноглобулінів (Ig G – 18,3 г/л та Ig M – 2,2 г/л) та інтерлейкінів (IL-10 – 26,4 n2/мл та IL-12 – 182 n2/мл).
Проведене лікування – доксициклін (Юнідокс Солютаб) 100 мг по 2 рази на добу, 2 тижні; Метронідазол (250 мг) по 1 таблетці двічі на день упродовж 14 днів; Аєвіт 1 капсула, 2 рази на день, 1 місяць; віт. С 500 мг, 1 раз на добу – 10 днів; Йогурт 1 капсула 3 рази на добу, 1 місяць; Карсил 1 таблетка 3 рази на добу, 2-3 місяця; Аесцин по 1 таблетці 3 рази на добу 1 місяць (далі по 1 таблетці 2 рази на добу – 20 днів, та протягом 24 днів, а потім по 1 таблетці 1 раз на день – 1 місяць); Мебікар по 1 таблетці 3 рази на добу упродовж 1 місяця; Тіотриазолін 1 таблетці 3 рази на добу 1 місяць. Зовнішньо використовували гель Аесцин – наносили тонким шаром 2 рази на день.
На фоні лікування помічено покращання перебігу шкірного процесу на 7-й день терапії. Повне зникнення клінічних проявів та покращання лабораторно-функціональних показників спостерігалося через 3 місяці після початку лікування.
Для профілактики виникнення рецидиву, рекомендували користуватися доглядом Rosaliac IR INTENS 2 рази на день.
Впродовж 18 місяців нагляду рецидиву захворювання не виявлялося.
2. Хвора Т., 58 роки, історія хвороби № 2691, перебувала під спостереженням в Запорізькому обласному клінічному шкірно-венерологічному диспансері з приводу розацеа, папуло-пустульозна форма, рецидив. Звернулась зі скаргами на множинні висипи на шкірі обличчя, що тривали впродовж 6 років. Висипання у вигляді множинних папул, пустул на шкірі щік, носа, підборіддя, дрібного лущення на гіперемованій, інфільтрованій шкірі. Суб’єктивно – свербіння, відчуття повзання мурашок по шкірі обличчя. Щорічно проходила амбулаторне лікування за місцем проживання, яке давало тимчасовий ефект. При клінічному обстеженні виявлено еритему на шкірі носа, щік, підборіддя застійно рожевого кольору, папули діаметром 5-6 мм, пустули та дрібно пластинчате лущення, множинні телеангіоектазії, розширені пори. Через тривалий виражений косметичний дефект, пацієнтка неспокійна та дратівлива. Об’єктивно: АТ – 150/90 мм. рт. ст., пульс – 120 уд/хв., білий дермографізм. Консультована терапевтом, ендокринологом, з призначенням терапії супутньої патології.
Загальноклінічний аналіз крові виявив зниження лейкоцитів, підвищення ШОЕ. Аналіз сечі – без відхилень. При біохімічному аналізі крові виявлено підвищення активності ферментів АлАТ (22 Од/л) та АсАТ (44 Од/л), збільшення показників загального холестерину (7,4 ммоль/л), ЛПНЩ (3,44 мкмоль/л), підвищення рівня тригліцеридів (1,9 мкмоль/л).
Дослідження мікрофлори виявило ріст Staphylococcus еpidermidis, S. saprophiticus, S. aureus, Streptococcus haemolyticus, дріжджеподібні гриби Сandida, гриби роду Malassezia – M. furfur. Інтенсивність колонізації мікроорганізмів у пробах шкіри була 109 КУО/см2.
При мікроскопічному дослідженні зішкрябку на демодекс виявлено Demodex foliculorum більше 5 кліщів на 1 см2.
Дослідження психологічного статусу виявило симптоми вираженої тривожності (за ШТГ – 22 бали) та помірних депресивних симптомів (за ШДЗ – 64 бали).
Результати дослідження ВНС виявили дисбаланс із перевагою симпатичної регуляції.
При аналізі імунного статусу виявлено пригнічення функції фагоцитів (НСТ-тест – 11,3 %), зміни кількісного складу основних популяцій та субпопуляцій лімфоцитів – зниження CD4+ (0,48·109/л), CD8+ (0,36·109/л), коефіцієнту СD4+/СD8+ (1,52), збільшення СD16+ (1,46·109/л) та CD22+ (0,45·109/л); збільшення рівня імуноглобулінів (Ig G – 21,3 г/л та Ig M – 2,6 г/л) та інтерлейкінів (IL-10 – 28,4 n2/мл та IL-12 – 189 n2/мл).
Проведене лікування – доксициклін (Юнідокс Солютаб) 100 мг по 2 рази на добу, 3 тижні; Метронідазол (250 мг) по 1 таблетці двічі на день упродовж 14 днів; Аєвіт 1 капсула, 2 рази на день, 1 місяць; віт. С 500 мг, 1 раз на добу – 10 днів; Йогурт 1 капсула 3 рази на добу, 1 місяць; Карсил 1 таблетка 3 рази на добу, 2-3 місяця; Аесцин по 1 таблетці 3 рази на добу 1 місяць (далі по 1 таблетці 2 рази на добу – 20 днів, та протягом 24 днів, а потім по 1 таблетці 1 раз на день – 1 місяць); Мебікар по 1 таблетці 3 рази на добу упродовж 1 місяця; Тіотриазолін 1 таблетці 3 рази на добу 1 місяць. Зовнішньо використовували гель Аесцин – наносили тонким шаром 2 рази на день.
На фоні лікування відмічено покращання перебігу шкірного процесу на 10-й день терапії, повне зникнення клінічних проявів та покращення лабораторно-функціональних показників відзначалося після трьох місяців лікування.
Для профілактики виникнення рецидиву, рекомендували користуватися доглядом Rosaliac IR INTENS 2 рази на день.
Впродовж подальшого нагляду за пацієнткою та профілактичного обстеження, через 6 місяців було встановлено, що у хворої з’явилося відчуття жару та приливів до обличчя, підвищилися показники артеріального тиску – 150/95 мм. рт. ст., хвора почала відмічати появу гіпергідрозу долоней. При лабораторному обстеженні було виявлено збільшення кількості лімфоцитів, почали зменшуватися показники СD4+, CD8+ та індекс CD4+/CD8+. У мікробному пейзажі шкіри збільшилася патогенна флора, а інтенсивність колонізації мікроорганізмів почала складати 105 КУО/см2. При вивченні психоемоційного стану, виявлено збільшення симптомів тривожності вище помірного рівня (за ШТГ – 20 балів). При обстежені ВНС виявлено зменшення деяких показників ВСР, які вказували на початок зсуву баланса у бік симпатичної регуляції.
У зв’язку з виявленням початку змін клініко-лабораторних даних, хворій було рекомендовано профілактичний курс лікування Аесцином та Мебікаром по 1 таблетці двічі на добу, впродовж трьох тижнів із подальшим використанням догляду Rosaliac.
Після проведеного профілактичного лікування лабораторні показники мали тенденцію до нормалізації. Впродовж подальшого спостереження протягом року, рецидиву захворювання виявлено не було.
* * *
Таким чином, на підставі клініко-лабораторних даних підтверджена ефективність розробленого способу лікування та профілактики рецидивів розацеа.
Розроблені методи прогнозування дозволили отримувати суб’єктивні та об’єктивні дані про початок раннього патологічних змін в організмі, вчасно коригувати виявлені порушення та запобігти розвитку рецидиву захворювання.
Результати даних проведених досліджень були представлені в наступних публікаціях:
1. Василенко А.В. Обгрунтування диференційованої тактики лікування демодекозів та вульгарних вугрів / А.В. Василенко // Дерматовенерологія. Косметологія. Сексопатологія. – 2011. – № 1-4. – С. 239–241.
2. Василенко А.В. Комплексная дифференцированная терапия больных рецидивами розацеа с учетом изменений показателей вариабельности сердечного ритма и изменений психологического статуса / А.В. Василенко // Запорожский медицинский журнал. – 2015. – № 4 (91). – С. 79–84.
3. Василенко А.В. Комплексна диференційована терапія хворих рецидивами розацеа із використанням сучасних ангіопротекторів / А. В. Василенко // Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции: материалы научной конференции. – Харьков, 2015. – С. 18–25.
4. Патент на корисну модель № 86374 Україна, МПК А61К31/00, А61К9/00. Спосіб лікування розацеа / А.В. Василенко, заявник і патентовласник Запорізький державний медичний університет. – № u201308689; заявл. 10.07.2013; опубл. 25.12.2013, Бюл. № 24.
5. Василенко А.В. Використання протизапальних засобів різновекторної дії при лікуванні розацеа / А. В. Василенко // Медицина та фармація XXI століття – крок у майбутнє: матеріали 72 Всеукраїнської науково-практичної конференції молодих вчених та студентів з міжнародною участю, присвячена Дню науки, м. Запоріжжя, 19-20 квітня 2012 р. – Запоріжжя, 2012. – С. 61–62.
6. Василенко А.В. Наш досвід комплексної терапії розацеа з використанням венопротекторів та транквілізаторів / А.В. Василенко // Сборник научных трудов: Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции. – Харьков, 2013. – С. 58–63.
7. Василенко А. В. Особливості лікування різних клінічних форм розацеа з використанням транквілізаторів / А. В. Василенко // Від клінічних настанов до уніфікованих протоколів діагностики та лікування в дерматовенерології: матеріали науково-практичної конференції, м. Київ, 21–22 березня 2013 р. – К., 2013. – С.19-20.
РОЗДІЛ 6
УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
За даними літератури останніх років відомо, що розацеа є актуальною медико-соціальною проблемою через широку розповсюдженість захворюваності та часте рецидивування хвороби. Залишаються остаточно не вирішеними питання стосовно етіології, деяких сторін патогенезу, лікування цього дерматозу та, особливо, профілактичних заходів. Відсутні дослідження стосовно особливостей клініки та перебігу рецидивів розацеа. Як відзначають більшість авторів, рецидиви, з’являються як після впливу деяких триггер факторів, так і спонтанно спостерігаються у 80-95 % хворих на розацеа. Тому це привертає увагу вчених до вивчення саме цієї проблеми з метою призупинення прогресування хвороби, пошуку ефективних засобів терапії, попередження та методів прогнозування виникнення рецидивів розацеа на основі аналізу загально клінічних методів, біохімічних показників аналізу крові, мікробного пейзажу шкіри, психоемоційного статусу, стану вегетативної нервової та імунної систем, що і визначило мету виконаної дисертаційної роботи.
Під наглядом знаходилось 80 хворих на розацеа у віці від 29 до 72 років, середній вік – (41,1±16,4) року. Серед них було 54 жінки (67,5 %) та 26 чоловіків (32,5 %). Серед досліджуваних – 20 пацієнтів (13 жінок та 7 чоловіків) із вперше виявленою розацеа та 60 пацієнтів (41 жінок та 19 чоловіків) із рецидивами розацеа. Контрольну групу складали 20 осіб (10 чоловіків та 10 жінок), які були практично здорові, не мали в анамнезі дерматологічної чи супутньої патології.
Встановлено, що хворі на розацеа були переважно у віці від 40 років в (66 з 80 хворих – 82,5 %). Захворювання частіше реєстрували у пацієнтів жіночої статті, що співпадає з даними літератури.
При порівняльному аналізі даних анамнезу та клінічних проявів виявлено, що у хворих із рецидивом розацеа виявлені певні особливості.
Так, у 5 із 20 хворих (25 %) з уперше виявленою розацеа та у 52 з 60 хворих (86,6 %) із рецидивом розацеа були суб’єктивні скарги (свербіж, печіння і поколювання, стягнутість, сухість шкіри із лущенням, відчуття приливів до обличчя, набряк обличчя, відчуття повзання мурашок, оніміння), що, у свою чергу, викликали більш суттєві психоемоційні розлади.
Серед досліджених у 18 (27,5 %) хворих була діагностована еритематозно-телеангіоектатична (судинна) форма, у 53 (72,5 %) – папуло-пустульозна форма розацеа, у 4 (5 %) – інфільтративно-продуктивна форма розацеа та у 5 (6,25 %) – офтальморозацеа. Еритематозно-телеангіоектатична форма розацеа виявлена в 13 хворих (65 %) із уперше виявленою розацеа та у 6 хворих (10 %) із рецидивом. Папуло-пустульозна форма розацеа була у 7 хворих (30 %) із уперше виявленою розацеа та у 45 хворих (75 %) із рецидивом. Інфільтративно-продуктивна форма розацеа була діагностована лише у 4 хворих (6,7 %) із рецидивом дерматозу. Встановлено, що у хворих із первинним епізодом розацеа частіше відзначалася еритематозна форма, а при рецидивах розацеа переважала папуло-пустульозна форма розацеа.
У 14 (17,5 %) хворих із рецидивом розацеа патологічний процес був більш (c2=9,4, р<0,01) виражений та поширений, оскільки відзначали ураження всієї шкіри обличчя та шкіри волосистої частини голови.
При аналізі тяжкості розацеа по шкалі діагностичної оцінки ШДОР було встановлено, що серед хворих із рецидивом розацеа переважали пацієнти із середнім ступенем тяжкості (середній бал становив 10,4 ±1,5 у 49 (81,6 %) пацієнтів). У хворих із уперше встановленим епізодом розацеа, частіше був виявлений легкий ступінь (середній бал – 5,4±1,1 у 17 (85 %) пацієнтів).
Ефект від попереднього лікування хворих із рецидивом розацеа характерезувався як короткочасний або недостатній. Перебіг дерматозу був частіше (c2=5,4, р<0,05) прогредієнтно прогресуючий та рецидивуючий. Спонтанних ремісій у пацієнтів не було. Ремісії тривали в середньому 1-3 місяці та починалися тільки після лікування.
Деякі хворі могли пов’язати розвиток чи загострення дерматозу з певною причиною (триггерними факторами), а саме: інтенсивна фізична активність (спостерігалась у 15 хворих – 19 %), стрес (у 46 пацієнтів – 58 %), використання косметичних або медикаментозних засобів (у 32 пациента – 40 %), тривала інсоляція (у 16 пациентів – 20 %), гостра їжа та алкоголь (у 27 пациентов – 34 %), горячі ванни, сауна (у 12 пациентов – 15 %). 22 хворих (28 %) ні з чим не повязували розвиток чи загострення розацеа. Хворі із рецидивом розацеа відзначали наявність (c2=7,6, р<0,05) водночас декількох факторів, що провокували захворювання.
У хворих із рецидивом розацеа захворюваність супутньою патологією була значно вищою (c2=7,8, р<0,05), ніж у пацієнтів із уперше виявленим епізодом розацеа, та найчастіше супроводжувалась захворюваннями шлунково-кишкового тракту, серцево-судинною патологією та наявністю хронічної інфекції в організмі.
У минулому 68 з 80 хворих відзначали перенесені захворювання: інфекційні (грип, гострі респіраторні захворювання, дизентерія), дитячі інфекції (вітряна віспа, кір, скарлатина), запальні (тонзиліт, ангіна фурункульоз, апендицит) та патологію шлунково-кишкового тракту (гастрит, виразкова хвороба, гепатит, холецистит, панкреатит). Слід зазначити, що саме хворі із рецидивами розацеа найчастіше (c2=6,7, р<0,05) вказували на раніше перенесені захворювання.
У хворих при рецидиві, на відміну від здорових осіб та пацієнтів з уперше виявленою розацеа, при біохімічних дослідженнях до лікування значно частіше (c2=5,2, р<0,05) спостерігали порушення, які проявлялися статистично значущим (р<0,05) зниженням рівня загального білка, збільшенням загального білірубіну, змінами активності ферментів АлАТ та АсАТ. Виявляли зміни в ліпідному обміні, а особливо підвищення показників холестерину ЛПНЩ та тригліцеридів, що ймовірно пояснюється рядом супутньої патології, яка має вплив на організм та обтяжує перебіг захворювання, провокуючи розвиток рецидивування дерматозу.
Особливості та якісно-кількісні зміни мав мікробний пейзаж шкіри при рецидивах розацеа. Перебіг захворювання ускладнювався різноманіттям штамів мікроорганізмів, високою інтенсивністю мікробної колонізації шкіри, збільшенням патогенних видів та переважанням їх асоціацій, що, як наслідок, ускладнювало перебіг дерматозу, який набував більш виразний запальний характер та прогредієнтний перебіг. Патогенні коки були виявлені майже в усіх хворих із рецидивами (92 %), у той час як у хворих із уперше виявленою розацеа їх виявляли у 16 %, а в контрольній групі (практично здорові особи) – тільки у 5 %. Активний синергізм M. furfur відзначено із стафілококами та ентеробактеріями, а C. albicans з усіма видами. Найбільш часто у хворих на розацеа висівався S. аureus та S. epidermidis. Інтенсивність колонізації проб шкіри складала 107-109 КУО/см2. Чутливість мікрофлори до антибіотиків залежала від видів мікроорганізмів та коливалась у широкому діапазоні.
Керуючись результатами досліджень, можна зробити висновок, що патогенна мікрофлора викликає загострення дерматозу та його рецидиви, що вказує на етіологічний зв’язок між ступенем обсіменіння шкіри патогенними мікроорганізмами та тяжкістю перебігу розацеа. Супутня патологія, зниження загальної резистентності організму – це те, що найчастіше спостерігається у таких хворих і створює, таким чином, сприятливі умови для розвитку сапрофітуючих організмів та для переходу їх в патогенну флору. Тому врахування особливостей перебігу розацеа доцільне при підборі методів раціональної ефективної терапії та прогнозуванні розвитку рецидиву захворювання.
У хворих із рецидивом розацеа, виявлено достовірно вищі показники наявності D. folliculorum, порівняно з групою хворих з уперше виявленою розацеа. Встановлено, що у 18 (30 %) пацієнтів із рецидивом розацеа та у трьох (15 %) пацієнтів з уперше встановленим діагнозом розацеа кількість кліщів була більшою від 5 осіб на 1 см2. Але разом з тим, виявлення кліщів на шкірі здорових осіб контрольної групи доводить те, що демодекс належить до сапрофітів, кількість якого під впливом різних чинників і обтяжуючих факторів на шкірі збільшується, що можна розцінювати як один із прогностичних ознак розвитку рецидиву розацеа.
У хворих із рецидивом розацеа при дослідженні психоемоційного стану було виявлено, що показники за ШТГ і за ШДЗ коливалися в межах помірної тривожності та депресивних симптомів середнього ступеня й були достовірно вищими, ніж у хворих групи порівняння. При проведенні лікування велике значення мало раннє виявлення психологічної напруги, що допомагало здійснювати корекцію виявлених порушень, запобігати розвитку рецидивів та прогнозувати перебіг захворювання.
У більшості (c2=4,3, р<0,05) хворих із рецидивом розацеа, на відміну від хворих із уперше встановленим діагнозом, виявляли коливання артеріального тиску (у 56 %), зміну частоти пульсу (у 37 %), зміну місцевого та рефлекторного дермографізму (у 48 %), підвищену пітливість долонь і підошв (у 69 %), що є показниками функціональних порушень регуляції ВНС.
У хворих із рецидивом розацеа, у порівнянні з групою хворих із уперше виявленим епізодом розацеа та показниками практично здорових людей, при дослідженні вегетативної регуляції серцевої діяльності за допомогою використання системи кардіографії «Сardiolab» виявляли більш виражені статистично достовірні (р<0,05) порушення центральних механізмів регуляції, у вигляді зниження потужності основних часових (SDNN, ВАР,) та спектральних (ТР, VLF, LF, HF) показників ВСР на фоні підвищення показників Мо, АМо, ІН та індексу вегетативного балансу в бік переважання симпатичної регуляції.
При імунологічних дослідженнях у хворих із рецидивом розацеа встановлені особливості, які характеризувались пригніченням функції фагоцитів (зменшення ФІ, ФЧ та НСТ-тесту); змінами кількісного складу основних популяцій та субпопуляцій лімфоцитів, що характеризують Т‑клітинну недостатність (зниження рівнів CD4+, CD8+, коефіцієнта CD4+/CD8+ на фоні збільшення вмістуCD16+ та CD22+; збільшення рівня Ig G та Ig M; підвищення продукції IL-10 та -12). Фактично, при дослідженні у хворих на рецидиви розацеа виявлені порушення імунного статусу у вигляді Т-клітинної недостатності та імуносупресії з ознаками загальної недостатності В-клітинного ланцюга імунітету при відносній гіперфункції В-лімфоцитів.
Для лікування рецидивів розацеа досліджені нами пацієнти були розділені на 2 групи: перша група – 20 пацієнтів (13 жінок та 7 чоловіків) із уперше виявленою розацеа та друга група – 60 (41 жінка та 19 чоловіків) досліджених із рецидивами розацеа, які були співставні за статевим та віковим складом. Друга група була також поділена на дві підгрупи (по 30 осіб у кожній) для об’єктивної оцінки ефективності способів лікування.
Для лікування та запобігання рецидивів у майбутньому виявляли та рекомендували повністю усунути провокуючі фактори розвитку захворювання, щоб допомогти контролювати перебіг захворювання. Враховуючи індивідуальні особливості, хворим рекомендували розумно організувати спосіб життя. Всім хворим обґрунтовували необхідність щадного режиму й дієти, а саме: вилучити гарячі страви, прянощі, гостре, солоне (особливо йодовану сіль), оцет, соуси з приправами, смажене, копчене, екстрактивні речовини, консервовані продукти, тваринні жири, алкогольні напої, солодощі, а також деякі лікарські препарати.
Хворі на розацеа, які обстежувались як у основній, так і в групах порівняння з урахуванням загальноприйнятих рекомендацій, отримували стандартну терапію, яка складалася із загальної терапії (антибіотик – доксіциклін по 100 мг 1-2 рази на добу до 6-8 тижнів; або еритроміцин 500-1000 мг в 2 прийоми; 1-4 тиждні; або кларитроміцин 500 мг на добу – 2-4 тиждні; Метронідазол по 250 мг 2 рази на добу 2 тижні; вітамінотерапія: аскорбінова кислота 500 мг двічі на добу – 14 днів та Аєвіт по 1 капсулі 2 рази на добу – 1 місяць; йогурт по 1 капсулі тричі на добу; гепатопротектор силімарин по 1 таблетці 3 рази на добу 2-3 місяці). В зовнішній терапії призначали на уражені ділянки, двічі на добу – Метронідазол 1 % гель або крем, азелаїнову кислоту, крем 15 %.
Для комплексної терапії хворих на рецидиви розацеа було розроблено науково обґрунтований метод, особливостями якого є додаткове використання препаратів, які впливають на більшість факторів патогенезу і направлені на усунення всіх виявлених патогенетичних порушень та в комплексі мають посилений вплив на стабілізацію всього організму в цілому.
Так, хворі першої групи порівняння з уперше встановленим діагнозом розацеа та половина другої групи порівняння із рецидивом розацеа отримували тільки стандартну терапію. Основні обстежені другої групи із рецидивом розацеа отримували запропоновану методику лікування, як доповнення до стандартної терапії, коли додатково до стандартної терапії включали такі групи лікарських засобів як ангіопротектор, анксіолітик та метаболічний препарат з гепатопротекторною та імуномоделюючою дією.
Для корекції ангіодинамічних порушень у комплексній терапії хворих на рецидив розацеа призначали препарат Аесцин, що має вазорегулюючу та венотонічну дію на судинну систему шкіри. Препарат має також протизапальну, анальгізуючу, проти набрякову, антиоксидантну та помірну імунокоригуючу дії, покращує мікроциркуляцію і тим самим сприяє репарації органів і тканин. Препарат призначали по 1 таблетці (20 мг) тричі на день упродовж 1 місяця, далі – 20 днів по 1 таблетці двічі на день, а потім упродовж 1 місяця по 1 таблетці 1 раз на день.
У патогенетичній терапії використовували анксіолітик Мебікар ІС, який регулює стан ВНС й викликає слабкий загальний антипсихотичний та протитривожний ефект, володіє нормастенічними властивостями, сприяє нормалізації ліпідного обміну, покращує трофіку міокарда, знижує внутришньосудинну агрегацію еритроцитів, впливає на проникність судинної стінки та знижує в’язкість крові. Призначали Мебікар по 1 таблетці (0,3 г) тричі на день, від 20 до 45 днів.
У комплексній терапії для усунення імунних та супутніх порушень використовували препарат тіотриазолін, який володіє гепатопротекторними, імуномодулючими, мембраностабілізуючими, протиішемічними та антиоксидантними властивостями. Призначали препарат по 1 таблетці (100 мг) тричі на день, упродовж 30 днів.
Зовнішньо використовували лікарську форму препарату Аесцин у вигляді гелю. При цьому гепарин та диетиламіна саліцилат, що знаходяться у складі, надавали гелю протитромботичну, протизапальну та анальгізуючу дії (наносили двічі на день на уражену ділянку шкіри). Тривалість лікування залежала від характеру патологічного процесу.
Під час лікування та для профілактики розвитку рецидивів розацеа усім хворим роз’яснювали принципи раціонального догляду за шкірою, оскільки лагідний догляд запобігав появі почервоніння, подразнень і відчуття стягнутості.
Так, після початку лікування у хворих, які отримували терапію за рекомендованою методикою, стабілізацію стану та регрес проявів захворювання реєстрували в середньому на 8-10-й день. На відміну від цього, у хворих групи порівняння із рецидивом дерматозу, які отримали тільки стандартну терапію, стабілізація стану спостерігалось тільки на 21-24-й дні лікування та мала дуже слабку динаміку. У хворих із уперше виявленим епізодом розацеа ознаки стабілізації стану спостерігалися в середньому на 14-20-й день лікування.
У результаті лікування через 1 місяць у хворих першої групи порівняння (з уперше виявленою розацеа), які отримували стандартний метод терапії, покращання клініко-лабораторних показників спостерігалось у 46 % досліджених. У хворих другої групи (з рецидивами розацеа), які також лікувалися за стандартною схемою, регрес висипання на обличчі спостерігався у 21 % обстежених, при цьому в більшості взагалі не відзначали позитивної динаміки від лікування, що обумовлене більш тяжкими патогенетичними змінами при рецидивах та більш тяжким перебігом дерматозу. А от у хворих другої групи із рецидивом розацеа, які були проліковані за рекомендованою схемою терапії, відзначали статистично достовірне покращання клініко-лабораторних показників у 78 % хворих.
У 61 % пацієнтів першої групи з уперше виявленою розацеа повне одужання спостерігали через 3 місяці після початку лікування. Лише у 32 % паціентів другої групи, лікованих тільки стандартною терапією, повне одужання відзначали через 5 місяців лікування, а у решти (зберігалися ознаки запалення, інфільтрації, приєднання вторинної інфекції) спостерігали резистентність до терапії. У 87 % пацієнтів другої групи, які отримували терапію за рекомендованою схемою, повний регрес висипань дерматозу відзначали на другому місяці лікування.
Після проведення терапії за розробленою методикою у хворих другої групи з рецидивами розацеа не було виявлено таких суб’єктивних ознак як свербіння, печіння, поколювання, сухість, набряк, оніміння, стягнутість шкіри обличчя, відчуття повзання мурашок. У другій групі хворих із рецидивами розацеа, пролікованих лише за стандартною терапією, суб’єктивні ознаки виявляли у 23 із 30 пацієнтів. У першій групі з уперше виявленим епізодом розацеа після лікування стандартною терапією суб’єктивні ознаки виявляли у 4 із 20 пацієнтів.
Після лікування такі прояви вегето-судинних порушень, як підвищення артеріального тиску, лівідність пульсу, зміни місцевого та рефлекторного дермографізму, гіпергідроз долонь та підошв виявляли у 24 із 30 хворих другої групи із рецидивом розацеа, лікованих стандартною терапією та у 12 із 20 пацієнтів першої групи з уперше виявленим епізодом розацеа, також лікованих стандартною терапією. У хворих же другої групи із рецидивом розацеа, які отримували терапію за розробленою методикою, об’єктивні прояви порушень функціонального стану ВНС виявили лише у 6 із 30 хворих, до того ж вони характеризувалися значно меншими проявами.
У хворих із уперше виявленою розацеа після лікування за стандартною схемою нормалізація біохімічних показників була статистично незначною (р>0,05). У хворих із рецидивом розацеа, які отримували стандартну терапію, показники біохімічного дослідження крові були найгіршими, із дуже слабкою тенденцією до нормалізації. Відсутність статистично значимих змін після терапії обумовлені наявністю хронічної супутньої патології, яка не піддавалася корекції. У хворих із рецидивом розацеа, які отримували лікування за розробленою схемою на базі стандартної терапії, середні дані біохімічних показників мали статистично достовірну (р<0,05) тенденцію до відновлення у 17 (56,6 %) хворих. Так, у цих хворих виявлено тенденцію до нормалізації білкового обміну – підвищення рівня загального білка [(71,3±5,4) г/л]; коригування рівня вуглеводного обміну – зменшення рівня глюкози крові до нормальних показників; тенденцію до нормалізації показників активності ферментів – зниження рівня АлАт до (28,3±3,2) Од/л та АлАТ до (21,1±3,4) Од/л; тенденцію до нормалізації ліпідного обміну – зменшення показників ЛПНЩ до (1,24±0,2) мкмоль/л та ЛПВЩ до (3,01±0,3) мкмоль/л.
Після проведення лікування за рекомендованою схемою у 89 % хворих із рецидивами розацеа спостерігали усунення дисбалансу мікробного пейзажу ураженої шкіри обличчя. Зменшилася кількість та інтенсивність колонізації патогенних мікроорганізмів та їх асоціацій. Наявність непатогенних бактерій та деяких дріжджоподібних грибів після проведеного лікування відзначалася з такою ж частотою, як і у здорових осіб. А ось у 82 % хворих із рецидивом розацеа, які отримували лише стандартну терапію, та у 78 % хворих із уперше виявленим епізодом розацеа мікрофлора шкіри після лікування суттєво не змінювала характеристик.
Після проведеного лікування відзначали коригування кількості кліщів демодекс у всіх досліджених хворих на розацеа (не більше 5 кліщів на 1 см2).
У хворих із рецидивом розацеа при дослідженні психоемоційного стану було виявлено, що його показники за ШТГ та за ШДЗ були значно вищими (симптоми помірної тривожності та депресивних епізодів легкого ступеня), а після застосування розробленої нами терапії спостерігали зниження сумарних балів більше, ніж на 50 %, що було розцінено, як критерій ефективності терапії. У групах порівняння, де хворі лікувалися тільки за стандартною методикою, вираженість тривожних/депресивних симптомів залишалася практично в незмінених межах.
Так, у хворих першої групи (з уперше виявленим епізодом розацеа) після проведеної стандартної терапії середній бал за ШТГ складав 7,1±1,9, та 14,7±2,6 – у хворих 2-ї групи порівняння із рецидивом дерматозу. У хворих другої групи порівняння з рецидивом розацеа, які отримували терапію за нашою методикою, середній бал становив 5,4±3,1. Середній бал за ШДЗ після стандартної терапії становив 41,2±5,8 у хворих з уперше виявленою розацеа та 57,4±9,4 у хворих із рецидивом дерматозу. У хворих же з рецидивом розацеа, які отримували терапію, запропоновану нами, бал симптомів тривоги статистично достовірно знизився та становив 24,3±5,2.
У хворих із рецидивами розацеа після терапії за розробленою методикою, виявлені ознаки регресу вегетативних порушень у вигляді позитивної динаміки показників ВСР. Так, зареєстровано статистично достовірне (р<0,05) підвищення показників SDNN, BP, TP,VLF, LF, HF і нормалізація показників Мо, АМо та індексу вегетативного балансу порівняно із групою, яка лікувалася тільки за стандартною терапією.
Дослідження ВСР після лікування у обстежених хворих дозволило відзначити, що встановлені раніше порушення мали тенденцію до змін показників у бік фізіологічних норм, але в більшості пацієнтів, які отимували лише стандартну терапію (у 76 % з уперше встановленим діагнозом та у 92 % з рецидивом дерматозу), зберігалися ознаки вегетативних розладів. У хворих із рецидивом розацеа, які отримували розроблену терапію, позитивна динаміка мала більш виражений характер порівняно з результатами хворих із рецидивами розацеа, які отримували стандартну терапію.
Після терапії за рекомендованою методикою, в групі хворих із рецидивами розацеа ми спостерігали статистично значущу (p<0,05) тенденцію до нормалізації імунологічних показників дослідження. Так, показники функціональної активності фагоцитів (рівень нейтрофілів, ФІ, ФЧ, НСТ-тесту) збільшилися у 61 % пацієнтів. Позитивно змінилась кількість популяцій та субпопуляцій лімфоцитів (статистично достовірно збільшувалися рівені СD4+, CD8+ та індекс СD4+/CD8+; рівень CD22+ статистично значущо знижувався) у 71 % пацієнтів. Статистично достовірно (р<0,05) знижувались рівні Ig G та M у 54 % хворих та показники рівня інтерлейкінів у 62 % хворих.
У групі хворих з рецидивами розацеа, які отримали лише стандартну терапію, нормалізації імунологічних показників не відбувалась. Лише у 8 % хворих дещо збільшилися показники функціональної активності фагоцитів. Показники кількості популяцій та субпопуляцій лімфоцитів змінилися у 11 % хворих. Показники рівнів Ig G, M та рівня інтерлейкінів достовірно статистично знижувались у 13 % та 8 % хворих відповідно.
У хворих із уперше виявленою розацеа, які лікувалися за стандартною терапією, у деяких випадках спостерігалася тенденція до нормалізації імунологічних показників (збільшилися показники функціональної активності фагоцитів – у 26 % хворих; у 22 % хворих змінилися показники кількості популяцій та субпопуляцій лімфоцитів; статистично достовірно знизились показники рівнів Ig G та M у 34 % хворих). А у решти хворих цієї групи, з більш глибокими порушеннями, нормалізації показників виявлено не було.
При спостереженні за хворими після проведення терапії упродовж 18 місяців рекомендували тричі на рік проводити комплексне клінічне та функціонально-лабораторне обстеження для вчасного виявлення початку патогенетичних змін та їх корекції.
Врахування результатів власних досліджень дозволяє говорити про їхню значущість у визначені патогенезу рецидивів розацеа, можливість спостереження за ефективністю лікування в динаміці, а також про ймовірність прогнозування перебігу, щодо можливих ускладнень та рецидивування захворювання. Появу змін суб’єктивних, об’єктивних, функціональних та лабораторних показників розцінювали як перші ознаки наближення початку рецидиву розацеа.
Так, характерними ознаками наближення розвитку рецидиву розацеа являлась поява при дослідженні суб’єктивних (відчуття свербежу, печіння, стягнутості шкіри, приливів до обличчя) та об’єктивних (зміни артеріального тиску, пульсу, зміни дермографізму, поява гіпергідрозу долонь чи підошв) проявів вегето-судинних порушень.
Характерною ознакою появи рецидиву при дослідженнях були також зміни лабораторних показників. Так, критеріями розвитку рецидиву являлися зменшення кількості лейкоцитів та лімфоцитів, прискорення ШОЕ, зміна біохімічного аналізу крові (збільшення показників активності ферментів у сироватці крові). Також змінювалися показники імунного статусу, особливо показники НСТ-тесту, СD4+, CD8+ та індексу CD4+/CD8+, які мали тенденцію до зменшення і свідчили про початок декомпенсації супутньої патології, котра, в свою чергу, впливає на перебіг розацеа.
Ще одним із показників наближення рецидиву являлася якісно-кількісна зміна мікробного пейзажу шкіри (превалювання патогенної мікрофлори; збільшення кількісті малассезій, кандіди, кишкової палички, протею на фоні значного дисбалансу та різкого зниження непатогенної флори – коринебактерій, непатогенних піококів; збільшення інтенсивності колонізації більше 105 КУО/см2 та асоціацій мікроорганізмів).
Ознакою появи рецидиву були показники психоемоційного стану хворих (збільшення симптомів стривоженості вище помірного рівня).
Прогностичним критерієм стосовно розвитку рецидиву розацеа являлися зміни показників ВСР, які досліджувалися за допомогою «Cardiolab» і мали тенденцію до зменшення. Особлива увага приділялась вивченню показника потужності спектру впливу гуморальних систем (VLF), показника потужності спектра низькочастотних коливань (LF) – маркера змін симпатичної ланки ВНС, показника потужності спектру високочастотних коливань (HF) – маркера змін парасимпатичної регуляції. Досліджували також показник вегетативного балансу LF/HF, який при ознаках розвитку рецидиву починав збільшуватися.
Цей комплекс діагностичних критеріїв ми використовували для прогнозування можливого рецидиву розацеа.
З метою попередження виникнення рецидиву, у випадку виявлення початкових змін лабораторних показників, які були обрані нами як критерії розвитку рецидива, ми проводили профілактичне лікування, яке складалося з профілактичного курсу – прийому Аесцину по 1 таблетці двічі на день та Мебікару по 1 таблетці двічі на день, упродовж трьох-чотирьох тижнів.
З метою профілактики розвитку рецидивів розацеа ми рекомендували для хворих використовувати спеціальний догляд Rosaliac AR INTENS та спеціальні засоби – влітку сонцезахисні креми з фільтром SPF більше 30, взимку – жирні креми та пудри для захисту від морозу, для зволоження, заспокоєння та пом’якшення шкіри впродовж дня.
У комплекс профілактичних заходів зі своєчасного попередження розвитку рецидивів розацеа також входили рекомендації щодо виявлення та попередження провокуючих факторів індивідуально для кожного хворого – раціональне працевлаштування, дотримання дієти, консультації суміжних фахівців для контролю за загальним станом організму та своєчасним лікуванням.
При дослідженні віддалених результатів спостереження (терміном до 18 місяців) виявлено, що у пацієнтів першої групи зафіксовано 6 (30 %) випадків виникнення рецидиву, у хворих другої групи, які отримали тільки стандартну терапію – 28 (93,2 %) випадків, частина з яких реєструвалася вже на другому місяці спостереження. В той же час у хворих другої групи, які отримали лікування та профілактичні заходи за розробленою методикою, виявлено лише 2 (6,6 %) випадки виникнення рецидиву, що протікали в досить м’якій формі.
У 6 хворих першої групи з уперше встановленим діагнозом розацеа, у яких при обстеженні були виявлені більш значні порушення, при подальшому спостереженні констатували розвиток рецидиву дерматозу, що підтвердило достовірність прогнозування з використанням відібраних критеріїв.
Результати порівняння подальшого перебігу та клінічних проявів дерматозу після проведеного лікування свідчать про ефективність запропонованої методики комплексної терапії та профілактики розвитку рецидивів у хворих на розацеа.
ВИСНОВКИ
У дисертаційній роботі представлено теоретичне узагальнення та нове вирішення наукової задачі, що полягає у підвищенні ефективності лікування хворих із рецидивами розацеа на підставі вивчення перебігу дерматозу, імунологічного статусу, мікробіоценозу шкіри, психоемоційних порушень та змін ВНС.
1. Зростання захворюваності населення на розацеа та часте рецидивування дерматозу, недостатність інформації у літературних джерелах про особливості патогенетичних змін при рецидивах, на сучасному етапі свідчить про необхідність ретельного вивчення механізму розвитку рецидивів та розробки комплексного методу їх лікування і прогнозування.
2. Клінічні прояви та перебіг розацеа у хворих з рецидивами мають більш тяжкий, прогредієнтний перебіг, резистентність до стандартної терапії, нетривалі ремісії, наявність більш вираженої супутньої патології. Визначено зміни показників біохімічного аналізу крові (зниження рівня загального білка, збільшення білірубіну та активності АлАТ та АсАТ, підвищення холестерину ЛПНЩ і тригліцеридів) та мікробіоценозу шкіри (збільшення патогенної флори, інтенсивності колонізації проб шкіри 107–109 КУО/см2, асоціацій мікроорганізмів (M. furfur зі стафілококами та ентеробактеріями, C. albicans з усіма видами).
3. У хворих із рецидивами розацеа, на відміну від від пацієнтів із вперше встановленим діагнозом, виявлено достовірні зміни показників психоемоційного стану в межах помірної тривожності та депресивних симптомів середнього ступеня, розлади вегетативної регуляції серцевої діяльності: зниження потужності основних часових (SDNN, ВР) та спектральних (ТР, VLF, LF, HF) показників на фоні підвищення показників Мо, АМо, ІН та індексу вегетативного балансу в бік переважання симпатичної регуляції.
4. У хворих з рецидивами розацеа встановлено пригнічення функції фагоцитів (зменшення фагоцитарного індексу, фагоцитарного числа та НСТ‑тесту), зміни кількісного складу основних популяцій та субпопуляцій лімфоцитів, що характеризуються зниженням рівня CD4+, CD8+, коефіцієнта CD4+/CD8+ на фоні збільшення вмісту CD16+ та CD22+, збільшення рівня Ig G та Ig M та підвищення продукції інтерлейкінів-10 та -12, що свідчить про Т‑клітинну недостатність та імуносупресію з ознаками гіперфункції В‑лімфоцитів.
5. Встановлено прогностичні критерії розвитку рецидиву розацеа, які проявлялися появою: суб’єктивних (свербіж, відчуття печіння, стягнутості шкіри, приливів до обличчя) та об’єктивних ознак (зміни артеріального тиску, пульсу, дермографізму, гіпергідроз долонь чи підошов); загальнолабораторних змін (зменшення кількості лімфоцитів, прискорення ШОЕ, збільшення показників активності ферментів у сироватці крові), порушень імунологічних показників (зниження рівня НСТ-тесту, СD4+, CD8+ та індексу CD4+/CD8+); змін якісно-кількісного складу мікробного пейзажу шкіри (превалювання патогенної мікрофлори, наявність та збільшення кількості малассезій, кандіди, кишкової палички, протею на фоні значного дисбалансу та різкого зниження непатогенної флори, посилення інтенсивності колонізації більше 105 КУО/см2 та асоціацій мікроорганізмів); психоемоційного стану (збільшення симптомів стривоженості вище помірного); змін вегетативної нервової системи за даними функціонального дослідження (тенденція до зменшення VLF, LF, HF, збільшення показника вегетативного балансу LF/HF).
6. Розроблено та патогенетично обгрунтовано комплексний метод терапії хворих із рецидивами розацеа на основі стандартної терапії з використанням ангіопротектора (есцин), анксіолітика (мебікар), гепатопротектора та імуномодулятора (тіотриазолін), яка дозволяла отримати стабілізацію стану та регрес проявів захворювання в середньому на 8-10-й дні. У 87 % пацієнтів повний регрес дерматозу спостерігався в середньому на другому місяці лікування. При вивченні віддалених результатів у досліджених хворих встановлено 6,6 % випадків рецидивів через 9-12 місяців, які мали більш легкий перебіг, на відміну від хворих, що отримували лікування за стандартною терапією, у яких рецидиви зареєстровано вже на другому місяці спостереження. З метою попередження рецидивів при виявленні змін досліджених показників мікробіоценозу шкіри, імунітету, вегетативної та психоемоційної регуляції рекомендовано профілактичний курс лікування есцином та мебікаром.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Абрагамович Л. Є. Новий спосіб лікування васкулярного компонента розацеозної хвороби / Л. Є. Абрагамович // Український журнал дерматології, венерології, косметології. – 2005. – №3 (18). – С. 161.
- Адаскевич В. П. Акне вульгарне и розовые / В. П. Адаскевич. – М. : Медкнига; Н. Новгород: НГМА, 2005. – 160 с.
- Аравийская Е. Р. Симптомокомплекс «чувствительной» кожи: механизмы развития и тактика ведения пациентов / Е. Р. Аравийская // Клин. дерматол. и венерол. – 2008. – № 5. – С. 45-48.
- Барабанов Л. Г. Современный взгляд на этиопатогенез розацеа / Л. Г. Барабанов, А. П. Музыченко // ARS MEDICA. – 2010. – № 8. – С. 124-128.
- Белоусова Т. А. Медикаментозные акнеформные дерматозы / Т. А. Белоусова, И. Ю. Нетруненко, Е. В. Тишкина // Российский журнал кожных и венерических болезней. – 2006. – №5. – С. 64–67.
- Биткина О. А. Этиология и патогенез розацеа. Вопросы дифференциального диагноза и терапии / О. А. Биткина, Н. К. Никулин // Росcийский журнал кожных и венерических болезней. – 2010. – № 1. – С. 54-57.
- Біохімічні показники в нормі і при патології / Под ред. О. Я. Склярова. – К.: Медицина, 2007. – 318.
- Бутов Ю.С. Оптимизация терапии розацеаподобных заболеваний кожи лица / Ю. С. Бутов, Е. Н. Волкова // Новости медицины и фармации. Дерматология и косметология (тематический номер). – 2009. – № 276. – С. 5-8.
- Буянова О. В. Изменения иммунного статуса у больных розацеа / О. В. Буянова, Н. Ю. Сенишин, Л. О. Химейчук // Дерматовенерол. Косметол. Сексопатол. – 2008. – №11. – С. 274.
- Быстрицкая Е. А. Комплексный подход к лечению розацеа, демодикоза и акне у пациенток средней возрастной группы / Е. А.Быстрицкая, Т. Ф. Быстрицкая, Н. Н.Чернакова // Клиническая дерматология и венерология. – 2006. – №4. – С. 29–31.
- Вейн A. M. Вегетативные расстройства. Клиника, диагностика, лечение. – М., 2005. – 740 с.
- Верхогляд И. В. Юнидокс Солютаб в комплексной терапии розацеа / И. В. Верхогляд, Ю. А. Галлямова // Вестн. дерматологии и венерологии. – 2006. – №4. – С. 34–35.
- Возіанова С. В. Розацеа: патогенез, лікування та перспективи нових досліджень / С. В. Возіанова // Акт. пробл. трансп. медицины. – 2008. – № 2 (12). – С. 127-132.
- Возіанова С. В. Сучасні аспекти етіопатогенезу розацеа / С. В. Возіанова // Український журнал дерматології, венерології, косметології. – 2005. – № 3 (18). – С. 165.
- Вострокнутова Т. М. Клещи-железницы и проблемная кожа лица / Т. М. Вострокнутова, М. А. Мокроносова // Лечащий врач. – 2007. – № 9. – С. 10–12.
- Вульф К. Дерматология по Томасу Фицпатрику: атлас-справочник: пер. с англ. / К. Вульф, Р. Джонсон, Д. Сюрмонд; под ред. Е. З. Тимофеевой. 2-е изд. – М., 2007. – 1312 с.
- Голдберг Д. Д. Лазеро- и светолечение / Д. Д. Голдберг. – М.: ООО «Рид Элсивер», 2010. – 187 с.
- Горголь В. Т. Пути становления парозитизма в семействе Demodecae / В. Т. Горголь, Б. Г. Коган // Український журнал дерматології, венерології, косметології. – 2005. – № 3 (18). – С.168.
- Давыдова И. Б. Местное применение метронидазола в терапии акне и акнеформных дерматозов / И. Б. Давыдова, Н. А. Чхатвал, М. А. Королева // Клиническая дерматология и венерология. – 2008. – №5. – С. 73–75.
- Давыдова И. Б. Опыт применения 1 % крема метронидазола (розамет) при заболеваниях кожи лица / И. Б. Давыдова, М. А. Дмитриева // Клин. дерматол. венерол. – 2006. – № 1. – С. 56–59.
- Давыдова И. Б. Опыт применения метронидазола в комплексном лечении сосудистой патологии кожи / И. Б. Давыдова, Н. А. Чхатвал, М. А. Королева // Клиническая дерматология и венерология. – 2010. – № 6. – С. 62–64.
- Дерматовенерология: Нац. руководство / Под ред. Ю. К. Скрипкина, Ю. С. Бутова, О. Л. Иванова. – М.: ГЭОТАР – Медиа, 2011. – 1119 с.
- Дубровина А. А. Коррекция гемодинамических нарушений при розацеа высокоинтенсивным лазерным излучением: автореф. дис. на соиск. научн. степени канд. мед. наук: спец. 14.00.11 «Кожные и венерические болезни» / А. А. Дубровина. – СПб., 2011. – 20 с.
- Европейское руководство по лечению дерматологических заболеваний / Под ред. А. Д. Кацамбаса, Т. М. Лотти. – М. : МЕДпресс-информ. – 2008. – 736 с.
- Желтикова Т. М. Демодекоз – диагноз или симптом / Т. М. Желтикова // Медицинский вестник. – 2006. – № 38. – С. 16-20.
- Иванов О. Л. Кожные и венерические болезни / О. Л. Иванов. – М. : Шико, 2006. – С. 302–303.
- Иванов О. Л. Проблемы психодерматологии в трудах представителей Рахмановской школы / О. Л. Иванов // Российский журнал кожных и венерических болезней. – 2006. – № 4. – С.7-10.
- Иванова Ю. А. Особенности иммунологического статуса у больных периоральным дерматитом на фоне иммуномодулирующей терапии / Ю. А. Иванова, Ю. В. Начаров, Т. Б. Решетникова // Вестник новых медицинских технологий. – 2007. – Т. XIV, № 2. – С. 47–49.
- Иммунология: уч. пособие / Под. ред. Л. В. Ковальчука, Г. А. Игнатьевой, Л.В. Галковасий. – М.: ГЭОТАР – Медиа, 2010. – 176 с.
- К вопросу о патогенезе, клинике и терапии розацеа / Ю. С. Бутов, О. М. Демина, В. Ю. Васенова, М. М. Школьников // Клиническая дерматология и венерология. – 2006. – № 2. –С. 95-97.
- Калюжна Л. Д. Хвороби похідних шкіри / Л. Д. Калюжна. – К. : Грамота, 2008. – С. 31-39.
- Калюжна Л. Д. Можливості застосування препаратів метронідазолу в лікуванні розацеа та періорального дерматиту, поєднаних з демодекозом / Л. Д. Калюжна, К. О. Бардова // Укр. журн. дерматол., венерол., косметол. – 2012. – № 4 (47). – С. 42-46.
- Калюжна Л. Д. Хвороби похідних шкіри: Навч. посібник / Л. Д. Калюжна. – К. : Грамота, 2008. – 120 с.
- Калюжна Л. Д. Хвороби шкіри обличчя, слизової облонки ротової порожнини та червоної облямівки губ: Навч. посібник / Л. Д. Калюжна, Г. Ф. Білоклицька. – К.: Грамота, 2007. – 280 с.
- Калюжная Л. Д. Клинико-иммунологическая оценка состояния больных с различными клиническими формами розацеа / Л. Д. Калюжная, О. В. Стоянова, С. В. Возианова // Дерматологія та венерологія. – 2006. – № 3 (33). – С. 55–61.
- Калюжная Л. Д. Опыт применения азелаиновой кислоты (15 % гель «Скинорен») в терапии розацеа / Л. Д. Калюжная, Е. В. Стоянова, Е. Г. Черкесова // Дерматовенерология. Косметология. Сексопатология. – 2005. – № 4 (19). – С. 57–59.
- Караумов А. В. Иммунология, микробиология и иммунопатология / А. В.Караулов, С. А.Быков, А.С. Быков. – М. : Бином, 2012. – 328 с.
- Караумов А. В. Клиническая иммунология в дерматовенерологии и косметологии / А. В. Караумов, А. Д. Юцковский. – Владивосток : Медицина ДВ., 2013. – 202 с.
- Карелина О. Ю. Периоральный дерматит: лечение азелаиновой кислотой / О. Ю. Карелина, Ю. М. Карелин // Клиническая дерматология и венерология. – 2006. – №1. – С. 75–77.
- Карлова В. В. Эрадикация Helicobacter pillory как патогенетически обоснованный метод в терапии розацеа / В. В. Карлова // Мед. вест. Северного Кавказа. – 2008. – № 1. – С. 23-25.
- Катханова О. А. Этиопатогенетические аспекты розацеа, возможности терапии / О. А. Катханова, Н. Ю. Левченко, О. В. Аникиенко // Дальневосточный вестник дерматовенерологии косметологии и пластической хирургии. – 2012. – № 1. – С. 11-12.
- Кацамбас А. Д. Европейское руководство по лечению дерматологических заболеваний: пер. с англ. / ред. А. Д. Кацамбаса, Т. М. Лотти. – М.: МЕДпресс-информ, 2008. – 736 с.
- Кетлинский С. А. Цитокины / С. А. Кетлинский, А. С. Симбирцев. – СПб.: Фолиант, 2008. – 552 с.
- Клеточные механизмы генерации иммунологической памяти / В. И. Селедцов, Л. С. Литвинова, А. Г. Гончаров [и др.] // Цитокины и воспаление. – 2010. – Т. 9. – № 4. – С. 36-44.
- Клименко А. В. Діагностика та диференційна діагностика демодикозу, розацеа і вугрової хвороби (акне) на засадах доказової медицини з урахуванням аналізу результатів лабораторних тестів на наявність кліщів-демодицид та прикметних клінічних симптомокомплексів, притаманних цим дерматозам. Повідомлення 2 / А. В. Клименко, В. І. Степаненко // Український журнал дерматології, венерології, косметології. – 2009. – № 2 (33). – С. 75–85.
- Клименко А. В. Сучасна терапія при різних клінічних формах вугрової хвороби (акне) і акнеподібних дерматозах (розацеа, демодекоз) та раціональні та діагностичні й лікувальні заходи з підвищення її ефективності / А. В. Клименко, В. І. Степаненко // Український журнал дерматології, венерології, косметології. – 2008. –№ 3. – С. 46–57.
- Клинико-иммунологическая оценка эффективности изотритеонина в лечении розацеа: сб. научн. работ / Под ред. А. В. Сикорского. – Минск, 2011. – С. 108-112.
- Клинические рекомендации. Дерматовенерология / Под ред. А. А. Кубановой. – М. : ДЭКС-Пресс, 2007. – 300 с.
- Клінічна імунологія та алергологія: підручник / Під ред. Г. М. Дранника. – К. : Здоров’я, 2006. – 888 с.
- Коган Б. Г. Діагностика і терапія розацеа, демодикозу, дерматиту періорального з урахуванням спільних чинників виникнення, патогенезу та особливостей клінічного перебігу дерматозів: автореф. дис. на здоб. наук. ступ. док. мед. наук: спец. 14.01.20 «Шкірні та венеричні хвороби» / Б. Г. Коган. – К., 2006. – 44 с.
- Коган Б. Г. Порушення імунного статусу організму хворих на розацеа, демодикоз і періоральний дерматит з урахуванням патогенетичного значення інвазії шкіри кліщами демодицидами / Б. Г. Коган, В. І. Степаненко // Укр. журн. дерматології, венерології, косметології. – 2005. – №1. – С. 33–38.
- Коган Б. Г. Современные подходы в комплексном лечении пациентов с демодикозом и розовыми угрями / Б. Г. Коган // Украинский журнал дерматологии венерологии косметологии. – 2010. – № 4. – С. 55–62.
- Коган Б. Г. Стан судинного тонусу, показники системи гомеостазу та імунного статусу організму хворих на розацеа, демодикоз і дерматит періоральний / Б. Г. Коган, В. І. Степаненко // Укр. журн. дерматології, венерології, косметології. – 2005. – №2 (17). – С. 20–24.
- Кожные и венерические болезни: справочник / Под ред. О. Л. Иванова. – М. : Медицина, 2007. – 336 с.
- Корсунская И. М. Гель «Скинорен» в терапии розацеа / И. М. Корсунская, О. Б. Тамразова, С. С Бигвава // Российский журнал кожных и венерических болезней. – 2005. – № 3. – С. 37–40.
- Корсунская И. М. Опыт применения топических ретиноидов в наружной терапии папуло-пустулезной формы розацеа / И. М. Корсунская, И. Л. Сорокина // Материалы VI научно-практической конференции, посвященной памяти професора А. Л. Машкиллейсона. – М., 2010. – С. 46-47.
- Кочергин Н. Г. Современный взгляд на проблему выбора лекарственной формы средств наружной терапии / Н. Г. Кочергин, Д. Д. Петрунин // Клин. дерматол. и венерол. – 2012. – № 1. – С. 33-46.
- Кузина З. А. К вопросу о терапии розацеа / З. А. Кузина, Р. С. Данилевская, В. А. Гребенников // Клиническая дерматология и венерология. – 2011. – № 2. – С. 60-62.
- Кутасевич Я. Ф. Место системних ретиноидов в лечении розацеа / Я. Ф. Кутасевич, И. А. Маштакова, И. А. Олейник // Український журнал дерматології, венерології, косметології. – 2013. – № 1 (48). – С. 113-117.
- Леонова М. А. Особенности нарушения цитокиновой регуляции у больных розацеа / М. А. Леонова // Клин. лаб. диагностика. – 2010. – № 9. – С. 44-64.
- Лычкова А. Э. Механизмы синергизма отделов вегетативной нервной системы / А. Э. Лычкова // Успехи физиологических наук. – 2006. – Т. 37. – № 1. – С. 50-67.
- Мавров Г. И. Этиотропная терапия в комплексном лечении розацеа / Г. И. Мавров, Г. Арвеладзе // Жіночий лікар. – 2008. – № 4. – С. 46-49.
- Мавров И. И. Основы диагностики и лечения в дерматологии и венерологии: Руководство для врачей, интернов, студентов / И. И. Мавров, Л. А. Болотная, И. М. Сербина. – Харьков : Факт, 2007. – 792 с.
- Майер М. Новейшие достижения в лечении кожних болезней: топические и системные иммуномодуляторы / М. Майер // Российский журнал кожных и венерических болезней. – 2008. – № 4. – С. 49-54.
- Мареева Е. Б. Розамет в комплексной терапии розацеа / Е. Б. Мареева, С. В. Шкребец, Д. Е. Фирсова // Вестн. дерматологии и венерологии. – 2006. – № 3. – С. 46–48.
- Моргулис Ю. А. Гормональная заместительная терапия в лечении себорейного дерматита, розацеа и преждевременного выпадения волос у женщинв периоде менопаузы: автореф. дис. на стиск. научн. степени канд. мед. наук: спец. 14.01.20 «Кожные и венерические болезни» / А. Ю. Моргулис. – М., 2010. – 26 с.
- Новоселов В. С. Место фотопротекторов в дерматологической практике / В. С. Новоселов, А. В. Новоселов, А. Е. Богадельникова // Consilium medium. – 2008. – № 1. – С. 9-12.
- Обгольц И.А. Новые подходы к терапии розацеа / И. А. Обгольц // Современные проблемы дерматовенерологии, иммуннологии и врачебной косметологи. – 2010. – № 4. – С. 15-19.
- Озерская О. С. Рубцы кожи и их дерматокосметическая коррекция / О. С. Озерская. – СПб. : ОАО «Искусство России», 2007. – 224 с.
- Олисова О. Ю. Роль фактора сосудистого эндотелия в патогенезе розацеа и его медикаментозная коррекция / О. Ю Олисова, М. И. Додина // Клиническая дерматология и венерология. – 2012. – № 1. – С. 49-55.
- Олисова О. Ю. Современные сведения о патогенезе розацеа / О. Ю. Олисова // Экспериментальная и клиническая дерматокосметология. – 2010. – № 6. – С. 18–22.
- Опыт применения препарата «Орнизол» в комплексной терапии демодикоза / А. А. Франкенберг, В. А. Шевченко, С.В. Кривко [и др.] // Український журнал дерматології, венерології, косметології. – 2007. – № 2. – С. 41–44.
- Открытое рандомизированное сравнительное исследование трех схем наружной комбинированной терапии угревой сыпи / А. Ю. Сергеев, Г. Н. Макова, В. Ю. Сергеев [и др.] //Рос. Журн. кожн. и вен. бол. – 2010. – № 6. – С. 50–59.
- Павлова О. В. Основы психодерматологии / О. В. Павлова. – М. : Изд-во ЛКИ, 2007. – 240 с.
- Панкина Е .С. Нарушения микроциркуляции кожи лица при розацеа и методы их коррекции: автореф. дис. на соиск. научн. степени канд. мед. наук: спец. 14.01.20 «Кожные и венеические болезни» / Е. С. Панкина. – Спб., 2008. – 20 с.
- Пашинян А. Г. Принципы ухода за кожей пациентов с розацеа / А. Г. Пашинян, Е. С. Шаповал, Д. Г. Джаваева // Вестник дерматологии и венерологии. – 2012. – № 2. – С. 84–86.
- Пашинян А. Г. Терапия больных различными клиническими формами розацеа / А. Г. Пашинян // Вестник дерматологии и венерологии. – 2010. – № 6. – С. 83–85.
- Перламутров Ю. Н. Сравнительная оценка эффективности различных методов терапии розацеа / Ю. Н. Перламутров, В. Ш. Сайдалиева, К. Б. Ольховская // Вестник дерматологии и венерологии. – 2011. – № 3. – С. 73-79.
- Полушкина Н. Н. Диагностический справочник дерматовенеролога / Н. Н. Полушкина. – М. : АСТ, 2007. – 284 с.
- Поляков Л. Е. Статистические методы и обследования в медицине и здравохранении / Поляков Л. Е. – Л. : Медицина, 1971. – 200 с.
- Полях Я. А. Современные методы лечения розацеа / Я. А. Полях // Журнал дерматовенерології та косметології ім. М.О. Торсуєва. – 2007. – № 1–2 (14). – С. 108–116.
- Попов В. В. Вариабельность сердечного ритма: возможности применения в физиологии и клинической медицине / В. В. Попов, Л. Н. Фрицше // Український медичний часопис. – 2006. – № 3-4. – С. 24-32.
- Потекаев H. H. Акне и розацеа / H. H. Потекаев. – М: Бином, 2007. – 216с.
- Потекаев Н. Н. Лазер в дерматологии и косметологии / Н. Н. Потекаев, Л. С. Круглова. – М.: МВД. – 2012. -280 с.
- Потекаев Н. Н. Терапия различных форм acne vulgaris / Н. Н. Потекаев, Е. В. Дворянникова // Клинич. дерматология и венерология. – 2006. – № 1. – С. 41-43.
- Прогрессивные технологии ведения больных с угревой болезнью и постакне / Е. Н. Волкова, Н. К. Осипова, А. А. Григорьева, В. В. Платонов // Укр. журн. дерматол., венерол., косметол. – 2010. – № 3 (38). – С. 99-104.
- Проценко Т. В. Ефективність аерокріотерапії у комплексному лікуванні хворих із ранніми, пізніми та рожевими акне / Т. В. Проценко, В. Б. Андрійчук // Дерматологія та венерологія. – 2012. – № 1 (55). – С. 79–84.
- Проценко Т. В. Особливості біохімічного гомеостазу у хворих на рожеві вугри / Т. В. Проценко, О. В. Чубар, О. Д. Якубенко // Дерматологія та венерологія. – 2006. – № 2 (32). – С. 39–43.
- Прояви імунного реагування у хворих на різні клінічні форми розацеа / Л. Д. Калюжна, Т. І. Гавриленко, О. В. Стоянова [та ін.] // Дерматологія та венерологія. – 2005. – №2 (28). – С. 33–42.
- Психосициальные аспекты угревой болезни у женщин с синдромом гиперандрогенемии / Е. В. Дворянкова, Н. Н. Потекаев, М. В. Горячкина [и др.] // Клиническая дерматология и венерология. – 2007. – № 3. – С. 47-50.
- Раева Т. В. Психические расстройства в дерматологической практике: автореф. дис. на соиск. научн. степени докт. мед. наук: спец. 14.00.11. «Дерматология и косметология» / Т. В. Раева. – Томск, 2006. – 48 с.
- Розамет крем – высокоэффективное средство лечения розацеа / А. М. Лалаева, Т. В. Грибанова С. И. Данилов [и др.] // Вестн. дерматологии и венерологии. – 2005. – № 5. – С. 40–42.
- Розацеа: нове подходы к старым проблемам / Е. Н. Волкова, Н. К. Осипова, Ю. А. Родина, А. А. Григорьева // Российский журнал кожних и венерических болезней. – 2010. – № 2. – С. 33-39.
- Розов В. І. Адаптивні антистресові психотехнології: навчальний посібник / В. І. Розов. – К. : Кондор, 2009. – 278 с.
- Романенко И. М. Лечение кожных и венерических болезней: руководство для врачей / И. М. Романенко, Кулага В. В., Афонин С. Л. – В 2 ч. – М.: ООО «Медицинское информационное агентство», 2006. – Т.1 – 904 с., Т.2 – 888 с.
- Руководство по дерматокосметологии / Под ред. Е. Р. Аравийской и Е. В. Соколовского. – СПб.: ООО «Издательство Фолиант», 2008. – 632 с.
- Самоделкина К. А. Современные концепции в патогенезе розацеа / К. А. Самоделкина, Н. Г. Короткий // Клиническая дерматология и венерология. – 2012. – Vol. 2. – С. 2-8.
- Самцов А. В. Акне и акнеформные дерматозы / А. В. Самцов. – М. : ООО «ЮТКОМ», 2009. – 288 с.
- Свирид С. Г. Оцінка стану мікроциркуляції у хворих на розацеа / С. Г. Свирид, С. В. Чайка // Укр. журн. дерматології, венерології, косметології. – 2005. – № 2 (17). – С. 18–20.
- Свирид С. Г. Стан капілярного кровообігу у хворих на розацеа та корекція його порушень / С. Г. Свирид, М. В. Гречуха // Журнал дерматовенерології та косметології ім. М. О. Торсуєва. – 2007. – № 1-2 (14). – С. 56–60.
- Святенко Т. В. Дерматозы, осложненные вторичной инфекцией: акцент на наружную терапію / Т. В. Святенко, О. С. Дудник, А. А. Франкенберг // Дерматология. Косметология. Сексопатология. – 2009. – № 1-2 (12). – С. 268-272.
- Сенишин Н. Ю. Порівняння клінічної ефективності лікування рожевих вугрів «Мератином» з традиційними методами / Н. Ю. Сенишин // Український журнал дерматології, венерології, косметології. – 2005. – № 3 (18). – С. 160.
- Сергеенко Н. И. Функциональные взаимоотношения вегетативной нервной системы в условиях общей анестезии / Н. И. Сергеенко. – Витебск, 2009. – 236 с.
- Спрегаль в лечении больных розацеа и угревой болезнью, ассоциированных с демодекозом / Э. Н. Солошенко, Т. Д. Носовская, И. В. Гиржанова, О. Н. Стулий // Матеріали науково-практичної школи «Розробки молодих вчених дерматовенерологів» 24 листопада 2011. – Київ. – С. 71-73.
- Степаненко В. І. Комплексна етапна терапія хворих на акне та акнеподібні дерматози (розацеа, демодекоз) / В. І Степаненко, А. В. Клименко // Український журнал дерматології, венерології, косметології. – 2009. – № 3. – С. 50-61.
- Сухарев А. В. Медико-психологическая коррекция в условиях дерматологического стационара / А. В. Сухарев, Л. М. Демидова // Рос. журн. кож. и вен. бол. – 2006. – № 4. – С. 25-27.
- Тарасенко Г. Н. Роль патологии пищеварительного тракта и печени в патогенезе розацеа / Г. Н. Тарасенко, Е. С. Васильева, С. А. Белякин // Рос. журн. кож. вен. бол. – 2010. – № 1. – С 52-54.
- Тарасенко Л. М. Функціональна біохімія / Л. М. Тарасенко, В. К. Григоренко, К. С. Непорада; ред. Л. М. Тарасенко. – Вінниця : НОВА КНИГА, 2007. – 384 с.
- Тюрин Ю. А. Природная устойчивость бактерий к факторам врожденной иммунной системы, обусловленная бактериальными протеазами / Ю. А. Тюрин, И. Г. Мустафин, Р. С. Фассахов // Практическая медицина. – 2010. – № 1. – С. 7–13.
- Федотов В. П. Дерматовенерологія / В. П. Федотов, А. Д. Дюдюн, В. І. Степаненко. – Дніпропетровськ-Київ, 2008. – 600 с.
- Федотов В. П. Эпидемиология заболевания розацеа среди пациентов с патологией желудочно-кишечного тракта / В. П Федотов, Е. Б. Светлова // Сучасні проблеми дерматовенерології, косметології та управління охороною зоров’я: 3б. наук. праць. – Вип. 3. – Харків : Фоліо, 2004. – С. 286-287.
- Хайрудинов В. Р. Розацеа: современные представления о патогенезе, клинической картине и лечении / В. Р. Хайрудинов // Эффективная фармакотерапия. – 2014. – № 3. – С. 32-37.
- Чубар О. В. Комплексна терапія хворих на рожеві вугри із застосуванням киснево-озонової суміші / О. В. Чубар // Дерматологія та венерологія. – 2006. – № 1 (31). – С. 26–29.
- Чубарь О. В. Клинико-патогенетическое обоснование нових подходов к комплексной терапии больных розовими угрями: автореф. дис. на соиск. научн. степени канд. мед. наук: спец. 14.01.20. «Кожные и венерические болезни» / О. В. Чубарь. – Харьков, 2006. – 16 с.
- Щепитовски Я. Психодерматологические аспекты / Я. Щепитовски, А. Райх // Рос. журн. кожн. вен. болезней. – 2007. – № 4. – С. 17-21.
- Эффективность геля скинорен в наружной терапии больных угревой болезнью и розацеа / С. В. Батыршина, А. М. Гордеева, М. А. Богданова [и др.] // Вестн. дерматологии и венерологии. – 2005. – № 4. – С. 44–46.
- Юцковская Я. А. Обоснование патогенетической терапии приакнеподобных дерматозах, осложненных клещевой инвазией Demodex folliculorum / Я. А. Юцковская, Н. В. Кусая, С. Б. Ключник // Клиническая дерматология и венерология. – 2010. – № 3. – С. 60-63.
- A practical approach for the usae of oral isotretinoin for infantile acne / C. J. Barnes, L. F. Eichenfield, J. Lee [et al.] // Pediatr. Dermatol. – 2005. – Vol. 22 (2). – P. 166–169.
- Abram K. Risk factors associated with rosacea / K. Adram, H. Slim, H.I. Maaros // J. Eur. Acad. Dermotol. Venerol. – 2010. – Vol. 24. – P. 410-414.
- Ascenso A. Acne in the adult / A. Ascenso, H. C. Marques // Mini Rev. Med. Chem. – 2009. – Vol. 9 (1). – Р. 1–10.
- Aziz N. A man with changes on nose / N. Aziz, A. Khachemoune // J. Am. Acad. Dermatol. – 2007. – Vol. 57. – P. 551-553.
- Bakar O. The effect of azitromycin on reactive oxygen species in rosacea / O. Bakar, Z. Demircay, M. Yuksel // Clin. Exp. Dermatol. – 2007. – Vol. 32. – P. 197-200.
- Baldwin H. E. Diagnosis and treatment of rosacea: stste of the art / H. E. Baldwin // J. Drugs Dermatol. – 2012 – Vol. 11, № 5. – P. 725-730.
- Baldwin H. E. Oral therapy for rosacea / H. E. Baldwin // J. Drugs Dermatol. – 2006. – Vol. 5. – P. 16–21.
- Barati R. Corrective dermatocosmetological camouflage: An adjunct and aid to practice of dermatology. Experience of Rome and Naples / R. Barbati, L. Gallo, G Calabro // J. Plastic Dermatol. –2009. – Vol. 3, № 1. – P. 5-8.
- Berg V. An epidemiological study of rosacea / V. Berg, S. Liden // Acta. Dermat. Venerol. – 2008. – Vol. 69, № 5. – P. 419–423.
- Beridze L. R. Cryotherapy in treatment of skin demodecosis / L. R. Beridze, A. G. Katsitadze, T. G. Katsitadze // Georgian Med. News. – 2009. – Vol. 170. – P. 43–5.
- Bernestin E. F. Rosacea treatment using the new-generation, high-energy, 595 nm, long pulse-duration pulsed-dye laser / E. F. Bernstein, A. Kligman // Laser Surg. Med. – 2008. – Vol. 40. – P. 233-239.
- Beutner K. R. A look at the safety of metronidazole 1 % gel: cumulative irritation, contact sensitization, phototoxicity and photoallergy potential / K. R. Beutner, S. Lemke, B. Calvarese // Cutis. – 2006. – Vol. 77. – P. 12-17.
- Bialecka A. Different proinflammatory and immunogenic potentials of Propionibacterium acnes and Staphylococcus epidermidis: implications for chronic inflammatory acne / M. Mak, R. Biedron // Arch. Immunol. Ther. Exp. – 2005. Vol. 3. – P.79—85.
- Buechner S. A. Rosacea: an update / S. A. Buechner // Dermatology. – 2005. – Vol. 210. – P. 100–108.
- Butterwick K. J. Laser and light therapies for acne rosacea / K. J. Butterwick, L. S. Butterwick, A. Han // J. Drugs Dermatol. – 2006. –Vol. 5. – Р. 35–39.
- Casas C. Quantification of Demodex folliculorum by PCR in rosacea and its relationship to skin innate activation / C. Casas, C. Paul, M. Lahfa // Experimental Dermatology. – 2012. –Vol. 21. – P. 901-910.
- Chang B. P. Rosacea: an update on medical therapies / B. P. Chang // Skin Therapy Lett. – 2014. – Vol. 3. – P. 1–4.
- Chauhan N. Rosacea: pathophysiology and management principles / N. Chauhan, D. A. Ellis // Facial Plast. Surg. Clin. North Am. – 2013. – Vol. 21, No. 1. – P. 127-136.
- Chosidow O. Epidemiology of rosacea: updated data / O. Chosidow, B. Cribier // Ann. Dermatol. Venerol. – 2011. – Vol. 138. – P. 179-183.
- Chu C. Y. An open-label pilot study to evaluate the steroid inducted rosacea – like eruption / C. Y. Chu // J. Eur. Acad. Dermatol. Venerol. – 2007. – Vol. 21. – P. 484-490.
- Clibier B. Pathophysiology of rosacea: Redness, teleangioectasia and rosacea / B. Clibier // Ann Dermatol. Venerol. – 2011. – Vol. 138. – P. 184- 191.
- Clibier B. Rosacea under the microscope: Characteristic histological findings / B. Clibier // J. Eur. Acad. Dermatology Venerol. – 2013. – Vol. 37. – P. 1336-1343
- Comparison of efficacy of azithromycin versus doxycycline in the treatment of rosacea: a randomized open clinical trial / M. Akhiani, A. N. Ehsani, M. Ghiasi, A. K. Jafari // Int. J. Dermatology. – 2008. – Vol. 47, № 3. – P. 284-288.
- Conde J. F. Managing rosacea: a revive of use of metronidazole alone and in combination with oral antibiotics / J. F. Conde, C. B. Yeleverton, R. Balkrishnanh // J. Drugs Dermatology. – 2007. – Vol. 6. – № 5. – P. 495-498.
- Cosmetic Dermatology. Products and products / Ed. By Z. D. Draelos. – Chichester : Blackwell Publishing Ltd, 2010. – 532 p.
- Culp B. Rosacea: a review / B. Culp, N. Scheinfeld // J. Pharm. Fnd. Therap. – 2009. – Vol. 34. – P. 38-45.
- Dahan S. Laser and intense light management of couperose and rosacea /S. Dahan // Ann Dermatol. Venerol. – 2011. – Vol. 138 (3). – P. 219-222.
- Del Rosso J. Q. Advances in understanding and managing rosacea / J. Q. Del Rosso // J. Clinical and Aesthetic Dermatol. – 2012. – Vol. 5. – P. 16-25.
- Del Rosso J. Q. Selection of therapy for acne vulgaris: balancing concerns about antibiotic resistance / J. Q. Del Rosso // Cutis. – 2008. – Vol. 82 (5). – Р. 12–16.
- Demodicosis and rosacea: epidemiology and significance in daily dermatologic practice / F. Forton, M. A. Cermaux, T. Brasseur [et al.] // J. Am. Acad. Dermatol. – 2005. – Vol. 1. – P. 74—87.
- Dermatologue et infections sexuellrment transmissibles. 5 ed. / J. H. Saurat, J. M. Lachapelle, Lipsker Dan, Thomas Luc. – 2009. – P. 860-863.
- Diamantis S. Rosacea: clinical presentation and pathophysiology / S. Diamantis, H. A. Waldorf // J. Drugs Dermatol. – 2006. – Vol. 5. – Р. 8–12.
- Duzgun O. Comparison of Demodex folliculorum density in haemodialysis patients with a control group / O. Duzgun, M. Yagdiran, S. Aytekin // J. Eur. Academ. Dermatol. Venereol. – 2007. – Vol. 21, № 4. – P. 480-483.
- Eckel R. Rosacea: the strawberry fields of dermatology / R. Eckel // Prime Journal. – 2014. – Vol. 4, № 4. – P. 69-62.
- Effective and evidence –based management strategies for rosacea: summary of a Cochrane systematic review / E. J. Van Zuuren, S. F. Kramer, B. R. Carter [et al.] // Brit. J. Dermatol. – 2011. – Vol. 165. – P. 760-781.
- Elewski B. E. Rosacea – global diversity and optimized outcome: proposed international consensus from the Rosacea International Expert Group / B. E. Elewski, Z. Draelos, B. Dreno // J. Eur. Acad. Dermatol. Venerol. – 2011. – Vol. 25. – P.188-200.
- Fonseca G. P. Nailford Capillaroscopy as a diagnostic and prognostic method in rosacea / G. P. Fonseca, F. M. Brenner, C. S. Muller // An. Bras. Dermatol. – 2011. – Vol. – 86 (1). – P. 87-90.
- Freid R. G. Psychological oroblems in the acne patient / R. G. Fried, A. Wechsler // Dermatol. Ther. – 2006. – Vol. – 19 (4). – P. 237-240.
- Gallo R. L. TRL2 expression is increased in rosacea and stimulates enhanced serine protease production by keratinocytes / R. L. Gallo, K. Yamasaki // J. Invest. Dermatol. – 2011. – Vol. 131(3). – P. 688-697.
- Gollnick H. Azeliac acid 15 % gel in treatment of rosacea / H. Gollnick, A. Layton // Expert Open Pharmacotherapy. – 2008. – Vol. 9 (15). – P. 2699-2706.
- Gupta A. K. Rosacea and its management: an overview / A. K. Gupta, M. Chaundry // J. Eur. Acad. Dermatol. Venereol. – 2005. – Vol. 19, No. 3. – P. 273–285.
- Has Helicobacter pylori eradication therapy any effect on severity of rosacea symptoms / G. K. Gedik, A. Karaduman, B. Sivri, B. Caner // J. Europ. Acad. Dermatol. Venereol. – 2005. – Vol. 19, No. 3. – P. 398–372.
- Helm K. F. A clinical and histopathologic study of granulomatosus rosacea / K. F. Helm, J. Menz // J. Am. Acid. Dermatol. – 2010. – Vol. 25, No. 1. – P. 1038-1043.
- Holmes A. D. Potential role of microorganisms in the pathogenesis of rosacea / A. D. Holmes // J. Am. Acad. Dermatol. – 2013. – Vol. 69, № 6. – P. 1025-1032.
- Hsu C. Demodicosis: a clinicopathological study / C. Hsu, J. Lee // J. Am. Acad. Dermatol. – 2009. – Vol. 42. – P. 253-462.
- Jansen T. Clinical presentations and classification of rosacea / T. Jansen // Ann Dermatol. Venerol. – 2011. – Vol. 138. – P. 192-200.
- Jarmuda S. Potential role of Demodex mites and bacteria in the induction of rosacea / S. Jarmuda, N. O’Reilly, R. Zaba // J. Med. Microbiol. – 2012. – Vol. – 61. – P. 1504-1510.
- Kaszuba-Bartkowiak K. The Assessment of bacterial flora and antibiotic-sensitivity of bacteria isolated from conjunctival sac, skin of the eyelids and inflammatory lesions in patients with acne and rosacea / K. Kaszuba-Bartkowiak, R. Gos // Przegl. Lek. – 2007. – Vol. 64(12). – P. 991-996.
- Kennedy Carney C. Rosacea: a review of current topical. Systemic and light-based therapies / C. Kennedy Carney, W. Cantrell, B. E. Elewski // G. Ital. Dermatol. Venerol. – 2009. – Vol. 144 (4). – P. 637-688.
- Kim J. H. Oral azithromycin for treatment of intractable rosacea / J. H. Kim, Y. S. Oh, E. H. Choi // J. Korean Med. Sci. – 2011. – Vol. 26 (5). – P. 694-696.
- Kim T. G. Enhancing effect of pretreatment with topical niacin in the treatment of rosacea-associated erythema by 585-nm pulsed dye laser in Koreans: a randomized, perspective, split-face trial / T.G. Kim, J. H. Roh, S. B. Cho // Br. J. Dermatol. – 2011. – Vol. 164 (3). – P. 573-579.
- Layton A. Emergin therapies in rosacea / A. Layton, D. Thiboutot // J. Am. Acad. Dermatol. – 2013. – Vol. 69, № 6. – P. 57-65.
- Lazaridou E. Clinical and laboratory study of rosacea in northen Greece / E. Lazaridou, Z. Apalla, S. Sotiraki // J. Eur. Acad. Dermatol. Venerol. – 2010. – Vol. 24. – P. 565-571.
- Mentzel T. Cutaneosus angiosarcoma of the face: clinicophathologic and immunohistochemical study of a case resembling rosacea clinically / T. Mentzel, H. Kutzner // J. Am. Acad. Dermatol. – 2008. – Vol. 38, № 2. – P. 837-840.
- Michael J.G. Fathing treatment option for the eradicate on of intestinal protozoa // Nat. Clin. Pract. Gastroenterol. Hepatol. – 2006. – Vоl. 3, No. 12. – P. 436–445.
- Nally J. B. Topical therapies for rosacea / J. B. Nally, D. S. Berson // J. Drugs Dermatol. – 2006. – Vol. 5. – Р. 23–26.
- Neuhaus I. M. Comparative efficacy of nonpuragenic pulsed dye laser and intense pulsed light for erytematoteleangioectatic rosacea / I. M. Neuhaus, L. T. Zane, W. D. Tope // Dermatol. Surg. – 2009. – Vol. 35. – P. 920-928.
- Neumann E. Capillaropathy and capillaroneogenesis in the pathogenesis of rosacea / E. Neumann, A. Frithz // Int. J. Dermatol. – 2008. – Vol. 37, No. 4. – P. 263-266.
- Ortiz A. Topical PRK 124 (0,125 %) lotion for improving the signs and symptomps of rosacea / A. Ortiz, L. Elkeeb, A. Truiff // J. Drugs Dermatol. – 2009. – Vol. 8. – P. 459-462.
- Outcome measures in acne vulgaris: systematic review / H. Barratt, F. Hamilton, J. Car [et al.] // Br. J. Dermatol. – 2009. – Vol. 160 (1). – Р. 132–136.
- Pasmatzi E. Rosacea – like demodicosis induced by topical pimecrolimus: immunohistochemical evaluation of inflammatory infiltrate / E. Pasmatzi, M. Melachrinou // Hospital chronicles. – 2009. – Vol. 4, No. 4. – P. 172-174.
- Powell F. C. Rosacea / F. C. Powell // N. Engl. J. Med. – 2005. – Vol. 352. – P. 793–803.
- Propionibacterium Acnes acts as an adjuvant in vitro immunization of human peripheral blood mononuclear cells / Y. S. Jung, S. E. Matsumoto, M. Yamashita [et al.] // Biosci. Biotechnol. Biochem. – 2007. – Vol. 71. – P. 1963–1969.
- Retrospective analysis of the association between Demodex infestation and rosacea / Y. E. Zhao, L. P. Wu, Y. Peng, H. Cheng // Arch. Dermatol. – 2010. – Vol. 146, № 8. – P. 896-902.
- Rosina P. Videocapllaroscopic alterations in erytematoteleangiectatic rosacea / P. Rosina, M. R. Zamperetti, A. Giovanni // J. Am. Acad. Dermatol. – 2005. – Vol. – 54. – P. 100-104.
- Sanchez J. L. Granulomatous rosacea / J. L. Sanchez, A. C. Berlingeri-Ramos, D. V. Dueno // Am. J. Dermatopathol.- 2008.- Vol. 30.- № 1.- P. 6–9.
- Serdar Z. A. Efficacy of 1 % terbinafine cream in comparison with 0.75 % metronidazole gel for the treatment of papulopustular rosacea / Z. A. Serdar, Ş. Yaşar // Cutan. Ocul. Toxicol. – 2011. – Vol. 30. – P. 124–128.
- Shauber J. Antimicrobical peptides and the skin immune defense system / J. Shauber, R. L. Gallo // J. Allergy Clin. Immunol. – 2009. – Vol. 124. – P. 13-18.
- Sheinfeld N. A review of the diagnosis and treatment of rosacea / N. Sheinfeld, T. Berk // Postgrat. Med. – 2010. – Vol. 122. – P. 139-143.
- Shibata M. Glucocorticoids enhance Toll-like receptor 2 expression in human keratinocytes stimulated with Propionbacterium acnes or proinflammatory cytokines / M. Shibbata, M. Katsuyama, T. Onodera // J. Invest. Dermatol. – 2009. – Vol. – 129. – P. 375-382.
- Smith J. R. Expression of vascular endothelial growth factor and its receptors in rosacea / J. R. Smith, V. B. Lanier, R. M. Braziel // Br. J. Ophtalmol. – 2007. – Vol. – 91. – P. 226-229.
- Steinhoff M. New insights into rosacea pathophysiology: a review of recent findings / M. Steinhoff, J. Schauber, J. J Leyden // J. Am. Acad. Dermatol. – 2013. – Vol. 69, No. 6. – P. 15–26.
- Symptom severity psychological sequelae in rosacea: results and survey / D. Bohm, P. Schwanitz, S. Stock Gissendanner [et al.] // Phychol. Health Med. – 2014. – Vol. 19, № 5. – P. 586-591.
- Systemic isotretionin in the treatment of rosacea – doxycycline- and placebo-controlled, randomized clinical study / H. Gollnick, U. Blume-Peytavi, E. L. Szabo, K. G. Meyer // J. Dtsch. Dermatol. Ges. – 2010. – Vol. 8 (7). – P. 505-515.
- Tan J. Rosacea: current stste of epidemiology / J. Tan, M. Berg // J. Am. Acad. Dermatol. – 2013. – Vol. 69, No. 6. – P. 27-35.
- The impact of rosacea on quality of life: effects of demographic and clinical characteristics and various treatment modalities / B. Aksoy, A. Altaykan-Hapa, D. Egemen, F. Karagoz [et al.] // Br. J. Dermatol. – 2010. – Vol. 163, № 4. – P. 719-725.
- The seroprevalense of Helicobacter pylori and nitric oxide in acne rosacea / M. A. Gurer, A. Trel, D. Erbas [et al.] // Int. J. Dermatol. – 2009. – Vol. 41. – P. 768–770.
- Thiboutot D. M. Azeliac acid 15 % gel once daily versus twice daily in papulopusular rosacea / D. M. Thiboutot, A. B. Fleishher, J. Q. Del Rosso // J. Drugs Dermatol. – 2008. – Vol. 7. – P. 541-546.
- Treatment of rosacea / A. Parodi, F. Drago, S. Paolino, R. Gallo // Ann Dermatol. Venerol. – 2011. – Vol. 138 (3). – P. 211-214.
- Tuzum Y. Rosacea and rhinophyma / Y. Tuzum, R. Wolf, Z. Kutlubay // Clin. Dermatol. – 2014. – Vol. 32, № 1. – P. 35-46.
- Two A. M. Kallikrein 5-mediated inflammation in rosacea: clinically relevant correlations with acute and chronic manifestations in rosacea and how individual treatments may provide therapeutic benefit / A. M. Two, J. Q. Del Rosso // J. Clin. Aesthed. Dermatol. – 2014. – Vol. 7, № 1. – P. 20-25.
- Vieira A. C. Ocular rosacea – a review / A. C. Vieira, A. L. Hofling-Lima, M. J. Mannis // Arq. Bras. Oftalmol. – 2012. – Vol. 75, No. 5. – P. 363–369.
- Whitfeld M. Staphylococcus epidermidis: a possible role in the pustules of rosacea / M. Whitfeld, N. Gunasingam, L. J. Leow // J. Am. Acad. Dermatol. – 2011. – Vol. 64 (1). – P. 49-59.
- Wollina U. Rosacea and rhinophima in the elderly / U. Wollina // Clinics in Dermatology. – 2011. – Vol. 29. – P. 61-68.
- Wollina U. Rosacea and rhinophima: not curse of Celts but Indo Eurasions / U. Wollina, S. B. Verma // J. Cosmet. Dermatol. – 2009. – Vol. 8. – P. 234-235.
- Wu J. Treatment of rosacea with herbal ingredients / J. Wu // J. Drugs Dermatol. – 2006. – Vol. 5. – Р. 29–32.
- Yamasaki K. Rosacea as a disease of cathelicidins and skin innate immunity / K. Yamasaki, R. L. Gallo // J. Investig. Dermatol. Symp. Proc. – 2011. – Vol. 15, No. 1. – P. 12–15.
- Yamasaki K. The molecular pathology of rosacea / K. Yamasaki, R. L. Gallo // J. Dermatol. Sci. – 2009. – Vol. 55 (2). – Р. 77–81.
- Yentzer B. A. Changes in rosacea comorbidities and utilization over time / B.A. Yentzer, A.B. Fleischer // J. Drugs Dermatol. – 2010. – N 9 (11). – P. 1402-1406.
Додаток А
Акти впровадження






