Харківська медична академія післядипломної освіти
Міністерство охорони здоров’я України
Державна установа «Інститут дерматології та венерології
Національної академії медичних наук України»
Кваліфікаційна наукова
праця на правах рукопису
Сербіна Інесса Михайлівна
УДК 616.594.12-03-07-08
ДИСЕРТАЦІЯ
ГНІЗДОВА АЛОПЕЦІЯ: КЛІНІКО-МОРФОЛОГІЧНІ
ТА ПАТОГЕНЕТИЧНІ АСПЕКТИ,
ЛІКУВАЛЬНО-ДІАГНОСТИЧНА ТАКТИКА
14.01.20 – шкірні та венеричні хвороби
Медицина
Подається на здобуття наукового ступеня доктора медичних наук
Дисертація містить результати власних досліджень. Використання ідей,
результатів і текстів інших авторів мають посилання на відповідне джерело
_____________________________________________________________
(підпис, ініціали та прізвище здобувача)
Науковий консультант: Болотна Людмила Анатоліївна,
доктор медичних наук, професор
Харків – 2020
АНОТАЦІЯ
Сербіна І. М. Гніздова алопеція: клініко-морфологічні та патогенетичні аспекти, лікувально-діагностична тактика. – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня доктора медичних наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби (222. Медицина). – Харківська медична академія післядипломної освіти МОЗ України, Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2020.
Дисертацію присвячено проблемі підвищення ефективності терапії хворих на гніздову алопецію (ГА) шляхом розробки комплексного диференційованого методу лікування на підставі вивчення особливостей морфологічних, патофізіологічних, імунологічних та гормональних змін з урахуванням клінічних особливостей захворювання.
Численні гіпотези етіопатогенезу ГА, починаючи від генетичних основ імунної системи до специфічності автоантигенів і шляхів експресії, розуміння ролі екзогенних тригерів, поки не дозволяють отримати вичерпні відповіді, що обумовлює великі труднощі в розробці ефективних методів терапії захворювання. Тому вивчення ключових патогенетичних чинників, залучених у процеси регуляції життєвого циклу волосяного фолікула (ВФ) при ГА, сприятиме не тільки розуміння потенційних механізмів захворювання, можливого відновлення імунного привілею (ІП), виявленню нових маркерів прогнозування перебігу, ключем до розробки нових ефективних методів лікувального впливу, спрямованих на розрив патологічних шляхів, які підтримують автоімунізацію.
Уперше доведено, що ультраструктурні характеристики морфологічних та імуногістохімічних змін в осередку запалення ГА залежать від стадії патологічного процесу. Високий вміст лімфоцитів CD8+ за рахунок кооперації з Т‑хелперами CD4+, макрофагами формує опосередковану Т-клітинами цитотоксичну імунну відповідь, асоційовану з NК-клітинами, при збільшенні експресії прозапальних цитокінів в активну стадію хвороби. Розвиток фіброзу та склерозу, зниження інтенсивності імунозапальних процесів — характерні ознаки хронічного процесу при ГА.
Уперше визначено порушення стану білка теплового шоку масою кДа 70 (HSP-70) та показано зміни цитокінового гомеостазу, що свідчить про процеси імунної дисфункції у хворих на ГА, ступінь вираженості яких корелює з активністю, тяжкістю та тривалістю захворювання. Уперше показано роль ІL-17 в імунопатогенезі ГА, тісний кореляційний взаємозв’язок із клініко-лабораторними параметрами (активністю та тривалістю захворювання, значенням індексу тяжкості гніздової алопеції (ІТГА), VEGF, iNOS, HSP-70).
Уперше виявлено у хворих на ГА дисбаланс маркерів ангіогенезу, первинне значення з яких мають зрушення рівня VEGF, іNOS.
Доповнено дані щодо існування змін рівня кортизолу та інсуліну, коефіцієнта напруження адаптації, які характеризують різний ступінь тяжкості дії стресорного фактора — від напруження до виснаження адаптаційних механізмів організму з можливим зривом регуляторних процесів при ГА.
Уперше встановлено складні та тісні взаємозв’язки між досліджуваними показниками, особливостями клінічного перебігу, що дозволяє виділити предиктори розвитку ГА, серед яких переважне значення мають порушення рівня IL-17, VEGF, iNOS, HSP-70; прогностичні критерії тяжкого перебігу ГА, до яких належать: жіноча стать, наявність дистрофічних нігтьових пластинок (НП), атопія, автоімунні захворювання, втрата волосся на ділянках шкірного покриву при ураженні волосистої частини голови до 50 %, тривалість хвороби більше 1 року, вік хворого на початок захворювання до 17 років, відсутність жовтих точок при дерматотрихоскопії.
На підставі математичного підходу розроблено та запропоновано використання ІТГА, який дає можливість об’єктивно та комплексно оцінити втрату волосся на скальпі, інших ділянках шкіри, ураження НП, тест натягнення волосся та дерматотрихоскопічні маркери захворювання, що підвищує точність клінічних оцінок, дозволяє визначити терапевтичну тактику.
Розроблено комплексний патогенетично обґрунтований алгоритм лікування хворих на ГА з диференційованим використанням глюкокортикостероїдів (ГКС), донатору аргініну тівортіну, препарату зі стрес-протекторною і адаптогенною діями даларгіну, а також місцевого 5 % розчину міноксидилу дозволило підвищити ефективність лікування. Доведено ефективність використання сульфасалазину як альтернативного варіанту лікування у пацієнтів з ГА, які стійкі до ГКС та інших терапевтичних методів.
У роботі наведено дані обстеження 156 хворих на різні форми ГА віком від 18 до 64 років (66 чоловіків і 90 жінок). Контрольну групу склали 35 практично здорових осіб відповідного віку та статі. Виявлено різні клінічні форми ГА: осередкова (34,6 %), лінійна (15,4 %) (офіазис [10,3 %], зворотний офіазис [5,1 %]), багатоосередкова (26,9 %), дифузна форма (2,6 %), тотальна (12,8 %) (ТА) і універсальна алопеція (УА) (7,7 %). Тривалість захворювання становила в середньому 9,8 міс. з діапазоном від 2 тижнів до 10 років. Ранній дебют ГА у 44,8 % пацієнтів відзначено у віці 5–17 років. У 58,5 % пацієнтів зустрічалося від 2 та більше рецидивів захворювання. Як провокуючий фактор розвитку ГА найчастіше вказували стрес 32,7 % пацієнтів, а також атопічні й автоімунні захворювання – 16,3 %. Сімейний характер захворювання відзначили у 17,9 % пацієнтів. У 52,1 % хворих виявлено супутню патологію, серед якої переважали імуноопосередковані захворювання.
Вивчено особливості клінічного перебігу ГА і показано, що для оцінки ступеня тяжкості захворювання принциповими є не тільки кількість і розмір осередків на скальпі, але й загальний характер втрати волосся на шкірі, наявність дистрофічно змінених НП. Виділено основні дерматотрихоскопічні маркери ГА у хворих залежно від стадії патологічного процесу: достовірне збільшення кількості чорних точок, дистрофічного волосся при прогресуванні; велус – при регресі дерматозу; кількість жовтих точок не залежала від стадії.
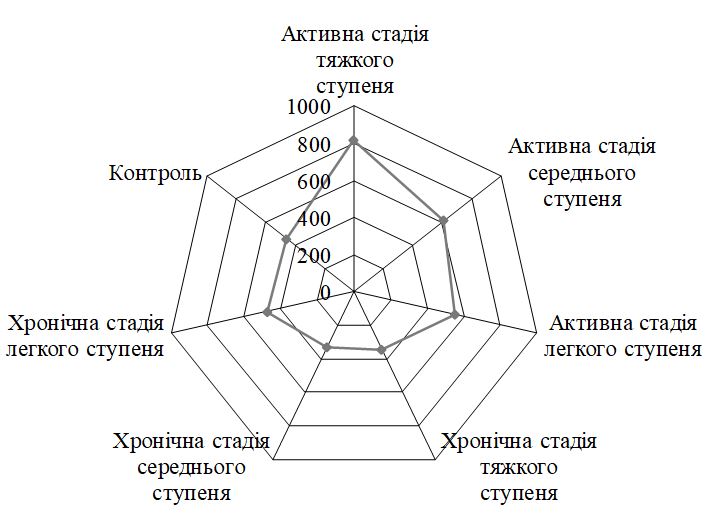
За визначенням ІТГА у хворих на ГА встановлено: легкий ступінь тяжкості у 41,0 % (64), середній та тяжкий ступінь тяжкості у 35,9 % (56) та 23,1 % (36) пацієнтів відповідно. З активною стадією патологічного процесу спостерігалося 79 пацієнтів (50,6 %), з них легкий ступінь тяжкості відзначено у 34 (43,0 %), середній і тяжкий ступені тяжкості – у 27 (34,2 %) і 18 (22,8 %) хворих відповідно. Хронічну стадію захворювання діагностували у 77 (49,4 %) пацієнтів, серед яких легкий ступінь перебігу ГА зустрічався у 30 (38,9 %), середній ступінь тяжкості – у 29 (37,6 %) і тяжкий – у 18 (23,5 %) хворих.
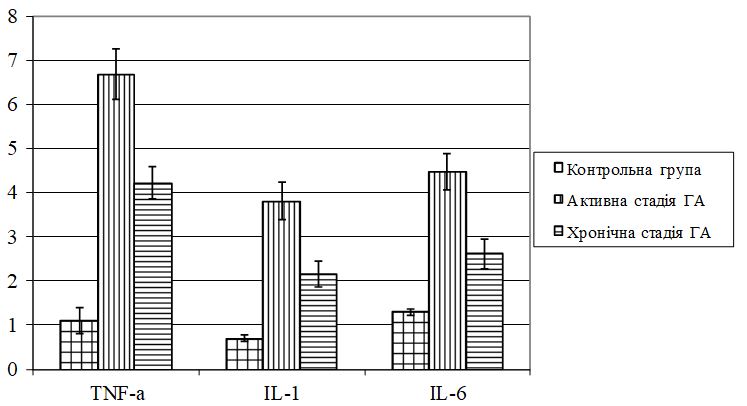
Встановлено морфологічні та імуногістохімічні зміни шкіри волосистої частини голови при ГА залежно від стадії патологічного процесу. Високий вміст лімфоцитів CD8+ за рахунок кооперації з Т хелперами CD4+, макрофагами формує опосередковану Т-клітинами цитотоксическую імунну відповідь, асоційовану з NК-клітинами, при збільшенні експресії прозапальних цитокінів (IL-1, IL-6, TNF-α) в активну стадію хвороби. У хронічну стадію переважали фіброзні і атрофічні процеси ГА з перифолікулярним і периваскулярним склерозом, мінімальним ступенем клітинної відповіді у вигляді лімфоцитогістіоцітарного інфільтрату, зменшенням і частковою атрофією ВФ.
Найбільш виражені порушення цитокінового гомеостазу з різноспрямованими змінами про- і протизапальних цитокінів відбувалися у пацієнтів із тяжким ступенем і активними проявами, коли вміст ІL-1β та ІL‑17 збільшувався в 3,2 та 3,6 раза, а ІL-4 та ІL-10 зменшувався в 1,9 та 2,1 раза відповідно відносно результатів у здорових осіб. Рівень HSP-70 збільшувався майже вдвічі в активну стадію при тяжкому перебігу порівняно зі значенням показника в хронічну стадію при відповідному ступені тяжкості ГА. Вихідна величина HSP-70 достовірно пов’язана з віком початку захворювання, активністю та ступенем тяжкості. Виявлена залежність рівня ІL-17 від значення ІТГА, активності та тривалості ГА. Аналіз впливу HSP-70 та ІL-17 на розвиток ГА встановив, що показники мають статистично значимий вплив на випадіння волосся. Збільшення секреції HSP-70 (c2 = 66,2 %) та ІL-17 (c2 = 81,4 %) підвищує ймовірність розвитку ГА.
Виявлено дисбаланс маркерів ангіогенезу, який характеризувався зміною рівня VEGF, sVEGFR1, EGF і показників системи NO. Найбільш значимі зміни діагностували при тяжкому перебігу, як в активну, так і хронічну стадії хвороби. Кореляційний аналіз показав наявність тісного кореляційного зв’язку між VEGF і sVEGFR1 (r = –0,70, р<0,05), VEGF та EGF (r = 0,81, р<0,05), sVEGFR1 і EGF (r = –0,70, р<0,05) у хворих з тяжким ступенем тяжкості ГА незалежно від стадії патологічного процесу; між NO і iNOS (r = 0,67, р<0,01), NO3 і iNOS (r = 0,56, р<0,05) у хворих ГА середнього та тяжкого ступеня тяжкості в активну стадію патологічного процесу. За допомогою дисперсійного аналізу виділені предиктори захворювання – VEGF (c2 = 0,716056, р<0,05) і iNOS (c2 = 0,674539, р<0,05).
Ендокринні порушення механізмів переносимості стресу у хворих на ГА проявилися різноспрямованими змінами адаптивних гормонів (кортизолу та інсуліну) залежно від активності, ступеня тяжкості та тривалості. Підвищення коефіцієнта адаптації К у хворих з ознаками прогресування захворювання, тяжким ступенем та тривалістю ГА до трьох років вказувало на напруження адаптаційних можливостей організму (в 1,5, 1,8 і 1,9 раза відповідно). Зниження К при хронізації ГА і тривалості хвороби більше трьох років свідчить про виснаження адаптаційних механізмів організму з можливим зривом регуляторних процесів (в 1,7 і 1,8 раза відповідно).
При оцінці якості життя (ЯЖ) відзначено, що хворі з тяжким ступенем ГА мали значення DLQI в 3,4 раза більше за показник при легкому ступеню тяжкості захворювання. Спостерігався значний зв’язок між загальним показником DLQI і віком пацієнтів (до 30 років значення було достовірно вищим, p<0,001), тривалістю захворювання (при випаданні волосся протягом понад 12 місяців показник достовірно збільшувався; p<0,001), гострим стресом протягом останніх 6 місяців (p = 0,02) та рівнем ІТГА (p<0,001).
Усі пацієнти були розподілені на три основні групи з урахуванням ступеня тяжкості і обсягу наданої медикаментозної допомог. Пацієнти кожної групи були розподілені на три підгрупи, при цьому в підгрупу «а» були об’єднані хворі з активною стадією, у «б» – із хронічною стадією, у «в» («в1»— з активною стадією, «в2»— з хронічною стадією) (контрольна підгрупа) — пацієнти, які отримували традиційну терапію.
Для лікування ГА було обрано препарати патогенетичної терапії – неспецифічної імуносупресивної терапії – ГКС, спосіб введення яких визначався ступенем тяжкості захворювання. Додатково залежно від ступеня тяжкості та стадії патологічного процесу використовувався препарат, який відновлює рівень NO, що поліпшує мікроциркуляцію в тканинах (тівортін), а також препарат, що нормалізує адаптивно-регуляторні процеси (даларгін). Як топічний засобіб призначався біологічний модулятор росту волосся – міноксидил у вигляді 5 % розчину. Сульфасалазин використовувався як варіант лікування у пацієнтів середнього ті тяжкого ступеня тяжкості з ГА, які стійкі до ГКС та інших терапевтичних методів. Застосування цих препаратів дозволило досягти позитивного результату при лікуванні у 79,4 % пацієнтів, що в 1,5 раза вище, ніж при використанні традиційної терапії, зменшити кількість рецидивів та подовжити ремісію. Доведено, що лікування за розробленим методом дозволило статистично значимо знизити значення ІТГА, відновити та покращити рівень показників імунного запалення, маркерів ангіогенезу, адаптаційних гормонів та їх коефіцієнту, підвищити ЯЖ пацієнтів.
Ключові слова: гніздова алопеція, патогенез, імуноморфологічні механізми, цитокіни, білок теплового шоку, маркери ангіогенезу, адаптація, якість життя, лікування.
ABSTRACT
Serbina I. M. Alopecia areata: clinical, morphological and pathogenetic aspects, treatment and diagnostic tactics. – Qualification scientific work with the manuscript copyright.
The Dissertation for the Scientific Degree of the Doctor of Medical Science on a Specialty 14.01.20 – Skin and Venereal Diseases. – Kharkiv Medical Academy of Postgraduate Education, State Establishment «Institute of Dermatology and Venereology of NAMS of Ukraine», Kharkiv, 2020.
The dissertation is devoted to the problem of increasing the effectiveness of therapy for patients with alopecia areata (AA) by developing a comprehensive differential treatment method based on the study of morphological, pathophysiological, immunological and hormonal changes, taking into account the clinical features of the disease.
Numerous hypotheses of AA’s etiopathogenesis, ranging from the genetic basis of the immune system to the specificity of autoantigens and expression pathways, understanding the role of exogenous triggers, at present do not allow you to get comprehensive answers, which causes great difficulties in developing effective methods of treatment of the disease. Therefore, the study of key pathogenetic factors, involved in the regulation of the life cycle of the hair follicle (HF) in AA, will facilitate not only in understanding of the potential mechanisms of the disease, possible restoration of immune privilege (IP), detection of new markers of course of the disease forecasting, but might also be the key to developing new effective methods of therapeutic influence, aimed at breaking the pathological pathways that support autoimmunization.
The fact that the ultrastructural characteristics of morphological and immunohistochemical changes in the inflammatory focus of AA depend on the stage of the pathological process is proven for the first time. High content of CD8+ lymphocytes with the use of cooperation with T helper CD4 +, macrophages forms a T-cell mediated cytotoxic immune response associated with NK cells, with increasing expression of the pro-inflammatory cytokines in the active stage of the disease. Development of fibrosis and sclerosis, decrease in intensity of immunoinflammatory processes – are distinctive signs of AA’s chronic process.
HSP-70 abnormalities were identified for the first time and changes in cytokine homeostasis were shown, indicating the processes of immune dysfunction in patients with HA, the inclemency of which correlates with the activity, severity and duration of the disease.
The role of IL-17 in the immunopathogenesis of HA, the correlation with clinical and laboratory parameters, was shown for the first time. For the first time an imbalance of markers of angiogenesis was detected in patients with AA, the paramount importance of which are the shifts in the level of VEGF and NOS.
It is shown that the change options in cortisol and insulin levels, the coefficient of stress adaptation, characterize the different severity of the stress factor – from stress to depletion of the body’s adaptive mechanisms with a possible disruption of regulatory processes in AA.
Complex and close relationships have been established between the studied indicators, features of the clinical course, that allows us to identify predictors of AA development, among which violations of the level of IL-17, VEGF, iNOS, HSP-70 are of paramount importance.
Prognostic criteria for severe AA, which include: female sex, the presence of dystrophic nail plates (NP), atopy, autoimmune diseases, scalp hair loss with lesions of the scalp up to 50 %, the duration of the disease more than one year, the patient’s age at the onset of the disease up to 17 years, no yellow spots during dermatotrichoscopy, are revealed.
Based on the mathematical approach, the use of AA severity index (SIAA) was developed and proposed. It empowers you to objectively and comprehensively assess hair loss on the scalp and other areas of the skin, lesions of the NP, hair tension test and dermatotrichoscopic markers of the disease, which increases the accuracy of clinical assessments and allows to determine therapeutic tactics.
A complex pathogenetically substantiated algorithm for the treatment of patients with AA with differentiated use of glucocorticosteroids (GCS), donor of arginine tivortin, a drug with stress-protective and adaptogenic effects of dalargin, as well as a local 5 % solution of minoxidil, has been developed and allowed to increase the effectiveness of treatment. The effectiveness of sulfasalazine as an alternative treatment in patients with AA who are resistant to corticosteroids and other therapeutic methods has been proven.
The study presents data from a survey of 156 patients with various forms of AA aged 18 to 64 years (66 men and 90 women). The control group consisted of 35 healthy individuals of the appropriate age and sex. Various clinical forms of AA have been identified: focal (34.6 %), linear (15.4 %) (ofiasis [10.3 %], reverse ofiasis (5.1 %]), multicellular (26.9 %), diffuse form (2.6 %) , total (12.8 %) (TA) and universal alopecia (UA) (7.7 %). The duration of the disease averaged 9.8 months. with a range from 2 weeks to 10 years. Early onset of AA in 44.8 % of patients was observed at the age of 5–17 years. 58.5 % of patients had 2 or more relapses. Stress was most often cited as a provoking factor by 32.7 % of patients, as well as atopic and autoimmune diseases – 16.3 %. The familial nature of the disease was noted in 17.9 % of patients. In 52.1 % of patients concomitant pathology was detected, among which immune-mediated diseases predominated.
The peculiarities of the clinical course of AA have been studied and it has been shown that not only the number and size of cells on the scalp, but also the general nature of hair loss on the skin and the presence of dystrophically altered NP are essential for assessing the severity of the disease. The main dermatotricoscopic markers of AA in patients depending on the stage of the pathological process are identified: a significant increase in the number of black dots, dystrophic hair with progression; velus – with regression of dermatosis; the number of yellow dots did not depend on the stage.
According to the definition of SIAA in patients with AA was found: mild in 41.0 % (64), moderate and severe in 35.9 % (56) and 23.1 % (36) patients, respectively. 79 patients (50.6 %) were observed with an active stage of the pathological process, of which a mild degree of severity was noted in 34 (43.0 %), moderate and severe – in 27 (34.2 %) and 18 (22.8 %) patients respectively. Chronic stage of the disease was diagnosed in 77 (49.4 %) patients, among whom mild AA occurred in 30 (38.9 %), moderate – in 29 (37.6 %) and severe – in 18 (23.5 %) of patients.
Morphological and immunohistochemical changes of the scalp in AA depending on the stage of the pathological process have been established. High content of CD8+ lymphocytes with the use of cooperation with T helper CD4+, macrophages forms a T-cell mediated cytotoxic immune response associated with NK cells, over the course of increase in the expression of pro-inflammatory cytokines (IL-1, IL-6, TNF-α) during the active stage of the disease. Fibrotic and atrophic processes of AA with peripheral and perivascular sclerosis dominated in chronic stage, with a minimal degree of cellular response in the form of lymphocytic histiocytic infiltrate, and a decrease and partial atrophy of the hair follicle.
The most pronounced disorders of cytokine homeostasis with multidirectional changes pro- and anti-inflammatory cytokines occurred in patients with severe stage and active manifestations, when the levels of IL-1β and IL-17 increased by 3.2 and 3.6 times, and IL-4 and IL-10 decreased by 1.9 and 2.1 times respectively compared to the results in healthy individuals. The value of HSP-70 almost doubled in the active stage in severe cases compared with the value of the indicator in the chronic stage with the corresponding severity of AA. The value of HSP-70 is reliably associated with the age of the onset of the disease, activity and severity. Correlation of the level of IL-17 with the value of the AA severity index, activity and duration of AA was found. An increase in the secretion of HSP-70 (c2 = 66.2 %) and IL-17 (c2 = 81.4 %) increases the likelihood of developing AA.
The imbalance of angiogenesis markers, which is characterized by a change in the level of VEGF, sVEGFR1, EGF and indicators of the NO system, was revealed. The most significant changes were diagnosed in severe cases, both in the active and chronic stages of the disease. Correlation analysis showed a close correlation between VEGF and sVEGFR1 (r = –0.70, p <0.05), VEGF and EGF (r = 0.81, p <0.05), sVEGFR1 and EGF (r = –0.70, p <0.05) in patients with severe severity of GA, regardless of the stage of the pathological process; between NO and iNOS (r = 0.67, p <0.01), NO3 and iNOS (r = 0.56, p <0.05) in patients with moderate to severe AA in the active stage of the pathological process. The analysis of variance identified disease predictors – VEGF (c2 = 0.716056, p <0.05) and iNOS (c2 = 0.674539, p <0.05).
Endocrine disorders of stress tolerance mechanisms in patients with AA were manifested by multidirectional changes in adaptive hormones (cortisol and insulin) depending on activity, severity and duration. An increase in the coefficient of adaptation K in patients with signs of disease progression, severe and duration of AA up to three years, indicated a strain on the adaptive capacity of the organism (1.5, 1.8 and 1.9 times, respectively). The decrease in K at chronicity of AA and duration of an illness more than three years testifies to exhaustion of adaptive mechanisms of an organism with possible failure of regulatory processes (in 1.7 and 1.8 times accordingly).
When assessing the quality of life (QOL), it was noted that patients with severe AA had values of DLQI 3.4 times higher than in mild disease. There is a significant association between total DLQI and the age of patients (up to 30 years the value was significantly higher, p <0.001), duration of the disease(for hair loss for more than 12 months, the rate increased significantly; p <0.001), acute stress during the last 6 months (p = 0.02) and the level of SIAA (p <0.001).
All patients were divided into three main groups according to the severity and amount of medical care provided. Patients in each group were divided into three subgroups: in subgroup “a” were patients with active stage, in “b” – with chronic, in “c” ((«с1»— active stage, «с2»— chronic stage) – patients who received traditional therapy (control subgroup).
Pathogenetic therapy drugs were selected for the treatment of AA – nonspecific immunosuppressive therapy – GKS, the method of administration of which was determined by the severity of the disease. Additionally, depending on the severity and stage of the pathological process, a medication was used that restores the level of NO, which improves microcirculation in the tissues (tivortin), as well as a medication that normalizes the adaptive-regulatory processes (dalargin). Biological modulator of hair growth – minoxidil in the form of a 5 % solution, was prescribed as a topical mean. Sulfasalazine has been used as an alternative treatment for patients with moderate to severe AA who are resistant to corticosteroids and other therapeutic methods. The use of these medications allowed to achieve a positive result in the treatment of 79.4 % of patients (which is 1.5 times higher than when using traditional therapy), reduce the number of relapses and prolong remission. It is proved that the treatment according to the developed method allowed to receive statistically significant reduction in the value of SIAA, to restore and improve the level of immune inflammation, markers of angiogenesis, adaptive hormones and their coefficient, to increase the QOL of patients.
Keywords: alopecia areata, pathogenesis, immunomorphological mechanisms, cytokines, heat shock protein, markers of angiogenesis, adaptation, quality of life, treatment.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Сербина И.М. Использование препаратов метаболического действия в терапии гнездной алопеции. Дерматовенерология. Косметология. Сексопатология. 2010. № 1–4. С. 52–55.
- Сербина И.М. Комплексный подход к диагностике гнездной алопеции. Дерматовенерология. Косметология. Сексопатология. 2011. № 1–4. С. 215–220.
- Сербина И.М. Гнездная алопеция: лечение и перспективы новых исследований. Клінічна імунологія. Алергологія. Інфектологія. 2012. № 1. С. 64–67.
- Сербина И.М. Исследование состояния цитокинов при гнездной алопеции с учетом активности заболевания. Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции. Сборник научных трудов. Х. : ХНМУ, 2013. С. 213–217.
- Сербина И.М., Овчаренко Ю.С. Оценка дерматоскопических маркеров при гнездной алопеции. Дерматовенерология. Косметология. Сексопатология. 2013. № 1–4. C. 34–38.
- Renboek phenomenon in an alopecia areata patient with psoriasis / Y. Ovcharenko, I. Serbina, A. Zlotogorski, Y. Ramot. Int. J. Trichology. 2013. Vol. 5, Iss. 4. P. 194–195.
- Сербина И.М.Особенности метаболизма азота оксида при гнездной алопеции. Укр. журн. дерматол., венерол., косметол. № 2. C. 55–59.
- Овчаренко Ю.С., Сербина И.М., Литвиненко Б.В. Трихоскопические дифференциально-диагностические алгоритмы нерубцовых алопеций. Дерматолог. 2014. Т. 5, № 01. С. 38–42.
- Сербина И.М. Цитокинопосредованные механизмы формирования гнездной алопеции. Научные ведомости БелГУ. Серия: Медицина. Фармация. № 24 (195), вып. 28. С. 32–38.
- Сербина И.М. Оценка степени тяжести у больных гнездной алопеции. Дерматологія та венерологія. 2014. № 4. С. 34–37.
- Сербина И.М. Интерлейкин 17 в патогенезе гнездной алопеции. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2014. № 1–2 (32). С. 90–93.
- Сербіна І.М. Імуноморфологічні особливості формування гніздової алопеції. Дерматологія та венерологія. 2016. № 3 (75). С. 52–60.
- Сербина И.М. Иммунопатологические аспекты гнездной алопеции. Дерматолог. 2016. № C. 180–187.
- Сербина И.М. Патогенез гнездной алопеции: иммунные механизмы. Международный медицинский журнал. 2016. Т. 22, № 3. С. 65–71.
- Болотная Л.А., Сербина И.М. Адаптационно-регуляторные механизмы при гнездной алопеции. Georgian medical news. 2017. № 11 (272). С. 75–80.
- Сербина И.М. Изучение сосудистого эндотелиального фактора у больных гнездной алопеции. Лікарська справа. 2017. № 3–4. С. 98–103.
- Сербіна І.М. Патогенетичне обґрунтування диференційованого підходу в терапії гніздової алопеції. Дерматологія та венерологія. 2018. № 3 (81). С. 46–50.
- Сербина И.М. Коморбидность при гнездной алопеции. Дерматологія та венерологія. № 2 (80). С. 67–72.
- Сербина И.М. Современные подходы в терапии гнездной алопеции у детей. Міжнародний медичний журнал. 2018. № 1. С. 68–73.
- Сербіна І.М. Клініко-патогенетичне значення білка теплового шоку при гніздовій алопеції. Дерматологія та венерологія. 2019. № 3 (85). С. 15–18.
- Сербіна І.М. Маркери ангіогенезу у хворих на гніздову алопецію. Міжнародний медичний журнал. 2019. № 3. С. 73–78.
- Пат. на корисну модель 115991 UA, МПК A61B10/00, A61B5/103. Спосіб діагностики тяжкості гніздової алопеції / І.М. Сербіна, Л.А. Болотна; заявник і патентовласник Харківська медична академія післядипломної освіти. № u201608561; заявл. 04.08.16; опубл. 10.05.17, Бюл. № 9.
- Пат. на корисну модель 123446 UA, МПК A61K31/00, A61P17/14. Спосіб диференційованого лікування гніздової алопеції / Л.А. Болотна, І.М. Сербіна; заявник і патентовласник Харківська медична академія післядипломної освіти. № u201709537; заявл. 29.09.17; опубл. 26.02.18, Бюл. № 4.
- Bolotnaya L., Serbina I. Changes in endothelial function in alopecia areata 9th EADV Spring Symposium “A dematological opera” 6-10 June. Verona, Italy – 2012. P. 331.
- Сербина И.М. Активация местных механизмов ангиогенеза при гнездной алопеции. Матеріали регіональної науково-практичної школи «Набуття молодих вчених дерматовенерологів», м. Київ, 15 листопада 2012 р. Київ, 2012. С. 87.
- Serbina I., Ramot Y. Pressure alopecia mimicking alopecia areata: Dermoscopy as a diagnostic aid in avoiding a potential clinical pitfall. 8th World Congress for Hair Research (WCHR 2014), May 14-17 2014, Jeju (Korea). Annals of Dermatology. 2014. Vol. 26, Suppl. 1. P. 28.
- Serbina I. Study of nitrogen oxide and heat shock protein 70 system in patients with alopecia areata. Materials of 8th national scientifically-practical conference with the internatiol participation «Reactive oxygen species, nitric oxide, antioxidants and human health», Smolensk, May 25–29th, 2014. Smolensk, 2014. Р. 181–182.
- Serbina I. Angiogenesis factors in alopecia areata. 9th World Congress for Hair Research, Miami (USA), November 18–21, 2015. Annals of Dermatology. 2015. Vol. 203. P. 32.
- Сербина И.М. Адаптационные гормоны при гнездной алопеции. Матеріали IX Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання наукової і практичної косметології», м. Запоріжжя, 24–25 квітня 2015 р. Запоріжжя, 2015. C. 56.
- Сербина И.М. Опыт использования комбинированной наружной терапии при гнездной алопеции. Матеріали XXXІІІ Всеукраїнської науково-практичної конференції за участю міжнародних спеціалістів «Ліки-Людині», м. Харків, 8 квітня 2016 р. Харків, 2016. С. 177.
- Serbina I.M. Alopecia areata. 17th Meeting of the European Hair Research Society: Abstract book, Tbilisi (Georgia), June 24–26 2016. Tbilisi, 2016. SA-01-6. P. 64.
- Сербина И.М. Коррекция нарушений метаболизма оксида азота при гнездной алопеции. Матеріали І Міжнародної науково-практичної конференції у двох томах «Ліки-людині. Сучасні проблеми фармакотерапії і призначення лікарських засобів», м. Харків, 30–31 березня 2017 р. Харків, 2017. Т. 2. С. 295.
- Serbina I. Disadaptation disorders and quality of life index in alopecia areata. 18th meeting of the EHRS Congress : Abstract book, Bologna (Italy), May 18–20 2018. Bologna, 2018. Р. 63.
- Serbina I. Alopecia areata: focus on comorbidity. 11 World Congress of Hair Research : Abstract book, April 24–27, 2019, Sitges, Barselona (Spain). P. 153–154.
- Сербина И.М. Проблемы коморбидности при гнездной алопеции. Нужно ли менять тактику лечения? 2-й Конгрес Українського товариства дослідження волосся (UHRS): Тезиси доповідей, м. Київ, 9–10 лютого 2019 р. Київ, 2019. С. 27.
ЗМІСТ
| Перелік умовних скорочень | 20 |
| Вступ | 22 |
| Розділ 1 Огляд літератури | 31 |
| 1.1 Клініко-епідеміологічні особливості, генетичні фактори гніздової алопеції | 31 |
| 1.2 Імунопатогенез гніздової алопеції | 36 |
| 1.3 Роль ростових факторів та інших медіаторів ангіогенезу в механізмах розвитку гніздової алопеції | 46 |
| 1.4 Стан адаптаційних механізмів при гніздовій алопеції | 50 |
| 1.5 Сучасні підходи до лікування гніздової алопеції | 52 |
| Розділ 2 Матеріали і методи дослідження | 67 |
| 2.1 Імуноферментне дослідження крові | 68 |
| 2.2 Спектрофотометричне дослідження крові | 70 |
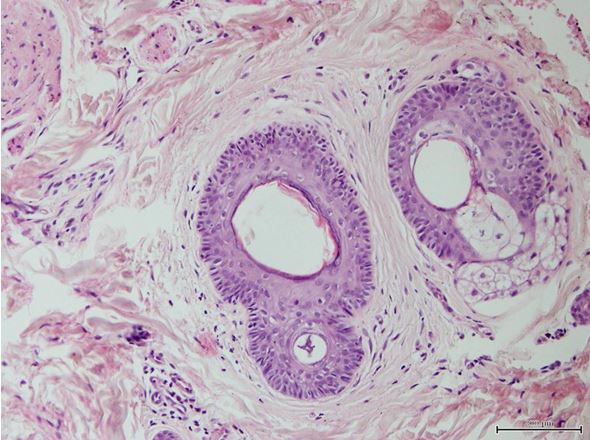
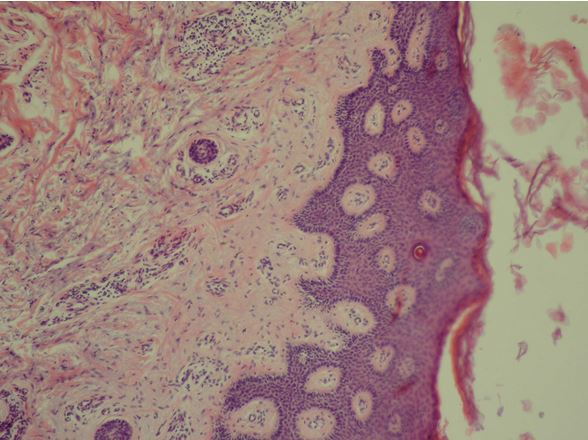
| 2.3 Морфологічне та імуногістохімічне дослідження біоптату шкіри | 71 |
| 2.4 Оцінка впливу захворювання на якість життя за допомогою опитувальника DLQI | 72 |
| 2.5 Інструментальне (дерматотрихоскопічне) дослідження | 73 |
| 2.6 Визначення індексу тяжкості гніздової алопеції | 74 |
| 2.7 Статистичний метод дослідження | 78 |
| Розділ 3 Клініко-інструментальна характеристика хворих на гніздову алопецію | 80 |
| 3.1 Клінічна характеристика хворих | 80 |
| 3.2 Оцінка дерматотрихоскопічної картини з урахуванням стадії патологічного процесу | 90 |
| Розділ 4 Імуноморфологічні механізми формування гніздової алопеції | 106 |
| Розділ 5 Цитокіновий профіль та рівень білка теплового шоку масою 70 кДа у пацієнтів із гніздовою алопецією |
123 |
| 5.1 Визначення стану цитокінів в залежності від ступеня тяжкості, активності та тривалості гніздової алопеції | 123 |
| 5.2 Аналіз рівня білка теплового шоку масою 70 кДа у хворих залежно від особливостей перебігу гніздової алопеції |
132 |
| Розділ 6 Ангіогенні фактори у хворих на гніздову алопецію | 138 |
| 6.1 Оцінка рівня VEGF, sVEGFR1 та EGF в залежності від перебігу гніздової алопеції | 138 |
| 6.2 Стан системи NO у хворих на гніздову алопецію | 147 |
| Розділ 7 Оцінка адаптаційно-регуляторних механізмів та якості життя пацієнтів із гніздовою алопецією | 160 |
| 7.1 Аналіз якості життя у обстежених хворих на гніздову алопецію | 161 |
| 7.2 Визначення рівня кортизолу, інсуліну та адаптаційного коефіцієнту у хворих на гніздову алопецію в залежності від активності, ступеня тяжкості та тривалості захворювання | 162 |
| Розділ 8 Комплексна патогенетична терапія хворих із гніздовою алопецією та клініко-лабораторна оцінка її ефективності |
173 |
| Розділ 9 Аналіз та узагальнення результатів дослідження | 202 |
| Висновки | 240 |
| Рекомендації | 245 |
| Список використаних джерел | 247 |
| Додаток А Акти впровадження | 286 |
| Додаток Б Список публікацій за темою дисертації та відомості про апробацію дисертації | 296 |
ПЕРЕЛІК УМОВНИХ СКОРОЧЕНЬ
АСТ – аспартатамінотрансфераза
АЛТ – аланінамінотрансфераза
БВВ – бал втрати волосся
БПВ
ВФ – волосяний фолікул
ГА – гніздова алопеція
ГГНС – гіпоталамо-гіпофізарно-надниркова система
ГКС – глюкокортикостероїди
ІП – імунний привілей
ІТ – імунна толерантність
ІТГА – індекс тяжкості гніздової алопеції
ІГХ – імуногістохімічні
ЛФ – лужна фосфатаза
НП – нігтьова пластинка
ЯЖ – якість життя
EGF – епідермальний фактор росту
HSP-70 – білок теплового шоку масою 70 кДа
IL – інтерлейкін
NO – оксид азоту
NOS – NO-синтази.
сNOS – конститутивна NOS
nNOS – нейрональна NOS
eNOS – ендотеліальна NOS
iNOS – індуцибельна NOS
IFN-γ – інтерферон – гамма
TNF-α – фактор некрозу пухлин – альфа
MHC – головний комплекс гістосумісності
DLQI – Dermatology Quality of Life Index (Дерматологічний індекс якості життя)
JAK-STAT (Janus Kinases – Signal Transducer and Activator of Transcription) – янус-кінази (JAK) – сигнальний білок-трансдуктор і активатор транскрипції (STAT)
«Рull test» – тест натягу волосся
SP – субстанція P
VEGF – судинний ендотеліальний фактор росту
sVEGFR1 – розчинний рецептор 1 VEGF
ВСТУП
Актуальність теми. Гніздова алопеція (ГА) посідає одне з провідних місць у сучасній дерматології у зв’язку зі зростанням захворюваності (від 3–5 % до 8–12 % серед дерматологічних хворих), особливо серед осіб у віці до 30 років (до 80 % пацієнтів), почастішанням тяжких торпідних форм, порушенням соціальної адаптації [32, 72, 137, 211, 285]. Численні гіпотези етіопатогенезу ГА, починаючи від генетичних основ імунної системи до специфічності автоантигенів і шляхів експресії, розуміння ролі екзогенних тригерів, поки не дають змоги отримати вичерпні відповіді, що зумовлює великі труднощі в розробці ефективних методів терапії захворювання [172, 236].
ГА розглядається як тканиноспецифічне автоімунне захворювання, опосередковане автоактивованими Т-лімфоцитами в умовах порушення імунної толерантності (ІТ) волосяних фолікулів (ВФ) і презентації власних автоантигенів. Передбачається, що важлива роль у розвитку і прогресуванні даного захворювання належить цитокіновому каскаду та лімфоцитарній ланці імунної системи [221, 337]. Розглядається значення активації T‑лімфоцитів за Th-1 типом із подальшим синтезом прозапальних цитокінів – інтерлейкінів (IL) -2, -6, -15, інтерферону γ (IFN-γ), фактора некрозу пухлин – α (TNF-α) та ін. Імовірним кандидатом на роль ключової ланки прозапальної відповіді, на додаток до Th-1 субпопуляції Т-лімфоцитів, може виступати система Th-17 [6, 149, 207]. Аналіз отриманих останнім часом даних показав, що позаклітинний білок теплового шоку (HSP-70) має безліч функцій, найважливіша з яких імуномодуляторна. Проводяться дослідження з вивчення ролі HSP-70 у патогенезі автоімунних захворювань [23, 144, 219]. Відсутність однозначних даних про імунопатологічні процеси є підставою для подальшого вивчення ролі цитокінів, у тому числі IL-17 та HSP-70 у патогенезі ГА.
Судинний ендотеліальний фактор росту (VEGF) є одним із найважливіших медіаторів росту ВФ [121, 122]. Інтерес дослідників привертає вивчення продукції розчинних форм рецепторів VEGF, і зокрема sVEGFR1, який є інгібітором трансдукції VEGF опосередкованого сигналу. Синтез VEGF стимулюється безліччю проангіогенних факторів, одним з яких є епідермальний фактор росту (EGF), що забезпечує морфогенез судини, хемотаксис клітин ендотелію, посилення проліферації клітин ендотелію капілярів [36, 38]. Виявлено роль EGF як посередника припинення анагену [284].
VEGF посилює вироблення ендотеліального чинника релаксації. Метаболіти оксиду азота (NO), будучи універсальними вторинними клітинними месенджерами й опосередковуючи фундаментальні функції з міжклітинної комунікації, клітинного дихання, імунологічного захисту, вазодилатації, беруть участь у захисних і ушкоджуючих реакціях організму при багатьох патологічних станах. Доведено, що NO активує синтез протекторних стрес-білків HSP-70 і може бути важливим механізмом антистресового захисту клітин [4, 40, 157, 256]. Дослідження NO та VEGF у хворих на ГА мають суперечливий характер [204, 331].
Психотравмуючий вплив ГА може досягати рівня зіставленого з наслідками життєзагрожуючих або інвалідизуючих станів, тому актуальним є оцінка якості життя (ЯЖ) при ГА [170]. Дедалі більше уваги приділяється стрес-системам організму при автоімунних захворюваннях. Гормони стресу здатні змінювати баланс Th-1/Th-2-цитокінів та впливати на дебют і перебіг автоімунного процесу [188].
Важливим є своєчасне встановлення діагнозу з використанням сучасних специфічних методів діагностики хвороб волосся – дерматотрихоскопії. Відсутність чітких діагностичних критеріїв, навичок інтерпретації отриманих результатів, може утрудняти оцінку повноцінної клінічної картини [307].
Аналіз міжнародних протоколів з лікування ГА показує, що нині не існує методів терапії, які гарантують відсутність рецидиву в майбутньому. Навіть імуносупресивні засоби можуть виявитися малоефективними або мати нестійкий результат, спричиняти серйозні побічні ефекти [41, 137, 352], що зумовлює необхідність розробки нових підходів терапії.
Таким чином, вивчення ключових патогенетичних чинників, залучених у процеси регуляції життєвого циклу ВФ при ГА, сприятиме не тільки розумінню потенційних механізмів захворювання, можливому відновленню імунного привілею, виявленню нових маркерів прогнозування перебігу, ключем до створення нових ефективних методів лікувального впливу, спрямованих на розрив патологічних шляхів, які підтримують автоімунізацію.
Зв’язок роботи з науковими програмами, планами, темами. Робота виконана на кафедрі дерматовенерології Харківської медичної академії післядипломної освіти відповідно до напрямку науково-дослідних робіт за темою: «Удосконалення методів терапевтичної корекції хронічних дерматозів на підставі дослідження їх патогенезу та сучасних клінічних особливостей» (№ держреєстрації 0112U000976, термін виконання 2011–2016 рр.) та «Оптимізація терапії хронічних дерматозів на підставі вивчення клінічних особливостей та патогенетичних механізмів» (№ держреєстрації 0118U000302, термін виконання 2017–2021 рр.). Особисто вивчено особливості клінічних проявів і перебігу, удосконалено діагностику хворих на ГА залежно від ступеня тяжкості та активності патологічного процесу, проведено аналіз морфологічних, патофізіологічних, імунологічних та гормональних змін, розроблено алгоритм патогенетичної терапії з урахуванням виявлених порушень та оцінено його ефективність.
Мета та задачі дослідження. Мета – удосконалення методів діагностики, підвищення ефективності терапії хворих на ГА шляхом розробки комплексного диференційованого методу лікування на підставі вивчення особливостей морфологічних, патофізіологічних, імунологічних та гормональних змін з урахуванням клінічних особливостей захворювання.
Для досягнення поставленої мети дослідження визначено задачі:
- Виявити особливості клінічних проявів, прогностичні критерії тяжкого перебігу ГА. Дослідити дерматотрихоскопічні зміни в осередках патологічного процесу.
- Дослідити морфологічні та імуногістохімічні зміни місцевих імунних реакцій в осередках ураження шкіри при ГА на підставі вивчення CD4+, CD8+, CD68+, CD56+, IL-1, IL-6, TNF-α залежно від стадії патологічного процесу.
- Проаналізувати рівень цитокінів (IL-1β, IL-2, IL-4, IL-10, IL-17) та HSP-70 у хворих при різних клінічних проявах ГА до та після лікування.
- Оцінити вміст маркерів ангіогенезу – sVEGFR1, VEGF та EGF у крові хворих у динаміці спостереження.
- Охарактеризувати метаболізм NО за вивченням рівня його метаболітів – NO2 і NO3 та NО-синтаз (NOS) при різних клінічних проявах ГА до та після лікування.
- Визначити стан стрес-адаптивної системи (кортизол, інсулін, адаптаційний коефіцієнт) у хворих на ГА залежно від активності, ступеня тяжкості та тривалості захворювання до та після лікування.
- Оцінити вплив ГА на ЯЖ хворого.
- Розробити комплексний патогенетично обґрунтований диференційований метод лікування хворих на ГА та оцінити його терапевтичну ефективність.
Об’єкт дослідження: ГА.
Предмет дослідження: клінічний перебіг, патогенетичні механізми розвитку, морфологічні зміни, імунне запалення, ангіогенез, стрес-адаптивні гормони, ЯЖ та ефективність терапії.
Методи дослідження: клінічні (аналіз скарг, анамнезу життя та хвороби, об’єктивного статусу, оцінка індексу тяжкості); соціально-психологічні (анкетування для визначення DLQI); імуноферментні (дослідження рівня IL, EGF, VEGF, sVEGFR, HSP-70, кортизолу та інсуліну крові); біохімічні (дослідження метаболітів NO, NOS крові); патоморфологічні й імуногістохімічні; інструментальні (дерматотрихоскопія); статистичні (параметричні та непараметричні методи обробки даних).
Наукова новизна отриманих результатів. Уперше доведено, що ультраструктурні характеристики морфологічних та імуногістохімічних змін в осередку запалення ГА залежать від стадії патологічного процесу. Високий вміст лімфоцитів CD8+ за рахунок кооперації з Т‑хелперами CD4+, макрофагами формує опосередковану Т-клітинами цитотоксичну імунну відповідь, асоційовану з NК-клітинами, при збільшенні експресії прозапальних цитокінів в активну стадію хвороби. Розвиток фіброзу та склерозу, зниження інтенсивності імунозапальних процесів — характерні ознаки хронічного процесу при ГА.
Уперше визначено порушення стану HSP-70 та показано зміни цитокінового гомеостазу, що свідчить про процеси імунної дисфункції у хворих на ГА, ступінь вираженості яких корелює з активністю, тяжкістю та тривалістю захворювання. Уперше показано роль ІL-17 в імунопатогенезі ГА, тісний кореляційний взаємозв’язок із клініко-лабораторними параметрами (активністю та тривалістю захворювання, ІТГА, VEGF, iNOS, HSP-70).
Уперше виявлено у хворих на ГА дисбаланс маркерів ангіогенезу (sVEGFR1, VEGF та EGF, NО, його метаболітів, іNOS та сNOS), первинне значення з яких мають зрушення рівня VEGF, іNOS, що створює умови для розвитку ендотеліальної дисфункції, імунозапальних реакцій і свідчить про безпосереднє залучення їх у механізми формування ГА.
Доповнено дані щодо існування змін рівня кортизолу та інсуліну, коефіцієнта напруження адаптації, які характеризують різний ступінь тяжкості дії стресорного фактора – від напруження до виснаження адаптаційних механізмів організму з можливим зривом регуляторних процесів при ГА.
Уперше встановлено складні та тісні взаємозв’язки між досліджуваними імунологічними показниками, маркерами ангіогенезу та адаптаційно-регуляторними гормонами, особливостями клінічного перебігу, що вказує на дисбаланс інтегральних систем регуляції патогенетичних механізмів.
Уперше визначено предиктори розвитку ГА, серед яких переважне значення мають порушення рівня IL-17, VEGF, iNOS, HSP-70; прогностичні критерії тяжкого перебігу ГА, до яких належать: жіноча стать, наявність дистрофічних нігтьових пластинок (НП), атопія, автоімунні захворювання, втрата волосся на ділянках шкірного покриву при ураженні волосистої частини голови до 50 %, тривалість хвороби більше 1 року, вік хворого на початок захворювання до 17 років, відсутність жовтих точок при дерматотрихоскопії.
Науково обґрунтовано доцільність використання диференційованого підходу в терапії ГА з урахуванням виявлених патогенетичних порушень, ступеня тяжкості та активності патологічного процесу.
Практичне значення отриманих результатів. На підставі математичного підходу розроблено та запропоновано використання ІТГА, який дає можливість об’єктивно та комплексно оцінити втрату волосся на скальпі, інших ділянках шкіри, ураження НП, тест натягнення волосся та дерматотрихоскопічні маркери захворювання, що підвищує точність клінічних оцінок, дає змогу визначити терапевтичну тактику (патент України на корисну модель № 115991 від 10.05.2017). Виділено основні дерматотрихоскопічні маркери ГА у хворих залежно від стадії патологічного процесу.
Розроблено комплексний патогенетично обґрунтований алгоритм лікування хворих на ГА з диференційованим використанням глюкокортикостероїдів (ГКС) у різних дозах і способах введення, донатору аргініну тівортіну, препарату зі стрес-протекторною й адаптогенною діями даларгіну, а також місцевого 5 % розчину міноксидилу дали можливість підвищити ефективність лікування (патент України на корисну модель № 123446 від 26.02.2018). Доведено ефективність використання сульфасалазину як альтернативного варіанту лікування в пацієнтів з ГА, які стійкі до ГКС та інших терапевтичних методів.
Проведені наукові дослідження дали змогу визначити роль імунологічних, ангіогенних та адаптаційно-стресорних факторів у патогенезі ГА, рекомендувати використання їх характеристик для перебігу захворювання.
Основні положення дисертації впроваджено в лікувальну практику: КНП Харківської обласної ради «Обласний клінічний шкірно-венерологічний диспансер № 1», КНП «Міський шкірно-венерологічний диспансер № 1» Харківської міської ради, КНП «Міський шкірно-венерологічний диспансер № 4» Харківської міської ради, КП «Кременчуцький обласний шкірно-венерологічний диспансер Полтавської обласної ради», КП «Рівненський обласний шкірно-венерологічний диспансер» Рівненської обласної ради, КП «Обласний шкірно-венерологічний диспансер» Дніпропетровської обласної ради, також у навчальний процес кафедр: дерматовенерології Національної медичної академії післядипломної освіти імені П.Л. Шупика, дерматології, венерології Львівського національного медичного університету імені Данила Галицького, загальної та клінічної імунології та алергології Харківського національного університету імені В.Н. Каразіна.
Особистий внесок здобувача. Дисертантом самостійно проаналізовано за темою дисертаційної роботи наукову літературу, проведено патентно-інформаційний пошук, визначено мету та задачі дослідження. Проведено клінічне, дерматотрихоскопічне та лабораторне обстеження хворих. Самостійно проаналізовано та статистично оброблено отримані результати, написані всі розділи дисертації. Спільно з науковим консультантом визначено мету і завдання наукових досліджень, сформульовано висновки, підготовлено патенти.
Усі опубліковані наукові праці, в яких викладено основні положення та зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, у дисертації використано лише ті ідеї, положення та висновки, які є результатом особистої роботи здобувача та становлять його індивідуальний науковий внесок. Конфлікту інтересів немає.
Наукові положення і результати, які виносилися на захист у кандидатській дисертації, не виносяться на захист здобувачем наукового ступеня доктора медичних наук у його докторській дисертації
Апробація результатів дисертації. Матеріали дисертаційного дослідження доповідалися та обговорювалися на всеукраїнських та міжнародних науково-практичних медичних конференціях, з’їздах, форумах: 3-й Международный конгресс ЕААД (Одеса, Україна, 2–3 червня 2013), 8th World Congress for Hair Research (WCHR 2014) (Jeju, Korea, May 14–17 2014), 9th World Congress for Hair Research (Miami, Florida, USA, 18–21 November 2015), 17th Meeting of the EHRS (Georgia, June 24–26 2016), науково-практична конференція 11-ті Київські дерматологічні дні (Київ, Україна, 12–14 жовтня 2016), XVII Ежегодное заседание союза трихологов (Санкт-Петербург, 22–24 июня 2017), науково-практична конференція з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі» (Харків, 10–11 листопада 2017), First Congress UHRS (Київ, Україна, 23-24 листопада 2017), International theoretical practical seminar “Patient and Doctor Forum” National alopecia association (Vilnius, Lithuania, Apr 27 2018), науково-практична школа «Питання профілактики, сучасна діагностика та інноваційні методи терапії в дерматовенерології» (Харків, Україна, 15–16 листопада 2018), 18th meeting of the EHRS Congress (Bologna, Italy, 18–20 May 2018), науково-практична конференція 15-ті Київські дерматологічні дні (Київ, Україна, 3–4 жовтня 2019), Second Congress UHRS (Київ, Україна, 9–10 лютого 2019), 11 World Congress of Hair Research (Sitges, Barselona, Apr 24 — 27 2019).
Публікації. За матеріалами дисертації опубліковано 35 друкованих праць, у тому числі статей у спеціалізованих наукових виданнях, рекомендованих ДАК України — 12, у журналах, що входять до міжнародних наукометричних баз SCOPUS — 3, Google Scholar, РІНЦ та ін. — 7, у закордонних виданнях — 3, у збірниках наукових праць — 1, у матеріалах наукових форумів різного рівня, включаючи міжнародні — 12, отримано 2 патенти на корисну модель.
Структура та обсяг дисертації. Дисертація викладена українською мовою, загальним обсягом – 301 сторінка машинописного тексту. Дисертація складається зі вступу, огляду літератури, опису матеріалів і методів, шести розділів власних досліджень, аналізу та узагальнення результатів, висновків, рекомендацій, списку використаних джерел та двох додатків. Бібліографія містить 366 джерел, із яких 113 робіт – кирилицею і 253 – латиницею. Містить 43 таблиці та 50 рисунків.
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУРИ
ГА – хронічне запальне захворювання ВФ, має непередбачуваний характер, може зачіпати волосяну частину голови і/або волосся на інших ділянках, проявлятися як відокремлені осередки облисіння або масштабна стрімка повна втрата волосся. Незважаючи на те, що ГА вважається відносно доброякісним захворюванням, випадіння волосся призводить до глибоких змін у психоемоційному статусі, аж до тяжких невротичних розладів і формування патологічної особистості [11, 194, 262, 285, 325].
1.1 Клініко-епідеміологічні особливості, генетичні фактори розвитку гніздової алопеції
За даними епідеміологічних досліджень, проведених у різних країнах, на ГА страждає від 1,7 % до 5 % населення. Популяційна частота захворювання становить 1:1000–3300 [120, 211]. Старт ГА може бути в будь-якому віці, однак частіше хвороба маніфестує до 40 років. Більш високою є поширеність у віці від 10 до 25 років (60 %). Недавні дослідження показують, що 1–2 % осіб із ГА молодші 2 років і 21–24 % – у віці до 16 років. ГА рідко зустрічається у дорослих, що старші за 60 років [134].
Ризик захворюваності протягом життя становить 1,7 %. Поширеність ГА, як правило, збігається в обох статей і представників різних рас. Проте, жінки частіше звертаються до лікаря з проблемою ГА [120, 125, 137, 214, 361, 365].
Більшість хворих відзначають більше одного епізоду захворювання. Рецидив перебігає у вигляді локальних осередків облисіння невеликих розмірів або більш великих осередків облисіння – субтотальної, тотальної або універсальної. Тяжкі тотальна та універсальна форми можуть маніфестувати і при першому епізоді захворювання. Вважають, що позбавляються від захворювання в межах 1 року тільки 34–50 % хворих. Приблизно у 5–10 % пацієнтів із дрібноосередковою ГА розвивається повна втрата волосся на шкірі голови (тотальна форма), в 1–2 % випадків – повне випадіння волосся на голові і тулубі (універсальна форма). Вилікування універсальної форми ГА можливе менш ніж у 10 % випадків [17, 211].
Відомо, що одним з основних критеріїв вибору тактики терапії хворого на ГА є ступінь тяжкості дерматозу. Сьогодні дерматологи всього світу використовують велику кількість різних індексів і шкал для характеристики тяжкості стану дерматологічних хворих. Це дозволяє підвищити точність клінічних оцінок і проаналізувати ефективність терапії. Використання об’єктивної та уніфікованої шкали, як інструменту оцінки тяжкості та активності патологічного процесу при ГА є актуальним [128].
Більшість лікарів у нашій країні для оцінки ступеня тяжкості втрати волосся при ГА використовують класифікацію І.В. Шуцького [48], в якій виділяють 4 ступеня тяжкості: I ступінь – поодинокі осередки ураження діаметром 3–5 см; II ступінь – осередки ураження діаметром 5–10 см; III ступінь – cубтотальна алопеція; IV ступінь – тотальна алопеція й універсальна алопеція.
Аналіз клінічної картини ГА на сучасному етапі показує, що ураження волосистої частини голови часто поєднується з утратою волосся на інших ділянках шкірного покриву і не тільки при УА. Дистрофії НП – частий симптом, наявність якого розцінюється як прогностично несприятлива ознака перебігу ГА [128]. Існуюча класифікація оцінки ступеня тяжкості не враховує дані фактори.
У клініці ГА відзначають стадії, що послідовно змінюють одна одну. Прогресуюча, стаціонарна та регресуюча – така стадійність використовуються вітчизняними лікарями в діагностиці ГА [11, 48]. В іноземній літературі в перебігу ГА виділяють активну, хронічну стадії та стадію регреса. При цьому відзначається, що тривалість хвороби не завжди корелює з її активністю [125, 128, 158, 340].
Безліч гіпотез етіопатогенезу ГА, що включають у себе різноманітні вихідні фактори, починаючи від генетичних основ імунної системи до специфічності автоантигенів і шляхів експресії, розуміння ролі екзогенних тригерів, поки не дозволяють отримати вичерпні відповіді.
Інформація, що отримана в ході проведених раніше аналізів генів-кандидатів і епідеміологічних досліджень, дозволила спочатку припустити, що ГА є захворюванням, в яке залучені складні взаємодії між кількома генами [216, 222]. В якості зовнішніх тригерів для реалізації генетичної схильності ГА розглядають фактори навколишнього середовища, включаючи вплив прозапальних речовин і, можливо, інших модуляторів, серед яких нейрогенні, обмінні, ендокринні порушення, алергічні стани та інфекційні збудники мають найбільше значення [150, 175, 222, 262, 285]. Хвороба має характер полігенного успадкування. Цілком імовірно, що складні взаємодії між навколишнім середовищем і генами визначають початок захворювання і його прояви для кожного індивіда (тип облисіння і тяжкість захворювання) [132]. Однак, конкретні подразники, необхідні для прояву ГА, все ще належить встановити.
Частота обтяженого сімейного анамнезу щодо ГА становить близько 10–20 % порівняно з 1,7 % у контрольній групі. Великий інтерес викликають випадки алопеції у близнюків. Попередні епідеміологічні та генетичні дослідження у монозиготних близнюків виявили конкордантність на рівні 55 %. Подібним чином ГА розвивалася спонтанно або після пересадки шкіри не у всіх однопометних мишей лінії С3Н/HeJ, з чого можна зробити висновок, що прояву ГА можуть сприяти екологічні та епігенетичні фактори, наприклад, метилювання ДНК і мікроРНК (miRNAs) [361].
У ході мета-аналізу численних повногеномних досліджень асоціацій було виявлено міцну асоціацію локусу лейкоцитарного антигену людини (HLA) з ГА, що підтримує гіпотезу автоімунного походження. Встановлено асоціацію ГА з генами локусів DQ і DR. Визначено декілька важливих асоціацій (HLA-DQB1, HLA-DRB1, HLA-A, HLA-B, HLA-C, NOTCH4, MICA), пов’язаних з ГА; також були знайдені гени, що знаходяться за межами ділянок HLA (AIRE і PTPN22) [222, 224]. Доведено, що до виникнення ГА більшою мірою схильні особи, що мають локуси IL2RA і TNF/LTA [246], ген SPATA5 на четвертій хромосомі [218]. Певне значення в розвитку ГА відводять геномам SNPs, STX17, Cxcr3, Cxcl9, Cxcl10, CTLA4, PRDX5 і IKZF4 / ERBB3, а також TNFa-308G/A [159, 215, 270]. Lew et al. було проведено дослідження 238 пацієнтів з ГА, в яких виявлено поліморфізм генів IL-17A і IL-17RA (IL-17A рецептора) [146]. Ці результати свідчать про те, що патологічна презентація антигену і регулювання автоімунітету можуть мати важливе значення для ініціювання ГА.
Визначено додаткові локуси, в яких знаходяться гени шляху активації апоптозу, регуляторних Т-клітин (Treg) і JAK-STAT сигналізації, деякі з цих генів залучені до розвитку інших автоімунних захворювань [129, 235]. Останні дослідження виявили надекспресію ULBP3 (цитомегаловірус-зв’язуючий протеїн) на 6 хромосомі (6q25) при ГА, що кодує активацію ліганд NK-клітинного рецептора NKG2D природних кілерів та ініціює автоімунну відповідь. ULBP3-кодовані білки у великих кількостях містяться в пошкоджених ВФ. Білки залучають NK-клітини, що містять рецептори NKG2D. При цьому в різних органах існує загальний механізм, який відповідає за експресію сигнальних білків для рецепторів NKG2D, що запускає процес знищення клітини. Ці гени відповідають за розвиток інших автоімунних захворювань, таких як ревматоїдний артрит і діабет 1 типу. Дані відкриття розглядаються як перспективні об’єкти у вивченні терапії і при ГА [217, 277].
Недавні повногеномнs дослідження асоціацій також ідентифікували IL-13 і KIAA0350/CLEC16A, які демонструють сприйнятливість локусів для ГА та інших автоімунних захворювань, які передбачають загальні автоімунні механізми розвитку [210].
Недавнє епідеміологічне дослідження, в якому порівнювали супутні захворювання ГА зі здоровою контрольною групою, показало значно вищу поширеність алергічного риніту (14,3 %), захворювання щитовидної залози (7,2 %) та атопічного дерматиту (5,0 %) у хворих на ГА. Відносно низька поширеність псоріазу (1,9 %) і вітиліго (0,3 %) була виявлена у пацієнтів з ГА, але, тим не менш, вона була значно вищою, ніж у контрольній групі [150]. В іншому епідеміологічному дослідженні автори використовували хворих на псоріаз в якості групи контролю, оскільки псоріаз також є опосередкованим Т-клітинами автоімунним захворюванням; були визначені профілі коморбідності. У цьому дослідженні серед пацієнтів з ГА значно більше поширеною була атопія (38,2 %) порівняно з хворими на псоріаз; інші захворювання, такі як дерматит (35,9 %), гіперліпідемія (24,5 %), артеріальна гіпертензія (21,9 %), анемія (19,6 %), захворювання щитоподібної залози (14,6 %) і цукровий діабет (11,1 %) також були вищими, ніж серед населення в цілому [150, 171, 175]. Потенційним взаємозв’язком між ГА і вищезгаданими супутніми захворюваннями є той факт, що розвиток одного або декількох з цих захворювань може використовувати аналогічні локуси високого ризику, популяції клітин імунної системи або профілі цитокінів, залучені в одну форму автоімунної хвороби, можуть сприяти розвитку інших автоімунних захворювань.
Алелі гена, що визначає більш високі рівні імунологічного нагляду або підвищені рівні костимуляціі, взаємопов’язані з презентацією антигену лімфоцитів, можуть посилити сприйнятливість до розвитку аберантних імунних відповідей, що призводить до захворювання. Можливо, що наявність інших автоімунних і атопічних захворювань може бути причинним фактором, що призводить до дестабілізації імунної системи та ініціювання каскаду подій, що обумовлює запуск ГА [13, 150, 361].
1.2 Імунопатогенез гніздової алопеції
Передбачається, що важлива роль у розвитку і прогресуванні даного захворювання відводиться цитокіновому каскаду і лімфоцитарній ланці імунної системи, що призводить до формування неспецифічного автоімунного запалення [25, 30, 36, 49, 141, 150, 159, 172].
Автоімунний сценарій розвитку ГА в даний час є кращим поясненням отриманих у ході клінічних досліджень даних [216, 270, 304, 347]. У периферичній крові у деяких хворих на ГА виявляли антитіла до тиреоглобуліну, обкладочних клітин, клітин наднирників, клітин щитовидної залози, антиядерні антитіла і ревматоїдний фактор. Ці результати дали привід для припущень про зв’язок ГА з автоімунними процесами, але перші більш конкретні вказівки на можливість автоімунних механізмів захворювання отримані з появою фактів про автоантитіла безпосередньо до ВФ [150, 171, 175, 188]. У периферичній крові хворих на ГА підвищено вміст специфічних IgG антитіл ВФ, ці антитіла присутні по периферії ВФ, особливо біля кордону активного ураження. Як автоантигени найчастіше розглядають меланоцит- і/або анаген-асоційований автоантиген ВФ. Кандидатами на роль автоантигенів називають фолікуло-специфічні протеїни волосся – такі, як специфічний для волосся кератин 44/46 кДа і трихогіалін [350]. Проте, специфічність мішеней автоантитіл ВФ може істотно варіюватися в осіб з ГА. Крім того, дослідження, що використовують ін’єкції автоантитіл у різних моделях, не показали, що автоантитіла чинили істотний патогенний вплив. Це говорить про те, що механізм ГА швидше за все є клітинним, а не антитіло-опосередкованим. Проте, наявність специфічних для ВФ автоантитіл свідчить про активність автоімунного механізму, і такі антитіла можуть надавати інформацію про антигенні мішені для Т-клітин [245, 361].
Асоціація ГА з іншими автоімунними хворобами підтримує припущення про автоімунний характер захворювання [29, 56, 222, 223]. Генетична мутація при синдромі автоімунної поліендокринопатії 1 типу виявляє зв’язок з ГА від 29 % до 37 %. Є дані про високу зустрічальність ГA при APEGED-синдромі (автоімунний кандидозний поліендокринопатичний ектодермально-диспластичний синдром). Синдром являє рецесивний стан, обумовлений мутацією гена автоімунної регуляції на хромосомі 21q22.3. Результати цього дослідження в поєднанні з високою частотою виявлення ГА у пацієнтів з синдромом Дауна побічно підтверджують, що гени-кандидати, які визначають сприйнятливість до ГА, можуть бути присутніми на 21 людській хромосомі [306].
На частку автоімунного тиреоїдиту припадає від 8 % до 28 % таких випадків, при цьому наявність тиреоїдних автоантитіл клінічно не корелює зі ступенем тяжкості ГА. Ко-експресія ГА і вітиліго становить 4–9 % [175]. Такі захворювання, як хвороба Аддісона, перніціозна анемія, псоріаз, червоний вовчак, целіакія, неспецифічний виразковий коліт, розсіяний склероз, частіше супроводжують тотальну і універсальну форми ГА [171].
Останні дослідження з використанням руксолітинібу показало, що застосування інгібітора JAK як засоб для лікування мієлофіброзу і ревматоїдного артриту дало позитивний ефект при ГА [129]. Той факт, що інгібітори JAK пригнічують цитокіни, що мають відношення до багатьох автоімунних захворювань, підтверджує теорію про те, що ГА могла б мати аналогічні механізми для деяких інших автоімунних захворювань.
Цитокіни в даний час можуть розглядатися як медіаторна ланка у формуванні патофізіологічної стадії автоімунних реакцій при ГА, порушуючи механізми підтримки стану ІТ структур ВФ [221, 337]. У патогенезі захворювання провідне місце відводиться активації T-лімфоцитів за Th-1 типом з подальшим синтезом прозапальних цитокінів – IL-2, IL-15, IFN-γ, TNF-α та ін. У нормальних умовах їх надпродукції перешкоджають цитокіни, які продукують Th-2 типу, здебільшого IL-10. У своїй інгібуючій дії на клітинний імунітет IL-10 синергічний з IL-4 [70, 132, 335]. У той же час в останні роки було поставлено під сумнів провідну патогенетичну роль Th-1 клітин в обраній моделі автоімунних захворювань і створено передумови для пошуку альтернативних механізмів автоагресивних імунних реакцій. Крім того, системна терапія антагоністами TNF-α, яка використовуються для лікування інших автоімунних захворювань, може спричинити або погіршити перебіг ГА, припускаючи, що важливими патогенетичними факторами можуть також бути й інші механізми. Імовірним кандидатом на роль ключової ланки прозапальної відповіді, на додаток до Th-1 субпопуляції Т-лімфоцитів, може бути система Th-17 [208, 223].
Встановлено, що Th-17 відіграють фундаментальну роль в імунопатогенезі широкого спектра автоімунних захворювань: ревматоїдний артрит, системний червоний вовчак, розсіяний склероз, псоріаз, реакції відторгнення трансплантату [16, 33, 42, 148, 156].
Відомо, що IL-17 індукує експресію Т-клітин і дендритних клітин, що призводить до міграції їх у ділянку запалення [213]. Активація ІЛ-17 може збільшити синтез прозапальних цитокінів, таких як TNF-β, IL-6 та IFN-γ [152].
Tanemura A. et al. виявили інфільтрацію клітин CD1 (+) IL-17A (+) Th-17 у дермі, особливо навколо ВФ, у всіх 4 випадках ГА в їх дослідженні [135]. Atwa M.A. et al. досліджували рівні IL-17, IL-21, IL-22, IL-6 і TNF-α в сироватці пацієнтів з ГА. Усі ці цитокіни були значно вищими в групі з ГА, ніж у контрольній групі [149]. Поки немає чітких даних про зв’язок між рівнем IL-17, тяжкістю та тривалістю ГА. Деякі результати свідчать про кореляцію ІЛ-17 з раннім початком захворювання. Однак для визначення точної ролі ІЛ-17 у патогенезі ГА необхідні подальші дослідження [240, 273].
Аналіз даних, отриманих останнім часом, показав, що позаклітинний HSP-70 має множинні функції, найважливіша з яких імуномодуляторна [23, 70, 113]. У процесі імунної відповіді цитокіни індукують експресію HSP-70, яким відводиться важлива роль у розпізнаванні антигенів і внутрішньоклітинній адгезії [31]. У нормі HSP-70 міститься переважно всередині клітини, завдяки чому до них не розвивається імунологічна толерантність. Саме ця властивість є причиною участі HSP-70 у патогенезі автоімунних захворювань. Будь-яке, в тому числі автоімунне пошкодження тканин призводить до викиду HSP-70 у позаклітинний простір, що стимулює макрофаги і дендритні клітини, в результаті чого посилюється синтез адгезивних молекул, прозапальних цитокінів [26, 147, 243]. У ході вивчення наукової літератури було знайдено лише поодинокі зарубіжні роботи останніх років з вивчення позаклітинного HSP-70 при ГА [286].
ВФ до теперішнього часу залишається «загадкою» для багатьох дослідників фізіології та морфології волосся. Це пов’язано, перш за все, з циклічністю росту і дією «біологічного годинника», що визначають тривалість життя волосся. Воно переходить від стрімкого зростання, пігментації і формування волосяного стрижня (анаген, фаза активного зростання, яка поділяється на стадії від I до VI) до короткої фази, коли запускаються апоптотичн процеси та відбувається інволюція органу (катаген). Після катагену і до повторного переходу в анаген ВФ вступає в період відносного спокою (телоген). Під час фази контрольованого випадіння волосся (екзоген) здорових фолікулів старий волосяний стрижень, як правило, випадає з ВФ після початку нового циклу зростання [222, 228]. Таким чином, зберігається загальна кількість волосяного покриву. Циклічність цих фаз чітко координується експресією гормонів, цитокінів, факторів росту, їх рецепторів і ретельно регулюється ендокринними, паракринними і автокринними шляхами. Порушення цих точно налаштованих шляхів може призвести до розвитку захворювань волосся [229, 337].
ГА характеризується порушенням циклу росту ВФ: запальні клітини (CD8+ Т-клітини, гладкі клітини, натуральні кілери та ін.) атакують тільки анагенові ВФ, які потім передчасно переходять у фазу катагену [222, 361]. У ході розвитку ГА до відновлення анагену часто настає екзоген або в разі дистрофічного анагену спостерігається стан, що називається кеноген, під час якого у ВФ не залишається видиміх волокон волосся [229, 269]. По суті, уражені ГА ділянки шкіри знаходяться в стані кеногену. Через спричинену запаленням дистрофію фолікула волосяний стрижень втрачає здатність міцно закріплюватися у волосяному каналі і швидко випадає, проте ВФ зберігає свою здатність до регенерації і циклічності функціонування, так як при ГА – на відміну від рубцевої алопеції – стовбурові клітини фолікула, як правило, не пошкоджені [230]. Таким чином, випадіння волосся при цьому захворюванні є оборотно. Як і більшість інших аутоімунних хвороб, ГА є хронічним рецидивуючим запальним захворюванням, що передбачає повторюваний характер провокуючих хворобу подій. При цьому, за відсутності перифолікулярного інфільтрату, волосся не випадає [223, 242].
Як у тваринних моделей ГА, так і людей, фолікулярне запалення здебільшого складають CD4+ і CD8+ Т-клітини, при цьому спостерігається їх чіткі розбіжності в розташуванні. За даними імуногістохімічного аналізу, активовані CD8+ Т-клітини можуть проникати у ВФ, в той час як CD4+ Т-клітини майже виключно розташовані в перифолікулярній ділянці [304]. Унаслідок цитотоксичності більшості CD8+ Т-клітин їх присутність у ВФ може легко порушити зростання волосся. Активовані цитотоксичні Т-лімфоцити при ГА TNF-α, Fas-ліганд та ін. Потенційно, ці молекули можуть запускати апоптоз у клітинах ураженого ГА ВФі в цілому порушити його нормальне функціонування [71, 163, 254]. У моделях ГА у гризунів виснаження CD8+ Т-клітин може блокувати розвиток захворювання. У щурячої моделі зниження рівня CD8+ Т-клітин призводить до кращої реакції росту волосся порівняно з виснаженням CD4+ Т-клітин, а збільшення цих клітин призводить до стрімкого відновлення ГА [304]. Підшкірні ін’єкції активованих CD8+ Т-клітин стимулюють різке локалізоване випадіння волосся виключно в місці ін’єкції, в той час як ін’єкції CD4+ Т-клітин не призводять до місцевої втрати волосся, але, врешті-решт, сприяють системному випадінню волосся за межами безпосередньої ділянки ін’єкцій [347]. Ці дослідження показують, що клітини CD8+ провокують руйнування ВФ і облисіння, в той час як клітини CD4+, імовірно, сприяють розвитку ГА, відіграючи свою класичну роль «помічника».
У гострій фазі ГА, коли CD8+ і CD4+ Т-лімфоцити проникають у перибульбарну ділянку, щільність клітин є показником активного прогресування захворювання [221, 249]. Сумарний вплив первинного інфільтрату запальних клітин може і не призвести до зміни циклу росту волосся, але негативно позначиться на функціонуванні ВФ і призведе до стану «дистрофічного анагену». Незважаючи на збереження фази анагену, інфільтрація запальних клітин, мабуть, порушує здатність ВФ виробляти волосяне волокно адекватного розміру або цілісності. Фаза екзогену може відбуватися зазвичай як етап загального циклу зростання волосся, але через анагенову дистрофію випавше волосся замінюється волокном, яке не забезпечує підтримання рівноцінного волосяного покриву [54, 224].
Збільшення кількості запальних клітин навколо ВФ може призводити до їх мініатюризації та скорочення циклу роста волосся: швидкі фази анагену і телогену (так звані «наногенові» ВФ). У міру розвитку захворювання поступово до 50 % від загальної кількості ВФ можуть перебувати в наногені. Кількість катагенових / телогенових фолікулів з часом зростає. Слід зазначити, що чим більша кількість ВФ переходить у фазу телогену, тим меншим є обсяг запалення в шкірі [132, 195].
У хронічну стадію ГА найбільш постраждалі ВФ вимушено переходять у тривалий телоген, при цьому не спостерігається будь-яких спроб переходу в анаген або рост нового волосся [132, 224]. На цьому етапі запалення, як правило, буде зосереджено в сосочковому шарі дерми навколо мініатюризованих ВФ. Виходячи з цього, ГА є запальним захворюванням, при якому ураження ВФ тісно взаємопов’язані зі змінами пери- та інтрафолікулярного запального інфільтрату [122, 125].
Визначальною імунологічною особливістю ВФ є створення ним середовища відносного імунного привілею (ІП), яке, як правило, робить малоймовірною автоімунну атаку на внутрішньофолікулярно експресовані автоантигени [221, 242].
ІП – термін, що позначає статус деяких частин тіла, в яких поява антигену не призводить до запальної імунної відповіді. У нормі тканинні трансплантати відторгаються, тому що стають об’єктом атаки з боку імунної системи. Але, в імунопривілейованих органах і тканинах реакція відторгнення трансплантата не відбувається протягом тривалого часу [76, 242]. Найбільш відомими імунопривілейованими органами є: мозок, очі, ембріон і плацента. З точки зору еволюції, ці органи мають життєве значення для тривалості існування, а імуноопосередковане запалення в будь-якому з цих органів може призвести до згубних наслідків.
Висловлене припущення, що нормальні ВФ представляють собою ділянку ІП, свідчить про можливу еволюційну зміну ролі волосся з плином часу. Експеримент Біллінгема на мишах (Біллінгем (Billingham) і Сильверс (Silvers) (1971) надав першу інформацію про імунний захист ВФ на моделі шкірних трансплантатів чорних морських свинок, пересаджених на білу шкіру несумісної лінії реципієнтів. Донорські меланоцити мігрували і протягом тривалого часу існували у фолікулах волосся господаря, на відміну від меланоцитів у епідермальній зоні [242, 361].
Процес ІП забезпечується: блокуванням поширення лімфатичних судин, обмежуючи, тим самим, їх доступність для елементів імунної системи; низьким рівнем експресії головного комплексу гістосумісності (MHC) I класу, необхідного Т-клітинам для презентації автоантигенів CD8+-Т-лімфоцитів; малою кількістю клітин Лангерганса або інших антигенпрезентуючих клітин; пригніченням активації NK-клітин; локальною продукцією цитокінів, що спричиняють імуносупресію, наприклад, TGF-β; присутністю нейропептидів; конститутивною експресією ліганда Fas, що контролює експресуючі рецептор Fas лімфоїдні клітини [208, 221, 222].
За аналогією, нормальні ВФ не експресують MHC класу I і II, навколо і всередині ВФ тільки незначна кількість клітин Лангерганса. Дезактивація MHC I класу може знижувати ризик того, що асоційовані з фолікулом автоантигени будуть презентовані CD8+ Т-клітинам [210, 218]. Однак така дезактивація експресії молекул MHC I класу тягне за собою ризик атаки на ВФ з боку NK-клітин, бо вони запрограмовані розпізнавати і усувати MHC-I-негативні клітини [234]. Щоб скоротити такий ризик, здорові ВФ дезактивують експресію лігандів, що стимулюють активацію NK-клітинних рецепторів NKG2D і секретують цитокіни та фактори росту, які пригнічують NK-клітини і мають імуносупресивні ефекти – α-МСГ, TGF-β, IGF-1, індоламін 2, 3-діоксигеназа (IDO), IL-10, IK-цитокін, який був виділений як фактор, що пригнічує IFN-γ-індуковану експресію антигенів МНС класу II [186, 222]. Ito T. і співавт. продемонстрували сильну експресію потужного міграцію інгібуючого фактора NK-клітин, який запобігає накопиченню NK-клітин навколо і всередині ВФ. У сукупності ці дані підтверджують участь ІП у зростанні волосся [228].
Існує припущення, що відмова ІП є стимулом до початку ГA. Генетична схильність, тригерні фактори можуть призвести до дезактивації імунопригнічуючих цитокінів [242]. Виявлено також значне зменшення рівня двох імунопригнічуючих агентів, які не були виявлені раніше при ГА: інгібітор проліферації лімфоцитів – IDO і Red/IK. Важливим є те, що на порушення імунопригнічуючого середовища ще до появи масштабної клітинної інфільтрації в перифолікулярних ділянках в осередках пошкодження, може вказувати масштабна дезактивація імунопригнічуючих компонентів, таких як IK і IDO і не тільки на пошкоджених, а й на навколоосередкових незачеплених ділянках. Недавні дослідження показали, що підвищення активності IDO відіграє важливу роль в активації імунологічної толерантності в багатьох Th-1-опосередкованих автоімунних захворювань [221].
Повногеномні аналізи асоціацій показують, що на певному етапі розвитку ГА активність можуть проявляти й інші прозапальні фактори і ліганди, що стимулюють NK-клітини та індукують відмову ІП. Хоча далеко не всі NК-клітини спостерігаються навколо здорових анагенових ВФ, фолікули в осередках пошкодження при ГА демонструють видимі скупчення CD56+ і NKG2D [217, 242, 328]. Крім того, ВФ при ГА надекспресують MICA-білок (MHC клас I-поліпептид-родинна послідовність А), який є ключовим NKG2D агоністом, тоді як експресія MICA у здорових фолікулах набагато менша [215]. Висновок про те, що надмірна NKG2D-опосередкована сигналізація може брати участь у патогенезі ГА, підкреслюється генетичним зв’язком між захворюванням і NKG2D-активуючими лігандами сімейства MICA, а саме – ULBP3. Фактично при ГА експресія ULBP3 білка активується навколо ВФ осередку ушкодження. В даний час існує припущення, що характерна інфільтрація Т-клітин у ділянці ВФ у вигляді «бджолиного рою» є результатом активації ліганд NK-клітинного рецептора NKG2D [217].
Імовірно нейропептиди, такі як кальцитонін ген-зв’язуючий білок (CGRP) і субстанція P (SP), також можуть мати провокуючу здатність до порушення ІП [224, 287]. Повідомлялося, що CGRP надає імунопригнічуючу дію при ГА; відсутність CGRP призводить до вазоконстрикції і гіперреактивності, включаючи автоімунні реакції. В осередках ГА у великих кількостях присутній SP, що спричиняє дегрануляцію тучних клітин і призводить до виділення великої кількості TNF-α, відомого як інгібітор росту волосся. Крім того, SP призводить до накопичення CD8+ клітин і стимулює вироблення великої кількості IFN-γ, який стимулює експресію молекул МНС класу I у нижній частині фолікулярного епітелію, в результаті чого відбувається представлення фолікулярних автоантигенів CD8+ клітин і втрати ІП. IFN-γ також може провокувати експресію молекул МНС класу II фолікулярним епітелієм, що призводить до другого напливу CD4+ клітин, які можуть допомагати діяльності CD8+ завдяки синтезу прозапальних цитокінів [186, 220, 252].
У прогресуючій стадії захворювання в периваскулярній і перибульбарній зонах ураженої ГА шкіри зафіксовано більш високу експресію молекул адгезії (ICAM-2 і ELAM-1), які зв’язують лейкоцити з ендотеліальними клітинами і беруть участь у переміщенні лейкоцитів у дерму [210]. У той же час рівень ліганд Fas, молекули, яка, як відомо, індукує апоптоз активованих Т-клітин і нейтрофілів, значно зменшений в осередку ушкодження ГА. Добре відомо, що Fas відіграє важливу роль в активації ІП очей, мозку і плода [221, 344].
Таким чином, дані факти були прийняті як доказ підтримки гіпотези відмови ІП при ГА, що призводить до подальшої атаки активованих лімфоцитів проти ВФ [132, 222, 361].
Як правило, лімфоцит-опосередковане запалення запускається тільки після активної презентації антигенного епітопу за сприяння кількох костимуляторних лігандів на антигенпрезентуючих клітинах [75, 245, 304]. Інфільтрація імунних клітин при ГА може бути пов’язана з неадекватною презентацією антигенних пептидів, отриманих з ВФ. Катагенова регресія ВФ призводить до масштабного апоптозу і тканинної перебудови, при якій імунні клітини зазвичай просочуються навколо ВФ [163]. У ході цього процесу імунна система може постійно бути під впливом антигенів. Автоімунні реакції не є безкомпромісною подією. Це прогресивна шкала відповідей з пороговим рівнем, вище за який спостерігається явне автоімунне захворювання [223, 254, 344].
1.3 Роль ростових факторів та інших медіаторів ангіогенезу в механізмах розвитку гніздової алопеції
У регулюванні циклу ВФ беруть участь різні медіатори; вони можуть виступати в якості промоторів або інгібіторів росту волосся. Одним з основних медіаторів росту і циклічного функціонування ВФ є фактор росту судинного ендотелію (VEGF), який здатний секретуватися різними клітинами, включаючи кератиноцити і фібробласти [25, 229, 337].
In vivo VEGF збільшує мікросудинну проникність і ангіогенез, сприяє взаємній адгезії кератиноцитів волосся, підвищує міцність, товщину і щільність волосся. У дермальних сосочках ВФ VEGF стимулює проліферацію клітин матриксу та ендотеліоцитів судинної мережі, формування речовини позаклітинного матриксу, підтримуючи, таким чином, фолікули у стані анагену [363]. На ранньому етапі анагену відбувається відновлення васкуляризації в сосочку волоса, що супроводжується посиленням експресії VEGF; разом з тим вступ зрілого ВФ у фазу катагену супроводжується зменшенням васкуляризації сосочка. При ГА змінюється архітектоніка перифолікулярних судин, а також порушується мікроциркуляція в сосочку ВФ в результаті їх спазму [30, 102]. Показано важливу роль ангіогенезу при ГА, порушення експресії VEGF в людських ВФ після контактної імунотерапії дифенципроном сприяло збереженню життєздатності ендотеліальних клітин і відновленню росту волосся [205].
VEGF – «професійний» ангіогенний фактор. що має виражену імуномодулюючу дію. Клітини імунної системи є одночасно і регуляторами ангіогенезу, і мішенями дії VEGF, оскільки вони володіють специфічними рецепторами для взаємодії з цим фактором. VEGF має здатність регулювати синтез цитокінів, зсуваючи баланс у бік Th-1 [46, 104, 301]. Додавання VEGF до щурячих Т-лімфоцитів, які стимульовані мітогеном або антигеном, спричинило підвищення продукції INF-γ і зниження продукції IL-10. На думку дослідників, VEGF здатний підсилювати розвиток автоімунного захворювання. З імуномодулюючих ефектів VEGF слід зазначити його здатність впливати на проліферацію ІЛ-2 залежних Т-лімфоцитів периферичної крові [108, 358].
Функція VEGF опосередковується взаємодією з трьома типами клітинних рецепторів – VEGFR1, VEGFR2 і VEGFR3. Для реалізації ефектів VEGF необхідна його взаємодія з VEGFR2, що призводить до фосфорилювання останнього і запуску каскаду внутрішньоклітинних реакцій. VEGFR3 бере участь у лімфогенезі. Великий інтерес дослідників привертає вивчення продукції розчинних форм рецепторів VEGF, і зокрема sVEGF-R1, який є інгібітором трансдукції VEGF опосередкованого сигналу, перешкоджаючи взаємодії останнього з VEGFR2 і обмежуючи секрецію VEGF у різних клітинах [103, 108, 166].
Синтез VEGF стимулюється безліччю проангіогенних факторів, включаючи EGF [27, 33, 118, 166]. EGF є одним із лігандів рецептору епідермального фактора росту (EGFR), експресованого на поверхні як нормальних, так і трансформованих епітеліальних клітин, і є вирішальним трансмембраним тирозин-кіназним рецептором у регуляції клітинного росту і диференціювання. Біологічна дія EGF здійснюється при його взаємодії з іншими факторами росту, які мають ангіогенні властивості, що забезпечує морфогенез судини, хемотаксис клітин ендотелію, посилення проліферації клітин ендотелію капілярів, експресію в них генів колагенази і гену фібронектину [182, 184, 267]. EGF активно бере участь у функціонуванні ВФ. В експерименті продемонстровано, що його ін’єкції призводять до уповільнення росту, випадіння волосся і потовщення епідермісу. Виявлено роль EGFR як посередника припинення анагену. Зниження рівня EGFR стимулювало утворення ВФ [284]. Механізм ефективного використання антраліну у хворих на ГА деякі дослідники пов’язують з його здатністю пригнічувати EGFR сигналізацію [226]. Bark-Lynn L. та співавт. у своєму дослідженні показали асоціацію між геном EGF, його рецептором EGFR і ГА [154].
В останні роки помітно зріс інтерес до проблеми патофізіологічної ролі NO при цілій низці патологічних станів [35, 55]. Завдяки використанню методів молекулярної біології, численні дослідження останніх років з переконливістю показали унікальні властивості NO в реалізації більшості найважливіших клітинних процесів організму у відповідь на вплив різних чинників. Метаболіти NO, будучи універсальними вторинними клітинними мессенджерами і опосередковуючи фундаментальні функції з міжклітинної комунікації, клітинного подиху, нейротрансмісії, імунологічного захисту, вазодилатації, беруть участь у захисних і ушкоджуючих реакціях організму при цілій низці патологічних станів, забезпечують функціонування ВФ [40].
Ендотелій судин розглядається як багатофункціональний орган, як важлива система регуляції тонусу судин, згортання крові, і, що особливо важливо, імунологічної резистентності організму. Серед численних властивостей ендотелію синтез NO є однією з провідних функцій [53, 366]. Аномальні ендотеліоцити капілярної мережі, поряд з клітинами власного сосочка, кератиноцитами матриксу і коркового речовини кореня волоса, меланоцитами волосяної цибулини також є ключовими клітинами-мішенями для розвитку ГА [120].
Утворення NО в організмі людини здійснюється в результаті окиснення атома азоту, що входить до складу амінокислоти L-аргініну, під дією трьох ізоферментів – NOS. NOS експресуються або генетично, конститутивно (сNOS – конститутивна: nNOS – нейрональна і eNOS – ендотеліальна), або після стимуляції цитокінами (iNOS – індуцибельна). nNOS і eNOS, регульовані іонами Са2+, залучені до фізіологічного контролю нейрональної і судинної функції відповідно [112]. eNOS є Са2+-залежною і синтезує NО в невеликих кількостях протягом декількох секунд після надходження будь-якого стимулу, що спричиняє підвищення концентрації внутрішньоклітинного Са2+. iNOS є Са2+-незалежним ізоферментом. Під впливом прозапальних цитокінів, серед яких найбільш вивчені IFN-γ, TNF-α, IL-6, IL-1β і TGF-β, запускається генна транскрипція iNOS і починається синтез NО [26].
Показано, що NO вносить свій внесок у патогенез ГА. Вивчалися докази асоціації поліморфізму гену eNOS з ГА. Геномну ДНК витягували у 176 суб’єктів, 87 пацієнтів з ГА і 89 здорових осіб з групи контролю. Генотип (4b / 4b) показав значний зв’язок із сприйнятливістю до ГА і мав частоту на 22 % вищу у пацієнтів, ніж у контролі (71 % проти 49 %) (c2 = 6,39, p = 0,011, OR = 2,63). Автори роблять висновок про значущу асоціацію поліморфізму в гені eNOS і сприйнятливість до ГА [331]. Передбачається, що NO може індукувати перехід від Th-1- до Th-2-лімфоцитів у імунній відповіді, а препарати донатори NO можуть бути корисні при лікуванні ГА [275].
Ендотелій судин розглядається як багатофункціональний орган, як важлива система регуляції тонусу судин, згортання крові, і, що особливо важливо, імунологічної резистентності організму. Серед численних властивостей ендотелію синтез NO є однією з провідних функцій [53, 366]. Аномальні ендотеліоцити капілярної мережі, поряд з клітинами власного сосочка, кератиноцитами матриксу і коркового речовини кореня волоса, меланоцитами волосяної цибулини також є ключовими клітинами-мішенями для розвитку ГА [120].
1.4 Стан адаптаційних механізмів при гніздовій алопеції
Стійкий характер імунних порушень, зв’язок розвитку і рецидивів дерматозу з психотравмуючими факторами опосередковано вказують на неповноцінність адаптаційного потенціалу організму хворих [288].
У теперішній час дедалі більше уваги приділяється стрес-системам організму при автоімунних захворюваннях [73]. Гормони стресу здатні змінювати баланс Th-1/Th-2-цитокінів та впливати на дебют і перебіг автоімунного процесу. За своєю біологічною природою стрес має адаптаційну спрямованість, при цьому основне навантаження припадає на ГГНС [20, 61]. Інсулін займає ключові позиції в розвитку загального адаптаційного синдрому, так як в організмі через нього реалізуються численні контрефекти по відношенню до регуляторного впливу глюкокортикоїдів [43, 68].
Існують ряд даних, що демонструють нейрогуморальні зміни при ГА. У недавньому дослідженні на мишачій моделі було встановлено, що ГА пов’язана зі зміною роботи ГГНС. Після активації ГА у постраждалих мишей зафіксовано істотне підвищення активності тонусу центральних і периферичних ланок ГГНС порівняно з групою контролю [190]. Виявлено також високу активність рецептора кортикотропін-рилізинг-гормону в осередках ГА, здатного запускати диференціювання опасистих клітин з мезенхіми ВФ [177].
Показано, що з розвитком ГА відбуваються зміни в експресії SР. Введення SP в шкіру мишей з ГА призводить до дегрануляції опасистих клітин, прискорює катагенову регресію ВФ, а також збільшує кількість з’єднань, що експресують CD8+ Т-клітини [248, 329].
«Спотворюючий ефект» тяжких форм ГА розглядається як фактор, що провокує цілий спектр «вторинних» психічних розладів. Крім того, пацієнти з тяжкими формами ГА більш схильні до стресу, отже, вони менш ефективно справляються з тяжкими життєвими ситуаціями, ніж здорові особи.
23 % дітей різного віку відчували різні види булінгу (агресивне переслідування (фізичний вплив, вербальний, загрози тощо) більше одного разу, 8 % – 2-3 рази на тиждень. 18 % – були побиті хоча б один раз. Дослідження показало важливість психологічного впливу на дітей ГА і необхідність обговорювати емоційні та соціальні наслідки цієї хвороби у дітей навіть раннього віку, а також членів їх сімей. Часто самі діти турбувалися про вплив їх хвороби на свої сім’ї [170].
Sinclair R. повідомив про взаємозв’язок наявності ГА і суїцидальних спроб у підлітків, що яскраво свідчить про недооціненість важливості психосоціального аспекту при наявності втрати волосся [123, 324].
Актуальним є оцінка ЯЖ при хронічних дерматозах як інтегрального показника, що описує найбільш важливі функції людини і дозволяє дати їх глибокий багатоплановий аналіз при розвитку хвороби та їх відновлення на тлі лікування. Оцінка ЯЖ широко використовується для характеристики тяжкості патологічного процесу, його динаміки та ефективності лікувальних заходів [56, 63, 69, 264].
Таким чином, імунна система є основною рушійною силою патологічного процесу при ГА. Проте питання «які початкові події призводять до розвитку ГA?» досі залишається основним і не вирішеним. У даний час гіпотези розвитку ГА здебільшого зосереджені на відмові ІП ВФ і презентації власних автоантигенів, що призводить до активізації та подальшої атаки Т-лімфоцитів.
Проводяться дослідження з ідентифікації автоантигенів, пов’язаних з розвитком ГА, але точний характер провокуючих захворювання антигенних епітопів або епітопу ще належить з’ясувати.
Патогенетична роль ангіогенезу в розвитку ГА свідчить про необхідність подальшого більш глибокого вивчення цього процесу, а також факторів, здатних впливати на регуляцію росту судин, взаємозв’язок імунного запалення і ступінь ендотеліальних порушень у хворих з різними формами і ступенем тяжкості дерматозу. Важлива оцінка ролі стресу, дезадаптаційних порушень у хворих на ГА. Виявлення ключових сигнальних факторів, залучених у процеси «включення» і «виключення» життєвого циклу волоса при ГА, сприятиме не тільки розумінню потенційних механізмів захворювання, можливого відновлення ІП ВФ.
1.5 Сучасні підходи до діагностики та лікування гніздової алопеції
У діагностиці захворювань волосся і шкіри волосистої частини голови в даний час дерматоскопія посідає міцні позиції як неінвазивний і ефективний метод. Для проведення трихоскопії необхідне спеціальне обладнання у вигляді комплексної діагностичної системи, яка поєднує комп’ютерну діагностичну програму і периферичне відеодіагностичне обладнання – відеодерматоскоп або трихоскоп, з робочим збільшенням від х10 до х1000. Вивчення волосистої частини голови за допомогою дерматотрихоскопа дозволяє отримати цінну клінічну інформацію про реальний стан шкіри. Дерматотрихоскопія не тільки полегшує діагностику хвороб волосся, але й є ключем у визначенні ефективності лікування [308].
Жовті точки вважаються найбільш характерною дерматотрихоскопічною ознакою ГА і спостерігаються у вигляді округлих або поліциклічних жовтих або рожево-жовтих крапок у фолікулах, можуть формуватися навколо уламків волосся (кадаверизоване волосся, чорні точки) або навколо дистрофічного волосся (волосся у вигляді знака оклику), частіше – в устях фолікулів, позбавлених волосся. При тривалому протягом ГА виявляють білі точки, які є ділянками цілеспрямованого руйнування фолікулів в результаті фіброзу. При поновленні росту волосся, як правило, з’являється псевдовелус – мініатюрне волосся, позбавлене пігменту, внаслідок залучення в патологічний процес фолікулярних меланоцитів, з часом їх пігментація посилюється. Коротке пушкове волосся може мати вигляд кілець. Відростання псевдовелусу є характерною ознакою ГА при регресі або ранній стадії медикаментозної ремісії [304, 308].
ГА має саморегуляційний характер перебігу. З одного боку, ми спостерігаємо спонтанне відновлення волосся, що випало, з іншого ж, відзначаємо тяжкі торпідні форми втрати волосся, резистентні до терапії. Часті випадки, коли зростання волосся відновлюється тільки при постійному лікуванні, а при припиненні лікування волосся знову випадає протягом декількох днів [137, 162]. Аналіз міжнародних рекомендацій лікування ГА показує, що на сьогоднішній день не існує універсального методу терапії ГА, що гарантує відсутність рецидиву в майбутньому. Поки не розроблено протокол лікування ГА, що ґрунтується на принципах доказової медицини або затверджений FDA [121, 236].
У недавньому аналізі бази даних PubMed при використанні термінів «рандомізовані контрольовані дослідження» і «alopecia areata» було знайдено лише 29 досліджень, які строго відповідали цим критеріям. Ці дослідження було проаналізовано з використанням American College of Physicians guideline grading system (системи атестації Американського коледжу лікарів). Оцінка полягала в тому, що більшість цих досліджень були тільки помірної якості. До тих пір, поки не будуть проведені надійні клінічні дослідження, триватимуть дебати щодо методів лікування при ГА [237].
Сучасний арсенал терапії ГА включає як сильнодіючі патогенетичні фармакологічні препарати, так і різноманітні ад’ювантні засоби. Відповідно до антигенної концепції патогенезу ГА до основної групи препаратів для патогенетичної терапії відносять глюкортикостероїди (ГКС), інші імуносупресанти, місцеві іританти і ПУВА-терапію [11, 15, 25, 44, 128, 159].
ГКС є найбільш доступними з імуносупресантів. При обмежених формах ГА найчастіше застосовують ГКС місцево, вони можуть використовуватися самостійно або в поєднанні з іншими видами лікування. Застосування топічних ГКС завдяки простоті, зручності є терапією першої лінії при ГА. Але аналіз використання місцевив ГКС при ГА вияивив закономівність їх призначення без урахування стадії патологічного процесу [133]. Найбільш часто у дорослих використовують 0,05 % клобетазолу пропіонат, суперпотентний стероїд, представлений у складі мазі, лосьйону, піни або шампуню. Використання піни клобетазолу пропіонату оцінювалося у 34 пацієнтів із середньою і тяжкою формою ГА в рандомізованому подвійному плацебо контрольованому дослідженні, що охоплювало 24 тижні. Через 12 тижнів відновлення волосся відзначено у 89 % пацієнтів, оброблених піною клобетазолу проти 11 %, які отримували плацебо [125].
Використання 2 % крему флуоцинолону ацетоніду 2 рази на добу надавало позитивний ефект у 61 % пацієнтів. Бетаметазону дипропіонат 0,05 % у вигляді крему також виявився досить ефективним засобом лікування хворих на ГА [142, 152, 192].
Лікування слід продовжувати протягом як мінімум трьох місяців, але припинити через 6 місяців, якщо відповіді немає. Побічні ефекти місцевих ГКС мають тимчасовий характер, можуть проявлятися у вигляді свербежу, печіння, фолікуліту, телеангіоектазій і атрофії шкіри [120].
Ін’єкції кортикостероїдів у глибоку дерму уражених ділянок є найпоширенішим методом лікування ГА з площею ураження до 50 % у дорослих, що дозволяє досягти оптимальних концентрацій у тканинах при мінімальній системній абсорбції [59, 133, 222].
Ретроспективний аналіз спостереження за пацієнтами з понад 50 % площі ураження шкіри голови, яким вводили ГКС внутрішньосередково, показав кращу відповідь у молодшому віці та при меншій тривалості ГА. Результати терапії у пацієнтів з ознаками активності були вищими, що робить їх кращими кандидатами на внутрішньосередкові ГКС [168].
Ефективність даного методу було показано в ході декількох неконтрольованих досліджень. Результатом одного з таких досліджень стало значне поліпшення стану у 82 % пацієнтів з локалізованою ГА, які протягом 12 тижнів отримували внутрішньосередкові ін’єкції тріамцинолону ацетоніду (вводиться від 2,5 до 10 мг/мл; менше 0,1 мл на 1 см2 ураженої шкіри) з періодичністю 1 раз на місяць. Серед побічних ефектів лікування: біль, атрофія і гіпопігментація. Ін’єкції в ділянку брів можуть супроводжуватися розвитком таких ускладнень, як глаукома, катаракта і оклюзія судин сітківки [101, 254, 360]. Дітям внутрішньоосередкові ін’єкції кортикостероїдів рекомендують у віці старше 10 років. Цей метод має обмеження внаслідок боязні уколів і
болю.
Shapiro J. et al. запропонували комбіноване лікування внутрішньосередковими ГКС і суперпотентними топічними ГКС протягом декількох місяців, якщо тримісячна монотерапія тріамцинолону не була ефективною [321].
В одному з досліджень оцінювалася ефективність і безпека ін’єкцій тріамцинолону ацетоніду та бетаметазону дипропіонату в різних концентраціях при осередковій ГА скальпа і бороди. Побічні ефекти на шостому місяці були більш поширені в групі з тріамцинолоном (24,3 % проти 10,6 %). Розведення бетаметазону дипропіонату ¼ (1,25 мг/дл) стало оптимальним для внутрішньоосередкового введення [356].
Повідомлялося, що 2,5 мг/мл тріамцинолону дає той же результат, що і 5 або 10 мг/мл у пацієнтів з ГА. Тому автори рекомендують використовувати тріамцинолон у меншій дозі при більшому об’ємі розведення (2,5 мг/мл, загальний об’єм 8 мл) і та ж доза для брів з об’ємом ≥0,5 мл у кожну брову [155]. Терапію припиняють, якщо пацієнт не відповідає на лікування протягом від 3 до 6 місяців. Внутрішньоосередкові ГКС як монотерапія може бути недостатньо ефективною при поширених формах ГА, але її можуть використовувати в якості додаткової терапії при системному лікуванні для прискорення дії оральних ГКС та інгібіторів Janus kinase (JAK) [241].
Системні ГКС широко використовуються при автоімунних захворюваннях і демонструють ефективність у терапії ГА у вигляді пероральних, внутрішньовенних та внутрішньом’язових форм. Однак системне застосування ГКС, як показали дослідження, не впливає на довгостроковий прогноз ГА. Стероїди, як правило, відновлюють волосся і стимулюють їх зростання на час лікування, після зниження дози або припинення прийому препарату часто розвивається рецидив [128, 142].
Задовільний рост волосся спостерігалося в семи випадках з 18 пацієнтів (38,9 %) з ГА (багатоосередкова , ТА і УА), які щодня приймали системні ГКС (15–40 мг преднізолону) протягом декількох місяців [165]. Відомі небажані явища довгострокової терапії системними ГКС, зокрема, порушення обміну речовин, цукровий діабет, гіпертонія і зниження мінеральної щільності кісткової тканини, розвиток акне, обмежують її призначення [125, 235].
Концепція пульс-терапії ГКС добре доведена і регулярно використовується у разі пемфігусу, ювенільного ревматоїдного артриту і трансплантації нирок, щоб максимізувати ефективність і мінімізувати токсичність препарату. Пульс-терапія високими дозами метилпреднізолону у дітей з множинними осередковами ГА і ТА/УА продемонструвала результат у 66 % пацієнтів у середньому через 12 місяців. Про будь-які небажані реакції цієї невеликої серії випадків не повідомлялося [232].
Оцінювали місячну пульсову дозу 5 мг/кг преднізолону у дітей з ГА у віці до 18 років [226]. Відновлення волосся було досягнуто у 60 % пацієнтів при оцінці через 6 місяців. Побічні ефекти введення ГКС у режимі пульс-терапії були мінімальними. Повне або косметично прийнятне відростання волосся через 4 міс після початку лікування спостерігалося у 58,3 % пацієнтів, які отримували пульс-терапію преднізолоном у дозі 300 мг per os при 4-тижневих інтервалах. У цьому ж дослідженні повідомляється про відростання волосся у 43 % пацієнтів, які отримували пульс-терапію в дозі 1000 мг преднізолону [18, 226, 235, 291]. Повне відростання волосся відзначалося у 71 % хворих дітей після внутрішньовенної пульс-терапії метилпреднізолоном у дозі 5 мг/кг на добу протягом 3 днів [290]. Zlotogorski А. і співавт. продемонстрували результати вперше зробленого систематичного огляду оригінальних досліджень, опублікованих у період між 1975 і 2015 роками, провели ретельний аналіз різних схем пульс-терапії ГКС для лікування ГА. Показано, що повну відповідь було отримано у 43 % популяції дослідження, а частота рецидивів становила 17 %. Критеріями доброї відповіді відзначено: невелика тривалість захворювання, декілька осередків, перший епізод [333].
Циклоспорин А – специфічний імуносупресивний препарат, пригнічує відповідь Тh1-клітин ВФ, вибірково діючи на рівні цитокінів та порушуючи кооперацію імунокомпетентних клітин. Циклоспорин відновлює рост волосся, але після відміни препарату може виникнути рецидив ГА. Крім того, застосування циклоспорину принципово не впливає на прогноз захворювання і має низку серйозних побічних ефектів (зміни сироваткових трансаміназ, креатиніну і холестерину в крові тощо). Ефективність місцевого застосування циклоспорину в лікуванні тяжких форм ГА доведено не було [42, 141, 338, 355].
Успішне лікування ГА метотрексатом було зареєстровано як у дорослих, так і в педіатричній групі [259, 272]. Chartaux E. і Joly P. описали 33 пацієнти з AT або AУ (середня тривалість захворювання – 7,7 року), у яких стандартна терапія не дала результатів. Відзначили, що метотрексат (15–25 мг) самостійно або в комбінації з пероральними кортикостероїдами (преднізолон 10-20 мг/день) дозволили досягти повного відновлення волосся у 63 % пацієнтів з комбінованим лікуванням і у 57 % пацієнтів, які отримували тільки метотрексат [169]. Незважаючи на те, що необхідні додаткові дослідження щодо методів лікування метотрексатом пацієнтів з ГА, використання його оцінюється як безпечна і ефективна терапія при втраті волосся > 50 % [201].
Є кілька повідомлень про можливість ефективного лікування резистентних форм ГА сульфасалазіном, його здатність мінімізувати рецидиви і пролонгувати ефект при скасуванні системних ГКС [153, 236, 299, 326]. Сульфасалазин являє собою коньюгат 5-аміносаліцилової кислоти (5-AСA) і сульфапіридину, використовується в терапії виразкового коліту, хвороби Крона, ревматоїдного артриту, червоного вовчака і псоріазу. Дія сульфасалазину при автоімунних захворюваннях опосередковується його імуномодулюючими, імуносупресивними і протизапальними ефектами [300]. Імуносупресивний ефект частково пояснюється блокуванням синтезу ДНК в імунокомпетентних клітинах, що призводить до порушення їх проліферації та диференціації. Сульфасалазин і його активний метаболіт 5-АСА пригнічують експресію прозапальних цитокінів і перш за все ФНП-a, ІЛ-1, ІЛ-8, вивільнення простагландину E2, інгібують клітинний хемотаксис і продукцію антитіл [300]. Можливо, завдяки регулюванню цих цитокінів, а також проліферації Т-клітин, активності NK-клітин і активації В-клітин сульфасалазин проявляє свою ефективність при ГА. Сульфасалазин має відносно хороший профіль безпеки [3, 253, 343].
В одному з досліджень показано, що призначення мезалазину (препарат подібний сульфасалазину, 5-AСA з уповільненим вивільненням) хворим дітям зі стійкими формами ГА самостійно або в поєднанні з пероральним кортикостероїдом, місцевим бетаметазоном, міноксидилом призвело до позитивних результатів [253].
Показанням до застосування топічної імуносупресивної терапії є тяжкі форми ГА – багатоосередкова, ТА і УА в хронічній стадії. Серед сенсибілізаторів, що використовуються на теперішній час: дифенілциклопропенон (DPCP) і дибутиловий ефір скварикової кислоти (SADBE) [133]. Хоча результати Ames-тесту щодо даних препаратів свідчать про відсутність мутагенних ефектів, жоден з них так і не був схвалений FDA, оскільки профіль їх безпеки до кінця не з’ясований. Суть методу полягає в штучній індукції на шкірі хворого на ГА алергічного контактного дерматиту за типом гіперчутливості уповільненого типу. У результаті активізуються Т-супресори і макрофаги, які модифікують імунний процес в ураженій ділянці шкіри, що сприяє відновленню зростання волосся. Частота позитивної клінічної відповіді у дорослих пацієнтів варіюється від 9 % до 87 % [235]. Частота рецидивів, зафіксована в ході досліджень у дітей, становить від 25 % до 90 %, при цьому випадки поширеного патологічного процесу характеризувалися гіршим прогнозом [198, 310].
Міноксидил (2,4-діаміно-6-піперидинопіримідин-3-оксид) є засобом прямого впливу на волосяні цибулини [222]. При системному використанні препарат має потужний вазодилатуючий ефект. Стимулююча дія міноксидилу на зростання волосся здійснюється за допомогою його сульфованих метаболітів, що діють в якості речовини, яка відкриває калієві канали. Основні ключові механізми, відомі на сьогоднішній день, здійснюються за рахунок ефекту стимуляції синтезу VEGF і простагландинів, причому цей ефект має дозозалежний характер. В одному з досліджень порівнювали ефективність різних концентрацій міноксидилу (1 % і 5 %) у лікуванні поширеної ГА: у пацієнтів, які отримували 5 % міноксидил, відновлення росту волосся було більш вираженим. Міноксидил діє синергічно з ГКС і тим самим покращує результати лікування ГА [25, 137, 140].
Досліджували ефект топічного міноксидилу на індуковане преднізолоном зростання волосся і дійшли висновку, що місцеве застосування міноксидилу обмежує або уповільнює постстероїдну втрату волосся у пацієнтів з ГА [278]. Поширеним побічним ефектом міноксидилу, особливо при більш високих концентраціях, є гіпертрихоз на обличчі та шиї, подразнюючий контактний дерматит або погіршення стану наявного раніше себорейного або атопічного дерматиту, а також можливе зниження артеріального тиску, особливо при використанні на великій площі поверхні [231, 325]. Схема лікування алопеції за допомогою міноксидилу все ще перебуває в стадії вдосконалення.
Розробка лікувальних «стратегій майбутнього» вимагає знання і розуміння тонких механізмів патогенезу ГА, в основі якої полягають порушення клітинної сигналізації. Поява генно-інженерних біологічних препаратів відкрило нові перспективи в терапії автоімунних і запальних захворювань. Цитокіни, що регулюють широкий спектр процесів у ході розвитку нормальної імунної відповіді, є одними з найбільш успішних терапевтичних мішеней [28, 100, 239].
Впровадження біологічних препаратів викликало надії на успішне управління імунологічними процесами при ГА. Оскільки передбачається, що TNF бере участь в патогенезі ГА, анти-TNF-α препарати були досліджені на їх здатність стримувати розвиток ГА. Хоча повідомлялося, що алефацепт має деяку ефективність, подвійне сліпе рандомізоване плацебо-контрольоване клінічне дослідження, що включало 45 пацієнтів із хронічним і тяжким перебігом ГА, не показало статистично значимого поліпшення після 12 послідовних тижнів порівняно з групою, що приймала плацебо [117]. У проспективному відкритому пілотному дослідженні етанерцепт, інгібітор TNF-α, був визнаний неефективним при лікуванні хворих з помірним ступенем тяжкості ГА [203]. Крім того, поодинокі повідомлення стверджують, що адалімумаб, етанерцепт та інфліксимаб індукують ГА [126, 131, 191, 281]. У теперішній час відсутнє розуміння механізмів індукції ГА і відсутність ефективності при прийомі інгібіторів TNF-α, що вимагає подальшого вивчення.
Устекінумаб є моноклональним IgG1-антитілом, яке зв’язується із субодиницею p40 IL-12 і IL-23 і пригнічує їх активність. Імунологічний шлях Th-17 і пов’язані з ним цитокіни, включаючи IL-23 і IL-17, мають важливе значення в патофізіології псоріазу, псоріатичного артриту та інших спондилоартропатій [271, 332]. Багато досліджень показали, що IL-23 відіграє важливу роль у функціональному забезпеченні Th-17 [251]. Оскільки підвищені рівні цитокінів Th-1 типу пов’язані з тяжкими формами ГА, інгібітори IL-12 (устекінумаб), як очікується, можуть бути ефективними в терапії ГА [320]. Guttman-Yassky E. та співавт. продемонстрували зростання волосся у трьох пацієнтів з ГА, які отримували 90 мг препарату підшкірно [206]. З іншого боку, опублікованj повідомлення про випадки розвитку ГА, що виникають під час лікування устекінумабом при псоріазі [124, 359].
Секукінумаб – антагоніст Th-17/IL-17, є рекомбінантним IgG1κ моноклональним антитілом, яке селективно інгібує IL-17A і активно використовується в терапії псоріазу [212]. Останні дослідження підтверджують можливість використання антагоніста Th-17/IL-17 у лікування ГА. Секукінумаб у даний час тестується в подвійному сліпому рандомізованому плацебо-контрольованому клінічному дослідженні для ГA (ClinicalTrials. Gov NTC02599129) [240, 273].
Останнім часом з’являються дедалі нові факти про значущість нової сигнальної системи JAK-STAT (Janus Kinases – Signal Transducer and Activator of Transcription) у розвитку цілої низки автоімунних захворювань [178, 179]. JAK-STAT система або шлях, що складається з Янус-кінази (JAK) і сигнального білка-трансдуктора і активатора транскрипції (STAT), передає інформацію від позаклітинних поліпептидних сигналів через трансмембранні рецептори безпосередньо до промоторів генів-мішеней у ядрі без участі вторинних месенджерів [298, 305]. Передача позаклітинних сигналів відбувається при цьому на цитокінові рецептори. Цитокіни, зв’язуючись з цими рецепторами, можуть активувати різні шляхи сигнальної трансдукції. Існує ряд цитокінів, які працюють саме з JAK кіназами. Якініби – препарати, що переривають механізм впливу інтерлейкінів на клітину за рахунок блокування JAK, показали ефективність при ГА.
Різке відновлення росту волосся спостерігалося в доклінічних дослідженнях з використанням JAK-інгібіторів у мишей C3H/HeJ, що обгрунтувало вивчення цих препаратів у людей [129].
Тофацитиніб – інгібітор JAK 1/3 типів, який перериває STAT-залежний сигнальний шлях, у даний час схвалений FDA для лікування ревматоїдного артриту [341, 345].
У ході доклінічних досліджень на мишах і випробувань у людей (15 дорослих пацієнтів із середньою і тяжкою ГА) із застосуванням місцевого nf перорального тофацитинібу, зафіксовано значне зниження активності цитотоксичних Т-лімфоцитів і відповідного інтерферонового профілю, яке супроводжувалося відновленням зростання волосся [180].
Описано досвід застосування тофацитинібу у 13 підлітків з ГА у віці 12–17 років: у 9 пацієнтів зафіксовано значне зростання волосся, а процентна зміна середнього бала за шкалою SALT становила 61 %. Інше дослідження показало, що у всіх восьми підлітків з УА, які отримували тофацитиніб по 5 мг двічі на день, діагностовано поліпшення із середнім збільшенням на 58 % показника SALT через 6 місяців. Повідомлені побічні ефекти були слабко вираженими. Незважаючи на невеликий розмір вибірки даних досліджень, вони ілюструють ефективність системного застосування тофацитинібу для лікування ГА у підлітків і ще раз свідчить про необхідність проведення подальших досліджень з цієї групою препаратів [180, 309, 345].
Ефективність руксолітинібу оцінювалася у 12 пацієнтів з помірною та тяжкою формами ГА (20 мг два рази на день протягом 3–6 місяців). Результати показали, що 75 % пацієнтів відзначили повне відновлення, часткове зростання діагностували в 92 % випадків наприкінці лікування. Однак протягом тримісячного періоду після припинення прийому препарату 9 пацієнтів відзначили різний ступінь втрати волосся [279].Системні інгібітори JAK пов’язані з несприятливими наслідками, включаючи серйозні інфекції, пошкодження кісткового мозку, зміни трансаміназ, а також недооціненість злоякісних новоутворень [114, 279, 283]. З огляду на серйозні побічні ефекти, які можуть виникнути в результаті довготривалої системної терапії інгібіторами JAK, вивчається можливість використання місцевих інгібіторів JAK. Однак цей метод лікування ще не був оцінений у великих дослідженнях. На сьогоднішній день існують дані про дівчинку-підлітка з УА, у якій спостерігалося значне зростання волосся з використанням 0,6 % крему руксолітинібу [181]. Повідомляється про 6 дітей (3–16 років) з різними формами ГА, які отримували місцеві інгібітори JAK – 1 % і 2 % креми тофацитинібу і руксолітинібу. Відзначено позитивні результати, які були стабільними більше 1 року [180, 298, 346].Топічні інгібітори JAK можуть бути терапією другої лінії для пацієнтів з різними формами ГА, у тому числі АТ і АУ, для яких системна терапія цими препаратами неможлива [292]. Клінічні випробування з JAK інгібіторами при ГА в даний час тривають, що дозволить розширити уявлення про ефективність і безпеку цих препаратів. Якщо ці засоби насправді виявляться ефективними, вони зможуть стати першим методом лікування ГА, схваленим FDA [247].У невеликих дослідженнях відзначено ефективність використання в терапії ГА статинів, що мають гіполіпідемічний, протизапальний та імуномодулюючий ефекти [327, 348]. Езетиміб має синергічний ефект при спільному застосуванні із симвастатином. У кількох дослідженнях показано успішне використання 40 мг / 10 мг щодня симвастатину/езетимібу протягом 12–24 тижнів у пацієнтів з ГА (40–70 % ураження шкіри голови), які були резистентні до іншого виду терапії. Однак утримати ефект після припинення терапії не вдавалося, що обґрунтовує подальше дослідження даного альтернативного методу [323, 348].В одному з перспективних клінічних досліджень було показано, що апреміласт, пероральний інгібітор фосфодіестерази-4, запобігає розвитку ГА у шкірних трансплантатах шкіри голови у мишей. Інгібітор фосфодіестерази-4 у даний час доступний для лікування атопічного дерматиту, і може бути ефективним при ГA, що потребує подальшого вивчення [197, 339].
Використання антидепресантів при лікуванні ГА часто недооцінюється. Важливо визначити, чи може антидепресантна терапія підвищити ефективність терапії у пацієнтів з ГА [202]. Багато авторів повідомляють про роль стресових факторів в ініціації захворювання, а також про зв’язок між тривожністю, афективними розладами і ГА. Позитивний ефект у вигляді росту волосся від використання іміпраміну, трициклічного антидепресанту, пароксетину, циталопраму відзначено в групах пацієнтів з ГА і психічною супутньою патологією [137, 145, 202].
В етапній терапії ГА не менш важливі, особливо у стаціонарній стадії, ад’ювантні засоби, що з успіхом застосовуються при диференційованому підході. З огляду на психоемоційні порушення, до комплексної терапії ГА включають різні ноотропні та седативні засоби (персен, тривалумен, сибазон, пантогам, фенібут, гліцин, пірацетам). При дефіцитних станах показано препарати цинку, міді, заліза, вітамін D [15, 42, 115, 176, 266, 342, 364].
В традиційній терапії ГА використовують препарати, що покращують макро-, мікроциркуляцію (ксантинола нікотинат, оксибрал, місцево – плацента композитум), призначеня яких не враховує стадію патологічного процесу захворювання [1, 11, 12, 49].
У комплексній терапії ГА широко застосовуються фізіотерапевтичні процедури. В останні роки з’явився принципово новий вид світлотерапії – вузькосмугова фототерапія з використанням ексимерного XeCl-лазера з довжиною хвилі 308 нм. Є дані про ефективне лікування ГА цим методом. Успіх застосування ексимерного лазера при даному захворюванні пов’язаний з його імуносупресивною дією [142].
***
Таким чином, на сьогоднішній день терапія ГА не завжди призводить до очікуваних результатів. Розвиток ускладнень і тяжких побічних ефектів, недостатнє дослідження ефективності та безпеки окремих засобів обмежують можливість широкого застосування великого спектру терапевтичних впливів і зумовлюють інтерес до пошуку нових і вдосконалення існуючих методів лікування ГА з метою індивідуалізації терапії, підвищення її ефективності та якості життя пацієнтів.
Матеріали даного розділу опубліковані в таких роботах:
- Сербина И.М. Гнездная алопеция: лечение и перспективы новых исследований. Клінічна імунологія. Алергологія. Інфектологія. 2012. № 1. С. 64–67 [82].
- Сербина И.М. Иммунопатологические аспекты гнездной алопеции. Дерматолог. 2016. № 2. C. 180–187 [85].
- 3. Сербина И.М. Современные подходы в терапии гнездной алопеции у детей. Міжнародний медичний журнал. 2018. № 1. С. 68–73 [98].
РОЗДІЛ 2
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
Для досягнення мети та реалізації завдань дисертаційної роботи було застосовано методи клінічної, інструментальної, лабораторної діагностики та сучасні методи статистичної обробки даних.
Дослідження проводилося на клінічній базі кафедри дерматовенерології Харківської медичної академії післядипломної освіти – КНП «Міський шкірно-венерологічний диспансер № 4» Харківської міської ради, у центральній науково-дослідній лабораторії Харківської медичної академії післядипломної освіти та центральній науково-дослідній лабораторії Харківського національного медичного університету. Обстежено 156 хворих на різні форми ГА віком від 18 до 64 років, з них 66 чоловіків і 90 жінок. Контрольну групу складали 35 практично здорових осіб (16 чоловіків і 19 жінок) віком від 18 до 40 років.
Дослідження проводилося на підставі Гельсінської Декларації Всесвітньої Медичної Асоціації та правил якості медичної практики (ICN GCP), добровільної участі, інформування пацієнтів про характер майбутнього дослідження.
Включення пацієнта у програму обстеження проводилося за спеціально розробленими критеріями відбору.
Критерії включення:
- установлений діагноз ГА;
- вік пацієнта від 18 років;
- підписання пацієнтами інформованої згоди на участь у дослідженні.
Критерії виключення:
- діагноз ГА викликав сумніви;
- значне спонтанне відновлення зростання термінального волосся;
- пацієнт у попередній період до 1 місяця отримував лікування, що здатне спричинити відновлення зростання волосся при ГА;
- наявність супутньої тяжкої патології у стадії суб- та декомпенсації;
- невиконання пацієнтом призначених рекомендацій за планом обстеження та лікування.
У процесі спостереження за хворими ретельно аналізувалися дані анамнезу, клінічного перебігу захворювання, при цьому зверталася увага не тільки на шкірні покрови та видимі слизові оболонки, а й на стан внутрішніх органів і систем. При необхідності хворі були консультовані суміжними спеціалістами: терапевтом, ревматологом, ендокринологом, невропатологом, гінекологом та ін.
Усім хворим при встановленні діагнозу та наступному спостереженні проводилися загальні аналізи крові, сечі, дослідження калу на яйця і членики гельмінтів, вивчалися показники ліпідного (загальні ліпіди, холестерин, тригліцериди, β-ліпопротеїди), вуглеводного (глюкоза крові), пігментного (білірубін і фракції) обмінів. Також проводилися дослідження активності ферментів крові (аспартатамінотрансферази (АСТ), аланінамінотрансферази (АЛТ), лужної фосфатази (ЛФ), креатиніну. Проводилася постановка стандартних серологічних реакцій крові на сифіліс і австралійський антиген. При необхідності у хворих досліджувався вміст заліза, феритину, вітаміну D, гормонів щитоподібної залози і рівень автоантитіл. Біохімічні показники крові визначалися за уніфікованими методами.
За наявності показань проводилося мікроскопічне дослідження НП на патогенні гриби, ультразвукове дослідження, рентгенографію.
2.1 Імуноферментне дослідження крові
Цитокіновий профіль сироватки крові досліджувався у 68 хворих на ГА. Венозна кров для дослідження бралась асептично натщесерце з ліктьової вени в кількості 10 мл. Для відокремлювання сироватки кров центрифугувалася при 3000 об/хв протягом 15 хв. Одержана сироватка заморожувалась у пластикових пробірках при температурі –20 °С. В якості контролю використовувалася сироватка крові 35 практично здорових людей відповідного віку та статі.
Вміст інтерлейкінів та факторів росту визначався методом твердофазного імуноферментного аналізу з використанням комерційних наборів фірми «Вектор-Бест» (Росія) – рівень продукції – IL-1β (пг/мл), ІЛ-4 (пг/мл), ІЛ-10 (пг/мл), ІЛ-17 (пг/мл) і VEGF (пг/мл); наборів «BCM Diagnostics» (США) – HSP–70 (нг/мл) і EGF (пг/мл); набору «Bender MedSystems» (Австрія) – sVEGFR1 (нг/мл).
Аналіз включав три етапи. На першому етапі контрольні та досліджувані зразки інкубувалися в лунках з іммобілізованими антитілами. Зв’язані з АТ рецепторні антагоністи до досліджених цитокінів виявлялися при інкубації з кон’югатом АТ людини і пероксидази хрону. Кількість зв’язаного кон’югату визначалася кольоровою реакцією з використанням субстрату – пероксидази хрону і хромогену – тетраметилбензидину. Після зупинки реакції сірчаною кислотою вимірювалася оптична щільність розчинів у лунках планшета при довжині хвилі 450 нм. Концентрація рецепторних антагоністів досліджуваних цитокінів у пікограмах на мілілітр (пг/мл) і нанограмах на мілілітр (нг/мл) визначалася за калібрувальним графіком, складеним згідно з інструкцією до наборів.
Рівень продукції гормонів кортизолу (нмоль/л) та інсуліну (мклОд/мл) визначався в сироватці крові 68 хворих на ГА і 35 здорових осіб групи контролю методом твердофазного імуноферментного аналізу з використанням комерційних наборів фірм «Вектор-Бест» (Росія). Коефіцієнт напруги адаптаційного потенціалу «К» розраховувався як співвідношення процентної кількості кортизолу та інсуліну [65].
Венозна кров для дослідження бралась асептично натщесерце з ліктьової вени в кількості 2 мл (з 8.00 до 8.30 годин ранку). Як стабілізатор використовувався 3,8 % розчин цитрату натрію. Для відокремлювання сироватки кров центрифугувалася при 1500 об/хв протягом 15 хв. Одержана сироватка заморожувалась у пластикових пробірках при температурі –20°С.
Принцип методу дослідження кортизолу: в лунках, при додаванні зразка, який досліджується, і кон’югату кортизол-пероксидаза під час інкубації встановлюється рівновага між кон’югатом та ендогенним кортизолом сироватки крові за зв’язування з антитілами, які іммобілізовані на внутрішній поверхні лунок. Ступінь забарвлення прямо пропорційна кількості зв’язаного антитілами кон’югату кортизол-пероксидаза. Після вимірювання оптичної щільності розчину в лунках на підставі калібрувальної кривої розраховується концентрація кортизолу в зазначених зразках.
Принцип методу дослідження інсуліну: метод визначення базується на двостадійному «сендвіч» варіанті твердофазного імуноферментного аналізу. На першій стадії до лунок стрипованого планшету з іммобілізованими моноклональними антитілами вносять калібрувальні та контрольний зразки з відомими концентраціями інсуліну, досліджувані зразки сироватки (плазми) крові. На другій стадії інсулін, що зв’язався у лунках, обробляють кон’югатом моноклональних антитіл до інсуліну. Утворені імунні комплекси «моноклональні антитіла – інсулін – кон’югат» виявляють ферментативною реакцією з Н2О2 та розчином тетраметилбензидину. Концентрація інсуліну в аналізованих зразках розраховується на підставі каліброваного графіку.
2.2 Біохімічне (спектрофотометричне) дослідження крові
Вміст NO в плазмі крові визначався у 68 хворих на ГА і 35 здорових осіб за рівнем його стійких метаболітів – нітритів (NО2) і нітратів (NО3). Після осадження білків сироватки крові NО3, що утворився з NО у водному середовищі, відновлювався в NО2, який реагував з компонентами реактиву Griess (N-1-нафтилетилен-діамінхлориду). Оптична щільність утвореної комплексної сполуки оцінювалася спектрофотометрично при довжині хвилі 520 нм. Метод визначення загальної (сумарної) активності NOS базується на фотометричному виявленні приросту рівня продукту ферментативної реакції NО2, які визначають в кислому середовищі за допомогою реактиву Griess. Активність конститутивної ізоформи ферменту визначалася за різницею загальної та iNOS [51, 60].
Венозна кров для дослідження NO та NOS бралась асептично натщесерце з ліктьової вени в кількості 2 мл. Як стабілізатор використовувався 3,8 % розчин цитрату натрію. Для відокремлювання сироватки кров центрифугувалася при 1500 об/хв протягом 15 хв. За дві доби до дослідження хворим призначалася спеціальна дієта з метою запобігання харчової контамінації нітратами і нітритами.
2.3 Морфологічне та імуногістохімічне дослідження біоптату шкіри
Вивчено біоптати шкіри скальпа 18 хворих із клінічним діагнозом ГА, підтвердженим гістологічно і дерматоскопічно. У дослідженні взяли участь 8 жінок і 10 чоловіків у віці від 20 до 45 років. В якості контролю використовувалися біоптати шкіри 5 здорових людей, взяті з волосистої частини голови під час пластичних операцій.
Зразки шкіри з осередків облисіння бралися за допомогою одноразового панча діаметром 4 мм. Після взяття біопсії матеріал фіксувався у 4 % розчині формаліну протягом 48 год і заливався в парафін. З парафінових блоків готувалися серійні зрізи товщиною 4-5 мкм. З метою оглядового забарвлення гістологічні зрізи забарвлювалися гематоксиліном і еозином. ІГХ дослідження проводилися за стандартизованою методикою з використанням серійних парафінових зрізів, поміщених на адгезивні скла, покриті полізином («Menzel-Glaser», Німеччина), та реактивів компанії DAKO. ІГХ панель включала в себе наступні антитіла: CD4 (Clone 4B12), CD8 (Clone С8/144В), CD68 (Clone PG-M1), CD56 (Clone 123C3). Прозапальні цитокіни: TNF-α, IL-1, IL-6. Система візуалізації EnVision™ FLEX+, Mouse, High pH (Link), Code K8012 на автостейнері фірми DAKO.
Інтенсивність цитоплазматичної експресії CD68, CD56, TNF-α, IL-1, IL‑6 оцінювалася напівкількісним методом на підставі інтенсивності забарвлення за наступною схемою: слабка експресія, помірна і виражена; CD4, CD8 – мембранна реакція. Морфометричне дослідження маркерів включало підрахунок позитивних клітин у 5 полях зору при збільшенні 200 за допомогою програми DP SOFT. Перегляд і цифрові фотографії мікропрепаратів здійснювалися за допомогою світлового мікроскопа «Olympus CX-4».
2.4. Анкетування для оцінки впливу захворювання на якість життя за шкалою DLQI
У даний час існує декілька специфічних для дерматології опитувальників. Було використано опитувальник «Дерматологічний індекс якості життя» – ДІЯЖ (Dermatology Life Quality Index – DLQI), який є найбільш цитованим інструментом оцінки ЯЖ пацієнтів через його високий ступінь об’єктивності та надійності [293, 294]. У нього включені питання, умовно поділені на шість основних критеріїв якості життя: фізичний (біль, свербіж), повсякденна активність, суспільне життя, особисті взаємовідносини, працездатність, комплаєнтність (зручність) терапії, що призначається, котрі характеризують перебіг дерматозу за останні 7 днів. Питання опитувальника адресовані безпосередньо пацієнтові, тому відповідати на них він має самостійно. Цифровий показник, що отримується в результаті аналізу відповідей, відображає рівень негативного впливу захворювання на ЯЖ пацієнтів [56].
Анкети складалися з двох частин. Перша частина, яку заповнював доктор, включала питання про стать, вік, сімейний анамнез захворювання, анамнез перебігу ГА (первинний епізод або рецидив), тривалість захворювання, наявність стресу протягом останніх 6 місяців, рід занять (у даний час працює і в даний час не працює), рівень освіти, інші захворювання (захворювання щитоподібної залози, цукровий діабет, атопія тощо). Друга частина включала питання оцінки безпосередньо DLQI. Питання можна класифікувати за 6 рубриками: симптоми і почуття (питання 1–2), повсякденна діяльність (питання 3–4), дозвілля (питання 5–6) і особисті стосунки (питання 8–9) – кожен пункт з максимальним значенням – 6 балів; робота (питання 7), а також лікування (питання 10) – по кожному з максимальним балом 3. Для оцінки клінічної інтерпретації оцінки балів DLQI було запропоновано певну систему. Згідно з цією системою, чим вищою була оцінка (кількість балів), тим гіршою ЯЖ. Кількість балів 0–1 інтерпретується як така, що не впливає на життя пацієнта, 2–5 – завдає незначного ефекту, 6–10 – помірного ефекту, 11–20 – дуже сильного ефекту, і 21–30 – як надзвичайно сильний ефект (табл. 2.1).
Таким чином, результат може знаходитися в діапазоні від 0 до 30 балів (табл. 2.1).
Таблиця 2.1 – Трактування значень індексу DLQI
| Значення індексу | Трактування |
| 0-1 | Шкірне захворювання не впливає на життя пацієнта |
| 2-5 | Шкірне захворювання незначно впливає на життя пацієнта |
| 6-10 | Шкірне захворювання помірно впливає на життя пацієнта |
| 11-20 | Шкірне захворювання дуже впливає на життя пацієнта |
| 21-30 | Шкірне захворювання має надзвичайно сильний вплив на життя пацієнта |
2.5 Інструментальне (дерматотрихоскопічне) дослідження
Дерматотрихоскопічне дослідження проводилися за допомогою комп’ютерно-діагностичної програми та дерматоскопічного обладнання Aramo SG (Корея), що дозволяє отримувати зображення зі збільшенням 60 і 200. Окрім виявлення специфічних стигм для різних алопецій, дослідження за допомогою дерматотрихоскопа покращує видимість ознак, що визначаються неозброєним оком. На волосистій частині голови подібні ознаки включають епідермальні та перифолікулярні лусочки, стан гирла фолікулів, дистрофію волосся і відмінності в їх діаметрі. Специфічні дерматотрихоскопічні стигми включають фолікулярні та нефолікулярні ознаки. Фолікулярні ознаки локалізовані з ВФ, до них належать жовті та білі точки, що охоплюють перифолікулярну зону. Наявність пігментації шкіри у вигляді сотів і васкулярних змін – нефолікулярні ознаки. Дерматотрихоскопія дозволяє визначити ступінь дистрофії волосся, що відбувається внаслідок розм’якшення стрижнів волосся при ГА. Волосся може бути зламаним одразу за появи на голові (чорні точки), або мати вигляд короткого викривленого волосся, або пеньків волосся конічної форми. Волосся у вигляді знаку оклику це зламані волоски з витертим потовщеним кінчиком; їх виявляють виключно при ГА здебільшого по краях осередку. Дерматотрихоскопія дозволяє ідентифікувати волосся у формі знаку оклику різної довжини. Довгі витонченні (coudability) волоски – це волосся зі звуженою проксимальною частиною. Іншою дерматоскопічною ознакою ГА є наявність псевдомонілетриксу – волосся з характерними звуженнями волосяних стрижнів [306].
Дерматотрихоскопічні ознаки ГА візуально підраховувалися в декількох зонах і визначався середній показник для кожного пацієнта.
2.6. Визначення індексу тяжкості ГА
Розроблено індекс тяжкості гніздової алопеції (ІТГА), де комбінуються кількісні оцінки ступеня вираженості основних проявів ГА на волосистій частини голови (тест натягнення волосся, дерматотрихоскопічні маркери) з оцінкою площі ураження, а також кількісні оцінки ступеня втрати волосся на інших ділянках і ураженні НП [67].
Оцінку ступеня втрати волос на волосистій частині голови проводять з використанням математичного підходу і візуальних допоміжних засобів. Усю поверхню скальпа приймали за 100 % і умовно поділяли на 4 квадранти, які відповідають лівій, правій, задній і верхній ділянкам волосистої частини голови. Площа лівої та правої ділянки – по 18 %; площа верхньої ділянки (парієтальної та тім’яної ділянки) – 40 %; задня ділянка (ділянка потилиці) – 24 %. Кожен квадрант також поділений на 4 частини, цифри в яких позначають, скільки відсотків становить втрата волосся на тій чи іншій ділянці. Ваговий коефіцієнт ділянки відповідає площі поверхні шкіри: 0,18 – ліва і права ділянки; 0,4 – верхня ділянка; 0,24 – потилична ділянка. Ступінь випадання волосся у пацієнта з ГА оцінювали візуально по всіх 4 сторонах скальпа у відповідній зоні квадранта. Ці дані дозволяють більш точно визначити ступінь втрати волосся на голові (рис. 2.1).
 Рисунок 2.1 – Схематичні зображення скальпа і площа його поверхні, %
Рисунок 2.1 – Схематичні зображення скальпа і площа його поверхні, %
Шкала втрати волосся на скальпі (S):
- 0 балів – 0 %;
- 1 бал – <10 %;
- 2 бали – 10–25 %.
- 3 бали – 26–49 %;
- 4 бали – 50–74 %;
- 5 балів – 75-99 %;
- 6 балів – 100 %.
Шкала втрати волосся на тілі (B) має на увазі повний огляд волосяного покриву пацієнта (ділянка бороди, вусів, брів, вій, а також кінцівок і тулуба) і представлена• 0 балів – збереження волосся на тілі;• 2 бали – часткова втрата волосся на тілі;• 4 бали – втрата 100 % волосся на тілі, виключаючи скальп.Шкала оцінки ураження НП (N):• 0 балів – відсутність дистрофічних змін;• 2 бали – часткове ураження нігтів;• 4 бали – дистрофія 20 нігтів.Для проведення тесту натягнення волосся («pull test») захоплювали невеликий пучок волосся (50-60 волосин) і з деяким зусиллям, але не дуже різко потягували волосся. Якщо в руках залишалось понад 10–20 % волосся, тест свідчить про наявність патологічного випадіння волосся (позитивний тест), у разі більше 20 % – різко позитивний.Шкала оцінки «pull test» (P):• 1 бал – негативний;• 2 бали – позитивний;• 3 бали – різко позитивний.За допомогою дерматотрихоскопії визначали наявність маркерів активності патологічного процесу.Шкала оцінки дерматотрихоскопічних маркерів активності (T):• 1 бал – 0 %;• 2 бали – < 50 %;• 3 бали – ≥ 50 %.Використання індексу дозволяє об'єктивно оцінити тяжкість ГА, ефективність проведеної терапії. ІТГА представлений числом від 0 балів (відсутність хвороби) до 44 балів (найтяжчий перебіг) і відображає площу ураження з урахуванням інтенсивності проявів клінічних ознак.
Значення від 1 до 12 балів відповідає легкому ступеню тяжкості, від 13 до 25 балів – середньому ступеню тяжкості процесу, від 26 до 44 балів – тяжкому перебігу ГА.
Табличний варіант розрахунку ІТГА наведено в таблицях 2.2 та 2.3. Запропонована шкала визначає терапевтичну стратегію ведення пацієнтів із різними проявами ГА. При значенні ІТГА – < 12 балів – використовується місцева терапія, при > 12 – необхідне призначення системної терапії.
Таблиця 2.2 – Шкала оцінки показників
| Індекс | 0 балів | 1бал | 2 бали | 3 бали | 4 бали | 5 балів | 6 балів |
| Площа ураження волосистої частини голови, % (S) | 0 | <10 | 11-24 | 25-49 | 50-74 | 75-99 | 100 |
| Ступінь втрати волосся на тілі (В) | Волосся збережені | Часткове
випадіння |
Повне випадін-ня | ||||
| Ступінь зміни НП (N) | Без ураження | Часткове ураження | Ура-ження 20 нігтів | ||||
| Pull тест (P)* | Негатив-ний
<10 % |
Позитив-ний
10-20 % |
Різко пози-тивний
>20 % |
||||
| Дерматотрихо-скопічні маркери активності:
волосся у вигляді знаку оклику; чорні точки; обламане волосся (T) |
0 % | <50 % | ≥50 % |
Примітка. * При площі ураження волосистої частини голови 100 % рull тест (Р) – різко позитивний
Таблиця 2.3 – Розрахунок ІТГА
| Ділянка голови | Pull тест
(Р) (бал) |
Трихоско-пічні маркери активності (Т)
(бал) |
Площа ураження волосистої частини голови, % (S) (бал) | Ваговий коефіцієнт ділянки | Бал втрати волосся
(БВВ) |
| Ліва (Л) | 0,18 | ||||
| Права
(П) |
0,18 | ||||
| Верхня
(В) |
0,40 | ||||
| Потилична
(П) |
0,24 | ||||
| БВВ (Л) = (P+Т)×S×0,18
БВВ (П) = (P+Т)×S×0,18 БВВ (В) = (P+Т)×S×0,40 БВВ (П) = (P+Т)×S×0,24 |
|||||
| Загальний БВВ = БВВ(Л)+БВВ(П)+БВВ(В)+БВВ(П) | |||||
| Індекс тяжкості гніздової алопеції = загальний БВВ+В+N | |||||
2.7 Статистичний метод дослідження
Статистична обробка даних, отриманих під час клінічних та лабораторних досліджень, здійснювалася за допомогою комп’ютерних програм SPSS Statistics 17.0, Microsoft Excel 2013 та OR-calculator. Залежно від завдання дослідження та типу даних були застосовані наступні статистичні методи: описової статистики шляхом обчислення медіан (Ме); критерій c2 Пірсона з поправкою Йєтса та точним критерієм Фішера; розрахунок показника співвідношення шансів (OR) з довірчими інтервалами; розрахунок середньої арифметичної величини та її стандартного відхилення (M±m); перевірка даних на нормальність розподілу за допомогою теста Колгоморова-Смірнова; після оцінки гомогенності груп тестом Левеня застосування t‑критерія Ст’юдента. Статистично значущими вважалися дані з рівнем імовірності р < 0,05.
Для виявлення лінійних зв’язків між кількісними і між кількісними і якісними порядковими показниками проводився кореляційний аналіз. Аналіз кореляцій в парах показників виконувався за допомогою Критерію Спірмена. Аналіз впливу факторів росту на розвиток алопеції виконувався за допомогою однофакторной і багатофакторної лінійної регресії, однофакторного і багатофакторного дисперсійного аналізу отриманих лінійних моделей. Статистичні розрахунки виконувалися за допомогою мови R версії v3.2.0 [39].
РОЗДІЛ 3
КЛІНІКО-ІНСТРУМЕНТАЛЬНА ХАРАКТЕРИСТИКА ХВОРИХ НА ГНІЗДОВУ АЛОПЕЦІЮ
3.1 Клінічна характеристика хворих
Під спостереженням перебувало 156 пацієнтів із діагнозом ГА (чоловіків – 66, жінок – 90, у віці 18–64 років). В обстежених виявлено різні клінічні форми ГА: осередкова (54 – 34,6 %), лінійна (24 – 15,4 %) (офіазис [16 – 10,3 %], зворотний офіазис [8 – 5,1 %]), багатоосередкова (42 – 26,9 %), дифузна форма (4 – 2,6 %), ТА (20 – 12,8 %) і УА (12 – 7,7 %), яким у МКХ‑10 відповідають коди діагнозів L61, L63.2, L63.8, L63.9, L63.0 и L63.1 (рис. 3.1).
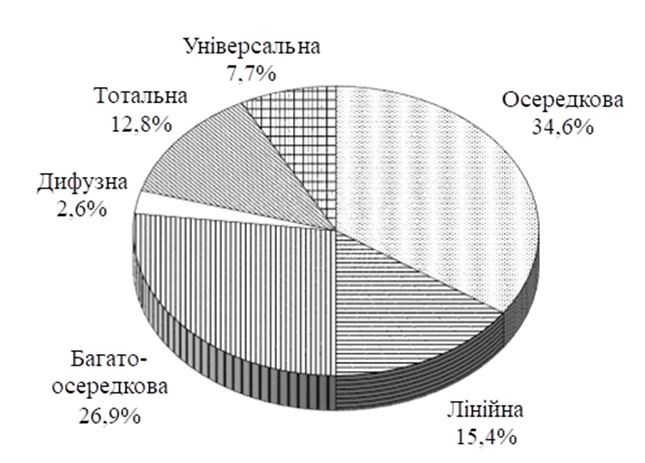 Рисунок 3.1 – Розподіл хворих на ГА залежно від клінічної форми
Рисунок 3.1 – Розподіл хворих на ГА залежно від клінічної форми
Розподіл хворих на ГА залежно від статі та віку представлено в таблиці 3.1.
Особи віком від 18 до 30 років становили 30,1 %, 31–40 років – 37,2 %, 41–50 років – 23,1 %, 51-60 років і старше – 9,6 %. Із наведених даних видно, що всі пацієнти перебували в активному працездатному віці, при цьому найбільша кількість хворих припадала на вік 18-40 років. Середній вік пацієнтів становив (38,4 ± 1,6) року. Серед цих пацієнтів було 66 (42,2 %) чоловіків у віці (36,2 ± 1,20) року і 90 (57,7 %) жінок у віці (41,6 ± 2,16) року. Жінки виявилися достовірно (p <0,001) старшими.
Таблиця 3.1 – Розподіл хворих на ГА за віком та статтю
| Вік хворих, роки | Стать | Кількість | Разом | |
| абс | % | |||
| 18-30 | ч
ж |
20
27 |
47 | 30,1 |
| 31-40 | ч
ж |
26
32 |
58 | 37,2 |
| 41-50 | ч
ж |
16
20 |
36 | 23,1 |
| 51-60 | ч
ж |
4
6 |
10 | 6,4 |
| 61 і старше | ч
ж |
–
5 |
5 | 3,2 |
| Всього | 156 | 156 | 100,0 | |
Дебют ГА варіював у широких вікових межах – від 3 до 62 років. Середній вік початку патологічного процесу – (20,8 ± 2,7) року. У 36 пацієнтів (23 %) перший епізод захворювання виник у віці до 10 років, з них у 6 – до 5 років; у 34 (21,8 %) – в 11-17 років; у 38 (24,4 %) – у 18-30 років; у 22 (14,1 %) – у віці 31-40 років; у 18 (11,6 %) – у 41–50 років і у 8 (5,1 %) – старше 50. Таким чином, дебют у 44,8 % пацієнтів відзначено у віці 5–17 років, у 38,5 % – у період 18-40 років і у 16,7 % – старше 40.
У 33,7 % пацієнтів із багатоосередковою, ТА й УА дебют хвороби відзначено у віці до 10 років (р ≤ 0,01), у той час як осередкове облисіння площею <25 % поверхні скальпа зустрічалося тільки у 7,4 % пацієнтів із раннім дебютом (р ≤ 0,01). Осередкова форма ГА спостерігалась у 48,1 % пацієнтів із дебютом хвороби старше 30 років (р ≤ 0,004), у той час як тяжкі форми – у 17,5 % хворих з початком хвороби в цей же віковий період (табл. 3.2).
Таблиця 3.2 – Вік хворих на початку захворювання ГА
| Вік хворих на початок захворю-вання, роки | Клінічні форми | Усього | |||||
| осеред-кова | лінійна | багато-осеред-кова | ТА | УА | дифузна | ||
| До 5 | – | – | 2 | 2 | 2 | – | 6 |
| 5–10 | 4 | 3 | 14 | 5 | 4 | – | 30 |
| 11–17 | 6 | 8 | 7 | 8 | 2 | – | 34 |
| 18–30 | 17 | 5 | 6 | 6 | 2 | 2 | 38 |
| 31–40 | 10 | 2 | 2 | 4 | 2 | 2 | 22 |
| 41–50 | 13 | 3 | 1 | 1 | – | – | 18 |
| 51–60 | 3 | 1 | 2 | – | – | – | 6 |
| 60 і старше | 1 | – | 1 | – | – | – | 2 |
| Разом | 54 | 22 | 36 | 26 | 12 | 4 | 156 |
ГА має хронічний перебіг із можливими періодами повної ремісії та відновленням волосся, а далі з відновленням втрати волосся різного ступеня вираженості. При цьому період ремісії може досягати до 10–15 років і більше. Тому більш інформативним для дослідження є оцінка тривалості ГА не від первинного факту початку захворювання, а від останнього рецидиву (епізоду).
Аналіз тривалості захворювання показав, що 65 хворих страждали на ГА до 6 місяців, 47 – мали тривалість від 6 місяців до 1 року, у 30 – тривалість захворювання відзначалася від 1 до 5 років і у 14 – понад 5 років (таблиця 3.3). Тривалість захворювання становила в середньому (9,8 ± 2,7) місяця з діапазоном від 2 тижнів до 10 років.
При цьому кількість рецидивів ГА спостерігалося від 1 до 8 протягом захворювання. У 58,5 % пацієнтів зустрічалося до 3 рецидивів. Пацієнти з ТА, УА та багатоосередковою формами захворювання достовірно частіше мали більше 2 рецидивів протягом життя (64,2 % хворих) (р ≤ 0,01).
Таблиця 3.3 – Тривалість захворювання
| Тривалість захворювання | Кількість пацієнтів, абс. (%) |
| До 6 місяців | 65 (41,7 %) |
| Від 6 місяців до 1 року | 47 (30,2 %) |
| Від 1 до 5 років | 30 (19,2 %) |
| Понад 5 років | 14 (8,9 %) |
Вивчення анамнезу дозволило встановити у деяких хворих на ГА фактори, які передували (можливо, провокували) розвиток дерматозу. 51 (32,7 %) пацієнт вказував на стрес як провокуючий фактор розвитку ГА. Зв’язок виникнення захворювання з атопічними і автоімунними захворювання (автоімунний тиреоїдит, вітиліго, атопічний дерматит тощо) відзначено 26 (16,7 %) пацієнтами. Дебют алопеції у 14 (8.9 %) хворих пов’язувався з ендокринними змінами (пологи, менопауза), у 12 (7,7 %) – з вакцинацією (протигрипозна вакцина, вакцинація від гепатиту В). 8 (5,1 %) хворих вказували в якості причини ГА інфекційні захворювання (гостре респіраторне захворювання, пневмонію та ін.). Причину виникнення захворювання ні з чим не пов’язували 45 (28,8 %) хворих. Сімейний характер захворювання відзначили 28 (17,9 %) пацієнтів.
Усі хворі були обстежені суміжними спеціалістами, супутні захворювання виявлено у 86 (52,1 %) пацієнтів із ГА. Розподіл за нозологічними формами у хворих на ГА наведено в табл. 3.4. Прояви атопії, включаючи атопічний дерматит, алергічний риніт і бронхіальну астму, діагностувались у 32 (20,5 %) пацієнтів із ГА, у той час як контактний дерматит і екзему – у 8 (5,1 %). У 16 (10,2 %) і 12 (7,69 %) пацієнтів відповідно спостерігалися гіперліпідемія і гіпертензія.
Психологічні порушення за типом тривожного розладу, депресії і порушення сну виявлено у 75 (48,0 %) пацієнтів, з них 38 пацієнтів з багатоосередковою, ТА і УА. Анемія і залізодефіцитні стани зустрічалася у 24 (15,4 %) хворих.
Таблиця 3.4 – Супутня патологія у хворих на ГА
| Супутні захворювання | Клінічні форми | Усього | |||||
| Осеред-кова | Лінійна | Багато-осередкова | Тоталь-на | Універ-сальна | Дифуз-на | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Атопія | – | 10 | 8 | 10 | 5 | – | 32 |
| Алергічні захворювання шкіри | – | 2 | 2 | 4 | – | – | 8 |
| Гіпертонічна хвороба | 6 | 2 | 3 | 4 | 1 | – | 16 |
| Гіперліпідемія | 6 | – | – | 4 | 2 | – | 12 |
| Психологічні порушення за типом тривожних розладів, депресії та порушення сну | 14 | 10 | 16 | 20 | 12 | 3 | 75 |
| Анемія та залізодефіцитні стани | 10 | 2 | 4 | 5 | 2 | 1 | 24 |
| Автоімунний тиреоїдит Хашимото | 16 | 4 | 12 | 3 | 4 | 1 | 32 |
| Цукровий діабет | – | – | 2 | 1 | 1 | – | 4 |
| Червоний вовчак і склеродермія | – | – | 2 | 4 | – | – | 6 |
Продовження таблиці 3.4
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Ревматоїдний артрит | – | – | 1 | 1 | – | – | 2 |
| Вітиліго | 2 | 2 | 4 | 5 | 1 | – | 14 |
| Псоріаз | 2 | – | 1 | 2 | 1 | – | 6 |
| Захворюванняшлунково-кишкового тракту | 4 | 2 | 5 | 6 | 5 | – | 22 |
| Захворювання нирок | – | 1 | 4 | 1 | – | – | 6 |
| Захворювання ЛОР-органів | – | – | 2 | 4 | – | – | 6 |
| Ендокринні порушення за типом гіпо- або гіпертиреозу | 2 | 3 | 5 | 4 | 2 | – | 18 |
| Гіперандро-генія | 3 | – | 1 | 4 | – | – | 8 |
| Злоякісні новоутворен-ня (лімфома, пухлина молочної залози) | – | – | 2 | – | – | – | 2 |
| Акне, трихотило-манія, фронтальна фіброзна алопеція | – | 1 | 2 | – | – | – | 3 |
Зв’язок з автоімунними захворюваннями відзначено у 57 (36,5 %) пацієнтів із супутньою патологією: захворювання щитоподібної залози у вигляді автоімунного тиреоїдиту Хашимото – 32 (20,5 %), цукровий діабет – 4 (2,6 %), червоний вовчак та склеродермія – 6 (3,8 %), ревматоїдний артрит – 2 (1,3 %), вітиліго – 14 (8,9 %), псоріаз – 6 (3,9 %). При цьому відзначено поєднання автоімунного тиреоїдиту і склеродермії у 1, автоімунного тиреоїдиту і вітиліго у 3, автоімунного тиреоїдиту і псоріазу у 1 пацієнта. Захворювання шлунково-кишкового тракту (хронічний гастрит і виразкова хвороба шлунка та дванадцятипалої кишки, целіакія) спостерігалися у 22 хворих (14,1 %), захворювання ЛОР-органів (гайморит) – у 6 (3,8 %.) Ендокринні порушення за типом гіпо- або гіпертиреозу зафіксовано у 18 (11,5 %) пацієнтів. У 8 (5,1 %) жінок виявлено гіперандрогенію. Злоякісні новоутворення (лімфома, пухлина молочної залози) діагностувалися у 2 (1,3 %) хворих. Інші дерматологічні захворювання у вигляді акне, трихотиломанії, фронтальної фіброзної алопеції виявлено у 3 пацієнтів (1,9 %).
У 32 (20,5 %) пацієнтів зустрічалася поєднана патологія. Наведені дані вказують на можливий вплив на перебіг ГА різноманітної моно- і поліорганної супутньої патології.
Виявлені дані демонструють високу частоту поєднання ГА з різними захворюваннями. Хвороби, пов’язані з ГА, передують або виникають на тлі розвиненого дерматозу і можуть впливати на ініціацію, характер і перебіг шкірного процесу. При ГА, як при будь-якому хронічному запальному дерматозі, створюється сприятливий ґрунт для появи інших уражень. Поєднання патології може бути обумовлено єдиною, хоча і передбачуваною причиною, патогенетичною близькістю (порушення імунної відповіді), однак незавжди вдається простежити спільні риси в механізмі розвитку захворювань [174, 263].
Власні результати узгоджуються з даними щодо високого превалювання інших імуноопосередкованих захворювань серед пацієнтів із ГА. Виявлено високі асоціації атопії і алергічних захворювань при ГА – 40 (25,6 %) пацієнтів, серед яких достовірно вищою є частота виникнення тяжких форм ГА (р ≤ 0,01). Пацієнти з ГА схильні до підвищеної частоти розвитку автоімунної патології, що пояснюється спільністю імунологічних механізмів розвитку цих захворювань. Виявлено достовірне підвищення автоантитіл до клітинних компонентів щитоподібної залози у 20,5 % хворих ГА, що дало підставу рекомендувати всіх хворих із ГА тестувати на наявність тиреоїдних автоантитіл і тиреоїдної дисфункції з метою їх своєчасного виявлення і адекватного лікування. Однак наявність автоантитіл щитоподібної залози не мало клінічної кореляції з тяжкістю ГА.
Виявлено високу психічну коморбідну патологію серед пацієнтів із ГА. «Спотворюючий ефект» дерматозу розглядається як фактор, що провокує цілий спектр «вторинних» психічних розладів. Показана достовірна залежність стану психологічних порушень за типом тривожного розладу, депресії та порушення сну від клінічної форми ГА (р ≤ 0,01) – 73 % пацієнтів з ГА мали більш тяжкі форми ГА у вигляді багатоосередкової, ТА й УА.
Імунозапальні та метаболічні порушення здатні змінювати гомеостаз і можуть сприяти розвитку таких захворювань, як дефіцитні стани, ендокринні порушення, гіперліпідемія, гіпертонія, захворювання шлунково-кишкового тракту та ін., які були виявлені у хворих на ГА.
ГА при першій появі у пацієнтів після 40 років частіше представлена осередковою формою (65,4 %), і більше половини дорослих пацієнтів із ГА мали менше 10 % ураження шкіри голови. Швидкопрогресуючий перебіг ГА з розвитком тяжких форм у вигляді багатоосередкової, ТА або УА в цьому віковому періоді був не типовим. У 2 пацієнток із злоякісними утвореннями дебют ГА у формі багатоосередкової і ТА відзначено у 62 і 54 роки відповідно. При цьому лімфома та карцинома молочної залози були діагностовані вже після дебюту ГА. Початок відростання волосся пацієнтка з лімфомою відзначила через 3 місяці після закінчення курсу променевої терапії та підтвердження ремісії. Через 8 місяців волосся відновилося. Цей факт і дані інших досліджень [225, 296] дають можливість розглядати ГА як паранеопластичний дерматоз, а також обґрунтовують проходження скринінгу на злоякісні захворювання у пацієнтів із дебютом і швидкопрогресуючим перебігом захворювання у віці 40 років і старше.
У пацієнтів із супутніми захворюваннями відзначено більш тяжкі форми ГА порівняно з хворими, які не мали соматичну патологію. Кореляційний аналіз показав зв’язок між окремими коморбідними станами і ступенем тяжкості ГА. Так позитивну кореляцію виявлено між атопією, психологічними порушеннями і тяжким перебігом ГА (р <0,01). Поширеність коморбідності у пацієнтів 18-40 років становила 26 %, серед осіб у віці старше 40 років – 56 %.
Проводився повний огляд волосяного покриву на волосистій частині голови, обличчі, тулубі, кінцівках, ділянці статевих органів і аксилярних зонах. Осередкова форма була представлена нумулярними осередками в ділянці волосистої частини голови або бороди у чоловіків. Офіазис характеризувався появою осередків облисіння в ділянці потилиці, які, зливаючись, у вигляді стрічки поширювалися в бік вушних раковин, досягаючи скронь. Інверсний (зворотній) офіазис (sisapho) – вид випадіння волосся в напрямку, протилежному офіазису (лобно-скронево-тім’яної ділянки). Багатоосередкова форма характеризувалася великими зонами ураження, що з’явилися в результаті злиття більш дрібних осередків. Для ТА характерною була повна відсутність волосся на скальпі. При УА були відсутні вже і щетинисте волосся (брови і вії), а також відзначалася часткова або повна втрата пушкового волосся на тілі. Виділяють дифузну форму ГА, яка характеризується швидким прогресуючим перебігом і великим ураження волосистої частини голови, її тяжко клінічно диференціювати з дифузною і андрогенетичною алопеціями. Клінічні форми можуть трансформуватися одна в одну, що є особливо актуальним при тяжкому перебігу захворювання.
При оцінці ступеня втрати волос на волосистій частині голови, що проводиться з використанням математичного підходу і візуальних допоміжних засобів, відзначають: втрата волосся до 25 % та 25 % відповідає осередковій формі, офіазису; 26–49 % – осередковій, багатоосередковій, офіазису, зворотньому офіазису; 50–74 % – офіазису, зворотньому офіазису, багатоосередковій, дифузній формі; 75–99 % – багатоосередковій, дифузній формі; 100 % – ТА та УА.
Дистрофії НП – симптом, наявність якого розцінюється як прогностично несприятлива ознака перебігу ГА. При огляді хворого на ГА оцінювався стан НП. Виявлено різні зміни за типом точкових втиснень, поздовжня смугастість, оніхорексис, лейконіхії та трахіоніхії у пацієнтів з різними формами захворювання.
Аналіз клінічної картини ГА в обстежених пацієнтів показав, що ураження волосистої частини голови часто поєднувалося з утратою волосся на інших ділянках шкірного покриву. У хворих з утратою волосся менше 25 % не спостерігалося жодних додаткових клінічних симптомів. При цьому у 8 (5,1 %) пацієнтів з утратою волосся від 26–49 % виявлено часткове випадання волосся на тілі і у 7 (4,5 %) – зміна НП, одночасно обидві ознаки – у 2 (1,3 %). Відзначено повне випадання волосся на тілі у 1 (0,6 %) хворого з офіазисною формою захворювання (22 % втрати волосся). Втрата волосся на голові від 50 % до 74 % супроводжувалася облисінням на інших ділянках – у 12 (7,8 %) і у 10 (6,4 %) – зміною НП, поєднанням з ураженням волосся на тілі та оніходистофією – у 5 (3,2 %) обстежених. При втраті волосся на голові від 75 % до 99 % часткове випадання волосся на тілі виявлено у 12 пацієнтів (7,8 %), зміна НП – у 12 (7,8 %), при цьому у 6 (3,8 %) хворих спостерігалося поєднання цих ознак. У пацієнтів з ТА волосся на інших ділянках було відсутнім повністю у 6 (3,9 %), а поєднання даної ознаки зі зміною НП спостерігалося у 5 (2,4 %) пацієнтів. У 2 хворих з УА і 2 з ТА відзначено ураження всіх нігтів за типом трахіоніхії.
У клініці ГА відзначалися стадії, що послідовно змінювали одна одну. Тривалість хвороби незавжди корелювала з її активністю. В активній (прогресуючій) стадії характерним є посилене випадіння волосся з розширенням меж осередку облисіння і можливістю визначення патогномонічних ознак захворювання (позитивна проба при ручній епіляції волосся або «pull test», можлива зміна кольору шкіри і симптоми у вигляді болісності, помірного свербежу, печіння, почуття «повзання мурашок» в осередку ураження, зона розхитаного волосся).
Хронічна або стаціонарна стадія характеризувалася наявністю сформованого осередку облисіння, коли розширення меж не відбувається, але зростання волосся в осередку є відсутнім. Такі пацієнти не скаржилися на суб’єктивні відчуття (на зміну чутливості шкіри в осередках облисіння). При клінічному огляді шкірні покриви в осередках облисіння були звичайного забарвлення, іноді шкіра виглядала гіпотрофічною. Зона розхитаного волосся по краю осередків у даних пацієнтів не визначалася.
У результаті успішної терапії наставала інша стадія – регресуюча (або відновлювальна), під час якої спостерігалося відростання волосся.
З активною стадією патологічного процесу спостерігалося 79 пацієнтів, з них легкий ступінь тяжкості відзначено у 34, середній і тяжкий ступені тяжкості – у 27 і 18 хворих відповідно. Хронічна стадія захворювання також діагностувалась у 77 пацієнтів, серед яких легкий ступінь перебігу ГА зустрічався у 30, середній ступінь тяжкості – у 29 і тяжкий – у 18 хворих.
3.2 Оцінка дерматотрихоскопічної картини з урахуванням стадії патологічного процесу
Виявлено дерматотрихоскопічні ознаки у 156 хворих на ГА:
- жовті точки – 82,6 %;
- чорні точки – 60,2 %;
- білі точки – 3,2 %;
- волосся у формі знака оклику – 34,4 %;
- конічне волосся – 14,2 %;
- зламане волосся – 24,5 %;
- пушкове волосся (псевдовелусне волосся) – 42,3 %;
- вузлуватий трихорексис – 4,5 %;
- монілетриксоподібне волосся – 2,1 %;
- перетяжки Поля-Пінкуса – 1,8 %.
Порівняльну дерматотрихоскопічну оцінку шкіри голови пацієнтів на різних стадіях ГА представлено в таблиці 3.5. Кількість жовтих точок не залежала від активності патологічного процесу та вони виявлялися як в активну, так і хронічну стадії ГА, що свідчить про наявність збереженого фолікулярного апарату із сальними залозами (рис. 3.2). Але відзначалась особливість при ТА та УА, коли кількість жовтих точок достовірно знижувалася майже в 2 рази порівняно з пацієнтами, у яких відсоток втрати волосся становив до 99 %. У даному випадку дерматотрихоскопічна картина збігалася з клінічною, так як у більшості хворих на ТА й УА шкіра в осередках ураження була витонченою, фолікулярний рисунок слабко виражений, часто спостерігалося просвічування розширених судин. При цьому відсутність жовтих точок у таких хворих – це прогностично несприятлива ознака для перебігу ГА та відповіді на терапію.
 Рисунок 3.2 – Жовті точки при ГА
Рисунок 3.2 – Жовті точки при ГА
Таблиця 3.5 – Порівняльна дерматотрихоскопічна оцінка шкіри голови пацієнтів на різних стадіях ГА
| Хворі з різними клінічними формами/ стадія патологічного процесу | Дерматотрихоскопічні маркери ГА | |||
| Жовті
точки |
Волосся у вигляді знака оклику, конічне волосся |
Чорні
точки |
Псевдовелус | |
| Осередкова:
активна, n=28 хронічна, n=26 |
21,5 ± 6,4
19,8 ± 5,4 |
4,4 ± 0,6
1,2 ± 0,2 |
3,3 ± 0,7
0 |
0
6,3 ± 1,2 |
| Лінійна, дифузна:
активна, n= 16 хронічна, n=12 |
26,3 ± 7,2
25,7 ± 6,3 |
4,7 ± 0,8
1,8 ± 0,6 |
3,9 ± 0,3
1,2 ± 0,6 |
0
8,6 ± 2,2 |
| Багатоосередкова:
активна, n=20 хронічна, n=22 |
32,8 ± 8,6
29,1 ± 5,2 |
4,8 ± 0,5
1,4 ± 0,2 |
5,9 ± 0,8
1,3 ± 0,5 |
0
7,3 ± 1,6 |
| ТА й УА:
активна, n=15 хронічна, n=17 |
21,4 ± 7,2
12,4 ± 2,6 |
0
0 |
3,9 ± 0,3
0 |
0
1,8 ± 0,2 |
Кількість дистрофічного волосся у вигляді знаку оклику і конічного волосся була найбільшою при активній стадії ГА у хворих з усіма типами ураження, крім ТА й УА, і достовірно знижувалася в 3,6–2,4 раза при хронічному перебігу захворювання (рис. 3.3).
Чорні точки візуалізувалися при всіх формах ГА в активну стадію і достовірно зменшувалися в 4,5–3,2 раза або були зовсім відсутні при хронізації процесу (рис. 3.4). Псевдовелусне волосся було відсутнім у хворих із прогресуванням захворювання, з’являлося у хронічну стадію (рис. 3.5). Інші трихоскопічні ознаки ГА не корелювали ні з типом випадіння волосся, ні зі стадією патологічного процесу.
 Рисунок 3.3 – Волосся у вигляді знака оклику при ГА
Рисунок 3.3 – Волосся у вигляді знака оклику при ГА
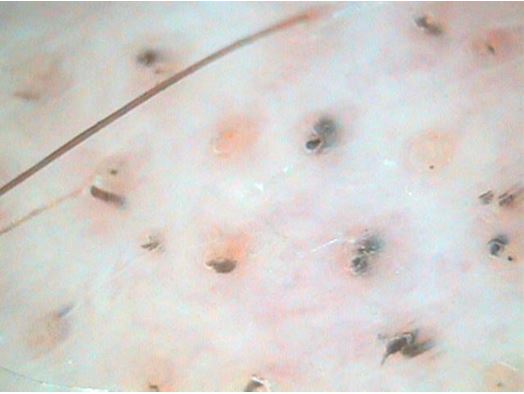 Рисунок 3.4 – Чорні точки, кадаверизоване волосся при ГА
Рисунок 3.4 – Чорні точки, кадаверизоване волосся при ГА
За визначенням ІТГА у хворих на ГА встановлено: легкий ступінь тяжкості у 41,0 %, середній та тяжкий ступінь тяжкості у 35,9 % та 23,1 % пацієнтів відповідно (табл. 3.6).
Дуже складно прогнозувати перебіг ГА, тому пошук факторів ризику захворювання є актуальним. Для визначення факторів ризику тяжкого перебігу ГА були проаналізовано наступні фактори: стать (жіноча / чоловіча), зміна НП (присутня / відсутня), утрата волосся на ділянках шкірного покриву крім волосистої частини голови (присутня / відсутня), атопія (присутня / відсутня), автоімунні захворювання (присутні / відсутні), вік хворого на початок захворювання (до 17 років/після 17 років), тривалість (≥1 року / <1 року), жовті точки (відсутні/присутні).
Рисунок 3.5 – Псевдовелусне волосся при ГА
Таблиця 3.6 – Розподіл хворих на ГА залежно від ІТГА
| ІТГА, бали | Кількість пацієнтів, абс. (%) |
| 1-12 | 64 (41,0 %) |
| 13-25 | 56 (35,9 %) |
| 26-44 | 36 (23,1 %) |
| Всього | 156 (100 %) |
За допомогою логістичного регресійного аналізу виявлено статистично значущі фактори ризику розвитку тяжкого перебігу ГА, до яких належать: жіноча стать, наявність дистрофічних нігтів, атопії, автоімунних захворювань, утрата волосся на ділянках шкірного покриву при ураженні волосистої частини голови до 50 % , тривалість хвороби більше 1 року або 1 рік, вік хворого на початок захворювання до 17 років, відсутність жовтих точок при дерматотрихоскопії. (табл. 3.7).
Таблиця 3.7 – Фактори ризику тяжкого перебігу ГА
| Фактори ризику | OR | 95 % CI | p-value |
| Стать (жіноча) | 1,844 | 1,335 ~ 2,568 | <0,001 * |
| Зміна нігтів (присутня) | 3,615 | 2,176 ~ 5,342 | <0,001 * |
| Утрата волосся на ділянках шкірного покриву крім волосистої частини голови (присутня) | 1.985 | 1.315 ~ 2.884 | <0.001 * |
| Атопія (присутня) | 1,911 | 1,482 ~ 2,625 | <0,001 * |
| Автоімунні захворювання (присутні) | 1,708 | 1,143 ~ 2,314 | 0,03 * |
| Вік хворого на початок захворювання (до 17 років) | 2,237 | 1,342 ~ 3,365 | <0,001 * |
| Тривалість (≥1 року) | 2 975 | 1 658 ~ 3 734 | <0,001 * |
| Жовті точки (відсутні) | 1,611 | 1,124 ~ 2,158 | 0,03 * |
Примітка. * р<0,05 – статистично значиме
Приклад. Пацієнтка Н., 28 років, скарги на випадання волосся на волосистій частині голови і по тілу. Зазначає перший осередок алопеції діаметром до 5 см у 12 років, коли після зовнішньої терапії волосся відновилося через 6-8 місяців. Інтенсивне випадіння волосся помітила 6 місяців тому, коли з’явився осередок алопеції в тім’яній ділянці, що збільшувався в розмірах. Близько 3 місяців назад відмітила випадіння волосся на шкірі кінцівок, зміну нігтів. Можливою причиною втрати волосся вважає хронічний стрес. Анамнез без особливостей.Status localis. При огляді волосистої частини голови відзначено осередок алопеції витягнутої форми розміром 5–9 см у тім’яній ділянці (60 % втрати волосся тім’яної ділянки, що відповідає 4 балам згідно шкали оцінки ІТГА), осередок алопеції в потиличній ділянці округлої форми, 5 см у діаметрі (15 % втрати волосся потиличної ділянки, що відповідає 2 балам згідно шкали оцінки ІТГА).
Шкіра в осередках не змінена. При проведенні «pull test» визначалося випадання волосся більше 20 % у потиличній ділянці – різко позитивний (3 бали згідно шкали оцінки ІТГА) і 15 % – у тім’яній ділянці (2 бали згідно шкали оцінки ІТГА). Дерматотрихоскопія: порожні вустя ВФ у поєднанні з жовто-коричневим забарвленням – жовті точки, кадаверизоване волосся у вигляді чорних точок у великій кількості, волосся у вигляді знаку оклику в усіх осередках (≥50 %) (3 бали згідно шкали оцінки ІТГА).
Визначалися осередки алопеції на шкірі гомілок, стегон і передпліч (2 бали згідно шкали оцінки ІТГА), оніходистрофія двох НП на правій руці за типом койлоніхії і лейконіхії (2 бали згідно шкали оцінки ІТГА). Діагноз: ГА, осередкова форма, активна стадія.
ІТГА. Підрахунок:БВВ (П) = (P+Т)ЧSЧ0,18 = 0 – дана ділянка не залучена до патологічного процесу;
БВВ (Л) = (P+Т)ЧSЧ0,18 = 0 – дана ділянка не залучена до патологічного процесу;
БВВ (В) = (P+Т)ЧSЧ0,40 = (3+3)Ч4Ч0,40 = 9,6;
БВВ (З) = (P+Т)ЧSЧ0,24 = (2+3) Ч2Ч0,24 = 2,4;
Загальний БВВ = БВВ (П) + БВВ (Л) + БВВ (В) + БВВ (П) = 0+0+9,6+2,4=12
ІТГА = Загальний БВВ + В + N = 12 + 2 + 2 = 18.
Даний показник відповідає середньому ступеню тяжкості ГА, враховує не тільки площу ураження волосистої частини голови, а й ступінь активності патологічного процесу, зміну НП і втрату волосся на тілі. Отриманий показник свідчить про прогностично несприятливий перебіг осередкової форми ГА і є критерієм для призначення препаратів системної дії.
Клінічний випадок 1.
Пацієнтка К., 23 років, мешканка м Харків, звернулася зі скаргами на випадання волосся на волосистій частині голови, висипання на шкірі.
Анамнез життя. Росла і розвивалася відповідно до віку. Шкідливих звичок немає. Сімейний дерматологічний анамнез без особливостей. Непереносимості лікарських препаратів не відмічає.
Анамнез захворювання. Вважає себе хворою з 13 років, коли вперше з’явилися висипання на шкірі тулуба, в ділянці ліктьових суглобів і був установлений діагноз псоріаз. На тлі терапії дерматоз регресував, відзначалися поодинокі псоріатичні елементи на шкірі в ділянці верхніх кінцівок протягом тривалого часу. Близько 8 років тому відзначила інтенсивне випадання волосся на волосистій частині голови. Пацієнтці було встановлено діагноз гніздова алопеція, тотальна форма. Протягом року ріст волосся повністю відновилося. У квітні місяці у хворої спостерігалося загострення псоріатичного процесу після сильного стресу, що проявилося множинними висипаннями на шкірі кінцівок, тулуба і волосистої частини голови, у зв’язку з чим отримувала місцеві кортикостероїди і традиційну терапію. У червні з’явилися скарги на осередкове випадання волосся на голові, з приводу чого звернулася на консультацію.
Дерматологічний статус. На шкірі тулуба, в ділянці ліктьових суглобів є поодинокі еритематозно-сквамозні висипання. На шкірі волосистої частини голови в потиличній ділянці, на межі росту волосся в ділянці чола, за вухами спостерігаються псоріатичні бляшки світло-рожевого кольору, з невираженою інфільтрацією і лущенням. На шкірі тім’яної ділянки визначається осередок алопеції, розміром 3 × 3 см, з чіткими кордонами, вільний від висипань (рис. 3.6). Відзначається зона розхитаного волосся по периферії осередку. Тест натягу волосся в цій зоні позитивний. НП не змінені.
Дерматотрихоскопія. В осередку алопеції виявлено «жовті точки» і волосся у вигляді знаку оклику, які є специфічними стигмами ГА. У місцях псоріатичних висипань відзначалися судинні петлі (червоні точки), поодинокі жовті кірки.
Рисунок 3.6 – ГА при псоріазі волосистої частини голови
Додаткові методи дослідження. Клінічний аналіз крові, рівень цукру, показники функцій нирок і печінки, рівень заліза, феритину, гормони щитоподібної залози, автоантитіла до структур щитовидної залози в межах норми.
Встановлено діагноз: звичайний псоріаз, стаціонарна стадія; ГА, осередкова форма, активна стадія.
У серпні цього ж року спостерігалося деяке зростання волосся, а у вересні зафіксовано рецидивування еритематозно-сквамозних бляшок, які збігалися з ділянками росту волосся в осередку алопеції (рис. 3.7).
Гістологія шкіри голови. Проведена біопсія волосистої частини (взятий свіжий висипний елемент з ознаками росту волосся) з використанням 4 мм циліндричного панча. Зразок біопсії показав паракератоз, акантоз і вирости в товщу сполучної тканини, а також розширені капіляри в сосочковому шарі дерми і поверхневий периваскулярний інфільтрат лімфоцитів у верхній дермі (рис. 3.8).
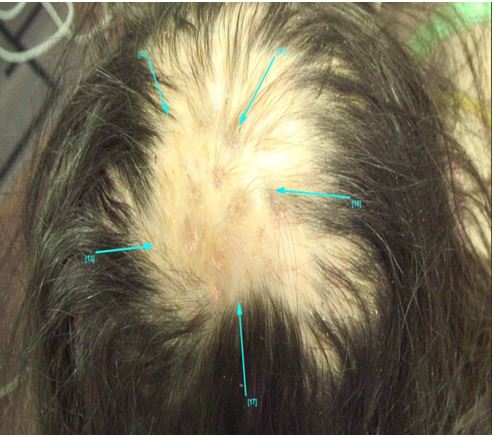 Рисунок 3.7 – Відновлення росту волоссяу свіжих псоріатичних осередках
Рисунок 3.7 – Відновлення росту волоссяу свіжих псоріатичних осередках
Рисунок 3.8 – Результати гістологічного дослідження ділянки волосистої частини голови. Забарвлення гематоксиліном та еозином, х 100
Дерматотрихоскопія. У свіжих осередках зростання волосся в осередку алопеції відзначався велус, червоні точки.
На підставі клінічного, дерматотрихоскопічного і гістологічного досліджень встановлено рецидив псоріазу волосистої частини голови в осередках ГА.
У пацієнтки діагностовано важливі риси феномена Ренбека: зменшення проявів псоріазу на волосистій частині голови при рецидиві ГА; рецидив псоріазу на волосистій частині голови при відновленні нормального росту волосся.
Клінічний випадок 2.
Пацієнтка А., 62 років, звернулася зі скаргами на випадання волосся на волосистій частині голови (рис. 3.9).
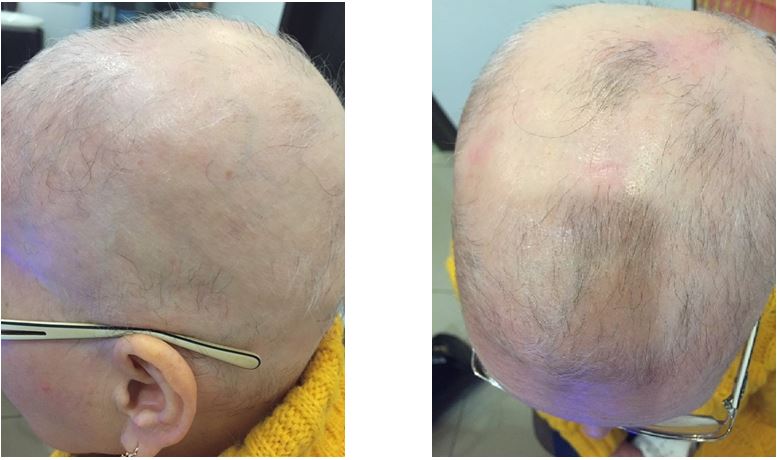 Рисунок 3.9 – Багатоосередкова форма ГА у пацієнтки 62 років
Рисунок 3.9 – Багатоосередкова форма ГА у пацієнтки 62 років
Анамнез життя. Росла і розвивалася відповідно до віку. Шкідливих звичок немає. Сімейний дерматологічний анамнез без особливостей. Зазначає хронічний гастрит, автоімунний тиреоїдит, гіпертонічну хворобу.
Анамнез захворювання. Перші ознаки випадіння волосся помітила близько трьох місяців тому, ні з чим не пов’язує. Почуттю болю в ділянці скальпа передувало випадання волосся. Лікувалася самостійно без ефекту.
Дерматологічний статус. На шкірі волосистої частини голови осередки алопеції в тім’яній, потиличній, частково скроневих ділянках, зливного характеру. Площа ураження – 62 %. Тест натягу волосся негативний.
Шкіра в осередках не змінена.
Дерматотрихоскопія. В осередках алопеції виявлено «жовті точки» і волосся у вигляді знаку оклику, які є специфічними стигмами ГА.
Гістологічне дослідження. Наявність рясного неспецифічного запального інфільтрату, який локалізувався в нижній частині ВФ. Інфільтрат складався переважно з лімфоцитів, макрофагів та інших мононуклеарних елементів, розташовувався перифолікулярно і частково навколо судин. При цьому частина запальних елементів проникала всередину кореневої зони ВФ, між епітеліальними клітинами зовнішньої і внутрішньої оболонок епітеліальної піхви кореня волоса.
Додаткові методи дослідження включали консультацію гастроентеролога, ендокринолога, клінічний аналіз крові, біохімію крові. У пацієнтки діагноз – первинна неходжкінська лімфома шлунка MALT (mucosa-associated lymphoid tissue), Helicobacter pylori позитивна, ІІ стадія – був установлений за результатами клінічного, серологічного, ендоскопічного дослідження з проведенням біопсії, комп’ютерної томографії в умовах онкологічного центру через 4 місяці після дебюту ГА.
Пацієнтка отримувала антихелікобактерну терапію і променеву терапію шлунка і перигастральних лімфатичних вузлів. Ефективність терапії оцінювалася через 3 і 6 місяців. За результатами комплексного обстеження ознак рецидиву не виявлено, досягнута повна ремісія. Початок відростання волосся пацієнтка зазначила через 3 місяці після закінчення курсу променевої терапії. Через 8 місяців волосся відновилося (рис. 3.10).
Цей факт піднімає питання про можливість розгляду ГА як паранеопластичного дерматозу, а також про те, чи повинні пацієнти старше 40 років, з дебютом у цьому віці і швидко прогресуючим перебігом ГА, проходити скринінг на злоякісні захворювання.
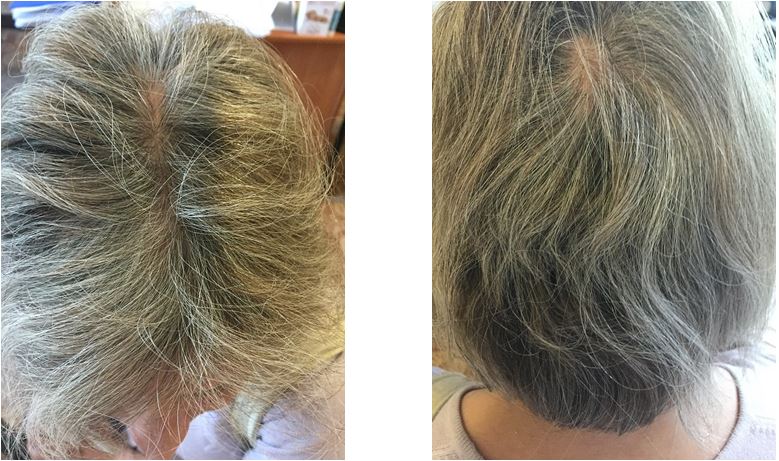 Рисунок 3.10 – Відновлення волосся через 8 міс після терапії неходжкінської лімфоми шлунка (MALT)
Рисунок 3.10 – Відновлення волосся через 8 міс після терапії неходжкінської лімфоми шлунка (MALT)
***
Таким чином, проведені клінічні дослідження дозволили констатувати, що ГА в умовах сучасної дійсності характеризується різноманітністю проявів, що обумовлено локалізацією й поширеністю патологічного процесу, характером пошкодження, стадією розвитку.
Середній вік пацієнтів становив (38,4 ± 1,6) року. Дебют ГА варіював у широких вікових межах: у 44,8 % пацієнтів відзначено у віці 5–17 років, у 38,5 % – у період 18–40 років і у 16,7 % – старше 40 років. Тривалість захворювання становила в середньому 9,8 міс. з діапазоном від 2 тижнів до 10 років. При цьому кількість рецидивів ГА визначалось від 1 до 8 протягом захворювання. Пацієнти з тяжким ступенем тяжкості захворювання достовірно частіше мали більше 2 рецидивів протягом життя (р ≤ 0,01). Як провокуючий фактор розвитку ГА найчастіше вказували стрес 32,7 % пацієнтів, а також атопічні й автоімунні захворювання – 16,3 %. Сімейний характер захворювання відзначили 17,9 % пацієнтів.
Привертає увагу висока питома вага у 55,1 % хворих супутніх захворювань. У 20,5 % пацієнтів зустрічалася поєднана патологія. Пацієнти з ГА схильні до підвищеної частоти розвитку імунозапальної патології. Виявлені дані демонструють високу частоту поєднання ГА з проявами атопії й автоімунними станами у 57,0 % пацієнтів. Інші дерматологічні захворювання (акне, трихотиломанія, фронтальна фіброзна алопеції, псоріаз та ін.) відзначино у 17,3 % пацієнтів, діагностовано феномен Ренбека. Виявлено високу психологічну коморбідну патологію за типом тривожного розладу, депресії та порушення сну серед 48 % пацієнтів із ГА. Показано поєднання ГА зі злоякісними захворюваннями у 1,3 % пацієнтів з дебютом швидкопрогресуючих багатоосередкової та ТА після 50 років, що не є типовим перебігом та дає можливість розглядати ГА як паранеопластичний дерматоз.
Відзначено часткову або повну втрату волосся на тілі у 12,2 % хворих при ГА з площею випадіння волосся до 50 % і у 32,6 % з клінічними формами ГА з площею випадіння понад 50 %. Різні зміни НП виявлено у 10,9 % пацієнтів із ГА з площею ураження до 50 % і у 33,7 % із більш поширеними формами. Поєднання різного ступеня випадіння волосся на тілі й дистрофії НП у обстежуваних хворих на ГА відзначено в 11,5 % випадків. Втрата волосся на тілі й ураження НП діагностувалися при втраті більше 25 % волосся на скальпі, і частота їхніх проявів збільшувалася в міру розширення площі ураження волосистої частини голови (р < 0,01).
З активною стадією патологічного процесу спостерігалося 50,6 % пацієнтів, з хронічною – 49,4 %. Найбільш поширеною дерматотрихоскопічною ознакою в обстежуваних пацієнтів виявлено жовті точки (82,6 %), потім чорні точки (60,2 %), дистрофічне волосся у вигляді знаку оклику та конічного (до 48,6 %) та псевдовелусне волосся (42,3 %). Кількість жовтих точок не залежала від активності патологічного процесу. Відзначалась особливість при ТА та УА, коли кількість жовтих точок достовірно знижувалася майже в двічі порівняно з пацієнтами, у яких відсоток втрати волосся становив до 99 %. Визначено достовірне збільшення кількості чорних точок, дистрофічного волосся при прогресуванні ГА, в той час, як псевдовелус був характерною ознакою при регресі, у хронічну стадію дерматозу.
Шляхом визначення ІТГА, встановлено легкий ступень тяжкості (від 1 до 12 балів) у 41,0 % хворих, середній (від 13 до 25 балів)– у 35,9 %, тяжкий (від 26 до 44 балів) – у 23,1 %.
Виявлено статистично значущі фактори ризику тяжкого перебігу ГА, до яких належать: жіноча стать (p<0,001), наявність дистрофічних НП (p<0,001), атопії (p<0,001), автоімунних захворювань (p=0,03), утрата волосся на ділянках шкірного покриву при ураженні волосистої частини голови до 50 % (p<0,001), тривалість хвороби більше 1 року або 1 рік (p<0,001), вік хворого на початок захворювання до 17 років (p<0,001), відсутність жовтих точок при дерматотрихоскопії (p=0,03).
Наведені у розділі положення висвітлені у наступних публікаціях:
- Renboek phenomenon in an alopecia areata patient with psoriasis / Y. Ovcharenko, I. Serbina, A. Zlotogorski, Y. Ramot. Int. J. Trichology. 2013. Vol. 5, Iss. 4. P. 194–195 [303].
- Сербина И.М., Овчаренко Ю.С. Оценка дерматоскопических маркеров при гнездной алопеции. Дерматовенерология. Косметология. Сексопатология. 2013. № 1–4. C. 34–38 [92].
- Сербина И.М. Оценка степени тяжести у больных гнездной алопеции. Дерматологія та венерологія. 2014. № 4. С. 34–37 [95].
- Овчаренко Ю.С., Сербина И.М., Литвиненко Б.В. Трихоскопические дифференциально-диагностические алгоритмы нерубцовых алопеций. Дерматолог. 2014. Т. 5, № 01. С. 38–42 [58].
- Сербина И.М. Коморбидность при гнездной алопеции. Дерматологія та венерологія. 2018. № 2 (80). С. 67–72 [89].
- Serbina I. Ramot Y. Pressure alopecia mimicking alopecia areata: Dermoscopy as a diagnostic aid in avoiding a potential clinical pitfall. 8th World Congress for Hair Research (WCHR 2014), May 14-17 2014, Jeju (Korea). Annals of Dermatology. 2014. Vol.26, Suppl. 1. P. 28 [315].
- Serbina I. Alopecia areata: focus on comorbidity. 11 World Congress of Hair Research : Abstract book, April 24-27, 2019, Sitges, Barselona (Spain). P.153–154 [312].
- Пат. на корисну модель 115991 UA, МПК A61B10/00, A61B5/103. Спосіб діагностики тяжкості гніздової алопеції / І.М. Сербіна, Л.А. Болотна; заявник і патентовласник Харківська медична академія післядипломної освіти. № u201608561; заявл. 04.08.16; опубл. 10.05.17, Бюл. № 9 [66].
РОЗДІЛ 4
ІМУНОМОРФОЛОГІЧНІ МЕХАНІЗМИ ФОРМУВАННЯ ГНІЗДОВОЇ АЛОПЕЦІЇ
Гістологічні та імуногістохімічні (ІГХ) дослідження демонструють наявність місцевої тканинної запальної реакції навколо ВФ, при цьому пери- та інтрафолікулярна клітинні відповіді свідчать про імунну атаку проти невідомого антигена ВФ [132]. Літературні дані, що стосуються опису патоморфологічної картини ГА, суперечливі, недостатньо повно висвітлюють характер розподілу клітин інфільтрату та їх імунний фенотип, оскільки не враховують стадію патологічного процесу. Тому метою дослідження стало вивчення морфологічних та ІГХ особливостей гострої та хронічної стадій ГА і уточнення патогенезу захворювання на підставі отриманих даних. У завдання дослідження входило визначення розподілу клітин CD4+, CD8+, CD68+, CD56+, профілів прозапальних цитокінів IL-1, IL-6, TNF-α в осередках ГА при гострій і хронічній стадіях захворювання.
Згідно даних літератури, гістологічні параметри ГА не корелюють з клініко-анамнестичними даними, такими як кількість і розмір осередків, супутня патологія та ін., а залежать тільки від тривалості захворювання і активності патологічного процесу [172, 357]. У зв’язку з цим, також було враховано тільки клінічні та дерматоскопічні параметри активності ГА та її тривалість.
При аналізі гістологічної картини шкіри волосистої частини голови при ГА зверталась увага на епідерміс, дерму і ВФ, мікроциркуляторне русло. Оцінювалися загальні морфологічні процеси при ГА, такі як наявність і розподіл запального інфільтрату, наявність склерозу, зміни епітелію фолікулів, присутність волосся у ВФ.
З активною стадією і тривалістю захворювання або поточного періоду хвороби в середньому від 2-3 тижнів до 6 міс. спостерігалися 9 пацієнтів. Хронічну стадію захворювання з тривалістю від 6 міс. до 6 років і більше констатовано у решти 9 хворих. Усі пацієнти не отримували лікування з приводу ГА протягом 6 міс. і більше.
Виявлено, що при різних стадіях ГА структурні зміни неоднорідні та представлені запально-дистрофічними процесами різного ступеня вираженості. В активній стадії ГА відзначався нерівномірно стовщений епідерміс, особливо поблизу поверхневих усть ВФ, акантоз, помірний гіперкератоз і потовщення зернистого шару до 2–3 рядів, поодинокі вакуолізовані епітеліоцити, помірний міжклітинний набряк, гіперхромія ядер базальних клітин. У дермі під епідермісом осередково виявилась помірна лімфогістіоцитарна інфільтрація з домішкою нейтрофілів, розпушення колагенових волокон, зменшення кількості капілярів, підвищена проникність судинної стінки, що супроводжувалося периваскулярним набряком (рис. 4.1).
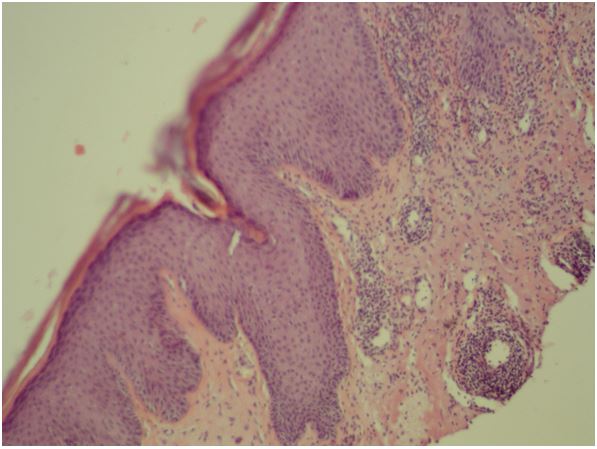 Рисунок 4.1 – Активна стадія. Потовщення епідермісу в зоні устя ВФ, акантоз, гіперкератоз, осередки запальної інфільтрації в дермі. Забарвлення гематоксиліном та еозином. Збільшення: об. 20, ок. 10.
Рисунок 4.1 – Активна стадія. Потовщення епідермісу в зоні устя ВФ, акантоз, гіперкератоз, осередки запальної інфільтрації в дермі. Забарвлення гематоксиліном та еозином. Збільшення: об. 20, ок. 10.
В осередках ураження перебували дрібні ВФ із деформацією волосяної цибулини, що відповідали IV фазі анагену або стадіям катагену, кеногену і телогену. У більшості ВФ волосся було відсутнім. В анагенових фолікулах спостерігалися множинні фрагменти волосяних стрижнів. У біоптатах шкіри, взятих у зоні розхитаного волосся, устя ВФ розширені. Однак зустрічалося дистрофічне термінальне волосся у фазі анагену, навколо якого визначався запальний інфільтрат. Зовнішні та кореневі піхви мали порушення структури з відокремленням сполучнотканинної сумки, в яких відзначалися виражені дегенеративні зміни. Епітелій цибулини волосся був з ознаками проліферації, дис- і паракератозу, нечисленними клітинами з внутрішньоклітинним набряком. Верхні шари ВФ характеризувалися відсутністю гранул кератогіаліну. Перифолікулярно визначалися лімфо-лейкоцитарні та гістіоцитарні інфільтрати. Запальна інфільтрація проникала в зовнішню кореневу піхву волосяної цибулини (рис. 4.2, 4.3).
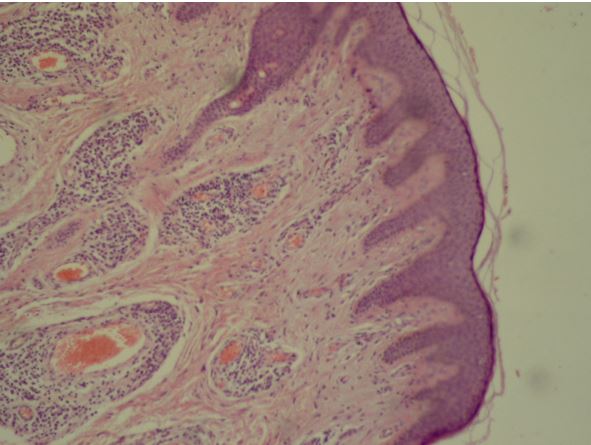 Рисунок 4.2 – Активна стадія. ВФ у стадії анагену з вираженою перифолікулярною запальною інфільтрацією. Забарвлення гематоксиліном та еозином. Збільшення: об. 20, ок. 10.
Рисунок 4.2 – Активна стадія. ВФ у стадії анагену з вираженою перифолікулярною запальною інфільтрацією. Забарвлення гематоксиліном та еозином. Збільшення: об. 20, ок. 10.
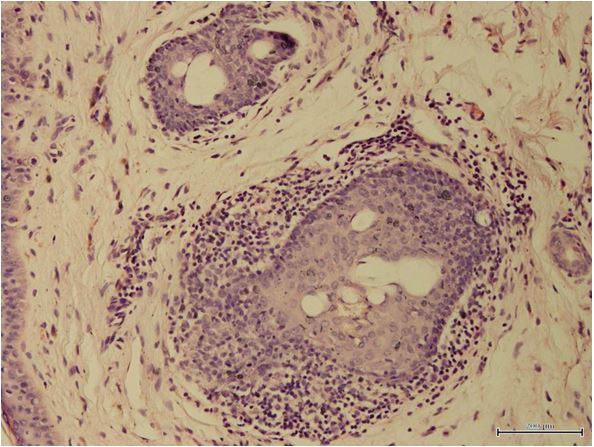 Рисунок 4.3 – Активна стадія. Проліферація епітеліоцитів деформованого ВФ; перифолікулярна запальна інфільтрація. Забарвлення гематоксиліном та еозином. Збільшення: об. 40, ок. 10.
Рисунок 4.3 – Активна стадія. Проліферація епітеліоцитів деформованого ВФ; перифолікулярна запальна інфільтрація. Забарвлення гематоксиліном та еозином. Збільшення: об. 40, ок. 10.
При аналізі біоптатів шкіри хворих із хронічною стадією ГА переважали фібропластичні та атрофічні процеси. Епідерміс також був нерівномірно стовщеним, відзначався більш виражений акантоз, пара- і гіперкератоз, проліферація епітелію базального шару. Виявлялися мізерні перифолікулярні та периваскулярні інфільтрати, що складалися з лімфоцитів, гістіоцитів і плазмоцитів, перифолікулярний і периваскулярний склероз, склероз дерми з потовщенням колагенових волокон і наявністю фіброзних тяжів, набряк дерми. Стінки більшості судин стовщені аж до облітерації судин. У рідкісних випадках спостерігалися явища ангіогенезу. Визначалося зменшення кількості ВФ, їх атрофія. У деяких ВФ виявлявся тонкий стрижень волосся, в якому меланін і меланоцити з цибулини волосся зникали (рис. 4.5, 4.6).
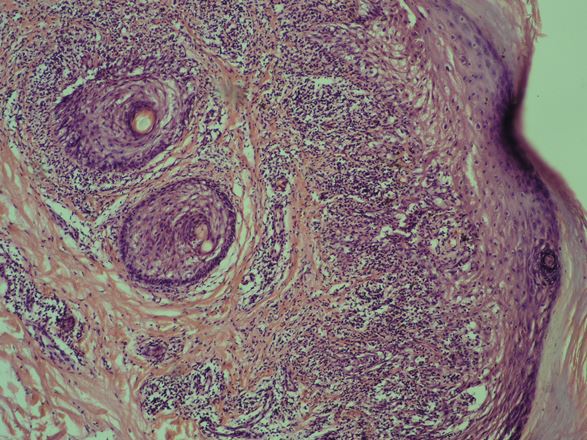 Рисунок 4.4 – Активна стадія. Проліферація епітеліоцитів ВФ; виражена перифолікулярна та дермальна запальна інфільтрація. Забарвлення гематоксиліном та еозином. Збільшення: об. 20, ок. 10
Рисунок 4.4 – Активна стадія. Проліферація епітеліоцитів ВФ; виражена перифолікулярна та дермальна запальна інфільтрація. Забарвлення гематоксиліном та еозином. Збільшення: об. 20, ок. 10
Рисунок 4.5 – Хронічна стадія. Виражений перифолікулярний склероз. Забарвлення гематоксиліном та еозином. Збільшення: об. 40, ок. 10.
Рисунок 4.6 – Хронічна стадія. Потовщений епідерміс із акантозом. Дрібні та рідкісні ВФ. Виражений склероз. Осередкова лімфогістіоцитарна і плазмоцитарна інфільтрація. Забарвлення гематоксиліном та еозином. Збільшення: об. 4, ок. 10.
За даними літератури відомо, що у шкірі здорових людей присутня невелика кількість Т-лімфоцитів і тканинних макрофагів, які, як правило, розташовуються навколо посткапілярних венул поверхневого сплетення або придатків шкіри.
У дослідженні в контрольній групі індекс співвідношення CD4/CD8 становив 1,08 ± 0,08. При цьому виявлено чітку мембранну реакцію в 5,40 ± 0.22 CD4 позитивних Т-лімфоцитів і 5,00 ± 0,31 позитивних CD8 Т-лімфоцитів (табл. 4.1).
У групі пацієнтів з активною стадією ГА в запальному інфільтраті дерми досліджуваних полів зору достовірно збільшувалася кількість CD4+ Т-лімфоцитів ([15,9 ± 0,28] клітини) і CD8+ Т-лімфоцитів ([25,7 ± 1,12] клітини) порівняно з контролем (р < 0,01). Імунорегуляторний індекс (ІРІ) становив 0,62 ± 0,08, що був достовірно нижчим за контроль (р < 0,01). CD4+ Т-лімфоцити локалізувалися розсіяно, переважно навколо фолікулів і судин, іноді в дермі під епідермісом. Цитотоксичні CD8+ Т-лімфоцити виявлялися у вигляді компактних скупчень також навколо фолікулів і судин, рідше в дермі та поодинокі клітини в міжепітеліальній зоні епідермісу. Причому більш компактна експресія CD8+ Т-лімфоцитів локалізувалася в поверхневих фолікулах, в яких були відсутні волосяні стрижні (рис. 4.7, 4.8).
Таблиця 4.1 – Кількість позитивних клітин CD4- і CD8- Т-лімфоцитів у запальному інфільтраті шкіри у хворих залежно від активності ГА та в контрольній групі і (M±m)
| Маркер | Контрольна група
n=5 |
Активна стадія ГА
n=10 |
Хронічна стадія ГА
n=8 |
| CD4 | 5,40 ± 0,22 | 15,9 ± 0,28 * | 11,5 ± 0,13 */** |
| CD8 | 5,00 ± 0,18 | 25,7 ± 1,12 * | 15,4 ± 0,19 * /** |
| CD4/CD8 | 1,08 ± 0,08 | 0,62 ± 0,08 * | 0,74 ± 0,06 * |
Примітка. * – достовірність відмінностей показників основних груп від контролю; ** – достовірність відмінностей показників між групами хворих (р < 0,01)
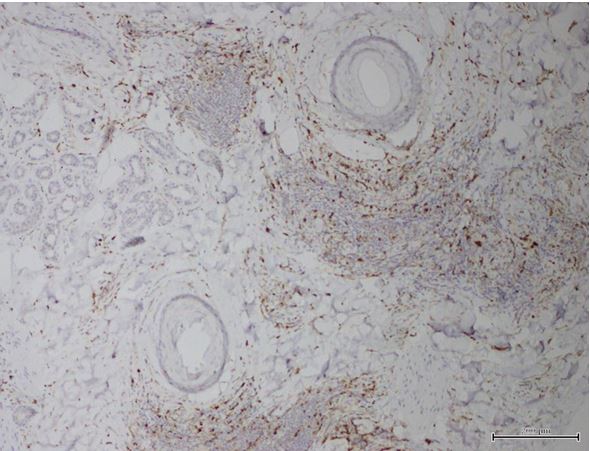 Рисунок 4.7 – Фрагмент шкіри. Активна стадія ГА. Експресія CD4 + Т‑лімфоцитів, що локалізуються перифолікулярно і периваскулярно. ІГХР. Система візуалізації FLEX. Збільшення: об. 20, ок. 10.
Рисунок 4.7 – Фрагмент шкіри. Активна стадія ГА. Експресія CD4 + Т‑лімфоцитів, що локалізуються перифолікулярно і периваскулярно. ІГХР. Система візуалізації FLEX. Збільшення: об. 20, ок. 10.
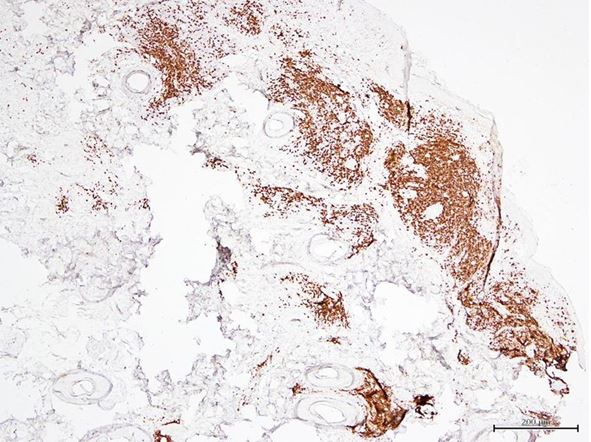 Рисунок 4.8 – Фрагмент шкіри. Активна стадія ГА. Експресія CD8+ Т-лімфоцитів, що локалізуються перифолікулярно і периваскулярно, в дермі. ІГХ реакція. Система візуалізації FLEX. Збільшення: об. 4, ок. 10.
Рисунок 4.8 – Фрагмент шкіри. Активна стадія ГА. Експресія CD8+ Т-лімфоцитів, що локалізуються перифолікулярно і периваскулярно, в дермі. ІГХ реакція. Система візуалізації FLEX. Збільшення: об. 4, ок. 10.
При хронічній стадії ГА аналіз експресії маркерів лімфоцитів показав достовірне зниження показників кількості позитивних CD4+ і CD8+ Т-лімфоцитів порівняно з показниками в активній стадії ГА – 11,5 ± 0,13 (CD4+) і 15,4 ± 0,19 (CD8+) позитивних клітин (р < 0,01). При цьому ІРІ збільшився порівняно з показником в активній стадії та становив 0,74 ± 0,06. Однак відмінності були недостовірними (р > 0,05).
Експресія CD56+ виявлялася здебільшою в запальному інфільтраті при активній стадії ГА (рис. 4.9). Найбільша кількість позитивних CD56+ клітин у зоні запального інфільтрату спостерігалася поблизу збережених фолікулів, і менша – поблизу пошкоджених фолікулів, що становила в середньому (10,12 ± 2,42) позитивних клітин. Інтенсивність цитоплазматичного забарвлення розцінювалась як слабка (рис. 4.10, 4.11). При хронічній стадії ГА кількість позитивних CD56+ клітин достовірно зменшувалася (5,36 ± 0,74) порівняно з активною стадією (р < 0,01), але була вищою, ніж у групі контролю (0,8 ± 0,28). Відзначалася слабка реакція на епітелії та більш інтенсивна в нервових стовбурах.
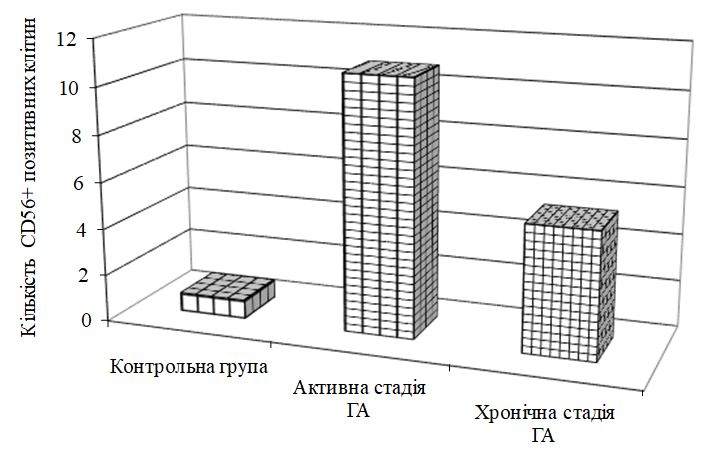 Рисунок 4.9 – Рівень експресії CD56+ у запальному інфільтраті шкіри
Рисунок 4.9 – Рівень експресії CD56+ у запальному інфільтраті шкіри
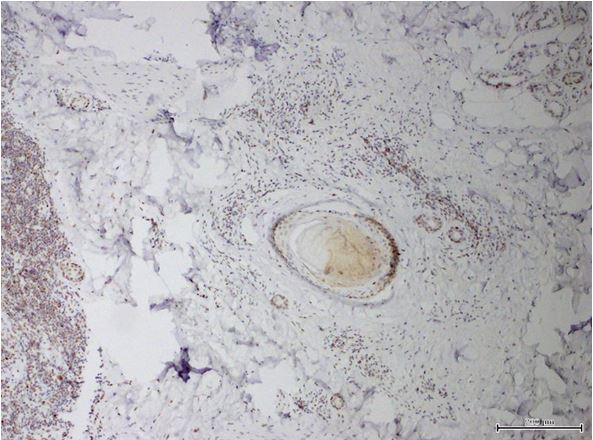 Рисунок 4.10 – Фрагмент шкіри. Активна стадія ГА. Експресія CD56 у клітинах запального інфільтрату поблизу збереженого ВФ. ІГХ реакція. Система візуалізації FLEX. Збільшення: об. 20, ок. 10.
Рисунок 4.10 – Фрагмент шкіри. Активна стадія ГА. Експресія CD56 у клітинах запального інфільтрату поблизу збереженого ВФ. ІГХ реакція. Система візуалізації FLEX. Збільшення: об. 20, ок. 10.
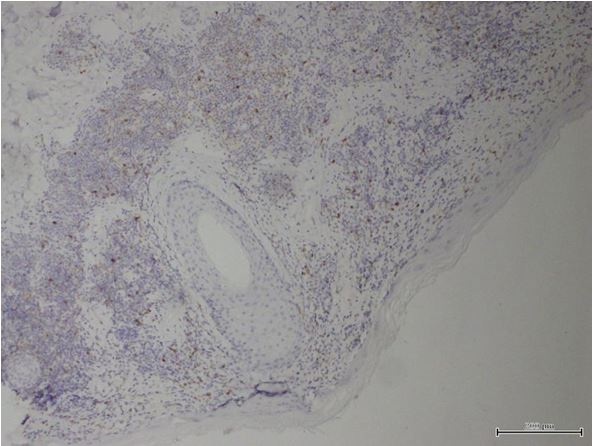 Рисунок 4.11 – Фрагмент шкіри. Активна стадія ГА. Експресія CD56 у клітинах запального інфільтрату поблизу пошкодженого ВФ. ІГХР. Система візуалізації FLEX. Збільшення: об. 40, ок. 10.
Рисунок 4.11 – Фрагмент шкіри. Активна стадія ГА. Експресія CD56 у клітинах запального інфільтрату поблизу пошкодженого ВФ. ІГХР. Система візуалізації FLEX. Збільшення: об. 40, ок. 10.
З метою детального вивчення рівня та якості макрофагального компонента запального інфільтрату в шкірі хворих на ГА проведено ІГХ реакцію з маркером макрофагальної генерації – CD68+. При аналізі ІГХ реакцій у біоптатах шкіри макрофаги розташовувалися розсіяно в межах запального інфільтрату, шикувалися ланцюжком по базальному шару фолікулярного епітелію, поодинокі макрофаги з’являлися в міжепітеліальній зоні. CD68+ клітини характеризувалися гранулярним забарвленням цитоплазми, мали різні розміри, переважно великі з вираженим інтенсивним забарвленням цитоплазми (рис. 4.12). При активній стадії ГА кількість CD68+ макрофагів становила 29,46 ± 4,32 (рис. 4.13). При хронічній стадії ГА кількість макрофагів зменшувалася, знижувалася інтенсивність забарвлення цитоплазми та її гранулярність. Кількість CD68+ макрофагів становила 16,64 ± 2,36. Показники за активної та хронічної стадій були достовірно змінені відносно контролю і між групами (р < 0,01).
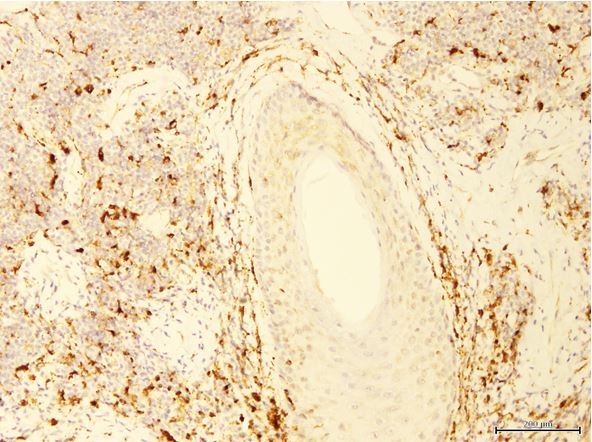 Рисунок 4.12 – Фрагмент шкіри. Активна стадія ГА. Експресія CD68 у клітинах запального інфільтрату поблизу пошкодженого ВФ. ІГХР. Система візуалізації FLEX. Збільшення: об. 40, ок. 10.
Рисунок 4.12 – Фрагмент шкіри. Активна стадія ГА. Експресія CD68 у клітинах запального інфільтрату поблизу пошкодженого ВФ. ІГХР. Система візуалізації FLEX. Збільшення: об. 40, ок. 10.
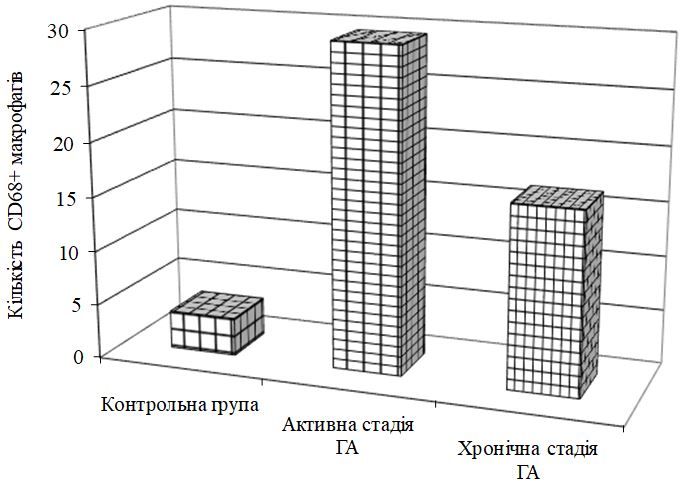 Рисунок 4.13 – Рівень експресії CD68+ макрофагів у запальному інфільтраті шкіри
Рисунок 4.13 – Рівень експресії CD68+ макрофагів у запальному інфільтраті шкіри
Експресія TNF-α при активній стадії становив (6,68 ± 0,57) клітини в досліджуваних полях зору і (4,22 ± 0,36) клітини при хронічній стадії ГА (рис. 4.14). Ці дані статистично достовірно відрізнялися відносно контролю ([1,10 ± 0,29] клітини) і між групами (р < 0,01) (рис. 4.15).
Рисунок 4.14 – Рівень експресії прозапальних цитокінів TNF-a, IL-1 та IL-6 у запальному інфільтраті шкіри
При аналізі експресії з маркером IL-1 також відзначалася цитоплазматична експресія в макрофагах і лімфоцитах при активній стадії ГА (рис. 4.16). При цьому кількість IL-1 становила (3,81 ± 0,42) клітини в досліджених полях зору. Експресія IL-1 при хронічній стадії – (2,16 ± 0,30) клітини. Обидва показники були достовірно відмінними від показника в контрольній групі ([0,70 ± 0,08] клітини) (р < 0,01) і недостовірно відрізнялися між собою (р > 0,05).
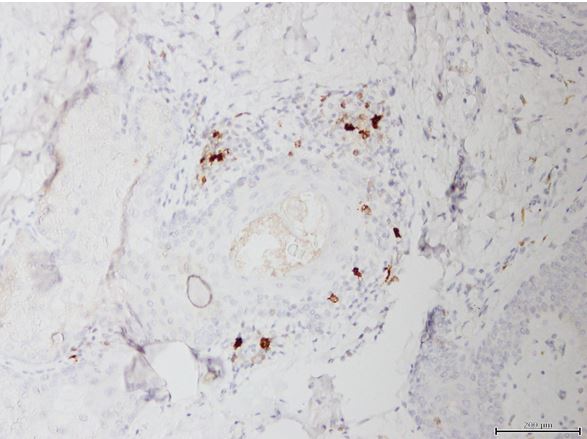 Рисунок 4.15 – Фрагмент шкіри. Активна стадія ГА. Експресія TNF-α у клітинах запального інфільтрату поблизу пошкодженого ВФ. ІГХР. Система візуалізації FLEX. Збільшення: об. 40, ок. 10.
Рисунок 4.15 – Фрагмент шкіри. Активна стадія ГА. Експресія TNF-α у клітинах запального інфільтрату поблизу пошкодженого ВФ. ІГХР. Система візуалізації FLEX. Збільшення: об. 40, ок. 10.
 Рисунок 4.16 – Фрагмент шкіри. Активна стадія ГА. Експресія IL-1 у клітинах запального інфільтрату поблизу пошкодженого ВФ. ІГХР. Система візуалізації FLEX. Збільшення: об. 20, ок. 10.
Рисунок 4.16 – Фрагмент шкіри. Активна стадія ГА. Експресія IL-1 у клітинах запального інфільтрату поблизу пошкодженого ВФ. ІГХР. Система візуалізації FLEX. Збільшення: об. 20, ок. 10.
Подібна ІГХ картина спостерігалася при аналізі мікропрепаратів з маркером IL-6, який при активній стадії ГА проявлявся цитоплазматичним забарвленням макрофагів і лімфоцитів і становив (4,48 ± 0,41) клітини, що вірогідно вище (р < 0,01), ніж при хронічній стадії – (2,62 ± 0,34) клітини (рис. 4.17). Дані показники достовірно (р < 0,01) відрізнялися від контролю ([1,30 ± 0,08] клітини).
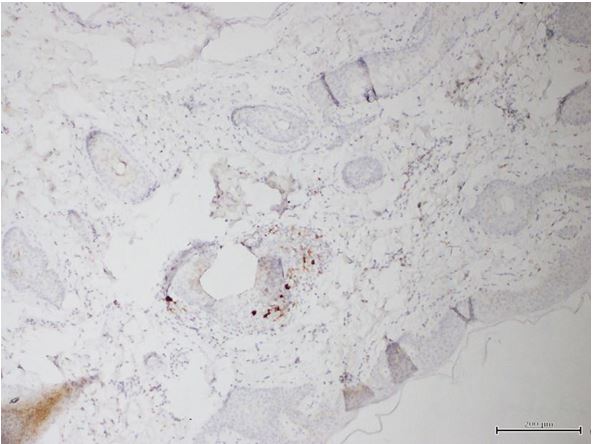 Рисунок 4.17 – Фрагмент шкіри. Активна стадія ГА. Експресія IL-6 у клітинах запального інфільтрату поблизу пошкодженого ВФ. ІГХР. Система візуалізації FLEX. Збільшення: об. 20, ок. 10.
Рисунок 4.17 – Фрагмент шкіри. Активна стадія ГА. Експресія IL-6 у клітинах запального інфільтрату поблизу пошкодженого ВФ. ІГХР. Система візуалізації FLEX. Збільшення: об. 20, ок. 10.
ГА характеризується порушенням циклу росту ВФ: запальні клітини (CD8+ Т-клітини, CD68+, NK-клітини та ін.), атакують анагенові ВФ. Збільшення кількості запальних клітин навколо ВФ призводить до їх мініатюризації та скорочення циклу росту волосся з переходом у кеноген. Ступінь вираженості інфільтрату корелювала з гостротою патологічного процесу і мала більш виражений характер у зразках з активною стадією ГА. При хронічній стадії ГА переважали фібропластичні та місцями атрофічні процеси. Крім фібробластів важливу роль у процесах фіброгенезу відіграють і макрофаги, одні з основних цитокінпродукуючих клітин організму. В основі патогенезу раннього фіброзування може полягати неконтрольована імунна відповідь, пов’язана з гіперцитокінемією.
При хронічному запаленні у хворих на ГА основну роль відіграють імунокомпетентні клітини, такі як CD68+ з домішкою поодиноких лімфоцитів CD8+. При активності ГА збільшувалася кількість CD8+ цитотоксичних Т-лімфоцитів у шкірі пацієнтів. За даними ІГХ аналізу, активовані CD8+ Т-клітини проникали у ВФ, у той час як CD4+ Т‑клітини майже виключно розташовані в перифолікулярній ділянці, що може бути причиною порушення росту волосся. Співвідношення CD4/CD8 вірогідно знижувалося відносно контролю, що пояснює зниження місцевого клітинного імунітету в осередку ураження. Крім того, підвищена кількість макрофагів у запальному інфільтраті шкіри свідчить про наявність імунної відповіді та персистенції хронічного запалення, що може бути діагностичним маркером не тільки класичних проявів ГА, а й мати значення при оцінці ефективності лікування.
Поодинокі NК-клітини спостерігалися навколо здорових анагенових ВФ, фолікули в осередках пошкодження при ГА демонстрували видимі скупчення CD56+. Слід відзначити виражену наявність позитивних NК‑клітин у запальному інфільтраті при активній стадії ГА.
Високий вміст лімфоцитів CD8+ за рахунок кооперації з Т‑хелперами (CD4+), макрофагами формує опосередковану Т-клітинами цитотоксичну імунну відповідь, асоційовану з NК-клітинами. Запальний лімфогістіоцитарний інфільтрат розташовується не тільки навколо ВФ, але може проникати всередину клітин волосяної цибулини і оточувати судини, що відображає морфогенез автоімунного запалення. Імунний цитоліз клітин ВФ здійснюється не тільки за рахунок Т-лімфоцитів, а й прозапальних цитокінів, таких як TNF-α, IL-1 і IL-6. TNF-α – сильний індуктор апоптозу, пригнічує проліферацію кератиноцитів. Цитокіни в даний час можуть розглядатися як медіаторна ланка у формуванні патофізіологічної стадії автоімунних реакцій при ГА, порушуючи механізми підтримки стану імунотолерантності структур ВФ. Досліджувані цитокіни продукуються клітинами як лімфогістіоцитарного інфільтрату, так і ВФ при їх імунному пошкодженні.
***
Таким чином, узагальнюючи дані морфологічного дослідження з використанням ІГХ з метою встановлення фенотипу клітин запального інфільтрату і реакції прозапальних цитокінів, можна стверджувати, що зміни в осередку запалення залежать від стадії патологічного процесу. В активну стадію захворювання визначається масивний запальний інфільтрат з переважанням цитотоксичних Т‑лімфоцитів (збільшення CD8+ – в 5,1, CD4+ – в 2,9, CD56+ – 12,7, CD68+ – в 7,3 раза відносно значення в групі контролю) і підвищеним вмістом прозапальних цитокінів (збільшення IL-1 – в 5,4 , IL-6 – в 3.4 та TNF-α – 6,1 раза відносно значення в групі контролю). Навпаки, у хронічну стадію ГА спостерігався мінімальний ступінь клітинної відповіді у вигляді зменшення запального інфільтрату і перерозподілу клітин інфільтрату (зменшення CD8+ – в 1,7 і CD4+ – в 1,4 раза відносно значень в активну стадію) з переважанням фібробластичних і гістіоцитарних елементів. Вміст прозапальних цитокінів Th-1 в хронічну стадію ГА також достовірно знижувався. Ці зміни відображають зміну запальної реакції в осередку ГА на репаративні та склеротичні механізми. Відсутність єдиної думки про причини появи і закономірності перебігу ГА робить актуальною проблему вивчення ланок патогенезу цього дерматозу, оскільки отримані дані дозволяють розробити патогенетичні підходи терапії з урахуванням стадії патологічного процесу.
Наведені у розділі положення висвітлені у наступних публікаціях:
- Сербіна І.М. Імуноморфологічні особливості формування гніздової алопеції. Дерматологія та венерологія. 2016. № 3 (75). С. 52–60 [77].
РОЗДІЛ 5
ЦИТОКІНОВИЙ ПРОФІЛЬ ТА РІВЕНЬ БІЛКА ТЕПЛОВОГО ШОКУ У ПАЦІЄНТІВ З ГНІЗДОВОЮ АЛОПЕЦІЄЮ
Імунозапальні процеси становлять основу патогенезу широкого спектру захворювань. За сучасними уявленнями, характер імунної відповіді залежить від переважної активації певних субпопуляцій Т-лімфоцитів, які мають здатність синтезувати цитокіни різних типів. Провідну роль у патогенезі ряду автоімунних захворювань, як відомо, відіграє імунна відповідь, що розвивається за Тh1-типом [318]. Реалізація автоімунного запалення не обмежується активністю тільки прозапальних цитокінів і пов’язана з продукцією протизапальних цитокінів, що протидіють їх впливу, в тому числі IL-4, IL-10, вміст яких на певному етапі визначає прогноз запалення, ступінь його прогресії [334]. Аналіз отриманих останнім часом даних показав, що позаклітинний HSP-70 має безліч функцій, найважливіша з яких імуномодуляторна [23].
Дані літератури з вивчення цитокінового профілю пацієнтів із ГА суперечливі. Дискусійність механізмів розвитку, відсутність однозначних даних про імунопатологічні процеси є підставою для подальшого вивчення ролі цитокінів, у тому числі ІL-17, HSP-70 у патогенезі ГА.
5.1 Визначення стану цитокінів в залежності від ступеня тяжкості, активності та тривалості гніздової алопеції
Як показали дослідження, рівень прозапальних цитокінів ІL-1β, ІL-17 у сироватці крові хворих на ГА ([3,98 ± 0,88] і [5,58 ± 1,42] пг/мл, p < 0,01) був підвищеним порівняно з даними, отриманими в контрольній групі ([1,87 ± 0,55] пг/мл і [2,72 ± 0,75] пг/мл відповідно). У той же час рівень протизапального ІL-4 мав лише тенденцію до зниження ([1,48 ± 0,35] пг/мл, р > 0,05), а вміст ІL-10 ([2,85± 0,58] пг/мл, р < 0,05) достовірно зменшувався ніж їх значення у групі контролю ([1,71 ± 0,34] і [3,97 ± 1,02] пг/мл відповідно) (рис. 5.1).
 Рисунок 5.1 – Рівень ІL-1β, ІL-4, ІL-10, ІL-17 у хворих на ГА
Рисунок 5.1 – Рівень ІL-1β, ІL-4, ІL-10, ІL-17 у хворих на ГА
Аналіз вмісту цитокінів при різних клінічних проявах дерматозів виявив їх залежність від ступеня активності патологічного процесу, ступеня тяжкості та тривалості захворювання (табл. 5.1).
Таблиця 5.1 – Рівень ІL-1β, ІL-4, ІL-10, ІL-17 у хворих на різні стадії активності ГА, (М ± m)
| Хворі на ГА,
стадії активності |
ІЛ-1β (пг/мл) | ІЛ-17 (пг/мл) | ІЛ-4 (пг/мл) | ІЛ-10 (пг/мл) |
| активна,
n=38 |
5,14 ± 1,38 ** | 6,84 ± 1,08 ** | 1,12 ± 0,21 * | 2,48 ± 0,48 * |
| хронічна,
n=30 |
3,25 ± 0,62 * | 4,76 ± 0,53
* |
1,80 ± 0,48 | 3,26 ± 0,75 |
| контрольна група,
n=35 |
1,87 ± 0,55 | 2,72 ± 0,75 | 1,71 ± 0,34 | 3,97 ± 1,02 |
Примітки:
* – значимість різниці з контрольною групою (р < 0,05).
** – значимість різниці з контрольною групою (р < 0,01)
У пацієнтів, які мали ознаки активності дерматозу, більш значно підвищувався рівень ІЛ-1b (р < 0,01), ІЛ-17 (р < 0,01) порівняно з контрольною групою. Приналежність ІЛ-1b до Th-1 типу імунної відповіді знаменує розвиток і посилення клітинної ланки імунітету і пригнічення гуморальних реакцій. Відомо, що підвищена продукція ІЛ-1b свідчить про активацію та загострення захворювання. Збільшення рівня ІЛ-17 демонструє його участь в імунній відповіді у пацієнтів із ГА. У той же час рівні протизапальних ІЛ-4 та ІЛ-10 були нижчими (р < 0,01), ніж у групі контролю.
У хронічну стадію у хворих на ГА вміст цитокінів ІЛ-1b (р < 0,01) та ІЛ-17 (р < 0,05) мали тенденцію до зниження порівняно з прогресуючою стадією, але були вищими, ніж у контрольній групі. У той же час рівень протизапального цитокіну ІЛ-4 статистично достовірно підвищувався (р < 0,01), а ІЛ-10 був нижчим значення здорових осіб, але збільшувався відносно його рівня при активності процесу (p < 0,05).
Зміна рівня прозапальних цитокінів залежала від тяжкості перебігу захворювання. Так, вміст ІЛ-1b у сироватці крові хворих із тяжким і середнім ступенем тяжкості був достовірно вищим (р < 0,05), ніж у хворих із легким ступенем тяжкості (р < 0,05). Привертає увагу факт збільшення рівня ІЛ-17 також при середньому та тяжкому ступенях тяжкості ГА (р < 0,05) порівняно з таким при легкому перебігу дерматозу, коли його концентрація не відрізнялася від референтних значень (табл. 5.2). При легкому ступені тяжкості ГА вміст ІL-4 та ІL-10 у сироватці крові мав тенденцію до підвищення порівняно з його значенням у здорових осіб (р > 0,05). У хворих середнього ступеня тяжкості відзначено зниження рівня ІL-4 (p < 0,05), ІL-10 (p < 0,05) відносно показників у контрольній групі. У хворих з тяжким перебігом ГА спостерігалося максимальне зниження рівня ІЛ-10 порівняно з його значенням у здорових осіб, вміст ІL-4 достовірно не відрізнявся від такого у хворих середнього ступеня тяжкості (р > 0,05).
Таблиця 5.2 – Рівень ІL-1β, ІL-4, ІL-10, ІL-17 у хворих залежно від ступеня тяжкості ГА, (М ± m)
| Хворі на ГА, ступінь тяжкості | ІЛ-1β (пг/мл) | ІЛ-17
(пг/мл) |
ІЛ-4 (пг/мл) | ІЛ-10 (пг/мл) |
| легкий,
n=30 |
2,82± 0,68 * | 3,18 ± 0,88 | 1,82 ±0,42 | 3,56 ± 0,93 |
| середній, n=20 | 4,83 ±0,92 *# |
5,54 ± 1,18
* |
1,52 ±0,36 | 2,71 ± 0,62
* |
| тяжкий,
n=18 |
4,91 ±1,22 *# | 7,82 ± 1,65
*# |
1,10 ±0,28
* |
2,34 ± 0,42
** |
| контрольна група,
n=25 |
1,87 ±0,55 | 2,72 ± 0,75 | 1,71 ±0,34 | 3,97 ± 1,02 |
Примітки:
* – значимість різниці з контрольною групою (р < 0,05).
** – значимість різниці з контрольною групою (р < 0,01).
# – значимість різниці з групою легкого ступеня тяжкості (р < 0,05)
Динаміка змін показників у різні ступені тяжкості мала більш виражену залежність з активністю патологічного процесу при ГА. Так у хворих в активну стадію з легким ([3,62 ± 0,49] пг/мл, р < 0,05), середнього ([5,42 ± 0,97] пг/мл, р < 0,05) і тяжкого ([6,27 ± 1,98] пг/мл, р < 0,05) ступенем перебігу ГА показники ІЛ-1β були достовірно вищими відповідно в 1,9; 2,8 і 3,4 раза, ніж у групі контролю. У хронічну стадію при легкому ступені значення ІЛ-1β не відрізнялося від референтних значень ([1,92 ± 0,56] пг/мл, р > 0,05), у той же час рівень показника при середньому ([4,20 ± 0,86] пг/мл, р < 0,05) і тяжкому ступенях ([3,62 ± 1,12] пг/мл, р < 0,05) був достовірно вищим за його значення у здорових осіб – в 2,2 та 2,0 рази відповідно (рис. 5.2).
Активна стадія патологічного процесу у пацієнтів легкого ([4,22 ± 0,48] пг/мл, р < 0,05), середнього ([6,68 ± 0,55] пг/мл, р < 0,05) і тяжкого ([8,92 ± 1,67] пг/мл, р < 0,05) ступенів тяжкості ГА супроводжувалася достовірним збільшенням рівня ІЛ-17 відповідно в 1,5; 2,5 і 3,3 раза відносно показника контролю. При відсутності активності проявів захворювання при легкому перебігу достовірних відмінностей показника ([2,20 ± 0,34] пг/мл, р > 0,05) ІЛ-17 не виявлено, при середньому ([4,65 ± 0,42] пг/мл, р < 0,05) і тяжкому ([6,81 ± 0,75] пг/мл, р < 0,05) ступенях тяжкості його значення було достовірно вищим, ніж у здорових осіб, але в 1,4 і 1,3 раза нижчим за відповідні значення у пацієнтів з ознаками прогресування хвороби (рис. 5.3).
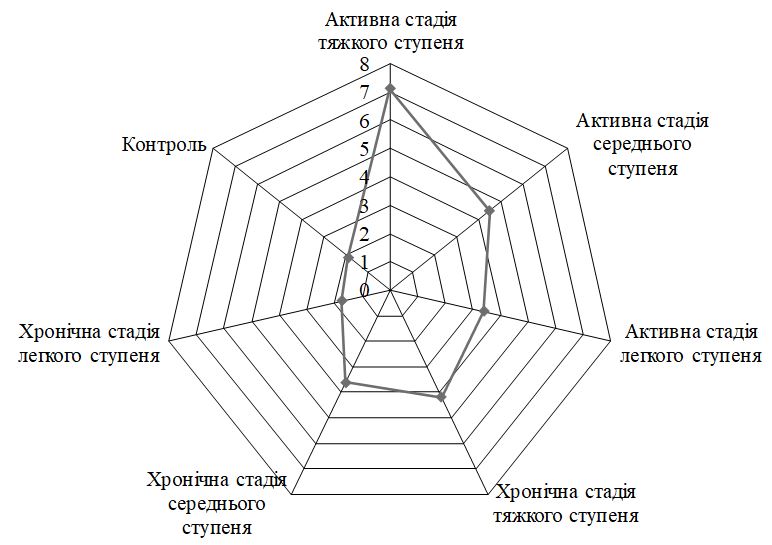 Рисунок 5.2 – Рівень ІL-1β (пг/мл) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Рисунок 5.2 – Рівень ІL-1β (пг/мл) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Достовірно значимі зміни рівня ІЛ-4 спостерігалися у пацієнтів із середнім та тяжким ступенями тяжкості при активності хвороби ([0,86 ± 0,09] і [0,95 ± 0,11] пг/мл, р < 0,05 відповідно), коли значення показника зменшувалось в 1,8 та 1,9 рази відповідно, статистично значимо не відрізнялись в між собою цих групах. В хронічну стадію ГА вміст ІЛ-4 достовірно збільшувався в 1,3 рази при тяжкому перебігу ([1,29 ± 0,32] пг/мл, р < 0,05 відповідно). При легкому ступені тяжкості показник у різні фази патологічного процесу достовірно не змінювався, але мав тенденцію до зниження при активному перебігу хвороби ([1,54 ± 0,38] пг/мл, р > 0,05 відповідно), та до збільшення при відсутності ознак прогресування ([2,10 ± 0,58] пг/мл, р > 0,05). Середній ступінь тяжкості та хронічний перебіг ГА характеризувалися тенденцією до збільшенням показника ([1,97 ± 0,43] пг/мл, р > 0,05) відносно його рівня в контрольній групі та збільшення в 2 рази відносно значення в активну стадію захворювання. При легкому ступені тяжкості показник у різні фази патологічного процесу не відрізнявся від референтних значень (рис. 5.4).
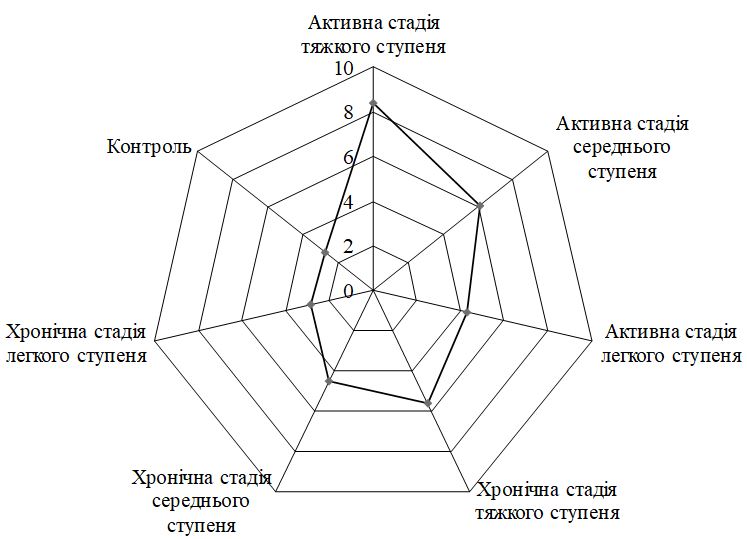 Рисунок 5.3 – Рівень ІL-17 (пг/мл) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Рисунок 5.3 – Рівень ІL-17 (пг/мл) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
 Рисунок 5.4 – Показник рівня ІL-4 (пг/мл) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Рисунок 5.4 – Показник рівня ІL-4 (пг/мл) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
У пацієнтів з ознаками активності захворювання при середньому та тяжкому ступенях тяжкості рівень ІL-10 достовірно знижувався ([2,65 ± 0,61] і [1,85 ± 0,18] пг/мл, р < 0,05) відносно значення у здорових осіб відповідно у 1,4 і 2,1 раза. При легкому ступені тяжкості і прогресуванні процесу значення ІЛ-10 ([2,77 ± 0,84] пг/мл, р < 0,05) також було нижчим відносно контрольної групи, в 1,4 рази вище ніж при тяжкому перебігу та не відрізнялось між його рівнем у хворих середнього ступеня тяжкості. При не активному процесі рівень показника ІL-10 мав тенденцію до збільшення при легкому ступені тяжкості ([4,28 ± 1,16] пг/мл, р > 0,05), достовірно знижувався при середньому і тяжкому перебігу ГА ([2,72 ± 0,60] і [2,82 ± 0,64] пг/мл, р < 0,05) в 1,4 раза відносно значення у здорових осіб, але не відрізнявся між цими групами (рис. 5.5).
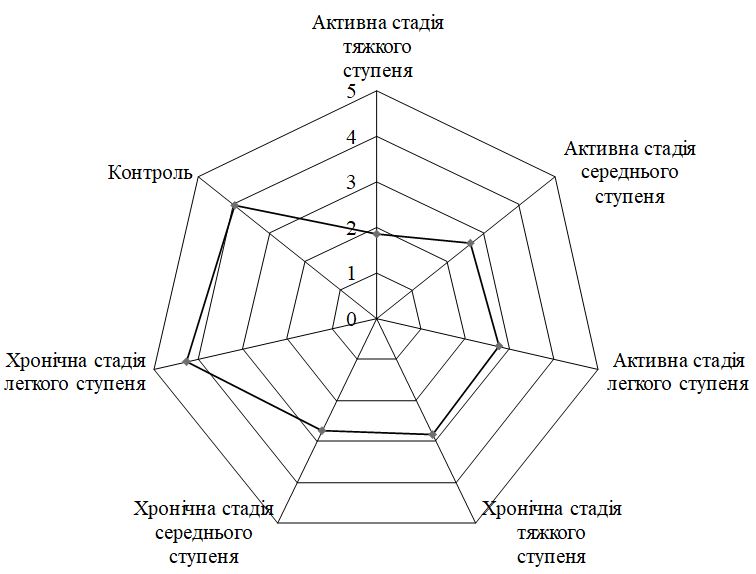 Рисунок 5.5 – Рівень ІL-10 (пг/мл) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Рисунок 5.5 – Рівень ІL-10 (пг/мл) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Аналіз отриманих результатів дослідження виявив у хворих на ГА кількісні зрушення досліджуваних показників залежно від тривалості патологічного процесу (табл. 5.3). При тривалості до 1 року та від 1 до 3 років рівень показника ІL-1β достовірно збільшувався (р < 0,05) порівняно зі значенням його в контрольній групі. У хворих на ГА протягом більше 3 років виявлено тенденцію до збільшення вмісту ІL-1β (р > 0,05) порівняно з показником контрольної групи, при цьому показник в 2,5 раза був нижчими значення у хворих із тривалістю процесу до 1 року. Достовірне збільшення рівня ІL-17 (р < 0,05) порівняно з його значенням у здорових осіб спостерігалося в усі періоди захворювання, але максимальне значення виявлялось при тривалості ГА до 1 року (збільшувалось в 2,2 рази відносно вісту у здорових осіб та в 1,4 рази порівняно з вмістом у хворіючих більше 3 років). При тривалості захворювання більше 3 років рівень показника ІЛ-4 був достовірно нижчим (р < 0,05), ніж у групі контролю та в 2,0 рази відносно хворіючих до 1 року. В період хвороби від до 1 року та від 1 до 3 років вміст ІL-4 достовірно не відрізнявся від концентрації показника здорових осіб (р > 0,05), але відзначалась тенденція до його збільшення при захворюванні до 1 року. Секреція ІL-10 мала тенденцію до збільшення у період до 1 року (р > 0,05). При тривалості ГА 1–3 роки та більше рівень ІL-10 достовірно знижувався (р < 0,05) відносно його значення у здорових осіб та була нижчою за рівень при тривалості до 1 року в 1,8 і 3,2 рази відповідно. При виявленні збільшення значення HSP-70 в усі періоди захворювання (р < 0,05) найвищим рівень відзначався у пацієнтів із тривалістю хвороби до 1 року.
Таблиця 5.3 – Рівень ІL-1β, ІL-4, ІL-10, ІL-17 у хворих залежно від тривалості ГА (М ± m)
| Тривалість захворювання хворих на ГА, роки |
ІL-1β (пг/мл) | ІL-17
(пг/мл) |
ІL-4
(пг/мл) |
ІL-10 (пг/мл) |
| до 1, n=32 | 5,43 ± 1,21* | 6,24 ± 1,69* | 1,92 ± 0,46 | 4,55 ± 0,78 |
| від 1 до 3, n=20 | 4,66 ± 0,96* | 5,82 ± 1,53* | 1, 58 ± 0,38 | 2,45 ± 0,86* # |
| більше 3, n=16 | 2,13 ± 0,63# | 4,32 ± 0,94 *# | 0,98 ± 0,24 *# | 1,38 ± 0,95* # |
| контрольна , n=25 | 1,87 ± 0,55 | 2,72 ± 0,85 | 1,71 ± 0,34 | 3,97 ± 1,02 |
Примітки:
* – значимість різниці з контрольною групою (р<0,05).
# – значимість різниці з групою до року (р<0,05)
5.2 Аналіз рівня білка теплового шоку масою 70 кДа у хворих залежно від особливостей пе1ребігу гніздової алопеції
Як показало дослідження, рівень HSP-70 у сироватці крові хворих на ГА ([0,334 ± 0,064] нг/мл, p < 0,05) був підвищеним порівняно з даними, отриманими в контрольній групі ([0,198 ± 0,061] нг/мл).
Виявлено достовірну залежність між вмістом HSP-70 та ступенем тяжкості дерматозу, коли відбувалося збільшення значення показника при всіх варіантах перебігу (p < 0,05), особливо при тяжкому ступені хвороби ([0,388 ± 0,073] нг/мл), p < 0,01) відносно рівня у здорових осіб.
У пацієнтів, які мали ознаки прогресування дерматозу, значно підвищувалася секреція HSP-70 ([0,448 ± 0,076] нг/мл, p < 0,01), порівняно з показником хворих при неактивних проявах ГА ([0,216 ± 0,052] нг/мл), коли його рівень не відрізнявся від референтних значень (р > 0,05).
Аналіз динаміки змін HSP-70 залежно від ступеня тяжкості та стадії патологічного процесу при ГА виявив більш виражені порушення (рис. 5.6). Так, при активних проявах захворювання значення HSP-70 достовірно підвищувалося у пацієнтів із середнім ([0,476 ± 0,074] нг/мл, р < 0,05) і тяжким ([0,510 ± 0,085] пг/мл, р < 0,05) ступенями тяжкості в 2,4 та 2,6 раза відповідно, але достовірно не відрізнялися між собою у хворих із різним перебігом. У хронічну стадію при тяжкому ([0,267 ± 0,065] нг/мл, р < 0,05) ступені ГА рівень HSP-70 був вищим у 1,4 раза від значення групи контролю та в 1,9 раза нижчим за вміст при активних проявах хвороби. При легкому ступені тяжкості рівень показника в активну стадію захворювання перевищував ([0,342 ± 0,071] нг/мл, р < 0,05) у 1,7 раза значення у здорових осіб та в 1,4 раза зменшувався відносно вмісту при тяжкому перебігу ГА. При неактивному процесі у хворих легкого та середнього ступеня рівень HSP-70 не відрізнявся від референтного значення (р > 0,05).
Вміст HSP-70 досліджувався залежно від тривалості ГА – до 1 року, від 1 до 3 років та більше 3 років. Виявлено збільшення значення HSP-70 в усі періоди захворювання (р < 0,05), найвищим рівень відзначався у пацієнтів із тривалістю хвороби до 1 року ([0,362 ± 0,088] нг/мл, р < 0,05).
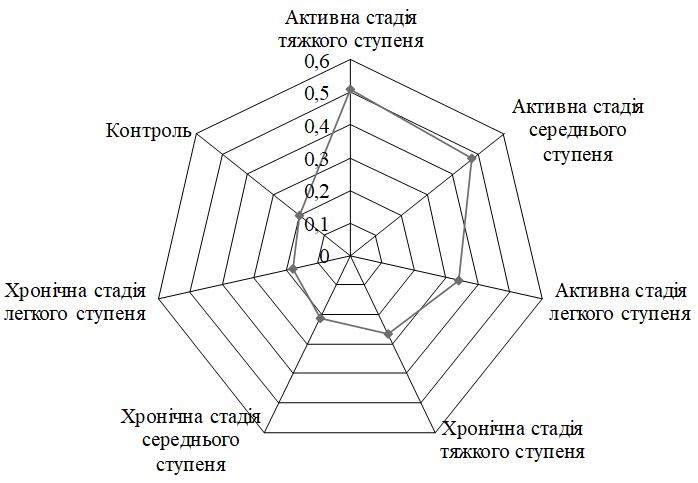 Рисунок 5.6 – Рівень HSP-70 (нг/мл) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Рисунок 5.6 – Рівень HSP-70 (нг/мл) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Виявлені тісні кореляційні взаємозв’язки між ІL-1β і ІL-17 (r = 0,71, р < 0,05), ІL-1β і HSP-70 (r = 0,68, р < 0,05) ІL-17 і HSP-70 (r = 0,75, р < 0,05) вказують на роль їх порушень у патоґенезі ГА.
Кореляційний аналіз зв’язку між вмістом цитокінів, HSP-70 та перебігом ГА показав, що вихідна величина ІL-17 достовірно пов’язана зі значенням ІТГА (r = 0,63, р = 0,037), активністю (r = 0,79, р = 0,017) та тривалістю (r = –0,68, р = 0,0048), рівень HSP-70 достовірно залежав від віку почата захворювання (r = –0,56, p = 0,047), активності (r = 0,74, p < 0,05) та ступені тяжкості (r = 0,69, p < 0,05). Аналіз впливу HSP-70 на розвиток ГА за допомогою однофакторної лінійної регресії встановив, що показники мають статистично значимий вплив на випадіння волосся. Збільшення секреції HSP-70 (c2 = 66,2 %) та ІL-17 (c2 = 81,4 %) підвищує ймовірність розвитку ГА.
Дослідження стану цитокінів та HSP-70 визначило їх зміни у 85,5 % хворих на ГА. При аналізі вмісту про- та протизапальних цитокінів у хворих на ГА залежно від стадії патологічного процесу, ступеня тяжкості та терміну захворювання, були виявлені порушення різного ступеня. У пацієнтів, які мали ознаки прогресування дерматозу, підвищувалася концентрація прозапальних цитокінів IL-1β та IL-17 (р < 0,01), порівняно з показниками хворих при неактивних проявах ГА (в 1,6 та 1,4 раза відповідно). Рівень протизапальних IL-4 та IL-10 був нижчим (р < 0,01) при активному перебігу (в 1,5 та 1,6 раза відповідно, відносно групи контролю), підвищувався в хронічну стадію ГА (р < 0,05), але не досягав значень контрольної групи.
Визначено динаміку збільшення маркерів запалення патологічного процесу (IL-17, IL-1β) від легкого до тяжкого ступеня тяжкості (р < 0,05). Вміст ІЛ-1b у хворих із тяжким і середнім ступенем тяжкості був достовірно вищим (р < 0,05), ніж у хворих із легким ступенем тяжкості (р < 0,05), але не відрізнявся між собою. Привертає увагу факт збільшення рівня ІЛ-17 також при середньому та тяжкому ступенях тяжкості ГА (р < 0,05) порівняно з таким при легкому перебігу дерматозу (в 1,7 та 2,5 раза відповідно), коли його концентрація не відрізнялася від референтних значень Більш значуще на ступінь тяжкості із протизапальних цитокінів реагував IL-10, рівень якого максимально знижувався у хворих із тяжким ступенем тяжкості (р < 0,05) (у 1,7 раза).
Найбільш виражені порушення відзначено при тяжкому ступені тяжкості з активними проявами захворювання, коли рівень прозапальних та протизапальних цитокінів мав різноспрямовані зміни — IL-1β та IL-17 збільшувалися в 3,2 та 3,6 раза, а IL-4 та IL-10 зменшувалися в 1,9 та 2,1 раза відповідно (р < 0,01). Установлено деякі закономірності в секреції цитокінів при становленні та подальшому розвитку ГА. Збільшення рівня IL-17 (р < 0,05) порівняно з його значенням у здорових осіб спостерігалося в усі періоди захворювання, але максимальний вміст виявлявся при тривалості ГА до 1 року (в 2,3 раза). Рівень показника IL-1β достовірно збільшувався (р < 0,05) при захворюванні до 1 та в період 1-3 роки (в 2,9 та 2,5 відповідно). Секреція IL-4 знижувалася тільки при продовженні строку хвороби більше 3 років (р < 0,05) (у 1,7 раза). При тривалості ГА 1–3 роки та більше 3 рівень IL-10 достовірно знижувався (р < 0,05) відносно його значення у здорових осіб та був нижчим за рівень при тривалості до 1 року (р < 0,05) (у 2,5 та 3,2 раза відповідно).
У пацієнтів, які мали ознаки прогресування дерматозу, секреція HSP-70 (p < 0,01), підвищувалась у 2,1 раза порівняно з показником хворих при неактивних проявах ГА, коли його рівень не відрізнявся від референтних значень (р > 0,05). Виявлено достовірну залежність між вмістом HSP-70 та ступенем тяжкості дерматозу, особливо при тяжкому ступені хвороби (p < 0,01) (у 1,9 раза). Аналіз динаміки змін HSP-70 залежно від ступеня тяжкості та стадії патологічного процесу при ГА виявив більш виражені порушення. Так, при активних проявах захворювання значення HSP-70 достовірно підвищувалося у пацієнтів із середнім (р < 0,05) і тяжким (р < 0,05) ступенями тяжкості в 2,4 та 2,6 раза відповідно, але достовірно не відрізнялися між собою. У хронічну стадію при тяжкому (р < 0,05) ступені ГА рівень HSP-70 був вищим у 1,4 раза від значення групи контролю та в 1,9 раза нижчим за вміст при активних проявах хвороби. При легкому ступені тяжкості рівень показника в активну стадію захворювання перевищував (р < 0,05) у 1,7 раза значення у здорових осіб та в 1,4 раза зменшувався відносно вмісту при тяжкому ступені тяжкості ГА. При неактивному процесі у хворих легкого та середнього ступеня рівень HSP-70 не відрізнявся від референтного значення (р > 0,05). Виявлено збільшення значення HSP-70 в усі періоди захворювання (р < 0,05), найвищим рівень відзначався у пацієнтів із тривалістю хвороби до 1 року (р < 0,05) (в 1,8 раза). Значення HSP-70 не обмежується лише роллю маркера пошкодження тканин та імунозапального процесу при ГА, а може бути частиною універсального цитопротективного механізму.
Виявлені тісні кореляційні взаємозв’язки між дослідженими показниками вказують на роль їх порушень у патоґенезі ГА. Збільшення секреції HSP-70 та ІL-17 підвищує ймовірність розвитку ГА та є предикторами тяжкого перебігу.
***
Таким чином, на підставі аналізу існуючих відомостей про клітинні та молекулярні механізми ГА показано роль цитокінів, HSP-70 у патогенезі захворювання. Отримані результати характеризуються дисбалансом системного цитокінового гомеостазу, який проявляється різноспрямованими змінами показників – підвищенням ІL-1β, ІL-17, HSP-70 і зниженням ІL-10 на тлі тенденції до зниження ІL-4 щодо значень контрольної групи. Ступінь імунологічних порушень корелювала з активностю, ступенем тяжкості та тривалістю патологічного процесу. Зміни, виявлені у процесі імунологічного дослідження, свідчать про поглиблення процесу імунної дисфункції при активності і в міру розвитку тяжкості дерматозу. Необхідно відзначити найбільш значущі порушення досліджуваних показників у пацієнтів, які мали ознаки активності і тяжкий ступінь перебігу ГА. Необхідно відзначити найбільш значущі порушення досліджуваних показників у пацієнтів, які мали ознаки активності і тяжкий ступінь перебігу ГА. Наявність кореляційних зв’язків між показниками у хворих на ГА підтверджують даний факт.
Наведені у розділі положення висвітлені у наступних публікаціях:
- Сербина И.М. Исследование состояния цитокинов при гнездной алопеции с учетом активности заболевания. Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции. Сборник научных трудов. Х. : ХНМУ, 2013. С. 213–217 [88].
- Сербина И.М. Интерлейкин 17 в патогенезе гнездной алопеции. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2014. № 1–2 (32). С. 90–93 [86].
- Сербина И.М. Цитокинопосредованные механизмы формирования гнездной алопеции. Научные ведомости БелГУ. Серия: Медицина. Фармация. № 24 (195), вып. 28. С. 32–38 [100].
- Сербіна І.М. Клініко-патогенетичне значення білка теплового шоку при гніздовій алопеції. Дерматологія та венерологія. 2019. № 3 (85). С. 15–18 [78].
- Serbina I. Study of nitrogen oxide and heat shock protein 70 system in patients with alopecia areata. Materials of 8th national scientifically-practical conference with the internatiol participation «Reactive oxygen species, nitric oxide, antioxidants and human health», Smolensk, May 25–29th, 2014. Smolensk, 2014. Р. 181–182 [316].
РОЗДІЛ 6
АНГІОГЕННІ ФАКТОРИ У ХВОРИХ НА ГНІЗДОВУ АЛОПЕЦІЮ
6.1 Оцінка рівня VEGF, sVEGFR1 та EGF в залежності від перебігу гніздової алопеції
В останні роки дедалі більша увага дослідників стала приділятися віжливій ролі ендотеліальних клітин судинного русла в розвитку органної патології. У здоровому організмі існує баланс між активаторами та інгібіторами росту нових кровоносних судин; при багатьох захворюваннях організм втрачає контроль над підтриманням цієї рівноваги. Одним із потужних промоторів ангіогенезу є VEGF – багатофункціональний білок, потенційний мітоген для епітеліальних клітин судин, мікро- і макроваскулярних клітин кровоносних і лімфатичних судин; при цьому транскрипція мРНК VEGF індукується різними факторами росту і цитокінами.
VEGF є одним з найважливіших медіаторів росту ВФ. Інтерес дослідників привертає вивчення продукції розчинних форм рецепторів VEGF, і зокрема sVEGFR1, який є інгібітором трансдукції VEGF опосередкованого сигналу, в т.ч. EGF.
Дослідження ролі VEGF, sVEGFR1 і EGF у патогенезі ГА поодинокі. Патогенетична роль ангіогенезу в розвитку ГА свідчить про необхідність подальшого глибшого вивчення цього процесу.
Як показали дослідження (рис. 6.1), рівень VEGF і sVEGFR1 у сироватці крові хворих на ГА ([91,45 ± 10,32] пг/мл і [0,095 ± 0,008] нг/мл відповідно) достовірно не відрізнявся порівняно з даними показниками в контрольній групі ([79,6 ± 7,31] пг/мл і [0,107 ± 0,008] нг/мл відповідно). У той же час рівень EGF був підвищеним ([109,51 ± 6,72] пг/мл, р < 0,05), ніж цей показник у здорових осіб ([83,62 ± 6,95] пг/мл).
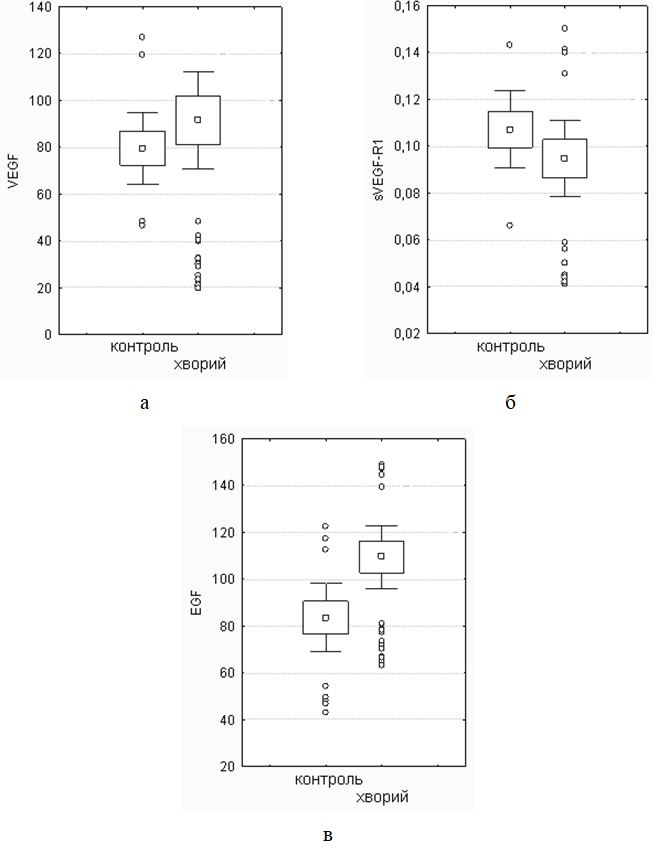 Рисунок 6.1 – Рівень VEGF (а), sVEGFR1 (б) та EGF (в) у хворих на ГА
Рисунок 6.1 – Рівень VEGF (а), sVEGFR1 (б) та EGF (в) у хворих на ГА
Дослідження ростових факторів залежно від стадії патологічного процесу (табл. 6.1) виявило, що у пацієнтів, які мали ознаки активності дерматозу, значно підвищувалася концентрація VEGF (р < 0,05) і EGF (р < 0,05) порівняно з контрольною групою. У той же час рівень sVEGFR1 був нижчим (p < 0,05), ніж у групі контролю. У хронічну стадію у хворих на ГА сироватковий рівень VEGF статистично достовірно знижувався (р < 0,05) порівняно з показником здорових осіб. Разом з тим, рівень sVEGFR1 був вищим, ніж в активну стадію, але достовірно не відрізнявся від значення контрольної групи. Показник EGF при хронізації процесу залишався підвищеним (p < 0,05) порівняно з даним показником у здорових осіб і майже не відрізнявся (р > 0,05) від його рівня при активності захворювання.
Таблиця 6.1 – Рівень VEGF, sVEGFR1 та EGF у хворих із різними стадіями активності ГА, (M ± m)
| Хворі на ГА, стадії активності | VEGF, пг/мл | sVEGFR1, нг/мл | EGF, пг/мл |
| активна, n=38 | 137,96 ± 13,7* | 0,073 ± 0,006* | 110,59 ± 10,15* |
| хронічна , n=30 | 31,65 ± 4,5* | 0,123 ± 0,015 | 108,12 ± 8,29* |
| контрольна група, n=25 | 79,6 ± 7,31 | 0,107 ± 0,008 | 83,62 ± 6,95 |
Примітка. * – значимість відмінності від контрольної групи (р<0,05) Результати рівня sVEGFR1, VEGF та EGF у хворих на ГА залежно від ступеня тяжкості наведено в табл. 6.2. Аналіз отриманих даних показав відсутність достовірної залежності між вмістом VEGF і ступенем тяжкості дерматозу, відзначено тенденцію до збільшення VEGF (р > 0,05) при тяжкому перебігу ГА. Вміст sVEGFR1 виявився зниженим при тяжкому ступені хвороби (p < 0,05), в інших випадках його значення не відрізнялося від показників контролю. Рівень EGF мав тенденцію (р > 0,05) до підвищення при легкому та середньому ступенях тяжкості, збільшувався більш значно у хворих із тяжким перебігом захворювання (p < 0,05).
Динаміка змін показників у різні ступені тяжкості мала більш виражену залежність з активністю патологічного процесу при ГА. Так у хворих в активну стадію із середнім ([196,96 ± 18,7] пг/мл, р < 0,05) і тяжким ([275,96 ± 26,2] пг/мл, р < 0,05) ступенями перебігу ГА показник VEGF був достовірно вищим, ніж у групі контролю і в 3,2 і 4,3 раза відповідно перевищував рівень у хворих із легким ступенем ([62,54 ± 6,2] пг/мл). У хронічну стадію при тяжкому ступені значення VEGF було мінімальним ([20,35 ± 2,5] пг/мл, р < 0,05), в 1,5 і 2,6 раза нижчим порівняно з показником легкого ([52,45 ± 7,5 пг/мл, р < 0,05) і середнього ([30,12 ± 4,8] пг/мл, р < 0,05) ступенями тяжкості відповідно (рис. 6.2).
Таблиця 6.2 – Рівень VEGF, sVEGFR1 та EGF у хворих залежно від ступеня тяжкості ГА (M ± m)
| Хворі на ГА, ступінь тяжкості | VEGF, пг/мл | sVEGFR1, нг/мл | EGF, пг/мл |
| легкий, n=30 | 66,67 ± 4,52 | 0,098 ± 0,005 | 74,66 ± 3,57 |
| середній, n=20 | 96,16 ± 23,00 | 0,117 ± 0,009 | 105,4 ± 6,95 |
| тяжкий, n=18 | 128,56 ± 28,10 | 0,076 ± 0,026* | 171,23 ± 10,36* |
| контрольна група, n=25 | 79,60 ± 7,31 | 0,107 ± 0,008 | 83,62 ± 6,95 |
Примітка. * – значимість відмінності від контрольної групи (р < 0,05)
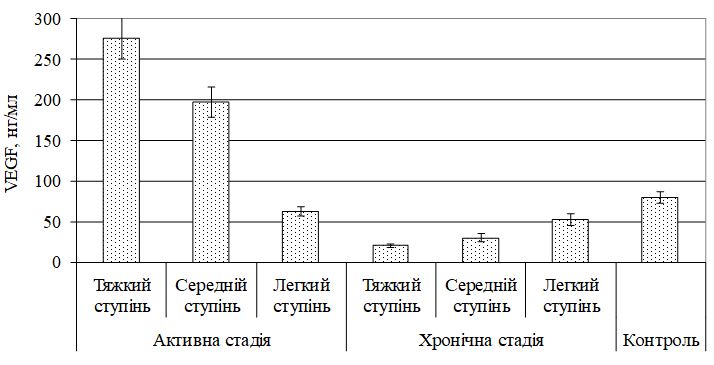 Рисунок 6.2 – Рівень VEGF у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадії
Рисунок 6.2 – Рівень VEGF у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадії
Достовірно значимі та різноспрямовані зміни значення sVEGFR1 спостерігалися у пацієнтів із тяжким ступенем тяжкості, як при активності хвороби ([0,032 ± 0,018] нг/мл, р < 0,05), так і у хронічну стадію ([0,128 ± 0,036] нг/мл, р < 0,05). При середньому та легкому ступенях тяжкості показник у різні фази патологічного процесу не відрізнявся від референтних значень (рис. 6.3).
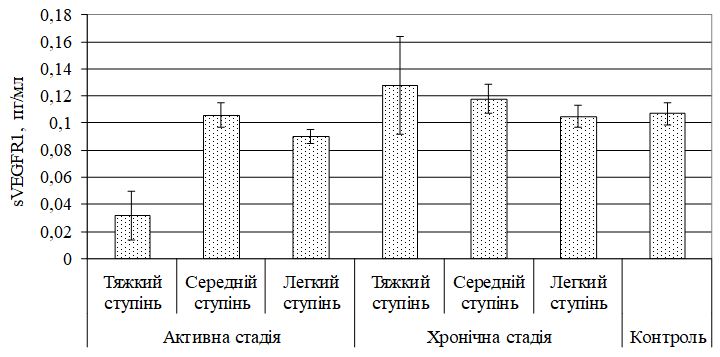 Рисунок 6.3 – Рівень sVEGFR1 у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадії
Рисунок 6.3 – Рівень sVEGFR1 у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадії
Достовірне збільшення середнього рівня показника EGF відзначалося при тяжкому перебігу ГА в активну ([184,45±28,29] пг/мл, p < 0,05) і хронічну ([161,34±20,14] пг/мл, p < 0,05) стадії, коли його значення достовірно відрізнялося від групи контролю, а також у 2,5 і 1,9 раза відповідно перевищувало рівень EGF при легкому та середньому ступенях тяжкості в активну стадію ([73,24±4,08] пг/мл, [96,43±12,44] пг/мл, p < 0,05) і 2,08 і 1,5 раза відповідно – у хронічну ([77,19±7,18] пг/мл, [112,43±25,23] пг/мл, p < 0,05) (рис. 6.4).
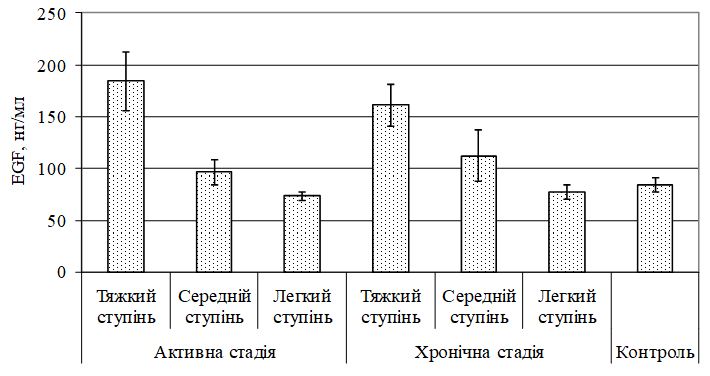 Рисунок 6.4 – Рівень EGF у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадії
Рисунок 6.4 – Рівень EGF у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадії
Кількісні зміни рівня VEGF, sVEGFR1 і EGF спостерігалися при різній тривалості захворювання (табл. 6.3). Аналіз вмісту VEGF у хворих на ГА дозволив констатувати, що при тривалості до 1 року рівень показника достовірно збільшувався (р < 0,05) порівняно з його значенням у контрольній групі. У тих, що хворіли на ГА 1-3 роки і більше 3 років, виявлено достовірне зниження вмісту VEGF (р < 0,05) як порівняно з показником контрольної групи, так і хворих з тривалістю до 1 року. Достовірне зменшення рівня sVEGFR1 (р < 0,05) порівняно з його значенням у здорових осіб спостерігалося при тривалості дерматозу до 1 року. При більшій тривалості захворювання рівень показника не відрізнявся від референтних значень, але був достовірно вищим (р < 0,05) за значення в групі хворих із тривалістю ГА до року. Концентрація EGF збільшувалася як у період до року (р < 0,05), так і при більшій тривалості ГА (р < 0,05) відносно його значення у здорових осіб.
Кореляційний аналіз показав наявність тісного кореляційного зв’язку між VEGF і sVEGFR1 (r = –0,70, р < 0,05), VEGF та EGF (r = 0,81, р < 0,05), sVEGFR1 і EGF (r = –0,70, р < 0,05) у хворих із тяжким ступенем ГА незалежно від стадії патологічного процесу. Доведена залежність VEGF від активності (r = 0,58, р < 0,05) та тривалості (r = –0,52, р < 0,05) патологічного процесу, значення ІТГА (г=0,40, р=0,039), рівня ІЛ-17 (r = 0,68, р = 0,034), ІЛ-1β (г=0,54, р=0,048) та NO (г=0,55, р=0,028).
Таблиця 6.3 – Рівень VEGF, sVEGFR1 і EGF у хворих залежно від тривалості ГА (М ± m)
| Хворі на ГА, тривалість захворювання, роки | VEGF, пг/мл | sVEGFR1, нг/мл | EGF, пг/мл |
| до 1, n=32 | 146,45 ± 14,4* | 0,076 ± 0,006* | 110,1 ± 9,8* |
| від 1 до 3, n=20 | 35,2 ± 7,26*# | 0,115 ± 0,014# | 105,1 ± 9,2* |
| більше 3, n=16 | 25,37 ± 3,35# | 0,139 ± 0,038# | 117,04 ± 17,6* |
| Контрольна група, n=25 | 79,6 ± 7,31*# | 0,107 ± 0,008# | 83,62 ± 6,95# |
Примітки:
* – значимість відмінності від контрольної групи (р < 0,05);
# – значимість відмінності від групи до року (р<0,05).
Аналіз впливу VEGF, sVEGFR1 и EGF на розвиток ГА за допомогою однофакторної лінійної регресії показав, що кожен з них має статистично значимий вплив на випадіння волосся. Так, збільшення показників VEGF (c2 = 84,2 %) і EGF (c2 = 22,8 %), зниження sVEGFR1 (c2 = 80,5 %) підвищує ймовірність розвитку ГА (р>0,05). При аналізі багатофакторної моделі встановлено, що всі показники є предикторами захворювання, при цьому VEGF (c2 = 0,716056, р <0,05) впливає на розвиток ГА більшою мірою, в меншій мірі sVEGFR1 (c2 = 0,255143 , р <0,05), і EGF (c2 = 0,130318, р <0,05) (табл. 6.4).
Виявлені порушення можуть створювати умови для розвитку ендотеліальної дисфункції, можливих імунозапальних реакцій і свідчить про безпосереднє залучення їх у механізми формування ГА.
Таблиця 6.4 – Сили впливу незалежних змінних (VEGF, sVEGFR1 і EGF) на ймовірність розвитку ГА
| Показник | c2 | Сума квадратів (SS) | Критерій Фишера (F) | p |
| VEGF | 0,716056 | 93,05723 | 197,3408 | 0,001 |
| sVEGFR1 | 0,225743 | 6,238207 | 12,42150 | 0,008 |
| EGF | 0,140245 | 2,728923 | 6,874218 | 0,019 |
Проведені дослідження встановили розлади в системі ангіогенних факторів у 81,3 % хворих на ГА, які мали залежність від активності, тяжкості та тривалості захворювання. Так, рівень VEGF у хворих на ГА достовірно не відрізнявся від значення в контрольній групі, але при аналізі вмісту показника залежно від стадії патологічного процесу були виявлені значні порушення – у пацієнтів, які мали ознаки активності дерматозу, вміст VEGF збільшувався в 1,7 раза, а при ознаках хронічного процесу – зменшувалася в 2,5 раза відносно значення у контрольній групі. Аналіз отриманих даних показав зміни рівня VEGF при різних ступенях тяжкості дерматозу залежно від активності патологічного процесу при ГА. При цьому в активну стадію із середнім і тяжким ступенем перебігу ГА показник VEGF був достовірно вищим у 2,5 та 3,4 раза відповідно, в 1,2 раза перевищував рівень у хворих із легким ступенем відносно його значення у групі контролю. Слід вказати, що при хронічному перебігу рівень VEGF достовірно знижувався при всіх ступенях тяжкості (при легкій та середній стадіях – у 2,6 та 1,5 раза відповідно), однак мінімальним був у хворих з тяжким перебігом (зменшувався в 3,9 раза) порівняно з показником здорових осіб.
Вміст sVEGFR1 у крові хворих достовірно знижувався в активну стадію (в 1,5 раза), а при хронічному перебігу ГА був на рівні показника здорових осіб, але вищим за значення при прогресуванні процесу (в 1,6 раза). Тяжкий ступінь ГА супроводжувався значним зниженням рівня sVEGFR1 в активну стадію (у 3,3 раза), підвищенням при хронізації захворювання (в 1,2 раза). При інших проявах ГА змін цього показника не зареєстровано.
Аналіз рівня EGF у хворих залежно від активності патологічного процесу виявив збільшення показника як в активну, так і в хронічну стадії ГА (в 1,3 раза) відносно значення в контрольній групі. Більш виражені порушення вмісту EGF виявлено у хворих при тяжкому ступені ГА в активну стадію, коли його значення збільшувалось у 2,2 раза порівняно з показником у здорових осіб.
Вивчення показників ангіогенезу у хворих з різною тривалістю патологічного процесу вказує на деякі особливості. Так, при тривалості ГА до 1 року рівень VEGF збільшувався в 1,8 раза відносно показника в контрольній групі. Рівень sVEGFR1 достовірно зменшувався в 1,4 раза. З подовженням строку хвороби зберігалися порушення показників. Так, констатовано достовірне зменшення рівня VEGF, особливо в період хвороби понад 5 років (у 3,1 раза), при цьому значення sVEGFR1 не відрізнялося від показника в контрольній групі, але в 1,7 раза було нижчим за показник при тривалості ГА до 1 року, що вказує на зміни характеру запалення при ГА в цей період патологічного процесу. Рівень EGF не залежав від тривалості захворювання та був збільшуваувся в 1,3–1,4 раза відносно його значення у здорових осіб у період захворювання як до 1 року, так і більше.
Збільшення вмісту VEGF у сироватці крові хворих на ГА, з одного боку, свідчить про активну проліферацію судин, з іншого – про ендотеліальну дисфункцію, яка може бути визначена як неадекватне (збільшене або знижене) утворення в ендотелії різних біологічно активних речовин. У прогресуючу стадію ГА спостерігається помірний ангіогенез, який регулюється макрофагальними елементами запального інфільтрату і частково ендотелієм існуючих судин. Показано, що високі рівні VEGF у сироватці крові індукують недостатність ангіогенезу з подальшим розвитком фіброзу [358]. Виявлене зниження VEGF у хронічну стадію особливо у хворих із середнім та тяжким ступенями тяжкості ГА може демонструвати недостатнє судинне забезпечення, пригнічення ангіогенезу, індукцію апоптозу, за допомогою активації генів Casp9 і Bad – основних чинників апоптозу клітин ВФ, що сприяє підтримці волосся у фазі телогену і можливості розвитку фіброзних змін. При цьому збільшення вмісту sVEGFR1 у даних пацієнтів, можливо, має компенсаторне значення.
6.2 Стан системи NO у хворих на гніздову алопецію
Численні дослідження в останні роки з переконливістю показали унікальні властивості NO в реалізації більшості найважливіших клітинних процесів людського організму у відповідь на вплив різних чинників. Метаболіти NO, будучи універсальними вторинними клітинними месенджерами і опосередковуючи фундаментальні функції з міжклітинної комунікації, нейротрансмісії, імунологічного захисту, вазодилатації, беруть участь у захисних і ушкоджуючих реакціях організму при цілій низці патологічних станів [157, 276]. NO залучений у формування термінової та довготривалої адаптації, маючи виражені захисні властивості при стресових впливах. Система NO може являти собою одну зі стрес-лімітуючих систем організму [47, 62, 256].
Беручи до уваги універсальність системи NO, необхідно оцінити її значимість при патології волосся. У доступній літературі недостатньо робіт, присвячених проблемі патофізіологічної ролі системи NО, її діагностичним і прогностичним аспектам при ГА, що і визначило мету роботи. Вміст NO оцінювався за рівнем його стійких метаболітів – NО2 і NО3, NOS – iNOS і cNOS.
Як показали дослідження, сумарний вміст метаболітів ендогенного NO у плазмі крові у хворих на ГА ([56,32 ± 6,12] мкмоль/л, p < 0,01) був підвищений порівняно з даними, отриманими в контрольній групі ([42,54 ± 6,24] мкмоль/л). Виявлено підвищення вмісту NO3 ([49,86 ± 4,41] мкмоль/л, p < 0,05), збільшення активності iNOS ([159,87 ± 17,28] пмоль/хв∙мг білка, p < 0,01), встановлено тенденцію до зниження рівня NO2 ([6,56 ± 1,87] мкмоль/л, р > 0,05) при зменшенні активності сNOS ([16,26 ± 2,1] пмоль/хв∙мг білка, p < 0,05) у плазмі крові хворих на ГА щодо показників у здорових осіб (NO2 – [8,24 ± 2,04] мкмоль/л, NO3 – [34,82 ± 2,04] мкмоль/л, iNOS – [68,24 ± 7,64] пмоль/хв∙мг білка, сNOS – [35,16 ± 6,62] пмоль/хв∙мг білка) (рис. 6.5).
 Рисунок 6.5 – Рівень метаболітів NO у хворих на ГА та осіб контрольної групи
Рисунок 6.5 – Рівень метаболітів NO у хворих на ГА та осіб контрольної групи
Аналіз вмісту NO при різних клінічних проявах дерматозів виявив його залежність від ступеня активності патологічного процесу, ступеня тяжкості та тривалості захворювання.
У пацієнтів, які мали ознаки активності дерматозу, значно підвищувався вміст NO (р < 0,01) порівняно зі значенням у хворих при неактивних проявах ГА (р < 0,05) (у 2,9 раза), а також щ1одо його рівня у здорових осіб. Збільшення значення NO в активну фазу дерматозу відбувалося за рахунок NO3, рівень якого достовірно перевищував значення показника контрольної групи (р < 0,01). У той же час спостерігалося зниження частки NO2 (р < 0,05). Привертає увагу факт збільшення активності iNOS при прогресуючому перебігу ГА (р < 0,01) – у 3,2 раза щодо значення цього показника у здорових осіб, а також у 2,4 раза порівняно з рівнем при хронічному перебігу захворювання (р < 0,05). Рівень сNOS, навпаки, знижувався як при активній (p <0,01), так і хронічній стадії хвороби (p < 0,05) (табл. 6.5).
Таблиця 6.5 – Рівень NО, його метаболітів, iNOS та сNOS у хворих на різні стадії активності ГА (М ± m)
| Хворі на ГА,
стадії активності |
NО,
мкмоль/л |
NO2,
мкмоль/л |
NO3,
мкмоль/л |
iNOS,
пмоль/ |
сNOS,
пмоль/ |
| активна, n=38 | 82,36 ± 7,04
** |
4,35 ± 1,82
* |
77,85 ± 5,15
** |
224,09 ± 26,15
** |
15,85 ± 1,65 ** |
| хронічна, n=30 | 28,45 ± 5,32
* |
6,84 ± 2,36 | 21,45 ± 3,32
* |
95,65 ± 6,54
* |
19,82 ± 3,42
* |
| Контрольна група,
n=25 |
42,54 ± 6,24 | 8,24 ± 2,04 | 34,82 ± 2,04 | 68,24 ± 7,64 | 35,16 ± 5,62 |
Примітки:
* – значимість різниці з контрольною групою (р < 0,05).
** – значимість різниці з контрольною групою (р < 0,01) При легкому ступені тяжкості ГА вміст метаболітів NО у плазмі крові не відрізнявся від показників здорових осіб, відзначалася тенденція до підвищення активності iNOS (р > 0,05) при незміненій активності сNOS. У хворих з ГА середнього ступеня тяжкості відзначено підвищення рівня NO3 (p < 0,05) і активності iNOS (p < 0,01), зниження активності сNOS (p < 0,05) і концентрації NO2 (p < 0,05) щодо значень показників у контрольній групі. У хворих із тяжким перебігом ГА спостерігалося максимальне зниження рівня активності сNOS (p < 0,01) порівняно з його значенням у здорових осіб, вміст метаболітів NO і активність iNOS достовірно не відрізнялися від таких у хворих середнього ступеня тяжкості (табл. 6.6).
Таблиця 6.6 – Рівень NО, його метаболітів, iNOS та сNOS у хворих залежно від ступеня тяжкості ГА (М ± m)
| Хворі на ГА, ступінь тяжкості |
NО,
мкмоль/л |
NO2,
мкмоль/л |
NO3,
мкмоль/л |
iNOS,
пмоль/ |
сNOS,
пмоль/ |
| легкий, n=30 | 43,65 ± 4,17 | 7,12 ± 1,88 | 37,08 ± 3,74 | 79,46 ±9,12 | 27,14 ± 4,56 |
| середній, n=20 | 62,56 ± 4,76
* |
4,72 ± 1,45
* |
58,44 ± 3,62
* |
178,82 ± 24,45
** |
14,32 ± 2,34
* |
| тяжкий, n=18 | 66,36 ± 5,65
* |
5,66 ± 1,57
* |
60,52 ± 4,16
* |
215,44 ± 27,32
** |
12,04 ± 2,28
** |
| контрольна група, n=25 | 42,54 ± 6,24 | 8,24 ± 2,04 | 34,82 ± 2,04 | 68,24 ±7,64 | 35,16 ± 5,62 |
Примітки:
* – значимість різниці з контрольною групою (р < 0,05).
** – значимість різниці з контрольною групою (р < 0,01)
Динаміка змін показників у різні ступені тяжкості мала більш виражену залежність з активністю патологічного процесу при ГА. Так у хворих в активну стадію з легким ([5,11 ± 1,42] мкмоль/л, р < 0,05), середнім ([4,56 ± 1,51] мкмоль/л, р < 0,05) і тяжким ([3,48 ± 1,14] мкмоль/л, р < 0,01) ступенями перебігу ГА значення показника NO2 було достовірно зниженим, ніж у групі контролю відповідно в 1,6 ,1,8 та 2,4 раза, але не відрізнялося між пацієнтами із середнім та тяжким перебігами. У хронічну стадію при легкому ступені значення NO2 не відрізнялося від референтних значень ([8,86 ± 1,48] мкмоль/л, р > 0,05), у той же час рівень показника при середньому ([5,51 ± 1,34] мкмоль/л, р < 0,05) і тяжкому ступенях ([5,92 ± 1,12] мкмоль/л, р < 0,05) був достовірно нижчим за його значення у здорових осіб, але достовірно не відрізнявся між значеннями у цих групах хворих (рис. 6.6).
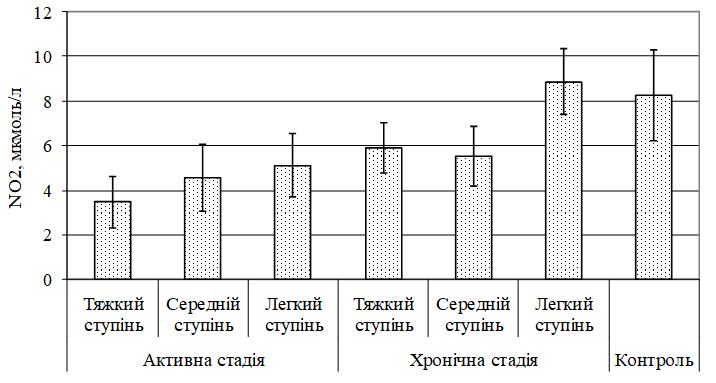 Рисунок 6.6 – Рівень NO2 у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Рисунок 6.6 – Рівень NO2 у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Достовірно значимі різнонаправлені зміни значення показника NO3 спостерігалися у пацієнтів із середнім та тяжким ступенями тяжкості, як при активності хвороби ([92,25 ± 7,49] і [96,28 ± 8,12] мкмоль/л, р < 0,05 відповідно), так і у хронічну стадію ([23,62 ± 3,72] і [19,12 ± 2,44] мкмоль/л, р < 0,05 відповідно). При легкому ступені тяжкості значення показника у різні фази патологічного процесу мали лише тенденції до збільшення при прогресуванні ([46,24 ± 6,72] мкмоль/л, р > 0,05) та зменшення при хронізації ГА ([27,18 ± 4,12], р > 0,05) (рис. 6.7).
У пацієнтів з ознаками активності захворювання при легкому, середньому та тяжкому ступенях тяжкості рівень iNOS достовірно збільшувався ([98,52 ± 0,61], [257,48 ± 0,17] і [308,27 ± 0,17] пмоль/хв∙мг білка, р < 0,05) відносно значення у здорових осіб відповідно у 1,4, 3,7 і 4,5 раза. При легкому ступені тяжкості та без прогресування процесу значення iNOS ([60,42 ± 1,21] пмоль/хв∙мг білка, р > 0,05) не відрізнялося від показника контрольної групи. При хронізації захворювання рівень показника iNOS достовірно збільшувався при середньому і тяжкому перебігах ГА ([100,26 ± 18,22] і [124,45 ± 20,15] пмоль/хв∙мг білка, р < 0,05) відповідно в 1,5 і 1,8 раза відносно значення у здорових осіб (рис. 6.8).
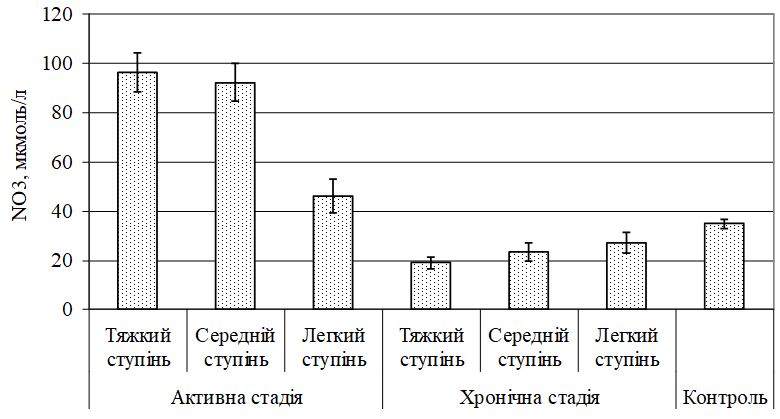 Рисунок 6.7 – Рівень NO3 у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Рисунок 6.7 – Рівень NO3 у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Рисунок 6.8 – Рівень iNOS у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
При активних проявах захворювання значення показника сNOS достовірно знижувалось у пацієнтів із середнім ([10,42 ± 1,39] нг/мл, р < 0,05) і тяжким ([8,11 ± 1,24] нг/мл, р < 0,05) ступенями тяжкості відносно рівня показника здорових осіб. У хронічну стадію при середньому ([18,22 ± 2,21] нг/мл, р < 0,05) і тяжкому ([15,34 ± 1,64] нг/мл, р < 0,05) перебігу ГА рівень сNOS також був достовірно нижчим відносно значення групи контролю, але в 1,7 та 1,9 раза вищим, ніж при активних появах захворювання. При легкому ступені тяжкості рівень показника у різні фази патологічного процесу не відрізнявся від референтних значень ([28,21 ± 2,64] і [26,08 ± 2,57] нг/мл, р < 0,05) (рис. 6.9).
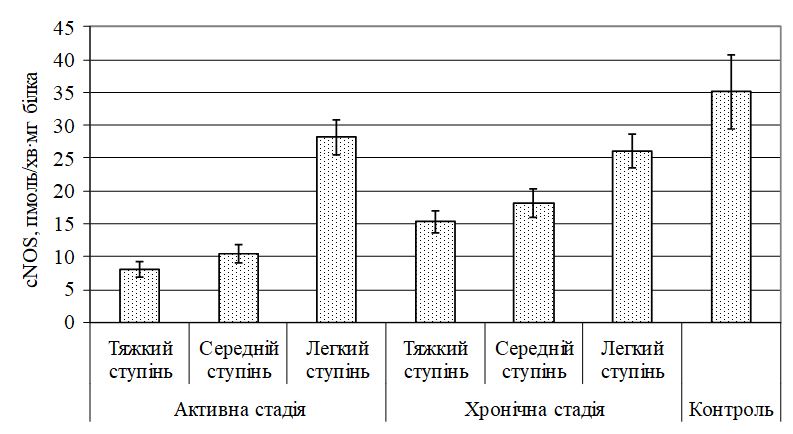 Рисунок 6.9 – Рівень cNOS у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Рисунок 6.9 – Рівень cNOS у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Аналіз отриманих результатів дослідження виявив у хворих на ГА кількісні зрушення досліджуваних показників залежно від тривалості патологічного процесу (табл. 6.7). При тривалості до 1 року рівень показника NO достовірно збільшувався (р < 0,05) порівняно зі значенням його в контрольній групі за рахунок синтезу NO3 (р < 0,05), рівень якого був в 1,9 раза більше, ніж у здорових осіб. При цьому відзначалося достовірне підвищення активності iNOS (р < 0,05), на фоні зниження рівня сNOS (р < 0,05) та NO2 (р < 0,05).
Таблиця 6.7 – Рівень NО, його метаболітів, iNOS та сNOS у хворих залежно від тривалості ГА (М ± m)
| Тривалість захворювання хворих на ГА, роки |
NО,
мкмоль/л |
NO2,
мкмоль/л |
NO3,
мкмоль/л |
iNOS,
пмоль/хв· мг білка |
сNOS,
пмоль/хв· мг білка |
| до 1, n=32 |
72,24 ± 8,34
* |
5,65 ± 1,75
* |
68,04 ± 6,21
* |
212,42 ± 26,06
* |
12,32 ±1,94
* |
| від 1 до 3, n=20 |
50,36 ± 6,65
# |
5,12 ± 1,82
* |
44,86 ± 4,15 | 138,65 ± 25,45
* |
22,16 ±3,48
* # |
| більше 3, n=16 |
28,26 ± 4,47
* # |
7,52 ± 2,36 | 21,78 ± 3,48
* # |
114,34 ± 20,62
* |
16,32 ± 3,52
* |
| контрольна група, n=25 |
42,54 ± 6,24 | 8,24 ± 2,04 | 34,82 ± 2,04 | 68,24 ± 7,64 | 35,16 ± 5,62 |
Примітки:
* – значимість різниці з контрольною групою (р<0,05).
# – значимість різниці з групою до року (р<0,05) У хворих на ГА протягом від 1 до 3 років виявлено тенденцію до збільшення вмісту NO (р > 0,05) порівняно з показником контрольної групи, при цьому його значення в 1,4 раза було нижчим, ніж у хворих із тривалістю процесу до 1 року. Рівень NO2 в цей період хвороби достовірно був нижчим (р < 0,05), а значення NO3 (р > 0,05) не відрізнялося від відповідних значень показників у здорових осіб.
При тривалості захворювання більше 3 років рівень показника NO був достовірно нижчим (р < 0,05), ніж у здорових осіб, та в 2,5 та 1,8 раза нижчим відносно груп хворих із тривалістю ГА до року та від 1 до 3 років відповідно (р < 0,05). Це зменшення відбувалося за рахунок вмісту NO3, рівень якого достовірно знижувався (р < 0,05) як відносно значення в групі контролю, так і при іншій тривалості захворювання (р < 0,01). Достовірне збільшення рівня iNOS (р < 0,05) та зменшення вмісту сNOS (р < 0,05) порівняно зі значеннями у здорових осіб спостерігалося у хворих при тривалості захворювання більше року.
Кореляційний аналіз показав наявність тісного кореляційного зв’язку між NO і iNOS (r = 0,67, р < 0,01), NO3 та iNOS (r = 0,56, р < 0,05) у хворих на ГА середнього та тяжкого ступеня тяжкості в активну стадію патологічного процесу.
Виявлено кореляційну залежність між рівнем NO і стадією патологічного процесу – при цьому в активну стадію позитивну (r = –0,72, р < 0,01), а при відсутності прогресування ГА – негативну (r = –0,38, р = 0,004), між VEGF і NO (г=0,55, р=0,028).
Кореляційний аналіз виявив також існування кореляційного зв’язку між вмістом iNOS та експресією ІЛ-17 (r=0,64, р<0,05), ІЛ-1β (r=0,43, р<0,05); рівнем NO та HSP-70 (r=0,52, р<0,05), VEGF (r=0,88, р<0,05) при ознаках активності ГА.
Аналіз впливу досліджених показників системи NO на розвиток ГА за допомогою однофакторної лінійної регресії показав, що збільшення показників NO3 (c2 = 64,3 %) та iNOS (c2 = 75,8 %), зниження сNOS (c2 = 52,8 %) підвищує ймовірність розвитку ГА (р<0,05). При аналізі багатофакторної моделі встановлено, що iNOS (c2 = 0,674539, р <0,05) впливає на розвиток ГА більшою мірою (табл. 6.8).
Динамічне вивчення вмісту показників системи NO дозволило виявити існування у 78,2 % хворих на ГА помірно вираженого дисбалансу, який проявлявся підвищенням рівня NO за рахунок збільшення NO3 та активності iNOS при зниженому рівні сNOS та незмінному значенні показника NO2. При аналізі показників залежно від стадії патологічного процесу виявлено різнонаправлені порушення. У хворих з активним перебігом захворювання відзначалося підвищення рівня NO, NO3 та iNOS, у той час як значення цих показників при хронічному перебігу знижувалося (у 2,8, 3,4 та 3,6 раза відповідно) (р < 0,05). Разом з тим, концентрація NO2 змінювалася лише при активному перебігу – відзначено зменшення в 1,8 раза, а зниження рівня сNOS у 1,9 раза не залежало від перебігу ГА (р < 0,05).
Таблиця 6.8 – Сили впливу незалежних змінних (метаболітів NО, iNOS та сNOS) на ймовірність розвитку ГА
| Показник | c2 | Сума квадратів (SS) | Критерій Фишера (F) | p |
| NO3 | 0,593781 | 67,43874 | 61,43763 | 0,008 |
| NO2 | 0,048456 | 1,965633 | 1,754336 | 0,142 |
| iNOS | 0,674539 | 88,54892 | 167,3278 | 0,002 |
| сNOS | 0,129034 | 6,596548 | 5,674115 | 0,023 |
Деякі особливості у стані системи NO відзначалися при різних ступенях тяжкості захворювання – рівень досліджуваних показників не змінювався при легкому перебігу, в той час як при середньому і тяжкому ступенях тяжкості виявлені порушення у вигляді збільшення NO, NO3, iNOS (у середньому – в 1,6; 1,8 та 2,8 раза відповідно) (р < 0,05) та зниження NO2 і сNOS (у середньому – в 1,6 та 2,4 раза відповідно) (р < 0,05) достовірно не відрізнялися між собою. Найбільш значущі порушення відзначалися при тяжкому перебігу захворювання як в активну, так і хронічну стадії ГА. При ознаках прогресування захворювання рівень показників NO, NO3, iNOS був максимально високим – збільшення у 2,3, 2,8 та 4,5 раза відповідно (р < 0,05). У хронічну стадію у пацієнтів з тяжким перебігом ГА їх значення значно зменшувалися відносно рівня при активному перебігу – в 3,9, 5,03 та 2,5 раза відповідно (р < 0,05), але якщо вміст NO та NO3 був достовірно нижчим відносно здорових осіб – в 1,6 та 1,7 раза відповідно, то значення показника iNOS в 1,7 раза більшим (р < 0,05).
При тривалості ГА до 1 року зрушення вмісту NO, NO3 та iNOS відзначалося в бік збільшення в 2,5, 3,1 та 1,9 раза відносно їх значень у період хвороби більше 3 років. З подовженням періоду захворювання більше 3 років відзначено пониження рівня NO та NO3 відносно показників контрольної групи в 1,5 та 1,6 раза відповідно (р < 0,05). Значення NO2 змінювалося лише при захворюванні до 3 років – зменшення в 1,4 раза (р < 0,05). Рівень сNOS знижувався при різній тривалісті ГА, але більш виражено до 1 року – в 2,8 раза (р < 0,05).
Проведене дослідження демонструє активацію прозапальних цитокінів – ІЛ-17, ІЛ-1β у пацієнтів із ГА, які знаходяться в тісній кореляції з експресією iNOS. Цей факт дозволяє припустити, що IL-17 поряд з іншими прозапальними цитокінами може бути потужним індуктором експресії iNOS.
***
Таким чином, виявлено дисбаланс маркерів ангіогенезу, який характеризується зміною вмісту VEGF, sVEGFR1, EGF та показників системи NO, що може створювати умови для розвитку ендотеліальної дисфункції, імунозапальних реакцій і свідчить про безпосереднє залучення їх у механізми формування ГА. Виявлені розлади в значному ступені корелюють з клінічними проявами дерматозу – активністю та ступенем тяжкості. Необхідно відзначити найбільш значущі порушення концентрації VEGF, sVEGFR1 і EGF у пацієнтів, які мали ознаки активності та тяжкій ступінь перебігу ГА. Змінна активність окислювального метаболізму L-аргініну у хворих на ГА супроводжується різноспрямованими змінами показників: зменшенням вмісту NO2 і сNOS, підвищенням рівня NO3 і iNOS особливо при прогресуванні захворювання, дефіцитом NO3 і сNOS при хронічній стадії патологічного процесу. Виявлений дисбаланс у системі NO вказує на можливість NO-залежних механізмів розвитку патологічного стану при ГА. Встановлено, що більшість показників є предикторами захворювання, при цьому порушення рівня VEGF та iNOS впливають на розвиток ГА більшою мірою. На наш погляд, корекція порушень стану ангіогенних факторів має бути складовою частиною комплексної терапії та мати диференційований принцип.
Наведені у розділі положення висвітлені у наступних публікаціях:
- Bolotnaya L., Serbina I. Changes in endothelial function in alopecia 9th EADV Spring Symposium “A dermatological opera”, Verona (Italy), 6-10 June 2012. Verona, 2012. P. 331 [161].
- Сербина И.М.Особенности метаболизма азота оксида при гнездной алопеции. Укр. журн. дерматол., венерол., косметол. № 2. С. 55–59 [94].
- Serbina I. Study of nitrogen oxide and heat shock protein 70 system in patients with alopecia areata. Materials of 8th national scientifically-practical conference with the internatiol participation «Reactive oxygen species, nitric oxide, antioxidants and human health», Smolensk, May 25-29th, 2014. Smolensk, 2014. Р. 181–182 [316].
- Serbina I. Angiogenesis factors in alopecia 9th World Congress for Hair Research, Miami (USA), November 18-21, 2015. Annals of Dermatology. 2015. Vol. 203. P. 32 [313].
- Сербина И.М. Изучение сосудистого эндотелиального фактора у больных гнездной алопеции. Лікарська справа. 2017. № 3–4. С. 98–103 [84].
- Сербіна І.М. Маркери ангіогенезу у хворих на гніздову алопецію. Міжнародний медичний журнал. 2019. № 3. С. 73–78 [79].
РОЗДІЛ 7
ОЦІНКА АДАПТАЦІЙНО-РЕГУЛЯТОРНИХ МЕХАНІЗМІВ ТА ЯКОСТІ ЖИТТЯ ПАЦІЄНТІВ ІЗ ГНІЗДОВОЮ АЛОПЕЦІЄЮ
В основі стресової відповіді полягає регуляція за принципом зворотного зв’язку, модулююча активність ГГНС і вегетативної нервової системи для захисту та адаптації організму до стресу за допомогою різноманітних пристосувальних реакцій. Гормони стресу здатні змінювати баланс Th-1/Th-2-цитокінів та впливати на дебют і перебіг автоімунного процесу. За своєю біологічною природою стрес має адаптаційну спрямованість, при цьому основне навантаження припадає на ГГНС. Інсулін посідає ключові позиції в розвитку загального адаптаційного синдрому, так як в організмі через нього реалізуються численні контрефекти відносно до регуляторного впливу ГКС [43, 68]. Зрив адаптаційних механізмів призводить до структурних та функціональних порушень на всіх рівнях і насамперед нейроендокринної та імунної систем, що є патогенетичною основою розвитку автоімунних захворювань.
Психотравмуючий вплив даного захворювання істотно перевершує вплив інших ушкоджень, що позбавляють зовнішньої привабливості (наприклад, ожиріння або рубці на відкритих ділянках тіла) і може досягати рівня, що може бути зіставлений із наслідками життєзагрожуючих або інвалідизуючих захворювань. Тривога і депресія, викликані безпосередньо наявністю різних форм ГА, можуть негативно впливати на перебіг захворювання через посередників стресу. Стійкий характер імунних порушень, зв’язок розвитку і рецидивів дерматозу із психотравмуючими факторами опосередковано вказують на неповноцінність адаптаційного потенціалу організму хворих на ГА.
7.1 Аналіз якості життя у обстежених хворих на гніздову алопецію
Актуальним є оцінка ЯЖ при хронічних дерматозах як інтегрального показника, що описує найбільш важливі функції людини і дозволяє дати їх глибокий багатоплановий аналіз при розвитку хвороби та їх відновлення на тлі лікування. Оцінка ЯЖ широко використовується для характеристики тяжкості патологічного процесу, його динаміки та ефективності лікувальних заходів [188, 264].
При оцінці DLQI у 140 пацієнтів із ГА значення показника варіювало від 1 до 30 балів, із середнім значенням 9,65 ± 7,22. При цьому оцінювався вплив на даний показник таких факторів: стать, вік (до 30 років і старше 30 років), рівень освіченості, тривалість захворювання (до 12 місяців або більше 12 місяців), сімейний анамнез за ГА, анамнез перебігу ГА (первинний епізод або рецидив), наявність стресу протягом останніх 6 місяців, ступінь тяжкості ГА, рівень ІТГА, супутні захворювання (захворювання щитоподібної залози, цукровий діабет, атопія та ін.).
Середні показники DLQI при різних ступенях тяжкості (легкому, середньому та тяжкому) становили (4,8 ± 2,5); (7,8 ± 5,2) і (16,4 ± 6,5) бала відповідно, що було статистично значущим (p < 0,001). Розподіл пацієнтів залежно від значення показника DLQI і ступеня тяжкості ГА показано на рис. 7.1.
Середній бал у групі чоловіків становив 7,6 ± 3,4, а у жінок – 11,8 ± 4,2, що було статистично достовірним (p = 0,02). Спостерігався значний зв’язок між загальним показником DLQI і віком пацієнтів (до 30 років значення було достовірно вищим – 11,28 ± 4,76; p < 0,001), тривалістю захворювання (при випаданні волосся протягом понад 12 місяців показник достовірно збільшувався до 16,21 ± 7,15; p < 0,001), гострим стресом протягом останніх 6 місяців (11,82 ± 6,10; p = 0,02) і рівнем ІТГА (13,75 ± 5,42; p < 0,001). Інші фактори не впливали на значення показника ЯЖ. Загальні бали DLQI пацієнтів не відрізнялися один від одного залежно від сімейного анамнезу ГА, рівня освіти, професії, інших супутніх захворювань (p > 0,05).
 Рисунок 7.1 – Розподіл пацієнтів залежно від значення DLQI і ступеня тяжкості ГА
Рисунок 7.1 – Розподіл пацієнтів залежно від значення DLQI і ступеня тяжкості ГА
Кореляційний аналіз виявив наявність позитивного зв’язку між значенням DLQI і віком пацієнтів (до 30 років) з алопецією; тяжким перебігом (ТА і УА), наявністю гострого стресу протягом останніх 6 місяців, а також випаданням волосся протягом понад 12 місяців та рівнем ІТГА – r = 0,51, r = 0,68, r = 0,52 і r = 0,64, r = 0,55 , р < 0,01 відповідно. 7.2 Визначення рівня кортизолу, інсуліну та адаптаційного коефіцієнту у хворих на ГА в залежності від активності, ступеня тяжкості та тривалості захворювання Дослідження рівня гормонів у сироватці крові хворих у цілому не виявило достовірних відмінностей вмісту інсуліну ([8,28 ± 0,5] мклОд/мл) та кортизолу ([520,8 ± 16,6] нмоль/л), порівняно зі значенням показників у здорових осіб ([458,4 ± 12,8] нмоль/л і [8,35 ± 0,5] мклОд/мл відповідно), але рівень кортизолу мав тенденцію до збільшення. Коефіцієнт К у всіх хворих мав тенденцію до підвищення (1,18 ± 0,08) (р > 0,05), у здорових осіб К становив 1,00 ± 0,02.
Аналіз вмісту гормонів при різних клінічних проявах дерматозів виявив їх залежність від ступеня активності та тяжкості патологічного процесу, тривалості захворювання.
Дослідження показників залежно від стадії патологічного процесу показало (табл. 7.1), що у пацієнтів з ознаками активності дерматозу значно підвищувався вміст кортизолу (р < 0,05) порівняно з аналогічним у контрольній групі. У той же час рівень інсуліну мав лише тенденцію до зниження (р > 0,05) щодо його рівня у здорових осіб. Значення К було достовірно підвищеним (р < 0,05).
Таблиця 7.1 – Рівень кортизолу, інсуліну та К у хворих на різні стадії активності ГА (М ± m)
| Хворі на ГА,
стадії активності |
Кортизол,
нмоль/л |
Інсулін,
мклОд/мл |
Коефіцієнт
К |
| Активна стадія, n = 38 | 658,8 ± 29,4* | 6,84 ± 0,7 | 1,76 ± 0,05 * |
| Хронічна стадія, n = 30 | 381,6 ± 12,4 # | 9,85 ± 0,4 # | 0,58 ± 0,02 *# |
| Контроль, n = 25 | 458,4 ± 12,8 | 8,35 ± 0,5 | 1,00 ± 0,04 |
Примітки:
* – значимість різниці з контрольною групою (р < 0,05).
# – значимість різниці з групою активної стадії (р < 0,05)
У хронічну стадію у хворих на ГА вміст кортизолу вірогідно знижувався (р < 0,05) відносно його значення у пацієнтів з активною стадією дерматозу. Рівень інсуліну при хронізації процесу був статистично достовірно вищим (р < 0,05), ніж при ознаках активності хвороби. Відповідно змінився і рівень коефіцієнта К, який становив 0,58 ± 0,02 та вірогідно відрізнявся від значення у здорових осіб (р < 0,05) (табл. 7.2). При легкому ступені тяжкості ГА вміст кортизолу та інсуліну в сироватці крові, а також коефіцієнт К не відрізнялися від аналогічних значень у здорових осіб (р > 0,05). У хворих із середнім ступенем тяжкості також відзначено відсутність достовірних змін рівня кортизолу та інсуліну щодо показників у контрольній групі, при цьому значення коефіцієнт К мало тенденцію до зниження (р > 0,05). У хворих із тяжким перебігом ГА спостерігалося достовірне підвищення рівня кортизолу (р < 0,05) і зниження інсуліну (р < 0,05) порівняно з їх значенням у здорових осіб. Коефіцієнт К у цій групі різко зростав (р < 0,05).
Таблиця 7.2 – Рівень кортизолу, інсуліну та К у хворих залежно від ступеня тяжкості ГА (М ± m)
| Хворі на ГА, ступінь тяжкості | Кортизол,
нмоль/л |
Інсулін,
мклОд/мл |
Коефіцієнт
К |
| Легкий ступінь тяжкості,
n=30 |
514,6 ± 18,6
|
8,78 ± 0,5 | 1, 09 ± 0,03 |
| Середній ступінь тяжкості, n=20 | 467,6 ± 15,8 | 9,71 ± 0,6 | 0,86 ± 0,04 |
| Тяжкий ступінь тяжкості,
n=18 |
598,7 ± 23,2
* |
6,48 ± 0,4
*# |
1,68 ± 0,08
*# |
| Контроль,
n=25 |
458,4 ± 12,8 | 8,35 ± 0,5 | 1,00 ± 0,04 |
Примітки:
* – значимість різниці з контрольною групою (р < 0,05).
# – значимість різниці з групою з легким ступенем тяжкості (р < 0,05)
Динаміка змін показників у хворих з різни ступенем тяжкості мала більш виражену залежність від активності патологічного процесу при ГА. Так у хворих в активну стадію з середнім ([610,9 ± 26,14] нмоль/л, р < 0,05) і тяжким ([816,2 ± 18,4] нмоль/л, р < 0,05) ступенями перебігу ГА показники кортизолу були достовірно вищими відповідно, ніж у групі контролю. В активну стадію з легким перебігом ГА значення кортизолу тільки мало тенденцію до збільшення від показника у здорових осіб ([551,77 ± 14,15] нмоль/л, р > 0,05).
У хронічну стадію при легкому ступені значення кортизолу не відрізнялося від референтних значень ([476,43 ± 15,24] нмоль/л, р > 0,05), у той же час рівень показника при середньому ([328,22 ± 16,78] нмоль/л, р < 0,05) і тяжкому ступенях ([342,56 ± 16,65] нмоль/л, р < 0,05) був достовірно нижчим за його значення у здорових осіб та не відрізнявся між значенням у цих групах (рис. 7.2).
Рисунок 7.2 –Рівень кортизолу (нмоль/л) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Активна стадія патологічного процесу у пацієнтів легкого ступеня тяжкості ([6,63± 0,6] мклОд/мл, р > 0,05) характеризувалася відсутністю достовірної різниці в рівні інсуліну у хворих та здорових осіб, але його рівень мав тенденцію до зниження. При середньому ([8,78 ± 0,65± 0,45] мклОд/мл, р < 0,05) і тяжкому ([5,56 ± 1,42] мклОд/мл, р < 0,05) ступенях тяжкості та ознаках прогресування ГА показник інсуліну мав різноспрямоване значення – тенденцію до збільшення та зменшення в 1,5 раза відповідно. При відсутності активності проявів захворювання та легкому перебігу достовірних відмінностей рівня показника ([10,11 ± 0,4] мклОд/мл, р > 0,05) інсуліну не виявлено, але відзначена тенденція до збільшення; при середньому ступені ([10,84 ± 0,82] мклОд/мл, р < 0,05) виявлялась аналогічна закономірність. Тяжкий перебіг без ознак активності ГА характеризувався ([7,79 ± 0,5] мклОд/мл, р < 0,05) тенденцією до зниження рівня інсуліну відносно в контрольній групі та в 1,4 рази вище ніж при прогресуванні процесу (рис. 7.3).
 Рисунок 7.3 – Рівень інсуліну (мклОд/мл) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Рисунок 7.3 – Рівень інсуліну (мклОд/мл) у хворих на ГА легкого, середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
При активних проявах захворювання рівень значення коефіцієнта К достовірно підвищувалось у пацієнтів із легким та тяжким ступенем тяжкості (1,51 ± 0,13 та 2,63 ± 0,32 відповідно, р < 0,05), у той час як при середньому ступені мав тенденцію до збільшення (1,27 ± 0,06, р > 0,05). У хронічну стадію при середньому (0,58 ± 0,05, р < 0,05) і тяжкому (0,62 ± 0,057, р < 0,05) перебігу ГА рівень коефіцієнта К був низчим відносно його значення в групі контролю в 1,7 та 1,6 раза відповідно, але достовірно не відрізнявся між собою. При легкому ступені тяжкості в цей період хвороби рівень показника не достовірно знижувався відносно контрольної групи (0,85 ± 0,11, р > 0,05) (рис. 7.4).
 Рисунок 7.4 – Рівень коефіцієнта К у хворих на ГА легкого,середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Рисунок 7.4 – Рівень коефіцієнта К у хворих на ГА легкого,середнього та тяжкого ступеня тяжкості в активну і хронічну стадію
Кількісні зміни рівня кортизолу та інсуліну спостерігалися при різній тривалості захворювання. Аналіз стану кортизолу у хворих на ГА дозволив констатувати, що при тривалості до одного року і з одного до трьох років рівень показника достовірно збільшувався (р < 0,05) порівняно зі значенням його в контрольній групі, але не відрізнявся між групами з тривалістю ГА до 3 років (р > 0,05). У хворих більше 3 років виявлено достовірне зниження вмісту кортизолу (р < 0,05) порівняно з показником контрольної групи. Достовірне зменшення рівня інсуліну (р < 0,05) порівняно з його значенням у здорових осіб спостерігалося при тривалості дерматозу як до одного року, так і в період від одного до трьох років. Достовірної різниці в значенні показника в цих групах не спостерігалося.
При більшій тривалості захворювання рівень показника був достовірно вищим (р < 0,05) за значення в групі контролю. Найвищий коефіцієнт К (р < 0,05) визначено у хворих при тривалості дерматозу від одного до трьох років, але його значення достовірно не відрізнялося в групі пацієнтів з тривалістю захворювання до одного року. Низький рівень коефіцієнта К (р < 0,05) щодо його значення в групі контролю визначався у пацієнтів, які хворіли більше 3 років (табл. 7.3).
Таблиця 7.3 – Рівень кортизолу, інсуліну та коефіцієнту К у хворих залежно від тривалості ГА (М ± m)
| Тривалість захворювання хворих на ГА, роки | Кортизол,
нмоль/л |
Інсулін,
мклОд/мл |
Коефіцієнт
К |
| До 1, n = 32 | 621,2 ± 14,8 * | 6,02 ± 0,5 | 1,88 ± 0,06 * |
| Від 1 до 3, n = 20 | 608,1 ± 16,3 * | 5,76 ± 0,4 * | 1,92 ± 0,12 * |
| Більше 3, n = 16 | 362,8 ± 10,8 *# | 12,04 ± 0,8 *# | 0,54 ± 0,05 *# |
| Контроль, n = 25 | 458,4 ± 12,8 | 8,35 ± 0,5 | 1,00 ± 0,04 |
Примітки:
* – значимість різниці з контрольною групою (р<0,05).
#– значимість різниці з групою тривалості захворювання до року (р<0,05)
Для з’ясування взаємного впливу досліджуваних гормонів був проведений кореляційний аналіз, який виявив статистично значущий негативний кореляційний зв’язок у пацієнтів із ГА між тривалістю захворювання, рівнем кортизолу та адаптаційного коефіцієнта К (r = –0,51; р < 0,001 та r = –0,58; р < 0,001) і позитивний – між активністю і значенням кортизолу (r = 0,54; р < 0,001).
Виявлені зміни характеризуються зниженням індексу ЯЖ, порушенням вмісту адаптивних гормонів у пацієнтів із ГА, що може створювати умови для розвитку імунозапальних реакцій і свідчить про безпосереднє залучення їх у механізми формування захворювання.
Оцінка ЯЖ, зроблена самим хворим, є цінним і надійним показником його загального стану, дає можливість здійснювати постійний моніторинг стану пацієнта. Дослідження показало, що ГА помірно впливає на ЯЖ, включаючи почуття втрати впевненості в собі й низький рівень самооцінки, фізіологічні аспекти життя пацієнтів, їх емоційне і соціальне благополуччя. Визначено, що більш виражені порушення ЯЖ асоційовані з молодим віком, коли так актуальні соціальна адаптація, пошук роботи і партнера (р < 0,05). Sinclair R. повідомив про взаємозв'язок наявності ГА і суїцидальними спробами у підлітків, що яскраво свідчить про недооціненість важливості психосоціального аспекту при наявності втрати волосся [324].
«Спотворюючий ефект» дерматозу розглядається як фактор, що провокує цілий спектр «вторинних» психічних розладів. Показано, що ЯЖ при ГА значно погіршувалася при більшій тривалості і при тяжкому ступені тяжкості хвороби (р < 0,05). Тривалий перебіг і поширеність ГА призводить до надмірного напруження реактивних сил організму, що тягне за собою виникнення фізичних і психологічних порушень з розвитком ознак дезадаптаційних розладів, характерних для синдрому хронічної втоми з астенічною симптоматикою (розлад сну і апетиту, явища депресії та ін.), що є фоном зниження ЯЖ хворих.
Незважаючи на складну етіологію автоімунних захворювань, можна стверджувати, що психологічний стрес відіграє ключову роль при ГА, що підтверджується наявністю позитивного кореляційного зв’язку між наявністю гострого стресу в період до 6 місяців і показником DLQI у пацієнтів (р < 0,05). Шкіра має локальну нейроендокринну вісь, що дозволяє їй реагувати на стрес. Підвищена активність осі гіпоталамус-гіпофіз-надниркові залози може ініціювати нейрогенне запалення, яке сприяє втраті імунної привілеї ВФ [151, 282]. У результаті виникає своєрідне «порочне коло»: стрес – ГА – психоемоційний статус хворого – ЯЖ хворого – ГА.
Одержані результати дозволили виявити у 88,5 % хворих на ГА ендокринні порушення універсальних механізмів переносимості стресу організмом. При аналізі адаптаційних гормонів були виділені два типи реакції на хворобу (стрес) кори надниркових залоз – збільшення або зменшення вмісту кортизолу в крові залежно від активності, ступеня тяжкості та тривалості ГА.
Отримані результати свідчать про те, що при прогресуванні ГА, тривалості хвороби до трьох років і тяжкому перебігу відбувається посилення секреції кортизолу, з яскравою активною захисною реакцією організму (в 1,32, 1,38 і 1,35 раза відповідно вище щодо його рівня у здорових осіб), але вона, ймовірно, є недостатньою в умовах посиленої антигенної стимуляції. Як результат при переході в хронічну стадію, а також при більш тривалому перебігу спостерігається зниження рівня кортизолу щодо його значення в групі контролю, можливо, за рахунок підвищеної його утилізації та виснаження функціональної активності кори надниркових залоз (в 1,45 і 1,32 раза відповідно). У той же час більш низький вміст гормону виявляється менш ефективним у протидії прозапальних стимулів.
Однак для організму більш значущим є не абсолютний, а відносний вміст ГКС у крові, тобто «інсуліновий фон». Інсулін посідає ключові позиції в розвитку загального адаптаційного синдрому, оскільки в організмі через нього реалізуються численні контрефекти по відношенню до регуляторного впливу глюкокортикоїдів. Рівень інсуліну у хворих на ГА мав різноспрямовані значення: збільшувався в 1,2 раза в хронічну стадію і в 1,4 – при тривалості понад трьох років; зменшувався в 1,3 раза при тяжкому ступені і в 1,4 – при тривалості до трьох років. Усі варіанти характеризують різний ступінь тяжкості впливу стресового чинника і свідчать про механізми, за допомогою яких організм прагне досягти стану резистентності.
Значення коефіцієнта К найбільш яскраво демонструвало зміни в адаптаційній системі. Підвищення коефіцієнта К у хворих з ознаками прогресування захворювання, тяжким ступенем тяжкості та тривалістю ГА до трьох років вказувало на напруження адаптаційних можливостей організму (в 1,5, 1,8 і 1,9 раза відповідно). Чим вищим є цей коефіцієнт, тим меншим резерв компенсаторних можливостей організму і тим більш загрозливою з точки зору прогнозу компенсації функцій стає стан напруги [7, 43].
Зниження К при хронізації ГА і тривалості хвороби більше трьох років свідчить про виснаження адаптаційних механізмів організму з можливим зривом регуляторних процесів (в 1,7 і 1,8 раза відповідно) [68].
На думку багатьох дослідників, вплив ендогенних протизапальних гормонів відіграє прогностично важливу роль вже на ранніх стадіях автоімунних захворювань: підставою є визнання значущості ендогенних протизапальних систем, як у гальмуванні гострих запальних реакцій, так і у хронізації запалення. Неадекватна реакція гормонів на імунозапальні стимули вважається фактором хронізації патологічного процесу [43, 151]. В умовах запалення при ГА відбувається трансформація гострої захисної запальної реакції у хронічний неконтрольований патологічний процес, що виявляється зміною відповідних фаз від підвищення до зниження рівня кортизолу та інсуліну, а також аналогічною зміною індексу К з напругою і зривом адаптаційних можливостей.
***
Таким чином, отримані дані свідчать про важливу роль стресу, дезадаптаційних порушень у хворих на ГА. Зміни, виявлені у процесі дослідження адаптивних гормонів – кортизолу і інсуліну, а також коефіцієнта напруги адаптаційного потенціалу К залежно від активності, ступеня тяжкості та тривалості дерматозу, зниження показника ЯЖ свідчать про зрив захисно-пристосувальних механізмів, що призводить до структурних та функціональних порушень на всіх рівнях і насамперед нейроендокринної та імунної систем, які є патогенетичною основою розвитку ГА. Виявлені порушення обґрунтовують використання засобів і методів лікувального впливу, спрямованих на розрив патологічних шляхів – підвищення стійкості до стресу і адаптивних можливостей у хворих на ГА.
Наведені у розділі положення висвітлені у наступних публікаціях:
- Сербина И.М. Адаптационные гормоны при гнездной алопеции. М‑ли IX Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання наукової і практичної косметології», м. Запоріжжя, 24–25 квітня 2015 р. Запоріжжя, C. 56 [81].
- Болотная Л.А., Сербина И.М. Адаптационно-регуляторные механизмы при гнездной алопеции. Georgian medical news. 2017. № 11 (272). С. 75–80 [9].
- Serbina I. Disadaptation disorders and quality of life index in alopecia areata. 18th meeting of the EHRS Congress : Abstract book. Bologna (Italy), May 18–20 2018. Bologna, 2018. Р.63 [314].
РОЗДІЛ 8
ЛІКУВАННЯ ХВОРИХ НА ГНІЗДОВУ АЛОПЕЦІЮ
ГА має непередбачуваний характер перебігу. З одного боку, спостерігається спонтанне відновлення волосся, з іншого ж, відзначаються тяжкі торпідні форми втрати волосся, резистентні до терапії. Часті випадки, коли зростання волосся відновлюється тільки при постійному лікуванні, а при припиненні терапії волосся знову випадає протягом декількох днів.
Аналіз міжнародних рекомендації лікування ГА показує, що на сьогоднішній день не існує універсального методу лікування, який гарантує відсутність рецидиву в майбутньому. Розвитку ефективних методів терапії перешкоджає відсутність єдиної думки про механізми, причини появи і закономірності перебігу ГА, що робить актуальною проблему вивчення етіопатогенезу цього дерматозу, розробки патогенетичних підходів до терапії.
На підставі власного морфологічного дослідження з використанням імуногістохімічних методик з метою встановлення фенотипу клітин запального інфільтрату і реакції прозапальних цитокінів встановлено, що зміни в осередку запалення залежать від стадії патологічного процесу. В активну стадію захворювання визначався масивний запальний інфільтрат з переважанням цитотоксичних Т-лімфоцитів, CD56+, CD68+ і підвищеним вмістом прозапальних цитокінів (IL-1, IL-6, TNF-α). У хронічну стадію ГА, навпаки, спостерігався мінімальний ступінь клітинної відповіді у вигляді зменшення запального інфільтрату і перерозподілу клітин інфільтрату (CD8+ і CD4+) з переважанням фібробластичних і гістіоцитарних елементів. Вміст прозапальних цитокінів у хронічну стадію ГА також достовірно знижувався. Ці дані відображають зміну запальної реакції в осередку ГА на репаративні та склеротичні процеси.
Динаміка імунного запалення при ГА і розвиток наслідків автоімунної атаки на фолікул, а також невизначена затримка конверсії фолікула в новий анагеновий цикл диктують етапність терапевтичних впливів, що раніше не враховувалося при призначенні лікування захворювання.
В активну стадію ГА, що характеризується розвитком вираженого імунного запалення, підвищенням рівня стійких метаболітів NO, рекомендована терапія спрямована на пригнічення цитотоксичних Т‑лімфоцитів і прозапальних цитокінів, VEGF, активності iNOS. У хронічній стадії патологічного процесу при ГА на тлі зменшення активності запальних реакцій, коли в тканинах переважають процеси регенерації і склерозу, відзначається дефіцит VEGF, метаболітів NO, протизапальна терапія має бути доповнена засобами, що поліпшують мікроциркуляцію в тканинах, нормалізують рівень NO, активність еNOS. Порушення адаптаційно-регуляторних механізмів обґрунтовує використання засобів і методів лікувального впливу, спрямованих на підвищення стійкості до стресу і адаптивних можливостей у хворих на ГА.
Ці дані обґрунтовують мету роботи – розробка комплексного диференційованого патогенетично обґрунтованого методу лікування пацієнтів з ГА з урахуванням стадійності перебігу захворювання та ступеня тяжкості.
Усі пацієнти були розподілені на три основні групи з урахуванням ступеня тяжкості й обсягу наданої медикаментозної допомоги: 1 групу склали 64 пацієнти з легким ступенем тяжкості (41 %); 2 групу — 56 пацієнтів із середнім ступенем тяжкості (35,9 %), 3 групу — 36 (23,1 %) пацієнтів із тяжким ступенем ГА. Пацієнти кожної групи були розподілені на три підгрупи, при цьому в підгрупу «а» були об’єднані хворі з активною стадією, в у «б» — із хронічною, у «в» — пацієнти, які отримували традиційну терапію без урахування стадії та ступеня тяжкості ГА (в1 — з активною стадією, в2 — з хронічною стадією) (контрольна підгрупа).
Для лікування ГА було обрано препарати патогенетичної терапії – неспецифічної імуносупресивної терапії – ГКС, доза і спосіб введення яких визначалися ступенем тяжкості захворювання. Додатково залежно від ступеня тяжкості і стадії патологічного процесу використовувався препарат, який відновлює рівень NO та поліпшує мікроциркуляцію в тканинах (тівортін), а також препарат, що нормалізує адаптивно-регуляторні процеси (даларгін). Як топічні засоби призначався біологічний модулятор росту волосся – міноксидил у вигляді 5 % розчину.
Аналіз літературних джерел останніх років свідчить про можливість ефективного і безпечного застосування L-аргініну як активного донатору NO в клінічній практиці при різних захворюваннях з порушенням в системі NO (серцево-судинні захворювання, плацентарні дисфункції, гепатити різної етіології, гіпоксичні та астенічні стани) [105]. Одним із перспективних препаратів для терапії ендотеліальної дисфункції є тівортін аспартат – вазодилататор і ангіопротектор, що представляє собою фізіологічний донатор NO. Клінічний ефект L-аргініну пояснюється відновленням ендотеліального синтезу NO до нормального рівня [24, 110].
Даларгін – синтетичний аналог ендогенного регуляторного пептиду лей-енкефаліну. Багаточисленні клінічні дослідження показали, що препарат активує репаративну регенерацію тканин, має імуномодулюючу, симпатолітичну дію, покращує мікроціркуляцію, інгібує перекисне окислення ліпідів за умов тканинної гіпоксії. Більшість хворих у процесі лікування даларгіном відзначали покращення самопочуття, приплив сил, підвищення працездатності [21, 48]. Дослідження показали, що препарат посилює активність нейроендокринної системи (гіпоталамо-гіпофізарно-надниркової, гіпоталамо-нейрогіпофізарної, симпато-адреналової), енергетичного обміну та імунореактивності організму хворих на псоріаз [22]. Введення даларгіну експериментальним тваринам зменшувало ступінь стресорних порушень гемостазу й функції ендокринної системи – зниження концентрації глікогену в печінці та збільшення рівня глюкози в крові, зменшення концентрації кортизолу, паратгормону та ін. [21]. Введення даларгіну тваринам напередодні стресового впливу блокує імуносупресивні та імуностимулюючі ефекти, що дозволяє припустити можливість корекції та профілактики стресіндукованих порушень імунітету [48].
Міноксидил – засіб прямого впливу на волосяні цибулини. При системному використанні препарат має потужний вазодилатуючий ефект. Здатність до швидкого розслаблення гладкої мускулатури судин має сульфований метаболіт міноксидилу – міноксидилсульфат, перетворення в який каталізується ферментами – сульфотрансферазами [133, 137]. Основні ключові механізми, відомі на сьогоднішній день, здійснюються за рахунок ефекту стимуляції синтезу VEGF. У дермальних сосочках ВФ VEGF стимулює проліферацію клітин матриксу та ендотеліоцитів судинної мережі, формування речовини позаклітинного матриксу, підтримуючи, таким чином, фолікули в стані анагену [255]. У ряді досліджень показано, що 5 % розчин міноксидилу дає кращий ефект при ГА, ніж нижчі його концентрації [200]. E.A. Olsen і співавт. [277] досліджували ефект топічного міноксидилу на індуковане преднізолоном рост волосся і дійшли висновку, що місцеве застосування міноксидилу обмежує або уповільнює постстероїдну втрату волосся у пацієнтів з ГА.
Традиційна терапія включала: вітамінні комплекси і мікроелементи (ревалід по 1 капсулі 3 рази на день, цинктерал по 1 таблетці 3 рази на день); засоби, що поліпшують мікроциркуляцію (пентоксифілін по 1 таблетці 3 рази на день); седативні препарати (ново-пасит по 5 мл препарату 3 рази на добу); ГКС для місцевого використання (крем мометазон); подразнюючі засоби (настоянка стручкового перцю); дарсонвалізація.
Розроблений алгоритм лікування хворих на ГА наведено на рис. 8.1.
Пацієнти 1а і 1б підгруп (26 і 18 осіб відповідно) для лікування локальних форм ГА застосовували зовнішньо клобетазолу пропіонат у формі мазі 0,05 %. Мазь із клобетазолу пропіонатом розподіляли тонким шаром на осередки облисіння, після чого накладали оклюзійну пов’язку на 6-8 годин. Процедура повторювалася протягом 6 днів, 7-й день – перерва. Тривалість курсу становила від 2 до 4 місяців. Пацієнтам 1а і 1б підгруп призначали даларгін. Препарат застосовували внутрішньом’язово 1 мл 1 раз на день протягом 14 днів. При хронічній стадії пацієнти додатково отримували тівортін аспартат перорально по 5 мл 4 рази на день протягом 21 дня, а також міноксидил 5 % у формі розчину, який втирали в осередки двічі на день 1–2 місяці.
Пацієнти 2а і 2б підгруп (18 і 20 осіб відповідно) для лікування ГА залежно від клінічної форми і торпідності захворювання застосовували внутрішньоосередкові ін’єкції бетаметазону дипропіонату / бетаметазону натрію фосфату. Розчин бетаметазону дипропіонату / бетаметазону натрію фосфату вводили внутрішньошкірне в осередок алопеції 1 раз на 3–4 тижні. Додатково призначали клобетазолу пропіонат у формі мазі 0,05 % на уражені ділянки. Усі пацієнти цієї групи отримували даларгін внутрішньом’язово 1 раз на день протягом 21 дня. При хронічному перебігу патологічного процесу в цій групі додатково призначався тівортін аспартат 100 мл у вигляді ін’єкцій внутрішньовенно протягом 7 днів. Далі пацієнти препарат отримували внутрішньо під час їжі по 5 мл 4 рази на день протягом 14 днів. 5 % міноксидил у формі розчину використовували двічі на день, втираючи в уражені зони 3-5 місяців.
Пацієнти 3а і 3б підгруп (12 осіб у кожній) отримували лікування системним ГКС – метилпреднізолон всередину (таблетки по 4 мг) за схемою: 32 мг/добу – 4-6 тижні з поступовим зниженням дози до повної відміни препарату. Усі пацієнти 3а й 3б підгруп цієї групи отримували даларгін внутрішньом’язово по 1 мл 2 рази на день протягом 21 дня. Тівортін аспартат 100 мл у вигляді ін’єкцій внутрішньовенно протягом 14 днів призначався пацієнтам 3б підгрупи. Далі пацієнти препарат отримували внутрішньо під час їжі по 5 мл 4 рази на день протягом 14 днів. 5 % міноксидил у формі розчину використовували двічі на день при хронічній стадії ГА, втираючи в уражені зони 4-8 місяців.
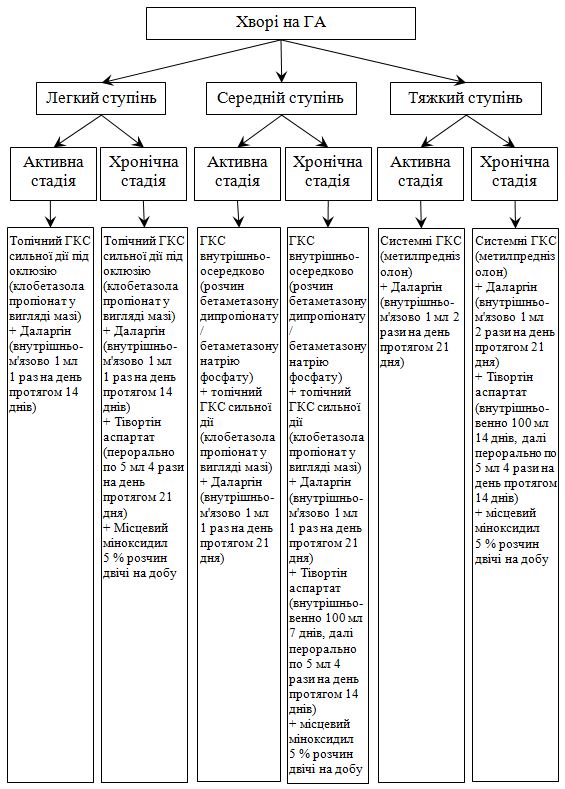 Рисунок 8.1 – Алгоритм лікування хворих на ГА
Рисунок 8.1 – Алгоритм лікування хворих на ГА
Контроль ефективності лікування проводився візуально неозброєним оком, а також за допомогою дерматотрихоскопічного обладнання. Оцінка ефективності терапії здійснювалася згідно наступних критеріїв: 1) клінічне одужання (повний ефект) – до 90 % або повне відновлення зростання волосся; 2) частковий ефект, що включає: значне поліпшення – припинення прогресування процесу, відновлення зростання волосся на 50–90 % площі ураження; незначне поліпшення – припинення прогресування процесу, відновлення зростання волосся на ділянці ураження менше 50 % площі ураження; 3) відсутність ефекту – значних змін у стані хвороби не відбулося, відбувається зростання одиничного велюсного волосся; 4) погіршення – поява нових осередків, поширення процесу. Результати ефективності терапії вивчалися через 1, 3 і 6 місяців після завершення лікування залежно від ступеня тяжкості та активності ГА.
Клінічне одужання реєструвалося у 36,8 % пацієнтів, які отримували лікування за розробленим методом, при цьому кращий ефект спостерігався при легкому та середньому ступенях тяжкості захворювання (20,8 % і 11,3 % відповідно) (табл. 8.1 і 8.2). У хворих з УА і ТА повне відновлення волосся відзначалося у 4,7 % випадків. Використання традиційної терапії дозволило досягти клінічного одужання у 20,0 % випадків тільки у пацієнтів легкого та середнього ступеня тяжкості (12,0 % і 8,0 % відповідно). Частковий ефект від розробленої та традиційної терапії спостерігався у 42,6 % і 32,0 % пацієнтів відповідно. Ефект від проведеної терапії був відсутній у 12,2 % хворих (3 пацієнти з локальною формою ГА і наявністю супутньої патології – вітиліго, гіпотиреоз і автоімунний тиреоїдит, бронхіальна астма, часткова втрата волосся по тілу; 5 хворих із середньотяжкими проявами ГА у вигляді офіазису, наявністю оніходистрофії та часткової втрати волосся по тілу, а також тривалістю захворювання більше 5 років і наявністю більше 3 рецидивів хвороби; 5 пацієнтів із тяжким ступенем тяжкості у вигляді ТА і УА з ураженням НП, тривалістю хвороби більше 5 років, відсутністю жовтих точок при дерматотрихоскопії, обтяженим сімейним анамнезом щодо ГА, наявністю алергічних захворювань шкіри) порівняно з 32,0 % пацієнтів, які отримували традиційне лікування. Погіршення патологічного процесу реєструвалося у 8,4 % випадків запропонованої терапії (3 пацієнти з осередковою формою і випадінням волосся на тілі, наявністю атопічного дерматиту, початком захворювання до 14 років – трансформація в офіазис і багатоосередкову; 5 пацієнтів із середньотяжким перебігом – 1 пацієнтка з дифузною формою ГА, яка трансформувалася в ТА, 2 хворих – із офіазисом, ревматоїдним артритом, повною втратою волосся по тілу, обтяженим сімейним анамнезом за ГА, тривалістю хвороби більше 3 роки; 2 пацієнти – з багатоосередковою формою, наявністю більше 3 рецидивів хвороби, оніходистрофією, депресією, алергічним ринітом; 5 пацієнтів із ТА, обтяженим сімейним анамнезом за ГА, оніходистрофією, початком захворювання до 12 років, наявністю більше 3 рецидивів хвороби, відсутністю жовтих точок при дерматоскопії) і 16,0 % випадків при використанні традиційної терапії.
Таблиця 8.1 – Результати лікування хворих на ГА за розробленим методом
| Результати лікування | Хворі на ГА | ||||||
| 1а і 1б підгрупи | 2а і 2б підгрупи | 3а і 3б підгрупи | Усього, % | ||||
| Абс. | % | Абс. | % | Абс. | % | ||
| Повний ефект | 22 | 20,8 | 12 | 11,3 | 5 | 4,7 | 36,8 |
| Частковий ефект | 16 | 15,2 | 18 | 17,0 | 11 | 10,4 | 42,6 |
| Відсутність ефекту | 3 | 2,8 | 5 | 4,7 | 5 | 4,7 | 12,2 |
| Погіршення | 3 | 2,8 | 3 | 2,8 | 3 | 2,8 | 8,4 |
Аналіз ефективності терапії у хворих залежно від ступеня тяжкості та активності ГА подано в таблицях 8.3–8.5.
Таблиця 8.2 – Результати лікування хворих на ГА, які отримували традиційну терапію
| Результати лікування | Хворі на ГА | ||||||
| 1в підгрупа | 2в підгрупа | 3в підгрупа | Усього, % | ||||
| Абс. | % | Абс. | % | Абс. | % | ||
| Повний ефект | 6 | 12,0 | 4 | 8,0 | – | – | 20,0 |
| Частковий ефект | 8 | 16,0 | 4 | 8,0 | 4 | 8,0 | 32,0 |
| Відсутність ефекту | 3 | 6,0 | 7 | 14,0 | 6 | 12,0 | 32,0 |
| Погіршення | 3 | 6,0 | 3 | 6,0 | 2 | 4,0 | 16,0 |
Таблиця 8.3 – Ефективність лікування хворих на ГА 1-ої групи
| Підгрупи хворих | Результати лікування | Усього | |||
| Повний ефект | Частковий ефект | Відсутність ефекту | Погіршення | ||
| 1а | 14 (53,8 %) | 9 (34,6 %) | 1 (3,8 %) | 2 (7,7 %) | 26 (100 %) |
| 1б | 8 (44,4 %) | 7 (38,9 %) | 2 (11,1 %) | 1 (5,6 %) | 18 (100 %) |
| 1в (в1+в2) | 6 (30,0 %) | 8 (40,0 %) | 3 (15,0 %) | 3 (15,0 %) | 20 (100 %) |
| Разом | 28 (43,7 %) | 24 (37,5 %) | 6 (9,4 %) | 6 (9,4 %) | 64 (100 %) |
Таблиця 8.4 – Ефективність лікування хворих на ГА 2-ої групи
| Підгрупи хворих | Результати лікування | Усього | |||
| Повний ефект | Частковий ефект | Відсутність ефекту | Погіршення | ||
| 2а | 6 (33,4 %) | 8 (44,4 %) | 2 (11,1 %) | 2 (11,1 %) | 18 (100 %) |
| 2б | 6 (30,0 %) | 10 (50,0 %) | 3 (15,0 %) | 1 (5,0 %) | 20 (100 %) |
| 2в (в1+в2) | 4 (22,2 %) | 4 (22,2 %) | 7 (38,9 %) | 3 (16,7 %) | 18 (100 %) |
| Разом | 16 (28,5 %) | 22 (39,3 %) | 12 (21,4 %) | 6 (10,8 %) | 56 (100 %) |
Таблиця 8.5 – Ефективність лікування хворих на ГА 3-ої групи
| Підгрупи хворих | Результати лікування | Усього | |||
| Повний ефект | Частковий ефект | Відсутність ефекту | Погіршення | ||
| 3а | 3 (25,0 %) | 6 (50,0 %) | 1 (8,3 %) | 2 (16,7 %) | 12 (100 %) |
| 3б | 2 (16,7 %) | 5 (41,7 %) | 4 (33,3 %) | 1 (8,3 %) | 12 (100 %) |
| 3в (в1+в2) | – | 4 (33,3 %) | 6 (50,0 %) | 2 (16,7 %) | 12 (100 %) |
| Разом | 5 (13,9 %) | 15 (41,6 %) | 11 (30,6 %) | 5 (13,9 %) | 36 (100 %) |
Результати клінічної ефективності лікування в підгрупах 1 групи демонстрували, що клінічне одужання та частковий ефект спостерігались у 88,4 % пацієнтів з активними проявами захворювання (53,8 % та 34,6 % відповідно) і у 83,3 % (44,4 % та 38,3 % відповідно) — без ознак прогресування. Лікувальний ефект був відсутній у 3,8 % пацієнтів з 1а підгрупи та у 11,1 % — з 1б. У 1в1 та 1в2 підгрупах клінічне одужання та частковий ефект відзначали у 66,7 % та 72,7 % випадках, а відсутність ефекту та погіршення — у 44,4 % та 18,2 % відповідно.
Повний клінічний ефект був отриманий у 33,4 % пацієнтів 2а підгрупи й у 30,0 % — 2б. При цьому частковий ефект був більш виражений у пацієнтів без ознак активності захворювання — 50,0 %, порівняно з результатом лікування у 2а підгрупі — 44,4 %. Відсутність ефекту від терапії в цій групі відзначено у пацієнтів як із хронічними, так і активними проявами ГА (11,1 % та 15,0 % відповідно). Погіршення процесу спостерігалося в 11,1 % випадків при прогресуванні ГА та в 5,0 % — при відсутності ознак активності ГА. У 2в підгрупі показники ефективності значно відрізнялися від їх значень при використанні розробленого методу, так повний і частковий ефект реєструвалися у 44,4 % випадків, а відсутність ефекту та погіршення перебігу ГА у 55,6 %. При цьому тільки у 16,7 % хворих 2в1 підгрупи спостерігалося клінічне одужання та частковий ефект, тоді як відсутність ефекту та погіршення — у 33,3 %.
Клінічне одужання відзначалось у 25,0 % пацієнтів 3 групи з активними проявами захворювання і у 16,7 % — без ознак прогресування. Відсутність лікувального ефекту в 3б підгрупі пацієнтів була найбільш вираженою — 33,3 %. Призначення традиційної терапії дало змогу досягти позитивних результатів у вигляді тільки часткового відростання волосся у 33,3 % пацієнтів, із яких 8,3 % в 3в1 підгрупі, водночас відсутність ефекту та погіршення процесу — у 41,7 % хворих із хронічною стадією патологічного процесу та у 25 % при прогресуванні ГА.
Вивчення динаміки значення ІТГА і оцінка ЯЖ свідчили про достовірний позитивний ефект при використанні розробленного алгоритму лікування. Так, оцінка ступеня тяжкості за шкалою ІТГА у процесі лікування запропонованою методикою виявила статистично значуще зниження кількості балів розглянутого індексу в усіх хворих ([2,0±1,4] бала при легкому ступеню, (6,0±2,5) бала при середньому та (14,0±5,1) бала при тяжкому, р < 0,05). При використанні традиційної терапії зниження значення ІТГА відбувалось в меншій мірі та не мало достовірної різниці у хворих на ГА середнього та тяжкого ступеня тяжкості відносно рівня до лікування (рис. 8.2).
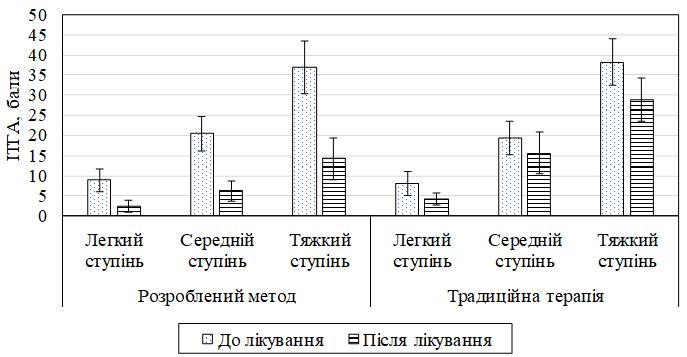 Рисунок 8.2 – Динаміка значення ІТГА у хворих після запропонованого методу лікування та традиційної терапії
Рисунок 8.2 – Динаміка значення ІТГА у хворих після запропонованого методу лікування та традиційної терапії
Середнє значення DLQI після запропонованого методу лікування знизилося більшою мірою, ніж при традиційній терапії, з різницею на (5,2 ± 2,6) бала, що вказує на більш виражений позитивний вплив на ЯЖ в основній групі пацієнтів (рис. 8.3).
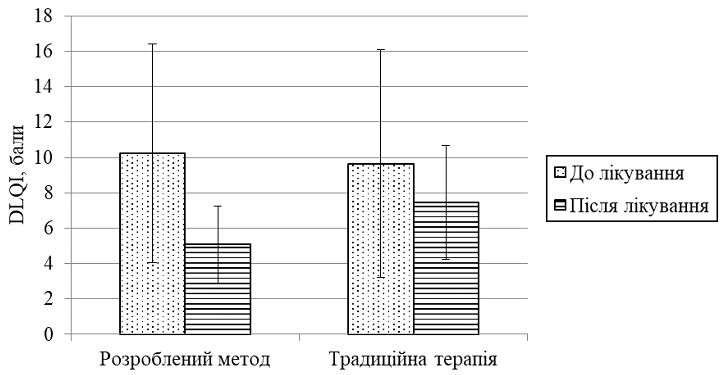 Рисунок 8.3 – Динаміка значення DLQI після запропонованого методу лікування та традиційній терапії
Рисунок 8.3 – Динаміка значення DLQI після запропонованого методу лікування та традиційній терапії
Відновлення зростання волосся у пацієнтів 1 групи (а і б підгрупи) спостерігалося на 12–18-й день лікування. Повне заростання осередків облисіння спостерігалося в терміни від 6 до 15 тижнів. Результати клінічної ефективності лікування в підгрупах 1 групи демонструють, що клінічне одужання спостерігалося у 53,8 % пацієнтів з активними проявами захворювання і у 44,4 % – без ознак прогресування. Лікувальний ефект був відсутній у 3,8 % пацієнтів у 1а підгрупі, 11,1 % – у 1б підгрупі. У 1с підгрупі ці показники значно відрізнялися і склали по 15,00 % відповідно. Значущих побічних ефектів не відзначалося. В окремих випадках спостерігався помірно виражений фолікуліт на скальпі у пацієнтів, які застосовували топічний ГКС засіб. Ретельний і своєчасний догляд за шкірою скальпа мінімізував прояви фолікуліту; після завершення лікування вони регресували спонтанно.
Відновлення зростання волосся у пацієнтів 2 групи (а й б підгруп) спостерігалося через 3-6 тижнів після початку терапії. Повний клінічний ефект був отриманий у 33,4 % пацієнтів 2а підгрупи і у 30,0 % – 2б. При цьому частковий ефект був більш виражений у пацієнтів без ознак активності захворювання – 50,0 %, порівняно з результатом лікування у 2а підгрупі – 44,4 %. Відсутність ефекту від терапії в цій групі відзначено у пацієнтів як з хронічними, так і активними проявами ГА (11,1 % та 15,0 % відповідно). Погіршення процесу спостерігалося в 11,1 % випадків при прогресуванні ГА та в 5,0 % – при відсутності ознак активності ГА. У 2в підгрупі показники ефективності значно відрізнялися від їх значень при використанні розробленого методу, так повний і частковий ефект реєструвалися у 22,2 % випадків відповідно, а відсутність ефекту і погіршення перебігу ГА у 55,6 % пацієнтів.
Поновлення зростання волосся у пацієнтів 3 групи спостерігалося на 4–8 тижні лікування. Клінічне одужання відзначалось у 25,0 % пацієнтів з активними проявами захворювання і у 16,7 % – без ознак прогресування. Відсутність лікувального ефекту в 3б підгрупі пацієнтів була найбільш вираженою – 33,3 %. Призначення традиційної терапії дозволило досягти позитивних результатів у вигляді тільки часткового відростання волосся у 33,3 % пацієнтів, у той же час відсутність ефекту і погіршення процесу – у 66,7 %. Ефект у підгрупах був гіршим у пацієнтів з обтяженим сімейним анамнезом за ГА, раннім початком захворювання – до 14 років, тривалістю ГА 5 років і більше, кількістю рецидивів ГА більше 2 протягом життя, наявністю супутньої патології у вигляді атопії, відсутність жовтих точок при трихоскопії.
При лікуванні системними ГКС із побічних ефектів найчастіше спостерігалися збільшення маси тіла від 4 до 7 кг (25,6 %) (повернення до вихідного показника відбувалося до кінця лікування або протягом 3 місяців після завершення терапії); стероїдні акне (12,3 %), які спонтанно регресували до моменту завершення лікування або відразу після його закінчення; кушингоїдні зміни ділянки облисччя в поєднанні з відкладенням жиру в ділянці верхнього плечового пояса (у 16,8 %) – вони проходили на 2–3-му місяці після завершення терапії; гіпертрихоз у ділянці обличчя і кінцівок (у 11,1 %) зникав до закінчення курсу лікування або протягом 1 місяця після його завершення. Тівортін і даларгін характеризувалися доброю переносимістю у пацієнтів із ГА, що узгоджується з даними інших досліджень [22, 106].
Віддалені результати лікування розробленим методом реєструвалися через 1 рік після його закінчення. Рецидиви ГА відзначено у 5 хворих 1 групи, у 7 – 2 групи і у 5 – 3 групи. Вони виникли частіше у пацієнтів, що мали більш тяжкі форми ГА, обтяжений сімейний анамнез за ГА, оніходистрофію, супутню патологію у вигляді автоімунних захворювань, наявність більше 2 попередніх епізодів хвороби, вплив стресу, як пускового фактора.
Відсутність ефекту від терапії та погіршення процесу відзначено у 22 (13,9 %) пацієнтів. Це обґрунтовало пошук ефективних методів лікування для даного контингенту хворих. Аналіз літератури дозволяє припустити, що існують випадки, торпідні до ГКС, можливо для досягнення позитивного ефекту мають бути більш високі дози препаратів і тривалість їх застосування в якості підтримуючої терапії. Однак відомі небажані явища довгострокової терапії ГКС обмежують її використання [121, 326]. Є кілька повідомлень про можливість лікуванні резистентних форм ГА сульфасалазином [300, 343]. Дія сульфасалазину при автоімунних захворюваннях опосередковується його імуномодулюючими, імуносупресивними і протизапальними ефектами [153, 330]. Імуносупресивний ефект частково пояснюється блокуванням синтезу ДНК в імунокомпетентних клітинах, що призводить до порушення їх проліферації та диференціації. Сульфасалазин і його активний метаболіт пригнічують експресію прозапальних цитокінів і перш за все TNF-α, ІL-1, ІL-8. Можливо, завдяки регулюванню цих цитокінів, а також проліферації Т-клітин, активності NK-клітин і активації В-клітин сульфасалазин проявляє свою ефективність при ГА [300, 343]. Сульфасалазин має відносно хороший профіль безпеки [153].
Ці дані обґрунтували можливість використання сульфасалазину в досліджуваних пацієнтів, які після отримання терапії протягом 3–6 місяців (залежно від ступеня тяжкості) не одержували позитивного результату, або процес погіршувався. Препарат призначався по 500 мг на день із щотижневим збільшенням до оптимальної добової терапевтичної дози 3 г у два прийоми. Тривалість застосування залежала від ступеня тяжкості ГА і склала від 3 до 8 місяців. Додатково призначався повторний курс препаратами патогенетичної терапії – тівортін, даларгін і міноксидил – відповідно до розробленого методу лікування.
Аналіз ефективності такої терапії показав, що клінічного одужання досягли 6 пацієнтів (27,3 %) (1 – із легким ступенем і активним перебігом, 2 – з легким ступенем і хронічним перебігом, 1 – із середнім ступенем і хронічною стадією та 2 – із середнім ступенем та активними проявами), частковий ефект реєструвався у 10 хворих (45,4 %) (2 – з легким ступенем, 5 – із середнім ступенем тяжкості, 2 – з тяжкою формою; у всіх пацієнтів були відсутні ознаки активності ГА; 1 пацієнт із багатоосередковою формою та прогресуванням хвороби). Відсутність ефекту відзначили 6 (27,3 %) пацієнтів, здебільшого з ТА і УА. 72,7 % пацієнтів (16 осіб) мали позитивний ефект у вигляді клінічного одужання і часткового відновлення волосся при ГА.
Побічні ефекти від прийому сульфасалазину у вигляді диспепсії, нудоти, головного болю та астенії спостерігалися в окремих випадках у перші місяці терапії і швидко купірувалися. Це дозволяє розглядати сульфасалазин як альтернативний препарат терапії у пацієнтів із ГА, які не відповідають на лікування ГКС.
У зв’язку з тим, що при дослідженні хворих на ГА до лікування виявлено різний ступінь вираженості порушень цитокінового гомеостазу, системи ангіогенних факторів, адаптаційно-регуляторних гормонів, залежний від активності, ступеня тяжкості та тривалості захворювання, розроблено алгоритм на принципах диференційованої терапії з урахуванням цих особливостей. Проведено аналіз досліджуваних показників у хворих 1–3 груп після лікування різними методами.
Призначення розробленого методу лікування хворим 1 групи сприяло нормалізації рівня ІЛ-1β та HSP-70, як при ознаках активності патологічного процесу, так і без них. При нормальних параметрах ІЛ-4 та ІЛ-10 в обох підгрупах, рівень ІЛ-17 при активному процесі знижувався в 1,4 раза (р < 0,05) та мав тенденцію до збільшення відносно значення здорових осіб (р > 0,05) (таблиця 8.6).
Таблиця 8.6 – Рівень ІЛ-1β, ІЛ-4, ІЛ-10, ІЛ-17 і HSP-70 у хворих на ГА легкого ступеня тяжкості залежно від активності процесу та методу лікування (M±m)
| Показники | Хворі на ГА | ||
| 1а, n=26 | 1б, n=18 | 1в, n=20 | |
| ІЛ-1β (пг/мл) | 2,98 ± 0,75* | 2,14 ± 0,62 | 2,64± 0,55 |
| ІЛ-17 (пг/мл) | 3,06 ± 0,45** | 2,57 ± 0,44 | 2,98 ± 0,75 |
| ІЛ-4 (пг/мл) | 1,62 ± 0,39 | 2,06 ± 0,46 | 1,76 ± 0,40 |
| ІЛ-10 (пг/мл) | 3,43 ± 0,88** | 4,16 ± 1,11 | 3,73 ± 0,86 |
| HSP-70 (нг/мл) | 0,238 ± 0,064* | 0,214 ± 0,048 | 0,270 ± 0,049 |
Прімітка: у цій та інших таблицях розділу достовірність відмін показників у хворих після лікування порівняно з аналогічним у здорових осіб – *, у хворих після лікування порівняно з аналогічним до лікування – **.
Динаміка показників цитокінового балансу у хворих 2 групи у процесі лікування, що наведена в табл. 8.7, вказувала на певні позитивні зрушення, які відбувалися при використанні розробленої терапії. Значення показників ІЛ-4 і HSP-70 нормалізовувався як у 2а, так і 2б підгрупах. Рівень ІЛ-1β та ІЛ-17 досягав значень, розрахованих у контрольній групі, і достовірно перевищував показники до лікування при неактивному перебігу хвороби (р < 0,01), тоді як при прогресуванні патологічного процесу його значення достовірно відрізнялося лише відносно до лікування (р < 0,05). Нормалізувався вміст ІЛ-10 у 2а підгрупі (р < 0,05), у хворих із хронічним перебігом показник залишався зниженим відносно хворих контрольної групи.
Таблиця 8.7 – Рівень ІL-1β, ІL-4, ІL-10, ІL-17 і HSP-70 у хворих на ГА середнього ступеня тяжкості залежно від активності процесу та методу лікування (M±m)
| Показники | Хворі на ГА | ||
| 2а, n=18 | 2б, n=20 | 2в, n=18 | |
| ІL-1β (пг/мл) | 2,97 ± 0,86** | 2,25 ± 0,61** | 3,54 ± 0,84 |
| ІL-17 (пг/мл) | 4,65 ± 0,42** | 3,15 ± 0,39** | 4,48 ± 0,65 |
| ІL-4 (пг/мл) | 1,78 ± 0,38* | 1,62 ± 0,40 | 1,59 ±0,41 |
| ІL-10 (пг/мл) | 3,54 ± 0,85* | 2,88 ± 0,65 | 3,06± 0,72 |
| HSP-70 (нг/мл) | 0,238 ± 0,066** | 0,186 ± 0,057 | 0,286± 0,049 |
Аналіз даних табл. 8.8 показав, що у процесі терапії хворих 3а та 3б підгруп залишався підвищеним рівень ІL-1β, ІL-17 та HSP-70 (р < 0,05) у хворих з активними проявами дерматозу відносно здорових осіб та достовірно знижувався при порівнянні зі значенням до лікування (р < 0,01). При неактивному процесі відзначалася нормалізація концентрації показника HSP‑70, вміст же ІL-1β та ІL-17 перевищував значення здорових осіб та достовірно знижувався порівняно з таким до лікування (р < 0,05). Застосування препаратів розробленого методу виявлялося більш ефективним для корекції рівня ІL-10 та ІL-4 в активну стадію патологічного процесу, коли їх значення збільшувалися відносно розрахованих показників до лікування р < 0,05. При наявності хронічного процесу показана відсутність змін в концентрації цих показників.
Таблиця 8.8 – Рівень ІL-1β, ІL-4, ІL-10, ІL-17 і HSP-70 у хворих на ГА тяжкого ступеня тяжкості залежно від активності процесу та методу лікування (M±m)
| Показники | Хворі на ГА | ||
| 3а, n=12 | 3б, n=12 | 3в, n=12 | |
| ІL-1β (пг/мл) | 3,22 ± 1,08** | 2,53 ± 0,76** | 4,05 ± 0,57 |
| ІL-17 (пг/мл) | 3,87 ± 0,65** | 3,42 ± 0,68** | 4,58 ± 0,71** |
| ІL-4 (пг/мл) | 1,23 ± 0,27** | 1,31 ± 0,38 | 1,12 ± 0,16 |
| ІL-10 (пг/мл) | 2,84 ± 0,26** | 2,95 ± 0,68 | 2,56 ± 0,39 |
| HSP-70 (нг/мл) | 0,267 ± 0,065** | 0,229 ± 0,057 | 0,304 ± 0,054 |
Результати впливу розробленої диференційованої терапії на стан маркерів ангіогенезу у різних групах наведено в табл. 8.9–8.11.
Таблиця 8.9 – Рівень маркерів ангіогенезу у хворих на ГА легкого ступеня тяжкості в залежності від активності процесу та методу лікування (M±m)
| Показник | Хворі на ГА | ||
| 1а, n=26 | 1б, n=18 | 1в, n=20 | |
| VEGF, пг/мл | 74,21 ± 6,9 | 71,65 ± 7,08 * | 68,15 ± 4,84 |
| sVEGFR1, нг/мл | 0,093 ± 0,006 | 0,116 ± 0,005 | 0,090 ± 0,006 |
| EGF, пг/мл | 78,44 ± 4,45 | 86,35 ± 4,76 | 72,58 ± 3,63 |
| NO2, мкмоль/л | 7,88 ± 1,35* | 8,11 ± 1,54 | 7,56 ± 1,16 |
| NO3, мкмоль/л | 32,15 ± 5,67* | 39,52 ± 5,92 | 40,32 ± 4,85 |
| iNOS, пмоль/хв·мг білка | 78,24 ± 6,53
** |
64,87 ± 5,48 | 77,36 ± 8,26 |
| сNOS
пмоль/хв·мг білка |
30,67 ± 2,78 | 36,12 ± 3,18 | 29,17 ± 3,66 |
Таблиця 8.10 – Рівень маркерів ангіогенезу у хворих на ГА середнього ступеня тяжкості залежно від активності процесу та методу лікування (M±m)
| Показник | Хворі на ГА | ||
| 2а, n=18 | 2б, n=20 | 2в, n=18 | |
| VEGF, пг/мл | 123,56 ± 16,8 ** | 75,43 ± 9,4 * | 90,21 ± 9,6 |
| sVEGFR1, нг/мл | 0,087 ± 0,005 | 0,121 ± 0,007 | 0,123 ± 0,008 |
| EGF, пг/мл | 78,54 ± 6,90 * | 88,32 ± 7,15 * | 93,37 ± 7,85** |
| NO2, мкмоль/л | 7,36 ± 1,84* | 8,66 ± 2,15* | 5,86 ± 1,43 |
| NO3, мкмоль/л | 51,25 ± 5,25** | 31,76 ± 3,18 * | 50,62 ± 4,54 |
| iNOS, пмоль/хв·мг білка | 126,52 ± 14,54** | 82,86 ± 8,63 | 142,34 ± 16,38** |
| сNOS, пмоль/хв·мг білка | 30,22 ± 4,57 * | 24,33 ± 2,79 ** | 19,65 ± 2,49** |
Таблиця 8.11 – Рівень маркерів ангіогенезу у хворих на ГА тяжкого ступеня тяжкості залежно від активності процесу та методу лікування (M±m)
| Показник | Хворі на ГА | ||
| 3а, n=12 | 3б, n=12 | 3в, n=12 | |
| VEGF, пг/мл | 145,24 ± 19,56** | 38,67 ± 6,45** | 103,34 ± 18,65** |
| sVEGFR1, нг/мл | 0,068 ± 0,022** | 0,116 ± 0,043* | 0,108 ± 0,037 |
| EGF, пг/мл | 98,12 ± 10,05* | 113,74 ±16,67** | 152,18 ± 18,62** |
| NO2, мкмоль/л | 7,18 ± 2,45* | 6,63 ± 2,18 | 5,98 ± 1,49 |
| NO3, мкмоль/л | 49,34 ± 5,12** | 28,59 ± 2,72* | 57,62 ± 4,27 |
| iNOS, пмоль/хв·мг білка | 126,44 ± 18,32** | 92,18 ± 15,54** | 120,45 ± 20,78** |
| сNOS, пмоль/хв·мг білка | 18,35 ± 4,86** | 16,56 ± 1,49 | 15,06 ± 1,47 |
Призначення препаратів розробленого алгоритму у хворих 1 групи сприяло нормалізації порушених досліджуваних показників майже однаково у пацієнтів з активними та неактивними проявами ГА. Рівень iNOS достовірно знижувався відносно значення до лікування (р < 0,05) та мав тенденцію до збільшення відносно вмісту у здорових осіб в 1а підгрупі (р > 0,05) (табл. 8.9).
У 2а підгрупі хворих після проведеної терапії поверталися до нормального стану показники sVEGFR1, EGF, NO2 та сNOS, у той час як рівень VEGF та iNOS зменшувався відносно значення до лікування (р<0,05), але не досягав вмісту в контрольній групі. Привертає увагу факт нормалізації значення частини досліджуваних параметрів при неактивному перебігу хвороби – VEGF, sVEGFR1, EGF, NO2, NO3. Секреція iNOS мала тенденцію до зниження відносно рівня до лікування та здорових осіб (р > 0,05), а значення сNOS достовірно відрізнялося від такого до лікування (р < 0,05) (табл. 8.10).
Використання розробленого методу лікування у хворих із тяжким перебігом сприяло нормалізації вмісту EGF, NO2 у 3а підгрупі, та NO3 у 3б, тоді як рівень NO2 у 3б підгрупі тільки мав тенденцію до збільшення (р > 0,05), а секреція сNOS у неактивний період хвороби залишалася без змін. Параметри інших показників достовірно відрізнялися від таких до лікування (р < 0,05) у хворих як із прогресуванням ГА, так і без ознак активності.
Динаміку стану показників кортизолу, інсуліну та адаптаційного коефіцієнту К залежно від призначених лікарських засобів наведено в табл. 8.12–8.14.
З наведених у таблиці 8.12 даних випливає, що рівень адаптаційних гормонів та їх коефіцієнту у хворих 1а та 1б підгруп нормалізувався в повному обсязі. У пацієнтів 2 групи, які отримували терапію згідно розробленого алгоритму, досліджувані показники змінювалися таким чином: рівень кортизолу досягав значення здорових осіб при обох стадіях патологічного процесу (р < 0,05), вміст інсуліну зменшувався в підгрупі «б» порівняно з таким до лікування (р < 0,05), коефіцієнт К відновлювався в обох підгрупах відносно значення в контрольній групі (р < 0,05) (табл. 8.13).
Таблиця 8.12 – Рівень кортизолу, інсуліну та К у хворих легкого ступеня тяжкості залежно від активності процесу та методу лікування (M ± m)
| Показник | Хворі на ГА | ||
| 1а, n=26 | 1б, n=18 | 1в, n=20 | |
| Кортизол, нмоль/л | 470,64 ± 16,53 | 422,52 ± 14,14 | 508,6 ± 12,7 |
| Інсулін, мклОд/мл | 8,08 ± 0,7 | 7,91 ± 0,5* | 8,39 ± 0,7 |
| Коефіцієнт К | 1,06 ± 0,08* | 0,97 ± 0,06 | 1,11 ± 0,03 |
Таблиця 8.13 – Рівень кортизолу, інсуліну та К у хворих середнього ступеня тяжкості залежно від активності процесу та методу лікування (М ± m)
| Показник | Хворі на ГА | ||
| 2а, n=18 | 2б, n=20 | 2в, n=18 | |
| Кортизол, нмоль/л | 427,84 ± 16,37* | 463,5 ± 18,12* | 467,6 ± 17,54 |
| Інсулін, мклОд/мл | 8,44 ± 0,46 | 7,74 ± 0,39** | 9,78 ± 0,58 |
| Коефіцієнт К | 0,94 ± 0,05 * | 1,05 ± 0,06* | 0,88 ± 0,05 |
Таблиця 8.14 – Рівень кортизолу, інсуліну та К у хворих тяжкого ступеня тяжкості залежності від активності процесу та методу лікування (M ± m)
| Показник | Хворі на ГА | ||
| 3а, n=12 | 3б, n=12 | 3в, n=12 | |
| Кортизол, нмоль/л | 641,76 ± 18,5** | 438,48 ± 14,2* | 540,6 ± 21,4 |
| Інсулін, мклОд/мл | 7,06 ± 0,43** | 9,58 ± 0,6* | 7,64 ± 0,5 |
| Коефіцієнт К | 1,68 ± 0,07** | 0,83 ± 0,03 ** | 1,28 ± 0,02** |
Рівень кортизолу у пацієнтів 3 групи, які мали ознаки прогресування дерматозу, зменшувався під впливом розробленої терапії відносно розрахованого показника до лікування (р<0,05). Відсутність ознак активності ГА у хворих цієї групи супроводжувалося збільшенням вмісту кортизолу порівняно з аналогічним контрольної групи (р < 0,05). Секреція інсуліну нормалізувалася після терапії в підгрупі 3б, тоді як у хворих підгрупи 3а його рівень зменшувався та достовірно відрізнявся від такого до лікування (р < 0,05). Значення коефіцієнту К змінювалося відповідно відновленню рівня гормонів після лікування. Виявлено достовірне зменшення при прогресуванні хвороби та підвищення в період відсутності ознак активності адаптаційного коефіцієнту відносно його значення до лікування в цих підгрупах (р < 0,05), але не досягав аналогічного параметра у здорових осіб (табл. 8.14).
Вивчення динаміки показників цитокінового балансу у хворих на ГА залежно від тривалості захворювання (табл. 8.15) показало, що у процесі лікування препаратами розробленого алгоритму нормалізувався рівень ІЛ-4, ІЛ‑10 і HSP-70 у всіх пацієнтів у період хвороби до 1 року, значення ІЛ-1β та ІЛ-17 залишалися підвищеними порівняно з такими у здорових осіб та достовірно знижувалися відносно аналогічних до лікування (р < 0,05). При більшій тривалості дерматозу виявлено нормалізацію рівня ІЛ-1β та ІЛ-4. Збільшене значення ІЛ-17 зберігалось у хворих із тривалістю від 1 до 3 років порівняно з таким у здорових осіб, але достовірно було нижчим відносно до терапії (р < 0,05). При більшій тривалості дерматозу виявлено нормалізацію рівня ІЛ-17. Параметри ІЛ-10 після лікування знаходилися в межах норми при тривалості захворювання від 1 до 3 років та не відрізнялися від аналогічного до терапії (р < 0,05) при збільшенні терміну хвороби. У хворих із тривалістю ГА більше 3 років виявлено підвищену концентрацію HSP-70 порівняно з такою у здорових осіб (р < 0,05), тоді як при тривалості від 1 до 3 років рівень показника достовірно досягав значення в контрольній групі (р < 0,05).
Таблиця 8.15 – Рівень ІL-1β, ІL-4, ІL-10, ІL-17 і HSP-70 у хворих із різною тривалістю ГА після лікування розробленим методом (M±m)
| Тривалість захворювання хворих на ГА, роки | ІЛ-1β (пг/мл) | ІЛ-17
(пг/мл) |
ІЛ-4
(пг/мл) |
ІЛ-10 (пг/мл) | HSP-70 (нг/мл) |
| До 1, n=32 | 2,88 ± 0,47 ** |
4,06± 0,84 ** |
1,84 ±0,35 * |
3,65 ± 0,87 * |
0,212 ± 0,031
* |
| Від 1 до 3,
n=20 |
2,17 ± 0,43 * |
4,12 ± 0,78
** |
1,85 ± 0,44 | 3,23 ± 0,72 * |
0,184 ± 0,028
* |
| Більше 3,
n=16 |
1,66 ± 0,41 * |
3,12 ± 0,64 * |
1,85 ± 0,53 * |
1,94 ± 0,49
** |
0,295 ± 0,036 |
| Контроль, n=25 | 1,87 ± 0,55 | 2,72 ± 0,85 | 1,71 ± 0,34 | 3,97 ± 1,02 | 0,198 ± 0,061 |
Аналіз наведених у табл. 8.16 даних дозволив констатувати позитивну динаміку показників адаптаційно-регуляторної системи при ГА після терапії: нормалізацію рівня інсуліну у хворих незалежно від тривалості; достовірне зменшення вмісту кортизолу порівняно з показником до лікування при тривалості до 1 року (р < 0,05) та відносно у здорових осіб у період від 1 до 3 років (р < 0,05), зростання його значення, а у хворіючих більше 3 років (р < 0,05). Визначено достовірне зниження коефіцієнту К при тривалості ГА до 3 років (р < 0,05), а при більшому терміні відзначено збільшення відносно показника до лікування (р < 0,05).
Результати дослідження ангіогенних факторів у хворих з різною тривалістю ГА після лікування подані в табл. 8.17. Визначено нормалізацію рівня NО, NO2 та сNOS у пацієнтів при різній тривалості захворювання. Вміст NO3 та iNOS відновлювався до рівня контрольної групи при тривалості від 1 до 3 років (р < 0,05). В інші періоди ГА значення цих показників достовірно змінювалося відносно вмісту до лікування (р < 0,05).
Таблиця 8.16 – Рівень кортизолу, інсуліну та коефіцієнту К у хворих із різною тривалістю ГА після лікування розробленим методом (M±m)
| Тривалість захворювання хворих на ГА, роки | Кортизол,
нмоль/л |
Інсулін,
мклОд/мл |
Коефіцієнт
К |
| До 1, n = 32 | 460,14 ± 12,36** | 7,76± 0,42 | 1,08 ± 0,03* |
| Від 1 до 3, n = 20 | 521,2 ± 15,7* | 8,06± 0,48* | 1,18± 0,07* |
| Більше 3, n = 12 | 389,9 ± 13,4* | 9,16 ± 0,57* | 0,78 ± 0,05** |
| Контроль, n = 25 | 458,4 ± 12,8 | 8,35 ± 0,5 | 1,00 ± 0,04 |
Таблиця 8.17 – Рівень NО, його метаболітів, iNOS та сNOS у хворих із різною тривалістю ГА після лікування розробленим методом (M±m)
| Тривалість захворювання хворих на ГА, роки |
NО,
мкмоль/л |
NO2,
мкмоль/л |
NO3,
мкмоль/л |
iNOS,
пмоль/хв· мг білка |
сNOS,
пмоль/хв· мг білка |
| До 1, n=32 |
55,84 ± 7,13** | 7,85 ± 2,02* | 48,12 ± 5,83** | 139,76 ± 20,32** | 29,86 ± 4,92* |
| Від 1 до 3, n=20 |
40,32 ± 4,56* | 8,45 ± 2,09* | 36,62 ± 3,47* | 72,53 ± 7,33* | 36,56 ± 5,45* |
| Більше 3, n=16 |
38,19 ± 3,25* | 7,89 ± 2,17 | 30,27 ± 4,15** | 81,67 ± 9,04 ** | 31,74 ± 5,13* |
| Контроль, n=25 |
42,54 ± 6,24 | 8,24 ± 2,04 | 34,82 ± 2,04 | 68,24 ± 7,64 | 35,16 ± 5,62 |
Призначення терапії сприяло нормалізації значення VEGF, sVEGFR1 та EGF у хворіючих на ГА до трьох років (табл. 8.18). При більшій тривалості захворювання відзначено достовірне збільшення рівня VEGF та EGF відносно вмісту до лікування (р < 0,05), тоді як концентрація sVEGFR1 перевищувала аналогічний у контрольній групі та не відрізнялася достовірно до лікування (р > 0,05).
Таблиця 8.18 – Рівень VEGF, sVEGFR1 і EGF у хворих залежно із різною тривалістю ГА після лікування розробленим методом (M±m)
| Хворі на ГА, тривалість захворювання, роки | VEGF, пг/мл | sVEGFR1, нг/мл | EGF, пг/мл |
| До 1 , n=32 | 82,4 ± 7,89* | 0,116 ± 0,007* | 80,72 ± 6,33* |
| Від 1 до 3, n=20 | 77,3 ± 6,46* | 0,096 ± 0,006 | 78,35 ± 5,74* |
| Більше 3, n=16 | 49,5 ± 5,34** | 0,143 ± 0,025 | 87,59 ± 6,61** |
| Контроль, n=25 | 79,6 ± 7,3 | 0,107 ± 0,008 | 83,62 ± 6,9 |
Таким чином, результати проведених досліджень свідчать про більш високу ефективність розробленого методу лікування. Досягнення позитивного результату – клінічного одужання та часткового ефекту – відзначено у 79,4 % хворих порівняно з традиційною терапією (52 %). Покращення частіше реєструвалося в 1 (а, б) та 2 (а, б) групах (відповідно 36 % та 28,3 %) порівняно з 3 (а, б) (15,1 %). Хворі 1в та 2в груп, які отримували лікування за традиційним методом, відзначали покращення тільки у 28,6 % та 16 % випадків відповідно, у 3в групі – клінічного одужання не відзначалося, а частковий ефект зафіксовано у 8 % пацієнтів. Застосування засобів диференційованої терапії дозволило в 3,0 раза збільшити тривалість ремісії та в 3,3 раза знизити кількість рецидивів.
Клінічні результати лікування виявилися взаємопов’язаними з показниками цитокінового балансу, ангіогенних факторів та адаптаційно-регуляторних гормонів. Аналіз лабораторних показників у хворих на ГА залежно від методу лікування дозволив установити незначну позитивну динаміку вивчених параметрів при використанні традиційної терапії.
Використання в комплексному лікуванні препаратів розробленого алгоритму в 1а та 1б підгрупах сприяло відновленню показників цитокінового балансу, значення більшості з яких не відрізнялося від вмісту у здорових осіб, тільки концентрація ІЛ-17 зменшувалася відносно рівня до лікування в 1,39 раза при активних проявах хвороби (р < 0,05) та не досягала значення контрольної групи. Динаміка показників системи NO, EGF, VEGF та його рецептора в 1а та 1б підгрупах також мала тенденцію до нормалізації, крім iNOS, коли його значення зменшувалося в 1,42 раза відносно до лікування (р < 0,05). Рівень адаптаційних гормонів та їх коефіцієнту у хворих 1а та 1б підгруп нормалізувався в повному обсязі (р < 0,05).
Позитивні зміни досліджених показників діагностувалися у хворих 2а та 2б підгруп. Залишався підвищеним рівень ІL-1β, ІL-17 та HSP-70 у хворих з активними проявами ГА порівняно з такими у здорових, але зменшувався в 1,8, 1,4 та 2,1 раза відповідно порівняно зі значеннями до лікування (р < 0,05). Секреція VEGF, NO3 та iNOS після лікування зменшувалася відповідно в 1,6, 1,8 та 2,04 раза з показниками до терапії (р < 0,05), але не досягала вмісту у здорових осіб. Слід відзначити зменшення рівня інсуліну у хворих з неактивними проявами ГА в 1,42 раза відносно показника до лікування (р < 0,05) при досягненні вмісту контрольної групи інших значень досліджених гормонів та адаптаційного коефіцієнту.
Відновлення показників 3а та 3б підгруп відбувалося менш значимо, що, вірогідно, обумовлює результати ефективності лікування у цих хворих. Так, залишався підвищеним рівень ІL-1β, ІL-17 та HSP-70 у хворих з активними проявами дерматозу відносно здорових осіб при зниженні відносно до отриманої терапії в 1,94, 2,32 та 1,91 раза (р < 0,05). При неактивному процесі вміст ІЛ-1β та ІЛ-17 знижувався порівняно з таким до лікування в 1,43 та 1,98 раза відповідно (р < 0,05), але не досягав значення здорових осіб. Рівень VEGF у хворих із тяжким перебігом і активними проявами хвороби знижувався в 1,91 раза та підвищувався в 1,87 раза порівняно зі значенням до лікування (р < 0,05). Секреція iNOS зменшувалася в різні періоди хвороби у 2,42 та 1,35 раза (а і б підгрупи відповідно), а сNOS підвищувалась у 2,26 раза у хворих 3а підгрупи відносно значень до лікування (р < 0,05), але відрізнялася від аналогічних контрольної групи. Параметри адаптаційно-регуляторної системи у хворих 3а підгрупи не досягали значень показників здорових осіб, але змінювалися відносно вмісту до лікування, особливо коефіцієнт К, значення якого збільшувалося в 1,58 раза (р < 0,05). У 3б підгрупі рівень кортизолу та інсуліну був у межах значень здорових осіб, але коефіцієнт К збільшувався тільки в 1,34 раза і не відновлювався в повному обсязі.
Аналізуючи одержані результати, можна зробити висновок, що диференційоване використання в комплексному лікуванні хворих на ГА препаратів розробленого алгоритму – ГКС, міноксидилу, тівортіну, даларгіну – сприяє одержанню стійкого клінічного ефекту та у зв’язку з доброю переносимістю, простотою призначення і доступністю засобів рекомендується для впровадження в практику дерматовенерологічних закладів.
***
Таким чином, динаміка імунного запалення при ГА і розвиток наслідків автоімунної атаки на фолікул диктують етапність терапевтичних впливів, що раніше не враховувалася при призначенні лікування. Результати проведеного дослідження свідчать про більш високу ефективність розробленого патогенетично обумовленого методу терапії ГА з диференційованим використанням ГКС у різних дозах і способах введення, донатору аргініну тівортін, препарату зі стрес-протекторною і адаптогенною діями даларгіну, а також місцевого розчину 5 % міноксидилу. Застосування цих препаратів дозволило досягти позитивного результату при лікуванні у 79,4 % пацієнтів, що в 1,5 раза вище, ніж при використанні традиційної терапії. При цьому відсутність ефекту і погіршення перебігу ГА діагностувалися в 2,5 раза частіше при лікуванні препаратами традиційної терапії. Сульфасалазин, що має імуносупресивний і протизапальний ефекти, може бути альтернативним варіантом лікування у пацієнтів з ГА, які стійкі до ГКС та інших терапевтичних методів.
Наведені у розділі положення висвітлені у наступних публікаціях:
- Сербина И.М. Гнездная алопеция: лечение и перспективы новых исследований. Клінічна імунологія. Алергологія. Інфектологія. 2012. № 1. С. 64–67 [82].
- Сербина И.М. Использование препаратов метаболического действия в терапии гнездной алопеции. Дерматовенерология. Косметология. Сексопатология. 2010. № 1–4. С. 52–55 [87].
- Сербина И.М. Активация местных механизмов ангиогенеза при гнездной алопеции. Матеріали регіональної науково-практичної школи «Набуття молодих вчених дерматовенерологів», м. Київ, 15 листопада 2012 р. Київ, 2012. С. 87 [99].
- Сербина И.М. Коррекция нарушений метаболизма оксида азота при гнездной алопеции. Матеріали І Міжнародної науково-практичної конференції у двох томах «Ліки-людині. Сучасні проблеми фармакотерапії і призначення лікарських засобів», м.Харків, 30–31 березня 2017 р. Харків, 2017. Т. 2. С. 295 [91].
- Сербина И.М. Опыт использования комбинированной наружной терапии при гнездной алопеции. Матеріали XXXІІІ Всеукраїнської науково-практичної конференції за участю міжнародних спеціалістів «Ліки-Людині», м. Харків, 8 квітня 2016 р. Харків, 2016. С. 177 [93].
- Сербіна І.М. Патогенетичне обґрунтування диференційованого підходу в терапії гніздової алопеції. Дерматологія та венерологія. 2018. № 3 (81). С. 46–50 [80].
- Пат. на корисну модель 123446 UA, МПК A61К31/00, A61B17/14. Спосіб диференційованого лікування гніздової алопеції / І.М. Сербіна, Л.А. Болотна; заявник і патентовласник Харківська медична академія післядипломної освіти. № u201709537; заявл. 29.09.17; опубл. 02.2018, Бюл. № 4 [66].
РОЗДІЛ 9
АНАЛІЗ ТА УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
ГА є запальним захворюванням ВФ з нерубцевим типом випадіння волосся на волосистій частині голови та інших ділянках шкірного покриву. В основі механізмів розвитку ГА полягають клітинно-опосередковані місцеві імунні реакції, пов’язані з Т-лімфоцитами і змінами цитокінового профілю, обумовлені генетичними факторами і екзогенними тригерами, що призводить до формування неспецифічного аутоімунного запалення, в умовах порушення ІТ ВФ. Генетичні дослідження та аналіз експресії генів людини показали значимість порушень NKGD-активуючого ліганду і природного рецептора цитотоксичності NKG2D, сигнальної системи JAK-STAT для розвитку ГА [137, 221].
До недавнього часу розвиток автоімунних захворювань пов’язували зі зміщенням балансу Тh-1- і Тh-2-клітин в бік перших. Однак з’являється все більше свідчень на користь того, що даній концепції недостатньо, щоб описати весь спектр патологічних аутоімунних процесів [207]. Дослідження останніх років показали, що важливу роль в порушенні механізму ІТ грають Th-17. Диференціація Th-17 відбувається незалежним від Th-1, Th-2 шляхом. Th-17 продукує ІЛ-17, який проявляє виражену прозапальну активність, індукує синтез різних медіаторів запалення, включаючи ФНО-α, ІФН-γ, ІЛ-1, ІЛ-6, відомих як потужних інгібіторів росту волосся, сприяє розвитку аутоімунних патологічних реакцій. Встановлено, що Th-17 відіграють фундаментальну роль в иммунопатогенезе широкого спектра аутоімунних захворювань [6, 149].
Безліч досліджень останнім часом присвячено пошуку маркерів активності запального процесу, ризику розвитку захворювань з метою більш точної та ранньої діагностики [23]. Участь БТШ-70 у патогенезі автоімунних захворювань уявляється складним і багаторівневим процесом, що визначається множинними його функціями у внутрішньоклітинних і позаклітинних комунікаціях [144, 219].
Одним із потужних промоторів ангіогенезу є VEGF – багатофункціональний білок, потенційний мітоген для епітеліальних клітин судин, мікро- і макроваскулярних клітин кровоносних і лімфатичних судин. Активація рецепторів VEGF призводе до включення численних внутрішньоклітинних пострецепторних сигнальних каскадів, які запускають ангіогенез та індукують прозапальні реакції. [121, 122].
Актуальним є вивчення продукції розчинних форм рецепторів VEGF, і зокрема sVEGF-R1, який є інгібітором трансдукції VEGF опосередкованого сигналу, перешкоджаючи взаємодії останнього з VEGFR2 і обмежуючи секрецію VEGF у різних клітинах [36, 38]. Синтез VEGF стимулюється безліччю проангіогенних факторів, включаючи EGF. Біологічна дія EGF здійснюється при його взаємодії з іншими факторами росту, які мають ангіогенні властивості, що забезпечує морфогенез судини, хемотаксис клітин ендотелію, посилення проліферації клітин ендотелію капілярів, експресію в них генів колагенази і гену фібронектину. Виявлено роль EGF як посередника припинення анагену [284].
Метаболіти NO, будучи універсальними вторинними клітинними месенджерами і опосередковуючи фундаментальні функції по міжклітинній комунікації, клітинному подиху, нейротрансмісії, імунологічному захисту, вазодилатації, беруть участь у захисних і ушкоджуючих реакціях організму при цілій низці патологічних станів [4, 40].
Патологічний ангіогенез має важливе значення в розвитку хвороб волосся. Вважають, що зрив ІТ є стимулом до початку ГА. Аномальні ендотеліоцити капілярної мережі, поряд з клітинами волосяного сосочка, кератиноцитами матриксу і коркового речовини кореня волосся, меланоцитами волосяної цибулини можуть бути ключовими клітинами-мішенями для розвитку ГА [157, 256]. Дослідження NO та VEGF у хворих на ГА мають суперечливий характер [204, 331].
Хоча ГА з точки зору вітальної загрози відноситься до легких, що не супроводжується ризиком летального результату, проте психотравуючий вплив даного захворювання може досягати рівня, порівнянного з наслідками життєзагрожуючих та інвалідизуючих захворювань. Стійкий характер імунних порушень, зв’язок розвитку і рецидивів дерматозу з психотравмуючими факторами опосередковано вказують на неповноцінність адаптаційного потенціалу організму хворих [188].
Актуальним є оцінка ЯЖ при хронічних дерматозах як інтегрального показника, що описує найбільш важливі функції людини і дозволяє дати їх глибокий багатоплановий аналіз при розвитку хвороби і їх відновлення на тлі лікування. Оцінка ЯЖ широко використовується для характеристики тяжкості патологічного процесу, його динаміки та ефективності лікувальних заходів [170].
Все більше уваги приділяється стрес-системам організму при аутоімунних захворюваннях. Гормони стресу здатні змінювати баланс Th-1 / Th-2 – цитокінів та впливати на дебют і перебіг автоімунного процесу [188]. За своєю біологічною природі стрес має адаптаційну спрямованість, при цьому основне навантаження падає на ГГНС. Інсулін займає ключові позиції в розвитку загального адаптаційного синдрому, так як в організмі через нього реалізуються численні контрефекти по відношенню до регуляторного впливу ГКС [61, 63, 65].
В епоху доказової медицини об’єктивізація клінічного діагнозу, тобто підтвердження захворювання за допомогою різних методів дослідження є важливим завданням. Це дозволяє скорочувати кількість діагностичних помилок і призначати в кожному випадку адекватне лікування, яке відповідає сучасним поглядам на проблему ГА. Відсутність чітких діагностичних критеріїв, навичок інтерпретації отриманих результатів, може утрудняти оцінку повноцінної клінічної картини. Виділення специфічних дерматотрихоскопічних стигм відкриє нові можливості в дослідженні та діагностиці хвороб волосся та ГА [308, 351].
ГА має непередбачуваний характер перебігу. З одного боку, спостерігається спонтанне відновлення волосся, з іншого ж, відзначаються тяжкі торпідні форми втрати волосся, резистентні до терапії. Як показує клінічний досвід, ріст волосся при ГА може відновитися після багаторічного їх відсутності. Тобто унікальний фізіологічний механізм відновлення ВФ, забезпечує його збереження від неминучої деструкції. ВФ при ГА зберігає і використовує механізм репаративної регенерації. Потенційно при будь-якій клінічній формі ГА і будь-якому терміні існування волосся здатні до повторного відростання, і такі випадки часто спостерігаються в клінічній практиці. Часті випадки, коли ріст волосся відновлюється тільки при постійному лікуванні, а при припиненні терапії волосся знову випадає протягом декількох днів [17, 237].
Аналіз міжнародних протоколів лікування ГА показує, що на сьогоднішній день не існує універсального методу лікування, який гарантує відсутність рецидиву в майбутньому. Поки не розроблено протокол лікування ГА, що базується на принципах доказової медицини або затверджений FDA. Розвитку ефективних методів терапії перешкоджає відсутність єдиної думки про механізми, причини появи і закономірності перебігу ГА, що робить актуальною проблему вивчення етіопатогенезу цього дерматозу, оскільки отримані дані дозволять розробити патогенетичні підходи терапії [238, 247].
Аналіз літератури та сучасних досліджень дав можливість взяти за мету удосконалення методів діагностики, підвищення ефективності терапії хворих на ГА шляхом розробки комплексного диференційованого методу лікування на підставі вивчення особливостей морфологічних, патофізіологічних, імунологічних та гормональних змін з урахуванням клінічних особливостей захворювання.
Відповідно до мети і для вирішення поставлених завдань було проведено обстеження 156 пацієнтів із діагнозом ГА (чоловіків – 66, жінок – 90, у віці 18–64 років). Виявлено різні клінічні форми ГА: осередкова (34,6 %), лінійна (15,4 %) (офіазис [10,3 %], зворотний офіазис [5,1 %]), багатоосередкова (26,9 %), дифузна форма (2,6 %), тотальна (12,8 %) і універсальна алопеція (7,7 %), Включення пацієнта у програму обстеження проводилося за спеціально розробленими критеріями відбору.
ГА характеризувалася надзвичайною варіабельністю таких показників, як час початку захворювання, тривалість, поширеність і характер втрати волосся. Дебют ГА варіював у широких вікових межах: у 44,8 % пацієнтів відзначено у віці 5–17 років, у 38,5 % – у період 18–40 років і у 16,7 % – старше 40 років. Ранній дебют ГА – до пубертатного періоду є предиктом більш тяжкого перебігу захворювання: у 33,7 % пацієнтів із багатоосередковою, ТА й УА дебют хвороби відзначено у віці до 10 років (р ≤ 0,01), у той час як осередкове облисіння зустрічалося тільки у 7,4 % пацієнтів з раннім дебютом (р ≤ 0,01). Тривалість захворювання становила в середньому 9,8 місяця з діапазоном від 2 тижнів до 10 років. Пацієнти з тяжкою формою захворювання достовірно частіше мали більше 2 рецидивів протягом життя (р ≤ 0,01). Як провокуючий фактор розвитку ГА найчастіше вказували стрес 32,7 % пацієнтів, а також атопічні й автоімунні захворювання – 16,3 %. Сімейний характер захворювання відзначили 17,9 % пацієнтів.
Проблема коморбідних станів у пацієнтів із ГА є актуальною й обумовлена їх впливом на перебіг і прогноз самого захворювання, вибір тактики лікування і на ЯЖ хворих. Привертає увагу висока питома вага (у 52,1 % хворих) супутніх захворювань. Хвороби, що пов’язані з ГА, передують або виникають на тлі розвиненого дерматоза. Супутні захворювання можуть впливати на ініціацію, характер і перебіг шкірного процесу. Результати дослідження дають можливість говорити про мультифакторіальність захворювання.
Пацієнти з ГА схильні до підвищеної частоти розвитку імунозапальної патології. Виявлені дані демонструють високу частоту поєднання ГА з проявами атопії й автоімунними станами (у 20,5 % і 36,5 % пацієнтів відповідно), наявність яких має прогностично несприятливе значення для перебігу ГА (р<0,05). Для атопічних станів характерно Th-2-опосередкований механізм формування. Це робить актуальним вивчення імунологічної взаємозв'язку ГА з атопічними респіраторними захворюваннями (атопічний дерматит (6,4%), алергічний риніт (8,9%) і бронхіальну астму (5,1%), з огляду на їх часту асоціацію та інший – Th-2-опосередкований механізм формування, для пошуку можливих альтернативних механізмів аутоагрессивних імунних реакцій і визначення оптимальної терапевтичної тактики при ГА.
Пацієнти з ГА схильні до підвищеної частоті розвитку аутоімунної патології (захворювання щитоподібної залози у вигляді автоімунного тиреоїдиту Хашимото (цукровий діабет (2,6 %), червоний вовчак та склеродермія (3,8 %), ревматоїдний артрит (1,3 %), вітиліго (8,9 %), псоріаз (3,9 %), що пояснюється спільністю імунологічних механізмів розвитку цих захворювань, де провідне місце відводиться активації T-лімфоцитів по Th-1 типу з подальшим синтезом прозапальних цитокінів – IL-2, IL-15, IFN-γ, TNF-α та ін.; Th-17 типу; JAK-STAT – сигнальній системі.
Виявлено високу психологічну коморбідну патологію за типом тривожного розладу, депресії та порушення сну серед 48 % пацієнтів із ГА. Ми показали, що більш виражені порушення асоційовані з молодим віком, коли так актуальна соціальна адаптація (р<0,01).
Імунозапальні та метаболічні порушення здатні змінювати гомеостаз і можуть сприяти розвитку таких захворювань, як дефіцитні стани, ендокринні порушення, гіперліпідемія, гіпертонія, захворювання шлунково-кишкового тракту, які ми виявили у майже 50% пацієнтів. З одного боку, вони можуть бути тригерами для реалізації, з іншого ж, розвиватися на тлі ГА.
Відзначено поєднання ГА зі злоякісними захворюваннями у 1,3 % пацієнтів з дебютом швидкопрогресуючих багатоосередкової та ТА після 50 років, що може обґрунтовувати розгляд ГА як паранеопластичного дерматозу.
У пацієнтів із супутніми захворюваннями відзначено більш тяжкі форми у вигляді ТА, УА та багаьлосередкової ГА порівняно з хворими, які не мали соматичної патології (р<0,01). Позитивну кореляцію виявлено між атопією, психологічними порушеннями і тяжкими формами ГА (р < 0,01).
Особливий інтерес представляла асоціація ГА і псоріазу у 23-річної пацієнтки, у якої на підставі клінічних, дерматотрихоскопічних, гістологічних методів дослідження діагностовано характерні риси феномена Ренбека – відновлення зростання волосся у псоріатичних бляшках на волосистій частині голови, що з’являються в осередках ГА. Механізм, що полягає в основі феномена Ренбека, не зовсім ясний. Імовірно перехід від псоріазу до ГА і назад може бути обумовлений зміною цитокінового балансу, що призводить до активації автоантигенами реакції з перемиканням на інші автоантигени. Кожен імунозапальний шлях підсилює свою власну відповідь і пригнічує протилежні шляхи, тим самим запобігаючи співіснування двох різних захворювань в одному місці. Тригер для точки перемикання з одного шляху на інший невідомий, і феномен Ренбека пропонує виняткову можливість проаналізувати цю невловиму точку.
Вивчено особливості клінічного перебігу ГА і показано, що для оцінки тяжкості захворювання принциповими є не тільки кількість і розмір осередків на скальпі, але й загальний характер втрати волосся на шкірі, наявність дистрофічно змінених НП. Відзначено часткову або повну втрату волосся на тілі у 12,2 % хворих при ГА з площею випадання волосся до 50 % і у 32,6 % з клінічними формами ГА з площею випадання понад 50 %. Різні зміни НП виявлено у 10,9 % пацієнтів із ГА з площею ураження до 50 % і у 33,7 % із більш поширеними формами. Поєднання різного ступеня випадання волосся на тілі й дистрофії НП у обстежуваних хворих на ГА відзначено в 11,5 % випадків. Втрата волосся на тілі й ураження НП діагностувалися при втраті більше 25 % волосся на скальпі, і частота їхніх проявів збільшувалася в міру розширення площі ураження волосистої частини голови (р < 0,01).
Клініко-лабораторне обстеження пацієнтів проводили відповідно до єдиного плану обстеження. При огляді важливе увага приділялася дерматотрихоскопічним ознаками ГА в осередку ураження, які вивчали із застосуванням трихоскопа – відеодіагностичного обладнання «Aramo SG», що дозволяє збільшити масштаб зображення і знімків поверхні шкіри в 60 і 200 разів. Дерматотрихоскопічні стигми ГА мали діагностичну цінність і дозволяли виділити захворювання серед інших хвороб волосся (андрогенетична алопеція, трихотіломания та ін.). Кількісна оцінка вираженості дерматоскопічних маркерів при різних стадіях ГА (активна, хронічна) визначала постадійну еволюцію фолікулярних стигм, що оптимізує клінічне дослідження і обґрунтовує етапність патогенетичної терапії захворювання в залежності від стадії патологічного процесу, а також може використовуватися для об’єктивізації оцінки ефективності лікувальних впливів.
Показано, що найбільш поширеною дерматотрихоскопічною ознакою в обстежуваних пацієнтів були: жовті точки, потім чорні точки, псевдовелусне волосся та дистрофічне волосся у вигляді знаку оклику та конічного. Кількість жовтих точок не залежала від активності патологічного процесу. Відзначалась особливість при ТА та УА, коли кількість жовтих точок достовірно знижувалася майже в 2 рази порівняно з пацієнтами, у яких відсоток втрати волосся становив до 99 %. Представлено дані про достовірне збільшення кількості чорних точок, дистрофічного волосся при прогресуванні ГА, в той час, як псевдовелус був характерною ознакою при регресі, у хронічну стадію дерматозу.
Сьогодні дерматологи всього світу використовують велику кількість різних індексів і шкал для характеристики тяжкості стану дерматологічних хворих. Відсутність критеріїв, що стандартизують визначення ступеня поширеності ГА, проявів активності, ускладнює групування пацієнтів за тяжкістю захворювання і знижує об’єктивність клінічних досліджень. У зв’язку з цим назріла необхідність розробки діагностичної шкали обстеження.
Використання ІТГА дозволяє підвищити точність клінічних оцінок, визначення терапевтичну тактику при ГА. В ІТГА комбінуються кількісні оцінки ступеня вираженості основних проявів ГА на волосистій частини голови (тест натягнення волосся, дерматотрихоскопічні маркери) з оцінкою площі ураження, а також кількісні оцінки ступеня втрати волосся на інших ділянках і ураженні НП.
Оцінку ступеня втрати волос на волосистій частині голови проводять з використанням математичного підходу і візуальних допоміжних засобів, що виражає офіційний математичний підхід до визначення облисіння і відновлення росту волосся [128].
Шкала втрати волосся на скальпі (S):
- 0 балів – 0 %;
- 1бал – >10 %;
- 2 бали – 10–25 %.
- 3 бали – 26–49 %;
- 4 бали – 50–74 %;
- 5 балів – 75-99 %;
- 6 балів – 100 %.
Шкала втрати волосся на тілі (B) має на увазі повний огляд волосяного покриву пацієнта (ділянка бороди, вусів, брів, вій, а також кінцівок і тулуба) і представлена:• 0 балів – збереження волосся на тілі;• 2 бали – часткова втрата волосся на тілі;• 4 бали – втрата 100 % волосся на тілі, виключаючи скальп.Шкала оцінки ураження НП (N):• 0 балів – відсутність дистрофічних змін;• 2 бали – часткове ураження нігтів;• 4 бали – дистрофія 20 нігтів.Шкала оцінки «pull test» (P):• 1 бал – негативний;• 2 бали – позитивний;• 3 бали – різко позитивний.Шкала оцінки дерматотрихоскопічних маркерів активності (T):• 1 бал – 0 %;• 2 бали – < 50 %;• 3 бали – ≥ 50 %.Бал втрати волосся (БВВ) розраховується з урахуванням ділянки голови: БВВ (Л) = (P+Т)ЧSЧ0,18; БВВ (П) = (P+Т)ЧSЧ0,18; БВВ (В) = (P+Т)ЧSЧ0,40; БВВ(П)=(P+Т)ЧSЧ0,24. Загальний БВВ= БВВ(Л)+БВВ(П)+БВВ(В)+БВВ(П). ІТГА= загальний БВВ+В+N.Використання індексу дозволяє об'єктивно оцінити тяжкість ГА, ефективність проведеної терапії. ІТГА представлений числом від 0 балів (відсутність хвороби) до 44 балів (найтяжчий перебіг) і відображає площу ураження з урахуванням інтенсивності проявів клінічних ознак. За його допомогою визначають тактику і стратегію ведення пацієнтів із ГА. Значення від 1 до 12 балів відповідає легкому ступеню тяжкості, від 13 до 25 балів – середньому ступеню тяжкості процесу, від 26 до 44 балів – тяжкому перебігу ГА. Запропонована шкала визначає терапевтичну стратегію ведення пацієнтів із різними проявами ГА. При значенні ІТГА – < 12 балів – використовується місцева терапія, при > 12 – необхідне призначення системної терапії.Відомо, що ГА часто має непередбачуваний характер перебігу, тому важливим є визначення прогностичних факторів За допомогою логістичного регресійного аналізу виявлено статистично значущі фактори ризику тяжкого перебігу ГА, до яких належать: жіноча стать (p < 0,001), наявність дистрофічних НП (p < 0,001), атопії (p < 0,001) автоімунних захворювань (p = 0,03), утрата волосся на ділянках шкірного покриву при ураженні волосистої частини голови до 50 % (p < 0,001), тривалість хвороби більше 1 року або 1 рік (p < 0,001), вік хворого на початок захворювання до 17 років (p < 0,001), відсутність жовтих точок при дерматотрихоскопії (p = 0,03).
Літературні дані, що стосуються опису патоморфологічної картини ГА, суперечливі, недостатньо повно висвітлюють характер розподілу клітин інфільтрату та їх імунний фенотип, оскільки не враховують стадію патологічного процесу. Тому метою дослідження стало вивчення морфологічних та ІГХ особливостей активного та хронічного перебігу ГА і уточнення патогенезу захворювання на підставі отриманих даних.
Детальний аналіз дозволив встановити ключові механізми дісморфогенеза ВФ. ГА характеризується порушенням циклу зростання ВФ: запальні клітини (CD8+ Т-клітини, CD68+, NK-клітини та ін.), атакують анагенові ВФ. Збільшення кількості запальних клітин навколо ВФ призводить до їх мініатюризації та скорочення циклу зрстання волосся з переходом у кеноген. Ступінь вираженості інфільтрату корелювала з гостротою патологічного процесу і мала більш виражений характер у зразках з активною стадією ГА. При хронічній стадії ГА переважали фібропластичні та місцями атрофічні процеси. Крім фібробластів важливу роль у процесах фіброгенезу відіграють і макрофаги, одні з основних цитокінпродукуючих клітин організму. В основі патогенезу раннього фіброзування може полягати неконтрольована імунна відповідь, пов’язана з гіперцитокінемією [340]. При хронічному запаленні у хворих на ГА основну роль відіграють імунокомпетентні клітини, такі як CD68+ з домішкою поодиноких лімфоцитів CD8+. При активності ГА збільшувалася кількість CD8+ цитотоксичних Т-лімфоцитів у шкірі пацієнтів. За даними ІГХ аналізу, активовані CD8+ Т-клітини можуть проникати у ВФ, у той час як CD4+ Т‑клітини майже виключно розташовані в перифолікулярній ділянці, що може легко порушити зростання волосся. Співвідношення CD4/CD8 вірогідно знижувалося відносно контролю, що пояснює зниження місцевого клітинного імунітету в осередку ураження. Крім того, підвищена кількість макрофагів у запальному інфільтраті шкіри свідчить про наявність імунної відповіді та персистенції хронічного запалення, що може бути діагностичним маркером не тільки класичних проявів ГА, а й мати значення при оцінці ефективності лікування. Слід відзначити виражену наявність позитивних ЕК‑клітин (CD56+) у запальному інфільтраті при активній стадії ГА. Останні дослідження виявили експресію ULBP3 при ГА, що кодує активацію ліганд NK-клітинного рецептора NKG2D природних кілерів та ініціює автоімунну відповідь. ULBP3-кодовані білки у великих кількостях містяться в пошкоджених ВФ. Білки залучають NK-клітини, що містять рецептори NKG2D. Дані відкриття розглядаються як перспективні об’єкти у вивченні терапії і при ГА [217, 277]. Імунний цитоліз клітин ВФ здійснюється не тільки за рахунок Т-лімфоцитів, а й прозапальних цитокінів, таких як TNF-α, IL-1 і IL-6, рівень яких достовірно збільшувався при ознаках активності (р<0,01).
У хронічній стадії ГА спостерігаються зниження щільності запального інфільтрату, перерозподіл його клітинного складу і зміни гомеостазу пошкодженої тканини, що свідчать про тенденцію до репаративних процесів, які мають загальні закони розвитку, незалежно від тканини. Клінічний досвід і дані літератури показують, що при 1-му розвитку хвороби частіше завершується повним відновленням ВФ як органа, і зростання волосся триває, але кожен наступний рецидив збільшує ймовірність розвитку репарації по патологічному шляху з частковим загасанням запального процесу і, відповідно, неповної репарацією ВФ з розвитком фіброзу і склерозу [30, 162]. В цьому випадку повноцінна регенерація пошкоджених тканин часто неможлива, що проявляється тяжкими формами ГА, торпідними до терапії. Порушення місцевих імунорегуляторних механізмів розглядається як тригерний фактор у формуванні патофізіологічної стадії автоімунних реакцій при ГА, що впливає на механізми підтримки стану імунотолерантності структур ВФ.
Питання зміни системного цитокінового потенціалу у хворих на ГА, до теперішнього часу також є предметом жвавих дискусій у наукових колах і не може вважатися остаточно вирішеними. Визначення профіля цитокінів можна розглядати як найважливішу характеристику функціонального стану імунної системи, що дозволяє зрозуміти механізм патогенезу захворювань. Крім того, аналіз рівня цитокінів є одним з ключових параметрів у ході вивчення терапевтичної ефективності препаратів [134, 135, 139]. Отже, розглянута проблема не нова, проте її актуальність на сучасному етапі безсумнівна і обумовлена, в першу чергу, відсутністю єдиної думки і загальноприйнятої точки зору не тільки щодо характеру та спрямованості імунологічних змін, але й їх взаємозв’язку з вираженістю клінічних проявів та перебігу ГА.
Дослідження цитокінового гомеостазу та рівня HSP-70 визначило їх зміни у 78,5 % хворих, які проявлялись підвищеним вмістом ІЛ-1β, ІЛ-17 та HSP-70 на фоні зниженого значення ІЛ-10 та тенденції до зниження ІЛ-4. Ступінь змін цитокінового гомеостазу залежить і, можливо, в якійсь мірі визначає клінічні прояви і перебіг ГА. У пацієнтів, які мали ознаки прогресування дерматозу, значно підвищувалася концентрація прозапальних цитокінів, особливо ІЛ-17 та HSP-70 (р < 0,01), порівняно з показниками хворих при неактивних проявах ГА. Рівень протизапальних ІЛ-4 та ІЛ-10 був нижчим (р < 0,01) при активному перебігу, підвищувався в хронічну стадію ГА (р < 0,05), але не досягав значень контрольної групи.
При тяжких формах дерматозу, було виявлено більш високі концентраційні значення прозапального цитокінового профілю. Визначено динаміку збільшення маркерів запалення патологічного процесу від легкого до тяжкого перебігу – ІЛ-17, ІЛ-1b та HSP-70. Більш значно на ступінь тяжкості із протизапальних цитокінів реагував ІЛ-10, рівень якого максимально знижувався у хворих тяжкого ступеня тяжкості (р < 0,05).
Найбільш виражені порушення відзначено при тяжкому ступені тяжкості з активними проявами захворювання, коли рівень прозапальних та протизапальних цитокінів мав різноспрямовані зміни – ІЛ-1β та ІЛ-17 збільшувались в 3,2 та 3,6 раза, а ІЛ-4 та ІЛ-10 зменшувались в 1,9 та 2,1 рази відповідно (р < 0,01), секреція HSP-70 була достовірно вище в 2,6 рази відносно значень контрольної групи (р < 0,01).
Установлено деякі закономірності в секреції цитокінів при становленні і дальшому розвитку ГА. Збільшення рівня ІЛ-17 (р < 0,05) порівняно з його значенням у здорових осіб спостерігалося в усі періоди захворювання, але максимальний вміст виявлявся при тривалості ГА до 1 року. Рівень показника ІЛ-1β достовірно збільшувався (р < 0,05) при захворюванні до 3 років. Секреція ІЛ-4 знижувалась тільки при продовженні строку хвороби більше 3 років. При тривалості ГА 1–3 роки та більше рівень ІЛ-10 достовірно знижувався (р < 0,05) відносно його значення у здорових осіб та був нижчим за рівень при тривалості до 1 року (р < 0,05). Збільшення значення HSP-70 в усі періоди захворювання (р < 0,05) та найвищим рівень відзначався у пацієнтів із тривалістю хвороби до 1 року.
Кореляційний аналіз зв’язку між експресією цитокінів, HSP-70 та перебігом, клініко-лабораторними параметрами ГА показав, що вихідна величина ІЛ-17 достовірно пов’язана з віком початку захворювання (r= –0,48, p = 0,037), значенням ІТГА (r = 0,63, р = 0,037), активністю (r = 0,790, р = 0,017) та тривалістю (r = –0,32, р = 0,0028). Виявлені тісні кореляційні взаємозв’язки між ІЛ-1β і ІЛ-17 (r = 0,71, р < 0,05), ІЛ-1β і HSP-70 (r = 0,68, р < 0,05) ІЛ-17 і HSP-70 (r = 0,75, р < 0,05) вказують на роль їх порушень у патоґенезі ГА.
Встановлено, що на тлі збільшення значення ІЛ-1β рівень протизапальних цитокінів ІЛ-10 і ІЛ-4 у хворих на ГА знижений, що може свідчити про пригнічення функції Th-2 типу та формування умов для розвитку імунозапальних реакцій. Кандидатом на роль ключової ланки прозапальної відповіді, на додаток до Th-1, виступає система Th-17, активність якої виявлена в дослідженні.
Найімовірніше ІЛ-17 індукує експресію різних прозапальних цитокінів, посилюючи каскад цитокінових реакцій і обтяжуючи патологічний процес. У процесі імунної відповіді цитокіни індукують експресію HSP, яким відводиться важлива роль у розпізнаванні антигенів і внутрішньоклітинної адгезії. Будь-яке, у тому числі автоімунне пошкодження тканин призводить до викиду HSP-70 у позаклітинний простір, що стимулює макрофаги і дендритні клітини, в результаті чого посилюється синтез адгезивних молекул, прозапальних цитокінів [219, 240]. Підвищений HSP-70 здатний активувати передачу стрес-асоційованих сигналів NK-клітин, експресія ліганд рецепторів яких NKG2D виявлена у фолікулярному епітелії волосяного фолікула при ГА, при цьому регулюючи імунний нагляд клітин. У результаті цього відбувається стимуляція молекул МНС класу 1, презентація фолікулярних автоантигенів CD8+-клітинам і втрата ІТ [78]. Збільшення сироваткового рівня HSP-70 у хворих на ГА на тлі підвищення ІЛ-1b і ІЛ-17, найбільш яскраво виражене при проявах активності процесу, що підтверджується наявністю кореляційних зв’язків між цими показниками. Це обґрунтовує можливість визначення цих показників як маркерів активного патологічного процесу при ГА.
Ендотелій – це метаболічно активний моношар клітин, який є джерелом великої кількості факторів і медіаторів, критично важливих для підтримки гомеостазу [36]. В останні роки велика увага приділяється аналізу змін функціонального стану ендотелію при різних патологічних процесах. Активація рецепторів VEGF на клітинах призводе до включення численних внутрішньоклітинних пострецепторних сигнальних каскадів, які запускають ангіогенез та індукують прозапальні реакції. Рівень VEGF може відображати інтенсивність процесів ангіогенезу, які є важливим етапом в ініціації і хронізації запального процесу [104, 358]. VEGF є одним з найважливіших медіаторів зростання ВФ [103]. Дослідження з вивчення ролі VEGF, sVEGFR1 і EGF у патогенезі ГА поодинокі. Патогенетична роль ангіогенезу в розвитку ГА свідчить про необхідність подальшого глибшого вивчення цього процесу.
Проведені дослідження встановили розлади в системі ангіогенних факторів у 81,3 % хворих на ГА. Так, рівень VEGF у хворих на ГА достовірно не відрізнявся від значення в контрольній групі, але при аналізі вмісту показника залежно від стадії патологічного процесу були виявлені значні порушення – у пацієнтів, які мали ознаки активності дерматозу, концентрація VEGF збільшувалася в 1,7 раза, а при ознаках хронічного процесу – зменшувалася в 2,5 раза відносно значення у контрольній групі.
Ступінь тяжкості захворювання не впливала на достовірні зміни в рівні VEGF, але аналіз концентрації показника у хворих при різних ступенях тяжкості ГА залежно від активності патологічного процесу виявив значні порушення. При цьому в активну стадію із середнім і тяжким ступенем перебігу ГА показник VEGF був достовірно вищим у 2,5 та 3,4 раза відповідно, в 1,2 раза перевищував рівень у хворих із легким ступенем відносно його значення у групі контролю. Слід вказати, що при хронічному перебігу рівень VEGF достовірно знижувався при всіх ступенях тяжкості (при легкій та середній стадіях – у 2,6 та 1,5 відповідно), однак мінімальним був у хворих з тяжким перебігом (зменшувався в 3,9 раза) порівняно з показником здорових осіб.
Вміст sVEGFR1 у крові хворих достовірно знижувався в активну стадію (в 1,5 раза), а при хронічному перебігу ГА був на рівні показника здорових осіб, але вищим за значення при прогресуванні процесу (в 1,6 раза). Тяжкий ступінь ГА супроводжувався значним зниженням концентрації sVEGFR1 в активну стадію (у 3,3 раза), підвищенням при хронізації захворювання (в 1,2 раза). При інших проявах ГА змін цього показника не зареєстровано. Аналіз рівня EGF у хворих залежно від активності патологічного процесу виявив збільшення показника як в активну, так і в хронічну стадії ГА (в 1,3 раза) відносно значення в контрольній групі. Більш виражені порушення вмісту EGF виявлено у хворих при тяжкому перебігу ГА в активну стадію, коли його значення збільшувалось у 2,2 раза порівняно з показником у здорових осіб. У дослідженні у пацієнтів з тривалістю ГА менше 1 року рівень VEGF в крові був в 4 раза вище, а sVEGFR1 достовірно зменшувався в 1,4 раза ніж у хворих з тривалим перебігом. Саме на початку захворювання ГА інтенсивно протікають процеси ангіогенезу. Концентрація EGF не залежала від тривалості захворювання та була збільшена в 1,3–1,4 раза відносно його значення у здорових осіб у період захворювання як до 1 року, так і більше.
Клітини імунної системи є одночасно і регуляторами ангіогенезу, і мішенями дії VEGF, оскільки вони мають специфічні рецептори для взаємодії з цим фактором. Цитокіни в даний час розглядаються як медіаторна ланка у формуванні патофізіологічної стадії автоімунних реакцій при ГА, порушуючи механізми підтримки стану імунотолерантності структур ВФ [122]. Можна припустити важливість ролі VEGF при ГА, як ключового чинника, що пов’язує запальну реакцію й ангіогенез, так як поряд із збільшенням продукції VEGF, зниженням рівня sVEGFR1, виявленими у хворих з активними проявами ГА і тяжким ступенем перебігу, тривалістю хвороби до 1 року, виявлено підвищену експресію EGF, а також прозапальних цитокінів, які безпосередньо беруть участь у розвитку автоімунного запалення.
Збільшення вмісту VEGF у сироватці крові хворих на ГА, з одного боку, свідчить про активну проліферацію судин, з іншого – про ендотеліальну дисфункцію, яка може бути визначена як неадекватне (збільшене або знижене) утворення в ендотелії різних біологічно активних речовин. На думку авторів, у прогресуючу стадію ГА спостерігається помірний ангіогенез, який регулюється макрофагальними елементами запального інфільтрату і частково ендотелієм існуючих судин. Показано, що високі рівні VEGF у сироватці крові індукують недостатність ангіогенезу з подальшим розвитком фіброзу [358]. Виявлене зниження VEGF у хронічну стадію особливо у хворих із середнім та тяжким ступенями тяжкості ГА може демонструвати недостатнє судинне забезпечення, пригнічення ангіогенезу, індукцію апоптозу, що сприяє підтримці волосся у фазі кеногену і можливості розвитку фіброзних змін, які спостерігалися в дослідженні біоптатів шкіри хворих із хронічною стадією ГА. При цьому зміна вмісту sVEGFR1 у даних пацієнтів, можливо, має компенсаторне значення.
Доведено залежність VEGF від активності (r = 0,58, р < 0,05) та тривалості (r = –0,52, р < 0,05) патологічного процесу, значення ІТГА (r = 0,40, р = 0,039), рівня ІЛ-17 (r = 0,68, р = 0,034), ІЛ-1β (r = 0,54, р = 0,048) та NO (r = 0,55, р = 0,028).
Оцінювали силу впливу досліджуваних факторів на розвиток ГА за допомогою однофакторної лінійної регресії. Аналіз впливу VEGF, sVEGFR1 и EGF на розвиток ГА показав, що кожен з них має статистично значимий вплив на розвиток випадіння волосся. Так, збільшення значення VEGF (c2 = 84,2 %) і EGF (c2 = 22,8 %), зниження sVEGFR1 (c2 = 80,5 %) підвищує ймовірність розвитку ГА (р>0,05). При аналізі багатофакторної моделі встановлено, що всі показники є предикторами захворювання, при цьому VEGF (c2 = 0,716056, р <0,05) впливає на розвиток ГА більшою мірою, в меншій мірі sVEGFR1 (c2 = 0,255143, р <0,05), і EGF (c2 = 0,130318, р <0,05).
VEGF – ангіогенний фактор, який має виражену імуномодулюючу дію. Клітини імунної системи є одночасно і регуляторами ангіогенезу, і мішенями дії VEGF, оскільки вони мають специфічні рецептори для взаємодії з цим фактором. Цитокіни в даний час розглядаються як медіаторна ланка у формуванні патофізіологічної стадії автоімунних реакцій при ГА, порушуючи механізми підтримки стану імунотолерантності структур ВФ [122]. Можна припустити важливість ролі VEGF при ГА, як ключового чинника, що пов’язує запальну реакцію й ангіогенез, так як поряд із збільшенням продукції VEGF, зниженням рівня sVEGFR1, виявленими у хворих з активними проявами ГА і тяжким ступенем перебігу, тривалістю хвороби до 1 року, виявлено підвищену експресію EGF, а також прозапальних цитокінів, які безпосередньо беруть участь у розвитку автоімунного запалення.
Виявлені порушення можуть створювати умови для розвитку ендотеліальної дисфункції, можливих імунозапальних реакцій і свідчить про безпосереднє залучення їх у механізми формування ГА. Збільшення рівня VEGF в крові може бути використано як маркер активного патологічного процесу, високого темпу прогресування ГА.
Ендотелій судин розглядається як багатофункціональний орган, як важлива система регуляції тонусу судин, згортання крові, і, що особливо важливо, імунологічної резистентності організму. Серед численних властивостей ендотелію синтез NO є однією з провідних функцій [53, 366]. Метаболіти NO – універсальні вторинними клітинні месенджери, які опосередковують фундаментальні функції по міжклітинній комунікації, клітинному подиху, нейротрансмісії, імунологічному захисту, вазодилатації, беруть участь у захисних і ушкоджуючих реакціях організму при цілій низці патологічних станів [157, 276]. Порушення VEGF, в свою чергу, потребує компенсаторної зміни рівня вазодилататорів. Аномальні ендотеліоцити капілярної мережі, поряд з клітинами власного сосочка, кератиноцитами матриксу і коркового речовини кореня волоса, меланоцитами волосяної цибулини також є ключовими клітинами-мішенями для розвитку ГА [120]. Тому доцільно було визначити стан обміну NO у хворих на ГА.
Аналіз вмісту показників системи NO дозволило виявити існування у 78,2 % хворих на ГА помірно вираженого дисбалансу, який проявлявся підвищенням рівня NO за рахунок збільшення NO3 та активності iNOS при зниженому рівні сNOS та незмінному значенні показника NO2. Більш ретельний аналіз виявив, що у хворих з активним перебігом захворювання відзначалося підвищення рівня NO, NO3 та iNOS, у той час як значення цих показників при хронічному перебігу знижувалося (у 2,8, 3,4 та 3,6 раза відповідно). Разом з тим, концентрація NO2 змінювалася лише при активному перебігу – відзначено зменшення в 1,8 раза, а зниження рівня сNOS у 1,9 раза не залежало від перебігу ГА. Деякі особливості у стані системи NO відзначалися при різних ступенях тяжкості захворювання – рівень досліджуваних показників не змінювався при легкому перебігу, в той час як при середньому і тяжкому ступенях тяжкості виявлені порушення у вигляді збільшення NO, NO3, iNOS (у середньому – в 1,6; 1,8 та 2,8 раза відповідно). Найбільш значущі порушення відзначалися при тяжкому перебігу захворювання як в активну, так і хронічну стадії ГА. При ознаках прогресування захворювання рівень показників NO, NO3, iNOS був максимально високим – збільшення у 2,3, 2,8 та 4,5 раза відповідно. У хронічну стадію у пацієнтів з тяжким перебігом ГА їх значення значно зменьшувалися відносно рівня при активному перебігу – в 3,9, 5,03 та 2,5 раза відповідно. При тривалості ГА до 1 року зрушення вмісту NO, NO3 та iNOS відзначалося в бік збільшення в 2,5, 3,1 та 1,9 раза відносно їх значень у період хвороби більше 3 років. З подовженням періоду захворювання більше 3 років відзначено пониження рівня NO та NO3 відносно показників контрольної групи в 1,5 та 1,6 раза відповідно. Значення NO2 змінювалося лише при захворюванні до 3 років – зменшення в 1,4 раза. Рівень сNOS знижувався при різній тривалісті ГА, але більш виражено до 1 року – в 2,8 раза.
Запалення при автоімунних захворюваннях обумовлено каскадом дії цілої низки цитокінів, що стимулює синтез NО і призводить до збільшення різних проявів автоімунного характеру, зокрема, збільшується антигенність білкових молекул [64, 74, 112]. У ряді наукових досліджень доведено важливу роль гіперпродукції цитокінів IL-2, IL-1β, ФНП-α та ІФН-γ в інгібуванні і припиненні росту ВФ, відома їх активуюча дія на індукцію iNOS. Під впливом імуногенних і прозапальних стимулів відбувається експресія гена, що відповідає за синтез iNOS [276, 317]. Проведене дослідження демонструє активацію прозапальних цитокінів – ІL-17, ІL-1β у пацієнтів із ГА, які знаходяться в тісній кореляції з експресією iNOS ((r=0,64, р<0,05), ІL-1β (r=0,43, р<0,05). Цей факт дозволяє припустити, що IL-17 поряд з іншими прозапальними цитокінами може бути потужним індуктором експресії iNOS. У зв'язку з цим, інтерес представляють дані інших досліджень, де повідомляється про позитивну кореляцію між цитокінами Th-17, включаючи IL-6, IL-23, IL-17A і продукцією NO у плазмі пацієнтів з автоімунними захворюваннями. Механізм, за допомогою якого IL-17 індукує продукцію NO, ймовірно, залежить від експресії NF-kB [185, 334].
Можна вважати, що при активній стадії патологічного процесу істотне підвищення ендогенного NO, гіперпродукція NO3 обумовлені активацією iNOS. У високих концентраціях NO має не регуляторну, а цитотоксичну дію, з ініціацією апоптотичних механізмів, деструктивних процесів, що обумовлюють посилення проявів автоімунного характеру. NO здатний ініціювати посилений синтез проапоптотичного білка р53. На думку багатьох авторів, підвищений апоптоз у волосяних цибулинах при ГА обумовлений автоімунними процесами і являє собою динамічну систему, яка може активуватися різними факторами. Нітрування білків за участю NO підвищує їх антигенність, що також сприяє автоімунним процесам, які визначають патогенез ГА [26, 353].
Активність iNOS зберігається протягом тривалого періоду і кількість NО, синтезованого в такий спосіб, значно перевищує кількість NО, виробленого за участю конститутивного ізоферменту NOS, особливо в умовах його дефіциту, який було виявлено у досліджених хворих.
Підвищена і тривала продукція NO і синтез протизапальних цитокінів може сприяти підвищеному виробленню VEGF, розвитку ендотеліальної дисфункції [362]. Даний факт можна підтвердити наявністю кореляційного зв’язку між вмістом NO і VEGF при прогресуванні патологічного процесу (r=0,88, р<0,05). Надмірний ангіогенез може сприяти склерозу [26]. Тому факт надмірної експресії VEGF та NO необхідно враховувати при виборі тактики лікування ГА в активну стадію.
Аналіз впливу досліджених ангіогенних факторів на розвиток ГА за допомогою однофакторної лінійної регресії показав, що кожен з них має статистично значимий вплив на розвиток випадіння волосся. Так, збільшення показників VEGF (c2 = 84,2 %) і EGF (c2 = 22,8 %), NO3 (c2 = 64,3 %) та iNOS (c2 = 75,8 %), зниження sVEGFR1 (c2 = 80,5 %) та сNOS (c2 = 52,8 %) підвищує ймовірність розвитку ГА (р<0,05). При аналізі багатофакторної моделі встановлено, що більшість показники є предикторами захворювання, при цьому VEGF (c2 = 0,716056, р<0,05) та iNOS (c2 = 0,674539, р <0,05) впливають на розвиток ГА більшою мірою.
NO виконує одну з ключових ролей у реалізації нейроендокринних відповідей, залучений у формування термінової та довготривалої адаптації, маючи виражені захисні властивості при стресових впливах [47, 62]. Значення HSP-70 не обмежується лише роллю маркера пошкодження тканин та імунозапального процесу при ГА, а є частиною універсального цитопротективного механізму [78].
До теперішнього часу доведено, що NO активує синтез протекторних стрес-білків HSP-70. Це означає, що NO-залежна активація HSP-70 може бути важливим механізмом антистресового захисту клітин. HSP можуть пригнічувати експресію NOS за рахунок зниження активації фактора транскрипції iNOS. Сенс цього явища, мабуть, полягає в обмеженні гіперпродукції NO і його цитотоксичної дії [104]. Ці дані підтверджуються наявністю тісного зв’язку між рівнем NO і HSP-70 при активних проявах ГА у досліджених пацієнтів (r=0,52, р<0,05). Можливо, ці зміни мають компенсаторний характер. Дефіцит NO, як і занадто високий його вміст у крові, свідчить про зрив адаптації і є несприятливим прогнозом. Корекція порушень стану ангіогенних факторів має бути складовою частиною комплексної терапії та мати диференційований принцип в залежності від ступеня тяжкості та активності хвороби.
ГКС беруть активну участь у взаємодії між нейроендокринної та імунної системами. Метою цієї регуляторної взаємодії є підтримання гомеостазу всього організму без надмірної деструкції і запалення [333]. Інсулін посідає ключові позиції в розвитку загального адаптаційного синдрому, так як в організмі через нього реалізуються численні контрефекти відносно до регуляторного впливу ГКС. Зрив адаптаційних механізмів призводить до структурних та функціональних порушень на всіх рівнях і насамперед нейроендокринної та імунної систем, що є патогенетичною основою розвитку автоімунних захворювань [26, 43, 73].
Функціональні порушення нейроендокринної системи, особливо в рамках психонейроендокринноімунного комплексу, мають важливе значення у виникненні і розвитку ГА, проте питання про роль гормонів і про зв’язок ендокринних порушень із патогенезом дерматозу вивчені недостатньо і є досить суперечливими
Дослідження дозволило виявити 88,5 % хворих на ГА ендокринні порушення універсальних механізмів переносимості стресу організмом. При аналізі адаптаційних гормонів були виділені два типи реакції на хворобу (стрес) кори надниркових залоз – збільшення або зменшення вмісту кортизолу в крові залежно від активності, ступеня тяжкості та тривалості ГА.
Отримані результати свідчать про те, що при прогресуванні ГА, тривалості хвороби до трьох років і тяжкому перебігу відбувається посилення секреції кортизолу, з яскравою активною захисною реакцією організму (в 1,32, 1,38 і 1,35 раза відповідно вище щодо його рівня у здорових осіб), але вона, ймовірно, є недостатньою в умовах посиленої антигенної стимуляції. Як результат при переході в хронічну стадію, а також при більш тривалому перебігу спостерігається зниження рівня кортизолу щодо його значення в групі контролю, можливо, за рахунок підвищеної його утилізації та виснаження функціональної активності кори надниркових залоз (в 1,45 і 1,32 раза відповідно). У той же час більш низький вміст гормону виявляється менш ефективним у протидії прозапальних стимулів.
Рівень інсуліну у хворих на ГА мав різноспрямовані значення: збільшувався в 1,2 раза в хронічну стадію і в 1,4 – при тривалості понад трьох років; зменшувався в 1,3 раза при тяжкому ступені і в 1,4 – при тривалості до трьох років. Усі варіанти характеризують різний ступінь тяжкості впливу стресового чинника і свідчать про механізми, за допомогою яких організм прагне досягти стану резистентності.
Значення коефіцієнта К найбільш яскраво демонструвало зміни в адаптаційній системі. Підвищення коефіцієнта К у хворих з ознаками прогресування захворювання, тяжким ступенем тяжкості та тривалістю ГА до трьох років вказувало на напруження адаптаційних можливостей організму (в 1,5, 1,8 і 1,9 раза відповідно). Чим вищим є цей коефіцієнт, тим меншим резерв компенсаторних можливостей організму і тим більш загрозливою з точки зору прогнозу компенсації функцій стає стан напруги [7, 43]. Зниження К при хронізації ГА і тривалості хвороби більше трьох років свідчить про виснаження адаптаційних механізмів організму з можливим зривом регуляторних процесів (в 1,7 і 1,8 раза відповідно), що підтверджується наявністю кореляційного зв’язку (р < 0,001).
На думку багатьох дослідників, вплив ендогенних протизапальних гормонів відіграє прогностично важливу роль вже на ранніх стадіях автоімунних захворювань: підставою є визнання значущості ендогенних протизапальних систем, як у гальмуванні гострих запальних реакцій, так і у хронізації запалення. Неадекватна реакція гормонів на імунозапальні стимули вважається фактором хронізації патологічного процесу [7, 151]. В умовах запалення при ГА відбувається трансформація гострої захисної запальної реакції у хронічний неконтрольований патологічний процес, що виявляється зміною відповідних фаз від підвищення до зниження рівня кортизолу та інсуліну, а також аналогічною зміною індексу К з напругою і зривом адаптаційних можливостей.
Актуальним є оцінка ЯЖ при ГА як інтегрального показника, що описує найбільш важливі функції людини і дозволяє дати їх глибокий багатоплановий аналіз при розвитку хвороби та їх відновлення на тлі лікування. Для оцінки ЯЖ використовували DLQI. Показник варіював в межах від 1 до 30 балів, із середнім значенням 9,65 ± 7,22. При цьому оцінювався вплив на даний показник таких факторів: стать, вік (до 30 років і старше 30 років), рівень освіченості, тривалість захворювання (до 12 місяців або більше 12 місяців), сімейний анамнез за ГА, анамнез перебігу ГА (первинний епізод або рецидив), наявність стресу протягом останніх 6 місяців, ступінь тяжкості ГА, рівень ІТГА, супутні захворювання (захворювання щитоподібної залози, цукровий діабет, атопія та ін.).
Середні показники DLQI при різних ступенях тяжкості (легкому, середньому та тяжкому) становили 4,8 ± 2,5; 7,8 ± 5,2 і 16,4 ± 6,5 відповідно, що було статистично значущим (p < 0,001). Спостерігався значний зв'язок між загальним показником DLQI і віком пацієнтів (до 30 років значення було достовірно вищим, p < 0,001), тривалістю захворювання (при випаданні волосся протягом понад 12 місяців показник достовірно збільшувався; p < 0,001), гострим стресом протягом останніх 6 місяців (p = 0,02) та рівнем ІТГА (p < 0,001). Інші фактори не впливали на значення показника ЯЖ. Загальні бали DLQI пацієнтів не відрізнялися один від одного залежно від сімейного анамнезу ГА, рівня освіти, професії, інших супутніх захворювань (p > 0,05).
Незважаючи на складну етіологію автоімунних захворювань, можна стверджувати, що психологічний стрес відіграє ключову роль при ГА, що підтверджується наявністю позитивного кореляційного зв’язку між наявністю гострого стресу в період до 6 місяців і показником DLQI у пацієнтів. Шкіра має локальну нейроендокринну вісь, що дозволяє їй реагувати на стрес. Підвищена активність осі гіпоталамус-гіпофіз-надниркові залози може ініціювати нейрогенне запалення, яке сприяє втраті імунної привілеї ВФ [151, 282]. У результаті виникає своєрідне «порочне коло»: стрес – ГА – психоемоційний статус хворого – ЯЖ хворого – ГА.
Динаміка імунного запалення при ГА і розвиток наслідків автоімунної атаки на фолікул, а також невизначена затримка конверсії фолікула в новий анагеновий цикл диктують етапність терапевтичних впливів, що раніше не враховувалося при призначенні лікування захворювання. Ці дані обґрунтовують розробку комплексного диференційованого патогенетично обґрунтованого методу лікування пацієнтів з ГА з урахуванням стадійності перебігу захворювання та ступені тяжкості.
В активну стадію ГА, що характеризується розвитком вираженого імунного запалення, підвищенням рівня стійких метаболітів NO, рекомендована терапія спрямована на пригнічення цитотоксичних Т‑лімфоцитів і прозапальних цитокінів, VEGF, активності iNOS. Для лікування ГА часто використовують препарати, що покращують мікроциркуляцію і активують процес неоангіогенезу. Однак проведені дослідження продемонстрували особливість цього процесу залежно від стадії патологічного процесу. У зв’язку з даними фактами вважаю, що застосування препаратів з ангіопротекторною ефектом, вкрай небажано в активну стадію ГА, оскільки виражена експресія VEGF на ранніх стадіях патологічного процесу може привести до склерозування судин з подальшим ремоделюванням періфолікулярної тканини, зокрема, її дезорганізації з формуванням фіброзу в результаті додаткової стимуляції ангіогенезу.
У хронічній стадії патологічного процесу при ГА на тлі зменшення активності запальних реакцій, коли в тканинах переважають процеси регенерації і склерозу, відзначається дефіцит VEGF, метаболітів NO, протизапальна терапія навпаки має бути доповнена засобами, що поліпшують мікроциркуляцію в тканинах, нормалізують рівень NO, активність еNOS [94]. Порушення адаптаційно-регуляторних механізмів обґрунтовує використання засобів і методів лікувального впливу, спрямованих на підвищення стійкості до стресу і адаптивних можливостей у хворих на ГА [9, 123].
Усі пацієнти були розподілені на три основні групи з урахуванням ступеня тяжкості й обсягу наданої медикаментозної допомоги: 1 групу склали 64 пацієнти з легким ступенем тяжкості (41 %); 2 групу — 56 пацієнтів із середнім ступенем тяжкості (35,9 %), 3 групу — 36 (23,1 %) пацієнтів із тяжким ступенем ГА. Пацієнти кожної групи були розподілені на три підгрупи, при цьому в підгрупу «а» були об’єднані хворі з активною стадією, в у «б» — із хронічною, у «в» — пацієнти, які отримували традиційну терапію без урахування стадії та ступеня тяжкості ГА (в1 — з активною стадією, в2 — з хронічною стадією) (контрольна підгрупа).
Для лікування ГА було обрано препарати патогенетичної терапії – неспецифічної імуносупресивної терапії – ГКС, доза і спосіб введення яких визначалися ступенем тяжкості захворювання. Додатково залежно від ступеня тяжкості і стадії патологічного процесу використовувався препарат, який відновлює рівень NO, що поліпшує мікроциркуляцію в тканинах (тівортін), а також препарат, що нормалізує адаптивно-регуляторні процеси (даларгін). Як топічні засоби призначався біологічний модулятор росту волосся – міноксидил у вигляді 5 % розчину.
Аналіз літературних джерел останніх років свідчить про можливість ефективного і безпечного застосування L-аргініну як активного донатору NO в клінічній практиці при різних захворюваннях з порушенням в системі NO (серцево-судинні захворювання, плацентарні дисфункції, гепатити різної етіології, гіпоксичні та астенічні стани) [105]. Одним із перспективних препаратів для терапії ендотеліальної дисфункції є тівортін аспартат – вазодилататор і ангіопротектор, що представляє собою фізіологічний донатор NO. Клінічний ефект L-аргініну пояснюється відновленням ендотеліального синтезу NO до нормального рівня [24, 110].
Даларгін – синтетичний аналог ендогенного регуляторного пептиду лей-енкефаліну. Спектр фармакологічної активності даларгіну широкий і відображає багатогранність функцій ендогенних регуляторних пептидів, спрямованих на підтримку гомеостаз. Численні клінічні дослідження показали, що препарат активує репаративну регенерацію тканин, володіє імуномодулюючою, симпатолітичною дією за гіперкатехоламінемії, інгібує перекисне окислення ліпідів за умов тканинної гіпоксії [7, 21, 22].
Міноксидил – засіб прямого впливу на волосяні цибулини. При системному використанні препарат має потужний вазодилатуючий ефект. Здатність до швидкого розслаблення гладкої мускулатури судин має сульфований метаболіт міноксидилу – міноксидилсульфат, перетворення в який каталізується ферментами – сульфотрансферазами [133, 137]. Основні ключові механізми, відомі на сьогоднішній день, здійснюються за рахунок ефекту стимуляції синтезу VEGF. У дермальних сосочках ВФ VEGF стимулює проліферацію клітин матриксу та ендотеліоцитів судинної мережі, формування речовини позаклітинного матриксу, підтримуючи, таким чином, фолікули в стані анагену [255]. У ряді досліджень показано, що 5 % розчин міноксидилу дає кращий ефект при ГА, ніж нижчі його концентрації [200]. E.A. Olsen і співавт. [277] досліджували ефект топічного міноксидилу на індуковане преднізолоном зростання волосся і дійшли висновку, що місцеве застосування міноксидилу обмежує або уповільнює постстероїдну втрату волосся у пацієнтів з ГА.
Розроблено алгоритм лікування хворих на ГА з урахуванням стадійності перебігу захворювання та ступені тяжкості.
Пацієнти 1а і 1б підгруп для лікування локальних форм ГА застосовували зовнішньо клобетазолу пропіонат у формі мазі 0,05 %. Мазь із клобетазолу пропіонатом розподіляли тонким шаром на осередки облисіння, після чого накладали оклюзійну пов’язку на 6-8 годин. Пацієнтам 1а і 1б підгруп призначали даларгін. Препарат застосовували внутрішньом’язово 1 раз на день протягом 14 днів. При хронічній стадії пацієнти додатково отримували тівортін аспартат перорально по 5 мл 4 рази на день протягом 21 дня, а також міноксидил 5 % у формі розчину, який втирали в осередки двічі на день 1–2 місяці.
Пацієнти 2а і 2б підгруп для лікування ГА застосовували внутрішньоосередкові ін’єкції бетаметазону дипропіонату / бетаметазону натрію фосфату у формі розчину для ін’єкцій, якій вводили внутрішньошкірне в осередок алопеції 1 раз на 3–4 тижні. Додатково призначали клобетазолу пропіонат у формі мазі 0,05 % на уражені ділянки. Усі пацієнти цієї групи отримували даларгін внутрішньом’язово 1 раз на день протягом 21 дня. При хронічному перебігу патологічного процесу в цій групі додатково призначався тівортін аспартат 100 мл у вигляді ін’єкцій внутрішньовенно протягом 7 днів. Далі пацієнти препарат отримували внутрішньо під час їжі по 5 мл 4 рази на день протягом 14 днів. 5 % міноксидил у формі розчину використовували двічі на день, втираючи в уражені зони 3-5 місяців.
Пацієнти 3а і 3б підгруп отримували лікування системним ГКС – метилпреднізолон всередину (таблетки по 4 мг) за схемою: 32 мг/добу – 4-6 тижні з поступовим зниженням дози до повної відміни препарату. Усі пацієнти 3а й 3б підгруп цієї групи отримували даларгін внутрішньом’язово 2 рази на день протягом 21 дня. Тівортін аспартат 100 мл у вигляді ін’єкцій внутрішньовенно протягом 14 днів призначався пацієнтам 3б підгрупи. Далі пацієнти препарат отримували внутрішньо під час їжі по 5 мл 4 рази на день протягом 14 днів. 5 % міноксидил у формі розчину використовували двічі на день при хронічній стадії ГА, втираючи в уражені зони 4-8 місяців.
Контроль ефективності лікування проводився візуально неозброєним оком, а також за допомогою трихоскопічного обладнання. Оцінка ефективності терапії здійснювалася згідно наступних критеріїв: 1) клінічне одужання (повний ефект) – до 90 % або повне відновлення зростання волосся; 2) частковий ефект, що включає: значне поліпшення – припинення прогресування процесу, відновлення зростання волосся на 50–90 % площі ураження; незначне поліпшення – припинення прогресування процесу, відновлення зростання волосся на ділянці ураження менше 50 % площі ураження; 3) відсутність ефекту – значних змін у стані хвороби не відбулося, відбувається зростання одиничного велюсного волосся; 4) погіршення – поява нових осередків, поширення процесу. Результати ефективності терапії вивчалися через 1, 3 і 6 місяців після завершення лікування.
Клінічне одужання реєструвалося у 36,8 % пацієнтів, які отримували лікування за розробленим методом, при цьому кращий ефект спостерігався при легкому та середньому ступенях тяжкості захворювання (20,8 % і 11,3 % відповідно). У хворих з УА і ТА повне відновлення волосся відзначалося у 4,7 % випадків. Використання традиційної терапії дозволило досягти клінічного одужання у 20,0 % випадків тільки у пацієнтів легкого та середнього ступеня тяжкості (12,0 % і 8,0 % відповідно). Частковий ефект від розробленої та традиційної терапії спостерігався у 42,6 % і 32,0 % пацієнтів відповідно. Ефект від проведеної терапії був відсутній у 12,2 % хворих порівняно з 32,0 % пацієнтів, які отримували традиційне лікування. Погіршення патологічного процесу реєструвалося у 8,4 % випадків запропонованої терапії і 16,0 % випадків при використанні традиційної терапії.
Виділено фактори, які негативно впливали на результат лікування – при ранньому дебюті хвороби – до пубертатного віку, тривалості останнього рецидиву більше 3 років, при кількості загострень більше 3, наявності тяжких форм захворювання – ТА і УА з ураженням НП, відсутності жовтих точок при дерматоскопії до лікування, обтяження сімейним анамнезом щодо ГА, наявності автоімунних та алергічних захворювань.
Результати клінічної ефективності лікування в підгрупах 1 групи демонструють, що клінічне одужання спостерігалося у 53,8 % пацієнтів з активними проявами захворювання і у 44,4 % – без ознак прогресування. Лікувальний ефект був відсутній у 3,8 % пацієнтів у 1а підгрупі, 11,1 % – у 1б підгрупі. У 1в підгрупі ці показники значно відрізнялися і склали по 15,00 % відповідно. Значущих побічних ефектів не відзначалося. В окремих випадках спостерігався помірно виражений фолікуліт на скальпі у пацієнтів, які застосовували топічний ГКС засіб. Ретельний і своєчасний догляд за шкірою скальпа мінімізував прояви фолікуліту; після завершення лікування вони регресували спонтанно.
Результати клінічної ефективності лікування в підгрупах 1 групи демонстрували, що клінічне одужання та частковий ефект спостерігались у 88,4 % пацієнтів з активними проявами захворювання (53,8 % та 34,6 % відповідно) і у 83,3 % (44,4 % та 38,3 % відповідно) — без ознак прогресування. Лікувальний ефект був відсутній у 3,8 % пацієнтів з 1а підгрупи та у 11,1 % — з 1б. У 1 та 1в2 підгрупах клінічне одужання та частковий ефект відзначали у 66,7 % та 72,7 % випадках, а відсутність ефекту та погіршення — у 44,4 % та 18,2 % відповідно.
Повний клінічний ефект був отриманий у 33,4 % пацієнтів 2а підгрупи й у 30,0 % — 2б. При цьому частковий ефект був більш виражений у пацієнтів без ознак активності захворювання — 50,0 %, порівняно з результатом лікування у 2а підгрупі — 44,4 %. Відсутність ефекту від терапії в цій групі відзначено у пацієнтів як із хронічними, так і активними проявами ГА (11,1 % та 15,0 % відповідно). Погіршення процесу спостерігалося в 11,1 % випадків при прогресуванні ГА та в 5,0 % — при відсутності ознак активності ГА. У 2в підгрупі показники ефективності значно відрізнялися від їх значень при використанні розробленого методу, так повний і частковий ефект реєструвалися у 44,4 % випадків, а відсутність ефекту та погіршення перебігу ГА – у 55,6 %. При цьому тільки у 16,7 % хворих 2в1 підгрупи спостерігалося клінічне одужання та частковий ефект, тоді як відсутність ефекту та погіршення — у 33,3 %.
Клінічне одужання відзначалось у 25,0 % пацієнтів 3 групи з активними проявами захворювання і у 16,7 % — без ознак прогресування. Відсутність лікувального ефекту в 3б підгрупі пацієнтів була найбільш вираженою — 33,3 %. Призначення традиційної терапії дало змогу досягти позитивних результатів у вигляді тільки часткового відростання волосся у 33,3 % пацієнтів, із яких 8,3 % в 3в1 підгрупі, водночас відсутність ефекту та погіршення процесу — у 41,7 % хворих із хронічною стадією патологічного процесу та у 25 % при прогресуванні ГА.
При лікуванні системними ГКС із побічних ефектів найчастіше спостерігалися збільшення маси тіла від (25,6 %) (повернення до вихідного показника відбувалося до кінця лікування або протягом 3 місяців після завершення терапії); стероїдні акне (12,3 %), які спонтанно регресували до моменту завершення лікування або відразу після його закінчення; кушингоїдні зміни ділянки облисччя в поєднанні з відкладенням жиру в ділянці верхнього плечового пояса (у 16,8 %) – вони проходили на 2–3-му місяці після завершення терапії; гіпертрихоз у ділянці обличчя і кінцівок (у 11,1 %) зникав до закінчення курсу лікування або протягом 1 місяця після його завершення. Тівортін і даларгін характеризувалися доброю переносимістю у пацієнтів із ГА, що узгоджується з даними інших досліджень [22, 105].
Віддалені результати лікування розробленим методом реєструвалися через 1-3 ріки після його закінчення. Рецидиви ГА відзначено у 9,6 % хворих 1 групи, у 17,5 % – 2 групи і у 38 % – 3 групи. Вони виникли частіше у пацієнтів, що мали більш тяжкі форми ГА, обтяжений сімейний анамнез за ГА, оніходистрофію, супутню, наявність більше 2 попередніх рецидивів хвороби, вплив стресу, як пускового фактора.
Відсутність ефекту від терапії та погіршення процесу відзначено у 22 (13,9 %) пацієнтів. Це обґрунтовує пошук ефективних методів лікування для даного контингенту хворих. Аналіз літератури дозволяє припустити, що існують випадки, торпідні до ГКС, можливо для досягнення позитивного ефекту мають бути більш високі дози препаратів і тривалість їх застосування в якості підтримуючої терапії. Однак відомі небажані явища довгострокової терапії ГКС обмежують її використання [121, 326]. Є кілька повідомлень про можливість лікування резистентних форм ГА сульфасалазином [300, 343]. Дія сульфасалазину при автоімунних захворюваннях опосередковується його імуномодулюючими, імуносупресивними і протизапальними ефектами [153, 330]. Імуносупресивний ефект частково пояснюється блокуванням синтезу ДНК в імунокомпетентних клітинах, що призводить до порушення їх проліферації та диференціації. Сульфасалазин і його активний метаболіт пригнічують експресію прозапальних цитокінів і перш за все TNF-α, ІL-1, ІL-8. Можливо, завдяки регулюванню цих цитокінів, а також проліферації Т-клітин, активності NK-клітин і активації В-клітин сульфасалазин проявляє свою ефективність при ГА [300, 343].
Ці дані обґрунтували можливість використання сульфасалазину в досліджуваних пацієнтів, які після отримання терапії протягом 3–6 місяців (залежно від ступеня тяжкості) не одержували позитивного результату, або процес погіршувався. Препарат призначався по 500 мг на день із щотижневим збільшенням до оптимальної добової терапевтичної дози 3 г у два прийоми. Тривалість застосування залежала від ступеня тяжкості ГА і склала від 3 до 8 місяців. Додатково призначався повторний курс препаратами патогенетичної терапії – тівортін, даларгін і міноксидил – відповідно до розробленого методу лікування.
Аналіз ефективності такої терапії показав, що клінічного одужання досягли 27,3 % пацієнтів, частковий ефект реєструвався у 45,4 % хворих. Відсутність ефекту відзначили 27,3 % пацієнтів, здебільшого з ТА та УА. 72,7 % пацієнтів мали позитивний ефект у вигляді клінічного одужання і часткового відновлення волосся при ГА. Побічні ефекти були мінімальними, спостерігалися в окремих випадках у перші місяці терапії і швидко купірувалися. Це дозволидо розглядати сульфасалазин як альтернативний препарат терапії у пацієнтів із ГА, які не відповідають на лікування ГКС.
Клінічні результати лікування виявилися взаємопов’язаними з показниками цитокінового балансу, ангіогенних факторів та адаптаційно-регуляторних гормонів.
Використання в комплексному лікуванні препаратів розробленого алгоритму в 1а та 1б підгрупах сприяло відновленню показників цитокінового балансу, значення більшості з яких не відрізнялося від вмісту у здорових осіб, тільки концентрація ІL-17 зменшувалася відносно рівня до лікування в 1,39 раза (р < 0,05) при активних проявах хвороби та не досягала значення контрольної групи. Динаміка змін показників системи NO, EGF, VEGF та його рецептора в 1а та 1б підгрупах була позитивною, їх вміст досягав значень здорових осіб, крім iNOS, коли його рівень зменшувався в 1,42 раза відносно до лікування (р < 0,05). Рівень адаптаційних гормонів та їх коефіцієнту у хворих 1а та 1б підгруп нормалізувався в повному обсязі.
Позитивні зміни досліджених показників діагностувалися у хворих 2а та 2б підгруп. Залишався підвищеним рівень ІL-1β, ІL-17 та HSP-70 у хворих з активними проявами ГА порівняно з такими у здорових, але зменшувався в 1,8, 1,4 та 2,1 раза відповідно порівняно зі значеннями до лікування (р < 0,05). Секреція VEGF, NO3 та iNOS після лікування зменшувалася відповідно в 1,6, 1,8 та 2,04 раза порівняно з показниками до терапії (р < 0,05), але не досягала вмісту у здорових осіб. Слід відзначити зменшення рівня інсуліну у хворих з неактивними проявами ГА в 1,42 раза відносно показника до лікування (р < 0,05) при досягненні вмісту контрольної групи інших значень досліджених гормонів та адаптаційного коефіцієнту.
Відновлення показників 3а та 3б підгруп відбувалося менш значуще, що, вірогідно, зумовлює результати ефективності лікування у цих хворих. Так, залишався підвищеним рівень ІL-1β, ІL-17 та HSP-70 у хворих з активними проявами дерматозу відносно здорових осіб при зниженні відносно до отриманої терапії в 1,94, 2,32 та 1,91 раза (р < 0,05). При неактивному процесі вміст ІL-1β та ІL-17 знижувався порівняно з таким до лікування в 1,43 та 1,98 раза відповідно (р < 0,05), але не досягав значення здорових осіб. Рівень VEGF у хворих із тяжким перебігом і активними проявами хвороби підвищувався в 1,87 раза порівняно зі значенням до лікування (р < 0,05). Секреція iNOS зменшувалася в різні періоди хвороби у 2,42 та 1,35 раза (а і б підгрупи відповідно) (р < 0,05), а сNOS підвищувалась у 2,26 раза у хворих 3а підгрупи відносно значень до лікування (р < 0,05), але відрізнялася від аналогічних контрольної групи. Параметри адаптаційно-регуляторної системи у хворих 3а підгрупи не досягали значень показників здорових осіб, але змінювалися відносно вмісту до лікування, особливо коефіцієнт К, значення якого збільшувалося в 1,58 раза (р < 0,05). У 3б підгрупі рівень кортизолу та інсуліну був у межах значень здорових осіб, але коефіцієнт К збільшувався тільки в 1,34 раза і не відновлювався в повному обсязі. Аналіз лабораторних показників у хворих на ГА залежно від методу лікування дозволив установити незначну позитивну динаміку вивчених параметрів при використанні традиційної терапії. Призначення традиційного методу лікування хворим 1 групи сприяло нормалізації рівня ІЛ-1β. При нормальних параметрах ІЛ-4 та ІЛ-10, рівень ІЛ-17 та HSP-70 мав тільки тенденцію до зменшення відносно значення до лікування (р > 0,05). Так, залишався підвищеним рівень ІL-1β, ІL-17 та HSP-70 у хворих 2в та 3в підгруп відносно здорових осіб, при зниженні відносно до отриманої терапії в 1,45 (р < 0,05), 1,24 (р > 0,05), 1,28 (р > 0,05) раза та 1,21 (р > 0,05), 1,18 (р > 0,05), 1,24 (р > 0,05) раза відповідно.
Рівень VEGF у хворих 2в1 та 3в1 підгруп з активними проявами хвороби знижувався в 1,28 та 1,20 (р > 0,05) раза відповідно порівняно зі значенням до лікування. А при хронічному перебігу значення показника VEGF у 2в2 та 3в2 підгрупах мало тенденцію до збільшення відносно здорових осіб (р > 0,05).
Секреція iNOS зменшувалася в різні періоди хвороби у 2в та 3в підгрупах у 2,04 (р < 0,05) та 1,12 (р > 0,05) раза, а сNOS підвищувалася в 1,26 раза у хворих 3в1 підгрупи відносно значень до лікування (р > 0,05), але не відрізнялася від аналогічних контрольної групи. Параметри адаптаційно-регуляторної системи у хворих 2в та 3в підгруп не досягали значень показників здорових осіб, але частково змінювалися відносно вмісту до лікування, особливо коефіцієнт К, рівень якого мав тенденцію до збільшення в 1,16 та 1,21 раза при проявах активності (р > 0,05). У 2в1 та 3в1 підгрупах значення коефіцієнта К також не відновлювалося в повному обсязі, збільшувалося в 1,26 та 1,12 (р > 0,05) раза відповідно.
Вивчення динаміки показників ІТГА і оцінка ЯЖ свідчили про достовірний позитивний ефект при використанні розробленного алгоритму лікування. Так, оцінка ступеня тяжкості за шкалою ІТГА у процесі лікування запропонованою методикою виявила послідовне зниження кількості балів розглянутого індексу в усіх хворих. Середнє значення DLQI після запропонованого методу лікування знизилося більшою мірою, ніж при традиційній терапії, з різницею на 3-8 балів, що вказує на більш виражений позитивний вплив на ЯЖ в основній групі пацієнтів.
Аналізуючи одержані результати, можна зробити висновок, що диференційоване використання в комплексному лікуванні хворих на ГА препаратів розробленого алгоритму – ГКС, міноксидилу, тівортіну, даларгіну – сприяло одержанню стійкого клінічного ефекту та у зв’язку з доброю переносимістю, простотою призначення і доступністю засобів рекомендується для впровадження в практику дерматовенерологічних закладів.
Використання розробленого патогенетично обумовленого методу терапії ГА з диференційованим використанням ГКС у різних дозах і способах введення, донатору аргініну тівортін, препарату зі стрес-протекторною і адаптогенною діями даларгіну, а також місцевого 5 % розчину міноксидилу підвищує ефективність лікування, дозволяє одержати позитивні результати у у 79,4 % пацієнтів, зменшити кількість рецидивів, нормалізувати більшість імунологічних показників, стан ангіогенних факторів і адаптаційних механізмів. Сульфасалазин, що має імуносупресивний і протизапальний ефекти, може бути варіантом лікування у пацієнтів з ГА, які стійкі до ГКС та інших терапевтичних методів. Достатня ефективність обраних засобів лікування, імовірно, є відображенням комплексної дії препаратів на рівні патогенетичних механізмів хвороби.
ВИСНОВКИ
У дисертаційній роботі наведено теоретичне узагальнення й нове вирішення наукової проблеми сучасної дерматовенерології, що полягає в підвищенні ефективності терапії хворих на ГА шляхом розробки патогенетично обґрунтованого комплексного диференційного методу лікування із застосуванням розробленого терапевтичного алгоритму на підставі вивчення клінічних, інструментальних, морфологічних, патофізіологічних, імунологічних та гормональних особливостей захворювання.
- Ураховуючи захворюваність ГА серед осіб молодого віку (до 30 років — 80 %), виражені порушення соціальної адаптації, почастішання тяжких торпідних форм, нез’ясованість патогенетичних механізмів та відсутність ефективних методів терапії, стає актуальним дослідження імунологічних, ангіогенних, адаптаційно-регуляторних механізмів розвитку захворювання залежно від перебігу та розробка методів корекції виявлених порушень.
- Клінічні дослідження дали змогу констатувати різноманітність проявів ГА, що зумовлено локалізацією й поширеністю патологічного процесу, стадією розвитку, коморбідними станами. Ранній дебют ГА у 44,8 % пацієнтів відзначено у віці 5–17 років. У 58,5 % пацієнтів траплялося від 2 та більше рецидивів захворювання. У 52,1 % хворих виявлено супутню патологію, серед якої переважали імуноопосередковані захворювання. Виявлено прогностичні критерії тяжкого перебігу ГА, до яких належать: жіноча стать, наявність дистрофічних нігтів, атопії, автоімунних захворювань, утрата волосся на ділянках шкірного покриву при ураженні волосистої частини голови до 50 %, тривалість хвороби більше 1 року, вік хворого на початок захворювання до 17 років, відсутність жовтих точок при дерматотрихоскопії. Виділено діагностичні дерматотрихоскопічні маркери ГА, які мали кореляцію зі стадією патологічного процесу.
- Установлено гістологічні та імуногістохімічні зміни шкіри волосистої частини голови при ГА залежно від стадії патологічного процесу. В активну стадію дерматозу виражений лімфогістіоцитарний інфільтрат розташовувався перифолікулярно з проникненням до волосяної цибулини, відзначено периваскулярний набряк. У хронічну стадію переважали фіброзні та атрофічні процеси ГА з перифолікулярним та периваскулярним склерозом, мінімальним ступенем клітинної відповіді у вигляді лімфоцитогістіоцитарного інфільтрату. У запальному інфільтраті в активну стадію ГА кількість CD8+ та CD4+, CD56+, CD68+ Т‑лімфоцитів значно збільшувалася (в 5,1; 2,9; 10,5 та 7,3 раза відповідно) порівняно з аналогічним показниками контрольної групи. У хронічну стадію ГА спостерігалося зниження щільності запального інфільтрату (зменшення CD8+ — в 1,7 і CD4+ — в 1,4 раза відносно значень в активну стадію). Експресія маркерів макрофагальної генерації та NК-клітин достовірно знижувалася відносно значень при ознаках активності ГА (в 1,7 та 1,9 раза відповідно), але не досягала рівня здорових осіб. Експресія прозапальних цитокінів (IL-1, IL-6, TNF-α) посилювалася незалежно від стадії, при цьому рівень показників в активну стадію перевищував їх значення в хронічну стадію (в 1,7, 1,6 та 1,5 раза відповідно).
- У 88,5 % хворих на ГА виявлено розлади цитокінового гомеостазу, пов’язані з клінічними проявами захворювання. Найбільш виражені порушення з різноспрямованими змінами про- і протизапальних цитокінів відбувалися у пацієнтів із тяжким ступенем і активними проявами, коли вміст ІL-1β та ІL-17 збільшувався в 3,2 та 3,6 раза, а ІL-4 та ІL-10 зменшувався в 1,9 та 2,1 раза відповідно відносно результатів у здорових осіб. Рівень HSP-70 збільшувався в усі періоди захворювання, найвищим відзначався при тривалості хвороби до 1 року, майже вдвічі збільшувався в активну стадію при тяжкому перебігу порівняно зі значенням показника в хронічну стадію. Аналіз впливу цитокінів на розвиток ГА встановив, що статистично значуще збільшення секреції HSP-70 (c2 = 66,2 %) та ІL-17 (c2 = 81,4 %) підвищує ймовірність розвитку ГА.
- Установлено дисбаланс факторів ангіогенезу у 81,3 % хворих, залежний від ступеня тяжкості, активності та тривалості ГА. У пацієнтів в активну стадію дерматозу вміст VEGF збільшувався в 1,7 раза, а при ознаках хронічного процесу — зменшувався в 2,5 раза, рівень sVEGFR1 у крові хворих достовірно знижувався в активну стадію в 1,5 раза відносно значення у контрольній групі. Максимальне відхилення значення показників спостерігалося при тяжкому ступені ГА — в активну стадію рівень VEGF збільшувався в 3,3 раза, sVEGFR1 знижувався в 3,4 раза, у хронічну стадію — VEGF зменшувався в 3,9, sVEGFR1 збільшувався в 1,2 раза. Вміст показника EGF підвищувався у всіх хворих на ГА (в 1,3 раза), виражені порушення рівня EGF виявлено при тяжкому ступені ГА в активну стадію, коли його значення збільшувалось у 2,2 раза порівняно з показником у здорових осіб. Збільшення значення VEGF (c2 = 0,716056) розглядається як предикторний фактор розвитку ГА.
- Існування у 78,2 % хворих на ГА помірно вираженого дисбалансу системи NO проявлялося підвищенням рівня NO за рахунок збільшення NO3 та iNOS при зниженому рівні сNOS та незмінному значенні показника NO2. При ознаках прогресування захворювання у хворих тяжкого ступеня тяжкості рівень показників NO, NO3, iNOS був максимально високим — збільшувався у 2,3, 2,8 та 4,5 раза відповідно. У хронічну стадію їх значення достовірно зменшувалися відносно рівня при активному перебігу — в 3,9, 5,03 та 2,5 раза відповідно. При тривалості ГА до 1 року порушення вмісту NO, NO3 та iNOS відзначалося в бік збільшення в 2,5, 3,1 та 1,9 раза відносно їх значень у період хвороби більше 3 років. Виявлено позитивні кореляційні зв’язки між значення iNOS та ІL-17, рівнем NO та HSP-70, VEGF при ознаках активності ГА. Збільшення секреції iNOS (c2= 0,674539) оцінюється як предикторний фактор втрати волосся при ГА.
- Ендокринні порушення у 88,5 % хворих на ГА виявилися різноспрямованими змінами адаптивних гормонів залежно від клінічних проявів. При прогресуванні, тривалості хвороби до 3 років і тяжкому ступені тяжкості відбувалося посилення секреції кортизолу (в 1,32, 1,38 і 1,35 раза відповідно), при переході в хронічну стадію, а також при більш тривалому перебігу — зниження рівня показника щодо його значення в групі контролю (в 1,45 і 1,32 раза відповідно). Рівень інсуліну мав різноспрямовані значення: збільшувався в 1,3 раза в хронічну стадію і в 1,4 — при тривалості понад 3 років; зменшувався в 1,3 раза при тяжкому ступені і в 1,4 — при тривалості до 3 років. Підвищення коефіцієнта К (в 1,6 раза) при ознаках прогресування захворювання вказувало на напруження адаптаційних можливостей організму, тоді як зниження показника при хронізації ГА і тривалості хвороби більше 3 років свідчило про виснаження адаптаційних механізмів організму з можливим зривом регуляторних процесів (у 1,7 і 1,8 раза відповідно).
- У хворих на ГА показник ЯЖ виявився пов’язаним із віком пацієнтів (до 30 років), тяжким перебігом, наявністю гострого стресу протягом останніх 6 місяців, випадінням волосся протягом понад 12 місяців та рівнем — r = 0,51, r = 0,68, r = 0,52, r = 0,64, r = 0,55 відповідно. Найгіршу ЯЖ мали хворі з тяжким ступенем ГА, коли значення DLQI перевищувало у 3,4 раза показник при легкому ступені тяжкості.
- Розроблено комплексний патогенетично обґрунтований алгоритм лікування хворих на ГА з урахуванням стадійності перебігу захворювання та ступеня тяжкості, що полягає в диференційному використанні ГКС у різних способах введення, донатору аргініну тівортіну, препарату зі стрес-протекторною й адаптогенною діями даларгіну, а також 5 % розчину міноксидилу. Сульфасалазин використовувався як альтернативний варіант лікування в пацієнтів середнього та тяжкого ступеня тяжкості з ГА, які стійкі до ГКС та інших терапевтичних методів. Застосування цих препаратів дало змогу досягти позитивного результату при лікуванні у 79,4 % пацієнтів, що в 1,5 раза вище, ніж при використанні традиційної терапії, зменшити кількість рецидивів та подовжити ремісію. Доведено, що лікування за розробленим методом дало змогу статистично значущо знизити значення ІТГА, відновити та покращити рівень показників імунного запалення, маркерів ангіогенезу, адаптаційних гормонів та їх коефіцієнту, підвищити ЯЖ пацієнтів.
РЕКОМЕНДАЦІЇ
- Для оцінки ступеня тяжкості ГА рекомендовано використовувати ІТГА. Математичний підхід дає можливість об’єктивно оцінити втрату волосся на скальпі, інших ділянках шкіри, ураження НП, а також тест натягнення волосся та дерматотрихоскопічні маркери захворювання. Легкий ступінь тяжкості відповідає від 1 до 12 балам, середній — від 13 до 25, тяжкий — від 26 до 44.
- Для прогнозування розвитку ГА виділено фактори ризику тяжкого перебігу, до яких належать: жіноча стать, наявність дистрофічних НП, атопії, автоімунних захворювань, утрата волосся на ділянках шкірного покриву при ураженні волосистої частини голови до 50 %, тривалість хвороби 1 рік та більше, вік хворого на початок захворювання до 17 років, відсутність жовтих точок при дерматотрихоскопії.
- Хворим на ГА доцільно проводити оцінку рівня IL-17, HSP-70, VEGF та іNOS, як найбільш значущих факторів для прогнозування можливості розвитку та визначення характеру клінічного перебігу захворювання. Значення IL-17 більше 7,35 пг/мл, HSP-70 більше 0,425 пг/мл, VEGF більше 289,76 пг/мл та іNOS більше 308,1 пмоль/хв·мг білка є маркерами тяжкого ступеня тяжкості та активної стадії ГА.
- Результати дисертаційного дослідження дозволяють рекомендувати пацієнтам в системі комплексного лікування хворих ГКС – у вигляді 0,05 % мазі клобетазолу пропіонату 6 днів на тиждень від 2 до 4 місяців при легкому ступені, внутрішньоосередкових ін’єкцій бетаметазону дипропіонату / бетаметазону натрію фосфату 1 раз на 4 тижні з додатковим призначенням клобетазолу пропіонат у формі мазі 0,05 % на уражені ділянки при середньому, метилпреднізолону усередину по 32 мг/добу 4–6 тижнів із поступовим зниженням дози при тяжкому ступені тяжкості; даларгін – внутрішньом’язово 1 мл 1-2 раз на день протягом 14-21 днів залежно від ступеня тяжкості; у хронічну стадію тівортін – перорально по 5 мл 4 рази на день протягом 21 дня при легкому ступені, 100 мл внутрішньовенно протягом 7-14 днів з подальшим пероральним прийомом до 14 днів при середньому та тяжкому ступені тяжкості; топічно міноксидил у вигляді 5 % розчину при відсутності ознак активності ГА від 2 до 8 місяців залежно від ступеня тяжкості.
- Пацієнтам середнього та тяжкого ступеня тяжкості ГА, які стійкі до ГКС та інших терапевтичних методів, рекомендовано використовувати сульфасалазин по 3 г на добу від 3 до 8 місяців залежно від ступеня тяжкості ГА, з додатковим призначенням препаратів патогенетичної терапії відповідно до розробленого методу лікування.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Адаскевич В.П., Тихоновская И.В. Клиника, диагностика и лечение гнездной алопеции : Метод. рекомендации. Минск, 2000. 42 с.
- Анализ индекса качества жизни DLQI (the dermatology life quality index) у пациентов с различными дерматологическими нозологиями / Е.Н. Ефанова, Е.А. Васильева, Н.В. Кобылянская, М.А. Калинин. Здоровье и образование в XXI веке. 2019. Т. 21, № 6. С. 22–26.
- Бадокин В.В. Эффективность и переносимость сульфасалазина при ревматических заболеваниях. Научно-практическая ревматология. 2005, Т. 43, № 4. С. 47–52.2
- Беловол А.Н. Дисфункция сосудистого эндотелия у больных псориазом. Укр. журн. дерматол., венерол., косметол. 2010. № 1 (36). С. 17–21.
- Белозоров А.П. Новая субпопуляция эффекторных хелперных Т-лимфоцитов (TH22) и ее участие в патогенезе заболеваний кожи. Дерматологія та венерологія. 2010. № 2 (48). С. 7–10.
- Белозоров А.П. Т-хелперы-17 (Th17) – новая субпопуляция эффекторных CD4+ лимфоцитов и их роль в патологии. Дерматологія та венерологія. 2008. № 4 (42). С. 19–21.
- Болотная Л.А., Калашникова В.С. Терапевтическая хронокоррекция нарушений адаптации при хронической экземе. Международный медицинский журнал. 2005. № 4. С. 89–92.
- Болотная Л. А., Сариан Е. И. Патогенез псориаза: сосудистый эндотелиальный фактор роста. Дерматовенерология. Косметология. Сексопатология. 2013. № 1- C. 34–37.
- Болотная Л.А., Сербина И.М. Адаптационно-регуляторные механизмы при гнездной алопеции. Georgian medical news. 2017. № 11 (272). С. 75–80.
- Борзилова Ю.А., Болдырева Л.А., Шлык И.В. Васкулоэндотелиальные факторы роста (VEGF): роль и место в патологических процессах. Вестник офтальмологии. 2016. № 4. С. 98–103.
- Борисова Е.Б. Лечение больных гнездной алопеции в зависимости от стадии и степени тяжести. Дерматологія та венерологія. 2009. № 3 (45). С. 38–43.
- Борисова Е.Б. Особенности гемодинамических нарушений у больных гнездной алопецией. Журнал дерматовенерологии и косметологии им. Н.А. Торсуева. 2009. № 1–2 (18). С. 68–73.
- Варламов Е.Е., Пампура А.Н., Сухоруков В.С. Значение цитокинов в патогенезе атопического дерматита. Российский вестник перинатологии и педиатрии. Т. 63б № 1. С. 28–33.
- Верхогляд И.В., Олисова О.Ю. Иммунные нарушения при гнездной алопеции. Экспер. и клин. дерматокосметол. 2010. № 4. С. 7–10.
- Верхогляд И.В., Олисова О.Ю., Гастроверхова И.П. Современные представления об этиологии, патогенезе и лечении очаговой алопеции. Российский журнал кожных и венерических болезней. 2010. № 1. С. 48–51.
- Взаимосвязь содержания факторов роста, цитокинов в сыворотке крови и моче с возрастом у пациентов с системной склеродермией / А.П. Ребров, Н.Б Захарова, Д.А. Патрикеева, О.Г. Карпова. Бюллетень медицинских интернет-конференций. 2014. T. 4, № 1. С. 15–20.
- Гаджигороева А.Г. Клиническая трихология. М. : Практическая медицина, 2014. 184 с.
- Гаджигороева А.Г. Оптимизация лечения гнездной алопеции при частичной потере волос на голове. Экспериментальная и клиническая дерматокосметология. № 3. С. 10–16.
- Губарева Е.Ю., Губарева И.В. Фактор роста эндотелия сосудов в качестве потенциального маркера субклинического поражения органов, опосредованного артериальной гипертонией. Сибирский медицинский журнал. 2019. Т. 34, № 3. С. 40–44.
- Гуляева Н.В. Нейрохимия стресса: химия стресс-реактивности и чувствительности к стрессу. Нейрохимия. 2018. № 2. С. 111–114.
- Демидов В.М., Демидов С.М., Вастьянов Р.С. Патогенетичне обґрунтування застосування регуляторних пептидів при комплексній терапії хронічного стресу в експерименті. Інтегративна антропологія. 2016. № 2. С.38–41.
- Добржанская Е.И. Оптимизация комплексного лечения больных с псориазом с учетом нарушений некоторых функций эндокринной системы. Медицина. 2015. №3 (153). С. 56–60.
- Евдонин А.Л., Медведева Н.Д. Внеклеточный белок теплового шока 70 и его функции. Цитология. 2009. Т. 51, № 2. С. 130–137.
- Жаринова В.Ю. Эндотелиальная дисфункция как мультидисциплинарная проблема. Кровообіг та гомеостаз. № 1–2. С. 9–15.
- Злотогорский А., Шапиро Д. Трихология. Второе издание / Под ред. А. Литуса, пер. с англ. Ю. Овчаренко. К., 2016. 276 с.
- Ивашкин В.Т., Драпкина О.М. Клиническое значение оксида азота и белков теплового шока. 2-е издание. М. : ГЭОТАР Медиа, 2011. 376 с.
- Иммунохимическая детекция эпидермального фактора роста при онкопатологии / Н.В. Пивень, А.И. Бураковский, М.Н. Тишкевич и др. Иммунопатология, аллергология, инфектология. № 4. С. 10–16.
- Интерлейкин-17: функциональные и структурные особенности; использование в качестве терапевтической мишени / О.С. Костарева, А.Г. Габдулхаков, И.А. Коляденко и др. Успехи биологической химии. 2019. Т. 59. С. 393–418.
- Интерлейкин 6 как патогенетический фактор, опосредующий формирование клинических проявлений, и мишень для терапии ревматических заболеваний и депрессивных расстройств / Т.А. Лисицына, Д.Ю. Вельтищев, А.М. Лила, Е.Л. Насонов. Научно-практическая ревматология. 2019. Т. 57. № 3. С.318–327.
- Исследование местных иммунных механизмов воспаления при гнездной алопеции с учётом активности заболевания / Н.Н. Потекаев, Е.А. Коган, А.Г. Гаджигороева и др. Клин. дерматология и венерология. 2010. № 5. С. 103–108.
- Кабалык М.А. Клинико-патогенетическое значение белков теплового шока с массой 70 и 27 кДа при остеоартрите. Научно-практическая ревматология. 2017. Т. 55, № 2. С. 187–191.
- Калюжная Л.Д. Патогенетическое обоснование протоколов лечения диффузных алопеций. Клінічна імунологія. Алергологія. Інфектологія. 2015. № 8 (87) С. 5–8.
- Кашутин C.Л., Дегтяр Ю.С. Содержание эпидермального фактора роста у больных псориазом и атопическим дерматитом. Цитокины и воспаление. 2008. № 2. С. 64–72.
- Кетлинский С.А., Симбирцев А.С. Цитокины. СПб. : ООО Изд-во «Фолиант», 2008. 552 с.
- Клинико-патогенетическое значение определения оксида азота в крови пациентов с бронхиальной астмой и гипертонической болезнью / А.В. Шаханов, Э.С. Бельских, В.А. Луняков, О.М. Урясьев. Казанский мед. журн. 2017. Т. 98, № 4. С. 492–496.
- Клиническая патофизиология : курс лекций / под ред. В.А. Черешнева, П. Ф. Литвицкого, В. Н. Цыгана. 2-е изд., испр. и доп. СПб. : СпецЛит, 2015. 472 с.
- Клиническое значение цитокинов при различных формах очаговой алопеции у детей / C.B. Костина, М.В. Хорева, A.C. Варивода и др. Современные проблемы дерматовенерологии. 2009. № 2 (5). С. 5–9.
- Клініко-патогенетична роль епідермального фактора росту при псоріазі / Я.Ф. Кутасевич, І.О. Олійник, Е.М. Солошенко, О.А. Гаврилюк. Український журнал дерматології, венерології, косметології. 2016. № 2 (61). С. 27–30.
- Кобзарь А.И. Прикладная математическая статистика. Для инженеров и научных работников. М. : Физматлит, 2012. 816 с.
- Кондакова А.К., Олейник И.А., Гаврилюк А.А. Содержание метаболитов оксида азота и некоторых показателей свёртывающей системы крови у больных псориазом. Дерматологія та венерологія. 2016. № 1. С. 23–33.
- Корекція порушень ремоделювання кісткової тканини при довготривалій кортикостероїдній терапії / Я.Ф. Кутасевич, І.О. Олійник, І.О. Маштакова, А.Е. Абдалла. Міжнародний ендокринологічний журнал. 2019. № 2. С. 93–98.
- Корнишева В.Г. Применение препарата Циклоферон (линимент) в местной терапии гнездной алопеции: Метод. рекомендации. СПб., 2010. 36 с.
- Кошукова Г.Н. Оценка адаптационно-приспособительных реакций больных ревматоидным артритом в зависимости от длительности течения заболевания. Таврический медико-биологический вестник. Т. 13, № 1 (49). С. 116–120.
- Кубанов А.А., Галлямова Ю.А. Возможности и перспективы терапии тяжелых форм гнездной алопеции. Лечащий врач. 2017. № 10. С. 76–80.
- Кубанов А.А., Галлямова Ю.А., Кораблева О.А. Изменения процессов регуляции ритма смены волос у женщин с нерубцующимися алопециями. Вестник дерматологии и венерологии. 2018. Т. 94, № 5. С. 39–49.
- Кубышкин В.Ф., Мангилёва Т.А., Малый К.М. Сосудистый эндотелиальный фактор роста у больных артериальной гипертензией І степени. Серце і судини. 2013. № 1. С. 32–37.
- Кузнецова В.Л., Соловьева А.Г. Оксид азота: свойства, биологическая роль, механизмы действия. Современные проблемы науки и образования. 2015. № C. 24–30.
- Литвиненко О.Ю. Оценка влияния аналога эндогенных опиоидов даларгина на реакцию системы крови при воспалении. Медицина сегодня и завтра. № 2–3 (63–64). С. 29–32.
- Мавров И.И., Болотная Л.А., Сербина И.М. Основы диагностики и лечения в дерматологии и венерологи: руководство для врачей, интернов, студентов. Харьков : Факт, 2007. 792 с.
- Махнева Н.В. Клеточные и гуморальные компоненты иммунной системы кожи. Российский журнал кожных и венерических болезней. 2016. Т. 19, № 1. С. 12–17.
- Метельская В.А., Гуманова Н.Г. Скрининг-метод определения уровня метаболитов оксида азота в крови. Клин. лаб. диагностика. 2005. № 6. С. 15–18.
- Механизмы и факторы ангиогенеза / Е.Н. Шамитова, И.С.Сымулова, М.М. Леванова, Э.А. Кашеварова. Международный журнал прикладных и фундаментальных исследований. № 9. C. 30–34.
- Механизмы развития эндотелиальной дисфункции и перспективы коррекции / С.Г. Дзугкоев, И.В. Можаева, Е.А. Такоева и др. Фундаментальные исследования. 2014. № 4 (ч. 1). С. 198–204.
- Морфологическая характеристика эпидермиса и дермы при диффузной, андрогенетической и гнездной алопециях / С.Л. Кашутин, Е.И. Теддер, Л.Л. Шагров и др. Российский журнал кожных и венерических болезней. 2018. № 2. С. 106–109.
- Мухамедова М.Г., Юсупов А.М., Халимбетова Н.Ю. Патогенетическая роль системы оксида азота и его метаболитов в развитии и прогрессировании хронической сердечной недостаточности. Буковинський медичний вісник. 2018. Т.22, № 3. С. 50–59.
- Новик А.А., Ионова А.А. Руководство по исследованию качества жизни в медицине. 2-е изд. М. : ЗАО «ОЛМА Медиа Групп», 2007. 320 с.
- Нуралиева Н.Ф., Юкина М.Ю., Трошина Е.А. Основы иммунопатогенеза аутоиммунных тиреопатий и сахарного диабета 1 типа. Доктор.Ру. 2019. № 4 (159). С. 49–53.
- Овчаренко Ю.С., Сербина И.М., Литвиненко Б.В. Трихоскопические дифференциально-диагностические алгоритмы нерубцовых алопеций. Дерматолог. 2014. Т. 5, № 01. С. 38–42.
- Олисова О.Ю., Верхогляд И.В., Гостроверхова И.П. Современные представления об этиологии, патогенезе и лечении очаговой алопеции. Российский журнал кожных и венерических болезней. 2010. № 1. С. 48–52.
- Определение оксида азота в сыворотке и плазме крови человека. Метод высокоэффективной жидкостной хроматографии / А.Г. Кобылянский, Т.В. Кузнецова, Г.Н. Соболева и др. Биомедицинская химия. 2003. № 6. С. 597–603.
- Орлова Н.В., Спирякина Я.Г., Морунов О.Е. Определение уровня кортизола в плазме крови пациентов с артериальной гипертонией при разной степени устойчивости к стрессорным воздействиям. Клиническая лабораторная диагностика. 2018. № 4. С. 210–215.
- Осипенко А. Роль системы оксида азота в процессах адаптации организма к физическим загрузкам. Наука в олимпийском спорте. 2014. № 1. С.23–30.
- Оценка качества жизни при сердечно-сосудистых заболеваниях / Р.М. Арамисова, З.А. Камбачокова, С.С. Дзуева и др. Трудный пациент. Т. 16, № 10. С. 6–9.
- Оценка роли полиморфных вариантов генов NO-синтаз в патогенезе псориаза / А.Г. Соболева, Л.Р. Сакания, И.М. Корсунская, В.В. Соболев. Молекулярная медицина. 2018. Т. 16, № 3. С. 62–64.
- Панин Л.Е. Биохимические механизмы стресса. Новосибирск : Наука, Сибирское отделение, 1983. 240 с.
- Пат. на корисну модель 115991 UA, МПК A61B10/00, A61B5/103. Спосіб діагностики тяжкості гніздової алопеції / І.М. Сербіна, Л.А. Болотна; заявник і патентовласник Харківська медична академія післядипломної освіти. № u201608561; заявл. 04.08.16; опубл. 10.05.17, Бюл. № 9.
- Пат. на корисну модель 123446 UA, МПК A61K31/00, A61P17/14. Спосіб диференційованого лікування гніздової алопеції / Л.А. Болотна, І.М. Сербіна; заявник і патентовласник Харківська медична академія післядипломної освіти. № u201709537; заявл. 29.09.17; опубл. 26.02.18, Бюл. № 4.
- Патофизиология: учебник: в 2 т. / Под ред. В.В. Новицкого, Е.Д.Гольдберга, О.И. Уразовой. Т. 1, гл. 4. Общие реакции организма на повреждение. 4-е изд., перераб. и доп. М. : ГЭОТАР-Медиа, 2009.
- Пашинян А.Г., Дворников А.С., Донцова Е.В. Оценка качества жизни больных псориазом: обзор современных исследований. Лечебное дело. № 2. С. 32–35.
- Понасенко О.А., Ганковская Л.В., Свитич О.А. Роль белка теплового шока 70 в патогенезе сердечно-сосудистой патологии. Медицинская иммунология. 2019. Т. 21, № 2. С. 201–208.
- Потекаев Н.Н., Терещенко Г.П., Гаджигороева А.Г. Современные представления об этиологии и патогенезе алопеции. Клин. дерматология и венерология. 2009. № 4. С. 4–8.
- Практическая дерматология : уч. пособие для врачей-интернов и врачей слушателей заведений (факультетов) последипломного образования / под. общ. ред. проф. Л.А. Болотной. Х. : С.А.М., 2015. 278 с.
- Репина Е.А. Механизмы адаптивного иммунитета (на модели сахарного диабета 1 типа). Сахарный диабет. № 2. С. 21–27.
- Роль оксида азота в процессах свободнорадикального окисления / А.Г. Соловьева, В.Л. Кузнецова, С.П. Перетягин и др. Вестник Российской военно-медицинской академии. 2016. № 1 (53). С. 226–233.
- Роль регуляторных Т-клеток в патогенезе псориаза: обзор литературы / К. Маттоцци, М. Салви, С. Д`Эпиро и др. РМЖ. Дерматология. 2016. № 10. С. 642–650.
- Сенников С.В., Хантакова Ю.Н. Роль субпопуляций Т-клеток в индукции иммунологической толерантности. Иммунология. 2017. Т. 38, № 4. С. 239–244.
- Сербіна І.М. Імуноморфологічні особливості формування гніздової алопеції. Дерматологія та венерологія. 2016. № 3 (75). С. 52–60.
- Сербіна І.М. Клініко-патогенетичне значення білка теплового шоку при гніздовій алопеції. Дерматологія та венерологія. 2019. № 3 (85). С. 15–18.
- Сербіна І.М. Маркери ангіогенезу у хворих на гніздову алопецію. Міжнародний медичний журнал. 2019. № 3. С. 73–78.
- Сербіна І.М. Патогенетичне обґрунтування диференційованого підходу в терапії гніздової алопеції. Дерматологія та венерологія. 2018. № 3 (81). С. 46–50.
- Сербина И.М. Адаптационные гормоны при гнездной алопеции. Матеріали IX Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання наукової і практичної косметології», м. Запоріжжя, 24–25 квітня 2015 р. Запоріжжя, C. 56.
- Сербина И.М. Гнездная алопеция: лечение и перспективы новых исследований. Клінічна імунологія. Алергологія. Інфектологія. 2012. № 1. С. 64–67.
- Сербина И.М Гнездная алопеция. Адаптационно-регуляторные механизмы и качество жизни пациентов. 1-й Конгресс Украинского общества исследования волос с международным участием : Тезисы докладов, г.Киев, 23–24 ноября 2017 г. К., 2017. С. 85.
- Сербина И.М. Изучение сосудистого эндотелиального фактора у больных гнездной алопеции. Лікарська справа. 2017. № 3–4. С. 98–103.
- Сербина И.М. Иммунопатологические аспекты гнездной алопеции. Дерматолог. 2016. № C. 180–187.
- Сербина И.М. Интерлейкин 17 в патогенезе гнездной алопеции. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2014. № 1–2 (32). С. 90–93.
- Сербина И.М. Использование препаратов метаболического действия в терапии гнездной алопеции. Дерматовенерология. Косметология. Сексопатология. 2010. № 1–4. С. 52–55.
- Сербина И.М. Исследование состояния цитокинов при гнездной алопеции с учетом активности заболевания. Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции. Сборник научных трудов. Х. : ХНМУ, 2013. С. 213–217.
- Сербина И.М. Коморбидность при гнездной алопеции. Дерматологія та венерологія. № 2 (80). С. 67–72.
- Сербина И.М. Комплексный подход к диагностике гнездной алопеции. Дерматовенерология. Косметология. Сексопатология. 2011. № 1–4. С. 215–220.
- Сербина И.М. Коррекция нарушений метаболизма оксида азота при гнездной алопеции. Матеріали І Міжнародної науково-практичної конференції у двох томах «Ліки-людині. Сучасні проблеми фармакотерапії і призначення лікарських засобів», м. Харків, 30–31 березня 2017 р. Харків, 2017. Т. 2. С. 295.
- Сербина И.М., Овчаренко Ю.С. Оценка дерматоскопических маркеров при гнездной алопеции. Дерматовенерология. Косметология. Сексопатология. 2013. № 1–4. C. 34–38.
- Сербина И.М. Опыт использования комбинированной наружной терапии при гнездной алопеции. Матеріали XXXІІІ Всеукраїнської науково-практичної конференції за участю міжнародних спеціалістів «Ліки-Людині», м. Харків, 8 квітня 2016 р. Харків, 2016. С. 177.
- Сербина И.М.Особенности метаболизма азота оксида при гнездной алопеции. Укр. журн. дерматол., венерол., косметол. № 2. С. 55–59.
- Сербина И.М. Оценка степени тяжести у больных гнездной алопеции. Дерматологія та венерологія. 2014. № 4. С. 34–37.
- Сербина И.М. Патогенез гнездной алопеции: иммунные механизмы. Международный медицинский журнал. 2016. Т. 22, № 3. С. 65–71.
- Сербина И.М. Проблемы коморбидности при гнездной алопеции. Нужно ли менять тактику лечения? 2-й Конгресс Украинского общества исследования волос с международным участием : Тезисы докладов, г. Киев, 9–10 февраля 2019 г. К., 201 С. 27.
- Сербина И.М. Современные подходы в терапии гнездной алопеции у детей. Міжнародний медичний журнал. 2018. № 1. С. 68–73.
- Сербина И.М. Активация местных механизмов ангиогенеза при гнездной алопеции. Матеріали регіональної науково-практичної школи «Набуття молодих вчених дерматовенерологів», м. Київ, 15 листопада 2012 р. Київ, 2012. С. 87.
- Сербина И.М. Цитокинопосредованные механизмы формирования гнездной алопеции. Научные ведомости БелГУ. Серия: Медицина. Фармация. № 24 (195), вып. 28. С. 32–38.
- Симбирцев А.С. Иммунофармакологические аспекты системы цитокинов. Бюллетень сибирской медицины. 2019. Т. 18б № 1. С. 84–95.
- Соотношение процессов апоптоза, пролиферации, неоангиогенеза и клеточной дифференцировки при иммунном воспалении в очагах гнездной алопеции / А.Г. Гаджигороева, Е.А. Коган, Н.Н. Потекаев, Г.П. Терещенко. Клиническая дерматология и венерология. 2010. № 2. С. 23–31.
- Состояние васкуло-эндотелиального фактора роста при ревматоидном артрите / Е.В. Феофанова, Н.И. Коршунов, Т.Г. Данилова и др. Иммунопатология, аллергология, инфектология. 2013. № С. 13–19.
- Стресс-лимитирующая система у пациентов с ишемией нижних конечностей / Р.Е.Калинин, А.С. Пшенников, И.А. Сучков и др. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. Т. 12, № 3. С. 123–131.
- Тивортин аспартат: новый безопасный и эффективный фармакологический препарат для стимуляции работоспособности спортсменов / Л.М.Гунина, Ю.Д. Винничук, А.В. Дмитриев и др. Український журнал медицини, біології та спорту. № 3 (5). С. 229–244.
- Шавловская О.А. Психодерматология: взгляд на проблему. Consilium Medicum. Дерматология. 2015. № 4. С. 27–32.
- Шепель Р.Н., Драпкина О.М. Новые векторы в диагностике метаболического синдрома: оценка уровня сосудистого эндотелиального фактора роста, пентраксина-3 и трансформирующего фактора роста бета. Кардиоваскулярная терапия и профилактика. 2019. Т. 18, № 6. С. 57–61.
- Фактор роста сосудистого эндотелия и иммунная система / Е.П Киселева, А.В. Крылов, Э.А. Старикова, С.А. Кузнецова. Успехи современной биологии. 2009. Т. 129, № 4. С. 1–12.
- Факторы, регулирующие ангиогенез / А.Н. Иванов, М.О. Куртукова, И.О. Бугаева, А.Н. Иванов. Современные проблемы науки и образования. 2015. № 5. С. 246.
- Функциональное состояние эндотелия сосудов, субклинические проявления атеросклероза у пациентов с суставным синдромом, обусловленным системными заболеваниями соединительной ткани, и возможность их коррекции путем применения L-аргинина / А.В. Курята, О.С. Митрохина, Т.К. Лысунец, Н.М. Тарнавская. Укр. ревматологічний журнал. 2013. № 54 (4). С. 39–44.
- Хамаде Л.М. Иммуноморфологические особенности цитотоксических клеток в очаге поражения при прогрессирующей стадии грибовидного микоза. Український журнал дерматології, венерології, косметології. 2016. № 4 (63). С. 25–30.
- Эндотелиальная дисфункция в патогенезе осложнений сахарного диабета. Сообщение I. Эндотелиальная дисфункция: этиология, патогенез и методы діагностики / А.И. Гоженко, А.С. Кузнецова, Е.С. Кузнецова и др. Ендокринологія. 2017. Т. 22, № 2. C. 171–181.
- Яковенко Л.Ф., Ромащенко О.В., Крупская И.В. Белки теплового шока в диагностике и прогнозировании нарушений репродуктивной функции у женщин. Здоровье женщины. 2018. № 7 (133). С. 77–83.
114. A double-blind, placebo-controlled trial of ruxolitinib for myelofibrosis / S. Verstovsek, R.A. Mesa, J. Gotlib et al. N. Engl. J. Med. 2012. Vol. 366. P. 799–807.
- Abdel Fattah N.S., Atef M.M., Al-Qaradaghi S.M. Evaluation of serum zinc level in patients with newly diagnosed and resistant alopecia areata. J. Dermatol. 2016. Vol. 55, Iss. 1. P. 24–29.
- Abdou A.L., Maraee A.H., Reyad W. Immunohistochemical expression of Heat shock protein 70 in vitiligo. Annals of Diagnostic. Vol. 17. P. 245–249.
- Alefacept for severe alopecia areata: a randomized, double-blind, placebo-controlled study / B.E. Strober, Menon, A. McMichael et al. Arch. Dermatol. 2009. Vol. 145, Iss. 11. P. 1262–1266.
- Alexandrescu D.T. Kauffman C.L., Dasanu A. The cutaneous epidermal growth factor network: can it be translated clinically to stimulate hair growth?. Dermatol. Online J. 2009. Vol. 15, Iss. 3. P. 1.
- Almutairi N., Nour T.M., Hussain H. Janus Kinase Inhibitors for the Treatment of Severe Alopecia Areata: An Open-Label Comparative Study. Dermatology. 2019. Vol. 235, Iss. 2. P. 130–136.
- Alopecia areata / C.H.Pratt, L.E. King Jr., A.G. Messenger et al. Nat Rev Dis Primers. Vol. 3. Article ID 17011.
- Alopecia areata: an appraisal of new treatment approaches and overview of current therapies / L.C. Strazzulla,H.C. Wang, L. Avila et al. J Am Acad Dermatol. 2018. Vol. 78, Iss. 1. P. 15–24.
- Alopecia areata: A multifactorial autoimmune condition / T.Simakou, J.P. Butcher, S. Reid, F.L. Henriquez. Journal of Autoimmunity. Vol. 98. P. 74–85.
- Alopecia areata and health-related quality of life: a systematic review and meta-analysis / F. Rencz, L. Gulácsi, M. Péntek et al. J. Dermatol. 2016. Vol. 175, Iss. 3. P. 561–571.
- Alopecia areata developing during ustekinumab therapy: report of two cases / M. Tauber, N. Beneton, P. Reygagne et al. J. Dermatol. 2013. Vol. 23. P. 912–913.
- Alopecia areata. Disease characteristics, clinical evaluation, and new perspectives on pathogenesis / L.C. Strazzulla, E.H.C. Wang, L. Avila et al. Am. Acad. Dermatol. 2018. Vol. 78, Iss. 1. P. 1–12.
- Alopecia areata during anti-TNF alpha therapy: nine cases / E. Le Bidre, G. Chaby, L. Martib et al. Dermatol. Venereol. 2011. Vol. 138, Iss. 4. P. 285–293.
- Alopecia Areata in the Elderly: A 10-Year Retrospective Study / Y.H. Jang, H.Park, S.L. Kim et al. Ann Dermatol. 2015. Vol. 27, Iss. 4. P. 411–416.
- Alopecia areata investigational assessment Part II / E. Olsen, M.K.Hordinsky, V. Price et al. J. Am. Acad. Dermatol. 2004. Vol. 51. Р. 440–447.
- Alopecia areata is driven by cytotoxic T lymphocytes and is reversed by JAK inhibition / L. Xing, Z. Dai, A. Jabbari et al. Med. 2014. Vol. 20, Iss. 9. P. 1043–1049.
- Alopecia areata prevalence by gender and age / K.P. Kyriakis, K. Paltatzidou, E. Kosma et al. J Eur Acad Dermatol Venereol. 2009. Vol. 23, Iss. 5. P. 572–573.
- Alopecia areata universalis during treatment of rheumatoid arthritis with anti-TNF-alpha antibody (adalimumab) / Y. Chaves, G. Duarte, B. Ben-Said et al. Dermatology. 2008. Vol. 217. P. 380.
- Alopecia areata update: part I. Clinical picture, histopathology, and pathogenesis / A. Alkhalifah, A. Alsantali, E. Wang et al. Am. Acad. Dermatol. 2010. Vol. 62. P. 177–188.
- Alopecia areata update: part II. Treatment / A. Alkhalifah, A. Alsantali, E. Wang et al. Am. Acad. Dermatol. 2010. Vol. 62. P. 191–202.
- Alopecia Areata. Current situation and perspectives / J. Juárez-Rendón, G. Rivera Sánchez, M.Á. Reyes-López et al. Arch. Argent. Pediatr. 2017. Vol. 115, Iss. 6. P. e404–e411.
- Alopecia areata: infiltration of Th17 cells in the dermis, particularly around hair follicles / A. Tanemura, N. Oiso, M. Nakano et al. Dermatology. 2013. Vol. 226. P. 333–336.
- Alopecia areata: a review of disease pathogenesis / F. Rajabi, L.A. Drake, M.M. Senna, N. Rezaei. J. Dermatol. 2018. Vol. 179, Iss. 5. P. 1033–1048.
- Alopecia areata: Review of epidemiology, clinical features, pathogenesis, and new treatment options / Darwin, P.A. Hirt, R. Fertig et al. Int. J. Trichol. 2018. Vol. 10, Iss. 2. P. 51–60.
- Alopecia areata is characterized by dysregulation in systemic type 17 and type 2 cytokines, which may contribute to disease-associated psychological morbidity / K.A. Bain, E. McDonald, F. Moffat et al. Br J Dermatol. Apr 13. doi: 10.1111/bjd.18008.
- Alopecia areata is characterized by expansion of circulating Th2/Th2/Th22, within the skin-homing and systemic T-cell populations / T. Czarnowicki, H.Y. He, H.C. Wen et al. Allergy. 2018. Vol. 73, Iss. 3. P. 713–
- Alopecia Areata – Part III: Prognosis and Treatment / J. Estefan, M. Ribeiro, E. Abad et al. Skinmed. 2016. Vol. 14, Iss. 5. P. 361–365.
- Al-Salam A., Azim A.A., Darwish H. Alopecia areata: Updates. The Gulf Journal of Dermatology and Venereology. 2013. Vol. 20, Iss. 2. P. 1–16.
- Alsantali Alopecia areata: a new treatment plan. J. Invest. Dermatol. 2013. Vol. 133, Iss. 5. P. 1393–1402.
- An integrated model of alopecia areata biomarkers highlights both TH1 and TH2 upregulation / T. Song, A.B. Pavel, H.C. Wen et al. J Allergy Clin Immunol. 2018. Vol. 142, Iss. 5. P. 1631‒1634.
- Analysis of serum heat shock protein 70 concentration for diagnosis and disease activity monitoring in patients with rheumatoid arthritis / S.R.Najafizadeh, Z. Ghazizadeh, A.A. Nargesi et al. Cell Stress and Chaperones. 2015. Vol. 20, Iss. 3. P. 537‒543.
- Antidepressant effects of citalopram on treatment of alopecia areata in patients with major depressive disorder / H. Abedini, S. Farshi, A. Mirabzadeh, S. Keshavarz. J. Dermatolog. Treat. 2014. Vol. 25, Iss. 2. P. 153–15
- Association between IL17A/ IL17RA gene polymorphisms and susceptibility to alopecia areata in the Korean population / B.L. Lew, H.R. Cho, S. Haw et al. Dermatol. 2012. Vol. 24. P. 61–65.
- Association of HSPA1B SNP rs6457452 with Alopecia Areata in the Korean population / Seok, H.S. Jeon, H.J. Park et al. Immunol. Invest. 2013. Vol. 43, Iss. 3. P. 452–465.
- Association of IL17A and IL17F genes with rheumatoid arthritis disease and the impact of genetic polymorphisms on response to treatment / O.S. Marwa, T. Kalthoum, K. Wajih, H. Kamel. Immunol. Lett. 2017. Vol. 183. P. 24–
- Atwa M., Youssef N., Bayoumy N.M. T-helper 17 cytokines (interleukins 17, 21, 22, and 6, and tumor necrosis factor-α) in patients with alopecia areata: association with clinical type and severity. Int. J. Dermatol. 2016. Vol. 55. P. 666–672.
- Autoimmune, atopic, and mental health comorbid conditions associated with alopecia areata in the United States / K.P. Huang, S. Mullangi, Y. Guo, A. Qureshi. JAMA dermatology. 2013. 149. P. 789–794.
- Azzawi S., Penzi L.R., Senna M.M. Immune Privilege Collapse and Alopecia Development: Is Stress a Factor. Skin Appendage Disord. 2018. Vol. 4, Iss. 4. P. 236–244.
- B cell activating factor and T-helper 17 cells: possible synergistic culprits in the pathogenesis of alopecia areata / M.A. Elela, H.I. Gawdat, R.A. Hegazy et al. Dermatol. Res. 2016. Vol. 308. P. 115–121.
- Bakar O., Gurbuz O. Is there a role for sulfasalazine in the treatment of alopecia areata?. J Am Acad Dermatol. Vol. 57. P. 703–706.
- Bark-Lynn L., Sik H., Woo-Young S. Association between epidermal growth factor and epidermal growth factor receptor gene polymorphisms and susceptibility to alopecia areata in Korean population. Am. Acad. Dermatol. 2013. Vol. 68, Iss. 4, Suppl. 1. P. AB103.
- Benefit of different concentrations of intralesional triamcinolone acetonide in alopecia areata: An intrasubject pilot study / T. Chu, K. McElwee, J. Shapiro et al. Am. Acad. Dermatol. 2015. Vol. 73, Iss. 2. P. 338–340.
- Bettelli E., Korn T., Vijay K. Th17: the third member of effector T cell trilogy. Opin. Immunol. 2007. Vol. 19, Iss. 6. P. 652–657.
- Biochemical and immunological studies on erythrocytes superoxide dismutase modified by nitric oxide in patients with alopecia areata: Implications in alopecia patchy persistent and alopecia universalis / Z.Rasheed, A.A. Alzolibani, H.A. Al-Shobaili et al. Immunol Lett. 2014. Vol. 160, Iss. 1. P. 50–57.
- Biomarkers of alopecia areata disease activity and response to corticosteroid treatment / J. Fuentes-Duculan, N. Gulati, K.M. Bonifacio et al. Exp Dermatol. 2016. Vol. 25, Iss. 4. P. 282–286.
- Biran, Zlotogorski A., Ramot Y. The genetics of alopecia areata: new approaches, new findings, new treatments.J. Dermatol. Sci. 2015. Vol. 78. P. 11–20.
- Boehncke W.H., Brembilla N.C. Autoreactive T-Lymphocytes in Inflammatory Skin Diseases. Front Immunol.2019. Vol. 10. P. 1198.
- Bolotnaya L., Serbina I. Changes in endothelial function in alopecia areata. 9th EADV Spring Symposium “A dermatological opera”, Verona (Italy), 6-10 June 2012. Verona, P. 331.
- Borde A., Åstrand A. Alopecia areata and the gut-the link opens up for novel therapeutic interventions. Expert Opin Ther Targets. 2018. 22, Iss. 6. P. 503–511.
- Botchkareva N.V., Ahluwalia G., Shander D. Apoptosis in the hair follicle. Invest. Dermatol. 2006. Vol. 126. P. 258–264.
- Browne R., Stewart L., Williams H.C. Is methotrexate an effective and safe treatment for maintaining hair regrowth in people with alopecia totalis? A Critically Appraised Topic. Br J Dermatol. 2018. Vol. 179, Iss. 3. P. 609–614.
- Bunker C.B. Systemic steroids in the treatment of alopecia areata. J. Dermatol.2004. Vol. 151. P. 246–247.
- Cao VEGF-mediated vascular functions in health and disease. Linköping, Sweden, 2015. 134 р.
- Cellular therapy with human autologous adipose-derived adult cells of stromal vascular fraction for alopecia areata / R. Anderi, N. Makdissy, A. Azar et al. Stem Cell Res Ther. 2018. Vol. 9, Iss. 1. P. 141.
- Chang K.H., Rojhirunsakool S., Goldberg L. Treatment of severe alopecia areata with intralesional steroid injections. J. Drugs Dermatol. 2009. Vol. 8, Iss. 10. P. 909–912.
169. Chartaux E., Joly P. Long-term follow-up of the efficacy of methotrexate alone or in combination with low doses of oral corticosteroids in the treatment of alopecia areata totalis or universalis [in French]. Ann. Dermatol. Venereol. 2009. Vol. 137. P. 507–513.
- Christensen T., Yang J.S., Castelo-Soccio L. Bullying and Quality of Life in Pediatric Alopecia Areata. Skin Appendage 2017. Vol. 3. P. 115–118.
- Clinical characteristics and prognostic factors in early-onset alopecia totalis and alopecia universalis / H.H. Cho, S.J. Jo, S.H. Paik et al. Korean Med. Sci. 2012. Vol. 27, Iss. 7. P. 799–802.
- Clinico etiological study of Alopecia areata / G. Bharathi, P. Venkata Ramana, K. Sridevi et al. Journal of Dental and Medical Sciences. 2015. Vol. 14, 6. P. 29–32.
- Clobetasol propionate 0.05 % under occlusion in the treatment of alopecia totalis/universalis / A. Tosti, B.M. Piraccini, M. Pazzaglia, C. Vincenzi. J Am Acad Dermatol. 2003. Vol. 49, Iss. 1. P. 96–98.
- Comorbidity and multimorbidity in the medical practice: A literature review / L. Collaku, M. Resuli, I. Gjermeni, M. Tase. Alban Med J. 2017. Vol. 4. P. 55–59.
- Comorbidity profiles among patients with alopecia areata: The importance of onset age, a nationwide population-based study / S.Y. Chu, Y.J. Chen, W.C. Tseng et al. Am. Acad. Dermatol. 2011. Vol. 65, Iss. 5. P. 949–956.
- Comparison of Zn, Cu, and Fe content in hair and serum in alopecia areata patients with normal group / L. Dastgheib, Z. Mostafavi-Pour, A. Abdorazagh et al. Res. Pract. 2014. Vol. 20. P. 784–795.
- Corticotropin-releasing hormone stimulates the in situ generation of mast cells from precursors in the human hair follicle mesenchyme / N. Ito, K. Sugawara, E. Bodó et al. Invest. Dermatol. 2010. Vol. 130, Iss. 4. P. 995–1004.
- Craiglow B.G., King B.A. Killing two birds with one stone: oral tofacitinib reverses alopecia universalis in a patient with plaque psoriasis. Invest. Dermatol. 2014. Vol. 134, Iss. 12. P. 2988–2990.
- Craiglow B.G., King B.A. Tofacitinib citrate for the treatment of vitiligo: a pathogenesis-directed therapy. JAMA Dermatol. 2015. Vol. 151, Iss. 10. P. 1110–
- Craiglow B.G., Liu L., King B. Tofacitinib for the treatment of alopecia areata and variants in adolescents. J. Am. Acad. Dermatol. 2017. Vol. 76. P. 29–32.
181. Craiglow B.G., Tavares D., King B.A. Topical ruxolitinib for the treatment of alopecia universalis. JAMA Dermatol. 2016. Vol. 152, Iss. 4. P. 490–491.
- Cruijsen H., Giaccone G., Hoekman K. Epidermal growth factor receptor and angiogenesis: opportunities for combined anticancer strategies. J. Cancer. 2006. Vol. 117, Iss. 6. P. 883–888.
- CXCL10 produced from hair follicles induces Th1 and Tc1 cell infiltration in the acute phase of alopecia areata followed by sustained Tc1 accumulation in the chronic phase / T.Ito, H. Hashizume, T. Shimauchi et al. Dermatol. Sci. 2013. Vol. 69, Iss. 2. P. 140–147.
- Cytokines and growth factors influence hair growth in vitro. Possible implications for the pathogenesis and treatment of alopecia areata / R. Hoffmann, W. Eicheler, A. Huth et al. Dermatol. Res. 1996. Vol. 288, Iss. 3. P. 153–156.
- Cytokines and Nitric Oxide in Immunopathogenesis of IBD and Potential Therapeutic Approaches / I. Soufli, H. Rafa, R. Toumi, T. Chafia. New Insights into Inflammatory Bowel Disease. 2016. 6. P. 125–141.
- Cytokines and other mediators in alopecia areata / S. Gregoriou, D. Papafragkaki, G. Kontochristopoulos et al. Mediators of inflamm. Vol. 2010. ID 928030.
- Damsky W., King B. JAK inhibitors in dermatology: The promise of a new drug class. J Am Acad Dermatol. 2017. Vol. 76, Iss. 4. P. 736–744.
- DavisS., Callender V.D. Review of quality of life studies in women with alopecia. Int J Womens Dermatol. 2018. Vol. 4, Iss. 1. P. 18–22.
- Demonstration of autoantibodies against tyrosine hydroxylase in patients with alopecia areata / E.H. Kemp, K. Sandhu, A.P. Weetman, A.J. McDonagh. Br. J. Dermatol. 2011. Vol. 165. P. 1236–1243.
- Development of alopecia areata is associated with higher central and peripheral hypothalamic-pituitary-adrenal tone in the skin graft induced C3H/HeJ mouse model / X. Zhang, M. Yu, W. Yu et al. J. Invest. Dermatol. 2009. Vol. 129. P. 1527–1538.
- Development of alopecia areata universalis in a patient receiving adalimumab / N. Garcia Bartels, H. Lee, M. Worm et al. Arch. Dermatol. 2006. Vol. 142, Iss. 12. P. 1654–1655.
- Devi M., Rashid A., Ghafoor R. Intralesional Triamcinolone Acetonide Versus Topical Betamethasone Valearate in the Management of Localized Alopecia Areata. Coll. Physicians Surg. Pak. 2015. Vol. 25, Iss. 12. P. 860–862.
- Dey V.K. Combination treatment of extensive and recalcitrant alopecia areata with oral and topical steroids with topical minoxidil: An open-label study of efficacy and safety in pediatric patients. Indian J Pediatr Dermatol. 2016. Vol. 17, Iss. 3. P. 173–178.
- D’Ovidio R. Alopecia Areata: news on diagnosis, pathogenesis and treatment. Ital. Dermatol. Venereol. 2014. Vol. 149. P. 25–45.
- Early stage alopecia areata is associated with inflammation in the upper dermis and damage to the hair follicle infundibulum / Zhang, Y. Zhao, Z. Cai et al. Australas J Dermatol. 2013. Vol. 54, No. 3. P. 184–191.
- Effects of low-dose recombinant interleukin 2 to promote T-regulatory cells in alopecia areata / Castela, F. Le Duff, C. Butori et al. JAMA Dermatol. 2014. Vol. 150, Iss. 7. P. 748–751.
197. Efficacy and safety of crisaborole ointment, a novel, nonsteroidal phosphodiesterase 4 (PDE4) inhibitor for the topical treatment of atopic dermatitis (AD) in children and adults / A.S. Paller, W.L. Tom, M.G. Lebwohl et al. J. Am. Acad. Dermatol. 2016. Vol. 75. P. 494–503.
- Efficacy and safety of diphenolcyclopropenone alone or in combination with anthralin in the treatment of chronic extensive alopecia areata: a retrospective case series / M. Durdu, D. Ozcan, M. Baba, D. Seckin. J. Am. Acad. Dermatol. 2015. Vol. 72, Iss. 4. P. 640–650.
- Efficacy and Safety of Methotrexate Combined with Low- to Moderate-Dose Corticosteroids for Severe Alopecia Areata / D. Anuset, G. Perceau, P. Bernard, Z. Reguiai. Dermatology. 2016. Vol. 232, Iss. 2. P. 242–248.
- Efficacy of topical 5 % minoxodil solution in the treatment of alopecia areata / Zaib, S. Rashid, R. Jabeen, A.A.K. Fraz. Pakistan Journal of Medical and Health Sciences. 2017. Vol. 11, Iss. 2. P. 795–798.
201. English J.C., Heinisch S. Methotrexate Treatment for Alopecia Areata with Greater than 50 % Involvement. Hair Ther. Transplant. 2015. Vol. 5, Iss. 3. ID. 1000138.
- Eskeland S., Halvorsen J.A., Tanum L. Antidepressants have Anti-inflammatory Effects that may be Relevant to Dermatology: A Systematic Review. Acta Derm. Venereol. 2017. Vol. 97, Iss. 8. P. 897–905.
- Etanercept does not effectively treat moderate to severe alopecia areata: an open-label study / B.E. Strober, K. Siu, A.F. Alexis et al. Am. Acad. Dermatol. 2005. Vol. 52, Iss. 6. P. 1082–1084.
- Evaluation of lipid peroxidation, oxidant/antioxidant status, and serum nitric oxide levels in alopecia areata / R. Koca, F. Armutcu, C. Altinyazar, A. Gürel. Med Sci Monit. 2005. Vol. 11, Iss. 6. P. CR296–CR299.
- Expression of vascular endothelial growth factor, apoptosis inhibitors (survivin and p16) and CCL27 in alopecia areata before and after diphencyprone treatment: an immunohistochemical study / O. Simonetti, G. Lucarini, M.L. Bernardini et al. Br. J. Dermatol. 2004. Vol. 150, Iss. 5. P. 940–948.
- Extensive alopecia areata is reversed by IL-12/IL-23p40 cytokine antagonism / E. Guttman-Yassky, Ungar, S. Noda et al. J. Allergy Clin. Immunol. 2016. Vol. 137. P. 301–304.
- Eyerich K., Dimartino V., Cavani A. IL-17 and IL-22 in immunity: driving protection and pathology. Eur J Immunol. Vol. 47, Iss. 4. P. 607–614.
- Fas deficient C3.MRL-Tnfrsf 6 (lpr) mice and Fas ligand deficient C3H/HeJ-Tnfsf 6 (gld) mice are relatively resistant to the induction of alopecia areata by grafting of alopecia areata-affected skin from C3H/HeJ mice / P. Freyschmidt-Paul, K.J. McElwee, V. Botchkarev et al. Investig. Dermatol. Symp. Proc. 2003. Vol. 8. P. 104–108.
- Five-year experience in the treatment of alopecia areata with DPC / B.M. El-Zawahry, D.A. Bassiouny, A. Khella, N.S. Zaki. J Eur Acad Dermatol Venereol. 2010. Vol. 24, Iss. 3. P. 264–269.
- Follow-up study of the first genome-wide association scan in alopecia areata: IL13 and KIAA0350 as susceptibility loci supported with genome-wide significance / D. Jagielska, S. Redler, F.F. Brockschmidt et al. J. Invest. Dermatol. 2012. Vol. 132, Iss. 9. P. 2192–2197.
- Fricke A.C.V., Miteva M. Epidemiology and burden of alopecia areata: a systematic review. Clin. Cosmet. Investig. Dermatol. 2015. Vol. 8. P. 397–403.
- Garnock-Jones K.P. Secukinumab: a review in moderate to severe plaque psoriasis. J. Clin. Dermatol. 2015. Vol. 16. P. 323–330.
- Gaspari A.A., Tyring S. New and emerging biologic therapies for moderate-to-severe plaque psoriasis: mechanistic rationales and recent clinical data for IL-17 and IL-23 inhibitors. Dermatol. Ther. 2015. Vol. P. 179–193.
- Gender differences in alopecia areata / M. Lundin, S. Chawa, A. Sachdev et al. J. Drugs Dermatol. 2014. Vol. 13. P. 409–413.
- Gene expression studies identifyCxcr3 and its ligands, Cxcl9, Cxcl10, and Cxcl11 in the pathogenesis of alopecia areata in the mouse / C. McPhee, Duncan, K. Silva et al. J. Invest. Dermatol. 2012. Vol. 132. P. 1736–1738.
- Genetic susceptibility and severity of alopecia areata in human and animal models / K. McElwee, P. Freyschmidt-Paul, A. Ziegler et al. J. Dermatol. 2001. Vol. 11. P. 11–16.
- Genome-wide association study in alopecia areata implicates both innate and adaptive immunity / L. Petukhova, M. Duvic, M. Hordinsky et al. Nature. 2010. Vol. P. 113–117.
- Genome-wide pooling approach identifies SPATA5 as a new susceptibility locus for alopecia areata / L. Forstbauer, F. Brockschmidt, V. Moskvina et al. Eur. J. Hum. Genet. 2012. 20. P. 326–332.
- Ghaderi R. A novel marker in patients with alopecia areata. MOJ Immunol. 2018. Vol. 6, Iss. 6. P. 311–314.
- Ghoreishi M., Martinka M., Dutz J. Type 1 interferon signature in the scalp lesions of alopecia areata. Brit.J. Dermatol. 2010. Vol. 163, Iss. 1. P. 57–62.
- Gilhar A. Collapse of Immune Privilege in Alopecia Areata: Coincidental or Substantial? Invest. Dermatol. 2010. Vol. 130, Iss. 11. P. 2535–2537.
- Gilhar A., Etzioni A., Paus R. Alopecia areata. Engl. J. Med. 2012. Vol. 366, Iss. 16. P. 1515–1525.
- Gilhar , Kalish R. Alopecia areata: a tissue specific autoimmune disease of the hair follicle. Autoimmun Rev. 2006. Vol. 5. P. 64–69.
- Gilhar , Paus R., Kalish R. Lymphocytes, neuropeptides, and genes involved in alopecia areata. J. Clin. Invest. 2007. Vol. 117. P. 2019–2027.
- Gong, Lim S.W. Alopecia areata as a paraneoplastic syndrome of Hodgkin’s lymphoma: A case report. Mol Clin Oncol. 2014. Vol. 2, Iss. 4. P. 596–598.
- Gregoriou S., Kazakos C., Rigopoulos D. Treatment options for alopecia areata. Expert Review of Dermatology. 2011. Vol. 6, 5. P. 537–548.
- Grenier P.-O., Veillette H. Treatment of alopecia universalis with oral alitretinoin: A case report. JAAD Case Rep. 2017. Vol. 3, Iss. 2. P. 140–142.
- Hair follicles from alopecia areata patients exhibit alterations in immune privilege-associated gene expression in advance of hair loss / H. Kang, W.Y. Wu, B.K. Lo et al. J. Invest. Dermatol. 2010. Vol. 130, Iss. 11. P. 2677–2680.
- Hair growth and disorders / U. Blume-Peytavi, A. Tosti, D.A. Whiting, R.M. Trüeb. Berlin : Springer, 2008. P. 311–320.
- Harries M.J.,Paus R. The pathogenesis of primary cicatricial alopecias. J. Pathol. 2010. Vol. 177. P. 2152–2162.
- Herskovitz I., Freedman J., Tosti A. Minoxidil induced hypertrichosis in a 2 year-old child. F1000Research. 2013. Vol. P. 226.
- High relapse rates despite early intervention with intravenous methylprednisolone pulse therapy for severe childhood alopecia areata / A. Smith, M. Trueb, M. Theiler et al. Pediatr. Dermatol. 2015. Vol.32, Iss. 4. P. 481–487.
- High-dose pulsed corticosteroid therapy combined with methotrexate for severe alopecia areata of childhood / J.H. Chong, A. Taïeb, F. Morice-Picard et al. J Eur Acad Dermatol Venereol. 2017. Vol. 31, Iss. 11. P. e476–e477.
- Hoglund P.,Brodin P. Current perspectives of natural killer cell education by MHC class I molecules. Rev. Immunol. 2010. Vol. 10. P. 724–734.
- Hordinsky M., Donati A. Alopecia areata: an evidence-based treatment update. J. Clin. Dermatol. 2014. Vol. 15. P. 231–246.
- Hordinsky M. Alopecia areata: The clinical situation. J. Investig. Dermatol. Symp. Proc. 2018 Vol. 19. P. S9–S11.
- Hordinsky M.K. Current Treatments for Alopecia Areata. Invest. Dermatol. Symp. 2015. Vol. 17, Iss. 2. P.44–46.
- Hordinsky M. Overview of alopecia areata. J Investig Dermatol Symp Proc. 2013. Vol. 16, Iss. 1. P. S13–S15.
- Hordinsky M.K. Treatment of alopecia areata: “What is new on the horizon?”. Dermatol Ther. 2011. Vol. 24, Iss. 3. P. 364–368.
- IL-17 inhibition: is it the long-awaited savior for alopecia areata? / Y. Ramot, B. Marzani, D. Pinto et al. Arch. Dermatol. Res. 2018. Vol. 310, Iss. 5. P. 383–
- Image gallery: treatment of refractory alopecia universalis with oral tofacitinib citrate and adjunct intralesional triamcinolone injections / L. Strazzulla, Avila, K. Lo Sicco, J. Shapiro. Br. J. Dermatol. 2017. Vol. 176, Iss. 6. P. e125.
- Immune privilege and the skin / T. Ito, C. Meyer, N. Ito, R. Paus. Curr. Dir. Autoimmun. 2008. Vol. 10. P. 27–52.
- Increased serum HSP70 levels are associated with the duration of diabetes / M. Nakhjavani, A. Morteza, L. Khajeali et al. Cell Stress and Chaperones. 2010. Vol. 15, Iss. 6. P. 959–9
- Investigation of interleukin-12, interleukin-17 and interleukin-23 receptor gene polymorphisms in alopecia areata / N. Aytekin, C. Akcali, S. Pehlivan et al. J Int Med Res. Vol. 43. P. 526–534.
- Investigation of the inflammatory mechanisms in alopecia areata / E.D. Cetin, Savk, M. Uslu et al. Am. J. Dermatopathol. 2009. Vol. 31. P. 53–60.
- Investigation of the male pattern baldness major genetic susceptibility loci AR/EDA2R and 20p11 in female pattern hair loss / S. Redler, F. Brockschmidt, R. Tazi-Ahnini et al. J. Dermatol. 2012. Vol. 166, Iss. 6. P. 1314–1318.
247. Iorizzo M., Tosti A. Emerging drugs for alopecia areata: JAK inhibitors. Expert Opin. Emerg. Drugs. 2018. Vol. 23, Iss. 1. P. 77–81.
- Ito T. Hair follicle is a target of stress hormone and autoimmune reactions. J. Dermatol. Sci. Vol. 60. P. 67–73.
- Ito Recent Advances in the Pathogenesis of Autoimmune Hair Loss Disease Alopecia Areata. Clin. Dev. Immunol. 2013. Vol. 2013. ID348546. P. 1–6.
- Janus kinase (JAK) inhibitors for the treatment of skin and hair disorders: a review of literature / A. Samadi, S. Ahmad Nasrollahi, A. Hashemi et al. J Dermatolog Treat. 2017. Vol. 28, Iss. 6. P. 476-483.
- Johnsson H.J., McInnes I. Interleukin-12 and interleukin-23 inhibition in psoriatic arthritis. Clin. Exp. Rheumatol. 2015. Vol. 33. P. S115–S118.
- Kasumagic-Halilovic , Prohic A., Karamehic J. Serum concentrations of interferon-gamma (IFN-g) in patients with alopecia areata: correlation with clinical type and duration of the disease. Med. Arh. 2010. Vol. 64, Iss. 4. P. 212–214.
- KiszewskiE., Bevilaqua M., De Abreu L.B. Mesalazine in the treatment of extensive alopecia areata: A new therapeutic option? Intern. J. Trichol. 2018. Vol. 10, Iss. 3. P. 99–102.
- Kos, Conlon J. An update on alopecia areata. Curr. Opin. Pediatr. 2009. Vol. 21. P. 475–480.
- Kranseler J.S., Sidbury Alopecia areata: Update on management. Indian Journal of Paediatric Dermatology. 2017. Vol.18, Iss. 4. P. 261–266.
- Kumar A., Chanana P. Role of Nitric Oxide in Stress-Induced Anxiety: From Pathophysiology to Therapeutic Target. Vitamins and Hormones. 2017. Vol. 103. P. 147–167.
- Kuty-Pachecka M. Psychological and psychopathological factors in alopecia areata. Psychiatr Pol. 2015. Vol. 49, Iss. 5. P. 955–964.
- Lack of efficacy of topical latanoprost in the treatment of eyebrow alopecia areata / E.K. Ross, C. Bolduc, H. Lui, J. Shapiro. J Am Acad Dermatol. 2005. Vol. 53, Iss. 6. P. 1095–1096.
259. Landis E.T., Pichardo-Geisinger R.O. Methotrexate for the treatment of pediatric alopecia areata. J. Dermatolog. Treat. 2018. Vol. 29, Iss. 2. P. 145–148.260. Late-Onset Alopecia Areata: A Retrospective Cohort Study / A. Lyakhovitsky, S. Gilboa, A. Eshkol et al. Dermatology. 2017. Vol. 233, Iss. 4. P. 289–294.261. Li J., Sinclair R. Clinical observations in alopecia areata: Implications and hypotheses. Australas J Dermatol. 2016. Vol. 57, Iss. 1. P. 29–31.
- Lifetime incidence risk of alopecia areata estimated at 2.1 % by Rochester Epidemiology Project, 1990-2009 / S. Mirzoyev, G. Schrum, D. Davis, R. Torgerson. Invest. Dermatol. 2014. Vol. 134. P. 1141–1142.
- Lim C.P., Severin R.K., Petukhova L. Big Data Reveal Insights into Alopecia Areata Comorbidities. J Investig Dermatol Symp Proc. 2018. Vol. 19, Iss. 1. P. S57–S61.
- Liu L.Y., King B.A., Craiglow B.G. Alopecia areata is associated with impaired health-related quality of life: A survey of affected adults and children and their families. J. Am. Acad. Dermatol.2018. Vol. 79, Iss. 3. P. 556–
- Long-Term Prognosis of Alopecia Totalis and Alopecia Universalis: A Longitudinal Study with More than 10 Years of Follow-Up: Better than Reported / Y.H. Jang, N.S. Hong, S.Y. Moon et al. Dermatology. 2017. Vol. 233, Iss. 2–3. P. 250–256.
- Lux-Battistelli C. Combination therapy with zinc gluconate and PUVA for alopecia areata totalis: an adjunctive but crucial role of zinc supplementation. Ther. 2015. Vol. 28, Iss. 4. P. 235–238.
- Maloney J., Gao L. Proinflammatory Cytokines Increase Vascular Endothelial Growth Factor Expression in Alveolar Epithelial Cells. Mediators of Inflammation. 2015. Vol. 2015. ID 387842. 7 p.
- Matzer F., Egger J.W., Kopera D. Psychosocial stress and coping in alopecia areata: a questionnaire survey and qualitative study among 45 patients. Acta Derm Venereol. 2011. Vol. 91, Iss. 3. P. 318–327.
- McElwee K., Sinclair R. Hair physiology and its disorders. Drug Discov. Today Dis. Mech. 2008.5. P. 163–171.
- McElwee K., Spiers E., Oliver R. In vivo depletion of CD8+ T cells restores hair growth in the DEBR model for alopecia areata. Br. J. Dermatol. 1996. Vol. 135, Iss. 2. P. 211–217.
- Mease P.J. Inhibition of interleukin-17, interleukin-23 and the TH17 cell pathway in the treatment of psoriatic arthritis and psoriasis. Opin. Rheumatol. 2015. Vol. 27. P. 127–133.
272. Methotrexate in Severe Childhood Alopecia Areata: Long-term Follow-up / P. Lucas, C. Bodemer, S. Barbarot et al. J. Acta Derm. Venereol. 2016. Vol. 96, Iss. 1. P. 102–103.
- Morsy H., Maher R., Negm D. Correlation between serum IL-17A level and SALT score in patients with alopecia areata before and after NB-UVB therapy. J. Cosmet. Dermatol. 2018. Vol. 17, Iss. 3. P. 533–
- Multivariate analysis of prognostic factors in patients with rapidly progressive alopecia areata / M. Uchiyama, C. Egusa, A. Hobo et al. J Am Acad Dermatol. 2012. Vol. 67, Iss. 6. P. 1163–1173.
- Namazi M.R. Nitric oxide donors as potential additions to anti-alopecia areata armamentarium. Inflamm. Res.2003. Vol. 52, Iss. 6. P. 227–229.
- Nitric oxide – important messenger in human body / M. Antosova, J. Plevkova, A. Strapkova, T. Buday. Open Journal of Molecular and Integrative Physiology. 2012. 2. Р. 98–106.
- Ohyama What is behind the ‘swarm of bees’ in alopecia areata. Br J Dermatol. 2018. Vol. 179, Iss. 5. P. 1023–1024.
- Olsen E.A., Carson S.C., Turney E.A. Systemic steroids with or without 2% topical minoxidil in the treatment of alopecia areata. Arch. Dermatol. 1992. Vol. 128, Iss. 11. P. 1467–1473.
279. Oral ruxolitinib induces hair regrowth in patients with moderate-to-severe alopecia areata / J. Mackay-Wiggan, A. Jabbari, N. Nguyen et al. JCI Insight. 2016. Vol. 1. P. e89790.280. Overview of cytokines and nitric oxide involvement in immuno-pathogenesis of inflammatory bowel diseases / I. Soufli, R. Toumi, H. Rafa, C. Touil-Boukoffa. World J Gastrointest Pharmacol Ther. 2016. Vol. 7, Iss. 3. P. 353–360.
- Pan Y., Rao N.A. Alopecia areata during etanercept therapy. Immunol. Inlamm. 2009. Vol. 17. P. 127–129.
- Paus R., Bulfone-Paus S., Bertolini M. Hair Follicle Immune Privilege Revisited: The Key to Alopecia Areata Management. J Investig Dermatol Symp Proc. 2018. Vol. 19, Iss. 1. P. S12–S17.
283. Placebo-controlled trial of tofacitinib monotherapy in rheumatoid arthritis / R. Fleischmann, J. Kremer, J. Cush et al. N. Engl. J. Med. 2012. Vol. 367. P. 495–507.
- Pretreatment of epidermal growth factor promotes primary hair recovery via the dystrophic anagen pathway after chemotherapy-induced alopecia /H. Paik, J.S. Yoon, H.H. Ryu et al. Exp. Dermatol. 2013. Vol. 22, Iss. 7. P. 496–499.
- Prevalence of psychological disorders in patients with alopecia areata in comparison with normal subjects / S. Aghaei, N. Saki, E. Daneshmand et al. ISRN Dermatology. 2014. Vol. 2014, Iss. 304370. P. 1–4.
- Prevention and treatment of alopecia areata with quercetin in the C3H/HeJ mouse model / T.С. Wikramanayake, A.С. Villasante, LМ. Mauro et al. Cell Stress and Chaperones. 2012. Vol. 17. Р. 267–274.
- Probing the effects of stress mediators on the human hair follicle: substance P holds central position / E. Peters,Liotiri, E. Bodo et al. Am. J. Pathol. 2007. Vol. 171. P. 1872–1886.
- Psychoneuroimmunologic aspects of skin diseases / L. Lugović-Mihić, Ljubesić, J. Mihić et al. Acta Clin. Croat. 2013. Vol. 52, Iss. 3. P. 337–345.
- Pullen LC. Alopecia Areata Associated With Autoimmune Comorbidity. URL:http://www.medscape.com/viewarticle/804646. Accessed: May 27, 2013.
- Pulse corticosteroid therapy for alopecia areata in children: a retrospective study / R. Friedland, R. Tal, M. Lapidoth et al. Dermatology. 2013. Vol. 227, Iss. 1. P. 37–44.
- Pulse methylprednisolone therapy for the treatment of extensive alopecia areata / G. Acikgoz, I. Ozmen, M. Cayirli et al. Dermatolog. Treat. 2014. Vol. 25, Iss. 2. P. 164–166.
292. Putterman E., Castelo-Soccio L. Topical 2 % tofacitinib for children with alopecia areata, alopecia totalis, and alopecia universalis. J. Am. Acad. Dermatol. 2018. Vol. 78, Iss. 6. P. 1207–1209.293. Quality of life in alopecia areata: a disease-specific questionnaire / G. Fabbrocini, L. Panariello, V. De Vita et al. J Eur Acad Dermatol Venereol. 2013. Vol. 27. P. e276–e280.294. Quality of life in alopecia areata: a study of 60 cases / M. Dubois, K. Baumstarck-Barrau, C. Gaudy-Marqueste et al. J Invest Dermatol. 2010. Vol. 130. P. 2830–2833.295. Quality of life in mild and severe alopecia areata patients / R. Abedini, Z. Hallaji, V. Lajevardi et al. Int J Womens Dermatol. 2018. Vol. 4, Iss. 2. P. 91–94.296. Ramot Y., Gural A., Zlotogorski A. Alopecia Areata as a Manifestation of Systemic Lymphoma: Report of Two Cases. Skin Appendage Disord. 2016. Vol. 2, Iss. 1–2. P. 63–66.297. Ramot Y., Zlotogorski A. Complete Regrowth of Beard Hair with Ruxolitinib in an Alopecia Universalis Patient. Skin Appendage Disord. 2018. Vol. 4, Iss. 2. P. 122–124.
- Randomized phase 2a efficacy and safety trial of the topical Janus kinase inhibitor tofacitinib in the treatment of chronic plaque psoriasis / W.C. Ports, Khan, S. Lan et al. Br. J. Dermatol. 2013. Vol. 169, Iss. 1. P. 137–145.
- Rashid S., Ahsan , Saeed W. Efficacy and safety of sulphasalazine in treatment of alopecia areata. J. Pakistan Assoc. Dermatol. 2015. Vol. 25, Iss. 4. P. 298–302.
- Rashidi T., Mahd A.A. Treatment of persistent alopecia areata with sulfasalazine. J. Dermatol. 2008. Vol. 47. P. 850–852.
- Relationship between VEGF Gene Polymorphisms and Serum VEGF Protein Levels in Patients with Rheumatoid Arthritis / A. Paradowska-Gorycka, A. Pawlik, K. Romanowska-Prochnicka et al. PLoS One. 2016; 11, Iss. 8. e0160769.
- Relevance of trichoscopy in the differential diagnosis of alopecia: A cross-sectional study from North India / M.J. Chiramel, V.K. Sharma, S. Khandpur, V. Sreenivas. Indian Journal of Dermatol. Vener and Leprol. 2016. Vol. 82, Iss. 6. P. 651–658.
- Renboek phenomenon in an alopecia areata patient with psoriasis / Y. Ovcharenko, I. Serbina, A. Zlotogorski, Y. Ramot. Int. Trichology. 2013. Vol. 5, Iss. 4. P. 194–195.
- Resistance to alopecia areata in C3H/HeJ mice is associated with increased expression of regulatory cytokines and a failure to recruit CD4+ and CD8+ cells / K. McElwee, R. Hoffmann, P. Freyschmidt-Paul et al. Invest. Dermatol. 2002. Vol. 119. P. 1426–1433.
- Reversal of Alopecia Areata Following Treatment With the JAK1/2 Inhibitor Baricitinib / A. Jabbari, Z. Dai, L. Xing et al. EBioMedicine. 2015. Vol. 2, Iss. 4. P. 351–355.
- Role of the autoimmune regulator (AIRE) gene in alopecia areata: strong assotiation of a potentially functional AIRE polymorphism with alopecia universalis / R. Tazi-Anhnini, M. Cork, D. Gawkrodger et al. Tissue Antigens. 2002. Vol. 60, Iss. 6. P. 489–495.
- Rork J.F., Rashighi M., Harris J. Understanding autoimmunity of vitiligo and alopecia areata. Curr Opin Pediatr. 2016. Vol. 28, Iss. 4. P. 463–469.
- Rudnicka L., Olszewska M., Rakowska A. Atlas of Trichoscopy. Dermoscopy in Hair and Scalp Disease. London : Springer Ltd, 2012. 507 р.
- Safety and efficacy of the JAK inhibitor tofacitinib citrate in patients with alopecia areata / M.K. Crispin, M. Ko, B.G. Craiglow et al. JCI Insight. 2016. Vol. 1, Iss. 15. P. e89776.
- Salsberg J.M., Donovan J. The safety and efficacy of diphencyprone for the treatment of alopecia areata in children. Dermatol. 2012. Vol. 148, Iss. 9. P. 1084–1085.
- Serbina I.M. Alopecia areata. 17th Meeting of the European Hair Research Society : Abstract book, Tbilisi (Georgia), June 24–26 2016. Tbilisi, 2016. SA-01-6. P. 64.
- Serbina I. Alopecia areata: focus on comorbidity. 11 World Congress of Hair Research : Abstract book, April 24-27, 2019, Sitges, Barselona (Spain). P.153–154.
- Serbina I. Angiogenesis factors in alopecia areata. 9th World Congress for Hair Research, Miami (USA), November 18-21, 2015. Annals of Dermatology. 2015. 203. P. 32.
- Serbina I. Disadaptation disorders and quality of life index in alopecia areata. 18th meeting of the EHRS Congress : Abstract book, Bologna (Italy), May 18–20 2018. Bologna, 2018. Р.
- Serbina I., Ramot Y. Pressure alopecia mimicking alopecia areata: Dermoscopy as a diagnostic aid in avoiding a potential clinical pitfall. 8th World Congress for Hair Research (WCHR 2014), May 14-17 2014, Jeju (Korea). Annals of Dermatology. 2014. Vol. 26, Suppl. 1. P. 28.
- Serbina I. Study of nitrogen oxide and heat shock protein 70 system in patients with alopecia areata. Materials of 8th national scientifically-practical conference with the internatiol participation «Reactive oxygen species, nitric oxide, antioxidants and human health», Smolensk, May 25-29th, 2014. Smolensk, 2014. Р. 181–182.
- Serum concentrations of selected proinflammatory cytokines in children with alopecia areata / K. Tabara, Kozłowska, A. Jędrowiak et al. Postepy Dermatol Alergol. 2019. Vol. 36, Iss. 1. P. 63–69.
- Serum cytokine and chemokine profiles in patients with alopecia areata / O. Bilgic, A. Sivrikaya, A. Unlu et al. J Dermatolog Treat. Vol. 27. P. 260–263.
- Serum Levels of Interleukin-2 and Interleukin-2 Soluble Receptor in Patients with Vitiligo / E. Kasumagic-Halilovic, N. Ovcina-Kurtovic, S. Soskic et al. British Journal of Medicine and Medical Research. 2016. Vol. 13, Iss. 10. P. 1–7.
- Serum T helper 1 cytokine levels are greater in patients with alopecia areata regardless of severity or atopy / N. Barahmani, Lopez, D. Babu et al. Clin. Exp. Dermatol. 2010. Vol. 35. P. 409–416.
- Shapiro J., Madani S. Alopecia areata: diagnosis and management J. Dermatol.1999. Vol. 38, Suppl. 1. P. 19–24.
- Shreberk-Hassidim R., Ramot Y., Zlotogorski A. Janus kinase inhibitors in dermatology: A systematic review. J Am Acad Dermatol. 2017. Vol. 76, Iss. 4. P. 745–
323. Simvastatin/Ezetimibe Therapy for Recalcitrant Alopecia Areata: An Open Prospective Study of 14 Patients / J.-W. Choi, D.-W. Suh, B.-L. Lew. Ann. Dermatol. 2017. Vol. 29, Iss. 6. P. 755–760.
- Sinclair R. Alopecia areata and suicide of children. J. Aust. 2014. Vol. 200, Iss. 3. P. 145–148.
- Sinclair R. Treating people with alopecia areata: what works and what doesn´t. J. Trichol. 2011. Vol. 3, Iss. 1. P. 31–33.
- Skogberg G., Jackson S., Åstrand A. Mechanisms of tolerance and potential therapeutic interventions in Alopecia Areata. Pharmacol. Ther. 2017. Vol. 179. P. 102–
327. Statins in skin: research and rediscovery, from psoriasis to sclerosis / A. Egesi, G. Sun, A. Khachemoune, RM. Rashid. J. Drugs Dermatol. 2010. Vol. 9, Iss. 8. P. 921–927.
- Structure and function of natural killer cell receptors: multiple molecular solutions to self, nonself discrimination /Natarajan, N. Dimasi, J. Wang et al. Ann. Rev. Immunol. 2002. Vol. 20. P. 853–885.
- Substance P as an immunomodulatory neuropeptide in a mouse model for autoimmune hair loss (alopecia areata) / F. Siebenhaar, A. Sharov, E. Peters et al. Invest. Dermatol. 2007. Vol. 127. P. 1489–1497.
- Sumara R., Uzma A., Wajieha S. Efficacy and safety of sulphasalazine in treatment of alopecia areata. J. Pakistan Assoc. Dermatol. 2015. Vol. 25, No. 4. P. 298–302.
- Susceptible and protective endothelial nitric oxide synthase gene polymorphism in alopecia areata in the Kuwaiti population / S. Alfadhli, N.J. Kharrat, B. Al-Tememy et al. 2008. Vol. 41, Iss. 7. P. 522–525.
- Systematic review and meta-analysis of ustekinumab for moderate to severe psoriasis / Y. Meng, Dongmei, P. Yanbin et al. Clin. Exp. Dermatol. 2014. Vol. 39. P. 696–707.
- Systematic review of pulse steroid therapy for alopecia areata / R. Shreberk-Hassidim, Y. Ramot, G. Zvi, A. Zlotogorski. J. Am. Acad. Dermatol. Vol. 74, Iss. 2. P. 327–374.
- T cell-derived inducible nitric oxide synthase switches off TH17 cell differentiation / J. Yang, Zhang, G. Lu et al. J Exp Med. 2013. Vol. 210, Iss. 7. P. 1447–1462.
- Tembhre M.K., Sharma V.K. T-helper and regulatory T-cell cytokines in the peripheral blood of patients with active alopecia areatа. J. Dermatol. 2013. Vol. 169. P. 543–548.
- The autoimmune basis of alopecia areata: a comprehensive review / N. Islam, P.S. Leung, A.C. Huntley, M.E. Gershwin. Autoimmun Rev. 2015. Vol. 14, Iss. 2. P. 81–89.
- The basic science of hair biology: what are the causal mechanisms for the disordered hair follicle? / T. Breitkopf, G. Leung, M. Yu et al. Dermatol. Clin. 2013. Vol. 31. P. 1–19.
- The effect of oral cyclosporine in the treatment of severe alopecia areata / G. Açıkgöz, Calışkan, M. Tunca et al. Cutan. Ocul. Toxicol. 2014. Vol. 33, Iss. 3. P. 247–252.
339. The PDE4 inhibitor, apremilast, suppresses experimentally induced alopecia areata in human skin in vivo / A. Keren, A. Shemer, Y. Ullmann et al. J. Dermatol. Sci. 2015. Vol. 77. P. 74–76.340. The profile of cytokines (IL-2, IFN-γ, IL-4, IL-10, IL-17A, and IL-23) in active alopecia areata / R.K. Gautam, Y. Singh, A. Gupta et al. Cosmet Dermatol. 2019. May 14. doi: 10.1111/jocd.12970.
- The safety and efficacy of a JAK inhibitor in patients with active rheumatoid arthritis: results of a double-blind, placebo-controlled phase IIa trial of three dosage levels of CP-690,550 versus placebo / J.M. Kremer, B.J. Bloom, F.C. Breedveld et al. Arthritis Rheum. 2009. Vol. 60. P. 1895–1905.
- The therapeutic effect and the changed serum zinc level after zinc supplementation in alopecia areata patients who had a low serum zinc level / H. Park, C.W. Kim, S.S. Kim, C.W. Park. Dermatol. 2009. Vol. 21, Iss. 2. P. 142-146.
- The Use of Sulfasalazine in Severe Types of Alopecia Areata / P. Chairerg, P. Asawanonda, M. Kongkabpan et al. Hair : Therap. Transplantat. 2011. 1, Iss. 1. Article ID 1000102.
- Thomas E., Kadyan R. Alopecia areata and autoimmunity: a clinical study. J. Dermatol. 2008. Vol. 53. P. 70–74.
- Tofacitinib for the treatment of severe alopecia areata and variants: A study of 90 patients / L.Y. Liu, B.G. Craiglow, F Dai, B.A. King. Am. Acad. Dermatol. 2017. Vol. 76, Iss. 1. P. 22–28.
346. Topical Janus kinase inhibitors for the treatment of pediatric alopecia areata / C.B. Bayart, K.L. DeNiro, L. Brichta et al. J. Am. Acad. Dermatol. 2017. Vol. 77. P. 167–170.
- Transfer of CD8(+) cells induces localized hair loss whereas CD4(+)/CD25(-) cells promote systemic alopecia areata and CD4(+)/CD25(+) cells blockade disease onset in the C3H/HeJ mouse model / K. McElwee, P. Freyschmidt-Paul, R. Hoffmann et al. Invest. Dermatol. 2005. Vol. 124. P. 947–957.
348. Treatment of alopecia areata with simvastatin/ezetimibe / C. Lattouf, J.J. Jimenez, A. Tosti et al. J. Am. Acad. Dermatol. 2015. Vol. 72, Iss. 2. P. 359–361.349. Treatment of Alopecia Areata With Tofacitinib / O. Ibrahim, C.B. Bayart, S. Hogan et al. JAMA Dermatol. 2017. Vol. 153, Iss. 6. P. 600–602.
- Trichohyalin is a potential major autoantigen in human alopecia areata / M. Leung, W. Sutton, A. Fenton, D. Tobin. Proteome Res. 2010. Vol. 9. P. 5153–5163.
- Trichoscopy of alopecia areata: An update / A. Waskiel, A. Rakowska, M.Sikora et al. J Dermatol. 2018. 45, Iss. 6. P. 692–700.
- Trüeb R.M., Dias M.F.R.G. Alopecia Areata: a Comprehensive Review of Pathogenesis and Management. Clin. Rev. Allergy Immunol.2018. Vol. 54, No. 1. P. 68–87.
- Tumor necrosis factor-like weak inducer of apoptosis: A novel serum marker in patients with severe alopecia / A.I. Al Taweel, A.M. Hamed, A.M.N. Abdelrahman, M.N.I. Hassan. Int J Trichol. 2019. Vol. 11, Iss. 3. P. 113–117.
- Two cases of alopecia areata treated with ruxolitinib: a discussion of ideal dosing and laboratory monitoring / A. Vandiver, N. Girardi, J. Alhariri, L.A. Garza. Int J Dermatol. 2017. Vol. 56, Iss. 8. P. 833–835.
- Update on the use of ciclosporin in immune-mediated dermatoses / C.E.Griffiths, Katsambas, B.A. Dijkmans et al. Br. J. Dermatol. 2006. Vol. 155, Iss. 2. P. 1–16.
- Ustuner P., Balevi A., Özdemir M. Best dilution of the best corticosteroid for intralesional injection in the treatment of localized alopecia areata in adults. Dermatolog. Treat. 2017. Vol. 28, Iss. 8. P. 753–761.
- Value of transverse section scalp biopsy in alopecia areata – a clinicopathological correlation / K. Jameel, A. Ejaz, M. Sohail, S.B. Rahman. Col. Phys. Surg. Pak. 2008. Vol. 18, Iss. 6. P. 338-341
- Vascular endothelial growth factor aggravates fibrosis and vasculopathy in experimental models of systemic sclerosis / Maurer, A. Distler, Y. Suliman et al. Ann. Rheum. Dis. 2014. Vol. 73, Iss. 10. P. 1880–1887.
- Verros , Rallis E., Crowe M. Letter: Alopecia areata during ustekinumab administration: co-existence or an adverse reaction?. Dermatol. Online J. 2012. Vol. 18, Iss. 7. P. 14.
- Wang E., Lee J., Tang M. Current Treatment Strategies in Pediatric Alopecia Areata. Indian J. Dermatol. 2012. 57, Iss. 6. P. 459–465.
- Wang, McElwee J. Etiopathogenesis of alopecia areata: Why do our patients get it?. Dermatologic Therapy. 2011. Vol. 24. P. 337–347.
- Yang X., Chang Y., Wei W. Endothelial Dysfunction and Inflammation: Immunity in Rheumatoid Arthritis. Mediators of Inflammation. Vol. 2016. Article ID 6813016.
- Yano , Brown F., Detmar M. Control of hair growth and follicle size by VEGF-mediated angiogenesis. J. Clin. Invest. 2001. Vol. 107, Iss. 4. P. 409–417.
- Yao C.A. Serum vitamin D level and disease severity of alopecia areata: A meta-regression analysis. Am. Acad. Dermatol.2018. Vol. 79, Iss. 3. P. e49–e50.
- Yoshimasu T., Furukawa F. Modified immunotherapy for alopecia areata. Autoimmun Rev. Vol. 15, Iss. 7. P. 664–667.
- Zhao Y., Vanhoutte P.M., Leung S. Vascular nitric oxide: Beyond eNOS. Journal of Pharmacological Sciences. 2015. Vol. 129, Iss. 2. P. 83–94.
ДОДАТОК А
АКТИ ВПРОВАДЖЕННЯ
ДОДАТОК Б
СПИСОК ПУБЛІКАЦІЙ ЗА ТЕМОЮ ДИСЕРТАЦІЇ ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ ДИСЕРТАЦІЇ
Список публікацій за темою дисертації:
- Сербина И.М. Использование препаратов метаболического действия в терапии гнездной алопеции. Дерматовенерология. Косметология. Сексопатология. 2010. № 1–4. С. 52–55.
- Сербина И.М. Комплексный подход к диагностике гнездной алопеции. Дерматовенерология. Косметология. Сексопатология. 2011. № 1–4. С. 215–220.
- Сербина И.М. Гнездная алопеция: лечение и перспективы новых исследований. Клінічна імунологія. Алергологія. Інфектологія. 2012. № 1. С. 64–67.
- Сербина И.М. Исследование состояния цитокинов при гнездной алопеции с учетом активности заболевания. Актуальные вопросы дерматологии, венерологии и ВИЧ/СПИД инфекции. Сборник научных трудов. Х. : ХНМУ, 2013. С. 213–217.
- Сербина И.М., Овчаренко Ю.С. Оценка дерматоскопических маркеров при гнездной алопеции. Дерматовенерология. Косметология. Сексопатология. 2013. № 1–4. C. 34–38.
- Renboek phenomenon in an alopecia areata patient with psoriasis / Y. Ovcharenko, I. Serbina, A. Zlotogorski, Y. Ramot. Int. J. Trichology. 2013. Vol. 5, Iss. 4. P. 194–195.
- Сербина И.М.Особенности метаболизма азота оксида при гнездной алопеции. Укр. журн. дерматол., венерол., косметол. № 2. C. 55–59.
- Овчаренко Ю.С., Сербина И.М., Литвиненко Б.В. Трихоскопические дифференциально-диагностические алгоритмы нерубцовых алопеций. Дерматолог. 2014. Т. 5, № 01. С. 38–42.
- Сербина И.М. Цитокинопосредованные механизмы формирования гнездной алопеции. Научные ведомости БелГУ. Серия: Медицина. Фармация. № 24 (195), вып. 28. С. 32–38.
- Сербина И.М. Оценка степени тяжести у больных гнездной алопеции. Дерматологія та венерологія. 2014. № 4. С. 34–37.
- Сербина И.М. Интерлейкин 17 в патогенезе гнездной алопеции. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2014. № 1–2 (32). С. 90–93.
- Сербіна І.М. Імуноморфологічні особливості формування гніздової алопеції. Дерматологія та венерологія. 2016. № 3 (75). С. 52–60.
- Сербина И.М. Иммунопатологические аспекты гнездной алопеции. Дерматолог. 2016. № C. 180–187.
- Сербина И.М. Патогенез гнездной алопеции: иммунные механизмы. Международный медицинский журнал. 2016. Т. 22, № 3. С. 65–71.
- Болотная Л.А., Сербина И.М. Адаптационно-регуляторные механизмы при гнездной алопеции. Georgian medical news. 2017. № 11 (272). С. 75–80.
- Сербина И.М. Изучение сосудистого эндотелиального фактора у больных гнездной алопеции. Лікарська справа. 2017. № 3–4. С. 98–103.
- Сербіна І.М. Патогенетичне обґрунтування диференційованого підходу в терапії гніздової алопеції. Дерматологія та венерологія. 2018. № 3 (81). С. 46–50.
- Сербина И.М. Коморбидность при гнездной алопеции. Дерматологія та венерологія. № 2 (80). С. 67–72.
- Сербина И.М. Современные подходы в терапии гнездной алопеции у детей. Міжнародний медичний журнал. 2018. № 1. С. 68–73.
- Сербіна І.М. Клініко-патогенетичне значення білка теплового шоку при гніздовій алопеції. Дерматологія та венерологія. 2019. № 3 (85). С. 15–18.
- Сербіна І.М. Маркери ангіогенезу у хворих на гніздову алопецію. Міжнародний медичний журнал. 2019. № 3. С. 73–78.
- Пат. на корисну модель 115991 UA, МПК A61B10/00, A61B5/103. Спосіб діагностики тяжкості гніздової алопеції / І.М. Сербіна, Л.А. Болотна; заявник і патентовласник Харківська медична академія післядипломної освіти. № u201608561; заявл. 04.08.16; опубл. 10.05.17, Бюл. № 9.
- Пат. на корисну модель 123446 UA, МПК A61K31/00, A61P17/14. Спосіб диференційованого лікування гніздової алопеції / Л.А. Болотна, І.М. Сербіна; заявник і патентовласник Харківська медична академія післядипломної освіти. № u201709537; заявл. 29.09.17; опубл. 26.02.18, Бюл. № 4.
- Bolotnaya L., Serbina I. Changes in endothelial function in alopecia areata 9th EADV Spring Symposium “A dematological opera” 6-10 June. Verona, Italy – 2012. P. 331.
- Сербина И.М. Активация местных механизмов ангиогенеза при гнездной алопеции. Матеріали регіональної науково-практичної школи «Набуття молодих вчених дерматовенерологів», м. Київ, 15 листопада 2012 р. Київ, 2012. С. 87.
- Serbina I., Ramot Y. Pressure alopecia mimicking alopecia areata: Dermoscopy as a diagnostic aid in avoiding a potential clinical pitfall. 8th World Congress for Hair Research (WCHR 2014), May 14-17 2014, Jeju (Korea). Annals of Dermatology. 2014. Vol. 26, Suppl. 1. P. 28.
- Serbina I. Study of nitrogen oxide and heat shock protein 70 system in patients with alopecia areata. Materials of 8th national scientifically-practical conference with the internatiol participation «Reactive oxygen species, nitric oxide, antioxidants and human health», Smolensk, May 25–29th, 2014. Smolensk, 2014. Р. 181–182.
- Serbina I. Angiogenesis factors in alopecia areata. 9th World Congress for Hair Research, Miami (USA), November 18–21, 2015. Annals of Dermatology. 2015. Vol. 203. P. 32.
- Сербина И.М. Адаптационные гормоны при гнездной алопеции. Матеріали IX Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання наукової і практичної косметології», м. Запоріжжя, 24–25 квітня 2015 р. Запоріжжя, 2015. C. 56.
- Сербина И.М. Опыт использования комбинированной наружной терапии при гнездной алопеции. Матеріали XXXІІІ Всеукраїнської науково-практичної конференції за участю міжнародних спеціалістів «Ліки-Людині», м. Харків, 8 квітня 2016 р. Харків, 2016. С. 177.
- Serbina I.M. Alopecia areata. 17th Meeting of the European Hair Research Society: Abstract book, Tbilisi (Georgia), June 24–26 2016. Tbilisi, 2016. SA-01-6. P. 64.
- Сербина И.М. Коррекция нарушений метаболизма оксида азота при гнездной алопеции. Матеріали І Міжнародної науково-практичної конференції у двох томах «Ліки-людині. Сучасні проблеми фармакотерапії і призначення лікарських засобів», м. Харків, 30–31 березня 2017 р. Харків, 2017. Т. 2. С. 295.
- Serbina I. Disadaptation disorders and quality of life index in alopecia areata. 18th meeting of the EHRS Congress : Abstract book, Bologna (Italy), May 18–20 2018. Bologna, 2018. Р. 63.
- Serbina I. Alopecia areata: focus on comorbidity. 11 World Congress of Hair Research : Abstract book, April 24–27, 2019, Sitges, Barselona (Spain). P. 153–154.
- Сербина И.М. Проблемы коморбидности при гнездной алопеции. Нужно ли менять тактику лечения? 2-й Конгрес Українського товариства дослідження волосся (UHRS): Тезиси доповідей, м. Київ, 9–10 лютого 2019 р. Київ, 2019. С. 27.
Відомості про апробацію результатів дисертації:
- 3-й Международный конгресс ЕААД (Одеса, Україна, 2–3 червня 2013), усна доповідь: Сербіна І.М. «Гніздова алопеція: сучасні питання патогенезу».
- 8th World Congress for Hair Research (WCHR 2014) (Jeju, Korea, May 14–17 2014), постерна доповідь: Serbina I. «Pressure alopecia mimicking alopecia areata: Dermoscopy as a diagnostic aid in avoiding a potential clinical pitfall».
- 9th World Congress for Hair Research (Miami, Florida, USA, 18–21 November 2015), постерна доповідь: Serbina I. «Angiogenesis factors in alopecia areata».
- 17th Meeting of the EHRS (Georgia, June 24–26 2016), усна доповідь: Сербіна І.М. «Гніздова алопеція»
- Науково-практична конференція 11-ті Київські дерматологічні дні (Київ, Україна, 12–14 жовтня 2016), усна доповідь: Сербіна І.М. «Гніздова алопеція: імуноморфологічні особливості»
- XVII Ежегодное заседание союза трихологов (Санкт-Петербург, 22–24 июня 2017), усна доповідь: Сербіна І.М. «Гнездная алопеция: современные стандарты терапии и перспективы новых исследований».
- Науково-практична конференція з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі» (Харків, 10–11 листопада 2017), усна доповідь: Сербіна І.М. «Иммуноморфологические особенности гнездной алопеции».
- International theoretical practical seminar «Patient and Doctor Forum» National alopecia association (Vilnius, Lithuania, Apr 27 2018), усна доповідь: Сербіна І.М. «Гнездная алопеция: вопросы и ответы».
- Науково-практична школа «Питання профілактики, сучасна діагностика та інноваційні методи терапії в дерматовенерології» (Харків, Україна, 15–16 листопада 2018), усна доповідь: Сербіна І.М. «Анализ международных стандартов лечения и перспективы новых исследований при гнездной алопеции».
- 18th meeting of the EHRS Congress (Bologna, Italy, 18–20 May 2018), постерна доповідь: Serbina I. «Disadaptation disorders and quality of life index in alopecia areata».
- The First Congress UHRS (Київ, Україна, 2017), усна доповідь: Сербіна І.М. «Гнездная алопеция: адаптационно-регуляторные механизмы и качество жизни пациентов».
- Науково-практична конференція 15-ті Київські дерматологічні дні (Київ, Україна, 3–4 жовтня 2019), усна доповідь: Сербіна І.М. «Патогенез и терапия гнездной алопеции: что нового?»
- The Second Congress UHRS (Київ, Україна, 9–10 лютого 2019), усна доповідь: Сербина И.М. «Проблемы коморбидности при гнездной алопеции. Нужно ли менять тактику лечения?»
- 11 World Congress of Hair Research (Sitges, Barselona, Apr 24 — 27 2019), усна доповідь: Serbina I. «Alopecia areata: focus on comorbidity».