Національна медична академія післядипломної освіти імені П. Л. Шупика
Міністерство охорони здоров’я України
Державна установа «Інститут дерматології та венерології
Національної академії медичних наук України»
Кваліфікаційна наукова
праця на правах рукопису
Петренко Анастасія Вадимівна
УДК 616.53-002.25-02:575.24/.25:575.191]-036.17-092-085-035
ДИСЕРТАЦІЯ ВИЗНАЧЕННЯ ТАКТИКИ ЛІКУВАННЯ АКНЕ НА ПІДСТАВІ ОЦІНКИ РОЛІ СПАДКОВОСТІ В ТЯЖКОСТІ ПЕРЕБІГУ
14.01.20 – шкірні та венеричні хвороби
Подається на здобуття наукового ступеня кандидата медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
__________________________________________________________________
(підпис, ініціали та прізвище здобувача)
Науковий керівник: Літус Олександр Іванович, доктор медичних наук, доцент
Київ – 2017
АНОТАЦІЯ
Петренко А.В. Визначення тактики лікування акне на підставі оцінки ролі спадковості в тяжкості перебігу. – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби. – Національна медична академія післядипломної освіти імені П.Л. Шупика, Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2017.
Дисертацію присвячено вирішенню важливого науково-практичного завдання – удосконаленню прогнозу та лікування тяжких форм акне.
Комплексним медичним дослідженням встановлено недосконалість системи прогнозу розвитку тяжких форм акне та лікування даного дерматозу, що потребувало наукового обґрунтування та оптимізації. Вивчення патогенетичних складових акне на сьогодні обґрунтовано базується на сімейній схильності до захворювання та на ролі в цьому вродженого імунітету. Propionibacterium acnes активує вроджений імунітет шляхом стимуляції Toll-like receptors (TLRs) и Protease-activated receptors (PARs) на клітинах фолікулів (головним чином кератиноцитах та клітинах Лангерганса), індукує секрецію антимікробних пептидів (AMPs) цими клітинами та себоцитами, призводячи до хронічного запалення фолікулів.
Недостатньо з’ясовано на сьогоднішній день роль спадковості в розвитку акне. Поліетіологічність акне спонукає до пошуку нових ланок патогенезу, розробки нових шляхів лікування та попередження переходу легких форм захворювання у більш тяжкі, що є практично значущим. Це сприятиме більш глибокому розумінню патогенезу акне, впровадженню в практичну роботу патогенетично обґрунтованих методів лікування, попередження ускладнень та покращення якості життя пацієнтів.
Визначено сучасні тенденції захворюваності та поширеності акне серед населення України, вікові особливості перебігу даного дерматозу, проаналізовано сімейні випадки захворюваності. Всього у дослідженні прийняло участь 95 осіб (84 хворих із середньо-тяжким і тяжким акне та 11 батьків пацієнтів). За особливостями клінічної картини всі хворі були поділені на дві групи по 42 людини в кожній. Кожна з груп була розділена на дві підгрупи залежно від статі.
Був проведений ретельний аналіз сімейного анамнезу, клінічних проявів хвороби по групах. Було встановлено, що тривалість захворювання в середньому складала 5,2 років, дебют акне відмічався в середньому у віці 15 років. 75 (92,6 %) пацієнтів відмічали зв’язок між дебютом захворювання та статевим дозріванням. 67 пацієнтів (79,8 %) відмічали, що захворювання у них починалося поступово.
Було проаналізовано наявність супутньої патології у хворих на акне. У 4 пацієнтів (4,8 %) були наявні вузлові утворення щитоподібної залози різного ступеня, проте у всіх хворих патологія була гормонально компенсована. 7 (16,3 %) пацієнток вказали на наявність у них синдрому полікістозних яєчників, 12 хворих (14,3 %) мали в анамнезі хронічний гастрит, що в період проведення даного дослідження перебував у стадії стійкої ремісії. Всі пацієнти проходили загальноклінічні обстеження: загальний аналіз крові з лейкоцитарною формулою, глюкоза крові, біохімічний аналіз крові (аланінамінотрансфераза, аспартатамінотрансфераза, загальний білок, креатинін, сечовина, С-реактивний білок (СРБ), ревматоїдний фактор), аналіз крові на мікрореакцію преципітації для експрес діагностики сифілісу, загальний аналіз сечі. У всіх пацієнтів, за винятком двох хворих на фульмінантне акне, всі загальноклінічні показники знаходились у межах норми. Пацієнти з проявами фульмінантого акне мали зміни в бік підвищення таких показників, як: загальний білок, СРБ. Також у даних хворих був наявний помірний лейкоцитоз (до 12 х 109/л). Усі пацієнти були обстежені на наявність демодекозу, як ускладнення основного захворювання. У 15 (17,9 %) хворих був виявлений Demodex folliculorum у значній кількості. Дана категорія пацієнтів отримала лікування від демодекозу, після чого був проведений контроль виліковності. У пацієнтів із середньо-тяжким акне демодекоз був виявлений у 4 хворих, а серед пацієнтів із тяжким акне – у 11.
Проаналізовано вплив акне на якість життя пацієнтів залежно від статі та тяжкості перебігу дерматозу за допомогою опитувальних листів CADI (Cardiff Acne Disability Index) та DLQI (Dermatology Life Quality Index). Всього за обома шкалами було проанкетовано 78 пацієнтів із середньо-тяжким та тяжким акне. Серед них було 36 жінок (22 – зі середньо-тяжким акне та 14 – із тяжким) та 42 чоловіки (14 – мали середньо-тяжке акне та 28 – тяжке).
За опитувальником CADI у всіх групах опитаних було показано значний вплив захворювання на психоемоційний стан пацієнтів.
Окрім того, згідно з даними проведеного анкетування, жінки із середньо-тяжким акне частіше вказували на високий вплив захворювання на психоемоційний стан порівняно з чоловіками, проте чоловіки з тяжким акне вказували на більш виражений вплив захворювання на їхню психоемоційну сферу, порівняно із жінками з аналогічною формою акне.
За опитувальником DLQI серед жінок із тяжким акне було виявлено дуже сильний вплив на якість життя та психоемоційний стан хворих, серед чоловіків із тяжким ступенем даного дерматозу в середньому був виявлений помірний вплив акне на якість життя, проте у окремих індивідів показники опитувальника сягали 20–22 балів.
Відмічено зв’язок тяжкості перебігу акне з показниками гормонального статусу (рівні сироваткових статевих гормонів). Серед обстежених жінок рівень дигідротестостерону (ДГТ) був значимо вищим у пацієнток із тяжким акне. А у 33 % усіх чоловіків, незалежно від групи, відмічалося підвищення рівня вільного тестостерону – (66,59 ± 7,23) пг/мл, що може вказувати на зв’язок акне з рівнем вільного тестостерону у периферійній крові.
Виявлено асоціацію між варіантами генотипу та комбінованим генотипом за досліджуваними генами та підвищеною схильністю до тяжкого акне. Дані результати дозволили виявити асоціацію між наявним у пацієнтів генотипом 388СТ за геном TLR-4 та підвищеною схильністю до тяжкого акне. Також було встановлено, що частота гетерозиготного варіанту за геном IL-1β (3953СT) була значуще збільшеною серед пацієнтів із середньо-тяжким акне. Було показано, що ризик розвитку тяжких форм акне значуще зростав при наявності у пацієнтів генотипу 781ТТ за геном IL-8. Було відмічено, що комбіновані генотипи 399СС+3953СС+781СС, 399СС+3953СС+781СТ за генами TLR-4, IL-1β, IL-8 та 3953CC+781CT за генами IL-1β, IL-8 виявляли частіше у пацієнтів із середньо-тяжким акне порівняно з тяжким акне.
Також відмічено асоціацію комбінованих генотипів зі зростанням рівня певних гормональних показників. Для аналізу було обрано варіанти генотипів генів IL-1β (C3953T) та IL-8 (С781Т) та рівні статевих гормонів, що показали найбільші відхилення від нормальних показників, а саме – вільний тестостерон у чоловіків та ДГТ і пролактин у жінок. Пацієнти були поділені на дві групи залежно від наявності або відсутності підвищення досліджуваного гормону (за нормальні бралися показники здорових осіб).
Для дослідження було взято 9 варіантів комбінованих генотипів за генами IL-1β (C3953T) та IL-8 (С781Т), з них лише за комбінацією 3953CT+781CT було виявлено статистично значиму різницю, що вказує на зв’язок даного комбінованого генотипу із підвищеним рівнем вільного тестостерону у хворих на акне.
Серед обстежених жінок показники ДГТ розподілилися між 6 варіантами комбінованих генотипів, з яких 2 показали значиму різницю (3953CC+781CT та 3953CT+781CT), що вказує на зв’язок даного комбінованого генотипу із підвищеним рівнем ДГТ у жінок, що хворіють на акне.
Обґрунтовано та розроблено оптимізований підхід до лікування акне з урахуванням показників молекулярно-генетичного обстеження, оцінено його прогностичну ефективність.
Ключові слова: акне, тяжкі форми акне, чинники ризику, молекулярно-генетичне обстеження, гормональний статус, якість життя пацієнтів, оптимізація лікування.
SUMMARY
Petrenko A.V. Determination of acne treatment tactics based on the assessment of the role of heredity in the severity of the course. – Qualifying scientific work on the rights of manuscripts.
Dissertation for the degree of a candidate of medical sciences in specialty 14.01.20 – Skin and Venereal Diseases. National Medical Academy of Postgraduate Education named after P.L. Shupyk, State Establishment “Institute of Dermatology and Venereology of National Academy of Medical Sciences of Ukraine”, Kharkiv, 2017.
The dissertation is devoted to the decision of an important scientific and practical task – to improve the prognosis and treatment of severe forms of acne.
Complex medical research has established the imperfection of the system for forecasting the development of severe forms of acne and the treatment of this dermatosis, which required scientific substantiation and optimization. The study of pathogenetic constituents of acne is based on the family propensity to disease and on the role of this innate immunity today. Propionibacterium acnes activates congenital immunity by stimulating Toll-like receptors (TLRs) and Protease-activated receptors (PARs) on follicle cells (mainly keratinocytes and Langerhans cells), induces the secretion of antimicrobial peptides (AMPs) with these cells and sebacites, resulting in chronic inflammation of the follicles.
The role of heredity in the development of acne has not been yet clarified. Poly etiology of acne stimulates to find new pathogenetic pathways, to develop new ways to treat and prevent the transition of mild forms of the disease to a more severe one, which is practically significant. This will contribute to a better understanding of the pathogenesis of acne, the introduction of pathogenetically validated treatments, the prevention of complications and the improvement of patient quality of life in the practical work.
The current trends in the incidence and prevalence of acne among the Ukrainian population, age characteristics of the course of this dermatosis are determined, and family cases of morbidity are analyzed. 95 persons (84 patients with moderate to severe acne and 11 parents of patients) took part in the study. According to the features of the clinical picture, all patients were divided into two groups of 42 persons in each. Each group was divided into two subgroups, depending on sex.
A thorough analysis of the family history, clinical manifestations of the disease by groups was conducted. It was found that the duration of the disease on average was 5.2 years, the debut of acne was noted on average at the age of 15 years. 75 (92.6%) of patients reported a connection between the debut of the disease and puberty. 67 patients (79.8%) noted that the disease began gradually.
The presence of other pathology in patients with acne was analyzed. In 4 patients (4.8%) there were thyroid nodules of different degrees, but in all patients the pathology was hormonally compensated. 7 (16.3%) women indicated that they had polycystic ovary syndrome, 12 patients (14.3%) had a history of chronic gastritis, which during the period of this study was in a stage of stable remission. All patients underwent general-clinical examinations: blood test with leukocyte formula, blood glucose, biochemical blood test (alanine aminotransferase, aspartate aminotransferase, total protein, creatinine, urea, C-reactive protein (CRP), rheumatoid factor), blood test for microreaction of fasting diagnosis of syphilis, urine analysis. In all patients, with the exception of two patients with fulminant acne, all general clinical parameters were within normal limits. Patients with manifestations of fulminant acne had a change in the direction of elevation of such indicators as: total protein, CRP. Also, these patients had moderate leukocytosis (up to 12 x 109 / l). All patients were screened for demodicosis as a complication of the underlying disease. In 15 (17.9%) patients, Demodex folliculorum was detected in a significant number. This category of patients received treatment for demodicosis, followed by control of cure. In patients with an average course of acne demodicosis was found in 4 patients, and among patients with severe course – in 11.
The effect of acne on the quality of life of patients depending on the sex and severity of the dermatosis through the Cardiff Acne Disability Index and DLQI (Dermatology Life Quality Index) have been analyzed. In total, 78 patients with moderate to severe acne were checked for both scales. Among them, 36 women (22 with acne of moderate severity and 14 with severe course) and 42 men (14 had acne with moderate severity and 28 with severe course).
According to the CADI questionnaire, all groups of respondents showed a significant effect of the disease on the psycho-emotional state of patients.
In addition, according to the survey data, women with moderate acne tended to indicate a high psycho-emotional impact of the disease compared to men, but men with severe acne pointed to a more pronounced impact of the disease on their psycho-emotional sphere, compared with women from a similar form of acne.
According to the DLQI questionnaire, among women with severe acne, a very strong influence on the quality of life and psycho-emotional state of patients was found, among men with a severe course of this dermatosis the moderate influence of acne on the quality of life was found on average; however, in some individuals, the questionnaire metrics ranged from 20-22 scores.
The connection between the severity of acne and the parameters of hormonal status (serum sex hormones) was noted. Among the examined women, the level of dihydrotestosterone (DHT) was significantly higher in patients with severe acne. In 33% of all men, regardless of the group, there was an increase in free testosterone levels (66.59 ± 7.23) pg / ml, which may indicate a relationship between acne and free testosterone levels in the peripheral blood.
The association between variants of genotype and combinations of genotype on the investigated genes and an increased susceptibility to severe acne is revealed. These results allowed to reveal an association between the 388ST genotype existing in the patients for the TLR-4 genome and the increased susceptibility to severe acne. It was also found that the frequency of the heterozygote variant for the IL-1β gene (3953 CT) was significantly increased among patients with moderate acne severity. It was also shown that the risk of developing acute forms of acne significantly increased with the presence of 781TT genotype for the IL-8 gene. It was noted that combinations of 399SC + 3953CS + 781CS, 399CS + 3953CS + 781TT genotypes with TLR-4, IL-1β, IL-8 and 3953CC + 781CT genes in IL-1β, IL-8 genes were more common in patients with acne in the middle severity compared to severe forms of acne.
Also, the combination of genotype with a rise in the level of certain hormonal indicators is noted. For analysis, variants of genotypes of IL-1β (C3953T) and IL-8 (C781T) genes and the levels of sex hormones that showed the greatest deviations from normal parameters, namely, free testosterone in men and DHT and prolactin in women were selected. Patients were divided into two groups, depending on the presence or absence of an increase in the test hormone (the normal values of healthy subjects were taken).
For the study, 9 combinations of genotypes based on the IL-1β (C3953T) and IL-8 (C781T) genes were taken, of which only a statistically significant difference was found with a combination of 3953CT + 781CT indicating the association of this combination of genotypes with elevated levels of free Testosterone in patients with acne.
Among the examined women, DHT indices were distributed among 6 combinations of genotypes, of which 2 showed a significant difference (3953CC + 781CT and 3953CT + 781CT), indicating the association of this combination of genotypes with elevated DHT in women with acne.
The optimized approach to the treatment of acne based on the parameters of the molecular genetic survey was substantiated and developed, and its predictive efficiency was estimated.
Key words: acne, acute forms of acne, risk factors, molecular genetic examination, hormonal status, quality of life of patients, optimization of treatment.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Петренко А.В. Вивчення деяких генних порушень у хворих на акне. Збірник наукових праць співробітників НМАПО імені П.Л. Шупика. 2016. Вип. 25. С. 132–136.
- Калюжна Л.Д., Гречанська Л.В., Петренко А.В. Клінічна ефективність ретиноїдів нового покоління в лікуванні акне. Дерматовенерологія. Косметологія. Сексопатологія. 2015. № 3–4. С. 16–21. (Дисертантом здійснено ведення медичної документації та спостереження за перебігом лікування хворих на акне).
- Літус О.І., Петренко А.В. Психоемоційний стан хворих на акне із урахуванням тяжкості перебігу та спадкової схильності. Дерматовенерологія. Косметологія. Сексопатологія. 2016. № 3–4. С. 10–12.
- Литус А.И., Петренко А.В. Особенности патогенетической характеристики акне с учетом функционального состояния кожи и наследственной склонности. Международный научно-практический журнал Дерматовенерология. Косметология. 2016. Т. 2, № 2. С. 208–212.
- Петренко А.В. Патогенетичні аспекти акне від вивчення стану шкіри до визначення деяких генетичних факторів. Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я: зб. наук. праць. 2016. Вип. 13. С. 219-224.
- Петренко А.В. Співставлення генетичної складової в родинах хворих на акне. Дерматологія та венерологія. 2017. № 1 (75). С. 20–23.
- Петренко А.В., Россоха З.І. Тяжкість перебігу акне в залежності від варіантів генних поліморфізмів. Дерматологія та венерологія. 2017. № 2 (76). С. 33–36. (Дисертантом проаналізовано вплив генних порушень на розвиток акне).
- Петренко А.В. Алгоритм лікування акне з урахуванням патогенетичних складових. Український журнал дерматології, венерології, косметології. 2017. № 2 (65). С. 44–48.
- Petrenko A.V., Litus O.I. Study of psycho-emotional state of patients with acne depending on the severity and hereditary factors. Galician medical journal. 2017. № 2 (27). URL: http://ojs.ifnmu.edu.ua/index.php/gmj/article/view/790.
- Петренко А.В., Приходько І.В. Аналіз патогенетичних складових у випадку фульмінантного акне. Дерматовенерологія. Косметологія. Сексопатологія. 2017. № 1–2 (5). С. 97–100. (Здобувачем здійснено аналіз ефективності лікування фульмінантного акне).
- Горовенко Н.Г., Петренко А.В., Россоха З.І. Аналіз рівня статевих гормонів у хворих на акне різного ступеню тяжкості з урахуванням впливу генетичних факторів. Дерматологія та венерологія. 2017. № 3 (77). C. 46–52. (Дисертантом проведено збір та аналіз даних гормональних та генетичних чинників у пацієнтів на акне).
- Калюжная Л.Д., Гречанская Л.В., Петренко А.В. Акне: современный взгляд на диагностику и лечение. Здоров’я України. 2017. № 4 (401). С. 46–47. (Дисертантом проведено аналіз сучасних літературних джерел).
- Пат. на корисну модель 121339 UA, МПК C12N15/00, A01H1/00, A01H1/08. Спосіб прогнозування розвитку тяжких форм акне за допомогою молекулярно-генетичних методів / А.В. Петренко; заявник і патентовласник Національна медична академія післядипломної освіти ім. П.Л. Шупика. № u201708769; заявл. 31.08.2017; опубл. 27.11.2017, Бюл. № 22.
- Гречанська Л.В., Петренко А.В. Від європейських до українських протоколів по лікуванню акне з позиції спадкових факторів. Тези доповідей Всеукраїнської науково-практичної конференції Української асоціації лікарів-дерматовенерологів і косметологів «Сучасні підходи до формування клінічних настанов з діагностики і лікування шкірних захворювань та інфекцій, що передаються статевим шляхом: європейський досвід і українські реалії», м. Тернопіль, 19-20 жовтня 2016 р. Український журнал дерматології, венерології, косметології. 2016. № 4 (63). С. 100–101. (Дисертантом зроблено аналіз впливу спадкових факторів на розвиток тяжких форм акне).
- Петренко А.В. Спадкові фактори та тяжкість перебігу акне. Матеріали всеукраїнської науково-практичної конференції молодих вчених НМАПО імені П.Л. Шупика, присвяченої Дню науки, м. Київ, 20 травня 2016 р. – К., 2016. – С. 102–104.
- Петренко А.В. Аналіз сімейної схильності при акне. Матеріали Регіональної науково-практичної конференції «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом», м. Святогірськ, 12-13 травня 2016 р. Святогірськ, 2016. С. 27.
- Петренко А.В. Деякі генні порушення у хворих на акне. Матеріали науково-практичної конференції «Спадкові та екологічні чинники в дерматовенерології», м. Київ, 29-30 березня 2016 р. Дерматовенерологія. Косметологія. Сексопатологія. 2016. № 1–2 (3). С. 79.
- Петренко А.В. Аналіз генетичного та гормонального статусу у пацієнтів з акне. Матеріали науково-практичної конференції з міжнародною участю «Новітні технології діагностичних, лікувальних та профілактичних заходів в дерматовенерології та методи і стан їхнього впровадження», м. Харків, 11–12 листопада 2016 р. Дерматологія та венерологія. 2016. № 3 (73). С. 83–84.
- Петренко А.В. Генні порушення, як безумовний фактор спадковості у хворих на акне. Матеріали 40-вої ювілейної науково-практичної конференції молодих вчених НМАПО імені П.Л. Шупика з міжнародною участю, присвяченої Дню науки: «Інновації в медицині: досягнення молодих вчених», м. Київ, 18 травня 2017 р. Київ, 2017. С. 48-50.
- Petrenko A.V. A case of acne fulminans. Abstracts of the 26th EADV Conference, Geneva, 13-17 September 2017. Geneva, Switzerland, 2017. Abstract ID 3214.
ЗМІСТ
| Перелік умовних скорочень | 12 |
| Вступ | 13 |
| Розділ 1 Матеріали і методи дослідження | 22 |
| Розділ 2 Загальноклінічна характеристика хворих на акне | 29 |
| 2.1 Сучасні класифікації акне | 29 |
| 2.2 Принципи і алгоритм розподілу пацієнтів у досліджуваних групах |
30 |
| 2.3 Результати клінічного обстеження хворих на акне | 31 |
| 2.3.1 Критерії включення і виключення пацієнтів з дослідження | 31 |
| 2.3.2 Принципи і алгоритм розподілу пацієнтів у досліджуваних групах | 32 |
| 2.4 Сучасні критерії оцінки якості життя у хворих на акне | 48 |
| 2.5 Аналіз якості життя у обстежуваних хворих на акне | 50 |
| 2.5.1 Оцінювання за шкалою CADI | 50 |
| 2.5.2 Оцінювання за шкалою DLQI | 52 |
| Розділ 3 Особливості клінічних проявів та обтяженість сімейного анамнезу у хворих на акне | 58 |
| 3.1 Сучасний погляд на роль спадковості у хворих на акне | 58 |
| 3.2 Особливості клінічних проявів та обтяженість сімейного анамнезу у хворих на акне | 59 |
| 3.3 Характеристика хворих на акне з урахуванням обтяженості сімейного анамнезу | 62 |
| Розділ 4 Особливості фенотипічних проявів акне залежно від варіантів генотипів | 69 |
| 4.1 Сучасні дослідження молекулярно-генетичних особливостей у патогенезі акне | 69 |
| 4.2 Молекулярно-генетичні аспекти у хворих на акне | 74 |
| Розділ 5 Характеристика рівня статевих гормонів у хворих на акне | 82 |
| 5.1 Роль статевих гормонів у розвитку та клінічному перебігу акне | 82 |
| 5.2 Визначення рівня статевих гормонів у хворих на акне | 85 |
| 5.3 Аналіз рівня статевих гормонів у хворих на акне залежно від тяжкості перебігу захворювання та спадкових факторів | 90 |
| 5.4 Корелятивні зв’язки гормонального статусу з поліморфізмом генів TLR-4, IL-1β та IL-8 у хворих на акне | 93 |
| Розділ 6 Обґрунтування алгоритму лікування хворих на акне | 97 |
| 6.1 Сучасні підходи до лікування акне | 97 |
| 6.2 Визначення алгоритму лікування хворих на акне залежно від тяжкості клінічного перебігу | 99 |
| 6.3 Оцінка рівня жирності шкіри у пацієнтів з акне залежно від терапії | 103 |
| Розділ 7 Аналіз та узагальнення результатів дослідження | 108 |
| Висновки | 122 |
| Рекомендації | |
| Список використаних джерел | 125 |
| Додаток А Акти впровадження | 149 |
| Додаток Б Список публікацій здобувача за темою дисертації та відомості про апробацію результатів дисертації | 151 |
| Додаток В | |
ПЕРЕЛІК УМОВНИХ СКОРОЧЕНЬ
АлАТ – аланінамінотрансфераза
АсАТ – аспартатамінотрансфераза
ДГТ – дигідротестостерон
ДНК – дезоксирибонуклеїнова кислота
ПЛР – полімеразна ланцюгова реакція
ПРЛ – пролактин
РНК – рибонуклеїнова кислота
СПКЯ – синдром полікістозних яєчників
УЗД – ультразвукове дослідження
ФСГ – фолікулостимулюючий гормон
ШОЕ – швидкість осідання еритроцитів
СРБ – С-реактивний білок
CADI – Cardiff Acne Disability Index (Кардифський індекс недієздатності пацієнтів з акне)
CI – confidence interval (довірчий інтервал)
DLQI – Dermatology Quality of Life Index (Дерматологічний індекс якості життя)
IL – інтерлейкін
OR – odds ratio (відношення шансів)
TLR – Toll-like receptor (Толл-подібний рецептор)
TNF-a – фактор некрозу пухлини – альфа
TGF-β – трансформуючий фактор росту – бета
ВСТУП
Актуальність теми. Акне – це хронічне мультифакторне захворювання апарату сальних залоз, що маніфестує переважно в пубертатному віці і характеризується гіперпродукцією шкірного сала, порушенням процесів фолікулярної кератинізації, колонізацією Propionibacterium acnes та запаленням, і є одним з найбільш розповсюджених захворювань людства [91, 176].
У 2013 р. зареєстровано 660 млн. хворих на акне на земній кулі, що становить 9,4 % популяції. Встановлено, що акне посідає восьме місце серед усіх хвороб у світі. На акне хворіють 80–90 % підлітків: 95–100 % хлопців-підлітків та 83–85 % – дівчат-підлітків у віці 16-17 років, а у 4 % захворювання продовжується і після 40 років (у 1 % чоловіків та 5 % жінок) [88, 92, 104, 189, 201].
Передумовою для виникнення акне є надлишкова продукція шкірного сала [98]. Незважаючи на майже універсальне уявлення про акне в молодих людей, все ж відносно замало відомостей щодо епідемічної ситуації [18, 70].
Екологічні чинники можуть впливати на поширеність акне; населення що веде здоровий стиль життя, не має схильності до прояву акне. Зокрема, останнім часом багато уваги приділяється дієті: епідеміологічні та наукові дослідження свідчать, що спосіб харчування мешканців західного регіону впливає на прояви акне [180]. Основними чинниками ризику розвитку пізніх акне у жінок вважають як гіперандрогенію, так і захворювання щитоподібної залози і органів малого тазу [13].
Патогенез захворювання комплексний, з ураженням сальних залоз, фолікулярною гіперкератинізацією, бактеріальною колонізацією [67, 69, 101]. Патофізіологія акне складається з комплексного впливу багатьох факторів, як внутрішніх так і зовнішніх, на пілосебаційний апарат [20, 33].
Акне – це андрогензалежні розлади волосяних фолікулів (або сально-волосяних елементів). Існують чотири основні патогенетичні фактори, взаємодія яких сприяє розвитку акне: 1) надмірне вироблення шкірного сала сальною залозою, 2) зміни в процесі кератинізації, 3) колонізація фолікулів Propionibacterium acnes, та 4) вивільнення медіаторів запалення.
Одним з перших кроків в утворенні акне є формування мікрокомедонів. Це розпочинається з кератинізації верхньої частини фолікула – вивідного отвору. Формування комедону проявляє себе на тому етапі, коли корнеоцити, які в нормі відторгаються у вивідну протоку та виділяються крізь фолікулярний отвір, злипаються. Ультраструктурними компонентами, що відповідні за злипання, є кератиносоми (ламелярні гранули), мембрани клітинної стінки, епідермальні ліпіди та міжклітинна цементуюча субстанція. У підлеглому фолікулярному епітелії гранули кератогіаліну збільшуються в розмірі та кількості, однак ламелярні гранули та тонофіламенти зменшуються. Комедон збільшується, а себацейна частка залози піддається регресу. У зв’язку з надзвичайно вузьким виходом на поверхню шкіри складаються умови для утворення пакету з кератиноцитів та шкірного сала. Також були повідомлення про відносний дефіцит лінолевої кислоти. Ранні неспецифічні запальні реакції менш характерні для рубцювання, ніж повільна специфічна запальна реакція. Саме вроджена імунна система шкіри взаємодіє із P. acnes та бере участь в індукції запалення [147].
Регуляція сальних ліпідів відбувається за участю рецепторів, що активовані проліфераторами пероксисом, які діють спільно з ретиноєвими Х-рецепторами, контролюючи зростання та диференціювання епідермісу, а також обмін ліпідів. Білки, що зв’язують стеролрегулюючі елементи, є ланкою у зростанні рівня ліпідів шкірного сала, що індукується інсуліноподібним фактором росту-1. Рецептори субстанції Р, нейропептиди, гормон, що стимулює α-меланоцити, інсуліноподібний фактор росту (IGF)-IR та кортикотропін-рилізінг-гормон (CRH)-R1, а окрім них – екзопептидази, такі як дипептидилпептидаза ІV та амінопептидаза N, також беруть участь у регуляції активності себоцитів. Сальні залози також можуть реагувати на зміни андрогенів та інших гормонів як ендокринний орган. При акне продукуються хемотактильні фактори, стимулюється синтез фактора некрозу пухлин і інтерлейкіну (IL) -1β. Індукція цитокіну за участю P. аcnes відбувається після активації Толл-подібного рецептора (TLR) 2, що опосередкована ядерним фактором-кВ (NF-kB) та фактором транскрипції активатора білка 1. Активація активатора білка 1 індукує гени матриксних металопротеїназ, секрет яких погіршує та змінює структуру шкіри [124, 189].
Сало людини, виходячи з сальної залози, складається зі сквалену, холестеролу, ефірів холестеролу, ефірів воску, триглицеридів. На сьогодні показано, що сальні залози та шкірне сало відіграють значну роль у вродженому імунному захисті. Останні роботи довели, що вільні жирні кислоти шкірного сала людини бактерицидні проти грам-позитивних організмів, маючи можливість збільшувати експресію β-дефензину – антимікробного пептиду. Додаткові антимікробні пептиди, включаючи каталіцидин, псоріазин, β-дефензин-1, β-дефензин-2, експресуються всередині сальних залоз. Функціонально пептиди каталіцидину мають пряму антимікробну активність проти P. acnes, також ініціюють продукцію прозапальних цитокінів в організмі хазяїна. Показано, що сальні залози регулюються андрогенами та ретиноїдами. Рецептори меланокортинів, що активують проліферацію пероксисом, кортикотропін-вивільняючий гормон та рецептори фактора росту, також відіграють велику роль. На продукцію сала можуть впливати нейроендокринні механізми, а на розвиток сальної залози цей вплив здійснюють рецептори фактора росту фібробластів [176].
Шкірне сало відіграє ключову роль в ініціації акне. Окислені ліпіди шкірного сала спричиняють проліферацію кератиноцитів та запальну відповідь цитокинів. У 18 хворих досліджували рівень екскреції шкірного сала, ступінь окислення сала та концентрації сквалену і проводили порівняння зі здоровими. Пероксидація ліпідів та процент окислення сквалену були значно вищими, ніж у здорових. Концентрація прозапального цитокіну IL-1α в роговому шарі була набагато вищою до лікування [73, 155].
Харчування може впливати на розвиток себореї та акне. Деякі ліпідні медіатори, які можуть впливати на диференціацію себоцитів та ліпогенез, активують пероксисом-проліфератор-активуючі рецептори (peroxisome proliferator-activated receptor – PPAR). Суттєвим є те, що продукти проліферації прозапальних цитокинів також здатні індукувати PPAR активацію та продукцію прозапальних цитокинів. Індукція запального сигнала пілосебацейному фолікулу є значущою складовою в розвитку акне. Інтерлейкін IL-1α значно представлений в комедонах і це індукує гіперпроліферацію шляхом посилення експресії гіперпроліферативних маркерів кератину (K6 та K16) та порушує диференціацію кератиноцитів вивідного протоку, що веде до збільшеної експресії філагрину, а далі до гіперкератинізації в протоці [59, 131, 214].
Зв’язок роботи з науковими програмами, планами, темами. Робота виконана на кафедрі дерматовенерології Національної медичної академії післядипломної освіти імені П. Л. Шупика у відповідності з напрямком науково-дослідних робіт за темою: «Обґрунтування терапевтичних підходів при хронічних дерматозах та ІПСШ з урахуванням їх патогенетичних особливостей» (№ держреєстрації 0108U009971, термін виконання 2014-2019 рр.). Дисертантом особисто вивчено особливості клініки, діагностики акне залежно від тяжкості перебігу та спадкової схильності, виконано аналіз молекулярно-генетичних, гормональних складових патогенезу акне, проведена диференційована терапія.
Мета та задачі дослідження. Мета – дослідити генетичні та андрогенасоційовані особливості тяжких та середніх форм акне та впровадити диференційований підхід в алгоритмі лікування.
Досягнення поставленої мети передбачало виконання таких задач:
- Визначити особливості клінічного перебігу тяжких форм акне в порівнянні із середньо-тяжкими формами.
- Оцінити показники якості життя у хворих на різні форми акне.
- Проаналізувати рівні статевих гормонів у хворих на різні форми акне.
- Провести порівняння поліморфних варіантів генів TLR-2 (G753A), TLR-4 (C399T), IL-1β (C3953T), IL-8 (С781Т) у хворих на тяжкі та середньо-тяжкі форми акне.
- Провести кореляційний аналіз впливу поліморфних варіантів генів TLR-2 (G753A), TLR-4 (C399T), IL-1β (C3953T), IL-8 (С781Т) та гормональних показників на перебіг акне.
- Запропонувати диференційований підхід у лікуванні акне на підставі оцінки генетичної схильності до даного дерматозу.
Об’єкт дослідження: тяжкі форми акне.
Предмет дослідження: патогенетичні механізми реалізації спадкової схильності при тяжких формах акне.
Методи дослідження: клінічні (для постановки діагнозу, визначення тяжкості перебігу акне); анкетування за шкалами CADI та DLQI з оцінкою якості життя; інструментальний (для виявлення супутньої патології); імуноферментні (для визначення рівнів сироваткових статевих гормонів); молекулярно-генетичний (визначення поліморфних варіантів генів TLR-2 (G753A), TLR-4 (C399T), IL-1β (C3953T), IL-8 (С781Т)); статистичні методи (для підтвердження вірогідності результатів).
Наукова новизна отриманих результатів. Вперше у хворих на середньо-тяжкі та тяжкі форми акне проведено характеристику поліморфних варіантів генів TLR-2 (G753A), TLR-4 (C399T), IL-1β (C3953T), IL-8 (С781Т) у взаємозв’язку з функціональним станом ендокринної системи (сироваткові рівні статевих гормонів), аналіз ролі порушень їх взаємовідносин у механізмах розвитку клінічних ознак захворювання.
Вперше виділено генотипи G753A гена TLR-2, C399T гена TLR-4, C3953T гена IL-1β, С781Т гена IL-8 за різних варіантів клінічного перебігу акне.
Вперше виконано прогнозування ймовірності розвитку та визначення характеру клінічного перебігу акне завдяки проведенню молекулярної діагностики з визначенням генотипів генів TLR-2, TLR-4, IL-1β, IL-8 на ранніх стадіях.
Доповнено наукові відомості про особливості клінічних проявів, перебігу та механізмів розвитку акне у хворих з наявним чи відсутнім сімейним анамнезом.
Розширено наукові дані щодо фенотипічних особливостей у пацієнтів з акне залежно від характерного варіанту генотипу та комбінації генотипів досліджуваних генів.
Науково обґрунтовано впровадження окремих схем комплексної терапії хворих на акне із застосуванням індивідуального підходу на підставі результатів молекулярної діагностики, що сприяло підвищенню ефективності лікування даного дерматозу.
Практичне значення одержаних результатів. Підходи, що були розроблені щодо впровадження обґрунтованої індивідуальної терапії пацієнтів на підставі дослідження корелятивних взаємозв’язків між варіантом генотипу, рівнем сироваткових статевих гормонів та особливостями клінічного перебігу акне, дозволяють підвищити ефективність лікувальних заходів. Основні положення дисертації впроваджено в практичну роботу Київської міської клінічної шкірно-венерологічної лікарні, поліклінічну роботу Національної дитячої спеціалізованої лікарні «ОХМАТДИТ» МОЗ України, дерматовенерологічного відділення Державної наукової установи «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами, Державної установи «Інститут дерматології та венерології НАМН України».
Особистий внесок здобувача. Дисертантом самостійно проаналізовано за темою дисертаційної роботи наукову літературу, проведено патентно-інформаційний пошук, визначено мету та задачі дослідження. Здобувачем проведено клінічне обстеження хворих, молекулярно-генетичне та гормональне дослідження, проаналізовано та статистично оброблено отримані результати за допомогою програм SPSS Statistics 17.0, Microsoft Excel 2013 та OR-calculator. Самостійно написані всі розділи дисертації, спільно з науковим керівником сформульовано висновки і рекомендації.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Конфлікту інтересів немає.
Апробація результатів дисертації. Матеріали дисертаційних досліджень доповідались та обговорювались на: всеукраїнських та міжнародних науково-практичних медичних конференціях, з’їздах, форумах: «Спадкові та екологічні чинники в дерматовенерології» (м. Київ, 29-30 листопада 2016 р.); «Новітні тенденції лікування та профілактики дерматовенерологічних проблем в рамках доказової медицини» в рамках ХІІ Львівського Медичного Форуму (м. Львів, 15 квітня 2016р.); «Впровадження сучасних досягнень медичної науки у практику охорони здоров’я України» в рамках V ювілейного Міжнародного медичного конгресу (м. Київ, 19-21 квітня 2016 р.); «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом» (м. Святогірськ, 12-13 травня 2016 р.); науково-практичній конференції, присвяченій 50-й річниці створення шкірно-венерологічного диспансеру № 1 Дніпровського району м. Києва (м. Київ, 16 вересня 2016 р.); «Інновації в медицині: досягнення молодих вчених» (м. Київ, 18 травня 2017р.); 26-му Конгресі Європейської академії дерматовенерології (Женева, Швейцарія, 2017).
Публікації. За матеріалами дисертації опубліковано 20 друкованих праць, у тому числі статей – 12, з них у спеціалізованих наукових виданнях, рекомендованих ДАК України – 5 (у моноавторстві – 3), у журналах, що входять до міжнародних наукометричних баз Index Copernicus, Google Scholar, РІНЦ, – 4, у закордонному виданні – 1, у збірниках наукових праць – 4, патент на корисну модель – 1, тез – 7, у тому числі закордонних – 1.
Структура та обсяг дисертації. Дисертація викладена українською мовою, загальним обсягом 143 сторінки машинописного тексту. Дисертація складається зі вступу, п’яти розділів власних досліджень, аналізу та узагальнення результатів, висновків, списку використаних джерел та трьох додатків. Бібліографія містить 214 джерел, із яких 57 робіт – кирилицею і 157 – латиницею. Містить 23 таблиці, 8 рисунків.
РОЗДІЛ 1
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
Для досягнення мети та реалізації задач дисертаційної роботи було застосовано методи клінічної, інструментальної та лабораторної діагностики, а також сучасні методи статистичної обробки даних.
1.1 Гормональне дослідження
Гормональне дослідження проводилося шляхом забору венозної крові у вакуумні пробірки з активатором згортання та гелем. Дослідження проводилися на імуноаналізаторі-фотометрі електрохемілюмінесцентному Elecsys 2010 фірми “Roche Diagnostics GmbH”. Дослідження відбувалось шляхом вимірювання кількості фотонів електрохемілюмінесцентного випромінювання та визначення вмісту речовин за атестованими методиками при проведенні імунологічних аналізів у клінічних та діагностичних лабораторіях. Діапазон вимірювання кількості фотонів перебував у межах від 120 до 5000000 [97, 157].
1.2 Молекулярно-генетичне дослідження
Забір периферійної крові проводився у вакуумні пробірки з калієвою сіллю етилендіамінтетраоцтової кислоти в якості антикоагулянту. Геномна ДНК для молекулярно-генетичного дослідження виділялася з периферійної крові за допомогою комерційної тест-системи “ДНК-сорб-В”. До цільної крові додавали лізуючий розчин та сорбент на силікагелі. Після лізису відмивалися зразки розчинами для відмивання № 1 та № 2, відповідно до інструкції. Для елюції ДНК з сорбенту додавали ТЕ-буфер. Отриманий супернатант, що містив очищену ДНК, використовували для проведення полімеразної ланцюгової реакції (ПЛР).
Для визначення поліморфних варіантів генів IL-1β (C3953T) (rs1143634) [74], IL-8 (C781T) (rs2227306) [132], TLR-2 (753 G/A) (rs 5743708), TLR-4 (399 C/T) (rs 4986791) [96] використовувалися модифіковані протоколи з олігонуклеотидними праймерами із застосуванням методу ПЛР та наступним аналізом поліморфізму довжини рестрикційних фрагментів. Досліджувані ділянки генів ампліфікувалися за допомогою специфічних праймерів («Metabion», Німеччина), наведених у табл. 1.1.
Таблиця 1.1 – Олігонуклеотидні праймери
| Ген (поліморфізм) |
Послідовність праймерів (5׳ – 3׳) | Розмір ампліфікованої ділянки ДНК |
| IL-1β
(C3953T) |
F-GTTGTCATCAGACTTTGACC
R-TTCAGTTCATATGGACCAGA |
249 п.н. |
| IL-8
(C781T) |
F-CTCTAACTCTTTATATAGGAATT
R-GATTGATTTTATCAACAGGCA |
203 п.н. |
| TLR-2
(753 G/A) |
CATTCCCCAGCGCTTCTGCAAGCTCC
GGAACCTAGGACTTTATCGCAGCTC |
129 п.н. |
| TLR-4
(399 C/T) |
GGTTGCTGTTCTCAAAGTGATTTTGGGAGAA
ACC TGA AGA CTG GAG AGT GAG TTA AAT GCT |
406 п.н. |
Специфічні фрагменти генів IL-1β (C3953T), IL-8 (C781T), TLR-2 (753 G/A), TLR-4 (399 C/T) ампліфікувалися із застосуванням комерційного набору Master MixPCR (фірми «NEOGEN», Україна).
Пробірки з готовою ампліфікаційною сумішшю ставилися в ампліфікатор «FlexCycler BU» («Analytic Jena», Німеччина) для забезпечення відповідного температурного режиму ПЛР. Продукти ампліфікації фрагментів ДНК (амплікони) генів IL-1β (C3953T), IL-8 (C781T), TLR-2 (753 G/A), TLR-4 (399 C/T) підлягалися гідролітичному розщепленню за допомогою ендонуклеаз рестрикції TaqI, EcoRI, MspI, HinfI («Thermo Scientific», США), відповідно. Для цього готувалася суміш для проведення рестрикційного аналізу.
Реакція рестрикції ділянки гена IL-1β (C3953T) проводилася в мікротермостаті при 65 °С протягом 12 годин. Рестрикцію IL-8 (C781T), TLR-2 (753 G/A), TLR-4 (399 C/T) здійснювали при температурі 37 °С протягом 12 годин. Реакцію рестрикції ділянки гена IL-1β (C3953T) зупиняли переміщенням пробірок у штатив за кімнатної температури, а ділянки гена IL-8 (C781T) та TLR-4 (399 C/T) – підвищенням температури до 65 °С, TLR-2 (753 G/A) – підвищенням температури до 80 °С впродовж 20 хвилин. Стан рестрикційних фрагментів генів IL-1β (C3953T), IL-8 (C781T), TLR-2 (753 G/A), TLR-4 (399 C/T) аналізувався в 3 % агарозному гелі (агароза фірми «Cleaver Scientific», Великобританія) з додаванням бромистого етидію. Для оцінки розміру фрагментів вносився маркер молекулярної ваги GeneRuler 50 bp DNA Ladder («Thermo Scientific», США), візуалізувалися гелі за допомогою трансілюмінатору. Обробка отриманого зображення проводилася в комп’ютерній програмі Vitran (рис. 1.1–1.3).
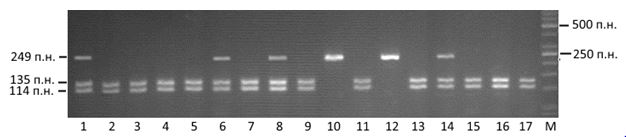
Рисунок 1.1 – Електрофореграма розподілу рестрикційних фрагментів гену IL-1β (C3953T)
Зразки 2-5, 7, 9, 11, 13, 15-17– генотип С3953С; зразки 1, 6, 8, 14 – генотип С3953Т; зразки 10, 12 – генотип Т3953Т; М – маркер молекулярної ваги.

Рисунок 1.2 – Електрофореграма розподілу рестрикційних фрагментів гену IL-8 (C781T)
Зразки 2, 3, 6-10, 13, 14, 16-18 – генотип С781С; зразки 1, 5, 11, 12 – генотип С781Т; зразки 4, 15 – генотип Т781Т; М – маркер молекулярної ваги.

Рисунок 1.3 – Електрофореграма розподілу ампліфікованих фрагментів гену TLR-2 (753 G/A)
Зразки 1-17 – генотип G753G; М – маркер молекулярної ваги.
Як видно з рисунку 1.1, амплікони гена IL-1β (C3953T) підлягали гідролітичному розщепленню за наявним сайтом рестрикції 5′-T↓CGA-3′, внаслідок чого утворювалися фрагменти з молекулярною вагою 135 п.н. та 114 п.н. – генотип СС. Сайт рестрикції зникав при нуклеотидній заміні С на Т в позиції 3953, тому при нуклеотиді Т розмір фрагменту ампліфікованої ділянки ДНК після дії рестриктази залишався незмінним – 249 п.н. Відповідно у гетерозигот (генотип СТ) на електрофореграмі спостерігалися всі три довжини фрагментів одночасно: 249, 135 та 114 п.н.
На рисунку 1.2 представлено електрофореграму рестриктів гену IL-8 (C781T). Гідролітичне розщеплення ампліфікованої ділянки ДНК рестриктазою відбувалося за наявності сайту рестрикції 5′-G↓ААТТС-3′, внаслідок чого утворювалися фрагменти з молекулярною вагою 184 та 19 п.н. (генотип СС). Сайт рестрикції зникав при нуклеотидній заміні С на Т в позиції 781, тому при генотипі ТТ розмір фрагменту ампліфікованої ділянки ДНК після дії рестриктази залишався незмінним – 203 п.н., у той час у гетерозигот (генотип СТ) спостерігалися всі три типи фрагментів одночасно: 203, 184 та 19 п.н.
На рисунку 1.3 представлено електрофореграму рестриктів гену TLR-2 (753 G/A). Гідролітичне розщеплення ампліфікованої ділянки ДНК рестриктазою відбувалося за наявності сайту рестрикції 5′-C↓CGG-3′, внаслідок чого утворювалися фрагменти з молекулярною вагою 104 та 25 п.н. (генотип GG). Сайт рестрикції зникав при нуклеотидній заміні G на A в позиції 753, тому при генотипі AA розмір фрагменту ампліфікованої ділянки ДНК після взаємодії з рестриктазою залишався незмінним – 129 п.н. У гетерозигот (генотип GA) спостерігалися всі три типи фрагментів одночасно: 129, 104 та 25 п.н.
На рисунку 1.4 представлено електрофореграму рестриктів гену TLR-4 (399 C/T). Гідролітичне розщеплення ампліфікованої ділянки ДНК рестриктазою відбувалося за наявності сайту рестрикції 5′-G↓АNTC-3′, який з’являється при нуклеотидній заміні С на Т в позиції 399, внаслідок чого утворювалися рестрикційні фрагменти 377 та 29 п.н., що відповідають генотипу ТТ. За відсутності сайту рестрикції фрагмент залишався незмінним 406 п.н. – генотип СС. У гетерозиготних носіїв реєструвалися всі типи фрагментів 406, 377 та 29 п.н. – генотип СТ.
1.3 Апаратний метод дослідження функціональних параметрів шкіри
Визначення функціональних параметрів шкіри проводилось на багатофункціональному портативному аналізаторі для діагностики поверхні шкіри Soft Plus (свідоцтво про державну реєстрацію № 8177/2008 від 26. 09. 2008 р. № 116-Адм). Даним апаратом проводилась себометрія (визначення показників жирності шкіри), що вимірювалась в умовних одиницях від 0 до 100. Функціональні параметри шкіри визначали на уражених ділянках до лікування та через 2 місяці від початку терапії. Під час обстеження пацієнтів датчик, що фіксував дані, знаходився перпендикулярно поверхні шкіри. Обов’язковими умовами проведення даного обстеження були: суха, чиста, не змащена засобами зовнішньої терапії шкіра [108].
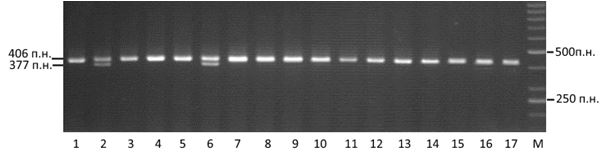
Рисунок 1.4 – Електрофореграма розподілу ампліфікованих фрагментів гену TLR-4 (399 C/T)
Зразки 1, 3-5, 7-17 – генотип С399С; зразки 2, 6 – генотип С399Т; М – маркер молекулярної ваги.
1.4 Статистичний метод
Статистична обробка даних, отриманих під час клінічних та лабораторних досліджень, проводилася за допомогою комп’ютерних програм SPSS Statistics 17.0, Microsoft Excel 2013 та OR-calculator. Залежно від завдання дослідження та типу даних були застосовані наступні статистичні методи: описової статистики шляхом обчислення медіан (Ме); критерій χ2 Пірсона з поправкою Йєтса та точним критерієм Фішера; розрахунок показника співвідношення шансів (OR) з довірчими інтервалами; розрахунок середньої арифметичної величини та її стандартного відхилення (M±m); перевірка даних на нормальність розподілу за допомогою теста Колгоморова-Смірнова; після оцінки гомогенності груп тестом Левеня застосування t-критерію Ст’юдента [14].
Статистично значущими вважалися дані з рівнем імовірності р <0,05.
РОЗДІЛ 2
ЗАГАЛЬНОКЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ НА АКНЕ
2.1 Сучасні класифікації акне
Дуже просту класифікацію тяжкості акне було описано в доповіді за 2003 рік від Міжнародного альянсу з покращення результатів лікування акне [99].
Спираючись на настанови, більшість оглядів та літературні посилання автори ідентифікували 4 групи з формування підгруп акне. В юнацьких акне обличчя відокремлено 4 головних клінічних критерії: 1) вік (від пубертату до 25 років), 2) розміщення (обличчя), 3) тип ураження (поліморфізм), 4) відсутність етіологічних факторів. Таким чином, було запропоновано розрізняти: акне та не-акне фолікулярні захворювання (ювенільні акне обличчя); інші форми акне; типи уражень (конглобатні, фульмінантні, мономорфні; вік: акне немовлят (від 3 місяців до 5 років), препубертатні акне (від 6 років до пубертату – адреналовий пубертат), акне жінок (>25 років), акне чоловіків (>25 років); акне, пов’язані із гормональними розладами: ендокринопатії жінок (особливо полікістоз яєчників); акне, індуковані екзогенними андрогенами; акне, індуковані андрогенними прогестинами (оральна контрацепція) [169].
Представлено п’ять різновидів хвороби: легка комедональна, легка папуло-пустульозна, помірна та тяжка вузлово/конглобатна форми [39, 41]. Згідно Європейських стандартів лікування акне, група розробки нормативів оптимізувала класифікацію пацієнтів з акне [187]. Експерти використали досить просту клінічну класифікацію: 1. Комедональне акне. 2. Легке-помірне папуло-пустульозне акне. 3. Тяжке папуло-пустульозне акне. 4. Тяжке вузлове акне, конглобатне акне.
2.2 Методи клінічного дослідження
Незважаючи на цілий ряд методик, що використовувалися для класифікації акне в 1960-х і 1970-х роках, саме метод спостереження Leeds був найпоширенішим [102]. Ця методика включала в себе два методи: метод оцінки та метод підрахунку. Методика включає прямий підрахунок незапальних та запальних висипань, враховуючи поверхневі папули і пустули, глибокі запальні ураження і макули. Переглянута (сучасна) система класифікації включає цифрову систему оцінки спини, грудей, а також обличчя. Система Echelle de Cotation des Lesions d’Acne (ECLA) «Підрахунок масштабу ураженого акне» продемонструвала значну надійність. Проте, оцінки ECLA не корелюють з оцінками якості життя, тому мають враховуватися обидва показники [86].
Клінічне дослідження було проведено 84 особам безпосередньо при зверненні з наступним суб’єктивним та об’єктивним моніторингом загального стану хворих, аналізом анамнезу.
Оцінка об’єктивного статусу пацієнтів базувалася на даних:
- Терапевтичного обстеження хворих (огляд, пальпація, перкусія, аускультація по органах і системах).
- Лабораторного загальноклінічного, біохімічного, гормонального обстеження крові.
- Молекулярно-генетичного обстеження.
- Інструментального обстеження (виявлення кліща роду Demodex); у разі необхідності: електрокардіографія, УЗД щитоподібної залози, органів малого тазу та черевної порожнини.
- Анамнестичних (збір анамнезу життя, хвороби, статевого та сімейного анамнезу).
- Консультативних висновків суміжних спеціалістів (гінеколог-ендокринолог, терапевт, ревматолог, гастроентеролог).
Загальноклінічні, біохімічні дослідження та обстеження на Demodex проводилися в клінічній лабораторії Київської міської клінічної шкірно-венерологічної лікарні. Молекулярно-генетичні обстеження проводилися у ДЗ «Референс-центр з молекулярної діагностики МОЗ України» на базі кафедри медичної та лабораторної генетики Національної медичної академії післядипломної освіти імені П.Л. Шупика. Гормональні дослідження проводились у приватних лабораторіях м. Києва.
2.3 Результати клінічного обстеження хворих на акне
Дослідження проводилося з 2015 по 2017 роки на кафедрах дерматовенерології і медичної та лабораторної генетики Національної медичної академії післядипломної освіти імені П.Л. Шупика, на базі Київської міської клінічної шкірно-венерологічної лікарні та консультативно-діагностичної поліклініки Національної дитячої лікарні «ОХМАТДИТ».
За даний період було обстежено 95 осіб (47 жінок, 48 чоловіків). Середній вік досліджуваних становив (20,5 ± 5,5) років, з крайніми коливаннями від 14 до 40 років (80,9 % обстежених були віком від 14 до 25 років). З 95 обстежених було 84 пацієнтів з акне та 11 батьків пацієнтів, що мали прояви акне у молодому віці.
2.3.1 Критерії включення і виключення пацієнтів з дослідження
Дослідження проводилось на підставі Гельсінської Декларації Всесвітньої Медичної Асоціації та правил якісної медичної практики (ІСН GCP), добровільної участі, інформування пацієнтів про характер майбутнього дослідження.
Включення пацієнтів у програму обстеження проводилося за спеціально розробленими критеріями відбору.
Критерії включення:
- Установлений діагноз акне.
- Наявність середньо-тяжкого або тяжкого ступеня тяжкості захворювання.
- Вік пацієнта від 14 до 65 років.
- Підписання пацієнтами та/або батьками пацієнтів інформованої згоди на участь у дослідженні.
Критерії виключення:
- Акне легкого ступеня тяжкості;
- Наявність супутньої тяжкої патології у стадії суб- та декомпенсації;
- Не виконання пацієнтом призначених рекомендацій та плану обстеження;
- Бажання пацієнта та/або батьків припинити участь у дослідженні.
2.3.2 Принципи і алгоритм розподілу пацієнтів у досліджуваних групах
За особливостями клініко-анамнестичних даних всі обстежені (95 осіб) були розподілені на три групи: 1-а група – пацієнти з середньоо-тяжким акне (n=42), 2-а група – пацієнти з тяжким акне (n=42), 3-я група – батьки пацієнтів, що мали прояви акне у минулому (n=11). Кожна група залежно від статі була поділена на дві підгрупи. Розподіл пацієнтів за статтю та групами представлено в таблиці 2.1.
Таблиця 2.1 – Розподіл пацієнтів за статтю та групами
| Група | Стать | |||
| Жіноча | Чоловіча | |||
| Абс. | % | Абс. | % | |
| 1 | 28 | 29,5 | 14 | 14,7 |
| 2 | 14 | 14,7 | 28 | 29,5 |
| 3 | 5 | 5,3 | 6 | 6,3 |
| Всього | 47 | 49,5 | 48 | 50,5 |
Діагноз був сформований згідно з Європейськими протоколами з діагностики та лікування акне, які були доповнені і розширені у 2016 році. Пацієнти на момент обстеження знаходились у стані загострення шкірного процесу.
За особливостями клініко-анамнестичних даних усі пацієнти, що ввійшли в дослідження були розподілені на три групи: 1-а група – хворі на акне середньо-тяжке (n = 42), 2-а група – хворі на акне тяжкого ступеня тяжкості (n=42), 3-я група – мати/батько пацієнтів з акне, які також мали значні прояви даної патології у молодому віці (n=11).
Всього було відібрано 84 пацієнти, хворих на акне. Середній вік пацієнтів 1-ої групи становив (21,8 ± 5,14) років, 2-ої групи – (19,5 ± 5,6) років, 3-ої групи – (44,8 ± 6,9) років. У віці 14-16 років було зареєстровано 24 пацієнти, 17-20 років – 24 пацієнти, 21-25 років – 21 пацієнт, 26-30 років – 10 пацієнтів, 31-40 років – 5 пацієнтів.
Всього було обстежено 14 (33,3 %) чоловіків з акне середньо-тяжким та 28 (66,7 %) чоловіків із тяжким перебігом даного дерматозу. Серед обстежених жінок у 28 (66,7 %) були прояви середньо-тяжкого акне, а у 14 (33,3 %) відмічався тяжкий перебіг (табл. 2.2).
Таблиця 2.2 – Характеристика пацієнтів з акне за статтю
| Група | Стать | |||
| Чоловіки | Жінки | |||
| Абс. | % | Абс. | % | |
| 1 (n=42) | 14 | 33,3 | 28 | 66,7 |
| 2 (n=42) | 28 | 66,7 | 14 | 33,3 |
| Всього | 42 | 100,0 | 42 | 100,0 |
Залежно від статевого розподілу, у чоловіків частіше відмічалися тяжкі форми акне, а у жінок – середнього ступеня. Ця закономірність прослідковувалася як у межах досліджуваної групи в цілому, так і для кожного вікового періоду окремо, за винятком вікової групи 17-20 років, де акне середнього ступеня тяжкості зустрічалися частіше у чоловіків, ніж у жінок та вікової групи 30-40 років, де тяжкі форми акне зустрічалися частіше у жінок, ніж у чоловіків (табл. 2.3).
Таблиця 2.3 – Віковий розподіл пацієнтів в залежності від статі та групи
| Вік | Група | |||
| 1 (n=42) | 2 (n=42) | |||
| Чоловіки | Жінки | Чоловіки | Жінки | |
| 14-16 | 1 (2,4%) | 6 (14,3%) | 11 (26,2%) | 5 (11,9%) |
| 17-20 | 7 (16,7%) | 4 (9,5%) | 10 (23,8%) | 3 (7,1%) |
| 21-25 | 4 (9,5%) | 9 (21,4%) | 5 (11,9%) | 3 (7,1%) |
| 26-29 | 2 (4,8%) | 6 (14,3%) | 1 (2,4%) | 1 (2,4%) |
| 30-40 | – | 3 (7,1%) | 1 (2,4%) | 2 (4,8%) |
| Всього | 14 (33,4%) | 28 (66,6%) | 28 (66,7%) | 14 (33,3%) |
З табл. 2.3 видно, що більшу частину пацієнтів становили люди віком 14-25 років, на частку яких припадало в сумі 68 осіб, що складало 80,9 % від загальної кількості хворих. Решта хворих належала до вікової категорії 26-40 років (16 пацієнтів, 19,1 %). Таким чином, хворі належали до молодої, працездатної частини популяції.
Тривалість захворювання становила від 2 до 23 років (у середньому 5,2 роки), дебют акне констатовано у віці від 12 до 21 років (у середньому 15,2 років). У жінок середній вік складав (21,02 ± 6,5) років, а тривалість захворювання складала 5,6 років. Середній вік чоловіків був (19,2 ± 3,8) років, середня тривалість акне – 4,8 років.
Половина обстежених хворих (n=42) мала прояви акне середньо-тяжкого ступеня тяжкості (Acne papulopustulosa), що проявлялися запальними папулами та пустулами у кількості 10-20, вузлами розміром менше 1 см у кількості до 10, відкритими та закритими комедонами у типових для акне локалізаціях. Інша половина була з проявами тяжкого акне (Acne nodosa) та мала запальні папули та пустули у кількості більше 20, вузли розміром менше 1 см у кількості 10-20, вузли, кисти, фістули у кількості до 5, виражене запалення та наявність рубців; в тому числі серед обстежених були пацієнти із фульмінантними та конглобатними акне (Acne fulminans, Acne conglobata), які мали багаточисельні комедони, папули та пустули у кількості більше 20, більше 20 вузлів розміром менше 1 см, більше 5 вузлів, кист, фістул, сильно виражене запалення, рубці.
У 75 (92,6 %) пацієнтів був виявлений зв’язок між дебютом захворювання та статевим дозріванням. 35 жінок (83,3 %) вказали на те, що перші прояви акне в них почали з’являтися в період від 1 року до початку менструацій та до 2 років після початку. Серед обстежених жінок значна частина (29, 69 %), вказувала на зв’язок між погіршенням проявів захворювання та фазою менструального циклу. Посилення висипу на шкірі відмічалося наприкінці другої фази менструального циклу та тривало 3-4 дні від початку нового циклу. Зв’язку між вагітністю/лактацією та перебігом акне встановлено не було, жодна з пацієнток, що мала дітей, не вказала на подібні особливості перебігу захворювання.
40 (95,2 %) чоловіків звернули увагу на те, що дебют акне співпадав із появою у них вторинних статевих ознак (табл. 2.4).
Таблиця 2.4 – Зв’язок між початком захворювання та статевим дозріванням у пацієнтів з акне
| Зв’язок
Стать |
Наявний | Відсутній | ||
| Абс. | % | Абс. | % | |
| Чоловіки | 40 | 47,6 | 2 | 2,4 |
| Жінки | 35 | 41,7 | 7 | 8,3 |
| Всього | 84 (100%) | |||
У 67 пацієнтів (79,8 %) захворювання починалося поступово, спочатку з’являлися відкриті та закриті комедони у себорейних зонах обличчя. Згодом, відмічалася поява поодиноких запальних папул та пустул, і лише через 4-5 років у середньому після початку захворювання набувало середньо-тяжкого та тяжкого перебігу (розповсюдженість процесу на шкірі обличчя, грудей та верхньої частини спини; наявність чисельних папул та пустул, у пацієнтів з тяжким перебігом – кист, запальних вузлів та рубців у місцях попереднього висипу). Більшість пацієнтів тривалий час лікувалися самостійно без вираженого ефекту, і тільки після років безуспішного самолікування зверталися до дерматолога з вираженими проявами хвороби та ускладненнями попереднього лікування. 61 (72,6 %) пацієнт мав зневоднену, пересушену шкіру з лущенням, на тлі якої були наявні елементи висипу, характерні для акне, що значно ускладнювало підбір топічної та системної терапії.
На момент первинного звернення серед пацієнтів чоловічої статі із середньо-тяжким перебігом акне (n=14) у 5 (35,7 %) висип був наявний лише на шкірі обличчя та був представлений запальними папулами (у кількості 10-20), пустулами (більше 5), чисельними комедонами (більше 20); вузли, кисти, фістули у даних пацієнтів були відсутні. У 7 (50 %) чоловіків із середньо-тяжким перебігом акне висип локалізувався на шкірі обличчя та спини. Шкіра спини була уражена здебільшого у верхній третині, висип там був представлений чисельними папульозними елементами (у кількості 15-20) з вираженим запальним компонентом, діаметром від 0,2 до 0,5 см, з чіткими межами та щільної консистенції; пустулами, деякі з яких мали тенденції до самостійного вскривання з утворенням серозно-гнійних кірочок на поверхні. У 2 (14,3 %) пацієнтів чоловічої статі із середньо-тяжким перебігом акне висип локалізувався, окрім шкіри обличчя та спини, на шкірі грудей та був представлений чисельними комедонами, папулами та поодинокими пустулами.
Серед жінок, що мали середньо-тяжкий перебіг акне (n=28) у більшої частини, а саме у 17 (60,7 %), висип обмежувався шкірою обличчя та був представлений здебільшого комедонами (більше 20) та папульозними елементами (у кількості 10-20), також були наявні поодинокі пустули та ерозії, що були вкриті серозно-гнійними кірочками. У 7 (25 %) пацієнток із середнім перебігом акне висип локалізувався також на шкірі спини, а саме – міжлопатковій ділянці, та був представлений папулами (у кількості 10-15) та поодинокими пустулами (до 5). У 4 (14,3 %) жінок із середнім перебігом захворювання процес був розповсюдженим та локалізувався на шкірі обличчя, спини та грудей. На кожній з уражених ділянок були наявні комедони (більше 20), запальні папули (у кількості 15-20) та пустули (до 5). Серед всіх пацієнток із середньо-тяжким перебігом акне практично у всіх (n=24) висип на шкірі обличчя локалізувався у ділянці підборіддя; у багатьох хворих (n=18) також була уражена ділянка лоба, а у 14 пацієнток висип був наявний на шкірі щік та носу.
Серед пацієнтів чоловічої статі, що мали тяжкі прояви акне (n=28) у 8 (28,6 %) висип обмежувався шкірою обличчя та був представлений, окрім багаточисельних комедонів, папул (>20), пустул (>5), також вузлами та кістами у кількості до 5 елементів, що мали значний запальний компонент, діаметр більше 1 см, щільну консистенцію та були болісні при пальпації. У 9 (32,1 %) чоловіків із тяжким перебігом акне висип розповсюджувався на шкіру обличчя та спини і був представлений усіма вище переліченими елементами, що супроводжувалися дуже вираженим запаленням. У 11 (39,3 %) пацієнтів чоловічої статі із тяжким перебігом акне серед уражених зон були обличчя, спина та груди, висип у кожній з ділянок був представлений чисельними комедонами, папулами (>20), пустулами (>5), вузлами та кистами (>5), що залишали після розрішення рубцеві зміни.
Серед жінок з тяжким перебігом акне (n=14) у 10 (71,4 %) висип локалізувався на шкірі обличчя та спини; у даних пацієнток окрім папул та пустул були наявні запальні інфільтровані вузли, болісні при пальпації, кисти, рубці на місцях попередніх висипань. У 4 (28,6 %) осіб подібна клінічна картина окрім шкіри обличчя та спини спостерігалася на шкірі грудей.
На момент проведення дослідження кількість пацієнтів, що звернулися до дерматолога вперше, складала 38 (45,2 %). До цього дані пацієнти мали прояви акне протягом 2-6 років та намагалися лікуватися самостійно, використовуючи косметичні засоби для проблемної шкіри. Частина пацієнтів зверталися по допомогу до косметологів, які здебільшого проводили пілінги та чистки шкіри обличчя, що мали короткотривалий ефект чи навпаки провокували нове загострення та погіршували перебіг акне.
Інша частина пацієнтів у кількості 34 (40,5 %) періодично відвідували дерматолога та отримували призначене ним лікування. Основу амбулаторного лікування становили переважно засоби для місцевого використання, до складу яких входили: антибактеріальні препарати (еритроміцин, кліндаміцин), ретиноїди (ізотретиноїн, адапален), бензоїл пероксид, азелаїнова кислота, цинку ацетат та їхні комбінації. Подібна терапія у більшості пацієнтів давала тривалу ремісію, проте з початком нового загострення у частини пацієнтів (19, 22,6%) відмічалася резистентність до засобів, що мали позитивний ефект до цього.
12 (14,3 %) пацієнтів проходили раніше стаціонарне лікування. Отримуване ними лікування відрізнялося від амбулаторного призначенням ін’єкційних вітамінних препаратів, аутогемотерапії, плазмаферезу та ультрафіолетового опромінення крові. Дана терапія давала найбільш тривалий ефект, проте у пацієнтів із тяжким перебігом акне з часом відмічалися нові загострення хвороби (рис. 2.1).
У 17 (20,2 %) пацієнтів початок захворювання був раптовим та мав одразу дуже тяжкий перебіг. Під спостереженням знаходилось 11 пацієнтів з конглобатним акне, з них 7 (63,6 %) – чоловіки (рис. 2.2). Ці пацієнти відмічали агресивний початок та перебіг захворювання, резистентність до попередньої терапії. Також 2 пацієнти з усіх обстежених мали фульмінантне акне та тяжкі системні прояви хвороби, такі як лихоманка (до 38,6 °С), загальна слабкість, поліартралгія. Характерними проявами фульмінантного акне були: чисельні кистозні та вузлові елементи з нагноюванням, що утворювали зливні осередки з некротичними ділянками.
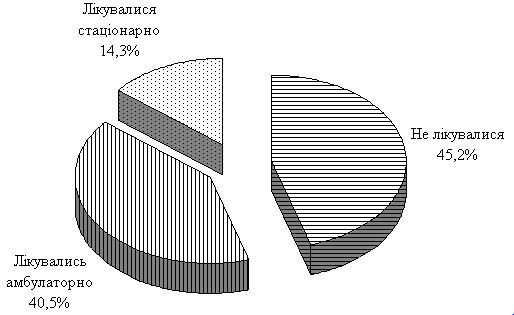
Рисунок 2.1 – Попереднє лікування пацієнтів з акне
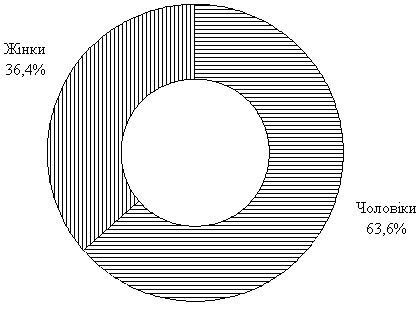
Рисунок 2.2 – Розподіл пацієнтів з конглобатними акне за статтю
Сезонні коливання проявів захворювання не мали чіткої вираженості – загострення акне у пацієнтів відбувалися протягом всього року.
Частина пацієнтів, а саме 31 (36,9 %) – вказали на зв’язок між дієтою та загостренням хвороби. Серед усіх продуктів, що могли спричинити погіршення перебігу акне, найбільше пацієнти вказували на вживання молочних продуктів (переважно цільного молока), простих вуглеводів (здебільшого солодощів), «фаст-фуду» та продуктів, що містять значну кількість консервантів (напівфабрикати).
Був проведений збір анамнезу на наявність у пацієнтів супутньої патології, а саме захворювань ендокринної системи, шлунково-кишкового тракту, серцево-судинної системи, автоімунних захворювань та ін. У 4 пацієнтів (4,8 %) були наявні вузлові утворення щитоподібної залози різного ступеня, проте в усіх хворих патологія була гормонально компенсованою. 7 (16,3 %) пацієнток вказали на наявність у них синдрому полікістозних яєчників (СПКЯ), дана група пацієнтів паралельно перебувала під наглядом у гінеколога-ендокринолога. 12 хворих (14,3 %) мали в анамнезі хронічний гастрит, що в період проведення даного дослідження перебував у стадії стійкої ремісії. У двох пацієнтів з фульмінантними акне були наявні прояви поліартриту, дані пацієнти паралельно отримували лікування у ревматолога (табл. 2.5).
Таблиця 2.5 – Наявність супутньої патології у хворих на акне
| Патологія | Кількість хворих | |
| Абс. | % | |
| Вузловий зоб | 4 | 4,8 |
| СПКЯ | 7 | 8,3 |
| Хронічний гастрит | 12 | 14,3 |
| Поліартрит | 2 | 2,4 |
| Відсутня | 59 | 70,2 |
Усі пацієнти проходили загальноклінічні обстеження: загальний аналіз крові з лейкоцитарною формулою, глюкоза крові, біохімічний аналіз крові (аланінамінотрансфераза (АлАТ), аспартатамінотрансфераза (АсАТ), загальний білок, креатинін, сечовина, С-реактивний білок (СРБ), ревматоїдний фактор), аналіз крові на мікрореакцію преципітації для експрес діагностики сифілісу, загальний аналіз сечі. У всіх пацієнтів, за винятком двох хворих на фульмінантне акне, усі загальноклінічні показники знаходились у межах норми. Пацієнти з проявами фульмінантного акне мали зміни в бік підвищення таких показників, як: загальний білок, СРБ. Також у даних хворих був наявний помірний лейкоцитоз (до 12 х 109/л). Усі пацієнти були обстежені на наявність демодекозу як ускладнення основного захворювання. У 15 (17,9 %) хворих був виявлений Demodex folliculorum у значній кількості. Дана категорія пацієнтів отримала лікування від демодекозу, після чого був проведений контроль виліковності. У пацієнтів із середнім перебігом акне демодекоз був виявлений у 4 хворих, а серед пацієнтів із тяжким перебігом – у 11 (рис. 2.3).
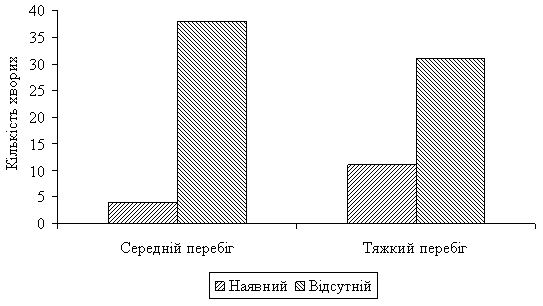
Рисунок 2.3 – Наявність демодекозу у пацієнтів з різних груп
Визначення індексу маси тіла показало, що всі обстежені пацієнти не мали відхилень (18,5–24,9 кг/м2). Середнє значення цього показника для вибірки становило 22,3, що відповідало нормальним значенням.
Наводимо приклади.
Приклад 1. Пацієнтка К., 18 років хворіє протягом 4,5 років, коли вперше з’явився висип на шкірі обличчя. Дебют захворювання співпав у часі зі статевим дозріванням. Перебіг акне мав певну циклічність із тенденцією до погіршення у другій фазі менструального циклу. Перші 3 роки захворювання мало легкий перебіг та характеризувалося наявністю комедонів (до 20), папул (до 10) та зрідка поодиноких пустул лише на шкірі обличчя. Пацієнтка лікувалася самостійно, застосовуючи засоби з догляду за проблемною шкірою, періодично відвідувала косметологічний кабінет, де їй проводили механічні чистки обличчя. Дані дії хворої мали незначний позитивний ефект, проте і погіршення динаміки акне не відмічалося. 1,5 роки тому захворювання почало прогресувати: збільшилася кількість папул, з’явилися пустули, висип поширився на шкіру спини та грудей, а згодом почали утворюватися запальні вузли, що не розв’язувалися протягом декількох місяців, були болісні при пальпації. Окрім цього, хвора почала відмічати зміни менструального циклу в бік подовження. На даному етапі пацієнтка звернулася до дерматолога. Було проведено загальноклінічне обстеження (загальний аналіз крові з лейкоцитарною формулою, аналіз крові на глюкозу, загальний аналіз сечі), біохімічний аналіз крові (АлАТ, АсАТ, загальний білок, креатинін, сечовина, СРБ, ревматоїдний фактор), аналіз крові на мікрореакцію преципітації для експрес-діагностики сифілісу), визначення рівня тиреоїдних гормонів. Дані показники знаходилися в межах норми. Хворій було проведено обстеження на Demodex, у результаті якого було виявлено Demodex folliculorum у значній кількості. Також пацієнтка була обстежена на рівні статевих гормонів у периферійній крові (тестостерон вільний, тестостерон загальний, дигідротестостерон (ДГТ), естрадіол, прогестерон, фолікулостимулючий гормон (ФСГ), пролактин), обстеження проводилося на 23 день менструального циклу та вона пройшла молекулярно-генетичне тестування для визначення поліморфізмів генів TLR-4, IL-1β та IL-8. За даними гормонального обстеження більша частина показників знаходилася в межах норми: тестостерон загальний – 0,97 нмоль/л, тестостерон вільний – 6,06 пг/мл, прогестерон – 3,02 нг/мл, естрадіол – 84,07 пг/мл, ФСГ – 5,8 мМо/мл. Проте, показники ДГТ та пролактину перевищували норми. Рівень ДГТ був вищим за максимально допустимі значення у 5 разів та становив 1834,77 пг/мл (норма – 24,0–368,0 пг/мл), а рівень пролактину у периферійній крові був 35,6 нг/мл (норма – 4,79–23,3 нг/мл).
За молекулярно-генетичним тестуванням було отримано наступні результати: за геном TLR-4 (С399T) був виявлений гомозиготний генотип СС, за геном IL-1β (C3953T) був наявний гомозиготний генотип ТТ, а за геном IL-8 (C781T) був наявний гетерозиготний генотип СТ.
З результатами проведених обстежень пацієнтка була направлена на консультацію до гінеколога-ендокринолога, де їй було проведено дообстеження, виставлений діагноз СПКЯ та призначено лікування (прийом комбінованих оральних контрацептивів), після чого вона повернулася задля призначення дерматологічної терапії. Було призначено бовтанку з 20 % бензилбензоатом на 3 тижні як терапію демодекозу; по закінченні цього періоду було проведено контроль виліковності та призначення подальшої терапії: місцево пацієнтка використовувала фіксовану комбінацію адапален + кліндаміцин двічі на добу протягом 3 місяців на папульозний та пустульозний висип і чистий іхтіол на вузлові елементи на ніч протягом 1 місяця, всередину отримувала нікотинамід рибозид у дозі 75 мг тричі на добу протягом 2 місяців.
Після завершення курсу лікування був проведений контрольний візит пацієнтки, на якому спостерігалося значне покращення стану хворої – на шкірі обличчя залишилися поодинокі папули та комедони, пустули та вузли були відсутні, шкіра спини та грудей очистилася повністю. Хворій було рекомендовано використання топічних препаратів з азелаїновою кислотою як підтримуючої терапії та подальше перебування під наглядом гінеколога-ендокринолога.
Приклад 2. Під спостереженням знаходився хворий С., 16 років, із тяжким перебігом акне. Хворий поступив на початку грудня 2016 року до дерматологічного відділення № 2 для дорослих Київської міської клінічної шкірно-венерологічної лікарні (КМКШВЛ).
З анамнезу з’ясовано, що помірний висип на шкірі обличчя з’явився у хворого у віці 14 років, коли вперше почали з’являтися комедони, вузлики, рідше гнійнички. Пацієнт не звертався до дерматолога, самостійно користувався косметичними засобами для проблемної шкіри, що призводили до незначного тимчасового ефекту.
Проте, восени 2016 року раптово процес різко загострився. На шкірі спини та грудей почали з’являтися вузли, кисти, що розв’язувалися формуванням атрофічних та гіпертрофічних рубців. Процес розповсюдився по всій верхній третині спини. На цьому етапі пацієнт звернувся до КМКШВЛ.
При огляді встановлено, що патологічний процес займав шкіру обличчя, спини, грудей. Шкіра обличчя блищала від надмірного змащення шкірним салом, у зоні носа, носогубної ділянки, щоках, підборідді помітні закриті та відкриті комедони, поодинокі вузлики червоного кольору без чіткого відмежування, розміром до кісточки вишні, та пустули. Разом з тим на шкірі спини та грудей процес був розповсюдженим, представлений великою кількістю червоного або синявого кольору вузлів та кист розміром до вишні, деякі з яких розкриті з постійною значною гноєтечею. При пальпації вузли та кисти помірно болісні. Поряд із гострим процесом, звертала на себе увагу значна кількість атрофічних та гіпертрофічних рубцевих змін.
Загальний стан хворого незадовільний: температура 37,5–38,8 0С, слабкість, сонливість, головний біль. Хворий скаржився на помірні болі в колінних та променезап’ясткових суглобах, у м’язах нижніх кінцівок. Саме нехарактерне для конглобатного акне погане самопочуття, постійна останнім часом підвищена температура, швидкий у часі розвиток клінічної загальної та шкірної картини, незвична для інших форм акне постійна гноєтеча дозволили встановити діагноз фульмінантного акне, госпіталізувати хворого та розпочати його детальне обстеження.
У загальному аналізі крові рівень гемоглобіну становив 146 г/л (норма – 130,0–160,0 г/л), лейкоцити – 11,5 х 109/л (норма – 4,0–9,0), ШОЕ – 14 мм/год (норма – 1–10 мм/год), лейкоцитарна формула: паличкоядерні – 1 %, сегментоядерні – 76 %, еозинофіли – 1 %, базофіли – 1 %, лімфоцити – 13 %, моноцити – 8 %.
Таким чином, на момент надходження пацієнт мав незначний лейкоцитоз, підвищення ШОЕ та зсув лейкоцитарної формули ліворуч.
Згідно даних біохімічного аналізу крові було отримано наступні результати: загальний білок – 88 г/л (норма – 65–85 г/л), сечовина – 4,5 ммоль/л (норма – 2,0–8,0 ммоль/л), креатинін – 76 мкмоль/л (норма – 44–110 мкмоль/л), СРБ – негативний, холестерин загальний – 4,7 ммоль/л (норма – до 5,0 ммоль/л), білірубін загальний – 10,2 мкмоль/л (норма – 0,8–25,5 мкмоль/л), АлАТ – 29,7 Од/л (норма – 12–48 Од/л), АсАТ – 30,0 Од/л (норма – 10–51 Од/л), ревматоїдний фактор – негативний.
Також серед проведених біохімічних досліджень було виявлено гіперпротеїнемію, що відповідало загальному стану хворого.
Пацієнт був обстежений на рівень статевих гормонів у периферійній крові: тестостерон загальний – 10,61 нмоль/л (норма – 8,64–29,0 нмоль/л), тестостерон вільний – 21,481 пг/мл (норма – 15,0–50 пг/мл), ДГТ – 518,07 пг/мл (норма – 250,0–990,0 пг/мл). Зазначені показники були у межах норми.
Хворому було проведено бакзасів виділень з пустул із визначенням чутливості до антибіотиків. Отримано такий результат: S. aureus (++++). Чутливий до: цефтриаксону, ванкоміцину, амікацину, левофлоксацину, доксицикліну. Стійкий до азитроміцину.
Було призначено наступне лікування: внутрішньовенно краплинно розчин цефтриаксону 1,0 + 0,9 % розчин NaCl по 100,0 2 рази на добу протягом 7 днів, внутрішньом’язово розчин вітаміну С 2,0 № 15, внутрішньом’язово розчин вітаміну В6 5 % 1,0 № 12, автогемотерапія за схемою (через день 2, 4, 6, 8, 10, 8, 6, 4, 2 мл), внутрішньом’язово розчин 12,5 % циклоферону 2,0 № 13, екстракт артишоку по 2 таблетки 3 рази на добу, кремнієвий сорбент по 1 пакету на добу протягом 6 днів, панкреатин по 1 таблетці 2 рази на добу, доксициклін по 100 мг (1 таблетка) 2 рази на добу 13 днів, екстракт валеріани по 2 таблетки 3 рази на добу, ізотретиноїн по 24 мг на добу.
Місцеве лікування: іхтіол, бовтанка з левоміцетином, цинкова бовтанка.
Пацієнт отримував системну антибактеріальну терапію протягом 2 тижнів, після чого йому був призначений ізотретиноїн у добовій дозі 24 мг на 1 місяць.
Загалом хворий провів у відділенні 1 місяць, після чого був виписаний із значним покращенням. Нові елементи висипу не з’являлися, старі елементи повністю регресували, залишивши тільки рубцеві зміни та поодинокі серозно-геморагічні кірочки на місцях попередніх висипань.
2.4 Сучасні критерії оцінки якості життя у хворих на акне
Більшість дослідників вивчають якість життя хворих на акне за шкалою CADI. Суб’єктивно визначається наявність гіперсебореї, еритеми та постзапальної пігментації. Так, були обстежені 374 жінки з 15 країн. У хворих з’ясовувалося, коли акне з’явилися вперше (в препубертаті – 12 років, у підлітковому віці – 12–19 років, у молодому віці – 20–25 років, або після 25 років). Вивчались і фактори життя, які можуть потенційно обтяжувати акне: хімічні речовини, щоденний стрес та стрес на роботі, куріння сигарет, дієтичні особливості, догляд за шкірою та використання косметики, коморбідні стани та супутнє лікування [90, 122]. У 347 грецьких студентів досліджено самооцінку за опитувальниками. Причини загострення акне у звітах наступні: дієта (62,3 %), гормони (55,1 %), погана гігієна (42,4 %), стрес (31,9 %), інфекція (14,9 %), генетика (5,7 %) [170].
Акне може бути причиною психологічного дистресу, пов’язаного із багатьма психіатричними станами. До цього слід віднести суїцидальні думки, психіатричні проблеми, ізоляцію від оточуючих [145]. 30–50 % підлітків відчувають психологічний дистрес, пов’язаний із акне: оцінка іміджу, ускладнення спілкування, соціальна дезадаптація, руйнування надій, тривога, гнівання, депресія, низька самооцінка [21, 22, 156]. Разом з тим, є роботи, в яких стверджується, що молоді за віком хворі на акне чоловіки не страждають на депресивні симптоми і ризик суїциду у них не більший, ніж у популяції [168].
При перехресному дослідженні 108 хворих із трьома дерматологічними захворюваннями (акне, псоріаз, атопічний дерматит) із загальних та дерматологічних лікарських прийомів були обстежені на наявність мінімальних психологічних порушень (неспокій, депресія, суспільна самосвідомість, соціальна тривожність, невротизм та екстраверсія-інтраверсія, саморейтинг тяжкості захворювання). При мультиваріантному аналізі не було виявлено розбіжностей із контрольною групою (98 людей, які не страждали на дерматологічні захворювання) [86, 134]. В окремих роботах було показано, що відповіді хворих на акне не відрізнялися від здорових. Разом з тим, серед студентів з акне 48,6 % вважали його причиною складних міжособистих стосунків, а 64,4 % – причиною зниженої самооцінки [170].
Звіт експертів Глобального альянсу з покращення наслідків акне підкреслює важливість розгляду акне як хронічного захворювання, яке здійснює значний вплив на якість життя пацієнтів та потребує активних терапевтичних підходів [54].
Критеріями клінічної характеристики акне може бути оцінка з двох точок зору: об’єктивного перебігу захворювання (на підставі видимих ознак) та впливу на якість життя. Є й інші аспекти характеристики, такі як рівень екскреції шкірного сала, утворення рубців або ж економічний вплив. Існують труднощі щодо об’єктивного оцінювання акне. Було описано більше 25 різних методів, але не існує спільної думки щодо їх застосування. Більшість цих методів не було апробовано, тому не можна безпосередньо порівнювати результати окремих досліджень [64, 193].
2.5 Аналіз якості життя у обстежуваних хворих на акне
Оцінюючи вплив захворювання на якість життя пацієнтів (n=78), використовувалися спеціально розроблені опитувальні листи CADI, що оцінював психоемоційну напруженість пацієнта та вплив акне на якість життя пацієнта, та DLQI, що оцінює вплив дерматологічної патології на повсякденне життя пацієнта. Усі пацієнти заповнювали листи без будь-яких труднощів.
Усього за обома шкалами було проанкетовано 78 пацієнтів із середньо-тяжким та тяжким перебігом акне. Серед них було 36 жінок (22 – з акне середньо-тяжкого ступеня тяжкості та 14 – із тяжким перебігом) та 42 чоловіки (14 – мали акне середньо-тяжкого ступеня тяжкості та 28 – тяжкий перебіг).
2.5.1 Оцінювання за шкалою CADI
Кардифський індекс соціальної дезадаптації, що пов’язана з акне, являє собою спрощений опитувальник. Даний тест демонструє, наскільки акне заважає людині жити повсякденним життям та отримувати позитивні емоції.
Опитувальник містить 5 питань з 4 варіантами відповіді в кожному, за які нараховуються бали від 0 до 3. Результат від 0 до 5 вказує на слабкий вплив захворювання на психоемоційну напруженість пацієнта, 6-10 – вказує на значний вплив, а при показниках від 11 до 15 вказує на високий вплив захворювання відповідно.
Більша частина питань у опитувальнику належить до подій, що відбувалися протягом останнього місяця, проте в останньому питанні пацієнтові пропонується оцінити, наскільки його турбує стан шкіри на момент опитування та охарактеризувати як: не турбує, мало турбує, сильно турбує та настільки погано, наскільки можливо.
Решта питань охоплюють опис як внутрішнього напруження пацієнта (на кшталт: чи були Ви агресивним, засмученим або сором’язливим внаслідок наявності вугрів протягом останнього місяця; як Ви охарактеризуєте відчуття щодо зовнішнього вигляду Вашої шкіри), так і соціального життя опитуваних протягом останнього місяця (наприклад: чи гадаєте Ви, що наявність вугрів перешкоджала Вашому щоденному соціальному життю, соціальним подіям чи відносинам з представниками протилежної статі; чи уникали Ви громадських роздягалень або використання купальників через Ваші вугрі).
Усього було проанкетовано 78 пацієнтів з акне середньо-тяжкого та тяжкого ступеня. Серед обстежених чоловіків з акне середньо-тяжкого ступеня тяжкості результат анкетування знаходився в діапазоні від 0 до 13 балів. Середнє значення у даній групі пацієнтів становило 6, медіана – 6, мода – 6. Чоловіки з тяжким перебігом акне показали наступні результати опитування: діапазон значень складав від 2 до 15 балів; середнє значення у пацієнтів із тяжким перебігом акне становило 8,6, медіана – 9,5, мода – 10.
Серед обстежених жінок результати анкетування дещо відрізнялися від даних, що показали пацієнти чоловічої статі. У жінок з акне середньо-тяжкого ступеня тяжкості результати були в межах від 4 до 11 балів; середнє значення складало 7 балів, медіана – 7,5, мода – 8. Серед жінок, що мали тяжкий перебіг акне, результати знаходилися в діапазоні від 3 до 12 балів; середнє значення становило – 8, медіана – 9, моду для даної групи пацієнтів не вдалося визначити, оскільки кожен із отриманих результатів не повторювався (табл. 2.6).
Можна відмітити, що акне сильно впливав на психоемоційний стан пацієнтів з даною патологією. Як можна бачити з результатів анкетування, у всіх групах опитаних було встановлено значний вплив захворювання на психоемоційний стан пацієнтів.
Таблиця 2.6 – Дані анкетування за шкалою CADI пацієнтів з акне
| Група
Значення |
Жінки | Чоловіки | ||
| Середньо-тяжкий перебіг | Тяжкий перебіг | Середньо-тяжкий перебіг | Тяжкий перебіг | |
| Середнє значення | 7 | 8 | 6 | 8,6 |
| Медіана | 7,5 | 9 | 6 | 9,5 |
| Мода | 8 | – | 6 | 10 |
Окрім того, згідно з даними проведеного анкетування, жінки із середньо-тяжким перебігом акне частіше вказували на високий вплив захворювання на психоемоційний стан порівняно з чоловіками, проте чоловіки із тяжким перебігом акне вказували на більш виражений вплив захворювання на їхню психоемоційну сферу, порівняно із жінками з аналогічною формою акне.
2.5.2 Оцінювання за шкалою DLQI
DLQI – дерматологічний індекс якості життя – використовується дерматологами для оцінки ступеня негативного впливу дерматологічного захворювання на різні аспекти життя пацієнта, що характеризує якість його життя в цілому. Індекс був розроблений спеціалістами Уельського університету у 1992 році. Анкета призначена для пацієнтів віком від 14 років. Питання опитувальника адресовані безпосередньо пацієнтові, тому відповідати на них він має самостійно. Цифровий показник, що отримується в результаті аналізу відповідей, відображує рівень негативного впливу захворювання на якість життя пацієнта.
Анкета містить 10 питань, кожне з яких має чотири варіанти відповіді: дуже сильно, значно, трохи, зовсім ні (за винятком одного запитання, що містить два варіанти відповіді – так або ні).
Метою опитування є визначення того, якою мірою проблеми зі шкірою впливали на життя пацієнта протягом останнього тижня. Одне з питань стосується суб’єктивних відчуттів хворого (наскільки сверблячою, чутливою, болісною чи пекучою була шкіра протягом останнього тижня), ще одне питання стосується проблеми отримання лікування – якою мірою лікування шкіри створювало проблеми у розпорядку дня та забирало час; решта питань торкаються соціального компоненту життя пацієнта: якою мірою Ви ніяковіли або соромилися через проблеми зі шкірою, наскільки сильно проблеми зі шкірою впливали на похід за покупками чи догляд за помешканням, наскільки сильно проблеми зі шкірою впливали на вибір одягу, спілкування з іншими людьми, проведення дозвілля, заняття будь-яким видом спорту, чи заважали проблеми зі шкірою навчатися або працювати, чи виникали труднощі у відносинах із друзями, статевими партнерами.
Кожне питання оцінюється за шкалою від 0 до 3 балів, питання, що містить два варіанти відповідей оцінюється у 0 або 3 бали. Таким чином, результат може знаходитись у діапазоні від 0 до 30 балів (табл. 2.7).
Серед обстежених чоловіків з акне середньо-тяжкого ступеня тяжкості результат анкетування знаходився в діапазоні від 0 до 4 балів. Середнє значення у даній групі пацієнтів становило 2,6, медіана – 2,5, мода – 4. Чоловіки з тяжким перебігом акне показали наступні результати опитування: діапазон значень був у межах від 5 до 22 балів; середнє значення у пацієнтів із тяжким перебігом акне складало 10,9, медіана – 9,5, мода – 8.
Серед обстежених жінок результати анкетування дещо відрізнялися від даних, що показали пацієнти чоловічої статі. У жінок з акне середньо-тяжкого ступеня тяжкості результати були в межах від 1 до 7 балів; середнє значення становило 4,8 балів, медіана – 5, мода – 7. Серед жінок, що мали тяжкий перебіг акне, результати знаходилися в діапазоні від 6 до 15 балів; середнє значення складало – 11,1, медіана – 11, мода – 11 (табл. 2.8).
Таблиця 2.7 – Трактування значень індексу DLQI
| Значення індексу | Трактування |
| 0-1 | Шкірне захворювання не впливає на життя пацієнта |
| 2-5 | Захворювання незначно впливає на життя пацієнта |
| 6-10 | Захворювання помірно впливає на життя пацієнта |
| 11-20 | Захворювання має дуже сильний вплив на життя пацієнта |
| 21-30 | Захворювання має надзвичайно сильний вплив на життя пацієнта |
Таблиця 2.8 – Дані анкетування за шкалою DLQI пацієнтів з акне
| Група
Значення |
Жінки | Чоловіки | ||
| Середній перебіг | Тяжкий перебіг | Середній перебіг | Тяжкий перебіг | |
| Середнє значення | 4,8 | 11,1 | 2,6 | 10,9 |
| Медіана | 5 | 11 | 2,5 | 9,5 |
| Мода | 7 | 11 | 4 | 8 |
Можна відмітити, що як у жінок, так і у чоловіків із середнім перебігом акне захворювання мало незначний вплив на якість життя пацієнтів, проте у жінок даний показник був у 2 рази вищим, ніж у чоловіків, що вказує на більшу соціальну та психоемоційну напруженість у зв’язку з наявністю захворювання.
Серед жінок із тяжким перебігом акне було виявлено дуже сильний вплив на якість життя та психоемоційний стан хворих. Серед чоловіків із тяжким перебігом даного дерматозу в середньому був виявлений помірний вплив акне на якість життя. Проте в окремих індивідів показники опитувальника сягали 20–22 балів.
* * *
У розділі наведено сучасні класифікації акне, що дозволяють чітко ідентифікувати клінічні форми захворювання із формуванням підгруп. Усього у дослідженні взяло участь 95 осіб (84 хворих на акне середньо-тяжкого і тяжкого ступеня та 11 батьків пацієнтів). За особливостями клінічної картини всі хворі були поділені на дві групи по 42 людини в кожній. Кожна з груп була розділена на дві підгрупи залежно від статі.
Був проведений ретельний аналіз сімейного анамнезу, клінічних проявів хвороби по групах. Було встановлено, що тривалість захворювання в середньому становила 5,2 роки, дебют акне відмічався в середньому у віці 15 років. 75 (92,6 %) пацієнтів відмічали зв’язок між дебютом захворювання та статевим дозріванням.
67 пацієнтів (79,8 %) відмічали, що захворювання у них починалося поступово.
Було проаналізовано наявність супутньої патології у хворих на акне. У 4 пацієнтів (4,8 %) були наявні вузлові утворення щитоподібної залози різного ступеня, проте в усіх хворих патологія була гормонально компенсована. 7 (16,3 %) пацієнток вказали на наявність у них СПКЯ. 12 хворих (14,3 %) мали в анамнезі хронічний гастрит, що в період проведення даного дослідження перебував у стадії стійкої ремісії. У двох пацієнтів з фульмінантним акне були наявні прояви поліартриту. Усі пацієнти проходили загальноклінічні обстеження: загальний аналіз крові з лейкоцитарною формулою, глюкоза крові, біохімічний аналіз крові (АлАТ, АсАТ, загальний білок, креатинін, сечовина, СРБ, ревматоїдний фактор), аналіз крові на мікрореакцію преципітації для експрес-діагностики сифілісу, загальний аналіз сечі. У всіх пацієнтів, за винятком двох хворих на фульмінантні акне, усі загальноклінічні показники знаходились у межах норми. Пацієнти з проявами фульмінантного акне мали зміни в бік підвищення таких показників, як: загальний білок, СРБ. Також у даних хворих був наявний помірний лейкоцитоз (до 12 х 109/л). Усі пацієнти були обстежені на наявність демодекозу як ускладнення основного захворювання. У 15 (17,9 %) хворих був виявлений Demodex folliculorum у значній кількості. Дана категорія пацієнтів отримала лікування від демодекозу, після чого був проведений контроль виліковності. У пацієнтів із середньо-тяжким перебігом акне демодекоз був виявлений у 4 хворих, а серед пацієнтів із тяжким перебігом – у 11.
Було проведено оцінку впливу захворювання на якість життя пацієнтів (n=78) із використанням спеціально розроблених опитувальних листів CADI, що оцінював психоемоційну напруженість пацієнта та вплив акне на якість життя пацієнта та DLQI, що оцінює вплив дерматологічної патології на повсякденне життя пацієнта. Усього за обома шкалами було проанкетовано 78 пацієнтів із середнім та тяжким перебігом акне. Серед них було 36 жінок (22 – з акне середньо-тяжкого ступеня тяжкості та 14 – із тяжким перебігом) і 42 чоловіки (14 – мали акне середньо-тяжкого ступеня тяжкості та 28 – тяжкий перебіг).
За опитувальником CADI жінки із середньо-тяжким перебігом акне частіше вказували на високий вплив захворювання на психоемоційний стан порівняно з чоловіками, проте чоловіки із тяжким перебігом акне вказували на більш виражений вплив захворювання на їхню психоемоційну сферу, порівняно із жінками з аналогічною формою акне.
За опитувальником DLQI серед жінок із тяжким перебігом акне було виявлено дуже сильний вплив на якість життя та психоемоційний стан хворих, серед чоловіків із тяжким перебігом даного дерматозу в середньому був виявлений помірний вплив акне на якість життя, проте в окремих індивідів показники опитувальника сягали 20–22 балів.
Наведені у розділі положення висвітлені у наступних публікаціях:
- Літус О.І., Петренко А.В. Психоемоційний стан хворих на акне із урахуванням тяжкості перебігу та спадкової схильності. Дерматовенерологія. Косметологія. Сексопатологія. 2016. № 3–4. С. 10–12 [22].
- Petrenko A.V., Litus O.I. Study of psycho-emotional state of patients with acne depending on the severity and hereditary factors. Galician medical journal. 2017. № 2 (27). URL: http://ojs.ifnmu.edu.ua/index.php/gmj/article/view/790 [21].
- Петренко А.В., Приходько І.В. Аналіз патогенетичних складових у випадку фульмінантного акне. Дерматовенерологія. Косметологія. Сексопатологія. 2017. № 1–2 (5). С. 97–100 [41].
- Petrenko A.V. A case of acne fulminans. Abstracts of the 26th EADV Conference, Geneva, 13-17 September 2017. Geneva, Switzerland, 2017. Abstract ID 3214 [162].
РОЗДІЛ 3
ОСОБЛИВОСТІ КЛІНІЧНИХ ПРОЯВІВ ТА ОБТЯЖЕНІСТЬ СІМЕЙНОГО АНАМНЕЗУ У ХВОРИХ НА АКНЕ
3.1 Сучасний погляд на роль спадковості у хворих на акне
Відомо, що захворюваність на акне серед школярів є високою та залежить від віку. Початок пубертату, надлишкова вага та опасистість, акне у батьків є провідними факторами для виникнення акне [114]. Роль генетичної схильності в розвитку акне з’ясована не остаточно, але відомо, що вона має мультифакторіальний характер. Встановлено, що кількість та розмір сальної залози та її наступна активність є вродженими, а конкордатність за схильністю та тяжкістю перебігу акне у ідентичних близнюків є дуже високою. Також широко відомо, що акне, включаючи вузлувато-кістозне акне, спостерігається в родинах хворих, але навіть при високій розповсюдженості захворювання важко довести наявність генетичних факторів [20, 22, 32].
Згодом було розпізнано деякі генетичні фактори. Так, був узятий до уваги високий збіг прояву хвороби серед ідентичних близнюків, також відома схильність до тяжкої форми акне у пацієнтів з позитивною сімейною історією акне. До цього часу мало що відомо про конкретні спадкові механізми. Цілком імовірно, що кілька генів відповідають за схильність до акне. До них належать гени цитохрому З450-1А1 і стероїд-21-гідроксилази. Расові та етнічні чинники також можуть внести свій вклад у відмінності в поширеності, тяжкості клінічних проявів та в наслідки акне [76, 105, 161]. Деякі спостереження за близнюками, родинами хворих засвідчили, що наявність акне серед родичів першої ланки – особливо матерів – має сильний вплив на вік початку захворювання, тяжкість перебігу та успіх від лікування [113, 135]. У пацієнтів із себореєю та акне відзначається значно більша кількість секреторних часточок у залозі порівняно з цим показником у здорових осіб (так звані генетично схильні). Запальні реакції проявляються до гіперпроліферації кератиноцитів. Зворотна регуляція інтерлейкіном-1α сприяє розвитку комедонів, незалежних від колонізації P. аcnes [59, 131].
Серед 211 високорегулюючих та 18 слабкорегулюючих генів в ураженій акне шкірі, порівняно з нормальною шкірою, значна доля належить тим, що впливають на регуляцію запалення. Акне – одне з найбільш розповсюджених захворювань шкіри, і відомо, що андрогени відіграють ключову роль у розвитку даного захворювання. Однак генетичні механізми, при яких ген андрогенного рецептора спричиняє акне, – невідомі. Обстежували 238 хворих на акне та 207 осіб контроля. Вивчали поліморфізми CAG та GGN гена андрогенного рецептора, асоційованого із акне. У чоловіків із CAG <23 та у жінок із CAG <24 був значний ризик акне порівняно з більш високими показниками. Це дослідження чітко визначило, що більш коротка CAG повторює довжину та специфічні гаплотипи гена андрогенного рецептора, що може бути ризиком розвитку акне та слугувати маркером схильності до акне [158].
Пік пренатальних андрогенів співпадає і з розвитком сальних залоз і пальців. Ці сучасні генетичні спостереження провели за 251 хворим на акне та 120 особами здорового контролю (72,5 % жінки) у віці 16-40 років. Відношення між довжиною пальців 2D:4D у жінок із акне були нижчими, ніж у здорових жінок. Однак у чоловіків із акне не було цієї різниці зі здоровими [71, 107, 137]. Також встановлено спадковість майже у 80 % родичів першого ступеня хворих на акне. При позитивній родинній історії акне виникає раніше та відзначається більш тяжким перебігом [6, 20, 33, 38, 40, 70].
3.2 Сімейний анамнез у обстежених хворих на акне
Було встановлено, що у пацієнтів з акне практично з однаковою частотою відмічалось успадкування акне як за батьківською (28,6 %), так і за материнською (26,2 %) лініями (рис. 3.1).

Рисунок 3.1 – Частота і тип успадкування акне у хворих на даний дерматоз
Сімейні випадки захворюваності на акне у тій чи іншій формі загалом ідентифіковано у 63 осіб (75,0 %). Було проведено детальне дослідження сімейного анамнезу в обстежуваних хворих. По можливості було визначено, хто саме з родичів страждав на акне у молодому віці з метою з’ясування їх ступеня родинності по відношенню до пробанда та належності до батьківської чи материнської ліній (табл. 3.1).
Таблиця 3.1 – Аналіз сімейного анамнезу залежно від наявності акне у молодому віці у родичів пробанда
| Родич пробанда | Ступінь тяжкості акне у родича пробанда (n=63) | ||
| Легкий | Середній | Тяжкий | |
| Батько | 2 | 16 | 6 |
| Мати | 7 | 10 | 5 |
| Рідний брат | 6 | 3 | 1 |
| Рідна сестра | 4 | 2 | 1 |
| Всього | 19 (30,2 %) | 31 (49,2 %) | 13 (20,6 %) |
У 24 осіб (38,1 %) акне простежується по батьківській лінії, при чому у більшості з них, а саме у 16 (25,4 % від загальної кількості родичів пробандів) у молодому віці мали місце акне середнього ступеня тяжкості. По материнській лінії акне відмічались у 22 осіб (34,9 %), причому більшість матерів також мали акне середнього ступеня тяжкості. Рідні брати пробандів хворіли на акне у 10 (15,9 %) випадках та мали переважно легкий перебіг акне, а рідні сестри – у 7 (11,1 %) та також страждали на легкий перебіг даного захворювання.
Серед усіх родичів пробандів, що вказали на наявність у себе акне в минулому, для молекулярно-генетичного обстеження було обрано тих батьків, матерів, брата, сестру, що мали тяжкий перебіг даного дерматозу. Таким чином, молекулярно-генетичне обстеження пройшли всі пацієнти з акне, що брали участь у дослідженні, 6 батьків, 5 матерів. В одному випадку пацієнти з тяжким перебігом акне були рідними братом та сестрою. При аналізі сімейного анамнезу в різних статевих групах пацієнтів з акне встановлено, що серед чоловіків частота випадків з обтяженою за акне спадковістю була вищою, ніж серед жінок (табл. 3.2).
Таблиця 3.2 – Сімейний анамнез в різних статевих групах пацієнтів з акне
| Сімейний анамнез | Чоловіки | Жінки | ||
| Абсолютні значення, n | Відсоток, % | Абсолютні значення, n | Відсоток, % | |
| Наявний | 39 | 92,9 | 24 | 57,1 |
| Відсутній | 3 | 7,1 | 18 | 42,9 |
| Всього | 42 | 100,0 | 42 | 100,0 |
3.3 Характеристика хворих на акне з урахуванням обтяженості сімейного анамнезу
У 11 хворих та їхніх батьків вивчалися поліморфні варіанти генів TLR-2 (G753A), TLR-4 (C399T), IL-1β (C3953T), IL-8 (С781Т). Для обстеження були залучені саме ті з батьків, які хворіли на тяжку форму акне в підлітковому віці або мали прояви ураження сальних залоз і на сьогодні. Таким чином, було обстежено 11 сімей хворих на акне (пацієнт разом із одним з батьків, який вказував на наявність виражених проявів даного захворювання у себе у підлітковому та/або молодому віці) (табл. 3.3).
Таблиця 3.3 – Результати генетичного обстеження у пацієнтів з акне та одного з батьків
| Ген | TLR-4 (C399T) | IL-1β (C3953T) | IL-8 (С781Т) | |||
| Обстежені | П | Б/м | П | Б/м | П | Б/м |
| Ч-б | CT | CT | CT | CT | СС | СТ |
| Ч-б | CT | CT | CT | CC | СС | СТ |
| Ч-б | CC | CC | CT | CT | СТ | ТТ |
| Ч-м | CC | CC | CT | CT | СТ | СТ |
| Ч-б | CC | CC | CT | CT | СТ | ТТ |
| Ч-м | CC | CT | CT | CC | ТТ | СТ |
| Ж-м | CC | CC | CT | TT | CC | CT |
| Ж-м | CC | CC | CC | CC | TT | CT |
| Ч-б | CC | CC | CC | CT | CT | CT |
| Ч-б | СС | СС | СС | СС | СТ | СТ |
| Ч-м | СС | СС | ТТ | СТ | СС | СС |
Примітка. П – пацієнт, Б/м – батько/матір, Ч-б – чоловік-батько, Ч-м – чоловік-матір, Ж-м – жінка-матір.
Серед пацієнтів було 9 хворих чоловічої статі віком 14–32 роки та 2 дівчини віком 14 та 18 років. З них 6 чоловіків пройшли обстеження з батьком, 3 чоловіки – з матір’ю та 2 жінки також обстежилися з матір’ю. Слід зауважити ще раз, що другий з батьків не мав ніколи проблем із шкірою обличчя.
У всіх 11 пацієнтів був тяжкий перебіг акне з висипом на шкірі обличчя, грудей та верхньої третини спини. Висип був представлений папульозно-пустульозними елементами, що займали більше 70 % поверхні зазначених ділянок. У трьох пацієнтів чоловічої статі крім того були присутні вузлові та кистозні елементи висипки з рубцевими змінами на місцях попереднього висипу. Також у всіх обстежених відмічалися чисельні відкриті та закриті комедони, серозно-гнійні та серозно-геморагічні кірочки на поверхні деяких пустул.
Хворі відмічали початок захворювання у віці 13–18 років, більшість з них перші роки захворювання не зверталися по спеціалізовану медичну допомогу, лікуючись самостійно або у косметолога. Значне погіршення перебігу акне починалося в середньому через 2,5 роки від початку захворювання. На момент огляду вищеописані пацієнти випробували на собі практично весь загальновідомий арсенал місцевих лікувальних засобів від акне, що давали короткотривалий незначний ефект.
Був детально зібраний анамнез, у тому числі й сімейний, що дало змогу відслідкувати наявність у минулому тяжкого перебігу акне у найближчих родичів пацієнтів. Таким чином, було вирішено обстежити пацієнтів та одного з батьків на наявність генних мутацій, що могли б свідчити про спадкову схильність до тяжкого перебігу акне. Для дослідження було обрано чотири гени, які згідно останніх літературних даних можуть мати зв’язок з наявністю акне: поліморфізм G753A гену TLR-2, поліморфізм C399T гену TLR-4, поліморфізм C3953T гену IL-1β та поліморфізм С781Т гену IL-8.
За геном TLR-2 (G753A) всі обстежені мали гомозиготний генотип 753GG.
За геном TLR-4 (C399T) у двох пацієнтів, що обстежувалися з батьком, були виявлені мутації за даним геном – і в дітей, і в батьків був виявлений гетерозиготний генотип 399СТ. В одного чоловіка, що обстежувався з матір’ю, був виявлений гомозиготний генотип 399СС за даним геном, проте у матері за даним геном був наявний гетерозиготний генотип 399СТ. У решти обстежених хворих та їхніх батьків/матерів був нормальний гомозиготний генотип 399СС.
За геном IL-1β (C3953T) тільки в однієї дівчини та її матері, а також у хлопця з батьком був гомозиготний генотип 3953СС, у решти родин були виявлені гетерозиготні генотипи 3953СТ або гомозиготні генотипи 3953ТТ у пацієнта та/або батька/матері. У трьох чоловіків, обстежених з батьком, та одного чоловіка, обстеженого з матір’ю, всі обстежені мали гетерозиготний генотип 3953СТ. В одного чоловіка, що обстежувався з батьком, та одного чоловіка, що обстежувався з матір’ю, був виявлений гетерозиготний генотип 3953СТ, проте їхні батько/матір мали нормальний генотип 3953СС. В одного хлопця був виявлений нормальний генотип 3953СС за даним геном, проте його батько мав гетерозиготний варіант за даним геном. У однієї пацієнтки була виявлена гетерозиготна мутація 3953СТ, а у її матері було виявлено гомозиготну мутацію 3953ТТ. Одна з пацієнток мала гомозиготний генотип 3953ТТ, а її матір – гетерозиготний генотип 3953СТ.
За геном IL-8 (С781Т) два пацієнти, що обстежувалися з батьком, та одна дівчина, що обстежувалася з матір’ю, мали нормальний генотип 3953СС, проте їхні батьки мали гетерозиготні варіанти. Два хлопці, що обстежувалися з батьком, та один, що обстежувався з матір’ю, мали гетерозиготні генотипи серед усіх обстежених. Два хлопці, що обстежувалися з батьком, мали гетерозиготний варіант генотипу, проте їхні батьки мали гомозиготний варіант 3953ТТ. Один чоловік та одна дівчина, що обстежувалися з матерями, мали гомозиготний варіант 3953ТТ, а їхні матері – 3953СТ. Лише один хлопець та його матір серед усіх обстежених мали нормальний гомозиготний генотип 3953СС.
Таким чином, у всіх обстежених хворих на акне їхні батьки мали мутацію хоча б за одним із зазначених генів, що дозволяє припустити вплив даних генів на наявність та тяжкість перебігу акне. Гомозиготні варіанти ТТ були виявлені лише у двох обстежених – у двох пацієнтів та двох батьків за геном IL-8 (С781Т) та одного пацієнта та однієї матері за геном IL-1β (C3953T). Найбільша кількість мутацій, як у пацієнтів, так і у батьків була виявлена за генами IL-1β (C3953T) та IL-8 (С781Т).
* * *
У розділі описано сучасні погляди на роль спадковості у хворих акне, описані патогенетичні фактори, що сприяють розвитку даного захворювання.
Проаналізовано дані сімейного анамнезу пацієнтів з акне, частоту та тип успадкування у хворих, тяжкість перебігу захворювання у родичів пробанда у минулому. Встановлено, що у 38,1 % осіб акне простежувалося по батьківській лінії, а у 34,9 % – по материнській, причому більшість батьків та матерів у минулому мали акне середнього ступеня тяжкості.
Проведено молекулярно-генетичне обстеження хворих на акне з одним з батьків, що вказав на наявність у себе тяжкого перебігу акне у минулому (6 батьків, 5 матерів).
Було виявлено, що у всіх обстежених хворих на акне їхні батьки мали варіанти генотипу СТ або СС за геном TLR-4 (C399T); СС, СТ або ТТ за геном IL-1β (C3953T); СС, СТ або ТТ за геном IL-8 (С781Т).
Наведені у розділі положення висвітлені у наступних публікаціях:
- Литус А.И., Петренко А.В. Особенности патогенетической характеристики акне с учетом функционального состояния кожи и наследственной склонности. Международный научно-практический журнал Дерматовенерология. Косметология. 2016. Т. 2, № 2. С. 208–212 [20].
- Петренко А.В. Аналіз сімейної схильності при акне. Матеріали Регіональної науково-практичної конференції «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом», м. Святогірськ, 12-13 травня 2016 р. Святогірськ, 2016. С. 27 [32].
- Петренко А.В. Генні порушення, як безумовний фактор спадковості у хворих на акне. Матеріали 40-вої ювілейної науково-практичної конференції молодих вчених НМАПО імені П.Л. Шупика з міжнародною участю, присвяченої Дню науки: «Інновації в медицині: досягнення молодих вчених», м. Київ, 18 травня 2017 р. Київ, 2017. С. 48-50 [37].
РОЗДІЛ 4
ОСОБЛИВОСТІ ФЕНОТИПІЧНИХ ПРОЯВІВ АКНЕ
ЗАЛЕЖНО ВІД ВАРІАНТІВ ГЕНОТИПІВ
4.1 Сучасні дослідження молекулярно-генетичних особливостей
у патогенезі акне
Значну роль у розвитку патологічного процесу при акне відіграє імунна система. Показано, що такі прозапальні чинники, як IL-1α, IL-1β, IL-8, фактор некрозу пухлини – альфа (TNF-α) впливають на стінку сально-волосяного фолікула та активізують кератинізацію. Прозапальні цитокіни через активацію циклооксигенази трансформують арахідонову кислоту в лейкотрієн В4. Це слугує початком виникнення каскаду імунологічних реакцій [58, 146]. У хворих на акне встановлено гіперпродукцію TNF-α та трансформуючого фактора росту – бета (ТGF-β), що сприяє активації клітинно-опосередкованих реакцій і схильності до формування фіброзу [15].
Розрізняють два імунних механізми проти інвазії патогенів: внутрішній (природний) та адаптивний (набутий) імунітет. Адаптивний (син.: набутий, лімфоцитарний) імунітет існує лише в 1,5 % усіх видів организмів, які існують на землі. Система вродженого захисту (син.: неспецифічний імунітет, вроджений імунітет) є філогенетично більш старою та присутня майже в усіх багатоклітинних організмах. Природний імунітет усуває з таких фізичних бар’єрів, як епітелій, слизова оболонка, інфекцію та формує негайну клітинну відповідь. Відповіді на запалення «вроджених» імунних клітин, таких як гранулоцити та макрофаги, можуть бути запущені швидко, дещо пізніше настає активація дендритичних клітин та природних кілерів [140]. Вроджений імунітет розпізнає патологічні мікроорганізми, а потім індукує захисну відповідь хазяїна. За даними дослідження, спрямованого на вивчення активації адаптивного і вродженого імунітету при ранніх проявах акне, значно підвищуються рівні цитокінів лінії Th17. Цитокіни, що беруть участь у диференціації лінії Th17 (IL-1β, IL-6, TGF-b, IL23p19) індуковані на рівні РНК, також індуковані і прозапальні цитокіни та хемокіни. Дослідження виявило наявність IL-17A-позитивних Т-клітин і активацію Th17-пов’язаних цитокінів при акне [118].
Встановлено, що механізм розпізнавання рецепторів знаходиться на патоген-асоційованих молекулярних патернах, що зберігаються серед мікроорганізмів. Найбільш повно вивченими рецепторами з групи патогенрозпізнаючих рецепторів є Toll-подібні рецептори (TLR), які розпізнають молекулярні патерни різних мікроорганізмів (бактерії, дріжджові гриби та віруси). На сьогодні описано більш ніж 11 типів TLR [9, 112].
Природна імунна система розпізнає патогени патоген-асоційованими молекулярними примірниками (РАМР), включаючи молекули грампозитивних та грамнегативних бактерій, ДНК та РНК вірусів, грибів, найпростіших та вказує на цільову специфічність. Рецептори ссавців відповідні за розпізнавання РАМР, а PRR (pattern recognisation receptors) – це примірник розпізнаючого рецептора. Неспроможність імунної системи розпізнавати патогени РАМР може привести до уповільнення або притуплення імунної відповіді. Більшість розпізнаючих рецепторів природної імунної системи є TLR, дрімливими рецепторами (NLR), RIG-I-подібними рецепторами (RLR) [31, 33, 34, 52, 139, 185, 186].
Один із механізмів формування акне полягає в ролі TLR, які опосередковують розпізнавання мікробних патогенів такими імунними клітинами, як моноцити, макрофаги та поліморфноядерні клітини. TLR2 виявили на поверхні моноцитів, які оточують фолікул при акне. Показано, що P. acnes вивільняють такі запальні медіатори, як IL-1α, IL-8 та TNF-α завдяки TLR2. Збільшення рівня IL-8 є результатом вивільнення лізосомальних ензимів з наступною деструкцією фолікулярного епітелію. Іншим запальним механізмом при акне є надмірна регуляція бета-дефензину‑1 та -2 людини. Серед 211 високомолекулярних та 18 низькомолекулярних генів в ураженій шкірі хворих на акне, порівняно з нормальною шкірою, значною складовою є шлях, який регулює запалення. Незначні запальні інфільтрати навколо вивідних протоків сальної залози та пізніше перифолікулярне запалення, підвищена цитокінова експресія з РНК та рівні протеїну приховано асоційовані з утворенням комедонів і не дають розвитися їм у пізній стадії запалення. TLR – трансмембранні рецептори, які складаються з позаклітинної частини, збагаченої лейцином та внутрішньоклітинного домену (гомологічного внутрішньоклітинного домену IL-1). При акне експресія TLR2 визначалася в біоптатах, особливо в перифолікулярних ділянках, спираючись на те, що кількість TLR2-позитивних клітин збільшується при тривалому перебігу акне. Була показана позитивна кореляція між тяжкістю акне та концентрацією клітин, які експресують TLR2 [36, 37, 162]. Продемонстровано, що TLR2 на моноцитах людини може бути активована P. acnes in vitro, що проявляється у збільшенні продукції IL-12 та IL-8. Кератиноцити та себоцити, які локалізовані поблизу пілосебаційного комплексу, здатні визначати і патогени, і ненормальні ліпіди. Себоцити людини експресують вроджені імунні молекули, такі як TLR2, TLR4, IL-1β, IL-6, CD1d и CD14. Таким чином, кератиноцити та себоцити можуть бути активовані P. acnes та регулювати вміст ліпідів у шкірному салі і продукувати інтерлейкіни [61, 66, 95, 109, 110]. Показано, що P. acnes може активувати TLR на кератиноцитах, що призводить подальшої продукції таких прозапальних цитокинів, як IL-8 та металопротеази [36, 37, 126, 144, 166].
P. acnes активує вроджений імунітет шляхом стимуляції TLR та протеазоактивованих рецепторів (PARs) на клітинах фолікулів (здебільшого кератиноцити та клітини Лангерганса), індукує секрецію антимікробних пептидів цими клітинами та себоцитами, призводячи до хронічного запалення фолікула [73]. Механізм запалення, який спровокований P. acnes, активує клас рецепторів імунної системи, які відомі як TLR, особливо TLR2 та TLR4 [81].
Термін цитокіни охоплює велику родину низько-молекулярних носіїв субстанцій, які відіграють провідну роль у міжклітинній комунікації. Цитокіни секретує майже будь-яка клітина, їх дія може реалізовуватись автокринним, паракринним або ендокринним способом. Цитокіни проявляють свою різноманітну біологічну активність шляхом поєднання зі специфічними рецепторами клітинної поверхні. При тому, що більшість цитокінів перебувають у розчинній формі, деякі можуть бути пов’язаними з мембранами, що робить складною диференціацію між цитокінами та рецепторами. Цитокіни впливають на проліферацію, диференціацію та активацію клітин. Кожний цитокін здійснює багато впливів, наявність яких не дозволяє провести чітке розподілення. Цитокіни, які продукуються лейкоцитами та впливають на білі клітини крові, мають назву IL. Колоніє-стимулюючий фактор означає ті медіатори, які індукують диференціацію клітин та проліферацію гемопоетичних материнських клітин. При реакції вродженого імунітету включаються більшість цитокінів із запальними (IL-1, IL-6, TNF-a, запальні цитокіни) та з антивірусними (інтерферон-α, -β) можливостями. При індукції ж адаптивного імунітету імунна відповідь залежить від цитокінів з імуномодуляторними можливостями (IL-2, -4, -10,
-12, -13, -18, -23, інтерферон-γ). Однак, ці медіатори презентують множинну або іноді перехресну активність, чому не завжди можливо відокремити запальні та імунологічні цитокіни [197].
TLR-специфічні сполуки з молекулярними структурами мікроорганізмів, що супроводжуються зміною конформації внутрішньоклітинного домену та активацією тимчасової сигналізації багатокомпонентної молекулярної структури, остаточно призводять до вивільнення антимікробних пептидів (дефізину, кателецитину) та цитокінів (IL-1β, -4, -5, -6, -8, -10, -12), що опосередкують запальну реакцію [31, 36, 37, 143, 148].
Важливим фактором, який стимулює проліферацію кератиноцитів, є саме цитокіни. В експерименті показано, що утворення комедонів було індуковано ІЛ-1α та блокувалось ІЛ-1 рецептором-антагоністом. ІЛ-1α виявлено на незапальних ділянках, які уражені акне, в незначній кількості.
Активація TLR2 та TLR4 P. acnes призводить до збільшення секреції IL-8, TNF-α та IL-1α. IL-1α, у свою чергу, стимулює більш високу активність кератиноцитів та репродукцію, яка забезпечує розвиток комедонів. Клітини сальних залоз також редукують більше антимікробних пептидів, таких як HBD1 та HBD2 у відповідь на зв’язок із TLR2 та TLR4 [81].
Проліферація та диференціація кератиноцитів регулюється ліпідами. За рахунок діапедезу та екстравазації (рух фагоцитів у дерму) відбувається накопичення в дермі імунокомпетентних клітин – нейтрофілів, макрофагів, базофілів, лімфоцитів, які, у свою чергу, продукують прозапальні монокіни та цитокіни – IL-8, -1β, активатори циклогенази. Внаслідок цих перетворень запускається лізис стінок чужорідних агентів і фагоцитоз. Із ризиком розвитку акне пов’язані також гени TNF. До того ж, встановлено поліморфізм TNF-α, IL-1α та CYP1A1 [34, 133, 162].
Прозапальні фактори, такі як IL-1α, -1β, -8; TNF-α, діючи на сально-волосяний фолікул, активують процеси кератинізації, вносячи суттєвий внесок у реалізацію фолікулярного гіперкератозу. Концентрація ІЛ-1α в ділянці відкритих комедонів в 1000 разів перебільшує таку на ділянках здорової шкіри. ІЛ-1α активує процеси гіперкератозу шляхом прямого стимулювання рецепторів до ІЛ-1α на кератиноцитах та стимулює вивільнення інших біологічно активних молекул (наприклад, судинного ендотеліального фактора росту та білка, що зв’язує ретиноєву кислоту). Прозапальні цитокіни активують фермент циклооксигеназу, в результаті чого з арахідонової кислоти утворюється головний медіатор запалення – лейкотрієн В4, який стимулює клітини Лангерганса, нейтрофіли, Т‑лімфоцити, моноцити та еозинофіли з наступним вивільненням ними гідролітичних ферментів та монооксиду азоту.
4.2 Молекулярно-генетичні аспекти у хворих на акне
Усі пацієнти, що брали участь у дослідженні, проходили молекулярно-генетичне обстеження за генами TLR-4 (C399T), IL-1β (C3953T), IL-8 (С781Т) та були поділені на дві групи залежно від ступеня тяжкості акне. Окрім того, 29 пацієнтів та 6 батьків були обстежені за геном TLR-2 (G753A), але оскільки у всіх обстежених за даним геном був виявлений гомозиготний генотип GG, було прийнято рішення припинити дослідження даного поліморфного варіанту у хворих на акне та їхніх батьків.
За геном TLR-4 (C399T) у досліджуваних було наявно два варіанти генотипів – СС та СТ. У всіх пацієнтів із першої групи (n=42) відмічався гомозиготний генотип СС, у другій групі (n=42) у 31 (73,8 %) хворого був гомозиготний варіант СС, а у 11 (26,2 %) – гетерозиготний генотип СТ, що достовірно пов’язано з тяжкістю перебігу акне (р<0,01). За геном IL-1β (C3953T) всього було виявлено три варіанти генотипів – СС, СТ, ТТ. Переважна більшість пацієнтів із першої групи (n=42) мали гомозиготний варіант СС за даним геном – 31 (73,8 %), а у другій групі даний варіант генотипу був виявлений у 20 (47,6 %) пацієнтів як достовірний (р<0,05); у 10 (23,8 %) хворих із першої групи та 17 (40,5 %) другої був наявний генотип СТ (р>0,05), а в 1 (2,4 %) пацієнта із середньо-тяжким перебігом акне та у 5 (11,9 %) хворих із тяжким акне був виявлений варіант генотипу ТТ (р>0,05).
За геном IL-8 (С781Т) за жодним з генотипів не було виявлено значимої різниці (р>0,05) (табл. 4.1).
Було проаналізовано частоту комбінованих генотипів за вище переліченими генами залежно від ступеня тяжкості захворювання. Значущу різницю показали два варіанти комбінацій. Комбінований генотип 399CC + 3953CC + 781CC було виявлено у 9 (21,4 %) із середньо-тяжким перебігом акне та у 1 (2,4 %) хворого на тяжкий перебіг акне (χ2 = 5,562; р<0,05; OR=0,089; 95%CI (0,01–0,74). Комбінований генотип 399CC + 3953CC + 781CT було виявлено у 21 (50 %) пацієнта із першої групи та 7 (16,7 %) хворих із другої (χ2 = 10,500; р<0,01; OR=0,2; 95%CI – 0,07–0,55) (табл. 4.2).
Таблиця 4.1 – Частота поліморфних варіантів генів TLR-4 (C399T), IL‑1β (C3953T), IL-8 (С781Т) в групах порівняння
| Ген/ поліморфізм | Генотип | Ступінь тяжкості акне | Значимість різниць | ||||
| Середній
n=42 |
Тяжкий
n=42 |
χ2 | Р | OR | 95%CI | ||
| TLR-4 (C399T) | СС | 42 (100 %) |
31 (73,8 %) |
10,461 | р<0,01 | – | – |
| СТ | 0 | 11 (26,2 %) |
10,461 | р<0,01 | – | – | |
| IL-1β (C3953T) | СС | 31 (73,8 %) | 20 (47,6 %) |
6,039 | р<0,05 | 3,1 | 1,24-7,75 |
| СТ | 10 (23,8 %) | 17 (40,5 %) |
2,674 | р>0,05 | 0,46 | 0,18-1,18 | |
| ТТ | 1 (2,4 %) |
5 (11,9 %) |
0,201 | р>0,05 | 0,18 | 0,02-1,61 | |
| IL-8 (С781Т) | СС | 16 (38,1%) | 11 (26,2 %) |
1,365 | р>0,05 | 1,73 | 0,68-4,38 |
| СТ | 25 (59,5 %) | 22 (52,4 %) |
0,435 | р>0,05 | 1,34 | 0,56-3,17 | |
| ТТ | 1 (2,4 %) |
9 (21,4 %) |
5,562 | р<0,05 | 0,089 | 0,01-0,74 | |
Окремо було проаналізовано комбінації двох генів – IL-1β (C3953T) та IL-8 (С781Т) у групах порівняння. З 9 можливих варіантів генотипу значущу різницю було виявлено лише у 1 – 3953CC + 781CT. Дану комбінацію мав 21 (50 %) пацієнт із першої групи та 11 (26,1 %) хворих із другої (χ2 = 5,048; р<0,05; OR=0,35; 95%CI – 0,14–0,88) (табл. 4.3).
Таблиця 4.2 – Частота розподілення комбінованого генотипу за генами TLR-4 (C399T), IL-1β (C3953T), IL-8 (С781Т) у групах порівняння
| Комбінація генотипів | Ступінь тяжкості акне | Значимість різниць | ||||
| Середній
n=42 |
Тяжкий
n=42 |
χ2 | Р | OR | 95%CI | |
| 399CC+3953CC+781CC | 9 (21,4 %) | 1 (2,4 %) | 5,562 | р<0,05 | 0,089 | 0,01-0,74 |
| 399CC+3953CC+781CT | 21 (50 %) | 7 (16,7 %) |
10,500 | р<0,01 | 0,2 | 0,07-0,55 |
| 399CC+3953CT+781CC | 6 (14,3 %) | 4 (9,5 %) | 0,114 | р>0,05 | 1,58 | 0,41-6,07 |
| 399CC+3953CT+781CT | 4 (9,5 %) | 7 (16,7 %) |
0,418 | р>0,05 | 0,53 | 0,14-1,95 |
| 399CC+3953CC+781TT | 1 (2,4 %) | 4 (9,5 %) | 0,359 | р>0,05 | 0,23 | 0,02-2,16 |
| 399CC+3953CT+781TT | 0 | 3 (7,1 %) | 0,120 | р>0,05 | – | – |
| 399CC+3953TT+781TT | 0 | 1 (2,4 %) | 0,500 | р>0,05 | – | – |
| 399CC+3953TT+781CC | 1 (2,4 %) | 1 (2,4 %) | 1,000 | р>0,05 | 1,00 | 0,06-16,53 |
| 399CC+3953TT+781CT | 0 | 3 (7,1 %) | 0,120 | р>0,05 | – | – |
| 399CT+3953CC+781CC | 0 | 3 (7,1 %) | 0,120 | р>0,05 | – | – |
| 399CT+3953CC+781CT | 0 | 4 (9,5 %) | 0,116 | р>0,05 | – | – |
| 399CT+3953CT+781CC | 0 | 2 (4,8 %) | 0,500 | р>0,05 | – | – |
| 399CT+3953CT+781CT | 0 | 1 (2,4 %) | 1,000 | р>0,05 | – | – |
| 399CT+3953CC+781TT | 0 | 1 (2,4 %) | 1,000 | р>0,05 | – | – |
Таблиця 4.3 – Частота розподілення комбінованого генотипу за генами IL‑1β (C3953T), IL-8 (С781Т) у групах порівняння
| Комбінація генотипів | Ступінь тяжкості акне | Значимість різниць | ||||
| Середній
n=42 |
Тяжкий
n=42 |
χ2 | Р | OR | 95%CI | |
| 3953CC+781CC | 9 (21,4 %) | 4 (9,5 %) | 1,456 | р>0,05 | 2,59 | 0,73-9,19 |
| 3953CC+781CT | 21 (50,0 %) | 11 (26,1 %) | 5,048 | р<0,05 | 0,35 | 0,14-0,88 |
| 3953CT+781CC | 6 (14,3 %) | 6 (14,3 %) | 0,097 | р>0,05 | 1,00 | 0,29-3,39 |
| 3953CT+781CT | 4 (9,5 %) | 8 (19,0 %) | 0,875 | р>0,05 | 0,45 | 0,12-1,61 |
| 3953CC+781TT | 1 (2,4 %) | 5 (11,9 %) | 0,201 | р>0,05 | 0,18 | 0,02-1,61 |
| 3953CT+781TT | 0 | 3 (7,1 %) | 0,120 | р>0,05 | – | – |
| 3953TT+781TT | 0 | 1 (2,4 %) | 1,000 | р>0,05 | – | – |
| 3953TT+781CC | 1 (2,4 %) | 1 (2,4 %) | 1,000 | р>0,05 | 1,00 | 0,06-16,53 |
| 3953TT+781CT | 0 | 3 (7,1 %) | 0,120 | р>0,05 | – | – |
* * *
У розділі описано сучасні погляди на роль вродженого та набутого імунітету на розвиток акне.
Систематизовано результати молекулярно-генетичного дослідження, що проводилося всім досліджуваним. Виявлено розподіл поліморфних варіантів за генами TLR-4 (C399T), IL-1β (C3953T), IL-8 (С781Т) у групах порівняння.
Проаналізовано частоту розподілу комбінованого генотипу за генами TLR-4 (C399T), IL-1β (C3953T), IL-8 (С781Т) та частоту розподілення комбінацій за генами IL-1β (C3953T), IL-8 (С781Т) у групах порівняння.
Було виявлено асоціацію між наявним у пацієнтів генотипом 388СТ за геном TLR-4 та підвищеною схильністю до тяжкого перебігу акне. Також було встановлено, що частота гетерозиготного варіанту за геном IL-1β (3953СT) була значуще збільшена серед пацієнтів із середньо-тяжким ступенем тяжкості акне.
Показано, що ризик розвитку тяжких форм акне значуще зростав при наявності у пацієнтів генотипу 781ТТ за геном IL-8.
Встановлено, що комбіновані генотипи 399СС + 3953СС + 781СС, 399СС + 3953СС + 781СТ за генами TLR-4, IL-1β, IL-8 та 3953CC + 781CT за генами IL-1β, IL-8 виявлялися частіше у пацієнтів з акне середньо-тяжкого ступеня тяжкості порівняно з тяжкими формами акне.
Наведені у розділі положення висвітлені у наступних публікаціях:
- Петренко А.В. Вивчення деяких генних порушень у хворих на акне. Збірник наукових праць співробітників НМАПО імені П.Л. Шупика. 2016. Вип. 25. С. 132–136. [36].
- Петренко А.В. Співставлення генетичної складової в родинах хворих на акне. Дерматологія та венерологія. 2017. № 1 (75). С. 20–23 [39].
- Петренко А.В., Россоха З.І. Тяжкість перебігу акне в залежності від варіантів генних поліморфізмів. Дерматологія та венерологія. 2017. № 2 (76). С. 33–36 [34].
- Петренко А.В. Спадкові фактори та тяжкість перебігу акне. Матеріали всеукраїнської науково-практичної конференції молодих вчених НМАПО імені П.Л. Шупика, присвяченої Дню науки, м. Київ, 20 травня 2016 р. – К., 2016. – С. 102–104 [40].
- Петренко А.В. Деякі генні порушення у хворих на акне. Матеріали науково-практичної конференції «Спадкові та екологічні чинники в дерматовенерології», м. Київ, 29-30 березня 2016 р. Дерматовенерологія. Косметологія. Сексопатологія. 2016. № 1–2 (3). С. 79 [38].
- Петренко А.В. Патогенетичні аспекти акне від вивчення стану шкіри до визначення деяких генетичних факторів. Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я: зб. наук. праць. 2016. Вип. 13. С. 219-224 [33].
- Пат. на корисну модель 121339 UA, МПК C12N15/00, A01H1/00, A01H1/08. Спосіб прогнозування розвитку тяжких форм акне за допомогою молекулярно-генетичних методів / А.В. Петренко; заявник і патентовласник Національна медична академія післядипломної освіти ім. П.Л. Шупика. № u201708769; заявл. 31.08.2017; опубл. 27.11.2017, Бюл. № 22 [28].
РОЗДІЛ 5
ХАРАКТЕРИСТИКА РІВНЯ СТАТЕВИХ ГОРМОНІВ
У ХВОРИХ НА АКНЕ
5.1 Роль статевих гормонів у розвитку та клінічному перебігу акне
Встановлено, що ключовим у виникненні акне є гормональні впливи. Андрогени, які продукуються поза сальною залозою, перш за все статевими залозами та наднирниковими залозами, здійснюють вплив на андроген-метаболізуючі ензими, такі, як 3β- і 17β-гідрооксистероїдна дегідрогеназа та 5α-редуктаза. Андрогенні рецептори, що розміщені в клітинах базального шару сальної залози та зовнішньої кореневої піхви волосяного фолікула, реагують на найбільш патентні андрогени, такі, як тестостерон та ДГТ. ДГТ має більше ділянок, що афінні до андрогенних рецепторів порівняно з тестостероном. Незважаючи на те, що роль ДГТ є головною в андрогенному опосередкуванні продукції сала, роль тестостерону в цьому процесі не може бути виключеною.
Доказано роль андрогенних рецепторів вже в неонатальному періоді. Від народження до приблизно 6–12 місяців у хлопчика-немовляти підвищений рівень лютеїнізуючого гормону та тестостерону як результат тестикулярної гіперпродукції. Крім того, як у хлопчиків, так і у дівчаток відзначається підвищений рівень дегідроепіандростерону. Як тестикулярна, так і надниркова андрогенна продукції зменшуються до першого року життя та залишаються стабільно низькими до пубертату. З початком виробки чоловічих статевих гормонів продукція сала надзвичайно збільшується. Часто ці зміни спостерігають ще за 1 рік до менархе у дівчат. Але слід зауважити, що такі зміни в складі сала спостерігаються як в осіб із акне, так і без акне.
Суттєвою ланкою патогенезу акне є спадково обумовлена гіперандрогенія, яка може проявлятись у вигляді абсолютного збільшення кількості гормонів (абсолютна гіперандрогенія) або підвищеною чутливістю рецепторів до нормальної або пониженої кількості андрогенів в організмі (відносна гіперандрогенія). Початок функціонування в пубертатному періоді системи гіпоталамус-гіпофіз-гонади проявляє себе в різкому збільшенні синтезу тестостерону – головного стероїду сім’яників. В яєчниках починається утворення естрогенів (здебільшого естрадіолу), безпосереднім попередником якого є андростендіол – головний андроген яєчників. Деякий внесок у синтез андрогенів в організмі (особливо в жіночому) вкладає корковий шар наднирників. В його сітчастій зоні синтезується головний попередник андрогенів – дегідроепіандростерон, який після ізомеризації в андростендіон відновлюється в тестостерон. Головна частина тестостерону (97–99 %), який циркулює в крові, знаходиться у зв’язаному стані із секс-стероїдзв’язуючим глобуліном (ССЗГ). Частіше зустрічаються стани відносної гіперандрогенії при нормальному або пониженому вмісті андрогенів в організмі. У клітинах сальних залоз – себоцитах – тестостерон під впливом фермента 5α-редуктази 1-го типу переходить у більш активний метаболіт – ДГТ, який є безпосереднім стимулятором росту та дозрівання себоцитів, утворення шкірного сала. Головними причинами відносної гіперандрогенії є підвищена активність 5α-редуктази 1-го типу, підвищена щільність ядерних ДГТ-рецепторів або збільшення вільної фракції тестостерону в крові як результат зменшення синтезу ССЗГ у печінці. Таким чином, відзначені зміни гормонального фону призводять до збільшення розмірів сальної залози та її підвищеного функціонування [8, 211].
Протягом пубертату в представників обох статей акне супроводжуються гіперандрогенією, переважно із підвищенням рівня тестостерону [81, 106].
Кератиноцити також мають здатність до метаболізму андрогенів та холестеролу власними ферментними системами. Порушення активації деяких з цих ферментних систем можуть змінювати внутрішньоклітинний рівень андрогенів та холестеролу. Таким чином, здійснюється вплив на проліферацію та диференціацію кератиноцитів [82, 206].
Акне розглядається як захворювання підлітків, але в літературі пишуть про жіночі акне, які зустрічаються все частіше. Зазвичай описується акне жінок у віці 25 років. У дорослих жінок відзначено розбіжність із акне у підлітків, особливо в клінічних аспектах та в розвитку захворювання. Центральну роль відіграють два патогенетичних фактори: гормональний та вроджений імунітет [166, 171, 180]. Виділяють фактори тригерні або такі, що обтяжують акне у жінок. Це внутрішні фактори: гормональні (приблизно у 80 % жінок загострення до менструації); генетичні передумови – у 50 % хворих були випадки акне в родині; зовнішні фактори (використання косметики, стрес); тютюнопаління (ймовірно призводить до незапальних акне). Висувають наступні фізіопатологічні гіпотези жіночих акне. Перш за все, периферичні гормональні захворювання, які супроводжуються гіперактивністю або ненормальною активністю ферментів, залучених у метаболізм гормонів, таких як 5-a-редуктаза, що експресується в шкірі себоцитами та кератиноцитами. Крім того, гіперчутливість гормональних рецепторів у цих клітинах. У крові зменшується рівень секс-створючого глобуліну, асоційованого зі збільшенням рівня вільного тестостерону. Вільний тестостерон стимулює рецептори в шкірі [30, 88, 93, 166, 188, 209].
У 79 % жінок, хворих на акне, виявлено зміни структури яєчників, у 72 % – полікістоз, у 62 % – порушення менструальної функції. Зі 109 жінок з виявленими гормональними порушеннями гіперандрогенію надниркового типу було встановлено у 44,9 %, гіперандрогенію яєчникового типу – у 20,2 %, гіперандрогенію змішаного типу – у 43,9 % відповідних пацієнток [27]. Таким чином, важливе значення у стимуляції функціонування сальних залоз та розвитку вугрової хвороби належить гормонам статевих та надниркових залоз [47, 49, 50].
5.2 Визначення рівня статевих гормонів у хворих на акне
У хворих на акне проводилось обстеження на рівні статевих гормонів у периферійній крові (n=63), середній вік яких становив (20,5 ± 5,53) років. Пацієнти були поділені на дві групи залежно від тяжкості перебігу.
До першої групи увійшов 31 пацієнт на акне середньо-тяжкого перебігу, з них – 12 чоловіків та 19 жінок. Другу групу склали 32 пацієнти із тяжким перебігом акне – 21 чоловік та 11 жінок.
Також обидві групи були поділені на дві підгрупи залежно від статі, оскільки показники гормонального статусу суттєво відрізняються у чоловіків та жінок.
Пацієнти мали акне середньо-тяжкого (помірні папуло-пустульозні) та тяжкого (виражені папуло-пустульозні та конглобатні) ступеня. У хворих із середньо-тяжким акне захворювання проявлялося запальними папулами, поодинокими пустулами, відкритими та закритими комедонами у типових для акне локалізаціях. Пацієнти на тяжке акне мали чисельні запальні папули та пустули, вузли та кисти, у тому числі серед обстежених були пацієнти із фульмінантним та конглобатним акне.
Чоловікам було проведено визначення тестостерону загального, тестостерону вільного та ДГТ. У жінок, окрім перелічених вище гормонів, додатково визначалися такі показники: пролактин, прогестерон, естрадіол, ФСГ. Усі жінки проходили обстеження на статеві гормони у лютеїновій фазі менструального циклу (з 18 по 24 день менструального циклу).
Середній вік чоловіків із першої групи (n=12) становив (20,8 ± 3,3) роки, початок захворювання відбувся у віці (15,6 ± 1,7) років; середній вік чоловіків із другої групи (n=21) був (19,0 ± 4,3) роки та початок захворювання припадав на вік (14,8 ± 2,0) роки (p>0,05).
Рівень тестостерону загального у чоловіків із першої групи складав (18,27 ± 4,4) нмоль/л (при нормальних показниках – 8,64–29,0 нмоль/л), а у чоловіків із другої групи – (20,9 ± 6,8) нмоль/л (p>0,05). Серед усіх обстежених чоловіків лише двоє пацієнтів із тяжким перебігом акне мали тенденцію до підвищення рівня загального тестостерону – 30,13 та 37,21 нмоль/л. Діапазон коливань за даним показником складав 9,15–37,21 нмоль/л, МЕ – 19,26.
Рівень тестостерону вільного у чоловіків із середньо-тяжким перебігом акне був (38,9 ± 14,0) пг/мл (при показниках у здорових осіб – 15,0–50,0 пг/мл), а у пацієнтів чоловічої статі із тяжким перебігом – (48,6 ± 18,83) пг/мл (р>0,05). Враховуючи, що діапазон коливань за даним показником був дуже широким (19,27–77,14 пг/мл, МЕ – 39,88), проте у 33 % усіх чоловіків, незалежно від групи, відмічалося підвищення рівню вільного тестостерону – (66,59 ± 7,23) пг/мл, що може вказувати на зв’язок акне з рівнем вільного тестостерону у периферійній крові. Рівень ДГТ у чоловіків із першої групи становив (589,85 ± 172,3) пг/мл (при показниках у здорових осіб – 250–990 пг/мл), а у пацієнтів із другої групи – (570,08 ± 172,9) пг/мл (р>0,05). Діапазон коливань за даним показником складав 323,06–984,65 пг/мл, МЕ – 550,81 (табл. 5.1).
Таблиця 5.1 – Показники рівнів сироваткових статевих гормонів у чоловіків залежно від ступеня тяжкості акне
| Показник | Здорові особи | 1 група (чоловіки) n=12 | 2 група (чоловіки) n=21 | Р |
| Вік (роки) | – | 20,8 ± 3,3 | 19,0 ± 4,3 | p>0,05 |
| Початок у віці (роки) | – | 15,6 ± 1,7 | 14,8 ± 2,0 | p>0,05 |
| Тестостерон загальний (нмоль/л) | 8,64-29,0 | 18,27 ± 4,4 | 20,9 ± 6,8 | p>0,05 |
| Тестостерон вільний (пг/мл) | 15,0-50,0 | 38,9 ± 14,0 | 48,6 ± 18,83 | p>0,05 |
| ДГТ (пг/мл) | 250,0-990,0 | 589,9 ± 172,3 | 570,1 ± 172,9 | p>0,05 |
Серед обстежених жінок із першої групи (n=19) середній вік становив (21,68 ± 5,9) років, початок захворювання здебільшого був у віці (15,0 ± 2,3) роки; а із другої (n=11) – середній вік (21,0 ± 8,2) років, початок – у (15,5 ± 2,2) роки (р>0,05).
Рівень тестостерону загального у жінок із першої групи складав (1,03 ± 0,6) нмоль/л (при показниках у здорових осіб – 0,29–1,67 нмоль/л), а із другої – (0,95 ± 0,42) нмоль/л (р>0,05). Діапазон коливань за даним гормоном становив 0,33–2,75 нмоль/л, МЕ – 0,83.
Рівень вільного тестостерону у жінок із середньо-тяжким перебігом акне становив (4,42 ± 1,6) пг/мл (при показниках у здорових осіб – до 9 пг/мл), а у другій групі – (4,27 ± 1,38) пг/мл (р>0,05). Діапазон коливань за рівнем вільного тестостерону у жінок складав 1,74–6,35 пг/мл, МЕ – 4,14.
Рівень ДГТ у пацієнток із першої групи становив (325,92 ± 112,16) пг/мл (при показниках у здорових осіб – 24–368 пг/мл), а серед жінок із другої групи – (927,79 ± 260,11) пг/мл, що було достовірно (р<0,05). Показники у жінок із середньо-тяжким перебігом акне знаходились у діапазоні 109,59–861,56 пг/мл, МЕ – 229,54; у пацієнток з тяжким перебігом – 98,12–2285,70 пг/мл, МЕ – 791,03. Діапазон коливань за рівнем ДГТ у всіх обстежених, незалежно від групи, складав 98,12–2285,70 пг/мл, МЕ – 275,6.
Аналіз рівня сироваткового прогестерону у жінок із першої групи показав (13,35 ± 6,0) нг/мл (показники здорових жінок у лютеїновій фазі менструального циклу – 1,7–27 нг/мл), а у другій – (7,8 ± 4,9) нг/мл (р>0,05). Рівень даного гормону знаходився у діапазоні 2,21–24,05 нг/мл, МЕ – 10,89. Загалом, показники прогестерону в усіх жінок, незалежно від групи, знаходились у межах норми. Рівень пролактину (ПРЛ) у першій групі складав (22,05 ± 11,3) нг/мл, ПРЛмин – 8,51 нг/мл, ПРЛмакс – 44,73 нг/мл, МЕ – 17,93 (показники здорових жінок у лютеїновій фазі менструального циклу 4,79–23,3 нг/мл), у другій групі – (27,26 ± 12,6) нг/мл, ПРЛмин – 10,37 нг/мл, ПРЛмакс – 45,71 нг/мл, МЕ – 28,96 (р>0,05), проте середній рівень пролактину у жінок із тяжким перебігом акне мав тенденцію до підвищення.
Визначення рівня естрадіолу у хворих із середньо-тяжким перебігом акне показало (107,4 ± 55,6) пг/мл (показники здорових жінок у лютеїновій фазі менструального циклу коливалися в межах 22,3–341,0 пг/мл), а з тяжким перебігом – (75,28 ± 48,5) пг/мл (р>0,05). Діапазон коливань за даним гормоном становив 25,27–218,57 пг/мл, МЕ – 89,04 – у всіх обстежених жінок рівень сироваткового естрадіолу не перевищував нормальні показники. Рівень ФСГ у жінок із першої групи складав (3,58 ± 1,4) мМО/мл (показники здорових жінок у лютеїновій фазі – 1,7–7,7 мМО/мл), а із другої групи – (4,33 ± 1,6) мМО/мл (р>0,05). Показники рівня естрадіолу в обстежених жінок знаходилися в межах 1,8–7,32 мМО/мл, МЕ – 3,78 (табл. 5.2).
Таблиця 5.2 – Показники рівнів сироваткових статевих гормонів у жінок залежно від ступеня тяжкості акне
| Показник | Здорові особи | 1 група (жінки) n=19 | 2 група (жінки) n=11 | Р |
| Вік (роки) | – | 21,68 ± 5,9 | 21,0 ± 8,2 | р>0,05 |
| Початок у віці (роки) | – | 15,0 ± 2,3 | 15,5 ± 2,2 | р>0,05 |
| Тестостерон загальний (нмоль/л) | 0,29-1,67 | 1,03 ± 0,6 | 0,95 ± 0,42 | р>0,05 |
| Тестостерон вільний (пг/мл) | До 9,0 | 4,42 ± 1,6 | 7,27 ± 10,0 | р>0,05 |
| ДГТ (пг/мл) | 24,0-368 | 325,92 ± 112,16 | 927,79 ± 260,11 | р<0,05 |
| Прогестерон (нг/мл) | 1,7-27* | 13,35 ± 6,0 | 7,8 ± 4,9 | р>0,05 |
| Пролактин (нг/мл) | 4,79-23,3* | 22,05 ± 11,3 | 27,26 ± 12,6 | р>0,05 |
| Естрадіол (пг/мл) | 22,3-341,0* | 107,43 ± 55,6 | 75,28 ± 48,5 | р>0,05 |
| ФСГ (мМО/мл) | 1,7-7,7* | 3,58 ± 1,4 | 4,33 ± 1,6 | р>0,05 |
Примітка. * – нормальні значення для лютеїнової фази менструального циклу.
5.3 Аналіз рівня статевих гормонів у хворих на акне залежно від тяжкості перебігу захворювання та спадкових факторів
Також був проведений аналіз між генними поліморфізмами та рівнями статевих гормонів. Для аналізу було обрано варіанти генотипів генів IL-1β (C3953T) та IL-8 (С781Т) (ген TLR-4 (C399T) не був включений, оскільки у всіх пацієнтів із підвищеними рівнями досліджуваних гормонів був наявний гомозиготний генотип СС за даним геном) та рівні статевих гормонів, що показали найбільші відхилення від нормальних показників, а саме вільний тестостерон у чоловіків та ДГТ і пролактин у жінок. Пацієнти були поділені на дві групи залежно від наявності або відсутності підвищення досліджуваного гормону (за нормальні бралися показники здорових осіб).
Для дослідження було взято 9 комбінованих генотипів за генами IL-1β (C3953T) та IL-8 (С781Т), з них лише за комбінацією 3953CT+781CT було виявлено статистично значиму різницю. Дана комбінація спостерігалась у 5 (41,7 %) пацієнтів із підвищеним рівнем вільного тестостерону та у 1 (4,8 %) із нормальними значеннями даного гормону (χ2 = 4,73; р<0,05; OR=0,07; 95%CI (0,007–0,707), що вказує на зв’язок даного комбінованого генотипу із підвищеним рівнем вільного тестостерону у хворих на акне (табл. 5.3).
Серед обстежених жінок показники ДГТ розподілилися між 6 комбінованими генотипами, з яких 2 показали значиму різницю. Комбінований генотип 3953CC + 781CT був наявний у 10 (52,6 %) пацієнток без підвищення рівня ДГТ та у жодної з підвищеним вмістом даного гормону (р<0,05); комбінацію 3953CT + 781CT було виявлено у 5 (45,4 %) пацієнток із підвищеним рівнем ДГТ та в 1 (5,3 %) хворої з нормальним рівнем (χ2 = 4,74; р<0,05; OR=0,007; 95%CI – 0,006–0,69), що вказує на зв’язок даного комбінованого генотипу із підвищеним рівнем ДГТ у жінок, що хворіють на акне (табл. 5.4).
За рівнем пролактину було проаналізовано розподілення між 7 комбінованими генотипами генів IL-1β (C3953T) та IL-8 (С781Т). Жодна з комбінацій не вказала на значимий вплив на рівень сироваткового пролактину у жінок з акне (табл. 5.5).
Таблиця 5.3 – Частота розподілення комбінованих генотипів за генами IL‑1β (C3953T), IL-8 (С781Т) залежно від наявності підвищення рівня сироваткового вільного тестостерону у чоловіків
| Комбінація генотипів | Підвищення рівня вільного тестостерону | Значимість різниць | ||||
| Було
n=12 |
Не було n=21 | χ2 | Р | OR | 95%CI | |
| 3953CC+781CC | – | 4 (19,1 %) | 0,27 | р>0,05 | – | – |
| 3953CC+781CT | 2 (16,7 %) | 10 (47,6 %) | 1,96 | р>0,05 | 0,22 | 0,03-1,25 |
| 3953CT+781CC | – | 3 (14,2 %) | 0,27 | р>0,05 | – | – |
| 3953CT+781CT | 5 (41,7 %) | 1 (4,8 %) | 4,73 | р<0,05 | 0,07 | 0,007-0,707 |
| 3953CC+781TT | – | 3 (14,3 %) | 0,28 | р>0,05 | – | – |
| 3953CT+781TT | 3 (25,0 %) | – | 0,28 | р>0,05 | – | – |
| 3953TT+781CC | 1 (8,3 %) | – | 0,36 | р>0,05 | – | – |
| 3953TT+781CT | 1 (8,3 %) | – | 0,36 | р>0,05 | – | – |
Таблиця 5.4 – Частота розподілення комбінованих генотипів за генами IL‑1β (C3953T), IL-8 (С781Т) залежно від наявності підвищення рівня сироваткового ДГТ у жінок
| Комбінація генотипів | Підвищення рівня ДГТ | Значимість різниць | ||||
| Було
n=11 |
Не було n=19 | χ2 | Р | OR | 95%CI | |
| 3953CC+781CC | – | 5 (26,3 %) | 0,13 | р>0,05 | – | – |
| 3953CC+781CT | – | 10 (52,6 %) | 6,47 | р<0,05 | – | – |
| 3953CT+781CC | 3 (27,3 %) | 1 (5,3 %) | 1,33 | р>0,05 | 0,15 | 0,01-1,65 |
| 3953CT+781CT | 5 (45,4 %) | 1 (5,3 %) | 4,74 | р<0,05 | 0,07 | 0,006-0,69 |
| 3953CC+781TT | 1 (9,1 %) | 2 (10,5 %) | 0,25 | р>0,05 | 0,85 | 0,068-10,61 |
| 3953TT+781CT | 2 (18,2 %) | – | 1,36 | р>0,05 | – | – |
| 3953TT+781CC | 1 (8,3 %) | – | 0,36 | р>0,05 | – | – |
| 3953TT+781CT | 1 (8,3 %) | – | 0,36 | р>0,05 | – | – |
Таблиця 5.5 – Частота розподілення комбінованих генотипів за генами IL‑1β (C3953T), IL-8 (С781Т) залежно від наявності підвищення рівня сироваткового пролактину у жінок
| Комбінація генотипів | Підвищення рівня пролактину | Значимість різниць | ||||
| Було
n=14 |
Не було n=16 | χ2 | Р | OR | 95%CI | |
| 3953CC+781CC | 1 (7,1 %) | 4 (25,0 %) | 0,67 | р>0,05 | 0,23 | 0,02-2,36 |
| 3953CC+781CT | 3 (21,5 %) | 6 (37,5 %) | 0,31 | р>0,05 | 0,45 | 0,08-2,31 |
| 3953CT+781CC | – | 4 (25,0 %) | 2,16 | р>0,05 | – | – |
| 3953CT+781CT | 5 (35,7 %) | 1 (6,25 %) | 2,41 | р>0,05 | 0,12 | 0,012-1,119 |
| 3953CC+781TT | 3 (21,5 %) | – | 0,46 | р>0,05 | – | – |
| 3953TT+781TT | 1 (7,1 %) | – | 0,005 | р>0,05 | – | – |
| 3953TT+781CT | 1 (7,1 %) | 1 (6,25 %) | 0,404 | р>0,05 | 0,86 | 0,049-15,3 |
| 3953TT+781CT | 1 (8,3 %) | – | 0,36 | р>0,05 | – | – |
5.4 Корелятивні зв’язки гормонального статусу із поліморфізмом генів TLR-4, IL-1β та IL-8 у хворих на акне
Серед обстежених жінок рівень ДГТ був значимо вищим у пацієнток із тяжким перебігом акне.
Також було виявлено асоціацію між наявним у пацієнтів генотипом 388СТ за геном TLR-4 та підвищеною схильністю до тяжкого перебігу акне.
Частота гетерозиготного варіанту за геном IL-1β (3953СT) була значуще збільшеною серед пацієнтів із середньо-тяжким ступенем тяжкості акне, а ризик розвитку тяжкого акне значуще зростав при наявності у пацієнтів генотипу 781ТТ за геном IL-8.
Комбіновані генотипи 399СС + 3953СС + 781СС, 399СС + 3953СС + 781СТ за генами TLR-4, IL-1β, IL-8 та 3953CC + 781CT за генами IL-1β, IL-8 виявлялися частіше у пацієнтів з акне середньо-тяжкого ступеня тяжкості порівняно з тяжким акне.
Виявлено асоціацію комбінованого генотипу 3953CT + 781CT за генами IL‑1β, IL-8 із зростанням вмісту вільного тестостерону у сироватці крові у чоловіків з акне.
Комбінований генотип 3953CC + 781CT за генами IL-1β, IL-8 був значимо асоційована зі зниженим рівнем ДГТ у жінок з акне, у той час як комбінований генотип 3953CT + 781CT за генами IL-1β, IL-8, навпаки, – з підвищеним рівнем ДГТ.
* * *
У розділі описано вплив гормональних чинників на розвиток та клінічний перебіг акне.
Проведено обстеження 63 хворих на акне з метою виявлення відхилень гормональних показників, таких як: тестостерон вільний, тестостерон загальний, ДГТ, естрадіол, прогестерон, пролактин, ФСГ та співставлення отриманих показників з даними клінічної картини. Пацієнти були поділені на дві групи залежно від тяжкості перебігу.
До першої групи увійшов 31 пацієнт на акне середньо-тяжкого перебігу, з них – 12 чоловіків та 19 жінок. Другу групу склали 32 пацієнти із тяжким перебігом акне – 21 чоловік та 11 жінок.
Також обидві групи були поділені на дві підгрупи залежно від статі.
Таким чином, серед обстежених жінок рівень ДГТ був значимо вищим у пацієнток із тяжким перебігом акне. А у 33 % усіх чоловіків, незалежно від групи, відмічалося підвищення рівня вільного тестостерону – (66,59 ± 7,23) пг/мл, що може вказувати на зв’язок акне з рівнем вільного тестостерону у периферійній крові.
Проаналізовано взаємозв’язок рівнів статевих гормонів у хворих на акне та спадкових факторів.
Виявлено, що серед жінок рівень ДГТ був значимо вищим у пацієнток із тяжким перебігом акне.
Було встановлено асоціацію комбінованого генотипу 3953CT + 781CT за генами IL-1β, IL-8 із зростанням вмісту вільного тестостерону в сироватці крові у чоловіків з акне.
Наведені у розділі положення висвітлені у наступних публікаціях:
- Горовенко Н.Г., Петренко А.В., Россоха З.І. Аналіз рівня статевих гормонів у хворих на акне різного ступеню тяжкості з урахуванням впливу генетичних факторів. Дерматологія та венерологія. 2017. № 3 (77). C. 46–52 [30].
- Петренко А.В. Аналіз генетичного та гормонального статусу у пацієнтів з акне. Матеріали науково-практичної конференції з міжнародною участю «Новітні технології діагностичних, лікувальних та профілактичних заходів в дерматовенерології та методи і стан їхнього впровадження», м. Харків, 11–12 листопада 2016 р. Дерматологія та венерологія. 2016. № 3 (73). С. 83–84 [29].
РОЗДІЛ 6
ОБҐРУНТУВАННЯ АЛГОРИТМУ ЛІКУВАННЯ ХВОРИХ НА АКНЕ
6.1 Сучасні підходи до лікування акне
Проблема удосконалення терапії акне залишається актуальною і в теперішній час, що пов’язано з високою частотою захворювання серед підлітків та осіб молодого віку, яка досягає 65–85 % [4, 16, 77, 179]. Різноманітність високоефективних сучасних препаратів зовнішньої та системної дії дозволяє обирати терапію індивідуально для кожного пацієнта з урахуванням клінічної форми, ступеня тяжкості перебігу захворювання, патогенезу, психосоматичного статусу пацієнта та супутньої патології [45, 82, 87, 149].
Сучасний підхід до лікування акне виділяє системну та топічну терапію. Із системних препаратів слід перш за все згадати антибіотики. Доксициклін, лімециклін, міноциклін та тетрациклін – усі мають однакову протизапальну ефективність. Тетрациклін дещо перевищує за ефективністю кліндаміцин та тетрациклін [89]. Найчастіші негативні медикаментозні ускладнення при застосуванні доксицикліну можна відкорегувати (для фоточутливих осіб це захист від сонця і споживання води при запаленні стравоходу), тоді як з найбільш властивими побічними ефектами при застосуванні міноцикліну (гіперчутливість, порушення функції печінки, синдром вовчака) це вдається не так легко [153]. Використовують антибіотики з урахуванням чутливості або широкого спектра їхньої дії [57, 83, 129, 204]. Нещодавно деякі експертні групи посилили ці рекомендації з огляду на збільшену в усьому світі резистентність до антибіотиків [63, 191]. Крім того, був зроблений огляд щодо ефективності і безпеки міноцикліну [178]. Міноциклін вважають домінуючим за ефективністю антибіотикотерапії акне, але в останні роки досить відомими стали спостереження за побічними ефектами міноцикліну.
Ретиноїдами (лат. retina – сітчатка, oid – похідне будь-чого) називають будь-які агенти, спроможні спричиняти специфічні біологічні відповіді в результаті зв’язування та активації рецепторів ретиноєвої кислоти. Додавання локально кліндаміцину і адапалену до системного ізотретиноїну не забезпечує більш високу ефективність порівняно з монотерапією ізотретиноїном [84]. Є роботи, в яких автори повідомляли, що рівень депресії серед користувачів ізотретиноїну становив від 1 % до 11 % у різних випробуваннях, які мають аналогічні показники в контрольних группах з пероральними антибіотиками. Разом з тим є твердження, що існує тенденція до меншої кількості або до менш тяжких депресивних симптомів після лікування ізотретиноїном [138].
Існують розробки, які чітко демонструють, що за параметрами ефективності та подовженості ремісії препарати, що базуються на системному ізотретиноїні, є стратегією вибору при лікуванні хворих як на середньо-тяжкі, так і на конглобатні акне [6, 11, 12, 27, 167]. Нормалізація процесів кератинізації та посилення десквамації кератиноцитів у сально-волосяному фолікулі та на шкірі пояснюють побічні реакції на ретиноїди. У себоцитах, навпаки, переважають RXR-α, стимуляція яких призводить до апоптозу себоцитів та, як наслідок, до зменшення салоутворення [24, 53, 127, 112, 205]. Вплив адапалену та ізотретиноїну на незапальні акне близький за ефективністю до бензоїлпероксиду та ізотретиноїну [181, 196].
Значне місце в алгоритмі лікування акне посіла топічна терапія. Порівняно з плацебо значну ефективність проти незапальних уражень продемонстрували: азелаїнова кислота, бензоїлпероксид та локальні ретиноїди [100, 115, 150, 173, 203]. Комбінація бензоїлпероксиду та кліндаміцину демонструє ефективність при незапальних акне проти монотерапії бензоїлпероксидом та порівняно з монотерапією кліндаміцином [120, 121]. Цікаво, що топічні ретиноїди, які застосовують при лікуванні акне, демонструють зниження TLR2 експресії. До речі, і нікотинамід шляхом взаємодії з TLR2 на кератиноцитах значно знижує IL-8 продукцію дозозалежним способом [199].
Відомо, що адапален є лише другою генерацією ретиноїдів, що використовуються в Європі. Він модулює епідермальну імунну систему, збільшуючи експресію CD1d та зменшуючи експресію IL-10 кератиноцитами. Це дає можливість припустити, що ці модуляції збільшують взаємодію між дендритичними клітинами та Т-лімфоцитами і посилюють антимікробну активність проти P. acnes. Відповідно, зменшена експресія TLR кератиноцитами може сприяти антимікробній активності адапалену [190]. Позитивно оцінили дослідники і комбінацію адапалену з бензоїлпероксидом [210].
У деяких роботах при лікуванні акне як новий напрямок рекомендують використовувати нікотинамід, враховуючи його салорегулюючу та протизапальну дію [35, 62, 94, 119, 175]. З’явилися роботи, де автори пропонують використання антиоксидантів топічної спрямованості [207].
Були спроби використовувати в лікуванні акне і нетрадиційні методи, такі, як акупунктура, фітотерапія, пілінг [72, 103, 177]. Деякі дослідники в лікуванні використовують комбінацію ретиноїдів або антибіотиків із пілінгом [65, 113].
6.2 Визначення алгоритму лікування хворих на акне залежно від тяжкості клінічного перебігу
При визначенні тактики лікування було прийнято рішення провести порівняльне лікування у двох групах: в одній групі – застосувати нікотинамід рибозид та стандартну терапію акне, а в іншій лише стандартну терапію. Хворі були поділені на дві групи по 39 чоловік незалежно від результатів молекулярно-генетичного обстеження. Кожна група додатково поділена на дві підгрупи залежно від тяжкості перебігу захворювання. До першої групи увійшло 20 пацієнтів із середньо-тяжким акне (Іа) та 19 пацієнтів з тяжким акне (Іb). До другої групи увійшло 21 хворий на середньо-тяжке акне (IIa) та 18 – з тяжким перебігом даного дерматозу (IIb).
Перша група отримувала нікотинамід рибозид у дозі 225 мг/добу у трьох прийомах протягом 2 місяців в якості системної терапії. Також пацієнти даної групи отримували стандартну системну терапію (пацієнти з тяжким перебігом акне отримували системні ретиноїди у середніх рекомендованих дозах, виходячи з розрахунку на масу тіла та місцеву антибактеріальну терапію двічі на добу, пацієнти із середньо-тяжким перебігом акне отримували системну антибактеріальну терапію та місцево топічні комбінації – топічний ретиноїд + топічний антибіотик). Друга група отримувала терапію, аналогічну першій групі за винятком нікотинамід рибозиду.
Було підраховано кількість елементів висипу, їх вид та локалізацію до та після проведеного лікування (табл. 6.1).
Таблиця 6.1 – Кількість елементів висипу у хворих на середньо-тяжке акне (групи Іа, ІІа) та тяжке акне (групи ІІа, ІІb) до початку лікування
| Елемент висипу
Група |
Папули | Пустули | Комедони | Вузли/кісти/ фістули | Вузли (менше 1см) |
| Іа
n=20 |
10-20 | 10-20 | >20 | – | < 10 |
| IIa
n=21 |
|||||
| Ib
n=19 |
>20 | >20 | >20 | 1-10 | > 10 |
| IIb
n=18 |
Після отримання пацієнтами призначеної терапії (група Іа отримувала нікотинамід рибозид та стандартне лікування, група ІІа отримувала лише стандартну терапію) протягом 2 місяців був проведений підрахунок елементів висипу, що залишилися по завершенні терапії. Залежно від ефективності лікування всіх пацієнтів було розподілено на три групи: «чиста шкіра» – повне очищення від висипу; «практично чиста шкіра» – поодинокі комедони, 1–4 папули, відсутність пустул, вузлів; «значне очищення шкіри» – поодинокі комедони, 5–7 папул, 1–3 вузли до 1 см, відсутність пустул (табл. 6.2).
Таблиця 6.2 – Кількість хворих на середньо-тяжке акне (групи Іа, ІІа) та тяжке акне (групи Іb, IIb,) залежно від ефективності терапії по завершенні лікування
| Результат
Група |
«Чиста шкіра» | «Практично чиста шкіра» | «Значне очищення шкіри» | χ2 | Р |
| Іа
n=20 |
14 | 5 | 1 | 7,849 | р<0,05 |
| IIa
n=21 |
7 | 6 | 8 | ||
| Іb
n=19 |
12 | 2 | 5 | 8,850 | р<0,05 |
| IIb
N=18 |
3 | 7 | 8 |
Таким чином, серед пацієнтів з першої групи, що приймали нікотинамід рибозид, достовірно більше хворих, у яких відмічалося значне покращення стану шкіри, порівняно із групою хворих, що отримували лише стандартну терапію.
До початку лікування у пацієнтів із тяжким перебігом акне (групи Іb та ІІb) відмічалися папули у кількості >20 на кожній з уражених ділянок (обличчя, груди, спина), пустули – >20, вузли/кисти/фістули – 1–10, вузли менше 1 см – більше 10, рубці у місцях попереднього висипу (див. табл. 6.1).
Після отримання пацієнтами призначеної терапії (група Іb отримувала нікотинамід рибозид та стандартне лікування, група ІІb отримувала лише стандартну терапію) протягом 2 місяців був проведений підрахунок елементів висипу, що залишилися по завершенні терапії. Залежно від ефективності лікування всіх пацієнтів було розподілено на три групи: «чиста шкіра» – наявність рубців, відсутність папул, пустул, кист та вузлів; «практично чиста шкіра» – 1-4 папули, 1 вузол, відсутність пустул та кіст; «значне очищення шкіри» – 5-10 папул, 3–4 вузли, відсутність пустул та кист (див. табл. 6.2).
Можна бачити, що серед пацієнтів із тяжким перебігом акне з першої групи, що приймали нікотинамід рибозид, кількість хворих, у яких відмічалося повне зникнення елементів висипу значимо перебільшує тих, хто отримував лише стандартну терапію.
Отримані дані були зіставлені з результатами молекулярно-генетичного дослідження. Серед пацієнтів з повним та практично повним очищенням шкіри у групі Іb у всіх пацієнтів відмічався генотип СТ або ТТ за геном IL-8 (С781Т), що може вказувати на особливо сильний вплив алеля Т на тяжкість перебігу акне; у хворих з групи IIb, що мали значне очищення шкіри, названі варіанти генотипу відмічалися лише в одного пацієнта.
До того ж серед пацієнтів з повним очищенням шкіри у групі Іа у всіх пацієнтів відмічалися поліморфні варіанти СТ або ТТ за геном IL-8 (С781Т), які асоціюються з більш тяжким перебігом акне, і навпаки – у хворих першої групи, що мали практично повне та значне очищення шкіри такі генотипи відмічалися лише у 3 пацієнтів (50,0 %).
6.3 Оцінка рівня жирності шкіри у пацієнтів з акне залежно від терапії
У пацієнтів з акне, що брали участь у дослідженні проводилася себометрія перед початком лікування та через 2 місяці. Пацієнти були поділені на дві групи залежно від терапії, що вони отримували: в одній групі – застосовувався нікотинамід рибозид та стандартна терапія акне, а в іншій – лише стандартна терапія. Кожна група додатково поділена на дві підгрупи залежно від тяжкості перебігу захворювання. До першої групи увійшло 20 пацієнтів із середньо-тяжким акне (Іа) та 19 пацієнтів з тяжкою формою акне (Іb). До другої групи увійшов 21 хворий на середньо-тяжке акне (IIa) та 18 – з тяжким перебігом даного дерматозу (IIb) (табл. 6.3).
Таблиця 6.3 – Показники себометрії до та після лікування залежно від терапії
| Групи | До лікування | Після лікування | Р |
| Іа
n=20 |
88,75 ± 8,86 | 41,75 ± 6,34 | р<0,05 |
| IIa
n=21 |
88,33 ± 7,79 | 66,90 ± 6,60 | р>0,05 |
| Ib
n=19 |
95,00 ± 5,52 | 45,78 ± 5,59 | р<0,05 |
| IIb
n=18 |
95,83 ± 4,92 | 41,11 ± 6,76 | р<0,05 |
Перша група отримувала нікотинамід рибозид у дозі 225 мг/добу у трьох прийомах протягом 2 місяців в якості системної терапії. Також пацієнти даної групи отримували стандартну системну терапію (пацієнти з тяжким перебігом акне отримували системні ретиноїди у середніх рекомендованих дозах, виходячи з розрахунку на масу тіла та місцеву антибактеріальну терапію двічі на добу, пацієнти із середньо-тяжким перебігом акне отримували системну антибактеріальну терапію та місцево топічні комбінації – топічний ретиноїд + топічний антибіотик). Друга група отримувала терапію, аналогічну першій групі за винятком нікотинамід рибозиду.
Таким чином, у пацієнтів із середньо-тяжким акне, що приймали нікотинамід рибозид разом із стандартною терапією (група Іа), показники жирності шкіри достовірно відрізнялися до початку лікування та по завершенні (р<0,05). У той же час показники себометрії до та після лікування у хворих на середньо-тяжке акне, що отримували лише стандартну терапію (група ІІа), не були достовірно значущі.
Серед хворих на тяжке акне (групи Іb та ІІb) показники жирності шкіри достовірно відрізнялися (р<0,05) до та після лікування незалежно від прийому нікотинамід рибозиду. Даний результат можна пояснити прийомом системних ретиноїдів пацієнтами з тяжким акне, що також мають суттєвий вплив на себорегуляцію.
* * *
У розділі описано сучасні підходи до системної та топічної терапії акне.
Продемонстровано алгоритми лікування акне у групах порівняння: частина пацієнтів (n=39) приймала нікотинамід рибозид у дозі 225мг/добу в поєднанні із стандартною терапією, інша частина (n=39) отримувала лише стандартну терапію. Кожна група була розділена на дві підгрупи залежно від тяжкості перебігу акне.
Було проведено оцінку клінічної картини пацієнтів до та після лікування – кількість елементів висипу, їх вид та локалізація.
Проаналізовано результати проведеного лікування, що вказали на значний вплив нікотинамід рибозиду у зазначених дозах на ефективність лікування акне як середньо-тяжкого, так і тяжкого ступеня.
Співставлено дані молекулярно-генетичного дослідження з результатами проведеної терапії, що вказало на наявність генотипів СТ або ТТ за геном IL-8 (С781Т), які асоціюються з більш тяжким перебігом акне, і навпаки – у хворих першої групи, що мали практично повне та значне очищення шкіри такі генотипи відмічалися лише у 3 пацієнтів (50,0 %).
Проведене вимірювання рівня жирності шкіри до та після лікування показало значущу різницю даного показника у пацієнтів із середньо-тяжким акне, що приймали нікотинамід рибозид, та у хворих на тяжке акне незалежно від прийому даного препарату.
Наведені у розділі положення висвітлені у наступних публікаціях:
- Калюжна Л.Д., Гречанська Л.В., Петренко А.В. Клінічна ефективність ретиноїдів нового покоління в лікуванні акне. Дерматовенерологія. Косметологія. Сексопатологія. 2015. № 3–4. С. 16–21 [11].
- Петренко А.В. Алгоритм лікування акне з урахуванням патогенетичних складових. Український журнал дерматології, венерології, косметології. 2017. № 2 (65). С. 44–48 [35].
- Гречанська Л.В., Петренко А.В. Від європейських до українських протоколів по лікуванню акне з позиції спадкових факторів. Тези доповідей Всеукраїнської науково-практичної конференції Української асоціації лікарів-дерматовенерологів і косметологів «Сучасні підходи до формування клінічних настанов з діагностики і лікування шкірних захворювань та інфекцій, що передаються статевим шляхом: європейський досвід і українські реалії», м. Тернопіль, 19-20 жовтня 2016 р. Український журнал дерматології, венерології, косметології. 2016. № 4 (63). С. 100–101 [6].
- Калюжная Л.Д., Гречанская Л.В., Петренко А.В. Акне: современный взгляд на диагностику и лечение. Здоров’я України. 2017. № 4 (401). С. 46–47 [12].
РОЗДІЛ 7
АНАЛІЗ ТА УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
Акне – це хронічне мультифакторне захворювання апарату сальних залоз, що маніфестує переважно в пубертатному віці і характеризується гіперпродукцією шкірного сала, порушенням процесів фолікулярної кератинізації, колонізацією P. acnes та запаленням, і є одним з найбільш розповсюджених захворювань людства [91, 176].
У 2013 р. зареєстровано 660 млн. хворих на акне на земній кулі, що становить 9,4 % популяції. Встановлено, що акне посідає 8 місце серед усіх хвороб у світі. На акне хворіють 80–90 % підлітків: 95–100 % хлопців-підлітків та 83–85 % – дівчат-підлітків у віці 16–17 років, а у 4 % захворювання продовжується і після 40 років (у 1 % чоловіків та 5 % жінок) [88, 92, 104, 189, 201].
Патогенез захворювання комплексний, з ураженням сальних залоз, фолікулярною гіперкератинізацією, бактеріальною колонізацією [67, 69, 101]. Патофізіологія акне складається з комплексу впливу багатьох факторів, як внутрішніх так і зовнішніх, на пілосебацейний апарат [20, 33].
Також широко відомо, що акне, включаючи вузлувато-кістозне акне, спостерігається в родинах хворих, але навіть при високій розповсюдженості захворювання важко довести наявність генетичних факторів [20, 22, 32].
Найбільш повно вивченими рецепторами з групи патогенрозпізнаючих рецепторів є TLR, які розпізнають молекулярні патерни різних мікроорганізмів (бактерії, дріжджові гриби та віруси). На сьогодні описано більш ніж 11 типів TLR [9, 112].
Показано, що P. acnes може активувати TLR, які експресують на кератиноцитах із продукцією таких прозапальних цитокинів, як IL-8 та металопротеази [36, 37, 126, 144, 166].
P. acnes активує вроджений імунітет шляхом стимуляції TLR та PARs на клітинах фолікулів (здебільшого кератиноцити та клітини Лангерганса), індукує секрецію антимікробних пептидів цими клітинами та себоцитами, призводячи до хронічного запалення фолікула [73]. Механізм запалення, який спровокований P. acnes, активує клас рецепторів імунної системи, які відомі як TLR, особливо TLR2 та TLR4 [81].
Важливим фактором, який стимулює проліферацію кератиноцитів, є саме цитокіни. В експерименті показано, що утворення комедонів було індуковано ІЛ-1α та блокувалось ІЛ-1 рецептором-антагоністом. ІЛ-1α виявлений на незапальних ділянках, які уражені акне, в незначній кількості.
Активація TLR2 та TLR4 P. acnes призводить до збільшення секреції IL-8, TNF-α та IL-1α. IL-1α, у свою чергу, стимулює більш високу активність кератиноцитів та репродукцію, яка забезпечує розвиток комедонів. Клітини сальних залоз також редукують більше антимікробних пептидів, таких як HBD1 та HBD2 у відповідь на зв’язок із TLR2 та TLR4 [81].
Протягом пубертату у представників обох статей акне супроводжуються гіперандрогенією, переважно зі збільшенням тестостерону [81, 106].
Кератиноцити також мають здатність до метаболізму андрогенів та холестеролу ферментними системами. Порушення активації деяких з цих ферментних систем можуть змінювати внутрішньоклітинний рівень андрогенів та холестеролу. Таким чином, здійснюється вплив на проліферацію та диференціацію кератиноцитів [82, 206].
Проблема удосконалення терапії акне залишається актуальною і в теперішній час, що пов’язано з високою частотою захворювання серед підлітків та осіб молодого віку, яка досягає 65–85 % [4, 16, 77, 179]. Різноманітність високоефективних сучасних препаратів зовнішньої та системної дії дозволяє обирати терапію індивідуально для кожного пацієнта з урахуванням клінічної форми, ступеня тяжкості перебігу захворювання, патогенезу, психосоматичного статусу пацієнта та супутньої патології [45, 82, 87, 149]. У деяких роботах при лікуванні акне як новий напрямок рекомендують використовувати нікотинамід, враховуючи його салорегулюючу та протизапальну дію [35, 62, 94, 119, 175].
Аналіз літератури та сучасних досліджень дав можливість взяти за мету дослідження генетичних та андрогенасоційованих особливостей тяжких та середніх форм акне та впровадити диференційований підхід в алгоритмі лікування.
У межах зазначеної мети завданнями дослідження були: 1. Визначити особливості клінічного перебігу тяжких форм акне порівняно зі звичайними формами. 2. Оцінити показники якості життя у хворих на різні форми акне. 3. Проаналізувати рівні статевих гормонів у хворих на різні форми акне. 4. Провести порівняння поліморфних варіантів генів TLR-2 (G753A), TLR-4 (C399T), IL-1β (C3953T), IL-8 (С781Т) у хворих на тяжкі та середні форми акне. 5. Провести кореляційний аналіз впливу поліморфних варіантів генів TLR-2 (G753A), TLR-4 (C399T), IL-1β (C3953T), IL-8 (С781Т) та гормональних показників на перебіг акне. 6. Запропонувати диференційований підхід у лікуванні акне на підставі оцінки генетичної схильності до даного дерматозу.
Для вирішення поставленої мети і завдань було застосовано методи клінічної, загальнолабораторної діагностики, гормональні, молекулярно-генетичні дослідження, використання анкет опитувальників задля визначення якості життя у пацієнтів з акне, а також сучасні методи статистичної обробки і аналізу медичних даних.
Об’єктом дослідження були тяжкі форми акне. Предметом дослідження були патогенетичні механізми реалізації спадкової схильності при тяжких формах акне.
Усього у дослідженні взяло участь 95 осіб (84 хворих на акне середнього і тяжкого ступеня та 11 батьків пацієнтів). За особливостями клінічної картини всі хворі були поділені на дві групи по 42 людини в кожній. Кожна з груп була розділена на дві підгрупи залежно від статі.
Для вирішення першого завдання проведено ретельний аналіз сімейного анамнезу, клінічних проявів хвороби по групах. Було встановлено, що тривалість захворювання в середньому становила 5,2 роки, дебют акне відмічався в середньому у віці 15 років. 75 (92,6 %) пацієнтів відмічали зв’язок між дебютом захворювання та статевим дозріванням.
67 пацієнтів (79,8 %) відмічали, що захворювання у них починалося поступово, спочатку з’являлися відкриті та закриті комедони у себорейних зонах обличчя. Згодом відмічалася поява поодиноких запальних папул та пустул, і лише через 4-5 років у середньому після початку захворювання переходило у середню та тяжку форми.
Було проаналізовано наявність супутньої патології у хворих на акне. У 4 пацієнтів (4,8 %) були наявні вузлові утворення щитоподібної залози різного ступеня, проте в усіх хворих патологія була гормонально компенсована. 7 (16,3 %) пацієнток вказали на наявність у них СПКЯ, дана група пацієнтів паралельно перебувала під наглядом у гінеколога-ендокринолога. 12 хворих (14,3 %) мали в анамнезі хронічний гастрит, що в період проведення даного дослідження перебував у стадії стійкої ремісії. У двох пацієнтів із фульмінантними акне були наявні прояви поліартриту, дані пацієнти паралельно отримували лікування у ревматолога.
Усі пацієнти проходили загальноклінічні обстеження: загальний аналіз крові з лейкоцитарною формулою, глюкоза крові, біохімічний аналіз крові (АлАТ, АсАТ, загальний білок, креатинін, сечовина, СРБ, ревматоїдний фактор), аналіз крові на мікрореакцію преципітації для експрес-діагностики сифілісу, загальний аналіз сечі. У всіх пацієнтів, за винятком двох хворих на фульмінантні акне, усі загальноклінічні показники знаходились у межах норми. Пацієнти з проявами фульмінантних акне мали зміни в бік підвищення таких показників, як загальний білок і СРБ. Також у даних хворих був наявний помірний лейкоцитоз (до 12 х 109/л). Усі пацієнти були обстежені на наявність демодекозу як ускладнення основного захворювання. У 15 (17,9 %) хворих був виявлений Demodex folliculorum у значній кількості. Дана категорія пацієнтів отримала лікування від демодекозу, після чого був проведений контроль виліковності. У пацієнтів із середньо-тяжким акне демодекоз був виявлений у 4 хворих, а серед пацієнтів із тяжким перебігом – у 11.
Задля вирішення другого завдання дослідження було проведено оцінку впливу захворювання на якість життя пацієнтів (n=78) із використанням спеціально розроблених опитувальних листів CADI, що оцінював психо-емоційну напруженість пацієнта та вплив акне на якість життя пацієнта, та DLQI, що оцінює вплив дерматологічної патології на повсякденне життя пацієнта. Усього за обома шкалами було проанкетовано 78 пацієнтів із середньо-тяжким та тяжким перебігом акне. Серед них було 36 жінок (22 – з акне середнього ступеня тяжкості та 14 – із тяжким перебігом) та 42 чоловіки (14 – мали акне середньо-тяжкого ступеня тяжкості та 28 – тяжкий перебіг).
За опитувальником CADI серед обстежених жінок результати анкетування дещо відрізнялися від даних, що показали пацієнти чоловічої статі. У жінок з акне середньо-тяжкого ступеня тяжкості результати були в межах від 4 до 11 балів; середнє значення становило 7 балів, медіана – 7,5, мода – 8. Серед жінок, що мали тяжкий перебіг акне, результати знаходилися в діапазоні від 3 до 12 балів; середнє значення складало – 8, медіана – 9, моду для даної групи пацієнтів не вдалося визначити, оскільки кожен із отриманих результатів не повторювався. У всіх групах опитаних було показано значний вплив захворювання на психоемоційний стан пацієнтів.
Окрім того, згідно з даними проведеного анкетування, жінки із середньо-тяжким перебігом акне частіше вказували на високий вплив захворювання на психоемоційний стан порівняно з чоловіками, проте чоловіки із тяжким перебігом акне вказували на більш виражений вплив захворювання на їхню психоемоційну сферу, порівняно із жінками з аналогічною формою акне.
За опитувальником DLQI серед обстежених чоловіків з акне середньо-тяжкого ступеня тяжкості результат анкетування знаходився в діапазоні від 0 до 4 балів. Середнє значення у даній групі пацієнтів становило 2,6, медіана – 2,5, мода – 4. Чоловіки з тяжким перебігом акне показали наступні результати опитування: діапазон значень складав від 5 до 22 балів; середнє значення у пацієнтів із тяжким перебігом акне становило 10,9, медіана – 9,5, мода – 8. Серед обстежених жінок результати анкетування дещо відрізнялися від даних, що показали пацієнти чоловічої статі. У жінок з акне середньо-тяжкого ступеня тяжкості результати були в межах від 1 до 7 балів; середнє значення складало 4,8 балів, медіана – 5, мода – 7. Серед жінок, що мали тяжкий перебіг акне, результати знаходилися в діапазоні від 6 до 15 балів; середнє значення становило – 11,1, медіана – 11, мода – 11. Можна відмітити, що як у жінок, так і у чоловіків із середньо-тяжким перебігом акне захворювання мало незначний вплив на якість життя пацієнтів, проте у жінок даний показник був в 2 рази вищим, ніж у чоловіків, що вказує на більшу соціальну та психоемоційну напруженість у зв’язку з наявністю захворювання.
Серед жінок із тяжким перебігом акне було виявлено дуже сильний вплив на якість життя та психоемоційний стан хворих, серед чоловіків із тяжким перебігом даного дерматозу в середньому був виявлений помірний вплив акне на якість життя, проте в окремих індивідів показники опитувальника сягали 20–22 балів.
Задля вирішення третього завдання у хворих на акне проводилось обстеження на рівні статевих гормонів у периферійній крові (n=63). Пацієнти були поділені на дві групи залежно від тяжкості перебігу.
До першої групи увійшов 31 пацієнт на акне середньо-тяжкого перебігу, з них – 12 чоловіків та 19 жінок. Другу групу склали 32 пацієнти з тяжким перебігом акне – 21 чоловік та 11 жінок.
Також обидві групи були поділені на дві підгрупи залежно від статі, оскільки показники гормонального статусу суттєво відрізняються у чоловіків та жінок.
Рівень тестостерону загального у чоловіків із першої групи становив (18,27 ± 4,4) нмоль/л (при нормальних показниках – 8,64–29,0 нмоль/л), а у чоловіків із другої групи – (20,9 ± 6,8) нмоль/л (p>0,05). Рівень тестостерону вільного у чоловіків із середньо-тяжким перебігом акне був (38,9 ± 14,0) пг/мл (при показниках у здорових осіб – 15,0–50,0 пг/мл), а у пацієнтів чоловічої статі із тяжким перебігом – (48,6 ± 18,83) пг/мл (р>0,05). Проте у 33 % усіх чоловіків, незалежно від групи, відмічалося підвищення рівня вільного тестостерону – (66,59 ± 7,23) пг/мл, що може вказувати на зв’язок акне з рівнем вільного тестостерону у периферійній крові. Рівень ДГТ у чоловіків із першої групи становив (589,85 ± 172,3) пг/мл (при показниках у здорових осіб – 250–990 пг/мл), а у пацієнтів із другої групи – (570,1 ± 172,9) пг/мл (р>0,05).
Рівень тестостерону загального у жінок із першої групи складав (1,03 ± 0,6) нмоль/л (при показниках у здорових осіб – 0,29–1,67 нмоль/л), а із другої – (0,95 ± 0,42) нмоль/л (р>0,05). Рівень вільного тестостерону у жінок із середньо-тяжким перебігом акне становив (4,42 ± 1,6) пг/мл (при показниках у здорових осіб – до 9 пг/мл), а у другій групі – (4,27 ± 1,38) пг/мл (р>0,05). Рівень ДГТ у пацієнток із першої групи становив (325,92 ± 112,16) пг/мл (при показниках у здорових осіб – 24–368 пг/мл), а серед жінок із другої групи – (927,79 ± 260,11) пг/мл, що було достовірно (р<0,05). Аналіз рівня сироваткового прогестерону у жінок із першої групи показав (13,35 ± 6,0) нг/мл (показники здорових жінок у лютеїновій фазі менструального циклу – 1,7–27 нг/мл), а у другій – (7,8 ± 4,9) нг/мл (р>0,05). Рівень ПРЛ у першій групі становив (22,05 ± 11,3) нг/мл, ПРЛмин – 8,51 нг/мл, ПРЛмакс – 44,73 нг/мл, МЕ – 17,93 (показники здорових жінок у лютеїновій фазі менструального циклу – 4,79–23,3 нг/мл), у другій групі – (27,26 ± 12,6) нг/мл, ПРЛмин – 10,37 нг/мл, ПРЛмакс – 45,71 нг/мл, МЕ – 28,96 (р>0,05), проте середній рівень ПРЛ у жінок із тяжким перебігом акне мав тенденцію до підвищення. Визначення рівня естрадіолу у хворих із середньо-тяжким перебігом акне показало (107,43 ± 55,6) пг/мл (показники здорових жінок у лютеїновій фазі менструального циклу коливалися в межах 22,3–341,0 пг/мл), а з тяжким перебігом – (75,28 ± 48,5) пг/мл (р>0,05). Рівень ФСГ у жінок із першої групи становив (3,58 ± 1,4) мМО/мл (показники здорових жінок у лютеїновій фазі – 1,7–7,7 мМО/мл), а із другої групи – (4,33 ± 1,6) мМО/мл (р>0,05).
Таким чином, серед обстежених жінок рівень ДГТ був значуще вищим у пацієнток із тяжким перебігом акне. А у 33 % усіх чоловіків, незалежно від групи, відмічалося підвищення рівня вільного тестостерону – (66,59 ± 7,23) пг/мл, що може вказувати на зв’язок акне з рівнем вільного тестостерону в периферійній крові.
Для вирішення четвертого та п’ятого задач усі пацієнти проходили молекулярно-генетичне обстеження за генами TLR-4 (C399T), IL-1β (C3953T), IL-8 (С781Т) та були поділені на дві групи залежно від ступеня тяжкості акне. Окрім того, 29 пацієнтів та 6 батьків були обстежені за геном TLR-2 (G753A), але оскільки в усіх обстежених за даним геном був виявлений гомозиготний генотип GG, було прийнято рішення припинити дослідження даного поліморфного варіанту у хворих на акне та їхніх батьків.
За геном TLR-4 (C399T) у досліджуваних були наявні два варіанти генотипів – СС та СТ. У всіх пацієнтів із першої групи (n=42) відмічався гомозиготний генотип СС, у другій групі (n=42) у 31 (73,8 %) хворого був гомозиготний варіант СС, а у 11 (26,2 %) – гетерозиготний генотип СТ, що достовірно пов’язано із тяжкістю перебігу акне (р<0,01). За геном IL-1β (C3953T) всього було виявлено три варіанти генотипів – СС, СТ, ТТ. Переважна більшість пацієнтів із першої групи (n=42) мали гомозиготний варіант СС за даним геном – 31 (73,8 %), а у другій групі даний варіант генотипу був виявлений у 20 (47,6 %) пацієнтів як достовірний (р<0,05); у 10 (23,8 %) хворих із першої групи та 17 (40,5 %) був наявний генотип СТ (р>0,05), а в 1 (2,4 %) пацієнта із середньо-тяжким перебігом акне та у 5 (11,9 %) хворих із тяжким акне був виявлений варіант генотипу ТТ (р>0,05).
За геном IL-8 (С781Т) за жодним з генотипів не було виявлено значимої різниці (р>0,05).
Також було проаналізовано частоту комбінованих генотипів за вище переліченими генами залежно від ступеня тяжкості захворювання. Значущу різницю показали два варіанти комбінацій. Комбінований генотип 399CC + 3953CC + 781CC було виявлено у 9 (21,4 %) із середньо-тяжким перебігом акне та у 1 (2,4 %) хворого на тяжкий перебіг акне (χ2 = 5,562; р<0,05; OR=0,089; 95%CI – 0,01–0,74). Комбінований генотип 399CC + 3953CC + 781CT було виявлено у 21 (50 %) пацієнта із першої групи та 7 (16,7 %) хворих із другої (χ2 = 10,500; р<0,01; OR=0,2; 95%CI – 0,07–0,55).
Окремо були проаналізовані комбінації двох генів – IL-1β (C3953T) та IL-8 (С781Т) у групах порівняння. З 9 можливих варіантів генотипу значуща різниця була виявлена лише у 1 – 3953CC + 781CT. Дану комбінацію мав 21 (50 %) пацієнт із першої групи та 11 (26,1 %) хворих із другої (χ2 = 5,048; р<0,05; OR=0,35; 95%CI – 0,14–0,88).
Дані результати дозволили виявити асоціацію між наявним у пацієнтів генотипом 388СТ за геном TLR-4 та підвищеною схильністю до тяжкого перебігу акне. Також було встановлено, що частота гетерозиготного варіанту за геном IL-1β (3953СT) була значуще збільшеною серед пацієнтів із середнім ступенем тяжкості акне. Також було показано, що ризик розвитку тяжких форм акне значуще зростав при наявності у пацієнтів генотипу 781ТТ за геном IL-8. Було відмічено, що комбіновані генотипи 399СС + 3953СС + 781СС, 399СС + 3953СС + 781СТ за генами TLR-4, IL-1β, IL-8 та 3953CC + 781CT за генами IL-1β, IL-8 виявлялися частіше у пацієнтів з акне середнього ступеня тяжкості порівняно з тяжкими формами акне.
Також був проведений аналіз між генними поліморфізмами та рівнями статевих гормонів. Для аналізу було обрано варіанти генотипів генів IL-1β (C3953T) та IL-8 (С781Т) (ген TLR-4 (C399T) не був включений, оскільки у всіх пацієнтів із підвищеними рівнями досліджуваних гормонів був наявний гомозиготний генотип СС за даним геном) та рівні статевих гормонів, що показали найбільші відхилення від нормальних показників, а саме вільний тестостерон у чоловіків та ДГТ та пролактин у жінок. Пацієнти були поділені на дві групи залежно від наявності або відсутності підвищення досліджуваного гормону (за нормальні бралися показники здорових осіб).
Для дослідження було взято 9 комбінованих генотипів за генами IL-1β (C3953T) та IL-8 (С781Т), з них лише за комбінацією 3953CT + 781CT було виявлено статистично значущу різницю. Дана комбінація спостерігалась у 5 (41,7 %) пацієнтів із підвищеним рівнем вільного тестостерону та у 1 (4,8 %) із нормальними значеннями даного гормону (χ2 = 4,73; р<0,05; OR=0,07; 95%CI – 0,007–0,707), що вказує на зв’язок даного комбінованого генотипу із підвищеним рівнем вільного тестостерону у хворих на акне.
Серед обстежених жінок показники ДГТ розподілилися між 6 комбінованими генотипами, з яких 2 показали значущу різницю. Комбінований генотип 3953CC + 781CT був наявний у 10 (52,6 %) пацієнток без підвищення рівня ДГТ та у жодної з підвищеним вмістом даного гормону (р<0,05); комбінація 3953CT + 781CT була виявлена у 5 (45,4 %) пацієнток із підвищеним рівнем ДГТ та в 1 (5,3 %) хворої з нормальним рівнем (χ2 = 4,74; р<0,05; OR=0,007; 95%CI – 0,006–0,69), що вказує на зв’язок даного комбінованого генотипу із підвищеним рівнем ДГТ у жінок, що хворіють на акне.
Для вирішення шостої задачі дослідження було прийнято рішення провести порівняльне лікування у двох групах: в одній групі – застосувати нікотинамід рибозид та стандартну терапію, а в іншій лише стандартну терапію. Хворі були поділені на дві групи по 39 чоловік незалежно від результатів молекулярно-генетичного обстеження. Кожна група додатково поділена на дві підгрупи залежно від тяжкості перебігу захворювання. До першої групи увійшло 20 пацієнтів зі середньо-тяжким перебігом акне (Іа) та 19 пацієнтів з тяжкою формою акне (Іb). До другої групи увійшли 21 хворий на середньо-тяжке акне (IIa) та 18 – з тяжким перебігом даного дерматозу (IIb).
Перша група отримувала нікотинамід рибозид у дозі 225 мг/добу у трьох прийомах протягом 2 місяців в якості системної терапії. Також пацієнти даної групи отримували місцеву терапію. Друга група отримувала лише стандартну терапію, аналогічну першій групі.
Після отримання пацієнтами із середньо-тяжким акне призначеної терапії (група Іа отримувала нікотинамід рибозид та стандартне лікування, група ІІа отримувала лише стандартну терапію) протягом 2 місяців був проведений підрахунок елементів висипу, що залишилися по завершенні терапії.
Залежно від ефективності лікування всіх пацієнтів було розділено на три групи: «чиста шкіра» – повне очищення від висипу; «практично чиста шкіра» – поодинокі комедони, 1-4 папули, відсутність пустул, вузлів; «значне очищення шкіри» – поодинокі комедони, 5–7 папул, 1–3 вузли до 1 см, відсутність пустул.
Виявлено, що серед пацієнтів з першої групи, що приймали нікотинамід рибозид, було достовірно більше хворих, у яких відмічалося значне покращення стану шкіри, порівняно із групою хворих, що отримували лише стандартну терапію.
Після отримання пацієнтами із тяжким перебігом акне призначеної терапії (група Іb отримувала нікотинамід рибозид та стандартне лікування, група ІІb отримувала лише стандартну терапію) протягом 2 місяців був проведений підрахунок елементів висипу, що залишилися по завершенні терапії.
Залежно від ефективності лікування всіх пацієнтів було розподілено на три групи: «чиста шкіра» – наявність рубців, відсутність папул, пустул, кіст та вузлів; «практично чиста шкіра» – 1–4 папули, 1 вузол, відсутність пустул та кіст; «значне очищення шкіри» – 5–10 папул, 3–4 вузла, відсутність пустул та кіст.
Відмічено, що серед пацієнтів із тяжким перебігом акне з першої групи, що приймали нікотинамід рибозид, кількість хворих, у яких відмічалося повне зникнення елементів висипу значно перебільшувало тих, хто отримував лише стандартну терапію.
Отримані дані були зіставлені з результатами молекулярно-генетичного дослідження. Серед пацієнтів з повним та практично повним очищенням шкіри у групі Іb у всіх пацієнтів відмічався генотип СТ або ТТ за геном IL-8 (С781Т), що може вказувати на особливо сильний вплив алеля Т на тяжкість перебігу акне; у хворих з групи IIb, що мали значне очищення шкіри, названі варіанти генотипу відмічалися лише в одного пацієнта.
До того ж серед пацієнтів з повним очищенням шкіри у групі Іа у всіх пацієнтів відмічалися поліморфні варіанти СТ або ТТ за геном IL-8 (С781Т), які асоціюються з більш тяжким перебігом акне, і навпаки – у хворих першої групи, що мали практично повне та значне очищення шкіри такі генотипи відмічалися лише у 3 пацієнтів (50,0 %).
Аналіз та узагальнення результатів дослідження дало можливість встановити, що важливим напрямком у попередженні розвитку тяжких форм акне є профілактична робота. Дана профілактична робота відрізняється залежно від обтяженості сімейного анамнезу, даних гормонального обстеження та молекулярно-генетичної діагностики. За результатами дослідження було розроблено схему лікування акне з урахуванням даних молекулярно-генетичної діагностики.
Проведене дослідження доводить, що обтяжений спадковий анамнез, наявність мутацій у досліджуваних генах є важливими предикторними факторами, що впливають на ризик формування тяжких форм акне.
ВИСНОВКИ
У дисертаційній роботі теоретично узагальнено вирішення наукового завдання – підвищення ефективності терапії хворих на акне шляхом розробки патогенетично обґрунтованого комплексного методу на підставі клінічних, психометричних, молекулярно-генетичних та гормональних показників.
- Враховуючи розповсюдженість акне серед населення (9,4 % популяції), захворюваність осіб молодого віку (80–90 % підлітків), соціальну дезадаптацію (30–50 % підлітків відчувають психологічний дистрес, пов’язаний із акне), можливий тяжкий перебіг, персистуючий перебіг у частини хворих (у 4 % акне продовжується після 40 років), резистентність тяжких форм до лікування, стає актуальною оптимізація терапії хворих на даний дерматоз із урахуванням тяжкості перебігу та спадкової схильності.
- Комплексне обстеження 95 (48 чоловіків та 47 жінок) хворих на акне та членів їхніх родин виявило, що тяжкий перебіг захворювання відзначено у 42 хворих, а у 42 хворих були прояви акне середнього ступеня тяжкості, більшу частину пацієнтів становили особи віком 14–25 років (80,9 % хворих), а до вікової категорії 26-40 років належали 16 пацієнтів (19,1 %), тобто обстежені хворі складали молоду, працездатну частину популяції. Тривалість захворювання в обстежених пацієнтів становила від 2 до 23 років (у середньому 5,2 років), дебют акне констатовано у віці від 12 до 21 року (в середньому 15,2 років). У 75 (92,6 %) пацієнтів був виявлений зв’язок між дебютом захворювання та статевим дозріванням. Сімейні випадки захворюваності акне загалом ідентифіковано у 63 осіб (75 %).
- Продемонстровано, що показники якості життя у 78 хворих на різні форми акне, означені за допомогою опитувальних листів CADI (оцінка психоемоційної напруженості), продемонстрували, що жінки із перебігом акне середньої тяжкості частіше вказували на високий вплив захворювання на психоемоційний стан (у середньому 7 балів) порівняно з чоловіками, проте чоловіки із тяжким перебігом акне вказували на більш виражений вплив (у середньому 8,6 балів), порівняно із жінками з аналогічною формою акне. За результатами опитувальника DLQI (вплив дерматологічної патології на повсякденне життя пацієнта) виявлено, що у жінок із середнім ступенем тяжкості акне даний показник був у 2 рази вищим, ніж у чоловіків. Серед жінок із тяжким перебігом акне був установлений більший вплив на якість повсякденного життя порівняно з чоловіками, а у окремих індивідів показники опитувальника сягали навіть 20–22 балів.
- З’ясовано, що рівень сироваткового ДГТ був значимо вищим (у 2,85 рази) у жінок із тяжким перебігом акне, ніж у жінок із середнім ступенем тяжкості. Показники у жінок із середньо-тяжким перебігом акне знаходились у діапазоні 109,6–861,6 пг/мл, МЕ – 229,5; у пацієнток з тяжким перебігом – 98,1–2285,7 пг/мл, МЕ – 791,0. У 33 % усіх чоловіків, незалежно від групи, відмічалося підвищення рівня вільного тестостерону (у 1,4 рази від верхньої межі норми), що може вказувати на зв’язок акне із рівнем вільного тестостерону у периферійній крові.
- Виявлено асоціацію між наявним у пацієнтів генотипом 388СТ за геном TLR-4 та підвищеною схильністю до тяжкого перебігу акне. Частота гетерозиготного варіанту за геном IL-1β (3953СT) була значуще збільшеною серед пацієнтів із середнім ступенем тяжкості акне. Ризик розвитку тяжких форм акне значуще зростав при наявності у пацієнтів генотипу 781ТТ за геном IL-8. Комбінації генотипів 399СС + 3953СС + 781СС, 399СС + 3953СС + 781СТ за генами TLR-4, IL-1β, IL-8 та 3953CC + 781CT за генами IL-1β, IL-8 виявлялися частіше у пацієнтів з акне середнього ступеня тяжкості порівняно з тяжкими формами акне.
- Виявлено асоціацію комбінації генотипів 3953CT + 781CT за генами IL-1β, IL-8 із зростанням вмісту вільного тестостерону в сироватці крові у чоловіків з акне. Комбінація генотипів 3953CC + 781CT за генами IL-1β, IL-8 була значимо асоційована зі зниженим рівнем ДГТ у жінок з акне, у той час як комбінація генотипів 3953CT + 781CT за генами IL-1β, IL-8 навпаки – з підвищеним рівнем ДГТ.
- Продемонстровано, що серед пацієнтів із середнім ступенем тяжкості акне, які приймали нікотинамід рибозид у дозі 225 мг/добу протягом 2 місяців, було достовірно більше хворих, у яких відмічалося значне покращення стану шкіри, порівняно із групою хворих, що отримували лише стандартну терапію. Було помічено, що серед пацієнтів із тяжким перебігом акне, що приймали нікотинамід рибозид, кількість хворих, у яких відмічалося повне зникнення елементів висипу значимо перебільшувало тих, хто отримував лише стандартну терапію. Отримані дані були співставлені з результатами молекулярно-генетичного дослідження. Серед пацієнтів, що мали генотип СТ або ТТ за одним або декількома досліджуваними генами, відмічалося повне або практично повне очищення шкіри на тлі прийому нікотинамід рибозиду.
РЕКОМЕНДАЦІЇ
Результати дисертаційного дослідження довели, що хворим на акне доцільно проводити молекулярно-генетичну діагностику з визначенням поліморфних варіантів генів TLR-4 (C399T), IL-1β (C3953T) та IL-8 (С781Т) для прогнозування можливості розвитку та визначення характеру клінічного перебігу захворювання.
Ідентифікація характеру комбінацій генотипів генів TLR-4, IL-1β та IL‑8 у взаємозв’язку з рівнем сироваткових статевих гормонів та клініко-анамнестичними особливостями перебігу захворювання дозволяє впроваджувати індивідуальний підхід до вибору тактики лікування хворих на акне.
Розроблено схему диференційованого лікування хворих на середньо-тяжке та тяжке акне. Результати дисертаційного дослідження дозволяють рекомендувати включення в комплексні схеми терапії хворих на акне середньо-тяжкого та тяжкого ступенів нікотинамід рибозид у дозі 225 мг/добу у трьох прийомах протягом 2 місяців.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
1. Адаскевич В.П. (2005). Акне: вульгарные и розовые. М.: Медицинская книга; Н.Новгород: Издательство НГМА.
2. Алиева П.М., Мамашева Г.Д. (2013). Современная терапия акне и акнеиформных дерматозов. Рос Журн Кож и Венер Бол. 6, 37-42.
3. Волкова Е.Н., Осипова Н.К., Григорьева А.А., Платонов В.В. (2014). Прогрессивные технологии ведения больных с угревой болезнью и постакне. Український журнал дерматології, венерології, косметології, 3(38), 99-104.
4. Гладько В.В., Масюкова С.А., Санакоева Э.Т. и др. (2009). Новые возможности в лечении акне. TeraMedicumNova, 1-5, 32-36.
5. Горячкина М.В. (2008). Роль психоэмоциональных факторов в развитии акне. Consilium medicum, 2, 8-12.
6. Гречанська Л.В., Петренко А.В. (2016). Від європейських до українських протоколів по лікуванню акне з позиції спадкових факторів. Український журнал дерматології, венерології та косметології, 4 (63), 100-101.
7. Иванов О.Л., Монахов С.А. (2010) Бьюти котрацепция с косметическим эффектом. Новая аптека, 5, 128-129.
9. Ионеско М.А. (2011). Современные средства, воздействующие на Toll–подобные рецепторы, в лечении воспалительных дерматозов. Вестн Дермат Венерол, 1, 94-96.
10. Калюжна Л.Д. (2008). Хвороби похідних шкіри (Навч. Посіб). Київ: Грамота.
11. Калюжна Л.Д., Гречанська Л.В., Петренко А.В. (2015). Клінічна ефективність ретиноїдів нового покоління в лікуванні акне. Дерматовенерологія. Косметологія. Сексопатологія,3-4,16-22.
12. Калюжная Л.Д., Гречанская Л.В., Петренко А.В. (2017). Акне: современный взгляд на диагностику и лечение. Здоров’я України, 4(401), 46-47.
13. Карвацька Ю.П., Денисенко О.І. (2013). Функціональний стан щитоподібної залози у хворих на вульгарні вугрі в регіоні з природним йододефіцитом. Журн дерматовенерол та косметол ім. М.О.Торсуєва, 1-2(30), 47-50.
14. Кобзарь А.И. (2012) Прикладная математическая статистика. Для инженеров и научных работников. М. : Физматлит, 816 с.
15. Коновалова Т.С. (2014). Показники імунологічного статусу організму в чоловіків, хворих на вугрову хворобу. Український журнал дерматології венерології косметології, 2(53), 47-57.
16. Кунгуров Н.В., Кохан М.М., Кенинсфет Ю.В. (2009). Терапия больных акне с различной тяжестью течения заболевания. Совр Проблем Дерматовенерол Иммунол Врач Косметол, 4, 28-32.
17. Кунгуров Н.В., Кохан М.М., Шабардина О.В. (2014). Опыт терапии больных со среднетяжелыми и тяжелыми акне препаратом «Акнекутан». Український журнал дерматології, венерології, косметології, збірник статей, 66-73.
18. Кутасевич Я.Ф., Бронова И.М. (2011). Базовая и адьювантная терапия при тяжелых формах акне. Український журнал дерматології венерології косметології, 2(57), 74-79.
19. Кутасевич Я.Ф., Маштакова И.А. (2014). Опыт лечения тяжелых форм угревой болезни. Український журнал дерматології, венерології, косметології, збірник статей, 9-15.
20. Литус А.И., Петренко А.В. (2016). Особенности патогенетической характеристики акне с учетом функционального состояния кожи и наследственной склонности. Дерматовенерология. Косметология (международный научный журнал), 2, 2, 208-212.
21. Літус О.І., Петренко А.В. (2017). Співставлення психоемоційного стану хворих на акне із тяжкістю перебігу та спадковими чинниками. Галицький лікарський вісник, 2(27), doi: 10.21802/gmj.2017.2.8.
22. Літус О.І., Петренко А.В. (2016). Психоемоційний стан хворих на акне із урахуванням тяжкості перебігу та спадкової схильності. Дерматовенерологія. Косметологія. Сексопатологія, 3-4(4), 10-12.
23. Лотти Т. Росси Р., Адаскевич В.П., Козловская В.В. (2008). Применение местной фотодинамической терапии в дерматологии. Рос Журн Кож Венер Бол, 2, 64.
24.Масюкова С.А., Мордовцева В.В., Кахишвили Н.Н. и др. (2014). Клинический опыт лечения акне низкими дозами изотретиноина. Клин Дерматол Венерол, 1, 68-71.
25. Миронов А.Ю., Терехова Ю.Б., Юрченко А.И. (2008). Этиопатогенетические аспекты терапии угревой болезни. Дерматология, 2, 13-14.
26. Монахов С.А. (2014). Радикальная терапия акне. Український журнал дерматології, венерології, косметології, збірник статей, 80-88.
27. Наумова Л.О., Степаненко В.І. (2014). Синдром гіперандрогенії у жінок, хворих на вугрову хворобу: алгоритм діагностики. Український журнал дерматології венерології косметології, 4(55), 34-41.
28. Пат. на корисну модель 121339 UA, МПК C12N15/00, A01H1/00, A01H1/08. Спосіб прогнозування розвитку тяжких форм акне за допомогою молекулярно-генетичних методів / А.В. Петренко; заявник і патентовласник Національна медична академія післядипломної освіти ім. П.Л. Шупика. № u201708769; заявл. 31.08.2017; опубл. 27.11.2017, Бюл. № 22.
29. Петренко А.В. (2017). Аналіз генетичного та гормонального статусу у пацієнтів з акне. Матеріали науково-практичної конференції з міжнародною участю «Новітні технології діагностичних, лікувальних та профілактичних заходів в дерматовенерології та методи і стан їхнього впровадження», м. Харків, 11-12 листопада 2016 р. Дерматологія та венерологія. № 3 (73). С. 83-84.
30. Петренко А.В., Горовенко Н.Г., Россоха З.І. (2017). Аналіз рівня статевих гомонів у хворих на акне різного ступеня тяжкості з урахуванням показників вродженого імунітету. Дерматологія та венерологія, 3(77), 46-52.
32. Петренко А.В. (2016). Аналіз сімейної схильності при акне. Матеріали регіональної науково-практичної конференції Святогорські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом, 27.
33. Петренко А.В. (2016). Патогенетичні аспекти акне від вивчення стану шкіри до визначення деяких генетичних факторів. Збірник наукових праць Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я, випуск 13, 219-224.
34. Петренко А.В., Россоха З.І. (2017). Тяжкість перебігу акне в залежності від варіантів генних поліморфізмів. Дерматологія та венерологія, 2(76), 33-36.
35. Петренко А.В. (2017). Алгоритм лікування акне з урахуванням патогенетичних складових. Український журнал дерматології, венерології, косметологїї, 2(65), 44-48.
36. Петренко А.В. (2016). Вивчення деяких генних порушень у хворих на акне. Збірник наукових праць співробітників НМАПО імені П.Л.Шупика, Випуск 25, Київ, 132-136.
37. Петренко А.В. (2017). Генні порушення, як безумовний фактор спадковості у хворих на акне. Матеріали 40-вої ювілейної науково-практичної конференції молодих вчених НМАПО імені П.Л. Шупика з міжнародною участю, присвяченої Дню науки, 48-50.
38. Петренко А.В. (2016). Деякі генні порушення у хворих на акне. Дерматовенерологія. Косметологія. Сексопатологія, 1, 2(3), 79.
39. Петренко А.В. (2017). Співставлення генетичної складової в родинах хворих на акне. Дерматологія та венерологія, 1(75), 20-23.
40. Петренко А.В. (2016). Спадкові фактори та тяжкість перебігу акне. Матеріали науково-практичної конференції молодих вчених НМАПО імені П.Л.Шупика, 102-104.
41. Петренко А.В., Приходько І.В. (2017). Аналіз патогенетичних складових у випадку фульмінантного акне. Дерматовенерологія. Косметологія. Сексопатологія,1-2(57), 97-100.
42. Потекаев Н.Н. (2008). Акне (угревая болезнь): современный взгляд на проблему. Дерматология, 1, 12-16.
43. Самцов А.В. (2009). Акне и акнеформные дерматозы. М: ЮТКОМ.
44. Самцов А.В., Стаценко А.В., Волкова С.В., Горбунов Ю.Г., Хайрутдинов В.Р. (2014). Вопросы эффективности и безопасности применения «Акнекутана» в косметології. Український журнал дерматології, венерології, косметології, збірник статей, 39-41.
45. Санакоева Э.Г., Масюкова И.В., Ильина И.В., Введенская Э.В., Плиева Д.В., Алиева П.М., Мамашева Г.Д. (2013). Рос Журн Кож и Венер Бол, 6, 37-42.
46. Семенуха К.В., Ковальская Е.А., Салей Е.А., Семенуха О.К., Ковальчук А.П. (2014). Новые подходы в лечении среднетяжелых форм акне с применением «Акнетина». Український журнал дерматології, венерології, косметології, збірник статей, 9-16.
47. Степаненко В.І., Іванов С.В., Наумова Л.О. та ін. (2015). Удосконалення сучасних методів лікування вугрової хвороби. Український журнал дерматології венерології косметології, 1(56), 40-49.
48. Степаненко В.І., Клименко А.В. (2010). Акне та акнеподібні дерматози (розацеа, демодекоз): стратегія комплексної етапної терапії. Клінічна імунологія. Алергологія. Інфектологія,1, 86-96.
49. Таркина Т.В. (2010). Разработка компонентных методов лечения и формирования условий стойкой ремиссии у больных акне и розацеа: автореф дис. канд мед наук. Алматы.
50. Тунина Н.В., Масюкова С.А., Пищулина А.А. (2005). Роль половых стероидных гормонов в патогенезе акне. Єксперимент и клин дерматокосметол, 2, 25-29.
51. Федорич Л.Я. (2014). Терапія хворих на акне з використанням системного ізотретиноїну LIDOSE та її оптимізація. Український журнал дерматології, венерології, косметології, збірник статей, 53-66.
52. Хаитов Р.М., Пащенков М.В., Пинегин Б.В. (2009). Роль паттерн-распознающих рецепторов во врожденном и адаптивном иммунитете. Иммунология, 1, 66-76.
53. Халдин А.А., Мареева Е.Б., Скворцова А.И. (2012). Патогенетические подходы к терапии вульгарных угрей. Рос Журн Кож Венер Бол, 3, 34-37.
54. Цепколенко В.А., Маврова Д.И. (2007). Современный подходы к патогенезу и лечению угревой болезни. Дерматологія та Венерологія, 4(38), 41-44.
55. Шаркова В.А., Рахманова С.Н. (2011). Структура микробиоценозов различных клинико-морфологических форм угревых элементов. Аллерг Иммун, 12, 31-37.
56. Шупенько О.М., Степаненко В.І., Короленко В.В. (2014). Перспективи ведення пацієнтів з акне з використанням системних кретиноїдів. Український журнал дерматології, венерології, косметології, збірник статей, 27-31.
57. Юцковский А.Д. Наумчик Г.А., Рахманова С.Н., Наход Е.В. (2010). Обоснование комбинированной антибактериальной терапии угревой болезни. Соврем Проблемы Дермат Иммунол Врач Косм, 1, 67-73.
58. Admani S., barrio V.R. (2013). Evaluation and treatment of acne from infancy to preadolescence. Dermatol Therapy, 26(6), 462-466.
59. Agak GW, Qin M, Nobe J. et al. (2014). Propionbacterium acnes induces an IL-17 response in acne vulgaris that is regulated by vitamin A and vitamin D. J Invest Dermatol, 134, 366-373.
60. Amichai S et al. (2008). Low-dose isotretinoin in the treatment of acne vulgaris. J Am Acad Dermatol, 58, 56-59.
61. Aramcibia S.A., Caroll J.B., Aguerre I.M., Silva P. et al. (2007). Receptors are key particihfynsin innate immune response. Biol Res, 40, 97-112.
62. Araviiskaia E. Dreno B. (2016). The role of topical dermocosmetics in acne vulgaris. J Eur Acad dermatol Venereol, 30, 926-935.
63. Aubin GG, Portillo ME, Trampuz A, Corvec S. (2014). Propionbacterium acnes, an emerging pathogen: from acne to implant-infections, from phylotype to resistence. Med Mal Infect, 44, 241-250.
64. Barrat H., Hamilton F., Car J., Lyons C., Layton A., Majeed A. (2009). Outcome measures in acne vulgaris: systemic review. Br J Dermatol, 160, 132-136.
65. Baumann IS, Oresajo C, Yatskayer M. et al. (2013). Comparison of clindamycin 1% and benzoyl peroxide 5% gel to a novel composition containing salicylic acid, capryloyl salicylic acid, HEPES, glycolic acid, citric acid and dioic acid in the treatment of acne vulgaris. J Drugs Dermatol, 12, 266-269.
66. Begon E, Michel I, Flageul B, Beaudoin I, et al. (2007). Expression, subcellular localization and cytokinic modulation of Toll-receptors (TLRs) in normal human keratinocytes: TLR2 up-regulation in psoriatic skin. Eur J Dermatol, 17, 6, 497-506.
67. Bellew S, Thiboutot D, Rosso JQ. (2011). Pathogenesis of acne vulgaris what’s new, what’s interesting and what may be clinically relevant. J Drugs Dermatol 10, 582-585.
68. Beylot C, Auffret N, Poli F et al. (2014). Propionbacterium acnes: an update on its role in the pathogenesis of acne. J Eur Acad Dermatol Venereol, 28, 271-278.
69. Bhambri S, Del Rosso JQ, Bhambri A. (2009). Pathogenesis of acne vulgaris: recent advances. J Drug Dermatol, 8, 615-618.
70. Bhate KW, Williams HC. (2013). Epidemiology of acne vulgaris. Journ Acad Dermat Vener, 168(3), 474-483.
71. Bilgic O., Dogdu M., Kaya Islamoglu G., Altinyazar C. (2014). The relationship between the second to fourth digit ratio and acne vulgaris. J Eur Acad Dermat Venereol, 28, 1340-1343.
72. Cao H., Yang G., Wang Y., Lin J.P., Smith C.A., Luo H., Lin G. (2015). Complementary therapies for acne vulgaris. Cochrane Database, 19, 1.
73. Capitanio B., Lora V., Ludovici M., Sinagra J.-L., Ottaviani M., Mastrofrancesco A., Ardigo M., Camera E. (2014). Modulation of sebum oxidation and interleukin-1α levels assotiates with clinical improvement of mild comedonal acne. Journ Eur Acad Dermat Vener, 28: 1792-1798.
74. Cauci S., Di Santolo M, Ryckman KK, et al. (2010). Variable number of tandem repeat polymorphisms of the interleukin-1 receptor antagonist gene IL-1RN: a novel association with the athlete status. BMC Med Genet, 11, 29-33.
75. Chen C.H., Wang Y., NakatsuJi T. et al. (2011). An innate bactericidal oleic acid effective against skin infection of methicillin-resistant staphylococcus aureus: A therapy concordant with evolutionary medicine. J Microbial Biotechnol, 21, 391-399.
76. Cheng C.E., Irwin B., Mauriello D., Liang L., Pappert A., Kimball A.B. (2010). Self-reported acne severity, treatment, and belief patterns across multiple racial and ethnic groups in adolescent students. Pediatr Dermatol, 27, 446-452.
77. Collier C.N., Harper J.C., Cafardi J.A., et al. (2008). The prevalence of acne in adults 20 years and older. J Am Acad Dermatol, 58(1), 56-59.
78. Colonna L., Pacifico V., Lello S., Sorge R., Raskovic D., Primavera G. (2012). Skin improvement with two different oestroprogestins in patients affected by acne and polycystotic ovary syndrome: clinical and instrumental evaluation. Journ Eur Acad Dermat Vener, 11, 1364-1321.
79. Danby F.W. (2005). Acne and milk, the diet myth, and beyond. J Am Acad Dermatol, 52, 360-362.
80. Dapne S, Hiscutt E. L., Seukeran D.C. (2011). Evaluation of the clinical efficacy of the 1450 nm laser in acne vulgaris: a randomized split-face, investigator – blinded clinical trial. Brit J Dermatol, 165(6), 1256-162.
81. Das S., Reynolds R.V. (2014). Recent advances in acne pathogenesis: Implications for therapy. Am J Clin Dermatol, 15(6), 479-488.
82. Decker A., Graber E.M. (2012). Over-the-counter acne treatments: a review. J Clin Aesth Dermatol, 5, 32-40.
83. Del Rosso J.Q., Kim J. (2009). Optimizing use of oral antibiotics in acne vulgaris. Dermatol Clin, 27(1), 33-42.
84. Dhir R., Geni N.P., Agarwal R., More Y.E. (2008). Oral isotretinoin is as effective as a combination of oral isotretinoin and topical anti-acne agents in nodulicystic acne. Indian J Dermatol Venereol Leprol, 74, 187.
85. Di Landro A., Cazzaniga S., Parrazzini F. et al. (2012). Family history, body mass index, selected dietary factors, menstrual history, and risk moderate to severe acne in adolescents and young adults. J Am Acad Dermatol, 67, 1129-1135.
86. Dreno B., Alirezai M., Auffret N., Beylot C., Chivot M. et al. (2007). Clinical and psychological correlation in acne: use of the ECLA and CADI scales. Ann Dermatol, 134, 451-455.
87. Dreno B., Araviiskaia E., Berardeska E. et al. (2014). The science of dermocosmetics and its role in dermatology. J Eur Acad Dermatol Venereol, 28, 1409-1417.
88. Dreno B., Layton A., Zouboulis C.C. et al. (2013). Adult female acne: a new paradigm. J Eur Acad Dermatol Venereol, 27, 1063-1070.
89. Dreno B., Thiboutot D., Gollnick H., et al. (2014). Antibiotic stewardship in dermatology: limiting antibiotic use in acne. Eur J Dermatol, 24, 330-334.
90. Dreno B., Thiboutot D., Layton A.M., Berson D., Perez M., Kang S. (2015). Large-scale international study enhances understanding of an emerging acne populations adult females. J Eur Acad Dermatol Venereol, 29, 1096-1106.
91. Dreno B., Alirezai M., Auffret N., Beylot C., Chivot M., Daniel F. et al. (2007). Clinical and psychological correlation in acne: use of the ECLA and CADI scales. Ann Dermatol Venereol, 134, 451-455.
92. Dreno B., Pola E., Pawin H. (2011). Development and evaluation of Global Acne Severety Scale (GEA Scale) suitable for France and Europe. J Eur Acad Dermatol Venereol, (25)1, 43-48
93. Dumont-Wallon G., Dreno B. (2008). Specifity of acne in women elder than 25 years. Presse Med, 37, 585-591.
94. Emanuele E., Bertona M., Altabas K. et al. (2012). Antiinflammatory effects of a topical preparation containing nicotinamide, retinol, and 7-dehydrocholesterol in patients with acne: a gene expression study. Clin Cosmeti Invesig Dermatol, 1, 33-37.
95. Ermertcan A.T., Ozturk F., Gunduz K. (2011). Toll-like receptors and skin. J Eur Acad Dermatol Venereol, 9, 997-1006.
96. Gazouli M., Mantzaris G., Kotsinas A. (2005). Association between polymorphisms in the Toll-like receptor 4, CD14, and CARD15/NOD2 and inflammatory bowel disease in the Greek population. World J Gastroenterol, 11(5), 681–685.
97. Gässler N., Peuschel T., Pankau R. (2000). Pediatric reference values of estradiol, testosterone, lutropin, follitropin and prolactin. Clin Lab, 46(11-12), 553-60.
98. Goldberg J.D., Berlin A.L. (2012). Acne and Rosacea. Epidemiology, Diagnosis, and Treatment. Manson Publishing, 15-28.
99. Gollnick H., Cunliffe W.J., Berson D., Dreno B., Finlay A.Y., Leyden J.J. et al. (2003). Management of acne: a report from a Global Alliance to Improve Outcomes in Acne. J Am Acad Dermatol, 49, S1-37.
100. Gollnick H.P., Draelos Z., Glenn M.J., Rosoph L.A., Kashuba A., Cornelison R., et al. (2009). Adapalene-benzoyl peroxide, a unique fixed-dose combination topical gel for the treatment of acne vulgaris: a transatlantic randomized, double-blind, controlled study in 1670 patients. Br J Dermatol, 161, 1180-1189.
101. Gollnick H.P. (2015). From new finding in acne pathogenesis to new approaches in treatment. J Eur Acad Dermatol Venereol, 29 (Suppl. 5), 1-7.
102. Gollnick H.P.M., Finlay A.Y., Shear N. (2008). Can we define acne as a chronic disease? If so, how and when? Am J Clin Dermatol, 9, 279-284.
103. Green B.A., Yu R.J., Van Scott E.J. (2009). Clinical and cosmoceutical uses of hydroxyacids. Clin Dermatol, 27, 495-501.
104. Hay R.J., Johns N.E., Williams H.C., Bolliger I.W., Dellavalle R.P. et al. (2013). The global burden of skin disease in 2010: an analysis of the prevalence and impact of skin conditions. J Eur Acad Dermatol Venereol, 134(6), 1527-1534.
105. Herane M.I., Ando I. (2003), Acne in infancy and acne genetics. Dermatology, 206, 24-28.
106. Hocesman E., Reynolds R.V. (2014). Polycystic ovary syndrome: a review for dermatologists. Part I. Diagnosis and manifestations. J Amer Dermatol, 71(5), 847.
107. Honekopp I., Watson S. (2010). Meta-analysis of digit ratio 2D : 4D shows greater sex difference in the right hand. Am J Hum Biol, 22, 619-630.
108. Hua W., Xie H., Chen T., Li L. (2014). Comparison of two series of non-invasive instruments used for the skin physiological properties measurements: the ‘Soft Plus’ from Callegari S.p.A vs. the series of detectors from Courage & Khazaka. Skin Res Technol, 20(1), 74-80.
109. Ishii K.J., Akira S. (2008). Innate immunity. In Rich RR, Fleisher TA, Shearer WT (Eds), Clinical immunology Principles and Practice, 3rd edn/ Elsevier Ltd, (p.p. 39-51), Philadelphia.
110. Jarrousse V., Castex-Rizzi N., Khammari A. et al. (2007). Zinc salts inhibit in vitro Toll-like receptor 2 surface expression by keratinocytes. Eur J Dermatol, 17, 492-496.
111. Jung J.Y., Choi Y.S., Yoon M.Y., Min S.U., Suh D.H. (2009). Comparison of a pulsed dye laser and a combined 585/1,064-nm laser in the treatment of acne vulgaris. Dermatol Surg, 35, 1181-1187.
112. Kang S.S., Kauls L.S., Gaspari A.A. (2006). Toll-like receptors: applications to dermatologic diseases. J Eur Acad Dermatol Venereol, 54(6), 951-983.
113. Kar B.R., Tripathy S., Panda M. (2013). Comparative study of oral isotretinoin versus oral isotretinoin + 20% salicylic acid peel in the treatment of active acne. J Cutan Aesthetic Surg, 6, 204-208.
114. Karkiauskiene J., Valiukeviciene S., Gollnick H., Stang A. (2014). The prevalence and risk factors of adolescent acne among schoolchildren in Lithuania: a cross-sectional study. J Eur Acad Dermatol Venereol, 28, 733-740.
115. Kawai T., Akira S. (2007). TLR signaling. Semin Immunol, 19, 24-32.
116. Kawashima M., Harada S., Loeshce C., Miyachi Y. (2008). Adapalene gel 0.1% is effective and safe for Japanese patients with acne vulgaris: a randomized, multicenter, investigator-blinded, controlled study. J Dermatol Sci, 49, 241-248.
117. Kaymak Y., Adisen E., Ilter N. et al. (2009). Dietary glycemic index and glucose, insulin-like factor-1. Insulin-like growth factor binding protein 3, and leptin levels in patients aemic food and milk consumption in the pathogenesis of acne vulgaris. Exp Dermatol, 18, 833-841.
118. Kelhala H.-L., Palatsi R., Fyhrquist N. et al. (2014). IL-17/Th17 pathway is activated in acne lesions. PLoS ONE. 2014; 9(8); e105238. doi: 10.1371/journal.pone.0105238.
119. Khodaeiani E., Fouladi R.F., Altabas M. et al. (2013). Topical 4% nicotinamide vs 1% clindamycin in moderate inflammatory acne vulgaris. Int J Dermatol, 52, 33-37.
120. Kircik L., Green L., Thiboutot D., Tangetti E., Wilson D., Dhawan S., et al. (2009). Comparing a novel solubilized benzoyl peroxide gel with benzoyl peroxide/clindamycin; final data from a multicenter, investigator-blind, randomized study. J Drugs Dermatol, 8, 812-818.
121. Kircik L.H. (2009). Compararive efficacy and safety results of two topical combination acne regimens. J Drugs Dermatol, 8, 624-230.
122. Kokandi A. (2010). Evaluation of acne quality of life 2-nd clinical severity in acne female adults. Dermatol Res Pract, (Epub ahead of print).
123. Krunic F. et al. (2008). Efficacy and tolerance of acne treatment using both spironolactone and combined contraceptive containing drospirenone. J Amer Acad Dermatol, 58, 60-62.
124. Kurokawa I., Danby F.W., Ju Q. et al. (2009). New developments in our understanding of acne pathogenesis and treatment. Exp Dermatol, 18, 821-832.
125. Kwon H.H., Yoon J.Y., Hong J.S., Jung J.Y., Park M.S., Suh D.H. (2012). Clinical and histological effect of a low glycaemic load diet in treatment of acne vulgaris in Korean patients: a randomized, controlled trial. Acta Derm Venereol, 92, 3: 241-246.
126. Lai Y., Gallo R.I. (2008). Toll-like receptors in skin infections and inflammatory diseases. Infect Disord Drug Targets, 8, 3, 144-155.
127. Layton A. (2009). The use of isotretinoin in acne. Dermatoendocrinol, 1(3), 162-169.
128. Layton AM. (2010). Disorders of the sebaceous Glands. In: Burns T., Breathnach S., Cisx N., Griffiths C. Rook’s Textbook of Dermatology. 8th ed. (p.p.38-39) Oxford. Wiley-Blackwell.
129. Leccia M.T., Auffret N., Claudel J.P., Corvec S., Dreno B. (2015). Topical acne treatments in Europe and the issue of antimicrobial resistence. J Europ Acad Dermat Venereol, 29, 8, 1485-1490.
130. Lee D., Kim M., Ham J. et al. (2012). In vitro evaluation of antibacterial activities and anti-inflammatory effects of Bifidobacterium spp. addressing acne vulgaris. Arch Pharm Res. 35, 1065-1071.
131. Lee J.W., Yoo K.H., Park K.Y. et al. (2011). Effectiveness of conventional, low-dose and intermittent oral isotretinoin in the treatment of acne: a randomized, controlled comparative study. Br J Dermatol, 164(6), 1369-1375.
132. Luo S, Wang F, Li Z, Deng J. (2013). Effect of the +781C/T polymorphism in the interleukin-8 gene on atherosclerotic cerebral infarction, and its interaction with smoking and drinking. PLoS One, 8, 258-263.
133. Machmood S.N., Bowe W.P. (2014). Diet and acne update: carbohydrates emerge as the man culprit. J Drug Dermatol, 13(4), 428-435.
134. Magin P.J., Pond C.D., Smith W.T., Watson A.B., Goode S.M. (2008). A cross-sectional study of psychological morbidity in patients with acne, psoriasis and atopic dermatitis in specialist dermatology and general practices. J Europ Acad Dermat Venereol, 22, 1435-1444.
135. Makrantonaki E., Gancenviciene R., Zouboulis C.C. (2011). An update on the role of the sebaceous gland in the pathogenesis of acne. Dermatoendocrinol, 3, 41-40.
136. Maloney J.M., Dietze P., Watson D., Niknian M., Lee-Rugh S., Sampson-Landers C. et al. (2008). Treatment of acne using a 3-milligram drospirenone/20-microgram ethyl estradiol oral contraceptive administered in a 24/4 regimen: a randomized controlled trial. Obset Gynecol, 112, 773-781.
137. Manning T.T. (2011). Resolving the role of prenatal sex steroids in the development of digit ratio. Proc Natl Acad Sci USA, 108, 16143- 16144.
138. Marqueling A.l., Zane L.T. (2007). Depression and suicidal behavior in acne patients treated with isotretinoin a systematic review. Semin Cutan Med Surg, 26, 210-220.
139.Marshak-Rothsten A. (2006). Toll-like receptors in systemic autoimmune disease. Nat Rev Immunol, 6, 823-835.
140. McInturiff I.E., Kim J. (2005). The role of Toll-like receptors in pathophysiology of acne. Semin Cutan Med Surg, 24, 73-78.
141. Melnik B.C. (2011). Evidence for acne-promoting effects of milk and other insulinotropic dairy products. Nestle Nutr Workshop Ser Pediatr Program, 67, 131-145.
142. Melnik B.C. (2009). Role of FGFR2-signaling in the pathogenesis of acne. Dermatoendocrinol, 1, 141-156.
143. Meyer T., Stickfleth E., Christophers E. (2007). Immune response profiles in human skin. Br J Dermatol, 157(suppl), 1-7.
144. Miller I.S. (2008). Toll-like receptors in skin. Adv Dermatol, 24, 71-87.
145. Misery L. (2011). Consequences of psychological distress in adolescents with acne. J Invest Dermatol, 131(2), 290-292.
146. Mouser P.E., Baker B.S., Seaton E.D. et al. (2013). Propionbacterium acnes – reactive T-helper-1 cells in the skin of patients with acne vulgaris. J Europ Acad Dermat Venereol,131(1), 1226-1228.
147. Murillo N., Raoult D. (2013). Skin microbiota: overview and role in the skin diseases acne vulgaris and rosacea. Futur Microbiol, 8(2), 209-220.
148. Musette P., Anquit Auckbus I., Begon E. (2006). Innate immunity: cutaneous expression on Toll-like receptors. Medecine Science, 22, 149-152.
149. Nast A., Dreno B., Bettoli V. et al. (2012). European evidence-based (S3) guidelines for the treatment acne. J Europ Acad Dermat Venereol, 26, (Suppl1) 1-29.
150. Nigland M., Grossman R. (2008). Tretinoin microsphere gel in facial acne vulgaris: a meta-analysis. J Drugs Dermatol, 7, 2-7.
151. Ochsendorf F. (2010). Minocycline in acne vulgaris benefits and risks. Am J Clin Dermatol, 11, 327-341.
152. Orion E., Wolf R. (2014). Psychologic factors in the development of facial dermatoses. Clinic Dermatol, 32(6), 763-766.
153. Orringer J.S., Sachs D.L., Bailey E., Kang S., Hamilton T., Voornees J.J. (2010). Photodynamic therapy for acne vulgaris: a randomized, controlled, split0face clinical trial of topical aminolevulinicacid and pulsed dye laser therapy. J Cosmet Dermatol, 9, 28-34.
154. Oshsendorf F., Degilz K. (2008). Drug therapy of acne. J Hautarzt, 39(7), 579-589.
155. Ottaviani M., Alestas T., Flori E., Mastrofrancesco A., Zouboulis CC., Picardo M. (2010). Free Fatty acids enhance the innate immune defense of human sebocytes by upregulating B-defensin-2 expression. J Invest Dermatol, 130, 985-994.
156. Ottaviani M., Camera E., Picardo M. (2010). Lipid mediators in acne. Mediators Inflamm, 858-876.
157. Owen W., Rawlins M., Roberts W. (2010). Selected performance characteristics of the Roche Elecsys testosterone II assay on the Modular analytics E 170 analyzer. Clin Chim Acta, 5, 1073-1079.
158. Pang Y., He C.D., Liu Y., Wang K.B., Xiao T.,Wang Y.K. et al. (2008). Combination of short CAG and GGN repeats in the androgen receptor gene is associated with acne risk in North East China. J Europ Acad Dermat Venereol, 22, 1445-1451.
159. Paoli A., Grimaldi K., Toniolo L., Canato M., Bianco A., Fratter A. (2012). Nutrition and acne: therapeutic potential of keratogenic diets. Skin Pharmaacol Physiol, 25(3), 84-91.
160. Pappas A., Johnsen S., Liu J.C., Eisinge M. (2009). Sebum analysis of individuals with and without acne. Dermatoendocrinol, 1, 157-161.
161. Perkins A., Cheng C., Hillebrand G., Muyamoto K., Kimball A.B. (2010). Comparison of epidemiology of acne vulgaris among Caucasian, Asian, Continental Indian and African American women. J Eur Acad Dermatol Venereol, 20, 167-176.
162. Petrenko A.V. (2017). A case of acne fulminans. Abstracts of the 26th EADV Conference, Geneva, 13-17 September 2017. Geneva, Switzerland, 2017. Abstract ID 3214 [162].
163. Picardo M., Ottaviani M., Camera E., Mastrofrancesco A. (2009). Sebaceous lipids. Dermatoendocrinol, 1, 68-71.
164. Plewig G., Cunliffe W.J., Binder N., Hoschen K. (2009). Efficacy of an oral contraceptive containing EE 0.03 mg and CMA 2 mg (Belara) in moderate acne resolution: a randomized, double-blind, placebo-controlled Phase III trial. Contraception, 80, 25-33.
165. Plewig G., Kligman A.M. (2000). Acne and rosacea. 3st ed. Berlin: Springer.
166. Preneau S., Dreno B. (2012). Female acne – a different subtype of teenager acne? J Eur Acad Dermatol Venereol, 26, 277-282.
167. Rademaker M., Wishart J.M., Birchall N.M. (2014). Isotretinoin 5 mg daily for low-grade adult acne vulgaris – placebo-controlled, randomized double-blind study. J Eur Acad Dermatol Venereol, 28, 747-754.
168. Rehn L.M.H., Meririne E., Hook-Nikanne J., Isometsa E., Henriksson M. (2008). Depressive symptoms, suicidal ideation and acne: a study of male Finnish conscripts. J Eur Acad Dermatol Venereol, 22, 561-567.
169. Revuz J., Pawin H., Poli F., Faure M., Chivot M., Beylot C., Dreno B. (2008). The advantage of establishing homogeneous patient groups: Is it worth isolating “juvenile acne of the face”? J Eur Acad Dermatol Venereol, 22, 1429-1434.
170. Rigopoulos D., Gregoriou S., Ifandi A., Efstathiou G., Georgala S., Chalkias J., Katsambas A. (2007). Coping with acne: beliefs and perceptions in a sample of secondary school 1. Greek pupils. J Eur Acad Dermatol Venereol, 21, 6, 806-810.
171. Rivera R., Guerra A. (2009). Management of acne in women over 25 years of age. Actas Dermosifiliogr, 100, 33-37.
172. Sami N.A., Attia A.T., Badawi A.M. (2008). Phototherapy in the treatment of acne vulgaris. J Drugs Dermatol, 7, 627-632.
173. Schmitt J.V., Masuda P.Y., Miot H.A. (2009). Acne in women: clinical patterns in different age-groups. An Bras Dermatol, 84, 349-354.
174. Schmitt J.V., Tavares M., Cerci F.B. (2011). Adult women with acne have a higher risk of elevated triglyceride levels with the use of oral isotretinoin. An Bras Dermatol, 86, 807-810.
175. Shahmoradi Z., Iraji F., Siadat A.H., Ghorbaini A. (2013). Comparison of topical 5% nicotiamid gel versus 2% clindamycin gel in the treatment of the mild-moderate acne vulgaris: a double-blinded randomized clinical trial. J Res Med Sci, 34, 434-437.
176. Shalita A.R., Del Rosso J.Q., Webster G.F. (2011). Acne vulgaris. Informa Healthcare, 1, 228.
177. Sharad J. (2013). Glycolic acid peel therapy – a current review. Clin Cosmet Investig Dermatol, 6, 281-288.
178. Simonart T., Dramaix M., De Maertelaer V. (2008). Efficacy of tetracyclines in the treatment of acne vulgaris: a review. Br J Dermato, 158, 208-216.
179. Simpson R.C., Gundlag D.J. Williams H.C. (2011). What’s new in acne? An analysis of systematic reviews and clinically significant trials published in 2010-2011. Clin Exp Dermatol, 36(8), 840-843.
180. Smith R.N., Mann N.J., Braue A., Makelainan H., Varigos G.A. (2007). A low-glycemic-load diet improves symptoms in acne vulgaris patients: a randomized controlled trial. Am J Clin Nutr, 86, 107-115.
181. Stinco G., Bragadin G., Trotter D., Pillon P. (2007). Relationship between sebostatic activity, tolerability and efficacy of three topical drugs to treat mild to moderate acne. J Eur Acad Dermatol Venereol, 21, 320-325.
182. Strauss J.S., Krowchuk D.P., Leyden J.J. et al. (2007). Guidelines of care for acne vulgaris management. J Amer Acad Dermatol, 10, 202-209.
183. Sugisaki H., Yamanaka K., Kakeda M., Kitagawa H., Tanaka K., Watanabe K. et al. (2009). Increased interferon-gamma, interleukin-12p40 and IL-8 production in Propionibacterium acnes-treated peripheral blood mononuclear cells from patient with acne vulgaris: host response but not bacterial species is the determinant factor of the disease. J Dermatol Sci, 55, 47-52
184. Suh D.H., Kwon H.H. (2015). What’s new in the physiology of acne? Br J Dermatol, 172(suppl. 1), 13-19.
185. Takeda K., Akira S. (2005). Toll-like receptors in innate immunity. Intern Immunol, 17, 1, 1-14.
186. Takeuchi O., Akira S. (2010). Pattern recognition receptors and inflammation. Cell, 140, 805-810.
187. Tan J.K., Tang J., Fung K., Gupta A.K., Thomas D.R., Sapra S. et al. (2007). Development and validation of a comprehensive acne severity scale. J Cutan Med Surg, 11, 211-216.
188. Tanghetti E.A., Kawata A.K., Daniels S.R., Yeomans K., Burk C.T., Callender V.D. (2014). Understanding the burden of adult female acne. J Clin Aesthet Dermatol, 7, 22-30.
189. Taylor M., Conzalez M., Porter R. (2011). Pathways to inflammation: acne pathophysiology. Eur J Dermatol, 21, 323-333.
190. Tenaud I., Khammari A., Dreno B. (2007). In vitro modulation of TLR-2, CD1d and IL-10 by adapalene on normal human skin and acne inflammatory lesions. Exp Dermatol, 16, 500-506.
191. Thiboutot D., Dreno B., Gollnick H. et al. (2013). A call to limit antibiotic use in acne. J Drugs Dermatol, 12, 1331-1332.
192. Thiboutot D., Gollnick H., Bettoli V. et al. (2009). New insights into the management of acne: an apdate from the Global Alliance to Improve Outcomes in Acne group. J Am Acad Dermatol, 60 (5 Suppl), S1-S50.
193. Thiboutot D., Gollnick H., Bettoli V., Dreno B., Kang S., Leyden J.J. et al. (2009). New insights into the management of acne: an update from the Global Alliance to Improve Outcomes in Acne group. J Am Acad Dermatol, 60, S1-50.
194. Thiboutot D.M., Weiss J., Bucko A., Eichenfield L., Jones T., Clark S., et al. (2007). Adapalene-benzoyl peroxide, a fixed-dose combination for the treatment of acne vulgaris: results of a multicenter, randomized double-blind, controlled study. J Am Acad Dermatol, 57, 791-799.
195. Thielitz A., Gollnick H. (2009). Overview of new therapeutic developments for acne. Expert Rev Dermatol, 4, 1, 55-65.
196. Thielitz A., Lux A., Wiede A., Kropf S., Papakonstantinou E., Gollnick H. (2015). A randomized investigator-blind parallel-group study to assess efficacy and safety of azelaic acid 15% gel vs adapalene 0,1% gel in the treatment and maintenance treatment of female adult acne. J Eur Acad Dermatol Venereol, 29, 789-796.
197. Thomson A.W. (1996). The cytokine handbook. (2nd edn). London: Academic Press.
198. Tochio T., Tanaka H., Nakata S., Ikeno H. (2009). Accumulation of lipid peroxide in the content of comedones may be involved in the progression of comedonogenesis and inflammatory changes in comedones. J Cosmet Dermatol, 8, 152-158.
199. Valins W., Amini S., Berman B. (2010). The expression of Toll-like receptors in dermatological diseases and the therapeutical effect of current and newer topical Toll-like receptor modulators. J Clin Aesthet Dermatol, 3(9), 20-29.
200. Vlassova N., Nah A., Zenilman J.M., James G., Lazarus G.S. (2011). New horizons for cutaneous microbiology: the role of biofilms in dermatologiacal disease. Br J Dermatol, 165, 751-759
201. Vos T., Flaxman J.D. (2012). Years lived with disability for 1160 sequelae of 289 diagnosis and injures 1990-2010: a systematic analysis for the global burden of disease study 2010. Lancet, 9859, 2163-2196.
202. Webster G., Cargill D.I., Quiring J., Vogelson C.T., Slade H.B. (2009). A combined analysis of 2 randomized clinical studies of tretinoingel 0.05% for the treatment of acne. Cutis, 83, 146-154.
203. Webster G. (2008). Commentary: Diet and acne. J Am Acad Dermatol, 58, 794-795.
204. Webster G.F., Graber E.M. (2008). Antibiotic treatment for acne vulgaris. Semin Cutan Med Surg, 27(3), 183-187.
205. Whitney K.M., Ditre C.M. (2011). Management strategies for acne vulgaris. Clin Cosmet Investig Dernatol, 4, 41-53.
206. Williams H.C., Dellavale R.P., Garner S. (2012). Acne vulgaris. The Lancet, 379, 361-372.
207. Yoon J,Y., Kwon H.H., Min S.U. et al. (2013). Epigallocatechin-3-gallate improves acne in humans by modulating intracellular molecular targets and ingibiting P.acnes. J Invest Dermatol, 133, 429-440.
208. Youn S.W. (2010). The role of facial sebum secretion in acne pathogenesis: facts and controversies. Clin Dermatol, 28, 8-11.
209. Zahra Ghodsi S., Orawa H., Zoboulious C.C. (2009). Prevalence, severity and severity risk factors of acne in high school pupils: a community-based study. J Invest Dermatol, 129, 2136-2141.
210. Zhou R., Jiang X. (2014). Effects adapalene-benzoyl peroxide combination gel in treatment or maintenance therapy of moderate or severe acne vulgaris: meta-analysis. Ann Dermatol, 26, 43-52.
211. Zouboulis C.C. (2010). Acne vulgaris. The role of hormones. Hautarzt, 61, 107-108.
212. Zouboulis C.C. (2009). Propionibacterium acnes and sebaceous lipogenesis: a love-hate relationship? J Invest Dermatol, 129, 2093-2096
213. Zouboulis C.C., Angres S., Seltmann H. (2011). Regulation of stearoyl-CoA and fatty acid desaturase 2 expression by linoleic acid and arachidonic acid in human sebocytes leads to enchancement of proinflammatory activity but does not affect lipogenesis. Br J Dermatol, 165, 269-275
214. Zouboulis C.C., Jourdan E., Picardo M. (2014). Acne is an inflammatory disease and alterations of sebum composition initiate acne lesions. J Eur Acad Dermatol Venereol, 28, 527-532.
ДОДАТОК А
АКТИ ВПРОВАДЖЕННЯ




ДОДАТОК Б
СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА ЗА ТЕМОЮ ДИСЕРТАЦІЇ
ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ РЕЗУЛЬТАТІВ ДИСЕРТАЦІЇ
- Петренко А.В. Вивчення деяких генних порушень у хворих на акне. Збірник наукових праць співробітників НМАПО імені П.Л. Шупика. 2016. Вип. 25. С. 132–136.
- Калюжна Л.Д., Гречанська Л.В., Петренко А.В. Клінічна ефективність ретиноїдів нового покоління в лікуванні акне. Дерматовенерологія. Косметологія. Сексопатологія. 2015. № 3–4. С. 16–21. (Дисертантом здійснено ведення медичної документації та спостереження за перебігом лікування хворих на акне).
- Літус О.І., Петренко А.В. Психоемоційний стан хворих на акне із урахуванням тяжкості перебігу та спадкової схильності. Дерматовенерологія. Косметологія. Сексопатологія. 2016. № 3–4. С. 10–12.
- Литус А.И., Петренко А.В. Особенности патогенетической характеристики акне с учетом функционального состояния кожи и наследственной склонности. Международный научно-практический журнал Дерматовенерология. Косметология. 2016. Т. 2, № 2. С. 208–212.
- Петренко А.В. Патогенетичні аспекти акне від вивчення стану шкіри до визначення деяких генетичних факторів. Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я: зб. наук. праць. 2016. Вип. 13. С. 219-224.
- Петренко А.В. Співставлення генетичної складової в родинах хворих на акне. Дерматологія та венерологія. 2017. № 1 (75). С. 20–23.
- Петренко А.В., Россоха З.І. Тяжкість перебігу акне в залежності від варіантів генних поліморфізмів. Дерматологія та венерологія. 2017. № 2 (76). С. 33–36. (Дисертантом проаналізовано вплив генних порушень на розвиток акне).
- Петренко А.В. Алгоритм лікування акне з урахуванням патогенетичних складових. Український журнал дерматології, венерології, косметології. 2017. № 2 (65). С. 44–48.
- Petrenko A.V., Litus O.I. Study of psycho-emotional state of patients with acne depending on the severity and hereditary factors. Galician medical journal. 2017. № 2 (27). URL: http://ojs.ifnmu.edu.ua/index.php/gmj/article/view/790.
- Петренко А.В., Приходько І.В. Аналіз патогенетичних складових у випадку фульмінантного акне. Дерматовенерологія. Косметологія. Сексопатологія. 2017. № 1–2 (5). С. 97–100. (Здобувачем здійснено аналіз ефективності лікування фульмінантного акне).
- Горовенко Н.Г., Петренко А.В., Россоха З.І. Аналіз рівня статевих гормонів у хворих на акне різного ступеню тяжкості з урахуванням впливу генетичних факторів. Дерматологія та венерологія. 2017. № 3 (77). C. 46–52. (Дисертантом проведено збір та аналіз даних гормональних та генетичних чинників у пацієнтів на акне).
- Калюжная Л.Д., Гречанская Л.В., Петренко А.В. Акне: современный взгляд на диагностику и лечение. Здоров’я України. 2017. № 4 (401). С. 46–47. (Дисертантом проведено аналіз сучасних літературних джерел).
- Пат. на корисну модель 121339 UA, МПК C12N15/00, A01H1/00, A01H1/08. Спосіб прогнозування розвитку тяжких форм акне за допомогою молекулярно-генетичних методів / А.В. Петренко; заявник і патентовласник Національна медична академія післядипломної освіти ім. П.Л. Шупика. № u201708769; заявл. 31.08.2017; опубл. 27.11.2017, Бюл. № 22.
- Гречанська Л.В., Петренко А.В. Від європейських до українських протоколів по лікуванню акне з позиції спадкових факторів. Тези доповідей Всеукраїнської науково-практичної конференції Української асоціації лікарів-дерматовенерологів і косметологів «Сучасні підходи до формування клінічних настанов з діагностики і лікування шкірних захворювань та інфекцій, що передаються статевим шляхом: європейський досвід і українські реалії», м. Тернопіль, 19-20 жовтня 2016 р. Український журнал дерматології, венерології, косметології. 2016. № 4 (63). С. 100–101. (Дисертантом зроблено аналіз впливу спадкових факторів на розвиток тяжких форм акне).
- Петренко А.В. Спадкові фактори та тяжкість перебігу акне. Матеріали всеукраїнської науково-практичної конференції молодих вчених НМАПО імені П.Л. Шупика, присвяченої Дню науки, м. Київ, 20 травня 2016 р. – К., 2016. – С. 102–104.
- Петренко А.В. Аналіз сімейної схильності при акне. Матеріали Регіональної науково-практичної конференції «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом», м. Святогірськ, 12-13 травня 2016 р. Святогірськ, 2016. С. 27.
- Петренко А.В. Деякі генні порушення у хворих на акне. Матеріали науково-практичної конференції «Спадкові та екологічні чинники в дерматовенерології», м. Київ, 29-30 березня 2016 р. Дерматовенерологія. Косметологія. Сексопатологія. 2016. № 1–2 (3). С. 79.
- Петренко А.В. Аналіз генетичного та гормонального статусу у пацієнтів з акне. Матеріали науково-практичної конференції з міжнародною участю «Новітні технології діагностичних, лікувальних та профілактичних заходів в дерматовенерології та методи і стан їхнього впровадження», м. Харків, 11–12 листопада 2016 р. Дерматологія та венерологія. 2016. № 3 (73). С. 83–84.
- Петренко А.В. Генні порушення, як безумовний фактор спадковості у хворих на акне. Матеріали 40-вої ювілейної науково-практичної конференції молодих вчених НМАПО імені П.Л. Шупика з міжнародною участю, присвяченої Дню науки: «Інновації в медицині: досягнення молодих вчених», м. Київ, 18 травня 2017 р. Київ, 2017. С. 48-50.
- Petrenko A.V. A case of acne fulminans. Abstracts of the 26th EADV Conference, Geneva, 13-17 September 2017. Geneva, Switzerland, 2017. Abstract ID 3214.
Відомості про апробацію результатів дисертації:
- Науково-практична конференція «Спадкові та екологічні чинники в дерматовенерології», м. Київ, 29–30 листопада 2016 р., усна доповідь: Петренко А.В. «Роль деяких генних порушень у хворих на акне».
- Науково-практична конференція «Новітні тенденції лікування та профілактики дерматовенерологічних проблем в рамках доказової медицини» в рамках ХІІ Львівського Медичного Форуму, м. Львів, 13–15 квітня 2016 р., усна доповідь: Петренко А.В. «Співставлення генетичних та гормональних складових із тяжкістю перебігу акне».
- V ювілейний Міжнародний медичний конгрес «Впровадження сучасних досягнень медичної науки у практику охорони здоров’я України», м. Київ, 19–21 квітня 2016 р., усна доповідь: Петренко А.В. «Аналіз поліморфізму генів TLR, як патогенетичних чинників акне».
- Регіональна науково-практична конференція «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом», м. Святогірськ, 12–13 травня 2016 р., усна доповідь: Петренко А.В. «Зв’язок сімейного анамнезу та генетичної схильності у хворих на акне».
- Науково-практична конференція, присвячена 50-й річниці створення шкірно-венерологічного диспансеру № 1 Дніпровського району м. Києва, м. Київ, 16 вересня 2016 р., усна доповідь: Калюжна Л.Д., Петренко А.В. «Акне у сучасних протоколах».
- 40-ва ювілейна науково-практична конференція молодих вчених НМАПО імені П.Л. Шупика з міжнародною участю, присвячена «Дню науки» «Інновації в медицині: досягнення молодих вчених», м. Київ, 18–19 травня 2017 р.), усна доповідь: Петренко А.В. «Генні порушення, як безумовний фактор спадковості у хворих на акне».
- 26-й Конгрес Європейської академії дерматовенерології, 13–17 вересня 2017 р., стендова доповідь: Petrenko A.V. «A case of acne fulminans».
ДОДАТОК В
ОПИТУВАЛЬНИКИ
КАРДИФСЬКИЙ ІНДЕКС НЕДІЄЗДАТНОСТІ ПРИ АКНЕ
| 1. Чи були Ви агресивним, засмученим чи сором’язливим внаслідок наявності вугрів протягом останнього місяця? | ð
ð ð ð |
(а) Дуже сильно
(б) Значно (в) Трохи (г) Зовсім ні |
| 2. Чи гадаєте Ви, що наявність вугрів протягом останнього місяця перешкоджала Вашому щоденному соціальному життю, соціальним подіям чи відносинам з представниками протилежної статі? | ð
ð ð ð |
(а) Дуже вплинуло на всі види діяльності (б) Помірно, у більшості видів діяльності (в) Рідко чи лише при деяких видах діяльності (г) Зовсім ні |
| 3. Чи уникали Ви протягом останнього місяця громадських роздягалень чи використання купальників через Ваші вугрі? | ð
ð ð ð |
(а) Весь час
(б) Більшість часу (в) Рідко (г) Зовсім ні |
| 4. Як Ви охарактеризуєте Ваші відчуття щодо зовнішнього вигляду Вашої шкіри за останній місяць? | ð
ð ð ð |
(а) Дуже пригнічені та
жалібні (б) Зазвичай турбував (в) Рідко турбував (г) Не турбував |
| 5. Будь ласка, вкажіть наскільки „поганим” на Вашу думку є стан Ваших вугрів зараз: | ð
ð ð ð |
(а) Настільки погано, як тільки можливо
(б) Сильно турбує (в) Мало турбує (г) Не турбує |
Motley and Finlay, 1992
ІНДЕКС ОЦІНКИ ЯКОСТІ ЖИТТЯ
ПАЦІЄНТІВ З ДЕРМАТОЛОГІЧНИМИ ЗАХВОРЮВАННЯМИ
| Лікарня №: | Дата: | DLQI | ||
| П.І.Б.: | Бал: | |||
| Адреса: | Діагноз: | |||
Мета цього опитування – визначити, якою мірою проблеми зі шкірою впливали на Ваше життя ПРОТЯГОМ ОСТАННЬОГО ТИЖНЯ. Будь ласка, відповідаючи на кожне питання, позначте галочкою (Ö) одну відповідь.
| 1. | Протягом останнього тижня наскільки сверблячою, чутливою, болючою або пекучою була Ваша шкіра? | Дуже сильно
Значно Трохи Зовсім ні |
|
||
| 2. | Протягом останнього тижня якою мірою Ви ніяковіли або соромилися через проблеми зі шкірою? | Дуже сильно
Значно Трохи Зовсім ні |
|
||
| 3. | Протягом останнього тижня наскільки сильно проблеми зі шкірою заважали Вам ходити за покупками чи доглядати за помешканням або садом/городом? | Дуже сильно
Значно Трохи Зовсім ні |
|
Не має до мене відношення | |
| 4. | Протягом останнього тижня наскільки сильно проблеми зі шкірою впливали на Ваш вибір одягу? | Дуже сильно
Значно Трохи Зовсім ні |
|
Не має до мене відношення | |
| 5. | Протягом останнього тижня наскільки сильно проблеми зі шкірою впливали на Ваше спілкування з іншими людьми або на проведення дозвілля? | Дуже сильно
Значно Трохи Зовсім ні |
|
Не має до мене відношення | |
| 6. | Протягом останнього тижня наскільки сильно проблеми зі шкірою ускладнювали Ваші заняття будь-яким видом спорту? | Дуже сильно
Значно Трохи Зовсім ні |
|
Не має до мене відношення | |
| 7. | Чи завадили Вам проблеми зі шкірою працювати або навчатися протягом останнього тижня?
Якщо “Ні”, то наскільки сильно проблеми зі шкірою відволікали Вас від роботи або навчання протягом останнього тижня? |
Так
Ні Значно Трохи Зовсім ні |
|
Не має до мене відношення | |
| 8. | Протягом останнього тижня якою мірою проблеми зі шкірою викликали труднощі у відносинах з Вашим партнером або з ким-небудь з Ваших близьких друзів або родичів? | Дуже сильно
Значно Трохи Зовсім ні |
|
Не має до мене відношення | |
| 9. | Протягом останнього тижня якою мірою проблеми зі шкірою викликали якi-небудь труднощі у статевому житті? | Дуже сильно
Значно Трохи Зовсім ні |
|
Не має до мене відношення | |
| 10. | Протягом останнього тижня якою мірою лікування шкіри створювало Вам проблеми, наприклад, порушувало порядок у Вашому помешканні або забирало час? | Дуже сильно
Значно Трохи Зовсім ні |
|
Не має до мене відношення | |
Переконайтесь, будь ласка, що Ви відповіли на КОЖНЕ питання. Дякуємо.
