Харківська медична академія післядипломної освіти МОЗ України
ДУ «Інститут дерматології та венерології НАМН України»
Кваліфікаційна наукова праця
на правах рукопису
Нарожна Марина Володимирівна
УДК 616.53-008.811.1-092 : 612.017 : 616.34-008.87-085 : 577.161.2
ДИСЕРТАЦІЯ
Себорейний дерматит: патогенетичні аспекти та комплексне
лікування з урахуванням статусу вітаміну D,
стану вродженого імунітету та мікробіоценозу кишечника
14.01.20 – шкірні та венеричні хвороби
222. Медицина
Подається на здобуття наукового ступеня
кандидата медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
_____________________________М. В. Нарожна
(підпис, ініціали та прізвище здобувача)
Науковий керівник: Болотна Людмила Анатоліївна,
доктор медичних наук, професор
Харків – 2018
АНОТАЦІЯ
Нарожна М. В. Себорейний дерматит: патогенетичні аспекти та комплексне лікування з урахуванням статусу вітаміну D, стану вродженого імунітету та мікробіоценозу кишечника. – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук (доктора філософіі) за спеціальністю 14.01.20 – шкірні та венеричні хвороби (222. Медицина). – Харківська медична академія післядипломної освіти МОЗ України, ДУ «Інститут дерматології та венерології НАМН України», Харків, 2018.
Дисертаційна робота присвячена підвищенню ефективності лікування хворих на себорейний дерматит (СД) шляхом розробки комплексного методу терапії на підставі вивчення статусу вітаміну D, стану вродженого імунітету та мікробіоценозу товстого кишечника
Для вирішення поставлених завдань застосовано клінічні, імунологічні, імуноферментні, бактеріологічні, статистичні методи дослідження. Під спостереженням перебувало 112 хворих на СД віком 23-54 років. В якості контрольної групи для порівняння лабораторних показників обстежено 22 практично здорових добровольців віком 22-52 років.
Серед хворих на СД виявилося в 1,4 рази більше чоловіків, ніж жінок. Найчастіше дебют захворювання визначено у період від 31 до 40 років. СД у родичів хворих І та II ступенів споріднення встановлено у 23,2 % випадків. Серед причин загострення дерматозу 75,9 % пацієнтів відзначали зміну пори року (частіше взимку і ранньою весною, рідше восени), 21,4 % – стреси, 17,9 % – порушення дієти. Більшість хворих (87,5 %) вказували на зникнення висипів чи значне покращення стану шкіри влітку. Достатньо вживали продукти, багаті вітаміном D, 36,6 % пацієнтів, недостатньо – 63,4 % хворих. Влітку носили закритий одяг 37,5 % хворих, відпочивали щороку та засмагали 24,1 % пацієнтів. Найчастіше діагностовано захворювання органів травлення (42,9 %). Клінічні прояви дисбактеріозу визначено у 65,4 % хворих.
У пацієнтів з СД вперше установлено порушення статусу вітаміну D за зменшенням в 1,9 рази рівня 25(OH)D у крові порівняно з показником контрольної групи. Нормальний вміст 25(OH)D виявлено у 7,3 % хворих, недостатність вітаміну D – у 61,8 % і дефіцит вітаміну D – у 30,9 % пацієнтів. У контрольній групі нормальний вміст транспортної форми вітаміну D встановлено у 63,6 % осіб, недостатність – у 27,3 % осіб і дефіцит – у 9,1 % осіб.
Дефіцит D-вітаміну при СД грає патогенетичну роль, на що вказує зв’язок з клінічними проявами. При недостатності вітаміну D у хворих переважав СД помірного ступеня тяжкості (61,1 %), незапальні прояви (66,7 %) та залучення у процес волосистої частини голови або обличчя (83,3 %), рідше виявлення грибів роду Malassezia на шкірі (16,7 %) порівняно з клінічними проявами у хворих з дефіцитом вітаміну D, при якому визначено у більшості випадків тяжкий ступінь тяжкості (71,4 %), запальні прояви хвороби (95,2 %), ураження декількох зон – обличчя і волосистої частини голови, тулуба (100,0 %), дріжджоподібні гриби Malassezia на шкірі (57,1 %). Середнє значення індексу поширеності і тяжкості СД у групі пацієнтів з дефіцитом вітаміну D достовірно перевищувало показник у хворих з недостатністю вітаміну D.
У пацієнтів із запальними проявами дерматозу вміст 25-гідроксивітаміну D понижувався в 2,3 рази, тоді як у хворих із незапальними проявами – тільки в 1,35 рази. Пониження рівня кальцидіолу втричі визначено при тяжкому ступені з багатоосередковим ураженням шкіри понад 15 % поверхні, що майже дорівнювало такому при вираженому дефіциті вітаміну D.
Уперше виявлено розлади гуморальних і клітинних факторів вродженого імунітету при СД, а саме пониження вмісту кателіцидину (LL-37) та активності нейтрофілів.
У хворих на СД визначено зменшення рівня LL-37 в 1,6 рази порівняно з показником контрольної групи. Вміст LL-37 зменшувався удвічі при тяжкому перебігу захворювання порівняно з таким у здорових осіб та достовірно відрізнявся від значення показника у хворих з легким і помірним ступенем тяжкості СД. Фагоцитарна дисфункція визначена у 81,8 % хворих на СД проти 9,1 % осіб контрольної групи. Достовірне одночасне зменшення фагоцитарного індексу (ФІ) на 70 % та фагоцитарного числа (ФЧ) на 38 % свідчить про зменшення кількості нейтрофілів з функціями фагоцитів та помірне ослаблення здібності нейтрофілів до поглинання мікроорганізмів у хворих на СД. Активація спонтанного НСТ-тесту (на 35 %), імовірно, обумовлена антигенною стимуляцією поліморфноядерних лейкоцитів в умовах колонізації шкіри M. furfur і вказує на посилення при СД кілінгової функції нейтрофілів. Пониження на 33 % індукованого НСТ-тесту у хворих є проявом помірного пригнічення функціональної активності нейтрофільних гранулоцитів.
Підтверджено, що дисбіоз кишечника має патогенетичне значення при СД. Еубіоз виявлено у 23,5 % хворих, дисбіоз I-III ступеня – у 76,5 % пацієнтів. Розлади характеризувалися зміною співвідношення між анаеробною і аеробною мікрофлорою, зниженням кількісного вмісту індигенної мікрофлори. У всіх пацієнтів відзначено зменшення в різній мірі (на 1-3 порядки) кількості біфідобактерій і лактобактерій, у 94,2 % пацієнтів – нормальної кишкової палички. На тлі якісного дисбалансу мікрофлори також виявлені зміни кількісного складу: кишкова паличка з гемолітичними властивостями у 25,0 %, лактозонегативна E. coli у 9,6 %, протей вульгарний – у 7,7 %, гриби роду Candida – у 36,5 % хворих.
Аналіз якісного і кількісного складу мікрофлори кишечника дозволив виявити залежність ступеня тяжкості СД від ступеня мікробіологічних порушень, типу і тривалості дерматозу. Більш суттєве зменшення кількості індигенної мікрофлори та збільшення обсіменіння умовно-патогенними мікроорганізмами слизової оболонки товстого кишечника встановлено при помірному і тяжкому захворюванні, запальному і тривалому дерматозі.
Проведена статистична оцінка взаємозв’язків клініко-лабораторних показників на базі кореляційно-регресійного методу аналізу, розроблено дві регресійні моделі для прогнозування перебігу дерматозу на підставі виділення прогностично значимих клінічних (індекс поширеності і тяжкості СД) та лабораторних показників (кателіцидин, ФЧ, 25(ОН)D).
Науково обгрунтовано доцільність використання в комплексній терапії хворих на СД вітаміну D3 та синбіотика. Для корекції рівня вітаміну D хворі на СД отримували водний розчин холекальциферолу (Аквадетрим Вітамін D3) по 2000 МО 1 раз на добу протягом 6 тижнів (при недостатності вітаміну D), по 3500 МО 1 раз на добу протягом 8 тижнів з переходом на 1500 МО протягом 4 тижнів (при дефіциті вітаміну D). Одночасно на фоні дієти призначали ДермаПро залежно від ступеня дисбактеріозу (по 1 капсулі протягом 14 днів при I ступені та відсутності клінічних проявів дисбактеріозу, протягом 21 дня – II і III ступені). Вітамін D3 і синбіотик рекомендували в холодну пору року на фоні комплексної традиційної терапії.
Лікування хворих на СД за розробленим методом сприяло підвищенню ефективності терапії (досягнення ремісії та значне покращення) в 1,5 рази порівняно з результатами терапії у хворих, що отримували традиційну терапію. Використання в комплексному лікуванні вітаміну D3 і синбіотика дозволило зменшити кількість рецидивів в 2,7 рази, подовжити період ремісії в 1,8 рази порівняно з аналогічними показниками у хворих при застосуванні традиційних засобів.
Результати лабораторних досліджень свідчать, що пацієнти з СД потребують призначення вітаміну D3 і синбіотика, під їх впливом відбувається не тільки регрес клінічних проявів у більшості хворих (пониження значення індексу поширеності і тяжкості в 4,4 рази), а й підвищення на 81 % рівня 25(ОН)D у сироватці крові, в той час як у хворих, які лікувалися традиційно, індекс зменшувався лише в 1,6 рази, а 25(ОН)D майже не змінювався (збільшувався на 10 %). Призначення комплексного лікування підтверджує модулюючий вплив на функціональний стан вродженого імунітету на підставі достовірного збільшення в 1,95 рази вмісту кателіцидину, в 1,6 рази ФІ і 1,3 рази ФЧ у хворих на СД. У пацієнтів, що лікувалися загальновизнаними засобами, вміст LL-37 підвищувався недостовірно, значення ФІ та ФЧ, активність НСТ-тесту спонтанного та індукованого не змінювалися порівняно з показниками до терапії. Призначення розробленої терапії обумовило нормалізацію кількісного та якісного складу кишкової мікрофлори у 71,4 % хворих, що лікувалися згідно запропонованого методу, і 9,1 % пацієнтів, які отримувалися традиційне лікування.
Висока ефективність препаратів, відсутність побічних явищ обгрунтовують доцільність використання засобів, що покращують статус вітаміну D та нормалізують рівень гуморальних і клітинних факторів вродженого імунітету, стан мікробіоти кишечника в лікуванні хворих на СД, і дозволяють їх рекомендувати для впровадження у практику охорони здоров’я.
Ключові слова: себорейний дерматит, статус вітаміну D, кателіцидин, фагоцитарна і функціональна активність нейтрофілів, мікробіоценоз кишечника, лікування, ефективність.
ANNOTATION
Narozhna M. V. Seborrheic dermatitis: pathogenetic aspects and complex treatment taking into account the status of vitamin D, state of innate immunity and intestinal microbiocenosis. – Qualifing scientific work as manuscript.
The thesis for obtaining Academic Degree of Ph.D. majoring in 14.01.20 – «Skin and venereal diseases» (222. Medicine). – Kharkiv Medical Academy of Postgraduated Education of Ministry of Health of Ukraine, State Establishment «Institute of Dermatology and Venereology of NAMS of Ukraine». Kharkiv, 2018.
The dissertation is devoted to the improvement of the treatment of patients with seborrheic dermatitis (SD) by developing a comprehensive therapeutic method based on the study of the status of vitamin D, the state of innate immunity and microbiocenosis of the colon.
The decision of the tasks was carried out using clinical, immunological, immunoenzyme, bacteriological, statistical methods of investigation. There were 112 patients aged 23-54 with SD under observation. As a control group, 22 healthy volunteers 22-52 years were examined for comparison of laboratory parameters.
Men were 1.4 times more than women among patients with SD. The debut of the disease is often defined in the period from 31 to 40 years. SD in relatives of patients of the I and II degrees of kinship was established in 23.2 % of cases. Among the causes of exacerbation of dermatoses, 75.9 % of patients reported changes in time of the year (more often in the winter and early spring, less often in autumn), 21.4 % – stresses, 17.9 % – a violation of a diet. The majority of patients (87.5 %) indicated a disappearance of rashes or a significant improvement in the skin condition in summer. 36.6 % of patients sufficiently consumed food rich in vitamin D, 63.4 % of patients consumed not enough. In summer, 37.5 % of the patients were wearing closed clothes, resting annually and sunbathing 24.1% of patients. The most commonly diagnosed diseases of the digestive system (42.9 %). Clinical manifestations of dysbiosis are reported in 65.4 % of patients.
For the first time in patients with SD, vitamin D status loss was detected a decrease of 1.9 times the level of 25(OH) D in the blood compared with the control group. Normal level of 25(OH)D was found in 7.3 % of patients, vitamin D insufficiency – 61.8 % and vitamin D deficiency – in 30.9 % of patients. In the control group, the normal level of the vitamin D transport form was set at 63.6 %, the insufficiency was 27.3 % and the deficiency was 9.1 %.
Deficiency of the D-vitamine plays a pathogenetic role in the SD, as indicated by the relationship with clinical manifestations. Patients with moderate severity of vitamin D deficiency (61.1 %) had noninflammatory manifestations (66.7 %) and involvement of scalp or face (83.3 %) less often it was diagnosed in patients with mild to moderate Malassezia on the skin (16.7 %) comparing with the clinical manifestations in patients with vitamin D deficiency, in which in most cases severe severity (71.4 %), inflammation of the disease (95.2 %), defeat several zones – the face and scalp, the body (100.0 %), yeast-like mildew Malassezia on the skin (57.1 %) were found. The mean value of index of prevalence and severity SD in the group of patients with vitamin D deficiency was significantly higher in patients with vitamin D insufficiency.
In patients with inflammatory manifestations of dermatosis, the level of 25-hydroxyvitamin D was reduced by 2.3 times, whereas in patients with non-inflammatory manifestations only 1.35 times. Decrease in the level of calcidilol is three times as determined with a severe degree with multicenter skin lesions of more than 15 % of the surface, which is almost equal to that for severe vitamin D deficiency.
For the first time, disorders of the humoral and cellular factors of innate immunity in CD were identified, namely, the reduction of the level of the antimicrobial peptide of the cathelicidin (LL-37) and the activity of neutrophils.
The study of LL-37 in serum of patients with SD determined a decrease in the level of 1.6 times comparing with the control group. In the case of inflammatory type of dermatosis, the LL-37 level in patients was lowered by 1.4 times in patients with noninflammatory SD and 1.8 times compared with the level in practically healthy subjects. The level of LL-37 decreased by twice as much in comparison with that of healthy individuals and significantly differed from the value of the index in patients with mild to moderate severity of SD. Phagocytic dysfunction is defined in 81.8 % of patients with SD versus 9.1 % of control group. A significant reduction of the phagocytic index (PhI) by 70 % and phagocyte number (PhN) by 38 % is evidence of a reduction in the number of neutrophils with phagocytic function and a moderate weakening of the ability of neutrophils to absorb microorganisms in patients with SD. The activation of a spontaneous NST test (by 35 %) is likely due to antigenic stimulation of polymorphonuclear leukocytes under colonization of the Malassezia spp. skin and indicates an increase in neutrophil ciliary function at the SD. A decrease of 33 % of the indoated NST test in patients is a manifestation of moderate inhibition of the functional activity of neutrophil granulocytes.
It has been verified that intestinal dysbiosis has a pathogenic significance in SD. As a result of bacteriological studies, eubiosis were detected in 23.5 % of patients, dysbiosos I-III degree – in 76.5 % of patients with SD. Disturbances were characterized by a change in the ratio between anaerobic and aerobic microflora, a decrease in the quantitative level of indigenous microflora. There was a decrease in the number of bifidobacteria and lactobacilli in various degrees (by 1-3 orders of magnitude) among all patients, the normal intestinal sticks was in 94.2 % of patients. Against the background of the qualitative imbalance of the microflora, changes in the quantitative composition were also detected: E. coli with hemolytic properties in 25.0 %, lactosonegative E. coli in 9.6%, Proteus vulgaris – 7.7 %, Candida spp. in 36.5 %.
The analysis of qualitative and quantitative composition of the intestinal microflora allowed to reveal the dependence of the degree of severity of SD on the degree of microbiological disorders, clinical type and duration of dermatosis. A more significant increase in the number of indigenous microflora and increased incubation by conditionally pathogenic microorganisms of the mucous membrane of the large intestine in moderate and severe diseases, inflammatory and prolonged dermatosis.
The statistical evaluation of the correlations between clinical and laboratory parameters based on the correlation-regression analysis method is developed, and two regression models for forecasting the course of dermatosis have been developed based on the allocation of prognostically significant clinical (index of prevalence and severity of SD) and laboratory parameters (cathelicidin, PhN, 25(OH)D).
It is scientifically substantiated the expediency of using in the complex therapy of patients with CD of vitamin D3 and synbiotic. To correct the level of vitamin D, patients with SD received an aqueous solution of cholecalciferol (Aquadetrim Vitaminum D3) at 2000 IU once a day for 6 weeks (with vitamin D insufficiency), 3500 IU once a day for 8 weeks with a change of 1500 IU for 4 weeks (with vitamin D deficiency). At the same time, on the background of the diet, DermaPro was prescribed, depending on the degree of dysbacteriosis (1 capsule for 14 days at stage I and absence of clinic manifestations of dysbiosis, for 21 days – II and III degrees). Vitamin D3 and synbiotic have been recommended in the cold season on the background of complex traditional therapy.
Treatment of patients with SD by the developed method contributed to an increase in the effectiveness of therapy (achievement of remission and significant improvement) in 1.5 times comparing with the results of therapy in patients receiving traditional therapy. Use in the integrated treatment of cholecalciferol and DermaPro allowed to reduce the number of relapses by 2.7 times, lengthen the remission period in 1.8 times comparing with similar indicators in patients with the use of traditional drugs.
The results of laboratory studies indicate that patients with SD need appointment of vitamin D3 and synbiotic under the influence of which not only regression of clinical manifestations in most patients occurs (index of prevalence and severity decrease 4.4 times), but also an increase of 81 % of serum 25(OH)D level of blood, whereas in patients treated traditionally, the index severity decreased only in 1.6 times, and 25(OH)D was almost unchanged (increased by 10 %). The use of complex therapy confirms the modulating effect on the functional state of innate immunity based on a significant increase in 1.95 times the level of LL-37, 1.6 times of PhI and 1.3 times of PhN in patients with SD. In patients treated with generally recognized agents, the level cathelicidin increased insignificantly, PhI and PhN values, the activity of the spontaneous and induced NST test did not change comparing with the rates of previous therapy. The appointment of the developed therapy caused the normalization of the quantitative and qualitative composition of the intestinal microflora in 71.4% of the patients treated according to the proposed method and 9.1% of the patients who received the traditional treatment.
The high efficacy of drugs, the absence of side effects justify the expediency of using agents that improve the status of vitamin D and normalize the level of humoral and cellular factors of innate immunity, the state of intestinal microbiota in the treatment of patients with SD and allow them to recommend for introduction into practice of health care.
Key words: cathelicidin, efficacy, intestinal microbiocenosis, phagocytic and functional activity of neutrophils, seborrheic dermatitis, treatment, vitamin D status.
Список публікацій здобувача за темою дисертації
Праці, в яких опубліковані основні наукові результати дисертації
1. Болотна Л. А., Нарожна М. В. Статус вітаміну D у хворих на себорейний дерматит. Медицина сьогодні і завтра. 2017. № 2 (75). С. 78-82.
2. Болотная Л. А., Нарожная М. В. Роль кателицидина LL-37 при себорейном дерматите. Дерматологія та венерологія. 2018. № 1 (79). С. 16-20.
3. Болотная Л. А., Нарожная М. В. Себорейный дерматит: современные представления о патогенезе. Міжнародний медичний журнал. 2015. № 1 (81). С. 96-99.
4. Нарожная М. В. Обоснование применения витамина D в лечении себорейного дерматита. Дерматовенерология. Косметология. 2017. Т. 3. № 3. С. 292-299. 5. Нарожная М. В. Пробиотики в лечении себорейного дерматита. Дерматовенерологія. Косметологія і Сексопатологія. 2017. № 1-2 (5). С. 55-57.
6. Нарожная М. В. Состояние микробиоценоза толстого кишечника у больных себорейным дерматитом. Міжнародний медичний журнал. 2018. Т. 24. № 1 (93). С. 73-79.
7. Bolotna L. A., Narozhna M. V., Sarian О. I. New approaches to the treatment of patients with seborrheic dermatitis. Inter Collegas. 2018. Vol. 5. No. 1. P. 50-54. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено узагальнення результатів).
Праці, які засвідчують апробацію матеріалів дисертації
1. Нарожна М. В. Особливості терапії себорейного дерматиту. Ліки – людині. Сучасні проблеми фармакотерапії і призначення лікарських засобів : матеріали XXXIII Всеукр. наук.-практ. конф. за участю міжнар. спеціалістів, 08 квітня 2016 р. Харків, 2016. С. 142.
2. Нарожна М. В. Показники системного імунітету та біоценозу кишечника у хворих на себорейний дерматит. Новітні тенденції лікування та профілактики дерматовенерологічних проблем у рамках доказової медицини : матеріали наук.-практ. конф., 15 квітня 2016 р. Львів, 2016. Укр. журн. дерматол., венерол., косметол. 2016. № 1 (60). С. 106.
3. Нарожна М. В. Фагоцитарна активність нейтрофілів периферичної крові при себорейному дерматиті. Новини і перспективи медичної науки : зб. наук. робіт XV наук. конф. студентів та молодих учених, 15-17 квітня 2015 р. Дніпропетровськ, 2015. С. 36.
4. Нарожна М. В. Фактори вродженого імунітету у хворих на себорейний дерматит. Сучасні методи діагностики та лікування коморбідної патології в дерматовенерологічній практиці на принципах доказової медицини : матеріали наук.-практ. конф. з міжнар. участю, 01-02 червня 2017 р. Чернівці, 2017. С. 91-92.
5. Нарожная М. В. Антимикробные пептиды при себорейном дерматите. Дерматовенерологія в розробках молодих науковців : матеріали наук.-практ. школи, 16-17 листопада 2017 р., м. Київ, 2017. Клінічна імунологія. Алергологія. Інфектологія. 2017. № 6 (103). С. 51.
6. Нарожная М. В. Влияние витамина D на течение себорейного дерматита : матеріали наук.-практ. конф. молодих вчених, присвяченої 25-річчю НАМН України, 23 березня 2018 р. Журнал НАМН України. Спеціальний випуск, 2018. Київ, 2018. С. 62.
7. Нарожная М. В. Клинические особенности себорейного дерматита с учетом статуса витамина D. Святогірські дерматовенерологічні дні: новітні методи діагностики і лікування в дерматовенерології та косметології : матеріали Всеукр. конф. за участю міжнар. спеціалістів, 25-26 травня 2017 р. Святогір’я, 2017. Журн. дерматовенерології та косметології імені М. О. Торсуєва. 2017. № 1 (37). С. 73.
8. Нарожная М. В. Комплексное лечение себорейного дерматита. Медицина XXI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 23 листопада 2017 р. Харків, 2017. С. 67-68.
9. Нарожная М. В. Местная терапия себорейного дерматита. Проблеми захворювань шкіри та інфекцій, що передаються статевим шляхом, у дітей та підлітків : матер. науково-практ. конф., 17-18 березня 2015 р. Київ, 2015. С. 30.
10. Нарожная М. В. Уровень кателицидина у больных себорейным дерматитом. Медицина XXI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 24 листопада 2016 р. Харків, 2016. С. 69-70.
11. Bolotnaya L. A., Narozhnaya М. Vitamin D levels in patients with seborrheic dermatitis : abstract 13th Spring Symposium of European Academy of Dermatology and Venereology, 19-22 May 2016. Athens, 2016. Abstract code P0532.
Праці, які додатково відображають наукові результати дисертації
1. Спосіб лікування себорейного дерматиту / Л. А. Болотна, М. В. Нарожна, О. І. Саріан: пат. на корисну модель № 122932 UA: МПК 61 А61 К 31/00. № u 2017 09841; заявл. 11.10.2017 ; опубл. 25.01.2018; Бюл № 2.
ЗМІСТ
| Перелік умовних позначень . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Вступ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Розділ 1 Огляд літератури . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.1 Сучасне уявлення про етіологію та патогенез себорейного дер- матиту . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.2 Роль вітаміну D та імунітету в патогенезі себорейного дерматиту . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.3 Принципи і методи лікування себорейного дерматиту . . . . . . . . Розділ 2 Матеріали та методи дослідження . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.1 Методика загального обстеження хворих . . . . . . . . . . . . . . . . . . . 2.2 Імунологічне дослідження . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.3 Імуноферментне дослідження . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.4 Бактеріологічне дослідження . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.5 Статистичні методи дослідження . . . . . . . . . . . . . . . . . . . . . . . . . . Розділ 3 Клінічна характеристика хворих на себорейний дерматит . . . . . . . Розділ 4 Статус вітаміну D у хворих на себорейний дерматит . . . . . . . . . . . Розділ 5 Фактори вродженого імунітету у хворих на себорейний дерматит 5.1 Рівень кателіцидину у хворих на себорейний дерматит . . . . . . . . 5.2 Фагоцитарна і функціональна активність нейтрофілів у хворих на себорейний дерматит . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Розділ 6 Мікробіоценоз товстого кишечника у хворих на себорейний дер- матит . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Розділ 7 Статистичний аналіз взаємозв’язків клініко-лабораторних показ- ників у хворих на себорейний дерматит . . . . . . . . . . . . . . . . . . . . . . Розділ 8 Лікування хворих на себорейний дерматит. . . . . . . . . . . . . . . . . . . . 8.1 Обґрунтування використання у хворих на себорейний дерматит засобів, коригуючих рівень вітаміну D, стан вродженого імуні- тету та мікробіоценоз товстого кишечника ………………………… 8.2 Клінічні результати лікування хворих на себорейний дерматит .. 8.3 Лабораторні результати лікування хворих на себорейний дерма- тит . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Розділ 9 Аналіз та узагальнення результатів дослідження . . . . . . . . . . . . . . . Висновки . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Рекомендації . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Список використаних джерел . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Додаток А Акти впровадження . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Додаток Б Список публікацій здобувача за темою дисертації та відомості про апробацію результатів дослідження . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
|
16
17 23 23 30 37 43 44 47 48 50 51 53 73 81 81 87 94 107 114 114 119 121 127 146 149 150 174 183 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
25(OH)D – 25-гідроксивітамін D
АМП – антимікробні пептиди
ГКС – глюкокортикостероїди
ІЛ – інтерлейкін
ІМТ – індекс маси тіла
ІНФ γ – інтерферон γ
ІФА – імуноферментний аналіз
НСТ-тест індук. – НСТ-тест індукований
НСТ-тест спонт. – НСТ-тест спонтанний
СД – себорейний дерматит
УФО – ультрафіолетове опромінення
ФНП α – фактор некрозу пухлини α
ФІ – фагоцитарний індекс
ФЧ – фагоцитарне число
ШКТ – шлунково-кишковий тракт
LGG – Lactobacillus GG
LL-37 – кателіцидин
SDASI (Seborrheic Dermatitis Area Severity Index) – індекс поширеності і тяжкості себорейного дерматиту
TLR – toll-подібні рецептори
Th – Т-хелпери
VDR – рецептори до вітаміну D
ВСТУП
Обґрунтування вибору теми дослідження. Себорейний дерматит (СД) є хронічним запальним рецидивуючим захворюванням шкіри. Дерматоз реєструється у 3-5% населення, однак лупа, як легка форма СД, спостерігається значно частіше [3, 31, 76, 102, 111, 196]. Висипи на відкритих ділянках шкірного покриву, що супроводжуються свербежем, призводять до психоемоційних розладів, понижують соціальну активність та якість життя хворих [36, 71, 152, 188, 204]. Враховуючи значне поширення дерматозу у осіб працездатного віку, збільшення захворюваності, відсутність ефективних методів терапії, вивчення механізмів розвитку СД є однією з актуальних проблем дерматології.
У теперішній час виділяють чинники, що сприяють розвитку захворювання: порушення секреції сальних залоз, мікрофлори шкіри, спадковість, ендокринні розлади, захворювання шлунково-кишкового тракту (ШКТ), лікарські засоби та ін. [6, 24, 77, 163, 166, 180]. Зв’язок перебігу дерматозу з порою року, відомості про участь вітаміну D у регуляції функцій шкіри (здатність впливати на імунні реакції, секрецію шкірного сала та ін.) припускають його можливу участь у патогенезі захворювання. Разом з тим, рівень вітаміну D у хворих на СД досліджено недостатньо [139].
Імунодефіцит є важливою ланкою патогенезу СД, враховуючи колонізацію шкіри дріжджоподібними грибами роду Malassezia [12, 20, 28, 120, 150, 212]. Відомості про стан вродженого імунітету при СД нечисленні, поодинокі роботи вказують на його порушення за участю макрофагів, NК-клітин [4, 187]. Результати останніх досліджень вказують на імовірну роль антимікробних пептидів (АМП), фагоцитарної ланки імунітету у патогенезі хронічних запальних дерматозів, однак роботи з комплексного вивчення рівня кателіцидину (LL-37) та активності нейтрофілів крові у хворих на СД відсутні.
Сьогодні доведено істотний вплив порушень мікробіоценозу кишечника на перебіг деяких шкірних захворювань [41, 64, 84, 131]. Крім того, встановлено, що дефіцит вітаміну D є додатковим некласичним фактором ризику дисбіозу [21, 121, 209]. Необхідно продовжити дослідження стану мікрофлори товстого кишечника при різних клінічних проявах СД.
Таким чином, особливої значущості набуває розкриття нових метаболічних, імунних і мікробіологічних аспектів патогенезу СД та обгрунтування методів комплексного лікування хворих.
Зв’язок роботи з науковими програмами, планами, темами. Дослідження є плановою науково-дослідною роботою Харківської медичної академії післядипломної освіти «Удосконалення методів терапевтичної корекції хронічних дерматозів на підставі дослідження патогенезу та сучасних клінічних особливостей» (номер державної реєстрації 0112U000976) і «Оптимізація терапії хронічних дерматозів на підставі вивчення клінічних особливостей та патогенетичних механізмів» (номер державної реєстрації 0118U000302). Дисертантом виконано розділ, що стосується вивчення патогенезу і розробки методу лікування хворих на СД.
Мета дослідження: підвищення ефективності лікування хворих на себорейний дерматит шляхом розробки комплексного методу терапії на підставі вивчення статусу вітаміну D, стану вродженого імунітету і мікробіоценозу товстого кишечника.
Для досягнення поставленої мети дослідження визначено завдання:
1. Вивчити клінічні прояви СД у пацієнтів з урахуванням рівня вітаміну D, провести статистичний аналіз взаємозв’язків клініко-лабораторних показників.
2. Визначити вміст 25-гідроксивітаміну D у крові хворих на СД до і після лікування.
3. Проаналізувати рівень кателіцидину крові у пацієнтів з СД в динаміці спостереження.
4. Дослідити фагоцитарну і функціональну активність нейтрофілів крові у хворих на СД в процесі терапії.
5. Оцінити стан мікробіоценозу товстого кишечника у хворих на різні клінічні прояви СД.
6. Розробити комплексний метод терапії хворих на СД та оцінити його клініко-лабораторну ефективність.
Об’єкт дослідження: себорейний дерматит.
Предмет дослідження: клінічні прояви, статус вітаміну D, гуморальні та клітинні фактори вродженого імунітету, мікробіоценоз кишечника, ефективність терапії.
Методи дослідження: клінічні (постановка діагнозу, визначення індексу поширеності і тяжкості дерматозу – SDASI, інтенсивності свербежу, оцінка ефективності лікування), імунологічні (фагоцитарна і функціональна активність нейтрофілів), імуноферментні (рівень 25(OH)D, кателіцидину), бактеріологічні (визначення видового і кількісного складу мікрофлори товстого кишечника), статистичні (параметричні і непараметричні).
Наукова новизна отриманих результатів. Вперше у пацієнтів з СД визначено порушення статусу вітаміну D у вигляді недостатності і дефіциту вітаміну (відповідно у 61,8 % та 30,9 % випадків).
Вперше виявлено розлади гуморальних і клітинних факторів вродженого імунітету при СД, а саме пониження вмісту кателіцидину та ослаблення у 81,8 % хворих фагоцитарної активності нейтрофілів з порушенням метаболічного потенціалу і функціонального резерву клітин.
Доповнено наукові дані про те, що у 76,5 % хворих на СД має місце дисбіоз кишечника, що підтверджується пониженням у різній мірі (на 1-3 порядки) кількості облігатної мікрофлори (біфідобактерій і лактобактерій), дисбалансом кишкової палички і збільшенням умовно-патогенної флори (ентеробактер, цитробактер, стафілокок епідермальний, дріжджоподібні гриби Candida). Визначено I-III ступені дисбіозу товстого кишечника та зв’язок з клінічними проявами дерматозу.
Науково обгрунтовано доцільність використання в комплексній терапії хворих на СД вітаміну D3 та синбіотика, проаналізовано їх ефективність.
Практичне значення одержаних результатів. Розроблено і впроваджено в практичну охорону здоров’я комплексний диференційований метод терапії хворих на СД з використанням у холодну пору року холекальциферолу (Аквадетрим Вітамін D3) та синбіотика (ДермаПро), які нормалізують більшість клініко-лабораторних показників, що забезпечує підвищення ефективності лікування (патент на корисну модель № 122932 UA 2017 р.).
Запропоновано визначення рівня 25(OH)D у крові хворих на СД у зв’язку з наявністю факторів, що сприяють розвитку порушень статусу вітаміну D.
Показано, що пацієнти з пониженою забезпеченістю вітаміном D (менше 50 нмоль/л) складають групу ризику тяжкого перебігу СД.
Розроблено дві регресійні моделі для прогнозування ступеня тяжкості СД на підставі виділення прогностично значимих клінічних (SDASI) та лабораторних показників (кателіцидин, фагоцитарне число, 25(ОН)D).
Спосіб лікування вітаміном D3 (холекальциферол) і синбіотиком (ДермаПро) впроваджено в лікувальну практику ДУ “Інститут дерматології та венерології НАМН України”, КЗОЗ «Обласний шкірно-венерологічний диспансер №1» (Харків), КУ «Запорізький обласний клінічний шкірно-венерологічний диспансер» ЗОР, КЗОЗ «Харківський міський шкірно-венерологічний диспансер №4», навчальний процес кафедри дерматовенерології Харківської медичної академії післядипломної освіти МОЗ України, кафедри дерматовенерології та косметології з курсом дерматовенерології і естетичної медицини факультету післядипломної освіти Запорізького державного медичного університету МОЗ України.
Особистий внесок здобувача. Дисертаційна робота є науковою працею, виконаною автором. Здобувачем виконано інформаційно-патентний пошук та аналіз літератури за темою дисертаційної роботи, сформульовано мету і завдання роботи. Самостійно проведено клінічне обстеження, лабораторні дослідження та лікування хворих на СД. Самостійно проведено статистичну обробку та узагальнення отриманих результатів, написано всі розділи дисертації, сформульовано висновки та практичні рекомендації.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, в роботі використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Конфлікту інтересів немає.
Апробація результатів дисертації. Матеріали дисертаційної роботи оприлюднено на XV наук. конф. студентів та молодих учених «Новини і перспективи медичної науки» (Дніпропетровськ, 15-17 квітня 2015 р.), науково-практ. конф. «Проблеми захворювань шкіри та інфекцій, що передаються статевим шляхом, у дітей та підлітків» (Київ, 17-18 березня 2015 р.), 13-му Весняному симпозіумі Європейської академії дерматології та венерології (Афіни, 19-22 травня 2016), наук.-практ. конф. молодих вчених з міжнар. участю «Медицина XXI століття» (Харків, 24 листопада 2016 р.), XXXIII Всеукр. наук.-практ. конф. за участю міжнар. спеціалістів «Ліки – людині. Сучасні проблеми фармакотерапії і призначення лікарських засобів» (Харків, 08 квітня 2016 р.), наук.-практ. конф. «Новітні тенденції лікування та профілактики дерматовенерологічних проблем у рамках доказової медицини» (Львів, 15 квітня 2016 р.), Всеукр. конф. за участю міжнар. спеціалістів «Святогірські дерматовенерологічні дні: новітні методи діагностики і лікування в дерматовенерології та косметології» (Святогір’я, 25-26 травня 2017 р.), наук.-практ. конф. з міжнар. участю «Сучасні методи діагностики та лікування коморбідної патології в дерматовенерологічній практиці на принципах доказової медицини» (Чернівці, 01-02 червня 2017 р.), наук.-практ. школі «Дерматовенерологія в розробках молодих науковців» (Київ, 16-17 листопада 2017 р.), конф. «5-е Минские дерматологические чтения имени академика А.Я. Прокопчука» (Мінськ, 22 вересня 2017 р.), конф. «12-е Киевские дерматологические дни» (Київ, 11-13 жовтня 2017 р.), наук.-практ. конф. молодих вчених з міжнар. участю «Медицина XXI століття» (Харків, 23 листопада 2017 р.), наук.-практ. конф. молодих вчених інституту з міжнар. участю, присвяченій 25-й річниці від дня заснування Національної академії медичних наук України «Новітні впровадження молодих вчених в сучасній дерматовенерології» (Харків, 07 лютого 2018 р.), наук.-практ. конф. молодих вчених, присвяченій 25-річчю НАМН України (Київ, 23 березня 2018 р.), засіданні Харківського наукового товариства дерматовенерологів та косметологів «Школа нових методів дагностики, лікування та профілактики в дерматовенерології» (Харків, 10 квітня 2018 р.).
Обсяг і структура дисертації. Дисертаційна робота викладена на 187 сторінках машинописного тексту, складається із вступу, огляду літератури, опису матеріалів і методів дослідження, 6 розділів власних досліджень, аналізу та узагальнення результатів, висновків, рекомендацій та списку використаної літератури і 2 додатків. Обсяг основного тексту дисертації складає 149 сторінках друкованого тексту. Бібліографічний список містить 236 джерел, з них 93 кирилицею і 143 латиницею. Роботу ілюстровано 40 таблицями, 16 рисунками.
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУРИ
1.1 Сучасне уявлення про етіологію та патогенез себорейного дерматиту
Себорейний дерматит (СД) представляє собою хронічне рецидивуюче запальне захворювання, яке характеризується посиленою або нормальною секрецією сальних залоз, зміною складу шкірного сала, наявністю еритематозно-сквамозних осередків на шкірі. Це досить поширений дерматоз, зустрічається у 3-5 % населення, хоча лупа як легка форма СД, спостерігається набагато частіше – від 30 до 80% населення [30, 94, 111, 176, 196]. Використання різних термінів (себорейний дерматит, себорейна екзема, лупа, пітиріаз волосистої частини голови) відображає складну природу цього стану [102, 152]. Висипання на відкритих ділянках шкірного покриву (обличчя, шия, голова), що супроводжуються вираженим свербежем, призводять до психоемоційних розладів, знижують соціальну активність та якість життя хворих [76, 136, 178]. З огляду на широке поширення дерматозу у осіб працездатного віку, постійне зростання захворюваності, хронічний рецидивуючий перебіг, відсутність ефективних методів терапії, вивчення механізмів розвитку СД є однією з актуальних проблем дерматології.
У даний час єдиної точки зору на етіологію і патогенез СД не існує. Загальновизнаними сьогодні є такі патогенетичні чинники: зміни рівня гормонів (переважно андрогенів), ліпідів шкіри, колонізації мікробіоти шкіри (Malassezia spp.), порушення імунної відповіді [3, 98, 102, 138, 204]. Виділяють ряд факторів, що сприяють розвитку захворювання – спадковість, ендокринні розлади, інфекційні агенти, захворювання нервової системи, ШКТ, лікарські препарати, вплив навколишнього середовища та ін. [24, 40, 77, 166, 176].
Певна роль у виникненні дерматозу належить генетичним факторам. Для хворих характерна так звана «себорейна конституція», яка відображає генетичну схильність до розвитку дерматозу, що супроводжується зміною якісного складу шкірного сала. Це сприяє зниженню або втраті його бактерицидних властивостей і створенню сприятливого середовища для розмноження сапрофітної і патогенної біоти та, відповідно, розвитку запалення [76, 180]. Існування генетичної схильності до формування дерматозу грунтується на підвищенні частоти HLA-AW30 і / або AW31, HLA-A10, HLA-A23 і HLA-B12 [71, 98, 166].
Переважне ураження ділянок шкіри, багатих сальними залозами, два вікових піки захворюваності (у дітей перших трьох місяців життя і постпубертаті), найбільше поширення у віці від 18 до 40 років (період підвищеного синтезу шкірного сала) і більш часта захворюваність чоловіків припускають вплив статевих гормонів на пілосебаційний комплекс [31, 76, 204, 236]. Висока частота СД у чоловіків узгоджується з тим, що мітотична активність, себосекреція знаходяться під безпосереднім контролем андрогенів: вільного тестостерону, дегідроепіандростерону, 4-андростендіону і т. д. Рівень загального тестостерону крові у більшості хворих на СД у межах норми, але конверсія тестостерону в дигідротестостерон у 20-30 разів вище порівняно зі здоровими особами [198]. Пониження рівня естрогенів є передвизначальним фактором розвитку захворювання у жінок в період менопаузи. СД не завжди асоціюється з надмірною секрецією шкірного сала, проте 50-60 % хворих мають жирну шкіру. В результаті досліджень останніх років стало очевидним, що сальні залози, забезпечують бар’єрну функцію шкіри, працюють як нейроімуноендокринний орган [72, 194, 235].
Нейрогенна теорія СД пов’язує посилену продукцію шкірного сала у пацієнтів, що страждають на неврологічні захворювання (хвороба Паркінсона, паралічі черепних нервів, сімейна амілоїдна полінейропатія, черепно-мозкова травма, порушення мозкового кровообігу, епілепсія), з порушенням обміну нейротрансмітерів [95, 102, 176]. При хворобі Паркінсона 1 ст. СД зареєстровано у 8,3 % хворих, 2 ст. – у 23,8 % пацієнтів, що часто обмежується ураженням обличчя і волосистої частини голови. При 3 ст. хвороби Паркінсона дифузний СД відзначено в 46,2 % випадків [86]. СД у цієї категорії пацієнтів характеризувався більш гострим початком і залученням до патологічного процесу значної площі ураження, вираженою торпідністю до лікування. Установлена позитивна кореляція між захворюваністю на СД, хворобою Паркінсона, високою щільністю дріжджів М. globosa і активністю фосфатази, ліпази [95]. До інших системних захворювань, при яких захворюваність на СД вища, відносять гіпертонію, гострий інфаркт міокарду, алкогольний панкреатит і алкоголізм, ожиріння [188].
Дестабілізація вегетативної і гормональної систем у хворих, можливо, пов’язана зі спадковою дезінтеграцією антиноцицептивної системи діенцефальної області ствола мозку (гіпоталамуса), яка регулює рівень опіатних нейропептидів крові, а через гіпофіз – з функціональним станом ендокринних органів [36]. Одним із біомаркерів свербежу, характерного симптому СД, є гістамін, його рівень у крові хворих вдвічі збільшений. Точний механізм, що призводить до звільнення гістаміну і свербежу, поки не з’ясований [194, 220]. Тим не менш, може залучатися катепсин S, активатор протеїнази активованого рецептору 2. Значне збільшення трьох біологічних маркерів спостерігалося при лупі та СД у порівнянні з показниками у здорових суб’єктів, ці маркери корелювали з клінічними проявами хвороби [117].
У розвитку себопатій найсильніший взаємозв’язок простежується із станом верхніх відділів ШКТ – хронічними запальними захворюваннями шлунка і дванадцятипалої кишки [40, 73].
Посилення функціональної активності сальних залоз під впливом різних екзогенних і ендогенних факторів супроводжується активацією дріжджоподібних ліпофільних грибів Malassezia spp., які входять до складу нормобіоти шкіри і ускладнюють перебіг СД, утворюючи асоціації з бактеріями [6, 37, 40, 221]. Установлено, що на здоровій шкірі знаходяться лише дріжджові клітини (бластоспори), а гіфальна (міцеліальна) фаза гриба виявляється переважно у лусочках шкіри хворих на десквамативні ураження.
Вивчення видового складу Malassezia spp. при СД показало, що з осередків виділяються майже усі види, частіш інших M. furfur, M. globosa, M. sympodialis, M. restricta, M. obtusa, M. slooffiae. На шкірі обличчя частіше визначалися M. restricta (27,5 %), M. globosa (17,5 %) і M. slooffiae (15 %) [3, 146, 187]. При СД на уражених ділянках шкіри волосистої частини голови кількість клітин дріжджоподібних грибів значно вища (83 %), ніж на видимо здоровій шкірі (46,0-55,4 %), при цьому переважають M. restricta і M. globosa [24, 132, 184].
Головне джерело ліпідів для M. furfur на шкірі людини – тригліцериди і вільні жирні кислоти, які продукують сальні залози, а також холестерол і холестеролові ефіри, що утворюються після розпаду кератинізованих клітин. Висока ліпазна активність збудника є основною причиною запальної відповіді при СД за рахунок виходу олеїнової та арахідонової кислоти з ліпідів шкірного сала. Споживаючи тригліцериди шкірного сала, M. globosa виділяє ненасичені жирні кислоти (олеїнову, арахідонову), компоненти яких спричиняють подразнення шкіри [132, 169]. Крім того, арахідонова кислота метаболізується циклогеназою, прозапальні ейкозаноїди (особливо простагландини) спричиняють запалення і пошкодження рогового шару. Синтезовані Мalassezia spp. ліпази використовуються як проліферативне паливо для дріжджів. Споживаючи тригліцериди шкірного сала, M. globosa виділяє ненасичені жирні кислоти, компоненти яких обумовлюють подразнення шкіри [194, 220].
Сучасні знання про природу лупи дозволяють стверджувати, що лупа є легкою незапальною формою СД і може трансформуватися в дерматит при трьох умовах: підвищена чутливість шкіри до формування запальних реакцій на дію олеїнової кислоти в результаті вродженої схильності; наявність шкірного сала в якості живильного середовища для грибів; наявності M. globosa в складі мікрофлори шкіри голови. При наявності лупи кількість Malassezia spp. зростає в 1,5-2 рази в порівнянні зі здоровою шкірою волосистої частини голови [3, 94, 191].
Відзначимо, що рід Malassezia є імунологічним парадоксом. При деяких обставинах, дріжджоподібні гриби активують каскад комплементу, спричиняють як клітинну, так і гуморальну імунну відповідь у здорових осіб. За інших обставин, Malassezia spp. мають можливість не тільки ухилятися від імунної системи, а й пригнічувати імунну відповідь, спрямовану проти неї. Показано, що Malassezia spp. володіють імуномодулюючою дією, їх висока імуногенна активність значно перевищує таку інших представників дріжджової біоти, що пояснюють багатою антигенною структурою ліпофільних грибів. Здатність до фагоцитозу Malassezia spp. у нейтрофільних лейкоцитів складає усього 5 %, але різко зростає після обробки фунгіцидними агентами [180].
Висловлено припущення, що Malassezia індукує секрецію цитокінів кератиноцитами, що в подальшому підсилює запальну відповідь [131, 169]. Підтверджено, що кератиноцити при взаємодії з М. furfur вивільняють низькі рівні інтерлейкіну (ІЛ)-1β, ІЛ-6, ІЛ-8, фактора некрозу пухлини (ФНП) α. Вміст наведених цитокінів залишається високим, коли кератиноцити взаємодіють з іншими видами анаскогенних дріжджів [132, 150].
У патогенезі СД роль Malassezia spp. залишається спірною. Багато дослідників основною причиною дерматозу і сьогодні вважають Malassezia, проте кількість цього ліпофільного мікроорганізма на шкірі хворих часто є нормальною [78, 176]. Malassezia змінює склад шкірного сала, сприяє запалення шкіри у сприйнятливих людей [212]. Значення Malassezia в патогенезі СД підтверджується результатами досліджень з оцінки ефективності лікування дерматозу протигрибковими засобами – кількість дріжджів зменшується, що призводить до клінічного поліпшення, а також збільшення періоду ремісії [210]. Діти, хворі на СД, мали більшу кількість Malassezia на шкірі, що, імовірно, не є визначальним фактором для запальної реакції, більш значимою є кількість ліпідів на поверхні шкіри та імунна відповідь людини на присутність грибка [152, 198].
Ряд фізіологічних і структурних особливостей шкіри дозволяють цьому органу функціонувати в якості міцного бар’єра, що обмежує внутрішнє середовище організму від впливу зовнішнього середовища. Довгий час шкірний покрив вважався суто механічним бар’єром від проникнення різних чужорідних речовин. Дріжджі роду Malassezia, здається, обумовлюють неспецифічну імунну відповідь, з якої починається каскад змін на шкірі при СД. Запалення спричиняє гіперпроліферацію рогового шару (лущення) і неповну диференціацію корнеоцитів, яка змінює бар’єр рогового шару і погіршує його функцію, тим самим збільшуючи доступ Malassezia spp. і посилює трансепідермальную втрату вологи [94, 123].
Хронічне пошкодження шкірного бар’єру (слабко пов’язані корнеоцити, мала кількість десмосом, посилений гідроліз десмосом, зміна структури і рівня ліпідів – керамідів і вільних жирних кислот) може призвести до порушення десквамації, погіршення гідратації, що призводить до епідермальної проліферації, аномального диференціювання кератиноцитів і дозрівання рогового шару, підвищення трансепідермальної втрати вологи які можуть лежати в основі деяких симптомів лупи і СД [76, 98].
В етіології СД та його ускладнень певну роль грає і бактеріальна мікрофлора. Про це свідчить більш висока частота обсіменіння уражених ділянок волосистої частини голови Staрhylococcus capitis, Micrococcus spp. і Acinetobacter spp. при запальному СД [33, 132, 152, 180].
Нормальну мікрофлору людини розглядають як філогенетичну систему чисельності мікробіоценозів, що характеризуються певним видовим складом. Сучасні мікробіологічні дослідження дозволяють достатньо чітко визначитися з поняттям «нормальний фізіологічний мікробіоценоз» для будь-якого біотопу організму-господаря. Він, як відомо, найчастіше представлено мікроаерофілами, факультативними та облігатними анаеробами, які в результаті міжвидової конкуренції за місця проживання і завдяки специфічній адгезії на епітеліальних клітинах сформувалися у визначені мікробні спільноти (кворум-сенсінг) або мікробні плівки [48, 128].
На сьогоднішній день встановлено, що мікрофлора кишечника є складовою частиною організму людини, виконує численні життєво важливі функції і закономірно залучається до патологічного процесу, що відбувається на рівні цілісного організму [26, 33, 108]. Порушення нормального мікробного біоценозу кишечника може бути результатом патології органів ШКТ (ферментопатії, дисбактеріозу), загострення хронічних захворювань (ендокринних, неврологічних), стресу, прийому ліків (антибіотики, кортикостероїди), неповноцінне харчування і т. д. При зміні біоценозу кишечника порушується одна з головних його функцій – бар’єрна та активуються умовно-патогенні мікроорганізми.
Відповідно до сучасних уявлень, нормальна мікрофлора товстого кишечника людини являє собою «екстракорпоративний орган», що складається з величезної кількості мікроорганізмів, об’єднаних в єдину екологічну систему: «організм людини – нормальна мікрофлора» [82, 128, 157]. Якщо захисні системи організму не можуть впоратися з патогенними факторами, через ряд біохімічних процесів, відбуваються порушення в складі мікробіоти кишечника, які в свою чергу можуть бути причиною різних захворювань [33, 152, 127].
У хворих на СД виявлено зміни кількісного і якісного складу мікробіоценозу шкіри та кишечника, які проявляються високою частотою колонізації сапрофітних представників мікрофлори в осередках ураження, різким зниженням кількості анаеробів і збільшенням умовно-патогенних мікроорганізмів кишкового тракту [28]. Зміни складу мікрофлори кишечника у 41,4 % хворих і виявлення грибів роду Malassezia spp. у 21,4 % пацієнтів не є підтвердженням головної ролі цих факторів у патогенезі СД, але при цьому повністю не виключають їх значення у розвитку дерматозу.
Нечисленні дослідження присвячені вивченню біоценозу кишечника пацієнтів з СД [28, 65], обумовлюють необхідність більш глибокого вивчення проблеми і пошуку ефективних методів лікування.
1.2 Роль вітаміну D та імунітету в патогенезі себорейного дерматиту
Довгий час вітаміну D відводилася роль гормона-регулятора гомеостазу кальцію і фосфору в організмі, однак за останнє десятиліття накопичено переконливі дані про участь у багатьох біологічних процесах – модуляція клітинного росту, нервово-м’язова провідність, імунітет та запалення [14, 23, 91, 193, 224 233]. Вітамін D володіє широким спектром біологічних властивостей і приймає участь у регуляції важливих фізіологічних функцій, його дефіцит має негативні наслідки і полягає в основі ряду патологічних станів і захворювань, в тому числі й шкіри [1, 66, 75, 89, 168, 173, 228].
У даний час недостатність і дефіцит 25(OH)D є пандемією, що зачіпає велику частину загальної популяції в усьому світі, включаючи дітей і підлітків, вагітних і годуючих жінок, дорослих, жінок у менопаузі, літніх людей [23, 147, 173]. Наприклад, поширеність рівня менше 30 нг/мл у жінок у постменопаузі складає 50 % у Таїланді і Малайзії, 75 % у США, 74,0-83,2 % у Росії, 90 % в Японії і Південній Кореї, Британії, Німеччині, Австрії [15, 18, 145, 153, 177]. В Україні недостатність вітаміну D спостерігається у всіх вікових групах – тільки 4,6 % мають рівень 25(ОН)D в межах норми, у 13,6 % відзначено недостатність D-статусу, у 81,8 % – дефіцит вітаміну D, при цьому важка форма дефіциту визначена у 37,3 % обстежених [70].
Вітамін D є унікальною речовиною, в певних умовах виконує функцію гормону. Вітамін D, що проникає в кров зі шкіри або надходить з їжею, біологічно інертний і вимагає первинного гідроксилювання у печінці за участю ферменту D-25-гідроксилази з утворенням 25-гідроксивітаміну D [25(OH)D], також відомого як кальцидіол. Останній в подальшому піддається повторному гідроксилюванню в нирках за участю 25(OH)D-1α-гідроксилази (CYP27B1), в результаті якого утворюється біологічно активна форма вітаміну D – 1,25-дигідроксивітамін D (1,25(OH)2D або кальцитріол) [18, 153, 216]. Рівень кальцитріолу крові визначається здебільшого активністю CYP27B1 в нирках, що знаходиться під контролем паратгормону, і жорстко регулюється негативним зворотним зв’язком, який замикається інгібуванням CYP27B1 високими концентраціями самого кальцитріолу і фактора росту фібробластів 23. Обмеженню утворення активної форми вітаміну сприяє стимуляція ферменту CYP24A1 (24-гідроксилази), який перетворює кальцитріол в неактивну, водорозчинну форму кальцитроєвої кислоти, що надалі виводиться із організму з жовчю [14, 23, 69, 173]. Активні метаболіти вітаміну D надають плейотропну дію на численні фізіологічні процеси, в тому числі активність захисних неспецифічних і адаптивних механізмів [91, 193, 224].
Більш ніж в 40 тканинах-мішенях визначено рецептори до вітаміну D (VDR). Всі компоненти метаболізму вітаміну D, VDR, а також рецептори ретиноїди-X, які діють спільно, об’єднують ендокринну систему вітаміну D. Вітамін D впливає за рахунок рецепторного впливу на біологічні реакції організму через транскрипцію генів (геномний механізм) і швидкі реакції внегеномного генезу [69, 79, 91, 121, 172, 217]. Кожна тканина контролює активність процесів самостійно, але залежить від адекватного рівня циркулюючого 25(OH)D3 [91, 228].
Більшість наукових даних, опублікованих в останні роки, переконливо свідчать про те, що недостатня забезпеченість вітаміном D істотно підвищує ризик не тільки рахіту і остеопорозу, а й цілого ряду інших захворювань – серцево-судинних, інфекційних, цукрового діабету і т. д. [27, 66, 67, 142, 164, 206]. У той же час, некласичні (позакісткові) ефекти, у більшості випадків, опосередковуються через місцеве (частіше, внутрішньоклітинне) гідроксилювання 25(OH)D в 1,25(ОН)2D з генерацією дуже високих внутрішньоклітинних концентрацій активної форми вітаміну D для індукції необхідних генних ефектів [23, 231, 233].
Антипроліферативна активність, пригнічення ангіогенезу, інвазивного клітинного росту вітаміном D передбачає роль цього гормону в розвитку раку і пригніченні росту пухлини (рак товстої кишки, молочної залози, легенів, підшлункової залози, яєчників, простати, ходжкінська і неходжкінська лімфоми) [99, 160, 205]. Є дані про те, що нестача вітаміну D пов’язана зі збільшенням ризику розвитку алергії у дітей та підлітків. Низький рівень вітаміну D пов’язаний з високою чутливістю до 11 з 17 алергенів (амброзія, дуб, шерсть собаки, таргани, арахіс) [42, 164, 165, 217, 231].
Вітамін D приймає участь у регуляції проліферації і диференціюванні клітин всіх органів і тканин, в тому числі клітин крові та імунокомпетентних клітин [118, 121, 151, 216]. Відкриття рецепторів кальцитріолу на багатьох клітинах імунної системи (активованих Т-лімфоцитах, макрофагах, незрілих лімфоцитах тимусу і зрілих CD8-клітинах), здатність мононуклеарних фагоцитів до продукції 1,25-дигідроксивітаміну D3 є доказом участі вітаміну D у функціонуванні вродженого і набутого імунітету [27, 66, 68, 149, 151]. Кальцитріол змінює експресію цільових генів в клітинах імунної системи, пригнічуючи транскрипцію найважливіших факторів, таких як ядерний фактор κB і сигнальних шляхів, Janus-кінази [79, 148].
Установлено, що дефіцит вітаміну D є додатковим некласичним фактором ризику розвитку дисбактеріозу (слизових рота, кишечника, генітального тракту) [21, 97, 164].
Унікальність шкіри як органу в тому, що вона є не тільки джерелом вітаміну D для організму, але й здатна реагувати на активний метаболіт вітаміну D. Як 1,25(OH)2D, так і VDR грають у шкірі істотну роль [199, 173, 179, 233]. Кальцій та 1,25(OH)2D виконують важливі і взаємодіючі функції в регулюванні процесу диференціювання клітин шкіри. 1,25(OH)2D збільшує експресію інволюкрину, трансглутамінази, лорикрину і філагрину, стимулює формування рогового шару, одночасно пригнічуючи гіперпроліферацію [216, 228]. 1,25(OH)2D та його рецептор індукує toll-подібні рецептори (TLR) 2 типу та його корецептор CD14, що ініціює вроджену імунну відповідь у шкірі [118, 200, 217, 231]. Активація цих рецепторів призводить до індукції CYP27B1, що в свою чергу індукує кателіцидин, в результаті чого відбувається загибель чужорідних мікроорганізмів.
Фотозахисний вплив вітаміну D на клітини шкіри включає зменшення пошкодження ДНК, пониження активності апоптозу, підвищення виживаємості клітин і зменшення еритеми, можливо, шляхом підвищення експресії металопротеїну в базальному шарі [181, 216].
Припускають порушення вітаміну D у патогенезі ряду шкірних захворювань, включаючи рак шкіри, псоріаз, іхтіоз, автоімунні захворювання шкіри – вітиліго, пухирчасті дерматози, склеродермія і червоний вовчак, а також атопічий дерматит, акне, випадіння волосся, інфекції та фотодерматози [160, 170, 197, 229]. Вітамін D і його аналоги мають велике значення для лікування псоріазу у зв’язку з посиленням диференціювання і ослабленням проліферації кератиноцитів, а також зниженням експресії протизапальних цитокінів та ряду інших генів [179, 207, 226]. У 47,6 % хворих на атопічний дерматит встановлено пониження рівня 25(OH)D в сироватці крові менше 75 нмоль/л, велику частоту тяжкого і середньотяжкого перебігу дерматозу [67, 175, 225].
Ліганди рецептора вітаміну D зменшують рівень експресії прозапальних цитокінів і надають терапевтичний ефект при багатьох запальних шкірних захворюваннях. Разом з тим, рівень вітаміну D при СД досліджено недостатньо. Вивчення рівня 25(OH)D у 22 хворих на СД у віці від 5 до 61 року виявило у 86,3 % випадків недостатність, 10,5 % – дефіцит вітаміну D, частіше у чоловіків 30-40 років [139].
Патогенез шкірних захворювань запального генезу (атопічний дерматит, псоріаз, плоский лишай та ін.) прямо чи опосередковано пов’язаний із дисфункцією імунної системи у зв’язку зі зміною кількісного складу, функціональної активності та кооперації між поліморфноядерними лейкоцитами, моноцитами / макрофагами, іншими антигенпрезентуючими клітинами [71, 77, 100, 116, 226].
В даний час активно обговорюється роль імунодефіцитних станів у розвитку десквамативних шкірних захворювань, обумовлених активізацією на цьому тлі умовно-патогенної флори, вірусних і змішаних інфекцій [103]. Важливим підтвердженням імунодефіциту як етіологічного фактора є висока поширеність СД серед ВІЛ-позитивних і хворих на СНІД (34-83 %) у порівнянні з показником в загальній популяції (приблизно 3 %) [186, 198, 203].
Імунопатогенез СД є складним і багатофакторним. Вроджений і набутий імунітет представляють собою дві взаємодіючі частини однієї системи, що забезпечує розвиток імунної відповіді на генетично чужорідні субстанції. В індуктивну стадію патогени чи інші чужорідні агенти, які попали в організм через різні бар’єрні тканини (шкіру, слизові оболонки), зустрічаються з факторами вродженого імунітету як гуморальними (білки системи комплементу, противомікробні пептиди), так і клітинними (фагоцитарні клітини, NK-клітини, Т-лімфоцити та ін.). В ефекторну стадію імунної відповіді відбувається елімінація патогенів, яка здійснюється в основному за участю механізмів вродженого імунітету, посилених за рахунок компонентів адаптивного імунітету. Зокрема, активація вродженої ланки імунітету і пов’язана з нею маніфестація локального і системного запалення сприяють розвитку і прогресу шкірних захворювань (атопічного дерматиту, акне). Слід брати до уваги тривалу прозапальну дію Malassezia spp., високу імуногенність дріжджів, здатних активувати комплемент і синтез прозапальних реактивних окислених метаболітів поліненасичених ліпідів поверхні шкіри [135].
СД характеризується клітинним типом імунної відповіді зі збільшенням кількості Т-супресорів, пониженнням коефіцієнта Т-хелпери / Т-супресори у 70 % пацієнтів і важливою роллю ІФН γ та ІЛ-2 [130, 186, 218]. У біоптатах шкіри хворих на СД містяться імунокомпетентні клітини CD4+, CD8+ і CD68+-гістіоцити, що локалізуються в епідермісі і периваскулярних інфільтратах, що свідчить про розвиток запалення за механізмом гіперчутливості уповільненого типу [162]. За тканинним розподілом імунокомпетентних клітин СД наближається до псоріазу, в периваскулярних інфільтратах переважають CD8-лімфоцити [198]. У хворих на СД виявлено наявність хронічної запальної реакції, в якій активну участь приймають фагоцити, NK-клітини, СD4+-Т-хелпери, СD8+-Т-супресори. Виявлені зміни імунограми свідчать про напругу клітинної і гуморальної ланок імунітету [71, 152].
У периферичній крові хворих на СД виявлено збільшення рівня ІЛ-10 на тлі депресії ІНФ γ і зниження продукції прозапальних ІЛ-1α, ІЛ-2, ІЛ-6 і ФНО α, в той же час, вміст ІЛ-1β і ФНО α при вираженому запальному процесі має тенденцію до підвищення [31, 71, 131, 232]. Після 6 тижнів лікування ітраконазолом в дозі 200 мг відзначена ремісія або істотне клінічне поліпшення у пацієнтів з СД. Після лікування рівень секреції ІФН γ у пацієнтів з СД значно збільшився, інших цитокінів (ІЛ-6, ІЛ-8) не відрізнявся від такого до лікування [219].
Менш вивченими при СД залишаються механізми і чинники вродженого імунітету. При СД відмічають збільшення кількості природних кілерів NK1+-, CD16+-клітин, пов’язаних з активацією комплементу в осередках СД, пониження рівня Ig A, Ig G [37, 176].
На початок XXI століття були отримані нові відомості, що дають уявлення про механізми розпізнавання чужорідних речовин на перших етапах їх впровадження, які здійснюються за участю патоген-розпізнаючих рецепторів, що є частиною вродженого імунітету. Якнайповніше вивченими рецепторами з групи патогенрозпізнаючих рецепторів є TLR, що визначають молекулярні патерни різних мікроорганізмів (бактерій, дріжджоподібних грибів або вірусів) [81]. У хворих на СД підвищена експресія TLR-2, їх активація при дії різних патогенів (у тому числі грибкових) на макрофаги та інші клітини вродженого імунітету обумовлює експресію безлічі генів хемокінів і прозапальних цитокінів (ІЛ-1, ІЛ-2, ІЛ-6, ФНО α і т. д.) [131, 137, 141].
Одними з компонентів вродженої системи імунітету є ендогенні АМП, що виступають не лише ендогенними антибіотиками, але відіграють важливу роль в розвитку процесів запалення, впливають на експресію ФНО α, ІЛ-1β, ІЛ-8, ІЛ-10, є хемотаксичним чинником для нейтрофілів, моноцитів, опасистих клітин, що регулюють активацію комлементу [75, 80, 87, 133, 174]. Нині у людини ідентифікований усього лише один член сімейства кателіцидинів: людський антимікробний протеїн (human cationic antimicrobial protein – hCAP-18/LL-37), головним чином виявлений у пероксидаза-негативних гранулах нейтрофілів, лімфоцитах і моноцитах, сквамозному епітелії, епітелії легеневої тканини. Кателіцидин також утворюється в кератиноцитах у відповідь на запальний стимул, механічне ушкодження шкіри або активацію TLR елементами бактерій, грибів, вірусів і простіших при першому контакті, без попередньої презентації антигену [122, 133, 214]. Кателіцидини часто називають за пептидною формою (LL-37) або формою білка-попередника hCAP18 з молекулярною масою (ММ) 18 kDa, який складається з N-кінцевого кателіцидинподібного і С-кінцевого антимікробного доменів [34]. Пептид LL-37 має антибактеріальні, протигрибкові і противірусні властивості. Ці властивості обумовлені електростатичною взаємодією LL- 37 з мембранами клітини [11, 31, 215].
Рівень пептиду LL-37 підвищується при ушкодженнях шкіри і різних стресових ситуаціях, що дало підставу віднести його до сигналів тривоги або алармінів [80, 105]. Цей пептид являється хематрактантом для нейтрофілів, моноцитів, дендритних клітин і Т-лімфоцитів; сприяє дозріванню дендритних клітин і розвитку Т-клітинної імунної відповіді [81, 214]. Кількість ендогенного пептиду різко зростає в шкірі при загоєнні рани, що дало основу деяким авторам називати пептид LL-37 ростовим чинником кератиноцитів.
При псоріазі рівень кателіцидину в шкірі різко підвищений порівняно з шкірою хворих на атопічний дерматит або здорових людей, знаходиться в процесованій формі у вигляді пептиду LL-37 з ММ 4,5 kDa [116]. У хворих середньотяжким і тяжким псоріазом рівень кателіцидину крові виявився пониженим [207]. Відомо, що хворі на атопічний дерматит з дефіцитом експресії LL-37 частіше страждають вакцинальною екземою [32, 116]. Підвищення рівня LL-37 виявлено у хворих на акне в залежності від ступеня тяжкості [44].
Результати досліджень привели до однозначних висновків про те, що дефекти в експресії або функціонуванні АМП можуть пояснити деякі аспекти патогенезу найрізноманітніших захворювань людини, таких як атопічний дерматит, кістозний фіброз, карієс та ін. [105, 214, 215]. В той же час роботи з вивчення кателіцидину при СД в доступній літературі відсутні, хоча багато досліджень указують на участь в хронічному запаленні шкіри клітинних і гуморальних чинників вродженого імунітету.
Недавні зарубіжні дослідження довели, що ключова роль в експресії АМП належить вітаміну D. Окрім впливу “сонячного” вітаміну практично на усі механізми вродженої і придбаної імунної відповіді [172, 174, 217], знайдено в промоторній області гену кателіцидину елемент відповіді на вітамін D (VDRE) [200, 211]. При взаємодії кальцитріолу з VDRЕ відбувається стимуляція експресії генів АМП – дефензину (HBD-2) і LL-37 [1, 15, 75, 79, 230]. У афроамериканців з низькою концентрацією 25(OH)D3 спостерігається недостатня індуцибельна експресія мРНК кателіцидину, у зв’язку з чим у них відзначається високий ризик захворювання туберкульозом [159]. Саме тому адекватне забезпечення організму вітаміном D відіграє важливу роль у відвертанні мікробної інвазії.
Останні дослідження показують, що кератиноцити мають рецептори вітаміну D, що інгібують проліферацію і стимулюють диференціювання клітин епідермісу, синтезують АМП [211, 140]. Dixon та ін. [183] припустили, що вітамін D сироватки крові може модулювати рівень циркулюючого LL-37.
Недостатня інформація не дозволяє зробити висновки про роль вітаміну D при СД, не визначено зв’язок з клінічними перебігом, рівнем кателіцидину, дисбактеріозом кишечника.
1.3 Сучасні підходи до лікування себорейного дерматиту
Наукові відкриття, які довели участь Malassezia spp. у розвитку СД, змінили стратегію лікування і змістили акценти від кортикостероїдних до протигрибкових агентів, але разом з цим зменшилася і частота небажаних явищ [6, 50, 73, 85, 136, 106, 163]. Встановлено, що під впливом антимікотичних засобів через 24 год відбувається дегідратація та вакуолізація цитоплазми клітини гриба, просвітлення клітинної стінки, від якої через 48 год залишається тільки тінь. Тому саме специфічному протигрибковому лікуванню СД віддається перевага перед протизапальною кортикостероїдною терапією [7, 101, 144]. В даний час лікування СД включає застосування різних місцевих протигрибкових препаратів, потенційно здатних лікувати дерматоз не тільки на шкірі волосистої частини голови, а й інших ділянках шкірного покриву. Серед безлічі протигрибкових препаратів перевагу слід віддати тим, які, по-перше, здатні накопичуватися в шарах шкіри, де розвивається патологічний грибковий процес, по-друге, не проникати в ті шари, де життєдіяльність грибів неможлива, і, по-третє, надавати протизапальну і кераторегулюючу дію.
При ураженні волосистої частини голови призначають шампуні, що містять кетоконазол, цинк, дисульфід селену, клімбазол, дьоготь, сірку [6, 16, 120, 132]. Кетоконазол має високу активність відносно багатьох грибів і особливо проти Malassezia spp. Механізм його дії полягає в інгібуванні біосинтезу ергостеролу через фермент С14-альфа-диметилазу і зміни ліпідного складу мембрани грибів. Крім дерматофітів препарат активний відносно дріжджових і дріжджоподібних грибів роду Candida, Malassezia [31, 162, 167]. В цілому кетоконазол пригнічує ріст M. furfur (P. ovale) у концентраціях, в 25-30 разів менших, ніж інші протигрибкові препарати, що застосовуються в терапії СД, і в кілька разів менших, ніж будь-які системні антимікотики [144, 150].
Цинку піритіон також надає пряму протигрибкову дію. Поступаючись кетоконазолу, цинку піритіон перевершує за протигрибковою активністю інші препарати, в тому числі сульфід селену і деякі імідазоли. Крім цього, препарати, що містять цинк, зменшують зростання резистентних штамів бактерій, пригнічують секрецію шкірного сала [12, 38, 9, 130].
Циклопіроксоламін є похідним гідроксипіридону, синтетичним протигрибковим агентом, який має виражену протизапальну дію. На відміну від інших антифунгальних агентів, циклопірокс не зачепає синтез стеролів, інгібує поглинання клітиною необхідних сполук [93, 101, 144, 176]. В лікуванні CД активні й інші лікарські форми циклопіроксу, включаючи креми, гелі, а також комбінації з іншими речовинами шампунів [158]. Піроктон оламін часто використовується у засобах проти лупи, надає бактерицидний вплив на Malassezia spp., перешкоджає їх розмноженню, що в свою чергу призводить до зменшення свербежу і лущення шкіри голови [101]. Дисульфід селену володіє протигрибковою дією і уповільнює цикл оновлення клітин за рахунок антимікробної і цитостатичної дії. Лікувальні засоби, що містять дисульфід селену, сірку, в основному безпечні та ефективні для лікування СД і лупи [12, 17, 106].
Застосування шампунів, що містять дьоготь і відлущуючі засоби, не дає швидкого і стійкого ефекту, особливо при тривалому процесі, оскільки усунення проявів дерматозу (інфільтрація, набряк, лущення, еритема) не завжди призводить до швидкого усунення патогенної флори.
При легких формах перебігу СД з локалізацією висипів на гладкій шкірі використовують мазь, крем або розчин протигрибкового препарату 1-2 рази на тиждень впродовж місяця [20, 24, 106, 120]. При тяжкому перебігу захворювання, що характеризується наявністю осередків з вираженим запаленням і щільним нашаруванням лусочок, перед застосуванням антимікотичних препаратів необхідно використати кератолітика (саліцилова кислота, препарати дьогтю та ін.) або розм’якшити лусочки за допомогою олій з подальшим застосуванням шампуню з кетоконазолом.
При неефективності цієї терапії, вираженому запаленні з гіперемією і мокнуттям рекомендують на короткий період часу топічні кортикостероїди середнього або високого ступеня протизапальної активності, що призводить до швидкого регресу симптомів (еритема, десквамація і свербіж) (крем 0,1% бетаметазону валерат або 0,025% бетаметазону дипропіонат, крем метилпреднизолону ацепонат або 0,1% мометазону фуроат та ін.) [7, 49, 76, 144, 171]. Топічні кортикостероїди доцільно використовувати в якості засобів другої лінії, тому що довгострокове використання пов’язане із стоншуванням шкіри і утворенням телеангіектазій.
Протизапальні топічні інгібітори кальциневрину – такролімус 0,03 і 0,1%, пімекролімус 1% є альтернативою місцевим кортикостероїдам, які перевершують за силою дії кортикостероїди з низькою ефективністю без побічних ефектів останніх і обумовлюють більш тривалу ремісію [20, 96, 163]. Ці модулятори є нестероїдними інгібіторами кальциневрину, чинять протизапальну дію, пригнічують синтез прозапальних цитокінів і медіаторів Т-лімфоцитами та іншими клітинами шкіри, що приймають участь у запаленні [125].
Інші терапевтичні варіанти, про які повідомляється в літературі, включають 1% гель метронідазолу, крем такальцитол (1,24-(R)-дигідроксивітамін D3), топічний літію сукцинат, бензоїлу пероксид [106].
Однією із складових комплексного лікування СД є вітамінотерапія. Вітаміни А, Є, РР, аскорбінова і фолієва кислоти нормалізують процеси відлущування, ороговіння, покращують функціонування імунної системи, а також знижують запальну реакцію [6, 39, 74]. Застосування рибофлавіну регулює окислювально-відновні процеси за рахунок участі вітаміну у білковому, жировому і вуглеводному обмінах. В терапію СД включають загальнозміцнюючі засоби, біогенні стимулятори, вітаміни групи В (В1, В2, В6), нікотинову кислоту, гліцерофосфат, препарати сірки, кальцію, міді, заліза, окис цинку [17, 31]. Регрес висипів, що супроводжується істотним зниженням жирності шкіри, поменшенням розмірів сальних залоз, а також диференційованих себоцитов, площі лімфоцитарно-макрофагальних скупчень у дермі, кількості кератиноцитів з вакуолізованою цитоплазмою відмічено після перорального застосування ретинолу пальмітату в дозі 200 000 MО впродовж 2 місяців [37].
Крім того, в комплексну терапію обов’язково включають ентеросорбенти з метою дезінтоксикації організму (активоване вугілля, метилкремнієвої кислоти гідрогель, лігнін гідролізний та ін.) [74, 84]. При системному лікуванні увагу приділяють ферментним препаратам, які покращують процес травлення, незамінним амінокислотам з ліпотропним ефектом, сприяючим утилізації жирових накопичень шляхом перетворення їх в енергію [39]. У разі виявлення дисбактеріозу потрібне проведення комплексу лікувальних заходів, нормалізуючих кишкову біоту [64, 84, 128, 157].
Виражені суб’єктивні відчуття (свербіж, відчуття стягування шкіри та ін.) в осередках ураження при СД є показанням до призначення антигістамінних препаратів [74, 94, 117].
При поширених формах СД і неефективності зовнішньої терапії показано застосування системних антимікотичних препаратів всередину протягом 2-4 тижнів [143, 163, 201]. Застосовуючи ітраконазол перорально в дозі 100 мг двічі на добу протягом тижня, потім – 200 мг протягом двох днів наступних двох місяців, прийшли висновку, що пероральні антимікотики повинні бути препаратами першої лінії для лікування тяжких форм СД [94, 176].
У особливо тяжких випадках призначають себосупресивні препарати, такі як ізотретиноїн, що зменшує активність і розмір сальних залоз на 90 % і мають протизапальну дію. Щоденний прийом препарату в добовій дозі від 0,1 до 0,3 мг/кг маси тіла після 4-х тижнів лікування призводить до поліпшення перебігу тяжкої себореї. У подальшому доза від 5 до 10 мг на добу дозволяє ефективно підтримувати стан впродовж декількох років [155]. При спостереженні за 5 пацієнтами, отримуючими ізотретиноїн із приводу акне, відмічена поява висипу на обличчі, схожого з СД [202].
Із фізичних методів застосовують дарсонвалізацію і кріомасаж шкіри волосистої частини голови, індуктотермію області надниркових залоз, лазеропунктуру тощо [72, 73]. При використанні транскраніальної електростимуляції ствола мозку у поєднанні із звичайними методами лікування, Ю. В Левіна, К. І. Разнатовський відмітили клінічне одужання у 15,2 %, значне поліпшення – у 37,6 % хворих СД [36].
Нині методом вибору при багатьох дерматозах є фототерапія, а оскільки багато пацієнтів з СД відмічають поліпшення в літній період, застосування цього виду лікування обгрунтовано. Описана десенсибілізуюча (протисвербіжна) дія ультрафіолету, викликана зниженням кількості серотоніну і гістаміну. Під дією опромінення посилюється також вироблення вітаміну D. Терапевтична ефективність опромінення в лікуванні шкірних захворювань є наслідком його імуносупресивного, протизапального і антипроліферативного впливу на тканини. В результаті лікування, що включає, окрім традиційних засобів, фототерапію променями довжиною 311 нм і препарат, що нормалізує мікрофлору кишечника, у 87,5 % пацієнтів відмічено клінічне покращення, у 91 % хворих досягнута нормалізація складу мікрофлори товстої кишки [64].
Резюме. Проведений аналіз літературних джерел свідчить, що останнім часом збільшилася частота виникнення десквамативних уражень шкіри зі схильністю до рецидивування і стійкістю до зовнішньої терапії, порушенням імунітету і неспецифічної резистентності, які є ключовими чинниками патогенезу хронічних захворювань, одним з яких є СД. Незважаючи на чисельні дослідження, залишається нез’ясованою патогенетична роль вітаміну D, його вплив на вроджений імунітет і мікробіоз кишечника у хворих на СД.
На наш погляд, подальше вивчення статусу вітаміну D, кателіцидину та активності нейтрофілів як факторів вродженого імунітету, кишкової мікробіоти, розробка комплексного лікування із своєчасною корекцією вітаміну D і дисбіозу кишечника може дозволити не лише підвищити ефективність терапії СД, а й попередити прогресування дерматозу.
Наведені у розділі положення відображено у публікації:
Болотная Л. А., Нарожная М. В. Себорейный дерматит: современные представления о патогенезе. Міжнародний медичниий журнал. 2015. № 1 (81). С. 96-99 [10].
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
Під нашим спостереженням перебувало 112 хворих на СД віком 23-54 років, які знаходилися на лікуванні та диспансерному спостереженні в медичному центрі «Союз» (м. Харків), КЗОЗ «Харківський міський шкірно-венерологічний диспансер № 4», КЗОЗ «Харківський обласний шкірно-венерологічний диспансер № 1» (клінічні бази кафедри дерматовенерології ХМАПО) з 2014 по 2017 рр. Усі хворі піддавалися комплексному клініко-лабораторному обстеженню згідно наказу МОЗ України № 312 від 08.05.2009 р. “Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання”.
Діагноз СД встановлювали на підставі скарг пацієнта, анамнезу життя і хвороби, клінічного огляду волосистої частини голови, обличчя, тулуба та кінцівок з визначенням об’єктивних і суб’єктивних ознак хвороби. Оцінювали також соматичний статус хворого, наявність супутніх і перенесених захворювань, уточнювали, чи застосовуються лікарські засоби наразі супутньої патології.
В якості контрольної групи для порівняння лабораторних показників обстежено 22 практично здорових осіб віком 22-52 років (11 чоловіків та 11 жінок).
Згідно Гельсінської декларації про права пацієнта, всіх обстежених осіб до початку дослідження в повному обсязі знайомили з метою, методологічними особливостями процедур дослідження, про що вони добровільно і власноручно підписали форму інформованої згоди на участь у цьому дослідженні. Протокол дослідження схвалено локальним етичним комітетом ХМАПО.
Критерії включення пацієнта в дослідження: наявність СД у чоловіків та жінок віком від 20 до 60 років, підписана інформована згода на участь. Критерії виключення пацієнта з дослідження: наявність супутніх захворювань в стадії загострення, хронічних хвороб нирок, печінкової недостатності, синдромів мальабсорбції, злоякісних утворень, психічних захворювань, хронічного алкоголізму, первинного гіперпаратиреозу, підвищена чутливість до ультрафіолетових променів, вагітність, період лактації, прийом препаратів, які порушують метаболізм вітаміну D, праця у нічну зміну. Пацієнти не повинні були лікуватися в останні три місяці протигрибковими засобами, кортикостероїдами, антиконвульсантами, вітамінами. Пацієнти у випадку позитивного тесту на ВІЛ виключалися із дослідження.
Відповідно до поставленої мети і завдань сформовано вибірку хворих на СД відповідно до критеріїв включення і виключення з дослідження. При оцінці ефективності різних схем терапії для забезпечення рівномірності розподілу пацієнтів по групах порівняння використовувався метод рандомізації.
2.1 Методика загального обстеження хворих
Загальноклінічні методи досліджень передбачали з’ясування скарг, анамнезу життя і хвороби пацієнта (вік на початку хвороби, її тривалість, наявність загострень, СД у родичів, супутньої патології тощо), наявність факторів ризику дерматозу (стрес, сезон, сімейний анамнез і т. п.); ретельне об’єктивне обстеження шкіри та слизових оболонок, периферичних лімфатичних вузлів, внутрішніх органів і систем організму (травної, ендокринної, сечостатевої, опорно-рухової); консультації суміжних спеціалістів за показаннями (терапевт, нефролог, гастроентеролог тощо).
В усіх хворих при встановленні діагнозу й наступному спостереженні проводили загальні аналізи крові та сечі, серологічні реакції крові на сифіліс, вивчення показників білкового (вміст загального білка і фракцій) та вуглеводного (вміст глюкози крові) обмінів, функціонального стану печінки – тимолова проба, проба Вельтмана, вміст білірубіну, аспартат- і аланінамінотрансфераз, дослідження калу на дисбактеріоз, яйця і членики гельмінтів. При виявленні змін складу мікрофлори товстого кишечника пацієнти спрямовувалися до гастроентеролога.
Біохімічні показники в динаміці спостереження визначали за уніфікованими методами [25]. Оцінку одержаних лабораторних досліджень проводили згідно Міжнародної системи одиниць.
Антропометричні показники (маса тіла і ріст) визначали за допомогою медичних терезів і ростоміра. У всіх хворих та осіб контрольної групи і групи порівняння визначали ІМТ або індекс Кетле як відношення маси тіла (в кг) до росту в м2 (кг/м2). Відповідно рекомендацій ВООЗ (1998) розроблена наступна інтерпретація показників ІМТ: 16,0 і менше – виражений дефіцит МТ, 16,5-18,4 – недостатня МТ (дефіцит), 18,5-24,9 – нормальна МТ, 25,0-29,9 – надмірна МТ, 30,0-34,9 – ожиріння I ступеня, 35,0-39,9 – ожиріння II ступеня, 40,0 і більше – ожиріння III ступеня. ІМТ, що перевищував 24,9 кг/м2, розцінювали як ознаку надмірної маси тіла, величини ІМТ ≥ 30,0 кг/м2 свідчили про ожиріння.
Для виявлення дріжджоподібних грибків роду Malassezia та виключення мікозу, спричиненого дерматофітами, до початку лікування проводили пряму мікроскопію зішкрябів з осередків лущення на волосистій частині голови та шкірі. Для цього до отриманого матеріалу на предметне скельце додавали 10 % розчин КОН для розчинення кератину і залишків кератиноцитів. Препарат накривали покривним склом, підсушували на слабкому полум’ї пальника і проводили мікроскопію. У 26 чоловіків до лікування при мікроскопічному дослідженні зішкрябів з гладенької шкіри та волосистої частини голови виявлено дріжджоподібні гриби Malassezia у вигляді округлих клітин, зібраних у грона, і коротких вигнутих гіфів міцелію характерної «банановидної» форми.
При первинному огляді хворих встановлювали тяжкість дерматозу за індексом поширеності і тяжкості СД (SDASI – Seborrheic Dermatitis Area Severity Index) [156], а також інтенсивність свербежу шкіри. Розрахунковий показник індексу SDASI визначали шляхом оцінки трьох клінічних симптомів захворювання (еритема, папули, лусочки) за 4-бальною шкалою від 0 до 3 (0 = відсутня; 1 = слабко виражена; 2 = помірна; 3 = сильна) в осередках ураження, розташованих в «себорейних зонах» (голова, обличчя, грудина, спина). Площа осередків СД вимірювалася за 5-бальною шкалою від 1 до 5 (1 = менше 10 %; 2 = 11-30 %; 3 = 31-50 %; 4 = 51-70 %; 5 = більше 70 %). Суму всіх балів приймали за підсумковий показник індексу SDASI. На підставі значень SDASI запропоновано виділяти три ступеня тяжкості СД (легкий = 0-7,9, помірний = 8,0-15,9 і тяжкий > 16). Свербіж оцінювали окремо за наступною градацією: 0 = відсутність; 1 = слабкий; 2 = помірний; 3 = сильний) [143]. Після лікування повторювали визначення SDASI і ступеня свербежу у хворих на СД. Ефективність проведеної терапії оцінювали за відсотковим зменшенням індексу SDASI аналогічно використанню динаміки PASI при псоріазі. Зниження індексу на 75 % і більше в результаті лікування вважається показником досягнення адекватного терапевтичного ефекту.
Для оцінки досягнутого терапевтичного ефекту наприкінці лікування враховували наступні критерії: 1) клінічне видужання – повне розв’язання основних суб’єктивних та об’єктивних ознак СД, SDASI понижувався на 90 % і більше; 2) значне покращення – повне розв’язання проявів СД в більшості висипів, але деякі з елементів повністю не регресували (залишилася незначна еритема, лущення чи інфільтрація), загальна площа ураженої шкіри зменшилася зі 100 до 30 % (більше ніж утричі), тобто регрес більшої частини висипів на 70 %, SDASI понижувався на 75 %; 3) покращення – загальна площа ураження шкіри зменшилася зі 100 до 50 % (майже вдвічі), в осередках ураження зберігалися помірно виражена еритема, лущення, інфільтрація, тобто регрес висипів менш ніж на 50 % (будь-яка позитивна динаміка шкірного процесу), пониження числового значення SDASI порівняно з вихідним на 50 %: 4) відсутність ефекту – істотних змін у стані хвороби не відбулося.
Залежно від застосованого методу терапії хворих на СД поділено на дві групи: 1 група (n=35) лікувалися за розробленим методом, 2 група (n=33) –отримувала традиційну терапію.
2.2 Імунологічне дослідження
Систему вродженого імунітету характеризують показники стану фагоцитозу, тесту відновлення нітросинього тетразолію (НСТ) спонтанного та індукованого та ін. Ці параметри дозволяють оцінити переважно поглинальну і бактерицидну активність фагоцитів, інтенсивність “кисеневого вибуху”, який відбувається всередині фагоцитуючих клітин.
Показники оцінки фагоцитарної активності нейтрофілів: фагоцитарний індекс (ФІ) – відсоток фагоцитів, які поглинули мікроорганізми, від їхньої загальної кількості, фагоцитарне число (ФЧ) – середня кількість мікробів, поглинених одним нейтрофілом крові [35].
Фагоцитарну активність нейтрофілів оцінювали за їх здатністю поглинати бактерії S. aureus (штамм 209). Для цього змішували 1 мл суспензії клітин (107) та 1 мл суспензії бактерій (109) у розчині Хенкса. Суміш інкубували 30 хв при температурі 37° С і постійному помішуванні. По закінченні процедури на склах готували мазки, які фарбували за Романовським-Гімзою. У препаратах підраховували 200 клітин, з них кількість клітин, які фагоцитували (ФІ) і кількість бактерій, які поглинуто однією клітиною (ФЧ).
Для оцінки функціональної активності фагоцитів крові використано НСТ-тест спонтанний (НСТ-тест спонт.) в модифікації Д. М. Маянського [45]. Сутність методу полягає в тому, що НСТ в присутності активних форм кисню, в першу чергу, супероксидного аніона-радикала, фарбується у синій колір внаслідок утворення нерозчинних гранул диформазану, а при їх відсутності залишається безкольоровим. За інтенсивністю утворення в цитоплазмі фагоцитів гранул диформазану при постановці НСТ-тесту можна судити про їх фагоцитарну та метаболічну активність [13]. В середовище інкубації додавали 0,025 мл фосфатного буфера (рН=7,2), 0,025 мл розчину НСТ («Лахема», Чехія) та 0,05 мл гепаринізованої крові, інкубували при температурі 37° С. Далі готували мазки, фіксували в метанолі і фарбували карміном. Результат представляли у відсотках диформазан-позитивних нейтрофілів від загальної кількості підрахованих клітин (500 поліморфноядерних нейтрофілів).
Для визначення функціонального резерву нейтрофілів використовували НСТ-тест індукований (НСТ-тест індук.). В якості індуктора використовували зимозан – полісахаридний комплекс з пекарських дріжджів, з якого готували суспензію у розведенні 50 мкг зимозану в 1 мл розчину Хенкса. По збільшенню показників НСТ-тесту у відповідь на стимуляцію зимозаном in vitro можна судити про резервних можливостях фагоцитів у відповідь на подразнення.
Індукований НСТ-тест проводили так само, як і спонтанний, але в середовище інкубації додатково додавали 0,025 мл суспензії, що містить 10 мкг зимозану. Результат представляли у відсотках диформазан-позитивних нейтрофілів на 100 нейтрофілів [43].
2.3 Імуноферментне дослідження
З метою визначення вітамін D-статусу та рівня LL-37 у 68 хворих на СД (40 чоловіків віком 23-54 років і 28 жінок у віці 25-52 років) досліджували методом імуноферментного аналізу (ІФА) рівень 25-гідроксивітаміну D (25(ОН)D) і кателіцидину у сироватці крові в динаміці спостереження (до і після терапії). Дослідження D-статусу пацієнтів, а також осіб контрольної групи проводилося в однаковий період року для нівелювання сезонних змін рівня кальцидіолу крові.
Забір крові з ліктьової вени в кількості 5 мл здійснювали в ранкові години (8-8.30 год) натще в стерильні пробірки у зимові місяці – з грудня по лютий. Сироватку крові відділяли від формених елементів центрифугуванням протягом 20 хв при 1100-1300 g, аліквотували і зберігали в мікроцентрифужних пробірках об’ємом 1,5 мл при температурі не нижче –20°C до проведення дослідження. Повторні цикли заморожування і відтаювання неприпустимі. Тестування проб проводили протягом 24 год після відтаювання.
Оцінка статусу вітаміну D проводилася шляхом вимірювання вмісту 25(ОН)D (кальцидіол) у сироватці крові (нмоль/л чи нг/мл) за допомогою ІФА «25-ОН-Vitamin-D ELISA» (фірма BioVendor, Чеська республіка). Застосовано «сендвіч»-метод твердофазного ІФА з використанням моноклональних антитіл. Реакцію ставили відповідно рекомендацій виробника.
Вміст 25(ОН)D у пробах з невідомим рівнем визначали за стандартною кривою, при цьому стандарти і зразки повинні аналізуватися одночасно. Межа визначення набору 25-ОН вітамін D складає 5,5 нмоль/л.
У набір включено 8-ямкові стрипи, що розділяються на окремі лунки, з імобілізованими моноклональними антитілами до 25-ОН вітаміну D. На першій реакційній стадії в лунках інкубують досліджувані зразки, розведені з 25-ОН вітаміном D, міченим біотином. Протягом інкубації невідома кількість вітаміну D у зразку пацієнта і відома кількість міченого біотином вітаміну конкурують за сайти зв’язування з імобілізованими антитілами. Непов’язаний 25-ОН вітамін D видаляється промиванням. Для виявлення зв’язаного міченого біотином 25-ОН вітаміну D проводять другу інкубацію, використовуючи стрептавідин, мічений пероксидазою. Зв’язана пероксидаза спричиняє кольорове забарвлення під час третьої реакції з субстратом тетраметилбензидину. Інтенсивність сформованого фарбування обернено пропорційна концентрації 25-ОН вітаміну D у зразку. Результати розраховувалися за допомогою стандартної калібрувальної кривої.
Дефіцит вітаміну D визначається, якщо вміст 25(ОН)D < 20 нг/мл (50 нмоль/л), виражений дефіцит вітаміну D – < 10 нг/мл (< 25 нмоль/л), недостатність – рівень 25(ОН)D 21-30 нг/мл (51-75 нмоль/л), адекватні рівні – понад 30 нг/мл (75 нмоль/л) [18]
Кількісне визначення рівня LL-37 у сироватці крові (нг/мл) проведено за допомогою ІФА (НК321, Human LL-37 ELISA Кit, фірма «Hycult biotech», Нідерланди). Визначення базується на «сендвіч»-методі твердофазного ІФА з використанням моноклональних антитіл до різних епітопів LL-37. Реакцію проводили відповідно до рекомендацій виробника.
Вміст кателіцидину у пробах з невідомим рівнем визначали за стандартною кривою (при цьому стандарти і зразки аналізувалися одночасно). Діапазон кількісного визначення LL-37 складав 0,14 – 100 нг/мл, чутливість методу – 0,14 нг/мл.
Зразки і стандарти вносяться у ячейки мікропланшета, покриті антитілами до LL-37 людини. За час інкубації антитіла, сорбовані в лунках мікропланшета, захоплюють кателіцидин. Присутній у пробі матеріал, що не зв’язався, видаляється під час відмивання. Потім у ячейки вносять кон’юговані з біотином антитіла до LL-37 людини. Якщо у пробі був присутній людський LL-37, то біотинільовані антитіла будуть зв’язуватися з LL-37, захопленим антитілами. Надлишок біотинільованих антитіл видаляють при промиванні. У ячейки вносять кон’югований з пероксидазою хріну стрептавідин (стрептавідин-пероксидаза), який специфічно реагує з біотинільованими антитілами, що пов’язалися з LL-37, захопленими при першій інкубації. Надлишок стрептавідин-пероксидази видаляють промиванням, в лунки вносять субстрат тетраметилбензидин.
Забарвлення розвивається пропорційно кількості кателіцидину, присутньому в пробі. Ферментативну реакцію зупиняють, добавляючи лимонну кислоту. Потім за допомогою спектрофотометра вимірюють абсорбцію при 450 нм.
2.4 Бактеріологічне дослідження
Для оцінки стану мікрофлори кишечника застосовувався стандартний бактеріологічний метод дослідження калу [92]. Матеріал відбирався в стерильний контейнер без транспортного середовища з ложечкою. Доставку до лабораторії здійснювали в максимально короткі строки (не більше 2 год при температурі 20-25°С або не більше 3 год при температурі 2-8°С). Методика оцінки складу фекальної мікрофлори містила визначення видового і кількісного складу мікрофлори. При цьому визначався рівень патогенних ентеробактерій, анаеробних та аеробних бактерій (на кров’яному агарі з цистином), дріжджоподібних грибів (на середовищі Сабуро), умовно-патогенних ентеробактерій (на трьох диференційно-діагностичних середовищах: цитрат, малонат, інозит), а також облігатної флори – біфідобактерій (на середовищі Блаурокка), лактобацил (на середовищі МРС), кишкових паличок (на середовищі Ендо). Ідентифікацію виділених мікроорганізмів проводили з урахуванням морфологічних, тинкторіальних, культуральних і ферментативних властивостей за допомогою «рутинних» методик.
У роботі використовувалася мікробіологічна класифікація дисбіозу кишечника, запропонована І. Б. Куваєвою і К. С. Ладодо [32], згідно якої виділяють чотири ступеня порушень.
2.5 Статистичні методи дослідження
Статистичний аналіз отриманих результатів, їх графічна інтерпретація здійснювалася за допомогою прикладних програм Microsoft Office Excel 2010 і триал-версії STATISTICA 13.3 EN.
На етапі формування бази даних клініко-лабораторних досліджень для виключення грубих помилок вимірів контролювали відсутність викидів в ряду досліджуваних показників за допомогою критерію варіаційного розмаху і критерію Диксона. Оскільки розмір вибірок за окремими групами хворих невеликий та умови нормальності розподілу за більшістю параметрів не виконуються, статистичний аналіз майже всіх показників проводився з використанням методів непараметричної статистики. Нормальність розподілу досліджуваних числових показників визначалась за допомогою критерію Шапіро-Уїлка. З’ясування значущості розбіжностей центральних тенденцій числових показників між двома групами проводилося за допомогою непараметричного критерію Манна-Уїтні [29].
У разі множинних порівнянь (більше, ніж між двома групами) використовувався непараметричний аналог дисперсійного аналізу (ANOVA) – критерій Крускала-Уолліса. Нульова гіпотеза про рівність середніх у групах відхилялась при рівні значимості р < 0,05.
Порівняльний аналіз між групами якісних показників (таких, як локалізація, гострота процесу, ступінь тяжкості) здійснювали за критерієм c2 [29]. Усі порівняння проводилися за довірчої вірогідності р = 95 %, отже у разі отримання обчисленого рівня значущості критеріальної статистики p < 0,05, різниця між групами вважалася значущою.
Кореляційні залежності між числовими показниками оцінювалися коефіцієнтами кореляції Спірмена або Пірсона у відповідності зі шкалою вимірювання змінних, що розглядалися. Значущість зв’язків між якісними (номінальними) показниками перевірялась на основі аналізу таблиць спряженості за допомогою критерію c2. Якість моделей апроксимації оцінювалася за допомогою коефіцієнта детермінації.
Для побудови моделей прогнозування ступеня тяжкості СД застосовано багатомірний регресійний аналіз [29].
РОЗДІЛ 3
КЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ НА СЕБОРЕЙНИЙ ДЕМАТИТ
Під спостереженням протягом чотирьох років перебувало 112 хворих на СД віком 23-54 років, з них 65 чоловіків та 47 жінок. Розподіл хворих за статтю та віком наведено в табл. 3.1.
Таблиця 3.1 – Розподіл хворих на себорейний дерматит за статтю та віком
| Вік,
роки |
Хворі на себорейний дерматит | |||||
| чоловіки | жінки | разом | ||||
| абс. | % | абс. | % | абс. | % | |
| 21-30 | 14 | 12,5 | 17 | 15,2 | 31 | 27,7 |
| 31-40 | 31 | 27,7 | 17 | 15,2 | 48 | 42,9 |
| 41-50 | 16 | 14,3 | 10 | 8,9 | 26 | 23,2 |
| 51-60 | 4 | 3,5 | 3 | 2,7 | 7 | 6,2 |
| Всього | 65 | 58,0 | 47 | 42,0 | 112 | 100,0 |
Серед хворих на СД чоловіків виявилося більше, ніж жінок (відповідно 65 і 47 осіб – 58,0 % і 42,0 %). Майже усі хворі (105 хворих – 93,8 %) перебували у віці 21-50 років, причому найбільша кількість (48 осіб) була на четвертому десятилітті життя, приблизно однакова – на третьому і п’ятому десятиліттях, тобто це була соціально активна, працездатна група населення. У віці 51-60 років СД зареєстровано у 7 (6,2 %) хворих.
Аналіз частоти СД у хворих різного віку за статевими ознаками (рис. 3.1.) виявив значне переважання хворих чоловіків у віці 31-40 років (31 пацієнт – 27,7 %) і 41-50 років (16 хворих – 14,3 %) порівняно з кількістю жінок у цих вікових періодах (відповідно 17 – 15,2 % та 10 – 8,9 %). У віці після 50 років дерматоз діагностовано у 4 (3,5 %) чоловіків та 3 (2,7 %) жінок.
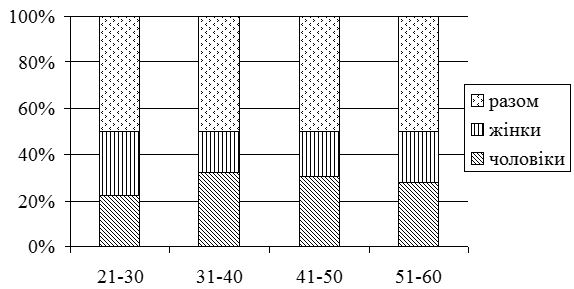
Рисунок 3.1 – Частота себорейного дерматиту у хворих різного віку та статі
Середній вік хворих на СД становив (35,7±2,1) року ([32,6±2,3] року у чоловіків, [39,5±2,4] року у жінок).
За соціальним походженням серед хворих на СД були службовці (48 осіб – 42,9 %), робочі (17 – 15,2 %), студенти (22 – 19,6 %), тимчасово непрацюючі. Останніх більше визначено серед жінок (17 пацієнток – 15,2 %), тоді як серед чоловіків – 8 (7,1 %) осіб.
Вік хворих на момент появи перших ознак дерматозу варіював у широких межах – від 18 до 50 років (табл. 3.2). Найбільшу групу (79 пацієнтів – 70,6 %) склали хворі, у яких перші ознаки СД з’явилися у віці 21-40 років. Найчастіше дебют захворювання припадав на період від 31 до 40 років – у 45 (40,2 %) хворих: у 29 (25,9 %) чоловіків та 16 (14,3 %) жінок. У віці до 20 років дебют дерматозу визначено у 14 (12,4 %) хворих, з однаковою частотою у чоловіків і жінок. У віці старше 40 років СД незначно частіше дебютував у жінок (у 12 – 10,7 %) порівняно з чоловіками (у 7 – 6,3 %). Середній вік початку СД у хворих дорівнював (33,1±1,5) року, у чоловіків хвороба починалася раніше ([31,6±1,7] року), ніж у жінок ([36,8±1,9] року).
Таблиця 3.2 – Вік хворих на себорейний дерматит на початку хвороби
| Вік,
роки |
Хворі на себорейний дерматит | |||||
| чоловіки | жінки | разом | ||||
| абс. | % | абс. | % | абс. | % | |
| до 20 | 7 | 6,2 | 7 | 6,2 | 14 | 12,4 |
| 21-30 | 22 | 19,6 | 12 | 10,8 | 34 | 30,4 |
| 31-40 | 29 | 25,9 | 16 | 14,3 | 45 | 40,2 |
| 41-50 | 7 | 6,3 | 12 | 10,7 | 19 | 17,0 |
| Всього | 65 | 58,0 | 47 | 42,0 | 112 | 100,0 |
СД у родичів хворих І та II ступенів споріднення встановлено в 26 (23,2 %) випадках.
Серед можливих причин дебюту СД, визначених у 59 (52,7 %) хворих, найчастіше вказувався негативний психоемоційний стрес (35 хворих – 31,2 %), перенесені інфекційні захворювання (тонзиліт, гострі респіраторні вірусні інфекції, вітрянка) – у 14 (12,5 %) хворих, застосування шампунів – у 10 (8,9 %). У 53 (47,3 %) пацієнтів імовірну причину виникнення дерматозу визначити не вдалося.
Тривалість захворювання коливалася від декількох місяців до 14 років (табл. 3.3). Найчисельнішу групу склали хворі з тривалістю СД на момент обстеження від 1 до 5 років (53 пацієнта – 47,3 %), серед них переважали чоловіки (31 хворий – 27,7 %). Другу за чисельністю групу склали пацієнти з тривалістю дерматозу до одного року – 25 (22,3 %) осіб, в якій також переважали чоловіки. Хворі з тривалістю патологічного процесу 5-10 років склали достатньо велику групу (20 осіб – 17,9 %), серед них чоловіків – 9,8 %, жінок – 8,1 %. Менш всього було пацієнтів з тривалістю СД більше 10 років – 14 (12,5 %) осіб.
Середня тривалість дерматозу у чоловіків – (5,6±1,6) року, жінок – (4,3±1,1) року.
Таблиця 3.3 – Тривалість захворювання на себорейний дерматит
| Тривалість
хвороби, роки |
Хворі на себорейний дерматит | |||||
| чоловіки | жінки | разом | ||||
| абс. | % | абс. | % | абс. | % | |
| до 1 | 15 | 13,4 | 10 | 8,9 | 25 | 22,3 |
| 1-5 | 31 | 27,7 | 22 | 19,6 | 53 | 47,3 |
| від 5 до 10 | 11 | 9,8 | 9 | 8,1 | 20 | 17,9 |
| більше 10 | 8 | 7,1 | 6 | 5,4 | 14 | 12,5 |
| Всього | 65 | 58,0 | 47 | 42,0 | 112 | 100,0 |
Частота рецидивів менше одного разу на поточний рік (1 раз на декілька років) встановлена у 11 (9,8 %) хворих, один раз на рік у 54 (48,2 %) пацієнтів, декілька разів (двічі, тричі) на рік – у 37 (33,1 %) хворих. Безперервно-рецидивуючий перебіг захворювання спостерігався у 10 (8,9 %) пацієнтів (рис. 3.2).
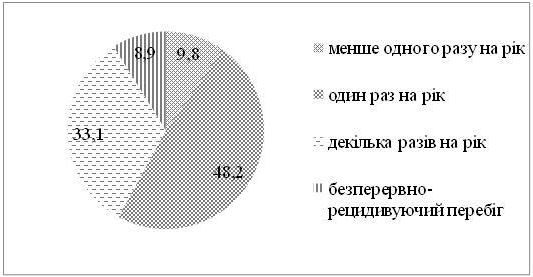
Рисунок 3.2 – Частота загострень себорейного дерматиту (%) протягом року
Тривалість останнього загострення у 28 (25,0 %) пацієнтів склала менше 1 міс., від 1 до 2 міс. – у 66 (58,9 %), майже 3 міс. – у 10 (8,9 %), приблизно 4 міс. – у 3 (2,8 %), 5 міс. і більше – у 5 (4,4 %) хворих.
Серед причин загострення дерматозу 85 (75,9 %) хворих відзначали зміну пори року (частіше взимку і ранньою весною, рідше восени) і кліматичних умов (кондиціонування повітря, підвищена вологість), 24 (21,4 %) – стреси, 20 (17,9 %) – порушення дієти (зловживання жирною, жареною і гострою їжею, алкоголем), 11 (9,8 %) осіб пов’язували із зміною шампуню. Іншими причинами, що провокували рецидиви хвороби, вказано прийом лікарських засобів (циметидин, хлорпромазин) 3 (2,7 %) хворими. У 17 (15,2 %) пацієнтів причину загострення з’ясувати не вдалося (рис. 3.3).
Більшість хворих (98 – 87,5 %) вказували на зникнення висипань чи значне покращення стану шкіри влітку.
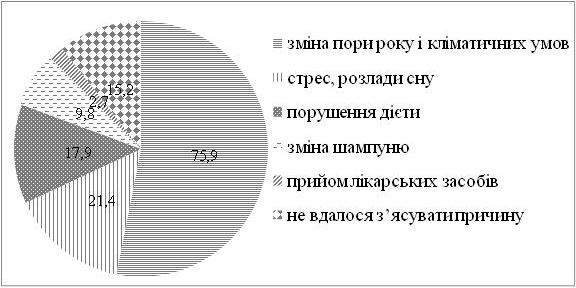
Рисунок 3.3 – Причини загострення себорейного дерматиту
У 26 (23,2 %) пацієнтів до лікування при мікроскопічному дослідженні зішкрябів з гладенької шкіри та волосистої частини голови виявлено гриби Malassezia у вигляді округлих клітин, зібраних у грона, і коротких вигнутих гіфів міцелію характерної «банановидної» форми.
При вивченні анамнезу приділяли увагу харчовому режиму – вживанню жирної морської риби: лосось, оселедець, сом, сардини, тунець та ін., молока і молочних продуктів, яловичої печінки тощо. Визначено, що морську рибу їли часто (три-чотири рази на тиждень) 14 (12,5 %) пацієнтів, рідко (один чи два рази на тиждень) 32 (28,6 %) хворих, молоко і молочні продукти – відповідно 27 (24,1 %) і 39 (34,8 %) хворих.
Влітку носили закритий одяг 42 (37,5 %) хворих, відпочивали щороку та засмагали 27 (24,1 %) пацієнтів, з них 10 (8,9 %) регулярно використовували сонцезахисні креми на обличчя і тулуб. Солярії хворі не відвідували.
Звертали увагу на фототип шкіри пацієнтів з СД. Фототип I визначено у 15 (13,4 %) хворих (8 чоловіків і 7 жінок), фототип II – у 91 (81,3 %) пацієнта (54 чоловіків і 37 жінок), фототип III – у 6 (5,3 %) хворих (3 чоловіків і 3 жінок).
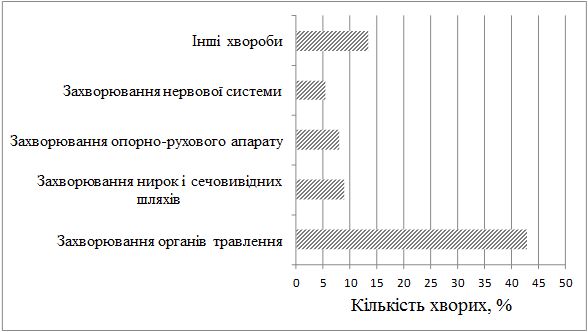
Рисунок 3.4 – Супутні захворювання у пацієнтів з себорейним дерматитом
Супутні захворювання були численні і встановлені за консультацією суміжних спеціалістів у 76 (67,9 %) хворих на СД. Найчастіше зустрічалися захворювання органів травлення – у 48 (42,9 %), нирок і сечовивідних шляхів – у 10 (8,9 %), опорно-рухового апарату – у 9 (8,0 %), нервової системи – 6 (5,4 %). Інші хвороби (ендокринної, дихальної, серцево-судинної, ЛОР-органів, шкіри) визначено у 15 (13,4 %) хворих (рис. 3.4). З боку інших систем визначено наступні: у 7 хворих – захворювання ЛОР-органів (хронічний гайморит у трьох, хронічний отит у двох), 3 хворих – серцево-судинної системи (аритмія у одного, ішемічна хвороба серця у одного, пролапс мітрального клапану у одного), 3 пацієнтів – дихальної системи (хронічний бронхіт у двох, бронхіальна астма у одного), 3 хворих – ендокринної системи (цукровий діабет у одного, аутоімунний тиреоїдит у двох), 6 хворих – шкіри (маласезіоз шкіри у чотирьох, акне у двох).
Таблиця 3.4 – Супутня патологія у хворих на себорейний дерматит
| Захворювання
органів та систем |
Хворі на себорейний дерматит | |||||
| чоловіки | жінки | разом | ||||
| абс. | % | абс. | % | абс. | % | |
| Захворювання ШКТ та гепатобілі-
арної системи |
28 | 25,0 | 20 | 17,8 | 48 | 42,9 |
| Захворювання нирок і сечовиділь-
ної системи |
6 | 5,3 | 4 | 3,6 | 10 | 8,9 |
| Захворювання опорно-рухового
апарату |
5 | 4,5 | 4 | 3,6 | 9 | 8,1 |
| Захворювання нервової системи | 3 | 2,7 | 3 | 2,7 | 6 | 5,4 |
| Захворювання шкіри | 4 | 4,5 | 2 | 2,7 | 6 | 5,4 |
| Захворювання ЛОР-органів | 2 | 1,8 | 3 | 2,7 | 5 | 4,5 |
| Захворювання серцево-судинної
системи |
1 | 0,9 | 2 | 1,8 | 3 | 2,7 |
| Захворювання дихальної системи | 1 | 0,9 | 2 | 1,8 | 3 | 2,7 |
| Захворювання ендокринної
системи |
1 | 0,9 | 2 | 1,8 | 3 | 2,7 |
У деяких хворих (24 осіб) зареєстровано два та більше супутніх захворювання. З них у 15 пацієнтів поєднувалися хронічна виразка 12-палої кишки і хронічний пієлонефрит, хронічний холецистит і хронічний гастрит, хронічний гастрит і дискінезія жовчовивідних шляхів, хронічний холецистит і хронічний гастрит, хронічний гастрит і хронічний панкреатит. У 5 пацієнтів встановлено хвороби ШКТ і ЛОР-органів (хронічний гастрит з хронічним гайморитом, хронічний гастрит з хронічним отитом) і у 4 хворих – ураження сечостатевої системи сумісно із хворобами опорно-рухового апарату (хронічний простатит чи хронічний пієлонефрит з остеохондрозом хребта). У дослідженні приймали участь пацієнти з супутніми хворобами у стадії клінічної ремісії.
На слабкість у проксимальних м’язах, дифузні болі у м’язах і тимчасове порушення рівноваги скаржилися 3 хворих, однак при обстеженні у суміжних спеціалістів патології не визначено.
Клінічні прояви дисбактеріозу – дискомфорт або несильні ниючі, тупі регулярні болі у животі встановлено у 12, метеоризм – у 7 пацієнтів, помірні порушення випорожнення у вигляді послаблення у 6 або закрепу у 10, їх чергування у 44 хворих.
У минулому хворі неодноразово лікувалися в амбулаторних чи стаціонарних умовах. Стійкий позитивний ефект попередньої терапії визначено у 17 (15,2 %) хворих, короткочасний – у 84 (75,0 %) хворих, безперервно рецидивуючий перебіг – у 11 (9,8 %) хворих, з них у 8 (7,1 %) – рефрактерність до традиційної терапії.
ІМТ у хворих на СД склав (25,30±0,82) кг/м2: у чоловіків – (25,11±0,85) кг/м2, жінок – (26,14±0,78) кг/м2. ІМТ у здорових осіб (24,2±1,1 кг/м2) достовірно не відрізнявся від такого у хворих на СД. Недостатню вагу мали 4 (3,6 %) хворих, нормальну – 75 (67,0 %) пацієнтів, надмірну вагу – 28 (25,0 %) хворих, ожиріння I ступеня – 3 (2,7 %), II ступеня – 2 (1,8 %) хворих. Серед хворих чоловіків надмірну вагу визначено у 17 пацієнтів, ожиріння I ступеня – у 2 хворих, ожиріння II ступеня – у 2 пацієнтів. Жінки з СД мали надмірну вагу в 11 випадках, ожиріння I ступеня – в одному випадку.
Діагноз СД в кожному випадку ми встановлювали на підставі скарг пацієнта, даних анамнезу захворювання (давність хвороби, тригерні фактори, кількість рецидивів, методи терапії, які застосовувалися раніше, їх ефективність) і клінічного огляду (локалізація висипів, наявність чи відсутність свербежу, лущення, еритеми, інфільтрації, папул, розчухів).
В обстежених 112 дорослих хворих на СД різноманіття клінічних проявів пов’язано з локалізацією висипів (волосиста частина голови, обличчя, тулуб та кінцівки), поширеністю шкірного процесу і характером ефлоресценцій. Шкіра обличчя у 37 хворих була потовщена, мала жирний блиск, прояви себостазу. Клінічна картина СД в цілому характеризувалася сквамозними, еритематозно-сквамозними осередками з поверхневою інфільтрацією чи без такої, частіше нечіткими межами, слабким або помірним свербежем. Лусочки у більшості випадків жирні, жовтуваті, легко відлущувалися. Характерні епізоди еритеми, коли шкіра в осередках ураження раптом червоніла. В фазі загострення нерідко з’являлися кірко-лусочки, посилювалися інфільтрація та свербіж. Рідше визначалися дрібні папульозні елементи на шкірі тулуба. СД схильний до поступового повільно прогресуючого і рецидивуючого перебігу, у частини хворих – резистентний до лікування, яке проводилося. Розрішення (регрес) висипів відбувалося з центру бляшок, в стадії регресу осередки в деяких випадках ставали кільцеподібними або набували химерні обриси.
Захворювання починалось, як правило, з появи осередків лущення (у 16 хворих) чи невеликих блідо-рожевих, рожевих або червоних осередків з сухими білими чи жовтими лусочками (у 18 пацієнтів) на шкірі волосистої частини голови. Потім осередки поширювалися у 29 хворих на інші ділянки шкірного покриву – завушну область, обличчя (у 14 хворих), міжлопаткову ділянку, зону грудини, пахвову і пахову ділянки (у 15 хворих), де мали вигляд еритематозно-сквамозних осередків до 2-3 см у діаметрі, покритих сухими білими чи жирними жовтуватими лусочками. У 21 хворого подібні висипи з’являлися тільки на обличчі, у 28 хворих – в зоні грудини, між лопатками, у великих складках (пахвова і пахова, під молочними залозами).
Ураження шкіри різних зон первинної локалізації у хворих на СД наведено в табл. 3.5.
Таблиця 3.5 – Розподіл хворих на себорейний дерматит у залежності від первинної локалізації процесу
| Локалізація
висипів |
Хворі на себорейний дерматит | |||||
| чоловіки | жінки | разом | ||||
| абс. | % | абс. | % | абс. | % | |
| Волосиста частина голови | 16 | 14,3 | 7 | 6,3 | 23 | 20,5 |
| Обличчя | 11 | 9,8 | 10 | 8,9 | 21 | 18,7 |
| Волосиста частина голови та
обличчя |
21 | 18,7 | 19 | 17,0 | 40 | 35,7 |
| Грудина, міжлопаткова зона | 11 | 9,8 | 3 | 2,7 | 14 | 12,5 |
| Верхні кінцівки | 2 | 1,8 | 3 | 2,7 | 5 | 4,5 |
| Нижні кінцівки | 2 | 1,8 | 2 | 1,8 | 4 | 3,6 |
| Інші частини
(великі складки) |
2 | 1,8 | 3 | 2,7 | 5 | 4,5 |
| Всього | 65 | 58,0 | 47 | 42,0 | 112 | 100,0 |
У дорослих хворих висипи розташовувалися на місцях, багатих сальними залозами. Найчастіше патологічний процес локалізувався на волосистій частині голови та обличчі (35,7 %), майже з однаковою частотою – тільки на волосистій частині голови (20,5 %) або обличчі (18,7 %), рідше – в зоні грудини (12,5 %), між лопатками, у невеликої кількості – на кінцівках та у великих складках тулуба (3,6-4,5 %). На свербіж скаржилося 35 хворих, переважно з локалізацією процесу на волосистій частині голови, на випадіння волосся – 15 хворих, особливо з тривалістю СД понад 5 років. Відзначали відчуття жару і стягування шкіри 22 пацієнти, переважно з осередками на шкірі.
На момент огляду волосиста частина була уражена у 83 (74,1 %) пацієнтів (частіше у чоловіків), обличчя – у 91 (81,2 %) хворих (частіше у жінок), тулуб – у 39 (34,8 %) хворих (частіше у чоловіків).
На волосистій частині голови у 12 пацієнтів процес був представлений лущенням (від легкої десквамації у вигляді дрібних муковидних білих лусочок до щільних численних сірувато-білих крупнопластинчастих лусочок, покриваючих різну площу шкіри голови) без гострозапальних явищ («суха себорея»). Усі хворі при наявності лупи (легка форма СД) скаржилися на свербіж шкіри різної інтенсивності. Більш тяжкі прояви СД на волосистій частині голови у 22 хворих характеризувалися еритематозними плямами і бляшками, покритими муковидними або сальними жовтими лусочками, а в окремих випадках лусочко-кірками і геморагічними кірочками, які нерідко були прикріплені до стрижня волосся (pseudo tinea amiantacea). Процес переходив у 29 пацієнтів з волосистої частини голови на шкіру лоба («себорейна корона»), уражалися ретроаурикулярні складки, шкіра обличчя, зовнішніх слухових проходів, з’являвся свербіж (запальний СД). Ізольоване ураження волосистої частини голови визначене майже вдвічі частіше у чоловіків, ніж у жінок. При залученні у процес шкіри волосистої частини голови у 15 хворих спостерігалося витончення і порідіння волосся.
У більшості хворих СД на обличчі починався в центральній зоні (назолабіальні зони), уражав брови, вії, лоб, рідше бороду і вуси, проявлявся еритематозними плямами, бляшками з нечіткими межами і лущенням на поверхні, у 14 пацієнтів супроводжувався свербежем, відчуттям жару і стягування шкіри. В процес у 6 хворих залучалися повіки, при цьому клінічна картина нагадувала розацеа очей. У таких випадках СД поєднувався з блефаритом і кон’юнктивітом, оклюзією мейбомієвих залоз, у 5 пацієнтів – із зовнішнім отитом. У 6 чоловіків в області бороди розташовувалися осередки СД.
Майже у третини хворих СД обличчя поєднувався з ураженням скальпа.
Осередки дерматозу у 28 хворих на тулубі представлені еритематозно-сквамозними висипами різного розміру (5-20 мм) з нечіткими межами, покритими жовтуватими сальними (рідше – сухими) лусочками. Дрібні або крупні лусочки легко відділяються від поверхні висипань. В окремих випадках виникають інфільтровані бляшки овальної форми («медальйони»), що зливаються між собою.
Подібні висипання на шкірі тулуба (грудини і міжлопаткової області – класичний варіант СД тулуба) визначені у 13 хворих. У 4 пацієнтів плями і бляшки мають периферичний ріст, лущення відзначається лише у центрі елементів. Це так званий пітиріазиформний варіант СД, який нагадує розовий лишай. У 7 пацієнтів висипи екзематизувалися, незначна інфільтрація надавала схожість з себорейним псоріазом. У двох хворих виявлено фолікулярний варіант СД, при якому на фоні гіперемії розташовувалися численні фолікулярні папули, що зливалися в бляшки, при цьому процес імітував фолікулярний дискератоз Дар’є. У двох пацієнтів дерматоз локалізувався в пахвинних, пахових складках, під молочними залозами, в аногенітальній зоні, біля пупка, був представлений ділянками гіперемії з вологою поверхнею, чіткими межами і липкими кірками на поверхні.
У разі приєднання вторинної інфекції у 3 хворих на поверхні осередків з’являлися тріщини і мокнуття.
Еритема осередків різної інтенсивності (блідо-рожева, рожева, червона) визначена у 79 хворих, в середньому склала (2,26±0,17) бала. Папульозні висипи (окремі чи бляшки) визначено у 41 хворого, в середньому склали (1,54±0,10) бали. Лущення різного ступеня (від незначного дрібнопластинчастого до крупнопластинчастого) виявлене у всіх хворих: у 25 хворих було незначним, у 59 – помірним і у 28 пацієнтів – сильним, в середньому склало (2,02±0,15) бала.
Свербіж волосистої частини голови був відсутній у 6 хворих, у 31 пацієнта коливався від незначного до сильного (тобто від 1 до 3 балів).
Залежність інтенсивності свербежу шкіри від тяжкості дерматозу наведено в табл. 3.6.
Таблиця 3.6 – Залежність інтенсивності свербежу від ступеня тяжкості себорейного дерматиту
| Ступінь тяжкості
дерматозу |
Інтенсивність свербежу, бали | |||||||
| 1 | 2 | 3 | разом | |||||
| абс | % | абс | % | абс | % | абс | % | |
| Легкий
Помірний Тяжкий Всього |
5
2 – 7 |
16,1
6,4 – 22,6 |
3
8 1 12 |
9,7
25,8 3,2 38,7 |
–
4 8 12 |
–
12,9 25,8 38,7 |
8
14 9 31 |
25,8
45,2 29,0 100,0 |
У пацієнтів з легким ступенем тяжкості СД у більшості випадків визначено свербіж інтенсивністю (0,75±0,11) бала, з середньотяжким перебігом – (1,81±0,32) бала, з тяжким ступенем дерматозу – (2,50±0,47) бала. В середньому інтенсивність свербежу у хворих на СД була помірною ([1,92±0,39] бала).
Единої класифікації СД не існує. Залежно класифікації Burton J. L. [113] у дорослих хворих виділяли наступні клінічні форми з урахуванням локалізації з найсильнішою інтенсивністю процесу: СД волосистої частини голови у 34 (30,4 %) хворих: лупа – у 12, запальний – у 22; СД обличчя у 50 (44,6 %) хворих, СД тулуба у 28 (25,0 %) хворих: класичний – у 13, екзематизований – у 7, складок – 2, пітиріазиформний – у 4, фолікулярний – у 2 хворих. Генералізований СД (еритродермія) у хворих не встановлено.
Залежно від переважної локалізації СД нами виділено наступні форми: СД волосистої частини голови – у 23 (20,5 %), СД волосистої частини голови і обличчя – у 40 (35,7 %), СД обличчя – у 21 (18,8 %), СД тулуба – у 28 (25,0 %) хворих.
Залежно від характеру клінічних проявів виділяли СД незапальний у 23 (20,5 %) хворих (чоловіків і жінок) і СД запальний у 89 (79,5 %) хворих (чоловіків і жінок).
Залежно від перебігу виділяли СД типовий (у 85 випадках) і нетиповий (у 27 хворих). При типовій формі еритематозно-сквамозні осередки розташовувалися на волосистій частині шкіри голови, обличчі, шиї, в завушних та інщих складках, а також на грудині і спині. Загострення дерматозу супроводжувалося мокнуттям, серозно-геморагічними кірками, сильним свербежем. Атипові форми: рожево-жовті, із слабким лущенням, чітко окреслені, нерідко поодинокі осередки, розташовані на шкірі обличчя, тулуба, кінцівок та інших ділянках гладенької шкіри. В таких випадках СД диференціювали з псоріазом, атопічним і контактним дерматитом, дерматофітіями, імпетиго, фолікулярним кератозом, різнокольоровим лишаєм (маласезіозом), дискоїдним червоним вовчаком, розацеа, сифілісом.
Згідно робочої класифікації Баконіної Н. В. [4] з урахуванням інтенсивності і поширеності висипань виділяють наступні ступені тяжкості СД: легкий – ізольовані, обмежені ураження (осередки) до 5 % площі чи лупа; середньотяжкий (помірний) – не більше 5 осередків з площею ураження від 5 до 15 % чи ураженням волосистої частини голови за типом асбестовидного лишая; тяжкий – багатоосередкове ураження з площею понад 15 %. Використовуючи наведену класифікацію, нами визначено ступінь тяжкості СД: легкий – у 39 (34,8 %), помірний – у 54 (48,2 %), тяжкий – у 19 (17,0 %) хворих.
У чоловіків і жінок за SDASI встановлено легкий ([5,4±0,8] бала) і помірний ([12,1±1,5] бала) ступінь тяжкості СД майже з однаковою частотою – відповідно у 36,9 % і 31,9 %, 49,2 % і 46,8 % випадків, тяжкий ([17,5±1,8] бала) – частіше у жінок (21,3 %), ніж у чоловіків (13,9 %). В середньому у хворих SDASI склав (11,1±1,3) бала.
Збільшення площі ураження, посилення еритеми, нашарування лусочко-кірок, інтенсивності свербежу, поява відчуття жару, мокнуття є проявами активної фази СД. Незначна еритема, лущення і свербіж, відсутність суб’єктивних відчуттів можуть розцінюватися як неактивна фаза дерматозу. Відповідно цього, дерматоз перебував в активній фазі у 73 хворих, неактивній – 39 у хворих.
Клінічне обстеження 36 хворих з недостатністю вітаміну визначило СД легкого і помірного ступеня тяжкості (відповідно у 14 і 22 хворих), незапальні прояви дерматозу у 24 пацієнтів, залучення у процес тільки волосистої частини голови (18 хворий) чи обличчя (12 пацієнтів), рідше тулуба (6), гриби роду Malassezia у лусочках і зішкрябах шкіри (у 6 хворих) порівняно з клінічними проявами у 21 пацієнта з дефіцитом вітаміну D, при яких визначено помірний і тяжкий ступінь тяжкості (відповідно у 6 і 15 хворих), запальні прояви у 20 випадків, ураження декількох зон – обличчя і волосиста частина голови, тулуб у всіх пацієнтів, гриби роду Malassezia у зішкрябах шкіри волосистої частини голови у 12 хворих.
Середні значення індексу SDASI у групі пацієнтів з недостатністю вітаміну D склали (10,5±1,7) бала, дефіцитом – (15,4±2,2) бала (p < 0,05).
Дослідження периферичної крові показали, що вміст еритроцитів у хворих на СД перебував у межах норми ([4,4±0,2]х1012/л). Рівень гемоглобіну та кольоровий показник також у межах норми ([125,5±1,1] г/л і [0,9-1,0] од.). Вміст тромбоцитів у хворих на СД становив (250±15)х109/л, лейкоцитів – (5,2±0,4)х109/л. Рівень моноцитів в усіх пацієнтів був у допустимих межах (3-11 %), ШОЕ мала тенденцію до підвищення ([17,6±2,4] мм/год) у 12 (10,7 %) хворих. Рівень глюкози крові натщесерце коливався в межах 4,4-6,3 ммоль/л, в середньому (5,5±0,8) ммоль/л.
Клінічне спостереження № 1.
Хвора К., 30 років, звернулася до ШВД у лютому зі скаргами на висипи на волосистій частині голови, обличчі і грудях, що супроводжувалися свербежем. Загострення шкірного процесу помітила після порушення дієти (зловживання жирної та смаженої їжі). Супутні захворювання: хронічний бронхіт. Сімейний анамнез: не обтяжений. Шкідливі звички: не палить, алкоголем не зловживає.
Діагноз: себорейний дерматит, типова форма, запальний тип, середньотяжкий ступінь тяжкості, SDASI – 10 балів.
Anamnesis vitae: росла та розвивалася відповідно віку, часто хворіла ГРВІ. Натепер працює менеджером, заміжня, має здорову дитину. Anamnesis morbi: Хворіє майже 5 років. Спочатку висипи локалізувалися тільки на волосистій частині голови, потім поширились на шкіру обличчя, груди. До лікаря не зверталася. Самостійно лікувалася протисеборейними шампунями і стероїдними кремами з тимчасовим позитивним ефектом. Нинішнє загострення протягом 2 тижнів.
Status localis: висипи запального характеру локалізуються на волосистій частині голови, обличчі, області грудей. Сип мономорфний, представлений еритематозно-сквамозними осередками, на волосистій частині голови внаслідок вираженого свербежу є геморагічні кірочки (рис. 3.5).
Шкіра за межами осередків блідо-рожевого кольору. Волосся жирне, проба на випадіння волосся негативна. Нігті не змінені. Лімфатичні вузли не збільшені.
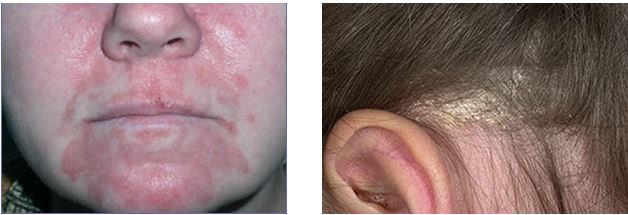
Рисунок 3.5 – Хвора на себорейний дерматит
У клінічному і біохімічному аналізі крові змін не виявлено. В імунологічному аналізі крові: 25(OH)D – 61 нмоль/л, LL-37 – 18 нг/мл, ФІ – 41 %, ФЧ – 2,7 ум. од., НСТ-тест спонт. – 28 %, НСТ-тест індук. – 48 %. При мікроскопічному дослідженні лусочок з уражених ділянок шкіри міцелій грибів не знайдено, при дослідженні мікрофлори кишечника всі показники в межах нормальних значень.
Хворій проведене комплексне лікування (левоцетиризин 1 таблетка на добу протягом 14 днів, Нейровітан 1 капсула на добу протягом 21 дня, холекальциферол (Аквадетрим Вітамін D3) по 2000 МО 1 раз на день протягом 6 тижнів, місцево – DS-емульсія, лосьон Содерм, шампунь з циклопіроксом). На фоні проведеної терапії відзначався регрес висипів на 17-19-й дні, причому свербіж не турбував уже наприкінці 2 тижня.
По закінченні терапії досягнута клінічна ремісія. Імунологічні показники: 25(OH)D – 83 нмоль/л, LL-37 – 25 нг/мл, ФІ – 58 %, ФЧ – 3,7 ум. од., НСТ-тест спонт. – 23 %, НСТ-тест індук. – 55 %. Після проведеної терапії пацієнтка знаходилася під спостереженням протягом 12 місяців. Через 7 міс. (у листопаді) відзначено рецидив дерматозу.
Клінічне спостереження № 2.
Пацієнт М., 42 років, у грудні звернувся на кафедру дерматовенерології ХМАПО зі скаргами на висипання на волосистій частині голови, обличчі, тулубі. Суб’єктивно турбує свербіж. Алергологічний анамнез: не обтяжений. Супутні захворювання: хронічний гастрит, дискінезія жовчовивідних шляхів. Загострення шкірного процесу пов’язує із сильним стресом. Сімейний анамнез: батько у віці старше 30 років страждав СД. Шкідливі звички: палить по півпачки за день, алкоголем не зловживає.
Діагноз: себорейний дерматит, типова форма, запальний тип, середньотяжкий ступінь тяжкості, SDASI –13 балів.
Anamnesis vitae: ріс та розвивався відповідно віку, в соціально забезпеченій сім’ї. В дитинстві хворів вітряною віспою, часто – ГРВІ. В теперішній час не працює, одружений, має здорову дитину. Anamnesis morbi: хворіє протягом 10 років, самостійно лікувався протисеборейними косметичними засобами (шампунь Нізорал). До дерматолога звертався у 2015 році, встановлено діагноз «себорейний дерматит». Застосовував антигістамінні препарати, вітаміни, кортикостероїдні креми і протисеборейні шампуні із тимчасовим позитивним ефектом. Теперішнє загострення протягом 1 місяця розвинулось після стресової ситуації.
Status localis: висипи запального характеру локалізуються на волосистій частині голови, обличчі, спині, у великих складках. Сип мономорфний, представлений еритематозно-сквамозними рожево-жовтого кольору осередками неправильної форми діаметром приблизно 2-4 см, з чіткими межами. На волосистій частині голови багато кірко-лусочок сірувато-жовтого кольору на еритематозному фоні (рис. 3.6). Волосся і нігті не змінені. Лімфатичні вузли не збільшені.
В клінічному і біохімічному аналізі крові змін не виявлено, за виключенням збільшеного вмісту лужної фосфатази – 57 Од/л (норма 10-49 Од/л). В імунологічному аналізі крові 25(OH)D – 29 нмоль/л, LL-37 – 16 нг/мл, ФІ – 34 % , ФЧ – 2,5 ум. од., НСТ-тест спонт. – 34 %, НСТ-тест індук. – 39 %. При мікроскопічному дослідженні лусочок з уражених ділянок шкіри міцелій патогенних грибів не знайдено, при дослідженні мікрофлори кишечника встановлено дисбіоз II ступеня.
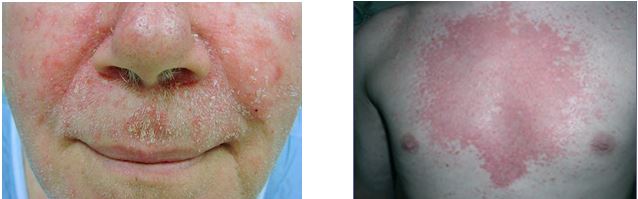
Рисунок 3.6 – Хворий на себорейний дерматит
Пацієнту проведене комплексне лікування (левоцетиризин 1 таблетка на добу протягом 14 днів, Кардонат 1 капсула тричі на добу протягом 21 дня, холекальциферол (Аквадетрим Вітамін D3) по 3500 МО 1 раз на добу протягом 8 тижнів з переходом на 1500 МО 1 раз на добу протягом 4 тижнів, синбіотик ДермаПро по 1 капсулі на день протягом 21 дня, місцево – лосьон Локоїд, лосьон Біфоназол, крем Псорікап, шампунь з піритіонатом цинку). На фоні проведеної терапії інтенсивність свербежу зменшилася через 7 днів, відзначався регрес висипів на 19-21 дні.
По закінченні терапії досягнута клінічна ремісія. Імунологічні показники: 25(OH)D – 76 нмоль/л, LL-37 – 22 нг/мл, ФІ – 56 %, ФЧ – 3,6 ум. од., НСТ-тест спонт. – 27 %, НСТ-тест індук. – 55 %. Після проведеної терапії пацієнт знаходився під спостереженням протягом 12 місяців. За даний період часу рецидивів СД не відзначено.
Резюме. Серед хворих на СД чоловіків в 1,4 рази більше, ніж жінок. Найчастіше (40,2 % випадків) дебют захворювання визначено у період 31-40 років. Серед причин загострення дерматозу 75,9 % пацієнтів відзначали зміну пори року, 21,4 % – стреси. Більшість хворих (87,5 %) вказували на зникнення висипань чи значне покращення стану шкіри влітку. Недостатньо вживали продукти, багаті вітаміном D, 63,4 % хворих. Влітку носили закритий одяг 37,5 % хворих, відпочивали щороку та засмагали 24,1 % пацієнтів. Найчастіше зустрічалися захворювання органів травлення (42,9 %), клінічні прояви дисбактеріозу виявлено у 65,4 % хворих. Надмірну вагу та ожиріння I і II ступеня мали відповідно 25,0 і 4,5 % хворих.
Встановлено різноманітні клінічні прояви СД, обумовлені локалізацією і характером висипів поширеністю шкірного процесу. При недостатності вітаміну D у хворих переважав СД помірного ступеня тяжкості (61,1 %), незапальні прояви (66,7 %) та залучення у процес волосистої частини голови або обличчя (83,3 %), рідше визначення Malassezia spp. на шкірі (16,7 %) порівняно з клінічними проявами у хворих з дефіцитом вітаміну D, при цьому визначено у більшості випадків тяжкий ступінь тяжкості (71,4 %), запальні прояви (95,2 %), ураження декількох зон (100,0 %), гриби роду Malassezia на шкірі (57,1 %). Середнє значення SDASI у групі пацієнтів з дефіцитом вітаміну D достовірно (в 1,5 рази) перевищувало показник у хворих з недостатністю вітаміну D.
Наведені у розділі положення відображено у наступних публікаціях:
1. Нарожная М. В. Влияние витамина D на течение себорейного дерматита. Наук.-практ. конф. молодих вчених, присвячена 25-річчю НАМН України, 23 березня 2018 р. Журнал НАМН України. Спеціальний випуск, 2018. Київ, 2018. С. 62 [56].
2. Нарожная М. В. Клинические особенности себорейного дерматита с учетом статуса витамина D. Святогірські дерматовенерологічні дні: новітні методи діагностики і лікування в дерматовенерології та косметології : матеріали Всеукр. конф. за участю міжнар. спеціалістів, 25-26 травня 2017 р. Святогір’я, 2017. Журн. дерматовенерології та косметології імені М. О. Торсуєва. 2017. № 1 (37). С. 73 [57].
РОЗДІЛ 4
СТАТУС ВІТАМІНУ D У ХВОРИХ НА СЕБОРЕЙНИЙ ДЕРМАТИТ
За останнє десятиліття накопичено переконливі дані про участь вітаміну D у багатьох біологічних процесах – регуляція мінерального обміну, імунітет та запалення, модуляція клітинного росту, нервово-м’язева проводимість, при цьому його дефіцит має негативні наслідки для організму і полягяє в основі ряду патологічних станів і захворювань, в тому числі й шкіри. Протизапальна та імуномодулююча дія і, відповідно, деякі антимікробні ефекти вітаміну D опосередковуються регуляцією функції антигенпрезентуючих клітин, модуляцією проліферації Т-лімфоцитів, продукції цитокінів, АМП і / або контролю експресії їх рецепторів та ін.
Основним об’єктивним індикатором статусу вітаміну D організму визнана транспортна форма цього вітаміну – 25(ОН)D (25-гідрокси-холекальциферол). Дослідження статусу вітаміну D при СД практично не проводилося, не визначено його взаємозв’язок із факторами вродженого імунітету, розвитком дисбіозу кишечника.
Рівень 25-гідроксивітаміну D у сироватці крові хворих на СД коливався від 27 до 124 нмоль/л, у осіб контрольної групи – від 37 до 142 нмоль/л. Результати дослідження вмісту кальцидіолу в групах обстеження наведено в табл. 4.1.
Таблиця 4.1 – Вміст 25(OH)D у хворих на себорейний дерматит (M±m)
| Групи обстеження | 25(OH)D, нмоль/л | р |
| Хворі на себорейний дерматит,
n = 68 |
52,44±3,27 | < 0,01 |
| Контрольна група, n = 22 | 100,59±7,72 | – |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи.
Визначення рівня 25(OH)D у сироватці крові хворих виявило суттєве його пониження ([52,44±3,27] нмоль/л) порівняно з показником у практично здорових осіб ([100,59±7,72] нмоль/л, р < 0,01).
Аналіз кількісних змін гідроксивітаміну D при СД дозволив виявити нормальний вміст 25(OH)D (більше 75 нмоль/л) у 5 хворих ([107,0±6,34] нмоль/л), недостатність вітаміну D (у межах 51-74 нмоль/л) – у 42 пацієнтів ([62,51±4,73] нмоль/л) і дефіцит вітаміну D (менше 50 нмоль/л) у 21 ([27,91±2,34] нмоль/л). Рівень менше 25 нмоль/л (тяжкий дефіцит вітаміну D) у хворих не визначався. У контрольній групі, незважаючи на нормальний середньостатистичний рівень кальцидіолу, також визначено відхилення показника. Нормальний вміст гідроксивітаміну D встановлено у 14 осіб ([124,5±6,2] нмоль/л), недостатність – у 6 осіб ([65,3±3,5] нмоль/л) і дефіцит – у 2 осіб ([39,0±3,1] нмоль/л). Випадків тяжкого дефіциту вітаміну D у практично здорових осіб не виявлено (рис. 4.1).
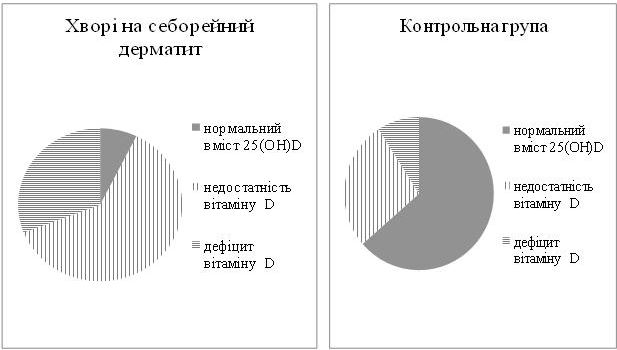
Рисунок 4.1 – Статус вітаміну D у хворих на СД та осіб контрольної групи
Залежності рівня 25(OH)D від статі хворих та осіб контрольної групи не виявлено (р > 0,05), однак тенденція до пониження значення показника спостерігалася у хворих пацієнток на відміну від жінок контрольної групи, у хворих чоловіків, навпаки, незначно збільшувався рівень кальцидіолу (табл. 4.2).
Таблиця 4.2 – Вміст 25(OH)D у крові хворих на себорейний дерматит залежно від статі (M±m)
| Групи обстеження, стать | 25(OH)D, нмоль/л | р |
| Хворі на себорейний дерматит:
чоловіки, n = 38 жінки, n = 30 |
55,10±3,55
51,34±4,16 |
> 0,05
> 0,05 |
| Контрольна група:
чоловіки, n = 11 жінки, n = 11 |
94,32±10,22
107,84±11,63 |
> 0,05
> 0,05 |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи відповідної статі.
У зв’язку з даними літератури про залежність статусу вітаміну D від віку осіб, проведено аналіз вмісту 25(ОН)D у різних вікових групах (табл. 4.3).
Визначена чітка залежність рівня кальцидіолу крові від віку як хворих, так і осіб контрольної групи. Значення показника поступово понижувалися з віком і достовірно відрізнялися від такого у практично здорових осіб в усіх вікових періодах (21-30, 31-40, 41-50 і 51-60 років). Звертає увагу суттєве пониження рівня 25(ОН)D у хворих після 40 років (відповідно [43,34±3,57] нмоль/л і [35,32±2,84] нмоль/л), що відповідало дефіциту вітаміну D в організмі людини.
Таблиця 4.3 – Вміст 25(OH)D у крові хворих на себорейний дерматит залежно від віку (M±m)
| Групи обстеження, роки | 25(OH)D, нмоль/л | р |
| Хворі на себорейний дерматит:
21-30 , n = 18 31-40, n = 26 41-50, n = 17 51-60, n = 7 |
67,78±4,33
53,93±4,86 43,34±3,57 35,32±2,84 |
–
– – – |
| Контрольна група:
21-30 років, n = 6 31-40, n = 6 41-50, n = 5 51-60, n = 5 |
132,21±7,92
118,50±5,05 90,23±13,78 51,60±5,64 |
˂ 0,01
˂ 0,01 ˂ 0,05 < 0,05 |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи відповідного віку.
Результати визначення рівня гідроксивітаміну D у хворих з урахуванням наявності чи відсутності запалення в осередках на обличчі, тулубі чи волосистій частині голови, типу і локалізації проявів СД та практично здорових осіб наведено в табл. 4.4.
У пацієнтів, що мали запальні прояви дерматозу (свербіж, еритема, мокнуття), вміст транспортної форми вітаміну D в сироватці крові значно понижувався та достовірно відрізнявся не тільки від показника у практично здорових осіб (р < 0,01), а й у хворих з незапальними проявами дерматозу в основному у вигляді мілко- та крупнопластинчастого лущення на волосистій частині голови (за критерієм Манна-Уїтні, р < 0,05). При типових і атипових проявах СД визначено достовірне пониження рівня 25-гідроксихолекальциферолу в крові порівняно з таким у осіб контрольної групи (р < 0,01), але між хворими з різним перебігом дерматозу показники не відрізнялися (р > 0,05). Майже однаково понижувався вміст 25(ОН)D у крові пацієнтів з СД в зоні волосистої частини голови чи обличчя (р < 0,05), більш значимо – при залученні одночасно волосистої частини голови та обличчя (р < 0,01). У хворих з локалізацією СД на тулубі та складках, переважно з тяжким і тривалим перебігом хвороби, вміст кальцидіолу у крові значно поменшувався порівняно з таким у осіб контрольної групи (р < 0,01), а також у хворих з ураженням тільки волосистої частини голови чи обличчя (р < 0,05).
Таблиця 4.4 – Вміст 25(OH)D у крові хворих залежно від типу, проявів і локалізації себорейного дерматиту (M±m)
| Групи обстеження | 25(OH)D, нмоль/л | р |
| Хворі на себорейний дерматит:
тип – запальний, n = 48 незапальний, n = 20 прояви – типові, n = 55 нетипові, n = 13 локалізація – волосиста частина, n = 14 волосиста частина і обличчя, n = 25 обличчя, n = 12 тулуб, n = 17 |
44,17±2,09
74,20±5,19х 53,18±4,75 49,31±4,12 74,53±5,94 47,41±3,66 62,08±5,23 36,55±2,62х |
< 0,01 < 0,05 < 0,01 < 0,01 < 0,05 < 0,01 < 0,05 < 0,01 |
| Контрольна група, n = 22 | 100,59±7,72 | – |
Примітки: р – рівень достовірності відмінностей показника між хворими та особами контрольної групи; х – достовірність відмінностей показника між хворими залежно від типу і локалізації дерматозу при р < 0,05.
Дослідження вмісту гідроксивітаміну D у пацієнтів з різним ступенем тяжкості хвороби (табл. 4.5) виявило їх односпрямовані порушення, при цьому максимальне зменшення рівня визначено при тяжкому ступені СД. Між значеннями показника у хворих з тяжким і легким ступенем тяжкості визначено достовірну відмінність (р < 0,05) за критерієм Краскела-Уоліса.
Таблиця 4.5 – Вміст 25(OH)D у крові хворих залежно від ступеня тяжкості себорейного дерматиту (M±m)
| Групи обстеження | 25(OH)D, нмоль/л | р |
| Хворі на себорейний дерматит,
ступінь тяжкості: легкий, n = 21 помірний, n =28 тяжкий, n = 19 |
75,19±4,40
49,29±2,85 33,61±1,50х |
< 0,05 < 0,01 < 0,01 |
| Контрольна група, n = 22 | 100,59±7,72 | – |
Примітки: р – рівень достовірності відмінностей показника між хворими та особами контрольної групи; х – достовірність відмінностей показника між хворими залежно від тяжкості процесу при р < 0,05.
Зміни вмісту кальцидіолу у хворих з різною тривалістю та частотою рецидивів СД наведено в табл. 4.6.
Таблиця 4.6 – Вміст 25(OH)D у крові хворих залежно від тривалості себорейного дерматиту (M±m)
| Групи обстеження | 25(OH)D, нмоль/л | р |
| Хворі на себорейний дерматит:
тривалість (роки) – до 5, n = 34 від 5 до 10, n = 23 понад 10 років, n = 11 рецидиви (кількість на рік) – один, n = 19 два, n = 34 більше двох, n = 15 |
55,61±3,58
53,79±5,32 42,80±5,12 53,71±3,92 59,45±4,07 34,60±1,61х |
< 0,01 < 0,01 < 0,01 < 0,01 < 0,01 < 0,01 |
| Контрольна група, n = 22 | 100,59±7,72 | – |
Примітки: р – рівень достовірності відмінностей показника між хворими та особами контрольної групи; х – достовірність відмінностей показника між хворими залежно від частоти рецидивів дерматозу при р < 0,05.
З подовженням терміну хвороби у крові всіх пацієнтів достовірно понижувався рівень 25(ОН)D відносно аналогічного показника у осіб контрольної групи. Не виявлено достовірних відмінностей між вмістом гідроксивітаміну D у хворих, які мали СД до 5 років та від 5 до 10 років (р > 0,05). При тривалості дерматозу понад 10 років рівень 25-гідроксихолекальциферолу різко зменшувався, однак достовірно не відрізнявся від такого у решти хворих. Встановлено, що рівень кальцидіолу у хворих понижувався більш виражено зі збільшенням частоти рецидивів СД. У пацієнтів з частотою загострень дерматозу більше двох разів на рік (безперервно-рецидивуючий перебіг) визначено найнижчий рівень гідроксивітаміну D, який достовірно відрізнявся від показника у хворих з рецидивами один чи двічі на рік (р ˂ 0,05).
Кореляційний аналіз з визначенням коефіцієнта кореляції установив кореляційні зв’язки у хворих на СД між 25(OH)D та клінічними проявами (негативного – r 25(OH)D–SDASI = – 0,69, r 25(OH)D–вік хворих = – 0,44, r 25(OH)D–частота рецидивів = – 0,51, р < 0,05).
Резюме. Дослідження рівня 25(OH)D у хворих на СД визначило його суттєве зменшення (в 1,9 рази) порівняно з показником контрольної групи. Нормальний вміст 25(OH)D виявлено у 7,3 % хворих, недостатність вітаміну D – у 61,8 % і дефіцит вітаміну D у 30,9 % пацієнтів (у контрольній групі відповідно – 63,6, 27,3 і 9,1 % осіб) (р ˂ 0,01).
Рівень кальцидіолу поступово понижувався з віком, особливо суттєво після 40 років. У пацієнтів із запальними проявамии дерматозу вміст 25-гідроксивітаміну D понижувався в 2,3 рази, тоді як у хворих з незапальними проявами дерматозу – тільки в 1,4 рази. Звертає увагу різке пониження 25(ОН)D у крові хворих з СД тулуба (в 2,8 рази) порівняно із зменшенням показника при СД тільки обличчя (1,6 рази), волосистої частини (в 1,3 рази), волосистої частини та обличчя (в 2,1 рази). Зменшення рівня кальцидіолу майже втричі визначено при тяжкому ступені з багатоосередковим ураженням шкіри понад 15 % поверхні, що майже дорівнювало такому при тяжкому дефіциті вітаміну D
Ступінь пониження вмісту 25(ОН)D не залежав від тривалості дерматозу, однак виявився пов’язаним з частотою рецидивів. При рецидивах дерматозу більше двох разів на рік вміст кальцидіолу понижувався в 1,55 рази у хворих порівняно з показником у пацієнтів з рецидивами один раз на рік.
Наведені у розділі положення відображено у публікаціях:
1. Болотна Л. А., Нарожна М. В. Статус вітаміну D у хворих на себорейний дерматит Медицина сьогодні і завтра. 2017. № 2 (75). С. 78-83 [8].
2. Нарожная М. В. Обоснование применения витамина D в лечении себорейного дерматита. Дерматовенерология. Косметология. 2017. Т. 3. № 3. С. 292-299 [60].
3. Bolotnaya L. A., Narozhnaya М. Vitamin D levels in patients with seborrheic dermatitis : abstract 13th Spring Symposium of European Academy of Dermatology and Venereology, 19-22 May 2016. Athens, 2016. Abstract code P0532 [110].
РОЗДІЛ 5
ФАКТОРИ ВРОДЖЕНОГО ІМУНІТЕТУ У ХВОРИХ
НА СЕБОРЕЙНИЙ ДЕРМАТИТ
Імунодефіцит є важливим моментом у патогенезі СД, враховуючи колонізацію дріжджоподібними грибами M. furfur, яка проявляється на будь-якому етапі захворювання – від початку адгезивних взаємодій грибів з епітелієм до розвитку запального процесу в шкірі. Першу лінію захисту організму від широкого спектра бактерій, грибів та вірусів забезпечують АМП – кателіцидини, дефензини, лактоферин та ін. Кателіцидини утворюються не тільки в нейтрофілах, епітелії слизових оболонок, а й кератиноцитах при взаємодії 1,25(ОН)2D з вітамін-D-рецепторами на багатьох клітинах імунної системи. Крім того, LL-37 функціонує як хемотаксичний агент для нейтрофілів, моноцитів і Т-клітин, сприяє ангіогенезу і васкуляризації, проліферації кератиноцитів.
Фагоцити є одними з основних компонентів імунної системи. Ці клітини є первинною ланкою в реакції організму на надходження антигену. В основі функціональної здібності фагоцитів полягяють процеси розпізнавання і поглинання, а також знешкодження і розщеплення чужорідних клітин.
Результати останніх досліджень вказують на можливу роль порушень експресії та рівня АМП, дефектів фагоцитарної ланки імунітету у патогенезі хронічних запальних дерматозів, однак роботи з комплексного вивчення гуморальних і клітинних факторів вродженого імунітету у хворих при СД відсутні.
5.1 Рівень кателіцидину у хворих на себорейний дерматит
Визначення кателіцидину у сироватці крові хворих виявило достовірне пониження вмісту ([20,19±2,07] нг/мл) порівняно з аналогічним показником у практично здорових осіб ([32,51±3,04] нг/мл, р < 0,05) (табл. 5.1), при цьому рівень АМП коливався від 8,31 до 34,20 нг/мл у хворих та від 25,17 до 41,04 нг/мл у осіб контрольної групи.
Таблиця 5.1 – Вміст кателіцидину у крові хворих на себорейний дерматит (M±m)
| Групи обстеження | LL-37, нг/мл | р |
| Хворі, n = 68 | 20,19±2,07 | < 0,05 |
| Контрольна група, n = 22 | 32,51±3,04 | – |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи.
Дослідження рівня кателіцидину у чоловіків та жінок, хворих на СД (табл. 5.2), не виявило достовірних відмінностей показника між пацієнтами, однак більш виражено вміст LL-37 зменшувався у жінок з дерматозом порівняно із особами жіночої статі групи контролю.
Таблиця 5.2 – Вміст кателіцидину у крові хворих на себорейний дерматит
залежно від статі (M±m)
| Групи обстеження, стать | LL-37, нг/мл | р |
| Хворі на себорейний дерматит:
чоловіки, n = 38 жінки, n = 30 |
20,73±1,94
19,51±2,01 |
< 0,05 < 0,01 |
| Контрольна група:
чоловіки, n = 11 жінки, n = 11 |
29,64±2,40
35,37±2,93 |
–
– |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи відповідної статі.
Дослідження вмісту LL-37 у сироватці крові хворих на СД різного віку (табл. 5.3) показало тенденцію до пониження значення показника одночасно із збільшенням віку пацієнтів, при цьому у практично здорових осіб такі зміни не встановлені і рівень кателіцидину майже не змінювався. У хворих віком 41-50 і 51-60 років вміст кателіцидину зменшувався більш виражено відносно такого у пацієнтів молодшого віку.
Таблиця 5.3 – Вміст кателіцидину у крові хворих на себорейний дерматит залежно від віку (M±m)
| Групи обстеження, роки | LL-37, нг/мл | р |
| Хворі на себорейний дерматит:
21-30 , n = 18 31-40, n = 26 41-50, n = 17 51-60, n = 7 |
24,78±2,55
20,55±2,03 16,46±1,68 16,13±1,85 |
–
– – – |
| Контрольна група:
21-30, n = 6 31-40, n = 6 41-50, n = 5 51-60, n = 5 |
32,53±2,32
32,92±2,17 32,31±2,43 32,17±2,82 |
< 0,05 < 0,01 < 0,01 < 0,01 |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи відповідного віку.
Результати дослідження рівня LL-37 у крові хворих з різними типами, проявами і локалізацією дерматозу наведена у табл. 5.4. Звертає увагу факт суттєвого зменшення рівня кателіцидину у хворих із запальним типом СД, який понижувався майже вдвічі ([17,94±1,56] нг/мл) відносно значення в контрольній групі (р ˂ 0,01), і достовірно не відрізнявся від аналогічного у пацієнтів із незапальним типом дерматозу ([25,60±1,92] нг/мл). При типових і нетипових клінічних проявах СД рівень LL-37 у сироватці крові хворих виявився пониженим порівняно з таким у осіб контрольної групи (р ˂ 0,05), однак між значеннями у хворих з різними типами хвороби різниці не визначено. Найнижчий рівень досліджуваного показника визначено при розташуванні хвороби на тулубі ([16,35±1,59] нг/мл), волосистій частині голови і обличчі ([18,53±1,62] нг/мл) (< 0,01). При ізольованому ураженні СД обличчя чи волосистої частини голови вміст LL-37 в крові також понижувався і достовірно відрізнявся від аналогічного параметра у осіб контрольної групи (р < 0,05).
Таблиця 5.4 – Вміст кателіцидину у крові хворих залежно від типу, проявів і локалізації себорейного дерматиту (M±m)
| Групи обстеження | LL-37, нг/мл | р |
| Хворі на себорейний дерматит:
тип – запальний, n = 48 незапальний, n = 20 клінічні прояви – типові, n = 55 нетипові, n = 13 локалізація – волосиста частина, n = 14 волосиста частина і обличчя, n = 25 обличчя, n = 12 тулуб, n = 17 |
17,94±1,56
25,60±1,92 20,79±1,41 17,63±1,35 25,11±2,08 18,53±1,62 23,42±1,86 16,35±1,59 |
< 0,01 < 0,05 < 0,05 < 0,01 < 0,05 < 0,01 < 0,05 < 0,01 |
| Контрольна група, n = 22 | 32,51±3,04 | – |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи.
Динаміка кателіцидину у хворих на СД урахуванням ступеня тяжкості дерматозу наведена в табл. 5.5. Потяжчання перебігу дерматозу супроводжувалося поступовим суттєвим зменшенням вмісту кателіцидину залежно від ступеня тяжкості дерматозу Найменший вміст LL-37 встановлено у хворих з тяжким СД ([12,61±1,36] нг/мл), найвищий – у пацієнтів з легким ступенем хвороби ([27,33±2,19] нг/мл). Звертає увагу достовірна відмінність вмісту АМП у хворих з легким і тяжким ступенем захворювання за критерієм Краскела-Уоліса (р < 0,05).
Таблиця 5.5 – Вміст кателіцидину у крові хворих залежно від ступеня тяжкості себорейного дерматиту (M±m)
| Групи обстеження | LL-37, нг/мл | р |
| Хворі на себорейний дерматит,
ступінь тяжкості: легкий, n = 21 помірний, n =28 тяжкий, n = 19 |
27,33±2,19
19,97±1,45 12,61±1,36х |
< 0,05 < 0,01 < 0,01 |
| Контрольна група, n = 22 | 32,51±3,04 | – |
Примітки: р – рівень достовірності відмінностей показника між хворими та особами контрольної групи; х – достовірність відмінностей показниками між хворими залежно тяжкості процесу при р < 0,05.
Результати дослідження вмісту кателіцидину з урахуванням тривалості і частота рецидивів дерматозу наведено в табл. 5.6. У хворих з різною тривалістю СД (до 5, від 5 до 10, більше 10 років) рівень LL-37 залишався пониженим відносно такого у осіб контрольної групи і не залежав від терміну хвороби. При цьому найнижчий рівень кателдицидину встановлено у хворих з терміном хвороби понад 10 років ([18,89±1,54] нг/мл). Аналіз рівня LL-37 виявив суттєве зменшення значення показника у хворих із загостреннями СД частіше двох разів на рік ([12,46±1,27] нг/мл) порівняно з аналогічним при рецидивах один чи двічі на рік (р < 0,05).
Кореляційний аналіз з визначенням коефіцієнта кореляції установив існування кореляційного зв’язку у хворих на СД між LL-37 та іншими показниками (позитивного – r LL-37-25(0H)D = 0,57, р < 0,05; негативного – r LL-37–SDASI = – 0,87, р < 0,05).
Таблиця 5.6 – Вміст кателіцидину у крові хворих залежно від тривалості і частоти рецидивів себорейного дерматиту (M±m)
| Групи обстеження | LL-37, нг/мл | р |
| Хворі на себорейний дерматит:
тривалість (роки) – до 5, n = 34 від 5 до 10, n = 23 понад 10, n = 11 рецидиви (кількість на рік) – один, n = 46 два, n = 13 більше двох, n = 9 |
20,55±1,66
20,27±1,87 18,89±1,54 20,18±2,05 23,12±1,98 12,46±1,27 |
< 0,01 < 0,01 < 0,01 < 0,05 < 0,05 < 0,01 |
| Контрольна група, n = 22 | 32,51±3,04 | – |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи.
Резюме. Проведене дослідження рівня кателіцидину у сироватці крові хворих на СД визначило зменшення в 1,6 рази порівняно з показником контрольної групи. Кількісний рівень пониження LL-37 не залежав від статі та віку хворих, клінічних проявів і тривалості дерматозу, однак виявився пов’язаним зі ступенем тяжкості захворювання. При запальному типі дерматозу вміст LL-37 у хворих зменшувався в 1,43 рази відносно такого при незапальному СД та в 1,81 рази порівняно з вмістом у практично здорових осіб. Вміст АМП зменшувався в 2,58 рази при тяжкому перебігу захворювання порівняно з таким у здорових осіб та достовірно відрізнявся від показника у хворих з легким і помірним ступенем тяжкості СД. Значно понижувався вміст кателіцидину при локалізації на волосистій частині голови та обличчі, тулубі (відповідно в 1,75 і 1,99 рази) відносно аналогічного в контрольній групі. При рецидивах дерматозу більше двох разів на рік рівень LL-37 у хворих зменшувався в 1,86 рази порівняно з показником у пацієнтів з рецидивами двічі раз на рік.
5.2 Фагоцитарна і функціональна активність нейтрофілів у хворих на себорейний дерматит
Вивчення фагоцитарної ланки імунітету виявило у 36 пацієнтів з СД пониження поглинальної і бактерицидної здібності нейтрофілів периферичної крові порівняно із здоровими особами (табл. 5.7). Встановлено достовірне пониження відсотка фагоцитуючих нейтрофілів і пониження середньої кількості мікроорганізмів, поглинених одним нейтрофілом (р ˂ 0,01), зміни кисень-залежної системи цитотоксичності – помірне збільшення показника спонтанного і пониження індукованого НСТ-тесту (р ˂ 0,05).
Таблиця 5.7 – Показники фагоцитарної та функціональної активності нейтрофілів у хворих на себорейний дерматит (M±m)
| Показник,
од. виміру |
Хворі,
n=44 |
Контрольна група, n=22 | р |
| ФІ, %
ФЧ, ум. од. НСТ-тест спонт., % НСТ-тест інд., % |
37,3±1,1
2,75±0,13 29,4±1,9 43,9±1,7 |
62,3±1,9
3,81±0,25 21,8±1,5 58,4±1,7 |
< 0,01 < 0,01 < 0,05 < 0,05 |
Примітка. р – рівень достовірності відмінностей показника між хворими та особами контрольної групи.
Аналіз змін лабораторних показників у хворих чоловіків та жінок різного віку (21-30, 31-40, 41-50 і 51-60 років) та осіб контрольної групи відповідної статі і віку виявив зміни, характерні для пацієнтів в цілому. У хворих чоловіків не визначено змін рівня ФІ ([35,1±1,6] %), ФЧ ([2,72±0,14] ум. од.), НСТ-тесту спонт. ([29,1±0,8] %) та НСТ-тесту інд. ([41,8±1,1] %) порівняно з жінками (відповідно [35,8±1,9] %, [2,69±0,15] ум. од., [28,20±0,79] % і [40,8±1,1] %). З віком і у хворих, і у здорових осіб встановлена тенденція до пониження значень усіх параметрів фагоцитарної ланки.
Результати дослідження фагоцитарної активності нейтрофілів у хворих з урахуванням типу висипів дерматозу наведено в табл. 5.8. При запальних проявах СД рівень ФІ та ФЧ понижувалися порівняно з показниками в контрольній групі та при незапальних висипах дерматозу за критерієм Манна-Уїтні (р ˂ 0,05). Зміни НСТ-тесту спонтанного у хворих також були односпрямовані – достовірно збільшувалися у хворих з незапальним типом відносно таких у контрольній групі та пацієнтів із запальними проявами хвороби (р ˂ 0,05). Значення ТНС-тесту індукованого у хворих із запальними проявами дерматозу, навпаки, достовірно понижувалося відносно значення у практично здорових осіб иа хворих з незапальним типом СД (p < 0,05)
Таблиця 5.8 – Показники фагоцитарної та функціональної активності нейтрофілів у хворих залежно від типу себорейного дерматиту (M±m)
| Показник,
од. виміру |
Хворі, тип | Контрольна
група, n =22 |
|
| запальний, n=21 | незапальний, n=13 | ||
| ФІ, %
ФЧ, ум. од. НСТ-тест спонт., % НСТ-тест інд., % |
31,75±1,34*
2,61±0,13* 27,1±1,6 38,90±0,77*х |
44,17±1,49*х
2,94±0,11*х 32,7±1,9* 47,30±1,31х |
62,3±1,9
3,81±0,25 21,8±1,5 58,4±1,7 |
Примітки: * – відмінності достовірні щодо контрольної групи при р < 0,05; х – відмінності достовірні між хворими залежно від типу дерматозу при p < 0,05).
У пацієнтів незалежно від проявів СД (табл. 5.9) значення ФІ та ФЧ достовірно понижувалися, НСТ-тесту спонтанного підвищувалися, НСТ-тесту індукованого знижувалися порівняно з контрольною групою (р < 0,05), однак між собою показники достовірно не відрізнялися (р > 0,05).
Таблиця 5.9 – Показники фагоцитарної та функціональної активності нейтрофілів у хворих залежно від клінічних проявів себорейного дерматиту (M±m)
| Показник,
од. виміру |
Хворі, клінічні прояви | Контрольна
група, n=22 |
|
| типові,
n=34 |
нетипові,
n=10 |
||
| ФІ, %
ФЧ, ум. од. НСТ-тест спонт., % НСТ тест інд., % |
37,40±1,46*
2,74±0,14* 29,3±1,8* 44,2±0,9* |
36,93±1,38*
2,82±0,15* 29,8±1,9* 43,2±1,3* |
62,32±1,89
3,81±0,25 21,8±1,5 58,4±1,7 |
Примітка. * – відмінності достовірні щодо контрольної групи при р < 0,05.
Фагоцитарна активність нейтрофілів у хворих з різною локалізацією процесу наведена в табл. 5.10.
Таблиця 5.10 – Показники фагоцитарної та функціональної активності нейтрофілів у хворих залежно від локалізації себорейного дерматиту (M±m)
| Показник,
од. виміру |
Хворі, локалізація | Контроль-
на група, n = 22 |
|||
| волосиста частина,
n = 10 |
волосиста частина і обличчя,
n = 13 |
обличчя,
n = 10 |
тулуб,
n = 12 |
||
| ФІ, %
ФЧ, ум. од. НСТ-тест спонт., % НСТ-тест інд., % |
43,1±1,6*
2,97±0,14* 32,4±1,9* 47,4±1,7 |
33,4±2,4**
2,63±0,15** 27,0±1,7 39,2±1,2** |
41,2±1,2*
2,84±0,15* 32,3±1,8* 44,9±1,5* |
27,8±1,7**
2,51±0,14** 25,7±1,6 37,0±0,8** |
62,3±1,9
3,81±0,25 21,8±1,5 58,4±1,7 |
Примітки: * – відмінності достовірні щодо контрольної групи при р < 0,05;
** – відмінності достовірні щодо контрольної групи при р < 0,01.
Поглинальна функція нейтрофілів у хворих з різною локалізацією процесу понижувалася порівняно з показниками у практично здорових осіб і не залежала від локалізації патологічного процесу. Мінімальні значення ФІ та ФЧ встановлено при локалізації процесу на тулубі, достовірні відмінностей не визначено. Найнижче значення НСТ-тесту спонтанного та індукованого визначено при локалізації СД на тулубі, волосистій частині голови і обличчі, майже однакові – при СД скальпа та обличчя. Достовірних відмінностей між параметрів з урахуванням локалізації дерматозу не встановлено.
Динаміка показників активності нейтрофілів виявилася пов’язаною з тяжкістю перебігу СД (табл. 5.11).
Таблиця 5.11 – Показники фагоцитарної та функціональної активності нейтрофілів у хворих залежно від ступеня тяжкості себорейного дерматиту (M±m)
| Показник,
од. виміру |
Хворі, ступінь тяжкості | Контроль-
на група, n = 22 |
||
| легкий,
n = 19 |
помірний,
n = 15 |
тяжкий,
n = 10 |
||
| ФІ, %
ФЧ, ум. од. НСТ-тест спонт.., % НСТ-тест інд., % |
44,6±1,2*
2,97±0,13* 33,7±1,7* 48,4±1,2* |
36,6±1,4**
2,70±0,14** 28,0±1,6* 40,3±0,7* |
23,4±1,2**х
2,43±0,12** 24,4±1,5х 35,2±0,7**х |
62,3±1,9
3,81±0,25 21,8±1,5 58,4±1,7 |
Примітки: * – відмінності достовірні щодо контрольної групи при р < 0,05; ** – відмінності достовірні щодо контрольної групи при р < 0,01; х – відмінності достовірні між хворими з легким і тяжким ступенем при р < 0,05.
Звертає увагу факт суттєвого пониження значення ФІ, НСТ-тестів у хворих з тяжким СД порівняно з аналогічними параметрами при легкому ступені тяжкості (р ˂ 0,05). Значення показників у хворих з помірним ступенем тяжкості займало проміжне місце між змінами у пацієнтів з тяжким і легким ступенем. У пацієнтів з тяжким перебігом рівень НСТ-тесту спонт. не відрізнявся від такого в контрольній групі (р > 0,05), НСТ-тесту інд. – значно понижувався (р ˂ 0,01).
Дослідження активності фагоцитів у хворих з різною тривалістю дерматозу (табл. 5.12) не встановило залежності від терміну хвороби – майже однакове пониження ФІ визначено у пацієнтів, що хворіють до 5, від 5 до 10 років, значення ФЧ виявилося найбільшим при існуванні дерматозу до 5 років. Більш значимо понижувалося значення НСТ-тесту інд. у пацієнтів з терміном хвороби понад 10 років порівняно з таким при давності дерматозу до 10 років (р ˂ 0,05).
Таблиця 5.12 – Показники фагоцитарної та функціональної активності нейтрофілів у хворих залежно від тривалості себорейного дерматиту (M±m)
| Показник,
од. виміру |
Хворі, тривалість, роки | Контроль-
на група, n = 22 |
||
| до 5,
n = 21 |
від 5 до 10,
n = 14 |
понад 10,
n = 9 |
||
| ФІ, %
ФЧ, ум. од. НСТ-тест спонт., % НСТ-тест інд., % |
35,9±1,6**
2,76±0,14** 29,4±1,8* 41,9±1,1* |
36,1±2,5*
2,69±0,15** 28,8±1,5* 41,9±1,5* |
32,1±2,9*
2,59±0,18* 26,5±1,4 38,5±1,7** |
62,3±1,9
3,81±0,25 21,8±1,5 58,4±1,7 |
Примітки: * – відмінності достовірні щодо контрольної групи при р < 0,05;
** – відмінності достовірні щодо контрольної групи при р < 0,01.
Результати вивчення активності фагоцитів у хворих з рецидивами СД наведено в табл. 5.13. Показники активності нейтрофілів різко понижувалися хворих з рецидивами більше двох разів на рік, при цьому залишалися майже на одному рівні при загостренні один та двічі на рік.
Кореляційний аналіз з визначенням установив кореляційну залежність у хворих на СД між активністю нейтрофілів та іншими показниками (позитивного – r ФЧ-25(0H)D = 0,53, р < 0,05, r ФЧ-LL-37 = 0,45, r ФІ-LL-37 = 0,47; негативного – r ФЧ–SDASI = – 0,733, r ФІ–SDASI = – 0,729, r НСТ спонт.–SDASI = – 0,727, r НСТ інд.–SDASI = – 0,72, р < 0,05).
Таблиця 5.13 – Показники фагоцитарної та функціональної активності нейтрофілів у хворих залежно від частоти рецидивів себорейного дерматиту (M±m)
| Показник,
од. виміру |
Хворі, кількість рецидивів | Контрольна група,
n = 22 |
||
| один,
n = 14 |
два,
n = 21 |
більше
двох, n = 9 |
||
| ФІ, %
ФЧ, ум. од. НСТ-тест спонт., % НСТ-тест інд., % |
38,4±1,9*
2,76±0,15** 29,9±1,5* 41,6±1,3* |
38,3±1,6*
2,79±0,14** 29,9±1,7* 43,4±1,1* |
24,2±1,6**х
2,45±0,13** 24,1±1,6 33,7±0,7**х |
62,3±1,9
3,81±0,25 21,8±1,5 58,4±1,7 |
Примітки: * – відмінності достовірні щодо контрольної групи при р < 0,05; ** – відмінності достовірні щодо контрольної групи при р < 0,01; х – відмінності достовірні між хворими з рецидивами один, два та більше двох на рік при р < 0,05.
Резюме. Фагоцитарна дисфункція визначена у 81,8 % хворих на СД проти 9,1 % осіб контрольної групи. Аналіз фагоцитарної активності нейтрофілів у хворих на СД визначив зменшення ФІ в 1,7 рази, ФЧ в 1,4 рази, НСТ-тесту інд. в 1,3 рази і збільшення НСТ-тесту спонт. в 1,4 рази порівняно з показником контрольної групи. Кількісний рівень змін фагоцитарної активності нейтрофілів не залежав від статі та віку хворих, клінічних проявів (локалізація, тривалість) дерматозу, однак деякі показники виявилися пов’язаними з типом, ступенем тяжкості і частотою рецидивів. При легкому ступені тяжкості ФІ зменшувався в 1,4 рази, при тяжкому – в 2,7 рази (р ˂ 0,05), ФЧ – відповідно в 1,3 і 1,6 рази. Зміни кисеньзалежної системи цитотоксичності також пов’язані з тяжкістю перебігу СД. При легкому ступені НСТ-тест спонт. підвищувався в 1,6 рази, при тяжкому – лише в 1,12 рази, НСТ-тест інд., навпаки, при легкому ступені понижувався незначно (в 1,2 рази), при тяжкому ступені – в 1,7 рази. При частому рецидивуванні (двічі та більше) суттєво зменшувався ФІ (в 2,6 рази) порівняно з таким при рецидивах один раз на рік (в 1,6 рази.
Наведені у розділі положення відображено у публікаціях:
1. Болотная Л. А., Нарожная М. В. Роль кателицидина LL-37 при себорейном дерматите. Дерматологія та венерологія. 2018. № 1 (79). С. 16-20 [9].
2. Нарожна М. В. Показники системного імунітету та біоценозу кишечника у хворих на себорейний дерматит. Новітні тенденції лікування та профілактики дерматовенерологічних проблем у рамках доказової медицини : матеріали наук.-практ. конф., 15 квітня 2016 р. Львів, 2016. Укр. журн. дерматол., венерол., косметол. 2016. № 1 (60). С. 106 [52].
3. Нарожна М. В. Фагоцитарна активність нейтрофілів периферичної крові при себорейному дерматиті. Новини і перспективи медичної науки : зб. наук. робіт XV наук. конф. студентів та молодих учених, 15-17 квітня 2015 р. Дніпропетровськ, 2015. С. 36 [53].
4. Нарожна М. В. Фактори вродженого імунітету у хворих на себорейний дерматит. Сучасні методи діагностики та лікування коморбідної патології в дерматовенерологічній практиці на принципах доказової медицини : матеріали наук.-практ. конф. з міжнар. участю, 01-02 червня 2017 р. Чернівці, 2017. С. 91-92 [54].
5. Нарожная М. В. Антимикробные пептиды при себорейном дерматите. Дерматовенерологія в розробках молодих науковців : матеріали наук.-практ. школи, 16-17 листопада 2017 р., м. Київ, 2017. Клінічна імунологія. Алергологія. Інфектологія. 2017. № 6 (103). С. 51 [55].
6. Нарожная М. В. Уровень кателицидина у больных себорейным дерматитом. Медицина XXI століття : матеріали наук.-практ. конф. молодих вчених з міжнар. участю, 24 листопада 2016 р. Харків, 2016. С. 69-70 [63].
