РОЗДІЛ 8
ХАРАКТЕР ПОШИРЕННЯ ІНФЕКЦІЙ, ЩО ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ, ПРИ УЧАСТІ НАРКОЗАЛЕЖНИХ
ОСІБ – АНАЛІЗ СЕКСУАЛЬНИХ МЕРЕЖ
При вивченні сексуальних мереж було проведено обстеження 172 пацієнтів, які назвали 246 статевих партнерів, з них 82 були названі двома і більше досліджуваними (враховувалися статеві зв’язки за період до одного року). Разом пацієнти та їх статеві партнери становили 418 окремих індивідуумів (181 жінка і 237 чоловіків), аналіз статевих зв’язків яких і послужив предметом даного мережевого дослідження. Мережеві характеристики аналізованої вибірки представлено в таблиці 8.1.
Аналіз сексуальних мереж 418 обстежених виявив 90 компонентів – окремих мереж (таблиця 8.2). Дві найбільші мережі мали 42 і 32 членів, тоді як найменші мережі складалися з двох чоловік (28 діад) і трьох осіб (22 тріади). З обстежених осіб – 74 людини ([17,7 ± 1,9] %) перебували у двох найбільших мережах, у діадах і тріадах складалися 160 осіб, що становило (38,3 ± 2,4) %. У сексуальних мережах, що містили від 4 до 26 осіб, потрапив 181 індивідуум або (43,3 ± 2,4) % обстежених (таблиця 8.3, рисунки 8.1, 8.2).
Таблиця 8.1 – Характеристика 418 індивідуумів (172 споживача психоактивних речовин і 246 їхніх статевих партнерів)
| Показник | Пацієнти (n=172) | Партнери (n=246) | Усього (n=418) | ||||
| n | % | n | % | n | % | ||
| Ступінь положення в мережі | 1 | 102 | 59,3±3,7* | 96 | 39,0±3,1* | 198 | 47,4±2,4 |
| 2–3 | 48 | 27,9±3,4** | 123 | 50,0±3,2** | 171 | 40,9±2,4 | |
| 4–7 | 22 | 12,8±2,5 | 27 | 11,0±2,0 | 49 | 11,7±1,6 | |
| «Центральність» положення в мережі | 0 | 105 | 61,0±3,7** | 78 | 31,7±3,0** | 183 | 43,8±2,4 |
| 1–3 | 49 | 28,5±3,4 | 124 | 50,4±3,2** | 173 | 41,4±2,4 | |
| 4–12 | 18 | 10,5±2,3 | 44 | 17,9±2,4 | 62 | 14,8±1,7 | |
Примітка. * – р < 0,05; ** – p<0,01.
Таблиця 8.2 – Розміри і кількість сексуальних мереж, утворених 418 індивідуумами (172 СПАР і 246 їхніх статевих партнерів)
| Розмір сексуальної мережі | Кількість мереж | Кількість індивідуумів | Кумулятивна кількість мереж | Кумулятивна кількість індивідуумів |
| 42 | 1 | 42 | 1 | 42 |
| 32 | 1 | 32 | 2 | 74 |
| 26 | 1 | 26 | 3 | 100 |
| 15 | 1 | 15 | 4 | 115 |
| 12 | 1 | 12 | 5 | 127 |
| 9 | 2 | 18 | 7 | 145 |
| 6 | 5 | 30 | 12 | 175 |
| 5 | 9 | 45 | 21 | 220 |
| 4 | 19 | 76 | 40 | 296 |
| 3 | 22 | 66 | 62 | 362 |
| 2 | 28 | 56 | 90 | 418 |
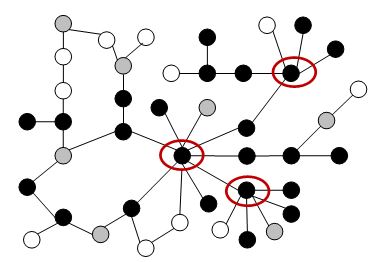
Рисунок 8.1 – Структура найбільшої сексуальної мережі з маркерами ІПСШ та ВІЛ, що складалася з 42 членів. Для даної мережі характерна наявність замкнутих структур, що говорить про підтримку певного рівня поширеності інфекції в популяції протягом тривалого часу. Усі
члени мали або позицію 2 – периферичний член великої мережі (ступінь = 1, центральність ≥1); або позицію 4 – всередині складного розгалуження (ступінь ≥2, центральність ≥1). Овалами вказані три ключові компоненти (ін’єкційні наркозалежні особи), які відповідальні
за зараження більшості членів цієї мережі. Чорні круги – маркери ІПСШ/ВІЛ, білі круги – маркерів ІПСШ/ВІЛ немає, сірі круги – не обстежені.
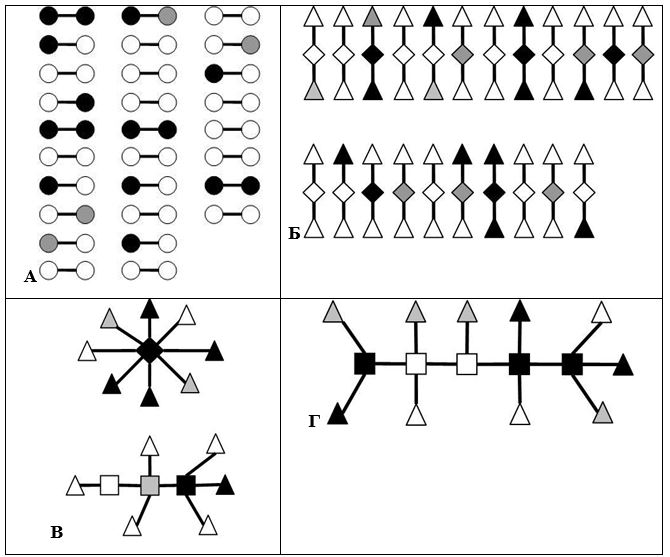
Рисунок 8.2 – Сексуальні мережі від 5 до 15 осіб склали 120 індивідуумів або (28,7 ± 2,2) % із 418 обстежених (А-Г). Ці мережі включали переважно пацієнтів з ІПСШ. Для них характерна відсутність замкнутих структур і наявність лінійних, розгалужених і рідше зіркоподібних структур, що говорить про епідемічну фазу поширення інфекції. Більшість членів мали позицію 1○ – член діади (ступінь = 1, центральність = 0) або позицію 2 ▲ – периферичний член мережі розміром 3 і більше (ступінь = 1, центральність ≥1); рідше зустрічалася позиція 3 ◊ – центр зіркоподібного компонента (ступінь ≥2, центральність = 0) і позиція 4 □ – всередині складного розгалуження (ступінь ≥2, центральність ≥1). Чорні круги – маркери ІПСШ/ВІЛ, білі круги – маркерів ІПСШ/ВІЛ немає,
сірі круги – не обстежені.
Таблиця 8.3 – Ризик інфікування ІПСШ та/або ВІЛ залежно від положення індивідуума в сексуальної мережі
| Позиція в мережі | Сту-пінь* | Цент-раль-ність | Роз-мір | Діа-метр | Форма зобра-ження на рис. 6.1 і 6.2 | Кількість | Ризик інфікування ІПСШ та/або ВІЛ – OR (довірчий інтервал 95%) † | |
| n | % | |||||||
| 1
Член діади |
1 | 0 | 2 | 1 | Коло | 56 | 13,4 ± 1,7 | 1,0 |
| 2
Периферичний член мережі розміром 3 і більше |
1 | ≥1 | ≥3 | ≥2 | Трикут-ник | 247 | 59,1 ± 2,4 | 4,3 (1,7 – 12,2) |
| 3
Центр зіркоподібного компонента |
≥2 | 0 | ≥3 | 2 | Ромб | 29 | 6,9 ± 1,2 | 7,8 (2,9 – 19,3) |
| 4
Всередині складного розгалуження |
≥2 | ≥1 | ≥4 | ≥3 | Квадрат | 86 | 20,6 ± 2,0 | 7,7 (3,8 – 21,4) |
Примітка. * – ступінь – кількість партнерів у кожного індивідуума; центральність – положення в мережі по відношенню до партнерів партнерів – чи кількість партнерів у безпосередніх партнерів; розмір – кількість індивідуумів у мережі; діаметр – максимальна кількість кроків між будь-якими двома членами мережі. † – Ризик інфікування – ступінь ризику (OR – odd ratio) обчислена за допомогою кластерного регресивного аналізу.
Отже, отримані результати даних дозволили з’ясувати значення розмірів і структури сексуальних мереж як маркера поширення ІПСШ та ВІЛ серед СПАР, а також оцінити зв’язок між становищем у мережі і ризиком інфікування. Це дозволяє вживати більш адекватних діагностичних і лікувально-профілактичних заходів. Інтенсивний показник захворюваності (знов зареєстрованих на 100 тис. населення за один рік), а також показник хворобливості (загальна кількість зареєстрованих на конкретний момент часу) не дозволяють повністю зробити оцінку епідеміологічної ситуації та ефективно протидіяти розповсюдженню ІПСШ та ВІЛ-інфекції серед СПАР. Було показано, що положення наркоспоживачів у сексуальної мережі більшою мірою визначає ризик інфікування ІПСШ, ніж такі показники, як вік, стать, кількість партнерів за останній рік і, навіть, частота застосування презервативів. Зокрема, індивідууми, що знаходяться всередині мереж, з двома і більше членами в 5 разів більше схильні до інфікування ІПСШ та/або ВІЛ порівняно з членами діад. Знаходження всередині мережі несе велику ймовірність зараження незалежно від того, чи знаходяться вони в центрі зіркоподібного компонента (позиція 3) або всередині розгалуження (позиція 4), як це показано на рисунках 8.1, 8.2 і в таблиці 8.3. А індивідууми, що мають одного партнера, так само мають високий ризик бути інфікованими, якщо вони знаходяться на периферії великої мережі, оскільки пов’язані через свого партнера з іншими людьми, що мають багато статевих контактів. Також було показано, що ступінь центральності не збільшує ризик у тих, хто має кілька партнерів. Іншими словами, чи знаходиться пацієнт в центрі «зірки», тобто має багато моногамних партнерів або в центрі розгалуження, має як моногамних, так і полігамних партнерів, ризик інфікуватися приблизно однаковий (OR = 7,8 і OR = 7,7) (див. табл. 8.3).
Отримані результати є дуже важливими у практичному плані, тому що розроблена типологія сексуальних мереж, яка дозволяє визначити ризик зараження ІПСШ/ВІЛ у СПАР без урахування багатьох соціометричних даних, збір яких у такого роду пацієнтів пов’язаний з технічними труднощами і фінансовими витратами. Для зниження ризику зараження ІПСШ/ВІЛ можливо різними заходами впливати на структуру сексуальних мереж. Слід зазначити, що наявність одного партнера протягом тривалого часу не знижує ризик зараження ІПСШ і взагалі кількість партнерів не завжди впливатиме на це. Це узгоджується з недавніми роботами щодо оцінки соціометричних показників, ризикованої статевої поведінки і споживання ПАР як фактори ризику зараження ІПСШ/ВІЛ статевим шляхом, де здавалося би, очевидні чинники виявилися несуттєвими [3, 4, 153]. Часто в епідеміологічних дослідженнях не враховується, що фактори ризику реалізуються через статевий контакт, який є результатом певної соціальної взаємодії. Тому в даному дослідженні набагато більше значення мало положення індивідуума в статевій соціальній мережі, ніж наявність «традиційних» факторів ризику. З’ясування соціальних контактів пацієнта на відміну від збирання статевого анамнезу пацієнта дозволяє побудувати сексуальну мережу, що дає змогу проводити адекватні та ефективні заходи профілактики. Традиційний аналіз захворюваності на рівні певного регіону, на відміну від визначення структури мережі та її щільності, не дозволяє виявити інтенсивність поширення ІПСШ у субпопуляції наркозалежних осіб [28, 32, 114, 122, 142, 153].
* * *
З огляду на викладене в цьому розділі, можна обґрунтувати наступні положення:
- При вивченні сексуальних мереж можна оцінити епідеміологічну ситуацію з ІПСШ та ВІЛ серед споживачів ПАР на даній території та серед окремих мікросоціальних груп. Властивості сексуальних мереж (розмір, структура, еволюція) дозволяють зрозуміти пріоритетні навички діяльності дерматовенерологічної служби.
- Обсяг та направленість лікувально-профілактичної діяльності стосовно ІПСШ залежить від того, в якої фазі перебуває епідемічний процес. Про це можна судити за допомогою аналізу сексуальних мереж. У першій фазі епідемії (експоненційне зростання) переважають сексуальні мережі з короткими петлями, пов’язаними один з одним. У фазі епідемічного насичення переважають довгі структури у вигляді гілок, які слабко пов’язані між собою (один або два члени сексуальної мережі). Тому з початку епідемії ефективним є вплив на центр сексуальної мережі (консультування та притягнення статевих контактів окремих ключових членів мереж), а після насичення (пізня фаза) рекомендовано проводити заходи, спрямовані на вразливу популяцію наркозалежних осіб у цілому (скринінг, масові обстеження методом аутріч, розробка просвітницьких програм для членів сексуальних мереж та медичного персоналу).
- Необхідно впроваджувати методику аналізу сексуальних мереж у профілактичну роботу щодо ІПСШ та ВІЛ-інфекції серед СПАР.
Матеріали розділу опубліковані у наступних виданнях:
- Мавров Г.І., Миронюк В.І., Осінська Т.В. Розповсюдження інфекцій, що передаються статевим шляхом серед споживачів психоактивних речовин – аналіз сексуальних мереж. Дерматологія та венерологія. 2018. № 2 (80). С.35–42 [41].
РОЗДІЛ 9
ПОПЕРЕДЖЕННЯ СИФІЛІСУ ТА ІНШИХ ІНФЕКЦІЙ, ЩО ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ, СЕРЕД
СПОЖИВАЧІВ ПСИХОАКТИВНИХ РЕЧОВИН (НАДАННЯ МЕДИКО-СОЦІАЛЬНОЇ ДОПОМОГИ)
Щорічно тисячі осіб в Україні заражаються сифілісом, трихомонозом, хламідіозом, генітальним герпесом. Присутність в організмі Treponema pallidum, Herpes sіmplex, Chlamydіa trachomatіs, Trіchomonas vagіnalіs значно підвищує ризик зараження ВІЛ або його передачу. Дослідження свідчать про взаємодію між ВІЛ-інфекцією та іншими ІПСШ [45, 55]. Тому профілактика ІПСШ повинна бути невід’ємною частиною заходів щодо забезпечення здоров’я нації. В даному розділі на підставі клінічних, лабораторних, епідеміологічних та соціальних досліджень пропонується програма профілактичних та організаційних заходів з боротьби зі статевими інфекціями серед СПАР. Запропонована програма розроблена з урахуванням стратегічного бачення розвитку медицини в XXI столітті, що пропонується ВООЗ. Це так звана концепція чотирьох «П» – профілактика, персоніфікація, прогнозування та партнерство. У запропонованій стратегії розглядаються безпечна сексуальна поведінка, індивідуальна профілактика, спеціалізована медична й психологічна допомога, а також моніторинг та оцінка результатів боротьби з ІПСШ. Пропонуються конкретні кроки з боку Міністерства охорони здоров’я України та інших відомств щодо реалізації програми. Акцентовано на гуманістичному підході з позицій соціальної політики держави, що базується на отриманих наукових даних і економічних можливостей. У програмі наводяться алгоритми надання допомоги наркозалежним у рамках спеціалізованих служб (другий і третій рівні). Наголошено на необхідності співпраці з іншими державними відомствами, громадськими організаціями та приватними структурами, які надають медичну допомогу СПАР.
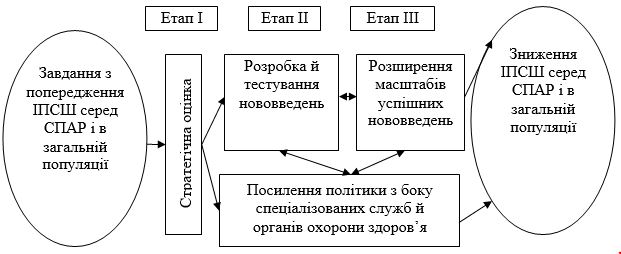
Програма орієнтована на кінцеву мету – поліпшення доступу до допомоги і до підвищення її якості. Здійснення програми передбачає три етапи: 1) стратегічну оцінку потреб і пріоритетів; 2) тестування нововведень; 3) розширення масштабів застосування. На кожному етапі досягаються результати, які сприяють зниженню розповсюдження ІПСШ серед СПАР, як це показано на рис. 9.1. Цей поступовий процес покликаний забезпечити прийняття стратегічних рішень і подальше інвестування коштів у програми на підставі доказових даних про ефективність у місцевих умовах і внеску зацікавлених сторін.
Рисунок 9.1 – Процес реалізації стратегічної програми профілактики
ІПСШ серед СПАР
Програма щодо профілактики ІПСШ серед СПАР використовує системну структуру (рис. 9.2) та акцентує увагу на критичні фактори, що впливають у сукупності на здійсненність, прийнятність, ефективність і довгостроковість заходів щодо профілактики ІПСШ серед СПАР і в загальній популяції. Системний погляд служить нагадуванням про те, що здатність нових технологій або послуг поліпшити доступ і якість медичної допомоги повинна оцінюватися в контексті системи охорони здоров’я в цілому. Увага до динамічної взаємодії між елементами структури визначає прийняття рішень протягом усіх трьох етапів здійснення програми.
Рисунок 9.2 – Системна структура, яка визначає стратегічний підхід щодо програми профілактики ІПСШ серед СПАР
На рис. 9.3 представлена концептуальна модель здійснення програми. Вона враховує значення більш широкого контексту системи охорони здоров’я у здійсненні профілактики ІПСШ серед СПАР та розглядає зміцнення системи охорони здоров’я для результативного поліпшення епідемічної ситуації з розповсюдженням ІПСШ. Так, у даній структурі для розробки і здійснення політики і програм конкретно вказуються точки впливу з метою зміцнення систем охорони здоров’я.
Так само в структурі враховується потреба розробки політики та програми на підставі фактичних даних. Відповідно, також визнається значення сприятливої нормативної бази і політичної волі, а також містяться конкретні рекомендації щодо зміцнення цих трьох галузей. Вибір конкретних дій для здійснення в кожній з цих галузей буде залежати від потреб і умов на місцях. В якості невід’ємної частини програми охорони здоров’я в галузі профілактики ІПСШ особливо виділяються моніторинг і оцінка як п’ятої галузі дії Програми. Структура дозволяє визначити точки впливу в цій галузі, надаючи ряд показників, що характеризують як стан системи охорони здоров’я (вкладення / процеси / результати), так і стан здоров’я населення (ефективність / вплив). Вони групуються за п’ятьма основними елементами сексуального здоров’я для використання при організації моніторингу і оцінки програми.
Рисунок 9.3 – Концептуальна модель профілактики ІПСШ, що здійснюється по п’яти областях дії програми
Заходи повинні спиратися на фактичні дані. За допомогою здійснення заходів та їх ретельної оцінки можна зібрати нові дані, які будуть враховані при розробці політики, програм і розширення діяльності. Тому важливо застосовувати наступний підхід: план → дія → аналіз → активізація (в разі успіху). Епіднагляд за ІПСШ включає нагляд за поведінкою і за іншими ІПСШ, включаючи ВІЛ серед СПАР. Подібний підхід забезпечить програми інформацією про належні заходи щодо боротьби як з ІПСШ, так і з ВІЛ-інфекцією.
За останні роки інтерес до профілактики ІПСШ, окрім ВІЛ, знизився. У даний час основні засоби в боротьбі з ВІЛ / СНІДом зосередилися на заходах в галузі антиретровірусної терапії, а також консультування у зв’язку з ВІЛ. В умовах організації охорони здоров’я України ця діяльність властива обласним центрам СНІДу, які не завжди тісно пов’язані з дерматовенерологічною і наркологічною службами. Включення ІПСШ в протоколи надання допомоги наркологічним хворим виявилося складним завданням, оскільки немає регламентованої взаємодії відповідних спеціалізованих служб. У зв’язку з цим, виникає потреба в експрес-тестах на ІПСШ. Впровадження таких тестів йде повільно, їх ціна залишається відносно високою, щоб уряд міг їх включити в національні програми.
Епідеміологія ІПСШ визначається не тільки споживанням ПАР, але й багатьма іншими пов’язаними детермінантами (в тому числі гендерною нерівністю, бідністю соціально-економічним занепадом), і далеко не всі з цих детермінант враховуються. При наданні допомоги СПАР важливо забезпечити стійкі поставки ліків і презервативів, що системі охорони здоров’я не завжди вдається. Консультування з питань зниження ризику також зазвичай не проводиться в дерматовенерологічній службі. Необхідна більш широка участь партнерів, представлених ЛПЗ наркологічного профілю і громадськими (неурядовими) організаціями. Крім цих недоліків у боротьбі з ІПСШ також сприяють такі чинники:
– брак інформації сприяють збереженню помилкових уявлень про ІПСШ та супутніх забобонів;
– багато інфекцій часто перебігають безсимптомно і тому залишаються нерозпізнаними;
– остракізм, притаманний шкірно-венерологічним диспансерам, як і раніше залишається потужною перешкодою профілактики та лікування ІПСШ.
На рівні формулювання політики і прийняття рішень діють наступні чинники. Особи, що визначають політику у сфері боротьби з наркоманією та токсикоманією, розглядають боротьбу з ІПСШ в якості фонового завдання. Ця ситуація потенційно посилюється через забобони і нерозуміння серйозності наслідків для здоров’я загальної популяції самим фактом високої розповсюдженості ІПСШ серед СПАР. Кошти виділяються всьому даному сектору охорони здоров’я, а не таким конкретним проектам, як боротьба з ІПСШ серед наркозалежних осіб. Тому не забезпечуються належний рівень допомоги для даних груп населення, особливо уразливих щодо ІПСШ.
У багатьох випадках проблема полягає в нестачі якісної дерматовенерологічної допомоги для пацієнтів наркологічного профілю. Наявність дерматовенерологічної служби, що займається діагностикою і лікуванням ІПСШ, не завжди призводить до покращення охоплення наркологічних хворих, навіть якщо ця служба оснащена на високому рівні та надає послуги безкоштовно. Щоб зробити допомогу доступною для СПАР, необхідно врахувати цілий ряд додаткових чинників і завжди орієнтуватися на потреби пацієнтів. Службу потрібно зробити більш зручною для наркологічних пацієнтів, при цьому мають значення територіальна доступність, доброзичливість персоналу, конфіденційність обстановки, дотримання медичної таємниці. У суспільстві та серед СПАР необхідно пропагувати безпечну статеву поведінку, зокрема підкреслюючи важливість діагностики і лікування ІПСШ. Для СПАР лікарські засоби і презервативи можуть бути недоступні через високу ціну або з інших причин. Можливо потрібно переглянути політику, щоб підвищити доступність препаратів, зокрема за допомогою лікарських субсидій для пацієнтів наркологічних клінік, широкого постачання для них презервативів, покриття витрат на діагностику та спеціалізовану допомогу за рахунок спеціальних фондів. Суттєво підвищити доступність дерматовенерологічної допомоги для СПАР допомагає виїзна робота.
Така уразлива група населення, як СПАР, потребує особливого підходу в консультуванні, наданні лікувально-діагностичної допомоги. Це обумовлено загальними поведінковими особливостями осіб, наявністю ризикованої сексуальної поведінки та іншими чинниками. Своєчасне виявлення випадку ІПСШ, діагностично-лікувальна допомога та профілактика ІПСШ серед наркозалежних мають бути суттєвим елементом у системі заходів, що протидіють розповсюдженню ВІЛ-інфекції в Україні.
Консультування з приводу ІПСШ є невід’ємною частиною лікувального процесу. Очевидна важливість використання різноманітних методів інформування, підтримка зусиль, які спрямовані на зміни моделей поведінки всіх верств населення, в першу чергу представників ключових груп.
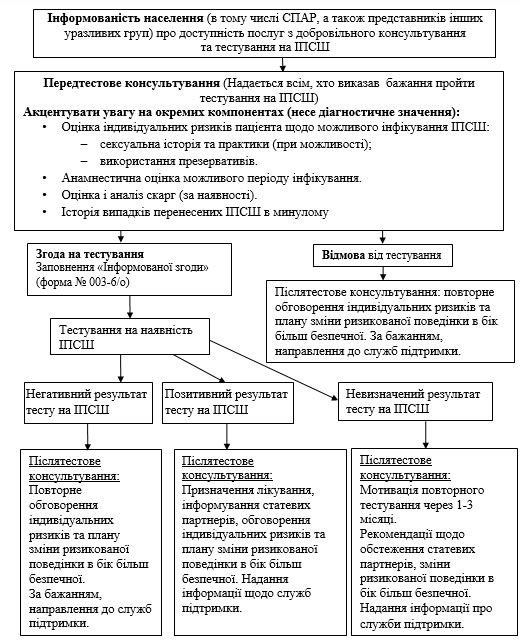
Консультування і тестування на ВІЛ-інфекцію досить добре впроваджено в наркологічну службу й службу боротьби з ВІЛ-інфекцією (відповідно до нормативно встановленого протоколу). На цей час підготовлено відповідний проект наказу МОЗ України, який знаходиться на етапі громадського обговорення та затвердження і зможе стати підставою для застосування його у практиці. Однак консультування з наголосом на ІПСШ в Україні проводиться далеко не завжди (якщо взагалі проводиться). Хоча дослідженнями показано, що таке консультування повинно стати невід’ємною частиною організації надання медичної допомоги наркозалежним особам [174].
Метою добровільного консультування та тестування (ДКТ) на ІПСШ є надання добровільної консультативної допомоги населенню щодо шляхів поширення ІПСШ та профілактики інфікування. Окрім того, сприяння прийняттю добровільного інформованого рішення щодо тестування на ІПСШ, визначення наявності статевих інфекцій. Також мотивування пацієнта та підтримка подальшої його безпечної поведінки щодо інфікування ІПСШ, отримання своєчасної медичної допомоги. Метою консультування також є такі аспекти, як усвідомлення пацієнтом важливості своєчасного початку терапії, підвищення прихильності до лікування, рекомендації з профілактики ІПСШ, обстеження на ВІЛ та гепатити В та С з питань репродуктивного здоров’я, послуг із планування сім’ї, підтримки, тощо.
Спосіб життя СПАР часто пов’язаний із правопорушеннями, конфліктами із законом та викликає осудження з боку суспільства. У зв’язку з цим, СПАР можуть з недовірою ставитися до послуг із консультування та тестування, які надаються державними службами чи службами на базі ЛПЗ. Послуги з ДКТ також можуть ускладнювати труднощі у залученні пацієнтів. Прикладом успішного вирішення цієї проблеми можуть бути програми, у яких ДКТ зорганізується у співпраці з громадськими організаціями. Це програми з профілактики ВІЛ, що реалізуються «за межами кабінетів», тобто з виходом чи виїздом до місць звичного перебування СПАР [60, 61, 62, 63].
Згідно результатів наших досліджень консультування споживачів психоактивних речовин має проводитися в певній послідовності (таблиця 9.1).
Таблиця 9.1 – Особливості консультування СПАР на ІПСШ
| Заходи | Послідовність дій |
| 1 | 2 |
| Оцінка загального стану пацієнта | Суб’єктивно оцінити наявність у пацієнта стану наркотичного або алкогольного сп’яніння, стану абстиненції.
При відсутності можливості сприйняття інформації пацієнтом призначити повторну зустріч. При адекватній реакції пацієнта продовжити консультування. |
| Мотивування пацієнта на проходження процедури консультування та тестування на ІПСШ | Повідомити, коли та де пацієнт зможе отримати результат цього тесту.
З’ясувати, чи буде у нього можливість зайти за результатом у цей час. Якщо ні, то пояснити, що він зможе отримати результат тестування та пройти післятестове консультування пізніше. Пояснити що: – важливо, щоб він повернувся за результатом; – після отримання результату він зможе обговорити з консультантом питання, що у нього виникнуть; – при потребі обговорення окремих питань він може прийти на додаткову консультацію |
Продовження таблиці 9.1
| 1 | 2 |
| Обговорення переваг обізнаності щодо стану здоров’я стосовно ІПСШ;
проведення разом з пацієнтом аналізу можливих «за» і «проти» знання свого статусу |
Пояснити, що пацієнт зробив важливий крок, прийшовши на цю консультацію, тому що знання, які він отримає, зможуть допомогти йому керувати своїм життям; обговорити переваги знання щодо стану його сексуального та репродуктивного здоров’я при наявності ІПСШ та з якими труднощами може бути пов’язане незнання свого статусу |
| Інформування пацієнта щодо отримання психологічної, соціальної та інших видів підтримки | Пояснити, що у випадку виникнення потреби у психологічній підтримці, можна звернутись за допомогою в організацію, яка займається наданням допомоги СПАР; доцільно надати контактну інформацію, вказуючи час та умови прийому цього консультанта |
| Інформація про групи взаємодопомоги | Проінформувати пацієнта про групи взаємодопомоги, які об’єднують людей з проблемами, подібними до його проблем, при можливості, надати контактну інформацію |
| Обговорення екстреної профілактики у випадку сексуального насильства | Пояснити, що сексуальне насильство пов’язане з підвищеним ризиком інфікування ІПСШ та ВІЛ внаслідок травмування слизових оболонок; розповісти про можливості екстреної профілактики ІПСШ та ВІЛ у разі сексуального насильства |
| Проведення разом з пацієнтом оцінки індивідуальних ризиків інфікування ІПСШ у випадку надання платних сексуальних послуг; обговорення можливості зменшення ризиків | Доцільно з’ясувати:
– досвід користування засобами запобігання інфікування ІПСШ; – про ситуації, коли не використовується презерватив, та причину цього; – разом з пацієнтом обговорити шляхи щодо зменшення ризиків інфікування |
Продовження таблиці 9.1
| 1 | 2 |
| З’ясування хибних уявлень у пацієнта щодо безпечних/ небезпечних сексуальних практик | Потрібно встановити:
– яким чином він визначає осіб, з якими статеві контакти є більш ризикованими щодо інфікування ІПСШ; – чи є якісь групи осіб, з якими він не пов’язує ризик інфікування ІПСШ, якщо так, то чому; – яким чином такі міркування впливають на його вибір поведінки |
| Обговорення ризиків інфікування ІПСШ для СПАР, які є одночасно робітницями комерційного сексу (РКС) | Визначити інформованість щодо поширеності ІПСШ серед СПАР та РКС; пояснити фактори підвищеного ризику інфікування ІПСШ; проінформувати, що частина РКС є СПАР, тобто несуть подвійну загрозу інфікування |
| Обговорення шляхів та засобів зменшення ризику інфікування | Скласти разом з пацієнтом план особистого захисту від інфікування ІПСШ та захисту його постійного партнера
Пояснити пацієнтові: – про значний вплив вживання ПАР на стан його здоров’я; – що задля зменшення ризику інфікування ІПСШ, ВІЛ, вірусами гепатитів В і С йому необхідно відмовитись від ін’єкційного вживання ПАР; – що при неможливості відмови від вживання ПАР на даний час потрібно не користуватись чужими, використаними або спільними шприцами, не давати іншим свій використаний шприц, не промивати використаний шприц у загальній ємкості з водою, для кожної ін’єкції використовувати стерильний (одноразовий) шприц; |
Продовження таблиці 9.1
| 1 | 2 |
| – необхідність використання якісного презервативу при кожному сексуальному контакті та протягом всього статевого акту. | |
| Післятестове консультування при негативному або невизначеному (сумнівному) результаті | Провести консультування з урахуванням вимог щодо відповідних заходів, які наведені в розділі 3 відповідних рекомендацій [Черкасов, Черкасов]. |
| Післятестове консультування у випадку позитивного результату;
планування майбутнього з деталізацією щодо зміни поведінки на менш ризиковану з метою поліпшення якості життя |
З’ясувати стан та можливість пацієнта сприйняти інформацію, при необхідності призначити повторну зустріч.
Подальше консультування провести відповідно до заходів, що наведені в в розділі 4 відповідних рекомендацій [Черкасов, Черкасов]. З’ясувати, чи вплине його позитивний статус на рішення щодо зменшення вживання ПАР. Якщо так, то слід визначити яким чином та яких результатів він очікує від подібних змін. |
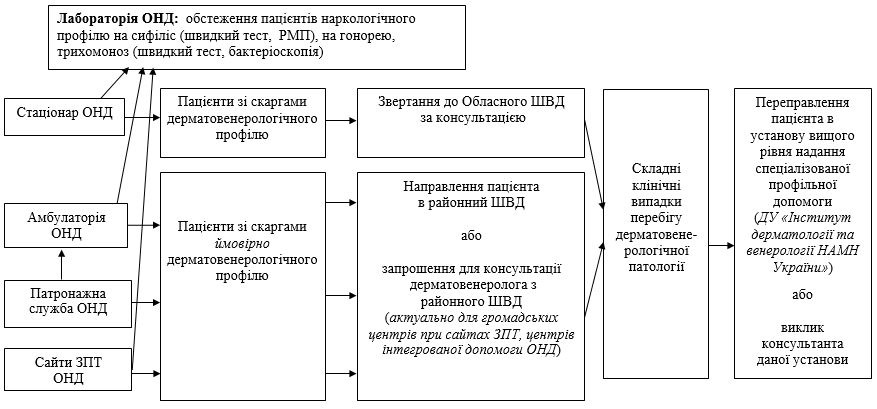
Післятестове консультування – це конфіденційний діалог між пацієнтом та консультантом. Метою цього заходу є обговорення результатів тесту на ІПСШ, надання необхідної інформації та психологічної підтримки. У зв’язку з цим були розроблені алгоритм спрямування пацієнта ЛПЗ наркологічного профілю щодо надання лікувально-діагностичної допомоги з приводу ІПСШ (рис. 9.4) та взаємодія фахівців наркологічної та дерматовенерологічної служб при наданні допомоги пацієнтам з наркологічною та дерматовенерологічною патологіями в умовах ЛПЗ наркологічного профілю (рис. 9.5).
Рисунок 9.4 – Алгоритм ведення пацієнта ЛПЗ наркологічного профілю при наданні спеціалізованої допомоги з приводу ІПСШ
Рисунок 9.5 – Взаємодія фахівців наркологічної та дерматовенерологічної служб при наданні допомоги пацієнтам
з наркологічною та дерматовенерологічною патологіями в умовах КЗОЗ «Обласний наркологічний диспансер».
Примітки: ОНД – обласний наркологічний диспансер; ЗПТ – замісна, підтримуюча терапія; ШВД – шкірно-венерологічний диспансер.
***
Профілактика ІПСШ повинна бути невід’ємною частиною заходів щодо забезпечення здоров’я нації. У даному розділі на підставі клінічних, лабораторних, епідеміологічних та соціальних досліджень розроблена програма профілактичних та організаційних заходів з боротьби зі статевими інфекціями серед СПАР. Програма боротьби з ІПСШ покликана служити керівництвом при здійсненні оперативних заходів у напрямку досягнення цілей розвитку суспільства.
Зокрема, програма повинна бути націлена на досягнення наступних завдань:
– посилити підтримку профілактики ІПСШ серед СПАР з боку уряду і міжнародних партнерів з розвитку;
– стимулювати залучення коштів та перерозподіл ресурсів з урахуванням національних пріоритетів, які забезпечать ефективність допомоги наркозалежним;
– забезпечити зниження негативного ставлення і врахування гендерного чинника в політиці щодо надання допомоги в зв’язку з ІПСШ;
– використовувати потенціал міжнародних партнерів та інститутів з метою розширення і підтримки заходів з профілактики ІПСШ серед СПАР.
Згідно запропонованої програми ефективне попередження ІПСШ і надання допомоги хворим, що зловживають наркотиками, може бути забезпечено за допомогою комплексу заходів з боку громадської охорони здоров’я:
– пропаганди безпечної статевої поведінки;
– сприяння ранньому зверненню за медичною допомогою;
– включення ІПСШ в Державну програму боротьби зі споживанням ПАР.
Необхідний комплексний підхід до ведення хворих, що включає:
– виявлення синдромів характерних для ІПСШ;
– відповідне етіотропне лікування синдрому;
– консультування щодо способів запобігання або зниження ризику інфекції;
– сприяння правильному і систематичному використанню презервативів;
– оповіщення і залучення статевих партнерів.
Матеріали розділу опубліковані у наступних виданнях:
- Нові підходи до діагностики та лікування ІПСШ в групах населення, уразливих щодо зараження ВІЛ (методичний посібник) / Г.І.Мавров, Г.М. Бондаренко, Ю.В. Щербакова, Л.В. Іващенко, В.І. Миронюк, Л.Й. Піньковська. Харків : МОЗ України, НАМН України, 2013. 48 с. [55].
- Мавров Г.І., Щербакова Ю.В., Миронюк В.І. Інфекції, що передаються статевим шляхом серед споживачів психоактивних речовин – чинники ризику та напрями профілактики. Дерматологія та венерологія. 2018. № 1 (79). С. 31–38 [45].
- Миронюк В.І. Інфекції, що передаються статевим шляхом, у осіб, які споживають психоактивні речовини. Розповсюдженість та ризики зараження. Український журнал дерматології, венерології, косметології. 2018. №1 (68). С. 67–71 [49].
- Мавров Г.І., Миронюк В.І. Залежність від психоактивних речовин як чинник інфікування ІПСШ та ВІЛ. Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я. Зб. наук. праць, під. ред. П.П.Рижка. 2018. Вип. 15. С. 229–237 [35].
- Мавров Г.І., Нагорний О.Є., Миронюк В.І. Реабілітація хворих з хронічними запальними процесами в сечостатевих органах. Дерматологія та венерологія. 2016. № 4 (74). С. 72–78 [42].
- Мавров Г.И., Каменев В.И., Миронюк В.И. Амбулаторное лечение больных ранним сифилисом дюрантными пенициллинами в сочетании с доксициклином. Дерматовенерология. Косметология. Сексопатология. 2016. № 1–4. С. 214–219 [26].
- Пат. на корисну модель 97172 UA, МПК А61В10/00. Спосіб обмеження поширення ВІЛ/СНІД та інфекцій, що передаються статевим шляхом, хворими груп підвищеного ризику / Г.І. Мавров, Г.М. Бондаренко, Ю.В. Щербакова, Л.В. Іващенко, Л.Й. Піньковська, В.І. Миронюк; заявник і патентовласник ДУ „Інститут дерматології та венерології НАМНУ”. № u201406144; заявл. 04.06.14; опубл. 10.03.15, Бюл. № 5 [65].
РОЗДІЛ 10
АНАЛІЗ ТА УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
Сифіліс продовжує залишатись актуальним для охорони здоров’я України. Сифіліс набув нових клінічних і епідемічних особливостей. Збільшилася кількість випадків нейросифілісу та вісцеральної патології. Одночасно ці дослідження, наряду з іншими авторами вказують на збільшення прихованих форм і випадків з дуже незначними проявами на шкірі та слизових оболонках [30, 43, 54]. Проникнення сифілісу в більш «благополучні» шари населення змушує переглянути існуючі протиепідемічні заходи. Україна, як й інші країни, перебуває під загрозою нової хвилі епідемії ВІЛ/СНІД та ІПСШ.
Проблему сифілісу неможна відокремлювати від епідемії ВІЛ/СНІД в Україні, оскільки з певних позицій ВІЛ-інфекція має розглядатися як така, що передається статевим шляхом. Проведеними епідеміологічними та лабораторними дослідженнями встановлено, що ІПСШ суттєво збільшують вірогідність зараження ВІЛ через статевий контакт. ВІЛ легше передається і легше сприймається при наявності у статевих партнерів сифілісу та інших венеричних інфекцій. Ерозії та виразки, запалення, пошкодження тканин, що притаманно сифілісу, а також багатьом ІПСШ, спричиняють зниження чинників захисту організму від зараження ВІЛ [46, 106, 145, 154]. Згідно проведених досліджень одним із чинників поширення сифілісу та інших ІПСШ визнається поширення наркоманії, що підтверджується даними інших авторів [23, 24].
Оскільки питання епідеміології, клініки сифілісу серед різних мікросоціальних груп та на різних територіях вивчено недостатньо, а особи з деліквентною поведінкою уникають контактів із державними лікувально-профілактичними установами, тому актуальним є вивчення клінічних і епідеміологічних особливостей сифілісу в конкретних регіонах. Вивчено характер розповсюдження сифілісу в Рівненській області, а також клінічних проявів захворювання [34, 38]. У 2016 році захворюваність на сифіліс зросла порівняно з 2015 роком на 39 випадків (34,7 %). Практично у половині районів відмічається збільшення кількості зареєстрованих випадків сифілісу. До 2014 року захворюваність на сифіліс в обласному центрі була явно вищою, ніж у цілому по Україні. Пік захворюваності в Рівненькій області настав на два роки пізніше, ніж у цілому по Україні, хоча характер динаміки захворюваності був подібним. Особливістю Рівненського регіону є більш стрімке зниження захворюваності порівняно з Україною. Однак в окремі роки спостерігається незначне збільшення нових випадків сифілісу. Причому особливо це наочно на рівні окремих районів. У різних районах характер захворюваності відрізняється залежно від соціально-економічної ситуації. Для прикладу було проаналізовано Острозький та Дубровицький райони. Захворюваність в області складається із захворюваності в різних містах та селах різних районів. При цьому особливості та відмінності між різними частинами території області нівелюються. Причому, динаміка захворюваності у двох районах, взятих для прикладу, відрізняється. Для Острозького району характерні сплески захворюваності у 2005, 2009 і 2015 роках. Закономірність поширення сифілісу в Дубровицькому районі відрізняється – мав місце незначний сплеск у 2005 і 2007 роках із швидким падінням у наступні роки до значень менше 10,0, при захворюваності по області більше 20,0. Каменєв В.І. (2002) виявив що особливістю Полтавського регіону порівняно з Україною в цілому є більш повільне зниження захворюваності на сифіліс. Пік захворюваності в Полтавській області (144,4 на 100 000 населення) наступив у 1998 році – на два роки пізніше, ніж у цілому по Україні. Отримані у роботі дані дещо відрізняються, бо маємо іншу епідемічну ситуацію [20]. Ще раніше Чинов Г.П. (1999) встановив закономірності поширення венеричних хвороб на регіональному рівні [76]. Залежність захворюваності від часу характеризується періодами підйому і спаду, які дозволяють із точністю 85–95 % прогнозувати циклічність епідемічного процесу при сифілісі в окремих регіонах. Отримані дані щодо регіональних особливостей епідеміології та клініки сифілісу в загальній популяції дозволяють оптимізувати диспансерну роботу з упором на ризиковані контингенти. Крива, що відображає динаміку захворюваності в Острозькому та Дубровицькому районах, близька до синусоїди з періодом коливань 3–4 роки. Цей метод дозволяє охарактеризувати зміни захворюваності за допомогою рівняння функції «захворюваність – час». Порівняння цих показників може означати, що на епідемічний процес поширення сифілісу в міській та сільській місцевостях діють різні фактори. Відмінність полягає не тільки в силі їх впливу. Крім того, у сільській місцевості відчутно впливають місцеві чинники, що визначають 2–3-літні флуктуації захворюваності, які можуть бути пов’язані з міграцією, сезонними роботами, періодичними поїздками людей, які працюють або вчаться у великих містах чи за межами України.
Пріоритетним напрямком діяльності дерматовенерологічної служби є активне виявлення хворих на сифіліс. Протягом 2016 року активно виявлено (при «вассерманізації» вагітних, донорів, соматичних хворих, при медоглядах) 75,2 % хворих, проти 77,3 % у 2015 р. Відсоток активного виявлення збільшується в міру падіння захворюваності. Якщо у 2003 р. він становив 65,2 %, то у 2016 р. – 75,2 %. Серологічне обстеження соматичних хворих залишається найбільш результативним способом активного виявлення сифілісу. На наведені дані впливають як реальна поширеність сифілісу серед зазначених контингентів, так і якість роботи різних медичних служб (акушерсько-гінекологічної, служби переливання крові), а також робота різних лікувально-профілактичних установ як державної, так і приватної власності, що здійснюють «вассерманізацію» соматичних хворих.
Серед заразних ранніх форм сифілісу в Рівненському регіоні за 7 років відбулися зміни у структурі діагнозу. Частка прихованих форм сифілісу зросла на 2,4 %. Відповідно знизилася питома вага хворих із маніфестними формами сифілісу за рахунок вторинного рецидивного. Однією із задач цього дослідження було вивчення клінічних особливостей сифілісу у хворих і його патоморфоз за досліджуваний період. Відзначено подовження середнього інкубаційного періоду (в середньому на 3,5 дні). Відсоток типових шанкерів – як ерозивних, так і виразкових – зменшився, а відсоток атипових шанкерів збільшився. Визначалося зменшення частоти розеоли майже на чверть. Папули на долонях і підошвах стали зустрічатися рідше, а папули порожнини рота стали зустрічатися частіше – відповідно 56,7 % і 70,0 %. В останні 7 років спостерігалося деяке почастішання алопеції – з 3,3 % до 10,0 %. Наведені дані дещо відрізняються від тих, що мали місце наприкінці дев’яностих і на початку двохтисячних років [20, 76].
Споживачі психоактивних речовин як окрема специфічна соціальна група має додаткові чинники ризику щодо інфікування сифілісом та іншими ІПСШ. Наявність комерційного сексу та секс чоловіків із чоловіками може ще більше сприяти високій поширеності статевих інфекцій серед наркозалежних осіб. Жінки в межах цієї групи часто надають сексуальні послуги не за винагороду, а в обмін на наркотики. Не маючи обізнаності про шляхи передачі та методи профілактики, такі жінки можуть продовжувати практику ризикованої поведінки й заражати своїх статевих партнерів. У попередніх дослідженнях показано, що потрібна комплексна модель профілактики ВІЛ та сифілісу одночасно [104]. Однак осторонь залишається питання епідеміології інших ІПСШ (гонорея, трихомоноз, хламідіоз, мікоплазмоз) серед наркологічних хворих в Україні. Ситуація вивчена недостатньо і слабко контролюється, оскільки особи, залежні від ПАР, уникають контактів із державними ЛПЗ. Тому було вивчено розповсюдження ІПСШ та ВІЛ-інфекції серед наркологічних хворих різного профілю, оцінено вплив типу наркотиків, виду й способу їх уведення на ризик зараження ІПСШ/ВІЛ. Інші автори дані нозології у СПАР не вивчали. Тому отримані дані мають ознаки новизни.
За даними проведеного дослідження, ІПСШ (без ВІЛ) знайдені у майже 40 % СПАР. Більший відсоток ІПСШ виявлено у жінок. За структурою захворюваності розподіл був наступним: сифіліс – 6,3 %, причому, у жінок сифіліс виявлявся у 2 рази частіше. Гонококова інфекція була у 7,4 %. Причому гонорея частіше виявлялась у чоловіків (8,2 %), ніж у жінок (5,7 %), хоча ці відмінності не були достовірними (р = 0,17). Хламідіоз виявився у 22,4 % хворих, частіше у чоловіків. Серед наркозалежних жінок Trichomonas vaginalis була виділена у 77,9 %, а серед чоловіків – у 17,3 % хворих, тобто в 4,5 рази частіше. Урогенітальний активний герпес діагностувався у 9,6 %, причому в жінок він виявлявся в два рази частіше порівняно з чоловіками – відповідно у 14,6 % та 7,1 %. А от наявність специфічних до ВПГ-2 антитіл мали близько половини чоловіків та жінок. Мікоплазмоз також був розповсюджений серед наркозалежних осіб – у цілому 28,1 %, причому мікоплазми в жінок виявлялися в 2,3 рази частіше. Показник ВІЛ-інфекції становив 38,4 %, серологічні маркери вірусного гепатиту В були виявлені у 42,8 % обстежених, гепатит С – у 66,8 %. Поширеність антитіл до ВПГ-2 становила 53,2 % (462). Таким чином, у наркозалежних осіб найчастіше спостерігалися вірусні ІПСШ – гепатити, герпес, ВІЛ – ці віруси «носить» від половини до 2/3 наркозалежних. Більшість статевих інфекцій, включаючи ВІЛ, перебігала в даних пацієнтів безсимптомно, або з вкрай нетиповими ознаками. У більшості випадків вони не були обізнані про факт свого зараження і продовжували статеве життя, часто не користуючись презервативами. У частини жінок секс на комерційній основі став джерелом отримання наркотиків або коштів на їх придбання. Дана практика завжди пов’язана з високим ризиком насильства і зараження ІПСШ. Характерно порівняння цих даних з німецьким дослідженням, що проводилося на 10 років раніше [128]. Наркозалежні жінки хворіли на сифіліс у 4,6 рази частіше, ніж чоловіки. Такі чинники як велика кількість статевих партнерів, обмін сексу на наркотики, секс у перший день знайомства були пов’язані з сифілісом у жінок. Однак ні соціально-демографічні фактори, ні сексуальна поведінка не були статистично значущими, щоб бути пов’язані з сифілісом серед наркозалежних чоловіків, що дещо суперечить отриманим даним [128, 146].
Більшість досліджуваних осіб мали значний стаж споживання ПАР – від двох до десяти років. Щодо ритму вживання, то близько третини робили це щоденно, а більшість уводили наркотик від одного до трьох разів на тиждень. Дуже важливим для гемоконтагіозних інфекцій є шлях уведення наркотичної речовини, а саме, ін’єкційний або неін’єкційний. У виборці спостерігався досить високий відсоток споживання неін’єкційних ПАР – 38,6 %, хоча більшість становила група СІН. Характер залежності визначає хімічна природа наркотику і відповідно його фармакодинаміка. У наркозалежних осіб зі стажем зловживання менше двох років достовірно більше шансів заразитися ІПСШ, ніж ВІЛ. Потім протягом 2–5 років ці шанси вирівнюються, а після 6–8 років навпаки – вірогідність мати ВІЛ стає вищою. А от у наркозалежних осіб із дуже великим «стажем» частіше спостерігалися різні ІПСШ. Вірогідно це пов’язано з тим, що більшість наркозалежних осіб цієї групи не належали до СІН.
Ритм вживання наркотику прямо залежав від ризику інфікування різними ІПСШ та ВІЛ. Зі зменшенням частоти до одного разу на місяць і більше знижується і вірогідність заразитися щонайменше в три рази. Характерно, що ін’єкційний шлях уведення ПАР збільшував у два рази ризик отримання ВІЛ порівняно з неін’єкційним. Однак це не стосується інших ІПСШ. Більше того, частота ІПСШ окрім ВІЛ у неін’єкційних наркозалежних осіб була дещо вищою, ніж у СІН. Однак звертає на себе увагу все ж таки досить високий відсоток ВІЛ-інфікованих серед неін’єкційних наркозалежних осіб – 23 %. Небезпечна сексуальна поведінка, обумовлена споживанням наркотиків, призводить до зараження не тільки ІПСШ, але й ВІЛ статевим шляхом.
Якщо порівнювати ризики залежно від хімічної природи наркотику, то найбільш небезпечним у плані інфікування ВІЛ було вживання опіатів (опій, героїн). Залежність від психостимуляторів дуже посилювала ризики зараження ІПСШ, а також і ВІЛ. Відносно меншу вірогідність інфікуватися мали споживачі алкоголю, психоделіків, галюциногенів та транквілізаторів. Порівняно з даними інших авторів відбулися зміни у структурі наркоспоживання. Хоча найбільш вживаним наркотиком вважається ін’єкційний героїн, частка СІН, які отримували його, знижується [52]. САР, що традиційно посідали друге місце серед ін’єкційних ПАР, поступилися синтетичному опіоїду метадону. Практично вийшли з ужитку опіати кустарного виробництва (макова соломка, «ханко», «чорна», «хімія» та ін.).
Серед СІН широко поширені ризиковані ін’єкційні практики: 57 % СІН використовували нестерильні шприци та голки і ділили ін’єкційне обладнання з іншими, у тому числі з ВІЛ‑інфікованими. Вживання наркотиків у групі було асоційоване з більш високим рівнем ін’єкційного ризику, оскільки призводило до спільного використання голок та шприців. Жінки СІН мали більш високий рівень ін’єкційного ризику зараження порівняно з чоловіками. Застосування тесту AuDIT показало, що до 68 % СІН поряд із застосуванням наркотиків вживали алкоголь. Цей факт заперечує загальноприйняту думку, що алкоголь несумісний з більшістю ін’єкційних наркотиків. Відомо, що при неможливості здобути наркотики СІН нерідко переходять на алкоголь, щоб полегшити стан гострого фізичного і психічного дискомфорту. Широке поширення в останні роки набуло одночасне вживання алкоголю і CAP (CAP – скорочено від capsule, тобто капсула, як правило, означає крек або ЛСД), а також куріння марихуани в поєднанні зі споживанням алкоголю.
Всупереч поширеному уявленню про низьку сексуальну активність наркозалежних осіб, 85 % з них були сексуально активні, а 57 % мали декількох статевих партнерів протягом шести місяців. СПАР характеризувалися ризикованою сексуальною поведінкою. При цьому прихильність наркозалежних осіб до використання презервативів була низькою: нерегулярно використовували презервативи з постійними партнерами 78 %, з випадковими – 46 %, з комерційними – 29 %. З огляду на низьку частоту використання презервативів статеві партнери, які не вживають наркотики можуть виступати в якості «моста», за допомогою якого ВІЛ-інфекція та ІПСШ поширюються в загальну популяцію. У плані суспільної небезпеки найбільше значення мають ін’єкційні наркозалежні особи. У групі СІН має місце тенденція до негативної взаємодії різних видів ризикованої поведінки. Сексуальний ризик, замаскований високим ризиком ін’єкційного вживання наркотиків, часто недооцінюється, що сприяє поширенню епідемії ІПСШ/ВІЛ. Тому профілактичні програми в середовищі СІН мають обов’язково включати також корекцію сексуальної поведінки.
Отримані дані в цілому узгоджуються з результатами інших досліджень [52, 68, 132]. Але на відміну від інших авторів у цій роботі:
– проаналізовано розповсюдженість окремих ІПСШ залежно від вікового, гендерного та інших соціальних факторів;
– показано найбільш небезпечні типи наркотиків та способи їх вживання;
– вивчено відмінності розповсюдження ІПСШ та ВІЛ‑інфекції в середовищі наркозалежних осіб, включаючи СІН;
– показано, що ризикована сексуальна поведінка даного контингенту хворих дозволяє виділяти їх в окрему, найбільш небезпечну соціальну групу, уразливу щодо зараження ІПСШ та ВІЛ;
– встановлено, що ці люди мало інформовані про інфекційну небезпеку. Тому слід визнати необхідність створення системи профілактики, чітко орієнтованої на СПАР з урахування отриманих даних.
Оскільки сифіліс посідає особливе місце серед ІПСШ, було проведено більш ретельне вивчення сифілісу серед наркологічних хворих, проведено оцінку впливу наркотиків на соціо-демографічні характеристики, клінічні прояви та серологічні особливості. Було виявлено, що серед пацієнтів, які страждають на наркоманію, кількість пацієнтів із сифілісом становила 6,3 %. Причому, у жінок сифіліс виявлявся в 2 рази частіше (у 9,6 %) порівняно з чоловіками – у 4,8 %. За клінічними формами сифілісу хворі розподілилися наступним чином: 67,3 % – прихований сифіліс ранній, пізній, неуточнений; 12,7 % – активні форми – всі вторинний рецидивний; 20,0 % – стан серорезистентності після чітко встановленого діагнозу й адекватного лікування в анамнезі. Найбільшу кількість пацієнтів, що вживали наркотики та хворих на сифіліс, виявлено серед осіб 20–30 років, тобто в період максимальної сексуальної активності та в найбільш сприятливому дітородному віці. У віці до 30 років переважали жінки (66,7 %) порівняно з чоловіками (14 – 50 %), після 40 років чоловіки переважали в два рази (майже 22 %), що пов’язано з відмінностями у статевій поведінці чоловіків і жінок різних вікових груп.
При аналізі активних форм сифілісу було виявлено певний патоморфоз клінічних проявів вторинного сифілісу у споживачів наркотичних речовин порівняно з даними власних багаторічних спостережень [34]. Встановлено зміну частоти виявлення окремих сифілідів. Визначалося зменшення частоти розеоли (29 %). Папули на долонях і підошвах траплялися досить часто – 71 %. Те ж саме можна сказати про папули порожнини рота – 86 %.
Більшість пацієнтів були жителями міста – 89,1 %. За соціальним станом пацієнти розподілялися наступним чином: працювали –34,5 %, не працювали –50,9 %, учні і студенти – 10,9 %, інваліди – 3,6 %. Таким чином, більшість пацієнтів основної групи не мали постійного місця роботи або навчання. При аналізі статевої функції встановлено, що більшість пацієнтів першого сексуального досвіду набули у віці до 16 років, а на випадкові статеві контакти вказала досить велика кількість осіб (67,3 %).
Встановлено, що супутні захворювання мали всі 55 пацієнтів (100 %): акушерсько-гінекологічна патологія, серцево-судинні захворювання, цукровий діабет, мікози шкіри та нігтів, простий герпес. Супутні венеричні хвороби виявлено у 53 % пацієнтів (трихомоноз, хламідіоз, мікоплазмоз, ВІЛ-інфекція). Аналіз проведених серологічних досліджень показав, що у хворих, які зловживали ПАР та хворіли на сифіліс, переважали низькі титри антитіл, які виявлялися в нетрепонемних тестах: РЗКк, РМП, РПР. Що стосується трепонемних тестів, то РЗКт, РІФ-абс, РІФ-200, ІФА та РПГА були позитивними в достатньо високих титрах.
У відмінності до власних даних відсоток хворих на сифіліс серед наркозалежних осіб у різних країнах сильно варіює (від 1 % до 60 %). Різниця між дослідженнями і часта наявність тільки одного дослідження на країну обмежує надійність оцінки поширеності. Власний аналіз показує, що асоціація сифілісу та вживання наркотиків спостерігається досить чітко, незалежно від характеристики обстежених осіб.
При сифілісі виникає специфічна запальна реакція, яка посилюється в результаті комбінованого впливу Treponema pallidum та наркотиків на захисні сили організму. У зв’язку з цим, цитокіновий статус відіграє важливу роль у патогенезі сифілісу у СПАР. Сифіліс, як і будь-яка інша інфекція, генерує синтез прозапальних і протизапальних цитокінів, які визначають перебіг і патогенез захворювання. Отримані дані про стан імунної відповіді проливають світло на причини рецидивів. Інші автори вже показали, що збудники ІПСШ здатні спричиняти дисрегуляцію цитокінового каскаду, перш за все, ІЛ-1, -6, -8, -10, хемокінів та інших сигнальних молекул [12, 27]. Але в дослідженні було вивчено особливості імунної відповіді у хворих на сифіліс СПАР шляхом визначення окремих найбільш знакових цитокінів та хемокінів. На відміну від інших авторів визначено активність ІЛ-1, -6, -8, ІНФ-γ, а також ТФР-β у культурі мононуклеарних клітин in vitro, а також у сироватці крові та сечі у 34 хворих із лабораторними маркерами сифілісу (сифіліс прихований ранній, пізній), які були серонегативними стосовно ВІЛ‑інфекції (основна група). Встановлено, що у СПАР, хворих на сифіліс, виявлено підвищення спонтанної й індукованої продукції клітинами крові прозапальних цитокінів ІЛ-1, -8, ТФР-β. Резерв стимуляції ІНФ-γ був нижчим, ніж у здорових донорів (23 особи), що свідчить про зниження компенсаторних можливостей моноцитарно-макрофагальної системи при сифілісі та наркотичній інтоксикації.
Вивчення продукції цитокінів та інших сигнальних молекул мононуклеарними клітинами показало достовірне підвищення як спонтанної, так й індукованої секреції ІЛ-1 та -8, тоді як продукція ІЛ-6 достовірно не відрізнялася від показників здорових осіб. Що стосується ІНФ-γ, то його продукція в основній групі була зниженою порівняно з контрольною групою здорових осіб. Паралельно було проведено оцінку концентрації зазначених цитокінів у сироватці крові та сечі хворих. Дослідження ІЛ-1, -8 та -6 у сечі продемонструвало їх низьку концентрацію у практично здорових осіб, тоді як у хворих на сифіліс наркозалежних осіб їх рівень був достовірно підвищеним. Таким чином, у сечі хворих концентрація прозапальних цитокінів була підвищеною, особливо з боку ІЛ-8. Характерно, що концентрація ІЛ-6 у сечі хворих була істотно підвищеною, в той час як показники продукції цього медіатора клітинами периферичної крові та сироватки крові не відрізнялися від норми. Дана комбінація цитокінового балансу не була характерна для хворих із сечостатевою інфекцією, що було виявлено іншими авторами [5, 12, 27].
Висока продукція ІЛ-1 і -8 клітинами наочно демонструє наявність хронічного запального процесу в організмі, причому незалежно від його клінічної маніфестації. В окремих хворих стимуляція підвищувала рівень цитокінів приблизно як і у практично здорових, що свідчить про збереження у них резервних можливостях клітин моноцитарно-макрофагальної системи. Однак у деяких хворих ці показники не підвищувалися. Висока концентрація прозапальних цитокінів (ІЛ-1, ІЛ-6, ІЛ 8) у сечі є додатковим маркером тяжкості перебігу сифілісу в наркозалежних осіб. Високий рівень ІЛ-1 впливає на активність Тх1, а потім через їхні сигнальні молекули активізуються Т-хелпери другого типу (Тх2) і Трег, що спричиняє дисбаланс цитокінової системи. Це унеможливлює елімінацію трепонем і спричиняє розвиток злоякісного або серорезистентного сифілісу [31]. Дане дослідження виявило високу активність Трег в імунокомпетентних клітинах хворих на сифіліс наркозалежних осіб, про що свідчить підвищення рівня ТФР-β. Рівень ТФР-β у сироватці крові в них також був достовірно підвищеним. Це відповідає попереднім даним про регуляцію за допомогою ТФР-β процесів проліферації, диференціації, міграції та апоптозу в різних клітинах [14]. Зазначені варіанти імунологічної недостатності дають підстави призначати додаткову терапію при лікуванні сифілісу у СПАР.
Щоб зрозуміти особливості епідеміологічної ситуації серед наркологічних хворих, було проведено додаткову оцінку впливу наркотиків і алкоголю на статеву поведінку, психологічні особливості з визначенням ступеня ризику зараження ІПСШ. Було детально обстежено 172 пацієнтів віком від 18 до 49 років, які перебували на лікуванні або спостереженні. Ті, що переважно вживали наркотики, склали 58,7 %, а тих, які переважно зловживали алкоголем, було 33,7 %, окрім того знаходилося на реабілітації 8,1 %. Чоловіків було 64,0 %, жінок – 36,0 %. На першому етапі дослідження був складений соціальний портрет анкетованих осіб. Опитування показало, що особи з вищою та неповною вищою освітою становили 12,8 %, із середньою та середньою спеціальною – 87,2 %. У сенсі занятості серед обстежених було 40,2 % робітників, службовців, студентів; 48,8 % безробітних і 11,0 % інвалідів.
Вивчалися показники сексуальної поведінки досліджуваних. Вік сексуального дебюту є однією з характеристик сексуальності людини. Серед обстежених почали статеве життя у віці до 14 років – 61,1 %; у віці 15–17 років – 16,3 %. Усі хворі продемонстрували небезпечну сексуальну поведінку: протягом останнього півріччя більше одного статевого партнера мали 86,6 % пацієнтів, протягом останнього місяця – 62,8 % пацієнтів. На наявність постійного статевого партнера поза шлюбом вказало 27,9 %, жили у шлюбі – (23,8 ± 3,2) %. Для 95,9 % опитаних були властиві випадкові статеві зв’язки, кілька статевих партнерів одночасно, а також вони мали в якості сексуальних партнерів представників інших груп ризику. Так 39,0 % наркозалежних мали регулярні контакти з жінками комерційного сексу. Значна частина досліджуваних хворих у цілому мала досить багато статевих контактів. Виявлення серологічних маркерів сифілісу було асоційовано з наданням сексуальних послуг за винагородження і насильством з боку партнерів по сексу.
Дослідження особистісних характеристик СПАР дозволило виявити наявність виражених внутрішньо-особистісних конфліктів у 58,1 %. Були виявлені психічні розлади депресивного спектру, причому в 23,3 % депресія мала виражений характер, що значно перевершувало її поширеність у загальній популяції. До 20 % опитаних демонстрували високий рівень безнадійності в оцінці суб’єктивного майбутнього. Особи з високим рівнем безнадійності та депресії характеризувалися більш ризикованою сексуальною поведінкою, а також негативними установками щодо зниження ризику, були схильні демонструвати саморуйнівну асоціальну поведінку. Встановлено, що більш схильними до депресії були жінки, які споживали наркотики й надавали сексуальні послуги, а також мали досвід сексуального насильства. ВІЛ‑позитивний статус респондентів був взаємопов’язаний з вираженістю депресії. Психологічне самопочуття СПАР було асоційоване з поширеністю негативних поведінкових установок в їх соціальному оточенні. При розробці та проведенні поведінкових інтервенцій у субпопуляції наркозалежних осіб необхідно враховувати особливості їхнього психічного статусу, особливо на етапі формування наркологічної ремісії.
Раніше декілька авторів показали високу частоту ВІЛ-інфекції серед пацієнтів наркологічного профілю [96, 132, 151]. Проведені дослідження підтвердили ці дані та суттєво доповнили їх стосовно сифілісу та інших ІПСШ. Також встановлено ризиковану сексуальну поведінку даного контингенту хворих, що дозволяє виділяти їх в окрему, найбільш небезпечну групу, уразливу щодо зараження ІПСШ та ВІЛ, оскільки вони знаходяться поза контролем лікувальних установ. Із соціального портрету пацієнтів видно, що ці люди мало інформовані про інфекційну небезпеку. Раніше мали місце пропозиції видання медичної освітньої літератури, чітко орієнтованої на такі групи ризику [52, 68]. Однак власні дослідження показують, що цього замало. Наркоманія є «фоном», «прихованим резервуаром» для виникнення і розповсюдження таких соціально значущих інфекцій, як ВІЛ та ІПСШ, які негативно впливають на генофонд усього суспільства і можуть призвести до його деградації. Тому ці захворювання вимагають організації системи активного виявлення хворих серед наркозалежних осіб. Необхідна розробка оптимальної програми діагностики, лікування і довгострокових стратегій із профілактики саме ІПСШ, а не тільки ВІЛ, серед наркологічних пацієнтів. Війна та внутрішня міграція в Україні створили тривожну епідеміологічну ситуацію. Нещодавно переміщені люди мають бути охоплені відповідними службами догляду та зниження шкоди, а також необхідна додаткова підтримка неурядових організацій та медичних закладів, які забезпечать запобігання місцевих спалахів ВІЛ та ІПСШ у східних і південних регіонах України, про що також свідчать дослідження з молекулярної епідеміології ВІЛ [57].
Власні дослідження показали, що не можна ефективно впливати на поведінку наркозалежних осіб, не враховуючи їх соціального оточення. Як правило це невеликі групи осіб, які тісно спілкуються (в тому числі мають статеві контакти один з одним). Вживання наркотиків пов’язано з формуванням особливих соціальних мереж, що регулюють поведінку індивідів, які входять до них і таким чином впливають як на їх власне здоров’я, так і здоров’я всього суспільства. Так до 95 % осіб, що входили в соціальні мережі СІН, і до 70 % їх постійних статевих партнерів (сексуальні мережі) також були активними СІН. Негативні поведінкові установки зумовлювали наркоспоживання в більш ранньому віці, вживання ін’єкційних САР, схильність до сексуального насильства, інфікування ВІЛ. Тобто, чим більш ризикованим є поводження оточуючих, тим більш ризикованим буде поведінка індивіда. Тому необхідне проведення утручань на рівні соціальних (сексуальних) мереж. Програми інтервенцій повинні враховувати особливості сексуальних мереж і мати на меті їх реструктуризацію і зміну прийнятої в мережах соціальної норми. При вивченні сексуальних мереж було проведено обстеження 172 пацієнтів, які назвали 246 статевих партнерів. Разом пацієнти та їх статеві партнери становили 418 окремих індивідуумів (181 жінка і 237 чоловіків), аналіз статевих зав’язків яких і послужив предметом наших мережевих досліджень.
Низка авторів уже досліджували сексуальні мережі у контексті боротьби з ІПСШ. Їх дані мають певні розбіжності, тому що в різних популяціях сексуальні мережі мають різну структуру, яка впливає на характер поширення статевих інфекцій [88, 122, 131, 143]. У власній роботі було вивчено розміри і структуру сексуальних мереж як індикаторів поширення ІПСШ та ВІЛ серед СПАР. Тобто було оцінено зв’язок між становищем у мережі та ризиком інфікування. Маючи такі дані, можна цілеспрямовано планувати лікувально-профілактичні заходи. Стає зрозумілим, що відстеження тільки захворюваності та традиційна диспансерна робота не дозволяють повною мірою оцінити ситуацію і адекватно реагувати на епідемію ІПСШ та ВІЛ-інфекції серед СПАР. Було показано, що положення в сексуальній мережі більшою мірою визначає ризик інфікування ІПСШ, ніж такі показники, як вік, стать, кількість партнерів, частота застосування презервативів. Зокрема, індивідууми, що знаходяться всередині мереж, з двома і більше членами в 5 разів більше схильні до інфікування ІПСШ та/або ВІЛ порівняно з членами «діад». Знаходження всередині мережі несе велику ймовірність зараження незалежно від того, чи знаходяться вони в центрі зіркоподібного компонента або всередині розгалуження. А індивідууми, що мають одного партнера, так само мають високий ризик бути інфікованими, якщо вони знаходяться на периферії великої мережі, оскільки пов’язані через свого партнера з іншими людьми, які мають багато статевих контактів. Також було вперше показано, що ступінь «центральності» не збільшує ризик у тих, хто має кілька партнерів. Іншими словами, чи знаходиться пацієнт у центрі «зірки», тобто має багато моногамних партнерів, або в центрі розгалуження, тобто має як моногамних, так і полігамних партнерів, ризик інфікуватися приблизно однаковий.
Типологія сексуальних мереж визначає ризик зараження ІПСШ/ВІЛ у СПАР. Можна впливати на структуру мереж за допомогою різних заходів і тим самим знизити ризик зараження ІПСШ/ВІЛ. Важливим також є встановлений факт, що наявність одного партнера, навіть тривалий час, не є обов’язково показником низького ризику зараження ІПСШ, і також кількість партнерів може не мати істотного значення для такого ризику. Це добре узгоджується з недавніми роботами щодо оцінки соціометричних показників, ризикованої статевої поведінки як факторів ризику зараження ІПСШ/ВІЛ статевим шляхом, де здавалося би, очевидні чинники виявилися несуттєвими [3, 4, 153]. У попередніх епідеміологічних дослідженнях не враховувався той факт, що ризик реалізується через статевий контакт, який є результатом певної соціальної взаємодії. Тому у власному дослідженні набагато більше значення мало положення індивідуума в статевій соціальній мережі, ніж наявність «традиційних» факторів ризику. Раніше у власних роботах було показано, що важливим є не просто збирання анамнезу пацієнта, але й встановлення його соціальних контактів з наступною побудовою сексуальної мережі та цілеспрямованим проведенням профілактичних заходів [28, 32].
Важливою доробкою є розуміння того, що структура мережі, особливо її щільність, відбиває інтенсивність поширення ІПСШ у субпопуляції наркозалежних осіб, яку не можна встановити при простому аналізі захворюваності на рівні області, міста, району. Сам по собі показник захворюваності не відображає внутрішніх тенденцій – чи то до подальшого зростання, чи до стабілізації або спаду епідемічного процесу. Це можна буде зрозуміти ретроспективно – через кілька років. А ось аналіз сексуальних мереж дозволяє оцінити епідемічну фазу вже зараз і заздалегідь спланувати відповідні заходи. Так, при високій захворюваності потенційно низька інтенсивність подальшого поширення ІПСШ асоціюється з фрагментованими «дендритними» мережами, які не мають циклічних структур, а висока інтенсивність поширення продукує щільні мережі з великою кількістю циклічних мікроструктур. Тому у фазі зростання мають переважати розгалужені мережі з великою кількістю статевих партнерів, у фазі стабілізації – великі циклічні структури, а у фазі спаду – лінійні структури, що обриваються. У даному дослідженні це видно на прикладі ВІЛ-інфекції та ІПСШ. При ВІЛ-інфекції має місце як би «насичення» при досить високій захворюваності без подальшого зростання, але і без тенденції до стабільного падіння. При спостереженні за кількістю випадків ІПСШ у різних популяціях, зростання захворюваності значною мірою можна пояснити тим, що система лабораторної діагностики переходить на молекулярно-біологічні методи (ПЛР, ліганзан ланцюгова реакція). Тому статистичне зростання деяких ІПСШ (хламідіоз, мікоплазмоз) відображає здебільшого поліпшення виявлення і, ймовірно, припиниться в найближчому майбутньому. Методологія аналізу сексуальних мереж дозволить зосередити зусилля на тих людях, які дійсно відповідальні за поширення ІПСШ. Якщо враховувати тільки кількість партнерів, то можна втратити багато пацієнтів, які, маючи тільки двох партнерів, є ключовими у формуванні локальних епідемічних осередків. Якщо є інформація про те, яка структура сексуальних мереж переважає, то можна визначити, що буде більш ефективним – впливати на ядерні групи (у разі великих замкнутих мереж із внутрішніми циклічними структурами), або на все населення (при наявності ізольованих мереж, що обриваються).
Таким чином на підставі багатьох досліджень інших авторів, і перш за все власних досліджень стає очевидним, що профілактика ІПСШ має бути невід’ємною частиною заходів щодо забезпечення здоров’я нації. На підставі ретельних клінічних, лабораторних, епідеміологічних та соціальних досліджень розроблено програму профілактичних та організаційних заходів із боротьби зі статевими інфекціями серед СПАР. Програма боротьби з ІПСШ покликана служити керівництвом при здійсненні оперативних заходів у напрямку досягнення зниження розповсюдження ІПСШ серед населення України.
Зокрема, програма має бути націлена на досягнення наступних завдань:
– посилити підтримку профілактики ІПСШ серед СПАР з боку уряду і міжнародних партнерів з розвитку;
– стимулювати залучення коштів та перерозподіл ресурсів з урахуванням національних пріоритетів, які забезпечать ефективність допомоги наркозалежним;
– забезпечити зниження негативного ставлення і врахування гендерного чинника в політиці щодо надання допомоги у зв’язку з ІПСШ;
– використовувати потенціал міжнародних партнерів та інститутів з метою розширення і підтримки заходів з профілактики ІПСШ серед СПАР.
Згідно запропонованої програми ефективне попередження ІПСШ і надання допомоги хворим, що зловживають наркотиками, може бути забезпечено за допомогою комплексу заходів з боку громадської охорони здоров’я:
– пропаганди безпечної статевої поведінки;
– сприяння ранньому зверненню за медичною допомогою;
– включення ІПСШ в Державну програму боротьби зі споживанням ПАР.
Необхідний комплексний підхід до ведення хворих, що включає:
– виявлення синдромів характерних для ІПСШ;
– відповідне етіотропне лікування синдрому;
– консультування щодо способів запобігання або зниження ризику інфекції;
– сприяння правильному і систематичному використанню презервативів;
– оповіщення і залучення статевих партнерів.
ВИСНОВКИ
У дисертації наведено теоретичне узагальнення і нове вирішення наукового завдання, що полягає у попередженні сифілісу та інших ІПСШ серед СПАР шляхом покращення діагностики, лікування та соціальної допомоги на підставі епідеміологічних та клінічних особливостей.
- Сифіліс та інші ІПСШ у СПАР – актуальна проблема в Україні, яку неможна відокремлювати від епідемії ВІЛ/СНІДу. Існують нерівномірності в поширенні сифілісу серед СПАР, немає систематизації чинників ризику. Також не встановлено деталі сексуальної поведінки. У програмах «зниження шкоди» для наркозалежних дуже мало приділяється уваги сифілісу та іншим ІПСШ. Не вивчено регіональні особливості епідеміології та клініки сифілісу на рівні загальної популяції, невідомі клініко-серологічні особливості сифілісу у СПАР. Без цих знань неможлива ефективна боротьба із сифілісом та іншими ІПСШ.
- В загальній популяції має місце зниження захворюваності на сифіліс за типом експоненти. Однак в окремі роки спостерігається збільшення сифілісу на рівні районів. Активне виявлення сифілісу збільшується. Серологічне обстеження соматичних хворих – найбільш результативний спосіб виявлення (36,2 %). Ефективність обстеження декретованих професій знижується – з 19,1 % до 12,2 %. Обстеження вагітних дає близько 7 % випадків. Роль донорів у виявлені сифілісу зростає – від 0,9 % до 8,7 %. Відбуваються зміни у структурі діагнозу. Прихований сифіліс переважає – 79,2 % хворих. Частішають випадки пізнього сифілісу. Має місце патоморфоз сифілісу. З 2010 року спостерігається: подовження інкубаційного періоду (на 3,5 дні), збільшення атипових шанкерів (з 16,7 % до 25,0 %), зменшення частоти розеоли (з 63,3 % до 40,0 %) і папул на долонях і підошвах (з 63,3 % до 45,0 %), збільшення частоти папул порожнини рота (з 56,7 % до 70,0 %), почастішання алопеції (з 3,3 % до 10,0 %).
- Залежність від ПАР поєднується з ІПСШ та ВІЛ (78,4 %), жінки схильні до більш високого ризику (85,8 %), ніж чоловіки (72,3 %), у жінок гепатити В і С, сифіліс і ВПГ-2 асоційовані з наданням сексуальних послуг за винагородження і насильством з боку партнерів. Серед ІПСШ найчастішою є трихомонадна інвазія (у жінок – до 80 %), мікоплазмоз (45,2 %). Серед ПАР більшість складають опіати (37 %), та психостимулятори (34 %). До 30 % наркозалежних вживають дезоморфін, метадон, галюциногени та інші ПАР. Ін’єкційний шлях уведення збільшує ризик отримання ВІЛ, однак спостерігається також високий відсоток ВІЛ-інфікованих серед неін’єкційних СПАР – 23 %, більше того, частота бактеріальних ІПСШ у неін’єкційних наркозалежних осіб вища, ніж у СІН, проте у СІН частіше траплялися вірусні ІПСШ – гепатити В і С, герпес (до 2/3 наркозалежних).
- Сифіліс продовжує циркулювати серед СПАР – 6,3 % мали цю інфекцію, причому жінки у 2 рази більше схильні до зараження, ніж чоловіки (відповідно 9,6 % і 4,8 %). Найбільша кількість хворих на сифіліс серед осіб віком 20–30 років. У віці до 30 років переважають жінки (66,7 %) порівняно з чоловіками (50 %), після 40 років – чоловіки (22 % і 11 %). Домінують приховані форми сифілісу (77 %). Серед активних проявів переважають папули порожнини рота (85,7 %), папули на долонях і підошвах (71,4 %), папули на тулубі (57,1 %). Супутні захворювання мають усі СПАР, хворі на сифіліс. Акушерсько-гінекологічна патологія виявляється у 48,1 % жінок, серцево-судинні захворювання – у 41,8 % осіб, цукровий діабет – у 10,9 %, дерматологічна патологія – у 58,2 %. Супутні статеві інфекції мають місце у половини (майже 53 % пацієнтів). Хворі на сифіліс СПАР мають низькі титри нетрепонемних серологічних тестів (РЗКк, РМП, РПР). Трепонемні тести (РЗКт, РІФ-абс, РІФ-200, ІФА та РПГА), як правило, позитивні у високих титрах.
- У СПАР спостерігається підвищення спонтанної та індукованої продукції прозапальних цитокінів (ІЛ-1, -8) та зниження продукції ІНФ-γ, що свідчить про зниження компенсаторних можливостей моноцитарно-макрофагальної системи. Виявлений високий рівень ІЛ-1 спричиняє дисбаланс цитокінової системи. Цей дисбаланс унеможливлює елімінацію патогенних збудників. Високі концентрації прозапальних цитокінів (ІЛ-1, -6, -8), а також ТФР-β при зниженні синтезу ІНФ-γ можна використовувати як ознаки несприятливого перебігу сифілісу у СПАР.
- Вживання ПАР поєднується з ризикованою статевою поведінкою: 22,7 % осіб починають статеве життя у віці до 14 років; 61,1 % – у віці 14–17 років. Більшість хворих (86,6 %) мають більше одного статевого партнера. Для 95,9 % СПАР властиві випадкові зв’язки та груповий секс; 39,0 % наркозалежних мають контакти з жінками комерційного сексу. Менше половини (41,3 %) пацієнтів використовують презервативи. У СПАР виявляються депресивні розлади (зокрема, у 23,3 % – сильна депресія). До 20 % мають високий рівень безнадійності в оцінці суб’єктивного майбутнього. Жінки більш схильні до депресії (р ≈ 0,02), здебільшого ті, які надавали сексуальні послуги за винагородження (р ≈ 0,05), а також мали досвід насильства (р ≈ 0,011). При проведенні поведінкових інтервенцій у субпопуляції СПАР необхідно враховувати особливості їхнього психічного статусу.
- Розмір і структура сексуальних мереж відображає поширення ІПСШ та ВІЛ-інфекції в конкретному соціумі на певній території, а позиція індивідуума в мережі визначає ризик інфікування. Індивідууми, що знаходяться всередині мереж, з двома і більше членами в 5 разів більше схильні до інфікування порівняно з членами «діад». Індивідууми, що мають одного партнера, можуть мати високий ризик, якщо знаходяться на периферії великої мережі. Ступінь «центральності» не збільшує ризик членів мережі, що мають кілька партнерів. Іншими словами, чи знаходиться пацієнт у центрі «зірки» (має багато моногамних партнерів) або в центрі «розгалуження» (має як моногамних, так і полігамних партнерів), ризик інфікуватися приблизно однаковий (OR = 7,8 і OR = 7,7). При розробці профілактичних заходів необхідно враховувати фазу епідемічного процесу. З початку епідемії мережі зв’язані множинними короткими «петлями», у фазі стабілізації переважають незв’язані довгі гіллясті структури. У ранній фазі епідемії ефективніше впливати як на загальну популяцію, так і на індивідууми в центрі мереж (консультування, патронажна робота), а в пізній ендемічній фазі краще проводити інформаційні й освітні кампанії та загальний скринінг.
- Розроблено програму заходів із боротьби з ІПСШ серед СПАР. Основні елементи програми: підтримка з боку державної системи охорони здоров’я, міжнародних партнерів та неурядових організацій; перерозподіл ресурсів з урахуванням пріоритетів; зниження негативного ставлення до наркозалежних; врахування гендерного чинника. Створено модель поведінкового втручання (медико-соціально-психологічний супровід у поєднанні з груповими тренінгами), що враховують особливості психології та статево-рольової поведінки. Суттєві елементи моделі: безпечна статева поведінка; раннє звернення за медичною допомогою; використання швидких діагностичних тестів, лікування синдромів ІПСШ; консультування щодо зниження ризику; сприяння використанню презервативів; залучення статевих партнерів.
РЕКОМЕНДАЦІЇ
При консультуванні СПАР стосовно ВІЛ необхідне обстеження на сифіліс та інші ІПСШ, а також на генітальний герпес і гепатит В і С. Хворим рекомендовано визначати ІЛ-1, -6, -8, а також ТФР-β та ІНФ-γ для виявлення ознак несприятливого перебігу захворювання. Високі концентрації ІЛ-1, -6, -8, а також ТФР-β при зниженні ІНФ-γ в сироватці та сечі дають підстави призначати додаткову терапію.
Рекомендовано проводити аналіз сексуальних мереж щодо розповсюдження ІПСШ та ВІЛ-інфекції серед СПАР. При розробці профілактичних заходів необхідно враховувати фазу епідемії. У ранній фазі рекомендована індивідуальна патронажна робота, а в пізній ендемічній фазі ефективнішими є освітні кампанії та скринінг.
При профілактиці ІПСШ та гемоконтагіозних інфекцій треба враховувати особливості психології та статево-рольової поведінки з акцентом на попередження фізичного та психологічного насильства стосовно жінок, споживачів ПАР.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Актуальні тенденції поширення залежності від психоактивних речовин в Україні: Щорічний аналітичний огляд / І.В. Лінський, М.В. Голубчиков, О.І. Мінко та ін. Харків, 2006. Вип. ІІІ. 46 с.
- Андрейчин М.А. Інфекційні хвороби i демографічна криза в Україні. Журнал АМН України. 2007. Т. 13, № 3. С. 533–542.
- Анфілова М.Р. Алгоритм оцінки ризику інфікованості Chlamydia trachomatis, Ureaplasma urealyticum та Micoplasma genitalium. Дерматологія та венерологія. 2016. № 2 (72). С. 13–24.
- Анфілова М.Р. Соціальний портрет сучасного підлітка із захворюваннями, що передаються статевим шляхом. Український журнал дерматології, венерології, косметології. 2012. № 3 (46). С. 144–147.
- Белан Э.Б., Желтова А.А. Применение иммуномодуляторов в лечении заболеваний респираторного тракта. Лекарственный вестник. 2017. Т. 11, № 3 (67). С. 24–31.
- Бондаренко Г.М. Определение содержания цитокинов периферической крови при болезни Рейтера. Дерматологія та венерологія. 2004. № 1 (23). С. 18–
- Взаимосвязь активности синтеза цитокинов (гамма-интерферона, интерлейкина-10) и HLA-фенотипа у больных с хроническим мочеполовым хламидиозом / А.Ф. Возианов, Г.Н. Дранник, Т.С. Монтаг и др. Український журнал дерматології, венерології, косметології. 2002. № 2 (5). С. 57–60.
- Вирусные гепатиты: клиника, диагностика, лечение / Н.Д. Ющук, Е.А. Климова, О.О. Гнойко и др. М. : «ГЭОТАР-Медиа», 2014. 160 с.
- ВІЛ-інфекція в Україні. Інформаційний бюлетень. К. : Державна установа «Центр громадського здоров’я Міністерства охорони здоров’я України», Державна установа «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», 2017. № 47. 148 с.
- Вышинский К.В., Павловская Н.И., Кошкина Е.А. Проблемы, связанные с употреблением алкоголя среди молодежи. Вопросы наркологии. 2011. № 1. С. 81–101.
- Гамалея Н.Б. Нарушения функций иммунной системы при алкогольной и наркотической зависимости. Наркология: Национальное руководство / Под ред. Н.Н. Иванца, И.П. Анохиной, М.А. Винниковой. М. : ГЭОТАР-медиа, 2008. С. 116–
- Деякі аспекти мікоплазмозу у чоловіків, з урахуванням показників цитокінового профілю / Т.В. Осінська, Т.В. Федорович, С.В. Унучко та ін. Дерматологія. Косметологія. Сексопатологія. 2016. № 3–4 (4). С. 56–57.
- Доскожаева С.Т. Оппортунистические инфекции и вторичные заболевания при ВИЧ-инфекции. Журнал Алматинского государственного института усовершенствования врачей. 2011. № 1. С. 20–22.
- Дранник Г.Н. Клиническая иммунология и аллергология: пособие для студентов, врачей-интернов, иммунологов, аллергологов, врачей лечебного профиля всех специальностей. 4-е изд., доп. К. : Нова книга, 2010. 552c.
- Захаров С.В. Ранній прихований сифіліс: у фокусі соціальні, епідеміологічні та медичні чинники. Дерматологія та венерологія. № 1. С. 44–49.
- Изучение особенностей употребления алкоголя населением г. Ярославля / Е.А. Кошкина, К.В. Вышинский, О.И. Гусева и др. Вопросы наркологии. 2014. № 3. С. 106–119.
- Инфекции, передающиеся половым путем, и социальная характеристика клиентов женщин коммерческого секса / Г.И. Мавров, Ю.В. Щербакова, Л.И. Пиньковская, В.И. Миронюк. Дерматологія та венерологія. 2013. № 4 (62). С. 44–55.
- Инфекции, передаваемые половым путем (ИППП) и ВИЧ-инфекция в группах риска. Распространяются ли возбудители по одним и тем же сетям? / С.Л. Плавинский, А.Н. Баринова, К.М. Ерошина и др. Российский семейный врач. 2009. № 1. С. 26–31.
- Ільїнська І.Ф. Варіанти вторинної імунологічної недостатності, їх діагностичні критерії та принципи імунокорекції (аналітичний огляд). Лаб. діагностика. 2010. № 4. С. 17–23.
- Каменєв В.І. Сучасні проблеми захворювань, що передаються статевим шляхом, в Полтавському регіоні України. Дерматологія та венерологія. 2002. № 4 (18). 57–59.
- Киржанова В.В. Медико-социальные последствия инъекционного употребления наркотиков в России (методы оценки и предупреждения) : Автореф. дисс. … д-ра мед. наук : 14.00.45. М., 2009. 35 с.
- Кобзарь А.И. Прикладная математическая статистика. Для инженеров и научных работников. М. : Физматлит, 2012. 816 с.
- Кошкина Е.А., Киржанова В.В. Основные показатели деятельности наркологической службы в Российской Федерации в 2007-2008 годах : Статистический сборник. М. : ФГУ ННЦ наркологии, 139 с.
- Кошкина Е.А., Киржанова В.В. Эпидемиология наркологических заболеваний / Под ред. Н.Н. Иванца, И.П. Анохиной, М.А. Винниковой. М. : ГЭОТАР-Медиа, 2011.
- Мавров Г.И. Хламидийные инфекции: биология возбудителей, патогенез, клиника, диагностика, лечение, профилактика. Монография. К. : Геркон, 2005. 524 c.
- Мавров Г.И., Каменев В.И., Миронюк В.И. Амбулаторное лечение больных ранним сифилисом дюрантными пенициллинами в сочетании с доксициклином. Дерматовенерология. Косметология. Сексопатология. 2016. № 1–4. С. 214–219.
- Мавров Г.И., Нагорный А.Е. Иммунные нарушения при половых инфекциях множественной этиологии (Herpes simplex-2, Chlamydia trachomatis, Ttrichomonas vaginalis). Український журнал дерматології, венерології, косметології. 2010. № 3 (38). С. 117–122.
- Мавров Г.И., Нагорный А.Е., Кочетова Н.В. Анализ сексуальных сетей при инфекциях, передающихся половым путем, – новое направление исследований и практической деятельности. Дерматологія та венерологія. 2010. № 2 (48). C. 18–29.
- Мавров Г.И., Нагорный А.Е., Чинов Г.П. Инфекции, передающиеся половым путем, и проблема сексуального и репродуктивного здоровья. Клінічна імунологія. Алергологія. Інфектологія. 2010. № 1. С. 5–15.
- Мавров Г.И., Осинская Т.В. Проблема сифилиса в местах лишения свободы. Журнал дерматовенерології та косметології ім. М.О.Торсуєва. 2013. № 1–2 (30). С. 135–
- Мавров Г.И., Щербакова Ю.В., Миронюк В.И. Эпидемиология латентного раннего сифилиса. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2016. № 1–2. С. 60–68.
- Мавров Г.И., Ярошенко А.А. Географическая концентрация инфекций, передающихся половым путем – неравномерность распространения в условиях крупного города. Дерматологія та венерологія. 2008. № 1 (39). C.90–116.
- Мавров Г.І., Бондаренко Г.М., Щербакова Ю.В. Особливості ведення пацієнтів з груп населення, уразливих щодо зараження ВІЛ. Дерматовенерологія. Косметологія. Сексопатологія. 2012. № 1– С. 240–246.
- Мавров Г.І., Маняк Н.В., Миронюк В.І. Динаміка поширення та клініко-епідеміологічні особливості сифілісу в Рівненській області. Дерматологія та венерологія. 2018. № 3 (81). С. 66–73.
- Мавров Г.І., Миронюк В.І. Залежність від психоактивних речовин як чинник інфікування ІПСШ та ВІЛ. Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я. Зб. наук. праць, під. ред. П.П. Рижка. 2018. Вип. 15. С. 229–237.
- Мавров Г.І., Миронюк В.І. Інфекції, що передаються статевим шляхом, серед осіб, які споживають психоактивні речовини. VII Міжнародний медичний конгрес : Тез. доп., м. Київ, 25 квітня 2018 р. К., 2018. С. 140.
- Мавров Г.І., Миронюк В.І. Сифіліс серед споживачів психоактивних речовин: клініко-епідеміологічні та серологічні особливості. Дерматовенерологія. Косметологія. Сексопатологія. 2017. № 1–4. С.148–152.
- Мавров Г.І., Миронюк В.І. Сифіліс у споживачів психоактивних речовин: систематичний огляд літератури. Дерматологія та венерологія. 2014. № 3 (65). С. 15–30.
- Мавров Г.І., Миронюк В.І., Осінська Т.В. Інфекції, що передаються статевим шляхом, та гемоконтагіозні інфекції серед осіб, які споживають психоактивні речовини: поширеність і ризики зараження. Матеріали науково-практичної конференції з міжнародною участю «Питання профілактики, сучасна діагностика та інноваційні методи терапії в дерматовенерології», 15–16 листопада 2018 р., м. Харків. Дерматологія та венерологія. 2018. № 3 (81). С. 95–96.
- Мавров Г.І., Миронюк В.І., Осінська Т.В. ІПСШ та ВІЛ-інфекція, серед осіб, які споживають психоактивні речовини. Матеріали Всеукраїнської науково-практичної конференцію з міжнародною участю “Сучасні технології у вирішенні клінічних і діагностичних задач дерматокосметології та інфекцій, що передаються статевим шляхом” (м. Святогірськ, 17-18 травня 2018 р.). Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2018. № 1 (39). С. 96.
- Мавров Г.І., Миронюк В.І., Осінська Т.В. Розповсюдження інфекцій, що передаються статевим шляхом серед споживачів психоактивних речовин – аналіз сексуальних мереж. Дерматологія та венерологія. 2018. № 2 (80). С. 35–42.
- Мавров Г.І., Нагорний О.Є., Миронюк В.І. Реабілітація хворих з хронічними запальними процесами в сечостатевих органах. Дерматологія та венерологія. 2016. № 4 (74). С. 72–78.
- Мавров Г.І., Фучижи І.С., Пиньковська Л.Й. Епідемічна ситуация і організація боротьби з інфекциями, що передаються статевим шляхом в Одеській області. Журнал дерматовенерології та косметології ім. М.О.Торсуєва. 2013. № 1-2 (30). С. 127–
- Мавров Г.І., Щербакова Ю.В. Особливості надання дерматовенерологічної допомоги представникам груп ризику, уразливим щодо зараження ВІЛ. Дерматологія та венерологія. 2012. № С. 9–18.
- Мавров Г.І., Щербакова Ю.В., Миронюк В.І. Інфекції, що передаються статевим шляхом серед споживачів психоактивних речовин – чинники ризику та напрями профілактики. Дерматологія та венерологія. 2018. № 1 (79). С. 31–38.
- Мавров І.І. Статеві хвороби: Пер. з рос. Тернопіль : ТДМУ, 2005. 716с.
- Мазус А.И., Левен И.И., Виноградов Д.Л. Неврологические проявления ВИЧ-инфекции. Клиническая медицина. 2009. № С. 59–60.
- Междисциплинарное взаимодействие в диагностике наркологических заболеваний и инфекций, передающихся половым путем / С.А. Корякин, И.Г. Шакуров, Е.О. Кузнецова, Н.И. Алтавил. Наркология. Т. 8, № 11. С. 32–34.
- Миронюк В.І. Інфекції, що передаються статевим шляхом, серед осіб, які споживають психоактивні речовини – розповсюдженість та ризики зараження. Укр. журн. дерматол., венерол., косметол. 2018. № 1 (68). С. 67–71.
- Миронюк В.І. Лікування сифілісу у ВІЛ-інфікованих – історичний екскурс та сучасна невизначеність (огляд літератури). Актуальні питання дерматології, венерології і ВІЛ/СНІД інфекції: Збірник наукових праць. Х. : изд-во «С.А.М.», 2015. С. 117–126.
- Миронюк В.І. Сифіліс у ВІЛ-інфікованих пацієнтів – концепція лікування (огляд літератури). Дерматологія та венерологія. 2015. № 2 (68). С. 20–29.
- Мультидисциплинарная модель профилактики инфекций, передаваемых половым путем, в группе потребителей инъекционных наркотиков / Т.В. Красносельских, А.В. Шаболтас, Р.В. Скочилов, Г.Е. Ураева. Вестн. дерматол. и венерол. 2016. № 3. С. 62–68.
- Нагорный А.Е. Роль сексуальных сетей в эпидемиологии инфекций, передающихся половым путем. Журнал дерматовенерологии и косметологии им. Н.А. Торсуева. 2011. № 3–4 (26). С. 63–69.
- Нейросифіліс на сучасному етапі: патогенез, клініка, діагностика, лікування / Г.І. Мавров, Е.Л. Баркалова, Л.Й. Пиньковська, В.І. Миронюк. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2014. № 1-2 (32). С. 114–
- Нові підходи до діагностики та лікування ІПСШ в групах населення, уразливих щодо зараження ВІЛ (методичний посібник) / Г.І. Мавров, Г.М. Бондаренко, Ю.В. Щербакова та ін.; МОЗ України, НАМН України. Харків, 2013. 48с.
- Окремі показники цитокінового статусу у хворих на сифіліс споживачів психоактивних речовин / Г.І.Мавров, В.І. Миронюк, Ю.В. Щербакова, Т.В. Осінська. Дерматологія та венерологія. 2018. № 4 (82). С. 13–16.
- Операционное исследование доступа к услугам по профилактике, лечению и сопровождению лечения ВИЧ-инфекции/СПИДа в условиях вооруженного конфликта на Востоке Украины (по заказу Программного Комитета Национального Совета по вопросам противодействия туберкулезу и ВИЧ-инфекции/СПИДу). К. : ЮНЕЙДС в Україні, 2016. 125 c.
- Организация медицинской помощи по ИППП/ВИЧ-инфекции для мужчин, имеющих секс с мужчинами, в Москве и Московской области / А.А. Кубанова, М.М. Васильев, И.А. Тоскин и др. Вестн. дерматол. и венерол. № 3. С. 16–17.
- Особенности употребления психоактивных веществ среди населения отдельных регионов России / Е.А. Кошкина, К.В. Вышинский, Н.И. Павловская и др. Наркология. 2010. № 4. С. 16–24.
- Особливості консультування на ВІЛ-інфекцію підлітків : Навчальний посібник для самостійної роботи / Г.І. Мавров, Л.Г. Ніколаєва, В.О. Савоськіна та ін. Харків: СПД ФО Степанов В.В., 2018, 34 с.
- Особливості консультування на ВІЛ-інфекцію працівників комерційного сексу : Навчальний посібник для самостійної роботи / Г.І. Мавров, Л.Г. Ніколаєва, В.О. Савоськіна та ін. Харків: СПД ФО Степанов В.В., 2017, 33 с.
- Особливості консультування на ВІЛ-інфекцію споживачів ін’єкційних наркотиків : Навчальний посібник для самостійної роботи / Г.І. Мавров, Л.Г. Ніколаєва, В.О. Савоськіна та ін. Харків: СПД ФО Степанов В.В., 2018. 32 с.
- Особливості консультування на ВІЛ-інфекцію ув’язнених та засуджених : Навчальний посібник для самостійної роботи / Г.І. Мавров, Л.Г. Ніколаєва, В.О. Савоськіна та ін. Харків: СПД ФО Степанов В.В., 2017, 27 с.
- Особливості мотиваційного консультування осіб з інфекціями, що передаються статевим шляхом, з метою формування безпечної статевої поведінки : Навчально-методичний посібник для самостійної роботи / Г.І. Мавров, Ю.В. Щербакова, Г.М. Бондаренко та ін. Харків: СПД ФО Степанов В. В., 2018. 36 с.
- Пат. на корисну модель 97172 UA, МПК А61В10/00. Спосіб обмеження поширення ВІЛ/СНІД та інфекцій, що передаються статевим шляхом, хворими груп підвищеного ризику / Г.І. Мавров, Г.М. Бондаренко, Ю.В. Щербакова, Л.В. Іващенко, Л.Й. Піньковська, В.І. Миронюк; заявник і патентовласник ДУ „Інститут дерматології та венерології НАМНУ”. № u201406144; заявл. 04.06.14; опубл. 10.03.15, Бюл. № 5.
- Показники лікувально-профілактичної допомоги хворим шкірними і венеричними захворюваннями в Україні / Відп. за вип. В.М. Заболотько. К. : Центр медичної статистики МОЗ України, 2018.
- Проблеми наркозалежності та аспекти сучасної медико-соціальної допомоги / С.І. Табачніков, М.Ю. Ігнатов, Є.М. Харченко та ін. Архів психіатрії. 2009. № 2 (57). С. 83–
- Распространенность инфекций, передаваемых половым путем, среди лиц, потребляющих психоактивные вещества / И.Г. Шакуров, С.А. Корякин, Е.Д. Кузнецова, Р.К. Кирасиров. Вестн. дерматол. и венерол. 2010. № 1. С. 15–19.
- Рекомендації з проведення добровільного консультування і тестування на інфекції, що передаються статевим шляхом, представників різних груп населення. Порядок проведення дотестового та післятестового консультування / Г.І. Мавров, Ю.В. Щербакова, Г.М. Бондаренко та ін. Харків : СПД ФО Степанов В. В., 2018. 42 с.
- Симбирцев А.С. Интерлейкин-1. Физиология. Патология. Клиника. СПб. : ООО «Изд-во Фолиант», 2011. 480 с.
- Скороходкина О.В., Лунцов А.В. Глюкозаминилмурамилдипептид в терапии пациентов с атопической бронхиальной астмой и клиническими проявлениями синдрома вторичной иммунной недостаточности. Российский аллергологический журнал. 2017. Т. 14, № 6. С. 91–97.
- Скороходкина О.В., Лунцов А.В. Характеристика синдрома вторичной иммунной недостаточности и возможности его коррекции у пациентов в многопрофильном стационаре. Практическая медицина. 2012. № 6. С. 161–165.
- Удосконалення лабораторної діагностики сифілісу в Україні (методичні рекомендації) / О.І. Літус, Я.Ф. Кутасевич, В.В. Кутова та ін. К. : МОЗ України, НАМН України, 2019. 26 с.
- Уткина Е.Ю. Проблемы наркомании среди молодежи и способы их профилактики. Ученые заметки ТОГУ. 2013. Т. 4, № 4. С. 569–573.
- Федеральные клинические рекомендации по диагностике и лечению синдрома зависимости / Т.В. Агибалова, В.Б. Альтшулер, М.А. Винникова и др. М., 2014. 57 с.
- Чинов Г.П. Структура заболеваемости сифилисом и гонореей в трех различных экономико-географических зонах Крыма. Журн. дерматологии и венерологии. 1999. № 2 (8). С. 96–97.
- Щербакова Ю.В. Вміст секреторного імуноглобуліну класу А як критерій оцінки стану місцевого імунітету у хворих різних груп населення з інфекціями, що передаються статевим шляхом. Дерматологія та венерологія. 2015. № 3 (69). С. 50–58.
- Щербакова Ю.В. Инфекции, передающиеся половым путем, и ВИЧ: проблема взаимовлияния. Дерматологія та венерологія. 2011. № С. 5–12.
- Щербакова Ю.В. Особливості взаємодії дерматовенерологічної та наркологічної служб при наданні допомоги пацієнтам наркологічного закладу з ІПСШ. Дерматологія та венерологія. 2015. № 2 (68). С. 94–102.
- Щербакова Ю.В., Миронюк І.С. Підсумки роботи навчальних семінарів для лікарів-дерматовенерологів «Основні принципи синдромного підходу лікування ІПСШ у представників уразливих щодо ІПСШ/ВІЛ груп населення» з імплементацією нового посібника ВООЗ/ФНООН/ЮНЕЙДС «Реалізація комплексних програм з боротьби з ВІЛ/ІПСШ серед робітників секс-індустрії: практичні підходи на основі сучасних заходів». Дерматологія та венерологія. 2014. № 2 (64). С. 83–85.
- A prospective study of syphilis and HIV infection among injection drug users receiving methadone in the Bronx / M.N. Gourevitch, D. Hartel, E.E. Schoenbaum et al. American Journal of Public Health. 1996. Vol. 86. P. 1112–1115.
- A Systematic Review of HIV and STI Behavior Change Interventions for Female Sex Workers in the United States / N. Abad, B.N. Baack, A. O’Leary et al. AIDS Behav. 2015. Vol. 19, Iss. 9. P. 1701–1719.
- Alarming epidemics of human immunodeficiency virus and hepatitis C virus among injection drug users in the northwestern bordering state of Punjab, India: prevalence and correlates / S. Panda, T. Roy, S. Pahari et al. Int J STD AIDS. 2014. Vol. 25, Iss. 8. P. 596–606.
- Association between recreational drug use and sexual practices among people who inject drugs in Southwest China: a cross-sectional study / S. Su, L. Zhang, F. Cheng et al. BMJ Open. 2018. Vol. 8, Iss. 6. Article ID e019730.
- Azim T., Bontell I., Strathdee S. Women, drugs and HIV / Int J Drug Policy. 2015. Vol. 26, Suppl. 1. P. S16–S21.
- Barber T.J., Quartin M., Browne R. Audit of early syphilis: a North London comparison. Int J STD AIDS. 2010. Vol. 21, Iss. 2. P. 151–152.
- Bloodborne sexually transmitted infections in patients presenting for substance abuse treatment in Jamaica / G. Dowe, M.F. Smikle, C. Thesiger, E. Williams. Sexually Transmitted Diseases. 2001. Vol. 28, No. 5. P. 266–269.
- Can Social Network Analysis Help Address the High Rates of Bacterial Sexually Transmitted Infections in Saskatchewan? / A. Trecker, J.R. Dillon, K. Lloyd et al. Sexually Transmitted Diseases. 2017. Vol. 44. Р. 338–343.
- Characteristics and predictors of HIV risk behaviors among injection-drug-using men and women in St. Petersburg, Russia / A.M. Somlai, J.A. Kelly, E. Benotsch et al. AIDS Educ Prev. 2002. Vol. 14, Iss. 4. P. 295–305.
- Chesson HW, Owusu-Edusei K Jr. Relative Impact of Different Strategies for Allocating Federal Funds for Syphilis Prevention. Sex Transm Dis. 2018. Vol. 45, Iss. 9S, Suppl. 1. P. S72–S77.
- Community-based survey of HIV transmission modes among intravenous drug users in Sicuani, China / Y. Ruan, K. Chen, K. Hong et al. Sexually Transmitted Diseases. 2004. Vol. 31. P. 623–627.
- Correlates to seroprevalent herpes simplex virus type 2 among rural Appalachian drug users / D.B. Stephens, M. Young, U.L. Mullins, J.R. Havens. J Med Virol. 2016. Vol. 88, Iss. 3. P. 512–520.
- Correlates of injection Drug Use among female sex workers in two Mexico-U.S. border cities / S.A. Strathdee, M.M. Philbin, S.J. Semple et al. Drug and Alcohol Dependence. 2008. Vol. 92. P. 132–140.
- Decreasing HIV, Syphilis, and Hepatitis C Infection After a Decade of Harm Reduction Implementation Among Drug Users in Southwestern Areas of China / Y. Chen, Z. Tang, S. Tang et al. J Stud Alcohol Drugs. 2018. Vol. 79, Iss. 2. P. 248–257.
- Drug users: A potentially important bridge population in the transmission of sexually transmitted diseases, including AIDS, in China / H. Liu, O. Grusky, X. Li, E. Ma. Sexually Transmitted Diseases. 2006. Vol. 33, No. P. 111–117.
- Dual epidemics of syphilis and methamphetamine use among drug users in Shandong Province of China / M. Liao, Kang, X. Tao et al. AIDS Care. 2013. Vol. 25, Iss. 10. P. 1236–1244.
- Effects of sex work on the prevalence of syphilis among injection drug users in 3 Russian cities / L. Platt, T. Rhodes, A. Judd et al. American Journal of Public Health. 2007. Vol. 97, No. 3. P. 478–485.
- Efficacy of a brief HIV prevention counseling intervention among STI clinic patients in Russia: a randomized controlled trial / N. Abdala, W. Zhan, A.V. Shaboltas et al. AIDS Behav. 2013. Vol. 17, Iss. 3. P. 1016–1024.
- Efficacy of HIV/STI behavioral interventions for heterosexual African American men in the United States: a meta-analysis / N. Abad, B.N. Baack, A. O’Leary et al. AIDS Behav. 2012. Vol. 16, Iss. 5. P. 1092–1114.
- Epidemics of HIV, HCV and syphilis infection among synthetic drugs only users, heroin-only users and poly-drug users in Southwest China / S. Su, L. Mao, J. Zhao et al. Sci Rep. 2018. Vol. 8, Iss. 1. P. 6615.
- Estimating the prevalence of syringe-borne and sexually transmitted disease among injection drug users in St Petersburg, Russia / N. Abdala, J.M. Carney, A.J. Durante et al. International Journal of STD & AIDS. 2003. Vol. 14, No. 10. P. 697–703.
- Gender differences in HIV risk behaviours among intravenous drug users in Catalonia, Spain / C. Folcha, J. Casabonaa, A. Espelt et al. Sanit. 2013. Vol. 27, Iss. 4. P. 338–343.
- Genital Herpes Zoster as Possible Indicator of HIV Infection / S. Ljubojević Hadžavdić, M. Kovačević, M. Skerlev, Š. Zekan. Acta Dermatovenerol Croat. 2018. Vol. 26, Iss. 4. P. 337–338.
- High seroprevalence of human herpesvirus 8 and herpes simplex virus 2 infections in men who have sex with men in Shanghai, China / Z. Liu, Fang, J. Zuo et al. J. Med. Virol. 2017. Vol. 89, Iss. 5. P. 887–894.
- High risk behaviors of injection drug users registered with harm reduction programme in Karachi, Pakistan / A. Altaf, S.A. Shah, N.A. Zaidi et al. Harm Reduction Journal. 2007. Vol. 4, No. 1. P. 7–14.
- High variability of HIV and HCV seroprevalence and risk behaviours among people who inject drugs: results from a cross-sectional study using respondent-driven sampling in eight German cities (2011-14) / B. Wenz, S. Nielsen, M. Gassowski et al. BMC Public Health. 2016. Vol. 16. P. 927.
- HIV, syphilis, and behavioral risk factors among female sex workers before and after implementation of harm reduction programs in a high drug-using area of China / L. Zhang, S. Liang, W. Lu et al. PLoS One. 2014. Vol. 9, Iss. 1. ID e84950.
- Iliceto P., Fino E. Beck Hopelessness Scale (BHS). European Journal of Psychological Assessment. 2015. Vol. 31, Iss. 1. P. 31–37.
- Impact of syphilis infection on HIV viral load and CD4 cell counts in HIV infected patients / R. Palacios, F. Jiménez-Oñate, M. Aguilar et al. Journal of Acquired Immune Deficiency Syndromes. 2007. Vol. 44, No. 3. P. 356–359.
- Impending concentrated HIV epidemic among injecting drug users in Central Bangladesh / T. Azim, M.S. Alam, M. Rahman et al. International Journal of STD & AIDS. 2004. Vol. 15, No. 4. P. 280–282.
- Incarceration history and risk of HIV and hepatitis C virus acquisition among people who inject drugs: a systematic review and meta-analysis / J. Stone, H. Fraser, A.G. Lim et al. Lancet Infect Dis. 2018. Vol. 18, Iss. 12. P. 1397–1409.
- Individual and network factors associated with prevalent hepatitis C infection among rural Appalachian injection drug users / J.R. Havens, M.R. Lofwall, S.D. Frost et al. Am J Public Health. 2013. Vol. 103, Iss. 1. P. e44–e52.
- Interventions to Improve Sexually Transmitted Disease Screening in Clinic-Based Settings / M.M. Taylor, J. Frasure-Williams, P. Burnett, I.U. Park. Sex Transm Dis. 2016. Vol. 43, Iss. 2, Suppl. 1. P. S28–S41.
- Jarlais D.C.D., Duong H.T. Ending HIV epidemics among people who inject drugs in LMICs. Lancet. 2018. Vol. 392, Iss. 10149. P. 714–716.
- Kalichman S.C., Pellowski J., Turner C. Prevalence of Sexually Transmitted Co-Infections in People Living with HIV/AIDS: Systematic Review with Implications for using HIV Treatments for Prevention. Sex Transm. Infect. 2011. Vol. 87, No. 3. P. 183–190.
- Lopez-Zetina J. Predictors of syphilis seroreactivity and prevalence of HIV among street recruited injection drug users on Los Angeles County. Sexually Transmitted Infections. 2000. Vol. 76, No. 6. P. 462–469.
- Male circumcision for HIV prevention in Papua New Guinea: a summary of research evidence and recommendations for public health following a national policy forum / A. Vallely, D.J. MacLaren, W. Kaleva et al. PNG Med J. 2011. Vol. 54, Iss. 3–4. P. 91–108.
- Methamphetamine Use Among Women Attending Sexually Transmitted Disease Clinics in Los Angeles County / S. Stahlman, Javanbakht, A. Stirland et al. Sex. Transm. Dis. 2013. Vol. 40, No. 8. – P. 632–638.
- Molecular epidemiology reveals the role of war in the spread of HIV in Ukraine / T.I. Vasylyeva, M. Liulchuk, S.R. Friedman et al. Proc Natl Acad Sci USA. 2018. Vol. 115, No. 5. P. 1051–1056.
- Morgan E., Skaathun B., Schneider J. Sexual, social, and genetic network overlap: a socio-molecular approach toward public health intervention of HIV. Am J Public Health. 2018. Vol. 108, Iss. 11. P. 1528–1534.
- Non-injection drug use and hepatitis C virus: A systematic review / R. Scheinmann, H. Hagan, C. Lelutiu-Weinberger et al. Drug and Alcohol Dependence. 2007. Vol. 89. P. 1–12.
- Omori R., Abu-Raddad L. J. Sexual network drivers of HIV and herpes simplex virus type 2 (HSV-2) transmission: A comparative mathematical modeling analysis. AIDS. 2017. 31, Iss. 12. Р. 1721–1732.
- Online interventions to address HIV and other sexually transmitted and blood-borne infections among young gay, bisexual and other men who have sex with men: a systematic review / R. Knight, M. Karamouzian, T. Salway et al. J Int AIDS Soc. 2017. Vol. 20, Iss. 3. doi: 10.1002/jia2.25017.
- Panda S., Kumar M.S. Injecting drug use in India and the need for policy and program change. Int J Drug Policy. 2016. Vol. 37. P. 115–116.
- Peer-to-peer injection: Demographic, drug use, and injection-related risk factors / S. Lamb, A.H. Kral, K. Dominguez-Gonzalez et al. Int J Drug Policy. 2018. Vol. 61. P. 44–51.
- Potential impact of implementing and scaling up harm reduction and antiretroviral therapy on HIV prevalence and mortality and overdose deaths among people who inject drugs in two Russian cities: a modelling study / J.A. Cepeda, K. Eritsyan, P. Vickerman et al. Lancet HIV. 2018. Vol. 5, Iss. 10. P. e578–e587.
- Potterat J.J., Rothenberg R.B., Muth S.Q. Network structural dynamics and infectious disease propagation. J. STD /AIDS. 1999. Vol. 10. P. 182–185.
- Prevalence and risk factors of syphilis infection among drug addicts / N. Scherbaum, B.T. Baune, R. Mikolajczyk et al. BMC Infect. Dis. 2005. Vol. 5. P. 33.
- Prevalence of Alcohol Use, Sexual Risk Behavior, and HIV Among Russians in High-Risk Settings: a Systematic Review and Meta-Analysis / C.W. Lan, L.A. Scott-Sheldon, K.B. Carey et al. Int J Behav Med. 2017. Vol. 24, Iss. 2. P. 180–190.
- R-Development Core Team. R: A language and environment for statistical computing. Vienna, Austria : R Foundation for Statistical Computing, 2018. URL: http://www.R-project.org.
- Wu J.T., Cowling B.J. Real-time forecasting of infectious disease epidemics. Hong Kong Med J. 2018. Vol. 24, Suppl. 6, Iss. 5. P. 26–29.
- Risk Factors for HIV, Viral Hepatitis, and Syphilis among Heroin Users in Northern Taiwan / -E. Wang, S.-K. Lin, S.-C. Chiang et al. Substance Use & Misuse. 2013. Vol.48, Iss. 1–2. P.89–98.
- Schwarzer G. meta: Meta-analysis. R-package version 4.9–3. 2018. URL: http://cran.at.r-project.org/web/packages/meta/index.html.
- Screening for sexually transmitted infections at a DeAddictions service in south India / M.P. Carey, V. Ravi, P.S. Chandra et al. Drug and Alcohol Dependence. 2006. Vol. 82, No. 2. P. 127–134.
- Screening for Syphilis Infection in Nonpregnant Adults and Adolescents: US Preventive Services Task Force Recommendation Statement / K. Bibbins-Domingo, D.C. Grossman, S.J. Curry et al. J. Am. Med. Assoc. 2016. Vol. 315, Iss. 21. P. 2321–2327.
- Serodiscordant partnerships and opportunities for pre-exposure prophylaxis among partners of women and men living with HIV in St. Petersburg, Russia / N. Gnatienko, J.A. Wagman, D.M. Cheng et al. PLoS One. 2018. Vol. 13, Iss. 11. ID e0207402.
- Sexual network position and risk of sexually transmitted infections / M. Fichtenberg, S.Q. Muth, B. Brown et al. Sex. Transm. Infect. 2009. Vol. 85. P.493–498.
- Sexual behavior and network characteristics and their association with bacterial sexually transmitted infections among black men who have sex with men in the United States / H.M.Scott, Irvin, L. Wilton et al. PLoS One. 2015. Vol. 10, Iss. 12. Article ID e0146025.
- Sexual networks of pregnant women with and without HIV infection / M. Johnson, J. Alarcón, D.M. Watts et al. AIDS. 2003. Vol. 17. P. 605–612.
- Sexually Transmitted Disease Testing of Human Immunodeficiency Virus-Infected Men Who Have Sex With Men: Room for Improvement / B.B. Dean, M. Scott, R. Hart et al. Sex Transm Dis. 2017. Vol. 44, Iss. 11. P. 678–684.
- Sexually transmitted infections and immune activation among HIV-infected but virally suppressed youth on antiretroviral therapy / T.L.K. Mullins, S.X. Li, J. Bethel et al. J Clin Virol. 2018. Vol. 102. P. 7–11.
- Smith C.M., Emmett L. Navigating an outbreak: geospatial methods for STI outbreak investigations. Sex Transm Infect. 2016. Vol. 92, Iss. 5. P. 327–328.
- Social networks as drivers of syphilis and HIV infection among young men who have sex with men / Fujimoto, C.A. Flash, L.M. Kuhns et al. Sex. Transm. Infect. 2018. Vol. 94, No. 5. P. 365–371.
- Static behavioral effects on gonorrhea transmission dynamics in a MSM population / B.R. Morin, L. Medina-Rios, E.T. Camacho, С. Castillo-Chavez. J Theor Biol. 2010. Vol. 267, Iss. 1. P. 35–40.
- Steinbrook R. HIV/AIDS in 2016 and Beyond. Am. Med. Assoc. 2016. Vol. 316, Iss. 11. P. 1139–1140.
- Substance use and sexual risk behaviour among HIV-positive men who have sex with men in specialized out-patient clinics / H. Dirks, S. Esser, R. Borgmann et al. HIV Med. 2012. Vol. 13, Iss. 9. P. 533–540.
- Syphilis among intravenous drug-using population: Epidemiological situation in St Petersburg, Russia / A.F.Karapetyan, Y.Y. Sokolovsky, E.R. Araviyskaya et al. International Journal of STD & AIDS. 2002. Vol. 13, No. 9. P. 618–623.
- Syphilis in Drug Users in Low and Middle Income Countries / L.S. Coffin, A. Newberry, H. Hagan et al. J. Drug Policy. 2010. Vol. 21, No. 1. P. 20–27.
- The alcohol use disorder identification test: guidelines for use in primary care. Second edition / T.F. Babor, C. Higgins-Biddle, J.B. Saunders, M.G. Monteiro. World Health Organization, 2001. URL: http://whqlibdoc.who.int/hq/2001/who_msd_msb_01.6a.pdf.
- The center for epidemiologic studies depression scale: a review with a theoretical and empirical examination of item content and factor structure / R.N. Carleton, A. Thibodeau, M.J. Teale et al. PLoS One. 2013. Vol. 8, Iss. 3. Article ID e58067.
- The expanding epidemic of HIV-1 in the Russian Federation / C. Beyrer, L. Wirtz, G. O’Hara et. al. PLoS Med. 2017. Vol. 14, Iss. 11. e1002462.
- Vulnerability to HIV infection among sex workers and non-sex worker female injecting drug users in Dhaka, Bangladesh: Evidence from the baseline survey of a cohort study / T. Azim, E.I. Chowdhury, M. Reza et al. Harm Reduction Journal. 2006. No. 3. P. 33–36.
- Wasserman S., Faust К. Social Network Analysis: Methods and Applications. New York : Cambridge University Press, 1994. 344 p.
- World Health Organization. Priority interventions: HIV/AIDS prevention, treatment and care in the health sector. WHO : July 2010. 174 р.
ДОДАТОК А
КОНСУЛЬТУВАННЯ СПОЖИВАЧІВ ПСИХОТРОПНИХ РЕЧОВИН
СТОСОВНО ІНФЕКЦІЙ, ЩО ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ
(методичний посібник для лікарів)
ВСТУП
Боротьба з ІПСШ на сучасному етапі є актуальною проблемою охорони здоров’я України. Особливу небезпеку представляють ІПСШ, які супроводжуються порушенням цілісності слизових оболонок, зокрема сифіліс, гонорея, хламідіоз, герпес, трихомоноз. Це сприяє проникненню ВІЛ через пошкоджені слизові оболонки. Ризик зараження ВІЛ за наявності симптомів підвищується в 3–5 разів. За темпами розповсюдження ВІЛ-інфекції Україна посідає одне з перших місць у Європі. Тенденція щодо зростання кількості ВІЛ-інфікованих зберігається. В останні роки основним шляхом передачі ВІЛ є статевий. Великий відсоток виявлених інфікованих осіб веде ризикований спосіб життя (вживання наркотичних засобів), що сприяє підвищенню ризику інфікування. Споживачі психоактивних речовин (СПАР) відіграють ведучу роль у динаміці поширення як ВІЛ так й ІПСШ. Ця уразлива група населення потребує особливого підходу в консультуванні, наданні лікувально-діагностичної допомоги, що обумовлено поведінковими особливостями. Своєчасне виявлення випадку ІПСШ, діагностично-лікувальна допомога та профілактика ІПСШ серед СПАР має бути суттєвим елементом у системі заходів, що протидіють розповсюдженню ВІЛ-інфекції в Україні. Консультування з приводу ІПСШ має бути невід’ємною частиною лікувального процесу.
РОЗДІЛ 1. ДОБРОВІЛЬНЕ КОНСУЛЬТУВАННЯ ТА ТЕСТУВАННЯ
1.1. Мета, завдання та принципи добровільного консультування та тестування на ІПСШ
Метою ДКТ на ІПСШ є надання добровільної консультативної допомоги населенню щодо шляхів поширення ІПСШ та профілактики інфікування. Окрім того, сприяння прийняттю добровільного інформованого рішення щодо тестування на ІПСШ, визначення наявності статевих інфекцій. Також мотивування пацієнта та підтримка подальшої його поведінки, безпечної, щодо інфікування ІПСШ, отримання своєчасної медичної допомоги. Метою консультування також є такі аспекти, як усвідомлення пацієнтом важливості своєчасного початку терапії, підвищення прихильності до лікування, рекомендації з профілактики ІПСШ, обстеження на ВІЛ та гепатити В та С. Завданнями ДКТ є зниження темпів поширення ІПСШ серед населення шляхом.
Сюди належать:
– інформування щодо шляхів поширення ІПСШ та відповідних ризиків інфікування, пов’язаних з кожним з них;
– ознайомлення із заходами та засобами зменшення ризику інфікування ІПСШ;
– оцінки індивідуального ризику інфікування ІПСШ, сприяння формуванню у пацієнта власної оцінки ступеня особистого ризику інфікування ІПСШ;
– інформування щодо процедури тестування та практичне значення результатів;
– сприяння прийняттю добровільного інформованого рішення щодо проходження тестування на наявність статевих інфекцій;
– тестування на ІПСШ;
– надання психологічної та соціальної підтримки;
– інформування про існуючі державні і комунальні заклади охорони здоров’я (ЗОЗ), інші державні та комунальні установи, організації та заклади, медичні заклади інших форм власності, об’єднання громадян, що надають медичну, психологічну, юридичну, соціальну та інші види допомоги особам, які її потребують;
– сприяння підвищенню рівня здоров’я населення та профілактики розповсюдження ВІЛ в країні, зокрема передачі статевим шляхом.
До процедури консультування і тестування існують певні вимоги. Це, перш за все, добровільність проходження тестування, конфіденційність процедури, анонімність. Також важливими компонентами є достовірність та повнота інформації, що сприятимуть прийняттю усвідомленого рішення. Що стосується добровільності, то тестування для виявлення ІПСШ може бути проведено тільки після усвідомленої та добровільної згоди пацієнта. Це означає, що пацієнту надано зрозумілою для нього мовою у доступній формі достатньо інформації, на підставі чого він зрозумів наслідки виявлення ІПСШ, дав письмово підтверджену згоду на проходження тестування або відмовився від нього чи відклав своє рішення щодо його проходження без будь-якого примусу. Добровільність передбачає також відсутність примусу щодо прийняття рішення стосовно зміни ризикованої поведінки особою, яка звернулась за послугами ДКТ. Щодо конфіденційності, інформація, яка стала відома консультанту чи особі, яка проводила тестування, під час надання послуг ДКТ (факт звернення особи, зміст отриманих послуг, дані про особисте життя пацієнта, контактні реквізити, результати тесту тощо), є конфіденційною. Лише у випадках, передбачених законами України ця інформація може бути передана законним представникам неповнолітнього або недієздатного пацієнта, закладам охорони здоров’я, органам прокуратури, слідства, дізнання, суду.
Перед- та післятестове консультування, а також повідомлення про результат тесту слід здійснювати з дотриманням конфіденційності. Ще один важливий аспект – анонімність. За бажанням пацієнта консультація та тестування можуть бути проведені анонімно, тобто без зазначення будь-яких даних, за якими може бути ідентифікована особа (паспортні дані, місце проживання тощо). У такому випадку ДКТ проводиться з використанням коду, який надається пацієнту для проходження консультування та тестування з отриманням його результатів. Для успішного консультування важливе надання пацієнтові достовірної та повної інформації. Кожному, хто має намір пройти тестування, необхідно запропонувати перед- та післятестове консультування. Під час даного заходу доцільно надати інформацію про мету та процедуру тестування, шляхи передачі, заходи та засоби профілактики ІПСШ, можливі результати тесту, існуючі можливості отримання медичної, в разі необхідності психологічної, соціальної допомоги. Обсяг та форма представленої інформації мають бути достатніми для прийняття усвідомленого рішення щодо доцільності та необхідність тестування. Пацієнтам, як з позитивним, так і з негативним результатом тесту, під час повідомлення про результат тесту в державному або комунальному закладі охорони здоров’я та післятестового консультування в разі необхідності слід надати інформацію про служби медичної, психологічної, соціальної та юридичної допомоги та можливо направити до них.
1.2. Особливості консультування споживачів психоактивних речовин
Пацієнти, які належать до СПАР, мають підвищені ризики зараження ІПСШ та ВІЛ. Їм властиві певні соціальні, поведінкові та інші особливості, що відрізняє їх від загального населення. При веденні таких пацієнтів доцільно враховувати дані особливості та застосовувати специфічні підходи. Слід приділяти належну увагу створенню атмосфери довіри, обговорювати усі важливі для них питання та можливості отримання необхідної допомоги, поінформувати про установи, заклади, організації, об’єднання громадян, які таку допомогу можуть надавати. Одним із найважливіших завдань консультування є підвищення мотивації наркозалежних до практик безпечної сексуальної поведінки. Спосіб життя СПАР, зокрема тих, які споживають ін’єкційні наркотики, часто пов’язаний із правопорушеннями, конфліктами з законом та викликає осудження з боку суспільства. У зв’язку з чим СПАР можуть з недовірою ставитись до послуг з консультування та тестування, які надаються державними службами чи службами на базі ЗОЗ. Послуги з ДКТ також можуть мати труднощі у залученні пацієнтів з числа СПАР. Прикладом успішного вирішення цієї проблеми можуть бути програми, у яких ДКТ зорганізується у співпраці з громадськими організаціями. Це програми з профілактики ВІЛ, що реалізуються «за межами кабінетів», тобто з виходом чи виїздом до місць звичного перебування СПАР. Доцільно приділяти достатньо уваги розвіюванню певних міфів, пов’язаних із статевою поведінкою, що існують у даній соціальній групі. Також надавати достовірну інформацію щодо безпечних та небезпечних моделей поведінки. Важливо, щоб декілька негативних результатів тестів на ІПСШ не призвели до втрати належної уваги до питань безпечного сексу. Консультантові слід пам’ятати, що представники цього соціального прошарку населення можуть одночасно належати до кількох уразливих груп. Наприклад РКС та ЧСЧ можуть одночасно бути СПАР, а СПАР можуть надавати сексуальні послуги в обмін на наркотики або винагороду.
РОЗДІЛ 2. ПРОЦЕДУРА КОНСУЛЬТУВАННЯ
Передтестове консультування – це співбесіда (з дотриманням принципів ДКТ) між консультантом та пацієнтом з метою надання інформації щодо профілактики передачі ІПСШ, допомоги у прийнятті усвідомленого рішення щодо тестування.
Метою передтестового консультування є оцінка індивідуального ризику інфікування, розробка індивідуального плану зменшення ризику зараження та визначення наслідків наявності чи відсутності інфікування для пацієнта. Консультант повинен тактовним способом пояснити причини, на підставі яких він задає питання, у тому числі інтимні. Також запевнити про конфіденційність інформації, отриманої ним під час консультування та результатів тесту. Консультант повинен надати інформацію про переваги та недоліки застосування методів діагностики ІПСШ (швидкі та підтверджуючи діагностичні тести). Право вибору методу надання допомоги залишається за пацієнтом. Вибір має бути виключно добровільним та інформованим. Консультування може бути поширене на подружжя (статевих партнерів, членів родини, друзів та інших осіб) лише за згодою пацієнта. Доцільно, щоб перед- та післятестове консультування проводив той самий консультант. За бажанням пацієнта ДКТ можуть бути проведені анонімно. Усі особи, яким пропонується пройти тестування, мають право відмовитися від нього. Консультанту потрібно надати інформацію усім особам, які звернулись за послугами ДКТ. В тому числі й тим особа, які відмовилися від тестування.
Інформацію має бути надано про:
- шляхи передачі ІПСШ;
- активну профілактику ІПСШ;
- можливості зараження та передачі ВІЛ-інфекції та інфекційних гепатитів статевим шляхом;
- можливості отримання консультативної, медичної допомоги та психологічної підтримки, якщо існує/виникне потреба (запобігання/попередження ІПСШ, посткоїтальна профілактика, тощо ).
На проведення тестування медичний працівник державного або комунального ЗОЗ має отримати інформовану згоду пацієнта («Інформована добровільна згода на проведення діагностики …» – форма № 003-6/о).
ПОРЯДОК ПЕРЕДТЕСТОВОГО КОНСУЛЬТУВАННЯ.
Метою передтестового консультування є досягання порозуміння з пацієнтом щодо завдань консультації.
При введенні в зміст консультації фахівець має пояснити про добровільність, конфіденційність консультування і тестування, саму процедуру ДКТ. Має бути надана інформація про мету та завдання консультування перед тестом на ІПСШ, методи діагностики ІПСШ із застосуванням швидких та підтверджуючих тестів. Пацієнт повинен бути проінформований щодо можливих результатів тесту, їх оцінки. Також фахівцем надається інформація про шляхи передачі ІПСШ, поведінкові ризики інфікування, заходи щодо профілактики інфікування та передачі ІПСШ та ВІЛ статевим шляхом.
Протягом консультування необхідно оцінити індивідуальний ризик інфікування, тобто поведінку, пов’язану з високим ризиком інфікування ІПСШ.
Доцільно провести розробку шляхів зниження ризику інфікування. Необхідно скласти індивідуальний план щодо зниження ризиків інфікування та профілактики передачі ІПСШ. Фахівець має надати інформацію про відповідні медичні, соціальні та інші служби. Також повідомити про джерела більш докладної інформації та можливості отримання додаткових консультацій. Важливе сприяння прийняттю пацієнтом рішення щодо проходження тесту. Доцільно оцінити готовність пацієнта пройти тестування. Обговорити з ним переваги знання свого стану здоров’я. Надати інформацію щодо методів лікувально-діагностичної допомоги (етіотропний, напівсиндромний, синдромний підхід). Оцінити наслідки з’ясування стану здоров’я для подальшого життя пацієнта (отримання лікування, зміна ризикованої поведінки, тощо). Надати пацієнту час для обмірковування обговорених питань. Переконатися, що пацієнт зрозумів отриману інформацію. За необхідності надати додаткові пояснення. З’ясувати бажання пацієнта щодо проходження тесту на ІПСШ.
Проходження тестування у державному або комунальному ЗОЗ.
Пацієнту, який дав згоду на проходження тесту при проведенні консультування у державних та комунальних ЗОЗ, медичний працівник повинен запропонувати йому заповнити форму № 003-6/о, направити до маніпуляційного кабінету для взяття клінічного матеріалу для тестування та призначити наступну зустріч.
При анонімному обстеженні форма № 003-6/о не заповнюється при проведенні консультування у державних та комунальних медичних установах, організаціях, закладах, а також медичних закладах інших форм власності на умовах анонімності.
2.1. Передтестове консультування
Введення в зміст консультації
Ставлення консультанта до пацієнта має бути професійним, поважливим, доброзичливим та толерантним. Пацієнту слід допомогти не тільки відчути себе комфортно під час консультування, а, головне, зрозуміти зміст консультації. Послідовність консультування наведено у табл. А.1.
Таблиця А.1 – Послідовність передтестового консультування
| Заходи | Послідовність дій |
| 1 | 2 |
| Знайомство з пацієнтом | Представитись та описати свою роль консультанта. |
| Пояснення принципу конфіденційності та можливості анонімного консультування та тестування | Поінформувати пацієнта щодо:
– добровільності, конфіденційності консультування та тестування; – відповідальності медичних працівників за розголошення конфіденційної інформації відповідно існуючих нормативних документів; – можливості вибору пацієнтом методів діагностики ІПСШ за допомогою клінічного обстеження, застосуванням швидких або підтверджуючих тестів; – можливості анонімного консультування та тестування; – можливості присутності сторонніх осіб (в тому числі родичів) під час консультування лише за умови отримання на це згоди пацієнта; – порядку отримання ним результату тесту. |
Продовження таблиці А.1
| 1 | 2 |
| Опис процедури ДКТ | Пояснити етапність процедури ДКТ:
– передтестове консультування; – тестування; – післятестове консультування. |
| Інформування щодо змісту передтестового консультування | Проінформувати щодо змісту консультування, тобто: надання інформації про шляхи передачі ІПСШ; поведінкові ризики інфікування, заходи щодо профілактики інфікування ІПСШ;
оцінка індивідуального ризику інфікування ІПСШ; розробка шляхів зниження індивідуальних ризиків інфікування; визначення наявної та необхідної підтримки. |
| Пояснення процедури тестування | Поінформувати пацієнта щодо:
процедури тестування; значення негативного, позитивного та невизначеного (сумнівного) результатів тесту. |
| Надання відповідей на запитання пацієнта | З’ясувати зрозумілість інформації для пацієнта та відповісти на його запитання |
2.2. Оцінка індивідуальних ризиків щодо зараження ІПСШ
Метою заходу є визначення в поведінці пацієнта індивідуальних ризиків щодо можливості зараження ІПСШ та допомога їх усвідомлення.
Консультант повинен зрозуміти занепокоєння пацієнта щодо наявності ІПСШ та сформувати для себе чітке уявлення щодо його можливих ризиків інфікування. Підхід до обговорення має бути доброзичливим та об’єктивним, що сприятиме розумінню пацієнтом специфіки своєї особистої поведінки.
Консультанту слід намагатися виявити фактори, що впливають на епізодичне або систематичне виникнення ризикованої поведінки пацієнта.
Послідовність дій при консультуванні з метою визначення індивідуальних ризиків щодо зараження ІПСШ наведено у табл. А.2.
Таблиця А.2 – Послідовність дій при консультуванні з метою визначення індивідуальних ризиків щодо зараження ІПСШ
| Заходи | Послідовність дій |
| 1 | 2 |
| Оцінка причин звернення пацієнта за послугами. | Запропонувати розповісти про причину звернення та можливі чи наявні ризики інфікування ІПСШ. З’ясувати причини занепокоєності щодо інфікування. |
| Аналіз останнього випадку ризикованої статевої поведінки | З’ясувати інформацію щодо:
– час та загальні обставини останнього випадку статевої ризикованої поведінки; – використання презервативу (наскільки вчасно та правильно його використовували); – причина, яка спонукала погодитись на незахищений сексуальний контакт, якщо такий був; – практика вживання ПАР у період такого контакту. |
| Оцінка рівня прийнятності ризику, пов’язаного зі статевою поведінкою | Доцільно з’ясувати:
– занепокоєння пацієнта щодо статевого акту з певною особою; – чи була б поведінка такою самою, якби він знав, що ця особа інфікована; – якщо ні, то яким чином змінилася б його поведінка. |
| Визначення ризикованої статевої поведінки | Запитати інформацію щодо:
– того, як часто виникають ризиковані ситуації; – кількості статевих партнерів протягом останніх 6 місяців; – наявності випадкових статевих партнерів; – досвіду частої зміни статевих партнерів |
Продовження таблиці А.2
| 1 | 2 |
| Визначення чинників та обставин, які впливають на ризик інфікування | З’ясувати, що саме з нижченаведеного і на скільки підвищує ризиковану поведінку пацієнта:
– алкоголь; – ПАР; – секс за винагороду (гроші, їжу, житло, наркотики, тощо). З’ясувати: – чи вживає пацієнт ПАР, якщо так, то які та як часто; – чи користується при цьому чужими шприцами або набирає наркотик із загального посуду; – наявність перенесених ІПСШ раніше, коли та яких; – наявність туберкульозу, ВІЛ-інфекції у пацієнта або його партнера; – застосування методів екстреної профілактики ІПСШ та ВІЛ; – застосування антибактеріальних засобів (які, як часто, коли останній випадок); – застосування місцевих антисептичних засобів (які, як часто використовуються); – застосування медикаментозних засобів екстреної профілактики вагітності; – наявність у минулому ІПСШ та терапевтичних засобів, що були застосовані при лікуванні; – наявність у статевого партнера ознак запалення статевих органів або інформації щодо діагностування фахівцем ерозії шийки матки, аднекситу, простатиту, тощо; – інформація щодо лікування статевого партнера з приводу будь-яких ІПСШ; – випадки переривання вагітності; – порушення оваріально-менструального циклу у жінок та порушення сексуальної функції у обох статей. |
Продовження таблиці А.2
| 1 | 2 |
| Оцінка ризику у сексуального партнера | З’ясувати:
– чи знає пацієнт про наявність у його партнера статевих контактів ще з кимось; – занепокоєння пацієнта щодо ризикованої поведінки партнера та їх наміри на майбутнє. |
| Оцінка спілкування з сексуальними партнерами | Запитати, чи обговорював пацієнт тему ризику інфікування ІПСШ/ВІЛ зі своїм партнером та чи йшла мова про можливість тестування на ІПСШ. |
| Підведення підсумків та розгляд ризиків пацієнта | Резюмувати інформацію та визначити основні ризики інфікування ІПСШ, про які розповів пацієнт.
Разом з пацієнтом визначити конкретні форми його ризикованої поведінки: – наявність випадкового статевого партнера; – досвід частої зміни статевих партнерів; – надання сексуальних послуг за плату; – вживання ПАР / алкоголю; – інше. Разом з пацієнтом встановити пріоритетність цих ризиків та фактори, які впливають на його поведінку. З’ясувати наявність інших питань, які слід обговорити. При наявності у теперішній час або в минулому певних форм ризикованої поведінки (вживання ПАР, надання сексуальних послуг за винагороду, одностатеві сексуальні контакти, тощо) провести консультування відповідно до розділів 2.5, 2.6, 2.7. За необхідності надати інформаційний буклет щодо питань ІПСШ/ВІЛ. |
2.3. Розробка шляхів зниження ризику інфікування
Метою заходу є посилення мотивації та підтримка зусиль пацієнта щодо необхідності зменшення ризику інфікування.
Виходячи з конкретних проблем пацієнта, необхідно:
- сприяти усвідомленню ним особистого ризику;
- приділяти увагу дисонансу (коли думки/принципи не збігаються з поведінкою) та суперечливості почуттів пацієнта щодо зменшення ризику;
- підвищувати його впевненість у собі, віру в свої сили та здатність щось зробити;
- посилатися на норми, які існують в суспільстві та в соціальній групі, до якої належить пацієнт;
- вивчити та визначити ресурси для підтримки пацієнта.
Послідовність дій при консультуванні у цьому разі наведено у таблиці А.3.
Таблиця А.3 – Консультування проводиться в наступній послідовності
| Заходи | Послідовність дій |
| 1 | 2 |
| Розгляд попередніх спроб зменшення ризику | Доцільно з’ясувати:
– дії пацієнта в минулому щодо зменшення ризику інфікування на ІПСШ та захисту себе та партнера. Розповісти пацієнту про заходи профілактики ІПСШ |
| Визначення успішного досвіду безпечних сексуальних стосунків пацієнта та перешкод у зменшенні ризику | Необхідно з’ясувати:
– чи практикував він безпечні статеві стосунки в минулому, якщо так, то чому; – що було найбільш складним у процесі зменшення ризику інфікування ІПСШ. |
| Вивчення факторів / ситуацій, які підвищують вірогідність поведінки високого ризику | Потрібно з’ясувати:
– вплив вживання ПАР (наркотиків чи алкоголю) на рішення пацієнта вступати в статеві контакти з високим ризиком інфікування; – наявність та причини ситуацій або партнерів, коли пацієнту складно домовитися про безпечний сексуальний зв’язок, якщо так, то чому; – вплив інших життєвих обставин (засмученість, відсутність роботи, розрив відносин, інше) на здатність пацієнта практикувати безпечні сексуальні стосунки |
Продовження таблиці А.3
| 1 | 2 |
| Визначення здатності особи обговорювати з друзями / партнерами ризик інфікування ІПСШ | Визначити:
– здатність пацієнта обговорювати питання ІПСШ зі своїми партнерами/друзями; – зміст бесід з ними про зменшення ризику інфікування ІПСШ/ВІЛ та його почуття при цьому. |
| Рольова гра, формування навичок, вирішення проблем (за можливості) | Запропонувати пацієнтові:
– продемонструвати повідомлення своєму статевому партнеру бажання користуватись презервативом; – розповісти, яку ймовірну відповідь дав би його партнер на пропозицію щодо тестування на ІПСШ. |
| Відпрацювання навичок користування презервативом | З’ясувати, що саме ускладнює використовування презервативу. Обговорити кілька прикладів з його життя.
Запропонувати продемонструвати на муляжі, як правильно користуватись презервативом |
| Визначення всіх варіантів зменшення ризику інфікування. | Доцільно з’ясувати, що було б найлегше та найскладніше пацієнту змінити у своїй ризикованій поведінці, обговорити чому.
Назвати пацієнту можливі варіанти зменшення його ризику. |
| Обговорення рівня ризику, який сприймається пацієнтом. | Визначити:
– наскільки зручно почуває себе пацієнт при запропонуванні того чи іншого методу зменшення його ризику (наприклад, використання презервативу зі статевим партнером); – наскільки непокоїть пацієнта можливість інфікування ІПСШ. |
| Звернення уваги пацієнта, якщо думки /принципи та його поведінка не збігаються або наміри пацієнта щодо зміни поведінки є суперечливими. | Обговорити та допомогти зрозуміти пацієнту існуючі протиріччя:
– занепокоєння щодо ВІЛ-інфікування та небажання використовування презервативів; – страх інфікування та бажання мати свободу і декілька партнерів; – інше. |
Продовження таблиці А.3
| 1 | 2 |
| Обговорення можливості підтримки в соціальній групі, до якої належить пацієнт, сім’ї, оточенні (ключові групи). | Необхідно з’ясувати:
– кому з рідних чи друзів довіряє пацієнт, з ким він обговорює особисті проблеми, такі як занепокоєння щодо інфікування ІПСШ; – що думає найближче оточення пацієнта (друзі, колеги) про необхідність особистого захисту від інфікування; – чи є в житті пацієнта особа, яка могла би підтримати його в униканні ризикованих ситуацій. |
| Підведення підсумків щодо варіантів зменшення ризику інфікування. | Обговорити варіанти, коли пацієнту вдається зменшити особистий ризик інфікування.
Запитати про пропозиції пацієнта щодо додаткових варіантів. Визначити, як можна зробити безпечну поведінку пацієнта особистим пріоритетом. |
| Визначення необхідності у додатковій допомозі. Надання інформації щодо можливості її отримання. | З’ясувати, яка додаткова допомога необхідна пацієнтові для зменшення власного ризику.
Надати інформацію про існуючі медичні, психологічні та соціальні служби та можливість отримання додаткових консультацій з питань ІПСШ/ВІЛ. Направити пацієнта у разі потреби до відповідних спеціалістів та служб (надати контактні телефони та адреси) |
2.4. Прийняття рішення щодо проходження тесту
Метою заходу є допомога пацієнтові прийняття добровільного інформованого рішення щодо тестування на ІПСШ.
Консультанту необхідно професійно і неупереджено довести пацієнту переваги знання свого стану сексуального та репродуктивного здоров’я, значення та наслідки результату тесту на ІПСШ, допомогти йому прийняти добровільне усвідомлене рішення щодо проходження тесту. Послідовність дій при консультуванні з метою допомоги пацієнтові прийняття добровільного рішення щодо тестування на ІПСШ наведено у таблиці. А.4.
Таблиця А.4 – Консультування з метою допомоги пацієнтові прийняття добровільного рішення щодо тестування на ІПСШ
| Заходи | Послідовність дій |
| 1 | 2 |
| Обговорення попереднього досвіду тестування та зміни в поведінці після отримання результату. | Доцільно з’ясувати:
– проходження в минулому пацієнтом тестування на ІПСШ та яким був цей досвід; – які зміни з метою зменшення ризику інфікування на ІПСШ відбулися у його поведінці при негативному результаті. |
| Обговорення почуттів пацієнта щодо проходження тестування. | Попросити пацієнта розповісти, що він відчуває вирішивши пройти тест на ІПСШ, та яким чином було прийнято це рішення.
З’ясувати, чи повідомляв пацієнт кому-небудь про своє рішення проходження тесту на ІПСШ, чи знають про це його(її) чоловік (дружина/партнер) та їх реакція на це рішення. |
| Обговорення того, наскільки пацієнт розуміє значення позитивного та негативного результату тесту. | З’ясувати, що розуміє пацієнт під позитивним / негативним результатом тесту.
Пояснити пацієнтові значення результатів тесту у випадку, якщо йому щось незрозуміло. |
| Оцінка готовності пацієнта щодо проходження тестування та прийняття результатів тесту. | Обговорити з пацієнтом його можливу реакцію на:
– позитивний результат; – негативний результат. Визначити: – який результат тесту очікує пацієнт; – кому зможе пацієнт розказати про результат тесту та хто зможе надати йому підтримку. |
Продовження таблиці А.4
| 1 | 2 |
| Обговорення життя при позитивному результаті тестів на ІПСШ. | Обговорити можливі зміни у житті пацієнта в разі позитивного результату.
Розповісти про особливості поведінки інфікованих ІПСШ осіб, необхідність виявлення та інформування всіх сексуальних партнерів, а також їх лікування. Інформувати щодо наслідків для репродуктивного здоров’я, якості життя. Проінформувати про доцільність лікування за рекомендаціями лікаря; дотримання рекомендацій щодо статевого життя, раціонального харчування, контролю виліковності. |
| Обговорення переваг знання свого стану репродуктивного здоров’я. | Розповісти, що при можливому визначенні позитивного тесту на ІПСШ (у майбутньому) пацієнт може:
– отримати лікування для збереження репродуктивного та сексуального здоров’я та профілактики ускладнень, які можуть виникнути при відсутності лікування наявних ІПСШ; також лікування проводитиметься з метою попередження виникнення репродуктивних порушень. Пацієнт отримає та зможе використовувати інформацію про методи профілактики ІПСШ із застосуванням бар’єрних та медикаментозних засобів, знання щодо своєчасного інформування та обстеження статевих партнерів, обговорення скарг та порушень з боку урогенітального тракту зі статевими партнерами. Це дозволити захистити своїх партнерів та майбутніх дітей від ІПСШ, підготуватися до здорового майбутнього своєї сім’ї. При з’ясуванні негативних результатів обстеження на ІПСШ пацієнт має змогу отримати додатковий стимул щодо використання необхідних засобів для профілактики інфікування у подальшому, доцільності періодичного профілактичного обстеження на ІПСШ, ВІЛ, інше. |
Продовження таблиці А.4
| 1 | 2 |
| Обговорення труднощів, пов’язаних із знанням стану свого репродуктивного здоров’я | Запитати у пацієнта, які негативні сторони може мати для нього знання стану свого репродуктивного здоров’я.
Обговорити з ним обставини, які його непокоять у зв’язку з цим, та чинники, які на них можуть вплинути. |
| Пропозиція пройти тестування у державному або комунальному ЗОЗ. | З’ясувати рішення пацієнта стосовно проходження тестування. Якщо пацієнт прийняв рішення про проходження тестування, інформувати його про можливість тестування у державних та комунальних ЗОЗ.
Якщо передтестове консультування проведено у вказаних ЗОЗ, запропонувати пацієнту заповнити форму № 003-6/о та направити до маніпуляційного кабінету для забору клінічного матеріалу для дослідження. Особам, що відмовились від тестування, запропонувати повторну консультацію та провести бесіду щодо зменшення ризику інфікування. |
| Призначення наступної зустрічі | Доцільно домовитися про час та місце наступної зустрічі. |
2.5 Консультування споживачів психоактивних речовин (СПАР)
Послідовність дій при консультуванні СПАР наведено у таблиці А.5.
Таблиця А.5 – Консультування СПАР
| Заходи | Послідовність дій |
| 1 | 2 |
| Оцінка загального стану пацієнта. | Суб’єктивно оцінити наявність у пацієнта стану наркотичного або алкогольного сп’яніння, стану абстиненції.
При відсутності можливості сприйняття інформації пацієнтом призначити повторну зустріч. |
Продовження таблиці А.5
| 1 | 2 |
| При адекватній реакції пацієнта продовжити консультування відповідно до розділу 2.1. | |
| Мотивування пацієнта на повне проходження процедури консультування та тестування. | Повідомити, коли та де пацієнт зможе отримати результат цього тесту.
З’ясувати, чи буде у нього можливість зайти за результатом у цей час. Якщо ні, то пояснити, що він зможе отримати результат тестування та пройти післятестове консультування пізніше. Пояснити що: – дуже важливо, щоб він повернувся за результатом; – після отримання результату він зможе обговорити з консультантом питання, що у нього виникнуть; – при потребі обговорення окремих питань він може прийти на додаткову консультацію. |
| Обговорення переваг обізнаності щодо стану особистого репродуктивного здоров’я з проблем ІПСШ. Проведення разом з пацієнтом аналізу можливих «за» і «проти» знання свого статусу. | Пояснити, що пацієнт вже зробив важливий крок, прийшовши на цю консультацію.
Тому що знання, які він отримає, зможуть допомогти йому керувати своїм життям. Обговорити переваги знання щодо стану його репродуктивного здоров’я з проблем ІПСШ та з якими труднощами воно може бути пов’язане. Разом з ним скласти переліки “за” та “проти” знання свого статусу. |
| Інформування пацієнта щодо можливості отримання психологічної, соціальної та інших видів підтримки для СПАР | Пояснити, що у випадку виникнення потреби у психологічній підтримці, можна звернутись за допомогою в організацію, яка займається наданням допомоги СПАР.
Доцільно надати контактну інформацію, вказуючи час та умови прийому цього консультанта. |
| Надання інформації про групи взаємодопомоги | Проінформувати пацієнта про групи взаємодопомоги, які об’єднують людей з проблемами, подібними до його. При можливості надати контактну інформацію. |
Продовження таблиці А.5
| 1 | 2 |
| Обговорення можливості екстреної профілактики у випадку сексуального насильства | Пояснити, що сексуальне насильство пов’язане з підвищеним ризиком інфікування ІПСШ та ВІЛ внаслідок травмування слизових оболонок.
Розповісти про можливості екстреної профілактики ІПСШ та ВІЛ у разі сексуального насильства. |
| Проведення разом з пацієнтом оцінки індивідуальних ризиків інфікування ІПСШ у випадку надання платних сексуальних послуг.
Обговорення можливості зменшення ризиків |
Доцільно з’ясувати:
– досвід користування засобами запобігання інфікування ІПСШ; – про ситуації, коли не використовується презерватив, та причину цього. Разом з пацієнтом обговорити шляхи щодо зменшення ризиків інфікування. |
| З’ясування хибних уявлень у пацієнта щодо безпечних/небезпечних сексуальних практик | Потрібно встановити:
– яким чином він визначає осіб, з якими статеві контакти є більш ризикованими щодо інфікування ІПСШ; – чи є якісь групи осіб, з якими він не пов’язує ризик інфікування ІПСШ. Якщо так, то чому; яким чином такі міркування впливають на його вибір поведінки. |
| Обговорення ризиків інфікування ІПСШ для СПАР та РКС | Визначити інформованість щодо поширеності ІПСШ серед СПАР та РКС.
Пояснити фактори підвищеного ризику інфікування ІПСШ для СПАР та РКС. Проінформувати, що частина РКС є СПАР, тобто мають подвійну загрозу інфікування. |
| Обговорення шляхів та засобів зменшення ризику інфікування | Скласти разом з пацієнтом план особистого захисту від інфікування ІПСШ та захисту його постійного партнера.
Пояснити пацієнтові: – про значний вплив вживання ПАР на стан його здоров’я; |
Продовження таблиці А.5
| 1 | 2 |
| – що задля зменшення ризику інфікування ІПСШ, ВІЛ, вірусами гепатитів В і С йому необхідно відмовитись від ін’єкційного вживання ПАР;
– що при неможливості відмови від вживання ПАР на даний час потрібно не користуватись чужими, використаними або спільними шприцами, не давати іншим свій використаний шприц, не промивати використаний шприц у загальній ємкості з водою, для кожної ін’єкції використовувати стерильний шприц; – необхідність використання якісного презервативу при кожному сексуальному контакті та протягом всього статевого акту. З’ясувати його наміри щодо першого кроку. |
|
| Післятестове консультування при негативному або невизначеному (сумнівному) результаті. | Провести консультування з урахуванням вимог щодо відповідних заходів, які наведені в розділі 3. |
| Післятестове консультування у випадку позитивного результату. Планування майбутнього з деталізацією щодо зміни поведінки на менш ризиковану з метою поліпшення якості життя. | З’ясувати стан та можливість пацієнта сприйняти інформацію, при необхідності призначити повторну зустріч.
Подальше консультування провести відповідно до заходів, що наведені в розділі 4. З’ясувати, чи вплине його позитивний статус на рішення щодо зменшення вживання ПАР. Якщо так, то слід визначити яким чином та яких результатів він очікує від подібних змін. |
РОЗДІЛ 3. ПІСЛЯТЕСТОВЕ КОНСУЛЬТУВАННЯ
Післятестове консультування – це конфіденційний діалог між пацієнтом та консультантом. Метою цього заходу є обговорення результатів тесту на ІПСШ, надання необхідної інформації та психологічної підтримки.
Повідомлення про результат тесту має обов’язково супроводжуватись післятестовим консультуванням. Доцільно одночасно проводити повідомлення щодо результатів обстеження та післятестове консультування.
Бажано, щоб післятестове консультування пацієнта у ЗОЗ відбувалося за участю того самого консультанта, що проводив й передтестове. Якщо передтестове консультування проводилось в іншій установі чи іншим фахівцем, консультанту необхідно з’ясувати у пацієнта, коли та в якому обсязі воно проводилось, яка інформація щодо ІПСШ пацієнтові вже надана. Враховуючи, що відомості про результат обстеження, наявність/ відсутність ІПСШ в особи, яка пройшла медичний огляд, є конфіденційними та становлять лікарську таємницю. Повідомлення про них дозволяється тільки особі, якої вони стосуються, а у випадках, передбачених законами України, також законним представникам цієї особи, закладам охорони здоров’я, органам прокуратури, слідства, дізнання та суду.
3.1. Первинне післятестове консультування при негативному результаті тесту
Метою заходу є привернення уваги пацієнта до необхідності застосування заходів зменшення ризику задля уникнення інфікування у майбутньому.
При негативному результаті важливо обговорити заходи щодо зниження ризику зараження ІПСШ. Необхідно провести консультування з питань безпечної поведінки та розглянути можливості спрямовування в інші служби, що допомагають змінити ризикований спосіб життя на менш ризикований. Консультантові доцільно повідомити про результат тесту простими словами, уникаючи специфічної термінології. Потрібно дозволити пацієнту відчути задоволення від того факту, що він не є інфікованим ІПСШ. В той же час підкреслити необхідність зміни ризикованої поведінки з тим, щоб уникнути зараження ІПСШ у майбутньому. Необхідно тактовно переконати пацієнта у необхідності проведення повторного тестування та обстеження статевих партнерів за наявності ризикованої поведінки протягом останніх 6 місяців.
Послідовність дій при післятестовому консультуванні наведено у таблиці А.6.
Таблиця А.6 – Післятестове консультування
| Заходи | Послідовність дій |
| Повідомлення пацієнта про результат. | Повідомити, що результат готовий. Доцільно представити його чітко та доступно. Пояснити, що негативний результат означає що пацієнт не інфікований ІПСШ.
Дочекатися усвідомлення пацієнтом результату тесту. Наголосити, що за наявності ризикованої поведінки протягом останніх 6 місяців, можливе інфікування без відображення цього в результатах тесту. Переконатися, що пацієнт вірно зрозумів результат тесту. |
| Визначення реакції пацієнта на результати тесту. | Дізнатися про почуття пацієнта після ознайомлення з негативним результатом. |
| Акцентування уваги на необхідності розгляду результату тесту у відношенні до ризику в межах періоду «серологічного вікна» | Пояснити, що з урахуванням «серологічного вікна» цей результат може не відображати наслідки нещодавнього ризику. |
| Висловлювання занепокоєння та серйозності щодо можливості інфікування ІПСШ пацієнта, якщо він підлягає постійному ризику | Наголосити на можливості інфікування, якщо пацієнт не приділить уваги зменшенню ризикованої поведінки. |
3.2. Первинне післятестове консультування при позитивному результаті тесту
Метою заходу є надання зрозумілої та точної інформації про позитивний результат тесту, підтримати пацієнта у сприйнятті цього. Післятестове консультування при позитивному результаті тесту передбачає консультування пацієнта, психологічну підтримку у сприйнятті діагнозу та допомогу у плануванні майбутнього, як найближчого, так і віддаленого.
Послідовність дій при післятестовому консультуванні при позитивному результаті наведено у таблиці А.7.
Таблиця А.7 – Післятестове консультування при позитивному результаті тесту
| Заходи | Послідовність дій |
| 1 | 2 |
| Повідомлення про результат тесту | Привітатись з пацієнтом.
У зрозумілій формі повідомити про результат тесту, уникаючи специфічної термінології. Пояснити, що цей результат свідчить про інфікування ІПСШ. За вимогою пацієнта видати йому довідку про результат тесту (форма № 27/о) |
| Визначення розуміння пацієнтом результату. | Запитати, як він розуміє цей результат. Переконатися, що пацієнт правильно зрозумів значення отриманого результату. |
| Усвідомлення проблем, пов’язаних із сприйняттям позитивного результату, надання необхідної підтримки. Обговорення можливих наслідків для особистого життя, сімейних та соціальних відносин. | Із співчуттям доцільно віднестись до психологічного стану пацієнта, пояснити, що потрібен час щоб вилікуватися.
Проінформувати, що існує можливість лікування, яке дозволяє отримати результат з високим ступенем вірогідності виліковності. Роз’яснити доцільність обстеження всіх наявних статевих партнерів (період визначається в залежності від нозології виявленого збудника та інкубаційного терміну) та їх лікування. |
Продовження таблиці А.7
| 1 | 2 |
| За необхідності, отримати консультації суміжних фахівців, пройти додаткові обстеження.
Пройти контролі виліковності (залежно від нозології та нормативних документів). Запитати, чи існує вірогідність того, що пацієнтка зараз вагітна (за необхідності направити до лікаря акушера-гінеколога). З’ясувати плани щодо народження дітей. Надати інформацію про те, що: – є певний ризик передачі ІПСШ дитині, але існує профілактичне лікування задля запобігання передачі ІПСШ від матері дитині; – необхідно своєчасно стати на облік у разі вагітності для отримання доступу до необхідних видів лікування. Якщо пацієнт не готовий до бесіди, запропонувати йому прийти на повторну консультацію та надати відповідні інформаційні матеріали. |
|
| Надання відповідей на незрозумілі питання. | З’ясувати у пацієнта:– зрозумілість інформації, яку він отримав;– наявність питань, які він хотів би з’ясувати або обговорити.За необхідності направити до відповідних фахівців. |
3.3. Первинне післятестове консультування при невизначеному (сумнівному) результаті тесту
Послідовність дій при післятестовому консультуванні при невизначеному результаті тесту наведено у таблиці А.8.
Таблиця А.8 – Післятестове консультування при невизначеному (сумнівному) результаті тесту
| Заходи | Послідовність дій |
| Повідомлення результату тесту та його роз’яснення. | Привітатись з пацієнтом.
Повідомити, що результат його тесту на даний час розцінено як невизначений або сумнівний. Пояснити, що можуть бути різні причини неможливості впевнено визначити наявність ІПСШ, а саме у випадках, якщо пацієнт має інше хронічне захворювання (ревматичний артрит, множинний склероз, системний червоний вовчак, цукровий діабет 1 типу, хвороба Адісона, анкілозуючий спондиліт, хронічний гепатит, злоякісні захворювання (особливо лімфопроліферативні злоякісні процеси), вагітність, вік понад 70 років, вакцинація що може призводити до виявлення неспецифічних антитіл, інші). Обговорити і пояснити пацієнту можливість перебування його в стадії «серологічного вікна»: час з моменту інфікування людини до появи антитіл до збудника ІПСШ, який може тривати від 1 до 6 місяців в залежності від нозології. Пояснити про необхідність дотримуватись безпечної щодо поширення ІПСШ поведінки до моменту отримання результату повторного тесту на ІПСШ, а саме: відкласти заплановану вагітність, зменшити кількість статевих партнерів, використовувати презерватив під час статевих контактів, відмовитись від донорства, інше. Надати пацієнтові інформаційні буклети і адреси державних, комунальних організацій та закладів, об’єднань громадян, що надають психоемоційну підтримку. Призначити дату та час наступної зустрічі з пацієнтом. |
3.4. Повідомлення партнера про результати тесту та скерування взаємовідносин з ним
Метою заходу є підготовка пацієнта до повідомлення про результат тесту партнеру(ам). Скласти план такого повідомлення.
Повідомлення партнера(ів) про проходження тесту на ІПСШ і його позитивний результат є важливим особистим питанням для пацієнта. Консультанту варто першому порушити це питання, щоб вирішити його разом з пацієнтом.
Послідовність дій при консультуванні у цьому разі наведено у таблиці А.9.
Таблиця А.9 – Консультування з метою підготовки пацієнта до повідомлення про результат тесту
| Заходи | Послідовність дій |
| 1 | 2 |
| Дізнатися, як пацієнт ставиться до того, щоб сповістити партнера(ів) про позитивний результат обстеження на ІПСШ. | Запитати, чи збирається він розповісти партнеру(рам) про свій результат тесту, що його непокоїть. |
| Визначення партнерів, які підлягають ризику інфікування, і яких необхідно повідомити про цей ризик. | Запитати, чи є конкретні партнери, які також могли б бути інфіковані ІПСШ. Запропонувати пацієнту повідомити їм про можливість інфікування та доцільність тестування на ІПСШ. |
| Обговорення можливих підходів до розкриття партнеру своїх результатів обстеження на ІПСШ. | З’ясувати, яким чином пацієнт збирається повідомити партнеру результат свого тесту. Також що б він хотів сказати, чи буде це для нього складно.
Обговорити вибір найбільш вдалого моменту для обговорення його статусу з партнером. |
Продовження таблиці А.9
| 1 | 2 |
| Направлення на ДКТ партнера(ів) пацієнта, які не знають стану свого репродуктивного здоров’я. | З’ясувати, чи знає його партнер про стан свого репродуктивного здоров’я. Запитати, чи може погодитись його партнер(и) пройти тест на наявність ІПСШ, що для цього треба зробити. |
| Очікування можливої реакції партнера | Запитати, якою, на його думку, буде реакція партнера на його повідомлення про позитивний результат. Чи мали вони з партнером важкі розмови у минулому. Допомогти звести до мінімуму наслідки, що стосуються відносин з партнером.
За необхідності допомогти пацієнту повідомити партнера про результати тестів, запросивши їх, за його згодою, на наступну консультацію. |
| Практика та рольова гра щодо різних підходів до розкриття свого стану репродуктивного здоров’я (за можливості). | Дати можливість пацієнту під час рольової гри з консультантом попрактикуватись у повідомленні його партнеру результатів тесту. |
| Роз’яснення необхідності дотримання пацієнтом профілактичних заходів для запобігання поширенню ІПСШ. | Роз’яснити пацієнту про необхідність дотримання профілактичних заходів, спрямованих на недопущення поширення ІПСШ, а саме про:– відмову від донорства крові, тканин та органів;
– виключення незахищених статевих контактів та необхідність повідомлення сексуальних партнерів про позитивні результати обстеження на ІПСШ; – виключення спільного використання засобів особистої гігієни, медичного інструментарію, в тому числі для нанесення татуювань, пірсингу, приготування та вживання ПАР ін’єкційним шляхом. Пояснити про відсутність загрози інфікування для членів сім’ї, співробітників при звичайних побутових контактах. |
3.5. Обговорення плану зниження ризику інфікування
Метою заходу є розробка конкретного, поетапного плану зменшення ризику інфікування ІПСШ.
Разом з пацієнтом потрібно розробити план зниження ризику його інфікування. Захід повинен відповідати вмінням та здібностям пацієнта, його мотивації щодо зміни певного типу поведінки. План повинен бути конкретним, вказувати на всі обставини та осіб (що, коли, хто, де і як), які братимуть участь у процесі зменшення ризику. План має представляти послідовність дій та поступовий рух пацієнта у напрямі зменшення ризику інфікування. Не слід підтримувати плани, що носять необґрунтований або радикальний характер щодо змін в житті пацієнта.
Послідовність дій при консультуванні з метою зниження ризику інфікування ІПСШ наведено у таблиці А.10.
Таблиця А.10 – Консультування з метою зниження ризику інфікування
| Заходи | Послідовність дій |
| 1 | 2 |
| З’ясування форми поведінки з метою зменшення ризику інфікування. | Разом з пацієнтом з’ясувати форми його поведінки, фактори, які пов’язані з ризиком інфікування ІПСШ.
Визначити, яким чином пацієнт бажав би зменшити ризик інфікування ІПСШ. Якщо пацієнт вибере зміну в поведінці зі словами «завжди» або «ніколи», підтримати його бажання усунути ризик, звернувши увагу на те, що зміна відбувається поступово. З’ясувати, який перший крок він планує здійснити в досягненні цієї мети. |
| Визначення поступових етапів в досягненні визначеної моделі поведінки. | З’ясувати, які незначні кроки пацієнт міг би зробити наступного тижня з метою зменшення ризику інфікування ІПСШ. |
| Розподіл діяльності щодо зменшення ризику на конкретні кроки. | З’ясувати, яким чином та коли пацієнт збирається реалізувати свої наміри. Конкретизувати їх та визначити послідовність. |
Продовження таблиці А.10
| 1 | 2 |
| Рольова гра, формування навичок, вирішення проблем (за можливості). | Попросити пацієнта:
– продемонструвати, як би він повідомив його статевого партнера, що бажає в подальшому (наприклад) користуватись презервативом; – розповісти, яку б, на думку пацієнта, відповідь дав би його партнер, якби він попросив його в подальшому (наприклад) користуватись презервативом. |
| Погодження з пацієнтом обґрунтованості та прийнятності плану. | З’ясувати, чи план прийнятний для пацієнта. |
| Вивчення почуттів пацієнта щодо реалізації свого плану. | З’ясувати, чи є план комфортним для пацієнта. |
При консультуванні пацієнта з епізодично виникаючою або разовою ризикованою поведінкою (разовий випадковий статевий контакт, тощо) план щодо зміни поведінки повинен бути скорегований відповідно. Консультант та пацієнт мають встановити терміни виконання цього плану. Цей етап є важливим, оскільки при негативному результаті тесту другий сеанс може не відбутися, під час якого консультант міг би проаналізувати досвід пацієнта щодо виконання плану. Доцільно обговорити можливість та порядок отримання, за необхідності, медичної та психосоціальної допомоги у відповідних установах, організаціях та закладах, об’єднаннях громадян, особливо з метою зниження ризику інфікування у майбутньому. При наявності показань призначити повторне консультування та/або повторне тестування на наявність ІПСШ через 1-3 місяці.
Видати засоби індивідуального захисту та інформаційні матеріали, за наявності. При наданні допомоги представникам уразливих груп доцільно проводити інформування про об’єднання громадян, соціальні служби. Надати у друкованому вигляді інформацію про заклади та організації, де він зможе отримати допомогу з цих питань, із зазначенням їх адреси, назв, телефонів. З’ясувати, що може перешкодити отриманню цієї допомоги/послуги. За наявності у пацієнта ознак депресії, схильності до суїциду надати йому поради щодо подолання такого стану. Наприклад, можливо повідомити про безкоштовний телефон довіри, порекомендувати допомогу психолога чи психіатра, інше.
Алгоритм проведення консультування та тестування на наявність ІПСШ, в якому схематично наведена інформація щодо ведення пацієнта з ІПСШ, подано на рис. А.1.
Рисунок А.1 – Алгоритм проведення консультування на тестування на ІПСШ
ДОДАТОК Б
АКТИ ВПРОВАДЖЕННЯ
СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА ЗА ТЕМОЮ ДИСЕРТАЦІЇ
ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
Список опублікованих праць за темою дисертації:
- Инфекции, передающиеся половым путем, и социальная характеристика клиентов женщин коммерческого секса / Г.И. Мавров, Ю.В. Щербакова, Л.И. Пиньковская, В.И. Миронюк. Дерматологія та венерологія. 2013. № 4 (62). С. 44–55.
- Нейросифіліс на сучасному етапі: патогенез, клініка, діагностика, лікування / Г.І. Мавров, Е.Л. Баркалова, Л.Й. Пинковська, В.І. Миронюк. Журнал дерматології та косметології ім. М.О. Торсуєва. 2014. № 1–2. С. 114–122.
- Мавров Г.І., Миронюк В.І. Сифіліс у споживачів психоактивних речовин: систематичний огляд літератури. Дерматологія та венерологія. 2014. № 3 (65). С. 15–30.
- Миронюк В.І. Сифіліс у ВІЛ-інфікованих пацієнтів – концепція лікування (огляд літератури). Дерматологія та венерологія. 2015. № 2 (68). С. 20–29.
- Мавров Г.І., Нагорний О.Є., Миронюк В.І. Реабілітація хворих з хронічними запальними процесами в сечостатевих органах. Дерматологія та венерологія. 2016. № 4 (74). С. 72–78.
- Мавров Г.И., Щербакова Ю.В., Миронюк В.И. Эпидемиология латентного раннего сифилиса. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2016. № 1–2. С. 60–68.
- Мавров Г.И., Каменев В.И., Миронюк В.И. Амбулаторное лечение больных ранним сифилисом дюрантными пенициллинами в сочетании с доксициклином. Дерматовенерология. Косметология. Сексопатология. 2016. № 1–4. С. 214–219.
- Мавров Г.І., Миронюк В.І. Сифіліс серед споживачів психоактивних речовин: клініко-епідеміологічні та серологічні особливості. Дерматовенерологія. Косметологія. Сексопатологія. 2017. № 1–4. С.148–152.
- Мавров Г.І., Щербакова Ю.В., Миронюк В.І. Інфекції, що передаються статевим шляхом серед споживачів психоактивних речовин – чинники ризику та напрями профілактики. Дерматологія та венерологія. 2018. № 1 (79). С. 31–38.
- Миронюк В.І. Інфекції, що передаються статевим шляхом, у осіб, які споживають психоактивні речовини. Розповсюдженість та ризики зараження. Український журнал дерматології, венерології, косметології. 2018. № 1 (68). С. 67–71.
- Мавров Г.І., Миронюк В.І., Осінська Т.В. Розповсюдження інфекцій, що передаються статевим шляхом серед споживачів психоактивних речовин – аналіз сексуальних мереж. Дерматологія та венерологія. 2018. № 2 (80). С. 35–42.
- Мавров Г.І., Маняк Н.В., Миронюк В.І. Динаміка поширення та клініко-епідеміологічні особливості сифілісу в Рівненській області. Дерматологія та венерологія. 2018. № 3 (81). С. 66–73.
- Окремі показники цитокінового статусу у хворих на сифіліс споживачів психоактивних речовин / Г.І. Мавров, В.І. Миронюк, Ю.В. Щербакова, Т.В. Осінська. Дерматологія та венерологія. 2018. № 4 (82). С. 13–16.
- Миронюк В.І. Лікування сифілісу у ВІЛ-інфікованих – історичний екскурс та сучасна невизначеність (огляд літератури). Актуальні питання дерматології, венерології і ВІЛ/СНІД інфекції: Збірник наукових праць. Х. : изд-во «С.А.М.», 2015. С. 117–126.
- Мавров Г.І., Миронюк В.І. Залежність від психоактивних речовин як чинник інфікування ІПСШ та ВІЛ. Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я. Зб. наук. праць, під. ред. П.П. Рижка. 2018. Вип. 15. С. 229–237.
- Пат. на корисну модель 97172 UA, МПК А61В10/00. Спосіб обмеження поширення ВІЛ/СНІД та інфекцій, що передаються статевим шляхом, хворими груп підвищеного ризику / Г.І. Мавров, Г.М. Бондаренко, Ю.В. Щербакова, Л.В. Іващенко, Л.Й. Піньковська, В.І. Миронюк; заявник і патентовласник ДУ „Інститут дерматології та венерології НАМНУ”. № u201406144; заявл. 04.06.14; опубл. 10.03.15, Бюл. № 5.
- Нові підходи до діагностики та лікування ІПСШ в групах населення, уразливих щодо зараження ВІЛ (методичний посібник) / Г.І. Мавров, Г.М. Бондаренко, Ю.В. Щербакова, Л.В. Іващенко, В.І. Миронюк, Л.Й. Піньковська. Харків : МОЗ України, НАМН України, 2013. 48 с.
- Мавров Г.І., Миронюк В.І., Осінська Т.В. ІПСШ та ВІЛ-інфекція, серед осіб, які споживають психоактивні речовини. Матеріали Всеукраїнської науково-практичної конференцію з міжнародною участю “Сучасні технології у вирішенні клінічних і діагностичних задач дерматокосметології та інфекцій, що передаються статевим шляхом” (м. Святогірськ, 17-18 травня 2018 р.). Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2018. № 1 (39). С. 96.
- Мавров Г.І., Миронюк В.І. Інфекції, що передаються статевим шляхом, серед осіб, які споживають психоактивні речовини. VII Міжнародний медичний конгрес : Тез. доп., м. Київ, 25 квітня 2018 р. К., 2018. С. 140.
- Мавров Г.І., Миронюк В.І., Осінська Т.В. Інфекції, що передаються статевим шляхом, та гемоконтагіозні інфекції серед осіб, які споживають психоактивні речовини: поширеність і ризики зараження. Матеріали науково-практичної конференції з міжнародною участю «Питання профілактики, сучасна діагностика та інноваційні методи терапії в дерматовенерології», 15–16 листопада 2018 р., м. Харків. Дерматологія та венерологія. 2018. № 3 (81). С. 95–96.
Відомості про апробацію результатів дисертації:
- Науково-практична конференція з міжнародною участю «Актуальні проблеми дерматології, венерології та ВІЛ/СНІД-інфекції», присвяченої 155-річчю професора Зеленева І.Ф., м. Харків, 18–19 червня 2015 р., усна доповідь: Миронюк В.І. «Лікування сифілісу у ВІЛ-інфікованих – історичний екскурс та сучасна невизначеність (огляд літератури)».
- Науково-практична конференція «Інноваційні технології в дерматовенерології. Міждисциплінарні зв’язки», м. Харків, 13 листопада 2015 р., усна доповідь: Мавров Г.І., Іващенко Л.В., Миронюк В.І. «Проблеми ВІЛ-інфекції в аспекті дерматовенерології».
- Науково-практична конференція, присвячена 25-річчю НАМН України «Прогрес у сучасній діагностиці інфекцій, що передаються статевим шляхом, інфекційних, поширених і важких дерматозів. Досягнення в лікуванні», м. Київ, 25 квітня 2018 р., усна доповідь: Мавров Г.І., Миронюк В.І. «Инфекции, передающиеся половым путем, среди лиц, потребляющих психоактивные вещества».
- Всеукраїнська конференція за участю міжнародних спеціалістів «Сучасні технології у вирішенні клінічних і діагностичних задач дерматокосметології та інфекцій, що передаються статевим шляхом», м. Святогірськ, 17–18 травня 2018 р., усна доповідь: Мавров Г.І., Осінська Т.В., Миронюк В.І. «ІПСШ та ВІЛ-інфекція серед осіб, які споживають психоактивні речовини».
- Науково-практична конференція лікарів дерматовенерологів і косметологів Харківської області з міжнародною участю «Актуальні питання дерматології, дерматоонкології, косметології, венерології, ІПСШ та інших соціально-небезпечних хвороб», м. Харків, 24 травня 2018 р., усна доповідь: Мавров Г.І., Осінська Т.В., Миронюк В.І. «Інфекції, що передаються статевим шляхом, серед осіб, які використовують психоактивні речовини».
- Всеукраїнська науково-практична конференція з міжнародною участю «Особливості надання дерматовенерологічної допомоги населенню України в умовах медичної реформи», м.Івано-Франківськ, 17–18 жовтня 2018 р., усна доповідь: Мавров Г.І., Каменєв В.І., Миронюк В.І. «Інфекції, що передаються статевим шляхом, серед осіб, які споживають психоактивні речовини».
- Науково-практична конференція з міжнародною участю «Питання профілактики, сучасна діагностика та інноваційні методи терапії в дерматовенерології», м. Харків, 15–16 листопада 2018 р., усна доповідь: Мавров Г.І., Миронюк В.І., Осінська Т.В. «Інфекції, що передаються статевим шляхом та гемоконтагіозні інфекції серед осіб, які споживають психоактивні речовини – розповсюдженість та ризики зараження».