РОЗДІЛ 7
СТАТИСТИЧНИЙ АНАЛІЗ ВЗАЄМОЗВ’ЯЗКІВ КЛІНІКО-ЛАБОРАТОРНИХ
ТА ІНСТРУМЕНТАЛЬНИХ ПОКАЗНИКІВ У ХВОРИХ
Для більш детальної оцінки ступеня і спрямованості взаємозв’язків між показниками системного запального процесу та іншими інтегральними параметрами, що відображають клінічний стан пацієнтів при наявності Пс та ГХ, проведено кореляційний аналіз (Pearson) у цілому в основній групі хворих. Кореляційна матриця взаємозв’язків клінічних проявів дерматозу, тяжкість якого можна оцінити визначенням індексу PASI, стану нейрогуморальної регуляції, маркерів запального процесу, апоптозу, ЕД та нітрозуючого стресу, наведена в табл. 7.1.
Отримані значення коефіцієнта кореляції Пірсона демонстрували такі варіанти взаємозв’язків між досліджуваними клініко-лабораторними показниками: індекс тяжкості Пс та його поширеності – PASI, демонстрував слабкий позитивний зв’язок з такими маркерами запалення, як IL-1α та IL-1β; більш виражений позитивний зв’язок середньої сили був між індексом PASI та TNF-α, а також IL-6 (r=+0,513 та +0,583 відповідно; р<0,05), що свідчить про більш значну залежність клінічних проявів і поширеності Пс від рівнів IL-6 і TNF-α, які можна використовувати як маркери тяжкості і поширеності псоріатичного ураження шкіри при поєднанні з ГХ.
Кортизол демонстрував дуже слабкий кореляційний зв’язок з індексом PASI, проте з інсуліном сила зв’язку була дещо сильнішою – на рівні слабкого позитивного. Таким чином, не спостерігалося безпосереднього суттєвого впливу цих гормональних маркерів на клінічні прояви Пс. Проте таки існувала досить високого ступеня взаємозалежність між станом нейрогуморальної регуляції і перебігом дерматозу, який реалізується через систему моноамінів, а саме – серотоніну. Встановлено середньої сили позитивний достовірний (r=+0,536; р<0,05) зв’язок між рівнем серотоніну в сироватці крові хворих на коморбідну патологію та індексом PASI. У свою чергу, вміст сироваткового серотоніну мав високого ступеня кореляційний зв'язок (r=+0,762; р<0,05) з рівнем тривоги та депресії, що дозволяє використовувати метод анкетування у якості прогнозування розвитку тяжкого, стійкого до терапії дерматозу і своєчасного призначення пацієнтам коригуючої терапії.
Таблиця 7.1 – Кореляційна матриця досліджуваних показників в цілому в групі хворих на Пс і ГХ
| Бал PASI | IL-1β | IL-1α | IL-6 | TNF-α | Кортизол | Інсулін | Нітро-тирозин | Ендо-телін-1 | Кас-паза-8 | VEGF- α | Гомоцис-
теїн |
EPCR | Серо-тонін | NOS | |
| Бал PASI | 1 | ||||||||||||||
| ІЛ-1 β | 0,334 * | 1 | |||||||||||||
| IL-1α | 0,23 | 0,682 * | 1 | ||||||||||||
| IL-6 | 0,583 * | 0,375 * | 0,642 * | 1 | |||||||||||
| TNF- α | 0,513 * | 0,683 * | 0,997 * | 0,617 * | 1 | ||||||||||
| Кортизол | 0,049 | –0,434 * | –0,236 | 0,076 | –0,258 | 1 | |||||||||
| Інсулін | 0,245 | 0,465 * | 0,315 | 0,292 | 0,331 * | 0,029 | 1 | ||||||||
| Нітротирозин | 0,329 * | 0,827 * | 0,589 * | 0,483 * | 0,76 * | –0,270 | 0,524 * | 1 | |||||||
| Ендотелін-1 | 0,218 | 0,917 * | 0,764 * | 0,432 * | 0,755 * | –0,322 | 0,324 * | 0,904 * | 1 | ||||||
| Каспаза-8 | 0,333 * | 0,677 * | 0,949 * | 0,783 * | 0,924 * | –0,184 | 0,335 | 0,621 * | 0,753 * | 1 | |||||
| VEGF- α | 0,587 * | 0,097 | –0,003 | 0,504 * | 0,28 * | 0,112 | –0,092 | 0,245 | 0,088 | 0,127 | 1 | ||||
| Гомоцистеїн | 0,448 * | 0,398 * | 0,652 * | 0,653 * | 0,602 * | 0,131 | 0,315 | 0,397 * | 0,413 * | 0,852 * | 0,149 | 1 | |||
| EPCR | –0,512 * | –0,429 * | –0,616 * | –0,660 * | –0,574 | –0,043 | –0,399 * | –0,348 | –0,364 | –0,807 * | –0,197 | –0,948 * | 1 | ||
| Серотонін | 0,536 * | 0,347 * | 0,520 * | 0,512 * | 0,440 | 0,204 | 0,369 | 0,174 | 0,340 | 0,845 * | 0,210 | 0,924 * | –0,948 * | 1 | |
| NOS | 0,412 * | –0,026 | –0,089 | –0,667 * | –0,31 * | 0,116 | 0,014 | 0,023 | –0,045 | –0,183 | 0,022 | –0,181 | 0,210 | –0,171 | 1 |
| Нітрити | 0,409 * | –0,042 | –0,132 | –0,701 * | –0,24 * | 0,087 | –0,023 | 0,413 * | –0,071 | –0,230 | 0,018 | –0,233 | 0,248 | –0,195 | 0,993 * |
Примітка. * – статистична значимість коефіцієнта кореляції Пірсона, р <0,05.
Якщо досліджувати зв’язок між маркерами нітрозуючого стресу та індексом PASI, то простежується така динаміка: нітротирозин, NOS та нітрити мали слабкий позитивний зв’язок з індексом тяжкості Пс та його поширеності (r=+0,329; 0,412 і 0,409 відповідно; р<0,05).
Маркери ЕД ендотелін-1 та гомоцистеїн також демонстрували позитивний зв’язок слабкої сили з індексом PASI, а маркер EPCR мав достовірно негативний зв’язок середньої сили (r=–0,512; р<0,05), тобто, чим вище значення EPCR, тим менше поширеність псоріатичного процесу та легше його перебіг.
Привертає увагу наявність достовірного зв’язку середньої сили показника поширеності ураження шкіри PASI з маркером неоваскуляризації VEGF-А (r=+0,587; р<0,05), що дозволяє нам провести паралель між активністю процесів новоутворення судин в дермі хворих на Пс+ГХ і площею ураження шкіри. В той же час, між VEGF-А і каспазою-8 не існує вираженої кореляції, це дозволяє нам зробити висновок, що не існує прямої залежності між площею ураження шкіри при дерматозі і ризиком розвитку артропатії.
Маркер апоптозу каспаза-8 та індекс PASI були достовірно (р<0,05) пов’язані між собою позитивним зв’язком слабкої сили (r=+0,333), що не дозволяє робити висновки стосовно безпосереднього впливу показника апоптозу на поширеність ураження шкіри. Високу силу кореляції демонструє каспаза-8 відносно цитокінів, і це не дивно, тому що з’ясовано взаємозв’язок цього маркера з артропатичною формою Пс та абсолютно природна системна запальна реакція на розвиток автоімунного запалення. Також визначається виражена кореляція між каспазою-8 і нітротирозином (r=+0,621; р<0,05), ендотеліном-1 (r=+0,753; р<0,05), що може свідчити про значний вплив нітрозуючого стресу і ступеня вазоконстрикції на формування саме артропатичної форми Пс.
Таким чином, з отриманих вище результатів можна зробити висновок: тяжкість Пс та поширеність процесу ураження шкіри у вигляді індексу PASI більше залежить від виявлення підвищеного рівня таких маркерів, як серотонін, TNF-α та IL-6, що є прямим обґрунтуванням для їх використання у клінічній практиці.
Наступний маркер запалення IL-1β демонстрував достовірний (р<0,05) позитивний зв’язок слабкої сили з IL-6, інсуліном, гомоцистеїном і серотоніном. Дуже слабкий позитивний зв’язок був між IL-1β і VEGF-a та дуже слабкий негативний зв’язок із NOS та нітритами. Позитивний достовірний (р<0,05) зв’язок середньої сили визначено між IL-1β та IL-1α, TNF-α та каспазою-8, що свідчить про прямий значущий зв’язок між патогенетичними ланцюгами системного запального процесу організму та розвитком апоптозу. Також виявлений позитивний достовірний (р<0,05) сильний зв’язок між IL-1β і нітротирозином (r=+0,827) та ендотеліном-1 (r=+0,917), тобто активність розвитку ЕД і нітрозуючого стресу прямо пов’язана із активністю системного запального процесу у вигляді маркера IL-1β. Кортизол та EPCR достовірно (р<0,05) демонстрували негативний слабкий зв’язок з IL-1β на рівні r=–0,434 та r=–0,429 відповідно, тобто рівень даного стресового гормону та експресія EPCR зменшуються при підвищенні рівня прозапального IL-1β [45, 49].
IL-1α демонстрував дуже слабкий негативний зв’язок з такими маркерами: VEGF‑α, NOS, нітрити, що не є статистично достовірним. Негативний зв’язок слабкої та середньої сили зафіксовано між IL-1α і кортизолом та EPCR, тобто, як і у випадку з IL-1β, рівень цього стресового гормону та експресія EPCR зменшувалися при підвищенні рівня прозапального IL-1α. Слабкий позитивний достовірний (р<0,05) зв’язок зафіксовано між IL-1α та інсуліном, а позитивний достовірний (р<0,05) зв’язок середньої сили – між IL-1α та IL-6 (r=+0,642), нітротирозином (r=+0,589), гомоцистеїном (r=+0,652) та серотоніном (r=+0,520), тобто, чим активніший системний запальний процес в організмі хворої людини і чим вищий рівень запального маркера IL-1α, тим вище рівень іншого прозапального маркера – IL-6, більш активно перебігають процеси нітрозуючого стресу, ЕД та ураження шкіри з формуванням типової клінічної картини дерматозу. Дуже сильна позитивна достовірна (р<0,05) кореляція визначена між IL-1α і TNF-α (r=+0,997) та каспазою-8 (r=+0,949), сильний позитивний достовірний (р<0,05) зв’язок – між IL-1α та ендотеліном-1 (r=+0,764), що свідчить про активацію ЕД та апоптозу зі збільшенням активності системного запального процесу у вигляді підвищення відповідних прозапальних маркерів (IL-1α та TNF-α).
При вивченні кореляційних зв’язків IL-6, отримані такі результати: позитивний зв’язок дуже слабкої сили існує між IL-6 і кортизолом, що не має суттєвого статистичного значення. Достовірний (р<0,05) позитивний зв’язок також слабкої сили має місце між IL-6 та інсуліном (r=+0,292), більш суттєвий – з нітротирозином (r=+0,483) та ендотеліном-1 (r=+0,432), що свідчить про формування стресової реакції організму у вигляді зростання інсуліну, активності нітрозуючого стресу та ЕД у відповідь на системний запальний процес. Достовірний (р<0,05) позитивний зв’язок середньої сили виявлений між IL-6 та TNF-α (r=+0,617), VEGF-α (r=+0,504), гомоцистеїном (r=+0,653) та серотоніном (r=+0,512) і сильний зв’язок із каспазою-8 (r=+0,783). Тобто, при збільшенні рівня IL-6 зростає тяжкість ЕД і, як результат – ступінь прояву ГХ, активність апоптотичних процесів в організмі та тяжкість дерматозу. В той же час, такі маркери, як EPCR, NOS і нітрити демонструють негативний достовірний (р<0,05) зв’язок середньої сили (r= –0,660, r= –0,667 та r= –0,701 відповідно), що свідчить про зменшення активності NOS і рівня нітритів із прогресуванням тяжкості запального процесу і збільшенням ступеня тяжкості вазоконстрикції як патогенетичної основи ГХ.
Наступний маркер запального процесу TNF-α демонстрував достовірний (р<0,05) слабкий зв’язок із такими параметрами, як інсулін (r = +0,331), VEGF-А (r = +0,28) і серотонін (r = +0,440). Позитивний достовірний (р<0,05) зв’язок середньої сили існував між TNF-α та нітротирозином (r = +0,575) і гомоцистеїном (r = +0,602), сильний кореляційний зв’язок – між TNF-α та ендотеліном-1 (r = +0,755), каспазою-8 (r = +0,924), що підтверджує сприйняття Пс як полісистемного захворювання, при якому чим активніше розвивається системний запальний процес і вищий рівень маркера цього процесу – TNF-α, тим активніше перебігають процеси нітрозування білків, апоптозу та ЕД при наявності супутньої ГХ. Виявлений негативний характер зв’язку слабкої сили між TNF-α та кортизолом, NOS та нітритами, а також негативний зв’язок середньої сили між TNF-α та EPCR свідчить про обернено пропорційний зв’язок між даними параметрами: чим активніший і триваліший запальний процес – тим менша активність NOS і нижчий рівень нітритів, гормону кортизолу та EPCR, що може свідчити про виснаження цих систем.
При вивченні кореляційних взаємозв’язків рівня кортизолу з іншими маркерами не було виявлено статистично значущих показників коефіцієнта кореляції Пірсона, а саме: позитивний дуже слабкий зв’язок з інсуліном, VEGF‑А, гомоцистеїном, серотоніном, нітритами та NOS; негативний дуже слабкий зв’язок з каспазою-8 та EPCR; негативний слабкий зв’язок з нітротирозином та ендотеліном-1.
Статистично значущі кореляційні зв’язки інсуліну такі: позитивний зв’язок слабкої сили з ендотеліном-1, каспазою-8, гомоцистеїном, серотоніном. Особливо звертає на себе увагу позитивний достовірний (р<0,05) середньої сили зв’язок із нітротирозином на рівні 0,524, що свідчить про пряму залежність високих рівнів інсуліну в організмі хворого на коморбідну патологію та активності нітрозуючого стресу. Кореляційний зв’язок інсуліну та VEGF-А, NOS і нітритів недостовірний та занадто слабкий; EPCR та інсулін пов’язані достовірним (р<0,05) негативним зв’язком середньої сили на рівні r = –0,399, тобто ендотеліопротекторні резерви організму значно знижуються при зростанні рівня інсуліну.
Нітротирозин не мав статистично значущих кореляційних зв’язків з такими показниками, як серотонін і NOS. З нітритами нітротирозин проявляв позитивний і слабкої сили (r = +0,413; р<0,05) зв’язок, VEGF-А та гомоцистеїн також пов’язані з нітротирозином позитивним кореляційним зв’язком слабкої сили, демонструючи взаємозалежність процесів нітрозуючого стресу та ЕД. EPCR та нітротирозин пов’язані негативним кореляційним зв’язком слабкої сили, що підтверджує дані про зниження ендотеліопротекторних властивостей організму з підвищенням активності нітрозування білків в організмі хворого. Ендотелін-1 і каспаза-8 впевнено демонстрували достовірний (р<0,05) позитивний зв’язок із нітротирозином сильного і середнього ступеня вираженості (r = +0,904 і r = +0,621 відповідно), тобто при наявності нітрозуючого стресу більш активно перебігають процеси апоптозу та ЕД.
Наступний маркер ЕД – ендотелін-1, не мав статистично значущих кореляційних зв’язків з такими маркерами, як VEGF-А, NOS і нітрити. Серотонін і гомоцистеїн мали позитивний зв’язок слабкої сили з ендотеліном-1 (r = +0,340 і r = +0,413 відповідно), а EPCR пов’язаний із ендотеліном-1 слабким зв’язком протилежної спрямованості
(r = –0,364), адже чим активніше перебігає ЕД, тим менші резерви ендотеліопротекції. Заслуговує на увагу позитивний достовірний сильний зв’язок (р<0,05) (r=0,753) між каспазою-8 та ендотеліном-1, тобто, чим більші прояви ЕД, тим більш виражені процеси апоптозу.
Дуже слабкий позитивний кореляційний зв’язок, згідно з кореляційною матрицею, виявлено між каспазою-8 та VEGF-А, з NOS, слабкий негативний зв’язок з нітритами, тобто, недостатня активність NOS і низький рівень нітритів провокують активність процесів апоптозу. Сильний достовірний (р<0,05) кореляційний зв’язок із знаком плюс між каспазою-8 та гомоцистеїном (r = +0,852) і серотоніном (r = +0,845) свідчить про активацію процесів апоптотичного шляху загибелі клітин на фоні ГГЦ та підвищеного рівня серотоніну. З урахуванням виявленого раніше взаємозв’язку між рівнем каспази-8 та артропатичною формою Пс, а тепер – і з рівнем серотоніну, який корелював із тривогою та депресією, можна провести паралель між психоемоційним станом пацієнта, можливістю формування артропатичної форми дерматозу і необхідністю дослідження рівня серотоніну та призначення відповідної коригуючої терапії. Між каспазою-8 та EPCR кореляційний зв’язок сильний достовірний (р<0,05) із знаком мінус (r = –0,807), тобто апоптотичні процеси в організмі лімітують ендотеліопротекторні резерви судинної системи.
Між VEGF-А та іншими ключовими маркерами системного патофізіологічного процесу при Пс та супутній ГХ виявлено слабкий позитивний кореляційний зв’язок, що не представляє суттєвого статистичного значення.
Гомоцистеїн був пов’язаний із NOS, згідно з отриманими даними, дуже слабким негативним зв’язком, а з нітритами – слабким негативним зв’язком, тобто високі рівні гомоцистеїну асоціюються з низькою активністю ферменту NOS і зниженням рівнів нітритів. Серотонін і гомоцистеїн пов’язані позитивним достовірним (р<0,05) дуже сильним кореляційним зв’язком (r = +0,924), взаємно потенціюючи патологічні ефекти при Пс і ГХ, а EPCR і гомоцистеїн мали аналогічний за силою зв’язок, але зі знаком мінус (r = –0,948).
EPCR та NOS і нітрити мали слабкий позитивний кореляційний зв’язок, що свідчить про більш виражені резерви ендотеліопротекції при значній активності NOS та більш високих значеннях нітритів. Із серотоніном EPCR був пов’язаний негативним достовірним дуже сильним кореляційним зв’язком (r = –0,948; р<0,05), тобто серотонін є тим маркером, за яким можна оцінити ендотеліопротекторні резерви організму хворого в прогресуючій стадії Пс на тлі ГХ.
У той же час, серотонін, як свідчать результати кореляційного аналізу, мав дуже слабкий негативний зв’язок з NOS і нітритами, що не представляє суттєвого статистичного значення і потребує самостійної корекції як одного, так і іншого ланцюга патогенезу досліджуваного коморбідного стану. У свою чергу, NOS і нітрити мали дуже сильний достовірний (р<0,05) позитивний кореляційний зв’язок (r = +0,993), що є логічним представленням більш високих рівнів нітритів при активації ферменту, який синтезує ці самі нітрити – NOS.
Слід зазначити, що при оцінці ступеня взаємозв’язку між вираженістю психоемоційних змін, згідно з результатами анкетування за допомогою госпітальної шкали тривоги та депресії, та рівнем серотоніну сироватки крові виявилося, що залежність має U-подібну форму, тому коефіцієнт кореляції низький (нелінійна асоціація, рис. 7.1).
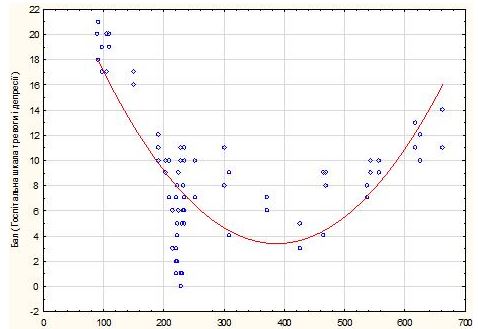
Рисунок 7.1 – Параболічна спряженість рівня тривоги та депресії (HADS) при Пс в залежності від рівня сироваткового серотоніну
Важливо підкреслити, що найбільші бали за цією госпітальною шкалою (>15 балів) частіше мали пацієнти з дуже низьким рівнем серотоніну (менше 100 нг/мл). Це свідчить про можливий патогенетичний зв’язок між цими процесами, про необхідність фармакологічної корекції цих порушень і про важливість індивідуалізації терапії із урахуванням рівня серотоніну. В той же час, кількість осіб зі встановленим станом наявності тривоги / депресії, згідно зі шкалою HADS (сума балів понад 11), була достовірно вищою як при рівні серотоніну менше 130 нг/мл, так і при різкій елевації цього нейротрансмітера (більше 600 нг/мл) при р < 0,05.
Як видно з наведених даних, крива вираженості тривожної і депресивної симптоматики (за госпітальною шкалою HADS) мала ступеневу (квадратичну) залежність. Але якщо низький рівень серотоніну прогнозовано й логічно асоціювався з високим ризиком формування зазначених розладів (відносний ризик (ВР) 1,5; 95 % ДІ 1,31-1,64), то наявність субклінічних емоційних порушень і ситуативної / особистісної тривожності (згідно з анкетуванням за допомогою Бослаб) у деяких осіб із Пс і максимальними концентраційними значеннями зазначеного біогенного аміну була досить несподіваною, причому серотоніновий синдром був виключений.
З огляду на прийняту узгодженість і валідність шкали HADS у різних дослідженнях з оцінки тяжкості симптоматики тривожних розладів і депресії не тільки в соматичних, але і психіатричних стаціонарах, імовірно, що даний факт може бути пов’язаний лише з метаболізмом серотоніну та потенційно пояснений можливою серотонін-резистентністю, гіперсенситивністю мембранних 5-HT‑рецепторів. Більш того, наведені суперечливі дані можна пояснити тим, що сироваткова концентрація серотоніну не корелює з цим же похідним триптофану в синапсах ЦНС (не ідентична). Також важливо зазначити, що серотонін міститься у фізіологічних депо (тромбоцити), що, також можливо, має певне значення при його визначенні у крові хворих на Пс.
Таким чином, отримані дані дозволяють зробити висновок, що рівень серотоніну при Пс достовірно асоціюється з поширеністю і тяжкістю депресивних і тривожних розладів, причому наявність зазначених епізодів психічного стану у пацієнтів з Пс більшою мірою був чітко пов’язаний з низькою активністю гормону медіаторних систем ЦНС, серотоніну (р<0,05).
Логічно припустити, що у хворих на Пс при поєднанні з ГХ між окремими лабораторними показниками, що відображають активність факторів неоваскуляризації (VEGF-А), апоптозу (каспаза-8), ЕД / оксидативного стресу (ендотелін-1, гомоцистеїн, нітротирозин, EPCR), вираженість імунозапальних реакцій (цитокіновий комплекс – ІЛ‑α, IL-1β, IL-6, TNF-α), патологію гемостазу (EPCR), тяжкість нейрогуморальних порушень (кортизол, інсулін, серотонін), існує певна спряженість, для вивчення якої з метою угруповування багатовимірних об’єктів і був використаний ієрархічний кластерний аналіз, котрий базується на представленні результатів окремих спостережень точками відповідного геометричного простору з подальшим виділенням «сузір’їв», кластерів (рис. 7.2). Причому важливо оцінити не тільки наявність, вираженість і статистичну значущість потенційних асоціацій, але й вивчити динаміку цих взаємозв’язків і ступінь відмінностей з групами порівняння з Пс або ГХ.
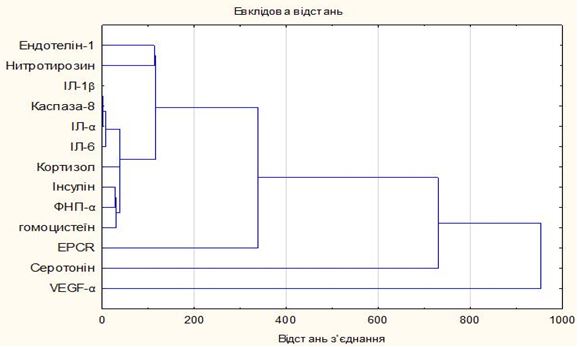
Рисунок 7.2 – Дендрограма кластерного аналізу досліджуваної групи
показників у хворих на Пс на тлі ГХ
Отже, вивчено отримані результати кластерного аналізу, проведеного з використанням статистичного пакету «Statistica 6.0». Аналізувалися різні лабораторні маркери у хворих на Пс, дані попередньо нормувалися. При аналізі визначався метод кластеризації, вид формули для відстані (евклідово) і кількість кластерів в еталонному алгоритмі. Середні значення для кожного кластера представлені на рисунку отриманої горизонтальної деревоподібної діаграми. На дендрограмі по горизонталі відзначено основні лабораторні маркери, а по вертикалі – відстані між об’єднаними кластерами, виражені за допомогою евклідової «метрики».
Проведений ієрархічний кластерний аналіз наочно демонструє, що на початковому етапі в агрегації формується асоціативний взаємозв’язок між основною ланкою прозапального цитокінового каскаду, а саме ІЛ (підтвердження системної запальної реакції, що лежить в основі розвитку як локальних (на рівні шкіри), так і позашкірних уражень у процесі прогресування дерматозу), і важливою роллю каспази-8 (маркера апоптозу), що підкреслює ініціальну роль імунозапального компонента, який запускає складний імунопатологічний процес, що реалізується у вигляді гіперпроліферації кератиноцитів, порушуючи їх диференціювання і формуючи імунне запалення в дермі, та апоптоз-індукованих процесів у хворих на Пс, які погіршуються наявністю ГХ. Отримані дані добре вписуються в концепцію цитокін-залежної дисфункції імунокомпетентних клітин при Пс, що проявляється, зокрема, їх апоптозним дисбалансом.
Далі, згідно з оцінкою нових вузлів у графі (місце формування нового кластера), видно величину відстані, на якій відповідні елементи зв’язуються в новий єдиний кластер. Паралельно йде утворення іншої агломерації, яку складають злиття кластера TNF-α з гомоцистеїном та інсуліном, з подальшим приєднанням кортизолу. Отримана структура відображена в ієрархічному дереві різними гілками, а зазначений кластер логічно доповнює первинний кластер (за рахунок наявності TNF-α) і свідчить про патогенетичну роль порушення вуглеводного обміну з формуванням ІР у розвитку псоріатичних уражень.
При цьому, на тлі зазначених метаболічних порушень, формування ГГЦ, ймовірно, за рахунок наявності ГХ, спостерігалося зростання цитотоксичності цього маркера, що, у свою чергу, призводило до потенціювання ендотелій-деструктивних медіаторів, порушення процесів коагуляції та ін., що в комплексі сприяло прогностично більш негативному і клінічно агресивному перебігу Пс.
За результатами угрупування можна зробити висновок, що тісно пов’язані між собою рівні ендотеліну-1 і нітротирозину, які відображають взаємозв’язок порушення функціонального стану васкулярного ендотелію з підвищенням рівня вазоконстрикторів (ендотеліну-1) і порушенням біодоступності NO, пул якого і так знижений з причини дисфункції ендотелію, але і пояснюється підвищеною деградацією активними формами кисню на тлі нітрозуючого стресу, на наявність якого вказував кінцевий продукт NO деструкції через пероксинітрит – нітротирозин. Ці процеси посилюють порушення регіонарного кровообігу, що має відображення в літературі, тому що Пс властиві виражені капілярні та артеріолярні судинні зміни, а макро- і мікроваскулярні розлади пов’язують з розвитком ЕД. У свою чергу, пошкодження ендотеліальних клітин при Пс може відбуватися під впливом факторів росту фібробластів та ендотеліоцитів, а також внаслідок активації ангіогенних прозапальних цитокінів, що підсилюють синтез молекул клітинної адгезії, які визначають ступінь мікроциркуляторних змін і порушень ендотеліальної функції судин.
На наступному етапі до останньої групи додається EPCR, який, взаємодіючи з АПС, що активується протеазами, рецептором аполіпопротеїну Е2 та інтегринами, справляє різні ефекти на систему гемостазу (антикоагулянтний ефект) та імунну систему організму (цитопротекторний ефект). Порушення цієї природної антикоагулянтної системи сприяє збільшенню судинного ушкодження і стресу, що додатково погіршує перебіг дерматозу, особливо на тлі ГХ, тому що показано, що у хворих на Пс при тривалому впливі факторів (імунні комплекси, медіатори запалення тощо) відбувається пошкодження ендотеліоцитів, що призводить до патологічної відповіді навіть на звичайні стимули у вигляді тривалої вазоконстрикції, тромбоутворення і клітинної проліферації.
Надалі мало місце злиття цього кластера з параметром «серотонін», продуктом метаболізму триптофану, який впливає на диференціювання і проліферацію епідермісу, обмін речовин в тканинах і т.ін. Причому серотонін є сполучною ланкою між нервовою, імунною, ендокринною системами і шкірою. Також важливо відзначити роль серотоніну як сполучної ланки між нейропсихологічним та імунологічним функціонуванням організму, особливо при коморбідності Пс та ГХ. Пізнє включення дозволяє відзначити вторинність порушення метаболізму серотоніну, тому що вихідний запуск імунної відповіді при даному патологічному стані активують про- і запальні цитокіни, які в свою чергу активують фермент деградації триптофану і серотоніну. Це і пояснює факт включення серотоніну на даному етапі.
Фінальне приєднання VEGF-А до розрахованої кластерної структури лабораторних маркерів при Пс на тлі ГХ відображає патофізіологічне значення збільшення ангіогенезу в результаті активації експресії цього сигнального білка при зазначеній коморбідності, ймовірно, остаточно детермінуючи інтенсивність запального процесу в шкірі. Гіперпродукція цього ангіогенного фактора призводить до неоваскуляризації, що відіграє важливе значення в патогенезі і клініці Пс.
На дендрограмі видно, що ці напрямки остаточно об’єдналися з усіма іншими на останніх етапах роботи алгоритму кластерного аналізу, яке пережило стійкість раніше сформованих груп.
Значення F-статистики, отримані для кожного вимірювання, є іншим індикатором того, наскільки добре відповідний вимір дискримінує кластери. Слід зазначити, що у пацієнтів груп порівняння угрупування, згідно з отриманою горизонтальною деревовидною діаграмою по підгрупах, були менш барвисті й інтерпретовані, часто недостовірні.
* * *
Згідно проведеної процедури ієрархічного кластерного аналізу, можна відзначити, що у хворих на Пс із супутньою ГХ між параметрами, що відображають активність апоптозу, ангіогенних факторів росту, ЕД, нітрозуючого і оксидативного стресу, а також вираженістю імунозапальних реакцій, патології гемостазу, вуглеводного обміну, метаболізму триптофану і метіоніну, існує статистично значущий взаємозв’язок, найбільш виражений і значущий при коморбідності.
Проведена процедура кластеризації та інтерпретації дозволяє аргументовано, на підставі глибокої оцінки суті процесів та оптимального розбиття на певні групи ряду об’єктів, зробити висновки про механізм розвитку патологічного процесу при одночасному перебігу Пс і ГХ.
При проведенні кореляційного аналізу за Пірсоном з’ясовано, що існує достовірний позитивний сильний статистично значимий зв’язок між такими показниками: IL-1β та нітротирозин, ендотелін-1; IL-1α та TNF-α, ендотелін-1, каспаза-8; IL-6 та каспаза-8; TNF-α та нітротирозин, ендотелін-1, каспаза-8; нітротирозин та ендотелін-1; ендотелін-1 та каспаза-8; каспаза-8 та гомоцистеїн, серотонін; гомоцистеїн та серотонін; NOS та нітрити. Достовірний негативний сильний статистично значимий кореляційний зв’язок існує між: IL-6 та нітритами; каспазою-8 та EPCR; гомоцистеїном та EPCR; EPCR та серотоніном. Отримані дані є підґрунтям для розробки напрямків терапевтичної корекції зазначеного коморбідного стану.
Матеріали даного розділу опубліковані в наступних роботах:
[35, 38, 44, 45, 50, 56, 95, 408]
РОЗДІЛ 8
КОМПЛЕКСНА ПАТОГЕНЕТИЧНА ТЕРАПІЯ
З КЛІНІКО-ЛАБОРАТОРНОЮ ОЦІНКОЮ ЇЇ ЕФЕКТИВНОСТІ
Усі хворі на Пс, яким було призначено терапію, були розподілені шляхом рандомізації на дві групи: 15 пацієнтів групи порівняння і 45 – основної групи. Порівняння відбувалося за ступенем тяжкості дерматозу, порушення ЯЖ. Усі пацієнти отримували традиційну терапію в умовах дерматологічного стаціонару згідно з наказом МОЗ України № 312 від 08.05.2009 та № 762 від 20.11.2015 [80, 82], хворі на Пс основної групи – додаткову терапію за спеціально розробленою методикою. Традиційна терапія складалася з дезінтоксикаційних, гіпосенсибілізуючих, протизапальних, судинних препаратів, гепатопротекторів, вітамінів; фізіотерапевтичного лікування; зовнішньої терапії. Пацієнтам з тяжкими формами Пс до лікування додавали цитостатики (метотрексат). Хворим на ГХ у поєднанні з Пс після обстеження і консультації кардіолога/терапевта призначалася традиційна адекватна антигіпертензивна терапія з персональним підбором патогенетично обґрунтованого лікування.
Слід нагадати, що хворим на Пс не рекомендовано призначення β‑адреноблокаторів, інгібіторів АПФ. Підтвердженням цього постулату були розвиток і прогресування дерматозу у 1 хворого з основної групи, що пов’язано з прийомом β‑адреноблокаторів. Саме тому пацієнтам основної групи призначали по два препарати з наступних груп антигіпертензивних препаратів:
– антагоністи кальцію;
– діуретики;
– блокатори рецепторів ангіотензину ІІ першого типу, або сартани.
Препарати з групи антагоністів кальцію були кращі за інші у хворих похилого віку, пацієнтів з проявами метаболічного синдрому, зі стенокардією, із захворюваннями периферичних артерій, гіпертрофією лівого шлуночка, при наявності безсимптомного атеросклерозу, ізольованій систолічній АГ, у хворих з хронічними обструктивними захворюваннями легенів, при високому ризику розвитку ішемічної хвороби серця.
Діуретики призначали переважно хворим похилого віку, з проявами метаболічного синдрому, високим ризиком розвитку ішемічної хвороби серця.
Хворим з попереднім інфарктом міокарду, фібриляцією передсердь, гіпертрофією лівого шлуночка, при наявності ниркової дисфункції, мікроальбумінурії, проявах метаболічного синдрому – рекомендовані блокатори рецепторів ангіотензину.
Питання призначення оптимального лікування хворих на Пс із супутньою ГХ залишається невизначеним, у зв’язку з обмеженою доказовою базою. З урахуванням результатів досліджень усім пацієнтам основної групи було призначено додатково курс терапії препаратом армадін (2-етил-6-метил-3-гідроксипіридину сукцинат) і сеанси БЗЗ. Армадін у дозі 4 мл (200 мг) призначали внутрішньовенно крапельно 1 раз на день протягом 10 днів з подальшим пероральним прийомом у добовій дозі 500 мг (армадін-лонг), тривалість курсу 3 місяці [77, 407].
Слід відзначити, що армадін є препарат з унікальним клінічним і фармакологічним спектром. В його основі полягає своєрідний потрійний механізм дії даного засобу, який полягає у спрямованому впливі на процеси окисного метаболізму клітин організму. В першу чергу цей вплив стосується корекції базових біохімічних процесів у клітинах шкіри, ендотелію судин, порушених у результаті дії ішемічного і автоімунного фактора, і складається з прямої антиоксидантної дії (зв’язування утворених в умовах гіпоксії вільних радикалів – активних форм кисню та гідроперекисів) і захисту клітинних мембран (зовнішніх та внутрішніх – мітохондріальних), що сприяє реалізації протективного ефекту щодо основних мембранозв’язаних ферментів (аденілатциклази, фосфодіестерази та ін.). Армадін також має непряму антиоксидантну дію (активація природної АОС – ферментів каталази та СОД, а також біосинтезу глутатіону), активує провідні ланки циклу Кребса – фермент сукцинатдегідрогеназу і, відповідно, сукцинатзалежні реакції, що безпосередньо визначають накопичення макроергічних фосфатів (аденозинтрифосфат, аденозиндифосфат). Це у свою чергу призводить до зниження концентрації лактату, попереджаючи розвиток лактоацидозу і серйозних порушень кислотно-лужної рівноваги [78]. Одним із важливих моментів у багатофакторному механізмі дії даного препарату є його здатність покращувати реологічні властивості крові, а також виражений гіполіпідемічний ефект. Призначення армадіну пацієнтам з такою поєднаною патологією, як Пс і ГХ, має за мету сприяти зменшенню об’єктивної і суб’єктивної симптоматики та поліпшенню ЯЖ внаслідок позитивного впливу на патогенетичні механізми оксидативного стресу. Армадіну також властива здатність пригнічувати утворення вільних радикалів при активації синтезу простагландинів і лейкотрієнів – провідної ланки ушкодження клітин на наступних етапах патофізіологічних реакцій при цій коморбідній патології. Ефективному застосуванню армадіну в умовах сформованої ГХ на тлі Пс сприяє також високий рівень безпеки даного препарату. Побічні ефекти відмічаються рідко і проявляються лише у вигляді нудоти, сухості в роті, сонливості, збудження або шкірних алергічних реакцій, ризик розвитку будь-яких серйозних ускладнень при застосуванні даного препарату відсутній. Крім того, армадін володіє мінімальним потенціалом міжлікарської взаємодії, що дозволяє безпечно застосовувати його в умовах комбінованої терапії з іншими засобами імуно-, вазо- і кардіотропного типу дії [71].
В останні часи популярність набувають методи біологічного управління, в основі яких полягають принципи БЗЗ, спрямованого на розвиток та вдосконалення механізмів саморегуляції фізіологічних функцій при різних патологічних станах. Цей метод найбільш вдало застосовується при корекції психосоматичних порушень. БЗЗ – це метод, який сприяє розвитку порушених процесів самоперцепції, диференціації внутрішніх відчуттів та релаксації. Релаксація – процес, який супроводжується зняттям психічного напруження, що призводить до зміни низки психофізіологічних характеристик, які свідчать про зниження напруги, вираженій у різній мірі [73]. Релаксація може бути як мимовільною, так і свідомою, досягнутою в результаті застосування спеціальних психофізіологічних методик, до яких саме і належить температурно-міографічний тренінг, що проводиться із застосуванням апаратного комплексу «Бослаб-професійний Плюс». Обладнання для біоуправління являє собою набір датчиків, що кріпляться на тіло пацієнта, панелі перетворюючого пристрою й комп’ютеру, що дозволяє знімати інформацію про основні фізіологічні процеси, а саме – електроміограму та температуру кінцівок. Релаксаційний тренінг біологічного управління відбувається через демонстрацію на екрані комп’ютера тих сигналів, які виходять за рамки індивідуальної норми стану систем організму. У процесі релаксаційного тренінгу пацієнт навчається змінювати ці параметри у необхідному напрямку для того, щоб зняти напругу і таким чином покращити свій функціональний стан.
Сеанси терапії БЗЗ з використанням температурного та міорелаксаційного тренінгу проводилися таким чином: для міорелаксаційного тренінгу на обличчі хворого фіксувалися датчики напруження фронтальних груп м’язів обличчя; для температурного тренінгу датчик фіксувався на дистальній фаланзі вказівного пальця кисті. Тренінги проводилися протягом 10 днів щоденно, тривалість одного сеансу тренінгу становила 50 – 60 хвилин. У подальшому вдома пацієнти самостійно протягом 1 місяця проводили аналогічні сеанси міорелаксації, використовуючи набуті навички [24, 75, 97].
Отримані дані показали досить позитивні антиоксидант-залежні механізми клінічної ефективності препарату з використанням розробленої методики терапії хворих на Пс на тлі ГХ. Слід зазначити, що у 33 з 45 хворих основної групи терапії клінічне покращення спостерігалося вже на першому тижні терапії, однак у 12 пацієнтів спостерігався торпідний перебіг дерматозу, що потребувало проведення додаткового аналізу. При детальному вивченні всіх показників з’ясувалося, що групу з резистентним до терапії станом склали пацієнти, які мали рівні серотоніну менші 100 нг/мл, порушення циркадного ритму АТ при добовому моніторуванні, високі рівні тривоги і депресії. У зв’язку з появою нових факторів впливу на перебіг дерматозу і ГХ, цим 12 пацієнтам було додатково призначено прийом препарату – антидепресанта есциталопрам у дозі 5 мг на добу протягом 2 місяців. Есциталопрам є селективним інгібітором зворотного захоплення серотоніну з високою спорідненістю з первинною ділянкою зв’язування. Протягом перших 5-7 днів пацієнти отримували ½ дози препарату, потім – усю добову дозу. На 16-20-й день прийому есциталопраму спостерігали розвинення клінічного ефекту у вигляді нормалізації психоемоційного стану, покращення сну, протягом другого місяця відбувалося закріплення отриманого результату. На останньому тижні поступово зменшували дозу есциталопраму до ½ і відміняли його.
Аналіз динаміки показників PASI і оцінка ЯЖ свідчили про достовірний позитивний ефект додавання в традиційну схему терапії Пс на тлі супутньої ГХ препарату армадін у поєднанні з БЗЗ-тренінгами, а також есциталопраму. Так, оцінка ступеня тяжкості псоріатичного ураження за шкалою PASI в процесі лікування запропонованою методикою виявила послідовне зниження кількості балів розглянутого індексу у всіх хворих (в 4,2 разу, р<0,01). Середнє значення DLQI після запропонованої схеми лікування знизилося на 55 % (р<0,01) в більшій мірі, ніж при традиційній терапії (34 %, р<0,05), з різницею на 6-8 балів, що вказує на більш виражений позитивний вплив на ЯЖ в основній групі пацієнтів. Було відзначено, що регрес показників PASI і DLQI в основній групі було більше, ніж у 2 рази, що свідчить про більш виразну достовірну динаміку регресу Пс у пацієнтів, які приймали запропоновану схему, в порівнянні з хворими, які отримували стандартну терапію. Ознака достовірної ефективності терапії – зниження PASI на 75 % (PASI 75) було виявлено у 29 (64,4 %) хворих, у 13 пацієнтів (28,9 %) – зниження PASI на 50 % в порівнянні з початком терапії (PASI 50), у 3 пацієнтів (6,7 %) – менше зниження, що обумовлено наявністю артропатичної форми Пс, вже існуючим станом ураження суглобів. Частота досягнення PASI 75 була статистично значимо вище в основній групі, при зіставленні з групою порівняння (χ² = 9,87 при р<0,05).
У групі хворих, які отримували в складі комплексної терапії армадін, БЗЗ-тренінги і есциталопрам, нівелювання основних симптомів (еритеми, інфільтрації, лущення тощо) було більш інтенсивним, ніж в групі порівняння (χ² = 11,7 при р<0,01), а клінічні прояви дерматозу в основній групі повністю зникли або істотно зменшилися. Клінічна динаміка в групі з традиційною терапією була менш виразною, більш того, в 7 випадках стан залишився без динаміки.
Відзначена позитивна динаміка стану тривоги і депресії (див. рис. 8.1).
Також слід зазначити, що покращився також перебіг ГХ на тлі запропонованої терапії. У 16 з 45 хворих основної групи (що склало 35,5 %), спостерігалося покращення стану серцево-судинної системи – цифри АТ поступово зменшувалися в середньому на 15-20 мм рт. ст., що потребувало консультації терапевта, кардіолога і призвело до зниження дози антигіпертензивних препаратів у 11 пацієнтів дослідженої групи (24,4 %).
Важливим результатом роботи стала зміна тривалості перебування пацієнтів в стаціонарі: зникнення ознак активності дерматозу, вихід в стійку ремісію наступали в середньому на (5,8 ± 0,91) дня раніше, що свідчить про статистично значуще (р<0,05) скорочення термінів терапії в основній групі хворих.
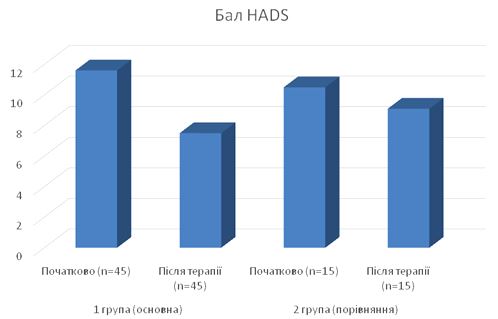
Рисунок 8.1 – Динаміка сумарного балу за шкалою HADS залежно від типу лікування
Ще один позитивний ефект від запропонованої схеми терапії полягає в тому, що значно зменшилася кількість рецидивів Пс в основній групі. Спостереження за пацієнтами, які отримували терапію в основній групі і групі порівняння, протягом 1 року довели, що: якщо в групі порівняння, які отримували традиційну терапію, відсоток хворих, у яких протягом року відзначалися рецидиви дерматозу, склав 80,00 % (24 хворих із 30), то при призначенні рекомендованої схеми – у 23 з 45 пацієнтів (51,1 %) спостерігалася стійка ремісія дерматозу і стабільний стан АТ (χ2 = 11,36, р = 0,001). Таким чином, запропонована схема терапії є водночас і методом профілактики рецидивів Пс, який перебігає на тлі ГХ.
Розглянемо отримані після терапії значення показників, що вивчали, у пацієнтів в групах дослідження, результати динаміки зазначених маркерів представлено у вигляді діаграми, див. рис. 8.2.
Як видно з отриманих даних, статистично значуще зниження рівня каспази-8 на 42,86 % (р<0,01) після застосування в стандартній схемі лікування препаратів армадін, есциталопрам і сеансів БЗЗ, значно перевершує рівень зниження каспази-8 у пацієнтів без призначення даного препарату в групі порівняння (7,69 %), що свідчить про зменшення її ролі, як проксимальної каспази, в загибелі клітин шляхом активування рецепторів сімейства фактору некрозу пухлини (TNF-α) під впливом проведеної комплексної терапії.
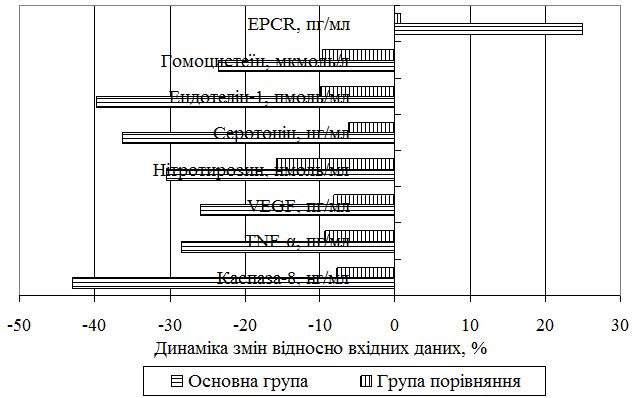
Рисунок 8.2 – Динаміка маркерів імунного запалення, дисфункції ендотелію, нейрогуморального стану на тлі терапії
Визначено достовірне (р<0,05) зниження рівня TNF-α в основній групі пацієнтів з використанням в терапії армадіну, сеансів БЗЗ і есциталопраму на 28,54 %, а в другій групі (порівняння) цей показник зменшився на 9,41 %, що об’єктивно підтверджує зменшення процесів імунного запалення у хворих на Пс з супутньою ГХ при використанні запропонованої схеми.
Після проведеного курсу лікування пацієнтів першої групи з використанням запропонованої схеми відзначалося також достовірне зниження рівня VEGF-А на 26,04 % (р<0,05), а в групі з традиційною терапією зниження рівня VEGF-А становило лише 8,11 %.
Також на тлі лікування у пацієнтів обох груп простежено динаміку активності серотонінергічних систем, що проявлялося в достовірній (р<0,05) нормалізації рівня серотоніну в основній групі після лікування більш ніж на третину (36,31 %), а в групі порівняння – на 6,23 %, що свідчить про значне підвищення ефективності стандартної терапії Пс в поєднанні з ГХ при включенні в схему армадіну, БЗЗ-тренінгів і есциталопраму.
Після проведеного лікування відзначене зниження рівня показника нітрозуючого стресу нітротирозину. В першій групі показник достовірно (р<0,05) зменшився на 30,49 %, а в другій – на 8 %, що може свідчити про обмеження процесів нітрозування і, як результат, зменшення загибелі клітин епідермісу і пошкодження судинного ендотелію, що в цілому призводить до стійкої ремісії захворювань.
У процесі комплексного лікування зазначено зниження рівня ендотеліну-1 достовірно (р<0,05) на 39,77 % у групі пацієнтів із запропонованою терапією, а без застосування армадіну, БЗЗ і есциталопраму динаміка зниження ендотеліну-1 склала лише 9,88 %, що поступається за ефективністю показникам пацієнтів першої групи.
Лікування пацієнтів з використанням розробленої методики достовірно знижувало показник EPCR на 24,96 % (р<0,01), а терапія без використання fрмадіну, есциталопраму і БЗЗ – на 0,71 %. Ці результати дозволяють зробити висновок про відсутність значущого впливу стандартної терапії Пс та ГХ без застосування антиоксидантів на показник EPCR і відповідно, тяжкість перебігу коморбідної патології.
Терапія Пс та ГХ із застосуванням армадіну, БЗЗ-тренінгів і есциталопраму зменшила також сироваткові рівні гомоцистеїну у пацієнтів достовірно (р<0,05) на 23,51 %, а без використання додаткової терапії – на 9,63 %, що свідчило про зменшення активності процесів оксидативного стресу і обмеження патологічного процесу в епідермісі.
Динаміка метаболізму глутатіону до і після курсу терапії наведена в таблиці 8.1.
При застосуванні додатково до стандартної терапії Пс препарату армадіну, БЗЗ-тренінгів і есциталопраму було визначено достовірне підвищення рівня відновлених тіолів в першій, основній групі пацієнтів на 27,65 % (р<0,05), а в групі порівняння спостерігалася лише тенденція до зростання рівня відновлених тіолів – 4,52 % (р>0,05). Рівень ГЛУо зменшився достовірно (р<0,05) після лікування в групі за запропонованою методикою на 33,01 %, а в групі з традиційною терапією – на 11,76 %. Збільшення запасів відновлених тіолів в організмі свідчило про значні резерви АОС і позитивний вплив проведеного лікування. Висока редокс-активність глутатіону і одночасно значна стійкість до окислення киснем, значна концентрація в клітині і можливість зберігати свій відновлений стан роблять його дуже важливим редокс-буфером внутрішнього середовища клітини.
Таблиця 8.1
Динаміка метаболізму глутатіону у хворих на Пс із супутньою ГХ на тлі терапії
| Показник,
одиниці виміру |
1 група (основна) | % величина різниці | 2 група (порівняння) | % величина різниці | ||
| Початково (n=45) | Після терапії (n=45) | Початково (n=15) | Після терапії (n=15) | |||
| ГЛУв, мкмоль / л | 15,3±0,41 | 19,53±0,46 * | +27,65 % | 15,5±0,45 | 16,2±0,29 | +4,52 % |
| ГЛУо, мкмоль / л | 3,12±0,05 | 2,09±0,07* | -33,01 % | 3,4±0,04 | 3,8±0,05 | +11,76 % |
| Співвідношення ГЛУв/ГЛУо, у.о. | 4,9±0,23 | 9,34±0,29* | +90,61 % | 4,56±0,21 | 4,26±0,15 | -6,58 % |
| СОД, у.о./мг білка/хв. | 21,13±1,24 | 52,56±1,09* | +148,75 % | 20,41±1,51 | 21,63±1,94 | +5,98 % |
Примітка. * – р <0,05 при порівнянні з вихідними значеннями.
Приріст співвідношення ГЛУв/ГЛУо в основній групі хворих після терапії армадіном, БЗЗ-тренінгами і есциталопрамом склав 90,61 % достовірно (р<0,05), а в групі порівняння відзначено менш значущу динаміку цього показника після стандартної терапії, яка становила 6,58 %, що підтверджує висновки про підвищення резерву АОС після використання запропонованої методики і обмеження процесів оксидативного стресу.
У першій групі після проведення запропонованої терапії на 148,75 % достовірно збільшилися також резерви СОД (р<0,05), а в другій групі активність СОД після лікування зросла лише на 5,98 %. Зазначене підвищення активності СОД, ймовірно, мало адаптивний характер в умовах оксидативного стресу при Пс [55, 407].
Згідно з проведеним аналізом матриць пов’язаності ознак у рамках виконання кореляційної адаптометрії для оцінки клінічної ефективності терапії, було отримано дані, що в 1 групі (основній) після проведеного лікування з призначенням армадіну, БЗЗ-тренінгів і есциталопраму структура тісноти кореляційних взаємозв’язків виявилася істотно менш вираженою і достовірною, ніж у 2 групі (порівняння). Про це інформативно і об’єктивно свідчила і величина обчисленої ваги кореляційного графа G (1 група до лікування – 8,7, після – 6,4; 2 група до лікування – 9,1, після – 8,5), що вказує на ефективність проведеної терапії для обох груп, але, більш виразну і наочну – для першої групи.
Таким чином, у хворих на Пс і ГХ водночас запропонована терапія сприяла достовірному зниженню проявів інтенсифікації ВРО і оксидативного (негативна динаміка ендотеліну-1 і позитивна щодо метаболізму глутатіону) стресу, що в свою чергу, зменшувало вираженість запальних процесів (регрес TNF-α) як безпосередньо, так і опосередковано, через протизапальну дію на клітини ендотелію і макрофаги антикоагулянтної протеїнази з продукцією компонентів і структур екстрацелюлярного матриксу та порушенням мікроциркуляції, підтримуючи таким чином ключові патогенетичні аспекти розвитку як дерматозу, так і ГХ. Зниження рівня VEGF і серотоніну на тлі цієї комбінованої терапії також обумовлювало статистично значимий позитивний клінічний і суб’єктивний ефект у вигляді регресу показника PASI, зниження рівня тривоги і депресії (оптимізація біосинтезу серотоніну), поліпшення ЯЖ.
З урахуванням потенційного впливу армадіну, есциталопраму та сеансів БЗЗ на зазначені патофізіологічні предиктори і ланки патогенезу, які в тій чи іншій мірі залучаються при формуванні та прогресуванні Пс на тлі ГХ, є досить перспективним в плані оптимізації терапії дерматозу. Отримані факти і наявність літературного обґрунтування цієї стратегії терапії розкривають нові можливості застосування антиоксидантів і потенційні шляхи реалізації їх позитивного ефекту при Пс, особливо в поєднанні з ГХ.
* * *
Введення в схему терапії хворих на Пс із супутньою ГХ антиоксиданту армадіну, тренінгів БЗЗ, інгібітору зворотного захвату серотоніну есциталопраму дозволило скоротити термін лікування пацієнтів на цю коморбідну патологію, домогтися більш ранньої стабілізації псоріатичного процесу, стійкого виходу в ремісію. Ознаку достовірної ефективності терапії – PASI 75 – було встановлено у 64,4 % хворих, PASI – у 28,9 %, у 6,7 % пацієнтів – менше зниження, що обумовлено наявністю артропатичної форми Пс. Частота досягнення PASI 75 була статистично вищою в групі із запропонованою методикою при зіставленні з групою порівняння (χ2 = 9,87 при р<0,05).
Покращився також перебіг ГХ на тлі запропонованої терапії. У 35,5 % пацієнтів основної групи спостерігалося покращення стану серцево-судинної системи – цифри АТ зменшувалися в середньому на 15-20 мм рт. ст., що призвело до зниження дози антигіпертензивних препаратів у 11 пацієнтів дослідженої групи (24,4 %).
Ще один позитивний ефект від запропонованої схеми терапії полягає в тому, що значно зменшилася кількість рецидивів Пс в основній групі. При призначенні рекомендованої схеми терапії у 51,1 % пацієнтів спостерігалася стійка, протягом року, ремісія дерматозу і стабільний стан АТ (χ2 = 11,36, р = 0,001).
Комбінована терапія сприяла найбільшому зниженню маркерів імунного запалення, поліпшенню обміну триптофану і метіоніну, нормалізації клітинних взаємин і мікросудинних процесів, а також поліпшенню емоційного, психічного стану, ЯЖ пацієнтів.
При проведенні курсу терапії препаратами армадін і есциталопрам у поєднанні з сеансами БЗЗ у хворих на Пс на тлі ГХ спостерігалася більш виражена й достовірно позитивна динаміка фінальних показників оксидативного стресу. Це супроводжувалося також активацією захисних механізмів АОС – значення концентрації СОД сироватки крові після лікування були на 148,75 % більшими при запропонованій схемі лікування (р>0,05) порівняно з 6,0 % при традиційній терапії.
Таким чином, результати запропонованої схеми терапії свідчать про її високу клінічну ефективність.
Матеріали даного розділу опубліковані в наступних роботах:
[24, 75, 77, 97, 407]
РОЗДІЛ 9
УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
Пс дотепер залишається однією з актуальних проблем сучасної клінічної дерматології і є однією з найбільш поширених хвороб шкіри з хронічним типом перебігу, для якого характерний як типовий висип, так і ураження опорно-рухового апарату, придатків шкіри і внутрішніх органів [182]. Пс рідко закінчується летальним результатом, але значно погіршує ЯЖ хворого, призводить до інвалідизації.
Багатьма роботами доведено, що схильність до Пс детермінується певними генами, реалізація яких залежить від різноманітних факторів зовнішнього середовища (тригерів). В останні роки зміцнилася думка про асоціацію шкірних проявів Пс з ураженням інших органів, системність уражень, у зв’язку з чим у науковій літературі застосовувався термін «псоріатична хвороба». Пс характеризується складністю патогенетичних запальних механізмів і має ряд спільних ознак з іншими складними за патогенезом, так званими коморбідними, захворюваннями, серед яких – серцево-судинна патологія [23, 25, 144]. Припускають, що розвиток коморбідності швидше за все базується на спільності патогенезу поєднаних захворювань і не залежить від стилю життя, доступності медичної допомоги або економічних чинників і зазвичай має тенденцію збільшуватися з віком. Майже половина хворих на Пс у віці старше 65 років має, принаймні, три коморбідності, а у двох третин – дві і більше [377]. Відзначено, що у хворих на ексудативний і пустульозний Пс спостерігається виражена соматична обтяженість. Крім схожих імунологічних механізмів виявлені також гени, спільні для Пс і виявленій при ньому коморбідності.
За оцінкою ряду досліджень патогенетичні механізми певних регуляторних процесів в організмі при Пс (дисліпідемія, порушення електролітного балансу, білкового і вуглеводного обміну, формування ендотеліальної і тканинної дисфункцій, розвиток васкулопатій) мають спільність з подібними механізмами при порушеннях системної гемодинаміки при АГ, зокрема, ГХ [167].
ГХ продовжує лідирувати в переліку найбільш поширених захворювань, охоплюючи третину дорослого населення в Україні. Сучасні схеми лікування ГХ, що ґрунтуються на блокуванні ключових нейрогуморальних систем, дозволили значною мірою знизити частоту основних серцево-судинних ускладнень цього захворювання (мозкового інсульту та інфаркту міокарда) [241]. Дослідження механізмів формування такої коморбідної патології, як Пс і ГХ, дозволить краще пізнати і зрозуміти деякі спільні ланки патогенезу й, можливо, розробити нові напрямки терапії, яка б покращила ефективність лікування як ГХ, так і Пс.
Відповідно до мети і для вирішення поставлених завдань протягом 2013-2017 рр. було проведено обстеження 460 хворих на Пс, які перебували на лікуванні у стаціонарних / диспансерних відділеннях КУ «ЗОШВКД» ЗОР. Пацієнтам було проведено загальноклінічне обстеження, офісне вимірювання АТ. В результаті обстеження у 171 (37,17 %) пацієнта була виявлена АГ, явища тривоги або депресії – у 244 (53,04 %) хворих, підвищений ІМТ – у 301 (65,44 %), гіперглікемія – у 44 (9,57 %), дисліпідемія – у 24,09 %. Найбільш частою у поєднанні з іншими коморбідними станами була АГ, тому далі в процесі динамічного спостереження перебували 254 особи, яких було розподілено в чотири групи:
І група порівняння – хворі на Пс – 72 особи;
ІІ група порівняння – пацієнти з ГХ – 47 осіб;
ІІІ група – основна – хворі на Пс в поєднанні з ГХ – 98 осіб;
ІV група – контрольна група – практично здорові особи – 37 осіб.
Діагноз Пс у першій (порівняння) і третій (основній) групах встановлювався на підставі клінічного протоколу ведення хворих на Пс (Наказ МОЗ України №762 від 20.11.2015 р.) та наказу МОЗ України від 08.05.2009 № 312 про надання медичної допомоги хворим на дерматовенерологічні захворювання [80, 82]. Ступінь тяжкості ураження шкіри оцінювався шляхом підрахунку стандартизованого індексу тяжкості Пс за методом Фредеріксона і Петерсона (PASI) [207], за його ж допомогою оцінювалася динаміку змін ураження шкіри. Вплив дерматозу на ЯЖ оцінювався за допомогою опитувальника DLQI [208], наявність тривоги та депресії – анкетуванням за допомогою госпітальної шкали тривоги та депресії (HADS) [422].
АГ у всіх випадках пацієнтів другої (порівняння) та третьої (основної) групи була представлена лише ГХ ІІ стадії з рівнем гіпертензії 1-3 ступеня різного кардіоваскулярного ризику, без адекватної систематичної антигіпертензивної терапії, діагноз встановлювався на підставі «Уніфікованого клінічного протоколу первинної, екстреної та вторинної (спеціалізованої) медичної допомоги «Артеріальна гіпертензія»» (Наказ Міністерства охорони здоров’я України № 384 від 24.05.2012 року) [83], і рекомендацій Європейського товариства з гіпертензії ESH / ESC 2013 року [26]. Хворі на гіпертонію, а також пацієнти з поєднанням Пс та ГХ поділялися за ступенем АГ (класифікація WHO / ISH Guidelines for the Management of Hypertension) за даними вимірювання «офісного» АТ [81]:
– 1 ступінь АГ – САТ – 140-159 мм рт.ст., ДАТ – 90-99 мм рт.ст.;
– 2 ступінь АГ – САТ – 160-179 мм рт.ст., ДАТ – 100-109 мм рт.ст.;
– 3 ступінь АГ – САТ – ≥180 мм рт.ст., ДАТ – ≥110 мм рт.ст.
за типом добового профілю АТ:
– нормальний добовий профіль АТ (тип «dipper»);
– недостатнє зниження нічного АТ (тип «non-dipper»);
– надмірне зниження нічного АТ (тип «over-dipper»);
– «нічна гіпертензія» (тип «night-peaker»).
У першій групі (порівняння) хворих на Пс було 34 чоловіки (47,00 %) і 38 жінок (53,00 %) у віці від 17 до 76 років. У другій групі порівняння (хворих на ГХ) обстежених було 47 осіб, з них чоловіків 16 (34,04 %), жінок – 31 пацієнтка (65,96 %), у віці від 22 до 75 років. У третій, основній групі, обстежених осіб було: 54 чоловіки (55,00 %) і 44 жінки (45,00 %) віком від 24 до 74 років.
Середній вік пацієнтів групи порівняння на Пс становив (41,67 ± 1,53) року, середній вік пацієнтів другої групи (хворих лише на ГХ) – (54,30 ± 1,56) року, третьої групи (основної) – у середньому склав (54,12 ± 1,02) року. Таким чином, Пс у поєднанні з ГХ зустрічався у більш старшої, порівняно з хворими лише на Пс, вікової групи, у середньому старші за 45 років (83 % в цілому по групі). Якщо порівнювати вік пацієнтів першої і третьої групи, які хворіли на Пс, то можна помітити, що в середньому пацієнти з коморбідною патологією були старшими за пацієнтів без АГ на 10-12 років. Більш старший вік у групі з коморбідною патологією, ймовірно, обумовлений тим фактом, що ГХ молодих осіб або має форму нейро-циркуляторної дистонії, або недостатньо часто верифікується / дообстежується, що й обумовлює діагностику ГХ на тлі Пс або без нього в більш старшому віці. У той же час, зазначений вік націлює на більш ретельне вивчення АТ у пацієнтів із Пс віком від 45 років.
Аналіз ІМТ по групах свідчить, що простежується достовірний зв’язок між підвищеним ІМТ і формуванням коморбідної патології. Так, у групі хворих лише на Пс відсоток пацієнтів з нормальним ІМТ становив 50 %, у пацієнтів, хворих лише на ГХ – 28 %, у хворих на Пс і ГХ – лише 10 %. Тобто, показник ІМТ є одним із факторів формування коморбідних станів у пацієнтів, які страждають на зазначений дерматоз. Отримані дані частково перегукуються з вищезазначеними спостереженнями, що у двох третин хворих на Пс віком від 65 років виявляють дві і більше коморбідних нозологій [87]. На мою думку, ретельне виявлення супутньої патології слід проводити вже у більш ранньому віці, від 45 років.
Найбільш частим провокуючим фактором розвитку захворювання пацієнти всіх груп визнали стрес, що потрібно враховувати при призначенні терапії і проведенні протирецидивних профілактичних заходів. Звертає на себе увагу істотна різниця у факторі успадкування у пацієнтів з нормальними цифрами АТ і підвищеними: при необтяженому Пс у 7 разів частіше зустрічалося генетичне детермінування дерматозу, але, з іншого боку, можливо, вони водночас успадкували толерантність до певних супутніх патологій, а пацієнти, які страждають на Пс із супутньою ГХ – менш стійкі до тригерних факторів, наприклад, стресу, що, можливо, і призвело до одночасного розвитку двох стрес-залежних захворювань.
Слід зазначити, що двоє пацієнтів з основної групи у якості причини початку або загострення захворювання відзначили прийом медичних препаратів (β‑адреноблокаторів), що зумовлює необхідність більш широкого інформування лікарів про необхідність дотримуватися рекомендацій стосовно призначення диференційованої антигіпертензивної терапії хворим на Пс.
Під час аналізу даних пацієнтів третьої групи (основної) щодо залежності від терміну діагностування Пс і ГХ виявлено, що тривалість дерматозу в даній групі знаходилася в діапазоні від 1 місяця до 52 років, середня його тривалість склала (17,03 ± 2,18) року. Тривалість ГХ становила в середньому близько (14,11 ± 2,38) року. Таким чином, Пс передував ГХ.
Виявлено особливості клінічних проявів і перебігу дерматозу при наявності супутньої ГХ. У переважної більшості хворих – 94 пацієнтів, що складає 95,9 % – спостерігалися розповсюджені форми дерматозу, лише у 4 (4,1 %) – обмежені (3 – інтертригінозні форми та 1 – долонно-підошовна). У пацієнтів третьої (основної) групи виділені такі клінічні форми Пс: вульгарний бляшковий – у 60 хворих (61,2 %), артропатичний – у 29 осіб (29,6 %), краплеподібний – в 1 пацієнта (1,0 %), еритродермія – у 3 (3,1 %) пацієнтів, інтертригінозний Пс – також у 3 (3,1 %) пацієнтів, пустульозний – в 1 (1,0 %) хворого, долонно-підошовний – в 1 (1,0 %) випадку. Індекс PASI в середньому в групі порівняння на Пс визначено на рівні 26,8 ± 1,3, а в основній групі –32,4±1,4.
Якщо порівнювати клінічні особливості формування Пс в 1 і 3 групах, то, по-перше, звертають на себе увагу відмінності в проявах вульгарного бляшкового Пс. У 5 пацієнтів 1 групи (порівняння) і 19 пацієнтів 3 групи (основної) спостерігалася більш виразна клініка дерматозу, що проявлялося наявністю у них більш інфільтрованих, ексудативних папул, з появою на їх поверхні не тільки характерних сріблясто-білих лусочок, але й серозно-геморагічних кірок. Луска на поверхні папул розташовувалася щільним шаром, погано відокремлювалася за рахунок просочування ексудатом. Підкреслюючи специфічний для цієї групи характер перебігу бляшкового Пс, ми виділили окремо цю категорію пацієнтів для порівняння в обох групах – вульгарний бляшковий Пс з явищами ексудації (раніше називався ексудативним Пс). Якщо в 1 групі (порівняння) таких пацієнтів було небагато (5 осіб; 6,9 %), то в групі з коморбідною патологією (група 3) таких пацієнтів виявилося значно більше – 19 осіб (19,4 %). Показник PASI у цих хворих в більшості випадків був вище 30, індекс DLQI свідчив про виражений вплив дерматозу на ЯЖ, що дозволяє нам віднести цю категорію пацієнтів в групу обтяженого перебігу Пс. Крім того, в третій (основній) групі привертає увагу наявність великої кількості хворих на артропатичну форму Пс – 29 пацієнтів (29,6 %) порівняно з 9 пацієнтами 1 групи (12,5 %), що свідчить про формування системного ураження. При цьому відзначаються значні відмінності в розвитку різних форм Пс і, що надзвичайно важливо, у зв’язку з гендерним фактором. У чоловіків, які страждають лише на Пс (1 група) легкі і середньо-тяжкі форми дерматозу склали 64,7 % (22 особи), у жінок – 81,6 % (31 випадок), в цілому по групі – 73,6 % (53 особи). В основній групі легкі та середньо-тяжкі форми реєструвалися у чоловіків у 35,2 % (19 пацієнтів), у жінок – в 21 випадку (47,7 % жінок), в цілому по групі – у 40,9 % (40 хворих) [96]. При цьому у чоловіків 3 групи (основної) тяжкі форми в половині випадків було представлено вульгарним Пс з явищами ексудації (18 хворих; 51,4 %) і в 1/3 – артропатичним Пс (12 хворих; 34,3 %), а у жінок переважав артропатичний Пс (17 пацієнток; 73,9 %).
Таким чином, легкі і середньо-тяжкі форми Пс в 1 групі (порівняння) склали 73,6 % (53 особи), а в основній групі – 40,9 % (40 осіб); відповідно, тяжкі форми в першій групі представлені 19 пацієнтами (26,4 %), в третій групі – 58 пацієнтами (59,18 %). Отже, встановлено, що приєднання ГХ до Пс значно ускладнює перебіг дерматозу, що супроводжується формуванням більш тяжких форм.
Питання зміни цитокінового потенціалу у хворих на Пс, а особливо в поєднанні з ГХ, до теперішнього часу також є предметом жвавих дискусій у наукових колах і не може вважатися остаточно вирішеними. Визначення профіля цитокінів можна розглядати як найважливішу характеристику функціонального стану імунної системи, що дозволяє зрозуміти механізм патогенезу захворювань. Крім того, аналіз рівня цитокінів є одним з ключових параметрів у ході вивчення терапевтичної ефективності препаратів [74, 86, 93]. Отже, розглянута проблема не нова, проте її актуальність на сучасному етапі безсумнівна і обумовлена, в першу чергу, відсутністю єдиної думки і загальноприйнятої точки зору не тільки щодо характеру та спрямованості імунологічних змін, але й їх взаємозв’язку з вираженістю клінічних проявів Пс при супутній ГХ.
Встановлено, що в основній групі пацієнтів у цілому вміст цитокінів достовірно перевищував аналогічні показники груп хворих лише на Пс або ГХ. У групі порівняння хворих на Пс рівень IL-1β збільшений у 2,43 разу (p<0,05), а в основній групі – збільшений у 7,86 разу (p<0,05) порівняно з хворими на ГХ групи порівняння. В основній групі рівень IL-1β збільшений у 3,24 разу порівняно з хворими лише на Пс (група 1) і достовірно перевершував показники групи 1 (Пс) і групи 2 (ГХ). Визначення рівня IL-1α свідчило, що найнижчий показник цього цитокіну – (0,37±0,04) пг/мл – зареєстровано в групі порівняння хворих на ГХ. У групі порівняння на Пс відзначалися більш високі показники – на 24,3 % (p<0,05), а в основній групі – значно вищі (збільшення в 4,65 разу) (p<0,05), порівняно з хворими лише на ГХ. У групі хворих на Пс у поєднанні з ГХ рівень IL-1α збільшився в 3,74 разу, достовірно відрізняючись від значень другої групи (ГХ).
Рівень IL-6 у хворих на Пс групи порівняння виявився вищим, ніж у хворих лише на ГХ (групи 2) на 15,6 % (p<0,05), а в групі з коморбідною патологією – у 5,82 разу більшим (p<0,05). В основній групі рівень IL-6 був достовірно (p<0,05) в 5,9 разу вищим відносно групи пацієнтів з ГХ.
У групі хворих лише на Пс відзначалося збільшення рівня TNF-α на 54,31 % (p<0,05) щодо групи порівняння з ГХ. В основній групі хворих відзначалося прогресивне збільшення рівня TNF-α в 4,11 разу (p <0,05) щодо групи хворих на Пс, і в 6,34 рази (p <0,05) стосовно групи порівняння на ГХ.
Виявлено достовірне зростання всіх досліджених показників напруги імунних реакцій при тривалості ГХ більше 5 років. При цьому, у хворих лише на ГХ (2 група порівняння) на тривалість хвороби реагував лише TNF-α, а у хворих на коморбідну патологію – усі досліджувані маркери, так вміст IL-1β і 1α, а також TNF-α при давнині ГХ більше 5 років – відмінності з групою порівняння склали 169,57 %, 95,88 % і 328,36 % відповідно, при р<0,01 в усіх випадках. Це свідчить про те, що поєднання ГХ з дерматозом має значно більший вплив на стан імунної системи, ніж лише дерматоз або ГХ. Та у всіх випадках термін ГХ впливавав на стан імунного запалення, що спонукає до необхідності ранньої діагностики ГХ та її корекції.
Тривалість дерматозу аналогічним чином впливало на стан імунітету. Але якщо у хворих на Пс без ГХ на тривалість дерматозу реагував тільки IL-1α, що, скоріше за все обумовлено наявністю артропатичних форм у цій підгрупі, то у хворих на коморбідну патологію реагували достовірним підвищенням рівнів IL-1β і -1α і, особливо, TNF-α. Таким чином, при порівнянні різних за тривалістю дерматозу, категорій пацієнтів основної групи, отримані такі дані: у пацієнтів при тривалому перебігу Пс статистично достовірно і значимо вищими були маркери запального процесу – IL-1α, IL-6 і TNF-α. Так, різниця в показниках IL-1α між групами пацієнтів основної групи з тривалістю до 5 років і більше 5 років становила 77,36 % (р<0,05), показник IL-6 – 44,68 % (р<0,05) і TNF-α – 288,15 % (р<0,05). При вивченні показника IL-1β відзначено, що цей маркер запального процесу був вищим навпаки в групі пацієнтів з Пс у поєднанні з ГХ тривалістю до 5 років на 11,67 % по відношенню до пацієнтів з давністю захворювання більше 5 років. Ці дані свідчать про необхідність ранньої терапевтичної корекції перебігу дерматозу, особливо при поєднанні з ГХ.
Зростання ІМТ більше 30 кг/м2 призводило до достовірного підвищення рівня цитокінів, зайва вага значно більше негативно впливала на перебіг дерматозу при наявності супутньої ГХ.
Чітких гендерних відмінностей за досліджуваними параметрами не було виявлено, крім основної групи, де було визначено відмінності у рівнях цитокінів: у жінок IL-1β вищий на 73,17 %, IL-1α – на 11,11 %, IL-6 – на 23,12 %, а по відношенню до TNF-α різниця з чоловіками становила 451,33 %, будучи при цьому статистично значущою і достовірною (р<0,05). Це можна пояснити більш частим формуванням артропатичної форми Пс у цій категорії пацієнтів порівняно з усіма іншими групами. При цьому в основній групі зберігалася загальна тенденція для найбільш високих значень за всіма цитокінами для будь-якої статі порівняно з особами без коморбідності (Пс або ГХ).
Біологічний вік не справляв будь-якого закономірного і пропорційного впливу на динаміку рівня цитокінів. Іноді більш молодий вік асоціювався з більш агресивним перебігом захворювання, судячи з рівня цитокінів, але в цілому в популяції пацієнтів ці потенційні відмінності нівелювалися впливом тривалості захворювання на активність цитокінового каскаду.
Показові та статистично значущі результати були отримані при порівнянні концентраційних значень цитокінів у групах пацієнтів з різним ступенем АГ – 3 ступінь завжди супроводжувався статистично достовірним значущим підйомом цифр маркерів запалення з відчутним відривом від показників аналогічних маркерів груп пацієнтів з 1-2 ступенем АГ.
При тяжких формах дерматозу, було виявлено більш високі концентраційні значення цитокінового профілю порівняно з бляшковою вульгарною, вульгарною з явищами ексудації формами Пс як без ГХ, так і в поєднанні з гіпертонією. Визначено закономірну динаміку збільшення маркера запалення лімфоцитарного генезу TNF-α при приєднанні до дерматозу ГХ. Зростання тяжкості і поширеності Пс згідно зростання PASI також провокувало елевацію IL-1β, IL-1α, IL-6 і TNF-α, а відповідно призводило до посилення вираженості запального процесу. Вивчення взаємозв’язку клінічних проявів Пс і супутньої ГХ показало, що у цій категорії хворих достовірно частіше реєструвалися тяжкі форми дерматозу, частіше відзначався рецидив дерматозу (χ2 = 9,97, при р<0,05).
Згідно проведеного кореляційного аналізу, у хворих на Пс, особливо при супутній ГХ, мав місце статистично значущий зворотний кореляційний зв’язок між ЯЖ і вираженістю цитокінової елевації. Крім того, спостерігався середньої сили (r=+0,513 та 0,583 відповідно при р<0,05) кореляційний зв'язок між тяжкістю перебігу дерматозу і рівнями TNF-α та IL-6 у сироватці хворих на досліджувану коморбідну патологію, що може дозволити використовувати вказані маркери у якості показників тяжкості перебігу Пс при поєднанні з ГХ.
Чисельні дослідження різних авторів доводять, що основними патологічними процесами при Пс є: порушення динамічної рівноваги таких структурних процесів, як проліферація, диференціювання та апоптоз клітин, імунне запалення шкіри, порушення нейрогуморального і ліпідного обміну.
У постійно оновлюваних тканинах шкіри механізми проліферації, диференціювання і загибелі клітин жорстко регулюються для запобігання надмірного епідермального росту. Дисфункція апоптозу, яка може виникнути в шкірі, обумовлює розвиток і хронізацію різної патології шкіри, включаючи Пс [623]. У той же час, ініціація процесів апоптозу тісно пов’язана з розвитком міжклітинного фіброзу, що збільшує жорсткість судинної стінки і знижує її податливість, і в підсумку призводить до системного підвищення АТ.
У попередніх наукових дослідженнях є нечисленні роботи, які присвячено вивченню стану апоптозу у хворих на Пс [176, 270], та дослідження маркерів апоптозу при поєднанні Пс і ГХ раніше не проводилося.
Проведений аналіз результатів непрямого твердофазного імуноферментного аналізу сироватки крові хворих свідчив про прогресивне зростання рівня маркера апоптозу каспази-8 у пацієнтів із зазначеною коморбідною патологією. Визначено, що в цій групі показник маркеру апоптозу достовірно випереджав аналогічні показники груп порівняння хворих на Пс або на ГХ на 52,38 % і 71,43 % (р<0,05), відповідно. Збільшення даного показника у пацієнтів основної групи на 53,33 % (р<0,05) при тривалості ГХ більше 5 років або при 3-му ступені АГ свідчило про негативний вплив тривалої АГ на стан апоптозу, що може провокувати більш тяжкий перебіг дерматозу. Це може частково пояснювати вплив такого коморбідного стану, як ГХ на формування фенотипу дерматозу і свідчить про єдність механізмів патогенезу цих двох нозологій, взаємопотенціювання один одного, цього не відбувається від впливу високого ІМТ, де максимальна різниця між групами становила лише 15,79 % (р<0,05).
Достовірна різниця рівня каспази-8 визначалася лише в основній групі між вульгарною бляшковою / краплеподібною / інтертригінозною і еритродермічною / артропатичною / пустульозною формами Пс, різниця становила 28,00 % (р<0,05). Це свідчить про те, що найбільш активні апоптотичні процеси відбуваються в осіб з тяжкими формами дерматозу при поєднанні Пс і ГХ. Суттєва різниця встановлена між групами з показником PASI≥30 і ≤ 10 при поєднаній патології – 51,72 %.
Слід зауважити, що при коморбідності у жінок рівень каспази-8 визначався на 26,32 % вищим, ніж у чоловіків, а відповідно і апоптотична загибель клітин у цьому випадку відбувалася більш активно порівняно з хворими чоловічої статі, де значною мірою реєструвалися і ексудативні форми Пс. Це можна пояснити більш вираженим системним процесом запалення у жінок, оскільки в цій групі саме у жінок переважав артропатичний Пс, а рівні зазначеного маркеру апоптозу можуть слугувати прогностичним критерієм розвитку системних форм дерматозу з ураженням суглобів. Оскільки показник апоптозу виявився більш залежним від активності ураження суглобів, з метою оцінки прогностичності фактора «рівень каспази-8» у розвитку артропатичної форми Пс, здійснено уніваріантний регресійний аналіз пропорційних ризиків Кокса, в результаті якого було підтверджено статистично значуще прогностичне значення рівня каспази-8 більше 0,22 нг/мл (ВР = 3,26, 95 % ДІ = 1,62-3,93, р=0,01) для розвитку збільшення частоти випадків артропатичного Пс.
Пс характеризується збільшенням чисельності Т-лімфоцитів запального інфільтрату і значним зростанням продукції цитокінів, у тому числі й каспази-8, що призводить до посилення запалення, порушення диференціювання кератиноцитів, неоангіогенезу в дермі. Тому водночас із дослідженням апоптозу проведено вивчення стану неоангіогенезу з визначенням VEGF-Α у пацієнтів всіх груп. Доведено, що даний фактор має антиапоптотичну дію, важливу роль відіграє VEGF-Α і при захворюваннях серцево-судинної системи, зокрема при ГХ, ремоделює судинну стінку. Виявлення даного маркера в сироватці крові є найбільш раннім маркером розвитку ЕД при початкових етапах внутрішньосудинного запалення.
Відомо, що неоваскуляризація відіграє важливу роль у патогенезі Пс і VEGF виступає при цьому головним ангіогенним фактором. Нечисленні дослідження, що стосуються поліморфізму генів VEGF при Пс, дали суперечливі результати. Гістохімічне дослідження VEGF у зразках пошкодженої шкіри хворих на Пс, а також вивчення рівня цього фактора росту в сироватці крові методом ІФА свідчило про достовірно вищий рівень VEGF у псоріатичних бляшках і достовірно більш високий вміст його в сироватці крові хворих на Пс порівняно зі здоровими людьми контрольної групи. Автори даної роботи виявили також, що у хворих на Пс із рівнем ушкодження шкіри вищим 10 балів за шкалою PASI рівень сироваткового VEGF був достовірно в 1,5 рази вищим, ніж у хворих на Пс із рівнем шкірних уражень меншим 10 балів [403].
У попередніх наукових дослідженнях стосовно ангіогенезу при Пс [12, 120, 196] встановлено, що надлишкова експресія VEGF у біоптатах шкірного висипу хворих на Пс призводить до гіперплазії кератиноцитів [196] і через дисфункцію імунної та нервової систем формує характерний фенотип Пс [246]. Крім того, VEGF сприяє збільшенню проникності судин, тим самим сприяючи міграції лейкоцитів у псоріатичну папулу [253], збільшення споживання кисню, розвитку оксидативного стресу [120].
При наявності робіт, присвячених вивченню рівня VEGF-Α і залежності від нього перебігу Пс, визначення стану неоваскулогенезу у хворих на Пс у поєднанні з ГХ раніше не проводилося. Це представляє значний інтерес, оскільки для кожної з цих патологій, згідно з останніми літературними даними, притаманний приріст сигнального білка васкулогенезу VEGF-Α, і комбінація цих захворювань може проявитися в збільшенні рівня цього маркера; до того ж, він може відіграти важливу роль для ранньої і більш точної діагностики загострення дерматозу при коморбідному стані, призначення своєчасної терапії.
У результаті проведеного дослідження виявлено, що одночасно зі зростанням рівня фактору апоптозу спостерігалася гіперпродукція маркера неоангіогенезу VEGF-Α. Так, рівень VEGF-А у пацієнтів основної групи був на 75,94 % і 44,39 % (р<0,05) вищим відносно хворих груп порівняння з ГХ або Пс відповідно достовірно. Визначено приріст VEGF-А в групі порівняння з ГХ і ІМТ більше 30 кг/м2 на 26,12 % (р<0,05) відносно пацієнтів з меншим ІМТ.
Фактор росту судинного ендотелію визначався у високих концентраціях при ГХ у чоловіків (на 15,27 % більше, ніж у жінок). Більш високий вміст VEGF‑А в сироватці хворих чоловіків порівняно з жінками з урахуванням особливостей клінічної картини може пояснювати наявність вираженого неоваскулогенезу у хворих на ексудативний Пс, який у чоловіків основної групи реєструвався частіше, ніж у жінок. VEGF-А мав найнижчі значення при вульгарній бляшковій / краплеподібній / інтертригінозній формах дерматозу, найвищі рівні спостерігалися при бляшковій з явищами ексудації формі Пс в основній групі, що може підтверджувати думку про специфічність цього показника саме для цієї форми. При порівнянні в основній групі з PASI до 10 і понад 30 балів визначалася відмінність в 177,13 % (р<0,05).
Це дозволило використовувати показник VEGF-А в якості прогностичного маркеру ступеня ураження шкіри. Враховуючи виражену залежність показника VEGF-А від ступеня ураження саме шкіри, методом ROC-аналізу було розраховано критичне значення рівня щодо асоціації з площею ураження шкіри, яке становило 700 пг/мл (майже 90 перцентиль). Таким чином, значення VEGF-А більше 700 пг/мл може достовірно слугувати маркером тяжкості ступеня ураження шкіри (у 92 % таких хворих PASI перевищував 30 ум. од.).
Наявність патологічного ангіогенезу у хворих на Пс у поєднанні з ГХ може бути, по-перше, наслідком підвищеної запальної активності, що було доведено у попередніх розділах, а по-друге, може слугувати ознакою гіпоксичного стану, що потребує призначення додаткової системної антигіпоксичної терапії. У цілому, проведене вивчення процесів ангіогенезу в зазначеної категорії пацієнтів, високі його рівні і зв’язок з тяжкістю перебігу дерматозу дозволяє прогнозувати розвиток перспективних нових ланок патогенетичної терапії Пс на тлі супутньої ГХ, а саме, розробку і використання в майбутньому препаратів-антагоністів VEGF.
Ендотелін – група біологічно активних пептидів широкого спектру дії, які є одним з найважливіших регуляторів функціонального стану ендотелію, морфологічно пов’язані з кров’ю з одного боку, і з м’язовою стінкою судин – з іншого. Їх вазоконстрикторні ефекти супроводжуються змінами системної та регіонарної гемодинаміки [249]. Крім того, ендотелін-1 є не лише потужним вазоконстриктором, він також має мітогенні властивості за рахунок прискорення росту клітин різного гістологічного типу.
Найвідоміший з ендотелінів – ендотелін-1 – у даний час розглядають як маркер і предиктор тяжкості та результату ішемічної хвороби серця. Вважають, що він також причетний і до несерцевої патології – такої, як післяпологові судинні ускладнення, ураження нирок (гломерулонефрит), ішемічні ушкодження мозку, цукровий діабет і, зокрема, Пс. У нормі концентрація ендотеліну в плазмі крові людини становить 0,1-1,0 фмоль/мл або не виявляється зовсім, 75 – 80 % вивільненого ендотелієм ендотеліну-1 виявляють у гладеньких м’язах судин.
При дослідженні ендотеліну у хворих на поєднану патологію (Пс і ГХ) було виявлено значне його підвищення порівняно з хворими лише на ГХ або на Пс, різниця становила 88,57 % і 68,57 % (р<0,05) відповідно і була статистично значущою і достовірною на користь групи з коморбідною патологією. Рівень ендотеліну-1 в сироватці крові хворих на Пс був на 175,00 % (р<0,05) вищим відносно пацієнтів з ГХ. Суттєвий вплив на рівень ендотеліну мала тривалість ГХ, у пацієнтів з терміном ГХ більше 5 років показники цього маркеру вазоконстрикції були вищими (на 45,8 %, р<0,05) порівняно з хворими на Пс і ГХ з тривалістю захворювання менше 5 років (р<0,05).
Ще один коморбідний стан значно впливав на рівень досліджуваного вазоконстриктора. У хворих на Пс і ГХ з ІМТ більше 30 кг/м2, спостерігалося підвищення ендотеліну-1 на 110,53 % (р<0,05) порівняно з пацієнтами нормальної маси тіла.
Поєднана патологія Пс і ГХ демонструвала найвищі рівні ендотеліну-1 при еритродермічній / артропатичній / пустульозній формі дерматозу, яка перевищувала показник вульгарної бляшкової / краплеподібної / інтертригінозної форми на 75,00 % (р<0,05), а відносно бляшкової з явищами ексудації форми на 71,15 % (р<0,05). Тяжкість ураження шкіри пов’язана з високими рівнями вазоконстрикторів, що було виявлено ще в роботі Біловол А.М. (2011). Це підтверджується рівнем ендотеліну-1 у групі з Пс і ГХ, де показники при PASI до 10 і понад 30 мали відмінності на рівні 82,76 % (р<0,05).
Таким чином, більш тяжкі та розповсюджені форми ураження шкіри у хворих на Пс, особливо в поєднанні з ГХ, значно швидше призводять до розвитку ЕД. Крім того, слід пам’ятати, що довготривала АГ, 3-й ступінь АГ і ІМТ більше 30 кг/м2 також вкрай негативно впливають на розвиток дисфункції ендотелію, підвищуючи ризик розвитку серцево-судинних ускладнень. Ці дані свідчать про необхідність своєчасної діагностики і терапевтичної корекції АГ, проведення роботи, спрямованої на нормалізацію маси тіла у хворих на Пс.
Гіперпродукція ендотеліну потребує компенсаторного підвищення рівня вазодилататорів, тому доцільно було визначити стан обміну одного з головних вазодилататорів – NO, а саме рівні NOS, нітритів і більш стійкого маркера обміну NO – нітротирозину.
З огляду на ту обставину, що побічним продуктом нітрозування біосубстратів виступає процес нітрозування білків, кількісною мірою вираженості цього процесу може виступати рівень нітротирозину. До того ж, більшість циркулюючих у крові протеїнів мають більш тривалий період напіввиведення, ніж NO [14], тому нітротирозин може слугувати критерієм стану нітрозуючого стресу.
Метаболічні порушення, як складова патогенезу Пс, тягнуть за собою зниження біодоступності NO (низький вміст у сироватці стабільних метаболітів NO) і підвищення вмісту нітротирозину в крові хворих. У нормі нітротирозину в сироватці (плазмі) крові або не виявляється, або його вміст дуже низький. Якщо збільшення вмісту нітротирозину супроводжується стрімким приростом у сироватці крові стабільних метаболітів NO, це найімовірніше свідчить про цитокін-індуковану активацію iNOS, яка здатна продукувати NO в токсичних концентраціях. Прогноз несприятливий, посилюється нітрозуючий стрес, йде деструкція тканин, окислювальна деактивація ферментів, ураження судинного русла, подальший розвиток системного запального процесу. Замість антипроліферативної активності надлишок NO в даній ситуації сприяє підтримці запальних процесів і активує проліферацію кератиноцитів, нітрозуючи активні регуляторні макромолекули [125].
Якщо вміст нітротирозину в процесі терапії знижується і при цьому спостерігається підвищення в сироватці рівня стабільних метаболітів NO – найімовірніше активізувалися адаптаційні механізми, підвищилася активність АОС захисту, тобто прогноз сприятливий, слід очікувати регрес захворювання [72], покращення метаболічної регуляції [19].
Аналіз рівня нітротирозину у пацієнтів в обстежених групах показав, що аналогічно даним попередніх показників, в основній групі з поєднаною патологією відзначено максимальний з усіх груп рівень нітротирозину, а стосовно груп порівняння визначено різницю в 46,42 % і 37,88 % (р<0,05) відносно хворих тільки на ГХ або Пс відповідно.
Значне зростання нітротирозину визначено у пацієнтів з двома коморбідними станами водночас – ГХ і ожиріння, різниця в показниках з ІМТ до 10 і більше 30 кг/м2 склала 52,5 %. Статистично достовірне підвищення маркерів вазоконстрикції визначено також у жінок основної групи, де значення нітротирозину було більшим відносно чоловіків на 311,51 % і обумовлено значною кількістю артропатичних форм. Це підтверджується різницею в показниках цього маркеру при порівнянні клінічних форм Пс, так при еритродермічній / артропатичній / пустульозній формі Пс визначено більш високі, на 46,39 % (р<0,05), показники порівняно з вульгарною бляшковою / краплеподібною / інтертригінозною формою і на 75,70 % (р<0,05) порівняно з бляшковою з явищами ексудації. Таким чином, виразність нітрозуючого стресу більше залежить від тяжкості перебігу Пс і найбільша – у пацієнтів з тяжкими клінічними формами дерматозу.
Оцінено ступінь взаємозв’язку між рівнем TNF-α і нітротирозину, який свідчив про наявність між ними прямої кореляційної взаємозалежності в сироватці крові у хворих основної групи (RsНТ-TNF = +0,76, р<0,01). У двох групах порівняння (на Пс і ГХ) взаємозалежність також була достовірною, але менш статистично значущою і менш вираженою (RsНТ-TNF = +0,33 і RsНТ-TNF = +0,52, р<0,05 для обох випадків відповідно).
За даними оцінки критерію χ² і таблиць спряженості можна відзначити, що в групі хворих, які страждали водночас на Пс і ГХ, у яких результати анкетування DLQI склали понад 17 балів, виявлялася статистично більш значуща кількість хворих з високою активністю нітрозуючого стресу (підвищеним рівнем нітротирозину більше 10 нмоль/мл – 90 перцентіль усіх значень нітротирозину), ніж у групі пацієнтів без Пс або ГХ (χ² = 12,7, р<0,01). Хворі з ГХ або Пс мали практично рівнозначні показники нітротирозину, а коморбідність істотно підвищувала даний показник.
Високі значення нітротирозину можуть свідчити або про істотне зниження біодоступності NO внаслідок виникнення оксидативного стресу, або про активацію iNOS, що супроводжується розвитком нітрозуючого стресу, саме тому виникла необхідність дослідження рівня NO, системи антиоксидантного захисту, активності iNOS.
Дослідницький інтерес визначення вмісту стабільних метаболітів NO викликаний тим, що в нормі підвищення утворення NO конститутивними синтазами можна віднести до адаптивних механізмів регуляції тонусу судин. Для кожної категорії хворих важливо встановити діапазон вмісту NO, вище якого ця високоактивна молекула з елемента адаптації перетворюється в елемент патогенезу захворювання. Дефіцит NO, як і занадто високий його вміст у крові, свідчить про зрив адаптації і є несприятливим прогнозом.
Аналізуючи отримані дані, можна зробити висновок, що коморбідна патологія найбільше сприяла активації синтезу нітритів, що проявлялося у вигляді підвищення значень NOS і, як результат даної активації, збільшення рівня самих нітритів. При ГХ без супутньої патології активність NOS перебувала на середньому рівні, а рівні нітритів були нижчими порівняно з іншими групами, тобто формувався певний дефіцит нітритів при ГХ, що вписується в концепцію патогенезу ГХ з погляду певної недостатності вазодилататорних нітритів та компенсаторного підвищення активності NOS. При наявності Пс у групі порівняння рівні нітритів підвищувалися, але активність NOS була нижчою відносно інших клінічних груп, що свідчило про помірну активність процесів нітрозуючого стресу в даної категорії пацієнтів.
При поєднаному перебігу дерматозу і ГХ найвищу активність NOS визначено у пацієнтів з еритродермічною / артропатичною / пустульозною формами Пс, яка перевищувала аналогічний показник бляшкової / краплеподібної / інтертригінозної форм на 98,39 % і бляшкової з явищами ексудації форми на 20,16 % (р<0,05). Рівні NOS визначалися в основній групі з бляшковою / краплеподібною / інтертригінозною формами як найнижчі серед усіх клінічних груп, а при бляшковій з явищами ексудації формі Пс – на середньому рівні значень, різниця між цими групами становила 65,10 % (р<0,05).
Рівні нітритів при коморбідній патології також були найвищими у пацієнтів з еритродермічною / артропатичною / пустульозною формами Пс, рівні нітритів при бляшковій / краплеподібній / інтертригінозній формах були нижчими на 86,41 %, а при бляшковій з явищами ексудації формі – на 17,59 % (р<0,05). Нітрити при бляшковій / краплеподібній / інтертригінозній формах в основній групі демонстрували найнижчі значення серед усіх форм, а при бляшковій з явищами ексудації формі визначалися середні рівні значень, різниця у відсотках між даними групами становила 58,53 % (р<0,05).
Раніше, у роботі Біловол А.М. (2011) були отримані аналогічні результати, також було встановлено паралельне зростання рівня нітритів зі зростанням тяжкості Пс при супутній ГХ, вивчення стану цих процесів було прогностичним критерієм визначення ступеня тяжкості хвороби.
Таким чином, отримані дані свідчать про найвищу активність NOS, гіперпродукцію як NO, так і пероксинітриту, про що свідчить рівень нітротирозину. Такий стан може розвиватися на тлі нестачі антиоксидантного захисту, що і спонукало до визначення рівня цих маркерів.
Активація ВРО є одним з факторів, що спричиняють пошкодження ендотелію, дезорганізацію біомембран і міжклітинних контактів, зниження антитромбогенного потенціалу та сприяє подальшому порушенню мікроциркуляції і гомеостазу. Підвищене утворення і накопичення в тканинах активних форм кисню, реактивних молекул і вільних радикалів спричиняють перенапруження і неспроможність у функціонуванні системи антиоксидантного захисту, що має в сполучній тканині найменший потенціал з формуванням явищ оксидативного стресу [296].
Для визначення наявності оксидативного стресу проаналізовано вміст різних форм глутатіону як маркера цього стану. Отримані дані свідчать, що рівень ГЛУв у хворих групи порівняння на Пс виявився нижчим, ніж при ГХ (друга група порівняння) на 25,81 % (p<0,05), у осіб основної групи – на 40,61 % (p<0,05) нижче. Рівень ГЛУо мав тенденцію до збільшення, відмінності з хворими лише на ГХ були достовірними та становили 30,24 % (p<0,05) і 11,11 % (p<0,05) відповідно в осіб основної та групи порівняння на Пс. Співвідношення ГЛУв / ГЛУо у хворих на Пс було значно нижчим, ніж при ГХ.
Різниця для пацієнтів першої контрольної групи (Пс без ГХ) становила 45,51 % (p<0,05), при наявності ГХ (основна група) – 37,87 % (p<0,05). Між хворими на Пс залежно від наявності або відсутності ГХ відносно ГЛУв / ГЛУо різниця була достовірною і становила 24,89 % (p<0,05). Таким чином, у хворих на Пс виявлено прогресуючі порушення з боку метаболізму глутатіону і подальші зміни тіол-дисульфідного балансу, які погіршувалися з наявністю ГХ. Це супроводжувалося достовірним зменшення активності СОД при Пс без ГХ на 13,08 % (p<0,05) і на 34,28 % (p<0,05) порівняно з хворими лише на ГХ.
Як спонтанні, так і стимульовані АФГ були найменшими в осіб з ГХ, у хворих на Пс при супутній ГХ досліджувані показники були вищими на 57,43 % (p<0,05) і 47,55 % (p<0,05) відповідно, у пацієнтів, хворих лише на Пс – на 23,27 % (p<0,05) і 22,03 % (p<0,05) відповідно, порівняно з ГХ. Збільшення спонтанних і стимульованих КФГ також було відзначено в групах пацієнтів з Пс.
АОС – це система, що блокує утворення високоактивних вільних радикалів, тобто активних форм кисню. У нормальних фізіологічних умовах невеликі кількості кисню постійно конвертуються в супероксид-аніони, перекис водню і гідроксильні радикали. Надлишкова продукція цих радикалів виступає в ролі чинника ушкодження, компенсаторним механізмом якого є АОС. Головний компонент цієї системи – мережа ферментів антиоксидантного захисту: СОД, глутатіонпероксидаза, каталаза і параоксонази [79].
При аналізі АОС були отримані результати, які свідчили про прогресуюче порушення антиоксидантної ланки. Різниця між значеннями СОД осіб при Пс у поєднанні з ГХ і Пс без ГХ становила 25,69 % (p<0,05), у свою чергу, їх середні значення були на 13,08 % (p<0,05) і 52,17 % (p<0,05) відповідно нижчими порівняно з хворими лише на ГХ. Отже, розвиток Пс на тлі ГХ супроводжувався різноспрямованою зміною з боку АОС, але достовірно виявлено дефіцит її активності.
Численні дані різних дослідників підтверджують думку про те, що оксидативний стрес є одним з неспецифічних ланок патогенезу багатьох захворювань, у тому числі Пс та ГХ і характеризується підвищенням рівня вільних радикалів [10, 16, 19]. Вільні радикали дуже реакційно-здатні й ушкоджують клітини шкіри, судинний ендотелій з розвитком гіперкератозу та запального процесу в кератиноцитах, зростанням вазоконстрикції. Порушення динамічної рівноваги про- і АОС призводить до зміни генерації вільних радикалів, що, в свою чергу, суттєво впливає на метаболізм NO, сприяє порушенню процесів його біодоступності і обумовлє прояви ЕД. Надлишкова продукція супероксиду, його накопичення в тканинах судин і переважання над антиоксидантами створюють стан оксидативного стресу, що запускає або підсилює реакції вазоспазму і гіперкератозу. Супероксид прямо або через продукт своєї взаємодії з NO – пероксинітрит (ONOO-) – здатний ініціювати процеси вільнорадикального окислення і пошкодження біополімерів стінки судин, зокрема ліпідів. Ці механізми оксидативного стресу (порушення функції судинного ендотелію і активація процесів гіперкератоза) сприяють як прогресуванню дерматозу, так і збільшенню ризику розвитку кардіоваскулярних ускладнень [70].
З огляду на всі оновлені концепції етіопатогенезу Пс, отримані протягом останніх років наукових пошуків, в яких захворювання розглядається як типовий патологічний процес – запалення в умовах функціональної недостатності систем антиоксидантного захисту та підвищеної експресії апоптозних рецепторів, а також порушення тіол-дисульфідного балансу, можна скоригувати існуючі схеми лікування Пс з урахуванням вищевказаних патогенетичних ланок [290]. Окислювальний стрес кератиноцитів, які не пройшли стадії диференціювання, є пусковим механізмом формування дефектного рогового шару – ключової ланки псоріатичного процесу. Також при цьому значно змінена активність АОС, зокрема, за рахунок збільшення концентрації церулоплазміну, зниження α-токоферолу, що свідчить про наявність запального синдрому [349].
Отримані результати комплексного обстеження та динамічного спостереження за хворими свідчать про наявність оксидативного стресу при такій коморбідній патології, як Пс і ГХ, а також про складну і неоднозначну систему регулювання про- і антиоксидантної рівноваги, які проявляється збільшенням активності ВРО і зниженням фізіологічного антиоксидантного захисту.
Низький рівень співвідношення відновлені / окислені форми (менше 6 у.о. (відносний ризик для цієї когорти хворих склав 6,57 з 95 % ДІ [4,52; 8,71]) достовірно збільшував майже в 4,5 разу ймовірність розвитку ускладнень Пс, згідно отриманого співвідношення шансів порівняно з пацієнтами, у яких зазначені показники були в межах норми, р<0,05.
Проведений багатофакторний дисперсійний аналіз у рамках математичного моделювання показав, що у пацієнтів з Пс на тлі ГХ клінічний стан (рівень PASI) достовірно детермінувався інтегральними змінами оксидативного статусу (оцінювався за співвідношенням рівня СОД до АФГстим. при F = 22,13, р<0,01) і був пов'язаний з тяжкістю АГ (F = 9,61, р <0,05), ступенем порушень ВСР (F = 4,88, р <0,05).
Дослідження останніх 15 років підтвердили і поглибили гомоцистеїнову теорію розвитку судинних порушень. Рівень гомоцистеїну у крові коливається в районі 10-15 мкмоль/л. ГГЦ діагностують у тому випадку, коли рівень гомоцистеїну у крові перевищує 15 мкмоль/л. Концентрація гомоцистеїну у плазмі крові в межах 15-30 мкмоль/л свідчить про помірну ГГЦ, від 30 до 100 мкмоль/л – проміжну, а більше 100 мкмоль/л – про важку. З віком рівень гомоцистеїну поступово зростає, причому у жінок швидкість цього зростання вище, ніж у чоловіків. Помірні фізичні навантаження сприяють зниженню рівня гомоцистеїну при ГГЦ. Споживання невеликої кількості алкоголю може знижувати рівень гомоцистеїну, а великі кількості спиртного сприяють зростанню гомоцистеїну у крові.
В останні роки з’явилися численні дані, що вказують на гомоцистеїн як незалежний фактор ризику серцево-судинних захворювань, який можна модифікувати. Обговорюються можливі патогенетичні механізми впливу гомоцистеїну на судинну стінку: порушення ендотелійзалежної вазодилатації, окисидативний стрес, перекисне окислення білків і ліпідів за рахунок зменшення продукції СОД, а також посилення тромбогенезу та коагуляції. Одним з найбільш значущих механізмів, через який реалізується дія всіх факторів ризику розвитку ГХ і Пс, визнана ЕД [413]. У сучасних дослідженнях ключова роль у запуску ЕД відводиться оксидативному стресу. Класичні фактори ризику (паління, САТ, надмірна вага і гіперхолестеринемія) не можуть повністю пояснити динаміку серцево-судинних ускладнень, так як їх поширеність сягає 15 % у жінок і 40 % у чоловіків. Порівняно недавно до потенційних факторів ризику атеросклерозу стали відносити ГГЦ. Взаємозв’язок між підвищенням концентрації гомоцистеїну у плазмі крові і збільшенням ризику серцево-судинної патології достовірно встановлено в ході Фрамінгемского дослідження (1996). Висловлюється припущення, що несприятлива роль гомоцистеїну у розвитку серцево-судинної патології обумовлена його впливом на тромбогенез [233]. Значна кількість з перерахованих чинників наявна у хворих на Пс у поєднанні з ГХ, тому визначення рівня гомоцистеїну у цієї категорії хворих було доцільним, раніше цю проблему досліджено не було.
У результаті обстеження осіб усіх груп виявлено збільшення рівня гомоцистеїну при різній патології, яке максимально виражено при коморбідному стані ([30,94 ± 2,48] мкмоль/л) порівняно з хворими лише на Пс або ГХ ([17,07 ± 0,68] та [10,46 ± 0,47] мкмоль/л відповідно), р<0,05. Таким чином, рівень гомоцистеїну основної групи на 66,19 % і 44,83 % (р<0,05) статистично достовірно перевищував показник груп порівняння з ГХ або Пс. Підйом рівня зазначеного маркера на 49,80 % при тривалості ГХ більше 5 років, на 23,36 % при тривалості дерматозу більше 5 років зафіксовано у пацієнтів основної групи (р<0,05), ГГЦ посилювався при 3 ступені АГ (на 47,06 %, р<0,05).
Статистично значущі результати отримано стосовно визначення залежності рівня гомоцистеїну від тяжкості перебігу Пс при поєднаній патології, спостерігалися наступні значення: при бляшковій / краплеподібній / інтертригінозній формах рівень амінокислоти був нижчим, ніж при бляшковій з явищами ексудації на 61,30 %, а показники еритродермічної / артропатичної / пустульозної форм перевершували аналогічні при бляшковій з явищами ексудації формі Пс на 22,96 %. Різниця між бляшковою / краплеподібною / інтертригінозною та еритродермічною / артропатичною / пустульозною формами становила 98,34 %. ГГЦ, як маркер тяжкості системного ураження органів, запального процесу і ступеня ЕД, визначався в максимальних значеннях при зростанні PASI від 10 до 30 і вище, особливо при наявності у пацієнтів поєднаної патології. Зростання PASI від 10-30 до цифр понад 30 призводило до збільшення вмісту гомоцистеїну на 37,17 % (р<0,05), групи Пс і ГХ і з PASI до 10 і понад 30 мали відмінності на рівні 48,64 % (р<0,05).
У результаті розвитку ЕД виникає дисбаланс між судинорозширювальними, судинозвужувальними, антитромботичними факторами, а також між проліферативними і прозапальними чинниками [6]. Таким чином, у пацієнтів з коморбідним станом складаються всі умови для більшого, порівняно з хворими лише на ГХ або Пс, розвитку ЕД. На тлі зазначеного необхідно було дослідити стан системи захисту ендотелію, що проведено визначенням рівня EPCR.
EPCR – мембранний білок, рецептор, що відіграє важливу роль в активації протеїну C. Активований протеїн С, зв’язуючись зі специфічним рецептором – EPCR, набуває нових протизапальних властивостей: він пригнічує звільнення запальних цитокінів (перш за все, TNF-α) в моделі запалення, спричиненого ендотоксинами; комплекс АПС/EPCR блокує адгезію лейкоцитів, запобігає інфільтрації лейкоцитів у тканини, поряд з антикоагулянтною, протизапальною і антиапоптотичною активностями, проявляє профібринолітичну активність, викликаючи звільнення тканинного активатора плазміногену з його комплексу з інгібітором. Дотепер не існує робіт, в яких було б визначено стан системи захисту ендотелію у хворих на Пс у вигляді дослідження EPCR.
Зниження рівня EPCR і його цитопротекторних властивостей відзначено в основній групі на противагу обом групам порівняння. У виділених групах пацієнтів максимальні значення EPCR зафіксовано в групі порівняння з ГХ, де перевищено аналогічний показник групи порівняння хворих на Пс на 20,94 % (р<0,05) і основної групи – на 98,72 % (р<0,05). Таким чином, мінімальна захисна дія АПС виявлена у хворих з поєднаною патологією, що проявилося в зниженні маркера EPCR, у той час, як максимальна компенсаторна активність АПС в умовах системної запальної відповіді організму зафіксована в групі хворих на ГХ, де виявлено найвищі рівні маркера EPCR.
Значний вплив на рівень EPCR мала тривалість ГХ, зростання ІМТ, та найбільший вплив мала форма Пс: при вульгарній бляшковій / краплеподібній / інтертригінозній формах рівень EPCR був вищим, ніж при бляшковій з явищами ексудації на 54,22 % або при еритродермічній / артропатичній / пустульозній формах – на 64,38 % (р<0,05), остання форма мала менші значення EPCR порівняно з бляшковою з явищами ексудації формою на 22,19 % (р<0,05).
Функціональні порушення нейроендокринної системи, особливо в рамках психонейроендокринноімунного комплексу, мають важливе значення у виникненні і розвитку Пс, проте питання про роль гормонів і про зв’язок ендокринних порушень із патогенезом дерматозу вивчені недостатньо і є досить суперечливими. До теперішнього часу існує дуже мало робіт із результатами комплексних великих досліджень гормонального статусу хворих на Пс, особливо при наявності коморбідних станів. У більшості робіт, присвячених ендокринній складовій Пс, зміни тих чи інших гормонів розглядаються в якості бази, на тлі якої розгортаються патологічні процеси в шкірі. При цьому порушення роботи ендокринних ефекторів трактується як в якості індуктора гіперпроліферативних шкірних процесів, так і в якості їх каталізатора [129, 209, 335].
Є багато даних про роль стресу в розвитку Пс і про порушення при цьому захворюванні роботи гіпоталамо-гіпофізарно-надниркової системи. Показано, що кортизол здатен активувати проліферацію кератиноцитів in vitro. Поряд із впливом глюкокортикостероїдів на кератиноцити ці гормони у високих концентраціях здатні спричиняти виражений імуносупресивний ефект. Не існує єдиної думки стосовно рівню кортизолу, а особливо показника кортизол/інсулінового індексу і залежності від нього тяжкості і перебігу Пс, а при поєднанні з ГХ є лише поодинокі роботи в цьому напрямку [221, 306].
Якщо порівнювати показники кортизолу в усіх досліджених групах, то можна побачити, що найвищі його значення ([21,18 ± 0,89] мкг/дл) спостерігалися саме в групі пацієнтів, які страждали лише на ГХ (друга група порівняння). При тривалій надлишковій продукції кортизолу відбувалося збільшення вмісту в крові реніну. Останній бере участь в утворенні ангіотензину I і сприяє підвищенню АТ. Глюкокортикоїди потенціюють ефект катехоламінів на периферичні судини, роль глюкокортикоїдів у патогенезі АГ незаперечна і доведена численними дослідженнями.
Стосовно хворих на Пс як першої групи порівняння, так і основної групи, можна відзначити достовірне зниження рівню кортизолу (відповідно [13,75 ± 1,09] і [6,26 ± 1,13] мкг/дл; р<0,05), що поряд з підвищенням рівня інсуліну призводить до нездатності, неспроможності формування повноцінної системи реагування на тригерні фактори, виснаження цієї системи.
При трактуванні результатів дослідження рівня інсуліну в крові хворих різних клінічних груп відзначалося зростання даного показника при поєднаній патології (у пацієнтів основної групи), а різниця в значеннях цього гормону відносно груп порівняння, як до першої (тільки з Пс), так і до другої (тільки з ГХ) становила 44,20 % і 66,67 % (р<0,05) відповідно, на користь коморбідної патології.
Пацієнти з тривалістю ГХ понад 5 років демонстрували вищі цифри інсуліну, а при формуванні коморбідної патології і тривалості ГХ понад 5 років – істотно знижувався кортизол. Це може свідчити про нестійкість до стресів пацієнтів з Пс у поєднанні з ГХ при тривалому, понад 5 років, існуванні поєднаної патології.
Надлишкова маса тіла при коморбідності підвищувала і кортизол, і особливо істотно інсулін. ІМТ більше 30 кг/м2 при ГХ призводив до зниження і кортизолу і інсуліну, а при Пс – знижував кортизол і підвищував інсулін. Досить суттєві гендерні відмінності виявлено в основній групі, де рівень кортизолу в чоловіків на 31,65 % був вище, ніж у жінок. Тож, велика частка розвитку системного ураження у жінок з коморбідною патологією із формуванням артропатичного Пс є проявом декомпенсації адаптації. У осіб чоловічої статі є більша схильність до появи порушення толерантності до вуглеводів і формування діабету при хронічному системному запальному процесі.
Вульгарна бляшкова форма Пс із вираженими явищами ексудації мала найвищі значення кортизолу у хворих основної групи. Значне зниження інсуліну відзначено при бляшковій формі Пс із вираженими явищами ексудації Пс у групі порівняння і при вульгарному Пс при поєднаній патології. Приєднання ГХ до Пс, збільшення площі ураження шкіри асоціювалися з високими значеннями кортизолу та інсуліну, а відповідно, формували фон для порушення толерантності до глюкози у таких пацієнтів і розвитку тяжких ускладнень на тлі гіперглікемії, у той же час сумарне зниження рівня кортизолу на тлі зростання інсуліну, а відповідно, зниження кортизол/інсулінового індексу, свідчило про зрив систем адаптації, особливо у пацієнтів з артропатичною формою Пс.
Відомо, що виникнення Пс в людини пов’язано зі стресом, розладами настрою, а також з лікуванням антидепресантами, тому значна увага лікарів звернена на патофізіологічну роль такого моноаміну, як серотонін, який виконує функції нейромедіатора в центральній і периферичній нервових системах. Існує велика кількість досліджень внеску серотоніну та інших компонентів серотонінергічної системи в розвиток і перебіг Пс [256, 284]. Показано, що рівень серотоніну в сироватці крові хворих на Пс можна порівняти з таким у здорових людей, а вміст серотоніну в тромбоцитах – достовірно нижчий, ніж у здорових. Проте імуногістохімічні дослідження показали, що експресія серотоніну була значно сильнішою в пошкоджених клітинах, клітинах потових залоз і клітинах сальних залоз, достовірно відрізняючись від аналогічних показників інтактної шкіри [305, 358]. При наявності окремих досліджень стосовно рівня серотоніну дотепер не проводили взаємозв’язок між ним і клінічною формою, перебігом дерматозу.
За отриманими результатами, хоча в цілому визначалося статистично достовірне переважання рівня серотоніну в групі хворих на коморбідну патологію порівняно з пацієнтами, які страждали лише на Пс або ГХ, слід відзначити, що в самій основній групі показники серотоніну були дуже неоднорідними. Після аналізу форми і перебігу дерматозу у хворих на коморбідну патологію з рівнем серотоніну до 100 і вищим 200 нг/мл з’ясувалося нижченаведене. У пацієнтів з рівнем серотоніну вищим 200 нг/мл у середньому спостерігалися високі цифри досліджуваного показника ([347,95 ± 73,12] нг/мл), серед пацієнтів цієї групи визначалися всі клінічні форми дерматозу, але у всіх них спостерігався класичний перебіг дерматозу з адекватною реакцією на проведення терапії. Слід зазначити, що у більшості пацієнтів цієї групи виявлено кореляційний зв’язок з підвищенням рівня VEGF-А, каспази-8, гомоцистеїну. Друга група хворих на Пс у поєднанні з ГХ, але рівнем серотоніну менше 100 нг/мл, середній показник серотоніну по групі склав 46,01 нг/мл, суттєво відрізнялася торпідністю дерматозу до терапії. Шляхом анкетування у цих пацієнтів було визначено високі (11-17) рівні тривоги та депресії. У цій групі хворих також спостерігалися різні клінічні форми дерматозу, але у 62,5 % пацієнтів дерматоз був резистентний до призначеної терапії, що змушувало призначати більш активну терапію у вигляді цитостатичних препаратів (метотрексату). У цій групі пацієнтів низький показник серотоніну був пов’язаний з підвищенням рівня кортизолу, що свідчило про напруженість механізмів адаптації.
Крім того, у переважної більшості пацієнтів цієї групи методом добового вимірювання визначено порушення циркадного ритму АТ у вигляді недостатнього його зниження у вечірні та нічні години. З урахуванням зазначеного, ця категорія пацієнтів потребувала виділення в окрему клініко-терапевтичну групу і призначення терапевтичної корекції з урахуванням метаболізму серотоніну. У осіб з найменшим рівнем серотоніну (меншим 100 нг/мл) реєструвалося більш істотне погіршення клінічної картини, що супроводжувалося достовірним підвищенням PASI і DLQI, зниження ЯЖ при зростанні рівня ключового цитокіну імунологічного каскаду TNF-α.
Важливо зазначити, що при оцінці ступеня взаємозв’язку між вираженістю емоційних змін згідно госпітальної шкали тривоги / депресії та рівнем серотоніну крові виявилося, що залежність мала U-подібну форму, тому коефіцієнт кореляції був низьким (нелінійна асоціація).
Слід зауважити, що дослідження рівня серотоніну проводилося раніше попередніми науковцями. Так, Біловол А.М. також виявляла підвищення рівня серотоніну в цілому у хворих на Пс і АГ [10], та розподіл хворих залежно від рівня серотоніну проведено вперше в даній роботі, визначено взаємозв’язок між перебігом, тяжкістю дерматозу і прогностичним значенням падіння рівня серотоніну, станом тривоги та депресії, показниками ДМАТ.
Стан вегето-судинної регуляції було досліджено за допомогою системи «Кардіолаб» у 90 хворих на Пс, серед яких 30 – з нормальним рівнем АТ, 36 – з супутньою ГХ і 24 практично здорові особи контрольної групи. У результаті встановлено, що у хворих лише на Пс спостерігалося збільшення тонусу симпатичної нервової системи зі зниженням потужності високочастотного компоненту спектра. У пацієнтів з одночасним перебігом Пс і ГХ було виявлено більш глибокі порушення ВНС і окрім збільшення тонусу симпатичної нервової системи спостерігалося зниження тонусу парасимпатичного відділу, що відображає комбіновані порушення центральних механізмів регуляції серцевого ритму.
Вперше було проведено ДМАТ у 59 пацієнтів, хворих на Пс, серед яких: 26 пацієнтів – з групи порівняння і 33 – з основної групи, які страждали водночас на Пс і ГХ. За результатами цього обстеження виявлено, що у хворих на Пс як з нормальним, так і підвищеним АТ, були порушення циркадного ритму. Переважаюча кількість хворих на Пс мала порушення циркадного ритму АТ у вигляді недостатнього його зниження у вечірні та нічні години, загальна кількість таких хворих становила 57,7 % (15 випадків) у першій групі (порівняння) та 63,6 % (21 пацієнт) – у третій (основній) групі. Недостатнє зниження АТ вночі зазвичай супроводжується більш частим ураженням органів-мішеней, це: гіпертрофія міокарда, серцева, ниркова недостатність, ретинопатія, гломерулосклероз та інше. Слід зазначити, що у 3 хворих на Пс при традиційному, офісному вимірюванні АТ АГ не було виявлено, рівень його становив 140/90 мм рт. ст, гіпертензію було виявлено лише при проведенні ДМАТ, у зв’язку з чим цих пацієнтів було віднесено до третьої групи (коморбідної патології). Це свідчить про більшу інформативність цього методу і дає підставу рекомендувати його для більш частого використання у хворих із зазначеним дерматозом.
У всіх обстежених хворих простежено взаємозв’язок між приналежністю до групи зниження АТ і формою Пс. У результаті проведених досліджень вперше було виявлено, що пацієнти з нормальним для більшості населення типом зниження АТ («dipper») представлені більш легкими формами Пс (вульгарним бляшковим). Хворі з патологічним зниженням АТ (категорії «non-dipper», «night-peaker» та «over-dipper») представлені більш тяжкими формами дерматозу (вульгарним бляшковим з явищами ексудації, де PASI>30 і DLQI>10, артропатичним, пустульозним, еритродермією).
Залежність тяжкості перебігу Пс від патологічного типу зниження АТ не була абсолютною, але однозначно ця тенденція простежувалася. Так, у групі з коморбідністю (3 група): більшість пацієнтів категорії «dipper» – 9 випадків (75,0 %) – представлена вульгарним бляшковим Пс, лише у 3 хворих визначено тяжкі форми (артропатичний, пустульозний, еритродермія). У групах категорії «non-dipper», «night-peaker» та «over-dipper» відсоток пацієнтів з вульгарним бляшковим Пс становив від 25,0 % (у групі «non-dipper») до 50,0 % (у групі «night-peaker»), а більшість хворих (75,0 % та 50,0 % відповідно) і 1 пацієнтка (100 %) у групі «over-dipper» – представлено тяжкими формами Пс.
Таким чином, можна провести взаємозв’язок між ступенем тяжкості дерматозу і порушенням добового профілю у хворих, які страждають на Пс. Зміни АТ у нічний час залежать від активності ряду нейрогуморальних систем. Так, у повільну фазу сну зниження АТ обумовлено зниженням симпатичного компонента регуляції в особі циркулюючих катехоламінів. У нічний час знижується чутливість барорецепторів, що також призводить до зниження АТ.
Отримані дані свідчать про наявність значних порушень у системі нейро-гуморальної регуляції, яка об’єднує суб’єктивні ознаки порушення ЯЖ у вигляді високих рівнів DLQI, тривоги та депресії, дисбалансу симпатичної/парасимпатичної нервової системи з порушенням циркадного ритму АТ, особливостями обміну серотоніну, неспроможністю адекватної відповіді на стреси у вигляді зниження КІІ, що призводить додатково до підвищення рівня вазоконстрикторів, розвитку ЕД, порушень у системі обміну NO, АОС. Це супроводжується формуванням тяжких, резистентних до терапії форм дерматозу.
Для виключення ролі саме віку на показники досліджуваних маркерів, всі групи дослідження поділили за віком, при цьому одержали подібні тенденції у молодшій (менш 50 років) і старшій (більше 50 років) групах щодо рівня нітротирозину, гомоцистеїну, серотоніну, каспази-8, IL-6, TNF-α, VEGF і EPCR.
Результати проведеного морфологічного аналізу виявили певні напрямки патологічних змін стану шкіри у пацієнтів досліджуваного клінічного профілю, а також структурно-функціональні особливості епітеліального, сполучнотканинного і мікроциркуляторного компонентів шкіри залежно від характеру патологічного процесу. Для розмежування і визначення конкретного впливу фактора псоріатичного процесу в прогресуючій стадії, ГХ та поєднаної патології (Пс і ГХ) на стан шкіри був проведений однофакторний дисперсійний аналіз за кожним означеним фактором, результати якого наведено у таблицях 9.1 і 9.2.
Дисперсійний аналіз впливу псоріатичного процесу в прогресуючій стадії на варіювання 14 досліджуваних морфологічних параметрів встановив, що найбільшою мірою дерматоз визначав зміни всіх досліджуваних параметрів епідермісу, варіювання відносного об’єму ГМЦР обох шарів дерми та проліферативної активності ендотеліоцитів і перицитів у складі ушкодженої шкіри, а також фібробластів при рівні значущості < 0,01. Меншою мірою від впливу Пс залежало варіювання діаметра внутрішньососочкових гемокапілярів. Значення діаметра артеріол і венул, мітотичної активності гладких міоцитів не мали суттєвої залежності від активності дерматозу.
Таблиця 9.1 – Вплив Пс і ГХ на варіювання морфологічних параметрів стану шкіри (кількісна оцінка за критерієм Снедекора, %)
| Параметри | Вплив досліджуваних факторів | ||
| Пс | ГХ | ||
| Ушкоджена шкіра | Неушкоджена шкіра | ||
| 1. МІ кератиноцитів | 78,1 ** | 23,0 | 19,2 |
| 2. Максимальна загальна товщина гермінативної зони епідермісу | 74,9 ** | 18,2 | 24,5 |
| 3. Мінімальна загальна товщина гермінативної зони епідермісу | 78,5 ** | 22,6 | 12,7 |
| 4. Чисельна щільність ядер кератиноцитів | 81,4 ** | 11,8 | 14,7 |
| 5. Відносний об’єм ГМЦР сосочкового шару дерми | 73,8 ** | 63,1 * | 30,3 |
| 6. Відносний об’єм ГМЦР сітчастого шару дерми | 76,0 ** | 58,9 * | 22,9 |
| 7. Діаметр артеріол підсосочкової сітки | 20,4 | 29,3 | 71,5 ** |
| 8. Діаметр венул підсосочкових сплетень | 6,9 | 17,5 | 21,4 |
| 9. Діаметр внутрішньососочкових гемокапілярів | 60,1 * | 66,1 * | 18,3 |
| 10. Діаметр гемокапілярів в основі капілярних петель | 64,7 * | 57,3 * | 22,7 |
| 11. МІ ендотеліоцитів | 85,2 ** | 60,6 * | 63,1 * |
| 12. МІ перицитів | 78,3 ** | 59,2 * | 56,8 * |
| 13. МІ гладких міоцитів | 32,0 | 30,3 | 74,4 ** |
| 14. МІ фібробластів | 74,6 ** | 65,4 * | 52,6 * |
Примітка. * – статистична достовірність при рівні значущості 0,05; ** – статистична достовірність при рівні значущості 0,01.
У клінічно неушкоджених контрлатеральних ділянках шкіри морфометричні параметри епідермісу не зазнавали істотного впливу (див. табл. 9.1). Навпаки, наявність хвороби у неактивному, але статистично значущому ступені (0,01 – 0,05) визначала варіювання відносного об’єму мікросудин дерми, а також діаметру гемокапілярів і показників МІ ендотеліальних клітин, перицитів і фібробластів у цих ділянках.
Таблиця 9.2 – Вплив поєднання Пс і ГХ на варіювання морфологічних параметрів стану шкіри (кількісна оцінка за критерієм Снедекора, %)
| Параметри | Вплив фактора поєднаної патології | |
| Ушкоджена шкіра | Неушкоджена шкіра | |
| 1. МІ кератиноцитів | 84,6 ** | 14,8 |
| 2. Максимальна загальна товщина гермінативної зони епідермісу | 76,8 ** | 32,3 |
| 3. Мінімальна загальна товщина гермінативної зони епідермісу | 82,1 ** | 27,3 |
| 4. Чисельна щільність ядер кератиноцитів | 90,7 ** | 22,8 |
| 5. Відносний об’єм ГМЦР сосочкового шару дерми | 81,7 ** | 66,8 * |
| 6. Відносний об’єм ГМЦР сітчастого шару дерми | 76,2 ** | 59,1 * |
| 7. Діаметр артеріол підсосочкової сітки | 84,5 ** | 67,3 * |
| 8. Діаметр венул підсосочкових сплетень | 37,3 | 60,6 * |
| 9. Діаметр внутрішньососочкових гемокапілярів | 95,2 ** | 68,0 * |
| 10. Діаметр гемокапілярів в основі капілярних петель | 92,1 ** | 57,4 * |
| 11. МІ ендотеліоцитів | 85,1 ** | 62,6 * |
| 12. МІ перицитів | 79,0 ** | 50,8 * |
| 13. МІ гладких міоцитів | 73,1 ** | 56,6 * |
| 14. МІ фібробластів | 85,3 ** | 61,2 * |
Примітка. * – статистична достовірність при рівні значущості 0,05; ** – статистична достовірність при рівні значущості 0,01.
У хворих на ГХ параметри епідермісу, а також щільність ГМЦР сосочкового і сітчастого шарів дерми не залежали від наявності АГ (див. табл. 9.1). Також не виявлялося суттєвої залежності варіювання показників венул і гемокапілярів від ГХ, однак зміни діаметру артеріол і мітотичної активності клітин мікросудинної стінки та фібробластів істотно визначалися саме наявністю гіпертензії: сила впливу за критерієм Снедекора становила 52,6 – 74,4 %.
Наведені результати дисперсійного аналізу підтверджують і кількісно уточнюють дані проведеного морфологічного дослідження, а також сучасні уявлення [134, 170] про те, що гіперплазія і дистрофія кератиноцитів мають локальний характер, який є характерним для псоріатично ушкоджених ділянок шкіри, у той час як гіперпроліферація клітин мікросудин і фібротичні прояви у складі сосочкового шару дерми належать до системних ушкоджень як у хворих на Пс, так і у пацієнтів з ГХ.
За даними дисперсійного аналізу впливу поєднаної патології (Пс і ГХ) на стан шкіри хворих похилого віку, у псоріатично ушкоджених ділянках усі досліджувані параметри порушень епідермісу в максимальному ступені залежали від коморбідного впливу – значення критерію Снедекора визначалися в межах 76,8 – 90,7 % і перевищували відповідні значення у групі хворих на Пс без ГХ (див. табл. 9.2). Навпаки, у складі епідермісу клінічно неушкоджених ділянок шкіри варіювання лінійних параметрів і мітотичної активності кератиноцитів не залежало від поєднаної патології, що свідчило про суто перифокальний характер змін епідермісу, які спостерігалися при морфологічному дослідженні шкіри хворих на Пс.
Найбільш виражений поєднаний вплив Пс і ГХ спостерігався відносно більшості параметрів мікроциркуляторного русла сосочкового і сітчастого шарів дерми ушкоджених ділянок шкіри, за виключенням діаметра венул підсосочкових сплетень (див. табл. 9.2). На особливу увагу заслуговує найвираженіший коморбідний вплив на зміни параметрів внутрішньососочкових гемокапілярів: на відміну від думки деяких дослідників про «кілька кровоносних судин, які займають центр сосочка» [90], у представленому дослідженні виявлено лише одну мікросудину (внутрішньососочковий гемокапіляр), ушкодження якої має критичну роль у розвитку патоморфологічних змін сосочкового шару дерми, що підтверджено даними інших авторів [33, 91, 92].
Важливо відзначити, що дисперсійний аналіз параметрів у складі клінічно неушкодженої шкіри також виявив помірний ступінь впливу Пс із супутньою ГХ на стан мікросудинного і сполучнотканинного компонентів дерми (див. табл. 9.2) навіть за умов відсутності специфічних псоріатичних елементів висипу та характерних деструктивних запально-ексудативних проявів у даних ділянках шкіри, що підтверджує системний характер мікроциркуляторних змін, встановлених за допомогою проведеного морфологічного аналізу.
При порівнянні рівня експресії іNOS за U-критерієм Манна-Вітні було встановлено достовірну різницю між експресією iNOS в епідермісі лише при псоріатичному ураженні та в епідермісі хворих на Пс і ГХ (р=0,041) з достовірно вищим рівнем експресїї у хворих на коморбідну патологію. У дермі шкіри пацієнтів з Пс групи порівняння було виявлено достовірну розбіжність порівняно зі шкірою хворих на Пс і ГХ (р=0,030). У той же час, за допомогою Т‑критерію Вілкоксона було виявлено достовірну різницю в експресії iNOS в епідермісі та дермі хворих на Пс і ГХ (р=0,001); у контрольних випадках достовірної розбіжності виявлено не було. Проте, як і у пацієнтів із Пс без ГХ у біоптатах псоріатично ушкодженої шкіри хворих основної групи у складі сосочкового та сітчастого шарів дерми спостерігалась інтенсивна цитоплазматична і навколоядерна експресія iNOS у фібробластах, ендотеліальних та гладком’язових клітинах судин мікроциркуляторного русла. Можливо, у пацієнтів даного контингенту індукцію iNOS посилює активація α‑адренорецепторів, що відбувається на тлі ГХ.
Враховуючи індукований характер експресії iNOS клітинами сполучної тканини та ендотеліоцитами і міоцитами мікросудин, доцільно припустити, що на тлі поєднаної патології (Пс і ГХ) у складі морфологічно ушкодженої шкіри відбувається істотна активація синтезу аномальних форм NOS, що за своєю інтенсивністю значно перевищує таку при Пс без ГХ і може слугувати критерієм глибини структурних змін шкіри у даного контингенту хворих.
У літературі відомі препарати, асоційовані з розвитком, загостренням і погіршенням перебігу Пс. До таких препаратів, які мають сильний причинно-наслідковий зв’язок із дерматозом відносять, зокрема, препарати літію, β‑адреноблокатори, інгібітори АПФ, протималярійні препарати, нестероїдні протизапальні препарати, тетрациклін [272, 300]. При цьому в багатьох дослідженнях є вказівки на ефект β-адреноблокаторів, як препаратів, котрі провокують розвиток Пс у хворих з гіпертензією [396, 414]. Можливий механізм такого критичного ефекту обумовлений здатністю даних препаратів блокувати β-адренергічні рецептори шкіри, запобігаючи впливу β-агоністів. Це в подальшому призводить до зниження внутрішньоклітинного рівня циклічного аденозинмонофосфату, порушення диференціювання і проліферації кератиноцитів [272]. Тому прийом антигіпертензивних препаратів пацієнтам основної групи призначали після консультації терапевта/кардіолога з урахуванням існуючих особливостей, по два препарати з наступних груп:
– антагоністи кальцію;
– діуретики;
– блокатори рецепторів ангіотензину ІІ першого типу, або сартани.
У процесі терапії під наглядом перебували 60 пацієнтів із Пс, які були розподілені шляхом рандомізації на дві групи – 15 пацієнтів групи порівняння, які отримували традиційну терапію, і 45 – основної групи, які отримували терапію за розробленою методикою. Усім хворим на Пс проводили традиційну терапію в умовах дерматологічного стаціонару. Традиційна терапія складалася з дезінтоксикаційних, гіпосенсибілізуючих, протизапальних, судинних препаратів, гепатопротекторів, вітамінів; фізіотерапевтичного лікування; зовнішньої терапії. Пацієнтам з тяжкими формами Пс до схеми лікування додавалися цитостатики (метотрексат).
З урахуванням результатів досліджень усім пацієнтам основної групи було призначено додатково курс терапії препаратом армадін і сеанси БЗЗ. Серед існуючих препаратів антиоксидантної групи в сучасній медицині увагу приділяють препаратам з мультимодальною комплексною дією відносно оксидативного стресу, наприклад, похідному бурштинової кислоти – 2-етил-6-метил-3-гідроксипіридину сукцинату (армадіну). Даний препарат активує найважливішу ланку природної АОС організму – фермент СОД, нормалізує вміст ліпідних фракцій, зменшує індекс холестерин / фосфоліпіди в клітинних мембранах, знижує параметри мікров’язкості мембран, тобто має виключно широкий спектр дії як «мембранний стабілізатор».
Армадін в дозі 4 мл (200 мг) призначався внутрішньовенно краплинно 1 раз на день протягом 10 днів з подальшим пероральним прийомом у добовій дозі 500 мг (армадін-лонг), тривалість курсу становила 3 місяці.
В останні часи популярності набувають методи біологічного управління, в основі яких полягають принципи БЗЗ, спрямованого на розвиток та вдосконалення механізмів саморегуляції фізіологічних функцій при різних патологічних станах. Цей метод найбільш вдало застосовується при корекції психосоматичних порушень. Він сприяє розвитку порушених процесів самоперцепції, диференціації внутрішніх відчуттів та релаксації.
Тренінги БЗЗ проводили протягом 10 днів щоденно, тривалість одного сеансу становила 50 – 60 хвилин. У подальшому вдома пацієнти самостійно протягом 1 місяця проводили аналогічні сеанси міорелаксації, використовуючи набуті навички.
Слід зазначити, що у 33 з 45 хворих основної групи, які застосовували розроблену методику, клінічне покращення спостерігалося вже на першому тижні терапії, однак у 12 пацієнтів спостерігався торпідний перебіг дерматозу, що потребувало провести додатковий аналіз. При детальному вивченні всіх показників з’ясувалося, що в групу з резистентним до терапії станом входили пацієнти, які мали рівні серотоніну менші 130 нг/мл, порушення циркадного ритму АТ при добовому моніторуванні, високі рівні тривоги та депресії. У зв’язку з появою нових факторів впливу на перебіг дерматозу і ГХ, цим 12 пацієнтам було додатково призначено прийом препарата – антидепресанта есциталопрам у дозі 5 мг на добу протягом 2 місяців. Есциталопрам є селективним інгібітором зворотного захвату серотоніну з високою спорідненістю з первинною ділянкою зв’язування. Есциталопрам не має зовсім або має дуже слабку здатність зв’язуватися з рядом рецепторів, включаючи: серотонінові 5-HT1А, 5-HT2 рецептори, дофамінові D1- і D2-рецептори, α1-, α2-, β-адренергічні рецептори, гістамінові H1-, мускаринові холінергічні, бензодіазепінові та опіатні рецептори [89].
Протягом перших 5-7 днів пацієнти отримували ½ дози препарату, потім – усю добову дозу. На 16-20-й день прийому есциталопраму спостерігалося розвинення клінічного ефекту у вигляді нормалізації психоемоційного стану, покращення сну, протягом другого місяця відбувалося закріплення отриманого результату. На останньому тижні поступово зменшувалася доза есциталопраму до ½ і він відмінявся.
Аналіз динаміки показників PASI і оцінка ЯЖ свідчили про достовірний позитивний ефект додавання до традиційної схеми терапії Пс на тлі супутньої ГХ препарату армадін у поєднанні з БЗЗ-тренінгами, а також есциталопраму. Так, оцінка ступеня тяжкості псоріатичного ураження за шкалою PASI у процесі лікування запропонованою методикою виявила послідовне зниження кількості балів розглянутого індексу в усіх хворих. Середнє значення DLQI після запропонованої схеми лікування знизилося більшою мірою, ніж при традиційній терапії, з різницею на 6-8 балів, що вказує на більш виражений позитивний вплив на ЯЖ в основній групі пацієнтів. Ознаку достовірної ефективності терапії – зниження PASI на 75 % (PASI 75) було виявлено у 29 (64,4 %) хворих, у 13 пацієнтів (28,9 %) – зниження PASI на 50 % порівняно з початком терапії (PASI 50), у 3 пацієнтів (6,7 %) – менше зниження, що обумовлено наявністю артропатичної форми Пс, уже існуючим станом ураження суглобів. Частота досягнення PASI 75 була статистично значимо вищою в основній групі при зіставленні з групою порівняння (χ² = 9,87 при р<0,05).
Клінічна динаміка в групі з традиційною терапією була менш вираженою, більше того, у 7 випадках стан залишився без динаміки.
Слід зазначити, що покращився також перебіг ГХ на тлі запропонованої терапії. У 16 з 45 хворих основної групи (що становило 35,5 %), спостерігалося покращення стану серцево-судинної системи – рівні АТ поступово зменшувалися в середньому на 15-20 мм рт. ст., що потребувало консультації терапевта, кардіолога і призвело до зниження дози антигіпертензивних препаратів у 11 пацієнтів дослідженої групи (24,4 %).
Важливим результатом роботи стала зміна тривалості перебування пацієнтів у стаціонарі: зникнення ознак активності дерматозу, вихід у стійку ремісію наставали в середньому на (5,8 ± 0,91) дня раніше, що свідчило про статистично значуще (р<0,05) скорочення термінів терапії в основній групі хворих.
Ще один позитивний ефект від запропонованої схеми терапії полягає в тому, що значно зменшилася кількість рецидивів Пс в основній групі. Спостереження за пацієнтами, які отримували терапію в основній групі і групі порівняння, протягом 1 року довели, що: якщо в групі порівняння, які отримували традиційну терапію, відсоток хворих, у яких протягом року відзначалися рецидиви дерматозу, становив 80,00 % (24 хворих з 30), то при призначенні рекомендованої схеми – у 23 з 45 пацієнтів (51,1 %) спостерігалася стійка ремісія дерматозу і стабільний стан АТ (χ2 = 11,36, р = 0,001). Таким чином, запропонована схема терапії є водночас і методом профілактики рецидивів Пс, який перебігає на тлі ГХ.
У хворих на Пс із супутньою ГХ терапія армадіном, есциталопрамом і сеансами БЗЗ сприяла достовірному зниженню проявів інтенсифікації ВРО, зокрема нітрозуючого (достовірне зменшення нітротирозину) і оксидативного (позитивна динаміка ендотеліну-1 і метаболізму глутатіону) стресів, що у свою чергу, зменшувало вираженість апоптотичних і запальних процесів (регрес каспази-8 і TNF-α) як безпосередньо, так і опосередковано, через протизапальну дію на клітини ендотелію і макрофаги антикоагулянтної протеїнази, через EPCR з продукцією компонентів і структур екстрацелюлярного матриксу та порушенням мікроциркуляції, регулюючи таким чином ключові патогенетичні аспекти розвитку Пс. Зниження рівня показників VEGF-А і серотоніну на тлі цієї комбінованої терапії також обумовлювало статистично значимий позитивний клінічний і суб’єктивний ефект у вигляді регресу клінічних проявів дерматозу (індекс PASI), поліпшення ЯЖ, зниження рівня тривоги/депресії.
Статистично значуще зниження рівня каспази-8 на 42,86 % (р<0,01) після застосування в стандартній схемі лікування нових препаратів значно перевершувало рівень зниження каспази-8 у пацієнтів без призначення розробленої схеми терапії (7,69 %), що свідчило про зменшення її ролі, як проксимальної каспази, в загибелі клітин. Відзначено також достовірне (р<0,05) синхронне зниження рівня TNF-α в першій групі пацієнтів з використанням запропонованої терапії на 28,54 %, а в другій групі цей показник зменшився на 9,41 %, що підтверджує думку про більш активний перебіг запального процесу в шкірі при більшому значенні TNF-α без застосування в терапевтичній схемі антиоксидантів.
Після проведеного курсу лікування пацієнтів основної групи препаратами армадін, есциталопрам, сеансами БЗЗ відзначалося також достовірне зниження рівня VEGF-А на 26,04 % (р<0,05), а в групі з традиційною схемою лікування зниження рівня VEGF-А становило лише 8,11 %. Поліпшення показників VEGF‑А призводило до зниження гіперпроліферації клітин ендотелію, інвазії ендотеліальних клітин у судинний матрикс, обмежує утворення нових капілярних трубок, що в цілому, гальмує процес патологічного ангіогенезу при поєднаному перебігу Пс і ГХ.
На тлі лікування армадіном, есциталопрамом і БЗЗ у пацієнтів обох груп знижувалася і активність серотонінергічних систем, що проявлялося в достовірному (р<0,05) зменшенні рівня серотоніну в першій групі після лікування більш ніж на третину (36,31 %) і в другій групі на 6,23 %, що свідчить про значне підвищення ефективності стандартної терапії Пс в поєднанні з ГХ при включенні в схему нової методики.
Відзначено зниження після проведеного лікування рівня показника нітрозуючого стресу нітротирозину, так у групі із запропонованою методикою показник достовірно (р<0,05) зменшився на 30,49 %, а в другій на 15,80 %, що свідчило про гальмування процесів нітрозування і, як результат, зменшення загибелі клітин епідермісу і пошкодження судинного ендотелію, що в цілому призводить до стійкої ремісії захворювань.
У процесі комплексного лікування відмічено зниження рівня ендотеліну-1 достовірно (р<0,05) на 39,77 % у групі пацієнтів із терапією армадіном, есциталопрамом, БЗЗ, а без застосування розробленої методики зменшення ендотеліну-1 становило 9,88 %, що поступалося за ефективністю лікування показникам першої групи пацієнтів.
Лікування пацієнтів з використанням нових терапевтичних методів достовірно підвищувало показник EPCR на 24,96 % (р<0,01), а терапія без використання – на 0,71 %. Також нова терапія Пс та ГХ достовірно (р<0,05) на 23,51 % зменшила значення гомоцистеїну у пацієнтів з розробленою методикою, а без використання запропонованих препаратів – на 9,63 %, що також свідчило про зменшення активності ЕД, ризику ускладнень від серцево-судинних захворювань.
Після застосування в стандартній терапії Пс препаратів армадін, есциталопрам і БЗЗ було визначено достовірне підвищення рівня відновлених тіолів у першій групі пацієнтів на 27,65 % (р<0,05), а в другій групі спостерігалася лише тенденція до їх зростання на рівні 4,52 % (р>0,05). Рівень ГЛУо зменшився достовірно (р<0,05) після лікування в першій експериментальній групі на 33,01 %, а в другій групі на 11,76 %. Збільшення запасів відновлених тіолів в організмі свідчило про значні резерви АОС і позитивний вплив проведеного лікування.
Приріст співвідношення ГЛУв/ГЛУо в першій групі хворих після запропонованої терапії склав 90,61 % достовірно (р<0,05), а в другій групі відзначено менш значущу динаміку в зміні цього показника після стандартної терапії, яка становила 6,58 %, що підтверджує наші висновки про підвищення резерву АОС після використання армадіну і обмеження процесів оксидативного стресу в організмі.
В основній групі також достовірно збільшилися резерви СОД на 148,75 % (р<0,05), а в другій групі, з традиційною терапією, активність СОД після лікування зросла на 5,98 %. СОД, як поліфункціональна сполука каталізує реакцію дисмутації супероксид-радикала з утворенням перекису водню і кисню, забезпечуючи захист організму від біоокисників і стійкість клітини в умовах оксидативного стресу.
Отримані факти впливу армадіну, есциталопраму та сеансів БЗЗ на зазначені патофізіологічні предиктори і ланки патогенезу, які тою чи іншою мірою залучаються при формуванні та прогресуванні дерматозу, наявність обґрунтування цієї стратегії терапії розкривають нові можливості застосування антиоксидантів і потенційні шляхи реалізації їх позитивного ефекту при Пс, особливо в поєднанні з ГХ.
ВИСНОВКИ
У роботі запропоновано теоретичне обґрунтування та нове вирішення актуальної наукової і практичної проблеми сучасної дерматовенерології, що полягає в оптимізації лікування хворих на псоріаз у поєднанні з ГХ шляхом розробки диференційованої комплексної терапії на підставі вивчення клінічних проявів, імунних та ангіогенних механізмів, нейрогуморальних процесів та морфологічних змін шкіри.
1. Значна поширеність псоріазу в загальній популяції, хронічний, рецидивуючий перебіг, зниження працездатності аж до інвалідизації пацієнтів, порушення їх соціальної активності визначають важливе медико-соціальне значення проблеми і обумовлюють необхідність подальших досліджень стосовно механізмів розвитку, особливостей клінічного перебігу дерматозу, нових напрямків терапії. Значний вплив коморбідної патології, яка обтяжує перебіг псоріазу, сприяє формуванню тяжких, резистентних до терапії форм, потребує подальшого вивчення. Одним із найбільш розповсюджених коморбідних станів є ГХ, тому розробка напрямку дослідження особливостей формування, перебігу, терапії та профілактики рецидивів цієї поєднаної патології є актуальним завданням клінічної дерматології.
2. При дослідженні АТ у 460 хворих на псоріаз АГ встановлена у 37,2 % пацієнтів. Згідно з результатами динамічного спостереження за 98 хворими на псоріаз основної групи, які мали супутню ГХ, порівняно з 72 хворими лише на псоріаз і 47 – тільки на ГХ, виявлено, що у 59,2 % пацієнтів основної групи діагностовано тяжкі форми псоріазу, серед яких найбільш типовими були артропатичний (у 29,6 %) і вульгарний бляшковий з вираженими явищами ексудації (19,4 %), де індекс PASI >30 і показник DLQI>10. При цьому спостерігалися гендерні відмінності у формуванні клінічних форм дерматозу: артропатичний псоріаз склав 73,9 % усіх форм у жінок, у чоловіків вульгарний з явищами ексудації становив 51,4 %, а артропатичний – 34,3 % усіх форм.
3. У пацієнтів, які страждають на псоріаз у поєднанні з гіпертонічною хворобою, рівні маркерів запального процесу (TNF-α, IL-1β, IL-1α, IL-6) достовірно перевищують аналогічні показники груп порівняння. Найбільш показовим є рівень TNF-α, який достовірно перевищує аналогічний показник групи хворих на гіпертонічну хворобу в 6,33 разу і в 4,1 разу – показник пацієнтів, які страждають лише на псоріаз. Активність запального процесу зростає з тривалістю хвороби, залежно від наявності ознак метаболічного синдрому, ступеня АГ, але найбільш значущий вплив на вміст цитокінів має тяжкість і поширеність дерматозу.
4. Найвищий рівень маркера апоптозу каспази-8 встановлено у жінок з артропатичною формою псоріазу, що може слугувати прогностичним критерієм формування псоріатичної артропатії у пацієнтів з коморбідною патологією. Тісний достовірний взаємозв’язок (r=+0,587) встановлено між тяжкістю перебігу дерматозу і маркером неоваскулогенезу VEGF-A у хворих на псоріаз із супутньою ГХ і найбільш виражено представлено у пацієнтів з явищами ексудації вульгарного бляшкового псоріазу, прогностичним критерієм якого може слугувати.
5. Найвищі рівні маркерів розвитку ендотеліальної дисфункції ендотеліну-1, гомоцистеїну мають місце у пацієнтів з коморбідною патологією. Це додатково ускладнюється розвитком патологічної активності NO-синтаз, гіперпродукцією NO, маркером чого є підвищений рівень нітротирозину. Зазначені процеси відбуваються найбільш виражено у пацієнтів з тяжким перебігом дерматозу, при артропатії. У цих же хворих встановлено найбільші рівні порушень оксидативного стресу, недостатність системи антиоксидантного захисту, ендотеліопротекції.
6. При наявності у хворих на псоріаз супутньої ГХ формується перенапруженість і зрив нейрогуморальної системи адаптації, що проявляється зниженням кортизол-інсулінового індексу, порушенням вегетативної регуляції з переважанням тонусу симпатичної нервової системи і зниженням вагусного впливу, формуванням патологічного типу циркадного ритму АТ, залежністю перебігу дерматозу від обміну серотоніну, рівня тривоги і депресії. Шляхом зіставлення клінічного перебігу псоріазу на тлі супутньої ГХ і показників сироваткового серотоніну встановлено, що найбільш сприятливий його рівень знаходиться в інтервалі від 130 до 200 нг/мл, при зниженні або перевищенні якого формуються резистентні до терапії форми дерматозу, що потребує додаткової терапевтичної корекції виявленого стану.
7. Морфологічним субстратом ушкодження шкіри у хворих на Пс і Гх є комплекс локальних і системних порушень, а саме: перифокальна гіперплазія і дистрофія кератиноцитів з акантолізом і деструкцією епідермально-дермального з’єднання; гіперпроліферація клітин у складі стінки мікросудин з розвитком гіалінозу й еластофіброзу артеріол; дисеміноване порушення ангіоархітектоніки артеріол і гемокапілярів; дифузний фіброз сосочкового шару і фіброеластоз сітчастого шару дерми; виражена експресія індуцибельної форми NO-синтази кератиноцитами та клітинами дерми. Даний комплекс порушень зустрічається у всіх без виключення хворих на Пс у прогресуючій стадії на тлі ГХ і викликає каскад типових патоморфологічних змін, які за своєю інтенсивністю значно перевищують ушкодження шкіри у хворих на Пс без АГ.
8. На підставі порівняльного аналізу в обстежених хворих анамнестичних даних, клінічних проявів і перебігу псоріазу, ускладнюючих факторів, а також результатів проведених лабораторних (визначення рівня TNF-α, VEGF-А, каспази-8, ендотеліну, нітротирозину, серотоніну, кортизолу, інсуліну, гомоцистеїну, ендотеліального рецептора протеїну C, показників оксидативного стресу), функціональних (вивчення ВСР, ДМАТ) досліджень визначено різні рівні патологічних зрушень та їх неоднорідність. На підставі проведеного аналізу було сформовано три групи хворих з вірогідною різницею досліджуваних показників: групу порівняння склали хворі на Пс і ГХ, які отримували традиційну терапію; другу групу склали хворі на Пс із супутньою ГХ, які додатково до традиційної терапії отримували антиоксидант армадін і сеанси БЗЗ, а в третій групі, з рівнем сироваткового серотоніну менше 130 нг/мл, ще й додатково отримували препарат есциталопрам.
9. Призначення хворим на Пс із супутньою ГХ комплексного лікування із застосуванням на тлі традиційної терапії антиоксиданту, інгібітора зворотного захвату серотоніну та сеансів БЗЗ дозволяє підвищити ефективність лікування, що підтверджено більш швидким регресом клінічним проявів дерматозу (PASI 75 встановлено у 64,4 % хворих, PASI 50 – у 28,9 % пацієнтів). Важливим результатом стала зміна тривалості перебування пацієнтів у стаціонарі: зникнення ознак активності дерматозу, вихід у стійку ремісію наставали в середньому на (5,8 ± 0,9) дня раніше, що свідчить про статистично значуще достовірне скорочення термінів терапії в групі хворих із запропонованою методикою. При призначенні рекомендованої схеми терапії у 51,1 % пацієнтів спостерігалася стійка, протягом року, ремісія дерматозу і стабільний стан АТ (χ2 = 11,36, р = 0,001). Комбінована терапія сприяла більшому, порівняно з традиційною терапією, зниженню маркерів імунного запалення, дисфункції ендотелію, нормалізації клітинних взаємин і мікросудинних процесів, а також поліпшенню емоційного, психічного стану, якості життя пацієнтів.
РЕКОМЕНДАЦІЇ
1. При наявності супутньої АГ у хворих на Пс доцільним є використання методики ДМАТ і дослідження ВСР для визначення несприятливих типів гемодинаміки, прогнозування розвитку тяжких форм дерматозу.
2. Для прогнозування розвитку артропатичного Пс можливе використання показника каспази-8, рівень якого більший за 0,22 нг/мл є маркером формування саме цієї форми дерматозу.
3. Критерієм ступеня ураження шкіри може виступати VEGF-А, рівень якого більший за 700 пг/мл достовірно свідчить про тяжкість, поширеність ураження шкіри з розвитком ексудативних форм Пс.
4. Доцільно використовувати співвідношення ГЛУв/ГЛУо в якості прогнозу, його показник нижчий за 6,0 у.о. є маркером розвитку тяжких форм Пс.
5. Для визначення рівня тривоги і депресії рекомендовано використання госпітальної шкали тривоги і депресії. Визначено необхідність співставлення рівня тривоги і депресії з показниками сироваткового серотоніну. При рівні серотоніну меншому, ніж 130 нг/мл і високому рівні тривоги/депресії слід використовувати селективний інгібітор зворотного захвату серотоніну есциталопрам. При рівні серотоніну більшому за 200 нг/мл поряд із седативною терапією слід використовувати методи біоадаптивного управління.
6. У зв’язку з виявленим дефіцитом системи антиоксидантного захисту, для лікування хворих на Пс із супутньою АГ доцільно застосовувати антиоксидант армадін у дозі 4 мл (200 мг) внутрішньовенно крапельно 1 раз на день протягом 10 днів з подальшим пероральним прийомом у добовій дозі 500 мг (армадін-лонг), тривалість курсу – 3 місяці.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Автандилов Г. Г. Медицинская морфометрия : руководство. Москва : Медицина, 1990. 384 с.
- Автандилов Г. Г., Яблучанский Н. И., Губенко В. Г. Системная стереометрия в изучении патологического процесса. Москва : Медицина, 1981. 192 с.
- Аметов А. С., Соловьева О. Л. Сердечно-сосудистые осложнения при сахарном диабете: патогенез и пути коррекции. Рус. мед. журн. 2011. № 27. С. 1694–1700.
- Аналіз показників експресії, імуногістохімічних маркерів проліферації, васкуляризації, базальноклітинної гіперплазії, сгромальної деградації, cd3+ і cd68+ мононуклеарної інфільтрації та клітин Лангерганса в залежності від форми та важкості перебігу псоріазу / І. Я. Возняк та ін. Морфологія. 2013. Т. 7, № 3. С. 117-126.
- Андреева А. А., Школьник В. В., Ярмыш Н. В. Взаимосвязь ремоделирования сосудов и маркеров иммунного воспаления у пациентов с гипертонической болезнью на фоне абдоминального ожирения. Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация. 2014. T. 25, № 4. C. 35-39.
- Беловол А. Н. Дисфункция сосудистого эндотелия у больных псоріазом. Укр. журн. дерматології, венерології, косметології. 2010. № 1 (36). С. 17-21.
- Беловол А. Н., Ткаченко С. Г. Изучение коморбидности псориаза и кардиометаболических нарушений. Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я : зб. наук. пр. Харків. 2014. Вип. 11. С. 35–42.
- Берегова А. А., Біловол А. М. Оцінка обміну катехоламінів у динаміці прогресування псоріазу. Вісн. проблем біології і медицини. 2015. Вип. 2 Т. №1. С. 103-107.
- Береговая А. А., Беловол А. Н., Стеценко С. А. Оценка состояния адаптивно-репаративных реакций по содержанию компонентов углеводсодержащих белков в сыворотке крови больных псориазом различной степени тяжести. Журн. Гродн. гос. медицинского ун-та. 2015. № 4. С. 44-47.
- Біловол А. М. Патогенез і терапія псоріазу з різним ступенем тяжкості ендогенної інтоксикації та артеріальної гіпертензії : дис. … докт. мед. наук. : 14.01.20 / Нац. мед. ун-т ім. О.О. Богомольця. Київ, 2011. 226 с.
- Болотная Л. А. Псориаз: патогенез, клинические проявления, принципы терапии. Східноєвроп. журн. внутрішньої та сімейної медицини. 2015. № 1. С.4-9.
- Болотная Л. А., Сариан Е. И., Лопандина А. А. Патогенетическое значение сосудистого эндотелиального фактора роста при псориазе. ScienceRise. 2016. Т. 2, № 3. С. 4-8.
- Буреш Я., Бурешова О., Хьюстон Д. Методики и основные эксперименты по изучению мозга и поведения. Москва : Высшая школа, 1991. 527 с.
- Бутов Ю. С., Васенова В. Ю., Шмакова A. C. Клинико-биохимический статус у больных псориазом и методы его коррекции. Рос. журн. кожных и венерических болезней. 2009. № 5. С. 23-27.
- Варіабельність серцевого ритму і її зв’язок з морфофункціональним станом правого шлуночка у хворих на хронічне легеневе серце внаслідок хронічного обструктивного захворювання легень / К. М. Амосова та ін. Укр. пульмонол. журн. 2009. № 3, С. 33-36.
- Возняк І. Я., Сизон О. О. Особливості змін цитокінових та імуноморфологічних показників у хворих на псоріаз. Журн. дерматовенерології та косметології ім. М. О.Торсуєва. 2016. № 1-2. С. 38-48.
- Гаврилюк А. А. Современные аспекты патогенеза и терапии псориаза (обзор литературы). Актуальні проблеми сучасної медицини : вісн. Укр. мед. стомат. акад. 2015. Т. 15, Вип. 3, Ч. 2. С. 300-306.
- Гельсінська декларація Всесвітньої медичної асоціації “Етичні принципи медичних досліджень за участю людини у якості об’єкта дослідження” / Всесвітня медична асоціація. Редакція від 01.10.2008.
- Донцова Е. В. Состояние системы перекисного окисления липидов и антиоксидантной защиты крови у больных псориазом и метаболическим синдромом. Научные ведомости Белгородского государственного университета. Серия : Медицина. Фармация. 2013. № 11. С. 95–98.
- Дюдюн А.Д., Макуріна Г. І., Полион Н.Н., Колева Н.Н., Али Лоай. Эффективность применения растительного комбинированного препарата ЛИВ.52 и Серезиса в комплексном лечении больных псориазом. Дерматологія. Косметологія. Сексопатологія. 2012. № 1-4. С. 291-296.
- Зенков Н. К., Ланкин В. З., Меньщикова Е. Б. Окислительный стресс: Биохимические и патфизиологические аспекты. Москва : МАИК «Наука/ Интерпериодика», 2001. 343 с.
- Исследование антиоксидантных свойств лекарственных препаратов : метод. пособие / под ред. Н. В. Юргеля, К. Н. Новикова. Москва, 2009. 68 с.
- Калюжна Л. Д., Повханич-Грицяк Т. М. Асоціація поліморфізму гена TNF-α з цитокіновим статусом та деякими клінічними особливостями у хворих на псоріаз. Зб. наук. праць співробіт. НМАПО ім. П. Л. Шупика. 2015. № 24 (2). С. 400-405.
- Кірієнко В. О., Макуріна Г. І., Якименко Є. С. Порушення фізіологічних маркерів психоемоційного напруження та їх корекція з використанням температурно-міографічного тренінгу в комплексній терапії псоріатичної хвороби у хворих з надмірною масою тіла та артеріальною гіпертензією. Укр. журн. дерматології, венерології, косметології. 2015. № 1. С. 24-32.
- Клініко-патогенетична роль епідермального фактора росту при псоріазі / Я. Ф. Кутасевич та ін. Укр. журн. дерматології, венерології, косметології. 2016, № 2. С. 27-30.
- Клінічні рекомендації з артеріальної гіпертензії європейського товариства гіпертензії (ESH) та європейського товариства кардіологів (ESC) / G. Mancia et al. 2013.
- Кондакова А. К., Олейник И. А., Гаврилюк А. А. Содержание метаболитов оксида азота и некоторых показателей свёртывающей системы крови у больных псоріазом. Дерматологія та венерологія. 2016. № 1. С. 23-33.
- Криницына Ю. М., Сергеева И. Г., Якубович А. И. Возрастные особенности патоморфологических изменений в коже при псориазе. Бюл. Вестн. СО РАМН. 2005. № 7. C. 12-16.
- Кутасевич Я. Ф., Олейник И. А., Гаврилюк А. А. Показатели метаболитов оксида азота у больных тяжелыми формами псориаза. Дерматологія та венерологія. 2014. № 3. С. 80-81.
- Куц Л. В. Современные аспекты патогенеза псориаза. Запорож. мед. журн. 2011. Т. 13, № 5. С. 29-32.
- Лакин Г. Ф. Биометрия. учебное пособие. 4-е изд., перераб. и доп. Москва : Высшая школа, 1990. 352 с.
- Макарчук А. О. Новий терапевтичний підхід до корекції інволютивних дефектів шкіри обличчя, ускладненої маласезійною інфекцією. Дерматологія та венерологія. 2015. № 1. C. 63-68.
- Макарчук О. І., Макарчук А. О. Структурно-функціональна характеристика шкіри у різних вікових категорій жінок із супутньою патологією. Morphologia. 2015. Т. 5, № 3. С. 54-58.
- Макурина Г. И. Ангиогенез как патогенетический фактор прогрессирования заболевания в условиях хронического дерматоза. Медична наука та практика ХХІ століття : зб. тез міжнар. наук.-практ. конф. (Київ, 3-4 лютого 2017 р.). Київ : «Київський медичний науковий центр», 2017. С. 39-42.
- Макурина Г. И. Апоптоз-опосредованные механизмы и цитокиновый баланс у больных псориазом на фоне артериальной гипертензии. Сучасні медичні технології. 2016. № 1 (28). С. 24-28.
- Макурина Г. И. Гомеостатический баланс гликемии как патогенетический аспект формирования хронического дерматоза на фоне артериальной гипертензии. Перспективні напрями розвитку сучасних медичних та фармацевтичних наук : зб. матеріалів міжнар. наук.-практ. конф. (Дніпро, 10-11 лютого 2017 р.). Дніпро : Організація наукових медичних досліджень «Salutem», 2017. С. 54-57.
- Макурина Г. И. Динамика сывороточных значений кортизола и инсулина как регуляторов вуглеводного обмела у больных псориазом в сочетании с гипертонической болезнью на этапах долговременной адаптации. Південноукр. мед. наук. журн. 2017. № 16. С. 62-63.
- Макурина Г. И. Изучение механизмов активации васкулярного эндотелия у больных псориазом и артериальной гипертензией. Запорож. мед. журн. 2016. № 1 (94). С. 19-24.
- Макурина Г. И. Клинико-лабораторные параллели тяжести псориаза и состояния апоптоза у пациентов с сопутствующей артериальной гипертензией. Актуальні питання теоретичної і практичної медицини : матеріали IV Міжнар. наук.-практ. конф. студентів і молодих учених (21-22.04.16). Сумы, 2016. С. 127.
- Макурина Г. И. Клинико-эпидемиологические особенности течения псориаза на фоне артериальной гипертензии у мужчин. Чоловіче здоров’я, гендерна та психосоматична медицина. 2016. № 1 (03). С. 116-121.
- Макурина Г. И. Клиническое значение нарушения обмена серотонина у пациентов с псориатической болезнью. Дерматологія та венерологія. 2016. № 1 (71). С. 34-41.
- Макурина Г. И. Маркеры нитротирозирующего стресса при псориазе и коморбидной артериальной гипертензии. Сборник материалов конференции, посвященной 100-летию академика В. Ю. Ахундова. Баку, 2016. С. 265-266.
- Макурина Г. И. Морфофункціональний стан шкіри у хворих на псоріаз із супутньою гіпертонічною хворобою. Актуальні питання косметології та дерматології : зб. матеріалів Х Всеукр. наук.-практ. конф. з міжнар. участю, 28-29 квітня 2016 р. Запоріжжя, 2016. С. 5-6.
- Макурина Г. И. Нитрозирующий стресс при псориатической болезни в сочетании с єссенциальной гипертензией. Вісн. проблем біології і медицини. 2015. Вип. 3. Т. 2 (123). С. 159-165.
- Макурина Г. И. Новые аспекты механизмов формирования псориаза при сопутствующей артериальной гипертензии. Актуальні проблеми сучасної медицини. 2016. Т. 16. Вип. 2 (54). С. 134-141.
- Макурина Г. И. Особенности развития псориатической болезни у пациентов с сопутствующей артериальной гипертензией. Клинические лекции по дерматовенерологии и косметологии / под ред. В. П. Федотова, А. И. Макарчука. Т. 3. Запорожье – Днепропетровск : Просвіта, 2014. С. 384-397.
- Макурина Г. И. Особенности суточного ритма артериального давления у больных псориазом с сопутствующей артериальной гипертензией. Актуальні питання клінічної медицини : матеріали ІХ Всеукр. наук.-практ. конф. молодих вчених (30 жовтня 2015 року). Запоріжжя, 2015. С. 69-70.
- Макурина Г. И. Особенности течения псориаза на фоне гипертонической болезни у мужчин. Дерматологія. Косметологія. Сексопатологія. 2016. № 1-4. С. 30-34.
- Макурина Г. И. Особенности формирования псориаза при коморбидной патологии. Сучасні наукові дослідження представників медичної науки – прогрес медицини майбутнього : зб. тез наук. робіт учасників міжнар. наук.-практ. конф. (1-2 квітня 2016 р.). Київ, 2016. С.49-51.
- Макурина Г. И. Патогенетические эффекты плазменных тиолов у больных псориазом на фоне артериальной гипертензии. Актуальні питання фармац.і мед. науки та практики. 2016. № 3 (22). С. 67-74.
- Макурина Г. И. Состояние эндотелиальной дисфункции у пациентов, страдающих псоріазом в сочетании с артериальной гипертензией. Дерматовенерология и эстетическая медицина. (Ташкент). 2015. № 3 (27). С. 144.
- Макурина Г. И., Федотов В. П., Визир В. А. Цитокиновый профиль больных псориазом с сопутствующей артериальной гипертензией. Актуальні питання косметології та дерматології : зб. тез ІХ Всеукр. наук.-практ. конф. з міжнар. участю (23-24 квітня 2015 р. м. Запоріжжя). Запоріжжя, 2015. – С. 14.
- Макуріна Г. І. Апоптозні аспекти порушення метаболізму цитокінів при псоріазі та гіпертонічній хворобі. Весняні наукові читання : матеріали ІІ міжнар. наук.-практ. конф., 28 квітня 2016 р. Київ : «Велес», 2016. Ч. 2. С. 121-123.
- Макуріна Г. І. Динаміка рівня фактору некрозу пухлин альфа при псоріазі в умовах гіпертонічної хвороби. Актуальні питання розвитку медичних наук у ХХІ ст. : зб. тез наук. робіт учасників міжнар. наук.-практ. конф., 27-28 травня 2016 р. Львів, 2016. С. 39-42.
- Макуріна Г. І. Ефективність комплексної терапії хворих на псоріаз. Актуальні питання наукової та практичної косметології 2017 : матеріали Всеукр. наук.-практ. конф. з міжнар. участю (27-28 квітня 2017 року, м. Запоріжжя). Запоріжжя, 2017. С. 21-22.
- Макуріна Г. І. Клініко-морфологічні паралелі у хворих на псоріаз із супутньою артеріальною гіпертензією. Укр. журн. дерматології, венерології, косметології. 2016. № 3 (62). С. 18-26.
- Макуріна Г. І. Морфологічні особливості мікроциркуляторного русла шкіри у хворих на псоріаз і гіпертонічну хворобу. Морфологія. 2016. Т. 10. № 1. С. 38-48.
- Макуріна Г. І. Особливості вегетативної регуляції у хворих на псоріаз у поєднанні з артеріальною гіпертензією. Дерматологія. Косметологія. Сексопатологія. 2015. № 3-4. С. 40-45.
- Макуріна Г. І. Оцінка впливу коморбідних станів у хворих на псоріаз. Дерматовенерологія. Косметологія. Сексопатологія. 2015. № 3-4. С. 120-121.
- Макуріна Г. І. Патоморфогенез сполучнотканинного компоненту шкіри хворих на псоріаз і гіпертонічну хворобу. Вісн. проблем біології і медицини. 2016. Вип. 2. Т. 2 (129). С. 191-194.
- Макуріна Г. І. Порівняльна характеристика перебігу псоріазу у чоловіків та жінок на тлі гіпертонічної хвороби. Особливості модернізації предмету досліджень представників медичних наук: зб. тез наук. робіт учасників між нар. наук.-практ. конф., 3-4 червня 2016 р. Київ, 2016. С. 68-70.
- Макуріна Г. І. Стан васкулярного ендотелію у хворих на ексудативний псоріаз. Медицина XXI століття: перспективні та пріоритетні напрями наукових досліджень: зб. матеріалів міжнар. наук.-практ. конф., Дніпро, 22–23 липня 2016. Дніпро : Організація наукових медичних досліджень «Salutem», 2016. С. 42-46.
- Макуріна Г. І. Стан ендотеліальної дисфункції у хворих на псоріаз із супутньою артеріальною гіпертензією. Медична наука та практика в умовах сучасних трансформаційних процесів : зб. тез наук. робіт учасників міжнар. наук.-практ. конф., 22-23 квітня 2016 р. Львів. 2016. Ч. 2. С. 21-23.
- Макуріна Г. І. Стан епідермісу та епідермально-дермального з’єднання шкіри хворих на псоріаз і гіпертонічну хворобу. Патологія. 2016. № 1 (36). С. 73-78.
- Макуріна Г. І. Стан метаболізму нейромедіатора серотоніна при формуванні артеріальної гіпертензії на тлі псоріазу. Актуальні проблеми клінічної, теоретичної, профілактичної медицини, стоматології та фармації : зб. матеріалів міжнар. наук.-практ. конф., Одеса, 8–9 квітня 2016 р. Одеса : ОМІ, 2016. С. 50-53.
- Макуріна Г. І., Баударбекова М. М. Особливості активності iNOS у вогнищах ураженої шкіри хворих на псоріаз із супутньою артеріальною гіпертензією. Патологія. 2016. № 2 (37). С. 40-46.
- Макуріна Г. І., Федотов В. П., Візір В. А. Гендерні особливості епідеміології та клініки псоріазу з супутньою артеріальною гіпертензією. Запорож. мед. журн. 2015. № 5. С. 28-32.
- Морфология человека : учеб. пособие. 2-е изд., перераб. доп. / под ред. Б. А. Никитюка, В. П. Чтецова. Москва : Изд-во МГУ, 1990. С. 17.
- Нейропротекция и нейропластичность : монография / И. Ф. Беленичев и др. Киев : Логос, 2015. 512 с.
- О роли активации свободнорадикального окисления в структурной и функциональной дезорганизации биосистем в условиях патологии / Н. П. Чеснокова и др. Успехи совр. естествознания. 2008. Т. 128, № 3.1. С. 25-34.
- Овчаренко Л. К., Циганенко И. В. Переваги застосування армадину у складі комплексної терапії ішемічної хвороби серця, зокрема стабільної стенокардії напруги та дисциркуляторної енцефалопатії. Мир медицины и биологии. 2016. № 2. С. 65-69.
- Олейник И. А. Гаврилюк А. А. Динамика содержания стабильного метаболита оксида азота и некоторых показателей свёртывающей системы крови у больных тяжёлыми формами псориаза в процессе комплексной терапии. Експерим. і клініч. медицина. 2016. № 1. С. 104-109.
- Осипова А. А. Введение в теорию психокоррекции. Москва : МПСИ; Воронеж, МОДЭК, 2000. 320 с.
- Особенности нарушений в системе цитокинов у больных псориазом / И. А. Олейник и др. Дерматологія та венерологія. 2015. № 4. С. 58-66.
- Пат. № 114594 Україна. Спосіб лікування псоріазу із супутньою артеріальною гіпертензією / Г. І. Макуріна, В. А. Візір. № u201610029 ; заяв. 03.10.2016 ; опубл. 10.03.2017, бюл. № 5.
- Пат. № 17279 Україна. Спосіб визначення вмісту 8-гідроксигуаніну в сечі як маркеру пошкодження нуклеїнових кислот / Ю. М. Колесник, І. Ф. Бєленічев, А. В. Абрамов, О. В. Н. В. Ганчева, Бухтіярова, С. В. Павлов. №u200603501 ; заявл. 31.03.2006 ; опубл. 15.09.2006, бюл. № 9.
- Пат. № 98942 Україна. Спосіб лікування хворих на псоріаз із супутньою артеріальною гіпертензією / Г. І. Макуріна, В. А. Візір, Є. С. Якименко. № u201413203 ; заяв. 09.12.2014 ; опубл. 12.05.2015, бюл. № 9.
- Патогенетичні аспекти превентивної корекції патологічної втоми в ранньому відновному періоді ішемічного інсульту у хворих з метаболічним синдромом / Т. І. Насонова та ін. Междунар. неврол. журн. 2016. № 1. С. 54-59.
- Полякова A. B., Теличко И. Н., Грашин P. A. Про- и антиоксидантные процессы у больных вульгарным псориазом и их роль в оценке тяжести и характера течения болезни. 2-й конгресс Евро-Азиатской Ассоциации дерматовенерологов : тезисы конференции. Москва, 2012. С. 138.
- Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання: Наказ МОЗ України від 08.05.2009 № 312.
- Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія»: Наказ МОЗ України від 03.07.2006 № 436.
- Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при псоріазі, включаючи псоріатичні артропатії : Наказ МОЗ України від 20.11.2015 № 762.
- Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при артеріальній гіпертензії: Наказ МОЗ України від 24.05.2012 № 384.
- Ромейс Б. Микроскопическая техника : [пер. с нем.]. Москва : Издательство иностр. литературы, 1953. 718 с.
- Саркисов Д. С., Перов Ю. Л. Микроскопическая техника : (руководство для врачей и лаборантов). Москва : Медицина, 1996. 544 с.
- Сизон О. О., Степаненко В. І. Артропатичний псоріаз: обгрунтування раціональних методів лікування та профілактики. Укр. журн. дерматології, венерології, косметології. 2011. № 1. С. 40-44.
- Сіренко Ю. М. Гіпертонічна хвороба і артеріальні гіпертензії. Донецьк : Видавець Заславський О. Ю., 2011. 304 с.
- Снедекор Дж. У. Статистические методы в применении к исследованиям в сельском хозяйстве и биологии. Москва : Сельхозгиз, 1961. 502 с.
- Справочник Видаль. Лекарственные препараты в России : справочник. Москва, 2011. 1728 с. 6.
- Степаненко Р. Л., Гичка С. Г. До питання морфогенезу шкірних елементів висипу при псоріазі. Укр. журн. дерматології, венерології, косметології. 2014. № 3. С. 19-23.
- Твердохліб І. В., Макарчук О. І. Морфологічна характеристика шкіри вискової області у пацієнтів із супутньою патологією у віковому аспекті. Morphologia. 2015. Т. 9, № 3. С. 83-88.
- Твердохліб І. В., Перцева Н. О., Турлюн Т. С. Динаміка морфологічних змін гранул тромбоцитів у хворих на артеріальну гіпертензію з високим кардіоваскулярним ризиком при застосуванні лозартану калію. Morphologia. 2014. Т. 8, № 2. С. 61-66.
- Фактор некроза опухоли, интерлейкины и липидный обмен при разных стадиях течения псориаза / Э. Н. Солошенко и др. Клінічна імунологія. Алергологія. Інфектологія. 2012. № 1-2. С. 62-64.
- Федотов В. П., Визир В. А., Макурина Г. И. Взаимосвязь между степенью тяжести псориаза и уровнем ФНО-α у больных псориазом в сочетании с гипертонической болезнью. Запорож. мед. журн. 2015. №3(90). С. 43-47.
- Федотов В. П., Визир В. А., Макурина Г. И. Особенности иммунорегуляторных процессов у больных псориазом в сочетании с гипертонической болезнью. Укр. журн. дерматології, венерології, косметології. 2015. №3 (58). С. 18-22.
- Федотов В. П., Візір В. А., Макуріна Г. І. Особливості клінічних проявів та перебігу псоріазу у хворих з супутньою артеріальною гіпертензією. Дерматологія. Косметологія. Сексопатологія. 2014. № 1-4. С. 47-50.
- Федотов В. П., Візір В. А., Макуріна Г. І. Оцінка ефективності нових методів психокорекції в комплексній терапії хворих на псоріаз з супутньою артеріальною гіпертензією. Молоді науковці – майбутнє української дерматовенерології : зб. робіт за матеріалами наук.-практ. школи (20-21 листопада 2014 року. м. Київ). Київ, 2014. С. 71-73.
- Цераидис Г. С. К этиологии и патогенезу псориаза. Дерматол., венерол. 2008. № 4. С. 8–16.
- Шилов В. И., Сержено В. И. Окислительный стресс кератиноцитов – этиопатогенетический фактор псориаза. Бюл. эксперим. биологии и медицины. 2000. Т. 129, № 4. С. 364-369.
100. Яшин А., Яшин Я. Высокоэффективная жидкостная хроматография маркеров окислительного стресса. Аналитика. Методология. 2011. № 1. С. 34–43.
101. A Comprehensive Study of Tumor Necrosis Factor-Alpha Genetic Polymorphisms, its Expression in Skin and Relation to Histopathological Features in Psoriasis / N. N. Moorchung et al. Indian J. Dermatol. 2015. Vol. 60, N 4. P. 345-350.
102. A global phase III randomized controlled trial of etanercept in psoriasis: Safety, efficacy, and effect of dose reduction / K. A. Papp et al. Br. J. Dermatol. 2005. Vol. 152, N 6. P. 1304–1312.
103. A mechanism for the initiation of allergen-induced T helper type 2 responses / C. L. Sokol et al. Nature Immunology. 2008. Vol. 9, N 3. P. 310–318.
104. A novel form of immune signaling revealed by transmission of the inflammatory mediator serotonin between dendritic cells and T cells / P. J. O’Connell et al. Blood. 2006; Vol. 107, N 3. P. 1010–1017.
105. A novel targeted T-cell modulator, efalizumab, for plaque psoriasis / M. Lebwohl et al. N. Engl. J. Med. 2003. Vol. 349, N 21. P. 2004–2013.
106. A randomized, double-blind, placebo-controlled phase III study evaluating efficacy and tolerability of 2 courses of alefacept in patients with chronic plaque psoriasis / G. G. Krueger et al. J. Am. Acad. Dermatol. 2002. Vol. 47. P. 821–833.
107. Accumulating evidence for the association and shared pathogenic mechanisms between psoriasis and cardiovascular-related comorbidities / J. Shlyankevich et al. Am. J. Med. 2014. Vol. 127, N 12. P. 1148-1153.
108. Activated protein C alters cytosolic calcium flux in human brain endothelium via binding to endothelial protein C receptor and activation of protease activated receptor-1 / E. Dömötör et al. Blood. 2003. Vol. 101, N 12. P. 4797-4801.
109. Activated protein C enhances human keratinocyte barrier integrity via sequential activation of epidermal growth factor receptor and Tie2 / M. Xue et al. J. Biol. Chem. 2011. Vol. 286. P. 6742–6750.
110. Activated protein C protects against diabetic nephropathy by inhibiting endothelial and podocyte apoptosis / B. Isermann et al. Nat. Med. 2007. Vol. 13. P. 1349–1358.
111. Activated protein C rescues the retina from ischemia-induced cell death / Z. J. Du et al. Invest Ophthalmol Vis Sci. 2011. Vol. 52. P. 987–993.
112. Activated protein C stimulates proliferation, migration and wound closure, inhibits apoptosis and upregulates MMP-2 activity in cultured human keratinocytes / M. Xue et al. Exp Cell Res. 2004. Vol. 299. P. 119–127.
113. Activated protein C to heal pressure ulcers / A. Wijewardena et al. Int. Wound. J. 2014. Vol. 13, N 5. P. 986-991.
114. Adipokines, psoriasis, systemic inflammation, and endothelial dysfunction / M. Lynch et al. Int J Dermatol. 2017. Vol. 56, N 11. P. 1103-1118. doi: 10.1111/ijd.13699.
115. Alteration of serotonin transporter messenger RNA level in the peripheral blood mononuclear cells from simian/human immunodeficiency virus infected Chinese rhesus macaques (Macaca mulatta) / K. Yu et al. Brain, Behavior, and Immunity. 2010. Vol. 24, N 2. P. 298–305.
116. Ambulatory blood pressure monitoring can unmask hypertension in patients with psoriasis vulgaris / Ahmet Bacaksiz et al. Med Sci Monit. 2013. Vol. 19. P. 501–509.
117. Ambulatory blood pressure normality: results from the PAMELA study / G. Mancia et al. J. Hypertens. 1995 Vol. 13. P. 1377–1390.
118. Amentoflavone protects against psoriasis-like skin lesion through suppression of NF-κB-mediated inflammation and keratinocyte proliferation / J. An et al. J. Mol Cell Biochem. 2016. Vol. 413, N 1-2. P. 87-95.
119. An international, randomized, double-blind, placebo-controlled phase 3 trial of intramuscular alefacept in patients with chronic plaque psoriasis / M. Lebwohl et al. Arch. Dermatol. 2003. Vol. 139, N 6. P. 719–727.
120. Angiogenesis and oxidative stress: common mechanisms linking psoriasis with atherosclerosis / A. W. Armstrong et al. J. Dermatol Sci. 2011. Vol. 63, N 1. P. 1–9.
121. Angiogenic activity in patients with psoriasis is significantly decreased by Goeckerman’s therapy / C. Andrys et al. Arch Dermatol Res. 2007 Vol. 298, N 10. P. 479–483.
122. Antidrug antibodies (ADAb) to tumour necrosis factor (TNF)-specific neutralising agents in chronic inflammatory diseases: A real issue, a clinical perspective / F. B. Vincent et al. Ann Rheum Dis. 2013. Vol. 72, N 2. P. 165–178.
123. Anti-Inflammatory Effects of Chloranthalactone B in LPS-Stimulated RAW264.7 Cells / X. Li et al. Int J Mol Sci. 2016. Vol. 17, N 11. pii: E1938.
124. Anti-interleukin-17 monoclonal antibody ixekizumab in chronic plaque psoriasis / C. Leonardi et al. N. Engl. J. Med. 2012. Vol. 366, N 13. P. 1190–1199.
125. Antioxidant status in patients with psoriasis / H. Nemati et al. Cell Biochem. Funct. 2014. Vol. 32, N 3. Р. 268-273.
126. Antiproliferative and Pro-Apoptotic Effect of Novel Nitro-Substituted Hydroxynaphthanilides on Human Cancer Cell Lines / T. Kauerova et al. Int J Mol Sci. 2016. Vol. 17, N 8. pii: E1219. doi: 10.3390/ijms17081219.
127. Arbiser J. L. Fumarate esters as angiogenesis inhibitors: key to action in psoriasis? J. Invest Dermatol. 2011 Vol. 131, N 6. P. 1189–1191.
128. Arsenic trioxide, arsenic pentoxide, and arsenic iodide inhibit human keratinocyte proliferation through the induction of apoptosis / W. P. Tse et al. J. Pharmacol. Exp. Ther. 2008. Vol. 326. P. 388-394.
129. Association between psoriasis and the metabolic syndrome. A cross-sectional study / A. D. Cohen et al. Dermatology. 2008. Vol. 216, N 2. Р. 152-155.
130. Association between the cytotoxic T-lymphocyte antigen-4 mutations and the susceptibility to systemic lupus erythematosus; Contribution markers of inflammation and oxidative stress / M. Tanhapour et al. Cell Mol Biol (Noisy-le-grand). 2016. Vol. 62, N 12. P. 56-61.
131. Atherogenesis and metabolic dysregulation in LDL receptor-knockout rats / S. D. Sithu et al. JCI Insight. 2017. Vol. 2, N 9. pii: 86442.
132. Aurangabadkar S.J. Comorbidities in psoriasis. Indian J. Dermatol Venereol Leprol. 2013. Vol. 79 (7). Р. 10-17.
133. Autoimmunity in the pathogenesis of hypertension / B. Rodriguez-Iturbe et al. Nat Rev Nephrol. 2014. Vol. 10. P. 56–62.
134. Baliwag J., Barnes D. H., Johnston A. Cytokines in psoriasis. Cytokine. 2015. Vol. 73, N 2. P. 342-350.
135. Bardin L. The complex role of serotonin and 5-HT receptors in chronic pain. Behavioural Pharmacology. 2011. Vol. 22, N 5-6. P. 390–404.
136. Barton M., Baretella O., Meyer M. R. Obesity and risk of vascular disease: importance of endothelium-dependent vasoconstriction. Br. J. Pharmacol. 2012. Vol. 165, N 3. P. 591–602.
137. Basavaraj K H., Navya M. A., Rashmi R. Stress and quality of life in psoriasis: an update. Int. J. Dermatol. 2011. Vol. 50. P. 783–792.
138. Basophils are the major producers of IL-4 during primary helminth infection / N. van Panhuys et al. The Journal of Immunology. 2011. Vol. 186, N 5. P. 2719–2728.
139. Belge K., Brück J., Ghoreschi K. Advances in treating psoriasis. F1000Prime Rep. 2014. Vol. 6. P. 4.
140. Biologic therapies in the treatment of psoriasis: A comprehensive evidence-based basic science and clinical review and a practical guide to tuberculosis monitoring / R. K. Sivamani et al. Clin. Rev. Allergy Immunol. 2013. Vol. 44, N 2. P. 121–140.
141. Biologics in the treatment of psoriasis: Clinical and economic overview / Y. Poulin et al. J. Cutan. Med. Surg. 2009. Vol. 13, Suppl 2. P. S49–S57.
142. Blood pressure and inflammation in apparently healthy men / C. U. Chae et al. Hypertension. 2001. Vol. 38. P. 399–403.
143. Blood pressure telemonitoring is useful to achieve blood pressure control in inadequately treated patients with arterialhypertension / C. L. Neumann et al. J. Hum. Hypertens. 2011. Vol. 25, P. 732-738.
144. Boehncke W. H, Brembilla N C. Unmet Needs in the Field of Psoriasis: Pathogenesis and Treatment. Clin Rev Allergy Immunol. 2017. doi: 10.1007/s12016-017-8634-3.
145. Borg J. Molecular imaging of the 5-HT1A receptor in relation to human cognition. Behav. Brain. Res. 2008. Vol. 195. P. 103–111.
146. Boureau Y. L., Dayan P. Opponency revisited: competition and cooperation between dopamine and serotonin. Neuropsychopharmacology. 2011. Vol. 36. P. 74–97.
147. Bouwens E. A., Stavenuiter F., Mosnier L. O. Mechanisms of anticoagulant and cytoprotective actions of the protein C pathway. J. Thromb Haemost. 2013. Vol. 11, suppl 1. P. 242–253.
148. Brodalumab, an anti-interleukin-17-receptor antibody for psoriasis / K. A. Papp et al. N. Engl. J. Med. 2012. Vol. 366, N 13. P. 1181–1189.
149. Bryk D., Olejarz W., Zapolska-Downar D. The role of oxidative stress and NADPH oxidase in the pathogenesis of atherosclerosis. Postepy Hig Med Dosw (Online). 2017. Vol. 71(0). P. 57-68.
150. Buzsáki G., Moser E. I. Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nat. Neurosci. 2013. Vol. 16. P. 130–138.
151. Canli T., Lesch K.-P. Long story short: the serotonin transporter in emotion regulation and social cognition. Nature Neuroscience. 2007. Vol. 10, N 9. P. 1103–1109.
152. Cardiovascular and Metabolic Diseases Comorbid with Psoriasis: Beyond the Skin / M. Furue et al. Intern Med. 2017. Vol. 56, N 13. P. 1613-1619. doi: 10.2169/internalmedicine.56.8209.
153. Carmeliet P. Angiogenesis in health and disease. Nat. Med. 2003. Vol. 9. P. 653–660.
154. CD4+ CD25+ T-regulatory cells in psoriasis. Correlation between their numbers and biologics-induced clinical improvement / A. G. Richetta et al. European Journal of Dermatology. 2011. Vol. 21, N 3. P. 344–348.
155. Cerejeira J., Lagarto L., Mukaetova-Ladinska E. B. Behavioral and psychological symptoms of dementia. Front. Neurol. 2012. Vol. 3. P. 73.
156. Characterisation of 5-HT3C, 5-HT3D and 5-HT3E receptor subunits: evolution, distribution and function / J. D. Holbrook et al. Journal of Neurochemistry. 2009. Vol. 108, N 2. P. 384–396.
157. Characterization of the interleukin-17 isoforms and receptors in lesional psoriatic skin / C. Johansen et al. British Journal of Dermatology. 2009. Vol. 160, N 2. P. 319–324.
158. Charnay Y., Léger L. Brain serotonergic circuitries. Dialogues Clin. Neurosci. 2010. Vol. 12. P. 471–487.
159. Chronic resveratrol enhances endothelium-dependent relaxation but does not alter eNOS levels in aorta of spontaneously hypertensive rats / J. W. Rush et al. Exp Biol Med (Maywood). 2007. Vol. 232. P. 814–822.
160. Chronic skin-specific inflammation promotes vascular inflammation and thrombosis / Y. Wang et al. J. Invest Dermatol. 2012. Vol. 132, N 8. P. 2067-75.
161. Chronobiologically Interpreted Ambulatory Blood Pressure Monitoring in Health and Disease / F. Halberg et al. Glob Adv Health Med. 2012 Vol. 1, N 2. P. 66-123.
162. Cohen A. D., Weitzman D., Dreiher J. Psoriasis and hypertension: a case-control study. Acta Derm Venereol. 2010 Vol. 90, N 1. P. 23–26.
163. Collins T. J. ImageJ for microscopy. BioTechniques. 2007. Vol. 43. P. 25-30.
164. Common alterations in the serotonin transporter in platelets and lymphocytes of psychotic patients / D. Marazziti et al. Pharmacopsychiatry. 2006. Vol. 39, N 1. P. 35–38.
165. Concordance between in vivo reflectance confocal microscopy and histology in the evaluation of plaque psoriasis / M. Ardigo et al. J. Eur. Acad. Dermatol. Venereol. 2009. Vol. 23, N 6. P. 660-667.
166. Coronary Plaque Characterization in Psoriasis Reveals High-Risk Features That Improve After Treatment in a Prospective Observational Study / J. B. Lerman et al. Circulation. 2017. Vol. 136, N 3. P. 263-276.
167. Correction: Association between Psoriasis Vulgaris and Coronary Heart Disease in a Hospital-Based Population in Japan / M. Shiba et al. PLoS One. 2016. Vol. 11, N 6. – e0158699. doi: 10.1371/journal.pone.0158699.
168. Crawshaw A. A., Griffiths C. E., Young H. S. Investigational VEGF antagonists for psoriasis. Expert Opin Investig Drugs. 2012. Vol. 21, N 1. Р. 33-43.
169. Current microscopy contributions to advances in science and technology / A. Méndez-Vilas et al. Badajoz : Formatex, 2012. 1523 p.
170. CYR61/CCN1: A Novel Mediator of Epidermal Hyperplasia and Inflammation in Psoriasis? / T. Quan et al. J. Invest. Dermatol. 2015. Vol. 135, N 11. P. 2562-2564.
171. Denault J.-B., Salvesen G. S. Caspases: keys in the ignition of cell death. Chem Rev. 2002. Vol. 102. P. 4489–4500.
172. Depression and the risk of psoriasis in US women / P. L. Dominguez et al. J. Eur. Acad. Dermatol. Venereol. 2013. Vol. 27. P. 1163–1167.
173. Determining the minimal clinically important difference and responsiveness of the Dermatology Life Quality Index (DLQI): further data / M. K. Basra et al. Dermatology 2015. Vol. 230, N 1. P. 27-33.
174. Development and pilot-testing of a psoriasis screening tool / P. L. Dominguez et al. Br J Dermatol. 2009 Vol. 161, N 4. P. 778–784.
175. Diagnosis and management of neonatal purpura fulminans / V. E. Price et al. Semin Fetal Neonatal Med. 2011. Vol. 16. P. 318–322.
176. Differential cytokine secretion of cultured bone marrow stromal cells from patients with psoriasis and healthy volunteers / K. Zhang et al. Eur. J. Dermatol. 2010. Vol. 20. P. 49–53.
177. Ding Y., Li Y. M., Zimmerman M. Role of CuZn superoxide dismutase on carotid body function in heart failure rabbits. Сardiovasc. Res. 2009. Vol. 81, N 4. P. 678–685.
178. Discrepant levels of vascular endothelial growth factor in psoriasis patients treated with PUVA, Re-PUVA and narrow-band UVB / A. Akman et al. Photodermatol Photoimmunol Photomed. 2008 Vol. 24, N 3. P. 123–127.
179. Doumas M., Anyfanti P., Bakris G. Should ambulatory blood pressure monitoring be mandatory for future studies in resistant hypertension: a perspective. Hypertension. 2012. Vol. 30, N 5. P. 874-876.
180. Downregulation of basophil-derived IL-4 and in vivo TH2 IgE responses by serotonin and other organic cation transporter 3 ligands / E. Schneider et al. Journal of Allergy and Clinical Immunology. 2011. Vol. 128, N 4. P. 864–871.
181. Drug induced psoriasis / V. Milavec-Puretic et al. Acta Dermatovenerol Croat. 2011 Vol. 19, N 1. P. 39–42.
182. Dual inhibition of PI3K/Akt and mTOR by the Dietary Antioxidant Delphinidin Ameliorates Psoriatic Features In-vitro and in an Imiquimod-induced Psoriasis-like Disease in Mice / J. C. Chamcheu et al. Antioxid Redox Signal. 2016. Vol. 26, N 2. P. 49-69.
183. Durand M. J., Gutterman D D. Diversity in Mechanisms of Endothelium-Dependent Vasodilation in Health and Disease. Microcirculation. 2013. Vol. 20, N 3. P. 239–247.
184. Economic burden of comorbidities in psoriasis patients in the United States: results from a retrospective U.S. database / S. R. Feldman et al. BMC Health Serv Res. 2017. Vol. 17, N 1. P. 337. doi: 10.1186/s12913-017-2278-0.
185. Eding C. B., Enerbäck C. Involved and Uninvolved Psoriatic Keratinocytes Display a Resistance to Apoptosis that may Contribute to Epidermal Thickness. Acta Derm Venereol. 2017. Vol. 97, N 7. P. 788-796. doi: 10.2340/00015555-2656.
186. Effect of treatment with methotrexate and coal tar on adipokine levels and indices of insulin resistance and sensitivity in patients with psoriasis vulgaris / M. Rajappa et al. Journal of the European Academy of Dermatology and Venereology. 2015. Vol. 29, N 1. P. 69–76.
187. Effective treatment of psoriasis with etanercept is linked to suppression of IL-17 signaling, not immediate response TNF genes / L. C. Zaba et al. J. Allergy Clin. Immunol. 2009. Vol. 124, N 5. doi: 10.1016/j.jaci.2009.08.046.
188. Effects of acute tryptophan depletion on prefrontal-amygdala connectivity while viewing facial signals of aggression / L. Passamonti et al. Biological Psychiatry. 2012. Vol. 71, N 1. P. 36–43.
189. Effects of Thiazide-Type and Thiazide-Like Diuretics on Cardiovascular Events and Mortality – Systematic Review and Meta-Analysis / H. G. Rik et al. Hypertension. 2015, Vol. 65, N 5. P. 1033-1040.
190. Efficacy and safety of secukinumab in the treatment of moderate-to-severe plaque psoriasis: A randomized, double-blind, placebo-controlled phase II dose-ranging study / K. A. Papp et al. Br. J. Dermatol. 2013. Vol. 168, N 2. P. 412–421.
191. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 76-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 1) / C. L. Leonardi et al. Lancet. 2008. Vol. 371. P. 1665–1674.
192. El-Domyati M., Barakat M., Abllel-Razek R. Expression of apoptosis regulating proteins, P53 and bcl-2, in psoriasis. J. Egypt wom Dermatol. Soc. 2006. Vol. 3. P. 46-51.
193. Elevated plasma levels of vascular endothelial growth factor and plasminogen activator inhibitor-1 decrease during improvement of psoriasis / H. J. Nielsen et al. Inflamm Res. 2002. Vol. 51, N 11. P. 563–567.
194. Elevated plasma migration inhibitory factor in hypertension-hyperlipidemia patients correlates with impaired endothelial function / B. Zhou et al. Medicine (Baltimore). 2016. Vol. 95, N 43. P. e5207-e5209.
195. Endothelial dysfunction: a comprehensive appraisal / R. J. Esper et al. Cardiovasc. Diabetol. 2006. Vol. 54. P. 1475-2840.
196. Epidermal vascular endothelial growth factor production is required for permeability barrier homeostasis, dermal angiogenesis, and the development of epidermal hyperplasia: implications for the pathogenesis of psoriasis / P. M. Elias et al. Am. J. Pathol. 2008. Vol. 173. P. 689–699.
197. Epinephrine enhances the response of macrophages under LPS stimulation / J. Zhou et al. Biomed Res Int. 2014. Vol. 2014. P. 254686.
198. ESH guidelines for blood pressure monitoring at home: a summary report of the Second International Consensus Conference on Home Blood Pressure. Monitoring J Hypertens. 2008. Vol. 26. Р. 505-1530.
199. Esmon C. T. Crosstalk between inflammation and thrombosis. Maturitas. 2004. Vol. 47. P. 305–314.
200. Etanercept and clinical outcomes, fatigue, and depression in psoriasis: Double-blind placebo-controlled randomised phase III trial / S. Tyring et al. Lancet. 2006. Vol. 367. P. 29–35.
201. Etanercept as monotherapy in patients with psoriasis / C. L. Leonardi et al. N. Engl. J. Med. 2003. Vol. 349, N 21. P. 2014–2022.
202. Evaluation of the impact of atmospheric pressure in different seasons on blood pressure in patients with arterial hypertension / M. Kamiński et al. Med Environ Health. 2016 Vol. 29, N5. P. 783-92.
203. Evans C. Managed care aspects of psoriasis and psoriatic arthritis. Am. J. Manag. Care. 2016. 8 Suppl. P. s238-243.
204. Existence of an endogenous circadian blood pressure rhythm in humans that peaks in the evening / S. A. Shea et al. Circ Res. 2011 Vol. 108, N 8. P. 980-984.
205. Expression of Angiogenic Factors in Psoriasis Vulgaris / L. Sankar et al. J Clin Diagn Res. 2017. Vol. 11, N 3. P. EC23-EC27. doi: 10.7860/JCDR/2017/23039.9525.
206. Expression of tachykinins and their receptors in plaque psoriasis with pruritus / B. Amatya et al. Br. J. Dermatol. 2011. Vol. 164. P. 1023–1029.
207. Finlay A. Y. Current severe psoriasis and the Rule of Tens. British Journal of Dermatology 2005. Vol. 152, N 5. P. 861-867.
208. Finlay A. Y., Khan G. K. Dermatology Life Quality Index (DLQI) – a simple practical measure for routine clinical use. Clinical and Experimental Dermatology. 1994. Vol. 19. P. 210-216.
209. Fitzgerald R. Psoriasis and insulin resistance: a review. J. Diab. Res. Clin. Met. 2014. Vol. 3. DOI : http://dx.doi.org/10.7243/2050-0866-3-3
210. Fluoxetine treatment to rats modifies serotonin transporter and cAMP in lymphocytes, CD4+ and CD8+ subpopulations and interleukins 2 and 4 / F. Fazzino et al. International Immunopharmacology. 2009. Vol. 9, N 4. P. 463–467.
211. Folkman J. Tumor angiogenesis: therapeutic implications. N. Engl. Med. 1971. Vol. 285. P. 1182–1186.
212. Fortune D. G., Richards H. L., Griffiths C. E. Psychologic factors in psoriasis: consequences, mechanisms, and interventions. Dermatol Clin. 2005 Vol. 23. P. 681–694. doi: 10.1016/j.det.2005.05.022.
213. From the Medical Board of the National Psoriasis Foundation: The risk of cardiovascular disease in individuals with psoriasis and the potential impact of current therapies / J. Hugh et al. J. Am. Acad. Dermatol. 2014. Vol. 70, N 1. P. 168-77.
214. Fronek A., DiTomasso D. G., Allison M. Noninvasive assessment of endothelial activity in patients with peripheral arterial disease and cardiovascular risk factors. Endothelium. 2007. Vol. 14. P. 199–205.
215. Fukudome K., Esmon C. T. Identification, cloning, and regulation of a novel endothelial cell protein C/activated protein C receptor. J. Biol. Chem. 1994. Vol. 269. P. 26486–26491.
216. Functional capacity and heart rate response: associations with nocturnal hypertension / P. Ritvo et al. BMC Cardiovasc Disord. 2015 Vol. 15. P. 74. doi: 10.1186/s12872-015-0064-7.
217. Functional selectivity and antidepressant activity of serotonin 1A receptor ligands / Z. Chilmonczyk et al. Int. J. Mol. Sci. 2015. Vol. 16. P. 18474–18506.
218. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage van den R. Bos et al. PLoS One. 2017. Vol. 12, N 4. P.e0175420.
219. Furue M., Kadono T. Psoriasis: Behind the scenes. J. Dermatol. 2016. Vol. 43, N 1. P. 4-8.
220. Garcia-Perez M. E., Stevanovic T., Poubelle P. E. New therapies under development for psoriasis treatment. Curr. Opin. Pediatr. 2013. Vol. 25, N 4. P. 480–487.
221. Glucagon-like peptide-1 (GLP-1) and the regulation of human invariant natural killer T cells: lessons from obesity, diabetes and psoriasis / A. E. Hogan et al. Diabetologia. 2011. Vol. 54. P. 2745–2754.
222. González García M. P. Cardiovascular Risk in Psoriasis. Actas Dermosifiliogr. 2017. doi: 10.1016/j.ad.2017.05.007.
223. Gottlieb A.B., Chao C., Dann F. Psoriasis comorbidities. J. Dermatolog Treat. 2008. Vol. 19 (1). Р. 5-21.
224. Grozdev I., Korman N., Tsankov N. Psoriasis as a systemic disease. Clin Dermatol. 2014. Vol. 32. P. 343–350.
225. Gudjonsson J. E., Johnston A., Ellis C N. Novel systemic drugs under investigation for the treatment of psoriasis. J. Am. Acad. Dermatol. 2012. Vol. 67, N 1. P. 139–147.
226. Hayashi F., Means T. K., Luster A. D. Toll-like receptors stimulate human neutrophil function. Blood. 2003. Vol. 102, N 7. P. 2660–2669.
227. Heidenreich R., Röcken M., Ghoreschi K. Angiogenesis drives psoriasis pathogenesis. Int J Exp Pathol. 2009. Vol. 90, N 3. P. 232-48.
228. Heidenreich R., Röcken M., Ghoreschi K. Angiogenesis: the new potential target for the therapy of psoriasis? Drug News Perspect. 2008. Vol. 21, N 2. P. 97–105.
229. Hellhammer D. H., Wust S., Kudielka B. M. Salivary cortisol as a biomarker in stress research. Psychoneuroendocrinology. 2009; Vol. 34. P. 163–171.
230. Higashi Y., Yoshizumi M. Exercise and endothelial function: Role of endothelium-derived nitric oxide and oxidative stress in healthy subjects and hypertensive patients. Pharmacology & Therapeutics. 2004. Vol. 102. P. 87–96.
231. High prevalence of masked uncontrolled hypertension in people with treated hypertension / J. R. Banegas et al. Eur Heart J. 2014 Vol. 35, N 46. P. 3304-3312.
232. Hirahara K., Nakayama T. CD4+ T-cell subsets in inflammatory diseases: beyond the Th1/Th2 paradigm. Int Immunol. 2016. Vol. 28, N 4. P. 163-71.
233. Homocysteine plasma levels in psoriasis patients: our experience and review of the literature / M. Giannoni et al. J. Eur. Acad. Dermatol. Venereol. 2015. Vol. 29, N 9. P. 1781-1785. doi: 10.1111/jdv.13023.
234. Hormone multifunctionalities: a theory of endocrine signaling, command and control / J. J. Mandoki et al. Progress in Biophysics and Molecular Biology. 2004. Vol. 86, N 3. P. 353–377.
235. How in-office and ambulatory BP monitoring compare: A systematic review and meta-analysis / S. Reino-Gonzalez et al. J. Fam Pract. 2017 Vol. 66, N 1. P. E5-E12.
236. How stress gets under the skin: cortisol and stress reactivity in psoriasis / A. W. Evers et al. Br. J. Dermatol. 2010. Vol. 163, N 5. P. 986–991.
237. Huggenberger R., Detmar M. The cutaneous vascular system in chronic skin inflammation. J Investig Dermatol Symp Proc. 2011. Vol. 15, N 1. P. 24-32.
238. Human mast cells are major IL-22 producers in patients with psoriasis and atopic dermatitis / S. Mashiko et al. J Allergy Clin Immunol. 2015. Vol. 136, N 2. P. 351–359.e1.
239. Hydrogen sulfide mitigates cardiac remodeling during myocardial infarction via improvement of angiogenesis / N. Qipshidze et al. Int J Biol Sci. 2012. Vol. 8, N 4. P. 430-441.
240. Hyperoxia inhibits nitric oxide treatment effects in alveolar epithelial cells via effects on L-type amino acid transporter-1 / M. V. Brahmajothi et al. Antioxid Redox Signal. 2014. Vol. 21, N 13. P. 1823-1836.
241. Hypertension, antihypertensive medication use, and risk of psoriasis / S. Wu et al. JAMA Dermatol. 2014 Vol. 150, N 9. P. 957-963.
242. IDO: a double-edged sword for TH1/TH2 regulation / H. Xu et al. Immunology Letters. 2008. Vol. 121, N 1. P. 1–6.
243. IL-17A, IL-22, IL-6, and IL-21 serum levels in plaque-type psoriasis in Brazilian patients / P. S. S. D. Oliveira et al. Mediators of Inflammation. 2015. Vol. 2015. P. 1-5.
244. Immune mechanisms in hypertension / C. De Ciuceis et al. High Blood Press Cardiovasc Prev. 2014. Vol. 21. P. 227–234.
245. Immunomodulatory effects mediated by serotonin / R. Arreola et al. J Immunol Res. 2015. Vol. 2015. P. 354957. doi: 10.1155/2015/354957.
246. Immunopathogenesis of psoriasis / Sabat R. et al. Exp. Dermatol. 2007. Vol. 16, N 10. P. 779–798.
247. Impact of 5-HT3 receptor antagonists on peripheral and central diseases / G. Fakhfouri et al. Drug Discov. Today. 2012. Vol. 17. P. 741–747.
248. Impact of antipsoriatic therapy on endothelial function / E. Cohen-Barak et al. Br. J. Dermatol. 2015. Vol. 173, N 6. P. 1440-1446.
249. Impact of depressive symptoms on oxidative stress in patients with psoriasis / F. Karababa et al. Redox Rep. 2013. Vol. 18, N 2. Р. 51-55. doi: 10.1179/1351000213Y.0000000039.
250. In silico database screening of potential targets and pathways of compounds contained in plants used for psoriasis vulgaris / B. H. May et al. Arch Dermatol Res. 2015. Vol. 307, N 7. P. 645-657.
251. In vivo imaging techniques for psoriatic lesions / C. Căruntu et al. Rom J Morphol Embryol. 2014. Vol. 55, Suppl 3. P. 1191-1196.
252. Inactivation of the gene for anticoagulant protein C causes lethal perinatal consumptive coagulopathy in mice / L. R. Jalbert et al. J. Clin. Invest. 1998. Vol. 102. P. 1481–1488.
253. Increased microvascular density and enhanced leukocyte rolling and adhesion in the skin of VEGF transgenic mice / M. Detmar et al. J. Invest. Dermatol.1998. Vol. 111, N 1. P. 1–6.
254. Independent association between inflammatory markers (C-reactive protein, interleukin-6, and TNF-alpha) and essential hypertension / L. E. Bautista et al. J. Hum Hypertens. 2005. Vol. 19. P. 149–154.
255. Inflammation and hypertension: new understandings and potential therapeutic targets / C. De Miguel et al. Curr Hypertens Rep. 2015. Vol. 17. P. 507.
256. Inflammatory signals in dendritic cell activation and the induction of adaptive immunity / O. Joffre et al. Immunol. Rev. 2009. Vol. 227, N 1. Р. 234-247.
257. Influence of narrowband ultraviolet B phototherapy on serum tumour necrosis factor-like weak inducer of apoptosis (TWEAK) in patients with psoriasis / H. Myśliwiec et al. Clin Exp Dermatol. 2017. Vol. 27. doi: 10.1111/ced.13188.
258. Influence of severity of the cutaneous manifestations and age on the prevalence of several cardiovascular risk factors in patients with psoriasis / D. J. Rosa et al. J. Eur. Acad. Dermatol. Venereol. 2012. Vol. 26. P. 348–353.
259. Integrated approach to comorbidity in patients with psoriasis / E. Daudén et al. Actas Dermosifiliogr. 2012 Vol. 103, Suppl 1. P. 1–64.
260. Interaction between genetic control of vascular endothelial growth factor production and retinoid responsiveness in psoriasis / H. S. Young et al. J. Invest Dermatol. 2006. Vol. 126, N 2. P. 453–459.
261. Interleukin 6 regulates psoriasiform inflammation-associated thrombosis / Y. Wang et al. JCI Insight. 2016. Vol. 1, N 20. P. e89384.
262. Interleukin-1Β interferes with epidermal homeostasis through induction of insulin resistance: implications for psoriasis pathogenesis / C. Buerger et al. Journal of Investigative Dermatology. 2012. Vol. 132, N 9. P. 2206–2214.
263. Interleukin-8-positive neutrophils in psoriasis / H. Duan et al. Journal of Dermatological Science. 2011. Vol. 26, N 2. P. 119–124.
264. Intermedin1-53 enhances angiogenesis and attenuates adverse remodeling following myocardial infarction by activating AMP-activated protein kinase / K. Chen et al. Mol Med Rep. 2017. Vol. 15, N 4. P. 1497-1506.
265. Involvement of IL-9 in Th17-associated inflammation and angiogenesis of psoriasis / T. P. Singh et al. PLoS One. 2013. Vol. 8, N 1. P. e51752.
266. Is psoriasis a pre-atherosclerotic disease? Increased insulin resistance and impaired endothelial function in patients with psoriasis / A. S. Karadag et al. Int. J. Dermatol. 2010. Vol. 49. P. 642-646.
267. Is the prevalence of psoriasis increasing? A 30–year follow-up of a population–based cohort / K. Danielsen et al. Br. J. Dermatol. 2013. Vol. 168. P. 1303–1310.
268. Ischemic cardiovascular involvement in psoriasis: a systematic review / S. Mosca et al. Int J Cardiol. 2015. Vol. 178. P. 191-199. doi: 10.1016/j.ijcard.2014.10.092.
269. Johnsson H. J., McInnes I. B. Interleukin-12 and interleukin-23 inhibition in psoriatic arthritis. Clin Exp Rheumatol. 2015. Vol. 33, Suppl 93. P. 115-118.
270. Kastelan M., Prpić-Massari L., Brajac I. Apoptosis in psoriasis. Acta Dermatovenerol Croat. 2009. Vol. 17, N 3. Р.182-186.
271. Keratinocyte overexpression of IL-17C promotes psoriasiform skin inflammation / A. Johnston et al. J. Immunol. 2013. Vol. 190, N 5. P. 2252-2262.
272. Kim G. K., Del Rosso J. Q. Drug-provoked psoriasis: is it drug induced or drug aggravated? Understanding pathophysiology and clinical relevance. J. Clin. Aesthet Dermatol. 2010 Vol. 3, N 1. P. 32–38.
273. Kiselyov A., Balakin K. V., Tkachenko S. E. VEGF/VEGFR signalling as a target for inhibiting angiogenesis. Expert Opin Investig Drugs. 2007. Vol. 16, N 1. Р. 83-107.
274. Korkmaz S., Korkmaz H. Effect of alterations in apoptotic pathway on development of metabolic syndrome in patients with psoriasis vulgaris. Br J Dermatol. 2017. Vol. 176, N 6. P. 1549-1557. doi: 10.1111/bjd.15185.
275. Korpanty G., Smyth E. Anti-VEGF strategies – from antibodies to tyrosine kinase inhibitors: background and clinical development in human cancer. Curr Pharm Des. 2012 Vol. 18, N 19. P. 2680–2701.
276. Kurihara T., Westenskow P. D., Friedlander M. Hypoxia-inducible factor (HIF)/vascular endothelial growth factor (VEGF) signaling in the retina. Adv. Exp. Med. Biol. 2014. Vol. 801. P. 275–281.
277. Kurosaki T. B-lymphocyte biology. Immunological Reviews. 2010. Vol. 237, N 1. P. 5–9.
278. Kynurenines in the CNS: recent advances and new questions / L. Vécsei et al. Nature Reviews Drug Discovery. 2013 Vol. 12, N 1. P. 64–82.
279. Langan E. A., Griffiths C. E., Paus R. Exploring the role of prolactin in psoriasis. Arch Dermatol Res. 2012. Vol. 304, N 2. P. 115–118.
280. Laurent S., Schlaich M., Esler M. New drugs procedures and devices for hypertension. Lancet. 2012. Vol. 380. P. 591-600.
281. Lebwohl M. Does Treatment of Psoriasis Reduce Cardiovascular Comorbidities? J. Invest. Dermatol. 2017. Vol. 137, N 8. P. 1612-1613. doi: 10.1016/j.jid.2017.06.001.
282. Leveque L., Khosrotehrani K. Feto-maternal allo-immunity, regulatory T cells and predisposition to auto-immunity. Does it all start in utero? Chimerism. 2014; Vol. 5, N 2. P. 59-62.
283. Lin S. H., Lee L. T., Yang Y. K. Serotonin and mental disorders: a concise review on molecular neuroimaging evidence. Clin. Psychopharmacol. Neurosci. 2014. Vol. 12. P. 196–202.
284. Liu T., Ji R. R. New insights into the mechanisms of itch: are pain and itch controlled by distinct mechanisms? Pflugers. Arch. 2013. Vol. 465, N 12. Р. 1671-85. doi: 10.1007/s00424-013-1284-2.
285. Lopez-Cruzan M., Herman B. Loss of caspase-2 accelerates age-dependent alterations in mitochondrial production of reactive oxygen species. Biogerontology 2013. Vol. 14. P. 121–130.
286. Luebberding S., Krueger N., Kerscher M. Age-related changes in male skin: quantitative evaluation of one hundred and fifty male subjects. Skin Pharmacol Physiol. 2014; Vol. 27, N 1. P. 9-17.
287. Luebberding S., Krueger N., Kerscher M. Mechanical properties of human skin in vivo: a comparative evaluation in 300 men and women. Skin Res Technol. 2014. Vol. 20, N 2. P. 127-135.
288. Luteolin inhibits human keratinocyte activation and decreases NF-κB induction that is increased in psoriatic skin / Z.Weng et al. PLoS One. 2014. Vol. 9, N 2. Р. 90739.
289. Lycopene, lutein and β-carotene as determinants of LDL conjugated dienes in serum / J. Karppi et al. Atherosclerosis. 2010. Vol. 209, N 2. P. 565–572.
290. Machado-Pinto J., Mdos S. D., Bavoso N. C. Psoriasis: new comorbidities. An. Bras. Dermatol. 2016. Vol. 91, N 1. Р. 8-14.
291. Mahil S. K., Capon F., Barker J. N. Update on psoriasis immunopathogenesis and targeted immunotherapy. Semin Immunopathol. 2016 Vol. 38, N 1. P. 11–27.
292. Manalo I. F., Gilbert K. E., Wu J. J. Survey of trends and gaps in dermatologists’ cardiovascular screening practices in psoriasis patients: Areas still in need of improvement. J. Am. Acad. Dermatol. 2015. Vol. 73, N 5. P. 872-874.e4. doi: 10.1016/j.jaad.2015.07.029.
293. Mándi Y., Vécsei L. The kynurenine system and immunoregulation. Journal of Neural Transmission. 2012. Vol. 119, N 2. P. 197–209.
294. Mathis K. W., Broome H. J., Ryan M. J. Autoimmunity: an underlying factor in the pathogenesis of hypertension. Curr Hypertens Rep. 2014. Vol. 16. P. 424.
295. McKelvey K., Jackson C. J., Xue M. Activated protein C: a regulator of human skin epidermal keratinocyte function. World J. Biol. Chem. 2014. Vol. 5. P. 169–179.
296. Mechanisms of Disease : Psoriasis / F. O. Nestle et al. N. Engl. J. Med. 2009. Vol. 361. N 5. P. 496-509.
297. Medzhitov R. Origin and physiological roles of inflammation. Nature. 2008. Vol. 454. P. 428–435.
298. Metabolism Regulates Exposure of Pancreatic Islets to Circulating Molecules In Vivo / A. Michau et al. Diabetes. 2016. Vol. 65, N 2. P. 463-475.
299. Microvascular changes in relation to inflammation and epidermal hyperplasia in chronic cutaneous lesions of psoriasis vulgaris / D. Výbohová et al. Histol Histopathol. 2017. Vol. 32, N 5. P. 461-470. doi: 10.14670/HH-11-811.
300. Milavec-Puretic V., Mance M., Ceovic R. Lipozencic Drug induced psoriasis. J. Acta Dermatovenerol. Croat. 2011. Vol. 19, N 1. Р. 39-42.
301. Molecular regulation of UVB-induced cutaneous angiogenesis / D. R. Bielenberg et al. J Invest Dermatol. 1998 Vol. 111, N 5. P. 864–872.
302. Monocyte-mediated defense against microbial pathogens / N. V. Serbina et al. Annual Review of Immunology. 2008. Vol. 26. P. 421–452.
303. Monti J. M. Serotonin control of sleep-wake behavior. Sleep Medicine Reviews. 2011. Vol. 15, N 4. P. 269–281.
304. Moodley K. K., Chan D. The hippocampus in neurodegenerative disease. Front. Neurol. Neurosci. 2014. Vol. 34. P. 95–108.
305. Morrell C. N., Aggrey A. A., Chapman L. M. Emerging roles for platelets as immune and inflammatory cells. Blood. 2014. Vol. 123, N 18. Р. 2759–2767.
306. Moynihan J., Rieder E., Tausk F. Psychoneuroimmunology: the example of psoriasis. G. Ital Dermatol Venereol. 2010. Vol. 145, N 2. Р. 221-228.
307. Mpact of risk factor for atherosclerosis on microvascular endothelial function: an in vitro study / V. Lubrano et al. Theor Biol Forum. 2015. Vol. 108, N 1-2. P. 75-88.
308. Mulder W. J. M., Griffioen A. W. Imaging of angiogenesis. Angiogenesis. 2010. Vol. 13, N 2. P. 71–74.
309. Nakamura Y., Ishii J., Kondo A. Applications of yeast-based signaling sensor for characterization of antagonist and analysis of site-directed mutants of the human serotonin 1A receptor. Biotechnol Bioeng. 2015. Vol. 112, N 9. P. 1906-1915.
310. National Institutes of Health, National Heart, Lung and Blood Institute. The Sixth Report of the Joint National Committe on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. NIH Publication. 1997. N. 98. P. 4080.
311. National Psoriasis Foundation Benchmark Survey. Accessed April 3, 2006.
312. Nestle F. O., Kaplan D. H., Barker J. Psoriasis. N Engl J Med. 2009. Vol. 361. P. 496–509.
313. New therapeutic applications for the anticoagulant, activated protein C / C. Jackson et al. Expert Opin Biol Ther. 2008. Vol. 8. P. 1109–1122.
314. Non-dipping nocturnal blood pressure in psoriasis vulgaris / A. Bacaksiz et al. Wien Klin Wochenschr. 2012. Vol. 124, N 23–24. P. 822–829.
315. Novel insight into the agonistic mechanism of alefacept in vivo: Differentially expressed genes may serve as biomarkers of response in psoriasis patients / A. S. Haider et al. J. Immunol. 2007. Vol. 178. P. 7442–7449.
316. NOX1, 2, 4, 5: counting out oxidative stress / K. Wingler et al. Br. J. Pharmacol. 2011. Vol. 164. P. 866–883.
317. Nuclear factor-κB pathway activation and phosphatase and tensin homolog downregulation in psoriasis / K. K. Hong et al. Br. J. Dermatol. 2016. Vol. 174, N 2. P. 433-435.
318. Obesity and inflammation: the linking mechanism and the complications / M. S. Ellulu et al. Arch Med Sci. 2017. Vol. 13, N 4. P. 851-863. doi: 10.5114/aoms.2016.58928.
319. Office and ambulatory blood pressure control in hypertensive patients treated with different two-drug and three-drug combinations / A. de la Sierra et al. Clin Exp Hypertens. 2016 Vol. 38, N 4. P. 409-414.
320. Old, new and emerging functions of caspases / S. Shalini et al. Cell Death Differ. 2015. Vol. 22. P. 526–539.
321. Olivier B. Serotonin: a never-ending story. Eur. J. Pharmacol. 2015. Vol. 753. P. 2–18.
322. Omboni S., Guarda A. Impact of home blood pressure telemonitoring and blood pressure control: a meta-analysis of randomized controlled studies. Am. J. Hypertens. 2011. Vol. 24, N 9. P. 989-998.
323. One device, one equation: the simplest way to objectively evaluate psoriasis severity / J. W. Choi et al. J Dermatol. 2015 Vol. 42, N 2. P. 154-158.
324. One-Year Clinical Outcomes among Patients with Metabolic Syndrome and Acute Myocardial Infarction / M. S. Ji et al. Korean Circ J. 2013 Vol. 43, N 8. P. 519–526.
325. Overexpression of vascular endothelial growth factor (VEGF) receptors on keratinocytes in psoriasis: regulated by calcium independent of VEGF / X. Y. Man et al. J. Cell Mol. Med. 2008. Vol. 12, N 2. P. 649–660.
326. Oxidation of melatonin and its catabolites, N1-acetyl-N 2-formyl-5-methoxykynuramine and N1-acetyl-5- methoxykynuramine, by activated leukocytes / S. O. Silva et al. Journal of Pineal Research. 2004. Vol. 37, N 3. P. 171–175.
327. Oxidative stress and psoriasis: the effect of antitumour necrosis factor-α inhibitor treatment / T. Bacchetti et al. Br. J. Dermatol. 2013. Vol. 168, N 5. Р. 984-989. doi: 10.1111/bjd.12144.
328. Patients with psoriasis are insulin resistant / M. Gyldenløve et al. Journal of American Academy of Dermatology. 2015. Vol. 72, N 4. P. 599–560.
329. Patients with severe sepsis vary markedly in their ability to generate activated protein C / P. C. Liaw et al. Blood. 2004. Vol. 104. P. 3958–3964.
330. Peluso I., Cavaliere A., Palmery M. Plasma total antioxidant capacity and peroxidation biomarkers in psoriasis. J. Biomed. Sci. 2016. Vol. 23, N 1. P. 52.
331. Pereira R., Amladi S. T., Varthakavi P. K. A study of the prevalence of diabetes, insulin resistance, lipid abnormalities, and cardiovascular risk factors in patients with chronic plaque psoriasis. Indian Journal of Dermatology. 2011. Vol. 56, N 5. P. 520–526.
332. Photochemotherapy inhibits angiogenesis and induces apoptosis of endothelial cells in vitro / H. Deng et al. Photodermatol Photoimmunol Photomed. 2004. Vol. 20, N 4. P. 191–199.
333. Platelet serotonin promotes the recruitment of neutrophils to sites of acute inflammation in mice / D. Duerschmied et al. Blood. 2013. Vol. 121, N 6. P. 1008–1015.
334. Practice guidelines of the European Society of Hypertension for clinic, ambulatory and self blood pressure measurement / E. O’Brien et al. J. Hypertens. 2005 Vol. 23. P. 697–701.
335. Prevalence of metabolic syndrome in patients with psoriasis: a hospital-based case-control study / P. Gisondi et al. Br. J. Dermatol. 2007. Vol. 157, N 1. Р. 68-73.
336. Protease activated receptor-2 mediates activated protein C-induced cutaneous wound healing via inhibition of p38 / S. M. Julovi et al. Am. J. Pathol. 2011. Vol. 179. P. 2233–2242.
337. Psoriasis / J. E. Greb et al. Nat Rev Dis Primers. 2016. Vol. 2. doi: 10.1038/nrdp.2016.82.
338. Psoriasis and hypertension severity: results from a case-control study / A. W. Armstrong et al. PLoS One. 2011 Vol. 6, N 3. P. e18227.
339. Psoriasis and hypertension: a case-control study / S. Armesto et al. J. Eur. Acad. Dermatol. Venereol. 2012. Vol. 26, N 6. P. 785–788.
340. Psoriasis and oxidative stress / I. Péter et al. Orv Hetil. 2016. Vol. 157, N 45. P. 1781-1785.
341. Psoriasis and risk of nonfatal cardiovascular disease in U.S. women: a cohort study / W. Q. Li et al. Br. J. Dermatol. 2012. Vol. 166, N 4. P. 811–818.
342. Psoriasis and Vascular Disease—Risk Factors and Outcomes: A Systematic Review of the Literature / R. V. Patel et al. J. Gen. Intern. Med. 2011. Vol. 26, N 9. P. 1036–1049.
343. Psoriasis in France and associated risk factors: results of a case-control study based on a large community survey / P. Wolkenstein et al. Dermatology. 2009. Vol. 218, N 2. P. 103–109.
344. Psoriasis іnduced by Anti-Tumor Necrosis Factor Alpha Agents: A Comprehensive Review of the Literature / F. Ciccarelli et al. Acta Dermatovenerol Croat. 2016. Vol. 24, N 3. P. 169-174.
345. Psoriasis Patients Describe Personalized Trade-offs in Treatment Decisions: Lessons Learned from Focus Groups / J. Kim et al. JAMA Dermatol. 2016. Vol. 152, N 6. P. 720–722. doi: 10.1001/jamadermatol.2016.0501
346. Psoriasis patients show signs of insulin resistance / S. Boehncke et al. British Journal of Dermatology. 2007. Vol. 157, N 6. P. 1249–1251.
347. Psoriasis plaque test with confocal microscopy: evaluation of different microscopic response pathways in NSAID and steroid treated lesions / M. Ardigò et al. Skin Res Technol. 2013. Vol. 19, N 4. P. 417-423.
348. Psoriasis: correlation between severity index (PASI) and quality of life index (DLQI) in patients assessed before and after systemic treatment / M. F. Silva et al. An Bras Dermatol. 2013. Vol. 88, N 5. P. 760-763.
349. Psoriasis: from pathogenesis to novel therapeutic approaches / G. Monteleone et al. Clinical Science. 2011. Vol. 120, N 1-2. Р. 1-11.
350. Qualitatively different modes of perirhinal-hippocampal engagement when rats explore novel vs. familiar objects as revealed by c-Fos imaging / M. Van Elzakker et al. European Journal of Neuroscience. 2010. Vol. 31, N 1. Р. 134-147.
351. Raj D., Brash D. E., Grossman D. Keratinocyte apoptosis in epidermal development and disease. J. Invest. Dermatol. 2006. Vol. 126. P. 243-57.
352. Rampton D. S. The influence of stress on the development and severity of immune-mediated diseases. J. Rheumatol. Suppl. 2011. Vol. 88. P. 43–47.
353. Reaction Intermediates and Molecular Mechanism of Peroxynitrite Activation by NO Synthases / J. Lang et al. Biophys J. 2016. Vol. 111, N 10. P. 2099-2109.
354. Recurrent vasculopathic skin lesions associated with homozygous protein C deficiency / P. I. Agras et al. Pediatr Dermatol. 2007 Vol. 24. P. 57–60.
355. Reinhard M., Poulsen P. L., Christensen K. L. Very poor agreement between routine outpatient clinic office and ambulatory blood pressure: time to improve an old hospital outpatient clinic routine? Blood Press Monit. 2016 Vol. 21, N 6. P. 340-344.
356. Relation between abnormalities in circadian blood pressure rhythm and target organ damage in normotensives / A. Soylu et al. Circ J. 2009 Vol. 73. P. 899–904.
357. Reliability of hypothalamic-pituitary-adrenal axis assessment methods for use in population-based studies / S. H. Golden et al. Eur. J. Epidemiol. 2011. Vol. 26. P. 511–525.
358. Ronpirin C., Tewin T. Psoriasis: A review of the role of serotonergic system. African Journal of Biotechnology. 2010. Vol. 9, N 11. Р. 1528-1534.
359. Sanders V. M. The beta2-adrenergic receptor on T and B lymphocytes: do we understand it yet? Brain Behav Immun. 2012. Vol. 26, N 2. P. 195–200.
360. Sarkar R., Chugh S., Bansal S. General measures and quality of life issues in psoriasis. Indian Dermatol Online J. 2016 Vol. 7, N 6. P. 481–488.
361. Schiffrin E. L. The Immune System: Role in Hypertension. Can J. Cardiol. 2013. Vol. 29, N 5. P. 543–548.
362. Schimmel L., Heemskerk N., van Buul J. D. Leukocyte transendothelial migration: A local affair. Small GTPases. 2016. Vol. 15. P. 1-15.
363. Sembulingam K., Sembulingam P. Essentials of Medical Physiology. 6th ed. Vol. 70. New Delhi: Jaypee Brothers Medical Publishers; 2012. p. 432.
364. Serotonin 2A receptor clustering in peripheral lymphocytes is altered in major depression and may be a biomarker of therapeutic efficacy / T. Rivera-Baltanas et al. Journal of Affective Disorders. 2014. Vol. 163. P. 47–55.
365. Serotonin receptor 3A expression in normal and neoplastic B cells / A. Rinaldi et al. Pathobiology. 2010. Vol. 77, N 3. P. 129–135.
366. Serotonin transporter in lymphocytes of rats exposed to physical restraint stress / M. Medina-Martel et al. NeuroImmunoModulation. 2013. Vol. 20, N 6. P. 361–367.
367. Serotonin-mediated tuning of human helper T cell responsiveness to the chemokine CXCL12 / E. Magrini et al. PLoS ONE. 2011. Vol. 6, N 8. doi: 10.1371/journal.pone.0022482.
368. Serum methylglyoxal level and its association with oxidative stress and disease severity in patients with psoriasis / S. Kaur et al. Arch Dermatol Res. 2013. Vol. 305, N 6. Р. 489-494. doi: 10.1007/s00403-013-1362-5.
369. Servey J. T., Stephens M. Cardiac Rehabilitation: Improving Function and Reducing Risk. Am Fam Physician. 2016 Vol. 94, N 1. P. 37-43.
370. Setting-up a bloodpressure and vascular protection clinic: requirements of the European Society of Hypertension / G. Stergiou et al. J. Hypertens. 2010. Vol. 28, N 8. P. 1780-1781.
371. Shahin Y., Khan J. A., Chetter I. Angiotensin converting enzyme inhibitors effect on arterial stiffness and wave reflections: a meta-analysis and meta-regression of randomised controlled trials. Atherosclerosis. 2012. Vol. 221. P. 18-33.
372. Singh S., Bhansali A. Randomized Placebo Control Study of Metformin in Psoriasis Patients with Metabolic Syndrome (Systemic Treatment Cohort) Indian J Endocrinol Metab. 2017. Vol. 21, N 4. P. 581-587. doi: 10.4103/ijem.IJEM_46_17.
373. Single-nucleotide polymorphisms of vascular endothelial growth factor in psoriasis of early onset / H. S. Young et al. J. Invest Dermatol. 2004. Vol. 122, N 1. P. 209–215.
374. Siramesine causes preferential apoptosis of mast cells in skin biopsies from psoriatic lesions / E. Hagforsen et al. 2017. Vol. 177, N 1. P. 179-187.
375. Sticherling M. Psoriasis and autoimmunity. Autoimmun Rev. 2016. Vol. 15, N 12. P. 1167-1170.
376. Su J. B. Vascular endothelial dysfunction and pharmacological treatment. World J Cardiol. 2015. Vol. 7, N 11. P. 719-41.
377. Sunitha S., Rajappa M., Thappa D. M. Comprehensive lipid tetrad index, atherogenic index and lipid peroxidation: Surrogate markers for increased cardiovascular risk in psoriasis. Indian J Dermatol Venereol Leprol. 2015. Vol. 81, N 5. Р. 464-471.
378. Suppression of VEGFR2 expression in human endothelial cells by dimethylfumarate treatment: evidence for anti-angiogenic action / M. Meissner et al. J. Invest Dermatol. 2011 Vol. 131, N 6. P. 1356–1364.
379. Tan J., Wolfe B. A patient decision aid for psoriasis based on current clinical practice guidelines. Archives of dermatology. 2012. Vol. 148, N 6, P. 718–723.
380. Tau oligomers impair memory and induce synaptic and mitochondrial dysfunction in wild-type mice / C. A. Lasagna-Reeves et al. Mol Neurodegener. 2011. Vol. 6. P. 39.
381. T-cell modulation for the treatment of chronic plaque psoriasis with efalizumab (Raptiva): Mechanisms of action / D. Jullien et al. Dermatology. 2004. Vol. 208. P. 297–306.
382. The anatomical basis for wrinkles / J. E. Pessa et al. Aesthet Surg J. 2014. Vol. 34, N 2. P. 227-234.
383. The association between blood pressure and lipid levels in Europe: European Study on Cardiovascular Risk Prevention and Management in Usual Daily Practice / C. Borghi et al. J Hypertens. 2016 Vol. 34, N 11. P. 2155-2163.
384. The association of psoriasis with autoimmune diseases / J. J. Wu et al. J. Am. Acad. Dermatol. 2012. Vol. 67, N 5. P. 924-930.
385. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials Cholesterol Treatment Trialists’ (CTT) Collaborators. Lancet. 2012. Vol. 380. P. 581–590.
386. The German National Program on Psoriasis Health Care 2005–2015: results and experiences / M. Augustin et al. Arch Dermatol Res. 2016 Vol. 308. P. 389–400.
387. The IL-23/T17 pathogenic axis in psoriasis is amplified by keratinocyte responses / M. A. Lowes et al. Trends in Immunology. 2013. Vol. 34, N 4. P. 174–181.
388. The master switch: the role of mast cells in autoimmunity and tolerance / B. A. Sayed et al. Annu Rev Immunol. 2008. Vol. 26. P. 705–739.
389. The use of dermal injection of activated protein C for treatment of large chronic wounds secondary to pyoderma gangrenosum / S. Kapila et al. Clin. Exp. Dermatol. 2014. Vol. 39. P. 785–790.
390. The Vascular Endothelium and Human Diseases / Rajendran Peramaiyan et al. Int J Biol Sci. 2013. Vol. 9, N 10. P. 1057–1069.
391. Therapeutic drug monitoring of patients with psoriasis during tumour necrosis factor (TNF)-α antagonist treatment using a novel interleukin-8 reporter cell line / Y. Kimura et al. Br. J. Dermatol. 2016. Vol. 175, N 5. P. 979-98.
392. Thirty Years of Saying NO: Sources, Fate, Actions, and Misfortunes of the Endothelium-Derived Vasodilator Mediator / P. M. Vanhoutte et al. Circ Res. 2016. Vol. 119, N 2. P. 375-396.
393. Thorslund K., El-Nour H., Nordlind K. The serotonin transporter protein is expressed in psoriasis, where it may play a role in regulating apoptosis. Arch. Dermatol. Res. 2009. Vol. 301, N 6. P. 449-457.
394. TNF inhibition rapidly down-regulates multiple proinflammatory pathways in psoriasis plaques / A. B. Gottlieb et al. J. Immunol. 2005. Vol. 175, N 4. P. 2721–2729.
395. Treatment of chronic leg ulcers with topical activated protein C / K. Whitmont et al. Arch. Dermatol. 2008. Vol. 144. P. 1479–1483.
396. Triggering drug use in patients with psoriasis: an investigative report from Turkey / Z. Ogretmen et al. Postepy Dermatol Alergol. 2014. Vol. 31. Р. 294-298.
397. Tumour necrosis factor-related apoptosis-inducing ligand (TRAIL): a possible pathogenic role in chronic plaque psoriasis / G. Caldarola et al. G. Ital. Dermatol. Venereol. 2016. Vol. 151, N 1. P. 17-24.
398. Twenty-Four-Hour Ambulatory Pulse Wave Analysis in Hypertension Management: Current Evidence and Perspectives / S. Omboni et al. Hypertens Rep. 2016 Vol. 18, N 10. P. 72.
399. Ultraviolet B irradiation of human skin induces an angiogenic switch that is mediated by upregulation of vascular endothelial growth factor and by downregulation of thrombospondin-1 / K. Yano et al. Br J Dermatol. 2005 Vol. 152, N 1. P. 115–121.
400. Unexpected role of anticoagulant protein C in controlling epithelial barrier integrity and intestinal inflammation / S. Vetrano et al. Proc Natl Acad Sci USA. 2011. Vol. 108. P. 19830–19835.
401. Use of biologics for psoriasis in Central and Eastern European countries / F. Rencz et al. J Eur Acad Dermatol Venereol. 2015. Vol. 29, N 11. P. 2222-2230.
402. Vascular endothelial growth factor in psoriasis: an indicator of disease severity and control / A. Nofal et al. J. Eur. Acad Dermatol. Venereol. 2009. Vol. 23, N 7. P. 803–806.
403. Vascular endothelial growth factor inhibitors: investigational therapies for the treatment of psoriasis / A. K. Weidemann et al. Clin Cosmet Investig Dermatol. 2013. Vol. 6. Р. 233-244.
404. Veritti D., Sarao V., Lanzetta P. Neovascular age-related macular degeneration. Ophthalmologica. 2012. Vol. 227, Suppl 1. P. 11–20.
405. Viera A. J., Hawes E. M. Management of mild hypertension in adults. BMJ. 2016 Vol. 355. P. i5719.
406. Viera A. J., Shimbo D. Ambulatory Blood Pressure Phenotypes and the Risk for Hypertension. Curr Hypertens Rep. 2014. Vol. 16, N 10. P. 481. doi: 10.1007/s11906-014-0481-5
407. Visir V. A., Makurina G. I. Clinical efficiency and dermoprotection of 2-ethyl-6-methyl-3-hydroxypyridine succinate drug in case of psoriasis: from the antioxidation point of view. Запорож. мед. журн. 2016. № 5 (98). С. 31-38.
408. Visir V. A., Makurina G. I. State of free-radical processes and antioxidant defence of patients with psoriasis and concomitant essential hypertension. Запорож. мед. журн. 2016. № 4 (97). С. 21-28.
409. Vizir V. A., Makurina G. I. Features of arterial hypertension course in patients with psoriasis. Запорож. мед. журн. 2017. Т. 19. № 2 (101). С. 129-134.
410. Voluntary activation of the sympathetic nervous system and attenuation of the innate immune response in humans / M. Kox et al. Proc Natl Acad Sci U S A. 2014. Vol. 111, N 20. P. 7379–7384.
411. Vorobjev I. A., Barteneva N. S. Temporal Heterogeneity in Apoptosis Determined by Imaging Flow Cytometry. Methods Mol Biol. 2016. Vol. 1389. P. 221-233.
412. Walls A. C., Qureshi A. A. Psoriasis and concomitant fibrosing disorders: lichen sclerosus, morphea, and systemic sclerosis. J. Am. Acad. Dermatol. 2012 Vol. 67, N 5. P. 1079-83.
413. Wang W. M., Jin H. Z. Homocysteine: A Potential Common Route for Cardiovascular Risk and DNA Methylation in Psoriasis. Chin. Med. J. (Engl). 2017. Vol. 130, N 16. P. 1980-1986. doi: 10.4103/0366-6999.211895.
414. Waqar S., Sarkar P. K. Exacerbation of psoriasis with β-blocker therapy. CMAJ. 2009. Vol. 181, N 1-2. Р. 60.
415. Whole Genome Sequencing Identifies Novel Compound Heterozygous Lysosomal Trafficking Regulator Gene Mutations Associated with Autosomal Recessive Chediak-Higashi Syndrome / Y. Jin et al. Sci Rep. 2017. Vol. 7. P. 41308.
416. Xue M., Campbell D., Jackson C. J. Protein C is an autocrine growth factor for human skin keratinocytes. J. Biol. Chem. 2007. Vol. 282. P. 13610–13616.
417. Xue M., Jackson C. J. Activated protein C and its potential applications in prevention of islet β-cell damage and diabetes. Vitam Horm. 2014. Vol. 95. P. 323–363.
418. Xue M., Jackson C. J. Autocrine actions of matrix metalloproteinase (MMP)-2 counter the effects of MMP-9 to promote survival and prevent terminal differentiation of cultured human keratinocytes. J. Invest. Dermatol. 2008. Vol. 128. P. 2676–2685.
419. Yeung H., Takeshita J., Mehta N.N. Psoriasis severity and the prevalence of major medical comorbidity: a population-based study. JAMA Dermatol. 2013. Vol. 149 (10). Р. 1173-1179.
420. Younes S. F., Bakry O. A. Immunohistochemical Evaluation of Role of Serotonin in Pathogenesis of Psoriasis. J Clin Diagn Res. 2016. Vol. 10, N 10. P. EC05-EC09.
421. Zangeneh F. Z., Fazeli A. The significance of stress hormones in psoriasis. Acta Med Iran. 2008. Vol. 46, N 6. P. 485–488.
422. Zigmond A. S., Snaith R. P. The hospital anxiety and depression scale. Acta Psychiatr Scand. 1983. Vol. 67, N 6. P. 361-370.
ДОДАТОК А
АКТИ ВПРОВАДЖЕННЯ
































ДОДАТОК Б
СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА ЗА ТЕМОЮ ДИСЕРТАЦІЇ ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ РЕЗУЛЬТАТІВ ДИСЕРТАЦІЇ
- Кірієнко В. О., Макуріна Г. І., Якименко Є. С. Порушення фізіологічних маркерів психоемоційного напруження та їх корекція з використанням температурно-міографічного тренінгу в комплексній терапії псоріатичної хвороби у хворих з надмірною масою тіла та артеріальною гіпертензією. Український журнал дерматології, венерології, косметології. 2015. №1 (56). С. 24-32 (Здобувачем зібрано та проаналізовано літературні дані, проведено узагальнення результатів та підготовку статті до друку).
- Федотов В. П., Визир В. А., Макурина Г. И. Особенности иммунорегуляторных процессов у больных псориазом в сочетании с гипертонической болезнью. Український журнал дерматології, венерології, косметології. 2015. №3 (58). С. 18-22 (Здобувачем особисто проаналізовано дані літератури, йому належить ідея та завдання дослідження, збір та обробка матеріалу).
- Федотов В. П., Визир В. А., Макурина Г. И. Взаимосвязь между степенью тяжести псориаза и уровнем ФНО-α у больных псориазом в сочетании с гипертонической болезнью. Запорожский медицинский журнал. 2015. №3(90). С. 43-47 (Здобувачем особисто сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних та їх узагальнення).
- Макуріна Г. І., Федотов В. П., Візір В. А. Гендерні особливості епідеміології та клініки псоріазу з супутньою артеріальною гіпертензією. Запорожский медицинский журнал. 2015. № 5 (92). С. 28-32 (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки).
- Макурина Г. И. Изучение механизмов активации васкулярного эндотелия у больных псориазом и артериальной гипертензией. Запорожский медицинский журнал. 2016. № 1 (94). С. 19-24.
- Макурина Г. И. Клиническое значение нарушения обмена серотонина у пациентов с псориатической болезнью. Дерматологія та венерологія. 2016. № 1 (71). С. 34-41.
- Макуріна Г. І. Стан епідермісу та епідермально-дермального з’єднання шкіри хворих на псоріаз і гіпертонічну хворобу. Патологія. 2016. № 1 (36). С. 73-78.
- Макуріна Г. І. Морфологічні особливості мікроциркуляторного русла шкіри у хворих на псоріаз і гіпертонічну хворобу. Морфологія. 2016. Т. 10. № 1. С. 38-48.
- Макуріна Г. І., Баударбекова М. М. Особливості активності iNOS у вогнищах ураженої шкіри хворих на псоріаз із супутньою артеріальною гіпертензією. Патологія. 2016. № 2 (37). С. 40-46 (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки).
- Макуріна Г. І. Клініко-морфологічні паралелі у хворих на псоріаз із супутньою артеріальною гіпертензією. Український журнал дерматології, венерології, косметології. 2016. № 3 (62). С. 18-26.
- Макурина Г. И. Патогенетические эффекты плазменных тиолов у больных псориазом на фоне артериальной гипертензии. Актуальні питання фармацевтичної і медичної науки та практики. 2016. № 3 (22). С. 67-74.
- Visir V. A., Makurina G. I. State of free-radical processes and antioxidant defence of patients with psoriasis and concomitant essential hypertension. Запорожский медицинский журнал. 2016. № 4 (97). С. 21-28 (Здобувачем зібрано та проаналізовано літературні дані, проведено аналіз отриманих результатів, їх узагальнення та підготовлено статтю до друку).
- Visir V. A., Makurina G. I. Clinical efficiency and dermoprotection of 2-ethyl-6-methyl-3-hydroxypyridine succinate drug in case of psoriasis: from the antioxidation point of view. Запорожский медицинский журнал. 2016. № 5 (98). С. 31-38 (Здобувачеві належить постановка проблеми, узагальнення результатів, підготовка статті до друку).
- Vizir V. A., Makurina G. I. Features of arterial hypertension course in patients with psoriasis. Запорожский медицинский журнал. 2017. Т. 19. № 2 (101). С. 129-134 (Здобувачем особисто проаналізовано дані літератури, йому належить ідея дослідження, проведено збір та обробка матеріалу).
- Дюдюн А.Д., Макуріна Г. І., Полион Н.Н., Колева Н.Н., Али Лоай. Эффективность применения растительного комбинированного препарата ЛИВ.52 и Серезиса в комплексном лечении больных псориазом. Дерматологія. Косметологія. Сексопатологія. 2012. № 1-4. С. 291-296 (Здобувачем зібрано та проаналізовано літературні дані, проведено узагальнення результатів та підготовку статті до друку).
- Федотов В. П., Візір В. А., Макуріна Г. І. Особливості клінічних проявів та перебігу псоріазу у хворих з супутньою артеріальною гіпертензією. Дерматологія. Косметологія. Сексопатологія. 2014. № 1-4. С. 47-50 (Здобувачем особисто сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних та їх узагальнення).
- Макурина Г. И. Нитрозирующий стресс при псориатической болезни в сочетании с єссенциальной гипертензией. Вісник проблем біології і медицини. 2015. Вип. 3. Т. 2 (123). С. 159-165.
- Макуріна Г. І. Особливості вегетативної регуляції у хворих на псоріаз у поєднанні з артеріальною гіпертензією. Дерматологія. Косметологія. Сексопатологія. 2015. № 3-4. С. 40-45.
- Макурина Г. И. Апоптоз-опосредованные механизмы и цитокиновый баланс у больных псориазом на фоне артериальной гипертензии. Сучасні медичні технології. 2016. № 1 (28). С. 24-28.
- Макуріна Г. І. Патоморфогенез сполучнотканинного компоненту шкіри хворих на псоріаз і гіпертонічну хворобу. Вісник проблем біології і медицини. 2016. Вип. 2. Т. 2 (129). С. 191-194.
- Макурина Г. И. Новые аспекты механизмов формирования псориаза при сопутствующей артериальной гипертензии. Актуальні проблеми сучасної медицини. 2016. Т. 16. Вип. 2 (54). С. 134-141.
- Макурина Г. И. Особенности течения псориаза на фоне гипертонической болезни у мужчин. Дерматологія. Косметологія. Сексопатологія. 2016. № 1-4. С. 30-34.
- Макурина Г. И. Клинико-эпидемиологические особенности течения псориаза на фоне артериальной гипертензии у мужчин. Чоловіче здоровʼя, гендерна та психосоматична медицина. 2016. № 1 (03). С. 116-121.
- Спосіб лікування хворих на псоріаз із супутньою артеріальною гіпертензією : пат. Україна № 98942 / Г. І. Макуріна, В. А. Візір, Є. С. Якименко. № u201413203 ; заяв. 09.12.2014 ; опубл. 12.05.2015, бюл. № 9 (Здобувачем розроблено та оформлено заявку, здійснено підготовку матеріалів заявки до друку).
- Спосіб лікування псоріазу із супутньою артеріальною гіпертензією : пат. Україна № 114594 / Г. І. Макуріна, В. А. Візір. № u201610029 ; заяв. 03.10.2016 ; опубл. 10.03.2017, бюл. № 5(Здобувачем розроблено та оформлено заявку, здійснено підготовку матеріалів заявки до друку).
- Макурина Г. И. Особенности развития псориатической болезни у пациентов с сопутствующей артериальной гипертензией. Клинические лекции по дерматовенерологии и косметологии / под ред. В. П. Федотова, А. И. Макарчука. Т. 3. Запорожье – Днепропетровск : Просвіта, 2014. С. 384-397.
- Федотов В. П., Візір В. А., Макуріна Г. І. Оцінка ефективності нових методів психокорекції в комплексній терапії хворих на псоріаз з супутньою артеріальною гіпертензією. Молоді науковці – майбутнє української дерматовенерології : зб. робіт за матеріалами наук.-практ. школи (20-21 листопада 2014 року. м. Київ). Київ, 2014. С. 71-73 (Здобувачем особисто проаналізовано дані літератури, йому належить ідея дослідження, проведено збір та обробка матеріалу).
- Макурина Г. И., Федотов В. П., Визир В. А. Цитокиновый профиль больных псориазом с сопутствующей артериальной гипертензией. Актуальні питання косметології та дерматології : зб. тез ІХ Всеукр. наук.-практ. конф. з міжнар. участю (23-24 квітня 2015 р. м. Запоріжжя). Запоріжжя, 2015. – С. 14 (Здобувачем особисто проаналізовано дані літератури, йому належить ідея дослідження, проведено збір, узагальнення матеріалу, підготовлено тези до друку).
- Макурина Г. И. Особенности суточного ритма артериального давления у больных псориазом с сопутствующей артериальной гипертензией. Актуальні питання клінічної медицини : матеріали ІХ Всеукр. наук.-практ. конф. молодих вчених (30 жовтня 2015 року). Запоріжжя, 2015. С. 69-70.
- Макуріна Г. І. Оцінка впливу коморбідних станів у хворих на псоріаз. Дерматовенерологія. Косметологія. Сексопатологія. 2015. № 3-4. С. 120-121.
- Макурина Г. И. Состояние эндотелиальной дисфункции у пациентов, страдающих псоріазом в сочетании с артериальной гипертензией. Дерматовенерология и эстетическая медицина. (Ташкент). 2015. № 3 (27). С. 144.
- Макурина Г. И. Маркеры нитротирозирующего стресса при псориазе и коморбидной артериальной гипертензии. Сборник материалов конференции, посвященной 100-летию академика В. Ю. Ахундова. Баку, 2016. С. 265-266.
- Макурина Г. И. Особенности формирования псориаза при коморбидной патологии. Сучасні наукові дослідження представників медичної науки – прогрес медицини майбутнього : зб. тез наук. робіт учасників міжнар. наук.-практ. конф. (1-2 квітня 2016 р.). Київ, 2016. С.49-51.
- Макуріна Г. І. Стан метаболізму нейромедіатора серотоніна при формуванні артеріальної гіпертензії на тлі псоріазу. Актуальні проблеми клінічної, теоретичної, профілактичної медицини, стоматології та фармації : зб. матеріалів міжнар. наук.-практ. конф., Одеса, 8–9 квітня 2016 р. Одеса : ОМІ, 2016. С. 50-53.
- Макуріна Г. І. Стан ендотеліальної дисфункції у хворих на псоріаз із супутньою артеріальною гіпертензією. Медична наука та практика в умовах сучасних трансформаційних процесів : зб. тез наук. робіт учасників міжнар. наук.-практ. конф., 22-23 квітня 2016 р. Львів. 2016. Ч. 2. С. 21-23.
- Макурина Г. И. Клинико-лабораторные параллели тяжести псориаза и состояния апоптоза у пациентов с сопутствующей артериальной гипертензией. Актуальні питання теоретичної і практичної медицини : матеріали IV Міжнар. наук.-практ. конф. студентів і молодих учених (21-22.04.16). Сумы, 2016. С. 127.
- Макуріна Г. І. Апоптозні аспекти порушення метаболізму цитокінів при псоріазі та гіпертонічній хворобі. Весняні наукові читання : матеріали ІІ міжнар. наук.-практ. конф., 28 квітня 2016 р. Київ : «Велес», 2016. Ч. 2. С. 121-123.
- Макурина Г. И. Морфофункціональний стан шкіри у хворих на псоріаз із супутньою гіпертонічною хворобою. Актуальні питання косметології та дерматології : зб. матеріалів Х Всеукр. наук.-практ. конф. з міжнар. участю, 28-29 квітня 2016 р. Запоріжжя, 2016. С. 5-6.
- Макуріна Г. І. Динаміка рівня фактору некрозу пухлин альфа при псоріазі в умовах гіпертонічної хвороби. Актуальні питання розвитку медичних наук у ХХІ ст. : зб. тез наук. робіт учасників міжнар. наук.-практ. конф., 27-28 травня 2016 р. Львів, 2016. С. 39-42.
- Макуріна Г. І. Порівняльна характеристика перебігу псоріазу у чоловіків та жінок на тлі гіпертонічної хвороби. Особливості модернізації предмету досліджень представників медичних наук: зб. тез наук. робіт учасників між нар. наук.-практ. конф., 3-4 червня 2016 р. Київ, 2016. С. 68-70.
- Макуріна Г. І. Стан васкулярного ендотелію у хворих на ексудативний псоріаз. Медицина XXI століття: перспективні та пріоритетні напрями наукових досліджень: зб. матеріалів міжнар. наук.-практ. конф., Дніпро, 22–23 липня 2016. Дніпро : Організація наукових медичних досліджень «Salutem», 2016. С. 42-46.
- Макурина Г. И. Ангиогенез как патогенетический фактор прогрессирования заболевания в условиях хронического дерматоза. Медична наука та практика ХХІ століття : зб. тез міжнар. наук.-практ. конф. (Київ, 3-4 лютого 2017 р.). Київ : «Київський медичний науковий центр», 2017. С. 39-42.
- Макурина Г. И. Гомеостатический баланс гликемии как патогенетический аспект формирования хронического дерматоза на фоне артериальной гипертензии. Перспективні напрями розвитку сучасних медичних та фармацевтичних наук : зб. матеріалів міжнар. наук.-практ. конф. (Дніпро, 10-11 лютого 2017 р.). Дніпро : Організація наукових медичних досліджень «Salutem», 2017. С. 54-57.
- Макуріна Г. І. Ефективність комплексної терапії хворих на псоріаз. Актуальні питання наукової та практичної косметології 2017 : матеріали Всеукр. наук.-практ. конф. з міжнар. участю (27-28 квітня 2017 року, м. Запоріжжя). Запоріжжя, 2017. С. 21-22.
- Макурина Г. И. Динамика сывороточных значений кортизола и инсулина как регуляторов вуглеводного обмела у больных псориазом в сочетании с гипертонической болезнью на этапах долговременной адаптации. Південноукраїнський медичний науковий журнал. 2017. № 16. С. 62-63.
Відомості про апробацію результатів дисертації:
1. VІІІ Всеукраїнська науково-практична конференція з міжнародною участю «Актуальні питання наукової і практичної косметології», м. Запоріжжя, 17-18 квітня 2014р., усна доповідь: Макуріна Г.І. «Особливості клінічних проявів та перебігу псоріазу з супутньою артеріальною гіпертензією».
2. Науково-практична школа «Молоді науковці – майбутнє української дерматовенерології», м. Київ, 20-21 листопада 2014р., усна доповідь: Макуріна Г.І., Федотов В.П., Візір В.А. «Оцінка ефективності нових методів психокорекції в комплексній терапії хворих на псоріаз із супутньою артеріальною гіпертензією».
3. ІХ Всеукраїнська науково-практична конференція з міжнародною участю «Актуальні питання косметології та дерматології», м. Запоріжжя, 23-24 квітня 2015р., усна доповідь: Макуріна Г.І. «Цитокиновый профиль больных псориазом с сопутствующей гипертензией».
4. Х Всеукраїнська науково-практична конференція з міжнародною участю «Актуальні питання косметології та дерматології», м. Запоріжжя 28-29 квітня 2016р., усна доповідь: Макуріна Г.І. «Комплексна терапія хворих на вугрову хворобу».
5. Всеукраїнська науково-практична конференція УАЛДВК «Оптимізовані засади функціонування дерматовенерологічної служби в умовах розвитку страхової медицини та лікарського самоврядування в Україні», м. Київ, 5-6 листопада 2015р., усна доповідь: Макуріна Г.І. «Обґрунтування клінічних особливостей перебігу псоріазу при супутній артеріальній гіпертензії шляхом вивчення стану обміну оксиду азоту».
6. Всеукраїнська науково-практична конференція УАЛДВК з міжнародною участю «Сучасні підходи до формування клінічних настанов з діагностики і лікування шкірних захворювань та інфекцій, що передаються статевим шляхом європейський досвід та українські реалії», м. Тернопіль, 19-20 жовтня 2016р., усна доповідь: Макуріна Г.І. «Особливості клініки, перебігу і терапії хворих на псоріаз з супутньою артеріальною гіпертензією».
7. ІХ Всеукраїнська науково-практична конференція молодих вчених «Актуальні питання клінічної медицини», м. Запоріжжя, 30 жовтня 2015р., усна доповідь: Макуріна Г.І. «Результаты мониторирования артериального давления у пациентов, страдающих одновременно псориазом и гипертонической болезнью».
8. Всеукраїнська Таврійська науково-практична конференція за участю міжнародних спеціалістів «Сучасні технології в рішенні організаційних, епідеміологічних, клінічних та діагностичних задач дерматовенерології», м. Херсон, 4-5 червня 2015р., усна доповідь: Макуріна Г.І. «Цитокіновий статус у хворих на псоріаз у поєднанні з гіпертонічною хворобою».
9. Науково-практична конференція «Новітні технології діагностичних, лікувальних та профілактичних заходів в дерматовенерології та методи і стан їхнього впровадження», м. Харків, 11-12 листопада 2016р., усна доповідь: Макуріна Г.І., Федотов В.П. «Деякі механізми формування псоріазу на тлі поєднаної гіпертонічної хвороби».
10. Науково-практична конференція за участю міжнародних спеціалістів «Індивідуальна анатомічна мінливість органів, систем, тканин людини та її значення для практичної медицини і стоматології», м. Полтава, 19-20 травня 2016р., усна доповідь: Макуріна Г.І. «Патоморфогенез сполучнотканинного компоненту шкіри хворих на псоріаз і гіпертонічну хворобу».
11. Науково-практична конференція «Унифицированные медицинские установки в ведении пациентов с хроническими формами дерматозов», м. Дніпро, 25 березня 2016 р., усна доповідь: Макуріна Г.І. «Новые возможности лечения и профилактики дерматозов».
12. Науково-практична конференція із міжнародною участю «Сучасні аспекти удосконалення надання спеціазізованої дерматовенерологічної допомоги населенню за вимогами імплементації Міжнародних медіко-санітарних правил», м. Харків, 2015р., усна доповідь: Федотов В.П., Макуріна Г.І. «Сучасні зовнішні засоби в лікуванні псоріатичної хвороби».
13. Науково-практична конференція «ХV-і читання ім.В.В.Підвисоцького», м.Одеса, 26-27 травня 2016 р.,усна доповідь: Макуріна Г.І. «Апоптозні аспекти порушення метаболізму цитокінів при псоріазі та артеріальній гіпертензії».
