Тернопільський національний медичний університет
імені І. Я. Горбачевського МОЗ України
Державна установа «Інститут дерматології та венерології
Національної академії медичних наук України»
Кваліфікаційна наукова
праця на правах рукопису
Когут Ігор Йосипович
УДК 616.5-001/-002-06:616.352/.62-008.222/.223]-08
ДИСЕРТАЦІЯ
ОСОБЛИВОСТІ ЛІКУВАННЯ І ПРОФІЛАКТИКИ
ПРОСТОГО КОНТАКТНОГО ПОДРАЗНЮВАЛЬНОГО
ДЕРМАТИТУ, АСОЦІЙОВАНОГО З НЕТРИМАННЯМ
ФІЗІОЛОГІЧНИХ ВІДПРАВЛЕНЬ
14.01.20 – шкірні та венеричні хвороби
222. Медицина
Подається на здобуття наукового ступеня кандидата медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
_______________________________________________ Когут І.Й.
(підпис, ініціали та прізвище здобувача)
Науковий керівник: Галникіна Світлана Олександрівна,
доктор медичних наук, професор
Тернопіль – 2019
АНОТАЦІЯ
Когут І. Й. Особливості лікування і профілактики простого контактного подразнювального дерматиту, асоційованого з нетриманням фізіологічних відправлень – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук (доктора філософії) за спеціальністю 14.01.20 – шкірні та венеричні хвороби (222. Медицина). – Тернопільський національний медичний університет імені І. Я. Горбачевського МОЗ України, Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2020.
Дисертаційна робота присвячена вирішенню актуального наукового завдання – удосконаленню діагностики, підвищенню ефективності лікування та профілактики дерматиту, асоційованого з нетриманням, шляхом розробки методу зовнішньої терапії на підставі вивчення клінічних даних, показників оцінювальних інструментів та мікробіологічних досліджень.
Актуальність роботи зумовлена тенденцією до збільшення популяції людей похилого віку, внаслідок чого зростає кількість осіб з нетриманням та пов’язаного з ним простого контактного подразнювального дерматиту, який має загальноприйняту скорочену назву – «дерматит, асоційований з нетриманням» (ДАН), частота якого серед мешканців будинків догляду досягає 36 %, тому становить не тільки медичну, а й соціальну проблему. Крім подразнювальної дії сечі і калу на шкіру в умовах оклюзії та мацерації, в патогенезі хвороби має значення зміна мікробіому шкіри, особливо підвищення частоти вторинної кандидної колонізації.
У догляді за шкірою при нетриманні дотримуються трьох послідовних етапів: очищення, зволоження і захисту, для чого використовують відповідні окремі або комбіновані засоби, проте більшість з них потребує підтвердження у клінічних дослідженнях. Пошук препарату, який може одночасно поєднувати очисні, зволожувальні, захисні й антисептичні властивості становить важливе наукове завдання, для вирішення якого у даній роботі було розроблено метод зовнішнього лікування і профілактики ДАН із використанням камфорної олії (камфора рацемічна 0,1 г у 1 мл олії соняшникової). Враховано, що камфора має місцеву протизапальну, антисептичну, протигрибкову, дезодоруючу дію, а соняшникова олія – очищувальні, емолієнтні та захисні властивості.
У проспективне спостережне дослідження увійшли 134 дорослі пацієнти з ДАН віком від 36 до 92 років, які перебували на тривалому стаціонарному догляді, серед яких 61,9 % становили жінки. У всіх пацієнтів було нетримання сечі, яке поєднувалось з нетриманням калу у 35,8 % осіб. Основну групу склали 104 хворих, які для очищення і захисту шкіри отримували запропонований метод зовнішнього лікування і профілактики ДАН, у якому просякнутими камфорною олією серветками очищували забруднені сечею та/або калом ділянки шкіри до досягнення чистої поверхні, після чого, для подальшого захисту шкіри, всі уражені ділянки та інтактні зони ризику змащували новою серветкою, просякнутою досліджуваним препаратом до отримання легкого жирного блиску поверхні шкіри. У групі порівняння (30 хворих) застосовували гігієнічні засоби, а саме, вологі серветки 3 в 1 або поєднання піни для очищення шкіри із захисним кремом. Порівнянню підлягали показники оцінювальних інструментів та лабораторних досліджень, визначені до початку та через один місяць лікування.
Для стандартизованої діагностики та визначення тяжкості ДАН у даній роботі було застосовано клінічно верифіковані оцінювальні інструменти, а саме: «Інструмент для визначення тяжкості дерматиту, асоційованого з нетриманням відправлень» (IADS); «Інтервенційний інструмент для оцінення дерматиту, асоційованого з нетриманням» (IAD-IT); «Гентський глобальний категоризаційний інструмент для ДАН» (GLOBIAD).
Встановлено, що характерними клініко-епідеміологічними ознаками ДАН є похилий вік ([77 ± 11] років), обмежена рухова активність (90,3 %), ураження нижніх частин сідниць, геніталій, міжсідничної складки та періанальної шкіри (70 % і більше), яскрава еритема (70 %), ерозії (50 %), грибкові висипання (51 %). Згідно з даними оцінювальних інструментів визначено, що типовими для ДАН є середній показник IADS [20,2 ± 6,5] бала, помірний ступінь за IAD – IT (60,6 %) і категорія 2В за GLOBIAD (28,8 %). Виявлено, що при подвійному нетриманні достовірно підвищується в 1,4 раза загальний бал тяжкості IADS, частіше розвивається тяжкий ступінь хвороби згідно з IAD-IT та категорії 1В, 2А і 2В згідно з GLOBIAD.
Мікробіологічні дослідження показали, що виявлення патогенних для шкіри бактерій є відносно низьким та не перевищує 4,8 % для золотистого стафілокока, 1,9 % – для гемолітичних стрептококів і 2,9 % для синьогнійної палички. Домінуюче місце у патогенному мікробіомі посідає Candida spp., яка висівається з поверхні ураженої шкіри у 37,5 % випадків, а при подвійному нетриманні її частота збільшується в 1,3 раза (47,9 %). Грибкові висипання підтверджуються за допомогою мікологічного посіву у 58,5 % випадків. Кандидна колонізація достовірно (р <0,001) пов’язана зі збільшенням показника загального балу IADS в 1,3 раза, зростанням ступеня тяжкості згідно з інструментом IAD-IT та підвищенням категорії захворювання згідно з інструментом GLOBIAD.
Запропонована методика зовнішнього застосування камфорної олії мала задовільні переносимість та профіль безпеки, на що вказували відсутність побічних ефектів та збереження показників загальноклінічних лабораторних аналізів у межах допустимих норм. Фармакоекономічний аналіз запропонованої методики зовнішнього використання камфорної олії показав суттєве зменшення витрати коштів у 2,5 раза порівняно з вартістю гігієнічних засобів для догляду за шкірою при нетриманні.
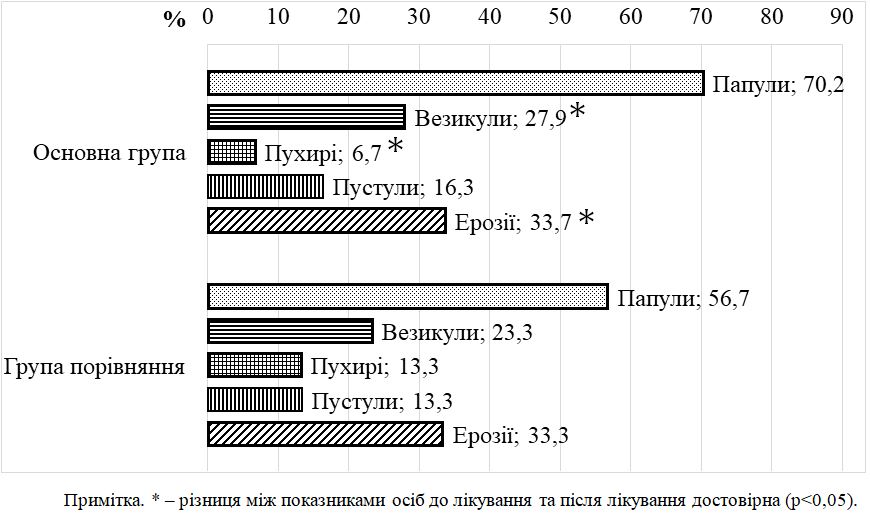
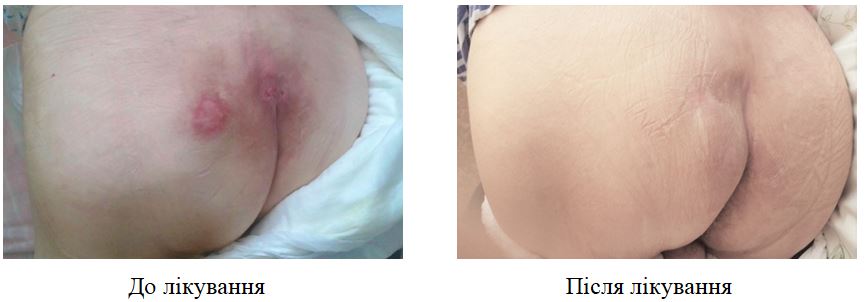
Після одномісячного курсу місцевого застосування камфорної олії у хворих на ДАН зменшилась кількість уражених ділянок шкіри в 1,2 – 2,1 раза, випадків яскравої еритеми у 12,0 разів, везикул – в 1,6 раза, пухирів – у 2,4 раза, ерозій – в 1,5 раза, грибкових висипань –в 1,6 раза. Недостатнім виявився лікувальний ефект тільки на нижніх частинах сідниць та пахвинних складках, що можна пояснити ймовірним негативним впливом тісно прилягаючих у цих місцях ізолюючих облямівок підгузків. За результатами оцінювальних інструментів після застосування запропонованого методу відбулося достовірне (p < 0,01) зниження загального балу IADS у 2 раза, зменшилась кількість випадків тяжкого ступеня IAD-IT в 1,5 раза і кількості випадків категорії 2В GLOBIAD в 1,9 раза. Встановлено, що в осіб з подвійним нетриманням, порівняно з нетриманням сечі, після лікування загальний бал тяжкості IADS залишався достовірно вищим в 1,5 раза, а частота виявлення кандидної колонізації переважала у 5,7 раза. Визначено, що кандидна колонізація, порівняно з випадками без колонізації, після проведеного лікування також пов’язана з вищим балом IADS в 1,5 раза, та суттєво переважає при тяжкому ступені IAD-IT у 6,0 раза та у категорії 2В GLOBIAD у 3,5 раза. Мікологічний аналіз виявив достовірне зниження частоти кандидної колонізації шкіри у 3,3 раза та частоти мікологічно верифікованих грибкових висипань у 3,8 раза.
Встановлено, що зовнішнє застосування камфорної олії має достовірну перевагу над гігієнічними засобами з догляду за шкірою у зменшенні частоти везикул та пухирів, збільшенні числа пацієнтів з легким ступенем хвороби, зниженні частоти виявлення Candida spp. в осіб з помірним ступенем тяжкості за IAD-IT, а в осіб з подвійним нетриманням – у додатковому зменшенні випадків помірного ступеня ДАН.
Відсутність еритеми чи інших симптомів у первинно інтактних зонах типового розташування ДАН, в яких проводилася обробка шкіри камфорною олією впродовж усього періоду спостереження, вказує на задовільний профілактичний ефект досліджуваного препарату.
Отже, запропонована методика зовнішнього лікування і профілактики ДАН має задовільний профіль безпеки, високу клінічну ефективність і помітний фармакоекономічний результат, на що вказують показники оцінювальних інструментів, лабораторних досліджень і математичних підрахунків. Крім того встановлено, що використання камфорної олії має перевагу над гігієнічними засобами догляду за шкірою в осіб з подвійним нетриманням та супутньою кандидною колонізацією шкіри.
Ключові слова: дерматит, асоційований з нетриманням, простий контактний подразнювальний дерматит, догляд за шкірою, камфора, камфорна олія, оцінювальні інструменти, кандида.
SUMMARY
Kohut I. J. Treatment and prevention features of simple contact irritant incontinence associated dermatitis. − Qualification scientific work on the rights of the manuscript.
Dissertation for the scientific degree of the candidate of medical sciences (Philosophy Doctor) in specialty 14.01.20 «Skin and Venereal Diseases» (222. Medicine). – I. Horbachevsky Ternopil National Medical University of Ministry of Health of Ukraine, State Establishment «Institute of Dermatology and Venereology of NAMS of Ukraine», Kharkiv, 2020.
This Thesis is aimed to solve the important scientific problem – to improve the diagnostics, treatment, and prevention of incontinence-associated dermatitis by developing a method of external therapy according to clinical data, indicators of evaluation tools and results of microbiological tests.
Actuality of Thesis is tied with a tendency to increasing of aged people in population resulting in an elevation of incontinent persons and related simple contact irritant dermatitis, commonly and briefly named Incontinence-Associated Dermatitis (IAD), reported to affect 36 % patients of care homes, presenting not only medical but also a social problem. Besides to the irritation of the skin by urine and faeces under occlusion and maceration, the change of microbiome, especially the increasing level of secondary candidal colonization, plays an important role in the pathogenesis of the disease.
Skin care regime in incontinence includes three consecutive steps: cleansing, moisturizing, and protecting, by using appropriate separate products or their combination, but most of these products need evaluation in clinical trials. Searching for a medicine that can combine cleansing, moisturizing, protective and antiseptic properties forms an important scientific task. To solve this task in this work, a method of external treatment and prevention of IAD with using camphorated oil (solution of racemic camphor 0.1 g in 1 ml of sunflower oil) was worked out. It is taken into account that camphor has local anti-inflammatory, antiseptic, antifungal, deodorizing effect, and sunflower oil – cleansing, emollient and protective properties.
This prospective observational study included 134 adult patients with IAD aged 36 to 92, hospitalized in long-term care units, 61,9 % of participants were women. All patients were urinary incontinent while 35.8 % of residents had double urinary and faecal incontinence. The main group included 104 patients who received a cleansing and protection of the skin by the proposed method of external treatment and prevention of IAD, in which contaminated with urine and/or faeces skin is cleaned by wipes impregnated with camphorated oil to achieve a clean surface, then to further protection of the skin, all affected areas and intact risk areas were wiped with a new cloth impregnated with camphorated oil to obtain a lightly oily shine surface.
In the comparison group (30 patients) wet wipes 3 in 1 or a combination of cleansing foam with protective cream were used. Study evaluations were compared at pre-treatment and 1-month post treatment timelines by mean of evaluation tools and laboratory tests. Clinically verified evaluation tools were used in this study for standardized diagnostics and assessment of disease severity, namely: “The Incontinence Associated Dermatitis and Its Severity Instrument” (IADS), “Incontinence Associated Dermatitis Intervention Tool” (IAD-IT), and The Ghent Global IAD Categorization Tool (GLOBIAD).
It was found in the study that the characteristic clinical and epidemiological signs of incontinence-associated dermatitis are: old age ([77 ± 11] years), limited motor activity (90.3%), localisation of lesions on the lower buttocks, genitals, crease between buttocks and perianal skin (70% or more), severe erythema (70%), erosions (50%), fungal rashes (51%). According to the evaluation tools, typical signs of IAD are: an average IADS score (20.2 ± 6.5) points, a moderate degree by IAD – IT (60.6%) and category 2B by GLOBIAD (28.8%). It was found that double incontinence significantly increases the overall IADS severity score by 1.4 times, causes higher rates of IAD-IT severe grade and GLOBIAD categories 1B, 2A and 2B.
According microbiological studies the detection of pathogenic bacteria on the skin is relatively low and does not exceed 4.8% for Staphylococcus aureus, 1.9% for Streptococcus haemolyticus and 2.9% for Pseudomonas aeruginosa. Candida spp. dominates in the pathogenic microbiome presenting isolation rate 37.5% on the affected skin, moreover double incontinence increases this rate by 1.3 times (47.9%). Fungal rashes are confirmed by mycological culture in 58.5% of cases. Candida spp. colonization is significantly (p <0.001) associated with a 1.3-fold increase in the overall IADS score, an increase in the severity grade according to the IAD-IT, and an increase in the disease category according to the GLOBIAD.
The proposed method of external application of camphorated oil had satisfactory tolerability and safety profile, which was proved by the absence of side effects and maintaining of laboratory tests results within normal ranges. Pharmacoeconomic analysis of the proposed method of external use of camphorated oil revealed a significant reduction in spending in 2.5 times compared to the cost of hygienic products for incontinence skin care.
After a one-month course of topical application of camphor oil in patients with IAD the number of affected skin areas decreased in 1.2 – 2.1 times, cases of erythema lowered in 12.0 times, vesicles – in 1.6 times, blisters – in 2.4 times, erosions – in 1.5 times, fungal rashes – in 1.6 times. The therapeutic effect was found to be insufficient only on the lower parts of the buttocks and inguinal folds, which can be explained by the probable negative impact of the closely adjacent insulating borders of diapers in these places. According to evaluation tools after the application of the proposed method the total IADS score significantly (p <0,01) reduced by 2 times, the number of severe cases of IAD-IT decreased by 1.5 times and the number of cases of category 2B GLOBIAD - by 1.9 times.
It was found that in persons with double incontinence, compared with urinary incontinence after treatment, the IADS overall severity score remains significantly higher by 1.5 times, and the level of candidal colonization – by 5.7 times higher. It was determined that candidal colonization, compared with cases without colonization, after treatment is also associated with a higher IADS score in 1.5 times. Candida spp. significantly prevails in severe IAD-IT by 6 times and in category 2B GLOBIAD – by 3.5 times. Mycological analysis revealed a significant decrease in candidal colonization by 3.3 times and in mycologically verified fungal rashes rate – by 3.8 times.
It has been determined that the external application of camphorated oil has a significant advantage over hygienic skin care products in reducing the frequency of vesicles and blisters, increasing the number of patients with mild disease, reducing the rate of candidal colonization in patients with moderate IAD-IT grade, and additional reducing of moderate IAD cases in persons with double incontinence.
The absence of erythema or other symptoms in the primary intact areas of the typical incontinence-associated dermatitis locations after course of application with camphorated oil throughout the observation period indicates on a satisfactory preventative effect of the study drug.
Based on the data obtained, the proposed method of external treatment and prevention of incontinence-associated dermatitis has satisfactory safety profile, high clinical effectiveness and pharmacoeconomic result, approved by results of evaluation tools, laboratory tests and calculations. In addition, application of camphorated oil has been found to have an advantage over hygienic skin care products in cases with double incontinence and concomitant candidal colonization of the skin.
Key words: incontinence associated dermatitis, simple contact irritant dermatitis, skin care, Camphor, camphorated oil, evaluation tools, Candida.
СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА
- Галникіна С.О., Когут І.Й. Дерматит, асоційований з нетриманням фізіологічних відправлень – новий підхід до «старої» проблеми. Український журнал дерматології, венерології, косметології. 2016. № 1 (60). С. 87–92.
- Когут І.Й., Галникіна С.О. Визначення ефективності лікування дерматиту, асоційованого з нетриманням фізіологічних відправлень за допомогою IADS і IAD-IT. Журнал дерматовенерології та косметології ім. М.О.Торсуєва. 2017. №. 2 (38). С. 98–101.
- Когут І.Й., Галникіна С.О. Застосування категоризаційного інструмента GLOBIAD для моніторингу дерматиту, асоційованого з нетриманням. Український журнал дерматології, венерології, косметології. 2018. № 3. С. 110–114.
- Когут І.Й., Галникіна С.О. Застосування оцінювальних інструментів IADS і IAD-IT при дерматиті, асоційованому з нетриманням відправлень. Ліки України плюс. 2018. № 1. С. 27–31.
- Когут І.Й., Галникіна С.О. Клініко-економічна ефективність застосування камфорної олії при дерматиті, асоційованому з нетриманням. Вісник соціальної гігієни та організації охорони здоров’я України. 2018. № 4 (78). С. 69–74.
- Kohut I., Galnykina S. The efficacy of topical camphorated oil in long-term care of residents with incontinence-associated dermatitis. Dermatology Review/Przegląd Dermatologiczny. 2019. Vol. 106, Iss. 6. P. 683–686.
- The role of Candida spp. contamination and efficacy of camphorated oil in skin care of incontinent associated dermatitis patients / I. Kohut, S. Galnykina, M. Kushynska et al. Pol Med J. 2020. Vol.XLVIII, Iss. P. 35–39.
- Пат. на корисну модель 107279 UA, МПК A61K 31/125, A61P 17/00, A61F 13/47, A61L 15/16. Спосіб лікування контактного дерматиту, асоційованого з нетриманням фізіологічних відправлень / С.О. Галникіна, І.Й. Когут, А.В. Павлишин; заявник і патентовласник ДВНЗ «Тернопільський державний медичний університет ім. І.Я.Горбачевського МОЗ України». № u201512640; заявл. 21.12.15; опубл. 25.05.16, Бюл. № 10.
- Когут І.Й. Особливості вторинного інфікування поверхні шкіри у хворих на асоційований з нетриманням дерматит. Інфекційні хвороби: поступи і проблеми в діагностиці, терапії і профілактиці: Матеріали ІХ з’їзду інфекціоністів України. м. Тернопіль, 7–9 жовтня 2015 р. Тернопіль : Укрмедкнига, 2015. С. 252–253.
- Галникіна С.О., Когут І.Й., Павлишин А.В. Лікування контактного дерматиту асоційованого з нетриманням фізіологічних відправлень. Zbior artykulow naukowych konferencji miedzynarodnowej naukowo-praktycnej „Osiagniecia naukowe, rozwoj, propozyciye na rok 2015” (30.12.2015 – 03.01.2016). Warszawa: Sp. Z.o.o. „Diamond trading tour”, 2015. P. 45–47.
- Когут І.Й. Порівняння ефективності препарату «Камфорна Олія» у лікуванні дерматиту, асоційованому з нетриманням фізіологічних відправлень. Дерматовенерологія. Косметологія. Сексопатологія. 2016. № 3–4. С. 47–48.
- Когут І.Й. Догляд за шкірою при дерматиті, асоційованому з нетриманням відправлень у хронічних хворих. Сучасні підходи до формування клінічних настанов з діагностики і лікування шкірних захворювань та інфекцій, що передаються статевим шляхом: європейський досвід та українські реалії: Всеукраїнська науково-практична конференція Української асоціації лікарів-дерматовенерологів і косметологів. м. Тернопіль, 19–20 жовтня 2016 р. Український журнал дерматології, венерології, косметології. 2016. № 4. С. 122–123.
- Kohut I., Galnykina S. Application of “Camphor Oil” medication in management of incontinence associated dermatitis. 2nd international transcaucasus congress on photodermatology and skin cancer; 2016 Oct 27–29, Tbilisi, Georgia. Tbilisi : ITC, 2016. P. 56.
- Когут І.Й., Галникіна С.О. Застосування діагностичних методик IADS і IAD-IT при дерматиті, асоційованому з нетриманням випорожнень. Здобутки клінічної та експериментальної медицини: матеріали підсумкової науково-практичної конференції, присвяченої 60-річчю ТДМУ. м. Тернопіль, 14 червня 2017 р. Тернопіль : ТДМУ, 2017. С. 55–57.
- Когут І.Й., Галникіна С.О. Супутня інфекція Candida spp. при дерматиті, асоційованому з нетриманням. Здобутки клінічної та експериментальної медицини: матеріали підсумкової науково-практичної конференції. м. Тернопіль, 6 червня 2018 р. Тернопіль : ТДМУ, 2018. С. 36–37.
- Когут І.Й., Галникіна С.О. Моніторинг перебігу дерматиту, асоційованого з нетриманням, за допомогою категоризаційного інструмента GLOBIAD. XVII конгрес світової федерації українських лікарських товариств: матеріали наукового симпозіуму. м. Тернопіль, 20 вересня 2018 р. Тернопіль : ТДМУ, 2018. С.176.
- Kohut I. Topical camphorated oil in incontinence-associated dermatitis. IDEA Congress 2019, 24-28 April 2019, Istanbul, Turkey. Istanbul : IDEA, 2019. P. 26.
- Когут І.Й., Галникіна С.О. Клініко-економічне обґрунтування застосування камфорної олії при дерматиті, асоційованому з нетриманням. Здобутки клінічної та експериментальної медицини: матеріали підсумкової LXII наук.-практ. конф., присвяченої 165-річчю від дня народження Івана Яковича Горбачевського, м. Тернопіль, 13 черв. 2019 р. Тернопіль : ТНМУ, 2019. С. 16–17.
ЗМІСТ
| Перелік умовних скорочень | 16 |
| Вступ | 17 |
| Розділ 1 епідеміологія, етіопатогенез, клініка, діагностика, лікування та профілактика дерматиту, асоційованого з нетриманням (огляд літератури) | 24 |
| 1.1 Епідеміологічна характеристика дерматиту, асоційованого з нетриманням | 24 |
| 1.2 Основні ланки патогенезу дерматиту, асоційованого з нетриманням | 25 |
| 1.3 Мікробіоценоз поверхні шкіри | 29 |
| 1.4 Діагностика дерматиту, асоційованого з нетриманням, та оцінювальні інструменти | 32 |
| 1.5 Сучасні підходи до лікування і профілактика дерматиту, асоційованого з нетриманням | 37 |
| Розділ 2 Матеріали та методи дослідження | 49 |
| 2.1 Критерії включення | 49 |
| 2.2 Критерії виключення | 49 |
| 2.3 Дизайн дослідження | 50 |
| 2.4 Методи клінічних досліджень 3 | 51 |
| Розділ 3 клініко-інструментальна характеристика хворих | 60 |
| 3.1 Загальна клінічна характеристика хворих | 60 |
| 3.2 Локалізація ділянок ураження дерматиту, асоційованого з нетриманням | 61 |
| 3.3 Поширеність та інтенсивність еритеми | 63 |
| 3.4 Інші первинні висипання та порушення цілісності шкіри | 63 |
| 3.5 Грибкові висипання у хворих на дерматит, асоційований з нетриманням | 64 |
| 3.6 Оцінка тяжкості дерматиту, асоційованого з нетриманням за показниками IADS | 64 |
| 3.7 Характеристика дерматиту, асоційованого з нетриманням за ступенями тяжкості згідно IAD-IT | 66 |
| 3.8 Категорії GLOBIAD | 67 |
| Розділ 4 Показники мікробіологічного обстеження біотопів шкіри у хворих на дерматит, асоційований з нетриманням | 72 |
| 4.1 Патогенна мікробіота шкіри в осередках ураження дерматиту, асоційованого з нетриманням | 72 |
| 4.2 Кандидна колонізація при різних типах нетримання | 74 |
| 4.3 Верифікація грибкових висипань і супутній кандидоз шкіри | 74 |
| 4.4 Показники оцінювальних інструментів залежно від кандидної колонізації | 76 |
| Розділ 5 Обґрунтування тактики зовнішнього лікування у хворих на дерматит, асоційований з нетриманням | 81 |
| 5.1 Стандартний режим догляду за хворими | 81 |
| 5.2 Догляд за шкірою за допомогою гігієнічних засобів | 82 |
| 5.3 Догляд за шкірою із використанням камфорної олії | 83 |
| 5.4 Патогенетичне обгрунтування показання до зовнішнього застосування камфорної олії для догляду за шкірою при нетриманні | 83 |
| 5.5 Характеристика активної речовини | 84 |
| 5.6 Фармако-економічне обгрунтування | 85 |
| Розділ 6 Результати лікування хворих на дерматит, асоційований з нетриманням | 90 |
| 6.1 Показники загальноклінічних лабораторних аналізів | 90 |
| 6.2 Зміна частоти ураження різних ділянок шкіри | 91 |
| 6.3 Зміни інтенсивності еритеми | 93 |
| 6.4 Інші первинні висипання та порушення цілісності шкіри | 95 |
| 6.5 Зміна показників оцінювальних інструментів | 97 |
| 6.6 Зміна стану мікробної колонізації шкіри | 104 |
| 6.7 Клінічні випадки у пацієнтів основної гупи | 110 |
| Розділ 7 Аналіз та узагальнення результатів дослідження | 114 |
| Висновки | 138 |
| Рекомендації | 140 |
| Список використаних джерел | 141 |
| Додаток А Дозвіл на використання і переклад інструмента IAD-IT | 160 |
| Додаток Б Дозвіл на використання і переклад інструмента GLOBIAD | 161 |
| Додаток В Інструкція для медичного застосування лікарського засобу «Камфорна олія» | 162 |
| Додаток Г Витяг з «Державного реєстру лікарських засобів України» | 165 |
| Додаток Д Акти впровадження | 166 |
| Додаток Е Список публікацій за темою дисертації та відомості про апробацію дисертації | 171 |
ПЕРЕЛІК УМОВНИХ СКОРОЧЕНЬ
ДАН – дерматит, асоційований з нетриманням
CI – confidence interval, довірчий інтервал
GLOBIAD – Гентський глобальний категоризаційний інструмент для дерматитів, асоційованих з нетриманням (The Ghent Global IAD Categorisation Tool)
IAD – дерматит, асоційований з нетриманням (Incontinence Associated Dermatitis)
IAD-IT – інтервенційний інструмент для оцінення дерматиту, асоційованого з нетриманням (Incontinence Associated Dermatitis Intervention Tool)
IADS – інструмент для визначення тяжкості дерматиту, асоційованого з нетриманням відправлень (The Incontinence Associated Dermatitis .and Its Severity Instrument)
MALDI-TOF – матрично-активована лазерна десорбція/іонізація-час-пролітання (Matrix Assisted Laser Desorption/Ionization-time-of-flight)
OR – odds ratio (відношення шансів);
PAS – Periodic acid – Schiff (періодична кислота Шиффа)
Актуальність теми. За даними звіту ООН про старіння населення світу, прогнозується переважання кількості жителів старших за 60 років [152]. На думку Lambert D. (2012), зі збільшенням у популяції кількості літніх людей зростає частота нетримання фізіологічних відправлень [128]. У місцях повторної локальної дії сечі та/або калу розвивається простий контактний подразнювальний дерматит, асоційований з нетриманням фізіологічних відправлень, який має загальноприйняту скорочену назву – «дерматит, асоційований з нетриманням» (ДАН), в англомовній літературі – incontinence-associated dermatitis (IAD) [48, 91, 109].
Враховуючи щораз вищі вимоги практичної медицини, забезпечення якісного догляду за хворими розглядається не лише медичною, а і соціальною проблемою. Кутасевич Я.Ф. (2019), вказує на наявність психоемоційного компоненту, що може суттєво обтяжити перебіг основного захворювання [38]. Mugita Y. et al. (2018) повідомляють, що у мешканців будинків догляду, нетримання спостерігається у 59,8 %, а серед останніх поширеність ДАН досягає 36,0 % [116]. Gray M., Giuliano K. (2018) подають дані, що серед госпіталізованих пацієнтів з нетриманням частота ДАН досягає 45,7 % [135]. Bliss D. et al. (2015) вказують, що ДАН розвивається приблизно через 2 тижні після початку фекального або подвійного нетримання [102]. Rohwer K. et al. (2013) отримали дані, що при фекальному нетриманні частота ДАН досягала 52,2 % [156].
Олійник І.О. та ін. (2018) звертають увагу на зміну складу мікробіоценозу поверхні шкіри, зокрема збільшення частоти висівання золотистого стафілококу при хронічних дерматозах [31]. На думку Campbell J. et al. (2017), бактеріальне інфікування шкіри не пов’язують з ДАН, тоді як клінічні ознаки інфікування Candida albicans, відповідно до візуального огляду кандидозного висипу, спостерігаються у 18 – 32 % пацієнтів і підтверджуються мікробіологічним дослідженням у 60 – 75 % випадків. Залишається нез’ясованим, чи нетримання сприяє підвищеній кандидній колонізації у пацієнта, чи, навпаки, нетримання виступає тригером для розвитку кандидної інфекції уже колонізованої шкіри [61, 64]. Bonifaz A. et al. (2016) вважають, що кандидні гриби найбільше відповідальні за вторинне інфікування поверхні шкіри при ДАН та виявляються у понад 80 % ускладнених випадків [161]. Van L. et al. (2008) вказують на високу ймовірність впливу супутнього кандидозу на формування тяжкого перебігу хвороби [172].
Foureur N. et al. (2006) вказують, що біопсія та гістопатологічне дослідження виявилися неспецифічними для діагностики ДАН під час первинної консультації [151]. Тому для об’єктивного визначення тяжкості та ризику розвитку ДАН запропоновано використовувати спеціальні оцінювальні інструменти у вигляді шкал, індексів чи алгоритмів [143, 91, 59].
У рекомендаціях з догляду за шкірою та лікування ДАН присутні пропозиції щодо використання різноманітних топічних засобів, проте більшість з них потребує належних клінічних досліджень. Використання комерційних засобів для догляду за шкірою, особливо зволожувачів, несе ризики, пов’язані з вмістом консервантів, ароматичних і парфумерних добавок, сурфактантів. За даними Beeckman D. et al. (2015) відомо лише про невелику кількість проведених клінічних досліджень, низької або середньої якості, в яких вивчалися засоби з догляду за шкірою при ДАН у дорослих [150]. Наявні в Україні засоби з догляду за шкірою при ДАН є відносно дороговартісними продуктами, тому існує потреба у пошуку ефективних і водночас економічно доступних препаратів для лікування і профілактики даного захворювання.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота виконана згідно з планом наукових досліджень, комплексної науково-дослідної програми кафедри управління та економіки фармації з технологією ліків Тернопільського національного медичного університету ім. І.Я. Горбачевського МОЗ України «Маркетингові, фармакоекономічні та технологічні дослідження із створення лікарських засобів» (№ державної реєстрації 0115U001530), в якій здобувач обґрунтував ефективність застосування олійного розчину камфори рацемічної для лікування ДАН.
Мета та задачі дослідження. Мета – підвищити ефективність лікування і профілактики дерматиту, асоційованого з нетриманням шляхом розробки методу зовнішньої терапії на підставі вивчення клінічних даних, показників оцінювальних інструментів та складу мікробіоценозу шкіри.
Відповідно, для досягнення мети були окреслені такі задачі дослідження:
- Вивчити клініко-епідеміологічні особливості перебігу ДАН на сучасному етапі.
- Визначити склад патогенної мікрофлори уражених ділянок шкіри у хворих на ДАН.
- Дослідити вплив типу нетримання та супутньої кандидної колонізації шкіри на перебіг ДАН.
- Розробити метод зовнішнього лікування дерматиту, асоційованого з нетриманням, з урахуванням результатів об’єктивного обстеження, показників оцінювальних інструментів, мікробіологічних досліджень та економічних даних.
- Визначити профіль безпеки місцевого застосування камфорної олії.
- З’ясувати профілактичну дію та економічну доцільність використання камфорної олії у хворих з нетриманням сечі і калу.
Об’єкт дослідження: простий контактний подразнювальний дерматит, асоційований з нетриманням.
Предмет дослідження: клінічні симптоми ДАН, показники оцінювальних інструментів для ДАН, показники мікробної колонізації уражених ділянок шкіри, фармакоекономічні дані.
Методи дослідження: загальні клінічні методи (збір анамнезу, об’єктивне обстеження), застосування оцінювальних інструментів IADS, IAD-IT, GLOBIAD (визначення ступеня тяжкості, стадії та категорії перебігу хвороби), лабораторні методи (клінічні аналізи крові, сечі, біохімічні аналізи крові), мікробіологічні дослідження (мікроскопічні та культуральні дослідження патогенних мікроорганізмів в осередках ураження шкіри), математично-статистичні методи.
Наукова новизна одержаних результатів. У хворих на ДАН, які перебувають на довготривалому стаціонарному догляді, вперше встановлено типові клінічні характеристики хвороби, визначено ступені тяжкості захворювання та проведено категоризацію пацієнтів за допомогою оцінювальних інструментів.
Уточнено наукові дані про стан мікробної колонізації шкіри при ДАН, виявлено домінування колонізації Candida spp, частота якої досягає 37,5 %.
З’ясовано, що тяжкість ДАН залежить від типу нетримання та супутньої кандидної колонізації шкіри. Вперше визначено, що частота кандидної колонізації зростає при подвійному нетриманні в 1,3 раза (до 47,9 %), а при тяжкому ступені хвороби – в 1,8 раза (до 65,4 %).
Уперше науково обґрунтовано і доведено клінічну ефективність та економічну доцільність запропонованого методу зовнішнього лікування та профілактики ДАН із використанням препарату камфорної олії.
Уперше доведено, що запропонований метод зовнішнього лікування має достовірно вищу клінічну ефективність, порівняно з гігієнічними засобами з догляду за шкірою при ДАН в осіб з подвійним нетриманням і колонізацією шкіри Candida spp.
Практичне значення одержаних результатів. Запропоновано використання вперше перекладених автором на українську мову міжнародно рекомендованих оцінювальних інструментів IADS, IAD-IT, GLOBIAD, які дозволяють стандартизувати діагностику ДАН, а саме визначати ділянки ураження, інтенсивність гіперемії, ознаки інфікування шкіри, перебіг захворювання, підраховувати загальний бал тяжкості у діапазоні від 0 до 52, проводити категоризацію хворих, а також порівнювати отримані показники у динаміці.
Розроблено та впроваджено у практику новий спосіб лікування та профілактики ДАН, який полягає в тому, що очищення і захист шкіри від дії сечі і калу проводиться за допомогою марлевих серветок, просякнутих камфорною олією тричі на добу із подальшою заміною підгузків (патент України на корисну модель № 107279 від 25.05.2016 р.).
Запропоновано надавати перевагу місцевому використанню камфорної олії для лікування ДАН в осіб з подвійним нетриманням, а також у хворих виявленою Candida spp., яке забезпечує, на відміну від гігієнічних засобів для догляду за шкірою, суттєве зниження частоти помірного ступеня хвороби у 2,0 раза, та зменшення частоти показника кандидної колонізації ураженої шкіри у 6,5 раза.
Підраховано, що місцеве застосування камфорної олії є у 2,5 раза дешевшим за гігієнічні засоби у формі вологих салфеток чи очищувальної піни із захисним кремом.
Результати роботи мають застосування у практиці дерматовенерологів, сімейних лікарів, геріатрів та працівників інших медичних спеціальностей, які надають медичну допомогу хворим з нетриманням.
Розроблена автором методика лікування і профілактики ДАН і використання оцінювальних інструментів впроваджені у практичну роботу Комунального закладу «Івано-Франківський обласний клінічний шкірно-венерологічний диспансер», Вінницького обласного клінічного шкірно-венерологічного диспансеру Вінницької обласної ради, а також у навчальний процес кафедри інфекційних хвороб з епідеміологією, шкірними та венеричними хворобами Тернопільського національного медичного університету ім. І.Я. Горбачевського МОЗ України, кафедри дерматології, венерології Львівського національного медичного університету ім. Данила Галицького, кафедри шкірних та венеричних хвороб Вінницького національного медичного університету ім. М. І. Пирогова.
Особистий внесок здобувача. Дисертаційна робота є самостійною науковою працею автора. Дисертант особисто виконав патентно–інформаційний пошук та аналіз наукової літератури, підбір тематичних хворих та їх клінічне обстеження, проспективне спостереження за хворими шляхом збору відомостей про перебіг захворювання та кінцеві точки за допомогою діагностичних інструментів, статистичну обробку цифрових даних, написав та оформив дисертацію.
Здобувач, з дозволу авторів, самостійно переклав на українську мову міжнародні, клінічно верифіковані, оцінювальні інструменти для діагностики і лікування ДАН, а саме: «Інтервенційний інструмент для оцінки дерматиту, асоційованого з нетриманням», англійською «Incontinence Associated Dermatitis Intervention Tool» (IAD-IT); «Інструмент для визначення тяжкості дерматиту, асоційованого з нетриманням відправлень», англійською «The Incontinence Associated Dermatitis And Its Severity Instrument»(IADS); «Гентський глобальний категоризаційний інструмент для ДАН», англійською «The Ghent Global IAD Categorisation Tool», (GLOBIAD).
Основні положення роботи та висновки обговорено з науковим керівником і сформульовано автором самостійно. Усі результати автор отримав особисто або за безпосередньої участі. Дисертантом самостійно проведено комплексне клініко-лабораторне обстеження та лікування 134 хворих на ДАН, облік і статистичну обробку показників результатів обстежень. Запозичень ідей та розробок співавторів публікацій не було. Формулювання завдань та інтерпретацію результатів здійснено разом з науковим керівником. У наукових працях, опублікованих у співавторстві, автору належить аналіз літератури, дані експериментальних досліджень, їх статистична обробка та підготовка матеріалу до друку.
Апробація результатів дисертації. Основні наукові положення, висновки та практичні рекомендації дисертаційної роботи були представлені на: підсумковій науково-практичній конференції, присвяченій 60-річчю Тернопільського державного медичного університету «Здобутки клінічної та експериментальної медицини» (Тернопіль, 2017); підсумковій науково-практичній конференції «Здобутки клінічної та експериментальної медицини» (Тернопіль, 2018); науковому симпозіумі «XVII конгрес світової федерації українських лікарських товариств» (Тернопіль, 2018); підсумковій LXII науково-практичній конференції «Здобутки клінічної та експериментальної медицини, присвяченій 165-річчю від дня народження Івана Яковича Горбачевського» (Тернопіль 2019); конгресі міжнародної асоціації дерматології та естетичної медицини «IDEACongress2019» (Стамбул, 2019) (додаток Е).
Публікації. За матеріалами дисертації опубліковано 18 наукових праць, у тому числі: 7 статей у визначених ДАК України фахових виданнях (з них 2 – у закордонних наукових фахових виданнях, які входять до міжнародних наукометричних баз даних наукового цитування Scopus, EMBASE, MEDLINE, PubMed, Index Copernicus, Google Scholar, ResearchGate, Index medicus, EBSCO); 10 тез у збірниках наукових конференцій; 1 патент України на корисну модель.
Обсяг та структура дисертації. Дисертація викладена на 174 сторінках (основна текстова частина – 125 сторінок) та охоплює вступ, огляд літератури, опис матеріалів і методів досліджень, 4 розділи власних досліджень, розділ аналізу та узагальнення результатів, висновки, рекомендації, список використаних джерел, що налічує 181 найменування (45 кирилицею, 136 латиницею), та 6 додатків. Робота ілюстрована 34 рисунками і 20 таблицями.
РОЗДІЛ 1
епідеміологія, Етіопатогенез, клініка, діагностика, лікування та профілактика дерматиту, асоційованого
з нетриманням (огляд літератури)
1.1 Епідеміологія дерматиту, асоційованого з нетриманням
ДАН – це особливий вид подразнювального контактного дерматиту внаслідок тривалого контакту з сечею і калом, який характеризується еритемою та набряком, у деяких випадках супроводжується пухирями, ерозіями або вторинним інфікуванням переважно періанальної чи генітальної шкіри [6, 128, 143].
Уперше термін ДАН (англійською мовою – «Incontinence Associated Dermatitis») запропонував для широкого та пріоритетного використання міжнародний консенсус спеціалістів, проведений у США у 2005 р. До цього, для означення ураження шкіри у разі нетримання сечі і калу у дорослих використовували такі терміни, як мацераційне пошкодження, перинеальний дерматит, перинеальний висип, іритативний дерматит, контактний дерматит, інтертриго, опрілості, пелюшковий дерматит, пелюшковий висип, ерозивний підгузковий дерматит Жаке [91, 92, 143, 172].
Поширеність ДАН у хронічних хворих становить 3,4 – 7,6 %, а серед госпіталізованих пацієнтів із гострою патологією – 20 – 36 % [91, 93, 109, 144, 153]. Mugita Y. et al. (2018) повідомляють, що у мешканців будинків догляду, нетримання спостерігається у 59,8 %, а серед останніх поширеність ДАН досягає 36,0 %. Зі збільшенням у популяції кількості літніх людей зростає частота поширення ДАН [128]. За даними Kayser S. et al (2019), частота ДАН у загальній когорті пацієнтів становить 4,3 %, а частота нетримання – 18 %. Серед пацієнтів з нетриманням у відділеннях для тривалого догляду ДАН спостерігався у 8,4 % хворих. У хворих з нетриманням сечі, ДАН виявлявся у 12 % пацієнтів, а при нетриманні калу – частота зростала до 26 % [84]. Arnold-Long M., Johnson E. (2019) визначили, що частота ДАН при поступленні у відділення з гострою патологією становила у середньому 16 % [54]. Згідно з останнім всесвітнім звітом ВООЗ про старіння та здоров’я, дерматит, асоційований з нетриманням віднесений до найбільш поширених вікових та залежних від догляду захворювань шкіри [82]. За даними звіту ООН про старіння населення світу прогнозується переважання кількості жителів старших за 60 років над молодшим населенням до 2050 року. Передбачається, що у Європі, до 2025 року 20 % популяції буде складатися з осіб старших за 65 років [128]. Серед пацієнтів у будинках догляду в США частота нетримання відправлень досягла 51 %, а випадків перинеального дерматиту – 5,7 % [144]. Також, за статистичними даними, у 73 % хворих на перинеальний дерматит виявляли нетримання відправлень, зокрема у 10 % було нетримання тільки сечі, у 15 % – нетримання тільки калу і у 48 % – поєднане урофекальне нетримання [144]. Hödl M. et al. (2019) підрахували, що у геріатричних закладах нетримання сечі спостерігається у 24,8 % пацієнтів, нетримання калу у 0,9 %, а подвійне – у 43,5 %, тоді як у лікарнях нетримання було достовірно рідше, відповідно в 11,9 %, 1,4 % і 6,9 % [98]. За іншими даними, у госпіталізованих пацієнтів ДАН виникав у 23,8 – 45,7 % хворих, у яких було нетримання сечі та/або калу, [61, 135, 166]. У хворих з гострою патологією, яка супроводжувалася фекальним нетриманням, ДАН розвивався з 1 по 6 добу у 36 % випадків, у середньому на 4 добу, та досягав найбільшої тяжкості на 8 день спостереження [110]. У пацієнтів, які знаходилися у закладах тривалого перебування та будинках догляду, ДАН розвивався приблизно через 2 тижні після початку фекального або подвійного нетримання [102]. При фекальному нетриманні частота ДАН досягала 52,2 %, а тяжкість перебігу ДАН достовірно корелювала зі ступенем фекального нетримання, частотою епізодів та об’ємом мимовільних дефекацій [156].
1.2 Основні ланки патогенезу дерматиту, асоційованого з нетриманням
Нетримання сечі та калу може бути наслідком вроджених дефектів розвитку, спінальної патології, неврологічних захворювань, інфекцій, пологів, психічних захворювань, старіння, хірургічних втручань на сечовому міхурі, інших органах малого тазу і тазовому дні [59, 106].
В основі патогенезу ДАН лежить подразнювальна дія сечі і калу на шкірний покрив. Ясна річ, короткочасний контакт шкіри з випорожненнями у фізіологічних умовах не зумовлює пошкодження. Агресивна дія екскретів виявляється в умовах оклюзії, мацерації і тертя шкіри, особливо за зниженої резистентності [106].
Модель ДАН на тваринах відтворюється у щурів за допомогою місцевої дії 1 % агарозного гелю з протеазами (трипсин, хімотрипсин), який викликає протеолітичну мацерацію шкіри [97]. У гвінейських свинок моделювання різної інтенсивності ДАН проводилося за допомогою 1 %, 2 %, 5 % і 10 % розчинів панкреатину протягом 3 днів [73]. Ліполітичні ферменти не викликають структурних пошкоджень, але прискорюють трансдермальне проникнення протеаз у мацерованій шкірі через пошкоджений шкірний бар’єр [116].
Тривалий контакт з вологою сечі, калу чи поту зумовлює надмірну гідратацію або мацерацію епідермісу, внаслідок чого збільшується його проникність до хімічних речовин і мікроорганізмів, створюються умови для заміни нормобіоценозу вторинною інфекцією й підвищується схильність шкіри до травматизації її поверхні під дією тертя чи розтягнення під час переодягання та перестелення [75, 93, 111].
Дія води на шкіру протягом чотирьох годин спричинює формування міжклітинних водних басейнів – цистерн, які збільшуються за тривалішої експозиції. Гіпергідратація епідермісу супроводжується пластинчастим розшаруванням ліпідних структур та руйнуванням рогового шару, яким пояснюють збільшення проникності шкіри до іритантів і десквамацію епідермісу. Тривала експозиція води чи сечі не зумовлює гіперемію шкіри в експерименті, проте відсутність еритеми не виключає пошкодження [175].
При пошкодженні рогового шару в епідермісі розгортається реакція відновлення ліпідних структур. Якщо відновлення відбувається повільно, а клітини епідермісу піддаються атаці мікроорганізмами та токсинами, кератиноцити починають секретувати цитокіни, що запускають запальну реакцію [45]. У відповідь на подразнення виникає запальний процес, у зоні якого збільшується вивільнення цитокінів, зростає трансепідермальна втрата води, посилюється дисбаланс рН на поверхні шкіри [8, 93].
Одним із головних пошкоджувальних чинників сечі і калу є їхня здатність змінювати рН поверхні шкіри [108, 172]. Нормальний рівень рН шкіри переважно перебуває в межах 5,5 – 5,9. Свіжа сеча має слабкокислий або слабкоосновний рН, а кал – слабкоосновну реакцію, тому вони несуттєво впливають на рН шкіри у фізіологічних умовах [75]. Приєднання поту, який має слабкоосновний рН, може збільшити основний потенціал поверхні шкіри до рН 8,0 [75].
У разі тривалого контакту із сечею, в умовах постійної надмірної вологості, за наявності на поверхні шкіри бактерій з уреалітичними властивостями, які розщеплюють сечовину сечі до аміаку, основність середовища збільшується до рН 8,0 – 11,0. У лужному середовищі змінюється стан ліпідної мантії шкіри, руйнується цілісність клітинного бар’єру, активізуються протеази і ліпази калу, швидко розмножуються бактерії та гриби, зокрема ванкоміцинрезистентний ентерокок, метицилінрезистентний золотистий стафілокок, Clostridium difficile, Candida albicans. Крім того, аміак спричинює запалення травмованої чи розтертої поверхні шкіри [75, 91, 106, 108, 172].
Детергенти, у тому числі мило, які використовують для щоденної гігієни, також можуть пошкоджувати ліпідну мантію та порушувати цілісність шкіри, внаслідок чого знижується рівень зволоження епідермісу та/або посилюється запальний процес [133].
В експерименті досліджено, що старіння є чинником, який збільшує мацерацію шкіри [49]. Шкіра, що старіє, більш схильна до пошкоджень, що пов’язано з повільним відновленням епідермального бар’єру, кумулятивним впливом ультрафіолетових променів, зниженою гідратацією, ксерозом, зниженою продукцією профілагрину та натурального зволожувального фактору, недостатнім вмістом сечовини у роговому шарі, зниженою активністю ферментів синтезу ліпідів, зміною цитокінового профілю, недостатньою ацидифікацією шкіри, пошкодженням стовбурових клітин епідермісу [76, 98]. Крім того, у старіючій шкірі зменшується кількість кровоносних судин, нервових закінчень, колагену, знижується вироблення шкірного сала, внаслідок чого шкіра стоншується, легко травмується, розтріскується та повільно загоюється [4, 179]. «Запальне старіння» характеризують як безсимптомне слабке хронічне запалення, що виникає в процесі фізіологічного старіння і відіграє роль патогенетичного чинника у розвитку низки вік-асоційованих захворювань [5]. На відміну від дітей, у дорослих ДАН супроводжується порушеннями кровопостачання, оксигенації, живлення, розладами чуття, значним механічним впливом на шкіру під час перестелення, застосуванням обмежувальних засобів, наприклад, ліжкових загорож [144].
Серед чинників ризику виникнення ДАН доведеними визначено такі [143]:
- тип нетримання (калу або/та сечі);
- частота епізодів нетримання, особливо калу;
- використання оклюзивних медичних виробів для утримання випорожнень;
- погіршення стану шкіри внаслідок старіння, вживання стероїдів, супутнього цукрового діабету;
- обмежений руховий режим;
- порушення свідомості;
- нездатність до проведення особистої гігієни;
- біль;
- підвищення температури тіла;
- прийом антибіотиків та імунодепресантів;
- недостатнє харчування;
- критичні захворювання.
Campbell J. et al. (2019) називають чинниками ризику ДАН вік, діарею, тривале перебування у палаті інтенсивної терапії, розлади дихання та сепсис [86].
Визначення рівня статистичної значущості серед різних чинників ризику розвитку ДАН засвідчило, що найвищий рівень доказовості мають: частота дефекації понад три рази на тиждень, наявність неоформлених та/або рідких випорожнень, сечі з різким запахом. Такі результати пояснюють тим, що рідкий кал має більшу концентрацію активних протеолітичних і ліполітичних ферментів, а сеча з різким запахом є ознакою присутності анаеробної мікрофлори, бактеріальна уреаза яких розщеплює сечовину до аміаку, олужнюючи рН [155]. Доведеними чинниками ризику ДАН також визнано частоту зміни абсорбентних підкладок більше ніж 4 рази на добу, нетримання сечі і калу, контрактури нижніх кінцівок, лежаче положення, каламутну сечу, надмірні вагінальні виділення, мацерацію шкіри, високий еритемний індекс ≥ 46 на сідницях, вік ≥ 65 років та індекс маси тіла менше ніж 18,5 кг/м2 [117, 155]. Розвиткові ДАН також сприяють натирання і здирання шкіри під час рухів і переміщення, ожиріння [59, 104].
Провісниками ураження шкіри при нетриманні визначено недостатню денну фізичну активність, низьку оксигенацію, неповноцінне харчування хворих та когнітивний дефіцит [103, 148]. У критично тяжких пацієнтів з нетриманням калу, в яких було встановлено 2 категорію за GLOBIAD, факторами ризику розвитку є рідкий стілець, діабет, вік, куріння, відмова від використання підгузок, гарячка, низьке насичення тканин киснем [114]. Натомість, ДАН виступає незалежним чинником ризику розвитку пролежневих виразок, незважаючи на заходи з контролю над знерухомленням [107].
1.3 Мікробіоценоз поверхні шкіри
Зміна складу мікробіоценозу поверхні шкіри є характерною для хронічних дерматозів [1, 31]. Для розуміння епідеміології ДАН потрібно детально вивчити мікробну колонізацію [10]. Здорова шкіра промежини здебільшого заселена коагулазонегативними стафілококами (97 %), лактобацилами (97 %) та коринебактеріями (92 %), менше кишковою паличкою (47 %), стрептококами групи В (38 %), ентерококами (34 %), альфа-стрептококами (32 %) [157]. Менш чисельними представниками нормальної мікрофлори промежини є Candida albicans (15 %), Staphylococcus aureus (13 %) та ентеробактерії (15 %) [58]. Частота виявлення S. aureus в пахових і періанальній ділянках відповідно становить 10,5 % і 12,5 %, тоді як при підгузковому дерматиті – 14,3 % і 21,4 % [134]. Серед них золотистий стафілокок володіє вираженими адгезійно-колонізаційними властивостями, які забезпечують високу вірулентність [11]. Присутність піогенних стрептококів створює ризик виникнення гнійничкових уражень, відшарування епідермісу з утворенням пухирів та ерозій [27].
Бактеріальне інфікування шкіри не пов’язують з ДАН, тоді як клінічні ознаки інфікування Candida albicans відповідно до візуального огляду кандидозного висипу спостерігають у 18 – 32 % пацієнтів, які підтверджується мікробіологічним дослідженнням у 60 – 75 % випадків [61, 64, 91]. У звичайних умовах на ділянках шкіри під підгузками за відсутності дерматиту кандидні гриби виявляються рідко, у 4 % випадків, тоді як при підгузковому дерматиті вони наявні у 70 – 92 % випадків [161]. За даними Gray M., Giuliano K. (2018), грибковий висип виявляється у 14,8 % (169/1140) пацієнтів з ДАН [135]. За даними Karsani A. et al. (2017), у пацієнтів з пелюшковим дерматитом Candida albicans виявляється у 35,0 % хворих, а інші види Candida – у 26,7%, тоді як у здорових осіб дані штами виявлялися значно рідше, відповідно в 17,1 % і 2,9 % [63]. До 40 – 60 % випадків важких форм кандидозу залишаються нерозпізнаними [2].
Candida albicans є найпоширенішим грибковим коменсальним мікроорганізмом людини і також є найчастішим етіологічним збудником, пов’язаним з інфікуванням шкіри при ДАН. Проте залишається нез’ясованим, чи нетримання сприяє підвищеній частоті кандидної колонізації у пацієнта, та чи, навпаки, нетримання виступає тригером для розвитку кандидної інфекції уже колонізованої шкіри [64].
Кандидні гриби, особливо Candida albicans, найчастіше відповідальні за вторинне інфікування поверхні шкіри та виявляються у понад 80 % випадків ДАН [161]. Інші види грибів, а саме Candida tropicalis, Candida parapsilosis та Candida glabrata, виявляються у менших кількостях [105, 161]. Розуміння колонізаційної епідеміології є важливим елементом для ефективної профілактики кандидозної інфекції у пацієнтів з ДАН [64].
Наявність сечі та фекалій на денудованій шкірі створює сприятливе середовище для розвитку грибкової інфекції [91, 135]. Candida albicans, будучи нормальним мешканцем шлунково-кишкового тракту, починає розмножуватися на шкірі при рівні pH від 6 до 7 [105]. Candida albicans та інші гриби є прикладом довершеної адаптації до змін pH, що контролюється двома їхніми генами: PHR2, що активується у кислому середовищі та дезактивується при зростанні pH, та PHR1, який діє протилежно, тобто активується у нейтральному або лужному середовищі. Іншим доведеним чинником розвитку грибів є рівень CO2, який підвищується в оклюзивному середовищі стандартних одноразових підгузків та рідко визначається при використанні дихаючих підгузків [161].
Кандидозну інфекцію при ДАН переважно розпізнають за макулопапульозним висипом у центрі, з характерним сателітним розсіюванням по периферії, поширюючись на здорову шкіру. Такі висипання також можуть спостерігатись у вигляді неспецифічних зливних папул, еритематозних та вкритих лусочками бляшок, з набряком чи мацерацією, інколи з пустулами [64, 172]. У тяжких випадках можуть виникати ерозії та виразки [86, 161].
У білих пастоподібних виділеннях, які вкривають бляшки, у центрі та периферії виявляється грибкова інфекція [172]. При прямому дослідженні з 10 % розчином гідроксиду калію можуть визначатися псевдогіфи та бластоконідії, вказуючи на інфікування Candida spp. Велика кількість бластоконідій характерна для інфікування C. glabrata. При вираженій мацерації можливий забір матеріалу для зафарбовування методами Гімза, періодичною кислотою Шиффа (PAS), Райта. Забір зразків здебільшого проводиться за допомогою тампонів на декстрозний агар Сабуро та, переважно, на хромогенне середовище CHROMcandida. Вирощені гриби можуть бути ідентифіковані біохімічними тестами – зимограмами, молекулярним дослідженням та протеомічним тестуванням MALDI-TOF [161].
Встановлено, що тільки 60 % первинних діагнозів кандидозної інфекції підтверджується за допомогою мікологічного або гістологічного дослідження. Серед пацієнтів із заключним діагнозом кандидозу, у 17 із 24 випадків були підтверджені культурально або за допомогою забарвлення PAS, а у 13 з 24 зразків було виявлено характерну гістологічну картину кандидозу [151].
Біопсія та гістопатологічне дослідження виявилися неспецифічними для діагностики більшості випадків ДАН під час первинної консультації, навіть при супутньому псоріазі та екземі. Суперінфекція чи інфекція Candida albicans має очевидні ознаки, тому біопсія доречна тільки у випадках неефективності протигрибкового лікування і стандартного гігієнічного догляду за шкірою [151]. Грибкова інфекція визначається у біоптаті у вигляді множинних псевдогіфів та бластоконідій у роговому шарі епідермісу та у дермі. Здебільшого при ДАН жодних лабораторних аналізів проводити не потрібно, крім мікологічного дослідження шкірних змивів [161].
1.4 Діагностика дерматиту, асоційованого з нетриманням, та оцінювальні інструменти
Клінічними симптомами ДАН є гіперемія, набряк, пухирі з прозорим ексудатом, ерозії та денудація шкіри [59, 93]. Денудація проявляється частковою втратою поверхні шкіри у вигляді острівців з нерівним краєм, з яких виділяється прозорий серозний ексудат і не супроводжується некрозом. Ерозії часто розташовуються в глибині складок шкіри [98]. Пацієнти можуть відчувати біль, свербіж, печіння в ділянці ураження [59]. Звичайно, що обов’язковою умовою діагнозу ДАН повинно бути нетримання сечі та/або калу [59]. Візуальний огляд та ретельний анамнез є основними елементами діагностики. При огляді пацієнта потрібно звернути увагу на ознаки мацерації, зміни пігментації, ділянки пошкодження шкіри, симптоми інфікування шкіри, зокрема кандидозу [131].
Класифікація ДАН остаточно ще не розроблена. За ступенями тяжкості ДАН поділяється на легкий, помірний і тяжкий. Легка стадія ДАН визначається найчастіше, досягаючи 69 % випадків, помірна – у 22 % і тяжка – у 9 % [113].
Для легкого ДАН характерне невелике почервоніння шкіри без порушення її цілісності, незначний суб’єктивний дискомфорт. Середній ступінь супроводжується помірним почервонінням і лущенням шкіри, утворенням кірочок, невеликими ділянками пошкодження поверхні, формуванням невеликих пухирів, помірним дискомфортом. За тяжкого ДАН спостерігаються інтенсивне почервоніння шкіри, глибоке її злущення, формування великих пухирів та ерозій, що супроводжуються мокненням та болем [108, 113].
Зони ураження ДАН частіше розташовуються на сідницях (73 %), в анальній ділянці (70 %), рідше – на статевих органах і в паху (36 %), на стегнах (24 %) і крижах (9 %) [105]. ДАН також локалізується у поперековій ділянці, в низу живота, у пахових згинах і місцях тісного прилягання абсорбентів [93].
Для об’єктивного визначення тяжкості та ризику розвитку ДАН запропоновано використовувати спеціальні оцінювальні інструменти у вигляді шкал, схем чи алгоритмів [59, 91, 143]. Клінічно та статистично верифікованими у дослідженнях є наступні:
- інструмент для визначення тяжкості дерматиту, асоційованого з нетриманням відправлень, англійською – The Incontinence Associated Dermatitis and its Severity instrument (IADS) [165];
- інтервенційний інструмент для дерматиту, асоційованого з нетриманням, англійською – Incontinence Associated Dermatitis Intervention Tool (IAD-IT), [59];
- інструмент для оцінення промежини, англійською – Perineal Assessment Tool [137];
- інструмент для оцінення периректальної шкіри, англійською – Perirectal Skin Assessment Tool [119];
- інструмент для оцінення стану шкіри при ДАН, англійською – IAD Skin Condition Assessment Tool [119];
- Гентський глобальний категоризаційний інструмент для ДАН, англійською – The Ghent Global IAD Categorisation Tool (GLOBIAD) [117].
Оцінювальні інструменти використовуються у практиці як для забезпечення правових і економічних вимог, так і для поліпшення якості надання догляду чи проведення наукових досліджень [67]. Проте, досі ще немає такого інструменту, який би перевершував усі інші, особливо щодо спеціфічного оцінення еритеми при ДАН [139] Використання більшості оцінювальних інструментів у повсякденній практиці виявилося складним і обтяжливим завданням для персоналу. Тому, для щоденного моніторингу існують спрощені шкали, ілюстрації та фотозразки, які, на жаль, не отримали належної клінічної та наукової верифікації [118].
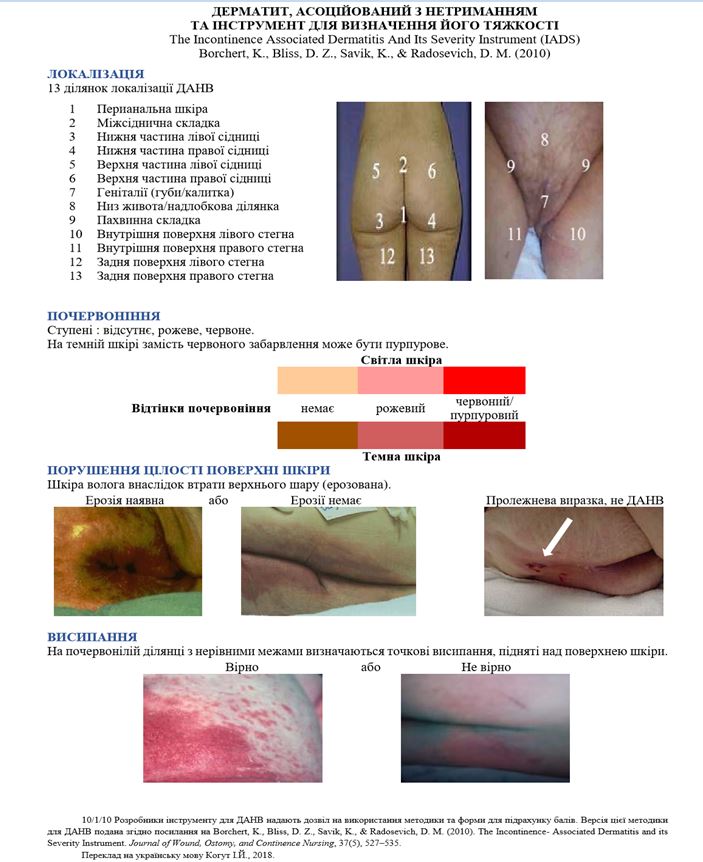
Інструментом IADS оцінюється 13 типових ділянок локалізації ДАН, в кожній з яких у балах визначають ступінь еритеми шкіри, наявність іншого висипу та пошкодження поверхні. Остаточний результат оцінювання виражається сумою всіх визначених балів у діапазоні значень від 0 до 52, що дає змогу стежити за динамікою перебігу захворювання та визначати ефективність лікування у коротких проміжках часу. Із поліпшенням стану хворого бал знижується [59, 60, 92]. Зі зростанням балу IADS, переважно вище від 9, збільшується ризик розвитку пролежнів [140, 141].
За допомогою IAD-IT можна визначити ризик розвитку ДАН, оцінити його ступінь перебігу, зафіксувати приєднання грибкового ураження та обрати відповідну лікувальну тактику [59, 91]. У валідаційному тестуванні інструмент продемонстрував високу дієвість та надійність під час використання як у наукових дослідженнях так і у клінічній практиці [165].
«Інструмент для оцінення периректальної шкіри» призначений для визначення ризику виникнення ДАН [53]. В інструменті використовують дані про тип іританту, тривалість та інтенсивність його дії, стан шкіри промежини, а також чинники виникнення діареї. За його допомогою можна визначити тяжкість ДАН, але не можливо оцінити ризик виникнення захворювання. Загальний бал знаходиться у межах від 4 (найменший ризик) до 12 (найбільший ризик) [60, 92, 105, 137].
«Інструмент для оцінення периректальної шкіри» охоплює дані про колір шкіри, її цілісність, розмір ураження та наявність суб’єктивних відчуттів у пацієнта [119]. «Інструмент для оцінення промежини» та «Інструмент для оцінення периректальної шкіри» широко використовувалися у 1990-их роках [53].
За допомогою «Інструмента для оцінення стану шкіри при ДАН», запропонованого Kennedy та Lutz, у балах від 0 до 3 визначають площу ураження, ступінь гіперемії та розмір ерозій [111, 119].
«Гентський глобальний категоризаційний інструмент для ДАН» (GLOBIAD) став результатом роботи сучасної команди, яка об’єднала у спільному процесі 22 міжнародних експерти та 823 клініцисти з 30 країн. Створення інструмента мало на меті провести міжнародно узгоджений опис ступенів тяжкості ДАН і стандартизувати документування патології у клінічній практиці та наукових дослідженнях [163]. GLOBIAD пройшов верифікацію за допомогою 3-рівневої процедури Delphi та перекладений на 15 мов, у тому числі й українською, що поліпшує якість клінічної діагностики та проведення досліджень ДАН [163, 171]. За допомогою GLOBIAD визначаються дві категорії тяжкості ДАН, які ґрунтуються на візуальному огляді уражених ділянок шкіри. Для кожної категорії подано фотозразок та перелік основних і додаткових критеріїв. Для 1 категорії основним критерієм є постійне почервоніння шкіри, а для 2 категорії – ерозії, денудації та екскоріації. Водночас кожна з категорій поділена на дві підкатегорії: без ознак інфікування (А) та з клінічними ознаками інфікування (В) [114]. Для щоденного моніторингу перебігу ДАН у наукових дослідженнях запропоновано модифікацію GLOBIAD-M, що полегшує збір даних та допомагає визначити категорію захворювання [68, 164].
Для додаткового дослідження стану шкіри також використовуються апаратні методи, такі як корнеометрія, еластометрія, рН-метрія, визначення еритемного індексу та трансепідермальної втрати води [76, 155, 157]. З віком відбувається суттєве стоншення епідермісу й дерми, зменшення акустичної щільності шкіри та показників корнеометрії, а також значне підвищення трансепідермальної втрати води [43].
Диференціальну діагностику переважно проводять з іншими захворюваннями, пов’язаними з надмірною дією вологи, пролежнями, інфекціями шкіри, анальним свербежем [106, 174]. Інтертриго локалізується на шкірі великих складок, має лінійну форму, тріщину в глибині складки, пов’язане з надмірною пітливістю, тертям, бактеріальним або грибковим ростом [106, 174]. Перистомальний дерматит локалізується довкола неприродних отворів, виникає внаслідок колостомії, ілеостомії, гастростомії, уростомії [174]. Навколорановий дерматит, спричинений надмірним виділенням ранового ексудату та вторинним інфікуванням шкіри, які призводять до пошкодження поверхні та сповільнення загоєння [174]. Мацерація шкіри виявляється при венозних і трофічних виразках, діабетичній ступні [174]. У місцях характерної локалізації ДАН потрібно відрізняти розчухи, наприклад при анальному свербежі. Пошкодження шкіри від лейкопластиру визначають за їх характерною формою [59]. Поверхневі садна від здирання та потертості шкіри виникають внаслідок тертя, головним чином під час перестелення, переодягання, зміни положення тіла та не пов’язані з ішемією чи дією сечі або калу [121].
Диференціальна діагностика ДАН із пролежнями І та ІІ ступенів є чи не найскладнішою у повсякденній практиці [112, 181]. На підставі аналізу даних різних джерел, ключові критерії диференціальної діагностики ДАН і пролежнів наведено у таблиці 1.1.
Таблиця 1.1 – Диференціальна діагностика пролежнів і ДАН [119, 143]
| Ознака | Пролежні | ДАН |
| Причина | Дія тиску | Дія сечі і калу |
| Локалізація | Над кістковими виступами, під медичними приладами | Не залежить від твердості підлеглих тканин, переважно над м’якими тканинами статевих губ, калитки, сідниць, паху, у складках шкіри |
| Колір пошкодження | Темно-червоне або пурпурове забарвлення саден | Еритема переважно неінтенсивна, червона |
| Форма пошкодження | Чіткі межі, овальна або округла форма | Нечіткі та звивисті контури |
| Глибина | Пошкодження глибоких шарів шкіри та підшкірної клітковини, пухирі, ерозії | Неглибоке пошкодження, в межах епідермісу, деколи дерми, найглибшим пошкодженням може бути ерозія |
| Некроз | Характерна ознака | Не буває |
| Інфекція | Можлива вторинна інфекція м’яких тканин | Можлива вторинна інфекція поверхні шкіри (кандидоз) |
З табл. 1.1 видно, що пролежні виникають унаслідок тривалого тиску власної ваги тіла на шкіру, тому їхній епіцентр завжди розташовується над кістковими виступами або під твердими медичними приладами [85, 93, 113]. Для пролежнів характерні овальні або округлі темно-червоні або пурпурові садна з чіткими межами, пошкодження глибоких шарів шкіри і формування некрозів [46, 108, 117].
На відміну від пролежнів, ДАН не прив’язаний до ділянок над кістковими виступами, переважно займає шкіру промежини, супроводжується мацерацією шкіри, еритема має нечіткі й звивисті контури, виразка чи некроз ніколи не формуються, а найглибшим пошкодженням може бути ерозія [59, 108, 181].
1.5 Сучасні підходи до лікування і профілактика дерматиту, асоційованого з нетриманням
Метою лікування і профілактики ДАН є захист шкіри від подальшої подразнювальної дії сечі і калу, створення умов для самостійного загоювання і відновлення шкіри, ерадикація шкірної інфекції [91, 93].
Програма ведення хворих на ДАН передбачає виявлення та усунення причини нетримання, догляд за шкірою, застосування абсорбентів, додаткових пристроїв для збирання калу й сечі, лікування інфекції шкіри, оптимізацію харчування і вживання рідини, а також освітню підтримку для хворого і персоналу [24, 59]. Призначення структурованого режиму догляду за шкірою, до якого входять використання неополіскуваних клінзерів, нанесення шкірних протектантів, введення, за потреби, фекальних дренажних систем достовірно покращують перебіг ДАН, знижують бал IADS та зменшують ризик розвитку пролежнів. Пацієнти з високим балом IADS більш схильні до розвитку пролежневих виразок [140]. Виконання протоколів з догляду і лікування шкіри призводило до значного поліпшення перебігу ДАН на 5 – 7 день спостереження [57].
Відомо лише про невелику кількість проведених клінічних досліджень, низької або середньої якості, в яких вивчалися засоби для догляду за шкірою, медичні процедури та оцінювальні інструменти для лікування і профілактики ДАН у дорослих [150]. Для поліпшення якості наукових досліджень у 2016 р. запропоновано проект CONSIDER (Core Outcome Set in IAD Research), який є дослідницьким протоколом для встановлення основного переліку наслідків і вимірювань при ДАН і входить у робочу міжнародну кокранівську групу вивчення шкіри CSG-COUSIN [115]. Попри широке практичне використання, майже всі рекомендації з ведення і профілактики ДАН мають низький, переважно ІV, рівень доказовості [59, 128]. Огляд результатів вивчення ефективності бар’єрних і зволожуючих засобів засвідчив недостатню наукову обґрунтованість рекомендацій щодо вибору препаратів для профілактики та лікування ДАН. Як свідчать дослідження, ефективність нашкірних засобів (зволожувачі, шкірні протектанти, або їх комбінації) залежить від поєднання інгредієнтів, загального складу та режиму використання [150]. Виявлено велику кількість варіацій у виборі програми базового догляду за шкірою, а також розбіжності в маркуванні гігієнічних засобів різними виробниками [69, 108, 149]. Згадані в рекомендаціях топічні засоби потребують подальшого наукового вивчення їхньої ефективності, комбінації складників та режиму застосування, використовуючи стандартизовані та порівнювані режими лікування і профілактики у різних умовах і регіонах [79, 126, 150].
Важливо зауважити, що на практиці для профілактики та для лікування ДАН використовуються однакові засоби та процедури [150]. У 2015 році глобальна експертна група з ДАН сформулювала загальні характеристики ідеального засобу для лікування і профілактики ДАН, який має:
- бути клінічно доведеним для лікування і профілактики ДАН;
- мати pH близький до шкірного рівня (примітка: pH застосовується не до всіх засобів, наприклад до тих, які не містять іонів водню, включно з деякими бар’єрними плівками);
- мати низький подразнювальний потенціал і бути гіпоалергенним;
- не викликати печію при нанесенні;
- бути прозорим або легко витиратися для огляду шкіри;
- використовуватися на етапах видалення та очищення, берегти час обслуговуючого персоналу та забезпечувати комфорт пацієнта;
- не збільшувати пошкодження шкіри;
- не впливати на абсорбцію чи дію засобів для лікування нетримання;
- бути сумісним з іншими топічними засобами, наприклад, з адгезивними пов’язками;
- бути прийнятним для пацієнтів, клініцистів та надавачів догляду;
- мінімізувати перелік засобів, ресурси та час, необхідні для забезпечення режиму догляду за шкірою;
- бути економічно вигідним [143].
У догляді за шкірою дотримуються трьох послідовних етапів: очищення, зволоження і захисту, для чого використовують відповідні окремі або комбіновані засоби [59, 174]. Для очищення поверхні шкіри від сечі, калу, бруду та інших іритантів надають перевагу спеціальним клінзерам, які містять детергенти, сурфактанти та мають збалансований для шкіри кислий рівень рН від 5,4 до 5,9. Рекомендовано відмовитися від використання мила і води, які створюють лужний рН і висушують шкіру [75, 173]. Очищувальні рухи повинні бути ніжними, без розтирання поверхні [138, 181]. Витирати шкіру від випорожнень потрібно м’якими ганчірками, щоб не пошкодити поверхню [149]. Засоби для очищення шкіри переважно містять диметикон як сурфактант, а наявність оксиду цинку зменшує частоту розвитку періанального дерматиту вдвічі [75].
Зволожувальні засоби бажано використовувати після кожного випадку нетримання [59]. Однак при ДАН перевагу надають емолієнтам, які заміщують втрачені ліпіди епідермісу та створюють олійну плівку, що запобігає випаровуванню води і висушуванню шкіри [108]. До емолієнтів належать мінеральні олії, воски, жирні кислоти, гліцериди, ізопропілу міристат, рідкий парафін [59, 133]. Нанесення емолієнтів з використанням фонофорезу збільшує гідратацію шкіри [32]. Оливкова олія, як емолієнт, ефективно зменшує ризик розвитку підгузкового дерматиту [122]. Соняшникова олія має пом’якшувальні, зволожуючі, захисні, протизапальні властивості, сприяє відновленню ліпідної мантії на сухих і мацерованих ділянках, зменшує трансепідермальну втрату води, посилює бар’єрний захист поверхні шкіри від агресивної дії сечі та калу, стимулює проліферацію кератиноцитів. За рахунок гідрофобних властивостей олії досягається її очищувальний ефект [81, 132, 136]. Проте, використання комерційних засобів для догляду за шкірою, особливо зволожувачів, несе ризики приєднання алергійного контактного дерматиту, пов’язаного з вмістом консервантів, ароматичних і парфумерних добавок, сурфактантів [91, 133].
Для захисту шкіри використовують протектанти або вологоутримуючі бар’єрні засоби, призначені для створення захисту від агресивної дії іритантів [91]. Типовою основою бар’єрних засобів є ліпідно-водна емульсія з додаванням оксиду цинку або оксиду титану, які формують тонку плівку, що відштовхує іританти. Оксид цинку добре захищає від подразників та мацерації, однак недостатньо зволожує та важко видаляється з поверхні шкіри. Оксид цинку також має протизапальні та антиоксидантні властивості [178]. Вазелін формує оклюзивний шар, збільшує гідратацію шкіри, добре захищає від дії сечі, проте менш ефективний проти дії калу [59, 138, 153]. Недоліками вазеліну є формування некомфортної недихаючої жирної поверхні, забруднення прилягаючої білизни, затримування на поверхні бруду, бактерій, збільшення ризику розвитку фолікуліту, утруднене відмивання в процесі очищення шкіри [178]. Диметикон (силоксан), похідний силікону, легко наноситься на шкіру тонкою напівпроникною плівкою, має властивості очищувача та емолієнта, проте формує менш ефективний захисний бар’єр порівняно з цинком та вазеліном [59, 174]. Силіконовмісні топічні засоби застосовуються у вигляді кремів та плівок, швидко всмоктуються та висихають, після чого стають прозорими [159]. Силіконовмісні препарати мають дихаючі властивості та не викликають місцевого дискомфорту, легко очищуються, мало забруднюють білизну, проте їх не рекомендується використовувати на відкритих ранах [90, 178]. Ефективними виявляються комбінації засобів, наприклад оксиду цинку з екстрактом календули або гамамелісу, а також комплексні фітопрепарати [29, 39, 41].
Задовільні лікувальні властивості при ДАН продемонстрували топічні засоби, до складу яких входять стеарат гідроксиду алюмінію та магнію у поєднанні з перуанським бальзамом, рициновою олією, трипсином. Паста з оксидом цинку зменшувала ексудацію та почервоніння шкірних ерозій [93]. Ефективними також є засоби, які містять алое та календулу [47]. Крем 4 % сукральфату забезпечує зникнення подразнювального підгузкового дерматиту у дорослих протягом 2 місяців застосування [130].
Топічне використання камфори забезпечує знеболювальний, протизапальний, протисвербіжний ефекти, створює відчуття прохолоди та інтенсифікує кровопостачання шкіри у місці застосування [122, 180]. Місцеве нанесення камфорної олії у загальноприйнятих дозах є безпечним та не несе ризику при правильному використанні [180]. Камфора чинить бактеріостатичну дію на Staphylococcus aureus у концентрації 5,0 – 7,0 мкг/мл та бактерицидну при вмісті 6,0 – 10,0 мкг/мл [52].
Zafar M. et. al. (2012) виявили, що камфора ефективна проти стандартних культур Staphylococcus aureus (ATCC 13565), але не ефективна проти E. coli, P. aeruginosa, S. typhi та B. subtilis. Натомість, камфора виявила свою ефективність проти клінічних ізолятів кишкової палички [83]. Дослідження Rahman F. et al. (2016) показало антимікробну активність камфорної ефірної олії проти Streptococcus mutans та Enterococcus faecalis [101]. Flayyih M. et al. (2012) визначили, що камфора у концентрації 10% інгібує P. aeruginosa [88]. Tirillini B. et al. (1996) виявили, що камфорна олія має фунгістатичну активність проти Candida albicans, Trichophyton mentagrophytes, Aspergillus flavus [170].
Захисні креми рекомендовано наносити у дозуванні не менше ніж 2 мг засобу на 1 см2 поверхні шкіри. Доведено, що нижчі дози захисного крему можуть не мати превентивного ефекту і недостатньо протидіяти подразнику [157]. Для забезпечення оптимальної ефективності протектант має бути спроможним підтримувати водовідштовхувальний бар’єр при різних ступенях вологи та спробах миття поверхні шкіри від забруднення при нетриманні [75]. Зменшення площі ранової поверхні на 20 – 40 % протягом 2 – 4 тижнів під дією лікування вважається добрим прогностичним індикатором загоєння [87].
Широкого застосування набули протектанти, в яких для формування тонкої захисної плівки використовують прозорий акрилатний термополімер, що не потребує видалення перед проведенням оцінювання шкіри [60, 167]. Нанесення акрилатної безалкогольної бар’єрної плівки на термополімерній основі 3 рази на тиждень виявилося клінічно ефективним та суттєво заощадливим порівняно з використанням інших бар’єрних засобів на основі вазеліну, цинку і диметикону, які рекомендовано застосовувати після кожного випадку нетримання [50]. Призначення акрилатвмісного засобу лише 2 рази на тиждень протягом 3 тижнів суттєво покращує перебігу ДАН [145]. Використання акрилатного термополімеру у комплексі заходів превентивного протоколу при ДАН призводить майже до повного попередження пошкодження шкіри [167]. Недоліком термополімерів є відчуття печії чи пощипування під час нанесення препарату, що пов’язано з екзотермічною хімічною реакцією полімеризації та випаровуванням розчинника [178].
Віднедавна набуло поширення використання ціаноакрилатної бар’єрної плівки, яка також суттєво знижує еритему, ексудацію та зменшує ерозії. Пурпурове забарвлення ціаноакрилатної плівки дозволяє бачити поверхню шкіри у місцях нанесення препарату. Ціаноакрилатна плівка також є прозорою і не потребує видалення з поверхні. Протипоказанням до застосування ціаноакрилату є відкрита рана, що утруднює широке його застосування при порушенні цілісності шкіри [129, 177]. Використання 2-октил-ціаноакрилату вирішує проблеми цитотоксичності, зменшує ступінь тимчасового нагрівання поверхні шкіри і подразнення під час екзотермічної реакції полімеризації препарату та зменшує частоту ранової інфекції у пацієнтів [158]. Під час експерименту встановлено, що ціаноакрилат має антибактеріальні властивості, на поживних середовищах інгібує ріст золотистого стафілококу, ентерококу, синьогнійної і кишкової палички, клебсієли, кандиди [160]. Однак ціаноакрилати поки що є відносно дорогими для використання та можуть викликати алергію [178].
Застосування нових медичних технологій в умовах ринкової економіки вказує на доцільність економічних розрахунків оптимального поєднання ефективності, безпеки, вартості лікування, що забезпечує результативне і економічно доступне лікування всім пацієнтам [3]. Bliss D. et al. (2007) підрахували, що вартість застосування бар’єрного крему без врахування затрат на роботу персоналу та супутніх витрат, може становити 0,22 – 0,25 $ за добу, тоді як використання захисної акрилатної термополімерної плівки, яку наносять 1 раз на 3 дні, здешевлює витрату на препарат у середньому до 0,04 $ на один епізод нетримання, але зазначена вартість не враховує витрати на кількаразове щоденне очищення. Використовуючи згадані бар’єрні засоби разом із засобом для очищення, витрати на догляд за шкірою зростають відповідно до 0,27 – 0,33 $ і 0,12 $ [50].
У пацієнтів з нетриманням варто надавати перевагу використанню комбінованих засобів для догляду за шкірою, коли в одному виробі поєднано очисні, зволожувальні, захисні й антисептичні компоненти [91]. Найбільшого поширення серед комбінованих засобів догляду за шкірою набули серветки, просякнуті одночасно клінзером, зволожувачем та протектантом [48, 149]. Використання просякнутих серветок об’єднує різні етапи догляду в один крок, чим пришвидшує обслуговування, проте може збільшувати вартість медичної допомоги [69]. Застосування серветок 3 в 1, просякнутих 3 % диметиконовою формулою, суттєво знижувало поширеність ДАН та сприяло зменшенню тяжкості уражень шкіри порівняно з використанням води з милом із нейтральним рН [48, 94]. Проте, використання на практиці кількох засобів в різних ємностях може стати наслідком випадкової неправильної послідовності їх застосування, а також збільшувати кількість і час процедур догляду за шкірою. Оптимальним рішенням вважається використання комбінованих виробів, наприклад готових серветок 3 в 1, придатних для одномоментного забезпечення етапів очищення, зволоження і захисту шкіри або серветок 2 в 1 – для очищення і захисту. Однак у комбінованих виробах крім основних діючих компонентів, наявні додаткові речовини для стабілізації суміші, що підвищує ризик побічних місцевих реакцій і збільшує вартість лікування. [46].
За додатковими показаннями у лікувальну програму ДАН додають протигрибкові препарати, стероїдні топічні протизапальні засоби, місцеві антибіотики, поглинаючі та утримуючі засоби [64, 92, 151, 176]. Корекція супутніх психосоматичних проявів може покращити лікування патології шкіри [38]. Місцеве застосування мупіроцину ефективно контролює піококову, зокрема стафілококову, інфекцію [26]. Використання нафтифіну ефективно долає як мікотичну так і бактерійну інфекцію [44].
Для лікування кандидної інфекції призначають ністатин та похідні імідазолу, до яких входять клотримазол, міконазол, кетоконазол, сертаконазол [93]. Місцеве застосування 0,77 % мазі циклопіроксу також призводить до клінічного видужання від пелюшкового дерматиту та ефективної ерадикації С. albicans, що підтверджено результатами мікологічних посівів і тестом з гідроксидом калію [89].
Для поглинання і відокремлення від поверхні шкіри сечі і калу застосовують абсорбенти, до яких належать підгузки і підкладки. У виробництві сучасних якісних поглинальних підгузків використовують технології, спрямовані на зменшення тертя, регулювання рН, стримування росту уреалітичних і патогенних мікроорганізмів [35, 99]. Наприклад, розташовані у підкладках спіралевидні клітковинні волокна з рН 5,5 здатні забезпечувати необхідний буфер на поверхні шкіри змоченої сечею [154]. Для попередження пошкодження надмірною вологою потрібно добирати відповідні розміри поглинальних виробів [80]. Застосування підгузків і підкладок з посиленою абсорбцією у передніх ділянках та механізмом попередження зворотного витікання призводить до достовірно швидшого і повного видужання у жінок похилого віку з ДАН [80]. Серед мешканців будинків догляду, які користуються підкладками при нетриманні, не було виявлено статистичної різниці між різними видами підкладок щодо їх впливу на виникнення ДАН [51]. Відомо, що частина нанесених на шкіру захисних кремів переноситься на утримуючий виріб, але це не створює перешкоди для всмоктування сечі [77].
Лікування нетримання охоплює заходи з модифікації способу життя та поведінки (зменшення ваги, виправлення харчування, вправи Кегеля), прийом медикаментів (антихолінергічні та бета-адренергічні препарати, естрогенова замісна терапія, трициклічні антидепресанти, інгібітори повторного захоплення серотоніну і норепінефрину), застосування відвідних приладів, хірургічну корекцію та електростимуляцію м’язів тазового дна [142, 162]. Для малоінвазивного відведення та збирання випорожнень використовують кондомні катетери, фекальні мішечки, постійні м’які еластичні уретральні та ректальні (інтраанальні) катетери, системи з гнучким обтуратором для збирання фекалій, які не допускають контакту випорожнень з поверхнею шкіри. Недоліками таких приладів є нетривале використання, обмеження рухливості та пересування пацієнта, закупорення просвіту твердими частинками. Застосування відвідних приладів доцільне для хворих з гострою патологією та обмеженим руховим режимом [60, 66, 74, 78]. Пацієнтам з обмеженими фізичними можливостями потрібно полегшувати користування туалетом, ванною, встановлювати додаткові опори, поручні, елеватори, сидіння [59].
Пов’язки повинні відповідати локальному рановому середовищу, бути атравматичними, адгезивними до вологого середовища, захищати довколоранову шкіру, контролювати вологість, впливати на ексудат та інфекцію, мати ранозагоювальні властивості та заощаджувати час персоналу [59]. Для лікування ран з надмірною ексудацією використовують поглинаючі пов’язки та відсмоктувальні апарати з негативним тиском [108, 147]. Тривала експозиція ураженої поверхні на повітрі може призвести до висушування шкіри та збільшення пошкодження [59].
Одним із чинників, які сприяють поліпшенню стану шкіри, її загоєнню та відновленню, є налагодження оптимізованого раціонального харчування та контроль за споживанням рідини [59]. Корекція мікрофлори кишечнику, зокрема з використанням ентеросорбентів, сприяє нормалізації біоти, зменшенню кількості грибів роду Candida та зникненню S. aureus [40].
Пацієнти з ДАН потребують психологічної підтримки, бо часто відчувають біль, дискомфорт, сум’яття через нетримання, схильні до соціальної ізоляції. Правильний психологічний підхід впливає на якість життя пацієнта, його мотивацію, здатність зрозуміти і сприйняти план лікування та догляду [59].
Пацієнти, його родичі та обслуговуючий персонал потребують постійного навчання й освітньої підтримки у питаннях догляду та лікування ДАН, що опираються на науково обґрунтовані рекомендації [59, 108]. Персонал з догляду потребує поглиблення знань про зв’язок нетримання з розвитком дерматиту та вміння відрізняти ДАН від пролежнів І – ІІ ступенів. Медична грамотність повинна охоплювати навики та правила поведінки, знання яких сприяє взаєморозумінню між персоналом і хворими та поліпшує результати догляду [95]. Негативними факторами, які знижують якість спілкування, є обмежений час у медперсоналу, збентеженість пацієнта та уникнення ним дискомфортних розмов про нетримання, а також зростання кількості осіб з деменцією [96]. Робота у команді покращує якість догляду за хворими з ДАН, адже знання медперсоналу зростають внаслідок спілкування з більш досвідченими колегами [71].
Якість ведення хворих підвищує злагоджена робота мультидисциплінарної команди із залученням сімейного лікаря, фізіотерапевта, дієтолога, соціального працівника, трудотерапевта, спеціаліста з ентеростомальної терапії і нетримання, клінічного фармаколога [59].
Ключовими інноваційними елементами медичної допомоги пацієнтам з патологічними та віковими змінами шкіри слід вважати: (а) комплексний підхід; (б) удосконалені технології освітньо-профілактичної роботи щодо обізнаності з чинниками ризику патології шкіри; (в) типові та, розроблені на їх основі, індивідуальні програми комплексної медичної допомоги пацієнту; (г) міждисциплінарні команди фахівців різних спеціальностей; (д) безперервний професійний розвиток лікарів-дерматовенерологів в напрямку оволодіння доказовими медичними технологіями; (е) мотиваційна складова моделі, яка передбачає врахування інтересів усіх зацікавлених сторін: пацієнта (отримання комплексу ефективних послуг в одному місці їх надання, за лояльною ціною), лікаря (матеріальна мотивація до праці та до безперервного професійного розвитку) та закладу охорони здоров’я (отримання прибутку, конкурентноспроможність) [9].
Ще одним важливим аспектом ведення ДАН є заходи, спрямовані на зменшення їхньої вартості з профілактики та лікування, тому пошук ефективних і водночас економічно виправданих засобів залишається актуальним для сучасної медичної науки [65].
* * *
Узагальнюючи дані наукової літератури, потрібно відзначити, що профілактика і лікування ДАН є важливим складником у забезпеченні надання якісного медичного догляду у пацієнтів з нетриманням, значну частину яких становлять особи похилого віку.
Знання етіології, патогенезу, факторів ризику ДАН сприяють правильному формуванню тактики ведення пацієнта та забезпечення умов для видужання і профілактики. Важливо поставити акцент на тому, що використання мила і лужних детергентів призводить до погіршення ДАН. В основі виникнення ДАН лежить подразнення шкіри сечею та/або фекаліями, тоді як грибкова чи бактеріальна інфекція тут не має ролі етіологічного агента, хоч і може посилювати прояви захворювання.
У клінічній практиці варто диференціювати ДАН з пролежнями, кандидозом шкіри та іншими захворюваннями, адже їх ведення і лікування може суттєво відрізнятися.
Використання стандартизованих і верифікованих оцінювальних інструментів забезпечує об’єктивність діагностики та уможливлює порівняння стану хвороби в процесі лікування та догляду за шкірою.
У лікуванні ДАН потрібно послідовно дотримуватися етапів очищення і захисту шкіри, для чого використовувати відповідні рекомендовані засоби.
Недостатня кількість порівняльних наукових досліджень щодо якості, ефективності та економічної вигоди засобів для очищення і захисту шкіри від забруднення випорожненнями ускладнює видання стандартизованих рекомендацій з ведення ДАН. Тому пошук нових лікарських засобів та режимів ведення хворих на ДАН потребує продовження та наукового вивчення.
Зміст розділу відображено в наступних публікаціях:
- Галникіна С.О., Когут І.Й. Дерматит, асоційований з нетриманням фізіологічних відправлень – новий підхід до «старої» проблеми. Український журнал дерматології, венерології, косметології. 2016. № 1 (60). С. 87–92 [6].
- Когут І.Й., Галникіна С.О. Визначення ефективності лікування дерматиту, асоційованого з нетриманням фізіологічних відправлень за допомогою IADS і IAD-IT. Журнал дерматовенерології та косметології ім. М.О.Торсуєва. 2017. №. 2 (38). С. 98–101 [16].
РОЗДІЛ 2
Матеріали та методи дослідження
Дисертаційне дослідження проводилося на кафедрі інфекційних хвороб з епідеміологією, шкірними і венеричними хворобами Тернопільського національного медичного університету ім. І.Я. Горбачевського. До проспективного спостережного дослідження увійшли 134 дорослі пацієнти обох статей із супутнім діагнозом ДАН, які перебували на тривалому стаціонарному догляді у Петриківському обласному геріатричному пансіонаті у період з липня 2014 р по січень 2019 року.
Лабораторні та мікологічні дослідження виконували у клініко-діагностичній лабораторії Тернопільського обласного клінічного шкірно-венерологічного диспансеру. Клініко-діагностична лабораторія атестована на проведення вимірювань у сфері поширення державного метрологічного нагляду в галузі охорони здоров’я (свідоцтво про атестацію РХ-1018/11 від 24.05.2011 р. і № 004247 від 16.07.2015 р.).
Діагноз ДАН встановлювався на підставі клініко-анамнестичних даних, а саме – наявності еритеми з або без інших характерних уражень, яка виникла внаслідок контакту із сечею та/або калом в осіб з нетриманням на періанальній шкірі, сідницях, геніталіях, низу живота, внутрішніх та задніх поверхнях стегон, міжсідничній і пахвинних складках. Вік хворих мав бути більший за 18 років.
Протипоказанням до участі у дослідженні були:
– тяжкий загальний стан;
– суттєві відхилення у показниках загальноклінічних лабораторних аналізів;
– відома тяжка ниркова недостатність (швидкість клубочкової фільтрації < 30мл/хв/1,73м2);
– відома тяжка печінкова недостатність (клас С за класифікацією Чайлд-Пью);
– системне використання глюкокортикоїдів та імунодепресантів протягом 30 днів перед початком дослідження;
– місцеве застосування топічних глюкокортикоїдів протягом 7 днів перед початком дослідження;
– місцеве використання антисептичних розчинів діамантового зеленого, фукорцину, йоду, повідону йоду та інших засобів, які перешкоджатимуть оцінюванню поверхні ураженої шкіри, до моменту зникнення штучного забарвлення шкіри;
– застосування камфорної олії протягом 1 місяця перед початком дослідження.
Пацієнти були розподілені на групи у випадковому порядку. Основну групу склали 104 хворих на ДАН, які для очищення і захисту шкіри отримували розроблений метод зовнішнього лікування і профілактики ДАН з використанням камфорної олії. Діючою речовиною досліджуваного лікарського засобу є камфора рацемічна у концентрації 0,1 г в 1 мл олії соняшникової. У групі порівняння, до якої увійшли 30 хворих на ДАН, застосовували гігієнічні засоби для догляду за шкірою в осіб з нетриманням, а саме вологі серветки 3 в 1 або поєднання піни для очищення шкіри із захисним бар’єрним кремом. Пацієнтам обох груп заходи з очищення та захисту шкіри проводились тричі на добу з подальшою заміною підгузків.
Дослідження охоплювало початкове обстеження у перший день спостереження та кінцеве обстеження, проведене через один місяць лікування, а саме на (30 ± 1) день. Усі пацієнти дали добровільну згоду на участь у цьому дослідженні.
Визначення ефективності лікування проводилося на основі порівняння зміни клінічних і лабораторних показників в оброблених препаратом ділянках з симптомами ДАН до та після лікування. Визначення профілактичного ефекту проводилося на основі відсутності розвитку симптомів ДАН у первинно інтактних зонах ризику, які також підлягали обробці досліджуваним препаратом протягом всього періоду спостереження.
2.4 Методи клінічних досліджень
Під час початкового обстеження проводилося опитування скарг і анамнезу, з деталізацією про супутні захворювання, отримане системне і локальне лікування, використані засоби догляду за шкірою при нетриманні, періодичність заміни підгузків.
На початку та в кінці дослідження проводилося повне об’єктивне обстеження з деталізацією локального статусу, а саме місць розташування та інтенсивності почервоніння, наявності інших висипань (папули, пустули, везикули, ерозії, некроз, лущення).
Грибковий висип встановлювався за наявності гіперемованих плям або папул, вкритих білим нальотом, переважно по периферії вогнища ДАН, які можуть поєднуватися з пустулами, ерозіями, мацерацією, набряком та супроводжуватися свербежем.
Після завершення дослідження в обох групах на підставі даних оцінювання стану шкіри проаналізовано ефективність проведеного лікування та профілактики ДАН.
2.4.1 Методи загальноклінічних лабораторних досліджень
Усім пацієнтам на початку та у кінці дослідження проводили загальний аналіз крові, загальний аналіз сечі, біохімічний аналіз крові (білок загальний, глюкоза, білірубін загальний, холестерин, креатинін, сечовина, аланінамінотрансфераза, аспартатамінотрансфераза, гамма-глютамілтрансфераза) за загальноприйнятими методиками [28].
2.4.2 Методи оцінювальних інструментів
За допомогою оцінювального інструмента IAD-IT визначено ступені ДАН та наявність грибкового висипу (рис. 2.1). Для ранньої стадії ДАН характерна дифузно рожева або почервоніла шкіра без чітких меж. При помірному ДАН уражена шкіра яскраво-червоного кольору, може бути блискуча та вогка, з мокненням, точковими кровоточивими ділянками, дрібними пухирцями, невеликими осередками втрати цілісності поверхні шкіри. За тяжкого ДАН уражена шкіра почервоніла, з денудованими ділянками, мокненням або кровоточивістю.
Встановлення ступеня тяжкості ДАН проводилось за допомогою інструмента IADS (рис. 2.2). Інструмент оцінює ступінь еритеми шкіри, наявність характерних висипань і порушення цілісності шкіри на 13 ділянках тіла, які найчастіше піддаються дії сечі та калу. Такими ділянками є періанальна шкіра, міжсіднична і пахвинна складки, верхня і нижня частини обох сідниць, геніталії, низ живота, задні і внутрішні частини обох стегон. Кінцевий результат оцінювання IADS виражається сумою найбільших балів, визначених для кожної ділянки. Діапазон можливих значень знаходиться в межах від 0 до 52 балів. З поліпшенням стану хворого, бал знижується. Для зручності підрахунку загального балу IADS використовується спеціальна форма (рис. 2.3).
За допомогою оцінювального інструмента GLOBIAD проведено категоризацію досліджуваних пацієнтів з ДАН на основі попередньо отриманих даних. Основними критеріями для належності пацієнтів до 1 категорії було постійне почервоніння шкіри, а до 2 категорії – втрата цілісності шкіри, а саме – ерозування везикул і пухирів, денудації та екскоріації. Критеріями належності хворих до підкатегорії В були ознаки інфікування шкіри, такі як біле лущення шкіри (підозра на грибкову інфекцію) або супутні ураження (пустули довкола ураження, підозра на інфікування грибом Candida albicans), видимий наліт на дні рани (жовтий/коричневий/сіруватий), зміна кольору дна рани на зелений (підозра на бактеріальну інфекцію Pseudomonas aeruginosa), надмірний рівень ексудату, гнійний ексудат або блискучий вигляд дна рани. Пацієнти, які не увійшли до підкатегорії В, були класифіковані як підкатегорія А (рис. 2.4) [18, 20].
 Рисунок 2.1 – Оцінювальний інструмент IAD-IT
Рисунок 2.1 – Оцінювальний інструмент IAD-IT
Рисунок 2.2 – Оцінювальний інструмент IADS
Форма для підрахунку балів
для визначення ТЯжкості Дерматиту
Асоційованого з нетриманням випорожнень
Інструкція
- Виберіть, найгірший тип пошкодження шкіри у кожній з 13 локалізацій.
- Запишіть одне число, яке відповідає обраному найгіршому типу пошкодження шкіри, у кожній з 13 локалізацій.
- Діапазон можливих значень суми балів знаходиться у діапазоні 0 – 52.
- Підсумуйте вказані 13 чисел для визначення загального бала тяжкості дерматиту, асоційованого з нетриманням відправлень. З поліпшенням стану захворювання загальний бал буде знижуватись.
| Дата______________ | |||||||||||||
| Почервоніння | Висипання | Порушення
цілісності |
|||||||||||
| Відсутнє
(0) |
Рожеве
(1) |
Червоне
(2) |
Наявне
(3) |
Наявне
(4) |
|||||||||
| 1 | Періанальна шкіра | ||||||||||||
| 2 | Міжсіднична складка | ||||||||||||
| 3 | Нижня частина лівої сідниці | ||||||||||||
| 4 | Нижня частина правої сідниці | ||||||||||||
| 5 | Верхня частина лівої сідниці | ||||||||||||
| 6 | Верхня частина правої сідниці | ||||||||||||
| 7 | Геніталії (губи/калитка) | ||||||||||||
| 8 | Низ живота/надлобкова | ||||||||||||
| 9 | Пахвинна складка | ||||||||||||
| 10 | Внутрішня поверхня лівого стегна | ||||||||||||
| 11 | Внутрішня поверхня правого стегна | ||||||||||||
| 12 | Задня поверхня лівого стегна | ||||||||||||
| 13 | Задня поверхня правого стегна | БАЛ | |||||||||||
| РАЗОМ | |||||||||||||
Рисунок 2.3 – Форма для підрахунку балів IADS для визначення тяжкості ДАН
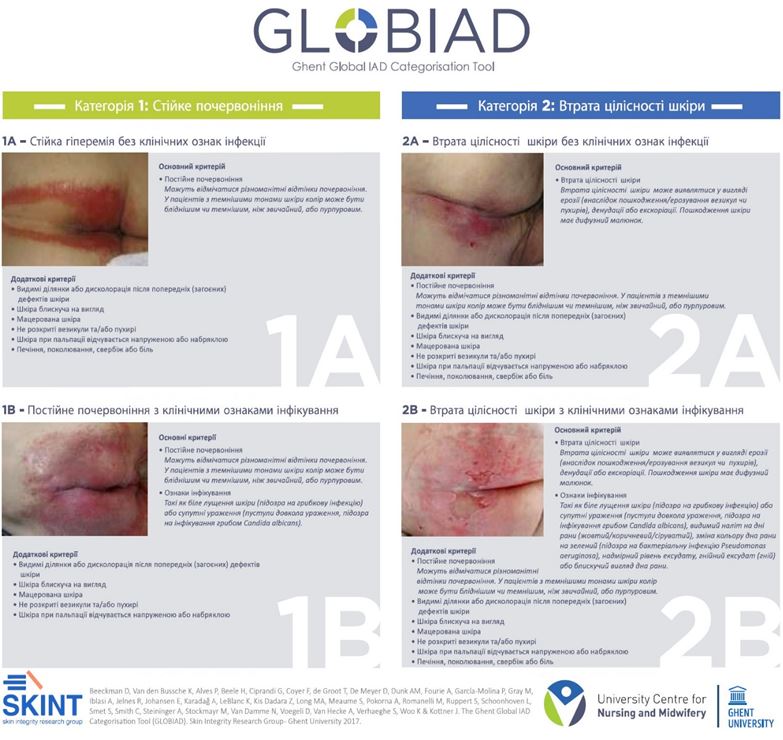 Примітка. Публікація та використання з дозволу K. Van den Bussche. Переклад на українську мову Когут І.Й., 2018. Доступно на http://bit.ly/GLOBIADukrainian
Примітка. Публікація та використання з дозволу K. Van den Bussche. Переклад на українську мову Когут І.Й., 2018. Доступно на http://bit.ly/GLOBIADukrainian
Рисунок 2.4 – Гентський глобальний категоризаційний інструмент для ДАН
2.4.3 Метод мікробіологічних досліджень
Виділення та ідентифікацію патогенних мікроорганізмів проводили за загальноприйнятими методиками [30, 37]. Для дослідження мікробіоти поверхні шкіри матеріал забирали з площі 1 см2 типового осередку висипань, розташованого в одній з пахових складок, за відсутності висипань у пахових складках – у найближчій ділянці з типовими висипаннями. а при відсутності типових висипань – у пахових складках, атравматично відносно до прилеглих тканин, дотримуючись правил асептики.
Відбір матеріалу виконували у перший день дослідження та через один місяць після лікування. Забір матеріалу проводили стерильним ватним тампоном, який поміщали у стерильне транспортне середовище типу Амієс і передавали у лабораторію у день забору. Зразки засівали на цукровий бульйон та на чашку з 5 % кров’яним агаром, при цьому на чашці посів проводили паралельними та перпендикулярними штрихами, формуючи решітку, після чого культивували 24 – 48 год за температури 37°С. У наступному, отримані колонії відсівали на високоселективні поживні середовища. Для мікологічного посіву на Candida spp. використовували середовище Сабуро для грибів, яке містило гентаміцин для пригнічення росту бактерій, культивування відбувалося 48 – 72 год за температури 37°С. Ідентифікацію Candida spp. проводили на підставі макроскопічного та мікроскопічного дослідження характерних колоній [25, 42]. Для виявлення грампозитивних коків і синьогнійної палички використовували кров’яний агар, і додатково, для золотистого та епідермального стафілококів – жовтково-сольовий агар. Інкубування відбувалося в термостаті 18 – 24 години при температурі 37°С. Ідентифікацію збудників проводили традиційним способом на підставі морфологічних, тинкторіальних та біохімічних властивостей показників типових колоній та мікроскопії за Грамом. Для ідентифікації стафілококів використовували визначення гемолітичної, лецитиназної та каталазної активності за стандартними методиками. Для ідентифікації гемолітичних стрептококів визначали вид гемолізу на кров’яному агарі [25, 30, 36].
2.5 Методи статистичної обробки даних
Створення первинної бази даних і статистична обробка результатів виконана за допомогою програмного забезпечення Microsoft Excel® 2016 та MedCalc®. Показники змінних подано в абсолютних і відносних значеннях, а також у середніх арифметичних (М) зі стандартним відхиленням (± m). Для визначення дисперсії показників непов’язаних сукупностей (розподіл за віком і статтю) застосовано підрахунок точного критерію Фішера. Для аналізу безперервних змінних (загальний бал IADS) використано парний двовибірковий t-критерій Ст’юдента при α = 0,05. Якщо абсолютне значення t-критерію було вищим за його критичне значення, то нульова гіпотеза відкидалася. Для аналізу категорійних показників (ступінь IAD-IT, результати мікологічного посіву, випадки грибкового висипу, категорії GLOBIAD) проведено біваріантний аналіз за допомогою визначення Хі-квадрат в тесті McNemar для біномних категорій, з використанням поправки за Edwards в основній групі. Статистична значущість була встановлена на рівні α = 0,05 зі ступенем свободи 1. Зміна показників вважалася достовірною при рівні значущості не менше ніж 0,05 (р<0,05) і високодостовірною при значущості не менше ніж 0,01 (р<0,01). Порівняння показників між групами проведене за допомогою регресійного аналізу з визначенням відношення шансів (OR) при 95 % довірчому інтервалі (СІ 95 %). Порівнянню підлягали показники, визначені перед початком лікування та через один місяць курсу лікування [34].
Матеріали досліджень у цьому розділі, оприлюднені та опубліковані в таких наукових роботах:
- Галникіна С.О., Когут І.Й. Дерматит, асоційований з нетриманням фізіологічних відправлень – новий підхід до «старої» проблеми. Український журнал дерматології, венерології, косметології. 2016. № 1 (60). С. 87–92 [6].
- Когут І.Й., Галникіна С.О. Визначення ефективності лікування дерматиту, асоційованого з нетриманням фізіологічних відправлень за допомогою IADS і IAD-IT. Журнал дерматовенерології та косметології ім. М.О.Торсуєва. 2017. №. 2 (38). С. 98–101 [16].
- Когут І.Й., Галникіна С.О. Застосування категоризаційного інструмента GLOBIAD для моніторингу дерматиту, асоційованого з нетриманням. Український журнал дерматології, венерології, косметології. 2018. № 3. С. 110–114 [18].
- Когут І.Й., Галникіна С.О. Застосування оцінювальних інструментів IADS і IAD-IT при дерматиті, асоційованому з нетриманням відправлень. Ліки України плюс. 2018. № 1. С. 27–31 [19].
- Пат. на корисну модель 107279 UA, МПК A61K 31/125, A61P 17/00, A61F 13/47, A61L 15/16. Спосіб лікування контактного дерматиту, асоційованого з нетриманням фізіологічних відправлень / С.О. Галникіна, І.Й. Когут, А.В. Павлишин; заявник і патентовласник ДВНЗ «Тернопільський державний медичний університет ім. І.Я.Горбачевського МОЗ України». № u201512640; заявл. 21.12.15; опубл. 25.05.16, Бюл. № 10 [33].
- Когут І.Й. Особливості вторинного інфікування поверхні шкіри у хворих на асоційований з нетриманням дерматит. Інфекційні хвороби: поступи і проблеми в діагностиці, терапії і профілактиці: Матеріали ІХ з’їзду інфекціоністів України. м. Тернопіль, 7–9 жовтня 2015 р. Тернопіль : Укрмедкнига, 2015. С. 252–253 [14].
- The role of Candida spp. contamination and efficacy of camphorated oil in skin care of incontinent associated dermatitis patients / I. Kohut, S. Galnykina, M. Kushynska et al. Pol Med J. 2020. Vol. XLVIII, Iss. 284. P. 35–39 [168].
- Kohut I., Galnykina S. The efficacy of topical camphorated oil in long-term care of residents with incontinence-associated dermatitis. Dermatology Review/Przegląd Dermatologiczny. 2019. Vol. 106, Iss. 6. P. 683–686 [125].
РОЗДІЛ 3
клініко-Інструментальна характеристика хворих
3.1 Загальна клінічна характеристика хворих
Під спостереженням перебували 134 хворих на ДАН, віком від 36 до 92 років, у середньому (77 ± 11) років, з них – 51 (38,1 %) чоловіків та 83 (61,9 %) жінок. Склад груп не відрізнявся за статтю, віком і балом IADS згідно з підрахунком дисперсії показників за допомогою точного критерію Фішера. Детальна клініко-анамнестична характеристика хворих наведена у табл. 3.1.
Таблиця 3.1 – Загальна клінічна характеристика хворих
| Основна група | Група порівняння | Разом | |
| n (%) | n (%) | n (%) | |
| Нетримання сечі | 104 (100,0 %) | 30 (100,0 %) | 134 (100,0 %) |
| Нетримання калу | 36 (34,6 %) | 12 (40,0 %) | 48 (35,8 %) |
| Загальний стан | |||
| – задовільний | 60 (57,7 %) | 20 (66,7 %) | 80 (59,7 %) |
| – середньої тяжкості | 44 (42,3 %) | 10 (33,3 %) | 54 (40,3 %) |
| Рухова активність | |||
| – задовільна | 9 (8,6 %) | 4 (13,4 %) | 13 (9,7 %) |
| – з допоміжними засобами | 34 (32,7 %) | 10 (33,3 %) | 44 (32,8 %) |
| – сидяче положення | 47 (45,2 %) | 9 (30,0 %) | 56 (41,8 %) |
| – лежаче положення | 14 (13,5 %) | 7 (23,3 %) | 21 (15,7 %) |
| Свідомість | |||
| – ясна | 70 (67,3 %) | 18 (60,0 %) | 88 (65,7 %) |
| – легко порушена | 29 (27,9 %) | 12 (40,0 %) | 41 (30,6 %) |
| – сплутана | 5 (4,8 %) | – | 5 (3,7 %) |
| Пролежні | 10 (9,6 %) | 1 (3,3 %) | 11 (8,2 %) |
Як свідчить табл. 3.1, у всіх пацієнтів було нетримання сечі, яке поєднувалося з нетриманням калу у 48 (35,8 %) осіб. Загальний фізичний стан був задовільним у 80 (59,7 %) пацієнтів, середньої тяжкості – у 54 (40,3 %) хворих. Рухова активність була задовільною у 13 (9,7 %) осіб. Обмежена рухова активність була у 90,3 % пацієнтів, а саме: могли пересуватися з допоміжними засобами 44 (32,8 %) обстежених, сидяче положення у 56 (41,8 %) осіб, а лежаче – у 21 (15,7 %) хворого. Більшість обстежених, а саме 88 (65,7 %) осіб не мали порушення свідомості, у 41 (30,6 %) пацієнта відзначено легкі порушення пам’яті та орієнтації і тільки у 5 (3,7 %) хворих свідомість була сплутана. Супутні пролежні були встановлені у 11 (8,2 %) хворих (табл. 3.1).
Серед основної патології у пацієнтів з ДАН були наслідки перенесеного інсульту головного мозку у 46 (34,3 %) пацієнтів, психічні розлади – у 44 (32,8 %) осіб, облітеруючий атеросклероз судин нижніх кінцівок – у 9 (6,7 %) осіб, ампутаційні кукси нижніх кінцівок також у 9 (6,7 %) хворих, декомпенсована серцева недостатність – у 7 (5,2 %) пацієнтів, цукровий діабет – у 6 (4,5 %) та ожиріння – у 2 (1,5 %) обстежених.
3.2 Локалізація ділянок ураження дерматиту, асоційованого з нетриманням
На початковому обстеженні найчастішими зонами ураження у пацієнтів основної групи та групи порівняння були нижні частини сідниць справа, відповідно у 86 (82,7 %) і 22 (73,3 %) хворих, та зліва – у 84 (80,8 %) і 23 (76,7 %), геніталії – у 79 (76,0 %) і 22 (73,3 %), міжсіднична складка – у 80 (76,9 %) і 21 (70,0 %), періанальна шкіра – у 78 (75,0 %) і 21 (70,0 %) осіб. Рідше уражалися внутрішні поверхні стегон зліва, відповідно у 54 (51,9 %) і 15 (50,0 %) і справа у 52 (50,0 %) і 17 (56,7 %), верхня частина сідниці зліва у 47 (45,2 %) і 14 (46,7 %) і справа у 43 (41,3 %) і 11 (36,7 %) пацієнтів. Задні поверхні стегон були змінені зліва відповідно у 39 (37,5 %) і 7 (23,3 %) і справа у 34 (32,7 %) і 8 (26,7 %) пацієнтів. Найрідше траплялися ураження у пахвинних складках, відповідно у 31 (29,8 %) і 11 (36,7 %) та в низу живота у 27 (26,0 %) і 9 (30,0 %) обстежених (рис. 3.1 і 3.2).
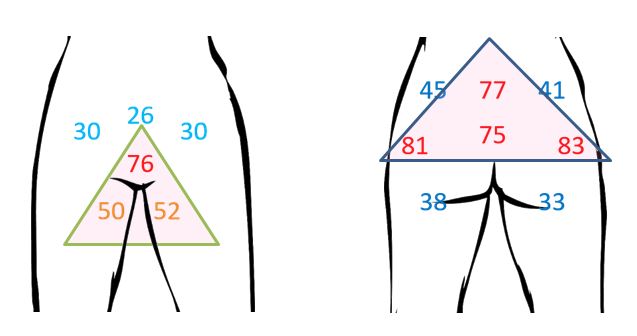
Рисунок 3.1 – Частота ураження ділянок при ДАН в основній групі до лікування, %
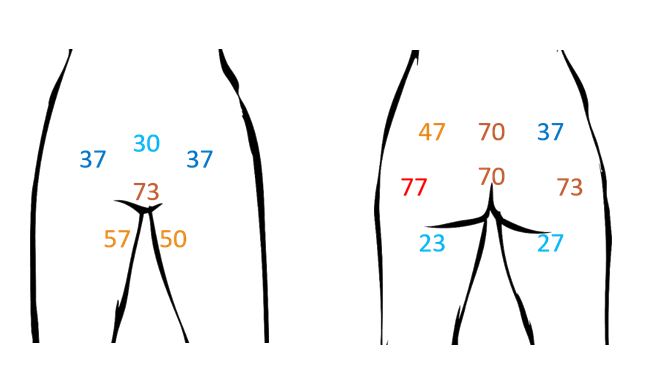
Рисунок 3.2 – Частота ураження різних ділянок при ДАН у групі порівняння до лікування, %
В основній групі, перед початком лікування, симптоми ДАН спостерігалися, у середньому, на 7 різних ділянках тіла. Після курсу лікування розповсюдженість симптомів захворювання зменшилась до 5 ділянок, однак така зміна не була достовірною (p = 0,43).
3.3 Поширеність та інтенсивність еритеми
Еритема шкіри спостерігалася у всіх пацієнтів перед початком лікування. Згідно з інструментом IADS відрізняють яскраву та легку еритему, для чого існують відповідні кольорові зразки. В основній групі вона була яскравою у 73 (70,2 %) хворих та легкою у 31 (29,8 %) особи, а у групі порівняння відповідно у 18 (60,0 %) і 12 (40,0 %) осіб. (рис. 3.3).
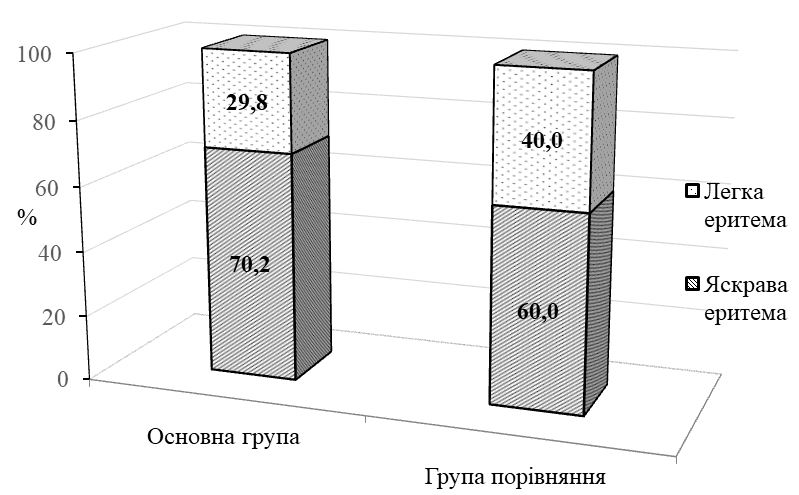 Рисунок 3.3 – Частота різних ступенів еритеми до лікування
Рисунок 3.3 – Частота різних ступенів еритеми до лікування
3.4 Інші первинні висипання та порушення цілісності шкіри
У ділянках, уражених ДАН, крім гіперемії, визначалися інші первинні елементи висипів, зокрема в основній групі папули були у 75 (72,1 %), везикули – у 45 (43,3 %), пухирі – у 17 (16,3 %) і пустули – у 24 (23,1 %) хворих, відповідні показники у групі порівняння становили 18 (60,0 %), 12 (40,0%), 4 (13,3 %) і 6 (20,0 %) осіб. Порушення цілісності шкіри при ДАН спостерігалося у вигляді ерозій у 50,0 % осіб в обох групах (рис. 3.4).
 Рисунок 3.4 – Частота інших висипань до лікування
Рисунок 3.4 – Частота інших висипань до лікування
3.5 Грибкові висипання у хворих на дерматит, асоційований з нетриманням
Грибковий висип встановлювався за наявності гіперемованих плям або папул, вкритих білим нальотом, переважно по периферії вогнища ДАН, які можуть поєднуватися з пустулами, ерозіями, мацерацією, набряком та супроводжуватися свербежем [64, 144]. Підраховано, що грибковий висип спостерігався на початку лікування у 53 (51,0 %) хворих основної групи та 12 (40,0 %) пацієнтів групи порівняння.
3.6 Оцінка тяжкості дерматиту, асоційованого з нетриманням за показниками IADS
Показник оцінювального інструмента IADS відображає рівень тяжкості ДАН в балах від 0 до 52 (з поліпшенням стану шкіри загальний бал знижується). Інструмент оцінює 13 типових ділянок локалізації ДАН, у кожній з яких у балах позначають ступінь еритеми шкіри, наявність іншого висипу та пошкодження поверхні. Остаточний результат оцінювання виражається сумою визначених балів. До початку лікування підраховано, що показник IADS становив в основній групі (20,2 ± 6,5) бали (діапазон 7 – 41 бали), а у групі порівняння – (19,0 ± 5,3) бали (діапазон 13 – 33) (рис. 3.5).
 Рисунок 3.5 – Показники балів IADS до лікування
Рисунок 3.5 – Показники балів IADS до лікування
З огляду літератури відомо, що тяжкість ДАН зростає при фекальному нетриманні, проте пошук у джерелах не виявив достатніх статистичних даних, у тому числі з використанням оцінювальних інструментів [57, 141]. Тому, у даній роботі було проаналізовано зв’язок тяжкості перебігу і ступеня захворювання з видом нетримання, для чого пацієнти були розділені на підгрупу 1, до якої увійшли особи з нетриманням тільки сечі (68 в основній групі та 18 в групі порівняння), та підгрупу 2, яку склали хворі з подвійним нетриманням (36 в основній групі і 12 в групі порівняння). Аналіз показників, проведений таким чином, виявив, що у 2 підгрупі (подвійне нетримання) загальний бал IADS був достовірно більшим в 1,4 раза, ніж у першій підгрупі (нетримання сечі), а саме (24,4±6,4) проти (17,9±5,5) бала, а у групі порівняння відповідно (22,9±5,1) проти (16,4±3,6) бала. Отримані результати вказують на те, що подвійне нетримання є вірогідним чинником тяжчого перебігу ДАН, що відображається вищими показником IADS(табл. 3.2).
Таблиця 3.2 – Загальний бал тяжкості IADS залежно від типу нетримання
| Нетримання сечі
(підгрупа 1) M ± m |
Подвійне нетримання
(підгрупа 2) M ± m |
t | tкрит | p | |
| Основна група | 17,9 ± 5,5 | 24,4 ± 6,4 | 5,21 | 2,00 | <0,01* |
| Група порівняння | 16,4 ± 3,6 | 22,9 ± 5,1 | 3,64 | 2,10 | <0,01* |
Примітка. * – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна (р<0,01).
3.7 Характеристика дерматиту, асоційованого з нетриманням за ступенями тяжкості згідно IAD-IT
Визначення ступеня тяжкості ДАН проводиться за допомогою інструменту IAD-IT. Критеріями легкого ступеня є неінтенсивне почервоніння шкіри без порушення її цілісності, незначний суб’єктивний дискомфорт. Середній ступінь супроводжується помірним почервонінням і лущенням шкіри, утворенням кірочок, невеликими ділянками пошкодження поверхні, формуванням невеликих пухирів, помірним дискомфортом. Тяжкий ДАН характеризується інтенсивним почервонінням, помітним лущенням, формуванням великих пухирів та ерозій, що супроводжуються мокненням та болем, який визначає виражений дискомфорт [108, 113]. Результати оцінювання IAD-IT наведені на рис. 3.6.
На рисунку 3.6 помітно, що за даними IAD-IT чисельно переважає когорта пацієнтів з помірним ступенем тяжкості ДАН. За результатами в основній групі на початку лікування легкий ДАН був виявлений у 15 (14,4 %), помірний ступінь – у 63 (60,6 %), а тяжкий – у 26 (25,0 %) хворих, а у групі порівняння відповідно у 5 (17,0 %), 12 (40,0 %) та 13 (43,0 %) хворих.
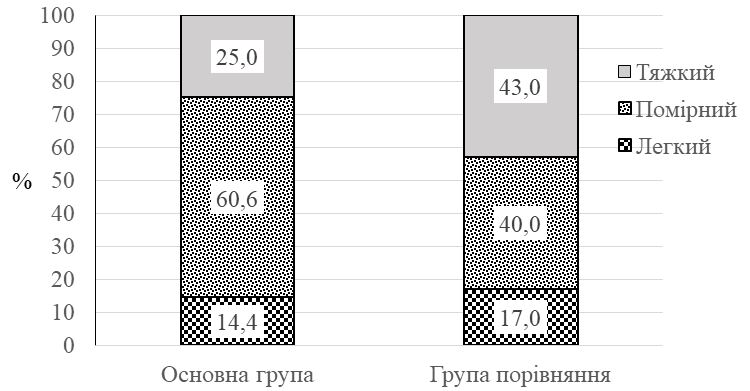 Рисунок 3.6 – Cтупені ДАН згідно IAD-IT до лікування
Рисунок 3.6 – Cтупені ДАН згідно IAD-IT до лікування
Підрахунок залежно від типу нетримання виявив, що нетримання сечі в основній групі достовірно переважає над подвійним нетриманням при легкому ступені в 4,0 раза (11,5 % проти 2,9 %), при помірному – в 2,7 раза (44,2 % проти 16,3 %). При тяжкому ступені, навпаки, подвійне нетримання зустрічається частіше в 1,6 раза (15,4 % проти 9,6 %), але така різниця не досягала достовірного рівня. У пацієнтів групи порівняння нетримання сечі також переважало при легкому та помірному ступені, відповідно у 4,0 (13,3 % проти 3,3 %) і 5,0 разів (33,3 % проти 6,7 %), а подвійне нетримання – при тяжкому ступені в 2,3 раза (30,0 % проти 13,3 %) (табл. 3.3).
За допомогою інструменту GLOBIAD хворі поділяються на дві категорії: категорія 1 – пацієнти з постійним почервонінням шкіри, категорія 2 – пацієнти, у яких додатково наявні ерозії, денудації та екскоріації шкіри. Кожна з категорій поділена на дві підкатегорії: А – без ознак інфікування та В – з клінічними ознаками інфікування шкіри [114]. Ознаками інфікування вважаються біле лущення шкіри (підозра на грибкову інфекцію), пустули довкола ураження (підозра на інфікування Candida albicans), видимий наліт на дні рани (жовтий/коричневий/сіруватий), зелений колір дна рани (підозра на інфекцію P. aeruginosa), надмірний рівень ексудату, гнійний ексудат та блискуче дно рани. Використовуючи відомі клінічні дані проведено категоризацію хворих на ДАН за допомогою інструмента GLOBIAD. На початку спостереження в основній групі до категорії 1А зараховано 29 (27,9 %) хворих, до 1В – 23 (22,1 %), до 2А – 22 (21,2 %) і до 2В – 30 (28,8 %) пацієнтів, у групі порівняння, відповідно, 13 (43,3 %), 2 (6,7 %), 5 (16,7 %) і 10 (33,3 %) пацієнтів (рис. 3.7). З рисунку 3.7 помітно, що при використанні даного способу категоризації хворих на ДАН чисельно переважають найлегша категорія 1А та найважча 2В.
Таблиця 3.3 – Ступені ДАН при різних типах нетримання до лікування
| Ступінь ДАН | Підгрупа 1
(подвійне нетримання) n/N, (%) |
Підгрупа 2
(нетримання сечі) n/N, (%) |
OR | CI min | CI max | p | ||||||
| Основна група | ||||||||||||
| Легкий | 3/104 (2,9 %) | 12/104 (11,5 %) | 0,23 | 0,06 | 0,83 | 0,03* | ||||||
| Помірний | 17/104 (16,3 %) | 46/104 (44,2 %) | 0,25 | 0,13 | 0,47 | <0,01** | ||||||
| Тяжкий | 16/104 (15,4 %) | 10/104 (9,6 %) | 1,71 | 0,74 | 3,97 | 0,21 | ||||||
| Група порівняння | ||||||||||||
| Легкий | 1/30 (3,3 %) | 4/30 (13,3 %) | 0,22 | 0,02 | 2,14 | 0,19 | ||||||
| Помірний | 2/30 (6,7 %) | 10/30 (33,3 %) | 0,14 | 0,03 | 0,72 | 0,02* | ||||||
| Тяжкий | 9/30 (30,0 %) | 4/30 (13,3 %) | 2,79 | 0,75 | 10,33 | 0,13 | ||||||
Примітка. * – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна (р<0,05); ** – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна (р<0,01).
Підрахунок у підгрупах залежно від типу нетримання за допомогою інструменту GLOBIAD виявив, що нетримання сечі достовірно переважає над подвійним нетриманням у найлегшій категорії 1А за GLOBIAD в 3,8 раза (22,1 % проти 5,8 %), а при 2A – в 4,5 раза (17,3 % проти 3,8 %). При приєднанні ознак інфікування, у категорії 1В така перевага зменшується до 1,6 раза (13,5 % проти 8,7 %) та стає недостовірною, а у категорії 2В, навпаки, уже подвійне нетримання починає переважати над нетриманням сечі в 1,3 раза (16,3 % проти 12,5 %). У пацієнтів з групи порівняння, нетримання сечі також достовірно переважало над подвійним нетриманням у категорії 1А у 5,5 раза (36,7 % проти 6,7 %), у категорії 2А – у 4,0 раза (13,3 % проти 3,3 %), у категорії 1В показники зрівнялися (3,3 % проти 3,3 %), тоді як у найважчій категорії 2В, як і в основній групі, подвійне нетримання переважало над нетриманням сечі у 4,0 раза (26,7 % проти 6,7 %). (табл. 3.4).
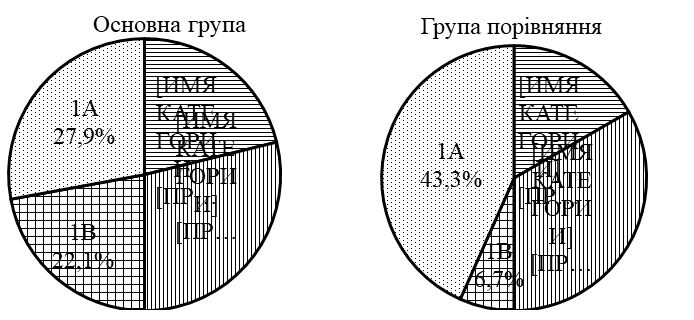 Рисунок 3.7 – Розподіл категорій GLOBIAD до лікування
Рисунок 3.7 – Розподіл категорій GLOBIAD до лікування
Таблиця 3.4 – Зміна складу категорій GLOBIAD при різних типах нетримання до лікування
| Категорія | Підгрупа 1
(нетримання сечі) n/N, (%) |
Підгрупа 2
(подвійне нетримання) n/N, (%) |
OR | CI min | CI max | p |
| Основна група | ||||||
| 1А | 23/104 (22,1 %) | 6/104 (5,8 %) | 4,64 | 1,80 | 11,94 | 0,002** |
| 1В | 14/104 (13,5 %) | 9/104 (8,7 %) | 1,64 | 0,68 | 3,98 | 0,272 |
| 2А | 18/104 (17,3 %) | 4/104 (3,8 %) | 5,23 | 1,71 | 16,06 | 0,004** |
| 2В | 13/104 (12,5 %) | 17/104 (16,3 %) | 0,73 | 0,34 | 1,59 | 0,431 |
| Група порівняння | ||||||
| 1А | 11/30 (36,7 %) | 2/30 (6,7 %) | 8,11 | 1,61 | 40,77 | 0,011* |
| 1В | 1/30 (3,3 %) | 1/30 (3,3 %) | 1,00 | 0,06 | 16,76 | 1,000 |
| 2А | 4/30 (13,3 %) | 1/30 (3,3 %) | 4,46 | 0,47 | 42,52 | 0,194 |
| 2В | 2/30 (6,7 %) | 8/30 (26,7 %) | 0,20 | 0,04 | 1,02 | 0,053 |
Примітка. * – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна (р<0,05); ** – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна (р<0,01).
* * *
На основі наведених у розділі 3 результатів можна зробити такі проміжні висновки:
- Встановлено, що характерними клініко-епідеміологічними ознаками ДАН є похилий вік (77 ± 11 років), обмежена рухова активність (90,3 %), ураження нижніх частин сідниць, геніталій, міжсідничної складки та періанальної шкіри (70 % і більше), яскрава еритема (70,2 %) та ерозії (50 %).
- Згідно з даними оцінювальних інструментів визначено, що типовими для ДАН є: середній показник IADS (20,2 ± 6,5) балів, помірний ступінь за IAD – IT (60,6 %) і найтяжча категорія 2В за GLOBIAD (28,8 %).
- Доведено, що подвійне нетримання є достовірним чинником підвищення загального балу тяжкості IADS (в 1,4 раза), розвитку тяжкого ступеню згідно з IAD-IT та категорій 1В, 2А і 2В згідно з GLOBIAD.
Матеріали досліджень у цьому розділі, оприлюднені та опубліковані в таких наукових роботах:
- Когут І.Й., Галникіна С.О. Визначення ефективності лікування дерматиту, асоційованого з нетриманням фізіологічних відправлень за допомогою IADS і IAD-IT. Журнал дерматовенерології та косметології ім. М.О.Торсуєва. 2017. №. 2 (38). С. 98–101 [16].
- Когут І.Й., Галникіна С.О. Застосування оцінювальних інструментів IADS і IAD-IT при дерматиті, асоційованому з нетриманням відправлень. Ліки України плюс. 2018. № 1. С. 27–31 [19].
- Когут І.Й., Галникіна С.О. Застосування категоризаційного інструмента GLOBIAD для моніторингу дерматиту, асоційованого з нетриманням. Український журнал дерматології, венерології, косметології. 2018. № 3. С. 110–114 [18].
- Когут І.Й., Галникіна С.О. Застосування діагностичних методик IADS і IAD-IT при дерматиті, асоційованому з нетриманням випорожнень. Здобутки клінічної та експериментальної медицини: матеріали підсумкової науково-практичної конференції, присвяченої 60-річчю ТДМУ. м. Тернопіль, 14 червня 2017 р. Тернопіль : ТДМУ, 2017. С. 55–57 [17].
- Когут І.Й., Галникіна С.О. Моніторинг перебігу дерматиту, асоційованого з нетриманням, за допомогою категоризаційного інструмента GLOBIAD. XVII конгрес світової федерації українських лікарських товариств: матеріали наукового симпозіуму. м. Тернопіль, 20 вересня 2018 р. Тернопіль : ТДМУ, 2018. С.176 [22].
- Когут І.Й. Догляд за шкірою при дерматиті, асоційованому з нетриманням відправлень у хронічних хворих. Сучасні підходи до формування клінічних настанов з діагностики і лікування шкірних захворювань та інфекцій, що передаються статевим шляхом: європейський досвід та українські реалії: Всеукраїнська науково-практична конференція Української асоціації лікарів-дерматовенерологів і косметологів. м. Тернопіль, 19–20 жовтня 2016 р. Український журнал дерматології, венерології, косметології. 2016. № 4. С. 122–123 [13].
РОЗДІЛ 4
Показники мікробіологічного обстеження
біотопів шкіри у хворих на дерматит, асоційований
з нетриманням
Для розуміння епідеміології ДАН потрібно детально знати стан мікробної колонізації ураженої шкіри [10]. Зміна мікробіоценозу характерна для всіх хронічних дерматозів [1, 31]. Вивчення складу патогенної мікрофлори шкіри дозволяє відрізнити ДАН від піодермій, інтертриго, дерматофітій шкіри. Бактеріальне інфікування шкіри переважно не пов’язують з ДАН, тоді як клінічні ознаки грибкового інфікування спостерігають у 18 – 32 % пацієнтів, які підтверджується мікробіологічним дослідженнням у 60 – 75 % випадків [61, 64, 91]. Candida albicans є найпоширенішим грибковим коменсальним мікроорганізмом людини і найчастішим етіологічним збудником, пов’язаним з інфікуванням шкіри при ДАН. Виявлення кандид на поверхні шкіри, ураженої первинною дією сечі та/або калу не заперечує діагноз ДАН, а вказує на приєднання супутнього кандидозу шкіри. Враховуючи вищенаведене, в усіх 134 досліджуваних пацієнтів були проведені мікробіологічні дослідження.
4.1 Патогенна мікробіота шкіри в осередках ураження дерматиту, асоційованого з нетриманням
Обстеження мікробіоти показало, що у хворих на ДАН частота виявлення патогенних для поверхні шкіри бактерій була відносно низькою. В основній групі золотистий стафілокок виявлено у 5 хворих (4,8 %), гемолітичні стрептококи – у 2 осіб (1,9 %), синьогнійну паличку – у 3 осіб (2,9 %), у групі порівняння, відповідно у 2 (6,7 %), 1 (3,3 %) та 1 (3,3 %) пацієнтів (табл. 4.1). У всіх випадках вказані мікроорганізми перебували в асоціації з Candida spp. Кількісний показник мікробного обсіменіння становив не більше 5 КУО/см2 для одного виду бактерій. У мікологічному посіві Candida spp. була виявлена у 39 (37,5 %) хворих основної групи та 11 (36,7 %) пацієнтів групи порівняння, а кількісний показник мікробного обсіменіння відповідно становив 11,4±4,1 і 12,4±4,4 КУО/см2.
Таблиця 4.1 – Склад патогенної мікрофлори у хворих на ДАН
| Мікроорганізм | Основна група (n=104) | Група порівняння (n=30) | ||
| n | % | n | % | |
| S. aureus | 8 | 4,8 | 2 | 6,7 |
| S. haemolyticus | 2 | 1,9 | 1 | 3,3 |
| P. aureginosa | 3 | 2,9 | 1 | 3,3 |
| Candida spp. | 39 | 37,5 | 11 | 36,7 |
Аналіз отриманих показників у табл. 4.1 підтверджує очевидне домінування Candida spp. серед інших хвороботворних організмів при ДАН. Тому, у даному дослідженні було проаналізовано особливості перебігу хвороби залежно від колонізації шкіри супутньою грибковою інфекцією. На рис. 4.1 представлено співвідношення частоти випадків з виявленою та не виявленою Candida spp. в осередках ушкодження шкіри у хворих на ДАН.
Примітка. * – різниця між показниками осіб з виявленою та не виявленою Candida spp достовірна (р<0,05); ** – різниця між показниками осіб з виявленою та не виявленою Candida spp достовірна (р<0,01).
 Рисунок 4.1 – Частота Candida spp. у хворих на ДАН до лікування
Рисунок 4.1 – Частота Candida spp. у хворих на ДАН до лікування
Як свідчать дані, наведені на рис. 4.1, частота випадків ДАН без Candida spp. достовірно переважає в 1,7 раза над кількістю пацієнтів з грибковим інфікуванням в основній групі (p<0,01) та групі порівняння (p<0,05).
4.2 Верифікація грибкових висипань і супутній кандидоз шкіри
Відомо, що грибкові висипання, діагностовані за клінічними симптомами, підтверджуються мікологічно у 65 – 75 % випадків [64, 151]. У даному дослідженні Candida spp. висівалася у 56,6 % (30 з 53) хворих з грибковими висипаннями в основній групі та у 66,7 % (8 з 12) таких хворих у групі порівняння, що в середньому складало 58,5 % (38 з 65) (рис. 4.2).
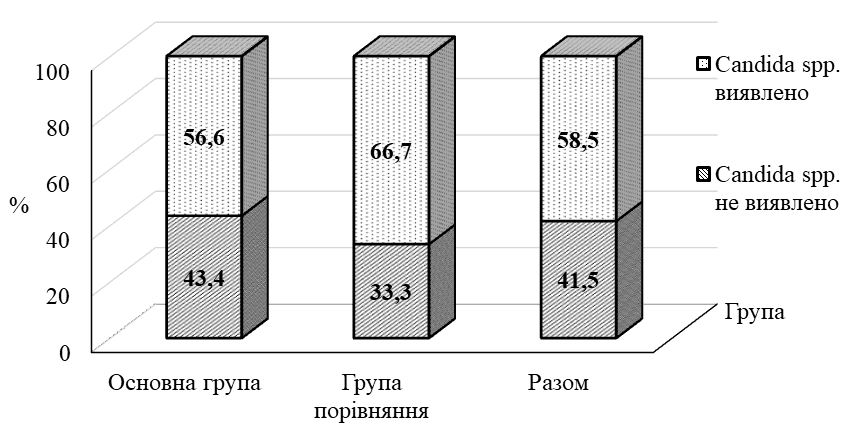 Рисунок 4.2 – Частота верифікації грибкових висипань до лікування
Рисунок 4.2 – Частота верифікації грибкових висипань до лікування
Грибкові висипання, підтверджені ростом грибів Candida spp. у мікологічному посіві прийнято вважати кандидозом шкіри, який у досліджуваних хворих розцінювався як супутній діагноз при ДАН. Усього в основній групі виявлено 28,8 % таких випадків (30 хворих), а у групі порівняння – 26,6 % (8 хворих), що в середньому становило 28,4 % (38 із 134 хворих) (рис 4.2).
4.3 Кандидна колонізація при різних типах нетримання
Наявність сечі та фекалій на шкірі створює сприятливе середовище для розвитку грибкової інфекції [91, 135]. Проте, залишається нез’ясованим, чи нетримання сприяє підвищеній частоті кандидної колонізації у пацієнта, чи, навпаки, нетримання виступає тригером для розвитку кандидної інфекції уже колонізованої шкіри [64]. Тому, показники частоти кандидної колонізації були вивчені залежно від типу нетримання, для чого пацієнти були поділені на підгрупу 1, до якої увійшли особи з нетриманням тільки сечі (68 в основній групі та 18 в групі порівняння), та підгрупу 2, яку склали хворі з подвійним нетриманням (36 в основній групі і 12 в групі порівняння). До початку лікування кандидні гриби виявлено в основній групі у 33,8 % (23 з 68) пацієнтів з нетриманням тільки сечі (підгрупа 1) та у 44,4 % (16 з 36) хворих з подвійним нетриманням (підгрупа 2), у групі порівняння відповідно у 22,2 % (4 з 18) та у 58,3 % (7 з 12) хворих, а при підрахунку в усіх разом відповідно у 31,4 % (27 з 86) та у 47,9 % (23 з 48) пацієнтів (рис 4.3).
 Рисунок 4.3 – Частота Candida spp. у хворих на ДАН залежно від типу нетримання
Рисунок 4.3 – Частота Candida spp. у хворих на ДАН залежно від типу нетримання
Як випливає з рис 4.3, частота колонізації Candida spp. при подвійному нетриманні переважала в 1,3 раза над частотою при нетриманні тільки сечі, але не досягала достовірної різниці, що вказує на відсутність зв’язку між кандидною контамінацією шкіри і типом нетримання, у тому числі подвійним, при ДАН.
4.4 Показники оцінювальних інструментів залежно від кандидної колонізації
Існують повідомлення, що кандидна колонізація корелює з тяжкістю ДАН, проте у дорослих, на відміну від досліджень у дітей при пелюшковому дерматиті, ці твердження не підкріплені достатньою кількістю наукових досліджень і ще не проводилися з використанням сучасних оцінювальних інструментів [161]. Підрахунок загального балу IADS залежно від грибкової колонізації виявив, що показники тяжкості у присутності Candida spp. до лікування були достовірно більші за показники при відсутності інфікування в обох групах, а саме загальний бал IADS в основній групі при супутній грибковій інфекції становив (23,5±7,5) бала, а без неї – був високодостовірно (р <0,001) нижчим в 1,3 раза і становив (18,2±5,2). У групі порівняння ці показники відповідно склали (21,7±4,1) і (17,5±5,3) бала та достовірно (р=0,03) відрізнялися між собою в 1,2 раза (рис. 4.4).
Примітка. * – різниця між показниками в осіб з виявленою та не виявленою Candida spp достовірна (р<0,05); ** – різниця між показниками в осіб з виявленою та не виявленою Candida spp достовірна (р<0,01).
Рисунок 4.4 – Загальний бал тяжкості IADS залежно від виявлення Candida spp. до лікування
Залежність частоти виявлення Candida spp. від різних ступенів ДАН також проаналізовано за допомогою інструменту IAD-IT. Виявлено, що при легкому ступені ДАН частота висівання Candida spp. в основній групі була найнижчою та становила 6,7 % (1 з 15) пацієнтів, при помірному ступені – більшою у 5 разів, досягаючи 33,3 % (21 з 63 пацієнтів). При тяжкому перебігу частота колонізації була найвищою – 65,4 % (17 з 26 пацієнтів) і високодостовірно (p < 0,01) відрізнялася від показника помірного ступеня у 2 рази, а від легкого – у 10 разів. У групі порівняння Candida spp. при легкому ступені не висівалася (0 з 5 пацієнтів), при помірному становила 16,7 % (2 з 12 пацієнтів), тоді як при тяжкому ступені – 69,2 % та була достовірно (p < 0,05) вищою за показник помірного ступеня у 4 рази (рис 4.5). Таким чином показано, що зі зростанням ступеня тяжкості збільшується частота кандидної колонізації, яка високодостовірно домінує при тяжкому ступені ДАН.
Примітка. * – різниця між показниками осіб з тяжким ступенем та помірним ступенем достовірна в основній групі (р<0,01), в групі порівняння (р<0,05); † - різниця між показниками осіб з тяжким ступенем та легким ступенем достовірна (р<0,01).
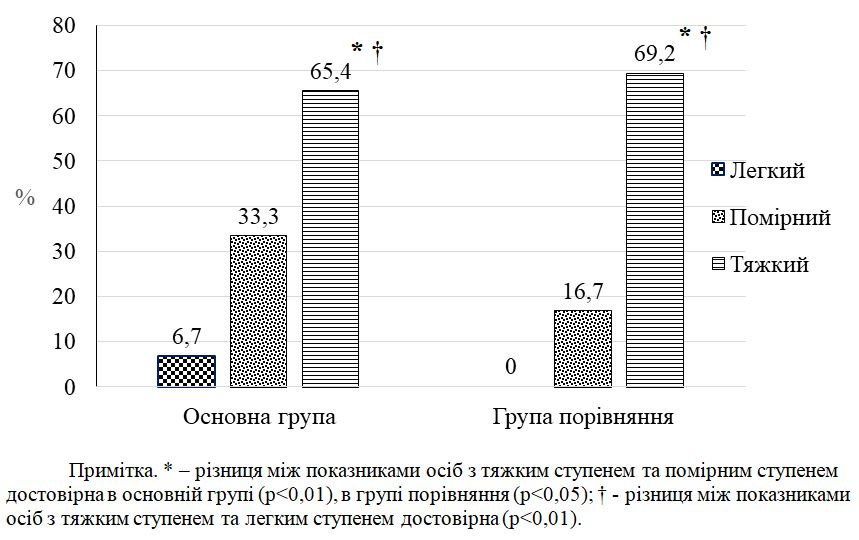 Рисунок 4.5 – Частота колонізації Candida spp. при різних ступенях ДАН за IAD-IT до лікування.
Рисунок 4.5 – Частота колонізації Candida spp. при різних ступенях ДАН за IAD-IT до лікування.
У цьому дослідженні також було вивчено зв’язок кандидної колонізації з категорією ДАН згідно інструменту GLOBIAD. В обох групах частота кандидної колонізації достовірно не відрізнялася між категоріями, крім категорії 1А, у якій грибкова інфекція була відсутня (рис.4.6).
 Рисунок 4.6 – Частота колонізації Candida spp. при різних категоріях ДАН за GLOBIAD. до лікування
Рисунок 4.6 – Частота колонізації Candida spp. при різних категоріях ДАН за GLOBIAD. до лікування
З рисунку 4.6 випливає, що при найлегшій категорії 1А грибкова інфекція не визначається, тоді як при категоріях 1В та 2А визначається на рівні відповідно 43,5 (10 з 23 хворих) і 40,9 % (9 з 22 хворих), а при категорії 2В збільшується ще у 1,5 раза – до 66,7 % (20 з 30 випадків). У групі порівняння було помітне лінійне зростання частоти висівання кандид, починаючи з категорії 1В, у якій Candida spp. виявлялася у 50,0 % (1 з 2 хворих), досягаючи максимуму у категорії 2В – 70,0 % (7 з 10 хворих).
* * *
Проведені дослідження патогенної мікробіоти шкіри у хворих на ДАН дозволили встановити, що:
- Частота виявлення патогенних для поверхні шкіри бактерій є відносно низькою та не перевищує 4,8 % для золотистого стафілокока, 1,9 % – для гемолітичних стрептококів і 2,9 % для синьогнійної палички.
- Candida spp. висівається з поверхні ураженої шкіри у 37,5 % випадків, а при подвійному нетриманні її частота збільшується в 1,3 раза (47,9 %).
- Грибкові висипання у хворих на ДАН верифікуються за допомогою мікологічного посіву у 58,5 % випадків.
- Кандидна колонізація високодостовірно (р <0,001) пов’язана зі збільшенням показника загального балу IADS в 1,3 раза.
- Частота виявлення Candida spp. високодостовірно (p < 0,01) збільшується зі зростанням ступеня тяжкості ДАН згідно з інструментом IAD-IT та підвищенням категорії захворювання згідно з інструментом GLOBIAD.
Матеріали досліджень у цьому розділі, оприлюднені та опубліковані в таких наукових роботах:
- Когут І.Й., Галникіна С.О. Застосування категоризаційного інструмента GLOBIAD для моніторингу дерматиту, асоційованого з нетриманням. Український журнал дерматології, венерології, косметології. 2018. № 3. С. 110–114 [18].
- The role of Candida spp. contamination and efficacy of camphorated oil in skin care of incontinent associated dermatitis patients / I. Kohut, S. Galnykina, M. Kushynska et al. Pol Med J. 2020. Vol. XLVIII, Iss. 284. P. 35–39 [168].
- Kohut I., Galnykina S. The efficacy of topical camphorated oil in long-term care of residents with incontinence-associated dermatitis. Dermatology Review/Przegląd Dermatologiczny. 2019. Vol. 106, Iss. 6. P. 683–686 [125].
- Когут І.Й. Особливості вторинного інфікування поверхні шкіри у хворих на асоційований з нетриманням дерматит. Інфекційні хвороби: поступи і проблеми в діагностиці, терапії і профілактиці: Матеріали ІХ з’їзду інфекціоністів України. м. Тернопіль, 7–9 жовтня 2015 р. Тернопіль : Укрмедкнига, 2015. С. 252–253 [14].
- Когут І.Й., Галникіна С.О. Супутня інфекція Candida spp. при дерматиті, асоційованому з нетриманням. Здобутки клінічної та експериментальної медицини: матеріали підсумкової науково-практичної конференції. м. Тернопіль, 6 червня 2018 р. Тернопіль : ТДМУ, 2018. С. 36–37 [23].
- Когут І.Й., Галникіна С.О. Моніторинг перебігу дерматиту, асоційованого з нетриманням, за допомогою категоризаційного інструмента GLOBIAD. XVII конгрес світової федерації українських лікарських товариств: матеріали наукового симпозіуму. м. Тернопіль, 20 вересня 2018 р. Тернопіль : ТДМУ, 2018. С.176 [22].
РОЗДІЛ 5
ОБГРУНТУВАННЯ тактики зовнішнього ЛІКУВАННЯ
у ХВОРИХ НА Дерматит, асоційований з нетриманням
Отримані дані клініко-лабораторних обстежень хворих на дерматит, асоційований з нетримання зумовлюють необхідність удосконалення існуючих методик лікування та догляду за шкірою, особливо у випадках енкопрезу, супутнього грибкового висипу та кандидного інфікування, що стало основою для розробки нового методу зовнішнього лікування хворих на даний дерматоз, з урахуванням принципів етіопатогенетичної доцільності та фармакоекономічного результату. З метою оцінки терапевтичної ефективності запропонованого нового методу зовнішнього лікування хворих на ДАН було створено дві досліджувані групи – основну та порівняння. Для статистичного аналізу впливу типу нетримання, наявності грибкового висипу та кандидної колонізації на ефективність лікування, пацієнти були поділені на відповідні підгрупи.
5.1 Стандартний режим догляду за хворими
Усім пацієнтам догляд надавався згідно з «Державним стандартом стаціонарного догляду за особами, які втратили здатність до самообслуговування чи не набули такої здатності» затвердженого наказом від 29.02.2016 р № 198 Міністерства соціальної політики України, який включав: дотримання лікувального режиму (сну, відпочинку та активності), раціональне харчування, лікування основного захворювання, за додатковими показаннями – лікувальну фізкультуру, масаж, фізіотерапію, у лежачих хворих – заняття з профілактики гіподинамії, рухова активність, повертання в ліжку, поверхневий масаж з метою профілактики пролежнів. Пацієнти отримували загальний душ або ванну, а лежачі хворі – вологе обтирання тіла та миття голови в ліжку, не рідше 1 разу на тиждень, підмивання геніталій – щоденно. При вираженому забрудненні шкіри фекаліями проводилося додаткове підмивання ганчіркою з теплою водою. Усі пацієнти з нетриманням користувались поглинаючими підгузками відповідного розміру, заміна яких проводилася 3 рази на добу, та додатково при потребі.
5.2 Догляд за шкірою за допомогою гігієнічних засобів
Догляд за забрудненою сечею та/або калом шкірою за допомогою гігієнічних засобів, а саме вологих серветок 3 в 1 або поєднання піни для очищення шкіри із захисним бар’єрним кремом тричі на добу під час заміни підгузків отримували пацієнти групи порівняння, до якої увійшли 30 хворих на ДАН.
До складу вологих серветок «Tena 3 in 1» входить понад 10 складників: ПЕГ-7-кокогліцериди, ПЕГ-40 гідрогенізована рицинова олія, феноксиетанол, тетранатрію ЕДТА, бензойна кислота, гліцерин, олеат гліцерину, дегідрооцтова кислота, поліамінопропілу бігуанід, етилексилгліцерин, парфумерна композиція. Спосіб застосування: протерти шкіру у місці забруднення до отримання чистої поверхні.
Піна для очищення «Seni care» замінює використання води і мила. До складу піни входять: біокомплекс з насіння льону (живить, заспокоює і знімає подразнення), пантенол, оливкова олія (зволожують шкіру), молочна кислота, абсорбент запаху сечі SINODOR®, пропан, бутан, ізопропан, сурфактанти та консерванти. Спосіб застосування: нанести піну на забруднені ділянки тіла з відстані приблизно 10 см. та рівномірно розподілити по шкірі, залишити на 1 – 2 хвилини, після чого витерти рушником або серветкою, водою не змивати.
Захисний крем «Seni care» призначений створення на поверхні шкіри бар’єру проти дії сечі і калу. Засіб містить Д-пантенол, екстракт ромашки (зволожують шкіру), біокомплекс насіння льону (живить, заспокоює і знімає подразнення), окис цинку (протизапальна дія), SINODOR® (абсорбент запаху сечі), рідкий парафін, церезиновий віск, ланолін, цетил ПЕГ, пропілпарабен, бромнітропропандіол, токоферол, пальмітат аскорбілу, аскорбінову кислоту. Спосіб застосування: нанести крем на попередньо очищену суху шкіру в місцях, які піддаються ризику внаслідок дії сечі та/або калу.
5.3 Догляд за шкірою із використанням камфорної олії
Метод зовнішнього використання камфорної олії для лікування і профілактики ДАН застосовували у пацієнтів основної групи, до якої увійшли 104 хворих на ДАН. Досліджуваний препарат використовували у вигляді просякнутих ним серветок, якими очищували забруднені сечею та/або калом ділянки шкіри до досягнення чистої поверхні, після чого, для забезпечення подальшого захисту шкіри, всі уражені ділянки та інтактні зони ризику змащували новою серветкою, просякнутою досліджуваним препаратом, промокаючи залишки засобу до отримання легкого жирного блиску поверхні шкіри, процедуру повторювали тричі на добу і частіше за потреби та супроводжували заміною підгузка. Обробка препаратом інтактних зон ризику проводилась з профілактичною метою. Розхід препарату становив, у середньому, 1 мл засобу на площу 100 см2 поверхні шкіри.
Препарат «Камфорна олія» належить до фармакотерапевтичної групи «Засоби, що застосовують місцево при суглобовому та м’язовому болю», код АТХ М02А Х10 (додаток В і Г). Реєстраційне посвідчення на препарат «Камфорна олія» № UA/0590/01/01 від 08.02.2014 затверджено наказом МОЗ України № 109 від 08.02.2014 р [12].
5.4 Патогенетичне обґрунтування показання до зовнішнього застосування камфорної олії для догляду за шкірою при нетриманні
Для лікування і профілактики ДАН використовуються топічні засоби для очищення, зволоження і захисту шкіри, що потребує їх послідовного або комбінованого застосування на кожному з етапів. Використання на практиці кількох засобів в різних ємностях може стати наслідком випадкової неправильної послідовності їх застосування, а також збільшувати кількість і час процедур догляду за шкірою. Оптимальним рішенням вважається використання комбінованих виробів, наприклад готових серветок 3 в 1, придатних для одномоментного забезпечення етапів очищення, зволоження і захисту шкіри або серветок 2 в 1 – для очищення і захисту. Однак у комбінованих виробах крім основних діючих компонентів, наявні додаткові речовини для стабілізації суміші, що підвищує ризик побічних місцевих реакцій і збільшує вартість лікування.
У процесі пошуку нового клінічно ефективного, безпечного та економічно вигідного офіцинального засобу для одномоментного проведення етапів очищення та захисту шкіри у хворих на ДАН було зроблено припущення, що препарат камфорної олії може замінити складні полікомпонентні комбінації у профілактиці та лікуванні ДАН. До уваги було взято те, що камфора має місцеву протизапальну, антисептичну, протигрибкову, відволікаючу, знеболювальну дію, усуває свербіж, та має дезодоруючий ефект [12, 62, 132, 100, 180]. Камфора ефективна проти таких бактерій як S. aureus, E. coli, P. aeruginosa, S. mutans та Enterococcus faecalis [83, 88, 101], та має фунгістатичну активність проти Candida albicans, Trichophyton mentagrophytes, Aspergillus flavus [170]. Здатність камфорної олії покращувати мікроциркуляцію шкіри додатково використовується у профілактиці пролежнів у лежачих хворих [62, 180]. Поєднання з олією соняшниковою забезпечує пом’якшуючі, зволожувальні, захисні та очищуючі властивості, а також доповнює протизапальну дію камфори. Олія соняшникова сприяє відновленню ліпідної мантії на сухих і мацерованих ділянках, зменшує трансепідермальну втрату води, посилює бар’єрний захист поверхні шкіри від агресивної дії сечі та калу, стимулює проліферацію кератиноцитів Очищувальний ефект олії досягається за рахунок гідрофобних властивостей [81, 132, 136]. Місцеве використання камфорної олії у загальноприйнятих дозах є безпечним та не несе ризику при правильному використанні [180].
5.5 Характеристика активної речовини
Камфора рацемічна – 1,7,7-триметилбіцикло[2.2.1]гептан-2-он, терпеноїд з хімічною формулою C10H16O, одержаний синтетичним шляхом. У природі трапляється правообертальний ізомер камфори, якого найбільше міститься у деревині камфорного лавра (Cinnamomum camphora), а також борнеокамфорного дерева (Dryobalanops aromatica Gaerth) [132].
Фармакологічні властивості камфори зумовлені наявністю в її молекулі функціонально активного атома кисню, яка має високий окиснювальний потенціал, порушує клітинні мембрани мікроорганізмів, руйнує багато активних сполук, що спричинюють запалення, біль і подразнення чутливих рецепторів шкіри [12].
5.6 Фармако-економічне обґрунтування
Розрахунки засвідчили, що на одну процедуру догляду за одною ділянкою шкіри площею 100 см2, у середньому, витрачалися 1 мл камфорної олії та 2 марлеві серветки. Зважаючи на те, що 1 флакон камфорної олії ємністю 50 мл коштує 4,5 грн (станом на 31.03.2017 р.), то 1 мл камфорної олії коштує 4,50 / 50 = 0,09 грн Якщо відомо, що 1 марлева серветка коштує 0,28 грн, то загальна вартість витрат на матеріали становила 0,09 + 0,28 * 2 = 0,65 грн на одну маніпуляцію на одній ділянці шкіри площею 100 см2.
У групі порівняння використовувались вологі серветки 3 в 1 або поєднання пінки для очищення з наступним нанесенням захисного крему. Враховуючи те, що одна упаковка вологих серветок ємністю 48 шт. коштує 79 грн (станом на 31.03.2017 р.), вартість однієї серветки становить 79 / 48 = 1,65 грн Зважаючи на те, що для однієї процедури обробки однієї ділянки шкіри переважно достатньо 1 вологої серветки 3 в 1, то вартість у підсумку складала 1,65 * 1 = 1,65 грн.
У випадку застосування поєднання піни для очищення шкіри із захисним бар’єрним кремом, на їх нанесення витрачалося 3 марлеві серветки. Враховуючи що один флакон пінки для очищення ємністю 500 мл коштує 123 грн, а середній розхід засобу становить близько 1 мл на одну забруднену ділянку, то вартість однієї порції піни становить 123 / 500 = 0,25 грн Додатково, якщо одна туба захисного крему ємністю 200 мл коштує 112 грн, а на одну забруднену ділянку необхідно витратити 1 мл засобу, то вартість однієї порції крему становить 112 / 200 = 0,56 грн У підсумку вартість використання пінки для очищення та захисного крему для однієї ділянки площі шкіри розміром 100 см2 коштувало 0,28 3 + 0,25 +0,56 = 1,65 грн (табл. 5.1).
Враховуючи наведені дані можна підрахувати, що економічна вигода використання камфорної олії порівняно з гігієнічними засобами становить 1,65 – 0,65 = 1,00 грн на одну процедуру догляду однієї ділянки шкіри площею 100 см2. Іншими словами, використання камфорної олії виявилося у 1,65 / 0,65 = 2,5 рази дешевше від застосування вологих серветок 3 в 1 або поєднання пінки для очищення шкіри із захисним бар’єрним кремом.
Таблиця 5.1 – Розрахунок вартості засобів для догляду за шкірою при ДАН (станом на 31.03.2017 р.)
| Камфорна олія | Вологі серветки
3 в 1 |
Пінка
для очищення |
Захисний крем | |
| Об’єм упаковки | 50 мл | 48 шт | 500 мл | 200 мл |
| Вартість, грн | 4,5 | 79 | 123 | 112 |
| Розхід на 1 протирання ділянки 100 см2, мл | 1 мл | 1 шт | 1 мл | 1 мл |
| Вартість засобу на 1 протирання ділянки 100 см2, грн | 4,5/50*1= 0,09 | 79/48*1=
1,65 |
123/500*1=
0,25 |
112/200= 0,56 |
| Вартість серветки марлевої 5х5 см, грн | 0,28 | – | 0,28 | 0,28 |
| Витрата серветок на протирання ділянки, шт | 2 | – | 2 | 1 |
| Вартість розходу серветок на 1 ділянку, грн | 0,28*2= 0,56 | – | 0,28*2= 0,56 | 0,28*1 |
| Вартість обробки 1 ділянки (засіб + серветки), грн | 0,09+0,56= 0,65 | 1,65 | 0,25+0,56=
0,81 |
0,56+0,28=
0,84 |
| 0,81+0,84=1,65 | ||||
Враховуючи те, що пацієнт потребував проведення догляду за шкірою не менше ніж 3 рази на добу, вартість витрат на камфорну олію становила 0,65*3*30 = 58,5 грн на місяць, а на гігієнічні засоби для 1,65*3*30 = 148,5 грн, то економія коштів, відповідно, складала 148,5 – 58,5 = 90 грн на одну ділянку у місяць. Зважаючи на те, що в одного пацієнта, в середньому, уражається 7 ділянок ДАН, вартість витрат на камфорну олію становила 58,5 * 7 = 409,5 грн на місяць, а на гігієнічні засоби для догляду 148,5 * 7 = 1039,5 грн, то економія коштів, відповідно, складала 1039,5 – 409,5 = 630 грн на одного пацієнта у місяць (табл. 5.2).
Таблиця 5.2 – Розрахунок економічної вигоди
| Вартість обробки
1 ділянки, грн |
Вартість обробки
у 1 пацієнта, грн |
|||
| Одна процедура | Один місяць | Одна процедура | Один місяць | |
| Камфорна олія | 0,65 | 58,50 | 4,55 | 409,50 |
| Гігієнічний засіб (вологі серветки 3 в 1 або поєднання пінки для очищення із захисним кремом | 1,65 | 148,50 | 11,55 | 1039,50 |
| Економія коштів | 1,00 | 90,00 | 7,00 | 630,00 |
* * *
На основі наведених у розділі 5 результатів можна зробити такі проміжні висновки:
- Розроблений метод зовнішнього лікування і профілактики ДАН, що полягає у застосуванні камфорної олії, яка має очищувальну, протизапальну, емолієнтну, зволожуючу, бар’єрну захисну, дезодороючу, протимікробну та протигрибкову дію, є патогенетично обґрунтованим.
- Використання камфорної олії суттєво зменшує витрати коштів на забезпечення догляду за шкірою при ДАН. Підраховано, що використання досліджуваного препарату у 2,5 рази дешевше за гігієнічні засоби, а економія коштів, в середньому, може становити 630 грн на місяць на одного пацієнта.
Матеріали досліджень у цьому розділі, оприлюднені та опубліковані в таких наукових роботах:
- Когут І.Й., Галникіна С.О. Клініко-економічна ефективність застосування камфорної олії при дерматиті, асоційованому з нетриманням. Вісник соціальної гігієни та організації охорони здоров’я України. 2018. № 4 (78). С. 69–74 [20].
- The role of Candida spp. contamination and efficacy of camphorated oil in skin care of incontinent associated dermatitis patients / I. Kohut, S. Galnykina, M. Kushynska et al. Pol Med J. 2020. Vol. XLVIII, Iss. 284. P. 35–39 [168].
- Kohut I., Galnykina S. The efficacy of topical camphorated oil in long-term care of residents with incontinence-associated dermatitis. Dermatology Review/Przegląd Dermatologiczny. 2019. Vol. 106, Iss. 6. P. 683–686 [125].
- Пат. на корисну модель 107279 UA, МПК A61K 31/125, A61P 17/00, A61F 13/47, A61L 15/16. Спосіб лікування контактного дерматиту, асоційованого з нетриманням фізіологічних відправлень / С.О. Галникіна, І.Й. Когут, А.В. Павлишин; заявник і патентовласник ДВНЗ «Тернопільський державний медичний університет ім. І.Я.Горбачевського МОЗ України». № u201512640; заявл. 21.12.15; опубл. 25.05.16, Бюл. № 10 [33].
- Когут І.Й. Догляд за шкірою при дерматиті, асоційованому з нетриманням відправлень у хронічних хворих. Сучасні підходи до формування клінічних настанов з діагностики і лікування шкірних захворювань та інфекцій, що передаються статевим шляхом: європейський досвід та українські реалії: Всеукраїнська науково-практична конференція Української асоціації лікарів-дерматовенерологів і косметологів. м. Тернопіль, 19–20 жовтня 2016 р. Український журнал дерматології, венерології, косметології. 2016. № 4. С. 122–123 [13].
- Kohut I., Galnykina S. Application of “Camphor Oil” medication in management of incontinence associated dermatitis. 2nd international transcaucasus congress on photodermatology and skin cancer; 2016 Oct 27–29, Tbilisi, Georgia. Tbilisi : ITC, 2016. P. 56 [124].
- Когут І.Й., Галникіна С.О. Клініко-економічне обґрунтування застосування камфорної олії при дерматиті, асоційованому з нетриманням. Здобутки клінічної та експериментальної медицини: матеріали підсумкової LXII наук.-практ. конф., присвяченої 165-річчю від дня народження Івана Яковича Горбачевського, м. Тернопіль, 13 черв. 2019 р. Тернопіль : ТНМУ, 2019. С. 16–17 [21].
РОЗДІЛ 6
Результати лікування хворих
на Дерматит, асоційований з нетриманням
6.1 Показники загальноклінічних лабораторних аналізів
Після закінчення лікування показники загального аналізу крові, загального аналізу сечі, біохімічного аналізу крові знаходилися у межах допустимих норм і статистично не відрізнялися від початкових в обох групах, що вказувало на задовільний профіль безпеки запропонованого лікування. Протягом спостереження не було відмічено побічних ефектів від застосування камфорної олії, у тому числі алергічних реакцій. Деталізація показників аналізів наведена у табл.6.1.
Таблиця 6.1 – Основні показники загальноклінічних лабораторних аналізів
| Показник | Основна група | Група порівняння | |||
| До лікування
M ± m |
Після лікування
M ± m |
До лікування
M ± m |
Після лікування
M ± m |
||
| Еритроцити, *1012 | 4,6 ± 0,4 | 4,8 ± 0,4 | 5,0 ± 0,3 | 4,6 ± 0,3 | |
| Гемоглобін, г/л | 140,0 ±10,8 | 148 ± 11,5 | 143,0 ±6,4 | 144 ± 6,4 | |
| Лейкоцити, *109 | 6,9 ±0,9 | 7,2 ± 0,9 | 7,6 ± 1,1 | 7,8 ± 1,1 | |
| Білок загальний, г/л | 77,4 ± 4,7 | 82,3 ± 5,2 | 77,4 ± 4,4 | 85,1 ± 5,3 | |
| Аланінамінотрансфераза, ОД/л | 27,4 ± 6,6 | 25,5 ± 5,9 | 36,9 ± 4,4 | 37,0 ± 5,0 | |
| Аспартатамінотрансфераза, ОД/л | 22,9 ± 5,7 | 21,8 ± 5,6 | 32,9 ± 5,9 | 33,1 ± 5,4 | |
| Креатинін, мкмоль/л | 95,3 ± 11,0 | 100,1 ± 9,9 | 96,2 ± 11,1 | 102,0 ± 9,9 | |
| Гамма-глутамілтрансфераза, ОД/л | 39,6 ± 9,8 | 39,2 ± 9,3 | 40,6 ± 7,9 | 41,4 ± 7,7 | |
6.2 Зміна частоти ураження різних ділянок шкіри
Після проведеного курсу лікування в основній групі відзначено достовірне (p < 0,05) зменшення частоти ураження періанальної ділянки в 1,3 раза (55,8 %), міжсідничної складки – в 1,2 раза (64,4 %), верхніх частин сідниць зліва – в 1,6 раза (28,8 %) і справа – в 1,8 раза (23,1 %), геніталій – в 1,9 раза (40,4 %), низу живота – у 2,1 раза (12,5 %), внутрішньої поверхні стегон зліва – в 1,5 раза (33,7 %) і справа – в 1,6 раза (31,7 %), задньої поверхні стегон зліва – в 1,8 раза (21,2 %) і справа – в 1,8 раза (18,3 %). Недостатнім виявилося зменшення числа випадків на нижніх частинах сідниць справа (75 %), зліва (76 %) і у пахвинних складках (20,2 %) (табл. 6.2, рис. 6.1).
Таблиця 6.2 – Ділянки ураження ДАН в основній групі після лікування
| № | Ділянка ураження | До лікування
n (%) |
Після лікування,
n (%) |
OR | CI min | CI max | p |
| 1 | Періанальна шкіра | 78 (75,0 %) | 58 (55,8 %) | 0,42 | 0,23 | 0,76 | 0,004** |
| 2 | Міжсіднична складка | 80 (76,9 %) | 67 (64,4 %) | 0,54 | 0,30 | 1,00 | 0,049* |
| 3 | Нижня частина лівої сідниці | 84 (80,8 %) | 79 (76,0 %) | 0,75 | 0,39 | 1,46 | 0,401 |
| 4 | Нижня частина правої сідниці | 86 (82,7 %) | 78 (75,0 %) | 0,63 | 0,32 | 1,23 | 0,176 |
| 5 | Верхня частина лівої сідниці | 47 (45,2 %) | 30 (28,8 %) | 0,49 | 0,28 | 0,87 | 0,015* |
| 6 | Верхня частина правої сідниці | 43 (41,3 %) | 24 (23,1 %) | 0,43 | 0,23 | 0,78 | 0,005** |
| 7 | Геніталії (губи/калитка) | 79 (76,0 %) | 42 (40,4 %) | 0,21 | 0,12 | 0,39 | 0,001** |
| 8 | Низ живота/надлобкова | 27 (26,0 %) | 13 (12,5 %) | 0,41 | 0,20 | 0,84 | 0,016* |
| 9 | Пахвинні складки | 31 (29,8 %) | 21 (20,2 %) | 0,60 | 0,32 | 1,13 | 0,115 |
| 10 | Внутрішня поверхня лівого стегна | 54 (51,9 %) | 35 (33,7 %) | 0,47 | 0,27 | 0,82 | 0,008** |
| 11 | Внутрішня поверхня правого стегна | 52 (50,0 %) | 33 (31,7 %) | 0,46 | 0,26 | 0,82 | 0,008** |
| 12 | Задня поверхня лівого стегна | 39 (37,5 %) | 22 (21,2 %) | 0,45 | 0,24 | 0,83 | 0,010* |
| 13 | Задня поверхня правого стегна | 34 (32,7 %) | 19 (18,3 %) | 0,46 | 0,24 | 0,88 | 0,018* |
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05);
** – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01).
У групі порівняння достовірне зменшення частоти ураження після отриманого курсу лікування відбулося тільки у міжсідничній складці та внутрішній поверхні лівого стегна, відповідно в 1,9 раза (36,7 %) і 2,1 раза (23,3 %). В інших локалізаціях ефективність лікування виявилася недостатньою (табл. 6.3, рис. 6.2).
Таблиця 6.3 – Ділянки ураження ДАН у групі порівняння після лікування
| Ділянка ураження | До лікування
n (%) |
Після лікування,
n (%) |
OR | CI min | CI max | p | |
| 1 | Періанальна шкіра | 21 (70,0 %) | 15 (50,0 %) | 0,43 | 0,15 | 1,24 | 0,118 |
| 2 | Міжсіднична складка | 21 (70,0 %) | 11 (36,7 %) | 0,25 | 0,08 | 0,73 | 0,011* |
| 3 | Нижня частина лівої сідниці | 23 (76,7 %) | 16 (53,3 %) | 0,35 | 0,11 | 1,05 | 0,062 |
| 4 | Нижня частина правої сідниці | 22 (73,3 %) | 18 (60 %) | 0,55 | 0,18 | 1,62 | 0,276 |
| 5 | Верхня частина лівої сідниці | 14 (46,7 %) | 8 (26,7 %) | 0,42 | 0,14 | 1,23 | 0,108 |
| 6 | Верхня частина правої сідниці | 11 (36,7 %) | 7 (23,3 %) | 0,53 | 0,17 | 1,62 | 0,263 |
| 7 | Геніталії (губи/калитка) | 22 (73,3 %) | 22 (73,3 %) | 1,00 | 0,32 | 3,14 | 1,000 |
| 8 | Низ живота/надлобкова | 9 (30,0 %) | 5 (16,7 %) | 0,47 | 0,14 | 1,61 | 0,227 |
| 9 | Пахвинні складки | 11 (36,7 %) | 6 (20,0 %) | 0,43 | 0,14 | 1,38 | 0,157 |
| 10 | Внутрішня поверхня лівого стегна | 15 (50,0 %) | 7 (23,3 %) | 0,30 | 0,10 | 0,92 | 0,035* |
| 11 | Внутрішня поверхня правого стегна | 17 (56,7 %) | 10 (33,3 %) | 0,38 | 0,13 | 1,09 | 0,072 |
| 12 | Задня поверхня лівого стегна | 7 (23,3 %) | 3 (10,0 %) | 0,37 | 0,08 | 1,58 | 0,177 |
| 13 | Задня поверхня правого стегна | 8 (26,7 %) | 3 (10,0 %) | 0,31 | 0,07 | 1,29 | 0,107 |
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05).
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05); ** – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01). Рисунок 6.1 – Частота ураження різних ділянок при ДАН в основній групі після лікування, %
 Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05).
Рисунок 6.2 – Частота ураження різних ділянок при ДАН у групі порівняння після лікування, %
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05).
Рисунок 6.2 – Частота ураження різних ділянок при ДАН у групі порівняння після лікування, %
6.3 Зміни інтенсивності еритеми
Після проведеного курсу лікування в основній групі кількість випадків яскравої гіперемії достовірно знизилася у 12 разів, до 6 (5,8 %) випадків (OR 0,14; 95 % CI, 0,06 – 0,36; р < 0,001), тоді як число пацієнтів з легкою гіперемією достовірно збільшилось у 3,2 раза до 98 (94, 2 %) осіб (OR 38,5; 95 % CI 15,2 – 97,0; p < 0,001). У групі порівняння відбулося повне зникнення яскравої еритеми (OR 0,11; 95 % CI 0,01-0,02; p = 0,002), а легка еритема визначалася у всіх пацієнтів (OR 90,3; 95 % CI 5,04-1616,60; p = 0,002) (табл. 6.4, рис. 6.3).
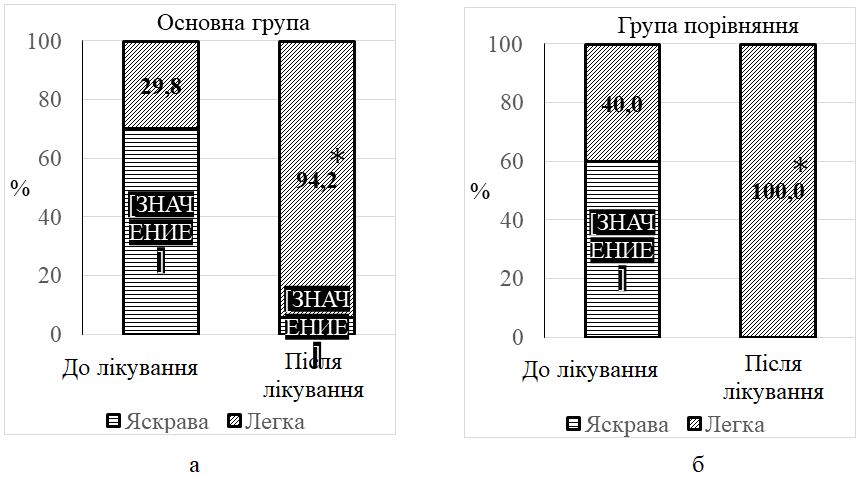 Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01).
Рисунок 6.3 – Зміна частоти різних ступенів еритеми в основній групі (а) та у групі порівняння (б)
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01).
Рисунок 6.3 – Зміна частоти різних ступенів еритеми в основній групі (а) та у групі порівняння (б)
Таблиця 6.4 – Зміни ступенів еритеми шкіри під дією лікування
| Група | Ступінь еритеми | До лікування,
n |
Після лікування,
n |
OR | CI min | CI max | p |
| Основна | Яскрава | 73 | 6 | 0,14 | 0,06 | 0,36 | < 0,001* |
| Легка | 31 | 98 | 38,5 | 15,20 | 97,00 | < 0,001* | |
| Порівняння | Яскрава | 18 | 0 | 0,11 | 0,01 | 0,20 | 0,002* |
| Легка | 12 | 30 | 90,3 | 5,04 | 1616,60 | 0,002* |
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01).
6.4 Інші первинні висипання та порушення цілісності шкіри
У ділянках, уражених ДАН, крім гіперемії визначалися й інші первинні елементи висипів, зокрема папули, везикули, пухирі і пустули. В основній групі за період лікування відбулося достовірне зменшення кількості везикул в 1,6 раза (27,9 %), пухирів у 2,4 раза (6,7 %) та ерозій – у1,5 раза (33,7 %). Частота пустул (16,3 %) знизилася в 1,4 раза, проте ця зміна не була достовірною, а кількість папул майже не змінилася (табл. 6.5, рис. 6.4).
Рисунок 6.4 – Частота інших висипань після лікування
Таблиця 6.5 – Зміна частоти інших висипань в основній групі
| Елемент висипання | До лікування,
n |
Після лікування,
n |
OR | CI min | CI max | p |
| Папули | 75 | 73 | 0,91 | 0,50 | 1,66 | 0,757 |
| Везикули | 45 | 29 | 0,51 | 0,28 | 0,90 | 0,021* |
| Пухирі | 17 | 7 | 0,37 | 0,15 | 0,93 | 0,035* |
| Пустули | 24 | 17 | 0,65 | 0,33 | 1,30 | 0,224 |
| Ерозії | 52 | 35 | 0,51 | 0,29 | 0,89 | 0,017* |
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05).
У групі порівняння, зменшення кількості первинних елементів висипів та ерозій було незначним і не досягло достовірного рівня, а зміни кількості пухирних висипань не відбулося зовсім (табл. 6.6, рис. 6.4).
Таблиця 6.6 – Зміна частоти інших висипань у групі порівняння
| Елемент висипання | До лікування,
n |
Після лікування,
n |
OR | CI min | CI max | p |
| Папули | 18 | 17 | 0,87 | 0,31 | 2,44 | 0,794 |
| Везикули | 12 | 7 | 0,46 | 0,15 | 1,40 | 0,169 |
| Пухирі | 4 | 4 | 1,00 | 0,23 | 4,43 | 1,000 |
| Пустули | 6 | 4 | 0,62 | 0,15 | 2,45 | 0,491 |
| Ерозії | 15 | 10 | 0,50 | 0,18 | 1,42 | 0,198 |
Під дією лікування частота грибкових висипань високодостовірно зменшилася в основній групі в 1,6 раза і становила 31,7 %, а у групі порівняння – достовірно знизилася у 2,4 раза, і досягла 16,7 % (рис. 6.5).
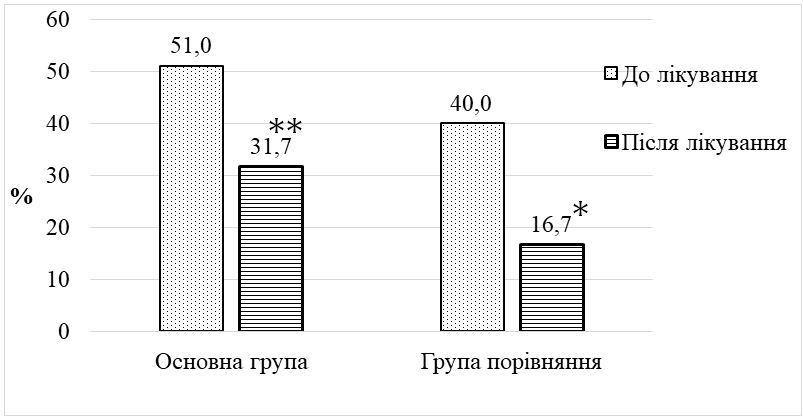 Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05);
** – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01).
Рисунок 6.5 – Зміна частоти грибкових висипань після лікування
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05);
** – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01).
Рисунок 6.5 – Зміна частоти грибкових висипань після лікування
Крім того, показники кількості грибкових висипань достовірно не відрізнялися між основною групою та групою порівняння, що вказує на подібну ефективність камфорної олії та гігієнічних засобів у зменшенні клінічних проявів ДАН.
У первинно інтактних зонах типового розташування ДАН, в яких проводилася профілактична обробка шкіри досліджуваним препаратом, не було виявлено виникнення еритеми чи інших ознак захворювання протягом усього періоду спостереження в обидвох групах.
6.5 Зміна показників оцінювальних інструментів
Підраховано, що через один місяць лікування показник IADS в основній групі високодостовірно (p < 0,001) знизився у 2 раза – до (9,9 ± 5,1) бала (діапазон 2 – 24 бали), а у групі порівняння у 2,3 раза – до (8,1 ± 4,2) бала (діапазон 2 – 19 балів). Зниження бала IADS відображає згасання інтенсивності почервоніння, зменшення кількості інших елементів висипів, порушеної цілісності шкіри, а також кількості уражених ділянок тіла (риc. 6.6).
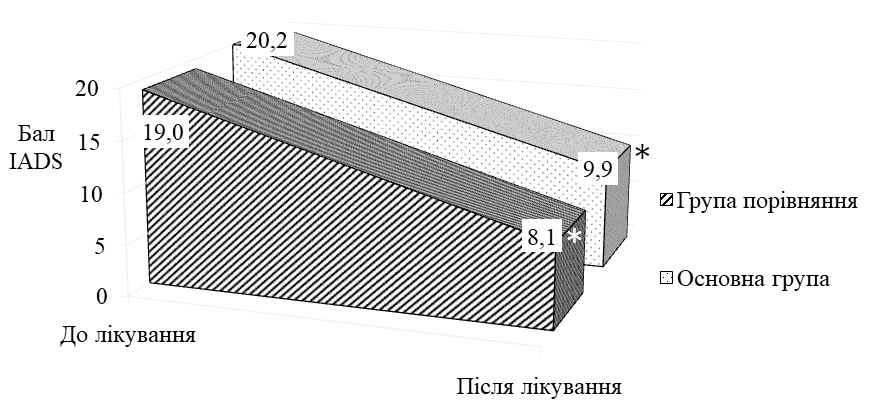 Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01).
Рисунок 6.6 – Динаміка зміни балів IADS у процесі лікування
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01).
Рисунок 6.6 – Динаміка зміни балів IADS у процесі лікування
За показником загального балу IADS не було виявлено достовірної відмінності між основною групою та групою порівняння як на початку (t = 0,97; t крит = 2,00; p = 0,335), так і у кінці (t = 1,95; t крит = 2,00; p = 0,056) дослідження, що вказувало на подібну ефективність досліджуваного препарату і гігієнічних засобів догляду за шкірою в осіб з нетриманням за цим показником (табл. 6.7).
Таблиця 6.7 – Загальний бал IADS, порівняння між групами
| Загальний бал IADS | Основна група | Група порівняння | t | tкрит | p |
| M ± m | M ± m | ||||
| До лікування | 20,2 ± 6,5 | 19,0 ± 5,3 | 0,97 | 2,00 | 0,334 |
| Після лікування | 9,9 ± 5,1 | 8,1 ± 4,2 | 1,95 | 2,00 | 0,056 |
Аналіз показників, проведений з врахуванням типу нетримання виявив, що для подвійного нетримання властивими є достовірно вищі показники загального балу IADS порівняно з пацієнтами, які мають нетримання тільки сечі, а саме в основній групі показник був вищий в 1,4 раза, відповідно (12,1±5,9) проти (8,8±4,4), а у групі порівняння в 1,8 раза, відповідно (11,2±4,2) проти (6,1±2,8) бала (табл. 6.8).
Таблиця 6.8 – Зміна загального балу тяжкості IADS залежно від типу нетримання після лікування
| Нетримання сечі
(підгрупа 1) M ± m |
Подвійне нетримання
(підгрупа 2) M ± m |
t | tкрит | p | |
| Основна група | 8,8±4,4 | 12,1±5,9 | 3,00 | 2,00 | <0,01* |
| Група порівняння | 6,1±2,8 | 11,2±4,2 | 3,57 | 2,11 | <0,01* |
Примітка. * – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна (р<0,01).
За показниками IAD-IT після курсу лікування в основній групі кількість легких випадків ДАН достовірно (p <0,01) збільшилась в 1,9 раза (26,9 %), помірних – не значно зменшилася (56,7 %), а тяжких – достовірно (p <0,01) зменшилася в 1,5 раза (16,3 %). У групі порівняння достовірне (p <0,05) поліпшення перебігу встановлене тільки за рахунок зменшення кількості випадків тяжкого ДАН в 1,9 раза (23,3 %), а зміни у кількості пацієнтів з легким і помірним ДАН були несуттєвими та відзначалися відповідно у 26,7 % і 50,0 % хворих (табл. 6.9, рис. 6.7, 6.8). Наведені результати показують, що камфорна олія має перевагу над гігієнічними засобами при легкому ступені ДАН.
До початку лікування групи достовірно відрізнялися між собою за кількістю осіб із помірним ДАН (OR 0,43; 95 % CI 0,19 – 0,99; p = 0,049), але після закінчення курсу терапії зазначена різниця зникла. За кількістю пацієнтів з легким і тяжким ступенем групи не відрізнялися між собою як до, так і після курсу лікування.
Поліпшення перебігу захворювання відбувалося поступово за рахунок переходу частини пацієнтів від тяжкого до помірного та від помірного до легкого ступеня ДАН. Впродовж місяця спостереження не було зареєстровано повного видужання або швидкого переходу від тяжкого ДАН у легкий.
Таблиця 6.9 – Зміна ступенів ДАН за IAD-IT після лікування
| Група | Ступінь ДАН | До лікування,
n (%) |
Після лікування,
n (%) |
χ2 | p |
| Основна група | Легкий | 15 (14,4 %) | 28 (26,9 %) | 11,08 | 0,001** |
| Помірний | 63 (60,6 %) | 59 (56,7 %) | 0,41 | 0,522 | |
| Тяжкий | 26 (25,0 %) | 17 (16,3 %) | 7,11 | 0,008** | |
| Група порівняння | Легкий | 5 (16,7 %) | 8 (26,7 %) | 1,0 | 0,317 |
| Помірний | 12 (40,0 %) | 15 (50,0 %) | 0,6 | 0,439 | |
| Тяжкий | 13 (43,3 %) | 7 (23,3 %) | 6,0 | 0,014* |
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05); ** – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01).
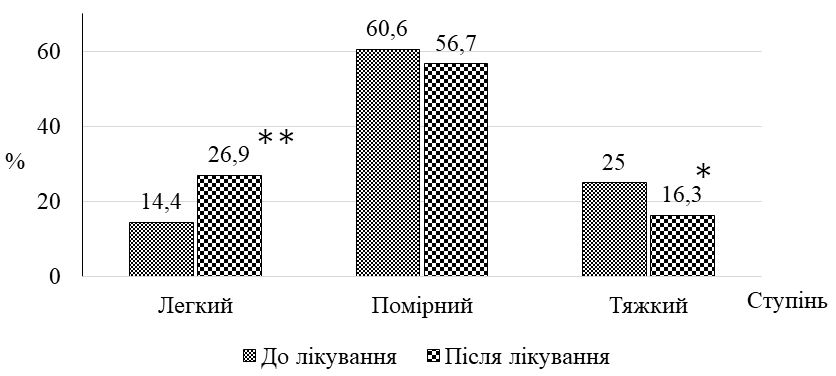 Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05); ** – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01).
Рисунок 6.7 – Динаміка зміни ступенів ДАН згідно IAD-IT в основній групі
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05); ** – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01).
Рисунок 6.7 – Динаміка зміни ступенів ДАН згідно IAD-IT в основній групі
 Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05).
Рисунок 6.8 – Динаміка зміни ступенів ДАН згідно IAD-IT у групі порівняння
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05).
Рисунок 6.8 – Динаміка зміни ступенів ДАН згідно IAD-IT у групі порівняння
Підрахунок у підгрупах залежно від типу нетримання після лікування виявив, що початкові співвідношення зберігалися, а саме, в основній групі нетримання сечі достовірно переважало при легкому і помірному ступенях, відповідно у 4,6 (22,1 % проти 4,8 %) і 2,0 раза (37,5 % проти 19,2 %), а подвійне нетримання переважало при тяжкому ступені в 1,8 раза (10,6 % проти 5,8 %). У пацієнтів групи порівняння тільки при легкому ступені достовірно переважало нетримання сечі (26,7 %), тоді як при помірному ступені перевага нетримання сечі над подвійним нетриманням в 1,5 раза (30,0 % проти 20,0 %) виявилася недостовірною, а при тяжкому ступені подвійне нетримання зустрічалося частіше у 6 разів (20,0 % проти 3,3 %), проте також не досягало достовірного рівня (табл. 6.10).
Таблиця 6.10 – Ступені ДАН при різних типах нетримання після лікування
| Ступінь ДАН | Підгрупа 1
(нетримання сечі) n/N, (%) |
Підгрупа 2
(подвійне нетримання) n/N, (%) |
OR | CI min | CI max | p | ||||||
| Основна група | ||||||||||||
| Легкий | 23/104 (22,1 %) | 5/104 (4,8 %) | 0,18 | 0,06 | 0,49 | <0,01** | ||||||
| Помірний | 39/104 (37,5 %) | 20/104 (19,2 %) | 0,40 | 0,21 | 0,74 | <0,01** | ||||||
| Тяжкий | 6/104 (5,8 %) | 11/104 (10,6 %) | 1,93 | 0,69 | 5,44 | 0,21 | ||||||
| Група порівняння | ||||||||||||
| Легкий | 8/30 (26,7 %) | 0/30 (0,0 %) | 0,09 | 0,01 | 0,82 | 0,03* | ||||||
| Помірний | 9/30 (30,0 %) | 6/30 (20,0 %) | 0,58 | 0,18 | 1,91 | 0,37 | ||||||
| Тяжкий | 1/30 (3,3 %) | 6/30 (20,0 %) | 7,25 | 0,82 | 64,46 | 0,08 | ||||||
Примітка. * – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна (р<0,05); ** – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна (р<0,01).
Як свідчать дані у табл. 6.10, запропонований метод лікування в основній групі має достовірну вищу клінічну ефективність у зниженні числа випадків помірного ступеня ДАН при подвійному нетриманні, порівняно з гігієнічними засобами для догляду, які використовувались в групі порівняння.
При порівнянні чисельності відповідних категорій GLOBIAD між групами не було виявлено достовірної різниці як на початку так і у кінці лікування. Через один місяць лікування досліджуваним препаратом в основній групі відбулося високодостовірне збільшення чисельності категорії 1А в 1,8 раза до 52 (50,0 %) пацієнтів (p < 0,001) та зменшення кількості осіб з категорією 2В в 1,9 раза до 16 (15,4 %) пацієнтів (p < 0,001). У групі спостереження відбулися подібні зміни, а саме достовірне збільшення чисельності категорії 1А в 1,4 раза до 18 (60,0 %) пацієнтів (p = 0,025) та достовірне зменшення кількості осіб з категорією 2В у 3,3 раза до 3 (10,0 %) пацієнтів (p = 0,020). Зміни в категоріях 1В і 2А в обох групах виявилися недостовірними (табл. 6.11).
Отримані дані аналізу ДАН за допомогою інструменту GLOBIAD вказують на подібну клінічну ефективність камфорної олії та гігієнічних засобів з догляду за шкірою, застосування яких найбільше впливає на зміну складу категорій 1А та 2В.
Таблиця 6.11 – Зміна складу категорій GLOBIAD в процесі лікування
| Група | Категорія | До лікування,
n (%) |
Після лікування,
n (%) |
χ2 | p |
| Основна | 1А | 29 (27,9 %) | 52 (50,0 %) | 21,04 | <0,001** |
| 1В | 23 (22,1 %) | 17 (16,3 %) | 1,79 | 0,181 | |
| 2А | 22 (21,2 %) | 19 (18,3 %) | 0,19 | 0,663 | |
| 2В | 30 (28,8 %) | 16 (15,4 %) | 12,07 | <0,001** | |
| Порівняння | 1А | 13 (43,3 %) | 18 (60,0 %) | 5,00 | 0,025* |
| 1В | 2 (6,7 %) | 2 (6,7 %) | 0,00 | 1,000 | |
| 2А | 5 (16,7 %) | 7 (23,3 %) | 0,50 | 0,480 | |
| 2В | 10 (33,3 %) | 3 (10,0 %) | 5,44 | 0,020* |
Примітка. * – різниця між показниками осіб до лікування та після лікування достовірна (р<0,05); ** – різниця між показниками осіб до лікування та після лікування достовірна (р<0,01).
Підрахунок за допомогою інструменту GLOBIAD у підгрупах 1 і 2 після лікування виявив, що частота нетримання сечі переважала над подвійним нетриманням в основній групі у категоріях 1А та 2А відповідно у 3,0 раза (37,5 % проти 12,5 %) та 1,7 раза (11,5 % проти 6,7 %), тоді як у категоріях з ознаками інфікування 1В та 2В кількість випадків нетримання сечі і подвійного нетримання стали статистично однаковими, відповідно 8,7 % проти 7,7 % і 7,7 % проти 7,7%.
У пацієнтів з групи порівняння, нетримання сечі також продовжувало достовірно переважати над подвійним нетриманням у категорії 1А у 5,0 раза (50,0 % проти 10,0 %), у категоріях 2А та 1В – було статистично незначимим, відповідно у 6,7 раза (6,7 % проти 0,0 %) і 2,5 раза (16,7 % проти 6,7 %), а у найважчій категорії 2В, як і в основній групі, подвійне нетримання переважало над нетриманням сечі у 2,0 раза (6,7 % проти 3,3 %). (табл. 6.12).
Таблиця 6.12 – Склад категорій GLOBIAD при різних типах нетримання
| Категорія | Підгрупа 1
(нетримання сечі) n/N, (%) |
Підгрупа 2
(подвійне нетримання) n/N, (%) |
OR | CI min | CI max | p |
| Основна група | ||||||
| 1А | 39/104 (37,5 %) | 13/104 (12,5 %) | 4,20 | 2,08 | 8,49 | <0,001** |
| 1В | 9/104 (8,7 %) | 8/104 (7,7 %) | 1,14 | 0,42 | 3,07 | 0,800 |
| 2А | 12/104 (11,5 %) | 7/104 (6,7 %) | 1,81 | 0,68 | 4,79 | 0,234 |
| 2В | 8/104 (7,7 %) | 8/104 (7,7 %) | 1,00 | 0,36 | 2,77 | 1,000 |
| Група порівняння | ||||||
| 1А | 15/30 (50,0 %) | 3/30 (10,0 %) | 9,00 | 2,24 | 36,17 | 0,020* |
| 1В | 0/30 (0,0 %) | 2/30 (6,7 %) | 0,19 | 0,01 | 4,06 | 0,286 |
| 2А | 2/30 (6,7 %) | 5/30 (16,7 %) | 0,36 | 0,06 | 2,01 | 0,242 |
| 2В | 1/30 (3,3 %) | 2/30 (6,7 %) | 0,48 | 0,04 | 5,63 | 0,561 |
Примітка. * – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна (р<0,05); ** – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна (р<0,01).
Як випливає з табл. 6.12, в обох групах у хворих з категорією 1А за GLOBIAD характерне достовірне переважання нетримання сечі.
6.6 Зміна стану мікробної колонізації шкіри
Внаслідок проведеного лікування кількість випадків інфікування патогенними бактеріями знизилася. В основній групі золотистий стафілокок виявлено у 2 осіб (1,9 %), синьогнійну паличку – у 1 хворого (1,0 %), тоді як гемолітичні стрептококи не виявлялися. У групі порівняння після лікування виявлено тільки золотистий стафілокок у 1 хворого (3,3 %). Дані показників складу патогенних бактерій виявилися незначущими, що підтверджує літературні дані про відсутність етіологічного зв’язку ДАН з цими мікроорганізмами.
Через один місяць лікування також відбулося достовірне зниження частоти висівання Candida spp. в основній групі у 3,3 раза (p<0,01), а в групі порівняння – в 1,8 раза (p<0,05), що відповідно становило 11,5 % (12 хворих) та 20,0 % (6 хворих) (рис. 6.9).
При порівнянні показників мікологічного посіву не було виявлено достовірної переваги одного з режимів лікування щодо впливу на колонізацію Candida spp.
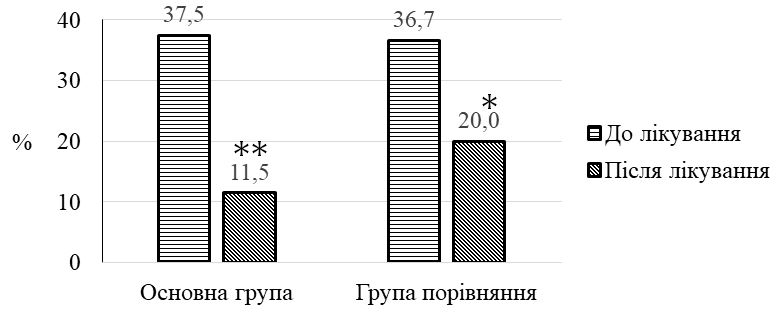 Примітка. * – різниця між показниками до лікування та після лікування достовірна (р<0,05);
** – різниця між показниками до лікування та після лікування достовірна (р<0,01).
Рисунок 6.9 – Зміна частоти висівання Candida spp. під дією лікування
Примітка. * – різниця між показниками до лікування та після лікування достовірна (р<0,05);
** – різниця між показниками до лікування та після лікування достовірна (р<0,01).
Рисунок 6.9 – Зміна частоти висівання Candida spp. під дією лікування
Після лікування переважання кількості випадків без виявленої Candida spp. збільшилось до 7,7 разів в основній групі та до 4,0 разів – у групі порівняння. (рис. 6.10). Встановлено, що елімініція кандидних грибів з поверхні шкіри не призводила до видужання від ДАН, проте зменшувала клінічні прояви хвороби.
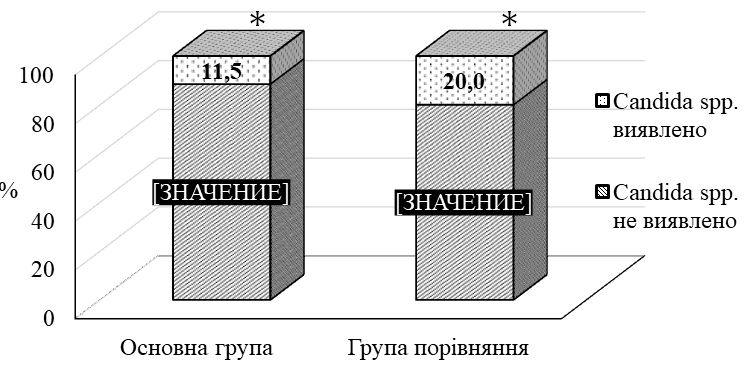 Примітка. * – різниця між показниками з виявленою та не виявленою Candida spp.достовірна (р<0,01).
Рисунок 6.10 – Частота Candida spp. у хворих на ДАН після лікування
Примітка. * – різниця між показниками з виявленою та не виявленою Candida spp.достовірна (р<0,01).
Рисунок 6.10 – Частота Candida spp. у хворих на ДАН після лікування
По закінченню курсу спостереження відбулися суттєві зміни у верифікації грибкових висипань, а саме, мікологічне підтвердження отримали 8 з 33 (24,2 %) пацієнтів основної групи і 4 з 5 (80,0 %) хворих групи порівняння. У групі порівняння частота верифікації грибкових висипань збільшилася, але статистичне порівняння не проводилося через невелику кількість вибірки (5 випадків) (рис.6.11).
 Рисунок 6.11 – Частота верифікації грибкових висипань після лікування
Рисунок 6.11 – Частота верифікації грибкових висипань після лікування
На рис. 6.11 звертає на себе увагу дуже низький показник верифікації в основній групі, що може мати декілька можливих пояснень, а саме: (а) інгібуючий вплив камфорної олії на ріст грибів, (б) елімінація кандид відбувається раніше ніж зникають видимі симптоми, характерні для грибкового висипання, іншими словами мікологічне видужання наступає швидше за клінічне.
Частота верифікованих грибкових висипань (супутній кандидоз шкіри) після лікування становила 7,7 % (8 із 104 хворих), що було у 3,8 раза менше за вихідний рівень (p < 0,01). У групі порівняння частота верифікованих грибкових висипань знизилась у 2 раза і становила 13,3 %. Достовірних змін у числі неверифікованих грибкових висипань після лікування не відбулося.
Після курсу лікування частота виявлення кандидних грибів знизилась в основній групі у пацієнтів з нетриманням тільки сечі (підгрупа 1) у 7,7 раза до 4,4 % (3 з 68) (p < 0,01) та у хворих з подвійним нетриманням (підгрупа 2) в 1,8 раза до 25,0 % (9 з 36), у групі порівняння відповідно у 4,0 раза до 5,6 % (1 з 18) та у 1,4 раза до 41,7 % (5 з 12) хворих, а при підрахунку в усіх разом відповідно у 6,7 раза до 4,7 % (4 з 86) (p < 0,01) та у 1,6 раза до 29,2 % (14 з 48) пацієнтів (рис 6.12).
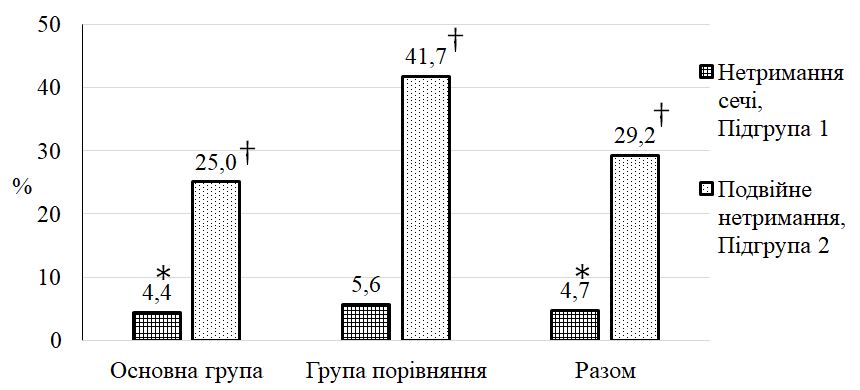 Примітка. * – різниця порівняно з показником до лікування достовірна (р<0,01); † – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна в основній групі та у всіх разом (р<0,01), у групі порівняння достовірна (р<0,05).
Рисунок 6.12 – Частота Candida spp. у хворих на ДАН залежно від типу нетримання після лікуванняПримітка. * – різниця порівняно з показником до лікування достовірна (р<0,01); † – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна в основній групі та у всіх разом (р<0,01), у групі порівняння достовірна (р<0,05).
Примітка. * – різниця порівняно з показником до лікування достовірна (р<0,01); † – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна в основній групі та у всіх разом (р<0,01), у групі порівняння достовірна (р<0,05).
Рисунок 6.12 – Частота Candida spp. у хворих на ДАН залежно від типу нетримання після лікуванняПримітка. * – різниця порівняно з показником до лікування достовірна (р<0,01); † – різниця між показниками осіб підгрупи 1 і підгрупи 2 достовірна в основній групі та у всіх разом (р<0,01), у групі порівняння достовірна (р<0,05).
Як свідчать дані рис. 6.12, зменшення показників частоти кандидної колонізації після лікування порівняно з вихідним рівнем було достовірним у пацієнтів підгрупи 1 основної групи та всіх пацієнтів разом. Крім того, на відміну від початкових значень, частота колонізації Candida spp. при подвійному нетриманні після проведеного лікування достовірно переважала над частотою при нетриманні тільки сечі в основній групі у 5,7 раза, у групі порівняння – у 7,4 раза та у всіх разом – у 6,2 раза (рис. 6.13). Отримані результати вказують на ефективне зниження частоти кандидної колонізації шкіри у пацієнтів з нетриманням сечі, тоді як при подвійному нетриманні таке зниження недостатнє і не досягає достовірного рівня.
Показник загального балу IADS при супутній грибковій колонізації після лікування достовірно знизився в основній групі в 1,7 раза до (13,9±6,6) бала, та був достовірно більшим у 1,5 раза за показник IADS в осіб без Candida spp. У групі порівняння загальний бал IADS після лікування також достовірно знизився у 2,1 раза до (10,3±4,5) бала, проте, на відміну від основної групи, статистично не відрізнявся від значення інструмента при відсутності Candida spp. (рис. 6.13).
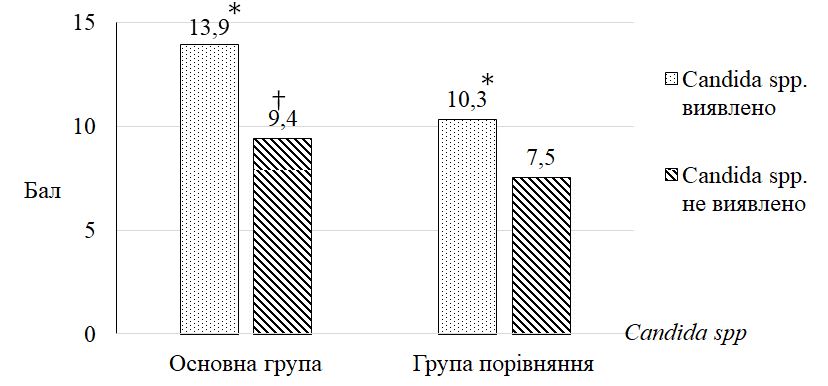 Примітка. * – різниця порівняно з показником до лікування достовірна (р<0,05);
† – різниця між показниками осіб з виявленою та не виявленою Candida spp достовірна (р<0,05).
Рисунок 6.13 – Загальний бал тяжкості IADS після лікування залежно від виявлення Candida spp.
Примітка. * – різниця порівняно з показником до лікування достовірна (р<0,05);
† – різниця між показниками осіб з виявленою та не виявленою Candida spp достовірна (р<0,05).
Рисунок 6.13 – Загальний бал тяжкості IADS після лікування залежно від виявлення Candida spp.
Після лікування відбулося зниження частоти кандидної колонізації при різних ступенях ДАН, визначених за допомогою інструменту IAD-IT. Підраховано, що частота висівання Candida spp. в основній групі при легкому ступені ДАН залишалася низькою та становила 7,1 % (2 з 28) пацієнтів, при помірному ступені – суттєво зменшилася у 6,5 разів і становила 5,1 % (3 з 59 пацієнтів). При тяжкому перебігу показник висівання Candida spp. знизився в 1,6 раза, але залишався найвищим – 41,2 % (7 з 17 пацієнтів) і високодостовірно (p < 0,01) відрізнявся від показника помірного ступеня у 8 разів, а від легкого – у 6 разів. У групі порівняння Candida spp. після лікування при легкому ступені надалі не висівалася (0 з 8 пацієнтів), при помірному – суттєво не змінилася і становила 20,0 % (3 з 15 пацієнтів), тоді як при тяжкому ступені – зменшилася в 1,6 раза до 42,9 %, була вищою за показник помірного ступеня у 2 рази, проте така перевага не досягала рівня статистичної достовірності (рис. 6.14).
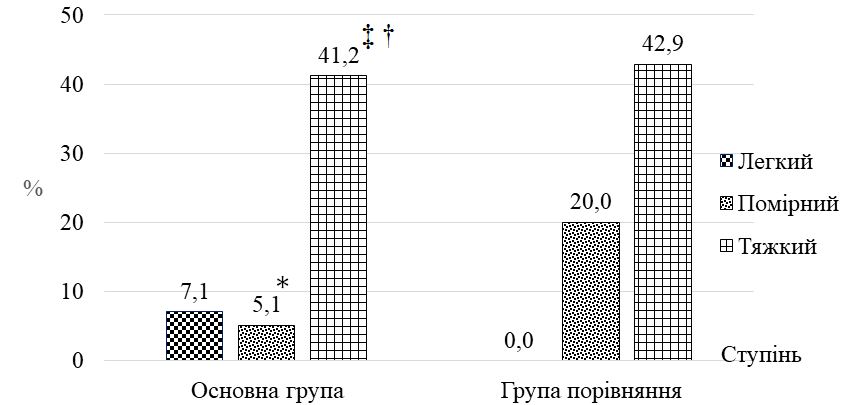 Примітка. * – різниця порівняно з показником до лікування достовірна (р<0,05);
‡ – різниця між показниками осіб з тяжким ступенем та помірним ступенем достовірна (р<0,05); † – різниця між показниками осіб з тяжким ступенем та легким ступенем достовірна (р<0,05).
Рисунок 6.14 – Частота колонізації Candida spp. при різних ступенях ДАН за IAD-IT після лікування.
Примітка. * – різниця порівняно з показником до лікування достовірна (р<0,05);
‡ – різниця між показниками осіб з тяжким ступенем та помірним ступенем достовірна (р<0,05); † – різниця між показниками осіб з тяжким ступенем та легким ступенем достовірна (р<0,05).
Рисунок 6.14 – Частота колонізації Candida spp. при різних ступенях ДАН за IAD-IT після лікування.
Таким чином показано, що незважаючи на зменшення випадків грибкової колонізації під дією лікування, домінування Candida spp. при тяжкому ступені хвороби залишається високим на достовірному рівні. З рис. 4.5 і 6.14 помітно, що під дією камфорної олії суттєво знижується частота кандидної колонізації при помірному ступені тяжкості, чого не відбувається у групі порівняння, що вказує на перевагу запропонованого методу зовнішнього лікування.
Розподіл випадків кандидної колонізації відповідно до категорій інструменту GLOBIAD змінився після лікування камфорною олією. Candida spp. з’явилася у категорії 1А у 3,8 % (2 з 52 хворих), проте вона визначалася у пацієнтів з категоріями 1В і 2А рідше у 4 рази і становила відповідно 11,8 (2 з 17 хворих) і 10,5 % (2 з 19 хворих). У категорії 2В частота виявлення Candida spp. після лікування зменшилась в 1,8 раза, проте залишилася найбільшою та становила 37,5 % (6 із 16 хворих). У групі порівняння відбулося збільшення частоти висівання кандид у категорії 1В у 2 рази до 100 % (2 з 2 пацієнтів), зменшення – у категорії 2В у 2 рази до 28,6 % (2 з 7 хворих), та залишилось без суттєвих змін – у категорії 2В, складаючи 66,7 % (2 з 3 хворих). При статистичному аналізі в основній групі частота кандидної колонізації достовірно не відрізнялася між категоріями, а у групі порівняння визначення достовірності не проводилося через малий склад вибірки (рис. 6.15).
 Рисунок 6.15 – Частота виявлення Candida spp. при різних категоріях ДАН за GLOBIAD після лікування.
Рисунок 6.15 – Частота виявлення Candida spp. при різних категоріях ДАН за GLOBIAD після лікування.
Дані на рис. 6.15 показують, що в основній групі частота кандидної колонізації в осіб з категорією 2В переважає у 3,5 раза частоту при категоріях 2А та 1В, та у 9,9 раза – при категорії 1А, проте така різниця виявилася недостовірною.
6.7 Клінічні випадки у пацієнтів основної групи
На прикладі пацієнтів подано наочний зразок для порівняння зміну стану шкіри при ДАН після отриманого курсу лікування за допомогою досліджуваного препарату, що відображено на відповідних зображеннях (рис 6.16, 6.17).
Пацієнт ГГС, 66 років, нетримання сечі внаслідок геміпарезу, ДАН з показниками IADS 14 балів, IAD-IT помірний, GLOBIAD категорія 2А. Через один місяць використання камфорної олії у пацієнта покращився стан шкіри, зменшилась інтенсивність і площа гіперемії, загоїлась ерозія, про що свідчили такі зміни показників IADS до 7 балів і GLOBIAD до категорії 1А, тоді як ступінь IAD-IT залишився помірний (рис. 6.16).
Рисунок 6.16 – Пацієнт ГГС, 66 років, до та після лікування камфорною олією
Пацієнтка ЛМК, 82 роки, внаслідок нетримання сечі, пов’язаного з цереброваскулярною патологією встановлено ДАН з показниками IADS 21 бал, IAD-IT помірний ступінь, GLOBIAD категорія 2B. Через один місяць використання камфорної олії у пацієнтки зменшилась інтенсивність і площа гіперемії, зникли симптоми грибкових висипань, про що свідчили зміни показників IADS до 8 балів та GLOBIAD до категорії 2А, тоді як ступінь IAD-IT залишився помірний (рис. 6.17).
 Рисунок 6.17 – Пацієнт ГГС, 66 років, до та після лікування камфорною олією
Рисунок 6.17 – Пацієнт ГГС, 66 років, до та після лікування камфорною олією
* * *
На основі наведених у розділі 6 результатів можна зробити такі проміжні висновки:
- Запропонована методика зовнішнього застосування камфорної олії мала задовільні переносимість та профіль безпеки, на що вказували відсутність побічних ефектів та збереження показників загальноклінічних лабораторних аналізів у межах допустимих норм.
- Місцеве застосування камфорної олії у хворих на ДАН супроводжується достовірно рідшим ураженням типових ділянок шкіри в 1,2 – 2,1 раза, зменшенням випадків яскравої еритеми у 12,0 разів та інших елементів висипань – у 1,5 – 2,4 раза, зниженням загального балу IADS у 2 раза, зменшенням кількості випадків тяжкого ступеня IAD-IT в 1,5 раза і кількості випадків категорії 2В GLOBIAD в 1,9 раза, зниженням виявлення Candida spp. у 3,3 раза та частоти мікологічно верифікованих грибкових висипань у 3,8 раза.
- Встановлено, що в осіб з подвійним нетриманням, порівняно з нетриманням сечі, після лікування загальний бал тяжкості IADS залишається достовірно вищим в 1,5 раза, а рівень частота кандидної колонізації переважає у 5,7 раза.
- Визначено, що кандидна колонізація, порівняно з випадками без виявленої Candida spp., після проведеного лікування пов’язана з вищим балом IADS (у 1,5 раза), суттєво переважає при тяжкому ступені IAD-IT (у 6 – 8 разів) та категорії 2В GLOBIAD (у 3,5 раза).
- Виявлено, що зовнішнє застосування камфорної олії має перевагу над гігієнічними засобами з догляду за шкірою в тому, що достовірно ефективніше зменшує частоту везикул в 1,6 раза та пухирів у 2,4 раза, збільшує чисельність складу пацієнтів з легким ступенем в 1,9 раза та помірним ступенем в осіб подвійним нетриманням у 2,0 раза, суттєво знижує частоту кандидної колонізації в 6,5 раза при помірному ступені тяжкості за IAD-IT.
- Відсутність еритеми чи інших симптомів у первинно інтактних зонах типового розташування ДАН, в яких проводилася обробка шкіри камфорною олією впродовж усього періоду спостереження, вказує на задовільний профілактичний ефект досліджуваного препарату.
Матеріали досліджень у цьому розділі, оприлюднені та опубліковані в таких наукових роботах:
- Когут І.Й., Галникіна С.О. Визначення ефективності лікування дерматиту, асоційованого з нетриманням фізіологічних відправлень за допомогою IADS і IAD-IT. Журнал дерматовенерології та косметології ім. М.О.Торсуєва. 2017. №. 2 (38). С. 98–101 [16].
- Когут І.Й., Галникіна С.О. Застосування категоризаційного інструмента GLOBIAD для моніторингу дерматиту, асоційованого з нетриманням. Український журнал дерматології, венерології, косметології. 2018. № 3. С. 110–114 [18].
- Когут І.Й., Галникіна С.О. Застосування оцінювальних інструментів IADS і IAD-IT при дерматиті, асоційованому з нетриманням відправлень. Ліки України плюс. 2018. № 1. С. 27–31 [19].
- Kohut I., Galnykina S. The efficacy of topical camphorated oil in long-term care of residents with incontinence-associated dermatitis. Dermatology Review/Przegląd Dermatologiczny. 2019. Vol. 106, Iss. 6. P. 683–686 [125].
- The role of Candida spp. contamination and efficacy of camphorated oil in skin care of incontinent associated dermatitis patients / I. Kohut, S. Galnykina, M. Kushynska et al. Pol Med J. 2020. Vol. XLVIII, Iss. 284. P. 35–39 [168].
- Пат. на корисну модель 107279 UA, МПК A61K 31/125, A61P 17/00, A61F 13/47, A61L 15/16. Спосіб лікування контактного дерматиту, асоційованого з нетриманням фізіологічних відправлень / С.О.Галникіна, І.Й. Когут, А.В. Павлишин; заявник і патентовласник ДВНЗ «Тернопільський державний медичний університет ім. І.Я.Горбачевського МОЗ України». № u201512640; заявл. 21.12.15; опубл. 25.05.16, Бюл. № 10 [33].
- Галникіна С.О., Когут І.Й., Павлишин А.В. Лікування контактного дерматиту асоційованого з нетриманням фізіологічних відправлень. Zbior artykulow naukowych konferencji miedzynarodnowej naukowo-praktycnej „Osiagniecia naukowe, rozwoj, propozyciye na rok 2015” (30.12.2015 – 03.01.2016). Warszawa: Sp. Z.o.o. „Diamond trading tour”, 2015. P. 45–47 [7].
- Kohut I. Topical camphorated oil in incontinence-associated dermatitis. IDEA Congress 2019, 24-28 April 2019, Istanbul, Turkey. Istanbul : IDEA, 2019. P. 26 [123].
- Когут І.Й. Порівняння ефективності препарату «Камфорна Олія» у лікуванні дерматиту, асоційованому з нетриманням фізіологічних відправлень. Дерматовенерологія. Косметологія. Сексопатологія. 2016. № 3–4. С. 47–48 [15].
- Когут І.Й. Порівняння ефективності препарату «Камфорна Олія» у лікуванні дерматиту, асоційованому з нетриманням фізіологічних відправлень. Дерматовенерологія. Косметологія. Сексопатологія. 2016. № 3–4. С. 47–48 [15].
РОЗДІЛ 7
Аналіз та узагальнення результатів дослідження
У світі існує тенденція до збільшення кількості осіб з нетриманням фізіологічних відправлень, адже захворювання найбільше поширене у людей похилого віку. У звіті ООН про старіння населення світу прогнозується переважання кількості жителів старших за 60 років [152]. Lambert D. (2012) вказує, що зі збільшенням у популяції кількості людей літнього віку збільшується частота нетримання сечі та калу [128]. Поширеність ДАН у хронічних хворих становить 3,4 – 7,6 %, а у пацієнтів із гострою патологією – 20 – 36 % [93, 109, 153]. Згідно даних Mugita Y. et al. (2018), у мешканців будинків догляду нетримання спостерігається у 59,8 %, серед яких ДАН досягає 36,0 % [116]. Gray M., Giuliano K. (2018) подають дані, що серед госпіталізованих пацієнтів з нетриманням частота ДАН досягає 45,7 % [135].
В основі патогенезу ДАН лежить подразнювальна дія сечі і калу на покрив тіла. Звичайно, короткочасний контакт шкіри з випорожненнями не зумовлює пошкодження, проте агресивна дія екскретів проявляється в умовах оклюзії, мацерації і тертя шкіри, особливо за зниженої резистентності [106]. У подразненому середовищі змінюється стан ліпідної мантії шкіри, руйнується цілісність клітинного бар’єру, активізуються протеази і ліпази калу, розмножуються бактерії та гриби. Детергенти, у тому числі мило, які використовують для щоденної гігієни, додатково можуть пошкоджувати ліпідну мантію, порушувати цілісність шкіри та посилювати запальний процес [133].
В умовах тривалої надмірної вологості, наявні на поверхні шкіри бактерії з уреалітичними властивостями розщеплюють сечовину сечі до аміаку, олужнюючи середовище, внаслідок чого порушується ліпідна мантія, активізуються протеази і ліпази калу, порушується мікробіоценоз [106, 108, 172]. S. aureus зустрічається в пахових і періанальній ділянках при підгузковому дерматиті відповідно у 14,3 і 21,4 % [134]. Наявність піогенних стрептококів створює ризик гнійничкових ускладнень, утворення пухирів та ерозій [27]. Candida albicans найчастіше пов’язана з інфікуванням шкіри при ДАН [51]. За відсутності дерматиту, кандидні гриби виявляються у 4 % випадків, тоді як при підгузковому дерматиті вони наявні у 70–92 % випадків [161]. Супутній кандидоз шкіри з високою ймовірністю впливає на формування тяжкого перебігу ДАН [172]. Проте, тільки 60 % попередніх діагнозів кандидозної інфекції підтверджуються лабораторно [151].
Доведеними чинниками ризику виникнення ДАН є тип нетримання (калу або/та сечі), обмежений руховий режим, порушення свідомості, недостатнє харчування, тяжкі супутні захворювання, старіння, вживання стероїдів та ін. [143].
Для стандартизованого об’єктивного визначення тяжкості та ризику розвитку ДАН запропоновано спеціальні оцінювальні інструменти у вигляді шкал та індексів. Найновішими і клінічно верифікованими інструментами є IADS,
IAD-IT, GLOBIAD, які використані в даній роботі [59, 92, 143].
У догляді за шкірою дотримуються трьох послідовних етапів: очищення, зволоження і захисту, для чого використовують відповідні окремі або комбіновані засоби [59, 174]. У пацієнтів з нетриманням варто надавати перевагу використанню комбінованих засобів з догляду за шкірою, коли в одному виробі поєднано очисні, зволожувальні, захисні й антисептичні компоненти [91]. Ще одним важливим аспектом ведення ДАН є заходи, спрямовані на зменшення вартості заходів з профілактики та лікування, тому пошук ефективних і водночас економічно виправданих засобів залишається актуальним для сучасної медичної науки [65]. Важливо зауважити, що на практиці для профілактики та для лікування ДАН використовуються однакові засоби та процедури [150].
У процесі пошуку такого клінічно ефективного, безпечного та економічно вигідного офіцинального засобу для одномоментного проведення етапів очищення та захисту шкіри у хворих на ДАН було зроблено припущення, що монокомпонентий препарат камфорної олії може замінити складні полікомпонентні комбінації у профілактиці та лікуванні ДАН. До уваги було взято те, що камфора має місцеву протизапальну, антисептичну, протигрибкову, відволікаючу, знеболювальну дію, усуває свербіж, та має дезодоруючий ефект [12, 62, 100, 132, 180], а олія соняшникова – пом’якшуючі, зволожувальні, захисні та очищаючі властивості, а також доповнює протизапальну дію камфори [81, 132, 136].
Метою даної роботи стало підвищити ефективність лікування і профілактики дерматиту, асоційованого з нетриманням шляхом розробки методу зовнішньої терапії на підставі вивчення клінічних даних, показників оцінювальних інструментів та складу мікробіоценозу шкіри.
Відповідно до мети у роботі вирішували наступні завдання: вивчити клініко-епідеміологічні особливості перебігу ДАН на сучасному етапі; визначити склад патогенної мікрофлори уражених ділянок шкіри у хворих на ДАН; дослідити вплив типу нетримання та супутньої кандидної колонізації шкіри на перебіг ДАН; розробити метод зовнішнього лікування дерматиту, асоційованого з нетриманням з урахуванням результатів об’єктивного обстеження, показників оцінювальних інструментів, мікробіологічних досліджень та економічних даних; визначити профіль безпеки місцевого застосування камфорної олії; з’ясувати профілактичну ефективність запропонованої методики у хворих з нетриманням сечі і калу.
У зв’язку з цим, було обстежено 134 пацієнти віком від 36 до 92 років, середній вік яких становив (77 ± 11) років, що є характерним для цього захворювання за даними літератури. У досліджуваній когорті пацієнтів було 61,9 % жінок, що також є притаманним для ДАН, адже нетримання у жінок трапляються частіше [151].
Для виконання роботи були використані діагностичні оцінювальні інструменти IADS, IAD-IT, GLOBIAD, загальноклінічні та мікробіологічні лабораторні дослідження поверхні шкіри, математично-статистичні методи.
Діагноз ДАН встановлювався при наявності еритеми з або без інших характерних уражень, яка виникла внаслідок контакту із сечею та/або калом в осіб з нетриманням на періанальній шкірі, сідницях, геніталіях, низу живота, внутрішніх та задніх поверхнях стегон, міжсідничній і пахвинних складках. Грибковий висип встановлювався за наявності гіперемованих плям або папул, вкритих білим нальотом, переважно по периферії вогнища ДАН, які можуть поєднуватися з пустулами, ерозіями, мацерацією та набряком.
У дослідженні не брали участі особи у яких був тяжкий загальний стан; суттєві відхилення у показниках заальноклінічних лабораторних аналізів; відома тяжка ниркова та/або печінкова недостатність; системне використання глюкокортикоїдів та імунодепресантів протягом 30 днів перед включенням у дослідження; місцеве застосування топічних глюкокортикоїдів протягом 7 днів перед початком дослідження; місцеве використання антисептичних розчинів діамантового зеленого, фукорцину, йоду, повідону йоду та інших засобів, які перешкоджатимуть оцінюванню поверхні ураженої шкіри, до моменту зникнення штучного забарвлення шкіри; застосування камфорної олії протягом 1 місяця перед початком дослідження.
Усім хворим проводили догляд за шкірою у ділянках, характерних для виникнення ДАН. Нанесення препарату в уражених ділянках проводили з лікувальною метою, а в ділянках без ознак захворювання – з профілактичною метою. У досліджуваній групі, яку склали 104 хворих, очищення і захист шкіри від дії сечі та калу проводилося за допомогою камфорної олії, а у групі порівняння, яку склали 30 хворих на ДАН, використовували гігієнічні засоби для догляду за шкірою при нетриманні, зокрема вологі серветки 3 в 1 або поєднання піни для очищення шкіри із захисним бар’єрним кремом. Очищення та захист шкіри проводились тричі на добу із подальшою заміною підгузків.
У перший день спостереження проводилося опитування скарг і анамнезу, з акцентом на супутні захворювання, отримане системне і локальне лікування, використані засоби догляду за шкірою при нетриманні, періодичність заміни підгузків. На початку та через один місяць лікування проводилось повне об’єктивне обстеження з деталізацією локального статусу, а саме місць розташування та інтенсивності почервоніння, наявності інших висипань (папули, пустули, везикули, пухирі, ерозії), визначення стадії ДАН за допомогою оцінювальних інструментів IADS, IAD-IT, GLOBIAD, а також мікробіологічне дослідження для визначення складу патогенної мікрофлори ураженої шкіри. З метою моніторингу профілю безпеки пацієнтів та спостереження за розвитком побічних ефектів чи токсичної дії досліджуваного препарату, усім пацієнтам на початку та у кінці дослідження проводили загальний аналіз крові, загальний аналіз сечі, біохімічний аналіз крові (білок загальний, глюкоза, білірубін загальний, холестерин, креатинін, сечовина, аланінамінотрансфераза, аспартатамінотрансфераза, гаммаглютамілтрансфераза).
Для дослідження мікробіоти поверхні шкіри матеріал забирали з площі 1 см2 типового осередку висипань, розташованого в одній з пахових складок, за відсутності висипань у пахових складках – у найближчій ділянці з типовими висипаннями. атравматично відносно до прилеглих тканин, дотримуючись правил асептики Отриманий матеріал транспортували у середовищі типу Амієс і передавали у лабораторію у день забору. Зразки засівали на цукровий бульйон та на чашку з 5 % кров’яним агаром, а культивування протягом 24–48 год за температури 37 °С отримані колонії відсівали на високоселективні поживні середовища. Ідентифікацію мікроорганізмів проводили на підставі морфологічних, тинкторіальних та біохімічних властивостей показників типових колоній та мікроскопії за Грамом.
Через (30 ±1) днів дослідження проводився аналіз ефективності проведеного лікування та профілактики ДАН, ґрунтуючись на показниках клінічних даних, оцінювальних інструментів, загальноклінічних та мікробіологічних аналізів.
Статистична обробка результатів проводилася за допомогою програмного забезпечення Microsoft Excel® 2016 та MedCalc® з використанням точного критерію Фішера для визначення дисперсії показників непов’язаних сукупностей, парний двовибірковий t-критерій Ст’юдента при α = 0,05, біваріантний аналіз з визначенням Хі-квадрат в тесті McNemar для біномних категорій, використовуючи поправку за Edwards в основній групі, при статистичній значущості на рівні α = 0,05 і ступенем свободи 1. Достовірною зміною показників вважали рівні значущості не менше ніж 0,05 (р<0,05) і високодостовірною – не менше ніж 0,01 (р<0,01). Показники відносних значень порівнювались за допомогою регресійного аналізу з визначенням відношення шансів (OR) при 95 % довірчому інтервалі (СІ 95 %). Порівнянню підлягали показники, визначені перед початком дослідження та через один місяць застосування препаратів.
З метою загальної клінічної характеристики пацієнтів було проаналізовано тип і причини нетримання сечі та калу, проведено диференціальну діагностику ДАН з пролежнями. Серед обстежених пацієнтів нетримання тільки сечі було встановлено у 64,2 %, а подвійне (поєднання нетримання сечі і калу) – у 35,8 % осіб, тоді як пацієнтів з нетриманням тільки калу у цьому дослідженні не було, що дещо відрізнялося від даних Bliss D. et al. (2006), за якими, серед 73 % хворих на перинеальний дерматит, які мали нетримання, у 10 % було нетримання тільки сечі, у 15 % – нетримання тільки калу, а у 48 % – поєднане урофекальне нетримання [144].
Відомо, що нетримання може бути наслідком вроджених дефектів розвитку, спінальної патології, неврологічних захворювань, інфекцій, пологів, психічних захворювань, старіння, хірургічних втручань на сечовому міхурі, інших органах малого тазу і тазовому дні [59, 106]. Нетримання сечі також пов’язане з інсультом, деменцією, когнітивними і функціональними порушеннями, знерухомленням, використанням катетерів [115]. У даній роботі серед основної патології в обстежених пацієнтів з супутнім нетриманням були наслідки перенесеного інсульту головного мозку у 34,3 % пацієнтів, психічні розлади у 32,8 % осіб, облітеруючий атеросклероз судин нижніх кінцівок у 6,7 % осіб, ампутаційні кукси нижніх кінцівок також у 6,7 % хворих і ще рідше – декомпенсована серцева недостатність (5,2 %), цукровий діабет (4,5 %) та ожиріння (1,5 %).
Звичайно, згадані захворювання можуть безпосередньо порушувати контроль над сечопуском та дефекацією, однак у частині випадків, контакт шкіри з сечею і калом відбувається під час випорожнень у ліжку, у тому числі у підгузки чи інші поглинаючі вироби, внаслідок захворювань, які обмежують руховий режим або створюють перешкоди у проведенні особистої гігієни. У цьому дослідженні рухова активність була обмежена у 90,3 % пацієнтів, які у 32,8 % потребували допоміжних засобів пересування, у 41,8 % мали сидяче положення, а у 15,7 % були лежачими, що підтверджується результатами Park K., Kim K. (2014), які виявили порушення рухової активності у 87 % хворих з ДАН [141]. Низький контроль випорожнень та нездатність до особистої гігієни також можуть бути пов’язані з розладами свідомості та прийомом седативних препаратів, на що вказують Wei L. et al. (2019) [72]. Серед обстежених у роботі пацієнтів легке порушення свідомості зафіксоване у 30,6 % хворих на ДАН, тоді як сплутана свідомість була у 3,7 % пацієнтів (табл. 3.1).
За даними Woo K. et al. (2017) поширеність пролежнів у хворих на тривалому догляді досягає 13 % [178]. Відомо про статистичний зв’язок між нетриманням сечі, нетриманням калу, подвійним нетриманням та розвитком пролежневих виразок. Проте немає даних, що пролежні є фактором ризику розвитку ДАН, натомість доведено, що ДАН виступає незалежним фактором ризику розвитку пролежневих виразок [107]. Відомо, що зі збільшенням балу IADS збільшується ризик розвитку пролежнів. Існує потреба у правильній диференціальній діагностиці цих станів, що впливає на якість лікування і профілактики. Такі стани можуть бути подібними на ранніх стадіях, проте піддаються розрізненню кваліфікованим персоналом. На відміну від пролежнів, ДАН не прив’язаний до ділянок над кістковими виступами, переважно займає шкіру промежини, супроводжується мацерацією шкіри, еритема має нечіткі й звивисті контури, виразки чи некроз ніколи не формуються, а найглибшим пошкодженням може бути ерозія [59, 108].
Згідно з результатами Lachenbruch C. et al. (2016), серед пацієнтів з пролежнями у 53 % наявні нетримання сечі та калу, а серед пацієнтів, які контролюють випорожнення, пролежні виявлялися у 4,1%, тоді як у пацієнтів з нетриманням пролежні розвивались у 16,3 % [127]. До порівняння, у проведеному дослідженні частота пролежнів становила 8,2 %, що не перевищує показники, подані у друкованих джерелах.
Впродовж реалізації першого завдання дослідження, а саме визначення клініко-епідеміологічних особливостей перебігу ДАН, було проведене об’єктивне обстеження хворих, з деталізацією локального статусу та застосування оцінювальних інструментів до початку та після завершення одномісячного курсу лікування.
Foureur N. et al. (2006) визначили, що біопсія та гістопатологічне дослідження виявилися неспецифічними для діагностики більшості випадків ДАН під час первинної консультації, навіть при супутньому псоріазі та екземі. Встановлення ДАН головним чином ґрунтується на візуальній характеристиці висипань, типовому розташуванні та очевидному зв’язку з пошкодженням від дії сечі та/або калу [151]. Для цього використовуються спеціальні оцінювальні інструменти, за допомогою яких можливі діагностика захворювання, класифікація, вибір тактики догляду та лікування. Оцінювальні інструменти також забезпечують правові та економічні вимоги медичного менеджменту, підходять для проведення наукових досліджень, що дозволяє забезпечити стандартизацію об’єктивного обстеження, проведення порівняння та статистичних підрахунків [67]. Багато дослідників пропонують у своїх працях власні оцінювальні інструменти чи схеми, які, переважно, мають локальний та емпіричний характер. Існує лише декілька оцінювальних інструментів для ДАН, які отримали клінічну і статистичну верифікацію та можуть бути використані у якості стандарту, серед яких найновішими є IADS, IAD-IT, GLOBIAD. За їх допомогою стає можливим проведення стандартизованого об’єктивного визначення симптомів ДАН, ступеня тяжкості хвороби у балах (IADS), розподілення пацієнтів за ступенями (IAD-IT) і категоріями (GLOBIAD), встановлення ефективності лікування та порівнювання результатів в динаміці. Однак використання оцінювальних інструментів у повсякденній практиці виявилося складним і обтяжливим завданням для персоналу. Тому, для щоденного моніторингу часто пропонуються спрощені шкали, ілюстрації та фотозразки, які, на жаль, ще не отримали належної клінічної та наукової верифікації [118]. Відомо, що інструменти, які використовуються для оцінення пролежнів не підходять для ДАН [60].
За допомогою інструмента IADS проводиться оцінювання у 13 типових локалізаціях ДАН, в кожній з яких у балах визначають ступінь еритеми шкіри, наявність іншого висипу та пошкодження поверхні. Остаточний результат оцінювання виражається сумою всіх визначених балів у діапазоні можливих значень від 0 до 52. Із поліпшенням стану хворого бал знижується. Зі зростанням бала IADS, переважно вище від 9, зростає ризик розвитку пролежнів [140, 141]. Широкий діапазон такої шкали балів дає змогу стежити за динамікою перебігу захворювання та визначати ефективність лікування у коротких проміжках часу.
Langemo D. et al. (2011) вказують, що ДАН найчастіше розташовується на сідницях (73 %), у періанальній ділянці (70 %), рідше – на статевих органах і в паху (36 %), стегнах (24 %), крижах (9 %) [69]. ДАН також може локалізуватися у поперековій ділянці, в низу живота, у пахових згинах і місцях тісного прилягання абсорбентів [93]. Seyfarth F. et al. (2011) зазначають, що залежно від типу нетримання захворювання розпочинається у промежині при фекальному нетриманні і генітальній ділянці – при сечовому нетриманні [76]. Найбільш повний перелік зон ураження ДАН наведений в оцінювальному інструменті IADS, де вказано 13 різних характерних ділянок (рис. 2.2). За даними Park K., Choi H. (2016), найчастішими ділянками локалізації ДАН є періанальна шкіра (111 із 120 хворих), міжсіднична складка (62 із 120 хворих), нижні частини сідниць зліва (47 із 120 хворих), нижні частини сідниць справа (42 із 120 хворих) і геніталії (42 з 120) [140]. У проведеному дослідженні отримано подібні дані, адже найчастішими зонами ураження у пацієнтів обох груп були нижні частини сідниць справа (82,7 %) і зліва (80,8 %), геніталії (76,0 %), міжсіднична складка (76,9 %), періанальна шкіра (75,0 %). Перед початком лікування, було визначено, що симптоми ДАН спостерігалися, у середньому, на 7 різних ділянках тіла в одного пацієнта.
Спільними критеріями для більшості інструментів для ДАН є визначення почервоніння шкіри, наявність ерозій та ознак приєднання кандидної інфекції. Правильна ідентифікація інтенсивності почервоніння та його локалізація мають першочергове значення. Почервоніння шкіри у місцях ДАН носить характер запальної бліднучої (при натисканні) еритеми червоного кольору різної інтенсивності. Зміни кольору шкіри важливо відрізняти від пролежнів, при яких еритема часто має небліднучий характер, помітні крововиливи або зони ішемії та некрозу шкіри. Зменшення почервоніння шкіри вказує на поліпшення перебігу захворювання [56, 70]. Згідно з інструментом IADS потрібно відрізняти яскраву та легку еритему, для чого наводяться роздруковані кольорові зразки. У цьому дослідженні еритема шкіри спостерігалася у всіх пацієнтів. До початку лікування вона була яскравою у 70,2 % хворих основної групи та 60,0 % групі порівняння.
Крім еритеми в ділянках ДАН визначаються й інші первинні елементи висипань, а саме папули, везикули, пухирі і пустули. Дані висипання вказують на прогресування та важчий перебіг ДАН, окремо враховуються у підрахунку балів оцінювального інструмента IADS та впливають на категоризацію пацієнтів у GLOBIAD [146, 163, 165]. Виявивши пустули, особливо у складках, підозрюють супутній кандидоз, а наявність везикул і пустул більше вказує на екзематизацію запального процесу та ризик порушення цілісності шкіри і виникнення ерозій [151]. У цьому дослідженні у пацієнтів переважали папульозні висипання, досягаючи 72,1 % в основній групі та 60,0 % у групі порівняння, частота виявлення яких помітно не змінювалася протягом курсу спостереження. Дещо рідше зустрічалися везикули (43,3 %) і пухирі (16,3 %), які відображають інтенсивність запального процесу та екзематизації, та пустули (23,1 %), які є індикатором супутнього інфікування.
Серед порушень цілісності шкіри визначаються тріщини, екскоріації та ерозії. Поверхневі тріщини та здертості виникають внаслідок тертя чи розтягнення шкіри, вказуючи на необережне поводження під час надання догляду, переодягання та перестелення. Ерозії шкіри переважно утворюються внаслідок розкриття везикул та пухирів і характерні для тяжкого або ускладненого перебігу ДАН. Наявність ерозій є критерієм для поділу пацієнтів на категорії та встановлення тяжкої форми хвороби. Long M. et al. (2012) вказують на 21,8 % розвитку ерозій серед хворих на ДАН, які знаходяться на довготривалому догляді [109]. За даними Campbell J.L. et al. (2016), частота виникнення поверхневих ерозій у хворих на ДАН, які перебували у відділеннях з гострою патологією, становила 47,4 % [61]. Результати цього дослідження подібні до вищенаведених показників Campbell J.L. et al. (2016). У проведеному дослідженні ерозії спостерігалися у 50,0 % осіб обох груп. Зменшення частоти ерозій під час лікування може бути наслідком зниження частоти виникнення везикул і пухирів, що пов’язано з протизапальною і ранозагоювальною дією досліджуваного препарату.
Грибкові висипання встановлюються при наявності гіперемованих плям та/або папул, вкритих білим нальотом, переважно по периферії вогнища ДАН, які можуть поєднуватися з пустулами, ерозіями, мацерацією, набряком та супроводжуватися свербежем [64, 114, 115, 144]. За даними Junkin J., Selekof J. (2007), грибкові висипання спостерігалися у 10 % хворих з нетриманням, при чому у 2,7% при нетриманні сечі та у 11,2 % при фекальному нетриманні у пацієнтів, госпіталізованих з гострою патологією [120]. За даними Gray M., Giuliano K. (2018), грибковий висип виявляється у 14,8 % (169/1140) пацієнтів з ДАН [135]. Однак не знайдено даних щодо частоти грибкових висипань серед хворих, які перебувають на довготривалому спостереженні. Підраховано, що показники частоти грибкових висипань, виявлених на шкірі до початку лікування (51,0 % в основній групі та 40,0 % у групі порівняння) були помітно вищі за наведені у літературі дані для осіб з гострою патологією.
Таким чином, характерними клініко-епідеміологічними ознаками ДАН визначено похилий вік (77 ± 11 років), обмежену рухову активність (90,3 %), ураження нижніх частин сідниць, геніталій, міжсідничної складки та періанальної шкіри (70 % і більше), яскраву еритему (70,2 %), ерозії (50 %).
Park K., Choi H. (2016) подають дані, в яких середній бал IADS становив 9,30 ± 7,42 у хворих з фекальним нетриманням, що перебували у відділенні інтенсивної терапії [140]. Behairy A., El-Mokadem N. (2015) визначили, що у відділенні невідкладної терапії показник IADS досягає (36,64 ± 10,93) бала в осіб з нетриманням [57]. У цьому дослідженні показник загального бала IADS становив (20,2 ± 6,5) бала (діапазон 7 – 41 бал), а у групі порівняння (19,0 ± 5,3) бала (діапазон 13 – 33).
Відомо, що тяжкість ДАН зростає при фекальному нетриманні, проте у науковій літературі немає достатньо статистичних даних, доведених на підставі показників оцінювальних інструментів [57, 141]. Тому, у даній роботі було проаналізовано, чи залежить тяжкість перебігу і ступінь захворювання від виду нетримання, для чого пацієнти кожної з груп були розділені на підгрупу 1 (особи з нетриманням тільки сечі) та підгрупу 2 (хворі з подвійним нетриманням). Виявлено, що у 2 підгрупі загальний бал IADS був достовірно більшим в 1,4 раза ніж у першій підгрупі, а саме (24,4 ± 6,4) проти (17,9 ± 5,5) бала, а у групі порівняння відповідно (22,9 ± 5,1) проти (16,4 ± 3,6) бала. Отже, подвійне нетримання є вірогідним чинником тяжчого перебігу ДАН за показником IADS.
За допомогою IAD-IT визначається ризик розвитку ДАН або його ступінь, встановлюється приєднання грибкового ураження та обирається відповідна лікувальна тактика [59, 91]. У валідаційному тестуванні інструмент продемонстрував високу дієвість та надійність при використанні як у наукових дослідженнях так і у клінічній практиці [165]. Згідно з показниками IAD-IT у цьому дослідженні переважали пацієнти з помірним ступенем ДАН, який визначався до лікування у 60,6 % основної групи та 40,0 % групи порівняння. Легкий ДАН був виявлений у 14,4 %, а тяжкий – у 25,0 % хворих, а у групі порівняння відповідно у 17,0 % і 43,0 % хворих (рис. 3.6).
Підрахунок складу ступенів ДАН згідно з інструментом IAD-IT залежно від типу нетримання виявив, що нетримання сечі достовірно переважає при легкому (в 4,0 раза) та помірному перебігу (у 2,7 раза). Навпаки, у хворих з тяжким ступенем ДАН частіше відмічалося подвійне нетримання (в 1,6 раза), проте така перевага не досягала достовірного рівня (табл. 3.3). Отже, присутність фекалій не впливала на розвиток тяжкого ступеня ДАН згідно з IAD-IT в обстежених пацієнтів у цьому дослідженні.
GLOBIAD став найсучаснішим міжнародно узгодженим і статистично верифікованим категоризаційним інструментом ДАН, що дозволяє стандартизувати документування патології у клінічній практиці та наукових дослідженнях [150]. Для 1 категорії основним критерієм є постійне почервоніння шкіри, а для 2 категорії – ерозії, денудації та екскоріації. Кожна з категорій, у свою чергу, поділена на дві підкатегорії: без ознак інфікування (А) та з клінічними ознаками інфікування (В) [171]. Симптомами інфікування вважають біле лущення (грибкова інфекція), пустули (Candida albicans), жовтий/коричневий/сіруватий наліт, зелений колір дна рани (P. aeruginosa), надмірна ексудація. Відомо, що у пацієнтів у відділеннях невідкладної допомоги частота 2 категорії GLOBIAD становила 46,1 %, а частота ознак вторинного інфікування (категорія 2В) – 4,2 % [114]. У цьому дослідженні до категорії 2 було зараховано 50,0 % пацієнтів, у яких ознаки вторинного інфікування (категорія 2В) були у 28,8 % хворих основної групи та 33,3 % пацієнтів групі порівняння (рис. 3.7).
Аналіз у підгрупах показав, що нетримання сечі достовірно переважає над подвійним нетриманням у найлегшій категорії 1А за GLOBIAD у 3,8 раза, 2A – у 4,5 раза, Приєднання симптомів інфікування зменшує цю перевагу до 1,6 раза та втрачає достовірність різниці. У пацієнтів категорії 2В, навпаки, подвійне нетримання переважає над нетриманням сечі в 1,3 раза, також не досягаючи достовірної відмінності. У пацієнтів з групи порівняння, нетримання сечі також достовірно переважає над подвійним нетриманням у категорії 1А у 5,5 раза, у категорії 2А – у 4,0 раза, у категорії 1В показники зрівнюються, а у категорії 2В подвійне нетримання переважає над нетриманням сечі у 4,0 раза (табл. 3.4). Отже, нетримання сечі характерне для легких категорій, а подвійне нетримання – для тяжких.
Таким чином, додатковими типовими інструментальними ознаками ДАН можна вважати середній показник IADS у (20,2 ± 6,5) бала, наявність помірного ступеня за IAD – IT (60,6 %) і категорії 2В за GLOBIAD (28,8 %). Встановлено, що подвійне нетримання достовірно підвищує загальний бал IADS в 1,4 раза, сприяє розвитку тяжкого ступеню згідно з IAD-IT та категорій 1В, 2А і 2В згідно з GLOBIAD.
Відомо, що при всіх хронічних дерматозах змінюється склад мікрофлори шкіри, у тому числі при ДАН [10]. Відомості про наявність патогенної мікрофлори допомагає диференціювати ДАН з піодерміями, інтертриго, дерматофітіями шкіри та ін. Бактеріальне інфікування шкіри переважно не пов’язують з ДАН, тоді як грибкове інфікування зустрічається досить часто (18–32) [61, 64, 91]. На думку Campbell J. et al. (2017), залишається нез’ясованим, чи нетримання сприяє підвищеній частоті кандидної колонізації у пацієнта, чи, навпаки, нетримання виступає тригером для розвитку кандидної інфекції уже колонізованої шкіри [64]. Незважаючи на відсутність етіологічного і патогенетичного зв’язку ДАН з Candida spp. наявність кандидної колонізації ураженої шкіри береться до уваги у клінічній практиці, адже вона є причиною розвитку грибкових висипань, які посилюють інтенсивність локальних проявів хвороби. Потрібно зазначити, що прояви кандидного інфікування не є критеріями для зміни ступеня перебігу ДАН, але визначають показання для призначення додаткових заходів для догляду і лікування. Виявлення кандид на поверхні шкіри не знімає діагноз ДАН, а доповнює його супутнім кандидозом. Тому, було поставлено завдання уточнити склад патогенної мікробіоти шкіри в осередках ДАН, для чого були виконані відповідні мікробіологічні дослідження.
Мікробіологічний посів виявив незначну кількість випадків колонізації поверхні шкіри супутньою патогенною бактерійною флорою, зокрема частота золотистого стафілококу була 4.8 %, що у 2,5 рази було меншим за дані Runeman B. et al (2004), які виявляли S. aureus у ділянці промежини у 13 % здорових осіб, та у 4,5 раза меншою від даних Ferrazzini G. et al. (2003), які виявляли збудник у перианальній ділянці у 21,4 % хворих на підгузковий дерматит [134, 169]. Інфікування поверхні шкіри гемолітичним стрептококом і синьогнійною паличкою було поодиноким, а саме, гемолітичні стрептококи виявлялися в 1,9 % випадків, синьогнійна паличка – у 2,9 % хворих. Отримані результати вказують на те, що дані патогенні бактерії не мають значущого впливу на перебіг ДАН. Крім того, усі виявлені мікроорганізми перебували в асоціації з Candida spp,, яка суттєво переважала і виявлялася у 37,5 % хворих основної групи та 36,7 % пацієнтів групи порівняння, а кількісний показник її мікробного обсіменіння відповідно становив 11,4±4,1 і 12,4±4,4 КУО/см2 (табл. 4.1). Отримані результати були подібними до даних Campbell J. et al. (2017), які спостерігали ріст Candida spp. у 43 % випадків у періанальній ділянці та у 24 % – у пахвинних складках пацієнтів з нетриманням [64]. Проте, випадків ДАН без патогенної колонізації було достовірно (p<0,05) більше в 1,7 раза порівняно з випадками з виявленою кандидною інфекцією (рис. 4.1).
Відомо, що наявність сечі та фекалій на шкірі сприяє розвитку грибкової інфекції [91, 135]. Тому, показники кандидної колонізації вивчалися залежно від типу нетримання. Відповідно, на початку спостереження кандидні гриби виявлялися у 31,4 % пацієнтів з нетриманням тільки сечі та у 47,9 % хворих з подвійним нетриманням (рис. 4.2). Враховуючи те, що така різниця в 1,3 раза виявилася недостовірною, можна припустити, що колонізація шкіри Candida spp. при ДАН не залежить від типу нетримання, у тому числі від подвійного забруднення сечею і калом.
Частота грибкового висипу є вищою за частоту кандидної колонізації, адже, як правило, не всі випадки з клінічними проявами грибкового ураження підтверджуються за допомогою мікологічного дослідження. За даними літератури відомо, що не більше 60–75 % грибкових висипань підтверджуються мікологічним посівом [64, 151]. У цьому дослідженні підраховано, що грибкові висипання були верифіковані за допомогою мікологічного посіву у 56,6 % хворих основної групи та у 66,7 % хворих групи порівняння, що в середньому становило 58,5 % і було наближеним до результату (60 %), вказаного Foureur N. et al. (2006) [151]. Отримані результати можна пояснити тим, що клінічні ознаки грибкових висипань тривають довше ніж відбувається мікологічне видужання, а топічні засоби можуть мати пригнічуючий вплив на ріст кандиди в посіві. Також можна припустити, що може мати місце певна гіпердіагностика грибкових уражень, визначених тільки згідно до рекомендованих клінічних симптомів.
За даними Foureur N. et al. (2006), біопсія та гістопатологічне дослідження виявилися неспецифічними для діагностики більшості випадків ДАН під час первинної консультації, навіть при супутньому псоріазі та екземі. На думку Bonifaz A. et al. (2016), у більшості випадків ДАН жодних лабораторних аналізів проводити не потрібно, крім мікологічного дослідження шкірних змивів [161].
Допускається, що кандидна колонізація може бути пов’язана з тяжкістю ДАН, проте це твердження не отримало достатнього наукового підтвердження. Van L. et al. (2008) вказують на високу ймовірність впливу супутнього кандидозу на формування тяжкого перебігу хвороби [172]. Bonifaz A. et al. (2016) вважають, що кандидні гриби найбільше відповідальні за вторинне інфікування поверхні шкіри при ДАН та виявляються у понад 80 % ускладнених випадків [161]. У цьому дослідженні було досліджено вплив Candida spp. на перебіг ДАН. За допомогою інструменту IADS виявлено, що показники тяжкості у присутності Candida spp. були достовірно більші за показники при відсутності інфікування, а саме, загальний бал IADS в основній групі при супутній колонізації до лікування становив (23,5 ± 7,5) бала, а без колонізації достовірно відрізнявся в 1,3 раза і становив (18,2 ± 5,2). У групі порівняння ці показники відповідно склали (21,7 ± 4,1) і (17,5 ± 5,3) бала та достовірно відрізнялися між собою в 1,2 раза (рис. 4.4).
Зв’язок кандидної колонізації зі ступенями тяжкості ДАН проаналізовано за допомогою інструменту IAD-IT. Виявлено, що Candida spp. при легкому ступені ДАН висівається рідко (6,7 %), при помірному ступені частота виділення зростає у 5 разів (33,3 %), а при тяжкому – в 10 разів (65,4 %). Отримані дані доводять, що зі зростанням ступеня тяжкості збільшується частота кандидної колонізації, яка достовірно переважає при тяжкому ступені ДАН (рис. 4.5).
За допомогою інструменту GLOBIAD у цьому дослідженні також було виявлено, що з підвищенням категорії захворювання зростає частота кандидної колонізації. Відтак, при найлегшій категорії 1А Candida spp. не висівається, тоді як при категоріях 1В та 2А визначається відповідно у 43,5 і 40,9 % пацієнтів, а при категорії 2В зростає ще більше, у 1,5 раза, досягаючи 66,7 % (рис. 4.6). Отже, частота грибкової колонізації зростає з підвищенням категорії GLOBIAD.
Отримані клініко-лабораторні дані, а саме показники оцінювальних інструментів, тип нетримання, грибковий висип та мікробна, головним чином кандидна, колонізація стали основою для розробки нового методу зовнішнього лікування хворих на ДАН, з урахуванням принципів етіопатогенетичної доцільності та додаткового фармакоекономічного результату.
Згідно з сучасними рекомендаціями, для лікування і профілактики ДАН використовуються топічні засоби для очищення, зволоження і захисту шкіри, що потребує їх послідовного або комбінованого використання на кожному з етапів. Наявність кількох засобів в різних ємностях може спричинити помилки у послідовності їх застосування, а також збільшувати витрати часу на процедури догляду за шкірою. Використання комбінованих виробів, наприклад готових серветок 3 в 1, придатних для одномоментного забезпечення етапів очищення, зволоження і захисту шкіри або серветок 2 в 1 – для очищення та захисту набуло найбільшого поширення. Однак у комбінованих виробах крім основних діючих компонентів, наявні додаткові речовини для стабілізації суміші, що підвищує ризик побічних місцевих реакцій і збільшує вартість лікування. Наприклад, до складу вологих серветок «Tena 3 in 1» входить понад 10 складників, а піна для очищення крім активних інгредієнтів містить пропан, бутан, ізопропан, сурфактанти та консерванти.
У процесі розробки нового методу зовнішнього лікування було проведено пошук клінічно ефективного, безпечного та економічно вигідного засобу для одномоментного проведення етапів очищення та захисту шкіри у хворих на ДАН. Таким виявився препарат камфорної олії, який може замінити складні полікомпонентні комбінації для лікування та профілактики ДАН. Враховано, що камфора має локальну протизапальну, антисептичну, протигрибкову, протисвербіжну дію та дезодоруючий ефект [12, 62, 100, 132, 180]. Фармакологічні властивості камфори зумовлені наявністю в її молекулі функціонально активного атома кисню, яка має високий окиснювальний потенціал, порушує клітинні мембрани мікроорганізмів, руйнує багато активних сполук, що спричинюють запалення, біль і подразнення чутливих рецепторів шкіри [12]. Камфора здатна діяти проти S. aureus, E. coli, P. aeruginosa, S. mutans та Enterococcus faecalis а також Candida albicans, Trichophyton mentagrophytes, Aspergillus flavus [83, 88, 101, 104]. Властивість камфорної олії покращувати мікроциркуляцію шкіри додатково використовується у профілактиці пролежнів у лежачих хворих [62, 180]. Наявна в препараті соняшникова олія має пом’якшуючі, зволожувальні, захисні та очищувальні властивості, сприяє відновленню ліпідної мантії, зменшує трансепідермальну втрату води, посилює захист від агресивної дії сечі та калу, стимулює проліферацію кератиноцитів [81, 132, 136]. Відомо, що зовнішнє використання камфорної олії у дорослих у загальноприйнятих дозах є безпечним при правильному використанні [180].
Враховуючи властивості препарату та загальні рекомендації з догляду за шкірою було розроблено методику зовнішнього лікування і профілактики ДАН, в основі якої покладене використання камфорної олії. Досліджуваний препарат застосовували у вигляді просякнутих ним серветок, якими очищували забруднені сечею та/або калом ділянки шкіри до досягнення чистої поверхні, після чого, для забезпечення подальшого захисту шкіри, всі уражені ділянки та інтактні зони ризику змащували новою серветкою, просякнутою досліджуваним препаратом, промокаючи залишки засобу до отримання легкого жирного блиску поверхні шкіри, процедуру повторювали тричі на добу і частіше за потреби та супроводжували заміною підгузка. Обробка препаратом інтактних зон ризику проводилась з профілактичною метою. Розхід препарату становив, у середньому, 1 мл засобу на площу 100 см2 поверхні шкіри. У пацієнтів групи порівняння звичний догляд за забрудненою сечею та/або калом шкірою проводився за допомогою підмивання теплою водою, витирання шкіри вологими серветками 3 в 1 або використання миючої піни із захисним бар’єрним кремом тричі на добу під час заміни підгузків. Крім того, усі пацієнти з нетриманням отримували стандартний стаціонарний лікувальний режим.
Використання просякнутих серветок об’єднує різні етапи догляду в один крок, чим пришвидшує обслуговування, проте може здорожчувати вартість медичної допомоги [50]. За даними Bliss D. et al. (2007), вартість застосування бар’єрного крему, без врахування затрат на роботу персоналу та супутніх витрат, може становити 0,22–0,25 $ за добу, тоді як використання захисної акрилатної термополімерної плівки, яка наноситься 1 раз на 3 дні, здешевлює витрату на препарат, у середньому, до 0,04 $ на один епізод нетримання, але до згаданої вартості не входять витрати на кількаразове щоденне очищення. При використанні згаданих бар’єрних засобів разом із засобом для очищення витрати на догляд за шкірою зростають відповідно до 0,27–0,33 $ і 0,12 $ [50].
Фармакоекономічні підрахунки запропонованої методики зовнішнього використання камфорної олії показали, що на одну процедуру догляду за однією ділянкою шкіри площею 100 см2, у середньому, витрачалося 0,65 грн. Враховуючи те, що пацієнт потребував догляду за шкірою не менше ніж 3 рази на добу, а в середньому, в одного хворого уражається 7 ділянок ДАН, витрати на використання запропонованої методики становили 409,5 грн на місяць на одного пацієнта. У той час витрати на вологі серветки 3 в 1 або на поєднання піни для очищення шкіри із захисним бар’єрним кремом були однаковими і складали 1,65 грн. Різниця у вартості між дослідним препаратом і гігієнічними засобами становила 1,00 грн на одній ділянці площею 100 см2. Іншими словами, використання камфорної олії було у 2,5 рази дешевшим від застосування вологих серветок 3 в 1 або поєднання піни для очищення шкіри із захисним бар’єрним кремом. Враховуючи ці дані встановлено, що економія коштів при застосуванні запропонованої розробленої методики може досягати 630 грн на місяць на одного пацієнта (табл. 5.1).
Наступним етапом даної роботи стало оцінювання терапевтичної та профілактичної ефективності методики зовнішнього застосування камфорної олії. Відомо, що місцеве використання камфорної олії у дорослих є повністю безпечним, проте, при внутрішньому вживанні може бути нейротоксичним [180]. Зважаючи на те, що вдихання парів камфори може чинити негативний вплив, проводився моніторинг неврологічної симптоматики та біохімічних маркерів функції печінки та нирок. З метою оцінки профіля безпеки досліджуваного препарату було проаналізовано результати загальноклінічних лабораторних досліджень, а саме загального аналізу крові, загального аналізу сечі, біохімічного аналізу крові, показники яких знаходилися у межах допустимих норм і статистично не відрізнялися від початкових протягом усього періоду спостереження. Також не було відмічено побічних ефектів від застосування камфорної олії, у тому числі алергічних реакцій, подразнення шкіри, неврологічних проявів токсичності (корчі, судоми).
Після проведеного курсу лікування відзначено достовірне (p < 0,05) зменшення в 1,2–2,1 раза частоти ураження у періанальній ділянці (55,8 %), міжсідничній складці (64,4 %), верхніх частинах сідниць зліва (28,8 %) і справа (23,1 %), на геніталіях (40,4 %), у низу живота (12,5 %), внутрішній поверхні стегон зліва (33,7 %) і справа (31,7 %) та задній поверхні стегон зліва (21,2 %) і справа (18,3 %). Недостатнім виявився лікувальний ефект тільки на нижніх частинах сідниць та пахвинних складках, що можна пояснити ймовірним негативним впливом тісно прилягаючих у цих місцях ізолюючих облямівок підгузків (рис. 6.1). У групі порівняння достовірне зменшення частоти ураження відбулося тільки у міжсідничній складці (в 1,9 раза) та внутрішній поверхні лівого стегна (в 2,1 раза) (рис. 6.2). У пошуку пояснення, чому ефект від лікування був найбільше помітний саме у міжсідничній складці, спадає на думку те, що у вказаній ділянці найдовше зберігається нанесений лікувальний засіб, адже шкіра тут не контактує з підгузком чи постіллю, які можуть поглинати препарат після його нанесення на шкіру.
Після курсу лікування розповсюдженість симптомів захворювання зменшилась до 5 ділянок у одного пацієнта, проте така зміна не була достовірною (p = 0,43).
Після проведеного лікування кількість випадків яскравої еритеми високодостовірно знизилася у 12 разів (до 5,8 %) в основній групі та зникла у групі порівняння, в якій у всіх пацієнтів еритема набула тільки легкого ступеня (рис. 3.3, 6.3). Таке зниження інтенсивності еритеми в обох групах можна пояснити зменшенням подразнення шкіри дією сечі і калу внаслідок ретельного догляду за шкірою, належним її очищенням та бар’єрним захистом.
Внаслідок проведеного лікування відбулося достовірне зменшення кількості везикул, пухирів та ерозій, а саме везикул – в 1,6 раза (27,9 %), пухирів – у 2,4 раза (6,7 %), ерозій – в 1,5 раза. Частота виявлення папул суттєво не змінилася, а пустул – знизилися в 1,4 раза, але така зміна була недостовірною (табл. 6.5, рис. 6.4). У групі порівняння зменшення кількості первинних елементів висипань було недостовірним (табл. 6.6, рис. 6.4). Отримані дані вказують на перевагу камфорної олії над гігієнічними засобами щодо зниження кількості везикул і пухирів, що можна пояснити протизапальними властивостями препарату, внаслідок чого зменшуються симптоми екзематизації та вторинного ерозування шкіри. Після проведеного курсу лікування в основній групі частота грибкових висипань також достовірно знизилась в 1,6 раза (31,7 %) (рис. 6.5).
У первинно інтактних зонах типового розташування ДАН, в яких проводилася обробка шкіри досліджуваним препаратом, не було виявлено виникнення еритеми чи інших ознак захворювання протягом усього періоду спостереження, що вказувало на задовільний профілактичний результат.
За допомогою оцінювального інструменту IADS встановлено високодостовірне (p < 0,01) зниження загального балу тяжкості у 2 рази, до (9,9 ± 5,1) бала під дією запропонованого лікування. Зниження балу IADS відображає згасання інтенсивності почервоніння, зменшення кількості інших елементів висипів, порушеної цілісності шкіри, а також кількості уражених ділянок тіла (риc. 6.6). Аналіз показників, проведений з врахуванням типу нетримання виявив, що для подвійного нетримання властивими є достовірно вищі показники загального балу IADS порівняно з пацієнтами, які мають нетримання тільки сечі, а саме в основній групі показник був вищий в 1,4 раза, відповідно (12,1 ± 5,9) проти (8,8 ± 4,4) бала (табл. 6.8).
За показниками IAD-IT відмічено достовірне (p <0,01) збільшення в 1,9 раза (26,9 %) числа легкого ступеню хвороби, незначне зменшення помірного (56,7 %), і достовірне (p <0,01) зменшення в 1,5 раза тяжкого ступеня (16,3 %). У групі порівняння достовірне (p <0,05) поліпшення перебігу встановлене тільки за рахунок зменшення кількості випадків тяжкого ДАН в 1,9 раза (23,3 %), а зміни у кількості пацієнтів з легким і помірним ДАН були несуттєвими та відзначалися відповідно у 26,7 і 50,0 % хворих (табл. 6.9, рис. 6.7, 6.8). Наведені результати показують, що камфорна олія має перевагу над гігієнічними засобами при легкому ступені ДАН. Поліпшення перебігу захворювання відбувалося поступово за рахунок переходу частини пацієнтів від тяжкого до помірного та від помірного до легкого ступеня ДАН. Впродовж місяця спостереження не було зареєстровано повного видужання або швидкого переходу від тяжкого ДАН у легкий.
Підрахунок у підгрупах залежно від типу нетримання після лікування виявив, що нетримання сечі продовжувало достовірно переважати при легкому і помірному ступенях, відповідно у 4,6 (22,1 % проти 4,8 %) і 2,0 раза (37,5 % проти 19,2 %), а подвійне нетримання переважало при тяжкому ступені в 1,8 раза (10,6 % проти 5,8 %). У пацієнтів групи порівняння достовірність переваги подвійного нетримання зберігалася при легкому ступені та втрачалася при помірному. Беручи до уваги дані показники можна вважати, що запропонований метод лікування в основній групі має достовірну вищу клінічну ефективність у зниженні числа випадків помірного ступеня ДАН при подвійному нетриманні, порівняно з гігієнічними засобами для догляду.
При порівнянні категорій GLOBIAD відбулося високодостовірне збільшення чисельності категорії 1А до 50,0 % пацієнтів (p < 0,001) та зменшення кількості осіб з категорією 2В до 15,4 % випадків (p < 0,001). У групі спостереження відбулися подібні зміни (табл. 6.11). Отримані дані вказують на подібну клінічну ефективність камфорної олії та гігієнічних засобів з догляду за шкірою, застосування яких найбільше впливає на зміну складу категорій 1А та 2В.
Підрахунок у підгрупах залежно від виду нетримання, після лікування виявив, що частота нетримання сечі переважала над подвійним нетриманням в основній групі у категоріях 1А та 2А відповідно у 3,0 раза (37,5 проти 12,5 %) та 1,7 раза (11,5 проти 6,7 %), тоді як у категоріях з онаками інфікування 1В та 2В кількість випадків нетримання сечі і подвійного нетримання стали статистично однаковими. Виявлені закономірності показують, що для легкої категорії 1А за GLOBIAD характерне переважання нетримання тільки сечі (табл. 6.12).
Внаслідок використання камфорної олії випадки інфікування патогенними бактеріями стали поодинокими, золотистий стафілокок виявлено у 2 осіб (1,9 %), синьогнійну паличку – у 1 хворого (1,0 %), тоді як гемолітичні стрептококи не виявлялися. Частота висівання Candida spp. достовірно знизилась у 3,3 раза (p<0,01), а в групі порівняння – в 1,8 раза (p<0,05), що відповідно становило 11,5 % і 20,0 % (рис. 6.9, 6.10). Отримані показники кандидної колонізації шкіри після лікування були подібними до показників, характерних для здорових осіб, наведеними Campbell J. et al. (2017). Встановлено, що елімініція кандидних грибів з поверхні шкіри не призводила до видужання від ДАН, проте зменшувала клінічні прояви хвороби.
По закінченню курсу спостереження відбулися суттєві зміни у верифікації грибкових висипань, а саме, мікологічне підтвердження отримували тільки у 24,2 % випадків основної групи. Такий низький показник верифікації може бути пояснений інгібуючим впливом камфорної олії або тим, що мікологічне видужання наступає швидше за клінічне. У групі порівняння частота верифікації грибкових висипань збільшилася до 80 %, але статистичне порівняння не було можливе через невелику кількість спостережень (рис. 6.11).
Після курсу лікування у пацієнтів з нетриманням тільки сечі відбулося суттєве зниження кандидної колонізації у 6,7 раза порівняно з показником до початку лікування, тоді як при подвійному нетриманні таке зниження відбулося тільки у 1,6 раза і було недостовірне. У зв’язку з тим, що частота колонізації Candida spp. після проведеного лікування у другій підгрупі достовірно переважала у 6,2 раза над частотою в першій підгрупі можна вважати, що подвійне нетримання виступає чинником підвищеної кандидної колонізації шкіри при ДАН (рис. 6.12).
Загальний бал IADS після лікування достовірно знизився, проте при супутній грибковій колонізації продовжував достовірно переважати над показником у пацієнтів без інфікування в основній групі в 1,5 раза. У групі порівняння перевага в 1,4 раза виявилася недостовірною (рис. 6.13). Отримані дані вказують на те, що запропонований метод лікування має більшу ефективність у зниженні тяжкості хвороби в осіб з подвійним нетриманням ніж гігієнічні засоби.
Частота висівання Candida spp. при легкому ступені ДАН залишалася низькою (7,1 %), при помірному ступені – суттєво зменшилася у 6,5 разів (5,1 %). При тяжкому перебігу рівень колонізації знизився в 1,6 раза, але залишався найвищим (41,2 %), достовірно (p < 0,01) переважаючи показник помірного ступеня у 8 разів, а легкого – у 6 разів (рис. 6.14). Таким чином показано, що незважаючи на зниження грибкової колонізації під дією лікування, домінування Candida spp. при тяжкому ступені хвороби залишається високим. Під дією камфорної олії суттєво знижується показник кандидної колонізації при помірному ступені тяжкості, чого не відбувається у групі порівняння, що вказує на перевагу запропонованого методу зовнішнього лікування.
Після лікування камфорною рівень Candida spp. у категоріях 1В і 2А зменшився у 4 рази і складав відповідно 11,8 % і 10,5 %. У категорії 2В частота виявлення Candida spp. зменшилась в 1,8 раза, проте залишилася найбільшою та становила 37,5 %, переважаючи показники категорій 1В і 2А більше ніж у 3 рази (рис. 6.15).
Отже, запропонований метод зовнішнього застосування камфорної олії для лікування і профілактики ДАН має задовільний профіль безпеки, ефективно зменшує кількість ділянок ураження, знижує яскравість еритеми та інших висипань, зменшує частоту кандидної колонізації ураженої шкіри та покращує клінічний перебіг захворювання за даними позитивних змін показників оцінювальних інструментів та мікробіологічних досліджень. Крім того встановлено, що використання камфорної олії має перевагу над гігієнічними засобами догляду за шкірою в осіб з подвійним нетриманням та кандидною колонізацією шкіри.
У дисертаційній роботі наведено теоретичне узагальнення та нове науково-практичне вирішення актуального завдання сучасної дерматології, що полягає у поліпшенні діагностики та підвищенні ефективності лікування і профілактики дерматиту, асоційованого з нетриманням шляхом застосування оцінювальних інструментів і удосконалення зовнішньої терапії на підставі вивчення клінічних даних та складу мікробіоценозу шкіри.
- У зв’язку з розповсюдженістю дерматиту, асоційованого з нетриманням, у пацієнтів похилого віку та хворих, які потребують тривалого стороннього догляду, приєднанням вторинного інфікування поверхні шкіри, актуальним є пошук нових методів діагностики, поглиблення дослідження складу мікрофлори та розробка клінічно доведених та економічно ефективних методів лікування та профілактики цього захворювання.
- З’ясовано, що на сучасному етапі характерними клініко-епідеміологічними ознаками ДАН є: похилий вік, обмежена рухова активність, ураження нижніх частин сідниць, геніталій, міжсідничної складки та періанальної шкіри, яскрава еритема, ерозії, супутні грибкові висипання, середній показник оцінювального інструменту IADS (20,2 ± 6,5) бала і помірний ступінь згідно з IAD-IT.
- Визначено частоту, з якою виявляються патогенні мікроорганізми на уражених ділянках шкіри: Candida spp. – 37,5 %, S. aureus – 4,8 %, P. aureginosa – 2,9 %, S. haemolyticus – 1,9 %.
- Доведено, що кандидна колонізація достовірно пов’язана зі збільшенням показника загального балу IADS (в 1,3 раза), розвитком тяжкого ступеню хвороби згідно з IAD-IT та підвищенням категорії захворювання згідно з інструментом GLOBIAD. Подвійне нетримання є достовірним чинником підвищення загального балу тяжкості IADS (в 1,4 раза) і переважання частоти кандидної колонізації (у 5,7 раза) порівняно з особами з нетриманням тільки сечі після курсу зовнішнього лікування.
- Розроблено метод зовнішнього лікування хворих на ДАН, що полягає у використанні камфорної олії з метою очищення та захисту шкіри від дії сечі та калу, який вірогідно підвищує ефективність лікування, що проявляється зменшенням частоти яскравої еритеми у 12,0 разів, інших елементів висипань – у 1,5–2,4 раза, зниженням загального балу IADS та кількості тяжких форм хвороби згідно з IAD-IT і GLOBIAD у 1,5–2,0 раза, зменшенням частоти кандидної колонізації у 3,3 раза та мікологічно верифікованих грибкових висипань у 3,7 раза.
- З’ясовано, що запропонований метод зовнішнього лікування має задовільний профіль безпеки, на що вказують результати загальноклінічних лабораторних аналізів і відсутність побічних ефектів.
7 Зовнішнє використання камфорної олії впродовж одного місяця чинить профілактичну дію, що ґрунтується на відсутності еритеми та інших висипань у первинно інтактних ділянках ризику виникнення ДАН та забезпечує економічну доцільність, на що вказує зменшення фінансових витрат у 2,5 раза порівняно з іншими гігієнічними засобами у формі вологих салфеток чи очищувальної піни із захисним кремом.
- За допомогою оцінювального інструмента IAD-IT рекомендується диференціювати легкий, помірний і тяжкий ДАН, визначати грибковий висип та обирати відповідну лікувальну тактику. Враховуючи зручність і простоту інструменту GLOBIAD його рекомендується використовувати для щоденного моніторингу захворювання, у тому числі середнім медичним персоналом, адже основними критеріями для поділу пацієнтів на дві категорії є лише почервоніння, ерозія та наявність ознаки інфікування поверхні шкіри. За показником оцінювального інструмента IADS відображається тяжкість ДАН в балах від 0 до 52, що дозволяє порівнювати стан ураженої шкіри до та після лікування. З поліпшенням стану шкіри загальний бал буде знижуватись.
- Для забезпечення етапів очищення і захисту шкіри від подразнювальної дії сечі та калу рекомендується методика лікування і профілактики ДАН, в основі якої є місцеве використання камфорної олії наступним способом: за допомогою просякнутої препаратом серветки очищують забруднені сечею та/або калом ділянки шкіри до досягнення чистої поверхні, після чого, для забезпечення подальшого її захисного бар’єру, всі уражені ділянки та інтактні зони ризику змащують новою серветкою, просякнутою досліджуваним препаратом, промокаючи залишки засобу до отримання легкого жирного блиску. Вказані заходи застосовуються не менше ніж тричі на добу та супроводжуються заміною підгузків. Витрата препарату, у середньому, становить 1 мл засобу на 100 см2 поверхні шкіри.
- У клінічних випадках ДАН, який супроводжується подвійним нетриманням, грибковим висипом та колонізацією Candida spp., для догляду за шкірою слід надавати перевагу запропонованій методиці використання камфорної олії.
- Аналіз структури та антибіотикорезистентності шкірної біоти хворих на алергодерматози / Я.Ф.Кутасевич, І.О. Олійник, С.К. Джораєва та ін. Дерматологія та венерологія. 2017. № 2 (76). С. 37–
- Аряєв М.Л., Котова Н.В. Рекомендації з діагностики, лікування та профілактики мікозів у новонароджених дітей. Неонатологія, хірургія та перинатальна медицина. 2014. Т. 4, № 1 (11). С. 129–135.
- Бондар С.А., Луцюк М.Б., Качула С.О. Економічна оцінка ефективності сорбційного методу еферентної терапії з включенням препарату на основі нанокремнезему у хворих хронічними дерматозами. Вісник Вінницького національного медичного університету. 2017. Т. 21, №2. С. 521–524.
- Володькіна А.В., Геращенко І.І. Біохімічні механізми старіння шкіри та сучасні підходи до їх корекції. Медична хімія. 2008. Т. 10, № 3. С. 19–25.
- Волошина-Андрашко І.О., Калмикова А.В., Яремкевич Р.Р. Дослідження впливу препарату Prostrolane Natural-B на основні патогенетичні ланки запального старіння шкіри. Український журнал дерматології, венерології, косметології. 2019. № 1. С. 21–27.
- Галникіна С.О., Когут І.Й. Дерматит, асоційований з нетриманням фізіологічних відправлень – новий підхід до «старої» проблеми. Український журнал дерматології, венерології, косметології. 2016. № 1 (60). С. 87–92.
- Галникіна С.О., Когут І.Й., Павлишин А.В. Лікування контактного дерматиту асоційованого з нетриманням фізіологічних відправлень. Zbior artykulow naukowych konferencji miedzynarodnowej naukowo-praktycnej „Osiagniecia naukowe, rozwoj, propozyciye na rok 2015” (30.12.2015 – 03.01.2016). Warszawa: Sp. Z.o.o. „Diamond trading tour”, 2015. P. 45–47.
- Гілюк В.В. Сучасний погляд на патогенез алергійного контактного дерматиту та перспективи вивчення природи контактної алергії. Український журнал дерматології, венерології, косметології. 2018. № 4 . С. 81–86.
- Глєбова Є.Є. Удосконалена модель організації медичної допомоги пацієнтам з патологічними та віковими змінами шкіри. Україна. Здоров’я нації. 2020. № 2. С. 28-34.
- Джораєва С.К. Стан показників протимікробної резистентності у хворих на алергодерматози, обтяжені стафілококовою інфекцією, в залежності від тяжкості перебігу захворювань. ScienceRise: Medical Science. 2020. № 1 (34). С. 35–40.
- Исследование отдельных патогенных свойств клинических изолятов стафилококков, выделенных от больных атопическим дерматитом / В.В. Гончаренко, С.К. Джораева, Ю.В. Щербакова и др. Дерматологія та венерологія. 2018. № 3. С. 85–86.
- Інструкція для медичного застосування лікарського засобу «Камфорна олія». Наказ МОЗ України № 109 від 08.02.2014 р. «Про державну реєстрацію (перереєстрацію) лікарських засобів (медичних імунобіологічних препаратів) та внесення змін до реєстраційних матеріалів». К., 2014. С. 14.
- Когут І.Й. Догляд за шкірою при дерматиті, асоційованому з нетриманням відправлень у хронічних хворих. Сучасні підходи до формування клінічних настанов з діагностики і лікування шкірних захворювань та інфекцій, що передаються статевим шляхом: європейський досвід та українські реалії: Всеукраїнська науково-практична конференція Української асоціації лікарів-дерматовенерологів і косметологів. м. Тернопіль, 19–20 жовтня 2016 р. Український журнал дерматології, венерології, косметології. 2016. № 4. С. 122–123.
- Когут І.Й. Особливості вторинного інфікування поверхні шкіри у хворих на асоційований з нетриманням дерматит. Інфекційні хвороби: поступи і проблеми в діагностиці, терапії і профілактиці: Матеріали ІХ з’їзду інфекціоністів України. м. Тернопіль, 7–9 жовтня 2015 р. Тернопіль : Укрмедкнига, 2015. С. 252–253.
- Когут І.Й. Порівняння ефективності препарату «Камфорна Олія» у лікуванні дерматиту, асоційованому з нетриманням фізіологічних відправлень. Дерматовенерологія. Косметологія. Сексопатологія. 2016. № 3–4. С. 47–48.
- Когут І.Й., Галникіна С.О. Визначення ефективності лікування дерматиту, асоційованого з нетриманням фізіологічних відправлень за допомогою IADS і IAD-IT. Журнал дерматовенерології та косметології ім. М.О.Торсуєва. 2017. №. 2 (38). С. 98–101.
- Когут І.Й., Галникіна С.О. Застосування діагностичних методик IADS і IAD-IT при дерматиті, асоційованому з нетриманням випорожнень. Здобутки клінічної та експериментальної медицини: матеріали підсумкової науково-практичної конференції, присвяченої 60-річчю ТДМУ. м. Тернопіль, 14 червня 2017 р. Тернопіль : ТДМУ, 2017. С. 55–57.
- Когут І.Й., Галникіна С.О. Застосування категоризаційного інструмента GLOBIAD для моніторингу дерматиту, асоційованого з нетриманням. Український журнал дерматології, венерології, косметології. 2018. № 3. С. 110–114.
- Когут І.Й., Галникіна С.О. Застосування оцінювальних інструментів IADS і IAD-IT при дерматиті, асоційованому з нетриманням відправлень. Ліки України плюс. 2018. № 1. С. 27–31.
- Когут І.Й., Галникіна С.О. Клініко-економічна ефективність застосування камфорної олії при дерматиті, асоційованому з нетриманням. Вісник соціальної гігієни та організації охорони здоров’я України. 2018. № 4 (78). С. 69–74.
- Когут І.Й., Галникіна С.О. Клініко-економічне обґрунтування застосування камфорної олії при дерматиті, асоційованому з нетриманням. Здобутки клінічної та експериментальної медицини: матеріали підсумкової LXII наук.-практ. конф., присвяченої 165-річчю від дня народження Івана Яковича Горбачевського, м. Тернопіль, 13 черв. 2019 р. Тернопіль : ТНМУ, 2019. С. 16–17.
- Когут І.Й., Галникіна С.О. Моніторинг перебігу дерматиту, асоційованого з нетриманням, за допомогою категоризаційного інструмента GLOBIAD. XVII конгрес світової федерації українських лікарських товариств: матеріали наукового симпозіуму. м. Тернопіль, 20 вересня 2018 р. Тернопіль : ТДМУ, 2018. С.176.
- Когут І.Й., Галникіна С.О. Супутня інфекція Candida spp. при дерматиті, асоційованому з нетриманням. Здобутки клінічної та експериментальної медицини: матеріали підсумкової науково-практичної конференції. м. Тернопіль, 6 червня 2018 р. Тернопіль : ТДМУ, 2018. С. 36–37.
- Колбасіна М.В., Колбасіна Л.П. Вікові зміни у процесі старіння в аспекті догляду за літніми людьми. Вісник наукових досліджень. 2010. № 1. С. 98–100.
- Культуральна діагностика дерматомікозів. Методичний лист / Харківський науково-дослідний інститут дерматології та венерології. Затверджений Вченою Радою МОЗ СРСР (протокол № 18 від 18.11 – 1986 р.). Харків, 1986.
- Кутасевич Я.Ф., Джораєва С.К. Олійник І.О. Нові можливості зовнішньої антибактеріальної терапії. Український журнал дерматології, венерології, косметології. 2019. № 2. С. 63–69.
- Кутасевич Я.Ф., Олейник И.А. Антибактериальная терапия в лечении гнойничковых заболеваний кожи. Український журнал дерматології та венерології. 2011. № 4 (43). С. 67–
- Манастирська О.С. Клінічні лабораторні дослідження: навчальний посібник для студ. вищ. мед. навч. закл. І-ІІ рівнів акредит. Вінниця : Нова Книга, 2007. 168 с.
- Марушко Ю.В. Профілактичні та лікувальні заходи при пелюшковому дерматиті в дітей. Здоров’я дитини. 2015. № 2 (61). С. 107–111.
- Нобл У.К. Микробиология кожи человека. М. : Медицина, 1986. 496 с.
- Особливості клiнiчних проявів aтoпiчнoгo дерматиту у пацієнтів з мутацiєю 2282del4 в генi фiлагрину / І.О. Олійник, С.К. Джораєва, К.Є. Iщeйкiн та ін. Дерматологія та венерологія. 2018. № 2 (80). С. 19–
- Оцінка ефективності комплексного лікування хворих на атопічний дерматит і екзему з використанням фонофорезу з емолєнтом / Я.Ф. Кутасевич, І.О. Олійник, О.М. Стулій, І.В. Зюбан. Дерматологія та венерологія. 2019. № 4 (86). С. 18–22.
- Пат. на корисну модель 107279 UA, МПК A61K 31/125, A61P 17/00, A61F 13/47, A61L 15/16. Спосіб лікування контактного дерматиту, асоційованого з нетриманням фізіологічних відправлень / С.О. Галникіна, І.Й. Когут, А.В. Павлишин; заявник і патентовласник ДВНЗ «Тернопільський державний медичний університет ім. І.Я.Горбачевського МОЗ України». № u201512640; заявл. 21.12.15; опубл. 25.05.16, Бюл. № 10.
- Петри А., Сэбин К. Наглядная медицинская статистика. Пер. с англ. под ред. В. П. Леонова. 2-е изд., перераб. и доп. М. : ГЭОТАР-Медиа, 2010. 168 с.
- Потенційні ризики для здоров’я дитини при застосуванні підгузків / Т.Ф. Харченко, В.М. Левицька, С.С. Ісаєва та ін. Сучасні проблеми токсикології, харчової та хімічної безпеки. 2014. № 3/4. С. 58–62.
- Практична мікробіологія: Посібник / С.І. Климнюк, І.О. Ситник, М.С. Творко, В.П. Широбоков. Тернопіль : Укрмедкнига, 2004. 440 с.
- Приказ № 535 МЗ СССР от 22.04.1985 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений. М., 1985.
- Психосоматичні розлади у хворих на алергодерматози та їх корекція / Я.Ф. Кутасевич, І.О. Олійник, І.О. Маштакова та ін. Дерматологія та венерологія. 2019. № 1 (83). С. 28–32.
- Савоськіна В.О. Оцінка клінічної ефективності застосування топічного препарату природного походження у дерматології. Дерматологія та венерологія. 2019. № 4 (86). С. 18–22.
- Ступенчастая энтеросорбция как оптимальный метод коррекции микробиоценоза кишечника у больных аллергодерматозами / Я.Ф. Кутасевич, И.А. Олейник, С.К. Джораева, В.Ю. Мангушева. Дерматологія та венерологія. 2016. №1 (71)/ C. 79–
- Супрун Е.В. Новые подходы к уходу за кожей детей раннего возраста и профилактике дерматита. Современная педиатрия. 2018 № 5 (93). С. 72–84.
- Уніфікація лабораторних методів дослідження в діагностиці захворювань, що передаються статевим шляхом / І.І. Мавров, О.П. Бєлозоров, Л.С. Тацьката ін. Харків : Факт, 2000. 120 с.
- Цепколенко Г.В. Неінвазивні інструментальні методи в оцінці структурно-функціональної основи старіння шкіри. Дерматологія та венерологія. 2019. № 2 (84). С. 27–30.
- Черновол А.С. Современный взгляд на оптимизацию наружной терапии стероидчувствительных дерматозов, осложненных вторичным инфицированием (обзор литературы). Український журнал дерматології, венерології, косметології. 2019. № 2 (73). С. 70–74.
- Шмелькова К.С. Порушення дермального бар’єру як причина хронізації дерматозів. Дерматологія та венерологія. 2016 № 1 (71). С. 11–15.
- A 3-in-1 perineal care washcloth impregnated with dimethicone 3 % versus water and ph neutral soap to prevent and treat incontinence-associated dermatitis: a randomized, controlled clinical trial / D. Beeckman, S. Verhaeghe, T. Defloor et al. Journal of Wound, Ostomy and Continence Nursing. 2011. Vol. 38, Iss. 6. P. 627–634.
- A randomized comparative trial on the therapeutic efficacy of topical aloe vera and calendula officinalis on diaper dermatitis in children / Y. Panahi, M. Sharif, A. Sharif et al. Scientific World Journal. 2012. Vol. 2012. ArticleID 810234. 5 p.
- A systematic review and meta-analysis of incontinence-associated dermatitis, incontinence, and moisture as risk factors for pressure ulcer development / D. Beeckman, A. van Lancker, A. van Hecke, S. Vergaeghe. Res Nurs Health 2014. Vol. 37, Iss. 3. P. 204–218.
- Aging enhances maceration-induced ultrastructural alteration of the epidermis and impairment of skin barrier function / T. Minematsu, Y. Yamamoto, T. Nagase et al. J Dermatol Sci. Vol. 62, Iss. 3. P. 160–168.
- An economic evaluation of four skin damage prevention regimens in nursing home residents with incontinence / D. Bliss, C. Zehrer, K. Savik et al. Journal of Wound, Ostomy and Continence Nursing. 2007. Vol. 34, Iss. 2. P. 143–152.
- An exploratory study of skin problems experienced by UK nursing home residents using different pad designs / S. Clarke-O’Neill, A. Farbrot, M. Lagerstedt et al. J Wound Ostomy Continence Nurs. 2015. Vol. 42, Iss. 6. P. 621–631.
- Antibacterial Effects of the essential oils of commonly consumed medicinal herbs using an in vitro model / M. Soković, J. Glamočlija, P. Marin et al. 2010. Vol. 15. P. 7532–7546.
- Arndt J., Kelechi T. An Overview of Instruments for Wound and Skin Assessment and Healing. J Wound Ostomy Continence Nurs. 2014. 41, Iss. 1. P. 17–23.
- Arnold-Long M., Johnson E. Epidemiology of Incontinence-Associated Dermatitis and Intertriginous Dermatitis (Intertrigo) in an Acute Care Facility. J Wound Ostomy Continence Nurs. 2019. Vol. 46, Iss. 3. P. 201–206.
- Beeckman D. A decade of research on incontinence-associated dermatitis (IAD): evidence, knowledge gaps and next steps. J Tissue Viability. 2017. Vol. 26, Iss. 1. P. 47–56.
- Beeckman D., Woodward S., Gray M. Incontinence-associated dermatitis: step-by-step prevention and treatment. Br J Community Nurs. Vol. 16, Iss. 8. P. 382–389.
- Behairy A., El-Mokadem N. Effect of skin intervention protocol on incontinence-associated dermatitis among patients with fecal incontinent. IOSR Journal of Nursing and Health Science. 2015. Vol. 4, Iss. 6. P. 24–31.
- Bender J., Faergemann J., Sköld M. Skin health connected to the use of absorbent hygiene products: a review. Dermatol Ther (Heidelb). 2017. Vol. 7. P. 319–330.
- Best practice recommendations for the prevention and management of incontinence-associated dermatitis / K. LeBlanc, D. Christensen, L. Robbs et al. Wound Care Canada. 2010. Vol. 8, Iss. 3. P. 6–24.
- Bianchi J., Segovia-Gуmez T. The dangers of faecal incontinence in the at-risk patient. Wounds International. 2012. Vol. 3, Iss. 3. P. 15–21.
- Campbell J.L., Coyer F.M., Osborne S.R. Incontinence-associated dermatitis: a cross-sectional prevalence study in the Australian acute care hospital setting. Int Wound J. 2016. Vol. 13, Iss. 3. P. 403–411.
- Camphor induces cold and warm sensations with increases in skin and muscle blood flow in human / T. Kotaka, S. Kimura, M. Kashiwayanagi, J. Iwamoto. Pharm. Bull. 2014. Vol. 37, Iss. 12. P. 1913–1918.
- Candida albicans and Napkin Dermatitis: Relationship and Lesion Severity Correlation / Karsani, A. Azolaibani, Y. Farouq et. al. Sudan Journal of Medical Sciences. 2017. Vol. 12, Iss. 3. P. 174–186.
- Candida albicans colonisation, continence status and incontinence-associated dermatitis in the acute care setting: a pilot study / J. Campbell, F. Coyer, A. Mudge et al. Int Wound J. 2017. Vol. 14. P. 488–495.
- Clinical and economic evidence supporting a transparent barrier film dressing in incontinence associated dermatitis and periwound skin protection / Guest, M. Greener, K. Vowden, P. Vowden. Journal of Wound Care. 2011. Vol. 20, Iss. 2. P. 76–84.
- Clinical evaluation of a flexible fecal incontinence management system / A. Padmanabhan, M. Stern, J. Wishin et al. J. Crit. Care. 2007. Vol. 16. P. 384–393.
- Clinical evaluation of a skin protectant for the management of incontinence-associated dermatitis: an open-label, nonrandomized, prospective study / M. Brennan, C. Milne, M. Agrell-Kann, B. Ekholm. J Wound Ostomy Continence Nurs. 2017. Vol. 44, Iss. 2. P. 172–180.
- CONSIDER – Core Outcome Set in IAD Research: study protocol for establishing a core set of outcomes and measurements in incontinence-associated dermatitis research / K. Van den Bussche, D. De Meyer, N. Van Damme et al. J Adv Nurs. Vol. 73, Iss. 10. P. 2473–2483.
- Corcoran E., Woodward S. Incontinence-associated dermatitis in the elderly: treatment options. J. Nurs. 2013. Vol. 22, Iss. 8. P. 1234–1240.
- Defloor T., Schoonhoven L. Inter-rater reliability of the EPUAP pressure ulcer classification system using photographs. J Clin Nurs. 2004. Vol. 13, Iss. 8. P. 952–959.
- Design and psychometric testing of the attitude towards the prevention of incontinence-associated dermatitis instrument (APrIAD) / N. Van Damme, A.Van Hecke, A. Himpens et al. Int Wound J. 2019. Vol. 16, Iss. 2. P. 492–502.
- Determining risk factors to develop a predictive model of incontinence-associated dermatitis among critically ill patients with fecal incontinence: a prospective, quantitative study / L. Wei, Y. Bao, Q. Chai et al. Wound Manag Prev. 2019. Vol. 65, Iss. 4. P. 24–33.
- Development of an animal model for inducing various degrees of severity of incontinence-associated dermatitis / Z. Wen, W. Zhu, Q. Liu et al. J Wound Ostomy Continence Nurs. Vol. 44, Iss. 6. P. 578–582.
- Do intra-anal bowel management devices reduce incontinence-associated dermatitis and/or pressure injuries? / T. Beeson, B. Eifrid, C. Pike, J. Pittman. J Wound Ostomy Continence Nurs. 2017. Vol. 44, Iss. 6. P. 583–588.
- Driver D. Perineal dermatitis in critical care patients. Crit Care Nurse. 2007. Vol. 27. P. 42–46.
- Dry skin, barrier function, and irritant contact dermatitis in the elderly / F. Seyfarth, S. Schliemann, D. Antonov, P. Elsner. Dermatol. 2011. Vol. 29, Iss. 1. P. 31–36.
- Dykes P., Bradbury S. Comparing the effectiveness and wash-off resistance of skin barrier creams: a healthy volunteer study. Journal of Wound Care. 2017. Vol. 26, Iss. 9. P. 552–557.
- Effect of a 1-piece drainable pouch on incontinence-associated dermatitis in intensive care unit patients with fecal incontinence a comparison cohort study / X. Zhou, Z. He, Y. Chen, L. Zuo. J Wound Ostomy Continence Nurs. 2017. Vol. 44, Iss. 6. P. 568–571.
- Effectiveness of topical skin products in the treatment and prevention of incontinence-associated dermatitis: a systematic review / Pather, S. Hines, K. Kynoch, F. Coyer. JBI Database System Rev Implement Rep. 2017. Vol. 15, Iss. 5. P. 1473–1496.
- Efficacy of an improved absorbent pad on incontinence-associated dermatitis in older women: cluster randomized controlled trial / J. Sugama, H. Sanada, Y. Shigeta et al. BMC Geriatrics. 2012. Vol. 12. P. 22.
- Eichenfield L.F., McCollum A., Msika P. The benefits of sunflower oleodistillate (sod) in pediatric dermatology. Pediatric Dermatology. 2009. Vol. 26, Iss. 6. P. 669–675.
- Enhancing SKIN health and safety in aged CARE (SKINCARE Trial): a study protocol for an exploratory cluster-randomized pragmatic trial / J. Kottner, E. Hahnel, M. El Genedy et al. Trials. 2019. Vol. 20. P. 302.
- Evaluation of antibacterial activity of camphor, benzoin, cubebs, fenugreek, apricot and cinnamon leaf against standard cultures and clinical isolates of an array of organisms / M. Zafar, F. Hassan, S. Naqvi et al. Pakistan Journal of Pharmacology. 2012. Vol. 29, No. 1. P. 1–7.
- Examining Prevalence and Risk Factors of Incontinence-Associated Dermatitis Using the International Pressure Ulcer Prevalence Survey / S. Kayser, L. Phipps, C. VanGilder, C. Lachenbruch. J Wound Ostomy Continence Nurs. 2019. Vol. 46, Iss. 4. P. 285–290.
- Exploration of pressure ulcer and related skin problems across the spectrum of health care settings in Ontario using administrative data / K.Y. Woo, K. Sears, J. Almost et al. Int Wound J. 2017. Vol. 14, Iss. 1. P. 24–30.
- Exploring Incontinence-Associated Dermatitis in a Single Center Intensive Care Unit: A Longitudinal Point Prevalence Survey / J. Campbell, J.L. Cook, A. Doubrovsky et al. J Wound Ostomy Continence Nurs. 2019. Vol. 46, Iss. 5. P. 401–407.
- Flanagan M. Improving accuracy of wound measurement in clinical practice. Ostomy Wound Manage. 2003. Vol. 49, Iss. 10. P. 28–40.
- Flayyih M., Majeed R. The Effects of Aloe vera Gel, Sesame Oil and Camphor Oil on Pseudomonas aeruginosa Isolated from Burnt Patients. Iraqi J Pharm Sci. 2012. Vol. 21, Iss. 2. P. 18–23.
- Gallup E., Plott T. A multicenter, open-label study to assess the safety and efficacy of ciclopirox topical suspension 0.77 % in the treatment of diaper dermatitis due to Candida. J Drugs Dermatol. 2005. Vol. 4, Iss. 1. P. 29–34.
- Gaps in nursing care for people with urinary incontinence / S.C. Reis, T.S. Oliveira, E.M.R. Dázio et al. ESTIMA, Braz. J. Enterostomal Ther. 2018. Vol. Article ID e3618.
- Gray M. Optimal management of incontinence-associated dermatitis in the elderly. Am J Clin Dermatol. 2010. Vol. 11, Iss. 3. P. 201–210.
- Gray M. Іncontinence-related skin damage: essential knowledge. Ostomy Wound Management. 2007. Vol. 53, Iss. 12. P. 28–32.
- Gray M., Giuliano K. Incontinence associated dermatitis, characteristics and relationship to pressure injury: a multisite epidemiologic analysis. J Wound Ostomy Continence Nurs. 2018. Vol. 45, Iss. 1. P. 63–67.
- Hall K., Clark R. A Prospective, descriptive, quality improvement study to decrease incontinence-associated dermatitis and hospital-acquired pressure ulcers. Ostomy Wound Manage. 2015. Vol. 61, Iss. 7. P. 26–30.
- Health literacy needs related to incontinence and skin damage among family and friend caregivers of individuals with dementia / D. Bliss, S. Rolnick, J. Jackson et al. J Wound Ostomy Continence Nurs. 2013. Vol. 40, Iss. 5. P. 515–523.
- Health literacy needs related to incontinence and skin damage among family and friend caregivers of individuals with dementia / S. Rolnick, D. Bliss, J. Jackson et al. J Wound Ostomy Continence Nurs. 2013. Vol. 40, Iss. 5. P. 515–523.
- Histopathology of incontinence-associated skin lesions: inner tissue damage due to invasion of proteolytic enzymes and bacteria in macerated rat skin / Y. Mugita, T. Minematsu, L. Huang et al. PLoS ONE. 2015. Vol. 10, Iss. 9. Article ID e0138117.
- Hödl M., Eglseer D., Lohrmann C. Clinical utility of the German Ghent Global IAD Categorization tool including incontinence-associated dermatitis prevalence and categories. Int J Urol Nurs. 2019. Vol. 13. P. 57–62.
- Improving diaper design to address incontinence associated dermatitis / A. Beguin, E. Malaquin-Pavan, C. Guihaire et al. BMC Geriatr. 2010. Vol. 10. P. 86–96.
- In vitro antagonistic activity of monoterpenes and their mixtures against ‘toe nail fungus’ Pathogens / R. Ramsewak, M. Nair, M. Stommel, L. Selanders. Res. 2003. Vol. 17. P. 376–379.
- In vitro Antibacterial Activity of Camphor oil against Oral Microbes / F. Rahman, V. Priya, R. Gayathri, R.V. Geetha. J. Pharm. Sci. Rev. Res. 2016. Vol. 39, Iss. 1. P. 119–121.
- Incidence and characteristics of incontinence associated dermatitis in community-dwelling persons with fecal incontinence / D. Bliss, T. Funk, M. Jacobson, K. Savik. J Wound Ostomy Continence Nurs. 2015. Vol. 42, Iss. 5. P. 525–530.
- Incidence and predictors of incontinence-associated skin damage in nursing home residents with new-onset incontinence / D. Bliss, M. Mathiason, O. Gurvich et al. J Wound Ostomy Continence Nurs. 2017. Vol. 44, Iss. 2. P. 165–171.
- Incidence of moisture-associated skin damage in an intensive care unit / J. Valls-Matarín, M. del Cotillo-Fuente, R. Ribal-Prior et al. Enferm Intensiva. 2017. Vol. 28. P. 13–20.
- Incontinence and incontinence-associated dermatitis / D. Langemo, D. Hanson, S. Hunter et al. Аdvances in skin & wound care. 2011. Vol. 24, Iss. 3. P. 126–140.
- Incontinence in the aged: contact dermatitis and other cutaneous consequences / M. Farage, K. Miller, E. Berardesca, H. Maibach. Contact Dermatitis. 2007. Vol. 57. P. 211–217.
- Incontinence-associated dermatitis a consensus / M. Gray, D. Bliss, D. Doughty et al. Wound Ostomy Continence Nurs. 2007. Vol. 34, Iss. 1. P. 45–54.
- Incontinence-associated dermatitis consensus statements, evidence-based guidelines for prevention and treatment, and current challenges / D. Doughty, J. Junkin, P. Kurz et al. Wound Ostomy Continence Nurs. 2012. Vol. 39, Iss. 3. P. 303–315.
- Incontinence-associated dermatitis in a long-term acute care facility / M. Long, L. Reed, K. Dunning, J. Ying. Journal of Wound, Ostomy and Continence Nursing. 2012. Vol. 39, Iss. 3. P. 318–327.
- Incontinence-associated dermatitis in critically ill adults time to development, severity, and risk factors / D. Bliss, K. Savik, M. Thorson et al. J Wound Ostomy Continence Nurs. 2011. Vol. 38, Iss. 4. P. 433–445.
- Incontinence-associated dermatitis (IAD) study: Blinded assessment and treatment with zinc oxide-based ointment / B. Razor, B. Buckley, P. Quiambao et al. WCET Journal. 2014. Vol. 34, Iss. 4. P. 13–23.
- Incontinence-associated dermatitis: a comprehensive review and update / Gray, D. Beeckman, D.Z. Bliss et al. Journal of Wound Ostomy & Continence Nursing. 2012. Vol. 39, Iss. 1. P. 61–74.
- Incontinence-associated skin damage in nursing home residents: a secondary analysis of a prospective, multicenter study / D. Bliss, C. Zehrer, K. Savik et al. Ostomy Wound Management. 2006. Vol. 52, Iss. 12. P. 46–55.
- Independent risk factors for the development of incontinence-associated dermatitis (category 2) in critically ill patients with fecal incontinence: A cross-sectional observational study in 48 ICU units / N. Van Damme, E. Clays, S. Verhaeghe et al. Int J Nurs Stud. Vol. 81. P. 30–39.
- Independent risk factors for the development of skin erosion due to incontinence (incontinence-associated dermatitis category 2) in nursing home residents: results from a multivariate binary regression analysis / N. Van Damme, K. Van den Bussche, D. De Meyer et al. Int Wound J. Vol. 14, Iss. 5. P. 801–810.
- Influence of digestive enzymes on development of incontinence-associated dermatitis: Inner tissue damage and skin barrier impairment caused by lipidolytic enzymes and proteases in rat macerated skin / Y. Mugita, T. Minematsu, G. Nakagami, H. Sanada. Int Wound J. 2018. Vol. 15, Iss. 4. P. 623–632.
- Interventions for preventing and treating incontinence-associated dermatitis in adults / D. Beeckman, N. Van Damme, L. Schoonhoven et al. Cochrane Database of Systematic Reviews. 2016. Vol. 11. Article ID CD011627.
- Is it feasible to use incontinence-associated dermatitis assessment tools in routine clinical practice in the long-term care setting? / S. Clarke-O’Neill, A. Farbrot, M. Lagerstedt et al. J Wound Ostomy Continence Nurs. 2015. Vol. 42, Iss. 4. P. 379–388.
- Junkin J., Selekof J. Beyond “diaper rash”: Incontinence-associated dermatitis: does it have you seeing red? Nursing. Vol. 38, Iss. 11, Suppl. P. 56hn1–6hn10.
- Junkin J., Selekof J. Prevalence of Incontinence and Associated Skin Injury in the Acute Care Inpatient. J Wound Ostomy Continence Nurs. 2007. Vol. 34, Iss. 3. P. 260–269.
- Kathleen F. Damage control: Differentiating incontinence-associated dermatitis from pressure injury. Nursing Critical Care. 2019. Vol. 4, Iss. 6. P. 28–35.
- Kiechl-Kohlendorfer U., Berger C., Inzinger R. The effect of daily treatment with an olive oil/lanolin emollient on skin integrity in preterm infants: a randomized controlled trial. Dermatol. 2008. Vol. 25, Iss. 2. P. 174–178.
- Kohut I. Topical camphorated oil in incontinence-associated dermatitis. IDEA Congress 2019, 24-28 April 2019, Istanbul, Turkey. Istanbul : IDEA, 2019. P. 26.
- Kohut I., Galnykina S. Application of “Camphor Oil” medication in management of incontinence associated dermatitis. 2nd international transcaucasus congress on photodermatology and skin cancer; 2016 Oct 27–29, Tbilisi, Georgia. Tbilisi : ITC, 2016. P. 56.
- Kohut I., Galnykina S. The efficacy of topical camphorated oil in long-term care of residents with incontinence-associated dermatitis. Dermatology Review/Przegląd Dermatologiczny. 2019. Vol. 106, Iss. 6. P. 683–686.
- Kottner J., Lichterfeld A., Blume-Peytavi U. Maintaining skin integrity in the aged a systematic review. J.Dermatol. 2013. Vol. 169, Iss. 3. P. 528–542.
- Ladha M., Wagg A., Dytoc M. An approach to urinary incontinence for dermatologists. Journal of Cutaneous Medicine and Surgery. 2016. Vol. 21, Iss. 1. P. 15–22.
- Lambert D. Prevention of incontinence-associated dermatitis in nursing home residents. Annals of Long-Term Care: Clinical Care and Aging. 2012. Vol. 20, Iss. 5. P. 25–29.
- Lian Y. Barrier products in the treatment of incontinence-associated dermatitis. Nursing Standard. 2016. Vol. 30, Iss. 47. P. 59–69.
- Markham T., Kennedy F., Collins P. Topical sucralfate for erosive irritant diaper dermatitis. Arch Dermatol. Vol. 136, Iss. 10. P. 1199–1200.
- MASD part 2: incontinence-associated dermatitis and intertriginous dermatitis a consensus / J. Black, M. Gray, D. Bliss et al. J Wound Ostomy Continence Nurs. 2011. Vol. 38, Iss. 4. P. 359–370.
- McCrea S. Camphor. Monograph for UKPID. URL: http://www.inchem.org/documents/ukpids/ukpids/ukpid19.htm.
- Methods to assess the protective efficacy of emollients against climatic and chemical aggressors / R. Roure, M. Lanctin, V. Nollent, C. Bertin. Res. Pract. 2012. Vol. 2012. Article ID 864734.
- Microbiological aspects of diaper dermatitis / G. Ferrazzini, R.R. Kaiser, S. Hirsig Cheng et al. Dermatology. 2003. Vol. 206. P. 136–141.
- Moisture-associated skin damage: overviewand pathophysiology / M. Gray, J.M. Black, M.M. Baharestani et al. J Wound Ostomy Continence Nurs. 2011. Vol. 38. P. 233–241.
- Natural Oils for Skin-Barrier Repair: Ancient Compounds Now Backed by Modern Science / A. Vaughn, A. Clark, R. Sivamani, V. Shi. Am J Clin Dermatol. Vol. 19, Iss. 1. P. 103–117.
- Nix D. Validity and reliability of the Perineal Assessment Tool. Ostomy Wound Manage. Vol. 48, Iss. 2. P. 43–49.
- Ousey K., O’Connor L. Incontinence-associated dermatitis made easy. Wounds UK. 2017. Vol. 13, Iss. 1. P. 1–6.
- Outcome measurement instruments for erythema associated with incontinence-associated dermatitis: Systematic review / D. De Meyer, S. Gabriel, J. Kottner et al. J Adv Nurs. 2019. Vol. 75, Iss. 11. P. 2393–2417.
- Park K., Choi H. Prospective study on Incontinence-Associated Dermatitis and its Severity instrument for verifying its ability to predict the development of pressure ulcers in patients with fecal incontinence. International Wound Journal. 2016. Vol. 13, Iss. 1. P. 20–25.
- Park K., Kim K. Effect of a structured skin care regimen on patients with fecal incontinence a comparison cohort study. J Wound Ostomy Continence Nurs. 2014. Vol. 41, Iss. 2. P. 161–167.
- Pressure ulcer risk in the incontinent patient: analysis of incontinence and hospital-acquired pressure ulcers from the International Pressure Ulcer Prevalence™ Survey / C. Lachenbruch, D. Ribble, K. Emmons, C. VanGilder. J Wound Ostomy Continence Nurs. 2016. Vol. 43, Iss. 3. P. 235–241.
- Pressure ulcers and incontinence-associated dermatitis: effectiveness of the Pressure Ulcer Classification education tool on classification by nurses / D. Beeckman, L. Schoonhoven, J. Fletcher, K. Furtado. Saf. Health Care. 2010. Vol. 19. P. 1–4.
- Prevalence and correlates of perineal dermatitis in nursing home residents / D. Bliss, K. Savik, S. Harms et al. Res. 2006. Vol. 55, Iss. 4. P. 243–251.
- Prevalence and Management of Urinary Incontinence in a Brazilian Hospital: A Prospective, Descriptive Study / E.L. Borges, J.T. Moraes, J.A. Otoni Spira et al. Wound Manag Prev. 2019. Vol. 65, Iss. 12. P. 12–20.
- Prevalence of urinary, fecal and double incontinence in the elderly living at home / T.A. Teunissen, W.J. van den Bosch, H.J. van den Hoogen, A.L. Lagro-Janssen. Int Urogynecol J Pelvic Floor Dysfunct. 2004. Vol. 15, Iss. 1. P. 10–13.
- Prevention and treatment of incontinence-associated dermatitis (IAD): contributes of nursing intervention / A. Tavares, A. Ramos, F. Mendes et al. J Perioper Crit Intensive Care Nurs. 2017. Vol. 3. Article ID e114.
- Prevention of incontinence-associated skin damage in nursing homes: disparities and predictors / D. Bliss, O. Gurvich, M. Mathiason et al. West J Nurs Res. Vol. 39, Iss. 5. P. 643–659.
- Prevention of incontinence-related skin breakdown for acute and critical care patients: comparison of two products / M. Brunner, C. Droegemueller, S. Rivers, W. Deuser. Urologic nursing. 2012. Vol. 32, Iss. 4. P. 214–219.
- Proceedings of the Global IAD Expert Panel. Incontinence associated dermatitis: moving prevention forward / D. Beeckman, J. Campbell, K. Campbell et al. Wounds International, 2015. 24 p.
- Prospective aetiological study of diaper dermatitis in the elderly / N. Foureur, B. Vanzo, S. Meaume, P. Senet. British Journal of Dermatology. 2006. Vol. 155. P. 941–946.
- Recommendations for managing cutaneous disorders associated with advancing age / P. Humbert, B. Dréno, J. Krutmann et al. Clinical Interventions in Aging. 2016. Vol. 11. P. 141–148.
- Rees J., Pagnamenta F. Best practice guidelines for the prevention and management of incontinence dermatitis. Nursing Times. 2009. Vol. 105, Iss. 36. P. 24–26.
- Rippon M., Colegrave M., Ousey K. Incontinence-associated dermatitis: reducing adverse events. British Journal of Nursing. 2016. Vol. 25, Iss. 18. P. 1016–1021.
- Risk assessment tool for incontinence-associated dermatitis in elderly patients combining tissue tolerance and perineal environment predictors: a prospective clinical study / Y. Ichikawa-Shigeta, H. Sanada, C. Konya et al. Chronic Wound Care Management and Research. 2014. Vol. 1. P. 41–47.ґ 1’
- Rohwer K., Bliss D., Savik K. Continence associated dermatitis in community-dwelling individuals with fecal incontinence. J Wound Ostomy Continence Nurs. 2013. Vol. 40, Iss. 2. P. 181–184.
- Schliemann S., Petri M., Elsner P. Preventing irritant contact dermatitis with protective creams: influence of the application dose. Contact Dermatitis. Vol. 70, Iss. 1. P. 19–26.
- Skin protectants made of curable polymers: effect of application on local skin temperature / M. Walt, N. Atwood, S. Bernatchez et al. Advances in Wound Care. 2017. Vol. 6, Iss. 4. P. 109–114.
- Southgate G., Bradbury S. Management of incontinence-associated dermatitis with a skin barrier protectant. British Journal of Nursing. 2016. Vol. 25, Iss. 9. P. 820–829.
- Stoffel J., Bernatchez S. Effect on microbial growth of a new skin protectant formulation. Adv Wound Care (New Rochelle). Vol. 6, Iss. 3. P. 73–79.
- Superficial mycoses associated with diaper dermatitis / A. Bonifaz, R. Rojas, A. Tirado-Sanchez et al. Mycopathologia. 2016. Vol. 181. P. 671–679.
- Systematic review of descriptive studies that investigated associated factors with the management of incontinence in older people in care homes / B. Roe, L. Flanagan, B. Jack et al. Int J Older People Nurs. 2013. Vol. 8. P. 29–49.
- The Ghent Global IAD Categorisation Tool (GLOBIAD) / D. Beeckman, K. Van den Bussche, P. Alves et al. Ghent University, 2017. 7 p. URL://users.ugent.be/~dibeeckm/globiadnl/nlv1.0.pdf.
- The Ghent Global IAD Monitoring Tool (GLOBIAM) to monitor the healing of incontinence-associated dermatitis (IAD): design and reliability study / K. Van den Bussche, S. Verhaeghe, A. Van Hecke, D. Beeckman. Int Wound J. Vol. 15, Iss. 4. P. 555–564.
- The incontinence-associated dermatitis and its severity instrument development and validation / K. Borchert, D. Bliss, K. Savik, D. Radosevich. Journal of Wound, Ostomy and Continence Nursing. 2010. Vol. 37, Iss. 5. P. 527–535.
- The inter-rater reliability of the incontinence-associated dermatitis intervention tool-D (IADIT-D) between two independent registered nurses of nursing home residents in long-term care facilities / B. Braunschmidt, G. Müller, M. Jukic-Puntigam, A. Steininger. J Nurs Meas. Vol. 21, Iss. 2. P. 284–295.
- The prevalence of incontinence-associated dermatitis in a South African sample: The impact of a preventative protocol / A. Fourie, I. Toit, V. Pettit et al. Wound Healing Southern Africa. 2016. Vol. 9, Iss. 2. P. 6–10.
- The role of Candida spp. contamination and efficacy of camphorated oil in skin care of incontinent associated dermatitis patients / I. Kohut, S. Galnykina, M. Kushynska et al. Pol Med J. 2020. Vol. XLVIII, Iss. 284. P. 35–39.
- The vulvar skin microenvironment: influence of different panty liners on temperature, pH and microflora / B. Runeman, G. Rybo, U. Forsgren-Brusk et al. Acta Derm Venereol. Vol. 84, Iss. 4. P. 277–284.
- Tirillini , Velasquez E., Pellegrino R. Chemical composition and antimicrobial activity of essential oil of Piper angustifolium. Planta Med. 1996. Vol. 62, Iss. 4. P. 372–373.
- Towards an international language for Incontinence-Associated Dermatitis (IAD): design and evaluation of psychometric properties of the Ghent Global IAD Categorisation Tool (GLOBIAD) in 30 countries / D. Beeckman, K. Van den Bussche, P. Alves et al. Br J Dermatol. Vol. 178, Iss. 6. P. 1331–1340.
- Van L., Harting M., Rosen T. Jacquet erosive diaper dermatitis: a complication of adult urinary incontinence. Cutis. 2008. Vol. 82. P. 72–74.
- van Wissen K., Blanchard D. Preventing and treating incontinence-associated dermatitis in adults. British Journal of Community Nursing. 2019. Vol. 24, Iss. 1. P. 32–33.
- Voegeli D. Moisture-associated skin damage: an overview for community nurses. British Journal of Community Nursing. 2013. Vol. 18, Iss. 1. P. 6–12.
- Warner R., Stone K., Boissy Y. Hydration disrupts human stratum corneum ultrastructure. Invest. Dermatol. 2003. Vol. 120, Iss. 2. P. 275–284.
- Wilson M. Incontinence-associated dermatitis from a urinary incontinence perspective. Br J Nurs. Vol. 27, Iss. 9. P. S4–S17.
- Woo K. Health economic benefits of cyanoacrylate skin protectants in the management of superficial skin lesions. International Wound Journal. 2014. Vol. 11, Iss. 4. P. 431–437.
- Woo K., Beeckman D., Chakravarthy D. Management of Moisture-Associated Skin Damage: A Scoping Review. Adv Skin Wound Care. Vol. 30, Iss. 11. P. 494–501.
- Yates A. Preventing skin damage and incontinence-associated dermatitis in older people. British Journal of Nursing. 2018. Vol. 27, Iss. 2. P. 76–77.
- Zuccarini P. Camphor: risks and benefits of a widely used natural product. Appl. Sci. Environ. Manage. 2009. Vol. 13, Iss.2. P. 69–74.
- Zulkowski K. Diagnosing and Treating Moisture-Associated Skin Damage. Skin. Wound Care. 2012. Vol. 25, Iss. 5. P. 231–236.
ДОДАТОК А
ДОЗВІЛ НА ВИКОРИСТАННЯ І ПЕРЕКЛАД ІНСТРУМЕНТА IAD-IT
ДОДАТОК Б
ДОЗВІЛ НА ВИКОРИСТАННЯ І ПЕРЕКЛАД ІНСТРУМЕНТА GLOBIAD
ДОДАТОК В
ІНСТРУКЦІЯ ДЛЯ МЕДИЧНОГО ЗАСТОСУВАННЯ ЛІКАРСЬКОГО ЗАСОБУ «КАМФОРНА ОЛІЯ»
Склад лікарського засобу:
діюча речовина:
1 мл розчину містить камфори рацемічної 0,1 г;
допоміжна речовина: олія соняшникова.
Лікарська форма.
Розчин олійний 10 %, нашкірний.
Основні фізико-хімічні властивості: прозора масляниста рідина жовтого кольору із запахом камфори.
Фармакотерапевтична група.
Засоби, що застосовують місцево при суглобовому та м`язовому болю. Код АТХ М02А Х10.
Фармакологічні властивості.
Фармакодинаміка.
Камфорна олія при місцевому застосуванні чинить протимікробну, протизапальну, відволікаючу, знеболювальну дію та усуває свербіж шкіри. Ці властивості зумовлені наявністю у молекулі камфори функціонально активної молекули кисню, яка має високий окиснювальний потенціал, порушує клітинні мембрани мікроорганізмів, руйнує багато активних сполук, що спричиняють запалення, біль і подразнення чутливих рецепторів шкіри.
Фармакокінетика.
Не вивчалася.
Клінічні характеристики.
Показання.
Призначати при ревматизмі, артритах, артралгії, міозитах, міалгії, ішіасі, шкірному свербежі.
Протипоказання.
Бронхіальна астма, пошкодження шкіри при опіках, порушення цілісності шкіри, гнійничкові захворювання шкіри в місці застосування препарату. Підвищена індивідуальна чутливість до компонентів препарату.
Особливі заходи безпеки.
Тільки для зовнішнього застосування. Уникати контакту препарату з очима, слизовими оболонками та відкритими ранами. Не втирати у ніздрі. У поодиноких випадках можливі алергічні реакції. У разі появи таких реакцій потрібно припинити застосування препарату і змити його залишки з місць нанесення теплою водою з милом.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Взаємодія поки що невідома.
Особливості застосування.
Застосування у період вагітності або годування груддю.
Застосовувати з урахуванням співвідношення користь для жінки/ризик для плода (дитини), яке визначає лікар.
Здатність впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Не досліджувалася.
Спосіб застосування та дози.
Камфорну олію застосовувати зовнішньо дорослим як самостійно, так і в комбінації з метилсаліцилатом, скипидаром та іншими лікарськими засобами для місцевого застосування. Застосовувати зовнішньо для розтирання і компресів при зазначених патологічних процесах. Спосіб застосування, кількість аплікацій, тривалість однієї аплікації зумовлені характером захворювання, його вираженістю, характером супутньої терапії.
Діти.
Не застосовувати дітям через відсутність клінічного досвіду.
Передозування.
Можливе посилення проявів побічних реакцій, відчуття сильного тепла та печіння.
При випадковому потраплянні внутрішньо можливі біль у животі, нудота, блювання, діарея, симптоми пригнічення центральної нервової системи, запаморочення, атаксія, судоми, припливи, сонливість, утруднення дихання.
Побічні реакції.
З боку шкіри: алергічні реакції, включаючи шкірні висипання, кропив’янку, свербіж, подразнення шкіри, почервоніння, дерматит, включаючи контактний дерматит.
З боку нервової системи: судоми.
З боку системи дихання: бронхоспазм.
Термін придатності. 2 роки.
Умови зберігання.
Зберігати в оригінальній упаковці, при температурі не вище 25 оС.
Зберігати у недоступному для дітей місці.
Упаковка.
По 30 мл у флаконах.
Категорія відпуску. Без рецепта.
Виробник.
ПРАТ «ФІТОФАРМ».
Місцезнаходження виробника та його адреса місця провадження діяльності.
Україна, 84500, Донецька обл., м. Бахмут, вул. Сибірцева, 2.
Заявник.
ПРАТ «ФІТОФАРМ».
Місцезнаходження заявника.
Україна, 02152, м. Київ, проспект Павла Тичини, будинок 1В, офіс А 504.
ДОДАТОК Г
ВИТЯГ З «ДЕРЖАВНОГО РЕЄСТРУ ЛІКАРСЬКИХ ЗАСОБІВ УКРАЇНИ»
|
ДОДАТОК Д
АКТИ ВПРОВАДЖЕННЯ


 ДОДАТОК Е
ДОДАТОК Е
СПИСОК ПУБЛІКАЦІЙ ЗА ТЕМОЮ ДИСЕРТАЦІЇ ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ ДИСЕРТАЦІЇ
Список публікацій за темою дисертації:
- Галникіна С.О., Когут І.Й. Дерматит, асоційований з нетриманням фізіологічних відправлень – новий підхід до «старої» проблеми. Український журнал дерматології, венерології, косметології. 2016. № 1 (60). С. 87–92.
- Когут І.Й., Галникіна С.О. Визначення ефективності лікування дерматиту, асоційованого з нетриманням фізіологічних відправлень за допомогою IADS і IAD-IT. Журнал дерматовенерології та косметології ім. М.О.Торсуєва. 2017. №. 2 (38). С. 98–101.
- Когут І.Й., Галникіна С.О. Застосування категоризаційного інструмента GLOBIAD для моніторингу дерматиту, асоційованого з нетриманням. Український журнал дерматології, венерології, косметології. 2018. № 3. С. 110–114.
- Когут І.Й., Галникіна С.О. Застосування оцінювальних інструментів IADS і IAD-IT при дерматиті, асоційованому з нетриманням відправлень. Ліки України плюс. 2018. № 1. С. 27–31.
- Когут І.Й., Галникіна С.О. Клініко-економічна ефективність застосування камфорної олії при дерматиті, асоційованому з нетриманням. Вісник соціальної гігієни та організації охорони здоров’я України. 2018. № 4 (78). С. 69–74.
- Kohut I., Galnykina S. The efficacy of topical camphorated oil in long-term care of residents with incontinence-associated dermatitis. Dermatology Review/Przegląd Dermatologiczny. 2019. Vol. 106, Iss. 6. P. 683–686.
- The role of Candida spp. contamination and efficacy of camphorated oil in skin care of incontinent associated dermatitis patients / I. Kohut, S. Galnykina, M. Kushynska et al. Pol Med J. 2020. Vol.XLVIII, Iss. P. 35–39. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку лабораторних даних та підотовку статті до друку).
- Пат. на корисну модель 107279 UA, МПК A61K 31/125, A61P 17/00, A61F 13/47, A61L 15/16. Спосіб лікування контактного дерматиту, асоційованого з нетриманням фізіологічних відправлень / С.О. Галникіна, І.Й. Когут, А.В. Павлишин; заявник і патентовласник ДВНЗ «Тернопільський державний медичний університет ім. І.Я.Горбачевського МОЗ України». № u201512640; заявл. 21.12.15; опубл. 25.05.16, Бюл. № 10. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та розроблено методику запропонованого способу лікування).
- Когут І.Й. Особливості вторинного інфікування поверхні шкіри у хворих на асоційований з нетриманням дерматит. Інфекційні хвороби: поступи і проблеми в діагностиці, терапії і профілактиці: Матеріали ІХ з’їзду інфекціоністів України. м. Тернопіль, 7–9 жовтня 2015 р. Тернопіль : Укрмедкнига, 2015. С. 252–253.
- Галникіна С.О., Когут І.Й., Павлишин А.В. Лікування контактного дерматиту асоційованого з нетриманням фізіологічних відправлень. Zbior artykulow naukowych konferencji miedzynarodnowej naukowo-praktycnej „Osiagniecia naukowe, rozwoj, propozyciye na rok 2015” (30.12.2015 – 03.01.2016). Warszawa: Sp. Z.o.o. „Diamond trading tour”, 2015. P. 45–47. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено узагальнення результатів).
- Когут І.Й. Порівняння ефективності препарату «Камфорна Олія» у лікуванні дерматиту, асоційованому з нетриманням фізіологічних відправлень. Дерматовенерологія. Косметологія. Сексопатологія. 2016. № 3–4. С. 47–48.
- Когут І.Й. Догляд за шкірою при дерматиті, асоційованому з нетриманням відправлень у хронічних хворих. Сучасні підходи до формування клінічних настанов з діагностики і лікування шкірних захворювань та інфекцій, що передаються статевим шляхом: європейський досвід та українські реалії: Всеукраїнська науково-практична конференція Української асоціації лікарів-дерматовенерологів і косметологів. м. Тернопіль, 19–20 жовтня 2016 р. Український журнал дерматології, венерології, косметології. 2016. № 4. С. 122–123.
- Kohut I., Galnykina S. Application of “Camphor Oil” medication in management of incontinence associated dermatitis. 2nd international transcaucasus congress on photodermatology and skin cancer; 2016 Oct 27–29, Tbilisi, Georgia. Tbilisi : ITC, 2016. P. 56.
- Когут І.Й., Галникіна С.О. Застосування діагностичних методик IADS і IAD-IT при дерматиті, асоційованому з нетриманням випорожнень. Здобутки клінічної та експериментальної медицини: матеріали підсумкової науково-практичної конференції, присвяченої 60-річчю ТДМУ. м. Тернопіль, 14 червня 2017 р. Тернопіль : ТДМУ, 2017. С. 55–57.
- Когут І.Й., Галникіна С.О. Супутня інфекція Candida spp. при дерматиті, асоційованому з нетриманням. Здобутки клінічної та експериментальної медицини: матеріали підсумкової науково-практичної конференції. м. Тернопіль, 6 червня 2018 р. Тернопіль : ТДМУ, 2018. С. 36–37.
- Когут І.Й., Галникіна С.О. Моніторинг перебігу дерматиту, асоційованого з нетриманням, за допомогою категоризаційного інструмента GLOBIAD. XVII конгрес світової федерації українських лікарських товариств: матеріали наукового симпозіуму. м. Тернопіль, 20 вересня 2018 р. Тернопіль : ТДМУ, 2018. С.176.
- Kohut I. Topical camphorated oil in incontinence-associated dermatitis. IDEA Congress 2019, 24-28 April 2019, Istanbul, Turkey. Istanbul : IDEA, 2019. P. 26.
- Когут І.Й., Галникіна С.О. Клініко-економічне обґрунтування застосування камфорної олії при дерматиті, асоційованому з нетриманням. Здобутки клінічної та експериментальної медицини: матеріали підсумкової LXII наук.-практ. конф., присвяченої 165-річчю від дня народження Івана Яковича Горбачевського, м. Тернопіль, 13 черв. 2019 р. Тернопіль : ТНМУ, 2019. С. 16–17.
Відомості про апробацію результатів дисертації:
- Підсумкова науково-практична конференція, присвячена 60-річчю Тернопільського державного медичного університету «Здобутки клінічної та експериментальної медицини», м. Тернопіль, 14 червня 2017 р., усна доповідь: Когут І.Й., Галникіна С.О. «Застосування діагностичних методик IADS і IAD-IT при дерматиті, асоційованому з нетриманням випорожнень».
- Підсумкова науково-практична конференція «Здобутки клінічної та експериментальної медицини», м. Тернопіль, 6 червня 2018 р., усна доповідь: Когут І.Й., Галникіна С.О. «Супутня інфекція Candida spp. при дерматиті, асоційованому з нетриманням».
- Науковий симпозіум «XVII конгрес світової федерації українських лікарських товариств», м. Тернопіль, 20 вересня 2018 р., усна доповідь: КогутІ.Й., Галникіна С.О. «Моніторинг перебігу дерматиту, асоційованого з нетриманням, за допомогою категоризаційного інструмента GLOBIAD».
- Підсумкова LXII науково-практична конференція «Здобутки клінічної та експериментальної медицини, присвячена 165-річчю від дня народження Івана Яковича Горбачевського», м. Тернопіль, 13 червня 2019 р., усна доповідь: Когут І.Й., Галникіна С.О. «Клініко-економічне обґрунтування застосування камфорної олії при дерматиті, асоційованому з нетриманням».
- Congress of International Dermatology, Dermatopathology and Esthetics Academy «IDEACongress2019», м. Стамбул, 24 – 28 квітня 2019 р., усна доповідь: Kohut I. «Topical Camphorated Oil in Incontinence-Associated Dermatitis».