РОЗДІЛ 5
ПАТОГЕНЕТИЧНА КОМБІНОВАНА ТЕРАПІЯ ХВОРИХ НА ОНІХОМІКОЗ З ВИКОРИСТАННЯМ ПРОТИГРИБКОВИХ І АНГІОПРОТЕКТОРНИХ ПРЕПАРАТІВ
5.1 Розробка патогенетичної комбінованої терапії хворих на оніхомікоз
Враховуючи отримані дані щодо модифікованих факторів, які за даними мультиваріантного регресійного аналізу в найбільшій мірі впливають на збільшення тривалості терапії, було вирішено дослідити ефективність комбінованого лікування.
З тих пацієнтів, які знаходилися під спостереженням, комбіновану терапію, котра включала призначення системних та/або місцевих протигрибкових препаратів та засобів для корекції мікроциркуляторних порушень з урахуванням індивідуальних особливостей хворих, отримували 76 хворих на оніхомікоз. Ці пацієнти увійшли в основну групу, тоді як 49 пацієнтів, які спостерігалися на попередньому етапі дослідження, склали контрольну групу.
Після оцінки стану кровообігу нігтьового ложа методом лазерної допплерівської флоуметрії 43 пацієнтам основної групи з порушенням мікроциркуляції був диференційовано призначений лікарський засіб з урахуванням виявленого гемодинамічного типу мікроциркуляції. Так, 25 (58,1 %) пацієнтам із спастичним гемодинамічним типом мікроциркуляції був призначений нафтидрофурил гідроген оксалат (енелбін) дозою 100–200 мг на добу, 4 (9,3 %) хворих із гіперемічним типом мікроциркуляції – діосмін/гесперидин у добовій дозі 2 таблетки на добу (у два прийоми).
14 (32,6 %) хворих із застійно-стазичним типом мікроциркуляції отримували нафтидрофурил гідроген оксалат в комплексі з діосмін/гесперидином у вище зазначених дозах. Тривалість корекційної програми складала 3 місяці.
Окремі характеристики основної та контрольної груп представлено в таблиці 5.1.
Таблиця 5.1 – Деякі характеристики досліджуваних груп
| Показник | Контрольна група (n=49) | Основна група (n=76) |
| 1 | 2 | 3 |
| Стать, n (%):
Чоловіки Жінки |
20 (40,8)
29 (59,2) |
20 (26,3)
56 (73,7) |
| Вік, М ± σ (роки) | 51,1 ± 16,15 | 44,12 ± 11,57 * |
| Тривалість захворювання, М ± σ (роки) | 2,8 ± 4,88 | 3,09 ± 5,3 |
| Локалізація грибкового ураження, n (%):
кисті стопи кисті та стопи |
13 (26,5)
22 (44,9) 14 (28,6) |
35 (46,1)
11 (14,5) 30 (39,5) |
| Кількість уражених нігтів, n (%):
1-2 > 2 |
11 (22,4)
38 (77,6) |
18 (23,7)
58 (76,3) |
| Локалізація ураження, n (%):
ІІ–V пальці руки І палець руки або ІІ–V пальці ноги І палець ноги |
5 (10,2)
9 (18,4) 35 (71,4) |
4 (5,3)
26 (34,2) 46 (60,5) |
| Клінічна форма ураження, n (%):
біла поверхнева дистально-латеральна проксимальна |
8 (16,3)
40 (81,6) 1 (2) |
4 (5,3)
71 (93,4) 1 (1,3) |
Продовження таблиці 5.1
| 1 | 2 | 3 |
| Глибина пошкодження нігтьової пластини, n (%):
до 1/3 довжини від 1/3 до 2/3 довжини > 2/3 довжини |
8 (16,3)
21 (42,9) 20 (40,8) |
12 (15,8)
37 (48,7) 27 (35,5) |
| Вираженість піднігтьового гіперкератозу, n (%):
немає або слабко виражений помірний (< 2 мм) виражений (> 2 мм) |
11 (22,4)
23 (46,9) 15 (30,6) |
15 (19,7)
41 (53,9) 20 (26,3) |
| Індекс КІОТОС, М ± σ (бали) | 16,4 ± 9,54 | 13,29 ± 8,12 |
Примітка. У таблиці наведено середні арифметичні значення досліджуваних показників (M) і середні квадратичні відхилення (σ).
Як видно з таблиці 5.1, за виключенням середнього віку хворих, який був достовірно вищим у контрольній групі хворих (р=0,01), групи порівняння виявилися гомогенними за переважною більшістю клініко-демографічних показників зокрема, не встановлено значущих відмінностей між локалізацією грибкового ураження, площею, формою ураження нігтів, вираженістю піднігтьового гіперкератозу та середнім значенням індексу КІОТОС (р>0,05).
Попереднє лікування хворих на оніхомікоз отримували 22 (28,9 %) хворих в основній групі та 17 (34,7 %) в контрольній (р=0,498), з них: у 19 та 16 пацієнтів відповідно призначена терапія виявилася неефективною, решти 3 та 1 розвинувся рецидив захворювання або повторне інфікування.
Соматичні коморбідні захворювання та стани були виявлені у 50 (65,8 %) досліджуваних пацієнтів основної групи, що достовірно не відрізнялося від аналогічного показника контрольної групи (61,2 %; р=0,33).
До початку лікування у переважної більшості хворих обох груп довжина неуражених патологічним міцелієм нігтьових пластинок була від 0,4 до 0,7 см, а саме: у 66 (71,0 %) хворих основної групи та у 18 (19,3 %) хворих контрольної групи (табл. 5.2). При цьому середня довжина нігтьової пластинки без клінічних ознак оніхомікозу (зміна кольору, структури тощо) в групах порівняння достовірно не відрізнялася ([0,42 ± 0,22] см у хворих основної групи та (0,49 ± 0,2) см в контрольній групі; р=0,3057). Цікаво, що у хворих з наявними мікроциркуляторними розладами довжина неуражених міцелієм нігтьових пластинок була достовірно меншою, ніж у хворих без порушень мікроциркуляції в уражених кінцівках ([0,4 ± 0,18] см проти (0,51 ± 0,23) см відповідно; р=0,005).
Таблиця 5.2 – Розподіл хворих в залежності від довжини нігтьових пластинок без клінічних ознак оніхомікозу на початку лікування
| Довжина неуражених міцелієм нігтьових пластинок, см | Контрольна група (n=49) | Основна група (n=76) |
| абс. (%) | абс. (%) | |
| 0-0,3 | 5 (10,2) | 7 (9,2) |
| 0,4-0,7 | 33 (67,3) | 54 (70,1) |
| 0,8-1,0 | 11 (22,4) | 15 (19,7) |
5.2 Порівняльний аналіз результатів комбінованого лікування хворих на оніхомікоз
Спостереження та лікування хворих проводили в середньому впродовж (10,69 ± 3,84) тижня (від 6 до 18 тижнів). Для оцінки ефективності досліджуваного комбінованого лікування застосовували результати клінічних і мікологічних досліджень. Клінічна оцінка методу включала оцінку скарг, динаміки об’єктивних проявів захворювання, строків відростання уражених нігтьових пластин, мікологічна ефективність – елімінацію грибів.
Повний регрес клінічних ознак через 8 тижнів зареєстровано у 71 (93,4 %) з 76 хворих основної групи та у 38 (77,6 %) з 49 пацієнтів контрольної групи (р=0,010).
Збереження клінічної маніфестації оніхомікозу у 8 (16,3 %) пацієнтів контрольної групи через 8 тижнів лікування можна пояснити наявністю на тлі існуючої коморбідної патології, зокрема, варикозної хвороби нижніх кінцівок у 5 хворих, цукрового діабету у 3 хворих, розладів мікроциркуляції у периферичних судинах нижніх кінцівок, котрі істотно зменшують біодоступність антимікотика. У решти 2 (4,1 %) пацієнтів контрольної групи мали місце розлади мікроциркуляції на тлі тривалого існування грибкової інфекції та у 1 (2 %) хворого з ураженням 2–3 нігтьових пластин по гіпертрофічному типу в сполученні з мікозом стоп. Водночас неповний регрес симптомів у 4 (5,3 %) хворих основної групи вірогідно був обумовлений тривалістю існуючого оніхомікозу (12–14 років) та у 1 (1,3 %) пацієнта був врослий ніготь, що підтримувало больовий синдром. У цих хворих за даними допплерівської флоуметрії порушення мікроциркуляції на момент обстеження були відсутніми.
На 10-му тижні лікування повний регрес клінічних ознак захворювання зафіксовано у всіх 76 хворих основної групи, тоді як в контрольній групі регрес симптомів до 10-го тижня лікування відбулося у 46 (93,9 %) хворих, а у решти 3 (6,1 %) пацієнтів цієї групи мав місце неповний регрес клінічних проявів.
Швидкість відростання уражених нігтьових пластин в ділянці кистей та стоп у досліджуваних пацієнтів із оніхомікозом, які отримували лікарські засоби для корекції мікроциркуляторних порушень, значно перевищувала таку в групі хворих із відсутністю терапії, спрямованої на ліквідацію розладів капілярного кровообігу (табл. 5.3).
Як видно з таблиці 5.3, впродовж перших 2-х тижнів спостереження змін у довжині нігтьових пластинок у пацієнтів контрольної групи не було. Лише у пацієнтів основної групи з’ясовано наявність незначного приросту уражених нігтьових пластин в ділянці кистей в середньому на (0,02 ± 0,04) см.
Таблиця 5.3 – Порівняльна характеристика середньої швидкості росту нігтьових пластинок у хворих на оніхомікоз кистей та стоп в групах порівняння
| Локалізація | Строки спостереження, тижні | Швидкість росту нігтьових пластинок (М ± σ), см | Значення
tst |
|
| Контрольна група (n=13) | Основна
група (n=35) |
|||
| Кисті | 2 тиждень | 0 | 0,02 ± 0,04 | 2,652 |
| 4 тиждень | 0,05 ± 0,07 | 0,13 ± 0,09 | 2,759 | |
| 6 тиждень | 0,13 ± 0,14 | 0,23 ± 0,14* | 2,091 | |
| 8 тиждень | 0,13 ± 0,3 | 0,29 ± 0,15* | 2,513 | |
| 10 тиждень | 0,17 ± 0,11 | 0,28 ± 0,07** | 3,697 | |
| 12 тиждень | 0,15 ± 0,06 | 0,29 ± 0,09** | 5,346 | |
| Стопи | Контрольна група (n=36) | Основна
група (n=41) |
||
| 2 тиждень | 0 | 0 | – | |
| 4 тиждень | 0,05 ± 0,03 | 0,09 ± 0,08 | 2,959 | |
| 6 тиждень | 0,11 ± 0,13 | 0,26 ± 0,13** | 4,967 | |
| 8 тиждень | 0,14 ± 0,26 | 0,24 ± 0,13* | 2,078 | |
| 10 тиждень | 0,1 ± 0,04 | 0,21 ± 0,08** | 7,719 | |
| 12 тиждень | 0,12 ± 0,01 | 0,25 ± 0,09** | 8,034 | |
Примітки:
- * – рівень значущості відмінностей показників порівняно з контрольною групою p<0,05;
- ** – рівень значущості відмінностей показників порівняно з контрольною групою p<0,01.
На 4-му тижні спостереження та лікування у пацієнтів основної групи середня швидкість росту нігтьових пластинок кистей склала (0,13 ± 0,09) см, стоп – (0,09 ± 0,08) см, що було в 2,6 та 1,8 рази більше, ніж у хворих контрольної групи (відповідно: (0,05 ± 0,07) см та (0,05 ± 0,03) см; р=0,008 та р=0,004).
На 6-му тижні лікування у пацієнтів основної групи показник приросту нігтьових пластинок кистей склав (0,23 ± 0,14) см, стоп – (0,26 ± 0,13) см, що в 1,7 та 2,4 разу перевищувало показник приросту у хворих контрольної групи (відповідно: (0,13 ± 0,14) см та (0,11 ± 0,13) см; р=0,042 та р<0,001).
У процесі лікування на 8-му тижні середній приріст нігтів кистей у хворих основної групи склав (0,29 ± 0,15) см, стоп – (0,24 ± 0,13) см, що було в 2,2 та 1,7 разу більше за аналогічнічні показники хворих контрольної групи ([0,13 ± 0,3] см та [0,14 ± 0,26] см відповідно; р=0,016 та р=0,041).
Впродовж 10 тижнів лікування швидкість відростання нігтьових пластинок була також достовірно вищою у хворих основної групи: середній приріст нігтів кистей склав (0,28 ± 0,07) см, стоп – (0,21 ± 0,08) см проти (0,17 ± 0,11) та (0,10 ± 0,04) см хворих контрольної групи (р=0,002).
Виявлена тенденція більш швидкого відростання уражених нігтьових пластин в ділянці кистей та стоп у процесі саногенезу у пацієнтів основної групи, яким проводилась корекція мікроциркуляторних порушень, зберігалася до 12 тижня лікування. Так, на 12-му тижні по завершенні лікування у пацієнтів основної групи середній приріст нігтів кистей склав (0,29 ± 0,09) см, стоп – (0,25 ± 0,09) см, що було в 1,9 та 2 рази більше за відповідні показники пацієнтів контрольної групи ([0,15 ± 0,06] см та [0,12 ± 0,01] см відповідно; р<0,001).
Динаміка відростання нігтьових пластинок кистей та стоп у хворих в групах порівняння представлена в таблиці 5.4, а її графічне зображення – на рисунках 5.1 та 5.2.
Згідно даних таблиці 5.4, динаміка відростання нігтьових пластинок кистей та стоп мала позитивну тенденцію до росту у пацієнтів обох груп.
Проте, звертає увагу, що, починаючи з 8 тижня у хворих на оніхомікоз кистей та з 6 тижня у хворих з грибковим ураження стоп, середні значення довжини нігтів в основній групі були достовірно більшими, ніж у в контрольній. Крім цього у переважної більшості пацієнтів основної групи до 4–6 тижня лікування нігтьові пластини набували нормотрофічної структури, особливо у хворих з грибковим ураження кистей. В зв’язку з чим на даному етапі хворих на оніхомікоз кистей завершували призначену лікувальну програму.
Таблиця 5.4 – Порівняльна характеристика середньої довжини нігтьових пластинок у хворих на оніхомікоз кистей та стоп
| Локалізація | Строки спостереження, тижні | Середнє значення довжини нігтя (М ± σ), см | Значення
tst |
|
| Контрольна група (n=13) | Основна
група (n=35) |
|||
| Кисті | Вихідне | 0,52 ± 0,25 | 0,41 ± 0,23 | 1,370 |
| 2 тиждень | 0,52 ± 0,25 | 0,43 ± 0,23 | 1,127 | |
| 4 тиждень | 0,57 ± 0,29 | 0,55 ± 0,24 | 0,162 | |
| 6 тиждень | 0,69 ± 0,27 | 0,79 ± 0,22 | 1,082 | |
| 8 тиждень | 0,83 ± 0,43 | 1,08 ± 0,14** | 3,005 | |
| 10 тиждень | 0,99 ± 0,39 | 1,36 ± 0,15** | 4,759 | |
| 12 тиждень | 1,14 ± 0,37 | 1,65 ± 0,14** | 6,903 | |
| Стопи | Контрольна група (n=36) | Основна
група (n=41) |
||
| Вихідне | 0,48 ± 0,18 | 0,42 ± 0,21 | 1,354 | |
| 2 тиждень | 0,48 ± 0,18 | 0,42 ± 0,21 | 1,354 | |
| 4 тиждень | 0,53 ± 0,19 | 0,51 ± 0,2 | 0,427 | |
| 6 тиждень | 0,65 ± 0,21 | 0,77 ± 0,22* | 2,636 | |
| 8 тиждень | 0,79 ± 0,32 | 1,02 ± 0,27** | 3,384 | |
| 10 тиждень | 0,89 ± 0,3 | 1,23 ± 0,22** | 5,692 | |
| 12 тиждень | 1,01 ± 0,30 | 1,47 ± 0,25** | 7,346 | |
Примітки:
- * – рівень значущості відмінностей показників порівняно з контрольною групою p<0,05;
- ** – рівень значущості відмінностей показників порівняно з контрольною групою p<0,01.
Як видно з рисунку 5.1, впродовж 8-го тижня лікування у пацієнтів основної групи з оніхомікозом кистей середне значення довжини нігтя склало (1,08 ± 0,14) см, на 10-му тижні – (1,36 ± 0,15) см, на 12-му – (1,65 ± 0,14) см, що було достовірно більше за відповідні середні показники хворих контрольної групи (відповідно: (0,83 ± 0,43), (0,99 ± 0,39) та (1,14 ± 0,37) см), р<0,01.
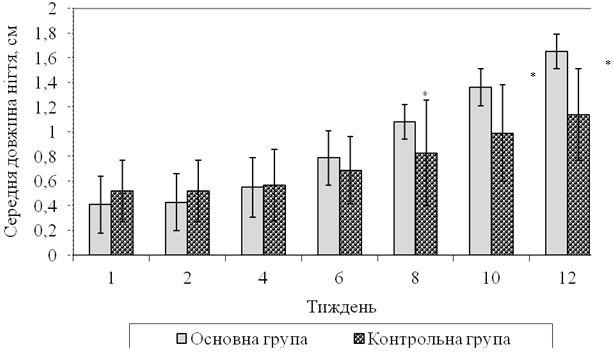
Рисунок 5.1 – Динаміка відростання уражених нігтьових пластин в ділянці кистей у хворих на оніхомікоз контрольної (n=13) та основної (n=35) груп.
На рисунку 5.2 видно, що динаміка відростання нігтьових пластинок у процесі саногенезу у хворих основної групи на оніхомікоз кистей також достовірно відрізнялася. Середнє значення довжини нігтів стопи склало на 6-му тижні (0,77 ± 0,22) см, на 8-му – (1,02 ± 0,27) см, на 10-му – (1,23 ± 0,22) см та на 12-му – (1,47 ± 0,25) см проти відповідно (0,65 ± 0,21), (0,79 ± 0,32), (0,89 ± 0,3) та (1,01 ± 0,30) см в контрольній групі; р<0,01.
Таким чином, аналіз отриманих даних показав, що у пацієнтів основної групи, яким проводилась диференційована корекція мікроциркуляторних порушень, швидкість відростання нігтів кистей майже в 2 разів вища, ніж у пацієнтів контрольної групи ([1,24 ± 0,22] см проти [0,63 ± 0,27] см; р<0,001), середній показник приросту яких становив (0,21 ± 0,11) см/місяць проти (0,11 ± 0,07) см/місяць в контрольній групі (р<0,05). Середня швидкість відростання нігтів стоп у хворих основної групи також була в 2 рази вищою, ніж в контрольній групі ([1,06 ± 0,23] проти [0,53 ± 0,22] см; р<0,001), середній показник приросту склав (0,18 ± 0,11) см/місяць проти (0,09 ± 0,05) см/місяць у контрольній групі (р<0,05).
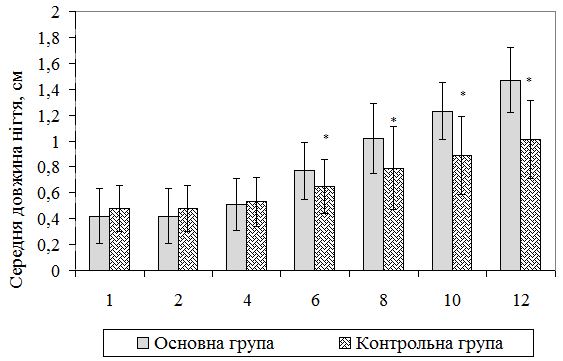
Рисунок 5.2 – Динаміка відростання уражених нігтьових пластин у ділянці стоп у хворих на оніхомікоз контрольної (n=36) та основної (n=41) груп.
При порівнянні кінцевих та початкових показників суб’єктивного комфорту у контрольній групі за допомогою тесту Wilkoxon для двох залежних вибірок виявлено значуще покращення показників шкали оцінки дискомфорту із зменшенням середніх оцінок вираженості останнього з (3,18 ± 1,81) до (1,82 ± 1,55) бала (|z|=5,51; р<0,001). Водночас значущих відмінностей щодо ступеня виразності суб’єктивного дискомфорту за «Шкалою станів» А.Б. Леонової виявлено не було, показники змінилися неістотно: з (51,71 ± 6,83) до (52,12 ± 7,01) бала (|z|=1,277; р=0,202) (рис. 5.3).
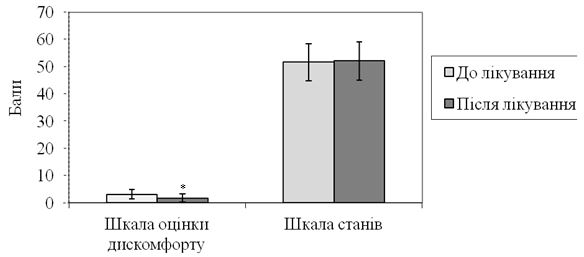
Рисунок 5.3 – Порівняння динаміки показників суб’єктивного комфорту (за шкалою оцінки дискомфорту та «Шкалою станів» А.Б. Леоновой) у хворих на оніхомікоз контрольної групи (n=49).
Застосування госпітальної шкали оцінки тривоги і депресії (HАDS) виявило ефект зниження порушень емоційного стану хворих на оніхомікоз (рис. 5.4).
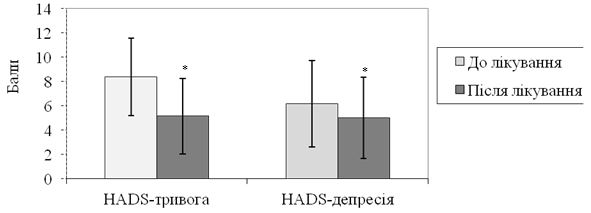
Рисунок 5.4 – Порівняння динаміки тривоги та депресії (за госпітальною шкалою оцінки тривоги і депресії, HADS) у хворих на оніхомікоз контрольної групи (n=49).
Як видно з рисунку 5.4, середні показники тривоги склали на початку терапії (8,37 ± 3,19) бала, після лікування – (5,16 ± 3,12) бала (|z|=6,504; р<0,001), депресії – відповідно (6,18 ± 3,55) та (5,02 ± 3,34) бала (|z|=6,687; р>0,001). Таким чином, по завершенню лікування спостерігалося зниження тривоги / депресії від рівнів субклінічно вираженої тривоги / депресії до нормальних показників.
При порівнянні кінцевих та початкових показників психологічного статусу у групі, котра отримувала медикаментозну корекцію мікроциркуляторних порушень (основна група), також виявлено значущі відмінності в динаміці показників суб’єктивного комфорту, тривоги та депресії (р<0,001). Зведені дані щодо динаміки клініко-психологічних даних в групах порівняння наведені в таблиці 5.5.
Результати обстеження хворих з використанням DLQI показали виразне покращення якості життя після завершення лікування у аналізованих пацієнтів як контрольної, так і основної групи (табл. 5.6).
Як видно з таблиці 5.6, середнє значення DLQI на початку дослідження у пацієнтів контрольної групи було (8,41 ± 9,19) бала, тоді як по завершенню лікування його середнє значення склало (5,2 ± 6,24) бала (|z|=5,89; р<0,001), у хворих основної групи – (8,39 ± 8,38) та (3,05 ± 3,77) бала відповідно ((|z|=7,51; р<0,001).
Звертає увагу, що у хворих контрольної групи найбільш значуще покращення показників якості життя зафіксовано у соціальній активності (|z|=5,69; р<0,001) та впливі оточуючого середовища на якість життя (|z|=5,26; р<0,001). Водночас, при порівнянні кінцевих і початкових показників якості життя в основній групі виявлено достовірні відмінності не тільки щодо соціальної активності (|z|=7,62; р<0,001) та впливу оточуючого середовища на якість життя (|z|=7,77; р<0,001), а й у емоційній сфері (|z|=7,62; р<0,001) (див. табл. 5.6).
Для визначення відмінностей між контрольною групою та основною групою (хворі, котрим здійснювалася корекція мікроциркуляції) проведено розрахунок різниць середніх значень досліджуваних параметрів і їхнє порівняння для двох незалежних вибірок.
Таблиця 5.5 – Порівняння показників суб’єктивного комфорту та психологічного статусу в досліджуваних групах хворих на оніхомікоз, отримані при дослідженнях до та після завершення лікування
| Показник | Група | Значення показників (M ± σ), бали |
Різниця (95 % ДІ) | |
| До лікування | Після лікування | |||
| Оцінка за шкалою дискомфорту | Контрольна | 3,18 ± 1,81 | 1,82 ± 1,55 | 1,37 (1,09,1,65), р<0,001 |
| Основна | 3,26 ± 1,45 | 0,76 ± 0,88 | 2,5 (2,32, 2,68), р<0,001 | |
| Оцінка суб’єктивного комфорту за «Шкалою станів» | Контрольна | 51,71 ± 6,83 | 52,12 ± 7,01 | -0,41 (-0,97, 0,16), р=0,153 |
| Основна | 51,88 ± 7,19 | 54,66 ± 7,28 | -2,78 (-3,23, -2,33), р<0,001 | |
| HADS оцінка тривоги | Контрольна | 8,37 ± 3,19 | 5,16 ± 3,12 | 3,20 (2,88, 3,53), р<0,001 |
| Основна | 8,56 ± 3,29 | 2,86 ± 2,41 | 5,71 (5,07, 6,35) , р<0,001 | |
| HADS оцінка депресії | Контрольна | 6,18 ± 3,55 | 5,02 ± 3,34 | 1,16 (0,97, 1,35), р<0,001 |
| Основна | 5,71 ± 3,04 | 4,28 ± 2,62 | 1,43 (0,85, 2,02), р<0,001 | |
Примітка. У таблиці наведено середні арифметичні значення досліджуваних показників (M) та стандартні квадратичні відхилення (σ).
Таблиця 5.6 – Порівняння оцінок чотирьох сфер якості життя (опитувальник ВООЗ для оцінки якості життя, WHOQOL-BREF) у групах хворих на оніхомікоз до та після завершення лікування
| Сфери якості життя | Група | Значення показників (M ± σ), бали |
Різниця (95 % ДІ) | |
| До лікування | Після лікування | |||
| Фізичне здоров’я | Контрольна | 25,26 ± 2,02 | 25,3 ± 2,04 | -0,04 (-0,1, 0,02), р=0,16 |
| Основна | 24,97 ± 5,81 | 25,03 ± 5,84 | -0,05 (-0,1, -0,001), р=0,05 | |
| Психологічне здоров’я | Контрольна | 22,85 ± 2,29 | 22,91 ± 2,32 | -0,07 (-0,14, 0,01), р=0,083 |
| Основна | 24,84 ± 5,94 | 25,61 ± 6,02 | -0,76 (-0,86, -0,67), р<0,001 | |
| Соціальні відношення | Контрольна | 12,78 ± 1,28 | 14,34 ± 1,59 | -1,57 (-1,82, -1,31), р<0,001 |
| Основна | 12,99 ± 6,19 | 16,07 ± 6,34 | -3,08 (-3,53, -2,62), р<0,001 | |
| Оточуюче середовище | Контрольна | 26,93 ± 1,96 | 28,83 ± 2,24 | -1,89 (-2,26, -1,52), р<0,001 |
| Основна | 26,59 ± 7,01 | 29,01 ± 7,29 | -2,42 (-2,57, -2,27), р<0,001 | |
Примітка. У таблиці наведено середні арифметичні значення досліджуваних показників (M) та стандартні квадратичні відхилення (σ).
Порівнюючи кінцеві й початкові психологічні дані у хворих основної та контрольної груп, отримано значущі відмінності в динаміці зміни показників суб’єктивного комфорту як за шкалою оцінки дискомфорту, так і за «Шкалою станів» А.Б. Леоновой, а також в динаміці зміни вираженості тривоги (р<0,001). Зміни вираженості депресивних розладів були незначущими (р>0,05) (табл. 5.7).
Таблиця 5.7 – Порівняння динаміки показників суб’єктивного комфорту та психологічного статусу між контрольною та основною групами, бали
| Показники | Контрольна група (n=49) | Основна група (n=76) | Значення
tst |
| М±μ різниці | М±μ різниці | ||
| Оцінка за шкалою дискомфорту | -1,37 ± 0,14 | -2,5 ± 0,09** | 7,057 |
| Оцінка суб’єктивного комфорту за «Шкалою станів» | 0,41 ± 0,28 | 2,78 ± 0,23** | -6,564 |
| HADS оцінка тривоги | -3,2 ± 0,16 | -5,71 ± 0,32** | 5,935 |
| HADS оцінка депресії | -1,16 ± 0,09 | -1,43 ± 0,29 | 0,724 |
Примітки:
- У таблиці наведено середні арифметичні значення досліджуваних показників (M) та стандартні помилки середніх (μ);
- ** – рівень значущості відмінностей показників порівняно з контрольною групою p<0,001.
На відміну від контрольної групи, пацієнти основної групи продемонстрували достовірно нижчі показники DLQI на момент завершення лікування ([3,05 ± 3,77] бала проти [5,2 ± 6,24] бала в контрольній групі; р=0,018). Крім цього, під час порівняння середніх значень якості життя, визначених за опитувальником ВООЗ – WHOQOL-BREF по завершенню лікування, встановлено значущі відмінності між групами в емоційній сфері (р=0,001) та соціальної активності (р=0,027) (рис. 5.5).
Таким чином, наведена характеристика матеріалу дає підстави вважати, диференційована корекція мікроциркуляторних порушень в комплексі з антимікотичними засобами достовірно прискорює регрес клінічних проявів захворювання та сприяє збільшенню в 2 рази швидкості відростання нігтів кистей та стоп. Останнє призводить до ліквідації косметичного дефекту, функціональних та психологічних проблем, що ймовірно пояснює відмінності у виразності фізичного й морального дискомфорту, а також якості життя у хворих порівнюваних груп. Отримані дані дозволяють рекомендувати оцінку DLQI у хворих на оніхомікоз в якості критерію ефективності призначеного лікування, а також акцентують увагу на необхідності подальшого вивчення та необхідності корекції факторів, що спричиняють погіршення життя у хворих цієї категорії.
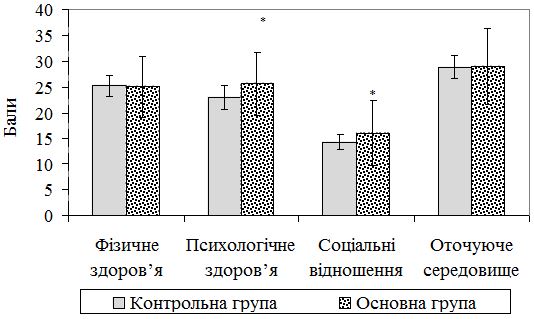
Рисунок 5.5 – Відмінності показників якості життя у хворих на оніхомікоз контрольної (n=49) та основної (n=76) групи.
5.3 Порівняльний аналіз строків мікологічної негативації в процесі лікування
Аналіз динаміки мікологічної негативації впродовж лікування показав, що мікологічна елімінація збудника наставала раніше у хворих, у яких проводилася корекція мікроцироциркуляторних розладів в порівнянні з пацієнтів, яким модуляція мікроциркуляторної дисфунції не проводилась (група контролю).
Середні строки антифунгальної терапії виявилися істотно більшими в контрольній групі хворих на оніхомікоз – (12,45 ± 3,92) проти (9,34 ± 3,24) тижня в основній групі пацієнтів, де проводилась диференційована корекція виявлених за даними лазерної допплерівської флоуметрії мікроциркуляторних порушень (р<0,001). Цей показник набув достовірної різниці за рахунок достовірно швидшого мікологічного виліковування при оніхомікозі стоп, середні строки якого в основній групі склали (11,9 ± 2,1) проти (14,5 ± 2,1) тижня у хворих контрольної групи (р<0,05), тоді як середні строки мікологічної негативації збудника у хворих на оніхомікоз кистей достовірно не відрізнялися і склали (6,34 ± 0,91) тижня в основній групі та (6,77 ± 1,01) тижня в контрольній групі (р>0,05).
При цьому переважна більшість хворих основної групи – 65 (85,5 %) мали мікологічну негативацію до 12-го тижня, тобто на ранніх строках лікування, що було на 40,6 % більше, ніж серед хворих контрольної групи, де на 12-му тижні лікування мікологічна негативація відбулася тільки в 22 (44,9 %) випадках (СШ 7,25; 95 % ДІ: [3,095-16,99], р<0,001) (рис. 5.6). У решти хворих мікологічне виліковування визначалося на 14-му тижні у 14 (28,6 %) хворих контрольної групи та у 9 (11,8 %) пацієнтів основної групи; на 16-му – у 9 (18,4 %) та 2 (2,6 %) хворих відповідно та на 18-му – у 5 (10,2 %) хворих контрольної групи (рис. 5.6).
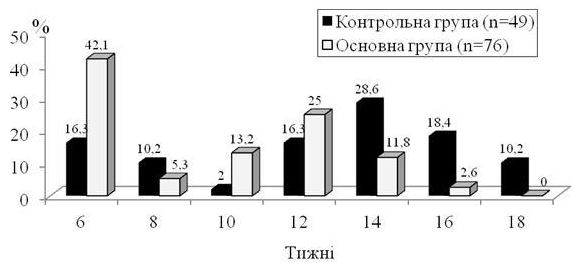
Рисунок 5.6 – Терміни мікологічної негативації серед хворих на оніхомікоз контрольної (n=49) та основної (n=76) груп.
Більші терміни мікологічної негативації у хворих контрольної групи вірогідно пов’язані із існуванням мікроциркуляторних порушень, які за даними літератури підтримують персистування грибкової інфекції. Це припущення підтвердив проведений аналіз строків мікологічної негативації у хворих контрольної групи із співставленням кількості пацієнтів із різними типами порушення мікроциркуляції. Цей аналіз дозволив з’ясувати, що достовірні відмінності між підгрупами хворих відмічаються як при наявних розладах мікроциркуляції в цілому ([13,79 ± 3,24] проти [10,19 ± 3,89] тижня у хворих без розладів мікроциркуляції; р=0,005), так і той факт, що пацієнти з окремими видами мікроциркуляторних порушень мають достовірно вищі строки антифунгальної терапії в порівнянні з тими пацієнтами, у яких був діагностований нормоциркуляторний тип гемодинаміки за даними лазерної допплерівської флоуметрії (рис. 5.7).
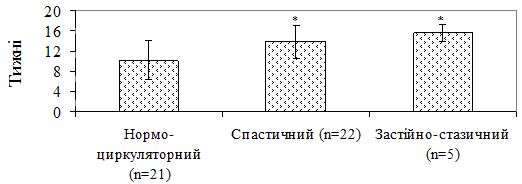
Рисунок 5.7 – Строки мікологічної негативації у хворих на оніхомікоз із мікроциркуляторними порушеннями та хворих на оніхомікоз із нормоциркуляторним типом гемодинаміки.
Як видно за даними рисунку 5.7, строки мікологічної негативації статистично не відрізнялися між групами хворих із спастичним і застійно-стазичним типом гемодинаміки (р=0,251), однак терміни мікологічної елімінації збудника у хворих із спастичними та застійно-стазичними порушеннями мікроциркуляції були достовірно тривалішим у порівнянні з хворих без розладів мікроциркуляції (відповідно: (13,79 ± 3,24) та (15,6 ± 1,67) тижня проти (10,19 ± 3,89) тижня у хворих із нормоциркуляторним типом гемодинаміки; р=0,002 та р<0,001).
З’ясовано, що сповільнене видужування прямо корелює із наявністю мікроциркуляторних розладів (r=0,504; р<0,001), а застійно-стазичний тип порушення мікроциркуляції в найбільшій мірі збільшує терміни мікологічною негативації у хворих на оніхомікоз (р<0,001).
Таким чином, мікологічне одужання визначалося у 74 (97,4 %) хворих основної групи до 14-го тижня, а у 2 (2,6 %) хворих – на 16-му тижні. Клінічне одужання визначено у 72 (94,7 %) хворих цієї групи. Водночас строки антифунгальної терапії в контрольній групі хворих на оніхомікоз, яким не проводилося корекції мікроциркуляторних порушень, були істотно більшими і відповідали 14-ти тіжням у 16 (76,2 %) хворих при оцінці мікологічного виліковування та 16-ти тижням у 42 (85,7 %) при оцінці клінічного одужання.
* * *
Отримані дані дозволяють зробити висновок, що клінічне одужання та елімінація збудників у пацієнтів основної групи, яким проводилася патогенетично обгрунтована корекція діагностованих за даними лазерної допплерівської флоуметрії мікроциркуляторних порушень, відбувалися швидше, ніж у пацієнтів контрольної групи.
Матеріали даного розділу викладені в наступних роботах:
1. Кізіна І. Є. Диференційований підхід до комплексного лікування оніхомікозів із урахуванням коморбідних мікроциркуляторних порушень // Український журнал дерматології, венерології, косметології. 2017. № 1 (64). С. 52-58 [18].
2. Кізіна І. Є. Ефективність терапії хворих на оніхомікоз з використанням протигрибкових і ангіопротекторних препаратів // Дерматологія, косметологія, сексопатологія. 2017. № 1-2 (5). С. 14-19 [19].
3. Кізіна І. Є. Психологічна складова якості життя у хворих з оніхомікозом як критерій ефективності лікування // Дерматологія та венерологія. 2015. № 4. С. 50-57 [22].
РОЗДІЛ 6
ПОЛІМЕРАЗНА ЛАНЦЮГОВА РЕАКЦІЯ ЯК МЕТОД КОНТРОЛЮ ВИЛІКОВНОСТІ ТА ОЦІНКИ РЕЗУЛЬТАТІВ ЛІКУВАННЯ ХВОРИХ НА ОНІХОМІКОЗ
6.1 Строки негативації полімеразної ланцюгової реакції в процесі лікування хворих на оніхомікоз контрольної групи
В контрольній групі хворих для оцінки перебігу та результатів лікування були вивчені строки мікологічної негативації результатів мікроскопії та ПЛР, специфічної до Т. rubrum, та ПЛР із панфунгальними праймерами, а також проведено порівняння можливостей мікроскопії та ПЛР в оцінці ефективності проведеної терапії. Контроль мікологічної негативації проводили, починаючи з 6 тижня лікування і надалі один раз на 2 тижні.
З’ясовано, що у частини пацієнтів негативація мікроскопії та ПЛР відбувалася в різні строки. Так, в контрольній групі у 20 з 28 хворих відбулася негативація обох аналізів: і мікроскопії, і ПЛР, що склало 71,4 %, а у решти 8 (28,6 %) хворих першим негативним виявився результат мікроскопії, тоді як результат ПЛР тесту залишався позитивним. Це відповідно позначилося на строках мікологічної негативації, які за результатами мікроскопії склали в середньому (12,07 ± 3,1) тижня, а за результатами ПЛР, специфічної до Т. rubrum, та ПЛР із панфунгальними праймерами, – (14,21 ± 4,5) тижня (р=0,043).
Оскільки строки мікологічної негативації безперечно залежать від локалізації ураження, було вирішено перевірити отримані висновки щодо можливостей мікроскопії та ПЛР в оцінці ефективності проведеної терапії залежно від локалізації ураження. Отримані дані наведені в таблиці 6.1.
Таблиця 6.1 – Терміни мікологічної негативації результатів мікроскопії та ПЛР у пацієнтів на оніхомікоз кистей в залежності від локалізації ураження
| Мікологічна
негативація, тижні |
Оніхомікоз кистей | Оніхомікоз стоп/кистей і стоп | ||
| Мікроскопія
(n=6) |
ПЛР
(n=6) |
Мікроскопія (n=22) | ПЛР
(n=22) |
|
| абс. (%) | абс. (%) | абс. (%) | абс. (%) | |
| 6 | 4 (66,7 %) | 4 (66,7 %) | – | – |
| 8 | 2 (33,3 %) | 2 (33,3 %) | – | |
| 10 | – | – | 1 (4,5 %) | – |
| 12 | – | – | 4 (18,2 %) | 3 (13,6 %) |
| 14 | – | – | 9 (40,9 %) | 7 (31,8 %) |
| 16 | – | – | 7 (31,8 %) | 10 (45,5 %) |
| 18 | – | – | 1 (4,5 %) | 2 (9,5 %) |
Як видно з таблиці 6.1, у хворих на оніхомікоз кистей негативація результатів мікроскопічного дослідження та ПЛР на етапах дослідження співпадала, тоді як у хворих на оніхомікоз стоп та оніхомікоз кистей і стоп негативація більше третини результатів мікроскопії мала місце в більш ранні терміни, порівняно з результатами ПЛР.
Дані мікроскопії демонструють мікологічну елімінацію збудника до 14-го тижня лікування у 63,6 % хворих на оніхомікоз стоп та оніхомікозами кистей та стоп, що майже в 1,5 рази більше, ніж при застосуванні ПЛР для верифікації негативації результатів мікологічних досліджень (45,5 %).
Таким чином, проведений аналіз продемонстрував більш короткі терміни негативації результатів мікроскопії серед досліджуваних хворих, порівняно з результатми ПЛР, що не підтверджує доцільність використання ПЛР в якості методу контролю виліковності та оцінки результатів лікування хворих на оніхомікоз.
6.2 Аналіз впливу клініко-демографічних факторів та соматичної коморбідності на строки мікологічної негативації за даними полімеразної ланцюгової реакції у хворих на оніхомікоз
Аналізуючи строки ерадикації грибів і, відповідно, тривалість антифунгальної терапії, було зроблено спробу математичного аналізу сукупності даних з метою виявлення можливих факторів, здатних впливати на перебіг оніхомікозу, зокрема, терміни мікологічної негативації. З цією метою проаналізовано строки мікологічної негативації за даними ПЛР (табл. 6.2). Медіани та інтерквартильні розмахи (25 та 75-й перцентилі) строків мікологічної негативації у досліджуваній групі хворих на оніхомікоз склали 14,0 [8,0; 16,0] місяців.
Таблиця 6.2 – Вплив деяких клініко-демографічних характеристик на строки мікологічної негативації за даними ПЛР у хворих на оніхомікоз (n=49)
| Показник | n | Строки мікологічної негативації за даними ПЛР, Me [Q25; Q75] | р |
| Стать
Чоловіки Жінки |
20
29 |
15,0 [14,0; 16,0]
14,0 [8,0; 16,0] |
0,380 |
| Вік
≤ 40 років > 40 років |
12
37 |
14,0 [6,5; 16,0]
14,0 [10,0; 16,0] |
0,940 |
| Тривалість оніхомікозу
≤ 1 року > 1 року |
17
32 |
14,0 [8,0; 16,0]
14,0 [12,0; 16,0] |
0,311 |
| Локалізація ураження:
кисті рук стопи |
13
36 |
7,0 [6,0; 8,0]
14,0 [13,0; 16,0] |
<0,001 |
Продовження таблиці 6.2
| Показник | n | Строки мікологічної негативації за даними ПЛР, Me [Q25; Q75] | р |
| Індекс КІОТОС
≤ 6 > 6 |
11
38 |
8,0 [6,0; 8,0]
16,0 [14,0; 16,0] |
<0,001 |
| Хронічне захворювання
немає є |
21
28 |
14,0 [8,0; 16,0]
16,0 [12,0; 16,0] |
0,01 |
| Мікроциркуляторні розлади
немає є |
21
28 |
12,0 [6,0; 14,0]
16,0 [14,0; 16,0] |
0,017 |
Примітка. У таблиці наведено медіани (Mе) та інтерквартильні розмахи (25-й та 75-й процентилі) [LQ, HQ].
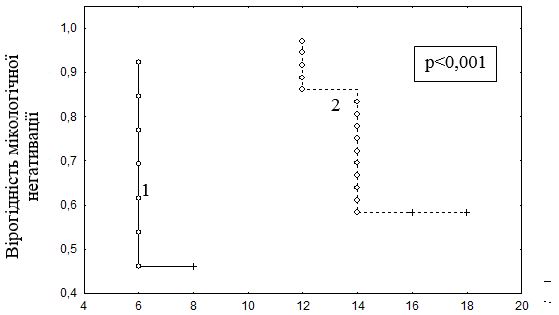
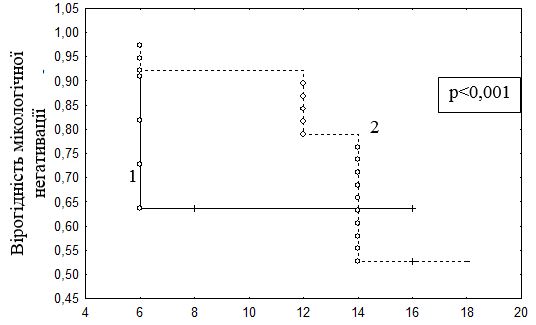
Цілком закономірно, що у пацієнтів з ізольованим грибковим ураженням нігтів кистей мікологічна негативація за даними ПЛР відбувається набагато швидше, ніж у пацієнтів з ураженням нігтів стоп та стоп і кистей (Ме = 7,0 [6,0; 8,0] проти Ме = 14,0 [13,0; 16,0] роки; U-критерій Манна – Уітні, р<0,001). Порівняння термінів мікологічної негативації у хворих з ураженням нігтів кистей та стоп за допомогою математико-статистичної моделі виживаності (Survival analysis) та лог-рангового критерію показало наявність статистично значущої різниці відносно строків ерадикації грибів (р<0,001) у цих групах хворих (див. табл. 6.2). Графічна оцінка представлена за допомогою методу Каплана – Мейера (рис. 6.1).
Дані, наведені в таблиці 6.2, свідчать, що медіана строків ерадикації грибів була в 2 рази більшою у хворих з індексом КІОТОС > 6 (Ме = 16,0 [14,0; 16,0]), в порівнянні з пацієнтами, у яких індекс КІОТОС був ≤ 6 (Ме = 8,0 [6,0; 8,0]) (U-критерій Манна – Уітні, р<0,001). Під час аналізу темпів прогресування захворювання за допомогою кривих виживаності Каплана – Мейера та лог-рангового критерію було встановлено, що величина індексу КІОТОС достовірно впливає на строки мікологічної негатива ції (р<0,001) (рис. 6.2).
Місяці до мікологічної негативації
Рисунок 6.1 – Тривалість захворювання від початку дослідження до мікологічної негативації за даними ПЛР у хворих з ізольованим ураженням нігтів кистей та ураженням нігтів стоп/стоп і кистей (аналіз Каплана – Мейера):
- ізольоване грибкове ураження нігтів кистей;
- грибкове ураження нігтів стоп або кистей та стоп.
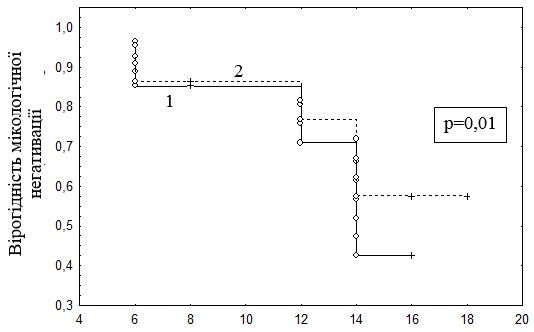
Строки мікологічної негативації залежали від тяжкості та вираженості коморбіної патології. Так, у випадках наявності супутніх хронічних захворювань медіана мікологічної негативації за даними ПЛР була достовірно вищою (Ме = 16,0 [12,0; 16,0]), в порівнянні з пацієнтами без соматичної патології (Ме = 14,0 [8,0; 16,0]) (U-критерій Манна – Уітні, р=0,049). Під час аналізу термінів ерадикації грибів за допомогою «кривих виживаності» Каплана – Мейера та лог-рангового критерію було встановлено, що строки мікологічної негативації є більш тривалими у випадках наявності коморбідної соматичної патології (р=0,01) (рис. 6.3).
Місяці до мікологічної негативації
Рисунок 6.2 – Тривалість захворювання від початку дослідження до мікологічної негативації за даними ПЛР у хворих з величиною індексу КІОТОС ≤ 6 та > 6 (аналіз Каплана – Мейера):
- індекс КІОТОС ≤ 6;
- індекс КІОТОС > 6.
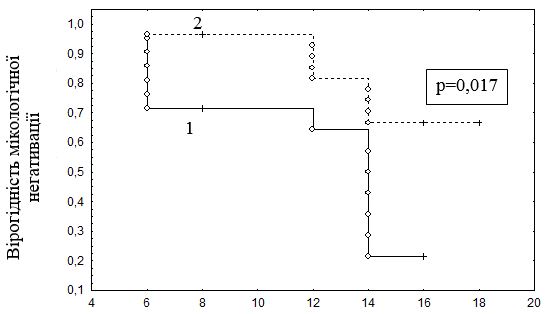
Результати дослідження продемонстрували, що строки мікологічної негативації також залежать від стану мікроциркуляторного русла і є достовірно довшими у пацієнтів з наявними мікроциркуляторними порушеннями , складаючи 16 місяців (Ме = 16,0 [14,0; 16,0]), тоді як у разі відсутності порушень мікроциркуляції – 12,0 місяців (Ме = 12,0 [6,0; 14,0]); U-критерій Манна – Уітні, р<0,001).
 Місяці до мікологічної негативації
Місяці до мікологічної негативації
Рисунок 6.3 – Тривалість захворювання від початку дослідження до мікологічної негативації за даними ПЛР у хворих з коморбідною патологією без такої (аналіз Каплана – Мейера):
- немає коморбідної патології;
- є коморбідна патологія.
Аналіз ймовірності досягнення події за методом множинних оцінок Каплана – Meйера (рис. 6.4) показав, що наявність розладів мікроциркуляції призводить до істотного збільшення строків ерадикації грибів (лог-ранговий критерій, р=0,006).
Для визначення значущих факторів мікологічної негативації було застосовано регресійний аналіз Кокса, який дозволив проаналізувати вплив кожного предиктора окремо на процес мікологічної негативації за даними ПЛР залежно від кількості витрачених на лікування місяців. Серед клінічних показників досліджуваних хворих негативно впливали на строки ерадикації грибів величина індексу КІОТОС (HR=0,951, ДІ: [0,905-0,998]). З інших факторів регресійний аналіз Кокса виявив статистично значущий вплив фактору мікроциркуляторних розладів – як їх наявності, так і
відсутності (HR=2,980, ДІ: [1,263-7,030]) – на терміни мікологічної негативації.
Місяці до мікологічної негативації
Рисунок 6.4 – Тривалість захворювання від початку дослідження до мікологічної негативації за даними ПЛР у хворих з мікроциркуляторними порушеннями та без таких (аналіз Каплана – Мейера):
- немає розладів мікркоциркуляції;
- є розлади мікркоциркуляції.
У той же час теоретично клінічно значущі при оніхомікозі чинники, такі як локалізація грибкового ураження та наявність коморбідної патології, не зберегли своїх властивостей при регресійному аналізі Кокса, отже, їхня частка дисперсії пояснювалася факторами, котрі вже включено до рівняння.
Такими чином, клінічно значущими предикторами швидкості ерадикації грибів виявилися індекс КІОТОС, більш високі величини якого збільшують строки мікологічної негативації в 4,9 рази (р=0,042), та мікроциркуляторні розлади, наявність котрих асоціюється із зростанням строків ерадикації грибів майже в 2,98 рази (р=0,013). Останнє спонукало дослідити строки негативації ПЛР у процесі лікування хворих на оніхомікоз основної групи, яким проводилася корекція мікроциркуляторні порушень, в порівнянні з аналогічними показниками хворих контрольної групи. Результати проведеного аналізу наведені нижче.
6.3 Строки негативації полімеразної ланцюгової реакції в процесі лікування хворих на оніхомікоз основної групи
Як і у хворих контрольної групи, оцінку термінів мікологічної елімінації у хворих основної груп проведено за допомогою традиційного мікроскопічного дослідження та ПЛР, специфічної до Т. rubrum, та ПЛР із панфунгальними праймерами. Враховуючи неспівпадіння термінів мікологічного виліковування у хворих на оніхомікоз кистей та стоп, пацієнтів основної та контрольної груп було розподілено залежно від локалізації грибкового ураження на: хворих на оніхомікоз тільки кистей (6 хворих у контрольній групі, 35 – в основній) та хворих на оніхомікоз стоп та кистей і оніхомікоз стоп (22 та 39 хворих відповідно).
Позитивні клінічні зміни відмічалися у більшості (21 – 60 %) хворих на оніхомікоз кистей в основній групі та у 4 (66,7 %) хворих в контрольній групі на 4-му тижні лікування, але негативація результатів мікроскопії та ПЛР-аналізу у всіх пацієнтів аналізованих груп відмічалася тільки починаючи з 6-го тижня лікування (табл. 6.3).
На 6-му тижні у хворих на оніхомікоз кистей спостерігалася негативація результатів мікроскопічного дослідження та ПЛР у 30 (85,7 %) хворих основної групи. В контрольній групі мікологічна негативація була встановлена у 4 (66,7 %).
На 8-му тижні у хворих на оніхомікоз кистей після закінчення лікування клінічне та мікологічне одужання відбулося у всіх пацієнтів контрольної групи та у 34 (97,2 %) основної. Як було показано вище, строки мікологічної негативації в аналізованих групах хворих на оніхомікоз кистей статистично не відрізнялися (р>0,05) (табл. 6.3).
Таблиця 6.3 – Строки мікологічної негативації результатів мікроскопії та ПЛР у хворих на оніхомікоз кистей (n=41)
| Мікологічна
негативація, тижні |
Контрольна група | Основна група | ||
| Мікроскопія
(n=6) |
ПЛР
(n=6) |
Мікроскопія
(n=35) |
ПЛР
(n=35) |
|
| абс. (%) | абс. (%) | абс. (%) | абс. (%) | |
| 6 | 4 (66,7 %) | 4 (66,7 %) | 30 (85,7 %) | 30 (85,7 %) |
| 8 | 2 (33,3 %) | 2 (33,3 %) | 4 (11,4 %) | 4 (11,4 %) |
| 10 | – | – | 1 (2,9 %) | 1 (2,9 %) |
| 12 | – | – | – | – |
| 14 | – | – | – | – |
Розподіл хворих на оніхомікоз стоп та оніхомікоз кистей та стоп в групах порівняння в залежності від строків мікологічної негативації показаний в таблиці 6.4.
Таблиця 6.4 – Строки мікологічної негативації результатів мікроскопії та ПЛР у хворих на оніхомікоз стоп та оніхомікоз кистей і стоп (n=61)
| Мікологічна
негативація, тижні |
Контрольна група | Основна група | ||
| Мікроскопія (n=22) | ПЛР
(n=22) |
Мікроскопія
(n=39) |
ПЛР
(n=39) |
|
| абс. (%) | абс. (%) | абс. (%) | абс. (%) | |
| 6 | – | – | – | – |
| 8 | – | 1 (2,6 %) | – | |
| 10 | 1 (4,5 %) | – | 10 (25,6 %) | 10 (25,6 %) |
| 12 | 4 (18,2 %) | 3 (13,6 %) | 18 (46,2 %) | 19 (47,5 %) |
| 14 | 9 (40,9 %) | 7 (31,8 %) | 9 (22,1 %) | 8 (20,5 %) |
| 16 | 7 (31,8 %) | 10 (45,5 %) | 1 (2,6 %) | 2 (5 %) |
| 18 | 1 (4,5 %) | 2 (9,5 %) | – | – |
Як видно з таблиці 6.4, на 8-му тижні лікування мікологічна негативація за даними мікроскопії зареєстрована у 1 (2,6 %) хворого основної групи.
На 10-му тижні серед пацієнтів основної групи мікологічна елімінація збудника була виявлена в 10 (25,6 %) випадках згідно результатів мікроскопічного дослідження та ПЛР та в контрольній групі у 1 (4,8 %) хворого за даними мікроскопії (р=0,04).
На 12-му тижні у пацієнтів основної групи у 18 (43,9 %) відбулася негативація результатів мікроскопічного дослідження та ПЛР та у 1 хворого з мікологогічною негативацією за даними мікроскопії на 8-му тижні отримано негативний результат ПЛР. В контрольній групі мікологічна елімінація збудника встановлена у 4 (18,2 %) (за даними мікроскопії та ПЛР – 3 випадки, за даними тільки мікроскопії – 1 випадок). Отже, можна стверджувати, що в основній групі до 12-го тижня мікологічна негативація відбулася у 29 (74,4 %) хворих, що у порівнянні з контрольною групою (22,7 %) достовірно більше (р<0,001).
На 14-му тижні лікування серед пацієнтів основної та контрольної групи мікологічна негативація встановлена ще в 9 (21,1 %) та 9 (40,9 %) випадках відповідно. В результаті чого до 14-го тижня мікологічна негативація була виявлена у 38 (97,4 %) хворих основної групи, що перевищувало частоту мікологічної елімінації в контрольній групі на 33,8 % (р=0,001) (див. табл. 6.4).
На 16-му тижні лікування повна мікологічна негативація відбулася у всіх пацієнтів основної групи та у 95,5 % хворих контрольної групи, останній 1 (4,5 %) хворий групи конролю набув мікологічну елімінацію на 18-му тижні.
* * *
Підсумовуючи наведені в даному розділі дані, слід підкреслити, що у частини пацієнтів строки негативації мікроскопії та ПЛР не співпадають: у 71,4 % хворих відбулася негативація обох аналізів (і мікроскопії, і ПЛР), а у 28,6 % хворих першим негативним виявився результат мікроскопії, тоді як результат ПЛР тесту залишався позитивним. Це відповідно позначається на середніх строках мікологічної негативації, які за результатами мікроскопії склали в середньому (12,07 ± 3,1) тижня, а за результатами ПЛР, специфічної до Т. rubrum, та ПЛР із панфунгальними праймерами, – (14,21 ± 4,5) тижня (р=0,043).
В обох досліджуваних групах хворих встановлено більш короткі терміни негативації результатів мікроскопії, порівняно з результатми ПЛР, що не підтверджує доцільність використання ПЛР в якості методу контролю виліковності та оцінки результатів лікування хворих на оніхомікоз.
Матеріали даного розділу викладені в наступній роботі:
Кізіна І. Є. Інформативність полімеразної ланцюгової реакції для діагностики, оцінки перебігу й результатів лікування оніхомікозу // Biomedical and biosocial anthropology. 2015. № 25. С. 169-172 [20].
РОЗДІЛ 7
АНАЛІЗ І УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
В Україні, як і в інших країнах світу, за останні десятиріччя відзначена загальносвітова тенденція зростання рівня захворюваності на мікози [24, 54, 59]. За даними ВООЗ, у середньому кожний п’ятий житель Землі інфікований грибами, кожний десятий має виражені клінічні прояви і цей показник постійно підвищується, особливо із збільшенням віку пацієнта [46, 67]. Зокрема, в групі людей старше 70 років оніхомікоз вражає кожного другого [28]. Не зважаючи на впровадження новітніх фармацевтичних засобів [11, 71, 145, 146], оніхомікози і досі залишаються важливою проблемою охорони здоров’я, оскільки вони не тільки являють тривало існуюче вогнище мікотичної інфекції, яке сприяє ї розповсюдженню на шкіру хворого, але й істотно знижують якість життя, завдаючи хворим чималого фізичного та морального дискомфорту [129], призводять до виникнення психологічних, косметичних та функціональних проблем [60].
Виходячи з процесів та тенденцій, які відбуваються у світовій дерматології, слід визнати, що на даний момент залишається багато не висвітлених питань щодо ранньої діагностики оніхомікозів та, в подальшому, верифікації негативаціїї збудника цього захворювання. Невивченим є відношення факторів ризику розвитку оніхомікозу до строків мікологічної негативації й відростання здорового нігтя. Залишається поза увагою спеціалістів вірогідна залежність ефективності лікування від стану мікроциркуляції. Дослідження цього питання, ймовірно, є перспективним для розробки методів терапії та профілактики захворювання. Не останнє місце посідають і недоліки існуючих препаратів: недостатня клінічна ефективність, токсичність, побічні ефекти. Таким чином, проблема мікозів змушує медиків та фармацевтів усього світу концентрувати зусилля для її вирішення.
Тому основною метою проведеного дослідження стало обґрунтування напрямків та визначення заходів, спрямованих на підвищення ефективності діагностично-лікувальної допомоги та покращення якості життя хворих на оніхомікоз.
Враховуючи, що зростанням рівня захворюваності на оніхомікоз значною мірою зумовлюють соціальні чинники, зокрема, розширення мережи послуг для населення, таких як басейни, сауни, косметологічні кабінети [189], першим етапом роботи стало вивчення епідеміологічних характеристик оніхомікозу у Вінницькій області та впливу факторів ризику розвитку оніхомікозу на модифікацію ризику зараження в окремих районах Вінницької області.
Епідеміологічні оцінки проводились у популяції постійного населення Вінницької області. Захворюваність на оніхомікоз у Вінницькій області впродовж 2015–2017 рр. склала 38,4, 38,9 та 35,6 випадків на 100000 населення відповідно, що в цілому збігається з даними про поширеність даного стану в українській популяції [37, 38]. Ефект загального часового тренду у Вінницькій області виявився суттєвим (р<0,001), із зменшенням ризику зараження протягом 2015–2017 років на 32,4 %.
Встановлено суттєві просторові відмінності в територіальних ризиках зараження з найвищими значеннями у Бершадському, Калинівському та Іллінецькому районах з відповідним перевищенням очікуваних значень (значення відносного ризику) 417.9/15.1= 27,6 разів, 230.4/14.5 =15,8 разів 129.6/9.4=13,8 разів (р<0,0001).
Під час аналізу впливу факторів ризику розвитку оніхомікозу (кількість саун в районі, кількість салонів краси в районі, середньозважене значення рН грунту території району, кількість населення району) на рівень захворюваності в досліджуваному регіоні виявляються дві основні тенденції: зростання ризику розвитку оніхомікозу при появі додаткового салону краси на території району (р<0,05) та при збільшенні рН ґрунту на одиницю на території району (р<0,001). Так, за наддисперсною моделлю Пуассона з’ясовано зростання ризику розвитку оніхомікозу при появі додаткового салону краси на території району на 1 %, за просторово-динамічною моделлю – на 2,2 % та за просторовою моделлю – на 4,3 %, тоді як ефект саун та рН ґрунту набув переконливої суттєвості (р<0,001) лише за просторово-динамічною моделлю із збільшення ризику зараження на оніхомікоз на 26,8 % при появі додаткової сауни на території району та зменшенням ризику зараження на 10,7 % при збільшенні рН ґрунту на одиницю.
Враховуючи вплив на зростання захворюваності оніхомікозом медичних чинників, зокрема, збільшення кількості випадків хвороб та станів, які часто супроводжуються грибковими інфекціями (цукровий діабет, імунодефіцитні стани, порушення кровообігу в дистальних відділах кінцівок і т. п.), важливим питанням залишається проблема відношення клініко-демографічних факторів до перебігу оніхомікозу, в тому числі строків мікологічної негативації та якості життя хворих. Це стало другою важливою метою дослідження, у зв’язку з чим було проведено проспективне когортне дослідження, в якому взяли участь 49 (20 чоловіків, 29 жінок) хворих на оніхомікоз середнім віком (51,1 ± 16,15) року (від 19 до 74 років), які лікувалися у Вінницькому обласному шкірно-венерологічному диспансері впродовж 2015 року. Середня тривалість захворювання склала в середньому – (2,8 ± 4,9) роки, що співвідноситься з даними літератури та ймовірно пояснюється тим, що важливим фактором є зорове сприйняття хворим змінених за формою і кольором нігтьових пластинок кистей, що змушує його якомога раніше звертатися до лікаря, особливо коли він дізнається про інфекційний характер захворювання [8].
У більшості (81,6 %) пацієнтів визначалася дистально-латеральна форма оніхомікозу, у 16,3 % – біла поверхнева та у 2 % – проксимальна. Переважна більшість хворих (83,7 %) мали пошкодження нігтьової пластинки від 1/3 її довжини та помірно виражний або виражений піднігтьовий гіперкератоз. Індекс КІОТОС [49] у досліджуваних хворих склав в середньому (16,4 ± 9,54) бала (від 1 до 30 балів).
За даними літератури клінічна діагностика без лабораторного підтвердження нездатна однозначно підтвердити або спростувати діагноз оніхомікозу, незважаючи на відомі випадки такої практики при відсутності або недоступності будь-яких методів мікологічною діагностики в розпорядженні лікаря [33].
На сьогодні методи лабораторного підтвердження клінічного діагнозу оніхомікозу можна умовно розділити на регламентовані (стандартні), які використовуються масово на регулярній основі, та на перспективні або дослідні, що використовуються в спеціальних умовах і у обмежених контингентів хворих.
До регламентованих методів лабораторної діагностики оніхомикозу відносяться мікроскопія і посів. Згідно отриманих даних, за допомогою мікроскопії було отримано 47 позитивних результатів з 49, що склало 95,9 %,
що в цілому співвідносяться з результатами інших досліджень, згідно даних виявлення оніхомікозу за допомогою мікроскопії варіюють в межах 37–92 % [33]. Таким чином, дані спостереження співпадають з даними літератури, у якій представлено значну кількість повідомлень про недоліки світлової КОН-мікроскопії, зокрема, достовірні відмінності в результатах КОН мікроскопії, котрі проводяться різними лабораторіями і фахівцями [33, 49].
Слід зазначити, що в даному дослідженні мікроскопія дозволила верифікувати лише наявність грибкової інфекції, але не вид збудника. Тривалий час єдиним методом етіологічної верифікації оніхомікозу був посів матеріалу з виділенням та ідентифікацією культури. Проте, дане дослідження вимагає часу, великих ресурсів лабораторії, особливої кваліфікації персоналу. Крім цього, зростання культур провідних збудників оніхомікозу – дерматофітів – може зайняти 2 і більше тижня, істотно збільшуючи час до встановлення діагнозу та початку лікування [33, 49].
Результати ряду досліджень виявили високу загальну точність масової ПЛР-діагностики (94 %) в стандартних клінічних умовах [12, 49, 62]. Однак, результати цього дослідження дещо відрізняються від отриманих іншими дослідниками даних. Так, результати ПЛР тесту, специфічного до Т. rubrum, і ПЛР із панфунгальними праймерами (включають маркери Microsporum audouinii, T. mentagrophytes var. mentagrophytes, T. schoenleinii, T. terrestre, T. rubrum, T. tonsurans, T. soudanens, Epidermophyton floccosum, Candida spp), у дослідних хворих виявилися позитивним тільки у 30 (61,2 %) з 49 пацієнтів. Таким чином, інформативність ПЛР для виявлення патологічного міцелію в нігтьових пластинках виявилася меншою, в порівнянні з мікроскопією. Проте, безумовно, слід зазначити, що результати ПЛР дозволили, по-перше, за 1 добу підтвердити діагноз дерматофітії нігтів, по-друге, ідентифікувати вид збудника, тоді як мікроскопія встановити видоспецифічність збудника взагалі не дозволяє. За даними дослідження, основним збудником оніхомікозу у досліджуваних хворих були дерматоміцети, серед яких найбільш часто (60 %) виявлявся T. rubrum, що збігається з даними про етіологію оніхомікозу [22, 25, 67]. В 12 (40 %) випадках був отриманий позитивний результат ПЛР із панфунгальними праймерами та негативний результат ПЛР, специфічній до T. rubrum. Ці пацієнти розглядались як ті, що мають оніхомікоз нез’ясованої етіології, і призначалася їм етіотропна терапія антифунгальними препаратами широкого спектру дії.
Цікаво, що з 30 позитивних зразків, отриманих методом ПЛР, позитивною мікроскопія була тільки у 28 (93,3 %) хворих, а негативна – у 2 (6,67 %) пацієнтів. У останніх двух пацієнтів повторна мікроскопія нігтьових пластинок також виявилася негативною, а ПЛР знову була позитивною, що дозволило поставити діагноз оніхомікозу та прийняти рішення про призначення відповідної терапії. Ці дані свідчать, що використання ПЛР-діагностики дозволяє виявити оніхомікоз на ранній стадії та вчасно попередити подальше поширення інфекції. А це в свою чергу означає, що проведення мікроскопії не повинно виключати застосування ПЛР для діагностики захворювання, ці два метода повинні доповнювати один одного, оскільки мікроскопія дозволяє верифікувати наявність грибкової інфекції, тоді як результати ПЛР допомагають ідентифікувати вид збудника.
У пацієнтів виявлялися різноманітні супутні захворювання, найчастіше артеріальна гіпертензія (28,4 %), патологія вен нижніх кінцівок (18,4 %) і ожиріння (14,3 %). 22 (44,9 %) особи мали коморбідну патологію за декількома органними системами. У літературі можна знайти підтвердження, що ризик розвитку оніхомікозу підвищують судинні захворювання (особливо при ураженні судин нижніх кінцівок), ожиріння, цукровий діабет, деформація кісткового апарату стоп [11, 25]. Зокрема, судинні захворювання призводять до порушення відтоку крові, погіршення метаболізму в тканинах, що також може ускладнювати терапію оніхомікозу. Крім цього, дослідження продемонстрували, що пацієнти, які страждають на різні дерматози, мають високу частоту психологічних, косметичних та функціональних проблем. Останні асоціюються із виникненням афективних розладів та з істотним зниження якості життя [8]. Все зазначене спонукало оцінити ступінь дискомфорту та змін психічного статусу у досліджуваних хворих на оніхомікоз.
За шкалою оцінки дискомфорту середнє значення вираженості дискомфорту у даних хворих склало (4,18 ± 1,81) бала, а за «Шкалою станів» А.Б. Леонової – (51,71 ± 6,83) бала. Отримані дані свідчать, що в цілому оніхомікоз не викликає вираженого зниження суб’єктивного комфорту. Водночас, цілком закономірно, що більший дискомфорт викликали грибкове ураження нігтів кистей або поєднане ураження нігтей стоп та рук, ніж оніхомікоз стоп. Результати обстеження хворих за HАDS у цілому продемонстрували субклінічно виражений рівень тривожно-депресивних розладів (середнє значення вираженості тривоги – (8,37 ± 3,19) бала, депресії – (6,18 ± 3,55) бала). Водночас, з хворих із клінічно вираженою тривогою та депресію 85,7 % та 83,3 % відповідно мали грибкове ураження нігтів кистей або поєднане ураження нігтей рук та стоп.
Виходячи з отриманих даних, необхідно акцентувати увагу практичних лікарів на необхідності проведення когнітивно-поведінкової терапії як доповнення до загальноприйнятої терапії з метою зниження рівня тривоги і усунення викликаних нею внутрішньоособистісних проблем.
Середнє значення DLQI у досліджуваних хворих становило (8,41 ± 9,19) бала, що в цілому, безумовно, означає помірний вплив оніхомікозу на якість життя хворого. Високе значення індексу в більшості випадків визначалося у пацієнтів з грибковим ураженням нігтів рук (при DLQI: 21–30 / частота ураження нігтів рук – 71,4 %), а також у пацієнтів з високим рівнем суб’єктивного дискомфорту та високим рівнем тривожно-депресивних розладів (при DLQI 21–30 / рівень дискомфорту за шкалою оцінки дискомфорту – 5,0 ± 1,83, за шкалою станів – 44,71 ± 8,77; HADS-тривога –10,71 ± 2,21; HADS-депресія – 10,85 ± 1,07), р<0,05.
Серед різних сфер, що складають концепцію якості життя згідно протоколу WHOQOL-BREF найвище та найнижче середнє значення мали сфера 4 (вплив оточуючого середовища на якість життя) (в середньому – (26,93 ± 1,96) бала) та домен 3 (соціальні відношення) (в середньому – (12,78 ± 1,28) бала) відповідно. Згідно результатів множинного регресійного аналізу, наявність хронічного захворювання робить достовірний внесок у зниження фізичного компоненту якості життя при оніхомікозі, сфери соціальних відносин та взаємодії з оточуючим середовищем, тоді як найбільший сильний вплив на психіологічний компонент якості життя демонструють стать (жіноча), тривалість існування грибкового ураження та наявність тривожних розладів. Звертає увагу той факт, що зниження оцінки соціальних відносин асоціюється із зростанням величини індексу КІОТОС, що ймовірно пов’язано із негативним сприйняттям хворими більш вираженого ураження за локалізацією, площею та наявністю косметичного дефекту.
Таким чином, згідно отриманих результатів для покращення якості життя тільки протигрибкової терапії не достатньо. Існує необхідність виділення груп хворих, які мають супутні (коморбідні) захворювання, оскільки їх наявність може погіршувати результати лікування та якість життя хворих. Отже, слід визнати, що оцінка якості життя хворих на оніхомікоз до і після лікування є джерелом додаткової інформації та важливим критерієм ефективності лікування дерматологічних хворих цієї категорії.
Аналіз даних лазерної допплерівської флоуметрії у хворих на оніхомікоз дозволив виявити широку поширеність ультразвукових ознак мікроциркуляторних порушень серед пацієнтів із грибковим ураженням нігтьових пластинок. У 57,1 % хворих тканинний кровотік пальців з ураженими грибком нігтями відрізняється від стану мікрокровотоку на аналогічних сегментах неуражених пальців іншої кінцівки. Серед вказаної групи в 21 (42,9 %) випадку величина резерву капілярного кровотоку відповідала нормоциркуляторному гемодинамічному типу мікроциркуляторного русла, тоді як у 22 (44,9 %) хворих був виявлений спастичний, у 5 (10,2 %) – застійно-стазичний та у 1 (2 %) – гіперемічний гемодинамічний тип мікроциркуляції.
При порівнянні груп пацієнтів з наявними та відсутніми порушеннями мікроциркуляції виявлено, що у хворих із мікроциркуляторними розладами тривалість захворювання та кількість уражених нігтів перевищували аналогічні показники у пацієнтів з нормоциркуляторним типом мікроциркуляції. Крім цього у хворих на оніхомікоз із наявними порушеннями мікроциркуляції переважає дистально-латеральна та проксимальна форма ураження нігтьової пластинки (92,9 %), а у 46,4 % пацієнтів – ураження більше ніж на дві третини. Цими даними можна пояснити той факт, що індекс КІОТОС у пацієнтів із мікроциркуляторними розладами майже в 2 рази перевищував аналогічний показник у осіб без порушення мікроциркуляції (р<0,001). І, нарешті, найважливішим з отриманих результатів, імовірно, є факт впливу гемодинамічних порушень мікроциркуляторного русла на терміни негативації результатів мікологічного дослідження у хворих на оніхомікоз стоп. Так, у цілому по групі середні строки мікологічної негативації були на 26,5 % більшими у хворих з мікроциркуляторними розладами, ніж у пацієнтів без таких (р<0,001). Зокрема, негативація результатів мікологічного дослідження у хворих на оніхомікоз стоп, які не мають мікроциркуляторних порушень, відбувалася в середньому на 2,6 місяці раніше, ніж при їх наявності (р<0,05), тоді як у разі ізольованого оніхомікозу кистей мікроциркуляторні розлади достовірно не вплинули на терміни мікологічної негативації (р>0,05). Саме тому в дослідженні основна увага була спрямована на вивчення цих патогенетичних особливостей серед хворих на грибкові захворювання нігтьових пластинок.
Можна припустити, що приховані гемодинамічні порушення мікроциркуляторного русла верхніх та нижніх кінцівок вірогідно створюють сприятливі умови для проникнення грибкової інфекції та розвитку захворювання. З іншого боку, гриби в свою чергу викликають порушення кровообігу мікроциркуляторного русла при їх тривалому персистуванні, що підтверджуються результати сучасних досліджень. При цьому численні публікації засвідчують факт підвищення ризику розвитку оніхомікозу при наявності коморбідних судинних захворювань (особливо при ураженні судин нижніх кінцівок), цукрового діабету і т. п., котрі створюють підґрунтя для істотних мікроциркуляторних розладів та знижують ефективність лікування [11, 13, 25]. Отже, імовірно, що наявні порушення мікроциркуляції у хворих на оніхомікоз обґрунтовують необхідність розширення меж медикаментозного впливу, зокрема, використання вазоактивних засобів в комплексній терапії даного захворювання.
Базуючись на отриманому клінічному матеріалі, було побудовано ряд прогностичних моделей впливу досліджуваних клініко-демографічних показників та коморбідності на терміни мікологічної негативації за даними ПЛР.
Як показав аналіз за методом множинних оцінок Каплана-Мейера, статистично достовірний вплив на терміни ерадикації збудника захворювання демонструють локалізація грибкового ураження на пальцях стоп, індекс КІОТОС > 6, наявність супутніх хронічних захворювань та мікроциркуляторних порушень, а регресійна модель Кокса показала, що індекс КІОТОС та наявність мікроциркуляторних розладів являються незалежними факторами, які впливають на швидкість ерадикації грибів. Так, більш високі величини індексу КІОТОС збільшують строки мікологічної негативації в 4,9 рази (р=0,042), а наявність мікроциркуляторних порущень асоціюється із зростанням строків ерадикації збудника майже в 2,98 рази (р=0,013). Очевидно, отримані дані демонструють наявність різнопланових зв’язків стану мікроциркуляторного русла та клінічного перебігу оніхомікозу.
Таким чином, завдяки отриманим результатами були обґрунтувані напрямки підвищення ефективності комплексного лікування хворих на оніхомікоз, яке включало призначення системних та/або місцевих протигрибкових препаратів та засобів для корекції мікроциркуляторних порушень з урахуванням гемодинамічного типу мікроциркуляції.
Для оцінки ефективності запропонованої програми проведено контрольоване клінічне дослідження. У дослідженні взяли участь 49 пацієнтів, які отримували лише антифунгальну терапію (контрольна група) та 79 хворих, котрим крім ідентичного протигрибкового лікування проводилась диференційована корекція виявлених за даними лазерної допплерівської флоуметріх мікроциркуляторних порушень. Так, у разі спастичного гемодинамічного типу мікроциркуляції пацієнтам основної групи був призначений нафтидрофурил гідроген оксалат (енелбін), хворих із гіперемічним типом мікроциркуляції – Детралекс, а хворі з застійно-стазичним типом мікроциркуляції отримували нафтидрофурил гідроген оксалат в комплексі з Детралексом. Тривалість корекційної програми склала 3 місяці.
При порівнянні середньої швидкості регресу клінічних ознак захворювання в контрольній та основній групах доведено, що використання вазоактивних препаратів для лікувальної корекції розладів мікроциркуляції при оніхомікозі забезпечує більш швидкий регрес симптомів захворювання. Повний регрес клінічних ознак через 8 тижнів зареєстровано у 71 (93,4 %) хворих основної групи та у 38 (77,6 %) пацієнтів контрольної групи (р=0,010), на 10-му тижні лікування – у всіх 76 хворих основної групи та у 46 (93,9 %) хворих групи контролю.
При порівнянні середніх значень швидкості відростання уражених нігтьових пластин у групах порівняння встановлена тенденція більш швидкого відростання уражених нігтьових пластин в ділянці кистей та стоп у процесі саногенезу у пацієнтів основної групи, яким проводилась корекція мікроциркуляторних порушень, зберігалася до 12 тижня лікування включно (р<0,05). Швидкість відростання нігтів кистей та стоп у пацієнтів основної групи була майже в 2 разів вища, ніж у пацієнтів контрольної групи (р<0,001), середній показник приросту нігтів кистей становив (0,21 ± 0,11) см/місяць проти (0,11 ± 0,07) см/місяць в контрольній групі, а стоп – (0,18 ± 0,11) проти (0,09 ± 0,05) см/місяць відповідно (р<0,05).
У переважної більшості до 4–6 тижня лікування нігтьові пластини набували нормотрофічної структури, особливо у хворих з грибковим ураження кистей. В зв’язку з чим на даному етапі хворі на оніхомікоз кистей завершували призначену лікувальну програму.
При порівнянні кінцевих та початкових показників психологічного статусу в досліджуваних групах доведено значущі відмінності в динаміці показників суб’єктивного комфорту, тривоги та депресії (р<0,001), DLQI (р<0,001). Усі перераховані показники були кращими в групі, де хворим проводилася корекція мікроциркуляторних розладів (p<0,05), а виключенням оцінки вираженості депресії, яка достовірно не відрізнялася по завершенню лікування від аналогічного показника контрольної групи.
Під час порівняння середніх значень якості життя, визначених за опитувальником WHOQOL-BREF по завершенню лікування, встановлено значущі відмінності між групами в емоційній сфері (р=0,001) та соціальної активності (р=0,027).
DLQI та показники опитувальника WHOQOL-BREF, відіграючи роль сурогатних точок дослідження, по завершенню лікування мали позитивну динаміку в групі, де проводилась корекція наявних мікроциркуляториних порушень. Їхня клінічна значущість проявляється в поєднанні з ліквідацією косметичного дефекту, функціональних та психологічних проблем у більшості учасников основної групи, на відміну від контрольної групи, де виразність фізичного й морального дискомфорту була значуще вищою. Отримані дані дозволяють рекомендувати оцінку DLQI у хворих на оніхомікоз в якості критерію ефективності призначеного лікування, а також акцентують увагу на необхідності подальшого вивчення та необхідності корекції факторів, що спричиняють погіршення життя у хворих цієї категорії.
При порівнянні строків мікологічної негативації в процесі лікування встановлено, що середні строки антифунгальної терапії виявилися істотно більшими в контрольній групі хворих на оніхомікоз – (12,45 ± 3,92) проти (9,34 ± 3,24) тижня в основній групі пацієнтів, де проводилась диференційована корекція виявлених за даними лазерної допплерівської флоуметрії мікроциркуляторних порушень (р<0,001). Цей показник набув достовірної різниці за рахунок достовірно швидшого мікологічного виліковування при оніхомікозі стоп (р<0,05), тоді як середні строки мікологічної негативації збудника у хворих на оніхомікоз кистей достовірно не відрізнялися.
При цьому переважна більшість хворих основної групи – 65 (85,5 %) мали мікологічну негативацію до 12-го тижня, тобто на ранніх строках лікування, що було на 40,6 % більше, ніж серед хворих контрольної групи, де на 12-му тижні лікування мікологічна негативація відбулася тільки в 22 (44,9 %) випадках (СШ 7,25; 95 % ДІ: [3,095-16,99], р<0,001). У решти хворих мікологічне виліковування визначалося на 14-му тижні у 14 (28,6 %) хворих контрольної групи та у 9 (11,8 %) пацієнтів основної групи; на 16-му – у 9 (18,4 %) та 2 (2,6 %) хворих відповідно та на 18-му – у 5 (10,2 %) хворих контрольної групи.
Більші терміни мікологічної негативації у хворих контрольної групи вірогідно пов’язані із існуванням мікроциркуляторних порушень, які за даними літератури підтримують персистування грибкової інфекції. Це припущення підтвердив проведений аналіз строків мікологічної негативації у хворих контрольної групи із співставленням кількості пацієнтів із різними типами порушення мікроциркуляції. З’ясувано достовірні відмінності між підгрупами хворих як при наявних розладах мікроциркуляції в цілому ([13,79 ± 3,24] проти [10,19 ± 3,89] тижня у хворих без розладів мікроциркуляції; р=0,005), так і серед пацієнтів із окремими видами мікроциркуляторних порушень в порівняні з тими пацієнтами, у яких був діагностований нормоциркуляторний тип гемодинаміки за даними лазерної допплерівської флоуметрії. Терміни мікологічної елімінації збудника у хворих із спастичними та застійно-стазичними порушеннями мікроциркуляції були достовірно тривалішим у порівнянні з хворих без розладів мікроциркуляції (відповідно р=0,002 та р<0,001).
Кореляційний аналіз показав, що сповільнене видужування асоціюється з наявністю мікроциркуляторних розладів (r=0,504; р<0,001), а застійно-стазичний тип порушення мікроциркуляції в найбільшій мірі збільшує терміни мікологічною негативації у хворих на оніхомікоз (р<0,001).
Встановлено наявність позитивних клінічних змін у більшості хворих на оніхомікоз кистей обох груп на 4-му тижні лікування, але негативація результатів мікроскопії та ПЛР-аналізу відмічалася, починаючи лише з 6-го тижня лікування.
Аналіз отриманих даних дозволяє зробити висновок, що клінічне одужання та елімінація збудників у пацієнтів основної групи, яким проводилась диференційована корекція діагностованих за даними лазерної допплерівської флоуметрії мікроциркуляторних порушень, відбувалися швидше, ніж у пацієнтів контрольної групи. Так, мікологічне одужання визначалося у 74 (97,4 %) хворих основної групи до 14-го тижня, а у 2 (2,6 %) хворих – на 16-му тижні. Клінічне одужання визначено у 72 (94,7 %) хворих цієї групи. Водночас строки антифунгальної терапії в контрольній групі хворих на оніхомікоз, яким не проводилося корекції мікроциркуляторних порушень, були істотно більшими і відповідали 14-ти тіжням у 16 (76,2 %) хворих при оцінці мікологічного виліковування та 16-ти тижням у 42 (85,7 %) при оцінці клінічного одужання.
У літературі можна знайти підтвердження того, що метод ПЛР істотно підвищує виявлення оніхомікозу в порівнянні з регламентованими методами (мікроскопія, посів), доведена його висока специфічність та чутливість. При цьому численні публікації засвідчують факт достовірної відповідності результатів ПЛР та регламентованих методів [33, 49, 150]. Водночас, визначенню діагностичної можливості ПЛР як методу контролю вилікованості оніхомікозу приділяється увага майже не приділялася.
Було з’ясовано, що у хворих на оніхомікоз кистей негативація результатів мікроскопічного дослідження та ПЛР на етапах дослідження співпадала, тоді як у хворих на оніхомікоз стоп та оніхомікоз кистей і стоп негативація практично третини результатів ПЛР наступала в більш пізні терміни, порівняно з результатами мікроскопії. Так, дані мікроскопії продемонстрували мікологічну елімінацію збудника до 14-го тижня лікування у 63,6 % хворих на оніхомікоз стоп та оніхомікозами кистей та стоп, що було майже в 1,5 рази більше, ніж при застосуванні ПЛР для верифікації негативації результатів мікологічних досліджень (45,5 %).
Отже, у частини пацієнтів негативація мікроскопії та ПЛР відбувалася в різні строки. У 71,4 % хворих відбувається негативація обох аналізів: і мікроскопії, і ПЛР, а у 28,6 % хворих першим негативним виявляється результат мікроскопії, тоді як результат ПЛР тесту залишається певний час позитивним. Це відповідно позначилося на строках мікологічної негативації, які за результатами мікроскопії склали в середньому (12,07 ± 3,1) тижня, а за результатами ПЛР, специфічної до Т. rubrum, та ПЛР із панфунгальними праймерами, – (14,21 ± 4,5) тижня (р=0,043).
Таким чином, проведений аналіз продемонстрував більш короткі терміни негативації результатів мікроскопії серед досліджуваних хворих, порівняно з результатами ПЛР, що не підтверджує доцільність використання ПЛР в якості методу контролю виліковності та оцінки результатів лікування хворих на оніхомікоз.
На завершення слід підкреслити, що завдяки використанню комплексного методу діагностики, спрямованого як на верифікацію діагнозу грибкової інфекції (ПЛР), так і на виявлення коморбідної патології, серед хворих на оніхомікоз вдалося виявити велику групу патологій, котрі асоціюються з мікроциркуляторними розладами. Крім цього, проведене дослідження показало, що підхід до призначення медикаментозної терапії повинен базуватися на принципі індивідуального підбору та потребує розширення меж фармакологічної медикації у випадках наявних коморбідних захворювань і станів при оніомікозах, зокрема, призначення вазоактивних препаратів у комплексній терапії даного захворювання.
ВИСНОВКИ
У дисертаційній роботі проведено теоретичне обгрунтування і нове практичне рішення актуального завдання сучасної дерматовенерології – підвищення ефективності лікування хворих на оніхомікози шляхом удосконалення діагностики та розробки комбінованої терапії за рахунок вивчення стану мікроциркуляції шкіри та ефективності використання молекулярного методу ПЛР для моніторингу перебігу та контролю виліковності у даної групи пацієнтів.
- Враховуючи велику поширеність, різноманітність клінічних форм та хронічний перебіг оніхомікозів, актуальним є пошук факторів, котрі впливають на строки мікологічної негативації та показники якості життя хворих, а також розробка комплексних методів лікування на підставі вивчення розладів мікроциркуляції в шкірі уражених пальців.
- У Вінницькій області захворюваність на оніхомікоз впродовж проведеного дослідження склала 38,4, 38,9 та 35,6 на 100 тисяч населення відповідно. Встановлено достовірні просторові відмінності в територіальних ризиках зараження з найвищими значеннями у Бершадському, Калинівському та Іллінецькому районах з відповідним перевищенням значення відносного ризику 417,9/15,1 = 27,6 разу, 230,4/14,5 =15,8 разу та 129,6/9,4=13,8 разу. Ризик розвитку оніхомікозу зростав при появі додаткового салону краси на території району на 1 % за наддисперсною моделлю Пуассона, на 2,2 % за просторово-динамічною моделлю, на 4,3 % за просторовою моделлю. При появі додаткової сауни на території району ризик зараження на оніхомікоз зростав на 26,8 %, а при збільшенні рН ґрунту на одиницю – зменшувався на 10,7 %.
- З’ясовано, що клінічно значущими предикторами швидкості ерадикації грибів є індекс КІОТОС, більш високі величини якого достовірно збільшували строки мікологічної негативації в 4,9 разу, та мікроциркуляторні розлади, наявність яких асоціювалася зі зростанням строків ерадикації збудника майже в 2,98 разу. Зростання величини індексу КІОТОС асоціювалося зі зниженням якості життя, зокрема, оцінки соціальних відносин, що пов’язано із негативним сприйняттям хворими більш вираженого ураження за локалізацією, площею та наявністю косметичного дефекту.
- Виявлено, що у хворих на оніхомікоз із наявними порушеннями мікроциркуляції переважали дистально-латеральна та проксимальна форми ураження нігтьової пластинки (92,9 %), а у 46,4 % пацієнтів – ураження більше ніж на дві третини, у зв’язку з чим індекс КІОТОС в 2 рази значуще перевищував аналогічний показник у осіб без порушення мікроциркуляції. Негативація результатів мікологічного дослідження у хворих на оніхомікоз стоп, які не мали мікроциркуляторних порушень, відбувалася в середньому на 2,6 місяця раніше, ніж при їх наявності, тоді як у разі ізольованого оніхомікозу кистей достовірного впливу мікроциркуляторних розладів на терміни мікологічної негативації виявлено не було.
- Запропоноване комплексне лікування хворих на оніхомікоз із залученням як антифунгальних засобів, так і засобів із диференційованим впливом на розлади мікроциркуляції, прискорювало регрес клінічних проявів оніхомікозу, сприяло достовірному збільшенню в 2 рази швидкості відростання нігтів кистей та стоп, забезпечувало мікологічну негативацію у 97,4 % хворих, що на 11,7 % більше, ніж у пацієнтів при традиційному лікуванні, а також дозволило поліпшити показник емоційної сфери, соціальної активності та DLQI у хворих експозиційної групи.
- Встановлено, у 71,4 % хворих відбулася негативація обох аналізів (і мікроскопії, і ПЛР), тоді як у 28,6 % хворих першим виявився негативним результат мікроскопії, а результат ПЛР тесту залишався позитивним. Середні строки мікологічної негативації за результатами мікроскопії цих хворих становили в середньому (12,07±3,1) тижня, що достовірно раніше – в середньому на 2,14 тижня, ніж за результатами ПЛР, специфічної до Т. rubrum, та ПЛР із панфунгальними праймерами ([14,21±4,5] тижня). Отримані дані свідчать про недоцільність використання лише методу ПЛР для контролю виліковності оніхомікозу.
РЕКОМЕНДАЦІЇ
- Для покращення якості життя існує необхідність виділення груп хворих, які мають коморбідні захворювання, оскільки їх наявність погіршує результати лікування та якість життя хворих.
- При клінічному обстеженні хворих на оніхомікоз та коморбідні стани, особливо при наявності тотального ураження нігтьової пластинки, необхідним є проведення лазерної допплерівської флоуметрії з метою виявлення розладів мікроциркуляції.
- Корекцію мікроциркуляторних порушень при проведенні антифунгальної терапії у хворих із спастичним гемодинамічним типом мікроциркуляції доцільно забезпечувати нафтидрофурилом гідроген оксалатом (енелбін) дозою 100–200 мг на добу, у пацієнтів із гіперемічним типом мікроциркуляції – діосміном/гесперидином у добовій дозі 2 таблетки на добу (у два прийоми). У разі застійно-стазичного типу мікроциркуляції необхідним є паралельне застосування нафтидрофурилу гідроген оксалату в комплексі з діосміном/гесперидином.
- При веденні хворих на оніхомікоз рекомендується спостереження за динамікою параметрів якості життя, як інформативного показника ефективності призначеної терапії.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Айзятулов Р. Ф. Этиология, патогенез, клиника и комплексная терапия микозов стоп, онихомикозов // Клінічна імунологія. Алергологія. Інфектологія. 2013. № 8. С. 38-42.
- Акмаева А. Р. Применение лазеров Q-Switched 1064/532 нм и ND: YAG: 1064 нм в лечении онихомикозов стоп // Российский журнал кожных и венерических болезней. 2015. Т. 18, № 3. С. 48-50.
- Болотная Л. А., Шмелькова Е. С. Оптимизация местной терапии при дерматофитиях // Український журнал дерматології, венерології, косметології. 2011. № 3 (42). С. 87-92.
- Боулинг Д. Диагностическая дерматоскопия. Иллюстрированное руководство / Пер. с англ.; под ред. А. А. Кубановой. М. : Изд. Панфилова; БИНОМ. Лаборатория знаний, 2013. 160 с.
- Бурова С. А. Опыт лечения онихомикозов кистей и стоп местными антимикотиками // Consilium medicum. Дерматология. 2015. № 1. С. 12-15.
- Бурова С. А. Особенности лечения грибковых инфекций кожи и ее придатков в группах риска // Клиническая дерматология и венерология. 2014. № 1. С. 42-46.
- Буянова О. В., Волошинович М. С. Клінічний досвід лікування хворих на оніхомікоз // Український журнал дерматології, венерології, косметології. 2008. № 2. С. 70-72.
- Васенова В. Ю., Чернов Д. Н., Бутов Ю. С. Некоторые аспекты психологического статуса больных онихомикозами // Российский журнал кожных и венерических болезней. 2007. № 2. С. 59-64.
- 9. Водопьянова Н. Е. Психодиагностика стресса. СПб. : Изд-во Питер, 2009. 336 с.
- Волкославська В. М. Про динаміку деяких показників стану шкірно-венерологічної допомоги за 2000-2015 рр. в Україні // Дерматологія та венерологія. 2016. № 3. С. 61-68.
- Дюдюн А. Д., Салей Е. А., Полион Н. Н. Комплексное лечение больных онихомикозом // Український журнал дерматології, венерології, косметології. 2015. № 1. С. 87-91.
- Использование метода ПЛР-диагностики у пациентов с микотической патологией / С. Г. Лыкова, С. В. Липатникова, О. Н. Гришаева и др. // Успехи медицинской микологии. 2006. № 8. С. 100-101.
- Касымов О. И., Салимов Б. М., Касымов А. О. Клинико-иммунологические особенности онихомикоза у лиц пожилого и старческого возрастов // Научно-практический журнал ТИППМК. 2012. № 2. С. 17-22.
- Калюжная Л. Д. Современные особенности клиники и лечения онихомикозов // Український медичний часопис. 2013. № 1. С. 45-48.
- Калюжная Л. Д. Терапия онихомикозов с применением тербинафина по схеме пульс-терапии // Український медичний часопис. 2013. № 4 (96). С. 75-77.
- Касихина Е. И., Яковлев А. Б. Онихомикозы // Лечащий врач. 2012. № 5. С.49-52.
- Кізіна І. Є. Вплив клініко-демографічних факторів та коморбідності на якість життя хворих на оніхомікоз // Дерматологія та венерологія. 2016. № 4 (74). С. 64-71.
- Кізіна І. Є. Диференційований підхід до комплексного лікування оніхомікозів із урахуванням коморбідних мікроциркуляторних порушень // Український журнал дерматології, венерології, косметології. 2017. № 1 (64). С. 52-58.
- Кізіна І. Є. Ефективність терапії хворих на оніхомікоз з використанням протигрибкових і ангіопротекторних препаратів // Дерматологія, косметологія, сексопатологія. 2017. № 1-2 (5). С. 14-19.
- Кізіна І. Є. Інформативність полімеразної ланцюгової реакції для діагностики, оцінки перебігу й результатів лікування оніхомікозу // Biomedical and biosocial anthropology. 2015. № 25. С. 169-172.
- Кізіна І. Є. Оніхомікоз у Вінницькій області: погляд на проблему через призму популяційного дослідження // Biomedical and biosocial antropology. 2014. № 23. С. 235- 238.
- Кізіна І. Є. Психологічна складова якості життя у хворих з оніхомікозом як критерій ефективності лікування // Дерматологія та венерологія. 2015. № 4. С. 50-57.
- Кобзарь А. И. Прикладная математическая статистика. Для инженеров и научных работников. М. : Физматлит, 2012. 816 с.
- Короленко В. В. Стан проблеми та сучасні підходи до ведення пацієнтів з оніхомікозами // Український журнал дерматології, венерології, косметології. 2012. № 3 (46). С. 118-123.
- Котрехова Л. П. Подходы к лечению онихомикоза у пациентов с коморбидными состояниями // Эффективная фармакотерапия. 2015. № 33. С. 44-45.
- Котрехова Л. П., Вашкевич А. А. Профилактика рецидива онихомикоза стоп 5 % лаком с аморолфином у больных, завершивших лечение с полным выздоровлением // Клиническая дерматология и венерология. 2013. № 6. С. 86-91.
- Кутасевич Я. Ф., Зимина Т. В. Дифференцированная терапия как современный метод лечения больных онихомикозом // Дерматологія та венерологія. 2002. № 1. С. 28-29.
- Літус О. І., Кізіна І. Є. Показники лазерної допплерівської флоуметрії в оцінці мікроциркуляції при лікуванні оніхомікозів // Вісник Вінницького національного університету. 2016. Т. 20, № 1 (1). С. 81-85.
- Лыкова С., Немчанинова Л., Спицына А. Онихомикоз: лечение и профилактика // Врач. 2016. № 3. С. 11-16.
- Матушевская Е. В., Свирищевская Е. В. Нафтифин в терапии грибковых инфекций кожи: 40 лет успеха // Вестник дерматологии и венерологии. 2014. № 2. С. 72-77.
- Местная и комбинированная терапия онихомикозов. Пособие для врачей / Ю. В. Сергеев, Е. В. Мокина, А. Ю. Сергеев и др. М. : Нац. акад. микол. 2013. 40 с.
- Микозы стоп: профилактика и лечение. В поисках эффективной парадигмы / Ю. Н. Моцаренко, Е. Л. Верба, A. M. Глоба и др. // Український журнал дерматології, венерології, косметології. 2004. № 1. С. 46-48.
- Насколько точна «классическая» лабораторная диагностика онихомикозов? / А. Ю. Сергеев, Ю. В. Сергеев, В. Е. Маликов, Н. Е. Жарикова // Успехи медицинской микологии. 2006. № 8. С. 87-89.
- Нові можливості лікування грибкових уражень у пацієнтів з хронічними дерматозами. Аналіз спостережень у динаміці / О. І. Літус, Л. С. Осипова, В. І. Літус, Т. В. Сольська // Укр. журн. дерматології, венерології, косметології. 2006. № 2. С. 75-79.
- Новые возможности местного лечения пациентов с онихомикозом / А. Д. Дюдюн, Е. А. Салий, Н. Н. Полион, В. В. Горбунцов // Український журнал дерматології, венерології, косметології. 2013. № 2. С. 149-153.
- Новий молекулярно-генетичний метод, що застосовується для діагностики оніхомікозу / Я. Ф. Кутасевич, І. О. Олійник, І. О. П’ятикоп та ін. // Дерматологія та венерологія. 2015. № 3. С. 81-82.
- Онихомикозы в Украине / А. Руденко, Э. Коваль, В. Полищук, Е. Заплавская // Ліки України. 2000. № 6 (35). С. 22-24.
- Онихомикоз у жителей Украины (диагностика, этиология, эпидемиология, лечение) / А. В. Руденко, Э. З. Коваль, П. П. Рижко, Э. А. Заплавская. К. : ТСК, 2007. 248 с.
- Особенности терапии онихомикозов на фоне псориаза / Л. Р. Сакания, Л. Ш. Тогоева, И. В. Оленич и др. // Клиническая дерматология и венерология. 2017. Т. 16, № 4. С. 62-65.
- Опыт успешного лечения онихомикозов итраконазолом (Итразол®) / Н. Н. Потекаев, О. В. Жукова, А. А. Цыкин, Н. С. Сирмайс // Русский медицинский журнал. 2014. № 24. С. 1790-1765.
- Первый опыт прямой ПЛР диагностики дерматофитии ногтей / А. Ю. Сергеев, П. Г. Богуш, Н. Ю. Земляная и др. // Успехи медицинской микологии. 2004. № 3. С. 19-21.
- Потекаев Н. Н., Жуковский Р. О., Жукова О. В. Онихомикоз : справочник. М. : Медиа Сфера, 2009. 92 с.
- Применение ПЦР для выявления ДНК грибов в образцах ногтей у больных онихомикозом / Я. Ф. Кутасевич, А. П. Белозоров, А. С. Чеховская и др. // Дерматологія та венерологія. 2014. – № 3 (65). С. 43-50.
- Проценко Т. В., Проценко О. А. Опыт лечения онихомикоза // Український журнал дерматології, венерології, косметології. 2013. № 3 (50). С. 112-115.
- Рецидивы, реинфекция и эффективность лечения онихомикозов в 2013 г. / А. Ю. Сергеев, Е. В. Мокина, Н. В. Савченко и др. // Иммунопатология, аллергология, инфектология. 2013. № 3. С. 90-99.
- Рукавишникова В. М. Микозы стоп. М. : Элис-Ком, 2003. 334 с.
- Савоськина В. А., Бильченко А. А. Дерматоскопическая картина и гистологические корреляции при некоторых дерматологических заболеваниях // Клінічна імунологія. Алергологія. Інфектологія. 2013. № 8. С. 9-22.
- Салей Е. А. Состояние микроциркулярного русла у больных онихомикозом // Дерматовенерология. Косметология. Сексопатология. 2015. № 3-4. С. 202-209.
- Сергеев А. Ю. Молекулярная диагностика онихомикозов: опыт внедрения отечественной ПЛР-системы обнаружения возбудителей дерматофитии ногтей. Иммунопатология, аллергология, инфектология. 2007. № 3. С. 17-24.
- Сергеев Ю. В. Орунгал: рациональная терапия онихомикозов // Вестник дерматологии и венерологии. 1997. № 1. С. 56-59.
- Сергеев Ю. В., Сергеев А. Ю. Порядок Onygenales и медицинская микология. Новое в систематике и номенклатуре грибов / под. ред. Ю. Т. Дьякова и Ю. В. Сергеева. М., 2003. С. 164-192.
- Сергеев А. Ю., Сергеев Ю. В. Грибковые инфекции: Руководство для врачей. М. : Бином, 2008. 280 с.
- Серёгина Е. И., Некипелова А. В. Современная терапия онихомикозов : [материалы Итоговой науч.-практ. конф. интернов и ординаторов и Конкурса молодых учёных в рамках XII Междунар. конгр. “Доказательная медицина – основа современного здравоохранения”, г. Хабаровск, 31 мая 2013 г.] / Ин-т повышения квалификации специалистов здравоохранения м-ва здравоохранения Хабар. края, г. Хабаровск // Здравоохранение Дал. Востока. 2013. № 2. Ст. 33. С. 103-104.
- Соколова Т. В., Малярчук А. П., Малярчук Т. А. Результаты многоцентрового исследования по изучению поверхностных микозов кожи в регионах Российской Федерации и оценке эффективности их лечения сертаконазолом // Клиническая дерматология и венерология. 2013. № 5. С. 28-39.
- Соколова Т. В., Малярчук А. П., Газарян О. Л. Эпидермофития крупных складок в практике дерматолога // Российский журнал кожных и венерических болезней. 2014. Т. 17, № 4. С. 36-42.
- Сонин Д. Б. Опыт применения препаратов аморолфина в терапии онихомикоза // Consilium medicum. 2015. Прил. Дерматология № 1. С. 42-46.
- Суворов А. П., Суворов С. А. Экспресс-диагностика онихомикозов // Современная микология в России. Тезисы докладов І Съезда микологов России. 2008. Т. 1. С. 343-344.
- Ускладнений оніхомікоз у хворих з метаболічним синдромом: клінічні аспекти девіацій лабораторних ознак ендотеліальної дисфункції та полігіповітамінозу / О. Н. Надашкевич, А. Р. Вергун, З. М. Кіт, О. М. Вергун // Міжнародний ендокринологічний журнал. 2015. № 5. С. 116-120.
- Файзуллина Е. В. Современные тенденции эпидемиологии онихомикоза // Проблемы медицинской микологии. 2014. Т. 16, № 1. С. 18-22.
- Фанталова Е. Б. Диагностика и психотерапия внутреннего конфликта // Самара : Издательский дом БАХРАХ-М, 2001. 128 с.
- Федотов В. П., Горбунцов В. В. Грибы как осложняющий фактор некоторых дерматозов (патогенез, клинические особенности и терапия) // Дерматовенерология. Косметология. Сексопатология. 2008. № 1/2. С. 295-296.
- Цыкин A. A., Иванов О. Л., Ломоносов К. М. Диагностика онихомикозов с использованием ПЛР // Современная микология в России. 2008. Т. 2. С. 464-465.
- Цыкин А. А. Онихомикозы: современное состояние проблемы // Consilium medicum. 2013. № 1. С. 9-12.
- Чеховська Г. С. Оніхомікози: рання діагностика та комплексне лікування з урахуванням структурних змін нігтьових пластинок і виду збудника. Дисертація канд. мед. наук: 14.01.20, Держ. установа “Ін-т дерматології та венерології НАМН України”. Харків, 2014. 160 с.
- Чеховська Г. С. Структурные изменения ногтевых пластин в процессе комплексного лечения больных онихомикозами // Дерматовенерология. Косметология. Сексопатология. 2014. № 1-4. С. 172-178.
- Юцковский А. Д., Федотов В. П. Иммунология дерматофитий. М. : Вузовская книга, 2013. 144 с.
- Этиология онихомикозов у жителей Украины / А. Руденко, Э. Коваль, Е. Заплавская, В. Полищук // Ліки України. 2000. № 10 (39). С. 52-54.
- Эффективность комплексного, комбинированного лечения больных онихомикозом / Е. А. Салей, А. Д. Дюдюн, В. В. Гладышев, В. В. Луць // Дерматовенерология. Косметология. Сексопатология. 2014. № 1-4. С. 186-192.
- Яковлев А. Б. Современные концепции терапии микроспории и трихофитии // Российский журнал кожных и венерических болезней. 2014. № 6. С. 22-29.
- A comparative study of three extraction protocols of DNA from nails: Potential use in the diagnosis of onychomycoses / T. Kotrotsiou, A. Chatzimichaloglou, A. Nasr et al. // Mycoses. 2017. Vol. 60, № 3. P. 183-187.
- A pilot single centre, double blind, placebo controlled, randomized, parallel study of Calmagen® dermaceutical cream and lotion for the topical treatment of tinea and onychomycosis / M. Parekh, G. Ramaiah, P. Pashilkar et al. // BMC Complement Altern Med. 2017. Vol. 17, № 1. P. 464.
- An investigation of how fungal infection influences drug penetration through onychomycosis patient’s nail plates / W. J. McAuley, S. A. Jones, M. J. Traynor et al. // Eur. J. Pharm. Biopharm. 2016. Vol. 102, № 2. P. 178-184.
- An observational and descriptive study of the epidemiology of and therapeutic approach to onychomycosis in dermatology offices in Brazil / N. Di Chiacchio, M. V. Suarez, C. L. Madeira , W. R. Loureiro // An Bras Dermatol. 2013. Vol. 88, Suppl. 1. P. 3-11.
- Anselin L., Bera A. Spatial dependence in linear regression models, with an introduction to spatial econometrics. In A Ullah, D Giles (eds), Handbook of applied economic statistics // New York : Marcel Dekker, 1998. Р. 237-290.
- Antifungal agents for onychomycosis: new treatment strategies to improve safety / L. T. Zane, S. Chanda, D. Coronado et al. // J. Dermatol. Online J. 2016. Vol. 22, № 3. P. 133-139.
- Arnold B., Kianifard F., Tavakkol A. A comparison of KOH and culture results from two mycology laboratories for the diagnosis of onychomycosis during a randomized, multicenter clinical trial: a subset study // J Am Podiatr Med Assoc. 2005. Vol. 95, № 4. P. 421-423.
- Ayanlowo O., Oladele R. O. Onychomycosis: updates and management challenges. A review // Niger Postgrad Med J. 2014. Vol. 21, № 2. P. 185-191.
- Baran R., Hay R. J. New clinical classification for onychomycoses // J. Mycol Med. 2014. Vol. 24, № 4. P. 247-260.
- Baran R., Chabasse D. Onychomycosis, what is new in 2014? // J. Mycol. Med. 2014. Vol. 24, № 4. P. 245-246.
- Bernhardt M. Onychomycosis // Skinmed. 2015. Vol. 13, № 3. P. 240.
- British Association of Dermatologists’ guidelines for the management of onychomycosis 2014 / M. Ameen, J. T. Lear, V. Madan et al. // Br. J. Dermatol. 2014. Vol. 171, № 5. P. 937-958.
- Building statistical models to analyse species distributions. In J Clark, A Gelfand (eds), Hierarchical modelling for the environmental sciences, statistical methods and applications / A. Gelfand, A. Latimer, S. Wu, J. Silander. Oxford: Oxford University Press, 2005. P. 33-50.
- Bunyaratavej S., Pattanaprichakul P., Leeyaphan C. et al. Onychomycosis: A study of self-recognition by patients and quality of life // Indian J. Dermatol. Venereol. Leprol. 2015. Vol. 81, № 3. P. 270-274.
- Causative agents of superficial mycoses isolated in Dakar, Senegal: Retrospective study from 2011 to 2015 / K. Diongue, M. A. Diallo, M. Ndiaye et al. // J. Mycol. Med. 2016. Vol. 26, № 4. P. 368-376.
- 85. Chabasse D., Pihet M. Onychomycoses due to molds // J Mycol Med. 2014. Vol. 24, № 4. P. 261-268.
- Clinical and mycological characteristics of onychomycosis due to Candida at Institut Pasteur of Côte d’Ivoire / K. E. Angora, A. Ira-Bonouman, A. H. Vanga-Bosson et al. // J. Mycol. Med. 2017. pii: S1156-5233(17)30221-4. [Epub ahead of print].
- Clinical evaluation of a novel commercial multiplex-based PCR diagnostic test for differential diagnosis of dermatomycoses / L. Mehlig, C. Garve, A. Ritschel et al. // Mycoses. 2014. Vol. 57, № 1. P. 27-34.
- Clinical trial designs for topical antifungal treatments of onychomycosis and implications on clinical practice / P. Rich, T. C. Vlahovic, W. S. Joseph et al. // Cutis. 2017. Vol. 100, № 4. P. 259-264.
- 89. Comparative study of direct polymerase chain reaction, microscopic examination and culture-based morphological methods for detection and identification of dermatophytes in nail and skin samples / T. Uchida, K. Makimura, K. Ishihara et al. // J Dermatol. 2009. Vol. 36, № 4. P. 202-208.
- Comparison of diagnostic methods for onychomycosis, and proposal of a diagnostic algorithm / M. Y. Jung, J. H. Shim, J. H. Lee et al. // Clin. Exp. Dermatol. 2015. Vol. 40, № 1. P. 479-484.
- Comparison of direct smear, culture and histology for the diagnosis of onychomycosis / M. L. Karimzadegan-Nia, A. Mir-Amin-Mohammadi, N. Bouzari, A. Firooz // J Dermatol. 2007. Vol. 48, № 1. P. 18-21.
- Complementary role of a polymerase chain reaction test in the diagnosis of onychomycosis / N. S. Chandran, J. Y. Pan, Z. A. Pramono et al. // Australas J Dermatol. 2013. Vol. 54, № 2. P. 105-108.
- Cook-Bolden F. E., Lin T. Efinaconazole solution 10 % for treatment of toenail onychomycosis in Latino patients // Cutis. 2017. Vol. 99, № 4. P. 286-289.
- Cost-effectiveness of confirmatory testing before treatment of onychomycosis / A. Mikailov, J. Cohen, C. Joyce et al. // JAMA Dermatology. 2015. Vol. 152, № 1. P. 276-281.
- Current and emerging options in the treatment of onychomycosis / B. Elewski, D. Pariser, P. Rich, R. K. Scher // Semin. Cutan. Med. Surg. 2013. Vol. 32, № 3. P. 9-12.
- Del Rosso J. Q. The role of topical antifungal therapy for onychomycosis and the emergence of newer agents // J Clin Aesthet Dermatol. 2014. Vol. 7, № 7. P. 10-18.
- Dermoscopic patterns in patients with a clinical diagnosis of onychomycosis-results of a prospective study including data of potassium hydroxide (KOH) and culture examination / M. A. Jesus-Silva, R. Fernandez-Martinez, R. Roldan-Marin et al. // Dermatol. Pract. and Concept. 2015. Vol. 5, № 1. P. 39-44.
- Dermoscopy in general dermatology / A. Lallas, I. Zalaudek, G. Argenziano et al. // Dermatol. Clin. 2013. Vol. 31, №. 4. P. 679-694.
- Descriptive analysis of mycological examination of patients with onychomycosis treated in private practice / J. V. Veasey, F. Nappi, C. Zaitz, L. H. Muramatu // An. Bras. Dermatol. 2017. Vol. 92, № 1. P. 134-136.
- Detection and differentiation of causative fungi of onychomycosis using PCR amplification and restriction enzyme analysis / S. C. Baek, H. J. Chae, D. Houh et al. // Int J Dermatol. 1998. Vol. 37, № 9. P. 682-686.
- Development and Evaluation of a Novel Real-Time PCR for Pan-Dermatophyte Detection in Nail Specimens / J. Gong, M. Ran, X. Wang et al. // Mycopathologia. 2016. Vol. 181, № 1-2. P. 51-57.
- Development of an oligonucleotide probe specific for Trichophyton rubrum / M. El Fari, H. J. Tietz, W. Presber et al. // Br J Dermatol. 1999. Vol. 141, № 2. P. 240-245.
- Diagnosis and Management of Onychomycosis Perspectives from a Joint Podiatric Medicine-Dermatology Roundtable / T. C. Vlahovic, W. S. Joseph, R. K. Scher et al. // J. Am. Podiatr. Med. Assoc. 2016. Vol. 106, № 2. P. 155-162.
- Diagnosis, clinical implications, and complications of onychomycosis / P. Rich, B. Elewski, R. K. Scher, D. Pariser // Semin Cutan Med Surg. 2013. Vol. 32, 2 Suppl. 1. S5-8.
- Diagnostic PCR of dermatophytes – an overview / Y. Gräser, V. Czaika, T. Ohst et al. // J Dtsch Dermatol Ges. 2012. Vol. 10, № 10. P. 721-726.
- 106. Difonzo E. M., Scarfì F., Galeone M. New formulation for topical treatment of onychomycoses // G. Ital. Dermatol. Venereol. 2017. Vol. 152, № 5. P. 432-435.
- Ding J., Li J., Liu Z., Tan Z. Clinical identification of common species of dermatophytes by PCR and PCR-RFLP // J Huazhong Univ Sei Technolog Med Sei. 2004. Vol. 24, № 6. P. 642-644.
- Direct detection of dermatophytes in skin samples; based on sequences of the chitin synthase 1 (CH SI) gene / R. Kano, A. Hirai, M. Muramatsu et al. // J Vet Med Sci. 2003. Vol. 65, № 2. P. 267-270.
- Drug delivery to the nail: therapeutic options and challenges for onychomycosis / B. S. Barot, P. B. Parejiya, H. K. Patel et al. // Crit Rev Ther Drug Carrier Syst. 2014. Vol. 31, № 6. P. 459-494.
110. Eba M. Onychomycosis in diabetic patients in Fako Division of Cameroon: prevalence, causative agents, associated factors and antifungal sensitivity patterns / M. Eba, A. L. Njunda, R. N. Mouliom et al. // J. BMC Res Notes. 2016. Vol. 22, № 9 (1). P. 494. E
111. Efficacy of topical resin lacquer, amorolfine and oral terbinafine for treating toenail onychomycosis: a prospective, randomized, controlled, investigator-blinded, parallel-group clinical trial / T. Auvinen, R. Tiihonen, M. Soini et al. // Br. J. Dermatol. 2015. Vol. 173, № 4. P. 940-948.
112. Eisman S., Sinclair R. Fungal nail infection: diagnosis and management // BMJ. 2014. Vol. 348, № 1. P. 1800.
113. Elewski B. E., Tosti A. J. Risk Factors and Comorbidities for Onychomycosis: Implications for Treatment with Topical Therapy // Clin. Aesthet. Dermatol. 2015. Vol. 8, № 11. P. 38-42.
114. Elewski B. E., , Vlahovic T. C., Korotzer A. Topical Treatment for Onychomycosis: Is it More Effective than the Clinical Data Suggests? // J. Clin. Aesthet. Dermatol. 2016. Vol. 9, № 11. P. 34-39.
115. Ellis D. H. Diagnosis of onychomycosis made simple // J Am Acad Dermatol. 1999. Vol. 40, 6Pt. 2. S3-8.
116. Elsayed M. M. Development of topical therapeutics for management of onychomycosis and other nail disorders: a pharmaceutical perspective // Control Release. 2015. Vol. 199, № 1. P. 132-144.
117. Epidemiologic Analysis of Onychomycosis in the San Diego Pediatric Population / C. R. Totri, S. Feldstein, S. Admani et al. // Pediatr Dermatol. 2017. Vol. 34, № 1. P. 46-49.
118. Epidemiological study of onychomycosis in older adults with onychodystrophy / E. Cozzani, A. F. Agnoletti, S. Speziari et al. // Geriatr Gerontol Int. 2016. Vol. 16, № 4. P. 486-491.
119. Epidemiology of dermatomycoses in Kerman province, southeast of Iran: A 10-years retrospective study (2004-2014) / S. Salari, S. A. Ayatollahi Mousavi, S. Hadizadeh, A. Izadi // Microb. Pathog. 2017. Vol. 110. P. 561-567.
120. Epidemiology of onychomycosis in Italy: prevalence data and risk factor identification / M. Papini, B. M. Piraccini, E. Difonzo, A. Brunoro // Mycoses. 2015. Vol. 58, № 11. P. 659-664.
121. Epidemiology of onychomycosis in Serbia: a laboratory-based survey and risk factor identification / E. Dubljanin, A. Džamić, I. Vujčić et al. // Mycoses. 2017. Vol. 60, № 1. P. 25-32.
122. Evaluation of a commercial PCR test for the diagnosis of dermatophyte nail infections / A. Spiliopoulou, C. Bartzavali, E. Jelastopulu et al. // J. Med. Microbiol. 2015. Vol. 64, Pt. 1. P. 25-31.
123. Evaluation of a new fluorescent reagent, fluorescent brightener 85, for the diagnosis of suspected onychomycosis compared with potassium hydroxide / X. Yue, A. Wang, H. Wang et al. // Mycoses. 2017. [Epub ahead of print].
124. Evaluation of PCR for the diagnosis of dermatophytes in nail specimens from patients with suspected onychomycosis / N. M. Luk, M. Hui, T. S. Cheng et al. // Clin Exp Dermatol. 2012. Vol. 37, № 3. P. 230-234.
125. Examining the importance of laboratory and diagnostic testing when treating and diagnosing onychomycosis / M. Ghannoum, P. Mukherjee, N. Isham et al. // Int. J. Dermatol. 2017. Vol. 57, № 2. P. 131-138.
126. Fast, simple and highly sensitive double-rounded polymerase chain reaction assay to detect medically relevant fungi in dermatological specimens / L. Turin, F. Riva, G. Galbiati, T. Cainelli // Eur J Clin Invest. 2002. Vol. 30, № 6. P. 511-518.
127. Feuilhade de Chauvin M. New diagnostic techniques // J Eur Acad Dermatol Venereol. 2005. Vol. 19, Suppl. 1.– P. 20-24.
128. Finlay A. Y., Khan G. K. Dermatology Life Quality Index (DLQI) – a simple practical measure for routine clinical use // Clin. Exp. Dermatol. 1994. Vol. 19, № 3. P. 210-216.
129. Ghannoum M., Isham N., Catalano V. A Second Look at Efficacy Criteria for Onychomycosis: Clinical and Mycological Cure // Br. J. Dermatol. 2014. Vol. 170, №. 1. P. 182-187.
130. Ghannoum M., Isham N. Fungal Nail Infections (Onychomycosis): A Never-Ending Story? // PLoS Pathog. 2014. Vol. 10, № 6. P. 1004-1005.
131. Gupta A. K., Studholme C. How do we measure efficacy of therapy in onychomycosis: Patient, physician, and regulatory perspectives // J Dermatolog Treat. 2016. Vol. 8, № 1. P. 1-7.
132. Gupta A. K., Cernea M. How effective is efinaconazole in the management of onychomycosis? // Expert Opin Pharmacother. 2016. Vol. 17, № 4. P. 611-618.
133. Gupta A. K., Paquet M. Management of Onychomycosis in Canada in 2014 // J. Cutan. Med. Surg. 2015. Vol. 19, № 3. P. 260-273.
134. Gupta A. K., Daigle D., Foley K. A. Network Meta-Analysis of Onychomycosis Treatments // Skin Appendage Disord. 2015. Vol. 1, № 2. P. 74-81.
135. Gupta A. K., Simpson F. C. New pharmacotherapy for the treatment of onychomycosis: an update // Expert Opin Pharmacother. 2015. Vol. 16, № 2. P. 227-236.
137. Gupta A. K., Versteeg S. G., Shear N. H. Onychomycosis in the 21st Century: An Update on Diagnosis, Epidemiology, and Treatment // J. Cutan. Med. Surg. 2017. Vol. 21, № 6. P. 525-539.
138. Gupta A. K., Nakrieko K. A. Onychomycosis Infections Do Polymerase Chain Reaction and Culture Reports Agree? // J. Am. Podiatr. Med. Assoc. 2017. Vol. 107, № 4. P. 280-286.
139. Gupta A. K., Simpson F. C. Routes of drug delivery into the nail apparatus: Implications for the efficacy of topical nail solutions in onychomycosis // J Dermatolog Treat. 2016. Vol. 27, № 1. P. 2-4.
140. Gupta A. K., Daigle D., Foley K. A. The prevalence of culture-confirmed toenail onychomycosis in at-risk patient populations // J Eur Acad Dermatol Venereol. 2015. Vol. 29, № 6. P. 1039-1044.
141. Gupta A. K., Daigle D., Foley K. A. Topical therapy for toenail onychomycosis: an evidence-based review //Am. J. Clin. Dermatol. 2014. Vol. 15, № 6. P. 489-502.
142. Gupta A. K., Daigle D., Carvieln J. L. The role of biofilms in onychomycosis //J Am Acad Dermatol. 2016. Vol. 74, № 6. P. 1241-1246.
143. Gupta A. K., Daigle D., Paquet M. Therapies for onychomycosis a systematic review and network meta-analysis of mycological cure // J Am Podiatr Med Assoc. 2015. Vol. 105, № 4. P. 357-266.
144. Identification of common dermatophytes (Trichophyton, Microsporum, Epidermophyton) using polymerase chain reactions / Y. Graser, M. el Fari, W. Presber et al. // Br. J. Dermatol. 1998. Vol. 138, № 4. P. 576-582.
145. Identification of dermatophyte species causing onychomycosis and tinea pedis by MALDI-TOF mass spectrometry / M. Erhard, U. C. Hipler, A. Burmester et al. // Exp Dermatol. 2008. Vol. 17, № 4. P. 356-361.
146. In vitro antifungal activity of organic compounds derived from amino alcohols against onychomycosis / C. A. Caneschi, A. M. Almeida, F. J. Martins et al. // Braz. J. Microbiol. 2017. Vol. 48, № 3. P. 476-482.
147. In Vitro Human Onychopharmacokinetic and Pharmacodynamic Analyses of ME1111, a New Topical Agent for Onychomycosis / N. Kubota-Ishida, N. Takei-Masuda, K. Kaneda et al. // Antimicrob. Agents Chemother. 2017. Vol. 62, № 1. P. 779-817.
148. Kallis P., Tosti A. Onychomycosis and Onychomatricoma // Skin Appendage Disord. 2016. Vol. 1, № 4. P. 209-212.
149. Kanzler M. H. Reevaluating the Need for Laboratory Testing in the Treatment of Onychomycosis: Safety and Cost-effectiveness Considerations // JAMA Dermatol. 2016. Vol. 152, № 3. P. 263-264.
150. Kizina I. E. Geostatistical modeling of onychomycosis incidence rates in Vinnitska oblast // «Дерматовенерология. Косметология». 2015. № 2. С. 10-17.
151. Lagrew J. P. A financial perspective on the topical treatment of onychomycosis // J. Am. Acad. Dermatol. 2016. Vol. 75, № 1. P. 37.
152. Laser treatment of onychomycosis due to Neoscytalidium dimidiatum: An open prospective study / A. P. Leverone, D. A. Guimarães, A. R. Bernardes-Engemann, R. Orofino-Costa // Med. Mycol. 2017. Vol. 56, № 1. P. 44-50.
153. Lipner S. R., Scher R. K. Efinaconazole 10 % topical solution for the topical treatment of onychomycosis of the toenail // Expert Rev Clin Pharmacol. 2015. Vol. 8, № 6. P. 719-731.
154. Lipner S. R., Friedman G., Scher R. K. Pilot study to evaluate a plasma device for the treatment of onychomycosis // Clin. Exp. Dermatol. 2017. Vol. 42, № 3. P. 295-298.
155. Litz C. E., Cavagnolo R. Z. Polymerase chain reaction in the diagnosis of onychomycosis: a large, single-institute study // Br. J. Dermatol. 2015. Vol. 163, № 3. P. 511-514.
156. Maleszka R., Ratajczak-Stefanska V., Mikulska D. The importance of mycological investigations in diagnostics of nail changes // Rocz Akad Med Bialymst. 2005. Vol. 50, Suppl. 1. P. 36-38.
157. Management of mycoses in daily practice / L. Drago, G. Micali, M. Papini et al. // G. Ital. Dermatol. Venereol. 2017. Vol. 152, № 6. P. 642-650.
158. Mayser P., Handrick W., Nenoff P. Sports-associated dermatophytoses : An overview // Hautarzt. 2016. Vol. 67, № 9. P. 680-688.
159. Molecular biological detection of dermatophytes in clinical samples when onychomycosis or tinea pedis is suspected. A prospective study comparing conventional dermatomycological diagnostics and polymerase chain reaction / I. Winter, S. Uhrlaß, C. Krüger et al. // Hautarzt. 2013. Vol. 64, № 4. P. 283-289.
160. Molecular diagnosis of onychomycosis / D. Petinataud, S. Berger, N. Contet-Audonneau, M. Machouart // J. Mycol. Med. 2014. Vol. 24, № 4. P. 287-295.
161. Molecular epidemiology, phylogeny and evolution of dermatophytes / C. Cafarchia, R. Iatta, M. S. Latrofa et al. // Infect Genet Evol. 2013. Vol. 20, № 1. P. 336-351.
162. Molecular Identification of Candida Species Isolated from Onychomycosis in Shanghai, China / X. Feng, B. Ling, X. Yang et al. // Mycopathologia. 2015. Vol. 180, № 5-6. P. 365-371.
163. Multilaboratory testing of antifungal drug combinations against Candida species and Aspergillus fumigatus: utility of 100 percent inhibition as the endpoint / P. Ren, M. Luo, S. Lin et al. // Antimicrob Agents Chemother. 2015. Vol. 59, № 3. P. 1759-1766.
163. Multiplex PCR assay for the detection of common dermatophyte nail infections / I. Dhib, A. Fathallah, A Yaacoub et al. // Mycoses. 2014. Vol. 57, № 1. P. 19-26.
164. Mycological diagnosis of onychomycosis / D. Chabasse, M. Pihet // J. Mycol. Med. 2014. Vol. 24, № 4. P. 269-278.
165. Mycological profile of hand onychomycosis amongs “Garba” sellers in Abidjan (Côte d’Ivoire) / P. C. M. Kiki-Barro, A. Konaté, F. K. Kassi et al. // J. Mycol. Med. 2017. Vol. 27, № 4. P. 543-548.
166. Mycology – an update. Part 1: Dermatomycoses: causative agents, epidemiology and pathogenesis / P. Nenoff, C. Krüger, G. Ginter-Hanselmayer, H. J. Tietz // J. Dtsch. Dermatol. Ges. 2014. Vol. 12, № 3. P. 188-209.
167. Mycology of Onychomycosis: A 5-year retrospective review (2011–2015) in Hospital Kuala Lumpur / R. Ramalingam, S. Kunalan, M. M. Tang et al. // Med. J. Malaysia. 2017. Vol. 72, № 3. P. 190-192.
168. Nenoff P., Ginter-Hanselmayer G., Tietz H. J. Fungal nail infections – an update: Part 1 – Prevalence, epidemiology, predisposing conditions, and differential diagnosis // Hautarzt. 2012. Vol. 63, № 1. P. 30-38.
169. Onychomycosis Diagnosis and Management: Perspectives from a Joint Dermatology-Podiatry Roundtable / R. K. Scher, A. Tosti, W. S. Joseph et al. // J. Drugs Dermatol. 2015. Vol. 14, № 9. P. 1016-1021.
170. Onychomycosis in Israel: epidemiological aspects / R. Segal, A. Shemer, M. Hochberg et al. // Mycoses. 2015. Vol. 58, № 3. P. 133-139.
171. Onychomycosis treatment in the United States / A. Taheri, S. A. Davis, K. E. Huang, S. R. Feldman // Cutis. 2015. Vol. 95, № 10. P. 15-21.
172. Onychomycosis: Does Cure Equate to Treatment Success? / B. E. Elewski, A. K. Gupta, T. Rosen et al. // Drugs Dermatol. 2016. Vol. 15, № 5. P. 626-632.
173. Onychomycosis: epidemiology, diagnosis, and treatment in a changing landscape / T. Rosen, S. F. Friedlander, L. Kircik et al. // Drugs Dermatol. 2015. Vol. 14, № 3. P. 223-33.
174. Onychomycosis: health-related quality of life considerations / J. W. Shaw, V. N. Joish, S. J. Coons et al. // Pharmacoeconomics. 2002. Vol. 20, № 1. P. 23-36.
175. Onychomycosis: modern diagnostic and treatment approaches / G. Tchernev, P. K. Penev, P. Nenoff et al. // Wien. Med. Wochenschr. 2013. Vol. 163, № 1-2. P. 1-12.
176. Onychomycosis: Strategies to Minimize Recurrence / A. K. Gupta, B. E. Elewski, T. Rosen et al. // J Drugs Dermatol. 2016. Vol. 15, № 3. P. 279-282.
177. Optimising the diagnostic strategy for onychomycosis from sample collection to FUNGAL identification evaluation of a diagnostic kit for real-time PCR / D. Petinataud, S. Berger, C. Ferdynus et al. // Mycoses. 2016. Vol. 59, № 5. P. 304-311.
178. Optimizing topical antifungal therapy for superficial cutaneous fungal infections: focus on topical naftifine for cutaneous dermatophytosis / J. Q. Del Rosso, L. H. Kircik // J. Drugs. Dermatol. 2013. Vol. 12, №11. P. 165-171.
179. Pajaziti L., Vasili E. Treatment of Onychomycosis – a Clinical Study // Med. Arch. 2015. Vol. 69, № 3. P. 173-176.
180. Performance of mycology and histopathology tests for the diagnosis of toenail onychomycosis due to filamentous fungi: Dermatophyte and non-dermatophyte moulds / F. G. Lavorato, D. A. Guimarães, M. G. Premazzi et al. // Mycoses. 2017. Vol. 60, № 9. P. 587-593.
181. Photoletter to the editor: Dermoscopy for discriminating between pityriasis rubra pilaris and psoriasis / A. Lallas, Z. Apalla, A. Karteridou, I. Lefaki // J. Dermatol. Case Rep. 2013. Vol. 7, № 1. P. 20-22.
182. Pollak R. A., Ilie C. Long-Term Follow-up of Onychomycosis Patients Treated With Efinaconazole // J. Drugs Dermatol. 2017. Vol. 16, № 12. P. 1269-1273.
183. Polymerase chain reaction in the diagnosis of onychomycosis / E. Area, M. A. Saracli, A. Akar et al. // Eur J Dermatol. 2004. Vol. 14, № 1. P. 52-55.
184. Polymerase chain reaction in the diagnosis of onychomycosis: a large, single-institute study / C. E. Litz, R. Z. Cavagnolo // Br. J. Dermatol. 2015. Vol. 163, № 3. P. 511-514.
185. Polymerase chain reaction-based detection of dermatophyte DNA with a fungus-specific primer system / M. Bock, M. Maiwald, R. Kappe et al. // Mycoses. 1994. Vol. 37, № 3-4. P. 79-84.
186. Prevalence and epidemiology of tinea pedis and toenail onychomycosis and antifungal susceptibility of the causative agents in patients with type 2 diabetes in Turkey / Y. Oz, I. Qoraan, A. Oz, I. Balta // Int. J. Dermatol. 2017. Vol. 56, № 1. P. 68-74.
187. Prognostic Factors for Complete Cure Following Treatment of Mild and Moderate Toenail Onychomycosis With Efinaconazole Topical Solution 10 / N. J. Jellinek, A. Korotzer // J. Drugs Dermatol. 2015. Vol. 14, № 8. P. 871-875.
188. Queller J. N., Bhatia N. The Dermatologist’s Approach to Onychomycosis // J. Fungi (Basel). 2015. Vol. 1, № 2. P. 173-184.
189. Qureshi H., Ormsby H. A., Kapadia N. Effects of modified sample collection technique on fuigal culture yield: nail clipping/scraping versus microdrill // J Pax Med Assoc. 2004. Vol. 54, № 6. P. 301-305.
190. Ranawaka R. R., de Silva S. H. Factors influencing cure rates of non-dermatophyte mold and Candida onychomycosis: analysis of outcomes in 81 patients who completed treatment // Int. J. Dermatol. 2017. Vol. 56, № 2. P. 202-208.
191. Rapid real-time diagnostic PCR for Trichophyton rubrum and Trichophyton mentagrophytes in patients with tinea unguium and tinea pedis using specific fluorescent probes / Y. Miyajima, K. Satoh, T. Uchida et al. // J Dermatol Sci. 2013. Vol. 69, № 3. P. 229-235.
192. Restriction fragment length polymorphism analysis of ribosomal DNA interger ic regior s is useful for differentiating strains of Trichophyton mentagrophytes / Т. Mochizuki, H. Ishizaki, R. C. Barton et al. // J Clin Microbiol. 2003. Vol. 41, № 10. P. 4583-4588.
193. Rodriguez D. A. Efinaconazole Topical Solution, 10 %, for the Treatment of Mild and Moderate Toenail Onychomycosis // J. Clin. Aesthet. Dermatol. 2015. Vol. 8, № 6. P. 24-29.
194. Rosen T., Stein Gold L. F. Antifungal Drugs for Onychomycosis: Efficacy, Safety, and Mechanisms of Action // Semin. Cutan. Med. Surg. 2016. Vol. 35, № 3. P. 51-55.
195. Rosen T. Tinea and Onychomycosis // Semin. Cutan. Med. Surg. 2016. Vol. 35, № 6. P. 110-113.
196. Roux G. A., Baudraz-Rosselet F. Algorithm to facilitate the management of onychomycosis // Rev. Med. Suisse. 2017. Vol. 13, № 556. P. 698-702.
197. Sato T.Onychomycosis // Med. Mycol. J. 2016. Vol. 57, № 4. P. 171-173.
198. Tachibana H., Kumagai N., Tatsumi Y. Fungicidal Activity in the Presence of Keratin as an Important Factor Contributing to In Vivo Efficacy: A Comparison of Efinaconazole, Tavaborole, and Ciclopirox // J. Fungi (Basel). 2017. Vol. 19, № 3 (4). P. E58.
199. Tavaborole in Difficult-to-Treat Onychomycosis Cases: A Post-hoc Assessment of Phase III Subjects / R. Aly, A. K. Gupta, T. Winter et al. // J. Drugs Dermatol. 2017. Vol. 16, № 10. P. 1016-1021.
200. Thatai P., Sapra B. Transungual Gel of Terbinafine Hydrochloride for the Management of Onychomycosis: Formulation, Optimization, and Evaluation // AAPS PharmSciTech. 2017. Vol. 18, № 6. P. 2316-2328.
201. The Diagnosis and Treatment of Nail Disorders / U. Wollina, P. Nenoff, G. Haroske, H. A. Haenssle // Dtsch. Arztebl. Int. 2016. Vol. 113, № 29-30. P. 509-518.
202. The efficacy and safety of tavaborole, a novel, boron-based pharmaceutical agent: phase 2 studies conducted for the topical treatment of toenail onychomycosis / M. E. Toledo-Bahena, A. Bucko, J. Ocampo-Candiani et al. // J. Drugs Dermatol. 2014. Vol. 13, № 9. P. 1124-1132.
203. The efficacy of fractional carbon dioxide (CO2) laser combined with terbinafine hydrochloride 1 % cream for the treatment of onychomycosis / J. Shi, J. Li, H. Huang et al. // J. Cosmet. Laser Ther. 2017. Vol. 19, № 6. P. 353-359.
204. The prevalence of Candida onychomycosis in Southeastern Serbia from 2011 to 2015 / S. Otašević, A. Barac, M. Pekmezovic et al. // Mycoses. 2016. Vol. 59, № 3. P. 167-172.
205. The prevalence of unsuspected onychomycosis and its causative organisms in a multicentre Canadian sample of 30 000 patients visiting physicians’ offices / A. K. Gupta, G. Gupta, H. C. Jain et al. // J Eur Acad Dermatol Venereol. 2016. Vol. 11, №. 1. Р. 136-137.
206. The role of dermoscopy in the diagnosis of distal lateral subungual onychomycosis / E. Kaynak, F. Göktay, P. Güneş et al. // Arch. Dermatol. Res. 2017. Vol. 310, № 1. P. 57-69.
207. The WHOQOL Group. Study protocol for the World Health Organization project to develop a Quality of Life assessment instrument (WHOQOL) // Qual. Life Res. 1993. Vol. 2, № 2. P. 153-159.
208. Tosti A., Elewski B. E. Onychomycosis: Practical Approaches to Minimize Relapse and Recurrence // Skin Appendage Disord. 2016. Vol. 2, № 1-2. P. 83-87.
209. Transungual delivery of efinaconazole: its deposition in the nail of onychomycosis patients and in vitro fungicidal activity in human nails / M. Sakamoto, N. Sugimoto, H. Kawabata et al. // J. Drugs Dermatol. 2014. Vol. 13, № 11. P. 1388-1392.
210. Trends in laboratory-diagnosed onychomycosis between 2006 and 2014 in the South West of England / C. Wlodek, A. Trickey, D. de Berker, E. M. Johnson // Br. J. Dermatol. 2017. Vol. 176, № 1. P. 237-240.
211. Use of diagnostic tests by dermatologists, podiatrists and family practitioners in the United States: pilot data from a cross-sectional survey / R. L. Koshnick, K. K. Lilly, K. St Clair et al. // Mycoses. 2007. Vol. 50, № 6. P. 463-469.
212. Usefulness of techniques based on real time PCR for the identification of onychomycosis-causing species / A. Z. Hafirassou, C. Valero, N. Gassem et al. // Mycoses. 2017. Vol. 60, № 10. P. 638-644.
213. Velasquez-Agudelo V., Cardona-Arias J. A. Meta-analysis of the utility of culture, biopsy, and direct KOH examination for the diagnosis of onychomycosis // BMC Infect Dis. 2017. Vol. 17, № 1. P. 166.
214. Verrier J., Monod M. Diagnosis of Dermatophytosis Using Molecular Biology // Mycopathologia. 2017. Vol. 182, № 1-2. P. 193-202.
215. Vlahovic T. C. Onychomycosis: Evaluation, Treatment Options, Managing Recurrence, and Patient Outcomes // Clin. Podiatr. Med. Surg. 2016. Vol. 33, № 3. P. 305-318.
216. Wang J., Wiznia L. E., Rieder E. A. Patient-Reported Outcomes in Onychomycosis: A Review of Psychometrically Evaluated Instruments in Assessing Treatment Effectiveness // Skin Appendage Disord. 2017. Vol. 3, № 3. P. 144-155.
217. Watanabe S., Anzawa K., Mochizuki T. High prevalence of superficial white onychomycosis by Trichophyton interdigitale in a Japanese nursing home with a geriatric hospital // Mycoses. 2017. Vol. 60, № 10. P. 634-637.
218. Watanabe S., Ishida K. Molecular Diagnostic Techniques for Onychomycosis: Validity and Potential Application // Am. J. Clin. Dermatol. 2017. Vol. 18, № 2. P. 281-286.
219. Weight change and Risk of Onychomycosis: A nationwide cohort study from Korea / S. J. Ha, K. D. Han, Y. Song, J. H. Lee // J .Am. Acad. Dermatol. 2017. Vol. 22, № 3. P. 190-196.
220. Westerberg D. P., Voyack M. J. Onychomycosis: Current trends in diagnosis and treatment // Am. Fam. Physician. 2013. Vol. 88, № 11. P. 762-770.
221. Yin Z., Xu J., Luo D. A meta-analysis comparing long-term recurrences of toenail onychomycosis after successful treatment with terbinafine versus itraconazole // J Dermatolog Treat. 2012. Vol. 23, № 6. P. 449-452.
222. Zang K., Sullivan R., Shanks S. A Retrospective Study of Non-thermal Laser Therapy for the Treatment of Toenail Onychomycosis // J. Clin. Aesthet. Dermatol. 2017. Vol. 10, № 5. P. 24-30.
223. Zeichner J. A. Onychomycosis to Fungal Superinfection: Prevention Strategies and Considerations / J. Drugs Dermatol. 2015. Vol. 14, № 10. P. 32-34.
224. Zeichner J. A. Onychomycosis to Fungal Superinfection: Prevention Strategies and Considerations / J. Drugs Dermatol. 2015. Vol. 14, № 10. P. 32-34.
225. Zigmond A. S., Snaith R. P. The Hospital Anxiety and Depression scale // Acta Psychiatr. Scand. 1983. Vol. 67, № 6. P. 361-370.
ДОДАТОК А
ТЕКСТ ПРОГРАМНОГО МОДУЛЮ WINBUGS БАЗОВОЇ МОДЕЛІ
Розрахунок параметрів моделей здійснювався в середовищі пакету МСМС семплерів WinBUGS, що є абревіатурою виразу Bayesian inference using Gibbs (software). Принципи семплера Гіббса описані в розділі 2. Дані для моделі та початкові значення параметрів наведені в Додатку Б.
Текст програми робочий і копіюється в програмний файл WinBUGS без змін. Пояснення ключових виразів подано вище в тексті розділу.
model{
for (k in 1:156) {
O[Year[k], Gender[k],GeoCodes[k]]<-Observed[k];
E[Year[k], Gender[k],GeoCodes[k]]<-M[k];
Observed[k]~dpois(mu[k]); Observedrep[k]~dpois(mu[k])
mu[k]~dgamma(a[k], b[k])
a[k]<-pow(M[k],1-key)/phi; b[k]<-pow(M[k],-key)/phi;
log(M[k])<- log(Expected[k])+bSauna*Sauna[k]+bSaloon*Saloon[k]
+bpH*pH[k]+bPop*(Population[k] – mean(Population[]))
cr[k]<-pow(Observedrep[k]-mu[k],2)/mu[k]
c[k]<-pow(Observed[k]-mu[k],2)/mu[k]
dnew[k]<-pow(Observed[k]-Observedrep[k],2)
var[k]<-M[k]*(1+phi*M[k])
}
#Posterior predictive check (PPC)
PPC<-step(sum(cr[])-sum(c[]))
#Posterior predictive loss (PPL)
Dnew<-sum(dnew[2:156])
Var<-sum(var[2:156])
PPL<-Dnew+Var
#Output for map
for (j in 1:26) {
Observed_Counts[j]<-sum(O[,,j])
Expected_Counts[j]<-sum(E[,,j])
}
#Priors
bSauna~dnorm(0, 0.01)
bSaloon~dnorm(0, 0.01)
bpH~dnorm(0, 0.01)
bPop~dnorm(0, 0.01)
key1~dgamma(1,1); key<-key1-1; phi~dgamma(1,1)
ДОДАТОК Б
ДАНІ ДЛЯ ПРОСТОРОВО-ДИНАМІЧНОЇ МОДЕЛІ
ЗАРАЖЕННЯ ОНІХОМІКОЗАМИ
Таблиця Б.1
| Observed | Expected | Year | Gender | Sauna | Saloon | рН | GeoCodes | Population |
| 3 | 13,43913 | 2015 | 1 | 0 | 38 | 5,2 | 6 | 54401 |
| 84 | 15,5043 | 2015 | 1 | 1 | 42 | 5,6 | 26 | 62917 |
| 8 | 19,31011 | 2015 | 1 | 5 | 37 | 5,8 | 8 | 75879 |
| 17 | 14,88513 | 2015 | 1 | 3 | 35 | 5,2 | 19 | 59227 |
| 8 | 17,73799 | 2015 | 1 | 4 | 93 | 5,2 | 7 | 71565 |
| 20 | 9,866522 | 2015 | 1 | 1 | 26 | 5,6 | 15 | 38797 |
| 27 | 14,97156 | 2015 | 1 | 0 | 45 | 5,8 | 4 | 59857 |
| 3 | 16,4828 | 2015 | 1 | 3 | 35 | 6,1 | 2 | 66572 |
| 15 | 8,774953 | 2015 | 1 | 4 | 20 | 5,8 | 21 | 35413 |
| 3 | 9,960566 | 2015 | 1 | 1 | 35 | 6,1 | 9 | 39941 |
| 3 | 9,202774 | 2015 | 1 | 0 | 24 | 5,2 | 3 | 37227 |
| 10 | 22,43533 | 2015 | 1 | 0 | 35 | 5,6 | 16 | 90121 |
| 0 | 6,8185 | 2015 | 1 | 3 | 9 | 5,6 | 11 | 27584 |
| 11 | 12,89932 | 2015 | 1 | 2 | 38 | 5 | 14 | 51690 |
| 2 | 5,614948 | 2015 | 1 | 1 | 5 | 5,2 | 10 | 22959 |
| 5 | 5,717146 | 2015 | 1 | 0 | 9 | 5,7 | 24 | 22145 |
| 19 | 7,870386 | 2015 | 1 | 1 | 12 | 5,5 | 5 | 32461 |
| 5 | 7,625761 | 2015 | 1 | 0 | 16 | 5,8 | 23 | 30546 |
| 4 | 8,748859 | 2015 | 1 | 1 | 28 | 5,4 | 17 | 35081 |
| 7 | 15,66956 | 2015 | 1 | 1 | 19 | 5,3 | 22 | 61400 |
| 7 | 14,42306 | 2015 | 1 | 7 | 40 | 5,4 | 18 | 58007 |
| 6 | 10,98853 | 2015 | 1 | 0 | 29 | 5,3 | 13 | 43971 |
| 11 | 15,85873 | 2015 | 1 | 6 | 88 | 5,8 | 1 | 64379 |
| 0 | 5,739978 | 2015 | 1 | 1 | 7 | 5,8 | 25 | 22922 |
| 16 | 14,88132 | 2015 | 1 | 1 | 33 | 5,4 | 12 | 59156 |
| 7 | 10,5705 | 2015 | 1 | 7 | 38 | 5,6 | 20 | 42246 |
| 6 | 13,47427 | 2015 | 0 | 0 | 38 | 5,2 | 6 | 54401 |
| 61 | 15,61578 | 2015 | 0 | 1 | 42 | 5,6 | 26 | 62917 |
Продовження таблиці Б.1
| Observed | Expected | Year | Gender | Sauna | Saloon | рН | GeoCodes | Population |
| 3 | 18,32208 | 2015 | 0 | 5 | 37 | 5,8 | 8 | 75879 |
| 13 | 14,45763 | 2015 | 0 | 3 | 35 | 5,2 | 19 | 59227 |
| 7 | 17,67649 | 2015 | 0 | 4 | 93 | 5,2 | 7 | 71565 |
| 19 | 9,373738 | 2015 | 0 | 1 | 26 | 5,6 | 15 | 38797 |
| 59 | 14,67146 | 2015 | 0 | 0 | 45 | 5,8 | 4 | 59857 |
| 4 | 16,45795 | 2015 | 0 | 3 | 35 | 6,1 | 2 | 66572 |
| 8 | 8,749034 | 2015 | 0 | 4 | 20 | 5,8 | 21 | 35413 |
| 2 | 9,814572 | 2015 | 0 | 1 | 35 | 6,1 | 9 | 39941 |
| 7 | 9,215292 | 2015 | 0 | 0 | 24 | 5,2 | 3 | 37227 |
| 9 | 22,1779 | 2015 | 0 | 0 | 35 | 5,6 | 16 | 90121 |
| 3 | 6,828614 | 2015 | 0 | 3 | 9 | 5,6 | 11 | 27584 |
| 5 | 12,69429 | 2015 | 0 | 2 | 38 | 5 | 14 | 51690 |
| 1 | 5,73402 | 2015 | 0 | 1 | 5 | 5,2 | 10 | 22959 |
| 4 | 5,279112 | 2015 | 0 | 0 | 9 | 5,7 | 24 | 22145 |
| 6 | 8,164282 | 2015 | 0 | 1 | 12 | 5,5 | 5 | 32461 |
| 8 | 7,499172 | 2015 | 0 | 0 | 16 | 5,8 | 23 | 30546 |
| 4 | 8,620098 | 2015 | 0 | 1 | 28 | 5,4 | 17 | 35081 |
| 20 | 14,78905 | 2015 | 0 | 1 | 19 | 5,3 | 22 | 61400 |
| 7 | 14,28965 | 2015 | 0 | 7 | 40 | 5,4 | 18 | 58007 |
| 9 | 10,78568 | 2015 | 0 | 0 | 29 | 5,3 | 13 | 43971 |
| 20 | 15,98352 | 2015 | 0 | 6 | 88 | 5,8 | 1 | 64379 |
| 0 | 5,612802 | 2015 | 0 | 1 | 7 | 5,8 | 25 | 22922 |
| 8 | 14,42857 | 2015 | 0 | 1 | 33 | 5,4 | 12 | 59156 |
| 6 | 10,35165 | 2015 | 0 | 7 | 38 | 5,6 | 20 | 42246 |
| 0 | 13,30791 | 2016 | 1 | 0 | 38 | 5,2 | 6 | 54115 |
| 67 | 15,21705 | 2016 | 1 | 1 | 42 | 5,6 | 26 | 62127 |
| 6 | 19,32962 | 2016 | 1 | 5 | 37 | 5,8 | 8 | 76338 |
| 14 | 14,69045 | 2016 | 1 | 3 | 35 | 5,2 | 19 | 58764 |
| 6 | 17,55739 | 2016 | 1 | 4 | 93 | 5,2 | 7 | 71219 |
| 23 | 9,741347 | 2016 | 1 | 1 | 26 | 5,6 | 15 | 38545 |
| 24 | 14,80579 | 2016 | 1 | 0 | 45 | 5,8 | 4 | 59642 |
| 4 | 16,27888 | 2016 | 1 | 3 | 35 | 6,1 | 2 | 66302 |
Продовження таблиці Б.1
| Observed | Expected | Year | Gender | Sauna | Saloon | рН | GeoCodes | Population |
| 17 | 8,637475 | 2016 | 1 | 4 | 20 | 5,8 | 21 | 35119 |
| 2 | 9,799559 | 2016 | 1 | 1 | 35 | 6,1 | 9 | 39542 |
| 5 | 9,06598 | 2016 | 1 | 0 | 24 | 5,2 | 3 | 36923 |
| 6 | 22,12326 | 2016 | 1 | 0 | 35 | 5,6 | 16 | 89459 |
| 2 | 6,669586 | 2016 | 1 | 3 | 9 | 5,6 | 11 | 27171 |
| 14 | 12,72902 | 2016 | 1 | 2 | 38 | 5 | 14 | 51201 |
| 1 | 5,529601 | 2016 | 1 | 1 | 5 | 5,2 | 10 | 22705 |
| 4 | 5,629855 | 2016 | 1 | 0 | 9 | 5,7 | 24 | 21915 |
| 18 | 7,74004 | 2016 | 1 | 1 | 12 | 5,5 | 5 | 32027 |
| 8 | 7,456526 | 2016 | 1 | 0 | 16 | 5,8 | 23 | 30139 |
| 2 | 8,615376 | 2016 | 1 | 1 | 28 | 5,4 | 17 | 34791 |
| 8 | 15,53829 | 2016 | 1 | 1 | 19 | 5,3 | 22 | 61255 |
| 12 | 14,20912 | 2016 | 1 | 7 | 40 | 5,4 | 18 | 57596 |
| 9 | 10,86894 | 2016 | 1 | 0 | 29 | 5,3 | 13 | 43786 |
| 19 | 15,69406 | 2016 | 1 | 6 | 88 | 5,8 | 1 | 64045 |
| 2 | 5,646564 | 2016 | 1 | 1 | 7 | 5,8 | 25 | 22684 |
| 13 | 14,68829 | 2016 | 1 | 1 | 33 | 5,4 | 12 | 58802 |
| 7 | 10,41995 | 2016 | 1 | 7 | 38 | 5,6 | 20 | 41914 |
| 0 | 13,94745 | 2016 | 0 | 0 | 38 | 5,2 | 6 | 54115 |
| 52 | 16,06623 | 2016 | 0 | 1 | 42 | 5,6 | 26 | 62127 |
| 5 | 19,18562 | 2016 | 0 | 5 | 37 | 5,8 | 8 | 76338 |
| 16 | 14,93527 | 2016 | 0 | 3 | 35 | 5,2 | 19 | 58764 |
| 9 | 18,31773 | 2016 | 0 | 4 | 93 | 5,2 | 7 | 71219 |
| 17 | 9,703728 | 2016 | 0 | 1 | 26 | 5,6 | 15 | 38545 |
| 68 | 15,25 | 2016 | 0 | 0 | 45 | 5,8 | 4 | 59642 |
| 8 | 17,1114 | 2016 | 0 | 3 | 35 | 6,1 | 2 | 66302 |
| 12 | 9,050556 | 2016 | 0 | 4 | 20 | 5,8 | 21 | 35119 |
| 5 | 10,12511 | 2016 | 0 | 1 | 35 | 6,1 | 9 | 39542 |
| 11 | 9,528822 | 2016 | 0 | 0 | 24 | 5,2 | 3 | 36923 |
| 4 | 22,94824 | 2016 | 0 | 0 | 35 | 5,6 | 16 | 89459 |
| 4 | 7,013778 | 2016 | 0 | 3 | 9 | 5,6 | 11 | 27171 |
| 9 | 13,07529 | 2016 | 0 | 2 | 38 | 5 | 14 | 51201 |
Продовження таблиці Б.1
| Observed | Expected | Year | Gender | Sauna | Saloon | рН | GeoCodes | Population |
| 1 | 5,899404 | 2016 | 0 | 1 | 5 | 5,2 | 10 | 22705 |
| 5 | 5,43678 | 2016 | 0 | 0 | 9 | 5,7 | 24 | 21915 |
| 9 | 8,374158 | 2016 | 0 | 1 | 12 | 5,5 | 5 | 32027 |
| 8 | 7,72857 | 2016 | 0 | 0 | 16 | 5,8 | 23 | 30139 |
| 2 | 8,914518 | 2016 | 0 | 1 | 28 | 5,4 | 17 | 34791 |
| 20 | 15,3704 | 2016 | 0 | 1 | 19 | 5,3 | 22 | 61255 |
| 3 | 14,80492 | 2016 | 0 | 7 | 40 | 5,4 | 18 | 57596 |
| 4 | 11,19635 | 2016 | 0 | 0 | 29 | 5,3 | 13 | 43786 |
| 21 | 16,55587 | 2016 | 0 | 6 | 88 | 5,8 | 1 | 64045 |
| 0 | 5,786592 | 2016 | 0 | 1 | 7 | 5,8 | 25 | 22684 |
| 10 | 14,95517 | 2016 | 0 | 1 | 33 | 5,4 | 12 | 58802 |
| 6 | 10,70387 | 2016 | 0 | 7 | 38 | 5,6 | 20 | 41914 |
| 1 | 12,02264 | 2017 | 1 | 0 | 38 | 5,2 | 6 | 53784 |
| 89 | 13,72049 | 2017 | 1 | 1 | 42 | 5,6 | 26 | 61524 |
| 5 | 17,85511 | 2017 | 1 | 5 | 37 | 5,8 | 8 | 77455 |
| 13 | 13,3084 | 2017 | 1 | 3 | 35 | 5,2 | 19 | 58477 |
| 4 | 15,93039 | 2017 | 1 | 4 | 93 | 5,2 | 7 | 70859 |
| 28 | 8,82931 | 2017 | 1 | 1 | 26 | 5,6 | 15 | 38350 |
| 13 | 13,4309 | 2017 | 1 | 0 | 45 | 5,8 | 4 | 59376 |
| 7 | 14,7294 | 2017 | 1 | 3 | 35 | 6,1 | 2 | 65945 |
| 8 | 7,81256 | 2017 | 1 | 4 | 20 | 5,8 | 21 | 34825 |
| 3 | 8,80628 | 2017 | 1 | 1 | 35 | 6,1 | 9 | 39133 |
| 3 | 8,18055 | 2017 | 1 | 0 | 24 | 5,2 | 3 | 36568 |
| 3 | 19,9381 | 2017 | 1 | 0 | 35 | 5,6 | 16 | 88639 |
| 3 | 5,99809 | 2017 | 1 | 3 | 9 | 5,6 | 11 | 26794 |
| 12 | 11,46502 | 2017 | 1 | 2 | 38 | 5 | 14 | 50709 |
| 0 | 4,95194 | 2017 | 1 | 1 | 5 | 5,2 | 10 | 22333 |
| 5 | 5,07101 | 2017 | 1 | 0 | 9 | 5,7 | 24 | 21705 |
| 15 | 6,94918 | 2017 | 1 | 1 | 12 | 5,5 | 5 | 31536 |
| 7 | 6,71398 | 2017 | 1 | 0 | 16 | 5,8 | 23 | 29791 |
| 3 | 7,7812 | 2017 | 1 | 1 | 28 | 5,4 | 17 | 34475 |
| 8 | 14,10563 | 2017 | 1 | 1 | 19 | 5,3 | 22 | 61075 |
Продовження таблиці Б.1
| Observed | Expected | Year | Gender | Sauna | Saloon | рН | GeoCodes | Population |
| 5 | 12,85417 | 2017 | 1 | 7 | 40 | 5,4 | 18 | 57143 |
| 5 | 9,87105 | 2017 | 1 | 0 | 29 | 5,3 | 13 | 43553 |
| 15 | 14,16737 | 2017 | 1 | 6 | 88 | 5,8 | 1 | 63639 |
| 0 | 5,08375 | 2017 | 1 | 1 | 7 | 5,8 | 25 | 22427 |
| 9 | 13,27949 | 2017 | 1 | 1 | 33 | 5,4 | 12 | 58444 |
| 5 | 9,38742 | 2017 | 1 | 7 | 38 | 5,6 | 20 | 41534 |
| 0 | 12,81062 | 2017 | 0 | 0 | 38 | 5,2 | 6 | 53784 |
| 71 | 14,68307 | 2017 | 0 | 1 | 42 | 5,6 | 26 | 61524 |
| 11 | 17,96501 | 2017 | 0 | 5 | 37 | 5,8 | 8 | 77455 |
| 11 | 13,71685 | 2017 | 0 | 3 | 35 | 5,2 | 19 | 58477 |
| 5 | 16,79642 | 2017 | 0 | 4 | 93 | 5,2 | 7 | 70859 |
| 25 | 8,904978 | 2017 | 0 | 1 | 26 | 5,6 | 15 | 38350 |
| 43 | 14,00111 | 2017 | 0 | 0 | 45 | 5,8 | 4 | 59376 |
| 5 | 15,71763 | 2017 | 0 | 3 | 35 | 6,1 | 2 | 65945 |
| 5 | 8,269878 | 2017 | 0 | 4 | 20 | 5,8 | 21 | 34825 |
| 4 | 9,268518 | 2017 | 0 | 1 | 35 | 6,1 | 9 | 39133 |
| 8 | 8,704374 | 2017 | 0 | 0 | 24 | 5,2 | 3 | 36568 |
| 9 | 21,00166 | 2017 | 0 | 0 | 35 | 5,6 | 16 | 88639 |
| 7 | 6,374214 | 2017 | 0 | 3 | 9 | 5,6 | 11 | 26794 |
| 5 | 11,96222 | 2017 | 0 | 2 | 38 | 5 | 14 | 50709 |
| 0 | 5,355426 | 2017 | 0 | 1 | 5 | 5,2 | 10 | 22333 |
| 4 | 4,973928 | 2017 | 0 | 0 | 9 | 5,7 | 24 | 21705 |
| 8 | 7,601052 | 2017 | 0 | 1 | 12 | 5,5 | 5 | 31536 |
| 11 | 7,046982 | 2017 | 0 | 0 | 16 | 5,8 | 23 | 29791 |
| 2 | 8,14461 | 2017 | 0 | 1 | 28 | 5,4 | 17 | 34475 |
| 16 | 14,14214 | 2017 | 0 | 1 | 19 | 5,3 | 22 | 61075 |
| 9 | 13,53858 | 2017 | 0 | 7 | 40 | 5,4 | 18 | 57143 |
| 4 | 10,2527 | 2017 | 0 | 0 | 29 | 5,3 | 13 | 43553 |
| 10 | 15,20999 | 2017 | 0 | 6 | 88 | 5,8 | 1 | 63639 |
| 0 | 5,278776 | 2017 | 0 | 1 | 7 | 5,8 | 25 | 22427 |
| 7 | 13,72823 | 2017 | 0 | 1 | 33 | 5,4 | 12 | 58444 |
| 6 | 9,800688 | 2017 | 0 | 7 | 38 | 5,6 | 20 | 41534 |
ДОДАТОК В
ТЕКСТ ПРОГРАМНОГО МОДУЛЮ WINBUGS
ПРОСТОРОВОЇ МОДЕЛІ
Розрахунок параметрів моделі здійснювався в середовищі пакету МСМС семплерів WinBUGS. Дані для моделі та початкові значення параметрів наведені в Додатку Б.
Найбільш доцільно ICAR(1) специфікація задається через розподіл car.normal, параметризований в термінах точності t=1/s2. Потрібна особлива ретельність і виваженість у визначені апріорного розподілу для t, так як апостеріорна дисперсія рандомізованих ефектів є надто чутливою для некоректних апріорних специфікацій. Однією з гарно випробуваних можливостей є використання гамма розподілу з параметром форми і оберненим параметром шкалювання, що дорівнюють 0,01. Це забезпечує середнє 1 і велику дисперсію 0,01/(0,01)2 = 100. Проте така поширена специфікація покладає має тенденцію до «віддалення» очікуваних значень від 0 (на шкалі стандартного відхилення рандомізованих ефектів), що в разі незначної просторової залежності між територіями, коли стандартне відхилення близьке до нуля, може призвести до індукції артефактної просторової структури. У зв’язку з цим Kelsall and Wakefield (1999) запропонували альтернативні параметри гамма розподілу, а саме gamma(0,5, 0,0005) для апріорного розподілу просторових рандомізованих ефектів s за ICAR(1) специфікації. Фактично це означає апріорне припущення, що стандартне відхилення рандомізованих ефектів має точку маси навколо 0,05 з 1 % апріорної вірогідності бути меншим за 0,01 чи більшим за 2,5, що негайно випливає з процентилей гамма розподілу. Саме ця специфікація гамма розподілу була залучена.
Текст програми робочий і копіюється в програмний файл WinBUGS без змін. Пояснення ключових виразів подано вище в тексті розділу.
model {
for (k in 1:156) {
E[Year[k], Gender[k],GeoCodes[k]]<-M[k]
Observed[k]~dpois(mu[k]); Observedrep[k]~dpois(mu[k])
mu[k]~dgamma(a[k], b[k])
a[k]<-pow(M[k],1-key)/phi; b[k]<-pow(M[k],-key)/phi;
log(M[k])<- log(Expected[k])+bSauna*Sauna[k]+bSaloon*Saloon[k]
+bpH*pH[k]+bPop*(Population[k] – mean(Population[]) )
+s[GeoCodes[k]]
cr[k]<-pow(Observedrep[k]-mu[k],2)/mu[k]
c[k]<-pow(Observed[k]-mu[k],2)/mu[k]
dnew[k]<-pow(Observed[k]-Observedrep[k],2)
var[k]<-M[k]*(1+phi*M[k])
}
#Posterior predictive check (PPC)
PPC<-step(sum(cr[])-sum(c[]))
#Posterior predictive loss (PPL)
Dnew<-sum(dnew[2:156])
Var<-sum(var[2:156])
PPL<-Dnew+Var
#Output for map
for (j in 1:26) {
Expected_Counts[j]<-sum(E[,,j])
}
#CAR priors for 26 barrows
s[1:26]~car.normal(adj[],weights[], num[],tau)
for(k in 1:sumNumNeigh) {
weights[k] <- 1
}
#Other priors
bSauna~dnorm(0, 0.01)
bSaloon~dnorm(0, 0.01)
bpH~dnorm(0, 0.01)
bPop~dnorm(0, 0.01)
key1~dgamma(1,1); key<-key1-1; phi~dgamma(1,1)
tau ~ dgamma(0.5, 0.0005) # prior on precision
sigma <- sqrt(1 / tau) # standard deviation
}
ДОДАТОК Г
ТЕКСТ ПРОГРАМНОГО МОДУЛЮ WINBUGS
ПРОСТОРОВО-ДИНАМІЧНОЇ МОДЕЛІ
Розрахунок параметрів моделі здійснювався в середовищі пакету МСМС семплерів WinBUGS. Дані для моделі та початкові значення параметрів наведені в Додатку Б.
Рандомізовані динамічні ефекти задані нормальними розподілами зі специфічними районам середніми, які в свою чергу є випадковими реалізаціями нормального розподілу з гіперпараметрами маси та дисперсії 0 та 100.
Текст програми робочий і копіюється в програмний файл WinBUGS без змін. Пояснення ключових виразів подано вище в тексті розділу.
model{
for (k in 1:156) {
E[Year[k], Gender[k],GeoCodes[k]]<-M[k];
Observed[k]~dpois(mu[k]); Observedrep[k]~dpois(mu[k])
mu[k]~dgamma(a[k], b[k])
a[k]<-pow(M[k],1-key)/phi; b[k]<-pow(M[k],-key)/phi;
log(M[k])<- log(Expected[k])+bSauna*Sauna[k]+bSaloon*Saloon[k]
+bpH*pH[k]+bPop*(Population[k] – mean(Population[]) )
+bYear[GeoCodes[k],Year[k]]*Year[k]*GeoCodes[k]
+s[GeoCodes[k]]
cr[k]<-pow(Observedrep[k]-mu[k],2)/mu[k]
c[k]<-pow(Observed[k]-mu[k],2)/mu[k]
dnew[k]<-pow(Observed[k]-Observedrep[k],2)
var[k]<-M[k]*(1+phi*M[k])
}
for (j in 1:26) {
b.dYear[j,k]<- bYear[j,3]- bYear[j,1]
}
Dynamics<-sum(b.dYear[j,])
#Posterior predictive check (PPC)
PPC<-step(sum(cr[])-sum(c[]))
#Posterior predictive loss (PPL)
Dnew<-sum(dnew[2:156])
Var<-sum(var[2:156])
PPL<-Dnew+Var
#Output for map
for (j in 1:26) {
Expected_Counts[j]<-sum(E[,,j])
}
#CAR priors for 26 barrows
s[1:26]~car.normal(adj[],weights[], num[],tau)
for(k in 1:sumNumNeigh) {
weights[k] <- 1
}
#Dynamic Random effect priors
for (j in 1:26) {
for (k in 1:3) {
bYear[j,k]~dnorm(Meanb[j], 0.01)
Meanb[j]~dnorm(0, 0.1)
}
}
#Other priors
bSauna~dnorm(0, 0.01)
bSaloon~dnorm(0, 0.01)
bpH~dnorm(0, 0.01)
bPop~dnorm(0, 0.01)
key1~dgamma(1,1); key<-key1-1; phi~dgamma(1,1)
tau ~ dgamma(0.5, 0.0005) # prior on precision
sigma <- sqrt(1 / tau) # standard deviation
}
ДОДАТОК Д
АКТИ ВПРОВАДЖЕННЯ





ДОДАТОК Е
СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА ЗА ТЕМОЮ ДИСЕРТАЦІЇ ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ РЕЗУЛЬТАТІВ ДИСЕРТАЦІЇ
- Кізіна І. Є. Оніхомікоз у Вінницькій області: погляд на проблему через призму популяційного дослідження // Biomedical and biosocial antropology. 2014. № 23. С. 235- 238.
- Літус О. І., Кізіна І. Є. Показники лазерної допплерівської флоуметрії в оцінці мікроциркуляції при лікуванні оніхомікозів // Вісник Вінницького національного університету. 2016. Т. 20, № 1 (1). С. 81-85.
- Кізіна І. Є. Психологічна складова якості життя у хворих з оніхомікозом як критерій ефективності лікування // Дерматологія та венерологія. 2015. № 4. С. 50-57.
- Кізіна І. Є. Інформативність полімеразної ланцюгової реакції для діагностики, оцінки перебігу й результатів лікування оніхомікозу // Biomedical and biosocial anthropology. 2015. № 25. С. 169-172.
- Кізіна І. Є. Вплив клініко-демографічних факторів та коморбідності на якість життя хворих на оніхомікоз // Дерматологія та венерологія. 2016. № 4 (74). С. 64-71.
- Кізіна І. Є. Ефективність терапії хворих на оніхомікоз з використанням протигрибкових і ангіопротекторних препаратів // Дерматологія. Косметологія. Сексопатологія. 2017. № 1-2 (5). С. 14-19.
- Кізіна І. Є. Диференційований підхід до комплексного лікування оніхомікозів із урахуванням коморбідних мікроциркуляторних порушень // Український журнал дерматології, венерології, косметології. 2017. № 1 (64). С. 52-58.
- Kizina I. E. Geostatistical modeling of onychomycosis incidence rates in Vinnitska oblast // Дерматовенерология. Косметология. 2015. № 2. С. 10-17.
Відомості про апробацію результатів дисертації:
- Регіональна науково-практична школа «Набуття молодих вчених дерматовенерологів», 23 листопада 2012 року, м. Київ, усна доповідь: Кізіна І. Є. «Стан проблеми в діагностиці та лікуванні оніхомікозів».
- Науково-практична конференція, присвячена 85-річчю дерматовенерологічної служби Вінницької області «Сучасні методи організації і технології в розвитку вітчизняної дерматовенерології», 11-12 вересня 2013 року, м. Вінниця, усна доповідь: Кізіна І. Є. «Розповсюдження оніхомікозів у Вінницькому регіоні».
- Науково-практична конференція «12-е Киевские дерматологические дни», 7-8 квітня 2017 року, м. Київ, усна доповідь: Кізіна І. Є. «Значення мікроциркуляторних розладів та їх корекція в лікуванні хворих на оніхомікоз».
