Вінницький національний медичний університет імені М. І. Пирогова
Міністерство охорони здоров’я України
Державна установа «Інститут дерматології та венерології НАМН України»
Кваліфікаційна наукова праця
на правах рукопису
Кізіна Ірина Євгеніївна
УДК [616.596-002.828-07:57.088.7]-085
ДИСЕРТАЦІЯ
КЛІНІКО-ЕПІДЕМІОЛОГІЧНІ ОСОБЛИВОСТІ ХВОРИХ НА ОНІХОМІКОЗ НА ПОДІЛЛІ ТА УДОСКОНАЛЕННЯ ЇХ ЛІКУВАННЯ З УРАХУВАННЯМ РОЗЛАДІВ МІКРОЦИРКУЛЯЦІЇ ШКІРИ
14.01.20 – шкірні та венеричні хвороби
222. Медицина
Подається на здобуття наукового ступеня кандидата медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
_________________________________________________
(підпис, ініціали та прізвище здобувача)
Науковий керівник: Літус Олександр Іванович, доктор медичних наук, доцент
Вінниця – 2017
АНОТАЦІЯ
Кізіна І.Є. Клініко-епідеміологічні особливості хворих на оніхомікоз на Поділлі та удосконалення їх лікування з урахуванням розладів мікроциркуляції шкіри. – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 «Шкірні та венеричні хвороби». – Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2017.
Наукова робота присвячена клініко-епідеміологічному обґрунтуванню заходів, спрямованих на підвищення ефективності лікування хворих із оніхомікозом. Вперше методом геостатистичного моделювання за трьома моделями (базовою наддисперсною Пуассона, просторовою та просторово-динамічною) досліджено рівень захворюваності, ризик зараження та фактори ризику розвитку оніхомікозів у популяції Подільського регіону України. Встановлено, що у Вінницькій області захворюваність на оніхомікоз впродовж 2011-2013 рр. склала 38,4, 38,9 та 35,6 на 100 тисяч населення відповідно. Встановлено суттєві (достовірність < 0,001) просторові відмінності в територіальних ризиках зараження з найвищими значеннями у Бершадському, Калинівському та Іллінецькому районах з відповідним перевищенням значення відносного ризику 417.9/15.1 = 27,6 разів, 230.4/14.5 =15,8 разів та 129.6/9.4=13,8 разів.
Аналіз гендерних особливостей захворювання продемонстрував більшу частоту даного захворювання у жінок, що суперечить результатам більшості популяційних досліджень та може свідчити про низьке виявлення оніхомікозів у чоловіків.
Під час аналізу впливу факторів ризику розвитку оніхомікозу (кількість саун в районі, кількість салонів краси в районі, середньозважене значення рН грунту території району, кількість населення району) на рівень захворюваності в досліджуваному регіоні виявляються наступні тенденції: ризик розвитку оніхомікозу зростає при появі додаткового салону краси на території району на 1 % за наддисперсною моделлю Пуассона, на 2,2 % за просторово-динамічною моделлю, на 4,3 % за просторовою моделлю. При появі додаткової сауни на території району ризик зараження на оніхомікоз зростає на 26,8 %, а при збільшенні рН ґрунту на одиницю – зменшується на 10,7 %.
Для з’ясування впливу клініко-демографічних особливостей та коморбідності у хворих на оніхомікоз на строки мікологічної негативації та показники якості життя проведено проспективне когортне дослідження серед 125 (40 чоловіків та 85 жінок) хворих на оніхомікози кистей та стоп, що дозволило визначити напрямки удосконалення їх лікування. У більшості (81,6 %) пацієнтів визначалася дистально-латеральна форма оніхомікозу, 83,7 % мали пошкодження нігтьової пластинки від 1/3 її довжини та помірно виражений або виражений піднігтьовий гіперкератоз. Клінічний індекс оцінки тяжкості оніхомікозів Сергеєва (КІОТОС) у досліджуваних хворих склав у середньому (16,4 ± 9,54) бала (від 1 до 30 балів).
За допомогою мікроскопії було отримано 47 позитивних результатів, що склало 95,9 %, результати полімеразної ланцюгової реакції виявилися позитивним у 30 (61,2 %) з 49 пацієнтів: у більшості (60 %) пацієнтів збудником оніхомікозу був T. rubrum, в 12 (40 %) випадках був отриманий позитивний результат полімеразної ланцюгової реакції із панфунгальними праймерами та негативний результат полімеразної ланцюгової реакції, специфічній до T. rubrum. Отримані дані дозволяють зробити важливий висновок: проведення мікроскопії не повинно виключати застосування полімеразної ланцюгової реакції для діагностики захворювання, ці два метода повинні доповнювати один одного, оскільки мікроскопія дозволяє верифікувати наявність грибкової інфекції, тоді як результати полімеразної ланцюгової реакції допомагають ідентифікувати вид збудника.
Отримані результати показали, що клінічно значущими предикторами швидкості ерадикації грибів є індекс КІОТОС, більш високі величини якого збільшують строки мікологічної негативації в 4,9 рази (достовірність = 0,042), та мікроциркуляторні розлади, наявність котрих асоціюється із зростанням строків ерадикації збудника майже в 2,98 рази (достовірність = 0,013). Зростання величини індексу КІОТОС асоціюється зі зниженням якості життя, зокрема, оцінки соціальних відносин (достовірність = 0,022), що пов’язано із негативним сприйняттям хворими більш вираженого ураження за локалізацією, площею та наявністю косметичного дефекту.
Результати множинного регресійного аналізу показали, що наявність хронічного коморбідного захворювання робить достовірний внесок у зниження фізичного компоненту якості життя при оніхомікозі, сфери соціальних відносин та взаємодії з оточуючим середовищем, тоді як найбільший сильний вплив на психіологічний компонент якості життя демонструють стать (жіноча), тривалість існування грибкового ураження та наявність тривожних розладів. Зниження оцінки соціальних відносин асоціюється із зростанням величини індексу КІОТОС, що ймовірно пов’язано із негативним сприйняттям хворими більш вираженого ураження за локалізацією, площею та наявністю косметичного дефекту
Аналіз даних лазерної допплерівської флоуметрії у хворих на оніхомікоз дозволив виявити широку поширеність ультразвукових ознак мікроциркуляторних порушень серед пацієнтів із грибковим ураженням нігтьових пластинок. Мікроциркуляторні розлади в шкірі уражених пальців мали місце у 57,1 % хворих на оніхомікоз без видимої судиної патології. Вихідний тканинний кровотік при наявності грибкового ураження ([36,43 ± 27,56] перфузійних одиниць) був у 2 рази нижчим за показник мікроциркуляції на аналогічних сегментах неуражених пальців іншої кінцівки ([78,56 ± 57,15] перфузійних одиниць; p=0,023).
Вперше було досліджено вплив розладів мікроциркуляції за даними лазерної допплерівської флоуметрії на клінічний перебіг оніхомікозу. Показано, що у пацієнтів із наявними порушеннями мікроциркуляції переважає дистально-латеральна та проксимальна форма ураження нігтьової пластинки (92,9 %), а у 46,4 % пацієнтів – ураження більше ніж на дві третини, в зв’язку з чим індекс КІОТОС в 2 рази перевищуває аналогічний показник у осіб без порушення мікроциркуляції (достовірність < 0,001). Негативація результатів мікологічного дослідження у хворих на оніхомікоз стоп, які не мають мікроциркуляторних порушень, відбувається в середньому на 2,6 місяці раніше, ніж при їх наявності (достовірність < 0,05), тоді як у разі ізольованого оніхомікозу кистей впливу мікроциркуляторних розладів на терміни мікологічної негативації вивлено не було (достовірність > 0,05).
Для з’ясування ефективності розробленого комплексного лікування із використанням протигрибкових препаратів і засобів із диференційованим впливом на розлади мікроциркуляції у хворих із оніхомікозом проведено відкрите контрольоване клінічне дослідження. У дослідженні взяли участь 129 хворих, які були розділені на 2 клінічні групи. Контрольну групу склали 49 хворих на оніхомікоз, які отримували стандартне лікування системними та/або місцевими антимікотичними засобами згідно існуючих інструкцій. Пацієнтам основної групи (n=76) була призначена комбінована терапія, котра включала призначення системних та/або місцевих протигрибкових препаратів та ангіопротекторних препаратів. Пацієнтам із спастичним гемодинамічним типом мікроциркуляції був призначений нафтидрофурил гідроген оксалат (енелбін) дозою 100-200 мг на добу, хворим із гіперемічним типом мікроциркуляції – детралекс у добовій дозі 2 таблетки на добу (у два прийоми). У випадках діагностованого застійно-стазичного типу мікроциркуляції хворі отримували нафтидрофурил гідроген оксалат в комплексі з детралексом у вищезазначених дозах. Тривалість терапії складала 3 місяці.
Комплексне лікування із використанням протигрибкових і ангіопротекторних препаратів дозволило прискорити регрес клінічних проявів оніхомікозу, сприяло збільшенню в 2 рази швидкості відростання нігтів кистей та стоп, забезпечило мікологічну негативацію на 12–14-му тижнях у 97,4 % хворих, що на 11,7 % більше, ніж у пацієнтів при традиційному лікуванні, а також дозволило поліпшити показник емоційної сфери (достовірність = 0,001), соціальної активності (достовірність = 0,027) та дерматологічний індекс якості життя (DLQI) у хворих експозиційної групи.
Кореляційний аналіз показав, що сповільнене видужування асоціюється з наявністю мікроциркуляторних розладів (r=0,504; р<0,001), а застійно-стазичний тип порушення мікроциркуляції в найбільшій мірі збільшує терміни мікологічною негативації у хворих на оніхомікоз (р<0,001).
Як показав аналіз Каплана-Мейера, статистично достовірний вплив на терміни мікологічної негативації збудника захворювання демонструють локалізація грибкового ураження на пальцях стоп, індекс КІОТОС > 6, наявність супутніх хронічних захворювань та мікроциркуляторних порушень.
Вперше у вітчизняній науковій практиці досліджена ефективність полімеразної ланцюгової реакції як методу контролю виліковності та оцінки результатів лікування хворих на оніхомікоз в динаміці. Встановлено, у 71,4 % хворих відбулася негативація обох аналізів (і мікроскопії, і полімеразної ланцюгової реакції), тоді як у 28,6 % хворих першим виявився негативним результат мікроскопії, а результат полімеразної ланцюгової реакції залишався позитивним. Середні строки мікологічної негативації за результатами мікроскопії цих хворих склали в середньому (12,07 ± 3,1) тижня, а за результатами полімеразної ланцюгової реакції, специфічної до Т. rubrum, та полімеразної ланцюгової реакції із панфунгальними праймерами, – (14,21 ± 4,5) тижня (достовірність = 0,043). Отримані дані свідчать про недоцільність використання методу полімеразної ланцюгової реакції для контролю вилікованості та оцінки результатів лікування хворих на оніхомікоз в динаміці.
Ключові слова: оніхомікоз, клінічна епідеміологія, розлади мікроциркуляції шкіри, комбінована терапія.
ABSTRACT
Kizina I.E. Clinical and epidemiological features of patients with onychomycosis in Podillia and improvement of their treatment taking into account disorders of the skin microcirculation – Qualifying scientific work on the rights of handwriting.
Thesis for Scientific Degree of Medical Science on specialty 14.01.20 – skin and venereal diseases. – State Establishment Institute of Dermatology and Venerologe of National Academy of Medical Sciences of Ukraine, Kharkiv, 2017.
The scientific work is devoted to the clinical and epidemiological substantiation of measures aimed at increasing of the efficiency of treatment of patients with onychomycosis. For the first time, the level of morbidity, risk of infection and risk factors for onychomycosis development in the population of the Podillya region of Ukraine has been investigated using three models (basic Poisson distribution, spatial and spatial-dynamic) of the method of geostatistical modeling. It was established that in the Vinnytsia region the incidence of onychomycosis during 2011-2013 was 38.4, 38.9 and 35.6 per 100 thousand of people, respectively. Significant spatial differences (reliability < 0,001) were fixed in the territorial risks of infection with the highest values in Bershad, Kalynivka and Illintsi districts with a corresponding above-limit value of the relative risk 417.9 / 15.1 = 27.6 times, 230.4 / 14.5 = 15.8 times and 129.6 / 9.4 = 13.8 times.
The analysis of the gender characteristics of the disease has shown a higher incidence of this disease by women, which contradicts the results of most population surveys and may indicate a low incidence of onychomycosis by men.
During the analysis of the influence of risk factors of onychomycosis (the number of saunas in the area, the number of beauty salons in the area, the average weighted pH of the soil area of the district, the population of the district) to the level of morbidity in the experimental region, the following trends are revealed: the risk of onychomycosis increases with the opening of an additional beauty salon on the territory of the region by 1 % in accordance with the Poisson distribution model, by 2.2 % in accordance with the spatial-dynamic model, by 4.3 % in accordance with the spatial model. With the appearance of an additional sauna in the district, the risk of infection with onychomycosis increases by 26.8 %, and with an increase of the pH of the soil per unit – decreases by 10.7 %.
A prospective cohort research was carried out among 125 (40 men and 85 women) patients with onychomycosis of the hands and feet, which allowed to determine the directions of improvement of their treatment to find out the influence of clinical and demographic features and comorbidity by onychomycosis patients on terms of mycological negativism and quality of life indicators. Most (81.6 %) patients had distal-lateral form of onychomycosis, 83.7 % patients had nail plate damage of 1/3 of their length and moderate or significant hyperkeratosis subungualis. The Clinical Index for assessing the severity of onychomycosis of Sergeyev’s (CIASOS) index in the examined patients was on average (16.4 ± 9.54) points (from 1 to 30 points).
47 positive results were obtained with microscopy, which was 95.9 %; the results of the polymerase chain reaction were positive by 30 (61.2 %) of 49 patients: in the majority (60 %) of patients the onychomycosis activator was T. rubrum, in 12 (40 %) cases a positive result of the polymerase chain reaction with panfundal primers was obtained, and the negative result of the polymerase chain reaction specific to T. rubrum. The evidence make for weighty conclusion: microscopy should not exclude the use of a polymerase chain reaction to diagnose the disease, these two methods should complement each other, and therefore the microscopy can verify the presence of fungal infection, while the results of the polymerase chain reaction help to identify the type of pathogen.
The obtained results showed that clinically significant predictors of the rate of eradication of fungi are the CIASOS index, the higher values of which increase the mycological negativization terms by 4.9 times (reliability = 0.042), and microcirculatory disorders, the presence of which is associated with an increase of the eradication time of the pathogen in almost 2.98 times (reliability = 0.013). The increase of the value of the CIASOS index is associated with a decrease of the quality of life, in particular, the assessment of social relations (reliability = 0.022), because of the negative perception by patients of more severe lesions by localization, area and the presence of cosmetic defect.
The results of multiple regression analysis showed that the presence of chronic comorbid disease makes a veracious contribution to reducing of the physical component of quality of life with onychomycosis, the sphere of social relations and interaction with the environment, while the strongest influence on the psychological component of quality of life is demonstrated by gender (female), duration of existence of fungal damage and the presence of anxiety disorders. Reducing of the assessment of social relations is associated with an increase of the value of CIASOS index, which is probably due to the negative perception by patients with more severe lesions due to localization, area and the presence of a cosmetic defect.
Data analysis of laser Doppler flowmetry by patients with onychomycosis allowed to reveal wide prevalence of ultrasound features of microcirculatory disorders among patients with fungal lesions of nail plates. Microcirculatory disorders in the skin of the affected fingers occurred by 57.1 % of patients with onychomycosis without visible vascular pathology. Output tissue blood flow with fungal lesions ([36.43 ± 27.56] perfusive units) was 2 times lower than the microcirculation indicant on similar segments of unaffected fingers of the other limb ([78.56 ± 57.15] perfusive units; p = 0.023).
For the first time, we investigated the effect of microcirculation disorders on the basis of laser Doppler flowmetry data on the clinical course of onychomycosis. It has been shown that distal-lateral and proximal lesions of the nail plate (92.9 %) predominates by patients with microcirculatory disturbances, and by 46.4 % of patients the defeat is dominated by more than two-thirds, resulting from the CIASOS index exceeds in 2 times the similar index by persons without microcirculation impairment (reliability <0.001). Negative reaction of results of mycological research by patients with onychomycosis of feet, which do not have microcirculatory disorders, occurs on average 2.6 months earlier than when they are present (reliability <0.05), whereas in the case of isolated onychomycosis of hands the influence of microcirculatory disorders on terms of mycological negative reaction was not found (reliability > 0.05).
For clearing of the effectiveness of developed integrated treatment with the usage of antifungal drugs and agents with differentiated effects on microcirculation disorders by patients with onychomycosis, an open controlled clinical trial was conducted. The research involved 129 patients, that were divided into 2 clinical groups. The control group consisted of 49 patients with onychomycosis who received standard treatment with systemic and/or local antimycotics in accordance with existing instructions. Patients in the main group (n = 76) were prescribed the combination therapy, which included the medication of systemic and/or local antifungal agents and angioprotective drugs. Patients with spastic hemodynamic type of microcirculation were prescribed naftidrofuryl gidrogene oxalate (angelbin) in a dose of 100-200 mg per day, for patients with hyperemic type of microcirculation – Detralex with daily dose of 2 tablets per day (in two doses). In cases of diagnosed constipation-static type of microcirculation, patients received naftidrofuryl gidrogene oxalate in a complex with a Detralex in the aforementioned doses. Duration of therapy was 3 months.
Complex treatment with using of antifungal and angioprotective drugs allowed to accelerate the recurrence of morbidity of onychomycosis, contributed to twofold increase of nail renewal of hands and feet, provided mycological negative reaction during 12-14 weeks by 97.4 % of patients, which was by 11.7 % more than by patients with traditional treatment, and also allowed to improve the rate of emotional sphere (reliability = 0.001), social activity (reliability = 0.027) and DLQI by patients of the exposure group.
Correlation analysis showed that delayed convalescence is associated with the presence of microcirculatory disorders (r = 0.504; p <0.001), and the constipation-static type of microcirculation disturbance increases the terms of mycological negative reaction by patients with onychomycosis (p <0.001).
As shown by the Kaplan-Meier analysis, the statistically significant influence on the terms of mycological negative reaction of the pathogen performs the localization of fungal lesions on the fingers of the feet, the CIASOS index> 6, the presence of concomitant chronic diseases and microcirculatory disorders.
For the first time in national scientific practice the effectiveness of polymerase chain reaction as a method of control of cure and evaluation of the treatment of patients with onychomycosis in dynamics was investigated. It has been established that by 71.4 % of patients, both analyses (microscopy and polymerase chain reaction) was negated, while by 28.6 % of patients negative result of microscopy was first, and the result of polymerase chain reaction remained positive. The average periods of mycological negative reaction based on the microscopic results of these patients were in average (12.07 ± 3.1) weeks, and according to results of a polymerase chain reaction, specific to T. rubrum, and a polymerase chain reaction with panfungal primers, – (14.21 ± 4.5) weeks (reliability = 0.043). The obtained data represent that using of the polymerase chain reaction method to control the cure and evaluate the outcome of the treatment of onychomycosis patients in the dynamics is inappropriate.
Key words: onychomycosis, clinical epidemiology, microcirculatory disorders, combined therapy.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Кізіна І. Є. Оніхомікоз у Вінницькій області: погляд на проблему через призму популяційного дослідження // Biomedical and biosocial antropology. 2014. № 23. С. 235- 238.
- Літус О. І., Кізіна І. Є. Показники лазерної допплерівської флоуметрії в оцінці мікроциркуляції при лікуванні оніхомікозів // Вісник Вінницького національного університету. 2016. Т. 20, № 1 (1). С. 81-85.
- Кізіна І. Є. Психологічна складова якості життя у хворих з оніхомікозом як критерій ефективності лікування // Дерматологія та венерологія. 2015. № 4. С. 50-57.
- Кізіна І. Є. Інформативність полімеразної ланцюгової реакції для діагностики, оцінки перебігу й результатів лікування оніхомікозу // Biomedical and biosocial anthropology. 2015. № 25. С. 169-172.
- Кізіна І. Є. Вплив клініко-демографічних факторів та коморбідності на якість життя хворих на оніхомікоз // Дерматологія та венерологія. 2016. № 4 (74). С. 64-71.
- Кізіна І. Є. Ефективність терапії хворих на оніхомікоз з використанням протигрибкових і ангіопротекторних препаратів // Дерматологія. Косметологія. Сексопатологія. 2017. № 1-2 (5). С. 14-19.
- Кізіна І. Є. Диференційований підхід до комплексного лікування оніхомікозів із урахуванням коморбідних мікроциркуляторних порушень // Український журнал дерматології, венерології, косметології. 2017. № 1 (64). С. 52-58.
- Kizina I. E. Geostatistical modeling of onychomycosis incidence rates in Vinnitska oblast // Дерматовенерология. Косметология. 2015. № 2. С. 10-17.
ЗМІСТ
| Перелік умовних скорочень
Вступ Розділ 1 Оніхомікоз: сучасний погляд на етіопатогенез, клініку, діагностику та лікування (огляд літератури) 1.1 Клініко-патогенетичні чинники та фактори ризику оніхомікозу 1.2 Новітні методи вивчення епідеміологічних станів населення 1.3 Актуальні питання діагностики оніхомікозу 1.3.1 Особливості клінічного обстеження хворих на оніхомікоз 1.3.2 Регламентовані методи діагностики оніхомікозу 1.3.3 Новітні методи діагностики оніхомікозу 1.4 Особливості сучасної антимікотичної терапії Розділ 2 Матеріал та методи дослідження 2.1 Загальна клінічна характеристика хворих 2.2 Методи клінічних досліджень 2.3 Методи мікроскопічного та бактеріологічного дослідження грибів 2.4 Метод молекулярно-генетичного дослідження грибів 2.5 Метод функціонального дослідження стану мікроциркуляції шкіри 2.6 Метод геостатистичного моделювання 2.7 Метод статистичної обробки матеріалу Розділ 3 Епідеміологічні особливості оніхомікозу у населення Поділля 3.1 Захворюванність на оніхомікоз у населення Поділля та фактори ризику його розвитку як основа для створення геостатистичної моделі 3.2 Базова модель аналізу захворюваності на оніхомікоз та факторів ризику його розвитку 3.2.1 Інформаційні характеристики базової моделі 3.2.2 Лінійний предиктор базової моделі 3.2.3 Тестування ефектів факторів ризику розвитку оніхомікозу за базовою моделлю 3.3 Просторова модель аналізу захворюванності на оніхомікоз та факторів ризику його розвитку (удосконалення базової) 3.3.1 Інформаційні характеристики просторової моделі 3.3.2 Тестування ефектів факторів ризику розвитку оніхомікозу за просторовою моделлю 3.4 Просторово-динамічна модель аналізу захворюванності на оніхомікоз та факторів ризику його розвитку 3.4.1 Інформаційні характеристики просторово-динамічної моделі 3.4.2 Тестування ефектів факторів ризику розвитку оніхомікозу за просторово-динамічною моделлю Розділ 4 Розлади мікроциркуляції шкіри, клініко-демографічні та психоемоційні особливості у хворих на оніхомікоз 4.1 Клініко-демографічні особливості та коморбідність у хворих на оніхомікоз 4.2 Особливості психоемоційного стану хворих на оніхомікоз 4.3 Розлади мікроциркуляції в шкірі уражених пальців хворих на оніхомікоз Розділ 5 Патогенетична комбінована терапія хворих на оніхомікоз з використанням протигрибкових і ангіопротекторних препаратів 5.1 Розробка патогенетичної комбінованої терапії хворих на оніхомікоз 5.2 Порівняльний аналіз результатів комбінованого лікування хворих на оніхомікоз 5.3 Порівняльний аналіз строків мікологічної негативації в процесі лікування Розділ 6 Полімеразна ланцюгова реакція як метод контролю виліковності та оцінки результатів лікування хворих на оніхомікоз 6.1 Строки негативації полімеразної ланцюгової реакції в процесі лікування хворих на оніхомікоз контрольної групи 6.2 Аналіз впливу клініко-демографічних факторів та соматичної коморбідності на строки мікологічної негативації за даними полімеразної ланцюгової реакції у хворих на оніхомікоз 6.3 Строки негативації полімеразної ланцюгової реакції в процесі лікування хворих на оніхомікоз основної групи Розділ 7 Аналіз і узагальнення результатів досліджень Висновки Рекомендації Список використаних джерел Додаток А Текст програмного модулю WinBUGS базової моделі Додаток Б Дані для просторово-динамічної моделі зараження оніхомікозами Додаток В Текст програмного модулю WinBUGS просторової моделі Додаток Г Текст програмного модулю WinBUGS просторово-динамічної моделі Додаток Д Акти впровадження Додаток Е Список публікацій здобувача за темою дисертації та відомості про апробацію результатів дисертації |
16
17 23 23 27 29 29 30 34 38 46 46 49 52 52 54 55 56 59 59 59 64 66 68 73 73 75 82 82 83 92 92 98 104 111 111 114 126 132 138 142 157 160 161 184 186 191 194 196 201 |
ПЕРЕЛІК УМОВНИХ СКОРОЧЕНЬ
| ДІ
КІОТОС ПЛР ПО ПНР ППР СШ СYР DLQI HАDS WHOQOL-BREF |
– довірчий інтервал
– клінічний індекс оцінки тяжкості оніхомікозів Сергеєва – полімеразна ланцюгова реакція – перфузійна одиниця – прогностичної цінності негативного результату – прогностична цінність позитивного результату – співвідношення шансів – система цитохромів Р450 – The Dermatology Life Quality Index – The hospital Anxiety and Depression Scale – The World Health Organization Quality of Life |
ВСТУП
Актуальність теми. Упродовж останніх 15-20 років реєструється істотне підвищення частоти інфекційних захворювань, спричинених грибами [34, 136, 173]. За даними літератури на частку грибкових уражень припадає майже 42 % усіх дерматозів, серед яких оніхомікоз є найпоширенішим [80, 119, 121]. За даними ВООЗ, грибкове ураження нігтів відмічається у 5-25 % населення Землі і цей показник постійно підвищується, особливо із збільшенням віку пацієнта [118, 197].
До 1999 року в Україні взагалі не було даних про розповсюдження мікотичної інфекції серед умовно здорового населення. В ході скринінгового проекту «Ахіллес», в якому з 1997 року брали участь 20 країн Європи [223], було встановлено, що в Україні серед 92 500 обстежених пацієнтів 28 283 (30,57 %) страждали різними грибковими захворюваннями. Встановлено, що щорічний приріст захворюваності оніхомікозами в Україні складає 5 % [10, 24, 54]. Водночас, слід зазначити, що на сьогодні немає реґіональних даних щодо рівня та структури захворюваності на оніхомікози, зокрема в популяції Подільського регіону України. Останнє затрудняє обґрунтовати планування медико-соціальної та профілактичної допомоги цієї категорії хворих.
На сьогодні відомо, що оніхомікоз можуть викликати близько 50 видів грибів, але основними збудниками є дерматофіти [65, 165, 180]. Хворі на оніхомікоз є джерелом розповсюдження інфекції як серед близьких родичів, так і в місцях загального користування. На превеликий жаль, рання діагностика оніхомікозів та, в подальшому, верифікація негативаціїї збудника цього захворювання є проблемами ведення цих хворих. Перспективним напрямом у діагностиці та оцінці результатів лікування хворих на оніхомікоз є полімеразна ланцюгова реакція (ПЛР) [43, 210, 212, 214, 218]. Суттєво, що дані про можливість використання цього методу для оцінки перебігу й результатів лікування у вітчизняній літературі не знайдені.
Розвитку оніхомікозу сприяють травми, мікротріщіни, судинні захворювання (особливо при ураженні судин нижніх кінцівок), ожиріння, цукровий діабет, деформація кісткового апарату стоп, тривале лікування антибіотиками, імунодепресантами, кортикостероїдами [20, 47, 58, 110, 157, 186]. В цьому аспекті цікавим є відношення факторів ризику розвитку оніхомікозу до строків мікологічної негативації й відростання здорового нігтя. Суттєво, що останні є досі невивченими. Крім цього, залишається поза увагою спеціалістів вірогідна залежність ефективності лікування від стану мікроциркуляції. Дослідження цього питання, ймовірно, є перспективним для розробки методів терапії та профілактики захворювання.
Оніхомікоз призводить до деструкції нігтів, часто спотворюючи їх, викликаючи больові відчуття різної сили, що, в свою чергу, призводить до виникнення психологічних, косметичних та функціональних проблем [65, 156, 129]. В зв’язку з цим, останнім часом з’явився інтерес до характеристики якості життя у хворих на оніхомікоз, оскільки поліпшення якості життя відноситься до однієї з важливих завдань в лікуванні пацієнтів цієї категорії.
Невизначеність більшості з перерахованих позицій у проблемі оніхомікозів, необхідність подальшого пошуку сучасних методів диференціальної діагностики та оцінки результатів лікування при комбінованій терапії даного захворювання і сформувало мету та завдання дослідження.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота є фрагментом науково-дослідної роботи кафедри шкірних та венеричних хвороб Вінницького національного медичного університету імені М. І. Пирогова МОЗ України «Розробка лікувально-профілактичних та лікувально-діагностично-реабілітаційних програм при важких хронічних дерматозах та захворюваннях, що передаються статевим шляхом, з метою підвищення якості життя пацієнтів» (№ державної реєстрації 0113U003463), в якій виконано розділ, присвячений удосконаленню лікувально-діагностичних заходів з ведення хворих на оніхомікоз. Автор самостійно проводив інформаційно-патентний пошук, брав участь у обстеженні та лікуванні хворих на оніхомікози.
Мета та задачі дослідження. Мета – підвищення ефективності лікування хворих на оніхомікоз шляхом удосконалення методу патогенетичної комбінованої терапії з використанням протигрибкових і ангіопротекторних препаратів на підставі вивчення клініко-епідеміологічних особливостей у хворих Поділля, показників якості життя, стану мікроциркуляції шкіри та діагностичної значущості різних методів діагностики для контролю виліковності у даної групи пацієнтів.
Задачі дослідження:
- Встановити рівень захворюваності та провідні фактори ризику розвитку оніхомікозу у населення Поділля на підставі геостатистичного моделювання.
- Оцінити вплив клініко-демографічних особливостей та коморбідності у хворих на оніхомікоз на строки мікологічної негативації та показники якості життя.
- Встановити поширеність та структуру розладів мікроциркуляції в шкірі уражених пальців хворих на оніхомікоз за даними лазерної допплерівської флоуметрії, її вплив на клінічні прояви захворювання, строки мікологічної негативації та показники якості життя.
- Удосконалити метод патогенетичної комбінованої терапії хворих на оніхомікоз з використанням протигрибкових і ангіопротекторних препаратів, оцінити його клінічну ефективність та вплив на покращення якості життя.
- Оцінити діагностичну значущість методу ПЛР для контролю виліковності та оцінки результатів лікування хворих на оніхомікоз.
Об’єкт дослідження – оніхомікоз.
Предмет дослідження – клініко-епідеміологічні параметри, клініко-морфологічні прояви оніхомікозів, стан мікроциркуляції та показники якості життя у хворих на оніхомікоз у процесі комбінованого лікування хворих на оніхомікоз.
Методи дослідження: вивчення скарг, анамнезу життя та захворювання, наявності коморбідної патології; об’єктивних ознак ураження нігтьових пластинок із визначенням локалізації та тяжкості ураження; клінічні (клінічний аналіз крові та сечі); мікологічний та молекулярний (ПЛР нігтьових пластинок) для верифікації наявності оніхомікозу; інструментальний (лазерна допплерівська флоуметрія) для оцінки стану мікроциркуляції; соціологічні для вивчення психоемоційних особливостей у хворих на оніхомікоз; математичні (метод геостатистичного моделювання для визначення рівня захворюваності та ризику факторів зараження на оніхомікоз); статистичний для математичної обробки отриманих даних.
Наукова новизна одержаних результатів. Вивчено рівень та структуру захворюваності на оніхомікози та уточнено представленість провідних факторів ризику зараження на території Вінницької області України.
Вперше у вітчизняній науковій практиці деталізовано вплив клініко-демографічних факторів на строки мікологічної негативації та якість життя хворих на оніхомікоз, що дозволило визначити напрямки удосконалення їх лікування. Показано, що провідними факторами, які асоціюються зі строками ерадикації збудника, є клінічний індекс оцінки тяжкості оніхомікозів Сергеєва (КІОТОС) та мікроциркуляторні розлади, при чому зростання величини індексу КІОТОС асоціюється з негативною динамікою якості життя, зокрема, оцінкою соціальних відносин (р=0,022).
Вивчено поширеність та структуру коморбідності при оніхомікозі, її вплив на перебіг захворювання та якість життя даної категорії хворих. Вперше показано, що у 57,1 % хворих на оніхомікоз без видимої судиної патології за даними лазерної допплерівської флоуметрії мають місце мікроциркуляторні розлади у шкірі уражених пальців. Вперше досліджено вплив розладів мікроциркуляції за даними лазерної допплерівської флоуметрії на клінічний перебіг оніхомікозу.
Науково обґрунтовано напрямки підвищення ефективності комплексної терапії оніхомікозів та покращення якості життя хворих із залученням засобів із диференційованим впливом на розлади мікроциркуляції.
Практичне значення отриманих результатів. За результатами комплексного обстеження з’ясовано ряд факторів, які впливають на строки мікологічної негативації й відростання здорового нігтя.
Опрацьовано та впроваджено у клінічну практику комплексний метод терапії хворих на оніхомікоз із залученням як протигрибкових засобів, так і засобів із диференційованим впливом на розлади мікроциркуляції.
Досліджена ефективність ПЛР як методу контролю виліковності та оцінки результатів лікування хворих на оніхомікоз у динаміці.
Основні наукові та практичні результати дисертаційної роботи впроваджені в лікувально-діагностичний процес Вінницького обласного клінічного шкірно-венерологічного диспансеру, Київської міської клінічної шкірно-венерологічної лікарні, ДУ «Інститут дерматології та венерології НАМН України», а також у навчальний процес кафедри шкірних та венеричних хвороб Вінницького національного медичного університету імені М.І. Пирогова та кафедри дерматовенерології Національної медичної академії післядипломної освіти імені П.Л. Шупика.
Особистий внесок здобувача. Дисертантом самостійно проведено аналіз наукової літератури, інформаційно-патентний пошук за темою дисертаційної роботи. Разом із науковим керівником сформульовано мету та задачі дослідження, обговорено отримані результати. За безпосередньою участю дисертанта проведено епідеміологічне та клінічне дослідження. Автором проведено збирання матеріалу дослідження, формування груп хворих, їх обстеження та лікування. Особисто дисертантом виконано статистичне опрацювання й аналіз отриманих результатів. Самостійно виконано написання всіх розділів дисертації, формулювання висновків та практичних рекомендацій, їхнє відображення в періодичних виданнях та впровадження до клінічної практики.
Дисертантом не запозичено результати та ідеї співавторів публікацій.
Апробація результатів дисертації. Основні положення дисертаційної роботи викладено в доповідях на регіональній науково-практичній школі «Набуття молодих вчених дерматовенерологів» (Київ, 2012), науково-практичній конференції, присвяченій 85-річчю дерматовенерологічної служби Вінницької області «Сучасні методи організації і технології в розвитку вітчизняної дерматовенерології» (Вінниця, 2013), науково-практичній конференції «12-е Киевские дерматологические дни» (Київ, 2017).
Публікації. За темою дисертації опубліковано 8 друкованих праць. Серед них: 7 статей у спеціалізованих наукових виданнях (у моноавторстві – 6), 1 – у журналі, що входить до міжнародних наукометричних баз даних Google Scholar та Російський індекс наукового цитування (Science Index).
Обсяг і структура дисертації. Дисертація викладена на 202 стрінках. Робота включає вступ, огляд літератури, опис матеріалу та методів дослідження, чотири розділи власних досліджень, аналіз та узагальнення отриманих результатів, висновки, рекомендації, список використаних джерел (225 джерел, із яких 69 – кирилицею, 156 – латиною), 6 додатків. Робота ілюстрована 30 таблицями та 24 рисунками.
РОЗДІЛ 1
ОНІХОМІКОЗ: СУЧАСНИЙ ПОГЛЯД НА ЕТІОПАТОГЕНЕЗ,
КЛІНІКУ, ДІАГНОСТИКУ ТА ЛІКУВАННЯ (ОГЛЯД ЛІТЕРАТУРИ)
1.1 Клініко-патогенетичні чинники та фактори ризику оніхомікозів
Період кінця XX – початку XXI століття характеризується помітним зростанням рівня захворюваності на мікози. Особливістю стало значне територіальне поширення низки грибкових інфекцій, зокрема дерматофітій, що можна пояснити інтенсивнішою міграцією населення та змінами способу життя в індустріальних країнах [136, 173]. Це зростання не вдалося зупинити й після впровадження новітніх фармацевтичних засобів [119, 204, 224]. За даними ВООЗ, у середньому кожний п’ятий мешканець Землі інфікований грибами, а кожний десятий має виражені клінічні прояви [216]. Інфікованість населення європейських країн мікозами стоп становить від 20 до 70 % [46, 67].
Аналогічна ситуація склалася і в Україні. Це значною мірою зумовили соціальні, медичні та фармакологічні чинники. Зокрема, погіршилася санітарно-просвітницька робота, розширилася мережа послуг для населення, таких як басейни, сауни, косметологічні кабінети, що за умови недотримання відповідних санітарних норм можуть ставати осередками інфекції, також є певні проблеми з лікуванням від грибкових хвороб соціально неблагополучних прошарків населення [110, 170]. До медичних чинників належать: загальне погіршення показників імунітету серед населення, використання інвазивних методів діагностики, зростання кількості випадків хвороб, які часто супроводжуються грибковими інфекціями (цукровий діабет, онкологічні захворювання, ВІЛ-інфекція). Серед фармакологічних чинників провідна роль належить застосуванню антибіотиків широкого спектра дії, використанню імуносупресивних препаратів при трансплантації органів тощо [1, 110]. Не останнє місце посідають і недоліки існуючих препаратів: недостатня клінічна ефективність, токсичність, побічні ефекти [86, 88]. Таким чином, проблема мікозів змушує медиків та фармацевтів усього світу концентрувати зусилля для її вирішення.
Нині відомо понад 400 видів грибів, які спричинюють захворювання у людини [23, 84, 195]. Питання щодо збудників мікозів ускладнюється й тим, що певні захворювання, клінічно дуже подібні до грибкових, насправді спричинюють інфекційні агенти інших таксономічних груп – бактерії та хромовики, тому такі хвороби дістали назву псевдомікозів. До бактерій належать збудники еритразми (Corуnebacterium minutissium), актиномікозу (Асtynomyces spp.), нокардіозів (Nocardia spp.) та деяких інших. До царства хромовиків (Сhromista), нещодавно відокремленого від царства грибів, належать збудники пітіозу (Руthium insidiosum) та риноспоридіозу (Rhinosporidium seeberi). Решту грибкових захворювань викликають представники царства грибів (Fungi) трьох класів – зигоміцети (збудники мукорозів, ентомофторозів), аскоміцети (збудники кандидозів, хромобластомікозу, феогіфомікозів, зокрема й чорної п’єдри, фузаріозу, фавусу, трихофітії, мікроспорії, епідермофітії, гістоплазмозу, бластомікозу, паракокцидіомікозу (американського бластомікозу), кокцидіомікозу) та базидіоміцети (збудники криптококозу, білої п’єдри, маласезіозів, у тому числі висівкоподібного лишаю) [52, 137, 165, 167]. Від систематичної належності того чи іншого збудника залежить вибір лікувальної тактики [51, 88, 198]. Класичний приклад – еритразма, збудника якої тривалий час вважали настільки близьким до гриба – збудника висівкоподібного лишаю, що зараховували їх до одного роду Microsporon. Проте з’ясувалося, що збудник еритразми чутливий до антибактеріального засобу – еритроміцину і зовсім нечутливий до протигрибкових препаратів, на які добре реагує збудник висівкоподібного лишаю, як і належить справжньому грибові. Зарахувавши збудника еритразми до бактерій, мікробіологи дали відповідь на це питання. Водночас лікування хвороб, спричинених хромовиками, можливе лише в разі застосування масивних доз азольних антимікотиків, передусім ітраконазолу [50].
Грибкові інфекції викликають алергійні захворювання, погіршують перебіг хронічних патологічних процесів, негативно впливають на імунітет [47, 188]. Ураження навіть одного нігтя може стати джерелом інфікування шкіри, волосся, інших нігтьових пластин, травного каналу, сечостатевої системи, очей, порожнини рота і органів центральної нервової системи [54].
Оскільки мікози є інфекційними хворобами, то основним є етіотропне лікування. Після елімінації збудника зникають усі симптоми. Патогенетична та симптоматична терапія без застосування етіотропної є цілком невиправданою як з точки зору клінічної ефективності, так і фармакоекономічної доцільності.
У 1999 році в Україні під координацією кафедри дерматовенерології Національного медичного університету імені О.О. Богомольця було проведено «Ахіллес-проект України». Це дослідження охопило 16 областей України, у ньому взяли участь 185 лікарів-дерматологів, яких контролювали й консультували 27 керівників підгруп – завідувачів кафедр медичних вузів, професорів, головних лікарів обласних шкірних диспансерів. Метою проекту було активне виявлення грибкових хвороб для з’ясування реальної поширеності мікозів в Україні, їхньої локалізації, етіології, середньої тривалості, використовуваних методів терапії, а також привернення уваги населення до потреби й можливості вилікування, підвищення його інформованості про сучасні методи терапії при грибкових інфекціях [37].
У рамках проекту було обстежено 92 492 громадян, з яких у 28 823 (31 %) було виявлено грибкові інфекції, а оніхомікози – у 14 715 (16 %), що становить 52 %.
Дослідження показали, що на сьогоднішній день в Україні за різноманітного спектра збудників оніхомікозу переважають асоціації дерматофітів з пліснявими (мікроміцетами), рідше з дріжджеподібними грибами [17]. Це дуже важливо враховувати при виборі препарату для лікування захворювання. А.В. Руденко та співавтнаводять такі дані з цього приводу: дерматофіти в монокультурі викликають 0,8 % оніхомікозів, мікроміцети в монокультурі – 24,1 %, асоціації дерматофіти + мікроміцети + бактерії – 45,7 %, асоціації) дерматофіти + мікроміцети + дріжджеподібні гриби – 25,6 %, асоціації дерматофіти + мікроміцети – 3,8 % [37, 67]. Було виявлено 33 роди, 103 види та 1728 штамів пліснявих грибів з класів Zygomycetes (порядок Mucorales) та Deuteromycetes (порядки Moniliales, Pycnidiales, Sphaeriales та Mycelia sterilia) [37, 84].
За даними європейської частини Ахіллес-проекту, оніхомікози діагностують у 23 % пацієнтів загальної популяції та у 40 % — із захворюваннями стоп. За результатами Ахіллес-проекту, проведеного в Україні, мікоз ступень має 31 % хворих загальної популяції [22]. Серед них оніхомікоз ступень виявляють у 52 % [67]. Дані дослідників з Японії свідчать про поширеність сквамозної та сквамозно-гіперкератотичної форм мікозів стоп на рівні 25 % серед пацієнтів загальної популяції, а оніхомікоз стоп – 59 % серед хворих на мікоз стоп [80].
У певних груп пацієнтів ймовірність розвитку оніхомікозу ступень вища, ніж у загальній популяції. Ризик розвитку оніхомікозу підвищують такі чинники: сімейна схильність до дерматомікозів, травма, цукровий діабет та порушення периферійної циркуляції крові [6, 39, 29, 208].
Цукровий діабет розглядають як чинник ризику для розвитку мікозу ступень [110, 186]. Окрім нього, вказують ще й такі:
1) захворювання судин [48, 113];
2) заняття спортом [157];
3) постійний контакт з вологою внаслідок особливостей соціальної поведінки і носіння гумового взуття та гіпергідроз [113, 121, 167];
4) ожиріння [219];
5) чоловіча стать [113].
Дані щодо впливу статі на частоту захворювання на оніхомікоз у літературі часті. Зокрема, на це вказують дані «Ахіллес-проекту», проведеного в Європі: мікоз та оніхомікоз ступень частіше виявляють у чоловіків та осіб старшого віку [67]. Результати інших досліджень свідчать, що частота мікозу та оніхомікозу ступень у чоловіків загальної популяції більш ніж у 2 рази перевищує ці показники в жінок, а відносний ризик розвитку мікозу та оніхомікозу ступень у осіб сильної статі є вищим за відносний ризик, пов’язаний із віком [113]. Загалом можна констатувати більший ризик розвитку мікоз ступень у чоловіків порівняно із жінками, в тому числі і серед хворих на цукровий діабет [134], однак причини такого домінування пояснюють по-різному: від особливостей соціальної поведінки [121] до можливої генетичної схильності.
Поширеність оніхомікозу ступень зростає з віком як у загальній популяції [29, 32], так і серед пацієнтів із цукровим діабетом [110]. За деякими даними, понад 90 % літніх людей мають оніхопатії ступень [217]. Вважається, що майже половина оніхопатій грибкової природи [13].
Отже, на сьогоднішній день, однією з найбільш значущих проблем медичної мікології є саме оніхомікоз.
1.2 Новітні методи вивчення епідеміологічних станів населення
В останні десятиліття проводяться масштабні дослідження щодо вивчення регіональних моделей і детермінант соціальних процесів, почасти завдяки інтенсивному розвитку аналітичних прикладних технологій і обчислювальних потужностей. Переломним являється впровадження Монте Карло + ланцюги Маркова технологій. Геостатистичне моделювання процесів здоров’я набуває все більшого поширення внаслідок можливості пояснення регіональних відмінностей. Часто для медичних подій використовується безперервний просторовий фрейм, який черпає потужність з ближчих у просторі даних через просторову матрицю ковариацій. Найбільш потужний і гнучкий вважається підхід Байєса, реалізований через алгоритми Монте Карло + ланцюги Маркова, які використовують також попередні структуровані розподіли геостатистичних параметрів. Доведено, що медичні події, зокрема рівні захворюваності, їх наслідків, зокрема смертності, мають чіткі розподіли як щодо груп населення, так і територій.
У той час як ієрархічний аналіз з неструктурованими залишками (exchangeable hierarchical analysis) доречний для опису просторово незалежних процесів, він демонструє неспроможність при відмінностях сусідніх територій [74]. Проблема навіть глибша, при включенні до моделі важливих факторів ризику, які пояснюють рівні захворюваності, виявляється ряд не менш важливих факторів, які не можуть бути безпосередньо ідентифіковані чи виміряні. Це так звана безпосередньо неспостережена гетерогенність (unobserved heterogeneity), яка в свою чергу просторово структурована. Так, A. Gelfand et al. (2005) спостерігав виражену просторову структурованість розподілу видів мікроорганізмів, яка включала просторові умови природного середовища та міжвидову конкуренцію [82]. Нажаль, геостатистичне моделювання захворюваності на оніхомікоз, апріорно з важливою просторовою структурою гетерогенностей як антропоноз, уникало уваги фахівців. Не знайдено прикладів геостатистичного вивчення захворюваності на оніхомікоз ні в Україні, ні за її межами. Проведено таке вивчення на базі території Вінницької області.
Класичним є дискретний фрейм з агрегованими щодо територій даними. Як правило, рівні просторового процесу виражають кількістю подій на певній території за певний проміжок часу (count data), напр. кількість зареєстрованих захворювань в просторовій епідеміології, а також середніми (напр., типовий сімейний дохід в просторовій економетрії). Це дослідження проведено саме в рамках класичного фрейму медичної просторової епідеміології, з більш детальним роз’ясненням організації даних у наступному підрозділі.
1.3 Актуальні питання діагностики оніхомікозу
1.3.1 Особливості клінічного дослідження хворих на оніхомікоз
Клінічна диференціальна діагностика ураження нігтів вкрай складна, відрізняється широким спектром різних ознак, на які слід звертати увагу [130, 215]. Наприклад, точкові вдавлення на поверхні нігтьової пластини можливі при псоріазі, екземі, поперечні борозенки – при псоріазі, екземі, пухирчатці, порушеннях кровообігу, кору, скарлатині, тифі та інших захворюваннях [166]. Такі дистрофічні зміни виникають внаслідок впливу ендогенних і екзогенних факторів. Симптоми ураження нігтів умовно поділяють на декілька груп: зміни форми і розмірів нігтів, дисхромії і розлади їх пігментації. Так, зміни форми і розмірів нігтів можливі в осіб з захворюваннями серцево-судинної системи, хронічним туберкульозом, емфіземою легенів, лейкозом, новоутвореннями в легенях та іншими хронічними захворюваннями [147].
Слід підкреслити, що в переважній більшості випадків зміни нігтів пов’язані з їх грибковим ураженням. Клінічні прояви оніхомікозу, що укладаються в симптомокомплекси оніхолізісу, гіперкератозу і інші типові зміни нігтів, можуть спостерігатися при ряді оніходістрофій. Між тим, і симптоматичні оніходистрофіі (псоріаз, червоний плоский лишай, нейротрофічні зміни тощо) можуть бути ускладнені приєднанням мікозу [169].
Відповідно до сучасної європейської класифікації, виділяють чотири форми оніхомікозу: дистально-латеральну піднігтьові, поверхневу білу, проксимальну піднігтеву і тотальну дистрофічну.
Незважаючи на те, що в останні роки встановлені клінічні ознаки, статистично достовірно дискримінаторні для оніхомікозу (зокрема, зміна кольору нігтів і білі плями на поверхні, одностороннє ураження нігтів стоп або одночасне ураження нігтів 1 і 5 пальців на одній стопі), існують розбіжності в оцінці цих змін між різними дослідниками [103, 197].
1.3.2 Регламентовані методи діагностики оніхомікозу
Клінічна оцінка оніхомікозу нездатна однозначно встановити діагноз і призначити лікування, засноване на протигрибкових препаратах [103]. Відомо, що частина лікуючих лікарів (у т.ч. сімейні лікарі загальної практики), взагалі не проводить лабораторну діагностику оніхомікозу перед початком протигрибкової терапії [211]. Тим не менш, сучасні керівництва і клінічні рекомендації виключають призначення антімікотіков без лабораторного підтвердження діагнозу [94], оскільки діагноз оніхомікозу без визначення збудника не є достовірним [80]. З цих позицій діагностика оніхомікозу укладається в концепцію діагностики будь-яких інфекційних захворювань, особливо беручи до уваги істинно контагіозну природу більшості збудників – дерматофітів [220, 222].
Лабораторна діагностика оніхомікозу проводиться з метою встановлення або підтвердження діагнозу захворювання [220]. Одним з головних аргументів на користь необхідності лабораторного дослідження є досить висока ймовірність діагностичної помилки при клінічній оцінці, що поряд з тривалістю і складністю системної терапії оніхомікозу робить практично неприпустимим лікування ex juvantibus.
Організаційна структура сучасної лабораторної діагностики оніхомікозу наведена в «Керівництві з лабораторної діагностики оніхомікозів» (2000). В даний час, як правило, переважає діагностичний метод збору лікарем матеріалу та направлення в мікологічну лабораторію / кабінет або збір матеріалу медичною сестрою в самій лабораторії з подальшою мікроскопією і/або посівом [4].
До регламентованих методів лабораторної діагностики оніхомікозу відносяться мікроскопічне і мікологічне (культуральне) дослідження.
У силу недостатньо високої точності кожної з методик рекомендується виконувати обидва дослідження в кожному випадку оніхомікозу [90], крім того, культуральне дослідження має значення у визначенні тактики лікування [97]. Обидві методики вимагають певного часу для виконання (до 24 год при мікроскопії та 7-28 днів при культивуванні) і кваліфікації персоналу лабораторії або лікаря, що виконує дослідження безпосередньо в кабінеті або відділенні дерматомікології.
У повсякденній практиці лікарів вважається допустимим підтвердження діагнозу оніхомікозу за допомогою хоча б однієї регламентованої методики, при використанні обох з них [196]. Цей підхід грунтується на недостатній чутливості кожної з методик, взятої окремо [70]. У той же час, практика вітчизняної охорони здоров’я показує, що багато лікарів-дерматологів виконують тільки одне регламентоване дослідження. Недоліки обох методик – низька чутливість і специфічність культурального дослідження [80], суб’єктивне сприйняття результатів і відсутність достатньо достовірних даних для аналізу чутливості мікроскопії [77], переконують деяких лікуючих лікарів взагалі утримуватися від лабораторної діагностики оніхомікозу, що може мати негативні наслідки в діагностиці та лікуванні. Серед традиційних технологій світлової мікроскопії, котрі використовуються в діагностиці оніхомікозу, в даний час найбільш широко використовується мікроскопія нефарбованих препаратів з попередньою обробкою (мацерацією, просвітленням) матеріалу розчином їдкого калію в концентраціях 5-30 % і часом витримки 0,5-24 год (КОН-мікроскопія). Мікроскопія є базовим і найбільш широко використовуваним методом лабораторної діагностики оніхомікозу [85], і дерматологи до теперішнього часу відчувають до неї найбільшу довіру. У європейських країнах КОН-мікроскопію як основний метод діагностики призначає не менше 63 % дерматологів перед початком лікування оніхомікозу [211].
У дослідженнях чутливість світлової мікроскопії оцінена в 64 %, порівнюючи її з гістологічної забарвленням солями перйодної кислоти (найкращий результат) і культивуванням (найгірший результат) в лабораторній діагностиці оніхомікозу [90]. Іранські автори оцінили чутливість світлової мікроскопії в 76,5 %, що практично не відрізнялося від чутливості гістопатологічного дослідження, але достовірно перевищувало показники посіву [91]. Оскільки результати світлової мікроскопії сприймаються візуально, їх інтерпретація суб’єктивна і у великій мірі залежить від кваліфікації дослідника. Крім того, як і при посіві, важлива кваліфікація лікаря, що бере матеріал для дослідження. Це може впливати на якість діагностики. Так, В. Arnold та співавтори встановили відхилення позитивних результатів у 55-85 % між 4 різними фахівцями [76]. D. Ellis і співавтори, проаналізувавши результати роботи 83 австралійських лабораторій, вказують, що відсоток позитивних результатів при світловій мікроскопії при великих обсягах досліджень варіює в межах 10-40 % [115]. При цьому опитування співробітників лабораторій продемонструвало, що там, де відсоток виявлення оніхомікозу виявлявся вищим, збільшувався час роботи з кожним зразком – до 20-30 хв. В.М. Рукавишникова, аналізуючи досвід вітчизняних і зарубіжних авторів до 2000 р., приводить показники достовірності мікроскопії для мікозів стоп в цілому, оцінюючи їх в 70-80 %. При цьому рекомендується переглядати не менше 3-4 препаратів з кожної патологічної ділянки [46].
Перевагою біопсії нігтя і гістопатологічного дослідження слід визнати їх використання для диференціальної діагностики оніхомікозу з оніходистрофіями [125]. До недоліків гістологічної діагностики відноситься її нездатність встановлювати видову, або хоча б групову належність збудників [123]. Крім того, забарвлення солями перйодної кислоти може давати негативний результат на ранніх стадіях оніхомікозу до враження нігтьового ложа, або при невеликій кількості матеріалу [87].
Мікологічне (культуральне) дослідження, що включає посів матеріалу з нігтів на спеціальне середовище з виділенням та ідентифікацією вирощеної культури, входить до числа регламентованих методик діагностики оніхомікозу, зазначених клінічними рекомендаціями в різних країнах [125, 130].
В якості показів для проведення культуральної діагностики наводяться «визначення виду збудника з метою уточнення діагнозу і вибору системного антімікотіка», тобто для оптимізації етіотропної терапії [33, 50, 213]. Завдання мікологічного дослідження можуть включати визначення можливості змішаної інфекції, підтвердження грибкової інфекції перед початком тривалого лікування антимікотиками, щоб виключити негрибкову патологію, а також з епідеміологічної метою для виявлення контактів [180].
Класифікація кожного випадку оніхомікозу згідно Міжнародної класифікації хвороб Х перегляду передбачає віднесення його до групи дерматофітії (В35.1), кандидозу (В37.2) або поверхневого мікозу іншої етіології (В36.8), що вже передбачає етіологічний діагноз, котрий можна встановити засобами регламентованих методів за допомогою культивування та ідентифікацією збудника [52].
Уявлення про можливість заміни мікологічного дослідження при оніхомікозі призначенням тих чи інших системних антімікотіков завдяки широкому спектру їх дії, висловлені в кінці 1990-х рр., залишаються дискусійними.
Важливою підставою для виконання культурального дослідження є збільшення чутливості діагностики, тобто підвищення виявлення оніхомікозу за рахунок посіву на тлі негативних результатів мікроскопії [201].
Традиційним способом мікологічної діагностики в дерматології залишається посів на середовище Сабуро, що містить глюкозу (40 г на 1 л в традиційному складі), пептони і агар. Інші класичні середовища та методики культивування на практиці використовуються рідко.
На середовищі Сабуро ростуть не тільки дерматофіти, але також плісневі і дріжджові збудники оніхомікозу, і багато контамінантів, в тому числі бактеріальних. У практику мікологічних лабораторій у Росії і за кордоном частіше входить використання антибактеріальних засобів і циклогексаміду, для пригнічення зростання швидкозростаючих цвілевих контамінантів. Разом з тим, циклогексимид може пригнічувати ріст ряду істинних збудників оніхомікозу, у зв’язку з чим рекомендується посів матеріалу одночасно на 2 середовища – з циклогексамидом і без нього [33]. Зростання культури дерматофітів може очікуватися через тиждень від початку культивування при кімнатній температурі, плісняві і дріжджові збудники та контамінанти можуть дати ріст вже на 2-3 добу. Проте, існування повільно зростаючих видів і штамів (наприклад, на фоні терапії) грибів призводить до необхідності витримувати культури в термостаті до 4 тижнів, і тільки після даного терміну зростання робити висновок про відсутність зростання. Це значно підвищує навантаження на персонал лабораторії, оскільки з 2 тижня культури треба перевіряти двічі на тиждень [33]. В цілому, за результатами аналізу раніше проведених за кордоном великих досліджень, відсоток позитивних посівів при оніхомікозі становить 17-60 % [91]. В американському дослідженні J. Weiberg і співавторів (2013), яке включало 105 хворих, чутливість посіву була оцінена в 59 % [92]. У метааналізі проведених досліджень М. Lawry і Е. Haneke (2009) чутливість культивування на середовищі Сабуро з антибіотиками склала 32 %, а на середовищі Літтмана – 23 % [89].
1.3.3 Новітні методи діагностики оніхомікозу
Незадоволеність точністю регламентованих методик в діагностиці оніхомікозу, а також існуючими підходами до визначення етіології була усвідомлена досить давно, змушуючи дослідників шукати нові, альтернативні способи діагностики [179, 206, 210]. Крім молекулярно–генетичних методів, пропонувалися інші технології визначення елементів збудника або його візуалізації в матеріалі з нігтів.
Найбільш часто в якості альтернативи традиційної КОН-мікроскопії розглядалось описане вище гістологічне дослідження при біопсії нігтя.
В якості іншої альтернативи деякий час розглядалися конфокальна мікроскопія in vivo і імуногістохімія [127]. Однак досвід використання цих методик обмежений. Зокрема, американські автори описали тільки 1 випадок успішного застосування конфокальної мікроскопії в діагностиці оніхомікозу, ніяких даних про порівняльну точність даного методу не приведено. Європейські дослідники також не провели аналіз точності конфокальної мікроскопії, або гістохімії. Автори, які застосували імуногістохімічні методи (спеціальне забарвлення біоптатів) звернули увагу на труднощі впровадження даного методу, який вимагав би специфічні реактиви на основі антитіл, які не розроблені для ряду видів і вимагають одночасного виконання культурального дослідження [77].
Однією з останніх вивчених за кордоном можливостей діагностики оніхомікозу є використання матриксспектрометрії MALDI–TOF (матрикс–асоційована лазерна дезорбція – іонізація часу польоту). У даній технології одержуваний спектр матеріалу з нігтів порівнюється з уже наявними і зареєстрованими в спеціальній базі даних спектрами певних (референтних) мікроорганізмів. Рівень точності даної методики дозволяє проводити видоспецифічну діагностику дерматофітів, що підтверджується порівнянням з молекулярно-генетичною ідентифікацією видів, що виростають в культурі. Недивлячись на те, що автори відзначають порівняльну економію при використанні витратних матеріалів у MALDI–TOF матрикс-спектромегрії в порівнянні з ПЛР, очевидною є неможливість впровадження даної методики в широку дерматологічну практику, що обумовлено вихідною складністю і дорожнечею устаткування [144].
Повідомлення про можливість електродіагностики оніхомікозу за допомогою вимірювання електричного опору нігтьових пластин, також становлять певний інтерес, проте достовірних даних по точності даної методики немає [57, 155].
В кінці 1990–х рр. почались активні пошуки методів молекулярно-генетичної діагностики дерматофітії. Їм передували роботи в галузі генетики і геносистематики дерматофітів, котрі дозволили багато в чому переглянути погляди на таксономію сімейства Arihrodermataceae, філогенез, номенклатуру і видовий склад родів Trichophyton і Microsporum [51, 177, 218]. Це пов’язано з тим, що дерматофіти є істинними патогенами і їх уточнена ідентифікація має важливе значення в практичній охороні здоров’я [51]. Піонерами у розробці молекулярних методів ідентифікації дерматофітів стали колективи японських [192], австралійських [100] і європейських [143] дослідників, а самі методи початково базувалися на тих же технологіях (поліморфізм довжин рестрикційних фрагментів, аналіз ITS–послідовностей та ін.), які використовувалися в роботах цих же та інших авторів з молекулярної систематики, що мали не прикладний, а фундаментальний характер.
У 1994 р. німецькі дослідники повідомили про створення праймерів, заснованих на фрагменті гена рибосомної субодиниці 18sPHK, специфічних для групи грибів. Ампліфікація цього фрагмента в ПЛР була позитивною для ряду культур дерматофітів, і негативною для лусочок шкіри здорових людей. Автори повідомляли про можливість використання таких систем в діагностиці дерматофітії [87, 105]. Пізніше ці автори дослідили 69 зразків матеріалу від хворих дерматомікозами, порівнюючи результати ПЛР з культурою. Детекція генетичного матеріалу дерматофітів була відзначена в 35 випадках інфекції, порівняно з 28 випадками в культурі. Автори зробили висновок про перевагу ПЛР перед культивуванням в діагностиці дерматофітії [185].
Інша група дослідників вивчила створені ними генетичні зонди для детекції Т. rubrum. Експерименти з виділення ДНК дерматофітів безпосередньо з клінічних зразків з подальшою ампліфікацією і гібридизацією виявилися успішними в 30 % випадків [102].
На основі 18sрДНК і ITS італійські автори в 2000 р. створили праймери для детекції ряду збудників дерматофітії людини і тварин і протестували їх з 40 зразками матеріалу, із чутливістю в 25 копій генома на 1 зразок. Автори повідомили про збіги результату ПЛР і культивування [126]. Японські дослідники в 2003 році провели спробу виявлення дерматофітів у клінічних зразках за допомогою праймерів на основі гена хітин-синтази 1 (CHS1) [108]. Німецькі дослідники для ідентифікації видів дерматофітів використовували систему ПЛР LightCycler з 7 наборами праймерів для 21 виду грибів, паралельно також застосовували поліморфізм довжин рестрикційних фрагментів. Для визначення виду дерматофітів і пліснявих грибів було потрібно не менше 2 реакцій ПЛР в системі LightCycler. Незважаючи на можливу перспективність методу, вартість дослідження на такій системі (нині системи LightCycler забезпечують ПЛР у режимі реального часу і гібридизацію) виключає його застосування в дерматомікології [191].
У 2007 році колектив європейських дослідників вивчив новий мультиплексний набір праймерів для визначення ряду збудників дерматофітів в клінічному матеріалі за допомогою ПЛР у реальному часі. Протягом 6 місяців вивчили 92 зразка клінічного матеріалу з нігтів, волосся та шкіри. Повідомлялося про високу чутливість і специфічність методики [183].
У 1998 р. корейські дослідники S. Baek і співавт. повідомили про використання праймерів на основі 18sРНК для видової ідентифікації збудників оніхомікозу [100].
Про успішну видоспецифічну ідентифікацію 7 видів дерматофітів на основі праймерів з генами топоізомерази II в 2004 році також повідомили китайські дослідники [107].
На основі цих даних в Росії в 2004 році групою дослідників було прийнято рішення про розробку системи генодіагностики дерматофітії і оніхомікозу на основі праймерів гена топоізомерази ІІ [12, 33]. Були розроблені перші генетичні зонди для прямої діагностики дерматофітії шкіри і нігтів [33]. Даний проект був ініційований у 2003 р. Національною академією мікології, з метою вивчення можливості застосування ПЛР у виявленні Trichophyton rubrum в клінічних зразках. Потім був створений аналогічний метод для Trichophyton mentagrophytes [62]. Було запропоновано проводити мультипраймерную ПЛР з двома парами олігонуклеотидних праймерів: одна пара праймерів специфічна для фрагмента геному Т. rubrum, друга пара праймерів специфічна для фрагмента геному Т. mentagrophytes. Вибір даних видів для створення пари видоспецифічних праймерів був обумовлений лідируючим положенням Т. rubrum і Т. mentagrophytes в етіології оніхомікозу [212].
Альтернативні спроби створення методу генодіагностики дерматофітії на основі інших праймерів з топоізомеразою до сьогоднішнього дня не мають успіху. У 2006 році А.Ю. Сергеєв і співавт. опублікували перші результати випробовування нової системи генодіагностики дерматофітії за даними 2004-2005 рр. Ефективність діагностики порівнювалась з результатами мікроскопії та культивування. Статистична оцінка не дозволила авторам дати розгорнутий аналіз діагностичної цінності методу [33]. Проте, авторам вдалося показати, що на відміну від мікроскопії, результати ПЛР практично не залежать від якості збору матеріалу (досвіду лікаря, що бере матеріал).
Можна відзначити, що в сучасній дерматології відсутні уніфіковані алгоритми діагностики оніхомікозу. Поряд із новітніми методами [36, 43, 101, 214, 175] широко використовуються і такі регламентовані методи, як мікроскопія та культуральне дослідження [81, 99, 112, 133, 148, 164]. Вибір тієї чи іншої методики залежить, у переважній більшості випадків, від власного клінічного досвіду та обізнаності дерматолога, тому і результати досліджень залишаються, певною мірою, суб’єктивними. Перспективним напрямом у діагностиці та оцінці результатів лікування оніхомікозів є ПЛР [137, 161, 184, 191], суттєво, що даних про можливість використання цього методу для оцінки перебігу й результатів лікування у вітчизняній літературі не знайдено.
1.4 Особливості сучасної антимікотичної терапії
Актуальним є питання лікування хворих на оніхомікоз. Беручи до уваги існування системних антимікотичних засобів широкого спектра дії, правильне використання яких забезпечує високий відсоток клініко-етіологічного вилікування з одночасно добрим профілем безпечності, потрібно удосконалювати методи оцінювання ефективності лікування хворих на оніхомікоз іншими антимікотичними засобами [20, 106, 178]. Доцільність розроблення цих методів зумовлена і потребою ранньої корекції терапії при оніхомікозі у разі її недостатньої ефективності [11, 75].
Пошуки ефективніших та безпечніших протигрибкових препаратів змусили звернути увагу на групу препаратів, що є похідними азолу [5, 31]. Ці засоби зв’язуються з системою цитохрому Р450 грибів, інгібують фермент 14α-диметилазу та блокують синтез ергостеролу, що входить до складу клітинних мембран грибів. Дія азолів – як фунгістатична, так і фунгіцидна. Спектр протигрибкової активності азолів включає дерматофіти, дріжджоподібні гриби (Candida albicans, Torulopsis glabrata, Malassezia spp. та ін.), диморфні гриби (Coccidioides intimitis, Blastomyces dermatidis, Sporothrix schrenkli) та плісеневі гриби Aspergillus spp. [7, 50]. Серед препаратів азольної групи виділяють препарати місцевої дії (біфоназол, ізоконазол, кетоконазол, клотримазол, міконазол, оксиконазол, омоконазол, еконазол) та системні антимікотики (кетоконазол (синтезований у 1977 р.), флуконазол (синтезований у 1982 p.), ітраконазол (синтезований у 1984 р.) [14, 17, 27, 30, 40].
Антимікотики, призначені для лікування хворих на оніхомікоз, повинні відповідати трьом головним вимогам: добре проникати в нігтьові пластинки, надовго в них затримуватися і не мати побічних ефектів, як загальних (пов’язаних з гепато-, нефротоксичністю), так і місцевих [16, 67]. При виборі препарату важливо враховувати те, що нині в Україні за досить різноманітного спектра збудників оніхомікозу переважають асоціації дерматофітів з плісневими, рідше – дріжджеподібними грибами [67]. А. Руденко та співавт. (2000) наводять такі дані з цього приводу: дерматофіти в монокультурі викликають 0,8 % усіх оніхомікозів, мікроміцети в монокультурі – 24,1 %, асоціації «дерматофіти + мікроміцети + бактерії» – 45,7 %, асоціації «дерматофіти + мікроміцети + дріжджеподібні гриби» – 25,6 %, асоціації «дерматофіти + мікроміцети» – 3,8 % [67].
Фармакотерапію оніхомікозу слід планувати з урахуванням цілої низки чинників [174, 187]. За даними Я.Ф. Кутасевич та співавт., вибираючи схему лікування, потрібно врахувати й оцінити за чотирибальною системою такі критерії [27]:
– форма ураження нігтьових пластинок (дистально-латеральна – 1 бал, піднігтьова біла – 2 бали, проксимальна – 3 бали, тотально-дистрофічна – 4 бали);
– кількість уражених нігтів (1-3 – 1 бал, 4-5 – 2 бали, 6-10 – 3 бали, понад 10 – 4 бали);
– тривалість захворювання (до 1 року – 1 бал, 1-3 роки – 2 бали, 4-5 років – 3 бали, більш як п’ять років – 4 бали);
– площа ураженого нігтя (найбільше ураженої нігтьової пластинки) (менше половини нігтя – 1 бал, половина нігтя – 2 бали, більше половини нігтя – 3 бали, тотальне ураження з залученням матриксу – 4 бали);
– наявність супутнього мікозу шкіри (обмежений мікоз – 1 бал, поширений мікоз – 2 бали);
– рецидив захворювання і попередня терапія (вперше виявлене захворювання – 1 бал, рецидив захворювання – 2 бали);
– піднігтьові зміни (гіперкератоз чи оніхолізис) (за наявності – 4 бали).
На підставі сумації балів автори методики пропонують поділяти хворих на оніхомікоз на клінічні групи:
– від 5 до 9 балів – легка форма;
– від 10 до 15 балів – помірної тяжкості;
– від 16 до 20 балів – середньої тяжкості;
– понад 20 балів – тяжка форма.
При легкій формі автори рекомендують застосовувати лише місцеву терапію, при помірно тяжкій – системну (якщо немає протипоказань до неї), але можливе досягнення ремісії і за умови ретельного проведення тільки місцевого лікування [19, 55]. У разі середньої тяжкості слід призначати системні антимікотики [68]. При тяжкій формі автори рекомендують призначати комбіновану терапію, яка включає видалення нігтьової пластинки засобом, що готується ех tempore (сечовина – 35 %, ланолін – 35 %, парафін – 10 %, віск – 10 %, вода дистильована – 10 %), місцеві та системні препарати антимікотики [13]. За даними різних авторів місцева фармакотерапія оніхомікозу ефективна у 29-46 % хворих, системна – у 76-95 % [32]. За ретельного підбору засобів та схеми їхнього застосування ефективність місцевої терапії може сягати 70 % [31, 44, 182, 194].
Для системної терапії оніхомікозу спочатку застосовували похідні триазолу – ітраконазол, флуконазол [5, 53], згодом – також похідні аліламіну. Першим активним аліламіном на фармацевтичному ринку став тербінафін [16, 32]. Механізм дії аліламінів полягає в блокуванні синтезу ергостеролу шляхом пригнічення ферменту сквален-2,3-епоксидази. Тербінафін активний щодо всіх патогенних для людини грибів, особливо – Trichophyton rubrum, Malassezia spp., міцеліальних форм Candida [50, 52]. Ця речовина має високу оніхотропність, причому швидкість дифузії тербінафіну перевищує швидкість росту нігтя. На другий день після прийому 250 мг концентрація в роговому шарі зростає в 10 разів, на дванадцятий день – в 70. При одноразовому нанесенні на шкіру 100 мкл крему на поверхню шкіри площею 30 см2 у сечі виявляється 3,5 % дози. Але надовго в тканинах, які містять кератин, препарат не затримується тому, що він має низьку кератинофільність [52].
Інший представник аліламінів, нафтифін, активний щодо дерматофітів, плісневих грибів Aspegillus та збудників споротрихозу, а також, що дуже важливо, має антибактеріальні властивості проти грампозитивних та грамнегативних бактерій – збудників вторинних та мікст-інфекцій [30, 52]. Порівняно з грізеофульвіном та азольними препаратами аліламіни забезпечують тривалішу ремісію. Серед місцевих побічних ефектів, які спричинюють аліламіни, можна назвати відчуття печіння і еритему після застосування гелю, крему, розчину; сухість (крем, розчин); запалення (крем, розчин); подразнення (крем); висипання і болючість при натискуванні (гель).
Для системної терапії при оніхомікозі застосовують похідні триазолу – флюконазол, ітраконазол, а також аліламіну (тербінафін). За даними В.Г. Коляденка, В.І. Степаненка, порівняльну ефективність системних протигрибкових препаратів слід оцінювати з огляду на їхній терапевтичний спектр дії, що дає змогу одночасно впливати на різні етіологічні асоціації збудників грибкових уражень [22].
Флюконазол виявляє активність до грибкових уражень, спричинених грибами виду Candida albicans. Захворювання, спричинені грибами Candida групи nonalbicans, малочутливі до флюконазолу.
Ефективність тербінафіну виявляється здебільшого у хворих із грибковим ураженням нігтів, спричиненим тільки однією групою грибів – дерматофітами. Потрібно також зазначити, що курс лікування цим препаратом тривалий і становить від З до 6 міс залежно від тяжкості ураження [32].
Ітраконазол має широкий спектр протигрибкової дії. Він активний стосовно дерматофітів, дріжджеподібних і пліснявих грибів. У разі внутрішнього вживання препарату він швидко виходить із кров’яного русла, накопичуючись у шкірі та нігтьових пластинках, де затримується на тривалий час (у нігтях зберігається до 9 міс після лікування).
Слід мати на увазі системні побічні ефекти антимікотиків, зокрема тербінафіну, які проявляються при тривалому (3-6 міс і довше) застосуванні у хворих на оніхомікоз.
Застосування препарату кетоконазолу спричинює притаманні йому побічні ефекти (алопеція, зниження лібідо та імпотенція у чоловіків, аменорея у жінок). У 10 % пацієнтів спостерігається підвищення печінкових трансаміназ, що потребує постійного контролю за рівнем печінкових ферментів у разі тривалого лікування.
Ітраконазол відрізняється однаково високою активністю у відношенні до дерматофітів, дріжджоподібних та пліснявих грибів. Його терапевтична доза у 20 разів нижча від токсичної. Важливою особливістю є те, що ітраконазол має високу спорідненість до цитохрому Р450 грибкової клітини (проте має низьку спорідненість з аналогічними ферментами людини) [11]. Після припинення курсу лікування терапевтична концентрація препарату зберігається у нігтьових пластинах понад 9 міс, а в крові – лише кілька днів, що дає можливість проводити лікування у вигляді пульс-терапії. Вона передбачає призначення ітраконазолу протягом 7 днів з подальшою тритижневою перервою. При оніхомікозі пальців рук потрібно провести 2 курси пульс-терапії, при ураженні нігтів пальців ніг – 3 курси. За такої схеми лікування немає помітної дії на метаболізм стероїдів в організмі пацієнта, що можливо в разі тривалого (багатомісячного) застосування азольних препаратів.
В.Г. Коляденко та В.І. Степаненко (2008) [22], узагальнюючи результати досліджень у рамках широкомасштабного проекту з активного виявлення і лікування грибкових захворювань («Ахіллес-проект»), констатували, що у разі виявлення дерматофітної, дріжджеподібної, пліснявої чи поєднаної етіології грибкового ураження нігтів або їхньої асоціації, а також коли не вдається встановити етіологію оніхомікозу, доцільно призначати ітраконазол.
Слід зауважити, що під час дослідження («Ахіллес-проекту») було обстежено й проліковано 12 589 хворих на оніхомікоз. Через півроку після початку лікування клінічне та мікологічне одужання зареєстровано у 75 % хворих, в решті випадків (при тотальному оніхомікозі) зауважили значне поліпшення (підростання 2/3 нігтя у випадках тотального ураження нижніх кінцівок). Хворим, у яких повністю не відросла нігтьова пластинка (відростання 2/3 нігтя), в більшості випадків запропонували продовження лікування (враховуючи давність захворювання понад 10 років, ступінь ураження (тотальні форми оніхомікозу) та вираженості піднігтьового гіперкератозу відповідно до індексу КІОТОС, запропонованого Ю.В. Сергеєвим (1997) для розрахунку методу та часу лікування хворих на оніхомікоз [50]. Кількість побічних ефектів визначено на рівні 5 %. Найчастіше це були подразнення травного каналу (нудота, тяжкість у надчеревній ділянці, діарея), які корегували лікарськими засобами та не потребували припинення лікування препаратом. Дані, які збирали та реєстрували лікарі в різних куточках України у рамках «Ахіллес-проекту» повністю корелюють з даними світової літератури.
Важливим аспектом терапії оніхомікозу є вік пацієнтів. Більшість авторів вказували на переважання серед хворих на оніхомікоз групи старших 60 років. Одні дослідники [61] вважають, що при дріжджеподібних та пліснявих мікозах (а саме така етіологія переважає при мікотичному ураженні нігтів у цій віковій групі) при призначенні лікування перевага надається ітраконазолу. Інші автори доводять, що в таких пацієнтів ефективна терапія тербінафіном [27, 44]. За їхніми даними, препарат добре переносять хворі на цукровий діабет, гіпертонічну хворобу та інші супутні з оніхомікозом захворювання. Ці ж автори вказують на додаткову перевагу цього засобу для зазначеної вище групи пацієнтів – прийом один раз на добу незалежно від їжі, оскільки рН шлункового соку не впливає на всмоктування препарату.
Важливими є також дані про взаємодію антимікотиків з системою цитохромів Р450 (СYР). До групи субстратів СYРЗА4 належать ітраконазол, кетоконазол, міконазол та частково флуконазол [135]. Індуктор цього СYР – грізеофульвін, а інгібітори – ітраконазол, кетоконазол, міконазол та у високих дозах – флуконазол. Тербінафін є субстратом СYР2С9 та інгібітором СYР206. Інгібітори СYР2С9 – міконазол та флуконазол. Ці дані слід враховувати у разі застосування антимікотиків одночасно з іншими препаратами, залежними від СYР-системи. Так, наприклад, похідні сульфонілсечовини метаболізуються за допомогою цитохрому Р450 2С та 3А. У зв’язку з цим спостерігалася гіпоглікемія у пацієнтів, що отримували азольну протигрибкову та супутню пероральну протидіабетичну терапію (толбутамід, глібенкламід або гліпізид) [134].
При дослідженні безпечністі лікування орунгалом хворих на оніхомікоз з супутнім імунодефіцитом, зумовленим хронічними соматичними захворюваннями було виявлено поліпшення окремих показників імунітету – відношення кілери/супресори, вмісту В-лімфоцитів, підвищення активності фагоцитів, бактерицидної активності сироватки крові [3].
Серед хворих на оніхомікоз, яких лікували орунгалом, гепатит реєструють з частотою 1:500 000, причому тільки на тлі постійного прийому препарату [50]. Випадків розвитку токсичного гепатиту у разі пульс-терапії орунгалом у світовій літературі не описано. Захворювання печінки є абсолютним протипоказанням до призначення грізеофульвіну, ламізилу, нізоралу [32].
Терапія оніхомікозу місцевими препаратами в сполученні із системним протигрибковими засобами часто виявляється недостатньо ефективною, в зв’язку з чим лікарю нерідко доводиться збільшувати тривалість використання системних антимікотиків або істотно подовжувати курс лікування місцевими препаратами [8, 26, 93, 120, 114, 140].
Необхідно відзначити, що серед широкого спектру антимікотичних препаратів, вибір антимікотичної терапії повинен носити етіологічно обґрунтований характер та володіти максимально високим рівнем безпеки, так як лікування хворих на оніхомікоз є досить тривалим, а у більшості пацієнтів є супутні захворювання [72, 95, 116].
РОЗДІЛ 2
МАТЕРІАЛ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Загальна клінічна характеристика хворих
Для вирішення завдань шляхом проспективного когортного дослідження було обстежено та проліковано 125 (40 чоловіків та 85 жінок) хворих на оніхомікози кистей та стоп у віці від 18 до 74 років (у середньому – (48,86 ± 13,92) року) (табл. 2.1), які лікувалися у Вінницькому обласному шкірно-венерологічному диспансері з січня 2012 р. по липень 2014 р.
Таблиця 2.1 – Розподіл хворих на оніхомікоз за віком та статтю
| Вікова
категорія |
Обидві статі
(n=125) |
Чоловіки
(n=40) |
Жінки
(n=85) |
|||
| n | % | n | % | n | % | |
| < 20 років | 2 | 1,6 | – | – | 2 | 2,4 |
| 20-29 років | 13 | 10,4 | 3 | 7,5 | 10 | 11,8 |
| 30-39 років | 27 | 21,6 | 7 | 17,5 | 20 | 23,5 |
| 40-49 років | 29 | 23,2 | 12 | 30,0 | 17 | 20,0 |
| 50-59 років | 29 | 23,2 | 9 | 22,5 | 20 | 23,5 |
| 60-69 років | 15 | 12,0 | 5 | 12,5 | 10 | 11,8 |
| ≥ 70 років | 10 | 8,0 | 4 | 10,0 | 6 | 7,0 |
| Середні значення, роки | 48,86 ± 13,92 | 48,7 ± 12,97 | 45,99 ± 14,33 | |||
Критеріями включення у дослідження були: 1) вік від 18 років до 75 років; 2) клінічні ознаки оніхомікозу (зміна кольору, прозорості та структури нігтів); 3) інформована згода хворих на участь у дослідженні.
Розміри вибірок були обґрунтовані, виходячи з необхідної статистичної потужності (80 %), рівня статистичної значущості (0,05) та стандартизованої різниці, що розраховувалася окремо для кожної групи.
Тривалість захворювання у хворих складала від 3 місяців до 35 років, у середньому (2,97 ± 5,17) року. Відомості про тривалість захворювання до моменту початку обстеження та лікування представлені в таблиці 2.2.
Таблиця 2.2 – Розподіл хворих на оніхомікоз за тривалістю захворювання (n=125)
| Тривалість захворювання | Кількість хворих | % хворих |
| До 1 року | 31 | 24,8 |
| 1 – 3 роки | 61 | 48,8 |
| 4 – 6 років | 29 | 23,2 |
| > 6 років | 4 | 3,2 |
| Всього | 125 | 100 |
За медичною допомогою з приводу грибкового ураження нігтів кистей та стоп з 125 хворих не зверталося 86, що склало 68,8 %. Решта 39 (31,2 %) хворих звернулися в клініку в зв’язку з неефективністю попереднього лікування.
У 54 (43,2 %) хворих був оніхомікоз кистей, у 51 (40,8 %) – стоп, у 20 (16 %) – стоп та кистей. Розподіл пацієнтів залежно від локалізації патологічного процесу на момент включення у дослідження наведено на рис. 2.1.
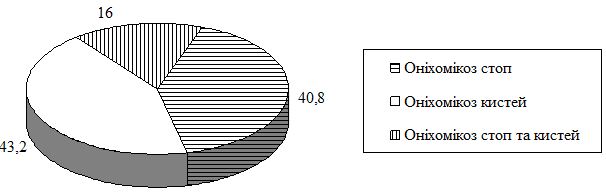
Рисунок 2.1 – Розподіл обстежених пацієнтів залежно від локалізації оніхомікозу.
Лікування хворих проводили відповідно до «Протоколу надання медичної допомоги хворим на дерматофітії нігтів» (наказ МОЗ України від 08.05.2009 р. № 312 «Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання»). Хворим був призначений системний антимікотик за схемою згідно інструкції.
У відповідності з метою та основними завданнями роботи були виділені дві клінічні групи. Контрольну групу склали 49 хворих на оніхомікоз, які отримували стандартне лікування системними та/або місцевими антимікотичними засобами згідно існуючих інструкцій. Пацієнтам основної групи (n=76) була призначена комбінована терапія, котра включала призначення системних та/або місцевих протигрибкових препаратів та ангіопротекторних препаратів.
Лікарський засіб для корекції мікроциркуляторних порушень призначався диференційовано з урахуванням виявленого за даними лазерної допплерівської флоуметрії гемодинамічного типу мікроциркуляції. Пацієнтам із спастичним гемодинамічним типом мікроциркуляції був призначений нафтидрофурил гідроген оксалат (енелбін) дозою 100-200 мг на добу, хворим із гіперемічним типом мікроциркуляції – діосмін/гесперидин у добовій дозі 2 таблетки на добу (у два прийоми). У випадках діагностованого застійно-стазичного типу мікроциркуляції хворі отримували нафтидрофурил гідроген оксалат в комплексі з діосмін/гесперидином у вищезазначених дозах. Тривалість терапії складала 3 місяці.
Результати проведеного лікування простежені у всіх пацієнтів та ґрунтувалися на даних клінічного, мікологічного та молекулярно-генетичного досліджень до лікування і через 4, 6, 8, 10, 12, 14, 16 та 18 місяців. Клінічна оцінка ефективності лікування включала оцінку скарг, динаміки об’єктивних проявів захворювання, а мікологічна ефективність полягала у факті елімінації грибів. Отримані результати та їх аналіз наведено в розділах 4 та 5.
2.2 Методи клінічних досліджень
Усім пацієнтам проведено клінічне обстеження, котре включало аналіз скарг, даних анамнезу захворювання (вивчали фактори ризику розвитку оніхомікозу), об’єктивне обстеження шкіри та нігтів (вимір довжини нігтьової пластинки від проксимального нігтьового валика до дистального кінця, мокнуття, гіперемія, лущення, сухість шкіри, тріщини, мікроскопія нігтьових пластинок).
До та після лікування проводили оцінку об’єктивних ознак ураження нігтьових пластинок із визначенням локалізації ураження (дистальне, латеральне, тотальне із залученням росткової зони, тотальне без залучення росткової зони, зміна зростання здорової нігтьової пластинки). Тяжкість ураження визначалася за допомогою КІОТОС [49].
Оцінка коморбідності ґрунтувалась на результатах детального опитування пацієнтів про супутні захворювання та порушення, анамнестичних відомостях та даних об’єктивного огляду. Сполучення різних захворювань аналізували за показником коморбідності – абсолютне число захворювань у однієї особи. Було проаналізовано патологічні стани наступних систем та органів з урахуванням ступеня їх важкості: захворювання серця, судинна патологія, патологія гемопоезу, захворювання дихальної системи, патологія органу зору та ЛОР-патологія, захворювання шлунково-кишкового тракту, печінки, нирок, сечостатева патологія, захворювання опорно-рухового апарату, неврологічна та психічна патологія, ендокринні та метаболічні хвороби.
Стан емоційної сфери оцінювали до і після лікування із застосуванням наступних методів: шкали оцінки дискомфорту [60], методики «Шкала станів» А.Б. Леоновой [9], госпітальної шкали оцінки тривоги і депресії (Hospital Anxiety and Depression Scale – HАDS) [225].
Оцінка стану емоційної сфери за шкалою оцінки дискомфорту передбачає вибір пацієнтом одного з семи висловлювань, котрі відображають його внутрішній стан на момент тестування. Має місце градація значень: 1-3 – низький рівень дискомфорту; 4-5 – середній рівень дискомфорту; 6-7 – високий рівень дискомфорту.
Методика «Шкала станів» А.Б. Леоновой уявляє собою 10 пар полярних тверджень з оціночною шкалою між ними. На цій шкалі респондент відмічає в якій мірі його відчуття на момент тестування знаходяться ближче до того чи іншого полюсу шкали. Отримані результати підсумовуються і оцінюються як: >54 – високий рівень суб’єктивного комфорту, гарне самопочуття; 48-54 – прийнятний рівень суб’єктивного комфорту, нормальне самопочуття; 41-48 – знижений рівень суб’єктивного комфорту, знижене самопочуття; <41 – низький рівень суб’єктивного комфорту, погане самопочуття.
Крім цього, для дослідження емоційних розладів у досліджуваних пацієнтів використовувалася Госпітальна шкала тривоги та депресії (HADS), розроблену A.S. Zigmond, R.P. Snaith в 1983 році для виявлення та оцінки тяжкості тривоги та депресії в умовах загальномедичної практики. За методикою, хворий сам заповнює опитувальник, який складається з 14 тверджень, що обслуговують дві підшкали: «тривога» (непарні пункти) та «депресія» (парні пункти). Під час інтерпретації результатів підраховується сумарний показник за кожною підшкалою, при цьому виділяють три зони його значень: 0–7 – «норма» (відсутність достовірних симптомів тривоги та депресії); 8–10 – «субклінічно виражена тривога/депресія»; 11 і більше – «клінічно виражена тривога/депресія» [225].
Для оцінки ступеня вірогідного негативного впливу оніхомікозу на різні аспекти життя пацієнта використовували «Дерматологічний індекс якості життя» (The Dermatology Life Quality Index – DLQI) [128]. Якість життя пацієнта характеризувалася в цілому як критерій оцінки ефективності проведеного лікування оніхомікозу. Цифровий показник, котрий отриманий в результаті аналізу відповідей пацієнта, відображає рівень негативного впливу захворювання на якість життя. DLQI розраховується шляхом підсумовування балів по кожному з 10 запитань, котре оцінюється респондентом за шкалою від 0 до 3 балів: 3 – дуже сильно; 2 – достатньо сильно; 1 – незначно; 0 – ні. DLQI розраховується шляхом сумування балів по кожному запитанню. Результат може варіювати від 0 до 30 балів. Максимальне значення DLQI – 30 балів. І чим ближче показник до цієї позначки – тим більш негативно захворювання позначається на якості життя пацієнта. При значенні 0–1 бали – оніхомікоз не впливає на життя пацієнта; при 2–5 – оніхомікоз має незначний вплив на життя пацієнта; при 6–10 – оніхомікоз надає помірний вплив на життя пацієнта; при 11–20 – оніхомікоз здійснює дуже сильний вплив на життя пацієнта; при 21–30 – оніхомікоз здійснює надзвичайно сильний вплив на життя пацієнта.
Короткий опитувальник ВООЗ для оцінки якості життя (The World Health Organization Quality of Life (WHOQOL-BREF), який використано для оцінки якості життя, включав 26 питань. Ці питання стосуються сприйняття індивідом різних аспектів свого життя та відображають 4 сфери якості життя: фізичні функції, психологічні функції, соціальні відносини та навколишнє середовище, а також безпосередньо вимірюється сприйняття респондентом своєї якості життя та здоров’я в цілому [207]. Протокол WHOQOL-BREF забезпечує кількісне визначення якості життя за зазначеними шкалами: чим вищими є значення показника, тим кращою є оцінка за обраною шкалою. Також результати тестування інтерпретуються в процентах з нульовою точкою відліку: 0 – 20 % – низький показник; 21 – 40 % – знижений показник; 41 – 60 % – середній показник; 61 – 80 % – підвищений показник; 81 – 100 % – високий показник.
Комісією з питань біомедичної етики Вінницького національного медичного університету імені М.І. Пирогова (протокол № 8 від 19.04.2012 р.) встановлено, що дане наукове дослідження відповідає етичним та морально-правовим вимогам згідно наказу МОЗ України № 281 від 01.11.2000 р. Від усіх хворих було отримано інформовану згоду на участь у дослідженні.
2.3 Методи мікроскопічного та бактеріологічного дослідження грибів
Для верифікації наявності оніхомікозу хворим проводили мікологічне дослідження, котре передбачало пряму мікроскопію патологічного матеріалу (шматочки з фрагментів нігтів). Патологічний матеріал обробляли 10-30 % розчином гідроксиду калію, витримували до 24 годин для розчинення кератину. Після експозиції матеріал вивчали під світловим мікроскопом при збільшеннях ×100 і ×400. Для кращої візуалізації характерних частин міцелію плісені, інколи до розчину гідроксиду калію в препарати додавали чорнила. При мікроскопії виявляли ниткоподібні гіфи грибів чи клітини, котрі пучкуються. Критерієм встановлення діагнозу оніхомікозу було виявлення міцелію грибів за результатами мікроскопії [52].
2.4 Метод молекулярно-генетичного дослідження грибів
В якості молекулярно-генетичного методу всім хворим, включеним у дослідження, виконували ПЛР за стандартною методикою та згідно з інструкцією виробника. Молекулярно-генетичні дослідження проводилися на базі лабораторії імунології, патоморфології та молекулярної генетики ДУ «Інститут дерматології та венерології НАМН України» (м. Харків).
Принцип методу заснований на багатократному повторюванні циків синтезу специфічної ділянки ДНК-мішені у присутності термостабільної ДНК-полімерази, дезоксинуклеозидтрифосфатів відповідного сольового буфера та олігонуклеотидних затравок – праймерів, які визначають кордони ампліфікуємої ділянки ДНК-мішені.
ДНК виділяли із зіскобів нігтьових пластинок. Забір матеріалу здійснювали скальпелем або лезом бритви. Фрагменти нігтя (зрізи) видаляли манікюрними ножицями або кусачками. При поверхневій формі оніхомікозу скальпелем або лезом бритви виконували зішкреби з поверхні нігтьової пластинки в ураженій ділянці. Зішкребували до появи шарів, які не уражені грибом. При дистально-латеральній піднігтьовій формі оніхомікозу брали фрагменти нігтьової пластинки, а при наявності гіперкератозу рогові маси збирали шляхом зішкребу гострокінцевим скальпелем з-під нігтьової пластинки, при цьому перші порції зішкребу також не використовували для аналізу, оскільки вони найбільшою мірою схильні до бактеріальної, грибкової та іншої контамінації. При проксимальній піднігтьовій формі матеріал збирали при видаленні всієї нігтьової пластинки, або її проксимальної частини за допомогою скальпеля або кусачок.
ПЛР проводили за допомогою набору реагентів з праймерами, які призначені для визначення наявності ДНК, специфічної до T. rubrum, та ПЛР із пангрибковими праймерами. В якості пангрибкових праймерів використали ITS4 5′- TCCTCCGCTTATTGATATGC і ITS5 5′- GGAAGTAAAAGTCGTAACAAGG – 3′. Для виявлення ДНК Т. rubrum використали праймери Uni, 5′- TCTTTGAACGCACATTGCGCC – 3′ і Т. rubrum – rev, 5′CGGTCCTGA- GGGCGCTGAA3′.
Ампліфікацію проводили в об’ємі 25 мкл суміші з додаванням 4 мкл ДНК в термоциклері (Терцик), вона включала один початковий цикл денатурації впродовж 10 хвилин при температурі 95°С і 45 циклів з наступним режимом: 30 сек. при температурі 94°С, 30 сек. при температурі 60°С і 30 сек. розширення при температурі 72°С (режим для проведення реакції, специфічної для Т. rubrum).
Продукти ампліфікації розділяли методом горизонтального електрофорезу в 1,5 % гелі агарози з додаванням 0,5 нг/мл етидіума броміду впродовж 15 хвилин, після чого аналізували на трансілюмінаторі при довжині хвилі збудливого світла 310 нм. Амплікони, отримані при використанні пангрибкових праймерів, мали довжину 600-700 нп, для Т. rubrum розмір амплікона складав 925 нп [52].
2.5 Метод функціонального дослідження стану мікроциркуляції шкіри
Для оцінки мікроциркуляції використано метод лазерної допплерівської флоуметрії після 20-хвилинної адаптації хворого при температурі 20°С. Використовували лазерний допплерівський флоуметр «Periflux System 5000» («Perimed», Швеція). Принцип його роботи ґрунтується на використанні монохроматичного когерентного гелій-неонового випромінювання низької енергії. Світло проникає крізь шкіру людини на глибину від 0,6 до 1,5 мм на площі 1 мм² поверхні. Тримач-термостат, нагрітий до 38°С, фіксувався липким кільцем до поверхні попередньо знежиреної шкіри. Вимірювання проводили на долонній поверхні середніх фаланг пальців. Реєстрували вихідний (базальний) рівень перфузії, вимірюваний в умовних перфузійних одиницях (ПО) протягом 3 хвилин, що дозволяло отримати усереднені дані. Контролем були вимірювання на аналогічних сегментах неуражених пальців іншої кінцівки.
На величину абсолютних показників істотно впливає цілий ряд факторів: температура тіла хворого, артеріальний тиск крові в момент дослідження, наявність анемії, ступінь виразності спазму судин і т.п. Домогтися стандартизації цих умов при повторних дослідженнях неможливо, тому основне діагностичне значення має функціональна проба з локальною гіпертермією. Після графічного фіксування вихідного рівня перфузії, за допомогою термостату температура датчика та ділянки шкіри, котра контактує з останнім, піднімається до 44°С. Реєструється збільшення кровотоку, яке пов’язано з розширенням судин шкіри під впливом температури. Діагностичне значення мають приріст перфузії на локальну гіпертермію та кратність збільшення кровотоку, що дозволяє оцінити резервні можливості мікроциркуляторного русла. За результатами оклюзійної функціональної проби обчислювали резерв капілярного кровотоку в %.
2.6 Метод геостатистичного моделювання
Рівень захворюваності на оніхомікоз у популяції Вінницької області та ризик зараження встановлювались шляхом геостатистичного моделювання за трьома моделями (базовою наддисперсною Пуассона, просторовою та просторово-динамічною). Для цього ретроспективно було проаналізовано звіти дерматологів різних районів Вінницької області відносно захворюваності та гендерних особливостей оніхомікозу за 2015-2017 роки. Дані про населення Вінницької області були взяті станом на 01.12.2017 р. згідно даних Головного управління статистики у Вінницькій області. Дані щодо кількості саун та салонів краси отримані з податкової служби Вінницької області. Територіальний індекс рН розраховувався як середньозважене територіальних вимірів і є типовим для території району.
Для аналізу геостатистичної моделі ризику зараження був написаний аналітичний програмний модуль мовою WinBUGS, що є абревіатурою виразу Bayesian inference using Gibbs (software). Розрахунок параметрів моделей здійснювався в середовищі пакету WinBUGS версії 1.4, з використанням семплеру Гіббса. Для діагностики конвергенції використані тести Гюке (Geweke’s Z) та Хейделберга-Велча (Heidelberg–Welch halfwidth test, H-W).
Підготовка даних, а також дослідження конвергенції в ланцюгах Маркова здійснена в середовищі математичної аналітичної системи R версії 3.1.0 на основі пакету CODA. Усі графічні зображення теж створені в середовищі R (пакет GRAPHICS). Тексти програмних модулів наведені в «Додатках». Він працює в середовищі WinBUGS. Для цього його слід скопіювати у новостворений файл скрипту. З середовища код обробляється процесором WinBUGS, який активується з передачею даних через call «bugs» пакету R2WinBUGS системи R. Результати симуляцій повертаються в середовище R у вигляді об’єкта спеціального класу WinBUGS (в тексті програмного модулю об’єкт позначено як «results»).
2.7 Метод статистичної обробки матеріалу
Статистичну обробку клінічних даних проводили загальноприйнятими методами варіаційної статистики із застосуванням комп’ютерних програм. Використовувались можливості електронних таблиць “Excel” і пакет статистичної обробки інформації SPSS 20 (©SPSS Inc.) [23].
Кількісні параметри представлені у вигляді M ± σ (середнє значення ± середнє квадратичне відхилення). Для порівняння параметричних даних (після перевірки кількісних даних на нормальний розподіл) застосовували двобічний t-критерій Стьюдента для 2-х груп незалежних сукупностей, при розподілі даних, що суперечать закону нормального розподілу, застосовували U-критерій Манна–Уітні. Порівняння зв’язаних вибірок проводили за допомогою критерію Вілкоксона (для 2-х груп).
Для порівняння гомогенності дисперсій у досліджуваних групах використовували тест Левена. Для знаходження відмінностей частот визначали співвідношення шансів (СШ, Odds Ratio), відносний ризик – ВР (Relative Risk), використовували метод визначення χ-квадрат (Пірсона) з корекцією Йетса на безперервність, для обчислення якого будували сітку «2х2». Для показників співвідношення шансів розраховували 95 % довірчий інтервал (ДІ). Показник вважався достовірним, якщо в ДІ не входило значення співвідношення шансів, яке дорівнює 1.
Статистично значущими вважалися відмінності при р<0,05 (95 %-й рівень значущості) і при р<0,01 (99 %-й рівень значущості). Зв’язок між показниками, що вивчалися, оцінювали за результатами кореляційного аналізу з обчисленням коефіцієнта кореляції Пірсона (r) або Спірмена (R) і подальшим встановленням його значущості за t-критерієм.
Для характеристики інформативності ПЛР та мікроскопічного методу використовували показники чутливості та специфічності. Чутливість розраховували як відношення кількості істинно позитивних результатів методу до суми кількостей істинно позитивних і хибнонегативних результатів тестів, що разом складають кількість істинних випадків захворювання. Для розрахунку чутливості методу використовували формулу:
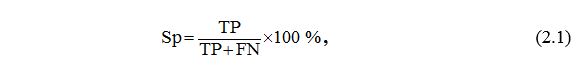
де Sp – чутливість;
TP – кількість істинно позитивних результатів;
FN – кількість хибнонегативних результатів.
Специфічність розраховували як відношення кількості істинно негативних результатів до суми кількостей істинно негативних і хибнопозитивних результатів, що разом складають кількість випадків, коли клінічні ознаки захворювання були відсутні. Для розрахунку специфічності застосовували формулу:
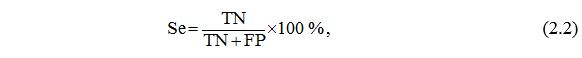
де Se – специфічність;
TN – кількість істинно негативних результатів;
FP – кількість хибнопозитивних результатів.
Прогностичну цінність позитивного результату (ППР, частка пацієнтів без клінічних ознак оніхомікозу, які мали негативний результат діагностичного тесту) розраховували за формулою:
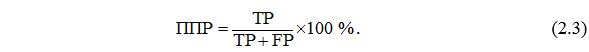
Для розрахунку прогностичної цінності негативного результату (ПНР, частка хворих з клінічними ознаками оніхомікозу та позитивним результатом діагностичного тесту) застосовували формулу:
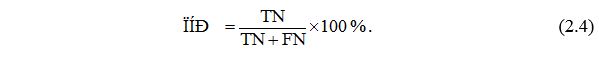
Діагностичну точність (Ас) методу визначали за формулою:
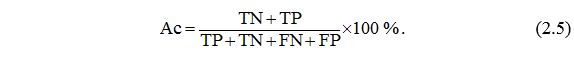
РОЗДІЛ 3
ЕПІДЕМІОЛОГІЧНІ ОСОБЛИВОСТІ ОНІХОМІКОЗУ
У НАСЕЛЕННЯ ПОДІЛЛЯ
3.1 Захворюванність на оніхомікоз у населення Поділля та фактори ризику його розвитку як основа для створення геостатистичної моделі
Дискретний фрейм передбачав агрегацію даних щодо кількості зареєстрованих випадків оніхомікозу у розрізі сільських районів Вінницької області. Дані щодо кількості мікозів згруповані по рокам спостереження (2015, 2016, 2017) та статі, утворюючи, таким чином, вставлені в райони статево-річні когорти.
Факторами ризику, зважаючи на шлях зараження, були кількість саун та салонів краси, тобто місць найбільш вірогідного ризику зараження (табл. 3.1). Крім того, в модель включена також річна кількість населення району як інтегральний показник розселення. Нижча кількість населення свідчить про більшу питому вагу сільського населення та менший розвиток району, що є важливими факторами ризику зараження.
У Вінницькій області захворюваність на оніхомікоз впродовж 2015-2017 рр. склала 38,4, 38,9 та 35,6 на 100 тисяч населення відповідно. Кількість випадків розвитку оніхомікозу в розрізі статі та років спостереження за районами Вінницької області наведені в таблиці 3.2.
3.2 Базова модель аналізу захворюваності на оніхомікоз та факторів ризику його розвитку
Так як залежна змінна представлена кількостями випадків оніхомікозу, отримано дискретну змінну, яка описується розподілом Пуассона:
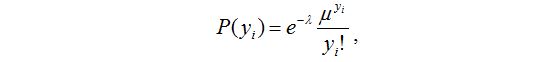
де уі – кількість випадків оніхомікозу в і-му районі, µ – середнє по всім районам (середнє значення розподілу).
Таблиця 3.1 – Агрегативні дані щодо факторів ризику розвитку оніхомікозу по районам Вінницької області
| Назва району | Сауни | Салони | рН ґрунту | Код території |
| Барський | 0 | 38 | 5,2 | 6 |
| Бершадський | 1 | 42 | 5,6 | 26 |
| Вінницький | 5 | 37 | 5,8 | 8 |
| Гайсинський | 3 | 35 | 5,2 | 19 |
| Жмеринський | 4 | 93 | 5,2 | 7 |
| Іллінецький | 1 | 26 | 5,6 | 15 |
| Калинівський | 0 | 45 | 5,8 | 4 |
| Козятинський | 3 | 35 | 6,1 | 2 |
| Крижопільський | 4 | 20 | 5,8 | 21 |
| Липовецький | 1 | 35 | 6,1 | 9 |
| Літинський | 0 | 24 | 5,2 | 3 |
| Мог.-Подільський | 0 | 40 | 5,5 | 16 |
| Мур.Куриловецький | 3 | 9 | 5,6 | 11 |
| Немирівський | 2 | 38 | 5,0 | 14 |
| Оратівський | 1 | 5 | 5,2 | 10 |
| Піщанський | 0 | 9 | 5,7 | 24 |
| Погребищенський | 1 | 12 | 5,5 | 5 |
| Теплицький | 0 | 16 | 5,8 | 23 |
| Томашпільський | 1 | 28 | 5,4 | 17 |
| Тростянецький | 3 | 47 | 5,3 | 22 |
| Тульчинський | 7 | 40 | 5,4 | 18 |
| Тиврівський | 0 | 29 | 5,3 | 13 |
| Хмільницький | 6 | 88 | 5,8 | 1 |
| Чечельницький | 1 | 7 | 5,8 | 25 |
| Шаргородський | 1 | 33 | 5,4 | 12 |
| Ямпільський | 7 | 38 | 5,6 | 20 |
Таблиця 3.2 – Кількість випадків розвитку оніхомікозу в розрізі статі та років спостереження по районам Вінницької області
| Назва району | Чоловіки | Жінки | ||||
| 2015 | 2016 | 2017 | 2015 | 2016 | 2017 | |
| Барський | 3 | 0 | 1 | 6 | 0 | 0 |
| Бершадський | 84 | 67 | 89 | 61 | 52 | 71 |
| Вінницький | 8 | 6 | 5 | 3 | 5 | 11 |
| Гайсинський | 17 | 14 | 13 | 13 | 16 | 11 |
| Жмеринський | 8 | 6 | 4 | 7 | 9 | 5 |
| Іллінецький | 20 | 23 | 28 | 19 | 17 | 25 |
| Калинівський | 27 | 24 | 13 | 59 | 68 | 43 |
| Козятинський | 3 | 4 | 7 | 4 | 8 | 5 |
| Крижопільський | 15 | 17 | 8 | 8 | 12 | 5 |
| Липовецький | 3 | 2 | 3 | 2 | 5 | 4 |
| Літинський | 3 | 5 | 3 | 7 | 11 | 8 |
| Мог.-Подільський | 12 | 10 | 4 | 10 | 10 | 13 |
| Мур.Куриловецький | 0 | 2 | 3 | 3 | 4 | 7 |
| Немирівський | 11 | 14 | 12 | 5 | 9 | 5 |
| Оратівський | 2 | 1 | 0 | 1 | 1 | 0 |
| Піщанський | 5 | 4 | 5 | 4 | 5 | 4 |
| Погребищенський | 19 | 18 | 15 | 6 | 9 | 8 |
| Теплицький | 5 | 8 | 7 | 8 | 8 | 11 |
| Томашпільський | 4 | 2 | 3 | 4 | 2 | 2 |
| Тростянецький | 20 | 23 | 20 | 31 | 27 | 21 |
| Тульчинський | 7 | 12 | 5 | 7 | 3 | 9 |
| Тиврівський | 6 | 9 | 5 | 9 | 4 | 4 |
| Хмільницький | 11 | 19 | 15 | 20 | 21 | 10 |
| Чечельницький | 0 | 2 | 0 | 0 | 0 | 0 |
| Шаргородський | 16 | 13 | 9 | 8 | 10 | 7 |
| Ямпільський | 7 | 7 | 5 | 6 | 6 | 6 |
| Всього | 316 | 312 | 282 | 311 | 322 | 295 |
Часто для розподілу Пуассона властива наддисперсність внаслідок не спостережуваних варіацій між одиницями дослідження, у цьому випадку районами. Крім того, фрейм дослідження має як просторову, так і динамічну компоненти, які необхідно викликають над дисперсність, так як порушують вимогу закону Пуассона щодо незалежності розподілу кількості випадків у часі та просторі [135]. Можливості превалювання окремих значень (у цьому випадку нулів) над очікуваним за розподілом Пуассона також викликає над дисперсність [146]. Без корекції на над дисперсність оцінки моделі втрачають змістовність, виявляються скошені з штучно звуженими інтервалами довіри, з наступними невалідними висновками.
Перевірено наявність порушення рівності середнього значення та дисперсії кількості спостережених випадків оніхомікозу даного дослідження. Виявляється (табл. 3.3), що дисперсії перевищують середні на порядок як у цілому масиві, так і у всіх вставних когортах, тобто на лице над дисперсність.
З огляду на це для акомодації наддисперсності розширено модель Пуассона до кон’югантної Пуассона-Гамма моделі, тобто:

Таблиця 3.3 – Середні та дисперсії розподілу кількості випадків розвитку оніхомікозу в розрізі статі та років спостереження по районам Вінницької області
| Рік | Стать | Обсяг | Середнє | Дисперсія |
| 2015 | Чоловіча | 26 | 11,6 | 263,6 |
| Жіноча | 26 | 11,5 | 231,9 | |
| 2016 | Чоловіча | 26 | 11,3 | 176,4 |
| Жіноча | 26 | 11,9 | 238,0 | |
| 2017 | Чоловіча | 26 | 10,3 | 293,9 |
| Жіноча | 26 | 11,0 | 226,6 | |
| Всі | 156 | 11,3 | 231,0 |
Тоді очікуване значення та дисперсія µі отримуються з параметрів Гамма розподілу як xі=аі/hі, та Var(µі)= аі/h2і=x2і/аі, відповідно результуючу дисперсію кількості випадків оніхомікозу (уі) знаходимо з популярного розкладу дисперсій як:
Var(уі)=E[Var(уі | µі)]+Var[E(уі | µі)]= xі + x2і/ai (3.2)
Таким чином включаючи над дисперсність через параметри аі Гамма розподілу, із зменшенням параметру над дисперсність збільшується. Середнє (очікуване) значення як правило враховує лише фіксовані ефекти з лінійним предиктором LP: .
Ідентифікація вимагає обмеження на параметри мікст Гамма розподілів, як наприклад аі=а в параметризації {xі,аі}, тобто µі ~Gamma(а, а/xі). Як наслідок, з f=1/а, отримуємо квадратичний вираз у функції дисперсії уі, яку називають NB2 (від негативного біноміального розподілу) з:
Var(уі)=E[Var(уі | µі)]+Var[E(уі | µі)]= xі + fx2і
У цій моделі використано генералізовану NBk форму, запропоновану Winkelmann and Zimmermann (1995), яка передбачає функцію дисперсії уі виду:
Var(уі)=E[Var(уі | µі)]+Var[E(уі | µі)]= xі + fxk+1і (3.3)
з k≥-1. Це досягається введенням екстра параметра k в апріорний мікст розподіл для µі:

Зокрема, значення k=0 і k=1 обумовлюють функції дисперсії відповідно NB1 та NB2, тобто лінійну і квадратичну в xі : Var(уі) = xі + fxі та Var(уі) = xі + fx2і.
3.2.1 Інформаційні характеристики базової моделі
Внаслідок проблем ідентифікації дисперсності, зокрема міксту Гамма розподілів у функції правдоподібності отримати класичні критерії інформаційної якості моделі, наприклад AIC, BIC, DIC неможливо.
Тому введено в програму аналізу два непараметричні критерії, а саме апостеріорна предикторна оцінка (posterior predictive check, PPC) та апостеріорні предикторні втрати (posterior predictive loss, PPL).
Обидва критерії основані на реплікованих значеннях залежної змінної уrep:
p(yrep|y) =∫p(yrep|θ)p(θ|y)dθ (3.5)
РРС-деривати.
Використано узгодженість реплікованих значень залежної змінної уrep (Observedrep у тексті програми) до очікуваних за моделлю ymod (mu у тексті програми) за критерієм хі-квадрат Байєса:

який має асимптотичний розподіл χ2n−1, незалежно від кількості параметрів моделі. Оцінюється вірогідність того, що апостеріорна вірогідність RB(θ) перевищує 95-й процентиль щільності розподілу χ2n−1. Про погані інформативні властивості моделі свідчать значення вірогідності, які значно перевищують 0,05.
Також використано аналог класичного тесту на достовірність шляхом оцінки апостеріорного предикторного р-значення, ppost (Kato and Hoijtink, 2004). Тест був визначений і винайдений (Meng, 1994) як вірогідність того, що тестова статистика T(yrep) за реплікованих значень yrep, перевищує або дорівнює такій за спостережених значень T(y) за моделі M(q), залежної змінної y і незалежних змінних х:
ppost = Pr[T(yrep,x) ≥ T(y,x)|y,x,M(q)] (3.7)
де x типово є матрицею значень ре дикторв без похибок виміру. Вірогідність розраховується на апостеріорному предикторному розподілі yrep за моделі М(q) та значень x. Як тестову статистику використано критерій хі-квадрат Байєса. Якщо отримане значення ppost знаходиться далеко від 0,5, це свідчить про погані інформаційні властивості моделі M(q). В тексті програмного модуля ppost позначено як РРС. Доданки RB(θ) для реплікованих та спостережених значень у позначено відповідно як сr та c.
PPL-деривати.
Інформаційна якість моделі може також бути оцінена на співставленні вибірок yrep з щільності апостеріорного предикторного розподілу, який отриманий на всіх спостережених значеннях, хоча й така процедура дещо консервативна внаслідок того, що присутність yi впливає на вибіркові значення yi,rep (Marshall and Spiegelhalter, 2003). Laud and Ibrahim (1995) та Meyer and Laud (2002) запропонували оцінювати інформаційні властивості моделі на наступному різновиді PPL критерію, який використаний в аналізі:
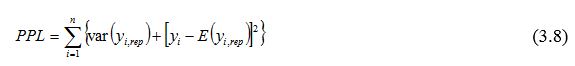
У тексті програмного модуля критерій позначено як РРL.
Дисперсія вибіркових значень yi,rep (var(yi,rep)) оцінена за квадратичним виразом NB2 (ф.3.2) і в тексті програмного модуля позначена як var.
3.2.2 Лінійний предиктор базової моделі
Лінійний предиктор моделі включає фактори ризику розвитку оніхомікозу, а саме: кількість саун в районі; кількість салонів краси в районі; середньозважене значення рН грунту території району; кількість населення району.
До лінійного предиктору моделі входить також очікуване значення кількості випадків оніхомікозу (в логарифмічній трансформації) для змістовної інтерпретації регресійних коефіцієнтів факторів ризику β, які в такій конструкції лінійного предиктора пов’язані з класичними епідеміологічними мірами зв’язку, а саме співвідношенням шансів (odds ratio, OR), і з невеликим зміщенням із відносним ризиком (relative risk, RR) тобто:
RR»OR=exp(β).
Очікувані значення кількості випадків оніхомікозу розраховувались по вставним статево-річним когортам для стандартизації ефектів β за змінними «стать» та «рік» і відповідним спрощенням лінійного пре диктора за рахунок вивільнення цих змішувальних факторів. Розрахунок очікуваних значень здійснювався за правилами прямої стандартизації.
Дані щодо очікуваної кількості випадків розвитку оніхомікозу в розрізі статі та років спостереження за районами Вінницької області наведені в таблиці 3.4. Величини останньої стрічки «Всього» фактично співпадають з такими відповідної стрічки таблиці 3.2, що доводить задовільну точність розрахунку.
Текст програмного модулю WinBUGS базової моделі надан в додатку А.
Таблиця 3.4 – Очікувана кількість випадків розвитку оніхомікозу в розрізі статі та років спостереження по районам Вінницької області
| Назва району | Чоловіки | Жінки | ||||
| 2015 | 2016 | 2017 | 2015 | 2016 | 2017 | |
| Барський | 13,439 | 13,308 | 12,023 | 13,474 | 13,947 | 12,811 |
| Бершадський | 15,504 | 15,217 | 13,720 | 15,616 | 16,066 | 14,683 |
| Вінницький | 19,310 | 19,330 | 17,855 | 18,322 | 19,186 | 17,965 |
| Гайсинський | 14,885 | 14,690 | 13,308 | 14,458 | 14,935 | 13,717 |
| Жмеринський | 17,738 | 17,557 | 15,930 | 17,676 | 18,318 | 16,796 |
| Іллінецький | 9,867 | 9,741 | 8,829 | 9,374 | 9,704 | 8,905 |
| Калинівський | 14,972 | 14,806 | 13,431 | 14,671 | 15,250 | 14,001 |
| Козятинський | 16,483 | 16,279 | 14,729 | 16,458 | 17,111 | 15,718 |
| Крижопільський | 8,775 | 8,637 | 7,813 | 8,749 | 9,051 | 8,270 |
| Липовецький | 9,961 | 9,800 | 8,806 | 9,815 | 10,125 | 9,269 |
| Літинський | 9,203 | 9,066 | 8,181 | 9,215 | 9,529 | 8,704 |
| Мог.-Подільський | 22,435 | 22,123 | 19,938 | 22,178 | 22,948 | 21,002 |
| Мур.Куриловецький | 6,819 | 6,670 | 5,998 | 6,829 | 7,014 | 6,374 |
| Немирівський | 12,899 | 12,729 | 11,465 | 12,694 | 13,075 | 11,962 |
| Оратівський | 5,615 | 5,530 | 4,952 | 5,734 | 5,899 | 5,355 |
| Піщанський | 5,717 | 5,630 | 5,071 | 5,279 | 5,437 | 4,974 |
| Погребищенський | 7,870 | 7,740 | 6,949 | 8,164 | 8,374 | 7,601 |
| Теплицький | 7,626 | 7,457 | 6,714 | 7,499 | 7,729 | 7,047 |
| Томашпільський | 8,749 | 8,615 | 7,781 | 8,620 | 8,915 | 8,145 |
| Тростянецький | 15,670 | 15,538 | 14,106 | 14,789 | 15,370 | 14,142 |
| Тульчинський | 14,423 | 14,209 | 12,854 | 14,290 | 14,805 | 13,539 |
| Тиврівський | 10,989 | 10,869 | 9,871 | 10,786 | 11,196 | 10,253 |
| Хмільницький | 15,859 | 15,694 | 14,167 | 15,984 | 16,556 | 15,210 |
| Чечельницький | 5,740 | 5,647 | 5,084 | 5,613 | 5,787 | 5,279 |
| Шаргородський | 14,881 | 14,688 | 13,279 | 14,429 | 14,955 | 13,728 |
| Ямпільський | 10,571 | 10,420 | 9,387 | 10,352 | 10,704 | 9,801 |
| Всього | 316,00 | 311,99 | 282,24 | 311,07 | 321,99 | 295,25 |
3.2.3 Тестування ефектів факторів ризику розвитку оніхомікозу за базовою моделлю
Спостережені випадки оніхомікозу, агреговані за роками та статтю по районам Вінницької області, наведені в картограмі (рис.3.1).
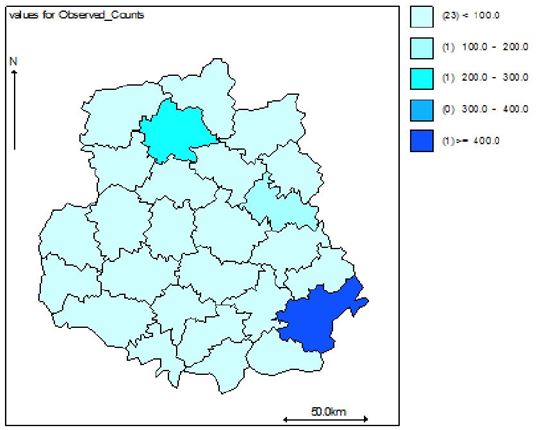
Рисунок 3.1 – Спостережені випадки зараження оніхомікозами в районах Вінницької області.
Результати оцінки параметрів моделі за семплером Гіббса наведені в таблиці 3.5. Всього використано 100 000 ітерацій, перші 4000 використані для адаптації алгоритму, на наступних 96000 оцінені параметри базової моделі. Перша колонка таблиці описує параметр моделі як він занотований у програмному модулі. Друга дає роз’яснення параметра. Третя показує середнє значення параметра на 96000 ітераціях. Четверта містить середньоквадратичні відхилення (s) параметрів, аналогічні до вибіркових помилок m класичної статистики. П’ята включає значення помилки Монте Карло (MC m), яка тестує достатність кількості ітерацій. Наступні колонки колонки дають розподіл оцінок параметрів, це якраз те, що не може бути зроблено в рамках класичної статистики і є особливо цінним для оцінки достовірності ефектів. Процентильні значення (2,5 % і 97,5 %) обрані так, що утворюють 95 % довірчий інтервал при двосторонньому тестуванню.
Інформаційні властивості моделі дуже гарні за середнім значенням РРС критерію, яке близьке до 0,5. Проте дуже скошений розподіл статистики з медіаною 0 свідчить про зворотне. Про це ж свідчить і велике значення інформаційного критерію PPL (середнє=14270, медіана=12720), яке на кілька порядків більше кількості одиниць спостережень. За таких інформаційних характеристик до висновків щодо ефектів факторів ризику слід відноситись з обачністю.
Значення параметра k (key) = 1,453 свідчить про актуальність саме форми над дисперсності NB2. Про те, що це однозначно не NB1 свідчать довірчі інтервали медіани, які не включають 0, проте й виключають 2. Саме ця форма використовуватиметься в тексті програмного модулю для моделювання форми над дисперсності в наступних моделях. Параметр над дисперсності f (phi) = 0,293 з медіаною розподілу 0,2421 суттєвий, так як значення 0 знаходиться за межами інтервалу процентильних значень (0,0599– 0,8095). За значеннями двох параметрів гіпотеза щодо над дисперсність розподілу кількості випадків розвитку оніхомікозу цілковито підтверджена. Саме тому базова модель над дисперсності врахована в наступних моделях.
Ефект кількості населення району на модифікацію ризику розвитку оніхомікозу (bPop) виявився не суттєвим, значення 0 знаходиться в межах інтервалу процентильних значень розподілу ефекту (-1,58E-5 – 2,09E-5).
Проте ефект кількості салонів краси (bSaloon) виявився високо суттєвим, значення 0 знаходиться далеко за межами інтервалу процентильних значень розподілу ефекту (0,0054 – 0,0271). Позитивне значення ефекту 0,010 за середнім та 0,0102 за медіаною свідчить про те, що ризик зараження типово зростає в exp(0,0102)= 1,01 разів при появі додаткового салону краси на території району, тобто на 1 %.
Таблиця 3.5 – Інформаційні характеристики, параметри базової моделі та очікувані кількості випадків розвитку оніхомікозу за районами
| Параметр моделі | Пояснення | Середнє | s | MC m | 2,5 % | Медіана | 97,5 % |
| PPC | Інформаційний критерій | 0,467 | 0,50 | 0,002 | 0,00 | 0,00 | 1,00 |
| PPL | Інформаційний критерій | 14270 | 6569 | 147,6 | 6618 | 12720 | 30770 |
| key | Форма над дисперсності | 1,453 | 0,2546 | 0,007 | 0,9817 | 1,4450 | 1,9890 |
| phi | Параметр над дисперсності | 0,293 | 0,2098 | 0,005 | 0,0599 | 0,2421 | 0,8095 |
| bPop | Ефект розміру населення району | 1,57E-6 | 9,32E-6 | 3,15E-7 | -1,58E-5 | 1,28E-6 | 2,09E-5 |
| bSaloon | Ефект кількості салонів краси | 0,010 | 0,0082 | 3,13E-4 | 0,0054 | 0,0102 | 0,0271 |
| bSauna | Ефект кількості саун | -0,138 | 0,0361 | 0,001 | -0,2064 | -0,1388 | 0,0638 |
| bpH | Ефект рН грунту | -0,025 | 0,0460 | 0,002 | -0,1166 | -0,0250 | 0,0646 |
| Очікувані № [1] | Хмільницький | 95,17 | 34,89 | 1,095 | 52,29 | 87,93 | 180,1 |
| Expected_Counts[2] | Козятинський | 82,87 | 17,82 | 0,592 | 56,32 | 80,15 | 125,6 |
| Expected_Counts[3] | Літинський | 59,97 | 7,44 | 0,152 | 47,00 | 59,4 | 76,12 |
| Expected_Counts[4] | Калинівський | 123,3 | 17,22 | 0,226 | 93,89 | 121,8 | 161,5 |
| Expected_Counts[5] | Погребищенський | 39,31 | 4,43 | 0,060 | 31,53 | 38,99 | 48,97 |
| Expected_Counts[6] | Барський | 104,4 | 12,32 | 0,196 | 82,88 | 103,3 | 131,3 |
| Expected_Counts[7] | Жмеринський | 152,7 | 62,42 | 2,003 | 77,80 | 139,1 | 307,2 |
| Expected_Counts[8] | Вінницький | 78,14 | 25,87 | 0,851 | 43,03 | 73,34 | 142,2 |
| Expected_Counts[9] | Липовецький | 61,65 | 7,91 | 0,186 | 48,01 | 60,98 | 79,06 |
| Expected_Counts[10] | Оратівський | 25,83 | 3,84 | 0,040 | 19,46 | 25,46 | 34,50 |
| Expected_Counts[11] | Мур.Куриловецький | 24,44 | 3,45 | 0,050 | 18,54 | 24,14 | 32,11 |
| Expected_Counts[12] | Шаргородський | 94,17 | 11,31 | 0,282 | 75,28 | 93,03 | 119,7 |
| Expected_Counts[13] | Тиврівський | 75,45 | 8,24 | 0,145 | 60,83 | 74,88 | 93,27 |
| Expected_Counts[14] | Немирівський | 74,85 | 6,59 | 0,127 | 63,55 | 74,26 | 89,51 |
| Expected_Counts[15] | Іллінецький | 55,27 | 5,45 | 0,082 | 45,67 | 54,87 | 67,13 |
| Expected_Counts[16] | Мог.-Подільський | 186,5 | 75,92 | 2,452 | 88,92 | 171,3 | 375,4 |
| Expected_Counts[17] | Томашпільський | 51,00 | 6,89 | 0,175 | 39,08 | 50,44 | 66,05 |
| Expected_Counts[18] | Тульчинський | 43,84 | 8,99 | 0,174 | 29,85 | 42,62 | 64,71 |
| Expected_Counts[19] | Гайсинський | 73,37 | 8,64 | 0,219 | 59,16 | 72,43 | 92,81 |
| Expected_Counts[20] | Ямпільський | 30,23 | 5,60 | 0,070 | 21,27 | 29,57 | 43,08 |
| Expected_Counts[21] | Крижопільський | 30,99 | 3,85 | 0,058 | 24,33 | 30,68 | 39,45 |
| Expected_Counts[22] | Тростянецький | 86,83 | 19,30 | 0,700 | 57,21 | 84,16 | 132,7 |
| Expected_Counts[23] | Теплицький | 44,04 | 5,98 | 0,076 | 33,92 | 43,52 | 57,36 |
| Expected_Counts[24] | Піщанський | 29,67 | 4,99 | 0,066 | 21,48 | 29,16 | 40,96 |
| Expected_Counts[25] | Чечельницький | 26,04 | 3,98 | 0,041 | 19,45 | 25,66 | 35,01 |
| Expected_Counts[26] | Бершадський | 109,3 | 13,62 | 0,210 | 86,25 | 108,1 | 139,6 |
Ефект кількості саун (bSauna) виявився не суттєвим, значення 0 знаходиться в межах інтервалу процентильних значень розподілу ефекту (‑0,2064 – 0,0638).
Ефект рН грунту (bpH) також виявився не суттєвим, значення 0 знаходиться в межах інтервалу процентильних значень розподілу ефекту (‑0,1166 – 0,0646).
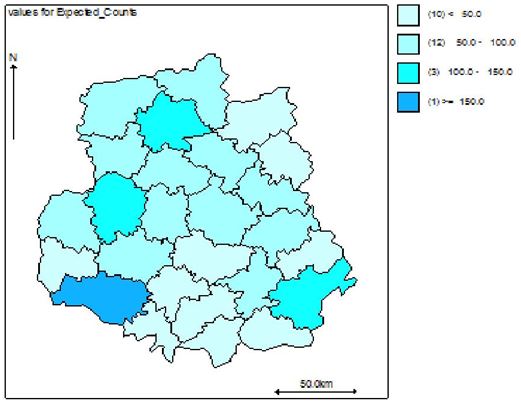
Рисунок 3.2 – Очікувані випадки зараження оніхомікозом за базовою моделлю в районах Вінницької області.
Очікувані значення кількості випадків розвитку оніхомікозу за районами досить суттєво відрізнялись від спостережених, що знаходиться у відповідності з низькою інформативністю базової моделі. Для унаочнення розподілу очікуваних за моделлю значень побудовано за ними картодіаграму (див. рис. 3.2), яка значно відрізняється від рисунку 3.1.
3.3 Просторова модель аналізу захворюванності на оніхомікоз та факторів ризику його розвитку (удосконалення базової)
3.3.1 Інформаційні характеристики просторової моделі
Просторова модель дозволяє простежувати і імплементувати просторові зв’язки використовуючи структуровані просторові залишки s в лінійному предикторі, а саме при просторовому процесі Пуассона:
Log(li)=µi+si (3.9)
де li – спостережений рівень процесу;
µi – очікуваний рівень процесу за фіксованими ефектами;
si – структуровані просторові залишки.
Один із шляхів до описання просторової кореляції між елементами вектора залишків s=(s1, … ,sp) є безпосередня специфікація сумісного багатомірного апріорного розподілу з ковариаційною матрицею, яка відтворює кореляції між територіями і та j. Типовими припущеннями, яких притримувалися і в цій моделі, є стаціонарність і ізотропність. Найпростішим є багатомірний нормальний закон розподілу, з нульовими середніми та ковариаційною матрицею Ss, тобто:
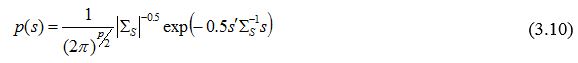
Ввівши матрицю точності Q=[qij]= Ss-1 i s[i]=(s1, …, si-1, si+1, …, sp), умовний розподіл для кожного si приймає одномірний нормальний закон, а саме:

з кореляцією між залишками si та sj Якщо визначити h як hіі=0 і hіj= – qij / qii, (i¹j), а також qii =аі/d з параметром дисперсії d, так що:

Тоді умовний розподіл для кожного si можна представити у формі умовної авторегресії, специфікованої Besag (1974):

Можливі різні специфікації hіj і аі в рівнянні (3.13). Використано ICAR(1) (intrinsic conditional autoregression with r=1) вид апріорного розподілу si, тобто:

Для досліджуваної моделі Пуассона з лінійним предиктором (3.9) запозичення «потужності» тестування через включення s має суто просторовий характер. Підстановкою ICAR(1) специфікації (3.14) в (3.13) отримано:

де запозичення потужності із сусідніх локалізацій очевидне і здійснюється через ваги wij.
Матриця точності (precision matrix) сумісного розподілу sі відповідно d‑1R з елементами матриці R:

Представлено ваги wij у вигляді бінарних індикаторів сусідства територій, а саме wij=1 для сусідніх територій і та j, і wij=0 у зворотному випадку. Це далі спрощує елементи матриці точності R, rii= ai і rij=-1 для сусідніх територій і та j та нулю у зворотному випадку. Така модифікація безпосередньо демонструє, що просторові зв’язки реалізуються через матрицю R. Не дивлячись на відносну простоту обраної специфікації і досить широке використання в практиці геостатистичного моделювання ICAR(1) моделі розподілу залишків sі, матриця R не є позитивно визначеною і інвертабельною, так як сума недіагональних елементів стрічки rij перевищує rii з нульовим детермінантом R, іншими словами сумісний розподіл sі неналежний (improper), тобто з невизначеним загальним середнім вектора s. Тому ICAR(1) може використовуватись лише для опису умовного апріорного розподілу просторово структурованих ефектів s, і в жодному разі не як функція правдоподібності просторових даних. З використанням термінів µi в лінійному предикторі процесу Пуассона (3.9) зручно передбачити нульові середні для елементів вектора s.
Текст програмного модулю WinBUGS просторової моделі надан в додатку В.
3.3.2 Тестування ефектів факторів ризику розвитку оніхомікозу за просторовою моделлю
Результати оцінки параметрів моделі за семплером Гіббса наведені в таблиці 3.6. Всього використано 100 000 ітерацій, перші 4000 використані для адаптації алгоритму, на наступних 96000 оцінені параметри просторової моделі.
Інформаційні властивості моделі дуже гарні за середнім значенням РРС критерію, яке близьке до 0,5. Проте дуже скошений розподіл статистики з медіаною 0,77 ще свідчить про невеликі проблеми. Значно покращилось порівняно з базисною моделлю значення інформаційного критерію PPL (середнє=7915, медіана=6906), які зменшилися майже вдвічі.
Значення параметра k (key) = 1,281 свідчить про актуальність саме форми над дисперсності NB2 і навіть з малою вірогідністю NB3. Про те, що це однозначно не NB1 свідчать довірчі інтервали медіани, які не включають 0, проте значення 2 і більші малоймовірні теж (всього 3,7 %). Тому продовжено використання NB2 в тексті програмного модулю для моделювання форми над дисперсності в наступній моделях. Параметр над дисперсності f (phi) = 0,052 з медіаною розподілу 0,0304 суттєвий, так як значення 0 знаходиться за межами інтервалу процентильних значень (0,0019– 0,2258), проте на порядок менший, ніж в базовій моделі, що свідчить про значне пояснення над дисперсності розподілу випадків заражень оніхомікозом просторовими ефектами sі. Проте базова модель над дисперсності збережена в наступній моделі з огляду на суттєвість параметра над дисперсності f.
Ефект кількості населення району на модифікацію ризику розвитку оніхомікозу (bPop) знов виявився не суттєвим, значення 0 знаходиться в межах інтервалу процентильних значень розподілу ефекту (-2,51E-5– 2,59E‑5).
Проте ефект кількості салонів краси (bSaloon) зріс в силі порівняно з базовою моделлю і ще збільшив свою достовірність, інтервал процентильних значень розподілу ефекту ще виразніше віддалився від 0 (0,009– 0,324). Позитивне значення ефекту 0,0433 за середнім та 0,042 за медіаною свідчить про те, що ризик зараження типово зростає в exp(0,042)= 1,043 разів при появі додаткового салону краси на території району, тобто на 4,3 %.
Ефект кількості саун (bSauna) залишився не суттєвим, значення 0 знаходиться в межах інтервалу процентильних значень розподілу ефекту (‑0,2685– 0,1236).
Ефект рН грунту (bpH) фактично набув суттєвості, значення 0 знаходиться на верхньому 97,5 % процентилі розподілу ефекту (‑0,2332– 0,0003).
Cтандартне відхилення вектора s становить 1,93 і є високо суттєвим з нульовим значенням далеко поза межами процентильного 95 % інтервалу.
Очікувані значення кількості випадків розвитку оніхомікозу за районами набагато краще за базову модель описують спостережені, що знаходиться у відповідності з суттєво кращою інформативністю просторової моделі над базовою. Для унаочнення розподілу очікуваних за моделлю значень побудовано за ними картодіаграму (рис. 3.3), яка майже відтворює рисунок 3.1.
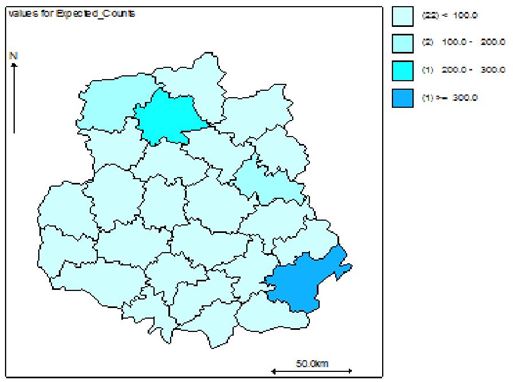
Рисунок 3.3 – Очікувані випадки зараження оніхомікозом
за просторовою моделлю в районах Вінницької області.
| Таблиця 3.6 – Інформаційні характеристики, параметри просторової моделі та очікувані кількості випадків розвитку оніхомікозу за районами | |||||||
| Параметр моделі | Пояснення | Середнє | s | MC m | 2,5 % | Медіана | 97,5 % |
| PPC | Інформаційний критерій | 0,579 | 0,294 | 0,005383 | 0,0 | 0,77 | 1,0 |
| PPL | Інформаційний критерій | 7915 | 3593 | 110,7 | 4753 | 6906 | 17080 |
| key | Форма над дисперсності | 1,281 | 0,397 | 0,015 | 0,559 | 1,262 | 2,123 |
| phi | Параметр над дисперсності | 0,0518 | 0,068 | 0,0021 | 0,0019 | 0,0304 | 0,2258 |
| bPop | Ефект розміру населення району | 1,88E-6 | 1,31E-5 | 6,99E-7 | -2,51E-5 | 2,24E-6 | 2,59E-5 |
| bSaloon | Ефект кількості салонів краси | 0,0433 | 0,0133 | 7,42E-4 | 0,009 | 0,042 | 0,324 |
| bSauna | Ефект кількості саун | 0,0578 | 0,0948 | 0,0051 | -0,2685 | -0,0615 | 0,1236 |
| bpH | Ефект рН грунту | -0,088 | 0,0701 | 0,0039 | -0,2332 | -0,0836 | 0,0003 |
| Очікувані № [1] | Хмільницький | 96,44 | 14,18 | 0,15 | 71,81 | 95,32 | 127,2 |
| Expected_Counts[2] | Козятинський | 33,01 | 6,75 | 0,12 | 21,63 | 32,39 | 48,11 |
| Expected_Counts[3] | Літинський | 37,56 | 7,08 | 0,12 | 25,22 | 36,99 | 52,84 |
| Expected_Counts[4] | Калинівський | 230,4 | 32,16 | 0,35 | 176,5 | 227,3 | 302,7 |
| Expected_Counts[5] | Погребищенський | 74,21 | 11,42 | 0,15 | 53,99 | 73,45 | 98,80 |
| Expected_Counts[6] | Барський | 11,70 | 3,74 | 0,11 | 5,57 | 11,27 | 20,19 |
| Expected_Counts[7] | Жмеринський | 39,88 | 7,38 | 0,12 | 27,37 | 39,25 | 56,24 |
| Expected_Counts[8] | Вінницький | 39,53 | 7,34 | 0,12 | 26,73 | 38,96 | 55,38 |
| Параметр моделі | Пояснення | Середнє | s | MC m | 2,5 % | Медіана | 97,5 % |
| Expected_Counts[9] | Липовецький | 21,07 | 4,98 | 0,10 | 12,74 | 20,52 | 32,20 |
| Expected_Counts[10] | Оратівський | 6,67 | 2,69 | 0,09 | 2,50 | 6,30 | 12,83 |
| Expected_Counts[11] | Мур.Куриловецький | 18,33 | 4,61 | 0,11 | 10,35 | 17,97 | 28,43 |
| Expected_Counts[12] | Шаргородський | 61,20 | 9,72 | 0,12 | 44,14 | 60,48 | 82,37 |
| Expected_Counts[13] | Тиврівський | 37,26 | 6,88 | 0,12 | 25,39 | 36,69 | 52,44 |
| Expected_Counts[14] | Немирівський | 56,65 | 9,21 | 0,12 | 40,66 | 55,93 | 76,60 |
| Expected_Counts[15] | Іллінецький | 129,6 | 17,89 | 0,17 | 98,23 | 128,30 | 168,6 |
| Expected_Counts[16] | Мог.-Подільський | 42,60 | 7,76 | 0,13 | 29,17 | 42,01 | 59,42 |
| Expected_Counts[17] | Томашпільський | 18,33 | 4,48 | 0,11 | 10,82 | 17,91 | 28,18 |
| Expected_Counts[18] | Тульчинський | 43,67 | 7,74 | 0,12 | 30,20 | 43,13 | 60,56 |
| Expected_Counts[19] | Гайсинський | 84,70 | 12,63 | 0,14 | 63,05 | 83,69 | 112,4 |
| Expected_Counts[20] | Ямпільський | 36,94 | 6,91 | 0,10 | 24,87 | 36,37 | 52,13 |
| Expected_Counts[21] | Крижопільський | 63,89 | 10,02 | 0,13 | 46,37 | 63,15 | 85,77 |
| Expected_Counts[22] | Тростянецький | 80,82 | 12,24 | 0,15 | 59,84 | 79,82 | 107,8 |
| Expected_Counts[23] | Теплицький | 47,93 | 8,33 | 0,12 | 33,49 | 47,33 | 66,24 |
| Expected_Counts[24] | Піщанський | 26,63 | 5,59 | 0,10 | 17,21 | 26,14 | 38,96 |
| Expected_Counts[25] | Чечельницький | 4,18 | 2,13 | 0,09 | 1,14 | 3,84 | 9,23 |
| Expected_Counts[26] | Бершадський | 417,9 | 58,09 | 0,55 | 315,4 | 414,0 | 545,2 |
| Параметр моделі | Пояснення | Середнє | s | MC m | 2,5 % | Медіана | 97,5 % |
| Залишки s[1] | Хмільницький | 0,47 | 0,57 | 0,03 | -0,69 | 0,49 | 1,51 |
| s[2] | Козятинський | -0,57 | 0,30 | 0,01 | -1,17 | -0,57 | 0,03 |
| s[3] | Літинський | 0,00 | 0,26 | 0,01 | -0,51 | 0,00 | 0,49 |
| s[4] | Калинівський | 1,26 | 0,33 | 0,02 | 0,59 | 1,25 | 1,90 |
| s[5] | Погребищенський | 0,97 | 0,26 | 0,01 | 0,46 | 0,97 | 1,49 |
| s[6] | Барський | -1,68 | 0,38 | 0,02 | -2,46 | -1,68 | -0,96 |
| s[7] | Жмеринський | -0,73 | 0,65 | 0,03 | -2,08 | -0,72 | 0,47 |
| s[8] | Вінницький | -0,47 | 0,44 | 0,02 | -1,32 | -0,47 | 0,38 |
| s[9] | Липовецький | -0,58 | 0,27 | 0,01 | -1,11 | -0,58 | -0,06 |
| s[10] | Оратівський | -1,15 | 0,49 | 0,02 | -2,13 | -1,13 | -0,21 |
| s[11] | Мур.Куриловецький | -0,14 | 0,41 | 0,02 | -0,93 | -0,15 | 0,71 |
| s[12] | Шаргородський | 0,02 | 0,23 | 0,01 | -0,42 | 0,01 | 0,46 |
| s[13] | Тиврівський | -0,21 | 0,25 | 0,01 | -0,69 | -0,21 | 0,29 |
| s[14] | Немирівський | 0,09 | 0,19 | 0,01 | -0,27 | 0,09 | 0,46 |
| s[15] | Іллінецький | 1,28 | 0,19 | 0,01 | 0,92 | 1,28 | 1,65 |
| s[16] | Мог.-Подільський | -0,87 | 0,57 | 0,03 | -2,02 | -0,89 | 0,24 |
| s[17] | Томашпільський | -0,61 | 0,28 | 0,01 | -1,16 | -0,61 | -0,08 |
| s[18] | Тульчинський | 0,02 | 0,44 | 0,02 | -0,86 | 0,04 | 0,90 |
| Параметр моделі | Пояснення | Середнє | s | MC m | 2,5 % | Медіана | 97,5 % |
| s[19] | Гайсинський | 0,43 | 0,20 | 0,01 | 0,05 | 0,43 | 0,82 |
| s[20] | Ямпільський | 0,22 | 0,48 | 0,02 | -0,73 | 0,22 | 1,21 |
| s[21] | Крижопільський | 0,89 | 0,34 | 0,02 | 0,25 | 0,88 | 1,59 |
| s[22] | Тростянецький | 0,30 | 0,30 | 0,01 | -0,27 | 0,30 | 0,91 |
| s[23] | Теплицький | 0,54 | 0,28 | 0,01 | -0,01 | 0,54 | 1,10 |
| s[24] | Піщанський | 0,30 | 0,36 | 0,02 | -0,41 | 0,31 | 0,98 |
| s[25] | Чечельницький | -1,62 | 0,57 | 0,03 | -2,96 | -1,58 | -0,59 |
| s[26] | Бершадський | 1,86 | 0,26 | 0,01 | 1,36 | 1,86 | 2,36 |
| sigma | Cтд. відхилення вектора s | 1,93 | 0,335 | 0,008 | 1,389 | 1,89 | 2,697 |
3.4 Просторово-динамічна модель аналізу захворюванності на оніхомікоз та факторів ризику його розвитку
3.4.1 Інформаційні характеристики просторово-динамічної моделі
Просторово-динамічна модель дозволяє простежувати і імплементувати просторово-динамічні зв’язки використовуючи структуровані просторові залишки s та динамічні зміни параметрів моделі. Обрано специфікацію динамічного ефекту заважаючи на явне переважання розміру масиву над часовим виміром (156>>3). А саме, введено 78 (26×3) рандомізованих ефектів, індивідуальних для районів кутів нахилу за кожний рік у лінійному предикторі, а саме при просторовому процесі Пуассона:
Log(li)=µi+bij +si (3.17)
де li – спостережений рівень процесу;
µi – очікуваний рівень процесу за фіксованими ефектами;
bij – рандомізований ефект індивідуального для району і кута нахилу за рік j;
si – структуровані просторові залишки.
Динамічний ефект (темп приросту випадків заражень на оніхомікоз) для району розраховувався як апостеріорна маса різниць ефектів 2017 і 2015 років для району.
Загальний динамічний ефект (темп приросту випадків заражень на оніхомікоз) розраховувався як маса апостеріорних різниць ефектів 2017 і 2015 років для районів.
Текст програмного модулю WinBUGS просторово-динамічної моделі надан в додатку Г.
3.4.2 Тестування ефектів факторів ризику розвитку оніхомікозу за просторово-динамічною моделлю
Результати оцінки параметрів просторово-динамічної моделі за семплером Гіббса наведені в таблиці 3.7. Всього використано 100 000 ітерацій, перші 4000 використані для адаптації алгоритму, на наступних 96000 оцінені параметри просторової моделі.
Інформаційні властивості моделі змінилися на краще за середнім значенням РРС критерію, яке близьке до 0,5. Про це свідчить зменшення скошеності розподілу статистики з медіаною 0,428. Значно покращилось порівняно з просторовою моделлю значення інформаційного критерію PPL (середнє=3768, медіана=3645), які зменшилися майже вдвічі. Значення параметра k (key) = 1,606 свідчить про актуальність форми над дисперсності NB2 і навіть з малою вірогідністю NB3. Про те, що це однозначно не NB1 свідчать довірчі інтервали медіани, які не включають 0, проте значення 2 і більші малоймовірні теж (всього 4,2 %). Параметр над дисперсності f (phi) = 0,035 з медіаною розподілу 0,029 суттєвий, так як значення 0 знаходиться за межами інтервалу процентильних значень (0,004– 0,1912), проте в півтора рази менший, ніж в просторовій моделі, що свідчить про додаткове пояснення над дисперсності розподілу випадків заражень оніхомікозом індивідуальними для територій районів динамічними ефектами b.dYearі.
Ефект кількості населення району на модифікацію ризику розвитку оніхомікозу (bPop) залишився не суттєвим, значення 0 знаходиться в межах інтервалу процентильних значень розподілу ефекту (-1,56E-5–2,76E‑5).
Ефект кількості салонів краси (bSaloon) зменшив силу порівняно з просторовою моделлю, проте залишився достовірним, інтервал процентильних значень розподілу ефекту ще виразніше віддалився від 0 (0,001– 0,049). Позитивне значення ефекту 0,0232 за середнім та 0,0214 за медіаною свідчить про те, що ризик зараження типово зростає в exp(0,0214)= 1,022 разів при появі додаткового салону краси на території району, тобто на 2,2 %.
| Таблиця 3.7 – Інформаційні характеристики, параметри просторово-динамічної моделі та очікувані кількості випадків розвитку оніхомікозу за районами | ||||||||
| Параметр моделі | Пояснення | Середнє | s | MC m | 2,5 % | Медіана | 97,5 % | |
| PPC | Інформаційний критерій | 0,437 | 0,4961 | 0,01978 | 0,0 | 0,428 | 1,0 | |
| PPL | Інформаційний критерій | 3768 | 454 | 41,1 | 586 | 3645 | 16562 | |
| key | Форма над дисперсності | 1,606 | 0,350 | 0,033 | 0,736 | 1,667 | 2,154 | |
| phi | Параметр над дисперсності | 0,0346 | 0,0492 | 0,0045 | 0,004 | 0,0290 | 0,1912 | |
| bPop | Ефект розміру населення району | 4,51E-6 | 1,18E-5 | 1,24E-6 | -1,56E-5 | 1,60E-6 | 2,76E-5 | |
| bSaloon | Ефект кількості салонів краси | 0,0232 | 0,0116 | 0,0008 | 0,0011 | 0,0214 | 0,0491 | |
| bSauna | Ефект кількості саун | 0,2752 | 0,1273 | 0,01337 | 0,08721 | 0,2376 | 0,5173 | |
| bpH | Ефект рН грунту | -0,115 | 0,058 | 0,004 | -0,2277 | -0,1022 | -0,0085 | |
| Dynamics | Часовий тренд: | -0,294 | 0,121 | 0,001 | -0,535 | -0,281 | -0,102 | |
| b.dYear[1] | Хмільницький | -1,68 | 0,89 | 0,07 | -3,28 | -1,59 | -0,48 | |
| b.dYear[2] | Козятинський | 0,30 | 0,24 | 0,02 | -0,16 | 0,30 | 0,81 | |
| b.dYear[3] | Літинський | -0,16 | 0,15 | 0,01 | -0,45 | -0,15 | 0,12 | |
| b.dYear[4] | Калинівський | -0,60 | 0,21 | 0,01 | -1,13 | -0,59 | -0,26 | |
| b.dYear[5] | Погребищенський | -0,21 | 0,23 | 0,01 | -1,04 | -0,16 | 0,00 | |
| b.dYear[6] | Барський | -0,24 | 0,09 | 0,01 | -0,41 | -0,24 | -0,04 | |
| b.dYear[7] | Жмеринський | -0,23 | 0,08 | 0,01 | -0,38 | -0,23 | -0,07 | |
| Параметр моделі | Пояснення | Середнє | s | MC m | 2,5 % | Медіана | 97,5 % | |
| b.dYear[8] | Вінницький | 0,10 | 0,08 | 0,01 | -0,06 | 0,09 | 0,25 | |
| b.dYear[9] | Липовецький | 0,01 | 0,07 | 0,01 | -0,11 | 0,01 | 0,17 | |
| b.dYear[10] | Оратівський | -0,10 | 0,07 | 0,01 | -0,22 | -0,10 | 0,04 | |
| b.dYear[11] | Мур.Куриловецький | 0,13 | 0,06 | 0,01 | 0,01 | 0,13 | 0,24 | |
| b.dYear[12] | Шаргородський | -0,09 | 0,07 | 0,01 | -0,28 | -0,08 | -0,02 | |
| b.dYear[13] | Тиврівський | -0,08 | 0,03 | 0,00 | -0,14 | -0,08 | -0,02 | |
| b.dYear[14] | Немирівський | -0,05 | 0,08 | 0,01 | -0,28 | -0,04 | 0,02 | |
| b.dYear[15] | Іллінецький | -0,08 | 0,04 | 0,00 | -0,15 | -0,08 | -0,03 | |
| b.dYear[16] | Мог.-Подільський | -0,03 | 0,09 | 0,01 | -0,20 | -0,04 | 0,17 | |
| b.dYear[17] | Томашпільський | -0,03 | 0,03 | 0,00 | -0,09 | -0,03 | 0,02 | |
| b.dYear[18] | Тульчинський | 0,03 | 0,03 | 0,00 | -0,04 | 0,03 | 0,10 | |
| b.dYear[19] | Гайсинський | -0,04 | 0,03 | 0,00 | -0,11 | -0,04 | 0,01 | |
| b.dYear[20] | Ямпільський | 0,01 | 0,03 | 0,00 | -0,04 | 0,02 | 0,07 | |
| b.dYear[21] | Крижопільський | -0,03 | 0,04 | 0,00 | -0,10 | -0,02 | 0,01 | |
| b.dYear[22] | Тростянецький | -0,03 | 0,05 | 0,00 | -0,17 | -0,03 | 0,01 | |
| b.dYear[23] | Теплицький | -0,02 | 0,02 | 0,00 | -0,06 | -0,02 | 0,02 | |
| b.dYear[24] | Піщанський | -0,02 | 0,02 | 0,00 | -0,06 | -0,02 | 0,03 | |
| b.dYear[25] | Чечельницький | 0,28 | 0,07 | 0,01 | 0,17 | 0,26 | 0,39 | |
| Параметр моделі | Пояснення | Середнє | s | MC m | 2,5 % | Медіана | 97,5 % | |
| b.dYear[26] | Бершадський | -0,09 | 0,03 | 0,00 | -0,17 | -0,08 | -0,04 | |
| Очікувані № : [1] | Хмільницький | 98,26 | 17,19 | 0,29 | 70,63 | 96,46 | 136,40 | |
| Expected_Counts[2] | Козятинський | 35,27 | 7,21 | 0,20 | 23,11 | 34,66 | 51,39 | |
| Expected_Counts[3] | Літинський | 39,08 | 7,67 | 0,19 | 26,10 | 38,32 | 56,25 | |
| Expected_Counts[4] | Калинівський | 311,20 | 493,70 | 11,95 | 170,40 | 237,20 | 933,20 | |
| Expected_Counts[5] | Погребищенський | 77,11 | 21,74 | 0,45 | 53,65 | 74,53 | 112,50 | |
| Expected_Counts[6] | Барський | 9,32 | 3,04 | 0,15 | 4,15 | 8,95 | 16,37 | |
| Expected_Counts[7] | Жмеринський | 45,29 | 9,25 | 0,31 | 30,48 | 44,21 | 66,05 | |
| Expected_Counts[8] | Вінницький | 40,75 | 7,74 | 0,18 | 27,71 | 40,05 | 58,04 | |
| Expected_Counts[9] | Липовецький | 23,62 | 5,28 | 0,17 | 14,52 | 23,14 | 35,43 | |
| Expected_Counts[10] | Оратівський | 5,23 | 2,20 | 0,12 | 2,04 | 4,93 | 10,21 | |
| Expected_Counts[11] | Мур.Куриловецький | 21,08 | 5,17 | 0,16 | 12,67 | 20,47 | 32,78 | |
| Expected_Counts[12] | Шаргородський | 61,80 | 10,47 | 0,16 | 44,14 | 60,78 | 85,35 | |
| Expected_Counts[13] | Тиврівський | 37,54 | 7,10 | 0,16 | 25,54 | 36,90 | 53,23 | |
| Expected_Counts[14] | Немирівський | 59,33 | 10,40 | 0,17 | 42,42 | 58,19 | 82,70 | |
| Expected_Counts[15] | Іллінецький | 135,00 | 28,26 | 0,45 | 95,75 | 131,30 | 198,40 | |
| Expected_Counts[16] | Мог.-Подільський | 44,21 | 8,75 | 0,27 | 29,98 | 43,19 | 64,26 | |
| Expected_Counts[17] | Томашпільський | 19,00 | 4,48 | 0,14 | 11,43 | 18,60 | 28,88 | |
| Параметр моделі | Пояснення | Середнє | s | MC m | 2,5 % | Медіана | 97,5 % | |
| Expected_Counts[18] | Тульчинський | 43,62 | 8,13 | 0,15 | 30,07 | 42,80 | 61,91 | |
| Expected_Counts[19] | Гайсинський | 83,33 | 14,00 | 0,19 | 60,08 | 81,87 | 114,80 | |
| Expected_Counts[20] | Ямпільський | 36,66 | 7,18 | 0,14 | 24,65 | 35,94 | 52,77 | |
| Expected_Counts[21] | Крижопільський | 65,70 | 29,00 | 0,90 | 44,31 | 62,01 | 102,90 | |
| Expected_Counts[22] | Тростянецький | 81,94 | 14,18 | 0,23 | 59,24 | 80,30 | 113,90 | |
| Expected_Counts[23] | Теплицький | 49,88 | 9,15 | 0,17 | 34,76 | 49,03 | 70,61 | |
| Expected_Counts[24] | Піщанський | 27,74 | 5,89 | 0,16 | 17,98 | 27,20 | 40,86 | |
| Expected_Counts[25] | Чечельницький | 2,78 | 1,58 | 0,09 | 0,68 | 2,45 | 6,49 | |
| Expected_Counts[26] | Бершадський | 546,70 | 2459,00 | 34,46 | 300,20 | 432,00 | 1332 | |
| Залишки: s[1] | Хмільницький | -0,13 | 0,45 | 0,03 | -1,15 | -0,07 | 0,72 | |
| s[2] | Козятинський | -0,42 | 0,44 | 0,02 | -1,39 | -0,37 | 0,28 | |
| s[3] | Літинський | -0,39 | 0,41 | 0,02 | -1,32 | -0,34 | 0,27 | |
| s[4] | Калинівський | 0,33 | 0,39 | 0,02 | -0,32 | 0,29 | 1,17 | |
| s[5] | Погребищенський | 0,47 | 0,44 | 0,03 | -0,20 | 0,42 | 1,42 | |
| s[6] | Барський | -0,19 | 0,42 | 0,02 | -1,03 | -0,13 | 0,66 | |
| s[7] | Жмеринський | -0,73 | 0,59 | 0,04 | -2,02 | -0,68 | 0,07 | |
| s[8] | Вінницький | -0,38 | 0,37 | 0,02 | -1,24 | -0,35 | 0,20 | |
| s[9] | Липовецький | -0,36 | 0,45 | 0,03 | -1,43 | -0,26 | 0,27 | |
| Параметр моделі | Пояснення | Середнє | s | MC m | 2,5 % | Медіана | 97,5 % | |
| s[10] | Оратівський | 0,27 | 0,54 | 0,03 | -0,70 | 0,16 | 1,48 | |
| s[11] | Мур.Куриловецький | -0,59 | 0,56 | 0,03 | -1,87 | -0,53 | 0,21 | |
| s[12] | Шаргородський | -0,10 | 0,29 | 0,01 | -0,70 | -0,07 | 0,50 | |
| s[13] | Тиврівський | -0,26 | 0,33 | 0,02 | -0,99 | -0,22 | 0,35 | |
| s[14] | Немирівський | -0,17 | 0,31 | 0,01 | -0,86 | -0,12 | 0,40 | |
| s[15] | Іллінецький | 0,33 | 0,35 | 0,02 | -0,23 | 0,30 | 1,06 | |
| s[16] | Мог.-Подільський | -0,34 | 0,42 | 0,02 | -1,25 | -0,29 | 0,41 | |
| s[17] | Томашпільський | -0,22 | 0,39 | 0,02 | -1,09 | -0,13 | 0,42 | |
| s[18] | Тульчинський | 0,12 | 0,38 | 0,02 | -0,61 | 0,06 | 1,00 | |
| s[19] | Гайсинський | 0,31 | 0,33 | 0,02 | -0,20 | 0,26 | 1,06 | |
| s[20] | Ямпільський | 0,28 | 0,44 | 0,03 | -0,42 | 0,19 | 1,26 | |
| s[21] | Крижопільський | 0,73 | 0,57 | 0,04 | -0,05 | 0,69 | 1,96 | |
| s[22] | Тростянецький | 0,34 | 0,34 | 0,02 | -0,22 | 0,30 | 1,05 | |
| s[23] | Теплицький | 0,08 | 0,34 | 0,02 | -0,67 | 0,06 | 0,75 | |
| s[24] | Піщанський | 0,16 | 0,41 | 0,02 | -0,67 | 0,11 | 1,03 | |
| s[25] | Чечельницький | 0,09 | 0,57 | 0,04 | -1,07 | 0,05 | 1,36 | |
| s[26] | Бершадський | 0,80 | 0,49 | 0,03 | -0,02 | 0,83 | 1,72 | |
| sigma | Cтд. відхилення вектора s | 0,99 | 0,55 | 0,03 | 0,03 | 1,02 | 2,04 | |
Ефект кількості саун (bSauna) набув високої достовірності і величини залишився не суттєвим, значення 0 знаходиться за межами інтервалу процентильних значень розподілу ефекту (‑0,08721– 0,5173). Позитивне значення ефекту 0,2752 за середнім та 0,2376 за медіаною свідчить про те, що ризик зараження типово зростає в exp(0,2376)= 1,268 разів при появі додаткової сауни на території району, тобто на 26,8 %.
Ефект рН ґрунту (bpH) набув переконливої суттєвості, значення 0 знаходиться за межами верхньої 97,5 % процентилі розподілу ефекту (‑0,2277– -0,0085). Негативне значення ефекту -0,115 за середнім та -0,1022 за медіаною свідчить про те, що ризик розвитку оніхомікозу типово зменшується в exp(-0,1022)= 0,9029 разів при збільшенні рН ґрунту на одиницю на території району, тобто зменшується на 10,7 %.
Ефект загального часового тренду (Dynamics) виявився суттєвим, з 95 % довірчим інтервалом (-0,535 – -0,102). Напрямок тренду негативний, з середнім ефектом -0,294 та медіаною -0,281 свідчить про зменшення ризику зараження протягом 2011-2013 років в exp(-0,281)= 0,755 разів, тобто на 32,4 %.
Стандартне відхилення вектора s становить 0,99, що майже вдвічі менше за таке просторової моделі і є високо суттєвим з нульовим значенням далеко поза межами процентильного 95 % інтервалу. Таке зменшення обумовлено «відтягненням» специфічної до територій інформації динамічними територіальними ефектами b.dYearі.
Очікувані значення кількості випадків розвитку оніхомікозу за районами дещо краще за просторову модель описують спостережені, що знаходиться у відповідності з суттєво кращою інформативністю просторово-динамічної моделі над просторовою. Для унаочнення розподілу очікуваних за моделлю значень побудовано за ними картодіаграму (рис.3.4), яка повністю відтворює рисунок 3.1.
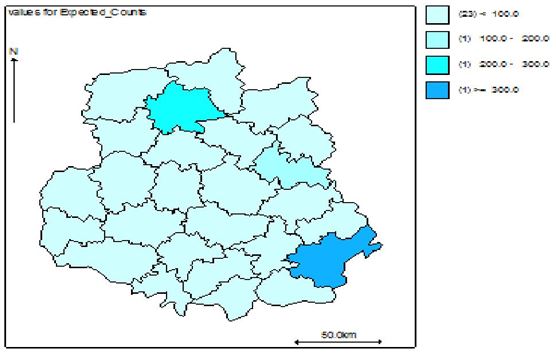
Рисунок 3.4 – Очікувані випадки зараження оніхомікозом
за просторово-динамічною моделлю в районах Вінницької області.
* * *
Таким чином, результати проведеного епідеміологічного дослідження ризику розвитку оніхомікозу на основі геостатистичного моделювання за трьома моделями (базовою над дисперсною Пуассона, просторовою та просторово-динамічною) дозволяють зробити наступні висновки:
- У Вінницькій області захворюваність на оніхомікоз впродовж 2011–2013 рр. склала 38,4, 38,9 та 35,6 на 100 тисяч населення відповідно.
- Встановлено суттєві (р<0,0001) просторові відмінності в територіальних ризиках зараження з найвищими значеннями у Бершадському, Калинівському та Іллінецькому районах з відповідним перевищенням очікуваних значень (значення відносного ризику) 417,9/15,1= 27,6 разів, 230,4/14,5 =15,8 разів 129,6/9,4=13,8 разів.
- Ефект загального часового тренду є суттєвим (р<0,001). Напрямок тренду є негативний, із зменшенням ризику зараження протягом 2015-2017 років на 32,4 %.
- Ефект кількості населення району на модифікацію ризику розвитку оніхомікозу є не суттєвим за всіх модифікацій моделей.
- Ефект кількості салонів краси є суттєвим (р<0,05). Ризик розвитку оніхомікозу зростає при появі додаткового салону краси на території району на 1 % за наддисперсною моделлю Пуассона, на 2,2 % за просторово-динамічною моделлю та на 4,3 % за просторовою моделлю.
- При появі додаткової сауни на території району ризик зараження на оніхомікоз зростає на 26,8 %, а при збільшенні рН ґрунту на одиницю – зменшується на 10,7 %.
Матеріали даного розділу викладені в наступних роботах:
1. Кізіна І. Є. Оніхомікоз у Вінницькій області: погляд на проблему через призму популяційного дослідження // Biomedical and biosocial antropology. 2014. № 23. С. 235- 238 [21].
2. Kizina I. E. Geostatistical modeling of onychomycosis incidence rates in Vinnitska oblast // «Дерматовенерология. Косметология». 2015. № 2. С. 10-17 [149].
РОЗДІЛ 4
РОЗЛАДИ МІКРОЦИРКУЛЯЦІЇ ШКІРИ, КЛІНІКО-ДЕМОГРАФІЧНІ ТА ПСИХОЕМОЦІЙНІ ОСОБЛИВОСТІ У ХВОРИХ НА ОНІХОМІКОЗ
4.1 Клініко-демографічні особливості та коморбідність у хворих на оніхомікоз
Обстежено когорту хворих з грибковими ураженнями нігтів кистей та стоп, котру склали 49 хворих, з них: 20 (40,8 %) чоловіків та 29 (59,2 %) жінок середнім віком (51,1 ± 16,15) року (від 19 до 74 років), які лікувалися у Вінницькому обласному клінічному шкірно-венерологічному диспансері впродовж 2013 року. Ці хворі в подальшому склали контрольну групу проведеного клінічного дослідження.
Середня тривалість захворювання коливалась в широких межах від від 2 місяців до 35 років (у середньому – (2,8 ± 4,9) року) і розподілилася наступним чином (рис. 4.1).
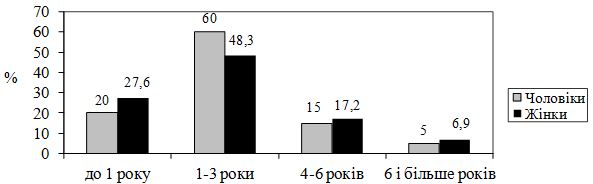
Рисунок 4.1 – Тривалість захворювання у чоловіків (n=20) і жінок (n=29).
З 49 хворих 32 за медичною допомогою з приводу грибкового ураження нігтів кистей та стоп не зверталися, що склало 65,3 %. Решта 17 (34,7 %) хворих звернулися в клініку в зв’язку з неефективністю попереднього лікування. У 13 (26,5 %) був оніхомікоз кистей рук, у 22 (44,9 %) – стоп, у 14 (28,6 %) – стоп та кистей.
Клінічні характеристики хворих на оніхомікоз наведені в таблиці 4.1, а їх графічне зображення – на рисунку 4.2.
Таблиця 4.1 – Клінічні характеристики хворих на оніхомікоз (n=49)
| Показник | Число хворих на оніхомікоз | |
| абс. | % | |
| Вік, роки
< 25 років 25-60 років > 60 років |
3
27 19 |
6,1 %
55,1 % 38,8 % |
| Кількість уражених нігтів
1-2 > 2 |
11
38 |
22,4 %
77,6 % |
| Локалізація ураження
ІІ–V пальці руки І палець руки або ІІ–V пальці ноги І палець ноги |
5
9 35 |
10,2 %
18,4 % 71,4 % |
| Клінічна форма ураження
біла поверхнева дистально-латеральна проксимальна |
8
40 1 |
16,3 %
81,6 % 2 % |
| Глибина пошкодження нігтьової пластинки
до 1/3 довжини від 1/3 до 2/3 довжини > 2/3 довжини |
8
21 20 |
16,3 %
42,9 % 40,8 % |
| Вираженість піднігтьового гіперкератозу
немає або слабко виражений помірний (< 2 мм) виражений (> 2 мм) |
11
23 15 |
22,4 %
46,9 % 30,6 % |
Як видно, у більшості (81,6 %) пацієнтів визначалася дистально-латеральна форма оніхомікозу, у 16,3 % – біла поверхнева та у 2 % – проксимальна (рис. 4.2-А). Переважна більшість хворих (83,7 %) мали пошкодження нігтьової пластинки від 1/3 її довжини (рис. 4.2-Б) та помірно виражний або виражений піднігтьовий гіперкератоз (рис. 4.2-В).
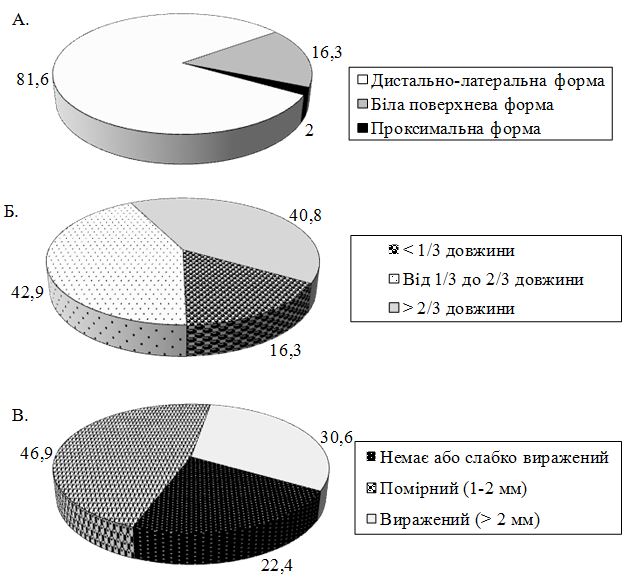
Рисунок 4.2 – Розподіл хворих на оніхомікоз (n=49) за клінічною формою ураження (А), глибиною пошкодження нігтьової пластинки (Б), вираженістю піднігтьового гіперкератозу (В).
Індекс КІОТОС [54] у досліджуваних хворих склав у середньому (16,4 ± 9,54) бала (від 1 до 30 балів).
Згідно отриманих даних, за допомогою мікроскопії було отримано 47 позитивних результати, що склало 95,9 %. Розподіл результатів проведеного мікроскопічного дослідження наведено на рисунку 4.3. Слід зазначити, що мікроскопія дозволила верифікувати лише наявність грибкової інфекції, але не вид збудника. Результати ПЛР тесту, специфічного до Т. rubrum, і ПЛР із панфунгальними праймерами (включають маркери Microsporum audouinii, T. mentagrophytes var. mentagrophytes, T. schoenleinii, T. terrestre, T. rubrum, T. tonsurans, T. soudanens, Epidermophyton floccosum, Candida spp), виявилися позитивним у 30 (61,2 %) з 49 пацієнтів (рис. 4.3).
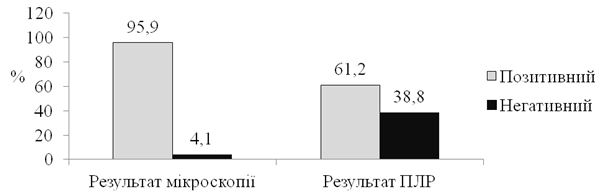
Рисунок 4.3 – Результати мікроскопічного дослідження та ПЛР у пацієнтів
з клінічними проявами ураження нігтів (n=49).
Аналіз етіологічної картини оніхомікозу за результатами ПЛР тесту представлений в таблиці 4.2.
Таблиця 4.2 – Результати ідентифікації патогенних грибів за результатами ПЛР у пацієнтів з патологією нігтів (n=30)
| Види збудника | Кількість пацієнтів | |
| Абс. | % | |
| Trichophyton rubrum – позитивний
Раn-Fungalis – позитивний |
18 | 60 |
| Раn-Fungalis – позитивний
Trichophyton rubrum – негативний |
12 | 40 |
Як видно з таблиці 4.2, у більшості (60 %) пацієнтів збудником оніхомікозу був T. rubrum. Поєднання позитивних результатів ПЛР, специфічної до T. rubrum, та ПЛР із панфунгальними праймерами підтверджує достовірність отриманих результатів, оскільки до панфунгальних праймерів входять маркери T. rubrum.
В 12 (40 %) випадках був отриманий позитивний результат ПЛР із панфунгальними праймерами та негативний результат ПЛР, специфічній до T. rubrum. Ці пацієнти розглядались як ті, що мають оніхомікоз нез’ясованої етіології та їм призначено етіотропну терапію антифунгальними препаратами широкого спектру дії.
З 30 позитивних зразків, отриманих методом ПЛР, позитивною мікроскопія була у 28 (93,3 %) хворих, а негативна – у 2 (6,67 %) пацієнтів. У останніх двух пацієнтів повторна мікроскопія нігтьових пластинок також виявилася негативною, а ПЛР знову була позитивною, що дозволило поставити діагноз оніхомікозу та прийняти рішення про призначення відповідної терапії. Ці дані свідчать, що використання ПЛР-діагностики дозволяє виявити оніхомікоз на ранній стадії та вчасно попередити подальше поширення інфекції.
Отримані дані дозволяють зробити важливий висновок: проведення мікроскопії не повинно виключати застосування ПЛР для діагностики захворювання, ці два метода повинні доповнювати один одного, оскільки мікроскопія дозволяє верифікувати наявність грибкової інфекції, тоді як результати ПЛР допомагають ідентифікувати вид збудника.
За даними проведеного клініко-лабораторного обстеження хворих соматична захворюваність при оніхомікозі мала подібну до популяційної структуру. Соматичні коморбідні захворювання та стани були виявлені у 30 (61,2 %) досліджуваних пацієнтів, з них 8 (16,3 %) учасників дослідження мали одне супутнє захворювання, у 10 (20,4 %) пацієнтів були дві коморбідні патології, а у 12 (24,5 %) – три і більше. 22 (44,9 %) особи мали коморбідну патологію за декількома органними системами.
За даними літератури ризик розвитку оніхомікозу підвищують судинні захворювання (особливо при ураженні судин нижніх кінцівок), ожиріння, цукровий діабет, деформація кісткового апарату стоп [10]. У зв’язку з цим, а також враховуючи порівняно невелику кількістю деяких супутніх захворювань в аналізованій когорті хворих на оніхомікоз, було вирішено для подальшого аналізу об’єднати наведені в таблиці 4.3 нозологічні одиниці у 7 категорій (в подальшому – змінних): 1) кардіоваскулярна (артеріальна гіпертензія, захворювання серця, синдром Рейно, патологія вен нижніх кінцівок), 2) респіраторна; 3) гастроінтестинальна; 4) ниркова патологія; 5) ендокринна; 6) скелетно-м’язова; 7) ментальна комор бідність (табл. 4.3).
Таблиця 4.3 – Частота супутніх захворювань у хворих на оніхомікоз
| Нозологічна одиниця | Кількість пацієнтів | |
| Абс. | % | |
| Артеріальна гіпертензія | 14 | 28,6 |
| Захворювання серця | 4 | 8,2 |
| Синдром Рейно | 2 | 4,1 |
| Патологія вен нижніх кінцівок | 9 | 18,4 |
| Хронічна патологія легень | 5 | 10,2 |
| Захворювання шлунково-кишкового тракту та печінки | 5 | 10,2 |
| Захворювання нирок | 4 | 8,2 |
| Патологія щитоподібної залози | 5 | 10,2 |
| Цукровий діабет | 6 | 12,2 |
| Ожиріння | 8 | 16,3 |
| Захворювання опорно-рухового апарату | 7 | 14,3 |
| Неврологічна та психічна патологія | 6 | 12,2 |
| Псоріаз | 2 | 4,1 |
| Анемія | 3 | 6,1 |
| Метаболічні захворювання | 1 | 2,0 |
Як видно з таблиці 4.3, найбільш частими супутніми захворюваннями у хворих на оніхомікоз були: артеріальна гіпертензія (28,4 %), патологія вен нижніх кінцівок (18,4 %) і ожиріння (14,3 %). Всі пацієнти отримували етіопатогенетичну терапію, котра була узгоджена із суміжними спеціалістами.
4.2 Особливості психоемоційного стану хворих на оніхомікоз
Дослідження останніх років продемонстрували, що пацієнти, які страждають на різні дерматози, мають високу частоту афективних розладів. При чому останні прямо корелюють зі ступенем тяжкості шкірного процесу. Крім цього, виникнення психологічних, косметичних та функціональних проблем асоціюється з істотним зниження якості життя [6]. Причому в деяких випадках оніхомікоз призводить до тривалої непрацездатності, а, отже, й втрати роботи. Все зазначене вище спонукало оцінити ступінь дискомфорту та змін психічного статусу у досліджуваних хворих на оніхомікоз.
За шкалою оцінки дискомфорту середнє значення вираженості дискомфорту склало (4,18 ± 1,81) бала, а за «Шкалою станів» А.Б. Леонової – (51,71 ± 6,83) бала. Зведені дані щодо оцінки ступеня суб’єктивної комфортності наявного грибкового ураження наведені в таблиці 4.4.
Таблиця 4.4 – Розподіл хворих (n=49) за ступенем суб’єктивної комфортності
| Рівень дискомфорту | Кількість хворих | |||
| Шкала оцінки дискомфорту | Шкала станів А.Б. Леоновой | |||
| абс. | % | абс. | % | |
| Низький | 6 | 7,6 % | 5 | 6,3 |
| Середній | 12 | 15,2 % | 5 | 6,3 |
| Високий | 31 | 39,2 % | 39 | 49,3 % |
Отримані дані свідчать, що в цілому оніхомікоз не викликає вираженого зниження суб’єктивного комфорту. Водночас, цілком закономірно, що ступінь дискомфорту залежав віж локалізації ураження (рис. 4.4).
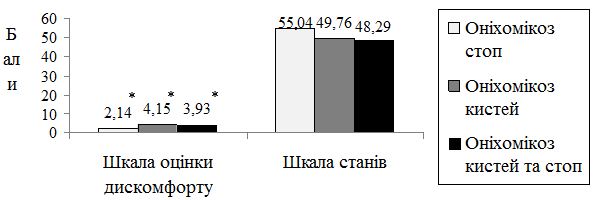
Рисунок 4.4 – Залежність зниження рівня суб’єктивного комфорту у хворих від локалізації оніхомікозу на момент включення у дослідження:
* – рівень значущості відмінностей середніх значень вираженості суб’єктивного дискомфорту порівняно з групою хворих з оніхомікозом стоп p<0,05.
Як видно з рисунку 4.4, більший дискомфорт викликали грибкове ураження нігтів кистей або поєднане ураження нігтей стоп та рук, ніж оніхомікоз стоп. У хворих, які мали грибкове ураження нігтів кистей, середні значення вираженості дискомфорту за шкалою оцінки дискомфорту таза «Шкалою станів» А.Б. Леонової – (2,31 ± 1,44) та (54,62 ± 6,55) бала достовірно відрізнялися від показників осіб без ураження нігтем рук ([3,5 ± 1,84] та [50,67 ± 6,71] бали відповідно; р=0,025 та р=0,044).
Результати обстеження хворих за Госпітальною шкалою оцінки тривоги і депресії (HАDS) показали, що середнє значення вираженості тривоги у хворих на оніхомікоз склало (8,37 ± 3,19) бала, депресії – (6,18 ± 3,55) бала, що в цілому демонструє субклінічно виражений рівень тривожно-депресивних розладів у хворих цієї категорії. Водночас, за цією шкалою клінічно виражену тривогу мали 42,8 %, клінічно виражену депресію – 12,2 % хворих (при бальних значеннях за шкалою HADS > 11 балів) (табл. 4.5). З цих хворих відповідно 85,7 % та 83,3 % мали грибкове ураження нігтів кистей або поєднане ураження нігтей рук та стоп.
Таблиця 4.5 – Розподіл хворих на оніхомікоз (n=49) за наявністю та ступенем вираженості тривожних та депресивних розладів (шкала HADS)
| Значення показника | Кількість хворих | |||
| HADS-тривога | HADS-депресія | |||
| абс. | % | абс. | % | |
| 0–7 балів | 18 | 36,7 | 31 | 63,3 |
| 8–10 балів | 10 | 20,4 | 12 | 24,5 |
| > 11 балів | 21 | 42,8 | 6 | 12,2 |
Виходячи з отриманих даних, необхідно акцентувати увагу практичних лікарів на необхідності проведення когнітивно-поведінкової терапії як доповнення до загальноприйнятої терапії з метою зниження рівня тривоги і усунення викликаних нею внутрішньоособистісних проблем.
Середнє значення DLQI у досліджуваних хворих становило (8,41 ± 9,19) бала, що в цілому, безумовно, означає помірний вплив оніхомікозу на якість життя хворого.
Таблиця 4.6 – Розподіл хворих на оніхомікоз (n=49) за значеннями DLQI
| Значення індексу | Кількість хворих | |
| абс. | % | |
| 0-1 | 8 | 16,4 |
| 2-5 | 22 | 44,9 |
| 6-10 | 3 | 6,1 |
| 11-20 | 9 | 18,4 |
| 21-30 | 7 | 14,2 |
Як видно з таблиці 4.6, частина хворих мала високе значення DLQI, що свідчить про сильний та надзвичайно сильний вплив захворювання на життя пацієнта – в 18,4 % та 14,2 % випадків відповідно. Високе значення індексу в більшості випадків визначалося у пацієнтів з грибковим ураженням нігтів рук (при DLQI: 21–30 / частота ураження нігтів рук – 71,4 %), а також у пацієнтів з високим рівнем суб’єктивного дискомфорту та високим рівнем тривожно-депресивних розладів (при DLQI 21–30 / рівень дискомфорту за шкалою оцінки дискомфорту – 5,0 ± 1,83, за шкалою станів – 44,71 ± 8,77; HADS-тривога –10,71 ± 2,21; HADS-депресія – 10,85 ± 1,07), р<0,05.
Як видно з таблиці 4.7, серед різних сфер, що складають концепцію якості життя згідно протоколу WHOQOL-BREF найвище та найнижче середнє значення мали сфера 4 (вплив оточуючого середовища на якість життя) (у середньому – (26,93 ± 1,96) бала) та домен 3 (соціальні відношення) (у середньому – (12,78 ± 1,28) бала) відповідно.
Таблиця 4.7 – Оцінка чотирьох сфер якості життя (опитувальник WHOQOL-BREF) за статтю, віком, тривалістю оніхомікозу, КІОТОС, наявністю хронічного захворювання та тривожно-депресивних розладів
| Сфери якості життя | ||||
| Фізичне здоров’я | Психологічне здоров’я | Соціальні відношення | Оточуюче середовище | |
| М ± σ | М ± σ | М ± σ | М ± σ | |
| Загальне | 25,26 ± 2,02 | 22,85 ± 2,29 | 12,78 ± 1,28 | 26,93 ± 1,96 |
| Стать:
– чоловіки – жінки – р |
24,89 ± 2,13
25,52 ± 1,93 0,316 |
23,79 ± 1,78
22,19 ± 2,4 0,013 |
13,37 ± 1,26
12,37 ± 1,15 0,009 |
27,16 ± 2,24
26,78 ± 1,76 0,542 |
Продовження таблиці 4.7
| Сфери якості життя | ||||
| Фізичне здоров’я | Психологічне здоров’я | Соціальні відношення | Оточуюче середовище | |
| М ± σ | М ± σ | М ± σ | М ± σ | |
| Вік:
≤ 40 років > 40 років – р |
24,75 ± 1,86
25,44 ± 2,06 0,295 |
24,08 ± 1,373
22,41 ± 2,32 0,015 |
13,42 ± 1,31
12,56 ± 1,21 0,045 |
27,08 ± 2,23
26,88 ± 1,89 0,784 |
| Тривалість оніхомікозу:
≤ 1 року > 1 року р |
24,6 ± 1,68
25,58 ± 2,11 0,098 |
24,0 ± 1,6
22,29 ± 2,38 0,007 |
13,33 ± 1,5
12,52 ± 1,09 0,041 |
26,53 ± 2,42
27,13 ± 1,71 0,401 |
| КІОТОС:
≤ 6 > 6 р |
24,83 ± 1,53
25,41 ± 2,16 0,324 |
24,42 ± 1,51
22,29 ± 2,28 0,001 |
13,42 ± 1,24
12,56 ± 1,24 0,045 |
26,5 ± 2,07
27,09 ± 1,93 0,40 |
| Хронічне захворювання:
– немає – є р |
25,95 ± 2,09
24,68 ± 1,8 0,032 |
23,67 ± 2,24
22,16 ± 2,13 0,025 |
13,33 ± 1,06
12,32 ± 1,28 0,005 |
27,67 ± 2,06
26,32 ± 1,68 0,021 |
| Тривога:
– немає -є р |
25,14 ± 2,03
25,44 ± 2,04 0,627 |
23,46 ± 2,12
21,89 ± 2,27 0,024 |
13,14 ± 1,3
12,22 ± 1,06 0,012 |
26,75 ± 2,14
27,22 ± 1,66 0,406 |
| Депресія:
– немає – є р |
25,12 ± 2,0
27,33 ± 0,58 0,002 |
23,02 ± 2,09
20,33 ± 4,04 0,048 |
12,79 ± 1,3
12,67 ± 1,15 0,873 |
26,88 ± 2,0
27,67 ± 1,15 0,366 |
Як видно з таблиці 4.7, ряд клініко-демографічних характеристик хворих на оніхомікоз визначає істотні відмінності між середніми величинами показників якості життя (р<0,05). В зв’язку з цим для перевірки гіпотези про внесок цих факторів в кінцеву оцінку чотирьох сфер якості життя був проведений регресійний аналіз, де у якості залежної перемінної були обрані сфери якості життя, а незалежними перемінними слугували стать, вік, тривалість оніхомікозу, індекс КІОТОС, наявність тривоги, депресії, коморбідних станів.
В таблиці 4.8 наведені результати множинного регресійного аналізу, згідно якого наявність хронічного захворювання робить достовірний внесок у зниження фізичного компоненту якості життя при оніхомікозі, сфери соціальних відносин та взаємодії з оточуючим середовищем, тоді як найбільший сильний вплив на психіологічний компонент якості життя демонструють стать (жіноча), тривалість існування грибкового ураження та наявність тривожних розладів.
Звертає увагу той факт, що зниження оцінки соціальних відносин асоціюється із зростанням величини індексу КІОТОС, що ймовірно пов’язано із негативним сприйняттям хворими більш вираженого ураження за локалізацією, площею та наявністю косметичного дефекту.
Таким чином, отримані дані свідчать, що максимальні значення DLQI, рівня суб’єктивного дискомфорту та тривожно-депресивних розладів мають пацієнти з локалізацією грибкового ураження на нігтях рук ізольовано або в поєднанні з оніхомікозом стоп. Крім цього, важливо розуміти, що оніхомікоз відноситься до патології, що істотно знижує якість життя пацієнтів і вимагає правильного підходу до вибору терапії.
Але згідно отриманих результатів для покращення якості життя тільки протигрибкової терапії не достатньо. Існує необхідність виділення груп хворих, які мають супутні (коморбідні) захворювання, оскільки їх наявність може погіршувати результати лікування та якість життя хворих.
Таблиця 4.8 – Звіт множинного регресійного аналізу впливу окремих клініко-демографічних факторів на чотири сфери якості життя
| Сфери якості життя | Незалежні перемінні | Нестандартизо-вані коефіцієнти | Стандартизовані коефіцієнти | t | р | |
| B | Стан-дартна похибка | Beta | ||||
| Cфера 1 | Хронічне захворювання | -1,396 | 0,573 | -0,349 | -2,437 | 0,020 |
| Cфера 2 | Стать | -0,738 | 0,355 | -0,287 | -2,078 | 0,045 |
| Тривалість оніхомікозу | -1,448 | 0,675 | -0,300 | -2,146 | 0,038 | |
| Тривога | -1,301 | 0,586 | -0,286 | -2,219 | 0,033 | |
| Сфера 3 | Хронічне захворювання | -0,758 | 0,328 | -0,298 | -2,311 | 0,026 |
| КІОТОС | -0,373 | 0,157 | -0,327 | -2,373 | 0,022 | |
| Сфера 4 | Хронічне захворювання | -1,434 | 0,584 | -0,369 | -2,456 | 0,019 |
Отже, слід визнати, що оцінка якості життя хворих на оніхомікоз до і після лікування є джерелом додаткової інформації та важливим критерієм ефективності лікування дерматологічних хворих цієї категорії.
4.3 Розлади мікроциркуляції в шкірі уражених пальців хворих на оніхомікоз
Результати оцінки мікроциркуляції методом лазерної допплерівської флоуметрии показали суттєві відмінності стану тканинного кровотоку при наявності грибкового ураження нігтів. Вихідний тканинний кровотік при наявності грибкового ураження ([36,43 ± 27,56] ПО) був в 2 рази нижче показника мікроциркуляції на аналогічних сегментах неуражених пальців іншої кінцівки ([78,56 ± 57,15] ПО; p=0,023).
Під час теплової проби внаслідок розширенням судин шкіри під впливом температури реакція шкірного кровотоку збільшилась як в неуражених, так і в уражених пальцях кистей або стоп, статистично достовірно в 1,5 рази показник мікроциркуляції був також нижче при наявності грибкового ураження ([185,0 ± 120,85] ПО) в порівнянні з результатом неуражених пальців іншої кінцівки ([270,38 ± 200,14] ПО; р=0,043), а приріст перфузії у відповідь на локальну гіпертермію був в 1,6 рази нижчим ([460,99 ± 542,33] %), порівняно зі здоровими пальцями ([751,54 ± 840,2] %); p=0,040).
Рівень перфузії при оклюзії артеріальних судин, т. т. біологічний нуль в неуражених та уражених пальцях кистей або стоп в абсолютних величинах не відрізнявся ([6,04 ± 3,39] та [37,3 ± 7,92] ПО; p>0,05). Проте, на здорових пальцях показника мікроциркуляції знизився на 76,8 % від початкового рівня тканинного кровотоку, на уражених грибком пальцях – на 61,9 %.
Максимальна постоклюзійна гіперемія в абсолютних одиницях на уражених пальцях кистей та стоп склала (125,52 ± 73,1) ПО, що статистично достовірно (p>0,05) не відрізнялося від величини кровотоку на здорових пальцях іншої кінцівки ([142,99 ± 108,69] ПО).
Резерв капілярного кровотоку в порівнюваних уражених та неуражених грибком пальцях статистично достовірно також не відрізнявся (відповідно: (437,92 ± 272,94) % та (419,58 ± 286,56) %; p>0,05). Однак, на уражених грибком пальцях величина резерву капілярного кровотоку в 21 (42,9 %) випадку відповідала нормоциркуляторному гемодинамічному типу мікроциркуляторного русла (рис. 4.5), тоді як у 22 (44,9 %) хворих був виявлений спастичний (рис. 4.6), у 1 (2 %) – гіперемічний (рис. 4.7), у 5 (10,2 %) – застійно-стазичний (рис. 4.8) гемодинамічний тип мікроциркуляції.
Рисунок 4.5 – Хворий П., 31 рік. Нормоциркуляторний гемодинамічний тип мікроциркуляторного русла за даними лазерної допплерівської флоуметрії з оклюзійною пробою (ендотелій-залежна вазодилятація).
Рисунок 4.6 – Хвора В., 60 років. Спастичний гемодинамічний тип мікроциркуляторного русла за даними лазерної допплерівської флоуметрії з оклюзійною пробою (ендотелій-залежна вазодилатація).
Рисунок 4.7 – Хворий Н., 45 років. Гіперемічний гемодинамічний тип мікроциркуляторного русла за даними лазерної допплерівської флоуметрії з оклюзійною пробою (ендотелій-залежна вазодилятація).
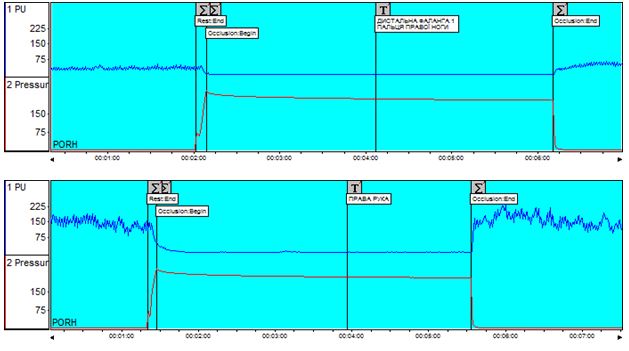
Рисунок 4.8 – Хвора П., 26 років. Застійно-стазичний гемодинамічний тип мікроциркуляторного русла за даними лазерної допплерівської флоуметрії з оклюзійною пробою (ендотелій-залежна вазодилатація).
Водночас, на здорових пальцях резерв капілярного кровотоку, що відповідав нормоциркуляторному гемодинамічному типу мікроциркуляторного русла, був виявлений в переважній більшості випадків спостеження (83,7 %), спастичний тип, котрий відзначається при зниженні притоку крові в мікроциркуляторне русло та підвищенні тонусу мікросудин, був діагностований в 14,3 % випадках та гіперемічний, що пов’язаний із дилатацією мікросудин притоку, – в 2 % випадках.
Таким чином, в 57,1 % випадках тканинний кровотік пальців з ураженими грибком нігтями відрізняється від стану мікрокровотоку на аналогічних сегментах неуражених пальців іншої кінцівки.
При порівнянні груп пацієнтів з наявними та відсутніми порушеннями мікроциркуляції виявлено, що у хворих із мікроциркуляторними розладами тривалість захворювання та кількість уражених нігтів перевищували аналогічні показники у пацієнтів з нормоциркуляторним типом мікроциркуляції (табл. 4.9).
Крім цього у хворих на оніхомікоз із наявними порушеннями мікроциркуляції переважає дистально-латеральна та проксимальна форма ураження нігтьової пластинки (92,9 %), а у 46,4 % пацієнтів – ураження більше ніж на дві третини. Цими даними можна пояснити той факт, що індекс КІОТОС у пацієнтів із мікроциркуляторними розладами (20,62 ± 7,81) майже в 2 рази перевищував аналогічний показник у осіб без порушення мікроциркуляції (10,78 ± 8,84; р<0,001) (табл. 4.9). І, нарешті, найважливішим, імовірно, з отриманих результатів є факт впливу гемодинамічних порушень мікроциркуляторного русла на терміни негативації результатів мікологічного дослідження у хворих на оніхомікоз стоп (табл. 4.9). Так, в цілому по групі середні строки мікологічної негативації були (14,64 ± 3,08) тижня у хворих з мікроциркуляторними розладами та (10,76 ± 4,12) тижня у пацієнтів без таких (р<0,001).
Звертає увагу, що негативації результатів мікологічного дослідження у хворих на оніхомікоз стоп, які не мають мікроциркуляторних порушень, відбувається в середньому на 2,6 місяці раніше, ніж при їх наявності ([12,46 ± 6,84] проти [15,06 ± 8,23] місяця; р<0,05), тоді як у разі ізольованого оніхомікозу кистей мікроциркуляторні розлади достовірно не вплинули на терміни мікологічної негативації (р>0,05).
Таблиця 4.9 – Порівняльна характеристика клінічних параметрів пацієнтів з мікроциркуляторними розладами та без таких
| Показник | Пацієнти з розладами мікроциркуляції (n=28) | Пацієнти без розладів мікроциркуляції (n=21) |
| Вік, роки1 | 55,0 [42,0-69,0] | 53,0 [37,0-61,0] |
| Тривалість хвороби, роки2 | 5,63 ± 3,41 | 2,97 ± 2,42* |
| Кількість уражених нігтів2 | 3,2 ± 1,6 | 1,9 ± 1,5* |
| Площа ураження, % | 85,3 % | 73,1 % |
| Індекс КІОТОС2 | 20,62 ± 7,81 | 10,78 ± 8,84* |
| Терміни мікологічної негативації, місяці:
– оніхомікоз кистей рук2 – оніхомікоз стоп2 |
6,36 ± 1,32
15,06 ± 8,23 |
6,94 ± 1,73
12,46 ± 6,84* |
Примітки:
- У таблиці наведено середні арифметичні значення досліджуваних показників (M) і середні квадратичні відхилення (σ);
- У таблиці наведено медіани (Mе) та інтерквартильні розмахи (25-й та 75-й процентилі) [LQ, HQ];
- * – рівень значущості відмінностей показників порівняно з групою пацієнтів з мікроциркуляторними розладами p<0,05.
* * *
Отримані дані дозволяються зробити висновок, що приховані гемодинамічні порушення мікроциркуляторного русла верхніх та нижніх кінцівок вірогідно створюють сприятливі умови для проникнення грибкової інфекції та розвитку захворювання. З іншого боку, гриби в свою чергу викликають порушення кровообігу мікроциркуляторного русла при їх тривалому персистуванні, що підтверджуються результати сучасних досліджень [25]. При цьому численні публікації засвідчують факт підвищення ризику розвитку оніхомікозу при наявності коморбідних судинних захворювань (особливо при ураженні судин нижніх кінцівок), цукрового діабету і т. п., котрі створюють підґрунтя для істотних мікроциркуляторних розладів та знижують ефективність лікування [11, 25, 41]. Останнє потребує подальшого дослідження з метою максимальної індивідуалізації тактики лікування та профілактики даної патології, а наявні порушення мікроциркуляції у хворих на оніхомікоз обґрунтовують необхідність розширення меж медикаментозного впливу, зокрема, використання вазоактивних засобів в комплексній терапії даного захворювання.
Матеріали даного розділу викладені в наступних роботах:
1. Кізіна І. Є. Вплив клініко-демографічних факторів та коморбідності на якість життя хворих на оніхомікоз // Дерматологія та венерологія. 2016. № 4 (74). С. 64-71 [17].
2. Літус О. І., Кізіна І. Є. Показники лазерної допплерівської флоуметрії в оцінці мікроциркуляції при лікуванні оніхомікозів // Вісник Вінницького національного університету. 2016. Т. 20, № 1 (1). С. 81-85 [28].
