5 КОМПЛЕКСНА ТЕРАПІЯ І ПРОФІЛАКТИКА ПРОТОЗОЙНИХ ІНВАЗІЙ СЕЧОСТАТЕВОЇ СИСТЕМИ
5.1 Розробка етапного методу комбінованого лікування хворих на сечостатевий трихомоноз з урахуванням статі, перебігу захворювання та можливої інвазії Trichomonas tenax, Pentatrichomonas hominis та Giardia lamblia
Загальновідомо, що всім найпростішим, зокрема, трихомонадам і лямбліям, притаманні фагоцитарні властивості [200]. При фагоцитозі, що здійснюється будь-якими найпростішими, частка мікроорганізмів не руйнується повністю – вони зберігаються всередині одноклітинного мікроорганізму неушкодженими (незавершений фагоцитоз) [8]. У разі незавершеного фагоцитозу коки, диплококи, мікоплазми, хламідії, бацилярні форми, віруси, що виходять, при загибелі трихомонад, або лямблій, здатні підтримувати запальний процес у сечостатевих шляхах, який часто сприймається за невилікуваний трихомоноз або посттрихомонадні ураження [162]. Тому, найпростіші, пряму патогенну дію яких на ССС людини ще не доведено, а перш за все, Trichomonas tenax та Pentatrichomonas hominis, мають розглядатись щонайменше в якості патогенетичних чинників ІПСШ. Саме через це, ерадикація Trichomonas tenax та Pentatrichomonas hominis із ССС людини, як і ерадикація Trichomonas vaginalis та Giardia lamblia, вочевидь, є обов’язковими. Таким чином, постали наукові задачі щодо розробки дієвих способів елімінації їх збудників із організму відповідних пацієнтів. Причому, найбільшу зацікавленість викликає елімінація найпростіших, перебування яких у ССС хворих на ІПСШ донедавна вважалось малоймовірним (Giardia lamblia) або неможливим (Trichomonas tenax та Pentatrichomonas hominis) [65].
При розробці метода лікування протозойних інвазій ССС були проаналізовані дані обстежень 106 хворих, серед них 45 (42,5 %) чоловіків, середній вік яких становив (39,8 ± 3,3) року, та 61 жінка (57,5 %); середній вік жінок становив (28,4 ± 4,7) року. З цих хворих були сформовані основна група (77 пацієнтів) та група порівняння (29 пацієнтів). Хворим основної групи застосовували послідовно: секнідазол по 2,0 г 1 раз на добу протягом 5 днів; препарат, що містить 0,5 г орнідазолу та 0,5 г ципрофлоксацину, – по 1 таблетці 3 рази на день при вазі більше 70 кг (або 2 рази на день при вазі менше 70 кг) протягом 10 днів. Поєднання різних антипротозойних препаратів значно зменшує можливі резистентності збудника. Крім того, використання ципрофлоксацину забезпечує елімінацію чутливої супутньої мікрофлори, яка сприяє підтриманню запалення [65, 162]. З метою поліпшення проникнення препарату до зони запалення пацієнтам призначалася фізіотерапія (лазеротерапія, магнітотерапія, СМВ терапія, фонофорез із гідрокортизоном). Крім того, пацієнти дотримувалися дієти № 5. Чоловіки, у разі потреби, отримували пальцьовий масаж передміхурової залози та ректальні протизапальні свічки. Жінки отримували щоденні вагінальні спринцювання та піхвові таблетки з ніфуротелем та ністатином, а також свічки з хлоргексидином послідовно протягом 8 та 10 днів, відповідно. Під час лікування пацієнтам суворо заборонялося мати сексуальні контакти, а в період контролю не дозволявся секс без застосування бар’єрних засобів.
Група порівняння отримувала метронідазол по 500 мг два рази на добу протягом 7–10 днів на тлі традиційної патогенетичної терапії згідно з існуючими протоколами лікування МОЗ та Європейського союзу (International Union against Sexually Transmitted Infections – IUSTI [163]. Результати ефективності терапії щодо елімінації патогенних мікроорганізмів із ССС визначалися згідно відповідних рекомендацій IUSTI [163]. Встановлення виліковності проводилося тричі – через 30, 60 днів і через 3 місяці після закінчення лікування – шляхом постановки зазначених ПЛР. Враховувалася також переносимість лікування (відсоток побічних реакцій на підставі об’єктивних і суб’єктивних ознак). Усім хворим проводилося дослідження функції печінки до і після лікування. Схема проведення контролю ефективності терапії представлена на рис. 5.1.
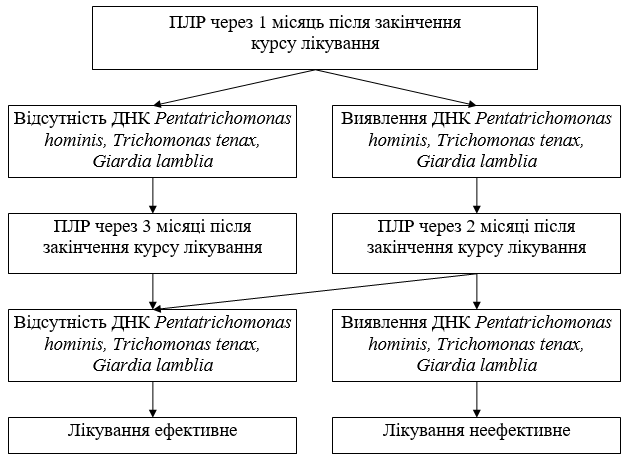 Рисунок 5.1 – Схема проведення контролю ефективності терапії лікування протозойних інвазій ССС
Рисунок 5.1 – Схема проведення контролю ефективності терапії лікування протозойних інвазій ССС
В основній групі (77 пацієнтів) клінічний ефект (повне завершення клінічних проявів – болі, свербіння, виділень з геніталій) спостерігався у 71 (92,2 %) хворих. Клінічні прояви зберігалися у 6 пацієнтів, хоча вираженість симптомів істотно зменшилася. Позитивний мікробіологічний ефект лікування отримано у 74 (96,1 %) хворих основної групи. У трьох пацієнтів були знову виявлені трихомонади та/або гіардії. Всі вони заперечували статеві зв’язки після лікування. У групі порівняння (29 пацієнтів) клінічний і мікробіологічний ефект був, відповідно, 23 (79,3 %) і 24 (82,8 %) (табл. 5.1). Як видно з табл. 5.1, клінічні та мікробіологічні результати, виражені у відсотках, в основній групі були достовірно вищі, ніж у групі порівняння. Різниця досягає достатнього рівня статистичної довіри, незважаючи на те, що вибірка досліджуваних хворих не була достатньо великою. Послідовне застосування секнідазолу, а також орнідазолу та ципрофлоксацину переносилося добре, без виражених побічних ефектів. Проте у переважній більшості пацієнтів, а саме у 49 осіб, тобто у (63,6 ± 5,5) % основної групи спостерігалися диспепсичні явища, що є природним при ентеральному вживанні нітроімідазолів; проте жодного разу не виникла необхідність припинення основного лікування. На підставі отриманих результатів можна зробити висновок, що застосування розробленої методики у комплексному лікуванні урогенітальної протозойної інвазії є обґрунтованим. Запропонований оригінальний метод лікування є ефективним, має задовільну переносимість та може бути рекомендованим для емпіричної терапії уражень ССС, спричинених протозойними інвазіями T. tenax, P. hominis та G. lamblia.
Таблиця 5.1 – Клінічний і мікробіологічний ефект лікування протозойних інвазій ССС
| Групи обстеження | Усього | Зникнення симптомів | P. hominis, T. tenax, G. lamblia не виявлені | |||
| Абс. | % | Абс. | % | Абс. | % | |
| Основна група (секнідазол + орнідазол + ципрофлоксацин) | 77 | 100 | 71 | 92,2 ± 3,1 | 74 | 96,1 ± 2,2 |
| Група порівняння (традиційна терапія) | 29 | 100 | 23 | 79,3 ± 7,5 | 24 | 82,8 ± 7,0 |
| t-критерій (р) | t = 2,57 (р = 0,012) |
t = 2,10 (р = 0,038) | ||||
Таким чином, проведено лікування 77 пацієнтів з ураженнями ССС на протозойні інвазії. В якості етіотропних препаратів послідовно використовували секнідазол по 2 таблетки один раз на день протягом 5 днів та комбінацію орнідазолу (0,5 г) та ципрофлоксацину (0,5 г) – по 1 таблетці три або два рази на день (залежно від ваги) протягом наступних 10 днів. Клінічне одужання досягнуто у 92,2 % випадків та бактеріологічну санацію – у 96,1 % випадків. Запропонований оригінальний метод лікування є ефективним, має задовільну переносимість та може бути рекомендованим для емпіричної терапії уражень ССС, викликаних протозойними інвазіями T. tenax, P. hominis та G. lamblia.
5.2 Чутливість мікроорганізмів, що є асоційованими з бактеріальним вагінозом, до антибактеріальних препаратів у осіб з колонізацією сечостатевого тракту Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia
Захворювання сечостатевих органів, що обумовлені патогенними та умовно-патогенними мікроорганізмами, які призводять до дисбіозу сечостатевих органів, продовжують залишатися нагальною проблемою сучасних дерматовенерології, гінекології та урології. Значною мірою це пов’язано з певними труднощами діагностики дисбіозів сечостатевих органів, їх резистентністю до лікування, що проводиться, надзвичайно високою поширеністю та можливим розвитком важких ускладнень, особливо тих, що впливають на репродуктивну функцію людини [42].
Серед інфекційних захворювань ССС у жінок, зумовлених дисбіозом ССС, найбільш поширеним в наш час є БВ [42]. БВ – інфекційний незапальний синдром, що пов’язаний з дисбіозом біотопа піхви, для якого притаманними є підвищення концентрації анаеробних (облігатних та факультативних) мікроорганізмів та значне зниження (відсутність) молочнокислих бактерій. Серед мікробних агентів, які відіграють роль у розвитку даної патології виділяють: Gardnerella vaginalis, Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum, Ureaplasma parvum, Atopobium vaginae, Bacteroides spp., Prevotella spp., Porphyromonas spp., Peptostreptococcus spp., Fusobacterium nuclearum, Enterococcus spp., Eubacterium spp., Clostridium spp., Dialister spp., Lachnobacterium spp., Listeria monocytogenes, Megasphera spp., Mobiluncus spp., Leptotrichia spp., Sneathia spp., Veillonella spp., Candida spp., Streptococcus spp., Staphylococcus spp. [150, 175].
Сьогодні БВ – найбільш поширена патологія ССС жінок репродуктивного віку. За даними літератури, в Україні на БВ хворіє від 21 до 33 % жінок [150]. Приблизно в 5 % випадків захворювання може перебігати абсолютно безсимптомно [38]. На сучасному етапі не доведено передачу БВ статевим шляхом, а частота виявлення цього синдрому залежить насамперед від соціальної приналежності та країни проживання групи обстежуваних жінок. Не встановлено також ступеня впливу виявленого у жінки БВ на стан здоров’я її статевого партнера – чоловіка, а ефективне лікування БВ часто залишається для лікаря terra inkognita [158].
Як відомо з літературних джерел, на розвиток та перебіг БВ можуть впливати такі чинники як: вживання антибіотиків, тривале використання внутриматкових контрацептивів, перенесені раніше або супутні запальні захворювання сечостатевих органів, зміни гормонального статусу, що супроводжуються порушеннями менструального циклу (переважно за типом олігоменореї або аменореї), зміна стану загального або місцевого імунітету, вплив малих доз іонізуючого опромінення, тютюнопаління, стресові впливи, часті спринцювання піхви, використання статевих іграшок, певні особливості статевої поведінки і багато інших екзогенних та ендогенних чинників [274].
Проблема БВ пов’язана не тільки з істотним поширенням даної патології, а і з високою частотою виникнення її ускладнень [125]. Зниження колонізаційної резистентності мікрофлори піхви створює умови для висхідного інфікування слизової оболонки матки та маткових труб і сприяє розвитку запальних захворювань органів малого тазу. Ускладнення, що пов’язані з БВ, включають насамперед хронічні запальні процеси внутрішніх статевих органів, розвиток спайкових процесів в малому тазі, безпліддя, самовільне переривання вагітності на різних її термінах. Встановлено також зв’язок БВ з неопластичними процесами шийки матки [50].
Класичними методами лабораторного обстеження при постановці діагнозу БВ є культуральне дослідження матеріалу, узятого з задньобокового склепіння піхви, і мікроскопічне дослідження відповідних мазків [66]. Однак, при дослідженні за допомогою оптичної мікроскопії дуже складно провести видову ідентифікацію мікроорганізмів. А при культуральному дослідженні можна виділити не більш 15 % мікроорганізмів із числа тих, що дійсно присутній у піхві при наявності виділень, оскільки анаеробна та мікроаерофільна мікрофлора не може розвинутись в аеробних умовах, яких дотримуються при виконанні бактеріальних засівів в рутинній практиці.
Для успішного лікування БВ доцільно робити індивідуальну етіологічну діагностику складових цього захворювання з метою виявлення саме тих його чинників, які мають підлягати медикаментозній корекції. Причому, важливо, щоб відповідна діагностика була не тільки якісною, але і кількісною, оскільки визначити які саме складові цієї поліетіологічної патології є збудниками захворювання і підлягають корекції, можна лише за їх співвідношенням до показника загальної бактеріальної маси у зразку, що досліджується [120, 121]. Методика генодіагностики, а саме ПЛР-РЧ за допомогою набору реагентів Фемофлор-16, дозволяє розв’язати проблему, швидкого і якісного виявлення найбільш клінічно значимих представників як аеробної, так і анаеробної мікрофлори, асоційованої з БВ. Таким чином, точна якісна і кількісна детекція складових анаеробного та мікроаерофільного дисбіозу ССС дозволить у кожному окремому випадку призначати адекватне індивідуалізоване етіотропне лікування хворим на БВ жінкам.
Оскільки БВ є поліетіологічним захворюванням, специфічну його терапію доцільно проводити раціонально, тобто намагатись досягти найбільшого результату при використанні якнайменшої кількості найменувань антибактеріальних препаратів (АБП). Зазвичай для визначення чутливості мікрофлори до АБП в лабораторних умовах використовують результати при бактеріальних засівах. При роботі з анаеробною та мікроаерофільною мікрофлорою отримати подібні дані складно, оскільки для цього виду лабораторного дослідження потрібні анаеробні умови, створення яких потребує значних додаткових коштів на спеціальне обладнання. Тому при виборі АБП для лікування БВ, що асоційований з анаеробною та мікроаерофільною мікрофлорою часто використовують емпіричні дані щодо чутливості того чи іншого мікроорганізму, які отримані з фармакологічних довідників та іншої спеціальної літератури. Досить часто підбір відповідних АБП додатково ускладнюється множинністю одночасно виявлених збудників, які потребують медикаментозної корекції.
Виходячи з вищесказаного, завданням даного етапу роботи було дослідження чутливості клінічно найбільш значимих складових БВ до АБП та розміщення отриманих даних у вигляді графічної інформаційної панелі. Робота виконувалася шляхом обробки даних відносно чутливості клінічно найбільш значимих складових БВ до найбільш часто вживаних при цій патології АБП.
Використовувався структурно-логічний аналіз даних спеціальних літературних джерел. Основні джерела інформації: Компендіум – лікарські препарати; довідник лікарських засобів МЗ України; довідник лікарських засобів під редакцією Відаля; статті наукових медичних періодичних видань; наукові монографії відповідної спрямованості; інструкції по використанню лікарських препаратів, дані системи Internet [52]. Отримані емпіричні дані були оформлені у вигляді графічної інформаційної панелі.
Відповідно до мети роботи, було створено зручну у використанні графічну інформаційну панель сучасних даних відносно чутливості клінічно найбільш значимих складових БВ до окремих АБП (табл. 5.2).
Спираючись на графічну інформаційну панель, можна зробити припущення, що АБП, які б могли впливати на всі вказані мікроорганізми, немає. Найбільше значення для лікування БВ в сучасних умовах мають такі АБП, як метронідазол, меропенем, цефепім і кліндаміцин.
Отримані дані відносно чутливості клінічно найбільш значимих складових БВ до окремих АБП, що оформлені у вигляді графічної інформаційної панелі, дозволять практичним лікарям в короткий термін визначатися із засобами загальної індивідуалізованої специфічної терапії цього захворювання в кожному окремому клінічному випадку. Це, у свою чергу, сприятиме збільшенню ефективності етіологічного лікування відповідного захворювання.
Для перевірки ефективності використання графічної інформаційної панелі при лікуванні хворих на ІПСШ, нами було відібрано 128 осіб: 46 чоловіків (35,9 %) та 82 жінки (64,1 %), які в складі мікробіоти своєї ССС мали мікроорганізми, що асоційовані з БВ, представлені переважно анаеробною та мікроаерофільною мікрофлорою. Середній вік пацієнтів, що спостерігались, становив (34 ± 2,5) року.
Таблиця 5.2 – Графічна інформаційна панель щодо чутливості клінічно найбільш значимих складових БВ до АБП
| Назва АБП |
Мікроорганізм | |||||||||||||||||
| Mycoplasma hominis | Mycoplasma genitalium | Ureaplasma urealiticum | Gardnerella vaginalis | Atopobium vaginae | Bacteroides | Pervotella | Porphyromonas | Peptostreptococcus | Fusobacterium nuclearum | Enterococcus | Eubacterium | Clostridium | Dialister | Mobiluncus | Veillonella | Streptococcus spp. | Staphylococcus spp. | |
| Цефтриаксон | – | – | – | – | – | + | – | – | + | – | – | – | + | – | – | – | + | + |
| Цефпіром | – | – | – | – | – | + | – | – | ± | ± | – | – | + | – | – | – | ± | + |
| Цефоперазон | – | – | – | – | – | + | + | – | + | – | + | – | + | – | – | + | + | + |
| Цефотаксим, сульбактам | – | – | – | – | – | + | + | – | – | + | + | + | + | – | – | + | + | + |
| Цефепім | – | – | – | + | ± | ± | ± | ± | + | + | + | ± | ± | ± | + | ± | + | + |
| Азитроміцин | – | – | + | + | – | + | – | – | + | – | – | – | + | – | – | – | + | + |
| Кларитроміцин | – | – | + | + | – | – | – | – | – | – | – | – | + | – | – | – | + | + |
| Спіраміцин | – | – | – | – | – | – | – | – | – | – | + | – | + | – | – | – | + | ± |
| Джозаміцин | + | + | + | – | – | + | – | – | + | – | – | – | + | – | – | – | + | + |
| Доксициклін | + | + | + | + | – | + | + | – | ± | – | ± | – | + | – | – | – | + | + |
| Ципрофлоксацин | + | + | + | – | – | – | – | – | – | – | + | – | ± | – | – | – | + | + |
| Моксифлоксацин | + | + | – | – | – | + | + | + | + | + | – | – | + | – | – | – | + | + |
| Гатіфлоксацин | + | – | + | – | – | ± | – | ± | – | ± | – | – | ± | – | – | – | ± | ± |
| Спарфлоксацин | + | + | ± | + | ||||||||||||||
| Кліндаміцин | – | – | – | + | – | + | – | – | + | + | + | + | + | – | + | – | + | + |
| Амоксицилін,
кислота клавулонова |
– | – | – | + | – | + | – | – | – | + | – | – | + | – | – | – | + | + |
| Метронідазол | – | – | – | + | – | + | + | – | + | + | – | + | + | – | – | + | – | – |
| Орнідазол | – | – | – | + | – | + | + | – | + | + | – | + | + | – | – | + | – | – |
| Ніфуротель | ± | – | ± | + | + | – | – | – | – | – | – | + | + | – | – | – | ± | + |
| Меропенем | – | – | – | + | – | – | + | + | + | + | + | + | + | + | + | – | + | + |
Примітка. «+» – збудник чутливий до препарату; «±» – збудник малочутливий до препарату; «–» – збудник не чутливий до препарату.
Визначення якісного і кількісного складу мікроорганізмів, що асоційовані з БВ, виконували за допомогою методу ПЛР-РЧ та набору реагентів Фемофлор‑16.
Усі пацієнти, які перебували під спостереженням, окрім мікроорганізмів, що асоційовані з БВ, мали в складі мікробіоти своїх сечостатевих органів і збудників ІПСШ. Тому лікувальна тактика була суто індивідуалізованою для кожного з пацієнтів окремо. Вона враховувала наявність збудників ІПСШ, їх чутливість до АБП, а також наявність мікроорганізмів, що асоційовані з БВ, та їх чутливість до АБП згідно даних графічної інформаційної панелі. Крім того, пацієнти отримували пробіотичні препарати (жінки отримували їх як внутрішньо, так і внутрішньопіхвово), та препарати що стимулюють опірність організму. Контрольні дослідження виконували через 1 місяць після закінчення курсу антибіотикотерапії.
Після проведення індивідуалізованого лікування, що враховувало наявність мікроорганізмів, які асоційовані з БВ, та їх чутливість до АБП згідно даних графічної інформаційної панелі погіршення стану мікробіоти ССС не реєструвалося в жодного з досліджуваних пацієнтів (табл. 5.3).
Стан мікробіоти ССС (щодо анаеробних та мікроаерофільних мікроорганізмів) залишився без змін у 2 пацієнтів (1,6 %). Незначне покращення мікробіоти ССС спостерігалось у 15 пацієнтів (11,7 %), 4 з яких були чоловіки (8,7 %), та у 11 жінок (13,4 %). Значне покращення мікробіоти ССС відбулось після лікування у 37 пацієнтів (28,9 %), з них було 12 чоловіків (26,1 %) та 25 жінок (30,5 %). Повна нормалізація мікробіоти ССС відбулась у 74 осіб (57,8 %), з них було 30 чоловіків (65,2 %) та 44 жінки (53,7 %).
Отже, використання графічної інформаційної панелі при терапії хворих на ІПСШ, які в складі мікробіоти своєї ССС мали мікроорганізми, що асоційовані з БВ, підвищує ефективність відповідного лікування. Динаміка змін мікробіоти ССС у чоловіків і жінок виявилась приблизно однаковою і перебувала в межах статистичної похибки.
Таблиця 5.3 – Ефективність лікування хворих на ІПСШ, які в складі мікробіоти своєї ССС мали мікроорганізми, що асоційовані з БВ
| №
з/п |
Динаміка змін мікробіоти ССС | Чоловіки | Жінки | Разом | |||
| Кіль-кість | % | Кіль-кість | % | Кіль-кість | % | ||
| 1 | Повна нормалізація мікробіоти | 30 | 65,2 | 44 | 53,7 | 74 | 57,8 |
| 2 | Значне покращення мікробіоти | 12 | 26,1 | 25 | 30,5 | 37 | 28,9 |
| 3 | Незначне покращення мікробіоти | 4 | 8,7 | 11 | 13,4 | 15 | 11,7 |
| 4 | Стан мікробіоти без змін | 0 | 0 | 2 | 2,4 | 2 | 1,6 |
| 5 | Погіршення стану мікробіоти | 0 | 0 | 0 | 0 | 0 | 0 |
Таким чином на даному етапі досліджень було:
– з’ясовано чутливість клінічно найбільш значимих складових БВ до окремих АБП та створено зручну у використанні графічну інформаційну панель відповідних даних;
– здійснено підбір АБП для лікування цієї патології, ускладнений її поліетіологічністю та приналежністю більшості збудників до анаеробної та мікроаерофільної мікрофлори;
– показано, що використання графічної інформаційної панелі при терапії хворих на ІПСШ, які в складі мікробіоти своєї ССС мали мікроорганізми, що асоційовані з БВ, підвищує ефективність відповідного лікування.
5.3 Розробка етапного методу комбінованого лікування хворих на поєднанні протозойно-бактеріальні інфекції сечостатевої системи
Дослідження біоценозу ССС пацієнтів проводилося методом ПЛР-РЧ набором реагентів Фемофлор-16, що включає: суміш для ПЛР-ампліфікації, специфічну для всіх бактерій (загальна бактеріальна маса), суміш, специфічну для лактобактерій (Lactobacillus spp.), і суміші, специфічні для умовно-патогенних мікроорганізмів. Він призначений для проведення 12 тестів, включаючи дослідження позитивних і негативних контрольних зразків, дозволяє виявляти 25 показників, включаючи 23 групи мікроорганізмів, контроль за взяттям матеріалу й загальну бактеріальну масу. Комплектація набору реагентів Фемофлор-16 наведена в підрозділі 2.10.
При дослідженні біоценозу урогенітального тракту визначають кількість мікроорганізмів у транспортному середовищі, пропорційну загальній засіяності відповідного біотопу. У зразках зішкребків з урогенітального тракту людини, що містили ДНК умовно-патогенних мікроорганізмів і лактобактерій, після проведення реакцій ампліфікації, детекційний ампліфікатор реєстрував експонентне збільшення рівня флуоресценції для відповідного мікроорганізму й загальної бактеріальної маси. В наборах у форматі Real-time в суміш для ампліфікації введено ДНК-зонди, кожний з яких містить флуоресцентну мітку й гасник флуоресценції. У випадку утворення специфічного продукту ДНК-зонд руйнується, що призводить до збільшення рівня флуоресценції, який фіксують спеціальними приладами [188].
Призначенням набору реагентів Фемофлор-16 є кількісне визначення відповідної мікрофлори у жінок. Інформації про зареєстровані в Україні способи ПЛР-РЧ кількісного визначення умовно-патогенної, переважно анаеробної, мікрофлори у чоловіків на початку дослідження не знайдено. Подібні дослідження анаеробної та мікроаерофільної мікрофлори ССС чоловіків на сучасному етапі «піонерські», їх результати не можна вважати абсолютно коректними, проте вони дозволяють зрозуміти співвідношення різних компонентів мікробіоценозу ССС у чоловіків як у числовому (логарифмічному) еквіваленті, так і графічно [139].
Дана частина дослідження полягала в обґрунтуванні, розробці та впровадженні експериментальної методики лікування поєднаних уражень ССС, спричинених трихомонадами різних видів та мікроорганізмами, асоційованими з БВ. Для проведення цього етапу відібрано групу з 56 хворих на ІПСШ хронічного перебігу, 17 (30,4 %) чоловіків та 39 (69,6 %) жінок.
Лікування інфекцій ССС людини, спричинених Т. vaginalis, складний процес, що пов’язано з частою хронізацією відповідних запалень, із значною резистентністю збудника до засобів специфічного лікування, багатоосередковістю запальних процесів. Даних про лікування трихомонозу ССС, викликаного Т. tenax або Р. hominis, у літературі не знайдено. Це зрозуміло, оскільки вважали, що вказані мікроорганізми не здатні до існування в урогенітальному тракті людини. Таким чином, у сучасній дерматовенерології, крім проблеми лікування інфекцій ССС людини, викликаних Т. vaginalis, з’явилась абсолютно нова проблема, пов’язана з відсутністю науково обґрунтованих підходів до лікування запалень ССС людини, спричинених Т. tenax або Р. hominis. Враховуючи значну схожість трьох трихомонад, здатних існувати в організмі людини, при розробці лікувальної методики робили припущення про ефективність однієї схеми раціональної терапії всіх збудників, що вивчаються. Оскільки єдина інформація з цього питання стосується лікування Т. vaginalis, в основі лікувальної тактики використовували методику раціональної терапії багатоосередкових інфекцій, викликаних саме цим збудником.
Для специфічного лікування трихомонозу застосовують антибіотичні препарати, до яких має чутливість збудник захворювання. Це, насамперед, препарати груп нітроімідазолів та нітрофуранів [33]. Крім того, одне з вирішальних значень при лікуванні хронічної трихомонадної інвазії має тривалість терапії. Вважають, що її доцільно проводити в терміни до 10–20 діб, використовуючи при цьому різні препарати [58].
Для успішного лікування БВ доцільно виконувати індивідуальну етіологічну діагностику складових цього захворювання з метою виявлення саме тих його чинників, які потребують медикаментозної корекції. При цьому важливо, щоб відповідна діагностика була не тільки якісною, але і кількісною, оскільки визначити, які саме складові цієї поліетіологічної патології є збудниками захворювання і потребують корекції, можна лише за їх співвідношенням до показника загальної бактеріальної маси у досліджуваному зразку. Методика генодіагностики, ПЛР-РЧ за набором реагентів Фемофлор-16 дозволяє вирішити проблему швидкого і якісного виявлення найбільш клінічно значущих представників як аеробної, так і анаеробної мікрофлори, асоційованої з БВ [158]. Таким чином, точна якісна і кількісна детекція складових анаеробного та мікроаерофільного дисбіозу ССС дозволить у кожному окремому випадку призначати адекватне індивідуалізоване етіотропне лікування жінкам хворим на БВ.
Для етіотропного лікування БВ застосовують багато методів, в тому числі, і індивідуалізованих. Однак, одним з найефективніших є одночасне застосування антибіотиків груп нітроімідазолів та фторхінолонів. Саме речовини цих хімічних груп здатні впливати на більшість збудників БВ. Тому поєднання нітроімідазолів та фторхінолонів найчастіше використовують при емпіричному підборі специфічної терапії хворих на БВ [42].
Таким чином, з’ясовано, що термін лікування поєднаних уражень ССС різними видами трихомонад та мікроорганізмами, що асоційованими з БВ, повинен бути порядка 15 діб, а терапія включати не менше двох препаратів з антипротозойною дією та фторхінолон. Виходячи з цього, як засіб одночасної етіотропної терапії трихомонадної інвазії та ерадикації мікроорганізмів, асоційованих з БВ, застосовувались послідовно представник групи нітроімідазолів – секнідазол (секнідокс), а також препарат, що містить комбінацію представника групи нітроімідазолів та представника групи фторхінолонів – 0,5 г орнідазолу і 0,5 г ципрофлоксацину (орципол). Секнідокс призначався по 2,0 г 1 раз на добу протягом перших 5 днів лікування, орципол – з 6-го по 15-й день лікування по 1 таблетці 3 рази на день при масі тіла > 70 кг та 2 рази на день при масі тіла < 70 кг протягом 10 днів.
У жінок лікування починалось відразу після припинення mensis, використовуючи останнє як біологічну провокацію. Під час проведення антибактеріальної терапії призначались у разі потреби (за результатами імунограми) також імуномодулюючі препарати з метою підвищення опірності організму. Крім того, чоловікам у разі потреби проводився пальцьовий масаж передміхурової залози та призначались ректальні протизапальні свічки. Жінки отримували щоденно вагінальні спринцювання та піхвові таблетки з ніфуротелем і ністатином або одним з препаратів групи нітроімідазолів, а також піхвові свічки з хлоргексидином послідовно протягом 5–10 та 10 днів відповідно. Під час лікування пацієнтам суворо забороняли мати сексуальні контакти, а в контрольний період їм не дозволяли цих контактів (в тому числі оральний та анальний секс) без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції. Після закінчення антибактеріальної терапії для відновлення кишкової та у разі потреби піхвової мікрофлори пацієнти отримували відповідні пробіотичні препарати протягом 10–14 днів.
Отже, лікування поєднаних уражень ССС, викликаних трихомонадами різних видів та мікроорганізмами, асоційованими з БВ, за запропонованою оригінальною схемою проведено у 56 хворих на ІПСШ хронічного перебігу. Забір біологічного матеріалу із ССС проводили через 1 міс після припинення антибактеріальної терапії. В результаті лікування досягнуто елімінації трихомонад у 54 ([96,4 ± 2,5] %) осіб дослідної групи. Повної нормалізації рівня мікрофлори, асоційованої з БВ, досягнуто у 31 ([57,4 ± 6,6] %) хворих. Значне зменшення кількості цієї мікрофлори виявлено у решти 24 ([42,6 ± 6,6] %) пацієнтів.
Слід зазначити, що майже всі пацієнти (51 особа) відмічали помірно виражені побічні ефекти щодо травного каналу (нудота, тяжкість у правій підреберній ділянці, металевий присмак у роті), але в жодному випадку не виникало побічних ефектів, які потребували б негайного припинення лікування. Це свідчить про задовільну переносимість запропонованого методу лікування.
Отримані результати свідчать про високу ефективність запропонованого оригінального методу лікування поєднаних уражень ССС, викликаних трихомонадами різних видів та мікроорганізмами, що асоційованими з БВ. Важливу роль в цьому, на думку автора, відіграє заборона на сексуальні контакти в контрольний період (в тому числі, оральний та анальний) без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції.
Підсумовуючи отримані дані, можна дійти висновку, шо трихомонадні інвазії та інфекції ССС, асоційовані з БВ, і актуальні для сучасної дерматовенерології та суміжних медичних спеціальностей. Дослідження трихомонадних уражень ССС, поєднаних з асоційованими з БВ інфекціями, перспективний напрям, вивчення якого може зумовити значне підвищення рівня діагностичного обстеження хворих на ІПСШ та ефективності їх лікування. Розроблено та застосовано новий метод лікування поєднаних уражень ССС, викликаних трихомонадами різних видів та мікроорганізмами, асоційованими з БВ. Отримані результати свідчать про високу ефективність та задовільну переносимість запропонованого оригінального методу лікування.
У даному дослідженні показано, що:
– обстеження поєднаних уражень ССС, викликаних трихомонадами та мікроорганізмами, асоційованими з БВ перспективний напрям, вивчення якого може зумовити значне підвищення точності та вичерпаності діагностики хворих на ІПСШ та ефективності їх лікування;
– у 92 % обстежених з трихомонадною інвазією в ССС виявлено збільшення показників мікрофлори, асоційованої з БВ;
– запропоновано лікування поєднаних уражень ССС, викликаних трихомонадами різних видів та мікроорганізмами, асоційованими з БВ, у 56 хворих на ІПСШ хронічного перебігу. Як етіотропні засоби послідовно використовувались препарати секнідокс по 2 таблетки 1 раз на день протягом 5 днів та орципол по 1 таблетці 3 або 2 рази на день (залежно від маси тіла) протягом наступних 10 днів;
– у результаті у 97 % осіб дослідної групи досягнуто елімінації трихомонад. Повної нормалізації рівня мікрофлори, асоційованої з БВ, досягнуто у 58 % хворих. Значне зменшення кількості цієї мікрофлори виявлено у 43 % пацієнтів;
– запропонований оригінальний метод лікування досить ефективний, задовільно переноситься хворими і його можна рекомендувати для емпіричної терапії поєднаних уражень ССС, викликаних трихомонадами різних видів та мікроорганізмами, асоційованими з БВ.
5.4 Лікування хворих на хронічні протозойні інвазії сечостатевої системи з використанням імуномодулюючого препарату суміші α- і ß-дефенсинів
Як відомо з літературних джерел, інфекційні ураження ССС часто набувають хронічно-рецидивуючого перебігу або резистентності до лікування, що проводиться, на тлі імунодефіциту [129]. Імунодефіцит– це спадковий або набутий дефект імунної системи, що виражається різким зниженням кількості окремих імунокомпетентних клітин або порушенням синтезу імуноглобулінів. Імунодефіцит (МКХ-10, D80 – D89) можна також визначити як порушення структури і функції будь-якої ланки цілісної імунної системи, втрата організмом здатності чинити опір будь-яким інфекціям і відновлювати порушення своїх органів. Крім того, при імунодефіциті сповільнюється або взагалі зупиняється процес оновлення організму. Спираючись на сказане вище, можна дійти висновку про необхідність у розробці нового ефективного методу лікування хронічного трихомонозу на тлі імунологічних порушень.
Одними з найбільш перспективних сьогодні є терапевтичні методи, які передбачають призначення з метою імунокорекції препаратів, що містять α і ß-дефенсини. Препарат Пропес, розроблений Науково-виробничим підприємством «НІР» (Україна) на сучасному етапі є єдиним зареєстрованим в нашій державі препаратом з імуномодулюючою дією, що містить дефенсини. Його отримують з ембріональної тканини великої рогатої худоби в результаті специфічного протеолізу. Дефенсини – це пептиди, що володіють протиінфекційною та протипухлинною активністю: α-дефенсини характеризуються переважно антибактеріальними і противірусними властивостями; ß-дефенсини, крім того, активні ще і відносно патогенних грибків. Цей препарат стимулює функціональну активність мононуклеарних фагоцитів і клітин-природних кілерів, тобто активізує неспецифічні чинники захисту організму. Він пригнічує продукцію прозапальних цитокінів при алергічних захворюваннях. Препарат має виражені антитоксичні ефекти, покращує функції печінки, пригнічує розвиток пухлинних процесів, сприяє регресії пухлин шляхом їх резорбції. Він не має мутагенних, ембріотоксичних, тератогенних, пірогенних і гемолітичних властивостей. Однією з істотних переваг суміші α- і ß-дефенсинів є його нетоксичність, що забезпечує велику терапевтичну широту вживання цього засобу [23]. У медичній практиці препарат суміші α- і ß-дефенсинів рекомендований для лікування різних захворювань на тлі порушень імунологічної реактивності. Здатність відновлювати активну і адекватну роботу імунної системи, регулювання балансу між різними ланками антиінфекційного захисту, відкриває препарату можливості покращувати функціонування організму людини в умовах імунодефіциту. Встановлено, що під його впливом підвищується кількість Т-лімфоцитів, нормалізується співвідношення їх субпопуляцій і рівень сироваткового фактору некрозу пухлин-α, а рівень інтерлейкiна-4 досягає рівня здорових осіб [130].
З урахуванням наведеного вище, можна зробити висновок щодо існування нагальної необхідності у розробці нового ефективного методу лікування хронічного трихомонозу на тлі імунодефіциту, зокрема, з використанням препарату суміші α- і ß-дефенсинів в якості засобу імунокорекції. Встановлення видової приналежності трихомонад при цьому, може сприяти збільшенню ефективності проведення клініко-діагностичних та лікувально-профілактичних заходів. Тому основним завданням даного розділу було вивчення ефективності комплексного лікування хворих на ІПСШ при наявності імунодефіциту з використанням препарату суміші α- і ß-дефенсинів.
Серед 77 осіб, хворих на ІПСШ, обох статей (29 чоловіків та 48 жінок), які звернулися за спеціалізованою медичною допомогою з приводу запалення ССС на тлі імунодефіциту, було виділено певну дослідну групу. Остаточний склад дослідної групи, до якої увійшли 32 (41,6 %) пацієнти, було сформовано за результатами виявлення у кожного з її членів протозойної інвазії ССС. Отже, в дослідній групі було 22 (68,8 %) жінки та 10 чоловіків (31,2 %), віком від 20 до 48 років. Середній вік складав (32 ± 2,5) року. Усі хворі, які спостерігались, мали хронічний перебіг ураження ССС. Серед скарг пацієнтів переважали відчуття дискомфорту в сечостатевих органах й виділення з них.
Trichomonas tenax було виявлено у 12 пацієнтів дослідної групи (37,5 %), Pentatrichomonas hominis – у 18 (56,3 %), Trichomonas vaginalis – у 2 (6,2 %).
Для дослідження стану імунної системи, використовували визначення в сироватці крові абсолютної кількості лімфоцитів, рівні Т-лімфоцитів (CD3+), Т‑хелперів (CD4+), Т-цитотоксичних лімфоцитів (CD8+); імунорегуляторний індекс Т-хелпери/Т-супресори; рівні активних Т-лімфоцитів, В-лімфоцитів (CD22+), лімфоцитів-кіллерів (CD18+), 0-лімфоцитів; реакцію бласттрансформації лімфоцитів з ФГА, фагоцитарний індекс, фагоцитарний показник, НСТ-тест, а також рівні імуноглобулінів А, G, М.
Для детекції збудників трихомонадної інвазії використовувався метод ПЛР-РЧ, ампліфікатор ДТ-96, праймери для виявлення Trichomonas vaginalis (виробництво НПО ДНК-технология, РФ) та оригінальні авторські праймери для виявлення Trichomonas tenax та Pentatrichomonas hominis [91, 92, 93].
З метою імунокорекції вводився препарат Пропес, що містить суміш α- і ß-дефенсинів. У медичній практиці він рекомендований для лікування різних захворювань на тлі порушень імунологічної реактивності. З цією метою препарат уводять по 2 мл 1 раз на добу протягом 10 діб або 1 раз на 2 доби протягом 20 діб. Здатність відновлювати активну і адекватну роботу імунної системи, регулювання балансу між різними ланками антиінфекційного захисту, відкриває препарату можливості покращувати функціонування організму людини в умовах імунодефіциту. Встановлено, що під його впливом підвищується кількість Т-лімфоцитів, нормалізується співвідношення їх субпопуляцій і рівень сироваткового фактора некрозу пухлини – α, а рівень інтерлейкiна-4 досягає рівня здорових осіб [103]. Препарат стимулює функціональну активність мононуклеарних фагоцитів і клітин – природних кілерів, тобто активізує неспецифічні імунні реакції організму. Він пригнічує продукцію прозапальних цитокінів при алергічних захворюваннях. Препарат має виражені антитоксичні ефекти, покращує функції печінки, пригнічує розвиток пухлинних процесів, сприяє регресії пухлин шляхом їх резорбції. Він не має мутагенних, ембріотоксичних, тератогенних, пірогенних і гемолітичних властивостей. Однією з істотних переваг зазначеного засобу, як інших препаратів групи дефенсинів, є його нетоксичність, що забезпечує велику терапевтичну широту вживання цього засобу [23].
Препарат суміші α- і ß-дефенсинів з метою імунокорекції вводився досліджуваним пацієнтам, внутрішньом’язово по схемі лікування захворювань, що пов’язані з порушенням імунологічного статусу, а саме, по 2 мл через день впродовж 20 днів. Його введення розпочиналось одночасно з курсом специфічної терапії трихомонадних інвазій [94]. А саме, внутрішньо призначався орнідазол по 1,5 г на добу. Препарат приймався по 0,5 г тричі на добу після їди на протягом 10 діб. У перший день лікування добова доза орнідазолу вживалася за один прийом під час вечері. Наступні 10 днів (з 11 по 20 дні лікування) хворі отримували по 400 мг ніфуротелю тричі на добу, незалежно від прийому їди. У разі необхідності, через 5 днів після початку специфічної антипротозойної терапії, пацієнтам одночасно індивідуалізовано призначались додаткові АБП з метою елімінації з урогенітальної системи інших збудників ІПСШ, не чутливих до ніфуротелю та орнідазолу.
Крім того, чоловіки, у разі потреби, отримували пальцьовий масаж передміхурової залози та ректальні протизапальні свічки. Жінки отримували щоденні вагінальні спринцювання та піхвові таблетки з ніфуротелем та ністатином, а також свічки з хлоргексидином послідовно протягом 8 та 10 днів, відповідно. Під час лікування пацієнтам суворо заборонялося мати сексуальні контакти, а в контрольний період не дозволявся секс без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції.
Trichomonas tenax було виявлено у 12 з 32 пацієнтів дослідної групи (37,5 %), Pentatrichomonas hominis – у 18 (56,3 %), Trichomonas vaginalis – у 2 (6,2 %). Відносно загалу 77 обстежених пацієнтів, хворих на ІПСШ та, одночасно, на іммунодефіцит, Trichomonas tenax було виявлено (15,5 %), Pentatrichomonas hominis – у 22 %, Trichomonas vaginalis – у 4,1 %.
Як видно з таблиці 5.4, у досліджуваних пацієнтів були достовірно змінені наступні середньотатистичні показники імунограм – кількості: (абсолютна кількість) лімфоцитів, Т-цитотоксичних лімфоцитів (CD8+), 0-лімфоцитів, активних Т-лімфоцитів, а також імунорегуляторного індексу (Тх/Тс). Причому, показник абсолютної кількості лімфоцитів був підвищений, вочевидь, внаслідок загальних процесів адаптації в організмах цих хворих. Показник кількості 0-лімфоцити був збільшений, а активних Т-лімфоцитів, відповідно, знижений. Показник Т-цитотоксичних лімфоцитів (CD8+) також був знижений, за рахунок чого істотно підвищився середньостатистичний показник імунорегуляторного індексу (Тх/Тс). Показники гуморальної ланки імунітету, фагоцитарний індекс, фагоцитарний показник та НСТ-тест змінені не були.
Показники імунограм досліджуваних пацієнтів вдруге визначались через 2 – 3 місяці після закінчення їм курсу введень препарату суміші α- і ß-дефенсинів. Як видно з таблиці, після лікування зазначеним засобом середньостатистичні показники імунограм досліджуваних пацієнтів повністю відновились до нормальних значень. У 5 з 32 пацієнтів (15,6 %), які перебували під нашим спостереженням, відзначали виникнення ущільнень в ділянці сідниць під час терапії, що проводилась. Ще 6 (18,8 %) мали скарги на деяку болісність у місцях ін’єкцій препарату. Вираженість названих побічних ефектів не була значною і не потребувала відміни цього препарату або призначення додаткової медикаментозної терапії для їх нівелювання. Таким чином, можна зробити висновок, що препарат суміші α- і ß-дефенсинів переноситься пацієнтами добре або задовільно.
Результати ефективності терапії щодо елімінації патогенних мікроорганізмів із ССС визначалися через 1, 2 і 3 місяці після закінчення специфічної терапії [279].
Таблиця 5.4 – Показники імунограм досліджуваних пацієнтів до та після лікування (n = 32)
| Показник імунограми | Результат до лікування |
Результат після лікування | Норма |
| Абсолютна кількість лімфоцитів, х10 | *3,00 ± 0,45 | 2,3 ± 0,42 | 1,5 – 2,4 |
| Т-лімфоцити (CD3+), % | 45 ± 5,1 | 45 ± 5,3 | 40 – 67 |
| Т-хелпери (CD4+), % | 33 ± 4,4 | 33 ± 4,7 | 23 – 48 |
| Т-цитотоксичні лімфоцити (CD8+), % | *12 ± 1,7 | **18 ± 1,6 | 17 – 25 |
| Імунорегуляторний індекс Тх/Тс | *2,7 ± 0,81 | 2,0 ± 0,75 | 1,1 – 2,2 |
| Активні Т-лімфоцити, % | *13,1 ± 3,1 | **23 ± 2,2 | 22 – 39 |
| В-лімфоцити (CD22+), % | 30,2 ± 6,0 | 30 ± 6,1 | 15 – 35 |
| Лімфоцити-кілери (CD18+), % | 17,3 ± 3,6 | 17 ± 3,5 | 15 – 20 |
| 0-лімфоцити, % | *25,2 ± 4,3 | **18 ± 1,9 | 15 – 20 |
| Реакція бласттрансформації лімфоцитів з ФГА, % | 78,4 ± 10,1 | 78 ± 10 | 70 – 82 |
| IgG, г/л | 12,3 ± 1,9 | 13,2 ± 1,8 | 7,5 – 15,45 |
| IgА, г/л | 2,1 ± 0,2 | 2,1 ± 0,3 | 1,75 – 2,5 |
| IgМ, г/л | 0,9 ± 0,2 | 0,9 ± 0,2 | 0,65 – 1,65 |
| Фагоцитарний індекс, % | 64 ± 11,0 | 60 ± 11,0 | 40 – 80 |
| Фагоцитарний показник | 5,2 ± 0,7 | 5,8 ± 0,4 | 4 – 8 |
| НСТ-тест | 17,2 ± 3,2 | 17 ± 1,8 | 10 – 30 |
Примітка:
* – достовірність різниці показників відносно даних контрольної групи здорових осіб (p ≤ 0,05);
** – достовірність різниці показників після лікування відносно даних до лікування (p ≤ 0,05);
n – кількість обстежених
Повної елімінації збудників трихомонадної інвазії з хронічним перебігом із ССС пацієнтів контрольної групи вдалося досягти у 31 (96,9 %) з 32 досліджуваних осіб. Скарги на виділення й дискомфорт у них припинились. Наступила клінічна та етіологічна виліковність. Невдале лікування одного пацієнта (відсутність елімінації Pentatrichomonas hominis) – можна пояснювати можливістю його реінфекції за рахунок невиконання статевого утримування в контрольний період.
Отже, терапію було проведено з послідовним внутрішнім застосуванням двох антипротозойних препаратів, що містять, відповідно, речовини орнідазол та ніфуротель, по 10 діб кожний. Поєднання антипротозойних препаратів різних груп значно підвищує ефективність відповідного лікування за рахунок зменшення можливих явищ резистентності з боку збудника захворювання. Крім того, використання ніфуротеля надає додаткові переваги, насамперед, пов’язані з елімінацією супутньої мікрофлори (Enterococcus faecalis та ін.) [99]. Тривалість специфічного лікування хронічного трихомонадного запалення склала 20 діб, що відповідає строкам антибактеріальної терапії за умови ураження внутрішніх статевих органів [51]. Але в даному випадку підвищена тривалість лікування була зумовлена також і імунодефіцитом.
У переважної більшості пацієнтів (близько 70 %) дослідної групи виникали різні диспептичні явища, що є природним при ентеральному призначенні препаратів фармакологічної групи нітроімідазолів, але жодного разу не виникла необхідність припинення розпочатого лікування за запропонованою схемою або призначення додаткового лікування, спрямованого на усунення відповідних побічних ефектів. Це дає право вважати за задовільну переносність запропонованого методу ерадикації збудників протозойної інвазії із ССС людини.
Отже, запропонований оригінальний метод лікування є ефективним, має задовільну переносність та може бути рекомендованим для емпіричної терапії уражень ССС, викликаних протозойними інвазіями, викликаних Trichomonas vaginalis, Trichomonas tenax та Pentatrichomonas hominis. Використання запропонованого методу дало змогу проводити ефективне лікування хронічного трихомонозу ССС, у результаті якого клінічне та бактеріологічне одужання наступило в 97 % випадків. Препарат суміші α- і ß-дефенсинів є високоефективним імунокоригуючим препаратом, який нормалізує показники імунограм у відповідних пацієнтів, а його застосування є доцільним в комплексному лікуванні хронічних протозойних інвазій, викликаних різними видами трихомонад, на тлі імунодефіциту.
5.5 Клінічні випадки (приклади лікування хворих на протозойно-бактеріальні інфекції сечостатевої системи)
Приклад 1. Випадок лікування хронічного уретропростатиту при виявленні Chlamydia trachomatis та Trichomonas tenax
У 2019 році звернувся за амбулаторною спеціалізованою медичною допомогою хворий Т., 41 рік. При звертанні він мав скарги на скудні виділення з уретри слизисто1го характеру, періодичне відчуття дискомфорту в ділянці кореня статевого члену. Перші скарги – на помірні виділення з уретри з’явились у нього близько 6 років тому, через два тижні після вагінального та орального сексу з “випадковою” статевою партнеркою, при якому засоби бар’єрної контрацепції не було застосовано. Через кілька місяців приєднались скарги на відчуття дискомфорту в промежині. Одружений. Вагінальні статеві контакти з дружиною після того випадку мав виключно з використанням презервативів. Супутніх захворювань не мав.
За вказаний період пацієнт декілька разів звертався для обстеження і лікування до лікарів за фахом урологія та дерматовенерологія. При обстеженні за допомогою методу ПЛР, у нього багаторазово виявляли Chlamydia trachomatis, а також неспецифічні бактеріальні мікроорганізми. З приводу хламідіозу ССС він декілька разів отримував відповідне лікування. Його дружину було також просановано, незважаючи на той факт, що Chlamydia trachomatis у неї жодного разу не було виявлено. Оскільки одужання не наступало, пацієнт Т був змушений звернутися для подальшого обстеження і консультації.
На прохання хворого було проведене лабораторне дослідження, що складалось з визначення за допомогою методу ПЛР, в біологічному матеріалі – зішкребків з уретри та віджатого секрету передміхурової залози наступних збудників ІПСШ: Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum, Ureaplasma parvum, Gardnerella vaginalis, Chlamydia trachomatis, Trichomonas vaginalis, Neisseria gonorrhoeae, Candida spp., а також бактеріоскопічного та бактеріологічного дослідження. Крім того, в рамках науково-дослідної роботи, було проведене додаткове спеціальне обстеження за допомогою методу ПЛР-РЧ з використанням оригінальних праймерів для виявлення представників роду найпростіших, які за нашими попередніми даними, набули здатність колонізувати ССС людини, а саме, Trichomonas tenax, Pentatrichomonas hominis, а також Giardia lamblia. Методом ПЛР, як і очікувалось, було виявлено Chlamydia trachomatis. Інших із зазначених вище мікроорганізмів цим методом виявлено не було. Методом ПЛР-РЧ було виявлено наявність, вірогідно (оскільки праймери є експериментальними і на даний час ще не мають сертифікату відповідності), Trichomonas tenax. Бактеріологічне дослідження дозволило виявити присутність помірної кількості Staphylococcus epidermidis. При бактеріоскопічному дослідженні виявлено збільшену лейкоцитарну реакцію як у зішкребках з уретри, так і у секреті передміхурової залози.
Встановлено діагноз: хронічний хламідійно-трихомонадний уретропростатит в стадії загострення. Персистуючий хламідіоз ССС.
Було зроблено припущення, що причиною персистуючого хламідіозу ССС може бути явище ендоцитобіозу при попаданні Chlamydia trachomatis всередину Trichomonas tenax, при чому, їх життєздатність зберігалась (за аналогією ендоцитобіозу Chlamydia trachomatis всередині Trichomonas vaginalis). Зважаючи на це, план лікування, яке проводилось амбулаторно, передбачав першочергово провести ерадикацію збудника трихомонадної інвазії, і, потому, ерадикацію збудника хламідіозу ССС. Хворому була призначена наступна терапія: в якості засобів етіотропної терапії доцільно застосовувати препарати з протистоцидною активністю. Наприклад, послідовно призначати Секнідокс (Секнідазол ) по 2,0 г 1 раз на добу протягом 5 днів та Орципол – препарат, що містить 0,5 г Орнідазолу та 0,5 г Ципрофлоксацину по 1 таблетці 3 рази на день.
Отже, перший курс терапії було проведено з послідовним внутрішнім застосуванням двох антипротозойних препаратів. Поєднання антипротозойних препаратів різних груп значно підвищує ефективність відповідного лікування за рахунок зменшення можливих явищ резистентності з боку збудника захворювання. Крім того, використання ципрофлоксацину надає додаткові переваги, насамперед пов’язані з елімінацією супутньої мікрофлори. Тривалість специфічного лікування хронічного трихомонозу в даного пацієнта склала 15 діб, що відповідає строкам антибактеріальної терапії за умови ураження внутрішніх статевих органів.
Після проведення першого курсу лікування було двічі (через 10 та 30 діб) проведено контролі, що передбачали дослідження за допомогою метода ПЛР-РЧ присутність Trichomonas tenax у відповідному біологічному матеріалі. Обидва контролі не показали присутності зазначеного мікроорганізму у зразках.
Надалі було проведений другий курс лікування, який було спрямовано на ерадикацію збудника хламідіозу ССС. З цією метою послідовно по 10 діб кожний, призначались два АБП, що мають виразну дію на збудник. Спочатку пацієнт отримував джозаміцин по 0,5 г тричі на добу незалежно від прийому їди, далі геміфлоксацин по 320 мг 1 раз на добу в один і той же час незалежно від прийому їди. Крім того, пацієнт на протязі курсу лікування отримував флуконазол по 100 мг 1 раз на 2 доби, а також щовечора ректальні свічки, що містили 1000000 ОД рекомбінантного інтерферону (перші 10 діб) та комбіновані свічки з іхтіолом та екстрактом ромашки (наступні 10 діб). Тривалість специфічного лікування хронічного хламідіозу в даного пацієнта склала 20 діб, що відповідає строкам антибактеріальної терапії за умови ураження внутрішніх статевих органів. Під час лікування пацієнту було заборонено мати сексуальні контакти, а в контрольний період (на протязі місяця) не дозволявся секс без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції.
Клініко-лабораторне спостереження після проведення другого курсу лікування тривало протягом 3 місяців. Щомісяця проводилось визначення методом ПЛР Chlamydia trachomatis у відповідному біологічному матеріалі. Всі три контролі показали відсутність зазначеного мікроорганізму у дослідних зразках.
Після проведеного лікування наступило клінічне одужання. Скарги на виділення й дискомфорт припинилися. У хворого наступила клінічна та етіологічна виліковність.
Окремо слід додати, що під час бесіди з дружиною пацієнта Т було з’ясовано наявність у неї скарг на стан ясен. Лікарем-стоматологом було встановлено діагноз пародонтит (при якому в запалених ясневих карманах при відповідному дослідженні часто знаходять Trichomonas tenax), та призначене лікування. Пацієнт Т. та його дружина отримали рекомендації утримуватись від орального сексу, принаймні до повного виліковування явищ пародонтиту.
Таким чином, у пацієнтів, що мають хронічні резистентні до лікування, що проводиться, запалення ССС, наприклад персистуючий хламідіоз, причиною запалення можуть бути МА, що містять в своєму складі “нетипові” для ССС мікроорганізми, такі як Trichomonas tenax. На нашу думку, за рахунок явища ендоцитобіозу, може відбуватись збереження частини дрібніших за трихомонади збудників під час спроби їх елімінації. Що і може виступати, як ми вважаємо, одним із найважливіших факторів рецидивів запальних захворювань урогенітального тракту. Отже, визначення виду трихомонад у ССС, імовірно, має вирішальну роль у запобіганні рецидивів і реінфекцій цього захворювання завдяки обґрунтуванню додаткових підстав для санації статевого партнера, або самого хворого з урахуванням можливості існування поєднаної генітально-екстрагенітальної інвазії.
Приклад 2. Випадок лікування хронічного уретриту та баланопоститу при виявленні Pentatrichomonas hominis у хворого на цукровій діабет І типу
У шкірно-венерологічне відділення Олександрівськові клінічної лікарні м. Києва у 2019 році звернувся за амбулаторною спеціалізованою медичною допомогою хворий Г., 33 роки. При звертанні він мав скарги на болісні еритематозно-ерозивні висипи на голівці статевого члену та внутрішньому листку крайньої плоті, скудні виділення з уретри. Дані скарги з’явились близько 3 місяців тому, через тиждень після вагінального та анального сексу з новою статевою партнеркою, при якому засоби бар’єрної контрацепції не було застосовано. В анамнезі безладне статеве життя – переважали сексуальні контакти, що не захищені бар’єрними засобами контрацепції, в тому числі, оральні й анальні. Одружений. Статеві контакти з дружиною мав виключно з використанням презервативів. Супутнє захворювання – цукровий діабет І типу, отримував 32 ОД інсуліну на добу.
Через кілька днів після виникнення скарг хворий звернувся до лікаря-уролога в поліклініці за місцем проживання. Діагностовано неспецифічний баланопостит. Прийняв курс лікування з використанням амоксициліну по 1,0 г внутрішньо 2 рази на добу протягом 5 днів, який не дав істотних результатів. Тоді було призначено повторний курс лікування, що тривав наступні 5 діб і складався з внутрішньом’язових ін’єкцій цефтриаксону по 1,0 двічі на добу, внутрішнього прийому флуконазолу по 0,1 на добу та місцевого щоденного обмивання офіцинальним розчином хлоргексидину біглюконату. Рекомендовані були також дієта №5 та статеве утримання. Після проведення зазначеного курсу терапії, хворий відзначив поліпшення стану шкіри голівки статевого члену та внутрішнього листка крайньої плоті, а також значне зменшення виразності скарг. Дане поліпшення тривало два тижні. Після чого пацієнт змушений був звернутися для подальшого обстеження і консультації.
На прохання хворого було проведене лабораторне дослідження, що складалося з визначення за допомогою методу ПЛР у біологічному матеріалі, взятому з поверхні ерозій та зішкребків з уретри, наступних збудників ІПСШ: Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum, Ureaplasma parvum, Gardnerella vaginalis, Chlamydia trachomatis, Trichomonas vaginalis, Neisseria gonorrhoeae, Candida spp., а також бактеріологічного дослідження. Останнє дозволило виявити присутність помірної кількості Staphylococcus s epidermidis. Жодного з зазначених вище мікроорганізмів методом ПЛР виявлено не було. Після цього хворому було запропоновано додаткове обстеження за допомогою методу ПЛР-РЧ з використанням оригінальних праймерів для виявлення представників роду найпростіших, які за нашими попередніми даними, можуть колонізувати ССС людини, а саме, Trichomonas tenax, Pentatrichomonas hominis, а також Giardia lamblia.
При обстеженні біологічного матеріалу, взятого з сечостатевих органів за допомогою методу ПЛР-РЧ було виявлено наявність Pentatrichomonas hominis. Встановлено діагноз: хронічний трихомоноз, хронічний баланопостит в стадії загострення. Хворому була призначена наступна терапія: в якості засобів етіотропної терапії доцільно застосовувати препарати з протистоцидною активністю. Наприклад, послідовно призначати Секнідокс (Секнідазол ) по 2,0 г 1 раз на добу протягом 5 днів та Орципол – препарат, що містить 0,5 г Орнідазолу та 0,5 г Ципрофлоксацину по 1 таблетці 3 рази на день.
Отже, терапію було проведено з послідовним внутрішнім застосуванням двох антипротозойних препаратів, поєднання антипротозойних препаратів різних груп значно підвищує ефективність відповідного лікування за рахунок зменшення можливих явищ резистентності з боку збудника захворювання. Крім того, використання ципрофлоксацину надає додаткові переваги, насамперед пов’язані з елімінацією супутньої мікрофлори. Тривалість специфічного лікування хронічного трихомонозу в даного пацієнта склала 15 діб, що відповідає строкам антибактеріальної терапії за умови ураження внутрішніх статевих органів. Але в даному випадку тривалість лікування була свідомо збільшена з огляду на супутню патологію, а саме цукровий діабет І типу.
На другий день від початку лікування за наведеною схемою почався процес епітелізації ерозій на шкірі головки статевого члену та крайньої плоті, який тривав протягом 5 днів. Еритеми за цей час значно зблідли і повністю регресували до припинення терапії.
Після проведеного лікування наступило клінічне одужання. Скарги на висипи, а також на виділення й дискомфорт припинилися.
При дослідженні зішкребків з уретри та шкіри головки статевого члену за допомогою ПЛР-РЧ через 30 діб після закінчення відповідного лікування Pentatrichomonas hominis виявлено не було. У хворого наступила клінічна та етіологічна виліковність.
Враховуючи сказане вище, можна зробити висновок, що у пацієнтів, які практикують анальний секс, не захищений бар’єрними засобами контрацепції та мають істотні соматичні захворювання, наприклад, цукровий діабет І типу, хронічний баланопостит може бути викликаний не типовими для цього стану мікроорганізмами, насамперед, Pentatrichomonas hominis. Для лікування подібного баланопоститу доцільно застосовувати системно два антипротозойних препарати, що містять, відповідно, субстанції орнідазол та секнідазол, а також 1 % крем з метронідазолом в якості засобу місцевої терапії.
Приклад 3. Випадок лікування кольпоцервіциту та сальпінгоофориту при виявленні Pentatrichomonas hominis
У шкірно-венерологічне відділення Олександрівської клінічної лікарні м. Києва у 2019 році звернулася за амбулаторною спеціалізованою медичною допомогою хвора С., 37 років. При зверненні вона мала скарги на виділення з піхви, періодичні відчуття дискомфорту внизу живота та періодичні відчуття лоскотання у піхві. На момент звертання скарги тривали протягом близько 5 років. Розлучена. Статеві контакти на протязі останніх 5 років мала виключно з використанням презервативів. Супутніх захворювань на момент звертання встановлено не було. Пацієнтка також мала додаткові скарги на часті розлади кишківника, швидку втомлюваність та схильність до гострих респіраторних інфекцій. Періодично зверталася до гінеколога поліклініки за місцем проживання. При останньому звертанні в поліклініку їй за результатами клініко-лабораторного обстеження було встановлено діагноз неспецифічний кольпоцервіцит і призначене лікування, що включало послідовні ін’єкції цефтриаксону по 1,0 г двічі на добу протягом 5 діб та ципрофлоксацину по 0,5 г внутрішньо 2 рази на добу на протязі наступних 5 діб. Крім того, було призначено внутрішньо флуконазол по 0,1 на добу протягом 10 діб, а також щоденні спринцювання піхви ротоканом та піхвові таблетки з хлоргексидином. Рекомендовані були також дієта № 5 та статеве утримання. Після проведення зазначеного курсу терапії, хвора відзначила поліпшення свого стану, а також значне зменшення виразності скарг. Дане поліпшення було короткостроковим. Через певний час пацієнтка змушена була звернутися для подальших обстеження і консультації.
Було проведене лабораторне обстеження, що складалося з визначення за допомогою ПЛР у біологічному матеріалі, взятому з уретри, піхви та цервікального каналу, наступних збудників захворювань, що передаються переважно статевим шляхом: Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum, Ureaplasma parvum, Gardnerella vaginalis, Chlamydia trachomatis, Trichomonas vaginalis, Neisseria gonorrhoeae, Candida spp., а також бактеріологічного дослідження. Останнє дозволило виявити присутність Enterococcus faecalis у помірній кількості. В результаті методом ПЛР не було виявлено жодного з зазначених вище мікроорганізмів. При виконанні клініко-лабораторного дослідження у хворої також було виявлено ерозію шийки матки, явища вульвовагініту та ендоцервіциту. При ультразвуковому дослідженні виявлено сальпінгоофорит. Скринінговий тест на вірус імунодефіциту людини, при цьому, був негативний.
Після проведення вказаного клініко-лабораторного обстеження хворій було запропоновано зробити додаткове спеціальне обстеження за допомогою методу ПЛР-РЧ із використанням оригінальних праймерів для виявлення найпростіших, які за попередніми даними здатні колонізувати ССС людини, а саме, Trichomonas tenax, Pentatrichomonas hominis, а також Giardia lamblia.
При обстеженні біологічного матеріалу, взятого з сечостатевих органів за допомогою методу ПЛР-РЧ було виявлено наявність Pentatrichomonas hominis. Встановлено діагноз: хронічний бактеріально-трихомонадний вульвовагініт, ендоцервіцит, сальпінгоофорит. Мікробна ерозія шийки матки.
Хворій була призначена наступна терапія: послідовно Секнідокс (Секнідазол) по 2,0 г 1 раз на добу протягом 5 днів та Орципол – препарат, що містить 0,5 г орнідазолу та 0,5 г ципрофлоксацину, по 1 таблетці 2 рази на день.
Для місцевого лікування додатково щоденно використовувалися спринцювання з розчином цитеалу, а також послідовно вагінальні таблетки з хлоргексидином та ніфуротелем протягом 10 та 8 діб, відповідно. Під час лікування пацієнтці було заборонено мати сексуальні контакти, а в контрольний період (протягом місяця) не дозволявся секс без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції. Додатковою вимогою була тимчасова відмова від носіння трусиків моделі “стринги”, використання яких, на нашу думку, може сприяти підвищеному обміну мікрофлорою між піхвою і задньопрохідним отвором.
Тривалість специфічного лікування хронічного бактеріально-трихомонадного запалення в даної пацієнтки склала 15 діб, що відповідає строкам антибактеріальної терапії за умови ураження внутрішніх статевих органів. На п’ятий день від початку лікування за наведеною схемою почалась епітелізація ерозії шийки матки, яка тривала до припинення терапії. Після проведеного лікування скарги на виділення й дискомфорт припинилися. Наступило клінічне одужання. При дослідженні зішкребків з уретри, піхви та цервікального каналу за допомогою ПЛР-РЧ через 10 та 30 діб після закінчення відповідного лікування Pentatrichomonas hominis виявлено не було. Enterococcus faecalis у результатах контрольних бактеріальних засівів також не виявлялось. У хворої наступила клінічна та етіологічна виліковність.
Враховуючи сказане вище, можна зробити висновок, що у пацієнтів, які мають хронічні запалення ССС, інфекційний процес може бути викликаний МА, до складу яких можуть входити не типові для цього стану мікроорганізми, насамперед, Pentatrichomonas hominis. Для лікування подібних хронічних інфекцій (інвазій) ССС доцільно застосовувати два антипротозойних препарати, що містять, відповідно, субстанції орнідазол та секнідазол, по 10 діб кожний.
Приклад 4. Випадок лікування хронічного рецидивуючого трихомонадно-бактеріального кольпоцервіциту
За спеціалізованою дерматовенерологічною допомогою звернулася хвора Ш., 38 років, яка мала скарги на помірні пінисті виділення з піхви, періодичні відчуття дискомфорту внизу живота та відчуття лоскотання у піхві напередодні місячних, а також на наступний день після статевих актів. На момент звертання скарги тривали протягом близько 7 років. Розлучена. Має дитину 13 років. Статеві контакти протягом останніх 3 років мала виключно з використанням презервативів. Соматичних захворювань на момент звертання встановлено не було. При останньому зверненні до гінеколога поліклініки за місцем проживання (приблизно за півроку до теперішнього звернення) їй було встановлено діагноз хронічний трихомонадний кольпоцервіцит. Призначене лікування, що включало послідовні прийоми метронідазолу та тинідазолу. Крім того, було призначено внутрішньо флуконазол, а також щоденні спринцювання піхви ротоканом та піхвові пігулки з метронідазолом. Рекомендовані були також дієта №5 та статеве утримання. Після проведення зазначеного курсу терапії хвора відзначила поліпшення свого стану, а також значне зменшення вираженості скарг. Дане поліпшення тривало близько місяця. Через певний час вона змушена була звернутися для подальших обстеження і консультації. З анамнезу було відомо, що пацієнтка за час своєї хвороби отримала декілька курсів лікування з приводу сечостатевого трихомоніазу. Лікарських призначень попереднього періоду не зберігла.
Було проведене лабораторне обстеження, що складалося з визначення за допомогою ПЛР у біологічному матеріалі, взятому з уретри, піхви та цервікального каналу наступних збудників захворювань, що передаються переважно статевим шляхом: Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum, Ureaplasma parvum, Gardnerella vaginalis, Chlamydia trachomatis, Trichomonas vaginalis, Neisseria gonorrhoeae, Candida spp., а також мікроскопічне та бактеріологічне дослідження. Останнє дозволило виявити присутність Enterococcus faecаlis у помірній кількості. За допомогою методу ПЛР було виявлено Trichomonas vaginalis. При клініко-лабораторному дослідженні у хворої також було виявлено ерозію шийки матки, явища кольпіту та ендоцервіциту.
Встановлено діагноз: хронічний бактеріально-трихомонадний кольпоцервіцит. Мікробна ерозія шийки матки.
Лікування трихомонадних інвазій сечостатевої системи сьогодні є важливою та складною проблемою дерматовенерології, а також суміжних спеціальностей, оскільки захворювання є багатоосередковим, має низку істотних ускладнень, а також характеризується високою імовірністю розвитку резистентності до терапії, що проводиться. Останнє, імовірно, має особливе значення з огляду на використання для елімінації Trichomonas vaginalis із сечостатевої системи людини сьогодні лише двох фармакологічних груп лікарських засобів – нітроімідазолів та нітрофуранів. Розвиток резистентності до препаратів цих груп значно зменшує шанси відповідних пацієнтів на одужання. Таким чином, виникнення резистентності до засобів етіотропної терапії при трихомоніазі є актуальною проблемою сучасної дерматовенерології та суміжних медичних фахів.
Для подолання резистентності мікрофлори сечостатевої системи при хронічно-рецидивуючому перебігу ІПСШ, традиційно використовуються засоби різних груп медичних препаратів, зокрема, біологічні стимулятори, протеолітичні ферменти, пірогенні та імуномодулюючі препарати, а також засоби біорегуляційної (антигомотоксичної – за Рекевегом) терапії. Їх призначення відбувається найчастіше перед початком призначення етіотропних препаратів.
Для лікування пацієнтки, що спостерігалася, було використано двохетапний підхід. Перший етап передбачав подолання резистентності до етіотропних препаратів. На другому – проводилася протистоцидна терапія.
Для подолання резистентності до засобів специфічної терапії було обрано біорегуляційну терапію з використанням зареєстрованих в Україні препаратів виробництва кампанії TM Heel (Німеччина). Було використано ампульовані офіцинальні препарати Лімфоміозот Н, Ехінацея композитум С, Убіхінон композитум, Мукоза композитум, Метро-Аднекс-Ін¢єль. Зазначені препарати забезпечували тканинний дренаж та детоксикацію, посилювали загальну та місцеву (слизових оболонок) опірність, а також антизапальний і антинабряковий ефекти. Уведення препаратів здійснювалося за оригінальною схемою, підшкірно та внутрішньом¢язово у перерахованому порядку, по 1 ампулі на добу. Таким чином, цикл уведень становив 5 днів, а на курс (25 діб) було застосовано 5 циклів. Разом з тим, для уникнення введень одного й того ж препарату в одну й ту ж анатомічну зону щоразу, використовувалася наступна їх послідовність: ліве передпліччя, підшкірно; праве передпліччя, підшкірно; ліве стегно, підшкірно; праве стегно, підшкірно; ліва сідниця, внутрішньом¢язово; права сідниця, внутрішньом¢язово; далі, відповідно, повторення послідовності. Додатковими перевагами біорегуляційної терапії, що проводилася, була незначна болісність препаратів, а також практично відсутність у них здатності спричиняти побічні ефекти.
Етіотропне лікування трихомонадної інвазії сечостатевої системи було розпочато одразу після закінчення біорегуляційної терапії, що співпало із закінченням mеnsis. Застосовувалися послідовно секнідазол по 2,0 г 1 раз на добу – увечорі, протягом 5 днів, а також препарат, що містить 0,5 г орнідазолу та 0,5 г ципрофлоксацину по 1 пігулці 3 рази на день. Поєднання різних антипротозойних препаратів значно підвищує ефективність відповідного лікування за рахунок зменшення можливих явищ резистентності з боку збудника захворювання.
Пацієнтка отримувала щоденні вагінальні спринцювання та піхвові пігулки з ніфуротелем та ністатином, а також свічки з хлоргексидином послідовно протягом 8 та 7 днів, відповідно. Ніфуротель є похідним нітроімідазолу, що надає додаткові переваги місцевому лікуванню за рахунок вираженої протистоцидної дії цього препарату. Хлоргексидин має широкий спектр дії на піхвову мікрофлору, протистоцидну та антибактеріальну дії, в тому числі. Під час лікування пацієнтці суворо заборонялося мати сексуальні контакти, а в контрольний період не дозволявся секс без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції.
Значна тривалість протистоцидної терапії в даної пацієнтки склала 15 діб. Тривалість була зумовлена хронічно-рецидивуючим перебігом трихомоніазу. На шостий день від початку лікування за наведеною схемою почалась епітелізація ерозії шийки матки, яка тривала до припинення терапії.
Результати ефективності лікування щодо елімінації Trichomonas vaginalis із сечостатевої системи визначалися згідно чинних рекомендацій – через 7, 14 і 30 днів після закінчення відповідної терапії. Використовувалися методи оптичної мікроскопії мазків із фарбуванням за Романовським, а також, одночасно, ПЛР. У жодному з контрольних досліджень Trichomonas vaginalis виявлено не було. Скарги на виділення й дискомфорт у пацієнтки, що перебувала під спостереженням, припинилися. Настала клінічна та етіологічна виліковність.
Таким чином, у результаті використання комплексної терапії, яка складалася на першому етапі із заходів щодо подолання резистентності до засобів етіотропного лікування, а на другому – використанні специфічних препаратів, вдалося досягти клінічної та етіологічної виліковності хронічного трихомонадно-бактеріального запалення сечостатевої системи з рецидивуючим (протягом 7 років) перебігом у 38-річної жінки.
Враховуючи сказане вище, можна зробити висновок, що у пацієнтів, які мають хронічні трихомонадно-бактеріальні запалення сечостатевої системи з рецидивуючим перебігом, лікування доцільно проводити в два етапи, на першому з яких проводити заходи щодо подолання резистентності збудників запалення до специфічних препаратів, а на другому – безпосередньо етіотропну терапію. Для першого етапу, як показав позитивний досвід цього спостереження, можна використовувати біорегуляційну терапію, а саме: Лімфоміозот Н, Ехінацея композитум С, Убіхінон композитум, Мукоза композитум, Метро-Аднекс-Ін¢єль за наведеною оригінальною схемою. В якості протистоцидного та протистоцидно-антибактеріального, відповідно, засобів можна використовувати препарати секнідазол, а також препарат, що містить 0,5 г орнідазолу та 0,5 г ципрофлоксацину.
5.6 Суспільна і особиста профілактика протозойних інвазій сечостатевої системи
Щодня не менше тисячі осіб в Україні заражаються на трихомоноз. Результатами інфікування є як гострі, так і хронічні інвазії, а також тяжкі віддалені наслідки для репродуктивної системи [5]. Окрім цього присутність в організмі, Trіchomonas vagіnalіs, а також Trichomonas tenax, Pentatrichomonas hominis і Gіardia lamblia значно підвищує ризик зараження ВІЛ або його передачу. Є дані про взаємодію між ВІЛ-інфекцією на ранній стадії і іншими ІПСШ. Цією взаємодією пояснюються до 40 % випадків передачі ВІЛ [72]. Профілактика трихомонозу і боротьба з ним повинні бути невід’ємною частиною заходів щодо забезпечення здоров’я нації.
З урахуванням соціальних, демографічних і міграційних процесів збільшення частки населення, яке зазнає ризику захворювання трихомоноз, триватиме. Ця інвазія і її ускладнення мають значні соціально-економічні наслідки, входячи в десятку найбільш частих причин звернення за медичною допомогою, складаючи істотну статтю витрат, як національного бюджету, так і сімейних бюджетів. На лікування ускладнень йде чимала частка витрат на високоспеціалізовану медичну допомогу при безплідді, запальних захворюваннях малого таза і сексуальних розладах. Часто не враховуються соціальні наслідки конфліктів між статевими партнерами і насильство в сім’ї. Перераховані фактори прямо впливають на якість життя, репродуктивне здоров’я та здоров’я молодого покоління.
В даному розділі на підставі отриманих даних, клінічних, лабораторних, епідеміологічних та соціальних досліджень пропонується системна концепція і програма профілактичних та організаційних заходів з боротьби з сечостатевими інвазіями, що спричинені трихомонадами і лямбліями. Запропонована програма розроблена з урахуванням стратегічного бачення розвитку медицини в XXI столітті, що відображена в «Цілях тисячоліття» в царині розвитку і зміцнення сексуального та репродуктивного здоров’я, сформульованого ВООЗ та ООН. Це, так звана концепція чотирьох «П» – профілактика, персоніфікація, прогнозування та партнерство. При розробці профілактичних і організаційних заходів щодо боротьби з генітальними інвазіями враховані рекомендації Глобальної стратегії профілактики ІПСШ та боротьби з ними на 2015-2021 рр. [228].
У запропонованій стратегії розглядаються методи забезпечення безпечної сексуальної поведінки, індивідуальної профілактики за допомогою бар’єрної захисту, доступною спеціалізованої допомоги, а також моніторинг та оцінка програм боротьби з трихомонозом і генітальним лямбліозом. Пропонуються конкретні кроки з боку Міністерства охорони здоров’я та інших відомств щодо реалізації програми. Акцентований підхід з позицій соціальної політики держави, повинен бути заснований на отриманих наукових даних і економічної рентабельності. У стратегії наводяться аргументи на користь надання якісної допомоги хворим на трихомоноз і лямбліоз в рамках першого і другого рівнів медико-санітарної допомоги, а також спеціалізованих служб (третій і четвертий рівень).
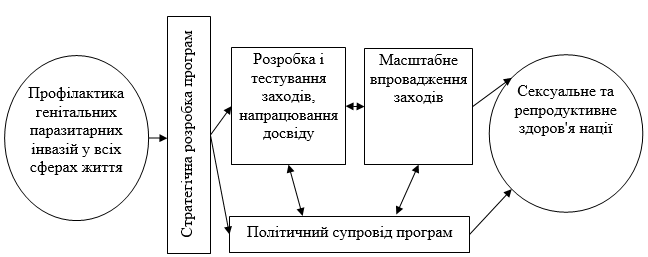 Рисунок 5.2 – Реалізація стратегічного підходу в профілактиці генітальних паразитарних інвазій Trіchomonas vagіnalіs, Trichomonas tenax, Pentatrichomonas hominis і Gіardia lamblia
Рисунок 5.2 – Реалізація стратегічного підходу в профілактиці генітальних паразитарних інвазій Trіchomonas vagіnalіs, Trichomonas tenax, Pentatrichomonas hominis і Gіardia lamblia
Наголошено на необхідності співпраці з іншими державними відомствами, громадськими організаціями та приватними структурами, які надають медичну допомогу. Пропонована програма містить рекомендації для керівників на високому рівні з метою мобілізації політичної волі для прискорення прийняття конкретних заходів.
Стратегічний підхід орієнтований на кінцеву мету – поліпшення доступу до медичної допомоги і підвищення її якості. Здійснення Стратегічного підходу передбачає три етапи: 1) стратегічну оцінку з метою виявлення потреб і пріоритетів; 2) тестування нововведень в обмежених масштабах (установа, населений пункт); 3) розширення масштабів (об’єднаний район, область, країна). На кожному етапі досягаються різноманітні результати, які посилюють програми і заходи політики і сприяють поліпшенню сексуального та репродуктивного здоров’я, як це показано на рис. 5.2. Цей поступовий процес покликаний забезпечити прийняття стратегічних рішень і подальше інвестування коштів в програми на основі доказових даних про ефективність в місцевих умовах і вкладу зацікавлених сторін.
Стратегічний підхід до профілактики ІПСШ забезпечує здатність лікувально-діагностичних і профілактичних заходів поліпшити якість медичної допомоги повинна оцінюватися в контексті системи охорони здоров’я в цілому, а не тільки по достоїнств самого заходу. Увага до динамічної взаємодії між елементами структури визначає прийняття рішень протягом усіх етапів здійснення Стратегічного підходу (рисунок 5.3).
Так само в структурі враховується потреба розробки політики та програм на основі фактичних даних. Відповідно, також визнається необхідність сприятливої законодавчої і регламентної бази, основи політики держави, наявність політичної волі щодо її виконання, а також конкретні рекомендації щодо зміцнення цих трьох областей. Вибір конкретних дій буде залежати від потреб і умов на місцях. В якості невід’ємної частини програм охорони здоров’я в галузі профілактики сечостатевих інвазій особливо виділяються моніторинг і оцінка як важливої оцінки стратегії. Структура дозволяє визначити точки впливу в цій області, надаючи ряд показників, що характеризують як стан системи охорони здоров’я (вкладення, процеси, результати), так і стан здоров’я населення (ефективність, вплив). Вони групуються за п’ятьма основними елементами сексуального та репродуктивного здоров’я [281].
 Рисунок 5.3 – Концепція профілактики генітальних паразитарних інвазій Trіchomonas vagіnalіs, а также Trichomonas tenax, Pentatrichomonas hominis і Gіardia lamblia
Рисунок 5.3 – Концепція профілактики генітальних паразитарних інвазій Trіchomonas vagіnalіs, а также Trichomonas tenax, Pentatrichomonas hominis і Gіardia lamblia
У попередніх розділах було показано, що в організмі людини можуть жити кілька десятків найпростіших мікроорганізмів. Так, наприклад, людина може бути носієм трьох видів трихомонад: Trichomonas tenax (elongata), Pentatrichomonas hominis (abdominalis), Trichomonas vaginalis. У ротовій порожнині у каріозних зубах та запалених ясневих карманах мешкає Trichomonas tenax. Pentatrichomonas hominis – коменсал товстого кишківника людини. Giardia lamblia є патологічним агентом травної системи людини, але, як відомо, в останні роки цей збудник достатньо часто виявляють у ССС людини. Було проведено декілька досліджень з використанням експериментальних оригінальних праймерів, які були розроблені спеціально для визначення Trichomonas tenax, Pentatrichomonas hominis та Giardia lamblia за допомогою найбільш сучасної модифікації методу ПЛР-РЧ [91, 92, 93]. Данні дослідження хворих на ІПСШ показали широку розповсюдженість протозойних інвазії ССС, що викликані Trichomonas tenax, Pentatrichomonas hominis та Giardia lamblia. Незважаючи на те, що питання паразитарних інвазій ССС, окрім тих, що спричинені Trichomonas vaginalis, для більшості лікарів є terra incognita, ми маємо великий досвід діагностики і лікування названих станів, з багатьма випадками рецидивів, виникає необхідність у розробці заходів щодо індивідуальної профілактики саме реінвазій.
На певному етапі досліджень постала нова наукова задача щодо вивчення можливості паразитарних реінвазій, викликаних не Trichomonas vaginalis, у пролікованих осіб, які мали відповідні ураженнями ССС, з метою їх профілактики. Тобто створити рекомендації для індивідуальної профілактики протозойних реінвазій ССС, викликаних не Trichomonas vaginalis.
Часто паразитарні інвазії ССС перебігають на тлі імунної недостатності, що ускладнює перебіг захворювання, погіршує його прогноз та викликає потребу у застосуванні імуномодулюючих засобів під час відповідного лікування. При фагоцитозі, що здійснюється будь-якими найпростішими, частка мікроорганізмів не руйнується повністю – вони зберігаються всередині одноклітинного мікроорганізму неушкодженими (незавершений фагоцитоз). Тому найпростіші, пряму патогенну дію яких на ССС людини ще не доведено, а перш за все, Trichomonas tenax та Pentatrichomonas hominis, мають розглядатись щонайменше в якості патогенетичних чинників ІПСШ. Саме через це, ерадикація Trichomonas tenax та Pentatrichomonas hominis з ССС людини, як і ерадикація Trichomonas vaginalis та Giardia lamblia, є необхідними.
Інфікування ССС людини на Trichomonas tenax відбувається перш за все при оральному сексі, оскільки цей найпростіший організм може жити в ротовій порожнині, особливо у хворих на парадонтит та парадонтоз, а також у дихальних шляхах [218]. Pentatrichomonas hominis та Giardia lamblia можуть жити в кишківнику людини, тому інфікування ССС людини на ці найпростіші організми можливе при анальному сексі [3, 11]. Хоча, не виключається і автоінокуляція, особливо у жінок, внаслідок анатомічного сусідства піхви та анального отвору [143].
Разом з тим, визначення виду найпростіших у ССС, імовірно, має вирішальну роль в запобіганні реінвазій, а також реінфекцій захворювання на ІПСШ (внаслідок неповного фагоцитозу патогенної та умовно-патогенної мікрофлори) завдяки додаткових підстав для лікування хворого з урахуванням можливих МА, поєднаної геніальної та екстрагенітальної інвазії, імунних порушень, а також обов’язкової санації статевих партнерів. У зв’язку з цим був запропонований комплекс рекомендацій для індивідуальної профілактики відповідних реінвазій. А саме:
- проведення адекватної ерадикації збудників протозойних інвазій ССС;
- санація власних екстрагенітальних осередків протозойних інвазій;
- санація генітальних та/або екстрагенітальних осередків протозойних інвазій у статевого партнера (партнерів);
- тривала відмова від сексуальних контактів (включно з оральними та анальними) без використання засобів бар’єрної контрацепції;
- нормалізація стану імунної системи.
* * *
Таким чином, проведено лікування 77 пацієнтів з ураженнями ССС на протозойні інвазії. В якості етіотропних препаратів послідовно використовували секнідазол по 2 таблетки один раз на день протягом 5 днів та комбінацію орнідазолу (0,5 г) та ципрофлоксацину (0,5 г) – по 1 таблетці три або два рази на день (залежно від ваги) протягом наступних 10 днів. Клінічне одужання досягнуто у 92,2 % випадків та бактеріологічну санацію – у 96,1 % випадків. Запропонований оригінальний метод лікування є ефективним, має задовільну переносимість та може бути рекомендованим для емпіричної терапії уражень ССС, викликаних протозойними інвазіями T. tenax, P. hominis та G. lamblia.
Отримані дані відносно чутливості клінічно найбільш значимих складових БВ до окремих АБП, що оформлені у вигляді графічної інформаційної панелі, дозволять практичним лікарям в короткий термін визначатися із засобами загальної індивідуалізованої специфічної терапії цього захворювання в кожному окремому клінічному випадку. Це, у свою чергу, сприятиме збільшенню ефективності етіологічного лікування відповідного захворювання.
У 92 % обстежених з трихомонадною інвазією в ССС виявлено збільшення показників мікрофлори, асоційованої з БВ. Запропоновано лікування поєднаних уражень ССС, викликаних трихомонадами різних видів та мікроорганізмами, асоційованими з БВ, у 56 хворих на ІПСШ хронічного перебігу. Як етіотропні засоби послідовно використовувались препарати секнідокс по 2 таблетки 1 раз на день протягом 5 днів та орципол по 1 таблетці 3 або 2 рази на день (залежно від маси тіла) протягом наступних 10 днів. У результаті у 97 % осіб дослідної групи досягнуто елімінації трихомонад. Повної нормалізації рівня мікрофлори, асоційованої з БВ, досягнуто у 58 % хворих. Значне зменшення кількості цієї мікрофлори виявлено у 43 % пацієнтів. Запропонований оригінальний метод лікування досить ефективний, задовільно переноситься хворими і його можна рекомендувати для емпіричної терапії поєднаних уражень ССС, викликаних трихомонадами різних видів та мікроорганізмами, асоційованими з БВ.
Препарат суміші α- і ß-дефенсинів є високоефективним імунокоригуючим препаратом, який нормалізує показники імунограм у відповідних пацієнтів, а його застосування є доцільним в комплексному лікуванні хронічних протозойних інвазій, викликаних різними видами трихомонад, на тлі імунодефіциту.
Розроблено, науково обґрунтовано та впроваджено в практичну охорону здоров’я нові методи комбінованого лікування хворих на протозойні інвазії ССС, спричинені як Trichomonas vaginalis, так і іншими збудниками протозойних інвазій, а саме, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia), в тому числі при поєднаних ураженнях з мікрофлорою, що є асоційованою з БВ (анаеробною та мікроаерофільною), а також на тлі порушень з боку імунної системи.
Запропоновано концепцію і програму профілактичних та організаційних заходів з боротьби з сечостатевими інвазіями, що спричинені трихомонадами і лямбліями. Створено рекомендації для індивідуальної профілактики протозойних реінвазій ССС, викликаних не Trichomonas vaginalis. А саме: проведення адекватної ерадикації збудників протозойних інвазій ССС; санація власних екстрагенітальних осередків протозойних інвазій; санація генітальних та/або екстрагенітальних осередків протозойних інвазій у статевого партнера (партнерів); тривала відмова від сексуальних контактів (включно з оральними та анальними) без використання засобів бар’єрної контрацепції; нормалізація стану імунної системи.
Матеріали даного розділу опубліковані в таких роботах:
- Protozoan genital invasions caused by the representatives of Trichomonas and Giardia / V. Fedorych, G.I. Mavrov, T.V. Osinska, Y.V. Shcherbakova. Wiadomości Lekarskie. 2020. Vol. 73, Iss. 2. P. 380–383 [255].
- FedorychDiagnostics and treatment of genital invasion caused by Trichomonas vaginalis and possibly other related species (Pentatrichomonas hominis and Trichomonas tenax) in patients with immunodeficiency. Georgian Medical News. 2020. No 12 (309). P. 81–85 [198].
- Клинический случай инвазии Trichomonas vaginalis беременной женщины и ее новорожденной / Г.И. Мавров, Т.В. Осинская, П.В. Федорич, Л.В. Гречанская. Georgian Medical News. 2019. № 12 (297). С. 41–46 [48].
- Fedorych P. Diagnostics and treatment of genital invasion caused by Trichomonas vaginalis and possibly other related species (Pentatrichomonas hominis and Trichomonas tenax) in patients with immunodeficiency. Georgian Medical News. 2020. No 12 (309). P. 81–85 [198].
- Fedorych P.V., Mavrov G.I. The role of protozoal infestations in chronic inflammation exacerbations in patients with genitourinary pathology. EURYKA: Health Science. No. 5. P. 28–33 [201].
- Подольський Вл.В., Подольский В.В., Федорич П.В. Оптимізація лікування хронічних запальних захворювань статевих органів у жінок фертильного віку з урахуванням міжнародного досвіду: метод. рек. (№ 94/2017). К., 2018. 12 с. [100].
- Пат. на корисну модель. 103397 Україна, МПК А61К 31/345 (2006.01),А61К 31/7080 (2006.01),А61/Р 17/04 (2006.01). Спосіб лікування хронічного трихомоніазу / Федорич П.В. – заявник та патентовласник. – u201506813; заявл. 09.07.2015; опубл. 10.12.15, Бюл. №23 [95].
- Пат. на корисну модель 109257 Україна, МПК А61К (2016.01),А61Р (2016.01). Спосіб лікування хронічного трихомоніазу сечостатевої системи, викликаного Trichomonas tenax або Pentatrichomonas hominis / Федорич П.В. – заявник та патентовласник. – u20151294; заявл. 21.12.2015; опубл. 25.08.16, Бюл. №16 [94].
- Визначення поширеності інфікування Giardia lamblia сечостатевої системи хворих з інфекціями, що передаються переважно статевим шляхом / П.В. Федорич, С.Б. Зелений, Л.Я. Федорич, Х.І. Шеховцова. Український журнал дерматології, венерології, косметології. 2015. № 2 (57). С. 67–70 [25].
- Федорич П.В. Випадок хронічного баланопоститу при виявленні Pentatrichomonas hominis. Український журнал дерматології, венерології, косметології. 2018. № 4 (70). С. 136–138 [132].
- Федорич П.В., Мавров Г.І., Осінська Т.В. Лікування протозойних інвазій сечостатевої системи викликаних Pentatrichomonas hominis, Trichomonas tenax та Giardia lamblia. Проблеми військової охорони здоров¢я: Збірник наукових праць Української військово-медичної академії 2019. № 52. С. 290–298 [156].
- Федорич П.В. Виявлення Pentatrichomonas hominis при кольпоцервіциті та сальпінгоофориті. Дерматологія та венерологія. 2018. № 3 (81). С. 77–79 [133].
- Федорич П.В., Мавров Г.І. Лікування генітальних інвазій, спричинених Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia. Дерматовенерологія. Косметологія. Сексопатологія. 2019. № 1–2. С. 5–10 [131].
- Федорич П.В. Індивідуальна профілактика протозойних реінвазій сечостатевої системи, викликаних не Trichomonas Vaginalis. Військова медицина України. 2019. Т. 19 (2). С. 66–68 [136].
- Федорич П.В. Протозойні інвазії сечостатевої системи у поєднанні зі збудниками бактеріального вагінозу у жінок фертильного віку та їхніх статевих партнерів. Здоровье женщины. 2018. № 7 (133). С. 11–16 [143].
- Федорич П.В. Діагностика та лікування поєднаних уражень сечостатевої системи трихомонадами різних видів і мікроорганізмами, асоційованими з бактеріальним вагінозом. Лікарська справа. 2018. № 5–6. С. 100–111 [135].
- Федорич П.В., Мавров Г.І. Випадок хронічного уретропростатиту при виявленні Chlamydia trachomatis та Trichomonas tenax. Здоров’я чоловіка. 2018. № 3 (66). С. 107–108 [151].
6 АЛГОРИТМИ НАДАННЯ МЕДИЧНОЇ ДОПОМОГИ ХВОРИМ НА ІНФЕКЦІЇ, ЩО ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ,
З УРАХУВАННЯМ ВИЯВЛЕННЯ РІЗНИХ ВИДІВ ТРИХОМОНАД ТА ЛЯМБЛІЙ
На підставі виконаних досліджень виникає необхідність у формалізації комплексу лікувально-профілактичних і організаційних заходів, а також епідеміологічного нагляду над статевою інвазією. Для покращення ранньої діагностики інвазії Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis і Gіardia lamblia було здійснено моніторинг та інформаційно-роз’яснювальну роботу в групах ризику. До основних компонентів епіднагляду за ІПСШ з урахуванням інвазії представників роду Trichomonas, а також Gіardia lamblia належать:
– реєстрація хворих із зазначенням віку, статі, провідного синдрому і етіологічних даних;
– оцінка поширеності трихомонозу і лямбліозу (клінічно виражених і безсимптомних форм) як у загальній популяції, так і серед окремих груп населення;
– моніторинг резистентності до протистоцидних препаратів;
– оцінка якості різних рівнів надання медичної допомоги;
– контроль віддалених результатів терапії за частотою репродуктивних і сексуальних порушень.
Епіднагляд включає в себе детермінанти епідеміології трихомонозу, зверненнями за медичною допомогою з урахуванням неповної реєстрації. Епіднагляд також виявляє групи населення, для яких потрібні цільові заходи, а саме, спеціальні дослідження з питань профілактики рецидивів і первинного зараження на трихомоноз і лямбліоз. Однак, ефективність діючих систем епіднагляду обмежується через недооцінку поширеності атипових форм трихомонозу і його безсимптомного перебігу. Тому необхідна розробка алгоритму виявлення хворих, що мають ризик розвитку посттрихомонозних станів. Для оцінки поширеності інвазії, її ускладнень і наслідків необхідний регулярний збір достовірних даних. Це вплине на ставлення до проблеми фахівців, що надають спеціалізовану медичну допомогу, і залучить додаткові ресурси для вирішення питання профілактики паразитарної патології та асоційованих ІПСШ.
Надзвичайно важливим питанням, що впливає на перебіг латентних і рецидивуючих паразитарних інвазій, є вивчення стійкості збудників до дії лікарських засобів. Органи епіднагляду повинні відстежувати і документувати випадки появи стійких штамів трихомонад і лямблій, регулярно оновлювати клінічні протоколи, своєчасно оповіщати практикуючих лікарів про внесені зміни. Рівні лікарської стійкості в різних регіонах України, як правило, відрізняються, що необхідно враховувати при формуванні терапевтичних алгоритмів.
Моніторинг протозойних інвазій ССС.
Моніторинг трихомонадної інвазії – це динамічне спостереження за коливаннями досліджуваних параметрів в популяційної групі або на окремій території. Отримана інформація необхідна для вибору пріоритетних напрямків діяльності і правильного розподілу ресурсів.
Аналізу рекомендується піддавати такі параметри:
– загальна кількість обстежених пацієнтів;
– кількість виявлених хворих з активними і неактивними формами паразитарних інвазій;
– загальна кількість пролікованих пацієнтів;
– кількість рецидивів захворювання протягом року;
– якість послуг, що надаються (обсяг лікувальних заходів згідно національних протоколів);
– укомплектованість кадрами;
– навантаження на одного лікаря;
– задоволення пацієнтів;
– оцінка успішності лікування і економічної ефективності;
– віддалений епідеміологічний аналіз (до 10 років).
Експертна оцінка ефективності лікування протозойних інвазій ССС.
Для підвищення якості послуг, що надаються пацієнтам, рекомендували впровадження систем професійної атестації та підвищення кваліфікації медиків. Велике значення, в плані підвищення якості лікування ІПСШ, також мало регулярне інспектування медичних установ, в тому числі і приватного сектора. Метою інспектування повинна бути об’єктивна експертна оцінка роботи тієї чи іншої установи, при якій у медичних працівників підвищувалася мотивація до вдосконалення роботи і поліпшення якості лікування, обліку та профілактики паразитарних інвазій та інших ІПСШ. Експертна оцінка сприяє підвищенню кваліфікації медпрацівників шляхом розбору складних випадків трихомонозу і проведення навчальних занять на робочому місці з обміном інформації при безпосередньому спілкуванні з колегами або через інтернет (телемедицина).
Для ефективного епідеміологічного нагляду за протозойними інвазіями ССС вимагає об’єднаних зусиль як державних, так і приватних профільних структур, робота яких в подальшому будується на основі довгострокового, взаємовигідного співробітництва. Рекомендовано створювати стратегічні об’єднання і коаліції за участю багатосторонніх медичних структур, засобів масової інформації, громадських організацій.
Профілактичну діяльність проводили з урахуванням конкретної групи населення, чинників уразливості і індивідуальних потреб. Велике профілактичне значення мали лекції на медичні теми в навчальних закладах, міжособистісні форуми. Спеціальну інформацію намагалися робити доступною і зрозумілою для конкретної аудиторії з урахуванням культурних, національних і гендерних особливостей регіону.
Важливим профілактичним аспектом при паразитарних ІПСШ було динамічне консультування пацієнтів з рецидивуючими формами трихоманозу. Це сприяло правильній поведінці хворих в період загострення ГВИ і зниження ризиків репродуктивних і статевих ускладнень.
Консультативно-профілактичний алгоритм включав:
- розширення знань пацієнта про правила проведення первинних лікувально-гігієнічних заходів в період загострення трихомонадної інвазії;
- ознайомлення з можливими клінічними варіантами ІПСШ, в тому числі з атиповими формами;
- подолання остракізму, властивого по відношенню до хворих ІПСШ і є потужною перешкодою профілактиці статевих й репродуктивних розладів;
- побудова взаємно-довірчих відносин з хворими (обґрунтованість своєчасного звернення до лікаря);
- орієнтування пацієнта на повноцінний здоровий спосіб життя (модифікація способу життя, нормалізація режимів сну, неспання, заняття спортом, усунення шкідливих звичок і провокуючих чинників).
Правильно організовані профілактичні заходи сприяли розширенню знань серед населення, стимулювання діалогу в суспільстві, зменшення упередженості до проблем ІПСШ.
Велике значення мало обстеження населення на наявність маркерів інфекції, спричиненої Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis), а також Gіardia lamblia, і ознак інших ІПСШ. При цьому, чітко дотримувалися уніфікованого алгоритму з наступним проведенням відповідних заходів (рис. 6.1, 6.2).
При проведенні профілактичних заходів широко охоплювали різні групи населення, особливо уразливі, та декретні контингенти, чітко розмежовували групи пацієнтів і контактних з ними осіб. Залучали статеві і побутові контакти шляхом коректного запрошення і надання можливостей консультування і лабораторного обстеження. При наявності показань до лікування дотримувалися національних та міжнародних протоколів і застосовували оригінальні власно розроблені методи лікування. Роз’яснювали мотивацію до подальшого лікування і диспансерного спостереження, оскільки скринінг і обстеження на паразитарну патологію, а також профілактична (превентивна) терапія нітроімідазолами та антибіотиками є важливими елементами як індивідуальної профілактики рецидивів, так і суспільної профілактики ІПСШ в популяції.
Згідно результатів наших досліджень консультування має проводитися в певній послідовності (таблиця 6.1).
Таблиця 6.1– Особливості консультування щодо ІПСШ
| Заходи | Послідовність |
| 1 | 2 |
| Оцінка загального стану пацієнта | Суб’єктивно оцінити наявність у пацієнта скарг, ознак та симптомів, характерних для протозойних інвазій ССС |
| Мотивування пацієнта на проходження процедури тестування на Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Gіardia lamblia за допомогою ПЛР | Повідомити, коли та де пацієнт зможе отримати результат цього тесту. З’ясувати, чи буде у нього можливість зайти за результатом у цей час. Якщо ні, то пояснити, що він зможе отримати результат тестування та пройти післятестове консультування пізніше.
Пояснити що: – після отримання результату він зможе обговорити з консультантом питання, що у нього виникнуть; – при потребі обговорення окремих питань він може прийти на додаткову консультацію |
| Обговорення переваг обізнаності щодо наявності Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Gіardia lamblia;
проведення разом з пацієнтом аналізу можливих «за» і «проти» різних підходів до лікування |
Пояснити, що пацієнт зробив важливий крок, прийшовши на цю консультацію, тому що знання, які він отримає, зможуть допомогти йому вилікуватись; обговорити переваги знання щодо стану його сексуального та репродуктивного здоров’я при наявності ІПСШ та з якими труднощами може бути пов’язане відсутність обстеження на Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Gіardia lamblia |
Продовження таблиці 6.1
| 1 | 2 |
| Інформація про групи взаємодопомоги | Проінформувати пацієнта про групи взаємодопомоги, які об’єднують людей з проблемами, подібними до його проблем, при можливості, надати контактну інформацію |
| Обговорення екстреної профілактики у випадку сексуального насильства | Пояснити, що сексуальне насильство пов’язане з підвищеним ризиком інфікування Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Gіardia lamblia; розповісти про можливості екстреної профілактики ІПСШ та ВІЛ у разі насильства |
| Проведення разом з пацієнтом оцінки індивідуальних ризиків інфікування Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Gіardia lamblia у випадку орогенітальних та ректальних контактів; обговорення можливості зменшення ризиків | Доцільно з’ясувати:
– досвід користування засобами запобігання інфікування ІПСШ; – про ситуації, коли не використовується презерватив, та причину цього; – разом з пацієнтом обговорити шляхи щодо зменшення ризиків інфікування; |
| З’ясування хибних уявлень у пацієнта щодо безпечних/ небезпечних сексуальних практик | Потрібно встановити:
– яким чином він визначає осіб, з якими статеві контакти є більш ризикованими щодо інфікування Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Gіardia lamblia; |
Продовження таблиці 6.1
| 1 | 2 |
| – чи є якісь групи осіб, з якими він не пов’язує ризик інфікування Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Gіardia lamblia, якщо так, то чому;
– яким чином такі міркування впливають на його вибір поведінки |
|
| Післятестове консультування при негативному або невизначеному (сумнівному) результаті | Провести консультування з урахуванням вимог щодо відповідних заходів, які наведені в рис. 6.1 |
| Післятестове консультування у випадку позитивного результату;
планування майбутнього з деталізацією щодо зміни поведінки на менш ризиковану з метою попередження рецидивів та реінфекцій |
З’ясувати стан та можливість пацієнта сприйняти інформацію, при необхідності призначити повторну зустріч.
Подальше консультування провести відповідно до заходів, що наведені в рис. 6.1 З’ясувати, чи вплинуть позитивні результати тесту на змінення сексуальної поведінки. Якщо так, то слід визначити яких результатів він очікує від подібних змін. |
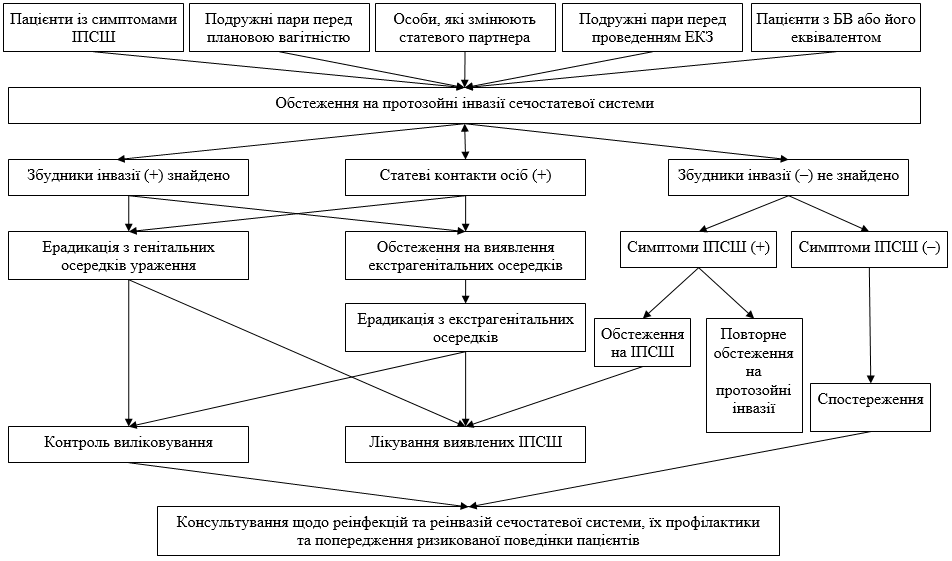 Рисунок 6.1 – Алгоритм (блок-схема) ведення пацієнтів при обстеженні їх на наявність статевої протозойної інвазії (Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, а також Gіardia lamblia)
Рисунок 6.1 – Алгоритм (блок-схема) ведення пацієнтів при обстеженні їх на наявність статевої протозойної інвазії (Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, а також Gіardia lamblia)
 Рисунок 6.2 – Алгоритм (блок-схема) маршруту пацієнтів лікувально-профілактичних закладів (ЛПЗ) гінекологічного та урологічного профілю при наданні спеціалізованої допомоги з приводу статевої протозойної інвазії (Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, а також Gіardia lamblia)
Рисунок 6.2 – Алгоритм (блок-схема) маршруту пацієнтів лікувально-профілактичних закладів (ЛПЗ) гінекологічного та урологічного профілю при наданні спеціалізованої допомоги з приводу статевої протозойної інвазії (Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, а також Gіardia lamblia)
* * *
На підставі виконаних досліджень виникає необхідність у формалізації комплексу лікувально-профілактичних і організаційних заходів, а також епідеміологічного нагляду над статевою інвазією. Для покращення ранньої діагностики інвазії Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis і Gіardia lamblia було здійснено моніторинг та інформаційно-роз’яснювальну роботу в групах ризику. Для закладів охорони здоров¢я України рекомендований алгоритм (блок-схема) ведення пацієнтів при обстеженні їх на наявність статевої протозойної інвазії (Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, а також Gіardia lamblia), а також алгоритм (блок-схема) маршруту пацієнтів ЛПЗ гінекологічного та урологічного профілю при наданні спеціалізованої допомоги з приводу статевої протозойної інвазії (Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, а також Gіardia lamblia).
Матеріали даного розділу опубліковані в таких роботах:
- Подольський Вл.В., Подольский В.В., Федорич П.В. Оптимізація лікування хронічних запальних захворювань статевих органів у жінок фертильного віку з урахуванням міжнародного досвіду: метод. рек. (№ 94/2017). К., 2018. 12 с. [100].
- Федорич П.В., Мавров Г.І. Лікування генітальних інвазій, спричинених Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia. Дерматовенерологія. Косметологія. Сексопатологія. 2019. № 1–2. С. 5–10 [131].
- Федорич П.В. Індивідуальна профілактика протозойних реінвазій сечостатевої системи, викликаних не Trichomonas Vaginalis. Військова медицина України. 2019. Т. 19 (2). С. 66–68 [136].
- Федорич П.В. Особливості інфекцій, що передаються статевим шляхом, в Україні. Український медичний вісник. 2013. № 7–8 (82). С. 62–63 [141].
7 АНАЛІЗ ТА ОБГОВОРЕННЯ ОТРИМАНИХ РЕЗУЛЬТАТІВ ДОСЛІДЖЕНЬ
Захворювання на трихомоноз (МКХ-10, А59), не дивлячись на інтенсивне вивчення, становить сьогодні чималу клінічну проблему в практиці лікарів дерматовенерологів, урологів і гінекологів. Трихомонадна інвазія має негативний вплив на фертильність та якість життя пацієнтів [17]. За даними ВООЗ, в останнє десятиріччя світовий показник захворюваності на сечостатевий трихомоніаз (МКХ-10, А59) становить близько 270 млн. осіб на рік [117]. Відсутність повної реєстрації в Україні не дозволяє достовірно оцінити поширеність захворюваності в різних регіонах і в різних популяціях. Однак, статистичні дані свідчать про те, що УТ залишається однією з найпоширеніших сечостатевих інфекцій в Україні [101].
Поширеність УТ серед жінок в Україні коливається в межах 5 – 30 % [101]. Серед чоловіків близько 10 % усіх інфекційних захворювань сечостатевої сфери припадає на УТ. Відсутність повної реєстрації в Україні не дозволяє достовірно оцінити поширеність захворюваності в різних регіонах і в різних популяціях [64]. Однак, актуальні статистичні дані свідчать про те, що УТ залишається однією з найпоширеніших сечостатевих інфекцій в Україні [20, 62].
Незважаючи на інтенсивне вивчення даної урогенітальної інвазії, у нас в країні, нажаль, немає достатніх відомостей і узагальнюючих даних про закономірності її поширення [2]. Багато дослідників стверджують, що захворюваність на УТ чоловіків і жінок в Україні є приблизно однаковою і становить близько 4 % серед дорослого населення [17, 27, 73, 78]. Серед осіб, що відвідують установи дерматовенерологічного профілю з приводу ІПСШ, Trichomonas vaginalis виявляються у 10 % випадків і більше [117]. Збільшення вірулентності збудника захворювання, а також певні труднощі в його діагностиці та розвиток резистентності до засобів специфічного лікування, часто призводить до хронізації запального процесу як зовнішніх, так і внутрішніх статевих органів, що погіршує прогноз, скорочує період стійкої ремісії [46].
Структура захворюваності на ІПСШ, включаючи й трихомоноз, постійно змінюється. Інформація щодо таких змін допомагає правильно планувати клініко-діагностичні заходи в закладах надання спеціалізованої медичної допомоги відповідним хворим. Зважаючи на це, постало наукове завдання з визначення поширеності трихомонозу в сучасних умовах, а також визначення частоти МА за участі Trichomonas vaginalis з іншими збудниками ІПСШ.
За допомогою методу ПЛР було проведено обстеження на Chlamydia trachomatis, Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum, Trichomonas vaginalis, Human papillomavirus та Neisseria gonorrhoeae біологічного матеріалу, отриманого в 2017 р. із сечостатевих органів у групи пацієнтів, хворих на ІПСШ, які проходили клініко-лабораторне обстеження на базі Олександрівської клінічної лікарні м. Києва. Обстежувалося 607 пацієнтів обох статей, у тому числі 295 (48,6 %) жінок та 312 чоловіків (51,4 %). Середній вік обстежених пацієнтів становив (32,0 ± 3,5) року.
Як видно, серед найбільш актуальних збудників ІПСШ на сучасному етапі в Україні традиційно продовжують лишатися Ureaplasma urealyticum – 48,77 %, Chlamydia trachomatis – 26,2 % та Mycoplasma hominis – 21,1 %. Однак, не може не викликати занепокоєння той факт, що найбільші цифри виявлення мав Human papillomavirus – 53,2 %. Такий високий показник, на думку автора, є результатом декількох факторів, а саме: проведення дослідження в цільовій групі пацієнтів, низького рівня щеплень від папіломавірусної інфекції, а також низької обізнаності загалу населення в країні з ризиками медичних наслідків від цієї інфекції.
Neisseria gonorrhoeae сьогодні продовжує бути одним з актуальних збудників ІПСШ – виявлено у 33 з 297 обстежених (8,45 %) пацієнтів. Mycoplasma genitalium у наш час виявляється не дуже часто, у 6,62 % з обстежених пацієнтів. Звертає на себе увагу значне зменшення виявлення Trichomonas vaginalis. Цей мікроорганізм було діагностовано лише у 5,23 % обстежених пацієнтів.
Для оцінки загальної поширеності трихомонозу були вперше поєднані дані щорічних статистичних звітів МОЗ України та результати локальних епідемічних спостережень з 2011 до 2018 рр. Встановлено, що захворюваність на трихомоноз в Україні становить близько 100 випадків на 100 000 населення за 2018 рік. Встановлено також тенденцію до зниження рівня виявленості трихомонозу, але темпи його сильно варіюють, залежно від місця проживання і вікового та гендерного складу популяції. У ряді регіонів і серед окремих вікових груп, зокрема молоді 15-19 років, захворюваність знижується досить повільно.
Важливим є припущення відносно того, що статистичні дані щодо трихомонадної інфекції сьогодні не відображають її фактичної поширеності внаслідок неповноцінної її реєстрації.
При трихомонозі виявлено значні гендерні та вікові особливості. Захворювання є більш поширеним серед жінок, особливо молодого віку. Хоча ступінь статевих відмінностей у частоті інфекції в деяких регіонах сильно різниться. Відзначається стабілізація показників захворюваності в осіб групи 40-59 років і, навіть, 60 років і старше, що вказує на необхідність глибоко вивчати дану вікову групу в плані розповсюдження трихомонозу та інших ІПСШ.
Показано, що важливим і, навіть, обов’язковим є вивчення епідеміології ІПСШ з позицій малих соціальних груп – осіб різного віку і статі, що мешкають на окремих територіях, а також мають певні особливості статевої поведінки, тому що аналіз загальних даних захворюваності не виявляє прихованих тенденцій і не дозволяє розробляти ефективні засоби профілактичної роботи. Вивчено як медико-біологічні, так і соціальні аспекти інвазії на Trichomonas vaginalis, враховуючи сучасні дані щодо мікробіології та діагностики збудника, а також лікування і профілактики.
Виявлено нові особливості сучасного періоду клінічних проявів УТ у поєднанні з мікст-інфекціями, що передаються статевим шляхом. Це дало розуміння того, що ураження ССС, спричинені такими комбінаціями мікроорганізмів характеризуються мало- або асимптомним, але тривалим перебігом захворювання, з підтримуванням запального процесу за рахунок наявності супутніх мікроорганізмів.
Важливим наслідком аналізу отриманих даних було те, що трихомонадна інвазія здатна спричиняти запальні прояви з боку статевих органів – кольпіту, вульвіту, цервіциту, ендоцервіциту, уретриту, простатиту, епідидиміту, циститу. Це досить суттєво, бо розширює спектр клінічного перебігу трихомонозу. На основі збільшення частоти атипових і резистентних до лікування форм було висловлено припущення про те, що трихомоноз зазнав певного клінічного патоморфозу, а саме, суттєво зріс відсоток висхідних ускладнень. Головний клінічний висновок з отриманих даних – необхідність в уточненні клінічних і лабораторних критеріїв діагнозу різних форм трихомонозу. Так, у пацієнтів чоловічої статі спостерігався вищий відсоток позитивних результатів ([48,1 ± 9,6] %) у хворих на хронічний простатит (середній вік – 30,1 року). Привернув увагу вік обстежених чоловіків із цим діагнозом у зв’язку з тим, що хоча віковий діапазон був від 20 до 80 років, переважну кількість хворих цієї групи склали пацієнти, які пройшли тридцятирічний рубіж. Даний факт є клінічно значущим, бо показує проблему так званого «трихомонадоносійства», коли хворі з малосимптомним перебігом інвазії не мають уяви щодо інфікування їх T. vaginalis. Отриманий показник демонструє високу інфікованість даного контингенту і свідчить про необхідність своєчасного обстеження та лікування. У чоловіків із хронічним уретритом відсоток знаходження T. vaginalis був нижчим і склав (37,1 ± 5,8) %. Достатньо високий, приблизно рівний процент визначено у жінок із хронічним ендоцервіцитом та аднекситом, показники знаходження збудників досягали 60 %. Настільки широка розповсюдженість інфекції у цих групах має велике значення з урахуванням репродуктивного періоду життя хворих, середній вік яких склав 29,5 при аднекситах та 29,9 року при ендоцервіцитах. Також високий показник спостерігався у групі жінок із хронічним циститом – (56,3 ± 12,4) %. Слід зазначити, що ця група складена з жінок більш старшого віку, середньовікове число склало 45,2 року, а розкид років у пацієнток був вельми широким, від 22 до 76. Таким чином, високий показник наявності інфекції у групі обстежених ([48,7 ± 3,6] %) свідчить про необхідність цільової вчасної діагностики трихомонадної інвазії для запобігання ускладнень.
Ряд нових клініко-морфологічних аспектів встановлено при ретельному ультраструктурному дослідженні. За допомогою методу електронної мікроскопії у пацієнтів із сечостатевим трихомонозом були охарактеризовані два морфотипи вірулентних форм T. vaginalis: грушоподібні та овальні, при цьому, останній морфотип явно переважав кількісно. А саме – у хворих на хронічний сечостатевий трихомоноз із млявим перебігом округлі форми склали більшість – 67 %. Цей факт можна екстраполювати також і на морфотипи, що вірогідно мають місце in vivo, оскільки культивування в живильному середовищі унеможливлює перехід T. vaginalis з одного морфотипу до іншого. Для овального морфотипу були описані нові ультраструктурні особливості: наявність гетерогенної за щільністю нуклеоплазми, відсутність типових диктіосом і сплощення цистерн апарату Гольджі. У приядерній ділянці спостерігалося скупчення різних за формою і щільністю везикул, відсутність впорядкованості в розташуванні рибосом (у грушоподібних форм збудника вони розташовувалися в ділянці ядра і організовувалися в полісоми). Крім того, звертала на себе увагу часткова редукція системи внутрішніх мембран, скорочення аксостилю, збільшення вакуолізації клітин, поліморфізм за розмірами, формою і щільністю гідрогеносом. Результати дослідження ультраструктурних особливостей дозволяють зробити впевнене припущення про те, що округлі форми T. vaginalis є однією з вірулентних, а не дегенеративних форм, як вважалося раніше, оскільки вони мають необхідну морфологічну організацію і, отже, здатні спричиняти патогенний вплив на макроорганізм. Разом з тим, структурні зміни, що спостерігалися в цитоплазмі клітин T. vaginalis округлих форм, вказують на зниження їх фізіологічної активності, що, можливо, свідчить про переживання ними несприятливих умов в організмі людини (наприклад, вплив протистоцидних препаратів). Теоретично й практично важливим є той факт, що дані ультраструктурні дослідження поставили питання про можливу належність різних морфотипів трихомонад до різних серотипів T. vaginalis або до інших видів роду Trichomonas.
Оскільки характеристики імунологічних штамів збудника трихомонозу в Україні ще ніколи не вивчалися, представляло науковий інтерес висвітлення цього аспекту біології трихомонад. Визначення молекулярно-біологічної характеристики збудників хронічного трихомонозу шляхом типування за допомогою імунобіологічних методів надало важливу інформацію для уточнення епідеміології трихомонад в Україні. Було з¢ясовано, що розподіл генотипів Trichomonas vaginalis за поліморфізмом гена актину в українській популяції характеризується домінуванням генотипу Е (68,96 %) при порівняно низькій частоті виявлення генотипів G (21,4 %), H (14,3 %) та А (3,45 %). Не було виявлено помітної різниці у розподілі генотипів Trichomonas vaginalis у центральному та північно-східному регіонах України.
До проведення відповідних досліджень стереотипи сексуальної поведінки сучасних українців сприймались, як своєрідна «terra incognita». Без вивчення цього суспільно-медичного аспекту неможливо істотно впливати на процеси подальшого поширення ІПСШ, а насамперед, при оральному та анальному сексі.
Виходячи зі сказаного вище, було проведено аналіз сексуальної поведінки молодих осіб. Отримані дані щодо практики орального та анального сексу серед вітчизняної молоді виявилися співставними з аналогічними даними інших країн. Низький рівень застосування презервативів при феляції є свідченням того, що оральний секс практично не сприймається як фактор можливості отримання чи передачі статевих інфекцій. Анальний секс також часто відбувається без застосування презервативів.
Досить важливим з клінічної та епідеміологічної точки зору є встановлений в даній роботи факт, що виникненню екстрагенітальних осередків запалення, спричинених збудниками ІПСШ, сприяє зміна стереотипу сексуальної поведінки людей. У теперішній час практикуються так звані «альтернативні» форми сексу, зокрема оральний та анальний. Це позначається на шляхах передачі та перебігу багатьох статевих інфекцій, а також виникненні поєднаних генітальних та екстрагенітальних уражень, спричинених збудниками ІПСШ [213, 227]. Було сформовано нове розуміння, що діагностичні заходи, які існують у сьогоднішній дерматовенерологічній практиці, не передбачають виявлення екстрагенітальних осередків запалення, спричинених збудниками ІПСШ [46]. Стало зрозумілим, що лікувальні методики не відповідають сучасним вимогам щодо повноти виліковування інфекційного процесу та зниження кількості рецидивів при таких захворюваннях. А відтак, постає необхідність розробки та впровадження нових алгоритмів обстеження хворих на ІПСШ та ефективних способів їх лікування. Доведено необхідність врахування особливостей інфекційного процесу при ІПСШ, пов’язану з його поліетіологічністю та можливістю існування екстрагенітальних осередків. Розроблено новітню концепцію здійснення загальновизнаних лікувальних заходів із застосуванням додаткових спеціальних терапевтичних методик, спрямованих саме на екстрагенітальні осередки, з обов’язковим урахуванням тяжкості перебігу та особливостей збудників.
До останнього часу вважалося, що в сечостатевому тракті людини здатна існувати виключно Trichomonas vaginalis [18]. Однак, схильність найпростіших до еволюційних змін та суттєві зміщення стереотипів сексуальної поведінки, зокрема, поширення практики анального та орального сексу, призвели до можливості існування в урогенiтальному тракті людини інших видів трихомонад, зокрема, Pentatrichomonas hominis та Trichomonas tenax [12, 13, 18]. Все це суттєво змінило ситуацію з розповсюдженням, діагностикою й лікуванням трихомонадної інвазії.
В Україні вперше, починаючи з 2013 року автором були проведені дослідження щодо визначення Pentatrichomonas hominis та Trichomonas tenax в урогенітальному тракті хворих на ІПСШ. Зазначені мікроорганізми було виявлено більше, ніж у третини пацієнтів із хронічним перебігом захворювання [9, 13, 19]. У дослідженнях було чітко дотримано умови про сексуальне утримання не менше 2 діб, що унеможливлювало розгляд Pentatrichomonas hominis та Trichomonas tenax в якості ТМ. Тривалість дослідження мінімізувало можливість контамінації біологічного матеріалу. Персистенція хронічного запального процесу у хворих, що спостерігались, дозволила припустити певну етіологічну роль Pentatrichomonas hominis та Trichomonas tenax у ньому. На основі отриманих даних було безперечно показано, що визначення виду трихомонад, їх санація і певна модифікація способу життя пацієнтів, має вирішальну роль в запобіганні рецидивів та реінфекцій трихомоніазу в сучасних умовах [20].
На сучасному етапі важливою є розробка та впровадження нових методів діагностики протозойних інвазій сечостатевої системи людини, які мають високу чутливість, специфічність, клінічну інформативність, а також доступні для медичних лабораторних служб різного рівня. Так, в Україні дотепер не проводилося визначення Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia в сечостатевій системі людини, зокрема, через відсутність відповідних діагностичних систем та реактивів.
Під час лабораторного обстеження пацієнтів потрібно враховувати, що всім трихомонадам, у тому числі Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia, притаманні фагоцитарні властивості, часто з неповним циклом травлення. У разі незавершеного фагоцитозу різноманітні бактерії, що виходять при загибелі трихомонад, здатні підтримувати запальний процес у сечостатевих шляхах, який часто сприймається як невилікуваний трихомоноз або посттрихомонадні ураження сечостатевої системи.
Дуже важливим є вибір методу лабораторної діагностики. При порівнянні мікроскопічної, культуральної діагностики та методу ПЛР при виявленні трихомонад було встановлено, що за допомогою засіву на спеціальне живильне середовище СВТ Trichomonas vaginalis було виявлено у 15,5 % з 97 досліджених пацієнтів. При проведенні дослідження методом ПЛР-РЧ цей збудник було діагностовано лише у 6 (6,2 %) осіб. Разом з тим, проведення ПЛР-РЧ з використанням праймерів для виявлення Trichomonas tenax та Pentatrichomonas hominis, дозволило діагностувати у 9 (9,3 %) відповідних пацієнтів Trichomonas tenax та у 12 (12,4 %) – Pentatrichomonas hominis.
На основі цих даних вироблена рекомендація, що одночасне використання праймерів для виявлення Trichomonas vaginalis, Trichomonas tenax та Pentatrichomonas hominis дозволяє робити діагностування трихомонад за допомогою методу ПЛР-РЧ більш ефективним (27,9 %), ніж за допомогою культурального методу на середовищі “СВТ”. Вочевидь, при проведенні діагностики трихомонозу за допомогою культурального методу в значній частині випадків Trichomonas tenax та Pentatrichomonas hominis помилково ідентифікуються як Trichomonas vaginalis.
Праймери, що застосовувалися для виявлення Trichomonas tenax, Pentatrichomonas hominis та Giardia lamblia, є авторськими, експериментальними. Тому визначення збудників за допомогою цих праймерів викликало питання щодо їх специфічності. Було проведене спеціальне мультицентрове генодіагностичне дослідження пацієнтів, хворих на ІПСШ з метою апробації оригінальних праймерiв для визначення Pentatrichomonas hominis методом ПЛР. Разом з тим, було запроваджено додатковий спосіб контролю відповідності оригінальних праймерів, які проходили апробацію. Він полягав у застосуванні «молекулярної мітки», що дає змогу оцінити відповідність молекулярної маси оригінального праймеру та ланцюжків ДНК, що визначаються за його допомогою.
Отримані в дослідженні позитивні результати ампліфікації свідчили про наявність у клінічних зразках ДНК збудників, що відрізняються від T. vaginalis, але належать до досить близьких до них таксономічних груп. Досить імовірно, що вони належать до родини Pentatrichomonas, але для того, щоб конкретизувати характер цих збудників, необхідні подальші дослідження з використання більш специфічних методів, зокрема секвенування отриманих ампліконів, що було зроблено в Україні вперше.
З метою перевірки отриманих даних було виконане додаткове дослідження зразків мікробних ДНК, отриманих від пацієнтів, що обстежувалися. Для цього використовувалися зразки, які з найбільшою вірогідністю мали в собі фрагменти ДНК досліджуваних найпростіших, що було визначено за допомогою методу ПЛР-РЧ. Це зразки, які давали позитивний сигнал не пізніше 30 циклу ампліфікації. Додаткове дослідження полягало у виявленні мікроорганізму, що досліджувався, за допомогою класичної ПЛР. Для подальшого дослідження шляхом секвенування було використано генетичний матеріал, взятий із ССС 62 пацієнтів (30 чоловіків та 32 жінки), хворих на ІПСШ. У кожного з цих хворих за допомогою авторських праймерів було попередньо виявлено один з наступних найпростіших мікроорганізмів, а саме Trichomonas tenax, Pentatrichomonas hominis або Gіardia lamblia. У кожного з них за умов проведення цього дослідження було попередньо виключено можливість інфікування на Trichomonas vaginalis.
Нуклеотидні послідовності, що були секвеновані, порівнювалися з відомими за допомогою сертифікованих комп’ютерних програм. Їхня приналежність до певних мікроорганізмів вважалась повністю доведеною. Вони абсолютно співпадали з нуклеотидними послідовностями саме Trichomonas tenax, Pentatrichomonas hominis або Gіardia lamblia. Результати секвенування повністю співпали з тими, що були отримані за допомогою ПЛР. Тобто, у 18 пацієнтів було визначено присутність Trichomonas tenax, у 23 – Pentatrichomonas hominis, у 21 – Gіardia lamblia.
Таким чином, у результаті проведеної роботи були запропоновані авторські праймери для ідентифікації Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia в біологічному матеріалі. Була доведена специфічність вищезгаданих праймерів за допомогою прямих та непрямих методів детекції, включно з секвенуванням.
Отримані результати доводять можливість та доцільність подальшого використання досліджуваних праймерів у повсякденній практиці закладів охорони здоров’я для виявлення ДНК збудників протозойних інвазій – Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia у біологічному матеріалі.
Власні дані показали, що інфікованість на Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia у вітчизняних пацієнтів з ІПСШ становить понад 30 %. Залишається загадкою причина такого масового виявлення цих видів найпростіших саме в нашій країні, можливо – це наслідки аварії на Чорнобильській атомній електростанції (зниження імунітету у популяції в цілому) або якісь інші чинники. Не виключено, що свою роль зіграли саме нові праймери для проведення діагностики методом ПЛР-РЧ.
Отже, хворих на ІПСШ, особливо з хронічним перебігом, доцільно додатково обстежувати (за допомогою методу ПЛР-РЧ) на наявність протозойних інвазій сечостатевої системи, які можуть бути спричинені окрім Trichomonas vaginalis, іншими найпростішими – паразитами організму людини, зокрема, Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia.
Рекомендації щодо діагностики Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia в сечостатевій системі хворих на ІПСШ, а також щодо відповідних лікувальних та профілактичних заходів, імовірно, мають бути внесені в локальні та національні протоколи щодо діагностики та лікування протозойних інвазій сечостатевої системи людини.
Оскільки було встановлено можливість перебування в ССС людини на сучасному етапі трьох різних видів трихомонад, постала наукова проблема щодо вивчення можливості одночасної інвазії ССС трихомонадами різних видів. Вирішення цього питання було істотним, перш за все, для формування уявлення про патогенність Trichomonas tenax і Pentatrichomonas hominis саме для ССС.
Трихомонадну інвазію було виявлено більше ніж у третини (38,9 %) зі 198 обстежених пацієнтів, хворих на ІПСШ з хронічним перебігом. «Trichomonas non vaginalis» було виявлено у 69 (34,8 %). Причому, у 41 (20,7 %) було діагностовано Trichomonas tenax, а у 28 (14,1 %) – Pentatrichomonas hominis. Рівень діагностування Trichomonas vaginalis у досліджуваній групі хворих склав лише 4 %.
Згідно результатів, отриманих при проведенні цього дослідження, при детекції трихомонад у біологічному матеріалі, взятому з ССС хворих на ІПСШ, не зустрічалося жодного випадку виявлення більше одного виду трихомонад у кожного з пацієнтів. Тобто, в ССС людини одночасно не можуть співіснувати різні види трихомонад. Явище, при якому відбуваються антагоністичні відносини видів, коли один організм обмежує можливості іншого, неможливість співіснування організмів, має назву антибіоз (термін було уведено мікробіологом Зельманом Вексменом у 1942 р.). Форма антибіозу, при якій два або більше видів організмів є біологічними ворогами за своєю суттю (використовують спільну кормову базу або спільні умови для розмноження), наприклад, хижі істоти різних видів, що мешкають на одній території і вживають один і той же харч, називається конкуренцією [43].
Спираючись на сказане вище, зроблено висновок, що саме внаслідок антибіозу в ССС людини не можуть існувати різні види трихомонад одночасно. Враховуючи високий рівень розповсюдженості та неможливість співіснування різних видів трихомонад у хворих на ІПСШ, можна зробити припущення про певну роль «Trichomonas non vaginalis» у виникненні торпідного та хронічного перебігу інфекційних захворювань ССС.
Трихомоноз вважається протозойно-бактеріальним захворюванням. Виходячи з цього, виникла зацікавленість у встановленні найбільш частих варіантів асоціацій збудників протозойних інвазій та бактеріальної мікрофлори, передусім анаеробної та мікроаерофільної, оскільки даних про це у досяжній літературі знайдено не було. Існують дані щодо виникнення патологічних МА, до складу яких входять Trichomonas vaginalis та мікрофлора, що є асоційованою з БВ [157]. МА – це взаємодіючі співтовариства мікроорганізмів. У МА можуть входити бактерії, дріжджі, водорості, гриби, а також інші мікроорганізми. Вони засновані на симбіотичних або метабіотічних стосунках. Окремі види мікроорганізмів, що становлять МА, зазвичай стійкі до продуктів життєдіяльності інших видів і використовують ці продукти як джерела свого існування [158]. У попередніх дослідженнях проводилося вивчення можливості одночасних уражень ССС БВ та збудниками протозойних інвазій [159]. Однак даних щодо видового складу МА, утворених мікрофлорою, асоційованою з БВ та Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia, не було знайдено в досяжній для опрацювання літературі. Однак на підставі отриманих даних можна зробити припущення, що мікроорганізми, асоційовані з БВ, часто зустрічаються в ССС пацієнтів з Trichomonas tenax, Pentatrichomonas hominis, а також Giardia lamblia. Причому група мікроорганізмів Gardnerella vaginalis / Prevotella bivia / Porphyromonas spp. визначається у понад 60 % відповідних пацієнтів при Trichomonas tenax. Enterobacteriaceae визначається у майже у 11–23 % хворих. Група мікроорганізмів Mobiluncus spp./Corynebacterium spp. визначалась у 23–33 %. Candida spp. виявляється більше, майже у 70 % пацієнтів, що мають цих збудників. Eubacterium spp. було знайдено у понад 54 % хворих. Що стосується умовно-патогенних генітальних мікоплазм (Ureaplasma (urealyticum + parvum), то вони більш часто з високою долею достовірності асоціюються в ССС із найпростішими збудниками лямбліозу Giardia lamblia – майже в 45 % випадках.
Таким чином, очевидно, що Trichomonas tenax та Pentatrichomonas hominis, а деякою мірою також і Giardia lamblia, як збудники протозойних інвазій ССС, досить часто утворюють патологічні МА з мікроорганізмами, що асоційовані з БВ. Тому мова йде про доцільність розгляду Trichomonas tenax та Pentatrichomonas hominis, і можливо також Giardia lamblia в якості важливих чинників БВ, а також відповідного анаеробного дисбіозу у чоловіків.
Слід окремо зазначити те, що всім найпростішим, зокрема, трихомонадам, притаманні фагоцитарні властивості. При фагоцитозі частина мікроорганізмів не руйнується повністю – вони зберігаються всередині одноклітинного мікроорганізму неушкодженими (незавершений фагоцитоз) [3]. У разі незавершеного фагоцитозу коки, диплококи, мікоплазми, хламідії, бацилярні форми, віруси, що виходять, при загибелі трихомонад, здатні підтримувати запальний процес у сечостатевих шляхах, який часто сприймається за невилікуваний трихомоніаз або посттрихомонадні ураження [11]. Тому, найпростіші, а перш за все, Trichomonas tenax та Pentatrichomonas hominis, мають розглядатися в якості патогенетичних чинників ІПСШ. Саме через це, ерадикація Trichomonas tenax та Pentatrichomonas hominis із ССС людини має бути обов’язковою.
Отже, актуальність проблеми сечостатевого трихомонозу пов’язана як з високим рівнем захворюваності, так і з можливістю колонізації ССС «новими» збудниками в результаті часткового змінення їх біологічних властивостей [9, 12, 13]. Врахування наявності збудників, які є морфологічно подібними до Trichomonas vaginalis, але відмінних від них за таксономічною приналежністю, надає можливість більш точного діагностування трихомоніазу та більш успішного його лікування та профілактики.
Проведення лікування УТ регламентовано відповідними настановами [79, 163]. Воно передбачає, насамперед, застосування препаратів, що мають специфічну антипротозойну активність. Це, як правило, речовини груп нітроімідазолів (метронідазол, тинідазол, секнідазол, орнідазол) та нітрофуранів (ніфуратель). Під час проведення антипротозойної терапії бажано проводити відповідне місцеве лікування, а також призначати імунобіологічні препарати з метою підвищення опірності організму. Під час лікування пацієнтам суворо забороняється мати сексуальні контакти, а в контрольний період не дозволяється секс без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції.
Для лікування хворих з різними клінічними формами трихомонозу рекомендується застосовувати диференційовані схеми. Лікування УТ має бути комплексним та індивідуалізованим і включати, крім етіотропної терапії, препарати з урахуванням механізмів патогенезу, зокрема гепатопротектори та адаптогени, згідно з Протоколом надання медичної допомоги хворим на сечостатевий трихомоноз [79, 163].
Плануючи розробку терапевтичних методик для лікування протозойних інвазій ССС, враховувався комплекс об¢єктивних медичних даних, а також рекомендації наукової спільноти стосовно ведення пацієнтів, хворих на трихомоноз. Перш за все, враховувалося те, що переважна більшість пацієнтів, хворих на протозойні інвазії ССС мали хронічний перебіг захворювання. Багато з них, враховуючи топіку запального процесу, мали ураження внутрішніх статевих органів, що є підставою для значного збільшення тривалості курсу перманентного етіотропного лікування, що проводиться. Не робилась різниця у підході до лікування різних збудників протозойних інвазій, а саме Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia. Оскільки методик лікування патологічних станів ССС, що викликані Trichomonas tenax та Pentatrichomonas hominis на сьогоднішній день немає взагалі, а для лікування Gіardia lamblia – малочисельні та нараховували незначні групи пацієнтів, за основу терапевтичних методик бралися рекомендації щодо ерадикації Trichomonas vaginalis.
Плануючи розробку методів лікування хворих на протозойні інвазії ССС, приймалось до уваги і те, що найпростіші мають властивість неповного фагоцитозу, зберігаючи в собі неушкодженими інші мікроорганізми, в тому числі і патогенні. Саме тому за умови комбінованих уражень ССС (уражень МА), ерадикація найпростіших має бути здійснена у першу чергу.
Сьогодні трихомоноз можна вважати протозойно-бактеріальною інфекцією, коли найпростіші і бактерії взаємно обтяжують перебіг інфекційного ураження сечостатевих органів. Досить часто, як показали власні дослідження, протозойні інвазії ССС супроводжуються одночасним ураженням мікрофлорою, що є асоційованою з БВ – переважно анаеробною та мікроаерофільною, причому, як у жінок, так і у чоловіків, що само по собі, є новітньою розробкою. Крім того, для лікування БВ часто використовують ті ж самі медикаментозні засоби, що і при лікуванні протозойних інвазій, насамперед препарати груп нітроімідазолів та нітрофуранів. Як показало вивчення літературних джерел, сьогодні не існує лікувальних методик щодо одночасної елімінації збудників протозойних інвазій (окрім Trichomonas vaginalis) ССС та мікроорганізмів, асоційованих з БВ. Тому, було взято за мету розробити методику лікування пацієнтів при поєднанні у них цих патологічних станів.
Враховуючи те, що БВ є захворюванням поліетіологічним (має близько 40 етіологічних чинників), його лікування у деяких випадках є досить складним завданням, особливо при одночасній наявності декількох збудників цього патологічного стану, в першу чергу, за рахунок складності раціонального підбору антибіотичних препаратів, за принципом – «максимальний ефект при мінімальній кількості різних АБП». Підбір антибіотиків при БВ обтяжений тією обставиною, що більшість мікроорганізмів, асоційованих з даним патологічним станом є анаеробними або мікроаерофільними. Тобто, вони apriori не дають росту на типових для повсякденної медичної практики діагностичних живильних середовищах та, відповідно, не може бути визначена їх чутливість до АБП за допомогою просякнутих ними дисків. Для полегшення підбору АБП для індивідуалізованого лікування станів, пов’язаних із мікрофлорою, асоційованою з БВ, було запропоновано оригінальну інформаційну панель. Вона була складена на основі емпіричних даних (фармакологічних довідників) щодо чутливості окремих мікроорганізмів, асоційованих з БВ до найбільш уживаних сьогодні АБП.
Наступним напрямком у розробці лікувальних методик був напрямок ерадикації збудників протозойних інвазій ССС у хворих на тлі порушень імунологічної реактивності. У попередніх дослідженнях було встановлено добрий ефект у лікуванні різних ІПСШ на тлі імунодефіциту препарату з групи дефенсинів. Додатковими перевагами цього препарату є можливість його призначення при онконастороженні та власний протизапальний ефект. Саме тому цей препарат було залучено для лікування пацієнтів із протозойними інвазіями ССС на тлі імунодефіциту (не пов’язаного зі СНІДом).
При розробці метода лікування протозойних інвазій ССС були проаналізовані дані обстежень 106 хворих, серед них 45 (42,5 %) чоловіків, середній вік яких становив (39,8 ± 3,3) року, та 61 жінка (57,5 %); середній вік жінок становив (28,4 ± 4,7) року. З цих хворих були сформовані основна група (77 пацієнтів) та група порівняння (29 пацієнтів). Хворим основної групи застосовувалися послідовно: секнідазол по 2,0 г 1 раз на добу протягом 5 днів; препарат, що містить 0,5 г орнідазолу та 0,5 г ципрофлоксацину, – по 1 таблетці 3 рази на день при вазі більше 70 кг (або 2 рази на день при вазі менше 70 кг) протягом 10 днів. Поєднання різних антипротозойних препаратів значно зменшує можливі резистентності збудника. Крім того, використання ципрофлоксацину забезпечує елімінацію чутливої супутньої мікрофлори, яка сприяє підтриманню запалення [65, 162]. З метою поліпшення проникнення препарату до зони запалення пацієнтам призначалася фізіотерапія (лазеротерапія, магнітотерапія, СМВ терапія, фонофорез із гідрокортизоном). Крім того, пацієнти дотримувалися дієти № 5. Чоловіки, у разі потреби, отримували пальцьовий масаж передміхурової залози та ректальні протизапальні свічки. Жінки отримували щоденні вагінальні спринцювання та піхвові таблетки з ніфуротелем і ністатином, а також свічки із хлоргексидином послідовно протягом 8 та 10 днів, відповідно. Під час лікування пацієнтам суворо заборонялося мати сексуальні контакти, а в період контролю не дозволявся секс без застосування бар’єрних засобів.
Група порівняння отримувала метронідазол по 500 мг два рази на добу протягом 7–10 днів на тлі традиційної патогенетичної терапії згідно з існуючими протоколами лікування МОЗ та Європейського союзу [163]. Результати ефективності терапії щодо елімінації патогенних мікроорганізмів із ССС визначалися згідно відповідних рекомендацій IUSTI, EADV [163]. Встановлення виліковності проводилося тричі – через 30, 60 днів і через 3 місяці після закінчення лікування – шляхом постановки зазначених ПЛР. Враховувалася також переносимість лікування (відсоток побічних реакцій на підставі об’єктивних і суб’єктивних ознак). Усім хворим проводилося дослідження функції печінки до і після лікування.
В основній групі (77 пацієнтів) клінічний ефект (повне завершення клінічних проявів – болі, свербіння, виділень з геніталій) спостерігався у 71 (92,2 %) хворих. Клінічні прояви зберігалися у 6 пацієнтів, хоча вираженість симптомів істотно зменшилася. Позитивний мікробіологічний ефект лікування отримано у 74 (96,1 %) хворих основної групи. У трьох пацієнтів були знову виявлені трихомонади та/або гіардії. Всі вони заперечували статеві зв’язки після лікування. У групі порівняння (29 пацієнтів) клінічний і мікробіологічний ефект був, відповідно, у 23 (79,3 %) і 24 (82,8 %). Клінічні та мікробіологічні результати, виражені у відсотках, в основній групі були достовірно вищі, ніж у групі порівняння. Різниця досягає достатнього рівня статистичної довіри, незважаючи на те, що вибірка досліджуваних хворих не була достатньо великою. Послідовне застосування секнідазолу, а також орнідазолу та ципрофлоксацину переносилося добре, без виражених побічних ефектів. Проте у переважній більшості пацієнтів, а саме у 49 осіб, тобто у (63,6 ± 5,5) % основної групи спостерігалися диспепсичні явища, що є природним при ентеральному вживанні нітроімідазолів; проте жодного разу не виникла необхідність припинення основного лікування. На підставі отриманих результатів можна зробити висновок, що застосування розробленої методики у комплексному лікуванні урогенітальної протозойної інвазії є обґрунтованим. Запропонований оригінальний метод лікування є ефективним, має задовільну переносимість та може бути рекомендованим для емпіричної терапії уражень ССС, спричинених протозойними інвазіями T. tenax, P. hominis та G. lamblia.
Проведено лікування 77 пацієнтів з ураженнями ССС на протозойні інвазії. В якості етіотропних препаратів послідовно використовували секнідазол по 2 таблетки один раз на день протягом 5 днів та комбінацію орнідазолу (0,5 г) та ципрофлоксацину (0,5 г) – по 1 таблетці три або два рази на день (залежно від ваги) протягом наступних 10 днів. Клінічне одужання досягнуто у 92,2 % випадків та бактеріологічну санацію – у 96,1 % випадків. Отже, запропонований оригінальний метод лікування є ефективним, має задовільну переносимість та може бути рекомендованим для емпіричної терапії уражень ССС, спричинених протозойними інвазіями T. tenax, P. hominis та G. lamblia.
Дана частина дослідження полягала в обґрунтуванні, розробці та впровадженні експериментальної методики лікування поєднаних уражень ССС, спричинених трихомонадами різних видів та мікроорганізмами, асоційованими з БВ. Для проведення цього етапу відібрано групу з 56 хворих на ІПСШ хронічного перебігу, 17 (30,4 %) чоловіків та 39 (69,6 %) жінок.
Для специфічного лікування трихомонозу застосовують антибактеріальні препарати, до яких має чутливість збудник захворювання. Це, насамперед, препарати груп нітроімідазолів та нітрофуранів [33]. Крім того, одне з вирішальних значень при лікуванні хронічної трихомонадної інвазії має тривалість терапії. Вважають, що її доцільно проводити в терміни до 10–20 діб, використовуючи при цьому різні препарати [58].
Для етіотропного лікування БВ застосовують багато методів, в тому числі й індивідуалізованих. Однак, одним з найефективніших є одночасне застосування антибіотиків груп нітроімідазолів та фторхінолонів. Саме речовини цих хімічних груп здатні впливати на більшість збудників БВ. Тому поєднання нітроімідазолів та фторхінолонів найчастіше використовують при емпіричному підборі специфічної терапії хворих на БВ [42].
Серед засобів одночасної етіотропної терапії трихомонадної інвазії та ерадикації мікроорганізмів, асоційованих з БВ, застосовувався послідовно представник групи нітроімідазолів – секнідазол (секнідокс), а також препарат, що містить комбінацію представника групи нітроімідазолів та представника групи фторхінолонів – 0,5 г орнідазолу і 0,5 г ципрофлоксацину (орципол). Секнідокс призначався по 2,0 г 1 раз на добу протягом перших 5 днів лікування, орципол – з 6-го по 15-й день лікування по 1 таблетці 3 рази на день при масі тіла > 70 кг та 2 рази на день при масі тіла < 70 кг протягом 10 днів.
У жінок лікування починалося відразу після припинення mensis, використовуючи останнє як біологічну провокацію. Під час проведення антибактеріальної терапії призначались у разі потреби (за результатами імунограми) також імуномодулюючі препарати з метою підвищення опірності організму. Крім того, чоловікам у разі потреби проводився пальцьовий масаж передміхурової залози та призначалися ректальні протизапальні свічки. Жінки отримували щоденно вагінальні спринцювання та піхвові таблетки з ніфуротелем і ністатином або одним з препаратів групи нітроімідазолів, а також піхвові свічки з хлоргексидином послідовно протягом 5–10 та 10 днів відповідно. Під час лікування пацієнтам суворо забороняли мати сексуальні контакти, а в контрольний період їм не дозволяли цих контактів (у тому числі оральний та анальний секс) без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції. Після закінчення антибактеріальної терапії для відновлення кишкової та у разі потреби піхвової мікрофлори пацієнти отримували відповідні пробіотичні препарати протягом 10–14 днів.
Отже, лікування поєднаних уражень ССС, спричинених трихомонадами різних видів та мікроорганізмами, асоційованими з БВ, за запропонованою оригінальною схемою проведено у 56 хворих на ІПСШ з хронічним перебігом. Забір біологічного матеріалу із ССС проводився через 1 міс після припинення антибактеріальної терапії. В результаті лікування досягнуто елімінації трихомонад у 54 ([96,4 ± 2,5] %) осіб дослідної групи. Повної нормалізації рівня мікрофлори, асоційованої з БВ, досягнуто у 31 ([57,4 ± 6,6] %) хворих. Значне зменшення кількості цієї мікрофлори виявлено у решти 24 ([42,6 ± 6,6] %) пацієнтів.
Слід зазначити, що майже всі пацієнти (51 особа) відмічали помірно виражені побічні ефекти щодо травного каналу (нудота, тяжкість у правій підреберній ділянці, металевий присмак у роті), але в жодному випадку не виникало побічних ефектів, які потребували б негайного припинення лікування. Це свідчить про задовільну переносимість запропонованого методу лікування.
Отримані результати свідчать про високу ефективність запропонованого оригінального методу лікування поєднаних уражень ССС, викликаних трихомонадами різних видів та мікроорганізмами, що асоційованими з БВ. Важливу роль у цьому, на думку автора, відіграє заборона на сексуальні контакти в контрольний період (у тому числі, оральний та анальний) без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції.
Підсумовуючи отримані дані, можна дійти висновку, що трихомонадні інвазії та інфекції ССС, асоційовані з БВ, актуальні для сучасної дерматовенерології та суміжних медичних спеціальностей. Дослідження трихомонадних уражень ССС, поєднаних з асоційованими з БВ інфекціями, перспективний напрям, вивчення якого може зумовити значне підвищення рівня діагностичного обстеження хворих на ІПСШ та ефективності їх лікування. Розроблено та застосовано новий метод лікування поєднаних уражень ССС, спричинених трихомонадами різних видів та мікроорганізмами, асоційованими з БВ. Отримані результати свідчать про високу ефективність та задовільну переносимість запропонованого оригінального методу лікування.
Для лікування пацієнтів із протозойними інвазіями ССС на тлі імунодефіциту було відібрано 32 пацієнти. Отже, в дослідній групі було 22 (68,8 %) жінки та 10 чоловіків (31,2 %), віком від 20 до 48 років. Середній вік складав (32 ± 2,5) року. Усі хворі, які спостерігалися, мали хронічний перебіг ураження ССС. Серед скарг пацієнтів переважали відчуття дискомфорту в сечостатевих органах й виділення з них.
Trichomonas tenax було виявлено у 12 пацієнтів дослідної групи (37,5 %), Pentatrichomonas hominis – у 18 (56,3 %), Trichomonas vaginalis – у 2 (6,2 %).
Препарат суміші α- і ß-дефенсинів з метою імунокорекції вводився досліджуваним пацієнтам внутрішньом’язово по схемі лікування захворювань, що пов’язані з порушенням імунологічного статусу, а саме по 2 мл через день впродовж 20 днів. Його введення розпочиналось одночасно з курсом специфічної терапії трихомонадних інвазій [94]. А саме, внутрішньо призначався орнідазол по 1,5 г на добу. Препарат приймався по 0,5 г тричі на добу після їжі протягом 10 діб. У перший день лікування добова доза орнідазолу вживалася за один прийом під час вечері. Наступні 10 днів (з 11 по 20 дні лікування) хворі отримували по 400 мг ніфуротелю тричі на добу, незалежно від прийому їжі. У разі необхідності, через 5 днів після початку специфічної антипротозойної терапії, пацієнтам одночасно індивідуалізовано призначалися додаткові АБП з метою елімінації з урогенітальної системи інших збудників ІПСШ, не чутливих до ніфуротелю та орнідазолу.
Крім того, чоловіки, у разі потреби, отримували пальцьовий масаж передміхурової залози та ректальні протизапальні свічки. Жінки отримували щоденні вагінальні спринцювання та піхвові таблетки з ніфуротелем та ністатином, а також свічки з хлоргексидином послідовно протягом 8 та 10 днів, відповідно. Під час лікування пацієнтам суворо заборонялося мати сексуальні контакти, а в контрольний період не дозволявся секс без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції.
Trichomonas tenax було виявлено у 12 з 32 пацієнтів дослідної групи (37,5 %), Pentatrichomonas hominis – у 18 (56,3 %), Trichomonas vaginalis – у 2 (6,2 %). Відносно загалу 77 обстежених пацієнтів, хворих на ІПСШ та, одночасно, на іммунодефіцит, Trichomonas tenax було виявлено (15,5 %), Pentatrichomonas hominis – у 22 %, Trichomonas vaginalis – у 4,1 %.
У досліджуваних пацієнтів були достовірно змінені наступні середньотатистичні показники імунограм – кількості: (абсолютна кількість) лімфоцитів, Т-цитотоксичних лімфоцитів (CD8+), 0-лімфоцитів, активних Т-лімфоцитів, а також імунорегуляторного індексу (Тх/Тс). Причому, показник абсолютної кількості лімфоцитів був підвищений, вочевидь, внаслідок загальних процесів адаптації в організмах цих хворих. Показник кількості 0-лімфоцитів був збільшений, а активних Т-лімфоцитів, відповідно, знижений. Показник Т-цитотоксичних лімфоцитів (CD8+) також був знижений, за рахунок чого істотно підвищився середньостатистичний показник імунорегуляторного індексу (Тх/Тс). Показники гуморальної ланки імунітету, фагоцитарний індекс, фагоцитарний показник та НСТ-тест змінені не були.
Показники імунограм досліджуваних пацієнтів вдруге визначалися через 2 – 3 місяці після закінчення їм курсу введень препарату суміші α- і ß-дефенсинів. Після лікування зазначеним засобом середньостатистичні показники імунограм досліджуваних пацієнтів повністю відновилися до нормальних значень. У 5 з 32 пацієнтів (15,6 %), які перебували під спостереженням, відзначали виникнення ущільнень у ділянці сідниць під час терапії, що проводилася. Ще 6 осіб (18,8 %) мали скарги на деяку болісність у місцях ін’єкцій препарату. Вираженість названих побічних ефектів не була значною і не потребувала відміни цього препарату або призначення додаткової медикаментозної терапії для їх нівелювання. Таким чином, можна зробити висновок, що препарат суміші α- і ß-дефенсинів переноситься пацієнтами добре або задовільно.
Результати ефективності терапії щодо елімінації патогенних мікроорганізмів із ССС визначалися згідно рекомендацій ВООЗ – через 1, 2 і 3 місяці після закінчення специфічної терапії [279].
Повної елімінації збудників трихомонадної інвазії з хронічним перебігом із ССС пацієнтів контрольної групи вдалося досягти у 31 (96,9 %) з 32 досліджуваних осіб. Скарги на виділення й дискомфорт у них припинились. Настала клінічна та етіологічна виліковність. Невдале лікування одного пацієнта (відсутність елімінації Pentatrichomonas hominis) можна пояснювати можливістю його реінфекції за рахунок невиконання статевого утримування в контрольний період.
Отже, терапію було проведено з послідовним внутрішнім застосуванням двох антипротозойних препаратів, що містять, відповідно, речовини орнідазол та ніфуротель, по 10 діб кожний. Поєднання антипротозойних препаратів різних груп значно підвищує ефективність відповідного лікування за рахунок зменшення можливих явищ резистентності з боку збудника захворювання. Крім того, використання ніфуротеля надає додаткові переваги, насамперед, пов’язані з елімінацією супутньої мікрофлори (Enterococcus faecalis та ін.) [99]. Тривалість специфічного лікування хронічного трихомонадного запалення склала 20 діб, що відповідає строкам антибактеріальної терапії за умови ураження внутрішніх статевих органів [51]. Але в даному випадку підвищена тривалість лікування була зумовлена також і імунодефіцитом.
У переважної більшості пацієнтів (близько 70 %) дослідної групи виникали різні диспептичні явища, що є природним при ентеральному призначенні препаратів фармакологічної групи нітроімідазолів, але жодного разу не виникла необхідність припинення розпочатого лікування за запропонованою схемою або призначення додаткового лікування, спрямованого на усунення відповідних побічних ефектів. Це дає право вважати за задовільну переносимість запропонованого методу ерадикації збудників протозойної інвазії із ССС людини.
Отже, запропонований оригінальний метод лікування є ефективним, має задовільну переносимість та може бути рекомендованим для емпіричної терапії уражень ССС, спричинених протозойними інвазіями, викликаних Trichomonas vaginalis, Trichomonas tenax та Pentatrichomonas hominis. Використання запропонованого методу дало змогу проводити ефективне лікування хронічного трихомонозу ССС, в результаті якого клінічне та бактеріологічне одужання наступило в 97 % випадків. Препарат суміші α- і ß-дефенсинів є високоефективним імунокоригуючим препаратом, який нормалізує показники імунограм у відповідних пацієнтів, а його застосування є доцільним у комплексному лікуванні хронічних протозойних інвазій, спричинених різними видами трихомонад, на тлі імунодефіциту.
У медичній практиці препарат суміші α- і ß-дефенсинів рекомендований для лікування різних захворювань на тлі порушень імунологічної реактивності. З цією метою препарат уводять по 2 мл 1 раз на добу протягом 10 діб або 1 раз на 2 доби протягом 20 діб. Здатність відновлювати активну і адекватну роботу імунної системи, регулювання балансу між різними ланками антиінфекційного захисту відкриває препарату можливості покращувати функціонування організму людини в умовах імунодефіциту. Встановлено, що під його впливом підвищується кількість Т-лімфоцитів, нормалізується співвідношення їх субпопуляцій і рівень сироваткового фактора некрозу пухлини – α, а рівень інтерлейкiна-4 досягає рівня здорових осіб [103]. Препарат стимулює функціональну активність мононуклеарних фагоцитів і клітин – природних кілерів, тобто активізує неспецифічні імунні реакції організму. Він пригнічує продукцію прозапальних цитокінів при алергічних захворюваннях. Препарат має виражені антитоксичні ефекти, покращує функції печінки, пригнічує розвиток пухлинних процесів, сприяє регресії пухлин шляхом їх резорбції. Він не має мутагенних, ембріотоксичних, тератогенних, пірогенних і гемолітичних властивостей. Однією з істотних переваг засобу, як інших препаратів групи дефенсинів, є його нетоксичність, що забезпечує велику терапевтичну широту вживання цього засобу [23].
Зважаючи на актуальність проблеми протозойних інвазій сечостатевої системи та отримані результати проведеного дослідження, можна дійти висновків, що:
- завдяки використанню інноваційних технологій у галузі дерматовенерології вдалося встановити нові чинники виникнення та/або перебігу ІПСШ;
- значна частина хворих на ІПСШ в наш час є недообстеженою щодо збудників протозойних інвазій, а саме, щодо Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia;
- з огляду на глобальне здоров’язбереження, визначення виду найпростіших у сечостатевій системі хворих, імовірно, має вирішальну роль у запобіганні рецидивів і реінфекцій частини ІПСШ, завдяки обґрунтуванню додаткових підстав для лікування відповідних пацієнтів та їх статевих партнерів;
- існує нагальна необхідність у широкому впровадженні праймерів для виявлення Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia в повсякденну практику закладів охорони здоров’я;
- рекомендації щодо діагностики Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia.
Визначення виду найпростіших у сечостатевій системі, імовірно, має вирішальну роль у запобіганні реінвазій, а також реінфекцій захворювання на ІПСШ (внаслідок неповного фагоцитозу патогенної та умовно-патогенної мікрофлори) завдяки додаткових підстав для лікування хворого з урахуванням можливих мікробних асоціацій, поєднаної геніальної та екстрагенітальної інвазії, імунних порушень, а також обов’язкової санації статевих партнерів. У зв’язку з цим, був запропонований комплекс рекомендацій для індивідуальної профілактики відповідних реінвазій. А саме: проведення адекватної ерадикації збудників протозойних інвазій ССС; санація власних екстрагенітальних осередків протозойних інвазій; санація генітальних та/або екстрагенітальних осередків протозойних інвазій у статевого партнера (партнерів); тривала відмова від сексуальних контактів (включно з оральними та анальними) без використання засобів бар’єрної контрацепції; нормалізація стану імунної системи.
На підставі виконаних досліджень виникає необхідність у формалізації комплексу лікувально-профілактичних і організаційних заходів, а також епідеміологічного нагляду над статевою інвазією. Для покращення ранньої діагностики інвазії Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis і Gіardia lamblia було здійснено моніторинг та інформаційно-роз’яснювальну роботу в групах ризику.
Епіднагляд включає в себе детермінанти епідеміології трихомонозу, звернення за медичною допомогою з урахуванням неповної реєстрації. Епіднагляд також виявляє групи населення, для яких потрібні цільові заходи, а саме, спеціальні дослідження з питань профілактики рецидивів і первинного зараження на трихомоноз і лямбліоз. Однак, ефективність діючих систем епіднагляду обмежується через недооцінку поширеності атипових форм трихомонозу і його безсимптомного перебігу. Тому необхідна розробка алгоритму виявлення хворих, що мають ризик розвитку посттрихомонозних станів. Для оцінки поширеності інвазії, її ускладнень і наслідків необхідний регулярний збір достовірних даних. Це вплине на ставлення до проблеми фахівців, що надають спеціалізовану медичну допомогу, і залучить додаткові ресурси для вирішення питання профілактики паразитарної патології та асоційованих ІПСШ.
Надзвичайно важливим питанням, що впливає на перебіг латентних і рецидивуючих паразитарних інвазій, є вивчення стійкості збудників до дії лікарських засобів. Органи епіднагляду повинні відстежувати і документувати випадки появи стійких штамів трихомонад і лямблій, регулярно оновлювати клінічні протоколи, своєчасно оповіщати практикуючих лікарів про внесені зміни. Рівні лікарської стійкості в різних регіонах України, як правило, відрізняються, що необхідно враховувати при формуванні терапевтичних алгоритмів.
Для ефективного епідеміологічного нагляду за протозойними інвазіями ССС необхідним є об’єднання зусиль як державних, так і приватних профільних структур, робота яких у подальшому будується на основі довгострокового, взаємовигідного співробітництва. Рекомендовано створювати стратегічні об’єднання і коаліції за участю багатосторонніх медичних структур, засобів масової інформації, громадських організацій.
Профілактична діяльність проводилася з урахуванням конкретної групи населення, чинників уразливості й індивідуальних потреб. Велике профілактичне значення мали лекції на медичні теми в навчальних закладах, міжособистісні форуми. Спеціальну інформацію намагалися робити доступною і зрозумілою для конкретної аудиторії з урахуванням культурних, національних і гендерних особливостей регіону.
Важливим профілактичним аспектом при паразитарних ІПСШ було динамічне консультування пацієнтів з рецидивуючими формами трихомонозу. Це сприяло правильній поведінці хворих у період загострення герпесвірусної інфекції і зниження ризиків репродуктивних і статевих ускладнень.
Для покращення ранньої діагностики інвазії Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis і Gіardia lamblia було здійснено моніторинг та інформаційно-роз’яснювальну роботу в групах ризику. Для закладів охорони здоров¢я України рекомендований алгоритм (блок-схема) ведення пацієнтів при обстеженні їх на наявність статевої протозойної інвазії (Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, а також Gіardia lamblia), а також алгоритм (блок-схема) маршруту пацієнтів ЛПЗ гінекологічного та урологічного профілю при наданні спеціалізованої допомоги з приводу статевої протозойної інвазії (Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, а також Gіardia lamblia).
ВИСНОВКИ
Запропоновано теоретичне обґрунтування та нове вирішення актуальної наукової і практичної проблеми сучасної дерматовенерології, що полягає в підвищенні ефективності діагностики, лікування, профілактики інвазій сечостатевої системи, спричинених Trichomonas vaginalis та іншими представниками типу найпростіших на підставі даних про їх епідеміологію, клініку, біологічні властивості збудників, морфопатогенез, а також про наявність супутньої колонізації умовно-патогенними збудниками.
- Значна поширеність, хронічний, рецидивуючий характер перебігу з можливістю виникнення тяжких ускладнень, недостатня вивченість механізмів патогенезу, негативні соціальні наслідки, а також недоліки в наданні медичної допомоги роблять проблему діагностики, лікування і профілактики протозойних інвазій сечостатевої системи актуальною для науки і практики та обумовлють необхідність її всебічного вивчення.
- Розроблено оригінальні праймери для виявлення Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia методом полімеразної ланцюгової реакції в модифікації «у реальному часі». Секвенування біологічного матеріалу, взятого від 62 пацієнтів, у яких було виявлено ДНК цих найпростіших показало відповідність оригінальних праймерів названим мікроорганізмам – тобто їх високу специфічність. Використання цих праймерів дозволяє виявляти протозойні інвазії сечостатевої системи удвічі ефективніше, ніж застосування культурального методу.
- Протозойні інвазії трапляються у 29 – 40% пацієнтів, з хронічним перебігом інфекцій, що передаються статевим шляхом. Поширеність Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia залежить від груп обстежуваних пацієнтів, і становить, відповідно, 9,3 – 32%; 12,4 – 16,4% і 4,2 – 6%. Має місце тенденція до зниження реєстрації трихомонозу, але темпи зниження варіюють, залежно від місця проживання, вікового та гендерного складу популяції. Захворюваність є більшою серед жінок, особливо, у молодому віці. В ряді регіонів серед молоді 15-20 років, захворюваність знижується досить повільно. Статистичні дані щодо трихомонадної інфекції не відображають її поширеності внаслідок неповної реєстрації.
- Ультраструктурні особливості трихомонад та супутніх бактерій в хворих на трихомоноз свідчать про те, що округлі форми vaginalis є однією з вірулентних, а не дегенеративних форм, оскільки вони мають необхідну морфологічну організацію і здатні спричиняти патогенний вплив на макроорганізм. Структурні зміни, що спостерігаються в цитоплазмі округлих форм, вказують на зниження їх фізіологічної активності внаслідок несприятливих факторів.
- Розподіл генотипів vaginalis за поліморфізмом гена актину в українській популяції характеризується домінуванням генотипу Е (69,0 %) при порівняно низькій частоті виявлення генотипів G (21,4 %), H (14,3 %) та А (3,5 %). При цьому не було виявлено достовірної різниці у розподілі генотипів T. vaginalis у центральному та північно-східному регіонах України.
- Клініко-імунологічні показники пацієнтів хворих на інфекції, що передаються статевим шляхом з хронічним перебігом, вказують на імунну недостатність клітинної ланки імунітету в 41,6 %. Це слугує підґрунтям для призначення імуномодулюючої терапії, зокрема препарату суміші дефензинів, призначення якого призводить до часткової нормалізації показників імунограм.
- Протозойні інвазії сечостатевої системи в 92% випадків супроводжують мікроорганізми, асоційовані з бактеріальним вагінозом. У жінок це частіше: Candida spp., Eubacterium spp., Mobiluncus spp./Corynebacterium spp., Gardnerella vaginalis/Prevotella bivia/ Porphyromonas spp. У чоловіків переважають наступні мікроорганізми: Enterobacteriaceae, Streptococcus spp., Staphylococcus spp,. Gardnerella vaginalis/Prevotella bivia/Porphyromonas spp., Eubacterium spp., Sneathia spp./Leptotrihia spp./Fusobacterium spp., Mobiluncus spp./Corynebacterium spp., Peptostreptococcus spp. Гендерні відмінності в частоті виявлення вказаних мікроорганізмів вказують на їх пристосування до сечостатевої системи чоловіків. Тому можна розглядати Pentatrichomonas hominis, Trichomonas tenax і Giardia lamblia в якості важливих чинників бактеріального вагінозу в жінок, а також відповідного анаеробного та мікроаерофільного дисбіозу в чоловіків.
- Запропоновано метод комплексного лікування уражень сечостатевої системи, спричинених трихомонадами та лямбліями, в тому числі, при супутньому інфікуванні анаеробними та мікроаерофільними мікроорганізмами за рахунок послідовного призначення секнідазолу та препарату, що містить 0,5 орнідазолу та 0,5 ципрофлоксацину. Клінічне одужання наступило в 93 % випадків, бактеріологічна санація – в 97 %. За наявності імунодефіцитних станів запропоновано курс лікування з подовженим (до 20 діб) строком послідовного прийому двох протистоцидних препаратів різних фармакологічних груп – ніфуротелю та орнідазолу. Разом з тим, з метою імунокорекції, одночасно призначається препарат суміші α і ß-дефенсинів. Бактеріологічна санація досягається в 96,9 %.
- Розроблено і впроваджено сучасні алгоритми надання та організації надання медичної допомоги хворим на сечостатевий трихомоноз з урахуванням можливості виявлення різних видів трихомонад та лямблії для запобігання тяжких медичних і соціальних наслідків хронічного перебігу інвазії. Запропоновано комплекс дій для суспільної та індивідуальної профілактики реінвазій.
РЕКОМЕНДАЦІЇ
Для покращення ранньої діагностики інвазій Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis і Gіardia lamblia слід проводити інформаційно-роз’яснювальну роботу в групах ризику, доцільно використовувати молекулярно-біологічні методи (ПЛР) для виявлення означених збудників. Необхідно забезпечити реєстрацію відповідних хворих із зазначенням віку, статі, провідного синдрому і етіологічних даних, як у загальній популяції, так і серед окремих груп населення.
Слід дотримуватись алгоритму ведення хворих, що мають ризик розвитку ускладнень, рецидивів та реінфекцій. При наявності показань до лікування застосовувати розроблені методи лікування. В якості етіотропних засобів доцільно послідовно використовуватит секнідазол по 2 г 1 раз на день протягом 5 днів, потім 500 мг ципрофлоксацину + 500 мг орнідазолу 2-3 рази (залежно від маси тіла) в день протягом 10 днів. При хронічних, повторних випадках змішаної трихомонадної інвазії, а також з метою імунокорекції вводиться суміш α- і ß-дефенсинів внутрішньом’язово по схемі – 2 мл через день впродовж 20 днів, одночасно з курсом специфічної терапії протозойних інвазій. А саме, внутрішньо призначається орнідазол по 1,5 г на добу. Препарат приймається по 0,5 г тричі на добу після їди на протягом 10 діб. У перший день лікування добова доза орнідазолу вживається за один прийом під час вечері. Наступні 10 днів хворі мають отримувати по 400 мг ніфуротелю тричі на добу, незалежно від прийому їди. У разі необхідності, через 5 днів після початку специфічної антипротозойної терапії, призначаються додаткові антибактеріальні препарати з метою елімінації з урогенітальної системи інших збудників ІПСШ, не чутливих до ніфуротелю та орнідазолу. Крім того, чоловіки, у разі потреби, мають отримувати пальцьовий масаж передміхурової залози та ректальні протизапальні свічки. Жінкам рекомендовані щоденні вагінальні спринцювання та піхвові таблетки з ніфуротелем та ністатином, а також свічки з хлоргексидином послідовно протягом 8 та 10 днів, відповідно. Під час лікування пацієнтам заборонено мати сексуальні контакти, а в контрольний період – лише із застосуванням презервативів. Запропоновано комплекс рекомендацій для індивідуальної профілактики відповідних реінвазій: проведення адекватної ерадикації збудників протозойних інвазій сечостатевої системи; санація власних екстрагенітальних осередків протозойних інвазій; санація генітальних та/або екстрагенітальних осередків протозойних інвазій у статевих партнерів; тривала відмова від сексуальних контактів, включно з оральними та анальними, без використання засобів бар’єрної контрацепції; нормалізація стану імунної системи.
Скринінг і обстеження на паразитарну патологію, а також профілактична терапія нітроімідазолами та антибіотиками є важливими елементами, як індивідуальної профілактики рецидивів, так і суспільної профілактики ІПСШ в цілому.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Абдрахманов Р.М., Халилов Б.В., Абдрахманов А.Р. Диагностика и лечение хронического урогенитального трихомониаза у мужчин. Урология. № 2. С. 47–51.
- Акабышева К.С., Рамазанова Б.А., Джумабаева С.М. Некоторые патогенетические аспекты урогенитального трихомониаза (литературный обзор). Вестник КазНМУ. 2015. № 1. С. 372–376.
- Актуальность инфекций, передающихся половым путем. Интервью с профессором А.Д. Юцковским. РМЖ. 2014. № 24. С. 1746–1750.
- Аналіз сексуальної поведінки сучасних молодих осіб із вищою освітою / П.В. Федорич, В.П. Філіпішин, Л.Я Федорич., І.Г. Миколюк, Мехмет Бюлент Багчі. Сучасні аспекти військової медицини. Збірник наукових праць. К., 2013. Вип. 20. С. 328–334.
- Андрейчев В.В. Дисбиотические нарушения микрофлоры в репродуктивном тракте у мужчин с хроническим трихомониазом : дис. канд. мед. наук : 03.02.03 – Микробиология; 14.01.10 – Кожные и венерические болезни. Челябинск, 2011. 156 с.
- Анфілова М.Р. Соціальний портрет сучасного підлітка із захворюваннями, що передаються статевим шляхом. Український журнал дерматології, венерології, косметології. 2012. № 3 (46). С. 144–147.
- Атаман О.В. Патофізіологія: в 2 т. Т 1 Загальна патологія: підручник для студ. вищ. мед. навч. заклад. Вінниця : Нова Книга, 2014. 592 с.
- Атлас по медицинской микробиологии, вирусологии и иммунологии. 2-е изд. / А.С. Быков, А.А. Воробьев, В.В. Зверев и др. М. : ООО «Медицинское информационное агенство», 2008. 340 с.
- Бардова К.О., Горбасенко Н.В. Трихомоноз у жінок: сучасні стандарти в лікуванні. Український журнал дерматології, венерології, косметології. 2012. № 2 (45). С. 112–116.
- Басова Т.А., Гладилин Г.П., Рогожина И.Е. Паразитозы у женщин с цервицитом, проживающих на территории города Саратова. Фундаментальные исследования. 2011. № 9–1. С. 11–14.
- Белова-Рахимова Л.В., Прохоренков В.И., Гузей Т.Н. Пути развития венерологии в России и СССР (1950-1959). Вестник дерматологии и венерологии. 2015. № 2. С. 141-147.
- Бобрицька Л.О. Ефективність метронідазолу й орнідазолу при лікуванні урогенітального трихомоніазу. Актуальні питання фармацевтичної і медичної науки та практики. 2011. Т. 24, № 1. С. 120–121.
- Бодня К.І. Лечение лямблиоза у детей и взрослых. Актуальная инфектология. 2015. № 4 (9). С. 31–37.
- Бодня К.І., Мочалова Г.О., Кадельник Л.О. Лямбліоз: обстеження і терапія в сучасних умовах. Актуальная инфектология. 2015. № 1 (6). С. 27–33.
- Бойчук А.В., Мельник В.Л., Шадрина В.С. Сучасні тенденції лікування мікст-інфекцій урогенітального тракту. Здоровье женщины. 2010. № 8. С. 153–156.
- Бондаренко Г.М., Никитенко И.Н. Опыт применения биорегуляторных пептидов в лечении пациентов с урогенитальной инфекцией. Дерматологія та венерологія. 2012. № 1(55). С. 69–74.
- Бондаренко Г.М., Никитенко И.Н., Щербакова Ю.В. Особенности лечения резистентного трихомониаза. Укр. журн. дерматології, венерології, косметології. 2016. № 2 (61). С. 79–84.
- Боровкова Е.И. Современные стандарты терапии инфекций, передаваемых половым путем. Медицинский совет. 2014. № 11. С. 84–89.
- Бочкарев Е.Г., Сергеев Ю.В. Место ПЦР в диагностике инфекций, передающихся половым путем. Иммунопатология, аллергология, инфектология. 2003. № 3. С. 112–116.
- Бурка О.А., Сідорова І.В. Trichomonas vaginalis: контроверсійні питання. Репродуктивна ендокринологія. 2017. № 6 (38). С. 31–34.
- Венгеров Ю.Я., Мигманов Т.Э., Нагибина М.В. Инфекционные и паразитарные болезни: справочник практического врача. М. : МЕДпрессинформ, 2010. 448 с.
- Взгляд клинического фармаколога на лечение урогенитальных инфекций / Л.Н. Ветошкина, А.Р. Умерова, И.П. Дорфман, Т.А. Ткаченко. РМЖ. 2015. Т. 23, № 19. С. 1137–1141.
- Вивчення впливу Цереброкурину® і ліпіну на зміни мітохондрій тканини мозку щурів в умовах експериментальної моделі гіпоксії / Т.К. Знаменська, В.І. Похилько, К.В. Розова та ін. Лікарська справа. 2006. № 8. С. 84–89.
- Визначення деяких найпростіших (Trichomonas tenax, Trichomonas hominis, Giardia lamblia, Entamoeba histolytica, Entamoeba gingivalis) у пацієнтів, хворих на урогенітальні інфекції методом ПЛР в реальному часі / П.В. Федорич, С.Б. Зелений, Л.С. Зайцева, О.В. Мазій. Український журнал дерматології, венерології, косметології. 2012. № 4 (47). С. 5–10.
- Визначення поширеності інфікування Giardia lamblia сечостатевої системи хворих з інфекціями, що передаються переважно статевим шляхом / П.В. Федорич, С.Б. Зелений, Л.Я. Федорич, Х.І. Шеховцова. Український журнал дерматології, венерології, косметології. 2015. № 2 (57). С. 67–70.
- Вялов С.С. Противомикробная терапия: алгоритмы выбора: Практич. рук-во. 3-е изд. М. : МЕДпресс-информ, 2012. 208 с.
- Гончарова С.Ю., Голодок Л.П., Хлопова О.В. Исследование микрофлоры урогенитального тракта женщин днепропетровской области с помощью метода полимеразной цепной реакции. Бiологiчний вiсник Мелiтопольского державного педагогiчного унiверситету iм. Богдана Хмельницького. 2015. Т. 5, № 2 (15). С. 75–84.
- Горчаков Д.А. Патогенетические особенности урогенитального трихомониаза в гендерном аспекте : дис. канд. мед. наук : 14.03.03 – Патологическая физиология. Саратов, 2014. 134 с.
- Григорьев А.Н. Современное состояние проблемы лабораторной диагностики урогенитального трихомониаза. Журнал акушерства и женских болезней. 2013. Т. LXII, № 1. С. 32–41.
- Гриценко В.А., Андрейчев В.В. Урогенитальный трихомониаз у мужчин: 1. Характеристика возбудителя и эпидемиологические особенности. Бюллетень Оренбургского научного центра УрО РАН. 2013 № 4. С. 1–14.
- Гриценко В.А., Андрейчев В.В., Иванов Ю.Б. Урогенитальный трихомониаз у мужчин: 2. Клинико-микробиологические аспекты. Бюллетень Оренбургского научного центра УрО РАН (электронный журнал). 2014. № 1. С. 1–13.
- Гущин А.Е., Рыжих П.Г., Махлай Н.С. Сравнение пределов обнаружения микроскопии, культурального посева и методов амплификации нуклеиновых кислот, используемых в лабораторной практике для выявления Trichomonas vaginalis. Клиническая дерматология и венерология. 2012. Т.10, № 3. С. 16–21.
- Дащук А.М., Петров Б.Р. Венерические болезни. (Инфекционные болезни, передающиеся половым путем): рук-во. Х. : С.А.М., 2009. 294 с.
- Державний формуляр лікарських засобів. Випуск десятий. К., 2018. 1222 с.
- Дерматологія, венерологія. Підручник / За ред. В.І. Степаненка. К. : КІМ, 2012. 848 с.
- Джораєва С.К., Мавров Г.І. Етіотропне лікування запальних захворювань сечостатевих органів. Тези/Absracts I-го міжнародного конгресу «Раціональне використання антибіотиків у сучасному світі. Antibiotic resistance STOP!», 15–16 листопада 2018 р., Київ, Україна. К., 2018. С. 28.
- Дисбиотические нарушения микрофлоры урогенитального тракта у мужчин с хроническим трихомониазом и хламидиозом. / В.А. Гриценко, В.В. Андрейчев, О.А. Воронова и др. Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. 2011. № 3 (16). С. 27–33.
- Дюдюн А.Д., Полион Н.Н., Горбунцов В.В. Секнидазол в комплексном лечении больных урогенитальным трихомониазом. Дерматовенерология. Косметология. Сексопатология. 2016. № 1–4. С. 287–292.
- Етіотропна профілактика післяопераційних ускладнень черезміхурової простатектомії у хворих на доброякісну гіперплазію передміхурової залози, інфікованих урогенітальним трихомоніазом / С.П. Пасєчніков, В.С. Грицай, А.С. Глєбов, С.В. Нашеда. Здоровье мужчины. 2016. № 3 (58). С. 164–167.
- К вопросу о роли полимеразной цепной реакции в комплексной диагностике урогенитальных инфекций / Е.В. Горелова, А.Г. Бойцов, Т.В. Домакова, В.С. Щеглов. Инфекция и иммунитет. 2011. Т. 1, № 2. С. 167–170.
- Каденко О.А., Болотюк М.В. Сравнительная характеристика эффективности методов лабораторной диагностики урогенитального трихомониаза собственные исследования. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. № 1–2. С. 86–94.
- Каминский В.В., Саханова А.А., Зеленская М.В. Современные подходы к терапии бактериальных вагинозов. К., 2007. 30 с.
- Камышева К.С. Основы микробиологии и иммунологии. Учебное пособие. М. : Феникс, 2016. 381 с.
- Кириуцов А.М., Лин Г.А., Чаплыгина В.А. Мочеполовой трихомониаз в практике врача-дерматовенеролога. Український журнал дерматології, венерології, косметології. 2011. № 4 (43). С. 107–112.
- Кисина В., Вавилов В., Гущин А. Урогенитальный трихомониаз: современный взгляд на проблему. Врач. 2010. № 1. С. 18–20.
- Кисина В.И., Гущин А.Е., Забиров К.И. Инфекции, передаваемые половым путем. М. : Гэотар-Медиа, 2020. 144 с.
- Клименко Н.А., Шевченко А.Н. Патологическая физиология. Ч. 1. Общая патология: учеб. пособие. Харьков : ХНМУ, 2010. 484 с.
- Клинический случай инвазии Trichomonas vaginalis беременной женщины и ее новорожденной / Г.И. Мавров, Т.В. Осинская, П.В. Федорич, Л.В. Гречанская. Georgian Medical News. 2019. № 12 (297). С. 41–46.
- Кобзарь А.И. Прикладная математическая статистика. Для инженеров и научных работников. М. : Физматлит, 2012. 816 с.
- Коблош Н.Д. Стан мікроекології статевих шляхів у жінок з патологією шийки матки. Здоровье женщины. 2014. № 3 (89). С. 149–152.
- Коган Б.Г., Гордеева Г.Д. Роль комбинированных антибактериальных средств в комплексном лечении воспалительных заболеваний женских половых органов смешанной этиологии. Здоровье женщины. № 5. С. 86–90.
- Компендіум 2019 – лікарські препарати / За ред. В.М. Коваленка. К. : Моріон, 2019. 2480 с.
- Компоненты PCR смеси [Электронный ресурс]. URL: http://molbiol.ru/protocol/12_01.html (дата обращения: 26.10.2018).
- Концепція загальнодержавної цільової програми розвитку системи спеціалізованої медичної допомоги пацієнтам із захворюваннями шкіри та інфекціями, що передаються статевим шляхом, на період до 2020 року. Український журнал дерматології, венерології, косметології. 2016. № 1 (60). С. 7–13.
- Корнацька А.Г., Вовк І.Б., Чубей Г.В. Запальні захворювання органів малого таза, спричинені інфекціями, що передаються статевим шляхом. Здоров’я України. 2012. № 4 (8). С. 38–39.
- Кулага В.В., Лемешко В.А. Кожные и венерические болезни. Практикующему врачу. К. : Изд-во «Книга плюс», 2013. – 512 с.
- Лечение урогенитального трихомониаза у мужчин в условиях возросшей резистентности Trichomonаs vaginalis / Подг. В. Лисица. Медичні аспекти здоров’я чоловіка. 2018. № 1 (28). С. 17–21.
- Лукьянов И.Э. Современные подходы к лечению резистентной трихомонадной инвазии в сочетании с хламидиозом, микоплазмозом и генитальным герпесом. Дерматологія та венерологія. 2015. № 3 (69). С. 5–15.
- Луцик Б.Д. Лабораторная диагностика некоторых паразитарных заболеваний человека. Лабораторна діагностика. 2013. № 3 (65). С. 55–59.
- Лысак В.В., Фомина О.В. Систематика микроорганизмов : учеб. пособие. Минск : БГУ, 2014. 304 с.
- Мавров Г.И., Нагорный А.Е. Ультраструктурные изменения сперматозоонов при инфекции, вызванной Herpes sіmplex, Chlamydіa trachomatіs, Trіchomonas vagіnalіs. Дерматологія та венерологія. 2012. № 4 (58). С. 45–57.
- Мавров Г.И., Нагорный А.Е., Чинов Г.П. Инфекции, передающиеся половым путем, и проблема сексуального и репродуктивного здоровья нации. Клінічна імунологія. Алергологія. Інфектологія. 2010. Спецвипуск № 1. С. 5–14.
- Мавров Г.И., Никитенко И.Н., Клетной А.Г. Проблема трихомониаза (современные подходы к диагностике, этиотропной и патогенетической терапии). Дерматологія та венерологія. 2003. № 2 (20). С. 7–11.
- Мавров Г.І., Чінов Г.П., Нагорний О.Є. Особливості сексуальності та структура інфекцій, що передаються статевим шляхом, в осіб старше 60 років. Клінічна імунологія. Алергологія. Інфектологія. 2011. Спецвипуск № 1. С. 62–67.
- Мавров І.І. Статеві хвороби: Пер. з рос. Тернопіль : ТДМУ, 2005. 716 с.
- Мавров І.І., Бєлозоров О.П., Тацька Л.С. Уніфікація лабораторних методів дослідження в діагностиці захворювань, що передаються статевим шляхом. Х. : Факт, 2000. 120 с.
- Мазур И.П., Бакшутова Н.А., Ставская Д.М. Клиническая и микробиологическая эффективность применения местных противомикробных и антисептических препаратов при лечении заболеваний пародонта. Современная стоматология. 2014. № 1. 32–38.
- МАКМИРОР Polichem – офіційна інструкція, ціна в аптеках, аналоги, склад, показання, відгуки [Електронний ресурс]. Компендіум. URL: https://compendium.com.ua/dec/269904/ (дата звернення: 29.11.2017).
- Малова И.О., Сидорова И.А. Рациональная терапия урогенитального хламидиоза у женщин репродуктивного возраста. Вопросы гинекологии, акушерства и перинатологии. 2014. № 1. С. 15–21.
- Махлай Н.С. Лабораторные методы диагностики урогенитального трихомоноза. Инфекция и иммунитет. 2011. Т. 1, № 3. С. 243–248.
- Медицинская микробиология, вирусология и иммунология : Учебник для студентов медицинских вузов / Под ред. А.А. Воробьева. 2-е изд. М. : ООО Медицинское информационное агентство, 2012. 704 с.
- Механізм проникнення ВІЛ-інфекції / Г.І. Мавров, Ю.В. Щербакова, К.Є. Іщейкін та ін. Вісник Української медичної стоматологічної академії «Актуальні проблеми сучасної медицини». 2019. Т. 19, Вип. 2 (66). С. 235–240.
- Молекулярно-генетическое исследование клинического материала с использованием праймеров к различным участкам генома Trichomonas vaginalis и различным видам царства Protozoa / А.Е. Гущин, П.Г. Рыжих, Л.А. Березина и др. Молекулярная диагностика. Том III. Раздел 14. Инфекции органов репродукции. М., 2010. С. 204–207.
- Молекулярное типирование Trichomonas vaginalis, циркулирующих в Украине,на основании полиморфизма гена актина / А.П. Белозоров, П.В. Федорич, Г.И. Мавров, А.Д. Зеленская, Е.Н. Горобчишина. Дерматологія та венерологія. 2019. № 1. С. 8–12.
- Мурзина Э.А. Резистентность к противомикробным препаратам – возрастающая проблема современности. Дерматовенерологія. Косметологія і сексопатологія. 2016. № 3–4. С. 34–37.
- Мустафина Г.Р. Информативность методов диагностики урогенитального трихомониаза и обоснование показаний к применению ПЦР в реальном времени : автореф. дисс. … канд. мед. наук : 03.02.03 – микробиология, 14.01.10 – кожные и венерические болезни. Уфа, 2010. 23 с.
- Муталляпова Г.З. Проблемы диагностики инфекций передающихся половым путем методом полимеразной цепной реакции. Клиническая медицина Казахстана. 2011. № 3, 4 (22, 23). С. 325–328.
- Нагорный А.Е. Эпидемиология генитального герпеса, хламидиоза и трихомоноза в Украине и регионах в период 2005 – 2010 годы. Український журнал дерматології, венерології, косметології. 2011. № 3 (56). С. 5–14.
- Наказ МОЗ України № 312 від 08.05.2009 «Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання». К., 2009.
- Неймарк С.Л., Неймарк О.С. Дискуссионные проблемы диагностики и лечения трихомонадной инфекции. Збірник наукових праць Асоціації акушерів-гінекологів України. 2014. Вип. 1–2. С. 236–238.
- Нечипоренко Н.М. Мікробні біоплівки в патогенезі резистентності та хронізації інфекцій урогенітального тракту. Дерматовенерологія. Косметологія. Сексопатологія. №1–2 (3). С. 44–54.
- Никитенко И.Н. Современный взгляд на проблему бактериального вагиноза. Дерматологія та венерологія. 2014. № 3 (65). С. 31–42.
- Федорич П.В. Обґрунтування необхідності поглибленого вивчення сучасних багатовогнищевих поєднаних генітально-екстрагенітальних ІПСШ. Наукова конференція молодих вчених Української військово-медичної академії: Тез. доп., м. Київ, 17–18 травня 2013 р. К., 2013. Ч.1. С. 51–52.
- Опыт применения местных средств в лечении урогенитального трихомоноза / Г.М. Бондаренко, Ю.В. Щербакова, И.Н. Никитенко и др. Репродуктивная эндокринология. 2014. № 2 (16). С. 49–55.
- ОРЦИПОЛ World Medicine – офіційна інструкція, ціна в аптеках, аналоги, склад, показання, відгуки [Електронний ресурс]. Компендіум. URL: https://compendium.com.ua/dec/262240/ (дата звернення: 29.11.2017).
- Осінська Т.В., Губенко Т.В., Унучко С.В. До питання трихомоніазу вагітних, хворих на сифіліс та мікоплазмоз. Тези доповідей Всеукраїнської науково-практичної конференції Української асоціації лікарів-дерматовенерологів і косметологів «Сучасні підходи до формування клінічних настанов з діагностики і лікування шкірних захворювань та інфекцій, що передаються статевим шляхом: європейський досвід і українські реалії», 19–20 жовтня 2016 р., м. Тернопіль. Український журнал дерматології, венерології, косметології. 2016. № 4 (63). С. 126.
- Основы молекулярной биологии клетки. 2-е изд. / Б. Альбертс, Д. Брей, К. Хопкин и др. М. : Бином. Лаборатория знаний, 2018. 768 с.
- Оценка методов амплификации нуклеиновых кислот для диагностики трихомониаза / Е.В. Шипицына, Е.А. Золотоверхая, А.Н. Григорьев и др. Журнал акушерства и женских болезней. 2011. № 3. С. 73–79.
- Пасечников С.П., Нашеда С.В. Оценка эффективности лечения воспалительных заболеваний мужских половых органов трихомонадно-бактериальной этиологии препаратом грандазол. Почки. 2015. № 3 (13). С. 27–31.
- Пасєчніков С.П., Нашеда С.В. Порівняльна характеристика ефективності полімеразної ланцюгової реакції та культурального методу у виявленні Trichomonas vaginalis у хворих на доброякісну гіперплазію передміхурової залози. Здоровье мужчины. 2015. № 1. С. 109–111.
- Пат. на винахід 107910 Україна, МПК С12/Q 1/68 (2006.01), С12/Q 1/04 (2006.01), С12/N15/11 (2006.01). Спосіб визначення присутності Trichomonas tenax у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201407161; заявл. 25.06.2014; опубл. 25.02.15, Бюл. № 4.
- Пат. на винахід 110759 Україна, МПК С12/Q 1/68 (2006.01),С12/Q 1/04 (2006.01),С12/N15/11 (2006.01), С12/R 1/90(2006.01). Спосіб визначення присутності Pentatrichomonas hominis у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201501255; заявл. 16.02.2015; опубл. 10.02.16, Бюл. №3.
- Пат. на винахід 110767 Україна, МПК С12/Q 1/68 (2006.01),С12/Q 1/04 (2006.01),С12/N15/11 (2006.01), С12/R 1/90(2006.01). Спосіб визначення присутності Giardia lamblia у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201505750; заявл. 11.06.2015 ; опубл. 10.02.16, Бюл. №3.
- Пат. на корисну модель 109257 Україна, МПК А61К (2016.01),А61Р (2016.01). Спосіб лікування хронічного трихомоніазу сечостатевої системи, викликаного Trichomonas tenax або Pentatrichomonas hominis / Федорич П.В. – заявник та патентовласник. – u20151294; заявл. 21.12.2015; опубл. 25.08.16, Бюл. №16.
- Пат. на корисну модель. 103397 Україна, МПК А61К 31/345 (2006.01),А61К 31/7080 (2006.01),А61/Р 17/04 (2006.01). Спосіб лікування хронічного трихомоніазу / Федорич П.В. – заявник та патентовласник. – u201506813; заявл. 09.07.2015; опубл. 10.12.15, Бюл. №23.
- Патофізіологія: підручник / М.Н. Зайко, Ю.В. Биць, В.Ф. Мислицький та ін.; за ред.: М.Н. Зайка, Ю.В. Биця, М.В. Кришталя. 4-е вид., перероб. і доп. К. : Медицина, 2014. 752 с.
- Перебіг післяопераційного періоду в залежності від виявленого збудника захворювань, що передаються статевим шляхом, у хворих на доброякісну гіперплазію передміхурової залози / С.П. Пасєчніков, В.С. Грицай, С.В. Нашеда, А.С. Глєбов. Здоровье мужчины. 2014. № 2. С. 75–78.
- Перинатальна інвазія Trichomonas vaginalis, як проблема репродуктивної медицини / Г.М. Бондаренко, Г.І. Мавров, Т.В. Осінська та ін. Журнал Національної академії медичних наук України. 2016. Т. 22, № 3–4. С. 368–376.
- Перламутров Ю.Н., Чернова Н.И. Эффективность применения «Макмирора» у больных с рецидивирующим мочеполовым трихомониазом. Український журнал дерматології, венерології, косметології. 2014. № 1 (52). С.102–104.
- Подольський Вл.В., Подольский В.В., Федорич П.В. Оптимізація лікування хронічних запальних захворювань статевих органів у жінок фертильного віку з урахуванням міжнародного досвіду: метод. рек. (№ 94/2017). К., 2018. 12 с.
- Показники лікувально-профілактичної допомоги хворим шкірними і венеричними захворюваннями в Україні / Відп. за вип. В.М. Заболотько. К. : Центр медичної статистики МОЗ України, 2017. 112 с.
- Порівняння ефективності діагностики трихомоніазу за культуральним методом та методом полімеразної ланцюгової реакції з використанням праймерів для виявлення Trichomonas vaginalis, Trichomonas tenax та Pentatrichomonas hominis. / П.В. Федорич, С.Б. Зелений, О.А. Садовська, К.В. Дудікова. Український журнал дерматології, венерології, косметології. 2017. № 1 (64). С. 65–69.
- ПРОПЕС НІР – офіційна інструкція, ціна в аптеках, аналоги, склад, показання, відгуки [Електронний ресурс]. Компендіум. URL: https://compendium.com.ua/dec/268217/.
- Разработка и применение тест-системы для определения чувствительности Trichomonas vaginalis к препаратам групп 5-нитроимидазола и 5-нитрофурана / А.Б. Жебрун, Л.А. Березина, А.В. Закревская и др. Журн. микробиол. эпидемиол. и иммунобиол. 2011. № 3. C. 71–75.
- Рахматулина М.Р. Терапия ассоциированных урогенитальных инфекций. Вестник дерматологии и венерологии. 2012. № 4. С. 112–117.
- Рыжих П.Г., Гущин А.Е. К вопросу о лабораторной диагностике урогенитального трихомониаза с учетом концентрации Trichomonas vaginalis в биологическом материале. Клиническая дерматология и венерология. 2013. Т. 11, № 5. С. 44–48.
- Рыжих П.Г., Гущин А.Е., Савочкина Ю.А. Сравнительная оценка аналитической чувствительности методов микроскопии и амплификации нуклеиновых кислот при обнаружении Trichomonas vaginalis. Клиническая дерматология и венерология. 2011. № 2. С. 28–35.
- Савичева А.М., Соколовский Е.В., Красносельских Т.В. Лабораторная диагностика урогенитального трихомониаза: Методические рекомендации. СПб. : Н‑Л, 2011. 36 с.
- Савоськина В.А. Современная проблематика трихомониаза: эпидемиология, клиника, течение, диагностика и терапия. Дерматологія та венерологія. 2018. № 3 (77). С. 18–26.
- СЕКНІДОКС World Medicine – офіційна інструкція, ціна в аптеках, аналоги, склад, показання, відгуки [Електронний ресурс]. Компендіум. URL: https://compendium.com.ua/dec/262749/ (дата звернення: 29.11.2017).
- Сивкович С.А. Использование отечественного препарата Пропес при лечении больных злокачественными лимфомами. Материалы конференции «Проблемы онкоиммунологии: научные и прикладные аспекты». К., 2003. С. 33.
- Симонова Е.В., Землянская Ю.М. Гетероморфизм Trichomonas vaginalis в организме мужчин с хроническим урогенитальным трихомониазом. Тихоокеанский медицинский журнал. 2016. № 1 (61). С. 56–58.
- Современные методы диагностики инфекций, передаваемых половым путем / А.С. Коновалов, А.В. Ходяков, А.Г. Зуева, Г.А. Хайруллина. Трудный пациент. 2018. Т. 16, № 4. С. 54–57.
- Состояние микрофлоры урогенитального тракта у половых партнеров при хроническом мочеполовом трихомониазе (обзор литературы) / Н.А. Неронова, Е.В. Симонова, Е.А. Жигалова и др. Бюллетень ВСНЦ СО РАМН. 2012. № 3 (85), ч. 1. С. 135–140.
- Сравнение лабораторных методов диагностики инфекций, вызываемых Trichomonas vaginalis / З.М. Мартикайнен, А.Н. Григорьев, О.С. Рыжкова и др. Журнал акушерства и женских болезней. 2014. Т. LXIII, № 1. С. 5–9.
- Степаненко В.І., Іванов С.В. Крем «Розамет» у лікуванні розацеа, баланопоститу та вульвовагініту. Український журнал дерматології, венерології, косметології. 2014. № 1 (53). С. 119–126.
- Степаненко В.І., Чоботарь А.І., Бондарь С.О. Дерматологія і венерологія: підручник для мед. ВНЗ І-ІІІ р.а. К. : Медицина, 2015. 336 с.
- Сучасні епідеміологічні аспекти трихомонозу в Україні / П.В. Федорич, Г.І. Мавров, Т.В. Осінська, Л.В. Іващенко. Дерматологія та венерологія. 2020. № 1 (87). С. 44–51.
- Сучасні уявлення про бактерицидну активність фагоцитів / Р.П. Маслянко, Д.М. Левківський, І.І. Олексюк, А.І. Падовський. Науковий вісник Львівського національного університету ветеринарної медицини та біотехнологій ім. Ґжицького. 2014. Т. 14, № 2 (1). С. 225–230.
- Сюч Н.И., Мачкалян К.Э., Брагина Е.Е. Ультраструктура влагалищных трихомонад: адаптационная изменчивость под влиянием мутагена (нитрозогуанидин). Клиническая дерматология и венерология. 2012. № 6. С. 80–87.
- Сюч Н.И., Мачкалян К.Э., Махнева Н.В. Фенотипическая изменчивость влагалищных трихомонад как причина устойчивости к метронидазолу. Российский журнал кожных и венерических болезней. 2016. № 19 (1). С. 64–68.
- Терапия метронидазолрезистентного трихомониаза комбинацией ципрофлоксацина и тинидазола / И.И. Горпинченко, М.Г. Романюк, А.М. Корниенко и др. Здоровье мужчины. 2014. № 1. С. 95–98.
- Трихомониаз – актуальные вопросы лабораторной диагностики / А.А. Чураков, Л.А. Дерюгина, Б.И. Блюмберг, В.М. Попков. Современные проблемы науки и образования. 2012. Вып. 2. С. 1–10.
- Трихомониаз: медико-биологические характеристики возбудителя и значимость лабораторных методов для верификации диагноза (аналитический обзор) / С.К. Джораева, В.В. Гончаренко, Е.В. Щеголева, А.Р. Бабута. Дерматологiя та венерологiя. 2016. № 3 (73). С. 15–28.
- Туркевич О.Ю. Деякі питання етіопатогенетичного обгрунтування комплексного лікування бактеріального вагінозу. Укр. журн. дерматології, венерології, косметології. 2010. № 1. С. 92–96.
- Удовиченко В.И. Клинико-фармакологическое обоснование применения нифуротела для лечения трихомониаза, ассоциированного с бактериальной и грибковой инфекцией (обзор опубликованных результатов зарубежных клинических исследований). Український журнал дерматології, венерології, косметології. 2013. № 3 (50). С. 116–122.
- Ультраструктурные особенности морфотипов Trichomonas vaginalis, выделенных от больных с хронической трихомонадной инвазией / П.В. Федорич, Г.И. Мавров, С.К. Джораева, Т.В. Осинская. Дерматологія та венерологія. 2018. № 4 (82). С. 17–22.
- Урогенитальный трихомоноз: новые возможности топической иммуномодулирующей терапии / Г.И. Мавров, Г.М. Бондаренко, Л.В. Иващенко и др. Дерматологiя та венерологiя. 2011. № 3 (53). С. 69–77.
- Устинов Д.В., Айзикович Б.И. Особенности иммунометаболического статуса у больных хроническим уретритом. Современные наукоемкие технологии. 2010. № 2. С. 122–123.
- Фармакологические свойства препарата Пропес (экспериментальное исследование) / В.В. Захаренко, В.Я. Найштетик, И.Г. Кудрявцева и др. Отчет Института фармакологии и токсикологии АМН Украины. К., 1993.
- Федорич П.В., Мавров Г.І. Лікування генітальних інвазій, спричинених Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia. Дерматовенерологія, косметологія, сексопатологія. 2019. № 1–2. С. 5–10.
- Федорич П.В. Випадок хронічного баланопоститу при виявленні Pentatrichomonas hominis. Український журнал дерматології, венерології, косметології. 2018. – № 4 (70). С. 136–138.
- Федорич П.В. Виявлення Pentatrichomonas hominis при кольпоцервіциті та сальпінгоофориті. Дерматологія та венерологія. 2018. № 3 (81). С. 77–79.
- Федорич П.В. Вопросы рациональной методологии и диагностики урогенитальных инфекций у мужчин. Дерматовенерология и эстетическая медицина. 2014. № 2 (22). С. 56–59.
- Федорич П.В. Діагностика та лікування поєднаних уражень сечостатевої системи трихомонадами різних видів і мікроорганізмами, асоційованими з бактеріальним вагінозом. Лікарська справа. 2018. № 5–6. С. 100–111.
- Федорич П.В. Індивідуальна профілактика протозойних реінвазій сечостатевої системи, викликаних не Trichomonas Vaginalis. Військова медицина України. 2019. Т. 19 (2). С. 66–68.
- Федорич П.В. К вопросу о возможности колонизации мочеполовой системы человека Trichomonas tenax и Pentatrichomonas hominis. Матеріали Науково-практичної конференції НМАПО ім. П.Л. Шупика «Місце дерматовенерології в міждисциплінарному вирішенні питань діагностики та лікування хронічних захворювань», м. Київ, 20–21 березня 2017 р. С. 117–118.
- Федорич П.В. Кількісне визначення мікрофлори, асоційованої з бактеріальним вагінозом, у сечостатевій системі чоловіків. Український журнал дерматології, венерології, косметології. 2014. № 3 (54). С. 57–62.
- Федорич П.В. Обґрунтування та апробація оригінального способу взяття біологічного матеріалу з метою адаптації діагностикума Фемофлор-16 для кількісної детекції анаеробної та мікроаерофільної мікрофлори сечостатевої системи чоловіків. Український науково-медичний молодіжний журнал. 2012. № 2. С. 155–158.
- Федорич П.В. Определение микрофлоры, ассоциированной с бактериальным вагинозом, в мочеполовой системе мужчин методом полимеразной цепной реакции в реальном времени. Военная медицина. 2015. № 1. С. 57–60.
- Федорич П.В. Особливості інфекцій, що передаються статевим шляхом, в Україні. Український медичний вісник. 2013. № 7–8 (82). С. 62–63.
- Федорич П.В. Погляд на проблему ерадикації мікрофлори, асоційованої з бактеріальним вагінозом. Матеріали науково-практичної конференції з міжнародною участю НМАПО ім. П.Л. Шупика «Дерматовенерологія в розробках молодих науковців», м. Київ, 28 листопада 2019 р. С. 25.
- Федорич П.В. Протозойні інвазії сечостатевої системи у поєднанні зі збудниками бактеріального вагінозу у жінок фертильного віку та їхніх статевих партнерів. Здоровье женщины. 2018. № 7 (133). С. 11–16.
- Федорич П.В. Трихомоніаз. Патоморфоз трихомонад. Військова медицина України. Т. 14, № 1. С. 62–67.
- Федорич П.В. Урогенітальний трихомоноз: новий погляд на проблему. Дерматологія та венерологія. 2017. № 4 (78). С. 12–16.
- Федорич П.В. Явище антибіозу при трихомонадній інвазії сечостатевої системи. Медичні аспекти здоров’я чоловіка. 2018. № 2 (29). С. 19–21.
- Федорич П.В., Зеленый С.Б. Трихомониаз. Выявление Trichomonas tenax и Pentatrichomonas hominis в мочеполовой системе женщин репродуктивного возраста, больных инфекциями, передающимися преимущественно половым путем. Здоровье женщины. 2014. № 3 (89). С. 167–170.
- Федорич П.В., Зеленый С.Б. Трихомониаз. Явление существования Trichomonas tenax в мочеполовой системе человека. Уральский медицинский журнал. № 1 (115). С. 93–97.
- Федорич П.В., Зеленый С.Б. Трихомониаз. Явление существования Trichomonas hominis в мочеполовой системе человека. Медицинская панорама. 2014. № 1 (145). С. 59–61.
- Федорич П.В., Корнієнко А.О., Федорич Л.Я. Бактеріальний вагіноз. Огляд літературних джерел. Український журнал дерматології, венерології, косметології. 2008. № 3 (30). С. 102–105.
- Федорич П.В., Мавров Г.І. Випадок хронічного уретропростатиту при виявленні Chlamydia trachomatis та Trichomonas tenax. Здоров’я чоловіка. 2018. № 3 (66). С. 107–108.
- Федорич П.В., Мавров Г.І. Поширеність протозойних інвазій при загостреннях хронічного запалення сечостатевої системи. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2018. № 2 (40). С. 37–42.
- Федорич П.В., Мавров Г.І. Сучасна клініко-епідеміологічна характеристика хворих на сечостатевий трихомоноз в Україні. Український журнал дерматології, венерології, косметології. 2020. № 1. С. 15–23.
- Федорич П.В., Мавров Г.І., Зелений С.Б. Виявлення Pentatrichomonas hominis в сечостатевій системі людини методом полімеразної ланцюгової реакції. Військова медицина України. 2018. Т. 18, № 4. С. 49–54.
- Федорич П.В., Мавров Г.І., Зелений С.Б. Можливість використання авторських праймерів для детекції, Pentatrichomonas hominis, Trichomonas tenax, Giardia lamblia в біологічному матеріалі. Журнал дерматовенерології та косметології імені М.О. Торсуєва. 2019. № 2 (42). 2019. С. 7–11.
- Федорич П.В., Мавров Г.І., Осінська Т.В. Лікування протозойних інвазій сечостатевої системи викликаних Pentatrichomonas hominis, Trichomonas tenax та Giardia lamblia. Проблеми військової охорони здоров¢я: Збірник наукових праць Української військово-медичної академії № 52. 2019. С. 290–298.
- Федорич П.В., Мацас Е.Ю., Мулькина Е.И. Применение диагностикума Фемофлор для исследования микрофлоры мочеполовой системы у пар половых партнёров при наличии воспаления. Уральский медицинский журнал. 2011. № 3 (81). С. 26–32.
- Федорич П.В., Примак А.В., Коновалова Т.С. Бактеріальний вагіноз: сучасний погляд на проблему. Раціональна терапія та реабілітаційні заходи щодо способу життя пацієнток. Український журнал дерматології, венерології, косметології. 2013. № 3 (50). С. 86–94.
- ФЕМОФЛОР-16 – тест-система для етіологічної діагностики бактеріального вагіноза / П.В. Федорич, О.М. Слободянюк, Т.С. Базиль та ін. Тези доповідей Наукової конференцій молодих вчених Української військово-медичної академії, м. Київ, 23–24 квітня 2010 р. К., 2010. С. 40–41.
- Хисматуллина З.Р., Мустафина Г.Р., Шакирова Г.Р. Вопросы диагностики и лечения урогенитального трихомониаза. Медицинский вестник Башкортостана. 2011. Т. 6, № 4. С. 81–83.
- Шиманская И.Г., Костюк С.А. Проблемы этиотропного лечения воспалительных заболеваний мочеполовых органов. Международные обзоры: клиническая практика и здоровье. 2014. № 6 (12). С. 68–72.
- Эффективность, переносимость и комплаентность секнидазола в комплексном лечении больных урогенитальным трихомониазом / А.Д. Дюдюн, Н.Н. Полион, И.А. Бабюк и др. Український журнал дерматології, венерології, косметології. 2013. № 3 (50). С. 144–149.
- 2015 European guidelines for the management of partners of persons with sexually transmitted infections / G.‐S. Tiplica, K. Radcliffe, C. Evans et al. JEADV. 2015. Vol. 29, Iss. 7. P. 1251–1257.
- A false-positive Trichomonas vaginalis result due to Trichomonas tenax presence in clinical specimens may reveal a possible T. tenax urogenital infection / T. Brosh-Nissimov, M. Hindiyeh, R. Azar et al. Clinical Microbiology and Infection. 2019. Vol. 25. Р.123–124.
- Afzan M.Y., Sivanandam S., Suresh K. Modified Field stain – rapid viability test for Trichomonas vaginalis. Appl. Microbiol. 2012. Vol. 112, No. 1. P. 132–137.
- An association between Trichomonas vaginalis and high-risk human papillomavirus in rural Tanzanian women undergoing cervical cancer screening / B. Lazenby, P.T. Taylor, B.S. Badman et al. Clin. Ther. 2014. Vol. 36. P. 38–45.
- An international Urogynecological association (IUGA)/international continence society (ICS) joint report on the terminology for the assessment of sexual health of women with pelvic floor dysfunction / R.G. Rogers, R.N. Pauls, R. Thakar et al. Int Urogynecol J. 2018. Vol. 29, Iss. 5. P. 647–666.
- Andrea S.B., Chapin K.C. Comparison of Aptima Trichomonas vaginalis Transcription-Mediated Amplification Assay and BD Affirm VPIII for detection of T. vaginalis in symptomatic women: performance parameters and epidemiological implications. J Clin Microbiol. 2011. Vol. 49. Iss. 866–869.
- Aptima Trichomonas vaginalis assay elucidates significant underdiagnosis of trichomoniasis among women in Brazil according to an observational study / M.P. Bruni, M. Freitas da Silveira, D. Stauffert et al. Sex Transm Infect. 2019. Vol. 95. P. 129–132.
- Asemota O.O. Trichomoniasis in Nigeria: A review. Biomedical Research. 2018. Vol. 29, Iss. 12. P. 2532–2539.
- Assessment of psycho-emotional state in patients with sexually transmitted infections in vulnerable groups to HIV infection / Yu. Shcherbakova, Ya. Kutasevych, G. Mavrov et al. 33rd IUSTI – Europe Congress on Sexually Transmitted Infections, 5–7 September 2019, Tallinn, Estonia. Tallinn, 2019. P. 109–110.
- Associations between county-level voter turnout, county-level felony voter disenfranchisement, and sexually transmitted infections among women in the Southern United States / D.F. Haley, A. Edmonds, V.J. Schoenbach et al. Ann Epidemiol. 2019. Vol. 29. P. 67–73.
- Avwioro O. G. Diagnosis of trichomoniasis in pap smears; How effective is it?. European Journal of Experimental Biology. 2011. Vol. 1, Iss. 1. P. 10–13.
- Bacterial communities in penile skin, male urethra, and vaginas of heterosexual couples with and without bacterial vaginosis / M. Zozaya, M.J. Ferris, J.D. Siren et al. Microbiome. 2016. Vol. 4, Iss.16. P. 161–166.
- Bacterial vaginosis and antibacterial susceptibility pattern of asymptomatic urinary tract infection in pregnant women at a tertiary care hospital, Visakhaptn, India / A.M. Bhavana, P.H.P. Kumari, N. Mohan. J. Microbiol. 2019. Vol. 11, No 6. Р. 488–495.
- Bacterial vaginosis is associated with uterine cervical human papillomavirus infection: a meta-analysis / E. Gillet, J.F. Meys, H. Verstraelen et al. BMC Infect Dis. 2011. Vol. 11, Iss. 1. Article number 10.
- Behavioral predictors of colonization with Lactobacillus crispatus or Lactobacillus jensenii after treatment for bacterial vaginosis: a cohort study / C. Mitchell, L.E. Manhart, K. Thomas et al. Infect Dis Obstet Gynecol. 2012. Vol. 2012. Article ID: 706540.
- Bioinformatics tools [Electronic Resource]. URL: https://www.ucsc-extension.edu/courses/bioinformatics-tools-databases-and-methods/ (date accessed: 12.2017).
- BLAST: Basic Local Alignment Search Tool / U.S. National Library of Medicine, National Center for Biotechnology Information [Electronic Resource]. URL: https://blast.ncbi.nlm.nih.gov/Blast.cgi (date accessed: 12.2017).
- Brooke Bland P., Rakoff A.E. The incidence of trichomonads in the vagina, mouth and rectum evidence that vaginal trichomonads do not originate in the mouth or intestine. JAMA. 1937. Vol. 108, No. 24. P. 2011–2013.
- Centre for Disease Control. Trichomoniasis – 2015 STD Treatment Guidelines. URL: www.cdc.gov/std/tg2015/trichomoniasis.htm.
- Chlamydia, gonorrhoea, trichomoniasis and syphilis: global prevalence and incidence estimates, 2016 / Rowley, S. Vander Hoorn, E. Korenromp et al. Bull World Health Organ. 2019. Vol. 97, Iss. 8. P. 548–562.
- Clinical features and sociodemographic factors affecting Trichomonas vaginalis infection in women attending a central sexually transmitted diseases clinic in Sri Lanka / S.D. Fernando, S. Herath, C. Rodrigo, L. Rajapakse. Indian J. Sex. Transm. Dis. 2012. Vol. 33, No. 1. P. 25–31.
- Clinical performance of the Solana®Point-of-Care Trichomonas assay from clinician-collected vaginal swabs and urine specimens from symptomatic and asymptomatic women / C.A. Gaydos, J. Schwebke, J. Dombrowski et al. Expert Rev Mol Diagn. 2017. Vol. 17. P. 303–306.
- Comparing the occurrence of Trichomonas vaginalis infections today to ten years ago among women prostitutes and gynecology and obstetrics patients / E. Polat, S. Sirekbasan, Z. Yıldırım et al. Parazitol. Derg. 2011. Vol. 35. P. 68–71.
- Congenital Transmission of Trypanosoma cruzi: A Review About the Interactions Between the Parasite, the Placenta, the Maternal and the Fetal/Neonatal Immune Responses / U. Kemmerling, A. Osuna, A.G. Schijman, C. Truyens. Front Microbiol. 2019. Vol. 10. P. 1854.
- Detection of intestinal Protozoa in the clinical laboratory / I.H. McHardy, M. Wu, R. Shimizu-Cohen et al. J Clin Microbiol. Vol. 52. P. 712–720.
- Detection rates of Trichomonas vaginalis, in different age groups, using real-time polymerase chain reaction / M. Stemmer, M.E. Adelson, J.P. Trama et al. J. Low. Genit. Tract. Dis. 2012. Vol. 16, Iss. 4. P. 352–357.
- Development of PCR Assays for Detection of Trichomonas vaginalis in Urine Specimens / C.I. Bandea, K. Joseph, E.W. Secor et al. Clin. Microbiol. 2013. Vol. 51, No. 4. P. 1298–1300.
- Differences in Oral Sexual Behaviors by Gender, Age, and Race Explain Observed Differences in Prevalence of Oral Human Papillomavirus Infection / G. D’Souza, K. Cullen, J. Bowie et al. PLoS One. 2014. Vol. 9, Iss. 1. Article ID e86023.
- Double-stranded RNA viral infection of Trichomonas vaginalis and correlation with genetic polymorphism of isolates / J. Fraga, L. Rojas, I. Sariego, A. Fernandez-Calienes. Experimental Parasitology. 2011. Vol.127. P. 593–599.
- Effect of trichomoniasis therapy on genital HIV viral burden among African women / B.L. Anderson, C. Firnhaber, T. Liu et al. Sex Transm Dis. 2012. № 39. Р. 638–642.
- Endobiont viruses sensed by the human host – beyond conventional antiparasitic therapy / N. Fichorova, Y. Lee, H.S. Yamamoto et al. PLoS One. 2012. Vol. 7, Iss. 11. Article ID: e48418.
- Epidemiology of curable sexually transmitted infections among women at increased risk for HIV in northwestern Tanzania: inadequacy of syndromic management / S.C. Francis, T.T. Ao, F.M. Vanobberghen et al. PLoS One. 2014. Vol. 9, Iss. 7. Article ID: e101221.
- Epidemiology of Trichomonas vaginalis and human papillomavirus infection detected by real-time PCR in Flanders / C.E. Depuydt, E. Leuridan, P. Van Damme et al. Obstet. Invest. 2010. Vol.70, Iss. 4. P. 273–280.
- European Centre for Disease Prevention and Control. Surveillance Atlas of Infectious Diseases [Electronic Resource]. URL: https://atlas.ecdc.europa.eu/public/index.aspx (date accessed 11.11.2016).
- Extensive genetic diversity, unique population structure and evidence of genetic exchange in the sexually transmitted parasite Trichomonas vaginalis / M.D. Conrad, A.W. Gorman, J.A. Schillinger et al. PLoS Negl. TroP. Dis. 2012. Vol. 6, Iss. 3. Article ID: e1573.
- Fedorych P. Diagnostics and treatment of genital invasion caused by Trichomonas vaginalis and possibly other related species (Pentatrichomonas hominis and Trichomonas tenax) in patients with immunodeficiency. Georgian Medical News. 2020. No 12 (309). P. 81–85.
- Fedorych P.V. Study of incidence of mainly sexually transmitted infections in Ukraine. 13th EADV Spring Symposium. Athens, Greece, 19–22 may 2016. P. 0774.
- Fedorych P.V., Mavrov G.I. Incidence of Sexually Transmitted Infections: Local Study in Ukraine. World Science. Vol. 2, Iss. 8 (36). P. 4–7.
- Fedorych P.V., Mavrov G.I. The role of protozoal infestations in chronic inflammation exacerbations in patients with genitourinary pathology. EUREKA: Health Science. No. 5. P. 28–33.
- Fox J., Fidler S. Sexual transmission of HIV-1. Antiviral Res. Vol. 85. P. 276–285.
- Genbank Overview / NCBI [Electronic Resource]. URL: https://www.ncbi.nlm.nih.gov/genbank/ (date accessed 20.10.2017).
- Genotyping, Drug Susceptibility and Prevalence Survey of Trichomonas vaginalis among Women Attending Gynecology Clinics in Hamadan, Western Iran, in 2014–2015 / M. Matini, H. Rezaei, M. Fallah et al. Iranian Journal of Parasitology. 2017. Vol. 12. N. 1. P. 29–37.
- Giardia diagnostic methods in human fecal samples: a comparative study / H.A. El-Nahas, D.A. Salem, A.A. El-Henawy et al. Cytometry B Clin Cytom. Vol. 84. P.4–9.
- Global Epidemiology of Sexually Тransmitted Diseases / A. Mindel, D.Dwyer, B. Herring, A.L. Cunningham. Sexually Transmitted Diseases. Vaccines, Prevention and Control. 2nd Academic Press, 2013. P. 3–43.
- Global Estimates of the Prevalence and Incidence of Four Curable Sexually Transmitted Infections in 2012 Based on Systematic Review and Global Reporting / L. Newman, J. Rowley, S. Vander Hoorn et al. PLoS One. 2015. Vol. 10. Article ID: e0143304.
- Group B Streptococci and Trichomonas vaginalis infections in pregnant women and those with spontaneous abortion at Sanandaj, Iran / A. Ahmadi, F. Farhadifar, M. Rezaii et al. Iranian Journal of Microbiology. 2018. 10, Iss. 3. Р. 166–170.
- Harp D.F., Chowdhury I. Trichomoniasis: evaluation to execution. Eur J Obstet Gynecol Reprod Biol. 2011. Vol. 157, Iss. 1. P. 3–9.
- Hart G.J., Elford J. Sexual risk behaviour of men who have sex with men: emerging patterns and new challenges. Curr Opin Infect Dis. 2010. Vol. 23, Iss. 1. P. 39–44.
- Hashim W., Jameel Y., Yousif J. Adiagnostic Study Of The Giardia Lamblia Parasite Genotypes, Which Causes Diarrhea Among The Patients In Najaf, Province, By Using The PCR Techniqu Kufa Journal for Nursing Science. 2013. Vol. 3, No. 2. P. 7–16.
- Heterosexual Anal and Oral Sex in Adolescents and Adults in the United States, 2011-2015 / M.A. Habel, J.S. Leichliter, P.J. Dittus et al. Sex Transm Dis. 2018. Vol. 45, Iss. 12. P. 775–782.
- High prevalence of Chlamydia trachomatis, Neisseria gonorrhoeae and particularly Trichomonas vaginalis diagnosed using US FDA-approved Aptima molecular tests and evaluation of conventional routine diagnostic tests in Ternopil, Ukraine / I. Boiko, D. Golparian, I. Krynytska, M. Unemo. APMIS. 2019. Vol. 127. P. 627–634.
- High prevalence of Pentatrichomonas hominis infection in gastrointestinal cancer patients / N. Zhang, H. Zhang, Y. Yu et al. Parasit Vectors. 2019. Vol. 12, Iss. 1. P. 423.
- Hinderfeld A.S., Simoes-Barbosa A. Vaginal dysbiotic bacteria act as pathobionts of the protozoal pathogen Trichomonas vaginalis. Microb Pathog. 2020. Vol. 138. Article ID: 103820.
- Howe K., Kissinger P.J. Single-dose compared with multidose metronidazole for the treatment of trichomoniasis in women: a meta-analysis. Sex Transm Dis. 2017. Vol. 44. P. 30–35.
- Humphreys J. Sexually transmitted infections, pregnancy, and intimate partner violence. Health Care Women Int. 2011. Vol. 32, Iss. 1. P. 23–38.
- Identification of Trichomonas in the Lung Sputum of Patients with Asthma and Chronic Pulmonary Disease Admitted to Masih Daneshvari Hospital by PCR Technique / F. Fozongari, A. Dalimi, M. Pourabdollah, M. Pirestani. Modares Journal of Medical Sciences: Pathobiology. 2014. Vol. 16, No. 4. P. 59–66.
- Identifying a consensus sample type to test for Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium, Trichomonas vaginalis and human papillomavirus / Coorevits, A. Traen, L. Bingé et al. Clinical Microbiology and Infection. 2018. Vol. 24, Iss. 12. P. 1328–1332.
- Impact of replacing cytology with human papillomavirus testing for cervical cancer screening on the prevalence of Trichomonas vaginalis: a modelling study / B.B. Hui, C.P. Reulein, R.J. Guy et al. Sex Transm Infect. 2018. Vol. 94. P. 216–221.
- Is there association between Trichomonas vaginalis infection and prostate cancer risk?: A systematic review and meta-analysis / A. Najafi, M.R. Chaechi Nosrati, E. Ghasemi et al. Microb Pathog. 2019. Vol. 137. Article ID: 103752.
- Kalendar R., Lee D., Schulman A.H. Java web tools for PCR, in silico PCR, and oligonucleotide assembly and analysis. 2011. Vol. 98, Iss. 2. P. 137–144.
- Kissinger P. Trichomonas vaginalis: a review of epidemiologic, clinical and treatment issues. BMC Infect Dis. Vol. 15. P. 307.
- Kissinger P., Adamski A. Trichomoniasis and HIV interactions: a review. Transm. Infect. 2013. Vol. 89, No. 6. P. 426–433.
- Lack of evidence for the involvement of rectal and oral trichomonads in the aetiology of vaginal trichomoniasis in Ghana / Y. Adu-Sarkodie, B.K. Opoku, T. Crucitti et al. Sex Transm Infect. 2007. Vol. 83. P. 130–132.
- Lefkowitz E.S., Vasilenko S.A., Leavitt C.E. Oral vs. Vaginal Sex Experiences and Consequences Among First-Year College Students. Arch Sex Behav. 2016. Vol. 45, Iss. 2. P. 329–337.
- Management of sexually transmissible infections in the era of multiplexed molecular diagnostics: a primary care survey / T. Brosh-Nissimov, R. Kedem, N. Ophir et al. Sex Health. 2018. Vol. 15, Iss. 4. P. P. 298–303.
- Marks L., Hunter D.J., Alderslade R. Strengthening Public Health Capacities and Services in Europe: a Framework for Action. World Health Organization, 2011. 60 p.
- Marty M., Bonner M., Vaysse F. Observation of trichomonads infection in a child with periodontitis by direct microscopy at the dental office. Parasitology. 2015. Vol. 142, Iss. 11. P. 1440–1442.
- Mavrov H.I., Osinska T.V., Fedorych P.V. Clinical and epidemiological characteristics and morphological peculiarities of urogenital trichomoniasis nowadays. Pathologia. 2020. Vol. 17, № 1 (48). P. 52–59.
- Mehr A.K., Zarandi A., Anush K. Prevalence of Oral Trichomonas tenax in Periodontal Lesions of Down Syndrome in Tabriz, Iran. Clin. Diagn. Res. 2015. Vol. 9, No. 7. P. ZC88–ZC90.
- Mehta S.D. Systematic review of randomized trials of treatment of male sexual partners for improved bacterial vaginosis outcomes in women. Sex Transm Dis. 2012. Vol. 39, Iss. 10. P. 822–830.
- Menezes C.B., Mello Mdos S., Tasca T. Comparison of permanent staining methods for the laboratory diagnosis of trichomoniasis. Inst. Med. Trop. S. Paulo. 2016. Vol. 58. Р. 5.
- Microscopy outperformed in a comparison of five methods for detecting Trichomonas vaginalis in symptomatic women / B. Nathan, J. Appiah, P. Saunders et al. Int J STD AIDS. 2015. Vol. 26. P. 251–256.
- Mielczarek E, Blaszkowska J. Trichomonas vaginalis: pathogenicity and potential role in human reproductive failure. Infection. 2016. Vol. 44. P. 447–458.
- Modeling the impact of Trichomonas vaginalis infection on HIV transmission in HIV-infected individuals in medical care / E.B. Quinlivan, S.N. Patel, C.A. Grodensky et al. Sex Transm Dis. 2012. Vol. 39. Р. 671–767.
- Molecular Characterization of Trichomonas vaginalis Strains Based on Identifying Their Probable Variations in Asymptomatic Patients / Spotin, S.T. Eghtedar, A. Shahbazi et al. Iran J Parasitol. 2016. Vol. 11, Iss. 4. P. 507–514.
- Molecular identification of Giardia lamblia isolates from adult human cases in southwest of Iran / E.S. Roointan, A. Rafiei, A.R. Samarbaf-Zadeh et al. African Journal of Biotechnology. 2013. Vol. 12, Iss. 9. P. 901–906.
- Molecular identification of Pentatrichomonas hominis in two patients with gastrointestinal symptoms / Meloni, C. Mantini, J. Goustille et al. J. Clin. Pathol. 2011. Vol. 64. P. 933–935.
- Molecular testing for Trichomonas vaginalis in women: results from a prospective U.S. clinical trial / J.R. Schwebke, M.M. Hobbs, S.N. Taylor et al. Clin Microbiol. 2011. Vol. 49. P. 4106–4111.
- Molecular typing of the actin gene of Trichomonas vaginalis isolates by PCR-restriction fragment length polymorphism / T. Crucitti, S. Abdellati, E. Van Dyck, A. Buve. Microbiol Infect. 2008. Vol. 14. P. 844–852.
- Molecular typing of Trichomonas vaginalis isolates by actin gene sequence analysis and carriage of T. vaginalis viruses / C. Masha, P. Cools, T. Crucitti, E.J. Sanders, M. Vaneechoutte. Parasites & Vectors. 2017. Vol. 10. N1. P. 537–545.
- Murray P.R., Rosenthal K.S.. Pfaller M.A. Medical microbiology. 8th ed. Philadelphia : Elsevier/Saunders, 932 p.
- New tetratrichomonas species in two patients with pleural empyema / E. Lopez-Escamilla, F. Sanchez-Aguillon, C.P. Alatorre-Fernandez et al. J Clin Microbiol. 2013. Vol. 51, Iss. 9. P. 3143–3146.
- Nitroimidazole-refractory giardiasis: a growing problem requiring rational solutions / E.R. Carter, L.E. Nabarro, L. Hedley, P.L. Chiodini. Clin Microbiol Infect. Vol. 24. P. 37–42.
- Patil M.J., Nagamoti J.M., Metgud S.C. Diagnosis of Trichomonas vaginalis from vaginal specimens by wet mount microscopy, in pouch TV culture system, and PCR. J Glob Infect Dis. Vol. 4, Iss. 1. P. 22–25.
- PCR Detection and Molecular Characterization of Pentatrichomonas hominis from Feces of Dogs with Diarrhea in the Republic of Korea / Y.A. Kim, H.Y. Kim, S.H. Cho et al. Korean J Parasitol. 2010. Vol. 48, No. 1. P. 9–13.
- Pentatrichomonas hominis infection in rheumatoid arthritis treated with adalimumab / C. Compaoré, F. Kemta Lekpa, L. Nebie et al. Rheumatology (Oxford). 2013. Vol. 52, Iss. 8. P. 1534–1535.
- Performance of rapid immunochromatographic assay in the diagnosis of Trichomoniasis vaginalis / N.L. El-Tantawy, M.M. Soliman, E.S. El-Sadeek, H.S. El-Nagar. Diagn Microbiol Infect Dis. Vol. 74. P. 49–53.
- Prevalence and correlates of Trichomonas vaginalis infection among female sex workers in a city in Yunnan Province, China / L. Luo, K.H. Reilly, J.J. Xu et al. Int J STD AIDS. Vol. 27. P. 469–475.
- Prevalence and risk factors for Chlamydia trachomatis, Neisseria gonorrhoeae and Trichomonas vaginalis infection in pregnant women in Papua New Guinea / A. Wangnapi, S. Soso, H.W. Unger et al. Sex. Transm. Infect. 2015. Vol. 91, Iss. 3. P. 194–200.
- Prevalence of sexually transmitted infections and enteric protozoa among homosexual men in western Sicily (south Italy) / M.A. Di Benedetto, F. Di Piazza, E. Amodio et al. J Prev Med Hyg. 2012. Vol. 53. P. 181–185.
- Prevalence of Trichomonas vaginalis infection in Hamadan City, Western Iran / Matini, S. Rezaie, M. Mohebali et al. Iran. J. Parasitol. 2012. Vol. 7, Iss. 2. P. 67–72.
- Prevalence of Trichomonas vaginalis infection in symptomatic and asymptomatic women in Central Vietnam / P.A. Ton Nu, V.Q. Nguyen, N.T. Cao et al. J Infect Dev Ctries. 2015. Vol. 9, Iss. 6. P. 655–660.
- Protozoan genital invasions caused by the representatives of Trichomonas and Giardia / P.V. Fedorych, G.I. Mavrov, T.V. Osinska, Y.V. Shcherbakova. Wiadomości Lekarskie. Vol. 73, Iss. 2. P. 380–383.
- Randomized, double-blind, comparative study of oral metronidazole and tinidazole in treatment of bacterial vaginosis / I.M. Raja, A. Basavareddy, D. Mukherjee, B.R. Meher. Indian J. Pharmacol. 2016. Vol. 48, Iss. 6. P. 654–658.
- Rapid diagnosis of parasitic diseases: current scenario and future needs / Momčilović, C. Cantacessi, V. Arsić-Arsenijević et al. Clinical Microbiology and Infection. 2018. Vol. 25, Iss. 3. P. 290–309.
- Review of rapid diagnostic tests used by antimicrobial stewardship programs / K.A. Bauer, K.K. Perez, G.N. Forrest, D.A. Goff. Clin Infect Dis. Vol. 59. P. S134–S145.
- Ribeiro L.C., Santos C., Benchimol M. Is Trichomonas tenax a parasite or a commensal? Protist. 2015. Vol. 166. P. 196–210.
- Risk of bacterial vaginosis, Trichomonas vaginalis and Candida albicans infection among new users of combined hormonal contraception vs LNG-IUS / M. Rezk, T. Sayyed, A. Masood, R. Dawood. Eur J Contracept Reprod Health Care. 2017. Vol. 22, Iss. 5. P. 344–348.
- Schwebke J.R., Muzny C.A., Josey W.E. Role of Gardnerella vaginalis in the Pathogenesis of Bacterial Vaginosis: A Conceptual Model. The Journal of Infectious Diseases. 2014. Vol. 210, Iss. 3. P. 338–343.
- Sexually transmitted infections among female sex workers tested at STI clinics in The Netherlands, 2006–2013 / M.M. Verscheijden, P.J. Woestenberg, H.M. Götz et al. Emerg Themes Epidemiol. Vol. 12. Article no.12.
- Standard asymptomatic check-up – Australian STI Management Guidelines 2014 / Australasian Sexual Health Alliance [Electronic Resource]. URL: www.sti.guidelines.org.au/standard-asymptomatic-check-up.
- STI Global Update Newsletter of the International Union against Sexually Transmitted Infections / International Union Against Sexually Transmitted Infections [Electronic Resource]. URL: http://www.astda.org/pdf/STI_Global_Update_March_2019.pdf.
- Summary of the recommendations on sexual dysfunctions in men / F. Montorsi, G. Adaikan, E. Becher et al. J Sex Med. 2010. Vol. 7, Iss. 11. P. 3572–3588.
- Tang Y.W., Stratton C.W. Advanced techniques in diagnostic microbiology. 2nd ed. New York : Springer Science and Business Media,
- The association of HIV status with bacterial vaginosis and vitamin D in the United States / A.L. French, O.M. Adeyemi, D.M. Agniel et al. J Womens Health (Larchmt). 2011. Vol. 20, Iss. 10. P. 1497–1503.
- Trichomonads in pleural effusion: case report, literature review and utility of PCR for species identification / Leterrier, F. Morio, B. Renard et al. New Microbiologica. 2012. Vol. 35. P. 83–87.
- Trichomonas vaginalis and Human Immunodeficiency Virus Coinfection Among Women Under Community Supervision: A Call for Expanded T. vaginalis Screening / A. Davis, A. Dasgupta, D. Goddard-Eckrich, N.El-Bassel. Sex Transm Dis. 2016. Vol. 43, Iss. 10. P. 617–622.
- Trichomonas vaginalis infection is uncommon in the British general population: implications for clinical testing and public health screening / Field, S. Clifton, S. Alexander et al. Sex. Transm. Infect. 2018. Vol. 94, Iss. 3. P. 226–229.
- Trichomonas vaginalis is most frequently detected in women at the age of peri-/premenopause: an unusual pattern for a sexually transmitted pathogen / S.M. Stemmer, E. Mordechai, M.E. Adelson et al. Am J Obstet Gynecol. 2018. Vol. 218, Iss. 3. P. 328.
- Trichomonas vaginalis prevalence, incidence, risk factors and antibiotic-resistance in an adolescent population / J.W. Krashin, E.H. Koumans, A.C. Bradshaw-Sydnor et al. Sex Transm. Dis. 2010. Vol. 37, Iss. 7. P. 440–444.
- Trichomonas vaginalis: Clinical relevance, pathogenicity and diagnosis / T. Edwards, P. Burke, H. Smalley, G. Hobbs. Rev. Microbiol. 2016. Vol. 42, Iss. 3. P. 406–417.
- Turovskiy Y., Sutyak Noll K., Chikindas M.L. The etiology of bacterial vaginosis. J Appl. Microbiol. 2011. Vol. 110, Iss. 5. P. 1105–1128.
- United Kingdom national guideline on the management of Trichomonas vaginalis 2014 / J. Sherrard, C. Ison, J. Moody et al. Int J STD AIDS. Vol. 25. P. 541–549.
- Van Der Pol B. Clinical and laboratory testing for Trichomonas vaginalis infection. Clin. Microbiol. 2016. Vol. 54. P. 7–12.
- Van Gerwen O.T., Muzny C.A. Recent advances in the epidemiology, diagnosis, and management of Trichomonas vaginalis infection. F1000Res. 2019. Vol. 8. Pii: F1000 Faculty Rev-1666.
- Wolitski R.J., Fenton K.A. Sexual health, HIV, and sexually transmitted infections among gay, bisexual, and other men who have sex with men in the United States. AIDS Behav. Vol. 15, Suppl. 1. P. S9–S17.
- Workowski K.A., Bolan G.A. Sexually transmitted diseases treatment guidelines, 2015. MMWR Recomm Rep. 2015. Vol. 64. P. 1–137.
- World Health Organization. Report on global sexually transmitted infection surveillance, 2018. Geneva : World Health Organization, 2018. 63 p.
- World Health Organization. Sexual and reproductive health. URL: https://www.euro.who.int/en/health-topics/Life-stages/sexual-and-reproductive-health/sexual-and-reproductive-health (date accessed 26.10.2018).
ДОДАТОК А
АНКЕТА ЩОДО ВИЗНАЧЕННЯ СЕКСУАЛЬНОЇ ПОВЕДІНКИ ХВОРИХ НА ІНФЕКЦІЇ, ЩО ПЕРЕДАЮТЬСЯ СТАТЕВИМ ШЛЯХОМ
- Стать:
- Чоловіча
- Жіноча
- Вік:
- Сімейний стан
- Одружений(а)
- Неодружений(а)
- Розведений(а)
- Освіта:
- Вища
- Середня
- У скільки повних років розпочато статеве життя: _____
- Скільки статевих партнерів (приблизно) Ви мали протягом життя _____
- Чи мали Ви на протязі життя випадок сексу з особою своєї статі:
- Так
- Ні
- Як часто Ви користуєтесь презервативами при традиційному сексі не з постійним партнером:
- Завжди
- В переважній більшості випадків
- Часто
- Рідко
- Дуже рідко
- Ніколи
- Не вступаю в такі сексуальні контакти
- Як часто Ви користуєтесь презервативами при оральному сексі:
- Завжди
- В переважній більшості випадків
- Часто
- Рідко
- Дуже рідко
- Ніколи
- Не вступаю в такий різновид сексуальних контактів
- Як часто Ви користуєтесь презервативами при анальному сексі:
- Завжди
- В переважній більшості випадків
- Часто
- Рідко
- Дуже рідко
- Ніколи
- Не вступаю в такий різновид сексуальних контактів
- Після орально-генітального контакту через певний час:
- Не маю жодних негативних відчуттів в сечостатевих органах
- Маю незначні суб’єктивні відчуття в сечостатевих органах, що швидко минають
- Маю значні суб’єктивні відчуття в сечостатевих органах, що швидко минають
- Маю незначні суб’єктивні відчуття в сечостатевих органах, що минають повільно
- Маю значні суб’єктивні відчуття в сечостатевих органах, що минають повільно
- Після анального сексу у якості активного партнера через певний час:
- Не маю жодних негативних відчуттів в сечостатевих органах
- Маю незначні суб’єктивні відчуття в сечостатевих органах, що швидко минають
- Маю значні суб’єктивні відчуття в сечостатевих органах, що швидко минають
- Маю незначні суб’єктивні відчуття в сечостатевих органах, що минають повільно
- Маю значні суб’єктивні відчуття в сечостатевих органах, що минають повільно
- Чи можете Ви спираючись на власний досвід стверджувати, що стан (запалення) ротової порожнини (мигдаликів, ясен, зубів), а також придаткових пазух носу Вашого статевого партнера здатний вплинути негативно на стан Вашої ССС:
- Так
- Ні
- Не можу визначитись
- Не маю власного досвіду з цього питання
- Чи можете Ви спираючись на власний досвід стверджувати, що стан прямої кишки Вашого статевого партнера здатний вплинути негативно на стан Вашої ССС:
- Так
- Ні
- Не можу визначитись
- Не маю власного досвіду з цього питання
- Чи хворіли Ви коли-небудь на інфекції ССС?
- Так
- Ні
- Які фактори сексуальної поведінки сприяють інфікуванню ССС?
ДОДАТОК Б
АКТИ ВПРОВАДЖЕННЯ
ДОДАТОК В
СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА ЗА ТЕМОЮ ДИСЕРТАЦІЇ
ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ РЕЗУЛЬТАТІВ ДИСЕРТАЦІЇ
- Федорич П.В., Мавров Г.І. Поширеність протозойних інвазій при загостреннях хронічного запалення сечостатевої системи. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2018. № 2 (40). С. 37–42.
- Федорич П.В., Мавров Г.І., Зелений С.Б. Можливість використання авторських праймерів для детекції, Pentatrichomonas hominis, Trichomonas tenax, Giardia lamblia в біологічному матеріалі. Журнал дерматовенерології та косметології імені М.О. Торсуєва. 2019. № 2 (42). С. 7–11.
- Федорич П.В. Трихомоніаз. Патоморфоз трихомонад. Військова медицина України. Т. 14, № 1. С. 62–67.
- Федорич П.В., Мавров Г.І., Зелений С.Б. Виявлення Pentatrichomonas hominis в сечостатевій системі людини методом полімеразної ланцюгової реакції. Військова медицина України. 2018. Т. 18, № 4. С. 49–54.
- Федорич П.В. Індивідуальна профілактика протозойних реінвазій сечостатевої системи, викликаних не Trichomonas Vaginalis. Військова медицина України. 2019. Т. 19 (2). С. 66–68.
- Федорич П.В. Обґрунтування та апробація оригінального способу взяття біологічного матеріалу з метою адаптації діагностикума Фемофлор-16 для кількісної детекції анаеробної та мікроаерофільної мікрофлори сечостатевої системи чоловіків. Український науково-медичний молодіжний журнал. 2012. № 2. С. 155–158.
- Mavrov H.I., Osinska T.V., Fedorych P.V. Clinical and epidemiological characteristics and morphological peculiarities of urogenital trichomoniasis nowadays. Pathologia. 2020. Vol. 17, № 1 (48). P. 52–59.
- Федорич П.В. Урогенітальний трихомоноз: новий погляд на проблему. Дерматологія та венерологія. 2017. № 4 (78). С. 12–16.
- Федорич П.В. Виявлення Pentatrichomonas hominis при кольпоцервіциті та сальпінгоофориті. Дерматологія та венерологія. 2018. № 3 (81). С. 77–79.
- Ультраструктурные особенности морфотипов Trichomonas vaginalis, выделенных от больных с хронической трихомонадной инвазией / П.В. Федорич, Г.И. Мавров, С.К. Джораева, Т.В. Осинская. Дерматологія та венерологія. 2018. № 4 (82). С. 17–22.
- Молекулярное типирование Trichomonas vaginalis, циркулирующих в Украине,на основании полиморфизма гена актина / А.П. Белозоров, П.В. Федорич, Г.И. Мавров, А.Д. Зеленская, Е.Н. Горобчишина. Дерматологія та венерологія. 2019. № 1. С. 8–12.
- Сучасні епідеміологічні аспекти трихомонозу в Україні / П.В. Федорич, Г.І. Мавров, Т.В. Осінська, Л.В. Іващенко. Дерматологія та венерологія. 2020. № 1 (87). С. 44–51.
- Федорич П.В., Мавров Г.І. Лікування генітальних інвазій, спричинених Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia. Дерматовенерологія. Косметологія. Сексопатологія. 2019. № 1–2. С. 5–10.
- Федорич П.В. Протозойні інвазії сечостатевої системи у поєднанні зі збудниками бактеріального вагінозу у жінок фертильного віку та їхніх статевих партнерів. Здоровье женщины. 2018. № 7 (133). С. 11–16.
- Федорич П.В., Мавров Г.І. Сучасна клініко-епідеміологічна характеристика хворих на сечостатевий трихомоноз в Україні. Український журнал дерматології, венерології, косметології. 2020. № 1. С. 15–23.
- Федорич П.В., Мавров Г.І. Випадок хронічного уретропростатиту при виявленні Chlamydia trachomatis та Trichomonas tenax. Здоров’я чоловіка. 2018. № 3 (66). С. 107–108.
- Визначення деяких найпростіших (Trichomonas tenax, Trichomonas hominis, Giardia lamblia, Entamoeba histolytica, Enthamoeba gingivalis) у пацієнтів, хворих на урогенітальні інфекції методом ПЛР в реальному часі / П.В. Федорич, С.Б. Зелений, Л.С. Зайцева, О.В. Мазій. Український журнал дерматології, венерології, косметології. 2012. № 4 (47). С. 5–10.
- Федорич П.В., Примак А.В., Коновалова Т.С. Бактеріальний вагіноз: сучасний погляд на проблему. Раціональна терапія та реабілітаційні заходи щодо способу життя пацієнток. Український журнал дерматології, венерології, косметології. 2013. № 3 (50). С. 86–94.
- Федорич П.В. Кількісне визначення мікрофлори, асоційованої з бактеріальним вагінозом, у сечостатевій системі чоловіків. Український журнал дерматології, венерології, косметології. 2014. № 3 (54). С. 57–62.
- Визначення поширеності інфікування Giardia lamblia сечостатевої системи хворих з інфекціями, що передаються переважно статевим шляхом / П.В. Федорич, С.Б. Зелений, Л.Я. Федорич, Х.І. Шеховцова. Український журнал дерматології, венерології, косметології. 2015. № 2 (57). С. 67–70.
- Порівняння ефективності діагностики трихомоніазу за культуральним методом та методом полімеразної ланцюгової реакції з використанням праймерів для виявлення Trichomonas vaginalis, Trichomonas tenax та Pentatrichomonas hominis / П.В. Федорич, С.Б. Зелений, О.А. Садовська, К.В. Дудікова. Український журнал дерматології, венерології, косметології. 2017. № 1 (64). С. 65–69.
- Федорич П.В. Випадок хронічного баланопоститу при виявленні Pentatrichomonas hominis. Український журнал дерматології, венерології, косметології. 2018. № 4 (70). С. 136–138.
- Protozoan genital invasions caused by the representatives of Trichomonas and Giardia / P.V. Fedorych, G.I. Mavrov, T.V. Osinska, Y.V. Shcherbakova. Wiadomości Lekarskie. Vol. 73, Iss. 2. P. 380–383.
- Клинический случай инвазии Trichomonas vaginalis беременной женщины и ее новорожденной / Г.И. Мавров, Т.В. Осинская, П.В. Федорич, Л.В. Гречанская. Georgian Medical News. 2019. № 12 (297). С. 41–46.
- FedorychDiagnostics and treatment of genital invasion caused by Trichomonas vaginalis and possibly other related species (Pentatrichomonas hominis and Trichomonas tenax) in patients with immunodeficiency. Georgian Medical News. 2020. No 12 (309). P. 81–85.
- Fedorych P.V., Mavrov G.I. The role of protozoal infestations in chronic inflammation exacerbations in patients with genitourinary pathology. EURYKA: Health Science. No. 5. P. 28–33.
- Fedorych P.V., Mavrov G.I. Incidence of Sexually Transmitted Infections: Local Study in Ukraine. World Science. Vol. 2, Iss. 8 (36). P. 4–7.
- Федорич П.В., Мацас Е.Ю., Мулькина Е.И. Применение диагностикума Фемофлор для исследования микрофлоры мочеполовой системы у пар половых партнёров при наличии воспаления. Уральский медицинский журнал. 2011. № 3 (81). С. 26–32.
- Федорич П.В., Зеленый С.Б. Трихомониаз. Явление существования Trichomonas tenax в мочеполовой системе человека. Уральский медицинский журнал. № 1 (115). С. 93–97.
- Федорич П.В., Зеленый С.Б. Трихомониаз. Явление существования Trichomonas hominis в мочеполовой системе человека. Медицинская панорама. 2014. № 1 (145). С. 59–61.
- Федорич П.В. Вопросы рациональной методологии и диагностики урогенитальных инфекций у мужчин. Дерматовенерология и эстетическая медицина. 2014. № 2 (22). С. 56–59.
- Федорич П.В. Определение микрофлоры, ассоциированной с бактериальным вагинозом, в мочеполовой системе мужчин методом полимеразной цепной реакции в реальном времени. Военная медицина. 2015. №1. С. 57–60.
- Федорич П.В., Корнієнко А.О., Федорич Л.Я. Бактеріальний вагіноз. Огляд літературних джерел. Український журнал дерматології, венерології, косметології. 2008. № 3 (30). С. 102–105.
- Федорич П.В., Зеленый С.Б. Трихомониаз. Выявление Trichomonas tenax и Pentatrichomonas hominis в мочеполовой системе женщин репродуктивного возраста, больных инфекциями, передающимися преимущественно половым путем. Здоровье женщины. 2014. № 3 (89). С. 167–170.
- Федорич П.В. Діагностика та лікування поєднаних уражень сечостатевої системи трихомонадами різних видів і мікроорганізмами, асоційованими з бактеріальним вагінозом. Лікарська справа. 2018. № 5–6. С. 100–111.
- Федорич П.В. Явище антибіозу при трихомонадній інвазії сечостатевої системи. Медичні аспекти здоров’я чоловіка. 2018. № 2 (29). С. 19–21.
- Аналіз сексуальної поведінки сучасних молодих осіб із вищою освітою / П.В. Федорич, В.П. Філіпішин, Л.Я Федорич., І.Г. Миколюк, Мехмет Бюлент Багчі. Сучасні аспекти військової медицини. Збірник наукових праць. К., 2013. Вип. 20. С. 328–334.
- Федорич П.В., Мавров Г.І., Осінська Т.В. Лікування протозойних інвазій сечостатевої системи викликаних Pentatrichomonas hominis, Trichomonas tenax та Giardia lamblia. Проблеми військової охорони здоров¢я: Збірник наукових праць Української військово-медичної академії 2019. № 52. С. 290–298.
- Федорич П.В. Особливості інфекцій, що передаються статевим шляхом, в Україні. Український медичний вісник. 2013. № 7–8 (82). С. 62–63.
- Fedorych P.V. Study of incidence ofmainly sexually transmitted infections in Ukraine. 13th EADV Spring Symposium. Athens, Greece, 19–22 may 2016. P. 0774.
- Федорич П.В. К вопросу о возможности колонизации мочеполовой системы человека Trichomonas tenax и Pentatrichomonas hominis. Матеріали Науково-практичної конференції НМАПО ім. П.Л. Шупика «Місце дерматовенерології в міждисциплінарному вирішенні питань діагностики та лікування хронічних захворювань», м. Київ, 20–21 березня 2017 р. С. 117–118.
- Типування Trichomonas vaginalis в Україні, на підставі поліморфізму гена актину /А.П. Белозоров, П.В. Федорич, Г.І. Мавров, А.Д. Зеленська. Матеріали Всеукраїнської науково-практичної конференції з міжнародною участю «Досягнення та перспективи в сучасній дерматовенерології: Європейський та український досвід, взаємодія науки та практики», 21–22 листопада 2019 р., м. Харків. Дерматологія та венерологія. 2019. № 3 (85). С. 51–52
- Федорич П.В., Мавров Г.І., Зелений С.Б. Апробація праймерів для виявлення Pentatrichomonas hominis в сечостатевій системі людини методом ПЛР. Матеріали науково-практичної конференції з міжнародною участю НМАПО ім. П.Л. Шупика «Дерматовенерологія в розробках молодих науковців», м. Київ, 22 листопада 2018 р. С. 44-45.
- Пат. на винахід 107910 Україна, МПК С12/Q 1/68 (2006.01), С12/Q 1/04 (2006.01), С12/N15/11 (2006.01). Спосіб визначення присутності Trichomonas tenax у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201407161; заявл. 25.06.2014; опубл. 25.02.15, Бюл. № 4.
- Пат. на корисну модель. 103397 Україна, МПК А61К 31/345 (2006.01),А61К 31/7080 (2006.01),А61/Р 17/04 (2006.01). Спосіб лікування хронічного трихомоніазу / Федорич П.В. – заявник та патентовласник. – u201506813; заявл. 09.07.2015; опубл. 10.12.15, Бюл. №23.
- Пат. на винахід 110759 Україна, МПК С12/Q 1/68 (2006.01),С12/Q 1/04 (2006.01),С12/N15/11 (2006.01), С12/R 1/90(2006.01). Спосіб визначення присутності Pentatrichomonas hominis у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201501255; заявл. 16.02.2015; опубл. 10.02.16, Бюл. №3.
- Пат. на винахід 110767 Україна, МПК С12/Q 1/68 (2006.01),С12/Q 1/04 (2006.01),С12/N15/11 (2006.01), С12/R 1/90(2006.01). Спосіб визначення присутності Giardia lamblia у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201505750; заявл. 11.06.2015 ; опубл. 10.02.16, Бюл. №3.
- Пат. на корисну модель 109257 Україна, МПК А61К (2016.01),А61Р (2016.01). Спосіб лікування хронічного трихомоніазу сечостатевої системи, викликаного Trichomonas tenax або Pentatrichomonas hominis / Федорич П.В. – заявник та патентовласник. – u20151294; заявл. 21.12.2015; опубл. 25.08.16, Бюл. №16.
- Подольський Вл.В., Подольский В.В., Федорич П.В. Оптимізація лікування хронічних запальних захворювань статевих органів у жінок фертильного віку з урахуванням міжнародного досвіду: метод. рек. (№ 94/2017). К., 2018. 12 с.
Відомості про апробацію результатів дисертації:
- Науково-практична конференція «Проблеми захворювань шкіри та інфекцій, що передаються переважно статевим шляхом, у дітей та підлітків», м. Київ, 17–18 березня 2015 р., усна доповідь: Шеховцова Х.І., Федорич П.В. «Визначення поширеності інфікування сечостатевої системи хворих на інфекції, що передаються переважно статевим шляхом, на Giardia Lamblia на сучасному етапі».
- І Збори військових дерматологів, науково-практичний семінар «Сьогодення дерматовенерології в України: стан, здобутки та напрямки розвитку. Взаємозв’язок військової та цивільної служби», м. Вінниця, 12–13 травня 2016 р., усна доповідь: Федорич П.В. «Діагностика протозойних вражень сечостатевої системи».
- 13th EADV Spring Symposium «Moving Boundaries», Athens, 19–22 May 2016, E-poster: Fedorych P. «Study of incidence of mainly sexually transmitted infections in Ukraine».
- Науково-практична конференція «Місце дерматовенерології в міждисциплінарному вирішенні питань діагностики та лікування хронічних захворювань», м. Київ, 20–21 березня 2017 р., усна доповідь: Федорич П.В. «До питання можливої колонізації сечостатевої системи людини Trichomonas tenax і Pentatrichomonas hominis».
- ІІІ (Х) з’їзд УАЛДВК, м. Львів, 22–23 листопада 2017 р., усна доповідь: Федорич П.В. «Діагностика та лікування поєднаних уражень сечостатевої системи мікроорганізмами, що асоційовані з бактеріальним вагінозом та трихомонадами».
- Всеукраїнська науково-практична конференція з міжнародною участю «Особливості надання дерматовенерологічної допомоги населенню України в умовах медичної реформи», м. Івано-Франківськ, 17–18 жовтня 2018 р., усна доповідь: Федорич П.В. «Мікробні асоціації Trichomonas vaginalis».
- Науково-практична конференція з міжнародною участю «Дерматовенерологія в розробках молодих науковців», м. Київ, 22 листопада 2018 р., усна доповідь: Федорич П.В. «Апробація праймерів для виявлення Pentatrichomonas hominis в сечостатевій системі людини методом полімеразної ланцюгової реакції».
- Науково-практична конференція з міжнародною участю «Досягнення та перспективи в сучасній дерматовенерології: європейський та український досвід, взаємодія науки та практики». м. Харків, 21–22 листопада 2019 р., усна доповідь: Федорич П.В. «Проблема діагностики та лікування протозойних інвазій сечостатевої системи, викликаних Trichomonas hominis, Pentatrichomonas tenax та Giardia lamblia».
- Науково-практична конференція «Сучасна дерматовенерологія в розробках молодих науковців», м. Київ, 28 листопада 2019 р., усна доповідь: Федорич П.В. «Погляд на проблему ерадикації мікрофлори, пов’язаної з бактеріальним вагінозом».















