3 ТРИХОМОНОЗ – ЕПІДЕМІОЛОГІЧНІ, СОЦІАЛЬНІ,
КЛІНІКО-МОРФОЛОГІЧНІ, МОЛЕКУЛЯРНО-БІОЛОГІЧНІ
ХАРАКТЕРИСТИКИ ЗАХВОРЮВАННЯ
3.1 Захворюваність на інфекції, що передаються статевим шляхом. Локальне дослідження
При проведенні локального дослідження визначалася поширеність інфікування на збудники, що є найбільш клінічно значимими для ССС хворих на ІПСШ в Україні на сучасному етапі.
За допомогою методу ПЛР було проведено обстеження на Chlamydia trachomatis, Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum, Trichomonas vaginalis, Human papillomavirus та Neisseria gonorrhoeae біологічного матеріалу, отриманого в 2017 р. із сечостатевих органів у групи пацієнтів, хворих на ІПСШ, які проходили клініко-лабораторне обстеження на базі Олександрівської клінічної лікарні м. Києва, Україна. Обстежувалося 607 пацієнтів обох статей, у тому числі 295 (48,6 %) жінок та 312 чоловіків (51,4 %). Середній вік обстежених пацієнтів становив (32,0 ± 3,5) року. Для виявлення зазначених мікроорганізмів у ССС хворих досліджуваної групи використовувалася методика ПЛР як найбільш специфічна і чутлива із сучасних методик визначення мікроорганізмів. Взяття біологічного матеріалу для дослідження на наявність урогенітальних інфекцій здійснювалося відповідно до діючих керівних документів [66]. Дослідні зразки після їх реєстрації розміщувалися в пробірках «Еппендорф», що містили 1 мл стерильного фізіологічного розчину, і зберігалися у замороженому вигляді при температурі –10 ºС до проведення дослідження.
Для детекції зазначених мікроорганізмів використовувалися сертифіковані в Україні праймери та ампліфікатор ДТ-96 виробництва НВО «ДНК Технологія» (Російська Федерація).
Chlamydia trachomatis було виявлено у 159 (26,2 %) з 607 обстежених пацієнтів – 85 чоловіків та 74 жінок. Mycoplasma hominis було виявлено у 122 з 585 (21,1 %) обстежених пацієнтів – 64 чоловіків та 58 жінок. Mycoplasma genitalium, відповідно, у 17 (6,62 %) з 258 пацієнтів – 6 чоловіків та 11 жінок. Ureaplasma urealyticum було виявлено у найбільшої кількості пацієнтів (305 осіб, тобто у 48,77 % з 601 обстеженого пацієнта) – 157 чоловіків та 148 жінок. Trichomonas vaginalis було виявлено у 28 (5,23 %) з 535 пацієнтів – 15 чоловіків та 13 жінок. Human papillomavirus було виявлено у 158 з 297 обстежених (53,2 %) пацієнтів – 88 чоловіків та 70 жінок. Neisseria gonorrhoeae було виявлено у 33 з 297 (8,45 %) пацієнтів – 8 чоловіків та 25 жінок (табл. 3.1).
Таблиця 3.1 – Виявлення збудників ІПСШ у групі обстежених пацієнтів: загальна кількість та залежно від статі
| № з/п | Збудник інфекції | Всього обстежених осіб | Загалом | Чоловіки | Жінки | |||
| абс. | % | абс. | % | абс. | % | |||
| 1 | Chlamydia
trachomatis |
607 | 159 | 26,2 | 85 | 14 | 74 | 12,2 |
| 2 | Mycoplasma
hominis |
585 | 122 | 21,1 | 64 | 11,07 | 58 | 10,03 |
| 3 | Mycoplasma
genitalium |
258 | 17 | 6,62 | *6 | 2,36 | 11 | 4,26 |
| 4 | Ureaplasma
urealyticum |
601 | 305 | 48,77 | 157 | 26,12 | 148 | 24,65 |
| 5 | Trichomonas
vaginalis |
535 | 28 | 5,23 | 15 | 2,8 | 13 | 2,43 |
| 6 | Human
papillomavirus |
297 | 158 | 53,2 | 88 | 29,63 | 70 | 23,57 |
| 7 | Neisseria
gonorrhoeae |
397 | 33 | 8,45 | *8 | 2,15 | 25 | 6,3 |
Примітка. * – достовірність різниці показників відносно даних чоловіків та жінок (p ≤ 0,05)
Як видно з таблиці 3.1, у гендерному аспекті Mycoplasma genitalium зустрічалася у жінок майже в 2 рази частіше, ніж у чоловіків (4,26 % та 2,36 %, відповідно), а Neisseria gonorrhoeae у жінок зустрічалася майже в 3 рази частіше, ніж у чоловіків (6,3 % та 2,15 %, відповідно). Інші мікроорганізми, що досліджувалися, виявлялися приблизно на одному рівні у чоловіків та жінок.
Звертає на себе увагу той факт, що кількість обстежень на різні збудники ІПСШ в Україні різко варіює, що на думку автора, є наслідком відсутності галузевих стандартів з венерології та відсутності страхування випадків зараження на ІПСШ у країні, а також дорожнечею обстеження відносно до середнього рівня життя. Таким чином, найбільшу кількість обстежень призначають на ті ІПСШ, які зустрічаються найчастіше (Chlamydia trachomatis, Mycoplasma hominis та Ureaplasma urealyticum), та Trichomonas vaginalis, з огляду на здатність до персистенції збудників ІПСШ всередині цих найпростіших [31].
Загальні показники виявлення збудників ІПСШ в групі обстежених пацієнтів представлено в графічному вигляді (рис. 3.1). Як видно, серед найбільш актуальних збудників ІПСШ на сучасному етапі в Україні традиційно продовжують лишатися Ureaplasma urealyticum – 48,77 %, Chlamydia trachomatis – 26,2 % та Mycoplasma hominis – 21,1 %. Однак, не може не викликати занепокоєння той факт, що найбільші цифри виявлення мав Human papillomavirus – 53,2 %. Такий високий показник, на думку автора, є результатом декількох факторів, а саме: проведення дослідження в цільовій групі пацієнтів, низького рівня щеплень від папіломавірусної інфекції, а також низькою обізнаністю загалу населення в країні з ризиками медичних наслідків від цієї інфекції.
Neisseria gonorrhoeae сьогодні продовжує бути одним з актуальних збудників ІПСШ – виявлено у 33 з 297 обстежених (8,45 %) пацієнтів. Mycoplasma genitalium у наш час виявляється не дуже часто, у 6,62 % з обстежених пацієнтів. Звертає на себе увагу значне зменшення виявлення Trichomonas vaginalis. Цей мікроорганізм було діагностовано лише у 5,23 % обстежених пацієнтів. Відомо, що до широкого запровадження методу ПЛР для діагностики Trichomonas vaginalis, коли основним діагностичним методом була мікроскопія забарвлених мазків, виявлення становило близько 30 % від загалу хворих на ІПСШ [62]. На думку автора, це можна пояснити виявленням саме Trichomonas vaginalis за допомогою високоспецифічного методу ПЛР у наш час, порівняно з давнішніми даними мікроскопії, коли за Trichomonas vaginalis помилково розцінювали інші види найпростіших, у тому числі Trichomonas tenax, Penta8trichomonas hominis та Giardia lamblia [98, 102].
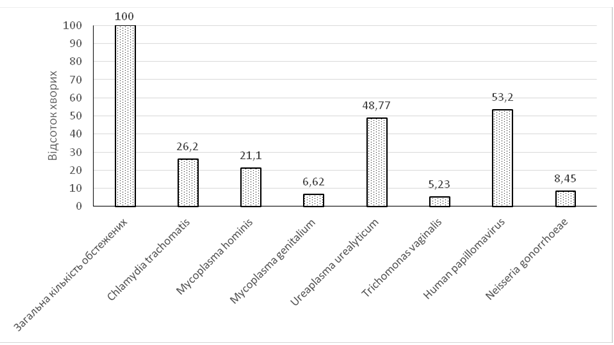 Рисунок 3.1 – Загальні показники виявлення збудників ІПСШ у групі обстежених пацієнтів
Рисунок 3.1 – Загальні показники виявлення збудників ІПСШ у групі обстежених пацієнтів
Таким чином, як показало локальне дослідження захворюваності на ІПСШ в Україні, найбільш клінічно значимими для ССС хворих на сучасному етапі є Human papillomavirus (53,2 %), Ureaplasma urealyticum (48,77 %), Chlamydia trachomatis (26,2 %) та Mycoplasma hominis (21,1 %). Тому, дослідження на ці мікроорганізми у вказаному регіоні на сучасному етапі є найбільш доцільним при проведенні діагностичних обстежень хворих з інфекціями ССС.
3.2 Епідеміологія сечостатевого трихомонозу
Поширеність та захворюваність на вагінальну інфекцію T. vaginalis вищі в африканських та латиноамериканських країнах, ніж в інших частинах світу (табл. 3.2). Різні дослідження, проведені в Данії, Великобританії та Франції, показали, що частота інфекції зменшується в промислово розвинених країнах [270]. Іранські дослідження визначили поширеність 2–8 % [253]. Однак, виходячи з культурних та соціальних факторів, цей показник недооцінюється і може перевищувати 30 %.
Таблиця 3.2 – Нові випадки та поширеність зараження T. vaginalis у жінок та чоловіків у віці від 15 до 49 років у різних регіонах світу [280]
| Регіон | Захворюваність
(нові випадки за 1 рік) |
Розповсюдженість (кількість хворих у загальній популяції) | ||||||
| Жінки | Чоловіки | Жінки | Чоловіки | |||||
| На 100 тис. | Абс. кіль-кість (млн.) | На 100 тис. | Абс. кіль-кість (млн.) | % | Абс. кіль-кість (млн.) | % | Абс. кіль-кість (млн.) | |
| Африка | 14600 | 28,1 | 16480 | 31,6 | 20,2 | 38,9 | 2 | 3,9 |
| Північна та південна Америки | 17770 | 42,5 | 18060 | 43,0 | 22,0 | 52,7 | 2,2 | 5,2 |
| Південно-східна Азія | 4030 | 18,5 | 5010 | 24,3 | 5,6 | 25,7 | 0,6 | 3,0 |
| Європа | 5170 | 11,6 | 4840 | 10,9 | 5,8 | 13,0 | 0,6 | 1,3 |
| Близький схід | 6400 | 9,7 | 6610 | 10,6 | 8,0 | 12,0 | 0,8 | 1,3 |
| Австралія – Океанія | 4560 | 21,9 | 4700 | 23,8 | 5,7 | 27,2 | 0,6 | 2,9 |
Наведені дані безперечно є оціночними. За відсутності програм спостереження, епідеміологія T. vaginalis не може бути відома повністю. У Сполучених Штатах у двох популяційних дослідженнях, які використовували тестування на ПЛР, виявлено у 2,3 % серед підлітків [212] та 3,1 % серед жінок 14–49 років [172]. Використовуючи ТАНК, рівень позитивності серед жінок Танзанії становив 11 % [194]. Жінки Папау-Нової Гвінеї також мають надзвичайно високий показник T. vaginalis, коливаючись від 21 % у вагітних жінок до 42,6 % у загальній популяції [251]. Інші дослідження населення, які використовували тестування нуклеїнових кислот, серед жінок репродуктивного типу в інших регіонах світу виявили нижчі показники (1 % у сільському В’єтнамі [254] та 0,37 % у Фландрії, Бельгія [195]. Частота скринінгу серед жінок, які відвідують клініки планування сім’ї, сильно різняться і залежать від профілю чинників ризику. Дослідження виявили рівень поширеності від 3,2–52 % у країнах, що розвиваються, та 7,6–12,6 % у США [206].
Поширеність трихомонозу серед жінок в Україні коливається в межах 5-30 %. Серед чоловіків 10 % усіх інфекційних захворювань статевої сфери припадає на трихомоноз. Відсутність повної реєстрації трихомонозу в Україні не дозволяє достовірно оцінити поширеність захворюваності в різних регіонах і в різних популяціях. Однак, статистичні дані свідчать про те, що трихомоноз залишається найпоширенішою статевою інфекцією в Україні (рис. 3.2). Нещодавно було проведено дослідження поширеності Trichomonas vaginalis в м. Тернопіль, за допомогою аналітичних тест-систем на основі ампліфікації нуклеїнових кислот APTIMA TV (США). Були послідовно обстежені сечостатеві мазки переважно симптоматичних жінок (n = 296) та чоловіків (n = 159). Поширеність інвазії T. vaginalis серед обох статей була близько 10 % (n = 47). Причому серед жінок цей показник склав 16 % (46/296), а серед чоловіків лише 0,6 % (1/159) [213]. За даними П.В. Федорича і Г.І. Маврова, в останні роки серед пацієнтів із запальними захворюваннями сечостатевих органів T. vaginalis виявляється за допомогою ПЛР в 5,2 %. Дещо частіше були інфіковані чоловіки (2,8 %), ніж жінки (2,4 %) [200]. При застосуванні методу мікроскопії процент виявлення трихомонад був досить високим (близько 30 %) [62]. Це можна пояснити високою специфічністю ПЛР, порівняно зі старими даними мікроскопії, коли інші найпростіші види, включаючи Trichomonas tenax, Pentatrichomonas hominis, помилково були ідентифіковані як T. vaginalis. Тільки в однієї третини чоловіків (31 %) інфекція супроводжується клінічними симптомами, тоді як у жінок симптоми відзначаються у 84 % випадків. Часто трихомоноз перебігає з ускладненнями (у жінок: ендоцервіцит – 59 %, аднексит – 44 %, ерозія шийки матки – 16 %, порушення менструального циклу – 12 %, у чоловіків: простатит – 88 %, орхоепідидиміт – 11 %, порушення статевої потенції – 24 %) [65, 98, 201].
Ще на початку 2000-х років було помічено, що санація трихомонад суттєво зменшує передачу ВІЛ статевим шляхом [224]. Дослідження, проведене в США, показало, що T. vaginalis сприяє захворюванню на ВІЛ та перевищує відносний внесок у відповідну захворюваність інших збудників ІПСШ [278]. Метронідазол, що застосовується для лікування інфекції T. vaginalis, значно зменшив кількість клітин, що не містять РНК ВІЛ. Більше того, у ВІЛ-інфікованих жінок ускладнення інфекції репродуктивних шляхів значно посилюються при наявності у них T. vaginalis і можуть зменшуватися, якщо ця інфекція контролюється [202, 224]. Дослідження показало, що інфекція T. vaginalis сприяла зараженню вірусом папіломи людини в 6,5 раза, збільшуючи ризик виникнення цервікальної неоплазії, як початкової стадії раку шийки матки [166]. Деякі штами T. vaginalis носять в собі власні віруси (Trichomonavirus), що вивільняється від заражених трихомонад й спричиняють запалення вже після лікування метронідазолом [193].
Таким чином, епідеміологія трихомонадної інвазії вивчена недостатньо. Немає однозначних трактовок цього захворювання щодо клінічної картини, патогенезу та можливих ускладнень. Невідомим залишаються також фактори ризику в окремих популяціях та причини гендерних, вікових та регіональних розбіжностей. Тому, метою даного дослідження було визначити розповсюдженість Trichomonas vaginalis серед статевих і вікових груп в Україні в цілому та в її окремих регіонах. З’ясувати закономірності поширення трихомонозу. Оцінити чинники ризику на це захворювання.
Для оцінки загальної поширеності трихомонозу були використані дані щорічних статистичних звітів МОЗ України та результати локальних епідемічних спостережень з 2011 до 2018 рр.
Аналіз захворюваності показав, що в Україні кількість знову зареєстрованих випадків трихомонозу повільно знижується, залишаючись, проте, на досить високому рівні – до 100 нових випадків на 100 000 населення в рік (рис. 3.2). За даними МОЗ України, у 2018 році було зареєстровано 41201 хворих на трихомоноз (8357 чоловіків і 32844 жінки). У перерахунку на інтенсивний показник захворюваності (на 100000 населення) це становило: всього – 97,6; чоловіки – 42,7; жінки – 145,0. За 2011-2018 роки інтенсивний показник захворюваності на трихомонадну інвазію (на 100 тис. населення на рік) у цілому по Україні зменшився в 1,97 раза (серед чоловіків – в 1,99 раза, а серед жінок – в 1,96 раза). Абсолютна кількість випадків реєстрації трихомонозу в Україні знижувалася швидше, оскільки населення країни зменшувалося. Тому абсолютний показник виявлення трихомонозу з 2011 по 2018 рр. зменшився для жінок в 2,12 раза, а для чоловіків – 2,14 раза (рис. 3.2, 3.3).
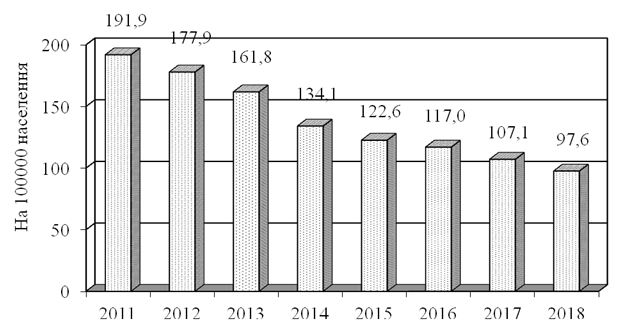 Рисунок 3.2 – Захворюваність на трихомоноз на 100 000 населення в Україні
Рисунок 3.2 – Захворюваність на трихомоноз на 100 000 населення в Україні
 Рисунок 3.3 – Кількість зареєстрованих випадків трихомонозу в Україні у 2011-2018 рр.
Рисунок 3.3 – Кількість зареєстрованих випадків трихомонозу в Україні у 2011-2018 рр.
Офіційні статистичні дані явно не відображають справжню поширеність трихомонозу в Україні. Про це свідчить вкрай нерівномірний розподіл захворюваності по регіонах, що ймовірно пов’язано з неповною реєстрацією, а також із лабораторною гіпо- та гіпер- діагностикою (табл. 3.3). Природно, якими б не були відмінності між регіонами (наприклад, між Херсонською (227,8) та Тернопільською областями (27,2), поширеність УТ в цих регіонах не може відрізнятися більш ніж у 8 з половиною разів! Очевидно, відмінності пов’язані не з об’єктивними даними, а з рівнем достовірності лабораторної діагностики та дотриманням наказів про обов’язкову реєстрацію трихомонозу, перш за все з боку приватних лікарів і суміжних фахівців – гінекологів та урологів. Викликає також недовіру й досить низька захворюваність у м. Києві (17,0), де багато фахівців і кращі можливості для якісної лабораторної діагностики. Ймовірно, в Києві багато випадків трихомонозу просто не реєструються і диспансерні заходи не проводяться!
Показники кількості випадків сечостатевого трихомонозу у чоловіків і жінок в окремих областях різняться досить істотно. У цілому по Україні в 2018 році знову інфікованих трихомонадами жінок було в 3,9 раза більше, ніж чоловіків. У Житомирській, Полтавській та Чернівецькій областях співвідношення чоловіків і жінок найбільш відрізняється більш ніж 1 до 30. В інших областях – Хмельницькій, Херсонській, Кіровоградській та Дніпропетровській кількість жінок із трихомонозом перевищує кількість чоловіків із трихомонозом не більше ніж у два рази (табл. 3.3). Причини таких великих відмінностей не відомі. У разі сильного переважання жінок на тлі високої загальної захворюваності (Житомирська область – 156,8) ймовірно має місце відсутність реєстрації трихомонозу у чоловіків з боку урологів при належній роботі акушерсько-гінекологічної служби. В областях, де загальна захворюваність низька (Полтавська – 62,2), можливо також «недопрацьовують» і гінекологи. Як правило, чим вища захворюваність в області, тим менше відмінностей у виявленості збудника у чоловіків і жінок (табл. 3.3). У динаміці, в цілому по Україні співвідношення захворюваності на трихомоноз чоловіків і жінок не змінюється. Так, в 2010 році жінки щодо захворюваності переважали в 3,3 раза або, відповідно, 90,9 і 304,4 на 100 000 населення кожної статі. Однак в окремих регіонах ситуація інша. Характерно, що в Київській області захворюваність серед чоловіків з 2010 по 2018 практично не змінилася, навіть злегка зросла (з 31,4 до 34,6), а серед жінок знизилася на 53,9 % (рис. 3.4). Дещо інша епідситуація в Харківській області, де серед чоловіків захворюваність впала вдвічі (з 54,4 до 99,4), а серед жінок знизилася більш, ніж в три рази (з 406,5 до 129,7) (рис. 3.4).
Таблиця 3.3 – Захворюваність на УТ в регіонах України в 2018 році.
| Область | Всього хворих | У т.ч. чоловіків | У т.ч. жінок | |||
| абс. числа | на 100000 населення | абс. числа | на 100000 населення | абс. числа | на 100000 населення | |
| Вінницька | 1 078 | 68,7 | 82 | 11,3 | 996 | 118,1 |
| Волинська | 770 | 74,3 | 105 | 21,5 | 665 | 121,6 |
| Дніпропетровська | 5 519 | 171,0 | 1 703 | 115,5 | 3 816 | 217,6 |
| Донецька (підконтрольна Україні) | 772 | 40,1 | 129 | 14,6 | 643 | 61,6 |
| Житомирська | 1 932 | 156,8 | 54 | 9,4 | 1 878 | 284,9 |
| Закарпатська | 931 | 74,2 | 130 | 21,5 | 801 | 122,9 |
| Запорізька | 839 | 48,7 | 53 | 6,7 | 786 | 84,0 |
| Івано-Франківська | 1 499 | 109,0 | 195 | 30,0 | 1 304 | 180,0 |
| Київська | 2 176 | 124,4 | 278 | 34,6 | 1 898 | 201,0 |
| Кіровоградська | 1 282 | 135,0 | 398 | 91,0 | 884 | 172,5 |
| Луганська (підконтрольна Україні) | 452 | 65,2 | 27 | 8,5 | 425 | 113,7 |
| Львівська | 2 468 | 98,3 | 445 | 37,4 | 2 023 | 153,2 |
| Миколаївська | 1 993 | 174,7 | 362 | 68,5 | 1 631 | 266,4 |
| Одеська | 5 348 | 225,5 | 1 190 | 106,6 | 4 158 | 331,0 |
| Полтавська | 875 | 62,2 | 26 | 4,0 | 849 | 112,0 |
| Рівненська | 697 | 60,1 | 180 | 32,7 | 517 | 84,9 |
| Сумська | 1 165 | 106,7 | 272 | 54,3 | 893 | 151,0 |
| Тернопільська | 285 | 27,2 | 16 | 3,3 | 269 | 48,2 |
| Харківська | 2 540 | 94,8 | 675 | 54,4 | 1 865 | 129,7 |
| Херсонська | 2 382 | 227,8 | 714 | 147,2 | 1 668 | 297,6 |
| Хмельницька | 2 689 | 211,5 | 915 | 155,1 | 1 774 | 260,4 |
| Черкаська | 1 473 | 121,1 | 219 | 39,2 | 1 254 | 190,5 |
| Чернівецька | 815 | 90,2 | 25 | 5,9 | 790 | 165,2 |
| Чернігівська | 729 | 72,1 | 96 | 20,9 | 633 | 114,7 |
| м. Київ | 492 | 17,0 | 68 | 5,1 | 424 | 27,3 |
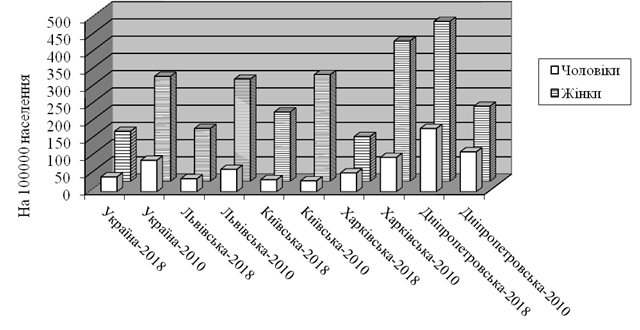 Рисунок 3.4 – Відмінності в захворюваності на генітальний трихомоноз в 2018 і 2010 рр. залежно від статі в різних регіонах України
Рисунок 3.4 – Відмінності в захворюваності на генітальний трихомоноз в 2018 і 2010 рр. залежно від статі в різних регіонах України
(на 100 000 населення відповідної статі)
Співвідношення міського і сільського населення серед нововиявлених випадків трихомонозу в Україні в 2018 році мало наступний вигляд: 111,5 – сільське і 91,3 – міське. У 2010 році в місті реєструвалося 207,0 на 100 000, а на селі – 203,7. Таким чином, на сьогоднішній день захворюваність на селі трохи вища, ніж у місті, хоча кілька років тому ці показники різнилися мало. Тенденція більш повільного зниження захворюваності на трихомоноз серед жителів села з роками збільшується. Так у Львівській та Київській областях захворюваність серед сільського населення переважала, відповідно в 1,5 і 1,4 раза порівняно з міським. А в 2010 році в Київській області захворюваність міських жителів переважала над сільськими в 1,5 раза. Там на 100 000 населення в 2010 році було 138,8 на селі і 208,7 – у місті. У цьому проявляються епідеміологічні особливості поширення трихомонозу навколо столичного мегаполісу (рис. 3.5). Захворюваність «йде» в сільську місцевість, де пацієнти менш доступні для проведення профілактичних диспансерних заходів.
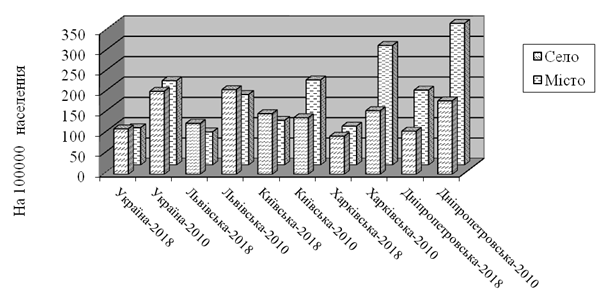 Рисунок 3.5 – Відмінності в захворюваності на УТ у 2018 і 2010 рр. залежно від місця проживання в різних регіонах України (інтенсивний показник на 100000 населення)
Рисунок 3.5 – Відмінності в захворюваності на УТ у 2018 і 2010 рр. залежно від місця проживання в різних регіонах України (інтенсивний показник на 100000 населення)
Вікові показники захворюваності свідчать про переважне поширення трихомонадної інвазії у чоловіків і у жінок від 20 до 30 років. У даний час відзначається досить висока захворюваність у дівчат 15-19 років – 152,7 на 100 000 населення цього віку. Це вища, ніж середня захворюваність по Україні серед жінок різного віку в 2018 році (145,0). По Україні співвідношення захворюваності серед юнаків та дівчат у цій віковій групі 1 до 2,4. У Київській області це співвідношення досягає 1 до 8,7 а в Харківській – 1 до 3,1. У Львівській області відмінності між молодими жінками та чоловіками до 20 років найменші – жінок більше, ніж чоловіків в 1,7 раза. Однак зі збільшенням віку співвідношення змінюється в бік збільшення частки жінок у всіх регіонах крім Київської області, де трихомоноз в останні роки істотно «помолодшав» (табл. 3.4, рис. 3.5).
Таблиця 3.4 – Захворюваність на УТ чоловіків і жінок різного віку (на 100 000 відповідного населення) у 2018 і 2010 рр.
| Чоловіки | Жінки | |||||||
| 15-19 років | 20-29 років | 30-39 років | 40-59 років | 15-19 років | 20-29 років | 30-39 років | 40-59 років | |
| Україна (2018) | 36,7 | 122,1 | 89,0 | 25,3 | 152,7 | 433,7 | 339,5 | 115,1 |
| Україна (2010) | 59,8 | 242,8 | 186,6 | 44,6 | 336,3 | 814,0 | 723,1 | 204,7 |
| Львівська (2018) | 81,3 | 125,7 | 65,4 | 8,4 | 136,6 | 496,5 | 393,9 | 78,4 |
| Львівська (2010) | 89,9 | 172,1 | 129,6 | 21,9 | 312,0 | 889,9 | 836,9 | 94,2 |
| Київська (2018) | 22,1 | 108,4 | 71,3 | 20,9 | 192,2 | 640,6 | 554,3 | 104,3 |
| Київська (2010) | 35,9 | 79,4 | 72,0 | 10,7 | 310,7 | 824,9 | 961,0 | 136,8 |
| Харківська (2018) | 29,7 | 121,2 | 128,1 | 37,2 | 91,5 | 364,9 | 330,9 | 101,4 |
| Харківська (2010) | 50,9 | 269,0 | 208,7 | 36,2 | 330,9 | 1143,5 | 1092,4 | 201,6 |
| Дніпропетровська (2018) | 160,3 | 340,6 | 219,6 | 67,0 | 354,1 | 703,1 | 483,0 | 155,7 |
| Дніпропетровська (2010) | 130,8 | 508,2 | 433,8 | 116,2 | 531,8 | 1118,4 | 885,1 | 274,4 |
При аналізі статевих і вікових відмінностей в захворюваності трихомоноз спостерігається суттєві відмінності в окремих областях України. У кожній області є свої особливості, очевидно, пов’язані з економічними і соціальними чинниками поширення трихомонозу. Наприклад, в Київській області серед чоловіків до 20 років захворюваність з 2010 року по 2018 впала в 4,1 раза, а серед жінок до 20 років знизилася тільки в 1,6 раза (табл. 3.4). Можна припустити, що захворюваність на трихомоноз у жінок до 20 років практично не знижується завдяки тому, що при наданні акушерсько-гінекологічної амбулаторної допомоги істотно зросла частка приватних структур, які часто просто не реєструють статеві інфекції. Серед чоловіків 30-39 років захворюваність на трихомоноз за вісім років знизилася в 1,8 раза, а серед жінок 30-39 років впала майже в 1,7 раза. Причому серед чоловіків 40-59 років захворюваність практично не змінилася за період 2010-2018 рр., а серед жінок даного віку знизилася незначно – в 1,3 раза (табл. 3.4, рис. 3.6).
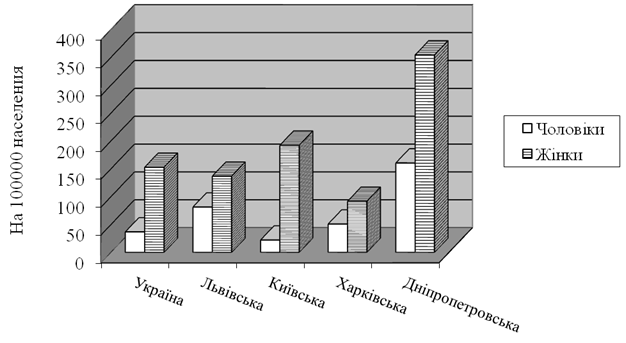 Рисунок 3.6 – Захворюваність на УТ у 2018 році серед населення у віці 15-19 років залежно від статі в різних регіонах України (на 100000 населення відповідної статі).
Рисунок 3.6 – Захворюваність на УТ у 2018 році серед населення у віці 15-19 років залежно від статі в різних регіонах України (на 100000 населення відповідної статі).
Докладний епідеміологічний аналіз генітальної трихомонадної інвазії показав, що захворюваність у ряді областей і в цілому в Україні продовжує залишатися високою близько 100 на 100 000. Має місце загальна тенденція до зниження рівня трихомонозу, але темпи зниження сильно варіюють, залежно від місця проживання і вікового та гендерного складу популяції. В ряді регіонів і серед окремих вікових груп – зокрема молоді 15-19 років, і особливо юнаків, захворюваність в останні роки знижується дуже повільно на тлі загальної явної тенденції до швидкого зниження. Статистика трихомонадної інфекції не відображає її фактичну поширеність в Україні і в регіонах. Тобто, реєстрація трихомонозу неповна. У ряді місць має місце гіпо- або гіпер-діагностика. Про це свідчить вкрай нерівномірний розподіл захворюваності по регіонах. Показники поширеності трихомонадної інвазії вочевидь залежать від медичних і соціальних факторів в окремих місцевостях, а також від статевої поведінки окремих вікових груп.
При трихомонозі наявно існують гендерні особливості. Захворювання завжди частіше зустрічається у жінок, особливо молодих. Хоча ступінь статевих відмінностей в частоті виявлення інфекції сильно відрізняється в різних областях України. В останні роки також відзначається відносна стабілізація захворюваності у осіб більш старшого віку – в групі 40-59 років і навіть 60 років і старше, що показує необхідність вивчати дану вікову групу в плані епідеміології трихомонозу та інших ІПСШ. Отримані дані дозволяють говорити про обов’язковий підхід до вивчення епідеміології ІПСШ з позицій малих соціальних груп – осіб різного віку і статі, що мешкають на окремих територіях. Аналіз загальних даних захворюваності часто вже не виявляє прихованих тенденцій і не дозволяє розробляти цільові засоби профілактичної роботи. Необхідно вивчати соціальні та біологічні аспекти епідемії трихомонадної інвазії, враховуючи сучасні основи діагностики, лікування і профілактики. До теперішнього часу немає відповіді на питання: чому в одних групах рівні виявлення інвазії ростуть, а в інших знижуються і навпаки? Які фактори визначають поширення? Як можна ефективно вплинути на епідемічний процес? Які лікувально-профілактичні та організаційні заходи необхідно проводити в кожній конкретній епідемічній ситуації?
Таким чином, були встановлені наступні положення:
- Захворюваність на трихомоноз в Україні становить 97,6 випадків на 100 000 населення за 2018 рік, і і 83,0 за 2019 рік. Встановлено тенденцію до зниження рівня виявленості трихомонозу, але її темпи сильно варіюють, залежно від місця проживання і вікового та гендерного складу популяції. В ряді регіонів і серед окремих вікових груп, зокрема молоді 15-19 років, захворюваність знижується досить повільно.
- Статистичні дані щодо трихомонадної інфекції сьогодні не відображають її фактичної поширеності внаслідок неповноцінної її реєстрації.
- При трихомонозі виявлено значні гендерні та вікові особливості. Захворювання є більш поширеним серед жінок, особливо молодого віку. Хоча ступінь статевих відмінностей в частоті інфекції в деяких регіонах сильно різниться. Відзначається стабілізація показників захворюваності в осіб групи 40-59 років і, навіть, 60 років і старше, що вказує на необхідність вивчати дану вікову групу в плані епідеміології трихомонозу та інших ІПСШ.
Обов’язковим стає підхід до вивчення епідеміології ІПСШ з позицій малих соціальних груп – осіб різного віку і статі, що мешкають на окремих територіях, а також мають певні особливості статевої поведінки. Аналіз загальних даних захворюваності вже не виявляє прихованих тенденцій і не дозволяє розробляти ефективні засоби профілактичної роботи. Необхідним є вивчення як медико-біологічних, так і соціальних аспектів інвазії Trichomonas vaginalis, враховуючи сучасні дані щодо мікробіології та діагностики збудника, а також лікування і профілактики станів, що він викликає.
3.3 Соціально-епідемічні та клінічні характеристики хворих на хронічний резистентний трихомоноз
Результати порівняння всіх досліджених хворих за віком, статтю та сімейним станом представлені в таблиці 3.5. Встановлено, що у всіх клінічних групах переважна більшість (86,7 % хворих) були у віці найбільшої соціально-економічної та репродуктивної активності (18-39 років), що свідчить про їх вплив на економічні та демографічні процеси суспільства. Гендерна розподіл серед хворих на УТ, показало, що чоловіків було (62,7 ± 3,1) %, а жінок – (37,3 ± 3,1) %, При цьому третина перебувала у шлюбі – (33,1 ± 3,0) %, розведених було (20,5 ± 2,6) %.
За соціальним станом: учнів і студентів було 96 ([39,8 ± 3,2] %), службовців – 52 ([21,6 ± 2,6] %), підприємців – 67 ([27,8 ± 2,9] %), робітників – 18 ([7,5 ± 1,7] %) і безробітних – 8 ([3,3 ± 1,2] %).
За результатами комплексного обстеження 241 хворого з трихомоноз, виявлена наступна супутня патогенна урогенітальна мікрофлора: хламідіоз – у 116 ([48,1 ± 3,2] %), мікоплазмоз – у 87 ([36,1 ± 3,1] %), гарднерельоз – у 40 ([16,6 ± 2,4] %) хворих. Крім цього, в даній групі у 123 (77,2 %) хворих діагностовано хронічну латентно поточну (безсимптомну) вірусну інфекцію: вірус простого герпесу 1 і 2 типу – у 118 ([49,0 ± 3,2] %), цитомегаловірус – у 19 ([7,9 ± 1,7] %) і вірус Епштейна-Барр – у 8 ([3,3 ± 1,2] %) хворих.
Таблиця 3.5 – Розподіл хворих на сечостатевий трихомоноз за віком, статтю та сімейним станом в динаміці при послідовному дослідженні
| Показники | Період обстеження, роки | ||||
| 2015–2016, n=35 |
2017–2018, n=79 | 2019, n=127 |
Усього, n = 241 |
||
| Вік хворих, роки | 18–29 | 22 (62,9 %) |
51 (64,6 %) |
81 (63,8 %) | 154 (64 %) |
| 30–39 | 8 (22,8 %) |
17 (21,5 %) |
30 (23,6 %) | 55 (23 %) | |
| 40–59 | 5 (14,3 %) |
11 (13,9 %) |
16 (12,6 %) | 32 (13 %) | |
| Статева прина-лежність | Чоловіки | 20 (57,1 %) |
52 (65,8 %) |
79 (62,2 %) | 151 (62,7 %) |
| Жінки | 15 (42,9 %) |
27 (34,2 %) |
48 (37,8 %) | 90 (37,3 %) | |
| Сімейний стан | Перебували у шлюбі (40 подружніх пар) | 12 (34,3 %) |
26 (32,9 %) |
42 (33,1 %) | 80 (33,2 %) |
| Розлучені | 8 (22,9 %) |
17 (21,5 %) |
25 (19,7 %) | 50 (20,5 %) | |
| Ніколи не перебували у шлюбі | 15 (42,8 %) |
36 (45,6 %) |
60 (47,2 %) | 111 (46 %) | |
При підтвердженні діагнозу трихомоноз у 241 обстежених хворих найбільш чутливим виявився метод ПЛР – 83-95 %. Він дещо гірше виявляв безсимптомні форми інфекції, хоча і при безсимптомній формі цей метод мав найбільшу чутливість в порівнянні з культурою і мікроскопією – 90 % (табл. 3.6). Що стосується мікроскопії нативного мазка, то позитивні результати виявлялися у 58-88 % залежно від клінічної форми. Пряма мікроскопія трихомонад в нативному мазку безпосередньо у виділеннях мала чутливість 35-70 %. Найкраще метод працював при неускладненій формі, коли трихомонади не затулялись великою кількістю супутньої мікробної флори і запальних клітин макроорганізму. Метод культури виявився оптимальним при комплексній діагностиці, різних клінічних форм сечостатевого хламідіозу. Він мав чутливість 84,6 % і специфічність – до 100 % і тому рекомендований при хронічних формах, а також як контроль вилікування.
Таблиця 3.6 – Лабораторні маркери трихомонадної інвазії при різних клінічних формах сечостатевого трихомонозу
| Клініка | Кіль-кість | ПЛР + | Нативный мазок + | Культура + | ||||
| Кіль-кість | % | Кіль-кість | % | Кіль-кість | % | |||
| Неускладнені форми
(Уретрит, баланопостит, вульвовагініт, цервіцит, ерозія шийки матки) |
124 | 118 | 95,2±1,9 | 86 | 69,4±4,1 | 108 | 87,1±3,0 | |
| Ускладнені форми
(простатит, епідидиміт, аднексит, цистит, сексуальні розлади, безпліддя) |
77 | 72 | 93,5±4,7 | 48 | 62,3±5,5 | 67 | 87,0±3,8 | |
| Безсимптомна форма | 40 | 33 | 82,5±6,5 | 23 | 57,5±7,8 | 29 | 72,5±7,1 | |
| УСЬОГО | 241 | 223 | 92,5±2,7 | 157 | 65,1±3,1 | 204 | 84,6±2,3 | |
При аналізі клінічних проявів у хворих на трихомоноз показано, що у 26 чоловіків (17 %) виявлено безсимптомний перебіг, а у 125 чоловіків (83 %) визначалася клінічна патологія з боку сечостатевого тракту. Провідним клінічним синдромом у 58 (38 %) хворих було виявлено уретрит, у 21 (14 %) – простатит, у 11 (7 %) – епідидиміт, у 23 (23 %) баланопостит. Копулятивні і репродуктивні розлади мали місце у 12 чоловіків, що склало 8 % (табл. 3.7). Серед 90 жінок у 76 (74 %) зустрічалася патологія як нижніх, так і верхніх поверхів урогенітального тракту.
Таблиця 3.7 – Переважаючий клінічний синдром у 241 хворого трихомонадною інвазією
| Переважаючий синдром | n | % |
| Чоловіки | ||
| Уретрит | 58 | 38,4 ± 4,4 |
| Баланопостит | 23 | 15,2 ± 2,9 |
| Простатит | 21 | 13,9 ± 2,8 |
| Епідидиміт | 11 | 7,3 ± 2,1 |
| Сексуальні розлади, безпліддя | 12 | 7,9 ± 2,2 |
| Відсутність симптоматики | 26 | 17,2 ± 3,1 |
| Усього | 151 | 100,0 |
| Жінки | ||
| Вульвовагініт | 17 | 18,9 ± 4,1 |
| Цервіцит | 9 | 10,0 ± 3,2 |
| Аднексит | 14 | 15,6 ± 3,8 |
| Ерозія шийки матки | 17 | 18,9 ± 4,1 |
| Цистит | 8 | 8,9 ± 3,0 |
| Сексуальні розлади, безпліддя | 11 | 12,2 ± 3,5 |
| Відсутність симптоматики | 14 | 15,6 ± 3,8 |
| Усього | 90 | 100,0 |
Цистит виявлено у 8 (9 %) жінок, вульвовагініт – у 17 (19 %), цервіцит – у 9 (10 %), ерозії шийки матки – у 17 (19 %), аднексит – у 14 (15,6 %). У 14 жінок (16 %) спостерігався безсимптомний перебіг трихомонадної інвазії. Порушення менструального циклу, безпліддя і сексуальні розлади превалювали як основний клінічний синдром у 11 жінок, що склало близько 12 % (табл. 3.7).
Головними скаргами у жінок були різні за кольором і кількістю виділення зі статевих органів, часто з неприємним запахом. Приблизно в однієї третини обстежених жінок реєструвалася хворобливість або дискомфорт внизу живота. Свербіж шкіри і слизових оболонок статевих органів відзначали до однієї третини хворих, печіння у 17 % і дизуричні розлади – у 9 % жінок. Більшість пацієнток мали комбінацію двох і більше скарг. Виділення зі статевих органів в більшості випадків були мізерними і мали слизовий вигляд.
Результати рутинних лабораторних тестів (клінічний аналіз сечі і крові) при трихомонозі істотно не змінювалися. Лише при ускладненні основної патології в ряді випадків відзначався помірний лейкоцитоз (лейкоцити до (8,6 ± 1,2) × 109/л зі збільшенням паличкоядерних до (5,9 ± 1,1) % і ШОЕ до (15,7 ± 1,4) мм/год) і термінальна лейкоцитурія (до 13 ± 3 в поле зору) зі збільшенням виділення слизу і помірною бактеріурією. Кількість лейкоцитів в аналізах сечі по Нечипоренко в середньому сягала 6500 ± 1000 в 1 мл.
Помірні зміни біохімічних показників сироватки крові відзначені лише у хворих з супутньою патологією, вказуючи на її вираженість. Під час загострень у поодиноких хворих нами зареєстровані підвищення в крові сечовини до 9,8 ммоль/л та креатиніну до 165 мкмоль/л, а також активність органоспецифічних ферментів: аспартатамінотрансферази до (1,3 ± 0,3) мкмоль/(год ∙ мл), аланінамінотрансферази до (1,01 ± 0,16) мкмоль/(год ∙ мл) і лужної фосфатази до (4,69 ± 1,12) Од/л. У ряду спостережуваних хворих відзначено також підвищення в плазмі крові показників вуглеводного обміну: фосфофруктокінази до (15,4 ± 1,7) мкмоль/г білка, альдолази до (4,02 ± 0,39) Од/мл і гексокінази до (14,9 ± 1,24) Од/мл, що враховувалося при проведенні комплексної терапії.
При клінічно вираженому БВ (масивні виділення з «риб’ячим запахом») метод ПЛР в 100 % випадків підтвердив у спостережуваних жінок наявність гарднерел. Цей же метод дозволив виявити наявність Gardnerella vaginalis також і в чоловіків.
Уретроскопічно у чоловіків виявлені обмежені зони набряклості і гіперемії з щілиноподібними заглибленнями темно-червоного кольору і грубими складками, а у окремих хронічних пацієнтів, які отримували місцеве лікування і інтенсивний масаж уретри на бужі, виявлена блідо-сіра тьмяна слизова з грубими складками і формуванням рубцевих звужень уретри на рівні її стволового відділу. Кольпоскопічне дослідження, виконане при гінекологічному обстеженні всіх спостережуваних жінок, дозволило діагностувати екзоцервіцит і ендоцервіцит. Ретенційні кісти з перифокальним запаленням (Наботові кісти або закриті залози) виявлені у 17 % хворих, а справжня ерозія шийки матки – у 19 обстежених. Кольпоскопічні дані дозволяли судити про ступінь запального ушкодження епітелію і залоз шийки матки.
Ультразвукове дослідження сечостатевих органів у чоловіків включало морфологічну оцінку стану кавернозних і печеристих тіл, передміхурової залози і органів калитки. Обмежені фіброзні зміни кавернозних тіл виявлено у 6 (4 %) хворих, і ще у 13 (8,6 %) виявлені фіброзно-ретенційні зміни в яєчках і особливо в їх придатках. Трансабдомінальне ультразвукове дослідження передміхурової залози, проведене у всіх обстежених чоловіків, виявило асиметричність за рахунок збільшення (набряклість) і фіброзно-фолікулярних змін в правій частці у 32 (21,2 %), а зони підвищеної ехогенності частіше відзначені в центральній частині залози (у 28 – 18,5 % обстежених) з утворенням кальцифікатів. У всіх жінок виконувалося оглядове поліпозиційне трансабдомінальне ультразвукове дослідження органів малого тазу з наповненим сечовим міхуром і частину жінок для уточнення ступеня деструкції маткових труб і яєчників дивилися трансвагінально. Найбільш часто виявлявся сальпінгоофорит і аднексит – у 14 (15,6 %), а також полікистозна дегенерація яєчників встановлена у 7 ([7,8 ± 2,8] %) і ендометріоз був у 6 (6,7 %).
Проведення поглибленого вивчення анамнезу, додаткове обстеження та консультації лікарів інших фахів дозволили виявити у обстежених пацієнтів певну супутню патологію (табл. 3.8).
Таблиця 3.8 – Супутні захворювання у 241 хворого на трихомонадну інвазію
| Супутні захворювання | Період обстеження, роки | |||||||
| 2015–2016,
n=35 |
2017–2018,
n=79 |
2019,
n=127 |
Усього,
n= 241 |
|||||
| абс. | % | абс. | % | абс. | % | абс. | % | |
| Шлунково-кишкового тракту (гастрит, холецистит, панкреатит, коліт) | 4 | 11,4 ± 5,4 | 15 | 20,3 ±4,5 | 27 | 21,3 ± 3,6 | 46 | 19,1±2,5 |
| Гнійно-запальні (апендицит, фурункульоз, отит) | 4 | 11,4 ± 5,4 | 11 | 13,9±3,9 | 19 | 15,0± 3,2 | 34 | 14,1±2,2 |
| Дихальної системи (бронхіти, пневмонія, бронхіальна астма, грип, ГРЗ) | 7 | 20,0 ± 6,8 | 22 | 46,8±5,6 | 33 | 26,0± 3,9 | 62 | 25,7±2,8 |
| Серцево-судинної системи (ішемічна хвороба серця, стенокардія, гіпертонічна хвороба) | 3 | 8,6 ± 4,7 | 2 | 2,5± 1,8 | 5 | 3,9± 1,7 | 10 | 4,1±1,3 |
| Шкірні (мікози, вугри, піодермія) | 6 | 17,1 ± 6,4 | 6 | 7,6±3,0 | 19 | 15,0± 3,2 | 31 | 12,9±2,2 |
| Відсутність захворювань | 11 | 31,4 ± 7,8 | 23 | 29,1±5,1 | 24 | 18,9± 3,5 | 58 | 24,1±2,8 |
У всіх трьох клінічних групах частіше за все відзначались запальні захворювання верхніх дихальних шляхів, захворювання шлунково-кишкового тракту, а також гнійно-запальні захворювання. В той же час, істотної різниці в частоті перенесених захворювань, виявлено не було, що свідчить про однорідність підбору пацієнтів.
Отже, особливості клінічних проявів УТ у поєднанні з мікст-інфекціями, що передаються статевим шляхом, характеризуються або мало- чи асимптомним тривалим перебігом захворювання, або багатофокусністю ураження, наявністю супутніх мікроорганізмів, які підтримують запальний процес, а також присутністю резидуальних явищ і ускладнень.
Таким чином, можна дійти наступних висновків:
- Особливості клінічних проявів УТ визначаються або малосимптомним тривалим перебігом (15-20 % випадків), або багатофокусним ураженням, наявністю супутніх мікроорганізмів, а також резидуальними явищами й ускладненнями.
- Найбільш чутливим методом діагностики Trichomonas vaginalis виявився метод ПЛР – до 95 %. Він дещо гірше виявляв безсимптомні форми інфекції, хоча і при безсимптомній формі цей метод мав найбільшу чутливість в порівнянні з культуральним методом і мікроскопією – до 90 %.
- Трихомонадна інвазія здатна спричиняти запальні прояви з боку статевих органів – кольпіту, вульвіту, цервіциту, ендоцервіциту, уретриту, простатиту, епідидиміту, циститу.
- Трихомоноз зазнав певного клінічного патоморфозу. Збільшилася частота атипових і резистентних до лікування форм. З іншого боку – зріс відсоток висхідних ускладнень; очевидно, що має місце необхідність в уточнені клінічних і лабораторних критеріїв діагнозу різних форм трихомонозу.
3.4 Клініко-морфологічна (ультраструктурна) характеристика хронічного, ускладненого трихомонозу
Було проведено клініко-лабораторне обстеження 189 пацієнтів у віці від 17 до 80 років. Наявність хламідійної інфекції верифікувалася за результатами виявлення збудника в епітеліальних клітинах уретри, цервікального каналу за методом прямої імунофлюоресценції та визначенні антитіл до C. trachomatis за допомогою імуноферментного аналізу з використанням наборів “Рекомби Слайд Хламидия” (Лабдиагностика, Россия) та імуноферментної тест-системи Vitrotest-Chlamydia IgG (Україна). Об’єктом електронно-мікроскопічного дослідження слугували 5–9 добові культури трихомонад, виділені від 52 хворих.
Критеріями включення до досліджуваної групи слугували наявність хронічних запальних захворювань сечостатевих шляхів з в’ялим перебігом, скудною симптоматикою та давністю захворювання більше 1 року. До когорти обстежених ввійшли пацієнти як жіночої, так і чоловічої статі, їх кількість склала 92 та 97 осіб, відповідно. Розкид вікового діапазону обстежених був достатньо широким, так вік пацієнтів чоловічої статі варіював від 17 до 80 років (середній вік – 36,3 ± 5,0), а жіночої – від 18 до 76 років (середній вік – 36,8 ± 5,1). Пік захворюваності припадав на віковий інтервал 27-32 роки (63,5 %). Серед обстежених жінок наявні синдроми розподілилися наступним чином: хронічний ендоцервіцит – 48 осіб, хронічний аднексит – 20 пацієнток, хронічний цистит – 16 жінок, інші діагнози (ерозія шийки матки, кольпіт, вульвовагініт) – 8 осіб. Серед чоловіків обстеження здійснено у 70 пацієнтів з хронічним уретритом та у 27 – з хронічним простатитом. Серед пацієнтів було 19 пар статевих партнерів, з них 16 родин та 3 неодружених пари. Усі вони обстежені для встановлення причин запальних захворювань органів малого тазу. Діагноз трихомонозу був верифікований у 92 ([48,7 ± 3,6] %) пацієнтів. Відсоток позитивних випадків був більш високим у результаті проведення посівів на р2ідкі живильні середовища. Загальна кількість середовищ, у яких спостерігався ріст трихомонад, досягла 92 зразків зі 189. Наявність збудників у мазках, забарвлених за Грамом, склала (20,6 ± 2,9) %. Відсоток позитивних результатів, отриманих бактеріологічно, виявився дещо вищим серед жінок: він сягнув (28,0 ± 3,3) % проти (20,6 ± 2,9) % у чоловіків. Характерно, що аналогічна картина спостерігалась і при бактеріоскопічному дослідженні мазків. Відсоток виявлення найпростіших у жінок становив (12,2 ± 2,4) %, а в чоловічих мазках – (8,5 ± 2,0) %. У нашій виборці більше половини пацієнтів були інфіковані трихомонадами у вигляді моноінфекції. Цей показник досяг (51,1 ± 5,2) % (96 хворих).
Також було проаналізовано кількість сателітних інфекцій. Аналіз показав, що відсоток хворих, у яких одночасно з трихомонадною, виявлено хламідійну інфекцію, становив (18,5 ± 4,0) % (35 хворих). Різні види умовно-патогенної мікрофлори виявлено у (30,4 ± 4,8) % (58) пацієнтів, у яких основним чинником запальних процесів була протозойна інвазія. Також у 9 ([4,8 ± 1,5] %) пацієнтів була діагностована мікоплазмова інфекція.
Був здійснений розподіл хворих по групах за віком. Вікові групи складено таким чином, щоб до них увійшли особи однакового сімейного стану. Так, у першій групі переважна кількість неодружених чоловіків була у віці 17–25 років, а жінок у віці 18-30 років. У другій групі більшість пацієнтів перебувала у шлюбі, вік чоловіків був обраний у діапазоні від 26 до 40 років, а жінок від 30 до 45. Третю групу обстежених складено з осіб більш старшого віку, а саме чоловіків старше 41 року, жінок – 45. При визначенні статевої структури хворих на трихомоніаз за досліджений період відзначалося більше осіб жіночої статі у першій групі. Наявна інфекція спостерігалась у (30,4 ± 4,8) % обстежених жінок, тоді як відсоток інфікованих чоловіків віком до 25 років склав (3,1 ± 1,7) %. У жінок наявність інвазії виявлялася суттєво частіше, ніж у чоловіків, що було пов’язане з дещо більш вираженою симптоматикою захворювання, яка змушує їх активніше звертатися за спеціалізованою допомогою. Хоча для меншої частини обстежених жінок визначався перебіг захворювань з мінімальною кількістю скарг (незначні виділення у вигляді білей). У другій групі показники виявлення трихомонад відрізнялися від першої. Було відмічено збільшення частоти випадків трихомонозу у чоловіків, які зросли до (24,7 ± 4,4) %. У обстежених жінок виявлена тенденція до невеликого зниження рівня інфікування. Слід підкреслити, що у даній групі переважна кількість пацієнтів мали більш тривалий період розвитку інфекції з хронізацією захворювання. У третій групі обстежених зниження частоти діагностування збудника спостерігалось як у жінок, так і у чоловіків і знизилася до (12,4 ± 3,3) % серед пацієнтів чоловічої статі та до (5,4 ± 2,4) % жіночої. Таким чином, отримані дані дозволяють зробити попередній висновок щодо необхідності моніторингу інфекції з позицій окремих популяційних груп за віком та статтю.
Таблиця 3.9 – Результати обстеження хворих на Trichomonas vaginalis залежно від топічного клінічного діагнозу
| Клінічний діагноз | Стать | Кількість хворих | Кількість позитивних результатів на Trichomonas vaginalis |
|
| Абс. | %±m | |||
| Хронічний уретрит | Чоловіки | 70 | 26 | 37,1 ± 5,8 |
| Хронічний простатит | Чоловіки | 27 | 13 | 48,1 ± 9,6 |
| Хронічний ендоцервіцит | Жінки | 48 | 29 | 60,4 ± 7,1 |
| Хронічний цистит | Жінки | 16 | 9 | 56,3 ± 12,4 |
| Хронічний аднексит | Жінки | 20 | 12 | 60,0 ± 10,9 |
| Інші (ерозія шийки матки, вульвовагініт, кольпіт) | Жінки | 8 | 3 | 37,5 ± 17,1 |
| Усього | Чоловіки+Жінки | 189 | 92 | 48,7 ± 3,6 |
Наступний аналіз результатів обстеження пацієнтів проведено з урахуванням домінуючих синдромів при захворюванні. За результатами досліджень було проведено аналіз верифікації трихомозу в хворих з різними клінічними діагнозами. Встановлено, що кількість виявлених позитивних результатів відрізнялася при запальних процесах різної локалізації. У таблиці 3.9 представлено розподіл хворих в залежності від клінічного діагнозу з визначенням позитивних результатів на Trichomonas vaginalis.
У результаті аналізу отриманих даних показано, що у пацієнтів чоловічої статі вищий відсоток позитивних результатів ([48,1 ± 9,6] %) спостерігався у хворих з хронічним простатитом (середній вік – 30,1 року). Привернув увагу вік обстежених чоловіків з цим діагнозом у зв’язку з тим, що хоча віковий діапазон був від 20 до 80 років, переважну кількість хворих цієї групи склали пацієнти, які пройшли тридцятирічний рубіж. Даний факт підкреслює проблему так званого «трихомонадоносійства», коли хворі з малосимптомним перебігом інвазії не мають уяви щодо наявності у них T. vaginalis. Отриманий показник демонструє високу інфікованість даного контингенту і свідчить про необхідність своєчасного обстеження та лікування. У чоловіків з хронічним уретритом відсоток знаходження T. vaginalis був нижчим і склав (37,1 ± 5,8) %. Достатньо високий, приблизно рівний процент визначено у жінок з хронічним ендоцервіцитом та аднекситом, показники знаходження збудників досягали 60 %. Настільки широка розповсюдженість інфекції у цих групах має немаловажне значення з урахуванням репродуктивного періоду життя хворих, середній вік яких склав 29,5 при аднекситах та 29,9 року при ендоцервіцитах. Також високий показник спостерігався у групі жінок з хронічним циститом – (56,3 ± 12,4) %. Слід зазначити, що ця група складена з жінок більш старшого віку, середньовікове число склало 45,2 року, а розкид років у пацієнток був вельми широким, від 22 до 76. Таким чином, високий показник наявності інфекції у групі обстежених ([48,7 ± 3,6] %) свідчить про необхідність вчасної діагностики трихомонадної інвазії для запобігання ускладнень.
На наш погляд, є актуальними дані, що демонструють видовий склад умовно-патогенної мікрофлори, яка виявлена у якості асоціантів T. vaginalis. Переважну кількість виділених мікроорганізмів представляли різні види стрептококів та стафілококів, а меншу частку – представники інших родин. Оскільки спостерігалися гендерні відмінності, то результати у чоловіків та жінок розглянуто окремо. У 34 жінок ([36,9 ± 5,0] %) було виділено штами умовно-патогенних мікроорганізмів у високих ступенях колонізації. Провідне місце серед ізольованих штамів бактерій зайняли стрептококи, а дещо нижчим виявився відсоток виявлення стафілококів, При цьому питома вага деяких видів була вищою, ніж інших. Серед стрептококів, що зустрічалися у даній групі, були представники трьох видів. Лідируючі позиції стрептококової компоненти зайняли S. mitis та S. mutans (26,3 % та 14,7 %, відповідно), а стафілококової – S. haemolyticus (17,6 %). Дещо нижчим виявився відсоток виявлення S. warneri (11,8 %). Достатньо високим процентом виявлення відзначилася E. coli, (11,8 %). У частини жінок (5,9 %) було вилучено Klebsiella spp. – мікроорганізм, який володіє достатньо вираженими патогенними властивостями та не є притаманним для даного біотопу.
За результатами бактеріологічних досліджень чоловіків результати мікробного складу сечостатевого біоценозу 41 хворого ([42,3 ± 5,0] %) відрізнялися від результатів, отриманих у жінок. В даному випадку «лідером» серед ізольованих мікроорганізмів був S. haemolyticus (19,5 %), а на другій позиції виявився представник роду стрептококів – S. mitis (12,2 %). Показано, що стрептококова компонента біоценозу серед чоловіків була представлена лише одним видом та була нижчою у процентному співвідношенні, ніж у жінок. Більш високий процент виявлення у чоловіків у порівнянні з жіночою групою був у Klebsiella spp. – показник досяг майже 10 %. Проте ізоляти E.coli було отримано у меншої частини чоловіків порівняно з жінками – 7,3 %. На відміну від жінок, в чоловіків було знайдено представника ентеробактерій – Рroteus mirabilis (4,9 %). З урахуванням тієї обставини, що цей мікроорганізм не повинен перебувати у даному біотопі, то навіть низький відсоток його виявлення можливо спричиняє запитання – як цей збудник з товстого кишечнику потрапив до уретри. При обстеженні 19 пар в було верифіковано діагноз трихомонадної інвазії. У сімох парах трихомонади були знайдені як у чоловіка, так і у дружини, у трьох парах – тільки у одного партнера. З урахуванням клінічних проявів, подружжя розподілилися наступним чином. Лише 7 пар звернулися до лікаря у зв’язку з основним діагнозом запальних процесів уретри та цервікального каналу. Переважна кількість пацієнтів мала ознаки синдромів ураження внутрішніх статевих органів – простатит у чоловіків, аднексит у жінок (як правило, ускладнення спостерігались у обох партнерів).
Таким чином, з представлених даних видно, що трихомонадна інвазія продовжує займати лідируючи позиції з розповсюдженості і являє собою загрозу здоров’ю як молодих людей, так і більш зрілих, призводить до появи ускладнень, що зумовлюють порушення репродуктивної, статевої та сечовидільної функцій організму.
На першому етапі електронно-мікроскопічного дослідження було проведено обстеження пацієнтів на наявність трихомонадної інвазії за допомогою бактеріоскопічних методів діагностики. Біологічний матеріал від хворих, зразки яких було виявлено позитивними при використанні методів світлової мікроскопії, засівали на селективне живильне середовище з метою накопичення біомаси збудника. Отримані таким чином зразки надалі вивчалися за допомогою методів трансмісивної електронної мікроскопії для отримання даних про ультраструктурні особливості T. vaginalis. На рис. 3.7 наведено фото препаратів зразків, отриманих від хворих на УТ.
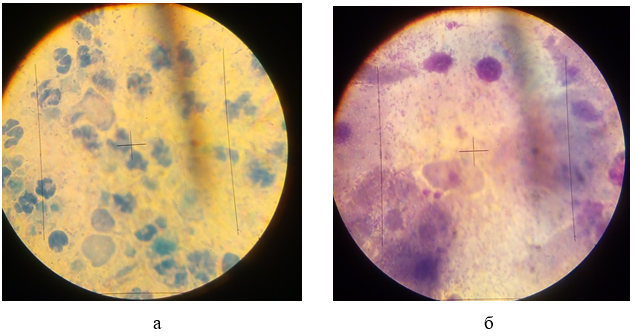
Рисунок 3.7 – T. vaginalis в мазку з цервікального каналу хворої К., забарвлення 1 % метиленовим синім (х 1000) (а) та T. vaginalis в мазку з піхви хворої Н., забарвлення за Грамом (х 1000) (б)
У препаратах, забарвлених 1 % метиленовим синім (рис. 3.7а), трихомонади візуалізувалися у вигляді округлих або овальних утворень, розташованих в слизу між клітинними елементами. Чітко простежувалася оболонка паразитів, ексцентрично розташоване ядро, інтенсивно забарвлене в синій колір, протоплазма – світло-синя, вакуолі – безбарвні. При такому способі забарвлення трихомонади мають характерний вигляд і добре розпізнаються. При використанні забарвлення за Грамом (рис. 3.7б) трихомонади фарбувалися блідо, їх оболонка мала вигляд тонкої смуги, сітчаста протоплазма помаранчево-червоного кольору, ядро – блідо фіолетового. Джгутики і ундулююча мембрана при цьому не розпізнавалися.
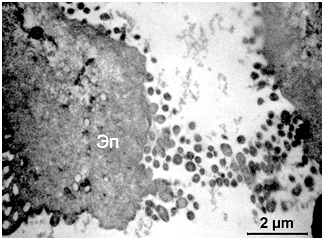
Оптичний аналіз напівтонких зрізів зразків, отриманих культуральним методом, свідчить про те, що їх клітинний склад представлений в основному десквамованими епітеліоцитами, мікроорганізмами різних видів і незначною кількістю трихомонад (рис. 3.8). В одному препараті могли зустрічатися як грушоподібний, так і овальний морфотип збудника. При цьому, у пацієнтів з хронічною інфекцією сечостатевих органів переважав округлий морфотип, а у пацієнтів з гострою – грушовидний.
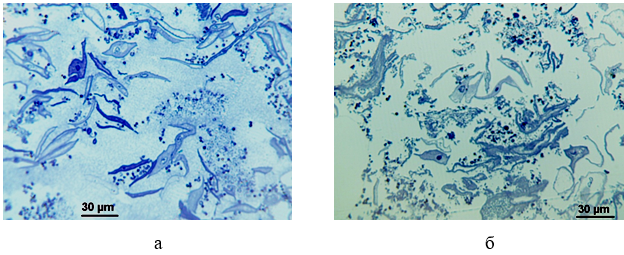 Рисунок 3.8 – Напівтонкі зрізи зразків, узятих з уретри хворого П. (а) та з піхви хворої В. (б)
Рисунок 3.8 – Напівтонкі зрізи зразків, узятих з уретри хворого П. (а) та з піхви хворої В. (б)
При дослідженні в трансмісивному електронному мікроскопі T. vaginalis, які були виділені від хворих на хронічні запальні захворювання сечостатевих органів з млявим перебігом, мали як округлу (овоїдну), так і класичну (грушоподібну) форму. Існує думка, що округлі форми – це один з можливих способів переживання несприятливих для T. vaginalis умов існування. Ці форми здатні ділитися амітотичним брунькоутворенням, а не поздовжнім поділом, як типові форми. Виявлені T. vaginalis характеризувалися варіабельністю розмірів: довжина 6 – 24 мкм (в середньому 10 – 12 мкм) ширина становила 5 – 12 мкм. Збудник був оточений унітарною цитоплазматичною мембраною без глікопротеїнового шару і додаткових оболонок, що було характерним як для округлої, так і для грушоподібної форми збудника. На деяких ділянках виявлялися фрагменти порушення цілісності цитоплазматичної мембрани (рис. 3.9, 3.10). У цитоплазмі збудника спостерігалися численні везикули, травні вакуолі, які визначалися як мультивезикулярна структура (В) і гідрогеносоми (Г) невеликих розмірів з щільним вмістом і гранулами глікогену. Хоча T. vaginalis схожа за багатьма характеристиками на інші еукаріоти, вона відрізняється від них за енергетичним метаболізмом і в цьому аспекті демонструє схожість з анаеробними бактеріями. Гідрогеносоми є аналогами мітохондрій, які у більш досконалих еукаріот відповідають за аналогічні метаболічні функції. При проведенні трансмісивної електронної мікроскопії було показано, що гідрогеносоми з щільним вмістом мали розмір 0,5 – 1,0 мкм в діаметрі, були оточені подвійною мембраною. Гідрогеносоми є місцем ферментативного окислення пірувату і утворюють АТФ при фосфорилюванні субстрату з утворенням водню, розкладаючи, таким чином, половину карбогідратів клітини, маючи гомологічні ферменти (феродоксин і амілази) раніше виявлені в бактеріях і еукаріотах. У гідрогеносом відсутні кристи, цитохроми і ДНК, які зазвичай знаходять в мітохондріях [60].
 Рисунок 3.9 – Фрагмент T. vaginalis. Цитолема має локальні порушення. Ядро містить гомогенний хроматин в конденсованому стані.
Рисунок 3.9 – Фрагмент T. vaginalis. Цитолема має локальні порушення. Ядро містить гомогенний хроматин в конденсованому стані.
У цитоплазмі спостерігаються численні везикули, травні вакуолі (В) і гідрогеносоми (Г) невеликих розмірів з щільним вмістом. У цитоплазмі зустрічаються електронносвітлі ділянки, які можуть свідчити про її набрякання
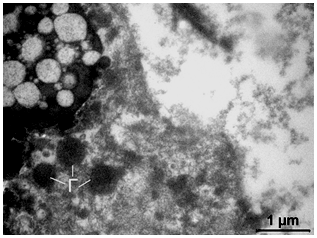 Рисунок 3.10 – Ділянка цитоплазми трихомонади зі зруйнованою цитолемою. У цитоплазмі розташовуються гідрогеносоми (Г) з гомогенним електронно-щільним вмістом і мультивезикулярна структура, оточена унітарної мембраною
Рисунок 3.10 – Ділянка цитоплазми трихомонади зі зруйнованою цитолемою. У цитоплазмі розташовуються гідрогеносоми (Г) з гомогенним електронно-щільним вмістом і мультивезикулярна структура, оточена унітарної мембраною
Ундулююча мембрана і джгутики у більшості клітин були відсутні, що може свідчити про нерухомість цих трихомонад. Аксостиль, пельта і коста також були скорочені, що морфологічно характерно для округлих форм збудника. Ядро округлої або овальної форми розташоване в основному по центру клітини. Ядерна оболонка у досліджених клітин зберігала цілісність, порові комплекси зустрічалися не часто (рис. 3.11). Хроматин був представлений гомогенним електронно-щільним матеріалом, що рівномірно заповнював ядро. Контур ядерної мембрани часто був звивистий. Також показано взаємодію зі структурою, що має морфологічні характеристики мікоплазм (наявність термінальної органели, за допомогою якої мікоплазма взаємодіє з еукаріотними клітинами, в даному випадку з T. vaginalis) [8]. З огляду на урогенітальну локалізацію досліджуваного матеріалу, це цілком може бути Mycoplasma genitalium (рис. 3.12). Контакт M. genitalium і T. vaginalis клітин не обмежується ділянкою термінальної органели і може бути в іншому місці бактеріальної клітини [8].
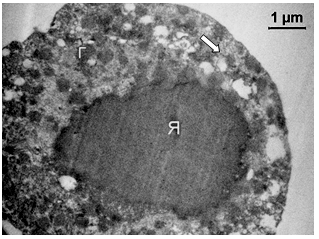 Рисунок 3.11 – Ультраструктура T. vaginalis. Цитолема, здебільшого, збережена, мікроворсин не містить. Ядро (Я) овальної форми заповнене хроматином однорідної структури і ступеня компактизації. Контур ядерної мембрани звивистий, в правій частині видно ядерні пори
Рисунок 3.11 – Ультраструктура T. vaginalis. Цитолема, здебільшого, збережена, мікроворсин не містить. Ядро (Я) овальної форми заповнене хроматином однорідної структури і ступеня компактизації. Контур ядерної мембрани звивистий, в правій частині видно ядерні пори
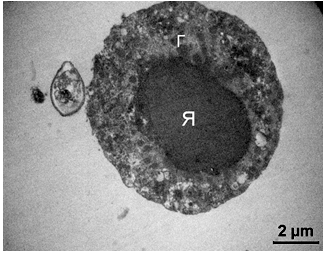 Рисунок 3.12 – T. vaginalis, що контактує з M. genitalium, на вершині якої визначається термінальна органела злегка витягнутої форми (→). Цілісність цитолеми трихомонади в деяких місцях порушена. Ядро (Я) овальне, заповнене гомогенним хроматином середньої електронної щільності. У цитоплазмі визначаються щільні невеликі гідрогеносоми (Г), а також травні вакуолі і везикули різних розмірів
Рисунок 3.12 – T. vaginalis, що контактує з M. genitalium, на вершині якої визначається термінальна органела злегка витягнутої форми (→). Цілісність цитолеми трихомонади в деяких місцях порушена. Ядро (Я) овальне, заповнене гомогенним хроматином середньої електронної щільності. У цитоплазмі визначаються щільні невеликі гідрогеносоми (Г), а також травні вакуолі і везикули різних розмірів
У деяких трихомонад, незважаючи на збереження цитолеми і каріолеми, спостерігалися істотні зміни в структурі ядра. Це проявлялося в низькій електронній щільності каріоплазми, зміні форми ядра, глибчастого гетерохроматину з високим ступенем компактизації, розташованого у ядерної мембрани і по всьому об’єму ядра (рис. 3.13, 3.14). Виявлений гетерохроматин може існувати як хроматин, що постійно мовчить (конститутивний гетерохроматин), де гени мікроорганізму лише зрідка експресуються, або як хроматин, репресований в ході специфічного клітинного циклу (факультативний гетерохроматин). За морфологічними ознаками ядра (за співвідношенням вмісту еу- і гетеро-хроматину) можна опосередковано оцінити активність транскрипції, а, отже, синтетичної функції трихомонади. При підвищенні метаболізму це співвідношення змінюється на користь еухроматину, при зниженні його інтенсивності – зростає вміст гетерохроматину.
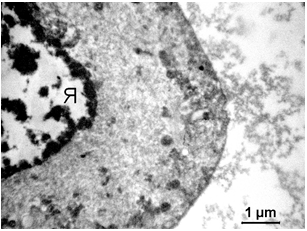 Рисунок 3.13 – Фрагмент T. vaginalis. Цитолема зберігає цілісність. Ядерна мембрана зберігається. Каріоплазма низької електронної щільності. Грудочки гетерохроматину високого ступеня компактизації розташовуються у ядерної мембрани і по всьому об’єму ядра. Цитоплазма містить везикули, короткі цистерни, мікрофіламенти, електроннощільні гранули.
Рисунок 3.13 – Фрагмент T. vaginalis. Цитолема зберігає цілісність. Ядерна мембрана зберігається. Каріоплазма низької електронної щільності. Грудочки гетерохроматину високого ступеня компактизації розташовуються у ядерної мембрани і по всьому об’єму ядра. Цитоплазма містить везикули, короткі цистерни, мікрофіламенти, електроннощільні гранули.
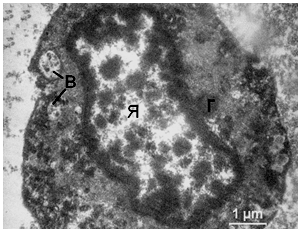 Рисунок 3.14 – T. vaginalis округлої форми. Ядро неправильної форми розташоване по центру клітини найпростішого. Цитолема і каріолеми цілісні. У цитоплазмі середньої електронної щільності виявляються одиничні гідрогеносоми (Г), численні електронно-щільні везикули. Каріоплазма значно просвітлена. Гетерохроматин великими грудочками дифузно розподілений по ядру і вздовж внутрішньої ядерної мембрани. В цитоплазмі виявляються травні вакуолі (В).
Рисунок 3.14 – T. vaginalis округлої форми. Ядро неправильної форми розташоване по центру клітини найпростішого. Цитолема і каріолеми цілісні. У цитоплазмі середньої електронної щільності виявляються одиничні гідрогеносоми (Г), численні електронно-щільні везикули. Каріоплазма значно просвітлена. Гетерохроматин великими грудочками дифузно розподілений по ядру і вздовж внутрішньої ядерної мембрани. В цитоплазмі виявляються травні вакуолі (В).
У цитоплазмі T. vaginalis визначається електронно-щільне утворення, можливо утворене інвагінацією плазматичної мембрани, так звана ендоцитозна везикула (coated vesicles), яка оточена клатриновою мережею (clathrine net), що являє собою білок оболонки облямованих бульбашок, який запобігає їх злиттю з лізосомами і перетравленню ферментами (рис. 3.15, 3.16).
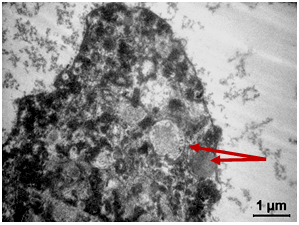 Рисунок 3.15 – В цитоплазмі визначається агрегація електронно-щільних везикул, травні вакуолі, поодинокі гідрогеносоми (Г).
Рисунок 3.15 – В цитоплазмі визначається агрегація електронно-щільних везикул, травні вакуолі, поодинокі гідрогеносоми (Г).
Цілісність цитолеми порушена. Стрілками показана ендоцитозна везикула, оточена клатриновою мережею
 Рисунок 3.16 – Фрагмент T. vaginalis. Цитолемма не скрізь чітко проглядається. Мікроворсини відсутні. Контур ядерної мембрани
Рисунок 3.16 – Фрагмент T. vaginalis. Цитолемма не скрізь чітко проглядається. Мікроворсини відсутні. Контур ядерної мембрани
звивистий. Гідрогеносоми (Г) мають рівномірну гомогенну структуру. У цитоплазмі клітини спостерігаються везикули, травна вакуоль (В),
а також електронносвітлі порожнини, що не окреслені елементарною мембраною
У цитоплазмі на тлі середньої електронної щільності визначалися вакуолі з електронно-прозорим вмістом і різноманітні за розміром гладкоконтурні і облямовані везикули, а також фагосоми (рис. 3.15, рис. 3.16). У всіх трихомонад виявлялися гідрогеносоми різних розмірів з вмістом середньої електронної щільності. Розподіл цих органел був неврегульованим.
У приядерній ділянці спостерігався комплекс Гольджі у вигляді скупчень різних за формою і щільністю везикул і стопок мембран (рис. 3.17, 3.18). Між ендоплазматичним ретикулумом (ЕПР) і ядерною мембраною спостерігаються окремі везикули і скупчення рибосом. Приядерна частина ЕПР з усіх боків охоплює ядро і дає вирости і розгалуження в цитоплазму. Можна припустити, що розгалужена область ЕПР взаємодіє з цис-зоною апарату Гольджі. У деяких T. vaginalis визначалися короткі цистерни шорсткого ЕПР. Вільні рибосоми також розташовувалися хаотично в цитоплазмі, в окремих областях вони збиралися в агрегати, деякі зони цитоплазми були вільні від рибосом. Слід зазначити, що у округлих форм трихомонад відбувалася часткова редукція системи внутрішніх мембран, збільшувалася вакуолізація клітин. Відсутність полісом і перерозподіл рибосом можуть бути пов’язані з редукцією ЕПР через зниження інтенсивності метаболізму, що характерно для округлих форм збудника.
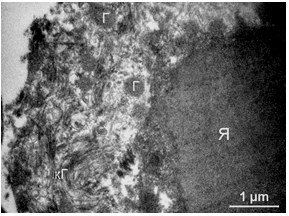 Рисунок 3.17 – Спостерігається порушення цілісності клітинної оболонки. Безпосередньо до ядра T. vaginalis прилягають фрагменти мембран, волокнисті елементи. Гідрогеносоми (Г) мають правильну округлу форму і вміст рівномірної електронної щільності. У цитоплазмі зустрічаються циркулярні цистерни комплексу Гольджі (КГ) і невелика кількість облямованих везикул
Рисунок 3.17 – Спостерігається порушення цілісності клітинної оболонки. Безпосередньо до ядра T. vaginalis прилягають фрагменти мембран, волокнисті елементи. Гідрогеносоми (Г) мають правильну округлу форму і вміст рівномірної електронної щільності. У цитоплазмі зустрічаються циркулярні цистерни комплексу Гольджі (КГ) і невелика кількість облямованих везикул
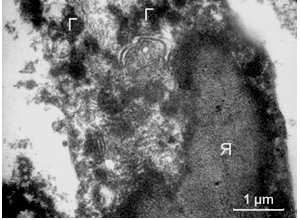 Рисунок 3.18 – Фрагмент T. vaginalis з деструкцією органел і цитоплазматичної мембрани. Ядро неправильної форми з гомогенним конденсованим хроматином. У цитоплазмі визначаються гідрогеносоми, агрегати електронно-щільних включень, мікротрубочки і стопки мембран комплексу Гольджі (КГ)
Рисунок 3.18 – Фрагмент T. vaginalis з деструкцією органел і цитоплазматичної мембрани. Ядро неправильної форми з гомогенним конденсованим хроматином. У цитоплазмі визначаються гідрогеносоми, агрегати електронно-щільних включень, мікротрубочки і стопки мембран комплексу Гольджі (КГ)
На ультратонких зрізах зразків, узятих з цервікального каналу, піхви і уретри, визначалася велика кількість різноманітних мікроорганізмів, які перебували між клітинами епітелію, Часто бактерії проявляли адгезію до епітеліальних клітин. Серед них траплялись коки, хламідії, гриби роду Сandida у вигляді бластоспор та ін. (рис. 3.19–3.22).
Рисунок 3.19 – Фрагменти двох спущених епітеліоцитів, до поверхні яких адгезують коки. Цитолема епітеліоцитів утворює мережу мікроворсинок.
У цитоплазмі переважають фібрилярні білки цитоскелету і дрібні вакуолі
 Рисунок 3.20 – Стрілками показані хламідії (C. trachomatis) на різних стадіях розвитку: ЕТ – елементарне тільце, ПТ – проміжне
Рисунок 3.20 – Стрілками показані хламідії (C. trachomatis) на різних стадіях розвитку: ЕТ – елементарне тільце, ПТ – проміжне
тільце, РТ – ретикулярне тільце
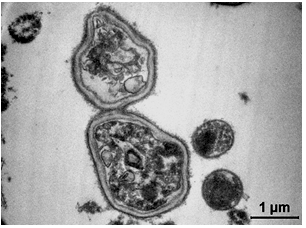 Рисунок 3.21 – Гриби роду Candida, що утворюють бруньки
Рисунок 3.21 – Гриби роду Candida, що утворюють бруньки
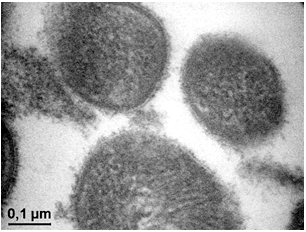 Рисунок 3.22 – Мікроорганізми роду Staphylococcus
Рисунок 3.22 – Мікроорганізми роду Staphylococcus
Таким чином, у пацієнтів з сечостатевим трихомонозом були виділені два морфотипи вірулентних форм T. vaginalis: грушовидні і овальні, при цьому, останній морфотип явно переважав кількісно. А саме – у хворих на хронічний сечостатевий трихомоноз з в’ялим перебігом, округлі форми склали більшість – 67 %. Цей факт можна екстраполювати також й на морфотипи, що вірогідно мають місце in vivo, оскільки культивування в живильному середовищі унеможливлює перехід T. vaginalis з одного морфотипу в інший. Для овального морфотипу виявлені характерні ультраструктурні особливості: наявність гетерогенної за щільністю нуклеоплазми, відсутність типових диктіосом і сплощення цистерн Апарату Гольджі. У приядерній ділянці спостерігалося скупчення різних за формою і щільністю везикул, відсутність впорядкованості в розташуванні рибосом (у грушовидних форм збудника вони розташовувалися в області ядра і організовувалися в полісоми). Крім того, звертала на себе увагу часткова редукція системи внутрішніх мембран, скорочення аксостилю, збільшення вакуолізації клітин, поліморфізм за розмірами, формою і щільністю гідрогеносом. Результати дослідження ультраструктурних особливостей дозволяють зробити припущення про те, що округлі форми T. vaginalis є однією з вірулентних, а не дегенеративних форм, як вважалося раніше, оскільки вони мають необхідну морфологічну організацію і, отже, здатні спричиняти патогенний вплив на макроорганізм. Разом з тим, структурні зміни, що спостерігаються в цитоплазмі клітин T. vaginalis округлих форм, вказують на зниження їх фізіологічної активності, що, можливо, свідчить про переживання ними несприятливих умов в організмі людини (наприклад, вплив протистоцидних препаратів). Однак, залишаються відкритими і потребують подальшого вивчення питання про можливу належність різних морфотипів трихомонад до різних серотипів T. vaginalis або, навіть, до інших видів роду Trichomonas.
Таким чином встановлено наступні положення:
- Інвазія Trichomonas vaginalis статевих органів посідає лідируючі позиції з розповсюдженості та призводить до появи ускладнень, що зумовлюють порушення репродуктивної, статевої та сечовидільної функцій організму. Діагноз трихомонозу був верифікований у 92 із 189 (48,7 %) пацієнтів з хронічними запальними захворюваннями сечостатевих органів, які мають млявий перебіг. Відсоток хворих, у яких одночасно з трихомонадною, виявлено хламідійну інфекцію, склав 18,5 % (35 хворих). Різні види умовно-патогенної мікрофлори виявлено у 30,4 % (58) пацієнтів, у 9 (4,8 %) пацієнтів була діагностована мікоплазмова інфекція. Кількість виявлених позитивних результатів відрізнялася при запальних процесах різної локалізації. У пацієнтів чоловічої статі вищий відсоток позитивних результатів (48,1 %) спостерігався у хворих з простатитом. Достатньо високий процент визначено у жінок з ендоцервіцитом та аднекситом (60 %).
- Встановлено гендерні та вікові відмінності поширення й клінічного перебігу сечостатевого трихомонозу, що надає можливість більш ефективного виявлення, лікування та профілактики даної інвазії в середині вразливих соціальних груп. Пік захворюваності припадає на віковий інтервал 27–32 роки (63,5 %). Переважне розповсюдження трихомонад визначено серед жінок віком 18–30 років, та серед чоловіків – 26–40 років, що свідчить про необхідність моніторингу даної інвазії з урахуванням віку та статі.
- У пацієнтів з хронічним перебігом трихомонозу атиповий овальний морфотип vaginalis при електронній мікроскопії культури збудника визначається частіше (67 %), ніж типовий грушовидний морфотип. Дослідження ультраструктурних особливостей T. vaginalis овального морфотипу дозволяє віднести їх до вірулентних формам збудника, а не дегенеративних, оскільки вони мають необхідну морфологічну організацію і здатні спричиняти патогенний вплив на макроорганізм.
3.5 Молекулярно-біологічна характеристика збудників хронічного трихомонозу
Протягом багатьох років робилися спроби більш детальної характеристики трихомонад, зокрема їх типування. У наш час описано декілька ефективних методів генотипування трихомонад [191, 197]. Одним із найбільш популярних методів генотипування трихомонад є метод, запропонований у 2008 році Crucitti T. еt al. [241]. Він базується на використанні техніки визначення поліморфізму рестрикційних фрагментів гена актину. За останні роки опубліковано декілька досліджень, які проводились за допомогою цього методу [204, 242].
До сьогодні характеристика генотипів трихомонад, що циркулюють в Україні, були відсутні. Це все стало підґрунтям для проведення дослідження щодо генотипування трихомонад, які виявляються у хворих на ІПСШ в Україні. Зразки для дослідження було отримано від хворих, які звертались для проведення спеціалізованого діагностичного дослідження з приводу запальних захворювань ССС в ДУ «Інститут дерматології та венерології НАМН України», м. Харків та Центр лабораторних досліджень «Дніпролаб», м. Київ.
Всього було використано 49 зразків, отриманих від хворих з різними формами хронічної урогенітальної патології, в яких методом ПЛР було виявлено ДНК T. vaginalis; провести генотипування вдалося в 29 клінічних зразках, серед яких було 21 діагностичний зішкребок з уретри або піхви, а також 8 зразків, що були отримані з діагностичної культури на Trichomonas vaginalis. 14 зразків було отримано від пацієнтів ДУ «Інститут дерматології та венерології НАМН України» та 15 – у Центрі лабораторних досліджень «Дніпролаб». Серед пацієнтів за гендером було 11 (37,9 %) чоловіків та 18 (62,1 %) жінок, середній вік їх склав (31,2 ± 3,5) року.
Не дивлячись на те, що для типування попередньо відбирались тільки зразки, що містили ДНК Т. vaginalis, з 49 дослідних зразків тільки в 29 випадках вдалося отримати амплікони, які були придатні для рестрикції. Можливо, це було пов’язано з малою кількістю ДНК збудника й значним степенем її деградації в зразках, в яких не вдалося ампліфікувати ген актин. На рис. 3.23 і 3.24 показано зразки отриманих електрофореграм.
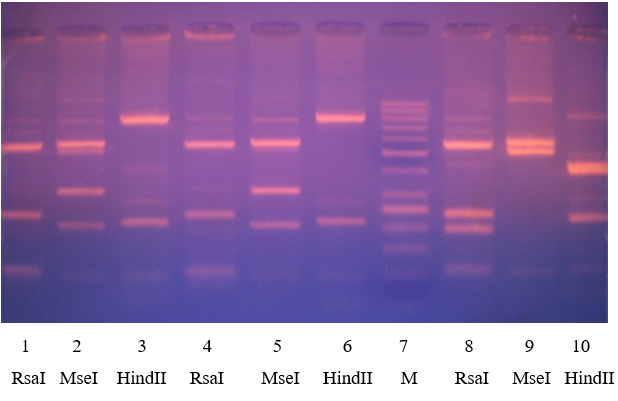 Рисунок 3.23 – Електрофореграма фрагментів ДНК, отриманих після рестрикції амплікону гена актину T. vaginalis. 1-3 полоси – зразок 1, генотипи А+Е; 4-6 полоси – зразок 2, генотип Е; полоса 7– маркер молекулярної маси 50 – 1000 п.н. (M); полоси 8-10 – зразок 3, генотип G.
Рисунок 3.23 – Електрофореграма фрагментів ДНК, отриманих після рестрикції амплікону гена актину T. vaginalis. 1-3 полоси – зразок 1, генотипи А+Е; 4-6 полоси – зразок 2, генотип Е; полоса 7– маркер молекулярної маси 50 – 1000 п.н. (M); полоси 8-10 – зразок 3, генотип G.
1, 4, 8 полоси – рестриктаза RsaI; 2, 5, 9 полоси – рестриктаза MseI; 3, 6, 10 полоси – рестриктаза HindII
У першому зразку рис. 3.23 водночас з типовою картиною, характерною для генотипу Е, відзначається додаткова полоса довжиною 519 п.н. після дії рестриктази MseI, що є характерним для генотипу А, що стало підґрунтям для висновку про присутність у даному зразку двох генотипів – А та Е.
З 29 протипованих зразків в 19 випадках було виявлено генотип Е (65,5 %), на другому місці – генотип G – 6 зразків (20,7 %) і на третьому – Н – 3 зразки (10,35 %), в одному випадку було виявлено одночасну присутність двох генотипів – А та Е (3,45 %). З урахуванням останнього випадку, можна сказати, що генотип Е в нашому дослідженні було виявлено в 20 випадках з 29, що складає 68,96 %.
 Рисунок 3.24 – Електрофореграма фрагментів ДНК, отриманих після рестрикції амплікону гена актину T. vaginalis. 1-3 полоси – зразок 21, генотип Н; 4-6 полоси – зразок 24, генотип Н; полоса 7– маркер молекулярної маси 50 – 1000 п.н. (M); полоси 8-10 – зразок 25, генотип G.
Рисунок 3.24 – Електрофореграма фрагментів ДНК, отриманих після рестрикції амплікону гена актину T. vaginalis. 1-3 полоси – зразок 21, генотип Н; 4-6 полоси – зразок 24, генотип Н; полоса 7– маркер молекулярної маси 50 – 1000 п.н. (M); полоси 8-10 – зразок 25, генотип G.
1,4,8 полоси – рестриктаза RsaI; 2, 5, 9 полоси – рестриктаза MseI; 3, 6, 10 полоси – рестриктаза HindII
Спектр фрагментів, що знаходилися після рестрикції в дослідних зразках в більшості випадків відповідали показникам, що наведені Crucitti et al. [241]. Разом з цим, в декількох випадках після рестрикції MseI була виявлена додаткова полоса довжиною близько 750 п.н. Можна припустити, що однією з причин її появи є недостатня активність ферменту MseI, при збільшенні кількості ферменту в 1,5 рази, її інтенсивність значно знижувалась.
Результати, які були отримані за зразками хворих північно-східного (Харків) та центрального (Київ) регіонів України, практично не відрізнялись. У першому випадку генотипи E, G та H були визначені у 8, 4 і 2 зразках, у другому – у 11, 2 и 2 зразках, відповідно.
Не вдалося також визначити зв’язок будь-яких особливостей клінічної картини трихомонозу з генотипом трихомонад, визначених за поліморфізмом гена актину.
Є цікавим порівняння отриманих результатів із спектром генотипів T. vaginalis, отриманих в інших культурно-географічних регіонах (табл. 3.10). Можна відзначити, що в більшості досліджень найбільш розповсюдженими генотипами є генотипи E та G. Виключенням є тільки дослідження Matini et al., 2017 [204] з визначенням у 56 % пацієнтів генотипу А. В українській популяції відзначається домінування генотипу Е, що було вираженим набагато більше, ніж в інших дослідженнях (68,96 %). Аналогічне, хоча і менш виражене домінування генотипу Е було виявлено Crucitti et al. [241] у Конго (55,7 %), а також Masha S.C. et al. [242] у Кенії (50 %). У цілому, в найбільшому ступені показники української популяції є близькими до даних, що були отримані Crucitti et al. у Конго [241].
Таблиця 3.10 – Спектри генотипів трихомонад, визначені методом поліморфізму гена актину в різних регіонах (за даними літератури та результатами власних досліджень)
| Генотипи | Регіони | ||||
| Конго [241] | Кенія [242] | Іран [204] | Іран [208] | Україна | |
| A | 1 (1.6 %) | – | 9 (56 %) | – | – |
| E | 34 (55.7 %) | 11 (50 %) | 1 (6 %) | 11 (24,4 %) | 19 (65,5 %) |
| G | 14 (23.0 %) | 3 (13,6 %) | – | 23 (51,1 %) | 6 (20,7 %) |
| H | 6 (9.8 %) | – | – | 6 (13,3 %) | 3 (10,35 %) |
| I | 1 (1.6 %) | 1 (4,5 %) | 6 (38 %) | 3 (6,6 %) | |
| M | 2 (3.2 %) | – | – | ||
| N | 2 (3.2 %) | 6 (27,3 %) | – | – | |
| P | 1 (4,5 %) | – | – | ||
| Поєднання | 2 (4,4 %) G+E | Е+А (3,45 %) | |||
Другою особливістю розподілу генотипів трихомонад в Україні можна вважати обмежений спектр визначених генотипів, оскільки виявити генотипи трихомонад I, M, N та Р в цьому дослідженні не вдалося зовсім.
Необхідно відзначити також, що за результатами дослідження Masha S.C. et al. [242] трихомонади, які належать до генотипу Е, володіють низкою біологічних особливостей, серед котрих клональна стабільність, а також низький рівень інфікування вірусами. Можливо, ці особливості генотипу Е можуть бути важливими у зв’язку з його високою розповсюдженістю в українській популяції.
Таким чином встановлено наступні положення:
- Розподіл генотипів Trichomonas vaginalis за поліморфізмом гена актину в українській популяції характеризується домінуванням генотипу Е (68,96 %) при порівняно низькій частоті виявлення генотипів G (21,4 %), H (14,3 %) та А (3,45 %).
- Не було виявлено помітної різниці у розподілі генотипів Trichomonas vaginalis у центральному та північно-східному регіонах України.
* * *
Підсумовуючи проведені дослідження, можна зазначити, що:
Реєструється зменшення виявлення Trichomonas vaginalis у пацієнтів, хворих на ІПСШ, як у локальному дослідженні, так і в Україні вцілому.
При трихомонозі наявно існують гендерні особливості. Захворювання завжди частіше зустрічається у жінок, особливо молодих. Хоча ступінь статевих відмінностей в частоті виявлення інфекції сильно відрізняється в різних областях України.
Особливості клінічних проявів УТ сьогодні визначаються або малосимптомним тривалим перебігом (15-20 % випадків), або багатофокусним ураженням, наявністю супутніх мікроорганізмів, а також резидуальними явищами й ускладненнями. Найбільш чутливим методом діагностики Trichomonas vaginalis залишається метод ПЛР – до 95 %. Трихомоноз зазнав певного клінічного патоморфозу. Збільшилася частота атипових і резистентних до лікування форм трихомонозу.
Стосовно даних електронної мікроскопії – з‘ясовано, що у пацієнтів з хронічним перебігом трихомонозу атиповий овальний морфотип T. vaginalis визначається частіше (67 %), ніж типовий грушовидний морфотип. Дослідження ультраструктурних особливостей T. vaginalis овального морфотипу дозволяє віднести їх до вірулентних формам збудника, а не дегенеративних, оскільки вони мають необхідну морфологічну організацію і здатні спричиняти патогенний вплив на макроорганізм.
Розподіл генотипів Trichomonas vaginalis за поліморфізмом гена актину в українській популяції характеризується домінуванням генотипу Е (68,96 %) при порівняно низькій частоті виявлення генотипів G (21,4 %), H (14,3 %) та А (3,45 %). Не було виявлено помітної різниці у розподілі генотипів Trichomonas vaginalis у центральному та північно-східному регіонах України.
Матеріали даного розділу опубліковані в таких роботах:
- Ультраструктурные особенности морфотипов Trichomonas vaginalis, выделенных от больных с хронической трихомонадной инвазией / П.В. Федорич, Г.И. Мавров, С.К. Джораева, Т.В. Осинская. Дерматологія та венерологія. 2018. № 4 (82). С. 17–22 [127].
- Молекулярное типирование Trichomonas vaginalis, циркулирующих в Украине,на основании полиморфизма гена актина / А.П. Белозоров, П.В. Федорич, Г.И. Мавров, А.Д. Зеленская, Е.Н. Горобчишина. Дерматологія та венерологія. 2019. № 1. С. 8–12 [74].
- Сучасні епідеміологічні аспекти трихомонозу в Україні / П.В. Федорич, Г.І. Мавров, Т.В. Осінська, Л.В. Іващенко. Дерматологія та венерологія. 2020. № 1 (87). С. 44–51 [118].
- Mavrov H.I., Osinska T.V., Fedorych P.V. Clinical and epidemiological characteristics and morphological peculiarities of urogenital trichomoniasis nowadays. Pathologia. 2020. Vol. 17, № 1 (48). P. 52–59 [230].
- Fedorych P.V., Mavrov G.I. Incidence of Sexually Transmitted Infections: Local Study in Ukraine. World Science. Vol. 2, Iss. 8 (36). P. 4–7 [200].
- Федорич П.В., Мавров Г.І. Сучасна клініко-епідеміологічна характеристика хворих на сечостатевий трихомоноз в Україні. Український журнал дерматології, венерології, косметології. 2020. № 1. С. 15–23 [153].
- Федорич П.В. Явище антибіозу при трихомонадній інвазії сечостатевої системи. Медичні аспекти здоров’я чоловіка. 2018. № 2 (29). С. 19–21 [146].
- Fedorych P.V. Study of incidence of mainly sexually transmitted infections in Ukraine. 13th EADV Spring Symposium. Athens, Greece, 19–22 may 2016. P. 0774 [199].
4 ПРОТОЗОЙНІ ІНВАЗІЇ СЕЧОСТАТЕВОЇ СИСТЕМИ, ЩО СПРИЧИНЕНІ НЕ TRICHOMONAS VAGINALIS
4.1 Сексуальна поведінка хворих на інфекції, що передаються статевим шляхом, як чинник, що визначає локус зараження на протозойні інвазії сечостатевої системи
Виникненню екстрагенітальних осередків запалення, спричинених збудниками ІПСШ, значною мірою сприяє зміна стереотипу сексуальної поведінки сучасних людей. В теперішньому житті все частіше практикуються так звані «альтернативні» форми сексу, зокрема оральний та анальний. Це не може не позначитись на характері передачі та перебігу багатьох статевих інфекцій, а також виникненні поєднаних генітальних та екстрагенітальних уражень, викликаних збудниками ІПСШ [225].
Оральний секс сьогодні – звичайна сексуальна практика гетеросексуальних і гомосексуальних пар. Науково доведено, що оральний секс – це шлях передачі гонореї, сифілісу і деяких інших інфекційних агентів. Феляція несе ризик придбання інфекції партнером по оральному сексу. Кунілінгус, імовірно, призводить до розвитку БВ [211]. З розповсюдженням практики орального сексу, останній став важливим потенційним шляхом передачі оральних, респіраторних і статевих патогенних мікроорганізмів. Національний центр медичної статистики США (National Center for Health Statistics, USA) надав у 2002 році детальну доповідь, яка ґрунтується на вивченні сексуальної поведінки 12571 чоловіків і жінок у віці від 15 до 44 років. У результаті цього дослідження було виявлено, що близько 12 % хлопців і 10 % дівчат у віці 15 – 19 років практикували гетеросексуальний оральний секс, не вступаючи в традиційні вагінальні зносини [278]. Серед чоловіків у віці 25 – 44 років 90 % практикували оральний секс, а 40 % – анальний секс із жінками. Серед жінок відсоток тих, що практикує анальний і оральний секс, був аналогічним. Згідно з результатами цього дослідження, 3 % опитаних американських чоловіків в останні 12 місяців свого життя мали анальний та/або оральний секс з іншими чоловіками, а 4 % жінок вступали у сексуальні відносини з іншими жінками. Природно, що при такій високій частоті застосування орального і анального сексу закономірно виникає питання про можливість передачі різних ІПСШ за цих умов [190].
Таким чином, ситуація, що склалася завдяки зміні сучасного стереотипу сексуальної поведінки, призвела до значного збільшення випадків поєднання генітальної та екстрагенітальної локалізації осередків запалення, що спричинені збудниками ІПСШ [212]. Алгоритми діагностичних заходів, що існують у сьогоднішній дерматовенерологічній практиці не передбачають широкого застосування засобів, спрямованих на виявлення екстрагенітальних вогнищ запалення, викликаних збудниками ІПСШ [46]. Лікувальні методики, з цієї причини, не відповідають сучасним вимогам щодо повноти виліковування інфекційного процесу, та зниження кількості можливих рецидивів при таких захворюваннях. А відтак, постає необхідність обґрунтування, розробки та впровадження в повсякденну практику закладів охорони здоров’я нових алгоритмів обстеження хворих на ІПСШ та ефективних способів їх лікування, які передбачали б урахування особливостей перебігу інфекційного процесу, викликаного збудниками ІПСШ, пов’язаних з його поліетіологічністю та можливістю існування екстрагенітальних вогнищ. Наявність останніх потребуватиме із здійсненням загальновизнаних лікувальних заходів, одночасного застосування додаткових спеціальних терапевтичних методик, використання котрих залежатиме від топіки екстрагенітального вогнища, тяжкості перебігу та особливостей власне збудника/збудників інфекційного процесу.
Переважна більшість даних щодо сексуальної поведінки на сучасному етапі походять з іноземних джерел. Стереотипи сексуальної поведінки сучасних українців, особливо молодих верств населення, нажаль, і досі залишаються практично terra incognita. Без вивчення цього суспільно-медичного аспекту, на глибоке переконання автора, неможливо істотно впливати на процеси подальшого поширення серед співвітчизників інфікування на ІПСШ, а насамперед, при оральному та анальному сексі.
Виходячи зі сказаного вище, метою цього фрагменту дисертаційної роботи був аналіз сексуальної поведінки сучасних молодих осіб.
Було проведено анкетування (ДОДАТОК А) 100 українців (50 чоловіків та 50 жінок) – молодих осіб (середній вік склав (24 ± 1) рік), що мають вищу освіту та живуть статевим життям, щодо особливостей їх статевої поведінки.
Для забезпечення чистоти дослідження всі без виключення респонденти мали гетеросексуальну орієнтацію. Молодь з вищою освітою використовувалась як найкраща для наукового вивчення частина популяції завдяки її широкому кругозору, більш високому рівню культури та здатності усвідомлювати важливість дослідження, що проводиться, а відтак – правдивості вказаних в анкетуванні даних.
Як показали результати дослідження, 4 чоловіків та 6 жінок (всього 10 осіб, або 10 % опитаних), які входили в групу дослідження, на момент анкетування перебували у шлюбі. 90 опитаних – неодружені.
Початок статевого життя визначався у чоловіків в період від 13 до 19 років ([17 ± 1] рік), та в період від 15 до 24 років ([18 ± 1] рік) у жінок.
Більше одного статевого партнера за життя зазначили всі респонденти-чоловіки (100 %) та переважна більшість жінок (96 %). Кількість статевих партнерів за життя при цьому визначалася в середньому (12 ± 2) особи у чоловіків та (5 ± 1) особа у жінок, що брали участь в анкетуванні.
Анальний секс регулярно використовували 33 досліджувані особи (33 %), з них було 7 респондентів-жінок (14 %) та 25 респондентів-чоловіків (50 %).
Оральний секс регулярно використовують 74 досліджувані особи (74 %), з них було 26 респондентів-жінок (52 % досліджуваних жінок) та 48 респондентів-чоловіків (96 % досліджуваних чоловіків). Привертає увагу той факт, що серед осіб, які не мають постійної практики орального сексу 92 % – жінки.
Отримані дані щодо практики орального та анального сексу серед вітчизняної молоді є зіставними з аналогічними даними американських дослідників стосовно громадян своєї країни [279].
Сексуальне спілкування з особами, що не є постійними сексуальними партнерами, мали 64 % респондентів. Переважна більшість із них (59 осіб – 92 %) використовує при цьому презервативи. Але застосовують презерватив при анальному сексі лише 26 з 33 (79 %) респондентів та лише 12 з 74 респондентів (16,3 %) – при оральному сексі. Такий низький відсоток застосування презервативів при феляції, навіть серед осіб з вищою освітою, є, на наше глибоке переконання, яскравим свідченням того, що оральний секс практично не сприймається як фактор можливості отримання чи передачі іншим сечостатевих інфекцій.
Таким чином, вивчаючи особливості статевої поведінки молодих осіб вікової групи (24 ± 1) рік, що мали вищу освіту та гетеросексуальну орієнтацію, бачимо, що 90 % з них є неодруженими. Майже всі з респондентів (98 %) мали більше одного статевого партнера за життя ([12 ± 2] особи у чоловіків та (5 ± 1) особа у жінок). Анальний секс регулярно використовують 33 % досліджуваних осіб. Оральний секс регулярно використовують 74 % досліджуваних осіб. Сексуальне спілкування з особами, що не є постійними сексуальними партнерами, мають 64 % з анкетованих. При цьому використовують бар’єрні засоби при традиційних статевих стосунках 92 % респондентів, в той час, як при анальних зносинах – 79 %, а при оральному сексі – тільки 16,3 %.
Отже, було вивчено стереотип сексуальної поведінки сучасної української молоді з вищою освітою. Відмічено часту практику орального та анального сексу. Низький рівень застосування презервативів при феляції є переконливим свідченням того, що оральний секс практично не сприймається як фактор можливості отримання чи передачі статевих інфекцій. Усе це, на думку автора, не може не позначитися на способах передачі та характері перебігу деяких статевих інфекцій, а також виникненні поєднаних генітальних та екстрагенітальних уражень, викликаних збудниками ІПСШ, що потребує подальшого поглибленого вивчення.
Таким чином, проведено аналіз сексуальної поведінки 100 представників сучасної української молоді.
За результатами анкетування осіб відповідної вікової групи встановлено, що анальний секс регулярно використовують 33 % досліджуваних осіб, 74 % опитаних постійно практикують оральний секс.
Отримані дані щодо практики орального та анального сексу серед вітчизняної молоді є співставними з аналогічними даними інших дослідників стосовно громадян різних країн.
Низький рівень застосування презервативів при феляції є свідченням того, що оральний секс практично не сприймається як фактор можливості отримання чи передачі статевих інфекцій. Анальний секс також часто відбувається без застосування презервативів.
Показано, що існуючий стереотип сексуальної поведінки сучасної гетеросексуальної молоді не може не позначитись на способах передачі та характері перебігу деяких сечостатевих інфекцій, а також виникненні поєднаних генітально-екстрагенітальних уражень, викликаних збудниками ІПСШ.
4.2 Порівняння мікроскопічної, культуральної діагностики та методу полімеразної ланцюгової реакції при виявленні трихомонад у сечостатевій системі хворих на інфекції, що передаються статевим шляхом
Діагноз «трихомоноз» встановлюється на підставі клінічних ознак захворювання і виявлення трихомонад у досліджуваному матеріалі. Для лабораторної діагностики застосовуються мікроскопічні, культуральні та молекулярно-біологічні методи дослідження, зокрема, ПЛР. Останні є на сучасному етапі найбільш інформативними і поширеними [40, 73].
У проведених попередніх дослідженнях з використанням експериментальних оригінальних праймерів, які були розроблені спеціально для визначення Trichomonas tenax та Pentatrichomonas hominis за допомогою методу ПЛР-РЧ, при обстеженні 72 пацієнтів, хворих на інфекції урогенітальної системи, було отримано наступні результати: у 23 (32 %) було діагностовано Trichomonas tenax, а у 12 (16,4 %) – Pentatrichomonas hominis [148, 149]. При цьому, було встановлено, що рівень діагностування саме Trichomonas vaginalis у хворих на урогенітальні інфекції становить 4 – 6 %. Потрібно відзначити, що діагностування Trichomonas vaginalis при використанні методу посівів на спеціальні живильні середовища може перевищувати виявленість цього збудника за допомогою методу ПЛР і становить близько 10 % [90]. З урахуванням встановленої можливості життєдіяльності в урогенітальному тракті людини не тільки Trichomonas vaginalis, а й інших видів трихомонад, постала нова дослідницька задача щодо порівняння ефективності діагностики трихомоніазу ССС людини за допомогою засівів на спеціальне живильне середовище та ПЛР за умови використання для останньої праймерів для виявлення як Trichomonas vaginalis, так і Trichomonas tenax та Pentatrichomonas hominis. Тому завданням даного етапу роботи було виявлення трихомонад у ССС хворих на запальні процеси урогенітального тракту за допомогою культуральної діагностики, зокрема, засівів на спеціальне живильне середовище СВТ порівняно з методом ПЛР-РЧ з використанням праймерів для виявлення Trichomonas vaginalis, Trichomonas tenax та Pentatrichomonas hominis.
Для дослідження використовувався біологічний матеріал із сечостатевих органів 97 пацієнтів, що звернулись в Шкірно-венерологічний диспансер №1 м. Києва у 2015-2019 рр. для проведення обстеження на наявність у них урогенітальних інфекцій. Вік обстежених пацієнтів коливався від 18 до 50 років. Згідно статі, жінок було 74, чоловіків – 23.
Для проведення дослідження на виявлення трихомонад методом культуральної діагностики використовувалося спеціальне живильне середовище СВТ виробництва Інститут Пастера (Санкт-Петербург, Російська Федерація). Для ПЛР використовувався ампліфікатор ДТ-96 виробництва НВО «ДНК- Технологія» (Російська Федерація). Застосовувався також праймер для визначення Trichomonas vaginalis виробництва кампанії ДНК-Технологія (Російська Федерація). Для виявлення Trichomonas tenax та Pentatrichomonas hominis застосовувались оригінальні праймери [91, 92].
Біологічний матеріал із сечостатевих органів досліджуваних пацієнтів для засівів на спеціальне живильне середовище СВТ і для проведення ПЛР-РЧ брався одночасно. Забір біологічного матеріалу для дослідження на наявність трихомонад у обстежених чоловіків проводили шляхом взяття зішкребків з уретри одноразовими зондами і секрету передміхурової залози після її пальцевого масажу. У жінок проводили взяття вагінальних виділень, а також зішкребків із уретри і цервікального каналу.
Як показало проведене дослідження, Trichomonas vaginalis за допомогою методу засіву на живильне середовище СВТ було виявлено у 15 (15,5 %) з 97 досліджуваних пацієнтів. Разом з тим, за допомогою методу ПЛР-РЧ Trichomonas vaginalis було виявлено лише у 6 (6,2 %) осіб, що перебували під спостереженням. Trichomonas tenax виявлено, відповідно, у 9 (9,3 %) осіб, а Pentatrichomonas hominis – у 12 (12,4 %).
Таким чином, загальне виявлення трихомонад за допомогою методу ПЛР-РЧ склало 27,9 %. Це майже вдвічі перебільшило їх виявлення за допомогою методу засіву на живильне середовище СВТ, що склало 15,5 %.
Порівняння виявлення саме Trichomonas vaginalis було наступним – у 15 (15,5 %) осіб за допомогою методу засіву на живильне середовище СВТ, та лише у 6 (6,2 %) осіб – за допомогою методу ПЛР-РЧ. Це дає підставу вважати, що в частині випадків досліджень методом засівів на живильне середовище, за Trichomonas vaginalis помилково приймають інших представників роду найпростіших, насамперед, Trichomonas tenax та Pentatrichomonas hominis.
Виникненню інфікування ССС на Trichomonas tenax та Pentatrichomonas hominis, на глибоке переконання, значною мірою сприяє зміна стереотипів сексуальної поведінки сучасних людей. У теперішньому житті дедалі частіше практикуються так звані «альтернативні» форми сексу, зокрема оральний та анальний. Це не могло не позначитися на характері перебігу статевих інфекцій, а також на виникненні поєднаних генітально-екстрагенітальних уражень.
Як відомо, найбільш інформативним на сьогоднішній день методом виявлення трихомонад у ССС хворих на ІПСШ в Україні вважається метод засівів на відповідне живильне середовище [117]. Причому, у всіх без виключення випадках виявлення найпростіших, вони ідентифікуються виключно як Trichomonas vaginalis. Навіть тоді, коли чисельні дослідження цих же пацієнтів та їх статевих партнерів за допомогою методу ПЛР (методом, що має набагато вищі чутливість та специфічність) жодного разу не дають виявлення саме Trichomonas vaginalis. А відтак, цілком природно вважати, що в частині випадків досліджень методом засівів на живильне середовище за Trichomonas vaginalis помилково приймають інших представників роду найпростіших. Це дає підставу для призначення курсу лікування антипротозойними препаратами пацієнтам, у яких таким чином виявлено найпростіших, та їх статевим партнерам. Це, з одного боку, дозволяє в багатьох випадках досягти виліковування таких хворих та позбавлення їх багаторічних поневірянь по профільних медичних закладах. Однак, при цьому часто залишається невідомим, який саме мікроорганізм насправді виявляють при використанні методу засівів біологічного матеріалу із ССС людини на відповідне живильне середовище.
Цілком природнім є питання з боку представників практичної дерматовенерології та лікарів суміжних спеціальностей відносно того, чи дійсно важливим є точне визначення виду найпростіших, насамперед трихомонад, у ССС людини, та чи не буде достатнім визначити лише сам факт наявності представників цього роду у сечостатевому тракті. Точне визначення виду трихомонад у ССС людини є важливим, насамперед, з точки зору попередження можливої реінфекції. Адже Trichomonas tenax – мікроорганізм, що існує в ротовій порожнині, а Pentatrichomonas hominis – у кишківнику людини. А відтак, не може бути виключена можливість реінфекції трихомонозу при практиці “альтернативного сексу” як з “старими”, так і з “новими” партнерами.
Таким чином, даний етап дослідження демонструє, що при одночасному дослідженні біологічного матеріалу з ССС пацієнтів, що було спрямованим на виявлення трихомонад, за допомогою методів засіву на живильне середовище СВТ та ПЛР-РЧ, у переважній більшості випадків при засівах ідентифікують як Trichomonas vaginalis інші мікроорганізми, що належать до найпростіших, а саме Trichomonas tenax та Pentatrichomonas hominis. Високий рівень виявлення Trichomonas tenax та Pentatrichomonas hominis, у ССС людини, у свою чергу, свідчить про важливість орального та анального сексу, що не захищений бар’єрними засобами контрацепції, у виникненні та/або перебігу інфекцій урогенітального тракту.
За допомогою порівняння мікроскопічної, культуральної діагностики та методу ПЛР при виявленні трихомонад у ССС хворих на ІПСШ безперечно встановлено:
- За допомогою методу засіву на спеціальне живильне середовище “СВТ” Trichomonas vaginalis було виявлено у 15,5 % з 97 досліджених пацієнтів. При проведенні дослідження методом ПЛР-РЧ цей збудник було діагностовано лише у 6 (6,2 %) осіб. Разом з тим, проведення ПЛР-РЧ з використанням праймерів для виявлення Trichomonas tenax та Pentatrichomonas hominis, дозволило діагностувати у 9 (9,3 %) відповідних пацієнтів Trichomonas tenax та у 12 (12,4 %) – Pentatrichomonas hominis.
- Одночасне використання праймерів для виявлення Trichomonas vaginalis, Trichomonas tenax та Pentatrichomonas hominis дозволяє робити діагностування трихомонад у ССС досліджуваних пацієнтів за допомогою методу ПЛР-РЧ більш ефективним (27,9 %), ніж за допомогою культурального методу, зокрема, засівів на спеціальне живильне середовище СВТ.
- При проведенні діагностики трихомонозу за допомогою культурального методу в значній частині випадків Trichomonas tenax та Pentatrichomonas hominis помилково ідентифікуються як Trichomonas vaginalis.
- Встановлений достатньо високий рівень діагностування Trichomonas tenax та Pentatrichomonas hominis у ССС обстежених пацієнтів свідчить про вагоме значення «альтернативних» статевих контактів, зокрема, орального та анального сексу за умови незахищеності бар’єрними засобами контрацепції, у виникненні та/або перебігу запальних процесів урогенітального тракту.
4.3 Апробація оригінальних праймерiв для визначення Pentatrichomonas hominis
Вперше в Україні було проведено попередні «пілотні» дослідження щодо визначення Pentatrichomonas hominis в урогенітальному тракті хворих на ІПСШ. За нашими даними, воно становило близько 14 % хворих на хронічний трихомоноз. У цьому дослідженні було чітке дотримання пацієнтами умови про сексуальне утримання не менше 2 діб, що унеможливлювало розгляд цих найпростіших у якості ТМ. Багатоетапність та тривалість проведеного дослідження (2013 – 2017 рр.) мінімізувало можливість контамінації біологічного матеріалу [154]. Персистенція хронічного запального процесу дозволило припустити певну етіологічну роль Pentatrichomonas hominis у виникненні та/або перебігу ІПСШ. Причому, визначення виду трихомонад у ССС та їх санація має, вочевидь, вирішальну роль у запобіганні рецидивів або реінфекцій трихомонозу [131].
Таким чином, актуальність проблеми виявлення Pentatrichomonas hominis у ССС людини пов’язана як з високим рівнем захворюваності на трихомоноз, так і з можливістю колонізації ССС «новими» збудниками в результаті їх патоморфозу [144]. Врахування наявності цього мікроорганізму, на наше переконання, надасть можливість більш точного діагностування, лікування та профілактики трихомонозу, включаючи санацію екстрагенітальних осередків інвазії. Тому необхідно розробити та впровадити в практику лікувально-діагностичних закладів України нові діагностичні системи для виявлення Pentatrichomonas hominis у біологічному матеріалі, взятому із сечостатевих органів. Свого часу було розроблено та запатентовано відповідний набір реагентів (праймери для детекцiї Pentatrichomonas hominis тa спосіб їх застосування [92]. При використанні означених праймерів для виявлення Pentatrichomonas hominis у проведеному попередньо досліджені було показано їх високу діагностичну цінність [102].
Враховуючи сказане вище, завданням даного дослідження стала апробація оригінальних праймерiв для визначення Pentatrichomonas hominis методом ПЛР.
З метою виявлення в ССС Pentatrichomonas hominis було проведене спеціальне генодіагностичне мультицентрове дослідження пацієнтів, хворих на ІПСШ. Біологічний матеріал для дослідження з використанням методу ПЛР було взято відповідно до вимог керівних документів [66] у пацієнтів, які звернулись за спеціалізованою медичною допомогою з приводу ІПСШ у провідні державні медичні установи України, а саме: ДУ «Інститут дерматології та венерології НАМН України» (м. Харків) – 14 пацієнтів; Міський шкірно-венерологічний диспансер (м. Київ) – 7 пацієнтів; Національний військово-медичний центр «ГВКГ» МО України (м. Київ) – 16 пацієнтів. Таким чином, дослідна група складалася з 37 пацієнтів обох статей, хворих на ІПСШ, з них було 5 жінок (13,5 %) та 32 чоловіки (84,5 %). Середній вік досліджуваних осіб становив (31,0 ± 3,5) року.
Методом генодіагностики, який був використаний у дослідженні, є ПЛР. В основу метода покладено компліментарна добудова ділянки геномної ДНК збудника, яка здійснюється in vitro за допомогою ферменту термостабільної ДНК-полімерази, дезоксинуклеозидтрифосфатів, відповідного сольового буфера та олігонуклеотидних затравок-праймерів, що визначають межі ампліфікованої ділянки ДНК-мішені. Специфічність методу визначається унікальністю генетичного матеріалу інфекційного агенту, до якого підібрані олігонуклеотидні праймери, які беруть участь у процесі ампліфікації.
З метою перевірки отриманих даних, було виконане додаткове дослідження зразків мікробних ДНК, отриманих від пацієнтів, що обстежувались. Для цього використовувались зразки, які з найбільшою вірогідністю мали в собі фрагменти ДНК Pentatrichomonas hominis, що було визначено за допомогою методу ПЛР-РЧ. Додаткове дослідження полягало у проведенні виявлення мікроорганізму, що досліджується, за допомогою класичної ПЛР з використанням електрофорезу в агарозному гелі. Паралельне використання ПЛР та ПЛР-РЧ дозволяє визначити параметри «фільтрації» даних при обліку ПЛР-РЧ з метою унеможливлення отримування хибнопозитивних результатів.
В якості праймерів для проведення ПЛР в обох її варіантах використовувались оригінальні праймери для визначення Pentatrichomonas hominis (8).
Разом з тим, було запроваджено додатковий спосіб контролю відповідності оригінальних праймерів, які проходили апробацію. Він полягав у застосуванні «молекулярної мітки», що дає змогу оцінити відповідність молекулярної маси оригінального праймеру та ланцюжків ДНК, що визначаються за його допомогою.
Праймери, використані в дослідженні, мають досить широкий спектр специфічності, який включає виявлення ДНК Pentatrichomonas hominis, а також ряду інших досить близьких до них збудників з родин Pentatrichomonas, Hypotrichomonas, Pseudotrichomonas, Cochlosoma, Honigbergiella, Monotrichomonas, Trichomitopsis, Tetratrichomonas, Pseudotrypanosoma, Honigbergiellida, Cryptotermes, Ditrichomonas та інші. У той же час, при їх використанні повністю виключена можливість ампліфікації ДНК Trichomonas vaginalis. Показником позитивної реакції є утворення амплікону довжиною 461 нп.
За результатами ПЛР-РЧ у 6 зразках були отримані позитивні результати на 28 – 30 циклі ампліфікації. Електрофореграми, отримані з цими зразками в гелі агарози з бромистим етидієм, наведено на рис. 4.1.
Можна відзначити, що в більшості з цих зразків (5 з 6) виявлявся специфічний амплікон довжиною 461 нп, який свідчить про наявність ДНК, яка ампліфікується праймерами, що були застосовані в реакції. У негативному зразку (№ 8) такий амплікон відсутній.
Окрім специфічного амплікону продукти реакції більшості зразків вміщують неспецифічні продукти ампліфікації іншої довжини, значна частина їх належить до низькомолекулярних продуктів. Наявність такої значної кількості неспецифічних продуктів свідчить про недостатню оптимізацію ПЛР, яка може заважати використовувати метод ПЛР в реальному часі без характеристики довжини отриманих ампліконів. Зокрема, зразок 6, який давав досить сильний позитивний сигнал на 18 циклі, характеризується майже виключно неспецифічними продуктами ампліфікації.
Отримані в дослідженні позитивні результати ампліфікації свідчать про наявність в клінічних зразках ДНК збудників, що відрізняються від T.vaginalis, але належать до досить близьких до них таксономічних груп. Цілком можливо, що вони належать до роду Pentatrichomonas, але для того, щоб конкретизувати характер цих збудників необхідні подальші дослідження з використання більш специфічних методів, зокрема секвенування отриманих ампліконів.
 Рисунок 4.1 – Електрофореграма, отримана за допомогою ПЛР
Рисунок 4.1 – Електрофореграма, отримана за допомогою ПЛР
З даних літератури з цього питання треба привести результати дослідження C.I. Bandea et al. (2013), які спробували виявити збудників видів T. tenax і P. hominis у зразках сечі хворих на урогенітальну патологію, використовуючи ампліфікацію специфічного для роду (родини) Trichomonas фрагменту гену 5.8S rRNA, що містив варіабельний внутрішній транскрибований спейсер ITSI, з наступним секвенуванням. При цьому виявити присутність T. tenax і P. hominis у досліджених зразках не вдалося [189].
Цілком можливо, що ДНК, яка виявляється ампліфікацією з використаними праймерами, належить до інших збудників.
Отримані результати показали, що:
- На сучасному етапі є перспективним розгляд Pentatrichomonas hominis у якості фактору виникнення та/або розвитку ІПСШ.
- За допомогою метода ПЛР у біологічному матеріалі, отриманому від хворих на ІПСШ, Pentatrichomonas hominis було виявлено у 6 (16,2 %) з 37 обстежених пацієнтів.
- Оригінальні праймери для визначення Pentatrichomonas hominis методом ПЛР показали свою високу діагностичну цінність. Їх доцільно запровадити в практику лікувально-діагностичних закладів України.
- Методом ПЛР показано, що в значної частині зразків, отриманих у хворих на хронічну урогенітальну інфекцію, виявляється ДНК збудників, які належать не до Trichomonas vaginalis, а до близьких до них таксономічних груп, можливо, що найчастіше вони представлені Pentatrichomonas hominis. Для встановлення видової приналежності цих збудників необхідні подальші дослідження.
4.4 Секвенування біологічного матеріалу для підтвердження наявності Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia (дослідження специфічності оригінальних праймерів для виявлення ДНК)
З метою перевірки отриманих даних було виконане додаткове дослідження зразків мікробних ДНК, отриманих від пацієнтів, що обстежувались. Для цього використовувались зразки, які з найбільшою вірогідністю мали в собі фрагменти ДНК досліджуваних найпростіших, що було визначено за допомогою методу ПЛР-РЧ. Це зразки, які давали позитивний сигнал не пізніше 30 циклу ампліфікації. Додаткове дослідження полягало у виявленні мікроорганізму, що досліджується, за допомогою класичної ПЛР з використанням електрофорезу в 2 % агарозному гелі з етидієм бромідом з наступною детекцією на трансілюмінаторі «Біоком» (РФ).
Для подальшого дослідження шляхом секвенування було використано генетичний матеріал, взятий із ССС 62 пацієнтів (30 чоловіків та 32 жінки), хворих на ІПСШ. Середній вік виборки осіб склав (31 ± 3,5) року. У кожного з цих хворих за допомогою авторських праймерів було попередньо виявлено один з наступних найпростіших мікроорганізмів, а саме Trichomonas tenax, Pentatrichomonas hominis або Gіardia lamblia. У кожного з них за умов проведення цього дослідження було попередньо виключено можливість інфікування на Trichomonas vaginalis. У 18 пацієнтів було визнвчено наявність Trichomonas tenax, у 23 – Pentatrichomonas hominis, у 21 – Gіardia lamblia.
Секвенування проводилося з використанням приладу фірми «Applied Biosystems» SOLIDtm System 5500xl (USA), який використовує емульсійну ПЛР і твердофазне лігування. Продукти ПЛР екстрагувалися з 2 % агарозного гелю, за допомогою DEAE Cellulose Menbrane (0,45μm) (Serva, Germany), використовуючи стандартну методику очищення [87]. Очищені продукти ампліфікації піддавалися подальшому секвенуванню згідно з інструкцією виробника.
Нуклеотидні послідовності, що були секвеновані, порівнювалися з відомими за допомогою програмного забезпечення до приладу SOLIDTM System 5500xl (USA), а також бази даних GenBank.
Оскільки нуклеотидні послідовності, що були секвеновані, порівнювалися з відомими послідовностями за допомогою сертифікованих комп’ютерних програм, то їхня приналежність вважалась повністю доведеною. Вони абсолютно співпадали з нуклеотидними послідовностями саме Trichomonas tenax, Pentatrichomonas hominis або Gіardia lamblia. Результати секвенування повністю співпали з тими, що були отримані за допомогою ПЛР. Тобто, у 18 пацієнтів було визначено присутність Trichomonas tenax, у 23 – Pentatrichomonas hominis, у 21 – Gіardia lamblia.
У результаті проведеної роботи було доведено можливість використання авторських праймерів для ідентифікації Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia в біологічному матеріалі. Була доведена специфічність вищезгаданих праймерів за допомогою прямих та непрямих методів детекції, включно з секвенуванням, як показано на рис. 4.2, 4.3, 4.4.
Отримані результати доводять можливість подальшого використання досліджуваних праймерів у рутинній практиці закладів охорони здоров’я для виявлення ДНК збудників протозойних інвазій – Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia в біологічному матеріалі.
 Рисунок 4.2 – Приклад результатів секвенування генетичного матеріалу, визначеного за допомогою авторського праймеру як Pentatrichomonas hominis
Рисунок 4.2 – Приклад результатів секвенування генетичного матеріалу, визначеного за допомогою авторського праймеру як Pentatrichomonas hominis
 Рисунок 4.3 – Приклад результатів секвенування генетичного матеріалу, визначеного за допомогою авторського праймера як Trichomonas tenax
Рисунок 4.3 – Приклад результатів секвенування генетичного матеріалу, визначеного за допомогою авторського праймера як Trichomonas tenax
 Рисунок 4.4 – Приклад результатів секвенування генетичного матеріалу, визначеного за допомогою авторського праймеру як Gіardia lamblia
Рисунок 4.4 – Приклад результатів секвенування генетичного матеріалу, визначеного за допомогою авторського праймеру як Gіardia lamblia
Таким чином, можна дійти наступних висновків:
- Показана можливість використання в медичній практиці авторських праймерів для виявлення ДНК Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia в біологічному матеріалі.
- За допомогою молекулярно-біологічних методів – ПЛР-РЧ та секвенування показано специфічність досліджуваних праймерів.
- Доведено можливість використання досліджуваних авторських праймерів у практиці закладів охорони здоров’я.
4.5 Явище антибіозу при трихомонадній інвазії сечостатевої системи
Отже, встановлено можливість перебування в ССС людини на сучасному етапі трьох різних видів трихомонад. З огляду на це, постала нова наукова проблема щодо вивчення можливості одноч1асної інвазії ССС трихомонадами різних видів. Вирішення цього питання є істотним, перш за все, для формування уявлення про патогенність Trichomonas tenax і Pentatrichomonas hominis саме для ССС.
Трихомонадну інвазію було виявлено більше ніж у третини (38,9 %) зі 198 обстежених пацієнтів, хворих на ІПСШ з хронічним перебігом. «Trichomonas non vaginalis» було виявлено у 69 (34,8 %). Причому, у 41 (20,7 %) було діагностовано Trichomonas tenax, а у 28 (14,1 %) – Pentatrichomonas hominis. Рівень діагностування Trichomonas vaginalis у досліджуваній групі хворих склав лише 4,0 %.
Згідно результатів отриманих при проведенні цього «пілотного» дослідження, при детекції трихомонад у біологічному матеріалі, взятому з ССС хворих на ІПСШ, не зустрічалося жодного випадку виявлення більше одного виду трихомонад у кожного з пацієнтів. Тобто, в ССС людини одночасно не можуть співіснувати різні види трихомонад.
Явище, при якому відбуваються антагоністичні відносини видів, коли один організм обмежує можливості іншого, неможливість співіснування організмів, має назву антибіоз (термін було уведено мікробіологом Зельманом Вексменом у 1942 р.). Форма антибіозу, при якій два або більше видів організмів є біологічними ворогами за своєю суттю (використовують спільну кормову базу або спільні умови для розмноження), наприклад, хижі істоти різних видів, що мешкають на одній території і вживають один і той же харч, називається конкуренцією [43].
Спираючись на сказане вище, можна зробити припущення, що саме внаслідок явища антибіозу у формі конкуренції, в ССС людини не можуть існувати різні види трихомонад одночасно. Враховуючи високий рівень розповсюдженості та неможливість співіснування різних видів трихомонад в ССС людини, зокрема хворих на ІПСШ з хронічним перебігом, можна зробити припущення про певну роль «Trichomonas non vaginalis» у виникненні та/або перебігу інфекційних захворювань ССС.
Таким чином, можна зробити такі висновки:
- Встановлено високий рівень (38,9 %) трихомонадної інвазії ССС у хворих на ІПСШ з хронічним перебігом.
- Переважна більшість випадків трихомонадної інвазії ССС (34,9 %) у обстежених пацієнтів була викликана «Trichomonas non vaginalis».
- При трихомонадній інвазії ССС встановлено існування явища антибіоза у формі конкуренції.
- Зроблено припущення про певну роль «Trichomonas non vaginalis» у виникненні та/або перебігу інфекційних захворювань ССС людини.
4.6 Асоціації умовно-патогенних бактерій та збудників протозойних інвазій у сечостатевій системі хворих на інфекції, що передаються статевим шляхом
Початкова вибірка обстежених осіб склала 198 пацієнтів, що проходили обстеження на ІПСШ з приводу наявності запалювальних захворювань ССС. Середній вік досліджуваних склав (32 ± 2,5) року. У всіх був встановлений хронічний перебіг урогенітальної інфекції, тієї чи іншої етіології. Попереднє обстеження за допомогою бактеріологічних та бактеріоскопічних методів, а ПЛР-РЧ визначило групу пацієнтів, що представлені в даній роботі. Подальше детальне обстеження було проведено у 71 пацієнтів, у яких попередньо були знайдені одночасно збудники протозойних інвазій та мікроорганізми, що асоційовані з БВ. Взяття та зберігання біологічного матеріалу із ССС для дослідження здійснювалося відповідно до чинних вимог [66]. Для ПЛР-РЧ використовувались ампліфікатор ДТ-96, набір реагентів «Фемофлор-16» (НПО ДНК-технология, РФ) та праймери для виявлення різних видів трихомонад та Giardia lamblia. Специфічність та чутливість використаних оригінальних праймерів для виявлення Trichomonas tenax, Pentatrichomonas hominis, а також Giardia lamblia підтверджено відповідними патентами України [91, 92, 93]. Призначенням набору реагентів Фемофлор-16 є кількісне визначення відповідної мікрофлори у жінок. Для кількісного визначення умовно-патогенної мікрофлори у чоловіків існує набір реагентів Андрофлор, який з’явився на ринку в 2017 році. Тому для діагностичного обстеження пацієнтів-чоловіків було адаптовано Фемофлор-16, що дозволило порівняти видовий склад мікробіоти статевих шляхів у чоловіків та жінок з трихомонадною та лямбліозною інвазією. Набір реагентів Фемофлор-16 дозволяє кількісно визначати наступні показники: загальна бактеріальна маса, Lactobacillus spp., Enterobacteriaceae, Streptococcus spp., Staphylococcus spp,. Gardnerella vaginalis/Prevotella bivia/Porphyromonas spp., Eubacterium spp., Sneathia spp./Leptotrihia spp./Fusobacterium spp., Megasphaera spp./Veilonella spp./Dialister spp., Lachnobacterium spp./Clostridium spp., Mobiluncus spp./Corynebacterium spp., Peptostreptococcus spp., Atopobium vaginae, Candida spp., Mycoplasma hominis, Ureaplasma (urealyticum + parvum), Mycoplasma genitalium [165].
За допомогою методу ПЛР-РЧ трихомонади в ССС було виявлено у 77 ([38,9 ± 3,5] %) зі 198 обстежених хворих на ІПСШ з хронічним перебігом. У 41 ([20,7 ± 2,9] %) було виявлено Trichomonas tenax, у 28 ([14,1 ± 2,5] %) – Pentatrichomonas hominis. Trichomonas vaginalis – у 8 ([4,0 ± 1,4] %). Giardia lamblia було виявлено у 11 пацієнтів ([5,6 ± 1,6] %). Таким чином, протозойні інвазії ССС встановлено у 88 ([44,4 ± 3,5] %) досліджуваних пацієнтів. У переважної більшості хворих із протозойною інвазією, а саме у 71 особи з 198 ([35,9 ± 3,4] %) було виявлено або БВ (жінки) або дисбактеріоз ССС, спричинений переважно анаеробною та мікроаерофільною мікрофлорою (чоловіки). Дані пацієнти і склали досліджувану групу. Кількість випадків виявлення кожного зі збудників протозойних інвазій у ССС у групі досліджуваних пацієнтів показано в табл. 4.1.
У кожного хворого був виявлений тільки один з чотирьох досліджуваних збудників. Група дослідження складалася з 45 чоловіків (63,4 %) та 26 жінок (36,6 %). У 13 пацієнтів (18,3 %) було діагностовано Trichomonas tenax, у 10 чоловіків (22,2 % із усіх чоловіків) та у 3 жінок (11,5 % із усіх жінок). У 48 пацієнтів (67,6 %) було діагностовано Pentatrichomonas hominis – у 29 чоловіків (64,4 %) та 19 жінок (73,1 %). Trichomonas vaginalis – у 1 пацієнта, жінки (3,8 %). Giardia lamblia було виявлено у 9 пацієнтів (12,7 %), 6 чоловіків (13,3 %) та 3 жінок (11,5 %). Значних гендерних відмінностей щодо частоти виявлення збудників протозойних інвазій у ССС досліджуваних пацієнтів виявлено не було.
Таблиця 4.1 – Виявлення збудників протозойних інвазій у ССС пацієнтів (n = 71)
| Збудники протозойних інвазій | Кількість хворих з позитивним результатом | |||||
| Загальна вибірка | Чоловіки | Жінки | ||||
| Абс. | % | Абс. | % | Абс. | % | |
| Trichomonas vaginalis | 1 | 1,4 ± 1,4 | 0 | 0 | 1 | 3,8 ± 3,8 |
| Trichomonas tenax | 13 | 18,3 ± 4,6 | 10 | 22,2 ± 6,2 | 3 | 11,5 ± 6,3 |
| Pentatrichomonas hominis | 48 | 67,6 ± 5,6 | 29 | 64,4 ± 7,1 | 19 | 73,1 ± 8,7 |
| Giardia lamblia | 9 | 12,7 ± 3,9 | 6 | 13,3 ± 5,1 | 3 | 11,5 ± 6,3 |
| *Всього | 71 | 100 | 45 | 100 | 26 | 100 |
Примітка. * – у кожного хворого був виявлений тільки один із чотирьох досліджуваних збудників
Показники виявлення мікроорганізмів, асоційованих з БВ наведені в табл. 4.2. Enterobacteriaceae було виявлено у 13 пацієнтів (18,3 %). Причому, у 10 чоловіків, що склало 22,2 % від чоловічої частини пацієнтів, а також у 3 жінок, що склало 11,5 % жіночої частини пацієнтів. Streptococcus spp. було виявлено у 11 пацієнтів (15,5 %). Всі вони були чоловіками, що склало 24,4 % з усіх чоловіків. Staphylococcus spp. було виявлено у 8 пацієнтів, також виключно у чоловіків, що склало 17,8 %. Група мікроорганізмів Gardnerella vaginalis/Prevotella bivia/ Porphyromonas spp. було виявлено у 24 пацієнтів (33,8 %). Причому, у 17 чоловіків, що склало 37,8 %, а також у 7 жінок, що склало 26,9 % від жіночої частини пацієнтів. Eubacterium spp. було виявлено у 38 пацієнтів (53,5 %). Причому, у 29 чоловіків, що склало 64,4 %, а також у 9 жінок, що склало 34,61 % жіночої частини пацієнтів. Група мікроорганізмів Sneathia spp./Leptotrihia spp./Fusobacterium spp. було виявлено у виключно у 4 чоловіків, що склало 8,9 %. Група мікроорганізмів Megasphaera spp./Veilonella spp./Dialister spp. було виявлено у 14 пацієнтів (19,7 %). Причому, у 10 чоловіків, що склало 22,2 % та у 4 жінок, що склало 15,4 %. Групу мікроорганізмів Lachnobacterium spp./Clostridium spp. було виявлено у 13 пацієнтів (18,3 %). Причому, у 9 чоловіків, що склало 20,0 % всіх чоловіків, та у 4 жінок, що склало 15,4 % усіх жінок. Група мікроорганізмів Mobiluncus spp./Corynebacterium spp. було виявлено у 37 пацієнтів (52,1 %). За гендером – у 35 чоловіків, що склало 77,8 % і у 2 жінок, що склало 7,7 %. Peptostreptococcus spp. було виявлено у 20 пацієнтів (28,2 %). Це були 16 чоловіків (35,6 %) та 4 жінки (15,4 %). Atopobium vaginae було виявлено у 4 пацієнтів (5,6 %) – у 1 чоловіка (2,2 %) та у 3 жінок (11,5 %). Candida spp. було виявлено у 49 пацієнтів (69,0 %). За статтю вони розподілились наступним чином: 35 чоловіків, що склало 77,8 % та 14 жінок, що склало 53,8 %. Mycoplasma hominis було виявлено у 1 пацієнта (1,4 %) – чоловіка, що склало 2,2 % від чоловічої частини пацієнтів. Ureaplasma (urealyticum + parvum) було виявлено у 15 пацієнтів (21,1 %). Причому, у 8 чоловіків, що склало 17,8 %, а також у 14 жінок, що склало 53,8 %. Mycoplasma genitalium було виявлено у 1 пацієнта (1,41 %) – чоловіка, що склало 2,22 % від усіх чоловіків.
Таблиця 4.2 – Виявлення мікроорганізмів, асоційованих із БВ, у ССС пацієнтів (n = 71)
| Види, таксономічні групи | Кількість хворих з позитивним результатом | |||||
| Загальна вибірка | Чоловіки | Жінки | ||||
| Абс. | % | Абс. | % | Абс. | % | |
| Enterobacteriaceae * | 13 | 18,3 ± 4,6 | 10 | 22,2 ± 6,2 | 3 | 11,5 ± 6,3 |
| Streptococcus spp. * | 11 | 15,5 ± 4,3 | 11 | 24,4 ± 6,4 | 0 | 0 |
| Staphylococcus spp. * | 8 | 11,3 ± 3,8 | 8 | 17,8 ± 5,7 | 0 | 0 |
| Gardnerella vaginalis/
Prevotella bivia / Porphyromonas spp. |
24 | 33,8 ± 5,6 | 17 | 37,8 ± 7,2 | 7 | 26,9 ± 8,7 |
| Eubacterium spp. * | 38 | 53,5 ± 5,9 | 29 | 64,4 ± 7,1 | 9 | 34,6 ± 9,3 |
| Sneathia spp./ Leptotrihia spp./ Fusobacterium spp. * | 4 | 5,6 ± 2,7 | 4 | 8,9 ± 4,2 | 0 | 0 |
| Megasphaera spp./
Veilonella spp. /Dialister spp. |
14 | 19,7 ± 4,7 | 10 | 22,2 ± 6,2 | 4 | 15,4 ± 7,1 |
| Lachnobacterium spp./
Clostridium spp. |
13 | 18,3 ± 4,6 | 9 | 20,0 ± 6,0 | 4 | 15,4 ± 7,1 |
| Mobiluncus spp./
Corynebacterium spp. * |
37 | 52,1 ± 5,9 | 35 | 77,8 ± 6,2 | 2 | 7,7 ± 5,2 |
| Peptostreptococcus spp. | 20 | 28,2 ± 5,3 | 16 | 35,6 ± 7,1 | 4 | 15,4 ± 7,1 |
| Atopobium vaginae | 4 | 5,6 ± 2,7 | 1 | 2,2 ± 2,2 | 3 | 11,5 ± 6,3 |
| Candida spp. | 49 | 69,0 ± 5,5 | 35 | 77,8 ± 6,2 | 14 | 53,8 ± 9,8 |
| Mycoplasma hominis | 1 | 1,4 ± 1,4 | 1 | 2,2 ± 2,2 | 0 | 0 |
| Ureaplasma (urealyticum + parvum) | 15 | 21,1 ± 4,8 | 8 | 17,8 ± 5,7 | 7 | 26,9 ± 8,7 |
| Mycoplasma genitalium | 1 | 1,4 ± 1,4 | 1 | 2,2 ± 2,2 | 0 | 0 |
| Всього ** | 71 | 100 | 45 | 100 | 26 | 100 |
Примітка. * – Процент виявлення відрізняється у чоловіків та жінок (p < 0,05); ** – у більшості хворих (61) були виявлені два і більше (до 9) досліджуваних збудників.
Таким чином, у хворих на ІПСШ з хронічним перебігом, що мають протозойні інвазії ССС, до складу відповідних патологічних МА частіше за все входять наступні мікроорганізми та/або їх групи: Candida spp., Eubacterium spp., Mobiluncus spp./Corynebacterium spp., Gardnerella vaginalis/Prevotella bivia/ Porphyromonas spp. Окрім того, можна відзначити значну перевагу частоти виявлення у чоловіків деяких мікроорганізмів, асоційованих з БВ, а саме: Enterobacteriaceae, Streptococcus spp., Staphylococcus spp,. Gardnerella vaginalis/Prevotella bivia/Porphyromonas spp., Eubacterium spp., Sneathia spp./Leptotrihia spp./Fusobacterium spp., Mobiluncus spp./Corynebacterium spp., Peptostreptococcus spp. Гендерні відмінності в частоті виявлення вказаних мікроорганізмів можуть вказувати на їх пристосування до ССС чоловіків, не зважаючи на певні відмінності лужності середовища існування [261]. Частота виявлення Atopobium vaginae, навпаки, була вищою серед жінок, що в основному співпадає з даними Zozaya M., et al., (2016) отриманими у чоловіків та жінок, але без врахування трихомонадної та лямбліозної інвазії [174].
Як показали отримані дані (табл. 4.3) лише один вид (група) мікроорганізмів виявлялися в цілому досить не часто – у 14 % хворих. Усі вони були жінками, що склало вже більше третини – 38,5 %. У 46 хворих (64,8 %) виявлялося три і більше мікроорганізмів. У 13 виявлено 6 мікроорганізмів і більше – це 18,3 % – тобто кожен шостий хворий.
Також показано, що частота випадків одночасного виявлення мікроорганізмів (груп мікроорганізмів), асоційованих із БВ, значно різнилася в гендерному аспекті. Так, виявлення відповідних мікроорганізмів у кількості 6, частіше відзначалось у чоловіків. По одному мікроорганізму, що асоційований з БВ, виявляли, виключно у обстежуваних жінок. Виходячи з цього, можна припустити, що чисельність мікроорганізмів в асоціаціях, що складаються з анаеробної та мікроаерофільної мікрофлори, може залежати від статі, завдяки відмінності властивостей середовища в статевих шляхах чоловіків та жінок (гормони, місцеві антитіла, рН, активні антибактеріальні пептиди, тощо).
Таблиця 4.3 – Частота одночасного виявлення мікроорганізмів (груп мікроорганізмів), асоційованих із БВ, у ССС пацієнтів (n = 71)
| Кількість виявлених видів, таксономічних груп | Кількість хворих з позитивним результатом | |||||
| Загальна вибірка | Чоловіки | Жінки | ||||
| Абс. | % | Абс. | % | Абс. | % | |
| 1 мікроорганізм* | 10 | 14,1 ± 4,1 | 0 | 0 | 10 | 38,5 ± 9,5 |
| 2 мікроорганізми | 15 | 21,1 ± 4,8 | 7 | 15,6 ± 5,4 | 8 | 30,8 ± 9,1 |
| 3 мікроорганізми* | 10 | 14,1 ± 4,1 | 9 | 20,0 ± 6,0 | 1 | 3,8 ± 3,8 |
| 4 мікроорганізми | 17 | 23,9 ± 5,1 | 13 | 28,9 ± 6,8 | 4 | 15,4 ± 7,1 |
| 5 мікроорганізмів | 6 | 8,5 ± 3,3 | 4 | 8,9 ± 4,2 | 2 | 7,7 ± 5,2 |
| 6 мікроорганізмів* | 5 | 7,0 ± 3,0 | 5 | 11,1 ± 4,7 | 0 | 0 |
| 7 мікроорганізмів | 4 | 5,6 ± 2,7 | 3 | 6,7 ± 3,7 | 1 | 3,8 ± 3,8 |
| 8 мікроорганізмів | 3 | 4,2 ± 2,4 | 3 | 6,7 ± 3,7 | 0 | 0 |
| 9 мікроорганізмів | 1 | 1,4 ± 1,4 | 1 | 2,2 ± 2,2 | 0 | 0 |
| Усього | 71 | 100 | 45 | 100 | 26 | 100 |
Примітка. * – процент виявлення відрізняється у чоловіків та жінок (p < 0,05)
Важливою частиною дослідження було проаналізувати частоту одночасного виявлення окремих збудників протозойних інвазій, а саме Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia разом з мікроорганізмами, асоційованими з БВ. Дані наведені в табл. 4.4.
На підставі наведених даних можна зробити висновки, що мікроорганізми, асоційовані з БВ, часто зустрічаються в ССС пацієнтів з Trichomonas tenax та Pentatrichomonas hominis, а також Giardia lamblia. Причому група мікроорганізмів Gardnerella vaginalis / Prevotella bivia / Porphyromonas spp. визначається у понад 60 % відповідних пацієнтів при Trichomonas tenax. Enterobacteriaceae визначається у майже у 11-23 % хворих. Група мікроорганізмів Mobiluncus spp./Corynebacterium spp. визначалась у 23-33 %. Candida spp. виявляється більше, майже у 70 % пацієнтів, що мають цих збудників. Eubacterium spp. було знайдено у понад 54 % хворих. Що стосується умовно-патогенних генітальних мікоплазм (Ureaplasma (urealyticum + parvum), то вони більш часто з високою долею достовірності асоціюються в ССС з найпростішими збудниками лямбліозу Giardia lamblia – майже в 45 % випадках.
Таблиця 4.4 – Частота одночасного виявлення в ССС пацієнтів окремих збудників протозойних інвазій (окрім Trichomonas vaginalis) разом з мікроорганізмами (групами мікроорганізмів), асоційованими з БВ (n = 70)^
| Види, таксономічні групи | Кількість хворих з позитивним результатом | |||||
| Trichomonas tenax | Pentatrichomonas hominis | Giardia lamblia | ||||
| Абс. | % | Абс. | % | Абс. | % | |
| Enterobacteriaceae | 3 | 23,1 ± 11,7 | 8 | 16,7 ± 5,4 | 1 | 11,1 ± 10,5 |
| Streptococcus spp. | 2 | 15,4 ± 10,0 | 7 | 14,6 ± 5,1 | 2 | 22,2 ± 13,9 |
| Staphylococcus spp. | 1 | 7,7 ± 7,4 | 5 | 10,4 ± 4,4 | 2 | 22,2 ± 13,9 |
| Gardnerella vaginalis/ Prevotella bivia / Porphyromonas spp. § | 8 | 61,5 ± 13,5 | 13 | 27,1 ± 6,4 | 2 | 22,2 ± 13,9 |
| Eubacterium spp. | 7 | 53,8 ± 13,8 | 26 | 54,2 ± 7,2 | 3 | 33,3 ± 15,7 |
| Sneathia spp./ Leptotrihia spp./ Fusobacterium spp. | 0 | 0 | 4 | 8,3 ± 4,0 | 0 | 0 |
| Megasphaera spp./
Veilonella spp. /Dialister spp. |
3 | 23,1 ± 11,7 | 10 | 20,8 ± 5,9 | 1 | 11,1 ± 10,5 |
| Lachnobacterium spp./
Clostridium spp. |
8 | 61,5 ± 13,5 | 24 | 50,0 ± 7,2 | 5 | 55,6 ± 16,6 |
| Mobiluncus spp./
Corynebacterium spp. |
4 | 30,8 ± 12,8 | 11 | 22,9 ± 6,1 | 3 | 33,3 ± 15,7 |
| Peptostreptococcus spp. | 1 | 7,7 ± 7,4 | 3 | 6,3 ± 3,5 | 0 | 0 |
| Atopobium vaginae | 8 | 61,5 ± 13,5 | 32 | 66,7 ± 6,8 | 7 | 77,8 ± 13,9 |
| Candida spp. | 9 | 69,2 ± 12,8 | 32 | 66,7 ± 6,8 | 6 | 66,7 ± 15,7 |
| Mycoplasma hominis | 2 | 15,4 ± 10,0 | 10 | 20,8 ± 5,9 | 2 | 22,2 ± 13,9 |
| Ureaplasma (urealyticum + parvum) § | 0 | 0 | 13 | 27,1 ± 6,4 | 4 | 44,4 ± 16,6 |
| Mycoplasma genitalium | 0 | 0 | 1 | 2,1 ± 2,1 | 0 | 0 |
| Всього* | 13 | 100 | 48 | 100 | 9 | 100 |
Примітки:
^ – одну жінку з Trichomonas vaginalis було виключено.
* – у частини хворих були виявлені два і більше досліджуваних збудників;
– процент виявлення відрізняється в залежності від збудника протозойної інвазії
- (p < 0,05)
Отже, можна зробити висновок, що Trichomonas tenax та Pentatrichomonas hominis, а деякою мірою також і Giardia lamblia, як збудники протозойних інвазій ССС, досить часто утворюють патологічні МА з мікроорганізмами, що асоційовані з БВ. На основі цих даних висунуто припущення про доцільність розгляду Trichomonas tenax та Pentatrichomonas hominis, і можливо також Giardia lamblia в якості важливих чинників БВ, а також відповідного анаеробного дисбіозу у чоловіків. Звісно ці висновки мають попередній характер, оскілки отримані на невеликих вибірках з точки зору статистики. Для підтвердження наведених даних необхідні подальші дослідження.
Таким чином встановлено, що:
- Протозойні інвазії ССС окрім Trichomonas vaginalis також здатні спричиняти Trichomonas tenax, Pentatrichomonas hominis, а також Giardia
- У хворих, що мають протозойні інвазії ССС, до складу МА найчастіше входять: Candida , Eubacterium spp., Mobiluncus spp./Corynebacterium spp., Gardnerella vaginalis/Prevotella bivia/ Porphyromonas spp. Має місце значна перевага частоти виявлення у чоловіків деяких мікроорганізмів, асоційованих з БВ, а саме: Enterobacteriaceae, Streptococcus spp., Staphylococcus spp,. Gardnerella vaginalis/Prevotella bivia/Porphyromonas spp., Eubacterium spp., Sneathia spp./Leptotrihia spp./Fusobacterium spp., Mobiluncus spp./Corynebacterium spp., Peptostreptococcus spp.
- Гендерні відмінності в частоті виявлення вказаних мікроорганізмів можуть вказувати на їх пристосування до ССС чоловіків, не зважаючи на певні відмінності лужності середовища існування. Доцільно розглядати Pentatrichomonas hominis та Trichomonas tenax і, можливо, також Giardia lamblia в якості важливих чинників БВ у жінок, а також відповідного анаеробного дисбіозу у чоловіків.
* * *
Підсумовуючи проведені дослідження, можна зазначити, що:
Отримані дані щодо практики орального та анального сексу серед вітчизняної молоді є співставними з аналогічними даними інших дослідників стосовно громадян різних країн. Існуючий стереотип сексуальної поведінки сучасної гетеросексуальної молоді не може не позначитись на способах передачі та характері перебігу деяких сечостатевих інфекцій, а також виникненні поєднаних генітально-екстрагенітальних уражень, викликаних збудниками ІПСШ.
Протозойні інвазії ССС окрім Trichomonas vaginalis також здатні спричиняти Trichomonas tenax, Pentatrichomonas hominis, а також Giardia lamblia.
Одночасне використання праймерів для виявлення Trichomonas vaginalis, Trichomonas tenax та Pentatrichomonas hominis дозволяє робити діагностування трихомонад у ССС досліджуваних пацієнтів за допомогою методу ПЛР-РЧ більш ефективним (27,9 %), ніж за допомогою культурального методу, зокрема, засівів на спеціальне живильне середовище СВТ. При проведенні діагностики трихомонозу за допомогою культурального методу в значній частині випадків Trichomonas tenax та Pentatrichomonas hominis помилково ідентифікуються як Trichomonas vaginalis
Оригінальні праймери для визначення Pentatrichomonas hominis методом ПЛР показали свою високу діагностичну цінність. Показана можливість використання в медичній практиці авторських праймерів для виявлення ДНК Trichomonas tenax, Pentatrichomonas hominis і Giardia lamblia в біологічному матеріалі.За допомогою молекулярно-біологічних методів – ПЛР-РЧ та секвенування показано специфічність цих праймерів.
При трихомонадній інвазії ССС встановлено існування явища антибіоза у формі конкуренції.
У хворих, що мають протозойні інвазії ССС, до складу МА найчастіше входять: Candida spp., Eubacterium spp., Mobiluncus spp./Corynebacterium spp., Gardnerella vaginalis/Prevotella bivia/ Porphyromonas spp. Має місце значна перевага частоти виявлення у чоловіків деяких мікроорганізмів, асоційованих з БВ, а саме: Enterobacteriaceae, Streptococcus spp., Staphylococcus spp,. Gardnerella vaginalis/Prevotella bivia/Porphyromonas spp., Eubacterium spp., Sneathia spp./Leptotrihia spp./Fusobacterium spp., Mobiluncus spp./Corynebacterium spp., Peptostreptococcus spp. Гендерні відмінності в частоті виявлення вказаних мікроорганізмів можуть вказувати на їх пристосування до ССС чоловіків, не зважаючи на певні відмінності лужності середовища існування.
Доцільно розглядати Pentatrichomonas hominis та Trichomonas tenax і, можливо, також Giardia lamblia в якості важливих чинників БВ у жінок, а також відповідного анаеробного дисбіозу у чоловіків.
Матеріали даного розділу опубліковані в таких роботах:
- Protozoan genital invasions caused by the representatives of Trichomonas and Giardia / V. Fedorych, G.I. Mavrov, T.V. Osinska, Y.V. Shcherbakova. Wiadomości Lekarskie. 2020. Vol. 73, Iss. 2. P. 380–383 [255].
- Fedorych P.V., Mavrov G.I. The role of protozoal infestations in chronic inflammation exacerbations in patients with genitourinary pathology. EURYKA: Health Science. No. 5. P. 28–33 [201].
- Федорич П.В., Примак А.В., Коновалова Т.С. Бактеріальний вагіноз: сучасний погляд на проблему. Раціональна терапія та реабілітаційні заходи щодо способу життя пацієнток. Український журнал дерматології, венерології, косметології. 2013. № 3 (50). С. 86–94 [158].
- Федорич П.В. Кількісне визначення мікрофлори, асоційованої з бактеріальним вагінозом, у сечостатевій системі чоловіків. Український журнал дерматології, венерології, косметології. 2014. № 3 (54). С. 57–62 [138].
- Порівняння ефективності діагностики трихомоніазу за культуральним методом та методом полімеразної ланцюгової реакції з використанням праймерів для виявлення Trichomonas vaginalis, Trichomonas tenax та Pentatrichomonas hominis / П.В. Федорич, С.Б. Зелений, О.А. Садовська, К.В. Дудікова. Український журнал дерматології, венерології, косметології. 2017. № 1 (64). С. 65–69 [102].
- Федорич П.В. Урогенітальний трихомоноз: новий погляд на проблему. Дерматологія та венерологія. 2017. № 4 (78). С. 12–16 [145].
- Федорич П.В. Трихомоніаз. Патоморфоз трихомонад. Військова медицина України. Т. 14, № 1. С. 62–67 [144].
- Федорич П.В., Мавров Г.І., Зелений С.Б. Виявлення Pentatrichomonas hominis в сечостатевій системі людини методом полімеразної ланцюгової реакції. Військова медицина України. 2018. Т. 18, № 4. С. 49–54 [154].
- Федорич П.В., Мавров Г.І. Поширеність протозойних інвазій при загостреннях хронічного запалення сечостатевої системи. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2018. № 2 (40). С. 37–42 [152].
- Федорич П.В., Мавров Г.І., Зелений С.Б. Можливість використання авторських праймерів для детекції, Pentatrichomonas hominis, Trichomonas tenax, Giardia lamblia в біологічному матеріалі. Журнал дерматовенерології та косметології імені М.О. Торсуєва. 2019. № 2 (42). С. 7–11 [155].
- Федорич П.В., Зеленый С.Б. Трихомониаз. Выявление Trichomonas tenax и Pentatrichomonas hominis в мочеполовой системе женщин репродуктивного возраста, больных инфекциями, передающимися преимущественно половым путем. Здоровье женщины. 2014. № 3 (89). С. 167–170 [147].
- Федорич П.В. Протозойні інвазії сечостатевої системи у поєднанні зі збудниками бактеріального вагінозу у жінок фертильного віку та їхніх статевих партнерів. Здоровье женщины. 2018. № 7 (133). С. 11–16 [143].
- Федорич П.В. Діагностика та лікування поєднаних уражень сечостатевої системи трихомонадами різних видів і мікроорганізмами, асоційованими з бактеріальним вагінозом. Лікарська справа. 2018. № 5–6. С. 100–111 [135].
- Аналіз сексуальної поведінки сучасних молодих осіб із вищою освітою / П.В. Федорич, В.П. Філіпішин, Л.Я Федорич., І.Г. Миколюк, Мехмет Бюлент Багчі. Сучасні аспекти військової медицини. Збірник наукових праць. К., 2013. Вип. 20. С. 328–334 [4].
- Федорич П.В. Обґрунтування та апробація оригінального способу взяття біологічного матеріалу з метою адаптації діагностикума Фемофлор-16 для кількісної детекції анаеробної та мікроаерофільної мікрофлори сечостатевої системи чоловіків. Український науково-медичний молодіжний журнал. 2012. № 2. С. 155–158 [139].
- Федорич П.В. Обґрунтування необхідності поглибленого вивчення сучасних багатовогнищевих поєднаних генітально-екстрагенітальних ІПСШ. Наукова конференція молодих вчених Української військово-медичної академії: Тез. доп., м. Київ, 17–18 травня 2013 р. К., 2013. Ч.1. С. 51–52 [83].
- Федорич П.В. К вопросу о возможности колонизации мочеполовой системы человека Trichomonas tenax и Pentatrichomonas hominis. Матеріали Науково-практичної конференції НМАПО ім. П.Л. Шупика «Місце дерматовенерології в міждисциплінарному вирішенні питань діагностики та лікування хронічних захворювань», м. Київ, 20–21 березня 2017 р. С. 117–118 [137].