Українська військово-медична академія
Міністерство оборони України
Державна установа «Інститут дерматології та венерології
Національної академії медичних наук України»
Кваліфікаційна наукова
праця на правах рукопису
Федорич Павло Володимирович
УДК [616.64+618.15]:616.993.1]-07-084-085
ДИСЕРТАЦІЯ
ПОПЕРЕДЖЕННЯ МЕДИКО–СОЦІАЛЬНИХ НАСЛІДКІВ ІНВАЗІЙ СЕЧОСТАТЕВОЇ СИСТЕМИ, СПРИЧИНЕНИХ ТРИХОМОНАДАМИ ТА ЛЯМБЛІЯМИ – ДІАГНОСТИКА, КОМПЛЕКСНА ТЕРАПІЯ, ПРОФІЛАКТИКА
14.01.20 – шкірні та венеричні хвороби
222. Медицина
Подається на здобуття наукового ступеня доктора медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
__________________________________________________________________
(підпис, ініціали та прізвище здобувача)
Науковий консультант: Мавров Геннадій Іванович, доктор медичних наук, професор
Харків – 2021
АНОТАЦІЯ
Федорич П.В. Попередження медико-соціальних наслідків інвазій сечостатевої системи, спричинених трихомонадами та лямбліями – діагностика, комплексна терапія, профілактика. – Кваліфікаційна наукова праця на правах рукопису.
Дисертація на здобуття наукового ступеня доктора медичних наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби (222. Медицина). – Українська військово-медична академія, Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2021.
Дисертаційна робота присвячена підвищенню ефективності лікування хворих на інвазії сечостатевої системи, спричинених трихомонадами та лямбліями, шляхом удосконалення діагностики цих станів, розробки рекомендацій щодо заходів їх профілактики, а також розробки методу комплексної терапії на підставі вивчення видової приналежності збудників, клініко-епідеміологічних даних, інвазій сечостатевої системи, спричинених трихомонадами та лямбліями впливу мікробних асоціацій та стану імунологічної реактивності пацієнтів на перебіг захворювання.
Наукова новизна полягає у тому, що у хворих на протозойні інвазії сечостатевої системи сьогодні є декілька збудників, а саме: Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia. Вперше показано значну поширеність Giardia lamblia, Trichomonas tenax, та, особливо, Pentatrichomonas hominis у сечостатевій системі хворих на інфекцій, що передаються статевим шляхом, (ІПСШ) з хронічним перебігом.
Доведено важливу роль Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia в перебігу та патогенезі ІПСШ з хронічним перебігом на сучасному етапі.
Вперше в Україні розроблено та отримано праймери для виявлення Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia ДНК у біологічних рідинах. Відповідність праймерів до окремих частин геному відповідних мікроорганізмів було підтверджено за допомогою методу секвенування.
Встановлені епідеміологічні закономірності трихомонадної інвазії сечостатевого тракту, а саме – поширеність Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia, а також чинники їх розповсюдження, проаналізовані особливості сексуальної поведінки хворих на ІПСШ та їх партнерів для встановлення анатомічних локусів зараження.
Описані особливості клінічного перебігу урогенітального трихомонозу в сучасних умовах, а саме – наявність генітальних і екстрагенітальних осередків, частота рецидивів, залежно від додаткової колонізації сечостатевих шляхів Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia а також умовно-патогенними, переважно, анаеробними та мікроаерофільними бактеріями.
Проведено порівняння мікроскопічної, культуральної діагностики та полімеразної ланцюгової реакції при виявленні трихомонад у сечостатевій системі хворих на ІПСШ.
Вперше виявлено зв’язок певних порушень імунного статусу з наявністю деяких протозойних інвазій сечостатевої системи людини (Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia).
Вперше показано взаємозв’язок протозойних інвазій сечостатевої системи з наявністю бактеріального вагінозу у жінок та дисбіотичного (анаеробного та мікроаерофільного дисбактеріозу сечостатевої системи) стану у чоловіків.
Вперше проведено молекулярне типування Trichomonas vaginalis, що циркулюють в Україні, на основі поліморфізму гена актину.
Проведено електронно-мікроскопічне дослідження уражених тканин хворих на трихомоноз. Вперше отримано клініко-лабораторні дані щодо патогенності овального морфотипу Trichomonas vaginalis.
Вперше було науково обґрунтовано комплексний метод лікування хворих на протозойні інвазії сечостатевої системи (спричинені Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia) із призначенням антипротозойної і патогенетичної терапії та доведено його ефективність.
Вперше впроваджено сучасний алгоритм надання медичної допомоги хворим на сечостатевий трихомоноз із урахуванням методів, що дозволяють виявляти й елімінувати різні види трихомонад та лямблії з урогенітального тракту для запобігання медичних і соціальних наслідків цієї інвазії.
Практичне значення одержаних результатів полягає у тому, що запропоновано для широкої медичної практики оригінальні праймери для виявлення за допомогою методу полімеразної ланцюгової реакції в реальному часі ДНК Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia – актуальних сьогодні збудників протозойних інвазій сечостатевої системи.
Розроблено, науково обґрунтовано та впроваджено в практичну охорону здоров’я нові методи комбінованого лікування хворих на протозойні інвазії сечостатевої системи, спричинені як Trichomonas vaginalis, так і іншими збудниками протозойних інвазій, а саме, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia), в тому числі при поєднаних ураженнях з мікрофлорою, що є асоційованою з бактеріальним вагінозом (анаеробною та мікроаерофільною), а також на тлі порушень з боку імунної системи.
Запропоновано системну концепцію і програму профілактичних та організаційних заходів з боротьби з сечостатевими інвазіями, що спричинені трихомонадами і лямбліями. Створено рекомендації для індивідуальної профілактики протозойних реінвазій сечостатевої системи, викликаних не Trichomonas vaginalis.
Ключові слова: трихомоноз, протозойні інвазії, сечостатева система, Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia, діагностика, лікування, профілактика.
SUMMARY
Fedorych P.V. Prevention of Medical and Social Consequences Caused with Genitourinary Invasions by Trichomonas and Lamblias: Diagnostics, Comprehensive Therapy, Prevention. – Qualifying scientific work as manuscript.
Thesis for the degree of Doctor of Medicine by speciality 14.01.20 – Skin and Venereal Diseases (222. Medicine). – Ukrainian Military Medical Academy, State Establishment “Institute of Dermatology and Venereology of the National Academy of Medical Sciences of Ukraine”, Kharkiv, 2021.
This thesis focuses on improved efficacy of treating the patients with genitourinary invasions by Trichomonas and Lamblias by improving the diagnostics of such conditions, development of recommendations for prevention, and development of a comprehensive therapy method based on the study of pathogen species, clinical data and epidemiological data, genitourinary invasions by Trichomonas and Lamblias, the influence of microbial associations and the state of immune response among the patients to the disease.
The scientific novelty lies in the fact that today the patients with protozoan genitourinary invasions have several pathogens, namely: Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia. Significant prevalence of Giardia lamblia, Trichomonas tenax, and especially Pentatrichomonas hominis in the genitourinary system of patients with chronic sexually transmitted diseases (STDs) has been shown for the first time ever.
It has been proved that Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia play an important role in the course and pathogenesis of chronic STDs at the present stage.
Primers for the DNA detection of Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia in biological fluids have been developed and obtained in Ukraine for the first time. The correspondence of the primers to individual parts of the genome of the corresponding microorganisms has been confirmed by sequencing.
Epidemiological patterns of Trichomonas genitourinary invasion, namely, the prevalence of Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis and Gardia lamblia, as well as their distribution factors have been established; the characteristics of sexual behavior of patients with STDs and their partners have been analyzed to identify the anatomical loci of infection.
Peculiarities of the clinical course of venereal trichomoniasis in modern conditions are described, namely, the availability of genital and extragenital foci, the frequency of recurrences, depending on additional colonization of the urogenital tract with Trichomonas tenax, Pentatrichomonas hominis and Giardia lamblia, and with opportunistic, mainly anaerobic and microaerogenic bacteria.
Microscopic, culture diagnostics and polymerase chain reaction have been compared in the context of Trichomonas detection in genitourinary system of patients with STDs.
Relation between certain immune status disorders and presence of some protozoal invasions in human urogenital system (Trichomonas tenax, Pentatrichomonas hominis and Gardia lamblia) has been revealed for the first time.
For the first time, кelation between protozoal genitourinary invasions and presence of bacterial vaginosis in women and dysbiotic (anaerobic and microaerophilic dysbacteriosis of genitourinary system) condition in men has been demonstrated.
For the first time, molecular typing of Trichomonas vaginalis circulating in Ukraine has been performed on the basis of actin gene polymorphism.
An electronic microscopy of affected tissues of the patients with trichomoniasis has been carried out. For the first time, clinical and laboratory data on pathogenicity of the oval morphotype Trichomonas vaginalis have been obtained.
For the first time, a comprehensive method of treating the patients with protozoal genitourinary invasions (caused by Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia) with the prescription of antiprotozoal and pathogenetic therapy has been scientifically substantiated and its efficacy has been proved.
For the first time, a modern algorithm for medical care to patients with urogenital trichomoniasis has been introduced, taking into account the methods that allow to detect and eliminate various types of Trichomonas and Lamblias from urogenital tract to prevent medical and social consequences of this invasion.
The practical significance of the obtained results is the original primers developed and offered for DNA detection of Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia (current pathogens of protozoal genitourinary invasions) by real time PCR for general medical practice.
New methods of combined treatment of patients with protozoal genitourinary invasions caused by both Trichomonas vaginalis and other agents of protozoal invasions, namely, Trichomonas tenax, Pentatrichomonas laminia, Giardia lamblia, including in combined lesions with the microflora associated with bacterial vaginosis (anaerobic and microaerophilic), and on the background of immune disorders, have been developed, scientifically substantiated and introduced into the general medical practice.
A system-based concept and a program of preventive and organizational measures to combat genitourinary invasions caused by Trichomonas and Lamblias have been offered. Recommendations for individual prophylaxis of protozoal genitourinary reinvasions caused by non–Trichomonas vaginalis have been developed.
Key words: trichomoniasis, protozoal invasions, genitourinary system, Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia, diagnostics, therapy, prevention.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Федорич П.В., Мавров Г.І. Поширеність протозойних інвазій при загостреннях хронічного запалення сечостатевої системи. Журнал дерматовенерології та косметології ім. М.О. Торсуєва. 2018. № 2 (40). С. 37–42.
- Федорич П.В., Мавров Г.І., Зелений С.Б. Можливість використання авторських праймерів для детекції, Pentatrichomonas hominis, Trichomonas tenax, Giardia lamblia в біологічному матеріалі. Журнал дерматовенерології та косметології імені М.О. Торсуєва. 2019. № 2 (42). С. 7–11.
- Федорич П.В. Трихомоніаз. Патоморфоз трихомонад. Військова медицина України. Т. 14, № 1. С. 62–67.
- Федорич П.В., Мавров Г.І., Зелений С.Б. Виявлення Pentatrichomonas hominis в сечостатевій системі людини методом полімеразної ланцюгової реакції. Військова медицина України. 2018. Т. 18, № 4. С. 49–54.
- Федорич П.В. Індивідуальна профілактика протозойних реінвазій сечостатевої системи, викликаних не Trichomonas Vaginalis. Військова медицина України. 2019. Т. 19 (2). С. 66–68.
- Федорич П.В. Обґрунтування та апробація оригінального способу взяття біологічного матеріалу з метою адаптації діагностикума Фемофлор-16 для кількісної детекції анаеробної та мікроаерофільної мікрофлори сечостатевої системи чоловіків. Український науково-медичний молодіжний журнал. 2012. № 2. С. 155–158.
- Mavrov H.I., Osinska T.V., Fedorych P.V. Clinical and epidemiological characteristics and morphological peculiarities of urogenital trichomoniasis nowadays. Pathologia. 2020. Vol. 17, № 1 (48). P. 52–59.
- Федорич П.В. Урогенітальний трихомоноз: новий погляд на проблему. Дерматологія та венерологія. 2017. № 4 (78). С. 12–16.
- Федорич П.В. Виявлення Pentatrichomonas hominis при кольпоцервіциті та сальпінгоофориті. Дерматологія та венерологія. 2018. № 3 (81). С. 77–79.
- Ультраструктурные особенности морфотипов Trichomonas vaginalis, выделенных от больных с хронической трихомонадной инвазией / П.В. Федорич, Г.И. Мавров, С.К. Джораева, Т.В. Осинская. Дерматологія та венерологія. 2018. № 4 (82). С. 17–22.
- Молекулярное типирование Trichomonas vaginalis, циркулирующих в Украине,на основании полиморфизма гена актина / А.П. Белозоров, П.В. Федорич, Г.И. Мавров, А.Д. Зеленская, Е.Н. Горобчишина. Дерматологія та венерологія. 2019. № 1. С. 8–12.
- Сучасні епідеміологічні аспекти трихомонозу в Україні / П.В. Федорич, Г.І. Мавров, Т.В. Осінська, Л.В. Іващенко. Дерматологія та венерологія. 2020. № 1 (87). С. 44–51.
- Федорич П.В., Мавров Г.І. Лікування генітальних інвазій, спричинених Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia. Дерматовенерологія. Косметологія. Сексопатологія. 2019. № 1–2. С. 5–10.
- Федорич П.В. Протозойні інвазії сечостатевої системи у поєднанні зі збудниками бактеріального вагінозу у жінок фертильного віку та їхніх статевих партнерів. Здоровье женщины. 2018. № 7 (133). С. 11–16.
- Федорич П.В., Мавров Г.І. Сучасна клініко-епідеміологічна характеристика хворих на сечостатевий трихомоноз в Україні. Український журнал дерматології, венерології, косметології. 2020. № 1. С. 15–23.
- Федорич П.В., Мавров Г.І. Випадок хронічного уретропростатиту при виявленні Chlamydia trachomatis та Trichomonas tenax. Здоров’я чоловіка. 2018. № 3 (66). С. 107–108.
- Визначення деяких найпростіших (Trichomonas tenax, Trichomonas hominis, Giardia lamblia, Entamoeba histolytica, Enthamoeba gingivalis) у пацієнтів, хворих на урогенітальні інфекції методом ПЛР в реальному часі / П.В. Федорич, С.Б. Зелений, Л.С. Зайцева, О.В. Мазій. Український журнал дерматології, венерології, косметології. 2012. № 4 (47). С. 5–10.
- Федорич П.В., Примак А.В., Коновалова Т.С. Бактеріальний вагіноз: сучасний погляд на проблему. Раціональна терапія та реабілітаційні заходи щодо способу життя пацієнток. Український журнал дерматології, венерології, косметології. 2013. № 3 (50). С. 86–94.
- Федорич П.В. Кількісне визначення мікрофлори, асоційованої з бактеріальним вагінозом, у сечостатевій системі чоловіків. Український журнал дерматології, венерології, косметології. 2014. № 3 (54). С. 57–62.
- Визначення поширеності інфікування Giardia lamblia сечостатевої системи хворих з інфекціями, що передаються переважно статевим шляхом / П.В. Федорич, С.Б. Зелений, Л.Я. Федорич, Х.І. Шеховцова. Український журнал дерматології, венерології, косметології. 2015. № 2 (57). С. 67–70.
- Порівняння ефективності діагностики трихомоніазу за культуральним методом та методом полімеразної ланцюгової реакції з використанням праймерів для виявлення Trichomonas vaginalis, Trichomonas tenax та Pentatrichomonas hominis / П.В. Федорич, С.Б. Зелений, О.А. Садовська, К.В. Дудікова. Український журнал дерматології, венерології, косметології. 2017. № 1 (64). С. 65–69.
- Федорич П.В. Випадок хронічного баланопоститу при виявленні Pentatrichomonas hominis. Український журнал дерматології, венерології, косметології. 2018. № 4 (70). С. 136–138.
- Protozoan genital invasions caused by the representatives of Trichomonas and Giardia / V. Fedorych, G.I. Mavrov, T.V. Osinska, Y.V. Shcherbakova. Wiadomości Lekarskie. 2020. Vol. 73, Iss. 2. P. 380–383.
- Клинический случай инвазии Trichomonas vaginalis беременной женщины и ее новорожденной / Г.И. Мавров, Т.В. Осинская, П.В. Федорич, Л.В.Гречанская. Georgian Medical News. 2019. № 12 (297). С. 41–46.
- FedorychDiagnostics and treatment of genital invasion caused by Trichomonas vaginalis and possibly other related species (Pentatrichomonas hominis and Trichomonas tenax) in patients with immunodeficiency. Georgian Medical News. 2020. No 12 (309). P. 81–85.
- Fedorych P.V., Mavrov G.I. The role of protozoal infestations in chronic inflammation exacerbations in patients with genitourinary pathology. EURYKA: Health Science. No. 5. P. 28–33.
- Fedorych P.V., Mavrov G.I. Incidence of Sexually Transmitted Infections: Local Study in Ukraine. World Science. Vol. 2, Iss. 8 (36). P. 4–7.
- Федорич П.В., Мацас Е.Ю., Мулькина Е.И. Применение диагностикума Фемофлор для исследования микрофлоры мочеполовой системы у пар половых партнёров при наличии воспаления. Уральский медицинский журнал. 2011. № 3 (81). С. 26–32.
- Федорич П.В., Зеленый С.Б. Трихомониаз. Явление существования Trichomonas tenax в мочеполовой системе человека. Уральский медицинский журнал. № 1 (115). С. 93–97.
- Федорич П.В., Зеленый С.Б. Трихомониаз. Явление существования Trichomonas hominis в мочеполовой системе человека. Медицинская панорама. 2014. № 1 (145). С. 59–61.
- Федорич П.В. Вопросы рациональной методологии и диагностики урогенитальных инфекций у мужчин. Дерматовенерология и эстетическая медицина. 2014. № 2 (22). С. 56–59.
- Федорич П.В. Определение микрофлоры, ассоциированной с бактериальным вагинозом, в мочеполовой системе мужчин методом полимеразной цепной реакции в реальном времени. Военная медицина. 2015. №1. С. 57–60.
- Федорич П.В., Корнієнко А.О., Федорич Л.Я. Бактеріальний вагіноз. Огляд літературних джерел. Український журнал дерматології, венерології, косметології. 2008. № 3 (30). С. 102–105.
- Федорич П.В., Зеленый С.Б. Трихомониаз. Выявление Trichomonas tenax и Pentatrichomonas hominis в мочеполовой системе женщин репродуктивного возраста, больных инфекциями, передающимися преимущественно половым путем. Здоровье женщины. 2014. № 3 (89). С. 167–170.
- Федорич П.В. Діагностика та лікування поєднаних уражень сечостатевої системи трихомонадами різних видів і мікроорганізмами, асоційованими з бактеріальним вагінозом. Лікарська справа. 2018. № 5–6. С. 100–111.
- Федорич П.В. Явище антибіозу при трихомонадній інвазії сечостатевої системи. Медичні аспекти здоров’я чоловіка. 2018. № 2 (29). С. 19–21.
- Аналіз сексуальної поведінки сучасних молодих осіб із вищою освітою / П.В. Федорич, В.П. Філіпішин, Л.Я Федорич., І.Г. Миколюк, Мехмет Бюлент Багчі. Сучасні аспекти військової медицини. Збірник наукових праць. К., 2013. Вип. 20. С. 328–334.
- Федорич П.В., Мавров Г.І., Осінська Т.В. Лікування протозойних інвазій сечостатевої системи викликаних Pentatrichomonas hominis, Trichomonas tenax та Giardia lamblia. Проблеми військової охорони здоров¢я: Збірник наукових праць Української військово-медичної академії 2019. № 52. С. 290–298.
- Федорич П.В. Особливості інфекцій, що передаються статевим шляхом, в Україні. Український медичний вісник. 2013. № 7–8 (82). С.62–63.
- Fedorych P.V. Study of incidence ofmainly sexually transmitted infections in Ukraine. 13th EADV Spring Symposium. Athens, Greece, 19–22 may 2016. P. 0774.
- Федорич П.В. К вопросу о возможности колонизации мочеполовой системы человека Trichomonas tenax и Pentatrichomonas hominis. Матеріали Науково-практичної конференції НМАПО ім. П.Л. Шупика «Місце дерматовенерології в міждисциплінарному вирішенні питань діагностики та лікування хронічних захворювань», м. Київ, 20–21 березня 2017 р. С. 117–118.
- Типування Trichomonas vaginalis в Україні, на підставі поліморфізму гена актину /А.П. Белозоров, П.В. Федорич, Г.І. Мавров, А.Д. Зеленська. Матеріали Всеукраїнської науково-практичної конференції з міжнародною участю «Досягнення та перспективи в сучасній дерматовенерології: Європейський та український досвід, взаємодія науки та практики», 21–22 листопада 2019 р., м. Харків. Дерматологія та венерологія. 2019. № 3 (85). С.51–52.
- Федорич П.В., Мавров Г.І., Зелений С.Б. Апробація праймерів для виявлення Pentatrichomonas hominis в сечостатевій системі людини методом ПЛР. Матеріали науково-практичної конференції з міжнародною участю НМАПО ім. П.Л. Шупика «Дерматовенерологія в розробках молодих науковців», м. Київ, 22 листопада 2018 р. С. 44-45.
- Пат. на винахід 107910 Україна, МПК С12/Q 1/68 (2006.01), С12/Q 1/04 (2006.01), С12/N15/11 (2006.01). Спосіб визначення присутності Trichomonas tenax у досліджуваному зразку та набір праймерів для його здійснення / ФедоричП.В., Зелений С.Б. – заявники та патентовласники. – а201407161; заявл. 25.06.2014; опубл. 25.02.15, Бюл. № 4.
- Пат. на корисну модель. 103397 Україна, МПК А61К 31/345 (2006.01),А61К 31/7080 (2006.01),А61/Р 17/04 (2006.01). Спосіб лікування хронічного трихомоніазу / Федорич П.В. – заявник та патентовласник. – u201506813; заявл. 09.07.2015; опубл. 10.12.15, Бюл. №23.
- Пат. на винахід 110759 Україна, МПК С12/Q 1/68 (2006.01),С12/Q 1/04 (2006.01),С12/N15/11 (2006.01), С12/R 1/90(2006.01). Спосіб визначення присутності Pentatrichomonas hominis у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201501255; заявл. 16.02.2015; опубл. 10.02.16, Бюл. №3.
- Пат. на винахід 110767 Україна, МПК С12/Q 1/68 (2006.01),С12/Q 1/04 (2006.01),С12/N15/11 (2006.01), С12/R 1/90(2006.01). Спосіб визначення присутності Giardia lamblia у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201505750; заявл. 11.06.2015 ; опубл. 10.02.16, Бюл. №3.
- Пат. на корисну модель 109257 Україна, МПК А61К (2016.01),А61Р (2016.01). Спосіб лікування хронічного трихомоніазу сечостатевої системи, викликаного Trichomonas tenax або Pentatrichomonas hominis / Федорич П.В. – заявник та патентовласник. – u20151294; заявл. 21.12.2015; опубл. 25.08.16, Бюл. №16.
- Подольський Вл.В., Подольский В.В., Федорич П.В. Оптимізація лікування хронічних запальних захворювань статевих органів у жінок фертильного віку з урахуванням міжнародного досвіду: метод. рек. (№ 94/2017). К., 2018. 12 с.
ЗМІСТ
| Перелік умовних позначень | 19 |
| Вступ | 20 |
| 1 Протозойні інвазії сечостатевої системи (огляд літератури) | 29 |
| 1.1 Біологічні властивості й патогенна роль представників роду richomonas (Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis), а також Gіardia lamblia | 29 |
| 1.2 Чинники розповсюдження інвазії Trichomonas vaginalis – медичні й соціальні наслідки | 32 |
| 1.3 Клінічний перебіг та лабораторна діагностика трихомонадної інвазії, роль молекулярно-біологічних методів | 37 |
| 1.4 Мікробні асоціації збудників протозойних інвазій у сечостатевій системі хворих на інфекції, що передаються статевим шляхом | 42 |
| 1.5 Лікування інвазії Trichomonas vaginalis | 47 |
| 2 Матеріали і методи | 65 |
| 2.1 Характеристика пацієнтів – груп обстеження, порівняння та контрольних груп | 65 |
| 2.2 Клінічне обстеження хворих | 68 |
| 2.3 Оцінка стану імунної системи пацієнтів | 69 |
| 2.4 Лабораторна діагностика збудників протозойної інвазії | 70 |
| 2.5 Методика постановки полімеразної ланцюгової реакції | 70 |
| 2.6 Методи отримання праймерів для виявлення Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia за допомогою методу полімеразної ланцюгової реакції в реальному часі | 72 |
| 2.7 Електронна мікроскопія в дослідженні ультраструктури трихомонад | 73 |
| 2.8 Молекулярне типування Trichomonas vaginalis | 73 |
| 2.9 Cеквенування біологічного матеріалу для підтвердження наявності Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia | 75 |
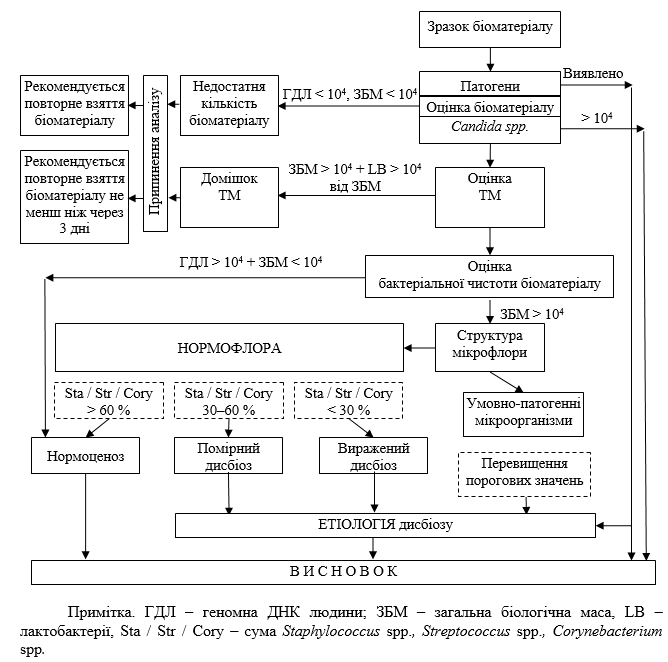
| 2.10 Визначення мікроорганізмів, асоційованих з бактеріальним вагінозом | 76 |
| 2.11 Вивчення сексуальної поведінки хворих | 78 |
| 2.12 Оцінка мікробіологічної та клінічної ефективності запропонованої специфічної антимікробної терапії та комбінованої терапії (специфічна плюс імуномодулююча) при елімінації збудників протозойних інвазій та їх патогенних мікробних асоціацій | 78 |
| 2.13 Статистичний аналіз | 80 |
| 3 Трихомоноз – епідеміологічні, соціальні, клініко-морфологічні, молекулярно-біологічні характеристики захворювання |
83 |
| 3.1 Захворюваність на інфекції, що передаються статевим шляхом. Локальне дослідження | 83 |
| 3.2 Епідеміологія сечостатевого трихомонозу | 87 |
| 3.3 Соціально-епідемічні та клінічні характеристики хворих на хронічний резистентний трихомоноз | 99 |
| 3.4 Клініко-морфологічна (ультраструктурна) характеристика хронічного, ускладненого трихомонозу | 106 |
| 3.5 Молекулярно-біологічна характеристика збудників хронічного трихомонозу | 124 |
| 4 Протозойні інвазії сечостатевої системи, що спричинені не Trichomonas vaginalis | 132 |
| 4.1 Сексуальна поведінка хворих на інфекції, що передаються статевим шляхом, як чинник, що визначає локус зараження на протозойні інвазії сечостатевої системи | 132 |
| 4.2 Порівняння мікроскопічної, культуральної діагностики та методу полімеразної ланцюгової реакції при виявленні трихомонад у сечостатевій системі хворих на інфекції, що передаються статевим шляхом | 136 |
| 4.3 Апробація оригінальних праймерiв для визначення Pentatrichomonas hominis | 140 |
| 4.4 Секвенування біологічного матеріалу для підтвердження наявності Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia (дослідження специфічності оригінальних праймерів для виявлення ДНК) | 145 |
| 4.5 Явище антибіозу при трихомонадній інвазії сечостатевої системи | 148 |
| 4.6 Асоціації умовно-патогенних бактерій та збудників протозойних інвазій у сечостатевій системі хворих на інфекції, що передаються статевим шляхом | 149 |
| 5 Комплексна терапія і профілактика протозойних інвазій сечостатевої системи | 162 |
| 5.1 Розробка етапного методу комбінованого лікування хворих на сечостатевий трихомоноз з урахуванням статі, перебігу захворювання та можливої інвазії Trichomonas tenax, Pentatrichomonas hominis та Giardia lamblia | 162 |
| 5.2 Чутливість мікроорганізмів, що є асоційованими з бактеріальним вагінозом, до антибактеріальних препаратів у осіб з колонізацією сечостатевого тракту Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia | 166 |
| 5.3 Розробка етапного методу комбінованого лікування хворих на поєднанні протозойно-бактеріальні інфекції сечостатевої системи | 173 |
| 5.4 Лікування хворих на хронічні протозойні інвазії сечостатевої системи з використанням імуномодулюючого препарату суміші α-і ß-дефенсинів |
178 |
| 5.5 Клінічні випадки (приклади лікування хворих на протозойно-бактеріальні інфекції сечостатевої системи) | 185 |
| 5.6 Суспільна і особиста профілактика протозойних інвазій сечостатевої системи | 197 |
| 6 Алгоритми надання медичної допомоги хворим на інфекції, що передаються статевим шляхом, з урахуванням виявлення різних видів трихомонад та лямблій | 208 |
| 7 Аналіз та обговорення отриманих результатів досліджень | 218 |
| Висновки | 247 |
| Рекомендації | 250 |
| Список використаних джерел | 252 |
| Додаток А Анкета щодо визначення сексуальної поведінки хворих на інфекції, що передаються статевим шляхом |
284 |
| Додаток Б Акти впровадження | 287 |
| Додаток В Список публікацій здобувача за темою дисертації та відомості про апробацію результатів дисертації | 301 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
АБП – антибактеріальні препарати;
БВ – бактеріальний вагіноз;
ЕПР – ендоплазматичний ретикулум
ІПСШ – інфекції, що передаються переважно статевим шляхом;
ЛПЗ – лікувально-профілактичний заклад;
МА – мікробні асоціації;
МІК – мінімальна інгібуюча концентрація;
МКХ-10 – міжнародна класифікація хвороб 10 перегляду;
НМАПО – Національна медична академія післядипломної освіти;
НАМНУ – Національна академія медичних наук України;
ПЛР – полімеразна ланцюгова реакція;
ПЛР-РЧ – полімеразна ланцюгова реакція в реальному часі;
ССС – сечостатева система;
ТМ – транзиторна мікрофлора;
ТАНК – тести на основі ампліфікації нуклеїнових кислот;
УАЛДВК – Українська асоціація лікарів-дерматовенерологів та косметологів;
УВМА – Українська військово-медична академія;
УТ – урогенітальний трихомоноз;
CD – cluster of differentiation;
DNA – дезоксирибонуклеїнова кислота;
Ig – імуноглобулін;
IUSTI – International Union against Sexually Transmitted Infections;
GC пари – пари нуклеотидів гуаніну і цитозину;
STDs – захворювання, що передаються статевим шляхом;
T. vaginalis – Trichomonas vaginalis;
Тх – T хелпери;
Тс – Т супресори;
ВСТУП
Актуальність теми. За останні декілька десятиліть істотно змінились умови життєдіяльності сучасної людини [54]. Разом з тим, як відомо, змінилась патогенність певних мікроорганізмів, що є паразитами або коменсалами сечостатевої системи (ССС) людини, наприклад, мікоплазм та гарднерелл [35]. Правомірно припустити, що непатогенні, як вважалось до останнього часу, Giardia lamblia та трихомонади (Trichomonas tenax, Pentatrichomonas hominis), могли зазнати певного патоморфозу і набути можливості колонізувати ССС людини, зокрема, у хворих на інфекції, що передаються переважно статевим шляхом (ІПСШ). Імовірно, такі властивості могли б виникнути при потраплянні цих збудників у ССС при незахищеному бар’єрними засобами оральному і анальному сексі, які є досить поширеними в теперішній час.
На сучасному етапі важливою є розробка та впровадження нових методів діагностики протозойних інфекцій ССС, які мають високу чутливість, специфічність, клінічну інформативність, а також доступні для лабораторних служб різного рівня [8, 29, 98]. Так, в Україні дотепер не проводилося визначення Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia в ССС людини, зокрема, через відсутність відповідних діагностичних систем та реактивів. Крім того, в Україні ще не проводилися дослідження з типування класичного збудника трихомонозу – Trichomonas vaginalis [242]. Питання щодо патогенності різних морфотипів цього мікроорганізму також залишається відкритим.
На сучасному етапі трихомоноз вважають змішаною протозойно-бактеріальною інфекцією [5, 84].
Під час обстеження пацієнтів потрібно враховувати, що всім трихомонадам притаманні фагоцитарні властивості, часто з неповним циклом травлення [123]. У разі незавершеного фагоцитозу різноманітні бактерії, що виходять при загибелі трихомонад, здатні підтримувати запальний процес у сечостатевих шляхах, який часто сприймається як невилікуваний трихомоноз або посттрихомонадні ураження [17]. Разом з тим, визначення виду найпростіших у ССС, імовірно, має вирішальну роль в запобіганні рецидивів і реінфекцій захворювання на ІПСШ завдяки санації статевого партнера, або самого хворого з урахуванням можливості існування поєднаної генітальної та екстрагенітальної інвазії. Крім того, для успішного лікування відповідних хворих, слід враховувати стан їх імунної системи [128], а також склад безперечно патогенних й умовно-патогенних мікробних асоціацій (МА), до яких входять збудники протозойних інвазій [50].
Зважаючи на актуальність проблеми протозойних інвазій ССС та отримані результати «пілотних» досліджень, виникла необхідність у більш ретельному вивченні представників типу найпростіших, з точки зору їх можливості колонізувати ССС людини. Визначення виду найпростіших у ССС, імовірно, має вирішальну роль у запобіганні рецидивів і реінфекцій завдяки санації статевого партнера, або самого хворого з урахуванням можливої поєднаної генітальної та екстрагенітальної інвазії. Крім того, для успішного лікування відповідних хворих на ІПСШ, слід враховувати стан їх імунної системи, а також склад патологічних МА, до яких входять збудники протозойних інвазій.
Зв’язок роботи з науковими програмами, планами, темами. Робота виконана в рамках науково-дослідної роботи Державної установи «Інститут дерматології та венерології Національної академії медичних наук України» на тему «Удосконалити заходи щодо діагностики, лікування, профілактики інфекцій, що передаються статевим шляхом, та ВІЛ-інфекції серед споживачів психоактивних речовин» (№ держреєстрації 0117U000984) та Української військово-медичної академії (УВМА) Міністерства оборони України на тему «Особливості клінічного перебігу, діагностики, лікування коморбідної соматичної патології у військовослужбовців та працівників Збройних Сил України, обумовленої факторами професійної діяльності» (№ держреєстрації 0114U003803). Здобувач є співвиконавцем теми. Дисертантом особисто виконано основні фрагменти наукових робіт з епідеміологічних, клінічних, імунологічних, мікробіологічних, молекулярно-біологічних, гістологічних, електронномікроскопічних досліджень, а також розробку медикаментозних та функціональних методів терапії й напрацювання алгоритмів надання спеціалізованої медичної допомоги.
Мета та задачі дослідження.
Мета роботи – підвищити ефективність діагностики, лікування, профілактики інвазій сечостатевої системи, спричинених Trichomonas vaginalis та іншими представниками типу найпростіших на підставі даних про їх епідеміологію, клініку, властивості збудників, морфоімунопатогенез, а також про наявність супутньої колонізації умовно-патогенними збудниками
Для досягнення поставленої мети були поставлені такі задачі:
- Провести бібліосемантичний аналіз і метааналіз наукових публікацій, статистичних звітів і медичних баз даних для виявлення невирішених наукових і практичних питань з проблеми діагностики, лікування та профілактики сексуально трансмісивних захворювань, спричинених Trichomonas vaginalis та іншими збудниками протозойних інвазій ССС.
- Розробити оригінальні праймери для виявлення ДНК Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia методом полімеразної ланцюгової реакції (ПЛР). Провести визначення їх специфічності за допомогою метода секвенування біологічного матеріалу. Порівняти ефективність розробленого ПЛР тесту з традиційними методами лабораторної діагностики.
- Оцінити поширеність Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia серед пацієнтів, хворих на ІПСШ. Встановити епідеміологічні закономірності розповсюдження трихомонадної інвазії сечостатевого тракту.
- Провести електронно-мікроскопічне дослідження біологічного матеріалу для визначення патогенезу змішаної трихомонадної інвазії та патогенності різних морфотипів Trichomonas vaginalis.
- Провести молекулярне типування Trichomonas vaginalis, що циркулюють в Україні, на основі поліморфізму гена актину.
- Виявити імунні порушення при колонізації сечостатевого тракту Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia та обґрунтувати призначення імуномодулюючого препарату в комплексі лікування.
- Визначити мікробні асоціації збудників, в тому числі, анаеробні та мікроаерофільні бактерії, що супроводжують протозойні інвазії ССС.
- Обґрунтувати і розробити методи комбінованого лікування хворих на урогенітальний трихомоноз і лямбліоз з урахуванням наявності супутнього інфікування анаеробними та мікроаерофільними бактеріями та імунних порушень.
- Розробити і впровадити алгоритм організації надання медичної допомоги хворим на урогенітальний трихомоноз і лямбліоз для запобігання виникнення медичних і соціальних наслідків цих інвазій.
Об’єкт дослідження – паразитарні інвазії сечостатевої системи.
Предмет дослідження – патогенетичні та клінічні особливості паразитарних інвазій ССС; лабораторні показники досліджень хворих на інфекції урогенітального тракту, їх зміни під впливом проведеної терапії; діагностика, лікування попередження медико-соціальних наслідків інвазій ССС.
Методи дослідження: бібліосемантичний аналіз; метааналіз; загальні клінічні (з’ясування скарг, анамнезу захворювання та життя, аналіз суб’єктивних і об’єктивних даних обстеження, постановка діагнозу, контроль ефективності лікування) та лабораторні (клінічні аналізи крові, сечі, калу, біохімічні та серологічні аналізи крові); мікробіологічні (мікроскопічні та культуральні дослідження мікробіоти ССС); імунологічні (показники імунограм); методи епідеміологічного аналізу; молекулярно-генетичні (ПЛР, секвенування); ультраструктурні (електронна мікроскопія); методи біометричної та медичної статистики.
Наукова новизна отриманих результатів. Наукова новизна полягає у тому, що у хворих на протозойні інвазії ССС виявлено декілька збудників інвазії, а саме: Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia. Вперше показано значну розповсюдженність уражень, спричинених Giardia lamblia, Trichomonas tenax та Pentatrichomonas hominis, ССС хворих на ІПСШ з хронічним перебігом.
Доведено важливу роль Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia в перебігу та патогенезі хронічних ІПСШ на сучасному етапі.
Доведено необхідність розробки праймерів для виявлення ДНК Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia у біологічних рідинах та обґрунтовано методики їх отримання.
Встановлено епідеміологічні закономірності трихомонадної інвазії сечостатевого тракту, а саме – поширеність Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia, а також чинники їх розповсюдження, проаналізовано особливості сексуальної поведінки хворих на ІПСШ та їх партнерів для встановлення можливих шляхів та локусів статевого зараження.
Визначено особливості клінічного перебігу сечостатевого трихомонозу в сучасних умовах, а саме – наявність генітальних і екстрагенітальних осередків, частота рецидивів, залежно від додаткової колонізації сечостатевих шляхів Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia, а також умовно-патогенними, переважно, анаеробними та мікроаерофільними бактеріями.
Проведено порівняння мікроскопічної, культуральної діагностики та ПЛР при виявленні трихомонад у ССС хворих на ІПСШ.
Вперше виявлено зв’язок імунодефіцитних станів з наявністю протозойних інвазій ССС людини.
Вперше показано взаємозв’язок протозойних інвазій ССС із наявністю бактеріального вагінозу (БВ) у жінок та еквіваленту цього стану у чоловіків (анаеробного та мікроаерофільного дисбактеріозу ССС).
Вперше проведено молекулярне типування Trichomonas vaginalis, що циркулюють в Україні, на основі поліморфізму гена актину.
Проведено електронно-мікроскопічне дослідження уражених тканин хворих на трихомоноз та охарактеризовано ультраструктурні особливості атипових трихомонад та супутньої бактеріальної флори. При цьому вперше отримано клініко-лабораторні дані щодо патогенності овального морфотипу Trichomonas vaginalis.
Науково обґрунтовано застосування нових комплексних методів лікування хворих на протозойні інвазії ССС (спричинені Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia), в тому числі із призначенням імунопатогенетичної і антипротозойної терапії та доведено їх ефективність.
Практичне значення отриманих результатів. Вперше впроваджено сучасний алгоритм надання медичної допомоги хворим на сечостатевий трихомоноз із застосуванням лікувально-профілактичних та організаційних підходів, що дозволяють елімінувати різні види трихомонад, а також лямблії з урогенітального тракту для запобігання ускладнень, що призводять до негативних медичних і соціальних наслідків. Розроблено, науково обґрунтовано та впроваджено в практичну охорону здоров’я нові методи комбінованого лікування хворих на протозойні інвазії ССС, спричинені як Trichomonas vaginalis, так і іншими збудниками протозойних інвазій, а саме Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia, в тому числі при поєднаних ураженнях із мікрофлорою, що є асоційованою з БВ (анаеробною та мікроаерофільною), а також на тлі порушень з боку імунної системи (патент України на корисну модель № 103397 від 10.12.2015; патент України на корисну модель № 109257 від 25.08.2016).
Вперше в Україні розроблено та отримано праймери для виявлення ДНК Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia у біологічних рідинах (патент України на винахід № 107910 від 25.02.2015; патент України на винахід № 110759 від 10.02.2016; патент України на винахід № 110767 від 10.02.2016). Відповідність праймерів до видоспецифічних ділянок ДНК зазначених мікроорганізмів було підтверджено за допомогою методу секвенування.
Запропоновано системну концепцію і програму профілактичних та організаційних заходів з боротьби із сечостатевими інвазіями, що спричинені трихомонадами і лямбліями. Створено рекомендації для індивідуальної профілактики протозойних реінвазій ССС, спричинених не Trichomonas vaginalis.
Основні положення дисертації впроваджено в практику роботи: клініки шкірних та венеричних хвороб КНП Харківської обласної ради «Обласний клінічний шкірно-венерологічний диспансер № 1»; КУ «Запорізький обласний шкірно-венерологічний диспансер» Запорізької обласної ради; Полтавського обласного клінічного шкірно-венерологічного диспансеру; КНП «Одеський обласний шкірно-венерологічний диспансер» Одеської обласної ради; КЗ «Рівненський обласний шкірно-венерологічний диспансер» Рівненської обласної ради; КНП «Міський клінічний шкірно-венерологічний диспансер № 5» Харківської міської ради; ДУ «Інститут дерматології та венерології НАМН України». Теоретичні положення дослідження і практичні рекомендації впроваджено в практику навчання студентів обох факультетів УВМА Міністерства оборони України, кафедри дерматовенерології та ВІЛ/СНІДу Харківської медичної академії післядипломної освіти; кафедри дерматовенерології та косметології з курсом дерматовенерології і естетичної медицини факультету післядипломної освіти Запорізького державного медичного університету.
Особистий внесок здобувача. Ідея дисертаційного дослідження належить автору разом із науковим консультантом. Автором розроблений план дослідження, визначені мета та завдання. Особисто автором проведені: бібліосемантичний пошук та аналіз літературних джерел, патентної ситуації, визначення актуальних питань проблеми, що вивчається. Клінічне обстеження, анкетування, лікування пацієнтів проведено здобувачем.
Дисертантом самостійно проведено комплексне клініко-лабораторне обстеження та лікування 1037 хворих на ІПСШ, облік і статистичну обробку показників результатів загальних клініко-лабораторних і спеціальних обстежень, особисто написано всі розділи дисертації. Особисто сформульовано всі наукові узагальнення, положення, результати, висновки та рекомендації.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, є авторськими. З наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Конфлікту інтересів немає.
Апробація результатів дисертації. Основні положення та результати роботи представлені здобувачем під час доповідей на з’їздах науково-практичних конференціях різного рівня: науково-практичній конференції Національної медичної академії післядипломної освіти (НМАПО) ім. П.Л. Шупика «Проблеми захворювань шкіри та інфекцій, що передаються переважно статевим шляхом, у дітей та підлітків» (Київ, 2015), 13th EADV Spring Symposium (Athens, 2016); науково-практичному семінарі І Збори військових дерматологів (Вінниця, 2016); ІІІ (Х) з’їзді Української асоціації лікарів-дерматовенерологів та косметологів (УАЛДВК) (Львів, 2017); науково-практичній конференції НМАПО ім. П.Л. Шупика «Місце дерматовенерології в міждисциплінарному вирішенні питань діагностики та лікування хронічних захворювань», (Київ, 2017); науково-практичній конференції з міжнародною участю НМАПО ім. П.Л. Шупика «Дерматовенерологія в розробках молодих науковців», (Київ, 2018); Всеукраїнській науково-практичній конференції УАЛДВК з міжнародною участю «Особливості надання дерматовенерологічної допомоги населенню України в умовах медичної реформи» (Івано-Франківськ, 2018); науково-практичній конференції з міжнародною участю НМАПО ім. П.Л. Шупика «Дерматовенерологія в розробках молодих науковців» (Київ, 2019); Всеукраїнській науково-практичній конференції з міжнародною участю «Досягнення та перспективи в сучасній дерматовенерології: Європейський та український досвід, взаємодія науки та практики» (Харків 2019).
Публікації. За результатами дослідження опубліковано 49 праць. З них: 6 статей у наукових фахових виданнях України (3 – у моноавторстві), 16 статей у фахових виданнях, акредитованих ДАК України, що входять до наукометричних баз (5 написані у моноавторстві); 10 статей у наукових виданнях інших держав (4 – англійською мовою, 3 – у моноавторстві), що входять до наукометричних баз Index Copernicus, Googlе Scholar, РІНЦ та інших; 7 статей у інших наукових виданнях України та 4 – у матеріалах наукових форумів різного рівня, включаючи міжнародні. Отримано 2 патенти України на корисну модель, та 3 патенти України на винахід. Опубліковано 1 методичні рекомендації. 4 із наведених вище статей входять до міжнародних наукометричних баз Scopus (3) та Web of Science (1).
Структура та обсяг дисертації. Дисертаційна робота викладена українською мовою на 308 сторінках машинописного тексту. Складається зі вступу, огляду літератури, характеристики матеріалів і методів дослідження, 4 розділів власних досліджень, обговорення результатів дослідження з аналізом та узагальненням отриманих даних, висновків, рекомендацій та списку використаної літератури. Робота ілюстрована 34 рисунками та містить 21 таблицю. Бібліографічний список містить 281 джерело, з них 162 – кирилицею і 119 – латиницею.
1 ПРОТОЗОЙНІ ІНВАЗІЇ СЕЧОСТАТЕВОЇ СИСТЕМИ
(ОГЛЯД ЛІТЕРАТУРИ)
1.1 Біологічні властивості й патогенна роль представників роду Trichomonas (Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis), а також Gіardia lamblia
У 1836 році французький бактеріолог Donne (Alfred François Donné, 1801–1878) виявив одноклітинний мікроорганізм у виділеннях статевих органів жінок і дав йому назву трихомонада – Trichomonas vaginalis. Пізніше, в 1870 році трихомонада була виявлена у жінок із запаленням придатків матки і детально описана І.П. Лазаровичем, а потім у 1910 році І.Ф. Зеленєв виділив цей збудник із секрету передміхурової залози при простатиті. Однак, тільки в 1940 році в експериментальних дослідженнях було остаточно доведено патогенність T. vaginalis. І вже у 1959 році на V з’їзді дерматовенерологів СРСР трихомоноз був офіційно визнаний венеричним захворюванням [11].
Трихомоноз – паразитарне захворювання ССС, що спричиняється одноклітинним паразитом Trichomonas vaginalis. [266]. Сучасна таксономічна систематизація збудника сечостатевого трихомонозу виглядає наступним чином [60]. Підцарство: Protozoa; Тип: Sacromastigophora; Підтип: Mastigophora; Клас: Zoomastogophorea; Підклас: Flagella, Сімейство: Trichomonadidae; Загін: Polumasstigida; Рід: Trichomonas; Вид: Trichomonas vaginalis Donné, 1836 [243].
Трихомонада – це одноклітинний найпростіший організм, що веде паразитичний образ життя. Існує тільки у вигляді вегетативної форми (трофозоїт), цист не утворює [273]. Трофозоїт має грушоподібне тіло довжиною 14 – 30 мкм. На передньому кінці тіла знаходяться 4 вільних джгутики й ундулююча мембрана, що доходить до середини тіла. Ядро одне, знаходиться ближче до переднього кінця тіла. Цитоплазма вакуолізована. Крізь усе тіло проходить аксостиль, який виступає на задньому кінці у вигляді шпички [109].
Завдяки рухам джгутиків та хвилеподібній (ундулюючій) мембрані трихомонади здатні активно пересуватися. Вони спроможні утворювати псевдоподії, що забезпечують їм амебоподібний рух. Висока пластичність цитоплазми дає змогу трихомонадам пристосовуватися до дуже вузьких проміжків між клітинами. Вони здатні до існування у джгутиковій та амебоподібній формах [21].
Ураження трихомонадами відіграють найбільшу роль серед протозойних інвазій ССС [55, 65]. Паразитарна інвазія – це медичний і біологічний термін, що визначає сукупність процесів, які відбуваються під час інфекційного процесу – взаємодії збудника і організму хазяїна, коли збудником є паразити. В епідеміології та паразитології інвазією називають факт проникнення паразитів в організм хазяїна, тобто зараження, зазвичай, паразитичними грибками, найпростішими, гельмінтами, або самі хвороби, які спричиняють паразитарні збудники: грибкові інвазії, протозойні інвазії. Ці хвороби відносять й до інфекційних [71].
Окремої уваги заслуговує здатність T. vaginalis до захвату і резервування різних патогенних і умовно-патогенних мікроорганізмів в результаті їх неповного фагоцитозу – «резервуарна» функція [18, 30, 260]. Це може зумовлювати можливість тривалої персистенції різних бактерій, вірусів або грибків і дозволяє, таким чином, пояснити невдалі спроби елімінації вказаних мікроорганізмів [31].
Атипові форми T. vaginalis є найбільш проблематичними при лабораторній діагностиці, особливо при використанні методики оптичної мікроскопії мазків, оскільки вони мають широку варіабельність відносно своєї форми, розмірів, наявності джгутиків і ядер [43]. Вірулентні форми трихомонад культивуються з труднощами, їх життєвий цикл в організмі людини досить складний, тому в клінічному матеріалі виявляються різні морфотипи паразита [60]. Біологічне значення поліморфізму T. vaginalis на сучасному етапі ще не визначено [112]. Основною і типовою цитоморфологічною формою цього мікроорганізма є грушовидна [260]. Вона характеризується активними обертальними і поступальними рухами, має характерну ундулюючу мембрану і чотири вільних джгутика на передньому кінці. Однак, при мікроскопії клінічного матеріалу досить часто виявляються нерухомі клітини трихомонад округлої форми. Округлий морфотип часто асоціюється з хронічним перебігом трихомонозу, він частіше зустрічається у чоловіків, ніж у жінок, причому морфологія T. vaginalis округлого морфотипу, та його клінічне значення вивчені недостатньо [70]. Як показали проведені нещодавно дослідження, у пацієнтів з хронічним перебігом трихомонозу атиповий овальний морфотип T. vaginalis при електронній мікроскопії культури збудника визначається частіше (67%), ніж типовий грушовидний морфотип, а ультраструктурні особливості T. vaginalis овального морфотипу не виключають наявність у них патогенних властивостей [127].
Доведено також існування декількох серотипів T. vaginalis (G, H, M, E), які мають певну генетичну відмінність і, навіть, здатні визивати дещо розбіжні клінічні прояви [237].
Відомо, що в організмі людини можуть жити кілька десятків найпростіших мікроорганізмів. Морфологічно вони можуть бути досить схожими з T. vaginalis [125]. Так, наприклад, людина може бути носієм трьох видів трихомонад: Trichomonas tenax (elongata), Pentatrichomonas hominis (abdominalis), Trichomonas vaginalis [43]. У ротовій порожнині у каріозних зубах та запалених ясневих карманах мешкає Trichomonas tenax [67, 229, 259]. Pentatrichomonas hominis – коменсал товстого кишечника людини [80, 248], його наявність, як відомо, визначається в травній системі усіх хребетних [247]. Тим не менш, трихомонадою, що здатна жити в урогенітальному тракті, донедавна вважалась виключно T. vaginalis [28]. Вважалось, що Trichomonas tenax і Pentatrichomonas hominis не можуть існувати в ССС людини, а, T. vaginalis, в свою чергу, – в ротовій порожнині і кишечнику [117].
1.2 Чинники розповсюдження інвазії Trichomonas vaginalis – медичні й соціальні наслідки
Захворювання на трихомоноз (МКХ-10, А59) становить чималу проблему в практиці лікарів-дерматовенерологів, урологів і гінекологів, мають негативний вплив на якість життя пацієнтів. Урогенітальний трихомоноз (УТ) є інфекцією, що передається переважно статевим шляхом (ІПСШ) [17, 46]. Поширення збудника в організмі господаря відбувається висхідним шляхом, а також лімфогенно [38, 56]. За даними ВООЗ, щорічний світовий показник захворюваності на УТ становить близько 270 млн. осіб. В Україні реєструється в середньому близько 250 тис. відповідних хворих на рік [117].
- vaginalis – це збудник, мабуть, найпоширенішої невірусної інфекцій з ІПСШ [10, 213]. Сечостатевий трихомоноз в більшості країн не є хворобою, яка підлягає обов’язковій реєстрації [206]. Тим не менш, за підрахунками Всесвітньої організації охорони здоров’я щорічно з’являються близько 300 мільйонів нових випадків цієї інфекції, причому, майже 90% з них відбулися в країнах з обмеженими ресурсами [251]. T. vaginalis є більш поширеною, ніж Chlamydia trachomatis, Neisseria gonorrhoeae та збудник сифілісу разом узяті. [223]. Глобальна розповсюдженість інвазії T. vaginalis оцінюється у 8,1% для жінок та 1,0% для чоловіків серед усієї популяції [209]. Ці показники можуть бути заниженими, оскільки вони отримані в результаті досліджень, в яких використовували мікроскопію, а не тести на основі ампліфікації нуклеїнових кислот (ТАНК). Окрім того, в багатьох країнах взагалі не існує офіційних систем спостереження за частотою ІПСШ [251].
Поширеність та захворюваність на вагінальну інфекцію, викликану T. vaginalis є вищими в африканських та латиноамериканських країнах, ніж в інших частинах світу. Різні дослідження, проведені в Данії, Великобританії та Франції, показали, що частота цієї інфекції зменшується в промислово розвинених країнах [270]. Іранські дослідження визначили відповідну поширеність у межах 2 – 8%. Однак, виходячи з культурних та соціальних факторів, цей показник недооцінюється і може перевищувати 30 % [253].
За відсутності програм спостереження, епідеміологія інвазії T. vaginalis не може бути відома повністю. В Сполучених Штатах в двох популяційних дослідженнях, які використовували тестування за допомогою методу ПЛР, що є одним з різновидів ТАНК, виявлено у 2,3 % серед підлітків [182] та 3,1% серед жінок віком 14 – 49 років [172]. Використовуючи ТАНК, рівень позитивності серед чоловіків Танзанії становив 11% [194]. Жінки Папуа – Нової Гвінеї також мають надзвичайно високий показник виявлення T. vaginalis, коливаючись у межах від 21% у вагітних жінок до 42,6% у загальній популяції [251]. Інші дослідження населення, які використовували тестування за допомогою ТАНК, серед жінок репродуктивного віку в інших регіонах світу виявили нижчі показники (1% у сільському В’єтнамі [254] та 0,37% у Фландрії (Бельгія) [195]. Частота скринінгу серед жінок, які відвідують клініки планування сім’ї, сильно різняться і залежать від профілю чинників ризику [185]. Дослідження виявили рівень поширеності УТ від 3,2 – 52 % в країнах, що розвиваються, та 7,6 – 12,6 % у США [181, 183, 277].
Поширеність УТ серед жінок в Україні коливається в межах 5 – 30 % [101]. Серед чоловіків близько 10% всіх інфекційних захворювань сечостатевої сфери припадає на УТ. Відсутність повної реєстрації в Україні не дозволяє достовірно оцінити поширеність захворюваності в різних регіонах і в різних популяціях [64]. Однак, актуальні статистичні дані свідчать про те, що УТ залишається однією з найпоширеніших сечостатевих інфекцій в Україні [20, 62].
УТ сьогодні є одним з найбільш розповсюджених захворювань у жінок пременопаузального віку [271]. Серед жінок фертильного віку за різними оцінками, УТ коливається в межах 30 %. У Російській Федерації трихомоноз вагітних виявляють в 0,98 – 32 % [2, 17], в тропічних країнах – до 40 %, при цьому загроза переривання вагітності відзначається в 36,7 % випадках. Приблизно 5 % дітей, що народилися від інфікованих матерів, Trichomonas vaginalis, заражаються інтранатально [86]. В Україні серед дітей офіційно щорічно реєструється до 500 випадків трихомонозу у віковій групі до – 14 років і близько 4 тисяч у групі – від 15 до 17 років [6, 84].
Незважаючи на інтенсивне вивчення даної урогенітальної інвазії, у нас в країні, нажаль, немає достатніх відомостей і узагальнюючих даних про закономірності її поширення [2]. Багато дослідників стверджують, що захворюваність на УТ чоловіків і жінок в Україні є приблизно однаковою і складає близько 4 % серед дорослого населення [17, 27, 73, 78]. Серед осіб, що відвідують установи дерматовенерологічного профілю з приводу ІПСШ, Trichomonas vaginalis виявляються у 10 % випадків і більше [117]. Збільшення вірулентності збудника захворювання, а також певні труднощі в його діагностиці та розвиток резистентності до засобів специфічного лікування, часто призводить до хронізації запального процесу як зовнішніх, так і внутрішніх статевих органів, що погіршує прогноз, скорочує період стійкої ремісії [46].
Патогенність T. vaginalis для людини не обмежується тільки специфічним запаленням [217]. Вона має різні прояви, зокрема, доведено роль цього збудника у формуванні патогенних мікробіоценозів [5, 114], у тому числі й БВ у жінок [50, 260], зниженні імунітету [84, 128], сприянні в розвитку гіперпластичних процесів в органах ССС людини [39, 45, 97, 165, 220, 221]; впливі на фертильність [235]. T. vaginalis можуть мешкати не тільки в сечостатевих органах, але і, навіть, в кров’яному руслі, куди проникають через міжклітинний простір та лімфатичні шляхи, за допомогою ферменту гіалуронідази [109]. Описані також спостереження інших екстрагенітальних уражень, спричинених трихомонадами, зокрема мигдаликів, шкіри, прямої кишки [65].
Було помічено, що санація трихомонад суттєво зменшує імовірність передачі ВІЛ статевим шляхом [171, 192, 224]. Дослідження, проведене в США, показало, що T. vaginalis сприяє захворюванню на ВІЛ та перевищує відносний внесок у відповідну захворюваність інших збудників ІПСШ [202]. Існують дані про те, що інфекція T. vaginalis сприяє зараженню вірусом папіломи людини в 6,5 разів, збільшуючи ризик виникнення цервікальної неоплазії, як початкової стадії раку шийки матки [166]. Деякі штами T. vaginalis можуть носити в собі власні віруси (Trichomonavirus), які здатні вивільнятися з заражених ними трихомонад й спричиняють запалення у ССС вже після лікування метронідазолом [193].
Встановлено, що УТ є багатовогнищевою інфекцією, при якій збудник може вражати як ССС, так і інші органи й системи [117]. У значної частини пацієнтів (25–50 %) визначаються латентні або стерті форми захворювання, які не супроводжуються жодними скаргами. Тому трихомонади нерідко виявляють як «знахідку» при проведенні профілактичних оглядів або при активному притягненні до обстеження статевих партнерів осіб, хворих на трихомоноз. Носійство трихомонад визначається у 40 – 50 % хворих із змішаною урогенітальною інфекцією [162].
Не дивлячись на інтенсивне вивчення, в сучасних умовах, існують певні труднощі в діагностиці трихомонозу і його лікуванні [70]. Спираючись на сказане вище, на сучасному етапі, виникла необхідність у більш ретельному вивченні представників типу найпростіших, з точки зору їх можливості колонізувати ССС людини та набуття патогенних властивостей при цьому. За останні декілька десятиліть істотно змінились умови життєдіяльності сучасної людини. Разом з тим, як відомо, змінилась патогенність певних мікроорганізмів в ССС людини, наприклад, мікоплазм та гарднерел [82]. Можна припустити більший ступінь розповсюдженості Giardia lamblia в ССС хворих на ІПСШ, а також припустити, що нехарактерні, як вважалось до останнього часу, для урогенітального тракту трихомонади (Trichomonas tenax та Pentatrichomonas hominis), теж могли зазнати певного патоморфозу і набути можливості колонізувати ССС людини. Імовірно, такі властивості могли б виникнути при попаданні цих збудників у ССС при незахищеному бар’єрними засобами, відповідно, оральному і анальному сексі, які набули великого поширення в інтимних стосунках наших сучасників. Оральний секс сьогодні – звичайна сексуальна практика гетеросексуальних і гомосексуальних пар [212]. Науково доведено, що оральний секс – це шлях передачі гонореї, сифілісу і деяких інших інфекційних агентів [3]. Феляція несе ризик придбання інфекції партнером по оральному сексу. Кунілінгус, імовірно, може призводити до БВ. З розповсюдженням практики орального сексу, останній став важливим потенційним шляхом передачі оральних, респіраторних і статевих патогенних мікроорганізмів [278]. Національний центр медичної статистики Сполучених Штатів Америки (National Center for Health Statistics, USA) надав у 2002 році детальну доповідь, яка ґрунтується на вивченні сексуальної поведінки 12571 чоловіків і жінок у віці від 15 до 44 років. В результаті цього дослідження було виявлено, що близько 12 % хлопців і 10 % дівчат у віці 15 – 19 років практикували гетеросексуальний оральний секс, не вступаючи в традиційні вагінальні зносини. Серед чоловіків у віці 25 – 44 років 90 % практикували оральний секс, а 40 % – анальний секс із жінками. Серед жінок відсоток тих, що практикує анальний і оральний секс, був аналогічним. Згідно з результатами цього дослідження, 3 % опитаних американських чоловіків в останні 12 місяців свого життя мали анальний та/або оральний секс з іншими чоловіками, а 4 % жінок вступали у сексуальні відносини з іншими жінками [210]. Природно, при такій високій частоті застосування орального і анального сексу виникає питання про можливість передачі ІПСШ при цьому [279].
Структура захворюваності на ІПСШ, включаючи УТ, постійно змінюється [280]. Інформація щодо таких змін допомагає правильно планувати клініко-діагностичні заходи в закладах надання спеціалізованої медичної допомого відповідним хворим. Зважаючи на це, постала наукова задача по визначенню поширеності трихомонозу в сучасних умовах, а також визначення частоти МА за участі збудників протозойних інвазій з іншими збудниками ІПСШ.
Існують дані щодо виникнення патологічних МА, до складу яких входять T. vaginalis та мікрофлора, що є асоційованою з БВ [81, 170]. МА – це взаємодіючі співтовариства мікроорганізмів. У МА можуть входити бактерії, дріжджі, водорості, грибки, а також інші мікроорганізми. Вони засновані на симбіотичних або метабіотічних стосунках. Окремі види мікроорганізмів, що становлять МА, зазвичай стійкі до продуктів життєдіяльності інших видів і використовують ці продукти як джерела свого існування [71].
За різними даними, трихомоноз у вигляді моноінфекції зустрічається лише в 10 – 35 % випадків. В інших 65 – 90 % він розвивається у вигляді змішаної інфекції. При цьому супутні інфекції зустрічаються з різною частотою. Так, трихомоноз може поєднуватися: з мікоплазмозом – у 47,3 % випадків; БВ – у 31,4 % випадків; з гонореєю – у 29,1 % випадків; з уреаплазмозом – у 20,9 % випадків; з хламідіозом – у 18,2 % випадків; з кандидозом (молочницею) – у 15,7 % випадків [63].
Епідеміологія протозойних інвазій ССС вивчена недостатньо. Немає однозначних трактовок цього захворювання щодо клінічної картини, патогенезу та можливих ускладнень. Невідомим залишаються також фактори ризику в окремих популяціях та причини гендерних, вікових та регіональних розбіжностей [78].
1.3 Клінічний перебіг та лабораторна діагностика трихомонадної інвазії, роль молекулярно-біологічних методів
Зазвичай інкубаційний період УТ триває від 2 днів до 2 місяців [1]. Якщо трихомоноз перебігає в стертій формі, то перші симптоми можуть проявитися через кілька місяців після зараження за умов зниження імунітету або загострень інших хронічних інфекцій [119].
УТ може перебігати у формі гострого, підгострого і хронічного запального процесу [44]. Клінічно проявляється у вигляді кольпіту, вульвіту, вестибуліту, цервіциту, ендоцервіциту, уретриту, циститу й інших формах запальної реакції, у тому числі і ерозій, виразок, що нагадують тверді шанкери. У чоловіків трихомонади можуть уражати уретру, її залози, сім`яні пухирці, передміхурову залозу, придатки яєчка, куперові залози, парауретральні протоки, залози крайньої плоті. Крім того, уражатись можуть сечовий міхур та ниркові миски [65]. У 5–10% хворих на УТ згодом спостерігається спонтанне клінічне та етіологічне одужання [47].
У чоловіків синдром ураження сечостатевого тракту характеризується розвитком уретриту. Можуть уражатися також передміхурова залоза і сечовий міхур. Імовірні розвиток утруднення сечовипускання, розладів сексуальних функцій, погіршення кількісних і якісних показників сперми, безпліддя [65]. Через свербіж хворі розчісують промежину, зовнішні статеві органи, на цих ділянках можуть виникати екскоріації [170]. Описано також ураження ССС людини ентамебами. Проведені нами дослідження в цьому напрямку показали відсутність поширення подібних станів серед хворих на ІПСШ в Україні [24].
На сучасному етапі залишається важливим розробка та впровадження нових методів діагностики протозойних інвазій ССС, оскільки для тих, що зараз існують є характерними неоднакові пороги чутливості та специфічності, а також ступені інформативності та доступності для лабораторних служб різного рівня [43, 69, 98].
Діагностика УТ, як правило, базується на лабораторному виявленні T. vaginalis у досліджуваному матеріалі, в меншій мірі вона базується на виявленні клінічних ознак захворювання, які не мають суворої специфічності [59]. У даний час для лабораторної діагностики цього захворювання застосовують чотири основні методи верифікації T. vaginalis: бактеріоскопічний, бактеріологічний, імунологічний і генодіагностичний. [41, 115, 197]. Для успішної діагностики УТ слід дотримуватися наступних принципів: поєднане використання різних методів діагностики; неодноразове дослідження матеріалу, що вивчається; забір матеріалу з різних вогнищ; правильна техніка забору біологічного матеріалу [65, 70, 107].
Матеріалом для верифікації T. vaginalis у чоловіків є виділення з уретри і секрет придаткових статевих залоз, сперма, центрифугат свіжої сечі, а у жінок – виділення з уретри, піхви і каналу шийки матки, а також осад сечі. У дітей досліджують виділення з уретри і вміст піхви [124, 219]. За необхідності досліджують матеріал з прямої кишки, вміст ерозій і виразок слизових оболонок і шкірних покривів [106, 246].
Бактеріоскопічний метод вважається відбірковим і базується на виявленні T. vaginalis у нативних і забарвлених препаратах [76]. Трихомонади диференціюють за візуалізацією типових морфологічних і тинкторіальних властивостей збудника [233]. Чутливість методу нативної мікроскопії варіює в широких межах – від 38 % до 82 % [173]. Дослідження забарвлених препаратів (метиленовим синім, діамантовим зеленим, за Грамом, за Романовським-Гімзою, за Лейшманом-Романовським) є можливим через тривалий час після взяття матеріалу, а також дає можливість одночасної ідентифікації супутньої мікрофлори [234]. Однак, даний метод дозволяє виявити тільки типові форми трихомонад [29].
Культуральний метод служить для виявлення T. vaginalis шляхом вирощування їх на штучних поживних середовищах і ідентифікації живих культур. Частота виявлення трихомонад при використанні бактеріологічного методу дослідження становить понад 90 % [31]. На сьогоднішній день культуральний метод, який вважається «золотим стандартом», найбільш прийнятний для верифікації діагнозу УТ у вагітних і обов’язковий для того ж у дітей. На сьогоднішній день широко використовуються модифікації живильних середовищ типу Джонсона-Трасселя, а також сольове козеїн-дріжджове середовище [90]. Суттєвим обмеженням культурального методу є тривалість проведення дослідження та його залежність від якості відповідних середовищ та дотримання температурного режиму [124, 276].
Серологічні методи діагностики для визначення антитрихомонадних антитіл (реакція аглютинації, зв’язування комплементу, імунофлюоресценції) не отримали практичного застосування через низьку діагностичної ефективності. Внутрішньошкірна проба з алергеном вагінальної трихомонади не знайшла широкого застосування в якості попереднього відбіркового тесту внаслідок частих недостовірних результатів [117, 249].
Використовується також метод флюоресцентного імуноферментного аналізу і метод ПЛР синтезу ДНК з використанням моноклональних антитіл до різних структур найпростіших, для прямого виявлення антигенів T. vaginalis [73, 123, 240]. Як не дивно, метод ПЛР у діагностиці УТ вважається одним з найменш інформативних. За виявленням T. vaginalis він поступається бактеріоскопічному методу діагностики і значно поступається бактеріологічному методові [133]. У той же час метод ПЛР вважається одним з найбільш специфічних із існуючих діагностичних підходів [40, 88, 113]. Разом з тим, при дослідженні інших уражень ССС, спричинених, наприклад, хламідіями, метод ПЛР є «золотим стандартом» діагностики [257]. Найбільш чутливою і специфічною модифікацією методу ПЛР є її різновид ПЛР у реальному часі (ПЛР-РЧ). [168, 189]. Крім того, ця модифікація дозволяє отримувати результат ПЛР уже в день взяття у хворого біологічного матеріалу [27, 188]. Виникає природне питання: чому ж тоді ПЛР «не спрацьовує» при діагностиці УТ? Відповідь на це питання, на нашу думку, полягає в існуванні або серологічних штамів T. vaginalis, які є досить відмінними між собою за генетичними ознаками (як, наприклад Ureaplasma urealyticum, Ureaplasma parvum і уреаплазма Т-960), або можливості колонізації ССС частини хворих на ІПСШ іншими найпростішими, зокрема Trichomonas tenax, Pentatrichomonas hominis або Giardia lamblia.
У процесі поглибленого вивчення способів діагностики УТ, увагу притягло виявлення дискордантності при ідентифікації даного збудника за умови одночасного використання для цього різних діагностичних методів [24]. Так, при одночасному використанні методів оптичної мікроскопії і ПЛР у одних і тих же пацієнтів при дослідженні одного і того ж їх біологічного матеріалу, результати визначення, істотно різнились. Причому, всупереч очікуванням, методика оптичної мікроскопії виявилася більш результативною, ніж ПЛР. Зважаючи на набагато більші специфічність і чутливість ПЛР, ніж оптичної мікроскопії, нами було зроблено припущення щодо можливості існування в сучасних умовах у ССС людини інших найпростіших, окрім T. vaginalis [24]. Подібне припущення періодично висовувалось фахівцями різних країн, проте випадки виявлення Trichomonas tenax і Pentatrichomonas hominis в ССС людини були поодинокі, не носили ознак масовості і вважались, як правило, результатом контамінації під час забору біологічного матеріалу [164, 268]. Разом з тим, існують чисельні дані щодо визначення в різних органах та системах людини Pentatrichomonas hominis [214, 239] та Trichomonas tenax [62, 244, 268]. В якості патологічних агентів для ССС кишкову й ротову трихомонади намагалися розглядати на рівні з T. vaginalis ще з минулого століття [180]. В нашому столітті більшість дослідників виявляли Trichomonas tenax або Pentatrichomonas hominis лише в поодиноких випадках, причому, переважно у жінок. Тому вони були схильними розцінювати свої результати або як контамінацію матеріалу, що досліджується, або як варіант транзиторної мікрофлори (ТМ) після орального чи анального сексу, що мав місце незадовго до взяття біологічного матеріалу для проведення відповідного дослідження [214, 231]. Поборники можливості колонізації ССС людини Trichomonas tenax та Pentatrichomonas hominis перебувають поки в опозиції до пануючої на сьогодні точки зору [77, 225].
Що стосується лямблій, у наш час виявлення Giardia lamblia в ССС хворих на ІПСШ становить близько 6 % [25, 279]. В останнє десятиліття, в зарубіжній науковій літературі з’явились повідомлення про ураження ССС Gіardia lamblia, зокрема, у чоловіків-гомосексуалістів [210, 252].
Було проведено декілька попередніх досліджень з використанням експериментальних оригінальних праймерів, які були розроблені спеціально для визначення Trichomonas tenax, Pentatrichomonas hominis та Giardia lamblia за допомогою ПЛР-РЧ [91, 92, 93]. «Пілотні» дослідження в різних групах хворих на ІПСШ показали широку розповсюдженість протозойних інвазії ССС, що викликані Trichomonas tenax, Pentatrichomonas hominis та Giardia lamblia. Наявність же у кожного з пацієнтів дослідної групи саме хронічного запального процесу в ССС, надає нам можливість зробити припущення про перспективність розгляду цих мікроорганізмів у якості факторів виникнення та/або перебігу сечостатевих інфекцій на сучасному етапі. При цьому, було встановлено, що рівень діагностування саме T. vaginalis у хворих на урогенітальні інфекції склав лише незначний відсоток [25, 102].
Отже, встановлено можливість перебування в ССС людини на сучасному етапі трьох різних видів трихомонад (Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis), а також Giardia lamblia. Відповідаючи на питання: «Чому слід виконувати ерадикацію найпростіших із ССС людини?», слід зазначити перш за все пряму пошкоджуючу дію Trichomonas vaginalis та Giardia lamblia [65]. Крім того, при фагоцитозі, що здійснюється будь-якими найпростішими [71], частка мікроорганізмів не руйнується повністю – вони можуть зберігатися всередині одноклітинного мікроорганізму неушкодженими (незавершений фагоцитоз). На сучасному етапі УТ вважають змішаною протозойно-бактеріальною інфекцією [5, 62]. Тому, під час обстеження пацієнтів потрібно враховувати фагоцитарні властивості найпростіших. У разі незавершеного фагоцитозу коки, диплококи, хламідії, бацилярні форми як грампозитивних, так і грамнегативних мікроорганізмів, що виходять, при загибелі трихомонад, здатні підтримувати запальний процес у сечостатевих шляхах, який часто сприймається за невилікуваний трихомоноз або посттрихомонадні ураження, створює певні труднощі у призначенні етапного лікування [84]. Тому найпростіші, пряму патогенну дію яких на ССС людини ще не доведено, а перш за все, Trichomonas tenax та Pentatrichomonas hominis, доцільно розглядати щонайменше в якості патогенетичних чинників ІПСШ. Саме через це, ерадикація Trichomonas tenax та Pentatrichomonas hominis із ССС людини, як і ерадикація Trichomonas vaginalis та Giardia lamblia, на погляд автора, мають бути обов’язковими.
1.4 Мікробні асоціації збудників протозойних інвазій у сечостатевій системі хворих на інфекції, що передаються статевим шляхом
Велика увага з боку дерматовенерологів і лікарів суміжних спеціальностей приділяється вивченню щодо нових інфекційних захворювань урогенітального тракту, таких як БВ. БВ – інфекційний незапальної синдром, пов’язаний з дисбіозом біотопу піхви, якому притаманні підвищення концентрації анаеробних (облігатних і факультативних) мікроорганізмів і значне зниження молочнокислих бактерій. Серед мікробних агентів, які грають роль у розвитку даної патології, виділяють Gardnerella vaginalis, Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealiticum, Ureaplasma parvum, Atopobium vaginae, Bacteroides spp., Prevotella spp., Porphyromonas spp., Peptostreptococcus spp., Fusobacterium nuclearum, Enterococcus spp., Eubacterium spp., Clostridium spp., Dialister spp., Lachnobacterium spp., Listeria monocytogenes, Megasphera spp., Mobiluncus spp., Leptotrichia spp., Sneathia spp., Veilonella spp., Candida spp., Streptococcus spp., Staphilococcus spp. та ін. [42, 81,172].
Численні результати клінічних та лабораторних досліджень, проведених в останнє десятиліття, переконливо доводять реальну можливість інфікування уретри чоловіків-статевих партнерів жінок, хворих БВ, умовно вагінальної мікрофлорою, яка складається переважно з анаеробних і мікроаерофільних бактерій. У чоловіків таку мікрофлору прийнято зазвичай розцінювати як транзиторну. ТМ сечостатевих органів – це умовно-патогенна мікрофлора, постійна присутність якої не притаманна для відповідної частини організму здорової людини. ТМ може викликати запальні процеси в сечостатевих органах і передаватися статевим шляхом лише при певних умовах. Саме тому, все стану і захворювання, пов’язані з наявністю ТМ, за літературними даними, рекомендується розглядати як інфекційний процес.
Чоловіча уретра, на відміну від здорової жіночого піхви, має більш лужне середовище, яка є сприятливим фактором для існування і розмноження там вагінальної мікрофлори. Однак не всі чоловіки схильні до зараження піхвової ТМ. Серед чоловіків, інфікованих ТМ можна чітко виділити три основні групи: 1) особи, які перенесли в минулому хламідійну або гонококковую інфекції; 2) хворі на хронічний простатит; 3) особи, які зловживають місцевими антисептиками для профілактики сечостатевих інфекцій. Носійство ТМ є найбільш поширеним варіантом її перебування в ССС чоловіків і відзначається у 50 – 70 % статевих партнерів жінок, хворих БВ. При цьому відбувається колонізація уретри Gardnerella vaginalis та іншими збудниками, асоційованими з БВ. Чоловіки при цьому можуть абсолютно нічого не відчувати суб’єктивно. Але за умови безладної статевого життя, вони можуть виступати в якості основного резервуара і розповсюджувачів відповідної мікрофлори серед жінок. Крім того, у чоловіків збудники, які асоціюються з БВ жінок, можуть викликати баланіти, баланопостити, хронічні простатити, а також бути передумовою розвитку аденоми передміхурової залози.
На сучасному етапі розвитку дерматовенерології ще немає чіткого уявлення про роль анаеробної і мікроаерофільна мікрофлори, що асоціюється з БВ, в етіології і патогенезі інфекцій ССС у чоловіків. За результатами наших попередніх досліджень подружніх пар, окремі збудники, які асоціюються з БВ, виявляються переважно в довільних комбінаціях, що доводить можливість нестатевого шляху інфікування ними. Таким чином, не можна виключити, що певна частина чоловіків, хворих ІПСШ, мають дисбіоз ССС, спричинений анаеробною і / або мікроаерофільною мікрофлорою за аналогією з БВ жінок.
Відомо, що серед інфекційних захворювань ССС у жінок, зокрема, фертильного віку, найбільш поширеним в наш час є БВ. БВ – інфекційний синдром, пов’язаний з дисбіозом вагіни, який характеризується високою концентрацією облігатних анаеробних мікроорганізмів та різким зниженням вмісту лактобацил або їх відсутністю [33]. БВ є незапальним захворюванням, проте, здатним значно обтяжувати перебіг ІПСШ, крім того, поліетіологічним [19]. У наш час визначено вже більше 40 мікробних агентів, які відіграють роль у розвитку БВ. Серед них найбільше значення мають: Gardnerella vaginalis, Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum, Bacteroides spp., Prevotella spp., Porphyromonas spp., Peptostreptococcus spp., Fusobacterium nuclearum, Enterococcus spp., Candida spp., Listeria monocytogenes, Mobiluncus spp., Leptotrichia spp., Streptococcus гр. viridans [42, 81, 172] та ін. Згідно даних вітчизняних дослідників щодо розповсюдження БВ в Україні, вказується, що частота даної патології залежить, насамперед, від контингентів обстежуваних жінок репродуктивного віку. Зокрема, частота виявлення БВ у пацієнток з патологічними піхвовими виділеннями становить від 61 % до 87 %. У жінок зі скаргами на тривалі, резистентні до лікування патологічні виділення, БВ діагностувався у 95 % випадків [42]. Після впровадження в лабораторно-діагностичну практику наборів реагентів, що дозволяють виявляти анаеробну та мікроаерогенну мікрофлору (за допомогою методу ПЛР) стало відомо, що названі мікроорганізми можуть спричиняти дисбактеріози ССС також і у чоловіків [139]. Подібні стани було описано відносно нещодавно, і тому, вони ще не мають загальновизнаної назви.
Таким чином, вивчення протозойних інвазій ССС, які перебігають у поєднанні з ураженнями, спричиненими мікроорганізмами, що асоційовані з БВ, у жінок фертильного віку та їх статевих партнерів-чоловіків є перспективним напрямком сучасної медицини, розвиток якого може призвести до значного підвищення рівня діагностичного обстеження хворих на ІПСШ та, як наслідок, покращення ефективності їх лікування. Насамперед, за рахунок обґрунтування проведення специфічної антибактеріальної терапії відповідним хворим, а також заходів щодо попередження їх реінфікування.
У 2016 році на вітчизняному ринку з’явилося відразу два відповідних набору реагентів. Крім анаеробної та мікроаерофільної мікрофлори, властивої для БВ, ці набори дозволяють визначати й інші, більш традиційні для дерматовенерологів і лікарів суміжних спеціальностей мікроорганізми, здатні спричинити ІПСШ. На думку автора, набори реагентів «Андрофлор» і «Андрофлор Скрін» виробництва НВО «ДНК Технологія» (Російська Федерація) є актуальними діагностикумами для дослідження мікрофлори урогенітального тракту чоловіків методом ПЛР в режимі реального часу. Ці набори позитивно зарекомендували себе як у лабораторіях, так і в клінічній практиці. Комбінація високої чутливості і специфічності, низький ризик контамінації, швидкість (1 – 1,5 години) отримання результату дослідження, можливість кількісного аналізу, можливість діагностики некультивованих мікроорганізмів роблять технологію ПЛР у режимі реального часу ключовою в діагностиці інфекційних хвороб у клінічній мікробіологічної лабораторії (табл. 1.1).
Як видно з таблиці 1.1, комплектація набору реагентів «Андрофлор» перевершує за кількістю визначених мікроорганізмів комплектацію «Андрофлор Скрін».
Одним з найбільш відповідальних етапів у дослідженні мікрофлори ССС чоловіків методом ПЛР у режимі реального часу є етап взяття біологічного матеріалу з органів ССС. Автором рекомендується використовувати оригінальний набір.
Таблиця 1.1 – Показники, що визначаються наборами реагентів для дослідження мікрофлори урогенітального тракту чоловіків методом ПЛР в режимі реального часу «Андрофлор®» і «Андрофлор® Скрін»
| Показник | Андрофлор® | Андрофлор® Скрин |
| Геномна ДНК людини | + | + |
| Загальна бактеріальна маса | + | + |
| Lactobacillus spp. | + | + |
| Staphylococcus spp. | + | + |
| Streptococcus spp. | + | + |
| Corynebacterium spp. | + | + |
| Gardnerella vaginalis | + | + |
| Atopobium claster | + | – |
| Megasphaera spp./Veilonella spp./Dialister spp. | + | – |
| Sneathia spp./Leptotrihia spp. /Fusobacterium spp. | + | – |
| Ureaplasma urealyticum | + | + |
| Ureaplasma parvum | + | + |
| Mycoplasma hominis | + | + |
| Bacteroides spp./Porphyromonas spp./ Prevotella spp. | + | – |
| Anaerococcus spp. | + | – |
| Peptostreptococcus spp./Parvimonas spp./Eubacterium spp. | + | – |
| Pseudomonas aeruginosa/Ralstonia spp./Burkholderia spp. | + | – |
| Heamophilus spp. | + | – |
| Enterobacteriaceae spp./Enterococcus spp. | + | + |
| Candida spp. | + | + |
| Mycoplasma genitalium | + | + |
| Trichomonas vaginalis | + | + |
| Neisseria gonorrhoeae | + | + |
| Chlamydia trachomatis | + | + |
Таким чином, набори реагентів «Андрофлор» і «Андрофлор Скрін» виробництва НВО «ДНК Технологія» (Російська Федерація) є актуальними діагностикумами для дослідження мікрофлори урогенітального тракту чоловіків методом ПЛР в режимі реального часу. Причому, «Андрофлор» більш доцільно використовувати для діагностики ІПСШ у пацієнтів з наполегливим хронічно-рецидивним перебігом захворювання, а також у осіб, що часто практикують оральний і / або анальний секс без використання бар’єрних засобів контрацепції. «Андрофлор Скрін» більш доцільно використовувати при діагностиці запальних процесів урогенітального тракту з невеликими кількістю і виразністю ускладнень.
1.5 Лікування інвазії Trichomonas vaginalis
Хоча сучасна венерологія має ефективні медикаментозні методи лікування більшості ІПСШ, позбутися УТ повністю надзвичайно складно, навіть, у наші дні [58, 161]. Справа в тому, що небілкова оболонка трихомонади не реагує на дію антибіотиків і може бути зруйнована тільки спеціальними протипротозойними препаратами [126]. Проведення лікування УТ регламентовано відповідними настановами [46]. Воно передбачає, насамперед, застосування препаратів, що мають специфічну антипротозойну активність [12]. Це, як правило, речовини груп нітроімідазолів (метронідазол, тинідазол, секнідазол, орнідазол) та нітрофуранів (ніфуратель) [9, 52, 68, 99]. Під час проведення антипротозойної терапії бажано одночасно проводити відповідне місцеве лікування [116], а також призначати імунобіологічні препарати з метою підвищення опірності організму [16]. Під час лікування пацієнтам суворо забороняється мати сексуальні контакти, а в контрольний період не дозволяється секс без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції [65, 279].
Для лікування хворих з різними клінічними формами трихомонозу рекомендується застосовувати диференційовані схеми. Згідно з ними, лікування УТ має бути комплексним та індивідуалізованим і включати, крім етіотропної терапії, препарати з урахуванням механізмів патогенезу, зокрема гепатопротектори та адаптогени, згідно з Протоколом надання медичної допомоги хворим на сечостатевий трихомоніаз [34, 79].
Неефективність лікування трихомонозу стала останнім часом все більше відзначатись в науковій літературі [7, 46]. Причини цього можуть бути зумовлені наступними факторами: зниження чутливості збудника до протистоцидних препаратів [36]; порушення всмоктування ліків в кишківнику та низька концетрація їх у вогнищах ураження; інактивація протистоцидних препаратів супутньою мікрофлорою [22, 51]; поширення збудника за межі ССС [272]. Крім наведених вище факторів, слід, на нашу думку, додати також моральну застарілість схем лікування УТ [26]; необхідність одночасної ерадикації інших збудників ІПСШ [85, 89, 99, 105, 184, 208]; недостатнє урахування індивідуальних факторів стану здоров’я хворих на ІПСШ (супутні захворювання), перш за все стану імунної системи; перепони з боку біоплівок для дії місцевих протистоцидних препаратів [215]; а також помилкове визначення за T. vaginalis інших представників підцарства Найпростіших, а саме Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia [15, 37, 84, 102].
Слід підкреслити, що збудник УТ Trichomonas vaginalis не лише змінив свої біологічні та морфологічні властивості, а й став високорезистентним до препаратів нітроімідазолового ряду [122]. Амебовидні трихомонади в багатьох випадках резистентні до протипротозойної терапії і після двоетапного лікування часто знову виявлялися при контрольних обстеженнях [57]. Стандартні методики і дозування препаратів в більшості випадків, нажаль, виявляються неефективними [121].
Отже, чинні схеми лікування УТ є застарілими. Вони потребують корекції у бік збільшення загальної курсової дози протистоцидних препаратів [18, 216] та/або їх чередування, враховувати склад МА у ССС [102]. Відомо, що лікуванню підлягають усі пацієнти, в кого виявлено піхвові трихомонади, а також хворі із запальними процесами, у яких під час дослідження трихомонад не знайдено, але вони були виявлені у статевого партнера [47, 275].
Аналізуючи зазначені фактори, що впливають на ефективність лікування трихомонозу, можна зауважити наступне: Способом подолання резистентності при лікуванні трихомонозу може бути використання підвищених доз пероральних протистоцидних препаратів [66]. Проте, внаслідок поганої переносності їх великих доз, можуть розвинутись ускладнення, насамперед, з боку травної системи, які потребуватимуть негайної відміни лікування [75]. Короткочасне підвищеної концентрації протистоцидних препаратів можна досягти за рахунок внутрішньовенного їх уведення. Як правило, це робиться у комбінації з пероральним і місцевим вживання препаратів специфічної терапії. Але цей спосіб також не є ідеальним. Лімфотропне уведення нітроімідазолів є досить ефективним, але має великий ризик виникнення ускладнень внаслідок непристосованості препаратів цієї групи до підшкірного уведення [96]. Ендолімфатичне уведення протистоцидних препаратів є сьогодні найбільш ефективним у лікуванні протозойних інвазій за рахунок створення «пікових» концентрацій відповідних засобів, але він потребує від лікаря кваліфікації хірурга і має виконуватись в умовах стерильної операційної [18], що не є можливим для повсякденної практики дерматовенерологічних закладів.
Порушення всмоктування ліків в кишківнику можна коригувати за рахунок попереднього лікування відповідної соматичної патології, що потребує певного часу і не завжди дає стійкий ефект [160]. Низька концентрація протистоцидних препаратів може бути пов’язана також з різним ступенем здатності ліків накопичуватись в різних тканинах і органах, а також за рахунок спайок [17], Частково цю проблему можна розв’язувати за рахунок призначення «провідників» для препаратів етіотропної терапії – протеолітичних ферментних препаратів, які здатні сприяти збільшенню концентрації медикаментів саме у вогнищах запалення [18].
Для подолання резистентності до протистоцидних засобів можна використовувати антигомотоксичні препарати (трихомонаден-флюор-ін’єль), а також препарати імунобіологічної дії (солкотриховак) [52].
Однак, найбільш перспективним, на нашу думку, є нормалізація імунологічної реактивності у відповідних пацієнтів [127, 129].
Препарат Пропес містить α- і ß-дефенсини. Він розроблений Науково-виробничим підприємством «НІР» (Україна) на сучасному етапі є єдиним зареєстрованим у нашій державі препаратом з імуномодулюючою дією, що містить дефенсини [52]. Його отримують з ембріональної тканини великої рогатої худоби в результаті специфічного протеолізу. Дефенсини – це пептиди, що володіють протиінфекційною та протипухлинною активністю: α-дефенсини характеризуються переважно антибактеріальними і противірусними властивостями; ß-дефенсини, крім того, активні ще і відносно патогенних грибків, а також здатні проявляти виражену протипухлинну активність [111].
Зазначений препарат відносять до фармакотерапевтичної групи «Антинеопластичні та імуномодулюючі засоби». Випускається у вигляді розчину для ін’єкцій по 2 мл в ампулах № 10. 1 ампула розчину містить амінокислоти і низькомолекулярні пептиди, які отримані із ембріонів великої рогатої худоби – 2.0 мл. Застосовується у комплексній терапії злоякісних новоутворень (рак легенів, рак нирок, рак печінки, рак стравоходу, рак прямої кишки, рак дванадцяти палої кишки, рак тонкого та товстого кишечнику, саркома м’яких тканин та кісток, меланоми), а також показаний для лікування захворювань, пов’язаних з порушеннями імунологічного статусу. Призначають внутрішньом’язово. У разі хірургічного лікування хворим призначають по 2 мл 2 рази на добу протягом 5 діб до операції та по 2 мл 1 раз на добу протягом 10 діб після операції. При консервативному лікуванні онкохворих препарат застосовують у двох дозових режимах (I, II): I – по 2 мл 1 раз на добу протягом 10 діб на фоні комбінованої хіміотерапії та при повторних курсах останньої; II – при тривалому радикальному опроміненні хворих з системними пухлинними захворюваннями або при паліативному опроміненні метастазів у кістках– призначають ідентично з режимом при хірургічному лікуванні, при цьому препарат може бути призначений до 20 мл на добу протягом 3 днів [130].
У медичній практиці препарат суміші α- і ß-дефенсинів рекомендований для лікування різних захворювань на тлі порушень імунологічної реактивності. З цією метою препарат уводять по 2 мл 1 раз на добу протягом 10 діб або 1 раз на 2 доби протягом 20 діб. Здатність відновлювати активну і адекватну роботу імунної системи, регулювання балансу між різними ланками антиінфекційного захисту, відкриває препарату можливості покращувати функціонування організму людини в умовах імунодефіциту. Встановлено, що під його впливом підвищується кількість Т-лімфоцитів, нормалізується співвідношення їх субпопуляцій і рівень сироваткового фактора некрозу пухлини – α, а рівень інтерлейкiна-4 досягає рівня здорових осіб [103].
Препарат суміші α- і ß-дефенсинів стимулює функціональну активність мононуклеарних фагоцитів і клітин – природних кілерів, тобто активізує неспецифічні імунні реакції організму. Він пригнічує продукцію прозапальних цитокінів при алергічних захворюваннях. Препарат має виражені антитоксичні ефекти, покращує функції печінки, пригнічує розвиток пухлинних процесів, сприяє регресії пухлин шляхом їх резорбції. Він не володіє мутагенними, ембріотоксичними, тератогенними, пірогенними і гемолітичними властивостями. Однією з істотних переваг зазначеного засобу, як інших препаратів групи дефенсинів, є його нетоксичність, що забезпечує велику терапевтичну широту вживання цього засобу [23].
Секнідазол (secnidazole), виробництва ЛАБОРАТОРІЯ БЕЙЛІ-КРЕАТ – ВЕРНУЙЄ, Франція. Виробляється у таблетках, вкритих плівковою оболонкою, 1 таблетка, вкрита плівковою оболонкою, містить секнідазолу 1,0 г. Упаковка препарату містить 2 таблетки. Належить до групи протипротозойних засобів, похідних нітроімідазолу.
Секнідазол – протипротозойний препарат групи нітроімідазолів з антибактеріальною дією. Секнідазол характеризується бактерицидним (проти грампозитивних та грамнегативних анаеробних бактерій) та амебіцидним (внутрішньо- та зовнішньокишечним) ефектом. Секнідазол особливо активний щодо Trichomonas vaginalis, Entamoeba histolytica, Giardia lamblia. Проникаючи всередину клітини мікроорганізму, секнідазол активується у результаті відновлення 5-нітрогрупи, за рахунок чого взаємодіє з клітинною ДНК. Відбувається порушення її спіралеподібної структури та руйнування ниток, інгібування нуклеотидного синтезу та загибель клітини.
Після застосування внутрішньо Секнідазол швидко та повністю абсорбується зі шлунково-кишкового тракту. Біодоступність становить приблизно 80 %. Секнідазол проходить через гематоенцефалічний бар’єр, проникає у грудне молоко. Час напіввиведення секнідазолу становить приблизно 25 годин, що дозволяє спростити схему прийому препарату, зробивши її більш зручною для пацієнтів.
Показаннями до використання Секнідазолу:
- трихомонадні уретрити та вагініти (спричинені Trichomonas vaginalis);
- БВ;
- амебіаз кишечнику (спричинений Entamoeba histolytica);
- амебіаз печінки (спричинений Entamoeba histolytica);
- лямбліоз (спричинений Giardia lamblia).
Протипоказаннями є:
- гіперчутливість до секнідазолу та інших похідних імідазолу;
- органічні захворювання центральної нервової системи.
Не застосовується у період вагітності або годування груддю. Не впливає на здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Спосіб застосування та дози. Секнідазол слід застосовувати внутрішньо безпосередньо перед вживанням їжі, запиваючи невеликою кількістю води. Рекомендуються наступні схеми:
– трихомонадні уретрити та вагініти, БВ: 2 таблетки одноразово;
– амебіаз кишечнику:
- гострий амебіаз: 2 таблетки одноразово;
- безсимптомний амебіаз, включаючи осередкову та цистну форми: щоденно по 2 таблетки за 1 прийом протягом 3 днів;
– амебіаз печінки: щоденно по 1,5 таблетки (1,5 г) за 1 або 2 прийоми, протягом 5 днів;
– лямбліоз: 2 таблетки 1 раз на добу протягом 3 днів.
Секнідазол легко переноситься, але можлива поява побічних ефектів:
– загальні порушення: загальна слабкість;
– з боку травного тракту: порушення травлення, нудота, біль у ділянці шлунку, металевий присмак у роті, глосит, стоматит;
– з боку системи кровотворення: помірна оборотна лейкопенія, оборотна нейтропенія;
– алергічні реакції: реакції гіперчутливості, включаючи гіперемію, висипання, кропив’янку.
Орципол – діючі речовини: ciprofloxacin, ornidazole, виробництва «ЛАБОРАТОРІЯ БЕЙЛІ-КРЕАТ – ВЕРНУЙЄ», Франція. 10 таблеток у блістері; 1 блістер у картонній коробці. 1 таблетка, вкрита плівковою оболонкою, містить ципрофлоксацину (у формі ципрофлоксацину гідрохлориду) 500 мг та орнідазолу 500 мг. Відноситься до групи комбіновані антибактеріальні засоби. Код АТС J01R A12.
Орципол – комбінований антимікробний та протипротозойний препарат, фармакологічна дія якого зумовлена властивостями компонентів, що входять до його складу: ципрофлоксацину (похідне фторхінолону II покоління) та орнідазолу (похідне 5-нітроімідазолу).
Ципрофлоксацин інгібує фермент ДНК-гіразу бактерій та пригнічує синтез бактеріальної ДНК; спричиняє морфологічні зміни у мембрані та клітинній стінці бактерій, що призводить до швидкої загибелі клітини. Діє на мікроорганізми у стані росту та спокою. Має широкий спектр протимікробної дії, активний щодо ряду анаеробних грампозитивних та грамнегативних мікроорганізмів: Staphylococcus spp. (у т.ч. штами, що продукують та не продукують пеніциліназу, метицилінрезистентні штами), Streptococcus spp. (включаючи штами S. pneumoniae і S. pyogenes), Enterococcus spp., Listeria monocytogenes; Enterobacter spp., Haemophilus influenzae, Klebsiella spp., Legionella spp., Moraxella catarrhalis, Morganella morganii, Neisseria spp., Proteus spp., Pseudomonas aeruginosa, Salmonella spp., Shigella spp., Vibrio cholerae, Campylobacter spp., Citrobacter spp., Yersinia enterocolitica, E. coli та інші − Mycobacterium tuberculosis, Chlamydia trachomatis і Mycoplasma hominis. До ципрофлоксацину резистентні: Ureaplasma urealyticum, Clostridium difficile, Nocardia asteroids, Treponema pallidum.
Mexaнізм дії орнідазолу пов’язаний з порушенням структури ДНК− чутливих мікроорганізмів. Активний щодо Trichomonas vaginalis, Giardia lamblia, Entamoeba histolytica,a також деяких анаеробних бактерій (у т.ч. Bacteroides spp., Clostridium spp., Fusobacterium spp.і анаеробних коків).
Після перорального застосування орнідазол швидко всмоктується у шлунково-кишковому тракті. Біодоступність – 90 %, Cmax у плазмі крові досягається у межах 3 годин. Зв’язування ципрофлоксацину з білками крові є незначним (20–30 %), а речовина знаходиться в плазмі крові переважно в неіонізованій формі. Ципрофлоксацин може вільно дифундувати в позасудинний простір. Вагомий об’єм розподілу у стані стійкої рівноваги, який досягає 2–3 л/кг маси тіла, доводить, що ципрофлоксацин проникає у тканини в концентраціях, які можуть у багато разів перевищувати рівень препарату в сироватці крові. Зв’язування орнідазолу з білками плазми крові становить приблизно 13 %. Діюча речовина проникає у спинномозкову рідину, інші рідини організму та в тканини. Концентрація орнідазолу у плазмі крові знаходиться у діапазоні 6–36 мг/л.
Орнідазол метаболізується в печінці з утворенням в основному 2-гідроксиметил- та α-гідроксиметилметаболітів. Обидва метаболіти менш активні щодо Trichomonas vaginalis та анаеробних бактерій, ніж незмінений орнідазол. Ципрофлоксацин виділяється здебільшого у незміненому вигляді як нирками, так і через кишечник. Період напіввиведення орнідазолу становить приблизно 13 годин. Після одноразового застосування 85 % дози виводиться протягом перших 5 днів, головним чином у вигляді метаболітів. Близько 4 % прийнятої дози виводиться нирками у незміненому вигляді.
Застосування орнідазолу показано при лікуванні змішаних інфекцій, що спричинені збудниками (мікроорганізмами і найпростішими), чутливими до компонентів препарату:
– захворювання ССС: гострий і хронічний пієлонефрит, простатит, цистит, епідидиміт, ускладнені або рецидивуючі інфекції сечовивідних шляхів;
– захворювання, що передаються статевим шляхом.
Протипоказаннями є:
– гіперчутливість до будь-яких компонентів препарату;
– підвищена чутливість до похідних фторхінолонів;
– підвищена чутливість до похідних нітроімідазолу;
– епілепсія, розсіяний склероз;
– ураження центральної нервової системи зі зниженням судомного порога (після черепно-мозкових травм, інсульту, запальних процесів у мозку та мозкових оболонок);
– подовжений інтервал QT, некомпенсована гіпокаліємія, одночасний прийом протиаритмічних засобів класу IА (зинідин, прокаїнамід) або класу III (аміодарон, соталол);
– патологічні ураження крові або інші гематологічні аномалії;
– одночасне застосування з тизанідином.
Орципол здатний впливати на швидкість реакції (зменшує) при керуванні автотранспортом або іншими механізмами. У період вагітності застосування препарату протипоказано.
Спосіб застосування та дози. Орципол слід застосовувати внутрішньо перед вживанням їжі або через 2 години після їжі. Таблетки приймати цілими, не розділяючи навпіл та не розжовуючи.
Курс лікування при гострих інфекціях становить 5-7 днів. Доза препарату та тривалість лікування залежать від чутливості мікроорганізмів, тяжкості і виду інфекційного процесу. Застосовувати по 1 таблетці 2 рази на добу протягом 5 днів, потім продовжувати ще 2-5 днів застосовувати ципрофлоксацин. Лікування слід продовжувати не менше 3 днів після зникнення клінічних симптомів захворювання.
Якщо не призначено інше, рекомендуються наступні добові дози:
- Інфекції сечовивідних шляхів:
– гострі, неускладнені − по 1 таблетці 2 рази на добу протягом 3 днів;
– цистит у жінок (до менопаузи) − 1 таблетка одноразово;
– ускладнені − по 1 таблетці 2 рази на добу протягом 7 днів.
- Інфекції статевих органів:
– неускладнена гонорея (включаючи екстрагенітальні вогнища інфекції) − 1 таблетка одноразово;
– аднексит, простатит, орхоепідидиміт − по 1 таблетці 2 рази на добу. Тривалість курсу лікування визначається чутливістю збудника до препарату та клінічною картиною. Лікування препаратом слід продовжувати ще мінімум 3 дні після зникнення симптомів захворювання та до повної нормалізації температури.
Побічні реакції ципрофлоксацину:
- організм у цілому: кандидоз, астенія, кандидоз слизової оболонки порожнини рота;
- з боку шлунково-кишкового тракту: нудота, блювання, діарея, метеоризм, панкреатит, білірубінемія, гепатит, підвищення рівня печінкових трансаміназ: АЛТ, АСТ, лужної фосфатази, аномальні значення функціональних тестів печінки, біль у ділянці шлунка і кишечнику, абдомінальний біль, диспептичні розлади, жовтяниця, холестатична жовтяниця, псевдомембранозний коліт, порушення функцій печінки, некроз печінки (дуже рідко прогресуючий до печінкової недостатності, що загрожує життю);
- з боку системи кровотворення та лімфатичної системи: еозинофілія, лейкопенія, анемія, нейтропенія, лейкоцитоз, тромбоцитопенія, тромбоцитемія, агранулоцитоз, змінені значення рівня протромбіну, гемолітична анемія, петехія (переміжна геморагія шкіри), панцитопенія (із загрозою для життя), пригнічення функції кісткового мозку (із загрозою для життя);
- з боку нервової системи: головний біль, запаморочення, розлади сну, парестезія, дизестезія, гіпестезія, тремор, судоми (включаючи епілептичний статус), порушення ходи, порушення координації, мігрень, сильні судоми великих м’язів, нестійка хода, психоз, інтракраніальна (внутрішньочерепна) гіпертензія, атаксія, посмикування, периферична нейропатія та полінейропатія;
- з боку опорно-рухового апарату та сполучної тканини: артралгія (біль у суглобах), м’язово-скелетний біль (наприклад біль у кінцівках, поперековій ділянці, грудній клітині), міалгія, набряк суглобів, артрит, підвищення м’язового тонусу, м’язова слабкість, загострення симптомів міастенії гравіс, тендиніт, розриви сухожиль (переважно ахіллових);
- з боку серцевої-судинної системи: тахікардія, синкопе (непритомність), вазодилатація (приплив), артеріальна гіпотензія, шлуночкова аритмія, подовження інтервалу QT, піруетна тахікардія (torsades de pointes), тромбоз судин;
- з боку метаболізму та харчування:анорексія, підвищення рівня креатиніну та азоту сечовини, набряк (периферичний, васкулярний, лицьовий), гіперглікемія, підвищена активність амілази, ліпази;
- з боку нирок та сечовидільної системи: порушення функцій нирок, ниркова недостатність, вагінальний кандидоз, гематурія, кристалурія, тубулоінтерстиціальний нефрит, гіперкаліємія;
- з боку шкіри та підшкірної клітковини: висипи, свербіж, кропив’янка, реакція фоточутливості, петехія, мультиформна еритема, вузликова еритема, синдром Стівенса- Джонсона (з потенційною загрозою життю), токсичний епідермальний некроз (з потенційною загрозою життю);
- з боку дихальної системи: диспное (включаючи астматичні стани), набряк гортані;
- з боку судин:васкуліт, синкопальний стан;
- з боку психіки: психотичні реакції та депресія з можливими суїцидальними ідеями/думками або спроби/вчинення самогубства, психомоторна збудливість, сплутаність свідомості, дезорієнтація, стривоженість, патологічні сновидіння, галюцинації;
- з боку імунної системи: алергічні реакції, алергічний/ангіоневротичний набряк, анафілактичний шок (небезпечний для життя), анафілактоїдна (анафілактична) реакція, сироваткова хвороба;
- органи чуття: втрата смакових відчуттів (порушення смаку), паросмія (порушення нюху), втрата нюху (зазвичай оборотна при відміні препарату);
- з боку органів зору: порушення зору, диплопія, ахроматопсія, порушення кольорового сприйняття;
- з боку органів слуху та лабіринту:дзвін у вухах, втрата слуху/порушення слуху;
- інфекції та інвазії: грибкові суперінфекції, антибіотико-асоційований коліт (дуже рідко – з можливою летальністю);
- загальні розлади: набряки, гарячка, підвищена пітливість (гіпергідроз);
- лабораторні показники: підвищення активності лужної фосфатази, відхилення від норми рівня протромбіну, підвищення активності амілази.
Побічні ефекти орнідазолу дозозалежні:
- з боку крові та лімфатичної системи: прояви впливу на кістковий мозок та нейтропенія;
- з боку імунної системи:реакція гіперчутливості, ангіоневротичний набряк;
- з боку шкіри та підшкірної клітковини:шкірні висипання, кропив’янка, свербіж;
- з боку нервової системи:запаморочення, сонливість, головний біль, тремор, ригідність м’язів, порушення координації, судоми, тимчасова втрата свідомості, ознаки сенсорної або змішаної периферичної нейропатії, збудження, сплутаність свідомості;
- з боку шлунково-кишкового тракту:порушення смаку, нудота, блювання, металевий присмак у роті, сухість у роті, диспепсія;
- з боку печінки та жовчовивідних шляхів: зміни печінкових функціональних проб, гепатотоксичність;
- загальні розлади: підвищення температури тіла, підвищена втомлюваність, задишка.
Макмірор, виробник “Poli Industria Chimica S.p.A.”, Італія. 1 таблетка містить ніфурателу 200 мг; двоопуклі таблетки білого кольору, вкриті цукровою оболонкою. 20 таблеток в упаковці. Фармакотерапевтична група похідні нітрофурану. АТ код: G01AX05.
Фармакодинаміка. Макмірор містить активний інгредієнт ніфурател, який є похідним нітрофурану. Препарат високоефективний щодо бактеріальних, протозойних та грибкових збудників. Ніфурател має високу ефективність та низьку токсичність, що обумовлюєширокий спектр його клінічного застосування. Ефективний проти мікро організмів, які спричиняють захворювання ССС. Вважається, що механізм дії полягає у взаємодії з бактеріальними ферментами. Антибактеріальний спектр дії включає грампозитивні та грам негативніаеробні та анаеробні бактерії такі, як Gardenerella vaginalis, Escherichia coli, Shigella, Salmonella spp, Bacillus spp, Proteus, Klebsiella pneumoniae, з діапазоном МІК від 2,5 до 50 мкг/мл. Ніфурател залежно від концентрації, може виступати як бактеріостатична, так і як бактерицидна речовина. Він є препаратом вибору для терапії сальмонельозів, шигельозів та інших кишкових бактеріальних інфекцій. Макмірор активний відносно Trichomonas vaginalis, високоактивний щодо грибів роду Candida, ефективний по відношенню до штамів Helicobacter pylori, які резистентні до метронідазолу.
Фармакокінетика. При пероральному прийомі швидко абсорбується із шлунково-кишкового тракту. Проникає через гематоенцефалічний і гематоплацентарний бар’єр, виділяється з грудним молоком. Метаболізується в печінці та м’язевій тканині. Повністю виводиться із організму нирками (30 – 50 % у незміненому вигляді), тим самим спричиняє антибактеріальну дію у сечовидільному тракті.
Показання для застосування. Вульвовагінальні інфекції, спричинені чутливими до препарату збудниками (патогенними мікроорганізмами, кандидами, трихомонадами, хламідіями). Пієлонефрит, уретрит, цистит, пієліт та інші захворювання сечовидільної системи. Кишковий амебіаз і лямбліоз. Ерадикація Нelicobacter pylori (у схемах антихелікобактерної терапії).
Вульво-вагінальні інфекції. Дорослим призначають по 4 – 6 таблеток на добу у 2 – 3 прийоми (по 400мг на 1 прийом, 2 – 3 рази на добу) після прийому їжі, запиваючи водою. Тривалість лікування становить в середньому 7 днів. Якщо лікування не дало бажаних результатів, рекомендується продовжити курс лікування. Статевий партнер також має пройти профілактичний курс лікування – по 1 таблетці 3 рази на добу протягом 7 днів. Дівчата віком від 10 років і старше: рекомендована доза становить 10 мг на 1 кг маси тіла на добу у 2 прийоми. Приймати препарат після прийому їжі. Тривалість лікування становить в середньому 7 днів.
Інфекції сечовидільних шляхів. Дорослі: рекомендована доза препарату залежить від ступеня тяжкості захворювання і становить 3 – 6 таблеток на добу (тобто по 200 – 400 мг) одноразово тричі на добу після їжі. Курс лікування становить у середньому 1 – 2 тижні. Діти віком від 6 років і старше: рекомендована доза становить 10–20 мг на 1 кг маси тіла на добу у 2 прийоми. Приймати після їжі. Тривалість лікування – 1 – 2 тижні.
Таблетки Макмірор є безпечними за необхідності подовження курсу лікування або повторного циклу лікування інфекцій сечовидільних шляхів. Результати лікування повинні контролюватися аналізами сечі на наявність інфекційних збудників.
Кишковий лямбліоз. Дорослі: по 2 таблетки 2 – 3 рази на добу, після їжі, протягом 7 діб. Діти віком від 6 років і старше: рекомендована доза – 15 мг на кг маси тіла на добу у 2 прийоми, після їжі, протягом 7 діб.
Побічна дія: у поодиноких випадках можливі шлунково-кишкові розлади: нудота, блювання, гіркота у роті, діарея. Алергічні реакції: у поодиноких випадках – шкірні висипання, свербіж.
Протипоказання. Підвищена чутливість до ніфурателу або будь якому з компонентів препарату. Дитячий вік до 6 років.
Передозування. Випадки передозування не зареєстровані.
Вплив на здатність керувати автомобілем або працювати зі складними механізмами – не виявлено.
Взаємодія з іншими лікарськими засобами. Небажаних ефектів при одночасному застосуванні препарату з іншими лікарськими засобами не спостерігалось.
Разом з тим, визначення виду найпростіших у ССС, імовірно, має вирішальну роль в запобіганні рецидивів і реінфекцій захворювання на ІПСШ завдяки обґрунтуванню додаткових підстав для санації статевого партнера, або самого хворого з урахуванням можливості існування поєднаної генітальної та екстрагенітальної інвазії. Крім того, для успішного лікування відповідних хворих на ІПСШ, слід враховувати стан їх імунної системи, а також склад патологічних МА, до яких входять збудники протозойних інвазій. Тому, актуальною також на сьогоднішній день є проблема розробки та впровадження в практику заходів охорони здоров’я ефективних та безпечних схем лікування урогенітальної патології, зокрема, для успішної ерадикації Trichomonas tenax, Pentatrichomonas hominis та Giardia lamblia [69, 220].
Профілактичні заходи УТ такі самі, як і при гонореї: виявлення та лікування хворих на трихомоноз; виявлення та притягнення до дослідження і лікування осіб – джерел зараження, проведення профілактичних медичних досліджень, санітарно-просвітницької та виховної роботи серед населення [196]. Дівчаток, хворих на трихомоноз, не допускають до дитячих закладів до повного виліковування. Жінки, що захворіли на трихомоноз, допускаються до праці у дитячих закладах лише після встановлення його вилікованості [98, 117].
Таким чином, у сучасних умовах, є актуальними наукові завдання щодо вивчення розповсюдженості протозойних інвазій серед хворих на ІПСШ, а саме найпростіших, перебування яких у ССС відповідних хворих донедавна вважалось малоймовірним (Giardia lamblia) або, навіть, взагалі неможливим (Trichomonas tenax та Pentatrichomonas hominis), а також розробка дієвих способів їх діагностики та елімінації із організму [98].
* * *
Таким чином, з урахуванням високих показників розповсюдженості протозойних інвазій ССС, складності та суперечливості їх етіопатогенетичних ланок, на що вказує мультифакторність даної патології, можливості існування екстрагенітальних вогнищ ураження, резистентності до традиційних методик терапії, тенденції до персистуючого торпідного характеру перебігу даного захворювання, а також великого спектру засобів, методів, методик лікування, дана група захворювань є актуальною проблемою сучасної дерматовенерології і диктує необхідність проведення подальших досліджень, які можуть дозволити розкрити нові ланцюги патофізіологічних змін, що відбуваються у пацієнтів як на локальному (в ССС), так і на системному загальноорганізменному рівнях та розробити на цій підставі нові напрямки терапії, які дадуть змогу підвищити її ефективність та значно покращити якість життя відповідних хворих.
Матеріали даного розділу опубліковані в таких роботах:
- Protozoan genital invasions caused by the representatives of Trichomonas and Giardia / V. Fedorych, G.I. Mavrov, T.V. Osinska, Y.V. Shcherbakova. Wiadomości Lekarskie. 2020. Vol. 73, Iss. 2. P. 380–383 [255].
- Пат. на винахід 107910 Україна, МПК С12/Q 1/68 (2006.01), С12/Q 1/04 (2006.01), С12/N15/11 (2006.01). Спосіб визначення присутності Trichomonas tenax у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201407161; заявл. 25.06.2014; опубл. 25.02.15, Бюл. № 4 [91].
- Пат. на винахід 110759 Україна, МПК С12/Q 1/68 (2006.01),С12/Q 1/04 (2006.01),С12/N15/11 (2006.01), С12/R 1/90(2006.01). Спосіб визначення присутності Pentatrichomonas hominis у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201501255; заявл. 16.02.2015; опубл. 10.02.16, Бюл. №3 [92].
- Пат. на винахід 110767 Україна, МПК С12/Q 1/68 (2006.01),С12/Q 1/04 (2006.01),С12/N15/11 (2006.01), С12/R 1/90(2006.01). Спосіб визначення присутності Giardia lamblia у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201505750; заявл. 11.06.2015 ; опубл. 10.02.16, Бюл. №3 [93].
- Федорич П.В. Трихомоніаз. Патоморфоз трихомонад. Військова медицина України. Т. 14, № 1. С. 62–67 [144].
- Визначення деяких найпростіших (Trichomonas tenax, Trichomonas hominis, Giardia lamblia, Entamoeba histolytica, Enthamoeba gingivalis) у пацієнтів, хворих на урогенітальні інфекції методом ПЛР в реальному часі / П.В. Федорич, С.Б. Зелений, Л.С. Зайцева, О.В. Мазій. Український журнал дерматології, венерології, косметології. 2012. № 4 (47). С. 5–10 [24].
- Федорич П.В., Зеленый С.Б. Трихомониаз. Явление существования Trichomonas tenax в мочеполовой системе человека. Уральский медицинский журнал. № 1 (115). С. 93–97 [148].
- Федорич П.В., Зеленый С.Б. Трихомониаз. Явление существования Trichomonas hominis в мочеполовой системе человека. Медицинская панорама. 2014. № 1 (145). С. 59–61 [149].
- Федорич П.В. Урогенітальний трихомоноз: новий погляд на проблему. Дерматологія та венерологія. 2017. № 4 (78). С. 12–16 [145].
- Порівняння ефективності діагностики трихомоніазу за культуральним методом та методом полімеразної ланцюгової реакції з використанням праймерів для виявлення Trichomonas vaginalis, Trichomonas tenax та Pentatrichomonas hominis / П.В. Федорич, С.Б. Зелений, О.А. Садовська, К.В. Дудікова. Український журнал дерматології, венерології, косметології. 2017. № 1 (64). С. 65–69 [102].
- Ультраструктурные особенности морфотипов Trichomonas vaginalis, выделенных от больных с хронической трихомонадной инвазией / П.В. Федорич, Г.И. Мавров, С.К. Джораева, Т.В. Осинская. Дерматологія та венерологія. 2018. № 4 (82). С. 17–22 [127].
- Визначення поширеності інфікування Giardia lamblia сечостатевої системи хворих з інфекціями, що передаються переважно статевим шляхом / П.В. Федорич, С.Б. Зелений, Л.Я. Федорич, Х.І. Шеховцова. Український журнал дерматології, венерології, косметології. 2015. № 2 (57). С. 67–70 [25].
- Федорич П.В., Мацас Е.Ю., Мулькина Е.И. Применение диагностикума Фемофлор для исследования микрофлоры мочеполовой системы у пар половых партнёров при наличии воспаления. Уральский медицинский журнал. 2011. № 3 (81). С. 26–32 [157].
- Федорич П.В., Корнієнко А.О., Федорич Л.Я. Бактеріальний вагіноз. Огляд літературних джерел. Український журнал дерматології, венерології, косметології. 2008. № 3 (30). С. 102–105 [150].
- Федорич П.В. Особливості інфекцій, що передаються статевим шляхом, в Україні. Український медичний вісник. 2013. № 7–8 (82). С. 62–63 [141].
- Федорич П.В. Погляд на проблему ерадикації мікрофлори, асоційованої з бактеріальним вагінозом. Матеріали науково-практичної конференції з міжнародною участю НМАПО ім. П.Л. Шупика «Дерматовенерологія в розробках молодих науковців», м. Київ, 28 листопада 2019 р. С. 25 [142].
- Федорич П.В., Примак А.В., Коновалова Т.С. Бактеріальний вагіноз: сучасний погляд на проблему. Раціональна терапія та реабілітаційні заходи щодо способу життя пацієнток. Український журнал дерматології, венерології, косметології. 2013. № 3 (50). С. 86–94 [172].
2 МАТЕРІАЛИ І МЕТОДИ
2.1 Характеристика пацієнтів – груп обстеження, порівняння та контрольних груп
Клінічні та лабораторні дослідження проводилися в Українській військово-медичній академії (м. Київ) і в Державній установі «Інститут дерматології та венерології НАМН України» (м. Харків). Дослідження виконано відповідно до етичних принципів Гельсінської декларації з дозволу комісії з біоетики ДУ «Інститут дерматології та венерології НАМН України».
З метою виконання поставлених в дисертаційному дослідженні завдань, використовувались дані значної кількості людей (дані від більше, ніж 3000 осіб) – хворих на ІПСШ пацієнтів та здорових осіб. Деякі дані брались ретроспективно з облікової документації та при анкетуванні (дані від більше, ніж 2000 осіб). Інші було отримано експериментальним шляхом (дані від більше, ніж 1000 пацієнтів). Окремі фрагменти дослідження, присвячені епідеміологічним аспектам трихомонозу в Україні, містять масиви інформації, що були отримані від багатотисячних груп спостереження і наведені у відповідній звітно-обліковій фаховій документації.
Отже, при виконанні різних фрагментів дослідження було використано наступні дані:
- Для визначення поширеності збудників ІПСШ серед хворих на запальні процеси ССС на сучасному етапі (локальне дослідження) було вивчено та проаналізовано в ретроспективі журнал Лабораторії молекулярних методів дослідження Олександрівської клінічної лікарні м. Києва за 2017 рік. Відповідні хворі, результати обстеження яких було зафіксовано в журналі, звертались за спеціалізованою медичною допомогою до лікарів за фахом дерматовенерологія, гінекологія та урологія. Усього проаналізовано дані 607 осіб.
- Для аналізу сексуальної поведінки сучасних молодих осіб було проведено анкетування 100 українців з гетеросексуальною орієнтацією (50 чоловіків та 50 жінок) – молодих осіб (середній вік склав (24 ± 1) рік), що мали вищу освіту та жили статевим життям, щодо особливостей їх статевої поведінки.
- Для обґрунтування та апробації оригінального способу взяття біологічного матеріалу з метою адаптації набора реагентів Фемофлор-16 для кількісної детекції анаеробної та мікроаерофільної мікрофлори ССС чоловіків було проведено клініко-лабораторне дослідження 30 чоловіків, яких було спеціально відібрано серед пацієнтів, що звернулись за спеціалізованою медичною допомогою з приводу хронічних запалень ССС в м. Києві у 2011 році. Основним критерієм відбору в дослідну групу було наявність БВ у статевих партнерів (дружин та/або постійних статевих партнерш з відповідним стажем не менше 6 місяців).
- Для визначення поширеності інфікування деякими найпростішими, а саме Trichomonas tenax, Pentatrichomonas hominis, Giardia lamblia ССС хворих на ІПСШ, у м. Київ та Харків в 2013 – 2020 рр. було проведене спеціальне дослідження, в групі з понад 450 осіб репродуктивного віку, що звернулися для обстеження на ІПСШ.
- Для складання порівняльної характеристики діагностики сечостатевого трихомонозу за допомогою методів засівів на живильне середовище та ПЛР-РЧ із застосуванням оригінальних діагностикумів для виявлення Trichomonas tenax, Pentatrichomonas hominis та Giardia lamblia було використано біологічний матеріал від 97 пацієнтів (2017 р.).
- Апробацію оригінальних праймерiв для визначення Pentatrichomonas hominis методом ПЛР проведено з біологічним матеріалом, взятому із ССС 37 хворих на протозойні інвазії (2018 р.).
- Молекулярне типування Trichomonas vaginalis, що циркулюють в Україні, на підставі поліморфізму гена актину проведено з матеріалом від 29 пацієнтів (2019 р.).
- Проведено секвенування 62 зразків біологічного матеріалу, взятого із ССС відповідних хворих, з метою виявлення нуклеотидних послідовностей, що є притаманними для Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia (2019 – 2020рр.).
- Проведено вивчення впливу препарату суміші α- і ß-дефенсинів на динаміку змін показників імунограм у 32 хворих на ІПСШ з хронічним перебігом та, одночасно, імунною недостатністю І ступеня (2015 – 2017 рр.).
- Визначено вплив препарату суміші α- і ß-дефенсинів на стан імунної системи 30 пацієнтів з хронічними протозойними інвазіями ССС в динаміці їх комплексного лікування (2017 – 2019 рр.).
- Електронну мікроскопію збудників протозойних інвазій було проведено з 62 зразками біологічного матеріалу, взятого із ССС відповідних хворих (2017 – 2018 рр.).
- Порівняння виявлення Trichomonas vaginalis методами оптичної мікроскопії, культуральним та ПЛР проведено у 377 пацієнтів (2017 – 2018 рр.).
- Клініко-епідеміологічну характеристику хворих на трихомоноз складено за даними 241 хворого (2018 – 2019 рр.).
- Епідеміологічні дані щодо трихомонозу в Україні було складено на основі чисельних даних профільних установ за період 2011 – 2018 рр. Характеристики захворюваності на трихомоноз по областям України за 2018 р. складалась при цьому з даних, що були отримані від 41201 хворого на цю інфекцію ССС.
- Дослідження складу МА збудників протозойних інвазій з мікрофлорою, що асоційована з БВ у хворих на хронічні інфекції ССС проведено у 71 хворого (2015 – 2019 рр.).
- Проліковано з використанням авторської схеми у 2013-2020рр більш, ніж 109 хворих на протозойні інвазії ССС із хронічним перебігом, що спричинені Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia.
- Проліковано з використанням оригінальної схеми у 2015–2020 рр. 71 хворого на протозойні інвазії ССС з хронічним перебігом, (спричинені Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis, Gіardia lamblia) та, одночасно, мікрофлорою, що є асоційованою з БВ).
Пацієнти мали відповідати усім переліченим критеріям включення:
- Сексуально активні чоловіки та жінки, у яких в біологічному матеріалі, взятому із сечостатевих органів ПЛР та/або ПЛР-РЧ було ідентифіковано Trichomonas vaginalis, Trichomonas tenax, Pentatrichomonas hominis або Gіardia lamblia.
- Свідоме надання пацієнтом інформованої згоди.
- Свідоме бажання пацієнта виконувати усі вимоги та процедури дослідження.
Критерії виключення пацієнтів з дослідження. Жоден з перелічених критеріїв не повинен бути виявленим:
- Вагітність.
- Менструація (обстеження не проводилося до закінчення кров’янистих виділень).
- Злоякісні пухлини будь-якої локалізації.
- Гостра інфекція сечових шляхів.
- Наявність гострого інфекційно-запального процесу будь-якої іншої, ніж урогенітальний тракт, локалізації.
- Наявність автоімунних захворювань та імунодефіцитних станів, зумовлених ВІЛ-інфекцією.
- Застосування будь-яких антимікробних препаратів протягом трьох місяців до включення пацієнта у дослідження.
- Порушення функції печінки.
2.2 Клінічне обстеження хворих
У обстежених хворих з ІПСШ ретельно збирався анамнез, звертали увагу на скарги, їх характер і давнину, особливості статевого життя (початок, шлюб, позашлюбні статеві контакти, вагітність, пологи і їх ускладнення, безплідність, потенція й ін.). З’ясовували наявність супутніх і перенесених захворювань. Приділяли особливу увагу на виявлення скарг хворих, що могли вказати на функціональні порушення, обумовлені змінами мікробіоценозу кишечнику (болю в різних ділянках живота, метеоризм, нестійкий стілець, нестерпність деяких харчових продуктів). Обстеження хворих на рецидиви урогенітальних інфекцій починалося з огляду шкіри і слизових оболонок зовнішніх статевих органів, стегон, промежини, перианальної ділянки, слизових оболонок порожнини рота. При огляді звертали увагу на колір шкіри, наявність висипань і їх характер, стан периферичних лімфатичних вузлів.
Під час огляду статевих органів чоловіків звертали увагу на стан статевого члену, зовнішнього і внутрішнього листків препуціального мішка, губок уретри, наявність виділень з уретри і їх характер. Звертали увагу на стан парауретральних залоз і наявність вад розвитку. Оглядаючи мошонку, яєчка та їх придатки, сім’яні канатики визначали їх розміри, консистенцію, болючість при пальпації. При відсутності гострозапальних явищ проводили пальцьове дослідження передміхурової залози.
При огляді жінок звертали увагу на стан великих і малих соромітних губ, слизової оболонки вагіни, бартолінієвих залоз, уретри, наявність парауретральних ходів, виділення та їх характер. Пальпуючи сечівник, визначали стан його стінок, наявність інфільтратів, ущільнень і виділень з уретри.
Огляд вагіни проводили за допомогою двостулкового дзеркала Куско. При цьому визначали величину і форму шийки матки, стан цервікального каналу, наявність гіперемії, набряку, дефекту епітелію екзо- і ендоцервіксу, виділень із шийкового каналу, їх кількість і характер. Під час бімануального дослідження визначали стан тіла матки і її придатків.
2.3 Оцінка стану імунної системи пацієнтів
У групи пацієнтів вивчалося використання препарату суміші α- і ß-дефенсинів при комплексному лікуванні ІПСШ, у тому числі протозойних інвазій ССС.
Для дослідження динаміки стану імунної системи, використовувалось визначення в сироватці крові абсолютної кількості лімфоцитів, рівні Т-лімфоцитів (CD3+), Т-хелперів (CD4+), Т-цитотоксичних лімфоцитів (CD8+); імунорегуляторний індекс Тх/Тс; рівні активних Т-лімфоцитів, В-лімфоцитів (CD22+), лімфоцитів-кілерів (CD18+), 0-лімфоцитів; реакцію бласттрансформації лімфоцитів з ФГА, фагоцитарний індекс, фагоцитарний показник, НСТ-тест, а також рівні Ig А, G, М [43, 71]. Дослідження «імунограми» виконувалось як стандартне (поточне) в лабораторії Українсько-німецького гастроентерологічного центру (м. Київ).
2.4 Лабораторна діагностика збудників протозойної інвазії
Діагностика трихомонадної інвазії ґрунтувалася на результатах комплексного обстеження, що включало: виявлення трихомонад у мазках виділень уретри, вагіни та цервікального каналу у жінок, а також уретри і секрету передміхурової залози чоловіків та культуральне дослідження біологічного матеріалу у рідкому живильному середовищі на основі бульйону М 305 (HiMedia, Індія) з наступною детекцією збудника за допомогою мікроскопії нативних вологих препаратів. Для бактеріосокопічної діагностики найпростіших у мазках матеріал був фіксований з наступним забарвленням за Грамом [31].
Також для проведення дослідження на виявлення трихомонад методом культуральної діагностики використовувалось спеціальне поживне середовище “СВТ” виробництва Інститут Пастера (Санкт-Петербург, Російська Федерація).
Використовувались також ТАНК, зокрема, ПЛР та ПЛР-РЧ [32].
2.5 Методика постановки полімеразної ланцюгової реакції
Взяття біологічного матеріалу для дослідження на наявність урогенітальних інфекцій здійснювали відповідно до посібника «Уніфікація лабораторних методів дослідження в діагностиці захворювань, що передаються статевим шляхом» [66]. Матеріал для досліджень брався одночасно із усіх можливих вогнищ уражень (уретра, цервікальний канал, піхва, сік простати). Для взяття матеріалу повинно пройти 1,5 – 2 години з часу останнього сечовипускання. У чоловіків виконувались зішкреби з уретри одноразовими зондами типу “ЗГУ – ЦМ”, виробництва Російської Федерації, та забір секрету передміхурової залози після її пальцьового масажу. У жінок – виконувався забір піхвових виділень, зішкребів та/або виділень уретри і цервікального каналу, також одноразовими зондами. Забір матеріалу з уретри (у чоловіків та жінок) здійснювався стерильними одноразовими зондами типу “ЗГУ – ЦМ” виробництва Російської Федерації. Зішкрябування слизової оболонки уретри у чоловіків здійснювався на глибину 2,5 – 4,0 см., а жінкам – на глибину 1,0 –1,5 см. Забір матеріалу зондом здійснювався обертовими рухами. Сік простати для дослідження брався після масажу простати [59].
Оскільки в даному дослідженні не ставилось за мету формулювання точних топічних діагнозів, то для підвищення рівня виявленості збудників та економії коштів, біологічний матеріал, взятий у кожного з пацієнтів окремо з усіх точок дослідження, змішувався у фізіологічному розчині в одному контейнері типу «Еппендорф». Дослідні зразки після їх реєстрації накопичували і зберігали у замороженому вигляді при температурі –10°С до постановки ПЛР.
Метод генодіагностики, який був використаний у дослідженні, є ПЛР. В основу метода покладено компліментарну добудову ділянки геномної ДНК збудника, яка здійснюється in vitro за допомогою ферменту термостабільної ДНК-полімерази, дезоксинуклеозидтрифосфатів, відповідного сольового буфера та олігонуклеотидних затравок-праймерів, визначаючих кордони ампліфікованої ділянки ДНК-мішені.
Кожний цикл складається з трьох стадій з різними температурними режимами. На першій стадії при 94°C відбувається розділення ланцюгів ДНК, на другій при 50-65°С приєднання (відпалювання) праймерів до гомологічних послідовностей на ДНК-мішені й на третій, при температурі 72°С – синтез нових ланцюгів ДНК за допомогою подовження праймера у напрямку 5`-3`. У кожному циклі здійснюється подвоєння кількості копій ампліфікованої ділянки, що дозволяє за 25 – 40 циклів напрацювати фрагмент ДНК, обмежений парою відібраних праймерів, у кількості, достатній для її детекції за допомогою електрофорезу. Реакція ампліфікації являє собою багаторазово повторювані цикли синтезу специфічної ділянки ДНК-мішені в присутності термостабільної ДНК-залежної-ДНК-полімерази.
Специфічність методу визначається унікальністю генетичного матеріалу інфекційного агента, до якого підібрані олігонуклеотидні праймери, які беруть участь в процесі ампліфікації.
Дослідження проводилось в ампліфікаторі ДТ-96 (ТОВ «НВО ДНК-технологія», Російська Федерація) згідно модифікованого протоколу постановки тесту. Для виявлення Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia застосовувались оригінальні праймери [91, 92, 93]. Застосовувався також праймер для визначення Trichomonas vaginalis виробництва кампанії ДНК-Технологія (Російська Федерація).
2.6 Методи отримання праймерів для виявлення Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia за допомогою методу полімеразної ланцюгової реакції в реальному часі
Для виявлення нуклеїнових кислот Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia використовувались оригінальні авторські праймери. Їх підбирали за допомогою програми Vector NTI. При цьому, використовували послідовності нуклеїнових кислот відповідних видів отриманих з бази даних GenBank (NCBI) [203]. Мінімальна довжина праймерів становила (24 ± 3) залишки нуклеотидів. На 3’-кінці праймери містили гуаніновий або цитидиновий нуклеотиди. Кількість GC пар у праймерах задавали таким чином, щоб температура випалу була однаковою для двох праймерів пари і знаходилася в межах від 59º до 64ºС.
Для перевірки унікальності праймерів використовували онлайн програму BLAST (NCBI) [179]. Для теоретичної перевірки продуктів ПЛР за допомогою підібраних праймерів використовували онлайн пакет програм Bioinformatics tools (база даних Університету м. Берклі, США [178].
Для детекції Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia в матеріалі з урогенітального тракту чоловіків і жінок використовувався метод ПЛР-РЧ, ампліфікатор ДТ-96, та оригінальні праймери для виявлення Trichomonas tenax, Pentatrichomonas hominis, а також Gіardia lamblia [53].
2.7 Електронна мікроскопія в дослідженні ультраструктури трихомонад
Об’єктом дослідження були 5-9 добові культури трихомонад, виділені від хворих з трихомонадною інвазією.
Для електронно-мікроскопічного дослідження матеріал попередньо змішувався з рівним об’ємом 3 %-го глутаральдегіду, приготованого на фосфатному буфері (рН 7,3–7,4). Час фіксації – 4 години. Суспензія клітин центрифугувалася при 750 об/хв. Осад відмивався у фосфатному буфері і постфіксувався в 1 %-му розчині чотириокису осмію протягом 2 годин.
Після зневоднення етиловим спиртом зростаючої концентрації (від 30% до 96%, двічі в абсолютному спирті) і пропіленоксиду зразки просочувались сумішшю Епон-аралдит-пропіленоксиду, укладались в Епон-аралдиті полімеризованої при 600 0С протягом 48 годин. Для вибору необхідного ділянки дослідження робились напівтонкої зрізи товщиною 0,5 мкм, які фарбувались метиленовим синім і переглядались в мікроскопі ЛЮМАМ-МП-4.
Для електронної мікроскопії ультратонкі зрізи, отримані на ультрамікротомі УМТП-7, контрастувались насиченим водним розчином уранілацетату і розчином цитрату свинцю. Ультраструктура клітин досліджувалась за допомогою електронного мікроскопа ПЕМ-125К при пришвидшеній напрузі 75 kV, забезпеченого системою знімання і аналізу зображення САІ – 01А (АТ «SELMI», Україна) з використанням CCD камери DX 2 і пакету програм фірми «KAPPA» (Німеччина).
2.8 Молекулярне типування Trichomonas vaginalis
Типування T. vaginalis проводили по поліморфізму гена актина [241]. Ген актина ампліфікувався гніздовим методом на термоциклері «Терцик» (РФ) з використанням двох пар праймерів – зовнішніх: Tv8S (5`‑TCTGGAATGGCTGAAGAAGACG-3`) і Tv9R (5`‑CAGGGTACATCGTATTGGTC-3`); та внутрішніх: Tv10S (5`‑CAGACACTCGTTATCG-3`) і Tv11R (5`‑CGGTGAACGATGGATG-3`). Реакційна суміш містила буфер для ПЛР (Thermo scientific с 2,5 мМ MgCl2, 0,2 мкМ праймерів и 0,3 мМ трифосфатів. В першому турі використовувались Taq-полімераза фірми Thermo scientific (Fermentas), в другому – Taq-полімераза фірми «Литех» (РФ), яка давала більш чіткі полоси ампліконів при електрофорезі в агарозі. Обсяг реакційної суміші першого тура – 25 мкл, другого – 40 мкл. Використовувався наступний режим ампліфікації: денатурація 95ºС 3 хвилини, 35 циклів, включно з денатурацією при 94ºС 40 с, віджиг при 55ºС 30 с і синтез при 72ºС – 3 хвилини, ампліфікація завершувалась інкубацією при 74 ºС протягом 2 хвилин.
Результати ампліфікації перевірялись пробним електрофорезом по 3 мкл в агарозі, після чого позитивні зразки розділялись на 3 аліквоти по 10 мкл, в них добавлялись по 3 од. рестриктаз RsaI, MseI або HindII, 1,5 мкл десятикратного буфера й проводилась інкубація при 37ºС 4 години.
Після рестрикції проводився електрофорез зразків у 3% гелі агарози в ТАЕ буфері на протязі 40 – 60 хвилин. Паралельно з зразками, що досліджувались, в якості маркерів молекулярної ваги використовувався набір (ThermoFisherScientific), який містить нуклеотиди довжиною 50, 100, 150, 200, 250 (акцентована полоса), 300, 400, 500 (акцентована полоса), 600, 700, 800, 900, 1000 пар нуклеотидів (п.н.).
При аналізі електрофореграм враховувався характерний для кожного генотипу спектр фрагментів ДНК, що утворюються при рестрикції, у відповідності до схеми, що була запропонована Crucitti et al. [241], наводиться в таблиці 2.1.
Використовувався наступний алгоритм диференціювання. По результатам рестрикції HindII виділялись дві групи генотипів: перша містить генотип А і Е й характеризується наявністю великого фрагмента довжиною 827 п.н., у інших генотипів цей фрагмент відсутній. В свою чергу, генотипи А і Е відрізняли один від одного по результатам рестрикції MseI – у А мається фрагмент довжиною 519 п.н. і відсутні фрагменти довжиною 315 п.н. й 204 п.н.
Таблиця 2.1 – Розміри фрагментів, групи патернів й генотипи актину штамів Trichomonas vaginalis і клінічних зразків із Кіншаси й Замбії
| Ге-но-тип | Рестрикція з HindII | Рестрикція з MseI | Рестрикція з RsaI | |||||||||||||||||||
| 827 п.н. | 426 п.н. | 401 п.н. | 213 п.н. | 60 п.н. | Па-терн HindII | 581 п.н. | 519 п.н. | 333 п.н. | 315 п.н. | 204 п.н. | 186 п.н. | Па-терн MseI | 568 п.н. | 452 п.н. | 236 п.н. | 190 п.н. | 116 п.н. | 106 п.н. | 103 п.н. | 87 п.н. | Па-терн RsaI | |
| A | + | – | – | + | + | 1 | + | + | – | – | – | – | 1 | + | – | + | + | – | + | – | – | 1 |
| E | + | – | – | + | + | 1 | + | – | – | + | + | + | 2 | + | – | + | – | – | + | + | + | 2 |
| G | – | + | + | + | + | 2 | + | + | – | – | – | – | 1 | + | – | + | + | – | + | – | – | 1 |
| H | – | + | + | + | + | 2 | + | + | – | – | – | – | 1 | + | – | + | – | – | + | + | + | 2 |
| I | – | + | + | + | + | 2 | + | + | – | – | – | – | 1 | – | + | + | + | + | + | – | – | 3 |
| M | – | + | + | + | + | 2 | + | – | + | – | – | – | 3 | + | – | + | + | – | + | – | – | 1 |
| N | – | + | + | + | + | 2 | + | – | + | – | – | – | 3 | + | – | + | – | – | + | + | + | 2 |
| P | – | + | + | + | + | 2 | + | – | + | – | – | – | 3 | – | + | + | – | + | + | + | + | 4 |
Примітка. «+» – фрагмент в наявності; «–» – фрагмент відсутній
Друга група генотипів (без полоси довжиною 827 п.н. після рестрикції HindII) поділялась на дві підгрупи: генотипи G, H, I характеризуються наявністю полоси 519 п.н., що близько розташована з полосою 581 п.н.; у генотипів M, N, P полоса 519 п.н. відсутня, проте присутня полоса довжиною 315 п.н.
Наступне диференціювання полягало на результатах рестрикції RsaI: всередині першої підгрупи – у генотипу H відсутня полоса 190 п.н., а у генотипу G – полоса 196 п.н.
Генотипи другої підгрупи M, N, P диференціюються за наступними признаками: у М відсутня полоса довжиною 452 п.н. й присутня полоса довжиною 190 п.н. У генотипу N відсутні обидві ці полоси, а у Р відсутня полоса 568 п.н. й присутня полоса довжиною 452 п.н.
2.9 Cеквенування біологічного матеріалу для підтвердження наявності Trichomonas tenax, Pentatrichomonas hominis та Gіardia lamblia
Секвенування виділень з урогенітального тракту чоловіків і жінок проводилось з використанням приладу фірми «Applied Biosystems» SOLIDtm System 5500xl (USA), який використовує емульсійну ПЛР і твердофазне лігірування. Продукти ПЛР екстрагувались з 2% агарозного гелю, за допомогою DEAE Cellulose Menbrane (0,45μm) (Serva, Germany), використовуючи стандартну методику очищення [87]. Очищені продукти ампліфікації піддавалися подальшому секвенуванню згідно з інструкцією виробника.
Нуклеотидні послідовності, що були секвеновані, порівнювалися з відомими за допомогою програмного забезпечення до приладу SOLIDTM System 5500xl (USA), а також бази даних GenBank [203].
2.10 Визначення мікроорганізмів, асоційованих з бактеріальним вагінозом
Проводилось за допомогою методу ПЛР-РЧ [77]. Використовувався ампліфікатор ДТ-96, набір реагентів ФЕМОФЛОР®-16 (НПО ДНК-технология, РФ). Призначенням набору реагентів ФЕМОФЛОР®-16 є кількісне визначення відповідної мікрофлори у жінок. Для кількісного визначення умовно-патогенної мікрофлори у чоловіків існує набір реагентів АНДРОФЛОР®, який з’явився на ринку в 2017 році, котрий має суттєві відмінності з набором реагентів Фемофлор-16 щодо переліку мікроорганізмів, які визначаються. Тому для діагностичного обстеження пацієнтів-чоловіків автором було адаптовано Фемофлор-16, що дозволило порівняти видовий склад мікробіоти статевих шляхів у чоловіків та жінок [139].
Набір реагентів ФЕМОФЛОР®-16 дозволяє кількісно визначати наступні показники: загальна бактеріальна маса, Lactobacillus spp., Enterobacteriaceae, Streptococcus spp., Staphylococcus spp,. Gardnerella vaginalis/Prevotella bivia/Porphyromonas spp., Eubacterium spp., Sneathia spp./Leptotrihia spp./Fusobacterium spp., Megasphaera spp./Veilonella spp./Dialister spp., Lachnobacterium spp./Clostridium spp., Mobiluncus spp./Corynebacterium spp., Peptostreptococcus spp., Atopobium vaginae, Candida spp., Mycoplasma hominis, Ureaplasma (urealyticum + parvum), Mycoplasma genitalium [159].
Спосіб взяття біологічного матеріалу здійснювався наступним чином: чоловікам, що не мочилися не менше 2 годин виконується масаж передміхурової залози. При цьому, секрет, який виділяється, має вільно витікати з уретри. Після чого одноразовим уретральним зондом виконується зішкріб з уретри з глибини 1,5–2 см. Пацієнти перед взяттям біологічного матеріалу для дослідження, не менше 2 тижнів не приймали антибіотики, не менше 2 діб утримуватися від алкоголю і від статевого життя. Дослідні зразки біологічного матеріалу після реєстрації розміщували в пробірки «Еппендорф», що містять 1 мл фізіологічного розчину і зберігали в замороженому вигляді до проведення дослідження. Алгоритм трактування результатів дослідження наведено на рис. 2.1.
Примітка. ГДЛ – геномна ДНК людини; ЗБМ – загальна біологічна маса, LB – лактобактерії, Sta / Str / Cory – сума Staphylococcus spp., Streptococcus spp., Corynebacterium spp.
Рисунок 2.1 – Алгоритм трактування результатів дослідження Фемофлор®-16 (за даними виробника)
2.11 Вивчення сексуальної поведінки хворих
До даної вибірки, увійшли 100 жителів Києва у віці від 23 і до 35 років (50 жінок і 50 чоловіки), які зверталися з приводу обстеження на венеричні хвороби або в зв’язку з різними скаргами з боку урогенітальної сфери. Їм було запропоновано заповнити спеціально розроблену анкету (додаток А).
Було проведено фізикальний медичний огляд і взято матеріал для обстеження на ІПСШ. Був ретельно зібраний статевий анамнез зі зверненням особливої уваги на статеві контакти за останні 5 років і на останніх статевих партнерів. Сексуальні стосунки визначалися як «будь-яка взаємна активність між партнерами, яка призводить до сексуального контакту незалежно від того, мали місце повний інтроїтус і оргазм, або не мали». Ті, хто мав секс хоча б один раз протягом останніх 3 місяців, вважалися «сексуально активними». Визначалися деталі сексуальної активності – вагінальний, оральний тощо. Респонденти ретельно розпитувались про сексуальні і супутніх феномени – лібідо, ерекція, еякуляція, любрикація, оргазм, болю, відчуття задоволення тощо. Були використані як суб’єктивні, так і об’єктивні критерії статевої дисфункції [167, 265].
2.12 Оцінка мікробіологічної та клінічної ефективності запропонованої специфічної антимікробної терапії та комбінованої терапії (специфічна плюс імуномодулююча) при елімінації збудників протозойних інвазій та їх патогенних мікробних асоціацій
Пацієнти отримували лікування трихомонадного запалення ССС згідно запропонованого оригінального методу, який передбачав двохетапну терапію. Перший її етап спрямований на досягнення елімінації T. tenax або T. hominis із ССС людини, а другий передбачає терапевтично-реабілітаційні заходи щодо припинення розвитку та профілактики ускладнень з боку шлунково-кишкового тракту. Лікування здійснювали наступним чином: внутрішньо призначали орнідазол по 1,5 на добу. Препарат приймався по 0,5 тричі на добу після їди на протягом 10 діб. У перший день лікування добова доза орнідазолу вживалася за один прийом під час вечері. Наступні 10 днів (з 11 по 20 дні лікування) хворі отримували препарат ніфуротель, який є офіцинальним, по 2 таблетки тричі на добу, незалежно від прийому їди. В Україні ніфуротель реалізовується під торговою назвою «Макмірор», що виробляється компанією «Доппель Фармацеутіці» (Італія). У разі необхідності через 3 – 5 днів після початку специфічної антипротозойної терапії, пацієнтам одночасно індивідуалізовано призначали додаткові препарати групи антибіотиків з метою елімінації з урогенітальної системи інших збудників ІПСШ.
Під час проведення антипротозойної та антибактеріальної терапії призначались також імуномодулюючі препарати з метою підвищення опірності організму. Для запобігання активації грибкової мікрофлори призначали також флуконазол по 100мг перорально через день – 10 прийомів на курс. Крім того, чоловіки, у разі потреби, отримували пальцьовий масаж передміхурової залози та ректальні протизапальні свічки. Жінки отримували щоденні вагінальні спринцювання препаратом цитеал (4 ковпачки препарату на 1 літр кип’яченої води) та піхвові пігулки макмірор-комплекс («Доппель Фармацеутіці», Італія), а також свічки гексикон послідовно протягом 8 та 10 днів, відповідно.
Другий етап лікування передбачав терапевтично-реабілітаційні заходи щодо припинення розвитку та профілактики ускладнень з боку шлунково-кишкового тракту. Призначалась комбінація з пробіотичного та пребіотичного препаратів протягом 20 діб.
Під час лікування пацієнтам суворо заборонялося мати сексуальні контакти, а в контрольний період не дозволявся секс без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції.
Друга група пацієнтів для лікування протозойних уражень ССС, в якості засобів етіотропної терапії ми застосовували послідовно Секнідазол по 2,0 г 1 раз на добу протягом 5 днів та препарат, що містить 0,5 г Орнідазолу та 0,5 г Ципрофлоксацину по 1 пігулці 3 рази на день при вазі більше 70 кг, (або 2 рази на день – при вазі менше 70 кг, 10 днів). Крім того, пацієнти дотримувалися дієти № 5. Чоловіки, у разі потреби, отримували пальцьовий масаж передміхурової залози та ректальні протизапальні свічки. Жінки отримували щоденні вагінальні спринцювання та піхвові пігулки з ніфуротелем та ністатином, а також свічки з хлоргексидином послідовно на протязі 8 та 10 днів, відповідно. Під час лікування пацієнтам суворо заборонялося мати сексуальні контакти, а в контрольний період не дозволявся секс без застосування бар’єрних засобів контрацепції з метою запобігання реінфекції.
2.13 Статистичний аналіз
Статистичне опрацювання результатів проведено з використанням пакету програм STATISTICA 9.0. (StatSoft). Вид ліцензії – Freeware. Аналіз включав внутрішньо групові статистики, а саме – середнє значення (М ± m стандартна помилка середнього – SEM. Для номінальних змінних взаємозв’язок розрахували за допомогою критерію Пірсона (χ2) і критерію Фішера (двобічний), оцінили значущість середніх відмінностей у незалежних вибірках за U-критерієм Манна–Уітні. Рівень достовірності був прийнятий p < 0,05 [49]. Для представлення даних, отриманих в результаті дослідження, використовувалися стандартні методи описової статистики. Для адекватного представлення числових даних попередньо проводилася перевірка поділу на нормальність. У разі вибірки малого обсягу (n <30) для перевірки на нормальність використовувався критерій W Шапіро-Уілкі, якщо обсяг вибірки був достатнім – використовувався критерій χ2. І в тому і в іншому випадку критична область розраховувалася для рівня значущості р = 0,05. У разі, коли поділ не відрізнявся від нормального для надання даних обраховувалось значення середнього арифметичного (М), середнього квадратичного відхилення (σ). Результати досліджень представлені в таблицях у вигляді: середнє арифметичне ± стандартне відхилення (М ± σ).
Математична обробка та аналіз результатів проведених досліджень здійснювались на персональному комп’ютері ІВМ. Для статистичного аналізу даних використовувалась програма MS Excel 2003. Визначали М – середню арифметичну величину, m – її похибку, Р –достовірність різниці середніх величин. Достовірність результатів оцінювали згідно критерію Стьюдента [49].
Матеріали даного розділу опубліковані в таких роботах:
- Пат. на винахід 107910 Україна, МПК С12/Q 1/68 (2006.01), С12/Q 1/04 (2006.01), С12/N15/11 (2006.01). Спосіб визначення присутності Trichomonas tenax у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201407161; заявл. 25.06.2014; опубл. 25.02.15, Бюл. № 4 [91].
- Пат. на винахід 110759 Україна, МПК С12/Q 1/68 (2006.01),С12/Q 1/04 (2006.01),С12/N15/11 (2006.01), С12/R 1/90(2006.01). Спосіб визначення присутності Pentatrichomonas hominis у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201501255; заявл. 16.02.2015; опубл. 10.02.16, Бюл. №3 [92].
- Пат. на винахід 110767 Україна, МПК С12/Q 1/68 (2006.01),С12/Q 1/04 (2006.01),С12/N15/11 (2006.01), С12/R 1/90(2006.01). Спосіб визначення присутності Giardia lamblia у досліджуваному зразку та набір праймерів для його здійснення / Федорич П.В., Зелений С.Б. – заявники та патентовласники. – а201505750; заявл. 11.06.2015 ; опубл. 10.02.16, Бюл. №3 [93].
- Федорич П.В. Обґрунтування та апробація оригінального способу взяття біологічного матеріалу з метою адаптації діагностикума Фемофлор-16 для кількісної детекції анаеробної та мікроаерофільної мікрофлори сечостатевої системи чоловіків. Український науково-медичний молодіжний журнал. 2012. № 2. С. 155–158 [139].
- Федорич П.В. Вопросы рациональной методологии и диагностики урогенитальных инфекций у мужчин. Дерматовенерология и эстетическая медицина. 2014. № 2 (22). С. 56–59 [134].
- Федорич П.В. Определение микрофлоры, ассоциированной с бактериальным вагинозом, в мочеполовой системе мужчин методом полимеразной цепной реакции в реальном времени. Военная медицина. 2015. № 1. С. 57–60 [140].