Міністерство охорони здоров’я України
Вищий державний навчальний заклад України
«Українська медична стоматологічна академія»
На правах рукопису
ЄМЧЕНКО ЯНА ОЛЕКСАНДРІВНА
УДК [616.5-001/-002+616.521]-071-80
ІНДИВІДУАЛІЗАЦІЯ ТЕРАПІЇ ХВОРИХ НА ПСОРІАТИЧНУ ХВОРОБУ
ТА МЕТАБОЛІЧНИЙ СИНДРОМ З УРАХУВАННЯМ ПОКАЗНИКІВ
СИСТЕМНОГО ЗАПАЛЕННЯ
14.01.20 – шкірні та венеричні хвороби
Дисертація на здобуття наукового ступеня
кандидата медичних наук
Науковий керівник:
Іщейкін Костянтин Євгенович
доктор медичних наук,
професор, заслужений діяч науки і техніки України
Полтава – 2016
ЗМІСТ
| Перелік умовних скорочень | 4 |
| Вступ | 5 |
| Розділ 1 Огляд літератури. Сучасні уявлення про патогенез псоріазу, коморбідні захворювання і принципи терапії | 10 |
| 1.1 Роль імунних розладів та системного запалення у механізмі розвитку псоріазу | 10 |
| 1.2 Деякі спільні патогенетичні аспекти псоріазу та метаболічного синдрому | 17 |
| 1.3 Сучасні засоби терапії псоріазу і метаболічного синдрому | 23 |
| Розділ 2 Матеріали та методи досліджень | 30 |
| 2.1 Обґрунтування програми дослідження та принципи формування дослідних груп | 30 |
| 2.2 Методи клінічного обстеження дерматологічного статусу | 35 |
| 2.3 Методи обстеження для діагностики метаболічного синдрому | 38 |
| 2.4 Методи лабораторних досліджень | 40 |
| 2.5 Схема лікування хворих на псоріаз із супутнім метаболічним синдромом | 43 |
| 2.6 Статистичні методи дослідження | 44 |
| Розділ 3 Результати власних досліджень | 45 |
| 3.1 Клінічна характеристика хворих на псоріаз | 45 |
| 3.2 Характеристика компонентів метаболічного синдрому у хворих на псоріаз | 49 |
| 3.3 Характеристика системного запалення у хворих на псоріаз із супутнім метаболічним синдромом | 54 |
| 3.4 Взаємозв’язок клініко-лабораторних показників у хворих на псоріаз та метаболічний синдром | 56 |
| Розділ 4 Оцінка ефективності включення метформіну гідрохлориду до комплексної терапії хворих на вульгарний псоріаз у стаціонарній стадії перебігу, середнього ступеня тяжкості з супутнім метаболічним синдромом | 60 |
| Розділ 5 Аналіз та обговорення результатів | 92 |
| Висновки | 108 |
| Рекомендації | 110 |
| Список використаних джерел | 111 |
| Додаток А Акти впровадження | 113 |
ПЕРЕЛІК УМОВНИХ СКОРОЧЕНЬ
АГ – артеріальна гіпертензія
АЛТ – аланінамінотрансфераза
АСТ – аспартатамінотрансфераза
АТ – артеріальний тиск
вч-CРБ – високочутливий СРБ
ДАТ – діастолічний артеріальний тиск
ДІЯЖ – дерматологічний індекс якості життя
ЗХС – загальний холестерин
ІЛ – інтерлейкін
ІМТ – індекс маси тіла
ІР – інсулінорезистентність
ЛПВЩ – ліпопротеїди високої щільності
ЛПДНЩ – ліпопротеїди дуже низької щільності
ЛПНЩ – ліпопротеїди низької щільності
МС – метаболічний синдром
ОС – окружність стегон
ОТ – окружність талії
ПсА – псоріатичний артрит
САТ – систолічний артеріальний тиск
СЗ – системне запалення
СРБ – С-реактивний білок
ССЗ – серцево-судинні захворювання
ТГ – тригліцериди
ЦД – цукровий діабет
ФНП-α – фактор некрозу пухлини – α
ХС – холестерин
DLQI – Dermatology Life Quality Index
ВСТУП
Актуальність теми. Псоріаз – одне з найбільш розповсюджених хронічних рецидивуючих мультифакторних захворювань шкіри з домінуванням генетичної упередженості, для якого характерні гіперпроліферація епідермальних клітин, порушення процесу кератинізації на тлі запальної реакції в дермі. При псоріазі спостерігається ураження не тільки шкіри, нігтів, суглобів, волосистої частини голови, а й різних органів, у зв’язку з чим останнім часом все частіше використовується термін «псоріатична хвороба», запропонований ще в 1953 р. А.Ф. Ухіним [1, 2, 3, 4, 5, 6].
Останнім часом почастішали випадки коморбідності псоріатичної хвороби та метаболічного синдрому (МС) [7, 8]. У свою чергу МС являє собою комплекс взаємопов’язаних факторів ризику розвитку серцево-судинних захворювань (ССЗ) та цукрового діабету (ЦД). Ці фактори включають дисглікемію, підвищений артеріальний тиск (АТ), підвищений рівень тригліцеридів (ТГ), низький рівень холестерину ліпопротеїдів високої щільності (ЛПВЩ) та ожиріння за абдомінальним типом.
У новітньому вченні про псоріаз важлива патогенетична роль відведена хронічному запаленню, яке поряд з імунопатологічною патогенетичною складовою призводить до метаболічних і судинних порушень. Таким чином, пацієнтів із псоріазом можна віднести до групи ризику з високою ймовірністю виявлення МС [9, 10, 11, 12]. За даними клінічних досліджень, псоріаз сам по собі може бути фактором ризику розвитку атеросклерозу, що узгоджується з відомим уявленням про участь хронічного системного запалення (СЗ) у розвитку захворювань [13]. Клініко-експериментальні дослідження показали, що ключову роль у розвитку атеросклерозу та псоріазу переважно відіграють одні й ті ж цитокіни – інтерлейкін (ІЛ)-1, -6 та фактор некрозу пухлини – α (ФНП-α) [14, 15, 16]. При цих патологічних станах відбувається активація генералізованого неспецифічного запалення і пошкодження ендотелію [13]. Системна запальна відповідь, яка є загальною патогенетичною ланкою при таких патологічних станах, видозмінює перебіг псоріазу, що призводить до тяжкого перебігу, який погано піддається стандартним методам лікування, значно знижує якість життя пацієнтів і нерідко призводить до інвалідизації хворих [17].
Незважаючи на різноманітність методів лікування хворих на псоріаз, незавжди можливо досягти бажаної ефективності без призначення засобів корекції метаболічних порушень та системного запалення [18]. Тому, не дивлячись на успіхи, досягнуті у вивченні патогенезу псоріазу та МС, проблема взаємозв’язку цих захворювань та перспективи їх корекції на сьогодні є актуальними та потребують подальшого дослідження.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота є самостійним фрагментом науково-дослідних робіт кафедри внутрішніх хвороб та медицини невідкладних станів з шкірними та венеричними хворобами Вищого державного навчального закладу України «Українська медична стоматологічна академія» «Роль запальних захворювань зубощелепного апарату в розвитку системного запалення» (номер держреєстрації 0112U001538) і «Розробка стратегії використання епігенетичних механізмів для профілактики та лікування хвороб, пов’язаних із системним запаленням» (номер держреєстрації 0114U000784). Дисертантом виконано фрагменти, присвячені вивченню впливу метформіну гідрохлориду на показники клінічного перебігу, системного запалення та вуглеводного обміну у хворих на псоріаз із супутнім МС, розробці та апробації нового способу комплексної терапії для лікування цих хворих з урахуванням показників СЗ та інсулінорезистентності (ІР).
Мета і задачі дослідження. Мета – підвищення ефективності лікування хворих на псоріаз із супутнім метаболічним синдромом шляхом індивідуалізації ранньої корекції метаболічних порушень та показників системного запалення.
Завдання дослідження:
- Оцінити клінічний перебіг псоріазу з супутнім МС.
- Оцінити рівень системного запалення та характер метаболічних порушень у хворих на псоріаз з супутнім МС.
- Виявити взаємозв’язки між рівнем системного запалення, клінічним перебігом псоріазу та метаболічними порушеннями у обстежених хворих.
- Вивчити динаміку клінічних проявів псоріазу, показників МС та системного запалення у хворих при використанні в комплексі традиційної терапії препарату групи бігуанідів метформіну гідрохлориду.
- Оцінити терапевтичну ефективність запропонованого методу лікування у хворих на псоріаз з супутнім МС в залежності від рівня системного запалення.
Об’єкт дослідження – звичайний псоріаз (стаціонарна стадія, середній ступінь тяжкості).
Предмет дослідження – клінічні прояви, імунне запалення, метаболічний синдром, вуглеводний обмін, результати лікування.
Методи дослідження: анкетування, загальноклінічні, біохімічні, імуноферментні, статистичні.
Наукова новизна отриманих результатів. Вперше на підставі визначення підвищеного рівня показників системного запалення у хворих на псоріаз із супутнім МС та встановлення взаємозв’язку між високочутливим С‑реактивним білком (вч-СРБ), клінічним перебігом та метаболічними порушеннями встановлено, що системна запальна відповідь є загальною ланкою патогенезу цих патологічних станів.
Визначено, що збільшення вмісту вч-СРБ у хворих на псоріаз із супутнім МС сприяє достовірному посиленню інтенсивності клінічних проявів псоріазу, підвищенню рівня цитокінів (інтерлейкіну-6 (ІЛ-6), фактора некрозу пухлини – α (ФНП-α)), вираженості порушень вуглеводного обміну (збільшення індексу інсулінорезистентності) та індексу маси тіла (ІМТ).
Вперше науково обгрунтовано необхідність включення метформіну гідрохлориду в комплексне лікування хворих на стаціонару стадію звичайного псоріазу середнього ступеня тяжкості з супутнім МС.
Доведено, що призначення метформіну гідрохлориду хворим на псоріаз із супутнім МС і високим рівнем системного запалення сприяє значному покращенню клінічного перебігу псоріазу, нормалізації рівня показників системного запалення, вуглеводного обміну порівняно з хворими, у яких рівень системного запалення був нижчим, та пацієнтами, які отримували традиційне лікування.
Практичне значення одержаних результатів. Розроблено та впроваджено в клінічну практику спосіб лікування хворих на псоріатичну хворобу з супутнім МС та підвищеним рівнем показників системного запалення (патент на корисну модель № 106056 від 11.04.16).
Розроблено алгоритм обстеження хворих на псоріаз із супутнім МС із включенням дослідження показників СЗ та вуглеводного обміну.
Підтверджено наявність особливостей клінічного перебігу псоріатичної хвороби на фоні МС.
Встановлено доцільність визначення СЗ у хворих на псоріаз із супутнім МС за рівнем вч-СРБ, що дозволяє їх стратифікувати на групи з високим (>13,9 мг/л) та низьким (<13,9 мг/л) рівнем СЗ.
Доведено клінічну ефективність включення метформіну гідрохлориду до комплексної терапії хворих на псоріаз із супутнім МС, що дозволяє скоротити термін лікування хворих, подовжити ремісію, зменшити кількість рецидивів та, імовірно, попередити розвиток тяжких форм псоріазу, ССЗ і ЦД.
Результати роботи впроваджено в навчальний процес кафедри внутрішніх хвороб та медицини невідкладних станів з шкірними та венеричними хворобами Вищого державного навчального закладу України «Українська медична стоматологічна академія», а також у практичну роботу Полтавського обласного клінічного шкірно-венерологічного диспансеру.
Особистий внесок здобувача. Дисертаційна робота є самостійною працею автора під керівництвом наукового керівника, яким визначені напрямок, мета й завдання дослідження. Дисертантом проведено аналіз літературних, наукових джерел та патентно-інформаційний пошук. Здійснено підбір тематичних хворих та їх комплексне обстеження згідно розробленого плану, проведено лікування пацієнтів. Самостійно написано всі розділи дисертації, проведено статистичну обробка клінічного матеріалу та інтерпретацію отриманих результатів усіх лабораторних методів дослідження, зроблено висновки.
Дисертантом спільно з Кайдашевим І.П., співробітником Вищого державного навчального закладу України «Українська медична стоматологічна академія», виявлено спільні аспекти патогенезу псоріазу та МС, визначено залежність клініко-лабораторних показників від рівня системного запалення у хворих на псоріаз у поєднанні з МС, проведено аналіз захворюваності та поширеності псоріазу.
Дисертантом не запозичено результати та ідеї співавторів публікацій.
Апробація результатів дисертації. Основні результати роботи обговорені на чотирьох обласних науково-практичних конференціях дерматологічної служби Полтавської області: «Системне запалення у хворих на псоріаз із супутнім метаболічним синдромом» (Полтава, 2014), «Аналіз захворюваності та поширеності псоріазу в Полтавській області за період з 2008 по 2013 роки» (Полтава, 2015), «Комплексне лікування хворих на псоріаз хворобу та метаболічний синдром з урахуванням показників системного запалення» (Полтава, 2015), «Вплив метформіну гідрохлорид на показники системного запалення у хворих на псоріатичну хворобу з супутнім метаболічним синдромом» (Полтава, 2015).
Публікації. За матеріалами дисертаційної роботи опубліковано 7 наукових праць, у тому числі 6 статей (з них 2 – в моноавторстві) у спеціалізованих наукових виданнях України, з яких 5 статті надруковано у журналі, що входить до міжнародної наукометричної бази «Російський індекс наукового цитування» та 1 стаття надрукована в іноземному періодичному виданні Грузії, 1 патент на корисну модель.
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУРИ. СУЧАСНІ УЯВЛЕННЯ ПРО ПАТОГЕНЕЗ ПСОРІАЗУ, КОМОРБІДНІ ЗАХВОРЮВАННЯ І ПРИНЦИПИ ТЕРАПІЇ
1.1 Роль імунних розладів та системного запалення у механізмі розвитку псоріазу
Незважаючи на новітні досягнення, псоріаз залишається однією з актуальних проблем сучасної дерматології в зв’язку із значною разповсюдженістю цього захворювання та відсутністю чітких уявлень про етіопатогенез, збільшенням кількості випадків тяжкого перебігу дерматозу, що нерідко призводить до інвалідизації та значно знижує якість життя пацієнтів [17, 19, 20].
Псоріаз у всіх його різних клінічних формах є одним з найбільш поширених хронічних запальних захворюваннь шкіри. За даними Міжнародної Федерації асоціацій псоріазу (International Federation of Psoriasis Associations) поширеність псоріазу в світі коливається в межах 1,2-5 % в загальних популяціях, а середній показник поширеності становить близько 3 % [21, 22, 23].
Незважаючи на значне поширення псоріазу та велику кількість робіт з цієї проблеми, до сих пір немає єдиного погляду на патогенез дерматозу. Переважна більшість дослідників вирішальну роль у механізмах розвитку псоріазу віддає спадковій схильності [24, 25]. Встановлено, що псоріаз є генетично детермінованим захворюванням, про що свідчить високий рівень захворюваності серед близьких родичів: більш висока конкордантність серед близнюків-монозигот, ніж серед дизигот; якщо на псоріаз хворіє один з батьків, ризик розвитку цього захворювання у дитини становить 8 %, якщо обидва – 41 %. Загальновизнано існування двох типів псоріазу. Псоріаз І типу пов’язаний з системою HLA-антигенів (HLA Cw6, HLA B13, HLA B17). Цей тип псоріазу розвивається у 65 % хворих, у більшості з яких дебют захворювання припадає на дитячий і молодий вік (до 25 років). Псоріаз II типу не пов’язаний з системою HLA-антигенів і виникає у більш старшому віці. Проте до цього часу не ідентифіковано ген, який відповідає за розвиток псоріазу [26]. Інші дослідження показали зв’язок генетичних чинників з порушеннями цитокінової регуляції імунної відповіді, які грають важливу роль в патогенезі псоріазу, в тому числі ФНП-α та ІЛ-23 [27; 28]. Взаємодія між різними генетичними факторами вважається складною і їх вплив має кумулятивне значення.
До провокуючих факторів виникнення псоразу відносяться такі як, травматичні, фізичні, хімічні, медикаментозні, біологічні, інфекційні фактори, а також неадаптоване харчування, емоційний та психогенний стреси [24].
На думку інших авторів, у патогенезі псоріазу провідну роль відіграють порушення адапційно-компенсаторних і нейроендокринних механізмів регуляції гомеостазу [24], які тісно пов’язані з внутрішньоклітинним метаболізмом і системою вторинних посередників, зокрема мелатоніну [29]. Залишаються до кінця не обгрунтованими вірусна, імунна і аутоімунна теорії розвитку псоріазу [24, 30]. Так, незважаючи на те, що дані імунологічних досліджень вельми численні, вони суперечливі і часом непорівняні. Можливо, це пов’язано з використанням різних методичних підходів без урахування клінічних особливостей захворювання, стадії процесу, супутньої патології. Більшість дослідників виявляли порушення в Т-клітинній ланці імунітету, які проявляються найчастіше зниженням рівня абсолютного та відносного вмісту Т-лімфоцитів, а саме Т-хелперів (СD4+) на тлі підвищення або зниження Т-супресорів (СD8+), а також зменшенням співвідношення СD4+/СD8+ порівняно зі здоровими особами. Зменшення вмісту Т-лімфоцитів, зокрема Т-хелперів, в периферичній крові дослідники пояснюють їх накопиченням в псоріатичних осередках, а Т-супресорну недостатність розглядають як провідну ланку в патогенезі захворювання. Активація СD4+ Т-лімфоцитів індукує ряд імунологічних реакцій, в тому числі активацію макрофагів, синтезуючих широкий спектр прозапальних медіаторів, в першу чергу цитокінів, таких як ФНП-α і ІЛ-1 [25, 31, 32, 33]. Встановлено, що ФНП-α є ключовим і відіграє найважливішу роль у розвитку псоріазу, а також псоріатичного артриту. ФНП-α виявили як в ураженій шкірі, так і в синовіальній тканині, його рівень корелює з тяжкістю процесу, а застосування специфічних речовин – інгібіторів ФНП-α, як лікарськіх препаратів дає значне клінічне поліпшення [34, 35, 36, 37, 38].
Для псоріатичної хвороби характерні гіперпроліферація епідермальних клітин, порушення процесу кератинізації на тлі запальної реакції в дермі, експресія молекул адгезії на ендотеліальних клітинах та підсилення ангіогенезу. Ці процеси опосередкуються, головним чином, активованими Т-лімфоцитами або клітинами Лангерганса та антигенпрезентуючими клітинами, які синтезують різні хемокіни та цитокіни. Встановлено особливості системної продукції та місцевого синтезу цитокінів у хворих на псоріаз, які проявляються достовірним збільшенням в сироватці крові вмісту прозапальних цитокінів – ІЛ-1β, ІЛ-6, IЛ-9, IЛ-12 (p40), IЛ-13, IЛ-16, IЛ-18, ФНП-α, інтерферону-γ, Th1‑цитокінів – інтерферону-γ; Th2-цитокінів – ІЛ-5, хемокінів, а також факторів імуногемопоезу, ростових факторів та адгезійних молекул [39, 40, 41].
У розвитку запалення місцеві механізми превалюють над системними, що обумовлено стазом і бар’єрними властивостями місцевого ураження. Їх порушення при псоріазі веде до виходу в кровотік підвищеної кількості цитокінів (зокрема, ІЛ-1, ФНП-α), що стимулюють виробництво білків гострої фази: С-реактивного білка (СРБ), компонентів комплементу, лактоферин та ін. Паралельно при системній дії цитокінів, які надходять з осередка запалення, активується гіпофіз-надниркова система, дія гормонів якої спрямована на пригнічення процесів вторинної альтерації тканини в осередку ураження, що автоматично призводить до зниження концентрації цитокінів, які надходять у кровотік. Під дією глюкокортикоїдів розвивається імуносупресія, що дозволяє уникнути надмірності імунної відповіді. Однак можливості її не безмежні і у хворих з часом розвивається гіпокортицизм. Вважається, що резервна здатність кори надниркових залоз у хворих на псоріаз зберігається в перші роки захворювання, а потім їх функція виснажується. Дослідження симпатико-адреналової системи у хворих на псоріаз виявило істотне зниження її функціональної активності [42, 43, 44]. Виснаження гіпофізарно-надниркової та симпатико-адреналової систем призводить до посилення дії цитокінів, серед яких провідне місце належить ФНП-α.
ФНП-α виробляється макрофагами, лімфоцитами, адипоцитами, тучними ними клітинами [42, 45, 46]. Його рівень підвищений як в крові, так і в уражених тканинах при важких формах псоріазу, а також у синовіальній рідині при псоріатичному артриті (ПсА) і знаходяться в прямій залежності від активності патологічного процесу. В результаті ефективної терапії встановлено закономірне зниження концентрації цього цитокіну [47]. Варто відзначити, що в сироватці крові рівень ФНП-α значно нижчий, ніж в тканинній рідині, що передбачає його місцеву продукцію [48].
ФНП-α має здатність підвищувати експресію адгезивних молекул на ендотеліальних клітинах і кератиноцитах, мобілізуючи циркулюючі клітини, які беруть участь в запальних реакціях до місця локального запалення тканини; індукувати синтез прозапальних цитокінів Т-лімфоцитами і макрофагами, що викликають запальну реакцію, індукувати синтез фактора росту клітин ендотелію, стимулювати синтез білків гострої фази в печінці, роз’єднувати процеси окислення і фосфорилювання в мітохондріях, направляючи потік електронів не на утворення аденозинтрифосфату, а на відновлення молекулярного кисню, що перешкоджає акумуляції енергії і стимулює її розсіювання в вигляді тепла [42, 49].
ІЛ-6 утворюється у всіх клітинах шкіри, включаючи як неушкоджені, так і пошкоджені псоріазом кератиноцити, моноцити, клітини Лангерганса, а також меланоцити [42, 48, 50, 51, 52]. Його утворення активують ІЛ-1 і ФНП-a [42, 53]. Підвищений рівень ІЛ-6 і його рецепторів виявлено в епідермісі псоріатичних висипань, міжклітинній рідині папул, на фібробластах і навіть в кератиноцитах. Рівні ІЛ-6 в тканинній рідині псоріатичних елементів значно вищі, ніж у непошкодженій псоріазом шкірі, шкірі здорових людей та сироватці крові. Рівень ІЛ-6 достовірно вище в прогресуючу стадію псоріазу в порівнянні зі стаціонарною стадією. В результаті ефективної терапії встановлено закономірне зниження концентрації цього цитокіну [48, 54]. ІЛ-6 має виражену пірогенну дію, а також є індуктором термінального диференціювання В‑лімфоцитів в антитілопродукуючі клітини і диференцируючим фактором для цитотоксичних Т-лімфоцитів, стимулює активність природних кілерних клітин, викликає продукцію білків гострої фази, діє як фактори хемотаксису Т-клітин, стимулюючи міграцію Т-клітин в епідерміс [42].
Така клінічна особливість псоріазу, як лущення, асоційована з гіперкератозом, свербежем, запаленням та сухістю рогового шару епідермісу [49]. Внаслідок, напевне, генетично детермінованої патологічної проліферативної активності кератиноцитів та метаболічних зрушень відбуваються структурні та функціональні зміни епідермісу, особливо рогового шару. На клітинному рівні це характеризується прискореною реорганізацією кератиноцитів та скороченим клітинним циклом, крім того, змінюється процес десквамації. При цьому клітинно-біологічна ціль диференціювання не досягається або здійснюється неповністю, внаслідок чого формуються неповноцінні кератиноцити. В результаті клітини, які утворюють верхній шар, не встигають відмирати і відлущуватися, а нові кератиноцити нашаровуються товстими наростами гіперкератозу [55].
Патологічний процес при псоріазі включає в себе також комплекс імунологічних реакцій шкіри з розвитком тяжкого запального процесу, епідермальною гіперпроліферацією з формуванням аномальної диференціації кератиноцитів. Після активації імунокомпетентних елементів на кератиноцитах і дендритних клітинах, відбувається активація Т-лімфоцитів, які мігрують в шкіру. Хомінг-рецептори, залучені в процес запалення, експресуються на поверхні клітин (cutaneus lymphocyte associated antigen, CLA). Під впливом цитокінів (ІЛ-12, ІЛ-23) зростають субпопуляції деяких функціональних Т‑клітин. До них відносяться Th1 і Th17 клітини, які в свою чергу, виробляють прозапальні цитокіни (ФНП-α, ІЛ-2, ІЛ-17 та ІЛ-22) [56, 57].
Ці процеси обумовлюють запальну реакцію при псоріазі, яка відбувається за участю імунокомпетентних клітин на місцевому рівні, а саме ендотелію, фібробластів та кератиноцитів, що підсилюють імунну реакцію шкіри через експресію молекул адгезії та інших імунологічних месенжерів. В результаті цього каскаду імунопатологічних реакцій виникає міграція нейтрофільних гранулоцитів, що є причиною утворення типових для псоріатичного ураження стерильних епідермальних мікроабсцесів. Збільшена проліферативна активність та аномальне дозрівання кератиноцитів є чинником гіперкератозу, який є характерною патогенетичною рисою псоріазу. При пустульозному варіанті клінічного перебігу псоріазу спостерігається сильна запальна реакція шкіри з більш вираженою міграцією нейтрофілів [58, 59]. Разом з тим, данне захворювання проявляється не тільки ураженням шкірних покривів, стадійністю, тяжкістю перебігу, а й можливим залученням до патологічного процесу опорно-рухового апарату та внутрішніх органів [60].
За даними клінічних досліджень, псоріаз сам по собі може бути фактором ризику розвитку атеросклерозу, що узгоджується з відомим уявленням про участь хронічного системного запалення у розвитку захворювання [61]. Показано, що надлишковий викид цитокінів в розвитку запальної реакції при загостренні псоріазу сприяє зміні співвідношення фракцій ліпопротеїдів крові [39, 40]. На фоні постійної ендогенної інтоксикації при загостренні псоріазу відзначено дисбаланс антиоксидантної системи, який спричиняє підвищення ліпопероксидації в тканинах та збільшення фракції модифікованих ліпопротеїдів низької щільності (ЛПНЩ), які надають цитотоксичну пошкоджуючу дію на ендотеліальні клітини судин і сприяють атеросклерозу [62].
При ПсА як у шкірі, так і суглобах спостерігаються виражені лімфоцитарні інфільтрати, обмежені сосочками дерми у шкірі та підстилаючим шаром строми у суглобах, запалення ентезису. Ключовими клітинами запалення у шкірі та суглобах є T-лімфоцити, зокрема, субпопуляція CD41 клітин. При цьому у синовіальній рідині співвідношення CD41/CD81 на рівні 2:1, що відповідає аналогічному співвідношенню, характерному для периферійної крові. У ділянці ентезису більш поширеною є CD81 субпопуляція T-клітин. Для синовіальної тканини при ПсА характерною є наявність Т‑клітинних інфільтратів, посилена васкуляризація та зниження кількості макрофагів порівняно зі змінами у синовіальній тканині, характерними для ревматоїдного артриту [63]. На відміну від шкіри, популяція лімфоцитів синовіальної тканини не виявляє ознак стимуляції шкірним лімфоцитарним антигеном, що свідчить про міграцію до шкіри та синовіальної тканини різних популяцій лімфоцитів. Підвищення рівнів сироваткового білка р40 (загальна субодиниця, присутня у структурі як ІЛ-12 так і ІЛ-23), виявлене у пацієнтів з ПсА порівняно зі здоровими особами з групи контролю, свідчить про гіпотетично важливу роль інтерлейкінів ІЛ-12/23 у патогенезі ПсА [49, 64, 65, 66, 67].
Виявлене підвищення інтенсивності міграції нейтрофілів при ПсА збігається з добре описаним явищем нейтрофільної інфільтрації, яке спостерігається в уражених псоріазом ділянках шкіри, та з наявністю нейтрофілів в ураженій ПсА синовіальній мембрані, які позитивні за рецепторами до фактора росту ендотелію судин.
Ангіогенез є характерним проявом ранніх етапів розвитку псоріазу та ПсА [38]. Наявність у шкірі та суглобах подовжених та звивистих судин свідчить про утворення незрілих судин внаслідок порушення регуляції ангіогенезу [68, 69, 70, 71]. Аналіз відеозображень судин мікроциркуляторного русла шкіри здорових і хворих на псоріаз продемонстрував у останніх 4-кратне збільшення кількості ендотеліальних клітин тільки поверхневої сітки без гіперплазії ендотелію судин глибокого судинного сплетіння. Дослідження з використанням дезоксиуридину показали, що ендотеліальний індекс проліферації складає 2,7 %, в той час як дослідження з використанням моноклональних антитіл до маркеру проліферації Ki-67 визначили збільшення індексу ендотеліальної проліферації до 3,1 % [72].
У суглобовій рідині пацієнтів з раннім ПсА наявні у великих концентраціях ФНП-a, ІЛ-8, ІЛ-6, ІЛ-1, ІЛ-10 та матриксні металопротеїнази. На ранніх етапах захворювання починається розпад колагену хрящової тканини під дією колагеназ; цей процес може розвиватись внаслідок обумовленого впливом цитокінів утворення протеаз [28, 58, 73, 74, 75].
1.2 Деякі спільні патогенетичні аспекти псоріазу та метаболічного синдрому
Відомо, що пацієнти, які страждають на псоріаз, мають значну схильність до низки важких захворювань, зокрема, депресії, деяких видів новоутворень. Також, значною мірою, у таких хворих підвищено ризик виникнення серцево-судинної патології та метаболічних розладів. Цю концепцію переконливо доводять численні наукові дослідження, проведені в різних країнах світу. Відмічений тісний зв’язок псоріазу з факторами ризику МС, дисліпідемії, гіпертонії, ЦД ІІ типу, ожиріння [76, 77, 78].
Майже половина хворих на псоріаз у віці старше 65 років мають 2-3 коморбідні захворювання [79]. При тяжкому псоріазі артеріальна гіпертензія зустрічалася у 20 % (в контрольній групі у 11,9 %), ЦД у 7,1 % (відповідно у 3,3 %), ожиріння у 20,7 % (у 13,2 %), гіперліпідемія у 6 % хворих (у 3,3 %) [80]. При більш легкому перебігу дерматозу відмінності менш виражені, однак зберігали статистичну значимість. Подібні дані одержані при аналізі хворих на псоріаз в дослідженні EXPRESS-II з інфліксимабом [81]. Частота випадків цукрового діабету склала 9,9 %, артеріальної гіпертензії (АГ) – 21,1 %, гіперліпідемії – 18,4 %, що перевищує показники в загальній популяції [82].
В останні роки все більше уваги при дослідженнях патогенезу псоріазу приділяється порушенням метаболічних процесів [24, 83]. Так, відомі повідомлення про порушення гліцинкон’югуючої функції печінки при псоріазі, оскільки встановлено взаємозв’язок між збільшенням концентрації некон’югованих жовчних кислот (дезоксихолієва і холієва) з торпідним та рецидивуючим перебігом захворювання [24]. Односпрямоване збільшення вмісту загальних ліпідів, фосфоліпідів, триацилгліцеридів і холестеролу як в епідермісі, так і в плазмі крові хворих на псоріаз підтверджують патогенетичну роль порушень ліпідного обміну [24, 82].
Передбачається, що в основі розвитку абдомінального ожиріння, цирозу печінки, АГ, дісліпопротеїдемії, порушенні толерантності до глюкози без розвитку ЦД, підвищеного вмісту в плазмі крові сечової кислоти, які останнім часом отримали назву МС, лежать загальні патогенетичні механізми, а причинами, які призводять до його розвитку, є імунологічні порушення і генетичні дефекти. Проміжною ланкою формування МС вважається ІР, яка являє собою знижену чутливість тканин до стимуляції інсуліном споживання глюкози. ІР пов’язують зі спадковими пострецепторними дефектами інсулінзалежного транспорту глюкози [84].
Особливістю патогенезу у хворих на псоріаз з ожирінням, на відміну від хворих без надмірної маси тіла є статистично значиме зростання гіперлептинемії (вище ніж у 2 рази) і збільшення системного цитокінового прозапального потенціалу (зростання ФНП-α на 74 %, ІЛ-1β – на 27 %). В експериментальній моделі культури клітин у хворих на псоріаз із ожирінням доведено можливість лептин-залежного підвищення місцевого (на рівні шкіри) цитокінового потенціалу (синтез кератиноцитами прозапальних цитокінів ФНП-α і ІЛ-1β), а також достовірне зниження останнього під впливом акарбози [85].
Поряд з генетично обумовленими дефектами вуглеводного обміну розвитку ІР сприяє також і абдомінальне ожиріння з переважною локалізаціей жиру в черевній порожнині, яке може бути першопричинним фактором розвитку різних проявів МС. При стресах абдомінальний жир (жир сальника і брижі) піддається ліполізу і в портальну вену потрапляє значна кількість вільних жирних кислот, які надходять у печінку, де вони повинні утилізуватися. Один шлях утилізації вільних жирних кислот, що масивно надходять до печінки при ліполізі абдомінального жиру – їх перетворення на глюкозу через процеси глюконеогенезу. При утилізації вільних жирних кислот цим шляхом печінка секретує в кровотік надлишкову кількість глюкози, внаслідок чого розвивається гіперглікемія, у відповідь на яку знижується рівень видалення інсуліну печінкою із кровотоку, що сприяє гіперінсулінемії, а це в свою чергу – розвитку ІР тканин.
Другий шлях утилізації вільних жирних кислот, які надходять до печінки – синтез ТГ, при якому посилюється секреція в кров ліпопротеїдів дуже низької щільності (ЛПДНЩ). Розвивається гіперліпідемія з підвищеною концентрацією в плазмі крові ТГ за рахунок ЛПДНЩ, яка супроводжується появою в крові підвищеного рівня холестерину (ХС) внаслідок збільшення концентрації ЛПНЩ у зв’язку з тим, що в кровотоці секретовані ЛПДНЩ піддаються дії ліполітичних ферментів – ліпопротеїдліпази і печінкової ліпази. Після розпаду ТГ великі частки ЛПДНЩ перетворюється в частинки ліпопротеїдів проміжної щільності, які після дії на них печінкової ліпази перетворюються на частки ЛПНЩ, представлені субфракцією дрібних щільних частинок. Ці дрібні щільні ЛПНЩ, характерні для ліпідного спектру при МС, високоатерогенні. Маючи незначну спорідненість до ЛПНЩ-рецепторів, вони довго циркулюють у кровотоці, окислюються, утворюючи хімічно модифіковані ЛПНЩ, які легко і неконтрольовано захоплюються макрофагами. Останні відіграють важливу роль у розвитку атеросклеротичної бляшки, яка легко розривається, а на її місці розвивається тромбоз [24, 86, 87].
Розвитку атеросклеротичного ураження судин сприяє і порушення функцій їх ендотелію. Одним з пошкоджуючих ендотелій факторів є дисліпопротеїдемія з підвищеним вмістом в плазмі крові ЛПНЩ і зниження вмісту ЛПВЩ, які здійснюють відтік ХС в печінку, де він катаболізує до жовчних кислот. Компенсаторною відповіддю на резистентність тканин до інсуліну незалежно від її першопричини є збільшення синтезу інсуліну в бета-клітинах підшлункової залози та його надлишкова секреція в кров [88, 89, 90]. Гіперінсулінемія, як закономірний наслідок ІР, веде до активації симпатоадреналової системи з підвищенням вмісту в крові катехоламінів, реніну, ангіотензину, а також до підвищення реабсорбції іонів натрію у печінкових канальцях, до проліферації гладком’язових клітин в артеріальній стінці, їх спазмування, що призводить до АГ [91, 92, 93, 94].
Гіперінсулінемія призводить до зниження активності ферменту ліпопротеїдліпази, що сприяє розвитку гіпертригліцеридемії, а також до підвищення апетиту, що сприяє ожирінню. У результаті ІР (гіперінсулінемія), гіперліпідемія та ожиріння посилюють одне одного [95, 96]. У процесі формування МС можливі поєднання не всіх, а лише двох-трьох його компонентів, наприклад, абдомінального ожиріння, АГ та гіперліпідемії без ІР у вигляді порушеної толерантності до глюкози або гіперінсулінемії. Проте вже при наявності поєднання АГ з ожирінням по абдомінальному типу можна говорити про прояви прихованої ІР, навіть якщо тест на толерантність до глюкози (індекс HOMA-IR) ще не виявив порушень. При цьому доцільно виділяти серед хворих на псоріаз осіб з поєднанням всього лише двох-трьох компонентів МС з метою призначення їм патогенетичної терапії, так як такі хворі зустрічаються набагато частіше, ніж особи з повним метаболічним синдромом.
В останні роки визначається збільшення поширеності МС серед населення індустріальних країн, у тому числі і серед хворих на псоріатичну хворобу, в 40-50 % випадків є наслідком впливу таких зовнішніх факторів, як хронічне переїдання і малорухливий спосіб життя на фоні генетичної схильності. Важливо пам’ятати, що клінічно виражене порушення толерантності до глюкози як прояв ІР, часто є лабільним. Толерантність до глюкози може стати нормальною при усуненні інших факторів метаболічного синдрому. При відсутності у хворих генетичного дефекту чи неможливості генетичного терапевтичного підходу, профілактичні заходи повинні бути спрямовані на зниження концентрації інсуліну в плазмі крові [24, 97, 98, 99].
Автори дослідження вказують на високі циркулюючі рівні лептину в осіб із псоріазом, що може бути спричинене не тільки жировою тканиною, але й запаленням. Розроблено заходи, які можуть скоротити рівень лептину – зменшення маси тіла істотно знизить рівень лептину й поліпшить чутливість до інсуліну, може зменшити вірогідність розвитку МС й несприятливих серцево-судинних захворювань [100].
Більшість дослідників дотримуються думки про те, що розвиток патологічних процесів при псоріазі не обмежується формуванням уражень тільки шкіри, а призводить до порушень функції різних органів і систем організму [100]. Вивченню таких супутніх псоріазу вісцеральних патологій присвячена низка робіт, у яких досліджується питання про взаємозв’язки, взаємозалежності та взаємообумовленості їх та проявів псоріазу. Такі дослідження дозволяють більш повно визначити суть псоріатичної хвороби й глибше зрозуміти її патогенез.
При проведенні порівняльного аналізу значення виявлених при псоріазі патологічних змін вмісту циклічних нуклеотидів у тканинах, нейрогуморального регулювання та обміну речовин (ліпідів, електролітів, білків тощо), морфофункціональних розладів мікроциркуляторного русла привертає увагу їхня спільність з такими ж показниками при порушеннях гемодинаміки, а точніше при ессенціальній АГ (гіпертонічна хвороба). З огляду на це, можна припустити наявність взаємозв’язку та взаємообумовленості псоріазу та гіпертонічної хвороби [62]. Запалення є фактором ризику розвитку підвищеного кров’яного тиску й може також сприяти резистентності до інсуліну, попередженню діабетичної стадії, коли організм не реагує на глюкозу, регулюючи вміст гормону інсуліну. Крім того, системне застосування стероїдної терапії або інші методи лікування псоріазу можуть сприяти розвитку діабету або гіпертонії [100, 101].
Доведено, що в основі МС лежить ІР (зниження дії інсуліну, спрямованого на стимуляцію утилізації глюкози тканинами за нормальної концентрації інсуліну) з подальшим компенсаторним зростанням вмісту інсуліну в крові (гіперінсулінемія), що зумовлює підвищення АТ за рахунок активної симпатичної нервової системи, гіперволемії, посилення проліферації гладеньких м’язових клітин судин (звужуючи їх просвіт), посилення чутливості судин до дії вазоконстриктів, а також дисфункції ендотелію. Системна запальна відповідь при таких патологічних станах, ймовірно, видозмінює перебіг псоріазу з можливим розвитком ССЗ та ЦД [102, 103, 104, 105, 106].
Цитокіни, ФНП-α, які відіграють важливу роль у патофізіології псоріазу, мають також важливе значення для патогенезу ожиріння. Доведено, що лептин (гормон насичення) має багатогранну імунологічну дію, зокрема стимулює проліферацію Т-лімфоцитів і продукцію ФНП-α у жировій тканині, отже, може бути спільною ланкою в розвитку псоріазу й ожиріння [107].
МС являє собою комплекс взаємопов’язаних факторів ризику розвитку ССЗ та ЦД. Ці фактори включають дисглікемію, підвищений АТ, підвищенний рівень ТГ, низький рівень холестерину ЛПВЩ та ожиріння (особливо центральне) [108, 109, 110, 111, 112]. У генезі МС велике значення мають генетичні дефекти. На сьогодні актуальною є проблема етіології МС: нез’ясованим залишається питання – чи винекнення цієї патології зумовлене однією певною причиною, чи її розвиток може бути прискорений внаслідок дії різних факторів. Найважливішими факторами ризику розвитку МС є ожиріння за абдомінальним типом та ІР. Інші стани поєднані з синдромом, включають малорухливий спосіб життя, старіння, гормональний дисбаланс, генетичну та етнічну схильність. В останні роки встановлена суттєва роль у розвитку МС ядерних транскрипційних факторів пероксисом проліфератор-активуючих рецепторів. Наявність деяких мутантних генів пероксисом проліфератор-активуючих рецепторів супроводжується розвитком тяжкої ІР з ліподистрофією та АГ. Рецептори, активують проліферацію пероксисом, а особливо пероксисом проліфератор-активуючих рецепторів -α та пероксисом проліфератор-активуючих рецепторів -γ здійснюють негативний регуляторний вплив на перебіг запального процесу та впливають на функціанування Т-лімфоцитів, моноцитів, макрофагів, дендритних клітин та опасистих клітин [113, 114, 115, 116].
Поширеність МС удвічі перевищує розповсюдженість ЦД, та в наступні 25 років очікується збільшення темпів його зростання на 50 % [113].
Відомо, що МС виявляється у 22-35 % жителів США, а дане спостереження демонструє високий рівень цієї патології і в країнах третього світу, що вимагає адекватної діагностики і лікування [117].
Отже, МС слід розглядати як важливу медико-соціальну проблему. Проведено понад 20 широкомасштабних досліджень на 5 континентах, що дало можливість оцінити тенденцію поширення МС в усьому світі. Загалом у популяції дорослого населення (30-69 років) МС виявляється в 15-25 % випадків. Не так давно були отримані результати російського дослідження, в якому показано, що МС зустрічається в 20,6 % дорослого населення, причому в жінок удвічі частіше; з віком число хворих збільшується [118, 119]. При проведенні дослідження в сільському районі Полтавської області виявлено, що серед чоловіків 35-68 років поширеність МС становила 2800 на 10 000 населення [113, 120].
Критерії для клінічної діагностики МС, які приняті IDF та AHA/NHLBI (у 2005 р. з модифікацією у 2009 р.) свідчать, що наявність 3 з 5 факторів, таких як: збільшення окружності таліі (визначається специфічно для країни або популяції); підвищення рівня ТГ (≥150 мг/дл або 1,7 ммоль/л); зниження рівня холестерину ЛПВЩ (<40 мг/дл або 1,0 ммоль/л) у чоловіків та (<50 мг/дл або 1,3 ммоль/л) у жінок; підвищення АТ ≥130 мм рт.ст. – систолічного та/або ≥ 85 мм рт.ст. – діастолічного; підвищення рівня глюкози натщесерце ≥ 110 мг/дл є достатніми для діагностики МС [11, 121, 122, 123, 124].
1.3 Сучасні засоби терапії псоріазу і метаболічного синдрому
Лікування псоріазу як системного захворювання спрямоване, по-перше, на гальмування Т-клітинної активації та/або екстравазації, по-друге, блокаду цитокінів та їх рецепторів, моноклональні антитіла до цитокінів їх рецепторів, по-третє, гальмування проліферації кератиноцитів [125, 126, 127].
Незалежно від стадії і клінічної форми хворі на псоріаз повинні дотримуватися визначених рекомендацій по харчуванню та догляду за шкірою [128, 129, 130, 131]. Лікувальне харчування є важливою складовою комплексної терапії в зв’язку з наявністю «синдрому негерметичного кишечника» і метаболічних розладів. В більшості випадків загострення мають легкий або помірний характер (висипання займають менше 10 % поверхні тіла) і підлягають, як правило, лікування з використанням засобів зовнішньої терапії. При помірному і тяжкому перебігу хвороби (PASI більше 10) проводиться комплексне лікування із застосуванням фототерапії, імуносупресорів, системних ретиноїдів, біологічної терапії [130, 132, 133, 134, 135, 136].
Загальновизнаним є призначення засобів місцевого лікування з урахуванням стадії, тяжкості захворювання та локалізації осередків ураження. Поряд з традиційними мазями, що містять саліцилову кислоту, сірку, дьоготь, нафталан, іхтіол, сечовину, активно застосовуються топічні глюкокортикостероїди, що належать до патогенетичної терапії першої лінії при легкому або середньотяжкому ураженні шкіри, тільки при відсутності клінічного ефекту від монотерапії топічними засобами або їх комбінаціями розглядається можливість інших видів лікування. Численні клінічні дослідження переконливо продемонстрували високу ефективність і безпеку топічних глюкокортикостероїдів останнього покоління (мометазону фуроат, метилпреднізолону ацепонат, гідрокортизону бутирата та ін.) при псоріазі та інших хронічних стероїдчутливих дерматозах [137, 138, 139]. Одним з напрямків зовнішнього лікування псоріазу є препарати, що містять як діючу речовину синтетичний аналог активного метаболіту вітаміну D – кальципотріол [140, 141].
Усі системні методи лікування псоріазу (глюкокортикостероїди, циклоспорин А, метотрексат, ацитретин та ін.) застосовуються відносно короткими курсами в зв’язку зі значним спектром клінічно значущих побічних ефектів [142, 143, 144, 145, 146]. Більшість дерматологів уникають призначення системних кортикостероїдів при лікуванні хворих на псоріаз через потенційний ризик загострення, розвиток еритродермії і пустульозу на тлі їх скасування [130, 147, 148, 149]. Цитостатичний препарат метотрексат пригнічує дегідрофолат-редуктазу і тимідилат-синтетазу, таким чином зменшується синтез ДНК і РНК, накопичується аденозин, що призводить до зменшення проліферації клітин та імунного запалення при псоріазі. Сучасна терапія важкого псоріазу заснована на використанні нових терапевтичних біотехнологій, так званих біологічних агентів: інфліксимабу, устекінумабу, адалімумабу, алефацепту та ін. [150, 151, 152, 153, 154, 155].
Серед усіх сучасних ефективних методів лікування провідне місце займає світлолікування. Фототерапія є ефективним, безпечним, економічно обґрунтованим методом на відміну від системної імуносупрессівной і біологічної терапії. Для лікування псоріазу застосовують фото-хіміотерапію – поєднання довгохвильового ультрафіолетового опромінення і фотосенсибілізатора всередину; селективну фототерапію – комбінація средньохвильового і довгохвильового опромінення; вузькохвильову фототерапію (довжина хвилі 311 нм) [156, 157, 158, 159]. Фотоімунологічний ефект світлолікування обумовлений глибиною проникнення ультрафіолетового опромінення. Ультрафіолетові В промені впливають в основному на епідермальні кератиноцити і клітини Лангерганса, а ультрафіолетові А промені проникають в більш глибокі шари шкіри і надають дію на дермальні фібробласти, дендритичні клітини і клітини запального інфільтрату. Ультрафіолетове опромінення викликає локальну імуносупресію шляхом прямого впливу на клітини Лангерганса і побічно – на численні прозапальні цитокіни і молекули адгезії, що створює умови для перемикання імунної відповіді з Th1 на Th2. Інші ефекти фототерапії пов’язані з інгібуванням епідермальної гіперпроліферації та ангіогенезу, селективним зменшенням Т‑лімфоцитів у псоріатичній шкірі в результаті їх апоптозу [160].
Широко використовуються в лікуванні звичайного псоріазу і додаткові методи – вітаміни групи В, аскорбінова кислота, фолієва кислота, вітаміни А, Е, РР, седативні засоби, гепатопротектори [161, 162, 163].
Існує думка, згідно з якою інгібітори гідроксиметилглутарил-КоА-редуктази – статини можуть застосовуватися в терапії хворих на хронічні запальні захворювання шкіри, в тому числі і псорізу [164]. Сьогодні не викликає сумнівів наявність у статинів неліпідних, плейотропних ефектів. Органопротективні ефекти статинів (у першу чергу сприятливий вплив на функцію ендотелію та медіатори запалення, антитромботична і антипроліферативна дія) розвиваються значно швидше, ніж знижується рівень ХС крові. У літературі представлені результати застосування статинів (симвастатин, аторвастатин, розувастатин) у хворих на псоріаз [165].
Всі хворі на псоріаз підлягають диспансерному спостереженню, в процесі якого вирішуються питання консультування іншими фахівцями, підтримуючої терапії, курортного лікування.
Проте не завжди можливо досягти бажаної ефективності, незважаючи на різноманітність методів лікування, хворих на псоріаз без призначення засобів корекції метаболічних порушень та системного запалення [166].
Основні підходи до лікування МС включають: 1) заходи, направлені на зниження маси тіла (медикаментозні та немедикаментозні); 2) препарати, які підвищують чутливість тканин до інсуліну (тіозолідиндіони, бігуаніди); 3) медикаментозне лікування основних проявів МС (гіпотензивна терапія, пероральні цукрознижуючі препарати, гіполіпідемічну терапію) [167].
Враховуючи те, що МС є захворюванням способу життя, тому і починати лікування необхідно зі зміни способу життя, яке включає дієту (правильне харчування), розширення фізичних навантажень і зменшення або усунення стресових ситуацій. Успіх лікування багато в чому залежить від того, наскільки пацієнт залучений в програму терапії, від його знань про своє захворювання, мотивації, поведінки, навчання принципам самоконтролю, тобто від компетентності пацієнта.
Метою дієти є усунення постпрандіальної гіперглікемії, гіперглікемії натще і зниження надмірної маси тіла, оскільки ожиріння сприяє прогресуванню діабетичних ускладнень. Так обмеження в їжі кількості продуктів з насиченими жирними кислотами і збільшення поліненасиченими – підвищують чутливість тканин до інсуліну. При цьому спостерігається зниження АТ і поліпшення ліпідограми. Так, за даними Дж. Джадд і співавторів (1989), обмеження насиченого жиру в їжі з 37 до 25 % від загальної калорійності протягом 3 тижнів призводить до вірогідного зменшення артеріального тиску. З’явилися дані про зниження АТ і атерогенності плазми у хворих есенціальною гіпертензією при включенні в дієту поліненасичених омега-3-жирних кислот, що містяться в жирі риб [168, 169, 170, 171].
Другим важливим чинником лікування ЦД 2 типу є розширення фізичної активності. Фізичні навантаження не тільки позитивно впливають на показники глікемії, сприяючи утилізації глюкози м’язами, але і покращують жировий обмін, сприятливо впливають на серцево-судинну систему, викликають позитивні емоції і допомагають протистояти стресовим ситуаціям, призводять до зниження ІР та гіперінсулінемії. Фізичні навантаження повинні бути індивідуалізовані з урахуванням віку хворого, ускладнень ЦД і супутніх захворювань. Пацієнтам із ЦД 2 типу достатньо 30-45 хвилин щоденної ходьби 2-3 рази на тиждень. Заохочується систематичне фізичне навантаження, яке відповідає можливостям пацієнта, його бажанням і стилю життя. Дієта та фізичні навантаження – це два наріжних камені, що лежать в основі лікування ЦД 2 типу [172].
Але, на жаль, багато хворих, особливо літнього віку, не завжди дотримуються дієти і не в змозі істотно розширити режим фізичних навантажень через наявність захворювань суглобів, ішемічної хвороби серця, важкої АГ, серцево-легеневої недостатності.
Тому, якщо за допомогою правильного харчування і фізичних вправ не вдається досягти хороших чи задовільних показників компенсації вуглеводного обміну, хворим на ЦД 2 типу необхідно призначити медикаментозне лікування.
Патогенетична терапія, тобто вплив на патофізіологічні механізми, що лежать в основі розвитку захворювання, є найбільш раціональним підходом до лікування такого складного захворювання, як МС. При такому підході призначення патогенетично обгрунтованого препарату може усунути необхідність застосування великої кількості ліків [173].
Виходячи з визначальної ролі ІР та супутньої їй гіперінсулінемії в розвитку МС, обгрунтовано лікування пацієнтів з МС та у період дебюту захворювання, до формування стійкого зниження секреторної функції β-клітин підшлункової залози, особливо при надмірній масі тіла або ожирінні, препаратами вибору є засоби, що знижують ІР периферичних тканин та відновлюють нормальну чутливість до інсуліну печінки, жирової і м’язової тканини. До таких препаратів належать бігуаніди.
В даний час першим препаратом вибору для досягнення хорошого метаболічного контролю глюкози при недостатній ефективності дієти і розширення фізичних навантажень у хворих на ЦД 2 типу та ІР з надмірною масою тіла та ожирінням є метформін.
Метформін – представник групи бігуанідів. Останнім часом дискутується питання про його профілактичне призначення хворим з МС. У 20-літньому британському дослідженні по лікуванню ЦД (UKPDS) показано, що у групі осіб з надлишковою масою тіла або ожирінням тільки використання метформіну дозволило достовірно знизити рівень смертності, обумовленої ЦД, на 42 %, ризик розвитку інфаркту міокарда – на 39 %, церебрального інсульту – на 41 %, розвиток всіх ускладнень ЦД – на 32 %. Крім того, використання метформіну знизило частоту приступів стенокардії [174].
Метформін володіє анорексигенною дією відносно легко засвоюваних вуглеводів. Сповільнюючи всмоктування вуглеводів, метформін не приводить до різкого збільшення цукру крові після їжі і збільшення маси тіла, а навпаки, сприяє її стабілізації. Лікування метформіном хворих з надмірною масою тіла приводить до помірного зниження ваги, в середньому на 5-7 кг за 3-4 місяці метформін не стимулює викид інсуліну з B-клітин підшлункової залози, тому не призводить до гіперінсулінеміі, не дає гіпоглікемій, які особливо небезпечні у хворих на ЦД 2 типу за рахунок можливого розвитку гострої серцево-судинної патології – інфаркту або інсульту.
Уповільнення всмоктування глюкози в кров під впливом метформіну полегшує функціонування підшлункової залози і оберігає її від перенапруги і виснаження. Встановлено, що метформін підвищує чутливість периферичних тканин до інсуліну, що сприяє стабілізації та/або зниженню маси тіла. При тривалому застосуванні він призводить до вирівнювання добової глікемічної кривої, зниження середньодобового рівня глікемії, зменшення рівня глікемії натщесерце, а також до зниження і нормалізації рівня глікозильованого гемоглобіну, що сприяє профілактиці пізніх ускладнень цукрового діабету. На відміну від препаратів сульфонілсечовини метформін знижує рівень цукру крові не за рахунок стимуляції секреції інсуліну В-клітинами підшлункової залози, а за рахунок збільшення поглинання глюкози клітинами периферичних тканин, насамперед м’язами, де він підвищує рівень глюкозних транспортерів. Тобто метформін діє на основну ланку патогенезу МС та ЦД 2 типу – на ІР, що має особливо важливе значення. Знижуючи постпрандіальну гіперглікемію, метформін зменшує ризик розвитку атеросклерозу у хворих з гіперінсулінемієюта ІР.
Проведені наукові дослідження показали, що метформін ефективно зменшує апетит, масу тіла та ІР вже на стадії тільки надлишкової маси тіла, запобігаючи або значно знижуючи ризик розвитку порушення толерантності до глюкози і переходу «предіабету» в ЦД 2 типу. Таким чином, призначення метформіну хворим на псоріатичну хворобу з супутнім МС сприятиме підвищенню ефективності лікування шляхом корекції метаболічних порушень, що зменшить ризик розвитку ССЗ та ЦД 2 типу у даних хворих [80, 81].
Незважаючи на успіхи, досягнуті у вивченні патогенезу псоріазу та МС, проблема взаємозв’язку цих захворювань та перспективи їх корекції на сьогодні є актуальними та потребують подальшого дослідження.
Основні наукові результати цього розділу опубліковані в працях автора:
- Ємченко Я.О. Деякі спільні аспекти патогенезу псоріазу та метаболічного синдрому / Я.О. Ємченко, К.Є. Іщейкін, І.П. Кайдашев // Світ медицини та біології. – 2013. – № 1 (36). – С. 176-180.
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕНЬ
2.1 Обґрунтування програми дослідження та принципи формування дослідних груп
Від пацієнтів, які взяли участь у дослідженні, була отримана інформаційна згода на проведення дослідження, яка була схвалена рішенням Комісії з біоетики та етичних питань ВДНЗУ ‟Українська медична стоматологічна академіяˮ (протокол № 123 засідання комісії з етичних питань та біоетики від 02.06.2015р.).
Перший етап дослідження включав прескринінг з метою відбору пацієнтів для подальшого обстеження.
Для виділення когорти дослідження на етапі прескринінгу проводився відбір серед хворих псоріазом, які знаходилися на стаціонарному лікуванні в Полтавському обласному клінічному шкірно-венерологічному диспансері. Шляхом аналізу медичних карт стаціонарних хворих, збору анамнестичних данних пацієнтів, проведення оцінки дерматологічного статусу хворих, визначення індексів PASI та Dermatology Life Quality Index (DLQI) були відібрані пацієнти з розповсюдженим псоріазом середнього ступеня важкості, стаціонарною стадією перебігу, віком від 40 до 60 років. В критерії відбору на етапі прескринінгу також включалася спроможність пацієнтів до участі в проведенні дослідження.
На наступному етапі скринінгу відібраним пацієнтам з розповсюдженим псоріазом середнього ступеня важкості, стаціонарною стадією перебігу було проведене загальне клінічне, лабораторне та інструментальне обстеження для верифікації метаболічного синдрому у даних хворих.
На основі отриманих результатів були відібрані 40 хворих на псоріатичну хворобу середнього ступеня важкості, стаціонарною стадією перебігу та ознаками метаболічного синдрому.
Критеріями включення хворих до групи спостереження з діагнозом псоріатична хвороба з середнім ступенем важкості стаціонарною стадією перебігу з ознаками метаболічного синдрому були:
- вік від 40 до 60 років;
- основне захворювання: псоріатична хвороба з середнім ступенем важкості, стаціонарною стадією перебігу;
- інформаційна згода пацієнта на участь у проведені дослідження;
- ожиріння по абдомінальному типу (окружність талії (ОТ) > 102 см у чоловіків, і ОТ> 88 см у жінок, при ІМТ> 25 кг/м²);
- показники АТ (систолічного ≥ 130 мм рт ст. та/або діастолічного ≥ 85 мм рт ст.) або прийом гіпотензивних препаратів;
- показники рівня тригліцеридів (≥ 150 мг/дл або >1,7 ммоль/л);
- зниження рівня холестерину ЛПВГ (< 40 мг/дл або < 1,0 ммоль/л) у чоловіків та (<50 мг/дл або 1,3 ммоль/л) у жінок;
- показники глюкози натщесерце ≥ 6,1 ммоль/л.
Критеріями виключення хворих з групи спостереження з діагнозом псоріатична хвороба з середнім ступенем важкості стаціонарною стадією перебігу з ознаками метаболічного синдрому були:
- відмова від основних методів обстеження та виконання режиму лікування;
- вагітність;
- лактація;
- наявність супутніх хронічних та на момент обстеження будь-яких гострих захворювань;
- наявність у хворих будь-яких інфекційних захворювань, які можуть впливати на перебіг захворювання та його лікування;
- хворі з клінічними ознаками прогресивної, стаціонарно-регресивної та регресивної стадії захворювання, так як динаміка клінічної картини при проведені терапії в цьому випадку буде недостатньо вираженою;
- тяжкі форми псоріатичної хвороби (еритродермія, псоріатична артропатія, хворі з псоріатичним ураженням нігтьових пластин);
- особи, які мають протипоказання до призначення метформіну;
- хворі, які вживають наркотичні речовини, алкоголь;
- вік хворих молодше 40 та хворі старше 65 років.
Всім хворим, що входили до складу когорти дослідження, яка складалася із 40 хворих на псоріатичну хворобу, проведені в динаміці спеціальні дослідження (клініко-лабораторна оцінка вираженості псоріатичної хвороби, клініко-лабораторна оцінка вираженості метаболічного синдрому та дослідження стану системного запалення).
Отримані анамнестичні, клінічні, лабораторні й інструментальні дані реєструвалися у власно розробленій обліково-статистичній карті тематичного хворого. Усім опитуваним хворим була надана гарантія конфіденційності інформації, яка збиралася. Методика проведення опитування була розроблена у відповідності з вимогами сучасної клінічної епідеміології. Перевірка анкет проводилася безпосередньо після проведення інтерв’ю з метою визначення інформації, якої бракує, або непослідовності даних. Заповнені карти підлягали ретельному аналізу і доповнювалися відомостями з первинної документації медичних карт (ф-112) стаціонарного хворого. Збиралися дані про захворювання на псоріатичну хворобу близьких родичів для виявлення спадковості на дане захворювання.
З історії хвороби реєстрували дані, скільки років хворіє даним захворюванням, з чим пов’язую виникнення захворювання, спадковість, в яку пору року виникають загострення, на яку добу від початку рецидиву хворий поступив до стаціонару та тривалість його лікування. Використовували дані фізикального обстеження. Фіксували результати стандартних та допоміжних методів дослідження, які включали загальний та біохімічний аналізи крові. Реєструвалися консультації лікарів-фахівців: терапевта, ендокринолога. Фіксували характер лікування хворих. У всіх обстежених пацієнтів на момент проведення дослідження були відсутні будь які інші гострі та хронічні захворювання не пов’язані з основною патологією.
Під час знаходження в стаціонарі усім хворих проводилось дослідження стану інсулінорезистентності, вуглеводного обміну та системного запалення шляхом дослідження сиворотки крові та призначали комплексну терапію псоріазу згідно з протколом. Для оцінки ефективності включення метформіну гідрохлориду до традиційної терапії хворих на псоріаз з МС проводилися дослідження динаміки основних клініко-лабораторних показників до та під час лікування. Всі пацієнти методом простої рандомізації поділені на дві групи: основну, в якій хворі додатково отримували метформін гідрохлорид та контрольну, до складу якої входили хворі, що отримували лікування псоріазу згідно протоколу (дієта, седативні, дезінтоксикаційні, антигістамінні засоби, гепатопротектори, вітаміни та місцеву терапію). Хворі основної групи додатково отримували метформін гідрохлорид по 1500 мг на добу протягом 6 місяців.
Для оцінки ефективності включення метформіну гідрохлориду в схеми традиційної терапії, хворим на псоріаз з ознаками МС проводилися дослідження динаміки основних показників, які відображають тяжкість та активність псоріазу, вираженість метаболічних порушень та СЗ до та під час лікування.
Для більш чіткого контролю лікування та впливу терапії на клініко-лабораторні показники в залежності від рівня СЗ кожна з груп була поділена за рівнем вч-СРБ в сиворотці крові за допомогою медіан на дві підгрупи: з високим рівнем СЗ та низьким рівнем СЗ. Таким чином, утворилось чотири підгрупи хворих. У створених підгрупах були розраховані середні показники, що характеризують вираженість запального процесу, метаболічних порушень і псоріазу. Імовірність похибки різниці розраховувалась як в середині кожної підгрупи, порівнюючи значення конкретного показника до та під час лікування, так і між підгрупами.
Схему формування груп спостереження, дизайн обстеження та індивідуалізація лікування хворих на псоріатичну хворобу та метаболічний синдром залежно від ступеня СЗ представлено на рис. 2.1.
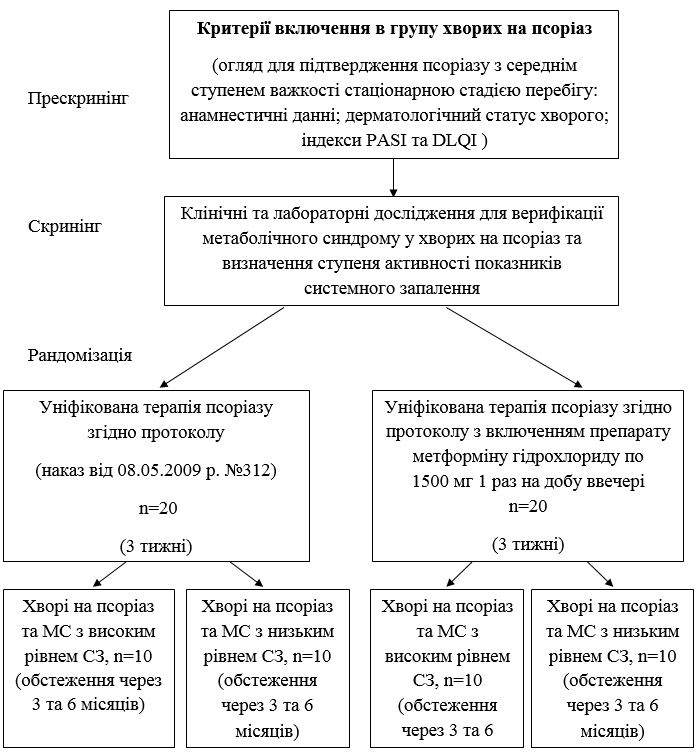
Рисунок 2.1 – Дизайн обстеження та індивідуалізація лікування хворих на псоріатичну хворобу та метаболічний синдром в залежності від рівня системного запалення
2.2 Методи клінічного обстеження дерматологічного статусу
Діагноз псоріазу виставлявся хворим на підставі візуальної оцінки патологічного шкірного процесу, так як характер шкірних висипань, їх динаміка і специфіка залишаються основними критеріями форми і стадії дерматозу [175].
Аналіз скарг, які пред’являли хворі, враховував наявність висипань на шкірі та їх локалізацію. Суб’єктивні відчуття, що супроводжують висипання: свербіж, відчуття стягування шкіри, печіння, поколювання, їх локалізацію та характер, болі в суглобах, їх локалізацію та характер.
При аналізі перебігу псоріатичного процесу з’ясовувалася тривалість захворювання; вік появи перших висипань; причина, з якою хворі пов’язували початок захворювання (стрес, травма, вагітність, робота з професійними шкідливостями, інфекційні захворювання); сезонність і частота загострень. Фактори, що викликають чергове загострення (стреси, інфекції, професійні шкідливості, загострення хронічних соматичних захворювань, зловживання алкоголем); тривалість цього загострення; ефективність попередніх курсів лікування.
Дані з анамнезу життя включали раніше перенесені захворювання; соціально-побутові особливості життя хворого; наявність даного дерматозу та інших шкірних захворювань у родичів першого ступеня споріднення, у непрямих родичів; можливі алергічні реакції на харчові продукти, хімічні речовини, медичні препарати.
Оцінювалися такі клінічні прояви шкірного патологічного процесу на момент госпіталізації, як локалізація (тулуб, кінцівки, голова, шкірні складки, універсальний процес, наявність висипань на слизових оболонках); площа ураження; характер висипань (папульозні елементи, які зливаються в бляшки, папульозно-бляшкові елементи, еритема, еритродермія, гіперкератоз, лущення – крупно- і дрібнопластинчасті лусочки, які легко відторгаються або утворення лускокірок, плями депігментації, екскоріації), а також специфічні симптоми: симптом Пильнова (ободок еритеми навколо морфологічного елемента, який свідчить про прогресування захворювання); симптом Кьобнера (ізоморфна реакція, яка полягає в розвитку псоріатичних елементів на місці травми шкіри – ознака прогресуючої стадії захворювання); “псоріатична триада Ауспітца” (почергове поява феноменів “стеаринової плями”, “термінальної плівки” та “точкового крововиливу” при поскаблюванні псоріатичних елементів) характерна для прогресуючої стадії псоріазу; симптом Воронова (псевдоатрофічний ободок навколо псоріатичних елементів) свідчить про регрес процесу.
З метою оцінки ступеня тяжкості псоріазу використовували декілька оціночних систем, які включають визначення площі та характер ураження шкіри та рівень погіршення якості життя пацієнта.
Для визначення площі і оцінки тяжкості та ступеня ураження шкіри при середньому та тяжкому перебігу псоріазу використовувався метод підрахунку BSA (Body Surface Area), який заснований на оцінці площі ураження [28], та міжнародний індекс Psoriasis Area and Severity Index (PASI), який дозволяє визначити не тільки площу ураження, але й оцінити тяжкість і ступінь ураження шкіри при середньому та тяжкому перебігу псоріазу. PASI є індексом, об’єднуючим активність захворювання з оцінкою інтенсивності еритеми, інфільтрації, лущення та визначенням поширеності процесу в різних анатомічних ділянках. Значення індексу варіює від 0 до 72 балів, чим вище індекс, тим більш тяжкий перебіг псоріазу. Для визначення індексу оцінки якості життя дерматологічних хворих застосовували анкети-опитувальники DLQI, її русифікований варіант – дерматологічний індекс якості життя (ДІЯЖ) [28]. Індекс може мати значення від 0 до 30. Чим індекс вище, тим сильніше негативний вплив нозології на якість життя.
Для визначення ступеня тяжкості псоріазу використовували співставлення одержаних у конкретного пацієнта індексів показників PASI і DLQI [176].
Рішенням Європейського Конгресу 2009 року системи об’єктивної та суб’єктивної оцінки псоріазу поєднано для визначення ступеня тяжкості псоріазу шляхом співставлення одержаних у конкретного пацієнта індексів/показників BSA, PASI і DLQI [176]: легкий перебіг псоріазу: BSA ≤ 10 балів, PASI ≤ 10 і DLQI ≤ 10; середньотяжкий та тяжкий перебіг псоріазу: BSA > 10 або PASI > 10 і DLQI > 10.
Окрім цього, клінічно легкий псоріаз може бути розглянуто як середньотяжкий або тяжкий, якщо BSA та PASI ≤ 10, але DLQI > 10, що свідчить про перевагу показника зміни якості життя. І навпаки, клінічно середньотяжкий або тяжкий псоріаз може бути розглянуто як легкий, якщо BSA або PASI > 10, але DLQI ≤ 10, що вказує на незначний вплив псоріазу на якість життя хворого.
Для повної та об’єктивної оцінки ефективності проведеного лікування використовували підрахунок відсотку (%) зниження індексу PASI по відношенню до вихідного рівня та зміни DLQI [28].
Індекс PAS1 підраховувався кожному пацієнту до початку лікування, через місяць лікування, а далі через 3 та 6 місяців під час наступного загострення хвороби. Для оцінки ефективності терапії порівнювався вихідний (базальний) PASI з PASI на 4, 8 і 24 тижні лікування (PASI0, PASI4, PASI8, PASI24). Оцінка динаміки PASI проводилася за методикою Siiler M.J., Joseph H.J. (1994):
1. Погана відповідь на терапію (PASI складає більше 10 % від вихідного).
2. Відсутність динаміки (коливання PASI до 10 % в бік збільшення або зменшення від вихідного).
3. Задовільна динаміка (зниження PASI на (11-50) % від вихідного).
4. Хороша динаміка (зниження PASI на (51-75) % від вихідного).
5. Відмінна динаміка (зниження PASI більше 75 % від вихідного).
DLQI оцінювався на початку дослідження, через місяць лікування, а далі через 3 та 6 місяців. Вимірювання параметрів якості життя хворих з шкірними проявами використовувалось з метою:
1) оцінки ступеня тяжкості хворого;
2) оцінки ефективності лікування;
3) підбору індивідуальної терапії в якості додаткового критерію;
4) оцінки ефективності нової терапії та ін.
2.3 Методи обстеження для діагностики метаболічного синдрому
Анамнестичне дослідження включало в себе:
1. Сімейний анамнез: спадкова схильність до ожиріння, ЦД, ішемічна хвороба серця, АГ;
2. Соціальний анамнез: особливості способу життя; харчові звички.
Всім хворим проводили антропометричні дослідження. Вимірювали зріст з точністю до 0,5 см за допомогою ростометру в положенні стоячи без взуття; визначали масу тіла з точністю до 100 г на стандартизованих важільних вагах в стані вранці натщесерце без верхнього одягу і взуття. На основі отриманих показників розраховували ІМТ [177]. Ожиріння діагностували відповідно до класифікації ВООЗ (1997).
З метою раннього виявлення ознак МС ідентифікувалися особи з помірно вираженою надлишковою масою тіла, але які мають ознаки відкладення жиру в абдомінальній області (сальник, брижа).
Вимірювання ОТ і окружності стегон (ОС) проводиться вранці натщесерце за допомогою сантиметрової стрічки з точністю до 5 мм: ОТ вимірюється в положенні стоячи, по середньопахвинній лінії на середині відстані між нижнім краєм грудної клітини і гребенем клубової кістки (не по максимальному розміру і не на рівні пупка), ОС – на рівні лобкового зчленування спереду і великого рожна стегна з латеральної сторони.
Згідно рекомендацій Європейських експертів (1998), показником абдомінального ожиріння вважалася ОТ > 94 см у чоловіків, > 80 см у жінок.
Тип розподілу жирової тканини визначали за величиною співвідношення ОТ до ОС, яке при абдомінальному ожирінні у жінок перевищує 0,85, а у чоловіків – 1.
Вимірювання АТ проводилося трьохкратно з п’ятихвилинними інтервалами в положенні лежачи через (5-10) хв після ходьби [178]. За годину до процедури пацієнтам рекомендували виключити каву, міцний чай, куріння. Спочатку АТ вимірювали на обох руках, потім для вимірювання використовували руку, на якій були зафіксовані більш високі значення. Компонентом метаболічного синдрому за критеріями ATP III вважався систолічний артеріальний тиск (САТ) вищий за 135 мм рт.ст. і/або діастолічний (ДАТ) вищий за 85 мм рт.ст. під час трьох різних вимірів, що є більш суворим порівняно з критеріями ВООЗ. Тяжкість артеріальної гіпертензії оцінювалася за критеріями ВООЗ і Международного общества артериальной гипертензии (1999).
Усім хворим проводили дослідження вуглеводного обміну та ступеня вираженості ІР шляхом визначення рівня глюкози в сироватці крові, за допомогою кількісного визначення глюкози глюкозооксидазним методом на фотометрі «StatFax 1904plus» набором («Диякон-ДС», Росія) та інсуліну за допомогою твердофазного імуноферментного аналізу (ELISA), заснованого на принципі «сендвич» згідно протоколу виробника з використанням набору реагентів (DRG, США). Дослідження проводились натщесерце після 8-12 годинного періоду нічного голоду. Для цього отримували венозну кров з кубітальної вени вранці натщесерце, після зсідання крові її центрифугували при 300 об/хв. протягом 30 хв. За норму вважали показники у сироватці крові рекомендовані інструкцією виробника: інсулін 2-25 мкОД/мл; глюкоза (3,9-6,4) ммоль/л, але згідно з визначенням метаболічного синдрому за норму ми вважали (> 5,6). Оцінку гіперглікемії проводили за критеріями Клінічної настанови та уніфікованого клінічного протоколу з ЦД II типу 2013 р.
Для оцінки ризику розвитку ЦД в групі людей з рівнем глюкози нижче 7 ммоль/л розраховували індекс ІР НОМА-ІR, вважаючи цей показник більш інформативним, ніж окремо глюкоза та інсулін натщє. Розраховували індекс ІР НОМА-IR за формулою: HOMA-IR = глюкоза натще (ммоль/л) × інсулін натще (мкМО/мл) / 22,5, де НОМА-IR – гомеостатична модель для оцінки резистентності до інсуліну (Homeostasis Model Assessment of Insulin Resistance).
НОМА-IR < 2,77 вважається нормою, а підвищення показника НОМА-IR > 2,86 балів свідчить про ІР.
Обсяг лабораторних досліджень включав визначення у відібраній вранці натщесерце периферичній крові показників загальноклінічного та біохімічного аналізу. Додатково всім пацієнтам для оцінки ліпідного спектра крові визначали вміст загального ХС (ЗХС) і ТГ з використанням стандартних тест-систем фірми “Ольвекс Діагностикум” (Росія) ферментативним методом на автоаналізаторі ‟A25 BioSystems.
Рівень холестерину у складі ЛПДНЩ визначали за відношенням ТГ/22,5. Забір крові проводили після 12 годинного голодування. Компонентами МС по рекомендаціями Міжнародної діабетичної асоціації (IDF) та AHA / NHLBI (2005 р. з модифікацією 2009 року) вважалася гіпертригліцеридемія (рівень ТГ > 150 мг/дл (> 1,7 ммоль/л), зниження рівня ХС ЛПВЩ у чоловіків < 40 мг/дл (1,0 ммоль/л), у жінок < 50 мг/дл (<1,3 ммоль/л).
2.4 Методи лабораторних досліджень
Загальний стан здоров’я хворих оцінювали також за показниками загальноклінічного та біохімічного аналізів крові.
Забір капілярної крові проводився зранку натще, за загальноприйнятою методикою. Забір венозної крові проводився зранку натще, з ліктьової вени за допомогою сухої силіконованої голки без шприцу вільною течією. 3-5 мл крові відбирали в суху центрифужну пробірку для отриманя сироватки.
Клінічний та біохімічний аналізи крові виконували за загальноприйнятими стандартними методиками [179]. Клітинний склад капілярної крові відображали в абсолютній кількості на одиницю об’єму, лейкоцитарну формулу виражали в процентах від загальної кількості лейкоцитів. За норму вважали референтні показники рекомендвні інструкцією стест-систем виробника, яким стандартизація дослідження проводилась на 100 000 чоловік за вимогами ВООЗ.
Доступність літератури, яка описує вказані методики, що були використані без модифікацій, звільнює від докладного опису методів досліджень (табл. 2.1).
Таблиця 2.1 – Методи досліджень
| Показники | Субстрат | Метод визначення | Нормальні значення |
| 1 | 2 | 3 | 4 |
| Гемоглобін, г/л | Кров капілярна | Гемоглобінціанідний з використанням ацетонциангидрина | Чоловіки – 130-160
Жінки – 120-140 |
| Еритроцити, ×10¹²/л | Кров капілярна | Підрахунку в лічильній камері | Чоловіки – 4,5-5,0
Жінки – 4,0-4,5 |
| Кольоровий показник | Кров капілярна | Розрахунковий метод | 0,85-1,1 |
| Лейкоцити, ×109/л | Кров капілярна | Підрахунку в лічильній камері | 4,0-9,0 |
| ШОЕ, мм/годину | Кров капілярна | Мікрометод Панченкова | 2-15 |
| Лейкоцитарна формула, % | Кров капілярна | Метод диференційного визначення у мазку | Еозинофіли – 0,5-5,0 Базофіли – 0-1,0 Паличкоядерні – 1,0-6,0 Сегментоядерні – 47,0-72,0 Лімфоцити – 19,0-37,0 Моноцити – 3,0-10,0 |
| Загальний білок, г/л | Кров венозна | Біуретова реакція | 64,0-83,0 |
| ЗХС, мкмоль/л | Кров венозна | Метод Ілька заснований на реакції Ліберман-Бурхард | 3,0-6,2 |
| Сечовина, ммоль/л | Кров венозна | По кольоровій реакції з диацетилмонооксидом | 2,5-8,3 |
| Креатинін, мкмоль/л | Кров венозна | По кольоровій реакції Яффе (метод Поппера) | 50,0-120,0 |
| Білірубін, мкмоль/л | Кров венозна | Ієндрашика, Клеггорна та Грофа | 8,0-21,0 |
| АСТ та АЛТ, (од/л) | Кров венозна | Динитрофенілгідразино-вий метод (метод Райтмана та Френкеля) | АСТ чоловіки – 5,0-41,0
АСТ жінки – 5,0-31,0 АЛТ чоловіки – 5,0-41,0 АЛТ жінки – 5,0-31,0 |
Примітка. АСТ – аспартатамінотрансфераза, АЛТ – аланінамінотрансфераза
Визначення показників СЗ та дослідження вуглеводного обміну проводилось на базі науково-дослідного інституту генетичних та імунологічних основ розвиту патології та фармакогенетики, при Вищому державному навчальному закладі України «Українська медична стоматологічна академія» м. Полтави. В сироватці крові хворих визначали вміст прозапальних цитокінів (ФНП-α, ІЛ-6), церулоплазміну та вч-СРБ. Концентрацію вч-СРБ, ФНП-α, ІЛ-6 визначали за принципом твердофазного «сендвич»-варіантного імуноферментного аналізу з використанням комерційних тест-систем «интерлейкин-6-ИФА-БЕСТ», «СРБ-ИФА-БЕСТ (высокочувствительный)», «А‑8756 альфа-ФНО-ИФА-БЕСТ» (ЗАО «Вектор-Бест», Россия) згідно рекомендованих методик, а концентрацію церулоплазміну визначали по методу Равіна (ПрАТ «Реагент» Украина). Дослідження проводились на багатоканальному фотометрі “STATFAX” (США).
За норму вважали показники у сироватці крові рекомендовані інструкцією виробника: для церулоплазміну це (180,0-450,0) мг/л; ФНП-α (0-6) пг/мл; ІЛ-6 (0-10) пг/мл; вч-СРБ (0,068-8,2) мг/л.
2.5 Схема лікування хворих на псоріаз із супутнім метаболічним синдромом
За час знаходження в стаціонарі (3 тижні) хворі обох груп отримували уніфіковану терапію псоріазу згідно протоколу надання медичної допомоги хворим [180], що включала: дієту № 15 (гіпоалергенна дієта з виключенням жирного, смаженого, копченого, гострого, екстрактивних блюд, алкоголю), седативні засоби (настоянка пустиннику, яку хворі приймали перед вживанням їжі по (30-50) крапель 3 рази на день), дезінтоксикаційні засоби (розчин реосорбілакту 200,0 в/в крапельно 1 раз на день №10), антигістамінні засоби (дезлоратадин по 1 таблетка (5 мг) 1 раз на добу), гепатопротектори (ессенціальні фосфоліпіди 5,0, розведені кров’ю пацієнта у співвідношенні 1:1, вводити в/в струменево повільно 1 раз на добу №10), вітаміни (аевіт по 1капсулі 1 раз на добу (30-40) діб), місцево (3 % саліцилова мазь 2 рази на добу та мазь бетасалік 2 рази на добу на відкриті ділянки тіла).
Хворі другої групи додатково приймали метформіну гідрохлорид для корекції метаболічних порушень. Таблетки метформину гідрохлорид хворі приймали по 1500 мг один раз на добу, увечері після вживання їжі. Призначення препарату починали з мінімальної дози 500 мг з поступовим збільшенням дози препарату на 500 мг один раз у тиждень. Таблетки хворі приймали цілими, не подрібнюючи та не розжовуючи їх.
Наприкінці стаціонарного етапу лікування всі хворі отримали рекомендації з приводу дієтотерапії, а хворі другої групи продовжували приймати метформин по 1500 мг один раз на добу.
2.6 Статистичні методи дослідження
Отримані дані були піддані статистичній обробці на IBM-комп’ютері, процесор Intel Pentium-4.1 із застосуванням пакетів прикладних програм «Біостат» і «SPSS-10.0». Відмінність результатів в дослідних групах вважалася достовірною при ймовірності похибки альтернативної гіпотези Р<0.05. Середні дані в групах обтеження наведені у вигляді М ± m, де М – середнє значення, m – середньо-квадратичне відхилення.
Для оінки різниці між даними в групах з нормальним розподілом використовували t-критерій Стьюдента. При неправильному розподілі для оцінки достовірності різниці між обстеженими групами використовували критерій Уілкінсона-Манна-Уїтні (u).
Для розподілу хворих за рівнем системного запалення використовували перцентилі, додатково дані приводилися у вигляді медіани (m), мінімальних і максимальних значень.
Для оцінки кореляційного взаємозв’язку між показниками в дослідних групах використовували коефіцієнти кореляції, підраховані методами Пірсона (r) та Спірмена (R) відповідно для параметричних та непараметричних показників. У випадку, якщо хоча б один з показників був непараметричним, використовувалося ранжування.
Графічні ілюстрації побудовані за допомогою комп’ютерних програм Microsoft Office. 2000.
РОЗДІЛ 3
РЕЗУЛЬТАТИ ВЛАСНИХ ДОСЛІДЖЕНЬ
3.1 Клінічна характеристика хворих на псоріаз
Всього було обстежено 129 хворих на псоріаз віком від 40 до 65 років. Когорта хворих, відібраних для участі в дослідженні, включала в себе 40 дорослих осіб, серед яких жінок було 15 осіб (37,5 %), а чоловіків-25 (62,5 %) віком від 40 до 65 років (середній вік хворих склав 50,05±7,10 роки) (табл. 3.1).
Таблиця 3.1 – Розподіл хворих когорти дослідження за статтю та віком
| Показник | Хворі когорти дослідження | ||
| n=40 | |||
| Стать | Жінки | Абсолютне число | 15 |
| % | 37,5 % | ||
| Чоловіки | Абсолютне число | 25 | |
| % | 62,5 % | ||
| Вік | М±m | 50,05±7,10 | |
Середня тривалість захворювання на псоріаз у даних хворих становила (19,25±1,96) року (коливалася від 1 до 44 років), тоді як дебют псоріазу припав на вік від 5 до 59 років. На спадковість по псоріазу вказували 11 (27,5 %) хворих, при цьому спадковість по материнській лінії відмічалась у 5 (12,5 %) осіб, а по батьківській лінії у 6 (15 %) осіб. Більшість хворих появу перших висипань відмічали після перенесеного нервового потрясіння – 35 (87,5 %) осіб, інші після переохолодження – 2 (5,0 %) особи, травми – 2 (5,0 %) особи та інфекційних захворювань – 1 (2,5 %) особа. Шкідливі звички виявлено у 22 (5,5 %) хворих, причому 21 (52,5 %) особа з них курила, а лише 1 (2,5 %) вживала алкоголь. При встановлені сезонності відмічено, що 6 хворих мали осінньо-зимовий тип псоріазу, 1-весняно-літній та 33 – змішаний. При визначені кількості рецидивів псоріазу за рік, встановлено, що рецидив захворювання спостерігався 1 раз на рік у 7 хворих, 2 рази на рік у 13 хворих, 3 – у 14 хворих та 4 – у 6 хворих (табл. 3.2).
Таблиця 3.2 – Анамнестичні дані хворих з приводу псоріатичної хвороби
| Показник | Значення, абс. (%) | |
| Середня тривалість захворювання (роки) | 19,25±1,96 | |
| Дебют захворювання (роки) | 5 – 59 | |
| Спадковість (особи) | материнська лінія | 5 (12,5 %) |
| батьківська лінія | 6 (15 %) | |
| Фактори провокуючі дебют захворювання (особи) | стрес | 35 (87,5 %) |
| переохолодження | 2 (5,0 %) | |
| травми | 2 (5,0 %) | |
| інфекційні захворювання | 2 (5,0 %) | |
| Сезонність захворювання (особи) | осінньо-зимовий тип | 6 |
| весняно-літній тип | 1 | |
| змішаний тип | 33 | |
| Кількість рецидивів за рік (особи) | 1 раз | 7 |
| 2 рази | 13 | |
| 3 рази | 14 | |
| 4 рази | 6 | |
| Шкідливі звички (особи) | палили | 21 (52,5 %) |
| вживали алкоголь | 1 (2,5 %) | |
Для виявлення особливостей перебігу псоріазу поєднаного з МС в якості групи контролю для порівняння досліджуваних показників була відібрана група хворих (20 осіб відповідного віку) на псоріаз стаціонарною стадією перебігу, середнього ступеня тяжкості без МС.
У всіх досліджуваних нами хворих висипання на шкірі мало розповсюджений характер, класичні місця локалізації та були представлені папульозними елементами, схильними до злиття в бляшки, чітко обмежені від здорової шкіри, застійно-червоного забарвлення, з вираженою інфільтрацією, повністю вкриті сріблясто-білими лусочками. Оцінка клінічного стану хворих визначалася за допомогою індексу PASI.
З анамнезу захворювання відомо, що всі пацієнти неодноразово отримували традиційне лікування з приводу псоріазу в амбулаторних умовах та стаціонарі. У хворих на псоріаз із супутнім МС ефективність попереднього лікування була короткочасною у 26 (65,0 %) хворих, практично не відзначали позитивного ефекту лікування 14 (40,0 %) пацієнтів, а періоди ремісії були нетривалими. При дослідженні клінічної картини в обох групах хворих було відмічено, що у всіх хворих висипання на шкірі мало розповсюджений характер, класичні місця локалізації та були представлені папульозними елементами, схильними до злиття в бляшки, чітко обмежені від здорової шкіри. Але траба відмітити, що у хворих на псоріаз з супутнім метаболічним синдромом псоріатичні висипання мали більш виражене застійно-червоне забарвлення, виражену інфільтрацію зі схильністю у більшості хворих до ексудації з товстим нашаруванням щільних сріблясто-білих лусочк, які повністю покривали псоріатичні висипання. Серед скарг у хворих на псоріаз з супутнім метаболічним синдромом були відмічені: свербіж та печіння шкіри у 19 (47,5 %) хворих, порушення сну, занепокоєння, тривогу в період загострення захворювання у 24 (60,0 %) хворих, що вплинуло на зниження якості життя пацієнтів, тоді як хворі на псоріаз без метаболічного синдрому подібних скарг не відмічали.
Для оцінки тяжкості клінічного перебігу псоріазу та площі ураження шкіри застосовували індекс PАSI та ДІЯЖ.
Показник індексу PASI у хворих на псоріаз без метаболічного синдрома становив від 11 до 14 [(12,2±0,16) бала], показник ДІЯЖ – від 11 до 12 [(11,2±0,05) бала], тоді як у хворих на псоріаз із супутнім МС показник індексу PASI становив від 12,0 до 16,8 [(14,2±0,18) бала], а показник ДІЯЖ – від 11 до 15 [(13±0,11) бала], що відповідає значенню середнього ступеня тяжкості процесу (табл. 3.3).
Таблиця 3.3 – Показники тяжкості перебігу псоріазу у обстежених хворих (М±m)
| Показник | Значення | |
| Хворі на псоріаз з МС (n=40) | Хворі на псоріаз без МС
(n=20) |
|
| Індекс PASI (бали) | 14,2±0,184 | 12,2±0,16 |
| Показник DLQI (бали) | 13±0,172 | 11,2±0,05 |
При співставленні одержаних показників індексів PASI та DLQI в обох групах обстежених хворих було відмічено, що у хворих на псоріаз з супутнім метаболічним синдромом показник індексу PASI на 18 %, а ДІЯЖ – на 16 % вище, ніж у хворих на псоріаз без метаболічного синдрома.
Клінічний приклад. Хвора П. 1972 р.н. Історія хвороби № 328. Хвора звернулася до дерматолога 26.02.13 р. зі скаргами: на висипання на шкірі волосистої частини голови, тулуба, верхніх та нижніх кінцівка, відчуття свербіжу, печіння і стягнення шкіри в ділянках висипання.
З анамнезу захворювання та життя відомо, що пацієнтка хворіє на псоріаз із 12 років. На диспансерному спостереженні перебуває з 1984 року, коли вперше було встановлено діагноз: поширений вульгарний псоріаз. Початок захворювання та подальші загострення шкірного патологічного процесу пов’язувала з части ми нервовими перенапруженнями. Хвора на наявність шкідливих звичок не вказувала. Алергійні реакції на медикаменти та продукти харчування заперечує. Перенесені заболеванния: в дитинстві – кір, дорослою – часті гострі респіраторні вірусні інфекції. Туберкульоз, венеричні захворювання та хронічні супутні захворювання заперечує. Спадковість з приводу псоріазу обтяжена по батьковій лінії. Загострення спостерігала 2 раз на рок в осінньо – зимовий період, а з 2001 року спостерігає почастішання рецидивів захворювання до 4 разів на рік, які не залежать від пори року. Неодноразово лікувалась амбулаторно та стаціонарно згідно з протоколами. Останні 4 роки хвора вказує на незадовільний ефект від лікування та подовження тривалості рецидивів захворювання.
Під час огляду на шкірі волосистої частини голови, поверхні тулуба, верхніх та нижніх кінцівоках виявлено множинні набрякло інфільтративні еритематозні папульозні висипання, які зливаються у великі бляшки неправильної форми, поверхня яких повністю вкрита щільним сріблясто-білим лущенням.
Індекс РАSІ = 16 балів, DLQI = 15.
При вимірюванні антропометричних показників було встановлено: зріст – 160 см; вага – 98 кг; ІМТ=38,1 кг/м²; окружність талії – 118 см.
При вимірюванні АТ встановлено: САТ – 145 мм.рт.ст., ДАТ – 85 мм.рт.ст.
За результатами клініко-інструментального дослідження встановлено діагноз: поширений вульгарний псоріаз, середньго ступеня тяжкості, стаціонарна стадія перебігу, змішаний тип з ознаками метаболічного синдрому.
3.2 Характеристика компонентів метаболічного синдрому у хворих на псоріаз
При вимірюванні АТ у хворих на псоріаз з супутнім метаболічним синдромом встановлено, що показники САТ були у межах від 150 до 160 мм рт. ст., при цьому середньогруповий показник становив (155,37±1,08) мм рт. ст., а показники ДАТ були у межах від 80 до 100 мм. рт. ст., середньогруповий показник відповідно – (93,04±1,45) мм рт. ст., але треба відмітити, що такі високі показники АТ у хворих, які склали дослідну групу, були відмічені вперше та встановленого діагнозу АГ в них не було. Всі хворі з приводу АТ були проконсультовані у відповідних спеціалістів. Тоді як у хворих на псоріаз без метаболічного синдрома показники САТ були у межах від 120 до 145 мм. рт. ст., при цьому середньогруповий показник становив (137,37±1,02) мм рт. ст., а показники ДАТ були у межах від 70 до 90 мм рт. ст., середньогруповий показник відповідно – (80,2±1,3) мм рт. ст. (табл. 3.4).
Таблиця 3.4 – Показники артеріального тиску у обстежених хворих (М±m)
| Показник | Значення | |
| Хворі на псоріаз з МС (n=40) | Хворі на псоріаз без МС
(n=20) |
|
| САТ (мм.рт.ст.) | 155,37±1,08 | 137,37±1,02 |
| ДАТ (мм.рт.ст.) | 93,4±1,45 | 80,2±1,3 |
При аналізі у хворих на псоріаз з супутнім метаболічним синдромом показників АТ було встановлено, що синдром АГ мали всі хворі, тоді як у хворих на псоріаз без метаболічного синдрома показники АТ знаходились у межах норми.
При вимірюванні антропометричних показників було відмічено, що у хворих на псоріаз з супутнім метаболічним синдромом на момент включення у дослідження середні показники антропометричних показників становили: маса тіла (100,57±1,74) кг (від 90 до 136 кг), зріст – (167,42±0,91) см (від 157 до 186 см), ОТ – (117,05±1,06) см (99-145 см), ОС – (114,57±1,26) см (102-150 см). Тоді як у хворих на псоріаз без метаболічного синдрома відповідні показники знаходились у межах норми.
Для визначення ступеня ожиріння у хворих на псоріатичну хворобу з супутнім МС підраховано ІМТ по формулі Кетле. Так, середньогруповий показник ІМТ становив (35,24±0,85) кг/м², у жінок відповідно – (37,26±5,63) кг/м², а у чоловіків – (35,8±4,22) кг/м2, що свідчить про наявність ожиріння у всіх дослідних хворих.
При визначені типу розподілу жирової тканини встановлено, що середній показник співвідношення ОТ/ОС у жінок становив (1,0±0,009), а у чоловіків – (1,04±0,007), а це свідчить про те, що усі хворі мали ожиріння по абдомінальному типу (табл. 3.5).
Таблиця 3.5 – Середнє значення антропометричних показників у хворих на псоріатичну хворобу та метаболічний синдром (М±m) (n=40)
| Показник | Значення | |
| жінки | чоловіки | |
| Маса тіла (кг) | 100,4±12,44 | 100,24±10,67 |
| Зріст (см) | 164,46±5,0 | 169,4±5,3 |
| ОТ (см) | 116,93±9,9 | 117,12±3,99 |
| ОС (см) | 117,13±11,03 | 113,04±5,02 |
| ІМТ (кг/м²) | 37,26 ± 5,63 | 35,8 ± 4,22 |
| Співвідношення ОТ/ОС | 1,0±0,009 | 1,04±0,007 |
При аналізі показників ІМТ у відповідності до класифікації ожиріння за ІМТ було встановлено, що надлишкову вагу тіла мав 1 хворий (2,5 %), ожиріння І ступеня – 22 хворих (52,5 %), ожиріння ІІ ступеня – 12 хворих (30,0 %) та ожиріння ІІІ ступеня – 5 хворих (12,5 %) (табл. 3.6).
Таблиця 3.6 – Ступінь ожиріння за ІМТ у хворих на псоріатичну хворобу та метаболічний синдром
| Показник | Хворі (кількість осіб, %) | ||
| Надлишкова вага тіла | 1 | (2,5 %) | |
| Ожиріння | І ступеня | 22 | (52,5 %) |
| ІІ ступеня | 12 | (30 %) | |
| ІІІ ступеня | 5 | (12,5 %) | |
Загальний стан здоров’я хворих оцінювали також за показниками загально-клінічного та біохімічного аналізу крові, результати яких наведені у таблицях 3.7 та 3.8.
Таблиця 3.7 – Дані загально клінічного аналізу крові у обстежених хворих (M±m)
| Показники | Значення | |
| Хворі на псоріаз з МС (n=40) | Хворі на псоріаз без МС (n=20) | |
| Гемоглобін, (г/л) | 148,33±6,11 | 146,5±5,2 |
| Вміст еритроцити, (10⁹/л) | 4,4±0,5 | 4,5±0,5 |
| Кольоровий показник | 1,0±0,05 | 0,95±0,03 |
| Вміст лейкоцитів, (10⁹/л) | 6,5±2,1 | 5,7±1,6 |
| Нейтрофіли паличкоядерні, (%) | 1,73±1,06 | 2,5±1,1 |
| Нейтрофіли сегментоядерні, (%) | 62,45±3,37 | 68±3,2 |
| Еозинофіли, (%) | 3,65±1,6 | 2,5±0,5 |
| Лімфоцити, (%) | 27,85±2,95 | 20±1,8 |
| Моноцити, (%) | 4,87±1,98 | 5,2±1,87 |
| ШОЕ, (мм/год) | 10,7±1,32 | 7,9±1,1 |
Аналізуючи дані, представлені у табл. 3.7, можна зазначити, що рівень усіх показників в обох групах хворих знаходиться у межах норми.
При аналізі отриманих результатів клініко-лабораторних досліджень референтними вважали значення показників, визначених лабораторією Полтавського обласного клінічного шкірно-венерологічного диспансеру, в якій і проводились дані дослідження.
При лабораторному обстежені хворих на псоріаз з супутнім метаболічним синдромом встановлено, що підвищення показника АЛТ спостерігається у 13 хворих (32,5 %), причому у 10 хворих цей показник у 1,5 рази перевищує референтне значення, а у 3 хворих у 2 рази, середнє значення якого становить (33,01±4,2) од/л. Тоді як підвищення показника АЛТ відмічається у 9 хворих (22,5 %), незначне підвищення показника відмічається у 3-х хворих, майже у 1,5 рази у 5 хворих та майже у 3,5 рази у одного хворого, середнє значення показника становить (32,45±3,54) од/л. Підвищення загального білірубіну відмічено у 3-х хворих (7,5 %) та перевищує верхню межу референтного значення майже 1,5 рази, а середній показник становить (14,22±3,6) г/л.
Таблиця 3.8 – Дані біохімічного аналізу крові у обстежених хворих (M±m)
| Показники | Значення | |
| Хворі на псоріаз з МС (n=40) | Хворі на псоріаз без МС (n=20) | |
| Загальний білірубін, мкмоль/л | 14,22±3,6 | 16,3±3.8 |
| АЛТ, од/л | 33,01±4,2 | 27±2,3 |
| АСТ, од/л | 32,45±3,54 | 25,1±2,2 |
| Загальний білок, г/л | 73,82±6,4 | 72,3±4,8 |
| ЗХС, ммоль/л | 9,0±0,2 | 5,2±0,2 |
| ТГ, ммоль/л | 3,4±0,05 | 1,5±0,05 |
| Глюкоза, ммоль/л | 6,32±1,2 | 5,4±0,5 |
| Сечовина, ммоль/л | 5,04±0,23 | 5,2±0,21 |
| Креатинін, ммоль/л | 87,95±6,7 | 89,2±6,3 |
При дослідженні показників загального білка, креатиніну та сечовини, встановлено що всі 40 хворих (100,0 %) мали значення показників які знаходились у межах норми. Так середній показник загального білка становив (73,82±6,4) г/л, креатиніну – (87,95±6,7) ммоль/л, а сечовини – (5,05±0,23) ммоль/л.
При дослідженні ліпідного обміну, оцінювали показники ЗХС, ТГ та концентрацію ХС у складі ЛПНЩ. В результаті дослідження встановлено, що у всіх хворих відмічалося підвищення рівня: ЗХС, середній показник якого становив (9,0±0,2) ммоль/л, ТГ – (3,4±0,05) ммоль/л та ЛПДНЩ – (1,55±0,02) ммоль/л.
Тоді як у хворих на псоріаз без метаболічного синдрома відповідні показники знаходились у межах норми.
При визначенні ІР досліджували показники інсуліну і глюкози та вираховували індекс HOMA-IR. При дослідженні було встановлено, що у 20 (25,0 %) хворих з когорти дослідження відмічалось підвищення рівня глюкози крові взятої вранці натщесерце, середній показник якої становить (6,32±1,2) ммоль/л та підвищення рівня інсуліну у 3 (7,5 %) осіб – (33,2±12,3) мкОд/мл. При розрахунку індексу HOMA-IR було встановлено, що підвищення спостерігається у 32 (77,5 %) осіб дослідної групи, а середній показник становить 4,8±1,8, що відображено у табл. 3.9. Тоді як у хворих на псоріаз без метаболічного синдрома відповідні показники знаходились у межах норми.
Таблиця 3.9 – Показники ліпідного та вуглеводного обміну у обстежених хворих (M±m)
| Показник | Значення | |
| Хворі на псоріаз з МС (n=40) | Хворі на псоріаз без МС (n=20) | |
| Загальний холестерин, ммоль/л | 9,01±0,2 | 5,2±0,2 |
| Тригліцериди, ммоль/л | 3,42±0,05 | 1,5±0,05 |
| Холестерин ЛПДНЩ, ммоль/л | 1,55±0,02 | 1,0±0,02 |
| Глюкоза крові, ммоль/л | 6,32±1,2 | 5,4±0,5 |
| Інсулін, мкЕд/мл | 33,2±12,3 | 18±2,5 |
| Індекс HOMA-IR | 4,8±1,8 | 2,3±0,2 |
3.3 Характеристика системного запалення у хворих на псоріаз із супутнім метаболічним синдромом
Основу запалення складає каскад імунних та біохімічних процесів. Найбільш важливими регуляторами запальної реакції є цитокіни (ІЛ-1α і β, ІЛ‑6, ФНП-α та ін.). Одним з ІЛ, що грає ключову роль в патогенезі псоріазу, атеросклерозу, інших імуноопосередкованих захворювань, є прозапальний IЛ-6. Білки гострої фази (церулоплазмін, гаптоглобін, СРБ і т.д.) виконують функції медіаторів імунної системи. Вч-СРБ (високочутливий, що визначається в низьких концентраціях) – один з найбільш ранніх індикаторів запалення, спричинених не тільки бактеріальними, а й імуноопосередкованими захворюваннями. Існуючі відомості про біомаркери запалення стосуються в основному вульгарного псоріазу в цілому, псоріатичного артриту, результати вивчення системного запалення у пацєнтів з псоріазом та МС з нечисленні та суперечливі. У зв’язку з цим доцільно проводити визначення маркерів запалення з метою уточнення їх патогенетичного значення у пацієнтів.
Для оцінки вираженості показників системного запалення визначали рівень вч-СРБ, ФНП-α, ІЛ-6 та церулоплазміну.
При дослідженні показників СЗ виявлено підвищення рівня вч-СРБ та ФНП-α в обох групах хворих. Так в групі хворих на псоріаз з супутнім МС виявлено підвищення рівня таких показників, як вч-СРБ у 39 (97,5 %) осіб, середньогруповий показник якого становив (14,14±1,1) мг/л; ФНП-α у 37 (92,5 %) осіб, середньогруповий показник – (22,7±12,8) пг/мл; ІЛ-6 у 6 (15,0 %) осіб, середній показник – (5,49±0,84) пг/мл. При дослідженні рівня церулоплазміну у пацієнтів було виявлено занижені показники у 9 осіб, тоді як у 31 пацієнта знаходився у межах норми, а середньогруповий показник церулоплазміну становив (215,94±10,08) мг/л. Тоді як у хворих на псоріаз без МС відповідні показники становили: вч-СРБ – (12,0±1,21) мг/л, ФНП-α – (18,5±7,8) пг/мл, ІЛ-6 – (4,9±0,65) пг/мл та церулоплазмін (203,94±10,01) мг/л (при референтних значеннях показників відповідно 0,068-8,2 мг/л, 0-6 пг/мл, 0-10 пг/мл, 180,0-450,0 мг/л) (табл. 3.10).
При порівнянні показників СЗ відмічено, що у хворих на псоріаз з супутнім МС рівень СЗ достовірно вищий за показниками: вч-СРБ на 18 %, ФНП-α – на 23 %, ІЛ-6 – на 12 %, ніж у хворих на псоріаз без МС.Таким чином, вивчення вмісту імунозапальних показників у пацієнтів з псоріатичною хворобою та супутнім МС виявило їх односпрямовані зрушення, що проявлялися підвищенням вмісту імунних показників – ФНП-α та ІЛ-6 та біохімічних маркерів запалення – вч-СРБ і церулоплазміну. Зверає увагу більш суттєве збільшення вмісту вч-СРБ і ФНП-α порівняно з ІЛ-6 та церулоплазміном.
Таблиця 3.10 – Показники системного запалення у обстежених хворих (M±m)
| Показник | Значення | ||
| Хворі на псоріаз з МС (n=40) | Хворі на псоріаз без МС (n=20) | референтне | |
| вч-СРБ, мг/л | 14,14±1,1 | 12,0±1,21 | 0,068-8,2 |
| ФНП-α, пг/мл | 22,7±12,8 | 18,5±7,8 | 0-6 |
| ІЛ-6, пг/мл | 5,49±0,84 | 4,9±0,65 | 0-10 |
| Церулоплазмін, мг/л | 215,94±10,08 | 203,94±10,01 | 180,0-450,0 |
3.4 Взаємозвязок клініко-лабораторних показників у хворих на псоріаз та метаболічний синдром
Для дослідження взаємозв’язку між процесом системного запалення, метаболічними порушеннями та клінічним перебігом псоріазу, всі хворі на псоріатичну хворобу з супутнім МС розділені на чотири підгрупи по квартілям в залежності від вмісту вч-СРБ у сироватці крові. У I підгрупу ввійшли пацієнти з помірним рівнем вч-СРБ – (7,5-13,4 мг/л), у II – з середнім (13,4-13,9 мг/л), у III – з високим (14-14, 6 мг/л), в IV – з дуже високим (15-17,2 мг/л). В утворених підгрупах хворих були розраховані середні значення антропометричних показників, вираженість перебігу псоріазу, вуглеводного та ліпідного обмінів і запального процесу (таблиця 3.11).
Таблиця 3.11 – Залежність клініко-лабораторних показників від рівня вч‑СРБ у хворих на псоріатичну хворобу та метаболічний синдром
| Показники | Підгрупи в залежності від рівня вч-СРБ (мг/л) | |||
| І – 12,32±1,77 (n=10) | ІІ – 13,65±0,18 (n=10) | ІІІ – 14,34±0,20 (n=10) | ІV – 15,61±0,86 (n=10) | |
| Індекс PASI (бали) | 13,09±0,21 | 14±0,28 | 14,56±0,27* | 15,33±0,31 * |
| Окружність талії (cм) | 117,4±6,1 | 116,7±4,22 | 117,8±10,13 | 116,5±7,93 |
| ІМТ(кг/м²) | 34,93±057 | 33,2±0,57 | 37,33±2,13# | 37,76±3,21# |
| CАТ (мм.рт.ст.) | 164,5±1,89 | 165,5±1,89 | 165,5±2,89 | 166,0±2,21 |
| ДАТ (мм.рт.ст.) | 95,6±3,9 | 96,0±2,96 | 92,0±2,6 | 90,0±1,67# |
| Глюкоза (ммоль/л) | 6,51±1,1 | 5,93±0,47 | 5,87±0,44 | 6,96±1,22 |
| Інсулін (мкЕд/мл) | 11,18±1,89 | 14,84±1,56 * | 16,59±2,18* | 19,19±3,55* |
| НОМА-IR | 3,22±0,64 | 3,91±0,5 | 4,08±0,45 | 5,33±0,92 |
| ЗХС (ммоль/л) | 8,8±0,3 | 9,5±0,58 | 8,66±0,42 | 9,07±0,27 |
| ТГ (ммоль/л) | 3,56±0,13 | 3,34±0,1 | 3,26±0,09 * | 3,52±0,07 |
| ЛПДНЩ (ммоль/л) | 1,56±0,09 | 1,52±0,05 | 1,48±0,04* | 1,6±0,09 |
| Церулоплазмін (мг/л) | 188,88±17,9 | 221,20±18,83 | 226,01±22,23 | 227,68±21,96 |
| ФНП-α (пг/мл) | 13,91±1,94 | 14,68±2,17 | 26,57±5,75 *# | 30,48±3,3*# |
| ІЛ-6 (пг/мл) | 2,69±0,51 | 3,6±0,56 | 5,74±1,6 | 9,93±2,37 *# |
Примітка. * – відмінності показників порівняно з I групою статистично достовірні (р≤0,05); # – відмінності показників порівняно з II групою статистично достовірні (р≤0,05); ! – відмінності показників порівняно з III групою статистично достовірні (р≤0,05)
Як видно з представлених даних, у виділених підгрупах спостерігається чітка залежність між паралельним збільшенням рівня вч-СРБ і підвищенням рівня таких показників: індекс PASI, ІМТ, САТ, інсулін, НОМА, ІЛ-6, ФНП-α і церулоплазмін, що вказує на взаємозв’язок між тяжкістю перебігу псоріазу, виразністю метаболічних порушень і системного запалення. Проведений внутрішньогруповий кореляційний аналіз серед підгруп пацієнтів дозволив встановити наступні достовірні позитивні взаємозв’язки між низьким рівнем показника вч-СРБ і ІМТ, а також між високим рівнем вч-СРБ та індексами PASI, САТ та ІЛ-6 (таблиця 3.12).
Таблиця 3.12 – Результати кореляційного аналізу за Пірсоном між вч-СРБ і даними клініко-лабораторних досліджень у хворих на псоріатичну хворобу та метаболічний синдром (r=)
| Показники | вч-СРБ (І група) (n=10) | вч-СРБ (ІІ група) (n=10) | вч-СРБ (ІІІ група) (n=10) | вч-СРБ (ІV група) (n=10) |
| Індекс PASI(бали) | +0,43 | +0,40 | +0,03 | +0,82 |
| Окружність талії(см) | +0,01 | +0,45 | +0,09 | +0,33 |
| ІМТ(кг/м²) | +0,65 | -0,29 | +0,29 | +0,19 |
| САТ | +0,21 | -0,27 | +0,20 | +0,77 |
| ДАТ | +0,34 | -0,17 | +0,58 | +0,06 |
| ЗХС (ммоль/л) | +0,22 | +0,16 | +0,27 | -0,78 |
| ТГ(ммоль/л) | +0,09 | +0,52 | +0,58 | +0,15 |
| Церулоплазмін(мг/л) | +0,13 | +0,39 | +0,12 | -0,24 |
| ФНП-α (пг/мл) | -0,10 | -0,33 | +0,06 | +0,10 |
| ІЛ-6 (пг/мл) | +0,36 | -0,20 | -0,16 | +0,66 |
| Глюкоза (ммоль/л) | +0,23 | -0,06 | -0,23 | -0,04 |
| Інсулін (мкОд/мл) | +0,47 | +0,25 | +0,19 | +0,44 |
| НОМА-IR | +0,50 | +0,15 | +0,10 | +0,46 |
Виявлено прямий кореляційний зв’язок у хворих з низьким рівнем системного запалення між показником вч-СРБ та ІМТ (r = +0,65) та у хворих з високим рівнем системного запалення між вч-СРП і індексом PASI (r = +0,82), САТ (r = +0,77) та ІЛ-6 (r = +0,66).
Виявлені кореляційні зв’язки підтверджують, що високий рівень системного запалення супроводжується порушеннями регуляції судинного тонусу і значним ураженням шкіри при псоріазі. Це свідчить про те, що запалення, яке виникає при псоріатичній хворобі, носить системний характер, надає стимулюючий вплив на імунологічні та метаболічні зміни, які обтяжують перебіг і збільшують тривалість псоріазу, а також призводять до розвитку супутніх захворювань. Таким чином, процеси системного запалення та ІР у хворих на псоріаз та МС можуть бути потенціальними мішенями комплексної терапії. Перспективами подальших досліджень є вивчення ефективності комплексних схем лікування хворих на псоріатичну хворобу середнього ступеня тяжкості з супутнім МС з урахуванням впливу на метаболічні порушення та показники системного запалення.
* * *
Таким чином, клінічний перебіг псоріазу із супутнім МС характеризується значною площею ураження шкіри та активністю процесу, частими рецидивами псоріазу (до 4 разів на рік), низькою ефективністю стандартної терапії, наявністю більш вираженого СЗ, яке полягало в підвищенні рівня ФНП-α, вч-СРБ, та порушенням вуглеводного обміну (НОМА, глюкоза, інсулін) порівняно із хворими на псоріаз без МС.
Основні наукові результати цього розділу опубліковані в працях автора:
1. Ємченко Я.О. Залежність клініко-лабораторних показників від рівня системного запалення у хворих псоріатичною хворобою середнього ступеня тяжкості з супутнім метаболічним синдромом / Я.О. Ємченко, К.Є. Іщейкін, І.П. Кайдашев // Світ медицини та біології. – 2014. – № 3 (45). – С. 40-43.
2. Ємченко Я.О. Аналіз захворюваності та поширеності на псоріаз в Україні та Полтавській області / Я.О. Ємченко, К.Є. Іщейкін, І.П. Кайдашев // Актуальні проблеми сучасної медицини. – 2014. – Т. 14, № 3 (47). – С. 72-76.
3. Ємченко Я.О. Особенности клинического течения псориаза у больных с сопутствующим метаболическим синдромом в зависимости от уровня системного воспаления / Я.О. Ємченко // Georgian Medical News. – 2014. – № 11 (236). – Р. 43-47.
РОЗДІЛ 4
ОЦІНКА ЕФЕКТИВНОСТІ ВКЛЮЧЕННЯ МЕТФОРМІНУ ГІДРОХЛОРИДУ ДО КОМПЛЕКСНОЇ ТЕРАПІЇ ХВОРИХ НА ВУЛЬГАРНИЙ ПСОРІАЗ
У СТАЦІОНАРНІЙ СТАДІЇ ПЕРЕБІГУ, СЕРЕДНЬОГО СТУПЕНЯ ТЯЖКОСТІ
З СУПУТНІМ МЕТАБОЛІЧНИМ СИНДРОМОМ
Для оцінки ефективності включення метформіну гідрохлориду в схеми традиційної терапії хворим на вульгарний псоріаз у стаціонарній стадії перебігу, середнього ступеня тяжкості з супутнім МС проведено дослідження динаміки основних показників, які відображають тяжкість та активність псоріатичної хвороби, вираженість метаболічних порушень та системного запалення до, під час лікування та у віддалені строки. Для визначення тяжкості перебігу псоріазу досліджували показники індексів PASI та ДІЯЖ; метаболічних порушень – показники вуглеводного та ліпідного обміну, рівень АТ, основні антропометричні показники для розрахунку ІМТ; стан системного запалення – за рівнем показників вч-СРБ, ФНП-α, ІЛ-6 та церулоплазміну. Для визначення у обстежених хворих взаємозв’язку між показниками системного запалення, метаболічних порушень та клінічним перебігом псоріазу провели кореляційний аналіз даних показників з вч-СРБ. Для цього всі пацієнти після проведення повного обстеження, в залежності від курсу проведеної терапії, методом простої рандомізації за допомогою таблиці випадкових чисел були поділені на 2 групи, в одній з яких проводилося досліджуване втручання, а в іншій (контрольній) – застосовувалися стандартні методи лікування. Рандомізовані контрольовані випробування проводяться з середини ХХ століття і є основою доказової медицини. Рандомізоване контрольоване дослідження найбільш оптимальне для оцінки ефективності лікування та має низьку ймовірність виникнення систематичної помилки. Для достовірності дослідження були зведені до мінімуму систематичні помилки і враховані можливі випадкові помилки. Для попередження систематичної помилки проводили рандомізоване контрольоване клінічне дослідження, а для усунення випадкових помилок застосовували адекватний статистичний метод обробки отриманих результатів, для обробки малих вибірок використовували непараметричний метод – U-тест Манна-Уїтні. У табл. 4.1 представлені основні вихідні характеристики пацієнтів обох груп.
Таблиця 4.1 – Основні вихідні показники пацієнтів дослідних груп (M±m) (n=20)
| Показник | І група (контрольна) | ІІ група (дослідна) |
| 1 | 2 | 3 |
| PASI, бали | 14,14±0,95 | 14,45±1,3 |
| ДАТ, мм рт.ст. | 94,25±1,8 | 92,55±1,6 |
| САТ, мм рт.ст. | 164,75±1,9 | 166,25±2,1 |
| ОТ, cм | 116,95±4,1 | 117,0±4,3 |
| ОС, cм | 114,6±3,8 | 114,55±3,8 |
| ІМТ, кг/м² | 35,25±1,8 | 35,24±1,7 |
| СРБ, мг/л | 14,025±1,3 | 13,935±1,2 |
| ФНП-α, пг/мл | 21,13±2,5 | 21,69±2,6 |
| ІЛ-6, пг/мл | 5,33±0,8 | 5,65±0,9 |
| Церулоплазмін, мг/л | 212,43±8,5 | 221,82±9,2 |
| Інсулін, мкОд/мл | 15,96±0,9 | 14,95±1,6 |
| Глюкоза, ммоль/л | 6,29±1,1 | 6,35±1,2 |
| НОМА | 4,17±0,5 | 4,09±0,5 |
| Білірубін загальний, мкмоль/л | 14,4±3,2 | 13,8±3,5 |
| АЛТ, од/л | 39,0±5,5 | 27,6±4,2 |
| АСТ, од/л | 37,85±5,0 | 27,1±3,8 |
| Білок загальний, г/л | 72,2±7,2 | 75,6±7,5 |
| ЗХС, ммоль/л | 9,4±0,5 | 8,6±0,4 |
| ТГ, ммоль/л | 3,3±0,1 | 3,5±0,1 |
| Сечовина, ммоль/л | 4,8±0,5 | 5,4±0,5 |
Продовження таблиці 4.1
| 1 | 2 | 3 |
| Креатинін, мкмоль/л | 80,9±3,5 | 96,7±3,7 |
| Гемоглобін, г/л | 151,2±7,8 | 144,6±7,3 |
| Еритроцити, ×10¹²/л | 4,5±0,3 | 4,2±0,2 |
| КП | 0,99±0,05 | 1,01±0,05 |
| Лейкоцити, ×10⁹/л | 6,5±0,5 | 6,6±0,5 |
| Еозинофіли, % | 2,65±0,2 | 4,65±0.3 |
| Паличкоядерні, % | 1,75±0,05 | 1,7±0,05 |
| Сегментоядерні, % | 61,1±3,2 | 64,1±3,3 |
| Лімфоцити, % | 29,5±1,5 | 25,9±1,5 |
| Моноцити, % | 4,9±0,5 | 4,85±0,5 |
| Базофіли, % | 0,15±0,01 | 0,15±0,01 |
| ШОЕ, мм/год | 10,7±1,2 | 10,9±1,3 |
На початку спостереження істотних відмінностей між групами виявлено не було.
Хворі першої групи отримували лікування з приводу псоріатичної хворобі згідно з протоколом, а другої – теж саме лікування з приводу псоріазу та цукрознижуючий препарат метформін для корекції метаболічних порушень.
Для оцінки впливу на перебіг псоріазу включення метформіну в схеми традиційної терапії, під час лікування було досліджено клінічний стан хворих та оцінено його важкість шляхом підрахунку індексу PASI та ДІЯЖ до та через 1, 3, 6 місяців лікування (таблиця 4.2).
Таблиця 4.2 – Динаміка середніх показників індексу PASI та DLQI у хворих на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім метаболічним синдром до та під час лікування (M±m) (n=20)
| І група хворих контрольна
(лікування згідно протоколу) |
ІІ група хворих (лікування згідно протоколу + метформін) | |
| PASI (бали) | ||
| До лікування | 14,14±0,95 | 14,45±1,3 |
| Через 1 міс | 11,78±0,6 | 10,85±0,7* |
| Через 3 міс | 6,05±0,3* | 1,5±0,1*# |
| Через 6 міс | 17,05±3,7 | 3,8±0,5*# |
| DLQI | ||
| До лікування | 13±0,75 | 13±0,75 |
| Через 1 міс | 11,75±0,7 | 11,25±0,6 |
| Через 3 міс | 8,5±0,4 | 2,5±0,1 |
| Через 6 міс | 14,25±3,7 | 5,5±0,5 |
Примітка. * – імовірність похибки різниці (р) між показником під час лікування та до лікування; # – імовірність похибки різниці (р) між показником лікування хворих метформіном та відповідним показником після стандартного лікування
Необхідно зазначити, що усі хворі були із середнім ступенем важкості перебігу псоріатичної хвороби, показники індексу PASI до лікування коливалися у межах від 12,0 до 16,8 бала, однак вираженість клінічної картини дещо відрізнялась. В основному це стосувалося розповсюдженості осередків уражень та площі, яку вони займали.
При дослідженні динаміки індексу PASI за перший місяць лікування, було встановлено, що індекс PASI в І групі дослідних хворих, які отримували лікування псоріазу згідно протоколу знизився на 17 % (PASI 17) – з (14,14±0,95) до (11,78±0,6) бала, а в ІІ групі хворих, що отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид – на 25 % (PASI 25) – з (14,45±1,3) до (10,85±0,7) бала.
При розрахунку ДІЯЖ було відмічено, що до лікування показник коливалися у межах від 11 до 15, а середньогруповий показник в обох групах складав 13, що свідчить про виражений вплив захворювання на якість життя пацієнтів.
При дослідженні динаміки ДІЯЖ за перший місяць лікування відмічено, що цей показник в І групі хворих, які отримували лікування псоріазу згідно протоколу, знизився на 9,5 % – з (13±0,75) до (11,25±0,6) бала, а в ІІ групі хворих, що отримували лікування псоріазу згідно протоколу та метформін, на 13,5 % – з (13±0,75) до (11,25±0,6) бала.
Таким чином, в обох групах спостерігалось незначне покращення після проведення стаціонарного курсу лікування, яке проявлялося зміною клінічної картини хворих, а саме незначним зменшенням вираженості інфільтрації, гіперемії та лущення псоріатичних бляшок, незначним зниження негативного впливу захворювання на якість життя пацієнтів. Побічних ефектів під час проведення терапії ні в одній з груп не відмічалось. Після виписки із стаціонару хворі обох груп продовжували місцеву терапію, прийом вітамінів та дотримувались дієти з приводу псоріатичної хвороби та МС, а хворі другої групи додатково продовжили прийом метформіну гідрохлориду в тій же дозі.
При визначенні динаміки шкірного патологічного процесу через 3 місяці лікування було встановлено достовірне зниження відповідного показника в обох групах хворих. Так, в І групі хворих, які лікувались згідно протоколу, покращення PASI 75 досягли 20 % пацієнтів, тоді як в ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформін, покращення PASI 75 досягли 85 % пацієнтів. Таким чином, середньогруповий показник індексу PASI в І групі становив 6,05±0,3, а в ІІ групі відповідно 1,16±0,10. В І групі хворих, що отримували лікування псоріазу згідно протоколу, частина елементів повністю редукувала з утворенням вторинних плям, частина псоріатичних бляшок регресувала в центральній своїй частині, у деяких хворих бляшки в ділянках колінних та ліктьових суглобів продовжували утримуватись, зберігаючи інфільтрацію та гіперемію з повним регресом лущення, це так звані чергові бляшки. В ІІ групі хворих, що отримували лікування псоріазу згідно протоколу та метформін у 85 % хворих спостерігався повний регрес псоріатичних висипань, у інших пацієнтів в деяких місцях псоріатичних висипань утримувалась гіперемія (пігментні плями).
При визначенні динаміки ДІЯЖ через 3 місяці лікування було встановлено, що в І групі хворих, які лікувались згідно протоколу, середньогруповий показник знизився до 8,5, що на 36,2 % нижче, ніж середньогруповий показник через 1 місяць лікування та на 42,3 % нижче, ніж до лікування. У хворих ІІ групи, які отримували лікування псоріазу згідно протоколу та метформін, середньогруповий показник ДІЯЖ знизився до 2,5, що на 77,8 % нижче, ніж середньогурповий показник через 1 місяць лікування та на 82,7 % нижче, ніж до лікування.
При подальшому спостереженні за хворими обох груп та визначенні динаміки шкірного патологічного процесу та впливу захворювання на якість життя пацієнтів через 6 місяців лікування визначено, що в першій групі хворих, які лікувались згідно протоколу, відмічається загострення псоріатичної хвороби у 16 (80,0 %) хворих. Середньогруповий показник індексу PASI у цих хворих становить (17,05±3,7) бала, а показник ДІЯЖ – 14,25 бала. Тоді як у хворих другої групи, що отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, спостерігалось загострення псоріатичної хвороби лише у 4 (20,0 %) хворих, що свідчить про значне подовження клінічної ремісії та зменшення зв’язку виникнення загострень від провокуючих факторів та супутньої патології. Середньогруповий показник індексу PASI у цих хворих становить (3,8±0,5) бала, а показник ДІЯЖ – 5,5 бала.
Для оцінці впливу включення метформіну гідрохлориду в схеми традиційної терапії на динаміку оцінюваних компонентів МС у пацієнтів, які страждають псоріатичною хворобою, нами були досліджені основні антропометричні показники, підрахований ІМТ, визначені показники АТ, ліпідного та вуглеводного обмінів.
При оцінці впливу лікування на антропометричні показники, були визначені ІМТ, ОТ, ОС до та під час лікування (таблиця 4.3).
Таблиця 4.3 – Динаміка середньогрупових антропометричних показників у хворих на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім метаболічним синдром до та під час лікування (M±m) (n=20)
| І група хворих контрольна
(лікування згідно протоколу) |
ІІ група хворих (лікування згідно протоколу + метформін) | |
| ІМТ (кг/м) | ||
| До лікування | 35,25±1,8 | 35,24±1,7 |
| Через 3 міс | 36,23±1,9 | 35,34±1,8 |
| Через 6 міс | 36,05±1,8 | 30,64±1,5# |
| ОТ (см) | ||
| До лікування | 116,95±4,1 | 117,0±4,3 |
| Через 3 міс | 120,13±4,2 | 117,11±4,2 |
| Через 6 міс | 120,11±4,2 | 113,03±4,1 |
| ОС (см) | ||
| До лікування | 114,6±3,8 | 114,55±3,8 |
| Через 3 міс | 114,73±3,9 | 114,56±3,8 |
| Через 6 міс | 114,7±3,9 | 113,19±3,6 |
Примітка. * – імовірність похибки різниці (р) між показником під час лікування та до лікування; # – імовірність похибки різниці (р) між показником лікування хворих метформіном гідрохлорид та відповідним показником після стандартного лікування
При дослідженні ІМТ було встановлено, що через 3 місяці лікування середньогруповий показник ІМТ в обох дослідних групах мав незначну тенденцію до підвищення, а через 6 місяців – тенденцію до зниження, але статистично значимою різниця була лише в ІІ групі хворих. Так, в І групі дослідних хворих, які отримували лікування псоріазу згідно протоколу, показник ІМТ через 3 місяці лікування підвищився на 2,8 % – з 35,25 до 36,23 кг/м2, а через 6 місяців лікування знизився на 2,3 % з 35,25 до 36,05 кг/м2. Тоді як у ІІ групі хворих, що отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид показник ІМТ підвищився на 0,3 % – з 35,24 до 35,34 кг/м2, а через 6 місяців лікування середньогруповий показник ІМТ знизився на 13,05 % – з 35,24 до 30,64 кг/м2.
При визначенні показника ОТ було відмічено, що через 3 міс. лікування в І групі дослідних хворих, які отримували лікування псоріазу згідно протоколу, відповідний показник підвищився на 2,7 % – з (116,95±4,1) до (120,13±4,2) см, тоді як в ІІ групі дослідних хворих, що отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, показник ОТ залишився майже незмінним та підвищився лише на 0,1 % – з (117,0±4,30) до (117,11±4,27) см. При аналізі відповідного показника через 6 міс. лікування було відмічено, що в І групі дослідних хворих показник ОТ залишився майже незмінним та становив 120,11 см, а в ІІ групі хворих спостерігалося зниження відповідного показника, який становив 113,03 см, що на 3,5 % нижче, ніж через 3 місяці лікування та на 3,4 % нижче, ніж до лікування.
При дослідженні показника ОС було відмічено, що через 3 місяці лікування відповідний показник в обох дослідних групах залишився майже не змінним. Тоді як через 6 місяців лікування було відмічено, що в І групі дослідних хворих цей показник залишився майже незмінним, а в ІІ групі спостерігалося зниження відповідного показника на 1,2 % з (114,55±3,8) до (113,19±3,6) см.
При оцінці впливу лікування на показники АТ (табл. 4.4) було відмічено, що через 3 міс. лікування в І групі дослідних хворих, які отримували лікування псоріазу згідно протоколу, показники САТ та ДАТ мали тенденцію до підвищення. Так, САТ підвищився на 0,5 % – з (164,75±1,9) до (165,5±1,9) мм рт. ст., а ДАТ на 1,3 % – з (94,25±1,8) до (95,5±1,9) мм рт. ст. Тоді як у ІІ групі дослідних хворих, що отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, відповідні показники залишились не змінними. При аналізі відповідних показників через 6 міс лікування було відмічено, що в обох дослідних групах відповідні показнки мали тенденцію до зниження, але статистично значимою вона була лише в ІІ групі хворих. Так, І групі хворих через 6 місяців лікування показник САТ становив (164,0±1,8) мм рт. ст., що на 0,5 % нижче, ніж до лікування та на 0,9 % нижче, ніж відповідний показник через 3 місяці лікування, а ДАТ – (93,99±1,8) мм рт. ст., що на 0,2 % нижче, ніж до лікування, і на 1,5 % нижче, ніж відповідний показник через 3 місяці лікування. Тоді як в ІІ групі дослідних хворих через 6 місяців лікування показник САТ знизився на 4 % – з (166,25±2,1) до (159,6±1,9) мм рт. ст., а ДАТ на 3 % – з (92,55±1,6) до (89,77±1,5) мм рт. ст.
Таблиця 4.4 – Динаміка середньогрупових показників АТ (мм.рт.ст.) у хворих на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім метаболічним синдром до та під час лікування (M±m) (n=20)
| І група хворих контрольна
(лікування згідно протоколу) |
ІІ група хворих (лікування згідно протоколу + метформін) | |
| САТ | ||
| До лікування | 164,75±1,9 | 166,25±2,1 |
| Через 3 міс | 165,5±1,9 | 166,25±2,1 |
| Через 6 міс | 164,0±1,8 | 159,6±1,9⃰ |
| ДАТ | ||
| До лікування | 94,25±1,8 | 92,55±1,6 |
| Через 3 міс | 95,5±1,9 | 92,55±1,6 |
| Через 6 міс | 93,99±1,8 | 89,77±1,5* |
Примітка. * – імовірність похибки різниці (р) між показником під час лікування та до лікування; # – імовірність похибки різниці (р) між показником лікування хворих метформіном гідрохлорид та відповідним показником після стандартного лікування
При оцінці впливу лікування на показники ліпідного обміну ми дослідили рівень ЗХС і ТГ через 3 та 6 місяців лікування (таблиця 4.5).
Таблиця 4.5 – Динаміка середньогрупових показників ліпідного (ммоль/л) обміну у хворих на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім метаболічним синдром до та під час лікування (M±m) (n=20)
| І група хворих контрольна
(лікування згідно протоколу) |
ІІ група хворих (лікування згідно протоколу + метформін) | |
| ЗХС | ||
| До лікування | 9,4±0,2 | 8,6±0,2 |
| Через 3 міс | 9,8±0,3 | 8,7±0,2# |
| Через 6 міс | 9,2±0,2 | 7,7±0,1⃰# |
| ТГ | ||
| До лікування | 3,3±0,1 | 3,5±0,1 |
| Через 3 міс | 3,5±0,13 | 3,6±0,11 |
| Через 6 міс | 3,2±0,09 | 2,4±0,07⃰# |
Примітка. * – імовірність похибки різниці (р) між показником під час лікування та до лікування; # – імовірність похибки різниці (р) між показником лікування хворих метформіном гідрохлорид та відповідним показником після стандартного лікування
При дослідженні ліпідного обміну було відмічено, що в І групі дослідних хворих, які отримували лікування псоріазу згідно протоколу, показники ЗХС і ТГ протягом всього лікування залишились статистично не змінними. Тоді як в ІІ групі хворих, що отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, через 6 місяців лікування спостерігається статистично значиме зниження відповідних показників. Так, через 3 міс. лікування відмічено, що в І групі дослідних хворих середньогруповий показник ЗХС підвищився на 4,3 % з (9,4±0,2) до (9,8±0,3) ммоль/л, а середньогруповий показник ТГ – на 6,1 % – з (3,3±0,1) до (3,5±0,13) ммоль/л. Тоді як, в ІІ рупі хворих через 3 місяці лікування середньогруповий показник ЗХС підвищився на 1,2 % – з (8,6±0,2) до (8,7±0,2) ммоль/л, а середньогруповий показник ТГ на 2,8 % – з (3,5±0,1) до (3,6±0,11) ммоль/л. При дослідженні відповідних показників через 6 місяців лікування було відмічено, що в І групі хворих середньогруповий показник ЗХС знизився до (9,2±0,2) ммоль/л, що на 6 % нижче, ніж відповідний показник через 3 місяці лікування, та на 2 % нижче, ніж відповідний показник до лікування, а середньогруповий показник ТГ – до (3,2±0,09) ммоль/л, що на 8,5 % нижче, ніж відповідний показник через 3 місяці лікування, та на 3 % нижче, ніж відповідний показник до лікування. Тоді як в ІІ групі хворих через 6 місяців лікування середньогруповий показник ЗХС знизився до (7,7±0,1) ммоль/л, що на 11,5 % нижче, ніж відповідний показник через 3 місяці лікування, та на 10,5 % менше, ніж відповідний показник до лікування, а середньогруповий показник ТГ – до (2,4±0,07) ммоль/л, що на 33 % нижче, ніж відповідний показник через 3 місяці лікування, та на 31,5 % нижче, ніж відповідний показник до лікування.
Для оцінки впливу лікування на показники вуглеводного обміну досліджувався рівень глюкози, інсуліну крові та підраховувався індекс HOMA‑IR для оцінки рівня ІР до та під час лікування (таблиця 4.6).
При аналізі отриманих результатів та дослідженні рівня глюкози крові, взятої вранці натщесерце, встановлено, що в обох групах на протягом всього лікування відповідний показник мав тенденцію до зниження, але більш вираженою була у хворих ІІ групи, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид. Так, через 3 міс. лікування було відмічено, що в І групі дослідних хворих середньогруповий показник глюкози знизився на 7 % – з (6,29±1,1) до (5,87±0,9) ммоль/л, а в ІІ групі хворих на 23,8 % – з (6,35±1,2) до (4,84±0,7) ммоль/л. При дослідженні відповідних показників через 6 місяців лікування було відмічено, що в І групі хворих середньогруповий показник глюкози знизився до (5,8±0,9) ммоль/л, що на 8 % нижче, ніж відповідний показник до лікування, тоді як в ІІ групі хворих відповідний показник знизився до (4,1±0,5) ммоль/л, що на 35,4 % нижче, ніж відповідний показник до лікування.
Таблиця 4.6 – Динаміка середньогрупових показників вуглеводного обміну у хворих на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім метаболічним синдром до та під час лікування (M±m) (n=20)
| І група хворих контрольна
(лікування згідно протоколу) |
ІІ група хворих (лікування згідно протоколу + метформін) | |
| Глюкоза крові (ммоль/л) | ||
| До лікування | 6,29±1,1 | 6,35±1,2 |
| Через 3 міс | 5,87±0,9 | 4,84±0,7 |
| Через 6 міс | 5,8±0,9 | 4,1±0,5 |
| Інсулін (мкЕД/мл) | ||
| До лікування | 15,96±0,9 | 14,95±1,6 |
| Через 3 міс | 36,17±2,6* | 12,9±1,1# |
| Через 6 міс | 42,24±3,5* | 10,55±0,9*# |
| НОМА-ІR | ||
| До лікування | 4,46±0,5 | 4,31±0,5 |
| Через 3 міс | 9,43±0,9* | 2,77±0,3*# |
| Через 6 міс | 10,88±0,7* | 1,92±0,2*# |
Примітка. * – імовірність похибки різниці (р) між показником під час лікування та до лікування; # – імовірність похибки різниці (р) між показником лікування хворих метформіном гідрохлорид та відповідним показником після стандартного лікування
При дослідженні рівня інсуліну, взятого вранці натщесерце, встановлено, що в І групі дослідних хворих, які отримували лікування псоріазу згідно протоколу, спостерігалось достовірне підвищення відповідного показника протягом всього лікування. У ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіном, рівень інсуліну крові мав тенденцію до зниження, яка була достовірно нижчою вже через 6 місяців лікування. Так, через 3 міс. лікування було відмічено, що в І групі дослідних хворих середньогруповий показник інсуліну підвищився на 127 % – з (15,96±0,9) до (36,17±2,6) мкОД/мл, тоді як в ІІ групі хворих середньогруповий показник інсуліну знизився на 14 % – з (14,95±1,6) до (12,9±1,1) мкОД/мл. При дослідженні відповідних показників через 6 місяців лікування було відмічено, що в І групі хворих середньогруповий показник інсуліну підвищився до (42,24±3,5) мкОД/мл, що на 17 % вище, ніж відповідний показник через 3 місяці лікування та на 165 % вище, ніж відповідний показник до лікування. В ІІ групі хворих через 6 місяців лікування середньогруповий показник інсуліну знизився до 10,55 мкОД/мл, що на 18 % нижче, ніж відповідний показник через 3 місяці лікування та на 30 % нижче, ніж відповідний показник до лікування.
При розрахунку індексу HOMA-IR та аналізі отриманих результатів даного показника було відмічено, що майже всі хворі обох дослідних груп до лікування мали ІР. При подальшому дослідженні відповідного показника було відмічено, що в І групі дослідних хворих спостерігалось достовірне підвищення індексу HOMA-IR протягом всього лікування, тоді як в ІІ групі хворих, навпаки, відбулося достовірне зниження відповідного показника. Так, через 3 міс. лікування було відмічено, що в І групі дослідних хворих середньогруповий показник індексу HOMA-IR підвищився на 111 % – з 4,46±0,5 до 9,43±0,9, тоді як в ІІ групі хворих середньогруповий показник індексу HOMA-IR знизився на 36 % – з 4,31±0,5 до 2,77±0,3. При дослідженні відповідних показників через 6 місяців лікування було відмічено, що в І групі хворих середньогруповий показник індексу HOMA-IR підвищився до 10,88±0,7, що на 15 % вище, ніж відповідний показник через 3 місяці лікування, та на 144 % вище, ніж відповідний показник до лікування. Тоді як в ІІ групі хворих через 6 місяців лікування середньогруповий показник індексу HOMA-IR знизився до 1,92±0,2, що на 31 % нижче, ніж відповідний показник через 3 місяці лікування, та на 56 % нижче, ніж відповідний показник до лікування. Як відомо, підвищуючи печінкову і периферичну чутливість до ендогенного інсуліну, метформіну гідрохлорид безпосередньо не впливає на секрецію інсуліну. При цьому на тлі зменшення ІР знижується базальний рівень інсуліну в сироватці крові. Завдяки всім зазначеним ефектам метформіну гідрохлориду, відбувається зниження рівня глюкози без ризику гіпоглікемічних станів, що є безперечною перевагою препарату. Поряд з цим, метформін має ряд інших метаболічних ефектів, включаючи і вплив на жировий обмін [56].
Для оцінки впливу лікування на показники системного запалення нами була досліджена динаміка таких показників, як вч-СРБ, ФНП-α, ІЛ-6 та церулоплазмін до та під час лікування (таблиця 4.7).
При дослідженні рівня ФНП-α було встановлено, що в І групі дослідних хворих, які отримували лікування псоріазу згідно протоколу, спостерігалось незначне підвищення відповідного показника протягом всього лікування. Тоді як в ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, спостерігалось достовірне зниження відповідного показника протягом всього лікування. Так, через 3 міс лікування було відмічено, що в І групі дослідних хворих середньогруповий показник ФНП-α підвищився на 1 % – з (21,13±2,5) до (21,35±2,5) пг/мл, тоді як в ІІ групі хворих середньогруповий показник ФНП-α знизився на 93 % – з (21,69±2,6) до (1,6±0,5) пг/мл. При дослідженні відповідних показників через 6 місяців лікування було відмічено, що в І групі хворих середньогруповий рівень ФНП-α підвищився до (21,5±2,6) пг/мл, що на 1 % вище, ніж відповідний показник через 3 місяці лікування та на 2 % вище, ніж відповідний показник до лікування. Тоді як в ІІ групі хворих через 6 місяців лікування середньогруповий показник ФНП-α знизився до (0,29±0,03) пг/мл, що на 82 % нижче, ніж відповідний показник через 3 місяці лікування, та на 99 % нижче, ніж відповідний показник до лікування.
Таблиця 4.7 – Динаміка середньогрупових показників системного запалення у хворих на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім метаболічним синдром до та під час лікування (M±m) (n=20)
| І група хворих
(лікування згідно протоколу) |
ІІ група хворих (лікування згідно протоколу + метформін) | |
| ФНП-α (пг/мл) | ||
| До лікування | 21,13±2,5 | 21,69±2,6 |
| Через 3 міс | 21,35±2,5 | 1,6±0,5* |
| Через 6 міс | 21,5±2,6 | 0,29±0,03*# |
| ІЛ-6 (пг/мл) | ||
| До лікування | 5,33±0,8 | 5,65±0,9 |
| Через 3 міс | 6,26±0,9 | 3,8±0,5# |
| Через 6 міс | 3,5±0,5 | 2,05±0,3*# |
| вч – СРБ (пг/мл) | ||
| До лікування | 14,025±1,3 | 13,935±1,2 |
| Через 3 міс | 14,7±1,4 | 8,7±1,2*# |
| Через 6 міс | 15,7±1,5 | 4,45±0,9*# |
| Церулоплазмин (мг/л) | ||
| До лікування | 212,43±7,6 | 219,45±7,8 |
| Через 3 міс | 232,99±7,7 | 233,18±7,8 |
| Через 6 міс | 218,84±7,3 | 194,95±7,0*# |
Примітка. * – імовірність похибки різниці (р) між показником під час лікування та до лікування; # – імовірність похибки різниці (р) між показником лікування хворих метформіном гідрохлорид та відповідним показником після стандартного лікування
При дослідженні рівня ІЛ-6 було відмічено, що через 3 місяці лікування в І групі хворих відповідний показник дещо підвищився, а в ІІ групі хворих мав тенденцію до зниження, тоді як через 6 місяців лікування спостерігається зниження рівня ІЛ-6 в обох підгрупах, але достовірно значимим воно було в ІІ групі. Так, через 3 міс. лікування було відмічено, що в І групі дослідних хворих середньогруповий показник ІЛ-6 підвищився на 17 % – з (5,33±0,8) до (6,26±0,9) пг/мл, тоді як в ІІ групі хворих середньогруповий показник ІЛ-6 знизився на 33 % – з (5,65±0,9) до (3,8±0,5) пг/мл. При дослідженні відповідних показників через 6 місяців лікування було відмічено, що в І групі хворих середньогруповий показник ІЛ-6 знизився до (3,5±0,5) пг/мл, що на 44 % нижче, ніж відповідний показник через 3 місяці лікування, та на 34 % нижче, ніж відповідний показник до лікування. Тоді як, в ІІ групі хворих через 6 місяців лікування середньогруповий показник ІЛ-6 знизився до (2,05±0,3) пг/мл, що на 46 % нижче, ніж відповідний показник через 3 місяці лікування, та на 64 % нижче, ніж відповідний показник до лікування.
При дослідженні рівня вч-СРБ було відмічено, що в І групі дослідних хворих, які отримували лікування псоріазу згідно протоколу, спостерігалось підвищення відповідного показника на протязі всього лікування. Тоді як в ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформін, спостерігалось достовірне зниження відповідного показника протягом всього лікування. Так, через 3 міс лікування було відмічено, що в І групі дослідних хворих середньогруповий показник вч-СРБ підвищився на 5 % – з (14,025±1,3) до (14,7±1,4) пг/мл, тоді як в ІІ групі хворих середньогруповий показник вч-СРБ знизився на 38 % – з (13,935±1,2) до (8,7±1,2) пг/мл. При дослідженні відповідних показників через 6 місяців лікування було відмічено, що в І групі хворих середньогруповий показник вч-СРБ підвищився до (15,7±1,5) пг/мл, що на 7 % вище, ніж відповідний показник через 3 місяці лікування, та на 12 % вище, ніж відповідний показник до лікування. В ІІ групі хворих через 6 місяців лікування середньогруповий показник вч-СРБ знизився до (4,45±0,9) пг/мл, що на 49 % нижче, ніж відповідний показник через 3 місяці лікування, та на 68 % нижче, ніж відповідний показник до лікування.
При дослідженні показників церулоплазміну до та під час лікування значущих змін показника в обох групах хворих не спостерігалось та значення показників знаходилось у межах норми.
Для більш чіткого контролю лікування та впливу терапії на клініко-лабораторні показники в залежності від рівня СЗ, кожна з груп була поділена за рівнем вч-СРБ в сиворотці крові за допомогою медіан на дві підгрупи: з високим рівнем системного запалення та низьким рівнем системного запалення. Таким чином, утворилося чотири підгрупи хворих. У створених підгрупах були розраховані середні показники, що характеризують вираженість запального процесу, метаболічних порушень і псоріатичної хвороби. Імовірність похибки різниці розраховувалась як в середині кожної підгрупи, порівнюючи значення конкретного показника до та під час лікування, так і між підгрупами, що відображено в табл. 4.8.
При аналізі отриманих результатів дослідження нами була відмічена чітка залежність більшості показників від рівня системного запалення. Так показники індексу PASI, ІМТ, ДАТ, ОС, вч-СРБ, ФНП-α, ІЛ-6, церулоплазмін та інсулін в обох дослідних підгрупах хворих з високим рівнем системного запалення були значно вищими ніж у хворих в підгрупах з низьким рівнем системного запалення, що вказує на взаємозв’язок між тяжкістю перебігу псоріазу, вираженістю метаболічних порушень та системного запалення. Було проаналізовано динаміку ефективності лікування через 3 та через 6 місяців лікування в середині кожної підгрупи в залежності від рівня системного запалення.
При оцінці впливу лікування на клінічний стан хворих в залежності від рівня системного запалення проводилося дослідження індексу PASI та ДІЯЖ через 1, 3 та 6 місяців лікування (таблиця 4.9).
Після закінчення стаціонарного лікування оцінена динаміка індексу PASI та ДІЯЖ за перший місяць лікування. Як видно з даних таблиці 4.9, достовірне зниження індексу PASI виявлялося лише в ІІ групі хворих з високим рівнем системного запалення. Аналізуючи динаміку середньогрупових показників індексу PASI в І групі хворих, які отримували лікування псоріазу згідно протоколу було відмічено, що в підгрупі хворих з високим рівнем системного запалення відповідний показник знизився на 17 % (PASI 17), а в підгрупі хворих з низьким рівнем системного запалення на – 16 % (PASI 16). При дослідженні відповідного показника в ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, було відмічено, що в підгрупі з високим рівнем системного запалення відповідний показник знизився на 30 % (PASI 30), а в підгрупі з низьким рівнем системного запалення на – 17 % (PASI 17).
Таблиця 4.8 – Залежність клініко-лабораторних показників від рівня СРП у хворих на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім метаболічним синдром під час лікування та у віддалені строки (M±m)
| Показник | І група (лікування згідно протоколу) | ІІ група (лікування згідно протоколу + метфорін) | ||
| підгрупа з високим рівнем СЗ (n=10) | підгрупа з низьким рівнем СЗ (n=10) | підгрупа з високим рівнем СЗ (n=10) | підгрупа з низьким рівнем СЗ (n=10) | |
| PASI, бали | 16,13±1,1 | 12,15±0,95 | 16,31±1,2 | 12,59±0,9 |
| ДАТ, мм рт.ст. | 100±1,8 | 88,5±1,6 | 93,5±1,6 | 91,6±1,6 |
| САТ, ммрт.ст. | 163,5±1,9 | 166,0±2,1 | 166,5±2,1 | 165,5±2,1 |
| ОТ, cм | 116,8±3,5 | 117,1±3,7 | 117,5±3,7 | 116,8±3,6 |
| ОС, cм | 115,9±3,9 | 113,3±3,6 | 115,3±3,8 | 113,8±3,6 |
| ІМТ, кг/м² | 36,45±1,9 | 34,05±1,7 | 36,38±1,9 | 34,09±1,6 |
| вч-СРБ, мг/л | 16,65±1,3 | 11,4±1,2 | 16,4±1,4 | 11,47±1,1 |
| ФНП-α, пг/мл | 30,6±2,6 | 11,66±2,2 | 26,45±2,7 | 16,93±2,4 |
| ІЛ-6, пг/мл | 6,62±0,8 | 4,04±0,6 | 9,05±0,9 | 2,25±0,3 |
| Церулоплазмін, мг/л | 234,2±7,8 | 190,7±7,2 | 219,5±7,7 | 219,3±7,6 |
| Інсулін, мкОд/мл | 16,65±1,5 | 15,26±1,6 | 19,13±1,7 | 10,76±1,5 |
| Глюкоза, ммоль/л | 6,62±0,9 | 5,97±1,1 | 6,87±1,2 | 5,82±0,9 |
| НОМА | 4, 16±0,5 | 4,19±0,5 | 5,24±0,5 | 2,93±0,3 |
| ЗХС, ммоль/л | 9,31±0,5 | 9,51±0,5 | 8,42±0,4 | 8,79±0,4 |
| ТГ, ммоль/л | 3,3±0,1 | 3,4±0,1 | 3,46±0,1 | 3,54±0,1 |
Таблиця 4.9 – Динаміка середньогрупових показників індексу PASI та DLQI у хворих на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім метаболічним синдром до та під час лікування в залежності від рівня системного запалення (M±m) (n=10)
| І група контрольна (лікування згідно протоколу) | ІІ група (лікування згідно протоколу + метформін) | |||
| підгрупа з високим рівнем СЗ | підгрупа з низьким рівнем СЗ | підгрупа з високим рівнем СЗ | підгрупа з низьким рівнем СЗ | |
| PASI | ||||
| До лікування | 16,13±1,1 | 12,15±0,95 | 16,31±1,2 | 12,32±0,9 |
| Через 1 міс | 13,35±0,7 | 10,2±0,5! | 11,5±0,6* | 10,2±0,5 |
| Через 3 міс | 6,7±0,3* | 5,4±0,3*! | 1,0±0,06*# | 2,0±0,1*#! |
| Через 6 міс | 19,6±0,72* | 14,5±0,73! | 2,0±0,09*# | 5,6±0,19*#! |
| DLQI | ||||
| До лікування | 14,9±0,8 | 11,2±0,6 | 14,9±0,8 | 11,2±0,6 |
| Через 1 міс | 13,5±0,7 | 10,0±0,5 | 12,5±0,6 | 10,0±0,5 |
| Через 3 міс | 9,0±0,3 | 7,0±0,3 | 2,0±0,05 | 3,0±0,06 |
| Через 6 міс | 16,0±0,9 | 12,5±0,7 | 4,0±0,09 | 7,0±0,2 |
Примітка. * – імовірність похибки різниці (р) між показником під час лікування та до лікування; # – імовірність похибки різниці (р) між показником лікування хворих метформіном та відповідним показником після стандартного лікування; ! – імовірність похибки різниці (р) між показником в підгрупі з більш високим рівнем СЗ та відповідним показником в підгрупі з нищим рівнем СЗ
Аналізуючи динаміку середньогрупових показників ДІЯЖ за перший місяць лікування в І групі хворих, які отримували лікування псоріазу згідно протоколу, відмічено, що в підгрупі хворих з високим рівнем системного запалення відповідний показник знизився на 9 % – з (14,9±0,8) до (13,5±0,7) бала, а в підгрупі хворих з низьким рівнем системного запалення на 11 % – з (11,2±0,6) до (10,0±0,5) бала. При дослідженні відповідного показника в ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, було відмічено, що в підгрупі з високим рівнем системного запалення відповідний показник знизився на 16 % – з (14,9±0,8) до (12,5±0,6) бала, а в підгрупі з низьким рівнем системного запалення на 11 % – з (11,2±0,6) до (10,0±0,5) бала.
Після виписки із стаціонару хворі обох груп продовжували місцеву терапію, прийом вітамінів та дотримувались дієти з приводу псоріатичної хвороби та МС, а хворі ІІ групи додатково продовжили прийом метформіну гідрохлорид у тій же дозі.
При визначенні динаміки шкірного патологічного процесу через 3 місяці лікування було встановлено достовірне зниження індексу PASI в усіх підгрупах хворих, але більш вираженим воно було в підгрупах хворих, які додатково отримували метформіну гідрохлорид. При дослідженні динаміки індексу PASI в І групі хворих було відмічено, що в підгрупі з високим рівнем системного запалення покращення PASI 75 спостерігалось у 10 % хворих, а в підгрупі хворих з низьким рівнем системного запалення – у 30 % хворих. При дослідженні відповідного показника в ІІ групі хворих було відмічено, що в підгрупі з високим рівнем системного запалення клінічного вилікування псоріазу (PASI 75 та вище) досягли 90 % хворих, а в підгрупі з низьким рівнем системного запалення – 80 % хворих.
Аналізуючи динаміку середньогрупових показників ДІЯЖ через 3 місяці лікування в І групі хворих, які отримували лікування псоріазу згідно протоколу було відмічено, що в підгрупі хворих з високим рівнем системного запалення відповідний показник знизився до (9,0±0,3) бала, що на 33 % нижче, ніж відповідний показник через 1 місяць лікування та на 40 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем системного запалення – до (7,0±0,3) бала, що на 30 % нижче, ніж відповідний показник через 1 місяць лікування та на 38 % нижче, ніж відповідний показник до лікування. В ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, було відмічено, що в підгрупі з високим рівнем системного запалення відповідний показник знизився до (2,0±0,05) бала, що на 84 % нижче, ніж відповідний показник через 1 місяць лікування та на 87 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ – до (3,0±0,06) бала, що на 70 % нижче, ніж відповідний показник через 1 місяць лікування, та на 97 % нижче, ніж відповідний показник до лікування.
У І групі хворих з високим рівнем СЗ рецидив псоріатичної хвороби спостерігався у 100 % хворих, а з низьким рівнем системного запалення – у 60 % хворих. Разом з тим в ІІ групі хворих з високим рівнем системного запалення загострення псоріатичної хвороби спостерігалося у 10 % хворих, а з низьким рівнем системного запалення – у 30 % хворих. Також потрібно відмітити, що у 40 % хворих І групи рецидив псоріазу спостерігався вже через 4 місяці лікування та індекс PASI у них був вище, ніж у хворих ІІ групи.
Аналізуючи динаміку середньогрупових показників ДІЯЖ через 6 місяців лікування в І групі хворих, які отримували лікування псоріазу згідно протоколу, було відмічено, що в підгрупі хворих з високим рівнем СЗ відповідний показник підвищився до (16,0±0,9) бала, що на 78 % вище, ніж відповідний показник через 3 місяці лікування, та на 7 % вище, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ – до (12,5±0,7) бала, що на 79 % вище, ніж відповідний показник через 3 місяці лікування та на 12 % вище, ніж відповідний показник до лікування. В ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, було відмічено, що в підгрупі з високим рівнем СЗ відповідний показник підвищився до (4,0±0,09) бала, що на 100 % вище, ніж відповідний показник через 3 місяці лікування, але на 73 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ – до (7,0±0,2) бала, що на 133 % вище, ніж відповідний показник через 3 місяці лікування, але на 38 % нижче, ніж відповідний показник до лікування.
Для оцінки впливу лікування на показники вуглеводного обміну в залежності від рівня СЗ досліджувався рівень глюкози, інсуліну крові та підраховувався індекс HOMA-IR для оцінки рівня ІР до та під час лікування (таблиця 4.10).
Таблиця 4.10 – Динаміка середньогрупових показників вуглеводного обміну у хворих на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім метаболічним синдром до та під час лікування в залежності від рівня системного запалення (M±m) (n=10)
| І група контрольна (лікування згідно протоколу) | ІІ група (лікування згідно протоколу + метформін) | |||||
| підгрупа з високим рівнем СЗ | підгрупа з низьким рівнем СЗ | підгрупа з високим рівнем СЗ | підгрупа з низьким рівнем СЗ | |||
| Глюкоза крові (ммоль/л) | ||||||
| До лікування | 6,62±0,9 | 5,97±1,1 | 6,87±1,2 | 5,82±0,9 | ||
| Через 3 міс | 6,30±0,9 | 5,44±1,1 | 5,23±0,9 | 4,44±0,5 | ||
| Через 6 міс | 6,38±0,8 | 5,21±1,1 | 4,24±0,8 | 3,96±0,3 | ||
| Інсулін (мкЕД/мл) | ||||||
| До лікування | 16,65±1,5 | 15,26±1,6 | 19,13±1,7 | 10,76±1,5 | ||
| Через 3 міс | 46,02±2,1⃰ | 26,32±3,5⃰! | 15,2±1,5# | 10,6±1,3#! | ||
| Через 6 міс | 46,78±2,6⃰ | 37,7±3,5⃰ | 10,9±1,1⃰# | 10,2±1,2# | ||
| НОМА-ІR | ||||||
| До лікування | 4,89±0,5 | 4,04±0,5 | 5,84±0,5 | 2,78±0,3 | ||
| Через 3 міс | 12,77±0,6⃰ | 6,1±0,9! | 3,53±0,4⃰# | 2,09±0,3#! | ||
| Через 6 міс | 13,25±0,9⃰ | 8,51±0,7⃰! | 2,05±0,3⃰# | 1,79±0,2# | ||
Примітка. * – імовірність похибки різниці (р) між показником під час лікування та до лікування; # – імовірність похибки різниці (р) між показником лікування хворих метформіном та відповідним показником після стандартного лікування; ! – імовірність похибки різниці (р) між показником в підгрупі з більш високим рівнем СЗ та відповідним показником в підгрупі з нищим рівнем СЗ
При дослідженні середньогрупового рівня глюкози через 3 місяці лікування в І групі хворих, які отримували лікування псоріазу згідно протоколу, було відмічено, що в підгрупі хворих з високим рівнем системного запалення відповідний показник знизився на 5 % – з (6,62±0,9) до (6,30±0,9) ммоль/л, а в підгрупі хворих з низьким рівнем системного запалення на 9 % – з (5,97±1,1) до (5,44±1,1) ммоль/л. При дослідженні відповідного показника в ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, було відмічено, що в підгрупі з високим рівнем системного запалення відповідний показник знизився на 24 % – з (6,87±1,2) до (5,23±0,9) ммоль/л, а в підгрупі з низьким рівнем системного запалення на 24 % – з (5,82±0,9) до (4,44±0,5) ммоль/л. При дослідженні відповідних показників через 6 місяці лікування в І групі хворих, які отримували лікування псоріазу згідно протоколу, було відмічено, що в підгрупі хворих з високим рівнем системного запалення відповідний показник підвищився до (6,38±0,8) ммоль/л, що на 1 % вище, ніж відповідний показник через 3 місяці лікування, але на 4 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ знизився до (5,21±1,1) ммоль/л, що на 4 % нижче, ніж відповідний показник через 3 місяці лікування та на 13 % нижче, ніж відповідний показник до лікування. У ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, було відмічено, що в підгрупі з високим рівнем СЗ відповідний показник знизився до (4,24±0,8) ммоль/л, що на 19 % нижче, ніж відповідний показник через 3 місяці лікування та на 38 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ до (3,96±0,3) ммоль/л, що на 11 % нижче, ніж відповідний показник через 3 місяці лікування, та на 32 % нижче, ніж відповідний показник до лікування.
При дослідженні рівня інсуліну було відмічено, що в І групі хворих, які отримували лікування псоріазу згідно протоколу, спостерігається достовірне підвищення відповідного показника протягом всього лікування. В ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, рівень інсуліну крові мав тенденцію до зниження, яка була достовірно нижчою вже через 6 місяців лікування в підгрупі хворих з високим рівнем СЗ. Таким чином, аналізуючи динаміку середньогрупового показника інсуліну через 3 місяці лікування в І групі хворих було відмічено, що в підгрупі з високим рівнем СЗ відповідний показник за 3 місяці лікування підвищився на 176 % – з (16,65±1,5) до (46,02±2,1) мкОД/мл, а в підгрупі з низьким рівнем СЗ на 72 % – з (15,26±1,6) до (26,32±3,5) мкОД/мл. При дослідженні відповідного показника в ІІ групі хворих було відмічено, що в підгрупі з високим рівнем СЗ показник інсуліну знизився за 3 місяці лікування на 21 % – з (19,13±1,7) до (15,2±1,5) мкОД/мл, а в підгрупі з низьким рівнем СЗ на 1 % – з (10,76±1,5) до (10,6±1,3) мкОД/мл. При дослідженні відповідних показників через 6 місяці лікування в І групі хворих було відмічено, що в підгрупі хворих з високим рівнем системного запалення відповідний показник підвищився до (46,78±2,6) мкОД/мл, що на 2 % вище, ніж відповідний показник через 3 місяці лікування та на 181 % вище, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ – до (37,7±3,5) мкОД/мл, що на 43 % вище, ніж відповідний показник через 3 місяці лікування, та на 147 % вище, ніж відповідний показник до лікування. В ІІ групі хворих було відмічено, що в підгрупі з високим рівнем СЗ відповідний показник знизився до (10,9±1,1) мкОД/мл, що на 28 % нижче, ніж відповідний показник через 3 місяці лікування та на 43 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ – до (10,2±1,2) мкОД/мл, що на 4 % нижче, ніж відповідний показник через 3 місяці лікування та на 5 % нижче, ніж відповідний показник до лікування.
При розрахунку індексу HOMA-IR та аналізі отриманих результатів було відмічено, що в І групі хворих, які отримували лікування псоріазу згідно протоколу, спостерігалось підвищення відповідного показника на протязі всього лікування, яке було достовірно вищим вже через 3 місяці лікування в підгрупі з високим рівнем системного запалення, а через 6 місяців – і в підгрупі з низьким рівнем системного запалення. Тоді як в ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, індекс HOMA-IR, навпаки, мав тенденцію до зниження, яка була достовірно нижчою вже через 3 місяці лікування в підгрупі з високим рівнем СЗ. Таким чином, аналізуючи динаміку середньогрупового показника індексу HOMA-IR через 3 місяці лікування в І групі хворих було відмічено, що в підгрупі з високим рівнем системного запалення відповідний показник за 3 місяці лікування підвищився на 161 % – з 4,89±0,5 до 12,77±0,6, а в підгрупі з низьким рівнем системного запалення на 51 % – з 4,04±0,5 до 6,1±0,9. При дослідженні відповідного показника в ІІ групі хворих було відмічено, що в підгрупі з високим рівнем системного запалення показник індексу HOMA-IR за 3 місяці лікування знизився на 40 % – з 5,84±0,5 до 3,53±0,4, а в підгрупі з низьким рівнем системного запалення на 25 % – з 2,78±0,3 до 2,09±0,3. При дослідженні відповідних показників через 6 місяців лікування в І групі хворих було відмічено, що в підгрупі хворих з високим рівнем системного запалення відповідний показник підвищився до 13,25±0,9, що на 4 % вище, ніж відповідний показник через 3 місяці лікування, та на 171 % вище, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем системного запалення – до 8,51±0,7, що на 40 % вище, ніж відповідний показник через 3 місяці лікування та на 110 % вище, ніж відповідний показник до лікування. Тоді як в ІІ групі хворих було відмічено, що в підгрупі з високим рівнем СЗ відповідний показник знизився до 2,05±0,3, що на 42 % нижче, ніж відповідний показник через 3 місяці лікування та на 65 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ – до 1,79±0,2, що на 14 % нижче, ніж відповідний показник через 3 місяці лікування та на 36 % нижче, ніж відповідний показник до лікування.
Для оцінки впливу лікування на показники системного запалення нами були досліджені такі показники, як вч-СРБ, ФНП-α, ІЛ-6 до та під час лікування (таблиця 4.11).
Таблиця 4.11 – Динаміка середньогрупових показників системного запалення у хворих на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім метаболічним синдром до та під час лікування в залежності від рівня системного запалення (M±m) (n=10)
| І група контрольна (лікування згідно протоколу) | ІІ група (лікування згідно протоколу + метформін) | |||||
| підгрупа з високим рівнем СЗ | підгрупа з низьким рівнем СЗ | підгрупа з високим рівнем СЗ | підгрупа з низьким рівнем СЗ | |||
| ФНП-α (пг/мл) | ||||||
| До лікування | 30,6±2,6 | 11,66±2,2 | 26,45±2,7 | 16,93±2,4 | ||
| Через 3 міс | 30,8±2,7 | 11,9±1,8! | 1,5±0,2⃰# | 1,7±0,2⃰# | ||
| Через 6 міс | 30,9±2,9 | 12,1±1,5! | 0,34±0,05⃰# | 0,2±0,003⃰#! | ||
| ІЛ-6 (пг/мл) | ||||||
| До лікування | 6,62±0,8 | 4,04±0,6 | 9,05±0,9 | 2,25±0,3 | ||
| Через 3 міс | 7,33±0,7 | 5,18±0,6 ! | 4,05±0,5⃰# | 3,6±0,7 | ||
| Через 6 міс | 3,82±0,5⃰ | 3,17±0,5 | 2,0±0,3⃰# | 2,1±0,3 | ||
| вч-СРБ (пг/мл) | ||||||
| До лікування | 16,65±1,3 | 11,4±1,2 | 16,4±1,4 | 11,47±1,1 | ||
| Через 3 міс | 17,5±1,4 | 11,9±1,2! | 8,5±1,2⃰# | 8,9±1,1 | ||
| Через 6 міс | 18,0±1,4 | 13,5±1,5! | 3,5±0,3⃰# | 5,4±0,5⃰#! | ||
Примітка. * – імовірність похибки різниці (р) між показником під час лікування та до лікування; # – імовірність похибки різниці (р) між показником лікування хворих метформіном та відповідним показником після стандартного лікування; ! – імовірність похибки різниці (р) між показником в підгрупі з більш високим рівнем СЗ та відповідним показником в підгрупі з нищим рівнем СЗ
При дослідженні рівня ФНП-α було відмічено, що в І групі хворих, які отримували лікування псоріазу згідно протоколу, спостерігається підвищення відповідного показника в обох підгрупах хворих протягом всього лікування. В ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, рівень ФНП-α мав тенденцію до зниження, яка була достовірно нижчою вже через 3 місяці лікування в обох підгрупах хворих. Таким чином, аналізуючи динаміку середньогрупового показника ФНП-α через 3 місяці лікування в І групі хворих було відмічено, що в підгрупі з високим рівнем системного запалення відповідний показник за 3 місяці лікування підвищився на 1 % -– з (30,6±2,6) до (30,8±2,7) пг/мл, а в підгрупі з низьким рівнем системного запалення на 3 % – з (11,66±2,2) до (11,9±1,8) пг/мл. При дослідженні відповідного показника в ІІ групі хворих було відмічено, що в підгрупі з високим рівнем системного запалення показник ФНП-α за 3 місяці лікування знизився на 94 % – з (26,45±2,7) до (1,5±0,2) пг/мл, а в підгрупі з низьким рівнем системного запалення на 90 % – з (16,93±2,4) до (1,7±0,2) пг/мл. При дослідженні відповідного показника через 6 місяці лікування в І групі хворих було відмічено, що в підгрупі хворих з високим рівнем СЗ відповідний показник залишився майже незмінним підвищившись лише до (30,9±2,9) пг/мл, а в підгрупі хворих з низьким рівнем системного запалення – до (12,1±1,5) пг/мл, що на 2 % вище, ніж відповідний показник через 3 місяці лікування та на 4 % вище, ніж відповідний показник до лікування. В ІІ групі хворих було відмічено, що в підгрупі з високим рівнем системного запалення відповідний показник знизився до (0,34±0,05) пг/мл, що на 77 % нижче, ніж відповідний показник через 3 місяці лікування та на 99 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ – до (0,2±0,003) пг/мл, що на 88 % нижче, ніж відповідний показник через 3 місяці лікування, та на 99 % нижче, ніж відповідний показник до лікування.
При визначенні рівня ІЛ-6 через 3 місяці лікування було відмічено, що в І групі хворих, які отримували лікування псоріазу згідно протоколу, спостерігалось підвищення відповідного показника. В ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, навпаки, відповідний показник мав тенденцію до зниження, яка була достовірно значимою в підгрупі з високим рівнем СЗ. При дослідженні відповідного показника через 6 місяців лікування спостерігалося його зниження в усіх підгрупах хворих, але достовірно значимим воно було в підгрупах з високим рівнем системного запалення. Так, аналізуючи динаміку середньогрупового показника ІЛ-6 через 3 місяці лікування в І групі хворих було відмічено, що в підгрупі з високим рівнем системного запалення відповідний показник за 3 місяці лікування підвищився на 11 % – з (6,62±0,8) до (7,33±0,7) пг/мл, а в підгрупі з низьким рівнем системного запалення на 28 % – з (4,04±0,6) до (5,18±0,6) пг/мл. В ІІ групі хворих було відмічено, що в підгрупі хворих з високим рівнем системного запалення показник ІЛ-6 за 3 місяці лікування знизився на 55 % – з (9,05±0,9) до (4,05±0,5) пг/мл, а в підгрупі з низьким рівнем системного запалення підвищився на 60 % – з (2,25±0,3) до (3,6±0,7) пг/мл. При дослідженні середньогрупового рівня ІЛ-6 через 6 місяців лікування в І групі хворих було відмічено, що в підгрупі хворих з високим рівнем СЗ відповідний показник знизився до (3,82±0,5) пг/мл, що на 48 % нижче, ніж відповідний показник через 3 місяці лікування, та на 42 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ – до (3,17±0,5) пг/мл, що на 39 % нижче, ніж відповідний показник через 3 місяці лікування та на 22 % нижче, ніж відповідний показник до лікування. В ІІ групі хворих було відмічено, що в підгрупі з високим рівнем СЗ відповідний показник знизився до (2,0±0,3) пг/мл, що на 51 % нижче, ніж відповідний показник через 3 місяці лікування та на 78 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ – до (2,1±0,3) пг/мл, що на 42 % нижче, ніж відповідний показник через 3 місяці лікування та на 7 % нижче, ніж відповідний показник до лікування. Але треба також відмітити, що рівень ІЛ-6 в 4 дослідних підгрупах хворих до початку та під час лікування знаходився у межах норми.
При визначенні рівня вч-СРБ було відмічено, що в І групі хворих, які отримували лікування псоріазу згідно протоколу, спостерігається підвищення відповідного показника протягом всього лікування. В ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформін, навпаки, рівень вч-СРБ мав тенденцію до зниження, яка була достовірно нижчою через 3 місяці лікування в підгрупі з високим рівнем системного запалення та в обох підгрупах хворих через 6 місяців лікування. Аналізуючи динаміку середньогрупового показника вч-СРБ через 3 місяці лікування в І групі хворих було відмічено, що в підгрупі хворих з високим рівнем системного запалення відповідний показник за 3 місяці лікування підвищився на 5 % – з (16,65±1,3) до (17,5±1,4) пг/мл, а в підгрупі з низьким рівнем системного запалення на 4 % – з (11,4±1,2) до (11,9±1,2) пг/мл. При дослідженні відповідного показника в ІІ групі хворих було відмічено, що в підгрупі з високим рівнем системного запалення показник вч-СРБ за 3 місяці лікування знизився на 48 % – з (16,4±1,4) до (8,5±1,2) пг/мл, а в підгрупі з низьким рівнем системного запалення на 22 % – з (11,47±1,1) до (8,9±1,1) пг/мл. Аналізуючи динаміку середньогрупового показника вч-СРБ через 6 місяців лікування в І групі хворих було відмічено, що в підгрупі з високим рівнем системного запалення відповідний показник підвищився до (18,0±1,4) пг/мл, що на 3 % вище, ніж відповідний показник через 3 місяці лікування та на 8 % вище, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем системного запалення – до (13,5±1,5) пг/мл, що на 13 % вище, ніж відповідний показник через 3 місяці лікування, та на 18 % вище, ніж відповідний показник до лікування. Тоді як, в ІІ групі хворих було відмічено, що в підгрупі з високим рівнем СЗ відповідний показник знизився до (3,5±0,3) пг/мл, що на 59 % нижче, ніж відповідний показник через 3 місяці лікування та на 79 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ – до (5,4±0,5) пг/мл, що на 39 % нижче, ніж відповідний показник через 3 місяці лікування та на 53 % нижче, ніж відповідний показник до лікування.
При оцінці впливу лікування на антропометричні показники в залежності від рівня системного запалення була досліджена динаміка ІМТ та ОС до та під час лікування (таблиця 4.12).
Таблиця 4.12 – Динаміка середньогрупових антропометричних показників у хворих на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім метаболічним до та під час лікування в залежності від рівня системного запалення (M±m) (n=10)
| І група контрольна (лікування згідно протоколу) | ІІ група (лікування згідно протоколу + метформін) | |||
| підгрупа з високим рівнем СЗ | підгрупа з низьким рівнем СЗ | підгрупа з високим рівнем СЗ | Підгрупа з низьким рівнем СЗ | |
| ІМТ (кг/м) | ||||
| До лікування | 36,45±1,9 | 34,05±1,7 | 36,38±1,9 | 34,09±1,6 |
| Через 3 міс | 37,79±1,9 | 34,67±1,7 | 36,38±1,9 | 34,3±1,6 |
| Через 6 міс | 37,62±1,9 | 34,48±1,7 | 30,28±1,5⃰# | 31,01±1,5 |
| ОС (см) | ||||
| До лікування | 115,9±3,9 | 113,3±3,6 | 115,3±3,8 | 113,8±3,6 |
| Через 3 міс | 116,01±3,9 | 113,45±3,6 | 115,3±3,8 | 113,82±3,6 |
| Через 6 міс | 115,97±3,9 | 113,43±3,6 | 113,46±3,6 | 112,92±3,5 |
Примітка. * – імовірність похибки різниці (р) між показником під час лікування та до лікування; # – імовірність похибки різниці (р) між показником лікування хворих метформіном та відповідним показником після стандартного лікування; ! – імовірність похибки різниці (р) між показником в підгрупі з більш високим рівнем СЗ та відповідним показником в підгрупі з нищим рівнем СЗ
При дослідженні ІМТ було відмічено, що в І групі хворих, які отримували лікування псоріазу згідно протоколу, відповідний показник залишився майже незмінним протягом всього лікування. В ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, було відмічено, що через 3 місяці лікування ІМТ залишився майже незмінним, а через 6 місяців лікування спостерігалось зниження відповідного показника в обох підгрупах хворих, але достовірно значимим було лише в підгрупі з високим рівнем системного запалення. Так, аналізуючи динаміку середньогрупового показника ІМТ через 3 місяці лікування, в І групі хворих було відмічено, що в підгрупі з високим рівнем системного запалення відповідний показник за 3 місяці лікування підвищився на 4 % – з (36,45±1,9) до (37,79±1,9) пг/мл, а в підгрупі з низьким рівнем системного запалення на 2 % – з (34,05±1,7) до (34,67±1,7) пг/мл. В ІІ групі хворих було відмічено, що в підгрупі хворих з високим рівнем системного запалення, показник ІМТ за 3 місяці лікування залишився незмінним, а в підгрупі з низьким рівнем системного запалення підвищився на 0,5 % – з (34,09±1,6) до (34,3±1,6) пг/мл. При дослідженні середньогрупового рівня ІМТ через 6 місяців лікування в І групі хворих відмічено, що в підгрупі хворих з високим рівнем СЗ відповідний показник знизився до (37,62±1,9) пг/мл, що на 0,5 % нижче, ніж відповідний показник через 3 місяці лікування та на 3 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ – до (34,48±1,7) пг/мл, що на 0,5 % нижче, ніж відповідний показник через 3 місяці лікування та на 1 % нижче, ніж відповідний показник до лікування. В ІІ групі хворих було відмічено, що в підгрупі з високим рівнем СЗ відповідний показник знизився до (30,28±1,5) пг/мл, що на 17 % нижче, ніж відповідний показник через 3 місяці лікування та на 17 % нижче, ніж відповідний показник до лікування, а в підгрупі хворих з низьким рівнем СЗ – до (31,01±1,5) пг/мл, що на 10 % нижче, ніж відповідний показник через 3 місяці лікування та на 9 % нижче, ніж відповідний показник до лікування.
При дослідженні ОС було відмічено, що в І групі хворих, які отримували лікування псоріазу згідно протоколу, відповідний показник залишився майже незмінним протягом всього лікування. В ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформіну гідрохлорид, було відмічено, що через 3 місяці лікування середньогруповий показник ОС залишився майже незмінним, а через 6 місяців лікування спостерігалось зниження відповідного показника в обох підгрупах хворих, але більш вираженим було лише в підгрупі з високим рівнем СЗ. Так, аналізуючи динаміку середньогрупового показника ОС через 6 місяців лікування в ІІ групі хворих, які отримували лікування псоріазу згідно протоколу та метформін, було відмічено, що в підгрупі хворих з високим рівнем системного запалення показник ОС знизився на 2 % – з (115,3±3,8) до (113,46±3,6) см, а в підгрупі з низьким рівнем системного запалення на 1 % – з (113,8±3,6) до (112,92±3,5) см.
* * *
Таким чином, запропонована комплексна терапія хворих на поширений неускладнений бляшковий псоріаз (стаціонарна стадія, середньій ступінь тяжкості) із супутнім МС з використанням метформіну гідрохлориду, мала найвищу клінічну ефективність призначення препарату в підгрупі хворих з високим рівнем вч-СРБ, що сприяло покращенню ефективності лікування, оціненої за ключовими показниками клінічного стану хворих, системного запалення та ІР.
Основні наукові результати цього розділу опубліковані в працях автора:
- Ємченко Я. О. Ефективність включення метформіну гідрохлорид до комплексної терапії хворих на псоріатичну хворобу та метаболічний синдром / Я. О. Ємченко, К. Є. Іщейкін // Світ медицини та біології. – 2015. – № 4 (54). – С. 22-28.
- Ємченко Я.О. Комплексне лікування хворих на псоріатичну хворобу та метаболічний синдром з урахуванням показників системного запалення / Я.О. Ємченко // Актуальні проблеми сучасної медицини. – 2015. – № 3 (51). – С. 114-119.
- Пат. на корисну модель 106056 UA, МПК А61К31/19, А61Р17/06, А61Р5/50; А61Р3/04. Спосіб лікування хворих на псоріатичну хворобу з супутнім метаболічним синдромом та підвищеним рівнем показників системного запалення / К.Є. Іщейкін, Я.О. Ємченко; заявник і патентовласник ВДНЗУ «Українська медична стоматологічна академія». – № u201510985; заявл. 09.11.2015; опубл. 11.04.2016, бюл. № 7.
РОЗДІЛ 5
АНАЛІЗ ТА ОБГОВОРЕННЯ РЕЗУЛЬТАТІВ
Псоріаз – одне з найбільш поширених захворювань, яке, за різними даними, охоплює приблизно 2-4 % населення земної кулі й посідає четверте місце в загальній структурі захворюваності шкіри. В останній час відмічено, що хворі на псоріаз мають підвищений ризик розвитку МС й окремих його складових. У 1995 році Henseler i Christophers помітили, що стаціонарні хворі на псоріаз (N=2941) в 1,5-2,0 рази частіше страждають на ожиріння або гіпертонію, ЦД порівняно зі стаціонарними хворими на інші дерматологічні захворювання. Збільшення підшкірно-жирової клітковини у хворих на псоріаз, що страждають на ожиріння, сприяє дисліпідемії та зростанню кардіометаболічного ризику [102]. Ці дані підтверджують, що модифікуючі чинники ризику, такі як ожиріння, можуть впливати і на маніфестацію псоріазу, і на кардіоваскулярну коморбідность. На думку авторів, запальні цитокіни, що продукуються псоріатичними бляшками, можуть відігравати важливу роль в запаленні, яке в результаті дає ІР і МС та діють як ланцюг між ожирінням і кардіоваскулярними хворобами і є фактором ризику розвитку підвищеного кров’яного тиску, а також може сприяти резистентності до інсуліну. Клініко-експериментальні дослідження показали, що ключову роль у розвитку атеросклерозу та псоріазу переважно грають одні й ті ж цитокіни (ІЛ-1, -6, ФНП-α) [181]. Крім того, системне застосування стероїдної терапії або інші методи лікування псоріазу можуть сприяти розвитку діабету або гіпертонії [102]. Тому в останні роки все більше уваги при дослідженні патогенезу псоріазу приділяється порушенням метаболічних процесів.
Однак, не дивлячись на успіхи, досягнуті у вивченні патогенезу псоріатичної хвороби та МС, проблема взаємозв’язку і лікування цих захворювань та перспективи їх корекції, на сьогоднішній день остаточно не з’ясовані.
Для вирішення даної проблеми ми провели дослідження хворих псоріатичною хворобою з ознаками МС. Метою нашого дослідження було підвищення ефективності лікування хворих на псоріатичну хворобу з ознаками МС шляхом ранньої корекції метаболічних порушень та процесів системного запалення.
Для вирішення першого завдання нами було проведено обстеження 40 хворих, у яких встановлено діагноз – поширений псоріаз (стаціонарна стадія, середній ступінь тяжкості) із супутнім МС. Серед хворих було 25 (62,5 %) чоловіків і 15 (37,5 %) жінок у віці від 40 до 60 років, тривалість основного захворювання коливалась від 1 до 44 років, дебют захворювання – від 5 до 59 років. Анамнестично осінньо-зимовий тип псоріазу мали 6 (15 %) пацієнтів, весняно-літній – 1 (2,5 %), недиференційований – 33 (82,5 %).
Псоріаз діагностували у пацієнтів відповідно до протоколу (наказ МОЗ України від 8.05.2009 р. № 312). Для оцінки тяжкості клінічного перебігу псоріазу та площі пошкодження шкіри застосовували індекс PАSI та показник BSA [180].
МС діагностували згідно з рекомендаціями Міжнародної діабетичної асоціації (IDF) та AHA / NHLBI (2005 р., з модифікацією 2009 р.). Визначали антропометричні показники з оцінкою ІМТ, яку розраховували за формулою Кетле: ІМТ = маса тіла (кг) / зріст (м)², тип розподілу жирової тканини визначали за величиною співвідношення ОТ до ОС, яке при абдомінальному ожирінні у жінок перевищує 0,85, а у чоловіків – 1.
У всіх досліджених пацієнтів спостерігалося виражене підвищення АТ, надлишкова маса тіла, відповідно збільшення ІМТ (класифікації ожиріння за ІМТ – ВООЗ, 1997). Надмірна маса тіла визначена у 1 (2,5 %) хворого, ожиріння I ступеня – у 22 (52,5 %), ожиріння II ступеня – у 12 (30,0 % ) та ожиріння III ступеня – у 5 (12,5 %) пацієнтів, при цьому ОТ склав (117,05 ± 1,06) см, ОС – (114,57 ± 1,26) см, співвідношення ОТ/ОС у жінок – 1,0 ± 0,009, чоловіків – 1,04 ± 0,007, що свідчило про наявність у всіх пацієнтів ожиріння за абдомінальним типом.
Середнє значення індексу PASI – (14,23±0,184) бали, свідчило про наявність у всіх хворих на псоріаз середнього ступеня тяжкості захворювання. При дослідженні ліпідного обміну у всіх хворих виявлено підвищення ЗХС, ТГ і ЛПДНЩ. Накопичені клініко-статистичні дані досліджень підтверджують факти порушень ліпідного обміну при псоріазі, характерні для атеросклеротичного процесу [183]. Несприятливим чинником розвитку псоріатичного процесу є підвищення вмісту загальних ліпідів та ЗХС в сироватці крові [184]. А.Б. Рахматова та Н.В. Білаш виявили кореляційну залежність між гіпертригліцеридемією та поширенням псоріатичного процесу. При цьому високу тригліцеридемію виявляли у хворих з бляшковою псоріатичною висипкою на долонях та підошвах. Про негативний вплив гіпертригліцеридемії на клінічний перебіг псоріазу вказували З.Б. Кешелева та співавтори. A. Venier, S. Urbani, A.V. Greco, M. Young та інші вважають, що для псоріазу характерна дисліпідемія, особливості якої впливають на характер клінічних проявів дерматозу [184]. С.Ю. Бутов зі співавторами встановили, що дисліпідемія при псоріазі корелює з імунологічними порушеннями та клінічним перебігом дерматозу [184]. Чимало авторів вказують на значні зміни вмісту ліпопротеїдів крові при псоріазі. У 62 % хворих на цей дерматоз зареєстровано гіперліпопротеїнемію. Встановлено, що порушення ліпопротеїнового обміну при псоріатичній хворобі здебільшого є стійким, причому в деяких випадках поєднуються із гіперхолестеринемією [184]. Так, відхилення рівня ліпідів в крові спостерігається вже при перших ознаках псоріатичної хвороби, а дисліпідемія, в свою чергу, вважається істотним фактором ризику розвитку макроваскулярних захворювань, таких як інфаркт міокарда. В свою чергу гіперліпідемія, особливо постпрандіальна, супроводжується ектопічним відкладенням ліпідів у м’язах, печінці та підшлунковій залозі, порушуючи активність ферментів, що беруть участь у метаболізмі глюкози, таким чином сприяючи наростанню ІР. Тривала гіпертригліцеридемія в умовах ІР порушує ендотелійзалежну вазодилатацію, викликає оксидативний стрес і є найважливішим фактором ризику раннього атеросклерозу.
Моніторинг стану вуглеводного обміну виявив у хворих досліджуваної групи виявив підвищення рівня глюкози в сироватці крові натще у 20 (25 %) хорих, інсуліну у 3 (7,55 %) і НОМА-IR у 32 (77,5 %) пацієнтів, що свідчить про переважання у хворих стану ІР, а остання як індуктор запалення є результатом ендотеліальної дисфункції. Таким чином, псоріаз і МС, особливо надлишкова маса тіла, стимулюють атеросклероз. Існує чимало доказів того, що найважливішою визначальною причиною розвитку і прогресування ІР є абдомінально-вісцеральне ожиріння [185].
Адипоцити вісцеральної жирової тканини, володіючи високою ліполітичною активністю, забезпечують масивне надходження вільних жирних кислот через систему ворітної вени в печінку. Це призводить до зменшення зв’язування інсуліну гепатоцитами, розвитку ІР на рівні печінки, гальмування супресивної дії інсуліну на глюконеогенез, зниженню метаболічного кліренсу інсуліну печінкою і розвитку системної гіперінсулінемії, у свою чергу сприяє розвитку периферичної ІР. Тривало існуюча гіперінсулінемія сприяє підвищенню активності симпатичної нервової системи, збільшенню об’єму циркулюючої крові через посилення реабсорбції іонів натрію і води в канальцях нирок, викликає вазоконстрикцію. Надлишок вільгих жирних кислот порушує інсулінзалежну утилізацію глюкози м’язовою тканиною, посилюючи периферичну ІР і створюючи передумови для розвитку гіперглікемії.
У печінці вільні жирні кислоти є субстратом для підвищеного синтезу ЛПДНЩ, багатих ТГ, приводячи в умовах ІР та гіперінсулінемії до розвитку атерогенної дисліпідемії, яка характеризується гіпертригліцеридемією, зниженням ХС ЛПВЩ, підвищенням ХС ЛПНГ, наявністю легко окислюючихся дрібних щільних частинок ЛПНЩ, а також постпрандиальною гіперліпідемією. Надмірна концентрація жирних кислот також викликає пряму ліпотоксічну дію на β-клітини підшлункової залози, стимулює глікогеноліз в печінці. ІР та гіперінсулінемія надають як прямий, так і опосередкований атерогенний вплив на стінки судин, сприяють розвитку дисліпідемії, ряду гормональних, метаболічних, прокоагулянтних і прозапальних порушень, активації симпатоадреналової системи і таким чином лежать в основі практично всіх складових МС [186].
У досліджуваних хворих відмічено підвищення активності трансаміназ: АЛТ у 13 (33,5 %) і АСТ у 7 (17,5 %) хворих, а це вказує на запалення гепатобіліарної системи, що знайшло підтвердження в дослідженнях Mehta N.N. і співавторів [187]. При оцінці показників системного запалення виявлено підвищення концентрації – вч-СРБ у 39 (97,5 %) хворих, ФНП-α у 37 (92,5 %) та ІЛ-6 у 6 (15 %) хворих, значущих змін показників церулоплазміну не спостерігалося. Як відомо істотний внесок у розвиток і прогресування ІР та атерогенних порушень привносить надмірна секреція вісцеральними адипоцитами таких адипокінів, як ФНП-α, ІЛ-6, лептин, інгібітор активатора плазміногену-1, ангіотензиноген, резистин та знижена секреція адипонектину, який володіє антиатерогенними і антидіабетичними властивостями.
Одним з безлічі біохімічних маркерів, спрямованих на виявлення дисфункції ендотелію, є СРБ. Значне його підвищення спостерігається у пацієнтів з поширеним псоріазом. Виявлено прямий кореляційний зв’язок рівня СРБ та індексу PASI. Вирішальним процесом в розумінні кардіоваскулярних захворювань при псоріазі виступає атеросклероз, а він прискорюється внаслідок наявності системного запалення [188]. Системно визначені прозапальні цитокіни, включаючи ФНП-α, підвищений рівень СРБ і активовані тромбоцити вказують на системний характер псоріатичного запалення [189]. Тромбоцити, задіяні в утворенні запального інфільтрату в атеросклеротичній бляшці, не тільки вказують на системний характер псоріатичного запалення, але й демонструють механізм, за допомогою якого псоріаз прямо веде до атеросклерозу. Крім того, свій внесок у розвиток системного запалення привносить надлишкова вага. Оскільки адипоцити секретують прозапальні цитокіни, такі як ФНП-α [190]. Таким чином, у хворих на псоріазом з супутнім МС відбувається формування патологічно замкнутого кола: ІР – ожиріння – системне запалення – ремоделювання тканин – АР – гіперінсулінемія – ліпотоксичність, що не так давно отримало назву «марш псоріазу» [191].
Таким чином, клінічний перебіг псоріатичної хвороби з супутнім МС характеризується значною площею ураження шкіри та активністю процесу [(РАSI (14,2±0,18) бала], частими рецидивами псоріатичної хвороби (до 4 разів на рік), низькою ефективністі стандартної терапії, наявністю системного запалення, яке полягало в підвищенні рівнів ФНП-α [(22,7±1,7) мг/мл], вч-СРБ [(14,14±1,1) мг/мл] та порушенням вуглеводного обміну (НОМА (4,8±0,5), глюкоза [(6,32±1,1) ммоль/л], інсулін [(33,2±2,5) мкОД/мл]).
Для вирішення другого завдання проведено дослідження взаємозв’язку між процесом СЗ, метаболічними порушеннями та клінічним перебігом псоріазу у обстежених хворих. Для цього всіх дослідних хворих на псоріатичну хворобу з супутнім МС розділили на чотири підгрупи по квартілям в залежності від рівня вмісту вч-СРБ у сироватці крові. У I підгрупу ввійшли пацієнти з помірним рівнем вч-СРБ – (7,5-13,4 мг/мл), у II – з середнім (13,4-13,9 мг/мл), в III – з високим (14,4-16,4 мг/мл), в IV – з дуже високим (15-17,2 мг/мл). В утворених підгрупах хворих було розраховано середнє значення таких показників, як антропометрія, вираженість перебігу псоріазу, вуглеводного та ліпідного обмінів і запального процесу.
У виділених підгрупах спостерігається чітка залежність між паралельним збільшенням рівня вч-СРБ і підвищенням рівня таких показників: індексу PASI, ІМТ, САТ, інсуліну, НОМА, ІЛ-6, ФНП-α і церулоплазміну, що вказує на взаємозв’язок між тяжкістю перебігу псоріазу, виразністю метаболічних порушень і системного запалення. Отже, системне запалення ускладнює перебіг псоріазу і призводить до розвитку ССЗ і діабету [192]. Проведений внутрішньогруповий кореляційний аналіз серед підгруп пацієнтів дозволив встановити наступні достовірні позитивні взаємозв’язки між низьким рівнем показника вч-СРБ і ІМТ, а також між високим рівнем вч-СРБ та індексами PASI, САТ та ІЛ-6.
Виявлені кореляційні зв’язки підтвердили, що високий рівень системного запалення супроводжується порушеннями регуляції судинного тонусу і значним ураженням шкіри при псоріазі.
Таким чином, у пацієнтів з псоріазом і МС важливу роль відіграє системний запальний процес, який супроводжується розвитком ІР, порушенням ліпідного та вуглеводного обмінів, регуляції тонусу судин. Наростання інтенсивності системного запалення супроводжується посиленням шкірних ушкоджень, підвищенням рівня САТ, порушенням ліпідного та вуглеводного обмінів. Процеси системного запалення та ІР у хворих з псоріазом і МС можуть бути потенційними мішенями комплексної терапії. У хворих псоріатичною хворобою з МС тяжкість клінічного перебігу [PASI – (15,61±0,86)] залежить від рівня системного запалення: вч-СРБ (r = 0,82, р<0,05), ІЛ-6 (r = 0,66, р<0,05), ФНП-α (r = 0,10, р<0,05); вираженості порушень вуглеводного обміну: інсулін (r = 0,44, р<0,05), НОМА (r =0,46, р<0,05); рівня підвищення маси тіла: ІМТ (r = 0,19, р<0,05).
Для вирішення третього завдання нами було проведено дослідження динаміки клінічних проявів у пацієнтів псоріатичною хворобою і МС в залежності від рівня системного запалення на тлі включення в комплекс традиційної терапії перорального цукрознижувального препарату групи бігуанідів – метформіну гідрохлориду.
При дослідженні клінічного стану хворих та динаміки показників індексу PASI, на тлі включення до схеми лікування хворих на псоріаз та МС метформіну, встановлено, що тривале застосування метформіну знижує кількість рецидивів псоріазу, подовжує період ремісії та призводить до більш легкого перебігу псоріатичної хвороби та свідчить про те, що в даному випадку прийом метформіну виявився більш ефективним методом лікування хворих, ніж дотримання ними дієти. Такий «уповільнений» вплив метформіну на клінічну картину псоріазу можна пояснити тим, що шкіра є одним з депо глюкози і глікогену в організмі, в ній швидко розвиваються дегенеративні процеси, пов’язані з накопиченням неутилізованої глюкози, при цьому її концентрація в позаклітинному просторі може бути втричі вище, ніж у нормі [24].
При дослідженні динаміки показників системного запалення на тлі включення до схеми лікування хворих на псоріаз та МС метформіну, було встановлено, що метформін позитивно впливає на показники СЗ вже на ранніх етапах лікування. Так, при дослідженні відповідних показників вже через 3 місяці лікування відмічено більш інтенсивне зниження показників ФНП-α, ІЛ-6 та вч-СРБ у порівнянні з групою хворих, які лікувались згідно протоколу та дотримувались дієти, тоді як при подальшому дослідженні відповідних показників через 6 місяців лікування спостерігалось інтенсивне зниження відповідних показників, яке призвело до їх нормалізації. Отже, можна стверджувати, що метформін впливає на показники системного запалення, зменшуючи їх рівень в крові, а при тривалому застосуванні приводить до їх нормалізації.
Отримані результати дослідження узгоджуються з даними літератури [193, 194]. Підвищення відповідних показників у хворих МС пояснюється результатами досліджень, в яких показано, що інсулін безпосередньо стимулює експресію генів ІЛ-6 та ФНП-α в жировій тканині [195]. Як показали дослідження останніх років, жирова тканина має ауто-, пара- і ендокринну функцію і секретує велику кількість речовин з різними біологічними ефектами, здатними викликати розвиток супутніх ожирінню ускладнень, у тому числі ІР [177]. Найбільш вивчений в даний час гормон – лептин секретується переважно адипоцитами. Він здійснює свою дію на рівні гіпоталамуса через спеціальні лептинові рецептори і зменшує синтез нейропептида Y, який продукується нейронами дугоподібного ядра. Лептин викликає зниження апетиту, збільшення тонусу симпатичної нервової системи і витрати енергії, а також зміни обміну речовин в периферичних органах і тканинах. ФНП- α і лептин – одні з факторів, за допомогою яких жирова тканина інформує гіпоталамус про стан жирових запасів організму. При ожирінні порушується фізіологічна роль ФНП-α як сигналу, контролюючого споживання їжі. ФНП-α синтезується, в тому числі моноцитами, макрофагами і адипоцитами. Збільшені адипоцити секретують велику кількість ФНП-α, що порушує взаємодію інсуліну з рецепторами, а також впливає на внутрішньоклітинні переносники глюкози (GLUT-4) як в адипоцитах, так і в м’язовій тканині, підсилюючи ІР.
На даний момент прозапальному цитокіну з плейотропним ефектам – ФНП-α відводиться ключова роль у патогенезі псоріазу. При псоріазі відзначається гіперпродукція ФНП-α в ділянках шкіри, залучених в патологічний процес, і збільшення його циркулюючої фракції. Серед безлічі його ефектів – індукція продукції інших цитокінів (ІЛ-1, ІЛ-6, ІЛ-8) [196, 197, 198, 199].
При дослідженні динаміки антропометричних показників відмічався позитивний ефект від лікування метформіном. Так, при дослідженні відповідних показників через 3 місяці лікування спостерігається менш інтенсивне підвищення ІМТ та залишаються незмінними показники ОТ і ОС, а у хворих які дотримувались дієти, спостерігається підвищення відповідних показників. При подальшому дослідженні, через 6 місяців лікування, спостерігається зниження відповідних показників, тоді як у хворих які дотримувались дієти вони залишились майже незмінними. Отже, можна стверджувати, що метформін впливає на антропометричні показники вже на ранніх етапах лікування, попереджуючи їх підвищення, та сприяє зниженню відповідних показників при тривалому застосуванні. Важливою властивістю препарату є його гальмівний вплив на всмоктування глюкози в кишечнику і слабкий анорексигенний вплив, тому на тлі застосування метформіну, як правило, спостерігається зниження маси тіла або її стабілізація і зменшення маси атерогенної вісцеральної жирової тканини.
При дослідженні динаміки показників АТ було відмічено позитивний ефект лікування метформіном у більшій мірі на показник САТ. При аналізі відповідного показника через 3 місяці лікування відмічено, що в групі дослідних хворих, які отримували лікування псоріазу згідно протоколу та дотримувались дієти, показники АТ мали тенденцію до незначного збільшення, а в групі хворих, що приймали метформін, показники АТ залишались незмінними. При аналізі відповідного показника через 6 міс лікування відмічено, що у хворих, які дотримувались дієти, цей показник залишився майже незмінним, тоді як в групі хворих, що приймали метформін, відповідний показник мав незначну тенденцію до зниження. Отже, аналізуючи отримані результати дослідження, можна відмітити, що тривале застосування метформіну дає позитивний ефект лікування, знижуючи показники АТ, та свідчить про те, що і в даному випадку прийом метформіну виявився більш ефективним методом лікування наших хворих, ніж дотримання дієти. Отримані нами результати підтверджується результатами досліджень в яких показано, що ІР та виникаюча при цьому стані компенсаторна гіперінсулінемія зачіпають ряд механізмів регуляції АТ: підвищується тонус симпато-адреналової системи, збільшується реабсорбція натрію і води нирками, змінюється мембранний транспорт катіонів у гладком’язових клітинах судин, порушується функція ендотелію. Зазначені механізми можуть вносити істотний внесок у розвиток АГ. Було показано, що для хворих з МС і ЦД 2-го типу характерно порушення добового ритму АТ та підвищення показників навантаження тиском під час нічного сну [200]. Вважається, що нічна гіпертензія у пацієнтів з ІР може бути пов’язана з порушенням циркадного ритму симпатичної активності під дією гіперінсулінемії і підвищеного вмісту вільних жирних кислот в плазмі крові. У ряді клінічних досліджень було відзначено вплив метформіну на рівень АТ у хворих з порушеною толерантністю до глюкози [201]. За даними широкомасштабних досліджень, у хворих з абдомінальним ожирінням і порушенням толерантності до глюкози на тлі терапії метформіном у дозі 1700 мг/добу протягом 16 тижнів поряд зі зниженням маси тіла (в середньому на 2,9 кг), поліпшенням показників глікемії і ліпідного обміну відзначалося зниження рівня САТ за даними добового моніторування як в денні, так і в нічні години, а також зменшення показників навантаження тиском в період нічного сну [201]. Отримані нами результати дослідження також співпадають з даними літератури [202, 203].
При оцінці впливу лікування на показники ліпідного обміну було встановлено, що до лікування всі хворі мали підвищений рівень ЗХС та ТГ. При дослідженні відповідних показників через 3 місяці лікування відмічено підвищення відповідних показників у всіх групах хворих, але треба відмітити, що більш вираженим воно було у хворих, які дотримувались дієти. При дослідженні відповідного показника через 6 місяців лікування відмічено зниження ЗХС та ТГ у всіх хворих, але в групі хворих, що дотримувались дієти воно було незначним у порівнянні з групою хворих, які приймали метформін. Отже, можна стверджувати, що метформін впливає на показники ліпідного обміну вже на ранніх етапах лікування, попереджуючи їх значне підвищення та приводить до значного зниження відповідних показників при тривалому застосуванні.
Результати досліджень співпадають з даними інших авторів [204]. Як відомо, основними характеристиками дисліпідемії при ІР є підвищення концентрації ТГ крові, ЛПДНЩ, зниження рівня ЛПВЩ, а також наявність більш дрібних і ЛПНЩ, що володіють високим ступенем атерогеності. Таким чином, для хворих з ІР найбільш характерна наявність дисліпідемії IV або IIБ типів. На тлі лікування метформіном відзначається зменшення порушень ліпідного спектра крові, пов’язаних з ІР. Рівень ТГ крові знижується в середньому на 20-30 % [205, 206]. Зниження рівня ТГ відбувається головним чином за рахунок зменшення вмісту в сироватці крові ЛПДНЩ. В результаті відновлення чутливості гепатоцитів та їх ліпопротеїдліпази до інсуліну продукція ЛПДНЩ печінкою зменшується, а елімінація збільшується. Апопротеїни і фосфоліпіди, які вивільняються з ЛПДНЩ і ЛПНЩ під дією ліпопротеїдліпази йдуть на побудову ЛПВЩ. Таким чином, збільшення кліренсу ЛПДНЩ супроводжується підвищенням утворення ЛПВЩ. Не виключено також, що метформін має прямий вплив на метаболізм ЛПВЩ в печінці шляхом впливу на активність печінкової ліпази і синтез білка apo-A-I. Деяке зниження рівня ЗХС крові (у середньому на 10 %), що спостерігається на тлі лікування метформіном, мабуть, є вторинним по відношенню до зниження рівня ЛПДНЩ, оскільки препарат не впливає на синтез ЗХС в печінці.
При оцінці впливу лікування на показники вуглеводного обміну ми дослідили рівень глюкози, інсуліну та індекс НОМА-IR до та під час лікування. Аналізуючи отримані результати показників вуглеводного обміну було встановлено, що метформіну гідрохлорид набагато краще впливає на стан вуглеводного обміну, ніж дотримання дієти. У хворих, що приймали метформін, вже через 3 місяці лікування відмічається більш інтенсивне зниження глюкози, нормалізація показників інсуліну та значне зниження індексу HOMA-IR в порівнянні з І групою хворих, що лікувались згідно протоколу та дотримувались дієти. Тому слід відмітити, що для досягнення значного лікувального ефекту метформін слід призначати на тривалий курс лікування.
Отримані нами результати узгоджуються з даними дослідження UKPDS (United Kingdom Prospective Diabetes Study, 1998), у хворих на ЦД 2-го типу з надмірною масою тіла метформін не уступав похідним сульфонілсечовини по здатності забезпечувати компенсацію вуглеводного обміну [206]. В клінічній практиці для лікування хворих на ЦД 2-го типу метформін застосовується з 1957 р., зарекомендувавши себе як ефективний антигіперглікемічний препарат. Основним механізмом дії метформіну є пригнічення продукції глюкози печінкою. Даний ефект препарату обумовлений підвищенням чутливості гепатоцитів до інсуліну, внаслідок чого знижується активність ключових ферментів глюконеогенезу (піруваткарбоксилазу і фосфоенолпіруваткарбоксикіназу). Крім того, метформін потенціює вплив інсуліну на ферменти обміну глікогену (фосфорилазу і глікогенсинтетазу), що призводить до зниження гликогеноліза і збільшення синтезу глікогену в клітинах печінки. Таким чином, метформін збільшує утилізацію і зменшує продукцію глюкози печінкою, що є найважливішою умовою зниження рівня базальної глікемії впродовж ночі і натщесерце. Крім того, антигіперглікемічний ефект метформіну частково пов’язаний з особливостями його дії в кішківнику. Метформін уповільнює транспорт глюкози у слизовій і серозній оболонках тонкої кишки, а також підсилює процеси анаеробного гліколізу і сприяє утилізації деякої кількості глюкози в стінці кішківника. В результаті гальмування всмоктування глюкози згладжуються «піки» гіперглікемії після прийомів їжі, що має важливе значення в досягненні компенсації цукрового діабету. На відміну від похідних сульфонілсечовини, метформін не призводить до підсилення секреції інсуліну, тому лікування метформіном не супроводжується ризиком розвитку гіпоглікемічних станів. Навпаки, відновлення чутливості тканин до інсуліну призводить до зменшення компенсаторної гіперфункції острівкового апарату підшлункової залози та до зниження гіперінсулінемії. Оскільки інсулін має виражену ліпотропну і антиліполітичну дією, зниження гіперінсулінемії сприяє стабілізації і навіть деякому зниженню маси у хворих на ЦД з ожирінням [207].
Для більш чіткого контролю лікування та впливу лікування на клініко-лабораторні показники в залежності від рівня системного запалення кожна з груп була поділена за рівнем вмісту вч-СРБ в сиворотці крові на дві підгрупи: перша підгрупа включала хворих на псоріаз та МС з високим рівнем системного запалення, а друга підгрупа хворих на псоріатичну хворобу та МС з низьким рівнем системного запалення. Таким чином, утворилося чотири підгрупи.
При оцінці впливу лікування метформіном на показники клінічного стану хворих та дослідженні індексу PASI в підгрупах хворих з низьким та високим рівнем системного запалення було відмічено, що застосування метформіну вже на протязі трьох місяців дає позитивний ефект як у хворим з низьким рівнем системного запалення, так і у хворих з високим рівнем системного запалення, попереджуючи розвиток ускладнень МС, подовжує період ремісії псоріазу, тим самим зменшуючи кількість рецидивів та запобігає розвитку тяжких форм дерматозу і призводить до більш легких форм перебігу псоріатичної хвороби. Треба відмітити, що більш виражений лікувальний ефект спостерігався в підгрупі хворих з високим рівем системного запалення, який проявлявся більш інтенсивним зниженням індексу PASI та меншою кількістю хворих, у яких спостерігався рецидив псоріатичної хвороби. Треба також відмітити, що у хворих, які отримували лікування псоріазу згідно протоколу та метформін, відмічена залежність середньогрупового показника індексу PASI від рівня середньогрупових показників інсуліну, глюкози крові індексу ІР НОМА-IR, ІМТ та вч-СРБ. Отримані результати дослідження свідчать про те, що метформін, впливаючи на рівень інсуліну, знижує ІР тканин та знижує рівень глюкози в крові і цим самим зменшує кількість стресів, які і призводять до рецидиву псоріазу і таким чином впливає безпосередньо на перебіг псоріазу продовжуючи тривалість його ремісії, та зменшуючи кількість його рецидивів.
Треба також відмітити, що ожиріння, яке спостерігається у наших хворих, призводить до системного запалення, тобто, підвищення показника вч-СРБ, а системне запалення, в свою чергу, до загострення псоріазу. Аналізуючи отримані результати дослідження, треба відмітити, що дієта у даному випадку виявилась неефективною, так як інсулінемія та перепади рівня інсуліну в крові, які спостерігаються за рахунок вживання їжі та призводять тим самим до коливань рівня глюкози крові, а це викликає розвиток депресії, хронічної втоми, стресів та напади голоду, які призводять до того, що людина починає об’їдатися вуглеводами, «заїдаючи» свої проблеми, що призводить до підсилення ІР тканин та до ожиріння, яке в свою чергу теж підсилює ІР, та СЗ. Системне запалення в свою чергу також сприяє розвитку ІР, розвитку ЦД ІІ типу та рецидивам псоріазу. Таким чином, утворюється так зване «порочне коло». При аналізі отриманих результатів дослідження можна говорити про те, що метформін впливає безпосередньо на ІР, знижуючи її за рахунок підсилення чутливості тканин до інсуліну, що сприяє зменшенню ожиріння та зниженню ІМТ, а це призводить до зменшення рівня системного запалення та безпосередньо до зниження показника вч-СРП, що зрештою сприяє зниженню ІР та зменшенню кількості рецидивів псоріазу.
При оцінці впливу лікування метформіном на показники системного запалення в підгрупах хворих з низьким та високим рівнем системного запалення було відмічено, що метформін має більш виражений лікувальний ефект в підгрупі хворих з високим рівнем системного запалення у порівнянні з іншими підгрупами дослідних хворих як на ранніх етапах лікування, так і у віддалені строки. Так, при дослідженні рівня відповідних показників спостерігається зниження ІЛ-6 вже через 3 місяці лікування та більш інтенсивне зниження ФНП-α, СРБ та ІЛ-6 через 6 місяців лікування метформіном, у порівнянні з іншими підгрупами хворих.
При оцінці впливу лікування на показники вуглеводного обміну в залежності від рівня системного запалення був відмічений позитивний ефект лікування метформіном в обох підгрупах хворих з низьким та високим рівнем системного запалення вже на ранніх етапах лікування. Так, спостерігалось інтенсивне зниження показника глюкози крові та менш виражене підвищення інсуліну крові та індексу НОМА-ІR вже через 3 місяці лікування метформіном та значне зниження відповідних показників через 6 місяців лікування у порівнянні з підгрупами хворих, які дотримувались дієти. Слід відзначити, що більш інтенсивне зниження відповідних показників спостерігалось в підгрупі хворих з високим рівнем системного запалення. Отже, можна стверджувати, що метформіну гідрохлорид призводить до більш вираженого лікувального ефекту у хворих з високим рівнем системного запалення.
При дослідженні впливу лікування на антропометричні показники в залежності від рівня системного запалення був відмічений позитивний ефект лікування метформіном в обох підгрупах хворих з низьким та високим рівнем системного запалення вже на ранніх етапах лікування. Так, вже через 3 місяці лікування показники ОС в обох підгрупах хворих з низьким та високим рівнем системного запалення та ІМТ в підгрупі хворих з високим рівнем системного запалення залишились незмінними, тоді як в підгрупі хворих з низьким рівнем системного запалення спостерігалось незначне підвищення відповідного показника, а через 6 місяців лікування спостерігалось більш інтенсивне зниження відповідних показників у порівнянні з підгрупами хворих, які дотримувались дієти. Але треба відмітити, що більш виражене зниження відповідних показників відбулося в підгрупі хворих з високим рівнем системного запалення. Отже, можна стверджувати, що метформіну гідрохлорид і в данному випадку призводить до більш вираженого лікувального ефекту у хворих з високим рівнем системного запалення.
Таким чином, додавання метформіну гідрохлориду до комплексної терапії хворих псоріатичною хворобою з МС зменшило інтенсивність клінічних проявів псоріазу (РАSI – (3,8±0,5) бала, р<0,05), кількість чергових загострень псоріазу [(1,2±0,01) разу на рік, р<0,05], зниження показників СЗ вч-СРБ [(4,45±0,9) пг/мл, р<0,05], ІЛ-6 [(2,05±0,3) пг/мл, р<0,05], ФНП-α [(0,29±0,03) пг/мл, р<0,05] та покращення вуглеводного обміну НОМА (1,92±0,2, р<0,05), інсуліну [(10,55±0,9) мкОД/мл, р<0,05], глюкози [(4,1±0,5) ммоль/л, р<0,05]. Індивідуалізація призначення метформіну гідрохлориду хворим на псоріаз із МС залежно від рівня СРБ показала найвищу клінічну ефективність призначення препарату в підгрупі хворих з високим рівнем СРБ [(16,4±1,4) пг/мл, р<0,05] порівняно з підгрупою хворих, в якій вч-СРБ склав (11,47±1,1) пг/мл (р<0,05).
ВИСНОВКИ
У дисертаційній роботі наведено теоретичне узагальнення та нове рішення наукового завдання, що полягає у підвищенні ефективності лікування хворих на псоріаз із супутнім МС шляхом призначення метформіну гідрохлориду на підставі вивчення показників клінічного перебігу, системного запалення та вуглеводного обміну.
1. Враховуючи виражену розповсюдженість псоріазу серед населення, значну питому вагу у загальній структурі захворювань шкіри, високу частоту метаболічних порушень, роль СЗ у патогенезі імуноопосередкованих хвороб, а також довготривалий рецидивуючий перебіг дерматозу, низьку ефективність терапії, актуальним є оптимізація терапевтичної тактики ведення хворих на псоріаз із супутнім МС.
2. Клінічний перебіг псоріазу з супутнім МС характеризується більш вираженим підвищенням індексу PASI (на 18 %), погіршенням ДІЯЖ (на 16 %), схильністю до ексудативних проявів, частими рецидивами хвороби до 4 разів на рік та низькою ефективністю традиційної терапії порівняно з групою хворих на псоріаз без МС.
3. У хворих на псоріаз із супутнім МС виявлено СЗ, яке полягало в підвищенні рівня ФНП-α на 23 %, вч-СРБ – на 18 %; порушення вуглеводного обміну за рахунок підвищення НОМА-IR на 73 %, глюкози – на 15 %, інсуліну – на 33 % порівняно з групою хворих на псоріаз без МС.
4. При середньому ступені тяжкості у хворих на стаціонарну стадію псоріазу із супутнім МС встановлено кореляційну залежність між індексом PASI і рівнем показників СЗ – вч-СРБ (r = 0,82, р<0,05), ІЛ-6 (r = 0,66, р<0,05), ФНП-α (r = 0,10, р<0,05), та порушенням вуглеводного обміну – інсулін (r = 0,44, р<0,05), НОМА-IR (r = 0,46, р<0,05); ІМТ (r = 0,19, р<0,05).
5. Включення метформіну гідрохлориду до комплексної терапії хворих на псоріаз із супутнім МС за 6 місяців лікування зменшило тяжкість перебігу псоріазу за показниками змін: PASI на 78 %, ДІЯЖ – на 61 % і кількість загострень псоріазу на 26 %; сприяло достовірному зниженню показників вуглеводного обміну: НОМА-IR на 82 %, інсуліну на 75 %, глюкози на 29 % та СЗ: вч-СРБ на 71 %, ІЛ-6 на 41 %, ФНП-α на 99 %; сприяло зниженню ІМТ на 13 %, ЗХ – на 16 %, ТГ – на 25 % порівняно з показниками групи контролю, які лікувалися згідно протоколу.
6. Призначення метформіну гідрохлориду хворим на псоріаз із супутнім МС залежно від рівня СЗ показало найвищу клінічну ефективність призначення препарату в підгрупі хворих із високим рівнем вч-СРБ [(16,4±1,4) пг/мл, р<0,05] порівняно з підгрупою хворих із низьким вч-СРБ [(11,47±1,1) пг/мл, р<0,05].
РЕКОМЕНДАЦІЇ
- Хворим на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім МС рекомендується проводити дослідження рівня СЗ за показниками: СРБ, ІЛ-6, ФНП-α; стану вуглеводного обміну за показниками: глюкоза, інсулін, та проводити розрахунок показника індексу НОМА-IR для визначення наявності ІР.
- Для підвищення ефективності лікування хворим на псоріаз середнього ступеня тяжкості, стаціонарною стадією перебігу з супутнім МС та високим рівнем СЗ рекомендується включити до комплексної терапії псоріазу препарат метформіну гідрохлорид (по 1500 мг на добу), що призводить до зменшення інтенсивності клінічних проявів псоріазу (РАSI), кількості чергових загострень дерматозу, зниження показників СЗ, покращення показників вуглеводного обміну та ІР.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
1. Reich K. The concept of psoriasis as a systemic inflammation: implications for disease management / K. Reich // J. Eur. Acad. Dermatol. Venereol. – 2012. – Vol. 58, No. 26, Suppl. 2. – Р. 3-11.
2. Бакулев А.Л. Псориаз как системная патология / А.Л. Бакулев, Ю.В. Шагова, И.В. Козлова // Саратовский научно-медицинский журн. – 2008. – Т. 4, вып. 1. – С. 13-20.
3. Мавров И.И. Основы диагностики и лечения в дерматологии и венерологии / И.И. Мавров, Л.А. Болотная, И.М. Сербина. – Х. : Факт, 2007. – 792 с.
4. Филимонкова Н.Н. Системная воспалительная реакция и явления дислипидемии при псориазе: литературный обзор / Н.Н. Филимонкова, Е.П. Топычканова, Н.В. Киселёва // Фундаментальные исследования. – 2013. – № 9 (ч. 1). – С. 188-194.
5. Psoriasis and systemic inflammatory diseases: potential mechanistic links between skin disease and co-morbid conditions / B.B. Davidovici, N. Sattar, J. Prinz [et al.] // J. Invest. Dermatol. – 2010. – Vol. 130, No. 7. – P. 1785-1796.
6. Bens G. Psoriasis: a systemic disease / G. Bens, F. Maccari, E. Esteve // Presse Med. – 2012. – Vol. 41, No. 4. – Р. 338–348.
7. Анализ международного опыта изучения коморбидности псориаза и метаболического синдрома / С.Г. Ткаченко, А.Н. Беловол, В.Б. Кондрашова [и др.] //Український журнал дерматології, венерології, косметології. – 2011. – № 2. – С. 29-37.
8. Вірстюк Н.Г. Особливості перебігу псоріазу у хворих з метаболічним синдромом / Н.Г. Вірстюк, М.С. Волошинович // Український журнал дерматології, венерології, косметології. – 2011. – № 3. – С. 19-22.
9. Ткаченко С.Г. Кардиометаболический риск у больных псоріазом / С.Г. Ткаченко, В.Б. Кондрашова // Дерматол. та венерол. – 2010. – № 2 (48). – С. 11-17.
10. Козлова М.В. Сучасний погляд на псоріатичну хворобу, що розвивається на фоні метаболічного синдрому (огляд літератури) / М.В. Козлова // Ліки України Плюс. – 2010. – № 2. – С. 18-19.
11. Кайдашев И.П. Эволюция понятия «метаболический синдром» и его современное значение / И.П. Кайдашев // Український медичний часопис. – 2012. – Т. ІІІ-ІV, № 2 (88). – С. 52-58.
12. Эффективность кратковременного включения метформина в комплексную терапию больных ишемической болезнью сердца в сочетании с метаболическим синдромом / А.В. Лавренко, М.С. Расин, Л.А. Куценко [и др.] // Лікарська справа. – 2010. – № 7-8 (1107). – С. 65-71.
13. Сариан Е.И. Дисфункция эндотелия у больных псориазом и статины / Е.И. Сариан // Международный медицинский журнал. – 2012. – Т. 18, № 3. – С. 89-93.
14. Späh F. Inflammation in atherosclerosis and psoriasis: common pathogenic mechanisms and the potential for an integrated treatment approach / F.Späh // Br. J. Dermatol. – 2008. – Vol. 159, Suppl. 2. – Р. 10-17.
15. Кауд Д. Влияние гормонов репродуктивной сферы на функциональную активность мононуклеарных лейкоцитов у больных псориазом / Д. Кауд // Таврический медико-биологический вестн. – 2009. – Т. 12, № 1. – С. 36–39.
16. Lowes M.A. Immunology of psoriasis / M.A. Lowes, M. Suarez-Farinas, J.G. Krueger // Ann. Rev. Immunol. – 2014. – Vol. 82, No. 32. – P. 227–255.
17. Беловол А.Н. Дисфункция сосудистого эндотелия у больных псориазом / А.Н. Беловол // Укр. журн. дерматол., венерол., косметол. – 2010. – № 1 (36). – С. 17-21.
18. S3-Guidelines on the treatment of psoriasis vulgaris / A. Nast, W.H. Boehncke, U. Mrowietz [et al.] // J. Dtsch Dermatol. Ges. – 2012. – Vol. 10, Suppl. 2. – P. S1-S95.
19. Naldi L. The clinical spectrum of psoriasis / L. Naldi, D. Gambini // Clin. Dermatol. – 2007. – Vol. 25, No. 9. – P. 510-518.
20. Boehncke W.H. Ethiology and Pathogenesis of Psoriasis / W.H. Boehncke // Rheum. Dis. Clin. North Am. – 2015. – Vol. 32, No. 41 (4). – P. 665-675.
21. Аравийская Е.Р. Барьерные свойства кожи и базовый уход: инновации в теории и практике / Е.Р. Аравийская, Е.В. Соколовский // Вестник дерматологии и венерологии. – 2010. – № 6. – С. 81-87.
22. Безродная А.И. Анализ популяционных особенностей заболеваемости псориазом в Украине / А.И. Безродная // Клінічна імунологія, алергологія, інфектологія. – 2011. – № 8. – С. 70-73.
23. Беловол А.Н. Доказательные аспекты расовой наследственности псориаза / А.Н. Беловол, А.А. Береговая, Н.Л. Колганов // Дерматологія та венерологія. – 2012. – № 1. – С. 5-9.
24. Солошенко Э.Н Об ассоциации псориаза и метаболического синдрома / Э.Н. Солошенко, Н.В. Жукова // Международный медицинский журнал. – 2006. – Т. 12, № 3. – С. 134-138.
25. Катунина О.Р. Роль врожденного и адаптивного иммунитета в патогенезе псориаза: обзор / О.Р. Катунина // Вестн. дерматол. венерол. – 2009. – № 5. – С. 43-48.
26. Свінціцький А.С. Метаболічні порушення у хворих на псоріаз і псоріатичний артрит / А.С. Свінціцький // Здоров’я України. – 2010. – № 3. – С. 69-71.
27. The endocannabinoid system of the skin in health and disease: novel perspectives and therapeutic opportunities / T. Bıró, B. I. Tóth, G. Haskó [et al.] // Trends in Pharmacological Sciences. – 2009. – Vol. 30, No. 8. – P. 411-420.
28. Особливості клінічного перебігу та удосконалення діагностики і лікування псоріазу : методичні рекомендації / Л.Д. Калюжна, О.І. Літус, О.О. Ошивалова [та ін.]. – К. : Національна медична академія післядипломної освіти імені П.Л. Шупика, Український центр наукової медичної інформації та патентно-ліцензійної роботи, 2013. – 64 с.
29. Болотна Л.А. Новий фармакотерапевтичний підхід до лікування псоріазу / Л.А. Болотна, О.В. Решетняк // Дерматологія та венерологія. – 2002. – № 2 (16). – С. 56–58.
30. Стан гуморального імунітету у хворих на псоріаз та псоріатичну артропатію: диференційна діагностика ступенів тяжкості псоріатичної артропатії із застосування методів нейроінформатики / Е.М. Солошенко, Я.Ф. Кутасевич, І.О. Олійник, О.І. Соловйова // Збірник наукових праць співробітників КМАПО ім. П.Л. Шупика. – К., 2005. – С. 440-449.
31. Cost-effectiveness analysis of TNF-a blockers for the treatment of chronic plaque psoriasis in the perspective of the Italian health-care system / S. de Portu, M. Del Giqlio, G. Altomore [at al.] // Dermatologic Therapy. – 2010. – Vol. 23. – P. 7-13.
32. Cytokine gene polymorphisms in Chinese patients with psoriasis / Y.T. Chang, C.T. Chou, C.W. Yu [at al.] // Br. J. Dermatol. – 2007. – Vol. 156. – P. 899-905.
33. Immunologic changes in TNF-alpha, sE-selectin, sP-selectin, sICAM-1, and IL-8 in pediatric patients treated for psoriasis with the goeckerman regimen / L. Borska, Z. Fiala, J. Kreisek [et al.] // Pediatric Dermatology. – 2007. – Vol. 24, No. 6. – P. 607-612.
34. Increased expression of the orphan nuclear receptor NURR1 in psoriasis and modulation following TNF-a inhibition / M. O’Kane, T. Markham, A.N. McEvoy [et al.] // J. Invest. Dermatol. – 2008. – Vol. 128. – P. 300-310.
35. Review article: anti TNF-a induced psoriasis in patients with inflammatory bowel disease / G. Fiorino, M. Allez, A. Malesci [at al.] // Aliment Pharmacol. Ther. – 2009. – Vol. 29. – P. 921-927.
36. Tobin A.M. TNFa inhibitors in the treatment of psoriasis and psoriatic arthritis / A.M. Tobin, B. Kirby // Biodrugs. – 2005. – Vol. 19, No. 1. – P. 47-57.
37. Tumour necrosis factor alpha (TNF-a) converting enzyme and soluble TNF-a receptor type 1 in psoriasis patients in relation to the chronic alcohol consumption / A.B. Serwin, M. Sokolowska, E. Dyleiko [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2008. – Vol. 22. – P. 712-717.
38. Barnas J.L. Ethiology and Pathogenesis of Psoriatic Arthritis / J.L. Barnas, C.T. Ritchlin // Rheum. Dis. Clin. North Am. – 2015. – Vol. 129, No. 41 (4). – P. 643-663.
39. Пинегин Б. В. Роль клеток иммунной системы и цитокинов в развитии псориаза / Б. В. Пинегин // Российский журнал кожных и венерических болезней. – 2013. – № 3. – С. 19-25.
40. Роль интерлейкинов в патогенезе псориаза : [обзор] / В. В. Соболев, Н. Л. Стародубцева, А. Г. Соболева [и др.] // Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. – 2010. – № 5. – С. 79-84.
41. Смирнова С. В. Клинико-иммунологические особенности псориаза / С. В. Смирнова, М. В. Смольникова, В. Ю. Райкова // Цитокины и воспаление. – 2010. – Т. 9, № 4. – С. 121-122.
42. Смирнова Л.М. Инфликсимаб при псориазе: европейский взгляд / Л.М. Смирнова, Н.Г. Кочергин // Русский медицинский журнал. – 2006. – Т. 14, № 5. – С. 362-367.
43. The neuroimmune connection interferes with tissue regeneration and chronic inflammatory disease in the skin / E.M. Peters, C. Liezmann, B.F. Klapp, J. Kruse // Ann. N. Y. Acad. Sci. – 2012. – Vol. 1262. – P. 118-126.
44. Современные представления об иммунопатогенезе псориаза: перспективы применения статинов / М.Н. Школьник, Ю.А. Васюк, Ю.Н. Перламутров [и др.] // Клин. дерматол. и венерол. – 2008. – № 4. – С. 10-17.
45. Psoriasis is associated with lipid abnormalities at the onset of skin disease / L. Mallbris, F. Granath, A. Hamsten, M. Ståhle // J. Am. Acad. Dermatol. – 2006. – Vol. 54, No. 5. – P. 614-621.
46. Markuszeski L. Heart rate and arrhythmia in patients with psoriasis vulgaris / L. Markuszeski, M. Zielinska // Arch. Med. Res. – 2007. – Vol. 38, No. 6. – P. 64-69.
47. Cytokines and anticytokines in psoriasis / A.T. Pietrzak A. Zalewska, G. Chodorowska [et al.] // Clinica Chimica Acta. – 2008. – Vol. 394. – P. 7-21.
48. Лукьянов А.М. Псориаз: объективизация выбора рациональной терапии: учеб. метод. пособие / А.М. Лукьянов. – Минск : Доктор Дизайн, 2011. – 192 с.
49. Белозоров А.П. Новая субпопуляция эффекторных хелперных Т-лимфоцитов (TH22) и ее участие в патогенезе заболеваний кожи / А.П. Белозоров // Дерматологія та венерологія. – 2010. – № 2 (48). – С. 7-10.
50. IL-6 and IL-10 promoter gene polymorphisms in psoriasis vulgaris / W. Baran, J.C. Szepietowski, G. Mazur [et al.] // Acta Derm. Venereol. – 2008. – Vol. 88. – P. 113-116.
51. Serum levels of TNF-a, IFN-y, IL-6, IL-8, IL-12, IL-17, and IL-18 in patients with active psoriasis and correlation with disease severity / O. Arican, M. Aral, S. Sasmaz [et al.] // Mediators of Inflammation. – 2005. – Vol. 5. – P. 273-279.
52. Cytokine profiles during infliximab monotherapy in psoriatic arthritis / A. Mastroianni, E. Minutilli, A. Mussi [at al.] // Br. J. Dermatol. – 2005. – Vol. 153. – P. 531-536
53. Expression of interleukin IL-1 family members upon stimulation with IL-17 differs in keratinocytes derived from patients with psoriasis and healthy donors / P. Muhr, J. Zeitvogel, I. Heitland [at al.] // Br. J. Dermatol. – 2011. – Vol. 165, No. 1. – P. 189-193.
54. The cytokine and chemokine network in psoriasis / B. J. Nickoloff, Н. Xin, F.O. Nestle [et al.] // Clin. Dermatol. – 2007. – Vol. 25, No. 6. – P. 568-573.
55. Андрашко Ю.В. Сучасний погляд на місце кератолітика в комплексному лікуванні псоріазу / Ю.В. Андрашко, І.Й. Шаркань // Український журнал дерматології, венерології, косметології. – 2010. – № 3 (38). – C. 42-46.
56. Ахлупкина М.В. Особенности нарушений в системе цитокинов и липидного обмена у больных псориазом / М.В. Ахлупкина, А.А. Свистунов, А.Л. Бакулев // Саратовский научно-медицинский журнал. – 2011. – Т. 7, № 2. – С. 434-437.
57. Sabbat R. Immunopathogenesis of psoriasis / R. Sabbat, S. Philips, C. Hoflich // Exp. Dermatol. – 2007. – Vol. 16, No. 9. – P. 779-798.
58. Naik H.B. Autoinflammatory pustular neutrophilic diseases / H.B. Naik, E.W. Cowen // Dermatol. Clin. – 2013. – Vol. 31, No. 3. – P. 405-425.
59. Griffiths C. E. Pathogenesis and clinical features of psoriasis / C. E. Griffiths, J. N. Barker // Lancet. – 2007. – Vol. 370, No. 11. – P. 263-271.
60. Clinical usefulness and patient satisfaction for treatment with low-dose cyclosporine administration in patients with moderate psoriasis vulgaris / M. Abe, H. Ishibuchi, T. Syuto [et al.] // J. Dermatol. – 2007. – Vol. 290. – Р. 3-34.
61. Байтяков В. В. Характеристика иммунных нарушений у больных распространённым псориазом в периоде обострения / В. В. Байтяков, Л. В. Новикова // Казанский медицинский журнал. – 2011. – Т. 92, № 6. – С. 807-813.
62. Farshchian M. Associations between cardiovascular risk factors and psoriasis in Iran / M. Farshchian, A. Ansar, A. Sobhan // Clin. Cosmet. Investig. Dermatol. – 2015. – Vol. 68, No. 8. – Р. 437-442.
63. Карнаух Ю.В. Еволюція поглядів на механізм розвитку псоріатичного артриту / Ю.В. Карнаух // Укр. терапевт. журн. – 2010. – №2. – С. 101-106.
64. Ghoreschi K. Immunopathogenesis and role of T-cells in psoriasis / K. Ghoreschi, C. Weigert, M. Rocken // Clin. Dermatol. – 2007. – Vol. 25, No. 11. – P. 574-580.
65. Беляев Г.М. Современное представление о патогенезе псориатической артропатии и лечении этих больных / Г.М. Беляев // Дерматологія та венерологія. – 2010. – № 1. – С. 7-31.
66. Нарушения реологических свойств сыворотки крови у больных псориазом / О.В. Синяченко, О.В. Делятин, О.А. Сосновская [и др.] // Дерматологія та венерологія. – 2012. – № 1. – С. 43-50.
67. Молочков В.А. Псориаз, псориатический артрит: клиника, диагностика, лечение : учеб. пособие / В.А. Молочков, Т.В. Коротаева, Е.С. Якубовская. – М., 2013. – 23 с.
68. Сизон О.О. Патогенетичні особливості розвитку псоріатичного артриту / О.О. Сизон, О.Ю. Туркевич // Український журнал дерматології, венерології, косметології. – 2009. – № 2. – С. 46-55.
69. Сизон О.О. Артропатичний псоріаз: обґрунтування раціональних методів лікування та профілактики. Частина 2 / О.О. Сизон, В.І. Степаненко // Укр. журн. дерматол., венерол., косметол. – 2011. – № 2. – С. 37-45.
70. Шостак Н.А. Современные подходы к диагностике и лечению псориатического артрита (обзор) / Н.А. Шостак, А.А. Клименко // Терапевтический архив. – 2008. – № 10. – С. 82-87.
71. Сизон О.О. Артропатичний псоріаз: проблемні питання діагностки та диференціації. Частина 1 / О.О. Сизон, В.І. Степаненко // Укр. журн. дерматол., венерол., косметол. – 2010. – № 2 (37). – С. 42-49.
72. Загртдинова Р. М. Особенности состояния микроциркуляции у больных эксудативным псориазом на фоне лечения / Р. М. Загртдинова, О. В. Шурыгина // Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. – 2011. – № 1. – С. 23-28.
73. Состояние цитокиновой регуляции клеточного и гу- морального иммунитета у больных генерализованной формой псориаза / П.П. Рыжко, О.В. Зайцева, Н.В. Жукова [и др.] // Пробл. екології та медицини. – 2008. – Т. 12, № 1-2. – С. 18-21.
74. Паньшина Н.Н. Клиническое значение интерлейкина-8 при псориатическом артрите / Н.Н. Паньшина, Л.Н. Шилова, А.В. Александров // Вестник ВолгГМУ. – 2015. – Вып. 3 (55). – С. 51-53.
75. Ibrahim G. The prevalence of psoriatic arthritis in people with psoriasis / G. Ibrahim, R. Waxman, P.S. Helliwell // Arthritis Rheum. – 2009. – Vol. 61. – P. 1373-378.
76. Некоторые аспекты общности патогенеза сахарного диабета 2 типа и псориаза / Ю.М. Штода, Н.А. Слесаренко, Т.И. Родионова [и др.] // Фундаментальные исследования. – 2014. – № 4 (ч. 3) – С. 647-654.
77. Солошенко Е. М. Метаболічні порушення ліпідного обміну у хворих на поширені дерматози / Е. М. Солошенко, Н. В. Жукова // Дерматологія та венерологія. – 2010. – № 2 (48). – С. 62-68.
78. Sommer D. Increased prevalence of the metabolic syndrome in patients with moderate to severe psoriasis / D. Sommer, M. Jenisch, M. Suchan // Arch. Dermatol. Res. – 2006. – Vol. 298, No. 7. – P. 321-328.
79. Вірстюк Н.Г. Вплив метаболічного синдрому на клінічні характеристики псоріазу / Н.Г. Вірстюк, М.М. Нікіфорук // Архів клінічної медицини. – 2015. – № 2 (21). – С. 10-11.
80. Микрюков А. В. Особенности течения псориаза у больных с избыточной массой тела и ожирением / А. В. Микрюков // Клиническая дерматология и венерология. – 2013. – № 6. – С. 52-56.
81. Донцова Е. Эффективность различных видов лечения больных псориазом с метаболическим синдромом / Е. Донцова // Врач. – 2013. – № 7. – С. 80-82.
82. Перламутров Ю. Н. Клинико-лабораторные характеристики псориаза, ассоциированного с гормонально-метаболическими нарушениями / Ю. Н. Перламутров, А. В. Микрюков // Российский журнал кожных и венерических болезней. – 2013. – № 5. – С. 46-50.
83. Naldi L. Epidemiology of comorbidities in psoriasis / L. Naldi, S. Mercuri // Dermatol. Ther. – 2010. – Vol. 23, No. 2. – P. 114-118.
84. Andersen C.J. Impact of Obesity and Metabolic Syndrome / C.J. Andersen, K.E. Murphy, M.L. Fernandez // Adv. Nutr. – 2016. – Vol. 7, No. 1. – P. 66-75.
85. Аль Касем Амин. Влияние системной терапии ожирения на уровень провоспалительного цитокина TNF-α в системном кровотоке у больных с гиперлептинемией / Амин Аль Касем // Імунологія та алергологія. – 2012. – № 4. – С. 58-61.
86. Пашинян А.Г. Особенности липидного обмена у больных псориазом на фоне сопутствующего метаболического синдрома / А.Г. Пашинян, Е.В. Донцова // Вестн. дерматол. венерол. – 2014. – № 4. – С. 40-45.
87. Кешилева Р.К. Характер липидно-фосфолипидных нарушений у больных псориазом / Р.К. Кешилева, А.Б. Рахматов // Укр. журн. дерматол., венерол., косметол. – 2010. – № 2 (37). – С. 51-56.
88. Мавров Г.И. Ангиогенез при псориазе / Г.И. Мавров, Е.И. Сариан // Дерматологія та венерологія. – 2012. – № 2 (56). – С. 36-43.
89. Міщенко Л.А. Роль нетрадиційних чинників серцево-судинного ризику в патогенезі гіпертонічної хвороби / Л.А. Міщенко // Укр. кардіол. журн. – 2012. – № 3. – С. 15-21.
90. Нові фактори серцево-судинного ризику і гіпертрофія лівого шлуночка у хворих на гіпертонічну хворобу / Л.А. Міщенко, Є.П. Свіщенко, О.О. Матова [та ін.] // Галицький лікарський вісник. – 2012. – Т. 19, № 2. – С. 67-70.
91. Pathogenesis of essential hypertension: historical paradigms and modern insights / R.J. Johnson, D.I. Feig, T. Nakagama, [et al.] // J. Hypertension. – 2008. – Vol. 26. – P. 381-390.
92. Association of parental hypertension with concentrations of select biomarkers in nonhypertensive offspring / W. Lieb, M.J. Pencina, T.J. Wang [et al.] // Hypertension. – 2008. – Vol. 52. – P. 381-386.
93. Inflammation in the pathophysiology of essential hypertension / F. Montecucco, A. Pnde, A. Quercioli [et al.] // Nephrol. – 2011. – Vol. 24, No. 01. – P. 23-34.
94. Ryan M.J. An Update on Immune System Activation in the Pathogenesis of Hypertension / M.J. Ryan // Hypertension Issue. – 2013. – Vol. 62, No. 2. – P. 226-230.
95. Draznin B. Molecular mechanisms of insulin resistance: serine phosphorylation of insulin receptor substrate-1 and increased expression of p85 alpha: the two sides of a coin / B. Draznin // Diabetes. – 2006. – Vol. 55. – P. 2392-2397.
96. Effect of acute physiological hyperinsulinemia on gene expression in human skeletal muscle in vivo / D. Coletta, B. Balas, A.O. Chaves [et al.] // Am. J. Physiol. Endocrinol. Metab. – 2008. – Vol. 294, No. 5. – P. 910-917.
97. Кайдашев И.П. NF-kB-сигнализация как основа развития системного воспаления, инсулинорезистентности, липотоксичности, сахарного диабета 2-го типа и атеросклероза / И.П. Кайдашев // Международный эндокринологический журнал. – 2011. – № 3 (35). – C. 35-40.
98. Elevated toll-like receptor 4 expression and signaling in muscle from insulin-resistant subjects / S.M. Reyna, S. Ghost, P. Tantiwong [et al.] // Diabetes. – 2008. – Vol. 57. – P. 2595-2602.
99. Tablazon I.L. Risk of cardiovascular disorders in psoriasis patients / I.L. Tablazon, A. Al-Dabagh, S.R. Feldman // Am. J. Clin. Derm. – 2013. – Vol. 14, No. 1. – P. 1-7.
100. Аль Касем Амин. Лептин-опосредованный синтез кератиноцитами больных псориазом с избыточной массой тела провоспалительного цитокина TNF-α / Аль Касем Амин // Таврический медико-биологический вестник. – 2012. – Т. 15, № 4 (60). – С. 28-31.
101. Comparison of various insulin sensivity indices in psoriatic patients and their relationship with type of psoriasis / S. Ucak, Tr. Ekmekci, O. Basat [et al.] // J. Eur. Acad. Dermatol. & Venereol. – 2006. – Vol. 20, No. 5. – P. 517-522.
102. Кауд Д. Особливості эндотоксин- и липофлавон-зависимой лимфоид-ной регуляции синтеза цитокинов IL-1β, IL-4 и TNF-α эндотелиальными клетками сосудов у больных псориазом, протекающим в сочетании с метаболическим синдромом / Д. Кауд // Дерматологiя та венерологiя. – 2008. – № 1. – С. 34-39.
103. Ryan C. Psoriasis is a systemic disease with multiple cardiovascular and metabolic comorbidities / C. Ryan, B. Kirby // Dermatol. Clin. – 2015. – Vol. 33, No. 1. – P. 41-55.
104. Mallbris L. Metabolic disorders in patients with psoriasis and psoriatic arthritis / L. Mallbris, C.T. Ritchlin, M. Stаhle // Curr. Rheumatol. Reports Iss. – 2006. – Vol. 8, No. 5. – P. 520-526.
105. Prevalence of cardiovascular risk factors in patients with psoriasis / A.L. Neimann, D.B. Shin, X. Wang [et al.] // J. Am. Acad. Dermatol. – 2006. – Vol. 55, No. 5. – P. 829–835.
106. Загртдинова Р.М. Сосудистые нарушения у больных псориазом, возможности их коррекции / Р.М. Загртдинова // Рос. журн. кож. и вен. болезней. – 2006. – №
. – С. 19-23.
107. Фактор некроза опухоли, интерлейкины и липидный обмен в разных стадиях течения псориаза / Э.Н. Солошенко, Н.В. Жукова, Т.П. Ярмак [и др.] // Клініч. імунологія. Алергологія. Інфектологія. – 2012. – № 1/2. – С. 62-64.
108. Мітченко О.І. Діагностика і лікування метаболічного синдрому, цукрового діабету, предіабету і серцево-судинних захворювань : Метод. рекомендації. – О.І. Мітченко, В.В. Корпачев. – К., 2009. – 42 с.
109. Фалько Е.А. Нарушения липидного обмена при псориатической болезни / Е.А. Фалько, Б.С. Хышиктуев // Дальневосточный мед. журн. – 2009. – № 2. – С. 118-122.
110. Canavese M. Vascular endothelial growth factor and psoriasis pathogenesis: major culprit, treatment target, or possible biomarker / M. Canavese, J. Schaube // Int. J. Clin. Rev. – 2011. – Vol. 7, No. 5. – P. 112-115.
111. Onumah N. Psoriasis and its comorbidities / N. Onumah, L.H. Kircik // J. Drugs Dermatol. – 2012. – Vol. 11, No. 5 (Suppl.). – P. s5-s10.
112. Clinical differences between early- and late-onset psoriasis in Thai patients / L. Chularojanamontri, K. Kulthanan, P. Suthipinittharm [et al.] // Int. J. Dermatol. – 2015. – Vol. 54, No. 3. – P. 290-294.
113. Вивчення поширеності PRO12Ala поліморфізму гена ППАР-γ2 в українській популяції з симптомами метаболічного синдрому / І.П. Кайдашев, Л.О. Куценко, О.А. Шликова [та ін.] // Международный эндокринологический журнал. – 2008. – № 1 (13). – С. 23-26.
114. Митченко Е.И. Метаболический синдром: состояние проблемы и лечебные подходы / Е.И. Митченко // Практична ангіологія. – 2006. – № 1. – С. 14-18.
115. De Fronzo R.A. Insulin resistance, lipotoxicity, type 2 diabetes and atherosclerosis: the missing links. The Claude Bernard Lecture 2009 / R.A. De Fronzo // Diabetologia. – 2010. – Vol. 53. – P. 1270-1287.
116. Correlation between changes of blood pressure with insulin resistance in type 2 diabetes mellitus with 4 weeks of pioglitazone therapy / L.M. Hettihewa, S.S. Jayasighe, K.G. Imendra [et al.] // Int. J. Diabetes Dev. Ctries. – 2008. – Vol. 28, No. 1. – P. 26-30.
117. Prevalence of metabolic syndrome among patients with psoriasis at a dermatologic service in the south of Brazil / H.C. Lima, F. Mulinari Brenner, G. Correia [et al.] // J. Am. Acad. Dermatol. – 2009. – Vol. 53. – P. 20-33.
118. Оганов Р. Метаболический синдром: путь от научной концепции до клинического диагноза / Р. Оганов, М. Мамедов, И. Колтунов // Врач. – 2007. – № 3. – С. 3-7.
119. Роль ППАР-γ в патогенезі цукрового діабету, атеросклерозу та метаболічного синдрому (огляд літератури) / І.П. Кайдашев, Л.В. Беркало, Л.О. Куценко [та ін.] // Проблеми екології та медицини. – 2007. – Т. 11, № 1-2. – С. 29-32.
120. Метаболический синдром у мужчин в возрасте 35 – 65 лет сельского района Полтавской области и возможности профилактической терапии «Аторвастатином190» / И.П. Кайдашев, В.Н. Васильев, И.М. Горбась [и др.] // Лікарська справа. – 2006. – № 8. – С. 48-52.
121. Мамедов М.Н. Возможны ли диагностика и лечение метаболического синдрома в реальной практике? / М.Н. Мамедов // Лечащий врач. – 2006. – № 6. – С. 34-39.
122. Farias D.R. Metabolic syndrome in coronary artery and occlusive vascular disease: a systematic review / D.R. Farias, A.F. Pereira, G. Rosa // Arg. Bras. Cardiol. – 2010. – Vol. 94, No. 6. – P. 150-178.
123. Relation of the metabolic syndrome to quantity of coronary atherosclerotic plaque / J. Butler, E.A. Mooyaart, N. Dannemann [et al.] // Am. J. Cardiol. – 2008. – Vol. 101, No. 8. – P. 1127-1130.
124. Adipokines, insulin resistance, and coronary artery disease / A. Qasim, N.N. Mehta, M.G. Tadesse [et al.] // J. Am. Coll. Cardiol. – 2008. – Vol. 52, No. 3. – P. 231-236.
125. Солошенко Е.М. Сучасні підходи до терапії хворих на розповсюджений псоріаз з урахуванням індикаторних показників метаболічних процесів / Е.М. Солошенко, Н.В. Жукова, О.М. Стулій // Дерматологія та венерологія. – 2012. – № 3. – С. 86-94.
126. Каленська О.В. Псоріаз: етіологія, патогенез, клініко-морфологічна картина, принципи лікування / О.В. Каленська, Л.В. Каленська, О.Г. Курик // Укр. журн. дерматол., венерол., косметол. – 2009. – № 3. – С. 5-9.
127. Донцова Е.В. Эффективность применения семакса в комплексной терапии больных псориазом с сопутствующим метаболическим синдромом / Е.В. Донцова // Человек и его здоровье. – 2013. – № 2. – С. 38-42.
128. Олисова О.Ю. Псориаз: эпидемиология, патогенез, клиника, лечение / О.Ю. Олисова // Consilium medicum. – 2010. – № 4. – С. 3-8.
129. Терлецкий О.В. Роль диеты в терапии больных псориазом / О.В. Терлецкий // Consilium Medicum. – 2009. – № 3. – С. 21-25.
130. Чикин В.В. Патогенетические аспекты лечения больных псориазом / В.В. Чикин, Л.Ф. Знаменская, А.А. Минеева // Вестн. дерматол. и венерол. – 2014. – № 5. – С. 86-90.
131. Соснина Е.А. Особенности клинических проявлений и терапия больных пустулезным псориазом / Е.А. Соснина, И.А. Чистякова // Леч. врач. – 2011. – № 10. – С. 13-19.
132. Коноваленко А.А. Особенности течения осложненных форм псориаза на современном этапе / А.А. Коноваленко // Мед. новости. – 2009. – № 5. – С. 100-104.
133. Liang H. Effects of methotrexate on serum expression of MMP-9 and VEGF in patients with psoriasis vulgaris / H. Liang, X. Fan, F. Liang // Pract. Pharm. Clin. Rem. – 2010. – Vol. 23, No. 2. – P. 234-237.
134. A Review of Biologic Therapies / M. Campa, B. Mansouri, R. Warren, A. Menter // Dermatol. Ther. (Heidelb). – 2016. – Vol. 6, No. 1. – P. 1-12.
135. Раціональна діагностика та лікування в дерматології та венерології : довідник лікаря / за ред. І. І. Маврова. – К. : Здоров’я України, 2007. – 324 с.
136. Федоренко О.Є. Клінічний досвід терапії псоріазу / О.Є. Федоренко // Український журнал дерматології, венерології, косметології. – 2012. – № 1 (44). – С. 59-62.
137. Филимонкова Н.Н. Наружная терапия больных псориазом / Н.Н. Филимонкова // Клин. дерматол. венерол. – 2009. – № 2. – С. 51-53.
138. Святенко Т.В. Місцева терапія при псоріазі: проблеми та шляхи їх розв’язання / Т.В. Святенко, І.Я. Возняк // Український журнал дерматології, венерології, косметології. – 2009. – № 3. – С. 13-17.
139. Lowes M.A. Pathogenesis and therapy of psoriasis / M.A. Lowes, A.M. Bowcock, J.G. Krueger // Nature. – 2011. – Vol. 451, No. 8. – P. 866-873.
140. Перламутров Ю.Н. Российский опыт применения современных комбинированных топических препаратов при лечении псориаза / Ю.Н. Перламутров, К.Б. Ольховская, С.С. Землякова // Лечащий врач. – 2008. – № 9. – С. 74–76.
141. Препараты кальципотриола в терапии псориаза / И.М. Корсунская, С.Е. Зеленцова, Е.А. Василевская, Л.Т. Тогоева // Вестник дерматологии и венерологии. – 2007. – № 3. – С. 45–46.
142. Григорьев Д.В. Оценка эффективности и безопасности комбинированного лечения больных псориазом метотрексатом и широкополосной средневолновой фототерапией / Д.В. Григорьев, В.В. Владимиров // Вестн. дерматол. венерол. – 2014. – № 6. – С. 14-17.
143. Дудченко М.О. Псоріаз, або лускатий лишай. Шкірні та венеричні хвороби / М.О. Дудченко, А.Ф. Артеменко // Шкірні та венеричні хвороби / За ред. М.О. Дудченка. – Вінниця : Нова книга, 2007. – С. 67-71.
144. Effectiveness and retention rates of methotrexate in psoriatic arthritis in comparison with methotrexate-treated patients with rheumatoid arthritis / E. Lie, T. Uhlig, M.S. Heiberg [et al.] // Ann. Rheum. Dis. – 2010. – Vol. 69. – Р. 671-676.
145. Беноит С. Псориаз в детском и подростковом возрасте. Клиническая картина и терапия / С. Беноит, Х. Хамм // Дерматолог. – 2010, № 01. – С. 31-38.
146. Kaur I. Systemic methotrexate treatment in childhood psoriasis: further experience in 24 children from India / I. Kaur, S. Dogra, A.J. Kanwar // Pediatr. Dermatol. – 2008. – Vol. 25. – Р. 184-188.
147. Кубанова А.А. Иммунные механизмы псориаза. Новые стратегии биологической терапии: обзор / А.А. Кубанова // Вестн. дерматол. венерол. – 2010. – № 1. – С. 35-47.
148. German evidence-based guidelines for the treatment of Psoriasis vulgaris / A. Nast, I. Kopp, M. Augustin [et al.] // Arch. Dermatol. Res. – 2007. – Vol. 299, No. 12. – P. 111-138.
149. Кутасевич Я.Ф. Особливості лікування псоріатичної хвороби на сучасному етапі / Я.Ф. Кутасевич, І.О. Олійник // Клін. імунологія. Алергологія. Інфектологія. – 2011. – № 1. – С. 31-36.
150. Good clinical response to anti-psoriatic treatment with adalimumab and methotrexate does not inflict a direct effect on compartmentalization of T-cell subsets: a pilot study / R.G. Van Lingen, E.M. De Jong, M.A. Berends [et al.] // J. Dermatol. Treat. – 2008. – Vol. 284. – Р. 7-19.
151. Кузнецов А.В. Лечение вульгарного псориаза иммунобиологическими препаратами / А.В. Кузнецов // Дерматолог. – 2010. – № 1. – С. 63-69.
152. Кузнецов А.В. Лечение вульгарного псориаза средней и тяжелой степени тяжести по терапевтическому алгоритму: опыт немецкой дерматологии / А.В. Кузнецов // II Всероссийский конгресс дерматовенерологов. – СПб., 2007. – Т. 9. – С. 24-28.
153. Weisenseel P. Implementation of the S3-guidelines for systemic and UV therapy of moderate to severe psoriasis vulgaris by an algorithm / P. Weisenseel, A.V. Kuznetsov, J.C. Prinz // J. Dtsch. Dermat. – 2007. – Vol. 18, No. 5. – Р. 683-688.
154. Etanercept 50 mg once weekly sustains safety and efficacy for up to 96 weeks in plaque psoriasis patients / B. Elewski, B. Strober, S. Tyring [et al.] // 15th Congress of EADV. – 2006. – Vol. 138 (4-8). – Poster No. 950757.
155. Adalimumab therapy for moderate to severe psoriasis: a randomized, controlled phase III trial / A. Menter, S.K. Tyring, K. Gordon [et al.] // J. Am. Acad. Dermatol. – 2008. – Vol. 58. – Р. 106-115.
156. Röcken M. Biologics bei entzündlichen Krankheiten der Haut: Wirkungsmechanismen – Möglichkeiten – Risiken / M. Röcken, Ch. Weigert // Plewig G. Fortschritte der praktischen Dermatologie und Venerologie / G. Plewig, P. Thomas. – 2006. – Vol. 20. – Р. 41-57.
157. Бабанин В.А. Стратегия лечения больных бляшечным псориазом при использовании узкополосной ультрафиолет В (NB-UVB, 311 нм) терапии / В.А. Бабанин, О.А. Притуло // Дерматологія та венерологія. – 2013. – № 1 (59). – С. 45-53.
158. Григорьев Д.В. Комбинированное лечение псориаза широкополосным средневолновым ультрафиолетовым излучением и метотрексатом / Д.В. Григорьев // Рус. мед. журн. – 2013. – № 8. – С. 413-416.
159. Volc S. Pathophysiological basis of systemic treatments in psoriasis / S. Volc, K. Ghoreschi // J. Dtsch Dermatol. Ges. – 2016. – Vol. 14, No. 6. – P. 557-572.
160. Хлебникова А. Н. Современные подходы к наружной терапии псориаза / А. Н. Хлебникова // Вестник дерматологии и венерологии. – 2012. – № 1. – С. 86-91.
161. Миронюк І.С. Реактивна психологічна тривожність з приводу дерматологічної патології при псоріазі // Укр. журн. дерматол., венерол., косметол. – 2006. – № 2 (21). – С. 33-35.
162. Распространенный псориаз: интегральные показатели липидного обмена и инсулиноподобный фактор роста – 1 / Э. Н. Солошенко, Н. В. Жукова, Т. П. Ярмак, З. М. Шевченко // Дерматовенерология. Косметология. Сексопатология. – 2011. – № 1–4. – С. 75–76.
163. Куценко И.В. Современные подходы к лечению десквамативных дерматозов волосистой части головы / И.В. Куценко, Е.Н. Куценко // Укр. журн. дерматол., венерол., косметол. – 2007. – № 1 (24). – С. 24-27.
164. Jowkar F. Statins in dermatology / F. Jowkar, М. Namazi // Int. J. Dermatol. – 2010. – Vol. 49, No. 11. – P. 1235-1243.
165. Мавров Г. И. Коррекция эндотелиальной дисфункции у больных обычным псориазом / Г. И. Мавров, Е. И. Сариан // Імунологія та алергологія: наука і практика. – 2012. – № 3. – С. 79-84.
166. European S3-Guidelines on the systemic treatment of psoriasis vulgaris / A. Nast, P. Gisondi, A.D. Ormerod [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2015. – Vol. 29, No. 12. – P. 2277-2294.
167. Метаболічний синдром та серцево-судинний ризик: сучасний погляд на проблему / І.М. Гідзинська, Г.З. Мороз, Т.С. Ласиця, М.В. Безугла // Артериальная гипертензия. – 2012. – № 2 (22). – С. 111–117.
168. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance / J. Tuomilehto, J. Lindstrom, J. Ericsson [et al.] // N. Eng. J. Med. – 2001. – Vol. 33. – Р. 342-345.
169. Гринюк С. М. Дієтотерапія в комплексному лікуванні псоріазу / С. М. Гринюк, Л. О. Хімейчук, Н. Ю. Сенишин // Галицький лікарський вісник. – 2013. – Т. 20, № 1. – С. 141-144.
170. Инсулиноподобный фактор роста-1 и углеводный обмен у больных распространенным псориазом / Э. Н. Солошенко, А. К. Кондакова, Н. В. Жукова [и др.] // Дерматологія та венерологія. – 2012. – № 1 (55). – С. 50-55.
171. Хардикова С. А. Состояние пищеварительной системы при псориазе / С. А. Хардикова, Э. И. Белобородова // Клиническая медицина. – 2012. – Т. 90, № 2. – С. 13-19.
172. Мітченко О.І. Діагностика і лікування метаболічного синдрому, цукрового діабету, предіабету і серцево-судинних захворювань: рекомендації асоціації кардіологів України та асоціації ендокринологів України / О.І. Мітченко, В.В. Карпачов // Серцево-судинні захворювання: рекомендації з діагностики, профілактики та лікування – К. : Моріон, 2011. – С. 68-79.
173. Кайдашев И.П. Метаболический синдром – основы патогенеза и лечения / И.П. Кайдашев, Л. А. Куценко, И.Л. Солохина // Проблеми екології та медицини. – 2009. – Т. 13, № 3-4. – С. 23-29.
174. Клінічна характеристика ефективності комбінації метформіну та раміприлу в комплексній терапії хворих з метаболічним синдромом / Л.Г. Савченко, Е.І. Кайдашева, Л. О. Куценко [та ін.] // Лікар. справа. – 2013. – № 1. – С. 109-117.
175. Скрипкин Ю.К. Кожные и венерические болезни / Ю.К. Скрипкин, А.А. Кубанова, В.Г.Акимов. – М. : Медицина, 2009. – 688 с.
176. Noninvasive evaluation of tacalcitol plus puva versus tacalcitol plus UVB-NB in the treatment of psoriasis: “right-left intra-individual pre/post comparison design” / V. Brazzelli, T. Barbagallo, F. Prestinari [et al.] // J. Immunopathol. Pharmacol. – 2005. – Vol. 755. – Р. 18-60.
177. Гмошинская A.A. Лептин крови у лиц с различной массой тела : автореф. дис. … канд. мед. наук : 14.00.05 – внутренние болезни; 14.00.03 – эндокринология / A.A. Гмошинская ; ГУ «Научный центр клинической и экспериментальной медицины Сибирского отделения РАМН». – Новосибирск, 2003. – 22 с.
178. Бритов А.Н. Борьба с артериальной гипертонией / А.Н. Бритов // Врач. – 1997. – № 5. – С. 33-34.
179. Камышников В.С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностике / В.С. Камышников. – 3-е изд. – М. : МЕДпресс-информ., 2009. – 896 с.
180. Наказ МОЗ України № 312 від 08.05.2009 р. «Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання».
181. More than skin deep: atherosclerosis as a systemic manifestation of psoriasis / A.B. Alexandroff, M. Pauriah, R.D. Camp [et al.] // Br. J. Dermatol. – 2009. – Vol. 161, No. 1. – P. 1-7.
182. Henseler T. A comparison between BSA, PASI, PLASI and SAPASI as measures of disease severity and improvement by therapy in patients with psoriasis / T. Henseler, K. Schmitt-Rau // Int. J. Dermatol. – 2008. – Vol. 157, No. 47. – Р. 10-23.
183. Шмакова А.С. Роль липидных нарушений и провоспалительных цитокинов в патогенезе и их коррекция : автореф. дис. … канд. мед. наук : 14.00.11 – кожные и венерические болезни / А.С. Шмакова. – М., 2009. – 18 с.
184. Буянова О.В. Стан проблем етіопатогенезу, лікування хворих на псоріаз в Україні, розробка сучасних теорій (Огляд сучасних літературних даних та обгрунтування перспективних напрямків подальших досліджень) / О.В. Буянова, Х.Д. Аль-Рамлаві // Український журнал дерматології, венерології, косметології. – 2005. – № 4. – С. 36-39.
185. Despres J.-P. Abdominal obesity: the most prevalent cause of the metabolic syndrome and related cardiometabolic risk / J.-P. Despres // J. Eur. Heart. – 2006. – Vol. 29, Suppl 8. – Р. 4-12.
186. Haffner S. Risk constellations in patients with the metabolic syndrome: epidemiology, diagnosis, and the treatment patterns / S. Haffner // Am. J. Med. – 2006. – Vol. 119, Suppl. 1. – P. 3-9.
187. Lipoprotein (a) in patients with psoriasis: associations with lipid profiles and disease severity / A. Pietrzak, J. Kadzielewski, K. Janowski [et al.] // Int. J. Dermatol. – 2009. – Vol. 48, No. 4. – P. 379-387.
188. Hotamisligil G.S. Inflammation and metabolic disorders / G.S. Hotamisligil // J. Nature. – 2006. – Vol. 444, No. 7121. – Р. 860-867.
189. Pereira M.G. Dyadic adjustment, family coping, body image, quality of life and psychological morbidity in patients with psoriasis and their partners / M.G. Pereira, L. Brito, T. Smith // Int. J. Behav. Med. – 2012. – Vol. 19, No. 3. – P. 260-269.
190. Wu Y. Prevalence of cardiovascular risk factors and other comorbidities among psoriasis patients / Y. Wu // J. Am. Acad. Dermatol. – 2007. – Vol. 191, No. 9. – Р. 23-27.
191. The inflammatory response in mild and in severe psoriasis / P. Rocha-Pereira, A. Santos-Silva, I. Rebelo [et al.] // Br. J. Dermatol. – 2004. – Vol. 150. – Р. 917-928.
192. Systemic and vascular inflammation in patients with moderate to severe psoriasis as measured by [18F]-fluorodeoxyglucose positron emission tomography/computed tomography (FDG-PET/CT): A Pilot Study / N.N. Mehta, Y.D. Yu, B. Saboury [et al.] // Arch Dermatol. – 2011. – Vol. 147, No. 9. – Р. 1031-1039./
193. Impact of metformin versus repaglinide on non-glycaemin cardiovascular risk markers related to inflammation and endothelial disfunction in non-oese patients with type 2 diabetes / S.S. Lund, L. Tarnow, C.D. Stehouwer [et al.] // Eur. J. Endocrinol. – 2008. – Vol. 158, No. 5. – P. 613-641.
194. Metformin inhibits TNF-alpha-induced I kappa B Kinase phosphorylation, I kappa B-alfa degradation and IL-6 production in endothelial cells through PI3K-dependent AMPK phoshorylation / N.L. Huang, S. H. Chiang, C.H. Hsveh [et al.] // Int. J. Cardiol. – 2009. – Vol. 134, No. 2. – P. 169-175.
195. Insulin stimulates interleukin-6 and tumor necrosis factor-α gene expression in human subcutaneous adipose tissue / R. Krogh-Madsen, P. Plomgaard, P. Keller [et al.] // Am. J. Physiol. Endocrinol. Metabol. – 2009. – Vol. 286, No. 2. – Р. 234-238.
196. Болотна Л.А. Пcориаз: патогенез, клинические проявления, принципы терапии / Л.А. Болотна // Схiдноєвропейський журнал внутрiшньої та сiмейної медицини. – 2015. – № 1. – С. 4-9.
197. Immunophenotype lymphocyte of peripheral blood in patients with psoriasis / J. Karamehic, L. Zecevic, H. Resic [et al.] // Med. Arch. – 2014. – Vol. 68, No. 4. – P. 236-238.
198. Клинико-биохимический статус у больных псориазом и методы его коррекции / Ю.С. Бутов, В.Ю. Васенова, А.С. Шмакова, О.М. Ипатова // Российский журнал кожных и венерических болезней. – 2009. – № 5. – С. 23-27.
199. Chemokines and cytokines network in the pathogenesis / B. Nedoszytko, M. Sokołowska-Wojdyło, K. Ruckemann-Dziurdzińska [et al.] // Postepy Dermatol. Alergol. – 2014. – Vol. 31, No. 2. – P. 84-91.
200. Increased sympathetic activity during sleep and nocturnal hypertension in type 2 diabetic patients with diabetic nephropathy / F.S. Neilsen, H.P. Hansen, P. Jacobsen [et al.] // Diabet Med. – 1999. – Vol. 68, No. 16 (7). – Р. 555-562.
201. Шубина А.Т. Влияние метформина на суточный профиль артериального давления у больных метаболическим синдромом / А.Т. Шубина, И.Ю. Демидова, Ю.А. Карпов // Международный журнал медицинской практики. – 2001. – № 1. – С. 33-35.
202. Greenhill C. Metformin, weight loss and NAFLD / C. Greenhill // Nat. Rev. Endocrinol. – 2010. – Vol. 6, No. 6. – P. 296.
203. Longerm effects of metformin and lifestyle modification on non-alcoholic Fatty lives disease obese adolescent / L. Tork, A. R. Damaso, A. De Piano [et al.] // J. Obes. – 2010. – Vol. 43. – P. 831-901.
204. Effect of 1-year treatment with metformin on metabolic and cardiovascular risk factors in non-diabetic upper-body obese subjects with wild glucosae anomalles: a post-noc analysis of the BIGPROL trial / A. Fontbonne, I. Dious, M. Baccara-Dinet [et al.] // Diabetes Metab. – 2009. – Vol. 35, No. 5. – P. 385-391.
205. Рекомендации экспертов Всероссийского научного общества кардиологов по диагностике и лечению метаболического синдрома. Второй пересмотр // Практическая медицина. – 2010. – № 5 (44). – С. 81-101.
206. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group // Lancet. – 1998. – Vol. 352. – Р. 854-865.
207. Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin / W.C. Knowler, E. Barrett-Connor, S.E. Fowler [et al.] // N. Engl. J. Med. – 2002. – Vol. 346, No. 7 (6). – Р. 393-403.
Додаток А
Акти впровадження




