МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ УКРАИНЫ
ДОНЕЦКИЙ НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
ИМ. М. ГОРЬКОГО
На правах рукописи
Борзых Юлия Александровна
УДК 616-003.923-08-035-059-084
ОБОСНОВАНИЕ КОМБИНИРОВАННОЙ
ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОЙ ТАКТИКИ ПРИ КЕЛОИДНЫХ
И ГИПЕРТРОФИЧЕСКИХ РУБЦАХ
14.01.20 – кожные и венерические болезни
Диссертация на соискание ученой степени
кандидата медицинских наук
Научный руководитель:
Проценко Татьяна Витальевна
доктор медицинских наук,
профессор
Донецк – 2014
| Список условных обозначений. | 4 |
| Введение | 5 |
| Раздел 1 Обзор литературы | 10 |
| 1.1 Современные представления о патогенезе и морфогенезе гипертрофических и келоидных рубцов | 10 |
| 1.2 Современные подходы к лечению гипертрофических и келоидных рубцов | 20 |
| Раздел 2 Материалы и методы исследования | 29 |
| 2.1 Клиническая характеристика больных | 29 |
| 2.2 Общеклинические методы | 29 |
| 2.3 Морфологические и иммуногистохимические | 31 |
| 2.4 Биофизические методы | 32 |
| 2.5 Статистические методы | 35 |
| Раздел 3 Клинические особенности патологических рубцов | 36 |
| Раздел 4 Морфологические и иммуногистохимические особенности патологических рубцов | 51 |
| Раздел 5 Особенности биофизических свойств патологических рубцов до лечения | 59 |
| Раздел 6 Лечение больных с патологическими рубцами | 70 |
| 6.1 Методика лечения | 70 |
| 6.2 Оценка результатов лечения | 73 |
| 6.2.1 Оценка клинических результатов | 73 |
| 6.2.2 Динамика изменения биофизических характеристик патологических рубцов после лечения | 85 |
| 6.2.3 Патоморфоз патологических рубцов после лечения | 95 |
| 6.3 Отдаленные результаты лечения | 128 |
| Раздел 7 Анализ и обсуждение полученных результатов | 133 |
| Выводы | 142 |
| Список использованных источников | 145 |
| Приложение А Акты внедрения | 169 |
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ
ГР – гипертрофические рубцы
ГМЦР – сосуды гемоциркуляторного русла сосочкового слоя дермы
ИГХ – исследование – иммуногистохимическое исследование
КВ – коллагеновые волокна
КР – келоидные рубцы
ЛИ – лейкоцитарная инфильтрация
МКДА – микродермабразия
mРНК – матричная рибонуклеииновая кислотаа
МЦР – микроциркуляторное русло
ОАВ – основное аморфное вещество
ПР – патологические рубцы
СК – соединительнотканные клетки
ТИК – топические ингибиторы кальциневрина
ТЭПВ – трансэпидермальная потеря влаги
Уд. вес – удельный вес
Ус. ед. – условные единицы
ФБл – фибробласты
СD34+ – cluster of differentiation
EGFR – epidermal growth factor receptor
CPF – коллагенпродуцирующий фактор
FAF – фибробластактивирующий фактор
FIF – фибробластингибирующий фактор
ICF – ингибиторный фактор роста фибробластов
TCGP – Т-клеточный фактор роста фибробластов
VEGF – vascular endothelial growth factor
ВВЕДЕНИЕ
Актуальность темы. Актуальность проблемы лечения гипертрофических (ГР) и келоидных рубцов (КР) приобретает большее значение на фоне увеличения количества больных, учащения случаев различных повреждений кожи, в результате которых образуются патологические рубцы (ПР): после плановых операций, травм, ожогов, ран и др. [58, 111, 116, 174].
Между тем, до сих пор еще не разработаны оптимальные методы их лечения, в связи с тем, что противоречивыми остаются многие вопросы пато- и морфогенеза, не существует единой их классификации [32, 177].
Не позволяет предложить оптимальную тактику ведения ПР разнообразие клинических их разновидностей и характеристик [6]. Фактически, несмотря на многовековой опыт и усилия современной науки, проблема лечения рубцов и достижения клинически и эстетически значимого результата все еще далеки от своего решения [7, 184]. Применяют различные средства деструкции ПР (криодеструкцию, лазерную деструкцию), рентгенотерапию лучами обычной жесткости и Букки, также электро-, фонофорез, мезотерапию с использованием ферментов и кортикостероидов, терапевтическую и оперативную дермабразию, употребление силиконовых пластин, гелей и хирургическое лечение [114, 184]. В то же время, анализ представленных в литературе результатов лечения рубцов различными способами показывает, что в 30-50% наблюдений отмечены рецидивы [33,188].
Несмотря на многочисленность методов терапии, до сих пор не существует хорошо отработанного и высокоэффективного способа лечения ПР. Считают перспективным в их лечении использование топических ингибиторов кальциневрина (ТИК), которые способны снижать передачу сигнала Т – лимфоцитами и транскрипцию интерлейкина-2 и ингибировать за счет этого иммунный ответ. Исследователи наблюдали уменьшение КР у пациентов, использовавших ТИК для лечения атопического дерматита [118, 162].
Однако только комплексное лечение ГР и КР, по мнению большинства специалистов, способствует достижению желаемого результата [34, 17, 184].
Все вышеупомянутое обусловливает практическое значение рассматриваемой проблемы.
Связь работы с научными программами, планами, темами.
Исследование является частью плановой научно-исследовательской работы кафедры дерматовенерологии и косметологии Учебно-научного института последипломного образования Донецкого национального медицинского университета им. М. Горького «Розробити нові методи лікування хронічних розповсюджених дерматозів та сексуально-трансмісивних інфекцій на підставі вивчення особливостей їх перебігу з урахуванням супутньої соматичної патології» (№ госрегистрации 0109U008725). Соискателем самостоятельно выполнен фрагмент, посвященный лечению патологических рубцов.
Цель и задачи исследования. Цель – повышение эффективности лечения больных с гипертрофическими и келоидными рубцами путем разработки патогенетически обоснованного комплексного метода терапии на основании изучения патоморфологических, иммуногистохимических и биофизических особенностей рубцово-измененной ткани.
Для достижения цели были поставлены следующие задачи:
- Изучить клинические особенности гипертрофических и келоидных рубцов у больных в зависимости от возраста, пола и длительности заболевания.
- Оценить морфологические и иммуногистохимические изменения кожи при гипертрофических и келоидных рубцах различной давности.
- Исследовать биофизические особенности гипертрофических и келоидных рубцов кожи в зависимости от давности их существования по параметрам эритемы, пигментации, состояния сосудистого компонента, вискоэластичности и рН кожи
- Разработать и внедрить в практику здравоохранения комплексный метод терапии больных с гипертрофическими и келоидными рубцами в зависимости от их давности путем этапного применения топических ингибиторов кальциневрина и деструктивных методов лечения.
- Проанализировать динамику морфологических, иммуногистохимических и биофизических показателей патологических рубцов после использования разработанного метода и оптимизировать профилактику их рецидивов.
Объект исследования: гипертрофические и келоидные рубцы.
Предмет исследования: клинические проявления, биофизические, морфологические и иммуногистохимические особенности гипертрофических и келоидных рубцов, терапевтическая эффективность.
Методы исследования: клинические, морфологические, иммуногистохимические, биофизические, статистические.
Научная новизна полученных результатов. Впервые выявлены специфические различия тканевой экспрессии CD34, VEGF, EGFR у больных с гипертрофическими и келоидными рубцами кожи до и после комплексного лечения. Подтверждено наличие морфологических изменений патологических рубцов и установлены признаки тканевых реакций, способствующих фибриллогенезу и прогрессированию рубцовых дефектов кожи независимо от их вида: лимфоцитарная инфильтрация дермы, низкий удельный вес сосудов микроциркуляторного русла, большая численность популяции фибробластов, контактирующих с коллагеновыми волокнами – потенциальных миофибробластов.
Впервые выявлены морфометрические особенности гипертрофических и келоидных рубцов и их динамика в процессе комплексного лечения (митотический индекс эпидермиса, соотношение численности лимфоцитов/макрофагов дермы, тканевая плотность гемососудов и фибробластов в одном поле зрения), которые подтвердили иммуномодулирующий и коллагенолитический эффекты топических ингибиторов кальциневрина и деструктивных методов лечения.
Впервые установлены клинически важные биофизические параметры патологических рубцов в зависимости от давности заболевания.
Научно обоснован патогенетический метод лечения больных с гипертрофическими и келоидными рубцами, а также дифференцированный подход к этапному применению топических ингибиторов кальциневрина и деструктивных методов на основании анализа морфологических, иммуногистохимических и биофизических показателей рубцово-измененной кожи.
Практическое значение полученных результатов. Разработан оригинальный этапный и комплексный подход к терапии больных с гипертрофическими и келоидными рубцами путем дифференцированного применения ТИК (такролимус 0,1 % мазь) и деструктивных методов лечения (хирургический, микродермабразия) в зависимости от давности их существования, который может быть рекомендован для внедрения в практику здравоохранения.
Предложена балльная шкала оценки состояния ПР, позволяющая в динамике контролировать эффективность терапии и оптимизировать лечебную тактику.
Разработан способ лечения больных с гипертрофическими рубцами (Патент Украины на полезную модель № 83835 от 25.09.2013), который заключается в комбинированном применении топических ингибиторов кальциневрина (2 раза в сутки в течение 4 недель, затем 1 раз в сутки 3 месяца) и деструктивных методов, что позволило повысить эффективность терапии – сократить сроки существования клинических симптомов в 1,6 раза.
Результаты диссертации внедрены в практику ККЛПЗ ОЗ «Областной кожно-венерологический диспансер» г. Донецка, КУ «Днепропетровская областная детская клиническая больница» Днепропетровского обласного совета, Полтавского областного клинического кожно-венерологического диспансера, КУ «Запорожский областной кожно-венерологический клинический диспансер» Запорожского областного совета, КУ «Ровенский областной кожно-венерологический диспансер» Ровенского областного совета.
Личный вклад соискателя. Вклад соискателя в получении результатов исследования является основным и заключается в самостоятельном анализе научных публикаций по теме диссертации. Самостоятельно проведен патентно-информационный поиск. Вместе с научным руководителем сформулированы цель и задачи работы. Самостоятельно проведено обобщение полученных результатов и их статистическую обработку, написаны все разделы диссертации, совместно с научным руководителем сформулированы выводы.
Соискателем совместно с Бондаренко Н.М., сотрудником кафедры гистологии, цитологии и эмбриологии Донецкого национального медицинского университета им. М. Горького, исследованы морфологические особенности патологических рубцов.
Диссертантом не были использованы результаты и идеи соавторов публикаций.
Апробация результатов диссертации. Основные положения работы были апробированы и обсуждены на XIII Национальном конгрессе из дерматокосметологии и эстетичной медицине (Донецк, 2013), научно-практической конференции «Від клінічних настанов до уніфікованих протоколів діагностики та лікування в дерматовенерологіі» (Киев, 2013), областном междисциплинарном семинаре в рамках профессиональной прерывистого курса «Школа по дерматологии» (Донецк, май 2014).
Публикации. По теме диссертации опубликовано 11 научных работ (9 в моноавторстве), среди которых 5 статей в научных фаховых изданиях Украины, 7 статей в наукометрических изданиях (5 статей, которые входят в наукометрическую базу данных Google Scholar и 2 статьи, входящие в наукометрическую базу Российский индекс научного цитирования), 1 патент на полезную модель, 1 работа опубликована в сборнике материалов конференции.
РАЗДЕЛ 1
ОБЗОР ЛИТЕРАТУРЫ
1.1 Современные представления о патогенезе и морфогенезе гипертрофических и келоидных рубцов
Оперативные вмешательства, производственные и бытовые травмы, а также некоторые дерматозы (акне) приводят к развитию ПР. Несмотря на многовековой опыт и усилия современной науки, проблема лечения рубцов и достижение клинически и эстетически значимого результата все еще далеки от своего решения [8].
Актуальность проблемы лечения рубцов приобретает еще большую значимость на фоне всё возрастающего потока больных с этой патологией, роста случаев различных повреждений кожи, в исходе которых преобладают патологические рубцы (после плановых операций, травм, ожогов, ран и др.) [35, 51, 70]. По данным разных авторов, ГР и КР встречаются у 5,8 % – 17,3 % [6] и от 4 % до 22 % пациентов с ПР, обратившихся в лечебные учреждения [57, 109, 194]. Такие пациенты направляются к хирургам или дерматовенерологам, к которым на сегодня относятся такие субсециальности, как медицинская косметология, оперативное лечение болезней кожи и фотодерматология [84].
До сих пор спорными остаются многие вопросы пато- и морфогенеза ПР, не существует единой классификации рубцов, что не позволяет разработать оптимальные методы их лечения и ставит проблему ПР в ряд актуальных нерешенных задач медицины [33, 83, 177]. Разнообразие клинических разновидностей рубцов и способов их характеристик затрудняет не только разработку их классификации, но и не позволяет предложить оптимальную тактику их ведения [6, 126].
Были предложены варианты клинической классификации рубцов кожи, предлагающие классифицировать их по виду (звездчатые, линейные, Z-образные); по срокам существования (старые и молодые); по характеру травмы (послеоперационные, послеожоговые, посттравматические, постэруптивные); по эстетическим характеристикам (эстетически приемлемые и эстетически неприемлемые); по влиянию на функции (влияющие и не влияющие) [58, 119, 136].
По классификации А.Е. Белоусова (2005) рубцы делили по форме (линейные, дугообразные, плоскостные, фигурные); по локализации (на открытых и закрытых участков тела); по глубине залегания (глубокие и поверхностные); по патогенетическому принципу (простые и патологические); по клинико-морфологическому принципу (атрофические, гипертрофические и келоидые) [7, 8].
Предложено выделять рубцы также по форме (веерообразные, звездчатые, келоидные рубцовые тяжи) и по причинам возникновения (после воспалительных процессов, после хирургических вмешательств, на месте травм, послеожоговые) [80, 134].
Известно разделение рубцов всех видов по гистологическому принципу [64, 75]. Так, рубцы делили на: гиалинизированные; старые рубцы с резким гиалинозом; фиброзные с негиалинизированными волокнами; гиперпластические с сильной пролиферацией фибробластов; фиброматозные с очаговой пролиферацией фибробластов в верхних слоях и образованием разрастаний типа мягких фибром [15, 16].
Комплексный анализ, проводимый в прикладных целях, позволил классифицировать рубцы по их клинико-морфологическому типу [6,58].
Л.А. Болховитинова и М.Н. Павлова (1977) в классификации рубцов выделили ГР, истинный или самопроизвольный келоид, рубцовый или ложный келоид [10]. В.В. Шафранов с соавторами (2006) предложил для КР клиническую классификацию, в которой выделяли четыре их вида в зависимости от формы: звездчатые формы, тяжи, веерообразной формы, в виде массива. Автор отдельно рассматривал варианты КР в зависимости от стадии роста (активные и неактивные) [19]. А.Е. Резникова (1999) выделяла патологические и простые рубцы, в свою очередь, патологические рубцы делила на ГР и КР, а последние еще на фибробластические (активные келоиды) и фиброзные (неактивные), а простые – на плоские и втянутые [73].
В Вене в 1996 году было принято решение все рубцы кожи делить на физиологические и нефизиологические (патологические), а патологические – на ГР и КР [58].
Представляет практический интерес развернутая клинико-морфологическая классификация, предлагающая выделение двух групп рубцов [75]. К первой группе отнесены рубцы, возникающие в результате адекватной патофизиологической реакции организма в ответ на повреждение кожи (нормотрофические, гипотрофические, атрофические рубцы). Во вторую группу включили КР и ГР. Существует мнение, что к истинным рубцам второй группы отнесятся только варианты келоидных рубцов (келоиды мочек ушных раковин, обширные и ограниченные по площади келоиды, акне-келоид и келоидная болезнь), а ГР следует выделить в отдельную группу, занимающую промежуточное положение между первой и второй группами [58, 73, 133].
Известно, что раневой процесс представляет собой сложный комплекс биологических явлений, завершающихся заживлением раны [198, 202]. При заживлении происходят деструктивные и восстановительные изменения тканей – соединительной, эпителиальной, нервной и мышечной. Доказано, что раневой и репаративный процессы представляют собой комплекс последовательных местных изменений и связанных с ними многочисленных общих реакций [5, 20, 64, 213].
В многокомпонентной системе клеточной регуляции процесса репарации важная роль принадлежит ростовым факторам, которые, являясь биологически активными веществами, стимулируют деление и дифференцировку различных клеток и служат основными переносчиками митогенного сигнала. Заживление раны представляет собой серию скоординированных реакций различных типов клеток поврежденной ткани, регулируемых локальными медиаторами – цитокинами, факторами роста. Благодаря их взаимодействию происходят процессы, приводящие к замещению дефекта в коже [58, 113, 138, 149].
Основную роль в регуляции как воспалительной реакции, так и регуляции репаративных процессов в коже имеют регуляторные молекулы – цитокины, секретируемые различными клетками (лимфоцитами, макрофагами, нейтрофилами, моноцитами, тучными клетками) [30, 87, 152]. Показано, что в данном процессе участвуют не только клеточные элементы соединительной ткани, но и вещества, продуцируемые различными клетками сосудистого эндотелия. Значение последних в процессах регенерации заключается в формировании грануляционной ткани, для нормального функционирования клеточных элементов которой необходим рост сосудов (ангиогенез) [64, 150].
КР и ГР, несмотря на клиническое сходство, различаются по этиологии и патогенетическим механизмам их развития [191]. Установлено, что КР и ГР представляют собой чрезмерное разрастание плотной фиброзной ткани, которая обычно развивается в процессе заживления поврежденной кожи. Основные отличия касаются строения микроциркуляторного русла, типа коллагена, формирующего соединительную ткань, клеточного состава и структуры матрикса (межклеточного вещества) [123, 165, 196]. КР выходит за зону повреждения и возвышается над уровнем кожи, редко проникает в подкожную клетчатку, постоянно растет и «врастает» в нормальные окружающие ткани, обычно не регрессирует спонтанно, часто рецидивирует после иссечения [78, 103, 167]. Доказано, что келоидное рубцевание зависит от возраста: в основном встречается в возрасте от 10-30 лет и реже – в другие периоды жизни; чаще у лиц африканского происхождения, чем у кавказского. Однако до настоящего времени спорными остаются определяющие причины развития келоидов [121, 176].
Интерес представляет факт, что келоидное рубцевание встречается только у человека. Во время проводимых исследований на фетальных моделях в механизме заживления раны у кроликов, овец и крыс, наилучшей моделью для человека является «красная duroc свинья» [148, 149]. Показано, что рубцевание не происходит при фетальном повреждении. Изучение механизмов регенерации ткани, экспрессии и регуляции факторов роста при фетальном рубцевании указывает на новые возможности контроля заживления раны. Фетальные повреждения имеют малую тенденцию к рубцеобразованию и в них не образуется грануляционная ткань [129, 178, 194]. Интересно, что поврежденные фетальные ткани не содержат больших количеств TGF-β1, тогда как раны взрослых содержат данную изоформу. Считается, что факторы роста семейства TGF ответственны за образование гипертрофического рубцеобразования, особенно изоформы β1 и β2 [92, 96, 197]. Установлено, что изоформа TGF-β3 может оказывать ингибирующее действие на образование рубца, являясь природным антагонистом TGF-β1 и TGF-β2 изоформ [154, 158, 159, 197]. Установлено, что заживление раны в слизистой полости рта имеет безрубцовый фенотип, механизм которого изучается в многочисленных исследованиях [185]. Считают, что установление отличий между заживлением слизистой полости рта и патологическим рубцеванием кожи может привести к пониманию механизмов регенерации кожи [144, 157].
В отличие от КР, ГР остается ограниченным травмированной областью, и не выходят за пределы первичной раны, спонтанно регрессирует на протяжении 12-18 месяцев, хотя регресс может быть не полным. В настоящее время уже достаточно хорошо установлены основные причины спонтанной регрессии рубцов [103]. Доказано что, одной из причин регрессии патологического ГР является уменьшение количества «раневых» фибробластов (миофибробластов), которые находились в процессе репарации в поврежденной ткани. Установлено, что именно эта популяция клеток играет основную роль в репаративных процесах, ответственна за отложение в зоне повреждения избыточного внеклеточного матрикса [169, 140, 182, 190].
Определенную роль в регрессии ГР в процессе деструкции избыточного матрикса (прежде всего – коллагена) играют группы ферментов – тканевые металлопротеиназы или матриксины, которые выделяются различными видами клеток (лейкоцитами, фібробластами, кератиноцитами и другими), и обечпечивают «оборот» внеклеточного матрикса. [173, 189, 183].
ГР и КР, по мнению некоторых авторов, могут рассматриваться как варианты типичного заживление раны. Считают, чтоIn a typical wound, anabolic and catabolic processes achieve equilibrium approximately 6-8 weeks after the original injury. в обычной ране, анаболические и катаболические процессы уравновешиваются примерно через 6-8 недель после первичной травмы. В этой стадии плотность рубца составляет примерно 30-40 %, по сравнению с плотностью здоровой кожи.As the scar matures, the tensile strength of the scar improves as a result of progressive cross-linking of collagen fibers. По мере созревания рубца, сила натяжения оптимизируется в результате прогрессирующего поперечного расположения коллагеновых волокон.At this point, the scar is usually hyperemic and it may be thickened, but it tends to subside gradually over months until a flat, white, pliable, possibly stretched, mature scar has developed. В этот период рубец обычно гиперемирован и может быть утолщен, но имеет тенденцию к постепенному уменьшению в течение нескольких месяцев до формирования плоского, белого, мягкого, возможно, растянутого созревшего рубца. When an imbalance occurs between the anabolic and catabolic phases of the healing process, more collagen is produced than is degraded, and the scar grows in all directions.Если происходит расбаллансировка между анаболической и катаболической фазами раневого процесса, коллагена синтезируется больше, чем распадается, и рубец растет во всех направлениях [112, 118, 122, 216]. Клинически это проявляется тем, что рThe scar is elevated above the skin and remains hyperemiрубец возвышается над поверхностью кожи и остается по-прежнему гиперемированым. Excessive fibrous tissue is classified as either a keloid or a hypertrophic scar.Избыток фиброзной ткани классифицируют либо как КР, либо как ГР [138, 209].
Доказано, что при патологическом рубцовом процессе отмечается высокая пролиферативная активность фибробластов, и длительное существование их активных форм. При обычном заживлении раны элементы соединительной ткани регрессируют после 3-й недели, в то время как в келоидном рубце фибробласты пролиферируют вокруг вновь образованных мелких сосудов, продолжая создавать плотные массы коллагена. Этот процесс может продолжаться от нескольких месяцев до нескольких лет [131]. Установлено, что фибробласты КР в 4 раза активнее синтезируют фибронектин, способствующий развитию грануляционной ткани и реэпителизации [214]. При заживлении ран фибронектин играет роль первичного каркаса, создающего определенную ориентацию фибробластов и коллагеновых волокон в зоне репарации [86]. Клеточный фибронектин секретируется макрофагами и фибробластами в процессе формирования грануляционной ткани [126].
Фибронектины – это связывающие гликопротеины, располагащиеся главным образом на базальной мембране, они играют роль в адгезии клеток, их миграции и дифференциации. Доказано, что в культуре фибробластов келоида человека экспрессия фибронектина регулируется TGF-b, IGF-I [197]. Большим количеством исследований показано, что уровень экспрессии фибронектина келоидных тканей и мРНК увеличивался почти в 4 раза в культуре келоидных фибробластов, по сравнению с нормальными фибробластами. Фибронектин сильно выражен как в гипертрофических, так и в келоидных тканях, по сравнению с нормальной дермой и локализован в фиброзных поражениях, ассоциированных с патологическими рубцовыми механизмами [203]. Установлено, что экспрессия фибронектина и уровни мРНК фибронектина в гипертрофических и келоидных фибробласта выше в культуре гипертрофических и келоидных фибробластов, по сравнению с нормальной тканью у того же самого пациента. Было также показано, что фибронектин уменьшается в созревших рубцах 5-20-летней давности, демонстрируя, что с течением времени кожа возвращается как можно ближе к своему нормальному состоянию (как до травмы). В то же время по данным других исследований не обнаружена разница в экспрессии фибронектина между КР и нормальной кожей или между клеточными культурами келоидных и нормальных фибробластов [138].
Известно, что в раневом матриксе находятся три компонента, участвующих в заживлении ран – тенасцин, тромбосподин и SPARC [212]. Тромбосподин продуцируется тромбоцитами, a SPARC – фибробластами и макрофагами. Транскрипция и трансляция коллагена 1 и 3 типов, фактор некроза, ламинина, переостина, тенасцина повышены в ГР и еще больше повышены в КР по сравнению с незрелыми рубцами и нормальной кожей [212, 137]. Однако, экспрессия гиалуроновой кислоты, дерматопонтина, декорина снижены в приподнятых кожных рубцах, а экспрессия и локализация коллагеновых фибрилл и эластиновых волокон в дерме изменена по сравнению с нормальной кожей и незрелыми рубцами [124, 142, 143, 186, 200].
Некоторые авторы объясняют образование ГР снижением количества декорина – протеогликана небольшого веса, присутствующего в 25 % концентрации от его содержания в нормальной коже. Точная роль декорина неизвестна, однако считают, что он является эндогенным антагонистом TGF-β в интрацеллюлярном матриксе [218, 215]. Тучные клетки, присутствующие в чрезмерном количестве в ГР, могут также вносить вклад в гипертрофическое рубцевание, способствуя чрезмерному образование вследствие секреции гистамина. В фибробластах ГР происходит снижение нормальной mРНК экспрессии коллагеназ, приводящей к уменьшению способности деградации коллагена и ремоделированию рубцовой ткани [107, 126, 212].
Гиалуроновая кислота регулирует TGF-b – компонент, в присутствии которого происходят самые ранние стадии ранозаживления [187, 220, 222]. Было доказано, что травма во время внутриутробного развития приводит к безрубцовому фенотипу при рождении [197]. На модели кроликов было доказано, что гиалуроновая кислота определялась в десятикратно большей концентрации в биоптатах фетальных рубцов, чем в неповрежденной фетальной коже того же самого животного. При иммуногистохимическом исследовании было продемонстрировано, что особая окраска гиалуроновой кислоты в КР различна, по сравнению с нормальными рубцами и нормальной тканью [139, 195]. Внутри келоидного повреждения окрашивание гиалуроновой кислотой – четко патологическое и осуществляется в ретикулярной последовательности между ненормально утолщенными волокнами коллагена [160]. Наибольшее содержание гиалуроновой кислоты в коже наблюдается у новорожденных, с возрастом этот показатель прогрессивно снижается. В тканевой культуре с большим содержанием гиалуроната почти не наблюдается образования коллагена, который формирует поствоспалительные рубцы [69, 91]. Фактор некроза опухолей – стимулированный ген 6 (TSG-6) и интер-a-ингибитор (IaI), которые связываются перекрестным образом с гиалуроновой кислотой IаI-тяжелыми цепями (HC), формируя ковалентные комплекс ГК-HC [125, 210, 143].
Имеется генетическая детерминированность патологического заживления и формирования ГР и КР [132, 151, 192].
Важную роль в патогенезе ГР и КР отводится иммунным механизмам [158]. В последние годы с помощью высокочувствительного твердофазного иммуноферментного анализа обнаружены естественные аутоантитела к медиаторам воспаления и различным типам коллагена, что может свидетельствовать об участии аутоиммунных процессов в разрастании рубцовой ткани и образовании патологических рубцов [1, 58, 63]. При иммуносупрессивном состоянии нарушаются регенераторные процессы, развиваются воспалительные реакции, раны заживают с частыми осложнениями [23]. Показана возможность ГР с активацией локальных клеточно-опосредованных реакций и повышение экспрессии HLA-DR – молекул на фибробластах и кератиноцитах, при этом рубцовая ткань инфильтрируется клетками с рецепторами к ИЛ-2, накапливаются CD1+ клетки Лангерганса [59, 79, 95].
Обсуждается участие факторов роста в стимуляции ангиогенеза, первичная роль сосудов в развитии грануляционной ткани, необходимым условием которой является формирование сети капилляров из эндотелиальных клеток [89, 90, 98]. Ламинины – семейство гликопротеинов, которые действуют как молекулы клеточной адгезии на базальной мембране, играют роль в ангиогенезе и пролиферации, миграции и дифференциации клеток в процессе ранозаживления, однако немного известно относительно их вовлечения в механизмы патологического рубцевания [206].
Установлено, что динамика репарации включает пролиферативную фазу заживления, которая сменяется разряжением сосудистой сети с последующим возрастанием синтеза соединительно-тканного матрикса [141, 205]. Адекватность разрастания соединительной ткани регулируется интерлейкином-ip (ИЛ-ip), контролирующим активность коллагеназы, ответственной за деградацию данного белках [12, 13, 93]. Межклеточные взаимодействия в этот период репарации обеспечиваются факторами роста, пара- и аутокринного механизмов действия, а также различными растворимыми медиаторами, среди которых выделяют эндотелий и оксид азота (NO) [55, 59, 60, 88, 97].
В патогенезе КР ведущую роль отводят нарушениям микроциркуляторного сосудистого русла кожи. Капилляры в рубцовой ткани обнаруживают в небольшом количестве [104, 139]. По данным некоторых авторов, при формировании келоидной ткани происходит не только количественное снижение числа капилляров, а функциональная их неполноценность. Это и является причиной гипоксии, активации функции эндотелиальной ткани и формирования фибробластов, которые не достигают состояния зрелых фибробластов [32, 107, 163]. Келоид характеризуется повышенным содержанием гиалуроновой кислоты и коллагена 3 типа [127]. В ткани ГР васкуляризация повышена, что обуславливает биосинтезирующую активность зрелых форм фибробластов и избыточный рост коллагена 1 типа [133].
До последнего времени состоянию эпидермиса в ПР не придавали большого значения [156]. Тем не менее, даже традиционными методами светооптической микроскопии обнаруживали морфологические признаки неполноценности эпидермиса (акантоз, гиперкератоз, неполноценность рогового слоя). Исследования последних лет, проводимые с использование ядерных и цитоплазматических маркеров пролиферации и дифференцировки (PCNA; Ki67; Histone mRNas; семейство цитокератинов; SPR; трансглютаминазы; инволюкрина; корнифина, филаггрина, лорикрина и др.), показали наличие выраженных нарушений дифференцировки эпидермоцитов в патологических рубцах кожи [207]. Исследования ряда ученых указали, что пролиферация кератиноцитов в КР и ГР очевидна [199, 208]. The expressions of Tenascin-C mRNA in keloids epidermal keratinocytes markedly increased in contrast with epidermal keratinocytes of hypertrophic scars and adult skin.Экспрессия тенасцин-C мРНК в КР кератиноцитов заметно больше, по сравнению с кератиноцитами ГР. The CK-16 and Ki-67 stainings significantly enhanced in the epidermal keratinocytes of keloids and hypertrophicВ КР увеличение экспрессии тенасцина-С наблюдалось в месте фибриллов коллагена в ретикулярной дерме, тогда как в нормальной коже экспрессия тенасцина-С происходила под базальной мембраной и дермально-эпидермальным соединением. Было показано, что уровни экспресии мРНК тенасцина были выше в КР, чем в зрелых нормальных рубцах [164, 167, 171, 217].
Б. Берман и В. Валинс (2010) в своей статье «Келоиды и гипертрофические рубцы» определили «узелок» коллагена как «структурно-функциональную единицу» ГР и КР. «Узелок», который отсутствовал в созревших рубцах, содержал высокую плотность фибробластов и однонаправленных коллагеновых фибрилл в высоко организованной и четко определенной ориентации. Кроме того, КР и ГР отличались от здоровой кожи богатым кровоснабжением, высокой плотностью мезенхимальных клеток и утолщением эпидермального слоя клеток. Попытки дифференцировать КР и ГР оказались трудным на ранних этапах созревания [85, 128]. Клинические отличия становятся более очевидными по мере созревания рубцов. Наиболее яркие гистологические различия – это присутствие широких, розовых пучков коллагена в КР, которых нет в ГР [27, 110, 116].
Таким образом, несмотря на многочисленные исследования, многие вопросы пато- и морфогенеза гипертрофических и келоидных рубцов остаются спорными, клинически ранняя их дифференциация не определена, что и объясняет сложность терапевтических подходов [77, 81, 102].
1.2 Современные подходы к лечению гипертрофических и келоидных рубцов
Лечение ГР и особенно КР до сих пор является нерешенной проблемой в современной медицине из-за высокого уровня рецидивирования последних и плохого понимания патогенеза патологического рубцевания в целом [2, 161, 94]. При анализе имеющейся литературы по проблеме лечения КР и ГР зачастую возникают сложности в сравнении результатов исследований вследствие недостаточной определенности критериев оценки эффективности терапии [21, 42, 99].
Лечение ГР и КР сопровождается рядом трудностей, о чём свидетельствуют применяемые с этой целью многочисленные методы, способы и средства [40, 41, 53].
Применяют различные способы деструкции представленной патологии, включающие криодеструкцию, лазерную деструкцию, рентгенотерапию лучами обычной жёсткости и Букки, а также электро-, фонофорез, мезотерапию с использованием ферментов и кортикостероидов, терапевтическую и оперативную дермабразию, применение силиконовых гелевых пластин и хирургическое иссечение [11, 37, 49, 114, 184].
С целью деструкции избыточной рубцовой ткани достаточно успешно используется криотерапия [22, 26, 44]. Эффект в данном случае обусловлен прямым повреждением клеток и изменением (некроз) микроциркуляторного русла под воздействием экстремально низких температур. Показано, что юные келоиды лучше поддаются лечению криовоздействием, чем более старые (особенно старше 12 месяцев) [19, 38, 106]. При использовании криотерапии неизбежна некоторая степень атрофии и гипопигментации, что связано с чувствительностью меланоцитов к низкой температуре [25, 46]. Однако, некробиотические изменения в большинстве случав распространяются не на всю толщу келоидного рубца, что очевидно, и обусловливает их дальнейшее рецидивирование [29, 50, 76].
До настоящего времени распространенным способом лечения остается внутрирубцовое введение стероидов [47, 71]. Кортикостероиды уменьшают рубцеобразование посредством уменьшения синтеза коллагена, глюкозаминогликанов, медиаторов воспаления и пролиферации фибробластов в процессе заживления раны [102, 172]. Наиболее часто используемый кортикостероид – триамцинолона ацетат в концентрации 10–40 мг/мл, назначаемый в зону повреждения посредством введения иглы с интервалом 4–6 недель. Эффективность такого лечения, как мономодели и как добавление к процедуре эксцизии рубца, очень высока [181]. Другим кортикостероидом, используемым для лечения келоидных рубцов, является бетаметазон. Особенно часто назначается введение кортикостероидных препаратов в рубцовую ткань при быстром росте рубца и явлениях выраженного воспаления, боли, зуде. При таком методе удается достичь снижения воспаления в молодых рубцах, однако риск осложнений довольно высок [117, 170].
Широко применяются топические кортикостероидные средства, которые наносятся ежедневно непосредственно на образование [56]. Осложнения при лечении кортикостероидами включают атрофию, телеангиоэктазии и нарушения пигментации [65, 74, 170, 209].
Сравнительно новым методом терапии является местное применение силиконовых пластин или силиконового геля. Механизм действия доподлинно не известен, однако, предполагают, что гидратация кожи под силиконом определяет воздействие кератиноцитов на фибробласты, и отмечается снижение выработки коллагена, различных факторов роста [118]. Ношение в течение нескольких месяцев силиконовых пластин обычно оказывает заметный терапевтический эффект. Основное требование к применению силиконовых пластин – это чистота поверхности пластины и области кожи, на которую ее накладывают. Оптимальный срок действия пластины – 24 часа в сутки, а минимальный срок аппликации составляет 12 часов в сутки. Продолжительность лечения не менее 3 месяцев [17, 201, 221].
Cиликоновые гели – неинвазивный метод профилактики и лечения ГР и КР, основу которого составляет инертный силикон, который действует поверхностно и не оказывает общего влияния на организм [121]. Тонкая пленка силиконового геля защищает область рубца от механических повреждений, увлажняет и повышает эластичность рубцовой ткани, создает особые условия, препятствующие ее дальнейшему разрастанию. Гель легко наносится на любые участки тела, используется 2 раза в день и не требует наложения давящих повязок [110]. Установлено, что при использовании геля для ремоделирования и профилактики образования рубцов в течение первого месяца замедляется прогрессирование рубца, прекращаются зуд и парестезии, заживают экскориации и изъязвления. В дальнейшем достоверно уменьшается толщина рубца, он бледнеет, исчезают признаки воспаления. Единственным из параметров рубца, коррекция которого не происходит – пигментация. Гель является эффективным средством для лечения и профилактики ограниченных рубцов [61, 101].
Для профилактики и лечения ПР рекомендуют применение геля, содержащего экстракт луковиц лука репчатого, гепарин и аллантоин. Доказано, что такой состав оказывает фибринолитическое, противовоспалительное, кератолитическое действие, стимулирует клеточную регенерацию без гиперплазии, ингибирует пролиферацию келоидных фибробластов [36]. Гель может быть использован при лечении как свежих, так и застарелых рубцов. Продолжительность лечения составляет от 3-х до 6-ти месяцев, а в некоторых случаях до одного года. Гель наносят 2-3 раза в сутки, легко втирая в рубцовую ткань. М.Ю. Герасименко и соавт. (2008) получили положительный результат при лечении рубцов с совместным использованием ультрафонофореза геля «Контрактубекс» и диметилсульфоксида [14, 135].
Лучевая терапия ПР, несмотря на ряд побочных эффектов, считается одной из наиболее эффективных, особенно в отношении упорно не поддающихся лечению келоидных рубцов, в комплексе с их хирургическим иссечением [34]. Рентгенотерапия (лучи Букки) основана на действии ионизирующего излучения на соединительную ткань, вызывающем отечность и разрушение коллагеновых волокон, фибробластов. Доза облучения зависит от величины рубца. Наиболее действенной дозой считается 800 Р 4 раза в течение 4-8 недель, при этом эффективность составляет 80 %. К нежелательным последствиям метода следует отнести эритему, зуд, гиперпигментации и атрофию кожи. Действию ионизирующего облучения подвергаются только поверхностные слои кожи (в частности, рубца), а на подлежащие ткани рентгеновская нагрузка незначительна. Противопоказанием к назначению Букки-терапии являются болезни почек, декомпенсация кровообращения, наличие дерматитов и остаточных ран. Идея применения рентгенотерапии очень рациональна, потому что в случае деструкции некоторого количества фибробластов достигается баланс между синтезом и деградацией сложного коллагена вплоть до изменения самой его структуры. Эта идея, в частности, реализована при использовании современной лазерной техники [48, 72].
Лазерная терапия широко используется в коррекции рубцовых изменений [48, 104]. Воздействие направленной лазерной энергии приводит к поглощению ее тканями, разогревающимися до высоких температур [105, 155]. В результате ткани рубца «выпариваются», а также происходит повреждение сосудов, питающих их. При этом просвет сосуда резко сужается, а потом и вовсе облитерируется. После прекращения поступления крови, ткани рубца заметно уменьшаются в размерах и постепенно атрофируются [60, 108, 110, 180]. Лазерное воздействие не подразумевает нарушения целостности кожного покрова. Лазерное лечение обладает высокой эффективностью, малым процентом рецидивов и может использоваться у широкого круга пациентов [54, 141, 142].
Считают, что лазерная абляция ГР и КР при использовании углекислого лазера (10600 нм) показала положительный результат с минимальной травмой ткани. При использовании углекислого лазера процент рецидивирования достигал 39–92 %, а при комбинации с постоперационным введением стероидов уровень рецидивирования достигал 25-74 % [111, 173, 179]. Аргоновый лазер (488 нм) сходен с углекислым лазером, может индуцировать сокращение коллагена через генерацию чрезмерного локального нагрев, однако он вызывает 45-93 % рецидивов [146, 203]. При использовании импульсного лазера на красителях (585 нм) происходит процесс фототермолиза, приводящий к микроваскулярному тромбозу [112, 147]. Некоторые авторы отмечали, что при применении импульсного лазера на красителях, рубцы становятся менее эритематозными и плотными [150, 172, 211].
В последние годы появляются большое разнообразие лекарственных средств нового поколения [66, 114, 166, 204, 219]. Так, в зарубежной литературе есть ряд сообщений о применении в лечении КР антагонистов кальция (Верапамил). Авторы этих публикаций единодушно отмечают выраженную способность верапамила к рассасыванию патологических рубцов при инъекционном способе введения препарата, но существенным недостатком методики считают выраженную болезненность такой процедуры [130, 184].
Появились исследования относительно того, что некоторые цитостатики (вещества, блокирующие деление клеток), видимо, благодаря способности угнетать разрастание клеток, эффективны при лечении КР и ГР [153, 166]. На сегодняшний день имеются данные по использованию двух препаратов из этой группы – 5-фторурацила и блеомицина. Первый из них применяется более широко при лечении рубцов и изучен лучше. В некоторых исследованиях эффективность монотерапии келоидов 5-фторурацилом сопоставима с таковой при терапии глюкокортикостероидами. В то же время при более длительном наблюдении больных имеются сообщения о высоком уровне рецидивирования келоидов после монотерапии 5-фторурацилом в течение одного года наблюдения. Показано, что эффективность лечения зависит от возраста рубца: чем более старый рубец, тем менее эффективна терапия. Конкретный механизм действия, так же как и в других случаях, изучен плохо. Возможно, 5-фторурацил, являясь антиметаболитом, угнетает размножение фибробластов [24, 145, 166]. Блеомицин исследован хуже, но, по некоторым сообщениям, эффективность терапии рубцов блеомицином превышает 80 %. В исследовании Saray при лечении КР и ГР, не поддающихся терапии глюкокортикостероидами, полная редукция рубца наблюдалась в 73 % случаев, эффективность терапии в различной степени выраженности была получена у всех пациентов. Это довольно высокие показатели эффективности, учитывая то, насколько плохо келоидные рубцы поддаются лечению. Показана также лучшая эффективность терапии блеомицином больших келоидных рубцов (площадью более 100 мм2) по сравнению с комбинированной терапией — сочетанием глюкокортикостероидов и криотерапии [24, 174].
В последние годы появились успешные попытки применения в коррекции рубцов при применении природного комплекса изоферментов коллагеназы молекулярной массой от 23 до 36 кДа (Ферменкол). Аппликации с Ферменколом рекомендуются на ранних стадиях формирования рубца, но не ранее 3–4 недель после травмы, ожога или оперативного вмешательства [43, 68]. Использование фонофореза и ферменкола позволяет доставлять коллагенолитические ферменты в глубоко расположенные участки рубцовоизмененной кожи [63, 109].
Распространенным методом является использование лидазы (гиалуронидазы). Гиалуронидаза – это фермент, специфическим субстратом которого служит гиалуроновая кислота. Гиалуронидаза способствует частичному лизису основного вещества соединительной ткани [28]. Препарат применяется при рубцовых контрактурах, ГР и КР. Лечебный эффект проявляется размягчением рубцов, появлением подвижности в суставах, устранением или уменьшением контрактур, рассасыванием гематом. При этом лечебный эффект более выражен в начальных стадиях патологического процесса [18, 35, 63].
Из новых перспективных направлений лечения, в первую очередь КР, следует отметить исследования в области применения антицитокиновых препаратов и гамма-интерферона. Интерферон, введенный в линию шва, после иссечения КР, может профилактически предотвращать рецидивы [181]. В исследованиях на животных было показано, что интерферон уменьшает фиброз после имплантации инородного тела, а также при заживлении кожных ожоговых ран. Однако немногочисленные проведенные клинические исследования выявили очень умеренный эффект, выражающийся в смягчении ткани КР и небольшом уменьшении его толщины [21].
Считают перспективным в лечении КР и ГР использование топических ингибиторов кальциневрина – такролимуса – иммуносупрессивного препарата. Механизм его действия заключается в ингибировании фосфатазы кальциневрина, что препятствует дефосфорилированию фактора активированных Т-клеток (NF-AT) и его транслокации в ядро клетки. Такролимус обладает механизмом сходным с таковым циклоспорина [9, 162, 168]. Ингибиторы кальциневрина снижают эффективность передачи сигнала Т- лимфоцитами и транскрипцию интерлейкина- 2, ингибируя за счет этого иммунный ответ. Такролимус обладает широким спектром иммуномодулирующих эффектов при различных заболеваниях кожи [118]. В настоящее время ТИК показаны для лечения детей в возрасте старше 2 лет и взрослых с АД различной степени тяжести. Возможно длительное применение ТИК у пациентов с АД в области лица и шеи, т.к такролимус не вызывает общих или местных побочных эффектов [9, 168]. Исследователи наблюдали разрешение КР у пациентов, использовавших такролимус для лечения атопического дерматита [118, 162]. Отмечено, что индекс высоты рубца, леченных такролимусом, был наполовину меньше, чем не леченных. Кроме того, клеточная воспалительная плотность клеток были значительно меньше у рубцов, обработанных ТИК.
Одним из эффективных методов сглаживания поверхности рубцовой ткани является дермабразия – метод механического выравнивания кожи. Кожу предварительно очищают в обрабатываемой зоне, затем зону рубца и близлежащие ткани шлифуют микрокристаллами корунда. Микродермабразия не требует анестезии, но при использовании данного способа возникает необходимость многократного ее повторения. Как изолированный способ МКДА неспецифична в своем влиянии на фазы образования рубца [62, 100, 115].
Анализ представленных в литературе результатов лечения рубцов различными способами показывает, что в 30—50 % наблюдений отмечены рецидивы. Несмотря на многочисленность методов терапии на сегодняшний день не существует универсальной, хорошо отработанной и высокоэффективной методики лечения ПР. Ни один из имеющихся методов терапии не может гарантированно предотвратить рецидивы [33, 39, 45, 82, 83, 188].
До сих пор недостаточно исследований в области модернизации лечения, нахождения средств устранения избыточной ткани рубца, перевода рубца из активной фазы в неактивную без побочных эффектов, в связи с чем и было выполнено настоящее исследование, т.к. по мнению большинства специалистов, только комплексное лечение способствует достижению желаемого результата [3, 17, 27, 51, 184].
Таким образом, проведенный анализ литературы и многочисленных исследований показал, что до настоящего времени спорными и не до конца изученными остаются многие вопросы пато- и морфогенеза патологических рубцов, не достаточно изучены клинико-эпидемиологические и гендерные особенности их развития в различных топографических регионах. Не исследованы биофизические свойства патологических рубцов в зависимости от их вида и давности существования, что существенно затрудняет выбор оптимальных методов лечения. Изложенное послужило планированию и проведению данного исследования.
РАЗДЕЛ 2
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1 Клиническая характеристика больных
Под нашим наблюдением находилось 127 больных с ПР, в т.ч. мужчин – 60 (47,2 %), женщин – 67 ( 52,8 %) в возрасте от 15 до 60 лет с давностью существования рубцов от 1 месяца до 4 лет, при этом КР были у 76 (59,8 %) больных, гипертрофические – у 51 (40,2 %). Посттравматические рубцы были у 74 (58,3 %) больных, послеоперационные у 53 (41,7 %) больных.
Критерием включения больных в работу являлось наличие гипертрофических и келоидных рубцов различной локализации, давности и генеза; согласие пациентов и / или их родителей на участие в исследовании и готовность выполнять назначения врача, подписание информированного согласия.
Критерии исключения: тяжелое соматическое состояние пациента, требующее системной медикаментозной терапии; неготовность пациента и/ или родителей выполнять рекомендации врача.
2.2 Общеклинические методы
Все пациенты подвергались комплексному общеклиническому обследованию с определением общего развернутого анализа крови, мочи, билирубина и его фракций, аланинаминотрансферазы, аспартатаминотрансферазы, общего белка и его фракций, глюкозы крови, креатинина, по общепринятым методам [5, 83]. По показаниям проводились ультразвуковое исследование органов брюшной полости и малого таза, щитовидной железы. Обследование проводили в соответствии с приказом МЗ Украины №286 от 07.06.2004 г. «Об усовершенствовании дерматовенерологической помощи населению Украины» [70].
Выделяли следующие виды рубцов: нормотрофические, атрофические, гипертрофические и келоидные [75]. В исследование включали пациентов с ГР и КР.
Рубцы расценивали как патологические гипертрофические, если они оставались ограниченными травмированной областью и спонтанно регрессировали на протяжении 12-18 месяцев, даже при неполном регрессе.
Келоидными расценивали патологические рубцы, если они выходили за зону повреждения и возвышались над уровнем кожи. КР обычно не регрессировали спонтанно, часто рецидивировали после иссечения [78].
Патологические рубцы оценивали по двум направлениям: по выраженности симптомов (эритема, плотность субъективные ощущения) и по давности существования.
Выраженность симптомов оценивали в баллах. Так, интенсивность цвета оценивали в баллах по четырехбалльной системе, где 0 баллов – цвет нормальной кожи; 1 балл – слабо розовый; 2 балла – розово-красный; 3 балла – интенсивно красный. Выраженность плотности также оценивали в баллах по четырехбалльной системе, где 0 баллов – отсутствие плотности; 1 балл – легкая степень плотности; 2 балла – умеренная выраженность плотности; 3 балла – резко выраженная плотность рубца. Интенсивность зуда оценивали по четырехбалльной системе, где 0 баллов – отсутствие зуда; 1 балл – легкая степень зуда; 2 балла – умеренная выраженность зуда; 3 балла – резко выраженный зуд в области рубца.
Клинические свойства ПР изучали в зависимости от их вида (гипертрофические, келоидные), давности (в том числе до 6 месяцев, от 6 месяцев до 1 года, от 1 года до 3 лет, более 3 лет).
Проведен сравнительный гендерный анализ патологических рубцов в зависимости от их вида и локализации.
2.3 Морфологический и иммуногистохимический методы
Для гистологического исследования полученный материал помещали в нейтральный забуференный 10 % раствор формалина (pH 7,4) на 0,1 % фосфатном буфере (рН=7,4) и фиксировали в течение 24 часов. После дегидратации кусочки заливали в парафин по стандартной методике.
На ротационном микротоме Shandon Finesse 325 (Thermo Scientific, США) изготавливали серийные гистологические срезы толщиной (5±1) мкм, которые затем окрашивали гематоксилином и эозином, по Ван Гизону по стандартной методике.
Для выявления эластических волокон использовали методику окрашивания по Вергоффу, для исследования колагеновых и мышечных волокон – трихромную методику по Массону [64]. Особенности васкуляризации и степень экспрессии факторов роста исследовали с помощью иммуногистохимической (ИГХ) методики. Для ИГХ-исследования срезы помещали на покрытые адгезивом стекла Super Frost Plus (Menzel, Германия). Для «демаскирования» антигенов регидратированные срезы подвергали термической обработке в растворе Target Retrieval Solution (DAKO, Дания) с использованием микроволновой печи Samsung CE118KFR. После блокирования неспецифического связывания белков протеиновым блоком (DAKO, Дания) и эндогенной пероксидазной активности пероксидазным блоком (DAKO, Дания) наносили первичные антитела. Использовали мышиные моноклональные антитела (МАТ) к CD34 (клон QBEnd-10, DAKO), МАТ к VEGF (клон VG1, Diagnostic BioSystem (DBS), США), МАТ к EGFR (клон 111.6, DBS). Визуализацию первичных антител проводили с помощью высокочувствительной полимерной системы детекции EnVision FLEX+ (DAKO). В качестве субстрата для пероксидазы хрена использовали DAB+ (DAKO). Препараты докрашивали гематоксилином Майера. Далее окрашенные срезы заключали в полусинтетическую среду Eukit (Kaltek, Италия).
Гистологические препараты изучали в светооптическом микроскопе Olympus ВХ-40, микрофотографии готовили с помощью цифровой фотокамеры Olympus U-TV1X с программным обеспечением Olympus DP-Soft.
Морфометрические показатели гипертрофических и келоидных рубцов измеряли с попомощью точечных и линейных тестовых систем [1] на микрофотографиях в 10 полях зрения оптического микроскопа, конечное увеличение ´ 200, отобранных случайным методом на 5 гистологических срезах у каждого обследованного пациента. Полученные значения морфометрических показателей лейкоцитарних инфильтратов (ЛИ), кровеносных сосудов микроциркуляторного русла (МЦР), основного аморфного вещества (ОАВ), коллагеновых волокон (КВ) и стромальных (соединительнотканных) клеток (СК) обрабатывали статистически с помощью стандартного пакета прикладных лицензионных програм.
В каждом случае ИГХ-исследования с маркерами к CD34, VEGF изучали в 30 полях зрения при увеличении 200. Подсчет удельного веса зрелых сосудов (CD34+) и вновь образованных (VEGF+) производили по позитивно окрашенным эндотелиальным клеткам (коричневое окрашивание) в каждом случае, как процентное соотношение общей площади сосудистого русла (мкм) к общей площади исследуемого поля зрения (мкм). Интенсивность окрашивания EGFR определяли как IHscore и рассчитывали по формуле: IHscore = Si х Sp, где Si – интенсивность окрашивания (0 – негативная, 1 – слабая, 2 – умеренная, 3 – высокая), Sp – % положительных клеток (1 – < 20 % позитивных клеток, 2 – 21-40 % позитивных клеток, 3 – 41-60 % позитивных клеток, 4 – 61-80 % позитивных клеток, 5 – 81-100 % позитивных клеток) [1].
2.4 Биофизические методы
Биофизические свойства ПР (интенсивность окраски и пигментации, вискоэластичность, трансэпидермальная потеря влаги, характер и особенности сосудистого компонента) оценивали в динамике с использованием 5 различных датчиков с помощью аппарата Multi Skin Test Center® MC 900, (Courage+Khazaka electronic, Германия) [193].
Степень выраженности эритемы рубцов обусловлена расширением капилляров и отражала стадию развития рубца (активный рост, регресс, исход).
Пигментация ПР обусловлена наличием в коже пигментов (меланина, гемоглобина, билирубина) [77], не является обязательным компонентом ПР, но может в последующем приводить к развитию дисхромии и эстетическим проблемам кожи.
Интенсивность эритемы и пигментации рубцов оценивали датчиком Mexameter, который располагали перпендикулярно поверхности кожи с использованием светозащитного колпачка. Измерение основано на принципе поглощения света основными хроматофорами кожи. Чем больше хроматофора содержится в коже, тем большее количество света будет поглощено и, соответственно, тем меньше света отразится от поверхности кожи и вернется обратно в измерительную систему датчика. Источник и приемник излучения расположены таким образом, чтобы измерять только диффузный рассеянный свет. Количество поглощенного кожей света пропорционально количеству гемоглобина и меланина [193]. Полученные данные интерпретировали в соответствии со степенью выраженности признака, оценивали от 0 – 100 условных единиц (ус. ед.), где 0 – 10 ус. ед. – признак отсутствует/слабо выражен, 10 – 50 ус. ед. – незначительно выражен, 50 – 100 ус. ед. – интенсивный признак.
Степень выраженности сосудистого компонента патологических рубцов отражала интенсивность и особенности сосудов МЦР. Его оценивали с помощью камеры Visioscope PC 35 и выражали в баллах, где 0 баллов – признак отсутствовал (сосуды и телеангиэктазии не наблюдали); 1 балл – наблюдали единичные сосуды (до 10 сосудов в поле зрения); 2 балла – умеренное количество сосудов (10-20 сосудов в поле зрения) и 3 балла – значительное количество сосудов (более 21 сосуда) [193].
Под вискоэластичностью понимали способность кожи к деформации (свойства упругости) при нагрузках различной интенсивности [31]. Вискоэластичность измеряли с помощью датчика Cutometer, который располагали в непосредственном контакте перпендикулярно поверхности кожи. Измерение основано на методе втягивания: кожа под воздействием отрицательного давления (400 mbar) втягивается в отверстие датчика в течение 3 секунд, и в течение следующих 3 секунд происходит возврат кожи в исходное положение. Степень расслабления (b), измеренная после определенного периода, сравнивалась с максимальным проникновением кожи в отверстие датчика (а), и определялась как вискоэластичность (Е). (а-b)/ а х 100 = Е [193]. Показатели вискоэластичности выражали в процентах и сопоставляли с показателями кожи по периферии рубца.
Трансэпидермальная потеря влаги (ТЭПВ) является непрерывным процессом диффузии и испарения влаги через слои эпидермиса, ее определяли с помощью датчика Tewameter и выражали в условных единицах. При установке датчика на кожу в его полости устанавливается градиент плотности водяных паров, испаряющихся с поверхности. Этот градиент измеряли с помощью двух пар сенсоров, расположенных в полости датчика, (одна пара измеряет температуру, другая — относительную влажность). Данные анализировали с помощью микропроцессора и рассчитывали скорость испарения воды с кожи. Интерпретация признака: ТЭПВ отсутствовала – от 0 до 10 усл. ед.; ТЭПВ незначительная – от 10 до 13 ус.ед.; ТЭПВ умеренная – от 13 до 17 ус.ед.; ТЭПВ повышенная – от 17 до 20 ус.ед. [195].
Уровень pH, которая отражает меру активности ионов водорода в растворе, количественно выражающий кислотность гидро-липидной мантии, вычисляли как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в молях на литр: pH=-lg(H+). Измерение уровня рН проводили с помощью датчика Skin-pH-Meter, представляющего собой стеклянную трубку, внутри которой расположен стеклянный электрод (Hg/Hg2Cl2 или Ag/AgCl) с плоской измерительной поверхностью. Интерпретация признака: кислая рН от 0 до 4,4; нейтральная рН от 4,4 до 5,8; щелочная рН от 5,8 до 14 [193].
2.5 Статистические методы
В диссертационной работе использованы методы вариационной статистики: проведен анализ частотных характеристик, параметров с расчетом и оценкой статистической значимости показателей; расчет средних значений показателей, оценки их вариабельности – средняя арифметическая (X), стандартное отклонение, ошибка средней (m). Сравнительный анализ с оценкой статистической значимости различий между группами при сравнении частотных характеристик проводили с использованием критерия Хи – квадрат (χ2). При сравнении количественных показателей проводилась оценка нормальности распределения по критерию Шапиро-Уилка, что являлось основанием для применения методов непараметрического анализа: критерий Вилкоксона, Манна-Уитни. Сравнительная прогностическая оценка методов лечения проводилась путем расчета отношения шансов (OR) с оценкой доверительного интервала и проверкой статистической значимости на уровне не ниже 95 %.
Все статистические показатели оценивались при заданном предельном уровне погрешности первого рода (α) не выше 5 % – p<0,05, и уровня погрешности второго рода (β) не выше 20 %.
Электронная база первичных данных создана с помощью программы электронных таблиц Microsoft Excel 2007. Анализ данных проводился с использованием лицензионного пакета статистического анализа Stata 12.
РАЗДЕЛ 3
КЛИНИЧЕСКИЕ И ГЕНДЕРНЫЕ ОСОБЕННОСТИ ПАТОЛОГИЧЕСКИХ РУБЦОВ
Проведен анализ данных клинических наблюдений 127 больных с ПР, в т.ч. мужчин 60 (47,2 %), женщин 67 (52,8 %) в возрасте от 15 до 60 лет, которые находились на лечении в областном клиническом кожно-венерологическом диспансере г. Донецка и «Врачебно-косметологической лечебнице» г. Донецка в период с 2010 по 2014 гг.
Среди всех ПР в наших наблюдениях преобладали больные с ГР по сравнению с келоидами – 76 (59,8 %) и 51 (40,2 %) больных соответственно.
Выявлено, что КР чаще встречались у женщин – 38 (74,5 %), а гипертрофические – у мужчин 47 (61,8 %) (р=0,0001) (рис. 3.1).
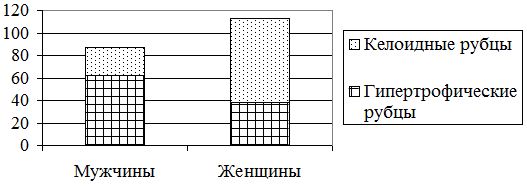
Рисунок 3.1 – Распределение больных по виду и полу патологических рубцов
При гендерно-возрастном анализе обращало внимание преобладание среди пациентов с ПР женщин – 67 (52,8 %) больных, мужчин было 60 (47,2 %). ГР и КР у женщин чаще встречались в возрасте до 30 лет – 19 (65,5 %) и 27 (71 %) больных соответственно (табл. 3.1). У мужчин ГР чаще были в возрастной группе 31 – 40 лет – 18 (38,3 %), а келоидные у пациентов 21 – 30 лет – 6 (46,2 %) больных соответственно (табл. 3.2).
Таблица 3.1 – Распределение патологических рубцов у женщин в зависимости от возраста и вида рубца
| Показатели | Возраст | |||||||||
| До 20 | 21-30 | 31-40 | Старше 40 | Всего,
n= 67 |
||||||
| Абс. | % | Абс. | % | Абс. | % | Абс. | % | Абс. | % | |
| Гипертрофические рубцы | 10 | 34,5 | 9 | 31 | 7 | 24,1 | 3 | 10,3 | 29 | 43,3 |
| Келоидные рубцы | 16 | 42,1 | 11 | 28,9 | 7 | 18,4 | 4 | 10,5 | 38 | 56,7 |
| р * | χ2=0,56; р=0,917 | – | – | |||||||
Примечание. р – оценка по критерию Хи-квадрат (χ2). Распределение по возрасту женщин с ГР и КР статистически значимо не различается (p>0,05).
Таблица 3.2
Распределение патологических рубцов у мужчин в зависимости от возраста и вида рубца
| Показатели | Возраст | |||||||||
| До 20 | 21-30 | 31-40 | Старше 40 | Всего, n= 67 | ||||||
| Абс. | % | Абс. | % | Абс. | % | Абс. | % | Абс. | % | |
| Гипертрофические рубцы | 7 | 14,9 | 13 | 27,7 | 18 | 38,3 | 9 | 19,1 | 47 | 78,3 |
| Келоидные рубцы | 3 | 23 | 6 | 46,2 | 2 | 15,4 | 2 | 15,4 | 13 | 21,7 |
| р * | χ2=3,2; р=0,360 | – | – | |||||||
Примечание. р – оценка по критерию Хи-квадрат (χ2). Распределение по возрасту мужчин с гипертрофическими и келоидными рубцами статистически значимо не различается (p>0,05).
При этом у мужчин чаще встречались ГР – 47 (78,3 %), чем у женщин – 29 (43,3 %). ГР у мужчин чаще были в возрастной группе 21-40 лет – 31 (66 %).
Обращало внимание, что КР преобладали у женщин до 20 лет – 16 (42,1 %) и достаточно редко были у женщин старше 40 лет – 4 (10,5 %) больных, у мужчин келоиды чаще были в возрастной группе 21-30 лет – 6 (46,2 %).
Следует отметить, что среди пациентов преобладали лица от 21 до 40 лет, т. е. самого активного, трудоспособного возраста. Это свидетельствует о высокой медико-социальной значимости изучаемой нами проблемы.
Пациенты, которые находились под нашим наблюдением, имели посттравматические или послеперационные рубцы с различной давностью рубцового процесса (рис. 3.2).
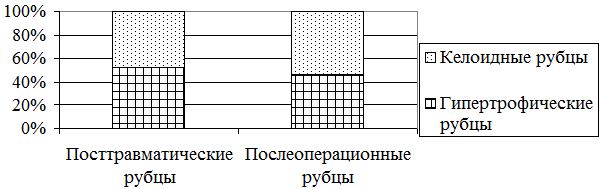
Рисунок 3.2 – Причинные факторы развития патологических рубцов
Посттравматические рубцы были у 74 (58,3 %) больных, при этом производственные травмы отмечены у 52 (70,3 %) больных, бытовые – у 22 (29,7 %) больных.
Больных с послеперационными рубцами было 53 (41,7 %), наиболее часто после удалений невусов и папиллом, после реконструктивно – восстановительных операций в связи с давними травмами.
Проведен анализ вида ПР в зависимости от этиологического фактора. В группе посттравматических рубцов преобладали гипертрофические – 46 (60,5 %). В группе послеперационных рубцов было больше келоидов – 23 (45,1 %).
Проведен сравнительный анализ вида рубцов в зависимости от локализации (табл. 3.3). Наиболее часто выявляли ПР в области лица – 48 (37,8 %), верхних конечностей – 34 (26,8 %) и ушных раковинах – 25 (19,7 %). Реже отмечали патологические рубцы в области грудины и нижних конечностей – 13 (10,2 %) и 7 (5,5 %) соответственно. ГР чаще обнаруживали на верхних конечностях – 31 (40,8 %) больных; келоиды же чаще встречались на лице – 25 (49,01 %). В области ушных раковин келоиды встречались в 2 раза чаще, чем ГР – 14 (27,5 %) и 11 (14,5 %) соответственно. В области грудины также чаще наблюдали келоиды, чем ГР – 7 (13,7 %) и 6 (7,9 %) больных соответственно. В области нижних конечностей чаще встречались ГР – 5 (6,6 %), чем келоиды – 2 (3,9 %) (табл.3.3).
Таблица 3.3 – Распределение пациентов с патологическими рубцами в зависимости от локализации
| Локализация | ГР, n = 76 | КР, n = 51 | Всего, n = 127 | |||
| Абс. | % | Абс. | % | Абс. | % | |
| Лицо | 23 | 30,3 | 25 | 49,01 | 48 | 37,8 |
| Ушные раковины | 11 | 14,5 | 14 | 27,5 | 25 | 19,7 |
| Грудина | 6 | 7,9 | 7 | 13,7 | 13 | 10,2 |
| Верхние конечности | 31 | 40,8 | 3 | 5,9 | 34 | 26,8 |
| Нижние конечности | 5 | 6,6 | 2 | 3,9 | 7 | 5,5 |
| р * | χ2=20,8; р=0,0003 | – | – | |||
Примечание. р – оценка по критерию Хи-квадрат (χ2). Выявлены статистически значимые различия (p<0,05) по распределению локализаций для гипертрофических и келоидных рубцов.
Учитывая выявленные особенности локализации различных видов рубцов, применяли особенно настороженную тактику при наличии травмы и операций в области лица и грудины с учетом высокого риска развития келоидов.
Для клинической оценки степени выраженности ПР использовали разработанную балльную оценку основных их признаков: плотность, окраска, зуд.
Отмечали преобладание ПР с интенсивностью окраски 2 балла – у 52 (41 %) больных, как среди ГР – у 31 (40,8 %) больных, так и среди келоидов – у 21 (41,2 %) больных. Интенсивно красная окраска (3 балла) была у 27 (21,3 %) больных с ПР, при этом у каждого третьего с келоидами – у 15 (29,4 %) и лишь у каждого пятого с ГР – у 12 (15,8 %). Цвет нормальной кожи наблюдали у 15 (11,8 %) больных, при этом чаще при гипертрофических рубцах – у 14 (18,4 %) больных, чем при келоидах – у 1 (1,9 %) больных (табл. 3.4). Интенсивность окраски в среднем составила (1,7±0,1) балла, при этом при ГР – (1,5±0,1) балла, при келоидах – (1,9±0,1) балла.
При оценке плотности отмечено преобладание ПР с умеренной выраженностью плотности – у 51 (40,2 %) больных, при этом ГР были у 33 (43,4 %), а КР – у 18 (35,3 %) больных. ПР с незначительной степенью плотности были у 45 (35,4 %) больных, больше ГР – у 31 (40,8 %), чем КР – у 14 (27,4 %). Отсутствие фиброза было у 6 (4,7 %) больных, и все они были ГР. Резко выраженный фиброз был у 25 (19,7 %) больных с ПР, у пациентов с келоидами в 4,5 раза чаще, чем у лиц с ГР (табл.3.4). Интенсивность фиброза в среднем составила (1,7±0,1) балла, в т.ч. при ГР – (1,5±0,1) балла, при КР – (2,1±0,1) балла.
Отмечено, что одинаково часто пациенты с ГР и КР отрицали либо отмечали легкий зуд – 38 (29,9 %) и 38 (29,9 %) больных соответственно. Пациентов с ГР, у которых отсутствовал зуд, было больше – 32 (42,1 %) больных, чем с келоидами – 6 (11,8 %) больных. С легкой степенью зуда было 27 (35,5 %) пациентов с ГР и 11 (21,6 %) пациентов с келоидами. Зуд в 2 балла отмечали у 34 (26,8 %) пациентов с ПР, преимущественно пациенты с келоидами (19 (37,3 %) больных), чем с ГР – 15 (19,7 %) больных. Обращало внимание, что резко выраженный зуд отмечали у 17 (13,4 %) больных, в основном у пациентов с КР – 15 (29,4 %) и лишь у 2 (2,6 %) больных с ГР (табл. 3.5). Интенсивность зуда в среднем составила (1,2±0,1) балла, в т.ч. при ГР – (0,8±0,1) балла, при КР – (1,8±0,13) балла.
Таблица 3.4 – Оценка клинических признаков патологических рубцов
| Симптом, баллы |
ГР, n = 76 | КР, n = 51 | Всего, n = 127 | |||
| Интенсивность окраски | Абс. | % | Абс. | % | Абс. | % |
| 0 | 14 | 18,4 | 1 | 1,9 | 15 | 11,8 |
| 1 | 19 | 25 | 14 | 27,5 | 33 | 25,9 |
| 2 | 31 | 40,8 | 21 | 41,2 | 52 | 41 |
| 3 | 12 | 15,8 | 15 | 29,4 | 27 | 21,3 |
| р * | χ2=9,7; р=0,021 | – | – | |||
| Фиброз | ||||||
| 0 | 6 | 7,9 | 0 | 0 | 6 | 4,7 |
| 1 | 31 | 40,8 | 14 | 27,4 | 45 | 35,4 |
| 2 | 33 | 43,4 | 18 | 35,3 | 51 | 40,2 |
| 3 | 6 | 7,9 | 19 | 37,3 | 25 | 19,7 |
| р * | χ2=19,4; р=0,0002 | – | – | |||
Примечание: р – оценка по критерию Хи-квадрат (χ2). Выявлены статистически значимые различия по интенсивности окраски (р=0,021) и выраженности фиброза (р=0,0002) в группах с гипертрофическими и келоидными рубцами.
Таблица 3.5 – Выраженность зуда у пациентов с патологическими рубцами
| Зуд, баллы | ГР, n = 76 | КР, n = 51 | Всего, n = 127 | |||
| 0 | 32 | 42,1 | 6 | 11,8 | 38 | 29,9 |
| 1 | 27 | 35,5 | 11 | 21,6 | 38 | 29,9 |
| 2 | 15 | 19,7 | 19 | 37,3 | 34 | 26,8 |
| 3 | 2 | 2,6 | 15 | 29,4 | 17 | 13,4 |
| р * | χ2=31,2; р=0,0001 | – | – | |||
Примечание. р – оценка по критерию Хи-квадрат (χ2). Выявлены статистически значимые различия по выраженности зуда (р=0,0001) в группах с гипертрофическими и келоидными рубцами.
Для оптимизации последующей лечебной тактики и сравнительного анализа исследуемых признаков все патологические рубцы были разделены на группы в зависимости от вида рубца (гипертрофические, келоидные) и давности их существования (до 6 месяцев, от 6 мес. до 1 года, от 1 года до 3 лет, свыше 3 лет) (рис. 3.3).
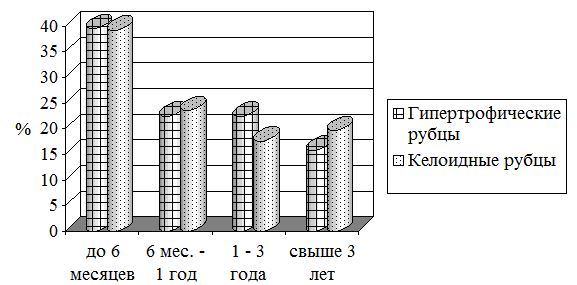
Рисунок 3.3 – Распределение патологических рубцов в зависимости от давности существования
Наиболее часто встречались «молодые» ПР с давностью до 6 месяцев – 50 (39,4 %) больных, при этом практически одинаково часто как ГР – 30 (39,5 %), так и КР – 20 (39,2 %) больных. ПР с давностью от 6 мес. до 1 года было 29 (22,8 %), при этом келоиды встречались немного чаще, чем ГР (у 12 (23,5 %) и 17 (22,4 %) больных соответственно). ПР с давностью от 1 года до 3 лет были у 26 (20,5 %) больных, несколько чаще гипертрофических – у 17 (22,4 %), чем келоидных – у 9 (17,6 %) больных. Менее всего было ПР с давностью более 3 лет – 22 (17,3 %) больных, при этом келоиды встречались чаще – у 10 (19,6 %) больных, чем гипертрофические – у 12 (15,8 %) больных.
Проведен анализ степени выраженности клинических признаков ПР в зависимости от их вида и давности.
В группе «молодых» рубцов давностью до 6 месяцев (50 (39,4 %) больных) примерно одинаково были представлены как ГР – 30 (39,5 %), так и келоиды – 20 (39,2 %) больных.
Жалобы на зуд были у 42 (84 %) пациентов с ПР давностью до 6 мес. (рис. 3.4, 3.5). Одинаково часто встречался легкий, умеренный и выраженный зуд – по 14 (28 %) больных соответственно. Однако, умеренный и резко выраженный зуд существенно чаще был у пациентов с КР – у 17 (85 %), чем с ГР – у 11 (36,7 %) пациентов. В тоже время при ГР часто отмечали отсутствие или легкую степень зуда – 19 (63,7 %), в сравнении с пациентами с КР – 3 (15 %). Выявлены статистически значимые различия по выраженности зуда (р=0,0002) в группах с ГР и КР давностью до 6 месяцев. Выраженность зуда составила в среднем (1,7±0,15) балла, в т.ч. у больных с ГР – (1,2±0,17) балла, у больных с КР – (2,5±0,17) балла (табл. 3.6).
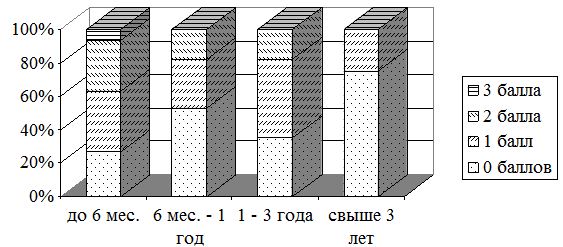
Рисунок 3.4 – Выраженность зуда у больных гипертрофическими рубцами в зависимости от его давности
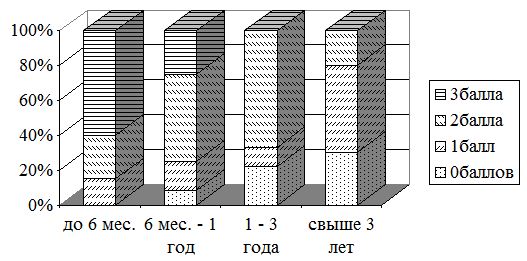
Рисунок 3.5 – Выраженность зуда у больных келоидными рубцами в зависимости от его давности
Таблица 3.6 – Выраженность признаков патологических рубцов в зависимости от их вида и давности существования (в баллах)
| Давность рубца | Патологические рубцы, М±m | ГР, М±m | КР, М±m | |||
| Интенсивность окраски | ||||||
| До 6 месяцев | 1 | 2,3±0,1 | 2,1±0,12 | 2,7±0,15 | ||
| От 6 месяцев до 1 года | 2 | 1,9±0,15 | 1,8±0,2 | 1,9±0,15 | ||
| От 1 года до 3 лет | 3 | 1,0±0,17 | 0,8±0,2 | 1,6±0,3 | ||
| Свыше 3 лет | 4 | 1,1±0,15 | 0,9±0,2 | 1,3±0,15 | ||
| р (1,2,3,4) | р=0,0001* | р=0,0001* | р=0,0002* | |||
| Фиброз | ||||||
| До 6 месяцев | 1 | 1,8±0,12 | 1,5±0,15 | 2,3±0,17 | ||
| От 6 месяцев до 1 года | 2 | 1,8±0,17 | 1,4±0,17 | 2,3±0,25 | ||
| От 1 года до 3 лет | 3 | 1,6±0,14 | 1,6±0,2 | 1,4±0,17 | ||
| Свыше 3 лет | 4 | 1,8±0,16 | 1,5±0,2 | 2,1±0,2 | ||
| р (1,2,3,4) | р=0,700 | р=0,855 | р=0,048* | |||
| Зуд | ||||||
| До 6 месяцев | 1 | 1,7±0,15 | 1,2±0,17 | 2,5±0,17 | ||
| От 6 месяцев до 1 года | 2 | 1,2±0,2 | 0,6±0,2 | 1,9±0,25 | ||
| От 1 года до 3 лет | 3 | 1,0±0,16 | 0,8±0,17 | 1,4±0,3 | ||
| Свыше 3 лет | 4 | 0,5±0,14 | 0,3±0,1 | 0,9±0,2 | ||
| р (1,2,3,4) | р=0,0004* | р=0,01* | р=0,0001* | |||
Примечание. * – различия между показателями в зависимости от давности рубца статистически значимы (оценка по критерию Краскела-Уоллиса)
При клинической оценке ПР давностью от 6 месяцев до 1 года (29 (22,8 %) больных) отмечено что ГР были у 17 (22,4 %) больных, КР – у 12 (23,5 %) больных.
Следует отметить, что у пациентов с ПР длительностью заболевания от 6 месяцев до одного года 10 больных (34,5 %) указывали либо на отсутствие зуда, либо на умеренную его выраженность – 9 (31 %). Так, на отсутствие зуда указывали 9 (52,9 %) больных с ГР, и лишь 1 (8,3 %) с келоидными. Умеренный зуд наблюдали чаще у пациентов с келоидами – 6 (50 %), и лишь у 3 (17,6 %) с ГР (рис. 3.4). Выраженный зуд отмечали у 3 (10,3 %) больных с ПР, при этом все пациенты имели исключительно келоиды – 3 (25 %).) (рис. 3.5). Выявлены статистически значимые различия по выраженности зуда (р=0,011) в группах с ГР и КР давностью от 6 месяцев до 1 года. Степень выраженности зуда представлена на рис.3.4, 3.5. Интенсивность зуда в этой группе была в среднем (1,2±0,2) балла, в т.ч. при ГР – (0,6±0,2) балла, при келоидах – (1,9±0,25) балла (табл. 3.6).
Патологические рубцы давностью от 1 года до 3 лет зарегистрированы у 17 больных с ГР (22,4 %) и 9 (17,6 %) пациентов с КР.
Пациенты с ПР давностью от 1 года до 3 лет отмечали зуд преимущественно в 1–2 балла – 18 (69,2 %) больных, причем чаще умеренный зуд в 2 балла беспокоил пациентов с келоидами – 6 (66,7 %), чем с ГР – 3 (17,6 %) (рис. 3.4, 3.5). Пациенты с ГР чаще жаловались на легкий зуд в исследуемой области – 8 (47 %), чем с келоидными – 1 (11,1 %). У 6 (23 %) пациентов с ПР зуд отсутствовал, при этом в 1,5 раза чаще у лиц с ГР. Выявлены статистически значимые различия по выраженности зуда (р=0,011) в группах с ГР и КР давностью от 1 года до 3 лет. Интенсивность зуда в среднем составила в этой группе (1,0±0,16) балла, в т.ч. при ГР – (0,8±0,17) балла, при КР – (1,4±0,3) балла (табл. 3.6).
При изучении 22 больных с ПР (17,3 %) давностью более 3 лет отмечено незначительное преобладание келоидных 10 (19,6 %) рубцов над ГР – 12 (15,8 %).
Следует отметить, что среди всех пациентов с ПР давностью свыше 3 лет было отмечено отсутствие зуда в области рубцов у 12 (54,5 %) пациентов. Легкий зуд отмечали 8 (36,4 %) больных. При этом, пациенты с келоидами вдвое чаще предъявляли жалобы на легкий зуд, чем больные с ГР – 5 (50 %) и 3 (25 %) больных соответственно (рис. 3.4). Умеренный зуд отмечали пациенты только лишь с КР – 2 (20 %) (рис. 3.5). Выявлены статистически значимые различия по выраженности зуда (р=0,011) в группах больных с ГР и КР давностью более 3 лет. В среднем, интенсивность зуда в этой группе была (0,5±0,14) балла, в т.ч. при ГР – (0,3±0,1) балла, при КР – (0,9±0,2) балла (табл. 3.6).
У большинства ПР до 6 месяцев одинаково часто наблюдали розово-красную и интенсивно красную окраску – по 21 больному (34 %) соответственно. Однако среди ГР чаще были рубцы с розово-красной окраской – у 16 (53,3 %) больных, чем при келоидных – у 5 (25 %) больных. Среди келоидов преобладали ПР с интенсивно красной окраской – у 13 (65 %) больных. Слабо розовой окраска была всего у 8 (16 %) пациентов, при этом в 2 раза чаще у больных с ГР – 6 (20 %), чем при КР – 2 (10 %) пациента. В среднем, интенсивность окраски составила – (2,3±0,1) балла, в т.ч. при ГР – (2,1±0,12) балла, при КР – (2,7±0,15) балла.
У большинства ПР этой группы наблюдали легкую степень плотности – у 19 (38 %) больных. Чаще при ГР, чем при келоидах – у 15 (50 %) и 4 (20 %) больных соответственно. Плотность ПР в 2 и более баллов была у 29 (58 %) больных, больше при келоидах – у 16 (80 %) больных, чем при ГР – у 13 (43,3 %) больных (табл. 3.9). Интенсивность плотности в среднем составила – 1,8 балла, в т.ч. при ГР – 1,5, при келоидах – 2,3 балла.
У 11 (37,9 %) больных с ПР от 6 месяцев до 1 года чаще встречались ПР с умеренной выраженностью фиброза, при этом значительно чаще ГР – у 9 (52,9 %), чем КР – 2 (16,7 %) больных. Легкая степень фиброза (1 балл) была у 9 (31 %) больных с ПР, чаще при ГР– у 6 (35,3 %) больных, чем при КР – у 3 (25 %). Резко выраженной плотность была у 7 (24,1 %) больных с рубцами, но встречались только при КР – 7 (58,3 %) больных. Выраженность фиброза составила в среднем (1,8±0,12) балла, в т.ч. при ГР – (1,5±0,15) балла, при КР – (2,3±0,17) балла. Среди 29 больных с ПР давность от 6 месяцев до 1 года розово-красная окраска была у 17 (58,6 %), при этом в 2,6 раза чаще у больных с ГР, чем с КР (табл. 3.6). Одинаково часто встречалась окраска в 1 и 3 баллов – по 5 (17,2 %) больных. У 2 (6,8 %) больных с ПР наблюдали цвет нормальной кожи, при этом только у больных ГР – 2 (11,8 %). Интенсивность окраски составила в среднем (1,9±0,15) балла, в т.ч. при ГР – (1,8±0,2) балла, при келоидах – (1,9±0,15) балла.
У 12 (46,2 %) больных с ПР от 1 года до 3 лет чаще отмечали интенсивность фиброза в 2 балла. При этом умеренная плотность несколько чаще встречалась при ГР – у 8 (47 %), чем при КР. Легкую степень плотности отмечали у 11 (42,3 %) больных с ПР, с КР таких больных было больше – 5 (55,6 %), чем с ГР – 6 (32,3 %). В тоже время отмечено, что выраженный фиброз среди ПР встречался только при ГР – 2 (11,8 %). Выраженность фиброза в этой группе больных с ПР в среднем составила (1,6±0,14) балла, в т.ч. при ГР – (1,6±0,2) балла, при келоидах – (1,4±0,17) балла.
У 9 (34,6 %) больных с ПР цвет рубцов был окраски нормальной кожи, чаще у больных с ГР – 8 (47 %), лишь у 1 (11,1 %) с келоидами. Одинаково часто встречалась слабо-розовая (у 8 (30,8 %) больных) и розово-красная окраска (у 8 (30,8 %) больных). При этом чаще наблюдали интенсивность окраски у больных с КР в 1 и 2 балла (3 (33,3 %) и 4 (44,4 %) пациентов соответственно), чем у больных с ГР (5 (29,4 %) и 4 (23,5 %) соответственно) (табл. 3.6). Интенсивность окраски в среднем составила (1,0±0,17) балла, в т.ч. при ГР – (0,8±0,2) балла, при КР – (1,6±0,3) балла.
Обращал на себя внимание тот факт, что у большинства больных с ПР в этой группе был отмечен умеренный фиброз (у 12 (54,5 %) больных), при этом несколько чаще у больных с ГР – 7 (58,3 %), чем с КР. Фиброз в 1 балл наблюдали у 6 (27,3 %) пациентов с ПР, чаще при ГР – 4 (33,3 %), чем при келоидах – 2 (20 %) (табл. 3.6). Отсутствие фиброза наблюдалось лишь у 1 (8,3 %) больного с ГР, а выраженный фиброз лишь у пациентов с келоидами – 3 (30 %). Выраженность фиброза в этой группе больных с ПР в среднем составила (1,8±0,16) балла, в т.ч. при ГР – (1,5±0,2) балла, при КР – (2,1±0,2) балла.
Установлено, что в этой группе преобладали рубцы со слабо-розовой окраской (у 12 (54,5 %) больных), как среди больных с ГР – (у 5 (41,7 %) больных), так и с КР – (у 7 (70 %) пациентов). В тоже время отмечено, что розово-красная окраска была у 6 (27, 3 %) пациентов, при этом несколько чаще у больных с КР – 3 (30 %), реже с ГР – 3 (25 %). Обращало внимание, что нормальный цвет кожи был у 4 (18,2 %) больных, при этом все они были с ГР (табл. 3.6). Интенсивность окраски в среднем в этой группе была (1,1±0,15) балла, в т.ч. при ГР – (0,9±0,2) балла, при КР – (1,3±0,15) балла.
Описание клинического случая. Пациентка Ш., 23 лет, (амб. карта № 72159 от 5.06.2012г.) обратилась с жалобами на зудящий патологический рубец в области грудины (рис. 3.6). Из анамнеза: 5 лет назад в этом месте был удален пигментный невус. Через некоторое время заметила изменение послеоперационного рубца, при этом вначале появилось небольшое образование в его пределах, которое постепенно увеличивалось в размерах, приобрело окраску красного цвета и сопровождалось зудом. В связи с увеличением размеров образования обратилась за медицинской помощью. При осмотре в области патологического послеоперационного рубца грудины отмечено четко ограниченное образование овально – округлой формы, выходящее за пределы атрофического рубца, размером около 1,5 см х 3 см, ярко розового цвета, плотно спаянное с подлежащими тканями, умеренно болезненное при пальпации, субъективно -умеренный зуд.
Диагноз: Келоидный рубец области грудины.
При оценке признаков рубца установлено: интенсивность окраски – 2 балла, плотность 3 балла, интенсивность зуда 2 балла. В общеклинических анализах и при обследовании органов брюшной полости, малого таза патологии не выявлено.
Особенностью этого случая был отсроченный рост постоперационного патологического рубца, выходящего за пределы первоначальной травмы, сопровождающийся субъективными ощущениями.
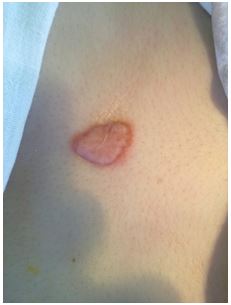
Рисунок 3.6 – Больная Ш., амб.к. № 72159 от 5.06.2012. Келоидный рубец в области грудины, давностью 5 лет
Сравнительный анализ ПР показал, что, независимо от давности рубца, клиническими изменениями характеризовались все виды рубцов, но особенно выраженные – келоидные (табл. 3.6).
Балльная оценка интенсивности окраски и выраженности зуда статистически значимо снижались с увеличением давности существования рубца (p<0,01).
Выраженность фиброзных изменений практически зависела от давности существования рубца только при келоидах (p<0,05).
Представленные изменения имели общую направленность при всех видах рубцов. Как видно из табл. 3.6, интенсивность признаков при КР существенно уменьшалась с увеличением длительности существования рубца – в среднем на -1,4 бала по оценке интенсивности окраски и -1,6 балла по выраженности зуда. При ГР также отмечено снижение интенсивности признаков по мере увеличения давности рубца, но в целом эти изменения несколько меньше: 1,3 балла по оценке интенсивности окраски и 0,9 балла по выраженности зуда, что учитывалось при планировании лечебной тактики.
* * *
Таким образом, проведенный анализ показал:
- В наших наблюдениях, среди патологических рубцов преобладали гипертрофические рубцы 76 (59,8 %).
- Отмечено преобладание посттравматических ГР и КР у 46 (60,5 %) и 28 (54,9 %) больных соответственно.
- Отмечено преобладание келоидов на лице (у 25 (49,01 %) человек), ушных раковинах (у 14 (27,5 %) пациентов), грудине (у 7 (13,7 %) больных), в то время как на верхних и нижних конечностях чаще встречались ГР соответственно у 31 (40,8 %) и 5 (6,6 %) больных.
- При клинической оценке отмечено, что интенсивность зуда в среднем составляла (1,2±0,1) балла, в т.ч. при ГР – (0,8±0,1) балла, при келоидах – (1,8±0,13) балла; интенсивность фиброза – (1,7±0,1) балла, в т.ч. при ГР – (1,5±0,1) балла, при КР – (2,1±0,1) балла; интенсивность окраски – (1,7±0,1) балла, при этом при ГР – (1,5±0,1) балла, при келоидах – (1,9±0,1) балла. Балльная оценка интенсивности окраски и выраженности зуда статистически значимо снижались с увеличением давности существования рубца (p<0,01).
- Выраженность фиброзных изменений практически не зависела от давности существования рубца (p<0,05).
Результаты этой главы опубликованы в следующих работах:
- Борзых Ю. А. Клинические особенности патологических рубцов / Ю. А. Борзых // Торсуєвські читання : збірник науково-практичних робіт. – Донецк, 2012. – Вип. 6. – С. 25–32.
- Борзых Ю. А. Клинико-эпидемиологические особенности гипертрофических и келоидных рубцов / Ю. А. Борзых // Міжнародний вісник медицини. – 2011. – № 1-2. – С. 14–16.
РАЗДЕЛ 4
МОРФОЛОГИЧЕСКИЕ И ИММУНОГИСТОХИМИЧЕСКИЕ ОСОБЕННОСТИ ПАТОЛОГИЧЕСКИХ РУБЦОВ
Морфологические, морфометрические и иммуногистохимические исследования проведены в зависимости от вида патологических рубцов (ГР и КР) и давности их существования.
Морфологическое исследование биоптатов кожи в зоне КР у пациентов позволили выявить признаки утолщения эпидермиса со сглаживанием дермо-эпидермальной границы, по сравнению с таковым у здоровых лиц, очаговые умеренно выраженные воспалительные изменения в виде лейкоцитарной инфильтрации между пучками КВ и вокруг гемокапилляров, разволокнение пучков коллагеновых волокон с их гомогенизацией, в глубоких зонах – преобладание дефинитивных клеточных форм (фиброцитов), гидропическую трансформацию основного аморфного вещества (рис. 4.1).
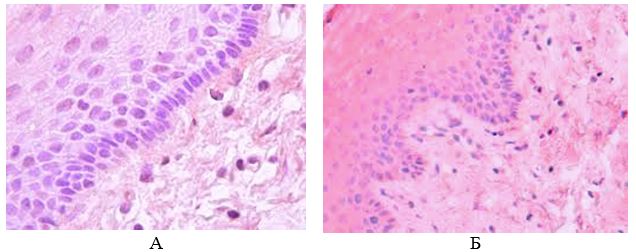
Рисунок 4.1 – Эпидермис в области КР (А) и ГР (Б) у пациентов до лечения. Окраска гематоксилином и эозином. А – ок. ×10, об. ×40; Б – ок. ×10, об. ×20.
При исследовании ГР отмечены признаки истончения эпидермиса, сглаженность сосочков дермы и их слабая лейкоцитарная инфильтрация. Обращала на себя внимание более высокая плотность клеток базального слоя по сравнению с таковой у пациентов с ГР (рис. 4.1).
У пациентов с ГР до лечения структурные особенности рубцовой трансформации дермы также не зависели от давности и проявлялись истончением эпидермиса, очаговыми умеренно выраженными воспалительными изменения субэпидермальной зоны в виде менее выраженной, чем у пациентов с КР, лимфоцитарно-плазмоцитарной инфильтрации между пучками волокон и вокруг гемокапилляров, разволокнением пучков коллагеновых волокон с их гомогенизацией и фибриноидным набуханием, преобладанием дефинитивных клеточных форм – фиброцитов (до 46,0±9,0 в одном поле зрения) (табл.4.1–4.3, рис. 4.2, 4.3), слабо выраженной гидропической трансформацией основного аморфного вещества, наличием немногочисленных узких с толстыми склерозированными стенками гемососудов в более глубоких отделах дермы.
Таблица 4.1 – Удельная площадь структурных элементов кожи пациентов с келоидными и гипертрофическими рубцами
| Структурные элементы | КР | ГР |
| М±m | М±m | |
| Лейкоцитарные инфильтраты | 0,33±0,07 | 3,44±0,05 |
| Основное аморфное вещество | 1,22±0,05 | 1,57±0,03 |
| Пучки коллагеновых волокон | 73,53±3,92 | 70,66±2,72 |
| Сосуды ГМЦР сосочкового слоя дермы | 8,27±1,40 | 8,27±0,25 |
| Соединительнотканные клетки | 16,65±1,71 | 17,18±0, 13 |
Морфологический анализ ПР показал, что при КР индекс митоза в эпидермисе был выше, чем при ГР [(0,33±0,07) и (0,24±0,04) ус.ед. соответственно]; лейкоцитарные инфильтраты в дерме были более выражены при ГР [(3,44±0,05) ус.ед. и (0,33±0,07) ус.ед. соответственно], при этом число фибробластов в 1 поле зрения при КР было почти в 2 раза больше, чем при ГР [(74±11) и (46±9) клеток соответственно] (табл.4.1).
Таблица 4.2 – Количественная характеристика очагов поражения кожи пациентов с келоидными рубцами
| Показатели | М±m |
| Численность клеток с фигурами митоза в эпидермисе в 1 поле зрения | 0,33±0,07 |
| Соотношение численности лимфоцитов/макрофагов | 1/1 |
| Количество гемососудов сосочкового слоя дермы (в 1 поле зрения) | 2,55±0,40 |
| Количество фибробластов в 1 поле зрения | 74,0±11,0 |
| Количество фибробластов, контактирующих с коллагеновыми волокнами в 1 поле зрения | 12,5±2,5 |
Таблица 4.3 – Количественная характеристика очагов поражения кожи пациентов с гипертрофическими рубцами
| Показатели | До лечения, М±m |
| Численность клеток с фигурами митоза в эпидермисе в 1 поле зрения | 0,24±0,04 |
| Соотношение численности лимфоцитов/макрофагов | 1/1 |
| Количество гемососудов сосочкового слоя дермы (в 1 поле зрения) | 2,00±0,15 |
| Количество фибробластов в 1 поле зрения | 46,0±9,0 |
| Количество фибробластов, контактирующих с коллагеновыми волокнами в 1 поле зрения | 25,14±1,04 |
Количество фибробластов, контактирующих с коллагеновыми волокнами в 1 поле зрения при КР было почти в 2 раза меньше, чем при ГР (12,5±2,5 и 25,14±1,04 соответственно) (табл.4.2).
При этом соотношение численности лимфоцитов к макрофагам при обоих видах рубцов существенно не отличалась. Количество гемососудов в 1 поле зрения было статистически значимо выше при КР, чем при ГР (2,55±0,4 и 2,0±0,15 соответственно).
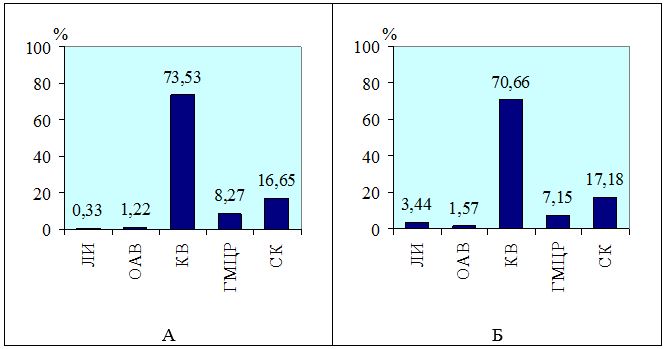
Рисунок 4.2 – Количественные показатели морфологических параметров кожи в зоне патологических рубцов у пациентов до комплексного лечения.
Примечание: А – келоидные рубцы, Б – гипертрофические рубцы; ЛИ – лейкоцитарные инфильтраты, ОАВ – основное аморфное вещество, КВ – коллагеновые волокна, ГМЦР – сосуды гемомикроциркуляторного русла, СК – соединительнотканные клетки.
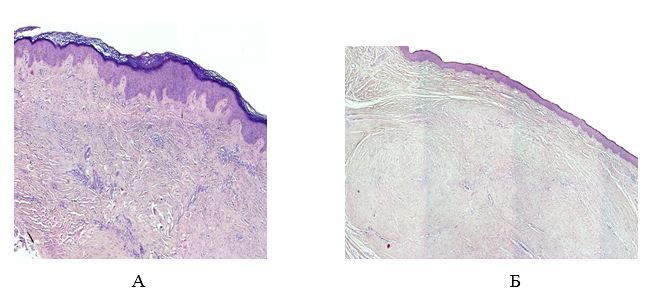
Рисунок 4.3 – Окраска гематоксилином и эозином, х30. ГР (А), КР (Б).
При гистохимическом окрашивании ГР по Вергоффу с целью выявления эластических волокон определялись лишь отдельные участки сохранных волокон. Группа пациентов с КР характеризовалась полным отсутствием эластических волокон (рис. 4.4).
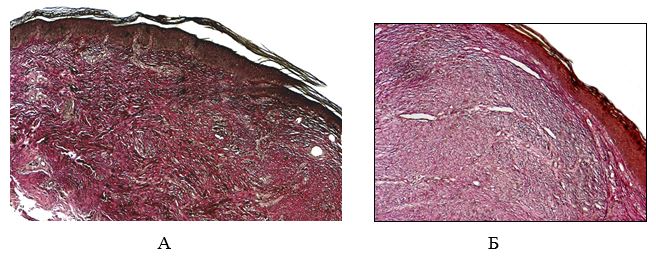
Рисунок 4.4 – Окраска по Вергоффу, х30. ГР (А) и КР (Б)
При трихромной окраске по Массону выявлены широкие рыхлые пучки и узлы коллагена как при ГР, так и при келоидах (рис. 4.5).
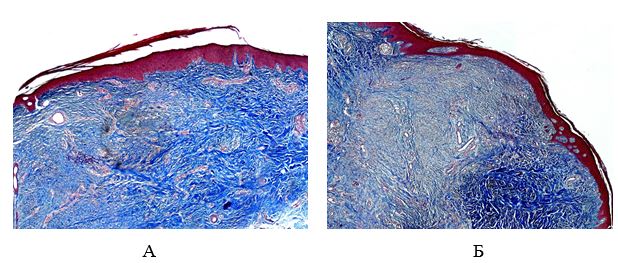
Рисунок 4.5 – ГР (А) и КР (Б). Окраска по Массону, х30.
Кроме стандартного гистологического и гистохимического окрашивания, у 23 пациентов нами было проведено ИГХ-исследование сосудистого русла рубцовой ткани (как зрелых сосудов, так и вновь образованных) и фактора пролиферации эпидермиса. Был определен удельный вес зрелых сосудов (CD34+) в группе пациентов с ГР, который составил (1,05±0,16) % на 1 мм2 (рис. 4.6, табл. 4.4). Удельный вес «молодых» образовавшихся сосудов разного калибра определялся по экспрессии маркера VEGF и составил в исследуемой группе (0,5±0,08) % на 1 мм2 (рис. 4.7, табл. 4.4). Экспрессия эпидермального фактора роста в данной группе больных не отмечалась (рис. 4.8, табл. 4.5)
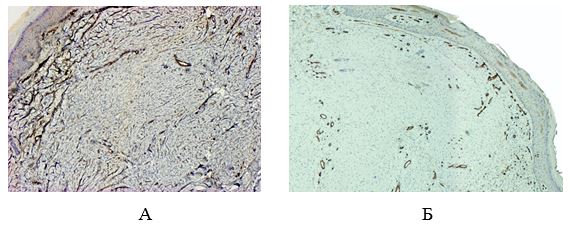
Рисунок 4.6 – Сосудистое русло в гипертрофическом (А) и келоидном рубце Б). ИГХ-исследование с моноклональными антителами к CD34. Система визуализации DAKO EnVision FLEX+ х30

Рисунок 4.7 – Вновь образованные сосуды в гипертрофическом (А ) и келоидном рубце (Б). ИГХ-исследование с моноклональными антителами к VEGF. Система визуализации DAKO EnVision FLEX+ х40
Рисунок 4.8 – Экспрессия эпидермального фактора роста в гипертрофическом (А) и келоидном рубце (Б). ИГХ-исследование с моноклональными антителами к EGFR. Система визуализации DAKO EnVision FLEX+ х40
Таблица 4.4 – Анализ экспрессии маркеров CD34, VEGF у пациентов с гипертрофическими и келоидными рубцами
| Показатели | ГР (n=23), абс. (P%±m%) | КР (n=17), абс. (P%±m%) | Уровень значимости отличия между группами, p |
| УВ зрелых сосудов на 1 мм2 (CD34+) | 1,05±0,16 | 0,68±0,12* | <0,05 |
| УВ вновь образованных сосудов на 1 мм2 (VEGF+) | 0,5±0,08 | 0,32±0,09* | <0,05 |
Примечание. *– отличие от гипертрофических рубцов статистически значимо (p<0,05)
Таблица 4.5 – Анализ экспрессии EGFR у пациентов с ГР и КР
| Показатели | IHscore EGFR | Уровень значимости отличия между группами, p |
| Гипертрофические рубцы до лечения | 0 | – |
| Келоидные рубцы до лечения | 0 |
Удельный вес CD34-позитивных сосудов при КР составил (0,68±0,12) % на 1 мм2 (рис. 4.6), тогда как этот же показатель вновь образованных сосудов достигал (0,32±0,09) % на 1 мм2 (табл. 4.4).
Как и в группе пациентов с ГР у больных с КР также не отмечалась экспрессия EGFR (табл. 4.5).
Выявленные изменения свидетельствовали об особенностях КР, выраженной их склонности к экспрессивному росту, что учитывалось при планировании лечебно – профилактической тактики.
* * *
Таким образом, при комплексных морфологических, иммуногистохимических и морфологических исследованиях выявлено:
- Признаки истончения эпидермиса со сглаженностью сосочков дермы при всех видах ПР, наиболее выраженные при КР.
- Воспалительная инфильтрация дермы, преобладание дефинитивных форм фибробластов и гидропической трансформации основного аморфного вещества дермы в обоих видах ПР, более выраженные при КР.
- Более выраженная митотическая активность эпидермиса при КР по сравнению с ГР.
- Количественное преобладание фибробластов в одном поле зрения при КР по сравнению с ГР, при этом количество фибробластов, контактирующих с коллагеновыми волокнами в одном поле зрения, было значительно больше при ГР.
- Количественное преобладание гемососудов сосочкового слоя дермы при КР по сравнению с ГР.
Результаты данного раздела опубликованы в следующих статьях:
1. Проценко Т. В. Морфологические особенности ремоделирования патологических рубцов при комплексном лечении с применением ингибиторов кальциневрина / Т. В. Проценко, Ю. А. Борзых, Н. Н. Бондаренко // Дерматологія та венерологія. – 2014. – № 1 (63). – С. 52–58.
РАЗДЕЛ 5
ОСОБЕННОСТИ БИОФИЗИЧЕСКИХ СВОЙСТВ ПАТОЛОГИЧЕСКИХ РУБЦОВ
У 127 больных провели оценку биофизических свойств ГР и КР по следующим параметрам: интенсивность эритемы и особенности сосудистого рисунка, выраженность пигментации, вискоэластичность, трансэпидермальная потеря влаги (ТЭПВ) и pН.
Исследовали четыре группы больных с ПР различной давности: 50 больных с ПР с давностью до 6 месяцев, 29 – с давностью от 6 до 12 месяцев, 26 – с давностью от 1 года до 3 лет и 22 – с давностью более 3 лет.
При анализе биофизических свойств ПР отмечено, что у 27 (21,3 %) больных до лечения отсутствовала эритема, интенсивная эритема определялась у 49 (38,6 %), при этом чаще наблюдалась незначительная эритема как у больных с ГР – 28 (36,8 %), так и с КР – 23 (45,1 %).
При ПР чаще встречалась незначительная пигментация – у 60 (47,2 %) больных. Выраженность пигментации у большинства пациентов с ГР (33 (43,4 %) больных) и с КР (27 (52,9 %) человек) соответствовала незначительному уровню.
При анализе сосудистого компонента у 60 (47,2 %) больных с ПР отмечалось преобладание умеренного количества сосудов. При этом у большего числа пациентов с ГР отмечали умеренное количество сосудов или единичные – 40 (52,6 %) и 21 (27,6 %) соответственно. У пациентов с КР отмечено преобладание умеренного и большого количества сосудов, соответственно – у 20 (39,2 %) и 23 (45,1 %) больных.
Оценивая вискоэластичность ПР, регистрировали преобладание рубцов с повышенной вискоэластичностью – 69 (54,3 %) больных. При этом, КР преобладали с повышенной вискоэластичностью – 40 (78,4 %), а большинство ГР были с умеренной вискоэластичностью – 41 (53,9 %).
При проведении анализа ТЭПВ установлено, что повышенный показатель был у большинства пациентов независимо от вида рубца – у 38 (50 %) с ГР и у 32 (62,7 %) с КР.
Что касается рН кожи при ГР и КР, то она была преимущественно щелочной и находилась в пределах 5,8-14 – у 40 (52,6 %) и у 32 (62,7 %) больных соответственно (табл. 5.1).
При анализе биофизических свойств ГР давностью до 6 месяцев отмечено, что у 19 (38 %) больных до лечения уровень эритемы отсутствовал или был незначительным, интенсивная эритема была у большинства пациентов 31 (62 %) и составляла от 50 – 100 усл. ед. Интенсивную эритему также отмечено у большинства больных с КР (14 (70 %) больных). Незначительная эритема зарегистрирована всего у 6 (30 %) пациентов.
Выраженность пигментации у большинства больных с ГР (28 (86,7 %) человек) и с КР (17 (85 %) человек) давностью до 6 месяцев соответствовала незначительному уровню либо отсутствовала.
При анализе сосудистого компонента у больных с ГР выявлено, что у 11 (36,7 %) больных сосуды отсутствовали или были единичные, а у 19 (63,3 %) отмечалось умеренное (от 10–20 сосудов) или большое количество (более 21) сосудов. У 19 (95 %) пациентов с келоидами отмечали преобладание умеренного и большого количества сосудов.
Оценивая вискоэластичность в зависимости от давности ПР, у 30 (60 %) больных зарегистрировано их преобладание с повышенной вискоэластичностью. При этом больных с КР было несколько больше – 18 (63,3 %), чем с ГР – 12 (40 %) больных. С умеренным уровнем вискоэластичности было 20 (40 %) больных с ПР, из них в 6 раз больше с ГР, чем с КР.
При проведении анализа ТЭПВ установлено, что повышенной она была у большинства пациентов независимо от вида рубца – у 16 (53,3 %) больных с ГР и у 12 (60 %) с КР, а умеренная и незначительная ТЭПВ была у 11 (36,7 %) пациентов с ГР и у 6 (30 %) с КР.
Таблица 5.1 – Биофизические свойства патологических рубцов
| Признак | ГР, n= 76 | КР, n = 51 | Всего, n=127 | |||
| Абс. | % | Абс. | % | Абс. | % | |
| Эритема | ||||||
| Отсутствует | 21 | 27,6 | 6 | 11,8 | 27 | 21,3 |
| Незначительная | 28 | 36,8 | 23 | 45,1 | 51 | 40,2 |
| Интенсивная | 27 | 35,5 | 22 | 43,1 | 49 | 38,6 |
| р | χ2=4,6; р=0,110 | – | – | |||
| Пигментация | ||||||
| Отсутствует | 30 | 39,5 | 16 | 31,4 | 46 | 36,2 |
| Незначительная | 33 | 43,4 | 27 | 52,9 | 60 | 47,2 |
| Интенсивная | 13 | 17,1 | 8 | 15,7 | 21 | 16,5 |
| р | χ2=1,18; р=0,556 | – | – | |||
| Сосудистый компонент | ||||||
| Отсутствуют сосуды | 3 | 3,9 | 0 | 0 | 3 | 2,4 |
| Единичные сосуды | 21 | 27,6 | 8 | 15,7 | 29 | 22,8 |
| Умеренное количество сосудов | 40 | 52,6 | 20 | 39,2 | 60 | 47,2 |
| Большое количество сосудов | 12 | 15,8 | 23 | 45,1 | 35 | 27,6 |
| р | χ2=14,6; р=0,0022 * | – | – | |||
| Висколастичность | ||||||
| Снижена | 6 | 7,9 | 2 | 3,9 | 8 | 6,3 |
| Умеренная | 41 | 53,9 | 9 | 17,6 | 50 | 3,9 |
| Повышенная | 29 | 38,2 | 40 | 78,4 | 69 | 54,3 |
| р | χ2=20,1; р=0,0001 * | – | – | |||
| ТЭПВ | ||||||
| Отсутствует | 1 | 1,3 | 0 | 0 | 1 | 0,8 |
| Незначительна | 14 | 18,4 | 6 | 11,8 | 20 | 15,7 |
| Умеренная | 23 | 30,3 | 13 | 25,5 | 36 | 28,3 |
| Повышенная | 38 | 50,0 | 32 | 62,7 | 70 | 55,1 |
| р | χ2=2,67; р=0,445 | |||||
| РН | ||||||
| Кислая | 15 | 19,7 | 6 | 11,8 | 21 | 16,5 |
| Нейтральная | 21 | 27,6 | 13 | 25,5 | 34 | 26,8 |
| Щелочная | 40 | 52,6 | 32 | 62,7 | 72 | 56,7 |
| р | χ2=1,78; р=0,411 | |||||
Примечание. р – оценка по критерию Хи-квадрат (χ2). * – различия статистически значимы, p<0,05).
Уровень рН кожи с ГР и КР был преимущественно щелочной и находился в пределах 5,8–14 – у 14 (46,7 %) и 13 (65 %) больных соответственно (табл. 5.2).
Рассматривая свойства ПР у больных до лечения с давностью ПР от 6 месяцев до 1 года отмечено, что у 23 (79,3 %) из 29 больных уровень эритемы был незначительным или интенсивным. При этом как с ГР, так и с КР у большинства пациентов имелся незначительный уровень эритемы, соответственно – у 8 (47,1 %) и 6 (50 %) больных.
У 22 (75,9 %) больных с ПР отмечали отсутствие или слабо выраженную пигментацию (0-10 ус. ед). Интенсивная пигментация наблюдалась лишь у 7 пациентов (24,1 %), в то время как у больных с ГР чаще встречалось отсутствие или незначительные уровни пигментации, а при КР незначительные и интенсивные уровни.
При анализе сосудистого компонента выявлено, что у 22 (75,8 %) больных с ГР и КР этот признак соответствовал 1–2 баллам. Оценивая вискоэластичность установлено, что с повышенным уровнем признака было 19 (65,5 %) больных с ПР, чаще с КР – 10 (83,3 %) больных, чем с ГР – 9 (52,9 %) больных; со средними показателями вискоэластичности – 10 (34,5 %), всего в 2,8 раза чаще регистрировалась у больных с ГР.
У 24 (82,8 %) больных с ПР отмечено умеренную и повышенную ТЭПВ.
Уровень рН кожи с ГК и КР до лечения была отклонена в щелочную сторону у 21 (72,4 %) пациентов (табл. 5.3).
Оценивая ПР до лечения давностью от 1 года до 3 лет отмечено, что у 22 (84,6 %) пациентов уровень эритемы был незначительным или отсутствовал. При этом 14 (82,4 %) пациентов с ГР не имели эритему или она отсутствовала, 7 (77,8 %) больных с КР имели незначительный уровень эритемы.
У 22 (84,6 %) больных с ПР отмечено отсутствие или незначительную пигментацию. Интенсивная пигментация наблюдалась у 4 (15,4 %) пациентов, в то время как у больных с ГР чаще встречалась незначительная пигментация (6 (35,3 %) человек), а у больных с КР ее отсутствие – у 5 (55,6 %) пациентов.
Таблица 5.2 – Биофизические свойства гипертрофических и келоидных рубцов давностью до 6 месяцев
| Признак | ГР, n =30 | КР, n =20 | Всего, n= 50 | |||
| абс. | % | Абс. | % | абс. | % | |
| Эритема | ||||||
| Отсутствует | 3 | 10 | 0 | 0 | 3 | 6 |
| Незначительная | 10 | 33,3 | 6 | 30 | 16 | 32 |
| Интенсивная | 17 | 56,7 | 14 | 70 | 31 | 62 |
| χ2=2,4; р=0,303 | ||||||
| Пигментация | ||||||
| Отсутствует | 14 | 46,7 | 6 | 30 | 20 | 40 |
| Незначительная | 12 | 40 | 11 | 55 | 23 | 46 |
| Интенсивная | 4 | 13,3 | 3 | 15 | 7 | 14 |
| χ2=1,44; р=0,486 | ||||||
| Сосудистый компонент | ||||||
| Отсутствуют сосуды | 3 | 10 | 0 | 0 | 3 | 6 |
| Единичные сосуды | 8 | 26,7 | 1 | 5 | 9 | 18 |
| Умеренное количество сосудов | 15 | 50 | 5 | 25 | 20 | 40 |
| Большое количество сосудов | 4 | 13,3 | 14 | 70 | 18 | 36 |
| χ2=17,7; р=0,0005* | ||||||
| Висколастичность | ||||||
| Снижена | 0 | 0 | 0 | 0 | 0 | 0 |
| Умеренная | 18 | 60 | 2 | 10 | 20 | 40 |
| Повышенная | 12 | 40 | 18 | 90 | 30 | 60 |
| χ2=12,5; р=0,0004 * | ||||||
| ТЭПВ | ||||||
| Отсутствует | 0 | 0 | 0 | 0 | 0 | 0 |
| Незначительна | 3 | 10 | 2 | 10 | 5 | 10 |
| Умеренная | 11 | 36,7 | 6 | 30 | 22 | 44 |
| Повышенная | 16 | 53,30 | 12 | 60 | 23 | 46 |
| χ2=0,252; р=0,882 | ||||||
| РН | ||||||
| Кислая | 7 | 23,3 | 2 | 10 | 9 | 18 |
| Нейтральная | 9 | 30 | 5 | 25 | 4 | 8 |
| Щелочная | 14 | 46,7 | 13 | 65 | 27 | 54 |
| χ2=9,1; р=0,011 * | ||||||
Примечание. р – оценка по критерию Хи-квадрат (χ2).
Таблица 5.3 – Биофизические свойства гипертрофических и келоидных рубцов давностью 6–12 месяцев
| Признак | ГР, n =17 | КР, n =12 | Всего, n= 29 | |||
| абс. | % | Абс. | % | абс. | % | |
| Эритема | ||||||
| Отсутствует | 4 | 23,5 | 2 | 16,7 | 6 | 20,7 |
| Незначительная | 8 | 47 | 6 | 50 | 14 | 48,3 |
| Интенсивная | 5 | 29,4 | 4 | 33,3 | 9 | 31 |
| χ2=0,207; р=0,901 | ||||||
| Пигментация | ||||||
| Отсутствует | 6 | 35,3 | 2 | 16,7 | 8 | 27,6 |
| Незначительная | 8 | 47 | 6 | 50 | 14 | 48,3 |
| Интенсивная | 3 | 17,6 | 4 | 33,3 | 7 | 24,1 |
| χ2=1,6; р=0,446 | ||||||
| Сосудистый компонент | ||||||
| Отсутствуют сосуды | 0 | 0 | 0 | 0 | 0 | 0 |
| Единичные сосуды | 6 | 35,3 | 3 | 25 | 9 | 31 |
| Умеренное количество сосудов | 8 | 47 | 5 | 41,7 | 13 | 44,8 |
| Большое количество сосудов | 3 | 17,6 | 4 | 33,3 | 7 | 24,1 |
| χ2=1,0; р=0,606 | ||||||
| Висколастичность | ||||||
| Снижена | 0 | 0 | 0 | 0 | 0 | 0 |
| Умеренная | 8 | 47,1 | 2 | 16,7 | 10 | 34,5 |
| Повышенная | 9 | 52,9 | 10 | 83,3 | 19 | 65,5 |
| χ2=2,9; р=0,089 | ||||||
| ТЭПВ | ||||||
| Отсутствует | 0 | 0 | 0 | 0 | 0 | 0 |
| Незначительна | 4 | 23,5 | 1 | 8,3 | 5 | 17,2 |
| Умеренная | 4 | 23,5 | 4 | 33,3 | 8 | 27,6 |
| Повышенная | 9 | 53 | 7 | 58,3 | 16 | 55,2 |
| χ2=1,22; р=0,542 | ||||||
| РН | ||||||
| Кислая | 1 | 5,8 | 1 | 8,3 | 2 | 6,8 |
| Нейтральная | 3 | 17,6 | 3 | 25 | 6 | 20,7 |
| Щелочная | 13 | 76,5 | 8 | 66,7 | 21 | 72,4 |
Примечание. р – оценка по критерию Хи-квадрат (χ2).
При анализе сосудистого компонента при ГР и КР выявлено, что у 15 (57,7 %) больных этот признак соответствовал 2 баллам (умеренное количество сосудов (10–20), при этом таких больных с ГР было 10 (58,8 %), а больных с келоидами – 5 (41,7 %).
Оценивая вискоэластичность, у 12 (46,2 %) больных установлено некоторое преобладание средней вискоэластичности ПР, при этом чаще у больных с ГР – у 10 (58,8 %), чем у больных с КР – у 2 (22,2 %) больных. Повышенная вискоэластичность наблюдалась у 11 (42,3 %) больных с ПР, при этом в 2 раза чаще у больных с келоидами. Низкий уровень вискоэластичности отмечен у 3 (11,5 %) больных, практически одинаковый при всех ПР.
При проведении анализа ТЭПВ зарегистрировано преобладание умеренной (13–17 ус. ед.) и повышенной (17–10 ус. ед.) ТЭПВ у 22 (84,6 %) больных. Уровень рН кожи у больных с ГК и КР до лечения была отклонена в щелочную сторону (у 13 (50 %)) (табл. 5.4).
Следует отметить, что среди ПР давностью свыше 3 лет (22 случая), в наших наблюдениях преобладали ГР – 12 (54,5 %) больных по сравнению с КР – 10 (45,5 %) случаев.
Обращало на себя внимание, что наиболее выраженная эритема была у больных с КР. Так, интенсивная эритема у больных с ГР была всего лишь у 2 (16,6 %), интенсивность пигментации была незначительной у 5 (41,6 %) пациентов с ПР и соответствовала 10–50 ус.ед. У 3 (30 %) больных с КР была интенсивная эритема, а незначительная степень выраженности пигментации – у 7 (70 %).
При анализе сосудистого компонента у больных ГР выявлено, что у 2 (16,6 %) больных сосуды отсутствовали или были единичные, у 7 (58,3 %) пациентов отмечено умеренное (от 10-20 сосудов) и у 3 (25 %) больных – большое количество сосудов (больше 21). У пациентов с келоидами регистрировалось преобладание умеренного и большого количества сосудов, соответственно – у 5 (50 %) и у 4 (40 %) больных.
Таблица 5.4 – Биофизические свойства гипертрофических и келоидных рубцов давностью от 1 года до 3 лет
| Признак | ГР, n =17 | КР, n =9 | Всего, n= 26 | |||
| абс. | % | Абс. | % | абс. | % | |
| Эритема | ||||||
| Отсутствует | 7 | 41,2 | 1 | 11,1 | 8 | 30,1 |
| Незначительная | 7 | 41,2 | 7 | 77,8 | 14 | 53,8 |
| Интенсивная | 3 | 17,6 | 1 | 11,1 | 4 | 15,4 |
| χ2=3,6; р=0,187 | ||||||
| Пигментация | ||||||
| Отсутствует | 6 | 35,3 | 5 | 55,6 | 11 | 42,3 |
| Незначительная | 8 | 47 | 3 | 33,3 | 11 | 42,3 |
| Интенсивная | 3 | 17,6 | 1 | 11,1 | 4 | 15,4 |
| χ2=0,996; р=0,608 | ||||||
| Сосудистый компонент | ||||||
| Отсутствуют сосуды | 0 | 0 | 0 | 0 | 0 | 0 |
| Единичные сосуды | 5 | 29,4 | 3 | 33,3 | 8 | 30,8 |
| Умеренное количество сосудов | 10 | 58,8 | 5 | 41,7 | 15 | 57,7 |
| Большое количество сосудов | 2 | 11,8 | 1 | 11,1 | 3 | 11,5 |
| χ2=0,042; р=0,979 | ||||||
| Висколастичность | ||||||
| Снижена | 2 | 11,8 | 1 | 11,1 | 3 | 11,5 |
| Умеренная | 10 | 58,8 | 2 | 22,2 | 12 | 46,2 |
| Повышенная | 5 | 29,4 | 6 | 66,7 | 11 | 42,3 |
| χ2=3,64; р=0,162 | ||||||
| ТЭПВ | ||||||
| Отсутствует | 0 | 0 | 0 | 0 | 0 | 0 |
| Незначительна | 3 | 17,6 | 1 | 11,1 | 4 | 15,4 |
| Умеренная | 4 | 23,5 | 1 | 11,1 | 5 | 19,2 |
| Повышенная | 10 | 58,8 | 7 | 77,8 | 17 | 65,4 |
| χ2=0,959; р=0,619 | ||||||
| РН | ||||||
| Кислая | 4 | 23,5 | 2 | 22,2 | 6 | 23,1 |
| Нейтральная | 5 | 29,4 | 2 | 22,2 | 7 | 26,9 |
| Щелочная | 8 | 47 | 5 | 55,6 | 13 | 50 |
| χ2=0,202; р=0,904 | ||||||
Примечание. р – оценка по критерию Хи-квадрат (χ2).
Повышенная вискоэластичность отмечалась у 9 (40,9 %) больных с ПР, при этом чаще при КР – у 6 (60 %), чем при ГР – у 3 (25 %) больных. Средние показатели вискоэластичности встречалась у 8 (36,4 %) больных, чаще при ГР – у 5 (41,7 %) больных, низкие – у 5 (22,7 %) больных с ПР, при этом в 3 раза чаще при ГР, чем при КР.
У 8 (66,6 %) больных с ГР отмечалась незначительная и умеренная ТЭПВ, при этом у 6 (60 %) больных с КР была преимущественно повышенная ТЭПВ. У 11 (50 %) больных с патологическими рубцами рН была отклонена в щелочную сторону (табл. 5.5).
При сравнительном анализе степени выраженности биофизических признаков у больных с ПР выявлена четкая тенденция их зависимости от вида и давности существования. С увеличением длительности существования ПР различия по биофизическим характеристикам между келоидными и ГР (p>0,05) становились менее выраженными.
* * *
Таким образом, при анализе биофизических свойств рубцово-измененной ткани установлено:
1. Преобладание незначительной эритемы у больных с ПР независимо от их вида, при этом эритема уменьшалась с увеличением длительности существования ПР, что четче прослеживалось у больных с ГР.
2. Незначительность пигментации в области ПР, независимо от их вида.
3. Преобладание умеренного количества сосудов у больных с ГР, а у пациентов с КР – большого количества сосудов.
4. Повышенную вискоэластичность у большинства больных с КР, в то время как ее умеренность у пациентов с ГР.
5. Повышенную ТЭПВ как у больных с ГР, так и с КР.
6. Щелочную рН при всех видах ПР.
Таблица 5.5 – Биофизические свойства гипертрофических и келоидных рубцов давностью более 3 лет
| Признак | ГР, n =12 | КР, n =10 | Всего, n= 22 | |||
| абс. | % | Абс. | % | абс. | % | |
| Эритема | ||||||
| Отсутствует | 7 | 58,3 | 3 | 30 | 10 | 45,5 |
| Незначительная | 3 | 25 | 4 | 40 | 7 | 31,8 |
| Интенсивная | 2 | 16,6 | 3 | 30 | 5 | 22,7 |
| χ2=1,78; р=0,412 | ||||||
| Пигментация | ||||||
| Отсутствует | 4 | 33,3 | 3 | 30 | 7 | 31,8 |
| Незначительная | 5 | 41,7 | 7 | 70 | 12 | 54,5 |
| Интенсивная | 3 | 25 | 0 | 0 | 3 | 13,6 |
| χ2=3,32; р=0,190 | ||||||
| Сосудистый компонент | ||||||
| Отсутствуют сосуды | 0 | 0 | 0 | 0 | 0 | 0 |
| Единичные сосуды | 2 | 16,7 | 1 | 10 | 3 | 13,6 |
| Умеренное количество сосудов | 7 | 58,3 | 5 | 50 | 12 | 54,5 |
| Большое количество сосудов | 3 | 25 | 4 | 40 | 7 | 31,8 |
| χ2=0,633; р=0,727 | ||||||
| Висколастичность | ||||||
| Снижена | 4 | 33,3 | 1 | 10 | 5 | 22,7 |
| Умеренная | 5 | 41,7 | 3 | 30 | 8 | 36,4 |
| Повышенная | 3 | 25 | 6 | 60 | 9 | 40,9 |
| χ2=3,14; р=0,208 | ||||||
| ТЭПВ | ||||||
| Отсутствует | 1 | 8,3 | 0 | 0 | 1 | 4,5 |
| Незначительна | 4 | 33,3 | 2 | 20 | 6 | 27,3 |
| Умеренная | 4 | 33,3 | 2 | 20 | 6 | 27,3 |
| Повышенная | 3 | 25 | 6 | 60 | 9 | 40,9 |
| χ2=2,8; р=0,274 | ||||||
| РН | ||||||
| Кислая | 3 | 25 | 1 | 10 | 4 | 18,2 |
| Нейтральная | 4 | 33,3 | 3 | 30 | 7 | 31,8 |
| Щелочная | 5 | 41,7 | 6 | 60 | 11 | 50 |
| χ2=1,1; р=0,588 | ||||||
Примечание. р – оценка по критерию Хи-квадрат (χ2).
Результаты раздела опубликованы в следующих статьях:
1. Борзых Ю. А. Особенности биофизических свойств молодых гипертрофических и келоидных рубцов / Ю. А. Борзых // Від клінічних настанов до уніфікованих протоколів діагностики та лікування в дерматовенерологіі : науково-практична конференція, м. Київ, 21-22 березня 2013 року. – К., 2013. – С. 14.
2. Борзых Ю. А. Биофизические свойства келоидных рубцов различной степени давности / Ю. А. Борзых // Питання експериментальної та клінічної медицини : збірник статей. – Донецьк, 2013. – Вип. 17, т. 1. – С. 65–69.
РАЗДЕЛ 6
ЛЕЧЕНИЕ БОЛЬНЫХ ПАТОЛОГИЧЕСКИМИ РУБЦАМИ
6.1 Методика лечения
Разработан комплексный этапный метод лечения ПР, включающих удаление избыточной рубцовой ткани хирургическим методом / или методом микродермабразии (МКДА) в сочетании с применением топического ингибитора кальциневрина (ТИК).
Для оценки эффективности разработанного подхода результаты лечения сравнивали в двух группах: основная группа (группа 1) – 96 пациентов, леченных по разработанному методу и группа сравнения (группа 2) – 31 больной, принимающих традиционную терапию, у которых были выполнены МКДА или хирургическое иссечение ПР без применения ТИК.
Результаты лечения анализировали в следующих подгруппах сравнения: до 6 месяцев – группы 1а и 2а, от 6 месяцев до 1 года – группы 1б и 2б, от 1 года до 3-х лет – группы 1в и 2в, свыше 3-х лет – группы 1г и 2г.
Группы сравнения были репрезентативными по основным сравниваемым признакам.
Проанализированы результаты лечения 96 пациентов основной группы, которые проходили лечение по разработанному методу и 31 пациента группы сравнения, пациенты которой лечились традиционно. Результаты лечения сравнивали в подгруппах в зависимости от давности рубца.
Так, в основной группе было 58 (45,7 %) больных с ГР и 38 (29,9 %) пациентов с КР, в группе сравнения – 18 (14,2 %) больных с ГР и 13 (10,2 %) пациентов с КР.
Выбор метода удаления ПР зависел от степени выраженности фиброза, который во многом зависел от давности рубца.
Удаление хирургическим способом включало иссечение ПР. После предварительной разметки, под местным обезболиванием 1 % раствором лидокаина, производилась иссечение в пределах здоровой ткани, затем с минимальной травматизацией краев раны и их мобилизацией, послойно зашивалась без натяжения (рис. 6.1).
Рисунок 6.1 – Больная Ш. Вид КР с разметкой (А). Вид рубца после хирургического иссечения (Б)
Критерием для хирургического иссечения был выраженный фиброз рубца, локализация (на мочках ушных раковин, лице, кистях), косметический дефект и/или нарушение функции
Полученные объективные данные позволили прийти к выводу, что при длительности заболевания до одного года обоснованным является применение ТИК в сочетании с микродермабразией. При однотипности использования мази (2 р в день в течение 4 недель, а затем 1 раз в день 3 месяца), в случаях до 6 месяцев после формирования рубца количество процедур микродермабразии не превышало 6 и достигало 8 при наличии рубца 6-12 месяцев давности. При наличии рубца свыше 3 лет – метод комбинированного лечения расширялся прежде всего за счет выполнения хирургического лечения, после снятия швов прибегали к использованию ТИК и только спустя месяц подключали микродермабразию – 1 раз в неделю 4-6 процедур. Ситуационно, начинали лечение с консервативного варианта, который отличался от больных с ПР со сроком давности процесса до 1 года количеством микродермабразий, которое достигало 14 процедур с параллельным использованием ТИК. Наиболее сложным был выбор лечения при длительности ПР от 1 года до 3 лет, при которых чаще характерен умеренный фиброз. В таких случаях, существенное влияние на выбор метода терапии оказывала локализация ПР и клинические проявления.
Контролируемая микродермабразия ПР проводилась с помощью аппарата Ultrapeel (Mattiolli Ingeneering, Италия) с мощностью вакуума от 0,1 до 0,7 Бар. Аппарат имеет нагнетающий и аспирационный компрессоры, резервуары с рабочим и использованным абразивным порошком, а также наконечник, через который происходит выброс микрокристаллов оксида алюминия. Процедура контролированной МКДА заключалась в следующем: предварительно очищали зону рубца и окружающую кожу водным раствором хлоргексидина биглюконта. Затем выполняли МКДА. Микрокристаллы корунда управляемым потоком под давлением подавались на кожу. Контакт происходил путем герметичного соприкосновения с кожей эллиптического отверстия, расположенного на наконечнике. Вакуумный эффект, создающийся при этом, доставлял поток кристаллов к коже. Глубина воздействия зависила от скорости выброса микрокристаллов, которая определялась скоростью движения наконечника, числом проходов по одному и тому же участку, типом кожи пациента. Таким образом, МКДА позволяла проводить обработку кожи на разной глубине – от поверхностных слоев эпидермиса до глубоких слоев дермы [106]. Количество сеансов и глубина воздействия, необходимые для получения стойкого положительного эффекта, определялась индивидуально в зависимости от выраженности фиброза ПР и давности их существования. Режим 1 раз в неделю, 6 – 8–14 процедур.
Обоснованием для использования ТИК была доказанная его способность ингибировать транскрипцию генов, кодирующих продукцию провоспалительных цитокинов (ИЛ-3, ИЛ-4, ИЛ-5), гранулоцитарно-макрофагального колониестимулирующего фактора и фактора некроза опухолей -α, которые принимают участие в начальных этапах активации Т-лимфоцитов. Помимо этого, под влиянием ТИК происходит ингибирование высвобождения медиаторов воспаления из тучных клеток, базофилов и эозинофилов, а также снижение экспрессии FcεRI (высокоаффинный поверхностный рецептор для иммуноглобулина Е) на клетках Лангерганса, что, в свою очередь, ведет к снижению их активности и презентирования антигена Т-лимфоцитам, что обрывает иммунозависимое воспаление в дерме.
Топический ИК применяли в виде 0,1 % мази такролимуса, которую наносили на рубцы 2 раза в сутки в течение 4 недель, в дальнейшем частота применения уменьшалась до 1 раза в сутки в течение 3 месяцев.
Эффективность разработанного подхода оценивали по ближайшим и отдаленным результатам лечения в 2х группах сравнения.
С целью профилактики такие пациенты находились под диспансерным наблюдением в течение 2 лет с проведением 1 раз в год контрольных биофизических исследований, на основании которых принималось решение о целесообразности повторного, противорецидивного курса лечения, предполагающего месячный курс одновременного использования ТИК и 2-3 процедур контролируемой МКДА.
6.2 Оценка результатов лечения
6.2.1 Оценка клинических результатов
Проведен анализ клинической эффективности лечения в группах сравнения в зависимости от давности существования ПР.
Клиническое проявление симптомов уменьшались не зависимо от методов лечения. В основной группе больных клинические проявления исчезали в более короткие сроки [(28 ± 3,1) дня против (45 ± 5,3) дня в группе сравнения], а остаточные явления были менее выраженными.
Сравнение интенсивности фиброза в сравниваемых подгруппах 1а и 2а после лечения свидетельствовало об отсутствии фиброза – у 25 (65,8 %) и у 7 (58,3 %) больных соответственно, при этом, в 1,6 раза чаще отсутствие фиброза регистрировали при ГР, чем при КР в группе 1а, и несколько чаще при КР в группе 2а. Фиброз в 1-2 балла после лечения в группе 2а выявлен чаще в 1,2 раза, чем в группе 1а, при этом только у больных с КР. Выраженный фиброз после лечения не встречался ни в одной группе. До лечения фиброз в 1–2 балла встречался в 2 раза и 1,6 раза чаще в сравнении с группами 1а и 2а.
На основании сравнительного анализа клинических результатов лечения, было отмечено, что в обеих подгруппах (1а и 2а) соответственно у 29 (76,3 %) и 7 (58,3 %) пациентов патологические рубцы были цвета нормальной кожи, в том числе у 20 (87 %) больных с ГР и у 9 (60 %) больных с КР в группе 1а; а также у 5 (71,4 %) больных с ГР и у 2 (40 %) больных с КР в группе 2а. При этом, до лечения пациентов с рубцами с отсутствием окраски не наблюдалось. Со слабо розовой окраской ПР в группе 2а встречались чаще в 1,8 раза, чем в группе 1а, при этом, в 3 раза чаще в группе 1а и в 2 раза чаще в группе 2а преимущественно при КР. Интенсивная окраска в 2-3 баллов в обеих исследуемых группах не встречалась, при этом до лечения интенсивная окраска рубцов была у 42 (84 %). При оценке патологических рубцов с давностью до 6 месяцев выявили: отсутствие зуда в сравниваемых группах 1а и 2а после лечения наблюдалось у 33 (86,8 %) и 7 (58,3 %) больных соответственно, в то время как до лечения отсутствие жалоб на зуд было всего лишь у 8 (16 %) пациентов. ГР встречались чаще – 21 (91,3 %), чем КР 12 (80 %). Легкий зуд отмечали в группе 1а у 5 (13,2 %) больных, в группе 2а – у 4 (33,3 %) больных, при этом до лечения с зудом в 1 балл было 14 (28 %) пациентов. Обращало внимание, что больных с ГР с легким зудом было в 2,3 раза больше, чем с КР. В основной группе зуд в 2-3 баллов не встречался; в группе сравнения отмечен у 1 (8,3 %) больного, при этом только у пациентов с КР (табл. 6.1).
Таблица 6.1 – Степень выраженности клинических признаков патологических рубцов основной и группы сравнения давностью заболевания до 6 мес.
| Симптомы | Основная группа, 1а | Группа сравнения, 2а | ||||||
| ГР, n = 23 | КР, n = 15 | ГР, n = 7 | КР, n = 5 | |||||
| Абс. | % | Абс. | % | Абс. | % | Абс. | % | |
| ФИБРОЗ, баллы | ||||||||
| 0 | 18 | 78,3 | 7 | 46,7 | 4 | 57,1 | 3 | 60 |
| 1 | 5 | 21,7 | 6 | 40 | 3 | 42,9 | 1 | 20 |
| 2 | 0 | 0 | 2 | 13,3 | 0 | 0 | 1 | 20 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| р * | χ2=30,4; р=0,0001* | χ2=18,8; р=0,0003* | χ2=12,0; р=0,007* | χ2=14,5; р=0,002* | ||||
| ОКРАСКА, баллы | ||||||||
| 0 | 20 | 87 | 9 | 60 | 5 | 71,4 | 2 | 40 |
| 1 | 3 | 13 | 6 | 40 | 2 | 28,6 | 3 | 60 |
| 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| р * | χ2=44,8; р<0,0001* | χ2=28,8; р=0,0001* | χ2=27,2; р=0,0001* | χ2=17,5; р=0,0006* | ||||
| ЗУД, баллы | ||||||||
| 0 | 21 | 91,3 | 12 | 80 | 4 | 57,1 | 3 | 60 |
| 1 | 2 | 8,7 | 3 | 20 | 3 | 42,9 | 1 | 20 |
| 2 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 20 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| р * | χ2=22,5; р=0,0001* | χ2=28,9;р=0,0001* | ||||||
Примечание. Р – статистическая оценка различий по сравнению с исходными характеристиками (критерий Хи – квадрат, * – р<0,05).
Отсутствие плотности рубца наблюдали у 15 (71,4 %) пациентов с ПР в группе 1б и у 4 (50 %) пациентов в группе 2б, при этом с ГР – у 9 (75 %) больных и с КР – у 6 (66,7 %) в группе 1б, а также у 3 (60 %) пациентов с ГР и 1 (33,3 %) больного с КР в группе 2б. Фиброз в 1 балл в 1б и 2б группах встречался практически одинаково – у 6 (28,6 %) и 2 (25 %) больных соответственно, чаще при КР, чем ГР. Фиброз в 2 балла встречался только в группе сравнения, при этом чаще у больных с КР, чем с ГР (табл. 6.2).
Таблица 6.2 – Степень выраженности клинических признаков патологических рубцов основной и группы сравнения давностью заболевания от 6 месяцев до 1 года
| Симптомы | Основная группа, 1б | Группа сравнения, 2б | ||||||
| ГР, n = 12 | КР, n = 9 | ГР, n = 5 | КР, n = 3 | |||||
| Абс. | % | Абс. | % | Абс. | % | Абс. | % | |
| ФИБРОЗ, баллы | ||||||||
| 0 | 9 | 75 | 6 | 66,7 | 3 | 60 | 1 | 33,3 |
| 1 | 3 | 25 | 3 | 33,3 | 1 | 20 | 1 | 33,3 |
| 2 | 0 | 0 | 0 | 0 | 1 | 20 | 1 | 33,3 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| р * | χ2=14,0; р=0,0001* | χ2=14,9;р=0,002* | χ2=5,2; р=0,076 | χ2=6,1;р=0,105 | ||||
| ОКРАСКА, баллы | ||||||||
| 0 | 10 | 83,3 | 6 | 66,7 | 4 | 80 | 1 | 33,3 |
| 1 | 2 | 22,2 | 3 | 33,3 | 1 | 20 | 1 | 33,3 |
| 2 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 33,3 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| р * | χ2=17,2; р=0,0006 | χ2=16,1;р=0,001* | χ2=10,1; р=0,02 | χ2=5,2;р=0,160 | ||||
| ЗУД, баллы | ||||||||
| 0 | 11 | 91,7 | 7 | 77,8 | 4 | 80 | 2 | 66,7 |
| 1 | 1 | 8,3 | 2 | 22,2 | 1 | 20 | 1 | 33,3 |
| 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| р * | χ2=15,2; р=0,076 | χ2=13,3;р=0,004* | χ2=1,5; р=0,476 | χ2=6,7;р=0,083 | ||||
Примечание. Р – статистическая оценка различий по сравнению с исходными характеристиками (до лечения) (критерий Хи – квадрат, * – р<0,05).
Весомые изменения произошли в изменении окраски в области рубцов: после лечения ПР побледнели у 16 (76,2 %) пациентов в 1б группе и у 5 (62,5 %) пациентов в 2б группе, при этом ГР было больше в обеих группах, чем келоидов. Отсутствие окраски до лечения было лишь у 2 (6,8 %) пациентов. Слабо розовая окраска чаще отмечалась в группе сравнения – у 2 (25 %) больных, больше в основной группе – у 5 (23, 8 %) больных, при этом чаще при КР, чем при ГР (табл. 6.2).
При оценке субъективных признаков отмечено, что у пациентов с ПР с давностью от 6 месяцев до 1 года после лечения, зуд отсутствовал у 18 (85,7 %) больных группы 1б и лишь у 6 (75 %) группы 2б. При этом у больных с ГР отсутствовал зуд у 11 (91,7 %), а у больных с КР – у 7 (77,8 %) в группе 1б, а в группе 2б таких больных было с ГР – 4 (80,5 %), с КР – 2 (66,7 %) больных. До лечения с отсутствием жалоб на зуд было лишь 10 (34,5 %) пациентов. На легкий зуд жаловались лишь 3 (14,3 %) пациента в группе 1б, в группе 2б – 2 (25 %). При этом ГР в группах 1б и 2б было 1 (8,3 %), 2 (22,2 %), а КР – 1 (20 %), 1 (33,3 %) больных.
Следует отметить, что в группе 1в отсутствие фиброза отмечали у 11 (55 %) больных, а в группе 2в – у 2 (33,3 %) пациентов. До лечения фиброз отсутствовал у 1 (3,8 %) пациента. В группе сравнения фиброз в 1 и 2 баллов встречался одинаково часто, при этом с одинаковой частотой в каждой группе. В основной группе фиброз в 1 и 2 балла отмечали у 6 (30 %) и 3 (15 %) больных, до лечения – у 11 (42,3 %) и 12 (46,2 %) больных соответственно. Фиброз в 3 балла до лечения встречался у 2 (7,7 %) больных, в то время как после лечения таких пациентов не наблюдали (табл. 6.3).
Окраска ПР в группах 1в и 2в, соответствующая цвету нормальной кожи, была у 12 (60 %) и 2 (33,3 %) больных соответственно. При этом в группе 1в чаще встречались келоиды с отсутствием окраски – 4 (66,7 %) случая, а в группе 2в одинаково часто как у больных с ГР – 1 (33,3 %), так и с КР – 1 (33,3 %). Несколько чаще в группе 1в отмечали слабо розовую окраску – у 8 (40 %) человек, посравнению с группой 2в, при этом больных с КР было одинаковое количество в обеих группах (по (33,3 %) больных), и несколько больше с ГР в 2в – 6 (42,9 %), чем в 1в – 1 (33,3 %).
Таблица 6.3 – Степень выраженности клинических признаков патологических рубцов основной и группы сравнения давностью заболевания от 1 года до 3 лет
| Симптомы | Основная группа, 1в | Группа сравнения, 2в | ||||||
| ГР, n=14 | КР, n=6 | ГР, n=3 | КР, n=3 | |||||
| Абс. | % | Абс. | % | Абс. | % | Абс. | % | |
| ФИБРОЗ, баллы | ||||||||
| 0 | 8 | 57,1 | 3 | 50 | 1 | 33,3 | 1 | 33,3 |
| 1 | 4 | 28,6 | 2 | 33,3 | 1 | 33,3 | 1 | 33,3 |
| 2 | 2 | 14,3 | 1 | 16,7 | 1 | 33,3 | 1 | 33,3 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| р * | χ2=11,3; р=0,01* | χ2=5,7; р=0,057* | χ2=2,4; р=0,497 | χ2=3,3; р=0,193 | ||||
| ОКРАСКА, баллы | ||||||||
| 0 | 8 | 57,1 | 4 | 66,7 | 1 | 33,3 | 1 | 33,3 |
| 1 | 6 | 42,9 | 2 | 33,3 | 1 | 33,3 | 1 | 33,3 |
| 2 | 0 | 0 | 0 | 0 | 1 | 33,3 | 1 | 33,3 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| р * | χ2=3,8; р=0,147 | χ2=6,7; р=0,083 | χ2=0,7; р=0,690 | χ2=1,1; р=0,785 | ||||
| ЗУД, баллы | ||||||||
| 0 | 12 | 85,7 | 4 | 66,7 | 2 | 66,7 | 1 | 33,3 |
| 1 | 2 | 14,3 | 2 | 33,3 | 1 | 33,3 | 2 | 66,7 |
| 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| р * | χ2=8,4; р=0,015* | χ2=6,7;р=0,038* | χ2=1,3; р=0,532 | χ2=4,9; р=0,089 | ||||
Примечание. Р – статистическая оценка различий по сравнению с исходными характеристиками (критерий Хи – квадрат, * – р<0,05).
При оценке зуда в области ПР давностью от 1 до 3 лет установлено, что отсутствие признака в группе 1в составило 16 (80 %), а в группе 2в – 3 (50 %) больных. В группе 1в было 12 (85,7 %) больных с ГР, с КР – 4 (66,7 %); в группе 2в больных с ГР было 2 (66,7 %), с келоидами – 1 (33,3 %) больной. До лечения на отсутствие зуда жаловались 6 (23 %) пациентов с ПР. С легким зудом в группе 1в было 4 (20 %) пациентов, при этом в группе 2в было 3 (50 %) таких больных, при этом келоидов было в 2 раза больше, чем ГР в обеих группах.
Отсутствие фиброза регистрировали в группе 1г у 13 (76,5 %) больных, в группе 2г – у 2 (40 %) больных, при этом в 2г группе эта тенденция четче прослеживалась у больных с келоидами (2 (25 %)), а в группе 1г с ГР – 7 (77,8 %) больных. Фиброз в 1 балл встречался у 4 (23,5 %) больных в 1г группе, и у 2 (40 %) в группе 2г, при этом в обеих группах чаще у больных с КР (у 2 (25 %) и 1 (50 %) больного соответственно).
Динамика окраски ПР после лечения ярче была в группе 1г – у 12 (70,6 %) больных, чем в группе 2г – у 3 (60 %) больных. Отмечено, что при ГР эффект лечения объективно был более выражен – у 7 (77,8 %) и у 2 (66,7 %) больных, чем при келоидах – у 5 (62,5 %) и у 1 (50 %) больных. Слабо розоваяя окраска наблюдалась у 5 (29, 4 %) больных в группе 1г и у 2 (40 %) больных группы 2г. Обращало внимание, что более выраженная окраска была у больных с КР в обеих группах (табл. 6.4).
Оценивая степень выраженности ПР сроком свыше 3 лет, было выявлено, что в группах 1г и 2г зуд отсутствовал у большинства пациентов, однако в группе 1г это наблюдалось у большего количества пациентов – у 14 (82,4 %) и у 3 (60 %) больных соответственно. Лучшая тенденция выявлялась у больных с ГР в обеих группах. Легкий зуд наблюдался у 5 (29,4 %) больных в группе 1г и у 2 (40 %) больных в группе 2г, при этом в 1г и 2г группах у больных с КР несколько чаще – у 1 (12,5 %), чем с ГР – 1 (11,1 %) и 1 (50 %) и 1 (33,3 %) больных соответственно (табл. 6.4).
Достижение оптимальных результатов лечения (исчезновение зуда, исчезновение фиброза, нормализация окраски) отмечали в обеих группах (1 и 2 группа) у больных с ГР, но чаще в основной группе (рис. 6.2, табл.6.5).
Таблица 6.4 – Степень выраженности клинических признаков патологических рубцов основной и группы сравнения давностью заболевания свыше 3 лет
| Симптомы | Основная группа, 1г | Группа сравнения, 2г | ||||||
| ГР, n = 9 | КР, n = 8 | ГР, n = 3 | КР, n=2 | |||||
| Абс. | % | Абс. | % | Абс. | % | Абс. | % | |
| ФИБРОЗ, баллы | ||||||||
| 0 | 7 | 77,8 | 6 | 75 | 1 | 33,3 | 1 | 50 |
| 1 | 2 | 22,2 | 2 | 25 | 1 | 33,3 | 1 | 50 |
| 2 | 0 | 0 | 0 | 0 | 1 | 33,3 | 0 | 0 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| р * | χ2=12,0; р=0,003* | χ2=14,0;р=0,003* | χ2=1,4; р=0,495 | χ2=7,2;р=0,065 | ||||
| ОКРАСКА, баллы | ||||||||
| 0 | 7 | 77,8 | 5 | 62,5 | 2 | 66,7 | 1 | 50 |
| 1 | 2 | 22,2 | 3 | 37,5 | 1 | 33,3 | 1 | 50 |
| 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| р * | χ2=4,8; р=0,092 | χ2=9,5;р=0,009* | χ2=1,5; р=0,482 | χ2=5,7;р=0,006 | ||||
| ЗУД, баллы | ||||||||
| 0 | 8 | 88,9 | 7 | 87,5 | 2 | 66,7 | 1 | 50 |
| 1 | 1 | 11,1 | 1 | 12,5 | 1 | 33,3 | 1 | 50 |
| 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| р * | χ2=0,6; р=0,422 | χ2=6,1;р=0,047* | χ2=0,1; р=0,770 | χ2=0,6;р=0,741 | ||||
Примечание. Р – статистическая оценка различий по сравнению с исходными характеристиками (до лечения) (критерий Хи – квадрат, * – р<0,05)
Исчезновение зуда в основной группе больных с ГР отмечено у 52 (89,7 %) пациентов. В группе сравнения этот показатель был существенно ниже, поскольку у 1/3 пациентов сохранился зуд после лечения, при снижении его интенсивности (p=0,019). По параметрам «исчезновение фиброза» и «нормализация окраски» различия достижения оптимальных результатов у больных с ГР менее значимы (p>0,05), однако сохраняется тенденция к лучшим результатам в основной группе (табл.6.5).
Рисунок 6.2 – Больная Д., 17 лет. Вид патологического рубца до комплексного лечения (А) и после (Б)
Таблица 6.5 – Частота достижения оптимальных результатов лечения в группах сравнения при гипертрофических рубцах
| Показатель | Групи | Достижение оптимального результата (0 баллов) | Отношение шансов OR (95 %ДІ) | р (χ2) |
| Исчезновение зуда | основная (n=58) | 52 (89,7 %) | 4,33
(1,19 – 15,81) |
0,019 * |
| сравнения (n=18) | 12 (66,7) | |||
| Исчезновение фиброза | основная (n=58) | 42 (72,4 %) | 2,63
(0,88 – 7,80) |
0,077 |
| сравнения (n=18) | 9 (50,0 %) | |||
| Нормализация окраски | основная (n=58) | 45 (77,6 %) | 1,73
(0,54 – 5,51) |
0,350 |
| сравнения (n=18) | 12 (66,7 %) |
Примечание. * – статистически значимая оценка (p<0,05).
Сравнительный анализ эффективности лечения больных с ГР показал, что вероятность достижения оптимального результата в основной группе по параметру «Исчезновение зуда» в 4,33 раза выше, чем в группе сравнения – OR = 4,33 (1,19 – 15,81); по признаку «Исчезновение фиброза» в основной группе – в 2,63 раза выше OR = 2,63 (0,88 – 7,80); по признаку «Нормализация окраски» в основной группе – в 1,73 раза выше OR = 1,73 (0,54 – 5,51). Интегральная оценка по трем вышеуказанным параметрам свидетельствует о статистически значимом преобладании вероятности достижения оптимального результата лечения в основной группе в сравнении с группой сравнения в среднем в 2,58 раза – OR = 2,58 (1,32 – 5,05) (рис. 6.3).
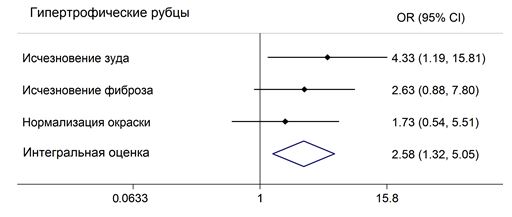
Рисунок 6.3 – Прогностическая оценка достижения оптимальных результатов в основной группе больных с ГР по сравнению с контрольной группой (группой сравнения) (по показателям отношения шансов – OR).
Достижение оптимальных результатов лечения (исчезновение зуда, исчезновение фиброза, нормализация окраски) отмечали в обеих группах (1 и 2 группа) у больных с КР при лучших результатах все же в основной группе (табл.6.6).
Исчезновение зуда в основной группе больных с КР отмечено у 30 (78,9 %) пациентов. В группе сравнения этот показатель был отчетливо ниже, поскольку у 7 (53,8 %) пациентов зуд сохранился после лечения. Показатели «исчезновение фиброза» и «нормализация окраски» были несколько выше в основной группе больных с КР. Так, исчезновение фиброза отмечено у 22 (57,9 %) пациентов основной группы и у 6 (46,2 %) группы сравнения, а нормализация окраски у 24 (63,2 %) основной группы и у 5 (38,5 %) группы сравнения.
Таблица 6.6 – Частота достижения оптимальных результатов лечения в группах сравнения при келоидных рубцах
| Показатель | Групи | Достижение оптимального результата (0 баллов) | Отношение шансов OR (95 %ДІ) | р (χ2) |
| Исчезновение зуда | основная (n=38) | 30 (78,9 %) | 3,21
(0,84 – 12,28) |
0,080 |
| сравнения (n=13) | 7 (53,8 %) | |||
| Исчезновение фиброза | основная (n=38) | 22 (57,9 %) | 1,60
(0,45 – 5,69) |
0,463 |
| сравнения (n=13) | 6 (46,2 %) | |||
| Нормализация окраски | основная (n=38) | 24 (63,2) | 2,74
(0,75 – 10,04) |
0,121 |
| сравнения (n=13) | 5 (38,5 %) |
Примечание. * – статистически значимая оценка (p<0,05).
Сравнительный анализ эффективности лечения у больных с КР показал, что вероятность достижения оптимального результата в основной группе по параметру «Исчезновение зуда» в 3,21 раза выше, чем в группе сравнения – OR = 3,21 (0,84 – 12,28); по признаку «Исчезновение фиброза» в основной группе – в 1,60 раза выше OR = 1,60 (0,45 – 5,69); по признаку «Нормализация окраски» в основной группе – в 2,74 раза выше OR = 2,74 (0,75 – 10,04). Интегральная оценка по трем вышеуказанным параметрам свидетельствует о преобладании вероятности достижения оптимального результата лечения в основной группе, чем в группе сравнения в среднем в 2,37 раза – OR = 2,37 (1,12 – 5,01) (рис. 6.4).
Рисунок 6.4 – Прогностическая оценка достижения оптима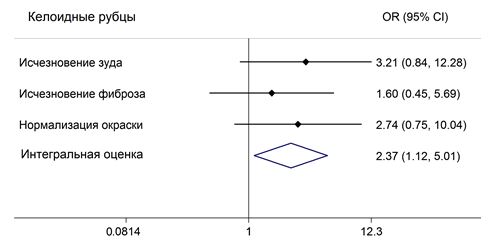 льных результатов в основной группе больных с КР по сравнению с контрольной группой (группой сравнения) (по показателям отношения шансов – OR).
льных результатов в основной группе больных с КР по сравнению с контрольной группой (группой сравнения) (по показателям отношения шансов – OR).
Таким образом, проведенные исследования показали:
1. При сравнительной характеристике больных с ПР до и после лечения выявлено значительное снижение зуда как в основной, так и в группе сравнения, более выраженное в основной группе. Анализируя клинические признаки больных с КР, установлено, что зуд отсутствовал у большинства пациентов в обеих группах, однако в основной группе это наблюдалось у большего количества пациентов. В группе сравнения сохранялся умеренный зуд после лечения.
2. В ходе лечения отмечено снижение плотности рубцов, более значимое в основной группе. В обеих группах после лечения отсутствовали ГР с фиброзом в 3 балла. Комплексное лечение КР повлияло на снижение их плотности, однако умеренная плотность сохранялась у 7,9 % больных с келоидами в основной группе и у 23,1 % больных группы сравнения.
3. После применения комбинированного лечения рубцы приобрели цвет нормальной кожи в 77,6 % случаев в основной группе, и у 66,7 % случаев в группе сравнения. В группе сравнения сохранялась окраска в 2 балла, в основной группе таких рубцов не наблюдалось. Келоиды с окраской в 0 баллов встречались чаще в основной группе, в группе сравнения отмечали большинство келоидов со слабо розовой окраской, а также сохранялось 15,4 % больных с КР, имеющими розово-красную окраску, после традиционного лечения.
4. Клинический анализ больных с ГР показал, что при применении комбинированного лечения жалобы на зуд исчезали в 4,33 раза чаще, чем в группе сравнения. При использовании комбинированной тактики у пациентов с КР эффективность терапии была в 3,21 раза выше, чем в группе сравнения. Уменьшение фиброза происходило быстрее в основной группе больных при всех видах ПР, однако более четче прослеживалось в группе больных с ГР, чем с КР (в 2,63 раза и 1,60 раза соответственно). Нормализация окраски отмечена при всех видах ПР как в основной, так и в группе сравнения, однако этот признак был четче выражен у больных с КР, чем у больных с ГР (в 2,74 раза и 1,73 раза соответственно).
6.2.2 Динамика изменения биофизических характеристик патологических рубцов после лечения
При анализе биофизических характеристик ПР после лечения давностью до 6 месяцев отмечено, что эритема отсутствовала у 31 (81,6 %) пациентов больных 1а группы и у 7 (58,3 %) пациентов 2а группы. При этом у 19 (82,6 %) пациентов с ГР и у 12 (80 %) с КР эритема отсутствовала. Незначительная эритема сохранялась у 7 (18,4 %) больных группы 1а и у 5 (41,7 %) больных группы 2а. Интенсивная эритема не встречалась ни в одной из групп.
У 28 (73,7 %) больных с ПР группы 1а отмечали отсутствие пигментации. В группе 2а у 8 (66,7 %) больных пигментация также отсутствовала. При этом в группе 1а практически одинаково встречались как ГР (у 17 (73,9 % больных)), так и келоиды – (у 11 (73,3 %) больных). В группе 2а чаще отмечали ГР – у 5 (71,4 %) больных. Незначительную пигментацию отмечали у 10 (26,3 %) больных группы 1а и у 4 (33,3 %) больных группы 2а. При этом в группе 1а практически одинаково часто встречались ГР и келоиды, а в группе 2а чаще КР – у 2 (40 %) больных.
При анализе сосудистого компонента выявлено, что после лечения у 23 (60,5 %) больных группы 1а и у 2 (16,7 %) больных группы 2а сосудистый компонент отсутствовал. При этом в обеих группах отсутствие сосудов чаще встречались при КР, чем при ГР. Единичные сосуды чаще встречались в группе 2а – (у 5 (41,7 %) больных), чем в группе 1а – (у 12 (31,6 %) больных). При этом в группе 1а встречались чаще келоиды – у 5 (33,3 %), чем ГР – у 7 (30,4 %) больных, а в группе 2а несколько чаще ГР – у 3 (42,9 %) больных, чем КР – у 2 (40 %) больных. Умеренное количество сосудов чаще отмечали в группе 2а – 5 (41,7 %), чем в группе 1а – 3 (7,9 %) больных.
При проведении анализа вискоэластичности установили ее снижение у 24 (63,1 %) больных с ПР группы 1а и у 6 (50 %) больных группы 2а, при этом в группе 1а больше при келоидах – у 10 (66,7 %) больных, чем при ГР – у 14 (60,9 %) больных; а в группе 2а несколько чаще при ГР – у 4 (57,1 %) больных, чем при келоидах – у 2 (40 %) больных. Средняя вискоэластичность несколько чаще наблюдалась в группе 2а – у 4 (33,3 %) больных, чем в группе 1а – у 12 (31,6 %) больных. Повышенные показатели вискоэластичности оставались у 2 (5,3 %) больных группы 1а и у 2 (16,7 %) больных группы 2а, при этом в обеих группах несколько чаще при келоидах.
При проведении анализа ТЭПВ после лечения в группах 1а и 2а отмечали ее отсутствие у 23 (60,5 %) больных и 6 (50 %) больных соответственно. При этом в обеих группах больных с ГР чаще – 15 (65,2 %) больных в группе 1а и 4 (57,2 %) в группе 2а, чем у больных с келоидами – 8 (53,3 %) в группе 1а и 2 (40 %) в группе 2а. Незначительная ТЭПВ несколько чаще встречалась в группе 1а – у 14 (36,8 %) больных, чем в группе 2а – у 4 (33,3 %) больных. При этом ТЭПВ отсутствовала у большинства пациентов с ГР – у 15 (65,2 %), как и у пациентов с КР – у 8 (53,3 %).
Уровень рН кожи у больных с ГР и КР после лечения стал нейтральным у 25 (65,8 %) и находился в пределах 4,4–5,8.
При анализе ПР после лечения давностью от 6 до 12 месяцев отмечено, что у 14 (66,7 %) пациентов группы 1б и у 5 (62,5 %) больных группы 2б эритема отсутствовала. При этом в обеих группах выраженный эффект наблюдался при ГР у 9 (75 %) больных группы 1б и у 4 (80 %) больных группы 2б. Незначительная эритема сохранялась у небольшого количества пациентов группы 1б – у 7 (33 %) больных и у 3 (37,5 %) больных группы 2б. При этом она чаще регистрировала при келоидах в группах 1б и 2б – у 4 (44,4 %) и у 2 (66,7 %) больных соответственно.
У большинства больных с ПР групп 1б (18 (85,7 %)) и 2б (6 (75 %)) после лечения отмечалось отсутствие пигментации. Так, пигментация после лечения отсутствовала у 4 (80 %) больных с ГР в группе 2б и у 8 (88,9 %) больных с КР группы 1б. Незначительная пигментация осталась у 3 (14,3 %) пациентов группы 1б, а в группе 2б – у 2 (25 %) пациентов. Незначительная пигментация в группе 1б с ГР встречалась в 2 раза чаще, чем с КР, а в группе 2б чаще у больных с КР – 1 (33,3 %), чем с ГР – 1 (20 %).
При анализе сосудистого компонента выявлено более частое его отсутствие в группе 1б (у 12 (57,1 %) больных), чем в группе 2б – (у 3 (37,5 %) больных), при этом в обеих группах несколько чаще у больных с ГР – у 7 (58,3 %) и у 2 (40 %) соответственно, чем с КР – у 5 (55,6 %) и у 1 (33,3 %) больных. Единичные сосуды чаще встречались в группе 2б – (у 3 (75 %) больных), чем в группе 1б (6 (28,6 %) больных). При этом единичные сосуды в группе 1б одинаково часто встречались как у больных с ГР – у 4 (33,3 %), так и у больных с КР – у 3 (33,3 %). В группе 2б единичные сосуды встречались несколько чаще у больных с ГР – у 2 (40 %), чем с КР – у 1 (33,3 %) больных. Умеренное количество сосудов после лечения в 2,6 раза чаще встречалось в группе 2б. При этом в обеих группах с 10-20 сосудами было больше келоидных рубцов.
При оценке вискоэластичности получили, что сниженный признак в 4,5 раза чаще встречался в группе 1б, чем в 2б, у больных с ГР, чем с КР. Средняя вису коэластичность превалировала в группе 2б (4 (50 %) больных ПР), чем в группе 1б (6 (28,6 %) больных). При этом в группе 1б чаще регистрировали келоиды, а в группе 2б – ГР. Повышенная вискоэластичность чаще наблюдалась в группе 2б – у 3 (37,5 %) больных, чем в группе 1б – у 3 (14,3 %) больных. При этом в группе 1б несколько чаще – у больных с ГР – 2 (16,7 %), чем с КР (7 (11,1 %) больных), а в группе 2б в 3 раза чаще келоиды.
При проведении анализа ТЭПВ отмечали ее отсутствие у 15 (71,4 %) пациентов группы 1б и у 5 (62,5 %) больных группы 2б. Отсутствие ТЭПВ при ГР группы 1б наблюдалось у 9 (75 %) больных, в то время как в группе 2б их было 3 (60 %) больных. Незначительная ТЭПВ сохранялась у 6 (28,6 %) больных группы 1б и у 3 (37,5 %) больных группы 2б. В обеих группах преобладали ГР с незначительными показателями ТЭПВ. Умеренная ТЭПВ встречалась только в группе 1б (1 (4,8 %) больных), при этом только у больных с КР – у 1 (11,1 %).
Показатель уровня рН кожи в области ПР стала нейтральной у большинства пациентов в обеих группах – у 16 (76,2 %) и у 5 (62,5 %) больных. Нейтральная рН встречалась в основном у больных с келоидами в обеих группах. Кислая рН встречалась у 4 (19 %) больных группы 1б и у 3 (37,5 %) больных группы 2б. В группе 1б чаще встречались келоиды – у 2 (22,2 %), чем ГР – у 2 (16,7 %), а в группе 2б ГР – у 2 (40 %) больных, чем КР – у 1 (33,3 %) больных. Щелочная рН встречалась только в группе 1б – 1 (4,8 %), и только у больных сё ГР – 1 (8,3 %).
Рассматривая свойства ПР до лечения давностью от 1 до 3 лет отмечено, что у 13 (65 %) больных в группе 1в эритема отсутствовала, в группе 2в их было всего лишь 2 (33,3 %). При этом в группе 1в у 9 (64,3 %) больных с ГР, а с келоидами у 4 (66,7 %) больных эритема отсутствовала после лечения. В группе 2в больных с ГР и КР было одинаковое количество. Незначительная эритема наблюдалась в основном в группе 2в – у 4 (66,7 %) больных, а в группе 1в таких больных было в 2 раза меньше. При этом несколько чаще в группе 1в регистрировались ГР – у 5 (35,7 %), в группе 2в одинаково часто – как ГР, так и КР.
У 16 (75,9 %) больных с ПР в группе 1в отмечали отсутствие или слабо выраженную пигментацию, а в группе 2в таких больных было 4 (66,7 %). При этом чаще в группе 1в встречались КР – 5 (83,3 %), в группе 2в одинаково часто встречались как ГР, так и КР. Незначительная пигментация в группе 1в наблюдалась у 4 пациентов (20 %), в группе 2в – у 2 (33,3 %). Обращало внимание преобладание ГР в группе 1в – у 3 (21,4 %), чем КР – у 1 (16,7 %), в то время как в группе 2в одинаково часто встречались больные с КР и ГР.
При анализе сосудистого компонента установлено, что одинаково часто в группе 1в наблюдалось отсутствие или единичные сосуды – у 9 (45 %) и 9 (45 %) больных соответственно, а в группе 2в чаще встречались единичные сосуды – у 4 (66,7 %) больных, чем их отсутствие (2 (33,3 %) больных). Отсутствие сосудов в группе 1в чаще встречалось у больных с келоидами (66,7 %), а единичные сосуды у больных с ГР – 7 (50 %). В группе 2в одинаково часто встречались как больные с ГР, так и с келоидами.
При анализе вискоэластичности зарегистрированы сниженные показатели в группе 1в у 10 (50 %) больных, в группе 2в – у 1 (16,7 %) больных, при этом в обеих группах чаще у больных с ГР. Средние показатели вискоэластичности в 2 раза чаще встречались в группе 2в, при этом одинаково часто как у больных с ГР, так и с КР, а в группе 1в чаще у больных с келоидами. Повышенная вискоэластичность оставалась у 3 (15 %) больных группы 1в и у 1 (16,7 %) больных группы 2в, при этом чаще у пациентов с КР в обеих группах.
При проведении анализа ТЭПВ отмечали ее отсутствие у большинства пациентов 13 (65 %) в группе 1в, при этом чаще у больных с КР – у 5 (83,3 %), чем с ГР – 8 (57,1 %). В группе 2в чаще встречали незначительную ТЭПВ (10-13 ус.ед.), в 2 раза чаще у больных с ГР, чем с КР. Несколько чаще в группе 2в выявлялась умеренная ТЭПВ (у 1 (16,7 %) пациента), чем в группе 1в (у 1 (5 %) пациента), при этом умеренная ТЭПВ отмечена в группе 1в только у больных с ГР, а в группе 2в – с КР.
Уровень рН кожи больных с ГК и КР после лечения отклонялся преимущественно в нейтральную сторону у 14 (70 %) пациентов в группе 1в и у 4 (66,7 %) пациентов в группе 2в. При этом, в группе 1в с нейтральной рН чаще встречались ГР (у 10 (71,4 %) больных), чем КР (у 4 (66,7 %) человек), в то время как в группе 2в одинаково часто отмечали как ГР, так и КР.
При сравнительном анализе эритемы ПР в группах 1г и 2г получили, что она отсутствовала у большинства пациентов – 12 (70,6 %) и 3 (60 %) соответственно. При этом более выраженным результат был у больных с ГР – у 7 (77,8 %) больных группы 1г и у 2 (66,7 %) больных группы 2б, чем с КР – у 5 (62,5 %) больных группы 1г и у 1 (50 %) больных группы 2г. Незначительная эритема сохранялась у большего количества больных группы 2г – у 2 (40 %), чем группы 1г – у 5 (29,4 %) больных, при этом в обеих группах больше при келоидах – у 3 (37,5 %) и у 1 (50 %) больного, чем при ГР – у 2 (22,2 %) и у 1 (33,3 %) больного.
Обращало внимание, что эффективнее пигментация исчезала у больных группы 1г – у 13 (76,5 %) больных, чем группы 2г – у 3 (60 %) больных. При этом в обеих группах более быстрый процесс отмечался у больных с ГР – у 7 (77,8 %) и у 2 (66,7 %), чем с КР – 6 (75 %) и 1 (50 %) больных. Незначительная пигментация в группе 1г встречалась в 1,7 раза реже, чем в группе 2г, при этом в обеих группах чаще у больных с КР, чем с ГР.
При анализе сосудистого компонента отмечено, что только в группе 1г имело место отсутствие сосудов – у 8 (47,1 %), причем чаще всего наблюдалось у больных КР – у 4 (50 %), чем ГР – у 4 (44,4 %). Единичные сосуды в 2,5 раза чаще встречались в группе 2г, чем в группе 1г, при этом в последней чаще среди больных с КР – у 2 (25 %), чем среди больных с ГР – у 2 (22,2 %). Наоборот, в группе 2г чаще регистрировали больных с ГР – 2 (66,7 %), чем с КР – 1 (50 %). Умеренное количество сосудов в 1,3 раза чаще выявляли в группе 2г.
При анализе вискоэластичности обращало внимание что, в группе 1г преобладали ПР со сниженными показателями – у 12 (70,6 %) больных, при этом было несколько больше больных с ГР – у 7 (77,8 %), чем с КР – у 5 (62,5 %) больных. В группе 2г сниженная вискоэластичность наблюдалась у 1 (20 %), при этом только при ГР. Средняя вискоэластичность в большей степени наблюдалась у больных группы 2г – у 3 (60 %) больных, чаще у больных с ГР – 2 (66,7 %), чем с КР – 1 (50 %). В группе 1г этот показатель составлял 4 (23,5 %) больных, при этом больше выраженный у больных с КР – 2 (25 %), чем у больных с ГР – 2 (22,2 %). Повышенная вискоэластичность оставалась значимой в группе 2г – у 1 (20 %) больного, при этом только при КР – 1 (50 %) больной. В группе 1г наблюдалось 1 (5,9 %) больной с ПР (КР).
Отсутствие ТЭПВ наблюдалось у 12 (70,6 %) больных группы 1г и всего лишь у 1 (20 %) больных группы 2г. При этом несколько чаще отсутствие ТЭПВ в группе 1г отмечали при ГР – у 7 (77,8 %) больных, чем при келоидах – у 5 (62,5 %) больных. В группе 2г только при ГР – 1 (33,3 %) больной. Обращало внимание, что незначительная ТЭПВ встречалась чаще в группе 2г (2 (40 %) больных), чем в группе 1г – 3 (17,6 %) больных, при этом в обеих группах превалировали КР. Умеренная ТЭПВ отмечалась у 2 (11,8 %) больных группы 1г и у 2 (40 %) больных группы 2г, в обеих группах чаще при келоидах.
У большинства больных ПР обеих групп рН была отклонена в нейтральную сторону – у 11 (64,7 %) и у 3 (60 %) больных. При этом в группе 1г с нейтральной рН чаще регистрировались КР – у 6 (75 %) пациентов, чем ГР – у 5 (55,6 %) больных. В группе 2г несколько чаще отмечали ГР – у 2 (66,7 %), чем КР – у 1 (50 %) больных. Кислая рН ПР наблюдалась несколько чаще в группе 1г – у 5 (29,4 %), чем в группе 2г – 1 (20 %) больных. При этом в группе 1г кислая рН превалировала у больных с ГР – 3 (33,3 %) – по сравнению с КР – 2 (25 %) больных. В группе 2г кислая рН была только при КР – 1 (50 %) больной. Щелочная рН в основном регистрировалась в группе 2г – у 1 (20 %), реже в группе 1г – у 1 (5,9 %) больных, причем у больных с ГР (у 1 (11,1 %) и у 1 (33,3 %) больных соответственно).
Достижение оптимальных результатов лечения (отсутствие эритемы, пигментации, сосудистого компонента, ТЭПВ, снижение вискоэластичности, нейтральная рН, отмечали в обеих группах больных с ГР, однако лучшие результаты чаще отмечали в основной группе.
Сравнительный анализ эффективности лечения показал, что вероятность достижения оптимального результата в основной группе у больных с ГР по параметру «Отсутствие эритемы» в 1,57 раза выше, чем в группе сравнения – OR = 1,57 (0,50 – 4,96); по признаку «отсутствие пигментации» – в основной группе в 1,33 раза выше, чем в группе сравнения OR = 1,33 (0,40 – 4,43); по признаку «отсутствие сосудистого компонента» – в основной группе в 3,50 раза выше OR = 3,50 (1,03 – 11,91). По параметру «снижение вискоэластичности» выше в основной группе в 2,57 раза, чем в группе сравнения OR = 2,57 (0,87 – 7,62); по признаку «отсутствие ТЭПВ» в основной группе в 2,05 раза выше OR = 2,05 (0,70 – 6,01); по параметру «нейтральная рН» показатели в основной группе были выше в 2,12 раза, чем в группе сравнения OR = 2,12 (0,67 – 6,67) (рис. 6.5).
Интегральная оценка по вышеуказанным параметрам свидетельствует о преобладании вероятности достижения оптимального результата лечения в основной группе по сравнению с группой сравнения в среднем в 2,11 раза – OR = 2,11 (1,33–3,34).
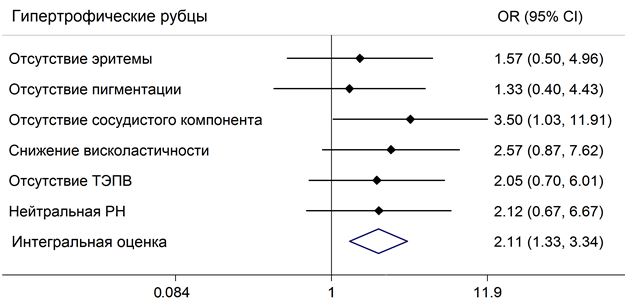
Рисунок 6.5 – Прогностическая оценка достижения оптимальных результатов по биофизическим признакам в основной группе больных с ГР по сравнению с группой сравнения (по показателям отношения шансов – OR)
Достижение лучших результатов лечения (отсутствие эритемы, пигментации, сосудистого компонента, ТЭПВ, снижение вискоэластичности, нейтральная рН) отмечали в обеих группах (1 и 2 группы) с КР. Однако лучшие результаты чаще отмечали в основной группе.
При анализе эффективности лечения выявлено, что вероятность достижения оптимального результата в основной группе у больных с КР по параметру «Отсутствие эритемы» в 3,47 раза выше, чем в группе сравнения – OR = 3,47 (0,94 – 12,85); по признаку «отсутствие пигментации» – в основной группе в 2,34 раза выше, чем в группе сравнения OR = 2,34 (0,60 – 9,16); по признаку «отсутствие сосудистого компонента» – в основной группе в 5,11 раза выше OR = 5,11 (1,21 – 21,68). По параметру «снижение вискоэластичности» – в основной группе в 7,56 раза выше, чем в группе сравнения OR = 7,56 (1,47 – 38,93); по признаку «отсутствие ТЭПВ» – в основной группе в 2,74 раза выше OR = 2,74 (0,75 – 10,04); по параметру «нейтральная рН» показатели в основной группе были выше в 1,35 раза, чем в группе сравнения OR = 1,35 (0,37 – 5,02).
Интегральная оценка по вышеуказанным параметрам свидетельствует о преобладании вероятности достижения оптимального результата лечения в основной группе больных с ПР по сравнению с группой сравнения в среднем в 3,14 раза – OR = 3,14 (1,82 – 5,42) (рис. 6.6).
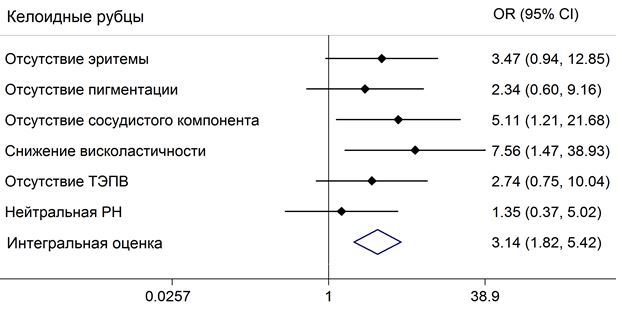
Рисунок 6.6 – Прогностическая оценка достижения оптимальных результатов по биофизическим признакам в основной группе больных с КР по сравнению с контрольной группой (группой сравнения) (по показателям отношения шансов – OR)
Таким образом, проведенные исследования показали:
- При сравнительном анализе биофизических свойств ГР и КР до и после лечения в двух группах выявлено снижение эритемы у больных с ГР по сравнению с таковой до лечения – (у 75,9 % в основной группе и у 66,7 % группе сравнения). При КР снижение эритемы рубца наблюдалось у 68,4 % больных в основной группе и всего лишь у 38,5 % больных в группе сравнения. Отсутствие пигментации после лечения наблюдалось у большинства пациентов с ГР и КР в обеих группах.
- При анализе сосудистого компонента после лечения больных с ГР установлено, что у 29 (50 %) больных основной группы и у 4 (22,2 %) больных группы сравнения сосудистый компонент отсутствовал, при этом до лечения этот признак был всего лишь у 3,9 %. При этом в обеих группах больных с КР отсутствие сосудов после лечения выявлялось чаще, чем с ГР – у 60,5 % и 50 % соответственно.
- При проведении анализа вискоэластичности установлено ее снижение у 36 (62,1 %) больных с ГР основной группы, при этом в группе сравнения эта величина практически в 2 раза меньше. У больных с КР этот показатель также снизился и составил 57,9 % в основной группе и всего лишь 15,4 % в группе сравнения. В группе сравнения превалировали ГР и КР умеренной вискоэластичности.
- Анализ ТЭПВ ПР показал, что в основной группе и группе сравнения она отсутствовала у 67,2 % больных с ГР и у 63,2 % больных с КР, а также у 50 % больных с ГР и всего лишь у 38,5 % больных с КР соответственно.
- Уровень рН кожи больных с ГР и КР после лечения стала нейтральной у 69 % и 68,4 % пациентов основной группы и у 61,1 % и 61,5 % больных группы сравнения.
- Наиболее выраженные биофизические изменения ПР основной группы наблюдали у больных с ГР по показателям эритема, вискоэластичность, ТЭПВ и рН.
- Наиболее выраженные изменения по биофизическим изменениям ПР после лечения наблюдали при келоидах.
- У больных с ГР эффективность лечения по показателям «отсутствие сосудистого компонента», «снижение вискоэластичности» была наиболее выраженной в основной группе – в 3,50 и 2,57 раза соответственно. У больных с КР эффективность терапии была выше в основной группе по параметрам «снижение вискоэластичности» – в 7,56 раза, «отсутствие сосудистого компонента» – в 5,11 раза, «отсутствие эритемы» – в 3,47 раза, «отсутствие ТЭПВ» – в 2,74 раза.
6.2.3 Патоморфоз патологических рубцов после лечения
При исследовании зоны КР у пациентов 1а группы (давность заболевания до 6 мес.) после комплексного лечения выявили сохранение высоты эпидермиса при тонком роговом слое и сглаженности вторичных сосочков дермы по сравнению с таковыми до лечения. Слабо выраженная лейкоцитарная инфильтрация имела место в рыхлой соединительной ткани дермы (рис. 6.7). Состав лейкоцитарных инфильтратов (ЛИ) отличался однообразием, поскольку в них преобладали макрофаги, единичными были нейтрофилы, тучные клетки и лимфоциты. Глубокая зона, по сравнению с субэпидермальной и зоной роста, содержала гемососуды с широкими просветами и явлениями стаза эритроцитов (рис. 6.8).
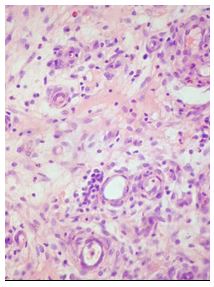
Рисунок 6.7 – Лейкоцитарная инфильтрация, множество активных фибробластов и сосудов ГМЦР в зоне роста КР у пациента подгруппы 1а. Окраска гематоксилином и эозином. Ок. ×10, об. ×40
В зоне рубца имели место толстые пучки КВ, отличающиеся от пучков КВ сетчатого слоя упорядоченным направлением. Между пучками отмечалось умеренно гидратированное ОАВ (рис. 6.9).
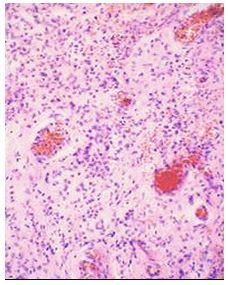
Рисунок 6.8 – Кровеносные сосуды с широкими просветами и явлениями стаза эритроцитов в глубокой зоне КР у пациента подгруппы 1а. Окраска гематоксилином и эозином. Ок. ×10, об. ×20
Рисунок 6.9 Упорядоченные пучки коллагеновых волокон, умеренно гидратированное ОАВ в зоне КР у пациента подгруппы 1а. Окраска по Ван Гизон. Ок. ×10, об. ×20
По результатам морфометрического исследования удельные площади структурных компонентов кожи в зоне КР давностью 6 мес (подгруппа 1а) в количественном отношении имели место статистически значимые различия по сравнению с таковыми до лечения. Так, значимо снизилась удельная площадь КВ (на 39,37 %, p<0,01), тогда как остальные показатели – возрастали (ОАВ в 8,7 раза, ГМЦР в 2,79 раза, ЛИ на 36,36 %, СК на 27,87 %), что подтвердило морфологическое исследование (табл. 6.7). При лечении пациентов данной подгруппы увеличилось количество клеток базального слоя с фигурами митоза (в 8,4 раза, p<0,001). В субэпидермальной зоне в 8,3 раза возросла численность макрофагов, что является благоприятным признаком, поскольку данные клетки регулируют регенераторные процессы в эпителии путем секреции факторов индукции и ингибиции пролиферации (табл. 6.8).
Таблица 6.7 – Удельная площадь структурных элементов кожи при комбинированном лечении пациентов с келоидными рубцами давностью до 6 мес и 6–12 мес
| Структурные элементы | До лечения, М±m | После лечения, М±m | |
| Подгруппа 1а | Подгруппа 1б | ||
| Лейкоцитарные инфильтраты (ЛИ) | 0,33±0,07 | 0,45±0,05 | 0,91±0,06* |
| Основное аморфное вещество (ОАВ) | 1,22±0,05 | 10,61±2,03** | 8,62±1,45** |
| Пучки коллагеновых волокон (КВ) | 73,53±3,92 | 44,58±3,77** | 50,8±6,02** |
| Сосуды ГМЦР сосочкового слоя дермы (ГМЦР) | 8,27±1,40 | 28,03±1,14** | 25,10±1,10** |
| Соединительнотканные клетки (СК) | 16,65±1,71 | 21,29±1,98* | 18,16±2,85 |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
Учитывая механическое выравнивание кожи при МКДА за счет удаления эпидермиса и верхней части сосочкового слоя дермы, пролиферативная реакция эпидермиса в данном случае явилась одним из факторов, усиливающих процесс деградации избытка КВ путем повышенной секреции коллагеназы базальными эпителиоцитами. Выявленная регрессия удельной площади пучков КВ зоны рубца (на 39,37 % по сравнению с таковой до лечения, p<0,05), подтверждает данную гипотезу и отражает смещение баланса фибриллогенез/коллагенолиз в сторону второго (рис. 6.10, 6 11).
Таблица 6.8 – Количественная характеристика келоидных рубцов давностью до 6 мес и 6–12 мес при комбинированном лечении
| Показатели | До лечения, М±m | После лечения, М±m | |
| Подгруппа 1а | Подгруппа 1б | ||
| Численность клеток с фигурами митоза в эпидермисе в 1 поле зрения | 0,33±0,07 | 2,77±0,14** | 2,05±0,34** |
| Соотношение численности лимфоцитов/макрофагов | 1/1 | 1/8,3** | 1/8,5** |
| Количество гемососудов сосочкового слоя дермы (в 1 поле зрения) | 2,55±0,40 | 3,75±1,02 | 3,72±0,46 |
| Количество фибробластов в 1 поле зрения | 74±11 | 56±9* | 54±6* |
| Количество фибробластов, контактирующих с коллагеновыми волокнами в 1 поле зрения | 12,5±2,5 | 1,2±0,4** | 1,3±0,70** |
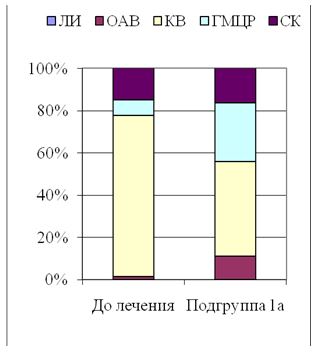
Рисунок 6.10 – Удельная площадь структурных компонентов кожи в зоне КР у пациентов подгруппы 1а после комплексного лечения
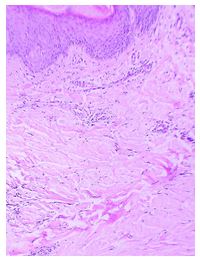
Рисунок 6.11 – Регрессия пучков КВ в зоне КР у пациента подгруппы 1а после лечения. Окраска гематоксилином и эозином. Ок. ×10, об. ×20
Выявленные явления могут быть следствием МКДА, сопровождающейся микротравматизацией сосочкового слоя дермы с развитием воспалительно-репаративного процесса, что сопровождалось приростом удельной площади сосудов ГМЦР в 3,38 раза за счет их дилатации (рис. 6.12). Описанные изменения можно объяснить нивелированием регуляторных влияний лимфоцитов с помощью лимфокинов, в частности, блокада секреции IFNγ, обусловленная применением ТИК.
Рисунок 6.12 – Периваскулярная лейкоцитарная инфильтрация и отек основного аморфного вещества в субэпидермальной зоны КР у пациента подгруппы 1б. Окраска гематоксилином и эозином. Ок. ×10, об. ×40.
В зонах роста КР у пациентов данной подгруппы выявили структурные проявления иммуносупрессивного действия ТИК на лимфоциты, которые в норме продуцируют фибробластактивирующий фактор (FAF), в виде уменьшения на 24,32 % популяции ФБл в зоне роста КР.
Кроме того, ТИК снижает продукцию фибробластами фибронектина соединительной ткани, который обеспечивает адгезию ФБл к КВ межклеточного матрикса и их дифференцировку в миофибробласты. В связи с этим можно предположить, что применение ТИК снизило внутритканевое содержание фибронектина, дифференцировку миофибробластов, что и проявилось уменьшением численности ФБл, контактирующих с КВ (в 10,41 раза).
Сходные однонаправленные изменения количественных показателей кожи имели у пациентов подгруппы 1б с КР давностью 6-12 мес (рис. 6.13). Удельная плотность КВ была сниженной на 30,91 % по сравнению с таковой до лечения. Менее выраженным, чем у пациентов с КР давностью до 6 мес (подгруппа 1а), был прирост удельной площади сосудов ГМЦР и СК (в 2,8 и на 9,07 % соответственно).
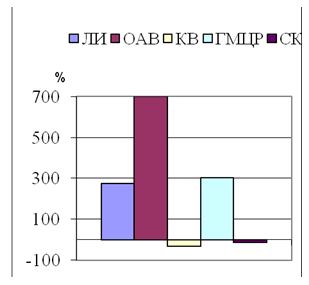
Рисунок 6.13 – Прирост удельной площади структурных компонентов кожи в зоне КР у пациентов подгруппы 1б после комплексного лечения.
Примечание: По оси абсцисс – показатели, по оси ординат – степень прироста в % по сравнению с таковыми до лечения.
Комплексное лечение пациентов 1-й группы с КР давностью 1-3 года (подгруппа 1в) и свыше трех лет (подгруппа 1г) сопровождалось менее выраженной и недостоверной регрессией коллагеновых волокон (рис. 6.14, 6.15). Несмотря на повышенную митотическую активность клеток в базальном слое эпидермиса данный слой даже при лечении истончался. При лечении ПР давностью 1-3 года сходным образом в количественном отношении возросшей сохранялась удельная площадь ЛИ и ОАВ (в 3,96 и 4,4 раза) по сравнению с таковой до лечения с доминированием макрофагов. При этом прирост удельного веса сосудов ГМЦР в глубоких зонах КР был минимальным по сравнению с таковым в подгруппах 1а и1б, что, вероятно, обусловлено ригидностью их стенки вследствие склеротических изменений и гиалиноза (табл. 6.9).
Рисунок 6.14 – Регрессия пучков КВ в зоне КР и лейкоцитарная инфильтрация субэпидермальной зоны у пациента подгруппы 1в после лечения. Окраска гематоксилином и эозином. Ок. ×10, об. ×20
Если сравнивать эффект комплексного лечения пациентов подгрупп 1в и 1г с таковым в подгруппах 1а и 1б, то отмечалась тенденция к росту удельной площади ЛИ начиная с 6 мес заболевания, а также снижение степени прироста удельных площадей КВ, сосудов ГМЦР (табл. 6.9). Причем удельный вес СК в субэпидермальной зоне достоверно снижался в КР давностью свыше 3 лет, а зональная плотность КВ при этом сохранялась практически неизменной по сравнению с таковой до лечения.
Рисунок 6.15 – Регрессия пучков КВ в зоне КР и лейкоцитарная инфильтрация субэпидермальной зоны у пациента подгруппы 1г после лечения. Окраска гематоксилином и эозином. Ок. ×10, об. ×20
Таблица 6.9 – Удельная площадь структурных элементов келоидных рубцов давностью 1-3 года и более 3 лет при комбинированном лечении
| Структурные элементы | До лечения, М±m | После лечения, М±m | |
| Подгруппа 1в | Подгруппа 1г | ||
| Лейкоцитарные инфильтраты (ЛИ) | 0,33±0,07 | 1,23±0,07** | 1,45±0,04** |
| Основное аморфное вещество (ОАВ) | 1,22±0,05 | 2,76±1,55 | 2,95±1,31 |
| Пучки коллагеновых волокон (КВ) | 73,53±3,92 | 68,06±2,84* | 73,46±3,77 |
| Сосуды ГМЦР сосочкового слоя дермы (ГМЦР) | 8,27±1,40 | 9,30±2,62 | 9,76±0,85* |
| Соединительнотканные клетки (СК) | 16,65±0,71 | 18,65±0,88 | 12,38±0,73* |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
Тем не менее, в подгруппах 1а и 1б в очагах роста КР к концу лечения выявили замещение «молодой» соединительной ткани, богатой основным аморфным веществом, на очаговые скопления фибробластов. После микроповреждения тканей кожи путем МКДА и развития начальной фазы воспалительной реакции, «покоящиеся» фибробласты субэпидермальной зоны трансформируются в секреторно активные клетки, что наряду с уменьшением диаметра сосудов ГМЦР, свидетельствует об уменьшении экссудативного компонента воспаления и реорганизации «молодой» соединительной ткани в зрелую. Отсутствие при этом лимфоцитарной инфильтрации зон роста является благоприятным признаком в течении заболевания и исключает возможность рецидивов роста КР (табл. 6.10).
Таблица 6.10 – Количественная характеристика келоидных рубцов давностью 1-3 года и более 3 лет при комбинированном лечении
| Показатели | До лечения, М±m | После лечения, М±m | |
| Подгруппа 1в | Подгруппа 1г | ||
| Численность клеток с фигурами митоза в эпидермисе в 1 поле зрения | 0,33±0,07 | 0,87±0,09** | 0,75±0,07** |
| Соотношение численности лимфоцитов/макрофагов | 1/1 | 1/3,6* | 1/3,4* |
| Количество гемососудов сосочкового слоя дермы (в 1 поле зрения) | 2,55±0,40 | 2,98±0,33* | 2,70±0,18 |
| Количество фибробластов в 1 поле зрения | 74±11 | 63±7* | 61±5* |
| Количество фибробластов, контактирующих с коллагеновыми волокнами в 1 поле зрения | 12,5±2,5 | 4,8±0,12** | 4,4±0,36** |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
Использование комбинированного лечения у пациентов 1-й группы с ГР давностью до 6 мес. сопровождалось сходными в качественном плане изменениями морфологии зоны рубца. По сравнению с кожей пациентов с КР эпидермис был меньшей толщины и численность клеток базального слоя с фигурами митоза была на 27,27 % меньше, чем у пациентов с КР (табл. 6.11).
Таблица 6.11 – Удельная площадь структурных элементов кожи гипертрофических рубцов давностью до 6 мес и 6-12 мес при комплексном лечении
| Структурные элементы | До лечения, | После лечения, М±m | |
| М±m | Подгруппа 1а | Подгруппа 1б | |
| ЛИ | 3,44±0,05 | 5,73±0,11** | 6,27±0,47** |
| ОАВ | 1,57±0,03 | 9,15±2,61** | 8,99±1,71** |
| Пучки КВ | 70,66±2,72 | 39,68±2,52** | 43,04±2,07** |
| ГМЦР | 8,27±0,25 | 9,30±0,76 | 9,76±1,21* |
| СК | 17,18±0, 13 | 26,57±1,23* | 24,20±0,96* |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
Обращал на себя внимание максимальный прирост удельной площади ОАВ (в 5,83 раза по сравнению с таковым до лечения) (рис. 6.16). Далее по степени прироста показателя по сравнению с таковым до лечения расположились сосуды ГМЦР (в 2,63 раза) и СК (в 1,54 раза). При этом в отличие от пациентов подгруппы 1а с КР в большей степени изменялось зональное содержание сосудов ГМЦР, чем СК (у пациентов с КР прирост удельной площади СК был большим, чем сосудов ГМЦР). При лечении ГР давностью до 6 мес. на 43,84 % снижалась удельная площадь КВ (табл. 6.12).
Соотношение лимфоциты/макрофаги смещалось вправо, однако не достигало такового у пациентов подгруппы 1а с КР (1/5,5 против 1/8,3). Увеличилась численность сосудов ГМЦР в одном поле зрения в сосочковом слое дермы (на 64 %). При этом на 28,26 % снизилось число ФБл, что может быть обусловлено гидропическими изменениями ткани. Слабо выраженной была лейкоцитарная инфильтрация субэпидермальной зоны после лечения (рис. 6.17). Сопоставимой была степень уменьшения численности ФБл, контактирующих с КВ (в 11,57 раз по сравнению с таковой до лечения).
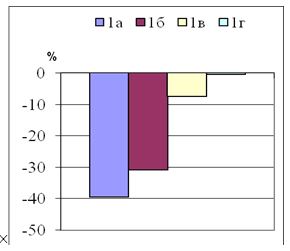
Рисунок 6.16 – Степень уменьшения удельной площади КВ кожи в зоне КР у пациентов после комплексного лечения.
Примечание: По оси абсцисс – подгруппы, по оси ординат – степень снижения показателя в % по сравнению с таковыми до лечения.
Таблица 6.12 – Количественная характеристика гипертрофических рубцов давностью до 6 мес и 6-12 мес при комбинированном лечении
| Показатели | До лечения, М±m | После лечения, М±m | |
| Подгруппа 1а | Подгруппа 1б | ||
| Численность клеток с фигурами митоза в эпидермисе в 1 поле зрения | 0,24±0,04 | 4,49±0,51** | 4,33±0,48** |
| Соотношение численности лимфоцитов/макрофагов | 1/1 | 1/5,5* | 1/5,2* |
| Количество гемососудов сосочкового слоя дермы (в 1 поле зрения) | 2,00±0,15 | 3,28±1,02* | 3,03±0,46 |
| Количество фибробластов в 1 поле зрения | 46±9 | 33±6* | 32±5* |
| Количество фибробластов, контактирующих с коллагеновыми волокнами в 1 поле зрения | 25,14±1,04 | 2,1±0,17** | 3,8±0,66** |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
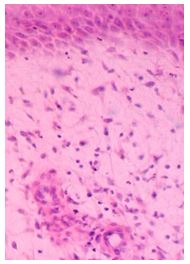
Рисунок 6.17 – Лейкоцитарная инфильтрация субэпидермальной зоны у пациента ГР подгруппы 1а после лечения. Окраска гематоксилином и эозином. Ок. ×10, об. ×40
У пациентов подгруппы 1б с ГР сохранялись выявленные в подгруппе 1а тенденции. Причем, если первые два показателя незначительно превысили таковые в подгруппе 1а, то последние два – не достигали таковых.
Соотношение лимфоциты/макрофаги сохранялось смещенным вправо, однако не достигало такового у пациентов подгруппы 1а с ГР (1/5,2 против 1/5,5). Незначительно меньшей, чем у пациентов подгруппы 1а, была численность сосудов ГМЦР в одном поле зрения в сосочковом слое дермы (< на 5,45 %). На сходно низком уровне было число ФБл (на 30,43 % меньше, чем до лечения), а абсолютные значения данного показателя у пациентов подгруппы 1б с ГР также были меньше, чем у аналогичных пациентов с КР (на 40,74 %). Степень уменьшения численности ФБл, контактирующих с КВ, была меньше, чем в подгруппе 1а (в 6,61 раз меньше таковой до лечения), однако превышала данный показатель у пациентов с КР в 2,92 раза (табл. 6.12).
Комплексное лечение пациентов с ГР давностью 1-3 года (подгруппа 1в) и свыше 3-х лет (подгруппа 1г) сопровождалось более выраженной регрессией КВ по сравнению с аналогичными подгруппами у пациентов с КР, и гидропическими изменениями ОАВ (рис. 6.18). Удельная площадь КВ после лечения в подгруппе 1в достоверно снизилась на 27,60 %, а в подгруппе 1г – на 16,16 % по сравнению с таковой до лечения (рис. 6.19).
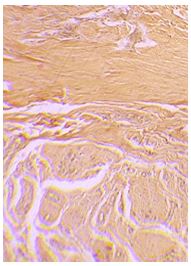
Рисунок 6.18 – Гидропические изменения ОАВ в глубокой зоне ГР у пациента подгруппы 1г после лечения. Окраска по Ван Гизон. Ок. ×10, об. ×20
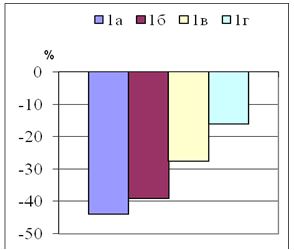
Рисунок 6.19 – Степень уменьшения удельной площади КВ кожи в зоне ГР у пациентов после комплексного лечения.
Примечание: По оси абсцисс – подгруппы, по оси ординат – степень снижения показателя в % по сравнению с таковыми до лечения.
Тем не менее, только в подгруппах 1а и 1б к концу лечения выявили замещение соединительной ткани рубца на рыхлую соединительную ткань в сосочковом и сетчатом слоях дермы. У пациентов с ГР давностью 1-3 года и более 3 лет имели место сходные с таковыми до лечения показатели тканевой плотности сосудов ГМЦР, фибробластов (табл. 6.13). Снижалась численность ФБл, контактирующих с КВ (соответственно в 5,13 и 5,46 раза) по сравнению с таковыми до лечения, что может отражать уменьшение дифференцировки миофибробластов и контрактции зоны ГР (табл. 6.14).
Таблица 6.13 – Удельная площадь структурных элементов гипертрофических рубцов давностью 1-3 года и более 3 лет при комбинированном лечении
| Структурные элементы | До лечения, М±m | После лечения, М±m | |
| Подгруппа 1в | Подгруппа 1г | ||
| Лейкоцитарные инфильтраты (ЛИ) | 3,44±0,05 | 8,07±0,14* | 8,79±0,10** |
| Основное аморфное вещество (ОАВ) | 1,57±0,03 | 3,71±0,08** | 3,83±0,07** |
| Пучки коллагеновых волокон (КВ) | 70,66±2,72 | 51,16±1,92** | 59,24±3,11* |
| Сосуды ГМЦР сосочкового слоя дермы (ГМЦР) | 8,27±0,25 | 14,92±0,58** | 13,04±0,23** |
| Соединительнотканные клетки (СК) | 17,18±0, 13 | 22,14±0,38* | 15,10±0,61 |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
Понимание сложного взаимодействия механизмов, вовлеченных в реализацию лечебного эффекта МКДА и ТИК, важно для разработки эффективной терапии рубцовых изменений кожи и для стратегического вмешательства в механизмы, которые выходят из-под контроля при фибротизации послеоперационных зон репарации. Судя по результатам наших исследований, основной клинический эффект МКДА обусловлен индукцией репаративных процессов в эпидермисе, которые сопровождаются параллельным увеличением секреции гидролитических ферментов (коллагеназы) кератиноцитами для разрушения избытка коллагеновых волокон рубца. Данный эффект, вероятно, усиливается коллагенолитическим действием макрофагов, вовлеченных в воспалительно-репаративный процесс при повреждении эпидермиса и дермы путем МКДА.
Таблица 6.14 – Количественная характеристика келоидных рубцов давностью 1–3 года и более 3 лет очагов при комбинированном лечении
| Показатели | До лечения, М±m | После лечения, М±m | |
| Подгруппа 1в | Подгруппа 1г | ||
| Численность клеток с фигурами митоза в эпидермисе в 1 поле зрения | 0,33±0,03 | 0,87±0,09** | 0,75±0,39** |
| Соотношение численности лимфоцитов/макрофагов | 1/1 | 1/3,6* | 1/3,4* |
| Количество гемососудов сосочкового слоя дермы (в 1 поле зрения) | 2,55±0,31 | 2,98±0,27* | 2,70±0,19 |
| Количество фибробластов в 1 поле зрения | 74±5 | 63±5 | 61±6* |
| Количество фибробластов, контактирующих с коллагеновыми волокнами в 1 поле зрения | 12,5±1,65 | 4,8±0,13** | 4,4±0,26** |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
Однако, достигнутый при этом эффект нельзя было бы сохранить при обычном течении воспаления в коже, поскольку кроме макрофагов в зону альтерации путем «хоминга» мигрируют лимфоциты для переключения макрофагальной стадии в фибробластическую (собственно репарацию). При этом однозначно прогнозировать модулирующий эффект лимфоцитов не представляется возможным, поскольку они продуцируют регуляторные молекулы, обладающие разнонаправленным эффектом: Т-клеточный фактор роста фибробластов (TCGP), ингибиторный фактор роста фибробластов (ICF), фибробластактивирующий фактор (FAF), коллагенпродуцирующий фактор (CPF), В-клеточный ингибитор продукции коллагена (FIF), а также интерферон g, тормозящий хемотаксис, пролиферацию ФБл и синтез колагена. Такролимус блокирует продукцию интерферона, следовательно, снимает цитотоксическое и ингибирующее действие данного цитокина на продукцию коллагена и фибронектина. Однако, в условиях повышенной продукции коллагенолитических ферментов эпителием и макрофагами, очевидно, повышенной оказывается лишь продукция фибронектина. При наличии фибронектина, возможными становится формирование лимфоцит-фибробластических контактов, которые являются одним из механизмов регуляции митотической активности ФБл. При использовании предложенного нами метода лечения даже в условиях избытка фибронектина, такие контакты маловероятны в силу низкой удельной численности лимфоцитов в тканях. Последний факт является благоприятным в плане профилактики рецидивирования КР. Также важным с патогенетической точки зрения эффектом комбинации МКДА и ТИК, можно считать его ингибирующий эффект на дифференцировку миофибробластов, что, несмотря на присутствие фибронектина, ограничивает рост и распространение ПР. Одной из версий избыточного отложения КВ в зоне рубцовых изменений считают связь актиновых микрофиламентов с внеклеточным фибронектином, располагающимся на КВ. Для подтверждения данной гипотезы необходимо исследование экспрессии α-SMA – маркера миофибробластов.
Таким образом, использование в комплексном лечении ТИК, позволяет изолированно нивелировать морфогенетические эффекты лимфоцитов, участвующих в воспалительно – репаративном процессе при МКДА у больных с КР и ГР. Морфологические исследования ПР позволили выявить положительный эффект комбинированного лечения, что сопровождалось репаративной регенерацией кожи околорубцовой зоны, коллагенолитическим эффектом в виде уменьшения удельной площади пучков КВ в зоне рубца, а также предупреждало дифференцировку миофибробластов в данной зоне.
Выявлены структурные особенности КР и ГР различной давности при лечении пациентов 2-й группы – группы сравнения.
Так, при исследовании КР у пациентов 2а подгруппы (давность заболевания до 6 мес) после лечения выявили истончение эпидермиса, который отличался тонким роговым слоем и невысокими вторичными сосочками дермы. Прирост удельной площади ЛИ достигал 9,6 раз по сравнению с таковым до лечения (табл. 6.15). Тем не менее, состав ЛИ отличался многообразием, поскольку в них выявлялись многочисленные лимфоциты, незначительное количество макрофагов, нейтрофилов и тучных клеток. В зоне роста КР выявили высокую тканевую плотность функционально активных ФБл (до 63±9 в одном поле зрения) на фоне немногочисленных неориентированных пучков КВ, редуцированные гемокапилляры. Отличительным признаком субэпидермальной зоны по сравнению с зоной роста были расширенные гемососуды с признаками стаза эритроцитов, а также гидратация ОАВ (рис. 6.20, 6.21).
Таблица 6.15 – Удельная площадь структурных элементов келоидных рубцов давностью до 6 мес и 6-12 мес кожи после лечения
| Структурные элементы | До лечения, М±m | После лечения, М±m | |
| Подгруппа 2а | Подгруппа 2б | ||
| Лейкоцитарные инфильтраты (ЛИ) | 0,33±0,07 | 3,17±0,11** | 5,24±0,53** |
| Основное аморфное вещество (ОАВ) | 1,22±0,05 | 7,34±2,03 | 8,17±1,45 |
| Пучки коллагеновых волокон (КВ) | 73,53±3,92 | 58,81±3,77 | 59,08±6,02 |
| Сосуды ГМЦР сосочкового слоя дермы (ГМЦР) | 8,27±1,40 | 28,00±1,14 | 25,10±1,10 |
| Соединительнотканные клетки (СК) | 16,65±0,71 | 2,68±0,98 | 2,41±0,85 |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
По результатам морфометрического исследования удельные площади структурных компонентов кожи в зоне КР давностью 6 мес (подгруппа 2а) распределились КВ > ГМЦР > ОАВ > ЛИ > СК. По-прежнему доминировали пучки КВ, однако за счет вазодилатации удельная площадь сосудов ГМЦР и ОАВ стали выше, чем удельная площадь ЛИ и СК. Степень уменьшения удельной площади КВ была меньшей, чем в 1-й группе (на 20,02 %, p<0,01). Высоким был прирост удельной площади ЛИ и ОАВ (соответственно в 9,6 и 6,7 раза по сравнению с таковым до лечения), тогда как удельная площадь сосудов ГМЦР возросла 3,4 раза, ЛИ на 36,36 %. На этом фоне достоверно снизилась удельная площадь КВ (на 20,02 %) и СК (в 6,28 раза) (табл. 6.15).
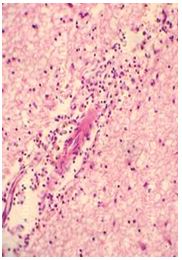
Рисунок 6.20 – Лимфоцитарная инфильтрация и гидропические изменения дермы субэпителиальной зоны КР (подгруппа 2а при лечении МКДА). Окраска гематоксилином и эозином. Ок. ×10, об. ×40
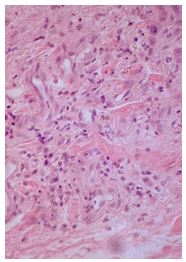
Рисунок 6.21 – Лейкоцитарная инфильтрация зоны роста КР у пациента подгруппы 2а при лечении МКДА. Окраска гематоксилином и эозином. Ок. ×15, об. ×40
После лечения МКДА пациентов 2-й группы с КР давностью до 6 мес (подгруппа 2а) в эпидермисе увеличилось количество клеток базального слоя с фигурами митоза (в 2,87 раза, p<0,001), однако оно было в 2,92 раза меньшим, чем у аналогичных пациентов подгруппы 1а, получавших комплексную терапию. В субэпидермальной зоне доминировала популяция лимфоцитов, что привело к смещению соотношения лимфоциты/макрофаги влево до 13,5/1 (табл. 6.16). Увеличение удельного веса лимфоцитов при этом можно рассматривать как проявление аутоиммунного процесса. Вероятно, при активизации воспалительно-репаративного процесса в зоне КР при МКДА под действием протеолитических ферментов лейкоцитов могут повреждаться пучки КВ рубца, обладающие антигенными свойствами, то «хоуминг» лимфоцитов призван элиминировать данные структуры межклеточного матрикса. В зоне роста КР обнаруживались зрелые активные ФБл, что может быть связано с секрецией лимфоцитами фибробластактивирующего фактора (FAF). Кроме того, обращал на себя внимание факт уменьшения на 27,20 % популяции ФБл, контактирующих с КВ, тогда как у пациентов 1-й группы данный показатель снижался в 10,41 раза по сравнению с таковым до лечения. Это отражало достаточно высокую адгезию ФБл к КВ межклеточного матрикса и возможность их дифференцировки в миофибробласты.
Описанные изменения количественных показателей кожи в зоне КР имели место и у пациентов подгруппы 2б с КР давностью заболевания 6-12 мес (табл. 6.15). Максимальный прирост был характерен для удельной площади ЛИ (в 15,87 раза выше таковой до лечения, p<0001), тогда как степень изменений остальных показателей была на уровне таковой у пациентов подгруппы 2а.
Использование МКДА у пациентов 2-й группы с КР давностью 1-3 года (подгруппа 2в) и свыше 3-х лет (подгруппа 2г) не приводило к значимой регрессии пучков КВ в зоне ПР, удельная площадь которых после лечения была на уровне таковой до лечения (табл. 6.17). У пациентов с рубцами давностью 1-3 года сходным образом возросла удельная площадь ЛИ, однако в количественном отношении степень прироста снижалась по мере увеличения сроков давности заболевания (соответственно в 11,09 раз и на 66,67 %), по сравнению с таковой до лечения. Максимальным приростом среди всех морфометрических показателей проявилась реакция ОАВ в подгруппах 2в и 2г.
Таблица 6.16 – Количественная характеристика келоидных рубцов давностью до 6 мес и 6-12 мес после лечения
| Показатели | До лечения, М±m | После лечения, М±m | |
| Подгруппа 2а | Подгруппа 2б | ||
| Численность клеток с фигурами митоза в эпидермисе в 1 поле зрения | 0,33±0,07 | 0,95±0,14** | 0,91±0,34** |
| Соотношение численности лимфоцитов/макрофагов | 1/1 | 13,5/1** | 12,4/1** |
| Количество гемососудов сосочкового слоя дермы (в 1 поле зрения) | 2,55±0,40 | 7,80±1,02 | 7,63±0,46 |
| Количество фибробластов в 1 поле зрения | 74±11 | 63±9 | 61±6 |
| Количество фибробластов, контактирующих с коллагеновыми волокнами в 1 поле зрения | 12,5±2,5 | 9,10±0,4** | 8,43±0,70** |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
Таблица 6.17 – Удельная площадь структурных элементов келоидных рубцов давностью 1-3 года и более 3-х после лечения
| Структурные элементы | До лечения, М±m | После лечения, М±m | |
| Подгруппа 2в | Подгруппа 2г | ||
| ЛИ | 0,33±0,07 | 4,07±0,07** | 4,68±0,05** |
| ОАВ | 1,22±0,05 | 6,25±0,53** | 5,09±1,68** |
| КВ | 73,53±3,92 | 68,30±2,79 | 69,44±2,13 |
| ГМЦР | 8,27±1,40 | 18,88±0,82** | 18,15±0,61** |
| СК | 16,65±1,71 | 2,50±0,15** | 2,64±0,33** |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
При этом наименее выраженным был прирост удельного веса сосудов ГМЦР (соответственно на 48,73 % и 30,11 %), но превышал таковой в подгруппах 1в и 1г, что было обусловлено как расширением их просвета, так и новообразованием (ангиогенезом). Последнее утверждение базируется на значимом приросте числа сосудов в одном поле зрения, которое возросло в 2,04 и 1,92 раза по сравнению с таковым до лечения, в отличие от подгрупп 1в и 1г, где данный показатель несущественно повышался.
Некоторое уменьшение регресса удельной площади СК и численности ФБл в одном поле зрения у пациентов подгруппы 2г может служить признаком пролиферации данных клеток в ходе развития воспалительно-репаративного процесса в коже при МКДА.
Если сравнивать эффект изолированного использовании МКДА у пациентов подгрупп 2в и 2г с таковым в подгруппах 1а и 1б, то тенденция к нарастанию удельной площади ЛИ начиная с 6 мес. заболевания сменялась, начиная с годичной давности КР, снижением степени прироста данного показателя. Лимфоциты по-прежнему оставались в составе ЛИ, соотношение лимфоциты/макрофаги оставалось смещенным вправо и составляло в подгруппе 2в – 9,7/1, а в подгруппе 2г – 9,2/1. (табл. 6.17). Удельная площадь КВ в зоне КР у пациентов подгрупп 2в и 2г не отличалась от таковой до лечения (рис. 6.22), в результате наибольшую регрессию КВ при лечении МКДА отмечали при давности заболевания до 12 мес, в более поздние сроки данный метод лечения являлся малоэффективным.
Применение МКДА как лечебного метода у пациентов 2-й группы с ГР давностью до 6 мес. сопровождалось сходными качественными изменениями морфологии зоны рубца. По сравнению с КР эпидермис был сходной толщины, хотя численность клеток базального слоя с фигурами митоза возросла с 0,24 (до лечения) до 0,66 в одном поле зрения, как и у пациентов с КР. Обращал на себя внимание сниженный, по сравнению с КР аналогичной давности, прирост удельной площади ЛИ субэпидермальной зоны (в 1,97 раза против 9,6 раза у пациентов с КР).
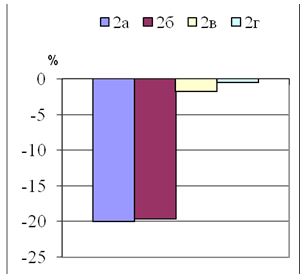
Рисунок 6.22 – Степень уменьшения удельной площади КВ кожи в зоне КР у пациентов после комплексного лечения.
Примечание. По оси абсцисс – подгруппы, по оси ординат – степень снижения показателя в % по сравнению с таковыми до лечения.
Отличительным признаком дермы у пациентов подгруппы 2а явились высокие сосочки и наличие лимфоцитов в более глубоких слоях дермы. Максимальный прирост имел место для удельной площади ОАВ (в 4,75 раза по сравнению с таковым до лечения). Увеличилась и удельная площадь сосудов ГМЦР (в 2,98 раза). По степени снижения удельной площади остальные показатели распределились: КВ > СК (соответственно на 24,83 % и 16,76 %). Обращает на себя внимание однонаправленность изменений удельного веса сосудов ГМЦР и СК у пациентов подгруппы 2а с КР и ГР, а также в 2 раза меньшее снижение содержания КВ. Соотношение лимфоциты/макрофаги смещалось влево и составило 10,4/1. В меньшей степени, чем у пациентов с КР, варьировали изменения тканевой плотности сосудов ГМЦР и фибробластов/фиброцитов. При этом численность ФБл, контактирующих с КВ, снизилась значимо, как по сравнению с таковой до лечения (на 58,63 %), так и в сравнении с аналогичной у пациентов подгруппы 2а с КР (в 2,15 раза) (табл. 6.18).
Таблица 6.18 – Количественная характеристика келоидных рубцов давностью 1-3 года и более 3 лет после лечения
| Показатели | До лечения, М±m | После лечения, М±m | |
| Подгруппа 2в | Подгруппа 2г | ||
| Численность клеток с фигурами митоза в эпидермисе в 1 поле зрения | 0,33±0,07 | 0,52±0,14** | 0,47±0,34* |
| Соотношение численности лимфоцитов/макрофагов | 1/1 | 9,7/1** | 9,2/** |
| Количество гемососудов сосочкового слоя дермы (в 1 поле зрения) | 2,55±0,40 | 5,10±1,02* | 4,80±0,46 |
| Количество фибробластов в 1 поле зрения | 74±11 | 65±9* | 66±6* |
| Количество фибробластов, контактирующих с коллагеновыми волокнами в 1 поле зрения | 12,5±2,5 | 4,8±0,4** | 4,4±0,70** |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
У пациентов подгруппы 2б с ГР сохранялись выявленные в подгруппе 2а тенденции – возросли удельная площадь ОАВ, ЛИ и сосудов ГМЦР (табл. 6.19), причем существенных количественных различий данных показателей по сравнению с аналогичными у пациентов подгруппы 2а не выявили. Тем не менее, удельная тканевая плотность СК была практически в 2 раза меньше таковой в подгруппе 2а (рис. 6.23, 6.24).
Соотношение лимфоциты/макрофаги сохранялось смещенным влево за счет доминирования лимфоцитов и не достигало такового у пациентов подгруппы 2а с ГР (соответственно 9,5/1 против 1/12,4). Стабильно повышенной была, как и у пациентов подгруппы 2а, численность сосудов ГМЦР в одном поле зрения в субэпидермальной зоне (в 2,6 раза по сравнению с таковой до лечения). Несколько выше, чем в подгруппе 2а, была тканевая плотность ФБл, практически достигнув таковой до лечения (на 8,7 % меньше). По сравнению с аналогичным показателем у пациентов подгруппы 1б с ГР число ФБл в одном поле зрения было выше на 31,25 %. Численность ФБл, контактирующих с КВ, была меньше, чем в подгруппе 2а (на 40,77 % меньше таковой до лечения), однако превышала данный показатель у пациентов с КР в 2,67 раза (табл. 6.20).
Рисунок 6.23 – Многочисленные пучки КВ на фоне гидратации ОАВ и расширенных кровеносных сосудов в зоне КР у пациента подгруппы 2б. Окраска по Ван Гизон. Ок. ×10, об. ×20
Рисунок 6.24 – Множество пучков КВ на фоне гидратации ОАВ и умеренно расширенных кровеносных сосудов в зоне КР у пациента подгруппы 2г. Окраска по Ван Гизон. Ок. ×10, об. ×20
Таблица 6.19 – Удельная площадь структурных элементов гипертрофических рубцов давностью до 6 мес. и 6-12 мес. кожи после лечения
| Структурные элементы | До лечения, | После лечения, М±m | |
| М±m | Подгруппа 2а | Подгруппа 2б | |
| Лейкоцитарные инфильтраты (ЛИ) | 3,44±0,05 | 6,81±0,05 | 6,59±0,06 |
| Основное аморфное вещество (ОАВ) | 1,57±0,05 | 7,46±2,03 | 7,12±1,45 |
| Пучки коллагеновых волокон (КВ) | 70,66±3,92 | 53,11±3,77 | 57,35±6,02 |
| Сосуды ГМЦР сосочкового слоя дермы (ГМЦР) | 8,27±0,25 | 21,33±1,14 | 20,80±1,10 |
| Соединительнотканные клетки (СК) | 17,18±0,13 | 14,30±0,98 | 11,14±0,85 |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
Таблица 6.20 – Количественная характеристика гипертрофических рубцов давностью до 6 мес. и 6-12 мес. после лечения
| Показатели | До лечения, М±m | После лечения, М±m | |
| Подгруппа 2а | Подгруппа 2б | ||
| Численность клеток с фигурами митоза в эпидермисе в 1 поле зрения | 0,24±0,04 | 0,66±0,07** | 0,61±0,14** |
| Соотношение численности лимфоцитов/макрофагов | 1/1 | 10,4/1** | 9,5/1** |
| Количество гемососудов сосочкового слоя дермы (в 1 поле зрения) | 2,00±0,15 | 5,30±1,82** | 5,20±0,95** |
| Количество фибробластов в 1 поле зрения | 46±9 | 41±8 | 42±9 |
| Количество фибробластов, контактирующих с коллагеновыми волокнами в 1 поле зрения | 25,14±1,04 | 10,4±0,08** | 10,15±0,93** |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
Лечение пациентов 2-й группы с ГР давностью 1-3 года (подгруппа 2в) и свыше 3 лет (подгруппа 2г) сопровождалось менее выраженной регрессией коллагеновых волокон по сравнению с аналогичными подгруппами у пациентов с КР. Удельная площадь КВ после лечения в подгруппе 2в и 2г практически не отличалась от таковой до лечения, однако достоверно превысила аналогичный показатель у пациентов подгруппы 1а и 1б (соответственно на 33,0 % в подгруппе 2в, на 18,06 % в подгруппе 2г) (рис. 6.20). При лечении МКДА удельная площадь ЛИ и ОАВ в обеих подгруппах превышала таковую до лечения в меньшей степени, чем в подгруппах 2а и 2б (на 18,31 % и 36,04 %). Наибольший прирост удельного веса отмечался для ОАВ (в 3,98-3,24 раза). Степень прироста удельной площади сосудов ГМЦР была незначительно меньше таковой в подгруппах 2а и 2б (соответственно в 2,64 и 2,53 раза выше таковой до лечения), но выше, чем в аналогичных подгруппах 2-й группы пациентов с КР (табл. 6.21).
Таблица 6.21 – Удельная площадь структурных элементов гипертрофических рубцов давностью 1-3 года и более 3 лет после лечения
| Структурные элементы | До лечения, М±m | После лечения, М±m | |
| Подгруппа 2в | Подгруппа 2г | ||
| ЛИ | 3,44±0,07 | 4,07±0,22 | 4,68±0,16 |
| ОАВ | 1,57±0,05 | 6,25±2,44** | 5,09±1,73** |
| Пучки КВ | 70,66±3,92 | 68,30±3,05 | 69,44±3,28 |
| ГМЦР | 8,27±0,25 | 18,88±0,99 | 18,15±1,04 |
| СК | 17,18±0,13 | 2,50±0,32 | 2,64±0,15 |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
Если сравнивать эффект комплексного лечения пациентов с ГР подгрупп 2в и 2г с таковым в подгруппах 2а и 2б, то по мере увеличения сроков давности заболевания отмечалась тенденция к уменьшению степени лейкоцитарной инфильтрации субэпидермальной зоны рубца и рубцовой ткани, а также снижение степени коллагенолитической активности, о чем свидетельствовало прогрессирующее снижение удельной площади КВ (рис. 6.25). Обращала на себя внимание относительная инертность сосудов ГМЦР, независимо от давности ПР – показатель превышал таковой до лечения в 2,5-3 раза, что, вероятно было обусловлено развитием воспалительно-репаративного процесса в субэпидермальной зоне при использовании МКДА. Причем, у пациентов 2-й группы с КР вариабельность данного показателя была выше и обусловлена морфологическими изменениями сосудов преимущественно зоны рубца. Аналогичную динамику у пациентов с ГР давностью 1-3 года и более 3-х лет проявляла митотическая активность клеток базального слоя эпидермиса. Если в подгруппах 2а и 2б данный показатель возрастал в 2,75 и 2,54 раза соответственно по сравнению с таковым до лечения, то в подгруппах 2в и 2г – повышался лишь на 54,17 % и 45,83 % соответственно (табл. 6.21). Тем не менее, только в подгруппе 2а к концу лечения выявили замещение соединительной ткани рубца на плотную неоформленную соединительную ткань в сетчатом слое дермы. Обращал на себя внимание тот факт, что по мере увеличения давности заболевания (до 1-3 лет и выше) почти вдвое снижалась численность ФБл в субэпидермальной зоне, что может отражать перераспределение тканевых компонентов за счет доминирования ОАВ. Аналогичным образом при давности ГР до 1 года значимо снижалась численность ФБл, контактирующих с КВ (соответственно на 58,63 % и 40,77 %) по сравнению с таковыми до лечения, тогда как по мере удлинения сроков заболевания степень уменьшения показателя – снижалась до 27,6 % и 17,54 % соответственно в подгруппах 2в и 2г, что может отражать уменьшение дифференцировки миофибробластов и контрактции зоны ГР (табл. 6.22).
По данным гистохимического окрашивания по Вергоффу у пациентов с ГР после лечения отмечалось очаговость эластиновых волокон и уменьшения площади КВ, при этом при келоидах, несмотря на проведенное лечение, отмечалось отсутствие эластических волокон, тогда как толщина КВ уменьшилась (рис. 6.26).
Таблица 6.22 – Количественная характеристика гипертрофических рубцов давностью 1-3 года и более 3 лет после лечения
| Показатели | До лечения, М±m | После лечения, М±m | |
| Подгруппа 2в | Подгруппа 2г | ||
| Численность клеток с фигурами митоза в эпидермисе в 1 поле зрения | 0,24±0,07 | 0,37±0,03* | 0,35±0,02* |
| Соотношение численности лимфоцитов/макрофагов | 1/1 | 7,4/1** | 7,2/1** |
| Количество гемососудов сосочкового слоя дермы (в 1 поле зрения) | 2,00±0,23 | 4,40±0,52** | 4,10±0,33** |
| Количество фибробластов в 1 поле зрения | 46±9 | 24±3** | 20±4** |
| Количество фибробластов, контактирующих с коллагеновыми волокнами в 1 поле зрения | 12,5±2,5 | 18,20±0,79* | 20,73±1,04** |
Примечание. * p<0,05, ** p<0,001 по сравнению с аналогичным показателем до лечения.
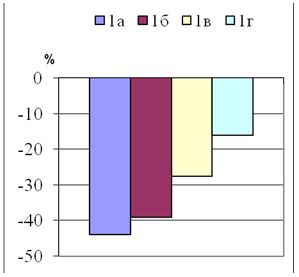
Рисунок 6.25 – Степень уменьшения удельной площади КВ кожи в зоне ГР у пациентов после комплексного лечения.
Примечание. По оси абсцисс – подгруппы, по оси ординат – степень снижения показателя в % по сравнению с таковыми до лечения.
Рисунок 6.26 – Гипертрофический рубец (А). Кело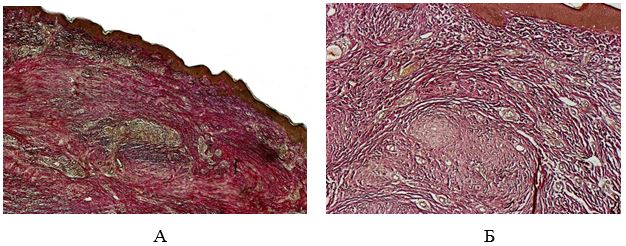 идный рубец (Б) после лечения. Окраска по Вергоффу, х30
идный рубец (Б) после лечения. Окраска по Вергоффу, х30
При анализе иммуногистохимических особенностей ГР после применения ТИК было установлено, что удельный вес зрелых сосудов в этой группе составил (1,93±0,2) % на 1 мм2, тогда как этот же показатель для вновь образованных сосудов достигал (0,86±0,09) % на 1 мм2 (рис. 6.27; табл. 6.23). Эпидермальный фактор роста характеризовался слабой степенью экспрессии и выявлялся в <20 % позитивных клетках, IHscore 1х2=2 (табл. 6.24, 6.25, рис. 6.28, 6.29).
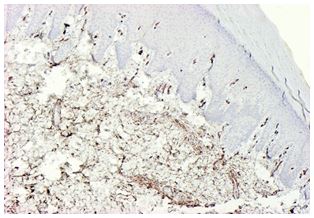
Рисунок 6.27 – Сосудистое русло в гипертрофическом рубце после лечения. ИГХ-исследование с моноклональными антителами к CD34. Система визуализации DAKO EnVision FLEX+ х30.
Таблица 6.23 – Экспрессия маркеров CD34, VEGF в гипертрофических и келоидных рубцах после лечения
| Показатели | Гипертрофические рубцы (n=23), абс. (P%±m%) | Келоидные рубцы (n=17), абс. (P%±m%) | Уровень значимости отличия между группами, p |
| Уд.вес зрелых сосудов на 1 мм2 (CD34+) | 1,93±0,2 | 1,03±0,21* | <0,05 |
| Уд.вес вновь образованных сосудов на 1 мм2 (VEGF+) | 0,86±0,09 | 0,61±0,1* | <0,05 |
Примечание. *– отличие от гипертрофических рубцов статистически значимо (p<0,05)
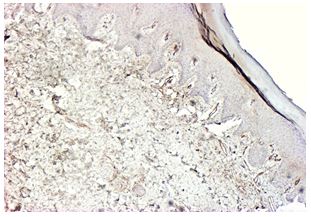
Рисунок 6.28 – Вновь образованные сосуды в гипертрофическом рубце после лечения. ИГХ-исследование с моноклональными антителами к VEGF. Система визуализации DAKO EnVision FLEX+ х30.
Удельный вес сосудистого русла (CD34-позитивные сосуды) в данной группе больных после лечения составил (1,03±0,21) % на 1 мм2, удельный вес вновь образованных сосудов – 0,61±0,1 на 1 мм2 (табл. 6.23, 6.26, рис. 6.30, 6.31). EGFR характеризовался умеренной степенью экспрессии в <20 % позитивных клеток, что составило IHscore 2х2=4 (табл. 6.25; рис. 6.32).
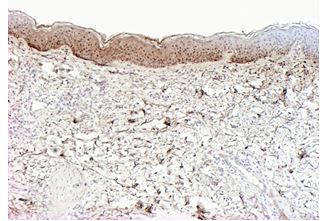
Рисунок 6.29 – Экспрессия эпидермального фактора роста в гипертрофическом рубце после лечения. ИГХ-исследование с моноклональными антителами к EGFR. Система визуализации DAKO EnVision FLEX+ х40.
Таблица 6.24 – Экспрессия маркеров CD 34, VEGF, EGFR в гипертрофических рубцах
| Показатели | До лечения | После лечения | Уровень значимости отличия между группами, p |
| Уд.вес зрелых сосудов на 1 мм2 (CD 34+) | 1,05±0,16 | 1,93±0,2* | <0,05 |
| Уд.вес вновь образованных сосудов на 1 мм2 (VEGF+) | 0,5±0,08 | 0,86±0,09* | <0,05 |
| IHscore EGFR | 0 | 1х2=2* | <0,05 |
Примечание. *– отличие показателей до лечения гипертрофических рубцов статистически значимо (p<0,05)
Таблица 6.25 – Экспрессия EGFR в гипертрофических и келоидных рубцах
| Показатели | IHscore EGFR | Уровень значимости отличия между группами, p |
| Гипертрофические рубцы до лечения | 0 | – |
| Келоидные рубцы до лечения | 0 | |
| Гипертрофические рубцы после лечения | 1х2=2 | 0,07 |
| Келоидные рубцы после лечения | 2х2=4 |

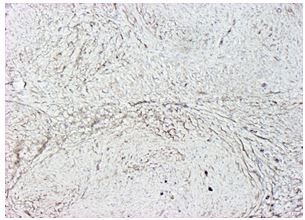
Рисунок 6.31 – Вновь образованные сосуды в келоидном рубце. ИГХ-исследование с моноклональными антителами к VEGF. Система визуализации DAKO EnVision FLEX+ х60
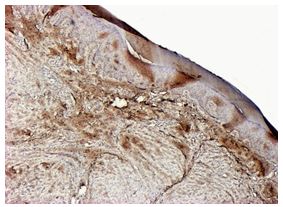
Рисунок 6.32 – Экспрессия эпидермального фактора роста в КР после лечения. ИГХ-исследование с моноклональными антителами к EGFR. Система визуализации DAKO EnVision FLEX+ х30
Таблица 6.26 – Экспрессия маркеров CD 34, VEGF, EGFR в КР
| Показатели | До лечения | После лечения | Уровень значимости отличия между группами, p |
| Удельный вес зрелых сосудов на 1 мм2 (CD 34+) | 0,68±0,12* | 1,03±0,21* | <0,05 |
| Удельный вес вновь образованных сосудов на 1 мм2 (VEGF+) | 0,32±0,09* | 0,61±0,1* | <0,05 |
| IHscore EGFR | 0 | 2х2=4* | <0,05 |
Примечание. *– отличие показателей до лечения келоидных рубцов статистически значимо (p<0,05)
Таким образом, на основании патоморфологических исследований установлено:
- Использование МКДА в качестве метода лечения КР и ГР сопровождалось умеренно выраженным воспалительно-репаративным процессом в субэпидермальной зоне с преобладанием лимфоцитарного компонента, что может отражать развитие аутоиммунной реакции на пучки КВ рубцовой ткани. Наиболее эффективным в плане коллагенолиза данный метод проявил себя у пациентов с КР и у пациентов с ГР при давности заболевания до 1 года.
- После лечения ТИК в группах пациентов с ГР и КР отмечалось уменьшение толщины пучков КВ по сравнению с группами больных с ПР, не получавших терапии. Очаговость сохранных эластических волокон в ГР и полное отсутствие в КР осталось неизменным в группах до и после применения комплексного лечения.
- Удельный вес сосудистого русла, как зрелых сосудов так и вновь образованных (CD34+, VEGF+), до и после применения ТИК в группах пациентов с КР был статистически значимо ниже, чем в группах с ГР (р<0,05). Установлено, что после применения ТИК в группе больных с ГР отмечалось статистически значимое увеличение удельного веса сосудистого русла (CD34+, VEGF+) и IHscore эпидермального фактора роста по сравнению с пациентами с ГР, не получавшими лечения (р<0,05). В группе больных с КР после применения ТИК также отмечалось статистически значимое увеличение удельного веса сосудистого русла (CD34+, VEGF+) и IHscore EGFR по сравнению с таковыми показателями у пациентов с КР, не получавшими лечения (р<0,05).
- Пациентам с ПР целесообразно применение комплексной терапии с применением ТИК и МКДА с целью стимуляции ангиогенеза в зоне рубца и увеличения пролиферации эпидермиса, что позволяет улучшить терапевтический и эстетический результаты больных с КР и ГР.
6.3 Отдаленные результаты
Отдаленные результаты лечения прослеженны в течение 2 лет у 105 пациентов (70 пациентов основной группы и 35 – группы сравнения).
Оценка отдаленных результатов эффективности лечения была проведена по клиническим и биофизическим признакам, а также по числу рецидивов.
Эстетическое восстановление рубцовой ткани представляет собой очень трудную и индивидуальную для каждого конкретного случая задачу. Реабилитация пациентов направлена на восстановление эстетического вида рубца – отсутствие зуда и эритемы, пигментации в области ПР и их плотности, отсутствие рубцовых контрактур.
Анализируя отдаленные результаты лечения по субъективному признаку – зуду, установили, что в основной группе после лечения и через 2 года после лечения легкий зуд и его отсутствие встречались примерно одинаково часто. При этом не было различий в группе с ГР. Больных с келоидами, которые указывали на отсутствие зуда и легкий зуд, увеличилось на 1,1 % (рис. 6.33).
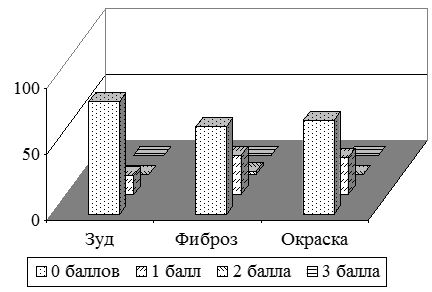
Рисунок 6.33 – Выраженность клинических признаков в основной группе после 2 лет наблюдения
Обращало на себя внимание то, что ПР с фиброзом в 3 балла встречались после 2 лет в 1,7 раза чаще, при этом в основном за счет больных с ГР, за это время фиброз в 3 балла снизился и у больных с келоидами. В группе 2 увеличилось количество больных с зудом в 2 балла, несколько снизился фиброз в 2 балла, розово-красная окраска (2 балла) стала несколько выраженней (рис. 6.34).
Жалобы на умеренный зуд увеличились в 1,7 раза, за счет больных с КР. Количество больных с фиброзом в 1 балл несколько увеличилось за счет уменьшения числа больных с фиброзом в 2 балла. Такие изменения отмечали как у больных с ГР, так и с КР. Однако, при последних они были более выражены. В окраске ПР были отмечены изменения в основном за счет уменьшения окраски в 2 балла, особенно при КР. Значимые изменения в основной группе больных произошли в трансформации плотности ПР в сторону ее уменьшения, особенно ГР. По другим признакам (зуд, окраска) группы были идентичны.
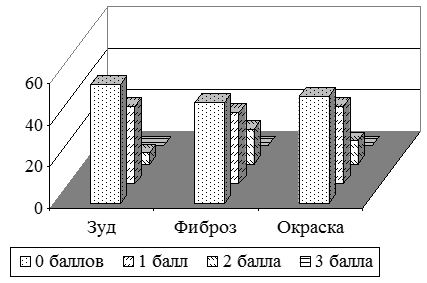
Рисунок 6.34 – Выраженность клинических признаков в группе сравнения после двух лет наблюдения
Определяющим фактором в окончательном определении результата лечения ПР являлось эстетическое восприятие самим пациентом лечения ПР.
При анализе отдаленных результатов лечения больных по оценке биофизических свойств ПР выявлено, что по всем признакам характеристики рубцов изменились в сторону уменьшения. Так, увеличилась незначительная эритема, при этом отсутствие эритемы встречалось у меньшего количества пациентов. Пигментация 10- 50 ус. ед. стала встречаться чаще, при этом появились случаи интенсивной пигментации. Сосудистый компонент стал более выраженным. Повысилась вискоэластичность за счет увеличения повышенных показателей. Увеличились показатели незначительной и умеренной ТЭПВ. Снизилось количество пациентов с нейтральной рН кожи. Повысились показатели кислой и щелочной рН (табл. 6.27).
Таблица 6.27 – Биофизические свойства патологических рубцов после двух лет наблюдения
| Признак | Основная группа | Группа сравнения | ||
| Всего, n= 70 | Всего, n= 35 | |||
| абс. | % | абс. | % | |
| Эритема | ||||
| Отсутствует | 51 | 72,9 | 18 | 51,4 |
| Незначительная | 19 | 27,1 | 17 | 48,6 |
| Интенсивная | 0 | 0 | 0 | 0 |
| Пигментация | ||||
| Отсутствует | 49 | 70 | 21 | 60 |
| Незначительная | 21 | 30 | 12 | 34,3 |
| Интенсивная | 0 | 0 | 2 | 5,7 |
| Сосудистый компонент | ||||
| Отсутствуют сосуды | 43 | 61,4 | 7 | 20 |
| Единичные сосуды | 21 | 30 | 20 | 57,1 |
| Умеренное количество сосудов | 6 | 8,6 | 8 | 22,9 |
| Большое количество сосудов | 0 | 0 | 0 | 0 |
| Висколастичность | ||||
| Снижена | 43 | 61,43 | 9 | 25,7 |
| Умеренная | 22 | 31,43 | 16 | 45,7 |
| Повышенная | 5 | 7,14 | 10 | 28,6 |
| ТЭПВ | ||||
| Отсутствует | 48 | 68,6 | 15 | 42,9 |
| Незначительна | 18 | 25,7 | 14 | 40 |
| Умеренная | 4 | 13,3 | 6 | 17,1 |
| Повышенная | 0 | 0 | 0 | 0 |
| рН | ||||
| Кислая | 16 | 22,9 | 11 | 31,4 |
| Нейтральная | 48 | 68,6 | 20 | 57,1 |
| Щелочная | 6 | 8,5 | 4 | 11,4 |
Таким образом, в группе 1 по многим признакам после лечения выявили улучшение показателей на фоне незначительного увеличения пигментации. Показатели сосудистого компонента и ТЭПВ улучшились. В группе 2 по всем показателям отметили некоторое ухудшение значений.
Рецидивы встречались в обеих группах, однако, в основной их было достоверно меньше [(2,1 ± 1,4) %], тогда как в группе сравнения – (16,1 ± 6,6) %.
Результаты данного раздела опубликованы в следующих статьях:
- Проценко Т. В. Морфологические особенности ремоделирования патологических рубцов при комплексном лечении с применением ингибиторов кальциневрина / Т. В. Проценко, Ю. А. Борзых, Н. Н. Бондаренко // Дерматологія та венерологія. – 2014. – № 1 (63). – С. 52–58.
- Борзых Ю. А. Сравнительная динамика морфогенеза патологических рубцов при комплексном лечении с применением топических ингибиторов кальциневрина / Ю. А. Борзых // Питання експериментальної та клінічної медицини : збірник статей. – Донецьк, 2014. – Вип. 18, т. 3. – С. 108–115.
- Борзых Ю. А. Обоснование терапевтической тактики при молодых гипертрофических и келоидных рубцах / Ю. А. Борзых // Журнал дерматовенерології та косметології ім. М. О. Торсуєва. – 2013. – № 1-2. – С. 96–98.
- Борзых Ю. А. Эффективность топического такролимуса в комплексном лечении келоидов / Ю. А. Борзых // Травма. – 2014. – Т. 15, № 1. – С. 50–52.
- Борзых Ю. А. Опыт лечения гипертрофических рубцов такролимусом / Ю. А. Борзых // Торсуєвські читання : збірник науково-практичних робіт. – Донецк, 2013. – Вип. 7. – С. 17-20.
- Пат. на корисну модель 83835 UA, МПК А61К38/23, А61Р17/02. Спосіб лікування гіпертрофічних рубців / Т. В. Проценко, Ю. О. Борзих; заявник та патентовласник Донецький національний медичний університет ім. М. Горького. – № u201306181 ; заявл. 20.05.2013 ; опубл. 25.09.2013, Бюл. № 18/2013.
РАЗДЕЛ 7
АНАЛИЗ И ОБОБЩЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Гипертрофические и келоидные рубцы до настоящего времени представляют актуальную проблему практического здравоохранения из-за частоты встречаемости, поражения лиц активного репродуктивного возраста, социальной дезадаптации пациентов. До настоящего времени спорными остаются вопросы пато- и морфогенеза формирования келоидных и гипертрофических рубцов. Так, обсуждается наследственная предрасположенность к их образованию [103], гендерно-возрастные и топографические особенности их формирования [23], вторичное инфицирование [118]. Противоречивы подходы к лечению келоидных и гипертрофических рубцов. Применяемы методы коррекции часто сопровождаются рецидивами [36]. Широко используемые методы деструкции (криодеструкция, микродермабразия, лазерное воздействие [38] также с высокой частотой сопровождаются рецидивами [100]. С целью подавления роста келоидных и гипертрофических рубцов применяется Букки-терапия и програничные рентгеновские лучи, кортикостероидные гормоны [58], ферментные средства: лидаза, лонгидаза [35]. Предложены методики применения блокаторов кальциевых каналов (Верапамил), однако до настоящего времени результаты исследований носят экспериментальный характер.
Учитывая изложенное, выявление морфоиммунологических особенностей рубцовой ткани у лиц активного репродуктивного возраста, у которых наиболее часто развиваются келоидные и гипертрофические рубцы, может способствовать совершенствованию лечения этой распространенной патологии. Существенно повысить эффективность лечения на раннем этапе формирования рубца позволяет применение препаратов ингибиторов кальциневрина, обладающих способностью подавлять цитокиновый каскад воспалительных реакций кожи и широко использующихся для лечения атопического дерматита, склеродермии, витилиго. В связи с этим, разработанное и предложенное лечение может иметь большое практическое значение для здравоохранения.
Целью работы было повышение эффективности лечения больных гипертрофическими и келоидными рубцами путем разработки патогенетически обоснованного комплексного метода терапии на основании изучения патоморфологических, иммуноморфологических и биофизических особенностей рубцово-измененной ткани.
Основу работы составили результаты лечения 127 больных с 76 гипертрофическими и 51 келоидными рубцами (67 женщин и 60 мужчин), которым оказывалась специализированная помощь во «Врачебно-косметологической лечебнице г. Донецка» и ККЛПЗ ОЗ «Областной кожно-венерологический диспансер» г. Донецка в период с 2010 по 2014 гг. Пациенты были разделены на две группы наблюдения. В основную группу вошли 96 больных, лечение которых осуществлялось по разработанной нами системе. В качестве сравнения служили результаты лечения у 31 пациентов, лечение которых проводилось традиционными методами.
В процессе работы применялись: клинический, биофизический, морфологический, иммуногистохимический, статистический методы.
Изучение клинических проявлений ГР и КР выявило высокую частоту заболевания у лиц трудоспособного возраста. При гендерном анализе установлено преобладание ПР у женщин, у которых наблюдались чаще КР – у 38 (56,7 %) по сравнению с мужчинами, у которых в большинстве превалировали ГР – у 47 (78,3 %). Отмечено преобладание КР у женщин до 20 – летнего возраста (16 больных – 42,1 %), ГР – у мужчин от 31-40 лет (18 больных – 38,3 %).
У всех пациентов посттравматические или послеоперационные ПР были различной давности. Из 74 (58,3 %) больных с ПР ГР регистрировались у 46 (60,5 %), а КР – у 28 (54,9 %) больных, при этом после производственных травм – у 52 (70,3 %) больных, а после бытовых – у 22 (29,7 %) больных. В структуре послеоперационных рубцов (у 53 (41,7 %) больных) чаще выявляли КР – у 23 (45,1 %), чем ГР – у 30 (39,5 %) больных, при этом наиболее чаще после аппендэктомий, удалений невусов и папиллом, после реконструктивно-восстановительных операций в связи с давними травмами.
Анализируя ПР по локализации, установлено, что больше всего было больных с поражением в области лица – у 48 (37,8 %), верхних конечностей – у 34 (26,8 %) и ушных раковин – у 25 (19,7 %). Реже отмечали ПР в области грудины и нижних конечностей – у 13 (10,2 %) и у 7 (5,5 %) больных соответственно. При этом ГР чаще были на верхних и нижних конечностях – у 31 (40,8 %) и у 5 (6,6 %) больных, а КР, чаще встречались на лице – у 25 (49,01 %), ушных раковинах – у 14 (27,5 %) и грудине – у 7 (13,7 %) больных.
При клинической оценке субъективных и объективных данных ПР установлено, что интенсивность зуда в среднем составляла (1,2 ± 0,1) балла, в т.ч. у больных с ГР – (0,8 ± 0,1) балла, с КР – (1,8 ± 0,13) балла; интенсивность фиброза составляла (1,7 ± 0,1) балла, в т.ч. у больных с ГР – (1,5 ± 0,1) балла, с КР – (2,1 ± 0,1) балла; интенсивность окраски составляла (1,7 ± 0,1) балла, при этом у пациентов с ГР – (1,5 ± 0,1) балла, с КР – (1,9 ± 0,1) балла. Балльная оценка интенсивности окраски и выраженности зуда статистически значимо снижалась с увеличением давности существования ПР (p <0,01). Выраженность фиброзных изменений практически не зависела от давности существования ПР (p <0,05).
При сравнительном анализе выраженности признаков биофизических свойств получено, что между КР и ГР с увеличением продолжительности существования ПР различия по биофизическим характеристикам становились менее выраженными (p>0,05).
При морфологическом исследовании биоптатов кожи в зоне КР выявлены признаки утолщения эпидермиса с очаговым сглаживанием дермо-эпидермального границы, умеренно выраженные воспалительные изменения в виде ЛИ между пучками КВ и вокруг гемокапилляров, разволокнение пучков КВ с их гомогенизацией, в глубоких зонах – преобладание дефинитивных клеточных форм, гидропическая трансформация ОАВ. При исследовании ГР отмечены признаки истончения эпидермиса, сглаженность сосочков дермы и их слабая ЛИ. Обращала внимание более высокая плотность клеток базального слоя. В КР индекс митоза в эпидермисе был выше, чем в ГР [(0,33 ± 0,07) и (0,24 ± 0,04) ус. ед. соответственно]; ЛИ в дерме были более выражены при ГР [(3,44 ± 0,05) ус. ед. и (0,33 ± 0,07) ус. ед. соответственно], при этом число фибробластов в 1 поле зрения при КР было почти в 2 раза больше, чем при ГР [(74 ± 11) и (46 ± 9) клеток соответственно]. Количество фибробластов, контактирующих с коллагеновыми волокнами в 1 поле зрения при КР было почти в 2 раза меньше, чем при ГР [(12,5 ± 2,5) и (25,14 ± 1,04) соответственно]. При этом соотношение численности лимфоцитов к макрофагов при обоих видах ПР существенно не отличалась, количество гемососудов в 1 поле зрения было статистически значимо выше при КР, чем при ГР (2,55 ± 0,4 и 2,0 ± 0,15 соответственно).
При гистохимической окраске ПР по Вергоффу определялись лишь отдельные участки сохранившихся эластических волокон при ГР и их полное отсутствие при КР. При трихромной окраске по Массону обнаружены как при ГР, так и при КР широкие пучки и узлы коллагена. При ИГХ-исследовании сосудистого русла ПР (как зрелых сосудов, так и вновь образованных) и фактора пролиферации эпидермиса определен удельный вес зрелых сосудов (CD34+) в группе пациентов с ГР, что составило (1,05 ± 0,16) % на 1 мм2. Удельный вес «молодых» сосудов различного калибра, который определялся по экспрессии маркера VEGF, составлял в исследуемой группе (0,5 ± 0,08) % на 1 мм2. Экспрессия эпидермального фактора роста в данной группе больных не отмечалась. Удельный вес CD34-положительных сосудов при КР составил (0,68 ± 0,12) % на 1 мм2, тогда как этот же показатель новообразованных сосудов достигал (0,32 ± 0,09) % на 1 мм2. Выявленные изменения свидетельствуют об особенностях КР, выраженной их склонности к экспрессивному росту, что необходимо учитывать при планировании лечебно-профилактической тактики.
Разработан метод комплексного этапного дифференцированного лечения пациентов с ПР кожи, учитывающий вид рубца и сроки их существования. При длительности заболевания до одного года было рекомендовано применение ТИК (такролимус мазь 0,1 % два раза в день в течение 4 недель, затем 1 раз в неделю 3 месяца) в сочетании с микродермабразией (при продолжительности до 6 мес. – 4–6 процедур, 6–12 мес. – 6–8 процедур), при ПР от 1-3 лет – от 8 до 10 процедур микродермабразии или хирургическое удаление. При давности ПР более 3 лет хирургическое иссечение рубцов сочетали с использованием ТИК после снятия швов, а через 1 мес. – с выполнением микродермабразии в режиме 1 раз в неделю (4-6 процедур).
Для оценки эффективности разработанного метода результаты лечения сравнивали в двух группах: основная группа (группа 1) – 96 (75,5 %) пациентов, лечившихся по разработанному методу и группа сравнения (группа 2) – 31 (24,4 %) больной, принимающих традиционную терапию, которым были выполнены микродермабразия или хирургическое иссечение ПР без применения ТИК. Результаты лечения анализировали в следующих подгруппах сравнения: до 6 месяцев – группы 1а и 2а, от 6 месяцев до 1 года – группы 1б и 2б, от 1 года до 3-х лет – группы 1в и 2в, более 3-х лет – группы 1г и 2г.
Как показал проведенный анализ, клинические проявления регрессировали независимо от методов лечения, однако в основной группе они исчезали в более короткие сроки [(28 ± 3,1) дня против (45 ± 5,3) дня в группе сравнения], к тому же остаточные явления были менее выраженными.
При сравнительном анализе эффективности лечения больных с ПР установлено, что чаще происходило достижение оптимальных результатов терапии у больных с ГР по жалобам на зуд. Так, в основной группе эти жалобы исчезали в 4,33 раза чаще, чем в группе сравнения (p<0,05).
При использовании комбинированной тактики у пациентов с КР достижения оптимального результата был в 3,21 раза выше в основной группе, чем в группе сравнения (p <0,05). Достижение хорошего результата по признаку фиброза было выше в основной группе при всех видах ПР, однако четче прослеживалось в группе больных ГР, чем с КР – в 2,63 раза и 1,60 раза соответственно (p>0,05). Анализ признака «нормализация окраски» показал сохранение тенденции к лучшим результатам при всех видах ПР как в основной, так и в группе сравнения, однако этот признак более четко выражен у больных с КР, чем с ГР – 2,74 раза и 1,73 раза соответственно (p> 0,05). Интегральная оценка по трем вышеуказанным параметрам свидетельствует о статистически значимом преобладании вероятности достижения оптимального результата лечения в основной группе относительно группы сравнения в среднем в 2,58 раза – OR = 2,58 (1,32 – 5,05) при ГР и в среднем в 2,37 раза – OR = 2,37 (1,12 – 5,01) при КР.
При анализе биофизических свойств ПР после лечения отмечено отсутствие эритемы у 70 (72,9 %) пациентов основной группы и у 17 (54,8 %) больных группы сравнения. У большинства больных ПР отмечено отсутствие пигментации, отчетливо в основной группе. Полный регресс сосудистого компонента у больных с ПР в основной группе регистрировали в 2,3 раза чаще, чем в группе сравнения. При анализе вискоеластичности отмечено ее снижение у 58 (60,4 %) больных основной группы, а в группе сравнения – только у 9 (29 %) больных. Снижение и отсутствие ТЭПВ наблюдали в обеих группах, однако в 1,4 раза чаще в основной группе. Уровень рН кожи стал нейтральным у 66 (68,7 %) пациентов основной и у 19 (61,3 %) группы сравнения. Статистически значимая динамика биофизических параметров рубцов по сосудистому компоненту, вискоэластичности, ТЭПВ, рН отмечалась более выраженной у пациентов, получавших комбинированную терапию с использованием деструктивных и топических методов.
При анализе эффективности лечения по биофизическим параметрам ПР наиболее выраженные изменения отмечались у больных с КР. У больных с ГР эффективность лечения по показателям «отсутствие сосудистого компонента», «снижение вискоеластичности» была наиболее выраженной в основной группе – в 3,50 и 2,57 раза больше, чем в группе сравнения соответственно. У больных с КР терапии была эффективнее в основной группе, чем в группе сравнения, по параметрам «снижение вискоэластичности» – в 7,56 раза больше, «отсутствие сосудистого компонента» – в 5,11 раза больше (p = 0,05), «отсутствие эритемы» – в 3,47 раза, «отсутствие ТЭПВ» – в 2,74 раза больше в основной группе (p > 0,05). Интегральная оценка по биофизическим параметрам свидетельствовала о преобладании вероятности достижения оптимального результата лечения в основной группе по сравнению с группой сравнения в среднем в 2,11 раза – OR = 2,11 (1,33 – 3,34) при ГР и в 3,14 раза – OR = 3,14 (1,82 – 5,42) при КР.
Результаты морфологического, ИГХ и морфометрического исследования подтвердили результативность использования ТИК и деструктивных методов лечения. Использование в комплексном лечении ТИК сопровождалось умеренно выраженным воспалительно – репаративным процессом в субэпидермальной зоне с преобладанием лимфоцитарного компонента. Возможно, механическое выравнивание кожи при микродермабразии за счет удаления эпидермиса и верхней части сосочкового слоя дермы, пролиферативная реакция эпидермиса была фактором, усиливающим процесс деградации избытка КВ путем повышенной секреции коллагеназы базальными эпителиоцитами [62]. Обнаруженная регрессия удельной площади пучков коллагеновых волокон зоны ПР подтверждает эту гипотезу и отражает смещение баланса фибриллогенез / коллагенолиз в сторону последнего. Микротравматизация сосочкового слоя дермы с развитием воспалительно-репаративного процесса сопровождалась приростом удельного площади сосудов гемомикроциркуляторного русла за счет их дилатации. Отмечено, что ТИК снижает продукцию фибробластами фибронектина соединительной ткани, который обеспечивает адгезию фибробластов к КВ межклеточного матрикса и их дифференцировки в миофибробласты. В связи с этим можно предположить, что применение ТИК способствовало уменьшению внутреннетканевого содержания фибронектина, дифференцировке миофибробластов, что и проявилось уменьшением численности фибробластов, контактирующих с коллагеновыми волокнами. При использовании предложенного метода лечения даже в условиях избытка фибронектина контакты маловероятны в силу низкого удельного численности лимфоцитов в тканях. Последний факт является благоприятным в плане профилактики рецидивирования КР. Также важным эффектом комбинации микродермабразии и ТИК, с патогенетической точки зрения, можно считать его ингибирующий эффект на дифференцировку миофибробластов, что, несмотря на присутствие фибронектина, позволяет ограничить рост ПР. Наиболее эффективным в плане коллагенолиза данный метод показал себя у пациентов с КР, тогда как у пациентов с ГР аналогичные явления имели место при давности рубцов до 1 года.
Морфологические исследования биоптатов рубцовых изменений кожи у пациентов КР позволили выявить схожие структурные изменения также в дерме околорубцовой зоны и зоны рубца, при этом положительный эффект комбинированного лечения заключался в подавлении морфогенетических процессов в «зонах роста» путем нивелирования пролиферативных эффектов лимфоцитов. Отсутствие при этом лимфоцитарном инфильтрации зон роста было благоприятным признаком течения ПР и исключало возможность рецидивов КР.
В ходе проведенного патоморфологического исследования с применением гистохимических методик и современных ИГХ-методов, выявлен ряд особенностей у пациентов с патологическими рубцовыми изменениями после комплексного лечения. Так, после местного лечения в группах больных с ГР и КР произошло уменьшение толщины пучков КВ по сравнению с группами больных ПР, не получавших терапии. Очаговость эластичных волокон в ГР и полное отсутствие в КР, осталась неизменной в группах до и после применения комплексного лечения.
При применении ТИК у больных с ГР выявлено статистически значимое увеличение удельного веса сосудистого русла (CD34+, VEGF+) и IHscore эпидермального фактора роста – 1,93 ± 0,2; 0,86 ± 0,09 и 1х2 = 2, по сравнению с пациентами с ГР, не получавших подобное лечение (р < 0,05). Следует отметить, что в группе больных с КР после терапии также отмечалось статистически значимое увеличение удельного веса сосудистого русла (CD34+, VEGF+) и IНscore EGFR – 1,03 ± 0,21; 0,61 ± 0,1 и 2х2 = 4 по сравнению с такими показателями у пациентов с КР, не получавших разработанный метод лечения (р < 0,05). По результатам иммуногистохимического исследования установлено, что пациентам с ПР целесообразно применение ТИК, несмотря на стимуляцию ангиогенеза в зоне рубца и увеличение пролиферации эпидермиса, так как позволяет улучшить терапевтический и эстетический результаты терапии.
Применение разработанного комплексного метода лечения больных ПР позволило повысить эффективность терапии – сократить сроки существования клинических симптомов в 1,6 раза (в основной группе (28,0 ± 3,1) дня, в группе сравнения – (45,0 ± 5,3) дня, р <0,05). Предложено использование ТИК в качестве профилактики рецидивов ПР в режиме 1 раз в сутки в течение месяца и микродермабразии (2-3 процедуры), что позволило уменьшить в 7,7 раза частоту их рецидивов (в основной группе (2,1 ± 1,4) % против (16,1 ± 6,6) % в группе сравнения, р <0,05).
ВЫВОДЫ
В диссертации приведено теоретическое обоснование и практическое решение актуальной задачи дерматовенерологии – повышение эффективности лечения больных с гипертрофическими и келоидными рубцами путем разработки патогенетически обоснованного комплексного метода терапии на основании изучения патоморфологических, иммуногистохимических и биофизических особенностей рубцово-измененной ткани.
- В связи с большой распространенностью патологических рубцов у населения (5,8-17,3%), ростом количества пациентов с этой патологией, обратившихся в лечебные учреждения (4-22%), частым формированием гипертрофических и келоидных рубцов кожи после производственных и бытовых травм, их рецидивированием после терапии, что приводит к социальной дезадаптации пациентов, особенно трудоспособного возраста, актуальным является разработка комплексного метода терапии больных с патологическими рубцами.
- При анализе клинических особенностей патологических рубцов у 127 пациентов выявлено преобладание келоидных рубцов у женщин (42,1 %) до 20-летнего возраста, гипертрофических рубцов – у мужчин (38,3 %) от 31-40 лет. У пациентов с келоидными рубцами установлена большая выраженность клинических проявлений – окраски 1,9 балла, зуда 1,8 балла и фиброза кожи 2,1 балла по сравнению с аналогичными при гипертрофических рубцах (соответственно 1,5; 0,8; 1,5 балла), а также взаимосвязь этих изменений с давностью существования рубца.
- Выявлены особенности тканевой экспрессии CD34+, VEGF+, EGFR+, связанные с видом патологического рубца кожи. У больных с гипертрофическими рубцами установлено повышение в 1,5 раза удельного веса как зрелых (CD34+), так и вновь образованных сосудов разного калибра (VEGF+) по сравнению с показателями у больных с келоидными рубцами. Установлено отсутствие экспрессии EGFR у пациентов с обоими видами рубцов. По результатам биофизического анализа установлено статистически значимые различия в частоте и степени проявления сосудистого компонента: у больных с гипертрофическими рубцами доминировало умеренное количество сосудов в зоне рубца (52,6 %), у больных с келоидами – большое количество сосудов (45,1 %), а также вискоэластичность в зоне рубцовых дефектов (умеренная – у 53,9 % пациентов с ГР, повышенная – у 78,4 % больных с КР.
- Разработан метод комплексного этапного дифференцированного лечения пациентов с патологическими рубцами кожи, учитывающий сроки их существования. При длительности заболевания до одного года показано применение топических ингибиторов кальциневрина (такролимус мазь 0,1 % два раза в день в течение 4 недель, затем 1 раз в неделю 3 месяца) в сочетании с микродермабразией (при длительности до 6 мес. – 4-6 процедур, 6-12 мес. – 6-8 процедур); при рубцах от 1-3 лет – от 8 до 10 процедур микродермабразии или хирургическое иссечение. При давности рубца свыше 3 лет хирургическое иссечение рубцов целесообразно сочетать с использованием топических ингибиторов кальциневрина после снятия швов, а спустя 1 мес. – с выполнением микродермабразии в режиме 1 раз в неделю (4-6 процедур).
- Показан лечебный патоморфоз патологических рубцов, проявляющийся ингибированием зон роста келоидов за счет снижения пролиферативных эффектов лимфоцитов, гипертрофических рубцов – усиление репаративной регенерации кожи, коллагенолитический эффект и снижение удельного веса миофибробластов. Независимо от вида рубца происходила активация процессов неоангиогенеза, что проявлялось увеличением экспрессии CD34+ и VEGF+ (при гипертрофических рубцах – 1,93 % и 0,86 %; при келоидных рубцах – 1,03 % и 0,61 % соответственно), увеличением экспрессии EGFR+, положительной динамикой биофизических параметров рубцов (сосудистого компонента, вискоэластичности, ТЭПВ, рН), более выраженной у пациентов, получавших комбинированную терапию с использованием деструктивных и топических методов.
- Использование разработанного комплексного метода лечения больных с патологическими рубцами позволило повысить эффективность терапии – сократить сроки проявления клинических симптомов в 1,6 раза. Предложено применение ТИК в качестве профилактики рецидивов патологических рубцов в режиме 1 раз в день в течение месяца и микродермабразии (2-3 процедуры), что позволило уменьшить в 7,7 раза частоту их рецидивов (в основной группе – 2,1% против 16,1 % в группе сравнения).
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Автандилов Г. Г. Медицинская морфометрия / Г. Г. Автандилов. – М. : Медицина,1990. − 381 с.
- Ахтямов Н. Комбинированная терапия келоидных рубцов / Н. Ахтямов // Вестник последипломного медицинского образования. – 2003. – № 3/4. – С. 77 – 78.
- Белозерская Ю. А. Комплексный подход к терапии больных со спонтанно образовавшимися келоидами / Ю. А. Белозерская, Т. В. Святенко, Н. И. Ющишин // Дерматология. Косметология. Сексопатология. – 2004. – № 1-2. – С. 153 – 155.
- Белозоров А. П. Новая субпопуляция эффекторных хелперных Т‑лимфоцитов (TH22) и ее участие в патогенезе заболеваний кожи / А. П. Белозоров // Дерматологія та венерологія. − 2010. − № 2 (48). − С. 7-10.
- Белозоров А. П. Современные методы лабораторной диагностики в дерматологии и венерологии / А. П. Белозоров // Дерматологія та венерологія. – 2008. − № 4. − С. 77-79.
- Белоусов А. Е. Пластическая хирургия рубцов: возможности и проблемы / А. Е. Белоусов // Эстетическая медицина. – 2005. – № 4. – С. 145 – 152.
- Белоусов А. Е. Рубец как аргумент при выборе содержания эстетической операции / А. Е. Белоусов // Пластич. хирургия и косметология. – 2011. – № 1. – С. 72 – 83.
- Белоусов А. Е. Рубцы и их коррекция / А. Е. Белоусов. – СПб. : Командор- SPB, 2005. – 128 с.
- Болотная Л. А. Возможности такролимуса в лечении больных хроническими дерматозами / Л. А. Болотная // Український журнал дерматології, венерології, косметології. − 2012. − № 2 (45). – С. 27-32.
- Болховитинова Л. А. Келоидные рубцы / Л. А. Болховитинова, М. Н. Павлова. – М. : Медицина, 1977. – 136 с.
- Бондарев C. B. Применение препаратов коллагеназы для лечения патологических рубцов кожи / C. B. Бондарев, И. И. Турковский, Б. А. Парамонов // Нижегор. мед. журн. прил. Комбустиология. – 2004. – С. 215 – 216.
- Бондарев C. B. Применение препаратов коллагеназы для лечения ран и рубцов кожи : автореф. дис. на соиск. ученой степ. канд. мед. наук : спец. 14.00.27 «Хирургия» / С. В. Бондарев. – СПб., 2008. – 21 с.
- Влияние возраста пациента на структуру рубцов при пограничных дермальных ожогах / А. Е. Гуллер, Л. В. Шурова, В. А. Мензул, А. Б. Шехтер // Эксперим. и клинич. дерматокосметология. – 2006. – № 3. – С. 6 – 14.
- Герасименко М. Ю. Контрактубекс и физические факторы в комплексном лечении рубцовых деформаций / М. Ю. Герасименко, Е. В. Филатова, В. А. Стучилов // II Съезд комбустиологов России : сб. науч. тр. – М., 2008. – С. 187 – 188.
- Гуллер А. Е. Рубцы кожи человека: диагностика, основанная на морфологических данных / А. Е. Гуллер, А. Б. Шехтер // Эксперим. и клинич. дерматокосметология. – 2005. – № 6. – С. 11 – 16.
- Гуллер А. Е. Структурная композиция рубцов кожи человека / А. Е. Гуллер // Молодые ученые в медицине : X Всерос. науч.-практ. конф. – Казань, 2005. – С. 217-218.
- Дворянкова Е. В. Клиника и лечение гипертрофических рубцов / Е. B. Дворянкова, А. Б. Захарова // Амбулатор. хирургия. – 2006. – № 4. – С. 67 – 69.
- Динамика гидратации рубцовой ткани при местном лечении препаратами коллагеназы / А. Н. Кузнецов, И. И. Турковский, Б. А. Парамонов [и др.] // Бюллетень экспериментальной биологии и медицины. – 2007. – Т. 143, № 5. – С. 560–562.
- Дифференциальная диагностика рубцовых гипертрофий в дерматологической практике / В. В. Гладько, В. В. Шафранов, А. В. Таганов [и др.] // Науч. тр. ГИУВ МО РФ. – М., 2006. – Т. VI. – С. 53 – 55.
- Дифференциальная диагностика типа рубцовой ткани у детей с последствиями термической травмы лазерной допплеровской флуометрией / Л. В. Шурова, И. В. Бурков, Н. Р. Бархударова, И. В. Соболева // Скорая мед. помощь. – 2006. – № 3. – С. 218 – 219.
- Забненкова О. Клинический опыт коррекции гипертрофических, келоидных и атрофических рубцов / О. Забненкова // Врач. – 2007. – № 2. – С. 32 – 34.
- Задорожный Б. А. Криогенное воздействие на кожу жидким азотом в эксперименте и клинике / Б. А. Задорожный, С. П. Чень, Я. Ф. Кутасевич // Вестник дерматологии. − 1976, № 3. − С. 26-31.
- Иванова Е. Келоидные и гипертрофические рубцы: вопросы патогенеза / Е. Иванова // Косметика и медицина. – 2007. – № 2. – С. 4 – 11.
- Иванова Е. Методы лечения келоидных и гипертрофических рубцов / Е. Иванова // Косметика и медицина. – 2007. – № 2. – С. 50 – 57.
- К вопросу о коррекции постакне рубцовых гипертрофий криогенным методом / В. В. Гладько, А. В. Таганов, В. В. Шафранов [и др.] // Роль Московской гошпитали в становлении и развитии отечественного государственного больничного дела, медицинского образования и науки : тез. докл. науч.-истор. конф., 7 дек. 2007 г. / ГВКГ им. Н. Н. Бурденко. – М., 2007. – С. 84 – 85.
- К вопросу о коррекции рубцовых постакне криогенным методом / В. В. Гладько, А. В. Таганов, В. В. Шафранов [и др.] // Науч. тр. ГИУВ МО РФ. – М., 2006. – Т. VI. – С. 55 – 56.
- Калюжная Л. Д. Дифференцированный подход к лечению рубцов / Л. Д. Калюжная, Е. А. Бардова // Український журнал дерматології, венерології, косметології. – 2012. − № 3 (46). – С. 83-88.
- Карпова Т. Н. Электро- и ультрафонофорез коллагеназы в коррекции рубцов кожи / Т. Н. Карпова, Г. Н. Пономаренко, А. В. Самцов // Вестн. Рос. воен.-мед. акад. – 2009. – Т. 1. – С. 89 – 93.
- Келоидные рубцы у детей / В. В. Шафранов, Е. Н. Борхунова, А. В. Таганов [и др.]. – М. : Издательский Дом «Династия», 2006. –112 с.
- Кетлинский А. Современные аспекты изучения цитокинов / А. Кетлинский // Russian journal of immunology. − 1999. − Т. 4, № l. − P. 46-52.
- Клинико-инструментальная диагностика типа рубца у ожоговых реконвалесцентов / И. В. Соболева, Л. И. Будкевич, Л. В. Шурова [и др.] // Рос. вестн. перинаталогии и педиатрии. – 2008. – № 5. – С. 59 – 64.
- Ключарева С. В. Патологические рубцы в практике дерматокосметолога: новые возможности терапии препаратом «Галадерм» / С. В. Ключарева, О. С. Нечаева, И. Г. Курганская // Вестн. эстет. медицины. – 2009. – № 2. – С. 41 – 49.
- Ключарева С. В. Проблемы терапии рубцов / С. В. Ключарева, И. Г. Курганская // Актуальные вопросы дерматовенерологии, посвященные 85‑летию ГУЗ Иркутского областного КВД : материалы науч. тр. – Иркутск, 2009. – С. 41-43.
- Ковалевский А. А. Профилактика и лечение гипертрофических и келоидных рубцов при ожогах : автореф. дис. на соиск. ученой степ. канд. мед. наук : спец. 14.00.27 «Хирургия», 14.00.35 «Детская хирургия» / А. А. Ковалевский. – Омск, 2005. – 14 с. ; ил.
- Козлов В. А. Лечение келоидных рубцов / В.А. Козлов, С. С. Мушковская, С. Б. Коновальская // Материалы 4-го международного конгресса по пластической, реконструктивной и эстетической хирургии. – Ярославль, 2003. – С. 94 – 95.
- Коляденко В. Г. Застосування гелю «Контрактубекс» в лікуванні та запобігання розвитку рубців : метод. рек. / В. Г. Коляденко, В. І. Степаненко, П. В. Бардов. – К., 2001. – 12 с.
- Криогенные и СВЧ-криогенные методы в лечении рубцовых гипертрофии / В. В. Шафранов, Е. Н. Борхунова, А. В. Таганов [и др.] // Новое в практической медицинской криологии. – М., 2005. – С. 73 – 74.
- Криогенные методы лечения постакне келоидных и гипертрофических рубцов / В. В. Гладько, А. В. Таганов, В. В. Шафранов [и др.] // Информ. арх. (медицина, биология, образование). – 2007. – Т. 1, № 1. – С. 149 – 150.
- Курганская И. Г. Восстановительные технологии ремоделирования келоидных рубцов кожи / И. Г. Курганская, С. В. Ключарева // Вестн. восстанов. медицины. – 2011. – № 2. – С. 11 – 14.
- Курганская И. Г. Новые возможности комплексной терапии рубцовых дефектов кожи / И. Г. Курганская, С. В. Ключарева // Современные технологии восстановительной медицины : тез XI междунар. конф. «АСВОМЕД-2010». – Сочи, 2010. – С. 206-207.
- Курганская И. Г. Новые технологии комплексной коррекции рубцов кожи / И. Г. Курганская // Здравница – 2010 : материалы Междунар. науч. конгр. – М., 2010. – С. 94-95.
- Курганская И. Г. Разработка новых технологий комплексной коррекции рубцов кожи / И. Г. Курганская // Развитие санаторно-курортной помощи, восстановительного лечения и медицинской реабилитации : тез. докл. Всерос. форума. – М., 2010. – С. 467.
- Курганская И. Г. Ультрафонофорез лонгидазы в коррекции патологических рубцов кожи / И. Г. Курганская, С. В. Ключарева, Т. Н. Карпова // Вестн. Рос. Воен.-мед. акад. – 2011. – № 2. – С. 97 – 100.
- Курганская И. Г. Физические методы комплексной коррекции келоидных рубцов кожи / И. Г. Курганская // Стратегия и тактика санаторно-курортной реабилитации больных после радикального лечения онкопатологии : материалы науч.-практ. конф. – Миргород, 2010. – С. 161-162.
- Кутасевич Я. Ф. Современные возможности совершенствования наружного лечения дерматологических больных / Я. Ф. Кутасевич // Український журнал дерматології, венерології, косметології. – 2007. – № 4. – С. 7-10.
- Куценко И. В. Лечение келоидных рубцов методом внутриочаговой аппаратной криодеструкции / И. В. Куценко // Дерматологія та венерологія. − 2010. − № 4 (50). – С. 70-75.
- Кушлинский Н. Е. Значение половых стероидов и ангиогенных факторов роста в профилактике осложнений рубцевания после косметических операций / Н. Е. Кушлинский, Е. Н. Малыгин, Т. Г. Тенчурина // Изв. высш. учеб. заведений. Сев.-Кавк. регион. Спецвып. Актуальные проблемы современной медицины. – 2006. – С. 83 – 87.
- Лазерная коррекция посттравматических рубцов кожи лица / Е. В. Маслова, Я. А. Юцковская, Н. В. Кусая, Н. Б. Метляева // Соврем. наукоемкие технологии. – 2004. – № 5. – С. 63 – 64.
- Лечение и профилактика патологического рубцевания ран с помощью “Дермофибразе” : пособие для врачей / под ред. К. Г. Селезнева. – Донецк, 2011. – 46 с. : табл.
- Лечение постэруптивных келоидных рубцов криогенным и СВЧ-криогенным методом / В. В. Гладько, А. В. Таганов, В. В. Шафранов [и др.] // Науч. тр. ГИУВ МО РФ. – Т. VII. – 2007. – С. 81 – 82.
- Мавров И. И. Основы диагностики и лечения в дерматологии и венерологии: руководство для врачей, интернов и студентов / И. И. Мавров, Л. А. Болотная, И. М. Сербина. – Харьков : Факт, 2007. − 792 c.
- Машковский М. Д. Лекарственные средства : пособие для врачей / М. Д. Машковский. − 16-е изд., перераб., испр. и доп. − Москва : Новая волна : Издатель Умеренков, 2012. − 1216 с.
- Международные рекомендации по ведению больных с рубцами (для международной комиссии экспертов по лечению рубцов) / Т. А. Мустоэ, Р. Д. Куттер, М. Н. Голд [и др.] // Клинич. дерматология и венерология. – 2006. – № 1. – С. 92 – 96.
- Метод неинвазивной оценки типа рубцовой ткани у детей с последствиями ожоговой травмы / Л. В. Шурова, И. В. Бурков, В. Н. Федорова, И. В. Соболева // Скорая мед. помощь. – 2006. – № 3. – С. 217 – 218.
- Нарушение окислительного метаболизма как критерий оценки течения раневого процесса в эксперименте / В. В. Захаров, А. В. Николаев, Ч. Р. Рагимов [и др.] // Бюл. эксперим. биологии и медицины. – 1991. – Т. 112, № 12. – С. 590 – 593.
- Никитин А. А. К тактике лечения келоидных и гипертрофических рубцов / А. А. Никитин, Н. З. Спиридонова, В. А. Павлович // Материалы ІX междунар. конф. челюстно-лицевых хирургов и стоматологов, Санкт-Петербург, 25-27 мая 2004 г. – СПб., 2004. – С. 122.
- Никитин А. А. Метод криодеструкции в лечении келоидных и гипертрофических рубцов кожи лица и шеи / А. А. Никитин, Н. З. Спиридонова, В. А. Павлович // Новое в практической криологии : материалы 2-й междунар. науч.-практ. конф., г. Москва, 17 нояб. 2005 г. – М., 2005. – С. 69.
- Озерская О. С. Рубцы кожи и их дерматокосметологическая коррекция / О. С. Озерская. – СПб. : ОАО «Искусство России», 2007. – 224 с.
- Павлович В. А. NO-терапия келоидных и гипертрофических рубцов в области лица и шеи: опыт применения / В. А. Павлович, В. М. Эзрохин, А. Б. Шехтер // Вестн. эстет. медицины. – 2009. – Т. 8, № 2. – С. 50 – 57.
- Павлович В. А. Лечение и профилактика келоидных и гипертрофических рубцов в области лица и шеи с помощью экзогенного оксида азота / В. А. Павлович, В. М. Эзрохин // Технологии XXI века в стоматологии и челюстно-лицевой хирургии : сб. науч. тр. науч.-практ. конф. стоматологов и челюстно-лицевых хирургов центр. федер. окр. с междунар. участием. – Тверь, 2008. – С. 103-104.
- Павлович В. А. Опыт лечения и профилактики рубцов келоидного и гипертрофического характера в области лица и шеи / В. А. Павлович, В. М. Эзрохин // Стоматология. – 2008. – T. 87, № 2. – С. 46-49.
- Панова О. Дермабразия и химические пилинги в коррекции рубцов / О. Панова, Е. Санчес // Kosmetik international. – 2006. – № 6. – С. 22 – 26.
- Парамонов Б. А. Применение ферментов при лечении больных с гипертрофическими рубцами / Б. А. Парамонов, И. И. Турковский, С. В. Бондарев // Вестн. хирургии им. И. И. Грекова. – 2007. – № 4. – С. 84 – 85.
- Патогенез и гистоморфологические особенности рубцовых изменений кожи / О. В. Жукова, Н. Н. Потекаев, А. Г. Стенько, А. А. Бурдина // Клиническая дерматология и венерология. – 2009. − № 3. – С. 4-9.
- Полукаров Н. В. Оценка эффективности комбинированного способа лечения рубцов кожи / Н. В. Полукаров, В. Г. Голубев, О. А. Галкина // Соврем. проблемы дерматовенерологии, иммунологии и врачебной косметологии. – 2007. – Т. 1, № 1. – С. 35 – 39.
- Полукаров Н. Современные методы лечения патологических рубцов кожи и рубцовых осложнений / Н. Полукаров, В. Г. Голубев // Врач. – 2007. – № 2. – С. 59 – 62.
- Пономаренко Г. Н. Физические методы лечения / Г. Н. Пономаренко. – СПб., 1999. – 252 с.
- Применение косметического средства ферменкол для профилактики и коррекции рубцов кожи : метод. рек. практикующим косметологам / под ред. Парамонова Б. А. – СПб., 2005. – 24 с.
- Притуло О. А. Эмолленты и медицинские технологии коррекции синдрома сухой кожи в дерматологической и косметологической практике / О. А. Притуло, А. В. Горбенко // Украинский журнал дерматологии и венерологии. – 2012. − № 2 (45). – С. 82-91.
- Про удосконалення дерматовенерологічної допомоги населенню України : наказ № 286 від 07.06.2004 р. Міністерства охорони здоров’я України [Електронний документ]. – Режим доступу : http://www.moz.gov.ua/ua/portal/dn_20040607_286.html.
- Проблемы диагностики и лечения патологических рубцов / В. Г. Мишалов, В. В. Храпач, И. А. Назаренко [и др.] // Хирургия Украины. – 2008. – № 4 (28). – С. 109 – 114.
- Проценко Т. В. Применение пограничных лучей Букки в комплексном лечении гипертрофических рубцов / Т. В. Проценко // Вестн. дерматологии и венерологии. – 1984. – № 9. – С. 42 – 46.
- Резникова А. Е. Клинико-морфологические особенности, лечение и профилактика рубцов лица и шеи у детей : диссертация на соискание ученой степени кандидата медицинских наук : 14.00.21 / Резникова Анна Евгеньевна. − Москва, 1999. − 431 с.
- Родионов А. Н. Дерматокосметология. Поражения кожи лица и слизистых: диагностика, лечение, профилактика / А. Н. Родионов. – СПб. : Наука и техника, 2011. – 909 с, ил.
- Самцов А. В. Классификация, сравнительная клиническая характеристика и тактика лечения келоидных и гипертрофических рубцов кожи / А. В. Самцов, О. С. Озерская // Вестн. дерматологии и венерологии. – 2002. – № 3. – С. 70 – 72.
- Санакоева Э. Г. Криодеструкция и СВЧ-криодеструкция келоидных рубцов / Э. Г. Санакоева, В. В. Гладько // Воен.-мед. журн. – 2008. – Т. 329, № 5. – С. 61 – 62.
- Святенко Т. В. Атлас клинической дерматовенерологии / Т. В. Святенко, А. А. Франкенберг, В. Г. Шлопов ; под ред. Т. В. Святенко. – 2-е изд. − Днепропетровск, Донецк : Кроссроуд, 2012. − 460 с.
- Святенко Т. Лечение постакне. Рубцы и пигментации как следствие угревой болезни / Т. Святенко, Я. Снаговская // Косметолог. – 2011. − № 5. – С. 80-82.
- Серов В. В. Соединительная ткань: функциональная морфология и общая патология) / В. В. Серов, А. Б. Шехтер. – М. : Медицина, 1981. – 312 с.
- Сибилева К. Ф. Лечение и профилактика келоидных рубцов / К. Ф. Сибилева // Труды ЦИУ. − М., 1964. − Т. 76. – С. 287-288.
- Соболева И. В. Обоснование тактики лечения детей с послеожоговыми рубцами кожи : автореф. дис. на соиск. ученой степ. д-ра мед. наук : спец. 14.00.35 «Детская хирургия» / И. В. Соболева. – М., 2007. – 26 с., ил.
- Сравнительный анализ лечебных эффектов современных методов ремоделирования рубцов кожи: многоцентровое рандомизированное исследование / Г. Н. Пономаренко, С. В. Ключарева, И. Г. Курганская [и др.] // Вопросы курортологии, физиотерапии и лечебной физической культуры. – 2011. – № 3. – С. 29 – 32.
- Стандарт медицинской помощи больным с рубцовыми состояниями, фиброзом кожи, келоидным рубцом // Проблемы стандартизации в здравоохранении. – 2007. – № 10. – С. 97 – 102.
- Степаненко В. І. Структура організації надання дерматологічної та венерологічної допомоги у провідних країнах світу в аспекті перспектив реформування дерматовенерологічної служби в Україні / В. І. Степаненко, В. В. Короленко // Український журнал дерматології, венерології, косметології. − 2012. − № 1 (44). – С.10-18.
- Степько А. Г. Особенности клинической оценки результатов консервативной терапии при патологических рубцах / А. Г. Степько, С. Г. Ананян // Детская хирургия. – № 1. – 2006. – С. 49 – 50.
- Тенчурина Т. Г. Аргинин в процессе репаративной регенерации при пластических операциях и ожоговых травмах / Т. Г. Тенчурина // Эксперимент. и клинич. дерматокосметология. – 2006. – № 1. – С. 6 – 10.
- Тенчурина Т. Г. Аргинин-индуктор механизма гипертрофических рубцов / Т. Г. Тенчурина, Н. Е. Кушлинский, Е. Н. Малыгин // Науч. мысль Кавказа. – 2006. – Прил. – С. 226 – 233.
- Тенчурина Т. Г. Дисбаланс вазоактивных компонентов и его роль в формировании гипертрофических рубцов при пластических операциях / Т. Г. Тенчурина // Фундамент. исслед. – 2006. – № 11. – С. 17 – 21.
- Тенчурина Т. Г. Значение половых стероидов и ангиогенных факторов роста в профилактике осложнений рубцевания после косметических операций / Т. Г. Тенчурина // Эксперим. и клинич. дерматокосметология. – 2005. – № 4. – С. 17 – 21.
- Тенчурина Т. Г. Механизмы патологического заживления ран после ожогов / Т. Г. Тенчурина // Эксперимент. и клинич. дерматокосметология. – 2007. – № 1. – С. 3 – 5.
- Тенчурина Т. Г. Некоторые аспекты клеточной регуляции в процессе заживления ран после маммопластики / Т. Г. Тенчурина // Анналы пластической, реконструктив. и эстет. хирургии. – 2004. – № 4. – С. 152 – 153.
- Тенчурина Т. Г. Оценка влияния факторов роста и тиреотропина на процесс заживления послеоперационной раны / Т. Г. Тенчурина // Эксперимент. и клинич. дерматокосметология. – 2005. – № 1. – С. 43 – 47.
- Тенчурина Т. Г. Продукция оксида азота и его роль в заживлении ран при абдоминальной пластике / Т. Г. Тенчурина // Анналы пластической, реконструктив. и эстет. хирургии. – 2004. – № 4. – С. 153 – 154.
- Тенчурина Т. Г. Профилактика формирования гипертрофических рубцов после пластических операций с помощью фитотерапии / Т. Г. Тенчурина // Изв. высш. учеб. заведений. Сев.-Кавк. регион. Сер. : Естеств. науки. – 2005. – № S10. – С. 85 – 87.
- Тенчурина Т. Г. Процессы клеточной регуляции при заживлении ран с развитием гипертрофических рубцов / Т. Г. Тенчурина // Успехи соврем. естествознания. – 2006. – № 2. – С. 20 – 24.
- Тенчурина Т. Г. Роль трансформирующего фактора роста – бета в процессе заживления ран у обожженных / Т. Г. Тенчурина // Изв. высш. учеб. заведений. Сев.-Кавк. регион. Спецвып. Актуальные проблемы современной медицины. – 2006. – С. 84 – 89.
- Тенчурина Т. Г. Системный уровень оксида азота в прогнозировании осложненного заживления ран / Т. Г. Тенчурина // Изв. высш. учеб. заведений. Сев.-Кавк. регион. Сер. : Естеств. науки. – 2005. – № S7. – С. 85 – 91.
- Филяева Ю. А. Гомеостатические особенности ангиогенных факторов при заживлении раны гипертрофическим рубцом после маммопластики / Ю. А. Филяева, Т. Г. Тенчурина // Соврем. проблемы науки и образования. – 2007. – № 1. – С. 121 – 125.
- Финиченко С. Устранение рубцовых изменений на коже методом контрастного массажа / С. Финиченко // Журн. по прикладной эстетике. – 2007. – № 5. – С. 24 – 34.
- Фисенко Г. И. Коррекция рубцовых изменений кожи лица методом ранней повторной дермабразии : автореф. дис. на соиск. ученой степ. канд. мед. наук : спец. 14.00.27 «Хирургия» / Г. И. Фисенко. – М., 2005. – 24 с.
- Фисталь Н. Н. Оценка эффективности геля Дерматикс в профилактике и лечении послеожоговых рубцов / Н. Н. Фисталь. – Укр. мед. часоп. – 2006. – № 2 (52) III – IV. – С. 65 – 67.
- Фисталь Н. Н. Патологические рубцы в косметологической практике / Н. Н. Фисталь // XII Национальный конгресс по дерматокосметологии и эстетической медицине. – Донецк, 2012. – С. 57.
- Фурманов А. Ю. Келоидные и гипертрофические рубцы / А. Ю. Фурманов // Medicus Amicus. − 2006. − № 2. − С. 87-90.
- Цветкова Г. М. Патоморфологическая диагностика заболеваний кожи : рук. / Г. М. Цветкова, В. Н. Мордовцев. – М. : Медицина, 1986. – 301 с.
- Цепколенко В. А. Лазерные технологии в эстетической медицине / В. А. Цепколенко. – К. : ЗАО «Компания Эстет», 2009. – 192 с.
- Чугуй Е. В. Криолечение рубцов покровных тканей : дис. … канд. мед. наук : 14.00.27 / Чугуй Елена Валентиновна. – Томск, 2003. – 149 с.
- Шехтер А. Б. Фибробласт фиброкласт: ультраструктурные механизмы резорбции коллагена / А. Б. Шехтер, З. П. Малинова // Арх. патологии. – 1975. – № 3. – С. 18 – 22.
- Щеголев В. В. Клинико-экспериментальное обоснование применения аллогенных фибробластов для лечения рубцов и атрофий кожи : дис. … канд. мед. наук : 14.00.11 / Щеголев Виталий Владимирович. – СПб., 2009. – 120 с.
- Электрофорез препарата ферменкол в лечении рубцов кожи в дерматологии и хирургии : методические рекомендации. – СПб., 2012. – 12 с.
- A review of the biologic effects, clinical efficacy, and safety of silicone elastomer sheeting for hypertrophic and keloid scar treatment and management / B. Berman, O. A. Perez, S. Konda [et al.] // Dermatol. Surg. – 2007. – Vol. 33, № 11. – P. 1291 – 1302.
- Alster T. Laser scar revision: a review / T. Alster, L. Zaulyanov // Dermatol. Surg. – 2007. – Vol. 33, № 2. – P. 131 – 140.
- Alster T. S. Nonablative cutaneous remodeling using radiofrequency devices / T. S. Alster, J. R. Lupton // Clin. Dermatol. – 2007. – Vol. 25, № 5. – P. 487 – 491.
- Assessment of Epidermal Growth Factor Receptor (EGFR) expression in human meningioma [Electronic resource] / A. G. Wernicke,A. P. Dicker, M. Whiton [et al.] // Radiation Oncology. – 2010. – Vol. 5. − Electronic data. − Access mode : http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2890616/.
- Atiyeh B. S. Keloid or hypertrophic scar: the controversy: review of the literature / B. S. Atiyeh, M. Costagliola, S. N. Hayek // Ann. Plast. Surg. – 2005. – Vol. 54, № 6. – P. 676 – 680.
- Atiyeh B. S. Nonsurgical management of hypertrophic scars: evidence-based therapies, standard practices, and emerging methods / B. S. Atiyeh // Aesthetic Plastic Surgery. – 2007. – Vol. 31, № 5. – P. 468-492.
- Baisch A. Hyperplastische narben und keloide / A. Baisch, F. Riedel // HNO. − 2006. − Vol. 54, № 12. − P. 981-994.
- Bayat A. Clinical management of skin scarring / A. Bayat, D. A. McGrouther // Skinmed. – 2005. – Vol. 4, № 3. – P. 165–173.
- Berman B. Keloid and hypertrophic scar [Electronic resource] / B. Berman, W. Valins. − Electronic data. − Access mode: http://misc.medscape.com/pi/android/medscapeapp/html/A1057599-business.html.
- Biryukov M. L. The scars caused by burns, their structure, varieties and complications / M. L. Biryukov, T. N. Belyakova, G. I. Dmitriev // Acta Chirurgiae Plasticae. − 1979. – Vol. 21, № 2. − С. 86-95.
- Bouwstra J. A. The skin barrier in healthy and diseased state / J. A. Bouwstra, M. Ponec. // Biochim. Biophys. Acta. – 2006. – Vol. 1758, № 12. – P. 2080 – 2095.
- Brown C. A. The use of silicon gel for treating children’s burn scars in Saudi Arabia: a case study / C. A. Brown // Occupational Therapy International. − 2002. − Vol. 9, № 2. − P. 121-130.
- Brown J. J. Genetic susceptibility to raised dermal scarring / J. J. Brown, A. Bayat // Br. J. Dermatol. – 2009. – Vol. 161, № 1. – P. 8 – 18.
- Burd A. Hypertrophic response and keloid diathesis: two very different forms of scar / A. Burd, L. Huang // Plast. Reconstr. Surg. – 2005. – Vol. 116, № 7. – P. 150e – 157e.
- Characterization of complexes formed between TSG-6 and inter-alpha-inhibitor that act as intermediates in the covalent transfer of heavy chains onto hyaluronan / M. S. Rugg, A. C. Willis, D. Mukhopadhyay [et al.] // J. Biol. Chem. – Vol. 2005280, № 27. – P. 25674-25686.
- Characterization of hyaluronan and TSG-6 in skin scarring: differential distribution in keloid scars, normal scars and unscarred skin / K. T. Tan, D. A. McGrouther, A. J. Day [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2011. – Vol. 25, № 3. – P. 317 – 327.
- Clark R. A. Fibrin and wound healing / R. A. Clark // Ann. N. Y. Acad. Sci. – 2001. – Vol. 936. – P. 355 – 367.
- Collagen fibril formation. A new target to limit fibrosis / H. J. Chung, A. Steplewski, K.Y. Chung [et al.] // J. Biol. Chem. – 2008. – Vol. 283, № 38. – P. 25879-25886.
- Comparative proteomic analysis between normal skin and keloid scar / C. T. Ong, Y. T. Khoo, A. Mukhopadhyay [et al.] // Br. J. Dermatol. – 2010. – Vol. 162, № 6. – P. 1302 – 1315.
- Comparison between human fetal and adult skin / N. A. Coolen, K. C. Schouten, E. Middelkoop, M. M. Ulrich // Arch. Dermatol. Res. – 2010. – Vol. 302, № 1. – P. 47 – 55.
- Copcu E. Combination of surgery and intralesional verapamil injection in the treatment of the keloid / E. Copcu, N. Sivrioglu, Y. Oztan // J. Burn Care Rehabil. – 2004. – Vol. 25, № 1. – P. 1 – 7.
- Deep dermal fibroblasts contribute to hypertrophic scarring / J. Wang, C. Dodd, H. A. Shankowsky [et al.] // Lab. Invest. – 2008. – Vol. 88, № 12. – P. 1278 – 1290.
- Development of gene microarray in screening differently expressed genes in keloid and normal-control skin / W. Chen, X. B. Fu, S. L. Ge [et al.] // Chin. Med. J. (Engl.). – 2004. – Vol. 117, № 6. – P. 877 – 881.
- Differences in collagen architecture between keloid, hypertrophic scar, normotrophic scar, and normal skin: an objective histopathological analysis / P. D. Verhaegen, P. P. van Zuijlen, N. M. Pennings [et al.] // Wound Repair Regen. – 2009. – Vol. 17, № 5. – P. 649 – 656.
- Do postsurgical interventions optimize ultimate scar cosmesis / M. H. Viera, S. Amini, S. Konda, B. Berman // Giornale italiano di dermatologia e venereologia : organo ufficiale, Società italiana di dermatologia e sifilografia. – 2009. – Vol. 144, № 3. – P. 243-257.
- Draelos Z. D. The ability of onion extract gel to improve the cosmetic appearance of postsurgical scars / Z. D. Draelos // J. Cosm. Dermatol. – 2008. – Vol. 7, № 2. – P. 101-104.
- Durani P. The Patient Scar Assessment Questionnaire: a reliable and valid patient-reported outcomes measure for linear scars / P. Durani, D. A. McGrouther, M. W. Ferguson // Plast. Reconstr. Surg. – 2009. – Vol. 123, № 5. – P. 1481 – 1489.
- Durbeej M. Laminins / M. Durbeej // Cell Tissue Res. – 2010. – Vol. 339, № 1. – P. 259 – 268.
- Effect of transforming growth factor-beta1 antisense oligonucleotides on matrix metalloproteinases and their inhibitors in keloid fibroblasts / G. M. Bran, U. R. Goessler, A. Baftiri [et al.] // Otolaryngol. Head Neck Surg. – 2010. – Vol. 143, № 1. – P. 66 – 71.
- Eming S. A. Inflammation in wound repair: molecular and cellular mechanisms / S. A. Eming, T. Krieg, J. M. Davidson // J. Invest. Dermatol. – 2007. – Vol. 127, № 3. – P. 514 – 525.
- Epigenetically altered wound healing in keloid fibroblasts / S. B. Russell, J. D. Russell, K. M. Trupin [et al.] // J. Invest. Dermatol. – 2010. – Vol. 130, № 10. – P. 2489 – 2496.
- Extracellular matrix molecules: potential targets in pharmacotherapy / H. Järveläinen, A Sainio, M. Koulu [et al.] // Pharmacol. Rev. – 2009. – Vol. 61, № 2. – P. 198 – 223.
- Fibrillin-1 and elastin are differentially expressed in hypertrophic scars and keloids / T. P. Amadeu, A. S. Braune, L. C. Porto [et al.] // Wound Repair Regen. – 2004. – Vol. 12, № 2. – P. 169 – 174.
- Fibroblasts from the growing margin of keloid scars produce higher levels of collagen I and III compared with intralesional and extralesional sites: clinical implications for lesional site-directed therapy / F. Syed, E. Ahmadi, S. A. Iqbal [et al.] // Br. J. Dermatol. – 2010. – Vol. 164, № 1. – P. 83 – 96.
- Fibrotic disorders in the eye: targets of gene therapy / S. Saika, O. Yamanaka, T. Sumioka [et al.] // Prog. Retin. Eye Res. – 2008. – Vol. 27, № 2. – P. 177 – 196.
- 5-fluorouracil blocks transforming growth factor-beta-induced alpha 2 type I collagen gene (COL1A2) expression in human fibroblasts via c-Jun NH2-terminal kinase/activator protein-1 activation / J. Wendling, A. Marchand, A. Mauviel, F. Verrecchia // Molecular Pharmacology. – 2003. – Vol. 64, № 3. – P. 707–713.
- 1550-nm nonablative laser resurfacing for facial surgical scars / A. M. Pham, R. M. Greene, H. Woolery-Lloyd [et al.] // Arch. Facial Plast. Surg. – 2011. – Vol. 13, № 3. – P. 203 – 210.
- Fractional photothermolysis: a new concept for cutaneous remodeling using microscopic patterns of thermal injury / D. Manstein, G. S. Herron, R. K. Sink [et al.] // Lasers Surg. Med. – 2004. – Vol. 34, № 5. – P. 426 – 438.
- Further similarities between cutaneous scarring in the female, red Duroc pig and human hypertrophic scarring / K. Q. Zhu, L. H. Engrav, R. N. Tamura [et al.] // Burns. – 2004. – Vol. 30, № 6. – P. 518 – 530.
- Gallant-Behm C. L. Cytokine and growth factor mRNA expression patterns associated with the hypercontracted, hyperpigmented healing phenotype of red duroc pigs: a model of abnormal human scar development? / C. L. Gallant-Behm, M. E. Olson, D. A. Hart // J. Cutan. Med. Surg. – 2005. – Vol. 9, № 4. – P. 165 – 177.
- Gene expression in human keloids is altered from dermal to chondrocytic and osteogenic lineage / M. Naitoh, H. Kubota, M. Ikeda [et al.] // Genes Cells. – 2005. – Vol. 10, № 11. – P. 1081 – 1091.
- Gene expression patterns in isolated keloid fibroblasts / L. Satish, J. Lyons-Weiler, P. A. Hebda, A. Wells // Wound Repair Regen. – 2006. – Vol. 14, № 4. – P. 463 – 470.
- Gene profiling of keloid fibroblasts show altered expression in multiple fibrosis-associated pathways / J. C. Smith, B. E. Boone, S. R. Opalenik [et al.] // J. Invest. Dermatol. – 2008. – Vol. 128, № 5. – P. 1298 – 1310.
- Genome scans provide evidence for keloid susceptibility loci on chromosomes 2q23 and 7p11 / A. G. Marneros, J. E. Norris, S. Watanabe [et al.] // J. Invest. Dermatol. – 2004. – Vol. 122, № 5. – P. 1126 – 1132.
- Genomic and proteomic profiling II: comparative assessment of gene expression profiles in leiomyomas, keloids, and surgically-induced scars / X. Luo, Q. Pan, L. Liu, N. Chegini // Reprod. Biol. Endocrinol. – 2007. – Vol. 5. – P. 35.
- Hantash B. M. Fractional photothermolysis: a novel aesthetic laser surgery modality / B. M. Hantash, M. B. Mahmood // Dermatol. Surg. – 2007. – Vol. 33, № 5. – P. 525 – 534.
- He X. J. A study of the abnormalities of human epiderm in keloids and hypertrophic scars / X. J. He, C. M. Han, J. P. Peng // Zhonghua wai ke za zhi. − 2004. – Vol. 42, № 14. – P. 845-848.
- Histology of the thick scar on the female, red Duroc pig: final similarities to human hypertrophic scar / N. Harunari, K. Q. Zhu, R. T. Armendariz [et al.] // Burns. – 2006. – Vol. 32, № 6. – P. 669 – 677.
- Histopathological differential diagnosis of keloid and hypertrophic scar / J. Y. Lee, C. C. Yang, S. C. Chao [et al.] // Am. J. Dermatopathol. – 2004. – Vol. 26, № 5. – P. 379 – 384.
- Hyaluronan facilitates transforming growth factor-beta1-mediated fibroblast proliferation / S. Meran, D. W. Thomas, P. Stephens [et al.] // J. Biol. Chem. – 2008. – Vol. 283, № 10. – P. 6530 – 6545.
- Hyaluronan-dependent pericellular matrix / S. P. Evanko, M. I. Tammi, R. H. Tammi, T. N. Wight // Adv. Drug Deliv. Rev. – 2007. – Vol. 59, № 13. – P. 1351 – 1365.
- Hypertrophic and keloidal scars: an approach to polytherapy // F. Boutli-Kasapidou, A. Tsakiri, E. Anagnostou, O. Mourellou // Int. J. Dermatol. – 2005. – Vol. 44, № 4. – P. 324-327.
- Hypertrophic scars and keloids. Part 1. Conventional treatments / A. C. Vivas, J. C. Tang, A. D. Maderal, M. H. Viera // Cosmetic Dermatology. – 2012. – Vol. 25, № 7. – P. 309-316.
- Hypoxia-induced HIF-1 alpha accumulation is augmented in a co-culture of keloid fibroblasts and human mast cells: involvement of ERK1/2 and PI-3K/Akt. / Q. Zhang, C. K. Oh, D. V. Messadi [et al.] // Exp. Cell Res. – 2006. – Vol. 312, № 2. – P. 145 – 155.
- Identification of unique gene expression patterns within different lesional sites of keloids / O. Seifert, A. Bayat, R. Geffers [et al.] // Wound Repair Regen. – 2008. – Vol. 16, № 2. – P. 254 – 265.
- Increased vascular endothelial growth factor may account for elevated level of plasminogen activator inhibitor-1 via activating ERK1/2 in keloid fibroblasts / Y. Wu, Q. Zhang, D. K. Ann [et al.] // Am. J. Physiol. Cell. Physiol. – 2004. – Vol. 286, № 4. – P. С905 – С912.
- Innovative therapies in the treatment of keloids and hypertrophic scars / M. H. Viera, S. Amini,W. Valins, B. Berman // J. Clin. Aesth. Dermatol. – 2010. – Vol. 3, № 5. – P. 20–26.
- International clinical recommendations on scar management / T. A. Mustoe, R. D. Cooter, M. H. Gold [et al.] // Plastic and Reconstructive Surgery. – 2002. – Vol. 110, № 2. – P. 560–571.
- Intradermal imus prevent scar hypertrophy in a rabbit ear model: a clinical, histological and spectroscopical analysis / H. Gisquet, H. Liu, W. C. Blondel [et al.] // Skin Research and Technology. – 2011. – Vol. 17, № 2. – P. 160-166.
- Jackson-Boeters L. Periostin localizes to cells in normal skin, but is associated with the extracellular matrix during wound repair / L. Jackson-Boeters, W. Wen, D. W. Hamilton // J. Cell Commun. Signal. – 2009. – Vol. 3, № 2. – P. 125 – 133.
- Kelemen O. A hypertrophiás hegek intralaesionalis szteroid és polisziloxán-tapaszos kezelésének összehasonlító klinikai vizsgálata / O. Kelemen, L. Kollár, G. Menyhei // Magy. Seb. – 2007. – R. 60, № 6. – L. 297 – 300.
- Kelly A. P. Update on the management of keloids / A. P. Kelly // Semin. Cutan. Med. Surg. – 2009. – Vol. 28, № 2. – P. 71 – 76.
- Keloids: a 6 year review of the clinical relevance of steroid therapy / A. Edwin, S. Mobin, V. Partha [et al.] // Abstracts of 12th Congress of the European Burns Association. – Budapest, 2007. – P. 29.
- Keloids: current concepts of pathogenesis / G. M. Bran, U. R. Goessler, K. Hormann [et al.] // Int. J. Mol. Med. – 2009. – Vol. 24, № 3. – P. 283 – 293.
- Keloids: pathophysiology and management / D. T. Robles, E. Moore, M. Draznin, D. Berg // Dermatology Online Journal [Electronic resource]. – 2007. – Vol. 13, № 3. – P. 9.
- Kirn-Safran C. Multifunctionality of extracellular and cell surface heparan sulfate proteoglycans / C. Kirn-Safran, M. C. Farach-Carson, D. D. Carson // Cell. Mol. Life Sci. – 2009. – Vol. 66, № 21. – P. 3421 – 3434.
- Köse O. Keloids and hypertrophic scars: are they two different sides of the same coin? / O Köse, A. Waseem // Dermatol. Surg. – 2008. – Vol. 34, № 3. – P. 336 – 346.
- Lane J. E. Relationship between age of ear piercing and keloid formation / J. E. Lane, J. L. Waller, L. S. Davis // Pediatrics. – 2005. – Vol. 115, № 5. – P. 1312 – 1314.
- Larson B. J. Scarless fetal wound healing: a basic science review / B. J. Larson, M. T. Longaker, H. P. Lorenz // Plast. Reconstr. Surg. – 2010. – Vol. 126, № 4. – P. 1172 – 1180.
- Laser in the treatment of hypertrophic burn scars / M. Kaweski, T. Bernard-Wisniewska, S. Sakiel [et al.] // Wound J. – 2008. – Vol. 5, № 1. – P. 87 – 97.
- Laser treatment of post-burn scars: potentials and limitations / A. Eberlein, H. Schepler, G. Spilker [et al.] // Burns. – 2005. – Vol. 31, № 1. – Р. 15 – 24.
- Lee J. H. Effects of interferon-alpha2b on keloid treatment with triamcinolone acetonide intralesional injection / J. H. Lee, S. E. Kim, A. Y. Lee // Int. J. Dermatol. – 2008. – Vol. 47, № 2. – P. 183 – 186.
- Lee S. H. An update of the defensive barrier function of skin / S. H. Lee, S. K. Jeong, S. K. Ahn // Yonsei Med. J. – 2006. – Vol. 47, № 3. – P. 293 – 306.
- Lee W. J. HSP 70 and its effect on expression matrix metalloproteinase-2,9 on the keloid / W. J. Lee, J. E. Lee // Abstracts of 12th Congress of the European Burns Association. – Budapest, 2007. – P. 55.
- Leventhal D. Treatment of keloids and hypertrophic scars: a meta-analysis and review of the literature / D. Leventhal, M. Furr, D. Reiter // Arch. Facial Plast. Surg. – 2006. – Vol. 8, № 6. – P. 362 – 368.
- Localization of small leucine-rich proteoglycans and transforming growth factor-beta in human oral mucosal wound healing / D. Honardoust, A. Eslami, H. Larjava, L. Häkkinen // Wound repair regen. – 2008. – Vol. 16, № 6. – P. 814 – 823.
- Low decorin expression along with inherent activation of ERK1,2 in ear lobe keloids / J. Meenakshi, S. Vidyameenakshi, D. Ananthram [et al.] // Burns. – 2009. – Vol. 35, № 4. – P. 519 – 526.
- Makino S. DHMEQ, a novel NF-kappaB inhibitor, suppresses growth and type I collagen accumulation in keloid fibroblasts / S. Makino, N. Mitsutake, M. Nakashima // J. Dermatol. Sci. – 2008. – Vol. 51, № 3. – P. 171 – 180.
- Marneros A. G. Keloids – clinical diagnosis, pathogenesis, and treatment options / A. G. Marneros, T. Krieg // J. Dtsch. Dermatol. Ges. – 2004. – Vol. 2, № 11. – P. 905 – 913.
- Matrix metalloproteinases and tissue inhibitors of metalloproteinases in patients with different types of scars and keloids / D. Ulrich, F. Ulrich, F. Unglaub [et al.] // J. Plast. Reconstr. Aesthet. Surg. – 2010. – Vol. 63, № 6. – P. 1015 – 1021.
- Moali C. Extracellular and cell surface proteases in wound healing: new players are still emerging / C. Moali, D. J. Hulmes // Eur. J. Dermatol. – 2009. – Vol. 19, № 6. – P. 552 – 564.
- Mofikoya B. O. Keloid and hypertrophic scars: a review of recent developments in pathogenesis and management / B. O. Mofikoya W. L. Adeyemo, A. A. Abdus-salam // Nigerian quarterly journal of hospital medicine. – 2007. – Vol. 17, № 4. – P. 134–139.
- Molecular dissection of abnormal wound healing processes resulting in keloid disease / B. Shih, E. Garside, D. A. McGrouther, A. Bayat // Wound repair regen. – 2010. – Vol. 18, № 2. – P. 139 – 153.
- Multi Skin Test Center® MC 900 & Software [Electronic resource]. − Electronic data. − Access mode: http://www.courage-khazaka.de/index.php/en/.
- Namazi M. R. Strategies for prevention of scars: what can we learn from fetal skin? / M. R. Namazi, M. K. Fallahzadeh, R. A. Schwartz // Int. J. Dermatol. – 2011. – Vol. 50, № 1. – P. 85 – 93.
- Neudecker B. A. Aberrant serum hyaluronan and hyaluronidase levels in scleroderma / B. A. Neudecker, R. Stern, M. K. Connolly // Br. J. Dermatol. – 2004. – Vol. 150, № 3. – P. 469 – 476.
- Periostin regulates collagen fibrillogenesis and the biomechanical properties of connective tissues / R. A. Norris, B. Damon, V. Mironov [et al.] // J. Cell. Biochem. – 2007. – Vol. 101, № 3. – P. 695 – 711.
- Prevention and reduction of scarring in the skin by Transforming Growth Factor beta 3 (TGFbeta3): from laboratory discovery to clinical pharmaceutical / N. L. Occleston, H. G. Laverty, S. O’Kane, M. W. Ferguson // J. Biomater. Sci. Polym. Ed. – 2008. – Vol. 19, № 8. – P. 1047 – 1063.
- Proksch E. The skin: an indispensable barrier / E. Proksch, J. M. Brandner, J. M. Jensen // Exp. dermatol. – 2008. – Vol. 17, № 12. – P. 1063 – 1072.
- Promoted activation of matrix metalloproteinase (MMP)-2 in keloid fibroblasts and increased expression of MMP-2 in collagen bundle regions: implications for mechanisms of keloid progression / R. Imaizumi, Y. Akasaka, N. Inomata [et al.] // Histopathology. – 2009. – Vol. 54, № 6. – P. 722 – 730.
- Reduced dermatopontin expression is a molecular link between uterine leiomyomas and keloids / W. H. Catherino, P. C. Leppert, M. H. Stenmark [et al.] // Genes chromosomes cancer. – 2004. – Vol. 40, № 3. – P. 204 – 217.
- Reisch R. G. Scars: a rewiew of emerging and currently available therapies / R. G. Reisch, E. Ericsson // Plastic and reconstructive surgery. – 2008. − Vol. 122, № 4. − P. 1068-1078.
- Robles D. T Abnormal wound healing: keloids / D. T. Robles, D. Berg // Clinics in dermatology. − 2007. − Vol. 25, № l. − P. 26-32.
- Role of vitronectin and fibronectin receptors in oral mucosal and dermal myofibroblast differentiation / K. A. Lygoe, I. Wall, P. Stephens, M. P. Lewis // Biol. Cell. – 2007. – Vol. 99, № 11. – P. 601 – 614.
- Sanders K. W. Topical mitomycin C in the prevention of keloid scar recurrence / K. W. Sanders, L. Gage-White, F. J. Stucker // Arch. Facial. Plast. Surg. – 2005. – Vol. 7, № 3. – P. 172 – 175.
- Sandjeu Y. Desmosealin and other components of the epidermal extracellular matrix / Y. Sandjeu, M. Haftek // J. Physiol. Pharmacol. – 2009. – Vol. 60, suppl. 4. – P. 23 – 30.
- Schultz G. S. Interactions between extracellular matrix and growth factors in wound healing / Schultz GS, A. Wysocki // Wound Repair Regen. – 2009. – Vol. 17, № 2. – P. 153 – 162.
- Shih B. Genetics of keloid scarring / B. Shih, A. Bayat // Arch. Dermatol. Res. – 2010. – Vol. 302, № 5. – P. 319 – 339.
- Shih B. Identification of novel keloid biomarkers through profiling of tissue biopsies versus cell cultures in keloid margin specimens compared to adjacent normal skin / B. Shih, D. A. McGrouther, A. Bayat // Eplasty. – 2010. – Vol. 10. – P. е24.
- Slemp A. E. Keloids and scars: a review of keloids and scars, their pathogenesis, risk factors, and management / A. E. Slemp, R. E. Kirschner // Curr. Opin. Pediatr. – 2006. – Vol. 18, № 4. – P. 396 – 402.
- Smad3 signalling plays an important role in keloid pathogenesis via epithelial- mesenchymal interactions / T. T. Phan, I. J. Lim, O. Aalami [et al.] // J. Pathol. – 2005. – Vol. 207, № 2. – P. 232 – 242.
- Sobanko J. F. Laser treatment for improvement and minimization of facial scars / J. F. Sobanko, T. S. Alster // Facial. Plast. Surg. Clin. North Am. – 2011. – Vol. 19, № 3. – P. 527 – 542.
- SPARC regulates extracellular matrix organization through its modulation of integrin- linked kinase activity / T. H. Barker, G. Baneyx, M. Cardó-Vila [et al.] // J. Biol. Chem. – 2005. – Vol. 280, № 43. – P. 36483-36493.
- Spatiotemporal expression of periostin during skin development and incisional wound healing: lessons for human fibrotic scar formation / H. M. Zhou, J. Wang, C. Elliott [et al.] // J. Cell Commun. Signal. – 2010. – Vol. 4, № 2. – P. 99 – 107.
- Studies of transforming growth factors beta 1-3 and their receptors I and II in fibroblasts of keloids and hypertrophic scars / O. Bock, H. Yu, S. Zitron [et al.] // Acta Derm. Venereol. – 2005. – Vol. 85, № 3. – P. 216-220.
- Syndecan-2 and decorin: proteoglycans with a difference – implications in keloid pathogenesis / A. Mukhopadhyay, M. Y. Wong, S. Y. Chan [et al.] // J. Trauma. – 2010. – Vol. 68, № 4. – P. 999 – 1088.
- Tanriverdi-Akhisaroglu S. Matrix metalloproteinase-2 and -9 activities in human keloids, hypertrophic and atrophic scars: a pilot study / S. Tanriverdi-Akhisaroglu, A. Menderes, G. Oktay // Cell Biochem. Funct. – 2009. – Vol. 27, № 2. – P. 81 – 87.
- Tenascin–X deficiency and Ehlers-Danlos syndrome: a case report and review of the literature / M. O’Connell, N. P. Burrows, M. J. van Vlijmen-Willems [et al.] // Br. J. Dermatol. – 2010. – Vol. 163, № 6. – P. 1340 – 1345.
- The molecular basis of inter-alpha-inhibitor heavy chain transfer on to hyaluronan / C. M. Milner, W. Tongsoongnoen, M. S. Rugg, A. J. Day // Biochem. Soc. Trans. – 2007. – Vol. 35, pt. 4. – P. 672 – 676.
- Topical tamoxifen therapy in hypertrophic scars or keloid in burns / A. Gragnani, M. Warde, F. Furtado, L. M. Ferreira // Arch. dermatol. res. – 2010. – Vol. 302, № 1. – P. 1 – 4.
- Tran K. T. Extracellular matrix signaling through growth factor receptors during wound healing / K. T. Tran, L. Griffith, A. Wells // Wound repair regen. – 2004. – Vol. 12, № 3. – P. 262 – 268.
- Treatment of hypertrophic scar with the silicone cushion / Y. K. Tosa, T. K. Satoh, Y. Hosaka [et al.] // Wound and regeneration. – 2004. – Vol. 12, № 1. – P. A6.
- TSG-6 transfers proteins between glycosaminoglycans via a Ser28-mediated covalent catalytic mechanism / K. W. Sanggaard, C. S. Sonne-Schmidt, T. P. Krogager [et al.] // J. Biol. Chem. – 2008. – Vol. 283, № 49. – P. 33919 – 33926.
- Zurada J. M. Topical treatments for hypertrophic scars / J. M. Zurada, D. Kriegel, I. C. Davis // J. Am. Acad. Dermatol. – 2006. – Vol. 55, № 6. – P. 1024 – 1031.
Приложение А
Акты внедрения





