Державна установа
«Інститут дерматології та венерології НАМН України»
Макуріна Галина Іванівна
УДК: 616.517-06-091.8-092.18-036-08-035
ПСОРІАЗ ТА КОМОРБІДНІ СТАНИ: КЛІНІКО-МОРФОЛОГІЧНІ ОСОБЛИВОСТІ, МЕХАНІЗМИ РОЗВИТКУ, ПІДХОДИ ДО ЛІКУВАННЯ
14.01.20 – шкірні та венеричні хвороби
Автореферат дисертації на здобуття наукового ступеня доктора медичних наук
Харків – 2017
Дисертацією є рукопис.
Робота виконана у Запорізькому державному медичному університеті МОЗ України.
Наукові консультанти:
доктор медичних наук, професор Федотов Валерій Павлович, Запорізький державний медичний університет МОЗ України, завідувач кафедри дерматовенерології та косметології з курсом дерматовенерології і естетичної медицини факультету післядипломної освіти;
доктор медичних наук, професор Візір Вадим Анатолійович, Запорізький державний медичний університет МОЗ України, проректор з науково-педагогічної роботи, професор кафедри внутрішніх хвороб № 2.
Офіційні опоненти:
доктор медичних наук, професор Біловол Алла Миколаївна, Харківський національний медичний університет МОЗ України, завідуюча кафедрою дерматології, венерології та медичної косметології;
доктор медичних наук, професор Бондар Сергій Анатолійович, Вінницький національний медичний університет імені М.І. Пирогова МОЗ України, завідувач кафедри шкірних та венеричних хвороб;
доктор медичних наук, професор Галникіна Світлана Олександрівна, Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України, професор кафедри інфекційних хвороб з епідеміологією, шкірними та венеричними хворобами.
Захист відбудеться «24» січня 2018 р. об 11:00 год. на засіданні спеціалізованої вченої ради Д 64.603.01 при ДУ «Інститут дерматології та венерології НАМН України» за адресою: 61057, м. Харків, вул. Чернишевська, 7/9.
З дисертацією можна ознайомитись у бібліотеці ДУ «Інститут дерматології та венерології НАМН України» (61057, м. Харків, вул. Чернишевська, 7/9).
Автореферат розісланий «21» грудня 2017 р.
Вчений секретар
спеціалізованої вченої ради
д. мед. н. Ю. В. Щербакова
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Псоріаз (Пс) до теперішнього часу залишається актуальною проблемою дерматології через значну поширеність дерматозу, недостатню вивченість етіології та механізмів розвитку, збільшення в останні роки частоти тяжких інвалідизуючих форм захворювання, соціально-психологічну дезадаптацію пацієнтів, торпідність до терапії та неминучість рецидивів (Біловол А. М., 2011; Сизон О. О., Степаненко В. І., 2011; Кутасевич Я. Ф., 2016; J. Kim, 2016). Саме тому епідеміологічне, клінічне та соціальне значення дослідження цього дерматозу в сучасних умовах важко переоцінити.
Згідно із сучасною науковою концепцією, Пс – це мультифакторна хвороба за участю генетичних і середовищних факторів, патогенетичною основою якої є хронічне запалення шкіри та інших органів. Існують дані, які дозволяють визначити Пс як системне і навіть автоімунне захворювання, в патогенезі якого важливу роль відіграють поліорганні зрушення, що може свідчити про системність ураження організму (Калюжна Л. Д., 2016; Sticherling M., 2016; Boehncke W. H., 2017; Furue M., 2017; Singh S., 2017). Вітчизняні та іноземні автори підкреслюють, що, за сучасними уявленнями про ПС, значну частину механізму розвитку його складає хронічне запалення, яке, поряд з імунопатологічною, нейроендокринною складовою, призводить до системних зрушень, серед яких – метаболічний синдром (Біловол А. М., 2014; Mosca S., 2016). Цей симптомокомплекс є одним із факторів ризику розвитку не тільки цукрового діабету, захворювань серцево-судинної системи, але й Пс, тому посідає особливе місце у дослідженні механізмів розвитку та особливостей перебігу дерматозу. З урахуванням цих факторів, в останні роки значна увага приділяється дослідженню коморбідних станів (Сизон О. О., 2016; Gottlieb A. B., 2008; Aurangabadkar S. J., 2013; Wang W. M., 2017). Одні з найчастіших – захворювання серцево-судинної системи, особливо гіпертонічна хвороба (ГХ), яка, за даними різних авторів, поширена у хворих на Пс (Tan J., 2012; Manalo I. F., 2015; González García M. P., 2017; Lebwohl M., 2017). Деякі автори вказують на наявність спільних патогенетичних факторів при Пс і ГХ (Біловол А. М., 2011; Болотна Л. А., 2015; Bonanad C., 2017), але, незважаючи на це, певні механізми розвитку взаємозв’язку, взаємозалежності та взаємодії цих двох нозологій остаточно не з’ясовані.
Важливим є диференційований підхід до призначення терапії хворим на різні клінічні форми Пс із супутньою ГХ залежно від ступеня артеріальної гіпертензії (АГ), у максимально ранні терміни виявлення, застосування адекватних комплексних методів, спрямованих не лише на припинення чи мінімізацію запальних процесів, пов’язаних з дерматозом, але й на покращення стану серцево-судинної системи. Більш глибоке і детальне розуміння механізмів формування цього коморбідного стану дозволить розробити систему терапевтичних заходів стосовно Пс на тлі супутньої ГХ, це сприятиме зниженню кількості інвалідизуючих форм дерматозу, профілактиці серцево-судинних подій, збереженню професійної працездатності та соціальної адаптації, покращенню якості життя (ЯЖ) пацієнтів. Потребує вдосконалення діагностика і проведення обґрунтованих лікувально-профілактичних заходів стосовно хворих на Пс із зазначеною супутньою патологією.
Зв’язок роботи з науковими програмами, планами, темами. Робота виконана в рамках науково-дослідної роботи Запорізького державного медичного університету «Розробка методів терапії та профілактики рецидивів хронічних дерматозів та хвороб, що передаються статевим шляхом, із урахуванням особливостей гомеостазу хворих та супутньої патології» (№ держреєстрації 0113U000800). Здобувач є співвиконавцем теми.
Дисертантом особисто виконано основні фрагменти наукових робіт з епідеміологічних, поведінкових, біохімічних, імуноферментних, функціональних, гістологічних, імуногістохімічних досліджень, розробка медикаментозних та функціональних методів терапії.
Мета та задачі дослідження. Мета роботи – оптимізація лікування хворих на псоріаз у поєднанні з ГХ шляхом розробки диференційованої комплексної терапії на підставі вивчення клінічних проявів, імунних та ангіогенних механізмів, нейрогуморальних процесів та морфологічних змін шкіри.
Для досягнення поставленої мети були поставлені такі задачі:
1. Дослідити клініко-епідеміологічні особливості Пс при коморбідній патології.
2. Визначити рівень прозапальних цитокінів у хворих при поєднанні Пс і ГХ залежно від особливостей клінічних проявів дерматозу.
3. Визначити показники прогнозування розвитку різних форм дерматозу залежно від стану ангіогенезу та апоптозу у хворих на Пс і ГХ.
4. Проаналізувати співвідношення рівня вазоконстрикторів та вазодилататорів у хворих на Пс у поєднанні з ГХ.
5. Оцінити рівень маркерів пошкодження та захисту ендотелію у пацієнтів з Пс на тлі супутньої ГХ.
6. Визначити особливості адаптаційних процесів при коморбідній патології на підставі дослідження гуморальних факторів, стану вегетативної нервової системи (ВНС), виявити взаємозв’язок між нейрогуморальною регуляцією, показниками добового моніторування артеріального тиску (ДМАТ) та перебігом Пс.
7. Дослідити особливості морфогенезу як в осередках ураження, так і в неураженій шкірі, значення обміну оксиду азоту (NO) шляхом імуногістохімічного дослідження активності індуцибельної NO-синтази (іNOS) безпосередньо в шкірі при Пс та ГХ.
8. Провести кореляційний аналіз клінічних особливостей, результатів лабораторного та інструментального дослідження основних патогенетичних процесів, гістологічних ознак ураження шкіри у хворих на Пс із супутньою ГХ.
9. Обґрунтувати доцільність призначення антиоксидантних препаратів, методу біоадаптивного управління, селективних інгібіторів зворотного захвату серотоніну хворим з коморбідною патологією.
10. Оцінити ефективність запропонованої терапії, розробити і впровадити в систему охорони здоров’я алгоритм терапії і профілактики рецидивів Пс у поєднанні з ГХ із застосуванням медикаментозних факторів, тренінгу біологічного зворотного зв’язку (БЗЗ).
Об’єкт дослідження: Пс, ГХ.
Предмет дослідження: особливості перебігу і клінічних проявів Пс у поєднанні з ГХ, стан нервово-ендокринної системи, прозапальної активації, функції ендотелію судин; показники метаболізму оксиду азоту, глутатіону, тіол-дисульфідного балансу, окисної модифікації білка, рівень та експресія NO-синтази, гістоморфологічний стан шкіри, ефективність лікування і профілактики.
Методи дослідження: клінічні (огляд хворого, збір анамнезу для постановки діагнозу, визначення форми, розповсюдженості Пс з визначенням PASI); анкетування з оцінкою ЯЖ, рівня тривоги і депресії; загальноклінічні лабораторні дослідження; біохімічні (ліпідограма, показники функції печінки, коагулограма, дослідження обміну оксиду азоту, стану антиоксидантної системи); імуноферментні: визначення вмісту васкуло-ендотеліального фактора росту А (VEGF-A), ендотеліального рецептора протеїну С (EPCR), фактора некрозу пухлини-α (TNF-α), ендотеліну-1, гомоцистеїну, нітротирозину, каспази-8, інтерлейкіну-1α (IL-1α), інтерлейкіну-1β (IL-1β), інтерлейкіну-6 (IL-6), інсуліну, кортизолу, серотоніну сироватки крові; інструментальні: ДМАТ, дослідження варіабельності серцевого ритму (ВСР), обстеження і проведення тренінгів БЗЗ за допомогою апарату «Бослаб-професійний Плюс»; патоморфологічні та імуногістохімічні (оцінка біоптатів псоріатичного висипу і неураженої шкіри у хворих на Пс, ГХ, їх поєднання); статистичні методи.
Наукова новизна одержаних результатів. Вперше на підставі аналізу результатів комплексних клініко-лабораторних та інструментальних досліджень визначено деякі спільні патогенетичні ланки Пс та ГХ, а саме – імунне запалення, дисфункція ендотелію, нейрогуморальні зрушення, гістоморфологічні процеси, експресія іNOS; показано, що сумація їх дії погіршує перебіг і посилює тяжкість псоріатичного процесу.
Вперше при Пс із супутньою ГХ встановлено порушення регуляції процесів ангіогенезу та апоптозу на підставі підвищення рівня VEGF-А і каспази-8.
Вперше встановлено дефіцит факторів ендотеліопротекції шляхом визначення зниженого вмісту EPCR, пов’язаного як з тяжкістю Пс, так і з приєднанням ГХ до дерматозу.
Вперше, з урахуванням результатів ДМАТ, у хворих на поєднану патологію визначено типи порушень циркадного ритму переважно у вигляді недостатнього його зниження у вечірні та нічні години, встановлено їх зв’язок з тяжкими формами Пс.
Вперше визначено типові морфологічні порушення в епідермісі і дермі із залученням епідермо-дермального з’єднання, мікроциркуляторного русла, залежні від прогресування дерматозу і поєднання з ГХ, дано гістоморфологічне обґрунтування особливостей встановлених клініко-лабораторних змін. Встановлено порушення метаболізму NO у шкірі хворих на Пс за рахунок активації iNOS, особливо при обтяженні ГХ.
Вперше, залежно від клініко-функціональних порушень, визначено показання, обґрунтовано і розроблено комплексну диференційовану терапію хворих на Пс при супутній ГХ із призначенням антиоксидантних, антидепресантних засобів, БЗЗ-тренінгу, визначено її ефективність.
У роботі дістало подальшого розвитку дослідження особливостей клінічного перебігу Пс залежно від статі, віку, маси хворих, тривалості та тяжкості дерматозу та ГХ, встановлено частоту асоціації Пс і ГХ.
Доповнено відомості щодо існування імунозапального процесу на підставі підвищення рівня прозапальних цитокінів при Пс, особливо в поєднанні з ГХ. Уточнено наукові дані про гуморальні зміни, ступінь напруження прозапальної цитокінової активації дослідженням TNF-α, ІL-1α, ІL-1β, ІL-6, показано значення маркерів системної запальної відповіді у формуванні тяжких форм дерматозу.
Підтверджено клініко-патогенетичне значення дисфункції ендотелію судин при Пс визначенням кореляційних зв’язків між тяжкістю перебігу дерматозу, ГХ і показниками ендотеліну-1, нітротирозину, гомоцистеїну.
Встановлено порушення метаболізму NO у вигляді підвищення у крові рівня ключових показників нітрозуючого стресу – NO-синтази, нітритів, нітротирозину, особливо при тяжких формах дерматозу і ГХ. Доповнено наукові дані стосовно стану антиоксидантної системи, простежено зв’язок між ступенем розладів і прогнозуванням перебігу дерматозу.
Визначено різницю стану регулюючих систем у хворих на Пс при наявності чи відсутності ГХ, зокрема показано, що дезадаптаційні розлади у цих хворих характеризуються змінами стресорних гормонів (зниження рівня кортизолу та підвищення рівня інсуліну, зниження кортизол-інсулінового індексу) і біогенного аміну (збільшення вмісту серотоніну) і є найбільш суттєвими при поєднанні дерматозу з ГХ. Вперше простежено взаємозв’язок між показниками тривоги/депресії і рівнем серотоніну сироватки крові у хворих із зазначеною коморбідною патологією.
Встановлено розлади механізмів регуляції варіабельності серцевого ритму з дисбалансом ВНС за рахунок посилення тонусу симпатичного відділу у хворих на Пс, одночасно з пониженням тонусу парасимпатичного відділу при поєднанні дерматозу з ГХ.
Практичне значення отриманих результатів. Розроблено і впроваджено в практичну охорону здоров’я метод терапії хворих на Пс із супутньою ГХ з використанням препаратів армадін, есциталопрам, БЗЗ-тренінгів, які нормалізують більшість клініко-лабораторних показників, що забезпечує підвищення ефективності лікування (патенти на корисну модель № 98942 UA [2015 р.] та № 114594 UA [2017 р.]).
Розроблено інтегральний підхід до ранньої діагностики коморбідних станів, своєчасної корекції виявлених клініко-лабораторних порушень.
Запропоновано визначення рівнів серотоніну, каспази-8, VEGF-A, нітротирозину сироватки крові, співвідношення глутатіону відновленого/окисленого для використання в якості прогностичних критеріїв подальшого можливого тяжкого перебігу дерматозу.
Показано доцільність проведення ДМАТ, що дозволяє виявити хворих на Пс з порушеннями нейрогуморальної регуляції тонусу судин і проводити надалі їх терапевтичну корекцію.
Запропоновано методику дослідження стану тривоги/депресії, яка на тлі дослідження рівня серотоніну сироватки крові є показанням для призначення психокоригуючої терапії.
Запропоновані системні, патогенетично обґрунтовані підходи до діагностики і лікування хворих на Пс із супутньою ГХ впроваджено в клініці КУ «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради (КУ «ЗОШВКД» ЗОР), КЗ «Обласний шкірно-венерологічний диспансер» (м. Дніпро), КУ Тернопільської обласної ради «Тернопільський обласний клінічний шкірно-венерологічний диспансер», ОКЗ «Криворізький шкірно-венерологічний диспансер», КЗ «Хмельницький обласний шкірно-венерологічний диспансер», Обласний шкірно-венерологічний диспансер Житомирської обласної ради, Закарпатський обласний клінічний шкірно-венерологічний диспансер, КЗ «Кіровоградський обласний шкірно-венерологічний диспансер», КУ «Одеський обласний шкірно-венерологічний диспансер», КЗ «Рівненський обласний шкірно-венерологічний диспансер».
Теоретичні положення дослідження і практичні рекомендації впроваджено в практику навчання студентів усіх факультетів Запорізького державного медичного університету (ЗДМУ). Результати дисертації впроваджені і використовуються в навчальному процесі ДЗ «Запорізька медична академія післядипломної освіти МОЗ України», ДЗ «Дніпропетровська медична академія МОЗ України», ДВНЗ «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України», ДВНЗ «Івано-Франківський національний медичний університет», Харківського національного медичного університету.
Деякі положення, висновки та пропозиції, викладені у дисертації, мають дискусійний характер і можуть бути основою для подальших наукових досліджень.
Особистий внесок здобувача. Дисертаційна робота є самостійною науковою працею, яка має наукове і практичне значення. Усі її основні положення одержано особисто автором. Матеріали наукових праць, виданих у співавторстві, використано у дисертації лише в частині, що належать здобувачу. У дисертації викладено наукові результати, які одержано особисто дисертантом під час науково-дослідних робіт протягом 2013-2017 років. Здобувачем особисто виконано інформаційно-патентний пошук та аналіз літератури за темою дисертаційної роботи. Самостійно здійснено відбір хворих, розподіл їх за групами, проведення та контроль результатів терапії. Автором сформовано базу даних, проведено статистичну обробку результатів дослідження, узагальнено результати роботи, написано розділи дисертаційної роботи, сформульовано висновки і рекомендації.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Конфлікту інтересів немає.
Апробація результатів дисертації. Основні положення роботи висвітлені та обговорювалися на VІІІ Всеукраїнській науково-практичній конференції з міжнародною участю «Актуальні питання наукової і практичної косметології» 17-18 квітня 2014 р. (м. Запоріжжя, 2014), науково-практичній школі «Молоді науковці – майбутнє української дерматовенерології» 20-21 листопада 2014 р. (м. Київ, 2014), ІХ Всеукраїнській науково-практичній конференції з міжнародною участю «Актуальні питання косметології та дерматології» 23-24 квітня 2015 р. (м. Запоріжжя, 2015), Х Всеукраїнській науково-практичній конференції з міжнародною участю «Актуальні питання косметології та дерматології» 28-29 квітня 2016 р. (м. Запоріжжя, 2016), Всеукраїнській науково-практичній конференції УАЛДВК «Оптимізовані засади функціонування дерматовенерологічної служби в умовах розвитку страхової медицини та лікарського самоврядування в Україні» 5-6 листопада 2015 р. (м. Київ, 2015), Всеукраїнській науково-практичній конференції УАЛДВК з міжнародною участю «Сучасні підходи до формування клінічних настанов з діагностики і лікування шкірних захворювань та інфекцій, що передаються статевим шляхом: європейський досвід та українські реалії» 19-20 жовтня 2016 р. (м. Тернопіль, 2016), ІХ Всеукраїнській науково-практичній конференції молодих вчених «Актуальні питання клінічної медицини» 30 жовтня 2015 р. (м. Запоріжжя, 2015), Всеукраїнській Таврійській науково-практичній конференції за участю міжнародних спеціалістів «Сучасні технології в рішенні організаційних, епідеміологічних, клінічних та діагностичних задач дерматовенерології» 4-5 червня 2015 р. (м. Херсон, 2015), науково-практичній конференції «Новітні технології діагностичних, лікувальних та профілактичних заходів в дерматовенерології та методи і стан їхнього впровадження» 11-12 листопада 2016 р. (м. Харків, 2016), науково-практичній конференції за участю міжнародних спеціалістів «Індивідуальна анатомічна мінливість органів, систем, тканин людини та її значення для практичної медицини і стоматології» 19-20 травня 2016 р. (м. Полтава, 2016), науково-практичній конференції «Унифицированные медицинские установки в ведении пациентов с хроническими формами дерматозов» (м. Дніпро, 25 березня 2016 р.), науково-практичній конференції із міжнародною участю «Сучасні аспекти удосконалення надання спеціалізованої дерматовенерологічної допомоги населенню за вимогами імплементації Міжнародних медико-санітарних правил» (Харків, 2015). науково-практичній конференції «ХV-і читання ім. В.В. Підвисоцького» (м. Одеса, 2016).
Публікації. За результатами дослідження опубліковано 45 праць, з них 21 стаття у фахових виданнях, акредитованих ДАК України (12 написані у моноавторстві), 14 статей, що входять до міжнародних наукометричних баз Web of Science, Index Copernicus, Googlе Scholar, РІНЦ та інших, з яких 3 – англійською мовою та 21 – у матеріалах наукових форумів різного рівня, включаючи міжнародні; отримано 2 патенти України на корисну модель, опубліковано 1 клінічну лекцію.
Структура та обсяг дисертації. Дисертаційна робота викладена українською мовою на 360 сторінках машинописного тексту. Складається зі вступу, огляду літератури, характеристики матеріалів і методів дослідження, 6 розділів власних досліджень, обговорення результатів дослідження з аналізом та узагальненням отриманих даних, висновків, рекомендацій та списку використаної літератури. Робота ілюстрована 46 рисунками та містить 98 таблиць. Бібліографічний список містить 422 джерела, з них 100 – кирилицею і 322 – латиницею.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріали і методи дослідження. Для реалізації мети і задач цієї роботи було проведено комплексне (загальноклінічне, лабораторне, інструментальне та гістоморфологічне) обстеження 460 хворих, які страждали на Пс і знаходилися на стаціонарному та/або диспансерному лікуванні в КУ «ЗОШВКД» ЗОР у 2013-2017 рр. Загальноклінічне обстеження здійснювалося відповідно до протоколів ведення хворих на Пс (Наказ МОЗ України № 312 від 08.05.2009 р., Наказ МОЗ України № 762 від 20.11.2015 р.). Проводився збір скарг пацієнтів, анамнез хвороби, аналізувалися дані об’єктивного обстеження, загальноклінічних, біохімічних лабораторних показників, при необхідності використовувалися інструментальні та функціональні методи діагностики.
Ступінь тяжкості ураження шкіри оцінювався шляхом підрахунку PASI (Psoriasis Area and Severity Index), за його ж допомогою оцінювалася динаміка змін ураження шкіри. Для оцінки ЯЖ був використаний опитувальник The Dermatology Life Quality Index (DLQI), рівень тривоги/депресії оцінювали за допомогою анкетування, використовуючи госпітальну шкалу тривоги та депресії (HADS).
Групу порівняння на ГХ склали 47 пацієнтів, які перебували на лікуванні в стаціонарі КУ «Міська лікарня №7 м. Запоріжжя». Для достовірності результатів у дослідження залучали пацієнтів, у яких АГ була представлена тільки ГХ ІІ стадії з рівнем гіпертензії 1-3 ступеня, без антигіпертензивної терапії протягом не менше 2 попередніх тижнів. При встановленні діагнозу керувалися Наказом МОЗ України № 436 від 03.07.2006 р. У всіх хворих за результатами комплексного клініко-анамнестичного та інструментально-лабораторного обстеження були відсутні дані, що свідчили про наявність хронічних захворювань нирок або ураження ниркових судин.
Групу контролю склали 37 практично здорових осіб, які зверталися в рамках профілактичних оглядів до КУ «ЗОШВКД» ЗОР у 2013-2017 рр.
При роботі із зазначеними особами дотримано загальних вимог і положень біоетики, які схвалені Першим національним конгресом з біоетики (Київ, 2001), а також затвердженням Етичного комітету ЗДМУ та ICH / GCP.
У процесі динамічного спостереження перебували 254 людини, які були об’єднані в такі групи:
1 група – перша група порівняння – хворі лише на Пс – 72 особи;
2 група – друга група порівняння – хворі лише на ГХ – 47 осіб;
3 група – основна група – хворі на Пс і ГХ водночас – 98 осіб;
4 група – контрольна група – практично здорові люди – 37 осіб.
Групи були зіставні за віком та гендерними характеристиками.
Визначення TNF-α, IL-1β, IL-1α, IL-6, VEGF-A, каспази-8, ендотеліну-1, нітротирозину, гомоцистеїну, EPCR, кортизолу, інсуліну, серотоніну у сироватці крові проводилося методом непрямого твердофазного імуноферментного аналізу згідно з інструкцією до набору in vitro в Навчальному медико-лабораторному центрі (НМЛЦ) ЗДМУ і в централізованій серологічній лабораторії КУ «ЗОШВКД» ЗОР. Визначення стабільних метаболітів NO, стану антиоксидантної системи здійснювалося також у НМЛЦ ЗДМУ.
ДМАТ проводилося з використанням системи АВРМ-04 (Угорщина), дослідження ВСР проводилося методом кардіоінтервалографії з визначенням показників за допомогою комп’ютерно-діагностичної системи «Cardiolab+», комплектації НТЦ «ХАІ-Медіком».
Психофізіологічне обстеження і курс релаксаційних температурно-міографічних тренінгів БЗЗ проводилися за допомогою програмно-апаратного комплексу «Бослаб-професійний Плюс» (комплектація Інституту молекулярної біології і біофізики СО РАМН) в «Університетській клініці ЗДМУ».
Біопсійний матеріал отримано у 38 хворих на Пс, з яких 18 – страждали на супутню ГХ, 20 – лише на Пс, 10 хворих на ГХ, групу контролю склали 10 практично здорових осіб. Серійні зрізи тканини забарвлювалися гематоксиліном та еозином, за Масоном, за Пачіні, за Ван-Гізоном, за Вейгертом, конго червоним – за Матсуура, за Маллорі-Слінченком. Використовувалися загальноприйняті стандарти гістологічних процедур. Імуногістохімічне визначення експресії iNOS проводилося згідно зі стандартизованими протоколами з використанням кролячих поліклональних антитіл до iNOS (клон 9242-PO, «Thermo Fisher Scientific Inc.», США). Дослідження проведено на базі Інституту клінічної патології ЗДМУ.
Отримані в дослідженні кількісні дані піддавалися статистичній обробці із застосуванням статистичного пакету ліцензійної програми «STATISTICA® for Windows 6.0» (StatSoft Inc., № AXXR712D833214FAN5), а також «SPSS 17.0», «Microsoft Excel 2003». Окремі статистичні процедури та алгоритми реалізовані у вигляді спеціально написаних макросів у відповідних програмах. Для всіх видів аналізу статистично значущими вважалися відмінності при р <0,05.
Результати досліджень та їх обговорення. У результаті загальноклінічного, лабораторного, інструментального обстеження 460 хворих на Пс, які перебували на лікуванні у стаціонарних відділеннях КУ «ЗОШВКД» ЗОР, АГ була виявлена у 171 (37,2 %) пацієнта, явища тривоги або депресії – у 244 (53,0 %), підвищений індекс маси тіла (ІМТ) – у 301 (65,4 %), гіперглікемія – у 44 (9,6 %), дисліпідемія – у 24,1 %. Найчастішою у поєднанні з іншими коморбідними станами була АГ, тому далі в процесі динамічного спостереження перебували 170 хворих на Пс, з яких 72 мали нормальні цифри артеріального тиску (АТ), у 98 – спостерігалася АГ.
Середній вік пацієнтів основної групи склав (54,1 ± 1,0) року, 83,0 % хворих у цілому по групі старші за 45 років, що націлило на ретельне дослідження АТ у пацієнтів із Пс цієї вікової категорії.
Аналіз ІМТ по групах свідчив, що простежувався достовірний зв’язок між підвищеним ІМТ і формуванням коморбідної патології. Так, у групі хворих лише на Пс відсоток пацієнтів з нормальним ІМТ склав 50,0 %, у хворих лише на ГХ – 28,0 %, на Пс і ГХ – 10,0 %.
У пацієнтів групи порівняння з Пс було виділено такі клінічні форми дерматозу: вульгарний бляшковий – у 75,0 %, артропатичний – у 12,5 % осіб, краплеподібний – у 5,5 % пацієнтів, еритродермію – у 2,8 % пацієнтів, інтертригінозний – у 2,8 %, долонно-підошовний – у 1,4 % хворих (рис. 1). Середній показник PASI в осіб цієї групи склав 26,8 ± 1,3.
У пацієнтів основної групи виділено такі клінічні форми Пс: вульгарний бляшковий – у 61,2 % хворих, артропатичний – у 29,6 % осіб, краплеподібний – в 1,0 % пацієнтів, еритродермію – у 3,1 % пацієнтів, інтертригінозний – також у 3,1 %, пустульозний – в 1,0 % хворих, долонно-підошовний – також в 1,0 % випадків (рис. 2). Індекс PASI в осіб цієї групи в середньому склав 32,4 ± 1,4.
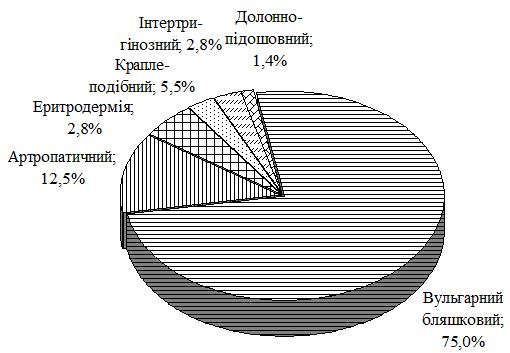
Рисунок 1 – Клінічні форми Пс в осіб групи порівняння
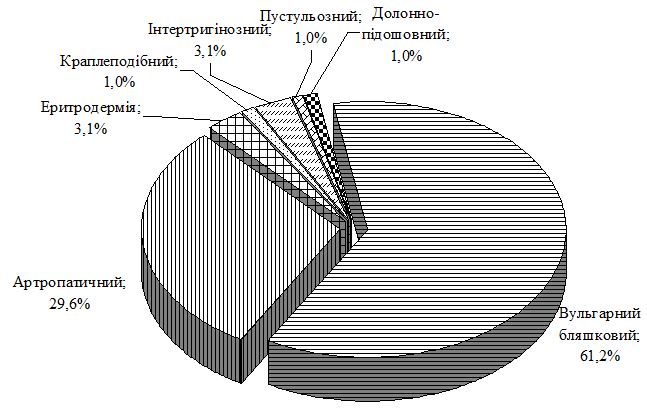
Рисунок 2 – Клінічні форми псоріазу у пацієнтів основної групи
Якщо порівнювати клінічні особливості формування Пс в основній і групі порівняння, то, по-перше, звертали на себе увагу відмінності у проявах вульгарного бляшкового Пс. У 5 пацієнтів групи порівняння і 19 пацієнтів основної групи спостерігалася більш виражена клініка дерматозу, з проявами ексудації. Підкреслюючи специфічний для цієї групи характер перебігу бляшкового Пс, виділено окремо цю категорію пацієнтів для порівняння в обох групах: вульгарний бляшковий Пс з явищами ексудації (раніше називався ексудативним Пс). Якщо в 1 групі (порівняння) таких пацієнтів було небагато (6,9 %), то в групі з коморбідною патологією таких хворих виявилося значно більше – 19,4 %, індекс PASI у них у більшості випадків був вищим 30, індекс DLQI свідчив про виражений вплив дерматозу на ЯЖ, що дозволило віднести цю категорію пацієнтів у групу обтяженого перебігу дерматозу. Крім того, в основній групі привертала увагу наявність великої кількості хворих на артропатичну форму Пс (29,6 %) порівняно з пацієнтами 1 групи (12,5%), що свідчило про формування системного ураження. Тяжкі форми в групі порівняння виявлено у 26,4 % пацієнтів, в основній групі – у 59,2 % пацієнтів, що свідчило про значний вплив приєднання ГХ на перебіг Пс. При цьому відзначено значні відмінності у розвитку різних форм Пс у зв’язку з гендерним фактором. У чоловіків основної групи тяжкі форми в половині випадків було представлено вульгарним Пс з явищами ексудації (51,4 %) і в 1/3 – артропатичним Пс (34,3 %), а у жінок переважав артропатичний Пс (73,9 %).
У хворих основної групи, які страждали на Пс у поєднанні з ГХ, рівень маркерів запального процесу достовірно перевищував аналогічні показники груп порівняння (хворих лише на Пс або ГХ). Встановлено, що в групі з коморбідною патологією рівень IL-1β збільшений у 7,86 разу (p<0,05) порівняно з хворими групи порівняння з ГХ і в 3,24 разу – порівняно з хворими лише на Пс (група 1). Визначення рівня IL-1α свідчило, що найнижчий показник цього цитокіну зареєстровано в групі порівняння з ГХ. У першій групі порівняння (хворих на Пс) відзначалися більш високі показники – у 3,74 разу (p<0,05), а в основній групі – значно вищі (збільшення в 4,65 разу) (p<0,05), порівняно з хворими на ГХ.
Рівень IL-6 у хворих групи порівняння з Пс виявився найнижчим, з пацієнтами групи 2 (лише з ГХ) різниця становила 15,6 % (p<0,05), а в групі з поєднаною патологією (група 3) – у 6,82 разу більшим за показник хворих лише на Пс (p<0,05). В основній групі рівень IL-6 був достовірно (p<0,05) в 5,90 разу вищим відносно показників групи пацієнтів з ГХ.
У групі хворих лише на Пс відзначалося збільшення рівня TNF-α на 54,31 % (p<0,05) щодо групи порівняння з ГХ. В основній групі хворих відзначалося прогресивне збільшення рівня TNF-α в 4,11 разу (p <0,05) щодо групи хворих на Пс і в 6,34 разу (p <0,05) – стосовно групи порівняння з ГХ.
Вміст IL-1β, IL-1α, а особливо TNF-α, статистично значуще виявився більш високим при тривалості дерматозу або гіпертензивного синдрому більше 5 років. Зі збільшенням ІМТ > 30 кг/м2, переважно в основній групі, відбувалося зростання маркерів системного запалення, найбільш яскраво це виражено стосовно рівня TNF-α – на 262,5 % (р˂0,05). Чітких гендерних відмінностей щодо досліджуваних параметрів не виявлено, окрім основної групи і тільки для TNF-α, де високі значення цитокіну (вищі у 5,51 разу) обумовлені наявністю великої кількості жінок із найвищими значеннями цього показника; це збігалося з клінічними проявами дерматозу в цій групі, де 73,9 % жінок страждали на артропатичний Пс.
Результати парної кореляції Спірмена (Rs) між рівнями цитокінів та показниками ЯЖ свідчили про достовірний односпрямований кореляційний зв’язок між значеннями критерію оцінки ЯЖ і вмістом цитокінів, при цьому найвищий рівень кореляції встановлено з TNF-α.
При дослідженні ангіогенезу достовірно встановлено, що рівень VEGF-А у пацієнтів основної групи ([760,01 ± 67,5] пг/мл) був у 4,16 та 1,80 разу вищим відносно хворих груп порівняння з ГХ або Пс відповідно. Ангіогенез істотно зростав на тлі приєднання ГХ до дерматозу і формування типової для цієї коморбідності форми – вульгарного Пс з явищами ексудації, що підтверджувалося зростанням показників VEGF-А зі збільшенням індексу PASI. Показник VEGF-А – найбільш показовий маркер, який свідчить саме про стан ураження шкіри, але менш достовірний при формуванні артропатичного Пс. Визначено критичний рівень VEGF‑А для формування ураження шкіри зі значною інфільтрацією, ознаками ексудації: більше 700 пг/мл (у 92 % таких хворих PASI перевищував 30 ум. од.).
Посилення ангіогенезу супроводжувалося зростанням активності апоптозу, що доведено дослідженням каспази-8 у пацієнтів основної групи порівняно з ГХ (вище у 3,5 разу) або ПС (у 2,1 разу більше) і визначено на рівні середніх значень (0,21 ± 0,03) нг/мл. Достовірну різницю рівня маркера апоптозу у пацієнтів з коморбідною патологією встановлено при тривалості ГХ або дерматозу більше 5 років, третьому ступені АГ, при ожирінні. Більш вираженим цей маркер був у жінок, при тяжких формах дерматозу, особливо – артропатичній формі, ступінь ураження шкіри у вигляді PASI також стимулював процеси апоптозу. Встановлено, що значення каспази-8 більше 0,22 нг/мл статистично достовірно асоціювалися із формуванням ураження суглобів при Пс.
При дослідженні вмісту фактора вазоконстрикції ендотеліну-1 в основній групі, який становив (0,35 ± 0,15) фмоль/мл, порівняно з групами хворих лише на ГХ або Пс, встановлено, що різниця склала на користь групи з коморбідною патологією 88,57 % і 68,57 % відповідно і була статистично значущою і достовірною. У хворих на Пс у поєднанні з ГХ спостерігалося також достовірне збільшення рівня універсального маркера нітрозуючого стресу нітротирозину (становив (17,32 ± 6,51) нмоль/мл), визначено достовірну різницю в 46,42 % і 37,88 % відносно хворих тільки на ГХ або Пс відповідно. Це свідчило про найбільшу окислювальну деструкцію NO саме при коморбідній патології. Надлишкова маса при поєднаній патології, тривалість ГХ більше 5 років, тяжкі форми дерматозу призводили до істотного зростання маркерів вазоконстрикції. У жінок значно вищим був і маркер нітрозування, й ендотелін-1, що можна пов’язати з наявністю у них значного відсотка артропатії.
Для оцінки взаємозв’язку рівня нітротирозину і напруженості імунітету у вигляді вмісту цитокінів було проведено кореляційний ранговий аналіз за P. Spearman (R) у кожній з окремих підгруп.
Розрахована оцінка ступеня взаємозв’язку між парами незалежних ознак, виражених в кількісній шкалі відповідно до поданої кореляційної матриці (рис. 3) і даних коефіцієнтів кореляції, виявилася найбільш тісною і статистично значущою у пацієнтів з Пс і супутньою ГХ і свідчила про наявність достовірної прямої взаємозалежності тяжкості перебігу дерматозу, параметрів нітрозуючого стресу, вираженості апоптозу та імунозапальної активності у цих хворих.
Рисунок 3 – Кореляційна матриця взаємозв’язку нітротирозину, цитокінів, каспази-8 зі ступенем ураження шкіри в групах хворих
У групі Пс без ГХ взаємозалежність також була достовірною, але менш статистично значущою і менш вираженою. У пацієнтів групи порівняння з ГХ кореляційні коефіцієнти виявилися різноспрямованими в парі.
Дослідження обміну оксиду азоту встановило найвищі рівні нітритів й активності NO-синтаз ([12,07 ± 0,73] нмоль/мг білка/хв) у групі з поєднаною патологією; саме в цій групі спостерігалася гіперпродукція NO (рівень нітритів становив (11,2 ± 0,63) мкмоль/л), але за наявності значного дефіциту системи антиоксидантного захисту, що продемонстровано зниженням рівня супероксиддисмутази (СОД) ([24,21 ± 1,44] умов.од./мг білка/хв проти (36,84 ± 1,09) умов.од./мг білка/хв групи порівняння з ГХ і (32,58 ± 1,63) умов.од./мг білка/хв групи порівняння з Пс), каталази ([1,19 ± 0,11) умов.од./мг білка/хв проти (2,67 ± 0,08) умов.од./мг білка/хв групи порівняння з ГХ і (1,89 ± 0,10) умов.од./мг білка/хв групи порівняння з Пс), зсувом відношення відновленого/окисленого глутатіону (ГЛУв/ГЛУо) у бік окислених форм; формувалися явища нітрозуючого й оксидативного стресу, дефіцит вазодилататорів, зростання ендотеліальної дисфункції. Встановлено, що пацієнти з низьким рівнем SH-груп (менше 1 ммоль/г білка) при паралельній активації оксидативного стресу є групою ризику щодо виникнення ускладнень і вимагають динамічного спостереження з індивідуальним підбором препаратів з доведеним антиоксидантним ефектом.
З метою виявлення прогностичних факторів розвитку ураження шкіри при Пс було використано логістичний регресійний аналіз з розрахунком регресійних коефіцієнтів, статистику Вальда, χ2 і співвідношення шансів з 95 % довірчим інтервалом. Після відповідних розрахунків виявилося, що низький рівень співвідношення ГЛУв/ГЛУо (менше 6 ум.од) достовірно збільшував майже в 4,5 разу ймовірність розвитку тяжких форм Пс згідно з отриманим співвідношенням шансів порівняно з пацієнтами, у яких вищевказані показники були в межах норми, р<0,05. У таблиці 1 наведено дані аналізу індексів PASI і DLQI в обстежених осіб залежно від стану тіол-дисульфідного балансу.
Таблиця 1 – Показники індексів PASI і DLQI хворих на Пс залежно від вираженості порушення тіол-дисульфідного балансу
| Показник,
од. виміру |
Хворі на Пс у поєднанні з ГХ (n=80) | |
| ГЛУв/ГЛУо > 6 у.о. | ГЛУв/ГЛУо < 6 у.о. | |
| PASI, бали | 22,8±1,0 | 32,4±2,8* |
| DLQI, бали | 19,21±0,84 | 43,20±3,04* |
Примітка. * – p <0,05 при порівнянні з групою ГЛУв / ГЛУо > 6 у.о.
У групі хворих із співвідношенням ГЛУв / ГЛУо нижче 6,0 у.о. визначалося максимальне підвищення PASI, яке складало 32,4 ± 2,8, при цьому різниця з аналогічними даними осіб з більш високим співвідношенням ГЛУв / ГЛУо склала 42,1 % (p<0,05). У пацієнтів з більш високим співвідношенням ГЛУв / ГЛУо різниця показника DLQI становила 2,24 разу (p<0,05) порівняно з пацієнтами із ГЛУв / ГЛУо менше 6,0 у.о.
Дослідженням гомоцистеїну встановлено, що найвищі його рівні ([30,94 ± 2,48] мкмоль/л) і розвиток дисфункції ендотелію максимально виявлено при коморбідній патології порівняно з групами хворих лише на ГХ або Пс (у 2,96 і 1,81 разу достовірно більше відповідно), при тривалості ГХ більше 5 років, третьому ступені АГ. Найвищі значення гомоцистеїну і, відповідно, ризик розвитку серцево-судинних подій зафіксовано в групах з еритродермічною / артропатичною / пустульозною формами, як при Пс на тлі нормальних цифр АТ, так і при одночасній ГХ. Виявлено, що гіпергомоцистеїнемія, як маркер тяжкості ендотеліальної дисфункції, зростав при підвищенні PASI до 30 і вище.
Встановлені факти високого вмісту вазоконстрикторів, маркерів дисфункції ендотелію на тлі дефіциту вазодилататорів, що супроводжувалося значним порушенням у системі антиоксидантного захисту, підкріплювалися також даними про порушення у системі захисту ендотелію у вигляді зниження рівня EPCR. Вміст цього маркера антикоагулянтної, цитопротективної та протизапальної активності у пацієнтів основної групи становив (800,68 ± 46,34) нг/мл, що в 1,99 разу нижчий відносно групи порівняння з ГХ ([1591,08 ± 51,98] нг/мл) та в 1,57 разу – відносно групи порівняння з Пс ([1257,87 ± 22,73] нг/мл). Відзначено зниження його захисних властивостей при тривалості ГХ або дерматозу більше 5 років, ожирінні. Цитопротекторний і антиапоптотичний ефект активованого протеїну С істотно знижувався при наявності тяжких форм дерматозу, зростанні PASI до 30 і вище.
Найчастішим чинником, який призводив до появи перших проявів, загострення Пс або ГХ у пацієнтів як основної, так і груп порівняння, був стрес, тому вплив його на різні ланки патогенезу коморбідного стану Пс і ГХ потребував ретельного вивчення. При дослідженні рівня кортизолу в групах з’ясовано, що найвищі його значення ([21,18 ± 0,89] мкг/дл) виявлено в групі порівняння з ГХ. У пацієнтів з ГХ рівень кортизолу був на 35,1 % вищим за аналогічний показник хворих першої групи порівняння, які страждали тільки на Пс, і на 238,3 % (р<0,05) – статистично достовірно вищим порівняно з пацієнтами з коморбідною патологією ([6,26 ± 1,13] мкг/дл). У пацієнтів основної групи рівень кортизолу зростав на 43,9 % (р<0,05) зі зростанням ІМТ понад 30 кг/м2. Виявлено досить суттєві гендерні відмінності лише в основній групі, де рівень досліджуваного гормону у чоловіків на 31,65 % був вищим, ніж у жінок. Тож велику частку розвитку системного ураження у жінок з формуванням артропатичного Пс можна пов’язати з наявністю декомпенсації адаптації у жінок при поєднанні дерматозу і ГХ. Значний вплив рівня АГ визначено у хворих з коморбідною патологією: в осіб з 3 ступенем АГ показники кортизолу були нижчими на 39,7 % порівняно з пацієнтами з 1-2 ступенем АГ.
При трактуванні результатів дослідження інсуліну у сироватці хворих різних клінічних груп відзначено максимальні цифри даного показника у пацієнтів основної групи, а різниця в значеннях цього гормону відносно груп порівняння, як першої (хворих лише на Пс), так і другої (хворих лише на ГХ), склала 44,2 % і 66,7 % (р<0,05) відповідно на користь коморбідної патології. Значна різниця цього показника – на 125,2 % (р<0,05) – відзначена при зростанні ІМТ більше 30 кг/м2. Найвищий рівень інсуліну демонструвала бляшкова форма з явищами ексудації, яка превалювала над вульгарною бляшковою / краплеподібною / інтертригінозною формами на 81,1 % і над еритродермічною / артропатичною / пустульозною – на 20,0 %, а дві останні форми мали різницю між собою у 33,7 % на користь тяжких форм Пс. Групи з коморбідною патологією і PASI до 10 і понад 30 мали відмінності в показниках інсуліну на рівні 36,8 % (р<0,05), що свідчило про порушення вуглеводного обміну на тлі зростання тяжкості перебігу дерматозу і ступеня ураження шкіри.
Оцінка гормонального профілю і показника кортизол-інсулінового індексу свідчила про патологічну активацію стрес-реалізуючих систем при високому його значенні (як, наприклад, у хворих групи порівняння з ГХ, де показник кортизол-інсулінового індексу склав (2,47 ± 0,34) ум.од.). І навпаки, виявлення низького показника співвідношення кортизолу та інсуліну в основній групі ([0,24 ± 0,09] ум.од.) свідчив про виснаження адаптаційних можливостей організму при Пс у поєднанні з ГХ і вказував на потенційний зрив регуляторних механізмів, наявність дезадаптаційних розладів і знижену стресостійкість.
Результати визначення рівня сироваткового серотоніну свідчили про наявність найвищих показників у групі з поєднаною патологією ([378,91 ± 40,85] нг/мл), а щодо груп порівняння, то різниця становила 119,7 % і 238,3 % (р<0,05) для пацієнтів із Пс і ГХ, відповідно. Серотонін визначався в максимальних значеннях при зростанні ступеня АГ, індексу PASI від 10 до 30 і вище, що відображало особливості відповіді організму на тяжкі форми дерматозу при коморбідному стані. Найбільш сприятливими рівнями серотоніну для хворих основної групи визначено від 130 до 200 нг/мл.
Слід зазначити, що при оцінці ступеня зв’язку між вираженістю психоемоційних змін згідно з результатами анкетування за допомогою госпітальної шкали тривоги і депресії та рівнем серотоніну сироватки крові встановлено, що залежність мала U-подібну форму, тому коефіцієнт кореляції був низьким (нелінійна асоціація, рис. 4). Найбільші бали за цією шкалою HADS (>15 балів) частіше мали пацієнти з дуже низьким рівнем серотоніну (менше 100 нг/мл), що свідчило про можливий патогенетичний зв’язок між цими процесами, необхідність фармакологічної корекції цих порушень і про важливість індивідуалізації терапії з урахуванням рівня серотоніну. У той же час, кількість осіб з установленим станом наявності тривоги/депресії згідно зі шкалою HADS (сума балів понад 11) була достовірно вищою як при рівні серотоніну менше 130 нг/мл, так і при різкому його зростанні (більше 600 нг/мл) при р < 0,05 (рис. 4).
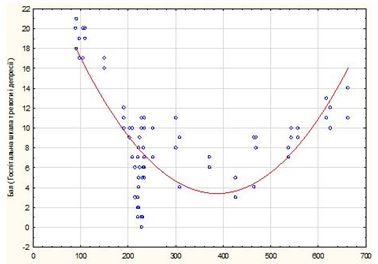
Рисунок 4 – Параболічна спряженість рівня тривоги та депресії (HADS) при Пс залежно від вмісту сироваткового серотоніну
Показано високу інформативність вивчення ВСР для оцінки стресових реакцій серцево-судинної системи та нейро-вегетативної регуляції. Дослідження ВСР у хворих на Пс свідчило про наявність особливостей співвідношення симпатичної та парасимпатичної ланок ВНС. Зростання показників LF у хворих на Пс групи порівняння свідчило про переважання тонусу симпатичної нервової системи. Достовірне зниження показника HF при Пс (в 1,31 разу порівняно з контрольною групою) і значне падіння його у пацієнтів з Пс і ГХ (у 3,75 разу порівняно з групою контроля) є показником дефіциту вагусного впливу. Показник LF/HF, який свідчить про співвідношення симпатичної і парасимпатичної ланок ВНС, означає, що у хворих лише на Пс є достовірне переважання тонусу симпатичної нервової системи, а при приєднанні ГХ – ще й зниження тонусу парасимпатичного відділу, що відображає комбіновані порушення центральних механізмів регуляції серцевого ритму. До того ж, у хворих на Пс у поєднанні з ГХ визначено, шо в більшості випадків тяжкі форми дерматозу корелювали з більш вираженими змінами вегетативної регуляції.
За результатами ДМАТ встановлено, що переважаюча кількість хворих на Пс мала порушення циркадного ритму АТ у вигляді недостатнього його зниження у вечірні та нічні години; загальна кількість таких хворих становила 57,7 % у групі порівняння з Пс та 63,6 % в основній групі. При цьому у 3 хворих на Пс при традиційному, офісному вимірюванні АТ гіпертензії не виявлено, підвищений рівень зафіксовано лише при проведенні ДМАТ, що дає підстави рекомендувати більш широке використання цього методу при обстеженні пацієнтів з Пс. У всіх хворих визначено взаємозв’язок між приналежністю до групи зниження АТ і формою Пс. У результаті виявлено, що пацієнти з нормальним для більшості населення типом зниження АТ («dipper») представлені більш легкими формами Пс (вульгарним бляшковим). Хворі з патологічним зниженням АТ (категорії «non-dipper», «night-peaker» та «over-dipper») представлені більш тяжкими формами дерматозу (вульгарним бляшковим з явищами ексудації, де PASI>30 і DLQI>10, артропатичним, пустульозним, еритродермією).
Проведений багатофакторний дисперсійний аналіз в рамках математичного моделювання показав, що у хворих на Пс із супутньою ГХ ступінь клінічних проявів дерматозу (PASI), ЯЖ (показники DLQI) достовірно змінювалися залежно від оксидативного статусу (оцінювалися за співвідношенням рівня СОД до стимульованих альдегідфенілгідразонів) при F = 22,13 (р<0,01), були пов'язані з тяжкістю ГХ (F = 9,61, р<0,05), ступенем порушення ВСР (F = 4,88, р<0,05) та порушенням циркадного ритму АТ (F = 4,88, р<0,05).
Логічно припустити, що у хворих на Пс при поєднанні з ГХ між окремими лабораторними показниками, які відображають активність факторів неоваскуляризації (VEGF-А), апоптозу (каспаза-8), ендотеліальної дисфункції (ендотелін-1, нітротирозин, гомоцистеїн, EPCR), вираженість імунозапальних реакцій (цитокіновий комплекс – ІL-α, IL-1β, IL-6, TNF-α), тяжкість нейрогуморальних порушень (кортизол, інсулін, серотонін), існує певна спряженість, для вивчення якої з метою угруповування багатовимірних об’єктів був використаний ієрархічний кластерний аналіз, котрий грунтується на представленні результатів окремих спостережень точками відповідного геометричного простору з подальшим виділенням «сузір’їв», кластерів (рис. 5).
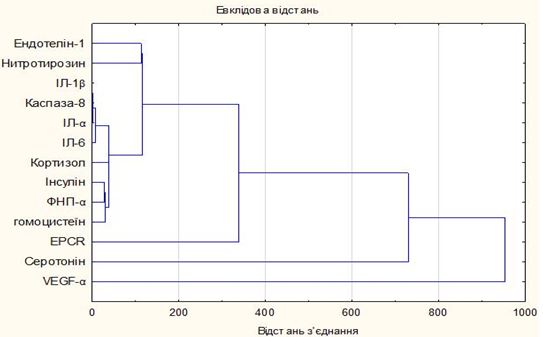
Рисунок 5 – Дендрограма кластерного аналізу досліджених показників у хворих на Пс із супутньою ГХ
Проведений ієрархічний кластерний аналіз наочно демонструє, що на початковому етапі в агрегації формується асоціативний взаємозв’язок між основною ланкою прозапального цитокінового каскаду у вигляді інтерлейкінів з маркером апоптозу каспазою-8, що підкреслює ініціальну роль імунозапального компонента. Далі, згідно з оцінкою нових вузлів у графі, паралельно йде утворення іншої агломерації, яку складають злиття кластера ТNF-α з гомоцистеїном та інсуліном, з подальшим приєднанням кортизолу. Отриману структуру відображено в ієрархічному дереві різними гілками, а зазначений кластер логічно доповнював первинний кластер (за рахунок наявності TNF-α) і свідчив про патогенетичну роль порушення вуглеводного обміну, формування інсулінорезистентності у розвитку Пс.
На тлі зазначених метаболічних порушень формування гіпергомоцистеїнемії, ймовірно, за рахунок наявності ГХ, набуває активності, що, у свою чергу, призводить до потенціювання ендотелій-деструктивних процесів, порушення коагуляції. За результатами угрупування можна зробити висновок, що тісно пов’язані між собою рівні ендотеліну-1 і нітротирозину, які відображають стан порушення функції ендотелію з підвищеним рівнем вазоконстрикторів (ендотеліну-1) і порушення біодоступності NO на тлі нітрозуючого стресу, на наявність якого вказує кінцевий продукт деструкції NO через пероксинітрит – нітротирозин. Ці процеси посилюють стан мікроциркуляції в осередках ураження, оскільки Пс властиві виражені капілярні та артеріолярні судинні зміни, а макро- і мікроваскулярні розлади пов’язують з розвитком ендотеліальної дисфункції. Із викладеного зрозуміло, чому на наступному етапі до останньої групи додається EPCR, який має різні ефекти впливу на систему гемостазу (антикоагулянтний ефект) та імунну систему організму (цитопротекторний ефект). Порушення цієї ланки сприяє збільшенню судинного ушкодження і стресу, що додатково погіршує перебіг дерматозу, особливо на тлі ГХ.
Надалі має місце злиття цього кластера з параметром «серотонін», який є сполучною ланкою між нервовою, імунною, ендокринною системами і шкірою. Пізнє включення дозволяє відзначити вторинність порушення метаболізму серотоніну, тому що вхідний запуск імунної відповіді при даному коморбідному стані активують про- і запальні цитокіни. Фінальне приєднання VEGF-А до розрахованої кластерної структури лабораторних маркерів при Пс на тлі ГХ відображає патофізіологічне значення збільшення неоангіогенезу при зазначеній коморбідності, що призводить до розвитку типової клініки Пс, особливо з характерними явищами ексудації. На дендрограмі видно, що ці напрямки остаточно об’єдналися з усіма іншими на останніх етапах роботи алгоритму кластерного аналізу, яке пережило стійкість раніше сформованих груп.
Пс, як і ГХ, є системним процесом, з ураженням різних систем та органів, а шкіра віддзеркалює стан організму в цілому і морфологічні ознаки псоріатичного висипу є переломленням досліджених у попередніх розділах патофізіологічних процесів.
Перифокальна гіперплазія і дистрофія кератиноцитів з акантолізом і деструкцією епідермально-дермального з’єднання, включаючи фрагментацію базальної епідермальної мембрани, виступають як типові патоморфологічні ланки ушкодження епідермісу у хворих на Пс у поєднанні з ГХ. Означений спектр порушень має локальний характер і викликає каскад патологічних перебудов, які за своєю інтенсивністю значно перевищують ушкодження шкіри у хворих на Пс без ГХ. У хворих на ГХ загальна цитоархітектоніка епідермісу і проліферативна активність кератиноцитів відповідають характеру вікової норми. Проте в прогресуючій стадії Пс наявність ГХ поглиблює ступінь локальних ушкоджень епітеліального компонента, посилюючи розвиток гіперкератозу, паракератозу, папіломатозної гіперплазії, міжклітинного і цитоплазматичного набряку епідермоцитів, розшарування і відшарування епідермісу за рахунок транссудації, мікроабсцесів Мунро, лейкоцитарної інфільтрації, еритродіапедезу і крововиливів.
У хворих на Пс і ГХ гіперпроліферація клітин (ендотеліоцитів, перицитів, гладких міоцитів) у складі стінки мікросудин з розвитком гіалінозу та еластофіброзу артеріол, а також порушення ангіоархітектоніки артеріол і внутрішньососочкових гемокапілярів на тлі дифузного фіброзу сосочків, являли собою системні ушкодження, які значно перевершували патологічні зміни мікроциркуляторного русла у хворих на Пс без ГХ. Типовими порушеннями тканинної структури шкіри на тлі поєднаної патології були також системний фіброз сосочкового шару і фіброеластоз сітчастого шару дерми. Наслідками патоморфогенезу ушкоджень дерми при розвитку псоріатичного процесу на тлі ГХ у хворих похилого віку були значний інтерстиційний набряк сосочкового шару; перифокальна лейкоцитарна інфільтрація, ексудація, транссудація, плазморагії у складі дермальних сосочків; лімфостаз і локальне розширення лімфатичної дренажної ланки мікроциркуляції; сладжування еритроцитів, еритродіапедез, крововиливи; посилення ендотеліальної дисфункції з активацією тромбоцитарного гемостазу.
Морфологічним субстратом ушкодження шкіри у хворих на Пс і ГХ є комплекс локальних і системних порушень структури епітеліального, сполучнотканинного і мікроциркуляторного компонентів, а саме: перифокальна гіперплазія і дистрофія кератиноцитів з акантолізом і деструкцією епідермально-дермального з’єднання, включаючи фрагментацію базальної мембрани епідермісу; гіперпроліферація клітин (ендотеліоцитів, перицитів, гладких міоцитів) у складі стінки мікросудин з розвитком гіалінозу й еластофіброзу артеріол; дисеміноване порушення ангіоархітектоніки артеріол і внутрішньососочкових гемокапілярів; дифузний фіброз сосочкового шару і фіброеластоз сітчастого шару дерми; виражена експресія іNOS кератиноцитами та клітинами дерми.
Даний комплекс порушень зустрічався у всіх без виключення хворих на Пс у прогресуючій стадії дерматозу на тлі ГХ і викликав каскад типових патоморфологічних змін, які за своєю інтенсивністю значно перевищували ушкодження шкіри у хворих на Пс без ГХ.
Результати проведеного морфологічного аналізу виявили певні напрямки патологічних змін стану шкіри у пацієнтів досліджуваного клінічного профілю, а також структурно-функціональні особливості епітеліального, сполучнотканинного і мікроциркуляторного компонентів шкіри залежно від характеру патологічного процесу. Для розмежування і визначення конкретного впливу Пс у прогресуючій стадії, ГХ або поєднаної патології (Пс і ГХ) на стан ураження шкіри був проведений однофакторний дисперсійний аналіз за кожним зазначеним фактором, результати якого наведені у таблицях 2-3.
Таблиця 2 – Морфологічні параметри стану шкіри груп порівняння (кількісна оцінка за критерієм Снедекора, %)
| Параметри | Вплив досліджуваних факторів | ||
| Пс | ГХ | ||
| Ушкоджена шкіра | Неушкод-жена шкіра | ||
| 1. МІ (мітотичний індекс) кератиноцитів | 78,1 ** | 23,0 | 19,2 |
| 2. Максимальна загальна товщина гермінативної зони епідермісу | 74,9 ** | 18,2 | 24,5 |
| 3. Мінімальна загальна товщина гермінативної зони епідермісу | 78,5 ** | 22,6 | 12,7 |
| 4. Чисельна щільність ядер кератиноцитів | 81,4 ** | 11,8 | 14,7 |
| 5. Відносний об’єм гемомікроциркуляторного русла сосочкового шару дерми | 73,8 ** | 63,1 * | 30,3 |
| 6. Відносний об’єм гемомікроциркуляторного русла сітчастого шару дерми | 76,0 ** | 58,9 * | 22,9 |
| 7. Діаметр артеріол підсосочкової сітки | 20,4 | 29,3 | 71,5 ** |
| 8. Діаметр венул підсосочкових сплетень | 6,9 | 17,5 | 21,4 |
| 9. Діаметр внутрішньососочкових гемокапілярів | 60,1 * | 66,1 * | 18,3 |
| 10. Діаметр гемокапілярів в основі капілярних петель | 64,7 * | 57,3 * | 22,7 |
| 11. МІ ендотеліоцитів | 85,2 ** | 60,6 * | 63,1 * |
| 12. МІ перицитів | 78,3 ** | 59,2 * | 56,8 * |
| 13. МІ гладких міоцитів | 32,0 | 30,3 | 74,4 ** |
| 14. МІ фібробластів | 74,6 ** | 65,4 * | 52,6 * |
Примітки: * – статистична достовірність при рівні значущості 0,05;
** – статистична достовірність при рівні значущості 0,01.
Таблиця 3 – Морфологічні параметри стану шкіри пацієнтів основної групи (кількісна оцінка за критерієм Снедекора, %)
| Параметри | Вплив фактора поєднаної патології | |
| Ушкоджена шкіра | Неушкоджена шкіра | |
| 1. МІ кератиноцитів | 84,6 ** | 14,8 |
| 2. Максимальна загальна товщина гермінативної зони епідермісу | 76,8 ** | 32,3 |
| 3. Мінімальна загальна товщина гермінативної зони епідермісу | 82,1 ** | 27,3 |
| 4. Чисельна щільність ядер кератиноцитів | 90,7 ** | 22,8 |
| 5. Відносний об’єм гемомікроциркуляторного русла сосочкового шару дерми | 81,7 ** | 66,8 * |
| 6. Відносний об’єм гемомікроциркуляторного русла сітчастого шару дерми | 76,2 ** | 59,1 * |
| 7. Діаметр артеріол підсосочкової сітки | 84,5 ** | 67,3 * |
| 8. Діаметр венул підсосочкових сплетень | 37,3 | 60,6 * |
| 9. Діаметр внутрішньососочкових гемокапілярів | 95,2 ** | 68,0 * |
| 10. Діаметр гемокапілярів в основі капілярних петель | 92,1 ** | 57,4 * |
| 11. МІ ендотеліоцитів | 85,1 ** | 62,6 * |
| 12. МІ перицитів | 79,0 ** | 50,8 * |
| 13. МІ гладких міоцитів | 73,1 ** | 56,6 * |
| 14. МІ фібробластів | 85,3 ** | 61,2 * |
Примітки: * – статистична достовірність при рівні значущості 0,05;
** – статистична достовірність при рівні значущості 0,01.
Дисперсійний аналіз встановив, що найбільшою мірою дерматоз призводив до зміни всіх досліджуваних параметрів епідермісу, варіювання відносного об’єму гемімікроциркуляторного русла обох шарів дерми та проліферативної активності ендотеліоцитів і перицитів у складі ушкодженої шкіри, а також фібробластів при рівні значущості <0,01. Меншою мірою від впливу загострення Пс залежало варіювання діаметру внутрішньососочкових гемокапілярів. Значення діаметру артеріол і венул, мітотичної активності гладких міоцитів не мали суттєвої залежності від псоріатичного процесу.
У клінічно неушкоджених контрлатеральних ділянках шкіри морфометричні параметри епідермісу не зазнавали істотного впливу захворювання (див. табл. 2). Навпаки, наявність хвороби у помірному, але статистично значущому ступені (0,01 – 0,05) визначала варіювання відносного об’єму мікросудин дерми, а також діаметру гемокапілярів і показників МІ ендотеліальних клітин, перицитів і фібробластів у цих ділянках.
Наведені результати дисперсійного аналізу підтверджують і кількісно уточнюють дані проведеного в роботі морфологічного дослідження, а також сучасні уявлення про те, що гіперплазія і дистрофія кератиноцитів мають локальний характер, який є характерним для псоріатично ушкоджених ділянок шкіри, у той час як гіперпроліферація клітин мікросудин і фібротичні прояви у складі сосочкового шару дерми належать до системних ушкоджень як у хворих на Пс, так і у пацієнтів з ГХ. У складі епідермісу клінічно неушкоджених ділянок шкіри варіювання лінійних параметрів і мітотичної активності кератиноцитів не залежало від фактора поєднаної патології, що свідчило про суто перифокальний характер змін епідермісу, які спостерігалися при морфологічному дослідженні шкіри хворих на Пс.
Найбільш виражений поєднаний вплив Пс і ГХ спостерігався відносно більшості параметрів мікроциркуляторного русла сосочкового і сітчастого шарів дерми ушкоджених ділянок шкіри, за виключенням діаметру венул підсосочкових сплетень. На особливу увагу заслуговує найвираженіший вплив коморбідного стану на зміни параметрів внутрішньососочкових гемокапілярів: на відміну від думки деяких дослідників про «кілька кровоносних судин, які займають центр сосочка», у дослідженні виявлено лише одну мікросудину (внутрішньососочковий гемокапіляр), ушкодження якої мало критичну роль у розвитку патоморфологічних змін сосочкового шару дерми, про що свідчили раніше деякі інші автори.
При порівнянні рівня експресії іNOS за U-критерієм Манна-Уїтні було встановлено достовірну різницю між експресією iNOS в епідермісі при Пс групи порівняння і в епідермісі хворих на Пс і ГХ (р=0,041) з достовірно вищим її рівнем у хворих на коморбідну патологію; аналогічна ситуація стосувалася змін у дермі в обох групах (р=0,030). Крім того, за допомогою Т-критерію Вілкоксона була виявлена достовірна різниця в експресії iNOS в епідермісі та дермі хворих на Пс і ГХ (р=0,001); у контрольних випадках достовірної розбіжності не виявлено. Як і в пацієнтів із Пс групи порівняння, у біоптатах псоріатично ушкодженої шкіри хворих на коморбідну патологію у складі сосочкового і сітчастого шарів дерми спостерігалась інтенсивна цитоплазматична і навколоядерна експресія iNOS у фібробластах, ендотеліальних та гладком’язових клітинах судин мікроциркуляторного русла.
Для більш детальної оцінки ступеня і спрямованості взаємозв’язків між дослідженими показниками проведено кореляційний аналіз (Pearson) в основній групі хворих. Кореляційна матриця взаємозв’язків клінічних проявів дерматозу, стану нейрогуморальної регуляції, маркерів запального процесу, апоптозу, ендотеліальної дисфункції, нітрозуючого та оксидативного стресів, наведена в табл. 4.
Отримані значення коефіцієнта кореляції Пірсона демонстрували такі варіанти взаємозв’язків між досліджуваними клініко-лабораторними показниками: визначено позитивний зв’язок середньої сили між індексом PASI і TNF-α та IL-6 (r=+0,513 та +0,583 відповідно; р<0,05), що свідчило про значну залежність клінічних проявів і поширеності Пс від рівнів IL-6 і TNF-α, які можна використовувати в якості маркерів тяжкості і поширеності псоріатичного ураження шкіри при поєднанні з ГХ.
Привертала увагу наявність достовірного зв’язку середньої сили показника PASI з маркером неоваскуляризації VEGF-А (r=+0,587; р<0,05), що дозволило провести паралель між активністю неогенезу хворих на Пс і ГХ і площею ураження шкіри. У той же час, між VEGF-А і каспазою-8 не існувало вираженої кореляції, це підтверджує, що не існує прямої залежності між площею ураження шкіри і ризиком розвитку артропатії.
NOS та нітрити мали середньої сили позитивний зв’язок з PASI (0,412 і 0,409 відповідно; р<0,05). Встановлено більш виражений позитивний достовірний (r=+0,536; р<0,05) зв’язок між рівнем серотоніну у сироватці крові хворих на коморбідну патологію та PASI. У свою чергу, вміст сироваткового серотоніну мав високого ступеня кореляційний зв'язок (r=+0,762; р<0,05) з рівнем тривоги та депресії, що дозволяє використовувати метод анкетування у якості прогнозування розвитку тяжкого, стійкого до терапії дерматозу і своєчасного призначення пацієнтам коригуючої терапії.
З урахуванням виявлених патогенетичних змін при перебігу коморбідної патології, статистичних даних було визначено напрямки терапії для зазначеної категорії хворих з призначенням антиоксидантного препарату, БЗЗ-тренінгів, антидепресанта.
Усім хворим на Пс як основної, так і групи порівняння призначалося стандартне лікування в умовах дерматологічного стаціонару: детоксикаційну, гіпосенсибілізуючу, протизапальну терапію, гепатопротектори, седативні препарати, вітаміни, при тяжких формах – цитостатики (метотрексат); за показаннями призначали фізіотерапевтичне лікування; усі хворі отримували топічну терапію. Хворим на ГХ як основної, так і групи порівняння після обстеження, консультації терапевта/кардіолога призначалася адекватна антигіпертензивна терапія з персональним підбором лікування.
Хворі на Пс із супутньою ГХ на останьому етапі дослідження були розподілені шляхом рандомізації на дві групи – 15 і 45 осіб, зіставні за основними клініко-дерматологічними параметрами. У групу пацієнтів з традиційною терапією увійшли 15 хворих, 45 пацієнтам із запропонованою методикою терапії додатково призначали препарат армадін у дозі 4 мл (200 мг) внутрішньовенно краплинно 1 раз на день протягом 10 днів з подальшим пероральним щоденним прийомом армадін-лонгу 500 мг (тривалість курсу – 3 міс.), есциталопраму (5 мг/добу) та курсу релаксаційних температурно-міографічних тренінгів БЗЗ. Тренінги проводилися протягом 10 днів щоденно, тривалість одного сеансу становила 50 – 60 хв. У подальшому вдома пацієнти самостійно протягом 1 місяця проводили аналогічні сеанси міорелаксації, використовуючи набуті навички.
Таблиця 4 – Кореляційна матриця досліджуваних показників в цілому у групі хворих на Пс і ГХ
| Бал PASI | IL-1β | IL-1α | IL-6 | TNF-α | Кортизол | Інсулін | Нітро-тирозин | Ендо-телін-1 | Кас-паза-8 | VEGF- α | Гомоцис-
теїн |
EPCR | Серо-тонін | NOS | |
| Бал PASI | 1 | ||||||||||||||
| ІЛ-1 β | 0,334 * | 1 | |||||||||||||
| IL-1α | 0,230 | 0,682 * | 1 | ||||||||||||
| IL-6 | 0,583 * | 0,375 * | 0,642 * | 1 | |||||||||||
| TNF- α | 0,513 * | 0,683 * | 0,997 * | 0,617 * | 1 | ||||||||||
| Кортизол | 0,049 | –0,434 * | –0,236 | 0,076 | –0,258 | 1 | |||||||||
| Інсулін | 0,245 | 0,465 * | 0,315 | 0,292 | 0,331 * | 0,029 | 1 | ||||||||
| Нітротирозин | 0,329 * | 0,827 * | 0,589 * | 0,483 * | 0,76 * | –0,270 | 0,524 * | 1 | |||||||
| Ендотелін-1 | 0,218 | 0,917 * | 0,764 * | 0,432 * | 0,755 * | –0,322 | 0,324 * | 0,904 * | 1 | ||||||
| Каспаза-8 | 0,333 * | 0,677 * | 0,949 * | 0,783 * | 0,924 * | –0,184 | 0,335 | 0,621 * | 0,753 * | 1 | |||||
| VEGF- α | 0,587 * | 0,097 | –0,003 | 0,504 * | 0,28 * | 0,112 | –0,092 | 0,245 | 0,088 | 0,127 | 1 | ||||
| Гомоцистеїн | 0,448 * | 0,398 * | 0,652 * | 0,653 * | 0,602 * | 0,131 | 0,315 | 0,397 * | 0,413 * | 0,852 * | 0,149 | 1 | |||
| EPCR | –0,512 * | –0,429 * | –0,616 * | –0,660 * | –0,574 | –0,043 | –0,399 * | –0,348 | –0,364 | –0,807 * | –0,197 | –0,948 * | 1 | ||
| Серотонін | 0,536 * | 0,347 * | 0,520 * | 0,512 * | 0,440 | 0,204 | 0,369 | 0,174 | 0,340 | 0,845 * | 0,210 | 0,924 * | –0,948 * | 1 | |
| NOS | 0,412 * | –0,026 | –0,089 | –0,667 * | –0,31 * | 0,116 | 0,014 | 0,023 | –0,045 | –0,183 | 0,022 | –0,181 | 0,210 | –0,171 | 1 |
| Нітрити | 0,409 * | –0,042 | –0,132 | –0,701 * | –0,24 * | 0,087 | –0,023 | 0,413 * | –0,071 | –0,230 | 0,018 | –0,233 | 0,248 | –0,195 | 0,993 * |
Примітка. * – статистична значущість коефіцієнта кореляції Пірсона, р <0,05.
Введення у схему терапії хворих на Пс із супутньою ГХ антиоксиданту армадін, тренінгів БЗЗ, інгібітора зворотного захвату есциталопраму дозволило скоротити термін лікування пацієнтів з цією коморбідною патологією, домогтися більш ранньої стабілізації псоріатичного процесу, стійкого виходу в ремісію. Ознаку достовірної ефективності терапії – PASI 75, було встановлено у 64,4 % хворих, PASI 50 – у 28,9 %, у 6,7 % пацієнтів – менше зниження, що обумовлено наявністю артропатичної форми Пс зі значним ураженням суглобів. Частота досягнення PASI 75 була статистично вищою в групі із запропонованою методикою при зіставленні з групою порівняння
(χ² = 9,87 при р<0,05).
Покращився також перебіг ГХ на тлі запропонованої терапії. У 35,5 % пацієнтів основної групи спостерігалося покращення стану серцево-судинної системи: цифри АТ зменшилися в середньому на 15-20 мм рт. ст., що привело до зниження дози антигіпертензивних препаратів у 11 пацієнтів дослідженої групи (24,4 %). Ще один позитивний ефект від запропонованої схеми терапії полягав у тому, що значно зменшилася кількість рецидивів Пс в основній групі. При призначенні рекомендованої схеми терапії у 51,1 % пацієнтів спостерігалася стійка, протягом року, ремісія дерматозу і стабільний стан АТ (χ2 = 11,36, р = 0,001).
Відзначено позитивну динаміку стану тривоги і депресії (див. рис. 6).
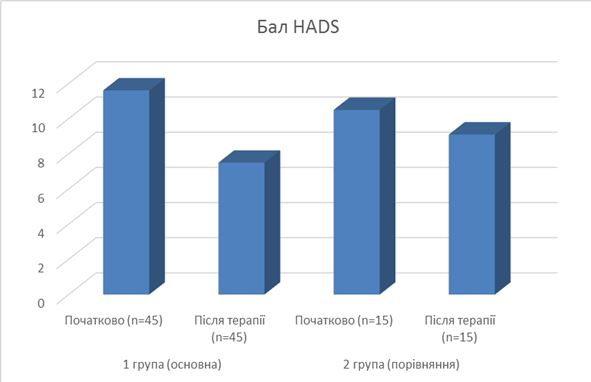
Рисунок 6 – Динаміка сумарного балу за шкалою HADS залежно від призначеної терапії
Динаміку маркерів досліджених патогенетичних процесів представлено на рис. 7. Так, статистично значуще зниження рівня каспази-8 на 42,9 % (р<0,01) після застосування в стандартній схемі лікування препаратів армадін, есциталопрам і сеансів БЗЗ значно перевершувало рівень зниження каспази-8 у пацієнтів без запропонованої схеми терапії в групі порівняння (7,7 %) (рис. 7).
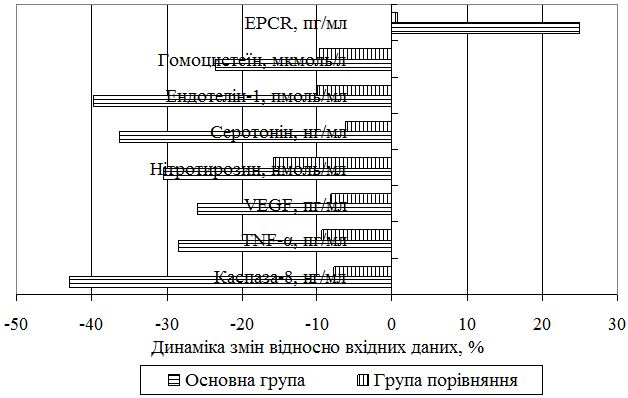
Рисунок 7 – Динаміка патогенетичних маркерів на тлі терапії
Визначене достовірне (р<0,05) зниження рівня ТNF-α в основній групі пацієнтів з використанням в терапії армадіну, сеансів БЗЗ та есциталопраму на 28,5 %, а в групі порівняння цей показник зменшився на 9,4 %; відзначалося також достовірне зниження показника VEGF-А на 26,0 % (р<0,05), а в групі з традиційною терапією зниження рівня маркера неоангіогенезу склало лише 8,1 %; простежена нормалізація рівня серотоніну в основній групі після лікування більш, ніж на третину (36,3 %), а в групі порівняння – на 6,2 %; відзначено зниження вмісту показника нітрозуючого стресу в першій групі на 30,5 %, а в другій – на 15,8 %, що свідчить про гальмування процесів нітрозування; відзначено зниження рівня ендотеліну-1 достовірно на 39,8 % в групі пацієнтів із запропонованою терапією, а без застосування армадіну, БЗЗ і есциталопраму динаміка зниження ендотеліну-1 склала лише 9,9 %; достовірно знижувався показник EPCR в групі із запропонованою методикою – на 25,0 % (р<0,01), а в групі порівняння – на 0,7 %; зменшилися сироваткові рівні гомоцистеїну на 23,5 %, а без використання додаткової запропонованої терапії – на 9,6 %. Динаміку метаболізму глутатіону до і після курсу терапії наведено в таблиці 4. При застосуванні додатково до стандартної терапії Пс препарату армадіну, БЗЗ-тренінгів і есциталопраму було визначено достовірне підвищення рівня відновлених тіолів у групі пацієнтів із запропонованою методикою на 27,7 % (р<0,05), а в групі порівняння спостерігалася лише тенденція до зростання рівня відновлених тіолів – 4,5 % (р>0,05). Рівень окисленого глутатіону зменшився достовірно (р<0,05) після лікування в групі із запропонованими додатково препаратами на 33,0 %, а в групі з традиційною терапією – на 11,8 % (табл. 5). Збільшення запасів відновлених тіолів в організмі свідчило про значні резерви антиоксидантної системи і позитивний вплив проведеного лікування.
Таблиця 5 – Динаміка метаболізму глутатіону у хворих на Пс із супутньою ГХ на тлі терапії
| Показник,
одиниці виміру |
1 група (основна) | % величина різниці | 2 група (порівняння) | % величина різниці | ||
| Початково (n=45) | Після терапії (n=45) | Початково (n=15) | Після терапії (n=15) | |||
| Відновлений глутатіон, мкмоль / л | 15,3 ± 0,41 | 19,53 ± 0,46 * | +27,65% | 15,5 ± 0,45 | 16,2 ± 0,29 | +4,52% |
| Окислений глутатіон, мкмоль / л | 3,12 ± 0,05 | 2,09 ± 0,07* | -33,01% | 3,4 ± 0,04 | 3,8 ± 0,05 | +11,76% |
| ГЛУв/ГЛУо, у.о. | 4,9 ± 0,23 | 9,34 ± 0,29* | +90,61% | 4,56 ± 0,21 | 4,26 ± 0,15 | -6,58% |
| СОД, у.о./мг білка/хв. | 21,13 ± 1,24 | 52,56 ± 1,09* | +148,75% | 20,41 ± 1,51 | 21,63 ± 1,94 | +5,98% |
Примітка. * – р <0,05 при порівнянні з вихідними значеннями.
Приріст співвідношення ГЛУв/ГЛУо в групі хворих після додаткової терапії армадіном, БЗЗ-тренінгами та есциталопрамом становив 90,6 % достовірно (р<0,05), а в групі порівняння відзначена менш значуща динаміка цього показника після стандартної терапії – 6,6 %, що підтвердило висновки про підвищення резерву антиоксидантної системи після використання запропонованої методики й обмеження процесів оксидативного стресу. У групі із запропонованою методикою після проведення терапії на 148,75 % достовірно (р<0,05) збільшилися також резерви СОД, а в другій групі активність СОД після лікування зросла лише на 6,0 %, що свідчило про значне підвищення активності системи антиоксидантного захисту.
ВИСНОВКИ
У роботі запропоновано теоретичне обґрунтування та нове вирішення актуальної наукової і практичної проблеми сучасної дерматовенерології, що полягає в оптимізації лікування хворих на псоріаз у поєднанні з ГХ шляхом розробки диференційованої комплексної терапії на підставі вивчення клінічних проявів, імунних та ангіогенних механізмів, нейрогуморальних процесів та морфологічних змін шкіри.
1. Значна поширеність псоріазу в загальній популяції, хронічний, рецидивуючий перебіг, зниження працездатності аж до інвалідизації пацієнтів, порушення їх соціальної активності визначають важливе медико-соціальне значення проблеми і обумовлюють необхідність подальших досліджень стосовно механізмів розвитку, особливостей клінічного перебігу дерматозу, нових напрямків терапії. Значний вплив коморбідної патології, яка обтяжує перебіг псоріазу, сприяє формуванню тяжких, резистентних до терапії форм, потребує подальшого вивчення. Одним із найбільш розповсюджених коморбідних станів є ГХ, тому розробка напрямку дослідження особливостей формування, перебігу, терапії та профілактики рецидивів цієї поєднаної патології є актуальним завданням клінічної дерматології.
2. При дослідженні АТ у 460 хворих на псоріаз АГ встановлена у 37,2 % пацієнтів. Згідно з результатами динамічного спостереження за 98 хворими на псоріаз основної групи, які мали супутню ГХ, порівняно з 72 хворими лише на псоріаз і 47 – тільки на ГХ, виявлено, що у 59,2 % пацієнтів основної групи діагностовано тяжкі форми псоріазу, серед яких найбільш типовими були артропатичний (у 29,6 %) і вульгарний бляшковий з вираженими явищами ексудації (19,4 %), де індекс PASI >30 і показник DLQI>10. При цьому спостерігалися гендерні відмінності у формуванні клінічних форм дерматозу: артропатичний псоріаз склав 73,9 % усіх форм у жінок, у чоловіків вульгарний з явищами ексудації становив 51,4 %, а артропатичний – 34,3 % усіх форм.
3. У пацієнтів, які страждають на псоріаз у поєднанні з гіпертонічною хворобою, рівні маркерів запального процесу (TNF-α, IL-1β, IL-1α, IL-6) достовірно перевищують аналогічні показники груп порівняння. Найбільш показовим є рівень TNF-α, який достовірно перевищує аналогічний показник групи хворих на гіпертонічну хворобу в 6,33 разу і в 4,1 разу – показник пацієнтів, які страждають лише на псоріаз. Активність запального процесу зростає з тривалістю хвороби, залежно від наявності ознак метаболічного синдрому, ступеня АГ, але найбільш значущий вплив на вміст цитокінів має тяжкість і поширеність дерматозу.
4. Найвищий рівень маркера апоптозу каспази-8 встановлено у жінок з артропатичною формою псоріазу, що може слугувати прогностичним критерієм формування псоріатичної артропатії у пацієнтів з коморбідною патологією. Тісний достовірний взаємозв’язок (r=+0,587) встановлено між тяжкістю перебігу дерматозу і маркером неоваскулогенезу VEGF-A у хворих на псоріаз із супутньою ГХ і найбільш виражено представлено у пацієнтів з явищами ексудації вульгарного бляшкового псоріазу, прогностичним критерієм якого може слугувати.
5. Найвищі рівні маркерів розвитку ендотеліальної дисфункції ендотеліну-1, гомоцистеїну мають місце у пацієнтів з коморбідною патологією. Це додатково ускладнюється розвитком патологічної активності NO-синтаз, гіперпродукцією NO, маркером чого є підвищений рівень нітротирозину. Зазначені процеси відбуваються найбільш виражено у пацієнтів з тяжким перебігом дерматозу, при артропатії. У цих же хворих встановлено найбільші рівні порушень оксидативного стресу, недостатність системи антиоксидантного захисту, ендотеліопротекції.
6. При наявності у хворих на псоріаз супутньої ГХ формується перенапруженість і зрив нейрогуморальної системи адаптації, що проявляється зниженням кортизол-інсулінового індексу, порушенням вегетативної регуляції з переважанням тонусу симпатичної нервової системи і зниженням вагусного впливу, формуванням патологічного типу циркадного ритму АТ, залежністю перебігу дерматозу від обміну серотоніну, рівня тривоги і депресії. Шляхом зіставлення клінічного перебігу псоріазу на тлі супутньої ГХ і показників сироваткового серотоніну встановлено, що найбільш сприятливий його рівень знаходиться в інтервалі від 130 до 200 нг/мл, при зниженні або перевищенні якого формуються резистентні до терапії форми дерматозу, що потребує додаткової терапевтичної корекції виявленого стану.
7. Морфологічним субстратом ушкодження шкіри у хворих на Пс і Гх є комплекс локальних і системних порушень, а саме: перифокальна гіперплазія і дистрофія кератиноцитів з акантолізом і деструкцією епідермально-дермального з’єднання; гіперпроліферація клітин у складі стінки мікросудин з розвитком гіалінозу й еластофіброзу артеріол; дисеміноване порушення ангіоархітектоніки артеріол і гемокапілярів; дифузний фіброз сосочкового шару і фіброеластоз сітчастого шару дерми; виражена експресія індуцибельної форми NO-синтази кератиноцитами та клітинами дерми. Даний комплекс порушень зустрічається у всіх без виключення хворих на Пс у прогресуючій стадії на тлі ГХ і викликає каскад типових патоморфологічних змін, які за своєю інтенсивністю значно перевищують ушкодження шкіри у хворих на Пс без АГ.
8. На підставі порівняльного аналізу в обстежених хворих анамнестичних даних, клінічних проявів і перебігу псоріазу, ускладнюючих факторів, а також результатів проведених лабораторних (визначення рівня TNF-α, VEGF-А, каспази-8, ендотеліну, нітротирозину, серотоніну, кортизолу, інсуліну, гомоцистеїну, ендотеліального рецептора протеїну C, показників оксидативного стресу), функціональних (вивчення ВСР, ДМАТ) досліджень визначено різні рівні патологічних зрушень та їх неоднорідність. На підставі проведеного аналізу було сформовано три групи хворих з вірогідною різницею досліджуваних показників: групу порівняння склали хворі на Пс і ГХ, які отримували традиційну терапію; другу групу склали хворі на Пс із супутньою ГХ, які додатково до традиційної терапії отримували антиоксидант армадін і сеанси БЗЗ, а в третій групі, з рівнем сироваткового серотоніну менше 130 нг/мл, ще й додатково отримували препарат есциталопрам.
9. Призначення хворим на Пс із супутньою ГХ комплексного лікування із застосуванням на тлі традиційної терапії антиоксиданту, інгібітора зворотного захвату серотоніну та сеансів БЗЗ дозволяє підвищити ефективність лікування, що підтверджено більш швидким регресом клінічним проявів дерматозу (PASI 75 встановлено у 64,4 % хворих, PASI 50 – у 28,9 % пацієнтів). Важливим результатом стала зміна тривалості перебування пацієнтів у стаціонарі: зникнення ознак активності дерматозу, вихід у стійку ремісію наставали в середньому на (5,8 ± 0,9) дня раніше, що свідчить про статистично значуще достовірне скорочення термінів терапії в групі хворих із запропонованою методикою. При призначенні рекомендованої схеми терапії у 51,1 % пацієнтів спостерігалася стійка, протягом року, ремісія дерматозу і стабільний стан АТ (χ2 = 11,36, р = 0,001). Комбінована терапія сприяла більшому, порівняно з традиційною терапією, зниженню маркерів імунного запалення, дисфункції ендотелію, нормалізації клітинних взаємин і мікросудинних процесів, а також поліпшенню емоційного, психічного стану, якості життя пацієнтів.
РЕКОМЕНДАЦІЇ
- При наявності супутньої АГ у хворих на Пс доцільне використання методики ДМАТ і дослідження ВСР для визначення несприятливих типів гемодинаміки, прогнозування розвитку тяжких форм дерматозу.
- Для прогнозування розвитку артропатичного Пс можливе використання показника каспази-8, рівень якого більше 0,22 нг/мл є маркером формування саме цієї форми дерматозу.
- Критерієм ступеня ураження шкіри може виступати VEGF-А, рівень якого більше 700 пг/мл достовірно свідчить про тяжкість, поширеність ураження шкіри з розвитком ексудативних форм псоріазу.
- Доцільно використовувати співвідношення ГЛУв/ГЛУо в якості прогнозу, його показник нижчий 6,0 у.о. є маркером розвитку тяжких форм псоріазу.
- Для визначення рівня тривоги і депресії рекомендовано використання госпітальної шкали тривоги і депресії. Визначено необхідність зіставлення рівня тривоги і депресії з показниками сироваткового серотоніну. При рівні серотоніну менше 130 нг/мл і високому рівні тривоги/депресії слід використовувати селективний інгібітор зворотного захвату серотоніну есциталопрам. При рівні серотоніну більше 200 нг/мл поряд із седативною терапією слід використовувати методи біоадаптивного управління.
- У зв’язку з виявленим дефіцитом системи антиоксидантного захисту, для лікування хворих на Пс із супутньою АГ доцільно застосовувати антиоксидант армадін у дозі 4 мл (200 мг) внутрішньовенно краплинно 1 раз на день протягом 10 днів з подальшим пероральним прийомом у добовій дозі 500 мг (армадін-лонг), тривалість курсу – 3 місяці.
СПИСОК ПРАЦЬ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Кірієнко В. О., Макуріна Г. І., Якименко Є. С. Порушення фізіологічних маркерів психоемоційного напруження та їх корекція з використанням температурно-міографічного тренінгу в комплексній терапії псоріатичної хвороби у хворих з надмірною масою тіла та артеріальною гіпертензією. Український журнал дерматології, венерології, косметології. 2015. № 1 (56). С. 24-32 (Здобувачем зібрано та проаналізовано літературні дані, проведено узагальнення результатів та підготовку статті до друку).
2. Федотов В. П., Визир В. А., Макурина Г. И. Особенности иммунорегуляторных процессов у больных псориазом в сочетании с гипертонической болезнью. Український журнал дерматології, венерології, косметології. 2015. № 3 (58). С. 18-22 (Здобувачем особисто проаналізовано дані літератури, йому належить ідея та завдання дослідження, збір та обробка матеріалу).
3. Федотов В. П., Визир В. А., Макурина Г. И. Взаимосвязь между степенью тяжести псориаза и уровнем ФНО-α у больных псориазом в сочетании с гипертонической болезнью. Запорожский медицинский журнал. 2015. № 3 (90). С. 43-47 (Здобувачем особисто сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних та їх узагальнення).
4. Макуріна Г. І., Федотов В. П., Візір В. А. Гендерні особливості епідеміології та клініки псоріазу з супутньою артеріальною гіпертензією. Запорожский медицинский журнал. 2015. № 5 (92). С. 28-32 (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки).
5. Макурина Г. И. Изучение механизмов активации васкулярного эндотелия у больных псориазом и артериальной гипертензией. Запорожский медицинский журнал. 2016. № 1 (94). С. 19-24.
6. Макурина Г. И. Клиническое значение нарушения обмена серотонина у пациентов с псориатической болезнью. Дерматологія та венерологія. 2016. № 1 (71). С. 34-41.
7. Макуріна Г. І. Стан епідермісу та епідермально-дермального з’єднання шкіри хворих на псоріаз і гіпертонічну хворобу. Патологія. 2016. № 1 (36). С. 73-78.
8. Макуріна Г. І. Морфологічні особливості мікроциркуляторного русла шкіри у хворих на псоріаз і гіпертонічну хворобу. Морфологія. 2016. Т. 10. № 1. С. 38-48.
9. Макуріна Г. І., Баударбекова М. М. Особливості активності iNOS у вогнищах ураженої шкіри хворих на псоріаз із супутньою артеріальною гіпертензією. Патологія. 2016. № 2 (37). С. 40-46 (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки).
10. Макуріна Г. І. Клініко-морфологічні паралелі у хворих на псоріаз із супутньою артеріальною гіпертензією. Український журнал дерматології, венерології, косметології. 2016. № 3 (62). С. 18-26.
11. Макурина Г. И. Патогенетические эффекты плазменных тиолов у больных псориазом на фоне артериальной гипертензии. Актуальні питання фармацевтичної і медичної науки та практики. 2016. № 3 (22). С. 67-74.
12. Visir V. A., Makurina G. I. State of free-radical processes and antioxidant defence of patients with psoriasis and concomitant essential hypertension. Запорожский медицинский журнал. 2016. № 4 (97). С. 21-28 (Здобувачем зібрано та проаналізовано літературні дані, проведено аналіз отриманих результатів, їх узагальнення та підготовлено статтю до друку).
13. Visir V. A., Makurina G. I. Clinical efficiency and dermoprotection of 2-ethyl-6-methyl-3-hydroxypyridine succinate drug in case of psoriasis: from the antioxidation point of view. Запорожский медицинский журнал. 2016. № 5 (98). С. 31-38 (Здобувачеві належить постановка проблеми, узагальнення результатів, підготовка статті до друку).
14. Vizir V. A., Makurina G. I. Features of arterial hypertension course in patients with psoriasis. Запорожский медицинский журнал. 2017. Т. 19. № 2 (101). С. 129-134 (Здобувачем особисто проаналізовано дані літератури, йому належить ідея дослідження, проведено збір та обробка матеріалу).
15. Дюдюн А.Д., Макуріна Г. І., Полион Н.Н., Колева Н.Н., Али Лоай. Эффективность применения растительного комбинированного препарата ЛИВ.52 и Серезиса в комплексном лечении больных псориазом. Дерматологія. Косметологія. Сексопатологія. 2012. № 1-4. С. 291-296 (Здобувачем зібрано та проаналізовано літературні дані, проведено узагальнення результатів та підготовку статті до друку).
16. Федотов В. П., Візір В. А., Макуріна Г. І. Особливості клінічних проявів та перебігу псоріазу у хворих з супутньою артеріальною гіпертензією. Дерматологія. Косметологія. Сексопатологія. 2014. № 1-4. С. 47-50 (Здобувачем особисто сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних та їх узагальнення).
17. Макурина Г. И. Нитрозирующий стресс при псориатической болезни в сочетании с єссенциальной гипертензией. Вісник проблем біології і медицини. 2015. Вип. 3. Т. 2 (123). С. 159-165.
18. Макуріна Г. І. Особливості вегетативної регуляції у хворих на псоріаз у поєднанні з артеріальною гіпертензією. Дерматологія. Косметологія. Сексопатологія. 2015. № 3-4. С. 40-45.
19. Макурина Г. И. Апоптоз-опосредованные механизмы и цитокиновый баланс у больных псориазом на фоне артериальной гипертензии. Сучасні медичні технології. 2016. № 1 (28). С. 24-28.
20. Макуріна Г. І. Патоморфогенез сполучнотканинного компоненту шкіри хворих на псоріаз і гіпертонічну хворобу. Вісник проблем біології і медицини. 2016. Вип. 2. Т. 2 (129). С. 191-194.
21. Макурина Г. И. Новые аспекты механизмов формирования псориаза при сопутствующей артериальной гипертензии. Актуальні проблеми сучасної медицини. 2016. Т. 16. Вип. 2 (54). С. 134-141.
22. Макурина Г. И. Особенности течения псориаза на фоне гипертонической болезни у мужчин. Дерматологія. Косметологія. Сексопатологія. 2016. № 1-4. С. 30-34.
23. Макурина Г. И. Клинико-эпидемиологические особенности течения псориаза на фоне артериальной гипертензии у мужчин. Чоловіче здоров’я, гендерна та психосоматична медицина. 2016. № 1 (03). С. 116-121.
24. Спосіб лікування хворих на псоріаз із супутньою артеріальною гіпертензією : пат. Україна № 98942 / Г. І. Макуріна, В. А. Візір, Є. С. Якименко. № u201413203 ; заяв. 09.12.2014 ; опубл. 12.05.2015, бюл. № 9 (Здобувачем розроблено та оформлено заявку, здійснено підготовку матеріалів заявки до друку).
25. Спосіб лікування псоріазу із супутньою артеріальною гіпертензією : пат. Україна № 114594 / Г. І. Макуріна, В. А. Візір. № u201610029 ; заяв. 03.10.2016 ; опубл. 10.03.2017, бюл. № 5 (Здобувачем розроблено та оформлено заявку, здійснено підготовку матеріалів заявки до друку).
26. Макурина Г. И. Особенности развития псориатической болезни у пациентов с сопутствующей артериальной гипертензией. Клинические лекции по дерматовенерологии и косметологии / под ред. В. П. Федотова, А. И. Макарчука. Т. 3. Запорожье – Днепропетровск : Просвіта, 2014. С. 384-397.
27. Федотов В. П., Візір В. А., Макуріна Г. І. Оцінка ефективності нових методів психокорекції в комплексній терапії хворих на псоріаз з супутньою артеріальною гіпертензією. Молоді науковці – майбутнє української дерматовенерології : зб. робіт за матеріалами наук.-практ. школи (20-21 листопада 2014 року. м. Київ). Київ, 2014. С. 71-73 (Здобувачем особисто проаналізовано дані літератури, йому належить ідея дослідження, проведено збір та обробка матеріалу).
28. Макурина Г. И., Федотов В. П., Визир В. А. Цитокиновый профиль больных псориазом с сопутствующей артериальной гипертензией. Актуальні питання косметології та дерматології : зб. тез ІХ Всеукр. наук.-практ. конф. з міжнар. участю (23-24 квітня 2015 р. м. Запоріжжя). Запоріжжя, 2015. – С. 14 (Здобувачем особисто проаналізовано дані літератури, йому належить ідея дослідження, проведено збір, узагальнення матеріалу, підготовлено тези до друку).
29. Макурина Г. И. Особенности суточного ритма артериального давления у больных псориазом с сопутствующей артериальной гипертензией. Актуальні питання клінічної медицини : матеріали ІХ Всеукр. наук.-практ. конф. молодих вчених (30 жовтня 2015 року). Запоріжжя, 2015. С. 69-70.
30. Макуріна Г. І. Оцінка впливу коморбідних станів у хворих на псоріаз. Дерматовенерологія. Косметологія. Сексопатологія. 2015. № 3-4. С. 120-121.
31. Макурина Г. И. Состояние эндотелиальной дисфункции у пациентов, страдающих псориазом в сочетании с артериальной гипертензией. Дерматовенерология и эстетическая медицина. (Ташкент). 2015. № 3 (27). С. 144.
32. Макурина Г. И. Маркеры нитротирозирующего стресса при псориазе и коморбидной артериальной гипертензии. Сборник материалов конференции, посвященной 100-летию академика В. Ю. Ахундова. Баку, 2016. С. 265-266.
33. Макурина Г. И. Особенности формирования псориаза при коморбидной патологии. Сучасні наукові дослідження представників медичної науки – прогрес медицини майбутнього : зб. тез наук. робіт учасників міжнар. наук.-практ. конф. (1-2 квітня 2016 р.). Київ, 2016. С.49-51.
34. Макуріна Г. І. Стан метаболізму нейромедіатора серотоніна при формуванні артеріальної гіпертензії на тлі псоріазу. Актуальні проблеми клінічної, теоретичної, профілактичної медицини, стоматології та фармації : зб. матеріалів міжнар. наук.-практ. конф., Одеса, 8–9 квітня 2016 р. Одеса : ОМІ, 2016. С. 50-53.
35. Макуріна Г. І. Стан ендотеліальної дисфункції у хворих на псоріаз із супутньою артеріальною гіпертензією. Медична наука та практика в умовах сучасних трансформаційних процесів : зб. тез наук. робіт учасників міжнар. наук.-практ. конф., 22-23 квітня 2016 р. Львів. 2016. Ч. 2. С. 21-23.
36. Макурина Г. И. Клинико-лабораторные параллели тяжести псориаза и состояния апоптоза у пациентов с сопутствующей артериальной гипертензией. Актуальні питання теоретичної і практичної медицини : матеріали IV Міжнар. наук.-практ. конф. студентів і молодих учених (21-22.04.16). Сумы, 2016. С. 127.
37. Макуріна Г. І. Апоптозні аспекти порушення метаболізму цитокінів при псоріазі та гіпертонічній хворобі. Весняні наукові читання : матеріали ІІ міжнар. наук.-практ. конф., 28 квітня 2016 р. Київ : «Велес», 2016. Ч. 2. С. 121-123.
38. Макурина Г. И. Морфофункціональний стан шкіри у хворих на псоріаз із супутньою гіпертонічною хворобою. Актуальні питання косметології та дерматології : зб. матеріалів Х Всеукр. наук.-практ. конф. з міжнар. участю, 28-29 квітня 2016 р. Запоріжжя, 2016. С. 5-6.
39. Макуріна Г. І. Динаміка рівня фактору некрозу пухлин альфа при псоріазі в умовах гіпертонічної хвороби. Актуальні питання розвитку медичних наук у ХХІ ст. : зб. тез наук. робіт учасників міжнар. наук.-практ. конф., 27-28 травня 2016 р. Львів, 2016. С. 39-42.
40. Макуріна Г. І. Порівняльна характеристика перебігу псоріазу у чоловіків та жінок на тлі гіпертонічної хвороби. Особливості модернізації предмету досліджень представників медичних наук: зб. тез наук. робіт учасників між нар. наук.-практ. конф., 3-4 червня 2016 р. Київ, 2016. С. 68-70.
41. Макуріна Г. І. Стан васкулярного ендотелію у хворих на ексудативний псоріаз. Медицина XXI століття: перспективні та пріоритетні напрями наукових досліджень: зб. матеріалів міжнар. наук.-практ. конф., Дніпро, 22–23 липня 2016. Дніпро : Організація наукових медичних досліджень «Salutem», 2016. С. 42-46.
42. Макурина Г. И. Ангиогенез как патогенетический фактор прогрессирования заболевания в условиях хронического дерматоза. Медична наука та практика ХХІ століття : зб. тез міжнар. наук.-практ. конф. (Київ, 3-4 лютого 2017 р.). Київ : «Київський медичний науковий центр», 2017. С. 39-42.
43. Макурина Г. И. Гомеостатический баланс гликемии как патогенетический аспект формирования хронического дерматоза на фоне артериальной гипертензии. Перспективні напрями розвитку сучасних медичних та фармацевтичних наук : зб. матеріалів міжнар. наук.-практ. конф. (Дніпро, 10-11 лютого 2017 р.). Дніпро : Організація наукових медичних досліджень «Salutem», 2017. С. 54-57.
44. Макуріна Г. І. Ефективність комплексної терапії хворих на псоріаз. Актуальні питання наукової та практичної косметології 2017 : матеріали Всеукр. наук.-практ. конф. з міжнар. участю (27-28 квітня 2017 року, м. Запоріжжя). Запоріжжя, 2017. С. 21-22.
45. Макурина Г. И. Динамика сывороточных значений кортизола и инсулина как регуляторов вуглеводного обмела у больных псориазом в сочетании с гипертонической болезнью на этапах долговременной адаптации. Південноукраїнський медичний науковий журнал. 2017. № 16. С. 62-63.
АНОТАЦІЯ
Макуріна Г. І. Псоріаз та коморбідні стани: клініко-морфологічні особливості, механізми розвитку, підходи до лікування. – На правах рукопису.
Дисертація на здобуття наукового ступеня доктора медичних наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби. – Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2017.
На основі порівняльного аналізу клінічних проявів псоріазу, ускладнюючих факторів, оцінки показників якості життя, тривоги/депресії, результатів проведених лабораторних, функціональних та патоморфологічних досліджень, визначено різні рівні патологічних зрушень у хворих на псоріаз при супутній гіпертонічній хворобі. На підставі досліджень сформовано три групи пацієнтів, у двох з них хворим додатково до традиційної терапії призначалися антиоксидант армадін і сеанси біологічного зворотного зв’язку, у третій – ще й антидепресант есциталопрам.
Встановлено, що призначення запропонованої терапії дозволяє підвищити клінічну ефективність, призводить до зниження артеріального тиску, нормалізації чи тенденції до нормалізації лабораторних і функціональних показників.
Ключові слова: псоріаз, гіпертонічна хвороба, тривога, якість життя, цитокіни, васкулогенез, апоптоз, адаптація, ендотеліальна дисфункція, біологічний зворотний зв’язок.
АННОТАЦИЯ
Макурина Г. И. Псориаз и коморбидные состояния: клинико-морфологические особенности, механизмы развития, подходы к лечению. – На правах рукописи.
Диссертация на соискание научной степени доктора медицинских наук по специальности 14.01.20 – кожные и венерические болезни. – Государственное учреждение «Институт дерматологии и венерологии НАМН Украины», Харьков, 2017.
На основе сравнительного анализа клинических проявлений псориаза, отягощающих факторов, оценки показателей качества жизни, тревоги / депрессии, результатов проведенных лабораторных, функциональных и патоморфологических исследований, определены различные уровни патологических сдвигов у больных псориазом при сопутствующей гипертонической болезни. На основании исследований сформированы три группы пациентов, в двух из них больным дополнительно к традиционной терапии назначались антиоксидант армадин и сеансы биологической обратной связи, в третьей – еще и антидепрессант эсциталопрам.
Установлено, что проведение предложенной терапии позволяет повысить клиническую эффективность, приводит к снижению артериального давления, нормализации или тенденции к нормализации лабораторных и функциональных показателей.
Ключевые слова: псориаз, гипертоническая болезнь, тревога, качество жизни, цитокины, васкулогенез, апоптоз, адаптация, эндотелиальная дисфункция, биологическая обратная связь.
ABSTRACT
Makurina G. I. Psoriasis and comorbid conditions: clinical and morphological features, mechanisms of development, approaches to treatment. – The manuscript.
The thesis for obtaining academic degree of Ph.D.Med. majoring in 14.01.20 – skin and venereal diseases. – State Establishment «Institute of Dermatology and Venereology of NAMS of Ukraine», Kharkiv, 2017.
Based on the comparative analysis of clinical manifestations of psoriasis, form of dermatosis and confounding factors, as well as results of laboratory studies (determination of the level of TNF-α, VEGF-α, serotonin, caspase-8, nitrotyrosine, cortisol, homocysteine, endothelial C-protein receptor, indices of oxidative stress), functional studies (research of heart rate variability, daily monitoring of arterial pressure) and pathomprphological studies the different levels of pathological shifts and their heterogeneity in patients with psoriasis in case of essential hypertension were determined.
On the basis of the data obtained, three groups of patients with the possible difference in studied parameters were formed: the first comparison group consisted of patients with psoriasis and without arterial hypertension who had standard therapy of dermatosis. The second group (the main one) consisted of patients with psoriasis and concomitant arterial hypertension, which, in its turn, comprised two subgroups formed depending on the level of serotonin (less and more than 100 ng/ml) and anxiety/depression index. In both subgroups with mentioned comorbid condition, patients also had standard therapy, but additionally took Armadine antioxidant and biological feedback sessions (in the first subgroup), and in the second subgroup with serotonin level less than 100 ng/ml they additionally took escitalopram (serotonin reuptake inhibitor).
Patients suffering from psoriasis in combination with arterial hypertension have levels of the inflammatory process markers which significantly exceed the similar parameters of the comparison groups of patients only with psoriasis or essential hypertension (EH).
It was determined that high values of apoptosis marker are registered for patients with comorbid pathology; this fact was confirmed by level of caspase-8 in the blood serum ([0.21 ± 0.03] ng/ml) as compared with the same parameter of patients with only psoriasis ([0.10 ± 0.01] ng/ml) or essential hypertension ([0.06 ± 0.01] ng/ml), p <0.05.
The significant correlation between severity of dermatosis course and index of the vascular endothelium growth factor in patients with psoriasis associated with essential hypertension was determined.
Patients with psoriasis, especially in case of the concomitant essential hypertension have hyperhomocysteinemia at the level of (30.94 ± 2.48) μmol/l for patients with comorbid pathology. Decrease of the level of endothelial C-protein receptor of (800.68 ± 46.34) ng/ml was also determined, compared with psoriasis patients of comparison group ([1257.87 ± 22.73] ng /ml) or essential hypertension ([1591.08 ± 51.98] ng / ml), which indicates significant disorder in vascular endothelial function of patients with comorbid pathology.
Based on results of the study of markers of cortisol and insulin humoral regulation there was determined that overlay of essential hypertension on psoriasis forms the more intensive and inadequate response which declares itself with decrease of cortisol level ([6.26 ± 1.13] μg/dl) (p <0.05). Increased insulin levels in patients with comorbid pathology ([25.77 ± 4.01] U/ml) are the more favourable conditions for the development of carbohydrate metabolism disorders in them.
It is shown that, hovewer generally the patients with psoriasis and concomitant arterial hypertension have increased level of marker of neuroimmune serotonin bonds ([378.91 ± 40.85] ng/ml), p <0.05, the detailed study revealed evident heterogeneity in indices of the main group. If serotonin level is less than 100 ng/ml the forms of dermatosis resistant to therapy shall be formed which correlates with the degree of anxiety/depression of HADS scale and requires additional therapeutic correction.
The prescription of complex treatment with the use of standard and additional therapy in form of Armadin antioxidant, escitalopram (serotonin reuptake inhibitor) and biofeedback sessions for patients with psoriasis and concomitant essential hypertension allows to increase the clinical results of treatment. This fact is confirmed by faster regression of clinical manifestations of dermatosis (PASI 75 was found in 66.7 % of patients, 26.7 % – PASI 50), decrease of quantity of relapses, reduction of hospital stay at the average by (5.8 ± 0.91) days, stabilization of blood pressure, as well as improvement or tendency to normalization of laboratory and functional indices of patients with comorbid pathology.
Key words: psoriasis, essential hypertension, anxiety, quality of life, cytokines, vasculogenesis, apoptosis, adaptation, endothelial dysfunction, biological feedback.
