Державна установа
«Інститут дерматології та венерології НАМН України»
Бочарова Вероніка Володимирівна
УДК 616.53-002.25/.34-07-08:612.017:616.85
ДІАГНОСТИКА ТА ЛІКУВАННЯ ВУГРОВОЇ ХВОРОБИ
З УРАХУВАННЯМ ЗНАЧЕННЯ НЕЙРОГЕННИХ ТА ІМУННИХ КОМПОНЕНТІВ В ПАТОГЕНЕЗІ ДЕРМАТОЗУ
14.01.20 – шкірні та венеричні хвороби
Автореферат
дисертації на здобуття наукового ступеня
доктора медичних наук
Харків – 2019
Дисертацією є рукопис.
Робота виконана в Одеському національному медичному університеті МОЗ України.
Науковий консультант:
доктор медичних наук, професор
Лебедюк Михайло Миколайович,
Одеський національний медичний університет
МОЗ України, завідуючий кафедрою дерматології та венерології.
Офіційні опоненти:
доктор медичних наук
Білозоров Олексій Павлович,
ДУ «Інститут дерматології та венерології НАМН України»,
завідувач лабораторії імунології, патоморфології та
молекулярної генетики;
доктор медичних наук, професор
Бондар Сергій Анатолійович,
Вінницький національний медичний університет імені М. І. Пирогова
МОЗ України, завідувач кафедри шкірних та венеричних хвороб;
доктор медичних наук, доцент
Горбунцов Вячеслав Вячеславович,
ДЗ «Дніпропетровська медична академія МОЗ України»,
професор кафедри шкірних та венеричних хвороб.
Захист дисертації відбудеться «30» жовтня 2019 р. об 11:00 годині на засіданні спеціалізованої вченої ради Д 64.603.01 при Державній установі «Інститут дерматології та венерології НАМН України» за адресою: 61057, м. Харків, вул. Чернишевська, 7/9.
З дисертацією можна ознайомитись в бібліотеці Державної установи «Інститут дерматології та венерології НАМН України» за адресою: 61057, м. Харків, вул. Чернишевська, 7/9.
Автореферат розісланий «28» вересня 2019 року.
Вчений секретар
спеціалізованої вченої ради,
д. мед. н. Ю. В. Щербакова
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Вугрова хвороба (акне) є одним із найпоширених захворювань осіб молодого віку, а частота звернення пацієнтів до дерматологів посідає одне з перших місць (Я. Ф. Кутасевич та співавт., 2013; С. О. Галникіна, 2015; В. М. Волкославська, 2016; R. C. Simpson et al., 2011; J. K. Tan, K. Bhate, 2015). На сьогодні особливістю даного дерматозу є тенденція до збільшення випадків більш тяжкого персистуючого перебігу (Л. Д. Калюжна, А. В. Петренко, 2014; Е. С. Литвин, А. А. Дащук, 2017), зростання відсотку резистентних до традиційних методик лікування форм захворювання, а також почастішання випадків вугрової хвороби у більш пізньому віці (Л. А. Болотная, Е. И. Сариан, 2015; В. А. Савоськина, 2017; S. J. Sinnott, 2017). Сучасними науковими дослідженнями підтверджено, що вугрова хвороба є мультифакторним захворюванням, із наявністю генетичної детермінації процесу, до провідних факторів етіопатогенезу якого належать як екзогенні, так і ендогенні, найбільш значимими з яких є різноманітні дисендокринії, патологія органів травлення (Ю. П. Карвацька, О. І. Денисенко, 2014; С. А. Бондар, 2016; О. О. Сизон, М. О. Дашко, 2017; J. Kazandjieva, N. Tsankov, 2017). У той же час питання щодо найбільш вагомого пускового фактору виникнення даного захворювання, тривалого його перебігу, залишається відкритим і спонукає до проведення подальших досліджень. Провідні ланки патофізіологічних змін, що відбуваються в сально-фолікулярному апараті шкіри при вугровій хворобі, постійно доповнюються даними імунологічних, мікробіологічних досліджень, що дозволяють розглядати акне як складний імунний патогенасоційований дерматоз, визначну роль при якому відіграють цитокіни різного функціонального призначення (А. В. Кормилицина, Н. М. Калинина, 2017; E. A. Tanghetti, 2013). З урахуванням того, що при вугровій хворобі елементи висипки локалізуються на обличчі, у таких пацієнтів відмічаються різноманітні розлади психофізіологічної сфери (О. А. Носачева и соавт., 2012; О. А. Шавловская, 2015; G. Scheider, 2013; M. S. Nestor, 2016), що погіршує якість їх життя. У той же час механізми формування психоемоційних розладів та їх значення в патогенезі дерматозу ще недостатньо вивчені. Недостатньо з’ясованими залишаються і нейроімунні зміни в організмі хворих на вугрову хворобу, зокрема – роль нейропептидів та їх значення у розвитку патофізіологічних змін як на системному, так і на локальному рівнях. З урахуванням встановленої єдності функціонування нервової, імунної та ендокринної систем організму та вагомим їх представленням у шкірі (М. А. Пальцев, И. М. Кветной, 2006), актуальним є вивчення особливостей молекулярних сполук, що реалізують як вроджену, так і адаптивну ланки імунної відповіді (А. П. Белозоров, 2017), до яких належать і низькомолекулярні катіонні пептиди – дефензини та ін. (A. Z. El-Ramly et al., 2016). З’ясування ролі дефензинів у тісному зв’язку з іншими важливими регуляторними пептидними сполуками (цитокіни, фактори росту, нейропептиди та ін.) та з урахуванням особливостей супутніх станів/захворювань, що діагностуються у переважної більшості пацієнтів з акне, у тому числі – дисбіотичні зміни кишечника та їх вплив на тяжкість перебігу дерматозу, може дозволити розкрити нові аспекти патологічних змін і удосконалити лікувально-профілактичні заходи (В. В. Горбунцов, А. Д. Дюдюн, 2014; В. І. Cтепаненко та співавт., 2015), значно покращуючи при цьому якість життя таких пацієнтів.
Зв’язок роботи з науковими програмами, планами, темами. Дисертація є фрагментом комплексних науково-дослідних робіт Одеського національного медичного університету: «Удосконалення алгоритмів діагностики, лікування та профілактики хронічних дерматозів та захворювань, що передаються статевим шляхом» та «Обґрунтування сучасних підходів до діагностики, лікування і профілактики хронічних дерматозів та захворювань, що передаються статевим шляхом» (номери державної реєстрації 0113U006428 та 0116U008932). Дисертантом особисто виконано фрагмент, що присвячений з’ясуванню нових аспектів патогенезу та клінічних особливостей перебігу вугрової хвороби і розробці та апробації на цій основі комплексної методики лікування хворих із використанням пептидомодулюючої та фітоантимікробної терапії.
Мета та завдання дослідження. Мета – підвищення ефективності лікування хворих на вугрову хворобу шляхом розробки методу комплексної патогенетичної терапії на підставі вивчення показників нейроімунних механізмів гомеокінезу.
Для досягнення цієї мети були поставлені такі задачі:
- Дослідити та проаналізувати клінічні особливості перебігу вугрової хвороби у обстежених хворих.
- Встановити частоту функціональних змін з боку психоемоційної сфери та органів шлунково-кишкового тракту у хворих на вугрову хворобу та з’ясувати взаємозв’язки між ступенями тяжкості перебігу дерматозу і психофізіологічним станом та функціональним станом товстого кишечника у обстежених хворих.
- Дослідити склад мікробіоти шкіри та порожнини товстого кишечника у хворих на вугрову хворобу.
- Вивчити вміст низькомолекулярних катіонних пептидів альфа-дефензинів у сироватці крові у хворих на вугрову хворобу.
- Визначити вміст у сироватці крові хворих на вугрову хворобу пептидних факторів нейрогенної регуляції неопіоїдної (субстанція Р) та опіоїдної природи (бета-ендорфін, лей-енкефалін).
- Вивчити вміст у сироватці крові хворих на вугрову хворобу цитокінових пептидних молекул: фактора некрозу пухлин – альфа (TNFα), інтерлейкіну-6 (IL‑6), трансформуючого фактора росту – бета (TGFβ1), інтерферону-гамма (IFNγ).
- З’ясувати наявність взаємозалежностей між дослідженими пептидними регуляторними молекулами та ступенем тяжкості клінічного перебігу дерматозу, психофізіологічного стану і кількісно-видовими показниками мікробіоти шкіри і товстого кишечника у хворих на вугрову хворобу та визначити на цій основі ймовірні провідні ланки патофізіологічних порушень при даному дерматозі.
- Удосконалити методику комплексного лікування хворих на вугрову хворобу з урахуванням отриманих результатів дослідження функціонального стану показників нейроімунного гомеокінезу і мікробних біотопів та визначити його ефективність.
- Оцінити результати проведення удосконаленої комплексної методики лікування хворих на вугрову хворобу у віддаленому періоді спостереження.
Об’єкт дослідження: вугрова хвороба.
Предмет дослідження: патогенетичні та клінічні особливості перебігу вугрової хвороби; показники мікробних біотопів шкіри і порожнини товстого кишечника та пептидних регуляторних сполук у хворих на вугрову хворобу; діагностика та лікування хворих на вугрову хворобу.
Методи дослідження: загальні клінічні (з’ясування скарг, анамнезу захворювання та життя, аналіз суб’єктивних і об’єктивних даних обстеження, постановка діагнозу, контроль ефективності лікування) та лабораторні (клінічні аналізи крові, сечі, калу, біохімічні та серологічні аналізи крові); психологічні (анкетування для визначення наявності/відсутності дисморфофобії та депресивних станів); мікробіологічні (мікроскопічні та культуральні дослідження мікробіоти осередків ураження шкіри та мікробіоти порожнини товстого кишечника); імунологічні (альфа-дефензини, субстанція Р, бета-ендорфін, лей-енкефалін, TNFα, IL-6, TGFβ1, IFNγ).
Наукова новизна отриманих результатів. У хворих на вугрову хворобу вперше встановлено високу частоту синдрому подразненого кишечника (78,9 %), що має прямий взаємозв’язок із тяжкістю дерматозу (r=0,574) та асоціюється з дисморфофобією (r=0,763) і депресивними станами (r=0,657).
Доведено важливу роль нейтрофілів у розвитку шкірного запалення у хворих на вугрову хворобу на підставі значного підвищення рівня альфа-дефензинів у сироватці крові, яке корелює з тяжкістю перебігу дерматозу (r=0,877) і вмістом у крові субстанції Р (r=0,875), IL-6 (r=0,789), TGFβ1 (r=0,674).
Вперше виявлено, що у хворих на вугрову хворобу поряд із підвищенням концентрації субстанції Р відбувається зниження рівня ендогенних лігандів опіоїдних рецепторів – бета-ендорфіну та лей-енкефаліну, що свідчить про розвиток відносної недостатності останніх, яка може сприяти розвитку запалення шкіри.
Вперше встановлено наявність у хворих на вугрову хворобу взаємозалежності між змінами кількісно-видового складу мікробіоти шкіри (підвищення Propionibacterium acnes і колонізація Staphylococcus aureus) та рівнем вмісту у сироватці крові альфа-дефензинів (r=0,851 і r=0,764, відповідно) і змінами кількісно-видового складу порожнини товстого кишечника (зниження Bifidobacterium, Lactobacillus і підвищення умовно-патогенних кишкових бактерій сімейства Enterobacteriaceae) та рівнем вмісту в сироватці крові TGFβ1 (r=–0,876, r=–0,654 і r=0,498, відповідно), що свідчить про можливий вплив цих процесів на формування кутанної (шкіра) і оральної (кишечник) толерантності.
Вперше показано, що цитокіновий спектр сироватки крові у хворих на вугрову хворобу із середнім і помірно тяжким її перебігом характеризується значним підвищенням рівня IL-6 (у 1,9 і 2,3 раза, відповідно), TNFα, TGFβ1 (у 1,7 і 2,1 раза, відповідно) та помірним зниженням IFNγ (у 1,4 і 1,8 раза, відповідно); виявлено зворотню кореляцію між IFNγ і IL-6, TGFβ1 (r=–0,925, r=–0,998, відповідно) при більш тяжких формах вугрової хвороби.
Вперше науково обґрунтовано комплексний метод лікування хворих на вугрову хворобу із призначенням диференційованого використання пептидомодулюючої та фітоантимікробної терапії та доведено його ефективність.
Практичне значення отриманих результатів. Розроблено, науково обґрунтовано та запропоновано новий спосіб лікування хворих на вугрову хворобу, який полягає у послідовному призначенні синтетичного аналогу лей-енкефаліну – гексапептиду (тирозин-2-аланіл-гліцин-фенілаланіл-лейцин-аргініну діацетат – Даларгін) внутрішньом’язово вранці по 1 мл 1 раз на добу (курс лікування 1-3 тижні залежно від ступеня тяжкості клінічного перебігу дерматозу) та фітоантимікробного засобу (суміші бісульфатів сангвінарину та холеритрину з рослин родини макових: маклеї серцеподібної та маклеї дрібноплідної – Сангвірітрин) у вигляді змащування вранці та ввечері – на початкових етапах із наступною базисною терапією разом із Сангвірітрином (патент України на корисну модель № 130470 від 10.12.2018), що дає змогу покращити найближчі (у 1,6 раза частіше забезпечити клінічне одужання та значне покращення) і віддалені клінічні результати (у 2,5 раза знизити частоту виникнення рецидивів та попереджає розвиток більш тяжких форм дерматозу).
Основні положення дисертації впроваджено в практику роботи: КУ «Запорізький обласний шкірно-венерологічний клінічний диспансер», Вінницького обласного клінічного шкірно-венерологічного диспансеру Вінницької обласної ради, Полтавського обласного клінічного шкірно-венерологічного диспансеру, Херсонського обласного шкірно-венерологічного диспансеру, Миколаївського обласного шкірно-венерологічного диспансеру Миколаївської обласної Ради, КЗ «Обласний шкірно-венерологічний диспансер» м. Дніпро, КНП «Одеський обласний шкірно-венерологічний диспансер» Одеської обласної Ради, а також у педагогічний процес кафедр: шкірних та венеричних хвороб ДЗ «Дніпропетровська медична академія МОЗ України» і Вінницького національного медичного університету імені М. І. Пирогова, дерматовенерології та косметології з курсом дерматовенерології та естетичної медицини факультету післядипломної освіти Запорізького державного медичного університету.
Особистий внесок здобувача. Дисертація є самостійною науковою працею автора. Разом із науковим консультантом, професором Лебедюком М. М. визначено мету і завдання наукових досліджень. Здобувачем самостійно проведено інформаційно-патентний пошук, аналіз даних вітчизняної та світової наукової літератури. Дисертантом самостійно проведено комплексне клініко-лабораторне обстеження та лікування 223 хворих на вугрову хворобу, облік і статистичну обробку показників результатів загальних клініко-лабораторних і спеціальних обстежень, особисто написано всі розділи дисертації, підготовлено до друку наукові публікації. Автором особисто сформульовано всі наукові узагальнення, положення, результати, висновки та рекомендації.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. Із наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Конфлікту інтересів немає.
Апробація результатів дисертації. Основні положення роботи викладено та обговорено на науково-практичних конференціях різного рівня: «Сучасні методи організації і технології в розвитку вітчизняної дерматовенерології» (Вінниця, 2013); «Актуальні питання естетичної медицини та зв’язок з суміжними спеціальностями» (Запоріжжя, 2013); «Сучасні проблеми фармакології, косметології та аромології» (Одеса, 2014); «Гуманітарний та інноваційний ракурс професійної майстерності: пошуки молодих учених» (Одеса, 2015); Сучасні методи діагностики та лікування коморбідної патології в дерматовенерологічній практиці на принципах доказової медицини (Чернівці, 2017); «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі» (Харків, 2017); «Медична наука в практику охорони здоров’я» (Полтава, 2017); VII з’їзді спеціалістів естетичної медицини (м. Одеса, 2016).
Публікації. За матеріалами дисертаційної роботи опубліковано 34 наукові роботи, у тому числі: 1 монографія (у співавторстві); 24 статті у наукових виданнях (11 – у моноавторстві), з яких 19 – у журналах, що входять до міжнародних наукометричних баз даних наукового цитування CORE, Російський індекс наукового цитування, CrossRef, Bielefeld Academic Search Engine (BASE), Ulrich’s Periodicals Directory, ResearchBib, WorldCat, Google Scholar (у тому числі – 9 за кордоном); 7 тез доповідей у збірниках матеріалів наукових конференцій; 1 патент України на корисну модель.
Структура та обсяг дисертації. Дисертаційна робота викладена українською мовою на 314 сторінках машинописного тексту, складається зі вступу, 7 розділів, загальних висновків, списку використаних джерел та двох додатків. Обсяг основного тексту дисертації складає 263 сторінки друкованого тексту. Робота ілюстрована 31 таблицями, 73 рисунками. Список використаних джерел містить 346 найменувань, з них 230 – кирилицею та 116 – латиницею.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріали та методи досліджень. У роботі наведено дані обстеження 223 хворих на вугрову хворобу, що були проведені в період з 2012 по 2018 рр. на базі обласних шкірно-венерологічних диспансерів (Запорізького та Одеського). Усім хворим було проведено повний обсяг загальних клініко-лабораторних обстежень згідно Наказу МОЗ України № 312 від 08.05.2009 р. стосовно рекомендацій надання медичної допомоги хворим на дерматологічні захворювання. За необхідності хворі були консультовані суміжними спеціалістами (у ендокринолога, гінеколога, гастроентеролога, психоневролога та ін.). Усі дослідження хворим на вугрову хворобу проводилися вранці натщесерце, дотримуючись встановлених правил підготовки та забору біоматеріалу відповідно до методики дослідження.
Критеріями включення в дослідження були: особи чоловічої та жіночої статі, які досягли 18-річного віку; папулопустульозна форма вугрової хвороби; здатність пацієнта до адекватної співпраці з лікарем та чіткого виконання рекомендацій щодо режиму, дієти та призначених засобів; письмова інформована згода пацієнта на участь у дослідженні.
Критеріями виключення були: комедональна форма вугрової хвороби і наявність у пацієнтів кіст, фістульозних акне, абсцесивних нориць; супутній демодекоз; клінічні прояви інфекційних хвороб на момент обстеження; хронічна патологія органів і систем у стадії загострення, декомпенсована супутня патологія, ендокринні порушення (у тому числі гіперандрогенія у жінок); прийом нерекомендованих засобів для системного лікування менш ніж за один місяць та протягом проведення дослідження; участь пацієнта в іншому клінічному дослідженні.
Контрольну групу становили 35 практично здорових осіб-добровольців, чоловічої статі – 16, жіночої – 19, у віці від 18 до 25 років, у яких напередодні не відмічалося гострих запальних захворювань і які протягом останніх півроку не приймали будь-яких загальнозміцнюючих, імунотропних і метаболічних засобів.
З метою встановлення особливостей психофізіологічного стану в усіх хворих на вугрову хворобу було проведено психологічні дослідження за методикою анкетного їх опитування, що передбачали визначення наявності/відсутності у них дисморфофобії (Г. В. Бочарова-Мараховська та співавт., 2010) і депресивних станів (І. В. Коваленко, 2005).
Додатково 117 хворим на вугрову хворобу та 35 практично здоровим особам (контрольна група) було проведено мікробіологічні та імунологічні дослідження.
Мікробіологічні дослідження включали вивчення кількісно-видового складу мікробіоти шкіри та порожнини товстого кишечника, що проводилися за загальноприйнятими традиційними методиками (У. К. Нобл, 1986; Р. В. Эпштейн-Литвак, Ф. Л. Вильшанской, 1977).
Імунологічні дослідження, що включали визначення вмісту у крові пептидних регуляторних молекул (нейропептидів, альфа-дефензинів та цитокінів), проводилися в Центральній науково-дослідній лабораторії Донецького національного медичного університету (2012–2014 рр.) із використанням методу твердофазного імуноферментного аналізу в суворій відповідності до інструкцій фірм-виробників тест-систем: «Substance P, 96; ng/ml» (для субстанції Р) і «Beta Endorphin, 96; ng/ml» (для бета-ендорфіну) фірми BCM Diagnostics, США; «Leu-Enkephalin, 96; ng/ml» (для лей-енкефаліну) – фірми LifeSpan BioSciences, США; «HNP1-3, Human, ELISA kit; pg/ml» (для антимікробних пептидів HNP1-3) – фірми «Hycult®Biotech», Нідерланди; «Human TNF-α ELISA, 96; pg/ml» (для TNFα), «Human IL-6 ELISA, 96; pg/ml» (для IL-6), «Human TGF-β1 ELISA, 96; ng/ml» (для TGFβ1) і «Human IFN-γ ELISA, 96; pg/ml» (для IFNγ) – фірми Bender MedSystem (BMS), Австрія. Для визначення оптичної щільності продуктів ферментативної реакції використовувався плашковий рідер «Multiscan FX» (Фінляндія). Визначення вмісту в нейтрофілах периферичної крові альфа-дефензинів (HNP1-3) проводилося методом проточної цитофлуориметрії на проточному цитометрі NaviousTM (Beckman Coulter, США) при довжині хвилі 488 нм за допомогою використання моноклональних антитіл «HNP1-3, Human, mAb D21» (Isotype: IgG1, Species: Human, 100 μg) фірми «Hycult®Biotech», Нідерланди).
Статистичну обробку отриманих даних проведено на персональному комп’ютері за допомогою ліцензійної програми «STATISTICA® for Windows 6.0» (StatSoft Inc., ліцензія № AXXR712D833214FAN5) із використанням параметричних та непараметричних методів, обчислювалися: середні значення (М), їх похибки (m); значення медіани розподілу (Me) та першого і третього квартилю розподілу (QI, QIII) – у разі відмінного від нормального закону розподілу; достовірність різниці показників (р) обчислювалася за U-критерієм Манна-Уітні, критерієм Вілкоксона, результати вважалися статистично значимими на рівні 95 % (р<0,05); коефіцієнти кореляції (r) – за критерієм парної кореляції Пірсона і рангової Спірмена.
Результати досліджень та їх обговорення. Обстежено 223 хворих на вугрову хворобу, серед яких осіб чоловічої статі – 86 (38,6 %), жіночої – 137 (61,4 %), у віці від 18 до 25 років. Переважна кількість хворих була у віці від 18 до 22 років (79,9 %), середній вік пацієнтів становив (21,1 ± 1,9) року. У всіх хворих мала місце папулопустульозна форма вугрової хвороби в стадії загострення. Висипка гострозапального характеру у вигляді папулопустул відмічалася лише на шкірі обличчя у 41 (18,4 %) хворих; у решти пацієнтів, окрім ураження обличчя, в патологічний процес була залучена шкіра спини та/або грудей, а крім папулопустул спостерігалися також поодинокі нодулярні ефлоресценції, діаметр яких не перевищував 1 см. У ділянці обличчя найчастіше висипка локалізувалася в ділянці щік (у 173 – 77,6 %), носа і носо-губних складок (у 131 – 58,7 %), підборіддя (у 124 – 55,6 %), чола (у 121 – 54,3 %) – тобто, у так званій «Т-зоні» (зоні найбільшої концентрації сальних залоз), дещо рідше – на шкірі скроневої ділянки (у 79 – 35,4 %); при цьому спостерігалося ураження одночасно кількох ділянок обличчя. У ділянці спини гострозапальні елементи висипки відмічалися у 162 (72,6 %), грудей – у 53 (23,8 %).
Основна кількість хворих на вугрову хворобу за соціальним статусом була представлена особами, що навчалися – студентами, а також працівниками сфери надання послуг – службовцями. Давність захворювання у хворих на вугрову хворобу була не менше трьох років, майже у половини з них (у 108 – 48,4 %) вона знаходилася в діапазоні від 5 до 7 років (середнє значення по всьому обстеженому контингенту становило (5,5 ± 1,6) року). Перші ознаки захворювання виникали переважно у 14–15-річному віці (у 183 – 82,1 %), у 19 (8,5 %) – у період від 16 до 19 років; у решти 21 (9,4 %) пацієнтів відмічався більш ранній початок розвитку патології (з 12- до 14-річного віку).
Анамнестично також з’ясовано, що у більшості хворих захворювання супроводжувалося частими рецидивами (від двох до чотирьох разів на рік), а ремісії були нетривалими. Лікування, що проводилося раніше (як правило – за традиційною методикою), забезпечувало порівняно нестійкий ефект. При цьому на неефективність терапії, що проводилася раніше, вказували 128 (57,4 %) пацієнтів, на її ефективність – 54 (24,2 %), решта пацієнтів (41 – 18,4 %) не змогли однозначно констатувати результати проведеного їм лікування. Серед факторів, що провокували загострення та/або рецидиви захворювання, більшість пацієнтів зазначала психоемоційне перенапруження та різноманітні стресові ситуації.
Серед супутніх захворювань, перенесених у минулому, найчастішою була патологія з боку органів шлунково-кишкового тракту (у 187 – 83,9 %): гастродуоденіти (у 51 – 22,9 %), гастрити (у 42 – 18,8 %), дискінезії жовчовивідних шляхів (у 37 – 16,6 %), панкреатити (у 35 – 15,7 %) та холецистити (у 22 – 9,9 %); в окремих осіб жіночої статі в анамнезі мали місце запальні захворювання придатків матки – аднексити (у 19 – 8,5 %).
Аналіз даних спадкового анамнезу дозволив встановити генетичну обтяжливість у 149 (66,8 %), із яких більш ніж у половини (у 91 із 149 – 40,8 %) хворих дана патологія спостерігалась як у батька, так і у матері, у решти (у 58 – 26,0 %) – лише в одного з батьків.
У хворих на вугрову хворобу за даними анамнестичних та об’єктивних обстежень з боку органів шлунково-кишкового тракту встановлено симптоми, характерні для синдрому подразненого кишечника, що були виявлені у 176 (78,9 %) пацієнтів. Діагностика даного синдрому ґрунтувалася на т. з. «Римських критеріях…» (2006) з реєстрацією наступних кишкових симптомів: 1) абдомінальний біль (як основний симптом); 2) інші симптоми з боку шлунково-кишкового тракту (вздуття, відчуття урчання, метеоризм); 3) закрепи; 4) функціональна диспепсія інших відділів шлунково-кишкового тракту; 5) позакишкові (негастроентерологічні) симптоми (головний біль мігренеподібного характеру, відчуття комка при ковтанні; неможливість спати на лівому боці, порушення сну, стомленість, лабільність настрою та ін.), кожен з яких оцінювався в 1 умовний бал (у. б.). При цьому на наявність синдрому подразненого кишечника вказували 2 і більше у. б. (від 0 у. б. – відсутність жодних скарг, тобто відсутність клінічних проявів синдрому подразненого кишечника, до максимальних 5 у. б., тобто при наявності усіх перерахованих вище симптомів, відповідно) з обов’язковою присутністю абдомінального болю. Вищезазначені скарги спостерігалися не менше 3 днів на місяць протягом останніх 3 місяців.
Психологічні дослідження у хворих на вугрову хворобу дозволили виявити наявність у них дисморфофобії різного ступеня вираженості (у всіх 223 обстежених – 100 %), із переважанням відсотка хворих, у яких ступінь її проявів відповідав помірному (у 79,5 %), а також зміни психоемоційної сфери у вигляді депресивних станів, що були встановлені у 93,3 %, ступінь вираженості яких у 60,1 % пацієнтів відповідав помірному, у 23,3 % – незначному та у решти (9,9 %) – вираженому. При цьому спостерігався тісний взаємозв’язок вираженості змін психофізіологічного стану (у вигляді дисморфофобії та депресивних станів) хворих із тяжкістю проявів захворювання на шкірі, що обумовлено насамперед косметичним дефектом шкіри на відкритих її ділянках – обличчі (коефіцієнти кореляції між ступенем клінічних проявів вугрової хвороби та вираженістю дисморфофобії та депресивних станів складали, відповідно, r=0,778 і r=0,817). Встановлено також існування взаємозв’язків між тяжкістю патологічного процесу на шкірі та вираженістю клінічних проявів синдрому подразненого кишечника у хворих на вугрову хворобу (r=0,574), а також між ступенем вираженості клінічних проявів синдрому подразненого кишечника і проявами дисморфофобії (r=0,763). Отримані дані вказують на те, що хворі на вугрову хворобу мають підвищений ступінь психологічного реагування, яке обумовлено дефектами їх зовнішності (наявність на візуально доступних для оточуючих ділянках шкіри змін її морфології як незапального, так і запального характеру), що призводить до формування стану соціальної дезадаптації даної категорії пацієнтів та підтверджується результатами психологічного дослідження. Депресивні стани, у свою чергу, залежать як від ступеня вираженості дисморфофобії (r=0,748), так і значно посилюються при наявності змін функціонального характеру з боку шлунково-кишкового тракту, на що і вказують встановлені в них значимі коефіцієнти кореляції.
Вищезазначені дані клінічного і психологічного обстежень дозволяють констатувати наявність у хворих на вугрову хворобу існування патологічного кола дерматозу, яке взаємозалежно створюється, а у подальшому «замикається» такими складовими, як: кутанна (висипка на шкірі), соціальна (дисморфофобія) та соматична (зміни з боку шлунково-кишкового тракту – супутня патологія з боку органів травлення та функціональні порушення у вигляді синдрому подразненого кишечника). У результаті цього вищезазначені складові діють синергічно одна на одну, що у подальшому і призводить до пролонгації патологічного процесу та більш тяжкого перебігу дерматозу.
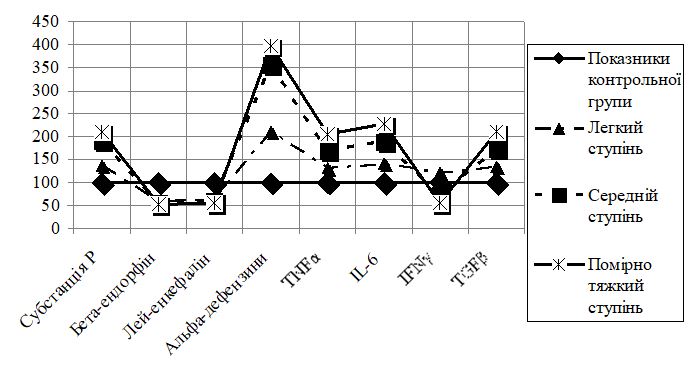
З урахуванням бактеріального компоненту запалення, що розвивається у шкірі хворих на вугрову хворобу і розглядається як один із важливих ланцюгів її патогенезу, та діагностованим синдромом подразненого кишечника, у 117 пацієнтів були проведені дослідження мікробіоти шкіри та порожнини товстого кишечника. Проведені дослідження дозволили встановити достовірні (р<0,05) зміни, порівняно з даними обстеження контрольної групи, як з боку мікробіоценозу шкіри, так і порожнини товстого кишечника, що характеризувалися кількісними та якісними їх зрушеннями. Дослідження мікробіоти шкіри у хворих на вугрову хворобу дозволили встановити достовірне (р<0,05) підвищення показника мікробного обсіменіння (104 – 107 КУО/см2 при показниках осіб контрольної групи не більше 103 КУО/см2). Серед висіяних із осередків ушкодження шкіри домінували представники Staphylococcus і Propionibacterium acnes (переважно у вигляді їх асоціацій – у 67,5 %). Середня кількість Propionibacterium acnes, що була виділена з осередків ушкодження у хворих на вугрову хворобу, достовірно (р<0,001) перевищувала показники осіб контрольної групи (відповідно, [17,9 ± 0,8] та [2,8 ± 0,5] КУО/см2). Окрім Staphylococcus aureus в осередках ураження шкіри висівалися також інші представники роду Staphylococcus, а саме – Staphylococcus epidermidis, середні значення кількості яких також достовірно (р<0,01) перевищували відповідні показники осіб контрольної групи ([34,4 ± 1,4] та [16,4 ± 0,9] КУО/см2, відповідно). При цьому кількість представників Staphylococcus saprophyticus була достовірно (р<0,001) нижчою ([2,5 ± 0,5] та [12,1 ± 0,7] КУО/см2, відповідно). Серед моноваріантів культур, що були висіяні у хворих на вугрову хворобу, переважали штами Staphylococcus aureus (у 11), Streptococcus pyogenes (у 10), Staphylococcus epidermidis (у 8), Propionibacterium acnes (у 6) та Corynebacterium minitissimum (у 3). Слід зазначити, що при середньому клінічному перебігу дерматозу монокультури були представлені Staphylococcus aureus, Streptococcus pyogenes, а при легкому – Staphylococcus epidermidis. Отже, при вугровій хворобі в осередках ушкодження шкіри на фоні надмірної колонізації Propionibacterium acnes створюються сприятливі умови для росту та розмноження Staphylococcus aureus та зростання кількості умовно-патогенних мікроорганізмів, які висівалися як в асоціаціях, так і у вигляді монокультур, що і проявляється піогенізацією полісебаційного комплексу. Такі осередки ушкодження шкіри стають джерелом неадекватної кількості патогенасоційованих молекул/патернів, виконуючи при цьому роль додаткових імунних стимулів-сигналів (т. з. генераторів) у ході запалення шкіри та її придатків. Ще одним таким осередком можуть виступати і органи кишкового тракту, про що також свідчать проведені дослідження мікробіоти порожнини товстого кишечника. Так, у хворих на вугрову хворобу встановлені кількісно-видові зміни проявляються на фоні достовірного (р<0,05) зниження облігатних представників порожнини товстого кишечника: бактерій роду Bifidobacterium ([6,09 ± 1,26] та [9,47 ± 0,56] Lg КУО/г, відповідно) і Lactobacillus ([4,99 ± 1,13] та [7,83 ± 0,38] Lg КУО/г, відповідно), збільшенням представників факультативної – умовно-патогенних кишкових бактерій сімейства Enterobacteriaceae роду: Enterobacter, Proteus, Citrobacter, Acinetobacter та ін. ([2,60 ± 1,03] та [0,97 ± 0,30] Lg КУО/г, відповідно) і грибів роду Candida ([2,38 ± 0,51] та [1,11 ± 0,32] Lg КУО/г, відповідно). Збільшення популяційного рівня умовно-патогенних кишкових бактерій та грибів роду Candida створює додаткове джерело патогенасоційованих молекул, що також спонукають до залучення в патологічний процес вже на загальноорганізменному рівні широкого спектру біологічно активних молекул, спрямованих на ліквідацію наявних змін. До таких молекул належать молекули пептидної природи, насамперед – нейропептиди, які продукуються не тільки в структурах центральної та периферичної нервових систем, але і в органах шлунково-кишкового тракту. Це перш за все ендогенні пептиди ендорфіни та енкефаліни, які реалізують свої функції через відповідні рецептори, беручи активну участь у процесах запалення різного ґенезу. Вони можуть слугувати маркерами не тільки ноцицепції та антиноцицепції, але й як індикатори та регулятори/модулятори психофізіологічного стану організму людини, особливо – за умов морфофункціональних зрушень, включаючи як кишечник, так і шкіру. Нейропептиди забезпечують регуляцію діяльності клітин різного походження – автокринну (власне самих цих клітин), паракринну (клітинного оточення) та на системному рівні. У зв’язку з цим, у хворих на вугрову хворобу було проведено імуноферментні дослідження вмісту в сироватці крові нейропептидів різного функціонального призначення (субстанції Р, бета-ендорфіну, лей-енкефаліну), альфа-дефензинів та цитокінів, що дозволили виявити достовірні їх зміни (рис. 1).
Рисунок 1 – Вміст у крові хворих на вугрову хворобу нейропептидів,
альфа-дефензинів та цитокінів (у відсотках; контрольна група – 100 %)
Згідно даних рис. 1 встановлено, що збільшення рівня вмісту у крові субстанції Р на фоні зниження бета-ендорфіну та лей-енкефаліну залежало від ступеня тяжкості клінічного перебігу вугрової хвороби. Так, рівень вмісту у крові субстанції Р у хворих на вугрову хворобу (у всіх обстежених) був достовірно (р<0,05) збільшеним у 1,79 раза порівняно з даними осіб контрольної групи, у той час як вміст у сироватці крові бета-ендорфіну та лей-енкефаліну був зниженим (у 1,81 та 1,69 раза; р<0,05). При цьому у хворих із легким клінічним перебігом вугрової хвороби рівні вмісту у крові субстанції Р були підвищеними у 1,35 раза ([5,89 ± 0,12] при [4,36 ± 0,06] нг/мл у контрольній групі), при середньому – у 1,91 ([8,32 ± 0,11] нг/мл), при помірно тяжкому – у 2,10 раза ([9,17 ± 0,14] нг/мл). Вміст у крові опіоїдних пептидів бета-ендорфіну та лей-енкефаліну був зниженим при легкому клінічному перебігу дерматозу – у 1,71 ([1,29 ± 0,07] при [2,20 ± 0,04] нг/мл у контрольній групі) та 1,55 раза ([3,68 ± 0,09] при [5,70 ± 0,07] нг/мл у контрольній групі), при середньому – у 1,80 ([1,22 ± 0,10] нг/мл) та 1,70 раза ([3,35 ± 0,11] нг/мл), при помірно тяжкому – у 1,95 ([1,13 ± 0,09] нг/мл) та 1,87 раза ([3,05 ± 0,12] нг/мл). При цьому субстанція Р виступає і в якості прозапального фактору і є індикатором змін психофізіологічного стану пацієнтів, про що свідчить встановлена взаємозалежність між різними ступенями вираженості дисморфофобії та рівнями у крові даного нейропептиду (r=0,984, r=0,651 та r=0,947) і депресивних станів (r=0,806, r=0,630). Між вмістом у крові опіоїдних пептидів (бета-ендорфіну, лей-енкефаліну) та ступенями вираженості дисморфофобії і депресивних станів встановлена залежність практично такої ж сили зв’язку, але зворотної спрямованості (відповідно, r=–0,984, r=–0,642, r=–0,934 і r=–0,810, r=–0,629 та r=–0,981, r=–0,647, r=–0,928 і r=–0,807, r=–0,630). Тобто, чим вираженіші ступені проявів змін з боку психофізіологічного стану пацієнтів, тим у більшій мірі знижується рівень ендогенних опіоїдних пептидів. Це вказує на важливе значення таких змін досліджених пептидних сигнальних молекул і дає підстави ствержувати, що субстанція Р при вугровій хворобі відіграє як роль «замикача» патологічного кола з боку морфофункціональних змін шкіри (зокрема – сально-волосяних фолікулів), так і посилювача/підтримувача психофізіологічних розладів з боку центральної нервової системи, що, у свою чергу, призводить до формування відносної недостатності лігандів опіоїдних рецепторів (бета-ендорфіну та лей-енкефаліну) і може впливати на формування досить тривалого та резистентного до традиційних методик лікування перебігу дерматозу.
Субстанція Р здатна також активувати/стимулювати синтез молекул т. з. першої лінії імунного захисту, спрямованих на ліквідацію мікробних факторів ушкодження, у тому числі й у шкірі, до яких належить один із найбільш еволюційно древніх класів – низькомолекулярні катіонні пептиди, зокрема – альфа-дефензини. Дослідження вмісту альфа-дефензинів у сироватці крові хворих на вугрову хворобу дозволили встановити достовірне зростання їх рівня (порівняно з даними осіб контрольної групи у 3,2 раза; р<0,001). При цьому найбільш виражене зростання вмісту у крові альфа-дефензинів (Me (QI; QIII) у пг/мл) спостерігалося у хворих із помірно тяжким перебігом вугрової хвороби, де їх середні значення були у 3,97 раза більшими 2002,0 (1956; 2022) за показники норми 510,0 (462; 548). При легкому та середньому клінічному перебігу дерматозу рівні вмісту у крові альфа-дефензинів були також достовірно вищими за показники осіб контрольної групи (р<0,01) і мали достовірну різницю порівняно з даними пацієнтів із помірно тяжким перебігом захворювання (1048,3 (1016; 1086) та 1783,0 (1714,0; 1871,5) відповідно; р<0,05). Аналіз даних дослідження вмісту альфа-дефензинів у нейтрофілах периферичної крові (методом проточної цитометрії) дозволив виявити дані протилежного спрямування – а саме достовірне їх зниження порівняно з даними обстеження осіб контрольної групи (Me (QI; QIII); в GM): 1260 (1067; 2035) та 930 (578,2; 1205,6). При цьому більш виражене їх зменшення також спостерігалося у хворих із помірно тяжким перебігом вугрової хвороби: при легкому перебігу 990 (680,4; 905,0), середньому – 922,4 (607,2; 1102,4) та помірно тяжкому – 900,5 (582,2; 1006,2); р<0,05. Те, що на фоні збільшеного вмісту в сироватці крові хворих на вугрову хворобу альфа-дефензинів відмічається їх зниження у нейтрофілах периферичної крові, може, з однієї сторони, вказувати/підтверджувати довготривалий перебіг дерматозу (роки) із частими загостреннями/рецидивами (що і виявлено при клінічному обстеженні хворих). З іншого боку це свідчить про те, що відбувається посилена дегрануляція нейтрофілів, наслідком чого є їх підвищений рівень у сироватці крові, який, до того ж, може бути обумовлений ще й додатковим джерелом їх надходження, тобто з осередку ушкодження (сально-волосяних фолікулів при гострозапальній формі акне). За умов тривалої персистенції та надмірної колонізації окремих біотопів (перш за все шкіри, кишечнику та ін.) умовно-патогенними та патогенними мікроорганізми, коли процес запалення не завершується одразу, а переходить у хронічну стадію, що має місце при вугровій хворобі, дефензини виступають в якості одних із перших т. з. комунікаторів переключення вродженої ланки імунної відповіді на адаптивну. У такому разі вони здійснюють не тільки протизапальний ефект, а проявляють одночасно ще й прозапальні властивості, за рахунок посиленої генерації кисневмісних метаболітів, які в свою чергу і є сигнальними молекулами-активаторами експресії генів т. з. прозапальних цитокінів, що підтверджується результатами імуноферментних досліджень цитокінового спектру сироватки крові хворих на вугрову хворобу. Так, у сироватці крові хворих на вугрову хворобу спостерігається підвищення вмісту TNFα, IL-6, TGFβ1 (по всьому обстеженому контингенту – у 1,68, 1,85, 1,72 раза, відповідно), причому найбільш виражені – при помірно тяжкому клінічному перебігу дерматозу (рис. 1). При цьому рівні вмісту у крові хворих на вугрову хворобу TNFα були достовірно вищими за показники осіб контрольної групи (р<0,05-0,01) і складали: при легкому перебігу дерматозу – (8,58 ± 0,50) пг/мл, середньому – (10,88 ± 0,93) пг/мл, помірно тяжкому – (13,33 ± 0,43) пг/мл (контрольна група – [6,50 ± 0,42] пг/мл). Практично така ж тенденція мала місце і стосовно сироваткових рівнів IL-6 та TGFβ1, що також були достовірно підвищеними порівняно з даними осіб контрольної групи (IL-6 – [3,65 ± 0,38] пг/мл, TGFβ1 – [6,90 ± 0,28] нг/мл) та відрізнялися залежно від тяжкості клінічного перебігу захворювання. Вміст IL-6 у сироватці крові хворих на вугрову хворобу з легким клінічним її перебігом складав (5,15 ± 0,41) пг/мл, середнім – (6,86 ± 0,52) пг/мл, помірно тяжким – (8,28 ± 0,57) пг/мл; TGFβ1 – (9,18 ± 0,32), (11,94 ± 0,74), (14,49 ± 0,80) пг/мл, відповідно (р<0,05-0,01).
Зміни вмісту IFNγ мали різноспрямований характер, залежно від ступеня тяжкості, достовірне підвищення (р<0,05) – при легкому ступені (1,22 раза – (28,13 ± 1,72) пг/мл при (23,06 ± 1,64) пг/мл у контрольній групі; р<0,05) і, навпаки – зниження при середньому та помірно тяжкому (у середньому – у 1,39 та у 1,81 раза: (16,59 ± 1,20) та (12,72 ± 1,10) пг/мл, відповідно; р<0,05); різниця досліджених показників при різній тяжкості клінічного перебігу захворювання також достовірна (р<0,05).
Таким чином, з урахуванням проведених досліджень, можна констатувати, що патогенез вугрової хвороби є достатньо складним, із залученням широкого спектру біологічно активних молекул, із яких до одного з головних молекулярних тригерів належить і нейропептид неопіоїдної природи субстанція Р. Вона здатна набувати та реалізувати свої багатовекторні біологічні впливи (перш за все – на нейрогенний компонент патогенезу даного дерматозу), бере участь практично на всіх рівнях перебігу захворювання. А саме: у процесах ініціації (виникнення/загострення дерматозу), підтримки (хронічний перебіг), посилення та кумуляції як локальних (висипка), так і загальноорганізменних (дисморфофобії, депресивні стани) рівнях. Отже, у патогенезі вугрової хвороби при папулопустульозній (гострозапальній) формі її клінічного перебігу однією із провідних ланок патофізіологічних змін, які розвиваються в т. з. себорейних ділянках шкіри, є нейроімунна. З урахуванням того, що шкіра є одним із найбільших органів єдиної нейроімуноендокринної регулюючої системи, завдяки тісним взаємозалежним взаєморегуляторним т. з. сітковим комунікаціям, процес запалення регулюється відповідними молекулами-модуляторами (нейропептидами, цитокінами, факторами росту, дефензинами та ін.), що і стримує/обмежує каскадність реакцій локального характеру (тобто – в сально-волосяних фолікулах), не дозволяючи йому виходити на системний рівень, незважаючи на довготривалий його перебіг. Про це свідчать отримані дані наявного дисбалансу в таких пацієнтів молекул пептидної природи та встановлені взаємозв’язки як між цими дослідженими маркерами, так і їх значимий взаємозв’язок із ступенем вираженості клінічних проявів дерматозу. Це диктує необхідність врахування при призначенні комплексу лікувальних та профілактичних заходів хворим на вугрову хворобу таких, які б здійснювали модулюючий вплив на наявний дисбаланс досліджених нейропептидів (субстанції Р, бета-ендорфіну, лей-енкефаліну), альфа-дефензинів та цитокінів, що і стало підґрунтям до розробки і впровадження нового методу лікування із послідовним використанням пептидомодулюючої (синтетичного аналогу лей-енкефаліну, гексапептиду – Даларгіну) терапії та топічного застосування фітоантимікробного препарату рослинного походження Сангвірітрину – на початковому етапі терапії із подальшим використанням базисного лікування разом із Сангвірітрином. Даний фітопрепарат, на відміну від синтетичних антимікробних засобів, проявляє бактеріостатичну дію на широкий спектр мікроорганізмів осередку запалення, у тому числі – на антибіотикорезистентні їх штами. Обґрунтуванням до включення в систему комплексу терапевтичних заходів Даларгіну стали отримані дані проведеного імуноферментного дослідження вмісту у сироватці крові хворих на вугрову хворобу, а саме – достовірне зниження нейропептидів опіоїдної природи (бета-ендорфіну та лей-енкефаліну), а також тією обставиною, що Даларгін належить до лікарських засобів метаболічної дії. Він, як природна для організму сполука, добре переноситься хворими, не здійснює негативного і побічного впливу, маючи при цьому широкий спектр біологічної дії, серед яких надважливими є такі, як стрес-лімітуючий, адаптогенний, антиоксидантний і імунотропний його ефекти та здатність активувати процеси репарації в низці тканин (у тому числі – у шкірі), що з урахуванням особливостей патофізіологічних змін при даному дерматозі є доцільним та патогенетично обґрунтованим.
З метою оцінки ефективності запропонованої методики лікування хворих на вугрову хворобу всі пацієнти були розподілені на чотири терапевтичні групи. Хворі першої групи (n=41) отримували лікування за стандартною методикою (згідно Наказу МОЗ України № 312 від 08.05.2009 р. «Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматологічні захворювання»). Хворі другої групи (n=38) на початковому етапі лікування отримували пептидомодулюючу терапію шляхом призначення синтетичного аналогу лей-енкефаліну Даларгіну (внутрішньом’язово вранці по 1 мл 1 раз на добу, курс лікування становив: при легкому клінічному перебігу дерматозу – 1 тиждень; середньому – 2 тижні, помірно тяжкому – 3 тижні) з наступним призначенням базисної терапії. Хворі третьої групи (n=65) додатково до традиційного лікування отримували фітоантимікробну терапію шляхом призначення Сангвірітрину (місцево у вигляді змащувань осередків ушкодження шкіри – до регресу елементів акне). Хворі четвертої (основної) групи (n=79) на початковому етапі отримували пептидомодулюючу (Даларгін – за методикою, як і в другій групі) і фітоантимікробну терапію (Сангвірітрин – за методикою, як і в третій групі), а після завершення курсу пептидомодулюючої (Даларгін) терапії переходили на використання базисної терапії із продовженням місцевого використання Сангвірітрину.
Результати ефективності оцінювалися традиційним методом за динамікою клінічних та лабораторних досліджень у найближчому та віддіалених періодах спостереження за хворими. Так, оцінюючи клінічну ефективність комплексної методики лікування з послідовним використанням пептидомодулюючої (Даларгін) та фітоантимікробної (Сангвірітрин) терапії вже на четвертому тижні спостерігався найбільш виражений регрес елементів висипки на шкірі у пацієнтів даної групи порівняно з хворими, що отримували лише стандартну терапію (перша група), або Даларгін (друга група) та Сангвірітрин (третя група) окремо. У хворих четвертої (основної) групи із середнім клінічним перебігом дерматозу на четвертому тижні лікування кількість пустул зменшувалась на 52,8 %, у той час як у хворих першої групи кількість пустульозної висипки зменшувалася на 40,5 %. Найбільш виражена динаміка спостерігалася на восьмому тижні лікування, коли у хворих із призначенням комплексного лікування з використанням Даларгіну та Сангвірітрину практично вдалося досягти повного регресу даних елементів акне (зменшення їх кількості порівняно з даними до початку терапії на 94,3 %), у той час як у хворих першої групи (лікування за стандартною методикою) їх кількість зменшилася лише на 67,5 % (р<0,05). Практично така ж тенденція спостерігалася і відносно папульозних елементів акне, при цьому значний регрес їх у хворих четвертої групи спостерігався вже на четвертому тижні лікування (зменшення їх кількості порівняно з даними до початку терапії – на 55,2 %), а практично повного регресу вдалося досягти також на восьмому тижні терапії (поодинокі елементи, кількість яких порівняно з початковими даними зменшилася на 91,7 %). У той же час у пацієнтів першої групи кількість папул на четвертому тижні лікування зменшилася лише на 39 %, і лише на восьмому – на 74,3 % (р<0,05). Нодулярні елементи у хворих обох груп регресували протягом усього періоду лікування, і найбільш виражений їх регрес спостерігався на восьмому тижні терапії, при цьому у хворих четвертої групи їх кількість зменшилася на 70,4 %, у пацієнтів першої – на 57,6 % (р<0,05). При помірно тяжкому клінічному перебігу вугрової хвороби динаміка висипки на шкірі відбувалася дещо повільніше. Так, у хворих на вугрову хворобу четвертої групи з помірно тяжким клінічним її перебігом на четвертому тижні кількість пустул зменшилася на 51,9 %, папул – на 51,2 %, на восьмому – на 81,5 % та 73,3 %, відповідно.
Добрі клінічні результати спостерігалися також у хворих другої групи і свідчать про достовірно (р<0,05) більш виражену динаміку елементів висипки порівняно з пацієнтами першої групи. При цьому, на фоні практично однакової тенденції щодо етапності регресу висипки, більш швидше відбувалася інволюція пустульозної висипки у хворих другої групи (порівняно з пацієнтами першої групи), кількість яких при легкому клінічному перебігу дерматозу вже на четвертому тижні зменшилася на 54,1 %, при середньому – на 51,0 %, при помірно тяжкому – на 40,8 %; папульозної – на 40,1 %, 52,6 % і 39,8 %; глибоких акне – на 70,0 %, 68,4 % і 37,9 % (у пацієнтів із легким, середнім і помірно тяжким клінічним перебігом, відповідно). У хворих першої групи на четвертому тижні елементи висипки регресували повільніше, при цьому кількість пустул у хворих із легким клінічним перебігом дерматозу зменшувалася на 43,8 %, із середнім – на 40,5 %, помірно тяжким – на 29,6 %, папул – на 30,6 %, 39,0 % і 29,1 %; глибоких акне – на 11,5 % і 9,1 %, що достовірно (р<0,05) відрізнялося від результатів відповідних показників у пацієнтів другої групи. Це свідчить про достеменно кращий ефект комплексу терапевтичних заходів, які отримували пацієнти другої групи, що ще в більшій мірі простежувалося на восьмому тижні лікування. Дещо більш швидкий регрес елементів гострозапальної висипки спостерігався і у хворих третьої групи, порівняно з хворими першої групи. Так, на четвертому тижні лікування кількість пустул у хворих із легким перебігом дерматозу (відносно до їх кількості до початку терапії) зменшувалася на 48,7 %, папул – на 34,2 %, із середнім клінічним перебігом, відповідно – на 40,8 % та 45,7 %. При цьому не дивлячись на дещо більш швидкий регрес морфологічних змін шкіри у пацієнтів третьої групи, достовірної різниці на четвертому тижні спостереження порівняно з пацієнтами першої все ж не спостерігалося. Практично така ж тенденція відмічалась і на восьмому тижні лікування (р>0,05). У той же час, різниця між кількісними показниками динаміки елементів висипки як на четвертому, так і на восьмому тижнях спостереження, була достовірною між результатами другої та третьої і четвертої, третьої та другої і четвертої, третьої та четвертої груп (р<0,05), що свідчить про достеменно більш високу ефективність лікування хворих на вугрову хворобу із призначенням комплексної терапії з використанням пептидомодулюючої (Даларгін), і особливо – в її поєднанні із фітоантимікробною терапією (Сангвірітрин).
Таким чином, після проведення терапії найбільш добрі клінічні результати, а саме регрес гострозапальної висипки на шкірі, спостерігалися у хворих четвертої терапевтичної групи (комплексне лікування з послідовним призначенням Даларгіну та Сангвірітрину), знижуючи у середньому кількість пустульозних елементів (порівняно з показниками до лікування) на 94,3 % при середньому клінічному перебігу дерматозу та на 81,5 % – при помірно тяжкому; папульозних – на 91,7 % при середньому та 73,3 % – при помірно тяжкому та глибоких акне – на 70,4 % і 83,1 %, відповідно. Одночасно спостерігалося і значне покращення з боку психофізіологічного стану хворих, що за даними психологічного дослідження свідчить про відсутність та/або зменшення вираженості ступеня проявів депресивних станів у даної категорії пацієнтів. Так, у хворих четвертої (основної) групи середній бал ступеня вираженості депресивних станів знижувався із (2,07 ± 0,6) до (1,01 ± 0,7) у. б., при цьому відсутність депресивних станів констатовано у 24,1 % пацієнтів, зниження ступеня вираженості їх проявів – у 72,2 %), у той час як у хворих першої групи він знижувався із (2,03 ± 0,6) до (1,65 ± 0,7) у. б. (при цьому відсутність депресивних станів констатовано у 10,5 % пацієнтів, зниження ступеня вираженості їх проявів – у 26,3 %) – р<0,01. Добрий позитивний ефект на стан психоемоційної сфери хворих на вугрову хворобу спостерігався і у пацієнтів другої групи, де відсутність депресивних станів констатовано у 28,6 % пацієнтів, зниження ступеня вираженості їх проявів – у 40,0 %, що також достовірно (р<0,05) відрізнявся від результатів у пацієнтів першої групи. Менш виражений позитивний ефект спостерігався у хворих третьої групи, де відсутність депресивних станів констатовано у 16,1 %, а зниження ступеня їх вираженості – у 32,1 % (р<0,05).
У результаті проведеного лікування найбільш добрі найближчі його наслідки спостерігалися у хворих четвертої (основної) групи, що забезпечило досягнення клінічного одужання (клінічної ремісії) та значного поліпшення у 94,9 % пацієнтів (при 58,5 % у групі порівняння, яка отримувала лікування за стандартною методикою) – рис. 2.
Рисунок 2 – Найближчі клінічні результати лікування у хворих на вугрову хворобу різних терапевтичних груп
Ефективність запропонованої методики лікування підтверджується і результатами контрольних лабораторних мікробіологічних та імуноферментних досліджень. Так, практично повне відновлення мікробного консорціума шкіри спостерігалося у хворих четвертої (основної) групи. Загалом у всіх групах спостерігалося збільшення висівання мікроорганізмів у вигляді їх асоціацій зі зменшення частоти виділення штамів Propionibacterium acnes (у першій групі даний представник мікробіоти верифікувався на 50,0 % рідше, ніж до початку терапії, у хворих другої, третьої та четвертої груп – на 73,0 %, 60,0 % та 75,0 %, відповідно) з одночасним зменшенням їх кількісних значень. На фоні цього, також констатовано зниження кількості виділених штамів Staphylococcus aureus, який найчастіше висівався у хворих першої групи. При цьому кількість його штамів була найнижчою у хворих четвертої групи (порівняно з даними до початку терапії кількість штамів знижувалася на 68,7 %), у той час як у хворих другої та третьої груп кількість штамів зменшувалася, відповідно на 65,5 % та 58,3 % (проти 44,4 % – у першій; р<0,05) із одночасним зниженням його кількості в осередках ураження шкіри. Це свідчить про суттєве зростання показника колонізаційної резистентності, на що вказує також збільшення популяційного рівня представників резидентної мікробіоти шкіри (Staphylococcus epidermidis, Staphylococcus saprophyticus та Corynebacterium minutissimum).
Така спрямованість прослідковувалась і у відношенні мікробіоценозу порожнини товстого кишечника. Практичне відновлення до фізіологічних параметрів як кількісного так і видового складу спостерігалося у хворих четвертої групи, що на тлі зростання популяційного рівня бактерій роду Bifidobacterium та Lactobacillus характеризувалося зниженням до фізіологічних значень кількості факультативних умовно-патогенних кишкових бактерій сімейства Enterobacteriaceae та грибів роду Candida. У хворих першої групи повне відновлення мікробіоти порожнини товстого кишечника спостерігалося лише при легкому клінічному перебігу вугрової хвороби, у той час як у пацієнтів із середнім клінічним перебігом захворювання, хоча й спостерігалася тенденція до нормалізації, однак рівні облігатних анаеробних бактерій роду Bifidobacterium та Lactobacillus залишалися достовірно (р<0,05) зниженими. У другій групі позитивна динаміка мікробіоти порожнини товстого кишечника була більш вираженою у хворих із середнім клінічним перебігом вугрової хвороби з достовірним зростанням кількісних значень анаеробних бактерій роду Bifidobacterium та Lactobacillus і аеробів роду Escherichia (Escherichia colі з нормальною ферментативною активністю) та повним відновленням бактерій роду Enterococcus із одночасною нормалізацією умовно-патогенних кишкових бактерій сімейства Enterobacteriaceae і практично незмінними кількісними показниками грибів роду Candida. При помірно тяжкому клінічному перебігу вугрової хвороби даної (другої) терапевтичної групи вищезазначені (достовірно змінені до лікування) показники мікробіоти порожнини товстого кишечника хоча й мали достовірно виражену тенденцію до відновлення, але все ж не досягали значень осіб контрольної групи. У хворих на вугрову хворобу з легким ступенем її клінічного перебігу дещо змінені до початку терапії кількісні показники основних представників мікробіоти порожнини товстого кишечника після проведеного лікування відновлювалися повністю як у першій, так і у другій та третій групах. У хворих третьої групи із середнім клінічним перебігом вугрової хвороби достовірна (р<0,05) позитивна динаміка змін мікробіоти порожнини товстого кишечника спостерігалася відносно всіх її представників, але фізіологічних значень при цьому досягали лише облігатні аероби роду Enterococcus. У хворих із помірно тяжким клінічним перебігом вугрової хвороби другої та четвертої груп спостерігалася виражена тенденція до нормалізації змінених до початку терапії кількісно-видових параметрів мікробіоти порожнини товстого кишечника (достовірна різниця між динамікою у цих двох групах спостерігалася відносно зростання рівня бактерій роду Lactobacillus та Escherichia та відновленням облігатних аеробів роду Enterococcus у пацієнтів обох терапевтичних груп (як другої, так і четвертої). Факультативні мікроорганізми (кишкові бактерії сімейства Enterobacteriaceae і гриби роду Candida) при цьому повністю нормалізувалися також у хворих четвертої групи та максимально наближалися до норми – другої групи. Це дає підстави констатувати практичне відновлення кишкової колонізаційної резистентності при комплексному лікуванні з послідовним використанням пептидомодулюючої (Даларгін) та фітоантимікробної (Сангвірітрин) терапії (четверта група), нейтралізуючи додаткове джерело патогенасоційованих молекул, що обтяжують клінічний перебіг даного дерматозу.
Нормалізація зрушень екто- (шкіра) та ендосимбіотичних (кишечник) консорціумів тісно пов’язана із вмістом у крові досліджених антимікробних пептидів, рівень яких (Me (QI; QIII); в пг/мл) після проведеної терапії з використанням різних методів знижувався до фізіологічних значень (510,0 [462; 548]) лише у пацієнтів четвертої групи (при середньому клінічному перебігу – з 1776,1 (1712,2; 1877,8) до 532,1 (497,2; 598,4), помірно тяжкому – з 2010,5 (1948,4; 2016,9) до 568,2 [502,1; 698,5]). У той же час, не дивлячись на виражену тенденцію до нормалізації у пацієнтів другої групи вони залишалися підвищеними (при легкому перебігу до лікування вони становили 1056,0 (1017,2; 1074,6) та після – 519,2 (497,5; 592,1); середньому: 1790,4 (1715,3; 1869,5) та 530,4 (504,8; 675,2); помірно тяжкому: 2003,0 (1958,1; 2030,4) та 708,6 (698,1; 975,3), відповідно). Така динаміка спостерігалася і у хворих першої (зниження від 1038,6 пг/мл (1011,5; 1085,1) до 1029,1 пг/мл (1003,2; 1070,8); від 1776,2 пг/мл (1705,0; 1892,4) до 1762,5 пг/мл (1698,7; 1862,2); від 2002,0 пг/мл (1940,3; 2028,5) до 1869,0 (1820,2; 1898,4), відповідно) та третьої груп (від 1050,3 (1014,6; 1080,2) до 931,5 (912,1; 1034,3) та від 1789,3 (1710,4; 1890,5) до 1722,1 (1700,8; 1805,2) при легкому та середньому клінічному перебігу дерматозу, відповідно). Тобто, вміст альфа-дефензинів у пацієнтів цих груп знижувався незначно, що достовірно відрізнялося від динаміки їх вмісту у крові хворих другої та четвертої груп.
На найбільш виражені позитивні результати пацієнтів четвертої групи із призначенням комплексного лікування з послідовним використанням пептидомодулюючої (Даларгін) та фітоантимікробної терапії (Сангвірітрин) вказували також контрольні дослідження рівнів вмісту у крові нейропептидів. А саме – зниження до фізіологічних значень ([4,36 ± 0,06] нг/мл) достовірно підвищеного вмісту в сироватці крові хворих субстанції Р (до лікування при середньому та помірно тяжкому клінічному перебігу дерматозу – (8,33 ± 0,11) та (9,14 ± 0,15) нг/мл, після лікування – (4,40 ± 0,10) та (4,59 ± 0,12) нг/мл, відповідно) з одночасним зростанням знижених до лікування рівнів вмісту у крові нейропептидів опіоїдної природи – бета-ендорфіну та лей-енкефаліну. При цьому показники вмісту у крові бета-ендорфіну до лікування при середньому та помірно тяжкому клінічному перебігу дерматозу були (1,21 ± 0,11) та (1,12 ± 0,08) нг/мл, після проведення терапії – (2,21 ± 0,05) та (2,08 ± 0,11) нг/мл, відповідно (норма – (2,20 ± 0,04) нг/мл); лей-енкефаліну до лікування – (3,34 ± 0,12) та (3,03 ± 0,12) нг/мл, після лікування – (5,72 ± 0,09) та (5,60 ± 0,08) нг/мл, відповідно (норма – (5,70 ± 0,07) нг/мл).
Практично така ж тенденція спостерігалась і у хворих другої групи, що також характеризувалося вираженою позитивною динамікою – відновленням до показників осіб контрольної групи у хворих із легким клінічним перебігом захворювання. При цьому рівні вмісту у крові субстанції Р знижувалися з (5,86 ± 0,10) до (4,47 ± 0,10) нг/мл; бета-ендорфіну та лей-енкефаліну – зростали від (1,28 ± 0,06) до (2,18 ± 0,07) нг/мл та від (3,67 ± 0,09) до (5,68 ± 0,10) нг/мл, відповідно. У пацієнтів із середнім та помірно тяжким клінічним перебігом дерматозу спостерігалася виражена тенденція до нормалізації: зниження вмісту у крові субстанції Р з (8,32 ± 0,11) до (5,05 ± 0,12) нг/мл та з (9,21 ± 0,11) до (5,23 ± 0,11) нг/мл, відповідно; зростання бета-ендорфіну, відповідно: від (1,22 ± 0,10) до (2,16 ± 0,10) нг/мл та від (1,15 ± 0,09) до (2,01 ± 0,07) нг/мл і зростання лей-енкефаліну: від (3,33 ± 0,11) до (5,64 ± 0,10) нг/мл та від (3,09 ± 0,13) до (5,43 ± 0,11) нг/мл, відповідно.
Рівні вмісту у крові досліджених нейропептидів залишалися достовірно зміненими у хворих першої та третьої груп. Так, до лікування вміст у крові субстанції Р пацієнтів із легким клінічним перебігом дерматозу першої групи знижувався з (5,90 ± 0,13) до (5,49 ± 0,15) нг/мл, третьої групи – з (5,89 ± 0,12) до (5,42 ± 0,10) нг/мл. Середні показники бета-ендорфіну та лей-енкефаліну зростали у пацієнтів першої групи від (1,28 ± 0,07) до (1,34 ± 0,08) нг/мл та від (3,66 ± 0,09) до (3,88 ± 0,12) нг/мл, третьої групи – від (1,29 ± 0,07) до (1,40 ± 0,06) нг/мл та від (3,68 ± 0,08) до (3,97 ± 0,09) нг/мл, відповідно. При середньому клінічному перебігу дерматозу рівень вмісту у крові субстанції Р у пацієнтів першої групи знижувався з (8,31 ± 0,11) до (7,99 ± 0,14) нг/мл, третьої – з (8,30 ± 0,10) до (7,61 ± 0,11) нг/мл. Рівні бета-ендорфіну та лей-енкефаліну зростали від (1,24 ± 0,09) до (1,28 ± 0,10) нг/мл та від (3,36 ± 0,11) до (3,47 ± 0,12) нг/мл у пацієнтів першої групи і від (1,22 ± 0,10) до (1,30 ± 0,06) нг/мл та від (3,36 ± 0,10) до (3,58 ± 0,12) нг/мл – третьої. У пацієнтів із помірно тяжким клінічним перебігом захворювання відповідні показники змінювалися: субстанція Р – з (9,25 ± 0,12) до (8,05 ± 0,13) нг/мл, бета-ендорфін – від (1,13 ± 0,079) до (1,34 ± 0,11) нг/мл, лей-екефалін – від (3,06 ± 0,09) до (3,28 ± 0,11) нг/мл (р<0,05). Це свідчить про пептидомодулюючий вплив включеного в систему комплексного лікування синтетичного аналогу лей-енкефаліну – гексапептиду, природного метаболіту Даларгіну. Такий ефект обумовлений реалізацією політаргетного впливу на організм людини Даларгіну, який здатен компенсувати ендогенну відносну недостатність опіатного пептиду лей-енкефаліну, однією з головних функцій якого є стрес-лімітуюча.
Динаміка вмісту у крові пептидних цитокінових регуляторних молекул також була різною у пацієнтів залежно від методики проведеного їм лікування та тяжкості клінічного перебігу вугрової хвороби. При цьому у хворих першої групи рівні вмісту в сироватці крові досліджених сполук змінювалися незначно, і як і у хворих третьої групи, залишалися достовірно зміненими. Так, вміст у крові прозапальних цитокінів TNFα та IL-6 у хворих на вугрову хворобу після проведеної терапії з використанням стандартного лікування пацієнтів першої групи змінювався незначно як при легкому (TNFα: від (8,62 ± 0,60) до (8,20 ± 0,66) пг/мл; IL-6: від (5,20 ± 0,42) до (4,86 ± 0,61) пг/мл), так і при середньому (TNFα: від (10,91 ± 1,00) до (10,40 ± 1,05) пг/мл; IL-6: від (6,77 ± 0,53) до (6,44 ± 0,60) пг/мл) та помірно тяжкому клінічному перебігу дерматозу (TNFα: від (13,35 ± 0,41) до (12,97 ± 0,54) пг/мл; IL-6: від (8,29 ± 0,46) до (7,95 ± 0,52) пг/мл), залишаючись достовірно підвищеними порівняно з даними осіб контрольної групи (TNFα – (6,50 ± 0,42) пг/мл; IL-6 – (3,65 ± 0,38) пг/мл).
Практично така ж динаміка спостерігалася і у пацієнтів третьої групи, незважаючи на дещо вираженіше зниження достовірно підвищених до лікування показників вмісту у сироватці крові TNFα та IL-6. У пацієнтів із легким клінічним перебігом їх рівні у крові знижувалися з (8,60 ± 0,54) до (8,12 ± 0,65) пг/мл та з (5,20 ± 0,41) до (4,78 ± 0,45) пг/мл; із середнім – з (10,79 ± 0,96) до (10,25 ± 1,01) пг/мл та з (6,74 ± 0,52) до (6,28 ± 0,61) пг/мл, відповідно (р>0,05). У пацієнтів другої та четвертої груп із середнім клінічним перебігом захворювання рівні вмісту у крові досліджених умовно прозапальних цитокінів нормалізувалися (TNFα: (6,99 ± 0,60) та (6,81 ± 0,40) пг/мл і IL-6: (4,05 ± 0,50) та (3,71 ± 0,30) пг/мл, відповідно). Максимальне наближення до показників осіб контрольної групи спостерігалося у хворих на вугрову хворобу другої групи з помірно тяжким клінічним перебігом (TNFα – (7,34 ± 0,73) пг/мл, IL-6 – (4,20 ± 0,43) пг/мл), а практичної нормалізації вони досягали у пацієнтів четвертої (основної) групи (TNFα – (7,22 ± 0,56) пг/мл, IL-6 – (4,17 ± 0,35) пг/мл).
Така динаміка була характерною і стосовно вмісту в сироватці крові TGFβ1, найбільш виражене зниження якого спостерігалося у пацієнтів другої групи з (9,16 ± 0,36) до (7,20 ± 0,45) нг/мл при легкому клінічному перебігу дерматозу; з (12,05 ± 0,76) до (7,92 ± 0,82) нг/мл та з (14,56 ± 0,88) до (8,04 ± 0,91) нг/мл – при середньому та помірно тяжкому, відповідно). Нормалізація вмісту у крові TGFβ1 спостерігалася у пацієнтів четвертої (основної) групи: зниження з (11,97 ± 0,67) до (7,15 ± 0,30) нг/мл при середньому клінічному перебігу дерматозу та з (14,45 ± 0,81) до (7,66 ± 0,61) нг/мл – при помірно тяжкому. У пацієнтів першої та третьої груп, незважаючи на деяке зниження, показники вмісту TGFβ1 у сироватці крові залишалися достовірно збільшеними порівняно з даними осіб контрольної групи. Рівні вмісту у крові TGFβ1 у пацієнтів першої групи з легким клінічним перебігом захворювання знижувалися з (9,24 ± 0,29) до (8,96 ± 0,34) нг/мл, третьої – з (9,15 ± 0,35) до (8,70 ± 0,64) нг/мл; із середнім – з (11,84 ± 0,81) до (11,49 ± 0,92) нг/мл першої групи і з (11,82 ± 0,78) до (11,19 ± 0,85) нг/мл – третьої та з (14,28 ± 0,78) до (13,52 ± 0,68) нг/мл у пацієнтів першої групи з помірно тяжким клінічним перебігом дерматозу (контрольна група – (6,90 ± 0,28) нг/мл).
Вміст IFNγ у сироватці крові хворих на вугрову хворобу з легким її клінічним перебігом першої групи, який до початку терапії був дещо підвищеним ([28,20 ± 1,61] пг/мл), відновлювався до показників осіб контрольної групи ([24,45 ± 1,10] пг/мл). У той же час, у пацієнтів із середнім та помірно тяжким клінічним перебігом дерматозу рівні IFNγ до початку терапії були навпаки зниженими ([16,52 ± 1,28] та [12,74 ± 1,05] пг/мл, відповідно), після проведеного стандартного лікування зростали незначно (до (17,84 ± 1,45) та (15,37 ± 1,28) пг/мл, відповідно), залишаючись достовірно зниженими порівняно з показниками осіб контрольної групи ([23,06 ± 1,64] пг/мл) і не мали достовірної динаміки. Більш добрі результати спостерігались у хворих другої групи. При цьому повне відновлення фізіологічного балансу вмісту у крові IFNγ відмічалося у хворих із легким (зниження до показників норми: з (28,04 ± 1,83) до (23,94 ± 1,20) пг/мл) та середнім клінічним перебігом вугрової хвороби (зростання рівня у крові IFNγ до показників норми – від (16,62 ± 1,21) до (21,95 ± 1,45) пг/мл). У хворих даної (другої) терапевтичної групи з помірно тяжким клінічним перебігом дерматозу знижені до лікування показники вмісту у крові IFNγ достовірно зростали, максимально наближаючись до значень осіб контрольної групи (від (12,60 ± 1,20) до (20,80 ± 1,63) пг/мл). Нормалізація ж вмісту у крові IFNγ спостерігалася майже в усіх пацієнтів після проведеного лікування з послідовним призначенням пептидомодулюючої (синтетичного аналогу лей-енкефаліну Даларгіну) та фітоантимікробної терапії (засобу рослинного походження Сангвірітрину) – четверта група. Так, вміст у крові IFNγ пацієнтів із середнім клінічним перебігом дерматозу до лікування був зниженим до (16,54 ± 1,21) пг/мл, після лікування він відновлювався – (23,51 ± 1,45) пг/мл; при помірно тяжкому – зростав з (12,80 ± 1,11) до (21,59 ± 1,63) пг/мл). У пацієнтів третьої групи вираженої динаміки змінених до лікування рівнів вмісту у крові IFNγ не спостерігалося, тобто відмічалася дещо краща, але практично така ж закономірність як і у пацієнтів першої групи. При цьому достовірних змін вмісту у крові (при порівнянні показників до та після лікування) у цих групах у хворих із середнім клінічним перебігом вугрової хвороби не спостерігалося. Відповідні показники IFNγ у пацієнтів третьої групи становили до лікування (16,71 ± 1,16) пг/мл, після – (18,05 ± 1,20) пг/мл, а при легкому клінічному перебігу дерматозу у пацієнтів третьої групи (як і першої) дещо підвищені до лікування показники вмісту у крові IFNγ (до (28,15 ± 2,01) пг/мл) нормалізувалися – (24,45 ± 1,10) пг/мл.
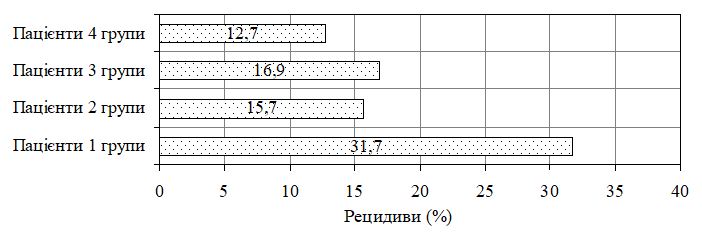
Віддалені результати лікування (що оцінювалися через півроку, рік та півтора року після його завершення) також були різними і залежали від комплексу проведених терапевтичних заходів. Так, у хворих на вугрову хворобу з легким клінічним перебігом дерматозу найчастіше рецидиви спостерігались у пацієнтів першої та третьої груп (у 10,0 % та у 9,1 % через півроку, відповідно), у той час як у пацієнтів другої групи з легким перебігом рецидивів захворювання за цей час не спостерігалося. Через рік у даної категорії пацієнтів рецидиви реєструвалися у 20,0 % першої, у 11,1 % – другої та у 13,6 % – третьої груп; така ж тенденція спостерігалася і в подальшому – через півтора року.
У пацієнтів із середнім клінічним перебігом дерматозу після проведеної терапії рецидиви через півроку в найменшій мірі виникали у хворих четвертої (у 7,2 %) та другої (у 8,3 %) груп, дещо частіше – у третій та першій (у 11,6 % та у 13,0 %, відповідно). Ще через півроку (тобто, через рік) – вдвічі частіше у пацієнтів першої та другої, у 1,8 раза частіше – третьої та у 1,4 раза – четвертої зі збереженням практично такої ж частоти їх виникнення ще через півроку (тобто, через півтора року).
Дещо частіше рецидиви виникали у хворих із помірно тяжким клінічним перебігом вугрової хвороби другої групи (порівняно з пацієнтами даного клінічного перебігу четвертої групи). При цьому через півроку рецидиви відмічалися у 20,0 % другої та 10,0 % – четвертої груп; ще через півроку частота рецидивів збільшилася вдвічі у другій та четвертій групах, практично з таким же збереженням частоти рецидивів і в подальшому (тобто, через півтора роки). До того ж, у хворих основної (четвертої) групи, у яких спостерігалися рецидиви захворювання, у жодному випадку не відмічалося переходу дерматозу в більш тяжкий ступінь, тоді як у 24,4 % хворих першої спостерігався більш тяжкий її перебіг (із розвитком тяжкої нодулярної та нодулярно-кистозної форм дерматозу). Частоту виникнення рецидивів у хворих на вугрову хворобу у віддаленому періоді спостереження (через півтора роки) наведено на рис. 3.
Рисунок 3 – Віддалені клінічні результати лікування у хворих на вугрову хворобу різних терапевтичних груп
Така різновекторність впливу розробленої методики комплексного лікування хворих на вугрову хворобу обумовлена здатністю до відновлення змінених показників мікробних біотопів (шкіри і порожнини товстого кишечника), фізіологічного балансу основних комунікаторів нейроімуноендокринних молекулярних/клітинних взаємодій і показників інтегральної вродженої (альфа-дефензинів) та адаптивної (цитокінів) ланок імунної відповіді. Це дозволяє нормалізувати стан психоемоційної сфери пацієнтів та відновлювати морфофункціональні параметри шкіри (регрес елементів акне). Отже, дана методика забезпечує добрі не тільки найближчі, але й віддалені результати лікування, що проявляється одужанням пацієнтів і скороченням кількості рецидивів (порівняно зі стандартною терапією) у 2,5 раза (р<0,05 – 0,01). Отримані результати свідчать про патогенетичну обґрунтованість та високу ефективність розробленого комплексного методу лікування хворих на вугрову хворобу, що полягає у послідовному призначенні синтетичного аналогу лей-енкефаліну – гексапептиду (тирозин-2-аланіл-гліцин-фенілаланіл-лейцин-аргініну діацетат – Даларгін) та фітоантимікробного засобу (суміші бісульфатів сангвінарину та холеритрину з рослин родини макових – Сангвірітрин) – на початкових етапах із наступною базисною терапією разом із Сангвірітрином, що дозволяє рекомендувати його до активного впровадження у практичну діяльність лікарів відповідного профілю.
ВИСНОВКИ
У дисертаційній роботі наведено теоретичне узагальнення та нове вирішення актуальної проблеми сучасної дерматовенерології, що полягає у підвищенні ефективності лікування хворих на вугрову хворобу шляхом удосконалення комплексної патогенетичної терапії на підставі вивчення клінічних проявів та показників нейроімунних механізмів гомеокінезу.
- У зв’язку з високою розповсюдженістю вугрової хвороби в осіб молодого віку, збільшенням частоти тяжких форм захворювання з розвитком соціофобічних станів, недостатньо з’ясованими патогенетичними механізмами дерматозу, зростанням випадків резистентності до стандартної терапії, актуальним є поглиблення досліджень патогенетичних механізмів та розробка диференційованих методів лікування захворювання з урахуванням провідних патогенетичних ланок.
- У всіх обстежених 223 хворих на вугрову хворобу встановлено наявність дисморфофобії та високу частоту депресивних станів (93,3 %), ступінь вираженості яких залежить від тяжкості клінічних проявів дерматозу (r=0,778 та r=0,817), а також від ступеня вираженості клінічних проявів синдрому подразненого кишечника, який діагностовано у 78,9 % хворих (r=0,574).
- Встановлено, що у хворих на вугрову хворобу мають місце достовірні зміни показників кількісно-видового складу мікробіоти шкіри (переважно у вигляді асоціацій штамів роду Staphylococcus на фоні колонізації Propionibacterium acnes – у 67,5 %) та товстого кишечника – зниження рівня нормобіоти (Bifidobacterium, Lactobacillus, Escherichia – у 1,6, 1,5, 1,3 раза, відповідно), зростання – умовно-патогенних кишкових бактерій (сімейства Enterobacteriaceae і грибів роду Candida – у 2,6 і 2,1 раза, відповідно), що свідчить про стан зниженої колонізаційної резистентності відповідних біотопів організму хворих.
- Виявлено достовірне зростання (у 3,2 раза) вмісту альфа-дефензинів у сироватці крові хворих на вугрову хворобу, що свідчить про активацію нейтрофільної реакції у хворих на акне.
- Встановлено, що у хворих на вугрову хворобу достовірно підвищується рівень субстанції Р у сироватці крові на тлі зниження рівнів пептидів опіоїдної природи – бета-ендорфіну (у 1,7 раза) та лей-енкефаліну (у 1,6 раза), що свідчить про наявність дисбалансу стрес-реалізуючих (субстанції Р) та стрес-лімітуючих (бета-ендорфін, лей-енкефалін) молекулярних маркерів і відображає наявність нейрогенного компоненту процесу запалення шкіри та зрушення в організмі хворих адаптаційних механізмів захисту.
- У хворих на вугрову хворобу виявлено достовірні зміни вмісту в сироватці крові цитокінів різного функціонального спрямування (підвищення рівнів IL-6, TNFα, TGFβ1 та зниження – IFNγ), вираженість яких тісно взаємозалежна зі ступенем тяжкості клінічного перебігу дерматозу.
- Встановлено взаємозв’язки між змінами кількісно-видових показників мікробіоти шкіри і вмістом у сироватці крові альфа-дефензинів, а також – змінами мікробіоти товстого кишечника і вмісту у сироватці крові TGFβ1, що свідчить про можливий регуляторний вплив цих пептидних молекул на формування та зрушення кутанних та оральних толерантних механізмів захисту організму хворих і, відповідно, на клінічні прояви захворювання на шкірі та розвиток синдрому подразненого кишечника у хворих.
- Розроблено, патогенетично обґрунтовано та впроваджено комплексний метод лікування хворих на неускладнену вугрову хворобу, що полягає у послідовному призначенні синтетичного аналогу лей-енкефаліну гексапептиду тирозин-2-аланіл-гліцин-фенілаланіл-лейцин-аргініну діацетат (Даларгін) та фітоантимікробного засобу Сангвірітрин (суміші бісульфатів сангвінарину та холеритрину з рослин родини макових), який забезпечує покращення стану шкіри (клінічне одужання і значне поліпшення у 1,6 раза частіше за стандартну терапію) та відновлення до фізіологічних значень вмісту в сироватці крові альфа-дефензинів, субстанції Р, бета-ендорфіну, лей-енкефаліну, IL-6, TNFα, TGFβ1, IFNγ та показників мікробіоти шкіри і товстого кишечника.
- Встановлено клінічну ефективність розробленої та впровадженої методики лікування хворих на вугрову хворобу (поетапне призначення синтетичного аналогу лей-енкефаліну Даларгіну та фітоантимікробного засобу Сангвірітрину) у віддаленому періоді спостереження, що полягає у достовірному (при порівнянні зі стандартною терапією) зниженні частоти виникнення рецидивів (у 2,5 раза) та попереджає розвиток більш тяжких форм дерматозу.
РЕКОМЕНДАЦІЇ
- Хворим на вугрову хворобу рекомендується доповнювати спектр діагностичних заходів із визначенням наявності/відсутності дисморфофобії, депресивних станів та синдрому подразненого кишечника.
- У системі комплексного лікування хворих на вугрову хворобу рекомендується послідовне призначення синтетичного аналогу лей-енкефаліну – гексапептиду (тирозин-2-аланіл-гліцин-фенілаланіл-лейцин-аргініну діацетат – Даларгін) внутрішньом’язово вранці по 1 мл 1 раз на добу (курс лікування 1–3 тижні залежно від ступеня тяжкості клінічного перебігу дерматозу) та фітоантимікробного засобу (суміші бісульфатів сангвінарину та холеритрину із рослин родини макових – Сангвірітрин) у вигляді змащування осередків ушкодження шкіри вранці та ввечері – на початкових етапах із наступним використанням разом із базисною терапією.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Бочарова В. В. Нейрогенные аспекты воспалительной реакции кожи при угревой болезни. Дерматологія та венерологія. 2015. № 2 (68). С. 42-48.
- Бочарова В. В. Патогенетичне обґрунтування нейропептидо-модулюючої терапії вугрової хвороби. Дерматологія та венерологія. 2017. № 4 (78). С. 17-20.
- 3. Бочарова В. В. Кореляційні зв’язки порушень систем пептидних сигнальних молекул і клінічних проявів вугрової хвороби. Дерматовенерология. Косметология. Сексопатология. № 1-4. С. 38-42.
- 4. Бочарова В. В. Детермінантні складові стресової реакції в патогенезі вугрової хвороби. Досягнення біології та медицини. № 1 (31). С. 22-26.
- Бочарова В. В. Стан ендогенних антимікробних пептидів у хворих на вугрову хворобу. Дерматологія та венерологія. 2018. № 2 (80). C. 26-29.
- Бочарова В. В. Клініко-патогенетичне значення трансформуючого фактора росту-бета при вугровій хворобі. Вісник морської медицини. 2018. № 1 (79). С. 37-40. doi: http://dx.doi.org/10.5281/zenodo.1307414.
- 7. Бочарова В. В. Новий напрямок комплексного лікування хворих на вугрову хворобу та оцінка його клінічної ефективності. Одеський медичний журнал. № 5 (169). С. 15-19.
- 8. Бочаров В. А., Гладчук В. Є., Бочарова В. В. Роль мікробних асоціацій в розвитку інфекцій з ушкодженням шкіри. Здобутки клінічної і експериментальної медицини. № 1 (20). С. 22-25. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки стосовно вульгарних акне).
- 9. Гладчук В. Є., Бочаров В. А., Бочарова В. В. Репараційна складова інфекційного запального процесу шкіри та її модуляція. Український медичний альманах. Т. 17. № 3. С. 19-22. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено обробку отриманих даних, зроблено висновки у відношенні до акне).
- Чинники хронізації ушкоджень губ і слизової оболонки рота при дерматозах / В.В. Бочарова, М. М. Лебедюк, Л. В. Куц, В. А. Бочаров, Л. П. Зубкова. Актуальні проблеми сучасної медицини: Вісник Української медичної стоматологічної академії. 2017. Т. 17. Вип. 4 (60). Ч. 1. С 201-205. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки стосовно хворих із ураженнями сально-волосяного аппарату – акне).
- 11. Bocharova V. Interdependence of Violations of Cytokine Peptide Signal Molecules in Patients with Acne. Dermatovenerology and Cosmetology. 2018. Issue 1 (2). P. 27-41. doi: 10.26886/2523-6946.1(2)2018.3
- 12. Bocharova V. V. Bioenergy Aspects in the Treatment of Acne. Bioenergetics in Medicine and Biology. V. 1(2). Р. 19-33. doi: 10.26886/2523-6938.1(2)2018.2
- Bocharova V. V. Integrated treatment of acne patients with peptidе modulative and phytoantibacterial therapy. Dermatovenerology and Cosmetology. 2018. Issue 2 (3). Р. 52-71. doi: 10.26886/2523-6946.2(3)2018.4
- Regulatory systems of structural-functional units of skin in norm and pathology / V. A. Bocharov, L. P. Zubkova, V. V. Bocharova, L. V. Kuts. Dermatovenerology and Cosmetology. 2017. Issue 1 (1). P. 4-15.
doi: 10.26886/2523-6946.1(1)2017.1 (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено обробку отриманих даних, зроблено висновки у відношенні до вульгарних акне). - Куц Л. В., Бочарова В. В. Ад’ювантні механізми імунотропної терапії хронічних дерматозів. Науковий огляд. 2014. Т. 2, № 1. С. 144-150. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки стосовно вугрової хвороби).
- Клинико-морфологические параллели вульгарных и розовых угрей / В. А. Бочаров, Г. П. Пеклина, В. В. Бочарова, А. Е. Романовский, С. В. Мокиенко. Науковий огляд. 2015. № 4 (14). С 83-91. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки відносно до вульгарних акне).
- Бочаров В. А., Бочарова В. В., Куц Л. В. Взаємозалежності порушень молекулярних систем ноци- та антиноцицепції в патогенезі хронічних дерматозів. Науковий огляд. 2016. № 3 (24). С 68-75. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки у відношенні до вугрової хвороби).
- Роль мікробних факторів та дефензинів в механізмах розвитку екзематозного хейліту / В. В. Бочарова, М. М. Лебедюк, В. А. Бочаров, Л. В. Куц. Науковий огляд. 2017. № 7 (39). С. 6-17. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки у відношенні до вугрової хвороби).
- Бочаров В. А., Куц Л. В., Бочарова В. В. Патогенетические аспекты клинической синдромологии «косметологического», «вегетативного» и «соматического» генеза при хронических дерматозах. Innovative Solutions in Modern Science. 2016. N. 2 (2). С. 31-38. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки стосовно вугрової хвороби).
- The role of signaling molecules in the development of cheilitis caused by UV irradiation and seborrheic eczema / V. V. Bocharova, M. N. Lebedyuk, V. A. Bocharov, L. V. Kuts. Innovative Solutions in Modern Science. 2017. N. 7 (16). P. 17-27. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки у відношенні до вульгарних акне).
- Express-bioenergetic diagnostics of accompanying diseases in acne / V. V. Bocharova, L. P. Zubkova, V. Ye. Gladchuk, V. A. Bocharov. Innovative Solutions in Modern Science. 2017. N. 8 (17). P. 63-74. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, зроблено висновки у відношенні до вульгарних акне).
- 22.Альтернативные методы коррекции нарушений микробиоты кожи при угревой болезни / Г. П. Пеклина, В. А. Бочаров, М. Н. Лебедюк, В. В. Бочарова. Естественно-гуманитарные исследования: Международный журнал. № 2 (8). С. 74-79. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки).
- Бочаров В. А., Куц Л. В., Бочарова В. В. Генетические аспекты развития дисморфофобии и депрессии при хронических дерматозах. Естественно-гуманитарные исследования: Международный журнал. 2016. №12 (2). С. 109-114. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки у відношенні до вугрової хвороби).
- 2Бочарова В. В. Корреляционные связи клинических и молекулярных показателей психоноцицептивной дисрегуляции у больных угревой болезнью. Фундаментальная наука и технологии – перспективные разработки: материалы VIІІ Международной научно-практической конференции, 18-19 апреля 2016 г., North Charleston, USA. North Charleston, 2016. Т. 1. С. 29-31.
- Лебедюк М. Н., Бочарова В. В. Угревая болезнь (проблемные аспекты, собственные исследования). Клинические лекции по дерматовенерологии, косметологии и эстетической медицине. Кол. моногр. / под ред. В. П. Федотова, А. И. Макарчука. Запорожье: Просвіта, 2017. Т. 5. С. 336-345. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки).
- Патент на корисну модель № 130470 Україна, МПК А61К36/00, А61К8/41, А61К8/64. Спосіб комплексного лікування вугрової хвороби / В. В. Бочарова, М. М. Лебедюк, заявник і патентовласник Одеський національний медичний університет. № u201806207; заявл. 04.06.2018; опубл. 10.12.2018, Бюл. № 23.
- Пеклина Г. П., Бочаров В. А., Бочарова В. В. Клинические и лабораторные обоснования применения гиалуроновой кислоты в косметологии. Наукові записки Міжнародного гуманітарного університету: збірник. Одеса: Міжнародний гуманітарний університет, 2014. Вип. 21. Ч. І. С. 273-279. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено обробку отриманих даних, зроблено висновки).
- Бочарова В. В. Особливості природної резистентності при вугровій хворобі. Гуманітарний та інноваційний ракурс професійної майстерності: пошуки молодих учених: Матеріали I Міжнародної науково-практичної конференція студентів, аспірантів та молодих учених, м. Одеса, 24 квітня 2015 р. Одеса, 2015. Ч. ІІ. С. 26-28.
- Бочаров В. А., Бочарова В. В. Місце дієтотерапії в комплексному лікуванні вугрової хвороби. Особливості модернізації предмету досліджень представників медичних наук: Збірник тез наукових робіт Міжнародної науково-практичної конференції, 5-6 червня 2015 р., м. Київ. Київ, 2015. С. 20-23. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки).
- Бочарова В. В., Лебедюк М. М. Удосконалення місцевої терапії вугрової хвороби. Сучасні методи діагностики та лікування коморбідної патології в дерматовенерологічній практиці на принципах доказової медицини: Матеріали науково-практичної конференції з міжнародною участю, м. Чернівці, 01-02 червня 2017 р. Чернівці, 2017. С. 46-47. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки).
- Бочарова В. В., Гладчук В. Є., Куц Л. В. Структурно-функціональні обґрунтування пептидомодулюючої терапії вугрової хвороби. International research and practice conference «Relevant issues of modern medicine: the experience of Poland and Ukraine»: Conference proceedings, October 20-21, 2017. Lublin, 2017. P. 15-18. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено обробку отриманих даних, зроблено висновки у відношенні до вугрової хвороби).
- Бочарова В. В., Куц Л. В. Порушення нейропептидної регуляції як чинники «ноцицептивного» та «імунного» парадоксів при хронічних дерматозах. Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі: матеріали науково-практичної конференції з міжнародною участю, м. Харків, 10-11 листопада 2017 р. Дерматологія та венерологія. 2017. № 3 (77). С. 96. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки у відношенні до вугрової хвороби).
- Бочарова В. В., Куц Л. В. Значення механізмів оральної та кутанної толерантності для патогенезу хронічних дерматозів. Тези ІІІ (Х) з’їзду Української асоціації лікарів-дерматовенерологів і косметологів, м. Львів, 22-23 листопада 2017 р. Український журнал дерматології, венерології, косметології. 2017. № 4 (67). С. 91. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки у відношенні до вугрової хвороби).
- Бочарова В. В., Куц Л. В. Опіоїдні механізми хронізації перебігу дерматозів. The development of medical sciences: problems and solutions: The international research and practical conference, Brno, the Czech Republic, April 27-28, 2018. Brno, the Czech Republic, 2018. Р. 26-28. (Здобувачем особисто проаналізовано дані літератури, сформульовано мету та завдання дослідження, проведено статистичну обробку отриманих даних, зроблено висновки стосовно вугрової хвороби).
АНОТАЦІЯ
Бочарова В. В. Діагностика та лікування вугрової хвороби з урахуванням значення нейрогенних та імунних компонентів в патогенезі дерматозу. – На правах рукопису.
Дисертація на здобуття наукового ступеня доктора медичних наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби. – Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2018.
Дисертацію присвячено проблемі підвищення ефективності лікування хворих на вугрову хворобу шляхом удосконалення комплексної патогенетичної терапії на підставі вивчення показників нейроімунних механізмів гомеокінезу. У хворих на вугрову хворобу встановлено достовірні зміни показників кількісно-видового складу мікробіоти шкіри та товстого кишечника, зростання рівня вмісту в сироватці крові альфа-дефензинів, субстанції Р, зниження рівнів бета-ендорфіну та лей-енкефаліну, підвищення вмісту цитокінів IL-6, TNFα, TGFβ1, різновекторні зміни вмісту IFNγ (залежно від ступеня тяжкості перебігу дерматозу). Розроблено та впроваджено патогенетично обґрунтований удосконалений спосіб комплексного лікування хворих на вугрову хворобу з послідовним призначенням синтетичного аналогу лей-енкефаліну (Даларгіну) та фітоантимікробного засобу (Сангвірітрину), який забезпечує відновлення до фізіологічних значень показників пептидних регуляторних молекул та мікробіоти шкіри і товстого кишечника, що сприяє підвищенню ефективності лікування, зменшує частоту та ступінь тяжкості перебігу рецидивів, попереджує розвиток більш тяжких форм дерматозу.
Ключові слова: вугрова хвороба, пептидні сигнальні молекули (нейропептиди, цитокіни, альфа-дефензини), синтетичний аналог лей-енкефаліну (Даларгін), фітоантимікробний засіб (Сангвірітрин).
АННОТАЦИЯ
Бочарова В. В. Диагностика и лечение угревой болезни с учетом значения нейрогенных и иммунных компонентов в патогенезе дерматоза. – На правах рукописи.
Диссертация на соискание ученой степени доктора медицинских наук по специальности 14.01.20 – кожные и венерические болезни. – Государственное учреждение «Институт дерматологии и венерологии НАМН Украины», Харьков, 2018.
Диссертация посвящена проблеме повышения эффективности лечения больных угревой болезнью путем усовершенствования комплексной патогенетической терапии на основании изучения показателей нейроиммунных механизмов гомеокинеза. У больных угревой болезнью установлено достоверные изменения показателей количественно-видового состава микробиоты кожи и толстого кишечника, рост уровня содержания в сыворотке крови альфа-дефензины, субстанции Р, снижение уровней бета-эндорфина и лей-энкефалина, повышение содержания цитокинов IL-6, TNFα, TGFβ1, разновекторные изменения содержания IFNγ (в зависимости от степени тяжести дерматоза). Разработан и внедрен патогенетически обоснованный усовершенствованный способ комплексного лечения больных угревой болезнью с последовательным назначением синтетического аналога лей-энкефалина (Даларгин) и фитоантимикробного средства (Сангвиритрина), который обеспечивает восстановление до физиологических значений показателей пептидных регуляторных молекул и микробиоты кожи и толстого кишечника, способствует повышению эффективности лечения, уменьшает частоту и степень тяжести рецидивов, предупреждает развитие более тяжелых форм дерматоза.
Ключевые слова: угревая болезнь, пептидные сигнальные молекулы (нейропептиды, цитокины, альфа-дефензины), синтетический аналог лей-энкефалина (Даларгин), фитоантимикробное средство (Сангвиритрин).
ABSTRACT
Bocharova V. V. Diagnostic and treatment of acne based on the value of neurogenic and immune components in the pathogenesis of dermatosis. – The manuscript.
The Dissertation for the Scientific Degree of the Doctor of Medical Science on a Specialty 14.01.20 – Skin and Venereal Diseases. – State Establishment «Institute of Dermatology and Venereology of NAMS of Ukraine», Kharkiv, 2018.
The dissertation is devoted to the increase of the effectiveness of treatment of patients with acne vulgaris by developing the method of complex pathogenetic therapy based on the study of indicators of neuroimmune mechanisms of homeokinesis.
The scientific novelty is that in patients with acne, for the first time, a high frequency of irritable bowel syndrome (78.9%) has been established, which has the direct relationship with the severity of dermatosis (r = 0.574) and is associated with dysmorphophobia (r = 0.763) and depressive states (r = 0.657).
An important role of neutrophils in the development of skin inflammation in patients with acne due to the significant increase in the level of alpha-defensins in serum, which correlates with the severity of the course of dermatosis (r = 0.877) and the content of the substance P (r = 0.875), IL-6 (r = 0.789), TGFβ1 (r = 0.674).
For the first time it was found that in patients with acute illness, along with an increase in the concentration of substance P, there is the decrease in the level of endogenous ligands of the opioid receptors – beta-endorphin and leu-enkephalin, indicating the development of the relative failure of the latter, which may contribute to the development of skin inflammation.
For the first time the presence of acne-related micro-organisms in the quantitative-species composition of the microbiota (increased Propionibacterium acnes and colonization of Staphylococcus aureus) and serum alpha-defensin blood levels (r = 0.851 and r = 0.764, respectively) and changes in the quantitative – the species composition of the large intestine cavity (reduction of Bifidobacterium, Lactobacillus and an increase in the conditionally pathogenic Еnterobacteriaceae bacterial Еnterobacteriaceae) and the level of TGFβ1 serum contents (r = –0.876,
r = –0.654 and r = 0.498, respectively), indicating the possible effect of these processes on the form reference skin and oral (intestine) tolerance.
It has been shown for the first time that the cytokine spectrum of blood serum in patients with acute and moderate acute illness is characterized by the significant increase in the level of IL-6 (1.9 and 2.3 times, respectively), TNFα, TGFβ1 (1.7 and 2.1 times, respectively) and a moderate decrease in IFNγ (1.4 and 1.8 times, respectively); the inverse correlation between IFNγ and IL-6, TGFβ1 (r = –0.925,
r = –0.998, respectively) was detected in more severe forms of acne.
For the first time the scientifically grounded complex method of treatment of patients with acute illness with the purpose of differentiated use of peptidmodulatory and phytoantimicrobial therapy and proved its effectiveness.
The practical significance of the results obtained is that the new method of treating acne with acute-inflammatory form of dermatosis has been developed, scientifically substantiated and proposed, which is an additional appointment to the background of the standard treatment of the synthetic analogue leu-enkephalin-hexapeptide (tyrosine-2-alanyl-glycine-phenylalanyl-leucine-arginine diacetate – Dalargin) intramuscularly in the morning by 1 ml 1 time per day (course of treatment: 1 week – with a slight degree of clinical severity of dermatosis, 2 weeks – at medium, 3 weeks – with severe) with the simultaneous administration of a phytoantibacterial agent (the mixture of bubbles sulfate sanguinarn and choleritrine from plants of the poppy family: mackerel of the heart and melliferous peppermint – Sangviritrin) in the form of lubrication in the morning and evening – until the full regress of the inflammatory elements of rash at different degrees of severity of the disease (patent of Ukraine to the utility model), which makes it possible to improve the nearest (1.6 times more often to provide clinical recovery and significant improvement) and long-distance (to reduce the incidence of relapse by 2.5 times). from entrepreneurs therapy of acne.
Key words: acne, peptide signaling molecules (neuropeptides, cytokines, alpha-defensins), synthetic analogue ley-enkephalin (Dalargin), phytoantibacterial agent (Sanguirhytryn).