Державна установа «Інститут дерматології та венерології
Національної академії медичних наук України»
Кваліфікаційна наукова
праця на правах рукопису
Мангушева Вікторія Юріївна
УДК 616.5-021.5-092-008.87-085.26+615.246.2+615.281.9
ДИСЕРТАЦІЯ
ПАТОГЕНЕТИЧНЕ ЗНАЧЕННЯ ПОРУШЕНЬ БІОЦЕНОЗУ ШКІРИ
ТА ЇХ КОРЕКЦІЯ У ХВОРИХ НА АЛЕРГОДЕРМАТОЗИ
14.01.20 – шкірні та венеричні хвороби
Подається на здобуття наукового ступеня кандидата медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
____________________________________________В.Ю. Мангушева
(підпис, ініціали та прізвище здобувача)
Науковий керівник: Кутасевич Яніна Францівна, доктор медичних наук, професор
Харків – 2018
АНОТАЦІЯ
Мангушева В.Ю. Патогенетичне значення порушень біоценозу шкіри та їх корекція у хворих на алергодерматози. – Кваліфікаційна робота на правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 «шкірні та венеричні хвороби». – ДУ «Інститут дерматології та венерології», НАМН України, Харків, 2018.
Дисертаційне дослідження виконано на базі ДУ «Інститут дерматології та венерології НАМН України» протягом 2015-2018 рр. та присвячено підвищенню ефективності лікування хворих на алергодерматози шляхом розробки комплексного методу терапії на підставі вивчення змін біоценозу шкіри та кишечника і імунного статусу.
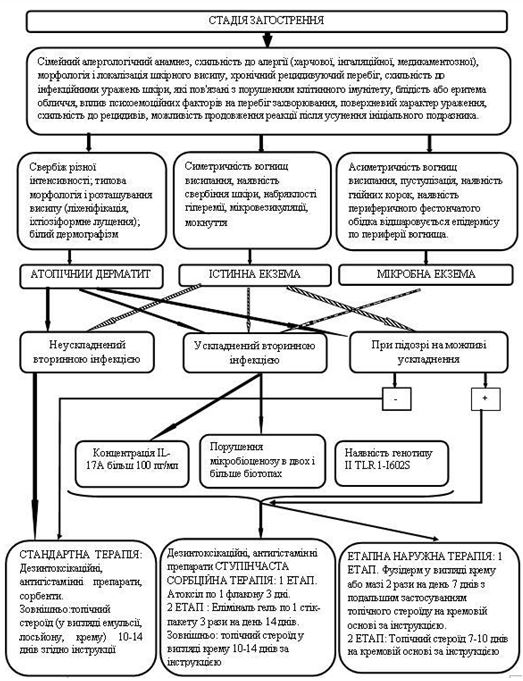
Обстежено 154 хворих на алергодерматози, які знаходилися на лікуванні у відділенні дерматології, інфекційних та паразитарних захворювань шкіри, у тому числі: 50 (32,5%) хворих на атопічний дерматит (АД); 52 (33,8%) хворих на істинну екзему (ІЕ) та 52 (33,8%) хворих на мікробну екзему (МЕ). У всіх хворих виконано анамнестичне та загально-клінічне дослідження з оцінкою тяжкості АД за індексом SCORAD, хворих на ІЕ та МЕ за індексом EASI. Здійснено мікробіологічні дослідження з якісним та кількісним аналізом біоценозу верхніх дихальних шляхів, шкіри та кишечнику, дослідження рівня інтерлейкину -17А та поліморфізму гена толл-подібного рецептора TLR1-I602S.
Порівняльний аналіз між групами пацієнтів залежно від основного діагнозу виявив окремі особливості. Зокрема, менша кількість пацієнтів у віці від 18 до 44 років, хворих на АД та ІЕ порівняно з МЕ, зі збільшенням у хворих на МЕ пацієнтів віком від 60 до 74 років. Крім цього, при АД та ІЕ відмічався більш ранній початок захворювання та його більша тривалість із загостреннями частіше навесні та восени, у той час як при МЕ відмічалося збільшення частоти загострень незалежно від сезону. Також для хворих на АД та ІЕ більш характерна можлива спадковість захворювання та наявність супутньої патології, особливо з боку органів травної системи. Однак слід зазначити, що у всіх хворих, незалежно від діагнозу, зустрічалися всі варіації показників, що аналізувалися, хоча і з різною частотою. Це є непрямим доказом загальних ланок патогенезу даних захворювань та свідчить про можливість уніфікації окремих методів лікування цих хворих.
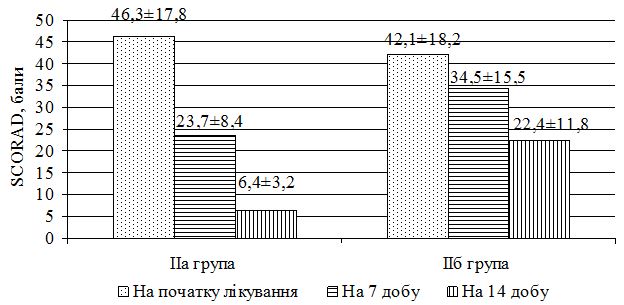
На початку лікування вираженість окремих клінічних проявів оцінювалась у більшості випадків як тяжкі, рідше – середньої тяжкості. У хворих на АД загальна тяжкість захворювання за шкалою SCORAD при надходженні на лікування у середньому складала 50,8±18,2 балів, у тому числі, у 5 (10,0%) менш 20 балів (легкий перебіг), у 8 (16,0%) – перебіг середньої тяжкості та у 37 (74,0%) – тяжкий перебіг захворювання. У хворих на ІЕ загальна тяжкість захворювання за шкалою EASI на початку лікування складала у середньому 43,2±16,7 балів, у тому числі, у хворих з легким перебігом (до 20 балів за шкалою EASI) було 4 (7,7%), середньої тяжкості – 18 (34,6%) (від 20 до 40 балів за шкалою EASI) та з тяжким перебігом (більш 40 балів за шкалою EASI) – 30 (57,7%). Загальна тяжкість захворювання за шкалою EASI у хворих на МЕ на початку лікування складала у середньому 54,2±15,3 балів, у тому числі, у 2 (3,8%) перебіг оцінено як легкий, у 7 (13,5%) – середньої тяжкості та у 43 (82,7%) – як тяжкий.
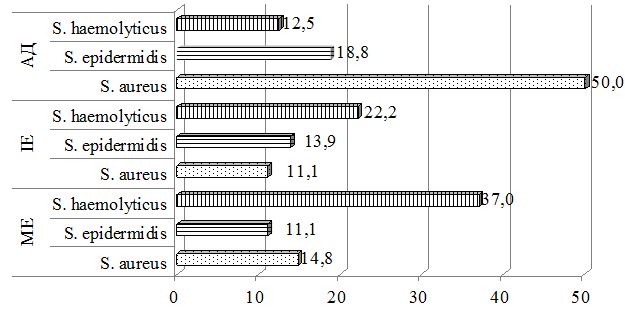
При бактеріологічному дослідженні виділень зіву пацієнтів усіх груп у період загострення, до лікування, у більшості випадків не виявлено значимих порушень як у кількісному, так і якісному складі мікроорганізмів. Лише у п’яти пацієнтів були виявлені представники умовно-патогенної мікрофлори з вираженим патогенним потенціалом у складі ценозу зіву – К. pneumoniae, K. ozaenae та S. pyogenes. Ступінь загального мікробного обсіменіння склала від 1х104 до 1х107 КУО/мл. При дослідженні виділень з носу пацієнтів даних груп було вилучено 82 лабораторних штами стафілококів, серед яких переважну більшість склали S. еpidermidis – 32,9 %, S. aureus – 17,1 %, S. haemolyticus – 17,1 %. Ступінь загального мікробного обсіменіння коливався від 1х103 до 1х106 КУО/мл. Важливо зауважити, що найчастіше S. aureus вилучався від хворих на АД, при цьому у 19,4 % обстежених (6 з 31 особи) збудник було виявлено паралельно в носових ходах і на шкірі.
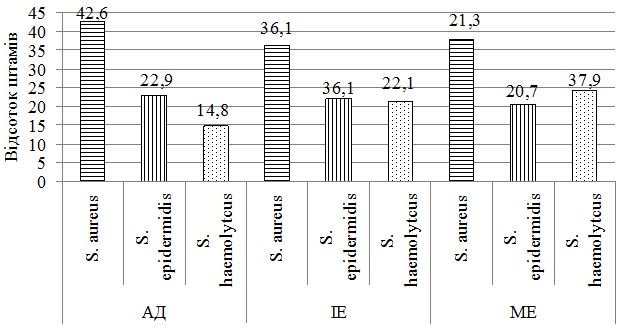
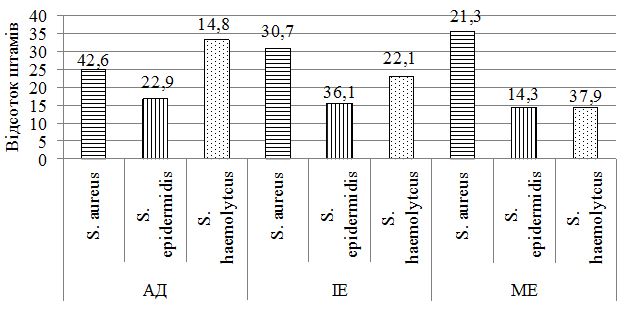
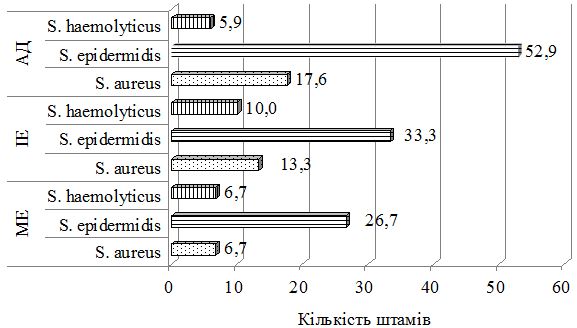
При дослідженні складу шкірного біотопу хворих до лікування було отримано 212 лабораторних штамів мікроорганізмів з переважанням стафілококової складової (85,8 %). Ступінь загального мікробного обсіменіння коливалась від 1х104 КУО/мл до 1х108 КУО/мл. Серед вилучених різновидів стафілококів у ценозі шкіри переважали S. aureus, S. haemolyticus та S. еpidermidis. Спостерігався зсув у складі шкірної біоти з переважанням найбільш агресивних видів, питома вага яких склала 60,8 %, з домінуванням S. aureus (42,6 % лабораторних штами) у хворих на АД та 36,1 % і 37,9 % відповідно у хворих на ІE та МЕ. В групі пацієнтів з АД відмічались більш виражені порушення у складі біотопу верхніх дихальних шляхів з ізоляцією лабораторних штамів S. aureus, які мали однаковий профіль антибіотикорезистентності зі шкірними різновидами збудника, що може свідчити про персистенцію збудника у різних екотопах вегетування макроорганізму.
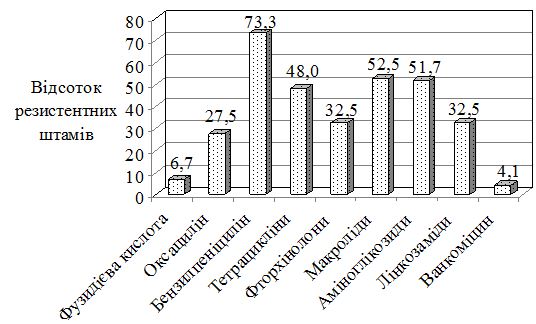
Встановлено, що стафілококи виявили високу резистентність до пеніциліну та макролідів (73,3 % та 52,5 % відповідно), помірну до аміноглікозидів, тетрациклінів та лінкозамідів (51,7%, 48,0 % та 32,5 % відповідно). Найбільшу чутливість штами показали до фузидієвої кислоти (93,3 % штамів). Загальна кількість штамів резистентних до оксациліну (MRSA + MR–CNS) склала 27,2 % (49 штамів). Серед метицилінрезистентних штамів 24,5 % мали ознаки MLS-резистентності (резистентність до макролідів), а 2 штами мали екстенсивну резистентність. Переважну більшість цих штамів було ізольовано від хворих на АД.
Порушення мікробіоти кишечника виявлено у всіх хворих: дисбактеріоз І ступеня у 10,0 %, ІІ ступеня – у 53,3 % обстежених, ІІІ ступеня у 36,7 %. Дисбіотичні порушення характеризувались зниженням кількісного вмісту індигенної мікрофлори. Виявлялось зниження біфідобактерій (30,0 %), лактобактерій (10,5 %) та нормальної кишкової палички (13,3 %). У 83,3 % хворих було виявлено зростання кількості умовно-патогенних бактерій (H. alvei, K. pneumoniae, Proteus spp., E. aerogenes). У 30,0 % обстежених виявлялась кишкова паличка з гемолітичними властивостями, у 20,0 % пацієнтів – лактозонегативна та у 6,7 % хворих – кишкова паличка зі зниженою ферментативною активністю. Гриби роду Candida було ізольовано у 73,3 % обстежених. У 13,3 % випадків було вилучено S. aureus, у 6,7% хворих було виявлено патогенні ентеробактерії (S. enteritidis), а у 10,0 % пацієнтів – мікроорганізми роду Clostridium. Таким чином, у більшості хворих з алергодерматозами, особливо у хворих на АД, виявлено порушення мікробіоценозу.
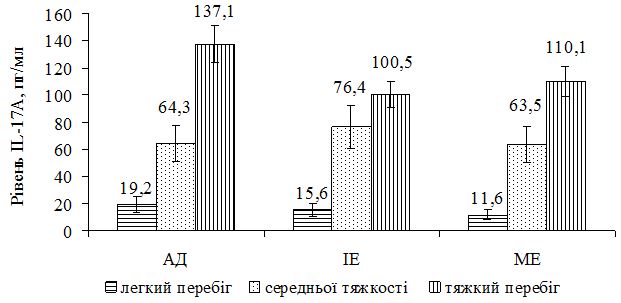
Дослідження вмісту IL-17А виконано у 33 хворих на АД, у 39 хворих на ІЕ, у 36 хворих на МЕ та у 23 практично здорових людей (контрольна група). В контрольній групі практично здорових осіб він складав у середньому 13,0±8,9 пг/мл. У хворих з АД він складав у середньому 113,7±60,6 пг/мл; у хворих ІЕ – 85,6±49,6 пг/мл, а у хворих на МЕ – у середньому 100,1±39,8 пг/мл. Незалежно від діагнозу рівень IL-17А у середньому був достовірно більшим, ніж в контрольній групі (p<0,05 за t-критерієм). За даними кореляційного аналізу виявлено пряму залежність вмісту IL-17А з тяжкістю захворювання: у хворих на АД – rP = 0,681 (p<0,001) та – rP = 0,722 (p<0,001) з величиною SCORAD; у хворих на ІЕ – rP = 0,400 (p=0,003) та – rP = 0,423 (p=0,002) з величиною EASI; у хворих на МЕ – rP = 0,613 (p<0,001) та – rP = 0,613 (p<0,001) з величиною EASI. Така залежність також підтверджується розподілом середніх значень вмісту IL-17А залежно від тяжкості алергодематозу.
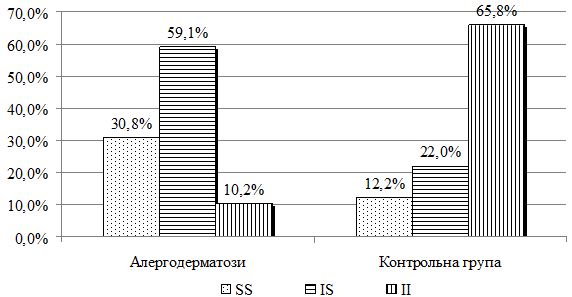
Дослідження поліморфізму гена TLR 1-I602S виконано у 39 хворих, у тому числі у 9 хворих на АД, у 11 хворих на ІЕ та у 19 хворих на МЕ. Контрольну групу склали 41 практично здорова особа. У хворих на алергодерматози (в цілому) генотип SS виявлено у 12 (30,8%) , генотип IS – у 23 (59,0%), а генотип ІІ – 4 (10,2%) випадках. У контрольній групі переважав активний генотип ІІ – 27 (65,8%), генотип SS виявлено у 5 (12,2%), а IS генотип – у 9 (22,0%) випадках (χ2=26,038, р<0,001). У хворих на АД активного генотипу гена TLR1-I602S ІІ не було, генотип IS виявлено у 7 (77,8%) випадках, а генотип SS – у 2 (22,2%) випадках. При ІЕ активного генотипу також не було, при цьому значно збільшилась частота малоактивного генотипу SS – 6 (54,5%) хворих, генотип ІS виявлений у 5 (45,5%) випадках. При МЕ генотип ІІ та SS виявлялися з однаковою частотою – по 4 (21,1%) хворих, а генотип ІS – у 11 (57,9%) хворих (p>0,05 за критерієм χ2 у всіх порівняннях). Незалежно від діагнозу різниця розподілу генотипів гена TLR1-I602S була статистично значима у порівнянні з контролем (р<0,05 за критерієм χ2).
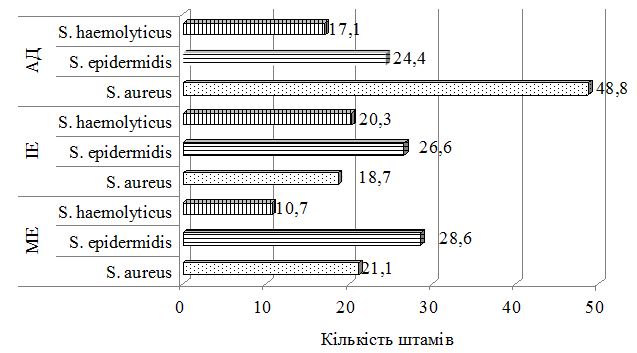
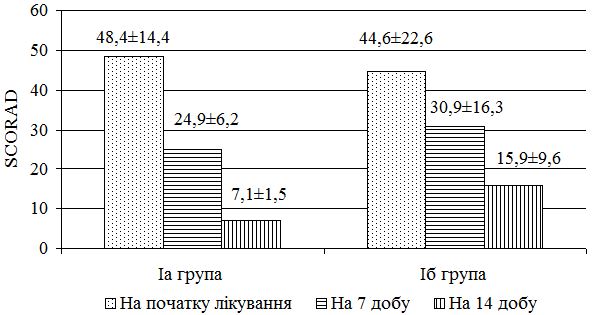
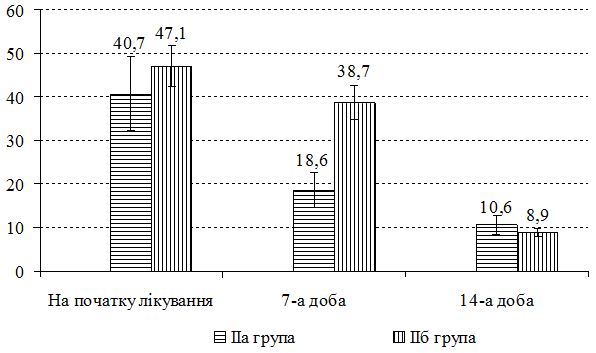
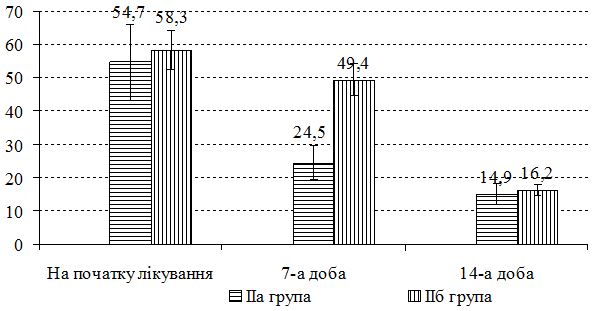
З урахуванням виявлених порушень запропоновано нові методи диференційованої терапії. Метод системної терапії – ступінчаста ентеросорбція (прийом атоксілу по 1 флакону на день протягом 3 днів з наступним прийомом еліміналь гелю по 1 стик-пакету 3 рази на день протягом 14 днів). Групу порівняння становили хворі, у яких ентеросорбція не проводилася. Встановлено, що застосування ступінчастої сорбційної терапії призводить до більш швидкого покращення стану пацієнтів – на 7 та 14 добу лікування. Cпостерігалося більш значне зниження тяжкості захворювання та частоти виявлення найбільш тяжких окремих клінічних симптомів порівняно з групою пацієнтів, які отримували традиційну терапію без ентеросорбції. Застосування ступінчастої сорбційної терапії у хворих на алергодерматози сприяло нормалізації мікробіоценозу кишечника та шкіри: кількість штамів S. aureus знизилася з 42,6 % до 35,7 % та 30,0 % відповідно у хворих на АД, з 36,1 % до 30,7 % та 23,1 % відповідно у хворих на ІЕ. Частота вилучення штамів S. еpidermidis зросла з 22,9 % до 40,0 % у хворих на АД, з 22,1 % до 38,4 % у хворих на ІЕ та з 20,7 % до 33,3 % у пацієнтів з МЕ. Спостерігалася нормалізація основних показників мікроценозу кишечника: збільшилася кількість біфідо- та лактобактерій, були відсутні S. aureus, умовно-патогенні ентеробактерії, лактонегативні кишкові палички та варіанти зі зниженою ферментативною активністю. Ступінчаста сорбційна терапія була більш ефективною у хворих на АД.
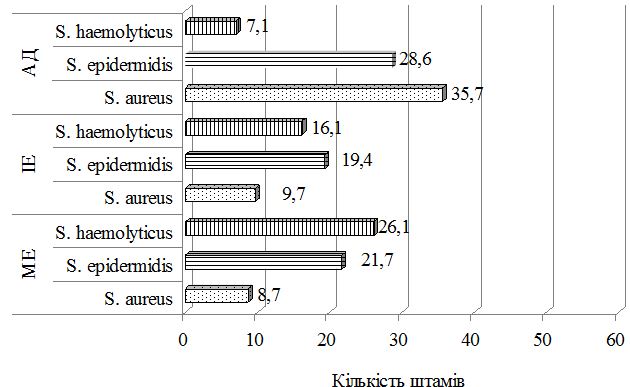
Був застосований метод етапної зовнішньої терапії: на першому етапі використовували препарат фузидієвої кислоти у вигляді мазі або крему 2 рази на день протягом 7 днів, чередуючи із застосуванням топічного стероїду у вигляді мазі або крему. На другому етапі застосовувався тільки топічний стероїд протягом 7 днів за схемою відповідно до інструкції виробника. Групу порівняння складали хворі, яким для зовнішньої терапії застосовано комбінований препарат (протимікробний інгредієнт та топічний стероїд) згідно інструкції виробника. При порівнянні ефективності двох підходів до зовнішньої терапії за результатами аналізу динаміки клінічних проявів алергодерматозів встановлено, що незалежно від діагнозу, застосування етапної зовнішньої терапії призводить до більш швидкого та значного зниження тяжкості захворювання та регресу клінічних симптомів порівняно з групою пацієнтів, які отримували лікування комбінованим топічним препаратом. Застосування етапної зовнішньої терапії також сприяло нормалізації мікробіоценозу шкіри: кількість штамів S. aureus знизилася з 48,8 % до 17,6 % у пацієнтів з АД, з 18,7 % до 13,3 % у хворих на ІЕ та з 21,4 % до 6,7 % у хворих на МЕ, проти з 50,0 % до 35,7 % у пацієнтів з АД, з 11,1 % до 9,7 % у хворих на ІЕ та з 14,8 % до 8,7 % у хворих на МЕ при лікуванні комбінованим місцевим засобом. Частота вилучення штамів S. еpidermidis зросла з 24,4 % до 52,9 % у хворих на АД, з 26,6 % до 33,3 % у хворих на ІЕ при застосуванні етапної зовнішньої терапії проти з 18,8 % до 28,6 % у хворих на АД та з 13,9 % до 19,4 % у хворих на ІЕ при лікуванні комбінованим місцевим засобом. Найільш ефективною етапна зовнішня терапія виявилась у хворих на МЕ.
Таким чином, можна стверджувати, що застосування запропонованих методів лікування (ступінчастої ентеросорбції та етапної зовнішньої терапії) призводить до більш швидкого покращення стану пацієнтів, нормалізації мікробіоценозу та імунного статусу.
Ключові слова: алергодерматози, біоценоз, толл-рецептори, поліморфізм гену TLR1-I602S, ІЛ-17А, ентеросорбція, зовнішня терапія
ANNOTATION
Mangusheva V.Yu. Pathogenetic value of the skin biocenosis disorders and their correction in patients with allergic dermatitis. Qualification work as manuscript.
Thesis for the degree of a candidate of medical sciences in specialty 14.01.20 “Skin and venereal diseases”.- State Esteblishment “Institute of Dermatology and Venereology”, NAMS of Ukraine, Kharkiv, 2018.
The dissertation research has been performed on the basis of the SE “Institute of Dermatology and Venereology of the National Academy of Medical Sciences of Ukraine” during 2015-2018 It considers the issues for to improving the efficiency of treatment of patients with allergic dermatoses by developing a complex therapeutic method based on the study of changes in the skin and intestine biocenosis and immune status.
154 patients with allergic dermatosis were examined and treated at the department of dermatology, infectious and parasitic diseases of the skin, including: 50 (32.5%) patients with atopic dermatitis (AD); 52 (33.8%) patients with true eczema (TЕ) and 52 (33.8%) patients with microbial eczema (МЕ). Anamnestic and general clinical study was carried out in all the patients with the assessment of the AD severity according to the SCORAD index, and according to the EASI index in patients with TE and ME. Microbiological investigations with a thorough qualitative and quantitative analysis of biocenosis of the upper respiratory tract, skin and intestine, as well as determination of the interleukin-17A level and the TLR1-1602S gene polymorphism of the Toll-like receptor were performed in the present study.
Comparative analysis between the groups of patients, depending on the main diagnosis, revealed some peculiarities. In particular, fewer patients in the age group from 18 to 44 years, patients with AD and TE compared to ME, with an increase in patients with ME in patients aged 60 to 74 years. In addition, with AD and TE, an earlier occurrence of the disease and its longer duration with exacerbations were observed more often in the spring and autumn, while the ME observed an increase in the frequency of exacerbations regardless of the season. Also, for patients with AD and TE more characteristic of possible heredity of the disease and the presence of concomitant pathology, especially from the organs of the digestive system. However, it should be noted that all patients, regardless of the diagnosis, met all the variations of the parameters that were analyzed, albeit at different frequencies. This is an indirect proof of the common parts of the pathogenesis of these diseases and suggests the possibility of unifying certain treatments for these patients.
At the beginning of the treatment, the state of individual clinical manifestations was estimated in most cases as severe, less frequent it was of a moderate severity. In patients with AD, on admission to the clinic for treatment, the average value of the overall disease severity on the SCORAD scale was 50.8 ± 18.2 points: less than 20 points (mild course of the disease) were registered in 5 patients (10.0%) , a moderate course in 8 (16, 0%), and a severe course of the disease in 37 (74.0%).
In patients with TE, the average value of the overall disease severity on the EASI scale at the beginning of the treatment was 43.2 ± 16.7 points, including 4 patients (7.7%) with a mild course (up to 20 points on the EASI scale), 18 (34.6%) patients (from 20 to 40 points on the EASI scale) with an average severity, and 30 (57.7%) patients with a severe course of the disease (more than 40 points on the EASI scale). The average value of the overall disease severity in patients with ME at the start of treatment on the EASI scale was 54.2 ± 15.3 points, including 2 (3.8%) patients with a mild course, 7 patients (13.5%) with a course of moderate severity, and 43 (82.7%) patients with a severe course of the disease.
In the bacteriological study of allotment excretion in all groups during the period of exacerbation, prior to treatment, in most cases no significant violations were detected in both the quantitative and qualitative composition of microorganisms. Only in 5 patients, the representatives of the conditionally pathogenic microflora with a pronounced pathogenic potential in the syllable cenosis – K. pneumoniae, K. ozaenae and S. pyogenes – were identified. The degree of total microbial contamination is from 1×104 to 1×107 CFU / ml. In the study of the nasal discharge of our patients before the threatment, 82 laboratory strains of staphylococci have been revealed with the overwhelming amount of S. epidermidis – 32.9%, S. aureus – 17.1%, S. hemolyticus – 17.1%. The degree of overal microbial contamination ranged from 1 x 10 3 to 1 x 106 CFU / ml. It is important to note that most often S. aureus is excreted most frequent by patients with AD, in addition, in 19,4% of the subjects it has been found simultaneously in the nasal passages and on the skin.
212 laboratory strains of microorganisms with a predominance of staphylococcal component (85.8%) have been received in the study of the skin biotope composition of patients before treatment. The degree of the overall microbial contamination varied from 1×104 CFU / ml to 1×108 CFU / ml. S. aureus, S. haemolyticus and S. epidermidis preponderate in the skin cenosis among the selected varieties of staphylococci. There is a shift in the composition of the skin biota with the predominance of the most aggressive species, the proportion of which is 60.8%, with the dominance of S. aureus (42.6% of laboratory strains) in patients with AD, and 36.1% and 37.9% of them ,respectively, have been found in patients with eczema. In the group of patients with AD, there are more pronounced disorders in the upper respiratory tract biotope with the isolation of S. aureus strains, which have the same profile of antibiotic resistance with the dermal types of the agent that may testify to the persistence of the agent in different ecotopes of the macroorganism vegetation.
It has been established that staphylococci have a high resistance to penicillin and macrolides (73.3% and 52.5%, respectively), moderate to aminoglycosides, tetracyclines and lincosamides (51.7%, 48.0% and 32.5% respectively). The greatest sensitivity of the strains has been observed to the fusidic acid (93.3% of the strains). The total number of the oxacillin-resistant strains (MRSA + MR-CNS) is 27.2% (49 strains). 24.5% of the methicillin-resistant strains have some signs of MLS-resistance (macrolide resistance), and 2 strains have extensive resistance. The principal amount of these strains has been singled out in patients with AD.
Intestinal microbiote disorders have been found in all of the examined patients: the І degree dysbacteriosis in 10.0%, the ІІ – in 53.3%, and the III degree in 36.7% of the examined subjects. Dysbiotic disorders are characterized by a decrease in the quantitative content of the indigenous microflora. A reduced amount of bifidobacteria (30.0%), lactobacillus (10.5%) and normal E. coli (13.3%) has been registered in the study. An increase in the level of the conditionally pathogeic bacteria (H. alvei, K. pneumoniae, Proteus spp., E. aerogenes) has been observed in 83.3% of the patients. E.coli with hemolytic properties has been determined in 30% of the examined subjects, lactose-negative bacteria- in 20.0%, and E. coli with a reduced enzymatic activity has been found in 6.7% of the observed. Candida fungis have been singled out in 73.3% of the examined, S. aureus – in 13.3% of the cases, 6.7% of our patients have pathogenic enterobacteria (S. enteritidis), and 10.0% of them have microorganisms of the genus Clostridium. Thus, disorders of microbiocenosis have been revealed in most of the patients with allergic dermatoses.
The study of the IL-17A content has been carried out in 33 patients with AD, 39 patients with IE, 36 patients with ME, and in 23 healthy subjects (control group). In the control group of practically healthy persons its level amounts to 13.0 ± 8.9 pg / ml on the average. In patients with AD, its average level amounts to 113.7 ± 60.6 pg / ml; in patients with IE – 85,6 ± 49,6 pg / ml, and in patients with ME to 100,1 ± 39,8 pg / ml. Regardless of the diagnosis, the IL-17A average level is significantly higher than that in the control group (p <0.05 on the T-criterion). According to the correlation analysis data, the direct dependence of the IL-17A content on the severity of the disease has been found: rP = 0.681 (p <0.001) and rP = 0.722 (p <0.001) in patients with AD on the SCORAD scale; rP = 0,400 (p = 0,003) and rP = 0,423 (p = 0,002) in patients with IE on the EASI scale; rP = 0.613 (p <0.001) and rP = 0.613 (p <0.001) in patients with ME on the EASI scale. The same dependence is also confirmed by the distribution of mean values of the IL-17A content, considering the severity of allergic dermatosis.
The study of polymorphism of the TLR 1-I602S gene was performed in 39 patients, including 9 patients with AD, 11 patients with TE and 19 patients with ME. The control group consisted of 41 practically healthy persons. In the patients with allergic dermatoses (in total) SS genotype has been found in 12 (30,8%) cases, genotype IS – in 23 (59,0%) , and genotype II – in 4 (10,2%) cases. In the control group, the active genotype II is owerhelming in 27 (65.8%), the least active genotype SS has been found in 5 (12.2%), and the genotype IS 9 (22.0%) cases (χ2 = 26.038, p < 0.001). In patients with AD, the active genotype of the TLR1-I602S II gene has not been found, the genotype IS has been observed in 7 (77.8%) cases, and the genotype SS has been found in 2 (22.2%) cases. In patients with TE, there was also no active genotype, with a significantly increased frequency of the low-aktive genotype SS-6 (54.5%) in patients, and the genotype of ІS has been determine in 5 (45.5%) cases. In patients with ME the II and SS genotypes have been revealed with the same frequency - each genotype in 4 (21,1%) patients, and the genotype IS - in 11 (57,9%) patients (p>0,05 by the criterion χ2 in all comparisons). Regardless of the diagnosis, the difference in TLR1-I602S genotype distribution is statistically significant as compared to the control (p <0.05 by χ2).
Taking into account the revealed violations proposed new methods of differentiated therapy. Method of system therapy– stepped enterosorbtion (1 vial of Atoxil per day within 3 days with a subsequent application of Eliminal gel – 1stick packet 3 times a day within 14 days). The comparison group was made up of patients who did not have enterosorbtion. It has been established that the use of stepped sorption therapy leads to a faster improvement of the patients’ condition – at the 7th and 14th day of treatment. There was a greater reduction in the severity of the disease and the frequency of detecting the most severe individual clinical symptoms compared with the group of patients who received traditional therapy without enterosorption. The use of the stepped sorption therapy in patients with allergic dermatoses contributes to normalization of the intestinal and dermal microbiocenosis: the number of S. aureus strains has decreased from 42.6% to 35.7% and 30.0%, respectively, in patients with AD, as well as from 36.1% to 30.7% and 23.1%, respectively, in patients with IE. The frequency of S. epidermidis strains registration has increased from 22.9% to 40.0% in patients with AD, from 22.1% to 38.4% in patients with IE, and from 20.7% to 33.3% in patients with ME. Normalization of the main signs of the intestinal microcenosis has also been observed: the number of bifidobacteria and lactobacilli has increased, S. aureus, conditionally-pathogenic enterobacteria, lacto-negative colibacillus and variants with a reduced enzymatic activity have not been determined.
The method of external phase therapy was applied: at the first stage the fusidic acid preparation is used as an ointment or cream 2 times a day for 7 days, alternating with the use of topical steroid, at the second stage we suggest topical steroid for 7 days in accordance with the manufacturer’s instructions. The comparison group consisted of patients for which the combination therapy (antimicrobial ingredient and topical steroid) was used for external therapy according to the manufacturer’s instructions. When comparing the effectiveness of the two approaches to external therapy based on the results of the analysis of the dynamics of clinical manifestations of allergic dermatitis, it has been established that, regardless of the diagnosis, the use of external phase therapy leads to a faster and significant reduction in the severity of the disease and regression of clinical symptoms compared with the group of patients treated with the combined topical preparation. The use of the external phase therapy also contributes to the normalization of the microbiocenosis of the skin: the number of S. aureus strains has decreased from 48.8% to 17.6% in patients with AD, from 18.7 to 13.3% in patients with IE and from 21.4% to 6.7% in patients with ME. After the treatment with a combined local remedy the decrease is from 50.0% to 35.7% in patients with AD, from 11.1% to 9.7% in patients with TE, and from 14.8% to 8.7% in patients with ME. The frequency of the S. epidermidis strains revealing has increased from 24.4% to 52.9% in patients with AD, from 26.6% to 33.3% in patients with TE after the use of external phase therapy. The increase from 18.8% to 28, 6% has been observed in patients with AD and from 13.9% to 19.4% in patients with TE after the treatment with a combined local remedy.
It can be argued that the application of the proposed treatment methods (stepped sorption therapy and external phase therapy) leads to faster improvement of the patient’s condition, normalization of microbiocenosis and immune status.
Key words: allergic dermatosis, biocenosis, TLR1-I602S gene polymorphism, interleukin-17A, enterosorbtion, external therapy
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Корекція мікробіоценозу кишечника методом ступінчастої елімінаційної терапії у хворих на алергодерматози / Я.Ф. Кутасевич, І.О. Олійник, С.К. Джораєва, В.Ю. Мангушева. Медицина сьогодні і завтра. 2017. № 3-4 (76-77). С. 109–115 (Дисертантом здійснено відбір хворих, їх обстеження та обробку матеріалу).
- Диференційований підхід до діагностики та зовнішньої терапії екземи / Я.Ф.Кутасевич, К.Є. Іщейкін, І.В. Зюбан, В.Ю. Мангушева. Дерматологія та венерологія. 2018. № 1 (79). С. 50–55 (Дисертантом розроблено диференційований підхід до діагностики та зовнішньої терапії хворих на екзему).
- Кутасевич Я.Ф., Джораева С.К., Мангушева В.Ю. Исследование состава микробиоты кожи и анализ ее антибиотикорезистентности у больных аллергодерматозами. Експериментальна і клінічна медицина. 2018. № 1 (78). С. 101–107 (Дисертантом проведено дослідження складу мікробіоти шкіри та проаналізовано її антибіотикорезистентність у хворих на алергодерматози).
- Особливості клінічних проявів атопічного дерматиту у пацієнтів з мутацією 2282del14 в гені філагрину / К.Є. Іщейкін, І.О. Олійник, С.К. Джораєва, І.В. Зюбан, В.Ю. Мангушева. Дерматологія та венерологія. 2018. № 2 (80). С. 19–25 (Дисертантом зроблено набір клінічного матеріалу та спостереження за хворими).
- Мангушева В.Ю. Дослідження вмісту інтерлейкину-17А у хворих на алергодерматози. Дерматологія та венерологія. 2018. № 3 (81). С. 17–21.
- Кутасевич Я.Ф., Білозоров О.П., Мангушева В.Ю. Дослідження поліморфізму гену тол-подібного рецептору 1 TLR-1-I602S у хворих на алергодерматози. Art of Medicine. 2018. Т. 3, № 7. С. 63–65 (Дисертантом проведено збір, статистичну обробку клінічного матеріалу та підготовку статті до друку).
- Кутасевич Я.Ф., Мангушева В.Ю. Оптимизация наружной терапии больных экземой. World Science. 2017. 4, Іss. 11 (27): С. 33–37.
- Research of certain pathogenic characteristics of clinical isolates of staphylococcus of skin biome / Y. Kutasevych, S. Dzhoraeva, V. Goncharenko, V. Mangusheva, Y. Sherbakova, N. Sobol, H. Shegoleva. EURECA: Нealth Science. 2018. № 2. С. 23–30 (Дисертантом проведено збір, статистичну обробку клінічного матеріалу та підготовку статті до друку).
- Пат. на корисну модель № 120805 UA, МПК A61K45/08, A61P17/00, A61P37/08. Спосіб лікування хворих на алергодерматози з порушенням мікробіоценозу кишечнику / Я.Ф. Кутасевич, І.О. Олійник, С.К. Джораєва, В.Ю. Мангушева. № u201701825; заявл. 27.02.17; опубл. 27.11.17, Бюл. № 22.
- Эффективность эфферентной терапии больных в лечении хронической экземы / Я.Ф. Кутасевич, И.А. Олейник, И.А. Маштакова, Р.К. Попова, В.Ю. Мангушева. Збірник робіт за матеріалами науково-практичної конференції «Дерматовенерологія в розробках молодих науковців», 19-20 листопада 2015 року, м. Київ. Дерматовенерологія. Косметологія. Сексопатологія. 2015. № 3–4 (2). С. 118–119 (Дисертантом проаналізована ефективність еферентної терапії в лікуванні хворих на хронічну екзему).
- Кутасевич Я.Ф., Олійник І.О., Мангушева В.Ю. Східчаста ентеросорбція в лікуванні хворих на поширені алергодерматози. Збірник робіт по матеріалам науково-практичної конференції «Сімейна медицина. Перспективи та шляхи подальшого розвитку». м. Львів, 13-15 квітня 2016 р. Львів, 2016. С. 84 (Дисертантом оптимізована схема лікування хворих на поширені алергодерматози).
- Особливості складу ценозів кишечника та шкіри у хворих на алергодерматози / Я.Ф. Кутасевич, І.О. Маштакова, С.К. Джораєва, В.Ю. Мангушева. Матеріали V ювілейного міжнар. мед. конгресу «Впровадження сучасних досягнень медичної науки у практику охорони здоров’я України», м. Київ, 19–21 квітня 2016 р. К., 2016. С. 84 (Дисертантом виявлені особливості складу ценозів кишечника та шкіри у хворих на алергодерматози).
- Мангушева В.Ю. Аналіз супутньої соматичної патології у хворих на хронічну екзему. Збірник робіт по матеріалам наук.-практ. конф. «Інноваційні досягнення в діагностиці інфекцій, що передаються статевим шляхом, інфекційних і грибкових захворювань та поширених дерматозів. Прогрес у лікуванні» VI міжнародного медичного конгресу, м. Київ, 25–27 квітня 2017 р. К., 2017, С. 163.
- Мангушева В.Ю., Джораева С.Н., Супрун К.Г. Особенности видового состава биотопа кожи у больных распространенными аллергодерматозами. Матеріали наук.-практ. конф. з участю міжнар. спеціалістів, присвяченого дню науки «Медична наука на перетині спеціальностей: сьогодення і майбутнє», м. Харків, 19 травня 2017 р. Харків, 2017. С. 71 (Дисертантом виявлено та проаналізовано особливості видового складу біотопу шкіри у хворих на розповсюджені алергодерматози).
- Мангушева В.Ю. Особенности клинических проявлений микробной экземы в области нижних конечностей. Матеріали науково-практичної конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», м. Харків, 10–11 листопада 2017 р. Дерматологія та венерологія. 2017. № 3 (77). С. 107.
- Мангушева В.Ю., Зюбан И.В. Особенности клинических проявлений атопического дерматита у пациентов с мутациями гена филаггрина. Наук.-практ. конф. молодих вчених, присвячена 25-рiччю Національної академії медичних наук України. Журнал Національної академії медичних наук України. 2018. Спеціальний випуск. С. 60 (Дисертантом особисто проведено збір та обробку даних, підготовлено статтю до друку).ЗМІСТ
| Перелік умовних позначень | 19 |
| Вступ | 20 |
| Розділ 1 Алергодерматози: сучасні уявлення про значення мікробіоценозу, імунопатогенезу та напрямки лікування | 26 |
| 1.1 Актуальність проблеми алергодерматозів | 26 |
| 1.2 Загальні уявлення про патогенез алергодерматозів | 28 |
| 1.3 Роль мікробіоценозу людини у виникненні алергодерматозів | 31 |
| 1.4 Актуальні питання імунопатогенезу алергодерматозів | 40 |
| 1.5 Сучасні принципи лікування алергодерматозів | 45 |
| Розділ 2 Матеріали та методи дослідження | 52 |
| 2.1 Методика загального обстеження хворих | 52 |
| 2.2 Мікробіологічні дослідження | 55 |
| 2.3 Визначення рівня інтерлейкіну-17А | 56 |
| 2.4 Визначення поліморфізму генів толл-подібних рецепторів | 56 |
| 2.5 Статистична обробка результатів дослідження | 57 |
| Розділ 3 Клінічна характеристика хворих на алергодерматози | 58 |
| 3.1 Загальна характеристика пацієнтів, що увійшли у дослідження | 58 |
| 3.2 Анамнестичні показники хворих на алергодерматози | 59 |
| 3.3 Вихідна вираженість окремих клінічних проявів та тяжкість алергодерматозів | 66 |
| Розділ 4 Мікробіоценоз основних біотопів хворих на алергодерматози | 83 |
| Розділ 5 Вміст інтерлейкину-17А в сироватці крові хворих на алергодерматози | 91 |
| Розділ 6 Результати дослідження поліморфізму гена TLR-1I602S | 94 |
| Розділ 7 Аналіз результатів лікування хворих на алергодерматози залежно від методу лікування | 98 |
| 7.1 Результати застосування ступінчастої сорбційної терапії у хворих на алергодерматози | 98 |
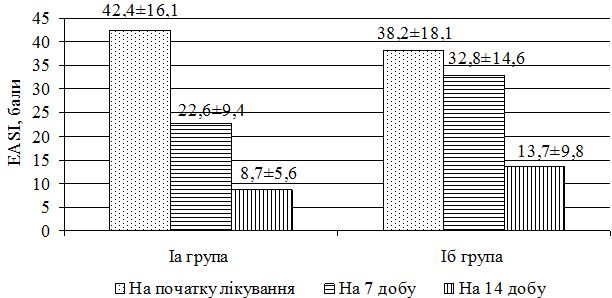
| 7.1.1 Динаміка клінічних проявів захворювання в процесі лікування | 100 |
| 7.1.2 Динаміка стану мікробіоценозу в процесі лікування | 111 |
| 7.1.3 Динаміка рівня інтерлейкіну-17A в процесі лікування | 114 |
| 7.2 Результати застосування етапної зовнішньої терапії у хворих на алергодерматози | 116 |
| 7.2.1 Динаміка клінічних проявів захворювання в процесі лікування | 118 |
| 7.2.2 Динаміка стану мікробіоценозу в процесі лікування | 130 |
| 7.2.3 Динаміка рівня інгтерлейкіну-17A в процесі лікування | 132 |
| Розділ 8 Аналіз та узагальнення результатів дослідження | 137 |
| Висновки | 156 |
| Рекомендації | 158 |
| Список використаних джерел | 159 |
| Додаток А Акти впровадження | 179 |
| Додаток Б Список публікацій здобувача за темою дисертації та відомості про апробацію результатів дисертації | 186 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
АД – атопічний дерматит
АМП – антимікробний пептид
ГКС – глюкокортикостероїди
ІЕ – істинна екзема
МЕ – мікробна екзема
ШКТ – шлунково-кишковий тракт
EASI – Eczema Area Severity Index
Ig – імуноглобулін
IL – інтерлейкін
IL-17A – інтерлейкін-17А
MBL – маноза-зв’язуючий лектин
MRSA – метицилін-резистентний S. аureus
NF-kB – ядерний фактор «каппа-бі»
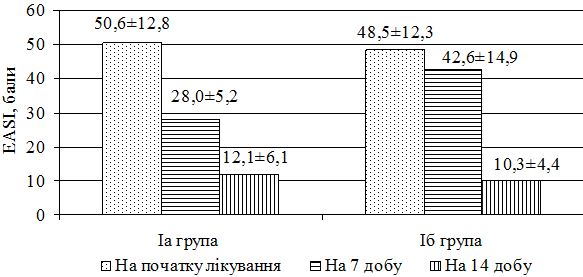
SCORAD – Scoring Atopic Dermatitis
TLR – толл-подібні рецептори
ВСТУП
Актуальність теми. Протягом останніх десятиліть у всьому світі спостерігається значне зростання захворюваності на алергічні захворювання, серед яких найбільш розповсюдженою патологією є алергодерматози. За даними епідеміологічних досліджень, розповсюдженість атопічного дерматиту (АД) серед дітей сягає 20 %, серед дорослих – 3 %, при цьому в окремих країнах вона зросла у 2–3 рази. Це стосується й інших алергічних захворювань шкіри [104, 111, 130, 153, 169]. Неухильне зростання поширеності алергодерматозів спостерігається й в Україні [12, 13, 23], при цьому, завдяки несвоєчасній діагностиці алергодерматозів, дані офіційної статистики значно менші, ніж справжня розповсюдженість цієї патології [67].
У патогенезі алергодерматозів провідне місце посідають порушення бар’єрної функції шкіри та імунопатологічні реакції [65, 69, 93, 100, 135, 179]. Значну роль в їх виникненні та розвитку відіграють порушення мікробіоценозу шкіри та інших біотопів організму людини [19, 49, 56, 71, 88, 99]. Співіснування макроорганізму та мікробіоти забезпечується різноманітними місцевими та системними механізмами. В останні десятиріччя їх вивченню присвячено багато досліджень [10, 11, 128, 150, 163, 177]. Зокрема, встановлено участь у розвитку імунопатологічних реакцій у хворих на алергодерматози прозапальних та протизапальних цитокінів [79, 84, 102, 141], а також значення толл-подібних рецепторів (TLR) у первинній детекції патогенних мікроорганізмів з наступною реалізацію ранніх механізмів вродженого імунітету [78, 82, 128]. Вроджені дефекти генів цих систем відіграють роль у розвитку алергодерматозів [16, 145, 146].
Але багато питань про взаємодію коменсальної та патогенної мікрофлори з окремими ланками імунної системи людини, тактика лікування алергодерматозів залежно від цих факторів залишаються не вирішеними та потребують подальшого вивчення [11, 22, 23]. Розуміння цих механізмів патогенезу алергодерматозів дозволить покращити вибір тактики лікування та його ефективність.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота є фрагментом науково-дослідної роботи ДУ «Інститут дерматології та венерології НАМН України» на тему: «Вивчити роль мутацій гену філагрину в порушенні епідермального бар’єру у хворих на хронічні дерматози і розробити методи корекції виявлених проявів» (номер держреєстрації 0117U000983), в якій дисертантом проаналізовані біологічні особливості мікрофлори, виявленої у хворих на алергодерматози, проведено аналіз молекулярно-генетичних складових патогенезу, а також розроблено методи лікування у хворих на алергодерматози.
Мета дослідження: підвищення ефективності лікування хворих на алергодерматози шляхом розробки комплексного методу терапії на підставі вивчення змін біоценозу шкіри та кишечника та імунного статусу.
Завдання дослідження:
- Вивчити особливості біоценозу шкіри у хворих на алергодерматози.
- Вивчити біологічні особливості мікрофлори, виявленої у хворих на алергодерматози. Визначити властивості та ферментативні особливості флори, що колонізує шкіру хворих на алергодерматози.
- Вивчити поліморфізм генів TLR, а також сироватковий рівень прозапального цитокіну інтерлейкін-17А (ІЛ-17А). З’ясувати їх участь у розвитку запалення у хворих на алергодерматози.
- Вивчити можливості та вдосконалити методи корекції порушень мікробіоценозу шкіри і кишечника шляхом ступінчастої сорбційної терапії у складі традиційного лікування.
- Вивчити динаміку біоценозу шкіри при використанні комбінованих зовнішніх препаратів і монопрепаратів, що містять кортикостероїди та протимікробні засоби. Розробити рекомендації щодо альтернативного методу комплексного зовнішнього лікування.
Об’єкт дослідження – алергодерматози (істинна екзема (ІЕ) та мікробна екзема (МЕ), атопічний дерматит).
Предмет дослідження – стан мікробіоценозу шкіри, кишечника та верхніх дихальних шляхів, поліморфізм гену TLR 1- I602S, рівень IL-17A, тяжкість захворювання за шкалою SCORAD у хворих на АД та EASI у хворих на екзему.
Методи дослідження: загальноклінічні (постановка діагнозу, визначення ступеня тяжкості перебігу дерматозу, контроль ефективності лікування), імуноферментні (визначення рівня IL-17А методом твердофазного аналізу за допомогою імуноферментного аналізатора), бактеріологічні (комплексна мікроскопічна та культуральна оцінка мікробіоценозу кишечнику, шкіри та верхніх дихальних шляхів), генетичні (визначення та аналіз поліморфізму гена TLR 1-I602S за методом поліморфізму довжини рестрикційних фрагментів за Johnson C. M.), статистичні (параметричні та непараметричні методи з використанням критеріїв Колмагорова-Смирнова, Ст’юдента і Фішера).
Наукова новизна отриманих результатів. Вперше встановлено особливості поліморфізму гену TLR1-I602S у хворих на алергодерматози. Зокрема визначено превалювання неактивних та малоактивних генотипів у хворих на АД та ІЕ, за виключенням хворих на МЕ при тяжкому її перебігу.
Показано, що вміст IL-17A в сироватці крові можна використовувати як маркер загострення алергодерматозів, а також він може слугувати показником оцінки ефективності терапії.
Доповнено уявлення про особливості біоценозу шкіри при різних алергодерматозах та дано характеристику біологічних особливостей і чутливості виділеної мікрофлори до антибактеріальних засобів на сучасному етапі.
Вперше вивчено динаміку біоценозу шкіри у хворих на алергодерматози в умовах проведення ступінчастої ентеросорбції.
Встановлено більш виражений вплив на розв’язання клінічних ознак захворювання та нормалізацію біоценозу шкіри при проведенні етапного зовнішнього лікування з використанням засобів антибактеріальної дії та топічних стероїдів порівняно з використанням комбінованих препаратів зовнішньої дії (фіксованих комбінацій подібного складу).
Практична значимість отриманих результатів. Розроблено ступінчастий метод ентеросорбції з використанням ентеросорбентів з різними властивостями, що дозволяє підвищити ефективність комплексної терапії хворих на алергодерматози.
Розроблено метод етапної зовнішньої терапії з використанням антибактеріальних засобів та топічних стероїдів.
Запропоновано використовувати рівень IL-17A в якості маркера загострення алергодерматозів і показника ефективності лікування.
Наукові результати дисертаційної роботи використовуються в практичній охороні здоров’я клініки ДУ «Інститут дерматології та венерології НАМН України», КНП «Харківський міський шкірно-венерологічний диспансер № 1» Харківської міської ради, КНП «Харківський міський шкірно-венерологічний диспансер № 2» Харківської міської ради, КЗОЗ Обласний клінічний шкірно-венерологічний диспансер № 1 (м. Харків), КУ «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради, Полтавського обласного клінічного шкірно-венерологічного диспансеру, а також у навчальний процес кафедри дерматології та венерології Одеського національного медичного університету. Назви установ наведені на момент отримання актів впровадження.
Особистий внесок здобувача. Автором самостійно проведено патентний пошук і виконаний огляд вітчизняної та зарубіжної літератури за тематикою дисертаційного дослідження, обґрунтовано актуальність дослідження, виконано формулювання мети дослідження і його завдань, розроблено дизайн дослідження, проведені аналіз і статистична обробка отриманих результатів, сформульовані висновки дисертаційної роботи. Дисертант особисто брав участь в обстеженні та лікуванні хворих, що увійшли у дослідження.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Дисертантом не були використані результати та ідеї співавторів публікацій. Конфлікту інтересів немає.
Апробація результатів роботи. Основні положення дисертаційної роботи були повідомлені та обговорювалися на науково-практичній конференції з міжнародною участю «Інноваційні технології в дерматовенерології. Міждисциплінарні зв’язки» (Харків, 2015), науково-практичній конференції «Стан та основні організаційні задачі дерматовенерологічної служби на сучасному етапі в Україні» (Київ, 2016), науково-практичній конференції «Новітні технології діагностичних, лікувальних та профілактичних заходів в дерматовенерології та методи і стан їхнього впровадження» (Харків, 2016), науково-практичній конференції молодих вчених дерматовенерологів «Розробки молодих вчених в сучасній дерматовенерології» (Харків, 2016), науково-практичній конференції VI міжнародного медичного конгресу «Інноваційні досягнення в діагностиці інфекцій, що передаються статевим шляхом, інфекційних і грибкових захворювань та поширених дерматозів. Прогрес у лікуванні» (Київ, 2017), науково-практичній конференції з участю міжнародних спеціалістів, присвяченій Дню науки «Медична наука на перетині спеціальностей: сьогодення та майбутнє» (Харків, 2017), науково-практичній конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом» (Харків, 2017), науково-практичній конференції молодих вчених інституту з міжнародною участю, присвяченій 25 річниці від дня заснування НАМН України «Новітні впровадження молодих вчених в сучасній дерматовенерології» (Харків, 2018), науково-практичній конференції молодих вчених НАМН України, присвяченій 25-рiччю Національної академії медичних наук України (Київ, 2018).
Публікації за темою дисертації. За темою дисертації опубліковано 16 друкованих праць, з них 6 – статті в наукових фахових журналах України (1 – в моноавторстві), 6 статей входять до міжнародних наукометричних баз Index Copernicus, Google Scholar, Ulrich’s Periodicals Directory, ResearchBib, Erih Plus, SIS, IIJIF, ROAD, «Наукова періодика України» Національної бібліотеки України ім. В.І. Вернадського, РІНЦ, 2 статті у закордонних виданнях, 7 тез доповідей. Одержано 1 патент України на корисну модель.
Структура і обсяг роботи. Дисертація викладена на 189 сторінках, складається зі вступу, огляду літератури, опису матеріалів та методів дослідження, 5 розділів власних досліджень, аналізу та обговорення отриманих результатів, висновків, рекомендацій, списку літератури, що містить 183 джерела (94 – кирилицею і 89 – латиницею), та двох додатків. Текст дисертаційної роботи ілюстрований 23 таблицями та 29 рисунками.
РОЗДІЛ 1
АЛЕРГОДЕРМАТОЗИ: СУЧАСНІ УЯВЛЕННЯ ПРО ЗНАЧЕННЯ МІКРОБІОЦЕНОЗУ, ІМУНОПАТОГЕНЕЗУ ТА НАПРЯМКИ ЛІКУВАННЯ
1.1 Актуальність проблеми алергодерматозів
Значне погіршення екологічних умов у містах, повсякденне використання різноманітних синтетичних сполук, погіршення якості води та їжі, застосування великої кількості фармакологічних препаратів призвело до значного зростання частоти алергодерматозів, які складають більше 80 % усіх алергічних захворювань [4, 90].
Про збільшення випадків дерматозів повідомляють дослідники з Італії, за даними яких з 2006 по 2012 рік кількість нових випадків АД у дітей зросла з 14,1 до 16,5 випадків, кропив’янки – з 10,1 до 11,6 випадків, контактних дерматитів – з 9,3 до 10,8 випадків на 1000 населення. Розповсюдженість АД зросла з 2,7 % до 8,5 %, хронічної кропив’янки – з 0,4 % до 0,8 % [105]. У Польщі на АД страждають від 4 % до 6,5 % населення (1,5–2,5 млн. осіб) [169]. У Німеччині розповсюдженість АД серед дітей у віці до 18 років у 2009 році становила 10,35 % [97], а кропив’янки в загальній популяції Німеччини складає 8,8 % [183]. За останніми даними, середня розповсюдженість кропив’янки у Німеччині серед дівчат старше 10 років становить 16,2 %, серед хлопчиків – 14,5 % [104]. В Ісландії захворюваність на екзему серед дорослих у 2007 році складала 7,1 % [121], хоча екологічні умови в цій країні найкращі у світі. В Англії захворюваність на екзему з 2001 до 2005 роки зросла з 9,58 до 13,58 випадків на 1000 населення, причому у 2005 році було виписано понад 13 млн. рецептів з цього приводу [166]. За даними найбільш великого епідеміологічного дослідження (International Study of Asthma and Allergies in Childhood – ISAAC), розповсюдженість АД серед дітей становить 15–20 %, а у дорослих – 1–3 %. За останні десятиліття вона зросла в індустріальних країнах у 2–3 рази [111, 153]. Окремі автори вважають, що АД виявляється майже у 10–30 % осіб у загальній популяції [135].
В Україні також поширеність хвороб шкіри протягом останніх років зростає. З 1999 по 2006 роки вона зросла на 13,1 % (з 4214,9 до 4851,1 на 100 000 населення) [12]. За даними Центру медичної статистики МОЗ України, у 2014 році кількість нових випадків захворювань шкіри та підшкірної клітковини складала 3659 випадків на 100 000 населення, а поширеність цієї патології – 4427 на 100 000 населення [85]. Ще більш вражаючі тенденції спостерігаються серед дітей та підлітків. Поширеність шкірних хвороб серед дітей і підлітків в Україні та захворюваність на них (на 100 000 дитячого населення) з 2001 по 2011 роки збільшилися на 5,4 % та 62,0 %, відповідно, у тому числі АД – на 69,7 % (в Харківській області на 100,3 %) та 60,6 %, відповідно. Збільшилася частота тяжких, рефрактерних форм АД [13].
Але, на думку Б.М. Пухлика (2013), розповсюдженість алергічних захворювань в Україні оцінити дуже складно, тому що дані офіційної статистики не охоплюють усіх алергічних захворювань, а ті, що наводяться, в десятки разів нижчі за аналогічні світові показники. За його оцінкою приблизна розповсюдженість АД у дітей становить 5–9 %, у дорослих – 2–4 %, хронічної кропив’янки – 2–3 % та 3–5 %, відповідно; контактного дерматиту – 0,1–0,2 % та 0,5–1,0 %, відповідно. При цьому своєчасно виявляється до 30 % випадків АД та до 10–15 % випадків кропив’янки [67].
Наявність дерматозів значно погіршує якість життя, завдяки їх клінічним проявам, необхідності звертання за медичною допомогою та застосування лікарських засобів [178, 183]. Крім цього, ці захворювання мають негативний вплив і на економіку держави. За даними аналізу економічних збитків, пов’язаних з АД, у США щорічні прямі витрати сягають 364 млн., а з урахуванням непрямих витрат – 3,8 млрд. доларів [148].
Усе вищевикладене пояснює зростаючий інтерес до алергодерматозів, зокрема, до невирішених проблем етіопатогенезу, методів профілактики та лікування.
1.2 Загальні уявлення про патогенез алергодерматозів
До алергодерматозів відносять АД, токсикодермії, екзему, алергічний дерматит, кропив’янку, контактний дерматит та ангіоневротичний набряк [1]. Слід відмітити існуючу неузгодженість термінології щодо алергодерматозів. На думку групи дослідників із США та Німеччини, терміни «атопічний дерматит», «атопічна екзема» та «екзема» використовуються для визначення схожої патології. Автори вважають, що для уніфікації підходів більш правильним буде застосування одного терміну – «атопічний дерматит», який в останні роки найчастіше застосовується в наукових публікаціях [129].
Цю групу захворювань поєднує провідна роль в їх розвитку алергічних реакцій негайного або сповільненого типу зі специфічними ураженнями шкіри на фоні системних порушень, пов’язаних з імунними розладами внаслідок поєднаного впливу спадкових факторів і навколишнього середовища [1, 5].
У структурі хронічних дерматозів АД посідає одну з лідируючих позицій. Високий рівень захворюваності АД, його дебют у ранньому віці, безперервно рецидивуючий перебіг патологічного процесу при наявності тенденції до збільшення стійких до традиційної терапії форм, зниження прихильності пацієнтів до лікування надають проблемі АД особливої актуальності [111, 153].
Значну роль у виникненні АД та його прогресуванні відіграють фактори зовнішнього середовища. Має значення підвищення концентрації хімічних сполук у повітрі в екологічно поганих умовах, контакт шкіри з металами, деякі інгредієнти косметичних засобів та ін. Дискутується значення харчових домішок, які розглядаються як можливі тригери загострень алергодерматозів [134].
АД часто асоціюється з іншими алергічними захворюваннями, хронічною патологією шлунково-кишкового тракту (ШКТ) та серцево-судинних захворюваннями. Ці супутні захворювання можуть виникнути в результаті хронічного запалення шкіри або бути певним імунологічним фоном, який призводе до імунних відхилень. Імунологічні розлади можуть призвести до зниження резистентності шкіри до факторів зовнішнього середовища [179].
Головними факторами патогенезу вважають порушення бар’єрної функції шкіри, алергічну реакцію, порушення імунних механізмів і мікробне забруднення, які активуються під впливом алергічних та неалергічних тригерів захворювання. Але основним фактором є дисфункція Т-клітинної ланки імунної системи з переважанням Th2-лімфоцитів [65]. Крім цього, у процесах активації імунних реакцій при АД має значення сенсибілізація до антигенів рослинного пилку, антигенів кліща домашнього пилу, антигенів білків S. aureus та Malassezia spp. Активно вивчається роль аутоалергічних реакцій [122]. Значну роль також має сенсибілізація до лікарських засобів, яка була виявлена у 10,5 % хворих на АД та у 38 % хворих на екзантематозні висипи та кропив’янку [81]. Неконтрольований прийом лікарських препаратів є причиною кропив’янки, а деякі медикаменти зовнішнього застосовування – контактного алергічного дерматиту [90].
При вивченні індивідуального та сімейного анамнезу у дітей, хворих на АД, прояви алергії в сім’ї виявлено у 88 % дітей, у 44 % дітей виявлено патологію органів травлення, зокрема, дискінезію жовчовивідних шляхів та панкреопатії. У 66 % дітей діагностовано різноманітні інфекційні ураження, у тому числі стрептококові та стафілококові ураження шкіри та слизових оболонок [45].
Загалом, найактивніше обговорюються дві гіпотези його формування. Згідно однієї з них, яка визначається як inside-outside (зсередини-ззовні), початковою ланкою в патогенезі даного захворювання є порушення внутрішніх процесів в організмі з проявами на шкірі, які вважаються «верхівкою айсберга». Вони обумовлені генетичними дефектами, які ведуть до аномалій імунної відповіді, зокрема надлишкової імуноглобулін (Ig) E-реакції або дисбалансу між субпопуляціями Т-хелперів. Первинні імунологічні порушення в ранніх стадіях із переважанням Th2-імунітету з підвищенням продукції прозапальних цитокінів (інтерлейкінів (IL) -4, -5, -13) та Ig E, а у хронічній стадії з превалюванням Th1 ланки імунітету. Тобто, первинними є імунологічні порушення, які потім призводять до запалення шкіри та ураження епідермального бар’єру [112].
Інша гіпотеза, відома як outside-inside (ззовні-всередину), віддає провідну роль стану епідермального бар’єру, порушення якого призводять до розвитку АД. При цьому уражений епідермальний бар’єр дозволяє алергенам проникати через шкіру і реалізувати свою дію через антигени, які впливають на імунні клітини-ефектори. Генетично обумовлений дефіцит філагрину, який забезпечує механічну стійкість кератинових філаментів та вологість шкіри за рахунок продуктів його метаболізму, є однією з причин розвитку АД. Але цей дефект спостерігається лише у 30 % хворих на АД [135].
У всіх хворих на алергодерматози спостерігається пригнічення Т‑клітинної ланки імунітету, зростання активності гуморального імунітету, зменшення активності загального комплементу, підвищення кількості циркулюючих імунних комплексів, інтенсифікація процесів ендотоксикозу, а також посилення процесів деструкції сполучної тканини. Ці процеси знаходились у прямій залежності від активності алергодерматозу [2].
В останні роки отримано докази, що причиною АД є поєднання генетичних та екологічних факторів. Серед генетичних факторів відомі мутації генів, що відповідають за стан бар’єрної функції шкіри, зокрема, філаггрину, та за формування вродженого та адаптивного імунітету. Значну роль відіграють також епігенетичні зміни, пов’язані з дією факторів зовнішнього середовища, а також з особливостями сучасного життя. Автори вважають, що встановлення генетичних та епігенетичних варіантів АД може бути основою для індивідуалізації тактики лікування [123, 143].
Імунопатогенез АД пов’язаний з порушенням Т-хелперної ланки імунітету, продукції цитокінів та їх специфічних рецепторів [149]. При вивченні показників клітинного та гуморального імунітету встановлено, що в стадії ремісії грубих відхилень не спостерігалося, але у 20 % дітей виявлено еозинофілію, зниження рівнів Ig А та Ig G при нормальному рівні Ig М, підвищення Ig Е спостерігалося лише у 40 % хворих [45]. У хворих на хронічні дерматози виявлено морфологічні та функціональні порушення клітинного і гуморального імунітету, зокрема, еозинофілію, лімфоцитопенію, підвищення кількості CD4 зі зниженням CD8, пригнічення міграції лейкоцитів, зниження концентрації Ig A та Ig G з підвищенням Ig E та інші, які сприяють розвитку імунопатологічних реакцій та обтяжують перебіг захворювань шкіри [3].
Загалом, слід відмітити, що патогенез алергодерматозів, у тому числі АД є багатофакторним за участю різноманітних системних та місцевих механізмів, які в кінцевому підсумку призводять до ураження шкіри. Серед цих факторів найважливішу роль відіграє мікробіоценоз людини та механізми співіснування та захисту макроорганізму від можливого патогенного впливу мікрофлори.
1.3 Роль мікробіоценозу людини у виникненні алергодерматозів
У забезпеченні захисту організму від біологічних факторів зовнішнього середовища значну роль відіграє нормальна (коменсальна, резидентна) мікрофлора. Величезна кількість різноманітних популяцій мікроорганізмів, які знаходяться на шкірі, на епітелії слизової оболонки верхніх дихальних шляхів, шлунково-кишкового та урогенітального тракту, складають нормальний мікробіоценоз, або мікробіоту організму [19]. Якісний та кількісний склад мікробіоти в нормі є відносно постійним та складається на 90 % з облігатної мікрофлори, 9,5 % – є факультативними та 0,5 % – транзиторними мікроорганізмами. Із загальної кількості мікрофлори в організмі людини на шкірі знаходиться до 18–29 %, до 40 % – у ШКТ, до 35 % – у ротовій порожнині та ротоглотці, та до 10 % – в урогенітальному тракті та зовнішніх статевих шляхах [6].
Мікрофлору представляють чотири основних групи мікроорганізмів – Firmicutes, Actinobacteria, Bacteroidetes та Proteobacteria [99]. Видовий склад коменсальної флори шкіри є неоднорідним на її окремих ділянках та залежить від кількості сальних та потових залоз, волосяних фолікулів, анатомічних особливостей та ін. Наприклад, на вологій шкірі в пахвовій ділянці кількість мікроорганізмів сягає 107/см2, на сухій шкірі передплічь – 102/см2 [99]. Вони утворюють специфічні для кожної локалізації екосистеми, які знаходяться у тісній взаємодії з макроорганізмом та беруть участь у забезпеченні біохімічної, метаболічної та імунної рівноваги в організмі людини та створюють захисний бар’єр проти патогенної мікрофлори [75, 170].
Механізмам захисної дії коменсальної мікрофлори присвячена значна кількість досліджень [6, 99, 115]. Встановлено, що мікроорганізми-коменсали виробляють бактеріоцини і токсичні метаболіти, які діють аналогічно антимікробним пептидам (АМП) шкіри та пригнічують патогенні мікроорганізми. Наприклад, основний представник нормальної мікрофлори – S. epidermidis виробляє фенол-розчинні модуліни, які мають бактеріцидну активність до патогенів – S. aureus, Streptococcus A та Escherichia coli. До бактеріоцинів також належать епіланцин К7, епіланцин 15х, стафілококцин 1580 та ін., які відносяться до лантобіотиків [99, 115]. Крім цього, встановлено, що фенол-розчинні модуліни підвищують активність АМП, які виробляються кератиноцитами шкіри – кателіцидину та β-дефензинів [115]. Інший захисний механізм від дії патогенів – бактеріальний конфлікт, завдяки якому мікроорганізми-коменсали конкурують з патогенними мікроорганізмами за живильні речовини та рецептори. Наприклад, S. epidermidis зв’язується з рецепторами кератиноцитів, блокуючи адгезію до них S. aureus [84].
Коменсали, як й інші мікроорганізми, спроможні створювати біоплівки за допомогою факторів адгезії, які підвищують їх резистентність до ушкоджуючих факторів, так званий «Quorum Sensing») («відчуття кворуму») [6, 99]. При цьому, окремі штами S. epidermidis, які секретують серин-протеази Esp, інгібують створення біоплівки S. aureus та перешкоджають їх колонізації [99, 115, 126]. Крім S. epidermidis антагонізм до S. aureus також мають Corynebacterium spp., у присутності яких також пригнічується колонізація S. aureus [128].
Мають значення й імунотропні ефекти коменсальної мікрофлори, які реалізуються специфічними компонентами мікробної клітини та продуктами їх життєдіяльності. Ці компоненти здатні активувати фагоцитарну активність макрофагів, моноцитів і гранулоцитів, Т- і В-ланку вродженого та адаптивного імунітету. У свою чергу, компоненти імунної системи людини, розташовані на слизових оболонках та шкірі, мають регуляторні протизапальні механізми, які забезпечують резистентність макроорганізму до антигенів коменсальної мікрофлори. Порушення якісного та кількісного складу мікробіоценозу або захисних механізмів макроорганізму призводить до різноманітних захворювань інфекційної та неінфекційної етіології [75, 84, 170].
Порушенням мікробіоценозу сприяють особливості харчування, наявність ожиріння та метаболічного синдрому, цукрового діабету та інших факторів. Так, при збагаченні їжі жирами збільшується кількість грамнегативної флори [72]. На стан мікробіоценозу шкіри впливають й антропогенні фактори зовнішнього середовища. Виявлено, що у жителів антропогенно навантажених міст збільшувалося загальне мікробне обсіменіння переважно за рахунок коагулазопозитивного стафілококу зі зменшенням біфідобактерій та лактобактерій у калі, а також із збільшенням патогенного стафілококу та гемофілів у ротоглотці [71]. Інші автори при вивченні якісного та кількісного складу мікробіоценозу ротової рідини і калу у практично здорових підлітків різних вікових груп у більшості випадків виявили зниження кількості індигенної мікрофлори та збільшення умовно-патогенних мікроорганізмів – Staphylococcus, Bacillus і Candida [56].
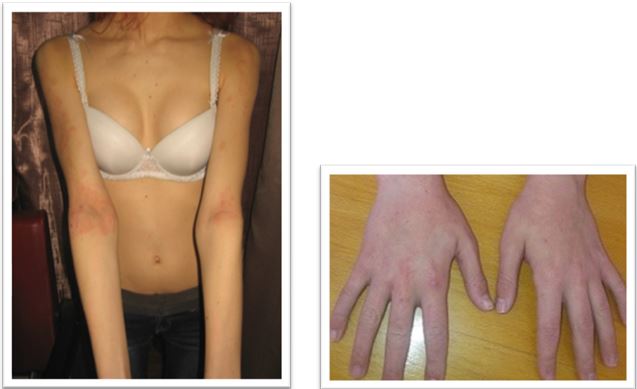
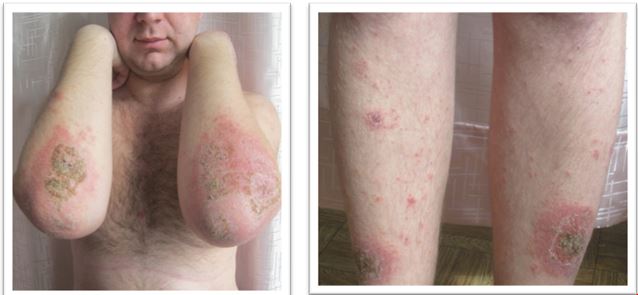
Значні зміни мікробіоценозу спостерігаються у хворих з ураженнями шкіри. Так, у хворих на поширені дерматози виявлено зміни якісного і кількісного видового спектру мікроорганізмів з появою в осередках ураженої шкіри S. haemolyticus, підвищення кількості Corynebacterium spp., Micrococcus spp., S. hominis, S. capitis, S. aureus на фоні зниження або підвищення S. epidermidis порівняно з осередками здорової шкіри тих же хворих [80]. Встановлено, що переважний вплив на характер перебігу АД надає колонізація шкіри хворих патогенними і умовно-патогенними мікроорганізмами, що ускладнюється інфекціями, спричиненими токсигенними штамами S. aureus, грибами роду Malassezia, дріжджоподібними грибами роду Candida, міцеліарними дерматофітами, вірусом простого герпесу та ін. [29]. Виявлено суттєві порушення мікробіоценозу шкіри у хворих на вугрову хворобу, які зростали зі збільшенням тяжкості захворювання [14].
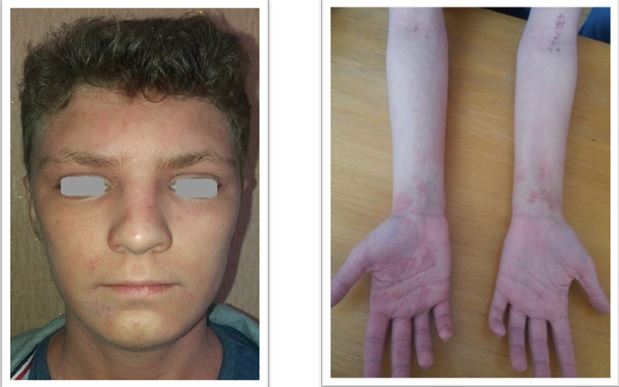
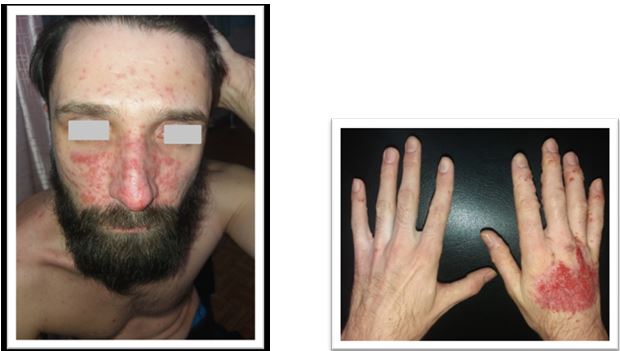
У результаті дослідження зішкребів уражених ділянок шкіри у хворих на АД S. аureus і S. еpidermidis були ідентифіковані у 37,50 % випадків, у 9,52 % випадків виявлялися дріжджоподібні гриби роду C. albicans у колонізації більше 104 КОЕ/см2, Malassezia spp., міцеліальних дерматофітів (Trichophyton spp., Epidermophyton spp.), а у 35,12 % – встановлено колонізацію шкірних покривів асоціацією стафілококів і грибів. У структурі ізольованої стафілококової колонізації шкірних покривів відзначено переважання S. aureus (54,76 %), S. epidermidis (38,69 %), асоціацію S. aureus і S. epidermidis (6,55 %) [6]. Слід зазначити, що при АД превалювання S. aureus визначається як на ураженій шкірі, так і на її інтактних ділянках [88].
Встановлено, що ступінь колонізації шкіри S. aureus прямо корелює з тяжкістю перебігу дерматозів. У засіві з осередку в усіх пацієнтів з поширеними дерматозами домінували мікроорганізми роду Staphylococcus (65,0 %), а саме: S. aureus (22,7 %), S. haemolyticus (15,9 %), S. еpidermidis (13,6 %), S. warneri (9,1 %), S. cohnii (6,8 %) та S. saprophyticus (4,6 %). При відсутності дерматозів також переважали стафілококи, але у більшості це були S. еpidermidis (82,5 %), менш часто висівалися S. haemolyticus (5,0 %), S. aureus (2,5 %) та інші (10,0 %) [20]. В іншому дослідженні встановлено, що мікробіоценоз шкіри хворих на АД був представлений S. aureus (62,5 %), S. capitis (25,0%), S. epidermidis (50,0 %) S. hominis (8,3 %), S. saprophyticus (10,8 %), Candida albicans (79,6 %), що перевищувало аналогічні показники здорових осіб (окрім S. epidermidis) [21]. Це узгоджується з даними інших дослідників, згідно з якими при АД на уражених ділянках шкіри переважають стафілококи та значно знижується мікробне різноманіття. Порушення мікробіоценозу шкіри дозволяє вважати, що дисбактеріоз є станом, характерним для АД [162]. Слід зазначити, що S. aureus висіваються зі шкіри здорової людини, але у кількості до 102 КУО/см2 [6], та лише у 5 % випадків [132, 142], а з уражених ділянок шкіри хворих на АД – у 80–95 % [103, 168].
- S. aureus також є коменсальним мікроорганізмом, який колонізує 25–30 % людської популяції, водночас, він є головною причиною інфекційних захворювань шкіри та підшкірної клітковини, але може уражати й інші тканини людського організму [128]. Основним місцем колонізації є епітелій порожнини носу, де кількість мікроорганізмів сягає 104–105 КУО/см2, але також він може локалізуватися внутрішньоклітинно в ендотеліальних та епітеліальних клітинах, фібробластах, кератиноцитах та фагоцитах [117].
Звертає на себе увагу також факт присутності патогенного штаму метицилін-резистентного S. аureus (MRSA) на шкірі дітей, хворих на АД, який був виявлений у 58,2 % випадків. При цьому, встановлено пряму кореляційну залежність частоти виділення MRSA штамів (r = 0,68) та ступеня обсіменіння шкіри (r = 0,54) з тяжкістю АД (за індексом SCORAD) [57].
До складу нормального мікробіоценозу також входять стрептококи, які завжди присутні у ротоглотці, ШКТ, на шкірі та ін. При порушеннях імунітету стрептококи також можуть призводити до розвитку захворювань, зокрема, псоріазу [28].
Крім зміни мікробіоти шкіри у хворих на АД у 32,74 % випадків визначається ізольована колонізація дріжджоподібними грибами роду C. albicans, рідше міцеліальними дерматофітами, Malassezia spp., плісеневими грибами роду Penicillium, Aspergillus, Cladosporium та Alternaria, а також асоціації декількох видів грибів у 25,0 %. Автори встановили, що у дітей раннього віку переважала стафілококова колонізація шкіри, а у старшій віковій групі – грибкова інфекція, також встановлено почастішання випадків бактеріально-мікотичної флори при рецидивуючому перебігу АД [5, 6].
Встановлено, що колонізація Malassezia у здорових людей сягає 78 %. Хворі на АД були колонізовані в усіх випадках, при цьому M. globosa та M. restricta виявлені у 90 %, M. furfur та M. sympodialis – у 49 % хворих [167]. За іншими даними, Malassezia виявлялася у 51,7 % хворих на АД. Домінували M. sympodialis. Найбільша колонізація була на шкірі голови (66,7 %), спостерігалася різниця колонізації між ураженою та неураженою шкірою, але не виявлено залежності від тяжкості захворювання [181].
При алергодерматозах спостерігаються зміни мікробіоценозу не тільки шкіри, але й ШКТ. В екосистемі кишечника людини домінують Bacteroidetes і Firmicutes, частка яких сягає 90 % усіх мікробів, 10 % мікробіоти представлено Actinobacteria, Proteobacteria, Verrucomicrobia і Fusobacteria [119]. Сапрофітна флора забезпечує колоніальну резистентність біотопу кишечника, зокрема, біфідобактерії та лактобактерії виділяють молочну, оцтову кислоти, інші речовини, які пригнічують надмірне розмноження умовно-патогенної мікрофлори та перешкоджають розвитку в слизовій патогенних мікробів. Крім цього, компоненти їх клітинної стінки активують систему імунної відповіді, що призводить до запуску адаптивних механізмів імунного захисту. Наприклад, біфідобактерії стимулюють клітинну ланку імунітету та синтез імуноглобулінів [46]. Лактобактерії сприяють зменшенню всмоктування алергенів у кишечнику та стимулюють синтез Ig А, які є антитілами проти харчових алергенів [61]. Більшість мікрофлори присутня в кишечнику у вигляді багатошарової біоплівки, а продукти життєдіяльності мікроорганізмів та їх розпаду потрапляють у хімус та в системний кровоток, призводячи до сенсибілізації до мікробних антигенів [21].
У пацієнтів з екземою в усіх випадках було виявлено порушення біоценозу товстої кишки зі зниженням облігатної флори (біфідобактерій, лактобактерій, непатогенних ешерихій) та збільшенням факультативної та облігатної мікрофлори (клебсієл, клостридій, грибків, кишкової палички з гемолітичними властивостями та S. aureus) [72]. Ці результати співпадають із результатами інших досліджень, згідно з якими у хворих на АД у всіх випадках був виявлений дисбіоз: І ступеня – у 17,4 %, ІІ – у 30,43 %, ІІІ – у 52,17 % пацієнтів. Кишкова мікрофлора характеризувалася масивним зростанням умовно-патогенної мікрофлори: Enterobacter agglomerans, Escherichia coli (hem+, hem-), Klebsiela pneumoniae, Proteus mirabilis, S. aureus, S. epidermidis. [21]. При цьому встановлено, що органічна патологія ШКТ зустрічається у 47 % дітей та у майже всіх дорослих пацієнтів з АД (у тому числі, дискінезії жовчних шляхів, хронічний гастродуоденіт, панкреатит, дисбіоз) [21]. Коморбідна патологія ШКТ характерна й для іншої дерматологічної патології [62, 86].
Колонізація кишечника патогенними і умовно-патогенними бактеріями спричиняє не тільки порушення кишкового мікробіоценозу, але й сприяє функціональним порушенням органів ШКТ. Поряд із дефіцитом лактобактерій і біфідобактерій спостерігається надлишкове зростання S. aureus, патогенних видів E. coli та грибків роду Candida. У свою чергу, умовно-патогенна мікрофлора спричиняє імунопатологічні реакції, зокрема окремі штами S. aureus виробляють токсини з властивостями суперантигенів. Ці фактори значно обтяжують перебіг АД [15, 46, 145, 146].
На думку Т.О. Литинської (2015), гастродуоденальна патологія за участю Helicobacter pylori є патогенетичним чинником псоріазу, екземи істинної та інфекційної, яка негативно впливає на перебіг дерматологічної патології [48].
Іншим доказом значущості мікробіоценозу ШКТ у розвитку уражень шкіри є наявність дисбіозу товстої кишки із субклінічним або латентним перебігом у всіх хворих на піодермію, причому тяжкість піодермії зростала разом із вираженістю дисбіозу [18]. Склад кишкової мікрофлори впливає на регуляторні властивості В-клітин, які відіграють роль у перебігу автоімунних реакцій [96].
Взаємодія коменсальної мікрофлори з макроорганізмом залежить від особливостей бар’єрної функції, зокрема унікальною властивістю шкіри є наявність рогового шару, який захищає макроорганізм від проникнення мікрофлори, а його порушення спричиняє зміни мікробіоценозу [160]. У той же час, не виявлено асоціації колонізації S. аureus верхніх дихальних шляхів та калу з порушенням бар’єрної функції шкіри [100].
Таким чином, роль порушень мікробіоценозу будь-якої локалізації в патогенезі різноманітної патології можна вважати доведеним фактом, але вивчення конкретних механізмів впливу мікробіоти на локальні та системні реакції макроорганізму досі є актуальним.
Будь-яка мікрофлора або має антигени у своій структурі, або вони утворюються в процесі життєдіяльності, і при відсутності відповідного захисту становляться факторами вірулентності або патогенності. Вірулентні фактори є штам-специфічними, але можуть змінюватися у межах одного роду в результаті міжвидової взаємодії, або в результатів адаптації до захисних факторів макроорганізму [20]. У стафілококів – це фактори адгезії, білки антифагоцитарної активності, внутрішньоклітинні ферменти та ін. [5, 65, 84], які обумовлюють коагулазну, лецитиназну, гемолітичну та ліпазну активності [20]. Відмічено різницю між фагомозаїкою уражених та неуражених ділянок шкіри у хворих на дерматози. Частота генів токсиноутворення (ентеротоксинів) серед S. aureus становила 86,7 %, у коагулазонегативних штамів – 13,3 % [87].
З наявністю факторів адгезії до фібронектину, ламеліну, фібриногену та інших рецепторів епідермісу шкірі хворих на АД пов’язують збільшення колонізації S. aureus [84]. Ці фактори також обумовлюють формування фолікулярних структур між клітинами S. aureus і клітинами рогового шару епідермісу, що призводить до утворення бактеріальної біоплівки, яка є одним із механізмів антибіотикорезистентності мікроорганізмів [5, 57].
Поряд із підвищенням адгезивних властивостей у стафілококів, які колонізують шкіру пацієнтів у період загострення АД, виявлено високу активність ферментів поширення (протеїнази і термонуклеази) і ферментів антиоксидантного захисту (каталази і супероксиддисмутази), що, на думку авторів, обумовлює тяжкість перебігу захворювання та сприяє розвитку резистентності до проведеної терапії [154].
Особливе місце в ініціації запалення мають екзотоксини S. aureus – ентеротоксин А, ентеротоксин В, ексфоліативний токсин та TSST1. Ці суперантигени продукують майже 80,0 % штамів S. aureus. Вони спричиняють запальні реакції у шкірі за рахунок активації моноцитів і лімфоцитів, які у відповідь на це виробляють прозапальні цитокіни [65, 84, 103, 106, 168].
Приєднанню вторинної інфекції у хворих на АД сприяє руйнування епідермального бар’єру. Серед тригерів активації мікробної флори у хворих на АД особливу роль відводять дефектам генів, відповідальних за формування епідермального бар’єру. Причиною епідермальної дисфункції вважають порушення проліферації та диференціювання епідермісу, в тому числі зміни в кератиноцитах і білках рогового конверта, зокрема, інволюкрину, лорикрину та філагрину [6, 116, 155]. Вважається, що однією з причин розвитку АД є спадкове порушення функції філагрину, завдяки чому знижується концентрація урокаїнової кислоти та піролідону карбонової кислоти, які спроможні інгібувати S. aureus [128].
Слід відмітити, що кератиноцити здатні розрізняти коменсали від патогенів шляхом диференційованої індукції АМП. Коменсали секретують фактори, які індукують експресію β-дефензину-3 та RNase7 кератиноцитами шляхом зв’язування TLR-2 та рецептор епідермального фактору роста, а також активації ядерного фактору «каппа-бі» (NF-kB), що індукує експресію АМП на низькому рівні, достатньому, щоб обмежити колонізацію патогенною мікрофлорою. Патогенні фактори S. аureus активують мітоген-активовані протеїнкінази і фосфатидилінозитол-3-кіназу та пригнічують активацію NF-kB. При цьому, рівень експресії AMП, індукований коменсалами шкіри, занадто малий, щоб вплинути на їх виживання, у той час як рівень експресії AMП, спричиненої S. аureus, може знищити патогени, але не впливає на коменсальну флору. На думку авторів, це свідчить про те, що для коменсальних та патогенних мікроорганізмів характерні специфічні механізми, які модулюють уроджений імунітет шкіри [177].
Крім цього, відомо, що шкіра є найбільшим нейроендокринним органом людини. Основним нейропептидом шкіри є субстанція Р. Її вважають головним медіатором нейрогенного запалення шкіри та свербежу. Французькі дослідники в експерименті in vitro доказали, що субстанція Р не тільки модулює запалення та імунну відповідь, впливає на кератиноцити та себоцити, але й має прямий вплив на мікроорганізми, підвищуючи їх вірулентність [150]. До захисних факторів, які експресуються кератиноцитами, також відносять РНКази, зокрема, RNase 7. Встановлено, що рівень експресії RNase 7 підвищується у хворих на АД порівняно зі здоровими людьми, що, ймовірно, пов’язано з колонізацією шкіри у цих хворих S. аureus [163].
Цілісність рогового і ліпідного конвертів здебільшого залежить від функціонування «коктейлю» з протеїназ та їх інгібіторів. Дією екзогенних протеїназ, які запускаються S. aureus, активно руйнується епідермальний бар’єр. У свою чергу, подальшому проникненню вторинної інфекції в шкіру хворих АД сприяє і порушення складу ліпідів шкіри, перш за все, за рахунок зниження вмісту фосфоліпідів, у значній мірі керамідів, дефіциту лінолевої кислоти, а також зміни секреції сальних і потових залоз і зрушення рН шкіри в бік алкалозу [127, 157].
Також у патогенезі АД доведено роль ендогенних АМП, а їх недостатня продукція визначена як ключовий чинник для розвитку інфекційних ускладнень [128, 159, 182]. У шкірі хворих на АД відзначається дисбаланс експресії АМП – дефензину (HNP 1-3), кателіцидину і секреторного інгібітору протеїнази лейкоцитів, що також сприяє приєднанню вторинної інфекції, що підсилює симптоми АД [57].
Таким чином, порушення бар’єрної функції шкіри призводить до приєднання вторинної інфекції, і, навпаки, патогенне мікробне забруднення ще більш підсилює порушення шкірного бар’єру.
1.4 Актуальні питання імунопатогенезу алергодерматозів
На особливу увагу заслуговують імуногенетичні порушення, які спостерігаються у хворих на АД. Цьому аспекту патогенезу захворювання в останні роки присвячено багато досліджень.
Імунну відповідь при АД можна розділити на дві фази – гостру і хронічну. Гостре запалення характеризується підвищеною активністю Th2 відповіді: експресією IL-4, IL-5 і IL-13, зниженням вироблення інтерферону-γ і підвищенням рівня загального і специфічного Ig E. На противагу цьому хронічне запалення характеризується підвищеною активністю Th1-відповіді, яка включає збільшення виробництва IL-12 макрофагами й еозинофілами, а також підвищення рівня маркерів хронічного запалення шкіри, таких як IL-5, -8 і інтерферон-γ. Протизапальні цитокіни IL-4 і -13 спільно з IL-5 стимулюють виробництво Ig E і міграцію еозинофілів у осередок запалення. Останнім часом було описано роль нових цитокінів, включаючи IL-16, -17, -21, -22, -23, -27, -31, -33, -35 і тимуса стромального лімфопоетину в імунопатогенезі АД [84]. Сенсибілізація хворих до аероалергенів відбувається через шкіру, для харчових алергенів – через ШКТ, але можлива також через шкіру [141].
За експериментальними та клінічними даними датських дослідників, у хворих на АД із дефіцитом філагрину спостерігається підвищення кількості клітин Th17, які продукують IL-17, у периферичній крові [102]. Th17, які експресують IL-17 та -22, відіграють важливу роль у розвитку захисних імунних реакцій, алерген-специфічних імунних реакцій, а також у процесах проліферації кератиноцитів. Зокрема, IL-17 індукує продукцію деяких цитокінів, хемокінів і антимікробних пептидів кератиноцитами. Th17 мають значення в патогенезі псоріазу, АД, токсидермій та інших гострих та хронічних захворювань [125, 137, 171].
Бактерії мають у своєму складі або секретують так звані патоген-асоційовані молекулярні патерни, які специфічно розпізнаються рецепторами системи вродженого імунітету, зокрема, TLR та внутрішньоклітинними нуклеотид-зв’язаними та олігомеризуючими доменами, а також маноза-зв’язуючими лектинами (MBL), які належать до системи комплементу. Останні зв’язуються з патогенами, призводячи до опсонізації для наступного фагоцитозу бактерій [128]. Дослідження TLR виявили їх ключову роль у детекції патогенних мікроорганізмів, які вторгаються в бар’єрні тканини людини, і реалізації ранніх механізмів природженого імунітету [78, 82].
TLR мають важливе значення для нашого імунного захисту проти мікробних інфекцій, активуючи клітинний імунітет. Відомо 13 TLR ссавців, які охоплюють абревіатурами від TLR1 до TLR13, що зв’язують різні ліганди і продукуються в організмі різними типами клітин. У людини існують 10 TLR. Вони експресуються на мембранах вроджених імунних клітин (дендритних клітинах, макрофагах, природних кілерів), адаптивних клітин імунітету (Т- і В‑лімфоцитах) і неімунних клітинах (епітеліальних та ендотеліальних клітинах). TLR, що розпізнають структури клітинної стінки бактерій (TLR1, TLR2, TLR4, TLR5 і TLR6), експресуються переважно на поверхні клітини, у той час як TLR3, TLR7, TLR8 і TLR9, що здатні зв’язуватися з нуклеїновими кислотами, розташовуються внутрішньоклітинно на поверхні ендосом. Розпізнавання пептидоглікану TLR2 на огрядних клітинах спричиняє їх дегрануляцію, що підсилює запальні зміни у тканинах і може запускати алергічний процес без участі Ig E і алергену [84].
TLR – це трансмембранні глюкопротеїди, які складаються з екстрацелюлярного, трансмембранного та цитоплазматичного доменів. Кожен представник сімейства TLR розпізнає специфічні патоген-асоційовані молекулярні патерни різноманітних мікроорганізмів [176]. Відомо, що при реакції TLR на відповідний структурний патерн розривається його комплекс із інгібітором, і TLR передає стимулюючий імпульс на білок NF-kB, внаслідок чого він транспортується в ядро клітини. Його активація призводить до стимуляції вироблення прозапальних цитокінів. При цьому коменсальна флора пригнічує активацію NF-kB, а патогенні та умовно-патогенні мікроорганізми, навпаки, активують TLR і стимулюють запальну відповідь [47]. При зв’язуванні лігандів із TLR ініціюється каскад реакцій із залученням кіназ рецептору IL-1 та ін. Фінальним результатом цього каскаду є збільшення експресії та секреції АМП, цитокінів та хемокінів в осередку інфекційного ураження з формування активної імунної відповіді [128]. Порушення структури генів TLR зумовлюють схильність пацієнтів з алергічними захворюваннями до мікробних інфекцій [16, 146].
Дослідження на мишах показали, що стафілококи спричиняють запалення при глибоких пошкодженнях, але їх присутність на епідермісі не викликає запалення. Це пов’язують із наявністю механізму гальмування запалення, який опосередковується стафілококовою ліпотейхоєвою кислотою, що діє на кератиноцити через TLR3. Було показано, що активація TLR3 необхідна для нормального запалення після ушкодження. Стафілококова ліпотейхова кислота пригнічує вивільнення цитокінів з кератиноцитів та запалення у відповідь на ушкодження за допомогою механізму TLR2-залежного механізму. Таким чином, автори прийшли до висновку, що TLR3 важливі для нормального перебігу запалення після поранення, а мікрофлора може модулювати запальні реакції шкіри [140]. S. epidermidis завдяки продукції ліпотейхової кислоти може інгібувати запалення шкіри, модулюючі запальні реакції при взаємодії TLR та індукуючи експресію β-дефензину людини 2 та 3 у кератиноцитах, які пригнічують зростання S. aureus та стрептококів групи В [139, 140]. При АД пептидоглікани клітинної стінки S. aureus індукують продукцію кератиноцитами медіаторів запалення і комплексу прозапальних цитокінів, що стимулюють більшість етапів запалення. Встановлено, що саме дисфункція в сигналах TLR2 є причиною стафілококової персистенції у пацієнтів, що є результатом порушення індукції антимікробних пептидів [78]. У патофізіології АД бере участь Th2-тип імунної відповіді, а надмірна активація Th2-профілю цитокінів, поряд з активацією TLR, призводить до переважання прозапальних цитокінів та хронізації процесу зі збільшенням автоімунного компонента [25]. Таким чином, TLR активують не тільки вроджений, але й адаптивний імунітет.
Отримані чисельні дані про наявність поліморфізму генів TLR, які призводять до змін резистентності до інфекційних та запальних захворювань, а також можливу роль цих змін у патогенезі інших складних захворювань, зокрема новоутворень [161, 174]. Описано поліморфізм TLR4 у позаклітинному домені Asp299Gly, при цьому варіанті гену порушується здатність TLR4 розпізнавати ліпополісахариди грам-негативних мікроорганізмів, зокрема, немовлята з таким варіантом частіше колонізовані М. catarrhalis [176].
Найбільш розповсюджений поліморфізм TLR2 пов’язаний із заміщенням амінокислоти у положенні 753 з аргініну на глутамін (Arg753Gln), що призводить до порушення відповіді на деякі ліганди зі збільшенням сприйнятливості до інфекційних агентів. Встановлено наявність зв’язку поліморфізму TLR2 R753Q та носійства S. aureus [176]. Комплекс TLR1 і TLR2 розпізнає різні мікробні компоненти, такі як пептидоглікан грам-позитивних та грам-негативних бактерій. Було показано, що TLR2 дуже чутливі до стафілококової інфекції [84].
TLR4 розпізнає ліпополісахарид із зовнішньої мембрани грамнегативних бактерій. Зниження експресії гена TLR4 пов’язано з бактеріальною колонізацією дихальних шляхів у дітей [118]. Ген мутації TLR4 Asp299Gly пов’язаний із ранньою бактеріальною колонізацією М. catarrhalis у дітей раннього віку, а також із грамнегативним сепсисом у пацієнтів у критичному стані [144, 176]. TLR3 зв’язується з РНК респіраторних вірусів та активує NF‑kB, який може збільшити сигналізації, щоб викликати у дихальних шляхах запалення при бронхіальній астмі [173]. Генний поліморфізм TLR3 призводить до зниження експресії TLR3 [156]. TLR3 Leu412Phe може бути пов’язаний із бронхіолітом у ранньому дитячому віці та з його загостреннями [175].
При вивченні поліморфізму гена TLR2 (2258G/A,) та гена TLR4 (896A/G та 1196C/T) серед дітей з АД було встановлено, що мутантний алель 896G гена TLR4 частіше виявлявся у дітей зі схильністю до гострих респіраторних вірусних інфекцій, у них частіше спостерігався тяжкий перебіг захворювання, супутній алергічний риніт, бронхіальна астма, ніж у хворих на АД із «диким» алелем [44].
Важливу роль у вродженому імунітеті відіграє MBL [113]. MBL – це кальцій-залежний лектин, який активує лектиновий шлях системи комплементу шляхом зв’язування з різними мікроорганізмами та здатний розпізнавати віруси і бактерії [133]. При зниженні концентрації MBL підвищується ризик інфекції дихальних шляхів, а у здорових дітей зростає частота колонізації верхніх дихальних шляхів S. aureus [176]. Зниження його рівня призводить до збільшення ризику інфекційних ускладнень та колонізації патогенною флорою [108, 109, 131, 136, 176, 180]. У дітей з АД виявлено підвищену частоту алельного варіанту гену MBL2, що призводить до зниження вмісту MBL. Однак наявність цього алельного варіанту не впливала на ступінь тяжкості захворювання [107].
Вищевикладене свідчить про досить складний патогенез алергодерматозів. Але не менш складною проблемою залишається тактика їх лікування, у зв’язку з різноманітністю провокуючих та реалізуючих факторів цих захворювань та з наявністю чисельних етіопатогенетичних механізмів і варіантів їх перебігу.
1.5 Сучасні принципи лікування алергодерматозів
Враховуючи дуже складний патогенез алергодерматозів за участю різноманітних екзогенних та ендогенних факторів, їх лікування має бути комплексним. Перш за все необхідно усунути дію алергенних і неалергенних тригерів, що вимагає дотримання дієти, усунення супутньої патології, догляд за шкірою та санітарно-гігієнічні заходи та ін. [8, 32, 70, 162].
Подальша терапія досить різноманітна та залежить від активності процесу, тяжкості захворювання, особливостей місцевих та системних порушень. Необхідно враховувати не тільки особливості захворювання, але й загальний стан пацієнта, включаючи супутню патологію, наявність осередків хронічної інфекції та ендотоксемії [58, 62, 86]. Для досягнення максимального ефекту лікування необхідно його індивідуально адаптувати до конкретного пацієнта з урахуванням стану шкіри, особливостей мікробіоценозу, а також інших факторів, наприклад, наявності алергії, подразників шкіри, тривожності, та психологічного стресу [164]. На думку А.В. Симонової та співавт. (2016), терапія має бути комплексною та персоналізованою, включаючи медикаментозну терапію, елімінаційну дієту, корекцію патології ШКТ із застосуванням про- та пребіотиків, ферментів, гепатопротекторів [74]. Найважливішою складовою лікування автори вважають корекцію патології ШКТ та печінки [74, 86].
Одним з основних напрямків лікування АД вважається базисна терапія, спрямована на відновлення бар’єрної функції шкіри [162]. Її завданнями є пригнічення алергічного запалення у шкірі, зменшення сухості шкіри, усунення та попередження осередків вторинного інфікування уражених ділянок шкіри, відновлення ураженого епідермісу, поліпшення захисних та бар’єрних функцій шкіри. Для цього застосовують препарати, які містять як окремі компоненти, так і кілька компонентів різноспрямованої дії [10, 24]. У зовнішньому лікуванні алергодерматозів використовують топічні антигістамінні препарати та кортикостероїди, селективні інгібітори кальціоневрину, емолієнти, кератолітичні, кератопластичні, епітелізуючі та інші препарати для зовнішнього застосування [70].
У лікуванні ІЕ найчастіше застосовують топічні глюкокортикостероїди (ГКС). Топічні ГКС (ТГКС) дозволяють швидко усунути симптоми дерматозів (свербіж, печіння) завдяки протизапальному, вазотропному, антиалергічному та антипроліферативному ефектам [89]. На відміну від системних препаратів, ТГКС мають високу спорідненість до рецепторів, значну місцеву протизапальну активність з мінімальною системною дією [94].
Якщо місцева терапія неефективна, необхідно призначати системне лікування – призначення препаратів з імуносупресивною та імуномодулюючою дією, зокрема, ГКС, циклоспорин, азатіоприн, мікофенольну кислоту метотрексат, алітретіоноїн, імуноглобуліни та гамма-інтерферон [165]. Системна терапія алергодерматозів передбачає застосування антигістамінних препаратів, мембраностабілізуючих засобів, неспецифічну гіпосенсибілізуючу терапію, вітамінів, препаратів, що впливають на нервову систему та спрямованих на нормалізацію патології ШКТ, зокрема гепатопротекторів, ферментів підшлункової залози, пробіотиків, а також антиоксидантів, нейропротекторних засобів тощо. За наявності показань призначають антибактеріальні або антимікотичні препарати. При тяжкому перебігу алергодерматозів застосовують системні ГКС [22, 70, 164, 165]. Крім ГКС із метою імуносупресії при лікуванні тяжких форм АД застосовують циклоспорин, який інгібує активацію та проліферацію Т-клітин. Його застосування виявилось ефективним, але він теж має небезпечні побічні ефекти, зокрема, ураження нирок і гіпертонія [151].
Доброю альтернативою застосуванню ГКС є антигістамінні препарати всіх поколінь [27]. Отримано позитивні результати при застосуванні неседативного антигістамінного препарату левоцетиризину гідрохлориду, який не викликає побічних ефектів навіть при збільшенні дози в 4 рази [26]. Застосування левоцетиризину у хворих на алергодерматози виявило більш високу активність, ніж дезлоратадин [1, 32].
Н.В. Кунгуров та співавт. (2013) вважають найбільш ефективним диференційований підхід до лікування з призначенням топічної терапії залежно від тяжкості процесу, фази захворювання, морфології уражень шкіри. Системну терапію кортикостероїдами автори призначають тільки при середньо тяжкому та тяжкому перебігу захворювання [33].
В останні роки вивчається ефективність препаратів-антитіл, дія яких спрямована на активність окремих клітин та цитокінів, зокрема, анти-СД20 (ритуксимаб), анти-IL-5 (меполізумаб), анти-Ig E (омалізумаб), анти-TNF-а (інфліксимаб) та ін. [120, 124, 158, 164, 172]. Перспективним напрямком у лікуванні АД вважають також алерген-специфічну імунотерапію [98, 152].
Враховуючи значення ендогенної інтоксикації в патогенезі алергодерматозів одним із важливих напрямків лікування вважається дезінтоксикаційна терапія. Її необхідність пов’язана з великою кількістю токсичних речовин, що утворюються в результаті різноманітних місцевих та системних імунопатологічних реакцій, запальних реакцій та продуктів метаболізму, що утворюються в результаті активації умовно-патогенної та патогенної мікрофлори на фоні дисбактеріозу [58, 91].
Серед методів активної детоксикації найбільш розповсюдженим у дерматологічній практиці є ентеросорбція, яка базується на пероральному прийомі препаратів, що мають сорбційну активність у ШКТ, адсорбують токсичні речовини, не вступаючи з ними в хімічні реакції. На цей час відомо багато препаратів, які відносять до групи ентеросорбентів, зокрема вуглеводні сорбенти на основі активованого або гранульованого вугілля, вуглеволокнистих матеріалів, йонообмінні смоли, природні харчові волокна, глини, целіти, силікагелі та інші [58, 59]. Препарати, що застосовуються для ентеросорбції, повинні мати селективну сорбційну активність, мінімально сорбувати корисні речовини, бути інертними у просвіті кишечника, не травмувати слизову оболонку ШКТ, добре евакуюватися та не мати неприємного смаку та запаху [58, 59, 63].
Одним з ефективних сорбентів вважають лігнін, який не засвоюється в травній системі людини, повністю ферментується кишковими бактеріями та має добру сорбційну активність [68]. Добрі результати при лікуванні алергодерматозів отримано при застосуванні Детоксилу, що сприяло швидкому регресу клінічних проявів захворювання та зменшенню або нормалізації маркерів ендогенної інтоксикації [9]. Доведена ефективність Атоксілу – ентеросорбенту на основі діоксиду кремнію, площа активної сорбції якого становить 400 м2 на 1 г речовини. У дітей із кропив’янкою та з алергією на їжу його застосування сприяло скороченню гострого періоду захворювання у хворих, покращенню стану ШКТ та ступеня синдрому надлишкового бактеріального зростання [63].
Селективним сорбентом нового покоління з комплексним механізмом дії є препарат Ентеросгель. Ентеросгель має високу сорбційну здатність, цитопротекторну дію на слизову оболонку ШКТ та позитивно впливає на мікрофлору товстого кишечника. Призначення препарату комплексної дії Ентеросгель у складі традиційної терапії призвело до скорочення періоду загострення в 1,7 рази, зниження індексу SCORAD у 5 разів на тлі зниження рівня плазмового ендотоксину [91].
Іншим напрямком лікування є санація осередків хронічної інфекції та нормалізація мікробіоценозу в біотопах людини, насамперед, шкіри та кишечника. При наявності у пацієнтів одночасно гострих запальних проявів і клінічних ознак піогенних ускладнень шкірного процесу призначаються зовнішні препарати відповідного складу [7]. У разі неможливості проведення бактеріологічних досліджень емпірична терапія проводиться препаратами, що містять фузидієву кислоту, чутливість штамів Staphylococcus aureus до якої зберігається на рівні 95,0–97,0 %, або препаратами, що містять мупіроцин, чутливість до якого також вкрай висока [33]. Необхідно відзначити, що в даний час терапія хворих із наявністю інфекційних ускладнень нерідко ускладнена через збільшення стійкості збудників S. аureus і S. epidermidis до антибіотиків: пеніциліну (до 80 % штамів), тетрацикліну (до 65 %), еритроміцину ( до 40 %), гентаміцину (до 30 % штамів). У свою чергу, використання антибактеріальних препаратів знижує чутливість S. aureus і сприяє подальшій селекції резистентної флори, а повторні та тривалі курси антибактеріальної терапії часто призводять до появи MRSA, які, у свою чергу, виробляють значну кількість суперантигенів [154, 168]. У пацієнтів із важкими і торпідними формами АД слід підозрювати наявність обсіменіння шкірного покриву штамами MRSA, що підтримують запалення у шкірі та тяжкість шкірного патологічного процесу. Цим хворим потрібно призначати зовнішні антибактеріальні препарати, що діють на MRSA, як засоби першої лінії терапії [57]. На думку D. Simon та T. Bieber (2014), системна антибіотикотерапія потрібна лише при серйозній бактеріальній суперінфекції при екземі [164].
Альтернативою антибактеріальної терапії на цей час вважають «антипатогенні» препарати, які впливають на ключові шляхи регуляції метаболізму, забезпечуючи мобілізацію механізмів протиінфекційного захисту. Зокрема, повідомляють про ефективність лікування АД, ускладненого бактеріальною та грибковою інфекцією, препаратом Травокорт, що містить ізоконазол та дифлюкортолону валерат, у поєднанні з препаратом для зволоженням шкіри [5].
Крім цього, для нормалізації мікробіоценозу застосовують пробіотики та пребіотики [11, 49]. Згідно останніх рекомендацій Всесвітньої гастроентерологічної асоціації, призначення пробіотиків може бути корисним у популяціях високого ризику для зниження ризику розвитку екземи, хоча відмічається, що на цей час чітких даних про схеми лікування з цією метою немає [119]. Також перспективним є включення в комплекс терапевтичних заходів пребіотиків, які є живильним середовищем для розвитку власної нормальної мікрофлори організму, що сприяє більш швидкому і стійкому відновленню нормальної автомікрофлори кишечника [114]. Як правило, в якості пребіотиків використовують речовини, що містять біфідогенні фактори, що стимулюють ріст і розвиток корисних бактерій, наприклад лактулозу – синтетичний стереоізомер молочного цукру лактози.
Досить ефективним при лікуванні алергодерматозів виявився комбінований препарат Лактофільтрум, який містить лігнін та пребіотик лактулозу. У зв’язку з відсутністю побічних ефектів препарат практично не має протипоказань до застосування [21, 72, 76]. При лікуванні хворих на АД із застосуванням Лактофільтруму в поєднанні зі стандартною терапією виявлено кращу динаміку регресу свербежу, нормалізацію дизбіозу поряд із зростанням якості життя [30]. Отримано добрий результат лікування АД при застосуванні Лактофільтруму водночас із препаратом Епадол, що містить омега-3 поліненасичені жирні кислоти [64]. Цікавим напрямком лікування також є модуляції відповіді TLR2 у шкірі. Зокрема препарат TLR2-Regul complex сприяє швидкому зменшенню запалення в результаті патогенної дії мікроорганізмами S. aureus або M. furfur [77].
* * *
Отже, алергодерматози є найбільш розповсюдженим варіантом алергічних захворювань, для яких характерні однотипові місцеві та системні порушення, пов’язані, головним чином, з імунними розладами. Їх реалізація на місцевому рівні призводить до уражень шкіри, в яких значну роль відіграють порушення місцевого мікробіоценозу. Але ці зміни майже завжди спричиняють зміну мікробіоти іншої локалізації (ротоглотки, кишечника тощо). Імунопатологія та порушення мікробіоценозу мають значення не тільки у виникненні уражень шкіри, але й у прогресуванні та хронізації патологічного процесу.
З урахуванням провідних ланок патогенезу алергодерматозів перспективними напрямками їх лікування є подальше удосконалення місцевої терапії та елімінація системних патологічних факторів, зокрема, за допомогою ентеросорбції.
- Диференційований підхід до діагностики та зовнішньої терапії екземи / Я.Ф.Кутасевич, К.Є.Іщейкін, І.В. Зюбан, В.Ю. Мангушева. Дерматологія та венерологія. 2018. № 1 (79). С. 50–55 [36].
- Корекція мікробіоценозу кишечника методом ступінчастої елімінаційної терапії у хворих на алергодерматози / Я.Ф. Кутасевич, І.О. Олійник, С.К. Джораєва, В.Ю. Мангушева. Медицина сьогодні і завтра. 2017. № 3-4 (76-77). С. 109–115 [41].
РОЗДІЛ 2
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Методика загального обстеження хворих
Дисертаційне дослідження виконано на базі ДУ «Інститут дерматології та венерології НАМН України» протягом 2015–2018 рр. У проспективному когортному дослідженні взяли участь 154 хворих на алергодерматози, які знаходилися на стаціонарному лікуванні у відділенні дерматології, інфекційних та паразитарних захворювань шкіри, у тому числі:
- 50 (32,5 %) хворих на АД;
- 52 (33,8 %) хворих на ІЕ;
- 52 (33,8 %) хворих на МЕ.
До початку лікування в усіх хворих вивчалися скарги, проводився збір анамнезу захворювання, алергологічний анамнез, з’ясовувався генетичний анамнез, котрий дозволяв встановити обтяжену спадковість у пацієнтів, які вказували на наявність алергічних реакцій та підвищену чутливість найчастіше до хімічних речовин у їх батьків та близьких родичів, анамнез життя. Проводилося об’єктивне обстеження, яке включало дослідження покривів шкіри та видимих слизових оболонок, стан периферичних лімфатичних вузлів, а також органів і систем. У разі необхідності пацієнти були консультовані лікарями інших спеціальностей (зокрема, терапевтом, ендокринологом, невропатологом, гастроентерологом).
Кількісне визначення тяжкості перебігу дерматозу при первинному огляді й у динаміці спостереження за хворими проводилося за системою бальної оцінки ступеня тяжкості АД (індекс SCORAD) [1]. На першому етапі проводилося визначення й оцінка об’єктивних симптомів, які характеризують інтенсивність шкірного процесу. До них у системі SCORAD віднесені:
1) еритема (гіперемія);
2) набряк / утворення папул;
3) мокнуття / корочки;
4) екскоріації;
5) ліхеніфікація;
6) сухість шкіри.
Ділянки шкіри, які вибиралися для оцінки, були із середньою інтенсивністю кожної з ознак у даного пацієнта, крім ділянок з найбільшим ураженням. Та сама ділянка могла бути обраною для характеристики двох і більше ознак. Сухість визначалася на ділянках без висипок. Кожну ознаку оцінено від 0 до 3 балів (0 – відсутність, 1 – легка вираженість, 2 – середня, 3 – важка) відповідно.
Наступним етапом був розрахунок площі ураження шкіри, для якого використовувалося правило «дев’яток», де за одиницю прийнята площа долонної поверхні кисті (одна долоня хворого – 1 % усієї поверхні шкіри). При цьому бралися до уваги тільки осередки запальних уражень, сухість шкіри не враховувалася. Площу ураженої шкіри виражено у відсотках від усієї поверхні тіла, прийнятої за 100 %. Половинні оцінки не враховувалися.
Із суб’єктивних ознак характеризувалися свербіж і порушення сну на підставі середнього ступеня їх вираженості протягом останніх трьох днів/ночей за 10-бальною шкалою.
Індекс SCORAD розраховувався за наступною формулою:
SCORAD = A/5 + 7B/2 + C,
де А – площа ураженої шкіри, %;
В – сума балів об’єктивних ознак (еритема, набряк / утворення папул, мокнуття / кірочки, екскоріації, ліхеніфікація та сухість шкіри);
С – сума балів суб’єктивних ознак (свербіж, порушення сну).
Клінічна картина тяжкості ІЕ та МЕ оцінювалася за допомогою індексу тяжкості захворювання і площі ураження при екземі (EASI) [1].
Для оцінки тяжкості екземи її вираженість досліджувалася на чотирьох ділянках:
- голова і шия (H) – 10 %;
- верхні кінцівки (U) – 20 %;
- тулуб (T) – 30 %;
- нижні кінцівки (L) – 40 %.
Відсоток ураженої площі в межах кожної з чотирьох ділянок оцінювався пропорційно в балах у ході аналізу: 0 – висипання відсутні; 1 – 10 %; 2 – 10–29 %; 3 – 30–49 %; 4 – 50–69 %; 5 – 70–89 %; 6 – 90–100 %.
Кожна з чотирьох ділянок тіла оцінювалася окремо за ключовими ознаками: «Еритема», «Інфільтрація/папули/набряк», «Екскоріації», «Ліхеніфікація». Середній ступінь тяжкості кожної ознаки в межах чотирьох ділянок оцінювався від 0 до 3 балів (0 – відсутня, 1 – слабкий ступінь, 2 – помірний ступінь і 3 – важкий ступінь), причому допускалися половинні оцінки. Загальну тяжкість захворювання оцінено після розрахунків в окремих ділянках за сумою отриманих даних (табл. 2.1).
Таблиця 2.1 – Індекс важкості захворювання та площі ураження при екземі
| Ділянка тіла | EASI, бали |
| Голова/шия (H) | (С + Е + В + Л) × Н × 0,1 = |
| Верхні кінцівки (UL) | (С + Е + В + Л) × UL × 0,2 = |
| Тулуб (T) | (С + Е + В + Л) × T × 0,3 = |
| Нижні кінцівки (LL) | (С + Е + В + Л) × LL × 0,4 = |
| EASI = H + UL + T + LL | Сума балів чотирьох ділянок тіла = |
Оцінку за шкалою SCORAD (у хворих з АД) та за шкалою EASI (у хворих на ІЕ та МЕ) виконано на початку дослідження (до призначення лікування), під час лікування (на 7 добу від початку терапії) та наприкінці лікування (на 14 добу від початку лікування). Оцінку перебігу захворювання здійснювали за динамікою загальної оцінки за шкалою SCORAD або EASI та за їх окремими показниками в абсолютному значенні та у відсотках до попереднього терміну визначення.
2.2 Мікробіологічні дослідження
Бактеріологічні дослідження були проведені на базі лабораторії мікробіології ДУ «ІДВ НАМНУ», лабораторія атестована (Свідоцтво про атестацію № 100-295/2015 від 20.11.2015 року (чинне до 19.11.2018 року) та має дозвіл на роботу зі збудниками ІІІ–IV груп патогенності.
Ідентифікацію вилучених зі шкіри бактерій проведено за допомогою методів класичної бактеріології на підставі вивчення морфологічних, культуральних та біохімічних властивостей [66, 92, 95]. Біологічний матеріал, отриманий з осередків шкіри, засівався на живильні та диференціально-діагностичні середовища. Визначення чутливості вилучених мікроорганізмів до антибактеріальних препаратів за допомогою диск-дифузійного методу та інтерпретацію отриманих результатів проводилося згідно міжнародних протоколів та нормативних документів МОЗ України [60, 110, 147]. Резистентні та помірно-резистентні мікроорганізми були об’єднані до групи нечутливих штамів. Контроль якості методики визначення чутливості мікроорганізмів до антибіотиків, якості реагентів, що використовувалися (живильні середовища та диски з антибіотиками), проводився із застосуванням контрольних штамів Американської колекції типових культур (АТСС): Е. соli АТСС 25922, S. aureus АТСС 25923, P. aeruginosa АТСС 27853, E. faecalis АТСС 29212.
Бактеріологічне дослідження копрокультур проводилося згідно з регламентуючими нормативними документами на базі бактеріологічної лабораторії Харківського обласного лабораторного центру МОЗ України. (Свідоцтво про атестацію лабораторії № 100-002/ 2013 від 04.01.2013р., чинне до 03.01.2018 р.). Вивчення кишкової біоти проводилося шляхом засіву серійних розведень фекалій із застосуванням щільних та рідких живильних середовищ із метою ідентифікації: на середовищі Сабуро – грибів роду Candida; на середовищі Ендо – лактозонегативних колоній; на середовищі Плоскірєва – ентеробактерій; на середовище Блаутрока і МРС – для виявлення біфідо- і лактобактерій [55]. Протягом 24–72 годин здійснювалося термостатування при температурі 37 ºС та проводився підрахунок колоній, що виросли, та їх ідентифікація згідно з Наказом МОЗ № 535 від 22.04.1985р. та діючими в Україні методичними вказівками та інформаційними листами.
Ступінь дисбіотичних порушень кишечника було оцінено згідно уніфікованої робочої класифікації Куваєвої – Ладодо [31].
2.3 Визначення рівня інтерлейкіну-17А
IL-17А – гомодимер, що продукується активованими Т-лімфоцитами та відіграє ключову роль при інфекційних та автоімунних захворюваннях, тому його визначення має значення для дослідження механізмів запалення та імунної відповіді.
Рівень IL-17А досліджувався методом твердофазного аналізу із застосуванням набору реагентів “ИФА-IL-17А” (виробник ТОВ «Цитокін»), що містить моноклональні антитіла до IL-17А. Визначення здійснювалося згідно інструкції виробника у лабораторії алергології ДУ «Інститут дерматології та венерології НАМН України» з використанням імуноферментного аналізатору АИФ-Ц-01С (Свідоцтво про атестацію лабораторії № 100-053/2015 від 30.03.2015р., чинне до 29.03.2019 р.).
Дослідження виконувалося на початку лікування та після курсу терапії (за абсолютною величиною та у відсотках порівняно з початковою величиною).
2.4 Визначення поліморфізму генів толл-подібних рецепторів
Аналіз поліморфізму гена TLR1-I602S проводився за методом поліморфізму довжини рестрикційних фрагментів за Johnson C. M. [129]. Використовувалося ДНК, виділена з крові. На першому етапі за допомогою специфічних праймерів (TLR1f ACAAGTGGATCCCTTAT-GTGTC і ACTGTTCTTGGACTAAAAGTTTATCAA (TLR1333) ампліфікувався фрагмент 1 екзону гену TLR1 довжиною 1338 пар нуклеотидів. Він піддавався дії рестриктази PstI, яка виявляла поліморфізм G1805T (I602S) первинної структури ДНК. Ампліфікація проводилася в термоциклері «Терцик» № 1 при наступному температурному режимі: первинна денатурація протягом 2 хвилин при 95° С з наступними 40 циклами: денатурація – 20 с при 95 °С, віджиг – 20 с при 53,5 °С, синтез – 1,5 хв. при 72 °С (програма TLR1), за допомогою приготованої реакційної суміші. Для визначення молекулярної маси фрагментів ДНК використовувався маркер молекулярної маси SM1191 (діапазон 100–1000 нп) виробництва «Thermo Scientific».
Результати аналізувалися візуально на трансілюмінаторі «Біоком» при довжині збуджуючого світла 310 нм. У випадку гаплотипу 602І амплікон не розщіплюється, у той час як амплікон гаплотипу 602S розщіплюється на фрагменти довжиною 790 та 548 нп. У гетерозигот на електрофореграмі визначалася ДНК довжиною 1338.
2.5 Статистична обробка результатів дослідження
Отримані результати були опрацьовані методами математичної статистики з використанням пакету PSРР (програмне забезпечення з вільним доступом, що не потребує ліцензії) з урахуванням рекомендацій до медико-біологічних досліджень [17]. Кількісні показники були перевірені на нормальність розподілу за допомогою критерію Колмагорова-Смирнова. Для порівняння кількісних показників був використаний t-критерій (Ст’юдента) для незалежних вибірок та парний критерій Ст’юдента для залежних вибірок (в окремій групі під час лікування). Для порівняння якісних показників використано таблиці спряженості з визначенням критерію χ2 (при малих вибірках – з поправкою Йєтса) або критерію Фішера. Відмінності вважали значущими при ймовірності нульової гіпотези менше 5 % (р<0,05).
РОЗДІЛ 3
КЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ НА АЛЕРГОДЕРМАТОЗИ
3.1 Загальна характеристика пацієнтів, що увійшли у дослідження
У дослідженні взяли участь 154 хворих на алергодерматози, у тому числі:
- 50 (32,5 %) хворих на АД;
- 52 (33,8 %) хворих на ІЕ;
- 52 (33,8 %) хворих на МЕ;
У структурі хворих переважали жінки – 88 (57,1 %), чоловіків було 66 (42,9 %). Середній вік хворих складав (42,8 ± 16,6) років (від 18 до 84 років), у тому числі:
- від 16 до 44 років – 88 (57,1 %);
- від 45 до 59 років – 34 (22,1 %);
- від 60 до 74 років – 29 (18,8 %);
- 75 років і більше – 3 (1,9 %).
Відносне переважання було у чоловіків віком 18–44 років, але достовірної різниці між чоловіками та жінками за віковою структурою не було (χ2=3,949; р=0,268). Вікову та гендерну структуру обстежених хворих залежно від основного діагнозу наведено у таблиці 3.1.
Суттєвої різниці за статтю залежно від діагнозу не було (χ2=0,668; р=0,716), за віковою групою були достовірні відмінності (χ2=21,303; р=0,002) – найбільш помітним було переважання пацієнтів віком 18–44 років серед усіх хворих, особливо серед хворих на АД та ІЕ (78,0 % та 55,8 %, відповідно).
При цьому помітним було зростання питомої ваги хворих віком 60–74 роки серед хворих на МЕ. Додатковий аналіз цього показника у групах залежно від діагнозу виявив, що середній вік хворих на АД становив (36,1 ± 16,5) років, що було недостовірно менше, ніж середній вік хворих на ІЕ – (41,8 ± 14,0) років (р=0,061 за t-критерієм), та достовірно менше, ніж у хворих на МЕ – (50,2 ± 16,2) роки (р<0,001 за t-критерієм). Середній вік хворих на ІЕ також був достовірно меншим, ніж хворих на МЕ (р=0,006 за t-критерієм).
Таблиця 3.1 – Розподіл обстежених хворих залежно від віку, статі та діагнозу
| Показник | Діагноз | Разом | ||
| АД | ІЕ | МЕ | ||
| Стать | ||||
| чоловік | 22 (44,0 %) | 20 (38,5 %) | 24 (46,2 %) | 66 (42,9 %) |
| жінка | 28 (56,0 %) | 32 (61,5 %) | 28 (53,8 %) | 88 (57,1 %) |
| Вікова група | ||||
| 18-44 | 39 (78,0 %) | 29 (55,8 %) | 20 (38,5 %) | 88 (57,1 %) |
| 45-59 | 6 (12,0 %) | 15 (28,8 %) | 13 (25,0 %) | 34 (22,1 %) |
| 60-74 | 5 (10,0 %) | 8 (15,4 %) | 17 (32,7 %) | 29 (18,8 %) |
| 75-90 | 1 (2,0 %) | – | 2 (3,8 %) | 3 (1,9 %) |
| Разом | 50 (100,0 %) | 52 (100,0 %) | 52 (100,0 %) | 154 (100,0 %) |
3.2 Анамнестичні показники хворих на алергодерматози
У дослідження увійшли хворі, у яких діагностовано найбільш розповсюджені форми хронічних алергодерматозів: 50 хворих на АД, 52 хворих на ІЕ та 52 хворих на МЕ. Ці захворювання мають спільні ланки патогенезу, тому були проаналізовані окремі анамнестичні показники про особливості початку та перебігу захворювання, наявність спадковості та супутньої патології.
Вік початку захворювання в обстежених хворих був досить різноманітним – у 34 (22,1 %) з 154 хворих, що увійшли у дослідження, захворювання почалося у дитинстві. У більшості хворих – 80 (51,9 %) – відмічено початок захворювання у молодому та середньому віці (18–44 роки), рідше початок захворювання був у віці від 45 років та більше. Порівняння цього показника залежно від основного діагнозу наведено у таблиці 3.2.
Таблиця 3.2 – Розподіл хворих за віком початку захворювання
| Вік початку захворювання | Діагноз | Разом | ||
| АД | ІЕ | МЕ | ||
| з дитинства | 12 (24,0 %) | 14 (26,9 %) | 8 (15,4 %) | 34 (22,1 %) |
| 18–44 | 32 (64,0 %) | 18 (34,6 %) | 30 (57,7 %) | 80 (51,9 %) |
| 45–59 | 6 (12,0 %) | 18 (34,6 %) | 8 (15,4 %) | 32 (20,2 %) |
| 60–74 | – | 2 (3,8 %) | 6 (11,1 %) | 8 (5,2 %) |
| Разом | 50 (100,0 %) | 52 (100,0 %) | 52 (100,0 %) | 154 (100,0 %) |
Виявлено достовірні відмінності віку початку захворювання (χ2=19,451; р<0,001) – найбільш помітно переважання серед хворих на АД та ІЕ пацієнтів, що хворіли з дитинства, а серед хворих на МЕ – збільшена частка хворих із початком захворювання у віці 60–74 роки (табл. 3.2).
Також виявлено достовірні відмінності (χ2=23,855; р=0,008) між групами пацієнтів за основним діагнозом залежно від тривалості захворювання – найбільш помітним було переважання серед хворих на АД пацієнтів, що хворіли більше 6 років (із дитинства), а серед хворих на МЕ – збільшена частка хворих із тривалістю захворювання 1–5 років (табл. 3.3).
Таблиця 3.3 – Розподіл хворих за тривалістю захворювання
| Тривалість захворювання | Діагноз | Разом | ||
| АД | ІЕ | МЕ | ||
| До 6 міс. | – | 7 (13,5 %) | 1 (1,9 %) | 8 (5,2 %) |
| 6 міс. – 1 рік | 15 (30,0 %) | 17 (32,7 %) | 15 (28,8 %) | 47 (30,5 %) |
| 1–5 років | 8 (16,0 %) | 16 (30,8 %) | 18 (34,6 %) | 42 (27,3 %) |
| 6–10 років | 12 (24,0 %) | 7 (13,5 %) | 7 (13,5 %) | 26 (16,9 %) |
| Більше 10 років | – | – | 1 (1,9 %) | 1 (0,6 %) |
| Разом | 50 (100,0 %) | 52 (100,0 %) | 52 (100,0 %) | 154 (100,0 %) |
Частота загострень основного захворювання залежно від діагнозу також достовірно розрізнялася (χ2=18,911; р=0,015) (табл. 3.4).
Таблиця 3.4 – Розподіл хворих залежно від частоти загострень захворювання
| Частота загострень | Діагноз | Разом | ||
| АД | ІЕ | МЕ | ||
| 1–2 рази на рік | 26 (52,0 %) | 25 (48,1 %) | 16 (30,8 %) | 67 (43,5 %) |
| 3–4 рази на рік | 8 (16,0 %) | 4 (7,7 %) | 11 (21,2 %) | 23 (14,9 %) |
| Тривалий перебіг з ремісією до 2 міс. | 2 (4,0 %) | 4 (7,7 %) | 11 (21,2 %) | 17 (11,0 %) |
| Вперше діагностовано | 14 (28,0 %) | 18 (34,6 %) | 11 (21,2 %) | 43 (27,9 %) |
| Без рецидивів | – | 1 (1,9 %) | 3 (5,8 %) | 4 (2,6 %) |
| Разом | 50 (100,0 %) | 52 (100,0 %) | 52 (100,0 %) | 154 (100,0 %) |
У хворих на АД найчастіше загострення захворювання 1–2 рази на рік спостерігалися у 52 %, при ІЕ – у 48,1 % пацієнтів. У пацієнтів з МЕ спостерігалося збільшення частки пацієнтів із загостреннями 3–4 рази на рік та тривалий перебіг із ремісією до 2 місяців (42,4 %) (табл. 3.4).
Залежно від сезонності загострень захворювання виявлено достовірні відмінності (χ2=27,651; р=0,035) (табл. 3.5).
Найбільш помітним було збільшення серед хворих на АД (26,0 %) та ІЕ (17,3 %) пацієнтів із загостреннями навесні та восени. Хворі на МЕ найчастіше не відмічали сезонності загострень захворювання.
В окремих хворих, що увійшли у дослідження, виявлено ознаки спадковості основного захворювання – наявність подібного захворювання у батьків або у близьких родичів. Цей фактор був найбільш розповсюджений серед хворих на АД. Наявність АД та інших алергічних захворювань у батьків відмічено у 16,0 % хворих, у близьких родичів – у 12,0 % хворих. Найменше цей фактор спостерігався серед хворих на МЕ (7,6 % у батьків та близьких родичів). Різниця між групами залежно від діагнозу статистично достовірна (χ2=16,050; р=0,013) (табл. 3.6).
Таблиця 3.5 – Розподіл хворих залежно від сезонності загострень основного захворювання.
| Сезон | Діагноз | Разом | ||
| АД | ІЕ | МЕ | ||
| Весна | 9 (18,0 %) | 6 (11,5 %) | 4 (7,7 %) | 19 (12,3 %) |
| Літо | 2 (4,0 %) | 1 (1,9 %) | 6 (11,5 %) | 9 (5,3 %) |
| Осінь | – | 6 (11,5 %) | 9 (17,3 %) | 15 (9,7 %) |
| Зима | 2 (4,0 %) | 5 (9,6 %) | 3 (5,8 %) | 10 (6,5 %) |
| Весна, літо | 4 (8,0 %) | 6 (11,5 %) | 4 (7,7 %) | 14 (9,1 %) |
| Весна, осінь | 13 (26,0 %) | 9 (17,3 %) | 2 (3,8 %) | 24 (15,6 %) |
| Осінь, зима | 4 (8,0 %) | 2 (3,8 %) | 3 (5,8 %) | 9 (5,8 %) |
| Цілий рік | 2 (4,0 %) | 5 (9,6 %) | 4 (7,7 %) | 11 (7,1 %) |
| Без сезонності | 14 (28,0 %) | 12 (23,1 %) | 17 (32,7 %) | 43 (27,9 %) |
| Разом | 50 (100,0 %) | 52 (100,0 %) | 52 (100,0 %) | 154 (100,0 %) |
Таблиця 3.6 – Розподіл хворих за спадковістю
| Наявність алергічних захворювань | Діагноз | Разом | ||
| АД | ІЕ | МЕ | ||
| У батьків | 8 (16,0 %) | 6 (11,5 %) | 2 (3,8 %) | 16 (10,4 %) |
| У близьких родичів | 6 (12,0 %) | 5 (9,6 %) | 2 (3,8 %) | 13 (8,4 %) |
| У далеких родичів | – | – | 5 (9,6 %) | 5 (3,2 %) |
| Немає | 36 (72,0 %) | 41 (78,8 %) | 43 (82,7 %) | 120 (77,9 %) |
| Разом | 50 (100,0 %) | 52 (100,0 %) | 52 (100,0 %) | 154 (100,0 %) |
Помітні відмінності залежно від діагнозу відмічено при аналізі причин загострень основного захворювання (χ2=44,571; р<0,001) (табл. 3.7).
Таблиця 3.7 – Розподіл хворих за основною причиною загострення захворювання
| Причина загострення | Діагноз | Разом | ||
| АД | ІЕ | МЕ | ||
| Стрес | 9 (18,0 %) | 17 (32,7 %) | 7 (13,5 %) | 33 (21,4 %) |
| Їжа | 2 (4,0 %) | 5 (9,6 %) | 3 (5,8 %) | 10 (6,5 %) |
| Хімічні сполуки | 1 (2,0 %) | 7 (13,5 %) | 8 (15,4 %) | 16 (10,4 %) |
| Сезонні фактори | 6 (12,0 %) | – | – | 6 (3,9 %) |
| Захворювання внутрішніх органів | – | 4 (7,7 %) | 4 (7,7 %) | 8 (5,2 %) |
| Фармпрепарати | 5 (10,0 %) | 5 (9,6 %) | 1 (1,9 %) | 11 (7,1 %) |
| Стрес та їжа | 11 (22,0 %) | 2 (3,8 %) | 6 (11,5 %) | 19 (12,3 %) |
| Кілька факторів | 10 (20,0 %) | 8 (15,4 %) | 9 (17,3 %) | 27 (17,5 %) |
| Не відомо | 6 (12,0 %) | 4 (7,7 %) | 14 (26,9 %) | 24 (15,5 %) |
| Разом | 50 (100,0 %) | 52 (100,0 %) | 52 (100,0 %) | 154 (100,0 %) |
У хворих на АД найчастішою причиною загострення було поєднання стресових ситуацій з харчовою алергією (22,0 %), у хворих на ІЕ – стрес (32,7 %), у хворих на МЕ – найчастіше загострення спостерігалися під впливом кількох факторів (17,3 %). Крім цього, у хворих на МЕ досить часто безпосередня причина захворювання залишалася невідомою (26,9 %), у той час як при АД вона була нез’ясованою лише у 12,0 % хворих, а у хворих на ІЕ – у 7,7 % випадків. Також привертає увагу, що при алергодерматозах загалом незалежно від основного діагнозу досить частою причиною загострень було кілька факторів (стрес, харчова алергія, хімічні сполуки, фармпрепарати та інші в різноманітних поєднаннях). Такий анамнез відмічено у 20,0 % хворих на АД, у 15,4 % хворих на ІЕ та у 17,3 % хворих на МЕ. Крім цього, слід відмітити, що сезонні причини загострень (насамперед загострення алергії навесні та восени) серед досліджених хворих виявлено лише у хворих на АД.
Залежно від наявності супутньої патології та її частоти між групами залежно від основного діагнозу також виявлено достовірні відмінності (χ2=38,703; р=0,029) (табл. 3.8).
Таблиця 3.8 – Супутня патологія у обстежених хворих
| Супутня патологія | Діагноз | Разом | ||
| АД | ІЕ | МЕ | ||
| Ендокринна патологія | 1 (2,0 %) | 3 (5,8 %) | 1 (1,9 %) | 5 (3,2 %) |
| Захворювання травної системи | 18 (36,0 %) | 10 (19,2 %) | 8 (15,4 %) | 36 (23,4 %) |
| Захворювання ЛОР-органів | 1 (2,0 %) | – | – | 1 (,6 %) |
| Захворювання серцево-судинної системи |
1 (2,0 %) | 1 (1,9 %) | 5 (9,6 %) | 7 (4,5 %) |
| Судинна патологія | 1 (2,0 %) | – | 4 (7,7 %) | 5 (3,2 %) |
| Гінекологічні захворювання | – | – | 1 (1,9 %) | 1 (,6 %) |
| Мікози | 2 (4,0 %) | 1 (1,9 %) | 7 (13,5 %) | 10 (6,5 %) |
| Глистна інвазія | 3 (6,0 %) | 5 (9,6 %) | 1 (1,9 %) | 9 (5,8 %) |
| Захворювання центральної нервової системи | – | 1 (1,9 %) | – | 1 (,6 %) |
| Поєднання двох захворювань | 6 (12,0 %) | 7 (13,5 %) | 6 (11,5 %) | 19 (12,3 %) |
| Поєднання трьох захворювань | 3 (6,0 %) | 4 (7,7 %) | 5 (9,6 %) | 12 (7,8 %) |
| Більше трьох захворювань | 5 (10,0 %) | 1 (1,9 %) | 4 (7,7 %) | 10 (6,5 %) |
| Немає | 9 (18,0 %) | 19 (36,5 %) | 10 (19,2 %) | 38 (24,7 %) |
| Разом | 50 (100,0 %) | 52 (100,0 %) | 52 (100,0 %) | 154 (100,0 %) |
Найбільш помітним серед хворих на АД було збільшення частоти захворювань травної системи (патологія ШКТ та печінки), які було виявлено у 36,0 % хворих. Ця патологія була менш частою серед хворих на ІЕ (19,2 %) та на МЕ (15,4 %), однак серед цих пацієнтів вона також спостерігалася частіше, ніж інші захворювання. Також слід відмітити збільшення серед хворих на ІЕ глистних інвазій, а серед хворих на МЕ – мікозів різної локалізації.
Таким чином, за результатами порівняльного аналізу між групами пацієнтів залежно від основного діагнозу виявлено певні відмінності. Зокрема, меньша кількість пацієнтів у віці від 18 до 44 років серед хворих на АД та ІЕ порівняно з МЕ, збільшення у хворих на МЕ пацієнтів віком від 60 до 74 років. Крім цього, при АД та ІЕ відмічався більш ранній початок захворювання та його більша тривалість із загостреннями частіше навесні та восени, у той час як при МЕ відмічалося збільшення частоти загострень незалежно від сезону. Також для хворих на АД та ІЕ більш характерна можлива спадковість захворювання і наявність супутньої патології, особливо з боку органів травної системи.
Однак слід зазначити, що у всіх хворих незалежно від діагнозу зустрічалися всі варіації показників, що аналізувалися, хоча і з різною частотою. Це є непрямим доказом загальних ланок патогенезу цих захворювань та свідчить про можливість уніфікації окремих методів лікування цих хворих.
Для здійснення порівняльного аналізу ефективності різних методів терапії більш показовими є наступні показники: клінічні прояви захворювання, результати лабораторних та інших методів дослідження. Ці показники динамічно змінюються під впливом лікування. Перш за все проаналізовано клінічні та лабораторні показники у хворих при первинному огляді (до початку лікування).
3.3 Вихідна вираженість окремих клінічних проявів та тяжкість алергодерматозів
Аналіз клінічних проявів АД, який був основним діагнозом у 50 хворих, що увійшли у дослідження, наведено у табл. 3.9.
Таблиця 3.9 – Розподіл хворих на АД за вираженістю основних клінічних проявів захворювання (n=50)
| Клінічний симптом | Вираженість клінічного симптому | |||
| немає | легкий | середній | тяжкій | |
| Еритема | – | 1 (2 %) | 21 (42 %) | 28 (56 %) |
| Набряк/папулоутворення | 5 (10 %) | 5 (10 %) | 28 (52 %) | 14 (28 %) |
| Мокнуття/ корки | – | 9 (18 %) | 18 (36 %) | 23 (46 %) |
| Екскоріації | – | – | 27 (54 %) | 23 (46 %) |
| Ліхеніфікації | 2 (4 %) | 2 (4 %) | 16 (32 %) | 30 (60 %) |
Згідно з частотою виявлення симптомів із різним ступенем вираженості, який оцінювався від одного до трьох балів залежно від тяжкості шкірного процессу, найбільш важким проявом АД були ліхеніфікації, що спостерігалися у 98 % хворих, причому в 32 % випадків їх вираженість була два бали та у 60 % – три. У всіх хворих спостерігалися екскоріації. Вираженість цього симптому у 54 % хворих була оцінена в два бали та у 46 % – у три. Не менш частим проявом була еритема, яка спостерігалась у всіх хворих, а її вираженість лише в одного хворого була оцінена в один бал, у 42 % – у два бали та у 56 % – у три.
Ілюстрацією випадку АД є наступне клінічне спостереження.
Хворий М., 31 рік, звернувся у клініку зі скаргами на розповсюджені висипання на шкірі верхніх та нижніх кінцівок, що супроводжувалися сильним свербежем.
Анамнез захворювання: вважає себе хворим з шестимісячного віку (зі слів матері), коли вперше, після введення прикорму, з’явилися висипання в ділянці обличчя, на шкірі волосистої частини голови, що супроводжувалися свербежем. За медичною допомогою звернулися до педіатра, яким було діагностовано «Алергічний дерматит» і призначено лікування. На фоні лікування відмічався швидкий регрес висипань. Подальші загострення відмічав щорічно, 3–4 рази на рік, здебільшого восени-взимку, а також після порушення дієти та гострих респіраторних захворювань. Однак наступні загострення супроводжувалися розповсюдженням процесу на шкіру кистей. Лікувався самостійно народними засобами (ванни з відварами ромашки, череди та ін.), тривалим застосуванням топічних кортикостероїдів. Неодноразово лікувались у алерголога та терапевта із застосуванням антигістамінних препаратів, сорбентів, топічних кортикостероїдів.
Спадковий анамнез: обтяжений – мати, рідна сестра та племінниця хворіють на АД.
Алергологічний анамнез: відмічає алергічні реакції на прийом тетрацикліну, вживання яєць, морепродуктів, холодну погоду.
Анамнез життя: цукровий діабет, хворобу Боткіна, венеричні хвороби в минулому заперечує. Страждає на часті застудні захворювання.
При об’єктивному обстеженні встановлено, що загальний стан хворого задовільний. Шкірні покриви і видимі слизові поза осередками ураження, звичайного кольору, вільні від висипань. Периферичні лімфатичні вузли не збільшені, не зрощені з навколишніми тканинами, безболісні при пальпації. Межі легень у нормі; дихання везикулярне, хрипи відсутні. Межі серця не розширені; діяльність серця ритмічна, тони чисті; частота серцевих скорочень – 94 уд. за хв.; артеріальний тиск – 120/80 мм рт. ст.; пульс – 70 уд. за хв. Язик вологий, чистий. Зів не гіперемований. Мигдалини не збільшені. Живіт при поверхневій пальпації м’який, безболісний. Печінка пальпується на 1 см нижче країв реберної дуги. Селезінка не збільшена. Нирки не пальпуються. Симптом Пастернацького негативний. Випорожнення не порушене. Неврологічної симптоматики немає.
Локальний статус: патологічний процес мав розповсюджений характер і локалізувався на шкірі згинальних поверхонь верхніх та нижніх кінцівок, задній поверхні шиї, у завушній ділянці, на шкірі обличчя (рис. 3.1).
Рисунок 3.1 – Пацієнт М., 27 років, діагноз:
АД – до лікування.
Висипання були представлені еритематозно-сквамозними осередками запального характеру, фолікулярними папулами, що мали тенденцію до злиття з утворенням осередків інфільтрації, дрібнопластинчатим лущенням, численними лінійними екскоріаціями. У ділянці ліктьових згинів та підколінних ямок – осередки ліхеніфікації з гіперпігментацією та посиленням шкірного рисунку. У місцях тривало існуючих висипань – ділянки гіпо- та гіперпігментації. На всіх ділянках відмічалася сухість шкіри, з ознаками ксерозу. Дермографізм змішаний. Свербіж – 9 балів (за десятибальною шкалою). Порушення сну – 6 балів (за десятибальною шкалою). Індекс SCORAD – 56 балів.
З додаткових ознак були відмічені симптоми «атопічного обличчя».
При обстеженні: загальний аналіз крові: Hb – 164 г/л, еритроцити – 4,5 х1012/л, кольоровий показник – 1,09, лейкоцити – 4,3х109/л, паличкоядерні – 1 %, сегментоядерні – 52 %, еозинофіли – 3 %, лімфоцити – 43 %, моноцити – 1 %, швидкість осідання еритроцитів – 3 мм/год. Загальний аналіз сечі – без патології; біохімічний аналіз крові: глюкоза – 4,8 ммоль/л, загальний білок – 69,1 г/л, білірубін загальний – 9,60 мкмоль/л, білірубін кон’югований – 2,16 мкмоль/л, аспартатамінотрансфераза – 0,48 ммоль/год∙л, аланінамінотрансфераза – 0,40 ммоль/год∙л.
При мікробіологічному обстеженні з ураженних ділянок (шкіра правої кисті) перед початком лікування виявили зростаня S. xylosus до 103 мк/мл, на шкірі правого зап’ястя виявили зростання S. xylosus до 105 мк/мл, слизової носу – S. xylosus 105 мк/мл та глотки – S. mitis в асоціації з Neisseria spp. 106 мк/мл. При мікробіологічному обстеженні після лікування на шкірі виявлено зростання до 103 мк/мл Staphylococcus spp. На слизовій носа виявлено зростання S. epidermidis в асоціації з S. aureus 5 x 104 мк/мл, глотки – S. mutans в асоціації з Neisseria spp. 5 x 105 мк/мл.
Генетичні дослідження виявили наявність генотипу IS гена TLR 1-I602S.
На підставі аналізу анамнестичних, клінічних, лабораторно-інструментальних досліджень було встановлено діагноз: АД, еритематозно-сквамозна форма з ліхеніфікацією, розповсюджений, середньої тяжкості перебіг, період загострення.
Особливостями даного випадку були обтяжений атопічний анамнез, тривалий перебіг, неадекватна терапія (неконтрольоване використання топічних кортикостероїдів).
Ліхеноїдна форма АД виявлялася розповсюдженими висипаннями з ураженням у середньому 48 % шкірного покриву. Висипання локалізувалися на згинальних поверхнях верхніх та нижніх кінцівок, верхній третині грудей та спини, тильній поверхні кистей та стоп, періорбітально, періорально.
Шкіра була сухою, застійно-синюшного кольору, тьмяною на вигляд. Висипання були представлені ліхеноїдними згрупованими плоскими полігональними папулами від 2 до 5 мм, екскоріаціями, лущенням та серозно-геморагічними кірочками, а також осередками ліхеніфікації та інфільтрації без чітких меж з гіперпігментацією та посиленням шкірного рисунку. У місцях тривало існуючих висипань – ділянки гіпо- та гіперпігментації. Такий перебіг захворювання демонструє наступне спостереження.
Хвора Л., 38 років, звернулася до клініки ДУ «Інститут дерматології та венерології НАМН України» зі скаргами на розповсюджені висипання на шкірі верхніх та нижніх кінцівок, що супроводжуються нестерпним свербежем.
Анамнез захворювання: вважає себе хворою з чотиримісячного віку (зі спогадів батьків), коли вперше з’явилися висипання в ділянці обличчя, що супроводжувалися свербежем. Протягом 13 років лікувалася у педіатра з діагнозом «Діатез». Займалася самолікуванням. Лікування значного поліпшення не приносило. При кожному наступному загостренні відбувалося розповсюдження процесу на нові ділянки. Неодноразово лікувалася в алерголога. У віці трьох років процес стабілізувався. Чергове загострення процесу відзначала у віці 15 років, що настало після важкого психоемоційного стресу. Займалася самолікуванням, використовуючи супрастин або діазолін, активоване вугілля, топічні кортикостероїди – елоком та ін. З того часу процес мав хронічний рецидивуючий характер із 3–4 загостреннями на рік, здебільшого після психоемоційних навантажень, порушення дієти та загострення холециститу. Серед інших провокуючих факторів відмічала роль засобів побутової хімії, контакт із синтетичними або вовняними виробами зі шкірою.
Спадковий анамнез: обтяжений – батько страждав на АД, мати – алергічний рино-кон’юнктивіт.
Алергологічний анамнез: відмічала алергічні реакції на контакт із косметичними та засобами побутової хімії, анальгін, вітаміни групи В.
Анамнез життя: цукровий діабет, туберкульоз, хворобу Боткіна, венеричні хвороби в минулому заперечує. Страждає на хронічний холецистит.
При об’єктивному обстеженні встановлено, що загальний стан хворої задовільний. Шкірні покриви і видимі слизові поза осередками ураження, звичайного кольору, вільні від висипань. Периферичні лімфатичні вузли не збільшені, не зрощені з навколишніми тканинами, безболісні при пальпації. Межі легень у нормі; дихання везикулярне, хрипи відсутні. Межі серця не розширені; діяльність серця ритмічна, тони чисті; частота серцевих скорочень – 74 уд. за хв.; артеріальний тиск – 120/80 мм рт. ст.; пульс – 74 уд. за хв. Язик вологий, обкладений білим нальотом. Зів не гіперемований. Мигдалини не збільшені. Живіт при поверхневій пальпації м’який, безболісний. При глибокій пальпації відрізки кишківника звичайних пальпаторних властивостей. Печінка пальпується на 1 см нижче країв реберної дуги. Селезінка не збільшена. Нирки не пальпуються. Симптом Пастернацького негативний. Випорожнення не порушене. Неврологічної симптоматики немає.
Локальний статус: патологічний процес мав розповсюджений характер і локалізувався на шкірі верхніх та нижніх кінцівок у ділянці ліктьових згинів, підколінних ямок, гомілковостопного суглоба, тильній поверхні кистей, періорбітально, періорально та на задній поверхні шиї. Шкіра суха, застійно-синюшного кольору, тьмяна на вигляд (рис. 3.2).
Висипання були представлені ліхеноїдними згрупованими плоскими полігональними папулами від 2 до 5 мм, екскоріаціями, лущенням та серозно-геморагічними кірочками, а також осередками ліхеніфікації та інфільтрації без чітких меж із гіперпігментацією та посиленням шкірного рисунку. У місцях тривало існуючих висипань – ділянки гіпо- та гіперпігментації. Шкіра на всьому протязі суха, з вираженим ксерозом.
З додаткових ознак були присутні симптоми «атопічного обличчя» (Деньє-Моргана, псевдо Хертога, сіруватий колір шкіри, гіперпігментація нижніх повік), полірованих нігтів, хейліт.
Дермографізм білий, стійкий. Індекс SCORAD – 59 балів. Свербіж – 8 балів (за десятибальною шкалою). Порушення сну – 7 балів (за десятибальною шкалою).
При обстеженні: загальний аналіз крові: гемоглобін – 130 г/л, еритроцити – 4,0 х1012/л, кольоровий показник – 0,92, лейкоцити – 5,9х109/л, паличкоядерні – 1 %, сегментоядерні – 58 %, еозинофіли – 1 %, лімфоцити – 31 %, моноцити – 5 %, швидкість осідання еритроцитів – 12 мм/год.; біохімічний аналіз крові: глюкоза – 4,0 ммоль/л, загальний білок – 78,7 г/л, білірубін загальний – 16,66 мкмоль/л, білірубін кон’югований – 2,16 мкмоль/л, аспартатамінотрансфераза – 0,41 ммоль/год∙л, аланінамінотрансфераза – 0,53 ммоль/год∙л.
Рисунок 3.2 – Хвора Л., 38 років, діагноз:
АД – до лікування.
При мікробіологічному обстеженні до лікування на шкірі правої гомілки виявлене зростання S. aureus 105 мк/мл, носу – S. aureus до 103 мк/мл, глотки – S. mitis в асоціації з Neisseria spp. 105 мк/мл.
Генетичні дослідження виявили наявність генотипу IS гена TLR 1-I602S.
Консультована суміжними фахівцями. Висновок гастроентеролога: хронічний холецистит у стадії нестійкої ремісії.
На підставі анамнестичних, клініко-лабораторних і даних об’єктивного дослідження було виставлено діагноз: АД, ліхеноїдна форма, розповсюджений, важкий перебіг, період загострення.
Особливостями даного випадку були обтяжений спадковий анамнез, тривалий важкий перебіг із збільшенням частоти загострень з 15-річного віку, зв’язок загострень здебільшого з психоемоційними навантаженнями, порушенням дієти та загостренням холециститу, а також із контактом із засобами побутової хімії, синтетичними або вовняними виробами, більш вираженими порушеннями вегетативного статусу та метаболічними порушеннями порівняно із середніми значеннями хворих з такою ж формою АД.
Серед клінічних проявів ІЕ найбільш важкими проявами була еритема, вираженість якої у 36,5 % хворих була оцінена в три бали та у 40,4 % – у два бали. Вираженість інфільтрації, папулоутворення та набряку у 28,9 % була оцінена в три бали, а у 44,2 % у два бали. Екскоріації та ліхеніфікації, які були оцінені у три бали, відмічалися у 23,1 % пацієнтів, у два бали – у 40,4 % (табл. 3.10).
Таблиця 3.10 – Розподіл хворих на ІЕ за вираженістю основних клінічних проявів захворювання (n=52)
| Клінічний симптом | Вираженість клінічного симптому | |||
| немає | легкий | середній | тяжкій | |
| Еритема | – | 12 (23,1 %) | 21 (40,4 %) | 19 (36,5 %) |
| Інфільтрація/папули/набряк | – | 14 (26,9 %) | 23 (44,2 %) | 15 (28,8 %) |
| Екскоріації та ліхеніфікації | – | 19 (36,5 %) | 21 (40,4 %) | 12 (23,1 %) |
| Везикуляція/мокнуття | – | 9 (17,3 %) | 20 (38,5 %) | 23 (44,2 %) |
Важливою клінічною ознакою ІЕ, що не є складовою частиною EASI, є наявність різної кількості везикул та мокнуття різної інтенсивності в осередках ураження. У 20 (38,5 %) осіб вираженість даної ознаки була оцінена в два бали, значна кількість везикульозних висипань та інтенсивне мокнуття виявлялось у 23 (44,2 %) осіб та оцінювалося в три бали.
Приклади ІЕ демонструють наступні клінічні спостереження.
Хворий Ч., 27 років звернувся до клініки ДУ «Інститут дерматології та венерології НАМН України» зі скаргами на висипання на верхніх та нижніх кінцівках, що супроводжувалися свербежем помірної інтенсивності.
Вважає себе хворим один рік. Самостійно змащував осередки висипань «Кремгеном». Останнє погіршення триває 2 тижні. Загострення шкірного процессу пов’язує із вживанням великої кількості кави, кока-коли та жирної, жареної їжі.
Спадковий анамнез не обтяжений, алергічні реакції не виявлені. Вірусний гепатит, малярію, туберкульоз, венеричні захворювання хворий заперечує.
При обстеженні загальний стан задовільний. Шкірні покриви і видимі слизові оболонки поза осередками ураження звичайного забарвлення, без висипань. Периферичні лімфатичні вузли не збільшені, безболісні при пальпації. Межі легень у нормі; дихання везикулярне, хрипи відсутні. Межі серця не розширені; діяльність серця ритмічна, тони чисті; частота серцевихскорочень – 82 удари за хв.; артеріальний тиск – 122/70 мм рт.ст.; пульс – 79 ударів за хв. Язик вологий, обкладений білим нальотом. Зів не гіперемований. Мигдалини не збільшені. Живіт при поверхневій пальпації м’який, безболісний. Печінка не пальпується. Селезінка не збільшена. Симптом Пастернацького негативний з обох сторін. Випорожнення не порушено.
При огляді шкірних покривів установлено, що патологічний процес мав розповсюджений характер і локалізувався на шкірі передпліч, ліктів, гомілок та стоп. Ураження шкіри у вигляді множинних осередків інфільтрації, гіперемії з великою кількістю папул, везикул, серозних та серозно-геморагічних кірочок та мокнуттям на поверхні (рис. 3.3).
При обстеженні: загальний аналіз крові: гемоглобін – 156 г/л, еритроцити – 4,6 х1012/л, кольоровий показник – 1,02, лейкоцити – 7,5х109/л, паличкоядерні – 1 %, сегментоядерні – 64 %, еозинофіли – 3 %, лімфоцити – 23 %, моноцити – 8 %, швидкість осідання еритроцитів – 15 мм/год.; біохімічний аналіз крові: глюкоза – 4,0 ммоль/л, загальний білок – 69,3 г/л, білірубін загальний – 14,9 мкмоль/л, білірубін кон’югований – 2,16 мкмоль/л, аспартатамінотрансфераза – 0,92 ммоль/ч∙л, аланінамінотрансфераза – 0,52 ммоль/ч∙л.
Рисунок 3.3 – Хворий Ч., 27 років, діагноз: ІЕ – до лікування.
При мікробіологічному обстеженні до лікування на шкірі правої гомілки виявлено зростання S. aureus 104 мк/мл, носу – S. xylosus 105 мк/мл, глотки S. mutans в асоціації з Neisseria spp. 105 мк/мл.
Генетичні дослідження виявили наявність генотипу SS гена TLR 1-I602S.
Індекс EASI становив 48,7 балів. Свербіж – 6 балів (за десятибальною шкалою). Порушення сну – 5 (за десятибальною шкалою).
На підставі анамнестичних, кініко-лабораторних і даних об’єктивного дослідження був поставлений діагноз: хронічна ІЕ, стадія загострення.
Хворий К., 32 роки звернувся до клініки ДУ «Інститут дерматології та венерології НАМН України» зі скаргами на висипання на шкірі обличчя та верхніх кінцівках, що супроводжувалися інтенсивним свербежем та активним мокнуттям.
Вважає себе хворим протягом двох років. Вперше свербіж виник на шкірі пальців обох рук, але через деякий час процес регресував. Займався самолікуванням, при загостренні процесу наносив на осередки мазь «Лоринден». Пацієнт відзначає загострення процесу в осінньо-весняний період, а також пов’язує погіршення стану з тривалим контактом з водою та хімічними речовинами – працює мийником машин на автомийці.
Спадковий анамнез не обтяжений; алергічні реакції не виявлені. Вірусний гепатит, малярію, туберкульоз, венеричні захворювання хворий заперечує.
При обстеженні загальний стан задовільний. Шкірні покриви і видимі слизові оболонки поза осередками ураження звичайного забарвлення, без висипань. Периферичні лімфатичні вузли не збільшені, безболісні при пальпації. Межі легень у нормі; дихання везикулярне, хрипи відсутні. Межі серця не розширені; діяльність серця ритмічна, тони чисті; частота серцевих скорочень – 85 ударів за хв.; артеріальний тиск – 119/71 мм рт.ст.; пульс – 74 ударів за хв. Язик вологий, обкладений білим нальотом. Зів не гіперемований. Мигдалини не збільшені. Живіт при поверхневій пальпації м’який, безболісний. Печінка не пальпується. Селезінка не збільшена. Симптом Пастернацького негативний з обох сторін. Випорожнення не порушено.
При огляді шкірних покривів установлено, що патологічний процес мав розповсюджений характер і локалізувався на шкірі обличчя та кистях обох рук. Представлений множинними гострозапальними осередками різного розміру з нечіткими межами, на поверхні яких розташовувалися папули рожево-червоного кольору, діаметром до 5 мм, покриті серозним корками, місцями відзначалося неінтенсивне лущення. На тилі правої кисті відзначався інфільтрований, еритематозний осередок ураження до 8 см у діаметрі, неправильної форми з великою кількістю папул, мікровезикул, серозних та серозно-геморагічних кірочок та інтенсивним мокнуттям на поверхні (рис. 3.4).
При обстеженні: загальний аналіз крові: гемоглобін – 147 г/л, еритроцити – 4,1 х1012/л, кольоровий показник – 1,02, лейкоцити – 3,3х109/л, паличкоядерні – 1 %, сегментоядерні – 67 %, еозинофіли – 4 %, лімфоцити – 24 %, моноцити – 1 %, швидкість осідання еритроцитів – 3 мм/год.; біохімічний аналіз крові: глюкоза – 4,6 ммоль/л, загальний білок – 78,9 г/л, білірубін загальний – 17,55 мкмоль/л, білірубін кон’югований – 3,33 мкмоль/л, аспартатамінотрансфераза – 0,36 ммоль/год∙л, аланінамінотрансфераза – 0,32 ммоль/год∙л.
Рисунок 3.4 – Хворий К., 32 роки, діагноз: ІЕ – до лікування.
Фото після лікування в розділі 4.
При мікробіологічному обстеженні до лікування на шкірі правої гомілки виявлений ріст S.aureus 5 х 103мк/мл, носу – виявлений ріст S.epidermidis 103 мк/мл, глотки S.piogenеs 105 мк/мл.
Генетичні дослідження виявили наявність генотипу SІ гена TLR 1-I602S.
Індекс EASI становив 52,6 балів. Свербіж – 6 балів (за десятибальною шкалою). Порушення сну – 8 (за десятибальною шкалою).
На підставі анамнестичних, клініко-лабораторних і даних об’єктивного дослідження був поставлений діагноз: хронічна ІЕ, стадія загострення.
Більш виражені клінічні прояви виявлялися у хворих на МЕ. Найбільш важким клінічним проявом у цих хворих була еритема. Вираженість еритеми була оцінена в три бали у 59,6 % пацієнтів, інфільтрації, папулоутворення та набряку – у 48,1 %, екскоріацій та ліхеніфікацій – у 46,2 % хворих. Вираженість цих симптомів у два бали спостерігалась у 34,6 %, 42,3 % та 34,6 % пацієнтів відповідно. Крім цього, характерними клінічними проявами захворювання були везикуляції та мокнуття, які у 38,5 % хворих оцінено як тяжкі, у 36,5 % – як середньої тяжкості та 21,2 % – як легкі (табл. 3.11).
Таблиця 3.11 – Розподіл хворих на МЕ за вираженістю основних клінічних проявів захворювання (n=52)
| Клінічний симптом | Вираженість клінічного симптому | |||
| немає | легкий | середній | тяжкій | |
| Еритема | – | 3 (5,8 %) | 18 (34,6 %) | 31 (59,6 %) |
| Інфільтрація/папули/набряк | – | 5 (9,6 %) | 22 (42,3 %) | 25 (48,1 %) |
| Екскоріації та ліхеніфікації | 1 (1,9 %) | 9 (17,3 %) | 18 (34,6 %) | 24 (46,2 %) |
| Везикуляція/мокнуття | 2 (3,8 %) | 11 (21,2 %) | 19 (36,5 %) | 20 (38,5 %) |
Наступне клінічне спостереження демонструє випадок МЕ.
Хворий Д., 63 роки звернувся до клініки ДУ «Інститут дерматології та венерології НАМН України» зі скаргами на висипання на шкірі обличчя, шиї, верхніх та нижніх кінцівок, тулубі, що супроводжувалися інтенсивним свербежем, порушенням сну.
Страждає на дерматоз протягом 7 років. Захворювання пов’язує з контактом із будівельними матеріалами (працював будівельником-штукатуром), систематично вживає алкоголь. Останнє погіршення триває 3 тижні. Самостійно несистематично наносив невідомі ТГКС.
Спадковість не обтяжена, алергічні реакції не виявлені. Вірусний гепатит, малярію, туберкульоз, венеричні захворювання хворий заперечує.
При обстеженні на шкірі обличчя, тулубі та кінцівках множинні осередки ураження, які мали гіперемований колір, корки і тріщини. Видимі слизові оболонки звичайного забарвлення, без висипань. Периферичні лімфатичні вузли не збільшені, безболісні при пальпації. Межі легень у нормі; дихання везикулярне, хрипи відсутні. Межі серця не розширені; діяльність серця ритмічна, тони чисті; частота серцевих скорочень – 71 удар за хв.; артеріальний тиск – 120/80 мм рт.ст.; пульс – 75 ударів за хв. Язик вологий, обкладений білим нальотом. Зів не гіперемований. Мигдалини не збільшені. Живіт при поверхневій пальпації м’який, безболісний. Печінка не пальпується. Селезінка не збільшена. Симптом Пастернацького негативний з обох сторін.
При огляді шкірних покривів установлено, що патологічний процес мав дифузний характер і локалізувався на шкірі обличчя, шиї, тулуба, верхніх та нижніх кінцівок (рис. 3.5).
Рисунок 3.5 – Хворий Д., 63 роки, діагноз: МЕ (до лікування).
Шкіра інфільтрована, з осередками ліхеніфікації. На поверхні були ерозії із серозно-гнійним вмістом, які підсихали в кірки жовто-бурого кольору. На обох гомілках відзначалася значна кількість серозно-гнійних та серозно-геморагічних кірочок. На внутрішній поверхні стегон є дисеміновані пустульозні елементи із запальною облямівкою по периферії. На шкірі спини та плечей розташовувалися осередки гіперемії з інфільтрацією, екскоріаціями, лущенням.
При обстеженні: загальний аналіз крові: гемоглобін – 140 г/л, еритроцити – 4,2х1012/л; лейкоцити – 9,8х109/л; еозинофіли – 7 %; паличкоядерні нейтрофіли – 1 %; сегментоядерні нейтрофіли – 53 %; лімфоцити – 35 %; моноцити – 1 %; швидкість осідання еритроцитів – 20 мм/год.; загальний аналіз сечі: кількість – 130,0 мл; колір – жовтий; прозорість – мутна; питома вага – 1034; рН – 6,5; білок – не знайдено; глюкоза – не знайдено, епітелій перехідний – 2–3 в полі зору; лейкоцити – 2–3 в полі зору; циліндри – не знайдено; солі – оксалати помірна кількість, урати багато; слиз – багато, відзначався аморфний рожевий осад; біохімічний аналіз крові: глюкоза – 5,0 ммоль/л; загальний білок – 73,0 г/л; білірубін загальний – 17,64 мкмоль/л; білірубін кон’югований – 2,55 мкмоль/л; аспартатамінотрансфераза – 0,83 ммоль/год∙л; аланінамінотрансфераза – 0,85 ммоль/год∙л.
При мікробіологічному обстеженні до лікування на шкірі кистей виявлено зростання S. xylosus ‹103 мк/мл, носу – S. xylosus ‹103 мк/мл, глотки S. mutans 106 мк/мл.
Індекс EASI становив 71,4 бали. Свербіж – 9 балів (за десятибальною шкалою). Порушення сну – 7 (за десятибальною шкалою).
Генетичні дослідження виявили наявність генотипу IІ гена TLR 1-I602S.
На підставі анамнестичних, клініко-лабораторних і даних об’єктивного дослідження був поставлений діагноз: хронічна МЕ, стадія загострення.
У хворих на АД загальна тяжкість захворювання за шкалою SCORAD при надходженні на лікування у середньому становила (50,8 ± 18,2) бали (95 % ДІ 45,6–55,9 балів), у тому числі у 5 (10,0 %) – менше 20 балів (легкий перебіг), у 8 (16,0 %) – перебіг середньої тяжкості та у 37 (74,0 %) – тяжкий перебіг захворювання.
У хворих на ІЕ загальна тяжкість захворювання за шкалою EASI на початку лікування складала у середньому (43,2 ± 16,7) балів (95 % ДІ 38,6–47,9 балів), у тому числі хворих із легким перебігом (до 20 балів за шкалою EASI) було 4 (7,7 %), середньої тяжкості – 18 (34,6 %) (від 20 до 40 балів за шкалою EASI) та з тяжким перебігом (більше 40 балів за шкалою EASI) – 30 (57,7 %).
Загальна тяжкість захворювання за шкалою EASI у хворих на МЕ на початку лікування становила у середньому (54,2 ± 15,3) бали (95 % ДІ 49,9–58,5 балів), у тому числі у 2 (3,8 %) перебіг оцінено як легкий, у 7 (13,5 %) – середньої тяжкості та у 43 (82,7 %) – як тяжкий.
Таким чином, у більшості хворих на початку лікування вираженість окремих клінічних проявів та тяжкість перебігу захворювання оцінювалась як тяжка, рідше – середньої тяжкості.
* * *
Таким чином, незважаючи на певні відмінності анамнестичних та клінічних даних у хворих на алергодерматози залежно від основного діагнозу (АД, ІЕ або МЕ), знайдено багато загальних характеристик, що є непрямим доказом спільних ланок патогенезу, для з’ясування яких виконано подальший аналіз.
За результатами розділу опубліковано наступні праці:
- Мангушева ВЮ. Аналіз супутньої соматичної патології у хворих на хронічну екзему. В кн. збірник робіт по матеріалам наук.-практ. конф. «Інноваційні досягнення в діагностиці інфекцій, що передаються статевим шляхом, інфекційних і грибкових захворювань та поширених дерматозів. Прогрес у лікуванні» VIII міжнародного медичного конгресу, м. Київ, 25–27 квітня 2017: 163 [52].
- Кутасевич ЯФ, Іщєйкін КЄ, Олійник ІО, Джораєва СК, Зюбан ІВ, Мангушева ВЮ. Особливості клінічних проявів атопічного дерматиту у пацієнтів з мутацією 2282del14 в гені філаггрину. Дерматологія та венерологія. 2018; 2 (80): 19–25 [37].
- Мангушева ВЮ. Особенности клинических проявлений микробной экземы в области нижних конечностей. Мат. наук.-практ. конф. з міжнар. участю “Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі”, м. Харків, 10-11 листопада 2017. Дерматологія та венерологія. 2017: 3 (77): 107 [54].
РОЗДІЛ 4
МІКРОБІОЦЕНОЗ ОСНОВНИХ БІОТОПІВ
ХВОРИХ НА АЛЕРГОДЕРМАТОЗИ
Як було зазначено в огляді літератури (див. розд. 1), мікробіоценоз людини являє собою цілісну біологічну систему, яка існує за рахунок рівноваги між мікрофлорою та макроорганізмом, але в умовах патології навіть непатогенні представники автофлори біологічних екотопів можуть стати джерелом автоінфекції. Крім того, у даних умовах зростає вірогідність формування нових мікробних асоціацій, що призводить до зміни якісного складу ценозу зі зникненням деяких симбіонтів.
У дослідженні брали участь 154 хворих на розповсюджені дерматози. Під час проведення бактеріологічних досліджень ізольовано 757 лабораторних штами мікроорганізмів – представників 6 родів.
Для проведення дослідження пацієнтів було розподілено на дві групи:
– Іа група – 30 хворих, у яких застосовано ступінчасту ентеросорбцію (11 хворих на АД, 12 хворих на ІЕ та 7 хворих на МЕ);
– Іб група – 20 хворих, які не отримували ентеросорбційну терапію (6 хворих на АД; 7 хворих на ІЕ та 7 хворих на МЕ).
При бактеріологічному дослідженні виділень зіву пацієнтів усіх груп у період загострення, до лікування, у більшості випадків не виявлено значимих порушень як у кількісному, так і якісному складі мікроорганізмів. Найчастіше до складу даного біотопу входили непатогенні стрептококи: S. mitis (55,7 %), S. mutans (31,4 %), S. oralis (7,1 %) та S. anginosus (2,9 %), що формували асоціації з непатогенними представниками роду Neisseria та Staphylococcus, Micrococcus і Corynebacterium. Лише у п’яти пацієнтів були виявлені представники умовно-патогенної мікрофлори з вираженим патогенним потенціалом у складі ценозу зіву – К. pneumoniae, K. ozaenae та S. pyogenes. Ступінь загального мікробного обсіменіння склала від 1х104 до 1х107 КУО/мл.
При дослідженні виділень носу пацієнтів даних груп було вилучено 82 лабораторних штами стафілококів, серед яких переважну більшість склали S. еpidermidis – 32,9 %, S. aureus –17,1 %, S. haemolyticus – 17,1 %. Ступінь загального мікробного обсіменіння коливався від 1х103 до 1х106 КУО/мл. Важливо зауважити, що найчастіше S. aureus вилучали від хворих на АД, при цьому у 19,4 % обстежених (6 із 31 особи) збудник було виявлено паралельно в носових ходах і на шкірі.
При дослідженні складу шкірного біотопу хворих до лікування було отримано 212 лабораторних штамів мікроорганізмів з переважанням стафілококової складової (85,8 %). Ступінь загального мікробного обсіменіння коливався від 1х104 до 1х108 КУО/мл. Серед вилучених різновидів стафілококів у ценозі шкіри переважали S. aureus, S. haemolyticus та S. еpidermidis. Отримані дані наведено на рис. 4.1.
Рисунок 4.1 – Видовий розподіл стафілококів, вилучених з осередків
ураження хворих на ІЕ, МЕ та АД.
При розгляданні складу шкірної біоти хворих на екзему та АД у період загострення, до лікування, спостерігався зсув у складі шкірної біоти з переважанням найбільш агресивних видів, питома вага яких становила 60,8 %, з домінуванням S. aureus (42,6 % лабораторних штамів) у хворих на АД та 36,1 % і 37,9 % відповідно у хворих на ІЕ та МЕ. Важливо зауважити, що саме у групі пацієнтів з АД відмічалися більш виражені порушення у складі біотопу верхніх дихальних шляхів з ізоляцією лабораторних штамів S. aureus, які мали однаковий профіль антибіотикорезистентності зі шкірними різновидами збудника, що може свідчити про персистенцію збудника у різних екотопах вегетування макроорганізму. Поява нерезидентних видів стафілококів із більш високим патогенним потенціалом на уражених шкірних ділянках була відмітною особливістю для більшості хворих на розповсюджені дерматози з переважанням S. aureus у біоті шкіри хворих на АД.
На наступному етапі дослідження було проведено визначення чутливості штамів стафілококів, вилучених з ушкоджених ділянок шкіри хворих обох груп, до антибактеріальних препаратів різних груп (рис. 4.2).
Рисунок 4.2 – Визначення резистентності вилучених лабораторних
штамів стафілококів до антибактеріальних препаратів різних груп.
У результаті проведених досліджень встановлено, що стафілококи виявили високу резистентність до пеніциліну та макролідів (73,3 % та 52,5 % відповідно), помірну до аміноглікозидів, тетрациклінів та лінкозамідів (51,7 %, 48,0 % та 32,5 % відповідно). Найбільшу чутливість штами показали до фузидієвої кислоти (93,3 % штамів). Загальна кількість штамів резистентних до оксациліну (MRSA + MR–CNS) становила 27,2 % (49 штамів). Важливо зауважити, що серед метицилінрезистентних штамів 12 (24,5 %) мали ознаки MLS-резистентності (резистентність до макролідів, що часто поширюється на споріднені з макролідами лінкозаміди та стрептограмін В), а 2 штами мали екстенсивну резистентність, при цьому переважна більшість цих штамів було ізольовано від хворих на АД.
Для дослідження стану біоти кишечника було включено 30 пацієнтів з алергодерматозами (10 хворих на АД, 11 хворих на ІЕ та 9 хворих на МЕ), яких було розподілено на дві групи по 15 осіб, репрезентативних за віком і статтю: основну та групу порівняння. Основна група використовувала, окрім базової терапії, атоксіл та еліміналь гель за схемою; у групі порівняння використовувалася тільки базова терапія.
У результаті проведених досліджень у пацієнтів обох груп порушення мікробіоценозу товстого кишечника було виявлено у всіх 30 осіб. Так, дисбактеріоз І ступеня було виявлено у 3 (10,0 %), ІІ ступеня – у 16 (53,3 %) обстежених, ІІІ ступеня – 11 (36,7 %). На рисунку 4.3 наведено результати бактеріологічного дослідження кишечної біоти. Дисбіотичні порушення характеризувалися зниженням кількісного вмісту індигенної мікрофлори, що стосувалось аеробних та анаеробних бактерій.
Дисбіотичні порушення характеризувалися зниженням кількісного вмісту індигенної мікрофлори, що стосувалось аеробних та анаеробних бактерій. Найчастіше виявлялося зниження біфідобактерій – у 9 осіб (30,0 %), зниження показників висіваності лактобактерій виявлено у 4 хворих (10,5 %). Вміст у кишечнику нормальної кишкової палички був знижений у 3 (13,3 %) обстежених. Також у 25 (83,3 %) хворих було виявлено зростання кількості умовно-патогенних бактерій (H. alvei, K. pneumoniae, Proteus spp., E. aerogenes).
Рисунок 4.3 – Частота виявлення клінічно значущих мікроорганізмів
у ценозі кишечника.
На тлі кількісного дисбалансу мікрофлори виявлялися зміни в якісному складі: у 9 (30,0 %) обстежених виявлялася кишкова паличка з гемолітичними властивостями, у 6 (20,0 %) пацієнтів – лактозонегативна та у 2 (6,7 %) хворих – кишкова паличка зі зниженою ферментативною активністю. Звертає на себе увагу частота виявлення грибів роду Candida. Дані гриби було ізольовано у 22 (73,3 %) обстежених. Також у 13,3 % випадків було вилучено S. aureus (рис. 4.3). Крім того, у 2 хворих було виявлено патогенні ентеробактерії (S. enteritidis), а у 3 (10,0 %) пацієнтів – мікроорганізми роду Clostridium.
Мікробній склад шкірного біому контрольної групи (здорові особи) був представлений у переважній більшості стафілококами, що формували асоціації з коринебактеріями та мікрококами. Серед стафілококів переважали штами S. еpidermidis (82,5 %). Кількість штамів S. haemolyticus та S. aureus становила 5,0 % та 2,5 % відповідно.
Для проведення дослідження впливу зовнішньої терапії на мікробіоту шкіри пацієнтів було розподілено на дві групи:
– ІІа група – 67 хворих, у яких застосовано етапну зовнішню терапію (24 хворих на АД; 18 хворим на ІЕ та 25 хворим на МЕ);
– ІІб група – 37 хворих, у яких для лікування застосовувався комбінований препарат, що містить протимікробний компонент та ТГКС згідно інструкції виробника (9 хворих на АД, 15 хворих на ІЕ та 13 хворих на МЕ).
На наступному етапі роботи проведено порівняльні дослідження щодо складу стафілококової компоненти шкіри хворих, що отримували терапію із застосуванням місцево комбінованого засобу або ступінчастої терапії до лікування.
На рис. 4.4–4.5 наведено дані щодо складу стафілококової компоненти шкіри хворих, які отримували терапію із застосуванням місцево комбінованого засобу або етапної терапії до лікування.
Рисунок 4.4 – Склад шкірного ценозу хворих, що отримували етапну терапію, до лікування.
Рисунок 4.5 – Склад шкірного ценозу хворих, що отримували терапію комбінованим засобом, до лікування.
Як видно з рис. 4.4–4.5, у хворих обох груп у період загострення (до початку терапії) при дослідженні матеріалу з уражених ділянок шкіри було виявлено переважно різновиди стафілококів, кількість штамів із патогенним потенціалом. У ІІа групі кількість штамів S. aureus 48,8 % визначалась у хворих на АД, у хворих на ІЕ – 18,7 % та у хворих на МЕ – 21,4 %. Частота вилучення штамів S. haemolyticus у хворих на АД становила 12,5 %, у хворих на ІЕ – 22,2 %, МЕ – 37,0 %. Кількість штамів S. еpidermidis у хворих ІІа групи склала 24,4 %, 26,6 %, 28,6 % відповідно.
У ІІб групі кількість штамів S. aureus 50,0 % визначалась у хворих на АД, у хворих на ІЕ – 11,1 % та у хворих на МЕ – 14,8 %. Частота вилучення штамів S. haemolyticus у хворих на АД становила 17,1 %, у хворих на ІЕ – 20,3 %, МЕ – 10,7 %. Кількість штамів S. еpidermidis у хворих ІІб групи склала 18,8 %, 13,9 %, 11,1 % відповідно.
* * *
Таким чином, у період загострення (до початку лікування) у більшості хворих на алергодерматозами, що увійшли у дослідження, особливо у хворих на АД, виявлено ознаки порушень мікробіоценозу, які полягали у пригніченні індигенної мікрофлори та активації умовно-патогенної мікрофлори з високим патогенним потенціалом. У багатьох випадках ці зміни були універсальними, тобто спостерігались у всіх біотопах (на шкірі, у виділеннях із зіву, носу та у вмісті товстої кишки).
Це свідчить про необхідність цілеспрямованої корекції цих порушень незалежно від основного діагнозу.
За результатами цього розділу надруковано наступні праці:
- Кутасевич ЯФ, Джораева СК, Мангушева ВЮ. Исследование состава микробиоты кожи и анализ ее антибиотикорезистентности у больных аллергодерматозами. Експериментальна і клінічна медицина. 2018: 1 (78): 101–107 [35].
- Кутасевич ЯФ, Маштакова ІО, Джораєва СК, Мангушева ВЮ. Особливості складу ценозів кишечника та шкіри у хворих на алергодерматози. В кн.: Матеріали V ювілейного міжнар. мед. конгресу «Впровадження сучасних досягнень медичної науки у практику охорони здоров’я України». К., 2016: 84 [39].
РОЗДІЛ 5
ВМІСТ ІНТЕРЛЕЙКИНУ-17А В СИРОВАТЦІ КРОВІ
ХВОРИХ НА АЛЕРГОДЕРМАТОЗИ
Дослідження вмісту IL-17А виконано у 33 хворих на АД, у 39 хворих на ІЕ, у 36 хворих на МЕ та у 23 практично здорових людей (контрольна група) (табл. 5.1).
Таблиця 5.1 – Рівень IL-17А в сироватці крові обстежених хворих на початку дослідження
| Діагноз | Рівень IL-17А (пг/мл) | ||
| M±SD | 95 % ДІ | ||
| Нижня границя | Верхня границя | ||
| АД (n=33) | 113,7 ± 60,61 | 96,4 | 130,9 |
| ІЕ (n=39) | 86,8 ± 48,61 | 73,3 | 100,3 |
| МЕ (n=36) | 99,9 ± 40,21 | 88,7 | 111,1 |
| Контрольна група (n=23) | 13,0 ± 8,9 | 9,1 | 16,9 |
Примітка. 1 – відмінності достовірні порівняно з контрольною гупою (p<0,05 за t-критерієм).
За результатами статистичного аналізу вміст IL-17А коливався в досить широких межах. У контрольній групі практично здорових осіб він складав у середньому (13,0 ± 8,9) пг/мл (від 1,3 пг/мл до 27,0 пг/мл) (95 % ДІ 9,1–16,9 пг/мл).
У хворих на АД він становив від 11,3 до 220,6 пг/мл (у середньому (113,7 ± 60,6) пг/мл), 95 % ДІ становив 96,4–130,9 пг/мл).
У хворих на ІЕ – від 6,8 до 252,8 пг/мл (у середньому – (85,6 ± 49,6) пг/мл); 95 % ДІ – 71,8–99,4 пг/мл. У хворих на МЕ – від 10,2 до 166,3 пг/мл (у середньому (100,1 ± 39,8) пг/мл); 95 % ДІ – 89,0–111,1 пг/мл.
Перш за все, привертає увагу, що незалежно від діагнозу вміст IL-17А у середньому був достовірно більшим, ніж у контрольній групі (p<0,05 за t‑критерієм). Найбільші значення відмічено у хворих на АД, дещо менші – у хворих на МЕ та ІЕ (різниця рівня IL-17А між групами хворих залежно від діагнозу статистично не значима – p>0,05 за t-критерієм).
За даними кореляційного аналізу було виявлено пряму залежність вмісту IL-17А та тяжкістю захворювання: у хворих на АД – rP = 0,681 (p<0,001) та rP = 0,722 (p<0,001) з величиною SCORAD; у хворих на ІЕ – rP = 0,400 (p=0,003) та rP = 0,423 (p=0,002) з величиною EASI; у хворих на МЕ – rP = 0,613 (p<0,001) та rP = 0,613 (p<0,001) з величиною EASI. Така залежність також підтверджувалася розподілом середніх значень концентрації IL-17А залежно від тяжкості алергодерматозу (рис. 5.1).
Рисунок 5.1 – Рівень IL-17А у хворих на алергодерматози залежно
від тяжкості захворювання до початку лікування (р<0,001 порівняно з контрольною групою при середньому та тяжкому перебігу та p>0,05
при легкому перебігу за t-критерієм).
При легкому перебігу АД вміст IL-17А склав у середньому (19,2 ± 5,1) пг/мл, що майже не відрізнявся від аналогічного показника в контрольній групі (р=0,079 за t-критерієм). При середньо-важкому перебігу він зростав до (64,3 ± 25,1) пг/мл, а при важкому сягав (137,1 ± 50,2) пг/мл (p<0,001 за t-критерієм з контрольною групою та з хворими з легким перебігом захворювання).
У хворих на ІЕ при легкому перебігу захворювання рівень IL-17А склав у середньому (15,6 ± 6,1) пг/мл, не відрізняючися від аналогічного показника контрольної групи (р=0,782 за t-критерієм). При середньо-важкому перебігу він зростав до (76,4 ± 37,5) пг/мл, при важкому – (100,5 ± 50,4) пг/мл (p<0,001 за t‑критерієм з контрольною групою та з хворими з легким перебігом). У хворих на МЕ ці показники становили (11,6 ± 1,9), (63,5 ± 29,6) та (110,1 ± 33,1) пг/мл у відповідні терміни з аналогічними результатами порівняння з контрольною групою.
* * *
Таким чином, у хворих на алергодерматози під час загострення захворювання спостерігається значне збільшення рівня IL-17А в сироватці крові. Це збільшення має значиму пряму кореляцію з тяжкістю перебігу захворювання, що свідчить про важливість імунного механізму в патогенезі захворювання та ролі прозапальних цитокінів. Ступінь цих порушень також залежить від вираженості змін мікробіоценозу, що є доказом необхідності його корекції.
За результатами цього розділу надруковано наступні праці:
- Мангушева ВЮ. Дослідження вмісту інтерлейкіну-17А у хворих на алергодерматози. Дерматологія та венерологія. 2018; 3 (81): 17-21 [53].
РОЗДІЛ 6
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ПОЛІМОРФІЗМУ ГЕНА TLR 1-I602S
Дослідження поліморфізму гена TLR 1-I602S виконано у 39 хворих, у тому числі у 9 хворих на АД, у 11 хворих на ІЕ та у 19 хворих на МЕ. Контрольну групу склала 41 практично здорова особа.
Оцінку результатів поліморфізму у хворих на алергодерматози наведено на рис. 6.1.
Рисунок 6.1 – Поліморфізм гена TLR1-I602S у хворих на алергодерматози
порівняно з контрольною групою (відмінності між групами достовірні – р<0,001 за критерієм χ2).
У хворих на алергодерматози (в цілому) генотип SS виявлено у 12 (30,8 %) випадках, генотип IS – у 23 (59,0 %) випадках, а генотип ІІ – 4 (10,2 %) випадках, тобто превалювали менш активні варіанти генотипу TLR1-I602S на відміну від розподілу генотипів у контрольній групі, в якій переважав активний генотип ІІ – 27 (65,8 %) випадків; найменш активний генотип SS виявлено у 5 (12,2 %), а генотип IS – у 9 (22,0 %) випадках (різниця поліморфізму гена TLR1-I602S у хворих на алергодерматози статистично достовірна порівняно з контрольною групою – χ2=26,038, р<0,001).
Результати аналізу поліморфізму гена TLR1-I602S залежно від діагнозу наведено у табл. 6.1.
Таблиця 6.1 – Результати визначення поліморфізму гена TLR1-I602S у хворих на алергодерматози
| Діагноз | Генотипи TLR1-I602S | р1 | ||
| SS | IS | II | ||
| АД (n=9) | 2 (22,2 %) | 7 (77,8 %) | – | 0,002 |
| ІЕ (n=11) | 6 (54,5 %) | 5 (45,5 %) | – | <0,001 |
| МЕ (n=19) | 4 (21,1 %) | 11 (57,9 %) | 4 (21,1 %) | 0,005 |
| Контрольна група (n=41) | 5 (12,2 %) | 9 (22,0 %) | 27 (65,8 %) | |
Примітка. 1 – р – достовірність відмінності порівняно з контрольною групою за критерієм χ2.
У результаті аналізу встановлено, що у хворих на АД активного генотипу гена TLR1-I602S ІІ не було, генотип IS виявлено у 7 (77,8 %) випадках, а генотип SS – у 2 (22,2 %) випадках. При ІЕ активного генотипу також не було, при цьому значно збільшилася частота малоактивного генотипу SS – 6 (54,5 %) хворих, генотип ІS виявлений у 5 (45,5 %) випадках. При МЕ генотипи ІІ та SS виявлялися з однаковою частотою – по 4 (21,1 %) хворих, а генотип ІS – у 11 (57,9 %) хворих (різниця між групами залежно від діагнозу статично не значима – p>0,05 за критерієм χ2 у всіх порівняннях). При цьому зберігалася статистично значима різниця розподілу генотипів гена TLR1-I602S незалежно від діагнозу порівняно з контролем АД – χ2=13,645, р=0,002; ІЕ – χ216,377, р<0,001; МЕ – χ2=10,755, р=0,005).
При додатковому аналізі поліморфізму гена TLR1-I602S залежно від тяжкості захворювання також виявлено окремі особливості (табл. 6.2–6.4).
У хворих на АД через малу кількість спостережень суттєвих закономірностей не виявлено (табл. 6.2).
Таблиця 6.2 – Результати визначення поліморфізму гена TLR1-I602S у хворих на АД залежно від тяжкості захворювання.
| Тяжкість АД за SCORAD |
Генотипи TLR1-I602S | ||
| SS | IS | II | |
| до 20 балів | 100 % | – | – |
| Більш 40 балів | 12,5 % | 87,5 % | – |
Примітка. Відмінності між групами залежно від тяжкості захворювання відсутні (р>0,05 за критерієм χ2).
Таблиця 6.3 – Результати визначення поліморфізму гена TLR1-I602S у хворих на ІЕ залежно від тяжкості захворювання
| Тяжкість ІЕ за IASI | Генотипи TLR1-I602S | ||
| SS | IS | II | |
| до 20 балів | 66,7 % | 33,3 % | – |
| 20–40 балів | 40,0 % | 60,0 % | – |
| Більш 40 балів | 66,7 % | 33,3 % | – |
Примітка. Відмінності між групами залежно від тяжкості захворювання відсутні (р>0,05 за критерієм χ2).
Таблиця 6.4 – Результати визначення поліморфізму гена TLR1-I602S
у хворих на МЕ залежно від тяжкості захворювання
| Тяжкість МЕ за IASI | Генотипи TLR1-I602S | ||
| SS | IS | II | |
| до 20 балів | – | 100,0 % | – |
| 20–40 балів | – | 50,0 % | 50,0 % |
| Більш 40 балів | 26,7 % | 53,3 % | 20,0 % |
Примітка. Відмінності між групами залежно від тяжкості захворювання відсутні (р>0,05 за критерієм χ2).
У хворих на ІЕ статистично значимих відмінностей поліморфізму залежно від тяжкості перебігу захворювання за критерієм χ2 не виявлено (р>0,05, табл. 6.3).
У хворих на МЕ розподіл генотипів TLR1-I602S відрізнявся (табл. 6.4).
Привертає увагу, що активний генотип гена TLR1-I602S переважно виявлявся у хворих із тяжким перебігом захворювання (з оцінкою за ЕASI більше 40 балів) – у 3 випадках (75 %) із загальної кількості з таким генотипом, але в цілому розподіл поліморфізму залежно від тяжкості також статистично значимо не розрізнявся (р>0,05 за критерієм χ2).
* * *
Таким чином, аналіз поліморфізму гена TLR1-I602S у хворих на алергодерматози виявив наступні особливості: у хворих на АД та ІЕ зустрічалися тільки неактивні та малоактивні генотипи, що свідчить про недосконалість системи вродженого антиінфекційного захисту та є можливою причиною великого ступеня обсіменіння біотопів патогенною та умовно-патогенною флорою.
У хворих на МЕ головною особливістю було те, що активний генотип найчастіше зустрічався при тяжкому перебігу захворювання, що можна пояснити наявністю дисбалансу прозапальних факторів, які утворюються під час активації TLR1, та протизапальних факторів на фоні автоімунних порушень у цих хворих. Непрямим доказом цих взаємовідносин є значний рівень прозапального IL-17A, що був виявлений у цих хворих.
За темою розділу опубліковано наступні праці:
- Кутасевич ЯФ, Білозоров ОП, Мангушева ВЮ. Дослідження поліморфізму гену тол-подібного рецептору 1 TLR-1-I602S у хворих на алергодерматози. Art of Medicine. 2018; 3 (7): 63–65 [34].
РОЗДІЛ 7
АНАЛІЗ РЕЗУЛЬТАТІВ ЛІКУВАННЯ ХВОРИХ
НА АЛЕРГОДЕРМАТОЗИ ЗАЛЕЖНО ВІД МЕТОДУ ЛІКУВАННЯ
7.1 Результати застосування сорбційної терапії у хворих на алергодерматози
Аналіз вихідних даних пацієнтів з алергодерматози (АД, ІЕ та МЕ), що були отримані під час госпіталізації в період загострення шкірного процессу до початку лікування, виявив окремі особливості анамнестичних даних залежно від основного діагнозу. При цьому встановлено, що характер зовнішніх проявів захворювань, наявність порушень мікробіоценозу, вміст прозапального цитокіну IL-17А та його залежність від тяжкості захворювання, а також особливості поліморфізму гену TLR 1-I602S мали досить схожий характер. Це свідчить про наявність спільних ланок патогенезу даних форм алергодерматозів та необхідність впливу на ці ланки за допомогою терапевтичних заходів.
Перш за все, увагу привернув досить розповсюджений метод лікування дисбіотичних порушень – ентеросорбція. На відміну від раніше застосованих методів ентеросорбційної терапії було запропоновано ступінчасту ентеросорбцію із застосуванням сорбентів із різними властивостями: атоксілу та еліміналь-гелю.
Атоксіл – високоактивний кремнієвий сорбент IV покоління з площею активної поверхні абсорбції більше 400 м2/г. Він підсилює транспорт харчових та бактеріальних алергенів, різноманітних токсичних продуктів, у тому числі середніх молекул, олігопептидів, амінів та інших речовин, що утворюються в процесі гниття білків у кишечнику, з внутрішніх середовищ організму (крові, лімфи, інтерстицію), у травний тракт за рахунок концентраційних і осмотичних градієнтів з подальшим їх виведенням з організму. Атоксіл має здатність електростатичної сорбції, завдяки якій препарат після розчинення у воді набуває негативний заряд і, відповідно, притягує все, що позитивно заряджене. Однак корисна мікрофлора, вітаміни і мікроелементи мають нейтральний заряд та ним не сорбуються. Крім того, цей препарат інактивує більшу білкову молекулу порівняно з іншими ентеросорбентами.
Еліміналь гель – комбінований препарат, що містить у своєму складі високоактивний кремнієвий сорбент і синтетичний дисахарид лактулозу (пребіотик). Препарат має протимікробну дію, надає опосередковані дезінтоксикаційну, бактерицидну і бактеріостатичну дії по відношенню до патогенних і умовно-патогенних бактерій і грибів. Надає спрямовану дію на виведення патогенних бактерій і ентеротоксинів, дозволяє відновити мікробіоценоз кишечника і стимулювати зростання і розвиток нормофлори – біфідо- і лактобактерій. Компоненти препарату мають взаємодоповнюючі властивості та підсилюють дію при корекції станів, пов’язаних із порушеннями функціонування ШКТ.
При призначенні ентеросорбції також враховувалася наявність супутньої патології ШКТ, яка була виявлена у багатьох хворих на алергодерматозами (як окрема патологія, або у сполученні з іншими супутніми захворюваннями).
Запропонований спосіб ступінчастої ентеросорбції передбачав прийом атоксілу по 1 флакону на день протягом трьох днів із наступним прийомом еліміналь гелю по 1 стик-пакету 3 рази на день протягом 14 днів.
Для оцінки даного методу лікування хворі були розподілені на наступні групи:
– Іа група – 30 хворих, у яких застосовано ступінчасту ентеросорбцію (11 хворих на АД, 12 хворих на ІЕ та 7 хворих на МЕ);
– Іб група – 20 хворих, які не отримували ентеросорбційну терапію (6 хворих на АД; 7 хворих на ІЕ та 7 хворих на МЕ).
Результати лікування оцінювалися на 7 та 14 добу після початку терапії.
7.1.1 Динаміка клінічних проявів захворювання в процесі лікування
Оцінка динаміки захворювання у пацієнтів з АД дозволила встановити наступне. На початку лікування тяжкість АД за шкалою SCORAD у хворих Іа групи становила (48,4 ± 14,4) бали (від 23,1 до 74,1; 95 % ДІ 28,7–68,1); у хворих Іб групи – (44,6 ± 22,6) (від 16,1 до 71,6; 95 % ДІ 20,9–68,2) (рис. 7.1). Тобто вихідний рівень тяжкості АД у хворих Іа групи був дещо більшим, ніж у Іб групі, але статистично не достовірно (р>0,05 за t-критерієм).
Рисунок 7.1 – Динаміка тяжкості АД за шкалою SCORAD у процесі лікування.
На 7 добу лікування величина SCORAD в Іа групі знизилась у середньому на (66,0 ± 9,7) %, складаючи (24,9 ± 6,2) бали, у Іб групі також зареєстровано позитивну динаміку, але величина SCORАD знизилась у меншому ступені – у середньому на (21,0 ± 12,0) % до (30,9 ± 16,3) бали (рис. 7.1). При цьому різниці між величиною SCORAD у цей термін між Іа групою та Іб групою також не виявлено (р>0,05 за t-критерієм).
На 14 добу лікування тяжкість захворювання за шкалою SCORAD у Іа групі у середньому складала (7,1 ± 1,5) балів, що було достовірно менше (р<0,05 за t-критерієм), ніж у Іб групі – (15,9 ± 9,6) балів. Тобто, застосування ступінчастої сорбційної терапії призвело до більш швидкого та більш значного зменшення основних клінічних проявів АД. На початку лікування в усіх хворих на АД виявлялася еритема. У Іа групі в трьох (27,3 %) випадках еритема була оцінена в 2 бали, у восьми (72,7 %) випадках – 3 бали. На 7 добу лікування тільки в одного (9,1 %) хворого зберігалася еритема в 3 бали, у шести (54,5 %) випадках вона оцінена в 2 бали, та у чотирьох (36,4 %) – в один бал. На 14 добу лікування у дев'яти (81,8 %) хворих еритеми не було, у двох (18,2 %) зберігалась еритема в 2 бали. У Іб групі на початку лікування в чотирьох (66,7 %) випадках еритема була оцінена в 2 бали та у двох (33,3 %) випадках – 3 бали. На 7 добу лікування у шести хворих (100 %) зберігалися еритема 2 бали. На 14 добу еритеми не було у чотирьох (66,7 %) хворих, у 2 (20,0 %) вона була оцінена в 1 бал. На початку лікування у всіх хворих на АД відмічалася наявність набряку та папул у різній кількості. У Іа групі у шести пацієнтів (54,5 %) відмічалася наявність набряку та папул, яка оцінювалася в 1 бал, у трьох (27,3 %) випадках була 2 бали, у двох (18,2 %) випадках – 3 бали. На 7 добу лікування в жодного хворого не відзначався ступінь вираженості у 2 та 3 бали, у семи випадках (63,6 %) випадках вона оцінена в 1 бал, відсутність набряку та папульозних елементів відмічалась у чотирьох (36,4 %) хворих. На 14 добу лікування в одному (9,1 %) випадку вираженість набряку та папул була оцінена в 1 бал, у шести (54,5 %) випадках відзначалася вираженість симптомів 2 бали, в чотирьох (36,4 %) випадках – 3 бали. У групі Іб на початку лікування у п'яти (83,3 %) хворих вираженість набряку та кількості папульозних елементів була оцінена в 2 бали, в одному (16,7 %) випадку – 3 бали. На 7 добу лікування в шести (100 %) випадках зберігався ступінь вираженості 2 бали. На 14 добу у двох (33,3 %) хворих визначалася відсутність набряку та папульозних елементів та у чотирьох (66,7 %) – 1 бал. Аналізуючи ступінь вираженості мокнуття та наявності різної кількості кірочок до початку лікування, слід зазначити, що в Іа групі в одного (9,1 %) пацієнта відзначався ступінь вираженості в 1 бал, у шести (54,5 %) випадках – 2 бали, у чотирьох (36,4 %) визначався ступінь вираженості в 3 бали. На 7 добу лікування у одного (9,1 %) пацієнта було відсутнє мокнуття та мала місце повна редукція кірочок, у п'яти (45,5 %) обстежених ступінь вираженості був оцінений в 1 бал, у чотирьох (36,4 %) – у 2 бали. В одного (9,1 %) хворого кількість кірочок була значною, мокнуття інтенсивним – ступінь вираженості був оцінений у 3 бали. На 14 добу лікування у більшої частини пацієнтів – шести (54,5 %) – були відсутні ознаки мокнуття та наявність кірочок, у п'яти (45,5 %) осіб ступінь вираженості був оцінений в 1 бал. Ступінь вираженості в 2 бали не визначався в жодному випадку. У групі Іб до початку лікування у п'яти (83,3 %) обстежених визначався ступінь вираженості в 3 бали – зберігалося мокнуття та виявлялася значна кількість кірочок, у однієї (16,7 %) особи відзначався ступінь в 1 бал. На 7 добу лікування у п'яти (83,3 %) обстежених ступінь вираженості був оцінений в 2 бали. В одного (16,7 %) хворого кількість кірочок була значною, мокнуття інтенсивним – ступінь вираженості була оцінена в 3 бали. На 14 добу мокнуття та кірочок не було у двох (33,3 %) хворих, у чотирьох (66,7 %) визначався ступінь вираженості в 1 бал. На початку лікування в усіх хворих на АД мали місце екскоріації, як наслідок інтенсивного свербежу. У Іа групі у семи (63,6 %) випадках ступінь вираженості екскоріацій був оцінений у 2 бали, у чотирьох (36,4 %) випадках – 3 бали. На 7 добу лікування важкий ступінь вираженості екскоріації не спостерігався в жодного хворого, у семи (63,6 %) випадках він оцінений у 2 бали, та у двох (18,2 %) – в 1 бал. У двох (18,2 %) осіб відмічався повний регрес екскоріацій. На 14 добу лікування у десяти (90,9 %) хворих екскоріації не виявлялись, у одного хворого (9,1 %) зберігались одиничні екскоріації та був визначений ступінь вираженості 1 бал. У групі Іб на початку лікування в одного (16,7 %) з обстежених визначався ступінь вираженості 2 бали та у п'яти (83,3 %) випадках – 3 бали. На 7 добу лікування в одному (16,7 %) випадку зберігалася значна кількість екскоріацій та визначався ступінь вираженості 3 бали, у п'яти (60,0 %) випадках 2 бали. На 14 добу екскоріації були відсутні у п'яти (83,3 %) хворих, у однієї (20,0 %) особи ступінь вираженості був оцінений в 1 бал. На початку лікування в усіх хворих на АД відмічалася ліхеніфікація різного ступеня вираженості. У Іа групі у двох (18,2 %) осіб ступінь вираженості ліхеніфікації була оцінена в 2 бали, у дев'яти (81,8 %) випадках – у 3 бали. На 7 добу лікування ступінь вираженості ліхеніфікації 3 бали був у одного (9,1 %) хворого, у семи (63,6 %) випадках він оцінений у 2 бали, та у трьох (27,3 %) – в 1 бал. На 14 добу лікування у двох (18,2 %) хворих спостерігався повний регрес ліхеніфікації, у п'яти (45,5 %) випадках вираженість ліхеніфікації була оцінена в 1 бал, у чотирьох (36,4 %) випадках – 2 бали. У групі Іб на початку лікування в одному (16,7 %) випадку вираженість ліхеніфікації була оцінена в 1 бал, у п'яти (83,3 %) випадках – 3 бали. На 7 добу лікування в одного (16,7 %) пацієнта зберігалася вираженість ліхеніфікації, яка була оцінена в 3 бали, у чотирьох (66,7 %) визначався ступінь вираженості ознаки у 2 бали та в одного (16,7 %) – 1 бал. На 14 добу повний регрес ліхеніфікації спостерігався в одному (16,7 %) випадку та у п'яти (83,3 %) визначався ступінь вираженості в 1 бал. Ефективність лікування демонструє клнічний приклад хворої Л. з діагнозом АД наприкінці лікування (Іа група) (рис. 7.2). Динаміка клінічних проявів у хворих на ІЕ була схожою (рис. 7.3). Тяжкість захворювання за шкалою EASI на початку дослідження в Іа групі становила (42,4 ± 16,1) бал (від 13,3 до 56,6; 95 % ДІ 34,9–52,4 бали); у групі Іб – (38,2 ± 18,1) бал (від 21,1 до 58,1; 95 % ДІ 21,5–55,0 балів). Різниця між групами за тяжкістю захворювання за шкалою у хворих на EASI була відсутня (р>0,05 за t-критерієм).
Рисунок 7.2 – Хвора Л., 38 років, діагноз: АД – наприкінці лікування (на початку лікування див. рис. 3.2).
Рисунок 7.3 – Динаміка тяжкості клінічних проявів у хворих на ІЕ за шкалою EASI.
На 7 добу лікування у хворих Іа групи, яким призначалася ступінчаста сорбційна терапія, вираженість клінічних проявів знизилась у середньому на (49,8 ± 8,9) %, складаючи у цей термін спостереження (22,6 ± 9,4) бали. На 14 добу лікування тяжкість захворювання за шкалою EASI знизилася до (8,7 ± 5,6) бали.
У групі пацієнтів, які не отримували елімінаційну терапію (Іб група), на 7 добу лікування середня тяжкість захворювання зменшилася в меншому ступені – на (12,9 ± 4,3) % до (32,8 ± 14,6) балів (р<0,001 за t-критерієм), на 14 добу вона знизилася до (13,7 ± 9,8) балів. Достовірної різниці величини EASI між Іа та Іб групами на 7 та 14 добу не виявлено (р>0,05 за t-критерієм).
На початку лікування у всіх хворих на ІЕ виявлялася еритема. У Іа групі в одного (8,3 %) пацієнта виявлена еритема в 1 бал, у трьох (25,0 %) випадках була еритема 2 бали, у восьми (66,7 %) випадках – 3 бали. На 7 добу лікування еритема у 3 бали не виявлялася в жодному випадку, у семи (58,3 %) випадках вона була оцінена в 2 бали, та у п’яти (41,7 %) – в 1 бал. На 14 добу лікування у 11 (91,7 %) хворих еритеми не було, в одному випадку (8,3 %) зберігалася еритема 2 бали.
У групі Іб на початку лікування у двох (28,6 %) випадках еритема була оцінена в 1 бал, у трьох (42,9 %) – у 2 бали та у двох (28,6 %) випадках – у 3 бали. На 7 добу лікування у двох (4,5 %) випадках зберігалася еритема 3 бали, у двох (28,6 %) випадках зберігалася вираженість ознаки в 1 бал та в трьох (42,9 %) – вираженість еритеми була оцінена в 2 бали. На 14 добу еритема була відсутня у шести (85,7 %) хворих, у одного хворого (14,3 %) вона була оцінена в 1 бал.
На початку лікування у всіх хворих на ІE мали місце такі ознаки, як наявність інфільтрації, папул та набряку. В Іа групі у двох (16,7 %) осіб визначався ступінь вираженості в 1 бал, у п’яти (41,7 %) випадках він був оцінений у 2 бали, у п’яти (41,7 %) випадках – у 3 бали. На 7 добу лікування ступінь вираженості 3 бали спостерігався у чверті обстежених – трьох (25 %), у двох (16,7 %) випадках він оцінений у 2 бали, та у семи (58,3 %) – в 1 бал. На 14 добу лікування у 11 (91,7 %) хворих відбувся повний регрес ознак, у одного (8,3 %) пацієнта був визначений ступінь вираженості в 1 бал.
У групі Іб на початку лікування інфільтрації, папули та набряк, які були оцінені за ступінем вираженості в 1 бал відзначалися у двох (28,6 %) випадках, у 2 бали – у чотирьох (51,7 %) та в одному (14,3 %) випадку – 3 бали. На 7 добу лікування в одного (14,3 %) хворого зберігався ступінь вираженості в 3 бали, у двох (28,6 %) ступінь вираженості був 2 бали та у чотирьох (51,7 %) – 1 бал. На 14 добу інфільтрації, папули та набряк регресували у п’яти (71,4 %) хворих, у двох (28,6 %) осіб вони були оцінені в 1 бал.
На початку лікування у всіх хворих на ІЕ відмічалася ліхеніфікація та наявність екскоріацій різного ступеня вираженості. У Іа групі в двох (16,7 %) обстежених відзначався ступінь вираженості 1 бал, у восьми (66,7 %) осіб він був оцінений у 2 бали, у двох (16,7 %) випадках – 3 бали. На 7 добу лікування ступінь вираженості 3 бали не відзначався в жодного хворого, у п’яти (41,7 %) випадках він оцінений у 2 бали, та у п’яти (41,7 %) – 1 бал. Повний регрес ліхеніфікації та екскоріацій виявлявся у двох (16,7 %) обстежених. На 14 добу лікування у всіх 12 (100 %) хворих спостерігався повний регрес ліхеніфікації та екскоріацій.
У групі Іб на початку лікування у двох (28,6 %) випадках вираженість ліхеніфікації та екскоріацій була оцінена в 1 бал, у двох (28,6 %) осіб – 2 бали та в трьох (42,9 %) випадках – 3 бали. На 7 добу лікування в жодного пацієнта не була виявлена значна вираженість ліхеніфікації та велика кількість екскоріацій, у п’яти випадках (71,4 %) ступінь вираженості ознаки була оцінена в 2 бали та у двох (28,6 %) осіб – в 1 бал. На 14 добу повний регрес ліхеніфікації та екскоріацій спостерігався у шести (85,7 %) осіб, в одному (14,3 %) випадку визначався ступінь вираженості 1 бал.
Аналізуючи ступінь вираженості мокнуття та наявності різної кількості везикул до початку лікування слід зазначити, що в Іа групі у 2 (16,7 %) пацієнтів відзначався ступінь вираженості в 1 бал, у трьох (25,0 %) випадках – 2 бали, у 7 (58,3 %) визначався ступінь вираженості в 3 бали. На 7 добу лікування у шести (50,0 %) пацієнтів було відсутнє мокнуття та мав місце повний регрес везикульозних висипань, у чотирьох (12,5 %) обстежених ступінь вираженості був оцінений в 1 бал, 2 (16,7 %) – у 2 бали. У жодного пацієнта не відзначався ступінь вираженості в 3 бали. На 14 добу лікування у всіх пацієнтів – 12 (100 %) – були відсутні ознаки мокнуття та наявність везикул.
У групі Іб до початку лікування у чотирьох (57,1 %) обстежених визначався ступінь вираженості в 3 бали – зберігалося мокнуття та виявлялася значна кількість везикул, у двох (28,6 %) осіб відзначався ступінь у 2 бали та в одного (14,3 %) обстеженого – 1 бал. На 7 добу лікування у двох (28,6 %) обстежених ступінь вираженості був оцінений в 1 бал, у чотирьох (57,1 %) пацієнтів – у 2 бали. В одного (14,3 %) хворого кількість везикульозних висипань була значною, мокнуття інтенсивним – ступінь вираженості була оцінена в 3 бали. На 14 добу мокнуття та везикул не було у 6 (85,7 %) хворих, у одного (14,3 %) визначався ступінь вираженості в 1 бал.
Ефективність обраної тактики лікування демонструє клінічне спостереження хворого Ч. (27 років) із діагнозом ІЕ наприкінці лікування (рис. 7.4).
Рисунок 7.4 – Хворий Ч., 27 років, діагноз: ІЕ – наприкінці лікування (на початку лікування див. рис. 3.3).
У хворих на МЕ на початку лікування тяжкість захворювання за шкалою EASI у середньому становила в Іа групі (50,6 ± 12,8) балів (від 41,4 до 71,6 балів; 95 % ДІ 48,8–62,4 бали), в Іб групі – (48,5 ± 12,3) бали (від 14,8 до 69,5 балів; 95 % ДІ 27,1–53,7 балів) (рис. 7.5). Різниця між групами статистично не достовірна (р>0,05 за t-критерієм).
Рисунок 7.5 – Динаміка тяжкості захворювання у хворих на МЕ у процесі лікування.
На 7 добу лікування в результаті застосування ступінчастої сорбційної терапії в Іа групі середня тяжкість клінічних проявів МЕ за шкалою EASI знизилася на (39,8 ± 16,9) % до (28,0 ± 5,2) бали. На 14 добу тяжкість клінічних проявів ще більше знизилася та становила у середньому (12,1 ± 6,1) бал.
У Іб групі порівняння у більшості випадків також зареєстровано позитивну динаміку, але на 7 добу середня тяжкість клінічних проявів за шкалою EASI знизилася лише на (19,0 ± 6,5) % до (42,6 ± 14,9) балів, та на 14 добу вона складала у середньому (10,3 ± 4,4) бали (рис. 7.5).
Середня оцінка тяжкості захворювання за шкалою EASI на 7 добу та на 14 добу лікування в Іа та в Іб групах не відрізнялася (p>0,05 за t-критерієм).
На початку лікування у всіх хворих на МЕ виявлялася еритема. У Іа групі в одного (14,3 %) пацієнта виявлена еритема в 1 бал, в одному (14,3 %) випадку була еритема 2 бали, у п’яти (71,4 %) випадках – 3 бали. На 7 добу лікування еритема 3 бали виявлялась у двох (28,6 %) хворих, у трьох (42,9 %) випадках вона оцінена в 2 бали, та у двох (28,6 %) – в 1 бал. На 14 добу лікування у чотирьох (57,1 %) хворих еритеми не було, у трьох (42,9 %) зберігалась еритема в 1 бал.
У групі Іб на початку лікування в трьох (42,9 %) випадках еритема була оцінена в 2 бали та в чотирьох (57,1 %) випадках – в 3 бали. На 7 добу лікування в однієї особи (14,3 %) зберігалися еритема 1 бал, у шести (85,7 %) випадках еритема була оцінена в 2 бали. На 14 добу еритема була відсутня у п’яти (71,4 %) хворих, в одному (14,3 %) випадку вона була оцінена в 1 бал, у одному випадку (14,3 %) зберігалася еритема 3 бали.
На початку лікування в усіх хворих на МE мали місце такі ознаки, як наявність інфільтрації, папул та набряку. У Іа групі у жодного обстеженого не визначався легкий ступінь (1 бал), у чотирьох (57,1 %) випадках ступінь вираженості була оцінена в 2 бали, у трьох (42,9 %) випадках – 3 бали. На 7 добу лікування ступінь вираженості в 3 бали спостерігався в одного (14,3 %) обстеженого, у трьох (42,9 %) випадках він оцінений в 2 бали, у трьох (42,9 %) пацієнтів – 1 бал. На 14 добу лікування у трьох (42,9 %) хворих відбувся повний регрес ознак, у чотирьох (57,1 %) пацієнтів був визначений ступінь ознак в 1 бал.
У групі Іб на початку лікування інфільтрації, папули та набряк, які були оцінені, як ступінь вираженості 1 бал відзначалися у двох (28,6 %) пацієнтів, 2 бали були відзначені в одного хворого (14,3 %) та в чотирьох (51,7 %) випадках – 3 бали. На 7 добу лікування в одному випадку (14,3 %) зберігався ступінь вираженості ознак 3 бали, у шести (85,7 %) – 2 бали. На 14 добу інфільтрації, папули та набряк регресували у трьох (42,9 %) хворих, у чотирьох (57,1 %) осіб він був оцінений в 1 бал.
На початку лікування у всіх хворих на МЕ відмічалася ліхеніфікація та наявність екскоріацій різного ступеня вираженості. У Іа групі в одного (14,3 %) обстеженого відзначався ступінь вираженості ознак 1 бал, у чотирьох (57,1 %) осіб він був оцінений у 2 бали, у двох (28,6 %) випадках – 3 бали. На 7 добу лікування важкий (3 бали) ступінь вираженості не відзначався в жодного хворого, у чотирьох (57,1 %) випадках він оцінений у 2 бали, та у двох (28,6 %) 1 бал. Повний регрес ліхеніфікації та екскоріацій виявлявся в однієї (14,3 %) особи. На 14 добу лікування у п’яти (71,4 %) хворих спостерігався повний регрес ліхеніфікації та екскоріацій, у двох (28,6 %) – 1 бал.
У групі Іб на початку лікування у чотирьох (57,1 %) випадках – у 2 бали та у трьох (57,1 %) випадках – 3 бали. На 7 добу лікування в однієї (14,3 %) пацієнтки зберігалася вираженість ліхеніфікації та велика кількість екскоріацій – 3 бали, у шести (70,0 %) випадках вираженість ознаки визначалася в 2 бали. На 14 добу повний регрес ліхеніфікації та екскоріацій спостерігався у трьох (42,9 %) випадках, у чотирьох (51,7 %) осіб визначався ступінь вираженості ознаки 1 бал.
Ступінь вираженості мокнуття та наявності різної кількості везикул до початку лікування в Іа групі відзначався в 1 бал у одного (14,3 %) пацієнта, у двох (28,6 %) випадках був оцінений в 2 бали, у чотирьох (57,1 %) визначався ступінь вираженості в 3 бали. На 7 добу лікування у чотирьох (57,1 %) пацієнтів було відсутнє мокнуття та мав місце повний регрес везикульозних висипань, у трьох (42,9 %) обстежених ступінь вираженості був оцінений в 1 бал. У жодного пацієнта не відзначався ступінь вираженості в 2 та 3 бали. На 14 добу лікування у всіх семи пацієнтів були відсутні ознаки мокнуття та наявність везикул.
У групі Іб до початку лікування у п’яти (71,4 %) обстежених визначався ступінь вираженості в 3 бали – мокнуття було інтенсивним та виявлялася значна кількість везикул, у двох (28,6 %) осіб відзначався ступінь у 2 бали. На 7 добу лікування в однієї (14,3 %) особи було відсутнє мокнуття та мав місце повний регрес везикульозних висипань, у двох (28,6 %) обстежених ступінь вираженості був оцінений в 1 бал, у трьох (42,9 %) пацієнтів – у 2 бали. В одного (14,3 %) хворого кількість везикульозних висипань була значною, мокнуття інтенсивним – ступінь вираженості була оцінена в 3 бали. На 14 добу мокнуття та везикульозних висипань не було у п’яти (71,4 %) хворих, у двох (28,6 %) визначався ступінь вираженості в 1 бал.
Таким чином, застосування ступінчастої сорбційної терапії дозволяє швидше купірувати запальний процес, про що свідчать як більш позитивна динамика загальної тяжкості алергодерматозів, так і частота виявлення їх окремих клінічних проявів.
7.1.2 Динаміка стану мікробіоценозу в процесі лікування
Аналіз результатів мікробіологічного дослідження на 14 добу лікування дозволив встановити наступне. Після проведеного лікування не спостерігалися суттєві зміни у складі ценозів верхніх дихальних шляхів у зазначених групах хворих, на відміну від змін, що відбулися в біотопі шкіри.
Як видно з наведених рисунків, після проведення традиційної терапії без використання ступінчастої ентеросорбції (Іб група), відмічалися деякі позитивні зміни у складі ценозу шкіри, але більш виражені зміни відбулися у групі пацієнтів, що отримували ентеросорбцію: так кількість штамів S. aureus – знизилася з 42,6 % до 35,7 % та 30,0 % відповідно у пацієнтів з АД, з 36,1 % до 30,7 % та 23,1 % відповідно у хворих на ІЕ. Частота вилучення штамів S. еpidermidis мала зворотну залежність. Так, кількість вилучень зросла з 22,9 % до 40,0 % у хворих на АД, з 22,1 % до 38,4 % у хворих на ІЕ та з 20,7 % до 33,3 % у пацієнтів з МЕ (рис. 7.6–7.7).
При дослідженні стану кишечника основної групи (15 осіб) після проведеної терапії було відмічено стійку тенденцію до нормалізації основних показників (рис. 7.8). Так, дисбактеріоз І ступеня було виявлено у 2 пацієнтів (13,3 %), ІІ ступеня – у 6 (40,0 %) обстежених, ІІІ ступеня –2 хворих (13,3 %), у 5 осіб (33,4 %) на фоні проведеної терапії відмічалася повна нормалізація основних показників дисбіозу кишечника. Крім того, майже в усіх пацієнтів нормалізувався вміст лакто- та біфідобактерій – 14 осіб (93,3 %), у всіх пацієнтів поновилася загальна кількість кишкових паличок, були відсутні гемолізуючі коки та умовно-патогенні ентеробактерії. Також спостерігалося зниження показників обсіменіння грибами роду Candida з 73,7 % до 26,7 % після проведеної комплексної терапії. При дослідженні матеріалу зі шкірного біотопу у даній групі пацієнтів також спостерігалася нормалізація у видовому складі мікроорганізмів: не було виявлено жодного штаму S. aureus, вилучення S. haemolyticus спостерігалося лише у 13,3 % (1 особа). Крім цього при дослідженні зразків із ділянок шкіри у 5 осіб (33,3 %) було ізольовано S. epidermidis, у 4 осіб (26,7 %) – S. sciuri та у 3 осіб (20,0 %) – S. saprophyticus. При дослідженні двох зразків зростання аеробної мікрофлори не було виявлено.
Рисунок 7.6 – Склад шкірної біоти у хворих на МЕ, ІЕ та АД Іа групи, наприкінці лікування.
Рисунок 7.7 – Склад шкірної біоти у хворих на МЕ, ІЕ та АД Іб групи, наприкінці лікування.
Рисунок 7.8 – Склад ценозу кишечника хворих на алергодерматози наприкінці лікування.
При дослідженні стану кишечника у групі порівняння (15 осіб) після лікування спостерігалася відсутність змін у біотопі кишечника. Дані дисбіотичні порушення характеризувалися зниженням кількісного вмісту індигенної мікрофлори, торкаючись як аеробних, так і анаеробних бактерій. Дисбактеріоз І ступеня було виявлено у 4 пацієнтів (26,6 %), ІІ ступеня – у 10 (66,7 %) обстежених, ІІІ ступеня – у 1 хворого (6,7 %). В основному зміни характеризувалися зниженням вмісту біфідо- (у 33,3 % обстежених) та лактобактерій (13,3 %), значним підвищенням вмісту кишкової палички з гемолітичною активністю (40,0 %), лактозонегативних кишкових паличок (13,3 %), кокових форм мікроорганізмів (S. aureus – 6,7 %) та наявністю грибків роду Candida (53,3 %) на тлі виявлення кишкової палички зі зниженою ферментативною активністю (6,7 %).
Отже, після проведеної терапії спостерігалася нормалізація основних показників мікроценозу кишечника, що проявилося нормалізацією кількості біфідо- та лактобактерій, відсутністю умовно-патогенних ентеробактерій. Крім того, відмічено поліпшення якісного складу, що проявилось у зникненні S. aureus, лактозонегативних кишкових паличок та варіантів із зниженою ферментативною активністю. Також відмічено зменшення кількості грибків роду Candida до 26,7 %.
Отримані дані свідчать про позитивну динаміку якісного складу мікробіоти шкіри під впливом ступінчастої ентеросорбції, що свідчить про ефективність цього методу у складі комплексної терапії хворих на алергодерматози.
7.1.3 Динаміка рівня інтерлейкіну-17A у процесі лікування
Була вивчена динаміка рівня IL-17A під час та наприкінці лікування.
Рівень IL-17A у хворих на АД на початку дослідження та через 14 діб лікування залежно від методу лікування наведено у табл. 7.1.
Таблиця 7.1 – Рівень IL-17A у хворих на АД залежно від методу лікування
| Іа група (n=11) | Іб група (n=6) | |
| На початку лікування | 179,7 ± 29,31 | 114,2 ± 30,4 |
| На 14 добу | 24,0 ± 9,5 | 23,2 ± 11,2 |
Примітка. 1 – різниця між Іа та Іб групою достовірна – р<0,05 за t-критерієм.
На початку лікування рівень IL-17A був найвищим у хворих Іа групи, становлячи (179,7 ± 29,3) пг/мл (95 % ДІ 160,0–199,4 пг/мл), що було достовірно більше, ніж у групі Іб – (114,2 ± 30,4) пг/мл (95 % ДІ 82,3–146,1 пг/мл) (р<0,05 за t-критерієм між Іа та Іб групою). У хворих на АД (Іа група), яким застосовувалася ступінчаста сорбційна терапія, на 14 добу лікування рівень IL-17A знизився на (85,8 ± 8,0) % до (24,0 ± 9,5) пг/мл. У групі Іб – на (79,3 ± 10,3) % до (23,2± 11,2)пг/мл %. Різниці між рівнем IL-17A через 14 діб лікування між групами залежно від методу лікування не виявлено (p>0,05 за t-критерієм), але слід зазначити більш значне зниження рівня IL-17A в Іа групі, тобто при застосуванні ступінчастої сорбційної терапії.
Отримані дані підтверджують патогенетичну значимість автоімунних порушень у хворих на АД, однією з особливостей яких є значне збільшення вмісту IL-17A, з іншого боку – патогенетичну обгрунтованість та ефективність сорбційної терапії, яка сприяє елімінації токсичних продуктів, у тому числі прозапальних цитокінів, представником яких є IL-17A.
Динаміку рівня IL-17A у хворих на ІЕ наведено у табл. 7.2.
Таблиця 7.2 – Рівень IL-17A у хворих на ІЕ залежно від методу лікування
| Іа група (n=12) | Іб група (n=7) | |
| На початку лікування | 88,9 ± 34,4 | 94,9 ± 38,5 |
| На 14 добу | 18,2 ± 16,7 | 39,7 ± 29,7 |
Примітка. Різниця між групами статистично не достовірна – р>0,05 за t-критерієм.
На початку лікування у хворих на ІЕ, які отримували ступінчасту сорбційну терапію (Іа група), рівень IL-17A складав у середньому (88,9 ± 34,4) пг/мл (від 16,5 до 142,3 пг/мл; 95 % ДІ 67,1–110,8 пг/мл). На 14 добу лікування він знизився на (79,0 ± 4,2) % до (18,2 ± 16,7) пг/мл (табл. 7.2).
У хворих Іб групи на початку лікування рівень IL-17A становив (94,9 ± 38,5) пг/мл (від 40,5 до 152,8 пг/мл; 95 % ДІ 59,3–130,5,4 пг/мл). Через 14 діб лікування він знизився у середньому на (61,7 ± 24,8) % до (39,7 ± 29,7) пг/мл (табл. 7.2).
Суттєвої різниці початкових значень вмісту IL-17A між групами не виявлено (р>0,05 за t-критерієм). Після лікування виявлено більш значне зниження його рівня у групі пацієнтів, що отримували ступінчасту сорбційну терапію порівняно з пацієнтами Іб групи.
Результати дослідження рівня IL-17A у хворих на МЕ наведено у табл. 7.3.
Таблиця 7.3 – Рівень IL-17A у хворих на МЕ залежно від методу лікування
| Іа група (n=12) | Іб група (n=7) | |
| На початку лікування | 130,3 ± 24,91 | 90,6 ± 20,3 |
| На 14 добу | 15,4 ± 5,21 | 30,8 ± 19,9 |
Примітка. 1 – різниця між Іа та Іб групою достовірна – р<0,05 за t-критерієм.
У хворих на МЕ, що отримували ступінчасту сорбційну терапію, на початку дослідження рівень IL-17A становив у середньому (130,3 ± 24,9) пг/мл (від 80,7 до 154,2 пг/мл; 95 % ДІ 107,2–153,3 пг/мл). Через 14 діб лікування він знизився у середньому на (88,1 ± 3,7) % до (15,4 ± 5,2) пг/мл. У хворих Іб групи початковий рівень IL-17A складав (90,6 ± 20,3) пг/мл (від 56,9 до 118,4 пг/мл; 95 % ДІ 71,8–109,4 пг/мл). На 14 добу він знизився на (71,3 ± 13,9) % до (30,8 ± 19,9) пг/мл.
Рівень IL-17A на початку лікування в Іа групі був достовірно більшим, ніж у Іб групі (p<0,05 за t-критерієм), а через 14 діб лікування достовірно меншим, ніж у Іб групі (p<0,05 за t-критерієм в обох порівняннях).
Таким чином, лікування хворих на алергодерматози незалежно від діагнозу та методу лікування призводить до зниження збільшеного в періоді загострення (до лікування) рівня IL-17A. Але ступінчаста сорбційна терапія сприяє більш значному зниженню збільшеного рівня IL-17A, особливо у хворих на АД та МЕ. Це свідчить про доцільність сорбційної терапії у хворих на алергодерматози не тільки при наявності патології ШКТ, але й при значно збільшеному рівні IL-17A.
7.2 Результати застосування етапної зовнішньої терапії у хворих на алергодерматози
Іншим напрямком удосконалення терапії хворих є зовнішня терапія, яка є обов’язковим провідним компонентом лікування цих хворих. З метою підвищення її ефективності був запропонований метод етапної зовнішньої терапії.
На початку лікування (перший етап лікування) застосовувався препарат фузидієвої кислоти у вигляді мазі або крему 2 рази на день протягом 7 днів, чергуючи із застосуванням топічного стероїду у вигляді мазі або крему. На другому етапі застосовувався тільки топічний стероїд протягом 7 днів за схемою відповідно до інструкції виробника.
Такий підхід був зумовлений тим, що фузидієва кислота має бактеріостатичну, а в дуже високих дозах – і бактерицидну активність, переважно проти грампозитивних бактерій. Згідно даним, що були отримані при вивченні мікробіоценозу шкіри, саме стафілококи є переважною флорою у хворих, які увійшли у дослідження. При цьому, розповсюдженість резистентних видів мікроорганізмів до фузидієвої кислоти дуже мала та не перевищує 1–2 % навіть у пацієнтів з важкими опіками. Антибактеріальний ефект фузидієвої кислоти базується на інгібуванні синтезу бактеріальних білків за допомогою взаємодії з фактором елонгації G – життєво важливим для бактеріальної клітини білком, який бере участь у процесі транслокації на рибосомі при утворенні пептидного зв’язку. Фузидієва кислота зв’язує в єдиний комплекс фактор елонгації G з органічними фосфатами – гуанозиндифосфат і гуанозинтрифосфат і стабілізує комплекс на рибосомі, порушуючи, таким чином, гуанозинтрифосфатазну функцію фактора елонгації G. При цьому порушується гідроліз гуанозинфосфатів, що призводе до припинення подовження пептидного ланцюга [73, 83].
Раннє застосування антибактеріальних препаратів при загостренні алергодерматозів може бути особливо корисним при наявності дефекту вродженого імунітету будь-якої природи. Зокрема це є корисним при наявності малоактивних та, особливо, неактивних генотипів TLR1-I602S, що також необхідно враховувати при визначенні тактики лікування.
Другим обов’язковим компонентом зовнішньої терапії були топічні стероїди. ТГКС дозволяють швидко знизити або редукувати запальні прояви на шкірі і усунути суб’єктивні симптоми дерматозів (свербіж, печіння). Терапевтичний ефект ТГКС обумовлює їх сильну протизапальну, судинозвужувальну, антиалергічну та антипроліферативну дію, які реалізуються в наступному результаті: гальмують міграції нейтрофілів, моноцитів і еозинофілів в осередок запалення; збільшують експресії генів, що кодують синтез білків ліпокортинів, які пригнічують активність лізосомальної фосфоліпази А2, що призводить до зменшення синтезу медіаторів запалення; активації гістамінази і зниження пов’язаного з нею рівня гістаміну в осередку запалення, зниження чутливості нервових закінчень до гістаміну; зниження активності гіалуронідази і лізосомальних ферментів, що зменшує проникність судинної стінки; зменшення утворення вільних радикалів; зменшення кількості антигенпрезентуючих і огрядних клітин; гальмування синтезу мукополісахаридів; гальмування синтезу нуклеїнових кислот. На відміну від системних препаратів, ТГКС мають ряд переваг: високу спорідненість до рецепторів; виражену місцеву протизапальну активність; мінімальну системну дію, що пов’язана з використанням їх у незначній концентрації і низькою біодоступністю.
Для оцінки методу лікування хворі були розподілені на наступні групи:
ІІа група – 67 хворих, у яких застосовано етапну зовнішню терапію (24 хворих на АД; 18 хворим на ІЕ та 25 хворим на МЕ).
ІІб група – 37 хворих, у яких для лікування застосовано комбінований препарат, що містить протимікробний компонент та ТГКС, згідно інструкції виробника (9 хворих на АД, 15 хворих на ІЕ та 13 хворих на МЕ).
Результати лікування оцінювалися на 7 та 14 добу після початку терапії.
7.2.1 Динаміка клінічних проявів захворювання в процесі лікування
На початку лікування тяжкість АД за шкалою SCORAD у хворих ІІа групи становила (46,3 ± 17,8) балів (від 18,7 до 65,4; 95 % ДІ 44,5–59,6 балів), що було більше, ніж у хворих ІІб групи – (42,1 ± 18,2) бали, але статистично не достовірно (р=0,165 за t-критерієм) (рис. 7.9).
Рисунок 7.9 – Динаміка тяжкості АД за шкалою SCORAD у процесі лікування.
На 7 добу лікування величина SCORAD в ІІа групі знизилась у середньому на (63,5 ± 0,9) % до (23,7 ± 8,4) бали, у ІІб групі також зареєстровано позитивну динаміку, але величина SCORАD знизилась у меншому ступені – у середньому на (17,7 ± 8,7) % до (34,5 ± 15,5) бали (рис. 7.9). При цьому різниця між величиною SCORAD у цей термін між ІІа та ІІб групами була достовірна (р=0,015 за t-критерієм). На 14 добу лікування тяжкість захворювання за шкалою SCORAD у ІІа групі складала (6,4 ± 3,2) бали, що було достовірно менше (р<0,001 за t-критерієм), ніж у ІІб групі – (22,4 ± 11,8) балів. Тобто, застосування етапної зовнішньої терапії з визначеними показаннями призвело до більш швидкого та більш значного зменшення загальної тяжкості захворювання за шкалою SCORAD. Позитивною була й динаміка окремих клінічних проявів. Найбільш показовим клінічним проявом була еритема. На початку лікування в ІІа групі у 14 (58,3 %) випадках еритема оцінена в 3 бали, та у 10 (41,7 %) – у 2 бали. На 7 добу важкої еритеми не виявлено у жодному випадку, у трьох (12,5 %) пацієнтів вона була оцінена в 2 бали та у 21 (87,5 %) – в 1 бал. На 14 добу еритему не виявлено у 17 (70,8 %) хворих, у семи (29,2 %) випадках – еритема була оцінена в 1 бал. У групі ІІб на початку лікування в одному (11,1 %) випадку еритема була оцінена в 1 бал, у чотирьох (44,4 %) – 2 бали та в чотирьох (44,4 %) випадках – 3 бали. На 7 добу лікування у двох (22,2 %) випадках зберігалася еритема в 3 бали, в однієї особи (11,1 %) – 2 бали та в шести випадках (66,7 %) – 1 бал. На 14 добу еритеми не було у шести (66,7 %) хворих, у одного (11,1 %) хворого вона була оцінена в 1 бал та у двох (22,2 %) осіб – у 2 бали. На початку дослідження в ІІа групі у 12 (50,0 %) випадках виявлявся виражений набряк та значна кількість папул (3 бали), у десяти обстежених (41,7 %) – 2 бали та у двох (8,3 %) випадках вираженість набряку та папул була оцінена в 1 бал. На 7 добу тяжкого ступеня вираженості набряку та папул не виявлено в жодному випадку, у п'яти (20,8 %) пацієнтів він був 2 бали та у 18 (75 %) – 1 бал. В одного пацієнта набряку та папульозних висипань не відмічалося. На 14 добу набряку та наявності папульозних елементів не виявлено у 20 (83,3 %) хворих, у чотирьох хворих (16,7 %) вираженість набряку та папул була оцінена в 1 бал, у жодного пацієнта не відмічався ступінь вираженості набряку та наявності папульозних елементів 2 бали. Ілюстрацією ефективності етапної зовнішньої терапії є наступне клінічне спостереження (рис. 7.10). У групі ІІб на початку лікування в однієї особи (11,1 %) вираженість набряку та кількості папульозних елементів була оцінена в 1 бал, у восьми (88,9 %) – 2 бали. Вираженого ступеня ознаки в 3 бали не відмічалося в жодного обстеженого. На 7 добу лікування в одного (11,1 %) пацієнта визначався ступінь вираженості набряку та значна кількість папульозних висипань у 3 бали, у чотирьох осіб (44,4 %) – у 2 бали та у трьох (33,3 %) – в 1 бал. Дана ознака була відсутня у одного (11,1 %) хворого. На 14 добу набряку та папульозних висипань не було у чотирьох (44,4 %) хворих, у 3 (33,3 %) визначався ступінь вираженості в 1 бал та у двох (30,0 %) випадках – 2 бали.
Рисунок 7.10 – Пацієнт М., 27 років, діагноз: атопічний дерматит – наприкінці лікування (на початку лікування див. рис. 3.1).
Крім цього, на початку дослідження в ІІа групі у 12 (50 %) випадках відзначалося виражене мокнуття та велика кількість кірочок (3 бали), у восьми (33,3 %) пацієнтів їх вираженість була оцінена в 2 бали та у чотирьох (16,7 %) хворих – 1 бал. На 7 добу у переважної більшості – 20 (83,3 %) осіб – визначався ступінь вираженості в 1 бал, у 3 (12,5 %) обстежених – у 2 бали, у жодного з обстежених тяжкий ступінь у 3 бали не було виявлено. Повний регрес мокнуття та редукція кірочок відзначалася у одного (4,2 %) пацієнта. На 14 добу в усіх 24 пацієнтів були відсутні кірочки та відзначалося повне купірування мокнуття. У ІІб групі до початку лікування у двох випадках (22,2 %) визначався ступінь вираженості 3 бали – зберігалося мокнуття та виявлялася значна кількість кірочок, у трьох (33,3 %) осіб ця ознака була у 2 бали та у чотирьох (44,4 %) – у 1 бал. На 7 добу в чотирьох випадках (44,4 %) визначався ступінь вираженості 1 бал, у чотирьох (44,4 %) обстежених – 2 бали, у одного (11,1 %) обстеженого тяжкий ступінь вираженості ознаки був оцінений у 3 бали. На 14 добу мокнуття та кірочок не було у шести (66,7 %) хворих, у двох випадках (22,2 %) визначався ступінь вираженості 1 бал та у однієї (11,1 %) особи – 2 бали. Також у ІІа групі у 10 хворих (41,7 %) випадках виявлено тяжкі екскоріації, які були оцінені в 3 бали, у 14 (58,3 %) – 2 бали. На 7 добу важкої вираженості екскоріацій не виявлено в жодного обстеженого, у трьох (12,5 %) пацієнтів вона була оцінена в 2 бали та у 21 (87,5 %) – в 1 бал. На 14 добу екскоріації не було виявлено у 18 (75,8 %) хворих, у двох (8,3 %) осіб вони були 2 бали, у чотирьох випадках (16,7 %) – 1 бал. У групі ІІб на початку лікування в п’яти (55,6 %) обстежених виявлялись екскоріації, які були оцінені в 2 бали та в чотирьох (44,4 %) випадках – 3 бали. На 7 добу лікування в одному (11,1 %) випадку зберігалася значна кількість екскоріацій – 3 бали, у чотирьох (44,4 %) випадках – 2 бали та в чотирьох (44,4 %) – 1 бал. На 14 добу екскоріації були відсутні у шести (66,7 %) хворих, у двох (22,2 %) випадках вона була оцінена в 1 бал та в однієї особи (11,1 %) – у 2 бали. Ліхеніфікація була визнана важкою та оцінена в 3 бали у 12 (50,0 %) хворих ІІа групи, у восьми (33,3 %) випадках – у 2 бали, та в одного (4,2 %) випадку вираженість ліхеніфікації була легкого ступеня. У трьох осіб (12,5 %) ця ознака була відсутня. На 7 добу важкого ступеня вираженості ліхеніфікації не виявлено у жодного пацієнта, в одного (4,2 %) обстеженого вона зберігалася у 2 бали та у 22 (91,7 %) – в 1 бал. В одного (4,2 %) пацієнта цієї ознаки не відмічалося. На 14 добу повний регрес ліхеніфікації спостерігався у 13 (54,2 %) хворих, у дев’яти (37,5 %) випадках вираженість ліхеніфікації була оцінена в 1 бал, у двох (8,3 %) пацієнтів – у 2 бали. У групі ІІб на початку лікування в чотирьох (44,4 %) випадках вираженість ліхеніфікації була оцінена в 3 бали, у п’яти (55,6 %) – у 2 бали. На 7 добу лікування у двох (22,2 %) пацієнтів зберігалася значна вираженість ліхеніфікації, яка була оцінена в 3 бали, у двох (22,2 %) – у 2 бали, та у п’яти (40,0 %) – в 1 бал. На 14 добу повний регрес ліхеніфікації спостерігався у п’яти (55,6 %) осіб, у двох (22,2 %) випадках він зберігався 2 бали та у 2 (22,2 %) пацієнтів – 1 бал. Динаміку клінічних проявів під впливом етапної зовнішньої терапії у хворих на ІЕ наведено на рис. 7.11. Тяжкість захворювання за шкалою EASI на початку дослідження в ІІа групі становила (40,7 ± 18,8) балів (від 11,4 до 69,4; 95 % ДІ 31,3–50,1 бал); у ІІб групі – (47,1 ± 14,0) балів (від 23,1 до 67,2; 95 % ДІ 39,3–54,8 балів). Різниця між групами за тяжкістю захворювання за шкалою EASI була відсутня (р>0,05 за t-критерієм).
Рисунок 7.11 – Динаміка тяжкості клінічних проявів у хворих на ІЕ за шкалою EASI, у процесі лікування.
На 7 добу у хворих ІІа групи після 7 діб лікування із застосуванням етапної зовнішньої терапії загальна тяжкість захворювання за шкалою EASI знизилась на (51,0 ± 12,6 %) % – до (18,6 ± 7,9) балів. Через 14 діб лікування вона складала (10,6 ± 4,5) балів. При застосуванні зовнішньої терапії комбінованим препаратом (ІІб група) на 7 добу лікування середня тяжкість захворювання зменшилась на (15,4 ± 9,1) % – до (38,7 ± 12,0) балів, на 14 добу вона знизилася до (8,9 ± 5,0) балів. Різниця між ІІа та ІІб групи на 7 добу достовірна (р<0,05 за критерієм). На 14 добу різниці середніх показників між групами не виявлено (р>0,05 за t-критерієм в усіх порівняннях).
Позитивною була й динаміка окремих клінічних проявів захворювання. На початку лікування у хворих ІІа групи в п’ятьох (27,8 %) випадках еритема оцінена в 3 бали, та у семи (38,9 %) – у 2 бали, та у 6 (33,3 %) відмічалася еритема в 1 бал. На 7 добу еритеми, оціненої в 3 бали, не виявлено в жодному випадку, в одного (5,6 %) пацієнта вона була оцінена у 2 бали та у 13 (54,2 %) – в 1 бал. Еритема була відсутня у чотирьох (22,2 %) осіб. На 14 добу еритему не виявлено у 14 (77,8 %) хворих, у чотирьох (22,2 %) – еритема була оцінена в 1 бал.
У групі ІІб на початку лікування в трьох (20,0 %) випадках еритема була оцінена в 1 бал, у восьми (53,3 %) осіб – у 2 бали та в чотирьох (26,7 %) хворих зберігалася еритема у 3 бали. На 7 добу лікування в одному (6,7 %) випадку зберігалися еритема у 3 бали, у шести (40,0 %) випадках еритема була оцінена у 2 бали та в чотирьох (16,6 %) – в 1 бал. У чотирьох хворих (26,7 %) дана ознака регресувала. На 14 добу еритема була відсутня у 11 (73,3 %) хворих, у чотирьох (26,7 %) випадках вона була оцінена в 1 бал.
Інфільтрація, папули та набряк у ІІа групі у семи (38,9 %) хворих оцінено як тяжкі (3 бали), у шести (33,3 %) осіб ступінь вираженості ознаки був оцінений у 2 бали, у п’яти (27,8 %) – в 1 бал. На 7 добу важкої вираженості інфільтрації, папул та набряку не виявлено, у 15 (83,3 %) зберігався ступінь вираженості ознаки в 1 бал, у двох (11,1 %) осіб – 2 бали, відсутні ознаки були в однієї (5,6 %) особи. На 14 добу лікування у 15 (83,3 %) хворих відбувся повний регрес даних ознак, у семи (16,7 %) пацієнтів був визначений 1 бал вираженості.
У групі ІІб на початку лікування інфільтрації, папули та набряк, оцінені в 1 бал, відзначалися у п’яти (33,3 %) пацієнтів, у восьми (53,3 %) випадках вираженість ознак була 2 бали, та у двох (13,3 %) випадках – 3 бали. На 7 добу лікування у двох (13,3 %) обстежених зберігався ступінь вираженості ознак 3 бали, у чотирьох (26,7 %) осіб – 2 бали, та у восьми (53,3 %) хворих – 1 бал. На 14 добу інфільтрації, папули та набряк регресували у 12 (80,0 %) хворих, у трьох (20,0 %) осіб він був оцінений в 1 бал.
Ліхеніфікація та наявність екскоріацій у п’яти (27,8 %) випадках у пацієнтів ІІа групи оцінено в 3 бали, у чотирьох (22,2 %) осіб – у 2 бали та у дев’яти (50,0 %) випадках – 1 бал. На 7 добу важкого ступеня вираженості ліхеніфікації та екскоріацій не виявлено у жодного пацієнта, у двох (11,1 %) пацієнтів вона була оцінена у 2 бали та у 15 (83,3 %) – 1 бал. У 1 (5,6 %) пацієнта набряку та папульозних висипань не відмічалося. На 14 добу повний регрес ліхеніфікації та екскоріацій спостерігався у 16 (88,9 %) хворих, у двох (11,1 %) вираженість ліхеніфікації була 1 бал.
У групі ІІб на початку лікування в шести (40,0 %) випадках вираженість ліхеніфікації та екскоріацій була оцінена в 1 бал, у 7 (46,7 %) – у 2 бали та у двох (13,3 %) випадках – у 3 бали. На 7 добу лікування в одного (6,7 %) пацієнта зберігалася значна вираженість ліхеніфікації та велика кількість екскоріацій – 3 бали, у п’яти (33,3 %) осіб – 2 бали, та у трьох (25,0 %) – 1 бал. Повний регрес ознаки відмічався у шести (40,0 %) осіб. На 14 добу повний регрес ліхеніфікації та екскоріацій спостерігався у 12 (80,0 %) осіб, у двох (13,3 %) випадках визначався легкий ступінь, який був оцінений в 1 бал, та в одного (6,7 %) хворого – 2 бали.
У ІІа групі ступінь вираженості мокнуття та наявності різної кількості везикул до початку лікування в 1 бал не відзначався в жодного пацієнта, у семи (38,9 %) випадках був оцінений у 2 бали, у 11 (61,1 %) визначався ступінь вираженості в 3 бали. На 7 добу лікування у дев’яти (50,0 %) пацієнтів було відсутнє мокнуття та мав місце повний регрес везикульозних висипань, у восьми (44,4 %) обстежених ступінь вираженості був оцінений в 1 бал, у однієї особи (5,6 %) – 2 бали. У жодного пацієнта не відзначався ступінь вираженості в 3 бали. На 14 добу лікування у всіх 18 пацієнтів були відсутні ознаки мокнуття та визначався повний регрес везикульозних висипань.
У групі ІІб до початку лікування у восьми (53,3 %) обстежених визначався ступінь вираженості в 3 бали – мокнуття було інтенсивним та виявлялася значна кількість везикул, у шести (40,0 %) осіб відзначався ступінь у 2 бали та в одного (6,7 %) пацієнта – 1 бал. На 7 добу лікування у двох (13,3 %) обстежених ступінь вираженості був оцінений в 1 бал, у дев’яти (60,0 %) пацієнтів у 2 бали. У чотирьох (26,7 %) хворих везикульозні висипання були значними та мокнуття інтенсивним – ступінь вираженості була оцінена в 3 бали. На 14 добу мокнуття та везикульозних висипань не було у 12 (80 %) хворих, у трьох (20 %) визначався ступінь вираженості в 1 бал.
Ефективність застосування етепної зовнішньої трапії у хворого на ІЕ демонструє наступне клінічне спостереження (рис. 7.12).
Рисунок 7.12 – Хворий К., 32 роки, діагноз: ІЕ– наприкінці лікування (на початку лікування див. рис. 3.4).
Таким чином, динаміка всіх показників у групі ІІа була кращою, ніж у пацієнтів ІІб групи.
Застосування етапної зовнішньої терапії у хворих на МЕ також призвело до доброї динаміки клінічних проявів захворювання (рис. 7.13).
На початку лікування тяжкість захворювання за шкалою EASI у середньому складала в ІІа групі – (54,7 ± 15,2) бали (від 18,4 до 76,5 балів; 95 % ДІ 48,4–61,0 балів), що не відрізнялося від аналогічного показника у хворих ІІб групи (58,3 ± 13,9) балів (р>0,05 за t-критерієм).
На 7 добу середня тяжкість захворювання за шкалою EASI у пацієнтів ІІа групи знизилася на (52,9 ± 14,0) % до (24,5 ± 7,8) балів та на 14 добу до (14,9 ± 7,5) балів. На 7 добу цей показник був достовірно меншим, ніж у пацієнтів ІІб групи – (49,4 ± 12,3) бали (p<0,05 за t-критерієм), у яких цей показник знизився на (15,5 ± 4,6) %, на 14 добу величина EASI становила (16,2 ± 13,9) бали (р>0,05 за t-критерієм порівняно з ІІа групою).
Рисунок 7.13 – Динаміка тяжкості захворювання у хворих на МЕзалежно від методу лікування, у процесі терапії.
Також позитивною була динаміка окремих клінічних проявів МЕ. На початку лікування в 15 (60,0 %) пацієнтів ІІа групи еритема оцінена в 3 бали, у дев’яти (36,0 %) осіб – у 2 бали та в одного (4,0 %) обстеженого відмічалася еритема в 1 бал. На 7 добу еритеми у 3 бали не виявлено в жодної особи, у семи (28 %) пацієнтів вона була оцінена в 2 бали та у 17 (68,0 %) – в 1 бал. Еритема була відсутня в 1 (4,0 %) особи. На 14 добу еритему не виявлено у 16 (64,0 %) хворих, у восьми (32,0 %) – еритема була оцінена в 1 бал, та у 1 (4,0 %) – у 2 бали.
У групі ІІб на початку лікування в одному (7,7 %) випадку еритема була оцінена в 1 бал, у п’яти (38,5 %) осіб – 2 бали та в семи (53,8 %) випадках – 3 бали. На 7 добу лікування у трьох (23,1 %) хворих зберігалися еритема у 3 бали, у шести (46,2 %) осіб еритема зберігалась у 2 бали, та в трьох (23,1 %) хворих – у 1 бал, в однієї особи (7,7 %) відзначалася відсутність проявів еритеми. На 14 добу еритема була відсутня у чотирьох (30,8 %) хворих, у восьми (61,5 %) осіб вона була оцінена в 1 бал, у одного (7,7 %) хворого зберігалася еритема 2 бали.
Інфільтрацію, папули та набряк на початку лікування у 13 (52,0 %) пацієнтів ІІа групи оцінено в 3 бали, у дев’яти (36,0 %) обстежених – у 2 бали, у трьох (12,0 %) – в 1 бал. На 7 добу важкої вираженості інфільтрації, папул та набряку (3 бали) не виявлено в жодного обстеженого, у 14 (56,0 %) осіб зберігався ступінь вираженості ознаки в 1 бал, у семи (28,0 %) випадках – у 2 бали, дані ознаки були відсутні у чотирьох (16,0 %) осіб. На 14 добу лікування у 18 (72,0 %) хворих відбувся повний регрес ознак, у 7 (28,0 %) пацієнтів був визначений ступінь вираженості ознаки в 1 бал.
У групі ІІб на початку лікування інфільтрації, папули та набряк 2 бали відзначалися у восьми (61,5 %) пацієнтів, у п’яти (38,5 %) випадках ознака була оцінена в 3 бали. На 7 добу лікування у двох (15,4 %) випадках зберігався тяжкий ступінь вираженості ознак – 3 бали, у семи (53,8 %) пацієнтів – 2 бали та у чотирьох (30,8 %) випадках – 1 бал. На 14 добу інфільтрації, папули та набряк регресували у восьми (61,5 %) хворих, у п’яти (38,5 %) осіб вона була оцінена в 1 бал.
На початку лікування в усіх хворих на МЕ ІІа групи відмічалася ліхеніфікація та наявність екскоріацій, у тому числі у 12 (48,0 %) випадках виражена ліхеніфікація та множинні екскоріації (3 бали), у семи (28,0 %) – 2 бали та у 6 (24,0 %) були оцінені в 1 бал. На 7 добу важкого ступеня вираженості ліхеніфікації та екскоріацій не виявлено у жодного пацієнта, у 3 (12,0 %) пацієнтів вона була оцінена у 2 бали та у 17 (68,0 %) – в 1 бал. У п’яти (20 %) пацієнтів набряку та папульозних висипань не відмічалося. На 14 добу повний регрес ліхеніфікації та екскоріацій спостерігався у 19 (76 %) хворих, у шести (24,0 %) вираженість ліхеніфікації була 1 бал.
У групі ІІб на початку лікування в одному (7,7 %) випадку ліхеніфікації та екскоріації були відсутні, у 2 (15,4 %) були оцінені в 1 бал, у чотирьох (30,8 %) обстежених – у 2 бали та у шести (46,2 %) випадках – у 3 бали. На 7 добу лікування в одного (7,7 %) пацієнта зберігалася значна вираженість ліхеніфікації та велика кількість екскоріацій, яка була оцінена в 3 бали, у восьми (61,5 %) випадках визначався ступінь вираженості 2 бали та в чотирьох (30,8 %) – 1 бал. На 14 добу повний регрес ліхеніфікації та екскоріацій спостерігався у дев’яти (69,2 %) осіб, у чотирьох (30,8 %) випадках ступінь тяжкості, який був оцінений в 1 бал.
На початку лікування у ІІа групі ступінь вираженості мокнуття та наявності різної кількості везикул 1 бал відзначався у 4 (16 %) пацієнтів, у дев’яти (36 %) випадках був оцінений у 2 бали, у 12 (48 %) визначався ступінь вираженості у 3 бали. На 7 добу лікування у 16 (64 %) пацієнтів було відсутнє мокнуття та мав місце повний регрес везикульозних висипань, у дев’яти (36 %) обстежених ступінь вираженості був оцінений в 1 бал. У жодного пацієнта не відзначалися ступені вираженості у 2 та 3 бали. На 14 добу лікування у всіх 25 пацієнтів були відсутні ознаки мокнуття та визначався повний регрес везикульозних висипань.
Інтенсивне мокнуття та значна кількість везикульозних висипань у групі ІІб до початку лікування у 10 (76,9 %) обстежених було оцінено в 3 бали, у двох (15,4 %) осіб відзначався ступінь у 2 бали та в одного (7,8 %) пацієнта – 1 бал. На 7 добу лікування у шести (46,2 %) обстежених ступінь вираженості був оцінений в 1 бал, у чотирьох (30,8 %) пацієнтів – у 2 бали. В одного (7,7 %) обстеженого зберігалася значна кількість везикульозних висипань та інтенсивне мокнуття – ступінь вираженості був оцінений у 3 бали. На 14 добу мокнуття та везикульозних висипань не було у восьми (61,5 %) хворих, у чотирьох (30,8 %) – визначався ступінь вираженості в 1 бал.
Ефективність застосування етапної зовнішньої терапії у хворих на МЕ демонструє наступний клінічний випадок (рис. 7.14).
Рисунок 7.14 – Хворий Д., 63 роки, діагноз: МЕ (наприкінці лікування) (на початку лікування див. рис. 3.5).
Загалом вираженість цих клінічних прояві на 7 добу була меншою при застосуванні етапної зовнішньої терапії порівняно з пацієнтами, які застосовували комбінований зовнішній препарат.
Таким чином, застосування етапної зовнішньої терапії призводить до більш швидкого покращення стану пацієнтів – на 7 добу лікування спостерігалося більш значне зниження середньої оцінки тяжкості захворювання та частоти виявлення окремих клінічних симптомів порівняно з групою пацієнтів, які застосовували комбінований препарат. При цьому етапна зовнішня терапія була більш ефективною у хворих на МЕ.
7.2.2 Динаміка стану мікробіоценозу в процесі лікування
Аналіз результатів мікробіологічних досліджень також виявив позитивну динаміку якісного та кількісного складу мікробіоти шкіри (рис. 7.15, 7.16).
Рисунок 7.15 – Склад шкірного ценозу хворих ІІа групи наприкінці лікування
Рисунок 7.16 – Склад шкірного ценозу хворих ІІб групи наприкінці лікування
Як видно з рис. 7.15, після проведеної терапії спостерігалися більш виражені зрушення у бік нормалізації складу біоти шкіри. Так кількість штамів з високим патогенним потенціалом – S. aureus – знизилась у 2,8 рази (з 48,8 % до 17,6 % у пацієнтів з АД), з 18,7 % до 13,3 % у хворих на ІЕ та з 21,4 % до 6,7 % у хворих на МЕ. Частота вилучення штамів S. еpidermidis мала зворотну залежність. Так, кількість виділень зросла з 24,4 % до 52,9 % у хворих на АД, з 26,6 % до 33,3 % у хворих на ІЕ.
Як видно з рис. 7.16, після проведеної терапії комбінованим препаратом також спостерігалися зрушення у бік нормалізації складу біоти шкіри. Але кількість штамів із високим патогенним потенціалом (S. aureus) знизилася з 50,0 % до лише 35,7 % у пацієнтів з АД, з 11,1 % до 9,7 % у хворих на ІЕ та з 14,8 % до 8,7 % у хворих на МЕ. Частота виділення штамів S. еpidermidis мала зворотну залежність. Так, кількість вилучень зросла з 18,8 % до 28,6 % у хворих на АД, з 13,9 % до 19,4 % у хворих на ІЕ та з 11,1 % до 21,7 % на МЕ.
Отримані дані свідчать про переваги етапної зовнішньої терапії порівняно з традиційною терапією у хворих на алергодерматози під час загострення.
7.2.3 Динаміка рівня інтерлейкіну-17A в процесі лікування
Крім цього, встановлено позитивну динаміку застосування етапної зовнішньої терапії на вміст прозапального цитокіну IL-17A.
Рівень IL-17A у хворих на АД на початку дослідження та через 14 діб лікування залежно від методу лікування наведено у табл. 7.4.
Таблиця 7.4 – Рівень IL-17A у хворих на АД залежно від методу лікування, в процесі терапії
| ІІа група (n=24) | ІІб група (n=9) | |
| На початку лікування | 100,7 ± 49,7 | 95,0 ± 59,3 |
| На 14 добу | 18,9 ± 7,8 | 15,3 ± 7,9 |
Примітка. Різниця між ІІа та ІІб групою не достовірна – р>0,05 за t-критерієм.
У період загострення (до початку лікування) рівень IL-17A у хворих ІІа групи становив (100,7 ± 49,7) пг/мл (95 % ДІ 79,7–121,7 пг/мл), що майже не відрізнялося від аналогічного показника ІІб групи – (95,0 ± 59,3) пг/мл (р>0,05 за t-критерієм).
У результаті застосування етапної зовнішньої терапії (ІІа група) рівень IL-17A на 14 добу лікування знизився на (82,2 ± 19,8) % до (18,9 ± 7,8) пг/мл, при застосуванні комбінованого препарату – на (85,8 ± 15,6) % до (15,3 ± 7,9 %) пг/мл. Різниці між рівнем IL-17A через 14 діб лікування між групами залежно від методу лікування не виявлено (p>0,05 за t-критерієм).
Динаміку рівня IL-17A у хворих на ІЕ наведено у табл. 7.5. На початку лікування у хворих на ІЕ ІІа групи рівень IL-17A становив (78,5 ± 54,6) пг/мл (від 6,8 до 169,6 пг/мл; 95 % ДІ 51,4–105,7 пг/мл), тобто спостерігався дуже великий розкид індивідуальних значень. У результаті лікування на 14 добу рівень IL-17A знизився у середньому на (59,5 ± 6,4) % до (24,3 ± 25,9) пг/мл. При цьому, статистично значимої різниці з аналогічним показником контрольної групи не виявлено (р>0,05 за t-критерієм).
Таблиця 7.5 – Рівень IL-17A у хворих на ІЕ залежно від методу лікування в процесі терапії
| ІІа група (n=18) | ІІб група (n=12) | |
| На початку лікування | 78,5 ± 54,6 | 89,6 ± 53,5 |
| На 14 добу | 24,3 ± 25,9 | 33,7 ± 32,1 |
Примітка. Різниця між ІІа та ІІб групою не достовірна – р>0,05 за t‑критерієм.
Більш кращу динаміку виявлено при застосуванні етапної зовнішньої терапії у хворих на МЕ (табл. 7.6).
На початку дослідження у хворих на МЕ ІІа групи рівень IL-17A становив (95,2 ± 37,4) пг/мл (від 10,2 до 161,2 пг/мл; 95 % ДІ 79,8–110,6 пг/мл). Через 14 діб лікування він знизився в середньому на (80,7 ± 13,8) % до (16,9 ± 15,6) пг/мл. У хворих ІІб групи на 14 добу він знизився до (28,4 ± 20,4) пг/мл (р<0,05 за t-критерієм між ІІа та ІІб групами).
Таблиця 7.6 – Рівень IL-17A у хворих на МЕ залежно від методу лікування під час терапії
| ІІа група (n=18) | ІІб група (n=15) | |
| На початку лікування | 95,2 ± 37,4 | 95,6 ± 43,6 |
| На 14 добу | 16,9 ± 15,61 | 28,4 ± 20,4 |
Примітка. 1 – різниця між ІІа та ІІб групою достовірна – р<0,05 за t-критерієм.
Отримані дані свідчать про ефективність етапної зовнішньої терапії за запропонованим методом, особливо у хворих на МЕ з вираженим порушенням мікробіоценозу шкіри. Це можна пояснити залежністю інтенсивності запальної відповіді від патологічних порушень мікробіоценозу, який спостерігається при МЕ. Одним із проявів та наслідків запальної відповіді є збільшення рівня прозапального цитокіну IL-17A під час загострення. Нормалізація мікробіоценозу під впливом етапної зовнішньої терапії сприяла зменшенню запалення та нормалізації рівня IL-17A.
* * *
За результатами аналізу клініко-лабораторних показників хворих на алергодерматози під час загострення до початку лікування незалежно від діагнозу виявлено загальні особливості: порушення мікробіоценозу шкіри, яке часто поєднувалося з порушенням мікробіоценозу інших біотопів, у тому числі товстої кишки; наявність активації прозапального механізму патогенезу захворювання; залежність тяжкості перебігу захворювання від вираженості дисбіотичних та імунних порушень; наявність неактивних та малоактивних генотипів гена TLR1-I602S у хворих на АД й ІЕ та схильність до тяжкого перебігу захворювання у хворих на МЕ з активним генотипом гена TLR1-I602S.
Аналіз застосування вдосконалених методів лікування свідчить, що незалежно від діагнозу ступінчаста сорбційна та етапна зовнішня терапія призводять до більш швидкого покращення стану пацієнтів – на 7 добу лікування спостерігалося більш значне зниження середньої оцінки тяжкості захворювання та частоти виявлення більш тяжких окремих клінічних симптомів порівняно з групами пацієнтів, які не отримували ступінчастої сорбційної та етапної зовнішньої терапії в лікуванні. При цьому ступінчаста сорбційна терапія була більш ефективною у хворих на АД, етапна зовнішня терапія була більш ефективною у хворих на МЕ. Це свідчить про доцільність диференційованої терапії хворих залежно від обраних показань.
Результати цього розділу опубліковано у наступних працях:
- Кутасевич ЯФ, Ищейкин КЕ, Зюбан ИВ, Мангушева ВЮ. Дифференцированный подход к диагностике и наружной терапии экземы. Дерматологія та венерологія. 2018; 1 (79): 50–55 [36].
- Кутасевич ЯФ, Олійник ІО, Джораєва СК, Мангушева ВЮ. Корекція мікробіоценозу кишечника методом ступінчастої елімінаційної терапії у хворих на алергодерматози. Медицина сьогодні і завтра. 2017; 3 (76): 109–115 [41].
- Кутасевич ЯФ, Мангушева ВЮ. Оптимизация наружной терапии больных экземой. World Science. 2017; 4(11) (27): 33–37 [38].
- Kutasevich Y, Dzhoraeva S, Goncharenko V, Mangusheva V, Sherbakova Y, Sobol N, Shegoleva H. Research of certain pathogenic characteristics of clinical isolates of staphylococcus of skin biome. EURECA: Нealth Science. 2018; 2: 24–30 [138].
- Кутасевич ЯФ, Олейник ИА, Маштакова ИА, Попова РК, Мангушева ВЮ. Эффективность эфферентной терапии больных в лечении хронической экземы. Мат. Наук.-практ. конф. “Дерматовенерологія в розробках молодих науковців”, 19-20 листопада 2015 р., м. Київ. Дерматовенерологія. Косметологія. Сексопатологія. 2015; 3–4 (2): 118–119 [40].
- Кутасевич ЯФ, Олійник ІО, Мангушева ВЮ. Східчаста ентеросорбція в лікуванні хворих на поширені алергодерматози. Збірник робіт по матеріалам науково-практичної конференції «Сімейна медицина. Перспективи та шляхи подальшого розвитку». Львів, 13-15 квітня 2016. Львів, 2016: 84 [43].
- 7. Мангушева ВЮ, Джораева СН, Супрун КГ. Особенности видового состава биотопа кожи у больных распространенными аллергодерматозами. В кн.: Матеріали наук.-практ. конф. з участю міжнар. спеціалістів, присвяченого дню науки «Медична наука на перетині спеціальностей: сьогодення і майбутнє», м. Харків, 19 травня 2017 р. Харків, 2017: 71 [51].
- Мангушева ВВ, Зюбан ИВ. Особенности клинических проявлений атопического дерматита у пациентов с мутациями гена филаггрина. В зб.: наук.-практ. конф. молодих вчених, присвячена 25-рiччю Національної академії медичних наук України. Журнал Національної академії медичних наук України. К., 2018: 60 [50].
РОЗДІЛ 8
АНАЛІЗ ТА УЗАГАЛЬНЕННЯ ОТРИМАНИХ РЕЗУЛЬТАТІВ
З огляду на зростання захворюваності, ускладнень перебігу, проблема алергодерматозів набула особливої актуальності. Потребуючим особливої уваги з теоретичного та практичного погляду в сучасної дерматології залишається вдосконалення та оптимізація діагностики та лікування даних захворювань.
В Україні щорічно реєструється зростання захворюваності на хвороби шкіри і підшкірної клітковини. Серед дерматозів, що характеризуються хронічним клінічним перебігом з періодами загострень і ремісій, провідне місце займають алергодерматози (екзема, атопічний дерматит та інші) [11, 12, 85, 104, 111, 153, 169].
Високий рівень захворюваності на ці дерматози серед населення України, тенденція до збільшення чисельності важких клінічних форм, зокрема дисемінація шкірної висипки, а також скорочення терміну ремісії та низький показник одужання, виділяють проблему алергодерматозів як одну з провідних в сучасній дерматології [111, 153]. Крім того, не до кінця з’ясовані питання етіології, патогенезу ускладнень алергодерматозів, а також мінливість їх клінічних проявів, обумовлених зміною імунобіологічної реактивності організму хворих, що істотно впливає на недостатню ефективність ряду методів і засобів, які традиційно застосовують для лікування цих захворювань.
Для клінічного перебігу алергодерматозів характерна послідовна зміна клініко-морфологічних форм, яка відображає ступінь вираженості запалення, нерідко посилюється при порушеннях біоценозу і приєднанні вторинної інфекції. Тому вивчення клінічних особливостей, інфекційних ускладнень дерматозів, передумов їх виникнення та можливостей запобігання обумовлює необхідність пошуку патогенетично обгрунтованих методів лікування алергічних дерматозів, що супроводжуються порушеннями біоценозу шкіри.
Одним з факторів, здатних запускати каскад імунологічних реакцій при алергодерматозах, є мікроорганізми, які населяють шкірні покриви [75, 99, 170]. Мікробіоценози шкіри людини є складними системами, відрізняються не тільки надзвичайною багатокомпонентністю, але і кількісним різноманіттям представників мікрофлори. Мікробіота шкіри є одним із захисних механізмів організму, проте при деяких станах вона перетворюється в невичерпний резервуар збудників екзогенних і ендогенних інфекцій [14, 19, 29, 80]. За станом автофлори шкіри можна судити про здоров’я людини, тому при захворюваннях відзначається якісна і кількісна зміна мікробних асоціацій шкірного покриву [19, 21]. Збалансований стан мікробіоценозу шкіри забезпечує колонізаційну резистентність даного біотопу. Наявність шкірної патології, змінює стійкість мікроекосистеми і призводить до дисбактеріозу шкіри і кишечника.
Таким чином, представники нормальної мікрофлори виконують фізіологічно важливу функцію підтримання внутрішнього середовища організму, беруть участь у формуванні імунобіологічної реактивності макроорганізму. Патогенні та умовно-патогенні мікроорганізми, які беруть участь у розвитку дисбактеріозу, можуть бути джерелами інфекції і сприяти хронізації дерматозів. Розуміння механізмів взаємодії мікробних асоціацій шкірного покриву, кишкової мікрофлори з імунною системою хворого представляє особливий науково-клінічний інтерес.
Вищевикладене стало обґрунтуванням мети дослідження – підвищення ефективності лікування хворих на алергодерматози шляхом розробки комплексного методу терапії на підставі вивчення змін біоценозу шкіри та кишечника й імунного статусу. Для досягнення мети було вивчено особливості біоценозу шкіри у хворих на алергодерматози та біологічні особливості мікрофлори, виявленої у хворих на алергодерматози; визначити властивості та ферментативні особливості флори, що колонізує шкіру хворих на алергодерматозами; вивчити поліморфізм генів толл-подібних рецепторів, а також сироватковий рівень прозапального цитокіну ІЛ-17А та з’ясувати їх участь у розвитку запалення у хворих на алергодерматози; вивчити можливості та вдосконалити методи корекції порушень мікробіоценозу шкіри і кишечника шляхом ступінчастої сорбційної терапії у складі традиційного лікування, а також динаміку біоценозу шкіри при використанні комбінованих зовнішніх препаратів і монопрепаратів, що містять кортикостероїди та протимікробні засоби, і розробити рекомендації щодо альтернативного методу комплексного зовнішнього лікування.
Були застосовані методи клінічної, загальної лабораторної діагностики, мікробіологічні, імунологічні дослідження, молекулярно-генетична діагностика для визначення мутацій, а також сучасні методи статистичної обробки і аналізу медичних даних.
У дослідженні прийняли участь 154 хворих на алергодерматози, у тому числі: 50 (32,5 %) хворих на АД, 52 (33,8 %) хворих на ІЕ, 52 (33,8 %) хворих на МЕ.
У структурі хворих переважали жінки – 88 (57,1 %), чоловіків було 66 (42,9 %). Середній вік хворих становив (42,8 ± 16,6) років, у тому числі: до 44 років – 88 (57,1 %); від 45 до 59 років – 34 (22,1 %); від 60 до 74 років – 29 (18,8 %); 75 років і більше – 3 (1,9 %). Суттєвої різниці за статтю залежно від діагнозу не виявлено. Переважали пацієнти віком 18–44 років серед всіх хворих, особливо серед хворих на АД та ІЕ (78,0 % та 55,8 % відповідно). Серед хворих на МЕ помітне зростання питомої ваги хворих віком 60–74 років. Додатковий аналіз цього показника у групах залежно від діагнозу виявив, що середній вік хворих на АД складав (36,1 ± 16,5) років, що було недостовірно менше, ніж у хворих на ІЕ – (41,8 ± 14,0) років (р=0,061 за t-критерієм), та достовірно менше, ніж у хворих на МЕ – (50,2 ± 16,2) роки (р<0,001 за t‑критерієм).
Залежно від віку початку захворювання виявлено переважання серед хворих на АД та ІЕ пацієнтів, що хворіють з дитинства, а серед хворих на МЕ – збільшена частка хворих з початком захворювання у віці 60–74 роки. Також виявлено достовірні відмінності між групами пацієнтів за основним діагнозом залежно від тривалості захворювання – найбільш помітно переважання серед хворих на АД пацієнтів, що хворіють більше 6 років (з дитинства), а серед хворих на МЕ – збільшена частка хворих із тривалістю захворювання 1–5 років.
У хворих на АД загострення захворювання 1–2 рази на рік спостерігалися у 52 %, при ІЕ – у 48,1 % пацієнтів. У пацієнтів з МЕ спостерігалося збільшення частки пацієнтів із загостреннями 3–4 рази на рік та тривалий перебіг з ремісією до 2 місяців (42,4 %).
Крім цього, у хворих на АД та ІЕ загострення найчастіше спостерігалися навесні та восени.
В окремих хворих, що увійшли у дослідження, виявлено ознаки спадковості основного захворювання – наявність подібного захворювання у батьків або у близьких родичів. Цей фактор був найбільш розповсюджений серед хворих на АД: алергодерматози та/або інші алергічні захворювання у батьків відмічено у 16,0 % хворих, у близьких родичів – у 12,0 % хворих. Найменше цей фактор спостерігався серед хворих на МЕ (7,6 % у батьків та близьких родичів).
Помітні відмінності залежно від діагнозу відмічено при аналізі причин загострень основного захворювання. У хворих на АД найчастішою причиною загострення було поєднання стресових ситуацій із харчовою алергією (22,0 %), у хворих на ІЕ – стрес (32,7 %), у хворих на МЕ – найчастіше загострення спостерігалися під впливом кількох факторів (17,3 %). Крім цього, у хворих на МЕ досить часто безпосередня причина захворювання залишалася невідомою (26,9 %), у той час як при АД вона була нез’ясованою лише у 12,0 % хворих, а у хворих на ІЕ – у 7,7 % випадків. Також привертає увагу, що при алергодерматозах загалом незалежно від основного діагнозу досить частою причиною загострень було кілька факторів (стрес, харчова алергія, хімічні сполуки, фармпрепарати та інші в різноманітних поєднаннях). Такий анамнез відмічено у 20,0 % хворих на АД, у 15,4 % хворих на ІЕ та у 17,3 % хворих на МЕ. Крім цього, слід відмітити, що сезонні причини загострень (насамперед загострення алергії навесні та восени) серед досліджених хворих виявлено лише у хворих на АД.
Залежно від наявності супутньої патології та її частоти між групами залежно від основного діагнозу також виявлено достовірні відмінності. Найбільш помітно серед хворих на АД збільшення частоти захворювань травної системи (патологія ШКТ та печінки), які було виявлено у 36,0 % хворих. Ця патологія була менш частою серед хворих на ІЕ (19,2 %) та на МЕ (15,4 %), однак серед цих пацієнтів вона також спостерігалася частіше, ніж інші захворювання. Також слід відмітити збільшення серед хворих на ІЕ глистних інвазій, а серед хворих на МЕ – мікозів різної локалізації.
Аналізуючи клінічні прояви АД, який був основним діагнозом у 50 хворих, слід зазначити, що найбільш важким проявом АД були ліхеніфікації, які спостерігалися у 98 % хворих, причому в 32 % випадків їх вираженість була середньою та у 60 % – тяжкою. У всіх хворих спостерігалися екскоріації. Вираженість цього симптому у 54 % хворих була середньою та у 46 % – тяжкою. Не менш частим проявом була еритема, яка спостерігалась у всіх хворих, а її вираженість лише в одного хворого була легкою, у 42 % – середньої вираженості та у 56 % – важкою.
Серед клінічних проявів ІЕ найбільш важкими проявами була еритема, вираженість якої у 36,5 % хворих була тяжкою та у 40,4 % – середньої важкості. Вираженість інфільтрації, папулоутворення та набряку була важкою у 28,9 % пацієнтів, а у 44,2 % хворих вона була середньої важкості. Екскоріації та ліхеніфікації були важкими у 23,1 % пацієнтів, середньої важкості – у 40,4 %. У 44,2 % хворих виявлено виражені везикульозні висипання та інтенсивне мокнуття, у 38,5 % хворих ці прояві оцінено як середньої тяжкості.
Виражені клінічні прояви виявлялися у хворих на МЕ. Найбільш важким клінічним проявом у цих хворих була еритема. Вираженість еритеми була тяжкою у 59,6 % пацієнтів, інфільтрації, папулоутворення та набряку – у 48,1 %, екскоріацій та ліхеніфікацій – у 46,2 % хворих. Середня вираженість цих симптомів спостерігалась у 34,6 %, 42,3 % та 34,6 % пацієнтів відповідно. Вираженість везикуляції та мокнуття у 38,5 % хворих на МЕ оцінено як тяжку, у 36,5 % випадках ці прояви оцінено як середньої тяжкості та у 21,2 % – як легкі.
У хворих на АД загальна тяжкість захворювання за шкалою SCORAD при надходженні на лікування у середньому складала (50,8 ± 18,2) балів, у тому числі, у 5 (10,0 %) менше 20 балів (легкий перебіг), у 8 (16,0 %) – перебіг середньої тяжкості та у 37 (74,0 %) – тяжкий перебіг захворювання.
У хворих на ІЕ загальна тяжкість захворювання за шкалою EASI на початку лікування складала у середньому (43,2 ± 16,7) балів, у тому числі у хворих з легким перебігом (до 20 балів за шкалою EASI) було 4 (7,7 %), середньої тяжкості – 18 (34,6 %) (від 20 до 40 балів за шкалою EASI) та з тяжким перебігом (більше 40 балів за шкалою EASI) – 30 (57,7 %).
Загальна тяжкість захворювання за шкалою EASI у хворих на МЕ на початку лікування складала у середньому (54,2 ± 15,3) балів, у тому числі у 2 (3,8 %) перебіг оцінено як легкий, у 7 (13,5 %) – середньої тяжкості та у 43 (82,7 %) – як тяжкий. Таким чином, у більшості хворих на початку лікування вираженість окремих клінічних проявів та тяжкість перебігу захворювання оцінювалась у більшості випадків як тяжка, рідше – середньої тяжкості.
У результаті бактеріологічних досліджень ізольовано 757 лабораторних штами мікроорганізмів – представників 6 родів.
При бактеріологічному дослідженні виділень зіву пацієнтів усіх груп до лікування у більшості випадків не виявлено значимих порушень як у кількісному, так і якісному складі мікроорганізмів. Найчастіше до складу даного біотопу входили непатогенні стрептококи: S. mitis (55,7 %), S. mutans (31,4 %), S. oralis (7,1 %) та S. anginosus (2,9 %), що формували асоціації з непатогенними представниками роду Neisseria та Staphylococcus, Micrococcus і Corynebacterium. Лише у п’яти пацієнтів були виявлені представники умовно-патогенної мікрофлори з вираженим патогенним потенціалом у складі ценозу зіву – К. pneumoniae, K. ozaenae та S. pyogenes. Ступінь загального мікробного обсіменіння становила від 1х104 до 1х107 КУО/мл.
При дослідженні виділень носу пацієнтів даних груп було вилучено 82 лабораторних штами стафілококів, серед яких переважну більшість склали S. еpidermidis – 32,9 %, S. aureus –17,1 %, S. haemolyticus – 17,1 %. Ступінь загального мікробного обсіменіння коливався від 1х103 до 1х106 КУО/мл. Важливо зауважити, що найчастіше S. aureus вилучався від хворих на АД, при цьому у 19,4 % обстежених (6 з 31 особи) збудник було виявлено паралельно в носових ходах і на шкірі.
При дослідженні складу шкірного біотопу хворих до лікування було отримано 212 лабораторних штамів мікроорганізмів з переважанням стафілококової складової (85,8 %). Ступінь загального мікробного обсіменіння коливався від 1х104 до 1х108 КУО/мл. Серед вилучених різновидів стафілококів у ценозі шкіри переважали S. aureus, S. haemolyticus та S. еpidermidis. При розгляданні складу шкірної біоти хворих на екзему та АД до лікування спостерігався зсув у складі шкірної біоти з переважанням найбільш агресивних видів, питома вага яких склала 69,2 %, з домінуванням S. aureus (42,6 % лабораторних штами) у хворих на АД та 36,1 % і 37,9 % відповідно у хворих на ІЕ та МЕ. Важливо зауважити, що саме у групі пацієнтів з АД відмічалися більш виражені порушення у складі біотопу верхніх дихальних шляхів з ізоляцією лабораторних штамів S. aureus, які мали однаковий профіль антибіотикорезистентності зі шкірними різновидами збудника, що може свідчити про персистенцію збудника у різних екотопах вегетування макроорганізму. Появу нерезидентних видів стафілококів з більш високим патогенним потенціалом на уражених ділянках шкіри було відмітною особливістю для більшості хворих на розповсюджені дерматози з переважанням S.aureus у біоті шкіри хворих на АД.
У результаті проведених досліджень встановлено, що стафілококи виявили високу резистентність до пеніциліну та макролідів (73,3 % та 52,5 % відповідно), помірну до аміноглікозидів, тетрациклінів та лінкозамідів (51,7 %, 48,0 % та 32,5 % відповідно). Найбільшу чутливість штами показали до фузидієвої кислоти (93,3 % штамів). Загальна кількість штамів резистентних до оксациліну (MRSA + MR–CNS) склала 27,2 % (49 штамів). Важливо зауважити, що серед метицилінрезистентних штамів 12 (24,5 %) мали ознаки MLS-резистентності (резистентність до макролідів, що часто поширюється на споріднені з макролідами лінкозаміди та стрептограмін В), а 2 штами мали екстенсивну резистентність, при цьому переважна більшість цих штамів було ізольовано від хворих на АД.
Дослідження мікробіоти кишечнику виконано у 30 хворих на алергодерматози, у тому числі у 11 хворих на АД, 13 хворих на ІЕ, та у 6 хворих на МЕ.
Порушення мікробіоценозу товстого кишечника було виявлено у всіх хворих: дисбактеріоз І ступеня було виявлено у 3 (10,0 %), ІІ ступеня – у 16 (53,3 %) обстежених, ІІІ ступеня – 11 (36,7 %). Дисбіотичні порушення характеризувалися зниженням кількісного вмісту індигенної мікрофлори, що стосувалось аеробних та анаеробних бактерій.
Найбільш часто виявлялося зниження біфідобактерій – у 9 осіб (30,0 %), зниження показників висіваності лактобактерій виявлено у 4 хворих (10,5 %). Вміст у кишечнику нормальної кишкової палички було знижено у 3 (13,3 %) обстежених. Також у 25 (83,3 %) хворих було виявлено зростання кількості умовно-патогенних бактерій (H. alvei, K. pneumoniae, Proteus spp., E. aerogenes). На тлі кількісного дисбалансу мікрофлори виявлялися зміни у якісному складі: у 9 (30,0 %) обстежених виявлялась кишкова паличка з гемолітичними властивостями, у 6 (20,0 %) пацієнтів – лактозонегативна та у 2 (6,7 %) хворих – кишкова паличка зі зниженою ферментативною активністю. Звертає на себе увагу частота виявлення грибів роду Candida. Дані гриби було ізольовано у 22 (73,3 %) обстежених. Також у 13,3 % випадків було вилучено S. aureus. Крім того, у 2 хворих було виявлено патогенні ентеробактерії (S. enteritidis), а у 3 (10,0 %) пацієнтів – мікроорганізми роду Clostridium. Таким чином, у більшості хворих на алергодерматозами, що увійшли у дослідження, особливо у хворих на АД, виявлено ознаки порушень мікробіоценозу. Ці порушення полягали у пригніченні індигенної мікрофлори та активації умовно-патогенної мікрофлори з високим патогенним потенціалом. У багатьох випадках ці зміни були універсальними, тобто спостерігались у всіх біотопах (на шкірі, у виділеннях із зіву, носу та у вмісті товстої кишки).
Дослідження вмісту IL-17А виконано у 33 хворих на АД, у 39 хворих на ІЕ, у 36 хворих на МЕ та у 23 практично здорових людей (контрольна група). За результатами статистичного аналізу вміст IL-17А коливався в досить широких межах. У контрольній групі практично здорових осіб він складав у середньому (13,0 ± 8,9) пг/мл (від 1,3 пг/мл до 27,0 пг/мл). У хворих на АД він складав у середньому (113,7 ± 60,6) пг/мл; у хворих на ІЕ – (85,6 ± 49,6) пг/мл, а у хворих на МЕ – у середньому (100,1 ± 39,8) пг/мл.
Перш за все, привертає увагу, що незалежно від діагнозу рівень IL-17А у середньому був достовірно більшим, ніж у контрольній групі (p<0,05 за t‑критерієм). Найбільші значення відмічені у хворих на АД, дещо менші – у хворих на МЕ та ІЕ (різниця концентрації IL-17А між хворих залежно від діагнозу статистично не значима – p>0,05 за t-критерієм).
За даними кореляційного аналізу було виявлено пряму залежність вмісту IL-17А та тяжкістю захворювання: у хворих на АД – rP = 0,681 (p<0,001) та rP = 0,722 (p<0,001) з величиною SCORAD; у хворих на ІЕ – rP = 0,400 (p=0,003) та rP = 0,423 (p=0,002) з величиною EASI; у хворих на МЕ – rP = 0,613 (p<0,001) та rP = 0,613 (p<0,001) з величиною EASI. Така залежність також підтверджувалася розподілом середніх значень вмісту IL-17А залежно від тяжкості алергодерматозу.
При легкому перебігу АД вміст IL-17А склав у середньому (19,2 ± 5,1) пг/мл, що майже не відрізнялосявід аналогічного показника в контрольній групі (р=0,079 за t-критерієм). При середньо-важкому перебігу він зростав до (64,3 ± 25,1) пг/мл, а при важкому сягав (137,1 ± 50,2) пг/мл (p<0,001 за t-критерієм з контрольною групою та з хворими з легким перебігом захворювання).
У хворих на ІЕ при легкому перебігу захворювання рівень IL-17А складав у середньому (15,6 ± 6,1) пг/мл, не відрізняючись від аналогічного показника контрольної групи (р=0,782 за t-критерієм). При середньо-важкому перебігу він зростав до (76,4 ± 37,5) пг/мл, при важкому – (100,5 ± 50,4) пг/мл (p<0,001 за t-критерієм з контрольною групою та з хворими з легким перебігом). У хворих на МЕ ці показники становили (11,6 ± 1,9), (63,5 ± 29,6) та (110,1 ± 33,1) пг/мл у відповідні терміни з аналогічними результатами порівняння з контрольною групою. У хворих на алергодерматози під час загострення захворювання спостерігалося значне збільшення вмісту IL-17А в сироватці крові. Це збільшення мало значиму пряму сильну кореляцію з тяжкістю перебігу захворювання, що свідчить про важливість імунного механізму в патогенезі захворювання та ролі прозапальних цитокінів. Ступінь цих порушень також залежить від вираженості порушень мікробіоценозу, що є доказом необхідності його корекції.
Дослідження поліморфізму гена TLR 1-I602S виконано у 39 хворих, у тому числі у 9 хворих на АД, у 11 хворих на ІЕ та у 19 хворих на МЕ. Контрольну групу склала 41 практично здорова особа. У хворих на алергодерматози (в цілому) генотип SS виявлено у 12 (30,8 %) випадках, генотип IS – у 23 (59,0 %) випадках, а генотип ІІ – 4 (10,2 %) випадках, тобто превалювали менш активні варіанти генотипу TLR1-I602S на відміну від розподілу генотипів у контрольній групі, в якій переважали активний генотип ІІ – 27 (65,8 %) випадків; найменш активний генотип SS виявлено у 5 (12,2 %), а генотип IS – у 9 (22,0 %) випадках (різниця поліморфізму гена TLR1-I602S у хворих на алергодерматози статистично достовірна у порівнянні з контрольною групою – χ2=26,038, р<0,001). залежно від діагнозу у хворих на АД активного генотипу гена TLR1-I602S ІІ не було, генотип IS виявлено у 7 (77,8 %) випадках, а генотип SS – у 2 (22,2 %) випадках. При ІЕ активного генотипу також не було, при цьому значно збільшилася частота малоактивного генотипу SS – 6 (54,5 %) хворих, генотип ІS виявлений у 5 (45,5 %) випадках. При МЕ генотип ІІ та SS виявлялися з однаковою частотою – по 4 (21,1 %) хворих, а генотип ІS – у 11 (57,9 %) хворих (різниця між групами залежно від діагнозу статично не значима – p>0,05 за критерієм χ2 у всіх порівняннях). При цьому зберігалася статистично значима різниця розподілу генотипів гена TLR1-I602S незалежно від діагнозу порівняно з контролем АД – χ2=13,645, р=0,002; ІЕ – χ216,377, р<0,001; МЕ – χ2=10,755, р=0,005).
У хворих на АД у зв’язку з малою кількістю спостережень суттєвих закономірностей не виявлено. У хворих на ІЕ статистично значимих відмінностей поліморфізму залежно від тяжкості перебігу захворювання не виявлено (р>0,05 за критерієм χ2). У хворих на МЕ привертало на увагу, що активний генотип гена TLR1-I602S переважно виявлявся у хворих із тяжким перебігом захворювання (з оцінкою за ЕASI більш 40 балів) – у 3 випадках (75 %) із загальної кількості з таким генотипом, але в цілому розподіл поліморфізму залежно від тяжкості також статистично значимо не розрізнявся (р>0,05). Таким чином, аналіз поліморфізму гена TLR1-I602S у хворих на алергодерматози виявив превалювання неактивних та малоактивних генотипів порівняно з контрольною групою досліджених. Активний генотип зустрічався тільки у хворих на МЕ, причому переважно при важкому перебігу захворювання.
У хворих на АД та ІЕ зустрічалися тільки неактивні та малоактивні генотипи, що свідчить про недосконалість системи вродженого антиінфекційного захисту та є можливою причиною великого ступеня обсіменіння біотопів патогенною та умовно-патогенною флорою.
У хворих на МЕ головною особливістю є те, що активний генотип найчастіше зустрічався при тяжкому перебігу захворювання, що можна пояснити наявністю дисбалансу прозапальних факторів, які утворюються під час активації TLR1, та протизапальних факторів на фоні автоімунних порушень у цих хворих. Непрямим доказом цих взаємовідносин є значний рівень прозапального Il17A, що був виявлений у цих хворих. Слід зазначити, що TLR є першими рецепторами для виявлення потенційних патогенів та ініціюють імунну відповідь, формують зв’язок між вродженою і адаптивною імунною відповіддю, а також відіграють важливу роль у патофізіології інфекційних і запальних захворювань [174].
За результатами аналізу клініко-лабораторних показників хворих на алергодерматози під час загострення до початку лікування незалежно від діагнозу виявлено загальні особливості: порушення мікробіоценозу шкіри, яке часто сполучалося з порушенням мікробіоценозу інших біотопів, у тому числі товстої кишки; наявність активації прозапального механізму патогенезу захворювання; залежність тяжкості перебігу захворювання від вираженості дисбіотичних та імунних порушень; наявність активних генотипів гена TLR1-I602S у хворих на АД та ІЕ та схильність до тяжкого перебігу захворювання у хворих на МЕ з активним генотипом гена TLR1-I602S.
Враховуючи мету і задачі дослідження та загальні особливості, які також є свідченням необхідності спрямованої корекції порушень у окремих хворих та було підставою для обгрунтування ефективності диференційованої терапії, увагу привернув досить розповсюджений метод лікування дисбіотичних порушень – ентеросорбцію. Завдяки елімінації ендогенних та екзогенних токсинів ентеросорбція сприяє покращенню загального стану та перебігу патологічного процесу [58]. На відміну від раніше застосованих методів ентеросорбційної терапії було запропоновано ступінчасту ентеросорбцію із застосуванням сорбентів з різними властивостями: атоксілу та еліміналь-гелю. При призначенні ентеросорбції також враховувалася наявність супутньої патології ШКТ, яка була виявлена у багатьох хворих на алергодерматозами (як окрема патологія, або у поєднанні з іншими супутніми захворюваннями).
Запропонований спосіб ступінчастої ентеросорбції передбачав прийом атоксілу по 1 флакону на день протягом 3 днів з наступним прийомом еліміналь гелю по 1 стик-пакету 3 рази на день протягом 14 днів.
Ступінчасту ентеросорбцію призначено 30 пацієнтам, які увійшли в основну (Іа) групу, у тому числі – 11 хворим на АД, 12 хворим на ІЕ та 7 хворим на МЕ. Групу порівняння склали 20 пацієнтів, які отримали традиційне лікування без застосування сорбційної терапії (Іб група).
На початку лікування тяжкість АД за шкалою SCORAD у хворих Іа групи складала (48,4 ± 14,4) балів; у хворих Іб групи – (44,6 ± 22,6). Тобто вихідний рівень тяжкості АД у хворих Іа групи був більшим, ніж у Іб групі, але статистично не достовірно (р=0,140 за t-критерієм). На 7 добу лікування величина SCORAD в Іа групі знизилась у середньому на (66,0 ± 9,7) %, у Іб групі – на (21,0 ± 12,0) %. На 14 добу лікування тяжкість захворювання за шкалою SCORAD в Іа групі у середньому складала (7,1 ± 1,5) балів що було достовірно менше (р<0,05 за t-критерієм), ніж у Іб групі – (15,9 ± 9,6) балів. Тобто, застосування ступінчастої сорбційної призвело до більш швидкого та більш значного зменшення основних клінічних проявів АД, при цьому вихідний стан у Іа групі був гіршим, ніж у хворих групи Іб. Ступінчаста сорбційна терапія виявилась ефективною й у хворих на ІЕ. Початкова тяжкість захворювання за шкалою EASI Іа групі становила (42,4 ± 16,1) балів; в групі Іб – (38,2 ± 18,1) балів (р>0,05 за t-критерієм). На 7 добу лікування у хворих Іа групи, яким призначалась ступінчаста сорбційна терапія, вираженість клінічних проявів знизилась у середньому на (49,8 ± 8,9) % у групі Іб на (12,9 ± 4,3) % – до (22,6 ± 9,4) балів та до (32,8 ± 14,6) балів відповідно (р<0,001 за t-критерієм). На 14 добу лікування тяжкість захворювання за шкалою EASI знизилась до (8,7 ± 5,6) бали в Іа групі та (13,7 ± 9,8) балів в групі Іб (р>0,05 за t-критерієм).
Подібну динаміку клінічних проявів виявлено у хворих на МЕ. На початку лікування тяжкість захворювання за шкалою EASI у середньому складала в Іа групі (50,6 ± 12,8), у хворих на МЕ у групі Іб – (48,5 ± 12,3) бали (р>0,05 за t-критерієм). На 7 добу лікування в результаті застосування ступінчастої сорбційної терапії в Іа групі середня тяжкість клінічних проявів МЕ за шкалою EASI знизилась на (39,8 ± 16,9) %, у групі Іб на (19,0 ± 6,5) %, до (28,0 ± 5,2) балів та до (42,6 ± 14,9) балів відповідно. На 14 добу величина EASI складала у середньому (12,1 ± 6,1) балів в Іа групі та (10,3 ± 4,4) балів в групі Іб (p>0,05 за t-критерієм на 7 та 14 добу).
Крім цього, ефективність ступінчатої сорбційної терапії підтверджено результатами дослідження мікробіоценозу. Встановлено, що в результаті лікування найбільш суттєві зміни відбулися у мікробіоценозі шкіри.
У хворих групи Іб після проведення традиційної терапії без використання ентеросорбції відмічалися деякі позитивні зміни у складі ценозу шкіри, але більш виражені зміни відбулися у групі пацієнтів Іа, що отримували ступінчасту ентеросорбцію: кількість штамів S. aureus знизилася з 42,6 % до 35,7 % та 30,0 % у пацієнтів з АД, з 36,1 % до 30,7 % та 23,1 % у хворих на ІЕ. Частота вилучення штамів S. еpidermidis мала зворотну залежність. Так, кількість вилучень зросла з 22,9 % до 40,0 % у хворих на АД, з 22,1 % до 38,4 % у хворих на ІЕ та з 20,7 % до 33,3 % у пацієнтів з МЕ. Це свідчить про більш позитивну динаміку якісного складу мікробіоти шкіри під впливом ступінчастої ентеросорбції та про більшу ефективність цього методу у складі комплексної терапії хворих на алергодерматози.
Вивчення вмісту IL-17A у процесі лікування в цих групах хворих також дозволило виявити певні закономірності. На початку лікування рівень цього цитокіну у хворих Іа групи складав (179,7 ± 29,3) пг/мл, в групі Іб (114,2 ± 30,4) пг/мл (р<0,05 за t-критерієм між Іа та групою Іб). На 14 добу лікування рівень IL-17A знизився на (85,8 ± 8,0) % до (24,0 ± 9,5) пг/мл, в групі Іб – на (79,3 ± 10,3) % до (23,2 ± 11,2 ) пг/мл (p>0,05 за t-критерієм). У хворих на ІЕ на початку лікування в Іа групі рівень IL-17A складав у середньому (88,9 ± 34,4) пг/мл; у групі Іб – (94,9 ± 38,5) пг/мл. На 14 добу лікування в Іа групі він знизився на (79,0 ± 4,2) % до (18,2 ± 16,7) пг/мл в групі Іб він знизився у середньому на (61,7 ± 24,8) % до (39,7 ± 29,7) пг/мл (р>0,05 за t-критерієм). У хворих на МЕ Іа групи на початку дослідження рівень IL-17A складав у середньому (130,3 ± 24,9) пг/мл; у групі Іб – (90,6 ± 20,3) пг/мл. Через 14 діб лікування в Іа групі він знизився у середньому на (88,1 ± 3,7) % до (15,4 ± 5,2) пг/мл; у хворих групи Іб – на (71,3 ± 13,9) % до (30,8 ± 19,9) пг/мл (p<0,05 за t-критерієм).
Таким чином, застосування ступінчастої ентеросорбції за запропонованим методом у хворих на алергодерматози сприяє поліпшенню динаміки клінічних проявів захворювання, більш якісному відновленні мікробіоценозу шкіри та нормалізації рівня IL-17A. Усе це сприяє більш швидкому усуненню ознак загострення алергодерматозів та свідчить про доцільність застосування ступінчастої ентерособції в комплексі лікування хворих на АД, ІЕ та МЕ.
Крім цього, було запропоновано вдосконалений метод зовнішньої терапії – етапну зовнішню терапію, який застосовувався переважно при наявності значних порушень мікробіоценозу шкіри з наявністю патогенної та/або умовно патогенної мікрофлори (переважно грампозитивної): на першому етапі застосовувався препарат фузидієвої кислоти у вигляді мазі або крему 2 рази на день протягом 7 днів, чергуючи із застосуванням топічного стероїду у вигляді мазі або крему. На другому етапі застосовувався тільки топічний стероїд протягом 7 днів за схемою відповідно до інструкції виробника.
Раннє застосування антибактеріальних препаратів при загостренні алергодерматозів може бути особливо корисним при наявності дефекту вродженого імунітету будь-якої природи. Зокрема це є корисним при наявності малоактивних та, особливо, неактивних генотипів TLR1-I602S, що також необхідно враховувати при визначенні тактики лікування.
Другим обов’язковим компонентом зовнішньої терапії були топічні стероїди.
Етапна зовнішня терапія була призначена 67 хворим, у тому числі, 24 хворих на АД; 18 хворим на ІЕ та 25 хворим на МЕ, які склали ІІа групу. У всіх інших випадках (37 хворих) для лікування алергодерматозів під час загострення застосовувався комбінований препарат (який містив протимікробний інгредієнт та ТГКС) згідно інструкції виробника – ІІб група, у тому числі, 9 хворих на АД, 15 хворих на ІЕ та 13 хворих на МЕ.
На початку лікування тяжкість АД за шкалою SCORAD у хворих ІІа групи – (46,3 ± 17,8) (від 18,7 до 65,4; 95 % ДІ 44,5–59,6), що було більше, ніж у хворих ІІб групи – (42,1 ± 18,2). На 7 добу лікування величина SCORAD в ІІа групі знизилась у середньому на (63,5 ± 0,9) % до (23,7 ± 8,4) бали, у ІІб групі також зареєстровано позитивну динаміку, але величина SCORАD знизилась у меншому ступені – у середньому на (17,7 ± 8,7) % до (34,5 ± 15,5) балів. При цьому різниця між величиною SCORAD у цей термін між ІІа та ІІб групами була достовірною (р=0,015 за t-критерієм).
На 14 добу лікування тяжкість захворювання за шкалою SCORAD в ІІа групі складала (6,4 ± 3,2) бали, що було достовірно менше (р<0,001 за t-критерієм), ніж ІІб групі – (22,4 ± 11,8) балів. Динаміку клінічних проявів під впливом етапної зовнішньої терапії у хворих на ІЕ відображає тяжкість захворювання за шкалою EASI на початку дослідження в ІІа групі, яка становила (40,7 ± 18,8) балів (від 11,4 до 69,4; 95 % ДІ 31,3–50,1 балів); у ІІб групі – (47,1 ± 14,0) балів (від 23,1 до 67,2; 95 % ДІ 39,3–54,8 бали). На 7 добу у хворих ІІа групи після 7 діб лікування із застосуванням етапної зовнішньої терапії загальна тяжкість захворювання за шкалою EASI знизилася на (51,0 ± 12,6) % – до (18,6 ± 7,9) балів. Через 14 діб лікування вона складала (10,6 ± 4,5) бали. При застосуванні зовнішньої терапії комбінованим препаратом (ІІб група) на 7 добу лікування середня тяжкість захворювання зменшилась на (15,4 ± 9,1) % – до (38,7 ± 12,0) балів, на 14 добу вона знизилася до (8,9 ± 5,0) балів. Застосування етапної зовнішньої терапії у хворих на МЕ також призвело до доброї динаміки клінічних проявів захворювання. На початку лікування тяжкість захворювання за шкалою EASI у середньому складала в ІІа групі – (54,7 ± 15,2) балів (від 18,4 до 76,5 балів; 95 % ДІ 48,4–61,0 балів), що не відрізнялося від аналогічного показника у хворих ІІб групи (58,3 ± 13,9) бали (р>0,05 за t-критерієм).
На 7 добу середня тяжкість захворювання за шкалою EASI у пацієнтів ІІа групи знизилась на (52,9 ± 14,0) % до (24,5 ± 7,8) балів та на 14 добу до (14,9 ± 7,5) балів. На 7 добу цей показник був достовірно меншим, ніж у пацієнтів ІІб групи – (49,4 ± 12,3) бали (p<0,05 за t-критерієм), у яких цей показник знизився на (15,5 ± 4,6) %, на 14 добу величина EASI становила (16,2 ± 13,9) бали (р>0,05 за t-критерієм порівняно з ІІа групою).
Вивчення вмісту IL-17A в процесі лікування в цих групах хворих також дозволило виявити певні закономірності. У період загострення (до початку лікування) рівень IL-17A у хворих ІІа групи становив (100,7 ± 49,7) пг/мл (95 % ДІ 79,7–121,7 пг/мл), що майже не відрізнялося від аналогічного показника ІІб групи – (95,0 ± 59,3) пг/мл (р>0,05 за t-критерієм). У результаті застосування етапної зовнішньої терапії (ІІа група) рівень IL-17A на 14 добу лікування знизився на (82,2 ± 19,8) % до (18,9 ± 7,8) пг/мл, при застосуванні комбінованого препарату – на (85,8 ± 15,6) % до (15,3 ± 7,9) пг/мл. Різниці між рівнем IL-17A через 14 діб лікування між групами залежно від методу лікування не виявлено (p>0,05 за t-критерієм). На початку лікування у хворих на ІЕ ІІа групи рівень IL-17A складав (78,5 ± 54,6) пг/мл (від 6,8 до 169,6 пг/мл; 95 % ДІ 51,4–105,7 пг/мл) – тобто спостерігався дуже великий розкид індивідуальних значень. У результаті лікування на 14 добу рівень IL-17A знизився у середньому на (59,5 ± 6,4) % до (24,3 ± 25,9) пг/мл. При цьому, статистично значимої різниці з аналогічним показником контрольної групи не виявлено (р>0,05 за t-критерієм). На початку дослідження у хворих на МЕ ІІа групи рівень IL-17A складав (95,2 ± 37,4) пг/мл (від 10,2 до 161,2 пг/мл; 95 % ДІ 79,8–110,6 пг/мл). Через 14 діб лікування він знизився у середньому на (80,7 ± 13,8) % до (16,9 ± 15,6) пг/мл. У хворих ІІб групи на 14 добу він знизився до (28,4 ± 20,4) пг/мл (р<0,05 за t-критерієм між ІІа та ІІб групами).
Отримані результати свідчать, що при наявності виражених порушень мікробіоценозу шкіри у хворих з тяжким перебігом захворювання доцільна етапна зовнішня терапія; при наявності порушень мікробіоценозу у двох та більше біотопах у поєднанні зі значним збільшенням рівня IL-17А та при наявності супутньої патології ШКТ доцільна ступінчаста ентеросорбція; при МЕ, особливо у хворих з наявністю значних порушень мікробіоценозу шкіри та при виявленні активних генотипів TLR1-I602S, доцільною є етапна зовнішня терапія. Таким чином, за результатами аналізу динаміки клінічних проявів алергодерматозів можна стверджувати, що незалежно від діагнозу застосування ступінчастої сорбційної та етапної зовнішньої терапії призводить до більш швидкого покращення стану пацієнтів – на 7 добу лікування спостерігалося більш значне зниження тяжкості захворювання та частоти виявлення більш тяжких окремих клінічних симптомів порівняно з групою пацієнтів, які отримували комбінований препарат, що містив антибактеріальний компонент та ТГКС. Ступінчаста сорбційна терапія була більш ефективною у хворих на АД, у той час як етапна зовнішня терапія була більш ефективною у хворих на МЕ. Цей підхід було узагальнено у вигляді алгоритму лікування хворих на алергодерматози (рис. 8.1).
Наведені дані свідчать про достатньо високу ефективність запропонованих методів лікування пацієнтів з алергодерматозами. Ефективність комплексного диференційованого підходу до терапії АД, МЕ та ІЕ з урахуванням основних факторів підкреслює патогенетичну обґрунтованість, адекватність даних методів терапії і дозволяє рекомендувати їх до впровадження у практичну діяльність.
Рисунок 8.1 – Алгоритм вибору тактики лікування хворих на алергодерматози
ВИСНОВКИ
У дисертаційній роботі наведено теоретичне обґрунтування та нове вирішення наукового завдання, яке полягає у підвищенні ефективності лікування хворих на алергодерматози (атопічного дерматиту, істинної та мікробної екземи) шляхом удосконалення комплексу терапії із застосуванням ступінчастої сорбційної терапії та етапної зовнішньої терапії.
- У зв’язку з широкою розповсюдженістю алергодерматозів як серед населення світу, так і в Україні, неухильним зростанням тяжких форм захворювання, складністю патогенезу, актуальним залишається поглиблене вивчення взаємодії коменсальної та патогенної мікрофлори з окремими ланками імунної системи людини. Розуміння цих механізмів патогенезу алергодерматозів дозволить удосконалити схеми комплексної терапії, тим самим покращити вибір тактики лікування та його ефективності.
- Встановлено, що у складі мікробіоценозу шкіри хворих на екзему та АД у період загострення до початку лікування спостерігався зсув з переважанням найбільш агресивних видів, питома вага яких склала 60,8 %, з домінуванням S. aureus (42,6 % лабораторних штамів) у хворих на АД та 36,1 % і 37,9 % відповідно у хворих на ІЕ та МЕ.
- У хворих на алергодерматози під час загострення захворювання спостерігається значне збільшення рівня IL-17А в сироватці крові. Це збільшення має сильну значиму пряму кореляцію з тяжкістю перебігу захворювання та вираженістю порушень мікробіоценозу, що свідчить про важливість імунного механізму в патогенезі захворювання та ролі прозапальних цитокінів. У результаті застосування етапної зовнішньої терапії у хворих на АД рівень IL-17A на 14 добу лікування знизився на (82,2 ± 19,8) % до (18,9 ± 7,8) пг/мл, при застосуванні комбінованого препарату – на (85,8 ± 15,6) % до (15,3 ± 7,9) % пг/мл; у хворих на ІЕ – на (59,5 ± 6,4) % та (62,4 ± 7,3) % відповідно та у хворих на МЕ на (80,7 ± 13,8) % та на (70,3 ± 10,6) % відповідно.
- Аналіз поліморфізму гена TLR 1-I602S у хворих на алергодерматози виявив превалювання неактивних та малоактивних генотипів у хворих на АД та ІЕ. Активний генотип зустрічався тільки у хворих на МЕ, причому переважно при важкому перебігу захворювання.
- Застосування ступінчастої сорбційної терапії у хворих на алергодерматози сприяло нормалізації мікробіоценозу кишечника та шкіри. Кількість штамів S. aureus знизилася з 42,6 % до 35,7 % та 30,0 % відповідно у хворих на АД, з 36,1 % до 30,7 % та 23,1 % відповідно у хворих на ІЕ. Частота вилучення штамів S. еpidermidis мала зворотну залежність, так кількість вилучень зросла з 22,9 % до 40,0 % у хворих на АД, з 22,1 % до 38,4 % у хворих на ІЕ та з 20,7 % до 33,3 % у пацієнтів з МЕ. Також спостерігалася нормалізація основних показників мікроценозу кишечника: збільшилася кількість біфідо- та лактобактерій, були відсутні S. aureus, умовно-патогенні ентеробактерії, лактонегативні кишкові палички та варіанти зі зниженою ферментативною активністю.
- Застосування етапної зовнішньої терапії сприяло нормалізації мікробіоценозу шкіри у хворих на алергодерматози. Кількість штамів S. aureus знизилася з 48,8 % до 17,6 % у пацієнтів на АД, з 18,7 до 13,3 % у хворих на ІЕ та з 21,4 % до 6,7 % у хворих на МЕ, проти з 50,0 % до 35,7 % у пацієнтів з АД, з 11,1 % до 9,7 % у хворих на ІЕ та з 14,8 % до 8,7 % у хворих на МЕ при лікуванні комбінованим місцевим засобом. Частота вилучення штамів S. еpidermidis мала зворотну залежність, так кількість вилучень зросла з 24,4 % до 52,9 % у хворих на АД, з 26,6 % до 33,3 % у хворих на ІЕ при застосуванні етапної зовнішньої терапії проти з 18,8 % до 28,6 % у хворих на АД та з 13,9 % до 19,4 % у хворих на ІЕ при лікування комбінованим місцевим засобом, що свідчить про ефективність розробленого методу.
РЕКОМЕНДАЦІЇ
- Хворим на алергодерматози з порушенням мікробіоценозу в різних біотопах рекомендується проводити дослідження вмісту прозапального IL-17A в сироватці крові, як маркера загострення алергодерматозів. Таке обстеження з урахуванням виявлених патологічних змін дозволить прогнозувати подальший перебіг дерматозу та може слугувати показником ефективності терапії.
- Аналіз поліморфізму гена TLR 1-I602S дозволяє прогнозувати подальший перебіг дерматозу і здійснювати диференційований підхід до призначення комплексного лікування хворим на алергодерматози.
- Хворим на алергодерматози до комплексної терапії з метою корекції мікрофлори шкіри та кишечника, показників імунного статусу, при відсутності протипоказань до призначення (індивідуальної чутливості до компонентів, виразкової хвороби шлунку та дванадцятипалої кишки у стадії загострення, шлункових та кишкових кровотеч, кишкової непрохідності, хворим на фенілкетонурію) рекомендується спосіб ступінчастої ентеросорбції, який передбачає прийом атоксілу по 1 флакону на день протягом 3 днів з наступним прийомом еліміналь гелю по 1 стик-пакету 3 рази на день протягом 14 днів.
- Хворим на алергодерматози особливо з дефектом вродженого імунітету, наявністю малоактивних та, особливо, неактивних генотипів TLR1-I602S з метою корекції мікрофлори шкіри, показників імунного статусу, більш швидкого усунення ознак загострення алергодерматозів до комплексної терапії доцільно призначати етапну зовнішню терапію: на першому етапі застосовувати препарат фузидієвої кислоти у вигляді мазі або крему 2 рази на день протягом 7 днів, чергуючи із застосуванням топічного стероїду у вигляді мазі або крему. На другому етапі застосовувати тільки топічний стероїд протягом 7 днів за схемою відповідно до інструкції виробника.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Адаскевич ВП. Диагностические индексы в дерматологии. М: Изд-во Панфилова; БИНОМ. Лаборатория Знаний, 2014. 352 с.
- Бакалець ОВ. Особливості перебігу алергічних дерматозів на тлі цитомегаловірусної інфекції: автореф. дис. … канд. мед. наук. Тернопільській державний медичний університет імені І.Я.Горбачевського МОЗ України 14.01.29 – клінічна алергологія. Київ, 2009, 20 с.
- Бакиров ИШ, Рыбин АВ, Потатуркина-Нестерова НИ, Нестеров АС. Клинико-иммунологические особенности больных хроническими дерматозами. Фундаментальные исследования. 2010; 4: 17-21.
- Балаболкин ИИ, Терлецкая РН, Дыбунова ЕЛ. Влияние экологических факторов на аллергическую заболеваемость детского населения Российской Федерации. Сибирское медицинское обозрение. 2008; 54 (6): 31–40.
- Батыршина СВ, Хаертдинова ЛА, Маланичева ТГ, Халилова РГ. Атопический дерматит: оптимизация топической терапии. Вестник дерматологии и венерологии. 2013; 3: 102-111.
- Батыршина СВ, Хаертдинова ЛА, Халилова РГ, и др. Микробиоценоз кожи у больных атопическим дерматитом и его коррекция. Практическая медицина. 2013; 1-4 (73): 33-
- Белоусова ТА, Горячкина МА, Катранова ДГ. Особенности микробиоценоза кожи у больных аллергодерматозами: проблема выбора наружной терапии. Клиническая дерматология и венерология. 2013; 11(3): 107-112.
- Беляев ГМ. Современные аспекты патогенеза аллергодерматозов, лечение больных этой патологией (по данным литературы и опыту автора). Дерматологiя та венерологiя. 2012; 2 (56): 7-26.
- Болотная ЛА. Терапевтическая коррекция эндогенной интоксикации у больных хроническими воспалительными дерматозами. Український журнал дерматології, венерології, косметології. 2014; 3 (54): 89-94.
- Болотна ЛА. Мікробна екзема: можливості комбінованої топічної терапії. Український журнал дерматології, венерології, косметології. 2015; 1:79-84.
- Болотна ЛА, Осипенко ТС Коррекция дисбиоза у больных атопическим дерматитом. 2014; 3: 67-68.
- Волкославська ВМ. Про динаміку деяких показників стану шкірно-венерологічної допомоги за 2000–2015 рр. в Україні. Дерматологія та венерологія. 2016; 3 (73): 61-68.
- Волкославська, ВМ, Гутнєв ОЛ. Про стан захворюваності та особливості перебігу деяких дерматозів у підлітків в Україні. Клиническая иммунология. Аллергология. Инфектология. 2013; 1: 16-20.
- Вольбин СВ, Ващенко КФ. Вивчення мікробіоценозу шкіри хворих на вугрову хворобу. Експериментальна та клінічна фізіологія і біохімія. 2010; 2: 68 –72.
- Галлямова ЮА. Атопический дерматит и дисбактериоз. Лечащий Врач. 2010; 10: 14–16.
- Гималова ГФ, Карунас АС, Хуснутдинова ЭК. Молекулярно-генетические аспекты атопического дерматита. Медицинская генетика. 2012; 12: 18–26.
- Гланц С. Медико-биологическая статистика. Пер. с англ. М., Практика, 1998; 459 с.
- Дашко МО, Денисенко ОІ. Показники системного імунітету та фагоцитозу у хворих на піодермії з різним ступенем змін біоценозу товстої кишки. Український журнал дерматології, венерології, косметології. 2014; 4 (56): 20–27.
- Джораєва СК, Гончаренко ВВ, Щоголєва ОВ, та ін. Склад та функції мікробіоценозів різних біотопів макроорганізму та клінічна значимість їх порушень. Дерматологія та венерологія. 2015; 2(68): 5-19.
- Джораєва СК, Кутасевич Я.Ф., Олійник ІО, та ін. Вивчення факторів патогенності стафілококової мікрофлори шкіри у хворих на поширені дерматози. Дерматологія та венерологія. 2013; 1 (59): 20–25.
- Джорджиева ОВ, Торгоева ЛШ, Мельниченко ОО, Корсунская ИМ Изучение микробоценоза кожи и кишечника у больных атопическим дерматитом. Дерматовенерология и дерматокосметология. 2012; 1: 32–35.
- Калюжна ЛД.Місце топічних глюкокортикоїдів у лікуванні дерматитів різної етіології. Здоровье женщины. 2016; 8: 33-36. – Режим доступу: http://nbuv.gov.ua/UJRN/Zdzh_2016_8_7.
- Калюжна ЛД, Гречанська ЛВ. Підхід до розробки уніфікованого клінічного протоколу з діагностики та лікування атопічного дерматиту. Український журнал дерматології, венерології, косметології. 2016; 3: 44-46. Режим доступу: http://nbuv.gov.ua/UJRN/Ujdvc_2016_3_9.
- Калюжная ЛД, Юрчик ЯН. Альтернативное решение для контроля фазы обострения при атопическом дерматите. Клінічна імунологія. Алергологія. Інфектологія. Спецвипуск. 2014; 1: 36-39.
- Катунина ОР, Резайкина АВ, Клыхалова ОИ. Роль распознающих рецепторов в инициации иммунного воспаления в коже больных псориазом. Вестник дерматологии и венерологии. 2010; 5: 84–91.
- Коган БГ, Верба ЕА. Новые европейские подходы в терапии резистентных форм аллергодерматозов. Український журнал дерматології, венерології, косметології. 2013; 1 (48): 1377-143.
- Коган БГ. Атопічний дерматит: акцент на безпечності лікування. Український журнал дерматології, венерології, косметології. 2013; 1 (48): 81-89.
- Короткий НГ, Песляк МЮ. Псориаз как следствие включения β-стрептококков в микробиоценоз кишечника с повышенной проницаемостью (концепция патогенеза). Вестник дерматологии и венерологии. 2005; 1: 9-18.
- Кочергин НГ, Черникова ЕА, Билалова УГ. и др. Атопический дерматит открытых участков и малассезиозная инфекция. Росс. журн. кож. и вен. болезней. 2011; 2: 31–33.
- Круглова ЛС. Симптомокомплекс дисбиоза у больных атопическим дерматитом и методы его коррекции. Лечащий врач. 2012; 5. Доступно на: http://www.lvrach.ru/2012/05/15435424.
- Куваева ИБ, Ладодо КС. Микроэкологические и иммунные нарушения у детей: Диетическая коррекция. Москва: Медицина, 1991, 240 с.
- Кузнецова ЛВ. Сучасні методи лікування хворих на алергодерматози. Клінічна імунологія. Алергологія. Інфектологія. 2014; 5 (7): 51-53.
- Кунгуров НВ, Кениксфест ЮВ, Кохан ММ, Левчик НК, Белых ОА, Стукова ЕИ. Иммунопатогенез атопического дерматита как основа для системной и топической терапии. Лечащий врач. 2013; 11. Доступно на: http://www.lvrach.ru/2013/11/15435855.
- Кутасевич ЯФ, Білозоров ОП, Мангушева ВЮ. Дослідження поліморфізму гену тол-подібного рецептору 1 TLR-1-I602S у хворих на алергодерматози. Art of Medicine. 2018; 3 (7): 63–65.
- Кутасевич ЯФ, Джораева СК, Мангушева ВЮ. Исследование состава микробиоты кожи и анализ ее антибиотикорезистентности у больных аллергодерматозами. Експериментальна і клінічна медицина. 2018: 1 (78): 101–107.
- Кутасевич ЯФ, Ищейкин КЕ, Зюбан ИВ, Мангушева ВЮ. Дифференцированный подход к диагностике и наружной терапии экземы. Дерматологія та венерологія. 2018; 1 (79): 50–55.
- Кутасевич ЯФ, Іщєйкін КЄ, Олійник ІО, Джораєва СК, Зюбан ІВ, Мангушева ВЮ. Особливості клінічних проявів атопічного дерматиту у пацієнтів з мутацією 2282del14 в гені філаггрину. Дерматологія та венерологія. 2018; 2 (80): 19–25.
- Кутасевич ЯФ, Мангушева ВЮ. Оптимизация наружной терапии больных экземой. World Science. 2017; 4(11) (27): 33–37.
- Кутасевич ЯФ, Маштакова ІО, Джораєва СК, Мангушева ВЮ. Особливості складу ценозів кишечника та шкіри у хворих на алергодерматози. В кн.: Матеріали V ювілейного міжнар. мед. конгресу «Впровадження сучасних досягнень медичної науки у практику охорони здоров’я України». К., 2016: 84.
- Кутасевич ЯФ, Олейник ИА, Маштакова ИА, Попова РК, Мангушева ВЮ. Эффективность эфферентной терапии больных в лечении хронической экземы. Мат. Наук.-практ. конф. “Дерматовенерологія в розробках молодих науковців”, 19-20 листопада 2015 р., м. Київ. Дерматовенерологія. Косметологія. Сексопатологія. 2015; 3–4 (2): 118–119.
- Кутасевич ЯФ, Олійник ІО, Джораєва СК, Мангушева ВЮ. Корекція мікробіоценозу кишечника методом ступінчастої елімінаційної терапії у хворих на алергодерматози. Медицина сьогодні і завтра. 2017; 3 (76): 109–115.
- Кутасевич ЯФ, Олійник ІО, Джораєва СК, Мангушева ВЮ. Спосіб лікування хворих на алергодерматози з порушенням мікробіоценозу шкіри. Патент України на корисну модель №120805, 27.11.2017.
- Кутасевич ЯФ, Олійник ІО, Мангушева ВЮ. Східчаста ентеросорбція в лікуванні хворих на поширені алергодерматози. Збірник робіт по матеріалам науково-практичної конференції «Сімейна медицина. Перспективи та шляхи подальшого розвитку». Львів, 13-15 квітня 2016. Львів, 2016: 84.
- Левченко ЛЮ, Ізмайлова ОВ, Шликова ОА, Кайдашев ІП. Поліморфізм 896A/G гена TLR4, а не 1196C/T гена TLR4 ТА 2258G/A гена TLR2 визначає тяжкий та ускладнений перебіг атопічного дерматиту у дітей. Цітологія і генетика. 2013; 47( 3): 46-53.
- Левченко ЛЮ, Микитюк МВ, Куценко НЛ, Кайдашев ІП. Особливості стану клітинного та гуморального імунітету у хворих на атопічний дерматит. Український журнал дерматології, венерології, косметології. 2010; 4 (39): 14-20.
- Летцель Х, Хергет Х. Управление симбиозом (лечение больных дисбиозом). Пер. с нем. М., 2009. 42 с.
- Ливзан МА. Пробиотики: новые грани хорошо знакомых средств. Лечащий врач. 2010; 2. Доступно на: http://www.lvrach.ru/2010/02/12157611.
- Литинська ТО. Вплив інфекції Helicibacter pylori на клінічний перебіг псоріазу, екземи справжньої та екземи інфекційної. Український журнал дерматології, венерології, косметології. 2015; 2 (57):37-42.
- Літус ОІ, Мартинюк ТМ, Бардова КО. Мікробіота шкіри та можливості її корекції пре- і пробіотиками при лікуванні хронічних дерматозів. International journal of antiibiotics and probiotics. 2017; 1(1): 93-104. Режим доступу: http://nbuv.gov.ua/UJRN/intjourantibpr_2017_1 %281 %29__9.
- Мангушева ВВ, Зюбан ИВ. Особенности клинических проявлений атопического дерматита у пациентов с мутациями гена филаггрина. В зб.: наук.-практ. конф. молодих вчених, присвячена 25-рiччю Національної академії медичних наук України. Журнал Національної академії медичних наук України. К., 2018: 60.
- Мангушева ВЮ, Джораева СН, Супрун КГ. Особенности видового состава биотопа кожи у больных распространенными аллергодерматозами. В кн.: Матеріали наук.-практ. конф. з участю міжнар. спеціалістів, присвяченого дню науки «Медична наука на перетині спеціальностей: сьогодення і майбутнє», м. Харків, 19 травня 2017 р. Харків, 2017: 71.
- Мангушева ВЮ. Аналіз супутньої соматичної патології у хворих на хронічну екзему. В кн. збірник робіт по матеріалам наук.-практ. конф. «Інноваційні досягнення в діагностиці інфекцій, що передаються статевим шляхом, інфекційних і грибкових захворювань та поширених дерматозів. Прогрес у лікуванні» VIII міжнародного медичного конгресу, м. Київ, 25–27 квітня 2017: 163.
- Мангушева ВЮ. Дослідження вмісту інтерлейкіну-17А у хворих на алергодерматози. Дерматологія та венерологія. 2018; 3 (81): 17-21.
- Мангушева ВЮ. Особенности клинических проявлений микробной экземы в области нижних конечностей. Мат. наук.-практ. конф. з міжнар. участю “Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі”, м. Харків, 10-11 листопада 2017. Дерматологія та венерологія. 2017: 3 (77): 107.
- Методические указания по бактериологической диагностике дисбактериоза кишечника (для работников бак. лабораторий СЭС Приднепровской железной дороги). Днепропетровск, 2001, 7 с.
- Михайлова ЕС, Самоукина АМ, Чернин ВВ, и др. Микробиота пищеварительного тракта подростков как показатель состояния здоровья. Верхневолжский медицинский журнал. 2014; 12(4): 6–10.
- Мурашкин НН, Глузмин МИ, Скобликов НЭ, и др. Роль метициллинрезистентных штаммов золотистого стафилококка в патогенезе тяжелых форм атопического дерматита в детском возрасте. Пути достижения ремиссии. Вестник дерматологии и венерологии. 2012; 1: 66-74.
- Мурзина ЭА. Обоснование применения энтеросорбентов в комплексной терапии хронических аллергодерматозов. Мистецтво лікування. 2013; 2–3 (98–99): 50-53.
- Нагорная НВ, Лимаренко МП. Энтеросорбция в педиатрической практике: выбор оптимального сорбента. Медицина сегодня. 2010; 11–12, 331–332.
- Наказ МОЗ України № 167 від 05.04.2007 «Про затвердження методичних вказівок “Визначення чутливості мікроорганізмів до антибактеріальних препаратів». К., 2007.
- Новокшонов АА., Соколова НВ, Бережкова ТВ, Сахарова АА. Клиническая эффективность нового энтеросорбента в комплексной терапии острых кишечных инфекций вирусной этиологии у детей // Лечащий Врач. 2009, № 7, c. 78–80.
- Новоселов АВ, Новоселов ВС, Лебедева СВ. Патология желудочно-кишечного тракта у дерматологических пациентов. Русский медицинский журнал. 2016; 10: 636-641.
- Охотникова ЕН, Меллина КВ, Бондаренко ЛВ, Паппа ИВ. Место современной энтеросорбции в лечении детей с аллергическими дерматозами. Современная педиатрия. 2012; 3(43): 79-83.
- Поліщук ДС. Застосування пребіотик-сорбенту та омега-3 поліненасичених жирних кислот у лікуванні хворих атопічним дерматитом. Український журнал дерматології, венерології, косметології. 2011; (41).
- Попов ИВ. Особенности микробиоценоза кожи при атопическом дерматите. Вестник последипломного медицинского образования. 2014; 2: 58-62.
- Приказ МЗ СССР № 535 от 22.04.1985 “Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений”.
- Пухлик БМ. Ситуация с аллергическими заболеваниями и аллергологией в Украине. Клінічна імунологія. Алергологія. Інфектологія. Спецвипуск. 2013; 2: 7-9.
- Ревякина ВА. Энтеросорбенты в комплексной терапии атопического дерматита у детей. Эффективная фармакотерапия в дерматовенерологии и дерматокосметологии. 2010; 2: 14-16.
- Резнікова АО. Оцінка імунологічних змін та алергологічних реакцій у хворих на атопічний дерматит різних вікових груп. Дерматологія та венерологія. 2015; 4 (70): 67–72.
- Резніченко НЮ, Пантюшенко ЛІ, Резніченко НЮ. Алергічний контактний дерматит: сучасні уявлення про лікування на основі огляду наукової літератури Актуальні питання фармацевтичної і медичної науки та практики. 2013; 3 (13): 69-72.
- Резніченко НЮ. Нормалізація біотопів за допомогою пробіотиків у жителів індустріальних центрів. Гастроентерологія. 2014; 1 (51): 27-30.
- Роживанова ТА, Полеско ИВ, Щербакова МЮ. Современные представления о микробиоценозе кожи и кишечника у больных экземой и метаболическим синдромом. Клиническая дерматология и венерология. 2015; 2: 11–16.
- Сергеев АЮ, Бурцева ГН, Сергеев ВЮ. Стафилококковая колонизация кожи, антибиотикорезистентность и противомикробная терапия при распространенных дерматозах. Иммунопатология, аллергология, инфектология. 2014; 4: 32-45.
- Симонова АВ, Кошелева ИВ, Шадыжева ЛИ. Оптимизация лечения и профилактики обострений атопического дерматита с учетом основных патогенетических факторов. Лечащий врач. 2016; 5. Доступно на: http://www.lvrach.ru/2016/05/15436473.
- Скрыпник ИН, Маслова АС. Роль нарушений микробиоценоза кишечника в патогенезе заболеваний внутренних органов. Ліки України. 2009; 6 (132): 65-70.
- Снарская ЕС. Коррекция эндотоксемии при атопическом дерматите у детей препаратом Лактофильтрум. Педиатрия. 2011; 2: 36-40.
- Снарская ЕС. Некоторые клинико-иммунологические аспекты патогенеза атопического дерматита и роль толл-подобных рецепторов. Лечащий врач. 2012; 4. Доступно на: http://www.lvrach.ru/2012/04/15435414.
- Снарская ЕС., Кряжева СС, Лавров АА. Роль толл-подобных рецепторов (TLR) активаторов врожденного иммунитета в патогенезе ряда дерматозов. Росс. журн. кож. и вен. болезней. 2012; 2: 9–12.
- Солошенко ЕМ, Джораєва СК, Гончаренко ВВ, Стулій ОМ. Аналіз структури та особливостей мікробіоти шкіри у хворих на розповсюджені дерматози. Дерматологія та венерологія. 2015; 4 (70): 73-81.
- Солошенко ЕМ, Жукова НВ, Соколов ВВ, Білоконь ОМ. Мікробіоценоз шкіри хворих на поширені дерматози. Журнал дерматовенерології та косметології ім. М.О.Торсуєва . 2010; 1–2 (20): .63–73.
- Солошенко ЕМ, Стулій ОМ, Рощенюк ЛВ, та ін. Захворюваність на поширені дерматози за даними звертання в лікувальні заклади шкірно-венерологічного та алергологічного профілю м. Харкова. Журнал дерматовенерології та косметології ім . М.О. Торсуєва. 2014; 1-2 (34): 36–41.
- Сорокина ЕВ, Масюкова С А. Роль толл-подобных рецепторов в патогенезе некоторых дерматозов. Клиническая дерматология и венерол. 2011; 5: 13–17.
- Страчинский ЛС, Дехнич АВ, Белькова ЮА. Сравнительная активность антибактериальных препаратов, входящих в лекарственные формы для местного применения, в отношении Staphylococcus aureus: результаты российского многоцентрового исследования. Клиническая микробиология и антимикробная терапия. 2002; 2(4): 157-163.
- Стукова ЕИ, Кениксфест ЮВ. Патогенетическое значение золотистого стафилококка при атопическом дерматите. Фундаментальные исследования. 2013; 7: 680–687.
- Українська База Медико-Статистичної Інформації «Здоров’я для всіх» [електронний ресурс]. Режим доступу: http://medstat.gov.ua/file/HFAUA_2017.rar.
- Успенская ЮБ. Хронические заболевания кожи через призму патологии желудочно-кишечного тракта. Эффективная фармакотерапия. 2016; 30: 34-36.
- Фалова ОЕ, Потатуркина-Нестерова НИ, Ильина ЕН. Взаимосвязь внутривидового разнообразия и генетических детерминант патогенности стафилококков кожи. Фундаментальные исследования. 2013; 12: 131–134.
- Фалова ОЕ. Анализ ассоциативного взаимодействия стафилококков в микробиоценозе кожи при хронических дерматозах. Международный журнал прикладных и фундаментальных исследований. 2013; 10: 461.
- Хаитов РМ, Ильина НИ (ред.) Аллергология и иммунология. Национальное руководство. М.: Геотар-Медиа. 2009. 656 с.
- Чоп’як ВВ, Головін РР, Насадюк ХМ. Контактний дерматит. Клін. імунологія. Алергологія. Інфектологія. 2008; 4 (15): 22–24.
- Шамов БА, Маланичева ТГ. Эффективность энтеросорбции в коррекции синдрома эндотоксинемии при атопическом дерматите у детей. Лечащий врач. 2010; 8. Доступно на: http://www.lvrach.ru/2010/08/15435018.
- Шелкова Н.Г., Прокопець В.П. Метод кількісного дослідження вмісту бактерій у клінічних матеріалах, що відібрані за допомогою ватного тампону. В кн.: Збірник наукових праць співробітників НМАПО ім..П.Л.Щупика. Київ, 2009; 17(2): 698-702.
- Шмелькова КС. Порушення дермального бар’єру як причина хронізації дерматозів. Дерматологія та венерологія. 2016; 1 (71): 11-15.
- Юнусова ЕИ. Экзема: дифференцированный подход к выбору наружной терапии. Лечащий врач. 2013; 5. Доступно на: http://www.lvrach.ru/2013/05/15435704.
- A Guide to Utilization of the Microbiology Laboratory for Diagnosis of Infectious Diseases: 2013 Recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM)a. Clinical Infectious Diseases Advance. 2013, 104 р.
- Alhabbab R, Blair P, Elgueta R, Stolarczyk E, Marks E, Becker PD, et al. Diversity of gut microflora is required for the generation of B cell with regulatory properties in a skin graft model. Scientific Reports. 2015; 5, 11554; doi: 10.1038/srep11554 (2015). nature.com/scientificreports.
- Augustin M, Radtke MA, Glaeske G et al. Epidemiology of Frequently Occurring Skin Diseases in Italian Children from 2006 to 2012: A Retrospective, Population-Based Study. Pediatr Dermatol. 2015; 32(5): 668–678.
- Bae JM, Choi YY, Park CO, Chung KY Lee KH. Efficacy of allergen-specific immunotherapy for atopic dermatitis: a systematic review and meta-analysis of randomized controlled trials. J Allergy Clin Immunol 2013;132:110–117.
- Baviera G, Leoni MC, Capra L, et al. Microbiota in healthy skin and in atopic eczema. BioMed Research International. 2014; – Article ID 436921, 6 p. http://dx.doi.org/10.1155/2014/436921.
- Berents TL, Carlsen KCL, Mowinckel P, et al. Skin barrier function and staphylococcus aureus colonization in vestibulum nasi and fauces in healthy infants and infants with eczema: a population-based cohort study / PlosONE. 2015; 12. DOI:10.1371/journal.pone.0130145.
- Boguniewicz M, Leung DYM. Recent insights into atopic dermatitis and implications for management of infectious complications. J Allergy Clin Immunol. 2010; 125(1): 4-13.
- Bonefeld CM, Petersen TH, Bandier J, Agerbeck C, Linneberg A, Ross-Hansen K, et al. Epidermal filaggrin deficiency mediates increased systemic T-helper 17 immune response. Br J Dermatol. 2016. DOI: 10.1111/bjd.14570.
- Bonness S, Szekat C, Novak N, Bierbaum G. Pulsed-field gel electrophoresis of Staphylococcus aureus isolates from atopic patients revealing presence of similar strains in isolates from children and their parents. Clin. Microbiol. 2008; 46 (2): 456–461.
- Brüske I, Standl M, Weidinger S. et al. Epidemiology of urticaria in infants and young children in Germany –results from the German LISAplus and GINIplus Birth Cohort Studies. Pediatr Allergy Immunol. 2014; 25(1): 36–42.
- Cantarutti A, Donà D, Visentin F, Borgia E, Scamarcia A, Cantarutti L, et al. Epidemiology of Frequently Occurring Skin Diseases in Italian Children from 2006 to 2012: A Retrospective, Population-Based Study.Pediatr Dermatol. 2015 Sep-Oct;32(5):668-78. doi: 10.1111/pde.12568.
- Cardona ID, Goleva E, Ou LS, Leung DY. Staphylococcal enterotoxin B inhibits regulatory T-cells by inducing glucocorticoid-induced TNF receptor-related protein ligand on monocytes. Allergy Clin. Immunol. 2006; 117: 688-695.
- Carréra MC, Moura P, Crovella S, et al. High polymorphism of the MBL2 gene in patients with atopic dermatitis. Allergy Asthma Immunol. 2010; 105(1): 39–42.
- Cedzynski M, Szemraj J, Swierzko AS, et al. Mannan-binding lectin insufficiency in children with recurrent infections of the respiratory system. Exp. Immunol. 2004; 136: 304–311.
- Chen J, Xu Z, Ou X, et al. Mannose-binding lectin polymorphisms and recurrent respiratory tract infection in Chinese children. J. Pediatr. 2009; 168: 1305–1313.
- Critically Important Antimicrobials for Human Medicine. 4th Revision 2013. WHO Library Cataloguing-in-Publication Data. WHO, 2016, 32 р.
- Dharmage SC, Lowe AJ, Matheson MC, et al. Atopic dermatitis and the atopic march revisited. 2014; 69: 17–27.
- Elias P, Steinhoff M. Outside to Inside (and now back to «outside») pathogenic mechanisms in atopic dermatitis. Invest. Dermatol. 2008; 128 (5): 1067–1070.
- Frakking FN, Brouwer N, van Eijkelenburg NK, et al. Low mannose-binding lectin (MBL) levels in neonates with pneumonia and sepsis. Exp. Immunol. 2007; 150: 255-262.
- Galdeano CM, Perdigton G. The probiotic bacterium Lactobacillus casei induces activation of the gut mucosal immune system through innate immunity. Vacc. Immunol. 2006; 13: 219–226.
- Gallo LR, Nakatsuji T. Microbial symbiosis with the innate immune defense system of the skin. J Investigative Dermatology. 2011; 131: 1974–1980; doi:10.1038/ jid.2011.182.
- Gao PS, Rafaels NM, Hand T et al. Filaggrin mutations that confer risk of atopic dermatitis confer greater risk for eczema herpeticum. Allergy Clin. Immunol. 2009; 24 (3): 507–513.
- Garzoni C, Kelley WL. Staphylococcus aureus: new evidence for intracellular persistence. Trends Microbiol. 2009; 17: 59-65.
- Grissell TV, Chang AB, Gibson PG. Reduced toll-like receptor 4 and substance P gene expression is associated with airway bacterial colonization in children. Pulmonol. 2007; 42: 380–385.
- Guarner F, Sanders ME, Eliakim R, Fedorak R, Gangl A, Garisch J, et al. Probiotics and prebiotics. World Gastroenterology Organisation Global Guidelines. February 2017. Abailable on: http://www.worldgastroenterology.org/ UserFiles/ file/ guidelines/probiotics-and-prebiotics-russian-2017.pdf.
- Haldar P, Brightling CE, Hargadon B, Gupta S, Monteiro W, Sousa A et al. Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med 2009;360:973–984.
- Harrop J, Chinn S, Verlato G. et al. Eczema, atopy and allergen exposure in adults: a population-based study. Exp Allergy. 2007; 37(4): 526-535.
- Heratizadeh A. Atopic dermatitis: new evidence on the role of allergic inflammation. Curr Opin Allergy Clin Immunol. 2016, Aug 4. [Epub ahead of print]. DOI: 1097/ACI.0000000000000308.
- Hoffjan S, Stemmler S. Unravelling the complex genetic background of atopic dermatitis: from genetic association results towards novel therapeutic strategies. Arch Dermatol Res. 2011; 30(8): 659-370. DOI: 10.1007/s00403-015-1550-6.
- Hotze M, Baurecht H, Rodrіguez E, Chapman Rothe N, Ollert M, Folster-Holst R, et al. Increased efficacy of omalizumab in atopic dermatitis patients with wild-type filaggrin status and higher serum levels of phosphatidylcholines. Allergy 2014;69:132– 135.
- Islander U, Andersson A, Lindberg E, Adlerberth I, Wold AE, Rudin A. Superantigenic Staphylococcus aureus Stimulates Production of Interleukin-17 from Memory but Not Naive T Cells. Infection and immunity. 2010; 78(1): 381–386 doi:10.1128/IAI.00724-09.
- Iwase T, Uehara Y, Shinji H. et al. Staphylococcus epidermidis Esp inhibits Staphylococcus aureus biofilm formation and nasal colonization. 2010; 465: 346–349.
- Janssens , van Smeden J, Gooris GS. et al. Lamellar lipid organization and ceramide composition in the stratum corneum of patients with atopic eczema. Nat. Genet. 2011; 44 (2): 207–214.
- Johannessen M, Sollid J-E, Hanssen A-M. Host and microbe determinants that may influence the success of S. aureus colonization. Cell. Inf. Microbiol. 2012; 2: 56. doi: 10.3389/fcimb.2012.00056.
- Johnson CM, Lyle EA, Omueti KO, Stepensky VA, Yegin O, Alpsoy E, Hamann L, Schumann RR, Tapping RI. Cutting edge: A common polymorphism impairs cell surface trafficking and functional responses of TLR1 but protects against leprosy. J Immunol. 2007; 178:7520–7524.
- Kanto R, Thysen JP, Pallr AS, Silverbrg JI. Atopic dermatitis, atopic eczema, or eczema? A systematic review, meta-analysis, and recommendation for uniform use of ‘atopic dermatitis. 2016. doi: 10.1111/all.12982.
- Karppinen S, Vuononvirta J, He Q, et al. Effect of rhinovirus infection on nazopharyngeal bacterial colonization in infant with wild or variant types of mannose-bilding lectin and tool-like receptors 3 and 4. J Pediatric Infect Dis Soc. 2013; 2(3): 240-24 doi: 10.1093/jpids/pit025.
- Kedzierska A, Kapińska-Mrowiecka M, Czubak-Macugowska M [et al.] Susceptibility testing and resistance phenotype detection in Staphylococcus aureus strains isolated from patients with atopic dermatitis, with apparent and recurrent skin colonization. J. Dermatol. 2008; 159 (6): 1290–1299.
- Kilpatrick DC. Mannan-binding lectin and its role in innate immunity. Med. 2002; 12: 335–352.
- Kim K. Influences of Environmental Chemicals on Atopic Dermatitis. Toxicol. Res. 2015; 31(2): 89– doi: 10.5487/TR.2015.31.2.089.
- Kim KH. Overview of atopic dermatitis. Asia Allergy. 2013; 3: 79-87.
- Koch A, Melbye M, Sorensen P et al. Acute respiratory tract infections and mannose-binding lectin insufficiency during early childhood. 2001; 285: 1316–1321.
- Korn T, Bettelli E, Oukka M, Kuchroo VK. IL-17 and Th17 Cells. Rev. Immunol. 2009; 27: 485-517.
- Kutasevich Y, Dzhoraeva S, Goncharenko V, Mangusheva V, Sherbakova Y, Sobol N, Shegoleva H. Research of certain pathogenic characteristics of clinical isolates of staphylococcus of skin biome. EURECA: Нealth Science. 2018; 2: 24–
- Lai Y, Cogen AL, Radek KA, et al. Activation of TLR2 by a small molecule produced by epidermidis increases antimicrobial defense against bacterial skin infections. J. Invest. Dermatol. 2010; 130: 2211–2221.
- Lai Y, Di Nardo A, Nakatsuji T, Leichtle A, Yang Y, et al. Commensal bacteria regulate Toll-like receptor 3-dependent inflammation after skin injury. Med. 2009; 15: 1377–1382. doi:10.1038/nm.2062.
- Lee J, Noh G, Lee S, Youn Y, Rhim J. Atopic dermatitis and cytokines: recent patents in immunoregulatory and therapeutic implications of cytokines in atopic dermatitis–part I: cytokines in atopic dermatitisRecent Pat Inflamm. Allergy Drug Discov. 2012; 6(3): 222-247. PMID: 22827753.
- Leung AD, Schiltz AM, Hall CF, Liu AH. Severe atopic dermatitis is associated with a high burden of environmental Staphylococcus aureus. Exp. Allergy. 2008; 38: 789–793.
- Liang Y, Chang C, Lu The genetics and epigenetics of atopic dermatitis-filaggrin and other polymorphisms. Clin. Rev. Allergy Immunol. 2015. DOI: 10.1007/s12016-015-8508-5.
- Lorenz E, Mira JP, Frees KL, Schwartz DA. Relevance of mutations in the TLR4 receptor in patients with gram-negative septic shock. Intern. Med. 2002; 162: 1028–1032.
- Madhok V, Futamura M, Thomas K S, Barbarot S. What’s new in atopic eczema? An analysis of systematic reviews published in 2012 and 2013. Part 1. Epidemiology, mechanisms of disease and methodological issues. Clin Exp Dermatol. 2015; 40 (3): 238–242.
- Madhok V, Futamura M, Thomas KS, Barbarot S. What’s new in atopic eczema? An analysis of systematic reviews published in 2012 and 2013. Part 2. Treatment and prevention. Clin Exp Dermatol. 2015; 40 (4): 349–54.
- Magiorakos AP, Svinivasan A, Carey RB, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Microbiol. Infect. 2012; 18: 268-281.
- Mancini AJ, Kaulback K, Chamlin SL. The socioeconomic impact of atopic dermatitis in the United States: a systematic review. Pediatr Dermatol. 2008; 25 (1): 1–
- Manti S, Chimenz R, Salpietro A, Colavita L, Pennisi P, Pidone C, Sturiale M, et al. Atopic dermatitis: expression of immunological imbalance. Biol. Regul. Homeost. Agents. 2015; 29(2) Suppl 1: 13-17.
- Mijouin L, Hillion M, Ramdani Y, Jaouen T, Duclairoir-Poc C, Follet-Gueye M-L, et al. Effects of a Skin Neuropeptide (Substance P) on Cutaneous Microflora. PLoS ONE.. 2013; 8(11): e78773. doi:10.1371/journal.pone.0078773.
- Mrowietz U, Klein CE, Reich K, Rosenbach T, Ruzicka T, Sebastian M et al. Cyclosporine therapy in dermatology. J Dtsch Dermatol Ges 2009;7:474–479.
- Novak N, Thaci D, Hoffmann M, Folster Holst R, Biedermann T, Homey B et al. Subcutaneous immunotherapy with a depigmented polymerized birch pollen extract–a new therapeutic option for patients with atopic dermatitis. Int Arch Allergy Immunol 2011;155: 252–256.
- Nutten S Atopic dermatitis: global epidemiology and risk factors. Nutr. Metab. 2015; 66 (suppl. 1): 8–16.
- Ortega-Loayza AG, Diamantis SA, Gilligan P, Morrell DS. Characterization of Staphylococcus aureus cutaneous infections in a pediatric dermatology tertiary health care outpatient facility. Am. Acad. Dermatol. 2010; 62 (5): 804–811.
- Paternoster L, Standl M, Chen CM, et al. Meta-analysis of genome-wide association studies identifies three new risk loci for atopic dermatitis. Genet. 2011; 44 (2): 187–192.
- Ranjith-Kumar CT, Miller C, Sun J. et al. Effects of single nucleotide polymorphisms on toll-like receptor 3 activity and expression in cultured cells. Biol. Chem. 2007; 282 (17): 696–705.
- Rippke F, Schreiner V, Doering T, et al. Stratum corneum pH in atopic dermatitis: impact on skin barrier function and colonization with Staphylococcus aureus. J. Clin. Dermatol. 2004; 5 (4): 217–223.
- Sanchez-Ramon S, Eguluz-Gracia I, Rodrіguez-Mazariego ME, Paravisini A, Zubeldia-Ortuno JM, Gil-Herrera J et al. Sequential combined therapy with omalizumab and rituximab: a new approach to severe atopic dermatitis. J Investig Allergol Clin Immunol 2013; 23: 190–196.
- Schauber J, Gallo RL. Antimicrobial peptides and the skin immune defense system. Allergy Clin. Immunol. 2008; 122: 261–266.
- Scholz F, Badgley BD, Sadowsky MJ, Kaplan DH. Immune Mediated Shaping of Microflora Community Composition Depends on Barrier Site. PLOS ONE. 2014; 9(1): e84019. | plosone.org.
- Schroder NW, Schumann RR. Single nucleotide polymorphisms of toll-like receptors and susceptibility to infectious disease. Lancet Infect. Dis. 2005; 5: 156–164.
- Seite S, Bieber T. Barrier function and microbiotic dysbiosis in atopic dermatitis. Clinical, Cosmetic and Investigational Dermatology. 2015; 8: 479–483.
- Simanski M, Harder J, Rademacher F. RNase 7 in Cutaneous Defense. J. Mol. Sci. 2016; 17, art. 560. doi:10.3390/ijms17040560.
- Simon D, Bieber Systemic therapy for atopic dermatitis. Allergy. 2014; 69: 46–55.
- Simon D. Systemic therapy of atopic dermatitis in children and adults. Curr Probl Dermatol 2011;41:156–164.
- Simpson CR, Newton J, Hippisley-Cox J, Sheikh A. Trends in the epidemiology and prescribing of medication for eczema in England. R. Soc. Med. 2009; 102(3): 108–117.
- Sugita T, Suto H, Unno T, et al. Molecular Analysis of Malassezia Microflora on the Skin of Atopic Dermatitis Patients and Healthy Subjects. J Сlin 2001; 39(10): 3486–3490.
- Suh L, Coffin S, Leckerman KH, et al. Methicillin-resistant Staphylococcus aureus colonization in children with atopic dermatitis. Dermatol. 2008; 25: 528–534.
- Sybilski AJ, Raciborski F, Lipiec A, et al. Atopic dermatitis is a serious health problem in Poland. Epidemiology studies based on the ECAP study. Postep Derm Alergol. 2015; XXXII(1): 1–10.
- Tlaskalová-Hogenová H, Stepánková R, Hudcovic T et al. Commensal bacteria (normal microflora), mucosal immunity and chronic inflammatory and autoimmune diseases. Lett. 2004; 93(2-3): 97–108.
- Tokura Y, Mori T, Hino Psoriasis and other Th17-mediated skin diseases. J UOEH. 2010; 32(4): 317-328.
- Toledo F, Silvestre JF, Munoz C. Combined therapy with low-dose omalizumab and intravenous immunoglobulin for severe atopic dermatitis. Report of four cases. J Eur Acad Dermatol Venereol 2012;26:1325–132.
- Torres D, Dieudonne A, Ryffel B. et al. Double-stranded RNA exacerbates pulmonary allergic reaction through TLR3: implication of airway epithelium and dendritic cells. Immunol. 2010; 185: 451–459.
- Trejo-de la OA, Hernández-Sancén P, Maldonado-Bernal C. Relevance of single-nucleotide polymorphisms in human TLR genes to infectious and inflammatory diseases and cancer. Genes Immun. 2014; 15(4): 199-209. DOI: 1038/gene.2014.10.
- Vuononvirta J, Koponen P, Helminen M, Korppi M. Toll-like receptor 3 L412F polymorphisms in infants with bronchiolitis and post-bronchiolitis wheezing. Infect. Dis. J. 2012; 31: 920–3.
- Vuononvirta J, Toivonen L, Gröndahl-Yli-Hannuksela K, et al. Nasopharyngeal bacterial colonization and gene polymorphisms of mannose-binding lectin and toll-like receptors 2 and 4 in infants. PLoS One. 2011; 6: e26198. doi: 10.1371/journal. pone.0026198.
- Wanke I, Steffen H, Christ C, et al. Skin commensals amplify the innate immune response to pathogens by activation of distinct signaling pathways. J Invest Dermatol. 2011; ;131(2): 382-390. doi: 10.1038/jid.2010.328.
- Weldon D. Quality of life in patients with urticaria and angioedema: assessing burden of disease. Allergy Asthma Proc. 2014 ; 35(1): 4–9.
- Werfel T, Allam JP, Biedermann T et Cellular and molecular immunologic mechanisms in patients with atopic dermatitis. J. Allergy Clin. Immunol. 2016; 138(2): 336-349. doi: 10.1016/j.jaci.2016.06.010 PMID:27497276.
- Wiertsema SP, Herpers BL, Veenhoven RH. [et al.] Functional polymorphisms in the mannan-binding lectin 2 gene: effect on MBL levels and otitis media. Allergy Clin. Immunol. 2006; 117: 1344–1350.
- Yim SM, Kim JY, Ko JH, et al. Molecular Analysis of Malassezia Microflora on the Skin of the Patients with Atopic Dermatitis. Dermatol. 2010; 22(1): 41–47.
- Zeeuwen PL, de Jongh GJ, Rodijk-Olthuis D. et al. Genetically Programmed Differences in Epidermal Host Defense between Psoriasis and Atopic Dermatitis Patients. PLoS ONE. 2008; 3 (6): 1-8.
- Zuberbier T, Balke M, Worm M et al. Epidemiology of urticaria: a representative cross-sectional population survey. Exp. Dermatol. 2010; 35(8): 869–873.
ДОДАТОК А
АКТИ ВПРОВАДЖЕННЯ
ДОДАТОК Б
СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА ЗА ТЕМОЮ ДИСЕРТАЦІЇ
ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ РЕЗУЛЬТАТІВ ДИСЕРТАЦІЇ
Список праць, опублікованих за темою дисертації:
- Корекція мікробіоценозу кишечника методом ступінчастої елімінаційної терапії у хворих на алергодерматози / Я.Ф. Кутасевич, І.О. Олійник, С.К. Джораєва, В.Ю. Мангушева. Медицина сьогодні і завтра. 2017. № 3-4 (76-77). С. 109–115.
- Диференційований підхід до діагностики та зовнішньої терапії екземи / Я.Ф.Кутасевич, К.Є. Іщейкін, І.В. Зюбан, В.Ю. Мангушева. Дерматологія та венерологія. 2018. № 1 (79). С. 50–55.
- Кутасевич Я.Ф., Джораева С.К., Мангушева В.Ю. Исследование состава микробиоты кожи и анализ ее антибиотикорезистентности у больных аллергодерматозами. Експериментальна і клінічна медицина. 2018. № 1 (78). С. 101–107.
- Особливості клінічних проявів атопічного дерматиту у пацієнтів з мутацією 2282del14 в гені філагрину / К.Є. Іщейкін, І.О. Олійник, С.К. Джораєва, І.В. Зюбан, В.Ю. Мангушева. Дерматологія та венерологія. 2018. № 2 (80). С. 19–25.
- Мангушева В.Ю. Дослідження вмісту інтерлейкину-17А у хворих на алергодерматози. Дерматологія та венерологія. 2018. № 3 (81). С. 17–21.
- Кутасевич Я.Ф., Білозоров О.П., Мангушева В.Ю. Дослідження поліморфізму гену тол-подібного рецептору 1 TLR-1-I602S у хворих на алергодерматози. Art of Medicine. 2018. Т. 3, № 7. С. 63–65.
- Кутасевич Я.Ф., Мангушева В.Ю. Оптимизация наружной терапии больных экземой. World Science. 2017. 4, Іss. 11 (27): С. 33–37.
- Research of certain pathogenic characteristics of clinical isolates of staphylococcus of skin biome / Y. Kutasevych, S. Dzhoraeva, V. Goncharenko, V. Mangusheva, Y. Sherbakova, N. Sobol, H. Shegoleva. EURECA: Нealth Science. 2018. № 2. С. 23–
- Пат. на корисну модель № 120805 UA, МПК A61K45/08, A61P17/00, A61P37/08. Спосіб лікування хворих на алергодерматози з порушенням мікробіоценозу кишечнику / Я.Ф. Кутасевич, І.О. Олійник, С.К. Джораєва, В.Ю. Мангушева. № u201701825; заявл. 27.02.17; опубл. 27.11.17, Бюл. № 22.
- Эффективность эфферентной терапии больных в лечении хронической экземы / Я.Ф. Кутасевич, И.А. Олейник, И.А. Маштакова, Р.К. Попова, В.Ю. Мангушева. Збірник робіт за матеріалами науково-практичної конференції «Дерматовенерологія в розробках молодих науковців», 19-20 листопада 2015 року, м. Київ. Дерматовенерологія. Косметологія. Сексопатологія. 2015. № 3–4 (2). С. 118–119.
- Кутасевич Я.Ф., Олійник І.О., Мангушева В.Ю. Східчаста ентеросорбція в лікуванні хворих на поширені алергодерматози. Збірник робіт по матеріалам науково-практичної конференції «Сімейна медицина. Перспективи та шляхи подальшого розвитку». м. Львів, 13-15 квітня 2016 р. Львів, 2016. С. 84.
- Особливості складу ценозів кишечника та шкіри у хворих на алергодерматози / Я.Ф. Кутасевич, І.О. Маштакова, С.К. Джораєва, В.Ю. Мангушева. Матеріали V ювілейного міжнар. мед. конгресу «Впровадження сучасних досягнень медичної науки у практику охорони здоров’я України», м. Київ, 19–21 квітня 2016 р. К., 2016. С. 84.
- Мангушева В.Ю. Аналіз супутньої соматичної патології у хворих на хронічну екзему. Збірник робіт по матеріалам наук.-практ. конф. «Інноваційні досягнення в діагностиці інфекцій, що передаються статевим шляхом, інфекційних і грибкових захворювань та поширених дерматозів. Прогрес у лікуванні» VI міжнародного медичного конгресу, м. Київ, 25–27 квітня 2017 р. К., 2017, С. 163.
- Мангушева В.Ю., Джораева С.Н., Супрун К.Г. Особенности видового состава биотопа кожи у больных распространенными аллергодерматозами. Матеріали наук.-практ. конф. з участю міжнар. спеціалістів, присвяченого дню науки «Медична наука на перетині спеціальностей: сьогодення і майбутнє», м. Харків, 19 травня 2017 р. Харків, 2017. С. 71.
- Мангушева В.Ю. Особенности клинических проявлений микробной экземы в области нижних конечностей. Матеріали науково-практичної конференції з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», м. Харків, 10–11 листопада 2017 р. Дерматологія та венерологія. 2017. № 3 (77). С. 107.
- Мангушева В.Ю., Зюбан И.В. Особенности клинических проявлений атопического дерматита у пациентов с мутациями гена филаггрина. Наук.-практ. конф. молодих вчених, присвячена 25-рiччю Національної академії медичних наук України. Журнал Національної академії медичних наук України. 2018. Спеціальний випуск. С. 60.
Відомості про апробацію результатів дисертації:
- Науково-практична конференція з міжнародною участю «Інноваційні технології в дерматовенерології. Міждисциплінарні зв’язки», м. Харків, 13 листопада 2015 р., усна доповідь: Мангушева В.Ю., Олійник І.О. «Переваги етапної сорбційної терапії хворих на алергодерматози».
- Науково-практична конференція «Новітні технологій діагностичних, лікувальних та профілактичних заходів в дерматовенерології та методи і стан їхнього впровадження», м. Харків, 11-12 листопада 2016 р., усна доповідь: Мангушева В.Ю. «Роль нарушений биоценоза в патогенезе алергодерматозов».
- Науково-практична конференція молодих вчених дерматовенерологів «Розробки молодих вчених в сучасній дерматовенерології», м Харків, 9 грудня 2016 р., усна доповідь: Мангушева В.Ю. «Динамічність мікробіоти шкіри та верхніх дихальних шляхів у хворих на алергодерматози».
- Науково-практична конференція «Стан та основні організаційні задачі дерматовенерологічної служби на сучасному етапі в Україні» V ювілейного міжнародного медичного конгресу «Впровадження сучасних досягнень медичної науки у практику охорони здоров’я», м. Київ, 19–21 квітня 2016 р., усна доповідь: Кутасевич Я.Ф., Олійник І.О., Мангушева В.Ю. «Ступінчаста ентеросорбція в комплексному лікуванні алергодерматозів».
- Науково-практична конференція «Інноваційні досягнення в діагностиці інфекцій, що передаються статевим шляхом, інфекційних і грибкових захворювань та поширених дерматозів. Прогрес у лікуванні» VI міжнародного медичного конгресу «Впровадження сучасних досягнень медичної науки у практику охорони здоров’я», м. Київ, 25–27 квітня 2017 р., усна доповідь: Мангушева В.Ю. «Стан мікрофлори шкіри та верхніх дихальних шляхів у хворих на екзему».
- Науково-практична конференція з участю міжнародних спеціалістів присвячених Дню науки «Медична наука на перетині спеціальностей: сьогодення та майбутнє», м. Харків, 19 травня 2017 р., усна доповідь: Мангушева В.Ю. «Особенности видового состава биотопа кожи у больных распространенными аллергодерматозами».
- Науково-практична конференція з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом», м. Харків, 10–11 листопада 2017 р., усна доповідь: Мангушева В.Ю. «Диференційований підхід до діагностики та місцевої терапії екземи».
- Науково-практична конференція молодих вчених інституту з міжнародною участю, присвячена 25 річниці від дня заснування НАМН України «Новітні впровадження молодих вчених в сучасній дерматовенерології», м. Харків, 7 лютого 2018 р., усна доповідь: Мангушева В.Ю. «Переваги етапної зовнішньої терапії у хворих на екзему».
- Науково-практична конференцiя молодих вчених Національної академії медичних наук України, присвячена 25-рiччю Нацiональної академії медичних наук України, м. Київ, 23 березня 2018 р., усна доповідь: Мангушева В.Ю., Зюбан І.В. «Особенности клинических проявлений атопического дерматита у пациентов с мутациями гена филаггрина».