Державна установа
«Інститут дерматології та венерології НАМН України»
На правах рукопису
ГАВРИЛЮК ОЛЕКСАНДРА АНАТОЛІЇВНА
УДК 616.517-036.17-008.9-092-085
ОПТИМІЗАЦІЯ КОМПЛЕКСНОЇ ТЕРАПІЇ ХВОРИХ НА ТЯЖКІ ФОРМИ ПСОРІАЗУ З УРАХУВАННЯМ ПОКАЗНИКІВ РЕГУЛЯЦІЇ ЗАПАЛЕННЯ
14.01.20 – шкірні та венеричні хвороби
Дисертація на здобуття наукового ступеня
кандидата медичних наук
Науковий керівник:
Олійник Ірина Олександрівна,
доктор медичних наук,
старший науковий співробітник
Харків – 2016
ЗМІСТ
| Перелік умовних позначень | 4 |
| Вступ | 5 |
| Розділ 1 Огляд літератури | 10 |
| 1.1 Сучасні аспекти патогенезу псоріазу: імунопатогенез, хронічне системне запалення, ремоделювання кісткової тканини |
10 |
| 1.2 Сучасні діагностичні можливості виявлення порушень опорно-рухового апарату при псоріазі |
26 |
| 1.3 Сучасні методи лікування тяжких форм псоріазу | 28 |
| Розділ 2 Матеріали та методи дослідження | 36 |
| 2.1 Методика загального обстеження хворих | 36 |
| 2.2 Біохімічні методи | 41 |
| 2.3 Імуноферментні дослідження | 42 |
| 2.4 Інструментальне обстеження | 43 |
| 2.5 Статистичні методи дослідження | 45 |
| Розділ 3 Клінічна характеристика хворих на різні клінічні форми псоріазу | 46 |
| Розділ 4 Імунологічні та біохімічні порушення у хворих на різні клінічні форми псоріазу | 65 |
| 4.1 Характеристика цитокінового статусу хворих на псоріаз залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому | 65 |
| 4.2 Рівень епідермального фактора росту в сироватці крові хворих на псоріаз та його клініко-патогенетичне значення | 76 |
| 4.3 Динаміка високочутливого С-реактивного білка у сироватці крові хворих на псоріаз залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому | 82 |
| 4.4 Інтенсивність продукції оксиду азоту в сироватці крові хворих на псоріаз залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому | 87 |
| 4.5 Аналіз динаміки окремих біохімічних маркерів сполучнотканинного обміну в сироватці крові хворих на псоріаз залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому | 92 |
| 4.6 Дослідження окремих показників згортальної системи крові у хворих на псоріаз залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому | 97 |
| Розділ 5 Характеристика стану суглобів у хворих на артропатичний псоріаз за методом дистанційної термографії | 106 |
| 5.1 Аналіз стану активності запальних проявів у суглобах за методом дистанційної термографії | 107 |
| 5.2 Розробка методу діагностики активності артропатичного псоріазу | 113 |
| Розділ 6 Розробка комплексного методу лікування хворих на тяжкі форми псоріазу з урахуванням виявлених особливостей показників регуляції запалення | 116 |
| 6.1 Обґрунтування застосування у хворих на тяжкі форми псоріазу в комплексній терапії засобу, що покращує мікроциркуляцію та хондропротектору | 116 |
| 6.2 Терапевтична ефективність розробленного комплексного методу лікування хворих на тяжкі форми псоріазу | 120 |
| 6.3 Динаміка лабораторних показників у хворих на тяжкі форми псоріазу при застосуванні розробленного комплексного методу лікування | 127 |
| Розділ 7 Обговорення результатів дослідження | 139 |
| Висновки | 154 |
| Рекомендації | 157 |
| Список використаних джерел | 158 |
| Додаток А Акти впровадження | 187 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
АП – артропатичний псоріаз
АЧТЧ – активований частковий тромбопластиновий час
ВАШ – візуально-аналогова шкала
ГП – глікопротеїни
ІДТ – інфрачервона дистанційна термографія
ІЛ – інтерлейкін
КСА – кістково-суглобовий апарат
ЛЕФ – лефлуномід
МТ – метотрексат
ПА – псоріатичний артрит
ПТІ – протромбіновий індекс
РФМК – розчинні фібрин-мономерні комплекси
СК – сіалові кислоти
СМП – симптомомодифікуючі препарати
СРБвч – С-реактивний білок високочутливий
ХМП – хворобомодифікуючі препарати
BSA – Body Surface Area (площа поверхні тіла)
DLQI – дерматологічний індекс якості життя
EGF – епідермальний фактор росту
INFγ – гамма-інтерферон
iNOS – індуцибельна
NO-синтаза
NOS – NO-синтаза
NO2– – нітрит-аніонNO3– – нітрат-аніон
PASI – Psoriasis Area and Severity Index (індекс розповсюдженності і тяжкості псоріазу)
TNFα – фактор некрозу пухлин – α
ВСТУП
Актуальність теми. Псоріаз – один з найбільш поширених хронічних дерматозів з невизначеною етіологією, посідає одне з провідних місць серед актуальних проблем сучасної дерматології. Пильний інтерес до псоріазу викликаний не тільки високою питомою вагою (12-15 %) серед інших дерматозів, але і збільшенням випадків тяжких форм захворювання, резистентних до терапії, які нерідко призводять до інвалідизації [10, 15, 19, 49, 91, 102, 107, 131, 132, 217, 223].
Незважаючи на наявність чисельних робіт, присвячених псоріазу, патогенетичні чинники даної хвороби на теперішній час залишаються недостатньо з’ясованими. Потребує поглибленого вивчення цитокіновий статус, система оксида азоту, окремі показники згортальної системи крові у хворих на псоріаз, тому що результати багатьох досліджень, проведених у цьому напрямку, є суперечливими. Актуальними залишаються питання діагностики ступеня тяжкості дерматозу та активності суглобового синдрому, що є необхідним для призначення адекватної терапії [81, 91, 131, 132].
Існуючі методи лікування на даний час є недостатньо ефективними, мало впливають на прогресуюче обтяження процесу та часто супроводжуються небажаними побічними явищами [29, 84, 103, 131, 132, 212, 245]. Тому практично значущим є розробка комплексних лікувальних методів з використанням препаратів, які мають протизапальний, імуносупресивний ефекти, а також засобів, що знижують можливість розвитку побічних явищ і ускладнень.
Таким чином, узагальнення результатів комплексного аналізу основних даних клінічних, біохімічних, імунологічних, інструментальних, статистичних досліджень дозволить уточнити деякі ланки патогенезу, виділити діагностично значущі критерії, обґрунтувати лікувальні заходи.
Зв’язок роботи з науковими програмами, планами, темами. Дослідження є фрагментом науково-дослідної роботи Державної установи «Інститут дерматології та венерології НАМН України» «Вивчити клініко‑біохімічні та імунологічні аспекти тяжких форм псоріазу та розробити комплексні методи лікування» (№ держреєстрації 0115U000579). Дисертантом виконано фрагменти, присвячені вивченню показників регуляції запалення у хворих на псоріаз залежно від ступеня тяжкості дерматозу та активності суглобового синдрому, аналізу стану запальних проявів у суглобах за методом дистанційної термографії (ДТ), розроблено комплексний метод терапії хворих на тяжкі форми псоріазу.
Мета і задачі дослідження. Мета – підвищення ефективності лікування хворих на тяжкі форми псоріазу шляхом розробки комплексного методу терапії на підставі вивчення показників регуляції запалення.
Для досягнення поставленої мети дослідження визначено наступні завдання:
1. Вивчити клінічні прояви тяжких форм псоріазу на сучасному етапі.
2. Визначити вміст інтерлейкіну (ІЛ) 1β, ІЛ-10 та високочутливого С‑реактивного білка (СРБвч) у сироватці крові хворих на різні клінічні форми псоріазу залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому.
3. Дослідити рівень епідермального фактору росту (EGF) в сироватці крові хворих на різні клінічні форми псоріазу в динаміці спостереження.
4. Проаналізувати вміст нітрит-аніону (NO2–), сіалових кислот (СК), глікопротеїнів (ГП) та окремих показників згортальної системи крові у хворих на різні клінічні форми псоріазу залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому і встановити взаємозв’язок NO2– з окремими ланками системи згортання крові.
5. Оцінити стан активності запальних проявів у суглобах та периартикулярних тканинах у хворих на артропатичний псоріаз (АП) за тепловізійною картиною.
6. Розробити комплексний метод терапії хворих на тяжкі форми псоріазу на підставі отриманих результатів досліджень.
Об’єкт дослідження – тяжкі форми псоріазу (псоріатична еритродермія, пустульозний, ексудативний та артропатичний псоріаз).
Предмет дослідження – клінічні, імунологічні, біохімічні особливості різних форм псоріазу, резорбція кісткової тканини, діагностика та результати терапії.
Методи дослідження: клінічні, біохімічні, імунологічні, інструментальні, статистичні.
Наукова новизна отриманих результатів. Дисертантом вперше за допомогою показано залежність рівня EGF у сироватці крові хворих на АП від активності уражень кістково-суглобового апарату (КСА), що характеризується зростанням вмісту EGF в 1,13-1,29 разу з ростом ступеня активності суглобового синдрому та вказує не тільки на гіперпроліферацію кератиноцитів, а й резорбцію кісткової тканини.
Вперше за допомогою сучасного методу ДТ встановлено субклінічне запалення в суглобах пацієнтів з псоріазом, що характеризується значенням температурного градієнту в межах 0,6-1,8 0С.
Розширено наукові дані про те, що у хворих на АП з переважанням запальних проявів у сполучній тканині рівні ІЛ-1β та NO2– в сироватці крові перевищують в 1,52 і 1,22 разу відповідно такі у пацієнтів з дегенеративно-дистрофічними змінами в суглобах.
Доповнено наукові дані про наявність регулюючого впливу NO2– на коагуляційну ланку згортальної системи крові та систему фібринолізу при псоріазі, що підтверджується існуванням двосторонніх кореляційних зв’язків NO2– з РФМК (r=0,56) і фібриногеном (r=0,37).
Практичне значення одержаних результатів. Розроблено та впроваджено в практику спосіб ранньої діагностики доклінічного запалення при АП та ступеня запальних проявів у процесі саногенезу з використанням дистанційної термографії (температурний градієнт 0,6-1,8 0С відповідає субклінічному запаленню, 1,9-2,6 0С – I ступеню активності, 2,61-3,5 0С – II, 3,52-6,44 0С – III) (Патент України на корисну модель № 103787 від 25.12.2015).
Розроблено алгоритм обстеження хворих на псоріаз для оцінки тяжкості дерматозу, активності суглобового синдрому та прогнозу перебігу захворювання.
Розроблено метод лікування хворих на тяжкі форми псоріазу, який полягає в застосуванні на фоні базової терапії (метотрексат [МТ] або лефлуномід [ЛЕФ]) препарату L-аргініну, що покращує мікроциркуляцію, по 100 мл внутрішньовенно краплинно 1 раз на добу 5 днів поспіль, потім по 10 мл 3 рази на день внутрішньо протягом 20 днів і хворим з наявністю уражень КСА – хондропротектору глюкозаміну сульфату по 400 мг (3,0 мл) внутрішньом’язово через день курсом 20 ін’єкцій протягом 40 днів, що дає змогу підвищити ефективність терапії (на 81,82 % і 65,0 % відповідно).
Результати роботи впроваджено в практику Державної установи «Інститут дерматології та венерології НАМН України», Київської міської клінічної шкірно-венерологічної лікарні, Комунального закладу охорони здоров’я «Обласний клінічний шкірно-венерологічний диспансер № 1» (м. Харків), Комунальної установи «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради, Полтавського обласного клінічного шкірно-венерологічного диспансеру, Кременчуцького обласного шкірно-венерологічного диспансеру, що підтверджується актами впровадження.
Особистий внесок здобувача. Дисертантом разом з керівником обрано тему, сформульовано мету, задачі роботи та напрямки проведення досліджень. Автором особисто проведено патентно-інформаційний пошук, аналіз наукових публікацій за темою дисертації. Здобувачем проведено клінічне обстеження та відбір пацієнтів для проведення досліджень, лікування хворих на тяжкі форми псоріазу. Усі дослідження проведені при безпосередній участі дисертанта. Самостійно зроблено статистичну обробку та узагальнення отриманих результатів, написано всі розділи дисертації, спільно з науковим керівником сформульовано висновки, підготовлено патент на корисну модель та наукові праці до друку.
Здобувачем спільно з П.М. Замятіним, К.В. Дубровським, співробітниками Державної установи «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України», проведено дослідження стану активності запальних проявів у суглобах за методом ДТ у хворих на АП. Дисертантом не були запозичені результати та ідеї співавторів публікацій.
Апробація результатів дисертації. Матеріали дисертаційної роботи оприлюднено та обговорено на науково-практичній школі «Молоді науковці – майбутнє української дерматовенерології» (Київ, 2014), науково-практичній конференції «Сучасні технології: діагностика, лікування та профілактика дерматовенерологічних захворювань» в рамках ІІІ Міжнародного медичного конгресу «Впровадження сучасних досягнень медичної науки в практику охорони здоров’я України» (Київ, 2014), науково-практичній конференції з міжнародною участю «Міжнародна інтеграція і наукові здобутки української дерматовенерології» (Харків, 2015), науково-практичній конференції «Нові організаційні та діагностично-лікувальні технології в дерматовенерологічній практиці» в рамках ІV Міжнародного медичного конгресу «Впровадження сучасних досягнень медичної науки у практику охорони здоров’я України» (Київ, 2015), 24 Конгресі Європейської академії дерматології та венерології (Копенгаген, 2015), науково-практичній конференції «Спадкові та екологічні чинники в дерматовенерології» (Київ, 2016), науково-практичній конференції «Стан та основні організаційні задачі дерматовенерологічної служби на сучасному етапі в Україні» в рамках V Ювілейного міжнародного медичного конгресу «Впровадження сучасних досягнень медичної науки у практику охорони здоров’я України» (Київ, 2016), 13 весняному симпозіумі Європейської академії дерматології та венерології (Афіни, 2016).
Публікації. За матеріалами дисертації опубліковано 22 наукові праці, в тому числі 9 статей (з них 2 – в моноавторстві), з яких 8 – у наукових фахових виданнях України, серед яких 6 статей у журналах, що входять до міжнародної наукометричної бази «Російський індекс наукового цитування» та 2 – Google Scholar, 12 тез доповідей (4 – закордонні) у збірниках матеріалів наукових конференцій, отримано 1 патент України на корисну модель.
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУРИ
1.1 Сучасні аспекти патогенезу псоріазу: імунопатогенез, хронічне
системне запалення, ремоделювання кісткової тканини
Псоріаз на сучасному етапі залишається одним з найбільш розповсюджених хронічних дерматозів і займає одне з провідних місць серед актуальних проблем сучасної дерматології. Поширеність даного дерматозу, згідно даних Міжнародної Федерації асоціацій псоріаза (International Federation of Psoriasis Associations) коливається від 1,2 до 5 % у загальних популяціях та в середньому становить 3% [20, 24, 49, 79, 89, 107, 138, 154, 192, 224, 225, 264], залежить від етнічних особливостей популяції і клімато-географічного регіону мешкання. Наприклад, в скандинавських країнах відзначається висока популяційна частота (до 4 %), в Кувейті – найнижча (0,11 %) порівняно з іншими регіонами світу. Також псоріаз рідко зустрічається у осіб негроїдної раси, японців і ескімосів [17, 23, 24, 94, 138, 154, 167, 196, 220, 225]. В Україні близько 1,5 млн. хворих на псоріаз [107, 138, 147]. В загальній структурі патології шкіри питома вага цього дерматозу досягає 12-15 %, а серед пацієнтів дерматологічних стаціонарів – 20-30 % [23, 49, 79, 89, 94, 138, 154].
На псоріаз хворіють однаково часто як чоловіки, так і жінки. Дерматоз може початися у будь-якому віці, однак виділяють два вікових піки (типи), коли найбільш імовірен дебют захворювання: I тип – зустрічається переважно у молодих людей у віці до 25 років, простежується спадковий характер захворювання та схильність до більш тяжкого перебігу; II тип – захворювання починається у віці старше 50 років і має доброякісний перебіг [15, 24, 94, 154]. У багатьох хворих відзначається зв’язок загострень дерматозу з порою року, частіше зустрічається «зимовий» тип із загостреннями захворювання в холодний період року, рідше – «літній» тип із загостреннями в теплу пору року, однак останнім часом спостерігається зростання втрати сезонного загострення хвороби [20, 24, 49, 79, 147].
Традиційно виділяють наступні клінічні форми псоріаза: звичайний (вульгарний) псоріаз, ексудативний, пустульозний, АП, псоріатична еритродермія. Ексудативний, пустульозний, АП і псоріатична еритродермія – є тяжкими формами дерматозу [88, 94, 99, 107, 219]. Хворі на тяжкі форми псоріазу, згідно узагальненних даних європейських та американських досліджень, складають близько 1/3 усіх хворих на псоріаз і є основним контингентом пацієнтів, що звертаються до лікаря [74, 192, 219].
Згідно сучасних уявлень, псоріаз – це хронічний генетично детермінований імунозалежний дерматоз мультифакторіальної природи, що характеризується гіперпроліферацією епідермальних клітин, порушенням кератинізації, запальною реакцією в дермі, порушенням мікроциркуляції, неінфекційними запальними та дегенеративно-дистрофічними змінами в опорно-руховому апараті, вісцеральними ураженнями [14, 18, 72, 94, 102, 200, 223]. На данний час псоріаз розглядається як системна або псоріатична хвороба, що включає комплекс взаємообумовлених, патогенетичних ланок: імунні, метаболічні, генетичні, нейроендокринні та інші порушення [12, 94, 226, 237, 238].
В останні роки спостерігається значне зростання захворюваності, в тому числі серед осіб молодого, працездатного віку, збільшення питомої ваги тяжких, інвалідизуючих форм псоріазу, торпідність до лікування, зниження рівня соціальної адаптації, професійної активності та якості життя хворих, що обумовлює важливість медико-соціальної проблеми даного дерматозу [4, 60, 97, 105, 111, 148, 162, 206].
Незважаючи на досить тривалу історію вивчення псоріазу та наявність великої кількості вітчизняних і зарубіжних робіт, присвячених даній проблемі, етіологія та патогенез захворювання залишаються до кінця нез’ясованими, що ускладнює розробку ефективних методів терапії, які дозволяють досягти тривалої клінічної ремісії [29, 114, 136, 137].
Однією з особливостей клінічних проявів псоріазу є ураження суглобового апарату [19, 89, 102, 215, 260]. Частота уражень КСА при псоріазі, за даними різних авторів, коливається від 1,0 до 60 % [89, 132, 138, 175, 216]. АП – одна з тяжких форм псоріазу, погано піддається терапії та є провідним фактором розвитку інвалідності приблизно у 15 % хворих, що настає у зрілому віці. Ураження суглобів при псоріазі може мати різні форми – від легких артралгій за типом олігоартриту до тяжких, деформуючих, що завершуються анкілозами. Встановлено первинність ураження ентезісів у хворих на псоріаз з розвитком ентезитів та в подальшому синовіїтів [131, 132, 134, 175, 216, 229]. Також визначено, що при легкому ступені тяжкості АП спостерігаються дегенеративно-дистрофічні зміни в хрящовій тканині, при середньотяжкому ступені тяжкості мають місце запальні ознаки та дегенеративно-дистрофічні зміни і при тяжкому ступені АП посилюється інтенсивність запального процесу та дегенеративно-дистрофічних змін у тканинах суглобів. Тобто при псоріазі первинно спостерігаються дегенеративно-дистрофічні ураження суглобів [89].
На даний час доведено, що при АП виділяють наступні форми: псоріатичний артрит (ПА), який супроводжується переважанням запальних проявів у сполучній тканині (бурсит, ентезіт, тендовагініт, лігаментит); псоріатичний остеоартроз, що супроводжується переважанням дегенеративно-дистрофічних проявів у сполучній тканині (лігаментоз); змішані (ПА і псоріатичний артроз), які супроводжуються наявністю запальних і дегенеративно-дистрофічних проявів у сполучній тканині та псоріатична артропатия [89].
В 50-64 % випадків АП, шкірні прояви передують суглобовому синдрому, в 8-10,4 % – АП починається одночасно з ураженням шкіри, а в 15-25,6 %, переважно у дітей, дерматоз визначається через рік після дебюту АП (латентний АП) [131, 136]. Зазначено відсутність залежності між тяжкістю та варіантом перебігу псоріазу і можливістю розвитку ураження суглобів при даному захворюванні [81, 131, 136]. Тяжкий артрит може спостерігатися при відсутності шкірних змін, в той час як артрит середнього ступеня тяжкості зазвичай протікає при помірному або тяжкому шкірному псоріазі [81, 131, 198].
Ексудативний псоріаз характеризується надмірною виразністю ексудативного компоненту запальної реакції в дермі, з подовженням, звивитістю та розширенням капілярів, підвищенням проникності їх стінок і утворенням навколосудинних інфільтратів, що складаються переважно з лімфоцитів, макрофагів і нейтрофільних лейкоцитів. Клінічна картина відрізняється від звичайного псоріазу та проявляється вогнищами гострого запалення з не різко вираженою інфільтрацією. Ексудат просякає та склеює лусочки, при видаленні яких оголюються мокнучі ділянки або ерозії. Характерна відсутність першого елемента псоріатичної тріади (феномен стеаринової плями). Ексудативний псоріаз частіше спостерігається у огрядних людей на тлі ожиріння [24, 94].
Пустульозний псоріаз є однією з тяжких форм захворювання та відрізняється особливо наполегливим перебігом і стійкістю до терапії [24, 74, 94, 144]. Виникненню цієї тяжкої форми дерматозу сприяють стресові ситуації, інфекції, нераціональна загальна або місцева терапія. Пустульозний псоріаз протікає з лихоманкою, лейкоцитозом, збільшеною ШОЕ, загальним тяжким станом. Раптово на тлі яскравої еритеми з’являються дрібні поверхневі пустули, що супроводжуються печінням, болісністю, вони можуть розташовуватися в зоні звичайних бляшок і на фоні раніше незміненої шкірі. Нові вогнища пустулізації з’являються приступоподібно, займаючи великі ділянки шкіри. Пустули, що злились, викликають відшарування епідермісу, може розвинутися еритродермія. Пустули стерильні. Виділяють дві клінічні форми пустульозного псоріазу: дисемінований (генералізований) пустульозний псоріаз (тип Цумбуша) і пустульозний псоріаз долонь та підошв (тип Барбера) [94, 144, 244].
Псоріатична еритродермія спостерігається у 2,5-3,0 % хворих на псоріаз, складаючи більше половини тяжких форм дерматозу, нерідко загрожує життю хворого, вимагає системної терапії на госпітальному етапі [49, 103, 154, 191, 262]. Дана форма захворювання розвивається внаслідок поступового прогресування псоріатичного процесу та злиття бляшок при нераціональній терапії або неправильній поведінці хворого (використання гарячих ванн, розтирання шкіри мочалкою, ультрафіолетове опромінення та ін.). Рідше еритродермія може виникати як перший прояв псоріазу. Шкірні покриви яскраво-червоного кольору, набряклі, інфільтровані, зі значним лущенням. Часто спостерігається свербіж, печіння, відчуття стягування шкіри, порушення загального стану, збільшення периферичних лімфовузлів, випадіння волосся. Для даної форми захворювання характерні виражені в тій чи іншій мірі порушення обмінних процесів: терморегуляції, кишкової абсорбції, водно-сольового та білкового обмінів. Посилення кровотоку в шкірі може призвести до гіпотермії, ураження серцево-судинної системи (гіпертонія, інфаркт міокарда, міокардит, недостатність серцевих клапанів) [24, 94, 103, 154].
Велике значення має правильна оцінка ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому, що є одним з найбільш складних питань, пов’язаних з діагностикою та лікуванням даного захворювання, від вирішення якого залежить тактика ведення хворих і обсяг та послідовність лікувальних заходів. Висока активність є несприятливим прогностичним фактором псоріазу, визначає швидкий темп деструктивних змін у периферичних суглобах, розвиток дактилітів, ентезопатій та позасуглобових проявів. Динаміка активності дозволяє судити про адекватність проведеного лікування [36, 81, 171, 175]. На сучасному етапі з методів діагностики псоріаза перевага віддається анамнестичним, клініко-лабораторним, у тому числі імунологічним, біохімічним та інструментальним методам [9, 37, 81, 115, 118, 171].
Найбільш об’єктивним способом визначення активності ПА є критерії (клінічні та лабораторні), розроблені С.В. Приваленко і В.В. Бадокіним [115], за якими враховують біль у суглобах, ранкову скутість, температуру тіла над суглобами та загальну температурну реакцію організму, швидкість осідання еритроцитів (ШОЕ), кількість лейкоцитів, СРБ, фібриногену, СК, α2- і γ-глобулінів. За цими показниками виділяють І ступінь активності – мінімальний, ІІ – середній ступінь та ІІІ – максимальний ступінь активності.
Оцінка ураження шкіри проводиться з використанням BSA (Body Surface Area) і PASI (Psoriasis Area and Severity Index) – індексів площі та тяжкості шкірних проявів псоріазу. Мінімальне значення індексу PASI – 0 балів, максимальне – 72 бали (легка, середня і тяжка форми псоріазу визначаються наступними діапазонами: 0-10, 11-30, 31 і більше балів відповідно) [81, 168].
Згідно з сучасними даними літератури, маніфестація шкірних і суглобових проявів при псоріазі являє собою підсумок тривалого запального процесу, що супроводжується розвитком складних метаболічних та патоімунних механізмів [32, 156]. Запалення, яке виникає при псоріазі, носить системний характер. Дослідниками передбачається, що імунологічні та метаболічні зміни, що виникають, обтяжують перебіг і збільшують тривалість псоріазу, а також призводять до розвитку супутніх захворювань [49, 80, 81, 126].
Оскільки гістопатологічною основою псоріатичної бляшки є незлоякісна гіперпроліферація епідермальних кератиноцитів, супутня гіперплазія та дилятація поверхневих судин шкіри, запальна реакція – псоріаз довгий час розглядали виключно як патологію шкіри, а супутні імунологічні зміни вважали вторинними [21, 93]. В теперішній час визнана точка зору, згідно якої псоріаз є імунозалежним запальним захворюванням, де основним феноменом є формування складної мережі взаємодій імунокомпетентних клітин, кератиноцитів, клітин синовіальної оболонки та цитокінів, що відносяться до найбільш значущих маркерів порушення процесів імунорегуляції при запальних захворюваннях [16, 55, 60, 82, 93, 182, 202, 209, 210, 217, 234].
Імунопатогенез псоріазу представляється складним багатокомпонентним процесом взаємодії клітинних і гуморальних складових імунної системи, при якому особлива роль належить прозапальним цитокінам, що синтезуються активованими імуноцитами та клітинами епідермісу. Присутність підвищених концентрацій прозапальних цитокінів активує кератиноцити до синтезу власних ІЛ, хемокінів і факторів росту, прискорює проліферацію кератиноцитів, неоангіогенез, що в цілому сприяє формуванню псоріатичної бляшки та запалення синовія [55, 80, 103, 180, 197, 214, 226, 253, 270].
Адекватність реакції запалення на всіх її етапах регулює система первинних і вторинних медіаторів. Це відбувається шляхом активації синтезу факторів росту, експресії рецепторів для цитокінів на мембрані клітин-мішеней, синтезу білків гострої фази [130, 235]. Характер імунної відповіді багато в чому визначає особливості розвитку запалення при різних захворюваннях, залежить від переважної активації певної субпопуляції Т-лімфоцитів [93]. Th-клітини, представники СD4+ популяції лімфоцитів, ділять на підгрупи за здатністю синтезувати ті чи інші групи цитокінів. Th-1 тип – це продуценти ІЛ-1, ІЛ-6, ІЛ-8, фактора некрозу пухлин альфа (TNFα), гамма-інтерферону (INFγ) та ІЛ-2, Th-2 тип продукують ІЛ-4, ІЛ-5, ІЛ-6, ІЛ-10 [80, 93, 103]. Цитокіни Th-2 типу забезпечують в першу чергу хелперний сигнал, щодо синтезу антитіл або аутоантитіл (гуморальний імунітет) і беруть участь у розвитку алергічних реакцій. Цитокіни Th-1 типу залучені в реакції клітинного імунітету (гіперчутливість уповільненого типу, клітинна цитотоксичність і запалення) [82, 129, 130]. Причому цитокіни, які продукуються цими субпопуляціями лімфоцитів, знаходяться в реципрокних відносинах, Th-1 цитокіни (прозапальні) – промоутери аутоімунного запалення, Th-2 цитокіни (протизапальні) пригнічують Th-1-опосередковану імунну відповідь [48, 82]. Відомо, що медіатори запалення, в тому числі прозапальні цитокіни, стимулюють кісткову резорбцію, сприяючи остеокластогенезу, в той час, як протизапальні цитокіни мають протилежну дію [58, 211].
ІЛ-1 – багатофункціональний цитокін, який грає важливу роль в опосередкуванні імунологічних і запальних реакцій. Синтезується макрофагами, кератиноцитами, фібробластами, клітинами Лангерганса, В-лімфоцитами, ендотеліальними клітинами та ін. Існує два підтипа ІЛ-1: альфа і бета. Вони виявляють однакову біологічну активність і зв’язуються з загальними рецепторами до ІЛ-1. ІЛ-1α пов’язаний з мембраною кератиноцитів, бере участь в представленні антигенів, активує переважно Т-лімфоцити, володіє аутокринною та паракринною дією. ІЛ-1β відіграє центральну роль в локальному і системному, гострому і хронічному запаленні [13, 116, 173, 174, 180, 205, 268]. Переважною формою IL-1 є IL-1β. Даний цитокин ініціює та регулює запальні, імунні процеси, активує нейтрофіли, Т- і В-лімфоцити, стимулює синтез білків гострої фази, EGF, інших прозапальних цитокінів і факторів росту, молекул адгезії, прокоагулянтів, простагландинів, оксиду азоту (NO), металопротеїназ. Також ІЛ-1β, активує хондроцити, остеобласти, збільшуючи експресію матриксних металопротеїназ, агреканаз, катепсина К, що призводить в результаті до деструкції хряща і резорбції кістки [12, 13, 116, 180, 190, 207].
ІЛ-10 відноситься до супресорних факторів, секретується Th-2 клітинами. Встановлено, що ІЛ-10 інгібірує синтез таких прозапальних цитокінів, як ІЛ-1, ІЛ-2, ІЛ-6, ІЛ-8, TNFα, INFγ, гранулоцитарно-макрофагальний колонієстимулюючий фактор (GM-CSF), а також синтез NO і має доведену антипсоріатичну дію [13, 180]. ІЛ-10 знижує секрецію колагену, матриксних металопротеїназ, впливає на диференціацію/активацію остеокластів, блокуючи остеокластогенез [157, 190, 201, 248].
Активація та диференціювання Th-клітин відбувається під впливом епідермальних імунокомпетентних клітин, що синтезують ендогенні медіатори з широким спектром дії – прозапальні цитокіни ІЛ-1, ІЛ-6, ІЛ-8, ІЛ-12, TNFα, які ініціюють ранню фазу імунного запалення [44, 93, 200].
Останнім часом активно вивчається роль цитокінів при захворюваннях із запальним (інфекційних та неінфекційних) патогенетичним компонентом розвитку і перебігу [93]. Першорядне значення в патогенезі псоріазу, на думку ряду дослідників, відіграють Т-клітини І типу [54, 61, 63, 156, 217]. Імунні зміні з девіацією цитокінового профілю, переважно за Th1-, Th17-типами з домінуванням прозапальних цитокінів, спричиняють порушення кератинізації, запалення, що обумовлює підтримку порочного круга і хронізацію патологічного процесу [6, 17, 54, 217, 236, 256]. Гіперпроліферація кератиноцитів при псоріазі обумовлена підвищеною продукцією TNFα і EGF, при цьому рівень TNFα корелює з тяжкістю захворювання [93, 151, 155, 218]. Згідно з результатами Кравченя та співавт. (2005) [76], прогресування псоріазу супроводжується пригніченням Т-клітинного імунітету та напругою гуморальної ланки, вираженим порушенням продукції імуноглобулінів і дисбалансом в системі про- та протизапальних цитокінів.
Літературні дані щодо експресії та ролі ключових про- та протизапальних цитокінів (TNFα, ІЛ-1β, INFγ, ІЛ-8, ІЛ-10, ІЛ-4 та ін.) при псоріазі суперечливі. Якщо в псоріатичній папулі встановлено підвищений вміст прозапальних цитокінів, то дані про рівень про- і протизапальних цитокінів у периферичній крові залишаються доволі неоднозначними [110]. Ряд робіт указує на переважання вмісту прозапальних цитокінів і відносно низьку експресію протизапальних цитокінів, що передбачає недостатню протирегулюючу здатність імунологічної системи [44, 63, 76, 80, 82, 108, 118, 139, 142, 217, 218, 220, 226, 227]. Інші автори висловлюють думку про відносну антизапальну поляризацію цитокінового спектру з переважанням ІЛ-4, ІЛ-5, ІЛ-10 при даному захворюванні [12, 44, 48, 49, 63, 105, 110, 119, 139, 218, 232].
У зв’язку з цим доцільно проводити визначення рівня ключових прозапального (ІЛ-1β) та протизапального (ІЛ-10) цитокінів у сироватці крові з метою вивчення характеру цитокінового дисбалансу у пацієнтів на різні клінічні форми псоріазу, залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому, що дозволить отримати додаткові критерії оцінки тяжкості дерматозу та активності запального процесу, резорбції кісткової тканини, прогнозування перебігу захворювання, патогенетичного обґрунтування призначаємої терапії, а також імунологічної ефективності проведеного лікування.
На даний час СРБ розглядається як найбільш чутливий показник запального процесу та ушкодження, є основним неспецифічним тестом оцінки активності захворювання у хворих з різноманітними запальними процесами та є критерієм тяжкості і прогнозу запалення [169]. СРБ – найбільш важливий представник білків гострої фази запалення, його синтез регулюється ІЛ-1, ІЛ-6, TNFα [22, 169, 179, 246, 247, 254]. У хворих на ПА в стадії прогресування встановлено різке підвищення рівня СРБ, в ремісію показники нормалізовувалися [247, 254]. Значне збільшення СРБ у хворих на середньотяжкий і тяжкий псоріаз підтверджує прозапальний зсув імунорегуляторних процесів і активність запалення [6, 179]. Разом з тим, деякі дослідники не виявили взаємозв’язок СРБ з індексом PASI у хворих на псоріаз [247]. Є роботи, присвячені вивченню СРБвч у хворих на звичайний псоріаз [126]. Визначення СРБвч необхідно для проведення оцінки активності запального процесу, перебігу дерматозу, моніторингу вираженності імунозапальних порушень, ефективності проведеної терапії. У вітчизняній літературі мало відомостей про вміст СРБвч в крові хворих на різні клінічні форми псоріазу.
Одним з факторів, які регулюють проліферативні процеси в епідермісі, є EGF [62, 118]. EGF був відкритий Stanley Cohen і Rita Levi-Montalcini, лауреатами Нобелівської премії в галузі фізіології і медицини 1986 року. Це глобулярний білок, с.м.м 6,4 кДа, що складається з 53 амінокислотних залишків, вперше виявлений в кінці 1950-х років як побічна фракція при очищенні фактора росту нервів з екстрактів гіпоталамуса корів, який був здатний стимулювати рост епітеліальних клітин. Згодом було показано, що специфічне зв’язування EGF з рецептором EGF-тирозинкіназою, розташованим на поверхні клітини, викликає безліч біологічних ефектів. EGF секретується кератиноцитами шкіри, активованими макрофагами, тромбоцитами, а також клітинами тканин головного мозку, нирок, слинних залоз, шлунка. Даний фактор росту може виявлятися в багатьох біологічних рідинах організму, його концентрація особливо висока в слині, сечі, шлунковому соці, сім’яній рідині та в грудному молоці. EGF має мітогенну дію, індукує проліферацію епідермальних, епітеліальних і ембріональних клітин, регулює диференціювання тканин, модулює органогенез, сприяє ангіогенезу, прискорює загоєння дрібних ран, при певних умовах може викликати малігнизацію клітин [25, 62, 108, 185, 186, 233, 251]. Також EGF збільшує вивільнення кальцію з кісткової тканини і стимулює резорбцію кістки, впливаючи на остеобласти, які виділяють фактор, що активує остеокласти [25, 163]. Крім того, у трансгенних мишей, для яких характерна підвищена секреція EGF, виявлена збільшена проліферація остеобластів [25, 163].
Кісткова тканина – це складна динамічна система, яка на етапах розвитку зрілості, при старінні та патології піддається фізіологічній перебудові (ремоделюванню), основою якого є процеси утворення та руйнування. Кісткове ремоделювання – складно регульований процес, в основі якого лежить взаємодія двох клітинних ліній: остеобластів, що забезпечують утворення кістки та остеокластів, які руйнують кісткову тканину. В генезі утворення та резорбції кістки в фізіологічних і патологічних умовах значна роль належить багатогранним міжклітинним взаємодіям, опосередкованим впливом безліччю цитокінів і факторів росту, зокрема ІЛ-1, TNFα, ІЛ-6, ІЛ-8, EGF та ін. [58, 211]. У фізіологічних умовах ремоделюванню піддається 2-10 % скелету в рік. У хворих на АП ремоделювання кісткової тканини відбувається при значно зниженому кісткоутворені та підвищеній резорбції кісткової тканини, причому ці процеси відбуваються на клітинному рівні вже на ранніх стадіях захворювання при легкому ступені, що є первинним у патогенезі захворювання [102]. Генез резорбції кісткової тканини при АП залишається нез’ясованим, проте останнім часом його розглядають з позицій ентез-асоційованої патології. Запальний процес з ентезів поширюється на кістку, периост, хрящ, кістковий мозок, що призводить до деструкції кістки, а у ряді випадків і до її проліферації, при цьому синовіїти, що притаманні ПА, розвиваються вдруге по відношенню до ентезитів та є результатом впливу прозапальних цитокінів, що вивільнюються в ентезах [8]. Велике значення в генезі резорбції кісткової тканини при ПА також мають порушення мікроциркуляції, які взагалі характерні для даного захворювання, і, особливо для остеолітичного варіанту [8]. Процеси кісткового ремоделювання та мінерального обміну, що відбуваються в організмі регулюються різними факторами. До системних факторів належать кальційрегулюючі гормони (паратиреоїдний гормон, кальцитонін і активний метаболіт вітаміну D – кальципотріол), інші системні гормони (глюкокортикоїди, інсулін, тиреоїдні та статеві гормони, соматотропний гормон), паракринні чинники (інсуліноподібний фактор росту, EGF, фактор росту фібробластів, тромбоцитарний фактор росту) [58, 211]. До місцевих чинників належать поліпептидні фактори росту (трансформуючий фактор росту бета та ін.), цитокіни, остеокальцин, остеонектін, простагландини, NO, іони Са2+, Р+, Мg2+, F–. Порушення продукції або взаємодії зазначених чинників призводить до розвитку патологічних процесів у кістковій тканині [58, 211].
У науковій літературі є відомості про участь EGF у патогенетичних механізмах розвитку псоріазу, однак ці дані нечисленні та досить суперечливі. Згідно з дослідженнями останніх років вважається, що EGF бере участь у процесах диференціювання, проліферації клітин та розвитку патологічного процесу при псоріазі [77, 108, 186, 190, 249]. Pietrzak at al., (1998), Саруханова (2003), Маркушева та ін. (2004), Кубанов та ін. (2007), Enerbäck, Anderson (2010, 2011) визначили підвищення вмісту EGF в сироватці крові та/або біоптатах шкіри у хворих на псоріаз у прогресуючий стадії, більш виражене в шкірі хворих на ексудативні форми дерматозу та зменшення концентрації данного показника в стаціонарній стадії, а також після проведення фототерапії [77, 108, 189, 190, 249]. Кореляцію з індексом PASI встановили Маркушева та ін. (2004), Кубанов та ін. (2007) [77, 108]. На негативну кореляцію з індексом PASI та незначне підвищення рівня EGF у сироватці крові пацієнтів із псоріазом вказують Fliziak, at al. (2014) [186]. У той же час деякі дослідники [Pietrzak at al., (1998), Enerbäck та K. Anderson (2010-2011)] не встановили кореляцію EGF з індексом PASI [189, 190, 249]. Кашутін та ін. (2008) визначили тільки тенденцію до підвищення EGF в крові хворих на псоріаз [62], а Przepiera-Bedzak at. al. (2013) не виявили підвищення вмісту EGF у сироватці крові пацієнтів із ПА [234].
Для визначення клініко-патогенетичної ролі EGF при псоріазі доцільно проводити визначення його рівня в сироватці крові на різні клінічні форми дерматозу, залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому.
В сучасному уявленні про псоріаз важлива патогенетична роль відведена хронічному запаленню, яке поряд з імунопатологічною патогенетичною «складовою» призводить до метаболічних і судинних порушень [14, 252]. Останнім часом активно вивчається роль NО в запальному процесі.
Перші дослідження, присвячені NO, одному з найважливіших медіаторів фізіологічних і патофізіологічних процесів, з’явилися наприкінці 80-х років ХХ століття [95, 149]. Відомо, що специфічним попередником NO є L-аргінін [128]. У клітинах NО синтезується з L-аргініну під впливом ферментів родини NО-синтаз (NOS) з утворенням L-цитруліну та оксиду азоту [125, 128]. При нестачі субстрату в клітинах фермент NOS починає відновлювати кисень до супероксид радикала і перекису водню, які мають токсичний вплив на клітини [128]. У біологічних системах NО значною мірою присутній у вигляді проміжних з’єднань. У міжклітинному просторі серед таких форм переважають S-нітрозотіоли, внутрішньоклітинною формою стабільного існування NO є динітрозольні комплекси заліза з тіолами, які виявлені, зокрема, в ендотелії та розглядаються в якості резервного пулу (депо) NO [122]. Оксид азоту, що продукується в організмі, зазнає цілий каскад перетворень, які призводять до утворення стабільних сполук: нітратів, нітритів, S-нітрозотіолів, нітротирозину. Найбільшим відсотком виходу із зазначених продуктів мають стабільні метаболіти оксида азоту – нітрат-аніони (NO3–) і NO2– [21, 95, 149].
У більшості робіт останніх років активно вивчається NO-синтазна складова циклу оксида азоту. Відомо, що NOS являє собою сімейство, що складається з трьох ізоформ, які кодуються різними генами [128, 228, 258]. Дві форми є конститутивними (нейрональна та ендотеліальна ізоформи), для активації яких не потрібен синтез нових протеїнів і вони постійно присутні в клітинах [128, 258]. Активність конститутивних ізоформ NOS прямо залежить від внутрішньоклітинної концентрації іонів кальцію і кальмодуліну. Через їх активацію постійно продукуються з коротким латентним періодом дуже малі (пікомолярні) кількості NO, які відіграють важливу біорегуляторну роль [128, 258]. Третя ізоформа ферменту – індуцібельна або макрофагальна (іNOS), виявлена в макрофагах, нейтрофілах, ендотелії, проявляє активність через 6-8 годин (час, необхідний для активації генів і початку синтезу ферменту) після зовнішнього впливу на клітину цитокінів (ІЛ-1, ІЛ -2, TNFα, INFγ), ліпополісахаридів бактерій, ендотоксинів [128, 149, 204, 228]. При цьому продукуються величезні (в 100-1000 разів більші, ніж при дії конститутивних ізоформ) кількості NO. Враховуючи, що високі дози NO токсичні для клітин, іNOS вважається патологічною і активується тільки при запаленні, гіпоксії, інфекційних процесах і багатьох патологічних станах [128]. Показано, що не тільки макрофаги, але і багато інших клітин (гепатоцити, гладкі м’язи, клітини шкіри, слизової оболонки тонкої кишки, хондроцити) здатні при певних зовнішніх впливах, в основному в умовах патології, синтезувати іNOS. Виділяють наступні агенти, що впливають на експресію іNOS: індуктори (ІЛ-1β, TNFα, INFγ, ліпополісахариди бактерій), активатори (циклічний аденозинмонофосфат, EGF, фактор росту фібробластів, плазмін), інгібітори (трансформуючий фактор росту бета, тромбоцитарний фактор росту, інсуліноподібний фактор росту, фактор росту гепатоцитів, дексаметазон, гідрокортизон, тромбін, S-нітрозо-N-ацетил-DL-пеніциламін, МТ) [12, 122, 125].
На даний час встановлено, що NО бере участь у функціонуванні серцево-судинної, імунної систем, системи згортання крові, фібринолітичної системи і системі ендотелію, також показана його участь в розвитку ряду патологічних процесів [122, 128, 149, 228]. Доведено вплив NО на проліферацію мієлоїдних прогенеторних клітин, функціонування Т-лімфоцитів, кератиноцитів [122, 128]. NО бере участь у регуляції судинного тонусу і кровотоку, системної та регіональної гемодинаміки, внутрішньоклітинної концентрації іонів кальцію та тонусу гладеньких м’язів, цитотоксичності, антимікробного захисту [128, 143]. Він істотно впливає і на систему згортання крові: перешкоджає тромбоутворенню, протидіючи агрегації і адгезії тромбоцитів і адгезії нейтрофілів до стінок судин, протидіє активації фосфоліпази А2, синтезу тромбоксану А2 і активації тромбоцитів [117]. NО є важливою складовою системи неспецифічної реактивності організму, впливає на різні сторони запалення, блокуючи або стимулюючи запальну відповідь, що залежить від його концентрації, типу та ступеня активації клітин, впливу інших медіаторів запалення та ін. Описані як про-, так і протизапальні ефекти NО [14, 117, 140, 149]. Так, з одного боку надлишок NО викликає виражену вазодилятацію, посилення кровотоку, підвищення судинної проникності, збільшення продукції прозапальних простагландинів [117, 140]. З іншого боку, він, у фізіологічних концентраціях, пригнічує адгезію нейтрофілів до ендотелію, синтез простагландину Е2, ІЛ-6, тромбоксану і продукцію супероксидних радикалів нейтрофилами, таким чином виявляючи протизапальну активність [117]. Встановлено багатостороній взаємозв’язкок L-аргініну з імунологічною реактивністю, де важливу роль в його реалізації відіграє NО, що утворюється з амінокислоти та має специфічний імуномодулюючий вплив, а також виступає в якості одного з основних ефекторів системи клітинного імунітету, виявляючи антимікробну, антипроліферативну та протипухлинну дію. Дефіцит NO призводить до підвищення синтезу прозапальних цитокінів та хемокінів, проліферації гладком’язових клітин, посиленню інтерстиціального росту та рестриктивних процесів [128]. Також NO має вплив на баланс Th1/Th2, селективно пригнічує активність Th1-клітин, сприяючи розвитку Th2-відповіді [128].
Існують медикаментозні підходи до корекції продукції NO в організмі, що здійснюються застосуванням сполук, здатних пригнічувати або підсилювати синтез іNOS, тим самим регулювати генерацію ендогенного NО [122]. Пригнічення експресії іNОS кератиноцитами в ділянці ураження у хворих на псоріаз спостерігали після використання кортикостероїдів, МТ, циклоспоріну А та ретиноїдів [122].
У літературі накопичуються дані про патогенетичну роль NО в розвитку псоріазу [21, 149]. В окремих роботах показана роль NО в підтримці запального процесу [149, 204, 228], розвитку дисфункції ендотелію при псоріазі, що можливо обумовлено порушенням активності окисного метаболізму L-аргініну та проявляється зниженням біодоступності NO і високим рівнем його інактивації [14, 21], встановлено підвищення рівня стабільних метаболітів оксиду азоту в плазмі крові у хворих в прогресуючій стадії псоріазу [95, 122]. Однак дослідження присвячені вивченню вмісту NО у пацієнтів на різні клінічні форми псоріазу, залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому, а також його впливу на цитокіновий статус і показники згортання крові практично не проводилися.
Відомості в науковій літературі про стан системи згортання і фібринолітичної систем крові при псоріазі досить різноманітні та суперечливі. Зустрічаються повідомлення про підвищення фібрінопептіда А і В, зниження антиплазміну, протеїну С, плазміногену у хворих на псоріаз у порівнянні з групою здорових донорів. Зміни рівнів фібриногену та антитромбіну III в проведених дослідженнях не виявлені. Автори приходять до висновку, що ці зміни є наслідком вторинної субклінічної коагулопатії споживання. Інші дослідники вказують на розвиток у пацієнтів гіперкоагуляції, що супроводжується зниженням антитромбіну III, підвищенням рівня гомоцистеїну при нормальних величинах протеїну С і протеїну S [203]. Гіперкоагуляційний статус може розвиватися у відповідь на системне запалення. Деякі автори виявили у пацієнтів із псоріазом збільшення рівнів загального гомоцистеїну, фібриногену, фібронектину, розчинних міжклітинних молекул адгезії (ICAM-1) [203, 164]. В дослідженнях системи гемостазу у хворих на торпідний вульгарний поширений псоріаз виявлена схильність до гіпокоагуляції на тлі зниження функції протизгортальної системи (зниження протромбінового індексу (ПТІ), тромбінового часу), зниженого фібринолізу, тромбоцитопенії, гіпофібриногенемії, а також посилення спонтанної агрегації еритроцитів і тромбоцитів у половини обстежених пацієнтів [2]. Була виявлена залежність порушень гемостазу від клінічного перебігу псоріазу [3], у хворих з часто рецидивуючим перебігом захворювання спостерігалися найбільш виражені зміни, пов’язані з підвищенням коагуляційного потенціалу і відповідно з підвищеним тромбоутворенням. При різному характері перебігу псоріазу значення тромбінового, протромбінового часу та рівня антитромбіну III не відрізнялися істотно від значень донорів [66]. Авторами показано, що традиційна стаціонарна гемореологічна та метаболічна терапія надає частковий клінічний ефект (PASI-відповідь < 50 %) і не знижує гіперкоагуляційний потенціал плазми крові, що вказує на доцільність проведення у цих хворих гемостазіологічної корекції лікарськими засобами [3]. Мірсаєвою (2007) були виявлені ознаки підвищеної коагулюючої активності крові. У стадії загострення захворювання виявлені однотипні зміни, які характеризувалися вираженою гіперкоагуляцією – підвищеним рівнем фібриногену, розчинних фібрин-мономірних комплексів (РФМК), ПТІ, зменшенням тромбінового часу та пригніченням фібринолітичної активності, що, на думку автора, свідчить про хронічну форму дисемінованого внутрішньосудинного згортання крові [32]. При цьому виявлені закономірності порушення параметрів гемостазу зберігалися на всьому протязі стаціонарного лікування – проведена стандартна терапія не приводила до нормалізації показників [32]. У вітчизняній літературі дослідження присвячені вивченню стану системи згортання крові у хворих на різні клінічні форми псоріазу, залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому відсутні.
Наведені дані свідчать про доцільність комплексного вивчення цитокінового статусу, рівня СРБ, динаміки рівня EGF, показників продукції NO та окремих ланок системи згортання крові при псоріазі, а також їх взаємозв’язку з метою отримання додаткових критеріїв для оцінки ступеня тяжкості дерматозу і активності суглобового синдрому, резорбції кісткової тканини, прогнозування перебігу захворювання та ефективності терапії, що проводиться.
1.2 Сучасні діагностичні можливості виявлення порушень опорно-рухового апарату при псоріазі
На данний час медицина отримує більш широкі діагностичні можливості, пов’язані насамперед із розвитком інструментальних методів і технічних засобів отримання інформації щодо функціонування та структурних властивостей біологічного об’єкта. Розробка та вдосконалення статистичних комп’ютерних програм, програмних пакетів обробки цифрових сигналів та зображень сприяють створенню сучасних діагностичних методів, які більш достовірно встановлюють кількісне співвідношення між вимірювальними фізичними параметрами та функціональними і органічними характеристиками досліджуваного об’єкту.
Одним з класичних ознак запалення є підвищення температури, вимірювання якої лежить в основі термодіагностики [47, 57, 70]. Термографія, як один із методів неінвазивного обстеження хворих, в Україні вперше була заснована академіками О.Ф. Возіановим та Л.Г. Розенфельдом на початку 1980-х років. Перші термографічні дослідження були виконані професором О.І. Мозговим на початку 70-х років ХХ століття в Київському науково-дослідному рентгенорадіологічному і онкологічному інституті [41]. Академік Л.Г. Розенфельд є засновником розробки теоретичних і практичних аспектів нового направлення променевої діагностики – неіонизуючого, безпечного методу – інфрачервоної дистанційної термографії (ІДТ).
ІДТ – сучасний безконтактний метод виміру та візуалізації природного теплового випромінювання тіла людини невидимої інфрачервоної ділянки електромагнітного спектру. Інфрачервоне випромінювання різних ділянок поверхні тіла людини визначається 3 факторами: особливостями васкуляризації поверхневих тканин, рівнем метаболічних процесів у них і відмінностями теплопровідності. У здорової людини природне теплове випромінювання тіла невидимої інфрачервоної ділянки електромагнітного спектру відносно постійне, а при патологічних станах, прийомі лікарських препаратів, проведенні навантажувальних проб і при здійсненні природної терморегуляціі організму видозмінюється [27, 165, 166]. Термографія дозволяє уточнити локалізацію функціональних змін, активність процесу та його поширеність, а також характер цих змін – запалення, порушення мікроциркуляції, злоякісність. Жоден з існуючих на сьогоднішній день методів не має такої широти діагностичного діапазону, можливості виявлення відразу багатьох груп захворювань, як термографія. Її значення та перевагу можна порівняти з рентгенографією, комп’ютерною томографією, магнітно-резонансною томографією, які застосовуються тільки для оцінки морфологічних особливостей обстежуваних областей, в той час як ІДТ дозволяє оцінювати функціональні зміни в динаміці (як при первинному обстеженні так і безпосередньо в процесі та після проведеного лікування) [27, 42, 47, 70, 165].
Також слід відмітити наступні переваги ІДТ: об’єктивність, неінвазивність, абсолютна нешкідливість та безпечність для лікаря і пацієнта, абсолютна відсутність протипоказань, швидкість та простота виконання дослідження, низька вартість, можливість багаторазового дослідження одного пацієнта та його диспансерного нагляду [67]. Слід підкреслити, що безконтактний тепловізійний метод визначення температури вигідно відрізняється від інших поєднанням високої температурної, просторової та часової роздільної здатності. Впровадження ІДТ у клінічну практику дозволило розширити можливості інструментальної діагностики захворювань опорно-рухової системи [57].
У поодиноких дослідженнях останніх років є відомості про можливість виявлення зон гіпертермії в ділянках шкіри з псоріатичної висипкою та у проекції ураження суглобів за допомогою методу дистанійної термографії [113], проте дослідження, присвячені аналізу стану активності запальних проявів у суглобах у хворих на АП відсутні.
1.3 Сучасні методи лікування тяжких форм псоріазу
Лікування псоріазу дотепер залишається актуальним і складним завданням практичної дерматології, що обумовлено відсутністю встановленої етіології дерматозу, недостатньою вивченістю численних ланок патогенезу захворювання, наявністю шкірного та суглобового синдромів, які взаємо обтягують перебіг захворювання [28, 73, 89, 102, 261].
Цілями терапевтичного втручання є: корекція імунних порушень, стабілізація та купірування проявів шкірного процесу, зменшення інтенсивності болю, скутості, зниження виразності запального процесу, стабілізація кістково-деструктивних змін у суглобах, зниження частоти рецидивів, збереження функції суглобів, відновлення працездатності та підвищення якості життя хворих . Дані цілі лікування досягаються патогенетично орієнтованими методами терапії з комплексним застосуванням фармакологічних засобів протизапальної, цитостатичної, імуносупресивної, вазоактивної, хондропротективної дії, препаратів, що впливають на розвиток остеопорозу, а також методів фототерапії, фотохіміотерапії, екстракорпоральної детоксикації, фізіотерапевтичних і реабілітаційних заходів [79, 89, 103, 114, 141, 161, 239, 261].
При виборі тактики лікування враховуються вік і стать хворого, стадія і тяжкість захворювання, клінічна форма, поширеність та локалізація дерматозу, активність запального процесу, наявність супутньої патології, можливість поєднання з іншими видами лікування, ефективність та переносимість попередньої терапії [26, 79, 100, 114, 133, 136, 141, 153, 239, 245, 259].
Сучасна дерматологія у своєму розпорядженні має широкий спектр засобів для лікування хворих на псоріаз, який залежить від ступеня тяжкості і клінічних проявів захворювання. При легких формах дерматозу використовують переважно зовнішні засоби, які включають топічні глюкокортикостероїдні препарати, засоби, що містять синтетичні аналоги вітаміну D3, активованого цинку пірітіон, а також мазі, до складу яких входять саліцилова кислота, нафталан, дьоготь, іхтіол та інші активні речовини [30, 46, 100, 120, 124, 136, 141]. При середньотяжких і тяжких формах псоріазу найбільш поширеними методами лікування є фототерапія та системні препарати: цитостатики, імуносупресивні засоби, ретиноїди, генно-інженерні препарати [31, 120, 136, 137, 141]. Однак, незважаючи на великий вибір препаратів і методів лікування хворих, у деяких пацієнтів, переважно з тяжкими формами псоріазу, не завжди відзначається виражений клінічний ефект від проведеної терапії або є протипоказання до їх призначення. Крім цього, застосування препаратів системної дії може супроводжуватися серйозними побічними ефектами [45, 88, 89, 102, 141, 242, 259].
Основу системної терапії псоріазу складають симптомомодифікуючі (СМП), хворобомодифікуючи препарати (ХМП) та засоби імунобіологічної дії (генно-інженерні препарати) [242].
СМП діляться на СМП швидкої дії, до яких відносяться нестероїдні протизапальні препарати, системні глюкокортикостероїдні препарати, анальгетики, міорелаксанти, спрямовані на пригнічення запалення, болю, скутості суглобів, і СМП повільної дії – хондропротектори, які мають структурно-модифікуючі властивості (стабілізують структурні зміни в гіаліновому хрящі) [9, 10, 89, 136, 137, 141]. СМП швидкої дії, крім глюкокортикоїдів, не впливають на темпи прогресування суглобового синдрому при псоріазі, тому їх призначення виправдане на початкових стадіях захворювання та для купірування больового синдрому у пацієнтів з середнім і тяжким ступенем АП [20, 49, 89, 90, 91]. Хондропротектори доцільно застосовувати у всіх пацієнтів з АП, незалежно від ступеня тяжкості, з огляду на доведеність наявності дегенеративно-дистрофічних змін у суглобах [102]. Серед нестероїдних протизапальних препаратів перевагу віддають препаратам, які за результатами досліджень, не мають інгібіруючого впливу на біосінтез глікозаміногліканів суглобового хряща. Це неселективні інгібітори циклооксигенази – ібупрофен, диклофенак (хондронейтральної дії), кетопрофен (хондропротективної дії) та селективні інгібітори циклооксигенази-2 – мелоксикам, ацеклофенак (хондропротективної дії) [7, 9, 136].
Використання системних глюкокортикостероїдів при псоріазі вкрай небажано. Допускається їх застосування при неможливості використання засобів базової терапії [89, 90, 102, 141]. Необхідно пам’ятати, що системна терапія глюкокортикостероїдами нерідко призводить до дестабілізації перебігу псоріазу з формуванням торпідних форм, а в окремих випадках сприяє трансформації щодо сприятливого псоріатичного процесу в пустульозний або еритродермічний [20, 90].
Препарати хворобомодифікуючої базової дії (МТ, сульфасалазин, ЛЕФ, циклоспорин А, ароматичні ретиноїди, препарати золота, дерівати фумарової кислоти, мікофенолат мофетил) спрямовані на пригнічення імунного запалення, що є теоретичним обгрунтуванням застосування даних засобів при псоріазі [9, 10, 39, 102, 136, 141, 255]. Вони здатні індукувати ремісію псоріазу та знизити темпи суглобової деструкції. Лікувальний ефект ХМП настає через 1,5-2 міс і більше від початку терапії, що пов’язано з їх акумуляцією в організмі [10, 73, 89, 91], тому тривалість лікування даними препаратами займає від 3-6 місяців до кількох років. З урахуванням сучасних уявлень, показання до імуносупресивної терапії можуть бути розширені, її слід починати на ранній стадії захворювання, особливо при тяжких формах, до появи деструктивних змін у КСА [9, 10, 73].
Ефективність препаратів хворобомодифікуючої базової дії щодо основних проявів псоріазу різна [10].
МТ є «золотим стандартом» базисної терапії, для лікування псоріазу застосовується з 1958 року, впливає на шкірний і суглобові синдроми, його ефективність доведена численними контрольованими дослідженнями. Будучи структурним аналогом фолієвої кислоти, він гальмує синтез нуклеїнових кислот, втручається у репродукцію клітин, тим самим пригнічує прискорений епідермопоез, інгібірує проліферацію лімфоцитів, продукцію великого спектра цитокінів, пригнічує запальні процеси сполучної тканини, але негативно позначається на процесах деструкції в хрящовій та кістковій тканині, що потребує додаткової медикаментозної терапії у вигляді хондропротекторів [73, 84]. Після застосування МТ у хворих на псоріаз спостерігали пригнічення експресії iNOS кератиноцитами в осередку ураження [149], також МТ має нормалізуючий вплив на показники стабільних метаболітів оксиду азоту сироватки крові та сечі хворих на ПА [140]. Позитивний вплив МТ при суглобовому синдромі пов’язаний з його здатністю концентруватися у синовіальній рідині та запаленому сухожильно-зв’язковому апараті. МТ є більш активним по впливу на шкірні прояви псоріазу та при тяжкому поширеному процесі з вираженим ексудативним компонентом, псоріатичній еритродермії є препаратом першої лінії. Призначається як у вигляді монотерапії, так і в комбінації з іншими засобами. Однак даний препарат в загальноприйнятих дозах не гальмує розвиток ерозій у суглобах, не має ефективного впливу на ентезіт і достовірного впливу на рентгенологічне прогресування захворювання [9, 10, 141, 177, 213, 221, 259].
Ефективно застосування при псоріазі імуносупресивного препарату ЛЕФ, який має одночасно симптомомодифікуючу та хворобомодифікуючу дію [10, 141]. Даний засіб має більш виразний вплив на суглобовий синдром. ЛЕФ селективно інгібірує синтез піримідину переважно в проліферуючих Т-лімфоцитах, а також блокує стимулюючий вплив прозапальних цитокінів на проліферацію імунокомпетентних клітин, надаючи протизапальний, імуномодулюючий та антипроліфератівний ефекти [10, 91]. Висока терапевтична ефективність, в тому числі здатність гальмувати розвиток і прогресування деструкції суглобів була показана у неодноразових багатоцентрових дослідженнях таких як: TOPAS (Treatment of Psoriatic Arthritis Study) у 2003 році, OSPAL (Європейське відкрите наглядове дослідження ефективності та переносимості ЛЕФ у хворих на ПА у реальній клінічній практиці) в 2013 році та ін. [10, 183, 212]. ЛЕФ не тільки активно впливає на запальну активність, але й уповільнює хрящову та кісткову деструкцію, характеризується кращою переносимістю порівняно з МТ, також ЛЕФ має найбільш високий рівень доказовості серед ХМП для лікування АП. Показаннями до призначення ЛЕФ при псоріазі є поліартритичний і дистальний варіанти суглобового синдрому, висока лабораторна активність запалення, торпідний перебіг захворювання, неефективність або погана переносимість інших ХМП, включаючи МТ [9, 10, 89, 91].
Сульфасалазин позитивно впливає на суглобовий синдром, має антипроліферативну та імуносупресивну дію. Як антагоніст фолієвої кислоти за допомогою індукції апоптозу макрофагів пригнічує експресію TNFα. Згідно з даними декількох рандомізованих контрольованих досліджень, сульфасалазин активно діє на прояви периферичного артриту [198, 221]. За рекомендаціями міжнародних експертів, при АП застосування сульфасалазину має обов’язково передувати призначенню інгібіторів TNFα [10, 102].
Циклоспорин А впливає на шкірні прояви псоріазу. Даний препарат показаний хворим з тяжкими формами дерматозу, коли звичайна терапія неефективна або є протипоказання до інших методів лікування, при АП застосовується рідко. Циклоспорин А можна використовувати в якості монотерапії або в комбінації з МТ. Одночасне його застосування з фототерапією протипоказано. Циклоспорин А через нефротоксичність застосовується значно рідше інших базисних препаратів [141, 259, 265].
Також ефективним засобом лікування псоріазу є ароматичні ретиноїди, які вже практично 30 років застосовуються у дерматологічній практиці для лікування ряду шкірних хвороб. Механізм їх дії при псоріазі лежить в гальмуванні проліферації клітин епідермісу, нормалізації процесів зроговіння та стабілізації мембранних структур клітин. Зокрема, ацитретин призначають у вигляді монотерапії в добовій дозі 10-40 мг, курс лікування 6-8 тижнів. Препарат здатний значно підвищувати клінічну ефективність фототерапії [262]. Ацитретин не слід призначати жінкам дітородного віку, через наявність тератогенного ефекту. Даний препарат має хороший терапевтичний ефект при псоріазі волосистої частини голови, артропатичному, пустульозному псоріазі та псоріатичному ураженні нігтьових пластин [136, 141, 259].
Значна кількість досліджень, присвячених ролі цитокінів у патогенезі деяких запальних захворювань, з’явилися підгрунтям для розробки принципово нових лікарських засобів – біологічних препаратів, які дозволяють досягти тривалої ремісії та швидко зменшити виразність основних симптомів захворювання. Їх поява і впровадження в практику являє собою значний «крок вперед» в лікуванні хворих на псоріаз [5, 29, 46, 49, 78, 79, 121, 150, 196, 230, 243]. Дані медикаменти широко використовуються за кордоном, а в останні роки стали застосовуватися і в Україні [193].
На даний час в Україні для лікування псоріазу зареєстровані наступні біологічні препарати: інфліксімаб (Ремікейд), адалімумаб (Хуміра), етанерцепт (Енбрел), устекінумаб (Стелара). Адалімумаб, інфліксімаб та етанерцепт є інгібіторами TNFα і рекомендовані для лікування хворих із середньотяжкими і тяжкими формами псоріазу та активного ПА. Устекінумаб є інгібітором ІЛ -12, ІЛ-23 і рекомендован для лікування середньотяжкої та тяжкої форм бляшкового псоріазу [45, 150, 152, 163, 187, 188, 266]. Проте висока вартість біологічних препаратів і відсутність віддаленних результатів лікування не дозволяє здійснювати таргетингову терапію в масовому порядку.
Стратегія біологічної терапії при псоріазі передбачає такі напрями: елімінацію патологічних Т-клітин, блокування активації Т-клітин або міграції їх в тканини, імунну корекцію для зміни ефекту цитокінів (підвищення рівня Th2 для нормалізації дисбалансу Th1/Th2), зв’язування постсекреторних цитокінів або їх рецепторів [49, 78, 141, 193]. Суттєвою ознакою препаратів біологічної дії є: настання швидкого терапевтичного ефекту та більш низька токсичність у порівнянні з іншими системними засобами [45, 83, 141, 143, 104].
На сучасному етапі триває вивчення цілого ряду інших інгібіторів цитокінів. Незважаючи на вищевикладене, згідно літературних даних, відзначається незначний відсоток хворих (від 20 до 50 %), які не реагують або недостатньо реагують на біологічну терапію [230], що дало поштовх до пошуку нових лікарських засобів, більш ефективних у значної кількості пацієнтів. Вивчення і краще розуміння патогенезу внутрішньоклітинних метаболічних шляхів викликало нові перспективи лікування псоріазу та розробки нового класу препаратів – інгібіторів протеїнкіназ, фосфодіестераз [170, 212]. Це низькомолекулярні речовини, які можуть застосовуватися перорально або місцево, що сприяє зниженню вартості лікування [45, 141, 230]. Ефективними, згідно з попередніми даними застосування інгібіторів різновидів протеїнкиіназ, виявилися: інгібітори янус-кіназ (перорального застосування – тофацитініб, місцевого застосування – руксолітініб), протеїнкінази С (сотрастаурін), які на даний час знаходяться в ІІІ фазі клінічних випробувань [150, 184, 194, 230, 240, 267]. На 24-му Конгресі (2015 р.) Європейської Академії дерматології та венерології в місті Копенгаген (Данія) доповідалися дані клінічного дослідження безпеки та ефективності інгібітору фосфодіестерази-4 – апреміласт у 500 пацієнтів з ПА (PALACE), який продемонстрував істотну ефективність та добру переносимість даного препарату та у 1257 хворих з помірним або тяжким бляшковим псоріазом (ESTEEM), яке показало ефективність апреміласта при помірному і тяжкому бляшечному псоріазі. Крім того, показана ефективність апреміласта щодо ряду проявів псоріазу, включаючи свербіж, ураження нігтів і волосистої частини голови, а також якості життя. Ці дані вже опубліковани [176, 232, 263]. Примітно, що в дослідженні PALACE-4 не відзначено опортуністичних інфекцій, включаючи туберкульоз, злоякісних новоутворень; а також серцево-судинних захворювань [176, 230, 263]. У 2015 році американська біотехнологічна компанія «Celgene» випустила на американський ринок інгібітор фосфодіестерази-4 апреміласт під торговою назвою «Otezla» у формі таблеток в дозі 30 мг. Даний препарат вже схвалений Євросоюзом, планується його вихід на ринок Великобританії [176, 232 263].
Фізіотерапію у дерматології використовують досить широко. Розроблено комплексні методики лікування псоріазу, які включають вплив ультразвуку, магніто-, лазеротерапії та фонофорез уражених ділянок [94, 102]. У міжрецидивний період рекомендовано санаторно-курортне, бальнеологічне лікування у Немирові, Хмільнику, Солотвино, П’ятигорську, Кисловодську [24].
* * *
Підсумовуючи представлені в огляді літератури дані, можна сказати, що комплексне вивчення ланок патогенезу та їх взаємозв’язку дозволить розширити уявлення про механізми розвитку дерматозу, виявити нові мішені лікування або стати основою для розробки нових шляхів патогенетично обгрунтованої диференційованої терапії псоріазу, визначити параметри оцінки тяжкості дерматозу та активності суглобового синдрому.
Зміст розділу відображено в наступних публікаціях:
- Кутасевич Я.Ф. Особенности патогенетической терапии артропатического псориаза / Я.Ф. Кутасевич, И.А. Олейник, А.А. Гаврилюк // Клінічна імунологія. Алергологія. Інфектологія. – 2014. – № 8 (77). – С. 61-65.
- Гаврилюк А. А. Современные аспекты патогенеза и терапии псориаза (обзор литературы) / А. А. Гаврилюк // Вісник Української медичної стоматологічної академії «Актуальні проблеми сучасної медицини». – 2015. – Т. 15, Вип. 3 (51), Част. 2. – С. 300-306.
- Кутасевич Я.Ф. Тяжкі форми псоріазу: особливості перебігу та сучасні підходи до терапії / Я.Ф. Кутасевич, І.О. Олійник, О.А. Гаврилюк // Науково-практична конференція “Сучасні технології: діагностика, лікування та профілактика дерматовенерологічних захворювань” в рамках ІІІ Міжнародного медичного конгресу «Впровадження сучасних досягнень медичної науки в практику охорони здоров’я України» : Тези доповідей, м. Київ, 14-16 жовтня 2014 р. – К., 2014. – С. 86.
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Методика загального обстеження хворих
Під нашим спостереженням перебувало 162 хворих на псоріаз віком 16-70 років, з яких 111 осіб мали тяжкі форми дерматозу (псоріатична еритродермія, ексудативний, пустульозний і артропатичний псоріаз) та 51 особа – звичайний (вульгарний) псоріаз, що знаходилися на стаціонарному лікуванні у відділенні дерматології, інфекційних та паразитарних захворювань шкіри ДУ “Інститут дерматології та венерології НАМН України” з 2013 по 2016 рр. Було обстежено 97 (59,8 %) чоловіків та 65 (40,2 %) жінок. Тривалість захворювання коливалась від 2 місяців до 30 і більше років.
Усі хворі піддавалися комплексному клініко-лабораторному обстеженню. При наявності показань хворих консультували лікарі-фахівці відповідного профілю.
Критерії включення пацієнта в дослідження: наявність різних клінічних форм псоріазу, вік від 16 до 70 років, інформована згода пацієнта. Критерії виключення пацієнта з дослідження: наявність супутніх захворювань в стадії загострення, злоякісних новоутворень, хронічної ниркової недостатності, печінкової недостатності, цирозу печінки, підвищення рівня печінкових трансаміназ більш ніж вдвічі від нормальних значень, вагітність, період лактації.
Загальноклінічне обстеження хворих до терапії передбачало з’ясування скарг, анамнезу життя і хвороби пацієнта (початок захворювання, його тривалість, сезонність, частота загострень, тривалість болю у суглобах, наявність псоріазу у родичів, супутньої патології тощо), вивчення даних щодо отриманого раніше лікування та його ефективності; об’єктивне обстеження шкіри та слизових оболонок з визначенням індексів BSA та PASI, обстеження периферичних лімфатичних вузлів, внутрішніх органів і систем організму.
Усім хворим до та після лікування проводили загальні аналізи крові та сечі, біохімічний аналіз крові з вивченням показників білкового (вміст загального білка) та вуглеводного (вміст глюкози крові) обмінів, функціонального стану печінки – вміст білірубіну, аспартат- і аланінамінотрансфераз, функціонального стану нирок – рівень креатиніну та сечовини, окремих маркерів сполучнотканинного обміну (СК та ГП). Додатково, в динаміці спостереження, проводилося визначення рівня NO2–, вмісту цитокінів ІЛ-1β, ІЛ-10, СРБвч, EGF в сироватці крові, а також окремих показників згортальної системи крові – ПТІ, фібриногену, РФМК, активованого часткового тромбопластинового часу (АЧТЧ). Матеріалом для дослідження була капілярна та венозна кров, забір якої проводився натще та ранкова сеча. Клінічні дослідження крові та сечі проводилися за уніфікованими методами [59]. Кількість тромбоцитів у капілярній крові підраховували в камері Горяєва згідно стандартним уніфікованим методам [59]. Оцінку одержаних лабораторних досліджень проводили згідно Міжнародної системи одиниць. Усі клінічні дослідження проводилися в клінічній лабораторії ДУ “Інститут дерматології та венерології НАМН України” (свідоцтво про атестацію № 100-297/2015 від 20.11.2015р.).
Для уніфікації та об’єктивізації тяжкості дерматозу, визначення порівняльної клінічної ефективності лікування, у хворих в процесі спостереження, застосовували оцінку загальної площі ураження шкіри – індекс BSA (Body Surface Area) та оцінку охоплення і тяжкості псоріазу – індекс PASI (Psoriasis Area and Severity Index), запропонованим H. Baker [168].
Розрахунок величини індексу PASI проводили за формулою:
PASI = 0,1 × (e + і + л) × Пг + 0,2 × (e + i + л) × Пв/к + 0,3 × (e + i + л)
Пт + 0,4 × (e + i + л) × Пн/к, (2.1)
де е – еритема;
і – інфільтрація;
л – лущення, що оцінювалися в балах від 0 до 4;
П – площа враженої поверхні (г – голови, т – тулуба, в/к – верхніх кінцівок та н/к – нижніх кінцівок) у балах.
Ступінь тяжкості псоріазу оцінювалася в залежності від значення індексу PASI: легкий ступінь – PASI ≤ 10; середній ступінь – PASI від 11 до 30; тяжкий – PASI ≥ 31.
Оцінка негативного впливу захворювання на якість життя хворих, в динаміці спостереження, проводилася за визначенням дерматологічного індексу якості життя (DLQI) [75, 120, 195], русифікованого проф. М.Г. Кочергіним (2001). DLQI складається з 10 питань, які характеризують різні аспекти життя хворого: професійні, побутові, сексуальні, соціальні, кожне з яких оцінюється в балах від 0 до 3. Мінімальне значення опитувальника дорівнює «0», максимальне – 30 балам. Чим більше балів, тим більший вплив здійснювало захворювання шкіри на якість життя і тим вона нижче. Отримана кількість балів інтерпретувалася наступним чином: 0-1 – захворювання шкіри не впливало на життя пацієнта, 2-5 – захворювання мало незначний вплив на життя пацієнта, 6-10 – помірний вплив, 11-20 – дуже сильний вплив і 21-30 – надзвичайно сильний вплив [120].
Оцінка вираженості болю у суглобах проводилася хворими за візуально-аналоговою шкалою (ВАШ) від 0 до 10 см, де 0 см – відсутність болю, 10 см – максимальний біль [37].
Для оцінки ступеня активності суглобового синдрому при АП застосовувалися критерії (клінічні та лабораторні), розроблені С.В. Приваленко та В.В. Бадокіним [115], згідно з якими враховують біль у суглобах, ранкову скутість температури тіла над суглобами та загальну температурну реакцію організму, ШОЕ, СРБ, кількість лейкоцитів, фібриногену, СК, α2– та γ-глобулінів. Виділяють І ступінь активності (мінімальний), ІІ – середній ступінь та ІІІ – максимальний ступінь активності.
Ефективність проведеної терапії прийнято оцінювати за відсотковим зменшенням індексу PASI. Загальновизнаними є PASI 50, PASI 75, PASI 90, що відповідає зниженню індексу на 50 %, 75 % та 90 % відповідно. В Європейських клінічних настановах щодо лікування псоріазу показник PASI 50 прийнятий як мінімальний рівень клінічної відповіді на терапію [120]. Для оцінки досягнутого терапевтичного ефекту наприкінці лікування враховували наступні критерії: 1) значне покращення – повне розв’язання проявів псоріазу в більшості висипань, але деякі з елементів повністю не розв’язалися (залишилася незначна еритема та інфільтрація), загальна площа ураженої шкіри зменшилася з 30-40 % до 10-15 % (утричі), індекс PASI порівняно з вихідним знижувався більш ніж на 50 %; 2) покращення – багато елементів повністю розв’язалися, в осередках інших висипань незначна еритема та інфільтрація зберігалися, повна відсутність лущення, загальна площа ураженої шкіри зменшилася з 40 % до 20 % (вдвічі), зниження числового значення індексу PASI порівняно з вихідним на 50 %; 3) незначне покращення – загальна площа враження шкіри зменшилася з 49-53 % до 27-28 % (майже вдвічі), в осередках ураження зберігалася помірно виражена еритема, інфільтрація, у деяких осередках – незначне лущення, значення індексу PASI знижувалося порівняно з вихідним на 30-48 %; 4) відсутність ефекту – істотних змін у стані хвороби не відбулося.
Динаміку величини індексу PASI в процесі лікування розраховували у відсотках за формулою:
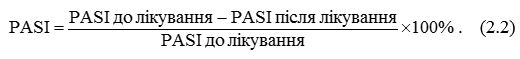
Відносно показника DLQI, метою терапії є досягнення його рівня 0 або 1 балу, якщо це можливо. Рівень показника DLQI менше 5 балів розглядався як мінімальний критерій для оцінки ефективності лікування [120].
Усі хворі за клінічною формою були розподілені на дві групи. І (основну) групу склали 111 хворих на тяжкі форми псоріазу (64 чоловіків і 47 жінок) віком 16-70 років (середній вік – [47,06 ± 1,32] роки), з них: Іа підгрупа – 53 особи (33 чоловіків і 20 жінок) у віці від 21 до 68 років (середній вік – [47,45 ± 1,65] років) з поширеним тяжким ураженням шкіри (пустульозна, ексудативна, еритродермічна форми псоріазу) і наявністю ураження КСА (артропатична форма псоріазу), серед яких із І ступенем активності суглобового синдрому – 18 хворих (9 чоловіків і 9 жінок), з ІІ – 24 пацієнти (17 чоловіків і 7 жінок) і ІІІ – 11 осіб (7 чоловіків і 4 жінки); Іб підгрупа – 36 хворих (16 чоловіків та 20 жінок) віком 25-70 років (середній вік – [48,11 ± 2,3] роки) на АП з мінімальними проявами шкірного синдрому, з яких із І ступенем активності суглобового синдрому – 12 осіб (8 чоловіків і 4 жінки), з ІІ – 15 пацієнтів (6 чоловіків і 9 жінок) і ІІІ – 9 хворих (2 чоловіків та 7 жінок); Ів підгрупа – 22 особи (15 чоловіків і 7 жінок) у віці 16-70 років (середній вік – [44,41 ± 3,81] років) з поширеним тяжким ураженням шкіри (пустульозна, ексудативна, еритродермічна форми псоріазу), але без ураження КСА. Група порівняння (ІІ група) складалася з 51 хворого (33 чоловіків та 18 жінок) віком 16-70 років (середній вік – [40,9 ± 2,22] роки) на звичайний (вульгарний) псоріаз.
Контрольна група включала 20 практично здорових осіб (10 чоловіків і 10 жінок) віком 18-67 років (середній вік – [35,43 ± 3,04] роки), репрезентативних за статю та віком.
Групи пацієнтів були репрезентативні за статю, віком, вихідним клінічним-лабораторним показникам.
Залежно від застосованого методу терапії 106 хворих на тяжкі форми псоріазу було розподілено на наступні терапевтичні групи: Iа підгрупа – 22 хворих (11 чоловіків та 11 жінок) віком від 29 до 67 років (середній вік – [47,59 ± 2,36] років) отримували терапію за розробленим методом з використанням МТ, L-аргініну та глюкозаміну сульфату; Iб підгрупа – 23 особи (16 чоловіків та 7 жінок) у віці 18-69 років (середній вік – [49,17 ± 2,33] років), що в комплексному лікуванні одержували препарат базової системної терапії МТ; ІІа підгрупа – 20 пацієнтів (13 чоловіків і 7 жінок) у віці від 25 до 70 років (середній вік – [47,35 ± 3,27] років) лікувалися за розробленим методом з використанням ЛЕФ, L-аргініну та глюкозаміну сульфату; ІІб підгрупа – 20 осіб (10 чоловіків та 10 жінок) віком від 27 до 70 років (середній вік – [47,9 ± 3,16] років), які в комплексному лікуванні отримували ЛЕФ і IIІ група – 21 хворий (13 чоловіків і 8 жінок) віком 17-70 років (середній вік – [45,57 ± 3,84] років) – одержували традиційну терапію.
Традиційна терапія передбачала застосування дезінтоксикаційних, антигістамінних, седативних, вазоактивних, нестероїдних протизапальних препаратів, гепатопротекторів, вітамінів за стандартними методиками. Місцево накладали топічні кортикостеїдні, кератолітічні, протизапальні, розсмоктуючі засоби. Використовувалися фізіотерапевтичні методи.
Усі хворі на псоріаз дотримувалися загальних рекомендацій: запобігати переохолоджень, перегрівання, застудних захворювань, стресових ситуацій, необґрунтованого використання лікарських засобів.
2.2 Біохімічні дослідження
Біохімічне обстеження проводилося в лабораторії біохімії ДУ “Інститут дерматології та венерології НАМН України” (свідоцтво про атестацію № 100-166/2013 від 06.06.2013р.).
Біохімічні показники в динаміці спостереження визначали всім 162 хворим на псоріаз та 20 практично здоровим особам за уніфікованими методами [59]. Оцінку одержаних лабораторних досліджень проводили згідно Міжнародної системи одиниць.
Загальний білок визначали біуретовим методом, глюкозу сироватки крові – глюкозооксидазним методом, визначення вмісту білірубіну та його фракцій у сироватці крові – за Йєндрашиком, активність амінотрансфераз у сироватці крові – колориметричним динітрофенілгідразиновим методом за Райтманом, Френкелем [59], СК – за методом Гесса [38], ГП – за методом О.П. Штенберга та Я.І. Доценко [59], визначення сечовини в сироватці крові проводили уреазним методом, креатініну – за методом Яффе з депротеїнізацією [59].
Визначення показників стабільного метаболіту оксида азоту (NO2–) в сироватці крові проводилося за методом W. Sessa [250] з реактивом Гриса [59].
Окремі показники згортальної системи крові досліджено у 135 хворих на псоріаз та у 20 практично здорових осіб. Вміст фібриногену визначали ваговим методом [59], АЧТЧ, РФМК та ПТІ – за стандартними уніфікованими методиками (набори „Технологія-Стандарт”) [59].
2.3 Імуноферментні дослідження
З метою визначення рівня показників цитокінового статусу та імунного запалення у 111 хворих (64 чоловіків і 47 жінок) на тяжкі форми псоріазу в динаміці спостереження та у 51 хворого (33 чоловіків та 18 жінок) на звичайний псоріаз досліджували у сироватці крові вміст прозапального цитокіна (IЛ-1β), протизапального цитокіна (ІЛ-10) та СРБвч. Також у 111 хворих (64 чоловіків і 47 жінок) на тяжкі форми псоріазу до і після лікування та у 51 хворого (33 чоловіків та 18 жінок) на звичайний псоріаз визначали рівень EGF в сироватці крові. Визначені показники порівнювалися з показниками 20 практично здорових осіб.
Забір крові з ліктьової вени в кількості 5 мл здійснювали в ранкові години (8-8:30 год) натще в стерильні пробірки. Сироватку крові відділяли від форменних елементів при центрифугуванні протягом 10 хв при 2500 g, аліквотували і зберігали в мікроцентрифужних пробірках об’ємом 1,5 мл при температурі –20°C до проведення дослідження. Зразки сироватки, в яких досліджували СРБвч зберігали не більше 6 місяців, IЛ-1β, IЛ-10, EGF – не більше 9 місяців.
Дослідження виконувалося в лабораторії алергології ДУ “Інститут дерматології та венерології НАМН України” (свідоцтво про атестацію № 100-053/2015 від 30.03.2015р.).
Методом твердофазного «сендвич»-варіантного імуноферментного аналізу за допомогою комерційних наборів ІФА-БЕСТ виробництва ЗАТ “Вектор-Бест” (Новосибірськ, Російська Федерація) визначали концентрацію IЛ-1β (пг/мл), ІЛ-10 (пг/мл), СРБвч (мг/л), наборів реагентів “ProCon EGF” виробництва ТОВ “Протеіновий контур” (Санкт-Петербург, Російська Федерація) – EGF (пг/мл). Аналізи виконували згідно з інструкціями виробників тест-систем [50, 51, 52, 53].
2.4 Інструментальне обстеження
Для верифікації діагнозу АП хворі підлягали рентгенологічному обстеженню суглобів.
Оцінка стану активності запальних проявів у суглобах методом дистанційної термографії проведена 55 хворим на АП. Обстежено 34 чоловіка (62 %) і 21 жінку (38 %). Середній вік хворих становив (45,22 ± 1,16) років. Серед 55 хворих на АП – 20 (36,4 %) з І (мінімальним) ступенем активності, 22 (40 %) пацієнта з ІІ (середнім) ступенем активності, 11 (20 %) осіб з ІІІ (максимальним) ступенем активності, у 2 (3,6 %) – активність відсутня.
Тепловізійна візуалізація суглобів і периартикулярних тканин проводилася на базі ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України» з використанням матричного тепловізора марки ТК-1, виробленим у фізико-технічному інституті низьких температур ім. Б. В. Вєркіна НАН України (Харків, Україна). Матричний тепловізор марки ТК-1 – сучасний професійний тепловізійний програмно-апаратурний комплекс на основі охолоджуваного багатоелементного приймача з оптико-механічним скануванням 6 покоління, спектральний діапазон 8-14 мкм (рис. 2.1).
Діапазон вимірювальних температур від -40° до +2000°С, чутливість менше 0,1°С. Прилад характеризується високою портативністю та компактністю (вага 1,6 кг з батареєю), що дозволяє здійснювати запис термозображень на карти пам’яті типу Compact Flash, з можливістю синхронного запису текстових та голосових коментарів, із вбудованою кольоровою відеокамерою, включає різноманітні функції аналізу і настройки термозображень в масштабі реального часу. Для зв’язку з персональним комп’ютером використовували цифрові інтерфейси (рис. 2.2).
При аналізі інфрачервоних зображень суглобів та периартикулярних тканин хворого з метою виключення артефактів при діагностиці необхідно враховувати вплив зовнішніх умов, які можуть сильно змінити значення температури шкіри людини і температурну топографію поверхні тіла.

Рисунок 2.1 – Матричний тепловізор марки ТК-1
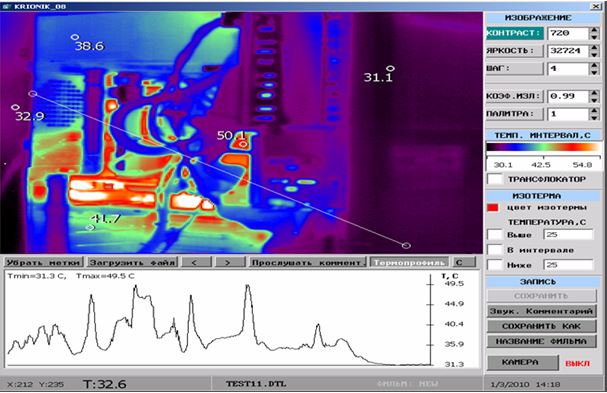
Рисунок 2.2 – Інтерфейс багатоелементного тепловізора ТК-1
Отримані кольорові термограми аналізувалися на кількісному та якісному рівнях, що полягає в оцінці зон гіпертермії та гіпотермії, визначенні температурного градієнту досліджуваної ділянки у порівнянні з оточуючими тканинами або симетричною ділянкою (виявлення термоасиметрії). Діагностичне значення мав температурний градієнт більше 0,60С [57].
2.5 Статистичні методи дослідження
Статистичний аналіз отриманих результатів здійснювався за допомогою стандартного пакета прикладних програм Microsoft Office Excel 2010 та StatSoft Statistica 6.0 [65].
На етапі формування бази даних клініко-лабораторних досліджень для виключення грубих помилок вимірів контролювали відсутність викидів в ряду досліджуваних показників за допомогою критерію варіаційного розмаху і критерію Діксона. Для перевірки гіпотези про нормальність розподілу варіант, виражених у кількісній шкалі, застосовували коефіцієнти асиметрії та ексцесу, а також критерій Шапіро-Уїлка [65]. Обчислялися значення середньої арифметичної (М), середнього квадратичного відхилення (σ), похибки визначення середньої арифметичної (m). Фінальні цифрові дані представляли в такому вигляді: середнє значення ± стандартна похибка середньої величини. За допомогою t-критерію Ст’юдента-Фішера визначали достовірність розходжень (р) порівнюваних групових середніх [92]. Усі порівняння проводилися за довірчої вірогідності р = 95 %, отже у разі отримання обчисленого рівня значущості критеріальної статистики p < 0,05, різниця між групами вважалася значущою.
У разі множинних порівнянь (більше, ніж між двома групами) використовувався багатофакторний дисперсійний аналіз (МANOVA) з обчисленням критерія Крускала-Уолліса або парний критерій із поправкою на множинність порівнянь у формулюванні Дункана [65, 92]. Порівняльний аналіз між групами якісних показників (таких, як стадія, активність, клінічна форма захворювання) здійснювали за допомогою кореляції ρ-Спірмена [65].
Кореляційні залежності між числовими показниками оцінювалися коефіцієнтами кореляції Пірсона у відповідності зі шкалою вимірювання змінних, що розглядалися [65, 92].
РОЗДІЛ З
КЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ НА РІЗНІ КЛІНІЧНІ ФОРМИ ПСОРІАЗУ
Під спостереженням протягом трьох років знаходилося 162 хворих на псоріаз серед яких було 97 чоловіків (59,8 %) та 65 жінок (40,2 %). Співвідношення чоловіків і жінок склало 1,49 : 1. Вік хворих коливався від 16 до 70 років, що характеризує захворюваність у всіх вікових категоріях. У чоловіків середній вік становив (41,61 ± 1,44) рік, а у жінок він був вищий – (50,75 ± 1,75) рік. Тому загальний середній вік (у зв’язку з більшістю хворих чоловіків) становив (45,28 ± 1,17) років.
Розподіл хворих за віком та статтю наведено в табл. 3.1.
Таблиця 3.1 – Розподіл хворих на звичайний псоріаз за віком та статтю
| Вік,
роки |
Хворі на псоріаз | |||||
| чоловіки | жінки | разом | ||||
| абс. | % | абс. | % | абс. | % | |
| до 20 | 5 | 3,01 | 3 | 2,01 | 8 | 4,7 |
| 21-30 | 26 | 16,05 | 5 | 3,01 | 31 | 19,1 |
| 31-40 | 15 | 9,26 | 6 | 3,72 | 21 | 13,1 |
| 41-50 | 19 | 11,73 | 12 | 7,41 | 31 | 19,2 |
| 51-60 | 20 | 12,35 | 24 | 14,81 | 44 | 27,2 |
| більше 60 | 12 | 7,41 | 15 | 9,26 | 27 | 16,7 |
| Всього | 97 | 59,8 | 65 | 40,2 | 162 | 100,0 |
З наведених у таблиці 3.1 даних видно, що серед хворих на псоріаз найбільшу групу (127 пацієнтів – 78,4 %) склали особи працездатного віку – 21-60 років, причому кількість хворих на третьому, четвертому і п’ятому десятиліттях життя була приблизно однаковою. У віці до 20 років псоріаз спостерігався у 8 (4,9 %) хворих, у віці старше 60 років – у 27 (16,7 %) хворих. Аналіз частоти псоріазу у хворих різного віку за статевими ознаками виявив загальну тенденцію збільшення кількості хворих чоловіків у віковій категорії 21-30 років (26 пацієнтів – 16,05 %), жінок – 51-60 років (24 хворих – 14,81 %).
Вік хворих на момент появи перших ознак дерматозу варіював у широких межах – від 3 до 65 років. Слід зазначити, що в середньому дебют захворювання припадав на вік (29,52 ± 1,15) років. При детальному аналізі гендерного розподілу хворих встановлено, що цей показник у чоловіків та жінок відрізнявся незначно: у чоловіків – (27,84 ± 1,3) років, у жінок – (32,09 ± 2,1) роки. Зазначені дані пов’язані з генетичною схильністю, частіше провоковані інфекцією, стресом, загостренням супутньої патології [14, 15].
Псоріаз I типу (у віці до 40 років) визначено у 128 (79,0 %) хворих, II типу (у віці старше 40 років) – 34 (21,0 %) пацієнтів.
Серед хворих на псоріаз були робочі, службовці, студенти, пенсіонери, тимчасово не працюючі. Серед можливих причин виникнення хвороби, встановлених у 91 (56,2 %) хворого, найчастіше вказувався психо-емоційний стрес (67 хворих – 73,6 %), перенесені інфекційні захворювання (гострі респіраторні вірусні інфекції, тонзиліт) – у 24 (26,4 %) хворих. У 71 (43,8 %) пацієнта імовірну причину захворювання не встановлено.
Тривалість хвороби коливалася від двох місяців до 30 і більше років. Середня тривалість захворювання на псоріаз становила (16,16 ± 1,13) років, серед чоловіків – (14,46 ± 1,16) років і серед жінок – (18,76 ± 2,21) років. До 10 років на псоріаз страждав 71 (43,8 %) пацієнт, від 11 до 20 років – 41 (25,4 %), 21-30 років – 29 (17,9 %) хворих, понад 30 років на псоріаз хворіла 21 особа (12,9 %) (рис. 3.1). Пацієнти з тривалістю захворювання до 10 років розподілялися таким чином: від 2 до 6 місяців – 7 осіб, від 7 до 12 місяців – 1, від року до п’яти – 40, від 6 до 10 років – 23 особи. Отже, у досліджуваній групі переважна більшість пацієнтів страждала на дану хворобу до 10 років.
Сімейний характер дерматозу виявлено у 42 (25,9 %) обстежених хворих.
У минулому пацієнти неодноразово лікувалися амбулаторно чи у стаціонарі. Стійкий позитивний ефект попередньої терапії відзначено у 24 (14,81 %) хворих на звичайний псоріаз, короткочасний – у 68 пацієнтів (41,97 %) на різні клінічні форми псоріазу, безперервно рецидивуючий перебіг – у 97 (59,88 %) хворих на псоріаз.
Рисунок 3.1 – Розподіл хворих на псоріаз за тривалістю захворювання
При клініко-анамнестичному обстеженні зимовий тип захворювання (загострення патологічного процесу восени або взимку) відзначено у 84 (51,85 %) хворих, літній (рецидиви навесні або влітку) – у 21 (12,95 %), у решти 57 (35,2 %) пацієнтів відмічали втрату сезонного загострення захворювання (позасезонний тип) (рис. 3.2).
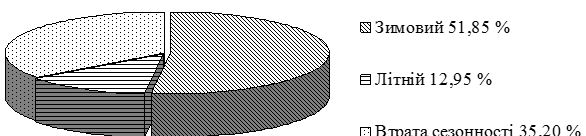
Рисунок 3.2 – Форми захворювання на псоріаз щодо сезонності
Серед 162 хворих на псоріаз у 111 (68,5 %) – спостерігалися тяжкі форми дерматозу (ексудативний, пустульозний, артропатичний псоріаз, псоріатична еритродермія), у 51 (31,5 %) – вульгарний (звичайний) псоріаз. Псоріатичну еритродермію виявлено у 4 хворих (рис. 3.3), ексудативну форму псоріазу – у 18 (рис. 3.4); на АП страждало 89 осіб, серед яких мінімальні шкірні прояви спостерігалися у 36 пацієнтів (рис. 3.5), у 53 хворих – в клінічній картині з боку шкірних проявів переважав розповсюджений процес, а саме: у вигляді псоріатичної еритродермії – у 12 осіб, пустульозного псоріазу – у 6 (рис. 3.6), ексудативної форми псоріазу – у 10 (табл. 3.2).
Таблиця 3.2 – Форми ураження шкіри у хворих на АП
| Форми | Кількість пацієнтів | |
| Абс. | % | |
| Псоріатична еритродермія | 12 | 13,5 |
| Пустульозний псоріаз | 6 | 6,7 |
| Ексудативний псоріаз | 10 | 11,2 |
| Звичайний псоріаз | 25 | 28,1 |
| Мінімальні шкірні прояви | 36 | 40,5 |
| Усього | 89 | 100 |
Наводимо опис клінічного спостереження випадку псоріатичної еритродермії.
Хворий П., 50 років (історія хвороби № 325 від 17.03.14 р.) поступив у клініку зі скаргами на ураження всього шкірного покриву, яке супроводжувалося печінням, помірним свербіжем, вираженним лущенням, сухістю шкіри, а також на загальну слабкість, періодичне підвищення температури тіла до 37,8-38,0 0С.
Хворіє псоріазом на протязі 16 років. Раніше неодноразово лікувався амбулаторно у дерматолога за місцем мешкання. Влітку 2013 року перебіг дерматозу погіршився, висипка покрила весь шкірний покрив, у зв’язку з чим хворий отримав стаціонарне лікування у шкірно-венерологічному диспансері за місцем мешкання, з поліпшенням. У зв’язку із загостренням дерматозу хворого госпіталізовано в стаціонар ДУ «ІДВ НАМН України».
Вірусний гепатит, туберкульоз, венеричні захворювання заперечував. Спадковість та алергоанамнез не обтяжені.
При надходженні у стаціонар загальний стан середньої тяжкості. Температура тіла 37,6°С. Астенічної статури, помірного харчування. Кістково-м’язова система без видимих патологічних змін. Периферичні лімфатичні вузли не збільшені. При аускультації: в легенях дихання везикулярне, тони серця ясні, ритмічні. Частота дихальних рухів (ЧДР) – 18/хв., частота серцевих скорочень (ЧСС) – 83 уд./хв., артеріальний тиск (АТ) – 130/85 мм рт. ст. Живіт при пальпації м’який, безболісний. Печінка пальпувалася по краю реберної дуги, селезінка не пальпувалася. Симптом постукування негативний з обох боків. Сечовиділення, дефекація не порушені (зі слів хворого).
При огляді: дерматоз мав розповсюджений характер, включаючи шкіру обличчя та волосистої частини голови. Ураження були представлені дифузною гіперемією шкіри, інфільтрацією, виразним крупнопластинчатим лущенням, вторинними глибокими тріщинами з геморагічними виділеннями, особливо на шкірі розгинальних поверхонь суглобів, що супроводжувалося вираженими больовими відчуттями (рис. 3.3, а-г).
Дані обстеження.
У клінічному аналізі крові відмічалася прискорена ШОЕ – 25 мм/год., що було свідченням гострозапального процесу.
У біохімічному аналізі крові СРБ – позитивний. Рівень NO2– підвищений – 30,72 мкмоль/л, що також свідчило про гострозапальний процес.
У коагулограмі збільшений вміст фібриногену – 4,88 г/л та РФМК – 5,5 х10-2 г/л, це вказувало на підвищену активність коагуляційної ланки, посилення безперервного внутрішньосудинного згортання крові, як відповіді на системне імунне запалення.
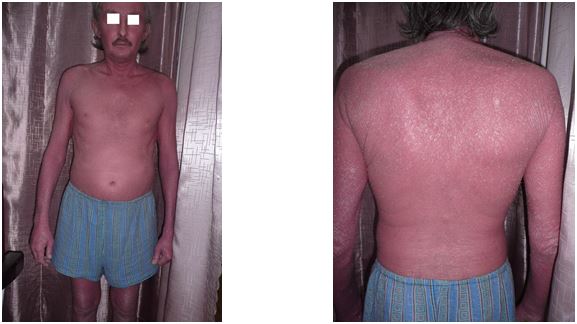
а б
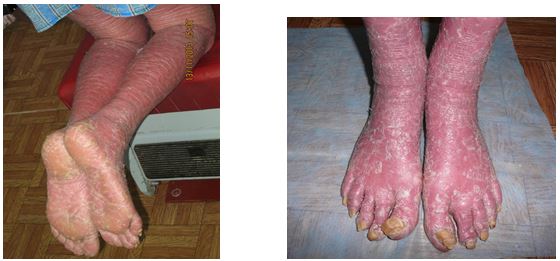
в г
Рисунок 3.3 – Хворий П., 50 років, історія хвороби № 325, діагноз: псоріатична еритродермія
Рівень ІЛ-1β був підвищений до 20,4 пг/мл, а ІЛ-10 знижений до 1,2 пг/мл, що свідчило про розвиток істотного цитокінового дисбалансу. Концентрація EGF збільшена до 513,8 пг/мл, СРБвч – також збільшена 47,4 мг/л, що було свідченням гострозапального процесу, розвитку гіперпроліферації кератиноцитів.
На підставі скарг, даних анамнезу, клініко-лабораторного обстеження поставлений діагноз: «Псоріатична еритродермія».
Наводимо клінічний випадок ексудативного псоріазу.
Хворий С., 42 роки (історія хвороби № 1407 від 25.12.14 р.) поступив у стаціонар зі скаргами на висипання по всьому шкірному покриву, печіння, помірний свербіж, вираженне лущенням у вогнищах висипань.
Хворіє псоріазом протягом 12 років. Раніше, раз на рік, лікувався у стаціонарі обласного шкірно-венерологічного диспансеру, останній курс терапії отримав у вересні 2014 року. Останнє загострення захворювання відмічав на протязі 2-3 тижнів. У зв’язку із загостренням дерматозу хворий поступив на лікування в стаціонар ДУ «ІДВ НАМН України».
Вірусний гепатит, туберкульоз, венеричні захворювання заперечував. Спадковість та алергоанамнез не обтяжені.
При надходженні у стаціонар загальний стан середньої тяжкості. Температура тіла 36,7°С. Правильної статури, помірного харчування. Кістково-м’язова система без видимих патологічних змін. Периферичні лімфатичні вузли не збільшені. При аускультації: в легенях дихання везикулярне, тони серця приглушені, ритмічні. ЧДР – 16/хв., ЧСС – 79 уд./хв., АТ – 130/90 мм рт. ст. Живіт при пальпації м’який, безболісний. Печінка пальпувалася по краю реберної дуги, селезінка не пальпувалася. Симптом постукування негативний з обох боків. Сечовиділення, дефекація не порушені (зі слів хворого).
При огляді: дерматоз мав розповсюджений характер. Представлений множинними папулами, інфільтративно-еритематозними бляшками з ексудативним компонентом, значним лущенням, луско-кірками та кірками на поверхні шкіри тулуба, верхніх і нижніх кінцівок. На п’яточних ділянках стоп – тріщини. Псоріатична тріада була позитивною (рис. 3.4, а-б).
Наводимо дані лабораторного обстеження.
У клінічному аналізі крові відмічалася прискорена ШОЕ – 20 мм/год., що свідчило про гострозапальний процес.
Рівень NO2– був підвищений до 27,88 мкмоль/л.
В коагулограмі збільшений вміст фібриногену до 4,1 г/л та РФМК – до 4,5 х10-2 г/л, що вказувало на підвищення активності коагуляційної ланки, посилення безперервного внутрішньосудинного згортання крові, як відповіді на системне імунне запалення.
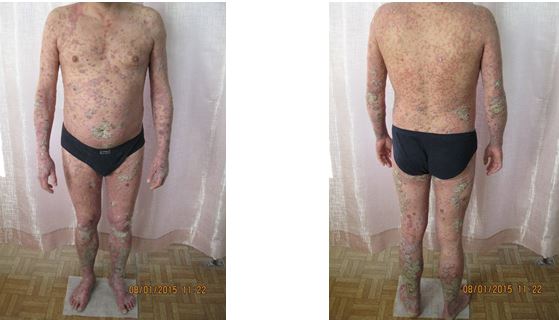
а б
Рисунок 3.4 – Хворий С., 42 роки, історія хвороби № 1407, діагноз: псоріаз розповсюджений, прогресуюча стадія, ексудативна форма
При імунологічному дослідженні рівень ІЛ-1β був збільшеним до 21,3 пг/мл, ІЛ-10 – також підвищеним до 7,9 пг/мл, концентрація EGF була збільшена до 456,8 пг/мл, СРБвч – до 29,3 мг/л, що було свідченням гострозапального процесу та розвитку гіперпроліферації кератиноцитів.
На підставі скарг, даних анамнезу, клініко-лабораторного обстеження хворого, був поставлений діагноз: «Псоріаз розповсюдженний, прогресуюча стадія, ексудативна форма».
Наводимо опис клінічного спостереження випадку АП з мінімальними шкірними проявами.
Хвора Л., 58 років (історія хвороби № 225 від 17.02.15 р.), поступила у стаціонар зі скаргами на висип на шкірі лівого стегна та сідниць, болі у суглобах кистей як у спокої, так і при русі, ранкову скутість в уражених суглобах до 15 хвилин та обмеження рухів у суглобах кистей.
На момент госпіталізації хворіла впродовж 7 років. Захворювання проявлялося обмеженими висипаннями на шкірі тулуба, кінцівок. Через 1 рік після маніфестації захворювання приєдналися болі в суглобах. З 2009 року є інвалідом ІІІ групи по псоріатичній артропатії. Лікувалася у шкірно-венерологічному диспансері за місцем проживання, та в клініці ДУ «ІДВ НАМН України». Останній курс лікування отримала в 2014 році. У зв’язку із загостренням хвороби була госпіталізована до відділення дерматології ДУ «ІДВ НАМН України».
Спадковість не обтяжена, алергічні реакції не виявлені. Вірусний гепатит, туберкульоз, венеричні захворювання заперечує. Хвора страждає близько 3 років на цукровий діабет ІІ типу та гіпертонічну хворобу ІІ ступеня. Приймає гіпотензивні та цукорознижуючі медикаменти.
При обстеженні загальний стан відносно задовільний. Правильної статури, помірного харчування. Температура тіла 36,9°С. Периферичні лімфатичні вузли не збільшені. При аускультації легень везикулярне дихання, хрипів немає, ЧДР 17/хв. При аускультації серця тони приглушені, ритмічні. ЧСС 78 уд./хв., АТ 130/75 мм рт. ст. Живіт при пальпації м’який, безболісний. Печінка пальпується по краю реберної дуги, селезінка не збільшена. Симптом постукування негативний з обох боків. Сечовиділення, дефекація не порушені (зі слів хворої).
При огляді: дерматоз мав обмежений характер. Представлений поодинокими папулами на шкірі сідниць та інфільтративно-еритематозною бляшкою на шкірі розгинальної поверхні нижньої третини лівого стегна із значним сріблястим лущенням. Псоріатична тріада була позитивною. Міжфалангові суглоби кистей набряклі, деформовані, рухи у суглобах обмежені, відмічалася «сосископодібна» конфігурація ІІІ та ІV пальців кистей (рис. 3.5, а-б).
Дані лабораторного та інструментального обстеження.
У клінічному аналізі крові ШОЕ становила 45 мм/год., що свідчило про гострозапальний процес у організмі.
У біохімічному аналізі крові звертав на себе увагу підвищений рівень глюкози натще – 9,5 ммоль/л, відмічався позитивний СРБ, підвищений рівень СК – 241 у.о.,ГП – 0,59 у.о., це свідчило про про наявність запальної реакції.
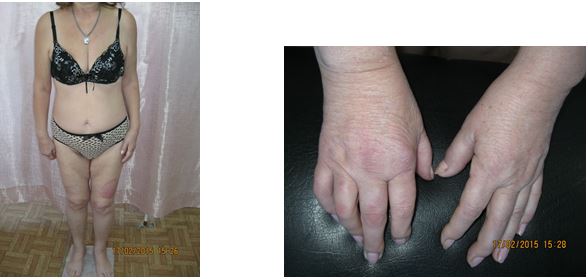
а б
Рисунок 3.5 – Хвора Л., 58 років, історія хвороби № 225, діагноз: псоріаз обмежений, псоріатична артропатія
Рівень NO2– був підвищений до 29,97 мкмоль/л.
В коагулограмі відзначався збільшений вміст фібриногену – 4,88 г/л та РФМК – 6,5 х10-2 г/л, що було ознаками підвищеної активності коагуляційної ланки та внутрішньосудинного згортання крові.
При імунологічному дослідженні рівень ІЛ-1β був істно збільшеним до 45,5 пг/мл, ІЛ-10 – зниженим до 4,9 пг/мл, тобто спостерігався значний цитокіновий дисбаланс. Концентрація EGF була збільшена до 548,9 пг/мл, СРБвч – до 37,7 мг/л, що було свідченням гострозапального процесу та процесів резорбції кісткової тканини.
За даними рентгенографії уражених суглобів від 2014 року псоріатична артропатія.
Для аналізу активності запальних проявів у суглобах та стану мікроциркуляції проводилася ДТ: при дослідженні виявлено гіпертермію в проекції міжфалангових суглобів І-ІV пальців обох кистей зі значенням температурного градієнту (+3,7 0С), симптом «термоапутації» V пальців кистей, гіпотермію стоп з температурним градієнтом (-2,2 0С) і «термоампутацією» І-V пальців обох стоп. Зазначені показники свідчили про наявність у хворої запалення в міжфалангових суглобах І-ІV пальців обох кистей та порушень мікроциркуляції в дістальних відділах кінцівок.
На підставі скарг, даних анамнезу, клініко-лабораторних та інструментальних досліджень був поставлений діагноз: «Псоріаз обмежений, прогресуюча стадія. Псоріатична артропатія дистально-проксимального типу, активність III ст., недостатність функції суглобів – I ст.
Наводимо клінічний випадок пустульозного псоріазу з псоріатичним поліатритом.
Хворий Б., 51 рік (історія хвороби № 180 від 12.02.14 р.), поступив у клініку зі скаргами на висипання на шкірі тулуба, шиї, волосистої частини голови, кінцівок, помірний свербіж, печіння, лущення, а також загальну слабкість, болі у спині, колінних суглобах і суглобах кистей та стоп як у спокої, так і при русі, ранкову скутість в уражених суглобах більше 15 хвилин та обмеження рухів у суглобах.
Хворіє псоріазом більше 30 років. Дерматоз раніше проявлявся обмеженими висипаннями на шкірі тулуба і/або кінцівок. Біль у суглобах з’явився 12 років назад. Хворий лікувався у ревматолога за місцем мешкання. З 2009 року є інвалідом ІІ групи по псоріатичній артропатії. Восени 2013 року перебіг дерматозу погіршився, висип на шкірі тулуба і кінцівок став розповсюджуватись та біль у суглобах збільшився, у зв’язку з чим хворий лікувався у дерматолога за місцем проживання. Останнє загострення захворювання з січня 2014 року, самостійно застосовував кортикостероїдні мазі, з незначним ефектом. У зв’язку з загостренням дерматозу хворий поступив для лікування в ДУ «ІДВ НАМН України».
Спадковість та алергоанамнез не обтяжені. Вірусний гепатит, туберкульоз, венеричні захворювання заперечував.
При надходженні у стаціонар загальний стан середньої тяжкості. Температура тіла 37,3°С. Астенічної статури, помірного харчування. Видимі слизові оболонки звичайного кольору, без висипань. Периферичні лімфатичні вузли не збільшені. При аускультації легень дихання везикулярне, хрипів немає, ЧДР – 18/хв. При аускультації серця тони приглушені, ритмічні. ЧСС – 83 уд./хв., АТ – 125/70 мм рт. ст. Живіт при пальпації м’який, безболісний. Печінка пальпувалася по краю реберної дуги, селезінка не пальпувалася. Симптом постукування негативний з обох боків. Сечовиділення, дефекація не порушені (зі слів хворого).
При огляді: дерматоз мав розповсюджений характер. Представлений на шкірі завушних складок, шиї та волосистої частини голови папульозними елементами з вираженим лущення, на шкірі тулуба, кінцівок – дифузними яскравими еритематозно-набряковими осередками з кірками, на фоні яких розташовані множинні дисеміновані пустульозні елементи, місцями з формуванням гнійних «озер» до 1-3 см у діаметрі, по периферії яких безліч дрібних пустульозних елементів. Нігтьові пластинки кистей, стоп потовщені, деформовані, коричнево-жовтого кольору. Хребет деформований, поза «прохача», колінні суглоби та суглоби кистей, стоп набряклі, рухи у суглобах обмежені, міжфалангові суглоби V пальців кистей деформовані (рис. 3.6, а-є).
Наводимо дані лабораторного та інструментального обстеження.
У клінічному аналізі крові відмічалося зниження кількості еритроцитів до 3,0х1012/л, зниження гемоглобіну до 89 г/л, кольорового показника – 0,74, підвищення кількості лейкоцитів – 16,4х109/л, прискорена ШОЕ – 77 мм/год., що було свідченням гострозапального процесу та розвитку гіпохромної анемії ІІ ступіня тяжкості.
У біохімічному аналізі крові звертав на себе увагу підвищений рівень СК – 226 у.о., ГП – 0,51 у.о., СРБ – позитивний, що свідчило про наявність запальної реакції.
Рівень NO2– був підвищений до 34,64 мкмоль/л.
В коагулограмі відзначався збільшений вміст фібриногену – 8,88 г/л та РФМК – 7,5 х10-2 г/л, це було ознаками підвищеної активності коагуляційної ланки та внутрішньосудинного згортання крові.
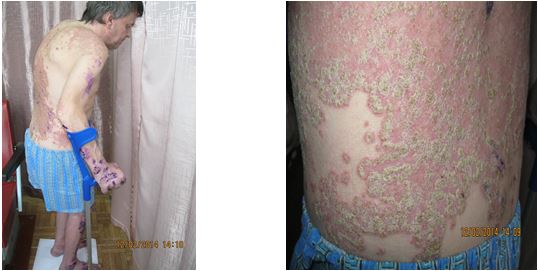
а б
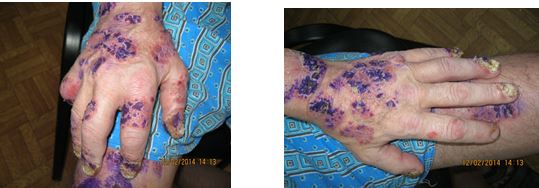
в г
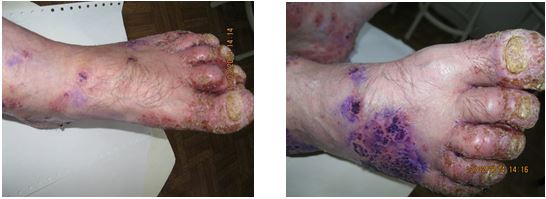
д є
Рисунок 3.6 – Хворий Б., 52 роки, історія хвороби № 180, діагноз: пустульозний псоріаз, псоріатичний поліартрит
При імунологічному дослідженні рівень ІЛ-1β був значно збільшеним – 28,8 пг/мл, ІЛ-10 – зниженим (5,1 пг/мл), тобто спостерігався виражений цитокіновий дисбаланс. Концентрація EGF була збільшена до 709,8 пг/мл, СРБвч – до 69,5 мг/л, що було свідченням гострозапального процесу та як гіперпроліферації кератиноцитів так і процесів резорбції кісткової тканини.
За даними рентгенографії уражених суглобів виявлено ПА.
При ДТ було виявлено: гіпертермію в проекції міжфалангових суглобів І‑ІV пальців обох кистей зі значенням температурного градієнту (+3,9 0С), гіпотермію – в проекції V пальців кистей (температурний градієнт -1,1 0С), гіпертермію – в проекції лівого колінного суглоба зі значенням температурного градієнту (+7,1 0С) та гіпертермію стоп з температурним градієнтом (+7,1 0С). Зазначені показники свідчили про наявність у пацієнта запалення в міжфалангових суглобах І-ІV пальців обох кистей, суглобах стоп та лівого колінного суглобу, а також ознак анкілозірування міжфалангових суглобів V пальців кистей.
На підставі скарг, даних анамнезу, клініко-лабораторних та інструментальних досліджень був поставлений діагноз: «Пустульозний псоріаз. Псоріатичний поліартрит, активність III ст., недостатність функції суглобів – IІІ ст. Супутня патологія: гіпохромна анемія ІІ ступеня».
Діагноз АП у всіх хворих було верифіковано за допомогою інструментальних методів діагностики (рентгенологічних, термографічних, магнітно-резонансної томографії, ультразвукове дослідження суглобів). Ураження шкіри у хворих на АП в 96,63 % випадків передувало в середньому на 9-10 років залученню до патологічного процесу кісток та суглобів, у 3 хворих (3,37 %) дебют захворювання починався з суглобового синдрому. До факторів, що провокували виникнення захворювання опорно-рухового апарату при псоріазі, за свідченням хворих, належали промислові та побутові травми суглобів, переохолодження, психоемоційні та фізичні перевантаження, загострення хронічних захворювань, оперативні втручання та перенесені інфекційні хвороби.
Ураження нігтьових пластинок кистей та стоп у вигляді “наперстка”, “масляної плями”, піднігтьового гіперкератозу, подовжньої і поперечної покресленості, потовщення нігтьових пластин виявлено у 82 (50,6 %) хворих.
Частота рецидивів менше 1 разу на поточний рік (1 раз на декілька років) встановлена у 12 (7,4 %) хворих, 1 раз на рік у 56 (34,6 %) пацієнтів та більше 1 разу на рік (два, три) – у 94 (58 %) хворого. З можливих причин загострення захворювання найчастіше, на думку пацієнтів, були нервово-психічні перевантаження (92 хворих – 56,8 %), застудні захворювання – гострі респіраторні вірусні інфекції, грип, бронхіт (9 хворих – 5,6 %), загострення хронічних захворювань – гайморит, тонзиліт та ін. (17 хворих – 10,5 %), аліментарні похибки (7 хворих – 4,3 %) та ін. У 37 (22,8 %) хворих з’ясувати причину загострення не вдалося (рис. 3.7).
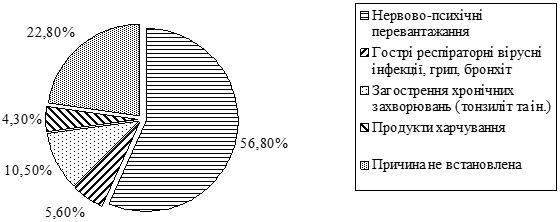
Рисунок 3.7 – Причини загострення псоріазу
Супутня патологія мала місце практично у всіх спостережуваних осіб з псоріазом. Найчастіше відзначалися: хвороби шлунково-кишкового тракту (шлунка, підшлункової залози та гепатобіліарної системи) – у 54 (33,3 %) хворих, захворювання серцево-судинної системи (ішемічна хвороба серця, гіпертонічна хвороба) – у 68 (41,9 %), дихальної системи (хронічний бронхіт) – 3 (1,8 %), ендокринної системи – 2,5 %: автоімунний тиреоїдит (у 1 пацієнта), цукровий діабет II типу (у 3 пацієнтів), жіночої статевої системи (міома матки) у 2 пацієнток (1,2 %), патологія сечовивідної системи (сечокам’яна хвороба) – у 10 (6,2 %), у 22 пацієнтів (13,6 %) визначалася поєднана патологія. Всі хронічні захворювання внутрішніх органів були в стадії клінічної ремісії.
У клінічній картині шкірного процесу спостерігалися обмежені (22,2 %), поширені (46,9 %) дрібно- та крупнобляшкові папульозні висипи, пустули (3,7 %), вогнища з ексудативним компонентом (17,3 %), еритродермія (9,9 %). Тяжкість та розповсюдженість шкірного процесу у хворих на псоріаз оцінювалася за індексами BSA та PASI, які коливалися від 2 до 88 % та 3,6 до 65 балів відповідно. В середному у хворих на псоріаз індекс BSA складав (25,77 ± 1,67) %, індекс PASI – (20,24 ± 1,15) балів; середне значення індексів BSA та PASI у хворих по групах відповідно розподілилося таким чином: в Іа підгрупі – (41,65 ± 2,02) % і (31,92 ± 1,35) балів, Іб – (6,78 ± 0,38) % і (6,96 ± 0,3) балів, Ів – (53,16 ± 3,95) % і (38,14 ± 2,52) балів і в ІІ групі – (10,86 ± 0,27) % і (9,75 ± 0,29) балів. Серед 162 пацієнтів з псоріазом, у 70 (43,3 %) – спостерігався легкий ступінь патологічного процесу (хворі на АП з мінімальними шкірними проявами і пацієнти на звичайний псоріаз), у 53 (32,7 %) – середній ступінь (хворі на звичайний псоріаз і тяжкі форми дерматозу), у 39 (24 %) – тяжкий ступінь патологічного процесу (особи з тяжкими формами дерматозу). За клінічною формою дерматозу та ступенем тяжкості пацієнти розподілялися таким чином: І (основна) группа (особи з тяжкими формами псоріазу), серед них з І (легким) ступенем – 36 хворих, з ІІ (середнім) ступенем – 36, з ІІІ (тяжким) ступенем – 39; ІІ група (група порівняння, хворі на звичайний псоріаз), з яких з І (легким) ступенем – 34 особи, з ІІ (середнім) ступенем – 17, з ІІІ (тяжким) ступенем хворих не було. В середньому індекси BSA та PASI, залежно від ступеня тяжкості захворювання по групах склали: у хворих І групи з І ступенем тяжкості – (6,78 ± 0,38) % і (6,96 ± 0,3) бали, з ІІ ступенем тяжкості – (32,5 ± 1,13) % та (25,25 ± 0,55) бала, з ІІІ ступенем тяжкості – (56,59 ± 2,33) % і (41,58 ± 1,46) балів відповідно; у пацієнтів ІІ групи з І ступенем тяжкості – (9,85 ± 0,23) % та (8,56 ± 0,22) балів, з ІІ ступенем тяжкості – (12,88 ± 0,34) % і (12,15 ± 0,87) бала відповідно.
Хворі на АП за ступенем активності суглобового синдрому розподілялися наступним чином: відсутність активності – у 2 пацієнтів (2,2 %), з І (мінімальним) ступенем активності – 28 осіб (31,5 %), з ІІ (середнім) ступенем активності – 39 (43,8 %), ІІІ (високим) ступенем активності – 20 осіб (22,5 %) (табл. 3.3).
Таблиця 3.3 – Розподіл хворих на АП за ступенем активності суглобового синдрому
| Ступінь активності суглобового синдрому |
Кількість пацієнтів | |
| Абс. | % | |
| І | 28 | 31,5 |
| ІІ | 39 | 43,8 |
| ІІІ | 20 | 22,5 |
| Немає активності | 2 | 2,2 |
| Усього | 89 | 100 |
Для оцінки вираженості болю у суглобах хворими на АП застосовувалась ВАШ. Індекс ВАШ варіював від 4 до 10 см, та в середньому по групах складав: в Іа підгрупі – (6,47 ± 0,21) см, Іб – (6,33 ± 0,23) см.
Залежно від форми захворювання пацієнти з АП і мінімальними шкірними проявами розподілялися на дві групи: з переважанням запальних проявів у сполучній тканині та з переважанням дегенеративно-дистрофічних змін у суглобах (табл. 3.4).
Таблиця 3.4 – Характеристика хворих на АП за формою захворювання
| Форма АП | Кількість пацієнтів | |
| Абс. | % | |
| АП з переважанням запальних проявів у сполучній тканині | 15 | 41,7 |
| АП з переважанням дегенеративно-дистрофічних проявів у сполучній тканині | 21 | 58,3 |
| Усього | 36 | 100 |
Оцінка негативного впливу захворювання на якість життя хворих, в динаміці спостереження, проводилася за визначенням дерматологічного індексу якості життя (DLQI) [96], який коливався від 9 до 30 балів [68]. В середньому у хворих на псоріаз індекс DLQI складав (17,69 ± 0,42) бали. Середне значення індекса DLQI по групах складало: в Іа підгрупі – (21,77 ± 0,65) бали, Іб – (13,47 ± 0,38) бали, Ів – (21,73 ± 1,1) бали і в ІІ групі – (14,69 ± 0,31) бали [85].
* * *
При вивченні клінічних проявів псоріазу виявлено високу частоту захворювання серед осіб працездатного віку (127 пацієнтів – 78,4 %), незначне переважання (в 1,49 разу) чоловіків серед обстежених хворих. Дебют дерматозу в середньому відбувався у віці 27-32 роки та йому у більшості випадків передували психо-емоційне перевантаження, перенесені інфекції. Найчисельнішу групу склали хворі з тривалістю захворювання на момент обстеження до 10 років (71 пацієнт – 43,8 %). Індекси BSA та PASI в середньому склали (25,77 ± 1,67) % і (20,24 ± 1,15) балу відповідно, індекс DLQI – (17,69 ± 0,42) балу. У 51,85 % хворих відзначено зимовий тип псоріазу, у 12,95 % – літній та у 35,20 % – невизначений (позасезонний) хворих. Супутню патологію мали майже всі пацієнти, найчастіше діагностувалися захворювання серцево-судинної системи та хвороби шлунково-кишкового тракту, у 22 хворих визначено поєднану патологію.
Таким чином, дані анамнезу клінічної картини хворих на псоріаз, особливо на тяжкі форми захворювання, що характеризуються негативним патоморфозом перебігу на сучасному етапі, спонукають фахівців до вивчення клінічних особливостей і вдосконалення сучасних методів адекватної терапії вже на початкових етапах захворювання з метою попередження розвитку тяжкого патологічного процесу і профілактики інвалідизації пацієнтів.
Зміст розділу відображено в наступних публікаціях:
1. Коморбидная патология у больных тяжёлыми формами псориаза / Я.Ф. Кутасевич, И.А. Олейник, А.А. Гаврилюк, В. П. Матюшенко // Молоді науковці – майбутнє української дерматовенерології : Матеріали науково-практичної школи, м. Київ, 20-21 листопада 2014 р. – К., 2014. – С. 35-36.
2. Дифференциальная диагностика псориатической ониходистрофии с онихомикозом и подногтевого кровоизлияния с меланомой / Я.Ф. Кутасевич, И.А. Олейник, А.С. Чеховская, А.А. Гаврилюк // Дерматологія та венерологія. – 2014. – № 2 (64) – С. 71-76.
РОЗДІЛ 4
ІМУНОЛОГІЧНІ ТА БІОХІМІЧНІ ПОРУШЕННЯ У ХВОРИХ
НА РІЗНІ КЛІНІЧНІ ФОРМИ ПСОРІАЗУ
4.1 Характеристика цитокінового статусу хворих на псоріаз залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому
Маніфестація шкірних і суглобових проявів при псоріазі являє собою підсумок тривалого запального процесу, який супроводжується розвитком складних патоімунних і метаболічних механізмів.
Найбільш важливими регуляторами запальної реакції є цитокіни (прозапальні – ІЛ-1α і β, ІЛ-6, TNFα та ін., протизапальні – ІЛ-4, ІЛ-5 ІЛ-10 та ін), яким належить одна з ключових ролей у виникненні псоріазу. Існуючі відомості щодо експресії та ролі ключових про- та протизапальних цитокінів (TNFα, ІЛ-1β, INFγ, ІЛ-8, ІЛ-10, ІЛ-4 та ін.) при псоріазі суперечливі. Якщо в псоріатичній папулі встановлено підвищений вміст прозапальних цитокінів, то дані про рівень про- і протизапальних цитокінів у периферичній крові залишаються доволі неоднозначними [110]. Ряд робіт вказує на переважання рівня прозапальних цитокінів і відносно низьку експресію протизапальних цитокінів, що передбачає недостатню протирегулюючу здатність імунологічної системи [63, 76, 82, 108, 139, 142, 217, 218, 226]. Інші автори висловлюють думку про відносну антизапальну поляризацію цитокінового спектру з переважанням ІЛ-4, ІЛ-5, ІЛ-10 при даному захворюванні [12, 44, 48, 49, 63, 105, 110, 119, 139, 218, 232]. У зв’язку з цим доцільно проводити визначення рівня ключових прозапального (ІЛ-1β) та протизапального (ІЛ-10) цитокінів з метою вивчення характеру цитокінового дисбалансу у пацієнтів на різні клінічні форми псоріазу, залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому.
Рівень ІЛ-1β у сироватці крові хворих на псоріаз коливався в широких межах – від 10,5 до 47,8 пг/мл, ІЛ-10 – від 0,9 до 10,8 пг/мл, у практично здорових осіб – (1,6-10,4) пг/мл та (0,9-7,2) пг/мл відповідно.
Результати проведеного дослідження цитокінів ІЛ-1β і ІЛ-10 наведені в таблиці 4.1.
Таблиця 4.1 – Рівень цитокінів ІЛ-1β та ІЛ-10 у крові хворих на псоріаз, залежно від клінічної форми захворювання (M ± m)
| Групи обстеження | Показник | ||
| ІЛ-1β, пг/мл | ІЛ-10, пг/мл | ІЛ-1β/ІЛ-10 | |
| Хворі на тяжкі форми псоріазу:
Іа підгрупа, n=53 Іб підгрупа, n=36 Ів підгрупа, n=22 І група, n=111 |
19,17 ± 0,573,хххх 26,78 ± 1,643,хххх 22,46 ± 0,893,хххх 22,29 ± 0,73,хххх |
4,51 ± 0,25ххх 4,25 ± 0,2хххх 5,06 ± 0,45х 4,53 ± 0,16хххх |
5,4 ± 0,552,хххх
7,13 ± 0,733,хххх 6,38 ± 1,391,ххх 6,16 ± 0,452,хххх |
| Хворі на звичайний псоріаз: ІІ група, n=51 | 15,44 ± 0,463 | 5,95 ± 0,262 | 2,81 ± 0,132 |
| Практично здорові особи: ІІІ група, n=20 | 4,48 ± 0,65 | 4,13 ± 0,54 | 1,55 ± 0,29 |
Примітка. Відмінності з контрольною групою при р < 0,01 – 1, р < 0,001 – 2, р < 0,0001 – 3, відмінності з ІІ групою при р < 0,05 – х, р < 0,01 – хх, р < 0,001 – ххх , р < 0,0001 – хххх.
Як свідчать дані таблиці 4.1, у всіх хворих на псоріаз (І та ІІ групи) рівень прозапального цитокіну ІЛ-1β достовірно збільшений (p < 0,0001) порівняно з контрольною групою. У пацієнтів Іа підгрупи вміст ІЛ-1β збільшений у 4,3 разу (p < 0,0001), Іб – у 5,9 разу (p < 0,0001), Ів – у 5,01 разу (p < 0,0001), у осіб ІІ групи – у 3,4 разу (p < 0,0001).
Слід зазначити, що у пацієнтів з тяжкими формами псоріазу (І група) вміст ІЛ-1β у сироватці крові достовірно вищий (р < 0,0001), ніж у хворих на звичайний псоріаз (ІІ група), що свідчить про більш виражений прозапальний зсув імунорегуляторних процесів і активацію запалення при тяжких формах захворювання. Аналіз середньостатистичних значень ІЛ-1β залежно від ступеня тяжкості дерматозу дозволив виявити збільшення даного показника зі збільшенням площі та вираженості запальних змін (табл. 4.2).
Таблиця 4.2 – Рівень цитокінів ІЛ-1β та ІЛ-10 у крові хворих на псоріаз, залежно від ступеня тяжкості захворювання (M ± m)
| Групи обстеження | Показник | ||
| ІЛ-1β, пг/мл | ІЛ-10, пг/мл | ІЛ-1β/ІЛ-10 | |
| Хворі на тяжкі форми псоріазу з різним ступенем
тяжкості, І (основна) група: І (легкий ступінь), n = 36 ІІ (середній ступінь), n = 36 ІІІ (тяжкий ступінь), n = 39 |
26,78 ± 1,64
19,11 ± 0,72 21,08 ± 0,714 |
4,25 ± 0,2
4,92 ± 0,241 4,44 ± 0,36 |
7,13 ± 0,73 4,27 ± 0,312 6,99 ± 1,03 |
| Хворі на звичайний псоріаз з різним ступенем тяжкості, ІІ група (порівняння):
І (легкий ступінь), n = 34 ІІ (середній ступінь), n = 17 |
15,13 ± 0,63
16,05 ± 0,57 |
2,62 ± 0,16
3,19 ± 0,235 |
6,24 ± 0,35
5,36 ± 0,33 |
Примітка. Відмінності між І і ІІ ступенями тяжкості І групи при р1 < 0,05 – 1, р1 < 0,001 – 2, відмінності між ІІ і ІІІ ступенями тяжкості І групи при р2 < 0,05 – 3, відмінності між І і ІІІ ступенями тяжкості І групи при р3 < 0,01 – 4, відмінності між І і ІІ ступенями тяжкості ІІ групи при р4 < 0,05 – 5.
У хворих на АП (Іа, Іб підгрупи) рівень ІЛ-1β у сироватці крові достовірно (р < 0,05, р < 0,01) зростав зі збільшенням ступеня активності суглобового синдрому (рис. 4.1), також у осіб Іа підгрупи, показник ІЛ-1β наростав зі збільшенням площі та вираженості запальних змін. Вміст ІЛ-1β, як видно на рис. 4.1, був достовірно вищим (р < 0,01) у пацієнтів з АП і мінімальними шкірними проявами, порівняно з показником у хворих на АП та поширеним тяжким ураженням шкіри.
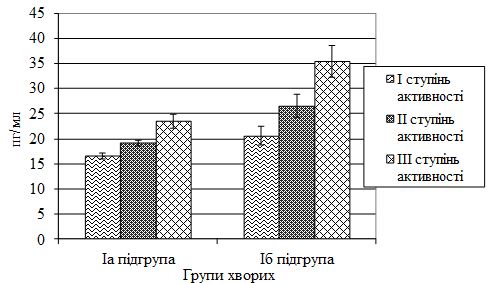
Рисунок 4.1 – Рівень ІЛ-1β у сироватці крові хворих на АП залежно від ступеня активності суглобового синдрому (р < 0,05, p < 0,01)
Враховуючи, що ІЛ-1β активує хондроцити, остеобласти, збільшуючи експресію матриксних металопротеїназ, агреканаз, катепсину К, що нарешті призводить до деструкції хряща і резорбції кістки [44, 129, 193, 201, 242], найбільш високий показник ІЛ-1β у хворих Іб підгрупи розцінювався як фактор, що впливає на процеси резорбції кісткової тканини при псоріазі.
При дослідженні протизапального цитокіну ІЛ-10 (табл. 4.1), який має антипсоріатичну дію [76], встановлено його достовірне підвищення у пацієнтів ІІ групи відносно осіб контрольної групи в 1,44 разу (p < 0,001). Виявлено тенденцію до підвищення вмісту ІЛ-10 у хворих на тяжкі форми псоріазу (І група) порівняно з показником контрольної групи (p > 0,05). У порівняні з показником ІІ групи рівень ІЛ-10 у осіб з тяжкими формами псоріазу (І група) достовірно нижчий (p < 0,0001): так у пацієнтів Іа, Іб та Ів підгруп відповідно нижче в 1,3, 1,4 та 1,17 разу (p < 0,001, p < 0,0001, p < 0,05), що також свідчить про порушення імунорегуляторних процесів зі зрушенням у бік Th-1 ланки імунної відповіді і активації запалення при тяжких формах захворювання, розвитку недостатньої протирегулюючої здатності імунологічної системи. Рівень ІЛ-10 залежно від ступеня тяжкості хвороби мав тенденцію до підвищення (табл. 4.2). Аналіз середньостатистичних значень данного показника у осіб з АП (Іа, Іб підгрупи) залежно від ступеня активності суглобового синдрому дозволив виявити достовірне (р < 0,05, p < 0,01) його зниження зі збільшенням ступеня активності, при цьому рівень ІЛ-10 у хворих на АП як з поширеним тяжким ураженням шкіри так і з мінімальними шкірними проявами був майже однаковим (рис. 4.2).
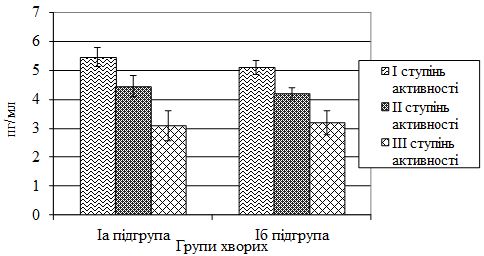
Рисунок 4.2 – Рівень ІЛ-10 у сироватці крові хворих на АП залежно від ступеня активності суглобового синдрому (р < 0,05, p < 0,01)
Наявність найнижчих показників вмісту ІЛ-10 у хворих на АП із III ступенем активності суглобового синдрому, розцінювалася як розвиток його недостатньої протирегулюючої дії на процеси резорбції кісткової тканини. Підставою для цієї точки зору є дані літератури, згідно з якими ІЛ-10 знижує секрецію колагену, матриксних металопротеїназ, впливає на диференціацію / активацію остеокластів, блокуючи остеокластогенез [157, 190, 201].
Отримані дані підтверджують думку ряду дослідників, які вказують на переважання при псоріазі рівня прозапальних цитокінів у периферичній крові і порушення імунорегуляторних процесів зі зрушенням у бік Th-1 ланки імунної відповіді [44, 76, 80, 108, 139, 217, 227].
Характерною особливістю імунологічних змін у хворих на псоріаз було порушення співвідношення ІЛ-1β/ІЛ-10. У всіх пацієнтів із псоріазом (І та ІІ групи) співвідношення ІЛ-1β/ІЛ-10 достовірно (р < 0,001) підвищувалося порівняно з показником контрольної групи (табл. 4.1). Співвідношення ІЛ-1β/ІЛ-10 у хворих Іа підгрупи підвищувалося в 3,48 разу (р < 0,001), Іб – в 4,6 разу (р < 0,0001), Ів – в 4,11 разу (р < 0,01), ІІ – в 1,8 разу (р < 0,001). У хворих на тяжкі форми псоріазу (І група) співвідношення ІЛ-1β/ІЛ-10 достовірно вище (р < 0,0001) відносно аналогічного показника у пацієнтів ІІ групи. Залежно від ступеня тяжкості захворювання виявлено зворотньопропорційну залежність: співвідношення ІЛ-1β/ІЛ-10 знижувалося зі збільшенням ступеня тяжкості дерматозу (табл. 4.2). Вивчення співвідношення ІЛ-1β/ІЛ-10 у пацієнтів з АП залежно від ступеня активності суглобового синдрому виявило достовірне зростання (р < 0,05, р < 0,01, р < 0,001) даного показника зі збільшенням ступеня активності (табл. 4.3).
Таблиця 4.3 – Співвідношення ІЛ-1β/ІЛ-10 у хворих на АП залежно від ступеня активності суглобового синдрому (M ± m)
| Показник | Іа підгрупа | Іб підгрупа | ||||
| І ступінь | ІІ ступінь | ІІІ ступінь | І ступінь | ІІ ступінь | ІІІ ступінь | |
| ІЛ-1β/ ІЛ-10 |
3,34±0,38 | 4,86±0,351 | 10,03±1,92,3 | 4,21±0,53 | 6,33±0,384 | 12,36±1,865,6 |
Примітка. Відмінності між І і ІІ ступенями активності Іа підгрупи при р1 < 0,01 – 1, відмінності між ІІ і ІІІ ступенями активності Іа підгрупи при р2 < 0,05 – 2, відмінності між І і ІІІ ступенями активності Іа підгрупи при р3 < 0,001 – 3, відмінності між І і ІІ ступенями активності Іб підгрупи при р4 < 0,001 – 4, відмінності між ІІ і ІІІ ступенями активності Іб підгрупи при р5 < 0,001 – 5, відмінності між І і ІІІ ступенями активності Іб підгрупи при р6 < 0,001 – 6.
Отже зі збільшенням ступеня тяжкості дерматозу і активності суглобового синдрому в периферичному кровотоці істотно збільшувався вміст прозапального цитокіну (ІЛ-1β) і зменшувався рівень протизапального цитокіну (ІЛ-10), що уточнює літературні дані про характер цитокінового дисбалансу при псоріазі [44, 76, 80, 108, 139, 142, 217, 227].
Таблиця 4.4 – Вміст цитокінів ІЛ-1β та ІЛ-10 у крові хворих на різні форми АП (M ± m)
| Форма АП | Показник | ||
| ІЛ-1β, пг/мл | ІЛ-10, пг/мл | ІЛ-1β/ІЛ-10 | |
| Хворі на АП з переважанням запальних проявів у сполучній тканині, n=15 | 33,49 ± 2,491,2 | 3,88 ± 0,33 | 9,86 ± 1,381,2 |
| Хворі на АП з переважанням дегенеративно-дистрофічних проявів у сполучній тканині, n=21 | 21,99 ± 1,491 | 4,51 ± 0,23 | 5,18 ± 0,441 |
| Практично здорові особи: ІІІ група, n=20 | 4,48 ± 0,65 | 4,13 ± 0,54 | 1,55 ± 0,29 |
Примітка: 1 – p1 < 0,0001 відмінності відносно групи практично здорових осіб, 2 – p2 > 0,001 відмінності відносно групи хворих на псоріатичний остеоартроз з переважанням дегенеративно-дистрофічних проявів у сполучній тканині (відмінностей не виявлено)
Аналіз середньостатистичних значень цитокінів ІЛ-1β і ІЛ-10, а також їх співвідношення (ІЛ-1β/ІЛ-10) у осіб на різні форми АП (табл. 4.4) виявив достовірне збільшення рівня ІЛ-1β в 1,52 разу (p < 0,001), співвідношення ІЛ-1β/ІЛ-10 в 1,9 разу (p < 0,001) у хворих на АП з переважанням запальних проявів у сполучній тканині порівняно з пацієнтами з переважанням дегенеративно-дистрофічних змін у суглобах. Рівень ІЛ-10 мав лише тенденцію до зниження у осіб з АП і переважанням запальних проявів порівняно з пацієнтами з переважанням дегенеративно-дистрофічних змін. При обох формах АП відзначалося статистично достовірне підвищення рівня ІЛ-1β в 7,47 і 4,9 разу відповідно (p < 0,001, p < 0,0001), співвідношення ІЛ-1β/ІЛ-10 – у 6,36 і 3,34 разу (p < 0,001) та спостерігалася тенденція до підвищення вмісту ІЛ-10 порівняно з аналогічними показниками контрольної групи.
Кореляційний аналіз з визначенням коефіцієнта кореляції Пірсона встановив існування кореляційних зв’язків у хворих на псоріаз між ІЛ-1β, ІЛ-10 та іншими показниками (табл. 4.5, 4.6, 4.7, 4.8).
Таблиця 4.5 – Кореляційний взаємозв’язок між імунологічними (ІЛ-1β, ІЛ-10, EGF, СРБвч), біохімічними показниками і індексом PASI у хворих Іа підгрупи
| ІЛ-1β | ІЛ-10 | СК | ГП | NO2– | СРБвч | EGF | PASI | |
| ІЛ-1β | 1,00 | -0,29х,4 | 0,64*,2 | 0,53*,2 | 0,29х,4 | 0,33х,3 | 0,45*,3 | 0,24 |
| ІЛ-10 | -0,29х,4 | 1,00 | -0,27 | -0,37*,3 | -0,02 | -0,29х,4 | -0,11 | -0,14 |
| СК | 0,64*,2 | -0,27 | 1,00 | 0,86*,1 | 0,18 | 0,27х,4 | 0,51*,2 | 0,17 |
| ГП | 0,53*,2 | -0,37*,3 | 0,86*,1 | 1,00 | 0,07 | 0,24 | 0,40*,3 | 0,12 |
| NO2– | 0,29х,4 | -0,02 | 0,18 | 0,07 | 1,00 | 0,26 | 0,32х,3 | 0,21 |
| СРБвч | 0,33х,3 | -0,29х,4 | 0,27х,4 | 0,24 | 0,26 | 1,00 | 0,33х,3 | 0,26 |
| EGF | 0,45*,3 | 0,11 | 0,51*,2 | 0,40*,3 | 0,32х,3 | 0,33х,3 | 1,00 | 0,33х,3 |
| PASI | 0,24 | -0,14 | 0,17 | 0,12 | 0,21 | 0,26 | 0,33х,3 | 1,00 |
Примітка. * – r < 0,01; х – r < 0,05; 1 – сильна кореляція (r > 0,7), 2 – кореляція середньої сили (r > 0,5), 3 – помірна кореляція (r > 0,3), 4 – слабка кореляція (r > 0,2)
Таблиця 4.6 Кореляційний взаємозв’язок між імунологічними (ІЛ-1β, ІЛ‑10, EGF, СРБвч), біохімічними показниками і індексом PASI у хворих Іб підгрупи
| ІЛ-1β | ІЛ-10 | СК | ГП | NO2– | СРБвч | EGF | PASI | |
| ІЛ-1β | 1,00 | -0,16 | 0,45*,3 | 0,40х,3 | 0,57*,2 | 0,69*,2 | 0,25 | -0,26 |
| ІЛ-10 | -0,16 | 1,00 | -0,25 | -0,21 | -0,50*,2 | -0,23 | -0,28 | 0,11 |
| СК | 0,45*,3 | -0,25 | 1,00 | 0,89*,1 | 0,66*,2 | 0,56*,2 | 0,41х,3 | 0,03 |
| ГП | 0,40х,3 | -0,21 | 0,89*,1 | 1,00 | 0,48*,3 | 0,51*,2 | 0,40х,3 | 0,03 |
| NO2– | 0,57*,2 | -0,50*,2 | 0,66*,2 | 0,48*,3 | 1,00 | 0,63*,2 | 0,31 | -0,12 |
| СРБвч | 0,69*,2 | -0,23 | 0,56*,2 | 0,51*,2 | 0,63*,2 | 1,00 | 0,42х,3 | -0,22 |
| EGF | 0,25 | 0,28 | 0,41х,3 | 0,40х,3 | 0,31 | 0,42х,3 | 1,00 | 0,06 |
| PASI | 0,26 | 0,11 | 0,03 | 0,03 | -0,12 | -0,22 | 0,06 | 1,00 |
Примітка. * – r < 0,01; х – r < 0,05; 1 – сильна кореляція (r > 0,7), 2 – кореляція середньої сили (r > 0,5), 3 – помірна кореляція (r > 0,3)
Таблиця 4.7 – Кореляційний взаємозв’язок між імунологічними (ІЛ-1β, ІЛ-10, EGF, СРБвч), біохімічними показниками і індексом PASI у хворих Ів підгрупи
| ІЛ-1β | ІЛ-10 | СК | ГП | NO2– | СРБвч | EGF | PASI | |
| ІЛ-1β | 1,00 | 0,04 | 0,27 | 0,2 | 0,26 | 0,53х,2 | 0,58*,2 | 0,31 |
| ІЛ-10 | 0,04 | 1,00 | -0,21 | -0,20 | -0,49х,3 | -0,49х,3 | -0,34 | -0,41 |
| СК | 0,27 | -0,21 | 1,00 | 0,94*,1 | 0,60*,2 | 0,29 | 0,44х,3 | 0,21 |
| ГП | 0,2 | -0,20 | 0,94*,1 | 1,00 | 0,55*,2 | 0,22 | 0,38 | 0,21 |
| NO2– | 0,26 | -0,49х,3 | 0,60*,2 | 0,55*,2 | 1,00 | 0,62*,2 | 0,61*,2 | 0,58*,2 |
| СРБвч | 0,53х,2 | -0,49х,3 | 0,29 | 0,22 | 0,62*,2 | 1,00 | 0,71*,1 | 0,40 |
| EGF | 0,58*,2 | -0,34 | 0,44х,3 | 0,38 | 0,61*,2 | 0,71*,1 | 1,00 | 0,42х,3 |
| PASI | 0,31 | -0,41 | 0,21 | 0,21 | 0,58*,2 | 0,40 | 0,42х,3 | 1,00 |
Примітка. * – r < 0,01; х – r < 0,05; 1 – сильна кореляція (r > 0,7); 2 – кореляція середньої сили (r > 0,5); 3 – помірна кореляція (r > 0,3)
Таблиця 4.8 – Кореляційний взаємозв’язок між імунологічними (ІЛ-1β, ІЛ-10, EGF, СРБвч), біохімічними показниками і індексом PASI у хворих ІІ групи
| ІЛ-1β | ІЛ-10 | СК | ГП | NO2– | СРБвч | EGF | PASI | |
| ІЛ-1β | 1,00 | 0,12 | 0,09 | 0,01 | 0,2 | 0,11 | 0,03 | 0,36*,2 |
| ІЛ-10 | 0,12 | 1,00 | 0,02 | -0,09 | 0,19 | -0,18 | -0,06 | -0,23 |
| СК | 0,09 | 0,02 | 1,00 | 0,62*,1 | 0,20 | 0,16 | 0,04 | -0,02 |
| ГП | 0,01 | -0,09 | 0,62*,1 | 1,00 | 0,30х,2 | -0,02 | -0,16 | -0,07 |
| NO2– | 0,2 | 0,19 | 0,20 | 0,30х,2 | 1,00 | -0,08 | 0,16 | 0,18 |
| СРБвч | 0,11 | -0,18 | 0,16 | -0,02 | -0,08 | 1,00 | 0,36*,2 | 0,24 |
| EGF | 0,03 | 0,06 | 0,04 | -0,16 | 0,16 | 0,36*,2 | 1,00 | 0,37*,2 |
| PASI | 0,36*,2 | -0,23 | -0,02 | -0,07 | 0,18 | 0,24 | 0,37*,2 | 1,00 |
Примітка. * – r < 0,01; х – r < 0,05; 1 – кореляція середньої сили (r > 0,5), 2 – помірна кореляція (r > 0,3)
При проведенні кореляційного аналізу встановлено існування наступних кореляційних зв’язків (табл. 4.5-4.8) між ІЛ-1β, ІЛ-10 та іншими показниками: у хворих на тяжкі форми псоріазу між ІЛ-1β і біохімічними параметрами (Іа підгрупа: позитивний – rІЛ-1β–СК = 0,64, rІЛ-1β–ГП = 0,53, rІЛ-1β–NO2 = 0,29, rІЛ1β‑СРБвч = 0,33, rІЛ-1β–EGF = 0,45, р < 0,05, р < 0,01; Іб підгрупа: позитивний – rІЛ-1β–СК = 0,45, rІЛ-1β‑ГП = 0,40, rІЛ-1β–NO2– = 0,57, rІЛ-1β–СРБвч = 0,69, р < 0,05, р < 0,01; Ів підгрупа: позитивний – rІЛ-1β–СРБвч = 0,53, rІЛ-1β–EGF = 0,58, р < 0,05, р < 0,01); між ІЛ-10 та біохімічними показниками (Іа підгрупа: негативний – rІЛ‑10–ГП = –0,37, rІЛ-10–СРБвч = ‑0,29, р < 0,05, р < 0,01; Іб підгрупа: негативний – rІЛ-10–NO2– = –0,50, р < 0,01; Ів підгрупа: негативний – rІЛ-10–NO2– = –0,49,
rІЛ-1β–СРБвч = –0,49, р < 0,05); у пацієнтів зі звичайним псоріазом між ІЛ-1β і клінічним показником (позитивний – rІЛ-1β–PASI = 0,36, р < 0,01).
У осіб контрольної групи існували високо значущі та значущі (r < 0,01, r < 0,05) кореляційні зв’язки середньої сили (r > 0,5) між ІЛ-10 та іншими лабораторними параметрами (табл. 4.9).
Таким чином, проведене дослідження показало: істотне підвищення в сироватці крові хворих на псоріаз прозапального цитокіну ІЛ-1β (у Іа підгрупі – у 4,3 разу, Іб – в 5,9 разу, Ів – в 5,01 разу, у осіб ІІ групи – в 3,4 разу, p < 0,0001); збільшення рівня ІЛ-10 у пацієнтів із вульгарним псоріазом у 1,44 разу (p < 0,001), тенденцію до підвищення ІЛ-10 у хворих на тяжкі форми псоріазу та достовірне збільшення співвідношення ІЛ-1β/ІЛ-10 (в Іа підгрупі – в 3,48 разу, Іб – в 4,6 разу, Ів – в 4,11 разу, ІІ групі – в 1,8 разу, p < 0,01) порівняно з показниками осіб контрольної групи, що свідчить про порушення імунорегуляторних процесів зі зрушенням у бік Th-1 ланки імунної відповіді при псоріазі. Вміст ІЛ-10 у пацієнтів Іа, Іб і Ів підгруп достовірно (p < 0,05, p < 0,001, p < 0,0001) знижувався відповідно в 1,3, 1,4 і 1,17 разу відносно показника хворих на вульгарний псоріаз. Найвищий достовірний рівень ІЛ-1β спостерігався у осіб з АП і мінімальними шкірними проявами (Іб підгрупа), що свідчить про його важливу роль у процесах резорбції кісткової тканини. Зі збільшенням ступеня тяжкості шкірного патологічного процесу спостерігали зростання ІЛ-1β (p < 0,01), тенденцію до підвищення ІЛ-10 та зниження співвідношення ІЛ‑1β/ІЛ-10 (p < 0,05). При посиленні ступеня активності суглобового синдрому відбувалося достовірне (p < 0,05, p < 0,01) зростання вмісту ІЛ-1β, зниження ІЛ‑10 і підвищення ІЛ-1β/ІЛ-10. Слід відмітити наявність найнижчих показників ІЛ-10 у хворих на АП з III ступенем активності суглобового синдрому, що розцінювалося як розвиток його недостатньої протирегулючої дії на процеси резорбції кісткової тканини. У пацієнтів з АП і переважанням запальних проявів у сполучній тканині рівень ІЛ-1β у периферичній крові та співвідношення ІЛ-1β/ІЛ-10 перевищували в 1,52 і 1,9 разу відповідно (p<0,001) аналогічні показники у хворих з переважанням дегенеративно-дистрофічних змін у суглобах [106, 109].
Таблиця 4.9 – Кореляційний взаємозв’язок між імунологічними (ІЛ-1β, ІЛ-10, EGF, СРБвч) і біохімічними показниками у осіб контрольної групи
| ІЛ-1β | ІЛ-10 | СК | ГП | NO2– | СРБвч | EGF | |
| ІЛ-1β | 1,00 | 0,14 | 0,19 | 0,25 | 0,10 | 0,16 | 0,45 |
| ІЛ-10 | 0,14 | 1,00 | -0,10 | -0,29 | 0,51х,1 | -0,23 | -0,66*,1 |
| СК | 0,19 | -0,10 | 1,00 | 0,61*,1 | -0,14 | 0,35 | -0,10 |
| ГП | 0,25 | -0,29 | 0,61*,1 | 1,00 | 0,02 | 0,14 | -0,19 |
| NO2– | 0,10 | 0,51х,1 | -0,14 | 0,02 | 1,00 | -0,41 | -0,11 |
| СРБвч | 0,16 | -0,23 | 0,35 | 0,14 | -0,41 | 1,00 | -0,30 |
| EGF | -0,45 | -0,66*,1 | -0,10 | -0,19 | -0,11 | -0,30 | 1,00 |
Примітка. * – r < 0,01; х – r < 0,05; 1 – кореляція середньої сили (r > 0,5)
Результати багатофакторного статистичного аналізу зв’язку клінічних та лабораторних ознак свідчили, що величина ІЛ-1β, ІЛ-10 достовірно (p < 0,05) пов'язана з індексом PASI, ступенем тяжкості шкірного патологічного процесу.
Кореляційні зв’язки помірної та середньої сили ІЛ-1β, ІЛ-10 з індексом PASI, СРБвч, NO2–, СК, ГП підтверджують їх роль не тільки в клінічному перебігу псоріазу, розвитку синдрома хронічного запалення, а й участі даних цитокінів у розвитку запальних та дегенеративно-дистрофічних процесів у суглобах хворих на псоріаз.
Отже, у хворих на псоріаз відзначалася низька експресія протизапального, антипсоріатичного цитокіну ІЛ-10, що, на тлі значного підвищення рівня прозапального цитокіну ІЛ-1β, свідчить про наявність дисбалансу між про- та протизапальними цитокінами, переважанні Th-1 клітин над Th-2 клітинами і розвитку недостатньої протирегулюючої здатності імунологічної системи. При цьому цитокіновий дисбаланс більш виражений при тяжких формах псоріазу, особливо при наявності суглобового синдрому, що дозволяє розглядати ІЛ-1β та ІЛ-10 в якості діагностично значущих критеріїв тяжкості псоріазу.
Вивчення цитокінового статусу дозволило встановити характер дисбалансу цитокінів при псоріазі, а також участь ІЛ-1β і ІЛ-10 у розвитку запальних та дегенеративно-дистрофічних процесів у суглобах. У хворих на тяжкі форми дерматозу виявляються більш суттєві відхілення в цитокіновому профілі ніж у хворих на звичайний псоріаз. Визначення рівня ІЛ-1β та ІЛ-10 доцільно використовувати для оцінки тяжкості перебігу дерматозу та активності суглобового синдрому, прогнозу розвитку захворювання, а також для патогенетичного обґрунтування призначаємої терапії.
4.2 Рівень епідермального фактора росту в сироватці крові хворих на
псоріаз та його клініко-патогенетичне значення
Одним із факторів, що регулюють проліферативні процеси в епідермісі, є EGF [108]. EGF був відкритий Stanley Cohen та Rita Levi-Montalcini, лауреатами Нобелівської премії в галузі фізіології та медицини 1986 року. Це глобулярний білок, с.м.м 6,4 кДа, складається з 53 амінокислотних залишків, вперше був виявлений наприкінці 1950-х років як побічна фракція при очищенні фактора росту нервів з екстрактів гіпоталамуса корів, який був здатний стимулювати рост епітеліальних клітин. Згодом було встановлено, що специфічне зв’язування EGF з рецептором EGF-тирозинкіназою, розташованим на поверхні клітини, викликає безліч біологічних ефектів. EGF секретується кератиноцитами шкіри, активованими макрофагами, тромбоцитами, має мітогенну дію, індукує проліферацію епідермальних, епітеліальних та ембріональних клітин, регулює диференціювання тканин, сприяє ангіогенезу, прискорює загоєння дрібних ран, при певних умовах може викликати малігнизацію клітин [25, 62, 108, 189, 193, 208, 223]. Відомо, що EGF збільшує вивільнення кальцію з кісткової тканини та стимулює резорбцію кістки, впливаючи на остеобласти, які виділяють фактор, що активує остеокласти [25, 172].
У науковій літературі є нечислені відомості про збільшення вмісту EGF у хворих на псоріаз, проте дослідження, присвячені клініко-патогенетичному значенню змін EGF у пацієнтів залежно від клінічної форми, ступеня тяжкості дерматозу та активності суглобового синдрому, його взаємозв’язку з іншими лабораторними показниками, не проводилися.
Рівень EGF у сироватці крові хворих на псоріаз варіював від 88,4 до 709,8 пг/мл, у практично здорових осіб – 36,1-215,1 пг/мл. Аналіз вмісту EGF у хворих на псоріаз в цілому показав його значне достовірне (р < 0,0001) збільшення (426,81 ± 12,72) пг/мл порівняно з рівнем даного показника практично здорових осіб (113,72 ± 11,91) пг/мл. Середнє значення вмісту EGF по групах складало: в Іа підгрупі – (537,99 ± 17,38) пг/мл, Іб – (459,35 ± 16,96) пг/мл, Ів – (420,45 ± 30,88) пг/мл (в цілому по І групі – 489,19 ± 12,47 пг/мл) і в ІІ групі – (291,05 ± 19,09) пг/мл (рис. 4.3). У пацієнтів Іа підгрупи вміст EGF був збільшений у 4,73 разу (p < 0,0001), Іб – у 4,04 разу (p < 0,0001), Ів – у 3,69 разу (p < 0,0001), осіб ІІ групи – у 2,56 разу (p < 0,0001) порівняно з контрольним показником. Слід зазначити, що у хворих на тяжкі форми псоріазу (І група) рівень EGF достовірно вище (р < 0,0001) відносно аналогічного показника у пацієнтів ІІ групи (особи зі звичайним псоріазом), що свідчить про більш виражені патоморфологічні процеси при тяжких формах дерматозу.

Рисунок 4.3 – Рівень EGF у сироватці крові хворих на псоріаз та у практично здорових осіб (р < 0,05, p < 0,01, p < 0,001, p < 0,0001)
Дослідження EGF залежно від ступеня тяжкості шкірного патологічного процесу дозволило виявити збільшення даного показника зі збільшенням площі та вираженості запальних змін (табл. 4.10).
Середнє значення вмісту EGF за ступенями активності суглобового синдрому у хворих на АП склало: у пацієнтів Іа підгрупи з І ступенем активності – (439,27 ± 29,68) пг/мл, ІІ – (565,69 ± 19,94) пг/мл, ІІІ – (639,12 ± 18,5) пг/мл; у осіб Іб підгрупи з І ступенем активності – (390,83 ± 28,97) пг/мл, ІІ – (468,71 ± 23,84) пг/мл, ІІІ – (535,11 ± 17,9) пг/мл. Аналіз середньостатистичних значень EGF у сироватці крові хворих на АП (Іа, Іб підгрупи) дозволив виявити достовірне (р < 0,05, р < 0,01) зростання показника зі збільшенням ступеня активності суглобового синдрому (рис. 4.4).
Як видно на рис. 4.4 у хворих на АП та поширеним тяжким ураженням шкіри рівень EGF у сироватці крові вище (р < 0,05) ніж у осіб з АП і мінімальними шкірними проявами.
Таблиця 4.10 – Рівень EGF у крові хворих на псоріаз, залежно від ступеня тяжкості захворювання (M ± m)
| Групи обстеження | EGF, пг/мл | р |
| Хворі на тяжкі форми псоріазу з різним ступенем
тяжкості, І (основна) група: І (легкий ступінь), n = 36 ІІ (середній ступінь), n = 36 ІІІ (тяжкий ступінь), n = 39 |
459,35 ± 16,96
491,99 ± 25,02 514,15 ± 21,58* |
–
р1 > 0,05 р2>0,05, р3<0,05 |
| Хворі на звичайний псоріаз з різним ступенем тяжкості,
ІІ група (порівняння): І (легкий ступінь), n = 34 ІІ (середній ступінь), n = 17 |
255,61 ± 19,48
361,95 ± 38,02* |
–
р4 < 0,05 |
Примітка: p1 – відмінності між І і ІІ ступенями тяжкості І групи, р2 – відмінності між ІІ і ІІІ ступенями тяжкості І групи, р3 – відмінності між І і ІІІ ступенями тяжкості І групи, р4 – відмінності між І і ІІ ступенями тяжкості ІІ групи, *- достовірність відмінностей виявлено
(р < 0,05)
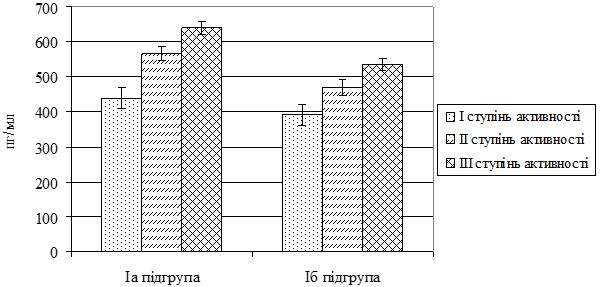
Рисунок 4.4 – Рівень EGF у сироватці крові хворих на АП залежно від ступеня активності суглобового синдрому (р < 0,05, p < 0,01)
Дослідження вмісту EGF в сироватці крові пацієнтів на різні форми АП (табл. 4.11) дозволило виявити достовірне його підвищення (р < 0,0001) у осіб з АП як з переважанням запальних проявів у сполучній тканині так і з переважанням дегенеративно-дистрофічних змін у суглобах в 4,36 і 3,8 разу відповідно відносно контрольної групи. При порівнянні данного показника між групами хворих з різними формами АП вірогідна різниця не встановлена.
Таблиця 4.11 – Вміст EGF у крові хворих на різні форми АП (M ± m)
| Групи обстеження | EGF, пг/мл | р |
| Хворі на АП з переважанням запальних проявів у сполучній тканині, n=15 | 496,47 ± 24,481 | р1 < 0,0001 р2 > 0,05 |
| Хворі на АП з переважанням дегенеративно-дистрофічних проявів у сполучній тканині, n=21 | 432,83 ± 21,891 | р1 < 0,0001 |
| Практично здорові особи: ІІІ група, n=20 | 113,72 ± 11,91 | – |
Примітка: 1 – p1 < 0,0001 відмінності відносно групи практично здорових осіб, p2 > 0,05 відмінності відносно групи хворих на псоріатичний остеоартроз з переважанням дегенеративно-дистрофічних проявів у сполучній тканині (відмінностей не виявлено)
Отже, рівень EGF мав тенденцію до зростання зі збільшенням ступеня тяжкості шкірного патологічного процесу площі та достовірно зростав зі збільшенням ступеня активності суглобового синдрому. Динаміка змін вмісту EGF більш чітко пов’язана зі ступенем активності суглобового синдрому. Найбільш високі його рівні були зареєстровані у хворих Іа підгрупи, а також у пацієнтів Іа та Іб підгруп з III ступенем активності суглобового синдрому. Враховуючи, що EGF приймає участь в процесах диференціювання, проліферації клітин, збільшує вивільнення кальцію з кісткової тканини і стимулює резорбцію кістки, впливаючи на остеобласти, які виділяють фактор, що активує остеокласти [25, 62, 108, 193], найбільш високі його показники у пацієнтів з поширеним тяжким ураженням шкіри (пустульозна, ексудативна, еритродермічна форми псоріазу) та наявністю ураження КСА були розцінені як фактор, що впливає як на гіперпроліферацію кератиноцитів так і на процеси резорбції кісткової тканини при псоріазі. Також цю думку підтверджує наявність досить високого вмісту EGF у хворих на АП з мінімальними шкірними проявами (Іб підгрупа), який майже однаковий з аналогічним показником у пацієнтів з тяжкими формами псоріазу, але без ураження КСА (Ів підгрупа) та більш чіткий зв’язок динамики рівня EGF зі ступенем активності суглобового синдрому.
Кореляційний аналіз з визначенням коефіцієнта кореляції Пірсона встановив існування кореляційних зв’язків у хворих на псоріаз між EGF та іншими показниками (табл. 4.5, 4.6, 4.7, 4.8). У пацієнтів з тяжкими формами псоріазу, Іа підгрупа: позитивний – rEGF-ІЛ-1β = 0,45, rEGF-СК = 0,51, rEGF–ГП = 0,4, rEGF–NO2– = 0,32, rEGF–СРБвч = 0,33, rEGF–PASI = 0,33, р < 0,05, р < 0,01; Іб підгрупа: позитивний – rEGF-СК = 0,41, rEGF–ГП = 0,4, rEGF–СРБвч = 0,42, р < 0,05; Ів підгрупа: позитивний – rEGF-ІЛ-1β = 0,58, rEGF-СК = 0,44, rEGF–NO2– = 0,61, rEGF–СРБвч = 0,71, rEGF–PASI = 0,42, р < 0,05, р < 0,01). У хворих на звичайний псоріаз між EGF та іншими клініко-лабораторними параметрами (позитивний – rEGF–СРБвч = 0,36, rEGF–PASI = 0,37, р < 0,01). У осіб контрольної групи існував високо значущий (r < 0,01) негативний кореляційний зв’язок середньої сили (r > 0,5) між EGF та ІЛ-10 (табл. 4.9).
Таким чином, проведене дослідження рівня EGF в сироватці крові хворих на псоріаз показало його суттєве збільшення в середньому в 4,3 разу порівняно з показником контрольної групи (р < 0,0001): у пацієнтів Іа підгрупи – у 4,73 разу, Іб підгрупи – у 4,04 разу, Ів підгрупи – у 3,69 разу, осіб ІІ групи – у 2,56 разу. Найвищий достовірний рівень EGF (р < 0,0001) спостерігався у хворих з поширеним тяжким ураженням шкіри (пустульозна, ексудативна, еритродермічна форми псоріазу) і наявністю ураження КСА, перевищуючи в 4,73 разу аналогічний показник практично здорових осіб, що свідчить про його важливу роль у процесах диференціювання, проліферації клітин та резорбції кісткової тканини. Виявлено тенденцію до підвищення EGF зі збільшенням ступеня тяжкості шкірного патологічного процесу та статистично значуще його зростання зі збільшенням ступеня активності суглобового синдрому, при цьому достовірно вищі його рівні реєструвалися у хворих на тяжкі форми псоріазу. Встановлено, що вміст EGF в сироватці крові хворих на АП з переважанням запальних проявів у сполучній тканині та у пацієнтів з АП і переважанням дегенеративно-дистрофічних змін значно перевищував контрольні значення (у 4,36 і 3,8 разу відповідно), але вірогідно по групах не відрізнявся.
Результати проведеного багатофакторного статистичного аналізу зв’язку клінічних та лабораторних ознак свідчили, що величина EGF достовірно (p < 0,001) пов'язана з індексом PASI, ступенем тяжкості шкірного патологічного процесу.
Клініко-патогенетичну роль змін EGF у хворих на псоріаз підтверджує існування тісних і помірних кореляційних зв’язків даного показника з деякими клініко-лабораторними параметрами (позитивного – rEGF–PASI = 0,42, rEGF-СРБвч = 0,71, rEGF–NO2– = 0,61, rEGF–СК = 0,51, rEGF–ГП = 0,40, р < 0,05, р < 0,01).
Отримані дані дозволяють стверджувати, що суттєве підвищення рівня EGF (у 2,56-4,73 разу) має значення в патогенезі псоріазу – з одного боку підвищена експресія даного фактора росту у хворих на псоріаз пов’язана з гіперпроліферацією кератиноцитів та розвитком вираженого запалення, що супроводжує даний процес, з іншого – свідчить про процеси резорбції кісткової тканини [241]. Зростання рівня EGF в сироватці крові хворих доцільно використовувати для оцінки ступеню тяжкості дерматозу та активності суглобового синдрому, прогнозу розвитку захворювання. Вивчення механізмів біологічних ефектів EGF дозволить розкрити нові мішені для терапевтичного впливу при псоріазі.
4.3 Динаміка високочутливого С-реактивного білка у сироватці крові хворих на псоріаз залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому
Визначення біомаркера імунного запалення – СРБвч – у сироватці крові хворих на псоріаз виявило коливання показників у широких межах – від 0,38 до 72,4 мг/л, практично здорових осіб – 0,1-6,2 мг/л. Результати дослідження СРБвч у хворих на різні клінічні форми псоріазу та практично здорових осіб представлені на рис. 4.5.
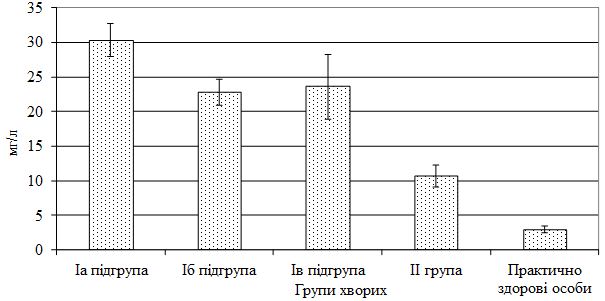
Рисунок 4.5 – Рівень СРБвч у сироватці крові хворих на різні клінічні форми псоріазу та практично здорових осіб (p < 0,05, p < 0,001, p < 0,0001)
Вивчення вмісту СРБвч у хворих на різні клінічні форми псоріазу в цілому, з високим рівнем достовірності (p < 0,0001) виявило односпрямовані зміни, які характеризувалися різким підвищенням його вмісту (21,56 ± 1,33) мг/л порівняно з аналогічним показником осіб контрольної групи (2,93 ± 0,47) мг/л. Так у пацієнтів Іа підгрупи вміст СРБвч у 10,36 разу (p < 0,0001) перевищував показник практично здорових осіб, Іб – у 7,75 разу (p < 0,0001), Ів – у 8,06 разу (p < 0,001) і ІІ групи – у 3,64 (p < 0,001) разу (рис. 4.5). Слід відзначити, що у хворих на тяжкі форми псоріазу (Іа, Іб, Ів підгрупи) рівень СРБвч у сироватці крові достовірно вищий [в 2,84 (p < 0,0001), 2,14 (p < 0,001) і 2,21 (p < 0,05) разу відповідно], відносно даного показника пацієнтів зі звичайним псоріазом (ІІ група), що свідчить про розвиток більш вираженого запального процесу у осіб з тяжкими формами дерматозу. Дослідження динаміки змін СРБвч залежно від ступеня тяжкості захворювання виявило тенденцію до його підвищення зі збільшенням площі та вираженості запальних змін (табл. 4.12). Посилення запального процесу проявлялося збільшенням вмісту СРБвч, але достовірної різниці між групами не виявлено.
Таблиця 4.12 – Вміст СРБвч у крові хворих на псоріаз, залежно від ступеня тяжкості захворювання (M ± m)
| Групи обстеження | СРБвч, мг/л | р |
| Хворі на тяжкі форми псоріазу з різним ступенем тяжкості,
І (основна) група: І (легкий ступінь), n = 36 ІІ (середній ступінь), n = 36 ІІІ (тяжкий ступінь), n = 39 |
22,8 ± 1,86
25,68 ± 2,9 30,86 ± 3,13* |
–
р1 > 0,05 р2>0,05, р3<0,05 |
| Хворі на звичайний псоріаз з різним ступенем тяжкості,
ІІ група (порівняння): І (легкий ступінь), n = 34 ІІ (середній ступінь), n = 17 |
8,89 ± 1,27
14,22 ± 4,03 |
–
р4 > 0,05 |
Примітка: p1 – відмінності між І і ІІ ступенями тяжкості І групи, р2 – відмінності між ІІ і ІІІ ступенями тяжкості І групи, р3 – відмінності між І і ІІІ ступенями тяжкості І групи, р4 – відмінності між І і ІІ ступенями тяжкості ІІ групи (відмінностей показників між групами не виявлено, окрім І групи між І і ІІІ ступенями тяжкості – *)
Аналіз динаміки біомаркеру імунного запалення СРБвч залежно від ступеня активності суглобового синдрому у хворих на АП дозволив виявити достовірне зростання (р < 0,05, р < 0,01, р < 0,001) даного показника зі збільшенням ступеня активності (рис. 4.6), при цьому рівень СРБвч достовірно вище (р < 0,05) у пацієнтів з АП і поширеним тяжким ураженням шкіри (Іа підгрупа).
Вивчення середньостатистичних значень СРБвч в сироватці крові хворих на різні форми АП дозволив виявити достовірне збільшення показника (p < 0,0001) у пацієнтів з АП як з переважанням запальних проявів у сполучній тканині (у 10,10 разу) так і з переважанням дегенеративно-дистрофічних змін (у 6,12 разу) порівняно з контрольним показником (табл. 4.13). Також спостерігалося достовірне підвищення вмісту СРБвч у 1,65 разу (p < 0,001) у хворих на АП з переважанням запальних проявів у сполучній тканині порівняно з аналогічним показником у пацієнтів з АП і переважанням дегенеративно-дистрофічних змін (табл. 4.13).
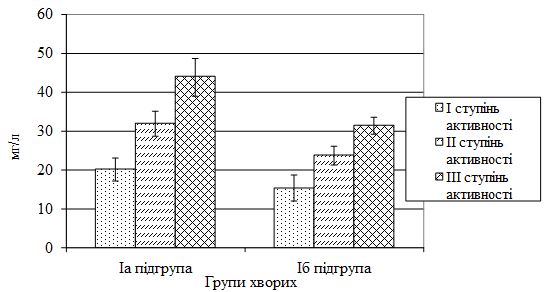
Рисунок 4.6 – Вміст СРБвч у сироватці крові хворих на АП залежно від ступеня активності суглобового синдрому (р < 0,05, р < 0,01, р < 0,001)
Проведений кореляційний аналіз з визначенням коефіцієнта кореляції Пірсона, встановив існування кореляційних зв’язків у хворих на псоріаз між СРБвч та іншими клініко-лабораторними показниками (табл. 4.5, 4.6, 4.7, 4.8). У пацієнтів з тяжкими формами псоріаза виявлено наступні кореляційні зв’язки, Іа підгрупа: позитивний – rСРБвч-СК = 0,27, rСРБвч–РФМК = 0,31, rСРБвч-ІЛ-1β = 0,33, rСРБвч-EGF = 0,33, р < 0,05, негативний – rСРБвч-ІЛ-10 = – 0,29, р < 0,05; Іб підгрупа: позитивний – rСРБвч-СК = 0,56, rСРБвч–ГП = 0,51, rСРБвч-NO2– = 0,63, rСРБвч–ПТІ = 0,48, rСРБвч–ФБГ = 0,61, rСРБвч–АЧТЧ = 0,43, rСРБвч–РФМК = 0,61, rСРБвч-ІЛ-1β = 0,69,
rСРБвч-EGF = 0,42, р < 0,05, р < 0,01; Ів підгрупа: позитивний – rСРБвч–NO2– = 0,62, rСРБвч–ФБГ = 0,64, rСРБвч–РФМК = 0,59, rСРБвч-ІЛ-1β = 0,53, rСРБвч-EGF = 0,71, р < 0,05, р < 0,01, негативний – rСРБвч-ІЛ-10 = –0,49, р < 0,05. У хворих на звичайний псоріаз: позитивний – rСРБвч–ФБГ = 0,31, rСРБвч–АЧТЧ = 0,35, rСРБвч–РФМК = 0,32, rСРБвч-EGF = 0,36, р < 0,05, р < 0,01.
Таблиця 4.13 – Рівень СРБвч у крові хворих на різні форми АП (M ± m)
| Групи обстеження | СРБвч, мг/л | р |
| Хворі на АП з переважанням запальних проявів у сполучній тканині, n=15 | 29,61 ± 2,141,х | р1 < 0,0001 р2 < 0,001 |
| Хворі на АП з переважанням дегенеративно-дистрофічних проявів у сполучній тканині, n=21 | 17,94 ± 2,291 | р1 < 0,0001 |
| Практично здорові особи: ІІІ група, n=20 | 2,93 ± 0,47 | – |
Примітка: 1 – p1 < 0,0001 відмінності відносно групи практично здорових осіб, х – p2 < 0,001 відмінності відносно групи хворих на псоріатичний остеоартроз з переважанням дегенеративно-дистрофічних проявів у сполучній тканині
Таким чином, дослідження біомаркеру імунного запалення СРБвч у хворих на псоріаз встановило зростання цього показника зі збільшенням площі та вираженості запальних змін, а також зі збільшенням ступеня активності суглобового синдрому. Наявність різкого підвищення СРБвч у пацієнтів з псоріазом вже при легкому ступені захворювання свідчить про розвиток у них хронічного системного запалення. Звертає увагу достовірно більш високі рівні СРБвч у осіб з тяжкими формами дерматозу, що вказує на наявність більш інтенсивного запального процесу у даної категорії хворих. Вміст СРБвч в сироватці крові пацієнтів на АП з переважанням запальних проявів у сполучній тканині статистично значимо в 1,65 разу перевищував аналогічний показник у пацієнтів з АП і переважанням дегенеративно-дистрофічних змін у суглобах.
Виявлено позитивні кореляційні зв’язки тісної та помірної сили між рівнем СРБвч у сироватці крові хворих на тяжкі форми псоріазу та вмістом СК, ГП, NO2–, ІЛ-1β, EGF і такими показниками згортальної системи крові як ПТІ, РФМК, фібриноген, АЧТЧ, також помірний негативний кореляційний зв’язок між СРБвч та ІЛ-10, сила яких збільшувалася з ростом ступеня тяжкості захворювання. У пацієнтів зі звичайним псоріазом встановлено кореляційні зв’язки помірної сили між рівнем СРБвч, EGF, РФМК, фібриногену, АЧТЧ.
Проведені дослідження дозволили виявити суттєві односпрямовані порушення СРБвч при різних клінічних формах псоріазу. Підвищення його рівня свідчить про формування у хворих на псоріаз синдрому хронічного системного запалення. Визначення показника СРБвч у сироватці крові хворих на псоріаз дозволить провести моніторинг вираженості імунозапальних порушень, оцінити перебіг дерматозу та ефективність проведеної терапії.
4.4 Інтенсивність продукції оксиду азоту в сироватці крові хворих на псоріаз залежно від ступеня тяжкості шкірного патологічного процесу та
активності суглобового синдрому
В сучасному уявленні про псоріаз важлива патогенетична роль відведена хронічному запаленню, яке поряд з імунопатологічною патогенетичною «складовою» призводить до метаболічних і судинних порушень [14, 252].
Останнім часом активно вивчається роль NО в запальному процесі. NО є важливою складовою системи неспецифічної реактивності організму, впливає на різні сторони запалення, блокуючи або стимулюючи запальну відповідь, що залежить від його концентрації, типу та ступеня активації клітин, впливу інших медіаторів запалення та ін. Описані як про- так і протизапальні ефекти NО [14, 140, 149]. NО, що продукується в організмі, зазнає цілий каскад перетворень, які призводять до утворення стабільних сполук: нітратів, нітритів, S-нітрозотіолів, нітротирозину. Найбільшим відсотком виходу із зазначених продуктів мають стабільні метаболіти оксида азоту – NO3– і NO2–.
У літературі накопичуються дані про патогенетичну роль NО у розвитку псоріазу [149]. В окремих роботах показана його роль в підтримці запального процесу [149], розвитку дисфункції ендотелію при псоріазі [14], встановлено підвищення рівня стабільних метаболітів оксиду азоту в плазмі крові у хворих в прогресуючій стадії псоріазу [95, 122]. Однак дослідження присвячені вивченню вмісту NО2– у пацієнтів на різні клінічні форми псоріазу, залежно від ступеня ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому, а також його впливу на цитокіновий статус і показники згортання крові практично не проводилися.
Результати дослідження стабільного метаболіту оксида азоту – NO2– у хворих на різні клінічні форми псоріазу та практично здорових осіб представлені на рис. 4.7.
Рівень NO2– у сироватці крові хворих на псоріаз коливався від 12,32 до 40,3 мкмоль/л. Вивчення вмісту NO2– у хворих на різні форми псоріазу в цілому виявило односпрямовані зміни, які характеризувалися статистично достовірним збільшенням рівня NO2– (24,91 ± 0,6) мкмоль/л в порівнянні з аналогічним показником контрольної групи (12,8 ± 0,62) мкмоль/л, p < 0,0001, який коливався від 9,22 мкмоль/л до 18,86 мкмоль/л.
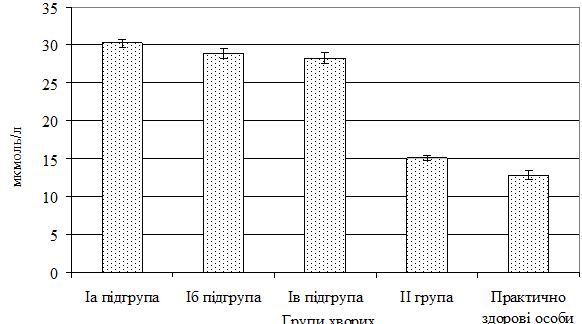
Рисунок 4.7 – Рівень NO2– у сироватці крові хворих на різні клінічні форми псоріазу та практично здорових осіб (p < 0,001, p < 0,0001)
Середнє значення рівня NO2– по групах складало: в Іа підгрупі – (30,23 ± 0,55) мкмоль/л, Іб – (28,92 ± 0,69) мкмоль/л, Ів – (28,24 ± 0,74) мкмоль/л [в цілому по І групі – (29,25 ± 0,37) мкмоль/л] і в ІІ групі – (15,05 ± 0,36) мкмоль/л (рис. 4.7). Необхідно відзначити, що у хворих на тяжкі форми дерматозу (Іа, Іб, Ів підгрупи) вміст NO2– у сироватці крові достовірно вищий [у 2,01 (p < 0,0001), 1,92 (p < 0,0001) і 1,87 (p < 0,0001) разу відповідно], відносно даного показника у пацієнтів зі звичайним псоріазом (ІІ група), що свідчить про розвиток більш вираженої запальної реакції у осіб з тяжкими формами захворювання. Аналіз середньостатистичних значень NO2– залежно від ступеня тяжкості псоріазу дозволив виявити тенденцію до зростання даного показника зі збільшенням площі та вираженості запальних змін (табл. 4.14).
За ступенями активності суглобового синдрому у хворих на АП рівень NO2– складав: у пацієнтів Іа підгрупи з І ступенем активності – (27,25 ± 0,47) мкмоль/л, ІІ – (30,59 ± 0,84) мкмоль/л, ІІІ – (34,12 ± 0,61) мкмоль/л; у осіб Іб підгрупи з І ступенем активності – (25,27 ± 0,44) мкмоль/л, ІІ – (28,96 ± 0,87) мкмоль/л, ІІІ – (33,74 ± 0,75) мкмоль/л.
Дослідження динаміки змін вмісту NO2– у сироватці крові хворих на АП (Іа, Іб підгрупи) дозволило виявити з високим ступенем достовірності (р < 0,001, р < 0,0001) зростання даного показника зі збільшенням ступеня активності суглобового синдрому, при цьому його рівень у пацієнтів Іа та Іб підгруп майже не відрізнявся (рис. 4.8).
Аналіз середньостатистичних значень NO2– в сироватці крові пацієнтів на АП дозволив виявити достовірне його збільшення (p < 0,0001) у хворих як з переважанням запальних проявів у сполучній тканині (у 2,52 разу) так і з переважанням дегенеративно-дистрофічних змін у суглобах (у 2,06 разу) порівняно з контрольним показником (табл. 4.15). Також спостерігалося достовірне збільшення вмісту NO2– в 1,22 разу (p < 0,001) у пацієнтів з АП і переважанням запальних проявів у сполучній тканині порівняно з аналогічним показником у хворих на АП і переважанням дегенеративно-дистрофічних змін.
Таблиця 4.14 – Вміст NO2– у крові хворих на псоріаз, залежно від ступеня тяжкості захворювання (M ± m)
| Групи обстеження | NO2–, мкмоль/л | р |
| Хворі на тяжкі форми псоріазу з різним ступенем тяжкості, І (основна) група:
І (легкий ступінь), n = 36 ІІ (середній ступінь), n = 36 ІІІ (тяжкий ступінь), n = 39 |
28,92 ± 0,69
28,89 ± 0,51 30,28 ± 0,72 |
–
р1 > 0,05 р2>0,05, р3>0,05 |
| Хворі на звичайний псоріаз з різним ступенем тяжкості, ІІ група (порівняння):
І (легкий ступінь), n = 34 ІІ (середній ступінь), n = 17 |
15,08 ± 0,44
14,98 ± 0,64 |
–
р4 > 0,05 |
Примітка: p1 – відмінності між І і ІІ ступенями тяжкості І групи, р2 – відмінності між ІІ і ІІІ ступенями тяжкості І групи, р3 – відмінності між І і ІІІ ступенями тяжкості І групи, р4 – відмінності між І і ІІ ступенями тяжкості ІІ групи (відмінностей показників між групами не виявлено)

Рисунок 4.8 – Вміст NO2– у сироватці крові хворих на АП залежно від ступеня активності суглобового синдрому (p < 0,001, p < 0,0001)
Проведено кореляційний аналіз з визначенням коефіцієнта кореляції Пірсона, який встановив існування кореляційних зв’язків у хворих на псоріаз між NO2– та іншими клініко-лабораторними показниками (табл. 4.5, 4.6, 4.7, 4.8). У пацієнтів з тяжкими формами дерматозу, Іа підгрупа: позитивний – rNO2–РФМК = 0,27, rNO2-ІЛ-1β = 0,29, rNO2-EGF = 0,32, р < 0,05; Іб підгрупа: позитивний – rNO2–СК = 0,66, rNO2–ГП = 0,48, rNO2-фібриноген = 0,37, rNO2–РФМК = 0,45, rEGF–СРБвч = 0,63, р < 0,05, р < 0,01; Ів підгрупа: позитивний – rNO2-СК = 0,60, rNO2–ГП = 0,55,
rNO2–РФМК = 0,56, rNO2–СРБвч = 0,62, rNO2-EGF = 0,61, rNO2–PASI = 0,58, р < 0,01, негативний – rNO2-ІЛ-10 = –0,49, р < 0,05. У хворих на звичайний псоріаз: позитивний – rNO2–ГП = 0,30, rNO2-тромбоцити = 0,44, р < 0,05, р < 0,01. У осіб контрольної групи існував статистично значущий (r < 0,05) кореляційний зв’язок середньої сили (r > 0,5) між NO2– та ІЛ-10 (табл. 4.9).
Таблиця 4.15 – Рівень NO2– у крові хворих на різні форми АП (M ± m)
| Групи обстеження | NO2–, мкмоль/л | р |
| Хворі на АП з переважанням запальних проявів у сполучній тканині, n=15 | 32,34 ± 0,731,х | р1 < 0,0001 р2 < 0,001 |
| Хворі на АП з переважанням дегенеративно-дистрофічних проявів у сполучній тканині, n=21 | 26,48 ± 0,661 | р1 < 0,0001 |
| Практично здорові особи: ІІІ група, n=20 | 12,8 ± 0,62 | – |
Примітка: 1– p1 < 0,0001 відмінності відносно групи практично здорових осіб, х– p2 < 0,001 відмінності відносно групи хворих на псоріатичний остеоартроз з переважанням дегенеративно-дистрофічних проявів у сполучній тканині
Таким чином, встановлено, що даний показник у хворих на псоріаз зростав зі збільшенням площі та вираженості запальних змін, а також зі збільшенням ступеня активності суглобового синдрому. Достовірно більш високі його рівні реєструвалися у пацієнтів з тяжкими формами дерматозу, що свідчить про розвиток інтенсивного запального процесу у даної категорії хворих, а також наявність реакції, спрямованої на компенсацію
та/або нормалізацію порушень гемостазу, змін регіональної
гемодинаміки шкіри, пригнічення проліферативних процесів [71, 146]. Вміст NO2– в сироватці крові хворих на АП з переважанням запальних проявів у сполучній тканині достовірно в 1,22 разу перевищував аналогічний показник у пацієнтів з переважанням дегенеративно-дистрофічних змін у суглобах.
Виявлений позитивний кореляційний зв’язок помірної сили між рівнем NO2– в сироватці крові хворих з тяжкими формами псоріазу і вмістом РФМК (r=0,56, р<0,01), фібриногену (r=0,37, р<0,05) та помірний позитивний кореляційний зв’язок між NO2– та кількістю тромбоцитів у пацієнтів зі звичайним псоріазом, свідчить про наявність регулюючого впливу NO2– на певні ланки згортальної системи крові при даному дерматозі. Кореляційні зв’язки середньої сили NO2– з індексом PASI, СРБвч, СК, ГП підтверджують його роль не тільки в клінічному перебігу псоріазу, а й участі в розвитку запальної реакції та процесах деструкції хряща у хворих на псоріаз [71].
Визначення показника NO2– в сироватці крові хворих на псоріаз дозволить оцінити тяжкість та активність патологічного процесу, перебіг дерматозу та ефективність проведеної терапії.
4.5 Аналіз динаміки окремих біохімічних маркерів сполучнотканниного обміну в сироватці крові хворих на псоріаз залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому
Для з’ясування особливостей сполучнотканинного обміну при різних клінічних формах псоріазу залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому проводилося вивчення в сироватці крові хворих таких біохімічних маркерів, як СК і ГП.
Рівень СК у сироватці крові хворих на псоріаз коливався від 120 до 282 у.о., ГП – у межах від 0,23 до 0,7 у.о., у практично здорових осіб – (144-170) у.о. та (0,27-0,4) у.о. відповідно.
Результати дослідження СК і ГП у хворих на різні клінічні форми псоріазу та практично здорових осіб представлені в таблиці 4.16.
При аналізі рівнів СК і ГП у сироватці крові хворих на різні клінічні форми псоріазу виявлено їх достовірне підвищення у пацієнтів з тяжкими формами дерматозу: Іа підгрупа – в 1,23 (p < 0,0001) і 1,45 (p < 0,001) разу, Іб – в 1,25 (p < 0,0001) і 1,45 (p < 0,001) разу, Ів – 1,14 (p < 0,01) і 1,36 разу (p < 0,001) відповідно, порівняно з показником контрольної групи (табл. 4.16).
Таблиця 4.16 – Рівні СК і ГП у крові хворих на псоріаз, залежно від клінічної форми захворювання (M ± m)
| Групи обстеження | Показник | |
| СК, у.о. | ГП, у.о. | |
| Хворі на тяжкі форми псоріазу:
Іа підгрупа, n=53 Іб підгрупа, n=36 Ів підгрупа, n=22 І група, n=111 |
193,98 ± 5,023,хххх 197,25 ± 6,233,ххх 180,05 ± 7,871,х 192,28 ± 3,523,хххх |
0,48 ± 0,022,ххх 0,48 ± 0,022,ххх 0,45 ± 0,022,хх 0,47 ± 0,013,хххх |
| Хворі на звичайний псоріаз: ІІ група, n=51 | 159,78 ± 2,4 | 0,34 ± 0,01 |
| Практично здорові особи: ІІІ група, n=20 | 157,9 ± 1,38 | 0,33 ± 0,01 |
Примітка. Відмінності з контрольною групою при р1 < 0,01 – 1, р1 < 0,001 – 2, р1 < 0,0001 – 3, відмінності з ІІ групою при р2 < 0,05 – х, р2 < 0,01 – хх, р2 < 0,001 – ххх , р2 < 0,0001 – хххх.
В той час у хворих на звичайний псоріаз (ІІ група) рівні СК і ГП майже не відрізнялися від контрольних значень (табл. 4.16), що свідчить про відсутність значної запальної реакції. Звертає увагу достовірне підвищення вмісту СК і ГП в сироватці крові пацієнтів з тяжкими формами псоріазу, який відповідно в Іа підгрупі перевищував в 1,21 (p < 0,0001) і 1,41 (p < 0,001) разу, Іб – в 1,23 (p < 0,001) і 1,41 (p < 0,001) разу, Ів – у 1,13 (p < 0,05) і 1,32 (p < 0,01) разу аналогічні показники у осіб зі звичайним псоріазом (ІІ група), що свідчить про розвиток вираженого запального процесу у хворих на тяжкі форми захворювання. Посилення запального процесу проявлялося збільшенням вмісту СК і ГП, але достовірної різниці між групами не виявлено (табл. 4.17).
Статистично достовірні зміни рівнів СК і ГП встановлено у хворих на АП залежно від ступеня активності суглобового синдрому.
Таблиця 4.17 – Вміст СК і ГП у крові хворих на псоріаз, залежно від ступеня тяжкості захворювання (M ± m)
| Групи обстеження | Показник | |
| СК, у.о. | ГП, у.о. | |
| Хворі на тяжкі форми псоріазу з різним ступенем тяжкості, І (основна) група: І (легкий ступінь), n = 36 ІІ (середній ступінь), n = 36 ІІІ (тяжкий ступінь), n = 39 |
197,25 ± 6,23
183,47 ± 5,85 195,82 ± 6,10 |
0,48 ± 0,02
0,46 ± 0,02 0,49 ± 0,02 |
| Хворі на звичайний псоріаз з різним ступенем тяжкості, ІІ група (порівняння):
І (легкий ступінь), n = 34 ІІ (середній ступінь), n = 17 |
159,68 ± 3,53
160,0 ± 1,66 |
0,35 ± 0,01
0,34 ± 0,01 |
Примітка: відмінностей показників між групами не виявлено (р > 0,05)
Дані показники достовірно підвищувалися (р < 0,05, р < 0,001, р < 0,0001) зі збільшенням ступеня активності суглобового синдрому (табл. 4.18), що свідчить про підсилення інтенсивності запального процесу. При цьому вміст СК і ГП у пацієнтів на АП з поширеним тяжким ураженням шкіри і АП та мінімальними шкірними проявами був майже однаковим, тобто рівень даних показників більш пов’язаний із суглобовим синдромом.
Аналіз середньостатистичних значень СК і ГП в сироватці крові хворих на різні форми АП дозволив виявити достовірне їх збільшення (p < 0,0001) як у пацієнтів з АП і переважанням запальних проявів у сполучній тканині (в 1,4 і 1,7 разу відповідно) так і з АП і переважанням дегенеративно-дистрофічних змін у суглобах (в 1,14 і 1,27 разу відповідно) порівняно з контрольним рівнем (табл. 4.19), що свідчить про альтернативні зміни в суглобах.
Таблиця 4.18 – Рівні СК і ГП у хворих на АП залежно від ступеня активності суглобового синдрому
| Групи хворих | Показники | |
| СК, у.о. | ГП, у.о. | |
| Іа підгрупа, І ступінь активності, n=18 | 164,83±5,95 | 0,37 ± 0,02 |
| Іа підгрупа, ІІ ступінь активності, n=24 | 200,67±6,23
p1 < 0,001 |
0,51 ± 0,03
p1 < 0,001 |
| Іа підгрупа, ІІІ ступінь активності, n=11 | 227,09±8,93
р2 < 0,05 р3 < 0,001 |
0,59 ± 0,03
р2 < 0,05 р3 < 0,0001 |
| Іб підгрупа, І ступінь активності, n=9 | 169,08 ± 5,13 | 0,38 ± 0,03 |
| Іб підгрупа, ІІ ступінь активності, n=9 | 194,13±8,35
р4 < 0,05 |
0,49 ± 0,04
р4 < 0,05 |
| Іб підгрупа, ІІІ степень активности, n=7 | 240,0±8,11
р5 < 0,01 р6 < 0,0001 |
0,59 ± 0,03
р5 < 0,05 р6 < 0,001 |
Примітка: p1 – відмінності між І і ІІ ступенями активності суглобового синдрому у хворих Іа підгрупи, р2 – відмінності між ІІ і ІІІ ступенями активності суглобового синдрому у хворих Іа підгрупи, р3 – відмінності між І і ІІІ ступенями активності суглобового синдрому у хворих Іа підгрупи, р4 – відмінності між І і ІІ ступенями активності суглобового синдрому у хворих Іб підгрупи, р5 – відмінності між ІІ і ІІІ ступенями активності суглобового синдрому у хворих Іб підгрупи, р6 – відмінності між І і ІІІ ступенями активності суглобового синдрому у хворих Іб підгрупи.
У осіб з АП і переважанням запальних проявів вміст СК і ГП перевищував в 1,23 та 1,33 разу відповідно (p<0,001) дані показники у хворих з переважанням дегенеративно-дистрофічних змін у суглобах (табл. 4.19).
Таблиця 4.19 – Рівень СК і ГП у крові хворих на різні форми АП (M ± m)
| Групи обстеження | СК, у.о. | ГП, у.о. | р |
| Хворі на АП з переважанням запальних проявів у сполучній тканині, n=15 | 221,6 ± 8,492,х | 0,56 ± 0,022,х | р1< 0,0001 р2 < 0,001 |
| Хворі на АП з переважанням дегенеративно-дистрофічних проявів у сполучній тканині, n=21 | 179,86 ± 6,651 | 0,42 ± 0,031 | р1 < 0,01 |
| Практично здорові особи:
ІІІ група, n=20 |
157,9 ± 1,38 | 0,33 ± 0,01 | – |
Примітка: 1 – p1 < 0,01, 2 – p1 < 0,0001 відмінності відносно групи практично здорових осіб, х – p2 < 0,001 відмінності відносно групи хворих на псоріатичний остеоартроз з переважанням дегенеративно-дистрофічних проявів у сполучній тканині
Таким чином, дослідження біохімічних маркерів сполучнотканинного обміну СК і ГП у хворих на псоріаз встановило зростання цих показників зі збільшенням ступеня тяжкості дерматозу та активності суглобового синдрому.
Наявність рівня СК і ГП у хворих на звичайний псоріаз (ІІ група) майже на рівні контрольних значень, свідчить про відсутність значної запальної реакції у цих осіб. Звертає увагу достовірно значне підвищення вмісту даних показників у сироватці крові пацієнтів з тяжкими формами псоріазу, особливо при АП, що вказує на розвиток більш інтенсивного запального процесу у даної категорії хворих, а також наявності деструктивних змін у суглобах. Рівні СК і ГП в сироватці крові пацієнтів з АП і переважанням запальних проявів у сполучній тканині статистично значимо в 1,23 і 1,33 разу відповідно перевищували аналогічні показники у хворих на АП і переважанням дегенеративно-дистрофічних змін у суглобах.
Багатофакторний статистичний аналіз зв’язку клінічних та лабораторних ознак свідчив, що величина СК і ГП достовірно (р < 0,001) пов'язана з індексом PASI, ступенем тяжкості патологічного процесу.
Визначення показників СК і ГП в сироватці крові хворих на псоріаз дозволить виявити та провести моніторинг вираженості запальних і деструктивних змін у суглобах, оцінити перебіг суглобового синдрому та ефективність проведеної терапії.
4.6 Дослідження окремих показників згортальної системи крові у хворих на псоріаз залежно від ступеня тяжкості шкірного патологічного процесу та
активності суглобового синдрому
Відомості в науковій літературі про стан згортальної та фібринолітичної систем крові при псоріазі нечисленні, також досить різноманітні і суперечливі. Дослідження присвячені вивченню стану системи згортання крові у хворих на різні клінічні форми псоріазу, залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому у вітчизняній літературі відсутні.
З метою оцінки стану системи згортання крові у хворих на псоріаз були обрані наступні показники: визначення ПТІ, АЧТЧ, РФМК, концентрації фібриногену, кількості тромбоцитів.
Результати дослідження показників коагуляційної (ПТІ, АЧТЧ, фібриноген), тромбоцитарної (кількість тромбоцитів у капілярній крові) ланок системи гемостазу та системи фібриноліза (РФМК) у крові хворих на псоріаз і здорових добровольців наведені в таблиці 4.20.
Як видно з таблиці 4.20 у хворих на псоріаз по всіх групах обстеження спостерігалися однонаправлені зміни: ПТІ, концентрація фібриногену, РФМК – збільшувалися, АЧТЧ та кількість тромбоцитів – зменшувалися у порівняні з групою практично здорових осіб.
Таблиця 4.20. Рівні окремих показників згортальної системи крові (ПТІ, фібриноген, РФМК, АЧТЧ, тромбоцити) у хворих на псоріаз та практично здорових осіб
| Показники | Іа підгрупа
n=46 |
Іб підгрупа
n=26 |
Ів підгрупа
n=20 |
ІІ група
n=43 |
Практично здорові особи, n=20 |
| ПТІ, % | 100,62±0,631,х | 102,67±0,963,хх | 101,19±0,892,х | 98,33±0,89 | 95,92±1,47 |
| Фібриноген, г/л | 4,85±0,293,ххх | 4,26±0,193,ххх | 4,14±0,253,хх | 3,29±0,12 | 3,11±0,10 |
| РФМК, х 10-2 г/л | 4,39±0,352,хх | 4,44±0,293,ххх | 4,25±0,253,ххх | 3,22±0,071 | 3,03±0,03 |
| АЧТЧ, с | 27,75±0,392 | 26,96±0,603 | 28,12±1,05 | 28,43±0,72 | 30,35±0,89 |
| Тромбоцити, х109/л | 233,03±6,04 | 231,19±7,89 | 238,17±5,09 | 230,58±7,13 | 244,14±7,41 |
Примітка: 1 – p1 < 0,05, 2– p1 < 0,01, 3– p1 < 0,001 відмінності відносно групи практично здорових осіб, х– p2 < 0,05, хх– p2 < 0,01, ххх– p2 < 0,001 відмінності відносно ІІ групи хворих (звичайний псоріаз)
Рівень ПТІ в сироватці крові хворих на псоріаз коливався від 83,33 до 109,59 %, у практично здорових осіб – у межах 85,42-108,33 %. У пацієнтів з тяжкими формами псоріазу (Іа, Іб, Ів підгрупи) його вміст був достовірно вищим у 1,04 (p < 0,05), 1,07 (p < 0,001) і 1,05 (p < 0,01) разу порівняно з показником контрольної групи, у осіб ІІ групи (звичайний псоріаз) – мав лише тенденцію до підвищення (табл. 4.20). Також у осіб з тяжкими формами дерматозу (І група) рівень ПТІ був достовірно вищим (p < 0,05, p < 0,01), відносно даного показника у пацієнтів зі звичайним псоріазом (ІІ група). Зі збільшенням площі та вираженості запального процесу ПТІ не зазнавав істотних змін (табл. 4.21).
Таблиця 4.21 – Окремі показники згортальної системи крові у хворих на псоріаз, залежно від ступеня тяжкості захворювання (M ± m)
| Групи хворих | Показники | ||||
| ПТІ, % | Фібриноген, г/л | РФМК, х 10-2 г/л | АЧТЧ, с | Тромбоцити, х109/л | |
| І група, І (легкий) ступінь тяжкості, n=26 | 102,67±0,96 | 4,26 ± 0,19 | 4,44 ± 0,29 | 26,96±0,6 | 231,19±7,89 |
| І група, ІІ (середній) ступінь тяжкості, n=32 | 99,72±0,77
p1 < 0,05 |
4,52 ± 0,31 p1 > 0,05 | 4,01 ± 0,34
p1 > 0,05 |
27,87±0,49
p1 > 0,05 |
230,52±7,51
p1 > 0,05 |
| І група, ІІІ (тяжкий) ступінь тяжкості, n=34 | 101,79±0,65
р2 < 0,05 р3 > 0,05 |
4,74 ± 0,32
р2 > 0,05 р3 > 0,05 |
4,66 ± 0,38
р2 > 0,05 р3 > 0,05 |
27,85± 0,66
р2 > 0,05 р3 > 0,05 |
238,24 ± 5,25
р2 > 0,05 р3 > 0,05 |
| ІІ група, І (легкий) ступінь тяжкості, n=30 | 97,35 ± 1,03 | 3,37 ± 0,17 | 3,27 ± 0,09 | 28,18± 0,82 | 222,85±7,64 |
| ІІ група, ІІ (середній) ступінь тяжкості, n=13 | 100,61±1,59
р4 > 0,05 |
3,09±0,11
р4 > 0,05 |
3,12 ± 0,06
р4 > 0,05 |
29,0 ± 1,52
р4 > 0,05 |
245,58±14,49
р4 > 0,05 |
Примітка: p1 – відмінності між І і ІІ ступенями тяжкості І групи, р2 – відмінності між ІІ і ІІІ ступенями тяжкості І групи, р3 – відмінності між І і ІІІ ступенями тяжкості І групи, р4 – відмінності між І і ІІ ступенями тяжкості ІІ групи.
Дослідження динаміки змін рівня ПТІ у сироватці крові хворих на АП (Іа, Іб підгрупи) дозволило виявити його достовірне (р < 0,05, р < 0,01, р < 0,001, р < 0,0001) зростання зі збільшенням ступеня активності суглобового синдрому (табл. 4.22). Вміст ПТІ у пацієнтів з АП та поширеним тяжким ураження шкіри (Іа підгрупа) і у осіб з АП і мінімальними шкірними проявами був майже однаковим.
Таблиця 4.22 – Рівні окремих показників згортальної системи крові у хворих на АП залежно від ступеня активності суглобового синдрому
| Групи хворих | Показники | ||||
| ПТІ, % | Фібриноген, г/л | РФМК, х 10-2 г/л | АЧТЧ, с | Тромбоцити, х109/л | |
| Іа підгрупа, І ступінь активності, n=18 | 97,52±1,53 | 3,71 ± 0,15 | 3,31 ± 0,18 | 26,92±0,82 | 233,65±10,74 |
| Іа підгрупа, ІІ ступінь активності, n=24 | 101,15±0,68
p1 < 0,05 |
4,68 ± 0,32
p1 < 0,05 |
4,0 ± 0,27
p1 < 0,05 |
28,02±0,62
p1 > 0,05 |
235,36±9,79
p1 > 0,05 |
| Іа підгрупа, ІІІ ступінь активності, n=11 | 103,21±0,66
р2 < 0,05 р3 < 0,01 |
6,54 ± 0,84
р2 < 0,05 р3 < 0,01 |
6,45 ± 1,19
р2 < 0,05 р3 < 0,05 |
28,19± 0,38
р2 > 0,05 р3 > 0,05 |
243,28 ± 9,29
р2 > 0,05 р3 > 0,05 |
| Іб підгрупа, І ступінь активності, n=9 | 97,31 ± 0,78 | 3,44 ± 0,28 | 3,25 ± 0,2 | 25,70± 0,91 | 232,68±12,88 |
| Іб підгрупа, ІІ ступінь активності, n=9 | 104,55±0,54р4 < 0,001 | 4,48 ± 0,13
р4 < 0,01 |
4,39 ± 0,25
р4 < 0,01 |
27,44±1,24
р4 > 0,05 |
234,36±13,64
р4 > 0,05 |
| Іб підгрупа, ІІІ степень активности, n=7 | 107,90±0,67 р5 < 0,001 р6 < 0,0001 | 5,17 ± 0,19
р5 < 0,01 р6 < 0,001 |
6,21 ± 0,49
р5 < 0,01 р6 < 0,001 |
28,14± 0,67
р5 > 0,05 р6 < 0,05 |
229,43±14,58
р5 > 0,05 р6 > 0,05 |
Примітка: p1 – відмінності між І і ІІ ступенями активності суглобового синдрому у хворих Іа підгрупи, р2 – відмінності між ІІ і ІІІ ступенями активності суглобового синдрому у хворих Іа підгрупи, р3 – відмінності між І і ІІІ ступенями активності суглобового синдрому у хворих Іа підгрупи, р4 – відмінності між І і ІІ ступенями активності суглобового синдрому у хворих Іб підгрупи, р5 – відмінності між ІІ і ІІІ ступенями активності суглобового синдрому у хворих Іб підгрупи, р6 – відмінності між І і ІІІ ступенями активності суглобового синдрому у хворих Іб підгрупи.
Що стосується фібриногену, то його вміст у хворих на псоріаз коливався у межах 2,22-10,43 г/л, у практично здорових осіб – від 2,66 до 3,99 г/л. Рівень фібриногену у хворих на тяжкі форми псоріазу (І група) в сироватці крові достовірно (p < 0,0001) в 1,45 разу перевищував даний показник контрольної групи; у пацієнтів зі звичайним псоріазом (ІІ група) вміст фібриногену залишався на рівні контрольних значень (табл. 4.20). Дослідження вмісту фібриногену в сироватці крові хворих на псоріаз залежно від ступеня тяжкості захворювання виявило тенденцію до зростання цього показника зі збільшенням площі та вираженості запальних змін (табл. 4.21). Рівень фібриногену у пацієнтів з АП (Іа, Іб підгрупа) достовірно (р < 0,05, р < 0,01, р < 0,001) зростав відповідно до збільшення ступеня активності суглобового синдрому, але достовірної різниці між групами хворих на АП з поширеним тяжким ураженням шкіри і з АП та мінімальними шкірними проявами не виявлено (табл. 4.22).
Маркером тромбінемії та внутрішньосудинного згортання крові служить РФМК [3, 66]. Вміст РФМК у хворих на псоріаз (І, ІІ група) також був достовірно (р < 0,05, р < 0,01, р < 0,001) підвищеним порівняно з контрольним показником (табл. 4.20) та коливався від 3 до 15 х 10-2 г/л; у практично здорових осіб його рівень варіював у межах 3-3,5 х 10-2 г/л. РФМК в сироватці крові хворих на тяжкі форми псоріазу (Іа, Іб і Ів підгруп) був достовірно вищим у 1,36 (p < 0,01), 1,38 (p <0,001) і 1,32 (p <0,001) разу відповідно, відносно аналогічного показника у пацієнтів ІІ групи зі звичайним псоріазом (табл. 4.20). Аналіз середньостатистичних значень РФМК залежно від ступеня тяжкості дерматозу виявив тенденцію до зростання цього показника зі збільшенням площі та вираженості запальних змін (табл. 4.21). Також відзначалося достовірне (р < 0,05, р < 0,01, р < 0,001) зростання рівня РФМК у пацієнтів на АП (Іа, Іб підгрупи) відповідно до збільшення ступеня активності суглобового синдрому, але достовірної різниці між групами хворих на АП з поширеним тяжким ураженням шкіри і АП та мінімальними шкірними проявами не виявлено (табл. 4.22). Отже високі показники вмісту РФМК у сироватці крові хворих на тяжкі форми псоріазу і його зростання зі збільшенням ступеня тяжкості дерматозу та активності суглобового синдрому свідчить про внутрішньосудинну активацію прокоагулянтної ланки системи гемостазу зі збільшенням тяжкості дерматозу.
АЧТЧ у хворих на псоріаз коливався від 18 до 39 секунд, у практично здорових осіб – у межах 23-37 секунд. У пацієнтів із псоріазом спостерігалося скорочення АЧТЧ (табл. 4.20): достовірне його скорочення відзначалося у осіб з АП, як з тяжким розповсюдженим ураженням шкіри так і з мінімальними шкірними проявами (Іа і Іб підгрупи); тенденція до скорочення цього показника виявлена у хворих Ів підгрупи та ІІ групи (табл. 4.20). АЧТЧ у хворих на тяжкі форми псоріазу порівняно з аналогічним показником ІІ групи вірогідно не відрізнявся. Дослідження динаміки змін АЧТЧ у пацієнтів з псоріазом залежно від ступеня тяжкості дерматозу та у хворих на АП (Іа, Іб підгрупи) залежно від ступеня активності суглобового синдрому виявило тенденцію до збільшення даного показника зі збільшенням площі та вираженості запальних змін та ступеня активності суглобового синдрому (табл. 4.21 і табл. 4.22).
Аналіз кількості тромбоцитів у капілярній крові хворих на псоріаз всіх груп виявив тенденцію до зменшення (табл. 4.20). Залежно від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому показник кількості тромбоцитів вірогідно по групах не відрізнявся.
Таким чином встановлено, що у хворих на псоріаз, спостерігаються зміни стану згортальної системи крові, ступінь та характер яких залежить від тяжкості та клінічного перебігу захворювання і проявляються підвищеною активністю коагуляційної ланки, посиленням безперервного внутрішньосудинного згортання крові, інтенсифікацією фібринолітичної системи крові, про що свідчать підвищені рівні ПТІ, фібриногену, скорочення АЧТЧ та надмірне утворення РФМК, які достовірно вищі у осіб з тяжкими формами дерматозу [71]. Отримані дані пов’язані з виразністю та обширністю запальної реакції дерми, розвитком порушень мікроциркуляторного русла при псоріазі, які при тяжких формах дерматозу носять генералізований характер і поєднуються зі схильністю до гіперкоагуляції, що узгоджується з даними літератури [3, 32, 95, 143, 269]. Також, результати дослідження свідчать про те, що розвиток псоріатичного процесу супроводжується активацією дисемінованого внутрішньосудинного згортання крові, викликаного підсиленням експресії прозапальних цитокінів (ІЛ-1β, TNF-α та ін.), як відповіді на системне імунне запалення, свідченням якого є надмірне утворення РФМК.
Визначення окремих показників згортальної системи крові у хворих на псоріаз дозволить оцінити тяжкість шкірного патологічного процесу та активність суглобового синдрому, перебіг дерматозу та виявить необхідність призначення симптоматичної терапії.
* * *
На підставі результатів власних отриманих даних у хворих на тяжкі форми псоріазу встановлені наступні лабораторні особливості: цитокіновий дисбаланс з переважанням прозапального цитокіну ІЛ-1β, збільшення рівнів EGF, СРБвч, NO2–, СК і ГП та зміни стану згортальної системи крові, які проявляються підвищеною активністю коагуляційної ланки, посиленням безперервного внутрішньосудинного згортання крові, про що свідчать підвищені рівні ПТІ, фібриногену, скорочення АЧТЧ та надмірне утворення РФМК, що пов’язано з виразністю та обширністю запальної реакції дерми з порушеннями мікроциркуляторного русла. Також проведені дослідження показали участь ІЛ-1β, ІЛ-10 в процесах ремоделювання кісткової тканини та зв’язок EGF не тільки з гіперпроліферацією кератиноцитів, а й процесами резорбції кісткової тканини.
Виконані дослідження засвідчили, що використання комплексного визначення ІЛ-1β, ІЛ-10, EGF, NO2–, ПТІ, фібриногену, РФМК підвищує точність встановлення ступеня тяжкості дерматозу, активності суглобового синдрому та прогнозу перебігу псоріазу. Застосування простих, доступних лабораторних тестів (СРБвч, СК і ГП) дозволяє провести моніторинг вираженості запальних порушень.
Зміст розділу відображено в наступних публікаціях:
1. Особенности нарушений в системе цитокинов у больных псориазом / И.А. Олейник, Э.Н. Солошенко, А.А. Гаврилюк [и др.] // Дерматологія та венерологія. – 2015. – № 4 (70) – С. 58-66. – Авторы также: З.М. Шевченко, Т.П. Ярмак.
2. Кондакова А.К. Содержание метаболитов оксида азота и некоторых показателей свёртывающей системы крови у больных псориазом / А.К. Кондакова, И.А. Олейник, А.А. Гаврилюк // Дерматологія та венерологія. – 2016. – № 1 (71). – С. 23-33.
3. Клініко-патогенетична роль епідермального фактору росту при псоріазі / Я.Ф. Кутасевич, І.О. Олійник, Е.М. Солошенко, О.А. Гаврилюк // Український журнал дерматології, венерології, косметології. – 2016. – № 2 (61) – С. 27-30.
4. Кутасевич Я.Ф. Показатели метаболитов оксида азота у больных тяжёлыми формами псориаза / Я.Ф. Кутасевич, И.А. Олейник, А.А. Гаврилюк // Збірник робіт за матеріалами науково-практичної конференції з міжнародною участю «Международная интеграция и научные достижения украинской дерматовенерологии» (м. Харків). – Дерматологія та венерологія. – 2014. – № 3 (65). – С. 80-81.
5. Оценка состояния цитокинового профиля у больных псориазом / Я.Ф. Кутасевич, И.А. Олейник, И.А. Маштакова А.А. Гаврилюк // Сборник работ по материалам международной научно-практической конференции «Состояние и проблемы дерматовенерологии и косметологии в Республике Узбекистан» (г. Ташкент, Узбекистан, 20-21 ноября 2015 г.). – Дерматовенерология и эстетическая медицина. – 2015. – № 3 (27). – С. 134-135.
6. Стан системи гемостазу та рівень нітрит-аніону у хворих на псоріаз / І.О. Олійник, О.А. Гаврилюк, Г.К. Кондакова [та ін.] // Збірник робіт за матеріалами науково-практичної конференції «Спадкові та екологічні чинники в дерматовенерології» (м. Київ, 29-30 березня 2016 р.). – Дерматовенерологія. Косметологія і сексопатологія. – 2016. – № 1-2 (3) – С. 76-77. – Автори також: Г.О. Семко, В.М. Цимбал.
7. Оцінка стану системи згортання крові у хворих на тяжкі форми псоріазу / Г.К. Кондакова, І.О. Олійник, І.О. Маштакова [та ін.] // науково-практична конференція “Стан та основні організаційні задачі дерматовенерологічної служби на сучасному етапі в Україні” в рамках V Ювілейного Міжнародного медичного конгресу «Впровадження сучасних досягнень медичної науки в практику охорони здоров’я України» : Тези доповідей, м. Київ, 19-20 квітня 2016 р. – К., 2016. – С. 86. – Автори також: О.А. Гаврилюк, О.О. Левченко, Г.О. Семко.
8. Role of epidermal growth factor in the pathogenesis of psoriasis / Y.F. Kutasevych, I.O. Oliinyk, I.O. Mashtakova, O.A. Gavrylyuk // Abstracts of the 13th Spring Symposium of the European Academy of Dermatology and Venereology, Athens, Greece, 19-22 May 2016. – Athens, 2016. – P. 1989.
РОЗДІЛ 5
ХАРАКТЕРИСТИКА СТАНУ СУГЛОБІВ У ХВОРИХ
НА АРТРОПАТИЧНИЙ ПСОРІАЗ ЗА МЕТОДОМ ДИСТАНЦІЙНОЇ ТЕРМОГРАФІЇ
Підвищення температури вище середньофізіологічного рівня є одним з класичних ознак запалення, вимірювання якої лежить в основі термодіагностики [47, 57, 70]. Одним із сучасних методів реєстрації температури досліджуваної ділянки є ІДТ.
ІДТ – безконтактний метод вимірювання та візуалізації природного теплового випромінювання тіла людини невидимої інфрачервоної ділянки електромагнітного спектру. У здорової людини природне теплове випромінювання тіла невидимої інфрачервоної ділянки електромагнітного спектру відносно постійне, а при патологічних станах, прийомі лікарських засобів, проведенні навантажувальних проб та при здійсненні природної терморегуляції організму видозмінюється. Неоднорідний поверхневий розподіл температури тіла людини при незмінних навколишніх умовах обумовлений станом наявних в шкірі та підшкірних шарах кровоносних судин і капілярів, м’язів, внутрішніх органів, підшкірно-жирової клітковини, а також метаболічними процесами, які відбуваються у внутрішніх органах. Отже, температурний рельєф поверхні тіла людини залежить, в остаточному підсумку, від рівня наповненості тканин кров’ю, ступеня її нагрівання при функціональній активності м’язів та внутрішніх органів, перерозподілу крові при регулюванні просвіту судин, а також від теплових властивостей тканини (теплопровідності, теплоємності). Ці параметри складають основу тепловізійної діагностики і дають можливість визначити клас патології, що виявляється за допомогою реєстрації термограм [27, 165]. Термографія надає можливість уточнити локалізацію функціональних порушень, активність процесу та його розповсюдженість, а також характер змін – запалення, порушення мікроциркуляції, злоякісність. Дистанційне тепловізійне обстеження тіла людини має велику перевагу перед деякими іншими способами одержання об’єктивної інформації щодо змін його температурного стану, що полягає в тому, що дослідник, отримуючи термограмму значних ділянок поверхні шкіри, досить легко може виділити зони з найбільш низькими або, навпаки, високими значеннями температур, в подальшому акцентуя увагу на обраних ділянках. ІДТ дозволяє оцінювати функціональні зміни в динаміці (як при первинному обстеженні так і безпосередньо в процесі та після проведеного лікування) і візуалізувати як м’які тканини суглоба, так і периартикулярні тканини [27]. ІДТ об’єктивно виявляє активні ділянки підвищення або зниження локальної температури як у доклінічній стадії захворювання, так і на стадії виражених змін [42, 47, 57, 70, 165].
У літературі є одиничні повідомлення про виявлення зон гіпертермії в ділянках шкіри з псоріатичними висипаннями та в проекції ураження суглобів при проведенні термографічного обстеження з використанням тепловізорів «старого» покоління [113], однак дослідження, присвячені аналізу стану активності запальних проявів у суглобах у хворих на АП залежно від ступеня активності запального процесу відсутні.
5.1 Аналіз стану активності запальних проявів у суглобах за методом дистанційної термографії
Оцінка стану активності запальних проявів у суглобах хворим на АП проводилася за допомогою метода ДТ з використанням матричного тепловізора марки ТК-1, виробленого у фізико-технічному інституті низьких температур ім. Б. В. Вєркіна НАН України (Харків, Україна).
З метою усунення можливого впливу на результати вимірювань факторів похибки при проведенні ДТ ретельно дотримувалися наступні умови:
– вимірювання температур проводилося в термонейтральной зоні, тобто в діапазоні комфортних температур (для роздягненої людини комфортна температура повітря в приміщенні кабінету при нормальному тиску та вологості і відсутності примусової вентиляції становить близько 22-24 °С);
– до початку дослідження пацієнти проходили температурну адаптацію в приміщенні з температурою, близькою до температури кабінету, протягом 20-30 хвилин;
– усі дослідження проводилися виключно в позі пацієнта стоячи, оскільки інфрачервоні портрети людини, що лежить або стоїть відрізняються;
– строго дотримувалися умови білатеральної фотографічної симетрії (досліджувана та контрольна області повинні знаходитися на однаковій відстані від об’єктива тепловізору);
– площа приміщення кабінету для термографічного дослідження повинна складати більше 20 м2, в ньому відсутні нагрівальні прилади спрямованної дії. Для освітлення кабінету використовуються лампи денного світла, які не створюють інтенсивних теплових зон;
– спільно з термографічним дослідженням у кабінеті паралельно проводиться термометрія повітря для контролю змін зовнішніх температурних умов.
Результати дослідження виводилися на екран персонального комп’ютера у вигляді кольорових зображень зі значенням температур – термограм, які потім підлягали аналізу на якісному рівні, що полягає в оцінці зон гіпертермії та гіпотермії, та кількісному рівні, що полягає у визначенні температурного градієнту досліджуваної ділянки у порівнянні з оточуючими тканинами або симетричною ділянкою (виявлення термоасиметрії). Діагностичне значення мав температурний градієнт більше 0,6 °С .
До групи дослідження увійшло 55 хворих на АП у віці від 25 до 65 років, з яких 21 особа (38 %) – жінки, 34 особи (62 %) – чоловіки. Усі хворі були розподілені на групи, згідно ступеня активності захворювання: до І групи увійшло 20 (36,4 %) пацієнтів з І (мінімальним) ступенем активності, ІІ група склала 22 (40 %) хворих з ІІ (середнім) ступенем активності, ІІІ група – 11 (20 %) осіб з ІІІ (максимальним) ступенем активності, та у 2 (3,6 %) пацієнтів активність була відсутня. При ДТ в проекції суглобів та периартикулярних тканин у хворих різних груп визначено різний температурний градієнт. При статистичній обробці даних параметричними методами температурний градієнт у хворих за групами розподілився наступним чином: І група – (2,26 ± 0,17) °С, ІІ група – (3,03 ± 0,23) °С, ІІІ група – (4,98 ± 0,73) °С. Було достовірно встановлено з ймовірністю безпомилкового прогнозу р=95 %, що температурний градієнт у хворих з І ступенем активності коливається у межах 1,9-2,6 °С (рис. 5.1), у хворих з ІІ ступенем активності – 2,61-3,5 °С (рис. 5.2) та у пацієнтів з ІІІ ступенем – 3,52-6,44 °С (рис. 5.3). У зв’язку з тим, що діагностичне значення має температурний градієнт більше 0,6 °С , значення даного показника у межах – 0,6‑1,89 °С відповідає субклінічному запаленню (рис. 5.4) [33, 87].
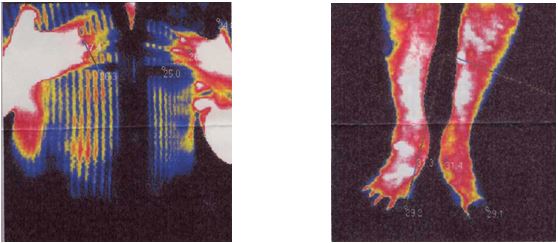
Рисунок 5.1 – Термограми хворого Д., 28 років, АП І ступінь активності
Отже, було встановлено пряму залежність між температурним градієнтом в проекції уражених суглобів і периартикулярних тканин та ступенем активності суглобового синдрому і відповідно рівнем показників регуляції запалення (ІЛ-1β, NO2–, СРБвч).
Також при проведенні ДТ серед 45 (81,8 %) з 55 обстежених хворих на АП, у 6 – було виявлено гіпотермію дистальних відділів кінцівок з коливанням температурного градієнту від -1,1 °С до -7,1 °С, яка проявлялася зниженням інфрачервоного випромінювання всієї кисті та/або стопи (рис. 5.5) і у 39 – визначено симптом «термоампутації» пальців кістей та/або стоп, що є ознаком порушення мікроциркуляції.
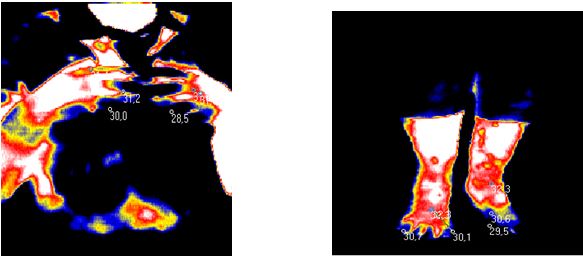
Рисунок 5.2 – Термограми хворої К., 57 років, АП ІІ ступінь активності

Рисунок 5.3 – Термограми хворого П., 65 років, АП ІІІ ступінь активності
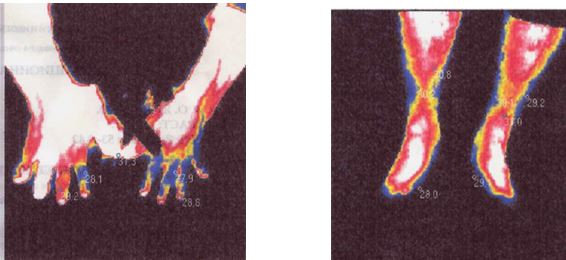
Рисунок 5.4 – Термограми хворого Я., 25 років, АП, активність відсутня
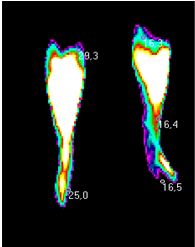
Рисунок 5.5 – Термограма хворого Ш., 52 роки, АП, гіпотермія стоп
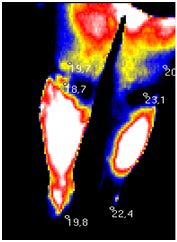
Рисунок 5.6 – Термограма хворої Б., 50 років, АП, симптом «термоампутації» обох стоп
Серед 39 пацієнтів з АП і наявністю симптома «термоампутації» у 4 – було визначено симптом «термоампутації» обох стоп (рис. 5.6), у 9 – симптом «термоампутації» пальців кистей (рис. 5.7), у 10 – симптом «термоампутації» пальців стоп (рис. 5.8) і у 16 – симптом «термоампутації» пальців кистей і стоп (рис. 5.9).
Таким чином, термографічна картина відображає стан активності запальних проявів у суглобах і також стан мікроциркуляції.
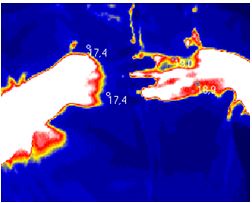
Рисунок 5.7 – Термограма хворого М., 61 рік, АП, симптом «термоампутації» І-V пальців правої кисті та І-ІІ пальців лівої кисті
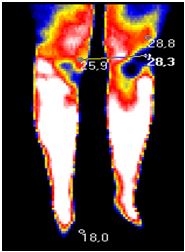
Рисунок 5.8 – Термограма хворої К., 52 роки, АП, симптом «термоампутації» І-V пальців обох стоп
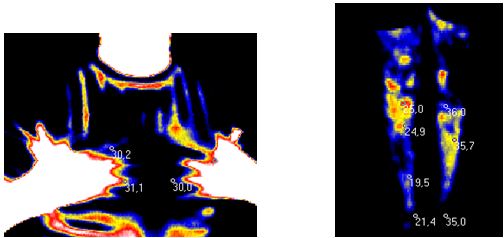
Рисунок 5.9 – Термограма хворого Г., 49 років, АП, симптом «термоампутації» І-V пальців кистей і обох стоп
5.2 Розробка методу діагностики активності артропатичного псоріазу
Розроблено різні методи оцінки активності патологічного процесу при АП, які необхідні для спостереження за перебігом хвороби та для вибору тактики лікування. Для визначення запалення в суглобах хворих на АП та запальної активності хвороби на даний час існує два основних напрямки: клініко-лабораторний та інструментальний, до якого належить рентгенографія та інші методи обстеження.
Рентгенологічне дослідження є класичним стандартним інструментальним методом обстеження хворих на АП [145]. Однак рентгенографія має певні недоліки, такі як: виявлення змін вже на стадії маніфестації клінічних ознак, підвищене променеве навантаження, що потребує наявність певного часу перед проведенням наступного обстеження, низька чутливість до патологічних змін периартикулярних та параоссальних м’яких тканин, та не є інформативною у визначенні запалення на ранній доклінічній стадії захворювання.
Патологічні зміни, які не виявляються за допомогою рентгенологічного методу, можуть бути виявлені за допомогою ультразвукового дослідження, магнітно-резонансної томографії та ДТ.
Ультразвукове дослідження опорно-рухового апарату дозволяє оцінити стан м’якотканинних структур (сухожиль та сухожильних піхв, зв’язок, гіалінового хрящу, синовіальної оболонки, суглобової сумки), субхондральної пластинки, наявність випоту. На підставі рентгенологічних та ультразвукових досліджень описана стадійність змін у суглобах при АП [1, 135].
Термографія дозволяє уточнити локалізацію функціональних змін, активність процесу та його поширеність, а також характер змін – запалення, порушення мікроциркуляції [27, 47, 57].
Діагностика активності АП виконувалася за допомогою матричного тепловізору (професійного тепловізійного програмно-апаратурного комплексу ТК‑1) шляхом вивчення абсолютної температури та температурного градієнту в області уражених суглобів та периартикулярних тканин.
Методика дослідження полягала в наступному. Перед проведенням дослідження проводилася коротка підготовка хворого, яка передбачала: заборону паління за 4 години до проведення дослідження, відміну лікарських засобів, що впливають на кровообіг та метаболічні процеси, також на поверхні тіла не повинно було бути ніяких косметичних засобів та мазей. В приміщенні, де проводилося дослідження, підтримується постійна температура повітря в межах 25 °С та вологість 55-65 %. Хворий оголював досліджувану частину тіла, після чого адаптувався до температури приміщення – 20-25 °С на протязі 20-30 хвилин. Потім пацієнта становили на відстань 1,5-2 м від апарата та виконували візуалізацію теплового випромінювання уражених суглобів і периартикулярних тканин, вимірювали абсолютну температуру. Після отримання термограм проводився їх якісний та кількісний аналіз, який полягав у загальному огляді зображення, вивченні зон гіпертермії та гіпотермії, визначенні температурного градієнту досліджуваної ділянки у порівнянні з оточуючими тканинами або симетричною зоною (термоасиметрія). Діагностичне значення мав температурний градієнт більше 0,6 °С. При цьому при температурному градієнті хворого у межах 1,9 °С-2,6 °С було діагностовано І ступінь активності АП, у межах – 2,61 °С-3,5 °С – ІІ ступінь активності, при температурному градієнті у межах 3,52 °С-6,44 °С – ІІІ ступінь активності; температурний градієнт у межах – 0,6 °С-1,8 °С відповідав субклінічному запаленню. Ефективність способу доведена клінічними дослідженнями [112].
* * *
Термографічна картина дозволяє визначити субклінічне запалення при відсутності характерних клініко-лабораторних змін на доклінічному етапі та судити про ступінь місцевої активності запалення в суглобах та периартикулярних тканинах у хворих на АП на стадії виражених змін, а також про процеси мікроциркуляції. Даний метод дозволяє діагностувати активність АП, у тому числі і на доклінічному етапі, що в подальшому дає можливість призначення адекватної терапії.
Зміст розділу відображено в наступних публікаціях:
1. Возможности дистанционной термографии в комплексной диагностике артропатического псориаза / Я.Ф. Кутасевич, И.А. Олейник, А.А. Гаврилюк [и др.] // Експериментальна і клінічна медицина. – 2015. – № 4 (69) – С. 91-93. – Авторы также: П.Н. Замятин, К.В. Дубровский.
2. Пат. на корисну модель № 103787 UA, МПК А61В10/00, А61F7/00. Спосіб діагностики активності артропатичного псоріазу / О.А. Гаврилюк, Я.Ф. Кутасевич, І.О. Олійник, П.М. Замятін. – № u201507325; заявл. 21.07.2015; опубл. 25.12.2015, Бюл. № 24.
3. Кутасевич Я.Ф. Ранняя диагностика латентной псориатической артропатии / Я.Ф. Кутасевич, И.А. Олейник, А.А. Гаврилюк // Научные труды первой научно-практической международной конференции Ассоциации дерматовенерологов Армении «Ереванские дерматовенерологические чтения» (г. Ереван, Армения, 22-23 мая 2015 г.). – Научно-медицинский журнал. – 2015. – № 10, Вып. 1. – С. 94.
РОЗДІЛ 6
РОЗРОБКА КОМПЛЕКСНОГО МЕТОДУ ЛІКУВАННЯ ХВОРИХ НА ТЯЖКІ ФОРМИ ПСОРІАЗУ З УРАХУВАННЯМ ВИЯВЛЕНИХ ОСОБЛИВОСТЕЙ ПОКАЗНИКІВ РЕГУЛЯЦІЇ ЗАПАЛЕННЯ
В останні роки, за рахунок впровадження нових технологій, які дозволяють швидко зменшити вираженість основних симптомів захворювання, досягти тривалої ремісії та підвищення якості життя, підходи до лікування псоріазу значно змінилися [150]. Однак, незважаючи на великий вибір препаратів і методів лікування хворих на псоріаз, у деяких пацієнтів, переважно з тяжкими формами дерматозу, не завжди відзначається виражений клінічний ефект від проведеної терапії або є протипоказання до її призначення. Крім цього, застосування імуносупресивних препаратів може супроводжуватися досить серйозними побічними ефектами [12, 35, 73, 79, 86, 89, 91].
Мета терапевтичного втручання полягає: в корекції імунних порушень, купіруванні проявів шкірного процесу, зменшенні інтенсивності болю, скутості, зниженні вираженості запального процесу, стабілізації кістково-деструктивних змін у суглобах, зниженні частоти рецидивів, збереженні функції суглобів, відновлення працездатності та підвищенні якості життя хворих [89, 141].
Дуже важливим принципом лікування тяжких форм псоріазу, зокрема АП, є застосування лікарських засобів, які забезпечують позитивний терапевтичний ефект і не ускладнюють перебіг як шкірного, так і суглобового синдромів [73, 89, 91].
6.1 Обґрунтування застосування у хворих на тяжкі форми псоріазу
в комплексній терапії засобу, що покращує мікроциркуляцію
та хондропротектору
На підставі результатів власних отриманих даних у хворих на тяжкі форми псоріазу встановлено наступні лабораторні особливості: цитокіновий дисбаланс з переважанням прозапального цитокіну ІЛ-1β [106, 109], збільшення рівнів EGF, СРБвч, NO2–, СК і ГП та зміни стану згортальної системи крові [64, 71, 241], які проявляються підвищеною активністю коагуляційної ланки, посиленням безперервного внутрішньосудинного згортання крові, про що свідчать підвищені рівні ПТІ, фібриногену, скорочення АЧТЧ та надмірне утворення РФМК, що пов’язано з вираженістю та обширністю запальної реакції дерми з порушеннями мікроциркуляторного русла [71, 111]. Також проведені дослідження показали участь ІЛ-1β, ІЛ-10 у процесах ремоделювання кісткової тканини та зв’язок EGF не тільки з гіперпроліферацією кератиноцитів, а й процесами резорбції кісткової тканини.
Враховуючи виявлені зміни в гомеостазі хворих на тяжкі форми псоріазу, для підвищення ефективності лікування був розроблений комплексний метод терапії, що включає додаткове застосування на фоні системних базових препаратів (МТ або ЛЕФ) L-аргініну та у пацієнтів з ураженням КСА хондропротектору з вираженими протизапальними, знеболюючими властивостями глюкозаміну сульфату.
З метою корекції імунних порушень, зменшення запального процесу, залежно від співвідношення активності шкірного та суглобового синдромів у комплексному лікуванні хворих на тяжкі форми псоріазу використовувалися ХМП, базові системні препарати протизапальної дії – МТ або ЛЕФ. Враховуючи підвищений рівень NO2–, внаслідок його інтенсивної експресії iNOS, з подальшим розвитком зниження його біодоступності, високим рівнем інактивації, виснаженням депо NO та розвитком його дефіциту, що призводить до дисфункції ендотелію, порушення мікроциркуляції та стану згортальної системи крові, з метою покращення мікроциркуляції, нормалізації функціонування ендотелію та стану згортальної системи крові, хворим додатково призначався препарат з цитопротекторною, антиоксидантною, мембраностабілізуючою дією L-аргінін («Тівортін»). Пацієнтам з ураження КСА для зменшення дегенеративно-дистрофічних змін, запалення та болю в суглобах і процесів резорбції кісткової тканини також додатково призначався СМП комплексної дії – глюкозаміну сульфат («Сінарта»).
МТ – структурний аналог фолієвої кислоти, гальмує синтез нуклеїнових кислот, втручається в репродукцію клітин, тим самим пригнічує прискорений епідермопоез, інгібірує проліферацію лімфоцитів, продукцію великого спектра цитокінів, пригнічує запальні процеси сполучної тканини, але негативно позначається на процесах деструкції в хрящовій та кістковій тканині [84]. Даний лікарський засіб є більш активним за впливом на шкірні прояви псоріаза, тому МТ у комплексній терапії одержували хворі з поширеним тяжким ураженням шкіри [73].
ЛЕФ – препарат імуносупресивної дії, селективно інгібірує синтез піримідину переважно в проліферуючих Т-лімфоцитах, блокує стимулюючий вплив прозапальних цитокінів на проліферацію імунокомпетентних клітин, виявляючи протизапальний та антипроліферативний ефекти. Даний препарат, у тому числі, має здатність гальмувати розвиток і прогресування хрящової та кісткової деструкції. ЛЕФ має більш виражений вплив на суглобовий синдром при псоріазі, тому в комплексній терапії його отримували хворі на АП з мінімальними шкірними проявами [89, 91].
Препарат «Сінарта» (глюкозаміну сульфат, реєстраційне посвідчення на лікарський засіб № UA/12122/01/01 від 28.02.2012 р.) – протизапальний, хондропротективний засіб, заповнює ендогенний дефіцит глюкозаміну, стимулює синтез глікозаміногліканів і, відповідно, суглобових протеогліканів, а також гіалуронової кислоти в синовіальній рідині; підвищує проникність суглобової капсули, відновлює ферментативні процеси в клітинах синовіальної мембрани та суглобного хрящу. Сприяє фіксації сірки в процесі синтезу хондроітинсірчаної кислоти, гальмує розвиток дегенеративних процесів у суглобах, проявляє протизапальні властивості, зменшує вираженість артралгій головним чином за рахунок його метаболічних активностей, здатності пригнічувати активність IЛ-1, лізосомальних ферментів, колагенази та фосфоліпази A2, відновлює функцію суглобів. Крім того, глюкозаміну сульфат знижує активність остеокластів, уповільнює резорбцію кісткової тканини [69].
Тівортін (реєстраційне посвідчення на лікарський засіб № UA/8954/01/01 від 13.09.2013 р.) містить амінокислоту L-аргінін, яка має антиоксидантну, цитопротекторну, антигіпоксичну, дезінтоксикаційну, мембраностабілізуючу і гепатопротекторну дію. Тівортін є субстратом для NОS – ферменту, що каталізує синтез NО в ендотеліоцитах. Препарат активує гуанілатциклазу і підвищує рівень циклічного гуанідинмонофосфату в ендотелії судин, зменшує активацію й адгезію лейкоцитів і тромбоцитів до ендотелію судин, пригнічує синтез протеїнів адгезії, включається в процеси фібринолізу, покращує мікроциркуляцію [69].
Комплексне традиційне лікування хворих на тяжкі форми псоріазу залежало від клінічної форми, ступеня тяжкості захворювання та активності суглобового синдрому, супутньої патології і складалося з дезінтоксикаційних (реосорбілакт), антигістамінних (тавегіл, цетиризин, левоцетиризин, дезлоратадин), седативних (гліцисед, екстракт валеріани), вазоактивних (нікотинова кислота), нестероїдних протизапальних препаратів (ревмоксикам, ксефокам), гепатопротекторів (тіотриазолін, антраль, фосфоглів), вітамінів (аскорбінова кислота, вітаміни групи В, фолієва кислота), препаратів магнію та калію (сірчанокисла магнезія, аспаркам). Місцево накладалися топічні кортикостеїдні (бетаметазон), кератолітічні (карбодерм), протизапальні (діклак-гель, діп-реліф), розсмоктуючі (папаверінова мазь, мазь, що містить похідні вітаміну D), зволожуючі (емолієнти), хондпропротективні (хондроксид) засоби. Використовувалися фізіотерапевтичні методи (ультрафіолетове опромінення, магнітотерапія, фонофорез).
Системний препарат базової терапії МТ використовувався в комплексній терапії хворих із тяжким розповсюдженим шкірним процесом, як без ураження КСА, так і з наявністю уражень КСА, у яких в анамнезі був відсутній вірусний гепатит, яких не турбували болі в ділянці печінки та при клініко-лабораторному обстеженні не виявлено ознак ураження гепато-біліарної системи.
МТ призначався за інтермітуючою схемою по 5 мг через 12 годин 3-4 рази поспіль, один раз на тиждень протягом 4 тижнів з наступним призначенням по 7,5 мг (2,5 мг 3 рази на день) 1 раз на тиждень. Доза та тривалість лікування залежали від форми та ступеня тяжкості захворювання, а також переносимості препаратe.
ЛЕФ застосовувався у пацієнтів з АП і мінімальними шкірними проявами, починаючи з насичуючої дози, що становить 100 мг 1 раз на добу протягом трьох днів з переходом на підтримуючу дозу 20 мг 1 раз на добу. Доза та тривалість лікування залежали від форми та ступеня тяжкості псоріаза, а також переносимості препарата. У середньому тривалість лікування ЛЕФ складала 6-8 місяців.
Базова терапія проводилася під контролем артеріального тиску, показників крові та функціональних проб печінки і нирок. При клініко-біохімічному спостереженні у хворих не відмічено ускладнень з боку гепато-біліарної системи. Усі пацієнти добре переносили лікування, ускладнень не відзначено.
L-аргінін («Тівортін») призначався додатково усім хворим на фоні базової терапії по 100 мл внутрішньовено крапельно 1 раз на день 5 днів поспіль, потім по 10 мл 3 рази на день внутрішньо протягом 20 днів.
Препарат глюкозаміну сульфат («Сінарта») призначався також на тлі базової терапії пацієнтам з АП по 400 мг (3,0 мл) внутрішньом’язово, через день, курсом 20 ін’єкцій протягом 40 днів.
Через 3 місяці терапії проводили імуноферментне (ІЛ-1β, ІЛ-10, EGF, СРБвч) та біохімічне дослідження крові (рівень NO2–, СК, ГП, ПТІ, РФМК, АЧТЧ, вміст фібриногену).
6.2 Терапевтична ефективність розробленого комплексного методу
лікування хворих на тяжкі форми псоріазу
З метою оцінки ефективності терапії хворих після лікування розробленим, загальновизнаним і традиційним методами проводилося порівняння клінічних та лабораторних результатів.
Залежно від застосованого методу терапії 106 хворих на тяжкі форми псоріазу було розподілено на наступні терапевтичні групи: Iа підгрупа – 22 хворих – отримували терапію за розробленим методом з використанням МТ, L-аргініну та глюкозаміну сульфату, Iб підгрупа – 23 особи – лікувалися загальновизнаним способом (у комплексному лікуванні одержувала препарат базової терапії МТ), ІІа підгрупа – 20 пацієнтів – лікувалися за розробленим методом з використанням ЛЕФ, L-аргініну та глюкозаміну сульфату, ІІб підгрупа – 20 осіб – отримували в комплексному лікуванні препарат базової терапії ЛЕФ і IIІ група – 21 хворий – одержували традиційну терапію. Усі групи хворих були однорідні за віком, статтю, клінічними формами, змінами лабораторних показників.
Для оцінки результатів лікування застосовувалися наступні клінічні критерії ефективності: значне покращення, покращення, незначне покращення, відсутність ефекту, які наведені в підрозділі 2.1. Аналіз клінічних результатів установив, що значне покращення наставало вдвічі частіше у хворих Iа і IIа підгруп (27,28 % і 10,0 % відповідно) порівняно з пацієнтами Iб і IIб підгруп, які лікувалися загальновизнаним способом (13,04 % і 5,0 % відповідно) (табл. 6.1). У пацієнтів ІІІ групи, які отримували традиційне лікування значне покращення спостерігалося у 4,76 % випадків. Покращення відзначалося також майже вдвічі частіше у хворих Iа і IIа підгруп, яким призначалася терапія за розробленою методикою (54,54 % і 55,0 % відповідно), ніж загальновизнаною – Iб і IIб підгрупи (відповідно 34,79 % і 35,0 %). У пацієнтів ІІІ групи покращення візначалося в 19,05 % випадків. Незначне покращення, навпаки, частіше зареєстровано в Iб і IIб підгрупах (52,17 % і 60,0 % відповідно), порівняно з аналогічним у хворих, які одержували терапію за розробленою методикою – Iа, IIа підгрупи (18,18 % і 35,0 % відповідно). Також незначне покращення спостерігалося у 61,89 % хворих ІІІ групи, які отримували традиційне лікування. Терапія виявилася неефективною тільки у пацієнтів III групи (14,3 %).
Індекси BSA і PASI у хворих різних груп до лікування були підвищеними і відповідно складали: у Ia підгрупі – (40,32 ± 3,65) % і (30,1 ± 2,44) бали, у Iб – (49,5 ± 4,63) % і (36,22 ± 3,02) бали, у IIa – (13,23 ± 2,84) % та (11,41 ± 2,1) бали, у IIб – (13,33 ± 3,01) % та (12,48 ± 2,14) бали, у IIІ групі – (38,02 ± 3,61) % і (29,22 ± 2,62) бали. Динаміка змін показників індексів BSA та PASI у хворих на тяжкі форми псоріазу в процесі лікування представлена на рис. 6.1.
Таблиця 6.1 – Результати лікування хворих на тяжкі форми псоріазу різними методами
| Результати
лікування |
Хворі після лікування різними методами | Разом | ||||
| I група, n=45 | II група, n=40 | IІI група,
n=21 |
||||
| Iа підгрупа, n=22 | Iб підгрупа, n=23 | IIа підгрупа, n=20 | IIб підгрупа, n=20 | |||
| абс./% | абс./% | абс./% | абс./% | абс./% | абс./% | |
| Значне покращення |
6/27,28 | 3/13,04 | 2/10,0 | 1/5,0 | 1/4,76 | 13/12,26 |
| Покращення | 12/54,54 | 8/34,79 | 11/55,0 | 7/35,0 | 4/19,05 | 42/39,62 |
| Незначне покращення |
4/18,18 | 12/52,17 | 7/35,0 | 12/60,0 | 13/61,89 | 48/45,28 |
| Відсутність ефекту | – | – | – | – | 3/14,3 | 3/2,84 |
| Всього | 22/100,0 | 23/100,0 | 20/100,0 | 20/100,0 | 21/100,0 | 106/100,0 |
При вивченні динаміки шкірного патологічного процесу після проведеної терапії майже по всіх групах констатовано статистично достовірне (р < 0,05, р < 0,01) зменшення індексів BSA і PASI (рис. 6.1). Так, після закінчення терапії в підгрупах, де в якості базового препарату призначався МТ, величина індексів BSA і PASI достовірно (р < 0,001) зменшувалася значно більше ніж у підгрупах, де в якості препарата базової терапії призначався ЛЕФ (рис. 6.1), що узгоджується з даними літератури [84, 89, 91]. У хворих Іа підгрупи індекси BSA і PASI в процесі терапії (рис. 6.1) зменшувалися на 50,11 % і 54,31 % відповідно з високим ступенем достовірності (р < 0,001, р < 0,0001) порівняно з аналогічними показниками осіб Іб підгрупи (зниження індексів на 44,0 % і 48,06 %) і ІІІ групи (зниження на 26,42 % і 31,59 %). У пацієнтів ІІа підгрупи при оцінці показників індексів BSA і PASI після лікування (рис. 6.1) відзначалося достовірне (р < 0,05, р < 0,0001) їх зменшення на 41,16 % і 44,38 % відповідно в порівнянні з аналогічними показниками у хворих ІІб підгрупи (зниження індексів на 37,18 % і 39,59 %) і ІІІ групи (зниження на 26,42 % і 31,59 %) [97].
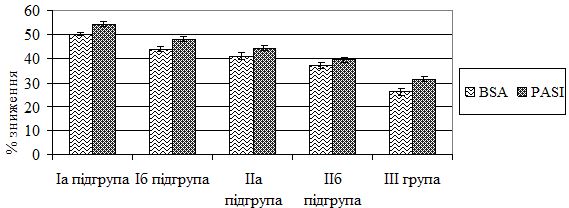
Рисунок 6.1 – Динаміка індексів BSA і PASI у хворих на тяжкі форми псоріазу в процесі лікування (p < 0,05, p < 0,001, p < 0,0001)
Рівень DLQI у всіх обстежених хворих до лікування був підвищеним та складав: у Ia підгрупі – (21,5 ± 1,11) бали, Iб – (20,3 ± 1,25) бали, IIa – (16,2 ± 1,16) бали, IIб – (15,55 ± 0,86) бали і в IIІ групі – (19,95 ± 1,12) бали. За індексом DLQI до лікування групи вірогідно не відрізнялися. Динаміка змін DLQI у хворих на тяжкі форми псоріазу в процесі лікування представлена на рис. 6.2.
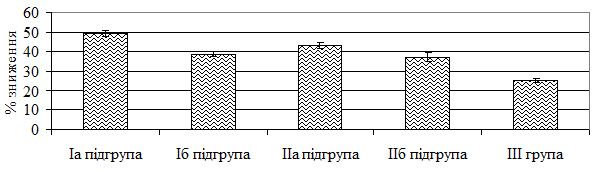
Рисунок 6.2 – Динаміка індексу DLQI у хворих на тяжкі форми псоріазу в процесі лікування (p < 0,05, p < 0,001, p < 0,0001)
У процесі терапії у хворих всіх груп рівень DLQI достовірно (р < 0,01, р < 0,001) знижувався (рис. 6.2). При оцінці результатів лікування у пацієнтів Іа підгрупи встановлено з високим ступенем достовірності (р < 0,001, р < 0,0001) зниження індексу DLQI на 49,49 % порівняно з аналогічним показником у хворих Іб підгрупи (зниження індексу на 38,84 %) і ІІІ групи (зниження на 25,35 %). У пацієнтів ІІа підгрупи після закінчення терапії індекс DLQI достовірно (р < 0,05, р < 0,001) зменшувався на 43,16 % порівняно з аналогічним показником хворих ІІб підгрупи (зменшення індексу на 37,2 %) і ІІІ групи (зменшення на 25,35 %) [34].
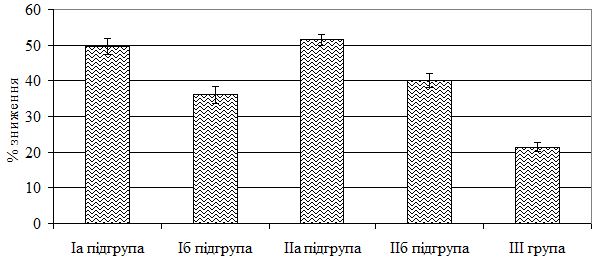
Рисунок 6.3 – Динаміка показника індексу ВАШ у хворих на АП у процесі лікування (р < 0,05, p < 0,001, p < 0,0001)
Показник вираженості болю в суглобах ВАШ до лікування по групах складав: у Ia підгрупі – (6,68 ± 0,35) см, Iб – (6,44 ± 0,44) см, IIa – (6,55 ± 0,29) см, IIб – (6,2 ± 0,33) см і IIІ групі – (5,69 ± 0,38) см. Динаміку змін показників індексу ВАШ у хворих на тяжкі форми псоріазу в процесі терапії представлено на рис. 6.3.
До лікування групи за індексом ВАШ вірогідно не відрізнялися. На тлі терапії у хворих усіх груп індекс ВАШ достовірно (р < 0,05, р < 0,01) знижувався порівняно з вихідним показником. Так, після закінчення лікування у пацієнтів Іа підгрупи встановлено з високим ступенем достовірності (р < 0,001, р < 0,0001) зниження індексу ВАШ на 49,62 % порівняно з аналогічним показником у хворих Іб підгрупи (зниження на 36,16 %) і ІІІ групи (зниження на 21,39 %). У осіб ІІа підгрупи після закінчення терапії індекс ВАШ достовірно (р < 0,05, р < 0,001) зменшувався на 51,45 % порівняно з аналогічним показником у хворих ІІб підгрупи (зменшення на 40,18 %) і ІІІ групи (зменшення на 21,39 %) [160, 231].
У пацієнтів з АП при обстеженні методом ДТ після лікування за розробленим методом відмічалося підвищення місцевої температури дистальних відділів кінцівок і відсутність симптому «термоампутації», що свідчило про покращення процесів мікроциркуляції (рис. 6.4, 6.5). Також спостерігалося зниження місцевої температури в проекції уражених суглобів, що свідчило про зменшення запалення у суглобах (рис. 6.6).
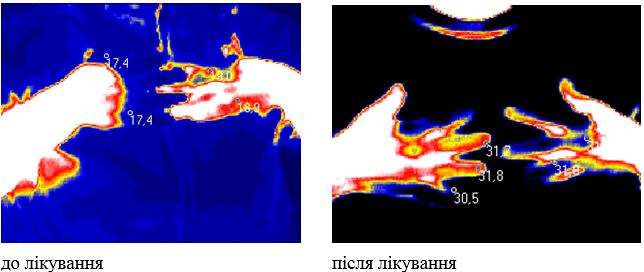
Рисунок 6.4 – Термограми хворого М., 61 рік, АП (до та після лікування за розробленим методом). До лікування визначався симптом «термоампутації» І-V пальців правої кисті та І-ІІ пальців лівої кисті, після лікування симтом «термоампутації» відсутній, спостерігалася гіпотермія V пальців обох кистей
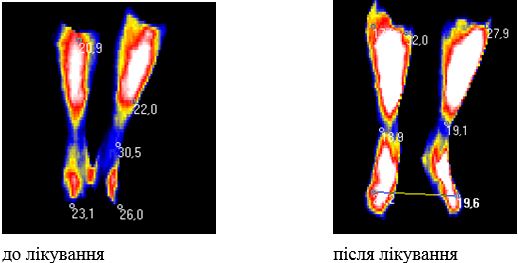
Рисунок 6.5 – Термограми хворої С., 59 років, АП (до та після лікування за розробленим методом). До лікування визначався симптом «термоампутації» обох стоп, після лікування спостерігався симтом «термоампутації» тільки ІІІ-V пальців обох стоп
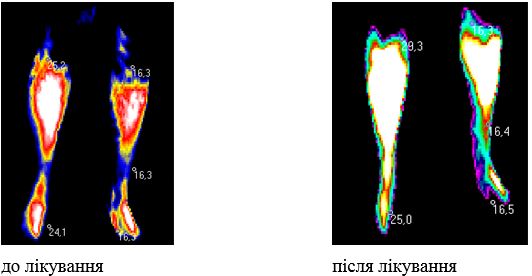
Рисунок 6.6 – Термограми хворого Ш., 52 років, АП (до та після лікування за розробленим методом). До лікування в проекції правого колінного суглобу та периартикулярних тканин визначалася гіпертермія з температурним градієнтом + 8,9 °С, після лікування – в проекції колінних суглобів нормотермія
Таким чином, лікування хворих на тяжкі форми псоріазу за розробленим методом сприяло підвищенню ефективності терапії (досягнення значного покращення та покращення) у 81,82 % хворих Іа підгрупи та 65,0 % у пацієнтів ІІа підгрупи. Використання L-аргініну в комплексній терапії дозволило досягти більш чіткого регресу висипань на шкірі та більш вираженого достовірного (р < 0,001, р < 0,0001) зниження індексів BSA і PASI відповідно на 50,11 % і 54,31 % у хворих Іа підгрупи і на 41,16 % та 44,38 % відповідно у осіб ІІа підгрупи порівняно з аналогічними показниками пацієнтів, яким L-аргінін не призначався (індекси BSA і PASI знижувалися в Іб, ІІб підгрупах і ІІІ групі відповідно на 44,0 % і 48,06 %; на на 37,18 % і 39,59 %; 26,42 % і 31,59 %). Індекс DLQI достовірно (р < 0,05, р < 0,001, р < 0,0001) більш виражено зменшувався на 49,49 % у хворих Іа підгрупи та 43,16 % у осіб ІІа підгрупи, які в комплексній терапії додатково отримували L-аргінін та глюкозаміну сульфат, порівняно з пацієнтами Іб, ІІб підгруп і ІІІ групи, яким L-аргінін і глюкозаміну сульфат не призначався (індекс DLQI відповідно знижувався на 38,84 %, 37,2 % і 25,35 %), тобто лікування хворих за розробленим методом дозволило досягти більш значного поліпшення якості життя пацієнтів на тяжкі форми псоріазу. Також при застосуванні L-аргініну спостерігалося покращення процесів мікроциркуляції у хворих, що підтверджується даними ДТ. Використання глюкозаміну сульфату в комплексній терапії дозволило досягти більш вираженого достовірного (р < 0,001, р < 0,0001) зниження індексу ВАШ на 49,62 % і 51,45 % у хворих Іа та ІІа підгруп відповідно, порівняно з аналогічним показником пацієнтів, яким глюкозаміну сульфату не призначався (індекс ВАШ знижувався в Іб, ІІб підгрупах і ІІІ групі відповідно на 36,16 %, 40,18 % і 21,39 %), тобто лікування хворих за розробленим методом дозволило досягти більш значного купірування болю в суглобах та зменшити використання нестероїдних протизапальних препаратів.
6.3 Динаміка лабораторних показників у хворих на тяжкі форми псоріазу при застосуванні розробленого комплексного методу лікування
Клінічному ефекту застосованих препаратів відповідала позитивна динаміка лабораторних показників.
Динаміку імунологічних, біохімічних показників та окремих показників згортальної системи крові в процесі лікування відображено в таблицях 6.2, 6.3, 6.4, 6.5, 6.6 і 6.7.
Таблиця 6.2 – Динаміка імунологічних показників у хворих на тяжкі форми псоріазу при лікуванні МТ (M ± m)
| Показ-ники | Практично здорові особи n=20 |
Іа підгрупа (n = 22) | Іб підгрупа (n = 23) | ІІІ група (n = 21) | |||
| до ліку-вання |
після ліку-вання |
до ліку-вання |
після ліку-вання |
до ліку-вання |
після ліку-вання |
||
| ІЛ-1β, пг/мл | 4,48 ± 0,65 | 20,54 ± 1,07 | 8,85 ± 0,85
р1 < 0,05 p2<0,001 |
22,15 ± 0,9 | 12,68 ± 0,88
р3 < 0,05 |
20,56 ± 1,49 | 14,49 ± 1,17 |
| ІЛ-10, пг/мл | 4,13 ± 0,54 | 4,64 ± 0,37 | 7,83 ± 0,61
р1 > 0,05 p2 < 0,01 |
5,0 ± 0,45 | 7,28 ± 0,75
р3 < 0,05 |
4,8 ± 0,35 | 5,5 ± 0,35 |
| ІЛ-1β/ ІЛ-10 | 1,55 ± 0,29 | 5,66 ± 1,0 | 1,37 ± 0,23
р1 < 0,05 p2 < 0,05 |
6,35 ± 1,33 | 2,21 ± 0,32
р3 > 0,05 |
4,69 ± 0,43 | 2,73 ± 0,22 |
| EGF, пг/мл | 113,72 ± 11,91 | 544,84 ± 25,27 | 302,06 ± 34,39
р1 > 0,05 p2 > 0,05 |
468,29 ± 29,41 | 308,4 ± 27,74
р3 > 0,05 |
469,2 ± 31,22 | 345,93 ± 23,01 |
| СРБвч, мг/л | 2,93 ± 0,47 | 24,25 ± 2,95 | 10,5 ± 1,47
р1 < 0,05 p2<0,01 |
30,15 ± 3,98 | 16,15 ± 2,5
р3 > 0,05 |
29,0 ± 4,95 | 19,98 ± 3,81 |
Примітка. p1 – достовірність відмінностей показників після лікування між Іа і Іб підгрупами; p2 – достовірність відмінностей показників після лікування між Іа підгрупою і ІІІ групою; p3 – достовірність відмінностей показників після лікування між Іб підгрупою і ІІІ групою.
У хворих усіх груп у сироватці крові до лікування зареєстровано достовірне (р < 0,05, р < 0,01, р < 0,001, р < 0,0001) збільшення рівнів ІЛ-1β, EGF, СРБвч та відзначено тенденцію до незначного збільшення вмісту ІЛ-10 (табл. 6.2, 6.3). За значеннями імунологічних показників до лікування групи між собою вірогідно не відрізнялися.
Таблиця 6.3 – Динаміка імунологічних показників у хворих на тяжкі форми псоріазу при лікуванні ЛЕФ (M ± m)
| Показ-ники | Практично здорові особи n=20 |
ІІа підгрупа (n = 20) | ІІб підгрупа (n = 20) | ІІІ група (n = 21) | |||
| до ліку-вання |
після ліку-вання |
до ліку-вання |
після ліку-вання |
до ліку-вання |
після ліку-вання |
||
| ІЛ-1β, пг/мл | 4,48 ± 0,65 | 25,99 ± 2,55 | 11,05 ± 1,27
р1 > 0,05 p2 > 0,05 |
23,79 ± 1,55 | 13,42 ± 0,93
р3 > 0,05 |
20,56 ± 1,49 | 14,49 ± 1,17 |
| ІЛ-10, пг/мл | 4,13 ± 0,54 | 4,1 ± 0,35 | 7,42 ± 0,61
р1 > 0,05 p2 < 0,01 |
4,39 ± 0,22 | 6,48 ± 0,29
р3 < 0,05 |
4,8 ± 0,35 | 5,5 ± 0,35 |
| ІЛ-1β/ ІЛ-10 | 1,55 ± 0,29 | 7,69 ± 1,27 | 1,78 ± 0,28
р1 > 0,05 p2 < 0,05 |
5,79 ± 0,52 | 2,15 ± 0,18
р3 > 0,05 |
4,69 ± 0,43 | 2,73 ± 0,22 |
| EGF, пг/мл | 113,72 ± 11,91 | 470,26 ± 29,32 | 205,98 ± 25,26
р1 > 0,05 p2<0,001 |
472,59 ± 27,06 | 257,58 ± 23,6
р3 < 0,05 |
469,2 ± 31,22 | 345,93 ± 23,01 |
| СРБвч, мг/л | 2,93 ± 0,47 | 26,08 ± 2,84 | 10,09 ± 1,65
р1 > 0,05 p2 < 0,01 |
22,65 ± 3,15 | 12,3 ± 1,95
р3 > 0,05 |
29,0 ± 4,95 | 19,98 ± 3,81 |
Примітка. p1 – достовірність відмінностей показників після лікування між ІІа і ІІб підгрупами; p2 – достовірність відмінностей показників після лікування між ІІа підгрупою і ІІІ групою; p3 – достовірність відмінностей показників після лікування між ІІб підгрупою і ІІІ групою.
Проведення терапії за трьома методами сприяло позитивній динаміці імунологічних показників порівняно з такими до лікування. Але під впливом комплексної терапії за розробленим методом спостерігалося більш суттевє зменшення вмісту ІЛ-1β, EGF, СРБвч і підвищення рівня ІЛ-10, а також нормалізація співвідношення ІЛ-1β/ІЛ-10 (р < 0,05, р < 0,01, р < 0,001, р < 0,0001) порівняно з аналогічними показниками в підгрупах хворих, які лікувалися загальновизнаним способом або отримували традиційну терапію (табл. 6.2, 6.3). Так у пацієнтів Іа і ІІа підгруп концентрація ІЛ-1β, EGF і СРБвч відповідно знижувалася на 54,57 % і 57,02 %, 46,34 % і 56,64 %, 55,17 % і 58,32 %, вміст ІЛ-10 підвищувався на 76,27 % і 82,37 %, показник співвідношення ІЛ-1β/ІЛ-10 зменшувався на 70,5 % і 76,39 % відповідно. Разом з тим, у осіб Iб, IIб підгруп, ІІІ групи рівні ІЛ-1β, EGF і СРБвч знижувалися відповідно на 41,3 %, 42,89 %, 29,93 %; 34,32 %, 46,08 %, 25,87 %; 41,99 %, 44,47 %, 30,91 %, концентрація ІЛ-10 підвищувалася на 46,58 %, 52,05 %, 21,32 % та показник співвідношення ІЛ-1β/ІЛ-10 зменшувався на 52,75 %, 60,18 %, 36,6 % відповідно [64, 98, 107]. Аналіз імунологічних показників між Іа підгрупою, де в якості базового препарата використовувся МТ, і ІІа підгрупою, в якій хворі в якості базового препарата отримували ЛЕФ, вірогідної різниці не виявив.
Таблиця 6.4 – Динаміка біохімічних показників у хворих на тяжкі форми псоріазу при лікуванні МТ (M ± m)
| Показ-ники | Практично здорові особи n=20 |
Іа підгрупа (n = 22) | Іб підгрупа (n = 23) | ІІІ група (n = 21) | |||
| до ліку-вання |
після ліку-вання |
до ліку-вання |
після ліку-вання |
до ліку-вання |
після ліку-вання |
||
| NO2–, мкмоль/л | 12,80 ± 0,62 | 30,64 ± 0,92 | 12,86 ± 0,04
р1<0,0001 p2<0,0001 |
28,3 ± 0,74 | 11,84 ± 0,16
р3<0,0001 |
28,48 ± 0,60 | 15,75 ± 0,36 |
| СК, у.о. | 157,9 ± 1,38 | 202,5 ± 9,02 | 164,5 ± 5,9
р1 > 0,05 p2 > 0,05 |
183,22 ± 8,03 | 159,45 ± 4,67
р3 < 0,01 |
181,76 ± 5,27 | 176,76 ± 4,06 |
| ГП, у.о. | 0,33 ± 0,01 | 0,51 ± 0,03 | 0,36 ± 0,02
р1 > 0,05 p2 < 0,05 |
0,43 ± 0,03 | 0,34 ± 0,02
р3 < 0,05 |
0,44 ± 0,02 | 0,42 ± 0,02 |
Примітка. p1 – достовірність відмінностей показників після лікування між Іа і Іб підгрупами; p2 – достовірність відмінностей показників після лікування між Іа підгрупою і ІІІ групою; p3 – достовірність відмінностей показників після лікування між Іб підгрупою і ІІІ групою.
Таблиця 6.5 – Динаміка біохімічних показників у хворих на тяжкі форми псоріазу при лікуванні ЛЕФ (M ± m)
| Показ-ники | Практично здорові особи n=20 |
ІІа підгрупа (n = 20) | ІІб підгрупа (n = 20) | ІІІ група (n = 21) | |||
| до лікування |
після лікування |
до лікування |
після лікування |
до лікування |
після лікування |
||
| NO2–, мкмоль/л | 12,80 ± 0,62 | 30,24 ± 1,0 | 12,9 ± 0,16
р1 < 0,05 p2<0,0001 |
27,96 ± 0,72 | 12,21 ± 0,2
р3<0,0001 |
28,48 ± 0,60 | 15,75 ± 0,36 |
| СК, у.о. | 157,9 ± 1,38 | 202,6 ± 9,08 | 159,11 ± 5,17
р1 > 0,05 p2 < 0,05 |
192,2 ± 7,65 | 171,1 ± 6,05
р3 > 0,05 |
181,76 ± 5,27 | 176,76 ± 4,06 |
| ГП, у.о. | 0,33 ± 0,01 | 0,5 ± 0,03 | 0,35 ± 0,02
р1 > 0,05 p2 < 0,05 |
0,48 ± 0,03 | 0,39 ± 0,02
р3 > 0,05 |
0,44 ± 0,02 | 0,42 ± 0,02 |
Примітка. p1 – достовірність відмінностей показників після лікування між ІІа і ІІб підгрупами; p2 – достовірність відмінностей показників після лікування між ІІа підгрупою і ІІІ групою; p3 – достовірність відмінностей показників після лікування між ІІб підгрупою і ІІІ групою
Рівні імунологічних показників після лікування у пацієнтів усіх груп не досягали контрольних значень, що свідчить про збереження імунного запалення, але у хворих, які отримували лікування за розробленим методом дані показникі були більш наближеними до параметрів контрольної групи (табл. 6.2, 6.3).
Групи пацієнтів за значеннями біохімічних показників до лікування вірогідно між собою не відрізнялися. Після лікування за трьома методами вишевказані показники зазнавали позитивних змін (табл. 6.4, 6.5).
Рівень NO2– у хворих Іа, Іб, ІІа, ІІб підгруп і ІІІ групи достовірно понижувався (р < 0,001, р < 0,0001) на 57,28 %, 57,15 %, 56,4 %, 55,95 % і 44,38 % відповідно, порівняно з таким до лікування.
Таблиця 6.6 – Динаміка окремих показників згортальної системи крові у хворих на тяжкі форми псоріазу при лікуванні МТ (M ± m)
| Показ-ники | Практично здорові особи n=20 |
Іа підгрупа (n = 22) | Іб підгрупа (n = 23) | ІІІ група (n = 21) | |||
| до ліку-вання |
після ліку-вання |
до ліку-вання |
після ліку-вання |
до ліку-вання |
після ліку-вання |
||
| ПТІ, % | 95,92 ± 1,47 | 100,37 ± 0,91 | 96,25 ± 1,14
р1 > 0,05 p2 < 0,05 |
100,69 ± 1,05 | 98,25 ± 1,01
р3 > 0,05 |
101,47 ± 1,11 | 100,09 ± 1,12 |
| Фібриноген, г/л | 3,11 ± 0,10 | 5,29 ± 0,52 | 4,14 ± 0,35
р1 > 0,05 p2 > 0,05 |
4,18 ± 0,22 | 3,48 ± 0,16
р3 > 0,05 |
4,43 ± 0,4 | 4,18 ± 0,39 |
| РФМК, х10-2 г/л | 3,03 ± 0,03 | 4,92 ± 0,73 | 3,74 ± 0,38
р1 > 0,05 p2 > 0,05 |
4,07 ± 0,25 | 3,12 ± 0,05
р3 < 0,05 |
4,26 ± 0,34 | 3,65 ± 0,2 |
| АЧТЧ, с | 30,35 ± 0,89 | 27,21 ± 0,6 | 27,0 ± 1,1
р1 > 0,05 p2 > 0,05 |
27,75 ± 0,85 | 27,48 ± 0,43
р3 > 0,05 |
28,49 ± 0,88 | 28,41 ± 1,03 |
| Тромбоцити, х109/л | 244,14 ± 7,41 | 235,23 ± 8,75 | 221,7 ± 10,31
р1 > 0,05 p2 > 0,05 |
242,13 ± 5,7 | 227,04 ± 7,81
р3 > 0,05 |
235,25 ± 9,24 | 230,48 ± 8,84 |
Примітка. p1 – достовірність відмінностей показників після лікування між Іа і Іб підгрупами; p2 – достовірність відмінностей показників після лікування між Іа підгрупою і ІІІ групою; p3 – достовірність відмінностей показників після лікування між Іб підгрупою і ІІІ групою
У осіб Іа та ІІа підгруп, які отримували лікування за розробленим методом, констатована нормалізація концентрації NO2–, у пацієнтів Іб і ІІб підгруп [40], які лікувалися за загальновизнаними методами, даний показник знижувався нижче рівня практично здорових осіб (табл. 6.4, 6.5). Використання традиційного методу дозволило понизити вміст NO2–, але його рівень перевищував аналогічний у осіб контрольної групи (р < 0,0001). Отже, традиційна терапія не надає нормалізуючого впливу на вміст NO2– в сироватці крові пацієнтів з тяжкими формами псоріазу, а наявність його підвищенної концентрації після лікування свідчить про збереження запальної реакції в організмі. Включення МТ в комплексну терапію хворих сприяє зниженню рівня NO2– нижче контрольних значень, що на фоні розвитку дефіциту NO та зниження його біодоступності у пацієнтів з псоріазом може викликати підсилення дисфункції ендотелію і запальної реакції, а також обумовити втрату протекторних властивостей NO [14, 122]. Використання в комплексному лікуванні L-аргініну сприяє нормалізації концентрації NO2– в сироватці крові [97].
Під впливом комплексної терапії, як за розробленим методом, так і за загальновизнаним способом відзначено нормалізацію (р < 0,05, р < 0,001) вмісту СК, ГП (табл. 6.4, 6.5). Але у пацієнтів Іа і ІІа підгруп спостерігалося більш виражене достовірне (р < 0,05, р < 0,001) зниження даних показників на 17,16 % і 19,31 %, 26,07 % і 26,92 % відповідно, порівняно з відсотком зниження рівнів СК і ГП у хворих Іб і ІІб підгруп (зниження на 9,17 % і 9,7 %, 14,43 % і 14,82 % відповідно). Традиційна терапія також позитивно впливала на рівень СК і ГП, але їх концентрація залишалася підвищеною і достовірно (р < 0,001) відрізнялася від таких у практично здорових осіб.
За значеннями окремих показників згортальної системи крові до лікування групи пацієнтів вірогідно між собою не відрізнялися (табл. 6.6, 6.7).
Використання комплексної терапії за розробленим методом сприяло значному пониженню рівня ПТІ, фібриногена, РФМК порівняно з такими до лікування (р < 0,05, р < 0,01), але показники фібриногену і РФМК перевищували (р < 0,05) рівні контрольної групи (табл. 6.6, 6.7).
Під впливом терапії за загальновизнаним способом, відзначено достовірне зниження (р < 0,05) вмісту фібриногена і РФМК у хворих Іб підгрупи, які в якості базового препарату отримували МТ. У пацієнтів ІІб підгрупи (базовий препарат ЛЕФ) спостерігалася тенденція до зниження даних показників. Разом з тим в обох підгрупах відзначено тенденцію до пониження (р > 0,05) рівня ПТІ. На фоні традиційної терапії концентрація ПТІ, фібриногену, РФМК мала лише тенденцію до пониження. Вірогідну різницю між підгрупами хворих не встановлено [97].
Таблиця 6.7 – Динаміка окремих показників згортальної системи крові у хворих на тяжкі форми псоріазу при лікуванні ЛЕФ (M ± m)
| Показ-ники | Практично здорові особи n=20 |
ІІа підгрупа (n = 20) | ІІб підгрупа (n= 20) | ІІІ група (n = 21) | |||
| до ліку-вання |
після ліку-вання |
до ліку-вання |
після ліку-вання |
до ліку-вання |
після ліку-вання |
||
| ПТІ, % | 95,92 ± 1,47 | 102,39 ± 1,22 | 99,53 ± 1,14
р1 > 0,05 p2 > 0,05 |
101,25 ± 1,13 | 99,28 ± 1,55
р3 > 0,05 |
101,47 ± 1,11 | 100,09 ± 1,12 |
| Фібриноген, г/л | 3,11 ± 0,10 | 4,65 ± 0,28 | 3,66 ± 0,18
р1 > 0,05 p2 > 0,05 |
4,11 ± 0,53 | 3,15 ± 0,27
р3 < 0,05 |
4,43 ± 0,4 | 4,18 ± 0,39 |
| РФМК, х10-2 г/л | 3,03 ± 0,03 | 4,39 ± 0,38 | 3,65 ± 0,23
р1 < 0,05 p2 > 0,05 |
4,27 ± 0,63 | 3,05 ± 0,05
р3 < 0,01 |
4,26 ± 0,34 | 3,65 ± 0,2 |
| АЧТЧ, с | 30,35 ± 0,89 | 27,47 ± 0,72 | 27,21 ± 1,1
р1 > 0,05 p2 > 0,05 |
26,73 ± 0,91 | 26,7 ± 1,09
р3 > 0,05 |
28,49 ± 0,88 | 28,41 ± 1,03 |
| Тромбоцити, х109/л | 244,14 ± 7,41 | 224,73 ± 11,28 | 218,91 ± 10,71
р1 > 0,05 p2 > 0,05 |
230,24 ± 11,09 | 231,85 ± 9,62
р3 > 0,05 |
235,25 ± 9,24 | 230,48 ± 8,84 |
Примітка. p1 – достовірність відмінностей показників після лікування між ІІа і ІІб підгрупами; p2 – достовірність відмінностей показників після лікування між ІІа підгрупою і ІІІ групою; p3 – достовірність відмінностей показників після лікування між ІІб підгрупою і ІІІ групою
Рівень АЧТЧ і кількість тромбоцитів під впливом терапії за трьома методами мали тенденцію до пониження, вірогідної різниці між групами, не встановлено.
Віддалені результати лікування оцінювалися шляхом спостереження за пацієнтами після закінчення терапії протягом одного року (табл. 6.8).
Таблиця 6.8 – Віддалені результати лікування хворих на тяжкі форми псоріазу
| Результати
лікування |
Хворі після лікування різними методами | Разом,
n=106 |
||||
| I група, n=45 | II група, n=40 | IІI група, n=21 |
||||
| Iа підгрупа, n=22 | Iб підгрупа, n=23 | IIа підгрупа, n=20 | IIб підгрупа, n=20 | |||
| абс./% | абс./% | абс./% | абс./% | абс./% | абс./% | |
| Рецидив двічі на рік | 1/4,5 | 3/13,1 | 0/0,0 | 2/10,0 | 4/19,05 | 10/12,26 |
| Один рецидив протягом року | 2/9,1 | 3/13,1 | 2/10,0 | 3/13,04 | 4/19,05 | 14/39,62 |
| Всього | 3/13,6 | 6/26,2 | 2/10,0 | 5/23,04 | 8/38,1 | 24/22,64 |
Отримані дані показали, що у хворих Іа підгрупи рецидив дерматозу двічі за рік виник у 1 (4,5 %) пацієнта, один рецидив протягом року – у 2 (9,1 %), у ІІа підгрупі спостерігався один рецидив у 2 (10 %) хворих, тоді як у 3 (13,1 %) пацієнтів Іб підгрупи рецидив виник двічі за рік спостереження, один – також у 3 (13,1 %) хворих, а у ІІб підгрупі рецидив двічі за рік – у 2 (10 %) пацієнтів, один рецидив – у 3 (13,04 %) осіб та в ІІІ групі у 4 (19,05 %) хворих спостерігався один рецидив за рік і у 4 (19,05 %) пацієнтів – два рецидиви протягом періоду спостереження (табл. 6.8).
* * *
Таким чином, лікування хворих на тяжкі форми псоріазу за розробленим методом сприяло підвищенню ефективності терапії (досягнення значного покращення та покращення) у 81,82 % хворих Іа підгрупи та 65,0 % у пацієнтів ІІа підгрупи. Зниження індексів BSA і PASI відбувалося на 50,11 % і 54,31 % у хворих Іа підгрупи і на 41,16 % та 44,38 % відповідно у осіб ІІа підгрупи порівняно з аналогічними показниками пацієнтів Іб, ІІб підгруп і ІІІ групи (індекси BSA і PASI знижувалися відповідно на 44,0 % і 48,06 %; на 37,18 % і 39,59 %; на 26,42 % і 31,59 %). Індекс DLQI більш виражено зменшувався у хворих Іа та ІІа підгруп порівняно з пацієнтами Іб, ІІб підгруп і ІІІ групи. Також при застосуванні L-аргініну спостерігалося покращення процесів мікроциркуляції у хворих, що підтверджувалося даними ДТ. Зниження індексу ВАШ у хворих Іа та ІІа підгруп відбувалося на 49,62 % і 51,45 % порівняно з аналогічним показником пацієнтів Іб, ІІб підгруп і ІІІ групи, де індекс ВАШ знижувався відповідно на 36,16 %, 40,18 % і 21,39 %.
Проведене лікування хворих на тяжкі форми псоріазу за трьома методами різною мірою сприяло нормалізації лабораторних показників. У хворих, які лікувалися традиційно або за загальновизнаним методом, залишався значно збільшеним вміст ІЛ-1β (в 3,23, 2,83 і 2,99 разу відповідно, р < 0,0001), СРБвч (у 6,81, 5,63 і 4,2 разу відповідно, р < 0,0001), EGF (у 3,04, 2,71 і 2,26 разу відповідно, р < 0,001), показник співвідношення ІЛ-1β/ІЛ-10 (в 1,76, 1,42 і 1,38 разу, р < 0,01) порівняно з такими у здорових осіб. Застосування розробленого методу терапії дозволило досягти більш позитивних результатів – рівень показників виявився менш підвищеним: ІЛ-1β (в 1,97 і 2,46 разу відповідно, р < 0,05), СРБвч (в 3,58 і 3,44 разу відповідно, р < 0,001), EGF (в 2,65 і 1,81 разу відповідно, р < 0,05), показник співвідношення ІЛ-1β/ІЛ-10 (у Іа підгрупі нормалізація, в ІІа – підвищення в 1,15 разу, р > 0,05) порівняно з аналогічними показниками контрольної групи. Терапія за розробленим методом певною мірою сприяла нормалізації біохімічних показників (NO2–, СК, ГП). Рівень NO2– у хворих, які отримували лікування за загальновизнаними методами, зменшувався нижче контрольного значення [(12,8±0,62) мкмоль/л] та складав відповідно в Іб підгрупі (11,84±0,16) мкмоль/л і ІІб – (12,21±0,2) мкмоль/л, p<0,001. Призначення препаратів традиційної терапії позитивно впливало на вміст NO2–, СК і ГП, однак виявилося, що їх концентрація перевищувала в 1,23, 1,12 і 1,27 разу (p<0,001) показники контрольної групи. Під впливом комплексної терапії за розробленим методом також відзначалася нормалізація ПТІ, значне зниження вмісту фібриногену в 1,28 і 1,27 разу та РФМК в 1,31 і 1,23 разу (p<0,05), але їх концентрація перевищувала контрольні показники. Застосування загальновизнаного методу лікування та традиційної терапії виявило тенденцію до пониження досліджуваних показників згортальної системи крові, однак вміст ПТІ, фібриногену, РФМК не досягав рівнів контрольної групи, що свідчить про збереження внутрішньосудинної активації прокоагулянтної ланки згортальної системи крові, як відповіді на системне запалення.
Віддалені результати лікування показали, що у хворих Іа і ІІа підгруп рецидиви протягом року відбувалися вдвічі менше порівняно з пацієнтами Іб та ІІб підгруп.
Доведено, що обґрунтоване призначення хворим на тяжкі форми псоріазу в комплексній терапії L-аргініну та глюкозаміну сульфату дозволяє істотно підвищити ефективність лікування у вигляді досягнення значного регресу клінічних проявів, зменшення вираженості рецидивів і покращення якості життя пацієнтів.
Висока ефективність препаратів, безпека застосування та їх позитивна фармекономіка обгрунтовують доцільність використання засобу, що покращує мікроциркуляцію L-аргініну («Тівортін») та хондропротектору глюкозаміну сульфату («Сінарта») в лікуванні хворих на тяжкі форми псоріазу та дозволяють рекомендувати їх для впровадження в практику охорони здоров’я.
Зміст розділу відображено в наступних публікаціях:
1. Гаврилюк А.А. Оценка динамики качества жизни пациентов тяжёлыми формами псориаза на фоне комплексной терапии / А.А. Гаврилюк // Дерматологія та венерологія. – 2015. – № 3 (69). – С. 59-63.
2. Олейник И.А. Динамика содержания стабильного метаболита оксида азота и некоторых показателей свёртывающей системы крови у больных тяжёлыми формами псориаза в процессе комплексной терапии / И.А. Олейник, А.А. Гаврилюк // Експериментальна і клінічна медицина. – 2016. – № 1 (70). – С. 104-109.
3. Динаміка показників метаболітів оксиду азоту у хворих на тяжкі форми псоріазу при застосуванні базової терапії / Я.Ф. Кутасевич, І.О. Олійник, І.О. Маштакова, О.А. Гаврилюк // науково-практична конференція “Нові організаційні та діагностично-лікувальні технології в дерматовенерологічній практиці” в рамках ІV Міжнародного медичного конгресу «Впровадження сучасних досягнень медичної науки в практику охорони здоров’я України» : Тези доповідей, м. Київ, 15-17 квітня 2015 р. – К., 2015. – С. 94.
4. Олейник И.А. Динамика содержания цитокинов у больных псориазом на фоне базовой системной терапии / И.А. Олейник, А.А. Гаврилюк // Збірник робіт за матеріалами науково-практичної конференції «Дерматовенерологія в розробках молодих науковців» (м. Київ, 19-20 листопада 2015 р.). – Дерматовенерологія. Косметологія і Сексопатологія. – 2015. – № 3-4 (2) – С. 124-125.
5. Олійник І.О. Динаміка вмісту епідермального фактору росту (EGF) у хворих на тяжкі форми псоріазу на тлі базової системної терапії / І.О. Олійник, І.О. Маштакова, О.А. Гаврилюк // Збірник робіт за матеріалами науково-практичної конференції «Новітні тенденції лікування та профілактики дерматовенерологічних проблем у рамках доказової медицини» у рамках ХІІ Львівського мед. форуму та ХХІІ мед. виставки «ГалМЕД» (м. Львів, 13-15 квітня 2016 р.). – Український журнал дерматології, венерології, косметології. – 2016. – № 1 (60) – С. 100-101.
6. Opportunities relief of pain with psoriatic arthritis / Y.F. Kutasevych, I.O. Oliinyk, I.O. Mashtakova, O.A. Gavrylyuk // Abstracts of the 24th Congress of the European Academy of Dermatology and Venereology, Copenhagen, Denmark, 7-11 October 2015. – Copenhagen, 2015. – P. 1665.
РОЗДІЛ 7
ОБГОВОРЕННЯ ОДЕРЖАНИХ РЕЗУЛЬТАТІВ
Псоріаз – один з найбільш поширених хронічних дерматозів, належить до групи генетично детермінованих захворювань мультифакторіальної природи з невизначеною етіологією та є актуальною медико-соціальною проблемою. Характеризується ростом захворюваності, питомої ваги тяжких форм, нез’ясованістю етіології та патогенезу, недосконалістю методів лікування, значним пониженням якості життя, розвитком психо-соціальної дезадаптації та інвалідизації хворих [11, 18, 94, 102, 127, 200].
Встановлено, що в патогенезі псоріазу провідну роль грає імунна відповідь. Імунопатогенез псоріазу представляється складним багатокомпонентним процесом взаємодії клітинних і гуморальних складових імунної системи, при якому особлива роль належить прозапальним цитокінам, що синтезуються активованими імуноцитами та клітинами епідермісу. Присутність підвищених концентрацій прозапальних цитокінів активує кератиноцити до синтезу власних ІЛ, хемокінів і факторів росту, прискорює проліферацію кератиноцитів, неоангіогенез, що в цілому сприяє формуванню псоріатичної бляшки та запаленню синовія [48, 49, 79, 108, 226]. Імунні зміні з девіацією цитокінового профілю, переважно за Th1-, Th17-типами з домінуванням прозапальних цитокінів, спричиняють порушення кератинізації, запалення, що обумовлює підтримку порочного кругу і хронізацію патологічного процесу [6, 17, 217, 256]. Існуючі відомості щодо експресії та ролі ключових про- та протизапальних цитокінів (TNFα, ІЛ-1β, INFγ, ІЛ-8, ІЛ-10, ІЛ-4 та ін.) при псоріазі суперечливі. Якщо в псоріатичній папулі встановлено підвищений вміст прозапальних цитокінів, то дані про рівень про- і протизапальних цитокінів у периферичної крові залишаються доволі неоднозначними [110]. Ряд робіт указує на переважання вмісту прозапальних цитокінів і відносно низьку експресію протизапальних цитокінів, що передбачає недостатню протирегулюючу здатність імунологічної системи [63, 76, 82, 108, 139, 142, 217, 218, 226]. Інші автори висловлюють думку про відносну антизапальну поляризацію цитокінового спектру з переважанням ІЛ-4, ІЛ-5, ІЛ-10 при даному захворюванні [12, 44, 48, 49, 63, 105, 110, 119, 139, 218, 232].
Одним з факторів, що регулюють проліферативні процеси в епідермісі є EGF [108]. Відомо, що специфічне зв’язування EGF з рецептором EGF-тирозинкіназою, розташованим на поверхні клітини, викликає безліч біологічних ефектів. EGF секретується кератиноцитами шкіри, активованими макрофагами, тромбоцитами, має мітогенну дію, індукує проліферацію епідермальних, епітеліальних та ембріональних клітин, регулює диференціювання тканин, сприяє ангіогенезу, прискорює загоєння дрібних ран, при певних умовах може викликати малігнизацію клітин [25, 62, 108, 189, 193, 208, 223]. Разом з тим, EGF збільшує вивільнення кальцію з кісткової тканини та стимулює резорбцію кістки, впливаючи на остеобласти, які виділяють фактор, що активує остеокласти [25]. Відомостей про вміст EGF у хворих на різні клінічні форми псоріазу та його клініко-патогенетичне значення у науковій літературі недостатньо.
В сучасному уявленні про псоріаз важлива патогенетична роль також відводиться хронічному запаленню, яке поряд з імунопатологічною патогенетичною «складовою» призводить до метаболічних і судинних порушень [14, 252]. Останнім часом активно вивчається роль NО в запальному процесі. NО є одним з найважливіших біологічних медіаторів, який володіє широким спектром дії в організмі людини. В клітинах NО синтезується з L-аргініну під впливом ферментів родини NОS з утворенням L-цитруліну та NО [128, 140]. NО бере участь у функціонуванні серцево-судинної, імунної систем, системи згортання крові, фібринолітичної системи і системи ендотелію, також показана його участь в розвитку ряду патологічних процесів [123, 124, 128, 149]. Доведено вплив NО на проліферацію мієлоїдних прогенеторних клітин, функціонування Т-лімфоцитів, кератиноцитів [128, 149]. NО бере участь у регуляції судинного тонусу і кровотоку, системної та регіональної гемодинаміки, внутрішньоклітинної концентрації іонів кальцію та тонусу гладеньких м’язів, цитотоксичності, антимікробного захисту [128, 140]. Він істотно впливає і на систему згортання крові: перешкоджає тромбоутворенню, протидіючи агрегації і адгезії тромбоцитів і адгезії нейтрофілів до стінок судин, протидіє активації фосфоліпази А2, синтезу тромбоксану А2 і активації тромбоцитів [117]. NО є важливою складовою системи неспецифічної реактивності організму, впливає на різні сторони запалення, блокуючи або стимулюючи запальну відповідь, що залежить від його концентрації, типу та ступеня активації клітин, впливу інших медіаторів запалення та ін. Описані як про- так і протизапальні ефекти NО [14, 140, 148, 228]. У деяких роботах показана роль NО в підтримці запального процесу [149], розвитку дисфункції ендотелію при псоріазі [14], встановлено підвищення рівня стабільних метаболітів оксиду азоту в плазмі крові у хворих в прогресуючій стадії псоріазу [122] однак дослідження присвячені вивченню вмісту NО у пацієнтів на різні клінічні форми псоріазу, а також його впливу на цитокіновий статус і показники згортання крові практично не проводилися.
Одним із методів оцінки наявності запалення є вивчення рівня СРБвч і біохімічних маркерів сполучнотканинного обміну (СК, ГП) в сироватці крові. В літературі є відомості про зміни маркерів сполучнотканинного обміну при АП [102]. У хворих на ПА в стадії прогресування встановлено різке збільшення рівня СРБвч, в ремісію показники нормалізувалися [254], також є роботи присвячені вивченню СРБвч у хворих на звичайний псоріаз [126]. У вітчизняній літературі мало відомостей про вміст СРБвч, СК і ГП в крові хворих на різні клінічні форми дерматозу.
При псоріазі виявлено зміни згортальної системи крові, що проявляються тенденцією до гіперкоагуляції при уповільненні фібринолізу, скороченням часу згортання крові [3, 66, 117]. Відомості в науковій літературі про стан системи згортання і фібринолітичної системи крові при псоріазі нечисленні, також досить різноманітні і суперечливі. Дослідження присвячені вивченню стану системи згортання крові у хворих на різні клінічні форми дерматозу, залежно від ступеня тяжкості захворювання та активності суглобового синдрому у вітчизняній літературі відсутні.
Проведення в дисертаційній роботі комплексного дослідження з визначенням клініко-патогенетичного значення дисбалансу цитокінів, EGF, NО2–, СРБвч, СК, ГП, окремих показників згортальної системи крові (ПТІ, фібриноген, РФМК, АЧТЧ, тромбоцити) сприятиме, більш глибокому розумінню патогенезу хвороби та розробці ефективних методів терапії.
З 2013 по 2016 рр. під спостереженням перебувало 162 хворих на псоріаз віком 16-70 років. Вивчення клінічних проявів псоріазу виявило високу частоту захворювання серед осіб працездатного віку (127 пацієнтів – 78,4 %), помірне переважання (в 1,49 разу) чоловіків серед хворих. Дебют дерматозу в середньому відбувався у віці 27-32 років та йому в більшості випадків передували психо-емоційне перевантаження, перенесені інфекції. Найчисельнішу групу склали хворі з тривалістю захворювання на момент обстеження до 10 років (71 пацієнт – 43,8 %). Зимовий тип псоріазу відзначено у 51,85 %, літній – у 12,95 %, невизначений (позасезонний) – у 35,20 % хворих. Супутню патологію мали майже всі пацієнти, найчастіше діагностувалися захворювання серцево-судинної системи та хвороби шлунково-кишкового тракту, у 22 хворих визначено поєднану патологію. Клінічна картина шкірного процесу характеризувалася обмеженими (22,2 %), поширеними (46,9 %) дрібно- та крупнобляшковими папульозними висипами, пустулами (3,7 %), вогнищами з ексудативним компонентом (17,3 %), еритродермією (9,9 %). Індекси BSA та PASI в середньому складали (25,77 ± 1,67) % і (20,24 ± 1,15) балу відповідно, індекс DLQI – (17,69 ± 0,42) бали.
З метою аналізу результатів лабораторних досліджень 162 пацієнтів з псоріазом розподілялися на дві групи, залежно від клінічної форми. І (основну) групу склали 111 хворих на тяжкі форми псоріазу (64 чоловіків і 47 жінок) віком 16-70 років (середній вік – [47,06 ± 1,32] роки), з них: Іа підгрупа – 53 особи (33 чоловіків і 20 жінок) у віці від 21 до 68 років (середній вік – [47,45 ± 1,65] років) з поширеним тяжким ураженням шкіри (пустульозна, ексудативна, еритродермічна форми псоріазу) і наявністю ураження КСА (артропатична форма псоріазу), серед яких із І ступенем активності суглобового синдрому – 18 хворих (9 чоловіків і 9 жінок), з ІІ – 24 пацієнти (17 чоловіків і 7 жінок) і ІІІ – 11 осіб (7 чоловіків і 4 жінки); Іб підгрупа – 36 хворих (16 чоловіків і 20 жінок) віком 25-70 років (середній вік – [48,11 ± 2,3] роки) на АП з мінімальними проявами шкірного синдрому, з яких із І ступенем активності суглобового синдрому – 12 осіб (8 чоловіків і 4 жінки), з ІІ – 15 пацієнтів (6 чоловіків і 9 жінок) і ІІІ – 9 хворих (2 чоловіків та 7 жінок); Ів підгрупа – 22 особи (15 чоловіків і 7 жінок) у віці 16-70 років (середній вік – [44,41 ± 3,81] років) з поширеним тяжким ураженням шкіри (пустульозна, ексудативна, еритродермічна форми псоріазу), але без ураження КСА. Група порівняння (ІІ група) складалася з 51 хворого (33 чоловіків та 18 жінок) віком 16-70 років (середній вік – [40,9 ± 2,22] роки) на звичайний (вульгарний) псоріаз.
Контрольна (ІІІ) група включала 20 практично здорових осіб (10 чоловіків і 10 жінок) віком 18-67 років (середній вік – [35,43 ± 3,04] роки), репрезентативних за статю та віком.
Вивчення цитокінового статусу показало: істотне підвищення в сироватці крові хворих на псоріаз прозапального цитокіну ІЛ-1β (у Іа підгрупі – в 4,3 разу, Іб – в 5,9 разу, Ів – в 5,01 разу, у осіб ІІ групи – в 3,4 разу, p < 0,0001); збільшення рівня ІЛ-10 у пацієнтів із вульгарним псоріазом в 1,44 разу (p < 0,001), тенденцію до підвищення ІЛ-10 у хворих на тяжкі форми псоріазу та достовірне збільшення співвідношення ІЛ-1β/ІЛ-10 (у Іа підгрупі – в 3,48 разу, Іб – в 4,6 разу, Ів – в 4,11 разу, ІІ групі – в 1,8 разу, p < 0,01) порівняно з показниками осіб контрольної групи, що свідчить про порушення імунорегуляторних процесів зі зрушенням у бік Th-1 ланки імунної відповіді при псоріазі. Вміст ІЛ-10 у пацієнтів Іа, Іб і Ів підгруп достовірно (p < 0,05, p < 0,001, p < 0,0001) знижувався відповідно в 1,3, 1,4 і 1,17 разу відносно показника хворих на вульгарний псоріаз. Найвищий достовірний рівень ІЛ-1β спостерігався у осіб з АП і мінімальними шкірними проявами (Іб підгрупа), що свідчить про його важливу роль у процесах резорбції кісткової тканини. Зі збільшенням ступеня тяжкості шкірного патологічного процесу спостерігали зростання рівня ІЛ-1β (p < 0,01), тенденцію до підвищення ІЛ-10 та зниження співвідношення ІЛ-1β/ІЛ-10 (p < 0,05). При посиленні ступеня активності суглобового синдрому відбувалося достовірне (p < 0,05, p < 0,01) зростання вмісту ІЛ-1β, зниження ІЛ-10 і підвищення ІЛ-1β/ІЛ-10. Слід відмітити наявність найнижчих показників ІЛ-10 у хворих на АП з III ступенем активності суглобового синдрому, що розцінювалося як розвиток його недостатньої інгібіруючої дії на процеси резорбції кісткової тканини. У пацієнтів з АП і переважанням запальних проявів у сполучній тканині рівень ІЛ-1β у периферичній крові та співвідношення ІЛ-1β/ІЛ-10 перевищували в 1,52 і 1,9 разу відповідно (p<0,001) аналогічні показники у хворих з переважанням дегенеративно-дистрофічних змін у суглобах [106, 109].
Кореляційні зв’язки помірні та середньої сили ІЛ-1β, ІЛ-10 з індексом PASI, СРБвч, NO2–, СК, ГП підтверджують їх роль не тільки в клінічному перебігу псоріазу, розвитку синдрома хронічного запалення, а й участі даних цитокінів в запальних і дегенеративно-дистрофічних процесах у суглобах хворих на псоріаз.
Отже, у хворих на псоріаз відзначалася низька експресія протизапального, антипсоріатичного цитокіну ІЛ-10, що, на тлі значного підвищення рівня прозапального цитокіну ІЛ-1β, свідчить про наявність дисбалансу між про- та протизапальними цитокінами, переважанні Th-1 клітин над Th-2 клітинами і розвитку недостатньої протирегулюючої здатності імунологічної системи. Підвищення співвідношення ІЛ-1β/ІЛ-10 також певною мірою вказує на розвиток цитокінового дисбалансу у хворих на псоріаз. При цьому цитокіновий дисбаланс більш виражений при тяжких формах псоріазу, особливо при наявності суглобового синдрому, що дозволяє розглядати ІЛ-1β та ІЛ-10 в якості діагностично значущих критеріїв тяжкості псоріазу. Отримані дані підтверджують думку ряду дослідників, які вказують на переважання при псоріазі рівня прозапальних цитокінів у периферичній крові і порушення імунорегуляторних процесів зі зрушенням у бік Th-1 ланки імунної відповіді [44, 76, 80, 108, 139, 142, 217, 227].
Дослідження біомаркера імунного запалення СРБвч у хворих на псоріаз встановило його зростання зі збільшенням площі та вираженості запальних змін, а також зі збільшенням ступеня активності суглобового синдрому. Наявність різкого підвищення СРБвч у хворих на різні клінічні форми псоріазу вже при легкому ступені захворювання свідчить про розвиток у них хронічного системного запалення; так у пацієнтів Іа підгрупи вміст СРБвч в 10,36 разу (p < 0,0001) перевищував показник практично здорових осіб, Іб – в 7,75 разу (p < 0,0001), Ів – в 8,06 разу (p < 0,001) і ІІ групи – в 3,64 (p < 0,001) разу. Звертає увагу достовірно більш високі його рівні у пацієнтів з тяжкими формами дерматозу (Іа, Іб, Ів підгрупи), у яких відповідно в 2,84 (p < 0,0001), 2,14 (p < 0,001) і 2,21 (p < 0,05) разу він перевищував показник осіб зі звичайним псоріазом, що вказує на наявність більш інтенсивного запального процесу у даної категорії хворих. Вміст СРБвч в сироватці крові хворих на АП з переважанням запальних проявів у сполучній тканині та пацієнтів на АП з переважанням дегенеративно-дистрофічних проявів у сполучній тканині достовірно вищий порівняно з таким у практично здорових осіб у 10,1 і 6,12 разу відповідно (p < 0,0001), також у хворих на АП з переважанням запальних проявів у сполучній тканині рівень СРБвч статистично значимо в 1,65 разу перевищував аналогічний показник у пацієнтів з АП і переважанням дегенеративно-дистрофічних змін у суглобах.
Отримані дані свідчать про формування синдрому системного запалення у хворих на псоріаз, вираженність якого збільшується зі зростанням ступеня тяжкості захворювання. Однією з причин розвитку цього стану, на нашу думку, є наявність цитокінового дисбалансу, а саме гіперпродукція прозапальних цитокінів, зокрема ключового ІЛ-1β. СРБ також є імуномодулятором, що в реалізації синдрому системного запалення активує функцію всіх клітин рихлої сполучної тканини (інтерстиціальної тканини, клітин ретикулоендотеліальної системи) і функцію клітин, які реалізують реакції вродженого імунітету шляхом посилення постачання їх субстратом для отримання енергії (синтезу АТФ) [246]. Треба відмітити, що до того часу, доки зберігається збільшений рівень СРБ, в організмі не може бути фізіологічного метаболізму; фізіологічні процеси будуть заміщені патофізіологічними.
Для діагностування ступеня тяжкості дерматозу, активності суглобового синдрому, прогнозу розвитку захворювання, а також для патогенетичного обґрунтування призначаємої терапії можна використовувати визначення в сироватці крові рівня ІЛ-1β, ІЛ-10. Дослідження показника СРБвч у хворих на псоріаз дозволить провести моніторинг вираженості імунозапальних порушень, оцінити перебіг дерматозу та ефективність проведеної терапії.
Аналіз вмісту EGF в сироватці крові хворих на псоріаз показав його суттєве збільшення в 4,3 разу порівняно з показником контрольної групи (р < 0,0001): у пацієнтів Іа підгрупи – в 4,73 разу, Іб – в 4,04 разу, Ів – в 3,69 разу, осіб ІІ групи – в 2,56 разу. Рівень EGF зростав зі збільшенням ступеня тяжкості дерматозу та активності суглобового синдрому, при цьому достовірно вищий його вміст реєструвався у хворих на тяжкі форми захворювання. Встановлено, що рівень EGF у хворих на АП з переважанням запальних проявів у сполучній тканині та пацієнтів з АП і переважанням дегенеративно-дистрофічних змін у суглобах значно перевищував контрольні значення (у 4,36 і 3,8 разу відповідно, р < 0,0001), але вірогідно по групах не відрізнявся.
Слід відмітити найвищий статистично достовірний рівень EGF (р < 0,0001) у хворих з поширеним тяжким ураженням шкіри (пустульозна, ексудативна, еритродермічна форми псоріазу) і наявністю ураження КСА, який перевищував у 4,73 разу аналогічний показник практично здорових осіб, що, враховуючи існування відомостей про участь EGF в процесах диференціювання, проліферації клітин, збільшенні вивільнення кальцію з кісткової тканини і стимуляції резорбції кістки [25, 62, 108, 172, 193], на нашу думку свідчить про його важливу роль не тільки в процесах гіперпроліферації кератиноцитів, а й резорбції кісткової тканини. Також цю думку підтверджує наявність досить високого показника EGF у хворих на АП з мінімальними шкірними проявами (Іб підгрупа – [459,35 ± 16,96] пг/мл), який майже однаковий з аналогічним показником у пацієнтів з тяжкими формами псоріазу, але без ураження КСА (Ів підгрупа – [420,45 ± 30,88] пг/мл) та більш чіткий зв’язок динамики рівня EGF зі ступенем активності суглобового синдрому.
Клініко-патогенетичну роль змін EGF у хворих на псоріаз підтверджує існування тісних і помірних кореляційних зв’язків даного показника з окремими клініко-лабораторними параметрами (PASI, СРБвч, NO2–, СК, ГП). Таким чином, отримані дані дозволяють стверджувати, що суттєве підвищення рівня EGF (в 2,56-4,73 разу) має значення в патогенезі псоріазу – з одного боку свідчить про гіперпроліферацію кератиноцитів та розвиток вираженого запалення, що супроводжує даний процес, з іншого – про процеси резорбції кісткової тканини. Зростання рівня EGF в сироватці крові хворих доцільно використовувати для оцінки тяжкості перебігу та активності захворювання, прогнозу його розвитку. Вивчення механізмів біологічних ефектів EGF дозволить розкрити нові мішені для терапевтичного впливу.
Вивчення вмісту NO2– в сироватці крові хворих на псоріаз показало, що даний показник зростав зі збільшенням площі та вираженості запальних змін, а також зі збільшенням ступеня активності суглобового синдрому [71]. Достовірно більш високі його рівні реєструвалися у пацієнтів з тяжкими формами дерматозу (Іа, Іб, Ів підгрупи), у яких відповідно в 2,01 (p < 0,0001), 1,92 (p < 0,0001) і 1,87 (p < 0,0001) разу він перевищував показник осіб зі звичайним псоріазом, що свідчить про розвиток інтенсивного запального процесу у даної категорії хворих, а також наявність реакції, спрямованої на компенсацію та/або нормалізацію порушень гемостазу, змін регіональної гемодинаміки шкіри, пригнічення проліферативних процесів [148, 149]. Вміст NO2– в сироватці крові хворих на АП з переважанням запальних проявів у сполучній тканині та пацієнтів з АП і переважанням дегенеративно-дистрофічних змін у суглобах достовірно вищий в 2,52 і 2,06 разу відповідно (p < 0,0001) порівняно з таким у практично здорових осіб, також у хворих на АП з переважанням запальних проявів у сполучній тканині рівень NO2– статистично значимо в 1,22 разу (p < 0,001) перевищував аналогічний показник пацієнтів з АП і переважанням дегенеративно-дистрофічних змін у суглобах.
Наявність кореляційних зв’язків середньої сили між NO2– та індексом PASI, СРБвч, СК, ГП, його підвищені рівні в сироватці крові пацієнтів з АП підтверджують роль NO2– не тільки в клінічному перебігу псоріазу, а й участі в розвитку запальної реакції та процесах деструкції хряща [12, 82, 211]. Виявлений позитивний кореляційний зв’язок помірної сили між рівнем NO2– в сироватці крові хворих з тяжкими формами псоріазу і вмістом РФМК, фібриногену, та помірний позитивний кореляційний зв’язок між NO2– і кількістю тромбоцитів у пацієнтів зі звичайним псоріазом, свідчить про наявність регулюючого впливу NO2– на певні ланки згортальної системи крові при даному дерматозі. Визначення показника NO2– в сироватці крові хворих на псоріаз доцільно використовувати для визначення ступеня тяжкості дерматозу, активності суглобового синдрому, перебігу захворювання, оцінки ефективності проведеної терапії.
Результати дослідження біохімічних маркерів сполучнотканинного обміну СК і ГП у хворих на псоріаз свідчать про зростання даних показників зі збільшенням ступеня активності суглобового синдрому. Наявність вмісту СК і ГП у хворих на звичайний псоріаз [(159,78 ± 2,4) і (0,34 ± 0,01) у.о.] майже на рівні контрольних значень [(157,9 ± 1,38) і (0,33 ± 0,01) у.о.], свідчить про відсутність значної запальної реакції у цих пацієнтів. Звертає увагу достовірно значне підвищення вмісту даних показників у сироватці крові хворих на тяжкі форми дерматозу, особливо при АП, що вказує на розвиток більш інтенсивного запального процесу у цій категорії хворих, а також наявності деструктивних змін у суглобах [Іа підгрупа – (193,98 ± 5,02) і (0,48 ± 0,02) у.о., Іб – (197,25 ± 6,23) і (0,48 ± 0,02) у.о., Ів – (180,05 ± 7,87) і (0,45 ± 0,02) у.о.]. Рівні СК і ГП у сироватці крові хворих на АП з переважанням запальних проявів у сполучній тканині та пацієнтів на АП з переважанням дегенеративно-дистрофічних проявів у сполучній тканині достовірно вищі в 1,4 і 1,7 разу та 1,14 і 1,27 разу відповідно (p < 0,0001) порівняно з такими у практично здорових осіб, також у хворих на АП з переважанням запальних проявів у сполучній тканині вміст СК і ГП статистично значимо в 1,23 і 1,33 разу відповідно (p < 0,001) перевищував аналогічні показники у пацієнтів з АП і переважанням дегенеративно-дистрофічних змін у суглобах. Визначення показників СК і ГП у сироватці крові хворих на псоріаз дозволить виявити та провести моніторинг вираженості запальних і деструктивних змін у суглобах, оцінити перебіг суглобового синдрому та ефективність проведеної терапії.
Дослідження окремих показників згортальної системи крові виявило, що у хворих на псоріаз спостерігаються зміни стану системи гемостазу, ступінь та характер яких залежить від тяжкості та клінічного перебігу захворювання і проявляються підвищеною активністю коагуляційної ланки, посиленням безперервного внутрішньосудинного згортання крові, інтенсифікацією фібринолітичної системи крові, про що свідчать підвищені рівні ПТІ, фібриногену, скорочення АЧТЧ та надмірне утворення РФМК, які достовірно вищі у осіб з тяжкими формами дерматозу [71, 111]. Отримані дані пов’язані з виразністю та обширністю запальної реакції дерми, розвитком порушень мікроциркуляторного русла при псоріазі, які при тяжких формах дерматозу носять генералізований характер і поєднуються зі схильністю до гіперкоагуляції, що узгоджується з даними літератури [3, 32, 95, 143, 269]. Також, результати дослідження свідчать про те, що розвиток псоріатичного процесу супроводжується активацією дисемінованого внутрішньосудинного згортання крові, викликаного підсиленням експресії прозапальних цитокінів (ІЛ-1β, TNFα та ін.), як відповіді на системне запалення, свідченням якого є надмірне утворення РФМК. Застосування простих і доступних лабораторних тестів (визначення окремих показників згортальної системи крові) дозволяє оцінити тяжкість патологічного процесу та активність суглобового синдрому, перебіг дерматозу та необхідність призначення симптоматичної терапії.
Проведення ДТ дозволило визначити субклінічне запалення у суглобах хворих на АП при відсутності характерних клініко-лабораторних змін на доклінічному етапі та судити про ступінь місцевої активності запалення в суглобах та периартикулярних тканинах на стадії виражених змін, тобто даний метод дозволяє діагностувати активність АП, а на доклінічному етапі виявити запалення, що в подальшому дає можливість призначення адекватної терапії на раннії етапах [33, 87, 112].
За результатами багатофакторного дисперсійного аналізу серед аналізуємих показників, провідними в патогенезі захворювання, виявилися ІЛ-1β, EGF, СРБвч.
На підставі результатів проведених досліджень у хворих на тяжкі форми псоріазу встановлені наступні лабораторні особливості: цитокіновий дисбаланс з переважанням прозапального цитокіну ІЛ-1β [106, 109], збільшення рівнів EGF, СРБвч, NO2–, СК і ГП та зміни стану згортальної системи крові [64, 71, 241], які проявляються підвищеною активністю коагуляційної ланки, посиленням безперервного внутрішньосудинного згортання крові, про що свідчать підвищені рівні ПТІ, фібриногену, скорочення АЧТЧ та надмірне утворення РФМК, що пов’язано з виразністю та обширністю запальної реакції дерми з порушеннями мікроциркуляторного русла [71, 111]. Також проведені дослідження показали участь ІЛ-1β, ІЛ-10 в процесах ремоделювання кісткової тканини та зв’язок EGF не тільки з гіперпроліферацією кератиноцитів, а й процесами резорбції кісткової тканини.
Враховуючи виявлені зміни в гомеостазі хворих на тяжкі форми псоріазу, для підвищення ефективності лікування був розроблений комплексний метод терапії, що включає, додаткове застосування на фоні системних базових препаратів (МТ або ЛЕФ) L-аргініну та у пацієнтів з ураженням КСА хондропротектору з вираженими протизапальними, знеболюючими властивостями глюкозаміну сульфату.
З метою корекції імунних порушень, зменшення запального процесу, залежно від співвідношення активності шкірного та суглобового синдромів в комплексному лікуванні хворих на тяжкі форми псоріазу використовувалися ХМП, базові системні препарати протизапальної дії – МТ або ЛЕФ. Приймаючи до уваги підвищений рівень NO2–, внаслідок його інтенсивної експресії iNOS, з подальшим розвитком зниження його біодоступності, високим рівнем інактивації, виснаженням депо NO та розвитком його дефіциту, що призводить до дисфункції ендотелію, порушення мікроциркуляції та стану згортальної системи крові, з метою покращення мікроциркуляції, нормалізації функціонування ендотелію та стану згортальної системи крові, пацієнтам додатково призначався препарат з цитопротекторною, антиоксидантною, мембраностабілізуючою дією, L-аргінін («Тівортін»). Пацієнтам з ураження КСА, для зменшення дегенеративно-дистрофічних змін, запалення та болю в суглобах і процесів резорбції кісткової тканини також додатково призначався СМП комплексної дії – глюкозаміну сульфат («Сінарта»).
Залежно від застосованого методу терапії 106 хворих на тяжкі форми псоріазу було розподілено на наступні терапевтичні групи: Iа підгрупа – 22 хворих – отримували терапію за розробленим методом з використанням МТ, L-аргініну та глюкозаміну сульфату, Iб підгрупа – 23 особи – лікувалися загальновизнаним способом (в комплексному лікуванні одержували препарат базової терапії МТ), ІІа підгрупа – 20 пацієнтів – лікувалися за розробленим методом з використанням ЛЕФ, L-аргініну та глюкозаміну сульфату, ІІб підгрупа – 20 осіб – отримували в комплексному лікуванні препарат базової терапії ЛЕФ і IIІ група – 21 хворий – одержували традиційну терапію.
Лікування хворих на тяжкі форми псоріазу за розробленим методом сприяло підвищенню ефективності терапії (досягнення значного покращення та покращення) у 81,82 % хворих Іа підгрупи та 65,0 % у пацієнтів ІІа підгрупи. Використання L-аргініну в комплексній терапії дозволило досягти більш чіткого регресу висипань на шкірі та більш вираженого достовірного (р < 0,001, р < 0,0001) зниження індексів BSA і PASI відповідно на 50,11 % і 54,31 % у хворих Іа підгрупи і на 41,16 % та 44,38 % відповідно у осіб ІІа підгрупи порівняно з аналогічними показниками пацієнтів, яким L-аргінін не призначався (індекси BSA і PASI знижувалися в Іб, ІІб підгрупах і ІІІ групі відповідно на 44,0 % і 48,06 %; на на 37,18 % і 39,59 %; 26,42 % і 31,59 %). Індекс DLQI достовірно (р < 0,05, р < 0,001, р < 0,0001) більш виражено зменшувався на 49,49 % у хворих Іа підгрупи та 43,16 % у осіб ІІа підгрупи, які в комплексній терапії додатково отримували L-аргінін, порівняно з пацієнтами Іб, ІІб підгруп і ІІІ групи, яким L-аргінін не призначався (індекс DLQI відповідно знижувався на 38,84 %, 37,2 % і 25,35 %), тобто лікування хворих за розробленим методом дозволяє досягти більш значного поліпшення якості життя пацієнтів на тяжкі форми псоріазу. Також при застосуванні L-аргініну спостерігалося покращення процесів мікроциркуляції у хворих, що підтверджується даними ДТ. Використання гюкозаміну сульфату в комплексній терапії дозволило досягти більш вираженого достовірного (р < 0,001, р < 0,0001) зниження індексу ВАШ на 49,62 % і 51,45 % у хворих Іа та ІІа підгруп відповідно, порівняно з аналогічним показником пацієнтів, яким глюкозаміну сульфат не призначалася (індекс ВАШ знижувався в Іб, ІІб підгрупах і ІІІ групі відповідно на 36,16 %, 40,18 % і 21,39 %), тобто лікування хворих за розробленим методом дозволяє досягти більш значного купірування болю в суглобах, та зменшити використання нестероїдних протизапальних препаратів [231]. У пацієнтів з АП при обстеженні методом ДТ після лікування за розробленим методом відмічалося зниження місцевої температури в проекції уражених суглобів, що свідчило про зменшення запалення у суглобах.
Проведене лікування хворих на тяжкі форми псоріазу за трьома методами різною мірою сприяло нормалізації лабораторних показників. У хворих, які лікувалися традиційно або за загальновизнаним методом, значно збільшеним залишався вміст ІЛ-1β (в 3,23, 2,83 і 2,99 разу відповідно, р < 0,0001), СРБвч (в 6,81, 5,63 і 4,2 разу відповідно, р < 0,0001), EGF (в 3,04, 2,71 і 2,26 разу відповідно, р < 0,001), показник співвідношення ІЛ-1β/ІЛ-10 (в 1,76, 1,42 і 1,38 разу, р < 0,01) порівняно з такими у здорових осіб. Застосування розробленого методу терапії дозволило досягти більш позитивних результатів – рівень показників виявився менш підвищеним: ІЛ-1β (в 1,97 і 2,46 разу відповідно, р < 0,05), СРБвч (у 3,58 і 3,44 разу відповідно, р < 0,001), EGF (у 2,65 і 1,81 разу відповідно, р < 0,05), показник співвідношення ІЛ-1β/ІЛ-10 (в Іа підгрупі нормалізація, в ІІа – підвищення в 1,15 разу, р > 0,05) в порівнянні з аналогічними показниками контрольної групи. Терапія за розробленим методом певною мірою сприяла нормалізації біохімічних показників (NO2–, СК, ГП). Рівень NO2– у хворих, які отримували лікування за загальновизнаним методом, зменшувався нижче контрольного значення [(12,8±0,62) мкмоль/л] та складав відповідно в Іб підгрупі (11,84±0,16) мкмоль/л і ІІб – (12,21±0,2) мкмоль/л, p<0,001. Призначення препаратів традиційної терапії позитивно впливало на вміст NO2–, СК і ГП, однак виявилося, що їх концентрація перевищувала в 1,23, 1,12 і 1,27 разу (p<0,001) показники контрольної групи. Під впливом комплексної терапії за розробленим методом також відзначалася нормалізація ПТІ, значне зниження вмісту фібриногену в 1,28 і 1,27 разу та РФМК в 1,31 і 1,23 разу (p<0,05), але їх концентрація перевищувала контрольні показники. Застосування загальновизнаного методу лікування та традиційної терапії виявило тенденцію до пониження досліджуваних показників згортальної системи крові, однак рівні ПТІ, фібриногену, РФМК не досягали показників контрольної групи, що свідчить про збереження внутрішньосудинної активації прокоагулянтної ланки згортальної системи крові, як відповіді на системне запалення.
Віддалені результати лікування показали, що у хворих Іа і ІІа підгруп рецидиви протягом року відбувалися вдвічі менше порівняно з пацієнтами Іб та ІІб підгруп.
Доведено, що обґрунтоване призначення хворим на тяжкі форми псоріазу в комплексній терапії L-аргініну та глюкозаміну сульфату дозволяє істотно підвищити ефективність лікування у вигляді досягнення значного регресу клінічних проявів, зменшення вираженості рецидивів і покращення якості життя пацієнтів.
Висока ефективність препаратів, безпека застосування та їх позитивна фармекономіка обгрунтовують доцільність використання засобу, що покращує мікроциркуляцію L-аргініну («Тівортін») та хондропротектору глюкозаміну сульфату («Сінарта») в лікуванні хворих на тяжкі форми псоріазу та дозволяють рекомендувати їх для впровадження в практику охорони здоров’я.
ВИСНОВКИ
У дисертації наведено теоретичне узагальнення і нове вирішення наукової задачі, що полягає в підвищенні ефективності лікування хворих на тяжкі форми псоріазу шляхом розробки комплексного методу терапії на підставі вивчення показників регуляції запалення.
1. Враховуючи високу частоту псоріазу в працездатному віці (78,4 %), збільшення питомої ваги тяжких форм дерматозу, резистентних до терапії, недостатнє вирішення питання патогенетичних особливостей псоріазу та наявність побічних ефектів імуносупресивної терапії, актуальним є вивчення ролі змін показників регуляції запалення в патогенезі даного дерматозу та розробка методу корекції виявлених порушень.
2. За результатами імунологічних досліджень у хворих на псоріаз уточнено дані про характер цитокінового дисбалансу, що проявлялося істотним підвищенням у сироватці крові рівня ІЛ-1β (у Іа підгрупі – у 4,3 разу, у Іб – у 5,9 разу, у Ів – у 5,01 разу, у ІІ групі – у 3,4 разу), підвищенням співвідношення IЛ-1β/ІЛ-10 (у Іа підгрупі – у 3,48 разу, Іб – у 4,6 разу, Ів – у 4,12 разу, ІІ групі – в 1,8 разу) порівняно з контрольними показниками. Виявлено підвищення вмісту СРБвч в сироватці крові пацієнтів із псоріазом (у Іа підгрупі – у 10,36 разу, Іб – у 7,75 разу, Ів – у 8,06 разу, ІІ групі – в 3,64 разу) порівняно з контрольним показником. Визначено залежність рівнів IЛ-1β, IЛ-10 та СРБвч від ступеня тяжкості дерматозу та активності суглобового синдрому.
3. Виявлено підвищення вмісту EGF в сироватці крові хворих на псоріаз (у Іа підгрупі – у 4,73 разу, Іб – у 4,04 разу, Ів – у 3,69 разу, ІІ групі – у 2,56 разу) відносно аналогічного показника контрольної групи. Більш істотне вірогідне підвищення рівня EGF спостерігалося у пацієнтів з тяжкими формами дерматозу порівняно з показником хворих на звичайний псоріаз. Встановлено залежне від ступеня тяжкості шкірного патологічного процесу та активності суглобового синдрому збільшення рівня EGF.
4. За результатами біохімічних досліджень у всіх хворих на псоріаз встановлено підвищення вмісту NO2– (у Іа підгрупі – у 2,36 разу, Іб – у 2,26 разу, Ів – у 2,21 разу, ІІ групі – у 1,17 разу) порівняно з показником практично здорових осіб. Рівень СК і ГП вірогідно збільшувався тільки у хворих на тяжкі форми псоріазу (у Іа підгрупі – у 1,23 разу, Іб – у 1,25 разу, Ів – у 1,14 разу) відносно аналогічних показників осіб контрольної групи. У пацієнтів з тяжкими формами псоріазу визначено достовірне зростання вмісту ПТІ, фібриногену, РФМК (відповідно у Іа підгрупі – у 1,05, 1,56, 1,45 разу, Іб – у 1,07, 1,37, 1,46 разу, Ів – у 1,05, 1,33, 1,4 разу), скорочення АЧТЧ (у Іа підгрупі – у 1,09 разу, Іб – у 1,12 разу, Ів – у 1,08 разу), а у осіб з вульгарним псоріазом – тільки підвищення рівня РФМК в 1,06 разу порівняно з відповідними контрольними показниками. Встановлено пряму залежність вмісту NO2–, ПТІ, фібриногену і РФМК від ступеня тяжкості дерматозу та активності суглобового синдрому і пряму залежність рівня СК і ГП від ступеня активності суглобового синдрому. Прямі кореляційні зв’язки NO2– з РФМК, фібриногеном і кількістю тромбоцитів свідчать про його регулюючий вплив на певні ланки згортальної системи крові при псоріазі.
5. При проведенні ДТ у хворих на АП встановлено, що температурний градієнт у межах 0,6-1,8 °С відповідає субклінічному запаленню, 1,9-2,6 °С – І ступеню активності, 2,61-3,5 °С – ІІ, 3,52-6,44 °С – ІІІ, це дозволяє визначити запалення у суглобах та периартикулярних тканинах на ранньому доклінічному етапі, встановити ступінь активності запалення на стадії виражених змін і проводити моніторинг у процесі терапії. Виявлено пряму залежність між температурним градієнтом в проекції уражених суглобів і периартикулярних тканин та рівнем показників регуляції запалення (ІЛ-1β, СРБвч, NO2–).
6. Запропоновано комплексний метод терапії хворих на тяжкі форми псоріазу з використанням на фоні базової терапії (МТ або ЛЕФ), засобу, що покращує мікроциркуляцію (L-аргінін) та хондропротектору (глюкозаміну сульфат), який дозволив підвищити ефективність лікування у 81,82 % і 65,0 % пацієнтів (при лікуванні за загальновизнаним способом – у 47,83 % та 40 % хворих відповідно), досягти зниження індексів BSA на 50,11 % і 41,16 %, PASI на 54,31 % і 44,38 %, DLQI на 49,49 % і 43,16 % та ВАШ на 49,62 % і 51,45 % (при терапії за загальновизнаним способом – на 44,0 % і 37,18 %; 48,06 % і 39,59 %; 38,84 % і 37,2 % відповідно), нормалізувати рівні NO2–, СК, ГП і ПТІ, співвідношення ІЛ-1β/ІЛ-10, достовірно знизити вміст EGF у 1,80 і 2,28 разу, СРБвч у 2,31 і 2,58 разу, фібриногену в 1,28 і 1,27 разу та РФМК в 1,31 і 1,23 разу.
РЕКОМЕНДАЦІЇ
1. Для ранньої діагностики та моніторингу запального процесу в суглобах хворих на АП рекомендовано проведення дистанційної термографії з визначенням температурного градієнту. Діагностичне значення має температурний градієнт більше 0,6 °С. Температурний градієнт у межах 0,6-1,8 °С відповідає субклінічному запаленню, в діапазоні 1,9-2,6 °С – І ступеню активності АП, 2,61-3,5 °С – ІІ, 3,52-6,44 °С – ІІІ.
2. Для встановлення ступеня тяжкості дерматозу, активності суглобового синдрому та прогнозу перебігу псоріазу з метою призначення адекватної терапії доцільно використовувати алгоритм обстеження пацієнтів із застосуванням окрім стандартних клініко-лабораторних методів, комплексного дослідження ІЛ-1β, ІЛ-10, EGF, NO2–, ПТІ, фібриногену, РФМК та інструментальних методів (рентгенографія та дистанційна термографія).
3. Запропоновано комплексний ефективний спосіб лікування хворих на тяжкі форми псоріазу, що передбачає на фоні базової терапії додаткове призначення:
– з метою покращення мікроциркуляції – L-аргініну (в дозі 100 мл внутрішньовенно краплинно 1 раз на добу 5 днів поспіль, потім по 10 мл 3 рази на день внутрішньо протягом 20 днів);
– пацієнтам з ураженням КСА для зменшення дегенеративно-дистрофічних та запальних змін, болю в суглобах і процесів резорбції кісткової тканини – глюкозаміну сульфату (у дозі 400 мг (3,0 мл) внутрішньом’язово, через день, курсом 20 ін’єкцій протягом 40 днів).
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Абдуллаев Р. Я. Возможности ультразвуковой диагностики при псориатическом артрите / Р. Я. Абдуллаев, И. А. Олейник, М. И. Спузяк // Международный медицинский журнал. – 2009. – № 17. – С. 13-17.
- Абрамкина М. М. Варианты коррекции гемореологических и гемостатических нарушений у больных торпидно протекающим псориазом / М. М. Абрамкина // Совещание проблем. науч. кожно-венеролог. центра Минздрава РСФСР: тезисы совещания. — Уфа, 1989. — С. 66—67.
- Адаскевич В. П. Особенности нарушений системы гемостаза при различном характере течения распространенного обыкновенного псориаза / В. П. Адаскевич, Ю. В. Козина // Вестник Витебского государственного медицинского университета. – 2010. – Т. 9. – № 3. – С. 105.
- Аковбян Г. В. Биологические препараты, как новая парадигма в лечении псориаза: (обзор литературы и собственные наблюдения) / Г. В. Аковбян, Г. Е. Шамина, О. В. Компасова // Клин. дерматол. венерол. – 2007. – № 2. – С. 17-21.
- Андрашко Ю. В. Імунобіологічна терапія блокатором ФНП-a: новий стандарт лікування псоріазу із середньотяжким та тяжким перебігом / Ю.В. Андрашко // Укр. журнал дерматології, венерології, косметології. – 2008. – № 2. – С. 35–36.
- Ахлупкина М. В. Особенности нарушений липидного спектра крови и цитокинового статуса при псориазе различной степени тяжести и патогенетическое обоснование повышения эффективности комплексной терапии заболевания: автореф. дис. на соиск. степени канд. мед. наук : спец. 14.03.03 “Патологическая физиология”, спец. 14.01.20 “Кожные и венерические болезни” / М. В. Ахлупкина. – Саратов, 2012. – 21 с.
- Бадокин В. В. Влияние нестероидных противовоспалительных препаратов на метаболизм суставного хряща / В. В. Бадокин // Русский медицинский журнал. – 2013. – № 32. – [Электронный ресурс]. – Режим доступа: http://rmj.ru.
- Бадокин В. В. Костная патология при псориатическом артрите / В. В. Бадокин // Научно-практическая ревматология. – 2007. – № 5. – С. 11-17.
- Бадокин В. В. Терапия поражения периферических суставов при псориатическом артрите / В. В. Бадокин // Русский медицинский журнал. – 2012. – № 7. – С. 354.
- Бадокин В. В. Эффективность и переносимость лефлуномида (Арава) в терапии псориатического артрита / В. В. Бадокин // Современная ревматология. — 2013. — № 4. — С. 92-96.
- Бадокин В. В. Влияние инфликсимаба на основные синдромы псориатического артрита / В. В. Бадокин, В. А. Молочков // Рос. журн. кожных и венерических болезней. – 2007. – № 2. – С. 21–26.
- Бакулев А. Л. Псориаз как системная патология / А. Л. Бакулев, Ю. В. Шагова, И. В. Козлова // Саратовский научно-медицинский журнал. – 2008. – № 1 (19). – С. 13-20.
- Белова О. В. Роль цитокинов в иммунологической функции кожи / О. В. Белова, В. Я. Арион, В. И. Сергиенко // Иммунология, аллергология, инфектология. – 2008. – № 1. – С. 41–55.
- Беловол А. Н. Дисфункция сосудистого эндотелия у больных псориазом / А. Н. Беловол // Укр. журн. дерматол., венерол., косметол. – 2010. – № 1 (36). – С. 17-21.
- Беловол А. Н. Доказательные аспекты расовой наследственности псориаза / А. Н. Беловол // Дерматол. венерол. – 2012. – № 1 (55). – С. 5-8.
- Белозоров А. П. Новая субпопуляция эффекторных хелперных Т‑лимфоцитов (TH22) и ее участие в патогенезе заболеваний кожи / А. П. Белозоров // Дерматол. венерол. – 2010. – № 2 (48). – С. 7-10.
- Бельтюкова А. С. Содержание и синтез цитокинов при псориазе : автореф. на соискание степени канд. мед. наук : спец. 14.00.36 “Аллергология и иммунология”, спец. 14.00.11 “Кожные и венерические болезни”. – СПб., 2009. – 19 с.
- Беляев Г. М. Псориаз, псориатическая артропатия. 3-е изд. / Г. М. Беляев, П. П. Рыжко. – М.: МедПресс-информ, 2005. – 290 с.
- Беляев Г. М. Современный взгляд на проблему лечения больных псориазом / Г. М. Беляев // Дерматол. венерол. – 2009. – № 3. – С. 7-17.
- Беляев Г. М. Современное представление о патогенезе псориатической артропатии и лечение этих больных / Г. М. Беляев // Дерматология и венерология. – 2010. – № 1 (47). – С. 7-30.
- Біловол А. Л. Патогенез і терапія псоріазу з різним ступенем тяжкості ендогенної інтоксикації та артеріальної гіпертензії : автореф. дис. на здобуття наук. ступеня докт. мед. наук : спец. 14.01.20 “Шкірні та венеричні хвороби” / А. Л. Біловол. – Харків, 2011. – 29 с.
- Біловол А. М. Роль середньомолекулярних пептидів та білків гострої фази у хворих на псоріаз та псоріаз, поєднаний з артеріальної гіпертензією / А. М. Біловол, А. А. Берегова, І. М. Штиров // Дерматологія та венерологія. – 2011. – № 2. – С. 69-71 .
- Болевич С. Б. Псориаз: современный взгляд на этиопатогенез / С. Б. Болевич // Вестник Российской военно-медицинской академии. – 2013. – № 2 (42). – С. 202-206.
- Болотная Л. А. Псориаз: патогенез, клинические проявления, принципы терапии / Л. А. Болотная // Східноєвроп. журн. внутріш. та сімейн. медиц. – 2015. – № 1. – С. 4-9.
- Бураковский А. И. Роль эпидермального фактора роста и его рецептора в развитии онкопатологии / А. И. Бураковский, Л. Н. Лухверчик, Н. В. Пивень // Наука в информационном пространстве – 2012 : VІІІ Международная научно-практическая интернет конференция, 4-5 октября 2012 г. : тезисы докл. – Киев, Украина, 2012. – [Электронный ресурс]. – Режим доступа: http://www.confcontact.com /2012 10 04/bi2 burakovsky.htm.
- Бутов Ю. В. Клинико-биохимический статус у больных псориазом и методы его коррекции / Ю. В. Бутов // Рос. журн. кожн. вен. болезней. – 2009. – № 5. – С. 23-27.
- Вайнер Б. Г. Матричное тепловидение в физиологии: исследование сосудистых реакций, перспирации и терморегуляции у человека / Б. Г. Вайнер. – Новосибирск : Издательство Сибирского отделения РАН, 2004. – 96 с.
- Валиханов У. А. Оценка состояния микроциркуляции у больных псориазом на фоне комплексной терапии / У. А. Валиханов, А. Б. Пакирдинов, М. Хаманова // Новости дерматовенерологии и репродуктивного здоровья. – 2008. – № 4. – С. 79-82.
- Владимиров В. В. Псориаз: этиопатогенез, клиника, лечение и профилактика / В. В. Владимиров, Е. В. Владимирова // Качество жизни. Медицина. – 2006. – № 6. – С. 38-44.
- Владимирова Е. В. Основы лечебного ухода за кожей при псориазе / Е. В. Владимирова // Клин. дерматол. венерол. – 2007. – № 4. – С. 79-83.
- Владимирова И. С. Возможности повышения эффективности комплексной терапии псориаза / И. С. Владимирова, К. Н. Монахов // Вестник дерматологии и венерологии. – 2010. – № 2. – С. 58-63.
- Внутрисосудистое свёртывание крови и уровень оксида азота у больных псориазом / О. М. Капулер, А. Р. Мирсаева, З. Р. Хисматуллина, Ф. Х. Камилов // Медицинская наука и образование Урала. – 2009. – № 4. – С. 39 ‑ 42.
- Возможности дистанционной термографии в комплексной диагностике артропатического псориаза / Я. Ф. Кутасевич, И. А. Олейник, А. А. Гаврилюк [и др.] // Експериментальна і клінічна медицина. – 2015. – № 4 (69) – С. 91-93.
- Гаврилюк А. А. Оценка динамики качества жизни пациентов тяжёлыми формами псориаза на фоне комплексной терапии / А. А. Гаврилюк // Дерматологія та венерологія. – 2015. – № 3 (69). – С. 59-63.
- Гаврилюк А. А. Современные аспекты патогенеза и терапии псориаза (обзор литературы) / А. А. Гаврилюк // Вісник Української медичної стоматологічної академії «Актуальні проблеми сучасної медицини». – 2015. – Т. 15, Вип. 3 (51), Част. 2. – С. 300-306.
- Гайдукова И. З. Биомаркеры при заболеваниях суставов, состояние проблемы и перспективы применения (обзор литературы) / И. З. Гайдукова, А. П. Ребров // Науч-практич. ревматол. – 2012. – № 54 (5). – С. 73–79.
- Годзенко А. А. Методы оценки воспалительной активности и эффективности терапии при спондилоартритах / А. А. Годзенко, Ю. Л. Корсакова, В. В. Бадокин // Современная ревматология. – 2012. – № 2. – С.66-76.
- Горячковський О. М. Клінічна біохімія в лабораторній діагностиці: Довідниковий посібник. – Вид. 3-е, вип. і доп. / О. М. Горячковський. – Одеса : Екологія, 2005. – 616 с.
- Григорьев Д. В. Оценка эффективности и безопасности комбинированного лечения больных псориазом метотрексатом и широкополосной средневолновой фототерапией / Д. В. Григорьев, В. В. Владимиров // Вестн. дерматол. венерол. – 2014. – № 6. – С. 14-17.
- Динаміка показників метаболітів оксиду азоту у хворих на тяжкі форми псоріазу при застосуванні базової терапії / Я. Ф. Кутасевич, І. О. Олійник, І. О. Маштакова, О. А. Гаврилюк // Впровадження сучасних досягнень медичної науки в практику охорони здоров’я України : ІV міжнародний медичний конгресс, 15-17 квітня 2015 р. : тези доп., збірник наукових праць. – Київ, 2015. – С. 94.
- Дистанционная инфракрасная термография как современный неинвазивный метод диагностики заболеваний / Л. Г. Розенфельд, А. В. Самохин, Е. Ф. Венгер [и др.] // Укр. мед. часопис. – 2008. – № 6 (68). – С. 92-97.
- Дистанційний інфрачервоний термограф з матричним фотоприймачем та досвід його використання у клінічній лікарні / Л. Г. Розенфельд, Є. Ф. Венгер, Т. В. Лобода [та ін.] // Український радіологічний журнал. – 2006. – № 14. – С. 450-456.
- Добржанська Є. І. Вивчення регуляторних механізмів нейроендокринної системи у хворих на псоріаз та корекція виявлених змін / Є. І. Добржанська // Дерматовенерол. Косметол. Сексопатол. – 2007. – № 1-4 (10). – С. 89-91.
- Довжанский С. И. Генетические и иммунные факторы в патогенезе псориаза / С. И. Довжанский, И. Я. Пинсон // Рос. журн. кожн. вен. болезней. – 2006. – № 1. – С. 14-19.
- Знаменская Л. Ф. Первый клинический опыт применения препарата устекинумаб (Стелара) в терапии больных псориазом в России / Л. Ф. Знаменская, С. И. Свищенко // Вестник дерматологии и венерологии. – 2012. – № 2. – С. 48-52.
- Знаменская Л. Ф. Препараты ингибиторов фактора некроза опухолей альфа в терапии больных псориазом / Л. Ф. Знаменская // Вестник дерматологии и венерологии. – 2010. – № 6. – С. 7-15.
- Иваницкий Г. Р. Современное матричное тепловидение в биомедицине / Г. Р. Иваницкий // Успехи физических наук. – 2006. – Т. 176, № 12. – С. 1293-1320.
- Ильина Н. И. Клиническая иммунология и иммуноопосредованные воспалительные заболевания / Н. И. Ильина // Рос. аллергол. журн. – 2010. – № 2. – С. 54-57.
- Иммунные механизмы псориаза. Новые стратегии биологической терапии / А. А. Кубанова, А. А. Кубанов, Дж. Ф. Николас [и др.] // Вестник дерматологии и венерологии. – 2010. – № 1. – С. 35-47.
- Инструкция по применению набора реагентов «ProCon EGF» для иммуноферментного определения концентрации эпидермального фактора роста (EGF) человека в сыворотке крови человека (ООО “Протеиновый контур”). – Санкт-Петербург, 2015. – 2 c.
- Инструкция по применению набора реагентов для иммуноферментного определения концентрации человеческого интерлейкина-1β в сыворотке крови человека (ЗАО “Вектор-Бест”). – Новосибирск, 2014. – 27 c.
- Инструкция по применению набора реагентов для иммуноферментного определения концентрации человеческого интерлейкина-10 в сыворотке крови человека (ЗАО “Вектор-Бест”). – Новосибирск, 2014. – 27 c.
- Инструкция по применению набора реагентов для иммуноферментного определения концентрации С-реактивного белка в сыворотке крови человека (высокочувствительный) (ЗАО “Вектор-Бест”). – Новосибирск, 2014. – 23 c.
- К вопросу о патогенезе псориаза / И. Я. Пинсон, С. И. Довжанский, М. В. Берщанская, О. Ю. Олисова // Рос. журн. кожн. вен. болезней. – 2006. – № 2. – С. 24-27.
- Казмирчук В. Е. Иммунная система кожи и клинические кожные «маски» иммунодефицитных заболеваний / В. Е. Казмирчук, Д. В. Мальцев // Клиническая иммунология. Аллергология. Инфектология. – 2009. – № 1. – С.45-49.
- Каленська О. В. Псоріаз: етіологія, патогенез, клініко-морфологічна картина, принципи лікування / О. В. Каленська, Л. В. Каленська, О. Г. Курик // Укр. журн. дерматол., венерол., косметол. – 2009. – № 3. – С. 5-9.
- Камзолова О. А. Тепловидение в оценке эффективности восстановительных мероприятий в ревматологии / О. А. Камзолова // Вестник новых медицинских технологий. Электронный журнал. – 2013. – № 1. – С. 235.
- Камилов Ф. Х. Клеточно-молекулярные механизмы ремоделирования костной ткани и её регуляция / Ф. Х. Камилов, Е. Р. Фаршатова, Д. А. Еникеев // Фундаментальные исследования (научный обзор). – 2014. – № 7. – С. 836–842.
- Камышников В. С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностике. – 3-е изд., перераб. и доп. / В. С. Камышников. – М. : Медпресс-информ, 2009. – 896 с.
- Катунина О. Р. Роль врожденного и адаптивного иммунитета в патогенезе псориаза: обзор / О. Р. Катунина // Вестн. дерматол. венерол. – 2009. – № 5. – С. 43-48.
- Кауд Д. Особенности эндотоксин- и липофлавон-зависимой лимфоидной регуляции синтеза цитокинов IL-1β, IL-4 и TNF α эндотелиальными клетками сосудов у больных псориазом, протекающим в сочетании с метаболическим синдромом / Д. Кауд // Дерматол. венерол. – 2008. – № 1. – С. 34-39.
- Кашутин С. Л. Содержание эпидермального фактора роста у больных псориазом и атопическим дерматитом / С. Л. Кашутин, Ю. С. Дегтяр // Цитокины и воспаление. – 2008. – Том 7, № 2. – С. 49-51.
- Кетлинский С. А. Цитокины / С. А. Кетлинский, А. С. Симбирцев. – СПб.: Фолиант, 2008. – 552 с.
- Клініко-патогенетична роль епідермального фактора росту при псоріазі / Я. Ф. Кутасевич, І. О. Олійник, Е. М. Солошенко, О.А. Гаврилюк // Український журнал дерматології, венерології, косметології. – 2016. – № 2 (61) – С. 27-30.
- Кобзарь А. И. Прикладная математическая статистика. Для инженеров и научных работников / А. И. Кобзарь. – М.: Физмалит, 2006. – 816 с.
- Козина Ю. В. Псориаз, система гемостаза: применение низкомолекулярных гепаринов / Ю. В. Козина // Вестник Витебского государственного медицинского университета. – 2013. – Т. 12, № 2. – С. 95–103.
- Колесов С. Н. Медицинское теплорадиовидение: современный методологический подход / С. Н. Колесов, М. Г. Воловик, М. А. Прилучный – Нижний Новгород : ФГУ «ННИИТО Росмедтехнологий», 2008. – 184 с.
- Комарцева В. В. Измерение показателей качества жизни у больных псориазом / В. В. Комарцева // Российский журнал кожных и венерических болезней. – 2009. – № 5. – С. 20-23.
- Компендиум 2013 – лекарственные препараты / В. Н. Коваленко, С. В. Сур, И. А. Зупанец и др. ; Под. ред. В. Н. Коваленко. – К. : Морион, 2013. – 2360 с.
- Компьютерная термодиагностика / А. Ф. Возианов, Л. Г. Розенфельд, Н. Н. Колотилов [и др.]. – К. : Б. и., 1993. – 152 с.
- Кондакова А. К. Содержание метаболитов оксида азота и некоторых показателей свёртывающей системы крови у больных псориазом / А. К. Кондакова, И. А. Олейник, А. А. Гаврилюк // Дерматологія та венерологія. – 2016. – № 1 (71). – С. 23-33.
- Коноваленко А. А. Особенности течения осложненных форм псориаза на современном этапе / А. А. Коноваленко // Мед. новости. – 2009. – № 5. – С. 100-104.
- Коротаева Т. В. Использование метотрексата в лечении псориаза и псориатического артрита / Т. В. Коротаева, Е. Л. Насонов, В. А. Молочков // Современная ревматология. – 2013. – № 2. – С. 1-8.
- Кочергин Н. Г. Последние тренды в лечении псориаза / Н. Г. Кочергин, Л. М. Смирнова // Лечащий врач. – 2011. – № 5. – С. 42-44.
- Кочергин Н. Г. Как улучшить качество жизни больного псориазом / Н.Г. Кочергин // Клиническая фармакология и терапия. – 2008. – № 2. – С. 43.
- Кравченя С. С. Некоторые клинико-иммунологические особенности эндотоксикоза при псориазе / С. С. Кравченя, А. Л. Бакулев, А. А. Свистунов // Российский журнал кожных и венерических болезней. – 2005. – № 3. – С. 21-23.
- Кубанов А. А. Динамика содержания факторов роста (эпидермального фактора роста и его рецептора, трансформирующего фактора роста-β) у больных распространённым псориазом при лечении узкополосным средневолновым ультрафиолетовым излучением с длиной волны 311 нм / А. А. Кубанов, М. М. Бутарева // Второй всероссийский конгресс дерматовенерологов, 25-28 сентября 2007 г. : тезисы докл. – Москва, Россия, 2007. – [Электронный ресурс]. – Режим доступа: http://www.dermatology.ru/collections/dinamika-soderzhaniya-faktorov-rosta-epidermalnogo-faktora-rosta-i-ego-retseptora-transf.
- Кузнецов А. В. Лечение вульгарного псориаза иммунобиологическими препаратами / А. В. Кузнецов // Дерматолог. – 2010. – № 1. – С. 63-69.
- Кунгуров Н. В. Биологическая терапия больных тяжёлыми формами псориаза / Н. В. Кунгуров, М. М. Кохан, Ю. В. Кениксфест // Вестник дерматологии и венерологии. – 2012. – № 4. – С. 91-95.
- Кунгуров Н. В. Системная воспалительная реакция и явления дислипидемии при псориазе / Н. В. Кунгуров, Н. Н. Филимонкова, Е. П. Топычканова // Фундаментальные исследования. – 2013. – № 9. – С. 188-194.
- Кундер Е. В. Псориатический артрит: классификация, активность, лабораторная и инструментальная диагностика / Е. В. Кундер // Вестник Витебского государственного медицинского университета. – 2013. – Т. 12, № 2. – С. 31–42.
- Кундер Е. В. Роль цитокинов в развитии системного и локального воспаления при псориатическом артрите / Е. В. Кундер // Цитокины и воспаление. – 2010. – Т. 9, № 1. – С. 25-28.
- Курдина М. И. Клинико-иммунологические изменения при лечении псориаза инфликсимабом / М. И. Курдина, Л. А. Макаренко, А. А. Полянская // Рос. журн. кожн. вен. болезней. – 2010. – № 3. – С. 28-32.
- Кутасевич Я. Ф. До питання про стан сполучнотканинного обміну при тривалій цитостатичній терапії у хворих на тяжкі хронічні дерматози / Я. Ф. Кутасевич, Г. К. Кондакова, І. О. Олійник // Дерматологія та венерологія. – 2012. – № 3 (57). – С. 80-85.
- Кутасевич Я. Ф. Качество жизни больных с тяжёлыми формами псориаза в процессе комплексного лечения / Я. Ф. Кутасевич, И. А. Олейник, А. А. Гаврилюк // Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я : науково-практична конференція з міжнародною участю, 20 квітня 2015 р. : тези доп., збірник наукових праць. – Харків, 2015. – С. 74-75.
- Кутасевич Я. Ф. Особенности патогенетической терапии артропатического псориаза / Я. Ф. Кутасевич, И. А. Олейник, А. А. Гаврилюк // Клінічна імунологія. Алергологія. Інфектологія. – 2014. – № 8 (77). – С. 61-65.
- Кутасевич Я. Ф. Ранняя диагностика латентной псориатической артропатии / Я. Ф. Кутасевич, И. А. Олейник, А. А. Гаврилюк // научные труды первой научно-практической международной конференции Ассоциации дерматовенерологов Армении «Ереванские дерматовенерологические чтения», 22-23 мая 2015 г. : тезисы докл. «Научно-медицинский журнал» – Ереван, Армения, 2015. – С. 94.
- Кутасевич Я. Ф. Современный взгляд на псориатическую болезнь / Я. Ф. Кутасевич, И. А. Олейник // Искусство лечения. – 2005. – № 6. – С. 6-11.
- Кутасевич Я. Ф. Иммуносупрессивная терапия больных артропатическим псориазом : Метод. рекомендации / Я. Ф. Кутасевич, И. А. Олейник – К., 2011. – 19 с.
- Кутасевич Я. Ф. Клинические проявления осложнений длительной терапии системными глюкокортикостероидными гормонами в практике дерматолога / Я. Ф. Кутасевич, И. А. Олейник, О. А. Левченко // Клінічна імунологія. Алергологія. Інфектологія. – 2012. – № 8. – С. 49-51.
- Кутасевич Я. Ф. Терапевтическая эффективность и переносимость лефлуномида в лечении кожных проявлений псориаза и псориатического артрита / Я. Ф. Кутасевич, И. А. Олейник // Український ревматологічний журнал. – 2010. – № 4 (42). – С. 37-41.
- Лапач С. Н. Статистические методы в медико-биологических исследованиях с использованием EXCEL / С. Н. Лапач, А. В. Чубенко, П. Н. Бабич.– К. : Морион, 2001.– 407 с.
- Левшин Р. Н. Современные представления об иммунопатогенезе псориатической болезни / Р. Н. Левшин, И. И. Бобынцев, Л. В. Силина // Курский научно-практич. вестн. “Человек и здоровье”. – 2007. – № 1. – С. 72-79.
- Мавров И. И. Основы диагностики и лечения в дерматологии и венерологии / И. И. Мавров, Л. А. Болотная, И. М. Сербина. – Х. : Факт, 2007. – 792 с.
- Мирсаева А. Р. Закономерности нарушений системы гемостаза у больных псориазом / А. Р. Мирсаева // Актуальные вопросы современной биохимии. – 2007. – С. 129-131.
- Новик А. А. Руководство по исследованию качества жизни в медицине / А. А. Новик, Т. И. Ионова ; Под ред. Ю. Л. Шевченко. – М. : ЗАО «ОЛМА Медиа Групп», 2007. – 523 с.
- Олейник И. А. Динамика содержания стабильного метаболита оксида азота и некоторых показателей свёртывающей системы крови у больных тяжёлыми формами псориаза в процессе комплексной терапии / И. А. Олейник, А. А. Гаврилюк // Експериментальна і клінічна медицина. – 2016. – № 1 (70). – С. 104-109.
- Олейник И. А. Динамика содержания цитокинов у больных псориазом на фоне базовой системной терапии / И. А. Олейник, А. А. Гаврилюк // Дерматовенерологія в розробках молодих науковців : науково-практична конференція, 19-20 листопада 2015 р. : тези доп. – Київ, 2015. Дерматовенерологія. Косметологія і Сексопатологія. – 2015. – № 3-4 (2) – С. 124-125.
- Олисова О. Ю. Псориаз: эпидемиология, патогенез, клиника, лечение / О. Ю. Олисова // Consilium medicum. – 2010. – № 4. – С. 3-8.
100. Олисова О. Ю. Современные методы лечения псориаза / О. Ю. Олисова, Н. П. Теплюк, В. Б. Пенегин // Русский медицинский журнал. – 2015. – №9. – С. 483-484.
101. Олійник І. О. Динаміка вмісту епідермального фактору росту (EGF) у хворих на тяжкі форми псоріазу на тлі базової системної терапії / І. О. Олійник, І. О. Маштакова, О. А. Гаврилюк // Новітні тенденції лікування та профілактики дерматовенерологічних проблем у рамках доказової медицини : науково-практична конференція у рамках ХІІ Львівського медичного форуму та ХХІІ медичної виставки «ГалМЕД», 13-15 квітня 2016 р. : тези доп. – Львів, 2016. Український журнал дерматології, венерології, косметології. – 2016. – № 1 (60) – С. 100-101.
102. Олійник І. О. Комплексне лікування хворих на артропатичний псоріаз з урахуванням ступеня тяжкості, особливостей перебігу захворювання : автореф. дис. на здобуття наук. ступеня докт. мед. наук : спец. 14.01.20 “Шкірні та венеричні хвороби” / І. О. Олійник. – Харків, 2009. – 37 с.
103. Оптимизация терапии больных псориазом различной степени тяжести : Метод. рекомендации / Н. В. Кунгуров, М. М. Кохан, Н. Н. Филимонкова [и др.]. – Екатеринбург, 2013. – 44 с.
104. Опыт эффективной терапии больных тяжёлым псориазом / Н. В. Кунгуров, Н. В. Зильберберг, М. М. Кохан [и др.] // Вестник дерматологии и венерологии. – 2012. – № 1. – С. 76-83.
105. Особенности нарушений в системе цитокинов и липидного обмена у больных псориазом / М. В. Ахлупкина, А. А. Свистунов, А. Л. Бакулев [и др.] // Саратовский научно-медицинский журнал – 2011. – Т. 7, № 2. – С. 434-437.
106. Особенности нарушений в системе цитокинов у больных псориазом / И. А. Олейник, Э. Н. Солошенко, А. А. Гаврилюк [и др.] // Дерматологія та венерологія. – 2015. – № 4 (70) – С. 58-66.
107. Особливості клінічного перебігу та удосконалення діагностики і лікування псоріазу : методичні рекомендації / Л. Д. Калюжна, О. І. Літус, О. О. Ошивалова [та ін.] // Національна медична академія післядипломної освіти ім. П. Л. Шупика, Український центр наукової медичної інформації та патентно-ліцензійної роботи. – К., 2013. – 64 с.
108. Оценка продукции различных цитокинов у больных псориазом / Л. И. Маркушева, В. А. Самсонов, А. Г. Саруханова [и др.] // Вестн. дерматол. венерол. – 2004. – № 4. – С. 4-6.
109. Оценка состояния цитокинового профиля у больных псориазом / Я. Ф. Кутасевич, И. А. Олейник, И. А. Маштакова [и др.] // Состояние и проблемы дерматовенерологии и косметологии в Республике Узбекистан : международная научно-практическая конференция, 20-21 ноября 2015 г. : тезисы докл. – Ташкент, Узбекистан, 2015 г. // Дерматовенерология и эстетическая медицина. – 2015. – № 3 (27). – С. 134-135.
110. Оценка состояния цитокинового профиля у больных псориазом на фоне иммуномодулирующей терапии / В. А. Охлопков, Е. К. Медведчиков, Дж. Ф. Николас [и др.] // Вестник дерматологии и венерологии. – 2010. – № 1. – С. 35-47.
111. Оцінка стану системи згортання крові у хворих на тяжкі форми псоріазу / Г. К. Кондакова, І. О. Олійник, І. О. Маштакова [та ін.] // Стан та основні організаційні задачі дерматовенерологічної служби на сучасному етапі в Україні : науково-практична конференція в рамках V Ювілейного міжнародного медичного конгреса, 19-20 квітня 2016 г. : тези доп. – Київ, 2015 г. – К., 2016. – С. 86.
112. Пат. на корисну модель № 103787 UA МПК А61В10/00 А61F7/00. Спосіб діагностики активності артропатичного псоріазу / О. А. Гаврилюк, Я. Ф. Кутасевич, І. О. Олійник, П. М. Замятін; заявник і патентовласник ДУ «Інститут дерматології та венерології НАМН України». – № u 2015 07325; заявл. 21.07.2015; опубл. 25.12.2015, Бюл. № 24.
113. Перехрестенко А. П. Характеристика теплового излучения у больных псориазом как метод объективной оценки стадии патологического процесса / А. П. Перехрестенко // Дерматологія та венерологія. – 2001. – № 1 (11). – С. 62-63.
114. Потекаев Н. Н. Патогенетически обусловленная терапия псориаза и псориатического артрита / Н. Н. Потекаев, Д. Н. Серов // Клиническая дерматология и венерология. – 2012. – № 4. – С.4–9.
115. Приваленко С. В. Метаболизм основного вещества соединительной ткани и коллагеновых белков у больных псориазом / С. В. Приваленко, В. В. Бадокин // Вестн. дерматологии и венерологии. – 1990. – № 10. – С. 11–17.
116. Про- и противовоспалительные цитокины при псориазе / Г. П. Адаменко, Т. В. Тихон, Е. И. Скребло [и др.] // Вестник Витебского государственного медицинского университета. – 2013. – Т. 12, № 2. – С. 108–112.
117. Псориаз и гемостаз / А. Р. Газиев, В. Н. Ослопов, Б. А. Шамов [и др.] // Практическая медицина. – 2013. – № 1–4 (73). – С. 20–23.
118. Псориаз и псориатический артрит / В. А. Молочков, В. В. Бадокин, В. И. Альбанова и др.; Под ред. В. А. Молочкова. – М., 2007. – 306 с.
119. Псориаз: коморбидности и комедикации / Н. Г. Кочергин, Л. А. Смирнова, Н. Н. Потекаев [и др.] // Врач. – 2009. – № 5. – С. 15-20.
120. Псоріаз, включаючи псоріатичні артропатії: адаптована клінічна настанова, заснована на доказах Код МКХ-10: L40 – Псоріаз // Фінальна версія. – К., 2015. – 223 с.
121. Радионова Е. Е. Антицитокиновая терапия псориаза / Е. Е. Радионова, Д. Н. Серов, О. Н. Введенская // Клин. дерматол. венерол. – 2010. – № 5. – С. 28-31.
122. Роль оксида азота в нормальной физиологии организма и при псориазе (обзор литературы) / Ю. С. Бутов, А. А. Архипенко, О. Г. Суколина, А. Г. Туманян // Российский журнал кожных и венерических болезней. – 2005. – № 3. – С. 24–27.
123. Роль оксида азота в патологии опорно-двигательного аппарата (часть 1) / А. И. Дубиков, А. В. Череповский, Л. А. Белоголовых [и др.] // Научно-практическая ревматология. – 2004. – № 3. – С. 78–82.
124. Роль оксида азота в патологии опорно-двигательного аппарата (часть 2) / А. И. Дубиков, А. В. Череповский, Л. А. Белоголовых [и др.] // Научно-практическая ревматология. – 2004. – № 4. – С. 53–56.
125. Сайфутдинов Р. Г. Роль оксида азота при заболеваниях внутренних органов (обзор литературы) / Р. Г. Сайфутдинов // Вестник современной клинической медицины. – 2009. – Т. 2, вып. 3. – С. 48-53.
126. Саріан О. І. Клініко-патогенетичне значення та корекція дисфункції ендотелія у хворих на звичайний псоріаз : автореф. дис. на здобуття наук. ступеня канд. мед. наук : спец. 14.01.20 “Шкірні та венеричні хвороби” / О. І. Саріан. – Харків, 2013. – 16 с.
127. Святенко Т. В. Місцева терапія при псоріазі: проблеми та шляхи їх розв’язання / Т. В. Святенко, І. Я. Возняк // Укр. журн. дерматол., венерол., косметол. – 2009. – № 3. – С. 13-16.
128. Северьянова Л. А. Механизмы действия аминокислоты L-аргинина на нервную и иммунную регуляторную систему (обзор литературы) / Л. А. Северьянова, И. И. Бобынцев // Курский научно-практический вестник «Человек и его здоровье». – 2006. – № 3. – С. 60-75.
129. Сергиевич А. В. Сравнительный анализ сывороточного уровня ФНО-α, ИЛ-1β, ИЛ-6 у пациентов с псориазом и псориатическим артритом / А. В. Сергиевич, А. М. Литвяков // Вестник Витебского государственного медицинского университета. – 2013. – Т. 12, № 3. – С. 64–71.
130. Серебренникова С. Н. Роль цитокинов в воспалительном процессе (сообщение I) / С. Н. Серебренникова, И. Ж. Семинский // Сиб. мед. журн. – 2008. – № 6. – С. 5-7.
131. Сизон О. О. Артропатичний псоріаз: проблемні питання діагностки та диференціації. Частина I. / О. О. Сизон, В. І. Степаненко // Укр. журн. дерматол., венерол., косметол. – 2010. – № 2 (37). – С. 42-49.
132. Сизон О. О. Артропатичний псоріаз: проблемні питання діагностки та диференціації. Частина ІІ. / О. О. Сизон, В. І. Степаненко // Укр. журн. дерматол., венерол., косметол. – 2010. – № 3 (38). – С. 31-41.
133. Сизон О. О. Застосування нових гепатопротекторів для корекції порушення обмінних процесів у комплексній терапії хворих на псоріаз / О. О. Сизон, О. Ю. Туркевич // Укр. журн дерматол., венерол., косметол. – 2008. – № 1. – С. 21-26.
134. Сизон О. О. Патогенетичні особливості розвитку псоріатичного артриту / О. О. Сизон, О. Ю. Туркевич // Укр. журн. дерматол., венерол., косметол. – 2009. – № 2. – С. 46-54.
135. Сизон О. О. Патогенетично обґрунтована класифікація артропатичного поріазу / О. О. Сизон, В. І. Степаненко // Український журнал дерматології, венерології, косметології. – 2009. – № 4 (35). – С.26-35.
136. Сизон О. О. Артропатичний псоріаз: обґрунтування раціональних методів лікування та профілактики. Частина 1 / О. О. Сизон, В. І. Степаненко // Український журнал дерматології, венерології, косметології. – 2011. – № 1 (40). – С. 7-24.
137. Сизон О. О. Артропатичний псоріаз: обґрунтування раціональних методів лікування та профілактики. Частина 2 / О. О. Сизон, В. І. Степаненко // Український журнал дерматології, венерології, косметології. – 2011. – № 2 (41). – С. 37-44.
138. Сизон О. О. Епідеміологія та взаємозалежність коморбідності артропатичного псоріазу і клінічного перебігу хвороби / О. О. Сизон // Український журнал дерматології, венерології, косметології. – 2014. – № 1 (52). – С. 14-24.
139. Симбирцев А. С. Цитокины: классификация и биологические функции / А. С. Симбирцев // Циток. восп. – 2004. – Т. 3, № 2 – С. 16-21.
140. Симонова О. В. Показатели стабильных метаболитов оксида азота в сыворотке крови и моче у больных псориатическим артритом / О. В. Симонова, Е. Н. Сухих, М. В. Тимин // Вестник Ивановской медицинской академии. – 2011. – Т. 16, № 1. – С. 20–23.
141. Современные методы терапии больных псориазом / Л. Ф. Знаменская, С. В. Яковлева, В. А. Волнухин, Е. В. Пирогова // Вестник дерматологии и венерологии.— 2011. – № 1 – С. 11-14.
142. Современные представления об иммунных механизмах развития псориаза / В. Р. Хайрутдинов, А. В. Самцов, А. В. Мошкалов, Е. Н. Имянитов // Вестник дерматологии и венерологии. – 2007. – № 1. – С. 3-7.
143. Содержание метаболитов оксида азота в плазме крови больных псориазом / О. М. Капулер, Н. З. Сарварова, А. Р. Мирсаева [и др.] // Медицинский вестник Башкортостана. – 2007. – Т. 2, № 3–4. – С. 101–104.
144. Соснина Е. А. Особенности клинических проявлений и терапия больных пустулезным псоразом / Е. А. Соснина, И. А. Чистякова // Леч. врач. – 2011. – № 10. – С. 13-19.
145. Спузяк М. І. Зміни кісток і суглобів при артропатичному псоріазі за данними рентгенологічного дослідження / М. І. Спузяк, І. О. Олійник // Український радіологічний журнал. – 2009. – № 17. – С.13-17.
146. Стан системи гемостазу та рівень нітрит-аніону у хворих на псоріаз / І. О. Олійник, О. А. Гаврилюк, Г. К. Кондакова [та ін.] // Збірник робіт за матеріалами науково-практичної конференції «Спадкові та екологічні чинники в дерматовенерології» (м. Київ, 29-30 березня 2016 р.). – Дерматовенерологія. Косметологія і сексопатологія. – 2016. – № 1-2 (3) – С. 76-77.
147. Структура захворюваності на поширені дерматози в Україні та Харківському регіоні / Е. М. Солошенко, В. М. Волкославська, О. Л. Гутнєв [та ін.] // Дерматовенерол. Косметол. Сексопатол. – 2008. – № 1-2. – С. 237-240.
148. Суколина О. Г. Комплексная оценка эффективности патогенетической терапии псориаза / О. Г. Суколина, Э. А. Баткаев // Вестн. дерматол. венерол. – 2007. – № 3. – С. 30-34.
149. Суколина О. Г. Роль оксида азота в патогенезе псориаза / О. Г. Суколина, Э. А. Баткаев // Российский журнал кожных и венерических болезней. – 2006. – № 1. – С. 21-24.
150. Тарадин Г. Г. Биологические препараты в лечении при псориатическом артрите / Г. Г. Тарадин, Н. Т. Ватутин, А. С. Смирнова // Украинский ревматологический журнал. – 2014. – № 3 (57). – С. 4-12.
151. Фактор некроза опухоли, интерлейкины и липидный обмен в разных стадиях течения псориаза / Э. Н. Солошенко, Н. В. Жукова, Т. П. Ярмак, З. М. Шевченко // Клініч. імунологія. Алергологія. Інфектологія. – 2012. – № 1/2. – С. 62-64.
152. Фармацевтична оцінка хворих на псоріаз: шляхи підвищення якості життя / І. Я Зупинець, І. А. Отришко, О. Ю. Побережник [та ін] // Фарм. часопис. – 2010. – № 1. – С. 70-75.
153. Федоренко О. Є. Клінічний досвід терапії псоріазу / О. Є. Федоренко // Укр. журн. дерматол. венерол. косметол. – 2012. – № 1 (44). – С. 59-62.
154. Филимонкова Н. Н. Современные клинико-анамнестические особенности псориаза / Н. Н.Филимонкова, Я. В. Кащеева, Е. П. Топычканова // Урал. мед. журн. – 2011. – № 8 (86). – С. 43–45.
155. Хайрутдинов В. Р. Современные представления об иммунных механизмах развития псориаза (обзор литературы) / В. Р. Хайрутдинов // Вестн. дерматол. венерол. – 2007. – № 1 – С. 3-7.
156. Цитокиновый дисбаланс в иммунопатогенезе псориаза / Ф. Х. Камилов, Н. А. Муфазалова, О. М. Капулер [и др.] // Фундаментальные исследования (научный обзор). – 2015. – № 1. – С. 1065–1071.
157. Цитокиновый профиль при псориатическом артрите: поиск взаимосвязей с воспалением и реологическими свойствами крови / Т. В. Коротаева, Е. Ю. Логинова, А. А. Новиков [и др.] // Научно-практическая ревматология. – 2011. – № 1. – С. 27-32.
158. Цитокиновый профиль сыворотки крови у больных хроническими распространёнными дерматозами с синдромом эндогенной интоксикации / Т. В. Копытова, Н. А. Добротина. Л. Н. Химкина [и др.] // Медицинская иммунология. – 2011. – Т. 13, № 2-3. – С. 205-210.
159. Чикин В. В. Патогенетические аспекты лечения больных псориазом / В. В. Чикин, Л. Ф. Знаменская, А. А. Минеева // Вестн. дерматол. венерол. – 2014. – № 5. – С.86 – 90.
160. Шаповалов Р. Г. Трансформация интегративных дерматологических индексов у больных псориатическим артритом под влиянием традиционного лечения с метотрексатом / Р. Г. Шаповалов, Т. П. Исаенко // Успехи современного естествознания. – 2014. – № 7. – С. 31-33.
161. Эффективность и безопасность лечения больных тяжёлыми формами псориаза / А. Л. Бакулев, С. С. Кравченя, Н. А. Слесаренко, А. А. Шабогина // Вестник дерматологии и венерологии – 2010. – №2 – С. 72-81.
162. Эффективность и переносимость лефлуномида при псориатическом артрите / А. О. Пчелинцева, Т. В. Коротаева, Ю. Л. Корсакова [и др.] // Русский медицинский журнал. – 2006. – Т. 14, № 25. – С. 1852-1858.
163. A computer tool for the fusion and visualization of thermal and magnetic resonance images / G. L. Bichinho, M. A. Gariba, I. J. Sances [et al.] // J. Digit. Imaging. – 2009. – Vol. 22, № 5. – P.527–534.
164. Abnormalitis of blood coagulation and fibrinolisis in psoriasis / F. Marongiu, G. G. Sorano, C. Bibbò [et al.] // Dermatol. – 1994. – Vol. 189. – P. 32-37.
165. Ammer K. Thermology 2003 – A computer-assisted literature survey with a focus on nonmedical applications of thermal imaging / K. Ammer // Thermology International. – 2004. – Vol. 14, № 1. – P.5–36.
166. Antoni C. Влияние инфликсимаба на дерматологические и суставные симптомы псориатического артрита: результаты изучения инфликсимаба в течение международного контролируемого исследования / C. Antoni, J. Smolen // Вестник дерматологии и венерологии. – 2006. – № 3. – С. 62.
167. Ayala F. Clinical aspects and comorbidities of psoriasis / F. Ayala, Е. Ayala // J. Rheumatol. Suppl. – 2009. – Vol. 83, № 6. – Р. 19-20.
168. Baker H. Psoriasis – clinical features / H. Baker // Br. Med. J. – 1994. – Vol. 3. – P. 231–233.
169. Beygi S. C-reactive protein in psoriasis: a review of the literature / S. Beygi, V. Lajevardi, R. Abedini // JEADV. – 2014. – Vol. 28.–P.700–711.
170. Bhagwat S. S. Kinase inhibitors for the treatment of inflammatory and autoimmune disorders / S. S. Bhagwat // Purinergic Signal. – 2009. – Vol. 5. – P.107–115.
171. Biomarkers in Psoriasis and Psoriatic Arthritis: GRAPPA 2008 / C. T. Ritchlin, A. A. Qureshi, K. de Vlam [et al.] // J. Rheumatol. – 2010. – Vol. 37. – P. 462-467.
172. Bravo R. Persistence of the competent state in mouse fibroblasts is in dependent of c-fosand c-myc expression / R. Bravo, J. Burckhardt, R. Muller // Exp. CellRes. – 1985. – Vol. 160. – P. 540-543.
173. Chandran V. Biomarkers in psoriatic arthritis: recent progress / V. Chandran, J. U. Scher // Curr. Rheumatol. Rep. – 2014. – Vol. 16. – P. 453.
174. Chandran V. Soluble biomarkers may differentiate psoriasis from psoriatic arthritis / V. Chandran // J. Rheumatol. Suppl. – 2012. – Vol. 89. – P. 65-66.
175. Classification criteria for psoriatic arthritis: development of new criteria from a large international study / W. Taylor, D. Gladman, P. Helliwell [et al.] // Arthitis. Rheum. – 2006. – Vol. 54. – P. 2665-2673.
176. Clinical potentional of apremilast in the treatment of psoriatic arthritis / A. Cauli, G. Porru, M. Piga [et al.] // Immunotargets Ther. – 2014. – Vol. 3. – P. 91–96.
177. Clinical practice guideline for an integrated approach to comorbidity in patients with psoriasis. / E. Dauden, S. Castaneda, C. Suarez [et al.] // JEADV. – 2013. – Vol. 27. – P. 1387-1404.
178. Combe B. Indications and efficacy of biologics in inflammatory arthritis / B. Combe // Bull. Acad. Natl. Med. – 2012. – Vol. 197, № 7. – P. 1279-1292.
179. C-reactive protein and leucocyte activation in psoriasis vulgaris according to severity and therapy / S. Coimbra, H. Olivera, F. Reis [et al.] // Eur. J. Dermatol. Venereol. – 2009. – Vol. 24, № 8. – P. 789-796.
180. Cytokine network in psoriasis revisited / A. Michalak-Stoma, A. Pietrzak, J. C. Szepietowski [et al.] // Eur. Cytokine Netw. – 2011. – Vol. 22, № 4. – P.160-168.
181. Cytokines and anticytokines in psoriasis / A. T. Pietrzak, A. Zalewska, G. Chodorowska [et al.] // Clin. Chim. Acta. – 2008. – Vol. 394, № 12. – P. 7-21.
182. Das R. Current concepts in pathogenesis of psoriasis / R. Das, A. Jain, V. Ramesh // Indian J. Dermatol. – 2009. – Vol. 54, № 1. – P. 7-12.
183. Development and initial validation of a screening questionnaire for psoriatic arthritis: the Toronto psoriatic arthritis screen (TOPAS) / D. D. Gladman, S. T. Schentag, B. D. Tom [et al.] // Ann. Rheum. Dis. – 2009. – Vol. 68. – P. 497-501.
184. Double-blind, placebo controlled, dose-escalation study to evaluate the pharmacologic effect of CP-690,550 in patients with psoriasis / M. G. Boy, C. Wang, B. E. Wilkinson [et al.] // J Invest. Dermatol. – 2009. – Vol. 29. – P. 2299–3029.
185. Duffy M. J. Use of molecular markers for predicting therapy response in cancer atients / M. J. Duffy // J Cancer Treatment Reviews. – 2011. – Vol. 37, № 2. – P.151–159.
186. Effect of psoriasis activity on epidermal growth factor (EGF) and the concentration of soluble EGF receptor in serum and plaque scales syndrome / I. Flisiak, M. Szterling-Jaworowska, A. Baran [et al.] // Clin. Exp. Dermatol. – 2014. – Vol. 39, № 4. – P.461–467.
187. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 76-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 1) / C. L. Leonardi, A. B. Kimball, K. A. Papp [et al.] // Lancet. – 2008. – Vol. 371. – P. 1665-1674.
188. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 52-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 2) / K. A. Papp, R. G. Langley, M. Lebwohl [et al.] // Lancet. – 2008. – Vol. 371. – P. 1675-1684.
189. Elevation of serum epidermal growth factor and interleukin 1 receptor antagonist in active psoriasis vulgaris / K. S. Anderson, S. Petersson, J. Wong [et al.] // Br. J. Dermatol. – 2010. – Vol. 163, № 5. – P.1085–1089.
190. Enerbäck Ch. Soluble biomarkers in psoriasis / Ch. Enerbäck // Eur. J. Dermatol. – 2011. – Vol. 21, № 6. – P. 844-850.
191. Erythrodermic psoriasis: Epidemiological clinical and therapeutic features about 60 cases / A. Hawilo, A. Zaraa, R. Benmously [et al.] // Tunis Med. – 2011. – Vol. 89 (11). – P. 841-847.
192. European Patients Perspectives on the Impact of Psoriasis: the EUROPSO Patient Membership Survey / Dubertret L., Mrowietz U., Ranki A. [et al.] // Br. J. Dermatol. – 2006. – Vol. 155, № 4. – Р. 729-736.
193. European S3-Guidelines on the systemic treatment of psoriasis vulgaris / D. Pathirana, A.D. Ormerod, P. Saiag [et al.] // JEDV. – 2009. – Vol. 23 (Suppl. 2). – Р. 5–70.
194. Evaluation of the novel protein kinase C inhibitor sotrastaurin as immunosuppressive therapy after renal transplantation / M. Matz, M. Naik, M. F. Mashreghi [et al.] // Expert Opin. Drug. Metab. Toxicol. – 2011. – Vol. 7.–P.103–113.
195. Finlay A. Y. Dermatology Life Quality Index (DLQI) – a simple practical measure for routine clinical use / A. Y. Finlay, G. K. Khan // Clin. Exp. Dermatol. – 1994. – Vol. 19. – P. 210-216.
196. German evidence-based guidelines for the treatment of Psoriasis vulgaris (short version) / A. Nast, I. Kopp, M. Augustin [et al.] // Arch. Dermatol. Res. – 2007. – Vol. 299, № 12. – P.111-138.
197. Ghoreschi K. Immunopathogenesis and role of T-cells in psoriasis / K. Ghoreschi, C. Weigert, M. Rocken // Clin. Dermatol. – 2007. – Vol. 25, № 11. – P. 574-580.
198. Gladman D. D. Psoriatic arthritis / D. D. Gladman, V. Chandran // Oxford University Press. – 2009. – 160 p.
199. Good clinical response to anti-psoriatic treatment with adalimumab and methotrexate does not inflict a direct effect on compartmentalization of T-cell subsets: a pilot study / R. G. Van Lingen, E. M. De Jong, M. A. Berends [et al.] // J. Dermatolog. Treat. – 2008. – Vol. 284. – P. 7-19.
200. Griffiths C. E. Pathogenesis and clinical features of psoriasis / C. E. Griffiths, J. N. Barker // Lancet. – 2007. – Vol. 370, № 11. – P. 263-271.
201. IL-10 inhibitis metalloproteinase and stimulates TIMP-1 production in human mononucluar phagosytes / S. Lacras, L. Nicod, R. Chicheportiche [et al.] // J. Clin Invest. – 1995. – Vol. 96 – P. 2304-8.
202. Immunopathogenesis of psoriasis / R. Sabbat, S. Philips, C. Hoflich [et al.] // Exp.Dermatol. – 2007. – Vol. 16, № 8. – P. 779-798.
203. Inflammation and hypercoagulable state in adult psoriatic men / O. Karabudak, R. E. Ulusoy, A. A. Erikci [et al.] // Arch. Derm. Venereol. – 2008. – Vol. 88. – P. 337–340.
204. Influence of endothelial nitric oxide synthase polymorphisms in psoriasis risk / Р. Coto-Segura, E. Coto. A. Mas-Vidal [et al.] // Archives of dermatological Research. – 2011. – Vol. 303 (6). – P. 445-449.
205. Interleukin-1, tumor necrosis factor-alpha and transforming growth factor-beta 1 and integrative meniscal repair: influences on meniscal cell proliferation and migration / K. M. Riera, N. E. Rothfusz, R. E. Wilusz [et al.] // Arthritis Res. Ther. – 2011. – Vol. 13, № 6. – P. 187.
206. Interleukin-10: an important immunoregulatory cytokine with major impact on psoriasis / K. Asadullah, R. Sabat, M. Friedrich [et al.] // Curr. Drug Targets Inflamm. Allergy. – 2004. – Vol. 3. – P. 185-192.
207. Investigation of IL-1, VEGF, PPARG and MEFV genes in psoriatic arthritis susceptibility / J. Bowes, P. Ho, E. Flynn [et al.] // Ann. Rheum. Dis. – 2012. – Vol. 71. – P.313–314.
208. Ivdra I. The influence of EGF and its receptor on keratinocyte proliferation and differentation in pathogenesis of psoriasis / I. Ivdra, I. Hartmane, I. Mikažāns // Medicīna. – 2010. – Vol. 755. – P.122–134.
209. Jadali Z. T-cell immune responses in psoriasis / Z. Jaladi, M. B. Eslami // Iran J. Allergy Asthma Immunol. – 2014. – Vol. 13, № 4. – P. 220-230.
210. Jariwala S P. The role of dendritic cells in the immunopathogenesis of psoriasis / S. P. Jariwala // Arch Dermatol Res. – 2007. – Vol. 299, No. 8. – P. 359–366.
211. Krajewska-Włodarzykc M. Bone tissue metabolism in psoriatic arthritis patients / M. Krajewska-Wtodarzykc, W. Samborski // Postępy Dermatologii i Alergologii. – 2012. – XXIX, № 2. – P. 114-117.
212. Leflunomide in psoriatic arthritis: Results from a large European prospective observational study / F. Behrens, F. Finkenwirth, K. Pavelika [et al.] // Arthr Care Res. – 2013. – Vol. 65, № 3. – P. 464–470.
213. Lie E. Effectiveness and retention rates of methotrexate in psoriatic arthritis in comparison with methotrexate-treated patients with rheumatoid arthritis / E. Lie, T. Uhlig, M. S. Heiberg [et al.] // Ann. Rheum. Dis. – 2010. – Vol. 69, № 4. – P. 671-676.
214. Lima E. A. Reviewing concepts in the immunopathogenesis of psoriasis / E. A. Lima, M. A. Lima // An. Bras. Dermatol. – 2011. – Vol. 86 (6). – P. 1151-1158.
215. Lisi P. Differential diagnosis of psoriasis / P. Lisi // Reumatismo. – 2007. – Vol. 59. – P. 56-60.
216. Lloyd P. Psoriatic arthritis: an update / P. Lloyd, C. Ryan, A. Menter // Arthritis. – 2012. – [Электронный ресурс]. – Режим доступа: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3504365/.
217. Lowes M. A. Pathogenesis and therapy of psoriasis / M. A. Lowes, A. M. Bowcock, J. G. Krueger // Nature. – 2011. – Vol. 451, № 8. – P. 866-873.
218. Mehlis S. L. The immunology of psoriasis and biologic immunotherapy / S. L. Mehlis, K. V. Gordon // J. Am. Acad. Dermatol. – 2005. – Vol. 69, № 10. – P. 1130-1136.
219. Meier M. Clinical spectrum and severity of psoriasis / M. Meier, P. Sheth // Curr. Probl. Dermatol. Basel. – 2009. – Vol. 38. – P. 1-20.
220. Menter A. Current and future of management of psoriasis / A. Menter, C. E. Griffiths // Lancet. – 2007. – Vol. 370, № 7. – P. 272-284.
221. Methotrexate versus cyclosporine in moderate-to-severe chronic plaque psoriasis / V. M. Heydendael, P. I. Spuls, В. С. Opmeer [et al.] // N. Engl. J. Med. – 2006. – Vol. 353, № 7. – Р. 658–665.
222. Mrowietz U. The importance of disease associations and concomitant therapy for the long-term management of psoriasis patients / U. Mrowietz, J. T. Elder, J. Barker // Arch. Dermatol. Res. – 2006. – Vol. 298. – P. 309-319.
223. Naldi I. The clinical spectrum of psoriasis / I. Naldi, D. Gambini // Clin. Dermatol. – 2007. – Vol. 25, № 9. – P.510–518.
224. Naldi L. Epidemiology of comorbidities in psoriasis / L. Naldi, S. Mercuri // Dermatol. Ther. – 2010. – Vol. 23, № 2. – P. 114-118.
225. Neimann A. The epidemiology of psoriasis / A. Neimann, S. Porter, J. Gelfand // Expert. Rev. Dermatol. – 2006. – Vol. 1, № 1. – P. 63-75.
226. Nestle F. O. Psoriasis / F. O. Nestle, D. H. Kaplan, J. Barker // N. Engl. J. Med. – 2009. – Vol. 361, № 5. – Р. 496—509.
227. Nestle F.O. Psoriasis / O. F. Nestle // Curr Dir Autuimmun. – 2008. – Vol. 10. – P.65–75.
228. Nitric oxide and malondialdehyde levels in plasma and tissue of psoriasis patients /A. A. Sikar, H. K. Ozdogan, D. Bayramgurler [et al.] // J. Eur. Acad. Dermat. Venerol. – 2012. – Vol. 26 (7). – P.833-840.
229. Norgrales K. E. New insights into the рathogenesis and genetic of psoriatis arthritis / K. E. Norgrales, R. D. Brasington, A. M.Bowcock // Nat. Clin. Pract. Rheumatol. – 2009. – Vol. 5. – P. 83–91.
230. Opportunities relief of pain with psoriatic arthritis / Y. F. Kutasevych, I. O. Oliinyk, I. O. Mashtakova, O. A. Gavrylyuk // Abstracts of the 24th Congress of the European Academy of Dermatology and Venereology, Copenhagen, Denmark, 7-11 October 2015. – Copenhagen, 2015. – P. 1665.
231. Ortiz-Ibáñez K. Tofacitinib and Other Kinase Inhibitors in the Treatment of Psoriasis / K. Ortiz-Ibáñez, M. M. Alsina, C. Muñoz-Santos // Actas Dermosifiliogr. – 2013. – Vol. 104, № 4. – P. 304–310.
232. Palfreeman A. C. New developments in the management of psoriasis and psoriatic arthritis: a focus on apremilast / A. C. Palfreeman, K. E. McNamee, F. E. McCann // Drug Des. Devel. Ther. – 2013. – Vol. 176, № 3.–P.201–210.
233. Protective effect of quercetin on the evolution of cisplatin-induced acute tubular necrosis / H. D. Francescato, T. M. Coimbra, R. S. Costa, L. Bianchi Mde // Kidney Blood Press Res. – 2004. – Vol. 27, № 3. – P. 148-158.
234. Przepiera-Bedzak H. Serum levels of angiogenic cytokines in psoriatic arthritis and SAPHO syndrome / H. Przepiera, K. Fischer, M. Brzosko // Polskie Archiw. Med. Wewn. – 2013. – Vol. 123, № 6. – P.297–302.
235. Psoriasis and systemic inflammatory diseases: potential mechanistic links between skin disease and comorbid conditions / B. B. Davidovici, N. Sattar, P. C. Jörg [et al.] // J. Invest. Dermatol. – 2010. – Vol. 130, № 7. – P.1785-1796.
236. Psoriasis vulgaris lesions contain discrete populations of Th1 and Th17 T cells / M. A. Lowes, T. Kikuchi, J. Fuentes-Duculan [et al.] // J. Invest. Dermatol. – 2008. – Vol. 128. – P. 1207-1211.
237. Pulg-Sanz L. Psoriasis, a systemic disease? / L. Pulg-Sanz // Actas Dermosifiliogr. – 2007. – Vol. 98, № 6. – P. 396-402.
238. Reich K. The concept of psoriasis as a systemic inflammation: implications for disease management / K. Reich // JEADV. – 2012. – № 26. – Suppl. 2. – P. 3-11.
239. Reich K. Treatment goal in psoriasis / K. Reich, U. Mrowietz // JDDG. – 2007. – Vol. 5. – P. 556-574.
240. Risk of tuberculosis reactivation with tofacitinib (CP-690550) / M. Maiga, S. Lun, H. Guo [et al.] // J Infec Dis. – 2012. – № 205.–P.1705–1708.
241. Role of epidermal growth factor in the pathogenesis of psoriasis / Y. F. Kutasevych, I. O. Oliinyk, I. O. Mashtakova, O. A. Gavrylyuk // Abstracts of the 13th Spring Symposium of the European Academy of Dermatology and Venereology, Athens, Greece, 19-22 May 2016. – Athens, 2016. – P. 1989.
242. S3-Guidelines on the treatment of psoriasis vulgaris / N. Alexander, B. Wolf-Henning, M. Ulrich [et al.] // JDDG. – 2012. – Vol. 10. – Suppl. 2. – P. 1-95.
243. Safety of treatment with biologics for psoriasis in daily practice: 5-year data / P. P. M. Van Lümig, R. J. Driessen, M. A. Berends [et al.] // J. Transl. Med. – 2010. – Vol. 8, № 1. – P. 16.
244. Salamon M. Psoriasis rupioides: a rare variant of a common disease / M. Salamon, A. Omulecki, A. Sysa-Jedrzejowska // Cutis. – 2011. – Vol. 88, No. 3. – P. 135-137.
245. Sandoval L. F. Systemic Therapies for Psoriasis: An Evidence-Based Update / L. F. Sandoval, A. Pierce, S. R. Feldman // Am. J. Clin. Dermatol. – 2014. – Vol. 55, № 6. – P. 568-573.
246. Scirica B. M. Is C-reactive protein an innocent bystander or proatherogenic culprit? The verdict is still out / B. M. Scirica, D. S. Morrow // Circulation. – 2006. – Vol. 113, № 2. – P. 2128-2134.
247. Sergeant A. C-reactive protein in psoriasis / A. Sergeant, A. Makrygeorgou, W. C. Chan // Br. J. Dermatol. – 2008. – Vol. 158, № 2. – P. 417-419.
248. Serological markers in psoriatic arthritis: promising tools / R. Ramonda, V. Modesti, A. Ortolan [et al.] // Exp Biol Med. – 2013. – Vol. 238, № 12. – P.1-6.
249. Serum epidermal growth factor in patients suffering from psoriasis / A. Pietrzak, B. Lecewicz-Torun, I. Jazienicka [et al.] // Clin. Investig. – 1998. – Vol. 4, № 2. – P.308–313.
250. Sessa W. The nitric oxide synthase family of proteins / W. Sessa // J. Vasc. Res. – 1994. – Vol. 31. – P. 131–143.
251. Slomiany B. L. Role of epidermal growth factor receptor transactivation in the activation of cytosolic phospholipase A2 in leptin protection of salivary gland acinar cells against ethanol cytotoxicity / B. L. Slomiany, A. Slomiany // J. Physiol. Pharmacol. – 2009. – Vol. 60, № 2. – P. 49-55.
252. Sommer D. Increased prevalence of the metabolic syndrom in patients with moderate to severe psoriasis / D. Sommer, M. Jenisch, М. Suchan // Arch. Dermatol. Res. – 2006. – Vol. 14, № 1. – P. 5–36.
253. Sprague A. H. Inflammatory cytokines in vascular dysfunction and vascular disease / A. H. Sprague, R. A. Khalil // Biochem. Pharmacol. – 2009. – Vol. 78, № 8. – P. 539-552.
254. Strouber B. Effect of etanercept on C-reactive protein levels in psoriatic arthritis / B. Strouber, C. Teller, P. Yamauchi // Br. J. Dermatol. – 2008. – Vol. 159, № 11. – Р. 322-330.
255. Sullivan J. Treatment for severe psoriasis / J. Sullivan // Aust. Prescr. – 2009. – Vol. 32. – P. 14-18.
256. The cytokine and chemokine network in psoriasis / B. J. Nickoloff, H. Xin, F. O. Nestle, J. Z. Qin // Clin. Dermatol. – 2007. – Vol. 25, № 6. – P. 568-573.
257. The pathogenic role of tissue-resident immune cells in psoriasis / O. Boyman, C. Conrad, G. Tonel [et al.] // Trends Immunol. – 2007. – Vol. 28. – P. 51-57.
258. The risk of mortality in patients with psoriasis. Results from a population – based study / J. M. Gelfand, A. B. Troxel, J. D. Lewis [et al.] // Arch. Dermatol. – 2007. – 143. – Р.493-499.
259. Thomas Richard D. Review of conventional systemic therapies for severe psoriasis / D. Thomas Richard // Skin Therapy Letter. com. – 2011. – [Электронный ресурс]. – Режим доступа: http://www.skintherapyletter.com.
260. Torre J. Utility and application in clinical practice of the CASPAR criteria / J. Torre // Rheumatol. Clin. – 2010. – Vol. 6 (Suppl. 1). – P. 18-21.
261. Traub M. Psoriasis pathophysiology, conventional and alternative approaches to treatment / M. Traub, K. Marshall // Alternative Medicine Review. – 2007. – Vol. 12. – P. 319-330.
262. Treatment of erythrodermic psoriasis with etanercept / M. Esposito, A. Mazzotta, C. de Falice [et al.] // Br. J. Dermatol. – 2006. – Vol. 155 (1). – P.156-159.
263. Treatment of psoriatic arthritis in a phase 3 randomised, placebo-controlled trial with apremilast, an oral phosphodiesterase 4 inhibitor / A. Kavanaugh, P. J. Mease, J. J. Gomez-Reino [et al.] // Ann. Rheum. Dis. – 2014. – № 0.– P. 1–7.
264. Truong B. Demographics, clinical disease characteristics, and quality of life in a large cohort of psoriasis patients with and without psoriatic arthritis / B. Troung, N. Rich-Garg, B. D. Ehst // Clin. Cosmet. Investig. Dermatol. – 2015. – Vol. 8. – P. 563-569.
265. Update on the use of ciclosporin in immune mediated dermatoses / C. E. Griffiths, A. Katsambas, B. A. Dijkmans [et al.] // Br. J. Dermatol. – 2006. – Vol. 155. – P. 1-16.
266. Ustekinumab, a human interleukin 12/23 monoclonal antibody, for psoriatic arthritis: randomised, double-blind, placebo-controlled crossover trial / A. Gottlieb, A. Menter, A. Mendelsohn [et al.] // Lancet. – 2009. – Vol. 373. – P. 633-640.
267. Vainchenker W. Constantinescu JAKs in pathology: role of Janus kinases in hematopoietic malignancies and immunodeficiencies / W. Vainchenker, A. Dusa, S. N. Semin // Cell Dev Biol. – 2008. – № 19.–P.385–393.
268. Veale D. J. Immunopathology of psoriasis and psoriatic arthritis / D. J. Veale, C. Ritchlin, O. FitzGerald // Ann Rheum Dis. – 2005. – Vol. 64. – P. 26–29.
269. Videocapillaroscopic findings in the microcirculation of the psoriatic plaque / R. De Angelis, L. Bugatti, P. Del Medico [et al.] // Dermatology. – 2002. – Vol. 204. – P. 236–239.
270. Voitenok N. N. T cell growth factor production and protein synthesis / N. N. Voitenok, N. V. Varivotskaya // Scand. J. Immunol. – 1984. – Vol. 19, № 4. – P.353–358.








