Державна установа «Інститут дерматології та венерології
Національної академії медичних наук України»
Кваліфікаційна наукова
праця на правах рукопису
Ата Мохамед Аббас Мохамед
УДК 616.5-004.1-031.84-073.082.6-074-085
ДИСЕРТАЦІЯ
ОПТИМІЗАЦІЯ ДІАГНОСТИКИ І ЛІКУВАННЯ ОБМЕЖЕНОЇ СКЛЕРОДЕРМІЇ З УРАХУВАННЯМ КЛІНІКО-ПАТОГЕНЕТИЧНОЇ РОЛІ МЕТАБОЛІЧНИХ ТА ІМУННИХ ПОРУШЕНЬ
14.01.20 – шкірні та венеричні хвороби
Подається на здобуття наукового ступеня кандидата медичних наук
Дисертація містить результати власних досліджень. Використання ідей, результатів і текстів інших авторів мають посилання на відповідне джерело
______________________________________Ата Мохамед Аббас Мохамед
(підпис, ініціали та прізвище здобувача)
Науковий керівник: Кутасевич Яніна Францівна, доктор медичних наук, професор
Харків – 2019
АНОТАЦІЯ
Ата Мохамед Аббас Мохамед. Оптимізація діагностики і лікування обмеженої склеродермії з урахуванням клініко-патогенетичної ролі метаболічних та імунних порушень. – Кваліфікаційна робота на правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 «шкірні та венеричні хвороби». – ДУ «Інститут дерматології та венерології НАМН України», Харків, 2019.
Дисертація присвячена проблемі підвищення ефективності діагностики і терапії обмеженої склеродермії (ОСД) на основі оптимізації діагностичної та лікувальної тактики.
У дисертації на підставі комплексного клінічного дослідження і аналізу причинно-наслідкових чинників розвитку ОСД доповнено наукові дані про особливості клінічної картини, конкретизовано зміни гомеостазу, які характерні для перебігу даного захворювання, а також доведено, що метаболічні властивості вивчених з’єднань узгоджуються з виявленими дистрофічними і деструктивними порушеннями в організмі пацієнта з ОСД при розвитку метаболічних та імунних порушень, підтверджених при проведенні досліджень на організменному та клітинному рівнях. Враховуючи розповсюдженість ОСД, хронічний персистуючий перебіг захворювання з формуванням стійких осередків атрофії та ущільнення шкіри, а також недостатню ефективність існуючої терапії та невирішеність питань діагностики прогресування захворювання, розв’язання цієї проблеми є актуальним для сучасної та практичної дерматології. Наведено теоретичне обґрунтування необхідності та нове вирішення наукового завдання, що полягає в підвищенні ефективності діагностики та лікування хворих на ОСД шляхом розробки комплексного методу терапії з урахуванням клініко-патогенетичної ролі метаболічних та імунних порушень.
Запропоновано низку варіантів сучасних етіопатогенетичних напрямків діагностики та лікування хворих, що страждають на зазначений дерматоз, які включають дистанційну тепловізійну діагностику й сучасну терапію з використанням запропонованої схеми комплексного лікування при ОСД.
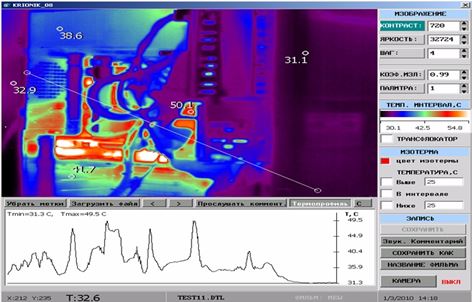
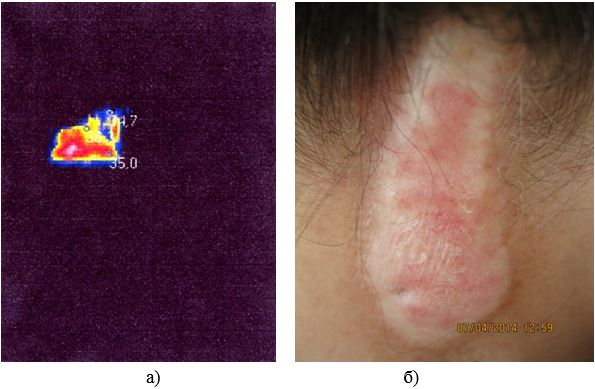
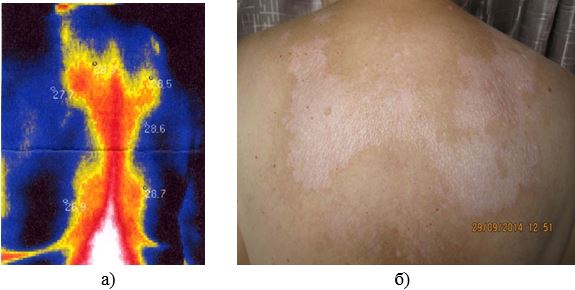
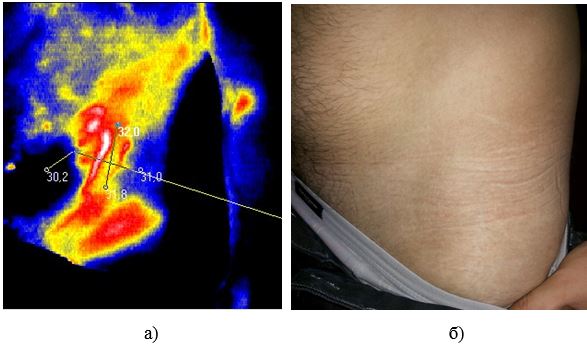
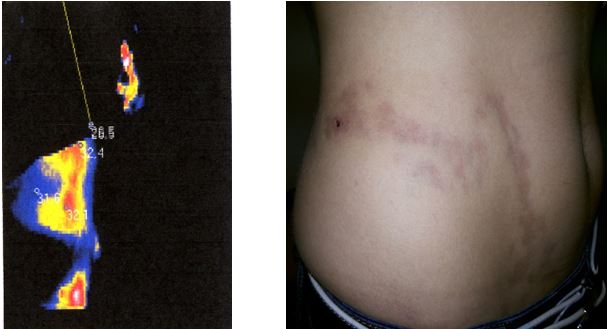
У роботі вперше розроблено метод тепловізійної діагностики загострень ОСД, який дозволяє судити про активність сполучнотканинного запалення або процесів склерозування в осередках ураження у пацієнтів із ОСД та надає можливість застосування дистанційної термографії як неінвазивного метода діагностики рецидивів у хворих з автоімунними захворюваннями сполучної тканини на доклінічному етапі. У дослідженні встановлено пряму залежність між клінічними проявами, зміною лабораторних показників та гіпертермованими ділянками. Проведене статистичне визначення, а саме порівняння отриманих значень температур між собою за методом Данна дозволило обґрунтувати температурну реакцію на ураження та залежність її від ступеня розповсюдженості ділянки шкіри, що може служити передумовою вдосконалення постановки діагнозу та призначення адекватної лікувальної терапії або профілактики даного виду дерматозу. Метод дозволяє судити про активність сполучнотканинного запалення або процесів склерозування в осередках ураження у пацієнтів із ОСД та надає можливість застосування дистанційної термографії як неінвазивного метода діагностики рецидивів у хворих з автоімунними захворюваннями сполучної тканини на доклінічному етапі.
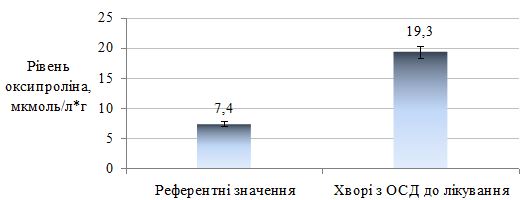
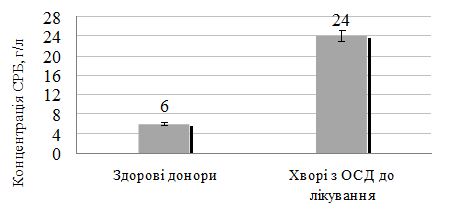
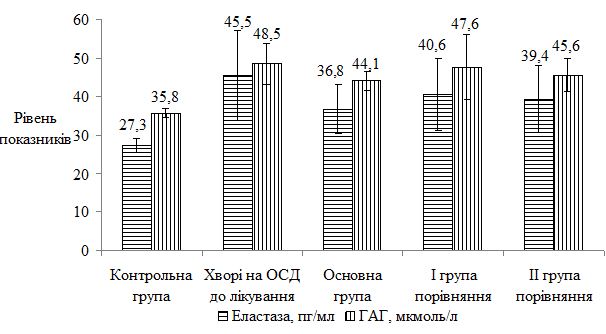
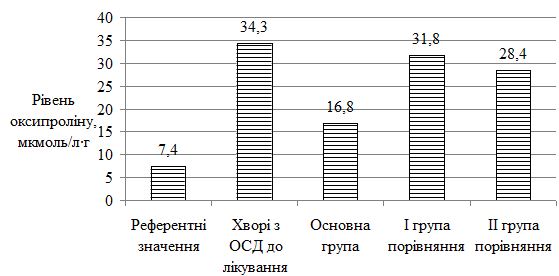
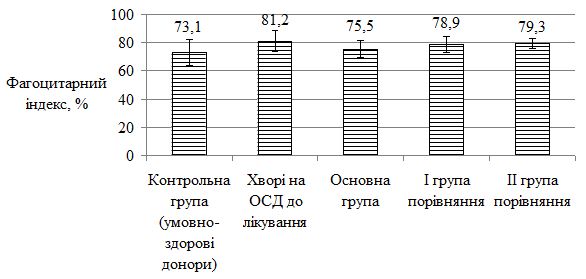
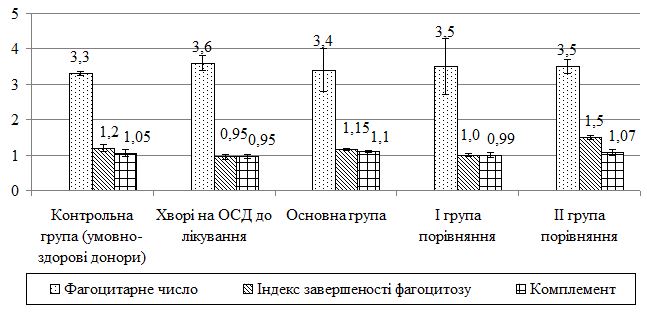
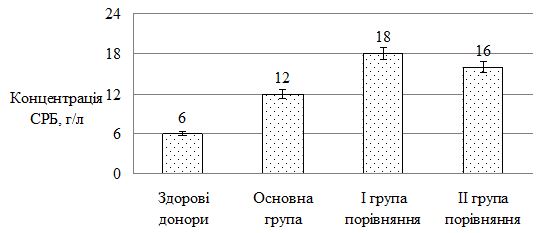
Оцінено стан метаболічних порушень у хворих на ОСД у період прогресуючої стадії захворювання, а також надано характеристику динаміки показників імунного статусу у процесі лікування. Проведені дослідження дозволили виявити в більшості випадків переважання значень досліджуваних показників у пацієнтів із ОСД до проведеного лікування. Було виявлено збільшення імунологічних показників (фагоцитарний індекс, фагоцитарне число, індекс завершення фагоцитозу, концентрація пептидів середньої молекулярної маси, циркулюючих імунних комплексів, лімфоцитотоксичність, антитіла до нативної ДНК, антиядерні антитіла); біохімічних показників (збільшення С-реактивного білку, концентрації магнію, a2-, b-, g-фракції, b‑ліпопротеїдів, ліпопротеїдів високої щільності та зниження концентрації хлору, альбуміну, a1-глобулінової фракції, загальних ліпідів, холестерину, триглицеридів). Особливо слід зазначити збільшення рівня показників структурно-метаболічного стану сполучної тканини – еластази, глікозаміногліканів, колагенолитичної активності плазми крові (за оксипроліном). Проведені дослідження виявили низку особливостей біохімічних показників і свідчать, що ОСД у прогресуючій стадії супроводжувалася порушеннями метаболічного обміну сполучної тканини, які пов`язані з активацією протеїназ і накопиченням в сироватці крові глікозаміногліканів. Високий кореляційний зв`язок між динамікою активності еластази та вмістом глікозаміногліканів сироватки крові при ОСД дозволяє використовувати ці показники для диференційної діагностики й вибору комплексної терапії, як прогностично значущі в динаміці патогенетичного лікування, що забезпечує підвищення ефективності його проведення, підвищує точність встановлення ступеня тяжкості перебігу дерматозу, вираженості процесу та прогнозу перебігу ОСД.
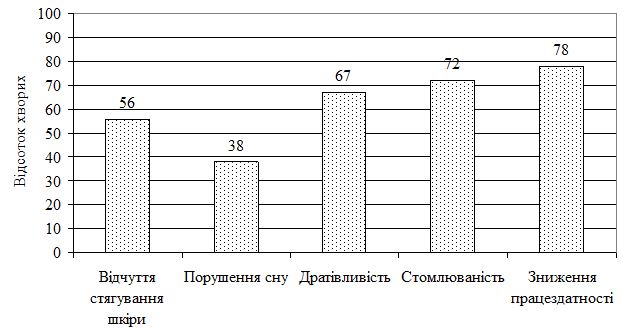
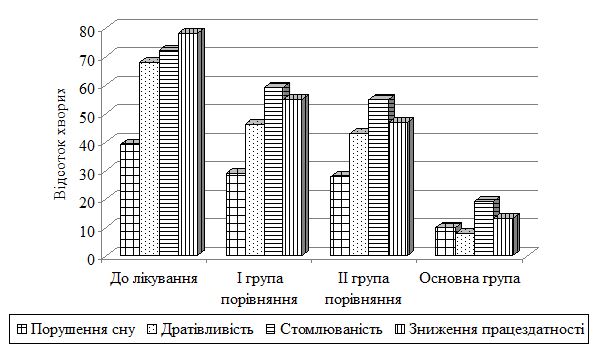
Проведене дослідження демонструє, що поліпшення загального стану хворих завжди є головною метою проведеної комплексної терапії ОСД. Моніторинг основних скарг з урахуванням клінічної картини ОСД дозволив оцінити ефективність комплексної терапії і в певній мірі допомогти у виборі та проведенні необхідної адекватної корекції хронічного дерматозу. Включення до складу базової терапії ОСД цитофлавіну сприяє більш значному зростанню порівняно зі стандартною терапією рівня самопочуття, активності, настрою, зменшенню запального процесу осередків у прогресуючій стадії. Комплексне лікування призводить до нормальних значень циркулюючих імунних комплексів малого діаметра, імуноглобуліну А, інтерлейкінів 1 і 4, фактора некрозу пухлини α, ефективно і достовірно знижує рівень інтенсивності почуття стягування шкіри, порушення сну, дратівливість, порог стомлюваності, а також підвищує працездатність.
Результати проведених досліджень свідчать про патогенетичну спрямованість комплексного застосування терапії на підставі розробленої схеми патогенетичного лікування, включно із застосуванням 2,5 % розчину тіотриазоліну і цитофлавіну на тлі традиційної терапії у пацієнтів із ОСД, що супроводжується швидким і вираженим регресом основних клінічних критеріїв дерматозу, і полягає в основі високого терапевтичного ефекту нового сучасного розробленого способу лікування.
Розроблений комбінований спосіб лікування є патогенетично обґрунтованим, високоефективним способом терапії та профілактики ОСД. Патогенетичний ефект визначається високим відновним потенціалом, що призводить до утворення та синтезу біологічно активних речовин, посилення активності імунокомпетентних клітин, стимуляції репаративних процесів, відновлювання активності ферментів антиоксидантного захисту. Безпечне застосування, доступність такої терапії обґрунтовують доцільність використання засобів, які покращують стан сполучної тканини в лікуванні хворих на ОСД і дозволяють їх рекомендувати для впровадження у практику охорони здоров’я. Впровадження результатів проведеного дослідження в практику дозволило оптимізувати результати лікування хворих на ОСД, сприяло зниженню ліжко-дня і поліпшенню якості їхнього життя в майбутньому.
Розроблено і впроваджено в клініку спосіб оцінки ефективності лікування хворих на ОСД (патент України на корисну модель № 109591 від 25.08.2016), в основу якого поставлено завдання розширення арсеналу способів оцінки ефективності лікування хворих на ОСД шляхом оцінки в сироватці крові активності еластази, колагенолітичної активності та накопичення глікозоаміногліканів, клінічне застосування якого дозволяє проводити диференційну діагностику, а також провести вибір комплексної терапії та забезпечити підвищення ефективності лікування пацієнтів із ОСД. Доведено можливість оцінки ефективності лікування хворих на різні форми та стадії ОСД шляхом визначення в сироватці крові активності еластази, колагенолітичної активності та накопичення глікозаміногліканів.
Розроблено алгоритм лікувально-діагностичної тактики для пацієнтів з ОСД, який базувався на процесах уповільнення прогресування хвороби, максимальної стабілізації процесу та регресу клінічної картини. Комплекс лікувальних заходів включав застосування медикаментозної терапії (антифіброзні, дезінтоксикаційні, судинні, метаболічні, мембраностабілізуючі препарати, цитопротектори, вітаміни, антиоксиданти), яка активувала дихання й енергоутворення у клітинах, поліпшувала процеси утилізації кисню тканинами, відновлювала активність ферментів антиоксидантного захисту, що підтверджується нормалізацією рівнів показників структурно-метаболічних порушень в сполучній тканині (еластази, колагенолітичної активності, вмісту глікозоаміногліканів), збільшенням рівнів протизапальних цитокінів інтерлейкінів-4 й -10 та вказує на активацію механізмів, спрямованих на згасання патологічного процесу. Вивчено вміст в сироватці крові хворих на ОСД про- і антизапальних цитокінів у 1-3 добу після госпіталізації та обґрунтовано їх прогностичне значення для діагностики та оптимізації патогенетичної терапії. Комплексне лікування призводить до нормальних значень циркулюючих імунних комплексів малого діаметра, імуноглобуліну А, інтерлейкінів-1 і -4, фактора некрозу пухлини α, ефективно і достовірно знижує рівень інтенсивності почуття стягування шкіри, порушення сну, дратівливість, порог стомлюваності, а також підвищує працездатність.
Результати клінічного дослідження і розробок істотно доповнюють відомості про патогенез, а також арсенал діагностики та комплексного лікування ОСД із застосуванням сучасних технологій і послужать методологічною основою для підвищення ефективності профілактики ОСД у рамках диспансеризації населення.
Ключові слова: обмежена склеродермія, сучасна діагностика, комплексне лікування.
SUMMARY
Atа Мokhamed Abbas Mokhamed. Optimization of diagnosis and treatment of limited scleroderma, taking into account the clinical and pathogenetic role of metabolic and immune disorders. – Qualifying scientific work on the rights of the manuscript.
Thesis for a candidate degree in medical sciences by specialty 14.01.20 – skin and venereal diseases. – SE “Institute of Dermatology and Venereology of NAMS of Ukraine”, Kharkiv, 2019.
The dissertation is devoted to the problem of increasing the effectiveness of diagnosis and treatment of localized scleroderma, on the basis of optimization of diagnostic and therapeutic tactics.
In the dissertation, on the basis of comprehensive clinical research and analysis of the causative factors of the development of localized scleroderma, scientific data on the features of the clinical picture, the changes of homeostasis changes that are characteristic for the course of this disease, and also proved that the metabolic properties of the studied compounds are consistent with the detected dystrophic and destructive disturbances in the body of the patient with localized scleroderma in the development of metabolic and immune disorders, confirmed in conducting research on the organism and cellular in vain Given the prevalence of localized scleroderma, the chronic persistent course of the disease with the formation of resistant cells of atrophy and skin consolidation, as well as the lack of effectiveness of existing therapy and the unresolved issues of diagnosis of progression of the disease, the solution to this problem is relevant for modern and practical dermatology. The theoretical substantiation of the necessity and the new solution of the scientific problem is proposed, which is to increase the efficiency of diagnosis and treatment of patients with limited scleroderma by developing a complex method of therapy, taking into account the clinical and pathogenetic role of metabolic and immune disorders.
A number of variants of modern etiopathogenetic directions of diagnostics and treatment of patients suffering from the specified dermatosis are offered, which include remote thermal imaging diagnostics and modern therapy with the use of the proposed scheme of complex treatment at localized scleroderma.
In the work, for the first time, the method of thermal imaging diagnostics of exacerbations of localized scleroderma has been developed, which allows to judge the activity of connective tissue inflammation or the processes of sclerosis in the cells of the lesion in patients with limited scleroderma and provides the possibility of using remote thermography as a non-invasive method for the diagnosis of relapses in patients with autoimmune connective tissue diseases at the preclinical stage. The study established a direct relationship between clinical manifestations, changes in laboratory parameters and hyperthermia. The performed statistical determination, namely, the comparison of the obtained values of temperatures with each other by the Dana method, allowed to substantiate the temperature reaction to the defeat and its dependence on the degree of distribution of the skin, which can serve as a prerequisite for improving the diagnosis and the appointment of adequate therapeutic therapy or prevention of this type of dermatosis. The method makes it possible to judge the activity of connective tissue inflammation or the processes of sclerosis in the lesion’s cells in patients with limited scleroderma and allows the use of remote thermography as a non-invasive method for the diagnosis of relapses in patients with autoimmune connective tissue diseases at the preclinical stage.
The state of metabolic disorders in patients with localized scleroderma during the progressive stage of the disease is assessed, as well as the characteristics of the dynamics of immune status parameters in the course of treatment. The conducted studies allowed to reveal in most cases the prevalence of the values of the studied parameters in patients with localized scleroderma before the treatment. An increase in immunological parameters (phagocytic index, phagocytic number, completion rate of phagocytosis, concentration of peptides of the average molecular weight, circulating immune complexes, lymphocytotoxicity, antibodies to native DNA, ANA antinuclear antibodies) were found. biochemical parameters (increase of CRP, magnesium concentration, a2-, b-, γ-fraction, b-lipoproteins, HDL and reduction of chlorine, albumin, a1-globulin fraction, total lipids, cholesterol, triglycerides). Particularly noteworthy is the increase in the level of indicators of the structural and metabolic state of the connective tissue – elastase, glycosaminoglycans, collagenolytic activity of the blood plasma (by oxyproline). The conducted studies have revealed a number of features of biochemical parameters and suggest that localized scleroderma in the progressive stage was accompanied by disorders of metabolic metabolism of connective tissue that are associated with activation of proteinases and the accumulation of glycosaminoglycans in the blood serum. The high correlation between the dynamics of elastase activity and the content of serum glycosaminoglycans under localized scleroderma allows the use of these indicators for differential diagnosis and the choice of complex therapy, as prognostically significant in the dynamics of pathogenetic treatment, which increases the effectiveness of its conduct, increases the accuracy of determining the degree of gravity of the course dermatosis, the severity of the process and the prognosis of the course of the localized scleroderma.
The conducted research demonstrates that improvement of the general condition of patients is always the main goal of the comprehensive treatment of localized scleroderma. Monitoring of the main complaints based on the clinical picture of localized scleroderma allowed to assess the effectiveness of complex therapy and to some extent help in choosing and conducting the necessary adequate correction of chronic dermatosis. Inclusion in the basic therapy of localized scleroderma Cytoflavin contributes to a more significant increase compared with standard therapy, level of well-being, activity, mood, reduction of inflammatory process of cells in the advanced stage. Complex treatment leads to normal values of circulating immune complexes of small diameter, immunoglobulin A, interleukins 1 and 4, tumor necrosis factor α, effectively and reliably reduces the level of intensity of feeling skin leakage, sleep disturbances, irritability, fatigue threshold, and also increases performance.
The results of the conducted research indicate the pathogenetic orientation of the complex application of therapy on the basis of the developed scheme of pathogenetic treatment, including the use of 2.5% solution of Thiotriazoline and Citoflavin against the background of traditional therapy in patients with focal scleroderma, accompanied by a rapid and severe regression of the main clinical criteria for dermatosis, and is the basis of the high therapeutic effect of a new modern developed method of treatment.
The developed combination method of treatment is pathogenetically grounded, highly effective method of therapy and prevention of limited scleroderma. The pathogenetic effect is determined by high restorative potential, which leads to the formation and synthesis of biologically active substances, enhancement of the activity of immunocompetent cells, stimulation of reparative processes, renewal of antioxidant defense enzymes activity. Safe use, the availability of such therapy justifies the feasibility of using drugs that improve the connective tissue in the treatment of patients with localized scleroderma and can recommend them for implementation in the practice of health care. Implementation of the results of the conducted research into practice allowed to optimize the results of treatment for patients with localized scleroderma, contributed to reducing the bed-day and improving the quality of their life in the future.
The method of assessing the effectiveness of treatment for patients with limited scleroderma is developed and implemented in the clinic (the Ukrainian Patent for Utility Model No. 109591), which is based on the task of expanding the arsenal of methods for assessing the effectiveness of treatment for patients with limited scleroderma by assessing the activity of elastase in blood serum, collagenolytic activity and accumulation glycosoaminoglycans, clinical application of which allows for differential diagnosis, as well as to make a choice of complex therapy and to provide increased eff the treatment of patients with localized scleroderma. The possibility of evaluating the effectiveness of treating patients with different forms and stages of localized scleroderma by the determination of elastase activity, collagenolithic activity and accumulation of glycosaminoglycans in blood serum was proved.
The algorithm of treatment-diagnostic tactics for patients with localized scleroderma was developed, which was based on the processes of slowing down the progression of the disease, the maximum stabilization of the process and regression of the clinical picture. The complex of medical measures included the use of medical therapy (antiphibrotic, detoxification, vascular, metabolic, membrane stabilizing preparations, cytoprotectors, vitamins, antioxidants), which activated respiration and energy formation in cells, improved processes of oxygen utilization by tissues, restored the activity of enzymes of antioxidant defense, which is confirmed by the normalization of levels indicators of structural and metabolic disorders in the connective tissue (elastase, collagenolytic activity, glycosoaminoglycic content ani), an increase in the levels of anti-inflammatory cytokines IL-4 and IL-10 and indicates the activation of mechanisms aimed at fading the pathological process. The content of serum in patients with localized scleroderma pro-and anti-inflammatory cytokines in the 1-3 days after hospitalization was studied and their prognostic value for diagnostics and optimization of pathogenetic therapy was substantiated. Complex treatment leads to normal values of circulating immune complexes of small diameter, immunoglobulin A, interleukins 1 and 4, tumor necrosis factor α, effectively and reliably reduces the level of intensity of feeling skin leakage, sleep disturbances, irritability, fatigue threshold, and also increases performance.
The results of clinical research and development significantly complement information about pathogenesis, as well as the arsenal of diagnosis and integrated treatment of localized scleroderma with the use of modern technologies and serve as a methodological basis for increasing the effectiveness of prevention of localized scleroderma in the framework of prophylactic population.
Key words: limited scleroderma, modern diagnostics, complex treatment.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Ата М. А. Дистанционное термометрическое исследование измененных кожных покровов у больных очаговой склеродермией. Дерматологія та венерологія. № 2 (80). С. 50–53.
- АтаМ. А. Лечение очаговой склеродермии с применением современных методов. Дерматологія та венерологія. 2018. № 3 (81). С. 22–24.
- Ата М. А. Особенности активности эластазы, коллагенолитической активности и содержания гликозаминогликанов у больных ограниченной склеродермией. Дерматологія та венерологія. 2018. № 4 (82). С. 23–26.
- Кутасевич Я.Ф., Ата М.А. Особенности формирования синдрома иммуно-эндокринной дисфункции у больных очаговой склеродермией в стадии обострения. Международный медицинский журнал. 2019. № 1 (97). С. 75–79.
- Ата М. А. Прогнозирование развития иммунной дисфункции у больных очаговой склеродермией по состоянию некоторых звеньев иммунного ответа. Дерматологія та венерологія. 2019. № 1 (83). С. 14–
- Ата М. А. Особенности биохимических изменений у больных ограниченной склеродермией. ScienceRise: Medical Science. 2019. № 1 (28). С. 20–24.
- Применение современных способов диагностики очаговой склеродермии / Янина Кутасевич, Ирина Олейник, Мохамед Ата, Петр Замятин, Константин Дубровский. Spatial aspects of socio-economic systems development: the economy, education and health care. Monograph. Opole, Poland : Publishing House WSZiA, P. 258–265.
- Пат. на корисну модель 109591 Україна, МПК 7 G01N33/49 (2006.01). Спосіб оцінки ефективності лікування хворих на вогнищеву склеродермію / М.А. Ата, Я. Ф. Кутасевич, В. І. Жуков. № u201602567; заявл. 16.03.2016; опубл. 25.08.2016, Бюл. № 16.
- Ата М. А. Оцінка ефективності лікування хворих на вогнищеву склеродермію. Мат. ХІІІ Міжнародної конференції студентів та молодих вчених «Актуальні питання сучасної медицини», м. Харків, 14-15 квітня 2016 р. Харків : ХНУ ім. В.Н. Каразіна, 2016. С. 31.
- Олійник І.О., Ата М.А., Кордон Т.В. Стан мікроциркуляторного русла шкіри при обмеженої склеродермії. Матеріали науково-практичної конф. з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», м. Харків, 10-11 листопада 2017. Дерматологія та венерологія. 2017. № 3 (77). С. 109.
ЗМІСТ
| Перелік умовних позначень | 16 |
| Вступ | 17 |
| Розділ 1 Сучасний стан проблеми діагностики і лікування хворих на обмежену склеродермію (літературний огляд) | 25 |
| 1.1 Становлення проблеми, структура, питома вага і класифікація обмеженої склеродермії | 25 |
| 1.2 Патогенетичні особливості обмеженої склеродермії | 32 |
| 1.3 Структурно-метаболічний стан сполучної тканини у хворих на обмежену склеродермію1.3 Структурно-метаболічний стан сполучної тканини у хворих на обмежену склеродермію | 36 |
| 1.4 Особливості клінічного перебігу та сучасні можливості діагностики обмеженої склеродермії | 39 |
| 1.5 Сучасні принципи терапії обмеженої склеродермії | 42 |
| Розділ 2 Матеріали та методи дослідження | 53 |
| 2.1 Методика загального обстеження хворих | 53 |
| 2.2 Біохімічні дослідження | 57 |
| 2.3 Імуноферментні дослідження | 60 |
| 2.4 Інструментальне обстеження | 65 |
| 2.5 Методи лікування | 67 |
| 2.6 Статистичні методи дослідження | 68 |
| Розділ 3 Клінічна характеристика хворих на обмежену склеродермію | 69 |
| Розділ 4 Імунний статус і порушення біохімічних показників у хворих на обмежену склеродермію |
76 |
| 4.1 Дослідження неспеціфічної резистентності та бар`єрних функцій у хворих на обмежену склеродермію до проведення лікування |
76 |
| 4.2 Особливості біохімічних змін у хворих на обмежену склеродермію до проведення лікування |
86 |
| Розділ 5 Дистанційне термометричне дослідження змінених шкірних покривів у хворих на обмежену склеродермію |
93 |
| 5.1. Характеристика даних термографії в ділянці шкірного осередку обмеженої склеродермії у хворих до та після лікування | 98 |
| 5.2. Вибір адекватної зони дослідження поверхневої температури тіла в ділянці шкірного ураження обмеженою склеродермією |
113 |
| Розділ 6 Розробка нових методів лікування хворих на обмежену склеродермію та динаміка імунологічних і біохімічних показників у процесі лікування |
120 |
| 6.1 Розробка нових методів терапії хворих на обмежену склеродермію та вивчення їх терапевтичної ефективності | 120 |
| 6.2 Характеристика клінічного використання методу комплексної терапії хворих на обмежену склеродермію за способом оцінки ефективності лікування |
121 |
| 6.3 Дослідження імунологічних показників у хворих на обмежену склеродермію після проведення лікування | 125 |
| 6.4 Прогнозування розвитку метаболічних та імунних порушень на підставі аналізу стану деяких ланок імунної відповіді у хворих на обмежену склеродермію |
129 |
| 6.5 Особливості біохімічних змін у хворих на обмежену склеродермію після проведення лікування | 135 |
| 6.6 Динаміка показників загального стану хворих на обмежену склеродермію після проведення комплексного лікування за різними методами | 138 |
| Розділ 7 Аналіз та узагальнення отриманих результатів | 145 |
| Висновки | 165 |
| Рекомендації | 167 |
| Список використаних джерел | 168 |
| Додаток А Акти впровадження | 190 |
| Додаток Б Список публікацій здобувача за темою дисертації та відомості про апробацію результатів дисертації |
195 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
ГАГ – глікозаміноглікани
ІЛ – інтерлейкін
ІФА – імуноферментний аналіз
КЛА – колагенолітична активність
ЛПВЩ – ліпопротеїди високої щільності
ОСД – обмежена склеродермія
ПСММ – пептиди середньої молекулярної маси
СРБ – С-реактивний білок
СТ – сполучна тканина
ФНП – фактор некрозу пухлини
ЦІК – циркулюючі імунні комплекси
HLA – система тканинної гістосумісності людини
ICAM-1 – циркулюючі молекули міжклітинної адгезії
VCAM – молекули адгезії судинного ендотелію
ВСТУП
Обґрунтування вибору теми дослідження. Сучасна медицина під терміном «склеродермія» об’єднує широку групу захворювань, найбільш відомими представниками якої є обмежена і системна склеродермія. Незважаючи на те, що останнім часом з’являється все більше робіт, присвячених проблемі склеродермії, залишаються неясними етіологія та патогенез захворювання, питання діагностики, клініки та ефективної терапії.
Обмежена склеродермія (ОСД) – хронічне захворювання сполучної тканини (СТ), яке характеризується ущільненням шкіри й підшкірної жирової клітковини внаслідок підвищення щільності колагену [31], є одним з найбільш частих захворювань шкіри і за даними багатьох дослідників залишається однією з актуальних проблем сучасної дерматології. Значимість її зростає у зв’язку з постійним збільшенням кількості хворих даної категорії [30].
За даними ВООЗ, у всіх індустріально розвинених країнах світу 400 000 із 10 млн. людей страждають на ОСД [59, 69, 84].
На думку більшості вчених, за останні 30-40 років відзначається зростання кількості хворих на дане захворювання. За даними МОЗ України, тільки за останні 4 роки захворюваність на ОСД у середньому збільшилася з 405,2 до 460,3 хворих на 100 000 населення і до 2013 року становила 455,8 випадків на 100 000 населення [55, 56].
Здебільшого це захворювання пов’язане з порушенням обміну речовин на фоні дисфункції нейроендокринної та імунної систем, включаючи і спадковий характер. Захворювання зустрічається у всіх вікових групах, але найчастіше в найбільш працездатному віці – 18-52 років, що й визначає медико-соціальну значимість ОСД [52, 57, 88, 118].
Слід підкреслити, що різноманіття клінічних форм склеродермії вимагає використання обґрунтованого, раціонального та індивідуального підходу до лікування з огляду на велику кількість неконтрольованих факторів, що є складним завданням для практичного лікаря. При цьому дії лікаря ґрунтуються, як правило, на апріорній імовірнісній оцінці симптомів дерматозу з одного боку, й детермінованому підході до постановки діагнозу і вибору схеми лікування – з іншого.
Крім того, має місце проблема неповноти вихідної діагностичної інформації, спричинена обмеженими можливостями окремих методів клініко-лабораторних та клініко-інструментальних досліджень [25, 119].
Таким чином, розробка і теоретичне обґрунтування нових перспективних методів діагностики й лікування хворих на ОСД, які базуються на алгоритмах вибору раціональної тактики лікування та дозволяють в умовах неповноти і неоднозначності діагностичної інформації здійснити індивідуалізований вибір терапевтичного впливу при мінімізації побічних ефектів, є актуальною науковою проблемою.
В останні роки намітився певний прогрес у розвитку питань клініко-патофізіологічної оцінки ОСД. Однак, значна частина досліджень останнього часу ґрунтується лише на теоретичній базі, без підтримки поглибленим аналізом клініко-експериментальних досліджень [41].
Результати вивчення такої важливої проблеми обговорюються на численних вітчизняних і міжнародних конференціях, з’їздах, конгресах і симпозіумах.
Незважаючи на опубліковані останнім часом монографії [61, 82, 114, 197] і дисертаційні роботи [55, 56], в яких сформульовані основні положення даної проблеми, низка важливих аспектів діагностики та лікування ОСД залишається невирішеною або вирішеною частково, оскільки роботи мають принципово описовий характер і лише частково розкривають особливості діагностичної та лікувальної тактики.
Уточнення незрозумілих питань патогенезу, розробка нових критеріїв діагностики, підбір ефективних препаратів базової терапії сприяють пошуку рішення даної проблеми. Значна кількість робіт свідчить про участь імунної й ендокринної систем у розвитку захворювання [14, 53, 59, 68, 162].
Також не висвітлені особливості розпізнавання ОСД з використанням сучасних клініко-інструментальних методів, зокрема тепловізійного обладнання, сучасних доклінічних інтегральних фізичних методів, які служать прогностичною основою обґрунтування маркерних інтеграційних метаболічних показників донозологічної діагностики, питання лікування залежно від характеру і ступеня ураження шкірних покривів і підлеглих тканин, а також принципи надання спеціалізованої допомоги таким хворим відповідно до сучасного рівня розвитку доктрини дерматології.
Єдиних стандартів надання лікувальної допомоги при ОСД у даний час в Україні немає, про що свідчать наведені вище показники незадовільних результатів лікування та їх розкид у хворих з даною патологією.
Ці факти сприяють подальшому вивченню фундаментальних уявлень про етіопатогенез ОСД на клітинно-мембранному, органному і системному рівнях організації організму [82].
Важливими складовими в розвитку ОСД є тканинна гіпоксія й мікроциркуляторні порушення, які впливають на клітинний метаболізм і стан клітинних мембран, що відзначається на рівні клітинного відновлення органу й імунокомпетентних структур. Саме з цими механізмами пов’язують причини несприятливих наслідків захворювання і розвитку ускладнень [150, 191].
Сучасний стан проблеми характеризується невирішеністю питань та недостатнім відображенням у літературі даних про специфіку ранньої діагностики, лікування хворих на ОСД, недоліками і недосконалістю схем раціональної лікувально-діагностичної тактики.
Стає очевидним пошук шляхів оцінки стану осередків ураження – шкіри хворих на ОСД за допомогою термографії. Актуальним є пошук нових патогенетично обумовлених методів лікування ОСД, що нормалізують гомеостаз на клітинному рівні.
Одним з таких методів є новий метод терапії з використанням сучасних препаратів, патогенетичний ефект якої визначається високим відновним потенціалом, що призводить до утворення та синтезу біологічно активних речовин, посилення активності імунокомпетентних клітин, стимуляції репаративних процесів та ін.
Таким чином, розробка сучасного патогенетично обґрунтованого методу лікування на підставі вивчення структурно-функціонального стану клітинних мембран при формуванні метаболічних та імунних порушень є актуальною, оскільки дозволить оптимізувати терапію хворих на ОСД шляхом впливу на процеси репаративного неоколагеногенезу й стан системи імунного захисту. Крім того, у доступній літературі не існує опису методик терапії з використанням сучасних схем лікування, спеціально розроблених для хворих на ОСД.
Оптимізація та підвищення ефективності лікування хворих цієї категорії може бути досягнута лише при комплексному, об’єктивно обґрунтованому підході до вибору лікувальної тактики, орієнтованої на клініко-патогенетичні особливості з урахуванням метаболічних та імунних порушень і застосуванням нової схеми комплексного лікування.
Актуальність цього дослідження зумовлена патофізіологічними, патогенетичними й клінічними проблемами, вирішення яких певною мірою дозволить поліпшити результати комплексного лікування хворих на ОСД.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота за обраним напрямком досліджень входить до тематичних планів і виконана відповідно до плану науково-дослідних робіт ДУ «Інститут дерматології та венерології НАМН України» і є фрагментом НДР «Розробити методи патогенетичної терапії хворих на обмежену склеродермію та хронічний червоний вовчак з урахуванням морфологічних змін шкіри, стану імунної системи і метаболізму сполучної тканини» (№ держреєстрації 0112U000007), у якій здобувач був співвиконавцем. Дисертантом особисто уточнено основні ланки етіопатогенезу ОСД, визначено алгоритм обстеження й розроблено комплексні лікувально-профілактичні методи.
Мета дослідження: підвищити ефективність діагностики та комплексного лікування хворих на ОСД на підставі вивчення показників мікроциркуляторного русла шкіри у ділянках ураження, імунологічних та біохімічних порушень.
Завдання дослідження:
- Вивчити клініко-епідеміологічні аспекти ОСД на сучасному етапі.
- Провести комплексну діагностику з обґрунтуванням застосування сучасних біохімічних та імунологічних методів дослідження для подальшого вивчення показників імунного та біохімічного гомеостазу у хворих на ОСД.
- Оцінити стан мікроциркуляції ділянок ураження за тепловізійною картиною.
- На підставі оцінки стану метаболічних порушень і динаміки показників імунного статусу хворих у період прогресуючої стадії захворювання розробити алгоритм лікувально-профілактичної тактики при ОСД.
- Провести порівняльну оцінку ефективності результатів застосування різних схем терапії з використанням традиційних лікувальних підходів на основі традиційної базової терапії та запропонованої схеми комплексного лікування хворих на ОСД.
Об`єкт дослідження: ОСД.
Предмет дослідження: патогенетичні й клінічні особливості, діагностика, імунний статус, лікування, профілактика та тактика ведення хворих на ОСД.
Методи дослідження: клінічні (постановка діагнозу, визначення ступеня тяжкості перебігу дерматозу, контроль ефективності лікування); інструментальні (тепловізійна візуалізація осередків); біохімічні (визначення глікозоаміногліканів (ГАГ) у сироватці крові, оцінка колагенолітичної активності (КЛА), дослідження еластази у сироватці крові); імунологічні (визначення вмісту автоімунних антитіл, визначення концентрації та константи циркулюючих імунних комплексів (ЦІК), визначення рівня субпопуляцій лімфоцитів); статистичні.
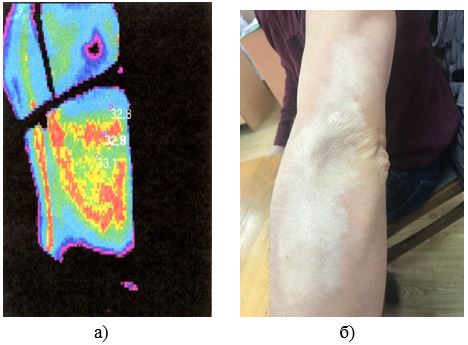
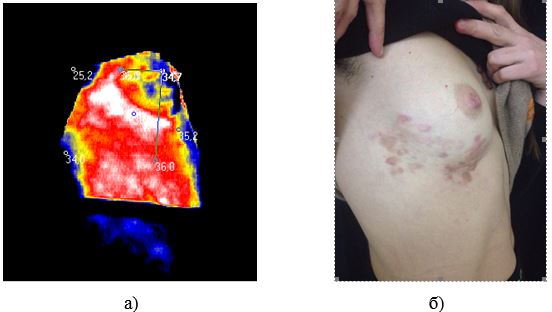
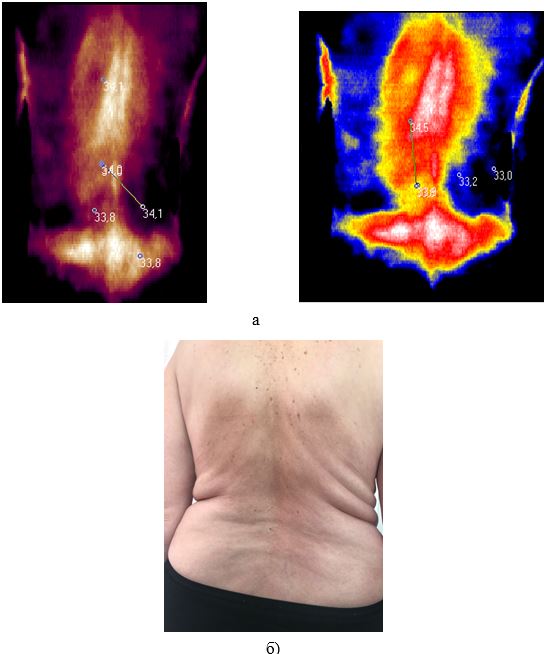
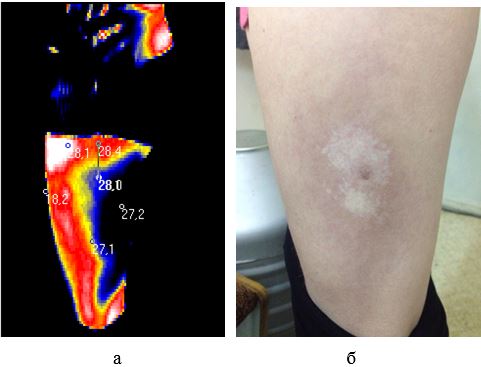
Наукова новизна отриманих результатів. Вперше дано тепловізійну оцінку стадій ОСД.
Доведена можливість діагностики прогресуючої стадії захворювання на доклінічному етапі.
Оцінено стан метаболічних порушень у хворих на ОСД у період прогресуючої стадії захворювання, а також надано характеристику динаміки показників імунного статусу у процесі лікування.
Обґрунтовано доцільність включення у терапевтичний комплекс засобів, що поліпшують реологічні властивості крові, неоколагеногенез та мають антигіпоксичну та антиоксидантну дію.
Доведено можливість оцінки ефективності лікування хворих на різні форми та стадії ОСД шляхом визначення в сироватці крові активності еластази, КЛА та накопичення ГАГ.
Практична значимість отриманих результатів. Розроблено метод комплексного лікування хворих на ОСД, що включає поряд із базовою терапією цитофлавін, який є природнім метаболітом організму, стимулює тканинне дихання та є метаболічним енергокоректором, а також тіотриазолін з антиоксидантною та мембраностабілізуючою дією.
Розроблено метод тепловізійної діагностики загострень ОСД на доклінічному етапі, а також метод оцінки ефективності лікування.
Запропоновано спосіб оцінки ефективності лікування, в основу якого покладено визначення кореляційних зв’язків між динамікою активності еластази, КЛА (за оксипроліном) та вмістом ГАГ у сироватці крові при ОСД (патент України на корисну модель № 109591 від 25.08.2016).
Основні положення дисертації впроваджено в практичну роботу КНП «Міський шкірно-венерологічний диспансер № 2» Харківської міської ради, КНП «Міський шкірно-венерологічний диспансер № 1» Харківської міської ради, КНП Харківської обласної ради «Обласний клінічний шкірно-венерологічний диспансер №1», КП «Рівненський обласний шкірно-венерологічний диспансер» Рівненської обласної ради, а також у навчальний процес кафедри дерматовенерології та ВІЛ/СНІДу Харківської медичної академії післядипломної освіти.
Особистий внесок здобувача. Ідея дисертаційної роботи, обґрунтування мети, завдань і способів їх вирішення належать автору. Автором особисто проведено аналіз вітчизняної та зарубіжної літератури з проблеми, інформаційний пошук, набір клінічного матеріалу, вибір і обґрунтування методів дослідження, статистичну обробку отриманих даних.
Автор самостійно провів обстеження, лікування, проаналізував і систематизував отримані результати, розробив і впровадив способи і пристрої для діагностики та лікування хворих зазначеної категорії.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Дисертантом не були використані результати та ідеї співавторів публікацій. Конфлікту інтересів немає.
Апробація результатів дисертації. Основні положення дисертації повідомлені та обговорені на XIII Міжнародній науковій конференції студентів та молодих вчених «Актуальні питання сучасної медицини» (Харків, 2016); науково-практичній конференції молодих вчених з міжнародною участю, присвяченій 25 річниці від заснування Національної академії медичних наук України «Новітні впровадження молодих вчених в сучасній дерматовенерології» (Харків, 2018); науково-практичній конференції лікарів дерматовенерологів та косметологів Харківської області з міжнародною участю «Актуальні питання дерматології, дерматовенерології, косметології, венерології, ІПСШ та інших соціально-небезпечних хвороб» (Харків, 2018); науково-практичній конференції з міжнародною участю «Питання профілактики, сучасна діагностика та інноваційні методи терапії в дерматовенерології» (Харків, 2018).
Публікації. За темою дисертації опубліковано 10 наукових праць, з них у виданнях, що рекомендовані ДАК України – 6 (5 – самостійно); серед них 6 – у виданнях, які входять до міжнародних наукометричних баз даних, 1 – у науковій монографії, тез – 2, отримано 1 патент України на корисну модель.
Структура і обсяг дисертації. Дисертація складається зі вступу, огляду літератури, чотирьох розділів власних досліджень, аналізу та обговорення отриманих результатів, висновків, рекомендацій і двох додатків. Робота, яку викладено на 197 сторінках тексту комп’ютерного набору, містить 38 рисунків і 33 таблиці. Список використаних джерел включає 215 джерел, з них 62 – кирилицею і 153 – латиницею.
РОЗДІЛ 1
СУЧАСНІ АСПЕКТИ ЕТІОЛОГІЇ, ПАТОГЕНЕЗА, ДІАГНОСТИКИ
І ТЕРАПІЇ ОБМЕЖЕНОЇ СКЛЕРОДЕРМІЇ (ОГЛЯД ЛІТЕРАТУРИ)
1.1 Становлення проблеми, структура, відносна кількість та класифікація обмеженої склеродермії
Склеродермія – системне прогресуюче ураження СТ із переважанням фіброзно-склеротичних і судинних порушень. ОСД (син.: морфеа) – хронічне захворювання СТ, яке характеризується ущільненням шкіри і підшкірної жирової клітковини внаслідок підвищення щільності колагену, є одним з найчастіших захворювань шкіри і, за даними багатьох дослідників, залишається однією з актуальних проблем сучасної дерматології [31, 58, 108, 159, 169, 211].
У декларації міжнародної конференції «Споріднені групи системних хвороб сполучної тканини: визначення статусу та менеджмент на основі міжнародних стандартів» (Київ, березень 2018) ОСД розглядається як мультифакторіальне захворювання з полігенним типом успадкування, в розвитку якого велике значення, більшою мірою, мають імунні та судинні порушення, що стосуються клітинної ланки імунітету, за типом облітеруючого ендартеріоліту з поширеними вазоспастичними змінами, які розвиваються переважно в шкірі та підшкірній клітковині [53, 181].
Значимість її зростає у зв’язку з постійним зростанням кількості хворих даної категорії дерматозів [30, 63, 169, 173].
Поширеність ОСД у світі мала тенденцію до стійкого збільшення протягом всього ХХ і має цю ж тенденцію на початку ХХІ століття, і буде неухильно зростати надалі, особливо кількість хворих на ОСД, що підлягають госпіталізації у профільні стаціонари [84, 94, 109, 122, 158, 170].
За статистикою ВООЗ, у розвинутих країнах світа 400 000 із 10 млн. людей страждають на ОСД [59, 69, 83].
За даними МОЗ України, як і в усьому світі, в останні роки відзначається тенденція до зростання захворюваності на ОСД. Так, тільки за останні 4 роки захворюваність на ОСД у середньому збільшилася з 405,2 до 460,3 хворих на 100000 населення і до 2013 року становила 455,8 випадків на 100000 населення. Захворюваність на ОСД становить у середньому від 1-2 до 33,5 випадків на 100000 населення. ОСД складає 0,3–1,0 % у загальній структурі дерматологічної захворюваності. В Україні щороку відзначається 2,0-2,7 нових випадків ОСД на 100 000 популяції на рік [55, 56].
За останнє десятиріччя істотно розширилися уявлення про захворювання СТ, серед яких за частотою друге місце посідає склеродермія [27, 102]. Переважно вражаються особи середнього віку, тенденція до хронічного рецидивуючого перебігу нерідко призводить до втрати працездатності та надає проблемі соціального значення. Увага дослідників прикута до цієї групи хвороб у зв’язку з недостатньою вивченістю патогенезу, зокрема механізмів розвитку імунних і мікроциркуляторних розладів, молекулярно-клітинних основ фіброзоутворення і склерозу [32].
ОСД характеризується системним прогресуючим ураженням СТ з переважанням фіброзно-склеротичних і судинних змін за типом облітеруючого ендартеріїту з поширеними вазоспастичними розладами [42, 130].
Здебільшого це захворювання пов’язане з порушенням обміну речовин на фоні дисфункції нейроендокринної та імунної систем, включаючи спадковий характер і навіть остеомієліт [85, 167]. Захворювання зустрічається у всіх вікових групах – від немовлят до людей похилого віку, але найчастіше в найбільш працездатному віці – 18-52 років, що і визначає медико-соціальну значимість ОСД [52, 57, 88, 118].
Системна і обмежена склеродермія є проявами єдиного своєрідного автоімунного патологічного процесу, що підтверджується односпрямованістю метаболічних порушень, патогістологічними змінами шкіри при цих формах захворювання, а так само випадками переходу локалізованого процесу в системний [34, 51, 168].
Незважаючи на багаторічну історію вивчення даної патології, єдиної точки зору на механізм розвитку ОСД до теперішнього часу немає. Не встановлено етіологію ОСД, недостатньо зрозумілі основні патологічні механізми захворювання і залишаються дискутабельними питання взаємозв’язків між її обмеженою та системною формами [74, 113].
У той же час немає сумніву, що ОСД – це багатокомпонентна проблема, основу якої складають взаємодія зовнішніх факторів і генетично обумовлена схильність до захворювання. Розвиток ОСД пов’язують із травмами, охолодженням, вібрацією, інфекцією, впливом кремнієвого пилу, хлорвінілом, блеоміцином, серотонінвмісних препаратів, силіконових матеріалів та після радіотерапії на тлі раку грудей [117, 120, 166].
Особливу увагу привертають групи ретровірусів і герпес-вірусів із властивою їм схильністю до персистенції, можливістю латентних і ендогенних форм, активація або експресія яких обумовлені впливом різних хімічних, біологічних та інших факторів [14, 125, 163].
Існує кілька загальновизнаних теорій виникнення склеродермії. Можна вважати, що різноманітні ендокринні, метаболічні, неврологічні (зокрема міопатичні), генетичні патологічні стани, поєднуючись із шкідливою дією зовнішніх факторів, призводять до формування патологічних змін, характерних для ОСД. Таким чином, більшість вітчизняних і зарубіжних дослідників визнають мультифакторну природу виникнення хвороби [72, 107, 140, 200].
Умовно можна виділити дві групи факторів: екзогенні та ендогенні (вроджені та набуті). Безсумнівно, що екзогенні фактори відіграють свою негативну роль щодо дебюту склеродермії. До них, в першу чергу, відносять: травми, в тому числі опіки, післяопераційні рубці, інфекційні агенти, фізичні дії, лікарські препарати та хімічні речовини [14, 112, 201, 203].
Важливою ланкою патогенезу захворювань СТ є розлади мікроциркуляції, загальні закономірності якої представлені при ОСД порушеннями тканинного кровотоку, проникності, транскапілярного обміну, гемостазу та реологічних властивостей крові. Каскадні порушення мікроциркуляції характеризуються деструкцією ендотелію мікросудин, редуплікацією базальних мембран капілярів, інтимальною проліферацією гладком`язових клітин із гіперпродукцією колагену (тип III) і збільшенням схильності до вазоконстрикції, внутрішньосудинних змін у вигляді агрегації клітинних елементів крові та ін. [21, 156].
У системі мікроциркуляції розігруються імунопатологічні, сполучнотканинні та інші реакції із залученням судинної стінки і прилеглих тканин. Виявлені певні морфологічні відмінності залежні від активності патологічного процесу, проте при кожному захворюванні генез і характер ураження судин суттєво відрізняється [1, 10, 109].
В останні роки багато дослідників розглядають вірусну теорію як найбільш значиму в розвитку різних автоімунних процесів [114].
У даний час ініціюючим чинником у розвитку ОСД вважають пошкодження ендотелію, яке може бути спричинене прямим або непрямим впливом антиендотеліальних антитіл, здатних активувати експресію молекул адгезії ендотеліальними клітинами (циркулюючі молекули міжклітинної адгезії (ICAM-1), молекули адгезії судинного ендотелію (VCAM), Е-селектин) [138]. На початкових етапах патологічного процесу в шкірі хворих на ОСД виявляється периваскулярний інфільтрат, на тлі якого в мікросудинній системі відбуваються функціональні та структурні зміни з найбільш вираженим ураженням судин сосочкового шару епідермісу. У пацієнтів з ОСД на поверхні ендотеліальних клітин і фібробластів виявлено підвищення експресії молекул ICAM-1 на 25 %, тільки на поверхні ендотеліальних клітин – VCAM-1 на 19 % [87].
Синтез ICAM-1, VCAM і Е-селектину посилюється під впливом цитокінів та клітинних медіаторів, інтерлейкінів (ІЛ) -1, -4 та фактора некрозу пухлини (ФНП) α, продукція яких при ОСД змінена. Ймовірно, в основі ініціації процесу лежить судинна мікротравма, яка спричиняє активацію ендотеліальних клітин, дисфункцію та порушення капілярної проникності [174, 193].
Одночасно розвиваються внутрішньосудинні зміни: агрегація і адгезія тромбоцитів, активація плазмових факторів VII і VIII, вивільнення вазоактивних амінів, гіперкоагуляція, мікротромбози, що підсилюють локальну ішемію. Активізовані при «коагуляційному каскаді» медіатори підсилюють деструкцію ендотелію, підтримуючи цикл пошкодження і наступної репарації судинної стінки з редуплікацією базальних мембран, інтимальною проліферацією гладком`язових клітин, а колаген, що знову надходить у циркуляцію, сприяє розвитку гемореологічних та імунних порушень. Розвивається характерна склеродермічна мікроангіопатія, органічно пов’язана з патологією метаболізму СТ [10, 128].
Участь імунних механізмів у розвитку системних захворювань СТ уявляється незаперечною. Зміни в системі взаємодії імунокомпетентних клітин, що призводять до активації В-лімфоцитів і гіперпродукції автоантигеноспецифічних при ОСД, є одними з найбільш важливих механізмів розвитку автоімунних порушень [14, 212].
Надмірна активація В-лімфоцитів може виникати при підвищенні активності Т-хелперів, дефіциті Т-супресорів, розладах антиідіотипової регуляції (системи придушення активності утворення антитіл), порушеннях у підсилюючих системах, наприклад, у системі комплементу. У разі автоімунних хвороб В- і Т-лімфоцити стають автоагресивними, надмірно реагують на будь-який, навіть неспецифічний стимул, а також набувають властивість реагувати з автоантигенами.
У хворих на ОСД виявлено широкий спектр різноманітних порушень клітинного та гуморального імунітету, таких як зниження кількості циркулюючих Т-лімфоцитів при нормальному рівні В-лімфоцитів, дисбаланс субпопуляцій Т-клітин за рахунок зменшення кількості супресорних клітин, дисрегуляція в системі Т-хелперів I і II порядку, підвищення експресії окремих фіброгенових цитокінів та ін. У хворих на ОСД спостерігається зменшення вмісту CD3+-клітин, дисбаланс CD4+, CD8+, CD16+ на тлі активації та підвищеної схильності лімфоцитів крові до апоптозу, зменшення кількості молекул клітинної адгезії [21, 56].
Дослідженнями останніх років встановлено, що Т-лімфоцити можуть впливати на процеси запалення та фіброзоутворення як за допомогою міжклітинних взаємодій, так і шляхом синтезу цитокінів, що змінюють функціональну активність клітин [132]. Цитокіни відіграють важливу роль у розвитку ОСД, є основними медіаторами імунної відповіді, здебільшого визначаючи його напрямок. Низка прозапальних цитокінів (ІЛ-1, -2, -6, -8) має фіброзогенну дію і відображає активність проліферативних процесів [56, 155].
Показано, що ІЛ-4 регулює проліферацію фібробластів, експресію генів і синтез компонентів екстрацелюлярного матриксу [117]. При ОСД спостерігається збільшення вмісту цитокінів (ІЛ-1β, -2, -6, -8, -10, -17), ФНП α та їх зв’язок із клінічними проявами хвороби [21]. У сироватці крові хворих на ОСД виявлено збільшення продукції імуноглобуліну G, ЦІК, кількості клітин із рецепцією CD25+ і HLA-DR при посиленому синтезі прозапальних і імунорегуляторних цитокінів – ІЛ-2, -4, -6, -10, ФНП α на тлі зниження вмісту CD3+, CD4+, CD54+ і CD25+/CD95+ [21, 55, 56].
Завдяки вивченню хромосомного апарату людини були виділені деякі генетичні фактори схильності до склеродермії, зокрема виявлено поєднання певних антигенів із системою тканинної гістосумісності людини (HLA): HLA‑A9, В8, В35, DR1, DR3, DR5, DR11, DR52 і С4а, які варіюють у різних популяціях. Існує думка, що односторонній розподіл і ураження по лініях Блашко із певною генетичної мозаїчністю свідчать про те, що нерідко лінійна склеродермія і, можливо, іноді багатоосередкова її форма можуть бути пов’язані зі шкірною мозаїчністю. Велику наукову і практичну значимість представляють встановлені асоціації між специфічними для склеродермії автоантителами, генетичними маркерами і певними клінічними характеристиками захворювання [17, 137].
Так, антицентромірні антитіла поєднуються з маркерами HLA DR1, DR4 осередковим ураженням шкіри, легеневою гіпертензією і хронічним перебігом, а антитіломірні антитіла – з DIG, DR5, DR7, дифузним ураженням шкіри, фіброзом легень і швидкопрогресуючим перебігом ОСД. Антитіла до рибонуклепротеїну частіше зустрічаються при підгострому перебігу і перехресних формах ОСД. Виявлені клініко-імуногенетичні асоціації дозволяють припускати, що носійство певних антигенів HLA привертає до продукції властивих ОСД автоантитіл і формування клінічних синдромів та субтипів захворювання [105].
Безсумнівною є роль ендокринних факторів у розвитку ОСД. Порушення функції ендокринної системи можна віднести до ендогенних факторів розвитку ОСД [14]. Підтверджують цей факт виявлені у хворих клінічні та морфологічні зміни щитоподібної залози, порушення її секреторної функції, а також взаємозв’язок з іншими ендокринопатіями (цукровий діабет II типу, дифузний нетоксичний зоб, аденома гіпофіза) [90]. Деякі ендогенні стани (менопауза, вагітність) також можуть бути тригерними факторами ОСД [89].
Факт більш високої захворюваності жінок деякі вчені пояснюють наслідком статевих гормональних відмінностей. Передбачається провідна роль дисгормональних порушень у системі гіпофіз-наднирники-яєчники у хворих на склероатрофічний ліхен [127]. Для дівчаток у зв’язку з низьким рівнем естрогенів характерні більш пізні терміни статевого дозрівання, менструальна дисфункція. Дані про зміни гормональних показників у хворих на захворювання СТ суперечливі.
У свою чергу до фізичних факторів, які можуть при певних обставинах провокувати виникнення захворювання, можна віднести: переохолодження (обмороження); перегрівання; вібрацію; сонячну інсоляцію; іонізуючу радіацію. Ця теорія підтримується локалізацією ОСД у межах поля випромінювання і переважно в ділянках, які отримують більш високі дози опромінення, при різних супутніх захворюваннях [116]. У літературі зустрічаються дані про лікарські препарати і вакцини як можливі причини виникнення ОСД [121].
ОСД нерідко відносять до групи так званих «хвороб цивілізації». Тому до набутих чинників відносять порушення з боку нервової системи, наприклад, психоемоційний стрес [115].
На сьогоднішній день існує безліч варіантів класифікацій ОСД. Описано різні патоморфологічні аспекти різних форм склеродермії [78, 133]. Виділяють бляшкову, лінійну, генералізовану, глибоку, пансклеротичну, комбіновану форми захворювання. Для кожної форми характерна еволюція патологічного процесу з чергуванням стадій запалення, фіброзу (склерозу) та атрофії шкіри, а при ОСД можливому ураженню підлягають м’язи, кістки і внутрішні органи (зокрема, у дітей), що призводить згодом до органічних (виражені атрофії, деформації, контрактури), функціональних, косметичних і психологічних порушень [67, 126, 131, 149].
Згідно з міжнародною класифікацією хвороб X перегляду розрізняють атрофічні ураження шкіри у вигляді склеро-атрофічного ліхена, атрофодермії Пазіні-П’єріні і окремо – ОСД. Однак найбільш повна класифікація, що відповідає сучасним уявленням (доповнена і перероблена), з урахуванням усіх відомих факторів етіології, патогенезу, клінічних ознак захворювання запропонована С.І. Довжанським (1979), яка представляється найбільш прийнятною для клінічної практики.
ОСД є характерним представником групи хвороб СТ автоімунної природи зі складним переплетенням гіпотетичних і вже відомих етіологічних і патогенетичних факторів: генетичних, імунологічних, спадкових та набутих порушень фіброутворення, мікроциркуляції та ін. [79].
Відсутність вичерпних даних про участь імунних механізмів у розвитку системних захворювань СТ при ОСД диктує необхідність проведення подальших досліджень цього питання. Потребують комплексного вивчення при різних проявах ОСД зміни в системі взаємодії імунокомпетентних клітин, що призводять до активації В-лімфоцитів і гіперпродукції автоантигеноспецифічних антитіл, є одними з найбільш важливих механізмів розвитку автоімунних порушень і надають вплив на перебіг дерматозу.
1.2 Патогенетичні особливості обмеженої склеродермії
Незважаючи на досить велику кількість досліджень, етіологія і патогенез ОСД залишаються до кінця нез’ясованими. На сьогоднішній день ОСД розглядається як хронічне захворювання, що супроводжується порушеннями клітинного імунітету, мікроциркуляції і підвищеним колагеноутворенням у результаті складної взаємодії пошкодження і дисфункції ендотеліальних клітин, запалення, автоімунних реакцій і активації фібробластів [207].
Одним з фундаментальних досліджень, що можуть бути проведені для уточнення деяких ланок патогенезу захворювання, є імунологічні. Зустрічаються поодинокі роботи, що дозволяють простежити імунологічні зміни у крові та шкірі, морфофункціональні порушення і процеси колагеноутворення при кожній стадії ОСД, але ці дані суперечливі та потребують поглибленого вивчення [21, 55, 56].
Враховуючи, що більшістю клініцистів визнається провідна роль імунних механізмів у патогенезі ОСД, представляється досить перспективним напрямок з вивчення пуринового метаболізму при цих захворюваннях, так як доведено, що окремі пуринові метаболіти, впливаючи на дозрівання і проліферацію імунокомпетентних клітин – лімфоцитів, значною мірою впливають на імунологічну реактивність і спрямованість імунологічних реакцій [20].
Актуальну медико-біологічну проблему являє собою дисфункція регуляторних систем тканинно-специфічного контролю процесів клітинного метаболізму і стану клітинних мембран як найважливіших компонентів гомеостазу, що відбуваються при численних захворюваннях шкіри, у тому числі при патологічних станах, обумовлених розвитком ОСД. На думку низки авторів, ОСД не може розвиватися в організмі, в якому система СТ зберегла свою реактивність. При цьому формування патологічного процесу відбувається завжди на тлі її пригнічення [204].
На сьогоднішній день не викликає сумніву, що в основі розвитку ОСД полягає порушення функції фібробластів. Фібробласти синтезують велику кількість незрілого колагену. Дія на ендотелій цитотоксичних чинників призводить до ураження дрібних судин. Характерні судинні порушення за типом облітеруючого ендартеріїту з поширеними вазоспастичними змінами, що розвиваються переважно в шкірі та підшкірній клітковині [92].
Порушення сигнального шляху фактора росту пухлини β прийнято вважати основними молекулярними механізмами розвитку фіброзу при склеродермії [178]. При цьому транскрипційні фактори сімейства AP-1 є ключовими сигнальними молекулами шляху фактора росту пухлини β. Вони регулюють експресію гена колагену 1 у фібробластах шкіри, а також стимулюють прогресію клітинного циклу за рахунок модуляції регуляторів клітинного циклу, таких як циклін D1 і циклін E [110]. Також відомо, що гени AP-1, що задіяні в запаленні й контролі клітинного циклу, опосередковано беруть участь у процесах проліферації, морфогенезу, апоптозу і диференціювання клітин [161].
Однак донині дослідження вивчення системи AP-1 як компонента регуляції синтезу колагену на генному рівні при ОСД не проводилося, хоча можна припустити її безпосередню участь у патогенезі склеродермічного процесу. У зв’язку з цим, особливої актуальності набуває оцінка експресії генів в осередках ураження при ОСД, результатом якої може стати поглиблення уявлень про формування і прогресування ОСД і розширення можливостей патогенетично обґрунтованого лікування.
ОСД також притаманні автоімунні патогенетичні фактори. Виявляють антитіла до різних ядерних компонентів, пов’язаних із хромосомами негістонним ядерним білком, а також до центромерів, фібробластів, колагену та ін. [98].
Можна не сумніватися у наявності зв’язку патогенезу склеродермії з порушеннями в імунній системі організму. Оцінка імунного статусу з діагностичною, лікувальною, прогностичною і профілактичною метою у хворих на ОСД залишається надзвичайно актуальним питанням [143]. Проведені численні дослідження імунного дисбалансу при різних формах ОСД. Одні з основних принципів оцінки імунного статусу були закладені Р.В. Петровим зі співавт. ще в 1984 році. Вони полягають у визначенні трьох основних компонентів імунітету (фагоцитозу, Т- і В-систем) на двох рівнях: кількісному і функціональному [93].
Для ОСД характерним є порушення взаємозв’язку між лімфоцитами і нейтрофілами, при цьому відзначається зниження рівня Т-лімфоцитів при незмінному або підвищеному рівні В-лімфоцитів. У наукових працях С.В. Лапина, А.А. Тотоляна (2010); S. Bhattacharyya, J. Varga (2015) відзначено зміну Т-клітинного імунітету зі збільшенням хелперної активності при зменшенні супресорної, зниження активності природних клітин-кілерів у хворих на ОСД [34, 76]. Такі зміни сприяють підвищеному виробленню цитокінів, включаючи ІЛ-2, 4 і 6, що в свою чергу призводить до подальшої активації Т-клітинної ланки імунітету.
Досліджено патогенетичне значення змін гуморального ланки імунітету у пацієнтів з ОСД. При цьому відзначено зміни з боку сироваткових імуноглобулінів і інтерферонового статусу у пацієнтів з ОСД. Визначено автоантитіла до нативних колагенів людини. Результати вивчення anti-topo II alpha-автоантитіл свідчать про їх провідну роль при ОСД і відміну від anti-topo I антитіл при системній склеродермії [195].
Якщо для існування будь-якого здорового організму необхідна відсутність імунної відповіді на власні органи і тканини, що містять автоантигени, то ОСД прийнято розглядати як своєрідне автоімунне захворювання, в основі якого полягають автоімунні й запальні реакції на антигени. Між тим, дотепер відповідальні за ініціацію автоімунної відповіді антигени при ОСД не відомі, також як практично при всіх автоімунних захворюваннях [179]. Порушення мікроциркуляції, імунітету та фіброзоутворення взаємодіють на рівні основних клітинних (імунокомпетентні клітини ендотелію, фібробласти, клітини крові) та рецепторно-лігандних систем (молекули адгезії, фактори росту, інтерлейкіни та ін.) [192].
Слід підкреслити, що діагностика ОСД визначається рівновагою між антизапальними і прозапальними чинниками, які сприяють прогресу захворювання. Останнім часом в якості таких метаболічних медіаторів імунної системи розглядаються цитокіни, серед яких ІЛ-1, -4, -6, -8, -10, ФНП a та ін. [178, 193].
У цьому аспекті великий інтерес представляє вивчення протизапальних цитокінів, що мають ефект, який може бути спрямований на обґрунтування імунотерапевтичних підходів у лікуванні ОСД, що базуються на гальмуванні або блокаді біологічної активності цитокінів та їх рецепторів. У науковій літературі є окремі дані, що свідчать про те, що цитокіни знаходяться безпосередньо в центрі запалення, виступають первинними активаторами генів, які включаються при запаленні [53].
Аналіз досліджень показує, що вивчення кооперативної взаємодії анти- і прозапальних цитокінів у хворих на ОСД, є актуальною науковою проблемою при обґрунтуванні імунотерапевтичного впливу в комплексному лікуванні пацієнтів із ОСД і диктує необхідність проведення подальших досліджень цього питання.
1.3 Структурно-метаболічний стан сполучної тканини у хворих на обмежену склеродермію
СТ становить близько 50 % від маси тіла людини. Вона виконує опорну, регуляторну, механічну, транспортну, зв’язуючу, захисну, імунологічну, дренажну, пластичну, кофакторну і багато інших функцій в організмі. Її особливостями є: мала кількість видів (фібробластів, хондробластів, остеобластів, кератобластів), переважання фібрилярних білків (колагену, еластину, фібронектину), міжклітинного матриксу, ГАГ та протеогліканів (протеоглікани містять 5 % білка і 95 % ГАГ) [187].
ГАГ СТ представлені: гіалуроновою кислотою, хондроїтин-сульфатами, кератан-сульфатами і дерматан-сульфатами, гепаран-сульфатами і гепарином. Основним білком СТ є фібрилярний білок колаген, який продукується фібробластами і має амінокислотну послідовність у своєму складі: 30 % гліцину, 20 % проліну і оксипроліну, 10 % аланіну, 1 % оксилізину і 40 % інших амінокислот [146]. При старінні колагену утворюється велика кількість поперечних зв’язків, у зв’язку з чим він і набуває більш жорсткої структури. Катаболізм колагену відбувається під впливом ферменту колагенази, активність якої може істотно змінюватися в умовах зростання і розвитку організму [153]. Важливим білком СТ є також фібрилярний білок еластин, який продукується фібробластами, здатний до зворотного розтягування у вертикальному і горизонтальному напрямку, що спостерігається у процесі зростання і розвитку органів і тканин. Амінокислотний склад еластину включає 30 % гліцину, 21 % аланіну, 13 % валіну, 10 % лейцину, 10 % лізину і 1 % оксипроліну. Катаболізм еластину здійснюється під впливом еластази. Відомо, що багато патологічних станів і захворювань супроводжуються структурно-метаболічними порушеннями з боку СТ. До них можуть бути віднесені ревматизм, ревматоїдний артрит, різні види склеродермії, дерматоміозит, вузликовий періартрит та ін. [183, 184].
Джерелом КЛА плазми крові можуть бути фермент колагеназа та інші протеази тканин і формених елементів крові Показано, що колагеназа відіграє пускову роль у ферментативному розщепленні колагену [209].
СТ відповідає зміною морфологічних особливостей і метаболічною перебудовою основних структурних компонентів при різних впливах факторів зовнішнього і внутрішнього середовища. Різні реакції СТ при ОСД включають зміни морфологічних і цитохімічних властивостей фібробластів, гістіоцитарну реакцію, зміну з боку опасистих клітин, метаболізму всіх клітин СТ, зміну структури і хімічних властивостей міжклітинної речовини СТ, її складу, властивостей, структури і функції базальних мембран, а також зміни в органах кровотворення. Морбідно-лімітуючі функції організму хворих на ОСД пов’язані зі структурними елементами СТ і насамперед із діяльністю макрофагів-резидентів [82].
Резистентність організму як міра ефективності його адаптації до перебігу ОСД багато в чому визначається функціонуванням сполучнотканинних макрофагів. Ці клітини забезпечують стабільність внутрішнього середовища, своєчасно очищаючи його від продуктів розпаду власних тканин, інфекційних агентів та ін. Змінюючи стан функціональної активності макрофагічної системи, вдається модифікувати опірність організму до морбідно-лімітуючих агентів при ОСД. Однак надмірна активація фагоцитів може супроводжуватися метаболічним вибухом, продукцією і секрецією високоактивних нестабільних продуктів відновлення кисню, перетворюючи клітини з ефекторів гомеостазу в індуктори каскаду патологічних процесів. Макрофаги – універсальні ефектори гомеостазу, що працюють як на рівні СТ, так і цілого організму.
Виявлено залежність між активністю гідролітичних і ліполітичних ферментів у макрофагах із підшкірної СТ і рівнем інсуліну в плазмі крові. Активуючий вплив на макрофагічну систему високої температури – відомий факт, який використовується для мобілізації цієї ланки резистентності в онкологічній практиці. Температура до 41 °С активує макрофаги, а вище 42 °С, навпаки, пригнічує їх активність. Введення цеолітів при перегріванні організму знижує реакцію макрофагів підшкірної пухкої СТ на високу температуру. У роботах N. El-Fekih et al. (2009) та T. Gambichler et al. (2011) виявлено, що введення пролактину призводить до збільшення чисельності гістиоцитів, спричиняє активацію гліколізу у фібробластах, макрофагах [145, 189].
У дослідженнях макрофагічної системи низкою дослідників показано, що формування дерматозу призводить до різкого (у 2 рази) збільшення чисельності фагоцитів. Відомо, що глюкокортикоїди гальмують вихід моноцитів у тканини та їх перетворення в макрофаги при запаленні. Високі дози гідрокортизону знижують загальну кількість фібробластів, при цьому зменшується кількість зрілих клітин, що інтенсивно продукують колаген. Встановлено, що під дією гідрокортизону в дозі 10 мг/кг знижується вміст опасистих клітин дерми [176].
Таким чином, СТ активно відповідає морфофункціональною перебудовою своїх структур на патологічні порушення і зміни, забезпечуючи адаптивно-компенсаторні реакції. Особлива роль належить клітинам макрофагічної системи, які можуть бути інструментом для підтримки і відновлення гомеостазу, контролем за якістю формування адаптації до різних форм впливу морбідно-лімітуючих агентів при ОСД [208].
Слід підкреслити, що в патогенезі ОСД виділяють три головних механізми розвитку захворювання: утворення мононуклеарних клітинних інфільтратів, ураження мікроциркуляторного русла, гіперпродукція знову синтезованої СТ. Дані процеси можуть перебігати як послідовно, так і одночасно, призводячи до клінічних та патоморфологічних проявів дерматозу. ОСД характеризується тривалим, хронічним, прогредієнтним перебігом із періодами ремісій і загострень, що спостерігається при всіх так званих автоімунних захворюваннях [151].
Особливості патогенезу ОСД нерозривно пов’язані з порушеннями гомеостазу та морфо-функціональними змінами, які зумовлюють розвиток захворювання. Ці порушення спричиняють неадекватну, а внаслідок цього, непрогнозовану реакцію організму, яка впливає на клінічний перебіг і результати її лікування.
Аналіз і оцінку дисметаболічних розладів гомеостазу при ОСД із позицій індивідуальних особливостей пацієнтів у сучасній літературі висвітлено недостатньо. Наведені відомості свідчать про доцільність їх комплексного вивчення. Усе це визначило ще одне з важливих завдань дослідження.
1.4 Особливості клінічного перебігу та сучасні можливості діагностики обмеженої склеродермії
Рання діагностика ОСД дозволяє не тільки підвищити ефективність лікування і скоротити його терміни, а й реалізувати принцип комплексності та диференціації, що найбільш актуальні в початковій стадії захворювання [134]. Дедалі більше для діагностики ОСД використовують відеокапіляроскопію [165], ехосонографію, еластографію [63, 91, 106, 135], а також магніто-резонансну томографію з болюсним посилюванням [147, 148, 175].
У багатьох країнах успішно застосовують термографічні обстеження для ранньої діагностики та своєчасного лікування різних захворювань. Методика дозволяє визначити поверхневу температуру досліджуваної анатомічної ділянки, зміни якої можуть бути клінічним симптомом патологічного процесу [150].
Термографічне обстеження із застосуванням сучасних термографів є ефективним неінвазивним діагностичним методом різних захворювань. Цей метод діагностики є практично єдиним допустимим при обстеженні дітей і вагітних [15]. Кожне нове покоління термографів розширює діагностичні можливості методу і визначає доцільність його застосування в медичній практиці. Обробка термограм і встановлення діагнозу не представляє особливої складності [157]. Використання дистанційної інфрачервоної термографії як додатковий метод діагностики дозволяє також виявляти низку патологічних змін в організмі людини. Наявність термографа дозволило б лікарю-дерматовенерологу не тільки швидко, без будь-яких наслідків для пацієнта діагностувати патологію шкіри, але й оцінювати динаміку перебігу захворювання, а також ефективність проведеного лікування.
Висипання на шкірі можуть бути поодинокими і множинними. Дані дермоскопії свідчать, що найчастіше зустрічається бляшкова склеродермія, яка характеризується формуванням плями бузкового кольору, центральна частина якої ущільнюється і набуває кольору слонової кістки. По периферії осередку зберігається бузковий віночок. Надалі на цьому місці формується атрофія, можливі дисхромія, телеангіектазії, випадання волосся. На місцях склеродермічних бляшок, особливо в поперековій ділянці, можливе формування атрофодерміі [139].
Я.Ф. Кутасевич (2011) розглядає склеродермію як автоімунне захворювання, при якому в основі порушень полягає взаємодія автоантигенів із лімфоїдними клітинами. При цьому Т-хелпери, активовані екзо- або ендогенними факторами, виробляють лімфокіни, що стимулюють фібробласти [29].
- Makino et al. (2013) вважають, що підвищений рівень колагенових білків, будучи джерелом активної антигенної стимуляції, створює фон, на якому при генетичній схильності реалізуються автоімунні реакції. Виникаюче порочне коло взаємовпливу лімфоїдних і колагенсинтезуючих клітин веде до прогресування фіброзного процесу [199].
При склеродермії спостерігаються різноманітні інші автоімунні порушення: різні автоантитіла, зниження рівня Т-лімфоцитів при незмінному або підвищеному вмісті В-лімфоцитів, зниження функції Т-супресорів при незміненій або підвищеній функції Т-хелперів, зниження функціональної активності природних кілерів [25].
Актуальність вивчення еластину в якості антигену визначається великою поширеністю його в органах і тканинах. Еластази, в свою чергу, становлять інтерес не тільки в якості основних учасників катаболізму еластину, але й як медіатори запальних процесів [1, 136]. Рівновага в системі «еластин – еластаза» визначає фізіологічне функціонування органів і тканин, що містять еластичні волокна. Порушення обміну еластину, поява змінених розчинних ізоформ із подальшим запуском механізмів автоімунітету може обумовлювати причетність досліджуваного біополімера до патогенезу поліорганної патології при системному склерозі [171, 190].
Антитілоутворення до еластину і еластаза при ОСД є не цілком вивченою проблемою. Проведені в цьому напрямку дослідження одиничні і не містять аналізу досліджуваних автоантитіл залежно від характеру перебігу, активності та клінічних форм захворювання [1, 177].
Удосконалення методів ранньої діагностики і диференційної діагностики ОСД є сьогодні пріоритетним напрямком дерматології та не тільки клінічна, але й економічна ефективність і доцільність, що досягають шляхом оцінки ступеня тяжкості дерматозів [46].
Цим вимогам у повній мірі відповідають модифікації імуноферментного методу аналізу (ІФА) з використанням іммобілізованих гранульованих препаратів із магнітними властивостями. Поряд із технічною доступністю метод відрізняє висока чутливість та економічність, що досягається підвищеною стабільністю іммобілізованого біополімера і можливістю регенерації сорбенту [124].
Дослідження діагностично-прогностичного значення рівня антитіл до еластину і еластази і можливих кореляційних зв’язків між цими показниками у хворих на ОСД є перспективним напрямком, здатним підвищити якість діагностики ревматичних захворювань і пролити світло на окремі механізми їх патогенезу. Остаточну діагностику виконують також за допомогою гістологічних досліджень [119].
Аналіз літературних даних вказує на відсутність загальноприйнятої програми і чітких уявлень про високоінформативний діагностичний алгоритм при ОСД. Для поліпшення результатів лікування ОСД необхідна розробка комплексу клініко-інструментальних і клініко-лабораторних диференційно-діагностичних критеріїв ОСД з урахуванням їх патогенетичного обґрунтування. У літературі, присвяченій даній проблемі, ці питання відображені недостатньо повно, що стало приводом для проведення наведеного дослідження.
Усе вищесказане визначає основні напрямки досліджень щодо вдосконалення існуючих та пошуку нових способів діагностики ОСД на підставі сучасних технологій із впровадженням їх у клінічну практику.
1.5 Сучасні принципи терапії обмеженої склеродермії
Лікування ОСД є складним завданням у зв’язку з прогресуючим характером захворювання, розвитком незворотного фіброзу і судинною патологією [81]. В якості засобів базової терапії при ОСД використовують найрізноманітніші засоби: тіолові з’єднання, кетотифен, мадекасол, вазодилататори (компламін і трентал), антагоністи кальцію (ніфедипін), дезагреганти (дипіридамол) та ангіопротектори (продектин), вітаміни групи В, препарати нікотинової кислоти, карнітину хлорид, дипромоній та ін. [96]. Велика кількість підходів до лікування ОСД, що існує у даний час, є недостатньо ефективними і не припиняє прогресуючого обтяження процесу та часто супроводжується небажаними побічними явищами [100, 104].
У зв’язку з розвитком напрямку практичної медицини мікроелементології, постають питання можливого впливу на патогенез ОСД макроелементного дисбалансу, у тому числі магнієвого та цинкового [141]. Так, Я. Ф. Кутасевич та В. В. Савенковою (2010) розроблено диференційований підхід до лікування хворих на ОСД [47].
Найбільш вірогідний механізм впливу дефіциту магнію на СТ – це посилення деградації колагенових та еластичних волокон і полісахаридних ланцюгів гіалуронової кислоти. В якості переносника магнію використовують оротову кислоту, що підвищує клітинну біодоступність катіонів і має низку додаткових переваг. Вплив оротової кислоти на метаболізм СТ обумовлений синтезом піримідинів. При її дефіциті порушується внутрішньоклітинна передача сигналів, підвищується рівень тригліцеридів. Оротат магнію не вступає в реакцію з кислотою шлунка і не виказує послаблюючої дії [13]. Отже, перспективним є використання магнероту, що містить магній та оротову кислоту, в якості макроелементного препарату у хворих на ОСД.
На перших етапах лікування в якості імунодепресивних засобів найчастіше призначають, як і при ОСД, хінолінові препарати (гідроксихлорохін сульфат, хлорохін фосфат і кінакрину гідрохлорид). Одночасно призначають калійвмісні препарати та анаболічні стероїди [103].
Використовують нестероїдні протизапальні засоби (напросин, мотрин, диклоберл та ін.), які стабілізують лізосомні мембрани, опосередковано через пригнічення синтезу пресорних простагландинів [97].
Серед імуномодулюючих препаратів особливо на ранніх стадіях ОСД використовують кортикостероїдні препарати (дексаметазон, преднізолон), хоча думки про доцільність їх застосування суперечливі. Глюкокортикоїди пригнічують більшість імунологічних реакцій, крім того, гальмують синтез ГАГ, колагену та еластину, продукцію колагенази, посилюють синтез інгібіторів протеаз, спричиняють зникнення в епідермісі клітин Лангерганса, а в дермі опасистих клітин, виказують судинозвужуючу та антипроліферативну дію [95].
Системний прийом кортикостероїдів показаний у пацієнтів з розповсюдженим процесом, високим ступенем активності, стан яких потребує негайного полегшення, а також при глибоких формах захворювання із залученням до патологічного процесу фасцій і м’язів. Рекомендують приймати помірні дози кортикостероїдів – 30–40 мг/добу внутрішньо протягом 3–6, а іноді – до 12 тижнів. При тривалих хронічних ураженнях ефективність системних кортикостероїдів незначна. Однак використання системних кортикостероїдів має високий ризик розвитку серйозних побічних ефектів і при їх відміні можливе загострення процесу, тому у хворих розвивається стероїдофобія [162].
Роботами C. C. Mok (2010) в комплексному лікуванні ОСД встановлено високу терапевтичну ефективність імуносупресантів, наприклад, мікофенолату мофетилу [160].
У закордонній літературі є дослідження з вивчення ефективності аналогу вітаміну D3 (кальцитриолу) при системній і місцевій терапії, який за рахунок пригнічення проліферації фібробластів, синтезу колагену та можливого пригнічення активації Т-лімфоцитів зменшує процеси фіброзу при ОСД [196].
При ОСД внутрішньо призначають бичачий колаген типу І по 0,1–0,5 мг щоденно протягом 12 місяців, що зменшує реактивність Т-клітин до колагену людини типу І [191].
Із препаратів антифіброзної дії застосовують лідазу, ронідазу, лонгідазу, що містять гіалуронідазу, яка розщеплює гіалуронову кислоту до глюкозаміноглюкуронової кислоти, збільшує проникність тканин. Проте погляди на ефективність даних препаратів на теперішній час суперечливі [210].
Як препарат антифіброзної дії використовують колхіцин, що пригнічує колагеноутворення, зменшує проліферацію фібробластів, впливає на активність колагенази, має протизапальну дію [197].
Ефективність інтерферону-a- та -g, що використовувалися в якості антифіброзних препаратів, була спростована при проведені подвійних сліпих плацебо-контрольованих досліджень. Однак лікування інтерфероном-g (50 мкг 3 рази на тиждень підшкірно) асоціюється зі стабілізацією стану шкіри, проте покращення може не спостерігатися [66].
У дерматологічній практиці одним з основних засобів лікування хворих на ОСД є використання ампіциліну, що входить до стандарту лікування.
До високоефективних препаратів відносять пеніцилін, продуктом гідролізу якого є Д-пеніциламін, який є антифібротичним засобом, що пригнічує утворення нерозчинного колагену, побічно надає імуносупресивну і протизапальну дію та забезпечує профілактику рецидивів у хворих на ОСД [45].
Точний механізм дії пеніциліну при ОСД нез’ясований. Вважають, що він має сануючий ефект при фокальній інфекції, інгібує утворення нерозчинного колагену, виказує імуносупресивну та судинорозширюючу дію, сприяє деполяризації макроглобулінових комплексів [68]. Обговорюється можливість впливу пеніциліну на фібрилогенез та поперечні зв’язки колагену, а також бореліозну інфекцію [144, 152, 205].
Пеніцилін є препаратом вибору при прогресуючій склеродермії та призначається по 1 млн ОД на добу в 2-3 ін’єкціях, на курс до 15 млн ОД 2-3 курсами з інтервалом між ними 1,5-2 міс.
В.В. Савенкова (2012) в якості базової терапії ОСД пропонує використання пеніциліну G [56]. В іноземній літературі зустрічаються поодинокі роботи, де пеніцилін G використовується як антифібротичний препарат при системній склеродермії, який діє як інгібітор пролілгідроксилази – ферменту, що дозволяє включити пролін і лізин у поліпептидний ланцюг і залучити вільні амінокислотні залишки до синтезу колагену [65].
Можливе використання цитостатичних засобів: метотрексат у дозі (15–20) мг на тиждень (0,5–1 мг/кг ваги). У ревматології механізм дії метотрексату пов’язаний із процесами поліглютамінування і утворення метаболітів, що інгібують «дистальні» фолатзалежні ферменти, та має власну протизапальну дію. Метотрексат впливає на синтез поліамінів і співвідношення CD4/CD8, інгібування функції нейтрофілів, пригнічуючи синтез супероксидних радикалів, фосфоліпази А2, значного спектра цитокінів [64]. На даний момент існує п’ять проспективних незалежних досліджень впливу метотрексату на ОСД. Добрі результати досягнуто при поєднанні низьких доз метотрексату з пульс-терапією глюкокортикоїдами при глибокій ОСД та гемісклеродермії за типом «удар шаблею», а також із мофетилом мікофенолату [99, 214]. Імуносупресія циклоспорином А більш ефективно спрямована проти Т-клітин, вивільнення ІЛ‑2 та інших цитокінів, що було оцінено в декількох відкритих дослідженнях. Однак вказують на часті ускладнення [202].
Антифіброзна терапія посідає головне місце у лікуванні хворих на цю патологію [76]. Використовують Д-пеніциламін, що має багатобічний вплив на метаболізм колагену: втручається в синтез колагену на стадії формування внутрішньомолекулярних зв’язків між молекулами тропоколагену, підтримуючи колаген у розчинній формі, який може бути зруйнований і виведений із сечею. Видаляючи з організму іони міді, Д-пеніциламін виказує інгібуючий вплив на фібробласти і гладком’язові клітини на внутрішньоклітинному рівні. Тому зменшується продукція кислих мукополісахаридів фібробластами. Зазначений препарат виказує імуномодулюючу і цитотоксичну дію. Однак Д-пеніциламін має значну побічну дію: депресія кісткового мозку, протеїнурія, виразка шлунково-кишкового тракту, дисгевзія, пухирчатка, міозит та ін.
Враховуючи, що у хворих на ОСД часто спостерігаються порушення функції печінки та жовчовивідних шляхів, а також прояви синдрому метаболічної інтоксикації, доцільним в якості базової допоміжної терапії є використання гепатопротекторів з вираженими антиоксидантними властивостями: реамберин, емоксипін, мексидол, гіпоксен, полієн, омега-3 та ін. [71, 198]. Привертає увагу новий вітчизняний препарат глутаргін, що в повному обсязі відповідає сучасним вимогам до гепатопротекторів [90].
У сучасній літературі з’являються повідомлення про використання дапсону в якості імуномодулюючого препарату, який стимулює імунну систему, нормалізує загальну кількість лімфоцитів, субпопуляцій CD4 і CD8, імунорегуляторний індекс, підвищує нейтрофільний фагоцитоз на фоні антибактеріальної, протизапальної, протисвербіжної й антиалергічної дії. За рахунок використання в капсулі має пролонговану дію. Терапевтичний ефект зберігається до 72 годин. У терапії другого вибору при ОСД, що включає еферентні методи лікування, найбільше поширення набули гемосорбція, імуносорбція, плазмаферез, ентеросорбція, а також екстракорпоральна фотохіміотерапія [38, 54, 75, 80].
Фізіотерапія включає електрофорез або фонофорез лідази, гідрокортизону, сульфату цинку, гіпербаричну оксигенацію, низькоінтенсивне лазерне опромінення, світлотерапію, PUVA-терапію, сірко-водневі, радонові ванни, аплікації парафіну, ізокериту або лікувальних грязей, масаж (звичайний підводний лімфодренаж), місцеву анестезію, а також активні фізичні вправи [75, 86, 101, 111, 154, 164, 194].
Особливе місце в лікуванні ОСД відводиться голкорефлексотерапії, що сприяє інтенсифікації дифузії кисню в гіпоксичні ділянки тканин [215].
Терапевтичний підхід при лікуванні ОСД залежить від клінічної форми, поширеності та стадії процесу, локалізації, віку, супутньої соматичної патології. У комплексній терапії використовуються антибіотики, препарати, що містять гіалуронідазу, препарати, що покращують мікроциркуляцію, вітаміни, імуномодулятори, ферменти [188, 206].
Слід підкреслити, що основною метою лікування ОСД є уповільнення прогресування хвороби, досягнення стабілізації процесу, а потім і регресу клінічної картини. Велика кількість підходів і методів, що існують у даний час для лікування ОСД, недостатньо ефективні, часто супроводжуються небажаними побічними явищами [73, 182]. Залежно від виявлення у хворих на ОСД тих чи інших ендокринних порушень призначається відповідна гормональна терапія, яка може мати імуномодулюючу дію при ОСД. Гормональна репарація гомеостазу за допомогою замісної гормональної терапії передбачає: зміну курсу патологічних станів у дермі і збільшення ефективності основної (базової) терапії обмежених форм склеродермії та відкриває нові можливості вдосконалення методів терапії жінок з ОСД у пре- і постменопаузальному періодах.
З огляду на значимість порушень периферичного кровообігу в патогенезі склеродермії призначають ангіопротектори для поліпшення мікроциркуляції та трофічних процесів в уражених осередках, сприяючи вирішенню патологічних змін шкіри. З цієї групи використовують: ксантинолу нікотинат (по 1-2 таблетці 2-3 рази на день), пентоксифілін (по 0,05-0,1 г 2-3 рази на день), апресин (по 0,005-0,015 г 2-3 рази в день). Один з цих препаратів приймають курсом тривалістю 3-4 тижні.
У зовнішній терапії ефективні диметилсульфоксид, солкосерил (желе і мазь), 2 % гель Троксевазин; мазь Вулнузан. Добрий терапевтичний результат одержано при застосуванні артрозилену і фітостимуліну. Крім того, серед засобів для зовнішнього застосування ефективні актовегін (5 % мазь, желе), 5 % пармідинова мазь. При лікуванні форм ОСД із локалізацією на геніталіях і в аногенітальній ділянці ефективним є застосування такролімусу і пімекролімусу.
Не викликає сумнівів ефективність застосування релаксину – поліпептиду, що утворюється під час вагітності; вазодилататорів – блокаторів кальцієвих каналів – ніфедипіну, блокаторів ангіотензинперетворюючого ферменту – каптоприлу, простагландинів – ілопросту, енопростенолу; імуносупресивних препаратів – метотрексату, циклофосфаміду. Описано виражений вплив вазопростану на мікроциркуляцію у хворих на різні форми склеродермії.
Широке застосування гормони кори надниркових залоз отримали завдяки своїй здатності затримувати розвиток реактивної СТ, яскраво вираженим протизапальним і антиалергічним властивостям. Кількість показань до їх призначення досягла декількох сотень і не має в цьому відношенні аналогів у медицині, але й кількість можливих ускладнень при їх застосуванні настільки ж велика [210]. У даний час широко застосовують лідазу і ронідазу, що містять гіалуронідазу. Специфічним субстратом гідролітичного ферменту тестикулярної гіалуронідази вважається основна речовина СТ – ГАГ: гіалуронова кислота, хондроїтин, хондроїтин-4-сульфат, хондроїтин-6-сульфат, які є цементуючою речовиною СТ. Під впливом гіалуронідази в результаті деполімеризації ГАГ втрачають свої основні властивості: в’язкість, і, як наслідок, збільшення проникності тканинних бар’єрів, підвищення еластичності рубцевої тканини; в клініці ця властивість проявляється у сплощенні рубців, збільшенні обсягів руху суглобів, зменшенні контрактур і попередженні їх формування; гіалуронова кислота втрачає здатність зв’язувати воду, і, внаслідок цього, відбувається полегшення руху рідини в міжклітинному просторі, зменшення набряклості тканини, розсмоктування гематом; хондроїтин-сульфати при деполімеризації втрачають здатність зв’язувати іони металів, а деполімерізація ГАГ – основної речовини СТ – перешкоджає утворенню колагенових волокон.
Лікувальний ефект пов’язаний із властивостями гіалуронідази покращувати мікроциркуляцію в тканинах і сприяти припиненню склерозу в осередках. Гіалуронідаза – це фермент, специфічним субстратом якого служить гіалуронова кислота. Остання є мукополісахаридом, до складу якого входять ацетилглюкозамін і глюкуронові кислоти. Гіалуронова кислота має високу в’язкість, її біологічне значення полягає головним чином у тому, що вона є цементуючою речовиною СТ. Гіалуронідаза, або «фактор поширення», спричиняє розпад гіалуронової кислоти до глюкозаміну глюкуронової кислоти і тим самим зменшує її в’язкість. Гіалуронідаза викликає збільшення проникності тканин і сприяє руху рідин у міжтканинних просторах. Гіалуронідаза міститься в різних тканинах організму. Співвідношенням системи гіалуронова кислота – гіалуронідаза значною мірою регулюється проникність тканин.
Протизапальну дію різних лікарських засобів (саліцилатів, похідних піразолону, адренокортикотропного гормону, глюкокортикоїдів, стероїдів та ін.) частково пов’язують з їх здатністю зменшувати активність гіалуронідази. Навпаки, дія деяких речовин, що викликають підвищення проникності (наприклад, бджолиної та зміїної отрут), пов’язана частково з наявністю в них гіалуронідази. Дія гіалуронідази має оборотний характер. При зменшенні її концентрації в’язкість гіалуронової кислоти відновлюється.
Таким чином, гіалуронідаза може застосовуватися для тимчасового зменшення в’язкості гіалуронової кислоти. Препарати, що містять гіалуронідазу (лідаза і ронідаза), отримують із сім’яників великої рогатої худоби. Лідазу вводять внутрішньом’язово по 1 мл із 32-64 УО в 1 мл 0,5 % розчину новокаїну. На курс – 15-20 ін’єкцій. Лікувальний ефект підвищується при поєднанні парентерального введення препарату з електрофоретичним. Курси повторюють через 1,5–2 міс. при наявності дерматосклерозу. Ронідазу застосовують зовнішньо, наносячи її порошок (0,5–1,0 г) на змочену фізіологічним розчином серветку. Накладають серветку на осередок ураження, фіксуючи бинтом протягом півдоби. Курс аплікацій продовжують 2–3 тижні [51].
У зв’язку з вищевикладеним практично значущим є розробка комплексних лікувальних методів з використанням препаратів, що цілеспрямовано впливають на синтез і розпад колагену, мають протизапальний, імуномодулюючий ефекти, а також засобів, що знижують можливість розвитку побічних явищ і ускладнень, впливають на гомеостаз за рахунок підвищення адаптаційного потенціалу організму, а також комплексних методів спеціального догляду за шкірою хворих на ОСД, які підвищують репаративні процеси в осередках ураження.
Таким чином, на підставі проведеного вивчення сучасних джерел літератури встановлено, що не до кінця висвітлено особливості розпізнавання ОСД з використанням сучасних клініко-інструментальних методів, зокрема тепловізійного обладнання, сучасних доклінічних інтегральних фізичних методів, які служать прогностичною основою обґрунтування маркерних інтеграційних метаболічних показників донозологічної діагностики. Дотепер не проаналізовано питання лікування залежно від характеру і ступеня ураження шкірних покривів і підлеглих тканин у комплексній терапії з використанням нових схем лікування, а також принципи надання спеціалізованої допомоги таким хворим відповідно до сучасного рівня розвитку доктрини дерматології.
Єдиних стандартів надання лікувальної допомоги при ОСД у даний час в Україні немає, про що свідчать наведені вище показники незадовільних результатів лікування та їх розкид у хворих з даною патологією. Крім того, в доступній літературі не існує опису критеріїв, спеціально розроблених для лікування хворих на ОСД. Необхідні подальші дослідження клінічних особливостей і вибір діагностичних критеріїв (початок, тривалість, обсяги терапії), що дозволило б створити лікувально-діагностичний алгоритм при ОСД. Усе це зумовило вибір напрямку і доцільність проведення даного наукового дослідження з подальшим вивченням фундаментальних уявлень про етіопатогенез ОСД на клітинно-мембранному, органному і системному рівнях організації організму з урахуванням даних динамічного моніторингу Е-розеткоутворюючих клітин лімфоцитів, Т-лімфоцитів і морфометричних досліджень тимуса, що уявляється вкрай важливим при формуванні синдрому імуно-ендокринної дисфункції.
Також має місце проблема неповної діагностичної інформації, що обумовлено обмеженими можливостями окремих методів клініко-лабораторних та клініко-інструментальних досліджень. Необхідні подальші клінічні обґрунтування, а також дослідження клінічних особливостей з вибором діагностичних критеріїв, що дозволило б створити алгоритм лікувально-профілактичної тактики при ОСД.
Таким чином, розробка і теоретичне обґрунтування нових перспективних методів діагностики і лікування хворих на ОСД, які базуються на алгоритмах вибору раціональної тактики лікування, що дозволяють в умовах неповноти й неоднозначності діагностичної інформації здійснити індивідуалізований вибір терапевтичних впливів при мінімізації побічних ефектів, є актуальною науковою проблемою.
* * *
Підсумовуючи представлені в огляді літератури дані, можна констатувати інтерес дослідників до проблеми й зазначити актуальність дослідження ОСД з метою розробки та вдосконалення лікування пацієнтів.
Виходячи з численних даних літератури, зростає кількість людей, які страждають на ОСД. І хоча за останні роки накопичено великий арсенал наукових даних щодо захворювань СТ, залишаються питання, які потребують детального вивчення для створення сучасної картини патогенезу ОСД – це, насамперед, етіологічні та патогенетичні фактори. Вивчення взаємозв’язку імунологічних, біохімічних та структурно-метаболічних маркерів СТ буде сприяти розширенню уявлень про механізми перебігу даного виду дерматозу, що, в свою чергу, дозволить проводити підбір адекватної лікувальної терапії та профілактичних заходів, що покращить прогноз захворювання та якість життя хворих на ОСД.
Зміст розділу відображено в наступних публікаціях:
- Ата М. А. Дистанционное термометрическое исследование измененных кожных покровов у больных очаговой склеродермией. Дерматологія та венерологія. № 2 (80). С. 50–53.
- Кутасевич Я.Ф., Ата М.А. Особенности формирования синдрома иммуно-эндокринной дисфункции у больных очаговой склеродермией в стадии обострения. Международный медицинский журнал. 2019. № 1 (97). С. 75–79.
- Ата М. А. Особенности биохимических изменений у больных ограниченной склеродермией. ScienceRise: Medical Science. 2019. № 1 (28). С. 20–24.
- Применение современных способов диагностики очаговой склеродермии / Янина Кутасевич, Ирина Олейник, Мохамед Ата, Петр Замятин, Константин Дубровский. Spatial aspects of socio-economic systems development: the economy, education and health care. Monograph. Opole, Poland : Publishing House WSZiA, 2015. P. 258–265.
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Методика загального обстеження хворих
Під спостереженням перебувало 107 хворих на ОСД, що знаходилися на стаціонарному лікуванні у відділенні дерматології ДУ «Інститут дерматології та венерології НАМН України» з 2014 по 2018 рр. Було обстежено 21 (19,58 %) чоловіків та 86 (80,41 %) жінок, віком 21–70 років. Найбільша кількість хворих на ОСД відзначалася у віковій групі 31–50 років. Усі хворі надходили до стаціонару у період маніфестації або загострення захворювання.
Постановка діагнозу базувалася згідно Міжнародної класифікації захворювань Х перегляду, в якій ОСД представлено у класі XII «Захворювання шкіри і підшкірної клітковини» за шифром L 94.0. Слід зазначити, що у контексті різноманіття існуючих визначень і класифікацій слід розглядати розвиток й формування синдрому імунної дисфункції, як фазний патологічний процес, що поступово розвивається при ОСД, в основі якого полягають порушення гомеостазу, загальних і місцевих адаптаційних процесів, зміцнення яких досягається проведенням адекватного комплексу проти заходів, у результаті чого настає період тимчасової нестійкої компенсації.
Анамнестичні дані включали відомості про давність і причини захворювання, проведене раніше лікування, дані про попередні та супутні захворювання. Особлива увага при зборі анамнезу приділялася тривалості перебігу і поширеності процесу, наявності супутньої патології. Також при огляді пацієнтів проводилася фотозйомка осередків ураження. Були досліджені загальний і біохімічний аналіз крові, а також імунологічні показники.
Для досягнення поставлених мети та завдань проведено клінічне дослідження, етапи якого представлено на рис. 2.1.
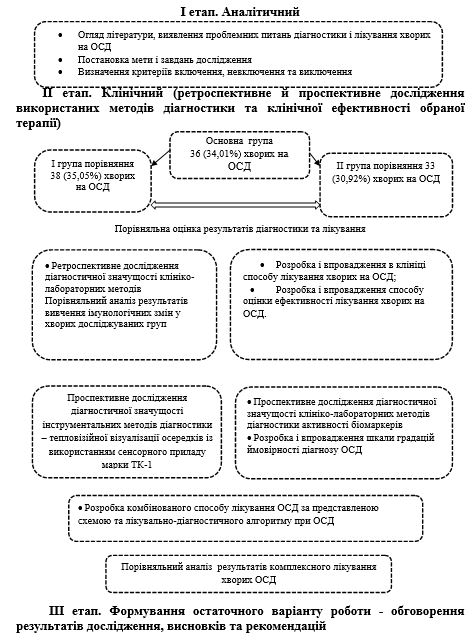
Рисунок 2.1 – Етапи дослідження
Критеріями включення в дослідження стали: наявність ОСД у хворих з установленим діагнозом, тобто, як типова картина захворювання в стадії еритеми (набряку) і/або ущільнення, так і відсутність ознак системності процесу, вік – від 25 до 70 років, отримання інформованої згоди пацієнта.
Критеріями невключення були: наявність злоякісних новоутворень і передракових захворювань шкіри й внутрішніх органів в анамнезі та на момент огляду, супутні захворювання, включно психічні, у стадії загострення, системна склеродермія, хвороба Лайма, схильність до келоїдоутворення, хронічна ниркова й печінкова недостатність, цироз печінки, підвищення рівня печінкових трансаміназ більш ніж удвічі від нормальних значень, вагітність і період лактації, а також протипоказання до призначення препаратів, що входять до терапевтичних схем лікування.
Критерії виключення пацієнта з дослідження (що планувалося використовувати): прояви небажаних явищ, що пов’язані з терапією або невиконанням режиму призначеної схеми терапії, але хворих, виключених із дослідження через небажані явища, пов’язані з розробленою терапією, не було.
З метою вивчення ефективності комбінованого використання традиційної терапії та нових схем лікування ОСД, які включали препарати тіотриазолін і цитофлавін, усіх пацієнтів було розподілено на три зіставні за всіма параметрами групи випадковим чином. Групи довільно формувалися з хворих, що відповідали критеріям включення.
В основну групу увійшли 36 (34,01 %) хворих на ОСД, що отримали комплексне лікування за схемою, методику якої було розроблено у клініці інституту: базове лікування (пеніцилін G – по 5,0 млн на 100,0 фізіологічного розчину внутрішньовенно краплинно протягом 10–12 діб; аскорбінова кислота 10,0 % – по 2,0 мл внутрішньом’язово протягом 10–15 діб; нікотинова кислота 1 % – по 1,0 мл внутрішньом’язово протягом 10 діб; зовнішнє лікування – траумель С мазь і аплікації з розчином димексиду 1:4 (згідно стандартам терапії ОСД), а також додатково тіотриазолін 2,5 % по 4,0 мл внутрішньом’язово протягом 10–15 діб та цитофлавін по 10,0 мл на 200,0 фізіологічного розчину внутрішньовенно краплинно протягом 10 діб із подальшим переходом на таблетовану форму препарату по 2 таблетки 2 рази на добу протягом 25 діб.
До І групи порівняння було включено 38 (35,05 %) пацієнтів, які отримували терапію, що включала тільки базове лікування.
У ІІ групу порівняння увійшли 33 (30,92 %) хворих, які одержували лікування за схемою, що включала базове лікування з додаванням тіотриазоліну 2,5 % по 4,0 мл внутрішньом’язово протягом 10-15 діб.
Для проведення порівняльного аналізу та отримання більш достовірних результатів дослідження додатково було введено контрольну групу, що складалася з 25 умовно-здорових обстежених добровольців, мешканців Харківського регіону.
Групи пацієнтів були репрезентативні за статтю, віком, вихідними клініко-лабораторними показниками.
Базове лікування передбачало застосування антифіброзних, дезінтоксикаційних, вазоактивних, нестероїдних протизапальних препаратів, гепатопротекторів, вітамінів за стандартними методиками. Місцево накладалися топічні протизапальні, розсмоктуючі засоби. Також у лікуванні хворих на ОСД використовувалися фізіотерапевтичні методи.
Загальноклінічне обстеження хворих до терапії передбачало з’ясування скарг, анамнезу життя і хвороби пацієнта (початок захворювання, його тривалість, сезонність, частота загострень, наявність ОСД у родичів, супутньої патології тощо), вивчення даних щодо отриманого раніше лікування та його ефективності; об’єктивне обстеження шкіри та слизових оболонок.
Усі хворі піддавалися комплексному клініко-лабораторному обстеженню з вивченням анамнезу, оглядом із оцінкою дерматологічного статусу.
Усі хворі на ОСД дотримувалися загальних рекомендацій: запобігати переохолоджень, гіперінсоляції та перегрівання, застудних захворювань, травм, стресових ситуацій, необґрунтованого використання лікарських засобів.
Усім хворим до та після лікування проводилися загальні аналізи крові та сечі, біохімічний аналіз крові з вивченням показників білкового та вуглеводного обмінів, функціонального стану печінки й нирок. Матеріалом для дослідження була капілярна та венозна кров, забір якої проводився натще та ранкова сеча.
Клінічні дослідження крові та сечі проводилися за уніфікованими методами. Оцінку одержаних лабораторних досліджень проведено згідно Міжнародної системи одиниць [35]. Усі клінічні дослідження проводилися в клінічній лабораторії ДУ «Інститут дерматології та венерології НАМН України» (свідоцтво про атестацію № 100-297/2015 від 20.11.2015р.). Імуноферментні дослідження виконували на базі діагностичної лабораторії молекулярних і клітинних технологій з імуноферментним і імунофлюоресцентним аналізом ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України» за допомогою сучасного мікроскопа Olympus BX-i53 (Japan) та програмного забезпечення.
Біохімічні дослідження проводилися на базі кафедри біологічної хімії Харківського національного медичного університету.
2.2 Біохімічні дослідження
Біохімічні методи. Біохімічне обстеження проводилося всім 96 спостереженим хворим на ОСД, а також 25 умовно-здоровим особам, мешканцям Харківського регіону, які були репрезентативні за віком і статтю.
Вміст білірубіну та його фракцій у сироватці крові визначався за Йєндрашиком, активність амінотрансфераз у сироватці крові – за Райтманом, Френкелем, глікопротеїди – за методом Штенберга О.Б. та Доценко М.Н., серомукоїди – за турбодиметричним методом [22], сіалові кислоти – за методом Гесса [12].
Метод визначення концентрації пептидів середньої молекулярної маси (ПСММ). Сироватка (плазма) оброблялася розчином трихлороцтової кислоти, надосадова рідина звільнялася від грубодисперсних білків, після попереднього розведення дистильованою водою детекція здійснювалася за допомогою спектрофотометрії. За величиною оптичної щільності судили про вміст пептидів середньої молекулярної маси. Оптична щільність зразків вимірювалася на спектрофотометрі СФ-46 при λ = 254 нм (дейтерієва лампа) відносно дистильованої води.
Референтні величини: рівень пептидів середньої молекулярної маси 0,180 – 0,250 од. Е [11].
Визначення співвідношення білкових фракцій сироватки крові методом електрофорезу на ацетатцелюлозних мембранах.
Визначення співвідношення білкових фракцій сироватки крові здійснювалося методом електрофорезу на ацетатцелюлозних мембранах на приладі ЕФ-1 із подальшим їх забарвленням та аналізом на аналізаторі фореграм типа АФ-1 (рис. 2.2).
Рисунок 2.2 – Електрофореграма білків сироватки крові на ацетатцелюлозній мембрані
Метод визначення концентрації С-реактивного білка (СРБ). Дослідження концентрації СРБ проводилося кількісним методом імуно-турбодиметрії за О. П. Шевченко (1997) [36].
Метод визначення концентрації магнію та хлору в сироватці крові. Визначення магнію та хлору сироватки крові здійнювалося за допомогою колориметричного аналізу за А. Ш. Бишевським, О. А. Терсеновим (1994) [22].
Метод визначення загальних ліпідів у сироватці крові. Визначення загальних ліпідів проводилося за В Н. Титовим, М. Г. Твороговою (1992); ліпопротеїдів високої щільності (ЛПВЩ), тригліцеридів, бета-ліпопротеїдів – за С. Е. Севериним (1977); концентрацію холестерину – за D. Vaidya (2005); коефіцієнт атерогенності розраховувався за формулою: коефіцієнт атерогенності = (загальний холестерин – ЛПВЩ)/ЛПВЩ) [36].
ГАГ і сумарні ГАГ (кислі мукополісахариди) визначались у сироватці крові з використанням трихлороцтової кислоти та відомої карбозольної реакції, яка забезпечує фіолетово-рожеве забарвлення. Фотометрія досліджуваних зразків проб здійснювалася при λ=530 нм. Вміст ГАГ у сироватці крові визначався через гексуронові кислоти в мкмоль/л за методикою П.Н. Шараєва та співавт. (1989) [37].
Оцінка КЛА плазми крові здійснювалася за сумарною кількістю (при ферментативному гідролізі) вільного і пептидно-зв’язаного оксипроліну в діагностичній пробі. Для цього знаходили за калібрувальною кривою відповідне оптичній щільності значення кількості оксипроліну при λ = 570 мкм. Величина КЛА плазми крові виражалася в мкмоль/л•ч [14, 39, 41].
Еластаза у сироватці крові досліджувалася за допомогою імуноферментного методу І.П. Гонтаря зі співавт. (2012) з використанням моноклональних антитіл і набору реактивів Human PMN Elastase Elisa RD 191021100) за інструкцією фірми «Biovendor» (Германія) [1].
Методи дослідження системи гемостаза. Для визначення концентрації фібриногену використовувався метод Т.М. Платонової зі співавт. (1993) [48]; для реєстрації тромбінового часу та активованого часткового тромбопластинового часу використовувався загальноприйнятий метод [19]; протромбіновий індекс реєструвався за загальноприйнятним методом із тромбопластином фірми «Sigma» (США) [18]; з метою визначення концентрації продуктів деградації фібрин/фібриногену використовувався метод затримки полімеризації мономерного фібрину [16]; розчинного фібрину – спосіб Т.В. Варецької зі співавт. (1992) [40]; антитромбіну-III – метод Ю.Л. Кацадзе, М.А. Котовщикової (1982) [23].
2.3 Імуноферментні дослідження
Метод визначення фагоцитуючої активності гранулоцитарних нейтрофілів. Фагоцитарна активність гранулоцитарних нейтрофілів визначалася в лейкоцитарній суспензії, отриманій з гепаринізованої крові. Для досліджень змішувалися рівні об’єми лейкоцитарної суспензії та відмитої суспензії пекарських дріжджів. Отримані зразки інкубувалися 60 хвилин при 37 0С, періодично помішуючи. Після інкубації готувалися мазки, які забарвлювалися барвником Романовського. Мікроскопування проводилося під імерсійною системою. Шляхом підрахунку відсотка клітин, що вступили в фагоцитоз, розраховувався фагоцитарний індекс. Середня кількість дріжджових клітин, що знаходяться в нейтрофілах крові, складала фагоцитарне число (ФЧ):
ФЧ = Nдр. / N фаг.,
де Nдр. – кількість поглинутих дріжджових клітин;
Nфаг. – кількість клітин, що вступили у фагоцитоз.
Метод визначення вмісту сироваткових імуноглобулінів класів А, М і G. Визначення вмісту сироваткових імуноглобулінів класів А, М і G здійснювалося спектрофотометрично на автоматичному імуноферментному аналізаторі STAT FAX 3200 (США). Для визначення концентрації використовувався стандартний набір моноспецифічних антисироваток до імуноглобулінів шкірного класу і контрольна сироватка з відомим вмістом імуноглобулінів (г/л) (виробник НДІ епідеміології та мікробіології ім. Н.Ф. Гамалеї, м. Москва; АО “Биомед” ім. І.І. Мечникова, м. Москва). Зразки, контрольну сироватку і антисироватки вносили в лунки планшета і додавали 7 % розчин поліетиленгліколю 6000 на фосфатному буфері (pH 7,4–7,5). Проби інкубувалися 60 хвилин при кімнатній температурі. Оптичну щільність вимірювали в біхроматичному режимі при λ1 = 405 нм і λ2 = 570 нм проти холостої проби (без сироватки крові). Концентрація сироваткових імуноглобулінів розраховувалася за калібрувальними графіками, побудованими для кожного класу імуноглобулінів.
Метод визначення вмісту автоімунних антитіл (тест на лімфоцитотоксичність). Визначення вмісту автоімунних антитіл проводилося за тестом на лімфоцитотоксичність (класичний метод Терасакі). Для проведення тесту використовувалася лейкоцитарна суспензія, яка готувалася з гепаринізованої крові, як описано раніше, та інкубувалася з гомологічною сироваткою крові при 37 °С протягом 30 хвилин. Для утворення комплексу антиген-комплемент-антитіло по краплях вносився фермент. Після інкубації при 37 °С протягом 15 хвилин до суспензії додавався барвник еозин, забарвлюючи клітини з пошкодженою отриманим комплексом клітинною мембраною. Препарати забарвлювалися метиленовим синім, інкубувалися 30 хвилин при 37 °С і підраховувалася кількість живих і мертвих клітин за диференційним забарвленням еозином. Про рівень автоімунних антитіл судили за відсотковим співвідношенням живих і мертвих клітин. Референтні величини відповідали 10–30 % вмісту автоімунних антитіл [24].
Метод визначення концентрації ЦІК. Вміст ЦІК у сироватці крові оцінювався спектрофотометрично після інкубації зразків у боратному буфері та поліетиленгліколі при кімнатній температурі. При інкубації відбувалася преципітація ЦІК на поліетиленгліколі, що позначалося на зміні оптичної щільності зразків. Вимірювання оптичної щільності проводилося спектрофотометрично на СФ-46 («Ломо», Росія) при довжині хвилі λ = 450 нм проти боратного буфера. Референтні величини: концентрація ЦІК – 50-100 од.
Метод визначення константи ЦІК. Принцип методу визначення константи ЦІК полягає в селективній преципітації ЦІК у градієнті щільності поліетиленгліколю. Проби після внесення різної кількості (1,5 мл і 2,0 мл) 5 % розчину поліетиленгліколю 6000 (проба 1 і проба 2 відповідно) інкубувалися 18 годин при 4 °С для утворення імунних комплексів. Після центрифугування при 2200 об./хв протягом 17 хвилин відділялася надосадова рідина. Супернатант розводили 0,1 N гідроксидом натрію і спектрофотометрично визначали оптичну щільність при довжині хвилі λ = 280 нм проти гідроксиду натрію. Константа ЦІК (ЦІКк) розраховувалася за формулою: ЦІКк = D2/D1, де D1 – оптична щільність у пробі 1; D2 – оптична щільність у пробі 2. Референтні величини: константа ЦІК – 1,1–1,5 [43].
Метод визначення рівня субпопуляцій лімфоцитів CD2+, CD3+, CD4+, CD8+ за допомогою моноклональних антитіл. Принцип методу полягає в специфічному зв’язуванні моноклональних антитіл, мічених флуоресцеїну ізотіоционатом, з відповідними поверхневими антигенами імунокомпетентних клітин. За допомогою люмінесцентного мікроскопа відбувався підрахунок клітин, мічених флуоресцеїну ізотіоционатом (використовували набір специфічних моноклональних антитіл Інституту експериментальної патології, онкології і радіобіології ім. Р. Є. Кавецького НАН України).
Імуноферментний метод визначення антитіл до ДНК (нативної, денатурованої).
Принцип методу базується на виявленні в сироватці крові антитіл, специфічних до антигену, адсорбованому на твердій фазі. Антитіла, які приєдналися до твердої фазі, визначають за допомогою специфічного антиглобулінового кон’югату антиімуноглобулін G (третій шар імунного комплексу) (рис. 2.3). Активність ферменту в складі імунного комплексу визначають за допомогою субстрат-хромогенної суміші. Інтенсивність забарвлення хромогену прямо пропорційна концентрації антитіл у зразку і визначається спектрофотометрично на автоматичному імуноферментному аналізаторі STATFAX 3200 (США) при довжині хвилі λ = 450 нм. Референтні величини: проба вважається позитивною при величині індексу реакції > 1,0. При значенні індексу реакції ≤ 1,0 проба вважається негативною. Збільшення титру органоспецифічних антитіл змінює забарвлення і оптичну щільність розчину в осередку.
Рисунок 2.3 – Стриповий планшет з іммобілізованими антитілами, які взаємодіють з різними концентраціями сироваткових
органоспецифічних антитіл
Метод скринінгу наявності автоімунних антитіл на специфічних скринінгових чипових панелях з іммобілізованими субстратами різних клітин.
Метод полягає у використанні іммобілізованих на предметних стеклах чіпів – мозаїки з різних антигенних клітинних субстратів, які здатні взаємодіяти з компонентами сироватки крові людини (антитілами) і при цьому фарбуватися флуоресцентними барвниками (рис. 2.4). Скринінговий метод аналізу є дуже точним і специфічним, але напівкількісним методом. У разі позитивної відповіді на наявність специфічних антитіл використовувався підтверджуючий ІФА-тест з моноспецифічними антитілами або підтверджуючі тести з використанням імуноблоту: вестерн-блот, лінійні блоти на скельцях і на нітроцелюлозних мембранах (рис. 2.5, 2.6, 2.7).
Вестерн-блот використовується для підтвердження повного репертуару і кількісного визначення органоспецифічних антитіл.
Скринінгове дослідження антиядерних антитіл методом непрямої імунофлюоресцентної мікроскопії з визначенням типу сироваткових специфічних антиядерних антитіл до мішеней клітинних ядер: рибонуклепротеіну – U1-nRNP, Sm; апарату Гольджі, анти-SS-A/Ro, анти-SS-B/La, MI-2, Ku виконувалось із застосуванням набору реактивів EUROIMMUN (Germany).
Рисунок 2.4 – Скляний слайд із чиповими осередками, які містять панель мозаїчних клітинних субстратів, що зв’язують специфічні антитіла
до клітинних органоїдів різних тканин: поперечно-смугастих міофібрил, тканин тимуса, нейтрофілів
Рисунок 2.5 – Високоафінні флюоресціюючі антитіла, тотально зв’язані з мембранами клітинних ядер
Рисунок 2.6 – Вестерн-блот на нітроцелюлозних мембранах виявляє репертуар специфічних антитіл. Подальше сканування
з використанням автоматизованої комп’ютерної програми дозволяє визначити точну концентрацію сироваткових патологічних лізуючих
антитіл. На вестерн-блоті виявлено безліч різних типів антитіл, титр яких перевищує контрольні значення
Рисунок 2.7 – Лінійні блоти на скельцях дозволяють локально обмежено визначити концентрацію органоспецифічних антитіл. На блоті
виявлено наявність великого титру антитіл типу SS-A, що характеризують наявність генералізованого автоімунного процесу
2.4 Інструментальне обстеження
Хворим на ОСД проводилася оцінка стану активності запальних проявів шкіри методом дистанційної термографії. Усього було обстежено 26 хворих на ОСД, з них 2 чоловіки (7,7 %) і 24 жінки (92,3 %). Середній вік хворих становив (45,22 ± 1,16) років. Серед 55 хворих на ОСД – 20 (36,4 %) з І (мінімальним) ступенем активності, 22 (40 %) пацієнта з ІІ (середнім) ступенем активності, 11 (20 %) осіб з ІІІ (максимальним) ступенем активності, у 2 (3,6 %) – активність відсутня.
Тепловізійна візуалізація склеродермічних осередків та здорових тканин шкіри проводилася на базі ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України» з використанням матричного тепловізора марки ТК-1, виготовленим у Фізико-технічному інституті низьких температур ім. Б. І. Вєркіна НАН України (Харків, Україна). Матричний тепловізор марки ТК-1 – сучасний професійний тепловізійний програмно-апаратурний комплекс на основі охолоджуваного багатоелементного приймача з оптико-механічним скануванням 6 покоління, спектральний діапазон – 8-14 мкм (рис. 2.8).
Рисунок 2.8 – Матричний тепловізор марки ТК-1
Діапазон вимірювальних температур від –40 до +2000 0С, чутливість – менша 0,1 0С. Прилад характеризується високою портативністю та компактністю (вага 1,6 кг із батареєю), що дозволяє здійснювати запис термозображень на карти пам’яті типу Compact Flash з можливістю синхронного запису текстових та голосових коментарів, із вбудованою кольоровою відеокамерою, включає різноманітні функції аналізу та налаштування термозображень у масштабі реального часу.
При аналізі інфрачервоних зображень тканин шкіри хворого з метою виключення артефактів при діагностиці необхідно враховувати вплив зовнішніх умов, які можуть сильно змінити значення температури шкіри людини і температурну топографію поверхні тіла.
Для зв’язку з персональним комп’ютером використовувалися цифрові інтерфейси (рис. 2.9).
Отримані кольорові термограми аналізувалися на кількісному та якісному рівнях, що полягає в оцінці зон гіпертермії та гіпотермії, визначенні температурного градієнту досліджуваної ділянки порівняно з оточуючими тканинами або симетричною ділянкою (виявлення термоасиметрії). Діагностичне значення мав температурний градієнт більше 0,6 0С [62].
Рисунок 2.9 – Інтерфейс багатоелементного тепловізора ТК-1
2.5 Метод лікування
Основна мета терапії ОСД – уповільнити прогресування хвороби, досягти максимальної стабілізації процесу, а далі – регресу клінічної картини. Хворі на ОСД мають отримувати комплексне, патогенетично обґрунтоване, диференційоване лікування з урахуванням клінічної форми, стадії, лабораторних показників, індивідуальних особливостей хворого. Існуючі в даний час різні методи терапії ОСД недостатньо ефективні і часто супроводжуються небажаними побічними явищами.
Таким чином, в дисертаційній роботі уявляється перспективним вивчення і розробка нових комбінованих фармакотерапевтичних методів лікування хворих на ОСД, включаючи традиційну терапію, а також додатково тіотриазолін 2,5 % по 4,0 мл внутрішньом’язово протягом 10-15 діб та цитофлавін по 10,0 мл на 200,0 фізіологічного розчину внутрішньовенно краплинно протягом 10 діб із подальшим переходом на таблетовані форми препарату по 2 таблетки 2 рази на добу протягом 25 діб [62].
2.6 Статистичні методи дослідження
Статистичний аналіз отриманих результатів здійснювався за допомогою стандартного пакета прикладних програм Microsoft Office Excel 2010 та StatSoft Statistica 6.0 [26, 70, 185].
На етапі формування бази даних клініко-лабораторних досліджень для виключення грубих помилок вимірів контролювалася відсутність викидів у ряду досліджуваних показників за допомогою критерію варіаційного розмаху і критерію Діксона. Для перевірки гіпотези про нормальність розподілу варіант, виражених у кількісній шкалі, застосовувалися коефіцієнти асиметрії та ексцесу, а також критерій Шапіро-Уїлка [33, 172]. Обчислялися значення середньої арифметичної (М), середнього квадратичного відхилення (σ), похибки визначення середньої арифметичної (m). Фінальні цифрові дані представлялися в такому вигляді: середнє значення ± стандартна похибка середньої величини. За допомогою t-критерію Ст’юдента-Фішера визначалася достовірність розходжень (р) порівнюваних групових середніх [129]. Усі порівняння проводилися за довірчої вірогідності р = 95 %, отже у разі отримання обчисленого рівня значущості критеріальної статистики p < 0,05 різниця між групами вважалася значущою.
У разі множинних порівнянь (більше ніж між двома групами) використовувався багатофакторний дисперсійний аналіз із обчисленням критерію Крускала-Уолліса або парний критерій із поправкою на множинність порівнянь у формулюванні Дункана. Порівняльний аналіз між групами якісних показників (стадія, активність, клінічна форма захворювання) здійснювався за допомогою кореляції Спірмена [77].
Кореляційні залежності між числовими показниками оцінювалися коефіцієнтами кореляції Пірсона у відповідності зі шкалою вимірювання змінних, що розглядалися [123, 186].
РОЗДІЛ 3
КЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ НА ОБМЕЖЕНУ СКЛЕРОДЕРМІЮ
Під спостереженням перебувало 107 хворих на ОСД, що знаходилися на стаціонарному лікуванні у відділенні дерматології ДУ «Інститут дерматології та венерології НАМН України» з 2014 по 2018 рр. Було обстежено 21 (19,58 %) чоловіків та 86 (80,41 %) жінок, віком 21-70 років (табл. 3.1).
Таблиця 3.1 – Вікова характеристика обстежених хворих на ОСД
| Вік, роки | Кількість пацієнтів, абс | Кількість пацієнтів, % |
| 21-30 | 6 | 5,607 |
| 31-40 | 43 | 40,187 |
| 41-50 | 34 | 31,775 |
| 51-60 | 16 | 14,953 |
| 61-70 | 8 | 7,478 |
З даних таблиці видно, що найбільша кількість хворих на ОСД відзначалася у віковій групі 31-50 років, що підтверджують літературні дані. Найбільш численну групу серед спостережуваних хворих становили жінки, як у цілому, так і в окремих вікових групах.
ОСД спостерігалася у всіх 107 пацієнтів, причому у 26 (24,29 %) хворих були виявлені одиничні (1-3 осередки), у 81 (75,71 %) хворих множинні – 4–7 осередків. Так, у 20 % випадків захворювання мало обмежений характер, у 80 % – поширений характер: уражалася шкіра тулуба, верхніх і нижніх кінцівок, шиї, обличчя. Виходячи з вищесказаного, локалізація осередків склеродермії, що зустрічалася найчастіше, була відзначена на шкірі тулуба у 29 пацієнтів (63 %). З них на шкірі живота – у 15 пацієнтів, на верхній частині спини – у 3 хворих, у ділянці попереку – 5 випадків, на грудній клітині – у 6 пацієнтів.
Так, найбільші осередки розміром до 15 см знаходилися на тулубі. Далі за частотою у 12 (26 %) осіб осередки розташовувалися на нижніх кінцівках, а саме на шкірі гомілок і стегон. Дане розташування часто відрізнялося симетричністю і множинністю елементів. Що стосується осередків склеродермії на шкірі обличчя (у ділянці лоба, носо-губної складки, верхньої повіки, у виличній ділянці, за вухом, на підборідді), то вони спостерігалися у 3 (6,5 %) випадках, на шиї у 2 (4,5 %) пацієнтів. З локалізацією процесу на обличчі пов’язані різного роду психоемоційні розлади пацієнта, моральні переживання, які виникали на тлі проблем в особистому житті, що в сукупності знижувало якість життя. Клінічно процес дебютував з появи злегка набряклої плями (стадія еритеми) рожевого кольору з бузковим відтінком по периферії, яка поступово збільшувалася в розмірах.
Згодом спостерігалася поява нових осередків. Пляма в центральній її частині, як правило, з часом блідла і ставало щільнішою (стадія індурації), а по периферії зберігався віночок лілового, рожево-синюшного кольору з фіолетовим відтінком, який переходив у незмінену шкіру, що по суті було критерієм активності процесу. У цілому, патологічні ділянки характеризувалися щільними осередками різної форми, різного кольору, вираженістю периферичного віночка зростання, глибиною ураження та явищами атрофії. Поява плям і подальший їх розвиток не супроводжувався вираженими суб’єктивними відчуттями. Хворі рідко відзначали відчуття поколювання і/або стягнутості шкіри.
На рис. 3.1 відображено фактори ризику, які спровокували початок ОСД. Так, отримані анамнестичні дані, дозволили встановити ряд факторів, провокуючих початок захворювання, серед яких найбільш часто зустрічалися: емоційне перенапруження і стрес – 15 (23,8 %); фізичні травми – 4 (4,34 %); гострі інфекційні захворювання – 8 (12,69 %); різні гормональні зміни – 3 (4,76 %); гіперінсоляція – 2 (3,17 %). При цьому 31 (49,20 %) хворий виникнення захворювання ні з чим не пов’язував.
Рисунок 3.1 – Фактори ризику, що спровокували початок захворювання в обстежених хворих
У всіх пацієнтів до проведення необхідного лікування оцінювалися поширеність, кількість патологічних осередків і сумарна площа ураження. До форми ураження, яка мала локальний характер, належали випадки з наявністю 1–3 осередків склеродермії; поширеним же вважалася наявність понад 4 осередків.
На рис. 3.2 представлено розподіл хворих за кількістю осередків ураження.
Як видно з табл. 3.2, серед супутніх захворювань переважали гіпертонічна хвороба та ішемічна хвороба серця – 32 (32,32 %) випадків. На другому місці за частотою були захворювання шлунково-кишкового тракту – 23 (23,23 %) пацієнтів із хронічнім гастритом, хронічнім холециститом, виразковою хворобою шлунка та дванадцятипалої кишки, дискінезією жовчовивідних шляхів. Серед осередків хронічної інфекції за частотою превалювали хронічний тонзиліт, хронічний гайморит (синусит), хронічний пієлонефрит.
Рисунок 3.2 – Розподіл хворих за кількістю осередків ураження шкірних покривів
Таблиця 3.2 – Характер супутніх захворювань у хворих на ОСД
| Супутня патологія | Кількість | % |
| Захворювання серцево-судинної системи | 32 | 32,32 |
| Захворювання шлунково-кишкового тракту | 23 | 23,23 |
| Захворювання нервової системи | 8 | 8,08 |
| Захворювання дихальної системи | 7 | 7,07 |
| Захворювання сечостатевої системи | 9 | 9,09 |
| Захворювання опорно-рухового апарату | 9 | 9,09 |
| Ендокринні захворювання | 11 | 11,11 |
Примітка. Кількість нозологічних форм може перевищувати кількість хворих на ОСД, оскільки у одного пацієнта діагностувалося кілька супутніх захворювань
У 14 (26,41 %) жінок відзначалися різні гінекологічні захворювання – дисфункція яєчників з порушенням менструального циклу, ерозія шийки матки, фіброзно-кістозна мастопатія, у групі з ендокринологічними порушеннями діагностовано цукровий діабет, ожиріння, автоімунний тиреоїдит.
Таким чином, аналіз клінічного матеріалу хворих, які перебували під спостереженням з різними формами ОСД, підтверджує дані, раніше опубліковані в літературі. Серед них – переважання жінок серед пацієнтів на ОСД, поширеність ендокринної патології, випадки передування захворюванню емоційних переживань, фізичних травм тощо. Також слід зазначити, що найчастіше більшість пацієнтів не пов’язували початок захворювання ні з чим з перерахованого вище.
Тривалість захворювання у пацієнтів, включених у дослідження, на момент первинного звернення становила від 3 місяців до 5 років (у середньому – (2,6 ± 0,5) року). Найчастіше дебют захворювання у пацієнтів ОСД припадав на вік 46–60 років, при цьому середній вік становив (48,24 ± 2,94) року. Більшість спостережуваних пацієнтів (59,81 %) мали початкові прояви склеродермічного процесу з великою тривалістю захворювання (табл. 3.3).
Таблиця 3.3 – Розподіл хворих у відповідності до давності захворювання
| Давність захворювання | Кількість пацієнтів | |
| Абс. | % | |
| До 6 місяців | 9 | 8,41 |
| 6 місяців – 1 рік | 34 | 31,78 |
| 1-5 років | 64 | 59,81 |
Таким чином, при вивченні клінічних проявів ОСД виявлено високу частоту захворювання серед осіб працездатного віку (83 пацієнтів – 77,31 %), значне переважання (у 4,1 раза) жінок серед обстежених хворих. Дебют дерматозу в середньому відбувався у віці 46-60 років, при цьому середній вік складав (48,24 ± 2,94) року та йому в більшості випадків передували психоемоційне перевантаження, перенесені інфекції. Найчисельнішу групу становили 64 (60 %) хворих із тривалістю захворювання на момент обстеження від 6 місяців до 1 року.
Супутню патологію мали майже всі пацієнти, найчастіше діагностувалися захворювання серцево-судинної системи та хвороби шлунково-кишкового тракту, у 22 хворих визначено поєднану патологію.
Таким чином, дані анамнезу клінічної картини хворих на ОСД спонукають фахівців до вивчення клінічних особливостей і вдосконалення сучасних методів адекватної терапії вже на початкових етапах захворювання з метою попередження розвитку подальшого тяжкого патологічного процесу і профілактики інвалідизації пацієнтів.
* * *
Вивчення клінічних проявів ОСД виявило високу частоту (40,2 %) хвороби в осіб працездатного віку – це виявилися пацієнти віком від 31 до 40 років. Серед обстежених пацієнтів переважну кількість складали жінки (80,41 %). Найбільш значущими факторами ризику, що спровокували початок захворювання в обстежених хворих, виявилися стрес, емоційне перенапруження та гострі інфекції. Супутня патологія була наявна майже в усіх пацієнтів. Переважна кількість пацієнтів (32,32 %) мала патологію серцево-судинної системи – гіпертонічна хвороба та ішемічна хвороба серця. Середня тривалість захворювання на момент первинного звернення становила 2,6 року.
Таким чином, дані щодо клінічної картини хворих на ОСД (працездатний вік, супутня патологія), пояснюють необхідність удосконалення існуючих та впровадження нових методів діагностики та лікування для недопущення розвитку патологічного процесу.
Зміст розділу відображено в наступних публікаціях:
- Ата М. А. Лечение очаговой склеродермии с применением современных методов. Дерматологія та венерологія. 2018. № 3 (81). С. 22–24.
- Кутасевич Я.Ф., Ата М.А. Особенности формирования синдрома иммуно-эндокринной дисфункции у больных очаговой склеродермией в стадии обострения. Международный медицинский журнал. 2019. № 1 (97). С. 75–79.
- Применение современных способов диагностики очаговой склеродермии / Янина Кутасевич, Ирина Олейник, Мохамед Ата, Петр Замятин, Константин Дубровский. Spatial aspects of socio-economic systems development: the economy, education and health care. Monograph. Opole, Poland : Publishing House WSZiA, 2015. P. 258–265.
РОЗДІЛ 4
ІМУННИЙ СТАТУС І ПОРУШЕННЯ БІОХІМІЧНИХ ПОКАЗНИКІВ У ХВОРИХ НА ОБМЕЖЕНУ СКЛЕРОДЕРМІЮ
У цьому розділі наведено зміни показників імунологічного та біохімічного обстеження у хворих на ОСД до проведення лікування.
4.1 Дослідження неспецифічної резистентності та бар’єрних функцій у хворих на обмежену склеродермію до проведення лікування
При вивченні фагоцитарної активності нейтрофілів і активності білків системи комплементу у хворих на ОСД були отримані наступні дані (табл. 4.1).
Таблиця 4.1 – Показники неспецифічної резистентності у хворих на ОСД до лікування
| Досліджувані групи | Показники неспецифічної резистентності | |||
| Фагоцитарний індекс, % | Фагоцитарне число | Індекс завершеності фагоцитозу | Комплемент | |
| Контрольна група (умовно-здорові донори) | 73,1±9,0 | 3,3±0,05 | 1,2±0,1 | 1,05±0,1 |
| Хворі на ОСД до лікування | 81,2±7,2* | 3,6±0,2* | 0,95±0,07 | 0,95±0,06 |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
Як видно з наведених у табл. 4.1 даних, у хворих на ОСД виявлено незначні зміни показників неспецифічної резистентності.
Фагоцитарний індекс, що відображає кількість нейтрофілів, які беруть участь у фагоцитозі пацієнтів на ОСД, був на 10,0 % вищим, ніж у контрольній групі.
Відзначено зростання фагоцитарного числа на 9,0 %. Перетравлювальна здатність нейтрофілів – індекс завершеності фагоцитозу був на 20,0 % нижчим, ніж у здорових донорів контрольної групи.
Також виявлено зниження на 10,0 % активності комплементу (при 1,05 ± 0,1 e контрольній групі).
На рис. 4.1 представлена фагоцитуюча активність гранулоцитарних нейтрофілів у пацієнта з ОСД.
Рисунок 4.1 – Фагоцитоз нейтрофільних гранулоцитів у хворої на ОСД. Збільшення 20×10
Фагоцитуюча активність гранулоцитарних нейтрофілів не відповідала стадії перебігу захворювання. Адгезія фагоцитуючих клітин свідчила про напруженість їх функціональної активності, відповідала верхній межі норми і становила 3,5 ум.од. Активність білків системи комплементу становила 0,99–1,07 ум.од.
В обстежуваних хворих на ОСД до проведення лікування виявлено зміни середніх показників гуморальної ланки імунітету (табл. 4.2).
Таблиця 4.2 – Показники ПСММ та гуморальної ланки імунітету у хворих на ОСД до лікування
| Досліджувані групи | Показники гуморальної ланки імунитету | |||
| ПСММ, ум. од. | Лімфоцито-токсичність, % | ЦІК, ум. од | ЦІКк | |
| Контрольна група
(умовно-здорові донори) |
0,244 ± 0,02 | 28,6 ± 2,30 | 98,3 ± 21,1 | 1,30 ± 0,08 |
| Хворі на ОСД до лікування | 0,298 ± 0,08 | 41,6 ± 3,7* | 142,5 ± 26,81* | 1,05 ± 0,06* |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
Як видно з таблиці, концентрація ПСММ у хворих на ОСД до проведення лікування становила (0,298 ± 0,08) ум. од, що була в 1,2 раза вищою, ніж у контрольній групі, що вказує на патологічні зрушення гомеостазу. У групі пацієнтів до лікування відзначалося достовірне зростання (в 1,5 рази) кількості автоімунних антитіл у тесті лімфоцитотоксичності.
Висока лімфоцитотоксичність сироватки крові свідчила про розвиток автоімунних реакцій у пацієнтів з досліджуваною патологією. Також у пацієнтів із ОСД максимально (в 1,5 рази) була підвищеною концентрація ЦІК, при контрольному значенні показника – (98,3 ± 21,1) ум.од. (Р ≥ 0,95).
Рівень ЦІКк, що характеризує їх молекулярну масу, був достовірно зниженим в 1,2 раза.
Проведено скринінгове дослідження антиядерних антитіл, яке виявило наявність цих антитіл у 9 пацієнтів з 19 обстежених у віці від 19 до 69 років.
У пацієнтів з наявністю антиядерних антитіл методом непрямої імунофлюоресцентної мікроскопії визначався тип сироваткових специфічних антиядерних антитіл до мішеней клітинних ядер: рибонуклепротеїну – U1-nRNP, Sm; апарату Гольджі, анти-SS-A/Ro, анти-SS-B/La, MI-2, Ku.
При цьому, у 6 пацієнтів молодого віку від 19 до 45 (середній вік – 34,3 року) в прогресуючій стадії виявлено антитіла до рибонуклеопротеїну U1-nRNP, які складалися з уридинового, багатого РНК комплексу з класичними РНП-антигенами з протеїнами: протеїну 70 kDa, протеїну А (33 kDa) і протеїну C (22 kDa) і Sm, і виконують сплайсинг молекул прематричної РНК.
Оскільки наявність антитіл до U1-nRNP і Sm зустрічається не тільки при ОСД, але й при системному червоному вовчаку та змішаному захворюванні СТ (наприклад, синдромі Шарпа), то слід очікувати, що у даної групи пацієнтів на наступних етапах можливий перехід ОСД у системну склеродермію.
Досліджені імунологічні параметри слід вважати інтегральними маркерами донозологічної діагностики системної патології (рис. 4.2, 4.3).
Рисунок 4.2 – Клітини Hep-2 хворої із ОСД на стадії профази (а) та інтерфази (б). Взаємодія сироваткових антитіл пацієнтів з антигенними структурами ядра – великогранулярне світіння всього ядра, за винятком ядерець. У мітотичних клітинах хромосоми залишаються темними,
а периферія рівномірно забарвлена (патерн АС-5). Збільшення 40×10
Антитіла до U1-nRNP антигенів на різних субстратах (Нер-2 і печінка приматів) виявлено у пацієнток молодого віку (середній вік 34,3 року) з ОСД у прогресуючій стадії, давність захворювання до 3 років.
У двох пацієнток у віці від 63 до 69 років (середній вік 66 років) з давністю захворювання більше 10 років у прогресуючій стадії виявлено інший тип автоантитіл до ядерних антигенів ANA-SS-A/Ro, SS-B/La, MI-2, Ku (рис. 4.4).
Рисунок 4.3 – Клітини Hep-2 хворої із ОСД на ядерних антигенах печінки приматів. Взаємодія сироваткових антитіл пацієнтів
з антигенними структурами ядра – на зрізах печінки мавпи також спостерігається гранулярне світіння; з антигенами ядерець реакції
немає. Реакція з ядрами клітин печінки мавпи має приблизно ту ж інтенсивність, що і з ядрами клітин Hep-2. Збільшення 20×10
Рисунок 4.4 – Клітини Hep-2 хворої з ОСД на стадії профазі та інтерфази. Взаємодія сироваткових антитіл пацієнтів з антигенними структурами ядер (SS-A/Ro, SS-B/La, MI-2, Ku) у вигляді однорідної і регулярної флуоресценції по всій нуклеоплазмі, ядерця були забарвлені; мітотичні клітини (метафаза, анафаза і телофаза) мають інтенсивно однорідно забарвлену масу хроматину (патерн АС-4). Збільшення 40×10
SS-A/Ro являє собою білок, зв’язаний з РНК Y1-Y5 у складі сплайсосому. SS-B/La антиген – нуклеоцитоплазматичний комплекс фосфопротеїну (48 kDa) з Ro РНК (hY1-hY5), який є термінальним транскрипційним фактором для РНК-полімерази III.
І тільки у 1 пацієнтки з давністю захворювання більше 12 років за допомогою інтегральних маркерів донозологічної діагностики виявлено антитіла до компонентів апарату Гольджі: гістилін/макрогольгін, гольгін-95/GM130, гольгін-160, гольгін-97, гольгін-245 (рис. 4.5).
Рисунок 4.5 – Клітини Hep-2 хворої з ОСД. Розривне плямисте або гранульоване перинуклеарне забарвлення у вигляді стрічки
з полярним розподілом у цитоплазмі (патерн АС-22). Збільшення 40×10
Як відомо, апарат Гольджі виконує накопичувальну і функцію виділення в клітині. Антитіла до цього органоїду можуть свідчити про його структурні порушення. Подібний вид антитіл часто виявляють при змішаній хворобі СТ, системному червоному вовчаку, гранулематозі з поліантититом.
У тестах на виявлення органоспецифічних антитіл методом ІФА у всіх обстежених хворих до лікування встановлено підвищений титр антитіл до нативної ДНК. Так, якщо враховувати, що рівень антитіл до активних ДНК у контрольній групі відповідав 0-1 од. Е, то у хворих на ОСД до проведення лікування даний показник значно зростав і становив (1,8 ± 0,05) од. Е (табл. 4.3).
Таблиця 4.3 – Концентрація органоспецифічних антитіл у хворих на ОСД до лікування
| Показники
Досліджувані групи |
Концентрація специфічних антинуклеарних антитіл методом імунофлюоресценції |
Концентрація специфічних антитіл до нативної ДНК методом ІФА, од. Е. |
| Контрольна група
(умовно-здорові донори) |
«-» | 0–1 |
| Хворі на ОСД до лікування | «++» | 1,8±0,05* |
Примітка. * – розбіжності істотні із достовірністю р < 0,05
Таким чином, можна відзначити, що концентрація специфічних антинуклеарних антитіл, яка виявляється методом імунофлюоресценції, у хворих ОСД до лікування відповідала «++».
Наявність антитіл, що специфічно зв’язуються, визначалася також методом імунофлюоресцентного аналізу на чипових слайдах з іммобілізованими стандартними субстратами: нейтрофілами, клітинами тимуса і поперечно-смугастого м’яза.
На рис. 4.6 наведено результати імунофлюоресцентного аналізу інтенсивного зв’язування специфічних антитіл з нейтрофільним субстратом у хворої М. з ОСД.
Рисунки 4.7 і 4.8 ілюструють зв’язування специфічних антитіл з ДНК і Р‑протеїном клітин тимуса у цієї ж хворої.
У хворої Г., 39 років, з виявленими антитілами до актину міофібрил виявлено, що мало місце формування активних клонів Т-лімфоцитів, висока гуморальна сенсибілізація і виражена лімфоцитотоксичність (рис. 4.9).
Рисунок 4.6 – Антинуклеарні ДНК на нейтрофільному субстраті у хворої з ОСД. Збільшення 40×10
Рисунок 4.7 – Антитіла до подвійної спіралі нативної ДНК на клітинах тимуса у хворої з ОСД. Збільшення 20×10
Рисунок 4.8 – Антитіла до Р-протеїну клітин тимуса у хворої з ОСД. Збільшення 40×10
Рисунок 4.9 – Антитіла до актину м’язових міофібрил у хворої з ОСД. Збільшення 20×10
У пацієнтів з ОСД поряд з показниками неспецифічної резистентності та гуморального імунітету до лікування досліджувалися також зміни середніх показників клітинного імунітету – експресію поверхневих маркерів диференціювання (CD) залежно від стану хворих (табл. 4.4).
Таблиця 4.4 – Рівень субпопуляцій лімфоцитів у хворих із ОСД до лікування
| Субпопуляції лімфоцитів | Контрольна група
(умовно-здорові донори) |
Хворі на ОСД
до лікування |
| CD2+, абс.к х 106 /л | 400,0±95,0 | 310,0±90,0 |
| CD2+, % | 16,3±3,4 | 22,6±3,3* |
| CD3+, абс.к х 106 /л | 1100,0±450,0 | 800,0±100,0 |
| CD3+, % | 62,0±6,5 | 43,8±4,6* |
| CD4+, абс.к х 106 /л | 600,0±195,0 | 690,0±180,0 |
| CD4+, % | 38,3±6,5 | 42,9±9,3 |
| CD8+, абс.к х 106 /л | 300,0±98,0 | 180,0±70,0 |
| CD8+, % | 23,4±4,4 | 19,0±2,0 |
| CD4+/CD8+ | 2,1±0,5 | 2,8±0,3 |
Примітка. * – розбіжності істотні із достовірністю р < 0,05
У пацієнтів з ОСД до лікування відзначалося пригнічення за деякими показниками Т-клітинного імунітету. Так, виявлено зниження на 29,0 % порівняно з контрольною групою відносної кількості найбільш значущої лімфоїдної субпопуляції CD3+ загальних Т-лімфоцитів. Також спостерігалося зменшення процентної кількості CD8+ – на 19,0 % відносно контролю.
Виявлено підвищення експресії диференціювального маркера CD2+ активних Т-лімфоцитів, що беруть участь у стимуляції В-клітин, на 30,0 % порівняно з контрольною групою здорових донорів. А рівень експресії CD4+ був вищим за контрольний на 12,0 %. Також спостерігалося підвищення (в 1,3 раза вище за референтні значення контрольної групи донорів) імунорегуляторного індексу CD4+/CD8+ до 2,8 ± 0,3 у групі ОСД до лікування, що вказує на наявність автоімунного процесу.
На рис. 4.10 наведено експресію кластера диференціювання CD2+.
Рисунок 4.10 – Експресія поверхневих маркерів диференціювання CD2+ на Т-лімфоцитах у хворої на ОСД. Збільшення 20×10
Аналіз отриманих результатів дослідження загальної резистентності та специфічних імунних реакцій у хворих на ОСД показав, що середні значення досліджуваних параметрів значно не відрізнялися від контрольних величин, за винятком показників, які характеризують високу гуморальну сенсибілізацію і ступінь ендогенної інтоксикації. Виявлено індивідуальний характер зміни показників резистентності та імунної відповіді, що залежав від стану хворих на ОСД.
У хворих із вираженою гуморальною сенсибілізацією і підвищеною активністю фагоцитозу спостерігалося, як правило, зниження експресії диференціювальних маркерів CD.
У деяких пацієнтів у прогресуючій стадії відзначали або імуносупресію в гуморальній та клітинній ланці, або надлишкову активацію неспецифічної резистентності і гуморальних реакцій, включаючи індуковану лімфоцитотоксичність і утворення антитіл до нативної ДНК.
В якості зручних прогностичних тестів перебігу захворювання можуть бути використані показники експресії маркерів клітинного диференціювання імунокомпетентних клітин – CD.
Активність білків системи комплементу і фагоцитуюча функція нейтрофілів мають важливе прогностичне значення, оскільки недостатність активності білків системи комплементу, надлишкова лімфоцитотоксичність і високий титр антитіл до ДНК є негативним прогностичним тестом перебігу дерматозу.
У чотирьох хворих із ОСД до лікування виявлено підвищення антитіл до нативної ДНК, що свідчить про розвиток виражених автоімунних реакцій. У хворих із дисфункціональними станами тимуса виявлено антитіла до Р‑протеїну і актину міофібрил міоїдних клітин тимуса, що свідчить про формування активних клонів Т-лімфоцитів, підвищену гуморальну сенсибілізацію і лімфоцитотоксичність.
4.2 Особливості біохімічних змін у хворих на обмежену склеродермію до проведення лікування
Програма досліджень передбачала вивчення особливостей структурно-метаболічного стану СТ у хворих із ОСД досліджуваних груп та у групі умовно-здорових пацієнтів.
Для цього у плазмі крові пацієнтів досліджуваних груп до лікування визначався вміст ГАГ, активність фермента еластази и КЛА плазми крові, які свідчать про стан структурно-метаболічних та обмінних процесів СТ при ОСД.
При вивченні структурно-метаболічного стану СТ у хворих із ОСД до лікування виявлено високу активність еластази, яка перевищувала даний показник в умовно-здоровій групі спостереження на 34 %. Вміст ГАГ у хворих із ОСД до лікування був підвищеним на 26 % порівняно з контрольною групою умовно-здорових донорів (табл. 4.5).
Таблиця 4.5 – Вміст ГАГ і активність еластази в плазмі крові хворих на ОСД до лікування
| Досліджувані групи | Показники, М±m | |
| Еластаза (пг/мл) | ГАГ
(мкмоль/л) |
|
| Контрольна група (умовно-здорові донори) | 27,3±1,8 | 35,8±1,2 |
| Хворі із ОСД до лікування | 41,5±11,6* | 48,5±5,4* |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
КЛА плазми крові не залежала від статі, добре корелювала з показниками активності і також була підвищеною (в 2,6 раза) у групі пацієнтів з ОСД до лікування порівняно з контрольною групою (табл. 4.6 і рис. 4.11).
Таблиця 4.6 – Динаміка рівня КЛА плазми крові (за оксипроліном) у хворих із ОСД до лікування
| Досліджувані групи | КЛА крові,
М±m (мкмоль оксипроліна/л·г) |
| Контрольна група
(умовно-здорові донори) |
7,4±0, 6 |
| Хворі із ОСД до лікування | 19,3±3,6* |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
Рисунок 4.11 – Динаміка рівня оксипроліна у хворих із ОСД до лікування й в умовно-здорових донорів
Як видно з даних табл. 4.6 і рис. 4.11, у пацієнтів з ОСД до лікування було виявлено достовірне збільшення оксипроліну. Рівні КЛА плазми крові у пацієнтів з ОСД до лікування перевищували дані умовно-здорових пацієнтів, що забезпечує цьому показнику важливе діагностичне і прогностичне значення при визначенні ступеня вираженості та локалізації осередків.
Таким чином, аналіз результатів проведених досліджень виявив ряд особливостей біохімічних показників і свідчить про те, що ОСД супроводжується глибокими порушеннями обміну СТ, які підтверджуються підвищенням активності еластази, КЛА сироватки крові та вмісту в ній ГАГ до лікування.
У групах хворих із ОСД до проведеного лікування і умовно-здорових донорів проведено дослідження рівня СРБ, концентрація якого зростає в сироватці крові при різних патологічних, запальних і деструктивних процесах і залежить від ступеня вираженості запального процесу (рис. 4.12).
У дослідженнях було показано, що у пацієнтів з ОСД концентрація СРБ була збільшеною до рівня 24 г/л, що в 4 рази була вищою, ніж у контрольній групі умовно-здорових донорів, і свідчила про перебіг гострої фази запального процесу.
Результати дослідження рівня концентрації магнію та хлору у хворих із ОСД залежно від перебігу захворювання до лікування наведено в табл. 4.7.
Рисунок 4.12 – Дослідження рівня СРБ у хворих на ОСД до лікування й в умовно-здорових донорів
Таблиця 4.7 – Показники рівня магнію та хлору у хворих із ОСД до лікування
| Показники
Досліджувані групи |
Магній, моль/л | Хлор, моль/л |
| Контрольна група (умовно-здорові донори) | 0,89 ± 0,18 | 102,50 ± 7,50 |
| Хворі з ОСД до лікування | 1,40 ± 0,21* | 95,56 ± 4,83 |
Примітка: * – розбіжності істотні із достовірністю Р > 0,95 (р < 0,05)
У сироватці крові хворих із ОСД до лікування виявлено достовірне підвищення вмісту магнію в 1,6 раза щодо контрольної групи здорових донорів і зниження рівня хлору в 1,1 раза, що характеризує наявність метаболічних порушень у даної категорії хворих, які зачіпають не тільки імунореактивність, а й водно-електролітний обмін.
Вивчення білкових фракцій сироватки крові показало наявність запального процесу у хворих на ОСД.
При дослідженні концентрації білкових фракцій сироватки крові у пацієнтів із ОСД до лікування виявлено зниження (на 10,0 %) альбумінової і α1‑глобулінової фракції та достовірне збільшення α2-глобулінової фракції (на 33 %) і β-глобулінової фракції (на 22 %) за рахунок збільшення концентрації СРБ, С3 і С4 білків системи комплементу.
Також у цій групі виявлено деяке зниження γ-глобулінової фракції (табл. 4.8).
Таблиця 4.8 – Вміст білкових фракцій сироватки крові у хворих із ОСД до лікування
| Показники
Досліджувані групи |
Білкові фракції, % | ||||
| Альбумін | Глобуліни | ||||
| a1 | a2 | b | g | ||
| Контрольна група (умовно-здорові донори) | 58,2 ± 4,1 | 3,2 ± 1,2 | 7,9 ± 1,5 | 12,5 ± 2,0 | 18,2 ± 2,9 |
| Хворі на ОСД до лікування | 52,5 ± 3,5 | 2,9 ± 0,6 | 12,2 ± 2,2* | 16,1 ± 0,9* | 16,3 ± 3,4 |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
При вивченні показників ліпідного обміну у хворих із ОСД до лікування були отримані наступні дані (табл. 4.9).
Виявлено зміни в рівні показників ліпідних фракцій у пацієнтів із ОСД при дослідженні до лікування. Відзначено знижений рівень загальних ліпідів (у 1,5 рази), холестерину (в 1,3 раза) і тригліцеридів (в 2,7 раза) щодо рівня контрольної групи здорових донорів. Концентрація ЛПВЩ, навпаки, була підвищеною в 2,7 раза порівняно з контролем і становила (2,1 ± 0,32) ммоль/л.
Таблиця 4.9 – Показники ліпідного обміну у хворих із ОСД до лікування
| Групи | Показники | |||||
| Загальні ліпіди, г/л | β-ліпо-протеїди ум.од. | Холестерин, ммоль/л | ЛПВЩ, ммоль/л | Триглі-цериди, ммоль/л | Коефіцієнт атеро-генності | |
| Контрольна група | 5,75 ± 2,30 | 44,5 ± 8,5 | 5,1 ± 0,8 | 0,79 ± 0,02 | 2,15 ± 0,8 | 2,5 ± 0,5 |
| Хворі з ОСД до лікування | 3,90 ± 0,34 | 45,7 ± 5,2 | 3,8 ± 0,3 | 2,1 ± 0,32* | 0,8 ± 0,03* | 0,34 ± 0,20* |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
Виходячи з цього, коефіцієнт атерогенності також був значно нижчим, ніж у контрольній групі (в 7,4 раза) і становив 0,34 ± 0,2.
Зміна показників ліпідного обміну і білкових фракцій додатково підтверджує порушення регуляторних і регенеративних функцій на рівні структурної організації клітинних мембран.
Підвищення вмісту магнію і зниження рівня хлору у хворих із ОСД до проведення лікування характеризує наявність глибоких метаболічних порушень у даної категорії пацієнтів, які зачіпають не тільки імунореактивність але й водно-електролітний обмін.
Слід зазначити, що аналіз досліджуваних показників загальної резистентності та специфічних імунних реакцій у хворих із ОСД не завжди дозволяє виявити наявність істотних змін імунореактивності до лікування. Однак індивідуальний аналіз неспецифічної резистентності та специфічної імунної відповіді у хворих дозволив виявити наявність серйозних змін у досліджуваних показниках до проведення лікування.
* * *
Проведені дослідження дозволили виявити в більшості випадків переважання значень досліджуваних показників у пацієнтів з ОСД до проведеного лікування. Було виявлено збільшення імунологічних показників (фагоцитарний індекс, фагоцитарне число, індекс завершення фагоцитозу, концентрація ПСММ, ЦІК, лімфоцитотоксичність, антитіла до нативної ДНК, антиядерні антитіла); біохімічних показників (збільшення СРБ, концентрації магнію, a2-, b-, g-фракції, b-ліпопротеїдів, ЛПВЩ та зниження концентрації хлору, альбуміну, a1-глобулінової фракції, загальних ліпідів, холестерину, тригліцеридів). Особливо слід зазначити збільшення рівня показників структурно-метаболічного стану СТ – еластази, ГАГ, КЛА плазми крові (за оксипроліном).
Дослідження показали, що комплексне визначення зазначених показників підвищує точність встановлення ступеня тяжкості перебігу дерматозу, вираженості процесу та прогнозу перебігу ОСД.
Зміст розділу відображено в наступних публікаціях:
- Кутасевич Я. Ф., Ата М. А. Особенности формирования синдрома иммуно-эндокринной дисфункции у больных очаговой склеродермией в стадии обострения. Международный медицинский журнал. 2019. № 1 (97). С. 75–79.
- Ата М. А. Прогнозирование развития иммунной дисфункции у больных очаговой склеродермией по состоянию некоторых звеньев иммунного ответа. Дерматологія та венерологія. 2019. № 1 (83). С. 14–19.
- Ата М. А. Особенности биохимических изменений у больных ограниченной склеродермией. ScienceRise: Medical Science. 2019. № 1 (28). С. 20–24.
РОЗДІЛ 5
ДИСТАНЦІЙНЕ ТЕРМОМЕТРИЧНЕ ДОСЛІДЖЕННЯ ЗМІНЕНИХ ШКІРНИХ ПОКРИВІВ У ХВОРИХ НА ОБМЕЖЕНУ СКЛЕРОДЕРМІЮ
У даний час медицина отримує все більш широкі діагностичні можливості, пов’язані перш за все з розвитком інструментальних методів і технічних засобів отримання інформації про функціонування та структурні властивості біологічного об’єкта. Розробка і вдосконалення статистичних комп’ютерних програм, програмних пакетів обробки цифрових сигналів та зображень сприяють створенню сучасних діагностичних методів, що більш вірогідно встановлюють кількісне співвідношення між вимірюваними фізичними параметрами і функціональними органічними характеристиками досліджуваного об’єкта.
Дистанційне тепловізійне обстеження тіла людини має велику перевагу перед деякими іншими способами одержання об’єктивної інформації щодо змін його температурного стану, що полягає в тому, що дослідник, отримуючи термограму значних ділянок поверхні шкіри, легко може виділити зони з найбільш низькими або, навпаки, високими значеннями температур, у подальшому акцентуючи увагу на обраних ділянках. Також даний метод дослідження неінвазивний, безпечний та абсолютно не має протипоказань.
Стає очевидним пошук шляхів оцінки стану осередків ураження – шкіри хворих на ОСД за допомогою термографії. При цьому, середня температура шкірних ділянок людини, що вимірюється, є фізичною величиною, яка інтегрально характеризує стан організму: наявність інфекцій, запальних реакцій, інтоксикації, дисфункції органів і систем. Разом з тим діагностичну інформацію містять і локально вимірювані значення температури, які можуть реєструватися контактним і безконтактним способом.
Слід підкреслити, що безконтактний тепловізійний метод визначення температури вигідно відрізняється від інших поєднанням високого температурного, просторового і тимчасового розв’язання.
Теплобачення є способом вимірювання та візуалізації теплового інфрачервоного випромінювання, що випускається всіма нагрітими тілами. Людське тіло, будучи джерелом теплового випромінювання, має неоднорідний поверхневий розподіл температури, яке видозмінюється як при наявності патологічних змін, прийомі лікарських препаратів або проведенні навантажувальних проб, так і при здійсненні природної терморегуляції організму. Висока чутливість просторово-часової динаміки температури до чинників, що впливають, говорить про широкі можливості діагностичних методів, що базуються на параметрах тепловізійних вимірювань. Разом з цим, у діагностиці стану будь-якого біологічного об’єкта існують свої труднощі. До них належать:
– морфологічна та функціональна складність об’єкта;
– різноманіття параметрів, що описують процеси життєдіяльності;
– складність контролю зовнішніх і внутрішніх факторів, що впливають на стан біологічного об’єкта;
– необхідність проведення комплексних досліджень;
– необхідність урахування різноманітних за фізичною природою причин виникнення похибок;
– специфічна форма і взаємопов’язаність сигналів різної фізичної природи, що мають інформацію про стан біооб’єкту.
Для неінвазивних температурних вимірювань найбільш доступною з тканин є шкіра, тому в більшості випадків теплобачення має справу з поверхневою шкірною тканиною. Шкіра людини має високий коефіцієнт випромінювання, значення якого є близьким до значення коефіцієнта випромінювання абсолютно чорного тіла (ε = 1), тому зміна її температури призводить до значної зміни потужності інфрачервоного випромінювання, яке випускається і детектується тепловізором. Низький коефіцієнт відображення шкіри в далекому інфрачервоному діапазоні мінімізує вплив нагрітих предметів навколишнього середовища на визначення температури ділянок шкіри. З використанням тепловізійної техніки це дозволяє з високою роздільною здатністю реєструвати точкову температуру, статичний розподіл температури і динаміку температурного розподілу.
Неоднорідний поверхневий розподіл температури тіла людини при незмінних оточуючих умовах обумовлений станом судин, наявністю в шкірі та підшкірних шарах кровоносних судин і капілярів, м’язів, внутрішніх органів, підшкірно-жирової клітковини, а також обмінними процесами, що відбуваються у внутрішніх органах.
Нагрівання ділянок тіла відбувається на 90 % за рахунок окислення вуглеводів у клітинах: кров, що постачає клітини різних тканин, нагрівається і переносить тепло, що утворилося, до поверхні, де воно може реєструватися тепловізором як інфрачервоне випромінювання.
Зміна поверхневого розподілу температури може відбуватися: при зміні зовнішніх умов, коли активізуються механізми терморегуляції у відповідь на зміну температури, конвективного теплообміну, вологості навколишнього середовища; у відповідь на заміну речовини навколишнього середовища, наприклад, при зануренні об’єкта в рідину; коли проявляються судинні реакції на штучне порушення; при фізичному навантаженні, коли відбувається активізація роботи груп м’язів, що призводить до зростання швидкості окислювальних процесів, споживання кисню, зміни серцевого ритму. При цьому змінюється загальна гемодинаміка тіла людини, відбувається поширення тепла у напрямку від ядра до поверхні, здійснюється терморегуляція за рахунок потовиділення (конвективна тепловіддача в повітря) і випромінювання в навколишнє середовище; при емоційному навантаженні, коли створюються умови легкого стресу, наприклад, складанням тестів із завданнями, що вимагають розумових затрат і виконуються в умовах обмеженого часу. Це може призводити до зміни хімічного складу крові шляхом вироблення гормонів, які впливають на тонус серцево-судинної системи і стан судин шкіри; при фармакологічній пробі, яка здійснюється шляхом введення в організм препаратів різного призначення з подальшим спостереженням зміни периферичного кровообігу.
Зміна поверхневого розподілу температури також може спостерігатися при впливі випромінювань у рамках наукових досліджень. У статичних термограмах діагностичну інформацію можна витягати з аналізу температурної асиметрії в контралатеральних ділянках, наприклад, шиї, грудей, спини, кінцівок одного і того ж об’єкта або при порівнянні термограми досліджуваного об’єкта з термограмою, що представляє розподіл температури в нормі.
Таким чином, температурний рельєф поверхні тіла людини залежить, у кінцевому підсумку, від рівня наповненості тканин кров’ю, від ступеня її нагрівання при функціональної активності м’язів і внутрішніх органів, від перерозподілу крові при регулюванні просвіту судин, а також від теплових властивостей тканини (теплопровідності, теплоємності). Ці параметри становлять основу тепловізійної діагностики і дають можливість визначити клас патології, що виявляється за допомогою реєстрації термограм.
Існують такі різновиди тепловізійних методів. Статичні тепловізійні методи ґрунтуються на отриманні та аналізі поодиноких тепловізійних знімків.
Динамічні тепловізійні методи базуються на отриманні та аналізі послідовності тепловізійних знімків. До конкретних сучасних динамічних методів належать: імпульсний метод, активний динамічний метод, імпульсно-фазовий метод, метод теплової томографії.
Імпульсний метод базується на проведенні обчислень функції температурного контрасту між патологічними і нормальними ділянками поверхні. Для спостереження динаміки температури використовується збудження нагріванням або охолодженням поверхні.
Активний динамічний метод ґрунтується на реєстрації температури у процесі нагрівання або охолодження, за отриманою залежністю ідентифікується математична модель поверхні, представленої у вигляді шарів, за допомогою якої визначаються властивості кожного шару. До схожої техніки належить тау-метод, який базується на виявленні характеристичного часу відновлення стабільної температури, зміненої примусовим охолодженням або нагріванням. Тау-метод виявляє патологічні ділянки шкіри, ґрунтуючись на відміні часу відновлення їх температури від часу відновлення здорових ділянок.
Імпульсно-фазовий метод базується на обчисленні амплітуди та фази температурної динаміки, на послідовності тепловізійних кадрів із використанням перетворення Фур’є. Даний метод поки не набув широкого застосування в медичній діагностиці.
Метод теплової томографії базується на вирішенні оберненої задачі визначення об’ємних властивостей об’єкта з розподілу температури на його поверхні. Даний метод успішно застосовується для оцінки об’ємного розподілу коефіцієнта теплопровідності, за яким оцінюється глибина опіку шкіри.
Мультиспектральні тепловізійні методи ґрунтуються на проведенні досліджень і зіставленні теплових властивостей об’єкта в декількох спектральних діапазонах.
Мультимодальні методи базуються на спільному використанні тепловізорів з вимірювальною апаратурою, яка отримує сигнал іншої фізичної природи. За класифікаційними ознаками причини температурного відхилення на термограмах ОСД є варіантом дерматологічної категорії серед хронічних системних дерматозів на тлі дисфункції нейроендокринної та імунної систем у вигляді іміджу соматосенсорних нейронних розладів.
Теплобачення за статичним температурним розподілом і його динамікою в часі виявляє функціональну активність осередків склеродермії різних ділянок тіла хворого на ОСД. Рівень перфузії крові та тонічний стан приповерхневих судин є одними з основних чинників, що визначають поверхневий розподіл температури. Вивчення процесів кровообігу і теплової інерції поверхні за допомогою реєстрації її температури становить інтерес для діагностики ОСД, що супроводжується судинною дисфункцією. Ця обставина ще раз підкреслює важливу роль мікроциркуляції крові в розподілі енергії, що поглинається поверхнею шкіри.
Зміни мікроциркуляції, що характерні для ОСД, обумовлені як ураженням самої судинної стінки, що призводе до порушення кровопостачання органів і тканин, так і зміною плазмових і клітинних властивостей крові. Крім того, навіть при обмежених варіантах склеродермії є загальні ознаки ураження судин з розвитком характерних мікроциркуляторних порушень на рівні капілярів, які виявляються тільки шляхом спеціальних інструментальних методів дослідження.
Разом з тим, випадкове штучне порушення кровообігу та судинні реакції, що відбуваються при цьому, істотно змінюють характер температурного відгуку шкірних покривів у ділянках склеродермічних осередків на зовнішні впливи.
Це дає можливість досліджувати і розробляти діагностичні методики, що ґрунтуються на чутливості часових залежностей температури до різних видів зовнішніх навантажень і на виявленні нормальної та патологічної реакції в ділянках склеродермічних осередків.
5.1 Характеристика даних термографії в ділянці шкірного осередку обмеженої склеродермії у хворих до та після лікування
При аналізі інфрачервоних зображень чутливих патологічно змінених ділянок поверхні склеродермічних осередків шкіри хворого з метою виключення артефактів при діагностиці необхідно враховувати вплив зовнішніх умов, які можуть надто змінити значення температури шкіри людини і температурну топографію поверхні тіла.
З метою усунення можливого впливу на результати вимірювань факторів похибки при проведенні термографічної дослідницької процедури ретельно дотримувалися наступних умов:
- Вимірювання температур проводилося в термонейтральній зоні, тобто в діапазоні комфортних температур (для роздягненої людини комфортна температура повітря в приміщенні кабінету при нормальному тиску і вологості та відсутності примусової вентиляції становить близько 22-24 °С).
- До початку обстеження пацієнту дозволяли пройти температурну адаптацію в приміщенні з температурою, близькою до температури кабінету, протягом 30 хвилин.
- Усі дослідження проводили виключно в позі пацієнта стоячи, оскільки інфрачервоні портрети лежачої людини та людини, що стоїть, розрізняються;
- Площа приміщення кабінету для тепловізійного дослідження становить понад 20 м2, у ньому відсутні нагрівальні прилади спрямованої дії. Для освітлення кабінету використані лампи денного світла, що не створюють інтенсивних теплових полів.
- Спільно з термографічним дослідженням у кабінеті паралельно проводилася термометрія повітря для контролю змін зовнішніх температурних умов. Строго дотримувалися умов білатеральної фотографічної симетрії (досліджувана та контрольна ділянки мали знаходитися на рівній відстані від об’єктива тепловізора).
Для безпосереднього аналізу термограм використовувалося програмне забезпечення, що входить у комплект поставки тепловізійного комплексу, при обробці за допомогою вбудованих інструментів виділялися ділянки з максимальними (уражену ділянку) і мінімальними (контрольну ділянку) значеннями температур. Дані значення будуть використані для їх подальшого математичного аналізу.
Таким чином, кореляція даних про теплову інерцію, визначену за допомогою тепловізора, та даних про швидкість кровотоку, що вимірювалася за допомогою доплеровського сканеру, говорить про можливість використання тепловізора для дослідження поверхневої перфузії крові.
Дистанційне тепловізійне обстеження тіла людини має величезну перевагу перед деякими іншими способами отримання об’єктивної інформації про зміни його температурного стану. Це полягає в тому, що дослідник, отримуючи термограму значних ділянок поверхні шкіри, легко може виділити зони з найбільш низькими або, навпаки, високими значеннями температур, у подальшому акцентуючи увагу на обраних ділянках. Також даний метод дослідження неінвазивний, безпечний і абсолютно не має протипоказань.
Деяким пацієнтам з ОСД, які знаходилися на лікуванні у клініці ДУ «Інститут дерматології та венерології НАМН України», за «сліпою» вибіркою проведено термометричне дослідження.
У групу дослідження увійшли 26 хворих на ОСД у віці від 17 до 65 років, з них 24 (92,3 %) – жінки, 2 (7,7 %) – чоловіки. При дистанційній термографії в проекції склеродермічних осередків до проведення лікування у 24 (92,3 %) пацієнтів досліджуваної групи у прогресуючій стадії (наявність віночка лілового, рожево-синюшного кольору з фіолетовим відтінком, який переходив в незмінену шкіру, що по суті й було критерієм активності процесу) були виявлені ділянки гіпертермії, що свідчило про наявність запалення в зазначених осередках (рис. 5.1–5.3).
Рисунок 5.1 – Термограма (а) та фото (б) хворої Ч., 54 років, ОСД у прогресуючій стадії до проведення лікування
Рисунок 5.2 – Термограма (а) та фото (б) хворої К., 59 років,обмежена розповсюджена склеродермія у прогресуючій стадії
до проведення лікування
Рисунок 5.3 – Термограма (а) та фото (б) хворого В., 40 років,ОСД у прогресуючій стадії до проведення лікування
Як правило, найвищі значення температури у хворих у прогресуючій стадії до проведення лікування фіксувалися ексцентрично, з їх максимумом у зонах, розташованих трохи нижче склерозованого осередку (рис. 5.4).
Рисунок 5.4 – Термограма (а) і фото (б) хворої К., 32 років у прогресуючій стадії до проведення лікування
У той же час у хворих у прогресуючій стадії при дещо більшій величині склеродермічного осередку, появі набряку м’яких тканин у його зоні, суб’єктивній болісності ураженої анатомо-функціональної ділянки тіла, зміни на термограмі до проведення лікування мали достатньо чіткий і однозначний характер (рис. 5.5).
Також у 2 (7,7%) пацієнтів в стадії атрофії шкіри, в проекції склеродермічних осередків при дистанційній термографії були виявлені ділянки гіпотермії, що свідчило про наявність процесів склерозування в даних осередках.
Після проведеної терапії у хворих досліджуваних груп спостерігалася наступна тепловізійна картина осередків запалення. Зокрема, звертаючи увагу на розміри патологічно зміненої шкіри і ступінь підвищення температури в даній ділянці, відзначали візуально наявність чіткої кореляційної залежності між цими величинами. При ураженнях відносно невеликої величини, які часто вже не супроводжуються наявністю суб’єктивних проявів, скарг з боку хворого на ОСД, не спостерігалося порушень симетричності розподілу температур щодо вертикальної вісі тіла (рис. 5.6–5.7).
Рисунок 5.5 – Термограми (а) і фото (б) хворої Г., 57 років, із ОСД у прогресуючій стадії до проведення лікування
Рисунок 5.6 – Термограма (а) і фото (б) хворого Р., 53 років, із ОСД після проведення курсу комплексної терапії
Рисунок 5.7 – Термограма (а) та фото (б) хворого М., 22 років, із ОСД після проведення курсу комплексної терапії
Слід підкреслити, що при регресі візуальних проявів склеродермії на шкірі (зменшення щільності, набряку та регрес облямівки) при дистанційній термографії було виявлено ділянки гіпертермії, що свідчило про наявність пролонгації запальних процесів у проекції даних осередків та потребувало продовження лікування цим хворим, а також ділянки гіпертермії в низці випадків (8 хворих) виявлялися до появи клінічних ознак прогресування захворювання.
Було встановлено пряму залежність між клінічними проявами, лабораторними змінами і ділянками гіпертермії у 15 пацієнтів обстежуваної групи (57,7 %). Також пряму залежність між клінічними проявами та ділянками гіпертермії було виявлено у 11 обстежуваних хворих, що склало 42,3 %. У 2 пацієнтів групи, що обстежувалася (7,7 %), встановлено пряму залежність між клінічними проявами у вигляді атрофії шкіри в осередках ураження і ділянками гіпотермії на термограмах.
Проведені раніше дослідження і методики дистанційного тепловізійного обстеження тіла людини, які базуються на реєстрації поверхневої температури, передбачають її вимір у центральній ділянці зміненої шкіри з прийняттям в якості контролю зони, віддаленої від нього на відстань, яка дорівнює його діаметру або належить симетричній ділянці тіла.
Проводячи своє дослідження, відразу ж були змушені виключити такі умови, що підлягали суворому дотриманню, тому що навіть на найперших етапах своєї роботи було констатовано, що далеко не в усіх випадках ділянка максимальних значень температури ураження відповідала його геометричному центру, що пояснюється стадійністю процесу і особливостями осередку при ОСД: склерозування в центральній частині і прогресування шляхом периферичного зростання, формування зони запалення й індурації в периферичних відділах осередку в прогресуючій стадії.
Надалі неодноразово були отримані підтвердження даного твердження, що потребувало корекції методики отримання числової інформації про температуру патологічного шкірного осередку склеродермії.
Зокрема, було вирішено досліджувати всю ділянку, уражену патологічною зміною у вигляді локального склеродермічного осередку, порівнюючи її з симетричною ділянкою тіла і при наявності достовірних їх відмінностей, фіксувати її максимальну і мінімальну температури, приймаючи їх як величини для подальшої обробки за допомогою математичного аналізу. Середні значення поверхневої температури за даними проведеної термометрії ділянок тіла в їх симетричному порівнянні наведено в табл. 5.1.
Таблиця 5.1 – Симетричність температур тіла хворих на ОСД
| Ділянка | t зліва, °С | t справа, °С | Середня t, °С | n |
| Шия | 33,7 ± 0,1 | 33,8 ± 0,1 | 33,8 | 2 |
| Груди | 33,7 ± 0,1 | 33,5 ± 0,1 | 33,6 | 4 |
| Живіт | 34,5 ± 0,1 | 34,6 ± 0,1 | 34,4 | 6 |
| Спина | 33,5 ± 0,1 | 33,6 ± 0,1 | 33,6 | 4 |
| Сідниці | 33,2 ± 0,1 | 33,3 ± 0,1 | 33,2 | 1 |
| Плечі | 32,9 ± 0,1 | 32,7 ± 0,2 | 32,8 | 1 |
| Передпліччя | 32,3 ± 0,1 | 32,4 ± 0,1 | 32,4 | 3 |
| Стегна | 32,7 ± 0,1 | 32,6 ± 0,1 | 32,6 | 2 |
| Гомілки | 31,9 ± 0,2 | 32,3 ± 0,2 | 32,2 | 3 |
| Усього спостережень | 26 | |||
Як випливає з представлених у таблиці даних спостережень, середня температура вивчених ділянок практично повністю відповідала літературним даним, а розподіл температур щодо осі симетрії тіла у них був незначним.
Для математичного підтвердження даного положення спільно зі співробітниками Національного технічного університету «Харківський політехнічний інститут» проведено статистичне дослідження, що полягає в парному порівнянні отриманих значень температур між собою з використанням методу Данна.
Вибір того чи іншого методу парного порівняльного аналізу (Стьюдента, Данна та ін.) обумовлений характером розподілу даних у досліджуваних групах і дотриманням правила рівності дисперсій. Виходячи із зазначених умов, робиться висновок на користь параметричних або непараметричних методів статистичного аналізу.
Відповідно, на першому етапі дослідження необхідно було переконатися в тому, що розподіл числових даних у порівнюваних групах характеризується нормальним типом, для чого далі був проведений розрахунок асиметрії та ексцесу за допомогою статистичної програми SPSS 13,0 for Windows (табл. 5.2).
Таблиця 5.2 – Значення асиметрії та ексцесу, що характеризують тип розподілу даних у групах досліджуваних ділянок тіла
| Ділянка | Зліва | Справа | ||
| Асиметрія | Ексцес | Асиметрія | Ексцес | |
| Шия | 0,328 | 1,425 | –0,856 | 0,843 |
| Груди | 1,042 | 0,775 | –0,227 | 0,284 |
| Живіт | –0,652 | 0,183 | 0,375 | 0,352 |
| Спина | –0,183 | –1,932 | 0,583 | –0,968 |
| Сідниці | 0,382 | –0,780 | 1,572 | 0,295 |
| Плечі | 1,003 | 0,337 | –0,998 | 0,994 |
| Передпліччя | 0,629 | 1,845 | 1,328 | 0,162 |
| Стегна | –0,283 | 1,005 | –0,552 | 1,056 |
| Гомілки | 0,643 | 0,386 | 0,372 | –1,633 |
Як випливає з наведеної таблиці, розподіл даних у порівнюваних групах відрізнявся від нормального типу. Як наслідок, стає очевидним вибір на користь непараметричних методів статистичного аналізу, а перевірка рівності дисперсій не є необхідною. Як і багато інших непараметричних методів, критерій Данна вираховувався, виходячи з рангів, які присвоювалися значенням у досліджуваних групах (табл. 5.3).
Таблиця 5.3 – Значення середнього рангу та кількості спостережень у досліджуваних групах
| Ділянка | Середній ранг | n | |
| Зліва | Справа | ||
| Шия | 54,4 | 23,7 | 2 |
| Груди | 43,3 | 56,4 | 4 |
| Живіт | 65,6 | 32,3 | 6 |
| Спина | 23,6 | 47,7 | 4 |
| Сідниці | 54,3 | 37,5 | 1 |
| Плечі | 77,8 | 56,2 | 1 |
| Передпліччя | 34,4 | 53,8 | 3 |
| Стегна | 26,6 | 74,5 | 2 |
| Гомілки | 34,5 | 42,4 | 3 |
| Усього спостережень | 26 | ||
Результати порівняння за критерієм Данна представлені у табл. 5.4.
Таблиця 5.4 – Обчислене значення критерію Данна у співвідношенні з його критичною величиною для порівнюваних пар при Р > 0,95
| Ділянка | Критерій Q | Критичне значення |
| Шия | 1,732 | 3,368 |
| Груди | 0,273 | 3,368 |
| Живіт | 0,338 | 3,261 |
| Спина | 1,854 | 3,529 |
| Сідниці | 1,006 | 3,124 |
| Плечі | 0,463 | 3,368 |
| Передпліччя | 0,554 | 3,529 |
| Стегна | 1,062 | 3,699 |
| Гомілки | 0,884 | 3,744 |
Як випливає з результатів парного порівняльного аналізу, поверхнева температура симетричних ділянок одних і тих же ділянок тіла в нормі достовірно не розрізнялася.
Таким чином, оскільки температура симетричних ділянок різних регіонів тіла в нормі достовірно не розрізнялася, існує можливість прийняття в якості контрольної величини значення температури ділянки, симетричної ураженій ОСД.
У деяких випадках (при розташуванні ураження на всій площі осередку склеродермії аналізованої поверхні тіла) це було враховано.
Значення асиметрії та ексцесу показників, що характеризують тип розподілу значень температури в ділянках ураженої та здорової шкіри, наведено в табл. 5.5.
Таблиця 5.5 – Значення асиметрії та ексцесу, що характеризують тип розподілу значень температури у ділянках ураженої та здорової шкіри
| Ділянка | Ділянки ураженої шкіри | Ділянки здорової шкіри | ||
| Асиметрія | Ексцес | Асиметрія | Ексцес | |
| Шия | 0,228 | -0,709 | 0,372 | -0,473 |
| Груди | 0,484 | 0,111 | 0,734 | 0,337 |
| Живіт | -0,389 | -0,428 | -0,326 | 0,328 |
| Спина | 0,419 | -0,761 | 0,462 | -0,228 |
| Сідниці | 0,228 | -0,514 | -0,538 | -0,853 |
| Плечі | -0,075 | -0,360 | -0,274 | 0,483 |
| Передпліччя | 0,110 | -0,072 | 0,446 | -0,112 |
| Стегна | 0,327 | 0,112 | 0,285 | 0,327 |
| Гомілки | 0,538 | 0,026 | -0,574 | -0,437 |
Оскільки порівнювані групи характеризувалися нормальним типом розподілу, на наступному етапі дослідження було проведено перевірку рівності дисперсії з використанням F-критерію, яка показала наступні результати, наведені в табл. 5.6.
Таблиця 5.6 – Результати перевірки рівності дисперсій порівнюваних груп
| Ділянка | Значення F обчислене | Значення F критичне |
| Шия | 1,453 | 2,950 |
| Груди | 1,004 | 3,310 |
| Живіт | 1,743 | 2,750 |
| Спина | 1,008 | 2,750 |
| Сідниці | 1,983 | 3,180 |
| Плечі | 1,116 | 3,110 |
| Передпліччя | 1,128 | 3,090 |
| Стегна | 1,743 | 2,950 |
| Гомілки | 1,097 | 2,750 |
З даних таблиці випливає, що вимога рівності дисперсій для аналізованих груп дотримувалася, що призвело до можливості застосування параметричних методів парного порівняльного аналізу, в якості якого, на даному етапі, адекватно було застосовано метод порівняння середніх із використанням t‑критерію Стьюдента (табл. 5.7).
Таблиця 5.7 – Обчислене значення критерія Стьюдента у співвідношенні до його критичної величини для порівняльних пар
| Ділянка | Значення t обчислене | Значення t критичне |
| Шия | 5,843 | 2,101 |
| Груди | 6,328 | 2,101 |
| Живіт | 6,093 | 2,080 |
| Спина | 5,374 | 2,080 |
| Сідниці | 8,682 | 2,110 |
| Плечі | 7,438 | 2,120 |
| Передпліччя | 4,218 | 2,120 |
| Стегна | 3,273 | 2,101 |
| Гомілки | 5,943 | 2,080 |
Як випливає з результатів парного порівняльного аналізу, поверхневі температури зміненої та здорової ділянок шкіри достовірно різнилися. Отже, застосований для проведення експериментального дослідження тепловізор ТК‑1, незважаючи на відносно невелику його роздільну здатність, міг був цілком коректно використаний для отримання об’єктивної кількісної інформації про температуру патологічно змінених ділянок хворих на ОСД.
Оскільки в задачах дослідження стояла мета – термодіагностика шкірних покривів при ОСД, то не можна було залишити без уваги можливість реєстрації за допомогою тепловізора змін температури в ділянці осередків. Показовим і вірним, з точки зору статистичного дослідження, був розподіл температур за давністю перебігу захворювання і порівняння їх диференціальних показників (різниці між значенням температури в ділянках ураженої та здорової шкіри) між собою.
Для цього були тимчасово об’єднані всі розглянуті вище групи різних ділянок тіла людини і проведено їх розбивку за часом перебігу ОСД без урахування локалізації ураження шкірних покривів.
Показники диференціальної температури протягом доби перебігу ОСД подано в табл. 5.8.
Таблиця 5.8 – Значення диференціальної поверхневої температури (At) відповідно до давності перебігу захворювання ОСД
| Давність захворювання ОС | At | Стандартне відхилення | n | Помилка середнього |
| До 1 року | 2,568 | 0,264 | 4 | 0,054 |
| 1–5 років | 2,064 | 0,421 | 16 | 0,064 |
| Більше 5 років | 1,002 | 0,265 | 6 | 0,044 |
Проведена перевірка розподілу даних у сформованих групах показала, що вони характеризувалися типом розподілу, відмінним від нормального, у зв’язку з чим для порівняльного аналізу найбільш доцільним стало використання непараметричних методів статистичного аналізу (табл. 5.9).
Таблиця 5.9 – Значення асиметрії та ексцесу, що характеризують тип розподілу значень в аналізованих групах
| Давність захворювання ОС | Асиметрія | Ексцес |
| До 1 року | 1,249 | 0,652 |
| 1-5 років | 1,843 | 0,263 |
| Більше 5 років | 0,983 | 0,962 |
Відповідно, як і раніше, використовувався метод Данна, який є непараметричним аналогом добре відомого способу Ньюмена-Кейлса. Ранги значень у досліджуваних групах, розподілені за принципом збільшення параметра, наведено в табл. 5.10.
Таблиця 5.10 – Значення середнього рангу і кількість спостережень у порівнюваних групах
| Давність захворювання ОС | Середній ранг | n |
| До 1 року | 76,43 | 4 |
| 1–5 років | 64,21 | 16 |
| Більше 5 років | 22,73 | 6 |
| Всього спостережень | 26 | |
Таким чином, температура ураженої ділянки шкіри хворого з ОСД, достовірно змінюючись залежно від тривалості захворювання ОСД, об’єктивно реєструється тепловізором ТК-1, який, відповідно, може бути використаний для об’єктивної констатації наявності та діагностики градієнта температур у зоні шкірного осередку у хворих на ОСД.
Проте, для створення однорідних груп і високої достовірності суджень, що є необхідною умовою будь-якого наукового дослідження, розробці критеріїв і способів їх використання має передувати перевірка залежності їх від комплексу факторів, які враховувалися, що представлено в наступному підрозділі.
5.2 Вибір адекватної зони дослідження поверхневої температури тіла в ділянці шкірного осередку обмеженої склеродермії
Регіонарні особливості зміни температури тіла людини у відповідь на наявність ОСД. Різні регіони тіла людини, маючи в нормі індивідуальну середню температуру, зумовлену існуванням особливостей у ступені їх кровопостачання й іннервації, демонструють різну здатність до адаптації при ОСД.
Природно, що наявність таких особливостей зумовлює необхідність вивчення температури шкіри уражених зон різної регіонарної приналежності.
Для перевірки припущення про наявність індивідуальних відмінностей середніх температур досліджених ділянок тіла з осередками склеродермії залежно від їх регіонарної приналежності був проведений порівняльний міжгруповий аналіз.
Як і раніше, проведенню його передувало дослідження груп на дотримання рівності дисперсій і приналежність їх до нормального типу розподілу, дані про що наведені в табл. 5.11 і 5.12.
Таблиця 5.11 – Значення асиметрії та ексцесу диференціальної температури груп синців різної регіонарної приналежності
| Ділянка | Асиметрія | Ексцес |
| Шия | 0,372 | –0,572 |
| Груди | 0,845 | –0,463 |
| Живіт | –0,362 | 0,734 |
| Спина | –0,563 | 0,463 |
| Сідниці | 0,372 | –0,533 |
| Плечі | –0,673 | –0,112 |
| Передпліччя | –0,574 | 0,856 |
| Стегна | 0,472 | 0,432 |
| Гомілки | 0,286 | –0,226 |
Таблиця 5.12 – Результати перевірки рівності дисперсій порівнюваних груп (обчислене значення F у співвідношенні з критичним)
| Гомілки | Стегна | Передпліччя | Плечі | Сідниці | Спина | Живіт | Груди | |
| Шия | 1,151* | 1,463* | 1,432* | 1,194* | 1,057* | 1,055* | 1,185* | 1,351* |
| Груди | 1,174* | 1,083* | 1,060* | 1,131* | 1,278* | 1,280* | 1,140* | |
| Живіт | 1,030* | 1,234* | 1,209* | 1,008* | 1,121* | 1,123* | ||
| Спина | 1,091* | 1,386* | 1,357* | 1,132* | 1,001* | |||
| Сідниці | 1,089* | 1,384* | 1,355* | 1,130* | ||||
| Плечі | 1,038* | 1,225* | 1,199* | |||||
| Передпліччя | 1,244* | 1,021* | ||||||
| Стегна | 1,271* |
Примітка. * – вимога рівності дисперсій дотримується
Оскільки вимогу рівності дисперсій дотримано, коректним є використання параметричних методів статистичного аналізу, в якості яких був використаний метод множинного парного порівняння середніх із використанням критерію Ньюмена-Кейлса – q (табл. 5.12).
Згідно з даними, отриманими в ході проведення тепловізійного обстеження пацієнтів із ОСД, параметри з використанням точніших способів порівняльного міжгрупового аналізу представлено у табл. 5.13.
Як випливає з даних таблиці, між деякими величинами, що порівнювалися, виявлено значущі відмінності, про що свідчили високі значення отриманих коефіцієнтів, які перевищували рівень критичної величини q.
Таким чином, оскільки середні температури змінених ділянок тіла з наявністю ділянок осередкового склеродермічного ураження різної регіонарної приналежності в деяких випадках достовірно відрізнялися, при проведенні подальшого аналізу було прийнято рішення сформувати ряд груп за ознакою локалізації поразки в одній з анатомо-функціональних областей тіла, об’єднавши відповідним чином групи, в яких зазначених відмінностей виявлено не було.
Таблиця 5.13 – Значення коефіцієнта Ньюмена-Кейлса для порівнюваних локалізацій осередків ОСД
| Плечі | Гомілки | Передпліччя | Стегна | Сідниці | Спина | Груди | Живіт | |
| Шия | 4,048* | 4,032* | 3,899* | 3,678* | 3,426* | 3,128* | 3,064* | 3,012* |
| Груди | 3,639* | 3,443* | 3,241* | 3,002 | 2,863 | 2,521 | 2,008 | |
| Живіт | 3,484* | 3,246* | 2,986 | 2,642 | 2,122 | 2,002 | ||
| Спина | 3,624* | 3,422* | 3,126* | 2,622 | 1,628 | |||
| Сідниці | 2,086 | 2,002 | 1,826 | 1,422 | ||||
| Плечі | 2,000 | 1,968 | 1,623 | |||||
| Передпліччя | 1,344 | 1,242 | ||||||
| Стегна | 1,322 |
Примітка. * – наявність достовірних відмінностей (Р > 95).
Залежність величини температури патологічно зміненої ділянки тіла від площі ураження шкірних покривів ОСД. Обробляючи отримані термограми, було констатовано залежність температурної реакції від стадії ОСД та її величини від ступеня поширеності ураженого осередку шкіри (рис. 5.8).
Таким чином, припустивши існування залежності між величиною ураження шкірних покривів і ступенем зміни температури, було проведено перевірку даної гіпотези шляхом порівняння між собою уражень, що розрізнялися за розмірними характеристиками, але були абсолютно ідентичними за локалізацією.
Природно, що в такому разі, для створення умов проведення коректного подібного аналізу був потрібний набір значної кількості матеріалу, що, беручи до уваги жорсткі вимоги до його однорідності, складно здійснити на практиці. Варіантом виходу з даної ситуації з’явилося порівняння між собою температур «крайніх варіантів» ураження шкірних покривів мінімальних і максимальних з усіх зареєстрованих розмірів.
Рисунок 5.8 – Термограма (а) та фото (б) хворої К., 28 років, на обмежену розповсюджену склеродермію
З урахуванням вищевикладеного було сформовано дві підгрупи:
– підгрупа А – невелике ураження – наявність ділянки склеродермічного ураження площею не більше 2 см2 без наявності набряку м’яких тканин і суб’єктивних проявів у вигляді скарг хворого на біль у його ділянці;
– підгрупа Б – ураження великих розмірів – наявність осередку склеродермії площею не менше 16 см2 без набряку м’яких тканин або з наявністю такого і зі скаргами хворого на болісність у його ділянці у спокої або при обмацуванні.
Розподіл даних у сформованих групах характеризувався нормальним типом (табл. 5.14).
При перевірці рівності дисперсій обчислене значення F-критерію склало 1,449, що при кількості спостережень, яке дорівнює 20, і встановленому критичному значенні F, яке дорівнює 2,850, для Р > 0,95 свідчило про виконання цієї умови і можливість використання для порівняльного аналізу критерію Стьюдента (табл. 5.15).
Таблиця 5.14 – Характеристика розподілу даних про площу ураження у підгрупах
| Площа ураження шкіри | Асиметрія | Ексцес |
| А – невелике ураження шкіри | 0,372 | 0,652 |
| Б – ураження великих розмірів | -0,118 | 0,396 |
Таблиця 5.15 – Середні значення диференціальної температури в підгрупах і результати їх порівняльного аналізу
| Площа ураження шкіри | At, °С | СКВ | Помилка середнього значення At | n |
| Невелике ураження шкіри | 0,378 | 0,162 | 0,057 | 14 |
| Ураження великих розмірів | 1,784 | 0,195 | 0,056 | 12 |
| Критерій Стьюдента | 17,507 | Критичне значення t | 2,093 | |
Примітка: At – середнє значення диференційної температури, °С; СКВ – середньоквадратичне відхилення; n — кількість спостережень
Обчислення значення критерію Стьюдента перевищувало його критичну величину, бо свідчило про наявність достовірних відмінностей порівнюваних підгруп, а висунута раніше гіпотеза про існування залежності між розмірами склеродермічного осередку і величиною температурної реакції шкіри на наявність ураження ділянки шкірних покривів вважалася підтвердженою.
При комплексному обстеженні хворих на ОСД з використанням дистанційної термографії було виявлено пряму залежність між ділянками гіпертермії, запальними клінічними проявами та лабораторними змінами у 15 пацієнтів (57,7 %), між ділянками гіпертермії та запальними клінічними проявами у 11 осіб (42,3 %). Також встановлено пряму залежність між ділянками гіпотермії на термограмах та клінічними проявами у вигляді атрофії шкіри в осередках ураження у 2 пацієнтів (7,7 %).
Теплобачення за статичним температурним розподілом та його динамікою в часі виявляє функціональну активність осередків склеродермії різних ділянок тіла хворого на ОСД. Рівень перфузії крові та тонічний стан поверхневих судин є одними з основних чинників, що визначають поверхневий розподіл температури. Вивчення процесів кровообігу та теплової інерції поверхні за допомогою реєстрації її температури представляє інтерес для діагностики ОСД, що супроводжується судинною дисфункцією. Ця обставина ще раз підкреслює важливу роль мікроциркуляції крові у розподілі енергії, що поглинається поверхнею шкіри.
Зміни мікроциркуляції, що характерні для ОСД, зумовлені як ураженням самої судинної стінки, що призводе до порушення кровопостачання органів та тканин, так і зміною плазмових і клітинних властивостей крові. Крім того, навіть при обмежених варіантах склеродермії є загальні ознаки ураження судин із розвитком характерних мікроциркуляторних порушень на рівні капілярів, які виявляються тільки спеціальними інструментальними методами дослідження.
Таким чином, даний метод дозволяє судити про активність сполучнотканинного запалення або процесів склерозування в осередках ураження у пацієнтів з ОСД та надає можливість застосування дистанційної термографії як неінвазивного метода діагностики рецидивів у хворих з автоімунними захворюваннями СТ на доклінічному етапі, а також дає можливість застосування даної методики в якості неінвазивного методу діагностики рецидивів ОСД.
* * *
Тепловізійне обстеження переважає перед іншими способами одержання інформації щодо змін температурного стану тіла, тому що дослідник, при отриманні термограмми ділянок поверхні шкіри, легко може виділити зони з найбільш критичними значеннями температур, у подальшому акцентуючи увагу на обраних ділянках.
У дослідженні встановлено пряму залежність між клінічними проявами, зміною лабораторних показників та гіпертермованими ділянками у 15 пацієнтів (57,7 %). Проведене статистичне визначення, а саме порівняння отриманих значень температур між собою за методом Данна дозволило обґрунтувати температурну реакцію на ураження та залежність її від ступеня розповсюдженості ділянки шкіри. Це може служити передумовою вдосконалення постановки діагнозу та призначення адекватної лікувальної терапії або профілактики даного виду дерматозу.
Даний метод дозволяє судити про активність сполучнотканинного запалення або процесів склерозування в осередках ураження у пацієнтів з ОСД та надає можливість застосування дистанційної термографії як неінвазивного метода діагностики рецидивів у хворих з автоімунними захворюваннями СТ на доклінічному етапі.
Зміст розділу відображено в наступних публікаціях:
- Ата М. А. Дистанционное термометрическое исследование измененных кожных покровов у больных очаговой склеродермией. Дерматологія та венерологія. 2018. № 2 (80). С. 50–53.
- Применение современных способов диагностики очаговой склеродермии / Янина Кутасевич, Ирина Олейник, Мохамед Ата, Петр Замятин, Константин Дубровский. Spatial aspects of socio-economic systems development: the economy, education and health care. Monograph. Opole, Poland : Publishing House WSZiA, 2015. P. 258–265.
- Олійник І.О., Ата М.А., Кордон Т.В.Стан мікроциркуляторного русла шкіри при обмеженої склеродермії. Матеріали науково-практичної конф. з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», м. Харків, 10-11 листопада 2017. Дерматологія та венерологія. 2017. № 3 (77). С. 109.
РОЗДІЛ 6
РОЗРОБКА НОВИХ МЕТОДІВ ЛІКУВАННЯ ХВОРИХ НА ОБМЕЖЕНУ СКЛЕРОДЕРМІЮ ТА ДИНАМІКА ІМУНОЛОГІЧНИХ І БІОХІМІЧНИХ ПОКАЗНИКІВ У ПРОЦЕСІ ЛІКУВАННЯ
6.1 Розробка нових методів терапії хворих на обмежену склеродермію та вивчення їх терапевтичної ефективності
Основна мета терапії ОСД – уповільнити прогресування хвороби, досягти максимальної стабілізації процесу, а далі регресу клінічної картини. Хворі на ОСД мають отримувати комплексне, патогенетично обґрунтоване диференційоване лікування, з урахуванням клінічної форми, стадії, лабораторних показників, індивідуальних особливостей хворого.
Базова терапія передбачала застосування антифіброзних, дезінтоксикаційних, вазоактивних, нестероїдних протизапальних препаратів, гепатопротекторів, вітамінів за стандартними методиками. Місцево накладалися топічні протизапальні, розсмоктуючі засоби. Також у лікуванні хворих на ОСД використовувалися фізіотерапевтичні методи.
Запропонований метод лікування ОСД із використанням 2,5 % розчину тіотриазоліну та субстратного антигіпоксанту цитофлавіну на тлі базового лікування отримали 33 (34,01 %) хворих на ОСД. Слід зазначити, що цитофлавін є комплексним препаратом, 1,0 мл розчину для внутрішньовенного введення якого містить 100 мг янтарної кислоти, 10 мг нікотинаміду, 20 мг рибоксину (інозину), 2 мг рибофлавіну мононуклеотиду (рибофлавіну). Фармакологічні ефекти обумовлені комплексним впливом речовин, які входять до складу його компонентів. Препарат стимулює дихання й енергоутворення у клітинах, поліпшує процеси утилізації кисню тканинами, відновлює активність ферментів антиоксидантного захисту. Препарат активує внутрішньоклітинний синтез білка, сприяє утилізації глюкози, жирних кислот і ресинтезу в нейронах γ-аміномасляної кислоти через шунт Робертса.
Оцінка найближчих результатів лікування хворих на ОСД проводилася за наступними клінічними критеріями:
– значне поліпшення – повна відсутність скарг із боку хворого, його добре самопочуття; зникнення запальних елементів висипу і запальних проявів при поверхневих формах, а також у пацієнтів із стадією еритеми та набряку; відновлення кольору шкіри або коричневий колір осередків, зменшення розмірів осередків, відсутність появи нових осередків, відновлення еластичності шкіри, зменшення щільності; нормалізація лабораторних показників протягом року і більше;
– поліпшення – задовільне самопочуття, частковий регрес елементів висипки, зменшення проявів запалення (збліднення запального вінчика периферичного росту, бурий колір осередків ураження та ін.), відсутність нових осередків ураження; позитивна динаміка лабораторних параметрів протягом 6 і більше місяців;
– погіршення – у процесі лікування спостерігалося обтяження шкірного патологічного процесу або подальше прогресування (збільшення кількості та розмірів осередків ураження шкіри, наявність бузкової облямівки навколо бляшок, посилення набряку та/чи індурації, суб’єктивних відчуттів), розвиток ускладнень і побічних ефектів;
– без ефекту – видимих змін ознак хвороби не спостерігалося.
6.2 Характеристика клінічного використання методу комплексної терапії хворих на обмежену склеродермію за способом оцінки ефективності лікування
Розроблено спосіб оцінки ефективності лікування хворих на ОСД (патент України на корисну модель № 109591 від від 25.08.2016). В основу даного способу поставлено завдання розширення арсеналу способів оцінки ефективності лікування хворих на ОСД шляхом оцінки в сироватці крові активності еластази, КЛА та накопичення ГАГ.
Поставлене завдання вирішувалося тим, що у відомому способі оцінки ефективності лікування хворих на ОСД, що включає вимір інтегральних маркерів функції СТ, у сироватці крови визначався вміст ГАГ, активність ферментів еластази та КЛА, при цьому оцінку КЛА сироватки крові здійснено за суммарною кількістю вільного та пептидно-зв`язаного оксипроліну в пробі крові, вміст ГАГ у сироватці крові визначався з використанням трихлороцтової кислоти та карбозольної реакції, активність еластази досліджувалась імуноферментним методом із використанням моноклональних антигенів та тест-системи і лікування оцінювалося як ефективне при реєстрації тенденції до нормалізації цих показників або їх зниження до попередніх вимірів.
На підставі проведеного дослідження встановлено підвищення в сироватці крові активності еластази, КЛА та вмісту ГАГ у прогресуючій стадії на початку терапії, що свідчило про структурно-метаболічні порушення у СТ.
Слід зауважити, що від стану СТ в організмі залежить ймовірність розвитку різних стадій ОСД, у зв’язку з чим було проведено дослідження з виявлення особливостей структурно-метаболічного стану СТ у хворих на ОСД усіх досліджуваних груп. Найбільший рівень еластази виявлено у групі хворих на ОСД до лікування – (45,5 ± 11,6) пг/мл. Після проведеного лікування у хворих на ОСД І та ІІ груп порівняння виявлено високу активність рівнів еластази ([40,6 ± 4,2] і [39,4 ± 3,7] пг/мл), що перевищували показники групи умовно-здорових донорів, відповідно в 1,5 і 1,4 раза відповідно. У хворих основної групи після лікування цей показник був збільшеним в 1,3 раза порівняно з референтними значеннями умовно-здорових донорів (рис. 6.1).
Вміст ГАГ був підвищеним у всіх досліджуваних групах. Максимальне збільшення вмісту ГАГ виявлено в групі хворих ОСД до лікування – (48,5 ± 5,4) мкмоль /л. Після проведеного лікування у хворих на ОСД групи порівняння цей показник перевищував рівень референтних значень групи умовно-здорових донорів у середньому в 1,4 раза. При цьому в основній групі вміст ГАГ перевищував рівень референтних значень групи умовно-здорових донорів усього на 18 % (рис. 6.1). КЛА плазми крові мала схожу динаміку, не залежала від статі та добре корелювала з показниками активності еластази, як це наведено у табл. 6.1.
Рисунок 6.1 – Вміст ГАГ і активність еластази у плазмі крові хворих на ОСД до лікування і залежно від одержуваної терапії
Таблиця 6.1 – Динаміка рівня КЛА плазми крові (за оксипроліном)
у хворих на ОСД до і після лікування
| Стадія патологічного процесу | КЛА крові, М±m (мкмоль оксипроліну/л·г) |
| Контрольна группа (умовно-здорові донори) | 7,4 ± 0,6 |
| Хворі на ОСД до лікування | 34,3 ± 3,6* |
| Хворі на ОСД після лікування | |
| Основна група | 16,8 ± 6,4 |
| І група порівняння | 31,8 ± 4,3* |
| ІІ група порівняння | 28,4 ± 3,5 |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
Як видно з даних рис. 6.2, найбільш високі значення оксипроліну виявилися у пацієнтів із ОСД до лікування – (34,3 ± 3,6) мкмоль оксипроліну/л∙г, а також після лікування в І групі порівняння і ІІ групі порівняння ([31,8 ± 4,3] і [28,4 ± 3,5] мкмоль оксипроліну/л∙г). При цьому в основній групі зафіксовано значне зніження цього показника майже вдвічі – (16,8 ± 6,4) мкмоль оксипроліну/л∙г порівняно з показниками хворих на ОСД до лікування. Однак ці рівні після лікування були значно нижчими, ніж показники у пацієнтів І і ІІ груп порівняння.
Рисунок 6.2 – Динаміка рівня оксипроліну у хворих на ОСД та умовно-здорових донорів
Рівні КЛА плазми крові у пацієнтів із ОСД до лікування перевищували дані умовно-здорових пацієнтів, що забезпечує цим показником важливе діагностичне і прогностичне значення при визначенні ступеня вираженості та локалізації осередків.
Таким чином, результати проведеного дослідження виявили низку особливостей біохімічних показників і свідчать, що ОСД у прогресуючій стадії супроводжувалася порушеннями метаболічного обміну СТ, які пов`язані з активацією протеїназ і накопиченням у сироватці крові ГАГ.
Високий кореляційний зв`язок між динамікою активності еластази, КЛА (за оксипроліном) та вмістом ГАГ сироватки крові при ОСД дозволяє використовувати ці показники для диференційної діагностики й вибору комплексної терапії, як прогностично значущі в динаміці патогенетичного лікування, що забезпечує підвищення ефективності його проведення.
6.3 Дослідження імунологічних показників у хворих на обмежену склеродермію після проведення лікування
В аналізованих групах хворих виявлено незначні зміни за показниками неспецифічної резистентності. У групах порівняння значення кількості нейтрофілів, що беруть участь у фагоцитозі (фагоцитарний індекс), достовірно не відрізнялися від рівня контрольної групи (рис. 6.3 і 6.4).
Рисунок 6.3 – Динаміка рівня фагоцитарного індексу у хворих на ОСД та умовно-здорових донорів
В основній групі пацієнтів після лікування фагоцитарний індекс був на 5 % нижчим, ніж у групах порівняння і становив 75,5 ± 6,0. Фагоцитарне число, що відображає середню кількість захоплених частинок фагоцитом, в основній групі становило 3,4 ± 0,6. Перетравлювальна активність нейтрофілів (індекс завершеності фагоцитозу) в основній групі пацієнтів була вищою, ніж у групі пацієнтів із ОСД до лікування на 13 % і становила 1,1 ± 0,03.
Рисунок 6.4 – Показники неспецифічної резистентності у хворих на ОСД досліджуваних груп після лікування
В основній досліджуваній групі після проведеного лікування також виявлено незначну активацію системи комплементу. У даній групі активність комплементу була на 6 % вищою порівняно з групами порівняння і на 13 % вищою, ніж у групі пацієнтів з ОСД до лікування. У досліджуваних хворих на ОСД після проведення лікування виявлено тенденцію до нормалізації середніх показників гуморальної ланки імунітету (табл. 6.2).
Таблиця 6.2 – Показники гуморальної ланки імунітету у хворих на ОСД досліджуваних груп після проведення лікування
| Досліджувані групи | Показники гуморальної ланки імунітету | |||
| ПСММ, ум. од. | Лімфоцито-токсичність, % | ЦІК, у. од | ЦІКк | |
| Контрольна група
(умовно-здорові донори) |
0,244 ± 0,02 | 28,6 ± 2,30 | 98,3 ± 21,1 | 1,30 ± 0,08 |
| Хворі на ОСД до лікування | 0,298 ± 0,08 | 41,6 ± 3,7* | 142,5 ± 26,81* | 1,05 ± 0,06 |
| Хворі на ОСД після лікування | ||||
| Основна група | 0,264 ± 0,01* | 30,2 ± 1,8 | 102,21 ± 15,1 | 1,20 ± 0,02 |
| І група порівняння | 0,278 ± 0,03* | 34,8 ± 1,2* | 113,2 ± 11,9 | 1,10 ± 0,05 |
| II група порівняння | 0,284 ± 0,07* | 33,6 ± 3,8 | 129,5 ± 16,8 | 1,10 ± 0,04 |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
Концентрація ПСММ у пацієнтів основної групи після лікування знаходилася на рівні (0,264 ± 0,020) ум. од., що була в 1,1 раза нижчою порівняно з групою пацієнтів із ОСД до лікування.
З огляду на високу біологічну активність ПСММ, у пацієнтів досліджуваних груп можливі прояви їх нейротоксичної дії, пригнічення процесів біосинтезу білка, пригнічення активності ряду ферментів (роз’єднання процесів окислення і фосфорилювання), виникнення станів вторинної імунодепресії, токсична дія на еритропоез. У пацієнтів при загостренні захворювання (І група порівняння) середній рівень автоімунних антитіл у тесті лімфоцитотоксичності перевищував референтні значення показника в середньому в 1,2 раза. У пацієнтів основної групи після проведеного лікування відзначено зниження на 15 % рівня лімфоцитотоксичності щодо І групи порівняння.
Також у пацієнтів I групи порівняння після лікування спостерігалося підвищення (на 13 %) рівня ЦІК до (113,2 ± 11,9) ум. од. Е при контрольному значенні показника – (98,3 ± 21,1) ум. од. Е (Р ≥ 0,95). В основній групі після лікування виявлено мінімальний рівень концентрації ЦІК порівняно з досліджуваними групами ([102,21 ± 15,1] ум. од.). Рівень ЦІКк, що характеризує молекулярну масу ЦІК, в основній групі після лікування був на 8 % нижчим, ніж у контролі. Що стосується оцінки концентрації антитіл до нативної ДНК, то були виявлені достовірні зміни концентрації специфічних антитіл до нативної ДНК методом ІФА у хворих двох досліджуваних груп порівняно з референтними значеннями. У хворих І і II груп порівняння після лікування виявлено більш високу концентрацію антитіл до подвійної спіралі ДНК (до (1,6 ± 0,06) од. Е) порівняно з хворими основної групи, у яких антитіла становили в середньому (1,20 ± 0,04) од. Е (Р ≥ 0,95). Отже, збільшення концентрації антитіл до нативної ДНК було достовірно взаємопов’язаним із перебігом захворювання і свідчило про наявність автоімунного компонента у хворих І і II груп порівняння з ОСД, навіть після проведеної комплексної терапії (табл. 6.3).
Таблиця 6.3 – Динаміка концентрації органоспецифічних антитіл у хворих на ОСД досліджуваних груп
| Показники
Досліджувані групи |
Концентрація специфічних антинуклеарних антитіл методом імунофлюоресценції | Концентрація специфічних антитіл до нативної ДНК методом ІФА, од. Е |
| Контрольна група (умовно-здорові донори) |
«–» | 0–1 |
| Хворі на ОСД до лікування | «++» | – |
| Хворі на ОСД після лікування | ||
| Основна група | «+» | 1,2 ± 0,04* |
| І група порівняння | «+++» | 1,6 ± 0,06* |
| II група порівняння | «++» | 1,4 ± 0,07* |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
У пацієнтів із ОСД після застосованих схем терапії досліджено експресію поверхневих маркерів диференціювання з урахуванням стану хворих (табл. 6.4).
У всіх хворих основної групи після лікування спостерігалося незначне пригнічення показників Т-клітинного імунітету. У ході дослідження встановлено незначне зниження відносної кількості найбільш функціонально значущої лімфоїдної субпопуляції CD3+ загальних Т-лімфоцитів – на 3 % щодо референтних значень показника (р ≤ 0,05). Відносні величини, що характеризують експресію диференційованих маркерів CD на Т-хелперній субпопуляції (CD4+), в основній групі були на рівні референтних значень. Експресія Т-кілерної (CD8+) субпопуляції Т-лімфоцитів була зниженою на 6 % відносно референтних значень. Виявлено підвищення експресії диференційованого маркера CD2+ активних Т-лімфоцитів, що беруть участь у стимуляції В-клітин, на 2,5 % порівняно з контрольною групою здорових донорів.
Таблиця 6.4 – Рівень субпопуляцій лімфоцитів у хворих на ОСД досліджуваних груп
| Субпопуляції лімфоцитів | Контрольна група (умовно-здорові донори) | Основна
група |
І група порівняння | II група порівняння |
| CD2+, х 106/л | 400,0±95,0 | 380,0±58,0 | 340,00±50,00 | 330,00±60,0 |
| CD2+, % | 16,3±3,4 | 17,8±2,8 | 19,00±3,2 | 18,00±2,4 |
| CD3+, х 106/л | 1100,0±450,0 | 1050,0±72,0 | 840,0±60,0* | 860,0±48,0* |
| CD3+, % | 62,0±6,5 | 60,0±15,2 | 42,25±4,1* | 53,25±5,7 |
| CD4+, х 106/л | 600,0±195,0 | 610,0±180,0 | 670,00±40,0 | 650,00±58,0 |
| CD4+, % | 38,3±6,5 | 37,0±7,6 | 41,00±3,4 | 40,50±4,2 |
| CD8+, х 106/л | 300,0±98,0 | 270,0±30,0 | 225,0±20,0 | 210,0±45,0* |
| CD8+, % | 23,4±4,4 | 21,93±2,23 | 20,8±1,13 | 19,8±2,6 |
| CD4+/CD8+ | 2,1±0,5 | 2,2±0,38 | 2,4±0, 3 | 2,7±0,23 |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
У пацієнтів І і II груп порівняння, на відміну від хворих основної групи, після лікування виявлено зниження (в середньому в 1,3 раза) абсолютної кількості CD2+, CD3+ і CD8+ субпопуляцій Т-лімфоцитів. Імунорегуляторний індекс CD4+/CD8+ в основній групі після лікування був на рівні референтних значень.
6.4 Прогнозування розвитку метаболічних та імунних порушень на основі аналізу стану деяких ланок імунної відповіді у хворих на обмежену склеродермію
Виходячи з мети досліджень, яка полягала у вивченні параметрів імунореактивності у хворих на ОСД до і після лікування, вдалося виявити індивідуальні значущі імуно-фізіологічні параметри, які в подальшому можуть бути використані для оцінки стану, прогнозу перебігу захворювання, вибору патогенетичної терапії й оцінки її ефективності.
Разом з тим, діагностична і прогностична значимість окремих показників імунної системи залишається недостатньо вивченою, і це, в першу чергу, стосується ЦІК. Їх якісний склад істотно впливає на перебіг захворювання. Патогенні властивості ЦІК визначаються сукупністю їх фізико-хімічних властивостей, до яких, у першу чергу, належать розміри, склад, концентрація і здатність фіксувати комплемент.
Молекулярна маса ЦІК визначає їх розмір, який є найважливішим показником патогенності, а також швидкість елімінації з організму: великі ЦІК швидко елімінуються і порівняно малопатогенні; дрібні ЦІК погано елімінуються, можуть відкладатися субендотеліально, не здатні активувати систему комплементу; ЦІК середнього розміру мають високу комплементзв’язувальну здатність і є найбільш патогенними.
Дослідження рівня ЦІК показало, що у хворих в основній групі після проведеного лікування цей показник перевищував величини в контрольній групі в 1,05 раза, а в І і II групах порівняння – в 1,2 раза.
ЦІКк у хворих в обох групах порівняння після лікування була зниженою та свідчила про низькі розміри цих комплексів.
Ефективність специфічної ендогенної детоксикаційної терапії відображає величина ПСММ. Стійке підвищення рівня цього показника може свідчити про несприятливий прогноз перебігу захворювання.
Дослідження концентрації ПСММ свідчило про те, що цей показник значно перевищував референтні значення в обох досліджуваних групах порівняння. Таким хворим показано проведення заходів, спрямованих на зниження рівня ендогенної інтоксикації.
Виявлена висока лімфоцитотоксичність сироватки крові і в основній групі, і в І та ІІ групах порівняння після проведеного лікування свідчить про розвиток у пацієнтів з ОСД автоімунних реакцій.
Так, при дослідженні сироватки крові у пацієнтів в основній групі та пацієнтів у І та ІІ групах порівняння методом ІФА виявлено наявність антитіл до нативної та денатурованої ДНК.
При цьому в І та ІІ групах порівняння концентрація автоантитіл достовірно відрізнялася від показників основної групи після лікування, що відбивалося на стані таких хворих та також свідчило про перевагу методу лікування, що пропонується (основна група).
Аналіз результатів обстеження пацієнтів основної групи після проведеного лікування показав, що найбільш значущими з усього масиву досліджуваних параметрів, що характеризують функціональну активність імунокомпетентних клітин, є диференціювальні маркери СD3+, CD4+ і CD8+.
Як відомо, зрілі Т-лімфоцити здійснюють імунологічний нагляд за антигенним гомеостазом в організмі, виконуючи дві важливі функції: ефекторну і регуляторну.
Ефекторна функція полягає у специфічній цитотоксичності по відношенню до чужорідних клітин. Регуляторна функція (Т-хелпери – Т-супресори) полягає в контролі за інтенсивністю розвитку специфічної реакції імунної системи на чужорідні антигени.
Таким чином, проведені дослідження субпопуляційного складу Т‑лімфоцитів у хворих основної групи після проведеного лікування показали зниження рівня CD3+, CD4+ і CD8+ Т-лімфоцитів порівняно з референтними значеннями.
Максимальне зниження експресії маркерів диференціювання CD3+ і CD4+ спостерігали після лікування і в І та ІІ групах порівняння, що свідчило про збереження у таких пацієнтів імунодефіцитних станів Т-клітинної ланки імунітету.
Регуляторні тимічні пептиди здійснюють дистанційне керування клітинами периферичної імунної системи, спричиняючи стимуляцію їх диференціювання і дозрівання.
Активовані лімфоїдні клітини периферичної імунної системи продукують цитокіни, які ініціюють проліферацію і дозрівання Т- і В-лімфоцитів.
При цьому знижені показники підвищуються, а гіперактивні процеси в окремих субпопуляціях Т-лімфоцитів повертаються до значень, близьких до нормального рівня.
Прогностичне значення про- й антизапальних медіаторів імунної системи в механізмі розвитку ОСД. Проблема прогнозування перебігу захворювання та результату лікування хворих на ОСД після проведеної комплексної терапії залишається остаточно не вирішеною.
У зв’язку з цим, актуальним завданням є розробка і впровадження в клінічну практику специфічних молекулярних і біохімічних маркерів, що характеризують стан біоенергетичних процесів імунологічного контролю, ступеня агресивності процесу і, крім того, дозволяють індивідуалізувати прогноз клінічного перебігу ОСД.
Одним із важливих чинників, залучених у процеси клітинної проліферації, диференціювання і контролю патологічного процесу при ОСД, є медіатори імунної системи. З огляду на вищесказане, було вивчено вміст у сироватці крові хворих на ОСД про- і антизапальних цитокінів у 1–3 добу після госпіталізації й обґрунтовано їх прогностичне значення для діагностики та оптимізації патогенетичної терапії.
Вивчення вмісту в сироватці крові медіаторів імунної системи до та після проведеного лікування виявило динамічні зміни всіх досліджуваних цитокінів і неоднозначну їх спрямованість у різних досліджуваних групах.
Так, у І і ІІ групах порівняння виявлено статистично достовірне збільшення концентрації всіх досліджуваних цитокінів, крім ІЛ-4 і ІЛ-10, які були знижені в другій групі порівняння на 30 % щодо референтних значень групи умовно-здорових донорів. У середньому відзначено зростання концентрації про- і антизапальних цитокінів від 2 до 7 разів.
Максимальний рівень ІЛ-10, який склав (67,6 ± 14,3) пкг/мл, виявлено в І групі порівняння (табл. 6.5).
В основній групі концентрацію прозапальних цитокінів було виявлено на рівні референтних значень групи умовно-здорових донорів. Концентрація протизапальних цитокінів ІЛ-4 й ІЛ-10 в основній групі перевищувала рівень референтних показників групи умовно-здорових донорів в 1,1 і в 1,3 раза відповідно.
Таблиця 6.5 – Динаміка про- й антизапальних медіаторів імунної системи в сироватці крові хворих на ОСД досліджуваних груп після лікування
| Показники, пкг/мл |
Досліджувані групи, М±m |
|||
| Контрольна група (умовно-здорові донори) | Основна група | І група порівняння | ІІ група порівняння | |
| ФНП-a | 3,6 ± 1,2 | 3,9 ± 1,4 | 7,8 ± 1,6* | 8,4 ± 2,7* |
| ІЛ-6 | 3,8 ± 1,1 | 4,1 ± 1,6 | 8,6 ± 1,2* | 10,5 ± 1,6* |
| ІЛ-1β | 4,3 ± 1,1 | 4,8 ± 1,5 | 8,2 ± 1,6* | 8,5 ± 1,9* |
| ІЛ-8 | 7,5 ± 1,6 | 7,8 ± 1,3 | 9,7 ± 1,3 | 11,4 ± 2,3* |
| ІЛ-4 | 9,2 ± 1,3 | 10,5 ± 1,7 | 14,8 ± 2,6 | 6,2 ± 0,8* |
| ІЛ-10 | 43,6 ± 5,2 | 55,4 ± 10,4 | 67,6 ± 14,3 | 36,4 ± 4,3* |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
Дослідження показали, що у хворих на ОСД у всіх досліджуваних групах зберігався ФНП-α, що може вказувати на активацію макрофагів, моноцитів, посилення цитотоксичної дії, індукцію секреції цитокінів. Дія ФНП-α може супроводжуватися посиленням проліферації та диференціюванням нейтрофілів, фібробластів, Т- і В-лімфоцитів, а також посиленням транскрипції прозапальних цитокінів – ІЛ-6, ІЛ-8 та ІЛ-1β.
Достовірне підвищення прозапальних цитокінів у групах порівняння ОСД вказує на активацію клітин-продуцентів прозапальних цитокінів (ІЛ-6, ІЛ-8 та ІЛ-1β): моноцитів, макрофагів, Т-лімфоцитів вторинного типу (i К-2 клітин), нейтрофілів, фібробластів, кератиноцитів, хондроцитів і епітеліальних клітин.
Такі зміни здатні посилювати стимуляцію В-клітин, Т-клітин, НК-клітин, підвищувати експресію міжклітинних адгезивних молекул ендотеліальними клітинами і адгезивні властивості макрофагів, нейтрофілів, активувати індукцію гепатоцитами білків гострої фази (гаптоглобін, церулоплазмін, СРБ та ін.), прискорювати диференціювання проліферуючих В-клітин у плазматичні та стимулювати ними антитілопродукцію, а також стимулювати проліферацію тимоцитів і перетворення Т-лімфоцитів у цитотоксичні лімфоцити.
Підвищення ІЛ-8 у сироватці крові хворих на ОСД вказує на посилення активності широкого спектру імунокомпетентних клітин (моноцитів, макрофагів, нейтрофілів, фібробластів, ендотеліальних клітин та ін.), яка супроводжується стимуляцією хемотаксису нейтрофілів, субпопуляцій Т‑лімфоцитів і базофілів. ІЛ-8 активує нейтрофіли до викиду ферментів лізосомами («дихальний вибух» і дегрануляція), підвищує спорідненість нейтрофілів до ендотеліальних клітин, індукуючи вихід лейкотрієну В4 з нейтрофілів і підвищує спорідненість моноцитів до клітин ендотелію. Це створює метаболічні умови для руйнування клітин шкіри.
Підвищення вмісту ІЛ-4 і ІЛ-10 у хворих на ОСД І групи порівняння вказує на активацію NK-клітин і Тh2-клітин, яка супроводжується посиленням функції Т-хелперів, розмноженням активних В-клітин, опасистих клітин і гемопоетичних клітин, пригніченням цитокінової продукції, у тому числі Т‑лімфоцитів первинного типу (Тh1-клітинами), пригніченням активності макрофагів, продукції моноцитами і макрофагами прозапальних цитокінів, на тлі підвищення проліферації В-лімфоцитів і секреції імуноглобулінів. Це свідчило про те, що у хворих на ОСД порушені центральні механізми розвитку і реалізації імунних реакцій, пов’язаних із пригніченням клітинної та гуморальної ланок імунної системи.
Таким чином, аналіз отриманих результатів дає підставу вважати, що в основній групі хворих на ОСД після проведеного лікування за сучасною розробленою схемою, значно активувалася продукція анти- і прозапальних медіаторів імунної системи, тоді як у І та ІІ групах порівняння хворих на ОСД зберігалося пригнічення секреції антизапальних цитокінів на тлі підвищення прозапальних медіаторів, що може мати прогностичне значення для подальшої оптимізації патогенетичної терапії у хворих цих груп.
Запорукою успішного лікування цих хворих може бути рання діагностика ОСД. На сьогоднішній день методи її виявлення розроблено все ще недостатньо ефективно, що не дозволяє визначати наявність преморбідного метаболічного стану на стадії формування хвороби і розвитку патологічного процесу і свідчить про необхідність подальшого вивчення етіології та патогенезу дисфункції еластази і колагену.
6.5 Особливості біохімічних змін у хворих на обмежену склеродермію після проведення лікування
У пацієнтів основної групи після проведеного лікування концентрація СРБ позитивно знижувалася до рівня в середньому 12 г/л, що була на 33 % і на 25 % нижчою, ніж у І та ІІ групах порівняння відповідно. У групах порівняння концентрація СРБ достовірно не відрізнялася від групи ОСД до лікування і перевищувала референтні показники контрольної групи в середньому в 3 рази, що свідчить про перебіг гострої фази запального процесу (рис. 6.5).
Рисунок 6.5 – Дослідження рівня СРБ після лікування у хворих досліджуваних груп з ОСД і умовно-здорових донорів
Результати дослідження рівня концентрації магнію та хлору у хворих на ОСД залежно від перебігу захворювання після лікування наведено в табл. 6.6.
Таблиця 6.6 – Показники рівня магнія й хлора у хворих із ОСД досліджуваних груп
| Показники
Досліджувані групи |
Магній, моль/л | Хлор, моль/л |
| Контрольна група (умовно-здорові донори) |
0,89 ± 0,18 | 102,50 ± 7,50 |
| Хворі на ОСД до лікування | 1,4 ± 0,21 | 95,56 ± 4,83 |
| Хворі на ОСД після лікування | ||
| Основна група | 0,91 ± 0,12 | 92,48 ± 4,95 |
| І група порівняння | 1,28 ± 0,62* | 93,6 ± 5,7 |
| II група порівняння | 1,34 ± 0,36* | 94,7 ± 4,9 |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
У сироватці крові хворих І і II груп порівняння відзначали підвищення вмісту магнію в 1,4 раза і зниження рівня хлору в 1,1 раза.
Вміст магнію та рівень хлору в сироватці крові хворих основної групи достовірно не відрізнявся від контролю – було виявлено позитивне зниження концентрації магнію (в середньому в 1,4 раза) і збільшення рівня хлору (в 1,1 раза), ніж у групах порівняння.
При дослідженні вмісту білкових фракцій у сироватці крові хворих на ОСД після проведеного лікування встановлено, що в основній групі пацієнтів показники були на рівні контрольної групи здорових донорів.
У групах порівняння виявлено достовірне підвищення α1-фракції глобулінів (в 1,6 раза) і зниження γ-фракції глобулінів (в 1,2 раза) порівняно з контрольними величинами.
Збільшення α1-фракції глобулінів відбувалося за рахунок збільшення концентрації стресових білків і кислих глікопротеїнів, а зниження γ‑глобулінової фракції – за рахунок споживання глобулінів при утворенні ЦІК (табл. 6.7).
Таблиця 6.7 – Вміст білкових фракцій сироватки крові у хворих на ОСД досліджуваних груп після проведення лікування
| Показники
Досліджувані групи |
Білкові фракції, % | |||||
| Альбумін | Глобуліни | |||||
| α1– | α2– | β- | γ- | |||
| Контрольна група (умовно-здорові донори) |
58,2 ± 4,1 | 3,2 ± 1,2 | 7,9 ± 1,5 | 12,5 ± 2,0 | 18,2 ± 2,9 | |
| Хворі на ОСД до лікування | 52,5 ± 3,5 | 2,9 ± 0,6 | 12,2 ± 2,2 | 16,1 ± 0,9 | 16,3 ± 3,4 | |
| Хворі на ОСД після лікування | ||||||
| Основна група | 56,6 ± 4,3 | 3,7 ± 0,6 | 8,8 ± 0,6 | 12,8 ± 2,1 | 18,1 ± 1,6 | |
| І група порівняння | 53,3 ± 3,6 | 5,1 ± 0,8* | 11,3 ± 2,3* | 14,7 ± 3,8 | 15,6 ± 1,8 | |
| II група порівняння | 52,8 ± 3,5 | 5,3 ± 1,02* | 11,4 ± 3,4* | 15,7 ± 2,9 | 14,8 ± 1,9* | |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
При дослідженні ліпідного обміну у хворих на ОСД після лікування були отримані дані, наведені в табл. 6.8.
Таблиця 6.8 – Показники ліпідного обміну у хворих на ОСД досліджуваних підгруп після проведення лікування
| Групи | Показники | |||||
| Загальні ліпіди, г/л | β-ліпопротеї-ди, ум.од. | Холестерин, моль/л | ЛПВЩ, моль/л | Триглі-цериди, ммоль/л | Коефіцієнт атероген-ності | |
| Контрольна група (умовно-здорові донори) | 5,75±2,3 | 44,5±8,5 | 5,1±0,8 | 0,79±0,02 | 2,15±0,8 | 2,5±0,5 |
| Хворі на ОСД до лікування | 3,9±0,34 | 45,7±5,2 | 3,8±0,3 | 2,1±0,32 | 0,8±0,03 | 0,34±0,2 |
| Хворі на ОСД після лікування | ||||||
| Основна група | 5,3±0,7 | 43,8±5,6 | 4,8±0,6 | 1,2±0,8 | 1,9±0,3 | 1,8±0,1 |
| І група порівняння | 4,9±0,4 | 44,7±5,2 | 4,1±0,3 | 1,9±0,9* | 1,1±0,03* | 1,1±0,2* |
| II група порівняння | 4,7±0,7 | 41,2±4,4 | 3,7±0,2* | 1,8±0,8* | 1,4±0,15* | 1,3±0,3* |
Примітка. * – розбіжності істотні з достовірністю р < 0,05
У групах порівняння було виявлено достовірне зниження щодо контрольних величин за вмістом холестерину (в 1,3 раза), ЛПВЩ (в 2,3 раза), тригліцеридів (в 1,7 раза). Також значно був знижений коефіцієнт атерогенності в цих групах – у середньому в 2 рази порівняно з контролем.
Що стосується основної групи, тут відзначено дворазове збільшення концентрації ЛПВЩ і деяке зниження коефіцієнта атерогенності (в 1,5 раза) порівняно з контрольною групою умовно-здорових донорів.
6.6 Динаміка показників загального стану хворих на обмежену склеродермію після проведення комплексного лікування за різними методами
Специфіка перебігу ОСД, а саме її прогредієнтність, часті рецидиви, неприємні суб’єктивні відчуття, в тому числі відчуття стягування, нерідко порушення сну, виникнення осередків на візуально помітних ділянках тіла значно погіршували загальний стан хворих.
Так, до лікування, у 90 (87,3 %) хворих відзначалися різного роду скарги, серед яких переважали: підвищена дратівливість, стомлюваність, порушення ритму нічного сну, зниження працездатності, тобто суб’єктивні симптоми, які свідчили про погіршення загального стану хворих на ОСД.
Основні скарги (суб’єктивні симптоми) обстежених хворих до проведення лікування подано на рис. 6.6.
Динаміку суб’єктивних симптомів, вивчених у трьох досліджуваних групах пацієнтів із ОСД, які отримували різні методи комплексної терапії, наведено на рис. 6.7.
На рис. 6.6 наочно продемонстровано, що найбільш виражене зниження суб’єктивної симптоматики у пацієнтів із ОСД було відзначено у пацієнтів основної групи, які отримували комбіновану терапію з включенням сучасних схем лікування, де у більшості хворих відзначався значний регрес (на 51,3 %) скарг, що спостерігалися в початковому стані.
Рисунок 6.6 – Основні скарги хворих на ОСД до проведення лікування
Рисунок 6.7 – Динаміка основних скарг хворих на ОСД у результаті проведення різних методів терапії
У групі порівняння I, до кінця лікування скарги хворих були менш вираженими, але знизилися в середньому на 21 %, а в групі порівняння II зниження відмічено всього на 16,5 %.
Показники гуморального імунітету змінювалися наступним чином: рівень ЦІК малого розміру у хворих у І групі порівняння, які отримали базову терапію, спочатку був вищим, ніж у групі контролю на 21,1 % (p < 0,05), залишаючись без змін при виписці.
В основній групі пацієнтів, які отримували комплексну терапію з цитофлавіном, показник ЦІК також був вищим за контроль на 32,9 % (p < 0,01), знизившись до кінця лікування на 14 % (p <0,05), не досягнувши, однак, значень умовно-здорових донорів контрольної групи. Рівень імуноглобуліну A в І і ІІ групах порівняння до початку лікування був вищим за контрольні дані на 43,2 % (p < 0,05) і 35,3 % (p < 0,05), відповідно.
На тлі досліджуваних видів терапії рівень імуноглобуліну A мав тенденцію до зниження в І групі порівняння і знизився в основній групі на 18,3 % (p <0,05), досягнувши рівня значень умовно-здорових донорів контрольної групи.
Імуноглобулін G у контрольній групі становив (1235,0 ± 66,1) мг%, у І групі порівняння показник значних коливань не мав, не відрізняючись від контролю. В основній групі із застосуванням цитофлавіну рівень імуноглобуліну G мав тенденцію до зниження на 5,9 % (p > 0,05), досягнувши значення (972,5 ± 35,18) мг%, що був нижчим, ніж у групі контролю на 21,3 % (p <0 ,05). Рівень імуноглобуліну M спочатку в І і ІІ групах порівняння був нижчим за показник умовно-здорових донорів на 27,2 % (p < 0,05) і 31,1% (p < 0,05), відповідно.
До кінця лікування показник мав тенденцію до підвищення у всіх досліджуваних групах. Значення НСТ-тесту, середнього цитохімічного коефіцієнту НСТ-тесту, активності фагоцитозу як до, так і після проведеного лікування у всіх досліджуваних групах значущих відхилень від контрольних даних не мали.
Динаміка значень цитокінового профілю характеризувалася різнонаправленістю змін. Так, ІЛ-1 спочатку був вищим за значення контролю у пацієнтів усіх досліджуваних груп (p < 0,05) і до кінця проведеної терапії мав достовірне зниження.
Рівень протизапального ІЛ-4 в основній групі початково був нижчим за контроль (p < 0,05) і мав достовірне зростання (p < 0,05), у І групі порівняння показник не відрізнявся від умовно-здорових донорів контрольної групи і не змінився на тлі лікування. Рівень ІЛ-8, який є прозапальним, до початку лікування у всіх досліджуваних групах достовірно від контрольних значень не відрізнявся, знизившись, однак, при виписці в основній групі (p < 0,05).
Значення ФНП, що спочатку були підвищені в усіх досліджуваних групах (p < 0,05), мали достовірне зниження (p < 0,05). Рівень ІЛ-6 не зазнав значних змін на тлі досліджуваних видів терапії у пацієнтів досліджуваних груп.
Отримані в дослідженні суперечливі дані лише підтверджують маловивчені та складні механізми функціонування деяких прозапальних цитокінів при автоімунних процесах. Розроблена терапія ОСД справляє позитивний вплив на основні показники гомеостазу у пацієнтів, сприяє зниженню прозапальних ІЛ-1 і ФНП α, а також редукції клінічних проявів.
Показники активності еластази, КЛА та вмісту ГАГ сироватки крові при ОСД у прогресуючій стадії слід вважати прогностично значущими в динаміці патогенетичної терапії, що проводиться. Ці показники дозволяють проводити диференційну діагностику, вибір комплексного лікування, що забезпечує підвищення ефективності лікування пацієнтів із ОСД.
Найбільш високі рівні активності протеїназ відзначалися у хворих на ОСД і були пов`язані з накопиченням значних концентрацій ГАГ у сироватці крові. Результати дослідження свідчать, що ОСД супроводжувалася порушеннями метаболічного обміну СТ, які пов`язані з активацією протеїназ і накопиченням у сироватці крові ГАГ.
Високий кореляційний зв`язок між динамікою активності еластази, КЛА (за оксипроліном) та вмістом ГАГ сироватки крові при ОСД дозволяє використовувати ці показники як прогностично значущі в динаміці патогенетичного лікування, що проводиться.
Таким чином, проведене дослідження демонструє, що поліпшення загального стану хворих завжди є головною метою проведеної комплексної терапії ОСД. Моніторинг основних скарг з урахуванням клінічної картини ОСД дозволив оцінити ефективність комплексної терапії і в певній мірі допомогти у виборі та проведенні необхідної адекватної корекції хронічного дерматозу. Включення до складу базової терапії ОСД цитофлавіну сприяє більш значному зростанню порівняно зі стандартною терапією рівня самопочуття, активності, настрою, зменшенню запального процесу в осередках у прогресуючій стадії.
Комплексне лікування призводить до нормальних значень ЦІК малого діаметра, імуноглобуліну А, ІЛ-1 і -4, ФНП α, ефективно і достовірно знижує рівень інтенсивності почуття стягування шкіри, порушення сну, дратівливість, порог стомлюваності, а також підвищує працездатність.
Результати проведених досліджень свідчать про патогенетичну спрямованість комплексного застосування терапії на підставі розробленої схеми патогенетичного лікування, включно із застосуванням 2,5 % розчину тіотриазоліну і цитофлавіну на тлі традиційної терапії у пацієнтів з ОСД, що супроводжується швидким і вираженим регресом основних клінічних проявів дерматозу, і лежить в основі високого терапевтичного ефекту нового сучасного розробленого способу лікування.
* * *
Проведене лікування пацієнтів з ОСД різного віку за традиційним і розробленим вдосконаленими методами різною мірою сприяло нормалізації лабораторних показників. Застосування запропонованого методу лікування ОСД із використанням цитофлавіну (основна група пацієнтів) призводило до більш вираженої нормалізації лабораторних показників та мало тенденцію наближення до рівня контрольної групи умовно-здорових донорів.
Було виявлено збільшення рівня еластази, КЛА та вмісту ГАГ у прогресуючій стадії на початку терапії, що вказувало на структурно-метаболічні порушення в СТ. Запропонована схема лікування призводила до нормалізації даних показників, що свідчило про згасання патологічного процесу.
Виявлено тенденцію до нормалізації основних імунологічних показників (індекс завершення фагоцитозу, концентрація ПСММ, ЦІК, лімфоцитотоксичність, експресія основних кластерів диференцировки Т‑клітин), що є позитивним прогностичним проявом перебігу ОСД. Різноспрямовані зміни концентрації ІЛ безсумнівно свідчать про їх участь у механізмах, що супроводжують перебіг ОСД. Насамперед, це прозапальні інтерлейкіни – ФНП-a, ІЛ-1β, ІЛ-6, ІЛ-8. Збільшення рівня протизапальних цитокінів ІЛ-4 та ІЛ-10 вказує на активацію механізмів, спрямованих на згасання патологічного процесу.
У пацієнтів основної групи визначено зниження концентрації СРБ – одного з основних показників запалення, що є позитивним прогностичним маркером. Виявлено нормалізацію у вмісті білкових та ліпідних фракцій до рівня контрольної групи умовно-здорових донорів.
Встановлено кореляційну залежність між лабораторними показниками та динамікою основних скарг хворих на ОСД. Мінімальний рівень скарг пацієнтів спостерігався в основній групі, тобто після запропонованого методу лікування, що свідчить про безсумнівну його ефективність.
Тобто, запропонований метод лікування хворих на ОСД, який передбачає використання 2,5 % розчину тіотриазоліну та цитофлавіну, супроводжується швидким та вираженим зниженням основних клінічних критеріїв цього виду дерматозу та має безсумнівний виражений терапевтичний ефект.
Висока ефективність препаратів, безпека застосування, можливість перорального прийому та доступність вказаних засобів обґрунтовують доцільність їх використання в лікуванні хворих на ОСД і дозволяють рекомендувати їх для широкого впровадження у практику охорони здоров’я.
Зміст розділу відображено в наступних публікаціях:
- Ата М. А. Лечение очаговой склеродермии с применением современных методов. Дерматологія та венерологія. 2018. № 3 (81). С. 22–24.
- Ата М. А. Особенности активности эластазы, коллагенолитической активности и содержания гликозаминогликанов у больных ограниченной склеродермией. Дерматологія та венерологія. 2018. № 4 (82). С. 23–26.
- Ата М. А. Прогнозирование развития иммунной дисфункции у больных очаговой склеродермией по состоянию некоторых звеньев иммунного ответа. Дерматологія та венерологія. 2019. № 1 (83). С. 14–19.
- Ата М. А. Особенности биохимических изменений у больных ограниченной склеродермией. ScienceRise: Medical Science. 2019. № 1 (28). С. 20–24.
- Пат. на корисну модель 109591 Україна, МПК 7 G01N33/49 (2006.01). Спосіб оцінки ефективності лікування хворих на вогнищеву склеродермію / М.А. Ата, Я. Ф. Кутасевич, В. І. Жуков. № u201602567; заявл. 16.03.2016; опубл. 25.08.2016, Бюл. № 16.
- Ата М. А. Оцінка ефективності лікування хворих на вогнищеву склеродермію. Мат. ХІІІ Міжнародної конференції студентів та молодих вчених «Актуальні питання сучасної медицини», м. Харків, 14-15 квітня 2016 р. Харків : ХНУ ім. В.Н. Каразіна, 2016. С. 31.
РОЗДІЛ 7
АНАЛІЗ ТА УЗАГАЛЬНЕННЯ ОТРИМАНИХ РЕЗУЛЬТАТІВ
ОСД – хронічне захворювання СТ, яке характеризується ущільненням шкіри й підшкірної жирової клітковини внаслідок підвищення щільності колагену, є одним з найчастіших захворювань шкіри і, за даними багатьох дослідників, залишається однією з актуальних проблем сучасної дерматології.
За даними ВООЗ, у всіх індустріально розвинених країнах світу 400 000 з 10 млн. людей страждають на ОСД.
За даними МОЗ України, тільки за останні 4 роки захворюваність на ОСД в середньому збільшилася з 405,2 до 460,3 хворих на 100000 населення і до 2013 року склала 455,8 випадків на 100000. В останні роки намітився певний прогрес у розвитку питань клініко-патофізіологічної оцінки ОСД.
Сучасний стан проблеми характеризується невирішеністю питань та недостатнім відображенням у літературі даних про специфіку ранньої діагностики, лікування хворих на ОСД, недоліками і недосконалістю схем раціональної лікувально-діагностичної тактики.
Стає очевидним пошук шляхів застосування для діагностики осередків ОСД сучасних технологій у вигляді дистанційної термографії. У зв’язку з цим, патогенетично обумовленим є пошук нових методів лікування ОСД, що нормалізують гомеостаз на клітинному рівні.
Одним із таких методів є нова схема терапії з використанням сучасних препаратів, патогенетичний ефект якої визначається високим відновним потенціалом, що призводить до утворення та синтезу біологічно активних речовин, посилення активності імунокомпетентних клітин, стимуляції репаративних процесів та ін.
Оптимізація та підвищення ефективності лікування хворих цієї категорії може бути досягнута лише при комплексному, об’єктивно обґрунтованому підході до вибору лікувальної тактики, орієнтованої на клініко-патогенетичні особливості з урахуванням метаболічних та імунних порушень і застосуванням нової схеми комплексного лікування.
Під спостереженням перебувало 107 хворих на ОСД, що знаходилися на стаціонарному лікуванні у відділенні дерматології ДУ “Інститут дерматології та венерології НАМН України” з 2014 по 2018 рр. Було обстежено 21 (19,58 %) чоловіків та 86 (80,41 %) жінок, віком 21-70 років. Найбільша кількість хворих на ОСД відзначалася у віковій групі 31–50 лет.
Усі хворі надходили до стаціонару у період маніфестації або загострення захворювання. Постановка діагнозу базувалась на Міжнародній класифікації захворювань Х перегляду, в якій ОСД представлено у класі XII «Захворювання шкіри і підшкірної клітковини» за шифром L 94.0. Слід зазначити, що у контексті різноманіття існуючих визначень і класифікацій слід розглядати розвиток і формування синдрому імунної дисфункції, як фазний патологічний процес, що поступово розвивається при ОСД, в основі якого полягають порушення гомеостазу, загальних і місцевих адаптаційних процесів, підкріплення яких досягається проведенням адекватного комплексу проти заходів, у результаті чого настає період тимчасової нестійкої компенсації.
Анамнестичні дані включали відомості про давність і причини захворювання, проведене раніше лікування, дані про попередні та супутні захворювання. Особливу увагу при зборі анамнезу було приділено тривалості перебігу і поширеності процесу, наявності супутньої патології. Також при огляді пацієнтів проводилася фотозйомка осередків ураження. Були досліджені загальний і біохімічний аналіз крові, а також імунологічні показники.
Для досягнення поставлених мети та задач проведено клінічне дослідження, етапи якого представлено на рис. 2.1.
Критеріями включення в дослідження стали: наявність ОСД у хворих із встановленим діагнозом, тобто, як типова картина захворювання в стадії еритеми (набряку) і/або ущільнення, так і відсутність ознак системності процесу, вік від 25 до 70 років, отримання інформованої згоди пацієнта.
Критеріями невключення були: наявність злоякісних новоутворень і передракових захворювань шкіри й внутрішніх органів в анамнезі та на момент огляду, супутні захворювання, включно психічні, у стадії загострення, системна склеродермія, хвороба Лайма, схильність до келоїдоутворення, хронічна ниркова й печінкова недостатність, цироз печінки, підвищення рівня печінкових трансаміназ більш ніж удвічі від нормальних значень, вагітність і період лактації, а також протипоказання до призначення препаратів, що входять до терапевтичних схем лікування.
Критерії виключення пацієнта з дослідження (що планувалося використовувати): прояви небажаних явищ, що пов`язані з терапією або невиконанням режиму призначеної схеми терапії, але хворих виключених із дослідження у зв`язку з небажаними явищами, пов`язаними з розробленою терапією, не було.
З метою вивчення ефективності комбінованого використання традиційної терапії та нових схем лікування ОСД, які включали препарати тіотриазолін і цитофлавін, усіх пацієнтів було розподілено на три зіставні за всіма параметрами групи випадковим чином. Групи довільно формувалися з хворих, що відповідали критеріям включення.
До основної групи увійшли 36 (34,01 %) хворих ОСД, що отримали комплексне лікування за схемою, методику якої було розроблено у клініці ДУ «Інститут дерматології та венерології НАМН України»: базове лікування (пеніцилін G – по 5,0 млн на 100,0 фізіологічного розчину внутрішньовенно краплинно протягом 10–12 діб; аскорбінова кислота 10,0 % – по 2,0 мл внутрішньом’язово протягом 10–15 діб; нікотинова кислота 1 % – по 1,0 мл внутрішньом’язово протягом 10 діб; зовнішнє лікування – траумель С мазь і аплікації з розчином димексиду 1:4 (згідно зі стандартами терапії ОСД), а також додатково тіотриазолін 2,5 % по 4,0 мл внутрішньом’язово протягом 10–15 діб та цитофлавін по 10,0 мл на 200,0 фізіологічного розчину внутрішньовенно краплинно протягом 10 діб із подальшим переходом на таблетовану форму препарату по 2 таблетки 2 рази на добу протягом 25 діб.
До І групи порівняння було включено 38 (35,05 %) пацієнтів, які отримували терапію, що включала тільки базове лікування. У ІІ групу порівняння увійшли 33 (30,92 %) хворих, які одержували лікування за схемою, що включала базове лікування з додаванням тіотриазоліну 2,5 % по 4,0 мл внутрішньом’язово протягом 10–15 діб.
Для проведення порівняльного аналізу та отримання більш достовірних результатів дослідження додатково була введена контрольна група, що складалася з 25 умовно-здорових обстежених добровольців, мешканців Харківського регіону.
Групи пацієнтів були репрезентативні за статтю, віком, вихідними клініко-лабораторними показниками.
Усі клінічні дослідження проводилися в клінічній лабораторії ДУ «Інститут дерматології та венерології НАМН України». Імуноферментні дослідження виконували на базі діагностичної лабораторії молекулярних і клітинних технологій з імуноферментним і імунофлюоресцентним аналізом ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України» за допомогою сучасного мікроскопа Olympus BX-i53 (Japan) та програмного забезпечення.
Тепловізійна візуалізація склеродермічних осередків та здорових тканин шкіри проводилася на базі ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України» з використанням матричного тепловізора марки ТК-1, виготовленим у Фізико-технічному інституті низьких температур ім. Б. І. Вєркіна НАН України (Харків, Україна).
Статистична обробка результатів дослідження здійснена з використанням непараметричного методу порівняння незалежних груп за Манна-Уітні, а також за допомогою стандартного пакета прикладних програм R, Microsoft Excel 2000 і STATISTICA 7.0. Усі дані оброблені методом варіаційної статистики з використанням критерію Стьюдента. Для вибору найбільш інформативних показників використано кореляційний, системний багатофакторний і регресивний аналіз.
Деяким пацієнтам з ОСД, які знаходилися на лікуванні у клініці ДУ «Інститут дерматології та венерології НАМН України, за «сліпою» вибіркою проведено термометричне дослідження.
У групу дослідження увійшли 26 хворих на ОСД у віці від 17 до 65 років, з них 24 (92,3 %) – жінки, 2 (7,7 %) – чоловіки. При дистанційній термографії в проекції склеродермічних осередків до проведення лікування у 24 (92,3 %) пацієнтів досліджуваної групи у прогресуючій стадії (наявність віночка лілового, рожево-синюшного кольору з фіолетовим відтінком, який переходив у незмінену шкіру, що по суті й було критерієм активності процессу) були виявлені ділянки гіпертермії, що свідчило про наявність запалення в зазначених осередках. Як правило, найвищі значення температури у хворих у прогресуючій стадії до проведення лікування фіксувалися ексцентрично, з їх максимумом у зонах, розташованих трохи нижче склерозованого осередку.
У той же час у хворих у прогресуючій стадії при дещо більшій величині склеродермічного осередку, появі набряку м’яких тканин в його зоні, суб’єктивній болісності ураженої анатомо-функціональної ділянки тіла, зміни на термограмі до проведення лікування мали достатньо чіткий і однозначний характер.
У 2 (7,7 %) пацієнтів у стадії атрофії шкіри, у проекції склеродермічних осередків при дистанційній термографії були виявлені ділянки гіпотермії, що свідчило про наявність процесів склерозування в даних осередках.
Після проведеної терапії у хворих досліджуваних груп відзначалася візуально наявність чіткої кореляційної залежності між цими величинами. При ураженнях відносно невеликої величини, які часто вже не супроводжувалися наявністю суб’єктивних проявів, скарг з боку хворого на ОСД, не спостерігалося порушень симетричності розподілу температур щодо вертикальної осі тіла.
Було встановлено пряму залежність між клінічними проявами, лабораторними змінами і ділянками гіпертермії у 15 пацієнтів обстежуваної групи, яка склала 57,7 %. Також пряму залежність між клінічними проявами та ділянками гіпертермії було виявлено у 11 обстежуваних хворих, що склало 42,3 %. У 2 пацієнтів групи, що обстежувалася (7,7 %) встановлено пряму залежність між клінічними проявами у вигляді атрофії шкіри в осередках ураження і ділянками гіпотермії на термограмах.
Різні регіони тіла людини, маючи в нормі індивідуальну середню температуру, зумовлену існуванням особливостей у ступені їх кровопостачання й іннервації, демонструють різну здатність до адаптації при ОСД. Для перевірки припущення про наявність індивідуальних відмінностей середніх температур досліджених ділянок тіла з осередками склеродермії залежно від їх регіонарної приналежності був проведений порівняльний міжгруповий аналіз, який показав, що між деякими величинами, що порівнювалися, виявлено значущі відмінності, про що свідчили високі значення отриманих коефіцієнтів, які перевищували рівень критичної величини q.
При комплексному обстеженні хворих на ОСД із використанням дистанційної термографії було виявлено пряму залежність між ділянками гіпертермії, запальними клінічними проявами та лабораторними змінами у 15 пацієнтів (57,7 %), між ділянками гіпертермії та запальними клінічними проявами у 11 осіб (42,3 %). Також встановлено пряму залежність між ділянками гіпотермії на термограмах та клінічними проявами у вигляді атрофії шкіри в осередках ураження у 2 пацієнтів (7,7 %).
Базова терапія передбачала застосування антифіброзних, дезінтоксикаційних, вазоактивних, нестероїдних протизапальних препаратів, гепатопротекторів, вітамінів за стандартними методиками. Місцево накладалися топічні протизапальні, розсмоктуючі засоби. Також у лікуванні хворих на ОСД використовувалися фізіотерапевтичні методи.
Запропонований метод лікування ОСД із використанням 2,5 % розчину тіотриазоліну та субстратного антигіпоксанту цитофлавіну на тлі базового лікування отримали 33 (34,01 %) хворих на ОСД. Слід зазначити, що цитофлавін є комплексним препаратом, 1,0 мл розчину для внутрішньовенного введення якого містить кислоту янтарну – 100 мг, нікотинамід – 10 мг, рибоксин (інозин) – 20 мг, рибофлавіну мононуклеотид (рибофлавін) – 2 мг. Фармакологічні ефекти обумовлені комплексним впливом речовин, які входять до складу його компонентів. Препарат стимулює дихання й енергоутворення у клітинах, поліпшує процеси утилізації кисню тканинами, відновлює активність ферментів антиоксидантного захисту. Препарат активує внутрішньоклітинний синтез білка, сприяє утилізації глюкози, жирних кислот і ресинтезу в нейронах γ-аміномасляної кислоти через шунт Робертса.
Оцінка найближчих результатів лікування хворих на ОСД проводилася за наступними клінічними критеріями:
– значне поліпшення – повна відсутність скарг із боку хворого, його добре самопочуття; зникнення запальних елементів висипу і запальних проявів при поверхневих формах, а також у пацієнтів із стадією еритеми та набряку; відновлення кольору шкіри або коричневий колір осередків, зменшення розмірів осередків, відсутність появи нових осередків, відновлення еластичності шкіри, зменшення щільності; нормалізація лабораторних показників протягом року і більше;
– поліпшення – задовільне самопочуття, частковий регрес елементів висипки, зменшення проявів запалення (збліднення запального вінчика периферичного росту, бурий колір осередків ураження та ін.), відсутність нових осередків ураження; позитивна динаміка лабораторних параметрів протягом 6 і більше місяців;
– погіршення – у процесі лікування спостерігалося обтяження шкірного патологічного процесу або подальше прогресування (збільшення кількості та розмірів осередків ураження шкіри, наявність бузкової облямівки навколо бляшок, посилення набряку та/чи індурації, суб’єктивних відчуттів), розвиток ускладнень і побічних ефектів;
– без ефекту – видимих змін ознак хвороби не спостерігалося.
Було розроблено спосіб оцінки ефективності лікування хворих на ОСД (патент на корисну модель № 109591 від 25.08.2016). В основу даного способу поставлено завдання розширення арсеналу способів оцінки ефективності лікування хворих на ОСД шляхом оцінки в сироватці крові активності еластази, КЛА та накопичення ГАГ.
Поставлене завдання вирішувалося тим, що у відомому способі оцінки ефективності лікування хворих на ОСД, що включає вимір інтегральних маркерів функції СТ, у сироватці крови визначався вміст ГАГ, активність ферментів еластази та КЛА, при цьому оцінка КЛА сироватки крові здійснювалася за сумарною кількістю вільного та пептидно-зв`язаного оксипроліну в пробі крові, вміст ГАГ у сироватці крові визначали з використанням трихлороцтової кислоти та карбозольної реакції, активність еластази досліджували імуноферментним методом з використанням моноклональних антигенів та тест-системи і лікування оцінювали як ефективне при реєстрації тенденції до нормалізації цих показників або їх зниження до попередніх вимірів.
На підставі проведеного дослідження встановлено підвищення в сироватці крові активності еластази, КЛА та вмісту ГАГ у прогресуючій стадії на початку терапії, що свідчило про структурно-метаболічні порушення у СТ.
Слід зауважити, що від стану СТ в організмі залежить імовірність розвитку різних стадій ОСД, у зв’язку з чим було проведено дослідження з виявлення особливостей структурно-метаболічного стану СТ у хворих на ОСД усіх досліджуваних груп. Так, після проведеного лікування у хворих на ОСД І та ІІ груп порівняння виявлено високу активність рівнів еластази ([74,3 ± 35,6], [62,6 ± 4,2] і [53,4 ± 3,7] пг/мл), що перевищувало показники групи умовно-здорових донорів, відповідно в 2,7; 2,3 і 1,9 раза відповідно. У хворих основної групи після лікування цей показник був збільшеним в 1,3 раза порівняно з референтними значеннями умовно-здорових донорів.
Вміст ГАГ був підвищеним у всіх досліджуваних групах. Максимальне дворазове збільшення вмісту ГАГ виявлено у групі хворих на ОСД до лікування – (48,5 ± 5,4) мкмоль/л. Після проведеного лікування у хворих на ОСД групи порівняння цей показник перевищував рівень референтних значень групи умовно-здорових донорів у середньому в 1,4 раза. При цьому в основній групі вміст ГАГ перевищував рівень референтних значень групи умовно-здорових донорів усього на 18 %. КЛА плазми крові мала схожу динаміку, не залежала від статі та добре корелювала з показниками активності еластази.
Найбільш високі значення оксипроліну виявлено у пацієнтів із ОСД до лікування, І групи порівняння, що страждають на ОСД і ІІ групи порівняння ([34,3 ± 3,6], [31,8 ± 4,3] і [28,4 ± 3,5] мкмоль оксипроліну/л/г).
Рівні КЛА плазми крові у пацієнтів із ОСД до лікування перевищували дані умовно-здорових пацієнтів, що забезпечує цим показником важливе діагностичне і прогностичне значення при визначенні ступеня вираженості та локалізації осередків. КЛА плазми крові у хворих основної групи була підвищеною в три рази, однак ці рівні були значно нижчими, ніж показники у пацієнтів І і ІІ груп порівняння.
Таким чином, результати проведеного дослідження виявили низку особливостей біохімічних показників і свідчать, що ОСД у прогресуючій стадії супроводжувалася порушеннями метаболічного обміну СТ, які пов`язані з активацією протеїназ і накопиченням у сироватці крові ГАГ. Високий кореляційний зв`язок між динамікою активності еластази, КЛА (за оксипроліном) та вмістом ГАГ сироватки крові при ОСД дозволяє використовувати ці показники для диференційної діагностики й вибору комплексної терапії, як прогностично значущі в динаміці патогенетичного лікування, що забезпечує підвищення ефективності його проведення.
В аналізованих групах хворих виявлено незначні зміни за показниками неспецифічної резистентності. В основній групі пацієнтів після лікування фагоцитарний індекс був на 5 % нижчим, ніж у групах порівняння і становив (75,5 ± 6,0) %. Фагоцитарне число, що відображає середню кількість захоплених частинок фагоцитом в основній групі становило 3,4 ± 0,6. Перетравлювальна активність нейтрофілів (індекс завершеності фагоцитозу) в основній групі пацієнтів була вищою, ніж у групі пацієнтів із ОСД до лікування на 13 % і становила 1,1 ± 0,03.
В основній досліджуваній групі після проведеного лікування також виявлено незначну активацію системи комплементу. У даній групі активність комплементу була на 6 % вищою порівняно з групами порівняння і на 13 % вищою, ніж у групі пацієнтів із ОСД до лікування.
У досліджуваних хворих на ОСД після проведення лікування виявлено тенденцію до нормалізації середніх показників гуморальної ланки імунітету.
Концентрація ПСММ у пацієнтів основної групи після лікування знаходилася на рівні (0,264 ± 0,02) ум. од., що була в 1,1 раза нижчою порівняно з групою пацієнтів із ОСД до лікування.
З огляду на високу біологічну активність ПСММ, у пацієнтів досліджуваних груп можливі прояви їх нейротоксичної дії, пригнічення процесів біосинтезу білка, пригнічення активності ряду ферментів (роз’єднання процесів окислення і фосфорилювання), виникнення станів вторинної імунодепресії, токсична дія на еритропоез. У пацієнтів при загостренні захворювання (І група порівняння) середній рівень автоімунних антитіл у тесті лімфоцитотоксичності перевищував референтні значення показника в середньому в 1,2 раза. У пацієнтів основної групи після проведеного лікування відзначено зниження на 15 % рівня лімфоцитотоксичності щодо І групи порівняння.
Також у пацієнтів I групи порівняння після лікування спостерігалося підвищення (на 13 %) рівня ЦІК до (113,2 ± 11,9) ум. од. Е при контрольному значенні показника – (98,3 ± 21,1) ум. од. Е (Р ≥ 0,95). В основній групі після лікування виявлено мінімальний рівень концентрації ЦІК порівняно з досліджуваними групами ([102,2 ± 15,1] ум. од. Е). Рівень константи ЦІК, що характеризує молекулярну масу ЦІК, в основній групі після лікування був на 8 % нижчим, ніж у контролі. Що стосується оцінки концентрації антитіл до нативної ДНК, то були виявлені достовірні зміни концентрації специфічних антитіл до нативної ДНК методом ІФА у хворих двох досліджуваних груп порівняно з референтними значеннями. У хворих І і II груп порівняння після лікування виявлено більш високу концентрацію антитіл до подвійної спіралі ДНК (до [1,60 ± 0,06] ум. од. Е) порівняно з хворими основної групи, у яких антитіла становили в середньому (1,20 ± 0,04) ум. од. Е (Р ≥ 0,95).
Отже, збільшення концентрації антитіл до нативної ДНК достовірно взаємопов’язане з перебігом захворювання і свідчить про наявність автоімунного компоненту у хворих із ОСД І і II груп порівняння, навіть після проведеної комплексної терапії.
У всіх хворих основної групи після лікування спостерігалося незначне пригнічення показників Т-клітинного імунітету. У ході дослідження встановлено незначне зниження відносної кількості найбільш функціонально значущої лімфоїдної субпопуляції CD3+ загальних Т-лімфоцитів – на 3 % щодо референтних значень показника (р ≤ 0,05). Відносні величини, що характеризують експресію диференційованих маркерів CD на Т-хелперній субпопуляції (CD4+), в основній групі були на рівні референтних значень. Експресія Т-кілерної (CD8+) субпопуляції Т-лімфоцитів була зниженою на 6 % відносно референтних значень. Виявлено підвищення експресії диференційованого маркера CD2+ активних Т-лімфоцитів, що беруть участь у стимуляції В-клітин, на 2,5 % порівняно з контрольною групою здорових донорів.
У пацієнтів І і II груп порівняння, на відміну від хворих основної групи, після лікування виявлено зниження (в середньому в 1,3 раза) абсолютної кількості CD2+, CD3+ і CD8+ субпопуляцій Т-лімфоцитів. Імунорегуляторний індекс CD4+/CD8+ в основній групі після лікування був на рівні референтних значень.
Виходячи з мети досліджень, яка полягала в дослідженні параметрів імунореактивності у хворих на ОСД до та після лікування, вдалося виявити індивідуальні значущі імунно-фізіологічні параметри, які в подальшому можуть бути використані для оцінки стану, прогнозу перебігу захворювання, вибору патогенетичної терапії та оцінки її ефективності.
Разом з тим, діагностична і прогностична значимість окремих показників імунної системи залишається недостатньо вивченою, і це, в першу чергу, стосується ЦІК. Їх якісний склад істотно впливає на перебіг захворювання. Патогенні властивості ЦІК визначаються сукупністю їх фізико-хімічних властивостей, до яких у першу чергу належать розміри, склад, концентрація та здатність фіксувати комплемент.
Молекулярна маса ЦІК визначає їх розмір, який є найважливішим показником патогенності, а також швидкість елімінації з організму: великі ЦІК швидко елімінуються і порівняно малопатогенні; дрібні ЦІК погано елімінуються, можуть відкладатися субендотеліально, не здатні активувати систему комплементу; ЦІК середнього розміру мають високу комплементзв’язувальну здатність і є найбільш патогенними. Дослідження рівня ЦІК показало, що у хворих в основній групі після проведеного лікування цей показник перевищував величини в контрольній групі в 1,05 раза, а в І і II групах порівняння – в 1,2 раза. Константа ЦІК у хворих в обох групах порівняння після лікування була зниженою і свідчила про низькі розміри цих комплексів.
Ефективність специфічної ендогенної детоксикаційної терапії відображає величина ПСММ. Стійке підвищення рівня цього показника може свідчити про несприятливий прогноз перебігу захворювання. Дослідження концентрації ПСММ свідчило про те, що цей показник значно перевищував референтні значення в обох досліджуваних групах порівняння. Таким хворим показано проведення заходів, спрямованих на зниження рівня ендогенної інтоксикації.
Виявлена висока лімфоцитотоксичність сироватки крові в основній групі та І і ІІ групах порівняння після проведеного лікування свідчить про розвиток у пацієнтів із ОСД автоімунних реакцій. Так, при дослідженні сироватки крові у пацієнтів в основній групі і пацієнтів у І та ІІ групах порівняння методом ІФА виявлено наявність антитіл до нативної та денатурованої ДНК. При цьому в І та ІІ групах порівняння концентрація автоантитіл достовірно відрізнялася від показників основної групи після лікування, що відбивалося на стані таких хворих.
Аналіз результатів обстеження пацієнтів основної групи після проведеного лікування показав, що найбільш значущими з усього масиву досліджуваних параметрів, що характеризують функціональну активність імунокомпетентних клітин, є диференціювальні маркери СD3+, CD4+ і CD8+. Як відомо, зрілі Т-лімфоцити здійснюють імунологічний нагляд за антигенним гомеостазом в організмі, виконуючи дві важливі функції: ефекторну і регуляторну. Ефекторна функція полягає у специфічній цитотоксичності по відношенню до чужорідних клітин. Регуляторна функція (Т-хелпери – Т-супресори) складається в контролі за інтенсивністю розвитку специфічної реакції імунної системи на чужорідні антигени.
Таким чином, проведені дослідження субпопуляційного складу Т‑лімфоцитів у хворих основної групи після проведеного лікування показали зниження рівня CD3+, CD4+ і CD8+ Т-лімфоцитів порівняно з референтними значеннями.
Максимальне зниження експресії маркерів диференціювання CD3+ і CD4+ спостерігалося після лікування і в І та ІІ групах порівняння, що свідчило про збереження у таких пацієнтів імунодефіцитних станів Т-клітинної ланки імунітету. Регуляторні тимічні пептиди здійснюють дистанційне керування клітинами периферичної імунної системи, спричиняючи стимуляцію їх диференціювання і дозрівання. Активовані лімфоїдні клітини периферичної імунної системи продукують цитокіни, які ініціюють проліферацію та дозрівання Т-і В-лімфоцитів. При цьому знижені показники підвищуються, а гіперактивні процеси в окремих субпопуляціях Т-лімфоцитів повертаються до значень, близьких до нормального рівня.
Проблема прогнозування перебігу захворювання та результату лікування хворих на ОСД після проведеної комплексної терапії залишається остаточно не вирішеною. У зв’язку з цим, актуальним завданням є розробка і впровадження в клінічну практику специфічних молекулярних і біохімічних маркерів, що характеризують стан біоенергетичних процесів імунологічного контролю, ступеня агресивності процесу і, крім того, дозволяють індивідуалізувати прогноз клінічного перебігу ОСД.
Одним з важливих чинників, залучених у процеси клітинної проліферації, диференціювання і контролю патологічного процесу при ОСД, є медіатори імунної системи. З огляду на сказане вище, було вивчено вміст у сироватці крові хворих на ОСД про- і антизапальних цитокінів у 1–3 добу після госпіталізації і обґрунтовано їх прогностичне значення для діагностики та оптимізації патогенетичної терапії.
Вивчення вмісту в сироватці крові медіаторів імунної системи до та після проведеного лікування виявило динамічні зміни всіх досліджуваних цитокінів і неоднозначну їх спрямованість у різних досліджуваних групах. Так, у І і ІІ групах порівняння виявлено статистично достовірне збільшення концентрації всіх досліджуваних цитокінів, крім ІЛ-4 і ІЛ-10, які були знижені в ІІ групі порівняння на 30 % щодо референтних значень групи умовно-здорових донорів. У середньому відзначено дворазове-семиразове зростання концентрації про- і антизапальних цитокінів. Максимальний рівень ІЛ-10, який становив (67,6 ± 14,3) пкг/мл, виявлено в І групі порівняння.
В основній групі концентрація прозапальних цитокінів була виявленою на рівні референтних значень групи умовно-здорових донорів. Концентрація протизапальних цитокінів ІЛ-4 і ІЛ-10 в основній групі перевищувала рівень референтних показників групи умовно-здорових донорів в 1,1 і 1,3 раза відповідно.
Дослідження показали, що у хворих на ОСД у всіх досліджуваних групах підвищувався ФНП-α, що може вказувати на активацію макрофагів, моноцитів, посилення цитотоксичної дії, індукцію секреції цитокінів. Дія ФНП-α може супроводжуватися посиленням проліферації та диференціюванням нейтрофілів, фібробластів, Т- і В-лімфоцитів, а також посиленням транскрипції прозапальних цитокінів – ІЛ-6, ІЛ-8 та ІЛ-1β.
Достовірне підвищення прозапальних цитокінів у групах порівняння ОСД вказує на активацію клітин-продуцентів прозапальних цитокінів (ІЛ-6, ІЛ-8 та ІЛ-1β): моноцитів, макрофагів, Т-лімфоцитів вторинного типу (i К-2 клітин), нейтрофілів, фібробластів, кератиноцитів, хондроцитів і епітеліальних клітин.
Такі зміни здатні посилювати стимуляцію В-клітин, Т-клітин, НК-клітин, підвищувати експресію міжклітинних адгезивних молекул ендотеліальними клітинами і адгезивні властивості макрофагів, нейтрофілів, активувати індукцію гепатоцитами білків гострої фази (гаптоглобін, церулоплазмін, СРБ та ін.), прискорювати диференціювання проліферуючих В-клітин у плазматичні та стимулювати ними антитілопродукцію, а також стимулювати проліферацію тимоцитів і перетворення Т-лімфоцитів у цитотоксичні лімфоцити.
Підвищення ІЛ-8 у сироватці крові хворих на ОСД вказує на посилення активності широкого спектру імунокомпетентних клітин (моноцитів, макрофагів, нейтрофілів, фібробластів, ендотеліальних клітин та ін.), яка супроводжується стимуляцією хемотаксису нейтрофілів, субпопуляцій Т‑лімфоцитів і базофілів. ІЛ-8 активує нейтрофіли до викиду ферментів лізосомами («дихальний вибух» і дегрануляція), підвищує спорідненість нейтрофілів до ендотеліальних клітин, індукуючи вихід лейкотрієна В4 з нейтрофілів і підвищуючи спорідненість моноцитів до клітин ендотелію. Це створює метаболічні умови для руйнування клітин шкіри.
Підвищення вмісту ІЛ-4 і ІЛ-10 у хворих на ОСД І групи порівняння вказує на активацію NK-клітин і Тh2-клітин, яка супроводжується посиленням функції Т-хелперів, розмноженням активних В-клітин, опасистих клітин і гемопоетичних клітин, пригніченням цитокінової продукції, у тому числі Т‑лімфоцитів первинного типу (Тh1-клітинами), пригніченням активності макрофагів, продукції моноцитами і макрофагами прозапальних цитокінів, на тлі підвищення проліферації В-лімфоцитів і секреції імуноглобулінів. Це свідчило про те, що у хворих на ОСД порушені центральні механізми розвитку і реалізації імунних реакцій, пов’язаних з пригніченням клітинної та гуморальної ланок імунної системи.
Таким чином, аналіз отриманих результатів дає підставу вважати, що в основній групі хворих на ОСД після проведеного лікування за сучасною розробленою схемою значно активована продукція анти- і прозапальних медіаторів імунної системи, тоді як у І та ІІ групах порівняння хворих на ОСД відзначено пригнічення секреції антизапальних цитокінів на тлі підвищення прозапальних медіаторів, що може мати прогностичне значення для подальшої оптимізації патогенетичної терапії у хворих цих груп.
Запорукою успішного лікування цих хворих може бути рання діагностика ОСД. На сьогоднішній день методи її виявлення розроблено все ще недостатньо ефективно, що не дозволяє визначати наявність преморбідного метаболічного стану на стадії формування хвороби і розвитку патологічного процесу і свідчить про необхідність подальшого вивчення етіології та патогенезу дисфункції еластази і колагену.
У пацієнтів основної групи після проведеного лікування концентрація СРБ позитивно знижувалася до рівня в середньому 12 г/л, що було на 33 % і на 25 % нижче, ніж у І та ІІ групах порівняння відповідно. У групах порівняння концентрація СРБ достовірно не відрізнялася від групи ОСД до лікування і перевищувала референтні показники контрольної групи в середньому в 3 рази, що свідчить про перебіг гострої фази запального процесу.
Вміст магнію і рівень хлору в сироватці крові хворих основної групи достовірно не відрізнявся від контролю – було виявлено позитивне зниження концентрації магнію (в середньому в 1,4 раза) і збільшення рівня хлору (в 1,1 раза), ніж у групах порівняння.
При дослідженні вмісту білкових фракцій у сироватці крові хворих на ОСД після проведеного лікування виявлено, що в основній групі пацієнтів показники були на рівні контрольної групи здорових донорів. У групах порівняння виявлено достовірне підвищення α1-фракції глобулінів (в 1,6 раза) і зниження γ-фракції глобулінів (в 1,2 раза) порівняно з контрольними величинами.
Збільшення α1-фракції глобулінів відбувалося за рахунок збільшення концентрації стресових білків і кислих глікопротеїнів, а зниження γ‑глобулінової фракції – за рахунок споживання глобулінів при утворенні ЦІК.
При дослідженні ліпідного обміну у хворих на ОСД після лікування у групах порівняння було виявлено достовірне зниження щодо контрольних величин за вмістом холестерину (в 1,3 раза), ЛПВЩ (у 2,3 раза), тригліцеридів (в 1,7 раза). Також значно був знижений коефіцієнт атерогенності в цих групах – у середньому в 2 рази порівняно з контролем. Що стосується основної групи, то тут відзначено дворазове збільшення концентрації ЛРВЩ і деяке зниження коефіцієнта атерогенності (в 1,5 раза) порівняно з контрольною групою умовно-здорових донорів.
Специфіка перебігу ОСД, а саме її прогредієнтність, часті рецидиви, неприємні суб’єктивні відчуття, у тому числі відчуття стягування, нерідко порушували сон, виникнення осередків на візуально помітних ділянках тіла значно погіршували загальний стан хворих. Так, до лікування, у 90 (87,3 %) хворих відзначалися різного роду скарги, серед яких переважали: підвищена дратівливість, стомлюваність, порушення ритму нічного сну, зниження працездатності, тобто суб’єктивні симптоми, які свідчили про погіршення загального стану хворих на ОСД.
Найбільш виражене зниження суб’єктивної симптоматики у пацієнтів із ОСД було відзначено у пацієнтів основної групи, які отримували комбіновану терапію із включенням сучасних схем лікування, де у більшості хворих відзначався значний регрес (на 51,3 %) скарг, що спостерігалися в початковому стані. У І групі порівняння до кінця лікування скарги хворих були менш вираженими, але знизилися в середньому на 21 %, а в ІІ групі порівняння зниження відмічено всього на 16,5 %.
Показники гуморального імунітету змінювалися наступним чином: рівень ЦІК малого розміру у хворих в І групі порівняння, які отримали базову терапію, спочатку був вищим, ніж у групі контролю на 21,1 % (p < 0,05), залишаючись без змін при виписці.
В основній групі пацієнтів, які отримували комплексну терапію з цитофлавіном, показник ЦІК також був вищим за контроль на 32,9 % (p < 0,01), знизившись до кінця лікування на 14 % (p < 0,05), не досягнувши, однак, значень умовно-здорових донорів контрольної групи. Імуноглобулін A в І і ІІ групах порівняння до початку лікування був вищим за контрольні дані на 43,2 % (p < 0,05) і 35,3 % (p < 0,05), відповідно. На тлі досліджуваних видів терапії рівень імуноглобулін A мав тенденцію до зниження в І групі порівняння і знизився в основній групі на 18,3 % (p < 0,05), досягнувши рівня значень умовно-здорових донорів контрольної групи. Імуноглобулін G у контрольній групі становив (1235,0 ± 66,14) мг%, у І групі порівняння показник значних коливань не зазнав, не відрізняючись від контролю. В основній групі із застосуванням цитофлавіну рівень імуноглобуліну G мав тенденцію до зниження на 5,9 % (p > 0,05), досягнувши значення (972,5 ± 35,18) мг%, що було нижчим, ніж у групі контролю на 21,3 % (p < 0,05). Рівень імуноглобуліну M спочатку в І і ІІ групах порівняння був нижчим за показник умовно-здорових донорів на 27,2 % (p < 0,05) і 31,1 % (p < 0,05), відповідно.
До кінця лікування показник мав тенденцію до підвищення у всіх досліджуваних групах. Значення НСТ-тесту, середнього цитохімічного коефіцієнту НСТ-тесту, активності фагоцитозу як до, так і після проведеного лікування у всіх досліджуваних групах значущих відхилень від контрольних даних не мали.
Динаміка значень цитокінового профілю характеризувалася різнонаправленістю змін. Так, ІЛ-1 спочатку був вищим за значення контролю у пацієнтів усіх досліджуваних груп (p < 0,05) і до кінця проведеної терапії мав достовірне зниження. Рівень протизапального ІЛ-4 в основній групі початково був нижчим за контроль (p < 0,05) і мав достовірне зростання (p < 0,05), у І групі порівняння показник не відрізнявся від умовно-здорових донорів контрольної групи і не змінився на тлі лікування. Рівень ІЛ-8, який є прозапальним, до початку лікування у всіх досліджуваних групах достовірно від контрольних значень не відрізнявся, знизившись, однак, при виписці в основній групі (p < 0,05).
Значення ФНП, що були спочатку підвищені в усіх досліджуваних групах (p < 0,05), достовірно знизилися (p < 0,05). Рівень ІЛ-6 не зазнав значних змін на тлі застосованих видів терапії у пацієнтів досліджуваних груп.
Отримані в дослідженні суперечливі дані лише підтверджують маловивчені та складні механізми функціонування деяких прозапальних цитокінів при автоімунних процесах. Базова терапія ОСД справляє позитивний вплив на основні показники гомеостазу у пацієнтів, сприяє зниженню прозапальних ІЛ-1 і ФНП α, а також редукції клінічних проявів.
Показники активності еластази, КЛА та вмісту ГАГ сироватки крові при ОСД у прогресуючій стадії слід вважати прогностично значущими в динаміці патогенетичної терапії, що проводиться. Ці показники дозволяють проводити диференційну діагностику, вибір комплексного лікування, що забезпечує підвищення ефективності лікування пацієнтів із ОСД. Найбільш високі рівні активності протеїназ відзначалися у хворих на ОСД і були пов`язані з накопиченням значних концентрацій ГАГ у сироватці крові. Результати дослідження свідчать, що ОСД супроводжувалася порушеннями метаболічного обміну СТ, які пов`язані з активацією протеїназ і накопиченням у сироватці крові ГАГ. Високий кореляційний зв`язок між динамікою активності еластази, КЛА (за оксипроліном) та вмістом ГАГ сироватки крові при ОСД дозволяє використовувати ці показники як прогностично значущі в динаміці патогенетичного лікування, що проводиться.
Проведене дослідження демонструє, що поліпшення загального стану хворих завжди є головною метою проведеної комплексної терапії ОСД. Моніторинг основних скарг з урахуванням клінічної картини ОСД дозволив оцінити ефективність комплексної терапії і в певній мірі допомогти у виборі та проведенні необхідної адекватної корекції хронічного дерматозу. Включення до складу базової терапії ОСД цитофлавіну сприяє більш значному зростанню порівняно зі стандартною терапією рівня самопочуття, активності, настрою, зменшенню запального процесу осередків у прогресуючій стадії. Комплексне лікування призводить до нормальних значень ЦІК малого діаметра, імуноглобуліну А, ІЛ-1 і -4, ФНП α, ефективно і достовірно знижує рівень інтенсивності почуття стягування шкіри, порушення сну, дратівливість, порог стомлюваності, а також підвищує працездатність.
Результати проведених досліджень свідчать про патогенетичну спрямованість комплексного застосування терапії на підставі розробленої схеми патогенетичного лікування, включно із застосуванням 2,5 % розчину тіотриазоліну і цитофлавіну на тлі традиційної терапії у пацієнтів із ОСД, що супроводжується швидким і вираженим регресом основних клінічних критеріїв дерматозу, і полягає в основі високого терапевтичного ефекту нового сучасного розробленого способу лікування.
Резюмуючи отримані дані, можна стверджувати, що розроблений комбінований спосіб лікування є патогенетично обґрунтованим, високоефективним способом терапії та профілактики ОСД.
До того ж, безпечне застосування, доступність такої терапії обґрунтовують доцільність використання засобів, які покращують стан СТ у лікуванні хворих на ОСД і дозволяють їх рекомендувати для впровадження у практику охорони здоров’я.
Впровадження результатів проведеного дослідження в практику роботи ДУ «Інститут дерматології та венерології НАМН України» дозволило оптимізувати результати лікування хворих на ОСД, сприяло зниженню ліжко-дня і поліпшенню якості їхнього життя в майбутньому.
ВИСНОВКИ
У дисертації наведено теоретичне обґрунтування необхідності та нове вирішення наукового завдання, що полягає в підвищенні ефективності діагностики та лікування хворих на ОСД шляхом розробки комплексного методу терапії з урахуванням клініко-патогенетичної ролі метаболічних та імунних порушень.
- Враховуючи розповсюдженість ОСД, хронічний персистуючий перебіг захворювання з формуванням стійких осередків атрофії та ущільнення шкіри, а також недостатню ефективність існуючої терапії та невирішеність питань діагностики прогресування захворювання, розв’язання цієї проблеми є актуальним для сучасної та практичної дерматології.
- За результатами комплексного обстеження хворих на ОСД залежно від стану було виявлено підвищення рівня ендогенної інтоксикації (на 20 %), що відбувалося на тлі зниження експресії антигенних маркерів CD3+ (на 29 %) та CD8+ (на 19 %). У декількох хворих (4 пацієнти) виявлено наявність антитіл до нативної ДНК, що підкреслювало наявність автоімунного компоненту. Збільшення концентрації СРБ (у 4 рази) вказувало на перебіг гострої фази запального процесу. Зміна вмісту білкових і ліпідних фракцій розглядалась як додаткові фактори порушення регуляторних і регенеративних функцій на рівні структурної організації клітинних мембран. Значне збільшення рівня еластази (на 35 %), ГАГ (на 27 %), КЛА плазми крові за оксипроліном (на 57 %) вказувало на незадовільний структурно-метаболічний стан СТ.
- При оцінці мікроциркуляційного стану уражених ділянок за допомогою тепловізійного дослідження у пацієнтів враховувалася стадійність та особливості осередку при ОСД. Найбільші значення температури фіксувались ексцентрично, за їх максимумом у зонах, розташованих у периферичних ділянках склеродермічного осередку. При комплексному обстеженні хворих на ОСД з використанням дистанційної термографії було виявлено пряму залежність між ділянками гіпертермії, запальними клінічними проявами та лабораторними змінами у 15 пацієнтів (57,7 %), між ділянками гіпертермії та запальними клінічними проявами в 11 осіб (42,3 %). Встановлено пряму залежність між ділянками гіпотермії на термограмах та клінічними проявами у вигляді атрофії шкіри в осередках ураження у 2 пацієнтів (7,7 %).
- Метод дистанційної термографії дозволяє судити про активність сполучнотканинного запалення або процесів склерозування в осередках ураження у пацієнтів з ОСД та надає можливість застосування дистанційної термографії як неінвазійного метода діагностики рецидивів у хворих з автоімунними захворюваннями СТ на доклінічному етапі.
- Розроблено алгоритм лікувально-діагностичної тактики для пацієнтів з ОСД, який базувався на процесах уповільнення прогресування хвороби, максимальної стабілізації процесу та регресу клінічної картини. Комплекс лікувальних заходів включав застосування медикаментозної терапії (антифіброзні, дезінтоксикаційні, судинні, метаболічні, мембраностабілізуючі препарати, цитопротектори, вітаміни, антиоксиданти), яка активувала дихання й енергоутворення у клітинах, поліпшувала процеси утилізації кисню тканинами, відновлювала активність ферментів антиоксидантного захисту, що підтверджувалося нормалізацією рівнів показників структурно-метаболічних порушень у СТ (еластази, КЛА, вмісту ГАГ), збільшенням рівнів протизапальних цитокінів ІЛ-4 й ІЛ-10 та вказувало на активацію механізмів, спрямованих на згасання патологічного процесу.
- Комбінована терапія з використанням розроблених схем лікування (у тому числі застосування 2,5 % розчину тіотриазоліну та субстратного антигіпоксанту цитофлавіну) у хворих на ОСД має більш високу терапевтичну ефективність: значне поліпшення у 68,2 % хворих порівняно із традиційною (46,3 %), та супроводжувалося нормалізацією імунологічних і біохімічних показників, а також маркерів структурно-метаболічного стану СТ.
РЕКОМЕНДАЦІЇ
У період маніфестації та прогресування ОСД необхідно проводити комплексне лікування: пеніцилін G – по 5,0 млн на 100,0 фізіологічного розчину внутрішньовенно краплинно протягом 10–12 діб; аскорбінова кислота 10,0 % – по 2,0 мл в/м протягом 10–15 діб; зовнішнє лікування – траумель С мазь і аплікації з розчином димексиду 1:4 (згідно стандартам терапії ОСД), а також додатково тіотриазолін 2,5 % по 4,0 мл внутрішньом’язово протягом 10–15 діб та цитофлавін по 10,0 мл на 200,0 фізіологічного розчину внутрішньовенно краплинно протягом 10 діб із подальшим переходом на таблетовану форму препарату по 2 таблетки 2 рази на добу протягом 25 діб.
В якості способу оцінки ефективності лікування доцільно визначати вміст ГАГ, активність ферментів еластази та КЛА сироватки крові за сумарною кількістю вільного та пептидно-зв’язаного оксипроліну.
Метод дистанційної термографії можливо використовувати для виявлення наявності прогресування захворювання (у ряді випадків навіть на доклінічній стадії).
ПЕРЕЛІК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Антителообразование к эластину и эластазе у больных диффузными заболеваниями соединительной ткани / И.П. Гонтарь, Н.В. Ненашева, Н.А. Матасова и др. Медицинский альманах. 2012. № 2 (21). С. 79–81.
- Ата М. А. Дистанционное термометрическое исследование измененных кожных покровов у больных очаговой склеродермией. Дерматологія та венерологія. № 2 (80). С. 50–53.
- АтаМ. А. Лечение очаговой склеродермии с применением современных методов. Дерматологія та венерологія. 2018. № 3 (81). С. 22–24.
- Ата М. А. Особенности активности эластазы, коллагенолитической активности и содержания гликозаминогликанов у больных ограниченной склеродермией. Дерматологія та венерологія. 2018. № 4 (82). С. 23–26.
- Ата М. А. Особенности биохимических изменений у больных ограниченной склеродермией. ScienceRise: Medical Science. 2019. № 1 (28). С.20–24.
- Ата М. А. Оцінка ефективності лікування хворих на вогнищеву склеродермію. Мат. ХІІІ Міжнародної конференції студентів та молодих вчених «Актуальні питання сучасної медицини», м. Харків, 14-15 квітня 2016 р. Харків : ХНУ ім. В.Н. Каразіна, 2016. С. 31.
- Ата М. А. Прогнозирование развития иммунной дисфункции у больных очаговой склеродермией по состоянию некоторых звеньев иммунного ответа. Дерматологія та венерологія. 2019. № 1 (83). С. 14–
- Біловол А.М., Колганова Н.П, Берегова А.А. Застосування комбінованих препаратів в лікуванні хронічних дерматозів. Український науково-медичний молодіжний журнал. 2012. № 3. С. 37–38.
- Болотная Л.А., Кутасевич Я.Ф. Современный взгляд на патогенез ограниченной склеродермии и хронической красной волчанки (обзор литературы). Дерматологія та венерологія. № 2 (64). С. 5–16.
- Волнухин В.А., Катунина О.Р., Мурадян Н.Л. О роли профиброзных цитокинов в патогенезе локализованной склеродермии. Вестн. дерматол. и венерол. 2012. № 1. С. 28–
- Габриэлян Н.Н., Липатова В.И. Опыт использования показателей средних молекул для диагностики нефрологических заболеваний у детей. Лаб. дело. 1984. № 3. С. 138–140.
- Горячковський О.М. Клінічна біохімія в лабораторній діагностиці: Довідниковий посібник. – Вид. 3, вип. і доп. Одеса: Екологія, 2005. 616 с.
- Громова О., Торшин И. Возможные молекулярные механизмы влияния дефицита магния и оротовой кислоты на дисплазию соединительной ткани. Эстетическая медицина. 2009. Т. VIII, № 1. С. 75–83.
- Дворников А.С., Круглова Л.С. К вопросу об этиологии и лечении ограниченной склеродермии. Вестник дерматологии и венерологии. 2010. № 6. С. 101–105.
- Доработка методик тепловизионного контроля поверхности биологических объектов / Е.М. Прохоренко, О.Е. Брюховецкая, В.Ф. Клепиков и др. Восточно-Европейский журнал передовых технологий. 2012. № 5 (59). С.65–68.
- Дранник Г.Н., Ена Я.М., Варецкая Г.Н. Продукты расщепления фибрина/фибриногена при патологических процессах. К. : Здоров’я, 1987. 184 с.
- Зарецкая Ю.М., Леднев Ю.А. HLA 50 лет: 1958–2008. Тверь : Триада, 2008. С. 152.
- Зимон И.Н., Далимов И.З. Агрегационные свойства тромбоцитов после операций по поводу острых гастродуоденальных язвенных кровотечений. Анест. и реанимат. 1987. № С. 59–62.
- Иванов Е.П. Диагностика нарушений гемостаза : практ. пособие для врачей. Минск : Беларусь, 1983. 222 с.
- Иммунология. Норма и патология: учебник, 3-е изд., перераб. и доп. / Р. М. Хаитов, Г. А. Игнатьева, И. Г. Сидорович. М. : ОАО Издательство Медицина, 2010. 182 с.
- Иммунопатологические нарушения и цитокиновый профиль при системной и ограниченной склеродермии / Н.В. Романова, Н.П. Шилкина, Е.Ю. Капрельянц, В.А. Романов. Терапевтический архив. № 5. С. 28–31.
- Камышников В.С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностике. 2-е изд., перераб. и доп. М. : Медпресс–информ, 2004. 920 с.
- Кацадзе Ю.Л., Котовщикова М.А. Определение активности комплекса антитромбин–III– гепарин в плазме крови. Лаб. дело. 1982. № С.232–234.
- Клиническая иммунология / под ред. А.В. Караулова. М. : Медицинское информационное агентство, 1999. 604 с.
- Ковальчук Л.В., Ганковская Л.В., Мешкова Р.Я. Клиническая иммунология и аллергология с основами общей иммунологии. М. : ГЭОТАР–Медиа, 2014. 640 с.
- Коханов А.В., Мусатов О.В., Мяснянкин А.А. Факторный анализ с использованием пакета программ «STATISTICA 6.0» на примерах иммунохимических исследований в ургентной медицине: учебное пособие. Астрахань : АГМА, 42 с.
- Круглова Л.С., Гильманова Л.В. Тактика ведения больных с ограниченной склеродермией. Рос. журнал кожных и венерических болезней. 2013. № С.25–29.
- Кутасевич Я.Ф., Ата М.А. Особенности формирования синдрома иммуно-эндокринной дисфункции у больных очаговой склеродермией в стадии обострения. Международный медицинский журнал. 2019. № 1 (97). С. 75–79.
- Кутасевич Я.Ф., Савенкова В.В. Бальна шкала оцінки ступеня тяжкості обмеженої склеродермії. Проблеми дерматології та ІПСШ від дитячого до похилого віку: Мат. регіональної науково–практичної школи. К., 2011. С. 52–53.
- Кутасевич Я.Ф., Савенкова В.В. Метод вторинної профілактики у хворих на обмежену склеродермію. Дерматологія. Косметологія. Сексопатологія. 2010. № 3. С. 48–53.
- Кутасевич Я.Ф., Савенкова В.В. Удосконалення терапії хворих на обмежену склеродермію. Укр. журн. дерматології, венерології, косметології. 2010. № 3 (38). С. 175.
- Кутасевич Я.Ф., Савенкова В.В., Носовська Т.Д. Спосіб оцінки ступеня тяжкості обмеженої склеродермії. Дерматологія та венерологія. 2010. №3 (49). С. 19–23.
- Ланг Т.А., Сесик М. Как описывать статистику в медицине; пер. с англ.; под ред. В.П. Леонова. М. : Практическая медицина, 2011. 480 с.
- Лапин С.В., Тотолян А.А. Иммунологическая лабораторная диагностика аутоиммунных заболеваний. СПб. : Человек, 2010. C. 12–24.
- Луговская С.А., Морозова В.Т., Почтарь М.Е. Лабораторная гематология. М. : Триада, 2006. 222 с.
- Меньшиков В.В. Лабораторные методы исследования в клинике. М. : Медицина, 1987. 270 с.
- Метод определения гликозаминогликанов в биологических жидкостях / П. Н. Шараев, В. Н. Пишков, Н. И. Соловьева и др. Лабораторное дело. 1987. № 5. С. 330–332.
- Новый иммунобиологический метод экстракорпоральной фотохимиотерапии ограниченной склеродермии / В.А. Молочков, А.В. Молочков, А.В. Кильдюшевский, О.А. Фомина. Рос. журнал кожных и венерических болезней. 2015. Т. 18, № 3. С. 13–16.
- Определение коллагенолитической активности плазмы крови / П. Н. Шараев, В. Н. Пишков, Н. Г. Зворыгина и др. Лабораторное дело. 1987. № 1. С. 60–62.
- Определение растворимого фибрина в плазме крови / Т.В. Варецкая, Л.И.Михаловская, Л.А. Свитальская, Я.М. Ена. Клин. лаб. диагностика. № 7–8. C. 10–14.
- Определение свободного и пептидно–связанного гидроксипролина в сыворотке крови / П.Н. Шараев, Е.П. Сахабутдинова, О.И. Лекомцева, С.В. Кошикова. Клин. лаб. диагностика. 2009. № С. 7–9.
- Особенности антителогенеза к эластину и эластазе у больных диффузными заболеваниями соединительной ткани в зависимости от активности воспалительного процесса / H.A. Матасова, Э.Р. Аветисова, О.В.Парамонова и др. Актуальные проблемы современной ревматологии: сб. научн. работ. Волгоград : ООО «Царицынская полиграфическая компания», 2011. Вып. XXVIII. 65–66.
- Оценка патогенных и непатогенных иммунных комплексов: метод. рекомендации МЗ СССР / Сост. Н.А. Константинова. М., 1986. 24 с.
- Пат. на корисну модель 109591 Україна, МПК 7 G01N33/49 (2006.01). Спосіб оцінки ефективності лікування хворих на вогнищеву склеродермію / М.А. Ата, Я. Ф. Кутасевич, В. І. Жуков. № u201602567; заявл. 16.03.2016; опубл. 25.08.2016, Бюл. № 16.
- Пат. на корисну модель 54168 Україна, МПК (2009) A61B17/00. Спосіб профілактики рецидивів у хворих на обмежену склеродермію / Я.Ф.Кутасевич, В.В. Савенкова. № u201005903; заявл. 17.05.2010; опубл. 210.2010, Бюл. № 20.
- Пат. на корисну модель 55784 Україна, МПК (2009): A61B10/00. Спосіб оцінки ступеня тяжкості обмеженої склеродермії та хронічного червоного вовчака / Я.Ф. Кутасевич, В. В. Савенкова. № u201007096; заявл. 08.06.2010; опубл. 27.12.2010, Бюл. № 24.
- Пат. на корисну модель 60092 Україна, МПК: A61K31/43 (2006.01). Спосіб лікування хворих на обмежену склеродермію / Я.Ф. Кутасевич, В. В. Савенкова. № u201013832; заявл. 22.11.2010; опубл. 09.06.2011, Бюл. № 11.
- Платонова Т.М. Особливості визначення вмісту фібріногену в плазмі крові за допомогою Анцистрону-Н-тромбіноподібного ферменту з отрути щитомордника звичайного (Agkistrodon halys halys). Фізіол. журнал. 1993. Т.39, № С. 15–19.
- Применение современных способов диагностики очаговой склеродермии / Янина Кутасевич, Ирина Олейник, Мохамед Ата и др. Spatial aspects of socio-economic systems development: the economy, education and health care. Monograph. Opole, Poland : Publishing House WSZiA, P. 258–265.
- Психодерматологія в Україні: сучасний погляд на проблему / Я. Ф. Кутасевич, M. Jafferany, Т. В. Святенко та ін. Дерматологія та венерологія. 2018. № 4. С. 8–12.
- Рахманов В.А., Хмельницкий Р.Х. К механизму действия лидазы при лечении больных склеродермией. Вестник дерматологии и венерологии. № 6. С. 3–7.
- Резніченко Н. Ю. Патологія шкіри при системних захворюваннях сполучної тканини у дорослих та дітей : Навчальний посібник. Запоріжжя, 2016. 92 с.
- Роль иммунных факторов в развитии склеродермии / Н.Н. Потекаев, И.М. Корсунская, С.Д. Гусева, З.А. Невозинская. Клиническая дерматология и венерология. 2014. № 3. С. 4–10.
- Роль экстракорпоральной фотохимиотерапии в индукции ингибирующих механизмов в регуляции иммунного ответа при ограниченной склеродермии / А. В. Кильдюшевский, В. А. Молочков, А. В. Молочков, О. А. Фомина. Рос. журнал кожных и венерических болезней. 2015. № 4. С. 29–34.
- Романенко К.В. Оптимізація комплексної патогенетичної терапії хворих на різні форми склеродермії з урахуванням клініко–морфологічних, імунних та судинних порушень: автореф. дис. на здобуття наукового ступеня д‑ра мед. наук: 14.01.20; ДУ «Інститут дерматології та венерології НАМН України», Харків, 2013. 31 с.
- Савенкова В.В. Комплексна терапія хворих на обмежену склеродермію та хронічний червоний вовчак з урахуванням патогенетичних розладів, клінічних та регіонально-екологічних особливостей перебігу: автореф. дис… ступеня д-ра мед. наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби. ДУ «Інститут дерматології та венерології АМН України». Харків, 2011. 35 с.
- Склеродермия: общий взгляд на проблему / Н. Н. Потекаев, И. М. Корсунская, С. Д. Гусева, З. А. Невозинская. Клиническая дерматология и венерология. 2013. № 5. С. 6–10.
- Скрипкин Ю.К., Главинская Т.А. Поражение кожи при болезнях соединительной ткани. Клиническая дермато-венерология в 2 т. М. : Гэотар–медиа, 2009. Т. 2. С.234–276.
- Снарская Е. С., Ромашкина А. С. Наследственная склеродермия. Рос. журнал кожных и венерических болезней. 2011. № 5. С. 47–49.
- Олійник І.О., Ата М.А., Кордон Т.В. Стан мікроциркуляторного русла шкіри при обмеженої склеродермії. Матеріали науково-практичної конф. з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», м. Харків, 10-11 листопада 2017. Дерматологія та венерологія. 2017. № 3 (77). С. 109.
- Хегер П. Г. Склеродермия / пер. с нем. под. ред. А. А. Кубановой, А. Н. Львова. М. : Издательство Панфилова; БИНОМ. Лаборатория знаний, 2013. С. 508–515.
- Шушарин А.Г., Морозов В. В., Половинка М. П. Медицинское тепловидение – современные возможности метода. Современные проблемы науки и образования. 2011. № С. 34–39.
- 14–MHz ultrasonography as an outcome measure in morphea (localized scleroderma) / K. A. Nezafati, R. L. Cayce, J. S. Susa et al. Archives of Dermatology. 2011. Vol. 147, Iss. 9. P. 1112–1115.
- A Case of Bullous Morphea Resistant to Methotrexate and Phototherapy Successfully Treated With Mycophenolate Mofetil / A. Cuellar-Barboza, J. Alberto Cardenas-De La Garza, C. Daniel Villarreal-Villarreal et al. Drugs Dermatol. 2018. Vol. 17, Iss. 10. P. 1123–1125.
- A case of juvenile localized scleroderma with anti–topoisomerase I antibody / K. Shimizu, T. Matsushita, K. Takehara, Y. Hamaguchi. J. Dermatol. 2018. doi: 10.1684/ejd.2018.3426. [Epub ahead of print]
- A case of localized scleroderma mimicking tinea cruris / J. I. Lee, H. Y. Jung, Y. B. Lee et al. Cutis. 2013. Vol. 92, Iss. 3. P. 5–6.
- A rare case of acquired partial lipodystrophy (Barraquer–Simons syndrome) with localized scleroderma / K. Payapvipapong, N. Niumpradit, A. Nakakes, K. Buranawuti. International J. Dermatology. 2014. Vol. 53, Iss. 1. P. 82–84.
- Alternatively activated macrophages (M2 macrophages) in the skin of patient with localized scleroderma / N. Higashi-Kuwata, T. Makino, Y. Inoue et al. Experimental Dermatology. 2009. Vol. 18, Iss. 8. P. 727–729.
- Anbiaee N. A., Tafakhori Z. Localized periodontal ligament space widening as the only presentation of scleroderma–reliability recheck: Author response. Dentomaxillofacial Radiology. 2012. Vol. 41, Iss. 5. Р. 441–442.
- Anthony D. Statistics for Health? Life and Social Sciences. Essex, United Kingdom : Ventus Publishing Aps, University of Essex, 2011. 292 p.
- Antiphospholipid antibodies in localized scleroderma: The potential role of screening tests for the detection of antiphospholipid syndrome / A. Lis-Święty, L. Brzezińska-Wcisło, H. Arasiewicz, B. Bergler-Czop. Postepy Dermatologii i Alergologii. 2014. Vol. 31, Iss. 2. P. 65–70.
- Arias-Palomo D., Borbujo–Martínez J. Localized scleroderma (Morphea). FMC en Atencion Primaria. 2010. Vol. 12, Iss. 10. 680–685.
- Arkachaisri T., Pino S. Localized Scleroderma Severity Index and global assessments: A pilot study of outcome instruments. Rheumatol. 2009. Vol. 36, Iss. 9. P. 2136–2143.
- Bakst R., Kovarik C., Werth V. P. A case of localized scleroderma in a sculptor and his wife. Clin. Rheumatol. 2009. Vol. 4, Iss. 31. P. 241–249.
- Bath psoralen-UVA photochemotherapy for localized scleroderma: Experience from a single institute / F. Pavlotsky, N. Sakka, A. Lozinski, A. Barzilai. Photodermatology Photoimmunology and Photomedicine. 2013. Vol. 29, Iss. 5. P. 247–252.
- Bhattacharyya S., Varga J. Emerging Roles of Innate Immune Signaling and Toll–Like Receptors in Fibrosis and Systemic Sclerosis. Current Rheumatology Reports. 2015. Vol. 17, Iss. 1. P. 474.
- Biecek P. Analiza danych z programem R. Warszawa : Wydawnictwo naukowe PWN, 2012. – 320 s.
- Bielsa Marsol I. Update on the classification and treatment of localized scleroderma. Actas Dermo–Sifiliograficas. 2013. Vol. 104, Iss. 8. Р. 654–666.
- Botulinum toxin type A for treatment of dyspareunia caused by localized scleroderma / E. Mousty, G. Rathat, C. Rouleau, P. L. Giacalone. Acta Obstet. Gynecol. Scandinavica. 2011. Vol. 90, Iss. 8. P. 926–927.
- Buense R., Duarte I. A., Bouer M. Localized scleroderma: Assessment of the therapeutic response to phototherapy. Anais Brasileiros de Dermatologia. 2012. Vol. 87, Iss. 1. Р. 63–69.
- Bullous localized scleroderma – Presentation of two cases, therapeutic difficulties / K. Kozłowicz, J. Gładysz, G. Chodorowska et al. Przeglad Dermatologiczny. Vol. 98, Iss. 3. P. 273–279.
- Burge K. Oxford Handbook of Medical Dermatology – Oxford Handbooks Series. Oxford, Cambridge, Philadelphia, New Delhi, 2013. 640 p.
- Careta M., Romiti R. Localized scleroderma: clinical spectrum and therapeutic update. An. Bras. Dermatol. 2015. Vol. 90, Iss. 1. P. 62–73.
- Case for diagnosis. Localized scleroderma or morphea / C. Tomiyoshi, A. S. Wojcik, E. M. Vencato et al. Bras. Dermatol. 2010. Vol. 85. P. 397–399.
- Case of localized scleroderma associated with osteomyelitis / E. Muroi, F. Ogawa, T. Yamaoka et al. Dermatology. 2011. Vol. 37, Iss. 1. P. 81–84.
- Case of localized scleroderma successfully treated with bath psoralen and ultraviolet a therapy / M. Uchiyama, Y. Okubo, H. Kawashima et al. Dermatology. 2010. Vol. 37, Iss. 1. Р. 75–80.
- Castro S. V., Jimenez S. A. Biomarkers in systemic sclerosis. Med. 2010. Vol. 4, Iss. 1. P. 133–147.
- Clinical characteristics of patients with juvenile localized scleroderma / Q. N. Sun, W. Du, B. Hu et al. Acta Academiae Medicinae Sinicae. 2009. Vol. 31. P. 48–50.
- Co-existence of Lichen Sclerosus and Localized Scleroderma in Female Monozygotic Twins / A. Lis-Święty, K. Mierzwińska, K. Wodok-Wieczorek et al. Pediatric and Adolescent Gynecology. 2014. Vol. 27, Iss. 6. P. 133–136.
- Comorbidity of localized scleroderma and primary biliary cholangitis / G. Bali, A. Szilvási, D. Inotai et al. Dtsch Dermatol. Ges. 2018. Vol. 16, Iss. 11. P. 1323–1327.
- Comparison of 2–D shear wave elastography with clinical score in localized scleroderma: A new method to increase the diagnostic accuracy / Y. Wang, J.L. Shan, H.Y. Chen, Z.F. Wu. Dermatol. 2018. Vol. 9, Iss. 3. Р. 147–153.
- Constitutive activation of c–Abl/protein kinase C–δ/Fli1 pathway in dermal fibroblasts derived from patients with localized scleroderma / S. Noda, Y. Asano, K. Akamata et al. British Journal of Dermatology. 2012. Vol. 167, Iss. 5. P. 1098–1105.
- Crichiutti G. Not only strabismus: Localized scleroderma. Medico de Bambino. 2009. Vol. 28, Iss. 1. Р. 43–44.
- Development and initial validation of the Localized Scleroderma Skin Damage Index and Physician Global Assessment of disease Damage: A proof-of-concept study / T. Arkachaisri, S. Vilaiyuk, K. S. Torok, T. A. Medsger Jr. Rheumatology. 2010. 49, Iss. 2. Р. 373–381.
- Dhaliwal C., Mackenzie A., Biswas A. Perineural inflammation in morphea (localized scleroderma): Systematic characterization of a poorly recognized but potentially useful histopathological feature. Cutaneous Pathology. 2014. Vol. 41, Iss. 1. Р. 28–35.
- Diagnosis and therapy of localized scleroderma / A. Kreuter, Krieg, M. Worm et al. J. Deutsch Dermatol. Ges. 2009. Bd.7, Iss. 6. Р. 1–14.
- Díaz J. L. R. Linear and localized scleroderma in plaques in a patient. FMC Formacion Medica Continuada en Atencion Primaria. 2010. Vol. 17, Iss. 8. Р. 543–544.
- Distinct autoimmune syndromes in morphea: a review of 245 adult and pediatric cases / J. J. Leitenberger, R. L. Cayce, R. W. Haley et al. Dermatol. 2009. Vol. 145. P. 545–550.
- Drug survival and predictors of drug survival for methotrexate treatment in a retrospective cohort of adult patients with localized scleroderma / J. S. Mertens, J. M. van den Reek, W. Kievit. Acta Dermato–Venereologica. 2016. Vol. 96, Iss. 7. P. 943–947.
- Dystrophic calcinosis cutis with transepidermal elimination secondary to localized scleroderma / K.E. Jung, J. Gye, S. Nam-Koong et al. Korean J. Dermatology. 2010. Vol. 48, Iss. 8. P. 711–713.
- Effectiveness of medium-dose ultraviolet A1 phototherapy in localized scleroderma / O. Su, N. Onsun, H.K. Onay et al. International Journal of Dermatology. 2011. Vol. 50, Iss. 8. P. 1006–1013.
- Effectiveness, side-effects and period of remission after treatment with methotrexate in localized scleroderma and related sclerotic skin diseases: An inception cohort study / E. B. Kroft, M.C. Creemers, F. H. van den Hoogen et al. British J. Dermatology. 2009. Vol. 160, Iss. 5. P. 1075–1082.
- Effects of Scleroderma sichuanensis Xiao (Hymenoptera: Bethylidae) venom and parasitism on nutritional content regulation in host Tenebrio molitor L. (Coleoptera: Tenebrionidae) / -H. Zhuo, W. Yang, D.-P. Xu, C.-P. Yang. Springerplus. 2016. Vol. 5, Iss. 1. Р. 101-107.
- Efficacy of anorectal biofeedback in scleroderma patients with fecal incontinence: a case-control study / J. Collins, Y. Mazor, M. Jones et al. Scandinavian J. Gastroenterology. 2016. Vol.51, Iss. 12. Р. 1433–1438.
- Establishment and gene expression analysis of disease–derived induced pluripotent stem cells of scleroderma / Z. Wang, K. Nakamura, M. Jinnin et al. Dermatological Science. 2016. Vol.84, Iss. 2. P. 186–196.
- Evaluation of echogenicity, vascularity index and tissue thickness of localized scleroderma ultrasound images using MATLAB / V. Mistry, J. Desai, S. Li et al. IEEE 37th Annual Northeast Bioengineering Conference. NEBEC, 2011. Р.577–586.
- Facial solitary morphea profunda presenting with painful trigeminal neuropathy: A case report / D. Moreno-Ajona, E. Moreno-Artero, M. R. García de Eulate et al. Cephalalgia. 2019. Vol. 39, Iss. 4. Р. 564–568.
- Fett N. M. Morphea (localized scleroderma). JAMA Dermatology. 2013. Vol. 149, Iss. 9. Р. 1124.
- Fett N., Werth V. P. Update on morphea: part I. Epidemiology, clinical presentation and pathogenesis. Amer. Acad. Dermatol. 2011. Vol. 64, Iss. 2. Р.217–228.
- Fibrosing connective tissue disorders of the skin: molecular similarities and distinctions / J. Canady, S. Karrer, M. Fleck, A. K. Bosserhoff. Dermatological Science. 2013. Vol. 70, Iss. 3. P. 151–158.
- Fractional carbon dioxide laser versus low-dose UVA–1 phototherapy for treatment of localized scleroderma: a clinical and immunohistochemical randomized controlled study / S. M. Shalaby, M. Bosseila, M. M. Fawzy et al. Lasers in Medical Science. 2016. Vol.31, Iss. 8. P. 1707–1715.
- Fusse-15, a new player in wound healing, is deregulated in keloid and localized scleroderma / S. Arndt, J. Schmidt, E. Wacker et al. American Journal of Pathology. 2011. Vol. 178, Iss. 6. Р. 2622–2631.
- Gabrielli A., Avvedimento E. V., Krieg T. Scleroderma. Engl. J. Med. 2009. Vol. 19, Iss. 360. Р. 1989–2003.
- Hakim A., Clunie G. J. A., Haq Oxford Handbook of Rheumatology – Oxford Handbooks Series. Oxford, Cambridge, Philadelphia, New Delhi, 2011. 640 p.
- Health-related quality of life, optimism, and coping strategies in persons suffering from localized scleroderma / B. Szramka-Pawlak, A. Dańczak-Pazdrowska, T. Rzepa et al. Psychology, Health and Medicine. 2013. Vol. 18, Iss. 6. P. 654–663.
- Hemandes Perez J. M. A.,Acosta Fernández O. Lung Disease Secondary to Morphea en Coup de Sabre, a Form of Localized Scleroderma. Archivos de Bronconeumologia. 2009. Vol. 45, Iss. 8. P. 411–412.
- Herrmann T. A. C., Günther C., Csere P. A rare but Significant Secondary Complication Following Breast Cancer Radiotherapy: Case Report and Review of the Literature on Radiation Reaction among Patients with Scleroderma / Morphea. Strahlentherapie und Onkologie. 2009. Vol. 185, Iss. 9. P. 603–607.
- High frequency ultrasound can detect improvement of lesions in juvenile localized scleroderma / F. Porta, O. Kaloudi, A. Garzitto et al. Modern Rheumatology. 2014. Vol. 24, Iss. 5. P. 869–873.
- Histological features of localized scleroderma en coup de sabre: A study of 16 cases / T. Taniguchi, Y. Asano, Z. Tamaki et al. Eur. Academy of Dermatology and Venereology. 2013. Vol. 28, Iss. 12. P. 1805–1810.
- Hoppe I. C., Trovato M. J., Rauscher G. E. Case report: Localized scleroderma of the breast after saline implant rupture. Eur. J. Plastic Surgery. 2011. Vol. 34, Iss. 2. 127–130.
- Implantation of autologous fat globules in localized scleroderma and idiopathic lipoatrophy – report of five patients / T. P. Zanelato, G. Marquesini, P. T. Colpas et al. Anais Brasileiros de Dermatologia. 2013. Vol. 88, Iss. 6, Suppl. 1. P. 120–123.
- Independent Association of Severity of Muscle Weakness With Disability as Measured by the Health Assessment Questionnaire Disability Index in Scleroderma / J.J. Paik, F.M. Wigley, A.F. Mejia, L.K. Hummers. Arthritis Care and Research. 2016. Vol. 68, Iss. 11. P. 1695–1703.
- Informatyka mediczna / pod red. R. Rudowskiego. Warszawa : Wydawnictwo naukowe PWN, 2012. 250 s.
- Interferon-gamma inducible protein–10 as a potential biomarker in localized scleroderma / K. E. Magee, C. E. Kelsey, K. L. Kurzinski et al. Arthritis Research and Therapy. 2013. Vol. 15, Iss. 6. Р. 188–196.
- Jackson C. T., Maibach H. I. Localized scleroderma variants: Pharmacologic implications. Dermatological Treatment. 2014. Vol. 25, Iss. 6. P. 529–531.
- Kapoor A. G., Kumar S. V., Bhagyalakshmi N. Localized scleroderma causing enophthalmos: A rare entity. Indian J. Ophthalmol. 2018. Vol. 66, Iss. 11. P. 1611–1612.
- Khamaganova , Savina M., Khromova S. Intranuclear protein fractions of lymphoid cells in patients with localized scleroderma. J. Invest Dermatol. 2012. Vol. 132, suppl. 2. P. 27–36.
- Kim K. T., Sun H., Chung E. H. A surgical approach to linear scleroderma using Medpor and dermal fat graft. Arch. Craniofac. Surg. 2018. Vol. 16, Iss. 3. Р. 71–81.
- Kozak K. Large Scale Data Handling in Biology. Essex, United Kingdom : Ventus Publishing Aps, University of Essex, 2010. 53 p.
- Kreuter A. Localized scleroderma. Dermatologic Therapy. 2012. Vol. 25, Iss. 2. P. 135–147.
- Kurzinski K. L., Zigler C. K., Torok K. S. Prediction of disease relapse in a cohort of paediatric patients with localized scleroderma. J. Dermatol. 2018. Vol. 13, Iss. 10. Р. 111–119.
- Kurzinski K., Torok K. S. Cytokine profiles in localized scleroderma and relationship to clinical features. Cytokine. 2011. Vol. 55, Iss. 2. Р. 157–164.
- Lee J., Wu Y., Kim H. Unbalanced data classification using support vector machines with active learning on scleroderma lung disease patterns. Applied Statistics. 2015. Vol. 42, Iss. 3. P. 676–689.
- Leroux M. B. A., Bergero A. Localized scleroderma. Differential diagnosis [Esclerodermia localizada. Diagnósticos diferenciales]. Revista Argentina de Dermatologia. 2011. Vol. 92, Iss. 3. P. 167–176.
- Li S. C., Liebling M. S. The use of Doppler ultrasound to evaluate lesions of localized scleroderma. Rheumatol. Rep. 2009. Vol. 23, Iss. 2. P. 352–361.
- Liewelyn H. Oxford Handbook of Clinical Diagnosis – Oxford Handbooks Series. Oxford, Cambridge, Philadelphia, New Delhi, 2013. 824 p.
- Local anti-type II collagen antibody production in rheumatoid arthritis synovial fluid. Evidence for an HLA-DR4-restricted IgG response / Ronnelid, J. Lysholm, A. Engstrom-Laurent et al. Arthritis. Rheum. 2014. Vol. 37. P. 1023–1029.
- Localized edema with sclerodermatous evolution: a possible form of skin chronic graft-versus-host disease associated with endothelial activation / M. Tardieu, M. Rybojad, R. Peffault de Latour et al. Blood. 2013. Vol. 122, Iss. 3. P. 463–465.
- Localized morphea treated with imiquimod 5% and dermoscopic assessment of effectiveness / E. Campione, E. J. Paternò, L. Diluvio. Dermatolog. Treat. 2009. Vol. 20. P. 10–13.
- Localized scleroderma and regional inflammatory myopathy / S. A. Zivković, W. Freiberg, D. Lacomis et al. Neuromuscular Disorders. 2014. Vol. 24, Iss. 5. P. 425–430.
- Localized scleroderma and zinc: a pilot study / A. Brocard, G. Quereux, D. Moyse, B. Dreno. J. Dermatol. 2010. Vol. 54, Suppl. 3. P. 46–51.
- Localized Scleroderma Cutaneous Assessment Tool (LoSCAT) adapted for use in adult patients: report from an initial validation study / A. Skrzypek-Salamon, A. Lis-Święty, I. Ranosz-Janicka, L. Brzezińska-Wcisło. Health Qual Life Outcomes. 2018. Vol. 16, Iss. 1. P. 185–192.
- Localized scleroderma en coup de sabre exacerbated during pregnancy followed by postpartum development of rheumatoid arthritis / S. Noda, Y. Asano, R. Ashida et al. European Journal of Dermatology. 2011. Vol. 21, Iss. 3. P. 441–442.
- Localized scleroderma unius lateri and Borrelia burgdoferi infection / B. Miglino, M. Viana, E. Zavattaro et al. Indian J. Dermatology, Venereology and Leprology. 2012. Vol. 78, Iss. 3. P. 383–385.
- Localized scleroderma: a retrospective study about 92 cases / N. El Fékih, I. Réjaibi, H. Kamoun et al. Tunis Med. 2009. Vol. 87. P. 573–578.
- Localized scleroderma: a series of 52 patients / C. Toledano, S. Rabhi, A. Kettaneh et al. J. Intern. Med. 2009. Vol. 20. P. 331–336.
- Localized scleroderma: MR findings and clinical features – Commentary / T. Huizinga, P. Nigrovic, E. Ruderman, H. Schulze-Koops. International J. Advances in Rheumatology. 2011. Vol. 9, Iss. 4. P. 148–149.
- Localized scleroderma–like reaction induced by doxifluridine / K.M. Lee, A.Y. Cho, Y. Lee et al. Korean J. Dermatology. 2009. Vol. 47, Iss. 1. P. 95–97.
- Localized severe scleroderma: A retrospective study of 26 pediatric patients / M. Beltramelli, P. Vercellesi, A. Frasin et al. Pediatric Dermatology. 2010. Vol. 27, Iss. 5. Р. 476–480.
- Longmore M. Oxford Handbook of Clinical Medicine – Oxford Handbooks Series. Oxford, Cambridge, Philadelphia, New Delhi, 2013. 920 p.
- Long-term clinical stabilization of scleroderma patients treated with a chronic and intensive IV iloprost regimen / R. Foti, E. Visalli, G. Amato et al. Rheumatology International. 2017. Vol. 37, Iss. 2. P.245–249.
- Luo C.-W., Chen Y. Phototactic Behavior of Scleroderma guani (Hymenoptera: Bethylidae) – Parasitoid of Pissodes punctatus (Coleoptera: Curculionidae). J. Insect. Behavior. 2016. Vol. 29, Iss. 6. P. 605–614.
- Maibach H. Scleroderma Models. Drug Discovery and Evaluation: Pharmacological Assay, Fourth Edition. 2015. P. 3907–3912.
- Medium-dose is more effective than low-dose ultraviolet A1 phototherapy for localized scleroderma as shown by 20-MHz ultrasound assessment / P. G. Sator, S. Radakovic, K. Schulmeister et al. Am. Academy of Dermatology. 2009. Vol. 60, Iss. 5. P. 786–791.
- MHC–compatible bone marrow stromal/stem cells trigger fibrosis by activating host T–cells in a scleroderma mouse model / Y. Ogawa, S. Morikawa, H. Okano et al. Life. 2016. Vol. 5. Art. no. e09394.
- MicroRNA-7 down-regulation mediates excessive collagen expression in localized scleroderma / M. Etoh, M. Jinnin, K. Makino et al. Archives of Dermatological Research. 2013. Vol. 305, Iss. 1. P. 9–15.
- Minkina W., Dudzik S. Infrared Thermography – Errors and Uncera tainties. New York : John Wiley & Sons, 2009. 200 p.
- Mleczko P. A., Gawroński S. A., Kapusta P. New inland localities of a rare gasteroid basidiomycete, Scleroderma septentrionale, in natural and anthropogenic habitats in central Europe. Polish Botanical J. 2009. Vol. 54, Iss. 1. P. 99–103.
- Moinzadeh P., Krieg T., Hunzelmann N. Imatinib treatment of generalized localized scleroderma (morphea). Am. Acad. Dermatol. 2010. Vol. 4. P. 356–362.
- Mok C. C. Mycophenolate mofetil for localized scleroderma. International Journal of Clinical Rheumatology. 2010. Vol. 5, Iss. 1. P. 33–36.
- Morphea (localized scleroderma): Baseline body surface involvement and antinuclear antibody may have a prognostic value / E. Alimova, D. Farhi, F. Plantier, A Carlotti. Clinical and Experimental Dermatology. 2009. Vol. 34, Iss. 7. Р. 491–492.
- Morphea and antithyroid antibodies / Dańczak–Pazdrowska, A. Polańska, J. Synakiewicz et al. J. Postepy Dermatol. Alergol. 2018. Vol. 35, Iss. 5. Р. 470–473.
- Morphea or localized scleroderma and extragenital lichen sclerosus / P. Moinzadeh, A. Kreuter, T. Krieg, N. Hunzelmann. Hautarzt. 2018. Vol. 69, Iss. 11. P. 892–900.
- Multiphoton laser scanning microscopy of localized scleroderma / K. Lu, J. Chen, S. Zhuo et al. Skin Res. Technol. 2009. Vol. 15, Iss. 4. P. 489–495.
- Nailfold videocapillaroscopy and serum VEGF levels in scleroderma are associated with internal organ involvement / M. De Santis, A. Ceribelli, F. Cavaciocchi et al. Autoimmunity Highlights. 2016. Vol. 7, Iss. 1. Р. 1–9.
- Nakamura-Wakatsuki T., Oyama N., Yamamoto T. Local injection of latency–associated peptide, a linker propeptide specific for active form of transforming growth factor–beta1, inhibits dermal sclerosis in bleomycin–induced murine scleroderma. Experimental Dermatology. 2012. Vol. 21, Iss. 3. P. 189–194.
- Neurologic manifestations of localized scleroderma: A case report and literature review / I. Kister, M. Inglese, R. M. Laxer, J. Herbert. Neurology. 2008. Vol. 71, Iss. 19. P. 1538–1545.
- New alternative therapy for orofacial localized scleroderma / X. S. Liu, Y. Gao, L. W. Zheng, H. Hua. Oral Surg., Oral Med., Oral Pathol., Oral Radiol. Endodontology. 2010. Vol. 14, Iss. 3. P. 142–151.
- Newland K., Marshman G. Success treatment of post–irradiation morphea with acitretin and narrowband UVB. Australas J. Dermatol. 2012. Vol. 53, Iss. 2. P. 136–138.
- Noh J., Kim W. J., Kim J. W. Localized scleroderma: a clinical study at a single center in Korea. International J. Rheumatic Disease. 2013. Vol. 16, Iss. 4. Р. 437–441.
- Orofacial manifestations of scleroderma. A literature review / M. Hadj Said, J. M. Foletti, N. Graillon et al. Revue de Stomatologie, de Chirurgie Maxillo–faciale et de Chirurgie Orale. 2016. Vol. 117, Iss. 5. Р.322–326.
- Pallaniappan R. Biological Signal Analysis. Essex, United Kingdom : Ventus Publishing Aps; University of Essex, 2010. 138 p.
- Parry Romberg syndrome with localized scleroderma: A case report / M. Khan, M. Khan, R. Negi, N. Gupta. Clinical and Experimental Dentistry. 2014. Vol. 6, Iss. 3. P. 313–316.
- Pathogenesis and therapeutic approaches for improved topical treatment in localized scleroderma and systemic sclerosis / I. Badea, M. Taylor, A. Rosenberg, M. Foldvari. Oxford Rheumatol. 2009. Vol. 48. P. 213–221.
- Perk S.-Y., Choi E. H. Diagnosis of localized scleroderma assisted by magnetic resonance imaging. Korean J. Dermatology. 2014. Vol. 52, Iss. 9. P. 651–653.
- Pierchalla A., Schulte K. W., Homey B. Linear localized scleroderma. Successful treatment with prednisolone pulse therapy and methotrexate. Hautarzt. 2010. Vol. 61, Iss. 10. P. 834–836.
- Primary localized cutaneous amyloidosis in patients with scleroderma / N. Kikuchi, E. Sakai, A. Nishibu et al. Acta Dermato-Venereologica. 2010. Vol. 90, Iss. 3. P. 326–327.
- Progranulin overproduction due to constitutively activated c-Abl/PKC–δ/Fli1 pathway contributes to the resistance of dermal fibroblasts to the anti–fibrotic effect of tumor necrosis factor-α in localized scleroderma / T. Miyagawa, Y. Ichimura, K. Nakamura et al. Dermatol Sci. 2018. Vol. 92, Iss. 2. P. 207–214.
- Pulsed dye laser in the treatment of localized scleroderma and its effects on CD34+ and factor XIIIa+ Cells: An immunohistochemical study / A. A. Tawfik, H. Shokir, M. Soliman et al. American Journal of Clinical Dermatology. 2013. Vol. 14, Iss. 3. P. 235–241.
- PUVA–therapy in the treatment of localised scleroderma – Own observations (preliminary report) / E. Syguła, L. Brzezińska-Wcisło, E. Krauze, M. Wygledowska-Kania. Dermatologia Kliniczna. 2009. Vol. 11, Iss. 3. P. 135–139.
- Rare association of localized scleroderma type morphea, vitiligo, autoimmune hypothyroidism, pneumonitis, autoimmune thrombocytopenic purpura and central nervous system vasculitis. Case report / F. Bonilla-Abadía, E. Muñoz-Buitrón, C. D. Ochoa et al. BMC Research Notes. 2012. Vol. 689, Iss. 5. Р. 38–49.
- Reconstruction of coup de sabre deformity (linear localized scleroderma) by using galeal frontalis muscle flap and demineralized bone matrix combination / T. Cavusoglu, I. Yazici, I. Vargel, E. I. Karakaya. Craniofacial Surgery. 2011. Vol. 22, Iss. 1. Р. 257–258.
- Recurrent myelitis in localized scleroderma / M. Miyamoto, M. Kinoshita, K. Tanaka, M. Tanaka. Clinical Neurology and Neurosurgery. 2014. Vol. 127. P. 140–142.
- Resolution with rituximab of localized scleroderma occurring during etanercept treatment in a patient with rheumatoid arthritis / M. S. Chimenti, M. Teoli, A. Di Stefani et al. Eur. J. Dermatology. 2013. 23, Iss. 2. Р. 273–274.
- Roterman-Konieczna I. Elementy informatyki medycznej. Krakow : Wydawnictwo Uniwersytetu Jagiellonskiego, 2011. 202 s.
- Roterman-Konieczna I. Statystyka na recepte. Wprowadzenie do statystyki medycznej. Krakow : Wydawnictwo Uniwersytetu Jagiellonskiego, 2010. 262 s.
- Scleroderma and dentistry: Two case reports / S. Dixit, C. Kalkur, A. P. Sattur et al. Medical Case Reports. 2016. Vol. 10, Iss. 1. Р. 1–6.
- Sclerodermatous chronic GVHD in patients receiving tyrosine kinase inhibitors after allogeneic hematopoietic cell transplantation / A. Salhotra, N. Tsai, S. H. Thomas et al. Bone Marrow Transplantation. 2015. Vol. 50, Iss. 1. P. 139–141.
- Significantly increased CCL5/RANTES and CCR7 mRNA levels in localized scleroderma / T. Gambichler, M. Skrygan, A. A. Labanski et al. Regulatory Peptides. 2011. Vol. 170, Iss. 1–3. Р. 4–6.
- Singer M., Webb A. Oxford Handbook of Critical Care – Oxford Handbooks Series. Oxford, Cambridge, Philadelphia, New Delhi, 2013, 704 p.
- Spickett G. Oxford Handbook of Clinical Immunology and Allergy – Oxford Handbooks Series. Oxford, Cambridge, Philadelphia, New Delhi, 2013. 584 p.
- Spleen tyrosine kinase (Syk) inhibitor fostamatinib limits tissue damage and fibrosis in a bleomycin–induced scleroderma mouse model / O.N. Pamuk, G. Can, S. Ayvaz. Clinical and Experimental Rheumatology. 2015. Vol. P. 15–22.
- Subcutaneous administration of polymerized type i collagen downregulates interleukin (IL)-17A, IL-22 and transforming growth factor-β1 expression, and increases Foxp3-expressing cells in localized scleroderma / J. Furuzawa-Carballeda, M. Ortíz-Ávalos, G. Lima et al. Clinical and Experimental Dermatology. 2012. Vol. 37, Iss. 6. Р. 599–609.
- Successful ultraviolet A1 phototherapy in the treatment of localized scleroderma: A retrospective and prospective study / C. Andres, A. Kollmar, M. Mempel et al. British Journal of Dermatology. 2010. Vol. 162, Iss. 2. Р. 445–447.
- Supernatants from culture of type i collagen-stimulated PBMC from patients with cutaneous systemic sclerosis versus localized scleroderma demonstrate suppression of MMP-1 by fibroblasts / M. Brown, A. E. Postlethwaite, L. K. Myers, K. A. Hasty. Clinical Rheumatology. 2012. Vol. 31, Iss. 6. Р. 973–981.
- Surface morphology and mechanical properties of fibroblasts from scleroderma patients / A. Reich, M. Meurer, B. Eckes et al. Cell Med. 2009. Vol. 47, Iss. 8. P. 1062–1076.
- Susan B., Dinny W. Oxford Handbook of Medical Dermatology – Oxford Handbooks Series. Oxford, Cambridge, Philadelphia, New Delhi, 2012. 640 p.
- Telakis E., Nikolaou A. C. Localized scleroderma (morphea) in a patient with chronic hepatitis. European Journal of Gastroenterology and Hepatology. 2009. Vol. 21, Iss. 4. P. 486.
- The downregulation of microRNA let–7a contributes to the excessive expression of type I collagen in systemic and localized scleroderma / K. Makino, M. Jinnin, A. Hirano et al. Journal of Immunology. 2013. Vol. 190, Iss. 8. P. 3905–3915.
- The localized scleroderma skin severity index and physician global assessment of disease activity: A work in progress toward development of localized scleroderma outcome measures / T. Arkachaisri, S. Vilaiyuk, S. Li et al. Rheumatology. 2009. Vol. 36, Iss. 12. Р. 2819–2829.
- Thoracic outlet syndrome secondary to localized scleroderma treated with botulinum toxin injection / E.N. Le, J. A. Freischlag, P. J. Christo et al. Arthritis Care and Research. 2010. Vol. 62, Iss. 3. Р. 430–433.
- Torok K. S., Arkachaisri T. Methotrexate and corticosteroids in the treatment of localized scleroderma: A standardized prospective longitudinal single-center study. Rheumatology. 2012. Vol. 39, Iss. 2. P. 286–294.
- Unrecognized radiation-induced localized scleroderma: a cause of postoperative wound-healing disorder / B. Kreft, J. Wohlrab, K. Radant et al. Clin. Exp. Dermatol. 2009. Vol. 34. P. 383–384.
- Using Optimal Test Assembly Methods for Shortening Patient–Reported Outcome Measures: Development and Validation of the Cochin Hand Function Scale–6: A Scleroderma Patient–Centered Intervention Network Cohort Study / A. W. Levis, D. Harel, E. A. Kwakkenbos et al. Arthritis Care and Research. 2016. Vol. 68, Iss. 11. P. 1704–1713.
- Using the polymerase chain reaction to Borrelia burgdorferi infection in localized scleroderma injure (morphea), in Venezuelan patients / F. Espinoza-León, F. Arocha, M. Hassanhi, J. Arévalo. Investigacion Clinica. 2010. Vol. 51, Iss. 3. Р. 381–390.
- Uzun S. Comment on Evaluation of choroidal thickness in patients with scleroderma. Eye (London). 2016. Vol. 30, Iss. 10. P. 1398.
- Valančiene G., Jasaitiene D., Valiukevičiene S. Pathogenesis and treatment modalities of localized scleroderma [Židininės sklerodermijos patogenezė ir gydymas]. Medicina. 2010. Vol. 46, Iss. 10. P. 649–656.
- Vasquez R. A., Sendejo C. B., Jacobe H. Morphea and other localized forms of scleroderma. Current Opinion in Rheumatology. 2012. Vol. 24, Iss. 6. P. 685–693.
- Vehe R. K., Riskalla M. M. Collagen Vascular Diseases: SLE, Dermatomyositis, Scleroderma, and MCTD. Pediatr Rev. 2018. Vol. 39, Iss. 10. P. 501–515.
- Vilela F. A., Carneiro S., Ramos-e-Silva M. Treatment of morphea or localized scleroderma: Review of the literature. Drugs in Dermatology. 2010. Vol. 9, Iss. 10. P. 1213–1219.
- Weibel L. A. Morphea (Localized Scleroderma). Harper’s Textbook of Pediatric Dermatology: Third Edition, 2011. Vol. 2. P. 1–13.
- Yamamoto T. Autoimmune mechanisms of scleroderma and a role of oxidative stress. Self Nonself. 2011. Vol. 2, Iss. 1. P. 4–10.
- Ye F., Kong G., Huang J. Anesthetic management of a patient with localised scleroderma. Springerplus. 2016. Vol.5, Iss. 1. Article ID 1507.
- Zaheen A., Stanbrook M. B., Anand A. Mycophenolate mofetil for scleroderma–related interstitial lung disease. The Lancet Respiratory Medicine. Vol. 4, Iss. 11. – Article ID PE53.
- Zhou Y. Observation on therapeutic effects of combined surrounding needling, bloodletting with cupping therapy for localized scleroderma. Acupuncture and Tuina Science. 2011. Vol. 9, Iss. 3. P. 154–155.
ДОДАТОК А
АКТИ ВПРОВАДЖЕННЯ
ДОДАТОК Б
СПИСОК ПУБЛІКАЦІЙ ЗДОБУВАЧА ЗА ТЕМОЮ ДИСЕРТАЦІЇ
ТА ВІДОМОСТІ ПРО АПРОБАЦІЮ РЕЗУЛЬТАТІВ ДИСЕРТАЦІЇ
Список праць, опублікованих за темою дисертації:
- Ата М. А. Дистанционное термометрическое исследование измененных кожных покровов у больных очаговой склеродермией. Дерматологія та венерологія. № 2 (80). С. 50–53.
- АтаМ. А. Лечение очаговой склеродермии с применением современных методов. Дерматологія та венерологія. 2018. № 3 (81). С. 22–24.
- Ата М. А. Особенности активности эластазы, коллагенолитической активности и содержания гликозаминогликанов у больных ограниченной склеродермией. Дерматологія та венерологія. 2018. № 4 (82). С. 23–26.
- Кутасевич Я.Ф., Ата М.А. Особенности формирования синдрома иммуно-эндокринной дисфункции у больных очаговой склеродермией в стадии обострения. Международный медицинский журнал. 2019. № 1 (97). С. 75–79.
- Ата М. А. Прогнозирование развития иммунной дисфункции у больных очаговой склеродермией по состоянию некоторых звеньев иммунного ответа. Дерматологія та венерологія. 2019. № 1 (83). С. 14–
- Ата М. А. Особенности биохимических изменений у больных ограниченной склеродермией. ScienceRise: Medical Science. 2019. № 1 (28). С. 20–24.
- Применение современных способов диагностики очаговой склеродермии / Янина Кутасевич, Ирина Олейник, Мохамед Ата, Петр Замятин, Константин Дубровский. Spatial aspects of socio-economic systems development: the economy, education and health care. Monograph. Opole, Poland : Publishing House WSZiA, P. 258–265.
- Пат. на корисну модель 109591 Україна, МПК 7 G01N33/49 (2006.01). Спосіб оцінки ефективності лікування хворих на вогнищеву склеродермію / М.А. Ата, Я. Ф. Кутасевич, В. І. Жуков. № u201602567; заявл. 16.03.2016; опубл. 25.08.2016, Бюл. № 16.
- Ата М. А. Оцінка ефективності лікування хворих на вогнищеву склеродермію. Мат. ХІІІ Міжнародної конференції студентів та молодих вчених «Актуальні питання сучасної медицини», м. Харків, 14-15 квітня 2016 р. Харків : ХНУ ім. В.Н. Каразіна, 2016. С. 31.
- Олійник І.О., Ата М.А., Кордон Т.В. Стан мікроциркуляторного русла шкіри при обмеженої склеродермії. Матеріали науково-практичної конф. з міжнародною участю «Сучасні підходи до діагностики, профілактики та інноваційні технології лікування інфекцій, що передаються статевим шляхом, поширених дерматозів, основні організаційні задачі», м. Харків, 10-11 листопада 2017. Дерматологія та венерологія. 2017. № 3 (77). С. 109.
Відомості про апробацію результатів дисертації:
- XIII Міжнародна наукова конференція студентів та молодих вчених «Актуальні питання сучасної медицини», м. Харків, 14–15 квітня 2016 р., усна доповідь: Ата М. А. «Оцінка ефективності лікування хворих на вогнищеву склеродермію».
- Науково-практична конференція молодих вчених з міжнародною участю, присвячена 25 річниці від заснування Національної академії медичних наук України «Новітні впровадження молодих вчених в сучасній дерматовенерології», м. Харків, 7 лютого 2018 р., усна доповідь: Ата М. А. «Сучасна діагностика очагової склеродермії за допомогою методу тепловізуалізації».
- Науково-практична конференція лікарів дерматовенерологів та косметологів Харківської області з міжнародною участю «Актуальні питання дерматології, дерматовенерології, косметології, венерології, ІПСШ та інших соціально-небезпечних хвороб», м. Харків, 24 травня 2018 р., усна доповідь: Ата М. А. «Сучасні методи комбінованої терапії очагової склеродермії».
- Науково-практична конференція з міжнародною участю «Питання профілактики, сучасна діагностика та інноваційні методи терапії в дерматовенерології», м. Харків, 15–16 листопада 2018 р., усна доповідь: «Імунологічні порушення у хворих на вогнищеву склеродермію».