Державна установа
«Інститут дерматології та венерології НАМН України»
ГЛУШОК ВІТАЛІЙ СТЕПАНОВИЧ
УДК 616.5-003.871-002.828:615.831.4]-08
СУЧАСНІ ПІДХОДИ І ПАТОМОРФОЛОГІЧНЕ ОБГРУНТУВАННЯ КОМПЛЕКСНОЇ ТЕРАПІЇ АКТИНІЧНОГО КЕРАТОЗУ
14.01.20 – шкірні та венеричні хвороби
Автореферат
дисертації на здобуття наукового ступеню
кандидата медичних наук
Харків – 2018
Дисертацією є рукопис.
Робота виконана у Державному вищому навчальному закладі «Тернопільський державний медичний університет імені І.Я. Горбачевського Міністерства охорони здоров’я України».
Науковий керівник:
доктор медичних наук, професор
Святенко Тетяна Вікторівна,
ДЗ «Дніпропетровська медична академія МОЗ України», професор кафедри
шкірних та венеричних хвороб.
Офіційні опоненти:
доктор медичних наук, професор
Солошенко Ельвіра Миколаївна,
ДУ „Інститут дерматології та венерології НАМН України”, завідуюча лабораторією алергології;
доктор медичних наук, професор
Лебедюк Михайло Миколайович,
Одеський національний медичний університет МОЗ України, завідувач кафедри дерматології та венерології.
Захист дисертації відбудеться «27» грудня 2018 р. об 11:00 год. на засіданні спеціалізованої вченої ради Д 64.603.01 при ДУ «Інститут дерматології та венерології НАМН України» за адресою: 61057, м. Харків, вул. Чернишевська, 7/9.
З дисертацією можна ознайомитись у бібліотеці ДУ «Інститут дерматології та венерології НАМН України» (61057, м. Харків, вул. Чернишевська, 7/9).
Автореферат розісланий «26» листопада 2018 р.
Вчений секретар
спеціалізованої вченої ради
д. мед. н. Ю. В. Щербакова
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Актинічний кератоз (АК) – як шкірна неоплазія і передраковий стан є клінічно значимим дерматозом у медичному і соціальному аспектах. Значимість АК обумовлена, перш за все, рівнем його поширеності. Згідно з даними Національного дослідження амбулаторної медичної допомоги, проведеному у США з 1990 до 1999 рр., АК був діагностований більш ніж на 47 млн. лікарських візитів у 14 % пацієнтів, які зверталися до дерматологів (T. Strunk et al., 2014; M. Arfan Ikram et al., 2018).
Більшістю провідних дерматологів світу АК розглядається як передраковий процес, однак впродовж останніх років були спроби перегляду цих наукових уявлень, згідно з якими АК вважається інтраепітеліальним плоскоклітинним раком шкіри (ПКРШ) на ранніх стадіях розвитку. Отже, вчасно не лікований АК – це ініціальне утворення, яке може прогресувати в ПКРШ (К. В. Обыденова, 2016; Н. Б. Толстихина, 2016; Э. Буйнаускайте и др., 2017; J. Scharnitz et al., 2015). Крім того, за даними сучасної літератури, АК є потужним предиктором виникнення меланоми або немеланомного раку шкіри (НМРШ) (О. О. Ошивалова, 2015, 2017; A. Blum et al., 2017; G. Paolino et al., 2017). Тому на тлі зростання захворюваності та поширеності меланоми і НМРШ пацієнти з АК є безпосередніми кандидатами для ретельного спостереження з метою профілактики і раннього ефективного лікування. Привертає увагу «омолодження» контингенту пацієнтів, хворих на АК, локалізація утворень (шкіра обличчя, скальпу, шиї, розгинальних поверхонь кистей), що у більшості випадків спричиняє видимий косметичний дефект і обумовлює соціальну дезадаптацію хворих.
Попри наявність великої кількості методик лікування АК, в Україні на даний час немає єдиних рекомендацій чи алгоритмів для вибору найбільш адекватного методу лікування при визначеному клінічному варіанті хвороби (В. М. Галченко, 2017; В. В. Кузнецов, 2017; Е. А. Левончук, 2017; A. Dodds, 2014). Існуючі складнощі пов’язані також із відсутністю критеріїв, які б дозволили передбачати тривалість персистування осередку неоплазії, злоякісну трансформацію у ПКРШ чи ймовірність спонтанного зворотнього розвитку (Ю. Б. Ященко та ін., 2015; А. Н. Хлебникова и др., 2017; J. Lin Matthew et al., 2014; C. Longo et al., 2016). Очікуваний ідеальний метод лікування АК має приводити до стійкого результату з усуненням усіх клінічних і субклінічних проявів АК, забезпечувати стійкий позитивний близький і віддалений результат і хороший косметичний ефект, тобто усувати ймовірність перетворення АК у ПКРШ. Водночас він має бути простим у застосуванні, зручним, не довготривалим, доступним економічно (Т. Е. Сухова и др., 2016; С. В. Ключарёва и др., 2017; C. Cantisani et al., 2016; R. Khanna et al., 2017).
Отже, існує необхідність продовження вивчення як патоморфологічних особливостей окремих клінічних варіантів АК, так і подальшого розкриття патогенетичних механізмів цього дерматозу, які впливають на різноманітність клінічних варіантів. Актуальність цієї сучасної проблеми визначає мету і завдання наукового дослідження.
Зв’язок роботи з науковими програмами, планами, темами. Тема дисертаційного дослідження входить до НДР ДВНЗ «Тернопiльський державний медичний університет імені I.Я. Горбачeвського МОЗ України»: «Патогенетичні закономірності та інформаційні моделі розвитку патологічних процесів за умов дії надзвичайних факторів на організм та їх корекція» (номер держреєстрації 0113U001239) і «Оцінка клінічного перебігу метаболічних та імунних порушень, змін функції органів та систем при внутрішніх захворюваннях за умови коморбідних станів» (номер держреєстрації №0113U001244), в яких здобувач був співвиконавцем і досліджував клінічні та патоморфологічні особливості перебігу і комплексної терапії АК.
Мета та задачі дослідження. Мета роботи – підвищення ефективності комплексної терапії АК шляхом обґрунтування методики лікування захворювання з урахуванням результатів клінічних, дерматоскопічних, патоморфологічних та імуногістохімічних досліджень.
Задачі дослідження:
- Дослідити клініко-анамнестичні особливості проявів і перебігу АК з урахуванням соціально-демографічних характеристик пацієнтів, оцінки суб’єктивних і об’єктивних симптомів захворювання.
- Визначити патоморфологічні характеристики шкіри у пацієнтів з різними клінічними варіантами і ступенем тяжкості АК за даними дерматоскопічного дослідження.
- Надати патогістологічну характеристику шкіри при різних клінічних варіантах АК у порівнянні з себорейним кератозом (СК).
- Оцінити зміни імуногістохімічних маркерів онкогенної трансформації (р53), проліферативної активності (Kі-67, cyclin D1), васкуляризації (CD34) та стромальної деградації (матриксної металопротеїнази 9 типу (ММР-9), маркера тканинного інгібітора протеїнази – 1 [ТІМР-1]) при АК і СК.
- Обґрунтувати методику комбінованої патогенетичної терапії АК з урахуванням результатів патогістологічних та імуногістохімічних досліджень і порівняти її ефективність з монотерапією (кріодеструкція рідким азотом).
- Розробити і запровадити методику мотиваційного консультування пацієнтів, хворих на АК, з метою підвищення ефективності лікування, профілактики прогресування і попередження рецидивів.
Об¢єкт дослідження: актинічний кератоз.
Предмет дослідження: клінічні, морфологічні зміни в осередках АК, проліферативна активність, імуногістохімічні маркери, діагностика, терапія і профілактика АК.
Методи дослідження: клінічні: вивчення скарг, анамнезу життя та хвороби, оцінка і аналіз суб’єктивних і об’єктивних ознак ураження шкіри, локалізації патологічних змін (для виявлення провокуючих факторів виникнення, розвитку і прогресування захворювання, встановлення діагнозу, проведення диференційної діагностики клінічних проявів, оцінки ефективності лікування); дерматоскопія (вивчення дерматоскопічних ознак в осередках ураження), морфологічні та ІГХ (для вивчення патогістологічних порушень в уражених ділянках шкіри, проведення диференціальної патогістологічної діагностики); статистичні (для підтвердження вірогідності результатів).
Наукова новизна одержаних результатів. Вперше в Україні визначено клінічні прояви і дерматоскопічні ознаки АК при різних ступенях тяжкості і різних клінічних варіантах у взаємозалежності з фототипами шкіри і проявами фотоушкодження.
Вперше визначено потенціал онкогенної трансформації, проліферативні властивості, васкуляризацію та стромальну деградацію при АК на підставі розширених імуногістохімічних (ІГХ) досліджень панч-біоптатів ураженої шкіри.
Вперше в Україні обґрунтовано і запропоновано комбіновану методику лікування АК, спрямовану на основні відомі ланки патогенезу захворювання, і порівняно її ефективність з традиційним методом кріодеструкції рідким азотом.
Обґрунтовано важливість і необхідність мотиваційного консультування пацієнтів для підвищення ефективності лікування, покращення комплаєнтності хворих щодо методів і засобів профілактики прогресування і виникнення рецидивів АК.
Практичне значення одержаних результатів полягає у розробці і впровадженні в практику способу діагностики і методики лікування пацієнтів, хворих на АК (патент України на корисну модель № 125617 від 10.05.2018 р., інформаційний лист № 31-2018). Доведено, що розроблена методика комбінованої послідовної терапії пацієнтів, хворих на АК із застосуванням кератолітичного засобу – 5% саліцилової мазі, кріодеструкції рідким азотом і процедури інтенсивного імпульсного світла (IPL) є малоінвазивною, простою в застосуванні, враховує фототип шкіри пацієнта, клінічну вираженість в осередках АК і забезпечує розрішення осередків АК в оптимальному часовому періоді та збільшення тривалості клінічної ремісії, порівняно з монотерапією кріодеструкцією. Методика високоефективна і може використовуватись у лікувально-профілактичних закладах дерматологічного профілю, косметологічних установах з метою отримання стійкої ремісії та косметичного ефекту.
Розроблено і складено методику мотиваційного консультування пацієнтів, хворих на АК, що складається з інформаційної і рекомендаційної частин; доведено її позитивний вплив на кінцеві клінічні результати лікування і профілактику рецидивів АК.
Розроблені автором методики діагностики і лікування пацієнтів, хворих на АК, впроваджені в навчальний процес на кафедрі дерматовенерології Національної медичної академії післядипломної освіти імені П.Л. Шупика, кафедрі інфекційних хвороб, епідеміології, шкірних та венеричних хвороб ДВНЗ «Тернопільський медичний університет імені І.Я. Горбачевського МОЗ України», кафедрі шкірних та венеричних хвороб з курсами патоморфології та фтизіатрії ДВНЗ «Ужгородський національний університет», кафедрі дерматології та венерології ДВНЗ «Івано-Франківський національний медичний університет», а також у практичну роботу Комунального закладу «Рівненський обласний шкірно-венерологічний диспансер» Рівненської обласної ради, ТОВ «Інститут псоріазу та хронічних дерматозів», Комунальної установи Тернопільської обласної ради «Тернопільський обласний клінічний шкірно-венерологічний диспансер» і Комунальної установи Тернопільської обласної ради «Тернопільський обласний клінічний онкологічний диспансер».
Особистий внесок здобувача. Дисертація є самостійною науковою працею здобувача. Дисертантом самостійно проведено аналіз наукової і патентної літератури з обраної проблеми, на підставі чого розроблені основні завдання та методологія дослідження. Самостійно проведено відбір хворих та клінічне спостереження за ними, здійснено статистичну обробку матеріалу, проаналізовані результати досліджень, їх теоретичне узагальнення та практичне застосування. Дисертантом систематизовано накопичений матеріал, написані всі розділи дисертації, сформульовані висновки й запропоновані практичні рекомендації. Основні публікації за темою мають оригінальний характер.
Усі опубліковані наукові праці, в яких викладено основні положення і зміст дисертації, авторські. З наукових праць, опублікованих у співавторстві, в дисертації використано лише ті ідеї, положення і висновки, які є результатом особистої роботи здобувача і становлять його індивідуальний науковий внесок. Конфлікту інтересів немає.
Апробація результатів дисертації. Основні положення роботи доповідались на: науково-практичній конференції «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом» (Святогірськ, 2016), міжнародному конгресі «XII International Congress of Dermatology» (Буенос-Айрес, Аргентина, 2017), науково-практичній конференції «12-е Киевские Дерматологические Дни» (Київ, 2017), ІІІ (Х) з’їзді Української асоціації лікарів-дерматовенерологів і косметологів (Львів, 2017), науково-практичній конференції «Менеджмент якісної спеціалізованої допомоги дерматовенерологічним пацієнтам» (Дніпро, 2018), науково-практичній конференції «13-ті Київські Дерматологічні Дні: Весняний симпозіум» (Київ, 2018), науково-практичній конференції: «Прикарпатські дерматовенерологічні дні 2018» (Яремче, 2018), науково-практичній конференції, присвяченої 25-річчю НАМН України «Прогресс в современной диагностике инфекций, передаваемых половым путем, инфекционных, распространенных и тяжелых дерматозов. Достижения в лечении» (Київ, 2018). На регіональному рівні: на переривчастих курсах для дерматовенерологів Тернопільської області (Тернопіль, 2015, 2016, 2018), на тематичній науково-практичній міжрегіональній конференції «Інновації медичної науки – в практику сімейного лікаря» (Тернопіль, 2018).
Публікації. За матеріалами дисертації опубліковано 14 друкованих праць, у тому числі 7 статей, з яких 4 – у журналах, що індексуються в міжнародних наукометричних базах даних, 2 – у зарубіжних журналах; 5 тез доповідей у матеріалах наукових форумів, 1 патент на корисну модель, 1 інформаційний лист.
Структура і обсяг дисертації. Дисертаційна робота викладена на 188 сторінках комп’ютерного тексту; складається зі вступу, огляду літератури, матеріалів і методів дослідження, 4 розділів власних досліджень, узагальнення результатів дослідження, висновків, рекомендацій, двох додатків; ілюстрована 40 таблицями і 44 рисунками. Список джерел містить 176 найменувань, з них 44 – кирилицею, 132 – латиницею.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріали і методи дослідження. Дослідження проводилося з 2015 по 2017 роки на кафедрі інфекційних хвороб з епідеміологією, шкірними та венеричними хворобами ДВНЗ «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України» на базі поліклінічного відділення Комунальної установи Тернопільської обласної ради «Тернопільський обласний клінічний шкірно-венерологічний диспансер». У цей період обстежено 110 пацієнтів у віці від 51 до 90 років (середній вік – (70,1 ± 0,9) років), з них 76 (69,1 %) жінок і 34 (30,9 %) чоловіків, 68 (61,8 %) міських і 42 (38,2 %) сільських мешканців. 90 пацієнтів були хворими на АК (основна група), 20 – на СК (група порівняння). Обидві групи хворих були статистично порівняними за віком, статтю і місцем проживання пацієнтів (р>0,05).
Діагноз усім пацієнтам встановлено на підставі оцінки клінічних проявів на шкірі, дерматоскопічних даних, з урахуванням скарг і даних анамнезу.
Критеріями включення пацієнтів у дослідження були: встановлений діагноз АК чи СК; добровільна згода пацієнта на участь у дослідженні відповідно до положень Гельсінської Декларації Всесвітньої Медичної Асоціації та правил якісної медичної практики (ICH GCP). Критерії виключення: наявність важкої супутньої патології у стадії суб- та декомпенсації; неможливість чи небажання виконувати рекомендації лікаря, дотримуватися плану обстеження; наявність супутніх дерматологічних захворювань, які могли б перешкоджати встановленню діагнозу АК, оцінці ефективності лікування.
Перед початком лікування усі хворі (90 осіб) на АК були рандомізовані на дві групи залежно від методики лікування. 1 група (основна) – хворі на АК (58 осіб), лікування котрим проведено комбінованою послідовною терапією; 2 група (порівняння) – хворі на АК (32 особи), котрим проведено кріодеструкцію рідким азотом (методика монотерапії). Обидві групи були статистично співставними (p>0,05) за віком, статтю і місцем проживання пацієнтів, а також за клінічними формами АК, ступенем важкості клінічних проявів захворювання, фототипами шкіри.
Оцінка локального дерматологічного статусу пацієнтів передбачала: визначення фототипу шкіри за класифікацією Фіцпатріка; підрахунок осередків АК і визначення їх розмірів; встановлення локалізації уражень; ідентифікацію морфологічних елементів; визначення кольору осередків АК; характеристику поверхні шкіри в місцях ураження; виявлення маркерів фотоушкодження.
При встановленні клінічного діагнозу АК виділялися такі клінічні варіанти: гіпертрофічний, пігментний, проліферативний. Важкість клінічних проявів встановлювалася за класифікацією Olsen (E.A. Olsen et al., 1991) з виділенням трьох стадій.
Для оцінки патологічних змін на шкірі при АК і СК використано неінвазивну методику імерсійної і поляризаційної дерматоскопії за допомогою дерматоскопу Heine delta 20T (Німеччина). Результати дерматоскопії архівували шляхом фотодокументування приладом Canon 450 D (Японія).
З метою оцінки патоморфологічних змін при кератозах проводили гістологічні та ІГХ дослідження панч-біопсійного матеріалу, отриманого від хворих на АК (15 осіб) та СК (9 осіб). Мікроскопія проводилася за допомогою світлового мікроскопу Zeiss Primo Star. Як ІГХ маркери використовувалися маркери: проліферації Ki-67 (клон SP6, 1:350, Thermo Scientific (TS), США) та Cyclin D1 (клон SP4, 1:150, TS, США), апоптозу p53 (клон SP5, 1:200, TS, США), ендотелію CD34 (клон Ab-1, 1:600, TS, США), протеолітичної активності MMP-9 (клон RB 9234PO, 1:200, TS, США) і TIMP1 (клон 102D1, 1:100, TS, США).
Морфометричне дослідження включало підрахунок кількості позитивно забарвлених ядер клітин (А. А. Кубанов и др., 2015; К. В. Обыденова и др., 2016); оцінку щільності судин та розрахунок діаметрів за мірною сіткою Chalkley (Г. В. Золотенкова и др., 2014); напівкількісний аналіз інтенсивності цитоплазматичного забарвлення за градаціями: (–) – немає реакції, (+/–) – слабка кластерна, (+) – слабка, (++) – помірна (Е. А. Левончук, 2015).
Статистичний аналіз проведений за допомогою програм R version 3.4.1 (2017-06-30) – “Single Candle” Copyright (C) 2017; The R Foundation for Statistical Computing Platform: x86_64-w64-mingw32/x64 (64-bit) та EXCEL-2003 (MicroSoft). Порівняння статистичних характеристик проводилися з використанням критеріїв Стьюдента (t), Хі-квадрат Пірсона (c2), двостороннього точного критерію Фішера, однофакторного дисперсійного аналізу ANOVA. Взаємозв’язок між ознаками оцінювався за коефіцієнтом рангової кореляції Спірмена (r).
Результати досліджень та їх обговорення. Аналіз скарг і даних анамнезу показав, що всі пацієнти з діагнозом АК (90 осіб – 100 %) скаржилися на висипання на шкірі переважно обличчя або інших ділянок голови та шорсткість шкіри. Сухість шкіри в місцях ураження відзначали 45,6 % хворих, утворення лусочок – 65,6 %; почервоніння шкіри – 73,3 %, свербіж – 37,8 %, рідко – кровоточивість – 6,7 %.
На відміну від АК, при СК кількість та спектр скарг були суттєво нижчими: наявність висипань на шкірі турбувала лише 55,0 % хворих на СК, шорсткість і утворення лусочок відзначали 15–20 % пацієнтів, почервоніння шкіри в місцях ураження не спостерігалося в жодному випадку (р<0,001 порівняно з АК).
На гіперінсоляцію в анамнезі вказали 74,4 % хворих на АК, з них більшість випадків (44,4 %) була спричинена необхідністю тривалого перебування на сонці, у зв’язку з родом діяльності/професією, в інших випадках – під час дозвілля/ відпочинку (30,0 %). Встановлено пряму асоціацію надмірної інсоляції, пов’язаної з родом діяльності, у жителів сільської місцевості порівняно з мешканцями міст (r=+0,43; p<0,001), а також у осіб більш старшого віку (r=+0,35; p<0,001).
При дослідженні структури хворих на кератози залежно від фототипу шкіри встановлено, що більшість з них (70,9 %) мали ІІ тип фоточутливості шкіри, в тому числі 73,3 % хворих на АК і 60,0 % пацієнтів, хворих на СК (р=0,279). Кількість пацієнтів з І фототипом шкіри була вищою у групі порівняння – 25,0 % хворих на СК проти 3,3 % хворих на АК (р=0,005). ІІІ фототип шкіри мали 23,3 % хворих на АК і 15,0 % пацієнтів, хворих на СК (р=0,556).
Маркери фотоушкодження (сухість, дряблість, зморшкуватість, нерівномірність пігментації, стоншення або атрофія шкіри, телеангіектазії, ефеліди) при АК виявлялися майже втричі частіше, ніж у хворих на СК – 58,9 % проти 20,0 % при р=0,002, і вірогідно асоціювалися з надмірною інсоляцією в минулому (r=+0,44; p<0,001). Відзначено тенденцію до зменшення частоти фотоушкодження шкіри у пацієнтів з ІІІ типом фоточутливості порівняно з І-ІІ типами (р=0,128).
У найбільшої частини хворих на АК виявлено два (47,8 %) або один (27,8 %) осередок ураження, що можна оцінювати як показник раннього звернення пацієнтів за медичною допомогою до дерматолога. Розміри осередків коливалися від 2 до 15 мм, середній розмір усіх осередків (M±m) – (6,19 ± 0,23) мм. Встановлено, що збільшення кількості осередків на шкірі обличчя асоціювалося з різними проявами фотоушкодження шкіри (r=+0,24; p=0,024), ІІ фототипом шкіри (r=+0,21; p=0,050) та надмірною інсоляцією (r=+0,25; p=0,022). Найчастішою локалізацією уражень у хворих на АК були щоки (78,9 %), шкіра носа (51,1 %) і чола (24,4 %).
Ідентифікація морфологічних елементів в осередках ураження показала їх різноманітність при АК – папула (57,8 % випадків), пляма (54,4 %), ерозія (10,0 %), шкірний ріг (7,8 %); при СК – переважно папули (75,0 %), у 25,0 % випадків себорейні кератоми мали плямистий вигляд (р=0,025 порівняно з АК).
Колір шкіри в осередках ураження при АК здебільшого був рожевим (65,6 %), у 31,1 % випадків – світло-коричневим, у 14,4 % – не зміненим (колір нормальної шкіри). При СК більшість кератом мали коричневий колір (75,0 %), у 25,0 % випадках – жовто-коричневий. У хворих на АК з ІІІ фототипом основним морфологічним елементом були плями (95,2 %) та світло-коричневий колір поверхні осередків ураження (100,0 %), у пацієнтів з ІІ фототипом – папули (68,2 %) і рожевий колір осередку ураження (81,8 %). Ерозію виявлено у 12,1 % пацієнтів з ІІ фототипом шкіри і в одного пацієнта з І типом.
Поверхня шкіри в осередках ураження АК і СК при пальпації була переважно шорсткою – відповідно у 64,4 % і 65,0 % випадків (р=1,00), злегка шорстка поверхня визначалася відповідно у 28,9 % і 35,0 % пацієнтів (р=0,598). Колюча поверхня характерна тільки для АК – 23,3 % (р=0,012).
В обстежених пацієнтів найчастіше діагностувався проліферативний АК – у 59 (65,6 %) хворих, який переважно характеризувався плоскими, шорсткими папулами (67,8 %), із середніми розмірами (6,30 ± 0,28) мм, з лусочками на поверхні, гіперемією в основі папул, рожевим кольором (81,4 %). У 23 (25,5 %) пацієнтів встановлено пігментний варіант АК, для якого властиві плямисті ураження (100,0 %), розміром (6,08 ± 0,43) мм, з шорсткою поверхнею (78,3 %), світло-коричневим кольором (100,0 %). Гіпертрофічний варіант АК діагностували лише у 7 (7,8 %) пацієнтів, в яких виявлені товсті шорсткі папули тілесного кольору або еритематозні, вкриті лусочками чи кірками, з часто колючою поверхнею (85,7 %), розміром (5,36 ± 0,82) мм. У одного пацієнта виявлено шкірний ріг, розміром 12 мм, як різновид гіпертрофічного АК.
Встановлено взаємозв’язок між різними клінічними варіантами АК і фототипом шкіри, наявністю маркерів фотоушкодження та вираженістю скарг. Так, проліферативний і гіпертрофічний варіанти АК вірогідно частіше (р<0,001) виявлялись у осіб з ІІ типом фоточутливості шкіри (93,2 % і 100,0 %), у той час як пігментний варіант – з ІІІ фототипом (87,0 %). Частота виявлення характерних проявів фотоушкодження на прилеглих до осередків ділянках шкіри обличчя була найменшою при пігментному АК (39,1 %) і найбільшою – при гіпертрофічному варіанті (85,7 %). На свербіж скаржилися всі пацієнти з гіпертрофічною формою АК (100,0 %), 40,7 % хворих з проліферативним варіантом і менше 10 % пацієнтів з пігментним АК. Почервоніння шкіри також було характерною ознакою проліферативного (93,2 %) і гіпертрофічного (71,4 %) варіантів АК.
Серед 90 хворих на АК І ступінь важкості встановлено у 25,5 % пацієнтів, ІІ ступінь – у 45,6 %, ІІІ ступінь – у 28,9 % пацієнтів. Перебіг АК був важчим у пацієнтів більш старшого віку: з ІІІ ступенем – у пацієнтів (74,6 ± 1,9) років, з ІІ ступенем – у пацієнтів (69,4 ± 1,2) роки, з І ступенем – у пацієнтів (69,1 ± 1,8) років (р=0,020 і р=0,046 порівняно з ІІІ ступенем). Важкий перебіг АК здебільшого визначався тривалою кумулятивною дією ультрафіолетового опромінення на ділянки шкіри, що піддаються інсоляції (r=+0,32; p=0,002), наявністю маркерів фотоушкодження шкіри (r=+0,22; p=0,034), а також при гіпертрофічній формі АК (r=+0,33; p=0,002).
За даними дерматоскопічного дослідження у хворих на АК найчастіше виявлялися лусочки (77,8 %), мішенеподібні фолікули (74,4 %), тонкі хвилясті судини (67,8 %) і еритема/ псевдосітка (65,6 %). Виражені фолікули діагностувались у 47,8 % пацієнтів. Рідше виявляли білі круги (32,2 %) і сірі ромбоподібні структури (25,6 %). Встановлено, що характерним для АК І ступеня є три дерматоскопічні ознаки: еритема/псевдосітка, тонкі хвилясті судини і лусочки; для АК ІІ ступеня тяжкості – мішенеподібні фолікули і лусочки; для ІІІ ступеня – мішенеподібні фолікули, лусочки і виражені фолікули. Для пігментного АК характерними є виражені фолікули, сірі ромбоподібні структури, мішенеподібні фолікули і білі круги; для проліферативного варіанту – еритема/рожева псевдосітка, лусочки і тонкі хвилясті судини; для гіпертрофічного варіанту – поєднання трьох дерматоскопічних ознак: мішенеподібних і виражених фолікулів і лусочок (100 %).
Під час гістологічного дослідження панч-біопсійного матеріалу ураженої шкіри при АК і СК встановлено, що випадки АК характеризувалися клітинною атипією різного ступеня тяжкості, що включала спотворення дозрівання базальних клітин, плеоморфізм ядер кератиноцитів, порушення стратифікації, часткову або повну втрату зернистого шару, гіперкератоз, наявність ділянок пара- і дискератозу, збільшення кількості мітотичних фігур базального та навіть парабазального шарів, розширення міжклітинних просторів та прояви апоптозу (рис. 1).
Загальними характеристиками гіпертрофічної форми АК виявилися надмірний гіперкератоз з частим утворенням на поверхні епідермісу багатоповерхових гіпереозинофільних без’ядерних лусок, помірні паракератоз та акантоз із ознаками клітинної атипії та незначним накопиченням меланіну базальними кератиноцитами. Пігментну форму АК відрізняло інтенсивне накопичення меланіну в епідермісі з переважно помірним гіперкератозом та акантозом, незначним паракератозом та незначною або помірною клітинною атипією. Проліферативна форма АК характеризувалася вираженим акантозом з утворенням широких акантотичних тяжів з тенденцією до брунькування, помірним гіперкератозом та різною клітинною атипією.
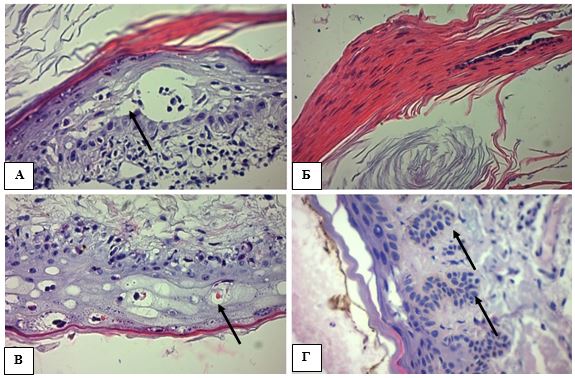
Рисунок 1 – АК: морфологічні ознаки ушкодження епідермісу, забарвлення гематоксилін-еозин (х400). А. Порушення дозрівання кератиноцитів – плеоморфні ядра, відсутність нормальної стратифікації плоского епітелію, розщеплення між базальним і парабазальним шарами епідермісу (стрілка). Б. Паракератоз – більшість зроговілих клітин має ядра. В. Дискератоз – краплини кератину в шипуватому шарі (стрілка). Г. Акантоз у вигляді брунькування, дисплазія базальних кератиноцитів (стрілки).
Найбільш значущими гістопатологічними особливостями при АК (окрім дисплазії І-ІІІ епітеліальних клітин) виявилися: запалення – круглоклітинний інфільтрат строми (100 %), дисплазія епітелію волосяних фолікулів (93,3 %), гіперкератоз (66,7 %), атрофія епідермісу (60,0 %), апоптоз базальних кератиноцитів (65,2 %), дисплазія себоцитів (53,3 %) та акантотичне брунькування (46,7 %).
При аналізі матеріалів СК визначилися чотири гістологічні типи за будовою: акантотичний (твердий, однорідний), ретикулярний або сітчастий (аденоїдний, залозистий), гіперкератозний (папіломатозний) та роздратований (ушкоджений). Головними проявами гістології СК виявилися гіперкератоз, акантоз, рогові кісти та інтенсивна пігментація базального шару.
В ІГХ профілі зразків при АК реєструвалися такі особливості: переважання р53 позитивності (66,7 % випадків р53 (+), 60 % мали експресію р53 вищу 10 %); переважання активної проліферації в базальних та парабазальних шарах епідермісу незрілих атипових клітин (66,7 % зразків мали індекс проліферації більше 30 %); помірну змішану ядерно-цитоплазматичну експресію cyclin D1 (33,3 % випадків із експресією вищою 30 %). У зразках при СК спостерігалася виключно негативна р53 реакція (100 % спостережень), рівень проліферативної активності рідко перевищував 10 %, експресія маркеру cyclin D1 була низькою і мала виключно інтрануклеарний характер.
Аналіз процесів васкуляризації за експресією маркеру CD34 показав збільшення кількості судин та їх діаметрів при АК порівняно із СК (в 1,8–2 рази, р<0,05), пов’язане з формуванням спотворених кавернозно-подібних судин навколо ділянок дисплазії епідермісу. При оцінюванні протеолітичної активності визначено сильний кореляційний зв'язок за експресією ММР-9 (r=+0,721; р=0,002) та наявність аберантної експресії маркеру ММР-9 та ТІМР-1 в обох групах.
Розроблено і впроваджено комбіновану методику терапії АК з урахуванням даних ІГХ досліджень про можливість активної проліферації і злоякісної трансформації. Пацієнтам 1 групи спостереження (58 пацієнтів) призначалася 5 % саліцилова мазь з метою кератолітичного ефекту, яка наносилася локально на осередки двічі щодня впродовж 5–7 днів. Після відшарування гіперкератотичних утворень проводилися 3–5 сеансів IPL у режимі, відповідному до фототипу шкіри пацієнта, 1 раз у 7–10 днів залежно від вираженості місцевої реакції. Контроль стану шкіри проводили візуально і методом дерматоскопії. Далі виконувалася кріодеструкція спреєм рідкого азоту одноразово тривалістю 10–15 с. Курс лікування тривав 1–2 місяці. Пацієнтам групи порівняння (2 група, 32 пацієнти) проводили одну процедуру кріодеструкції спреєм рідкого азоту тривалістю 10 с (монотерапія).
За даними порівняльного аналізу встановлено, що серед пацієнтів 1 групи було вірогідно більше хворих зі значним покращенням стану шкіри вже через 3 і 12 місяців після терапії. Так, через 3 місяці після комбінованої терапії гладкою поверхня шкіри була у 77,6 % пацієнтів, через 12 місяців – у 79,3 %. У пацієнтів, які отримали монотерапію, через 3 місяці гладка поверхня шкіри була у 40,6 % (p<0,001), через 12 місяців – у 59,4 % (р=0,043). Повне очищення шкіри через 3 місяці відбулось у 84,5 % пацієнтів 1 групи і лише у 37,5 % пацієнтів 2 групи (p<0,001), через 12 місяців – відповідно у 75,9 % і у 56,3 % пацієнтів (р=0,062).
Рецидиви через 3 місяці після лікування не виявлені у жодного пацієнта двох груп; через 12 місяців у 1 групі рецидивів було 22,4 %, а в групі порівняння – 43,8 % (р=0,035). Вірогідно частіше рецидиви мали місце у пацієнтів з гіпертрофічним клінічним варіантом АК (71,4 %), ураженнями ІІІ ступеня тяжкості (69,2 %) та значною кількістю осередків АК.
Маркери фотоушкодження шкіри через 3 місяці виявлялись у 34,5 % пацієнтів на тлі комбінованої терапії і у 59,4 %, яким проведено монотерапію (p=0,028); через 12 місяців – відповідно у 17,2 % і 53,1 % (p<0,001) пацієнтів. Відсутність косметичних дефектів через 3 місяці відзначена у 67,0 % пацієнтів 1 групи і у 40,6 % пацієнтів 2 групи (р=0,025). Моніторинг через 12 місяців збільшив ці показники до 87,9 % у групі комбінованої терапії і до 50,0 % – після кріодеструкції рідким азотом (p<0,001).
Враховуючи низький рівень обізнаності хворих на АК щодо шкідливості гіперінсоляції (32,2 %), знань правил перебування на сонці (13,3 %) та необхідності фотозахисту (28,9 %), а також наявність вираженого кореляційного зв’язку між хронічною гіперінсоляцією в анамнезі та клінічними і морфологічними проявами АК, розроблено і запроваджено методику мотиваційного консультування пацієнтів, що складається з інформаційної та рекомендаційної частин. Постлікувальний моніторинг прихильності хворих на АК до наданих знань показав суттєве покращення цих показників: щоденне нанесення ССЗ, через кожних 3 години реєструвалося у 68,9 % пацієнтів; 17,8 % пацієнтів наносили СЗЗ нерегулярно; 2,2 % – не застосовували СЗЗ. Щоденне використання СЗЗ зворотньо корелювало зі ступенем тяжкості АК (r=-0,30; p=0,004) і віком пацієнтів (r=-0,45; p<0,001), проте вже не асоціювалося з рівнем поінформованості про шкідливість ультрафіолетового опромінення. Емолієнти від початку лікування і перебування під спостереженням застосовували щоденно двічі 81,1 % пацієнтів; 18,9 % пацієнтів використовували такі засоби нерегулярно.
Таким чином, використання запропонованого способу лікування забезпечує вплив на основні ланки патогенетичних механізмів розвитку АК, спрямований на досягнення клінічного одужання, подовження ремісії та досягнення максимального косметичного ефекту.
ВИСНОВКИ
У дисертаційній роботі проведено теоретичне обґрунтування і нове науково-практичне вирішення актуального завдання сучасної дерматовенерології – покращення діагностики і підвищення ефективності комплексної терапії АК шляхом вивчення механізму розвитку дерматозу, клінічних особливостей, розробки алгоритму діагностики з урахуванням результатів клінічних, дерматоскопічних, патоморфологічних та імуногістохімічних досліджень і в поєднанні з профілактичними заходами.
- Враховуючи постійне зростання рівня захворюваності та поширеності АК, можливість його активної проліферації, прогресування і злоякісної трансформації в інвазивний рак, недостатню вивченість окремих ланок патогенезу захворювання, триваючі наукові дискусії (АК є передраковим станом чи інтраепітеліальним ПКРШ на ранній стадії свого розвитку), актуальним є пошук нових методів сучасної діагностики, поглиблене вивчення окремих ланок патогенезу і розробка удосконаленої комбінованої терапії.
- Встановлено, що переважними клініко-анамнестичними ознаками проявів і перебігу АК є: похилий і старечий вік пацієнтів (88,9 % старше 60 років), скарги на шорсткість (100 %) і почервоніння (73,3 %) шкіри з утворенням лусочок (65,6 %) у місцях ураження, ІІ тип фоточутливості шкіри (73,3 %), кумулятивна надмірна інсоляція в анамнезі (74,4 %), наявність маркерів фотоушкодження шкіри (58,9 %). Найчастішими морфологічними елементами в осередках ураження є папули (57,8 %) і плями (54,4 %) рожевого (65,6 %) або світло-коричневого кольору (31,1 %), здебільшого асоційовані з проліферативною формою АК (65,6 %), ІІ (45,6 %) і ІІІ ступенем (28,9 %) важкості дерматозу.
- За даними дерматоскопічного дослідження встановлено, що основними ознаками пігментного АК є виражені фолікули (100 %), сірі ромбовидні структури (100 %), мішенеподібні фолікули і білі круги (91,3 %); для проліферативного АК характерні – еритеми / рожева псевдосітка (94,9 %), лусочки (94,9 %), тонкі хвилясті судини (93,2 %); для гіпертрофічного клінічного варіанту – поєднання трьох дерматоскопічних ознак: мішенеподібних і виражених фолікулів та лусочок (100 %).
- За даними гістологічного дослідження встановлено, що основними морфологічними ознаками АК є клітинна атипія з вираженими явищами запалення, дисплазії епітелію волосяних фолікулів та себоцитів, атрофії епідермісу та апоптозу базальних кератиноцитів – від 53,3 % до 100 % випадків, порівняно із СК – від 0 % до 22,2 %.
- Імуногістохімічний профіль ураженої шкіри при АК свідчить, що це захворювання є здебільшого р53 позитивним, з активною проліферацією в базальних та парабазальних шарах епідермісу незрілих атипових клітин; характеризується вірогідним збільшенням щільності мікросудин та їхніх діаметрів за експресією маркеру CD34 (в 1,8-2 рази), підвищенням експресії маркеру ММР‑9 і аберантним ядерно-цитоплазматичним забарвленням епідермісу, що додатково свідчить про наявність клітинної атипії і підвищення проліферативної активності.
- Розроблено і впроваджено комбіновану методику терапії АК із застосуванням кератолітичного засобу, IPL-процедур і кріодеструкції рідким азотом, спрямовану на радикальне видалення осередків АК і попередження інвазивного росту, що забезпечує значне покращення стану шкіри з повним її очищенням у 84,5 % і 75,9 % пацієнтів через 3 і 12 місяців терапії, на відміну від монотерапії методом кріодеструкції рідким азотом з аналогічними результатами у 37,5 % і 56,3 % пацієнтів; швидкий повний регрес клінічних проявів захворювання; меншу кількість рецидивів (22,4 % проти 43,8 %); досягнення кращого косметичного ефекту (87,9 % проти 50,0 % пацієнтів).
- Встановлено низький рівень обізнаності хворих на АК щодо шкідливості гіперінсоляції (32,2 %), знань правил перебування на сонці (13,3 %) та необхідності фотозахисту (28,9 %) на первинному прийомі. Розробка і впровадження методики мотиваційного консультування пацієнтів сприяли підвищенню показників комплаєнтності до застосування СЗЗ (до 86,7 %) і емолієнтів (81,1 %), що безпосередньо позитивно позначилося на кінцевих клінічних результатах лікування і профілактики рецидивів АК.
РЕКОМЕНДАЦІЇ
- При встановленні діагнозу АК слід враховувати особливості клінічних і дерматоскопічних ознак дерматозу залежно від ступеня тяжкості і клініко-морфологічних варіантів захворювання.
- З метою покращення ранньої діагностики та своєчасного адекватного лікування АК доцільно дотримуватися двоетапного діагностичного алгоритму. Перший етап діагностики здійснюється на первинному (сімейними лікарями) і на вторинному (дерматологи багатопрофільних поліклінік) рівнях надання медичної допомоги і передбачає вивчення даних анамнезу щодо тривалості впливу сонячного випромінення, попередньої цитостатичної терапії, зловживання солярієм і т.ін.; визначення фототипу шкіри; оцінку клінічної візуальної симптоматики і локалізації патологічних змін на шкірі; проведення диференційної діагностики (з себорейним кератозом, хворобою Боуена, поверхневою базально-клітинною карциномою). Другий етап передбачає проведення дерматоскопічних (поляризаційна і неполяризаційна дерматоскопія) та ІГХ досліджень спеціалістами (дерматолог, дерматоонколог) третинного рівня.
- Для підвищення ефективності лікування хворих на АК рекомендується проведення комбінованої послідовної трьохетапної терапії із застосуванням кератолітичного засобу – 5 % саліцилової мазі двічі щодня впродовж 5–7 днів до відшарування лусочок і кірочок з наступними сеансами ІРL (з довжиною хвилі 560–1200 нм, імпульсом 22–26 Дж/см2) № 3-5 у режимі, відповідному до фототипу шкіри пацієнта, 1 раз на 7–10 днів залежно від вираженості місцевої реакції в зоні впливу; проведенням на заключному етапі кріодеструкції спреєм рідкого азоту тривалістю 10–15 с одноразово. Курс лікування – 1–2 місяці.
- З метою підвищення комплаєнтності пацієнтів до лікування і профілактики рецидивів АК важливо проводити мотиваційне консультування пацієнтів інформаційного і рекомендаційного характеру щодо шкідливості гіперінсоляції, знань правил перебування на сонці та необхідності фотозахисту.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Глушок В. С. Аналіз процесів васкуляризації та деградації позаклітинного матриксу при актинічному кератозі. Український журнал дерматології, венерології, косметології. 2017. № 4 (67). С. 22–27.
- Глушок В. С., Святенко Т. В. Можливості дерматоскопії в діагностиці актинічного кератозу. Здобутки клінічної і експериментальної медицини. 2018. № 2 (34). С. 37–41.
- Глушок В. С., Святенко Т. В. Власний досвід комбінованої послідовної терапії актинічного кератозу. Дерматологія та венерологія. № 1 (79). С. 39–42.
- Оцінка стану проліферативної активності та експресії онкомаркеру p53 в зразках актинічного кератозу / В. С. Глушок, Т. В. Святенко, І. С. Шпонька, О. В. Пославська. Морфологія. 2017. Т. 11, № 3. С. 6–12. (Здобувачем особисто сформульовано мету і завдання дослідження, проведено аналіз отриманих даних і їх узагальнення).
- Глушок В. С. Основні патофізіологічні механізми розвитку і прогресування актинічного кератозу. Журнал дерматовенерології та косметології імені М. О. Торсуєва. 2017. № 2 (38). С. 101–108.
- Hlushok V., Sviatenko T. The use of the sunscreens as a part of actinic keratosis management. Journal Experimental and Clinical Medicine. 2018. № 1. P. 43–47.
- Mixed nuclear-cytoplasmic immunostaining for cyclin D1, MMP-9, TIMP-1 in actinic keratosis and correlation with cellular proliferation / V. S. Hlushok, T. V. Sviatenko, I. Shponka, O. V. Poslavska. Derma 3. Tisícročia. 2018. T. XVIII, № 1-2. P. 16–24. (Здобувач особисто сформулював мету і завдання дослідження, провів аналіз отриманих даних і їх узагальнив).
- Глушок В. С., Святенко Т. В., Шпонька І. І., Пославська О. В. Спосіб діагностики актинічного кератозу: пат. 125617 Україна: МПК (2018.01), GO1N21/00; заявл. 22.01.2018; опубл. 10.05.2018, Бюл. № 9.
- Глушок В. С. Себорейний кератоз: аспекти диференціальної діагностики з актинічним кератозом. Журнал дерматовенерології та косметології імені М.О. Торсуєва. № 1 (39). С. 94–95.
- Hlushok V. S. A part of a prophylaxis of skin neoplasias in the region. Matherial of 2nd International transcaucasus congress on photodermatology and skin cancer. (Tbilisi, 27-29 october 2016). Tbilisi, 2016. 43–47.
- Hlushok V. S., Sviatenko T.V. New approach to the diagnostics of actinic keratosis in Ukraine. International Journal of Dermatology. 2017. Vol. 56. P. 1315–1316.
- ГлушокВ. С., Хара А. И. К вопросу о менеджменте дерматоонкологической помощи пациентам с актиническим кератозом. Дерматовенерология и эстетическая медицина. 2015. № 3 (27). С. 121. (Дисертанту належить ідея дослідження, самостійне проведення збору та узагальнення матеріалів, підготовка матеріалу до друку).
- Глушок В. С. Попередні результати скринінгових обстежень на актинічний кератоз. Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування та профілактики дерматозів та інфекцій, що передаються статевим шляхом : матеріали регіональн. наук.-практ. конф. (м.Святогірськ, 12-13 травня 2016 р.). Святогірськ, 2016. С. 14–15.
- Святенко Т. В., Глушок В. С. Комбінована терапія актинічного кератозу з врахуванням морфофенотипування. Інформаційний лист. Київ, 2018. № 31, вип. 2: Дерматологія та венерологія.
АНОТАЦІЯ
Глушок В.С. Сучасні підходи і патоморфологічне обґрунтування комплексної терапії актинічного кератозу. – На правах рукопису.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.20 – шкірні та венеричні хвороби. – Державна установа «Інститут дерматології та венерології НАМН України», Харків, 2018.
Дисертація присвячена підвищенню ефективності терапії актинічного кератозу (АК) шляхом обґрунтування методики лікування захворювання з урахуванням результатів клінічних, дерматоскопічних, патоморфологічних та імуногістохімічних досліджень.
Проведено поглиблене вивчення клінічних проявів і даних дерматоскопії при різних ступенях тяжкості і клінічних варіантах АК у 90 хворих, а також розширені імуногістохімічні дослідження панч-біоптатів ураженої шкіри при АК порівняно з себорейним кератозом.
Запропоновано комбіновану методику лікування АК, спрямовану на основні ланки патогенезу захворювання, порівняно її ефективність з традиційним методом кріодеструкції рідким азотом.
Обґрунтовано важливість мотиваційного консультування пацієнтів для підвищення ефективності лікування і покращення комплаєнтності хворих.
Ключові слова: актинічний кератоз, імуногістохімія, кріодеструкція, IPL, маркери p53, cyclin D1, CD34, Ki-67, MMP-9, TIMP-1.
АННОТАЦИЯ
Глушок В.С. Современные подходы и патоморфологическое обоснование комплексной терапии актинического кератоза. – На правах рукописи.
Диссертация на соискание ученой степени кандидата медицинских наук по специальности 14.01.20 – кожные и венерические болезни. – Государственное учреждение «Институт дерматологии и венерологии НАМН Украины», Харьков, 2018.
Диссертация посвящена повышению эффективности комплексной терапии актинического кератоза (АК) путем обоснования методики лечения заболевания с учетом результатов клинических, дерматоскопических, патоморфологических и иммуногистохимических исследований.
Проведено углубленное изучение клинических проявлений и данных дерматоскопии при различных степенях тяжести и клинических вариантах АК у 90 больных, а также расширенные иммуногистохимические исследования панч-биоптатов пораженной кожи при АК по сравнению с себорейным кератозом.
Предложено комбинированную методику лечения АК, направленную на основные звенья патогенеза АК, проведено сравнение ее эффективности с традиционным методом криодеструкции жидким азотом.
Обоснована важность мотивационного консультирования пациентов для повышения эффективности лечения и улучшения комплаентности больных.
Ключевые слова: актинический кератоз, иммуногистохимия, криодеструкция, IPL, маркеры p53, cyclin D1, CD34, Ki-67, MMP-9, TIMP-1.
SUMMARY
Hlushok V.S. Modern approaches and pathomorphological reasoning of the complex actinic keratosis therapy. – The manuscript.
Dissertation for the degree of a candidate of medical sciences on the specialty 14.01.20 – skin and venereal diseases. – State Establishment “Institute of Dermatology and Venereology of NAMS of Ukraine”, Kharkiv, 2018.
The scientific work is devoted to the improvement of the efficiency of the complex actinic keratosis therapy by substantiating the choice of the disease treatment method, considering the results of clinical, dermatological, pathomorphological and immunohistochemical studies.
In-depth study of clinical manifestations and dermoscopy data at various severity degrees and clinical variants of actinic keratosis (AK) in 90 patients with interdependence with skin phototypes and manifestations of photodamage have been carried out. The average age of the patients was 70.8 ±1,2 years old, 67.8 % of women, and 58.6 % of urban residents. The comparison group consisted of 20 patients with seborrheic keratosis (SK) of the corresponding age, sex and place of residence.
It was found, that the prevailing clinical and anamnestic features of the manifestations and course of AK are the following: old and senile age of patients (88.9 % older than 60 years old), complaints on the skin roughness (100 %) and redness (73.3 %) with the formation of scales in places of lesion (65.6 %), II type of the skin photosensitivity (73.3 %), cumulative excessive insolation in the past (74.4 %), presence of markers of skin photo lesions (58.9 %), 1 -2 focal lesions on the face, about 6 mm in size, with predominant localization in the cheek (78.9 %) and nose area (51.1 %) and palpational roughness of the surface of the affected skin. The most common morphological elements in the lesions are papules (57.8 %) and spots (54.4 %) of pink (65.6 %) or light brown (31.1 %) colour, mostly associated with the proliferative form of AK (65.6 %), II (45.6 %) and III degree (28.9 %) of severity of dermatosis.
According to the dermoscopy study, the main features of the pigmentary AK are the evident follicles (100 %), gray rhomboidal structures (100 %), targetoid follicles and white circles (91.3 %); for proliferative AK – erythema / pink pseudonetwork (94.9 %), scales (94.9 %), fine wavy vessels (93.2 %); for a hypertrophic clinical variant – a combination of 3 dermatoscopic signs: targetoid and evident follicles and scales (100 %).
Extended IHC studies of punch-bioptates of the AK affected skin were conducted and compared with the SK, the results of which gave an opportunity to evaluate the potential of oncogenic transformation, proliferative properties, vascularization and stromal degradation in AK. It was found that AK is mostly p53 positive, with active proliferation in the basal and parabasal layers of the epidermis of immature atypical cells and moderate mixed nucleic-cytoplasmic expression of cyclin D1. The analysis of the vascularization revealed a probable increase of the number of vessels in AK, in comparison with the SK (r=+0.480; p=0.033), as well as doubly enlarged vascular diameters in the AK group, associated with the formation of distorted cavernous neoplastic vessels around the areas of epidermis dysplasia (p<0.001). The assessment of the proteolytic activity in AK and SK samples determined a strong correlation between MMP-9 expression (r=+0.721; p=0.002) and the presence of aberrant expression of the MMP-9 and TIMP-1 markers in both subgroups, which further indicates the presence of cellular atypia and serves as a reliable prognostic indicator of increasing proliferative activity.
The combined therapy of AK with the data of conducted immunohistochemical studies of the possibility of active proliferation and malignant transformation, aimed on radical removal of focal AK lesions, that prevents the invasive growth, has been developed, clinically tested and implemented into practice. It was proved, that the proposed method, in comparison with the traditional method of cryodestruction with the help of liquid nitrogen, provides a significant improvement of the skin condition with its complete clearance in 84.5 % and 75.9 % of patients after 3 and 12 months of therapy in contrast to monotherapy by liquid nitrogen cryodestruction with the same results in 37.5 % and 56.3 % of patients. An appointment to patients with AK of the combined therapy with the use of traditional keratolytic agent, IPL procedures and liquid nitrogen cryodestruction gives the possibility to increase the effectiveness of treatment, which is confirmed by more rapid complete regression of clinical manifestations, less quantity of recurrense (22.4 % vs. 43.8 %) and the achievement of a better cosmetic effect – 12 months after treatment, the absence of cosmetic defects was noted in 87.9 % of patients in the combination therapy group and 50.0 % after the cryodestruction (p<0.001).
Key words: actinic keratosis, immunohistochemistry, cryodestruction, IPL, p53 markers, cyclin D1, CD34, Ki-67, MMP-9, TIMP-1.
