МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
ЛЬВІВСЬКИЙ НАЦІОНАЛЬНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ
ІМЕНІ ДАНИЛА ГАЛИЦЬКОГО
На правах рукопису
Возняк Ірина Ярославівна
УДК 616.517-036-092.19:616.155.3-097.37
ОПТИМІЗАЦІЯ ТАКТИКИ ВЕДЕННЯ ХВОРИХ НА ПСОРІАЗ
З УРАХУВАННЯМ ВАЖКОСТІ ПЕРЕБІГУ
ТА ІМУНОМОРФОЛОГІЧНОЇ ХАРАКТЕРИСТИКИ ШКІРИ
14.01.20 – шкірні та венеричні хвороби
Дисертація на здобуття наукового ступеня
кандидата медичних наук
Науковий керівник:
Святенко Тетяна Вікторівна
доктор медичних наук,
професор
Львів – 2015
ЗМІСТ
| Перелік умовних скорочень | 5 |
| Вступ | 6 |
| Розділ 1 Псоріаз як актуальна медико-соціальна проблема сучасної дерматології (огляд літератури) | 13 |
| 1.1 Сучасні уявлення про патогенетичні ланки розвитку псоріазу | 13 |
| 1.2 Особливості та роль імуноморфологічних змін у псоріатичних ураженнях шкіри | 19 |
| 1.3 Основні принципи терапії хворих на псоріаз | 26 |
| Розділ 2 Матеріали та методи досліджень | 33 |
| 2.1 Методи вивчення клінічних порушень хворих на псоріаз | 34 |
| 2.2 Загальноклінічні методи дослідження | 35 |
| 2.2.1 Загальний аналіз крові | 36 |
| 2.2.2 Загальний аналіз сечі | 37 |
| 2.2.3 Аналіз калу на яйця гельмінтів | 38 |
| 2.2.4 Визначення тривалості кровотечі за Дуке визначали згідно з Наказом МОЗ № 290 від 11.04.1972 р. | 38 |
| 2.4 Морфологічний метод дослідження | 38 |
| 2.5 Імуногістохімічні методи дослідження | 39 |
| 2.5.1 Розрахунок CD3+ Т-лімфоцитів, CD68+ макрофагів та S100+ дендритних клітин | 40 |
| 2.5.2 Реакції з маркерами матриксної металопротеїнази-9 та фактора росту ендотелію судин | 41 |
| 2.5.3 Визначення щільності судин | 42 |
| 2.5.4 Розрахунок індексу проліферації та базальноклітинної гіперплазії | 42 |
| 2.6 Визначення площі та важкості ураження | 42 |
| 2.7 Психометричне анкетування за опитувальником з якості життя пацієнтів з дерматологічними проблемами та „Псоріатичний індекс порушень” | 43 |
| 2.7.1 Обчислення дерматологічного індексу якості життя | 43 |
| 2.7.2. Обчислення псоріатичного індексу порушень | 44 |
| 2.8 Статистичні методи дослідження | 44 |
| Розділ 3 Клінічна характеристика хворих на псоріаз | 44 |
| Розділ 4 Аналіз особливостей імуноморфологічних змін ураженої шкіри у хворих на псоріаз | 46 |
| 4.1 Імуноморфологічні особливості псоріатичних шкірних ушкоджень залежно від стадії перебігу дерматозу | 53 |
| 4.2 Імуноморфологічні особливості перебігу псоріазу вульгарного залежно від ступеня його важкості | 53 |
| 4.3 Прогнозування ризиків прогредієнтного перебігу псоріазу | 78 |
| Розділ 5 Аналіз кількісної характеристики експресії фактора некрозу пухлини – альфа периферичної крові у хворих на псоріаз звичайний | 83 |
| Розділ 6 Характеристика показників якості життя хворих на псоріаз залежно від ступеня важкості дерматозу | 86 |
| 6.1 Оцінка якості життя обстежених пацієнтів за допомогою опитувальника з якості життя пацієнтів з дерматологічними проблемами | 87 |
| 6.2 Оцінка якості життя обстежених пацієнтів за допомогою опитувальника „Псоріатичний індекс порушень” | 88 |
| Розділ 7 Аналіз ефективності лікування псоріазу | 91 |
| 7.1 Рекомендовані методи лікування | 91 |
| 7.2 Динаміка імуноморфологічних показників у хворих на псоріаз після лікування | 96 |
| 7.3 Динаміка показників якості життя у хворих на псоріаз після лікування | 105 |
| 7.4 Динаміка показників клінічної ефективності лікування у хворих на псоріаз | 106 |
| Розділ 8 Аналіз та обговорення отриманих результатів досліджень | 110 |
| Висновки | 125 |
| Рекомендації | 128 |
| Список використаних джерел | 129 |
| Додаток А Акти впровадження | 149 |
ПЕРЕЛІК УМОВНИХ СКОРОЧЕНЬ
АЧТЧ – активований частковий тромбопластиновий час
Г-Е – гематоксилін-еозин
ІГХ – імуногістохімічний
ІП – індекс проліферації
ЛОКШВД – Львівський обласний комунальний шкірно-венерологічний диспансер
ММП – матриксна металопротеїназа
ОГ – основна група
ПХ – псоріатична хвороба
П1 – група порівняння №1
П2 – група порівняння №2
ЯЖ – якість життя
DLQI – дерматологічний індекс якості життя
IFN – інтерферон
IL – інтерлейкін
PASI – індекс площі ураження та важкості перебігу псоріазу
PDI – індекс недієздатності при псоріазі
TGF-a – трансформуючий фактор росту – альфа
TNF-a – фактор некрозу пухлини – альфа
VEGF – фактор росту ендотелію судин
ВСТУП
Актуальність теми. Псоріаз є одним з найбільш поширених і важких дерматозів, який характеризується тривалим, з частими рецидивами перебігом, що нерідко зумовлює тимчасову непрацездатність, а іноді – інвалідність [16, 43, 79]. На псоріаз хворіє до 3,5–5 % населення земної кулі [4]. У загальній структурі захворювань шкіри питома вага псоріазу становить 9 %, а серед госпіталізованих у дерматологічні стаціонари – 35–38 % [13]. Проблема вивчення псоріазу зумовлена перманентним зростанням рівня захворюваності, варіабельністю клінічного перебігу, нерідко розвитком атипових форм дерматозу, резистентних до будь-яких засобів терапії, що традиційно використовуються, зменшенням термінів ремісії при важких та атипових формах. Сьогодні значно збільшилась кількість звернень хворих на псоріаз різних вікових груп, зареєстровані форми, які рідко трапляються, водночас їх важко діагностувати [38, 55].
Актуальність проблеми псоріазу зумовлена також незрозумілою етіологією та багатьма аспектами патогенезу, внаслідок чого ефективність існуючих методів лікування недостатньо висока і спричинює неминучі рецидиви [69]. Висока частота псоріазу серед госпіталізованих хворих свідчить про труднощі і нерідко марні зусилля терапії в амбулаторних умовах. Псоріатична хвороба (ПХ), як хронічний постійно рецидивуючий дерматоз, суттєво погіршує якість життя (ЯЖ) пацієнтів, впливаючи на всі аспекти життя хворого: кар’єру, соціальну сферу, статеве життя та сімейні стосунки, що робить проблему актуальною і важливою не тільки у медичному, але й у соціальному аспекті. Про поширення психоматичних станів з точністю стверджувати важко, тому що показники захворювання зазвичай занижені, і ці хворі нерідко перебувають поза увагою лікарів. Однак частота психоматичних розладів доволі висока і коливається від 15 до 50 % в загальній медичній практиці [66]. Психосоматичні розлади є причиною скарг 36-71 % хворих, що звертаються до лікаря через шкірні хвороби.
У різні часи виникали різні теорії етіопатогенезу псоріазу, кожна теорія базується на відповідних клінічних спостереженнях та результатах окремих досліджень, серед них: неврогенна (одна з перших), про неї свідчить початок захворювання після значного психоемоційного стресу, деяка ефективність застосування седативних середників, вітамінів групи В, стреси та невротичні розлади призводять до скорочення періоду ремісій та виникнення загострень; ендокринна теорія – менструальні загострення псоріазу, покращення перебігу захворювання в період вагітності; інфекційна теорія – зв’язок псоріазу з фокальною інфекцією на мигдаликах, спадкова теорія – псоріаз у представників другого-п’ятого-шостого поколінь, сімейні випадки псоріазу, вища конкордатність монозиготних близнюків порівняно з дизиготними; обмінна теорія – покращення перебігу псоріазу під час голодування, при дотриманні певних дієт тощо. Однак, жодна з перелічених теорій не в змозі пояснити усі випадки псоріазу.
Сьогодні найбільш обґрунтованою теорією етіопатогенезу псоріазу вважають імунну, згідно з якою активація Т-клітин є ключовим моментом у каскаді взаємодій між клітинами запального інфільтрату, кровоносних судин та кератиноцитами, що зумовлює розвиток клінічних проявів псоріазу.
Згідно з найновішими даними літератури та останніми дослідженнями вирішальну роль у патогенезі ПХ відводять імунним порушенням у клітинній ланці імунітету з переважними змінами у Т-системі [37, 86], а саме Т-хелперам [115] а також дендритним клітинам (клітини Лангенгарса, плазматичні дендритні клітини, CD-11 субпопуляція), які безпосередньо стимулюють проліферацію Т‑лімфоцитів, секретують фактор некрозу пухлини – α (TNF-α), інтерферон (IFN) -γ, інтерлейкін (IL) -12, -23, -15 [163]. За даними Philipp S. et al. (2006), дендритні клітини через IL-12, IL-23 активізують наївні Т-клітини, запускаючи виділення прозапальних речовин, серед них: IL-17, IL-22, TNF-α, IFN-γ, IL-2, які ініціюють запалення, гіперпроліферацію кератиноцитів, остеокластів, ентероцитів, неоваскуляризацію, вазодилятацію, що й призводить до виникнення уражень шкіри та інших тканин, характерних для ПХ. З’ясування патогенетичної ролі протизапальних цитокінів при псоріазі дає особливі надії на вирішення проблеми псоріазу із подальшою розробкою нових перспективних напрямів базисної терапії, зокрема біологічних модифікаторів імунної відповіді – антизапальних цитокінів, моноклональних антитіл, антагоністів рецепторів, розчинних рецепторів. Однак висока вартість лікування біологічними модифікаторами імунної відповіді спричинює часто вибір інших засобів, незважаючи на зумовлений ними терапевтичний ефект та порівняно низький рівень органотропних побічних дій. Сьогодні лікарі та науковці ведуть активний пошук засобів, які б відповідали переліченим умовам і мали не тільки ефективність й безпечність для хворого, а ще й позитивну фармекономіку.
Зв’язок роботи з науковими програмами, планами, темами. Дослідження є фрагментом комплексних науково-дослідних робіт кафедр Львівського національного медичного університету імені Данила Галицького: терапії №2 та дерматології, венерології факультету післядипломної освіти “Патогенетичні підходи до діагностики та лікування деяких дерматозів (псоріаз, вульгарні вугрі) та захворювань, що передаються статевим шляхом негонорейної етіології” (№ держреєстрації 0106U012666); сімейної медицини та дерматології, венерології за темою «Клініко-експериментальне обґрунтування моніторингу, діагностики та стандартизованих методів лікування метаболічних захворювань внутрішніх органів та їх ускладнень» (№ держреєстрації 0106U001641). Здобувачем самостійно виконано розділи: «Сучасний погляд на зміни деяких показників гомеостазу в хворих з псоріатичною хворобою», «Сучасні підходи та особливості лікування хронічних дерматозів», «Матеріали та методи для вивчення та корекції порушених обмінних процесів у хворих на псоріаз», «Вивчення корелятивного взаємозв’язку між біохімічними показниками сироватки крові пацієнтів з псоріатичною хворобою”, та “Оцінка ефективності запропонованої терапії відповідно до динаміки змін показників лабораторного дослідження сироватки крові хворих з псоріатичною хворобою”.
Мета і задачі дослідження. Мета – підвищити ефективність терапії та розробити метод лікування хворих на псоріаз шляхом вивчення патогенетичних особливостей розвитку шкірних уражень за допомогою імунологічних, патогістологічних, імуногістохімічних (ІГХ) досліджень та показників якості життя.
Завдання дослідження:
1. Вивчити особливості перебігу, клінічних проявів, оцінити якість життя і психосоматичний статус хворих на псоріаз на сучасному етапі.
2. Дослідити морфологічні, ІГХ зміни у ділянках ураження шкіри хворих на псоріаз залежно від ступеня важкості дерматозу.
3. Оцінити рівень TNF-α у периферичній крові хворих на псоріаз залежно від ступеня важкості дерматозу.
4. Розробити комплексну патогенетичну терапію хворих на псоріаз вульгарний за результатами гістологічних, ІГХ та імунологічних досліджень.
5. Дати клініко-лабораторну оцінку ефективності розробленої терапії.
6. Розробити критерії оцінки ступеня тяжкості вульгарного псоріазу та створити математичну модель патологічного процесу з урахуванням імунологічних та ІГХ змін.
Об’єкт дослідження – псоріаз вульгарний (звичайний).
Предмет дослідження – клінічні, імунологічні, імуногістохімічні, патоморфологічні особливості перебігу псоріазу звичайного, результати лікування.
Методи дослідження: загальноклінічні, імунологічні, ІГХ, патоморфологічні, психометричні, статистичні.
Наукова новизна отриманих результатів. Дисертантом вперше за допомогою ІГХ досліджень доведено значущість процесів неоангіогенезу (маркери CD34, MMР-9, VEGF) в етіопатогенезі псоріазу; вперше доведено, що ангіогенез у псоріатично уражених ділянках шкіри супроводжується формуванням високоендотелізованих венул навіть на початку розвитку захворювання. Вивчено процеси базальноклітинної диференціації епітеліоцитів (маркер р63), індекс клітинної проліферації (маркер Кі-67), вперше встановлено, що експресія маркерів р63 та Кі-67 уже в стадії ранніх місцевих змін перевищує аналогічні показники здорової шкіри контрольної групи у 6 разів, що підтверджує дані про порушення процесів проліферації та диференціації при псоріазі. З’ясовано активність запалення за станом мононуклерної інфільтрації та дендритних клітини ураженої шкіри (маркери CD3 епідерміс/дерма, CD68 епідерміс/дерма, S100 епідерміс/дерма) залежно від важкості перебігу псоріазу; вперше встановлено співвідношення кількості дендритних клітин, макрофагів, нейтрофілів та Т-лімфоцитів (відповідно 1 : 2-3 : 3-4 : 10-15) у периваскулярних інфільтратах дерми. Вперше науково обґрунтовано комплексну терапію псоріазу з використанням надропарину кальцію та адеметіоніну, надано оцінку розробленої терапії. Уперше створено математичну модель патологічного процесу з урахуванням визначення ступеня тяжкості псоріазу з метою прогнозування розвитку важких форм, перебігу хвороби та оптимізації терапії.
Практичне значення одержаних результатів. Розроблено оригінальний метод комбінованого застосування в лікуванні хворих на вульгарний псоріаз надропарину кальцію та адеметіоніну, що приводить до усунення клінічних проявів захворювання, подовження тривалості ремісій та зменшення кількості рецидивів (патент на корисну модель № 91815 від 10.07.2014 та інформаційний лист №152-2014).
Результати роботи впроваджено в навчальний процес кафедри дерматовенерології Національної медичної академії післядипломної освіти ім. П.Л. Шупика, кафедри дерматовенерології ВДНЗУ «Буковинський державний медичний університет», кафедри дерматовенерології та косметології з курсом дерматовенерології і естетичної медицини ФПО Запорізького державного медичного університету, кафедри дерматології та венерології Одеського національного медичного університету.
Основні положення дисертації впроваджено в практику Львівського обласного комунального шкірно-венерологічного диспансеру, Комунальної установи «Запорізький обласний шкірно-венерологічний клінічний диспансер», Комунального закладу «Івано-Франківський обласний клінічний шкірно-венерологічний диспансер», Комунальної установи «Одеський обласний клінічний шкірно-венерологічний диспансер», Територіального медичного об’єднання «Дерматовенерологія» у місті Києві.
Особистий внесок здобувача. Внесок здобувача в отриманні результатів дисертаційної роботи є основним і полягає в самостійному аналізі наукових публікацій за темою дисертації. Самостійно проведено патентно-інформаційний пошук. Разом с науковим керівником сформульовано мету та задачі роботи. Самостійно проведено узагальнення отриманих результатів та їхню статистичну обробку, написано всі розділи дисертації, спільно з науковим керівником сформульовано висновки.
Здобувачем спільно з І.С. Шпонькою, О.В. Пославською, співробітниками ДЗ “Дніпропетровська медична акдемія МОЗ України”, досліджено морфологічні та імуногістохімічні особливості псоріатично ураженої шкіри, визначено основні ланки в патогенезі дерматозу.
Дисертантом разом із О.А. Білинською, співробітницею Львівського національного медичного університету імені Данила Галицького, проведено дослідження системи гемостазу та стану мікроциркуляції у хворих на псоріаз, дана характеристика виявлених порушень у системі згортання та морфологічних змін судин ураженої шкіри, зроблені відповідні висновки.
Дисертантом не були запозичені результати і ідеї співавторів публікацій.
Апробація результатів дисертації. Матеріали дисертації обговорені на науково-практичній конференції «Наукові розробки молодих вчених дерматовенерологів післядипломної освіти» (Київ, 2008), науково-практичній конференції з міжнародною участю «Роль санаторно-курортного лікування у вирішенні проблем збереження здоров’я нації, наукове, економічне, соціальне та суспільне його значення» (Моршин, 2009), Всеукраїнській науково-практичній конференції «Актуальні питання наукової і практичної косметології та зв’язок із суміжними спеціальностями» (Запоріжжя, 2009), IV Міждисциплінарній конференції «Актуальні питання наукової та практичної косметології» (Запоріжжя, 2010), науково-практичній конференції, присвяченій 100-річчю з дня народження видатного українського вченого, лікаря дермато-венеролога, професора М.І. Дубового (Львів, 2011), ІІІ Всеукраїнській науково-практичній конференції «Актуальні питання наукової і практичної косметології» (Запоріжжя, 2011), Всеукраїнській науково-практичній конференції з міжнародною участю «Мультидисциплінарний підхід до курації хворих на шкірні захворювання та інфекції, що передаються статевим шляхом» (Львів, 2013), 12 конгресі Словацької асоціації естетичної та косметологічної дерматології з міжнародною участю (Братислава, Словаччина, 2011).
Публікації. За матеріалами дисертації опубліковано 31 роботи, з яких 9 статей, зокрема 6 статей у фахових наукових виданнях, 2 статті у вітчизняних збірниках наукових праць, 1 – у закордонному збірнику, 3 статті у журналах, що входять до міжнародної наукометричної бази «Російський індекс наукового цитування», 1 патент на корисну модель, 1 навчально-методичний посібник (з грифом МОЗ), 1 інформаційний лист та 19 тез доповідей (у тому числі 7 іноземних).
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУРИ
1.1 Сучасні уявлення про патогенетичні ланки розвитку псоріазу
Псоріаз – хронічний папулосквамозний дерматоз поліетіологічної природи з часткою генетичного компоненту 64–72 %, який характеризується неконтрольованою, незлоякісною гіперпроліферацією епідермісу, порушенням кератинізації, запальною реакцією в дермі, змінами в різних органах і системах [38, 77, 79]. Через хронічний рецидивний тривалий перебіг хвороби частішають важкі форми псоріазу, стійкі до терапії, які нерідко інвалідизують хворих і навіть зумовлюють смерть. Псоріазом страждає 2–3 % населення земної кулі, незалежно від статі, віку та етнічної належності. У загальній структурі патології шкіри питома вага захворювання сягає 8-10 %, а серед госпіталізованих у дерматологічні стаціонари – 30-40 % [79, 96], тобто сьогодні псоріаз продовжує залишатися актуальною проблемою дерматології та найпоширенішим дерматозом.
Ще в 1841 р. Фердинанд Гебра [78] об’єднав дві форми за Р. Вілланом («lepra graecorum», або псоріаз ураження – у вигляді круглих плям та «lepra psora» – фігурний псоріаз) в одну – «рsoriasis». Наприкінці ХІХ століття Полотебнов А.Г. пов’язав шкірні висипання при псоріазі із суглобовими проявами. З цього часу неодноразово переглядали [77] аспекти як патогенезу псоріазу, так і, відповідно, клініки й лікування.
Псоріаз, або ПХ, належить до системних захворювань, котрі мають комплекс взаємозумовлених патогенетичних ланок: імунних, нейроендокринних, інфекційних та інших [13, 16, 19, 102]. Базовим чинником морфологічних змін при цьому дерматозі є прискорена проліферація епідермісу за рахунок скорочення клітинного циклу епідермоцитів, яка пов’язана із синтезом цитокінів, активованих Т-лімфоцитами [102, 127]. Тобто, псоріаз – це імунозалежне захворювання, що має доведену генетичну схильність (в 1994 році було виявлено чотири хромосомні локуси – 17q, 4q, 1q, 6p; пізніше знайшли більш чутливий регіон щодо псоріазу – 6р21.3 біля HLA-C – ген Psors 1 та MICA ген) [190], але дослідження морфології псоріатичних уражень залишається актуальним для кращого розуміння розвитку всіх патогенетичних ланок.
У науковій літературі не припиняється дискусія щодо належності псоріазу до суто шкірних захворювань. Дехто з дослідників запевняє, що так звана «супутня» патологія внутрішніх органів зумовлена безпосередньо псоріазом. Це підтверджують значна частота й кореляція ступеня її виявлення та активність перебігу псоріатичного процесу [52, 58]. З 60-х років ХХ століття в літературі інколи почали з’являтися припущення про належність псоріазу до групи колагенозів, які ґрунтуються на особливостях клінічних виявів та перебігу ПХ. Проте існують лише поодинокі описи патоморфології внутрішніх органів при aртpопатичному та ексудативному псоріазі, ускладненому амілоїдозом [76, 79].
Узагальнюючи отримані результати систематизованого морфологічного дослідження внутрішніх органів за умов різноманітних клінічних форм ПХ, слід зазначити, що виявлені морфологічні зміни у серці [102], які поєднуються з системним ушкодженням мікрогемоциркуляторного русла, значно погіршують оксигенацію органів і тканин, призводячи до гіпоксії й розвитку дистрофічних змін, а також пояснюють порушення основних функцій серцевого м’язу – автоматизму, збудження, провідності, скоротливості, які доволі часто реєструють клінічно при псоріазі [9].
Структурні зміни нирок зумовлюють порушення їх секреторно-екскреторної функції. Відповідно, зміни печінки спричинюють недостатність її монооксигеназної системи, що пояснює полівалентну нестерпність лікувальних препаратів, яка спостерігається у хворих на псоріаз [175]. Імунодефіцит з переважаючим ушкодженням Т-ланки імунітету у поєднанні з дефектами гуморальної відповіді [16, 118, 163] зумовлює знижену резистентність цього контингенту хворих до інфекційних агентів і часті септичні ускладнення при важких формах псоріазу. Стадійний характер структурних змін надниркових залоз при псоріазі (компенсаторно-пристосувальні реакції, зниження резервних можливостей, структурна і функціональна декомпенсація), який тісно пов’язаний із ступенем важкості і тривалістю захворювання, робить необхідною оцінку індивідуальних особливостей стану кіркової речовини надниркових залоз у кожного конкретного пацієнта перед призначенням кортикостероїдної терапії, щоб уникнути небажаних побічних явищ і ускладнень [179]. Сукупність перелічених структурних зсувів у поєднанні з клінічними особливостями цієї нозологічної одиниці дає змогу вважати, що псоріаз належить до групи ревматоїдних захворювань [76].
Окрім цього, чимало дослідників пов’язують системний характер ушкоджень при ПХ із патологією верхніх відділів тонкої кишки [175, 188]. Патологічні ураження різного ґенезу спричинюють різноманітні відхилення дванадцятипалої та тонкої кишок у вигляді «згладження» кишкових ворсинок та потоншення кишкової стінки, що зумовлює порушення її бар’єрної функції. Існують підтвердження, що лімфатична система – це найбільш ймовірний канал (дослідження з використанням поглинальних тестів EDTA з 51 Cr-міткою), по якому патогени поглинаються і транспортуються для видалення через шкіру. Якщо кількість циркулюючих токсинів стає надмірною, а печінка і нирки не в стані очистити від них організм, то розвиток аутоінтоксикації неминучий. Імунна система реагує на антигени і відбувається характерне аутоімунне запалення. Оскільки системна токсичність, пов’язана з кишковою проникністю, забезпечує доступ патогенів до різних органів, то можуть спостерігатися й додаткові порушення, найбільш характерні з яких – це хвороби суглобів, печінки, нирок.
За нормальних умов жовчні кислоти, які виділяються з жовчю, діють як детергени (здійснюючи фізико-хімічний захист) і можуть захистити організм від ендотоксинів грамвід’ємних бактерій кишківника, розщеплюючи їх в нетоксичні фрагменти і, таким чином, запобігають подальшому виділенню цитокінів. Відповідно до позитивного ЛАЛ-тесту, бактеріальні ендотоксини, які при цьому знаходяться в крові, можуть відігравати роль в патогенезі псоріазу. Імунна система організму реагує на антигени через виділення цитокінів, і, відповідно, – автоімунне запалення. Обидві циркулюючі рідини (кров і лімфа), насичені поживними речовинами, врешті надходять до печінки, де більшість імунних комплексів знешкоджується. Якщо печінка не затримує антигени, то вони будуть циркулювати через легені, серце, нирки, шкіру (через мігруючі лімфоцити) та інші частини організму, спричинюючи синдром поліорганної недостатності, як складний процес бактеріальної транслокації [11, 175, 188].
Комплексні дослідження доводять, що порушення серцево-судинної, гепатобіліарної систем і шлунково-кишкового тракту при псоріазі є обтяжливим чинником, що істотно впливає на важкість перебігу дерматозу. Це зумовлено тим, що численні регуляторні механізми організму залежать від функціонування відповідних систем.
Вивчаючи процеси біологічного окиснення шкіри у хворих на псоріаз, було виявлено, що ушкоджена шкіра при цьому дерматозі у 5-15 разів більше поглинає кисень, ніж у здорових людей [71]. Гіпоксія, яка внаслідок цього розвивається в епідермісі, спричинює зміну амінокислотного обміну, зокрема цистеїну. Якщо у інтактній шкірі (епідермісі) міститься цистеїн як продукт розщеплення цистину, то при псоріазі в лусочках переважає таурин. Таку зміну обміну цистину при псоріазі можна пояснити феноменом посиленого лущення, коли за відсутністі достатньої кількості цистеїну та накопичення таурину міжклітинні з’єднання порушуються. Такий механізм пояснює явище паракератозу при псоріазі.
У працях деяких учених доведено, що в епідермісі хворих на псоріаз збільшена кількість мітозів, причому прискорюється тотальна зміна епідермісу, що поєднується з порушенням клітинного диференціювання та паракератозом [116, 146, 162, 180]. Були зроблені спроби пояснити патогенез цих змін з точки зору місцевої тканинно-специфічної регуляції проліферації, яка здійснюється епідермальними кейлонами. Останні – це термолабільні глікопротеїди, розчинні у воді, тканинно-специфічні, що виробляються диференційованими клітинами епідермісу. Відомо два різновиди агентів, які контролюють поділ клітин: одна фракція запобігає вступу епідермоцитів у фазу С-1 клітинного циклу, тоді як інша – діє на клітини у фазі С-2 премітотичного періоду, порушуючи вступ клітин у фазу мітозу [165, 166, 174].
Псоріаз часто супроводжується порушенням ліпідного обміну [157, 175]. Відомо, що ліпіди циркулюють у біологічних рідинах у вигляді молекулярних комплексів – ліпопротеїнів, утворюючи різні функціональні елементи транспортної системи холестеролу, тригліцеридів та інших гідрофобних біологічно активних з’єднань. Холестерол є обов’язковим компонентом плазматичних мембран, з синтезом яких пов’язана проліферація клітин.
Причини порушення ліпідного обміну при псоріазі недостатньо зрозумілі, однак, на думку багатьох дослідників, однією з вагомих причин є зміна структури генів, відповідальних за синтез і метаболізм ліпідів, що може передаватися по спадковості [157, 175]. Спеціальні генетичні дослідження [89, 112] у хворих та здорових родичів пацієнтів свідчать, що гіперліпідемія, зокрема гіпертригліцеридемія є первинною і тим фактором, який сприяє розвитку псоріазу як хвороби обміну. Оскільки гіпертригліцеридемія у 95 % випадках зумовлена генетично [112], то можна вважати, що фактори, сприятливі до її розвитку та псоріазу, взаємопов’язані.
У деяких літературних джерелах зазначено, що серцево-судинні захворювання у пацієнтів із псоріазом доволі часто розвиваються на тлі гіперліпідемії та тригліцеридемії [170].
Чільне місце в розвитку псоріазу посідають ендокринні розлади [20]. Зокрема, сьогодні спостерігається зростання рівня тиреопатій, що пов’язують з погіршенням екологічних умов [52, 58]. Ураження щитоподібної залози, асоційовані як з пригніченням, так і з підвищенням її функціональної активності, характеризуються розвитком аутоімунних реакцій, появою циркулюючих антитіл до тиреоглобуліну, мікросомальним і тиреостимулюючим імуноглобулінами, що сприяє посиленню алергічного компонента. Порушується регуляція різних видів обміну та нейтралізація ушкоджувальних чинників зовнішнього середовища через зміни гормонального впливу на пероксидазну систему крові, стану циклічних нуклеотидів і цитокінів [20, 58].
У літературі є дані про взаємозв’язок супутніх захворювань і ПХ. Підвищений ризик серцево-судинних захворювань, таких як інфаркт і інсульт, а також підвищення смертності, що проявляється в скороченні тривалості життя приблизно на 3-4 роки, були зареєстровані у більш молодих пацієнтів з важкими формами псоріазу [24]. Точний механізм зв’язку між псоріазом та серцево-судинними захворюваннями досі не встановлено, але в ньому можуть бути задіяні гуморальні та клітинні медіатори запалення, з якими пов’язують і розвиток атеросклерозу, який теж має чимало схожого із ПХ [15, 16]. Зокрема, при артропатичному псоріазі запальний процес супроводжується дисбалансом інтерлейкінів і підвищенням рівнів TNF-α та С-реактивного білка, які теж відіграють ініціюючу роль у ґенезі атеросклерозу [67, 164]. Неалкогольну жирову хворобу печінки часто пов’язують з чинниками ризику серцево-судинних захворювань, особливо з метаболічним синдромом [58, 194]. Як свідчать дані досліджень, підвищені рівні пов’язаних із патогенезом ПХ прозапальних цитокінів спостерігаються й при депресії [14, 53, 186]. Психосоціальні супутні патології у пацієнтів не завжди пропорційні важкості ПХ, проте від них залежить перебіг дерматозу [66, 105].
Підсумовуючи вищезазначене, можна зробити висновок, що ПХ супроводжується значною кількістю патогенетичних чинників, які відіграють неабияку роль у розвитку чи перебігу дерматозу. У хворих на псоріаз виявлено зміни процесів біологічного окиснення в шкірі, вмісту біологічно активних речовин, диспротеїнемію, порушення фосфоліпідного обміну, імунного стану організму тощо. Таким чином, дані про механізми розвитку псоріазу мають хаотичний характер. Не структуровані результати щодо їх асоційованості між собою та клінічним перебігом дерматозу. Відсутні дані про інформативність деяких показників. Тому подальше їх вивчення безумовно розширює рамки уяви про механізми розвитку дерматозу та є цілком перспективним для подальшої розробки координованого лікувального втручання та контролю ефективності терапії таких пацієнтів.
1.2 Особливості та роль імуноморфологічних змін у псоріатичних ураженнях шкіри
Різке збільшення проліферації епідермальних клітин, яке відбувається при псоріазі, змусило дослідників зосередитись на можливих відхиленнях у самих кератиноцитах епідермісу [127], але ефективність імуносупресивних препаратів при лікуванні псоріазу довела порушення насамперед імунної системи. Наприклад, ультрафіолетове випромінювання В, фотохіміотерапія, кортикостероїди, цитостатики та антралін – інгібують різні аспекти імунної відповіді [8]. А перебування двох категорій Т-клітин, CD4+ і CD8+ лімфоцитів у місцях, уражених псоріазом, дало змогу багатьом авторам припустити, що псоріаз – це опосередкований Т-лімфоцитами дерматоз [25, 138]. Бабанін В.А. (2012) доводить, що використання NB-UVB терапії вірогідно знижує рівень експресії здебільшого цитотоксичних Т-лімфоцитів в запальному інфільтраті шкіри при бляшкоподібному псоріазі щодо хворих зі стандартними методами традиційної терапії [8].
Найбільш ранні морфологічні зміни, які можна зафіксувати, – це дилятація та звивистість, вони відбуваються в судинах дермальних сосочків. Водночас відбувається також неоваскулогенез, що супроводжується формуванням високоендотелізованих венул, які є спеціалізованими посткапілярними венулами, висланими високим призматичним або циліндричним ендотелієм. Ці фактори важливі для збільшення місцевої мікроциркуляції, яка може полегшувати переміщення Т-лімфоцитів (Th1-субпопуляції) у шкіру. Високоендотелізовані венули відіграють важливу роль у поповненні шкіри циркулюючими лімфоцитами, а ангіогенез стимулюють такі фактори, як IL-8 та трансформуючий фактор росту-a (TGF-a). Наявність неоангіогенезу при псоріазі потребує ретельного дослідження. Використання тримірної реконструкції навело дослідників на думку, що видовження сітки хребтів (акантотичних тяжів) спричинює появу судин горизонтального плетення, що набуває вигляду інтрапапілярних капілярів [74].
Відомо, що одним з основних активаторів неоангіогенезу є VEGF, що є активним мітогеном для мікро- і макроваскулярних клітин кровоносних і лімфатичних судин і здійснює свій ефект в синергізмі з фактором росту фібробластів-2 [109]. На поверхні ендотеліальних клітин розміщені три рецептори для VEGF, які є типовими рецепторними тирозинкіназами. Рецептор VEGF-1 (VEGF-R1) є продуктом гена flt-1; рецептор VEGF-2 (VEGF-R2) отримав назву KDR і є людським гомологом продукту мишачого гена flk-1; рецептор VEGF-3 (VEGF-R3) – продукт гена flt-4 [2, 23]. Дослідження в цій галузі при псоріазі представлені поодинокими закордонними публікаціями.
Crawshaw A.A. зі співавторами (2012) дослідили кілька антагоністів VEGF, що були схвалені для лікування різних злоякісних пухлин і проліферативної ретинопатії і визначили великий потенціал цих препаратів для лікування псоріазу, а саме моноклональні антитіла проти VEGF і VEGFRs, приманки до анти-VEGF-рецепторів та інгібітори тирозинкінази, які блокують ефекти VEGF/VEGFR [121].
Rashed Hayam E. та Eman H. Abd El-Bary (2012) продемонстрували рівні експресії VEGF та Bcl-2 білків у шкірі, ураженій псоріазом і визначили зв’язок між ними та прогнозом важкості перебігу цих факторів у патогенезі псоріазу [171]. Експресія VEGF була значно підвищена в ураженій шкірі порівняно з нормальною здоровою шкірою (p<0,0001), а експресія BCL-2 білка, навпаки, значно знизилася в уражених псоріазом ділянках шкіри (р <0,0001).
Дуже демонстративні результати Simonetti O. та співавторів (2006), що провели ІГХ дослідження на п’ятнадцяти кріозрізах псоріатичної шкіри з використанням антитіл VEGF, CD34, фактора VIII, макриксних металопротеїназ (ММП) -2, -9, тканинного інгібітора макриксних металопротеїназ-1 і -2. Псоріатична шкіра виявила значне збільшення експресії маркерів VEGF, CD34, фактор VIII, ММП-2 та ММП-9 (р=0,010, р=0,04, р=0,033, р=0,0001, р=0,007 відповідно) порівняно зі здоровою шкірою. До того ж усі різновиди псоріатичних шкірних тканин свідчать, що експресія тканинного інгібітора матриксних протеїназ -2 і -1 статистично вірогідно зменшилася в ураженій псоріазом шкірі (р=0,0001, р=0,001 відповідно). Вчені визначили, що надлишкова експресія VEGF корелювала з експресією ММП-2, що підкреслює роль VEGF при псоріазі як ключового фактора у зв’язку між запаленням і ангіогенезом [188]. Між тим, подібні вітчизняні дослідження відсутні.
За дослідженням Aronson Peter J. (2008) ангіопоетин-1 є основним агоністом рецептора тирозинкінази. Рецептори тирозинкінази експресують у різних типах клітин, включаючи ендотеліальні, епітеліальні, моноцити і нейтрофіли. Ангіопоетин-1 – рецептори тирозинкінази-2 сигналізація спричинює хемотаксичну дію нейтрофілів. До того ж ангіопоетин-1 інгібує секрецію тканинного інгібітора матриксних металопротеїназ і зумовлює секрецію ММП. Аберрантна експресія та активність тирозинкінази-2 у судинних і несудинних клітинах може спричинити розвиток псоріазу [111].
Наступним важливим кроком прогресії є залучення лімфоцитів сосочків дерми. Цьому сприяють деякі хемоаттрактанти, такі як тромбоцит-активаційний фактор і лейкотрієн В4 [109, 111, 126]. Невелика група лімфоцитів активовані до потрапляння в шкіру під час циркуляції в судинному руслі. Вони сполучаються з ендотеліальними клітинами венул дермальних сосочків, в результаті підвищення експресії різних молекул адгезії ендотеліальними клітинами і шляхом діапедезу через міжендотеліальні простори стінки судини активовані лімфоцити проходять в сосочки дерми. Пізніше нейтрофіли судинного русла в такий самий спосіб мігрують до рогового шару епідермісу. Хемотаксичні фактори, зокрема С5а анафілатоксин, беруть активну участь в їхньому залученні [126]. Таким чином, молекули адгезії, що контролюють процеси зв’язування з ендотеліальними клітинами, можна представити у трьох групах:
1) родина генів імуноглобулінів, що складається з ICAM-1 (CD54), ICAM-2 та VCAM-1 (vascular cell adhesion molecule-1) [128],
2) інтегріни [147, 189],
3) селектини (найбільш важливим із них є Е-селектин) [25].
Одна чи більше таких молекул адгезії супроводжують вибіркову адгезію CD4, CD45RO Т-хелпер клітин. Хайрутдинов та його співавтори (2011) доводять, що кількість CD4+ Т-регуляторних клітин в уражених псоріазом ділянках на порядок більша, ніж в шкірі здорових людей [72]. Виникнення різних цитокінів індукує підвищення експресії цих молекул адгезії при псоріазі, наприклад IL-1, IL-2, IL-4, фактор некрозу пухлин-a (TNF-a), IFN-g. Згідно з даними останніх досліджень, ультрафіолетові промені спектром В редукують експресію молекул адгезії ендотеліальними клітинами, що пояснює позитивну динаміку псоріатичних ушкоджень при цьому методі лікування [8]. До того ж рівні розчинного Е-селектину корелюють зі ступенем псоріатичних ушкоджень [25]. При розгляді двох популяцій Т-клітин – CD4+ та CD8+, методом імуногістохімії було доведено, що більша ушкоджувальна дія епідермісу належить CD8+ внаслідок їхнього накопичення саме в епідермісі, натомість CD4+ більшим чином зібрані в межах дерми [72]. Цитокіни, що беруть участь у міграції обох популяцій, активно досліджують, вони мають дискутабельний характер. Відомо, що один цитокін може мати більше ніж один ефект дії, а лімфоцити або кератиноцити можуть продукувати більше ніж один цитокін, загалом їхні можливості передбачають зміни судин, стимуляцію кератиноцитів, контроль лімфацитарної міграції та хемотаксис нейтрофілів [25]. Наприклад, IL-8 має потужність активувати хемотаксис сильніше, ніж різні фактори комплементу [109, 189]. Псоріазин, що належить до родини S100 протеїнів і є медіатором запалення, знижує негативний регуляторний ефект циклоспорину на інші цитокіти та їхні рецептори під час лікування псоріазу [141].
Кінцевий етап патогенезу псоріазу виникає саме при стимуляції кератиноцитів такими факторами, як IL-8, TGF-a, IFN-g і фосфоліпаза С / протеїнкіназа С, що спричинює їхній активний поділ та порушення дозрівання з елімінацією зернистого шару. IFN-g має особливе значення при активації росту кератиноцитів і може продукуватися більшістю лімфоцитів. Також відбувається підвищена експресія хемокіну класу СХС, IL-8 та GRO/меланомного стимулятора росту GRO-a. Перелічені фактори загалом не тільки активують нейтрофіли і лімфоцити, але й стимулюють проліферацію кератиноцитів. При цьому кількість проліферуючих кератиноцитів базальних і парабазальних шарів підвищується у 12 разів [188].
Суханова Н.М (2003) при проведенні імуноморфологічних досліджень з використанням моноклональних антитіл описала позитивне забарвлення ядер у всіх клітинах базального і значної частини шипуватого шарів при використанні PCNA, Ki-67, а також значне розширення зони експресії інволюкрин і цитокератину 16, які свідчать про дисрегуляцію процесів кератинізації при псоріазі [81].
TGF-a, рівень якого значно підвищується при псоріазі, переважно синтезується субкорнеальними кератиноцитами і має мітогенну та ангіогенну активність [72]. Підвищення рецепторів до епідермального фактора росту в базальному шарі епідермісу також може бути перспективним щодо таргетної терапії. Зниження рівня експресії проапоптотичного протеїну bcl-2 в базальному шарі епідермісу пов’язане з підвищенням проліферативної активності і асоційованим з ним збільшенням апоптозу кератиноцитів [171, 173]. Як результат гіперпроліферації в кератиноцитах підвищується експресія кератинів К6, К16 та К17, але різко знижується рівень кератинів індикаторів диференціації – К1, К2 та К10 [136]. Нейтрофіли, що накопичуються серед кератиноцитів у вигляді невеликих депозитів, також мають ушкоджувальну дію внаслідок підвищення експресії протеолітичних ферментів – ММП-2, ММП-9 [190].
Таким чином, можна виділити декілька ланок патогенезу, що безпосередньо пов’язані з прозапальними цитокінами:
- Дилятація судин, неоангіогенез дермальних сосочків та активація ендотелію (IL-1, IL-6, IL-8, TNF-a, TGF-a, IFN-g, ендотелін-1) [72, 111, 127].
- Залучення активованих лімфоцитів (IL-1, IL-8, TNF-a, псоріазин) [147, 192].
- Кератиноцит-лімфоцитарна інтеграція (IL-1, IL-7, IL-8, TNF-a, IFN-g) [190].
- Ампліфікація механізмів запалення (IL-1, IL-2, IL-6, IL-8, TNF-a, IFN‑g) [148].
- Проліферація кератиноцитів з порушенням дозрівання (IL-1, IL-3, IL‑6, IL-8, TGF-a, IFN-g, епідермальний фактор росту, ендотелін-1, insulin growth factor, GRO/меланомного стимулятора росту GRO-a, фосфоліпаза С / протеїнкіназа С) [72, 111].
Судинні порушення можуть зберігатися навіть після лікування та клінічної нормалізації епідермісу. Стійкість судинних порушень пояснюється більш швидким рецидивом захворювання [190].
Основні морфологічні ознаки псоріатичних уражень непогано вивчені достатньо і їх можна згрупувати таким чином:
• паракератоз (наявність/затримка ядер в роговому шарі) внаслідок порушення дозрівання кератиноцитів,
• наявність мікроабсцесів Munro-Sabouraud (нейтрофіли утворюють невеликі агрегати в паракератичному роговому шарі) та пустул Kogoj (в межах шипуватого шару епідермісу),
• відсутність зернистого шару, окрім як на нігтях, де навпаки наявне потовщення зернистого шару (збільшення оновлення клітин епідермісу і відсутність дозрівання),
• епідермальний акантоз, що стосується тільки міжсосочкових просторів (регулярне подовження акантотичних тяжів вниз),
• подовження і набряк шкірних сосочків,
• потоншення епідермального шару клітин над шкірними сосочками призводить до утворення так званих «потоншених супрапапілярних пластин»,
• збільшення кількості мітозів кератиноцитів,
• проліферація ендотеліальних клітин з гіпертрофією і розширенням капілярних судин дермальних сосочків (кровоносні судини в сосочках виглядають розширеними і звивистими, ці судини легко кровоточать, коли видаляють супрапапілярні пластинки, що призводить до точкових кровотеч – ознака Auspitz),
• генералізована Т-клітинна інфільтрація епідермісу та дерми, що можна помітити і при світловій мікроскопії.
У патогенезі псоріазу підкреслюється [17, 22] первинний характер порушень диференціювання кератиноцитів. Водночас, на відміну від інших проліферативних захворювань, при псоріазі спостерігається синхронність зростання мітотичної активності клітин і кількості кератиноцитів, що гинуть. Цей процес свідчить про існування певного «витратного» механізму функціонування епідермісу. З іншого боку, клітинну загибель можна розглядати як адаптивну рису кератиноцитного потенціалу, яка на етапі загострення дерматозу виявляється частково втраченою [32, 44].
Імуноморфологічні зміни, які спостерігаються при псоріазі, дали змогу виділити чотири типи перебігу захворювання. Перший тип характеризується розвитком гострого імунного запалення, акцентованістю реакції гіперчутливості миттєвого типу та домінуванням альтернативних і судинно-ексудативних явищ. Другому типу притаманне підгостре імунне запалення з поєднанням ознак сенсибілізації, як миттєвого, так і сповільненого типів з перевагою судинно-ексудативних і продуктивних проявів. Третій тип характеризується хронічним імунним запаленням у вигляді наявності лише гіперчутливості уповільненої дії з маніфестацією продуктивних і склеротичних явищ. Четвертий тип ідентифікується різним порушенням антигенспецифічної взаємодії імунокомпетентних клітин зі структурними компонентами різноманітних тканин і органів та розвитком дистрофічних і атрофічних процесів (аутоімунізація). Слід зазначити, що перелічені імуно-морфологічні зміни можуть асоціюватись або стадійно трансформуватись. Коливання виразності цих процесів у поєднанні з особливостями клінічного перебігу дали змогу верифікувати псоріаз у якості ревматичної хвороби – патології сполучної тканини імуноопосередкованого ґенезу [32, 38].
Цей спектр імуноморфологічної відповіді асоціюється з клінічним перебігом захворювання. Зокрема, еритродермія завжди відповідає першому типу розвитку псоріазу, а рефрактерна до лікування специфічна артропатія – четвертому. Подібна кореляція дає змогу окреслити терапевтичну тактику. Наприклад, імуностимуляція при перших двох типах, призначення імуносупресивних і кортикостероїдних засобів при третьому та четвертому варіантах розвитку дерматозу можуть виявитись не лише неефективними, а й значно ускладнити перебіг патологічного процесу. Тому вельми доцільним виглядає дослідження взаємозв’язку між клінічними проявами псоріазу та імунними розладами, що дає змогу обрати адекватний шлях терапевтичного втручання [39, 51].
1.3 Основні принципи терапії пацієнтів, хворих на псоріаз
Для лікування ПХ застосовують чимало різних медичних препаратів, які діють на мультифакторні патогенетичні механізми формування дерматозу [5, 6, 9, 10]. Щороку збільшується кількість нових лікувальних засобів і різноманітних методів лікування псоріазу, проте теоретично обґрунтованих високоефективних способів його терапії немає, оскільки жодна із запропонованих гіпотез патогенезу сьогодні не є загальновизнаною [4, 9]. Сполуки протизапальних, гіпосенсибілізуючих і вітамінних препаратів, які використовують протягом багатьох років, далеко не завжди ефективні. Гормональні, цитостатичні препарати, ретиноїди, фотохіміотерапія та її модифікації вибірково пригнічують проліферацію кератиноцитів, нерідко супроводжуються побічними явищами, ускладненнями та не гарантують ремісії [7, 9]. Тому, на думку деяких вчених, лікування псоріазу здебільшого симптоматичне [6, 10, 13, 22].
Характерно, що сьогодні виявлена наявність у хворих, особливо при важких формах псоріазу, вираженої інтоксикації з біохімічними та метаболічними порушеннями, що змушує застосовувати ефективні методи терапії – претензійно нові з використанням комплексу дезінтоксикаційних та засобів для санації [18].
Дані літератури про імунологічні порушення [32, 39, 50] у хворих на псоріаз послужили основою для розробки комплексних методів лікування із застосуванням імунотропних препаратів (Т-активін, тимоген, тималін, пірогенних засобів, стафілококового анатоксину, солей літію, фенбутолу, імунофану) [59]. Деякі дослідники використовували такі імунокоригуючі засоби як спленін, екстракт плаценти, протеїн, елеутерокок, мебетізол [61, 62]. Знижена активність кілерів периферичної крові свідчить про інтерферонову недостатність. Це зумовлює необхідність застосування парантерального введення препарату інтерферону та його індуктора – ізопринозину [45, 74]. Велике значення для корекції імунологічних порушень мають методи дезінтоксикаційної терапії [59, 69].
Рекомендовано в терапії псоріазу застосовувати імунотропний препарат – глюнат [64]. Запропонований метод лікування хворих дав змогу скоротити строки госпіталізації на 5 днів, збільшити тривалість ремісії на 4-6 місяців, зменшити кількість рецидивів від 1 до 3 років у 3-7 разів.
Механізм дії тігазону при псоріазі повністю не виявлений. Серед інших впливів він регулює проліферацію кератиноцитів Сьогодні використовують ароматичні ретиноїди синтетичних похідних вітаміну А: роакутан, ацитретин [124, 150]. Усі вони впливають на процеси кератинізації, зменшуючи клітинну проліферацію епідермісу, особливо з ПУВА-терапією [56, 173, 177].
Переважаюче використання гідроксиантренів, до яких належать дітранол [9, 29, 45, 48, 49], цитролін, антролін та новий препарат псоратрон, пояснюється їх надійністю, відсутністю системного впливу на організм пацієнта та віддаленими побічними ефектами. Частіше застосовують псоратрон чи його похідні. Препарат наносять тонким шаром на 30-60 хв на псоріатичні елементи. Після триденного лікування у більшості хворих спостерігали зменшення лущення та інфільтрації з подальшою тенденцією до регресії [13].
Приведені літературні дані про позитивні результати застосування цитостатиків [9, 29, 45, 48, 49], зокрема, циклоспорину А в терапії псоріазу. Сполука представляє собою циклічний поліпептид з амінокислотних послідовностей. Препарат виготовляють під комерційною назвою «Сандимун» [56, 61, 80]. До механізму терапевтичної дії сандимуну при псоріазі належить модуляція кальцієвих сигналів, антагоністичний вплив на мембранні клітинні рецептори, інгібіторний вплив на продукцію лімфоцитів, пригнічення фосфоліпідного обміну та експресії головного комплексу гістіосумісності. Сандимун впливає на активовані Т-лімфоцити, блокує транскрипцію генів, які кодують синтез Х-інтерферону і інтерлейкіну-2, що перериває подальшу активацію ефекторних клітин, пригнічує експресію рецепторів до інтерлейкіну-2 та імунокомпетентних клітин [112, 124].
Ще в ХХ столітті зауважили залежність перебігу ПХ від стану метаболізму кальцію. Особливо виражена гіпокальцемія при пустульозній формі псоріазу [110, 137]. Впродовж двадцяти років було доведено здатність кальцитріолу інгібувати проліферацію та підвищувати диференціацію кератиноцитів [27, 45, 94]. Це дало змогу зробити висновок, що кератиноцити є первинними клітинами-мішенями його дії. Серед лікарських препаратів, які впливають на кальцієвий обмін, є вітамін Д. Введення його у вигляді фонофорезу підтримує відповідний рівень препарату в крові. Отримані за останні роки нові дані про вітамін Д змінюють уявлення про його роль у процесах життєдіяльності та практично стирають грань між вітамінами та гормонами [48, 49, 114, 120, 132, 156].
До комплексу лікувальних заходів при патогенетичній терапії хворих на псоріаз запроваджено препарат А-бактерин з ентеросорбентом ЕСКН, що дало змогу отримати сприятливі результати лікування, зокрема скорочення його терміну в середньому на 8 днів без побічних явищ з нормалізацією обмінних процесів функції печінки, поліпшення імунного стану, позитивні кількісні та якісні зміни автофлори [23, 45, 102].
Однією з гіпотез виникнення псоріазу є так звана інфекційно-алергічна теорія, згідно з якою значну роль у розвитку захворювання відіграє хронічна фокальна інфекція, котра часто не проявляється, але може провокувати перші ознаки дерматозу та ускладнювати його перебіг, негативно впливаючи на імунний статус [16, 45, 73, 84]. Через це при лікуванні таких хворих супутню інфекцію необхідно усунути шляхом оперативних або консервативних методів, засобами, які мають антибактеріальні, гіпосенсибілізуючі та стимулюючі властивості.
Сьогодні триває дискусія про роль у патогенезі різних хвороб суперантигенів, які є продуктами обміну мікробних агентів. Існує гіпотеза, що суперантигени можуть впливати на розвиток захворювань, опосередкованих Т‑клітинами. До дерматозів, що супроводжуються суперантигенкерованими процесами, можна віднести і псоріаз. Вважають, що патологічний процес при псоріазі можуть спричинити суперантигени, зокрема токсини мікробного походження [84]. Це підтверджується літературними даними про виявлення на шкірі у хворих на пустульозний псоріаз золотистого стафілококу та ефектом антибіотикотерапії [90].
Зменшено впровадження в терапію псоріазу таких відомих засобів, як переливання крові, кровопускання, аутогемотерапія; оскільки ці методи екстракорпорального очищення крові (гемосорбція, перитонеальний гемодіаліз, плазмо- та лейкофорез) застосовують лише в особливих, найважчих випадках псоріазу [29, 45, 49].
Відомо, що ці ефективні методи лікування позитивно впливають на клітинний та гуморальний імунітет, очищують плазму від надлишку циркулюючих імунних комплексів, аутоантитіл, токсинів [87]. Екстракорпоральне опромінення крові при псоріазі застосовують впродовж останніх 20 років. З цією метою при заборі крові із судинної системи хворих її опромінюють ультрафіолетовими променями, а при поверненні – лазерним гелій-неоновим світлом з довжиною променя 0,63 мкм [49]. Проведені клініко-лабораторні спостереження свідчать про короткочасність впливу цього методу на збереження ремісії.
Частіше привертає увагу доцільність застосування фототерапії, яка має низку привабливих властивостей [6, 135]. Наприклад, сприятливий вплив сонця на перебіг деяких дерматозів, зокрема, псоріазу в літній період пояснюється дією ультрафіолетового опромінення, яке становить частину спектра, що сягає поверхні Землі поряд з видимим світлом та інфрачервоними променями. Ультрафіолетове опромінення на шкалі електромагнітних хвиль займає проміжну позицію між рентгенівськими променями та видимим сегментом. Розрізняють: UVC (200-280 нм), які не сягають поверхні Землі, затримуючись в озоновому шарі атмосфери та мають бактерицидні властивості, UVВ (280-320 нм) і UVА (320-400нм). У терапії хворих на дерматози застосовують промені двох останніх діапазонів. Слід зазначити, що особливістю ультрафіолетового опромінення є його виражений дермотропізм, оскільки глибина проникнення сягає 0,1 см. Однак вона залежить від довжини хвилі. Якщо UVВ сягає лише базальної мембрани, то UVА проникає й у дерму [6, 131]. Клінічне дослідження вивчення ефективності впливу ультрафіолетового опромінення на перебіг псоріазу підтверджує, що застосування довгохвильового опромінення навіть у високих дозах, без використання фотосенсибілізаторів не призводить до очікуваної динаміки. Водночас UVВ спричинює регрес елементів висипки [8].
Сьогодні розрізняють чотири варіанти фототерапії пацієнтів з патологією шкіри. Селективну фототерапію, яка представляє собою поєднання UVВ (295-330 нм) і UVА; вузькохвильову UVВ з максимальною емісією на довжині хвилі 311 нм; фотохіміотерапію (РUVА) – поєднане застосування UVА з фотосенсибілізаторами та фототерапію із призначенням UVА вузького спектра (UVA-1) з довжиною хвилі 370 нм [6, 9, 17, 177].
Механізм цитостатичного ефекту РUVА-терапії при псоріазі є достатньо суперечливим. Існує думка [172], що він реалізується внаслідок ковалентного приєднання молекули псоралену до піримідинових сполук ДНК. Стверджують [140], що фотоприєднання молекули псоралену до піримідинових нуклеотидів слід розглядати не як лікувальний, а як побічний ефект, що зумовлює ризик розвитку процесів мутагенезу та канцерогенезу. Терапевтична дія пов’язана з інтенсифікацією вільнорадикальних реакцій окиснення. Підтвердженням означеної концепції є більш ефективна Re-РUVА-терапія (поєднання РUVА-терапії з прийомом вітаміну А чи його синтетичних похідних – ретиноїдів), ніж використання лише фотосенсибілізаторів [140]. Зазначено, що більш сприятливий ефект спостерігається у хворих на еритродермію, артропатію, пустульозний псоріаз, тобто тих формах дерматозу, котрі часто резистентні до монотерапії РUVА. Очевидно, що вітамін А завдяки наявності в структурі подвійних сполучних зв’язків володіє фотосенсибілізуючими властивостями та, відповідно, стимулює окиснювальні процеси в організмі [173].
Необхідним компонентом терапевтичної тактики ведення хворих на псоріаз є зовнішнє лікування. Вважають, що топічні засоби не повинні мати побічної дії, натомість мають сприяти позитивній клінічній динаміці, значно покращувати ЯЖ пацієнтів. Місцева кортикостероїдна терапія не завжди забезпечує задовільний ефект, окрім цього, може спричинити низку ускладнень [3, 35, 36, 41, 120]. Тому, як альтернативне лікування, використовують засоби, що містять кальцитріол (1,25 гідроксихолекальциферол) [110], який представляє собою біологічно активний метаболіт вітаміну Д3. Експериментальні дослідження та клінічні спостереження [82, 151] свідчать про коригуючий вплив кальцитріолу на основні патогенетичні ланки псоріазу: зменшення гіперпроліферації та модуляцію диференціювання кератиноцитів і функціонального стану імунної системи шкіри, антизапальну активність. Така різноплановість дії кальцитріолу свідчить про його значну ефективність у поєднанні з РUVА-терапією у вигляді більш швидкого регресу елементів висипки та подовження тривалості міжрецидивного періоду [56, 132].
Розроблена комплексна методика лікування хворих на псоріаз, яка передбачає вплив ультразвуку. Вона відрізняється від інших тим, що хворим проводять лазеротерапію з 1 % розчином новокаїну вибраних точок акупунктури та фонофорез уражених ділянок шкіри з масляним розчином холікальцефенолу. Голковколювання, впливаючи на шкіру та тканини, що знаходяться глибше, сприяє появі нейрогуморальних реакцій. Підставою для проведення мезотерапії 1 % розчином новокаїну чи дипроспану послужило те, що він, окрім пасивної анестезії, створює умови для якісно нового слабкого подразнення [73, 74].
Значення порушення функції печінки в патогенезі псоріазу підтверджено численними клінічними спостереженнями [16, 58, 59]. Зроблено спробу використати в комплексі лікування хворих на псоріаз гальванічний метод, спрямований на підвищення внутріпечінкового кровоплину та покращення метаболічних функції печінки.
Трапляються праці з результатами нормалізації деяких обмінних процесів за допомогою гепатопротекторів та ліпотропних засобів (есенціале, лінетол, ліпоєва кислота, поліфітохол) [75] у поєднанні з лікарськими препаратами, що покращують вуглеводневий обмін (лимонтар, гранули солодки, глюкамін) та імунотропними препаратами (глюнат, мебетизол, лікопіл, тіотриазолін, гепарин, тимогар) [71, 73].
Таким чином, можна зробити висновок, що сьогодні немає високоефективних методів терапії псоріазу, чим і пояснюється постійний пошук нових способів лікування та апробація лікувальних засобів. Особливу увагу при цьому слід звернути на застосування препаратів, які мають виражений таргетний вплив на основні ланки патогенезу дерматозу (серед яких неоангіогенез, підвищена експресія прозапальних біологічних речовин).
Основні тези цього розділу висвітлені в наступних працях:
- Возняк І.Я. Нові можливості в лікуванні псоріазу / І.Я. Возняк, Т.В. Святенко // Стандарти лікування хронічних дерматозів та урогенітальних інфекцій : Матер. Всеукр. наук.-практ. конф. з міжнар. участю, 7 травня 2009 р., м. Донецьк. – Журнал дерматовенерології, косметології ім. М.О. Торсуєва. – 2009. – № 1-2 (18). – С. 117–118.
- Возняк І.Я. Вивчення деяких аспектів етіопатогенезу псоріазу / І.Я. Возняк // Журнал дерматовенерології, косметології ім. М.О. Торсуєва. – 2012. – № 1-2 (28). – С. 39–42.
- Возняк І.Я. Сучасні можливості та підходи до вибору місцевого лікування псоріазу. / І.Я. Возняк, Т.В. Святенко // Клиническая иммунология. Аллергология. Инфектология. – 2009. – № 8. – С. 41–45.
- Возняк І.Я. Псоріаз: теорія і практика / І.Я. Возняк, Т.В. Святенко // Журнал сімейного лікаря та сімейної медсестри. – 2008. – № 6. – С. 13–19.
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
У роботі проаналізовано епідеміологічні показники щодо захворювання на псоріаз у Львівській області за останні десятиріччя, результати власного клінічного обстеження 70 хворих на псоріаз. Епідеміологічні показники щодо поширення та зростання захворюваності на псоріаз у Львівській області вивчали за оцінкою даних статистичного відділення Львівського обласного комунального шкірно-венерологічного диспансеру (ЛОКШВД). Протягом 2011-2015 років під нашим клініко-лабораторним та додатковим обстеженням перебувало 70 хворих на псоріаз звичайний, які знаходились на амбулаторному та стаціонарному лікуванні на базі IV стаціонарного відділення ЛОКШВД. Контрольна група складалась із 20 практично здорових осіб.
Обсяг діагностичних заходів для хворих проводили згідно з наказом МОЗ України № 312 від 8.05.09 року «Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання», який передбачав клінічне, лабораторне, гістологічне обстеження хворих на псоріаз та консультації суміжних спеціалістів. Комісією з біомедичної етики Львівського національного медичного університету імені Данила Галицького встановлено, що дисертаційні дослідження виконані з дотриманням основних положень та норм біоетики (протокол №7 від 20.09.10 р).
Клінічний діагноз псоріазу вульгарного був виставлений на основі аналізу скарг, анамнезів хвороби та життя, огляду пацієнтів, за допомогою психометричних шкал, оцінки динаміки захворювання та аналізу впливу на перебіг дерматозу призначеного лікування. Комплекс лабораторних досліджень при обстеженні хворих на псоріаз вульгарний включав в себе: загальний аналіз крові; загальний аналіз сечі; реакцію Вассермана; аналіз калу на наявність яєць гельмінтів; аналіз рівня глюкози в крові та деяких імунологічних, ІГХ показників.
Усі загальноклінічні методи дослідження проводили на базі лабораторії ЛОКШВД. Додаткові лабораторні дослідження виконували на базі морфологічного відділу лабораторії діагностичного центру медичної академії ТОВ «Аптеки медичної академії» м. Дніпропетровськ, медичної лабораторії “Ескулаб” м. Львів (Ліцензія МОЗУ Серія АВ №492211. Свідоцтво про атестацію №РЛ1524/10). За наявності у хворих на псоріаз вульгарний супутньої вісцеральної патології проводили консультації відповідних фахівців (терапевта, ревматолога, ендокринолога, отоларинголога) з подальшим виконанням їх призначень. Додаткові дослідження та консультації проводили за показаннями.
2.1 Методи вивчення клінічних порушень хворих на псоріаз
Характеризуючи шкірний синдром ПХ, ми оцінювали: поширення, характер та величину папульозних елементів; ступінь інфільтрації бляшок; важкість перебігу та стадію патологічного процесу; наявність діагностичних специфічних тестів; сезонність висипань; частоту рецидивів; чутливість шкірного патологічного процесу до впливу УФ-променів; характер ушкоджень нігтьових пластинок; за необхідності – дані гістологічної діагностики.
Оцінювали вихідний стан і ефективність лікування, беручи до уваги терміни припинення появи свіжих висипань, периферичний ріст, зменшення інтенсивності забарвлення елементів висипу, початок регресу, розсмоктування папул, зменшення інфільтрації в їх основі, лущення. Клінічні результати лікування оцінювали за такими критеріями: 100 % – відповідають чистій шкірі; 75 % – значне поліпшення клініко-лабораторного стану; 50 % – середнє поліпшення; менше 50 % – незначне поліпшення; без змін; загострення.
Оцінюючи клінічний стан хворого на псоріаз, звертали увагу на локалізацію патологічного шкірного процесу, зокрема найчастіше дерматоз уражає шкіру на ліктях, колінах, волосистій частині голови, попереково-крижову ділянку і голівку статевого члена. Найбільш типовим вважали ураження з чіткими межами, рожевого кольору папули або бляшки, що вкриті сріблястими лусками та зміни у вигляді потовщення і відшарування нігтьової пластинки (оніхолізис).
Визначали й клінічні підтипи цього захворювання, важкість і характер перебігу. Виокремлювали бляшкоподібний, або звичайний псоріаз, вульгарний псоріаз, простий псоріаз (psoriasis vulgaris) (МКБ Х: L40.0) на основі типово піднятих над поверхнею здорової шкіри ділянок запаленої, червоної, гарячої шкіри, покритої сірою або сріблясто-білою лускою – псоріатичними бляшками. Псоріатичні бляшки мали тенденцію збільшуватися в розмірах, зливатися з сусідніми бляшками, формуючи цілі пластини бляшок («парафінові озера») [73, 77, 79].
Клінічну ефективність терапії оцінювали, спостерігаючи за хворими протягом одного року. Критеріями вважали тривалість клінічної ремісії та виразність рецидивів. При тривалості ремісії до 6 місяців результати лікування оцінювали як відсутність ефекту, від 6 до 12 місяців – нестійка клінічна ремісія і понад 12 місяців – стійка клінічна ремісія.
2.2 Загальноклінічні методи дослідження
Під час роботи були використані такі загальноклінічні методи дослідження: загальний аналіз крові; загальний аналіз сечі; реакція Вассермана; аналіз калу щодо виявлення яєць гельмінтів; визначення рівня глюкози.
Усі загальноклінічні методи дослідження проводили на базі лабораторії ЛОКШВД.
2.2.1 Загальний аналіз крові
Концентрацію гемоглобіну визначали за допомогою візуального гемоглобінометра згідно з Наказом МОЗ № 960 від 15.10.1974 р. Принцип методу: при змішуванні крові із хлористоводневою кислотою гемоглобін перетворюється в солянокислий гематин. При цьому червонуватий колір рідини змінюється на бурий. Розчин розводять водою до стандартного забарвлення, що відповідає певній концентрації гемоглобіну.
Кількість еритроцитів визначали в підрахунковій камері згідно з Наказом МОЗ № 290 від 11.04.1972 р. Принцип методу: підрахунок еритроцитів під мікроскопом у визначеній кількості квадратів розрахункової сітки і перерахунок на 10 мкл крові, виходячи з об’єму квадратів і розведення крові.
Швидкість осідання еритроцитів визначали згідно з Наказом МОЗ № 290 від 11.04.1972 р. Принцип методу: суміш крові з цитратом, перебуваючи у спокої, розшаровується на еритроцити (нижній шар) та плазму (верхній шар).
Кількість лейкоцитів визначали в підрахунковій камері згідно з Наказом МОЗ № 290 від 11.04.1972 р. Принцип методу: підрахунок лейкоцитів під мікроскопом у визначеній кількості квадратів розрахункової сітки і перерахунок на 1 мкл крові (або 1 л за системою СІ), виходячи з об’єму квадратів і розведення крові.
Кількість тромбоцитів у мазках крові (за Фоніо) визначали згідно з Наказом МОЗ № 290 від 11.04.1972 р. Принцип методу: ґрунтується на підрахунку кількості тромбоцитів у забарвлених мазках крові на 100 еритроцитів у розрахунку на 1 мкм (або 1 л) крові, виходячи із вмісту в цьому об’ємі кількості еритроцитів.
Морфологічні дослідження формених елементів крові із диференціальним підрахунком лейкоцитарної формули проводили згідно з Наказом МОЗ № 1175 від 21.11.1979 р. Принцип методу: мікроскопія сухих фіксованих і забарвлених мазків крові із диференціальним розмежуванням форм лейкоцитів.
Морфологію еритроцитів досліджували згідно з Наказом МОЗ № 1175 від 21.11.1979 р. Принцип методу: дослідження забарвлених мазків крові за допомогою імерсійної системи мікроскопа.
Кольоровий показник крові визначали згідно з Наказом МОЗ № 1175 від 21.11.79 р. Принцип методу: Індекс виражає відносний вміст гемоглобіну в еритроцитах. Обчислюють кольоровий показник, визначивши відношення двох часток, одержаних від поділу кількості гемоглобіну на кількість еритроцитів у нормі і в досліджуваній крові.
2.2.2 Загальний аналіз сечі
Визначення прозорості сечі. У нормальній сечі всі складові частини перебувають у розчині, тому свіжа сеча цілком прозора, якщо сеча мутна в момент виділення, то це означає, що в ній міститься значна кількість клітинних утворень, солей, бактерій, жирів. Встановлювали причину помутніння сечі наступним чином:
– якщо при нагріванні 4–5 мл сечі в пробірці вона стає прозорою, то помутніння було зумовлене сечокислими солями (уратами);
– якщо ступінь помутніння після нагрівання не змінюється, то до сечі додають 10–15 крапель оцтової кислоти, виникає повне або часткове зникнення помутніння: це свідчить про те, що воно було зумовлене фосфатами.
Питому вагу сечі (густину) визначали згідно з Наказом МОЗ № 1175 від 21.11.1979 р. Принцип методу: порівняння густини сечі із густиною води за допомогою урометра з діапазоном шкали від 1,001 до 1,050.
Кількісне визначення білка методом Брандберга–Робертса–Стольнікова проводили згідно з Наказом МОЗ № 290 від 11.04.1972 р. Принцип методу ґрунтується на кільцевій пробі Геллера: на межі азотної кислоти і сечі за наявності білка відбувається його коагуляція і з’являється біле кільце.
рН сечі визначали згідно з Наказом МОЗ СРСР № 1175 від 21.11.79 р. за допомогою лакмусових папірців. Принцип методу: зміна кольору лакмусових папірців залежно від значення рН сечі.
2.2.3 Аналіз калу на яйця гельмінтів
Метод лабораторної діагностики яєць гельмінтів із застосуванням детергентів (метод Красильнікова) (Наказ МОЗ № 960 від 17.05. 1977 р.)
Принцип методу: поверхнево-активні речовини звільняють яйця гельмінтів від калових мас внаслідок великої питомої ваги розчину.
2.2.4 Визначення тривалості кровотечі за Дуке визначали згідно з Наказом МОЗ № 290 від 11.04.1972 р.
Принцип методу: дослідження проводили при проколі кінчика пальця чи мочки вуха, глибина проколу не повинна була меншою за 3 мм. За умови дотримання цієї рекомендації кров виділятиметься самопливом без натиску. Після проколу вмикають секундомір. До першої краплі, що з’явилася, одразу прикладають смужку фільтрувального паперу, що вбирає кров. Не допустимо торкатися папером до шкіри, бо це може спричинити передчасну зупинки кровотечі. В подальшому папером забирають кров, що з’являється кожні 30 с. Дослідження проводять доти, поки на фільтрувальному папері залишаються сліди крові. Секундомір вимикають. У нормі тривалість кровотечі становить 2-4 хв.
2.3 Імунологічні методи дослідження
Концентрація фактора некрозу пухлини – альфа в периферичній крові визначалася методом твердофазного імуноферментного аналізу. Для цієї реакції використовували набір реагентів для імуноферментного визначення концентрації фактора некрозу пухлин альфа “Вектор-Бест” REF-А-8756, LOT-36 (міжнародні сертифікати ISO 9001 та ISO 13485 як досліджуваний матеріал) та сироватку крові в кількості 100 мкл на кожне дослідження. Використовували свіжі зразки та такі, що зберігалися до 3 місяців при температурі до 16оС (згідно з інструкцією використання реагентів для відтворення цих реакцій). Біологічний матеріал значно гемолізований, ліпемічний, мутний та такий, що містить осад чи завис еритроцитів, перед реакціями центрифугували 10-15хв при 3000 об/хв. Перед аналізом усі зразки прогрівали при температурі 18-25 оС протягом 30 хв. Розчин для розведення сироваток вносили в кожну лунку набору. В лунки А-1, В-1, С-1, D-1, E-1, F-1, G-1 вносили по 100 мкл калібровочного та контрольного зразків, в інші – по 100 мкл досліджуваного матеріалу. Стріпи закривали, поміщали в шейкер та інкубували 120 хв за температури 37°С при 700 об/хв. Лунки планшету промивали 5 разів розчином №1 тетраметилбензидину (350 мкл на лунку). Після останнього промивання планшет перевертали та поміщали на паперові рушники. Далі у кожну лунку додавали 100 мкл робочого розчину коньюгату №1, планшет інкубували 60 хв за температури 37°С при 700 об/хв, після чого лунки промивали 5 разів розчином 1 (350 мкл на лунку). Після останнього промивання планшет перевертали на паперовий рушник. В кожну із лунок додавали робочий розчин кон’югату №2 (100 мкл) та інкубували 30 хв за температури 37°С при 700 об/хв, знову проводили промивання тричі 350 мкл розчином 1 (розчин ФСБ-Т). Згодом у кожну лунку додавали 100 мкл робочого розчину тетраметилбензидину, після чого планшет інкубували в темряві 25 хв за температури 19-25°С; для призупинення реакції вносили 100 мкл стоп-реагенту. Реєстрували результати за допомогою СФ-46.
2.4 Морфологічний метод дослідження
Первинний біопсійний матеріал, отриманий шляхом punch-біопсії, занурювали в 10 % розчин нейтрального забуференного формаліну на 24 год з метою фіксації тканин. Після фіксації і проводки за стандартною методикою, матеріал заливали парафіном. Парафінові зрізи товщиною 4-5 мкм, що були отримані на мікротомі Microm HM-340, були депарафіновані і забарвлені гематоксиліном-еозином (Г-Е). Використовували світловий мікроскоп Leіca DMLS з використанням об’єктивів ×10, ×20, ×40, ×100 для оцінки ступеня важкості перебігу псоріазу, наявності достатньої кількості матеріалу і його якості для проведення подальшого ІГХ дослідження.
2.5 Імуногістохімічні методи дослідження
Принцип методу: для ІГХ дослідження було використано формалін-фіксовані та парафін-залиті примірники, відібрані шляхом ретельного морфологічного дослідження в стандартному забарвленні Г-Е. Парафінові зрізи відібраних блоків наносили на спеціальні адгезивні предметні скельця SuperFrost Plus. Після депарафінізації та регідратації зрізів проводили температурне демаскування антигенів в мікрохвильовій печі (зрізи були розміщені в цитратному буфері з рН 6.0 і підігрівалися при температурі +121°С 8 хв) та пригнічували активність ендогенної пероксидази 3 % розчином перекису водню протягом 20 хв. Далі інкубували зрізи з первинними антитілами у вологих камерах при температурі 23–250С протягом 30 хв. В якості первинних використовували моноклональні антитіла до CD3, CD68, Ki-67, VEGF, CD34, р63, S100 і поліклональне антитіло до ММП-9. Титр антитіл добирали окремо для кожного маркера з використанням у якості розчинника розчину antibody dіluent (DakoCytomation). Дані розведення первинних антитіл зведено в таблиці 2.1.
Далі проводили інкубацію зрізів з надчутливою системою візуалізації UltraVision Quanto (LabVision) у вологих камерах близько 30 хв при кімнатній температурі (примітка: після кожного етапу зрізи промивали у ТРИС буфері з рН 7,4 протягом 10 хв). Для ідентифікації реакції наносили розчин хромогену 3-діамінобензидин тетрахлориду (Quanto, LabVision) під контролем мікроскопу від 20 с до 3 хв, з проявом у вигляді коричневого забарвлення специфічних структур. Для ідентифікації тканинних структур зрізи додатково забарвлювали гематоксиліном Майєра протягом 1-3 хв. Наступну дегідратацію і занурення у бальзам здійснювали згідно з поширеними методиками. Для кожного маркера було зроблено контрольні дослідження з метою виключення помилково позитивного чи помилково негативного результатів.
Таблиця 2.1 – Панель первинних антитіл
| Антитіло | Клон | Розведення | Виробник |
| VEGF
CD34 Ki-67 р63 СD3 S100 СD68 MMР-9 |
клон VG1
клон QBEnd 10 клон SP6 клон 4А4 клон SP7 клон 4C4.9 клон PG-M1 поліклон |
1:100
1:100 1:200 1:50 1:500 1:700 1:100 1:100 |
DakoCytomation
DakoCytomation LabVision DakoCytomation LabVision LabVision LabVision LabVision |
2.5.1 Розрахунок CD3+ Т-лімфоцитів, CD68+ макрофагів та S100+ дендритних клітин
Розрахунок CD3+ Т-лімфоцитів (мембранне забарвлення), CD68+ макрофагів (цитоплазматичне забарвлення), та S100+ дендритних клітин (змішана реакція) виконували в 10 полях зору (×400) і розраховували як середнє арифметичне абсолютних значень, при цьому зазначали загальну кількість імуноцитів, їхню локалізацію (окремо зазначали відсоток інтраепідермального розташування з розрахунком на 100 кератиноцитів) за методикою багатьох авторів [8, 25, 72, 147]. До того ж, за рекомендаціями Ozdamar S.O. із співавторами (1996), для оцінки переміщення імунокомпетентних клітин дерму ділили на три зони: субепідермальну ділянку, серединну та глибокі шари дерми [158].
2.5.2 Реакції з маркерами матриксної металопротеїнази-9 та фактора росту ендотелію судин
Для аналізу ІГХ реакцій з маркерами MMР-9 та VEGF інтенсивність цитоплазматичного забарвлення оцінювали, порівнюючи з нормальною шкірою контрольної групи за п’ятьма категоріями: 0 – негативна реакція (жодної забарвленої клітини), 1 – слабка (позитивно забарвлені окремі розкидані клітини, чи розповсюджена, але слабка реакція), 2 – помірна (дорівнює нормальному епідермісу), 3 – сильна (більша кількість інтенсивно забарвлених клітин), 4 – надмірна (інтенсивно забарвлені практично всі клітини) за рекомендаціями Aronson Peter J. (2008) [111].
2.5.3 Визначення щільності судин
Для з’ясування щільності судин у зразках біоптатів шкіри підраховували кількість судин, за мембранною/субмембранною реакцією ендотелію з маркером CD34 у 10 полях зору при збільшенні ×400, згідно з рекомендаціями Ma W.Y. із співавторами (2012) [148]. Також всі отримані значення щільності мікросудин (ЩМ) ділили на три категорії за наступною шкалою, що була використана Maha Mohamed Amin із співавт. (2012): слабка васкуляризація (4-10 капілярів), помірна (11-20 капілярів) і значна (21-28 капілярів) [108].
2.5.4 Розрахунок індексу проліферації та базальноклітинної гіперплазії
Індекс проліферації (ІП) та рівень базальноклітинної гіперплазії обчислювали як відсоток клітин з інтрануклеарною реакцією на 1000 кератиноцитів з маркерами Ki-67 та р63 при збільшенні ×400, згідно з рекомендаціям Ma W.Y. із співавторами (2012) [148].
2.6 Визначення площі та важкості ураження
Важкість перебігу псоріазу за площею псоріатичних уражень та інтенсивність основних симптомів хвороби визначали методом бальної оцінки за допомогою індексу PASI [1].
Принцип методу: для оцінки важкості перебігу псоріазу виділяли такі ознаки: інтенсивність забарвлення ураженої шкіри – еритема (Е), інфільтрація (І) та лущення (Л), які оцінювали у балах від 0 (відсутність ознаки) до 4 (яскраво виражена ознака). Площу поверхні шкіри різних ділянок тіла поділяли у відсотковому значенні таким чином: голова – 10 %, тулуб – 30 %, верхні кінцівки – 20 %, нижні кінцівки – 40 %. Поширеність висипань виражали у числових значеннях: 0 (відсутність висипань), 1 бал (уражено менше 10 % поверхні), 2 бали (менше 30 %), 3 бали (менше 50 %), 4 бали (менше 70 %) та 6 балів (уражено 90-100 % поверхні даної ділянки). Значення PASI визначали знаходженням суми добутків ступенів важкості основних симптомів, відсоткового вираження чотирьох ділянок тіла та числових значень поширеності патологічних висипань уражених ділянок за формулою:
PASI = 0,1(Е + І + Л)АГ + 0,3(Е + І + Л)АТ + 0,2(Е + І + Л)АА + 0,4(Е + І +Л)АН. (2.1)
Aмплітуда коливання показників індексу – від 0 до 72 балів, більші значення показників індексу відповідали більш важкому ураженню.
2.7 Психометричне анкетування за опитувальником з якості життя пацієнтів з дерматологічними проблемами та „Псоріатичний індекс порушень”
Вплив псоріазу на ЯЖ обстежуваних пацієнтів та її зміни під час лікування оцінювали за DLQI та індексом недієздатності при псоріазі PDI [14, 27, 33].
2.7.1 Обчислення дерматологічного індексу якості життя
Опитувальник DLQI призначений для пацієнтів старших 16 років. Психометрична шкала складається з 10 питань, які відображають загальні аспекти зміни ЯЖ. За цією шкалою ЯЖ оцінювали за 6 основними параметрами: симптоми/самопочуття, повсякденна активність, приватне життя, терапія. Кожне питання пацієнт оцінював відповідною кількістю балів: вплив аспекту виражений – 3 бали, помірний – 2 бали, незначний – 1 бал, впливу немає – 0 балів. Cума балів від 0 до 1 балу свідчила про відсутність впливу псоріазу на якість життя респондента, 2-5 балів – незначний вплив, 6-10 помірний, 11-20 – значний, 21-30 – свідчать про істотне погіршення ЯЖ. Між значенням індексу DLQI та рівнем життя існує обернена залежність.
2.7.2 Обчислення псоріатичного індексу порушень
Опитувальник PDI призначений для пацієнтів старших 16 років. Використана в цій роботі версія складалася із 15 питань, які охоплювали повсякденну активність пацієнта, роботу/школу, особисті стосунки, відпочинок, лікування. Індекс обчислюювали методом Tick-box, який полягає у підрахунку виставлених за кожне запитання балів. Aмплітуда коливання показників індексу – від 0 до 45 балів, більше значення показників індексу відповідало нижчому рівню ЯЖ опитуваного.
2.8 Статистичні методи дослідження
Статистичну обробку матеріалів досліджень проводили з використанням пакету програм SPSS 17.0.
Первинну обробку отриманих даних проводили методами описової статистики з представленням результатів для кількісних ознак у вигляді: кількості спостережень (n), середньої арифметичної (M), стандартної похибки середньої величини (±m); для якісних ознак – у вигляді відносних показників (абсолютні значення і відсотки).
Статистичні характеристики у різних групах і в динаміці спостереження порівнювали, використовуючи параметричні і непараметричні критерії: оцінка вірогідності відмінностей середніх для незв’язаних вибірок (різні групи) – за критеріями Стьюдента (t) і Мана-Уітні (U), для зв’язаних (у динаміці) – за критеріями Стьюдента (t) і Вілкоксона (W); вірогідність відмінностей відносних показників – за критерієм Хі-квадрат Пірсона (c2) та точним двостороннім критерієм Фішера.
Перевірка відповідності розподілу кількісних показників, які вивчали, нормальному закону за критерієм Колмогорова-Смирнова свідчила, що в більшості випадків (80 %) гіпотеза про нормальний закон розподілу не відхилялася (p>0,05). З урахуванням цього, а також невеликої кількості спостережень при виконанні ІГХ аналізу при порівняннях використовували параметричні і непараметричні методи оцінки вірогідності відмінностей, а рівень значущості відмінностей (р) зазначали з урахуванням результатів, отриманих за всіма методами.
Для оцінки взаємозв’язку між ознаками виконували кореляційний аналіз з розрахунком коефіцієнтів рангової кореляції Спірмена (r).
Критичне значення рівня значущості (p) приймали ≤ 5 %.
РОЗДІЛ 3
КЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ НА ПСОРІАЗ
В Україні статистичні дані щодо захворюваності на псоріаз суттєво відрізняються від середніх показників в Європі і світі, оскільки поширеність хвороби протягом останніх десятиліть неухильно зросла – від 114,8 на 100 тис. населення в 1994 р. до 222,5 на 100 тис. в 2014 р. [13].
Кількість зареєстрованих випадків псоріазу у Львівській області зросла з 3127 у 1995 р. до 5963 у 2014 р., тобто в 1,9 разу, а динаміка вперше виявленого дерматозу збільшилася в 2,24 разу з різним показником виявлення захворювання в деякі роки. Зокрема, захворюваність на псоріаз зросла у міських мешканців чоловічої статі, працездатного віку, що призводить до частішої їх госпіталізації. У стаціонарних умовах частіше лікуються хворі з поширеною вульгарною формою псоріазу в прогресуючій стадії захворювання та артропатичним псоріазом зі сформованою кістковою патологією у більшості периферичних суглобів. На Львівщині спостерігається тенденція до омолодження псоріазу [76].
Під час роботи нами було обстежено 70 хворих на псоріаз, які перебували на стаціонарному лікуванні у ЛОКШВД за період з 2010 по 2014 роки та 20 практично здорових осіб без відповідної патології. Клінічне обстеження усіх пацієнтів проводили згідно з протоколом (наказ МОЗ України №312 від 08.05.2009 року) який передбачав аналіз скарг, анамнезів захворювання, життя, загального і локального статусів.
До групи спостереження залучали пацієнтів з поширеним псоріазом (L40.0) в прогресуючій стадії, легкого та середнього ступеня важкості перебігу, чоловічої та жіночої статі віком 24-58 років, зі стажем захворювання понад один рік, у котрих не діагностовано жодної іншої шкірної патології та тих, які дали інформовану згоду (у відповідності до принципів Гельсінської декларації прав людини, Конвенції Ради Європи про права людини і біомедицину та відповідних законів України) на участь у дослідженні.
Натомість до групи спостереження не входили:
– хворі з краплеподібним, артропатичним, пустульозним псоріазом, псоріатичною еритродермією;
– особи з важкою соматичною патологією (печінкова та ниркова недостатність, неконтрольована артеріальна гіпертензія, гіпертензивна чи діабетична нефропатії, септичний ендокардит);
– хворі із ерозивно-виразковим ураженнями шлунково-кишкового тракту у фазі загострення, особливо з тенденцією до кровотечі;
– пацієнти з кровотечами невизначеного ґенезу, вираженими спадковими та набутими порушеннями гемостазу, захворюваннями кровотворної системи, ті, що перенесли недавні травми чи операції на органах центральної нервової системи, зору та слуху;
– пацієнтки, котрі використовують внутрішньоматкові механічні контрацептиви, а також вагітні та жінки, які годують грудьми;
– пацієнти з залежністю від психоактивних речовин (наркотики, алкоголь).
Залежно від рекомендованого нами методу лікування усі хворі були поділені на основну групу (ОГ – 25 пацієнтів) та дві групи порівняння (П1 – 25 пацієнтів та П2 – 20 пацієнтів). Розподіл хворих залежно від статі подано в табл. 3.1.
Як свідчать дані табл. 3.1, серед хворих на псоріаз незначно переважають особи чоловічої статі – 41 (59 %) проти 29 (41 %) осіб жіночої статі. Це відповідає даним інших дослідників про те, що псоріазом хворіють як чоловіки, так і жінки, однак у дорослому віці захворюваність на цей дерматоз дещо вища у пацієнтів чоловічої статі [60].
Усі пацієнти були поділені на вікові групи (згідно з класифікацією ВООЗ, 1963): молодий вік – від 24 до 29 років, зрілий вік – від 30 до 44 років, середній вік – від 45 до 59 років, похилий – 60 років і старші. Детальний поділ хворих за віком поданий у табл. 3.2.
Таблиця 3.1 – Поділ хворих залежно від статі
| Пацієнти
(група) |
Всього | Стать | |||
| чоловіча | жіноча | ||||
| абс. ч. | % | абс. ч. | % | ||
| ОГ | 25 | 17 | 68* | 8 | 32 |
| П1 | 25 | 15 | 60 | 10 | 40 |
| П2 | 20 | 9 | 45 | 11 | 55 |
| Загальна кількість | 70 | 41 | 59* | 29 | 41 |
| Контрольна група | 20 | 12 | 60 | 8 | 40 |
Примітка: усі виділені групи статистично порівнювальні за статтю (p>0,05 при всіх порівняннях); * – p<0,05 порівняно з жінками.
Таблиця 3.2 – Поділ пацієнтів залежно від віку
| Пацієнти
(група) |
Вік, роки | Всього | |||||
| до 30 | 30 – 44 | 45 – 59 | |||||
| абс.ч. | % | абс.ч. | % | абс.ч. | % | ||
| ОГ | 4 | 16 | 15 | 60 | 6 | 24 | 25 |
| П1 | 2 | 8 | 14 | 56 | 9 | 36 | 25 |
| П2 | 1 | 5 | 12 | 60 | 7 | 35 | 20 |
| Загальна кількість | 7 | 10 | 41 | 59 | 22 | 31 | 70 |
| Контрольна | 5 | 25 | 12 | 60 | 3 | 15 | 20 |
Примітка: усі виділені групи статистично порівнювальні за віком (p>0,05 при всіх порівняннях)
Такий поділ свідчив про більшу поширеність захворювання серед осіб зрілого (59 %) та середнього (31 %) віку, на який припадає період максимального розквіту трудової та соціальної активності людини.
У структурі досліджуваних пацієнтів переважали мешканці міста 49 (70 %) порівняно із хворими, що проживають у сільській місцевості – 21 (30 %) (p<0,001). Можливо, в основі такого поділу хворих – більш уважне ставлення до стану свого здоров’я, а саме шкіри, та вищий рівень поінформованості серед містян.
Серед обстежених пацієнтів тих, що навчаються, було 8 (11 %) осіб, працюючих – 26 (37 %) та осіб, що не працюють – 36 (52 %).
Сімейний характер ПХ виявлено у 11 (15 %) обстежених. Серед факторів, які передували первинній появі шкірних проявів захворювання, виявлено: стресові ситуації у 24 (34 %) випадках, зловживання алкоголем – у 5 (7 %), мікробно-вірусний чинник – у 7 (10 %) осіб, травми – у 6 (9 %), шкідливість виробництва – у 1 (1 %). Причини початку захворювання не зазначило 27 (39 %) осіб.
Зимовий тип дерматозу зафіксовано у 31 (44 %) пацієнта, весняно-літній у – 4 (6 %) та недиференційований – у 35 (50 %).
Спираючись на дані анамнезу захворювання, ми вивчили характер перебігу псоріазу, що визначався за наступною класифікацією: помірно рецидивуючий перебіг – загострення дерматозу через рік та більше; часто рецидивуючий перебіг – кількість рецидивів не менше двох за рік; безперервно рецидивуючий перебіг – хронічний активний перебіг з мало вираженим ефектом проведеної терапії. Серед обстежених нами пацієнтів помірно рецидивуючий перебіг дерматозу виявлено у 24 (34 %) осіб, часто рецидивуючий перебіг – 40 (57 %) та безперервно рецидивуючий перебіг – у 6 (9 %) пацієнтів.
Оцінка ступеня важкості перебігу псоріазу – компонент розгорнутого діагнозу, що дає змогу визначити об’єм та інтенсивність терапії, а також згодом оцінити ефективність проведеного лікування. Сьогодні не існує єдиного поділу псоріазу за ступенем важкості перебігу цього дерматозу, але загально прийнятим вважають поділ за індексом PASI [65, 100], визначення якого враховує основні клінічні характеристики захворювання: еритему, інфільтраціяю та лущення, а також площу уражень на деяких ділянках шкіри пацієнта [103, 104, 105]. Поділ хворих залежно від ступеня важкості перебігу псоріазу вульгарного представлено у табл. 3.3.
Таблиця 3.3 – Поділ хворих залежно від ступеня важкості перебігу псоріазу
| Пацієнти
(група) |
Всього | Ступінь важкості дерматозу (PASI) | |||
| легкий | середній | ||||
| абс. ч. | % | абс. ч. | % | ||
| ОГ | 25 | 12 | 48 | 13 | 52 |
| П1 | 25 | 11 | 44 | 14 | 56 |
| П2 | 20 | 8 | 40 | 12 | 60 |
| Загальна кількість | 70 | 31 | 44 | 39 | 56 |
Примітка. Усі виділені групи статистично порівнювальні (p>0,05 при усіх порівняннях)
У 58 (83 %) пацієнтів з різними формами псоріазу ми спостерігали ураження нігтьових пластинок на руках чи ногах різного характеру та ступеня. Клінічно серед ранніх форм псоріатичного ураження нігтів: цяткова оніходистрофія «симптом наперстка» – у 35 (61 %) осіб, плямиста форма Кейнінга-Гасенфлюга або синдром «масляних плям» – у 13 (23 %) хворих. Пізні форми псоріатичної оніходистрофії проявлялися в 10 (16 %) пацієнтів у вигляді: гіпертрофічної (оніхогрифоз у вигляді «симптому піщаних хвиль» або «кігтя птаха»), атрофічної оніходистрофії або оніхолізісу. Нерідко діагностували й поперечні, поздовжні борозни нігтьових пластинок.
* * *
Таким чином, у дослідженні брали участь 70 хворих на псоріаз вульгарний з різним ступенем важкості перебігу, які документально підтвердили свою згоду.
Серед обстежених хворих переважали чоловіки (59 %), особи найбільш активного працездатного віку (59 %), міські мешканці (70 %). У 50 % випадків захворювання не залежало від сезону (невизначений тип), в 44 % – загострення відбувалось взимку. Перебіг дерматозу здебільшого мав часто рецидивуючий характер (57 %).
Клінічні прояви та перебіг псоріазу в досліджуваній групі були яскраво вираженими та надзвичайно різноманітними, і це справді має значення при виявленні особливостей певної клінічної форми щодо призначення лікування.
Основні тези даного розділу висвітлені в наступних роботах:
- Возняк І.Я. Захворюваність на різні форми псоріазу у жителів Львівської області / І.Я. Возняк, Н.Є. Городиловський // Матеріали науково-практичної конференції «Наукові розробки молодих вчених дерматовенерологів післядипломної освіти», 20 листопада 2008 р., м. Київ. – К., 2008. – С. 23–24.
- Voznyak I. Epidemiologic peculiarities of psoriasis in Ukraine / I.Voznyak, T. Svyatenko // Abstracts of the 18th Congress of the European Academy of Dermatology and Venereology, Berlin, 7-11 October 2009. – Berlin, 2009. – Р. 1247.
- Voznyak I. Psoriasis: the local dermatosis or systemic disease of human organism? / I.Voznyak, T. Svyatenko // Abstracts of the 2th World Congress of Psoriasis, Stokholm (Sweden), June 24 – 28 2009. – Stokholm, 2009. – Р. 44.
- Особливості перебігу псоріатичної хвороби на Львівщині / Возняк І.Я., Сизон О.О., Туркевич О.Ю. // Матеріали Всеукраїнської науково-практичної конференції «Дерматологія та дерматокосметологія» // №3(49). – 2010. – С.70-71.
- Епідеміологія та якість життя пацієнтів з псоріатичною хворобою / Возняк І.Я., Сизон О.О., Туркевич О.Ю. // Матеріали науково-практичної конференції //Дерматологія та венерологія. – 2011. – №2(52). – С. 152.
- Voznyak I. The prevalence and epidemiological characteristics of psoriasis morbidity in Lviv, Ukraine / I. Voznyak, T. Svyatenko // 4th congress of the psoriasis international network. – 4-6 July 2013, Paris, France. – JEADV. – 2013. – Vol. 27, Suppl. 4. – P. 43.
- Особливості епідеміології псоріатичної хвороби у мешканців Львівської області / Возняк І.Я., Сизон О.О., Хомяк В.А. // Матеріали науково-практичної конференції з міжнародною участю “Прикарпатські дерматовенерологічні дні”, 15-16.05.2014 р., м. Яремча.
РОЗДІЛ 4
Аналіз ОСОБЛИВОСТЕЙ ІМУНОМОРФОЛОГІЧНИХ ЗМІН УРАЖЕНОЇ ШКІРИ У ХВОРИХ НА ПСОРІАЗ
4.1 Імуноморфологічні особливості псоріатичних шкірних ушкоджень залежно від стадії перебігу дерматозу
Псоріаз звичайний як хронічне циклічне захворювання характеризується потужною динамікою місцевих змін, що морфологічно поділяються на три стадії: ранні місцеві зміни, стадія папули (бляшки) та стадія загоювання (старіння папули), які можуть варіювати тільки в межах важкості перебігу місцевих ушкоджень. Ці зміни не зовсім співпадають з класичними клінічними стадіями: прогресуючою, стаціонарною та регресуючою. Тому для з’ясування взаємозв’язку послідовних змін неоангіогенезу, запальної інфільтрації та порушення дозрівання кератиноцитів в цьому розділі надані відповідні результати морфологічних та ІГХ досліджень.
Ранні зміни на світлооптичному рівні зафіксувати впродовж перших 24 год у вигляді розширення та звивистості судин сосочків дерми і помірних периваскулярних лімфоцитарних інфільтратів з невеликим набряком навколишньої строми (рис. 4.1А). У кількох випадках у верхніх шарах епідермісу ми зауважили легкий екзоцитоз Т-лімфоцитів.
Маркер CD34, що дає специфічну мембранну/субмембранну реакцію з ендотелієм судин, допомагає більш детально оцінити якісні та кількісні зміни структури судин на ранніх стадіях розвитку псоріазу (рис. 4.1Б, В), коли епідерміс ще має звичайну будову при забарвленні Г-Е. Використовуючи шкалу інтенсивності васкуляризації шкіри за Amin M.M. [12], ми з’ясували, що псоріатично ушкодженні ділянки дерми в середньому мали (16,87±1,07) мікросудини при збільшенні (×400), що відповідає рівню помірної васкуляризації (11-20 капілярів). Нормальна шкіра контрольної групи мала середній показник 4,32±0,67 при (×400) на рівні слабкої васкуляризації (4-10 капілярів), що статистично вірогідно відрізняється від загальної групи хворих на псоріаз (р<0,001).
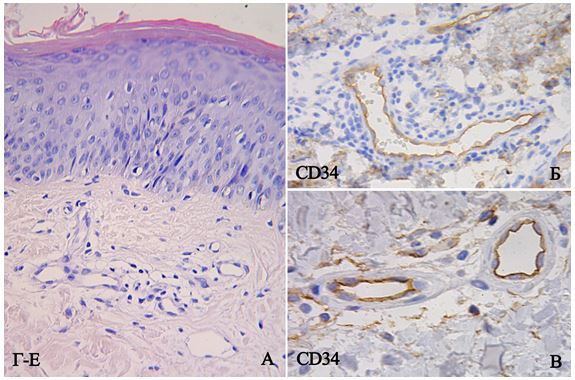
Рисунок 4.1.
Примітки:
А – Ранні псоріатичні зміни судин дерми, забарвлення Г-Е (×200).
Б – Реакція з CD34 в ендотелії звивистих і дилятованих судин, ІГХ метод (×1000).
В – Посткапілярні венули, що вислані високим призматичним або циліндричним ендотелієм, ІГХ метод (×1000)
Слід зауважити, що при ІГХ реакції з маркером CD34 на себе звертає увагу неоангіогенез із формуванням високоендотелізованих венул, які є особливими посткапілярними венулами, висланими високим призматичним або циліндричним ендотелієм (рис. 4.1В). Останній, як відомо, відіграє ключову роль у зв’язуванні активних Т-лімфоцитів через молекули адгезії і транспортуванні їх в прилеглу дерму та епідерміс при псоріазі.
Ангіогенез завжди супроводжується підвищенням експресії VEGF, втягнутих в патологічний процес тканин. ІГХ дослідження біоптатів шкіри з маркером VEGF навіть на початку розвитку захворювання показало у пацієнтів значно підвищену експресію фактора росту ендотелію судин в кератиноцитах епідермісу (окрім зроговілого шару) (рис. 4.2 А, Б) та в ендотелії судин і навколосудинних інфільтратах дерми псоріатично ушкоджених ділянок (рис. 4.2 В) порівняно з нормальною шкірою пацієнтів контрольної групи.
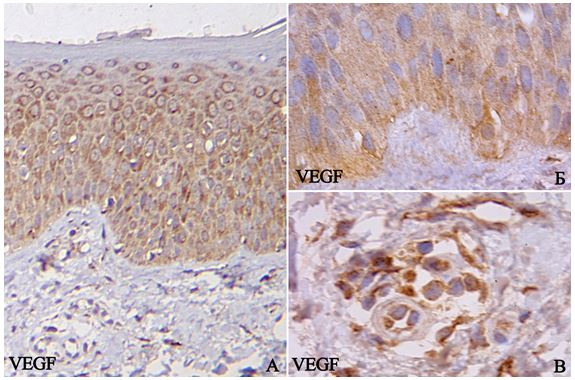
Рисунок 4.2.
Примітки:
А – Ранні псоріатичні зміни епідермісу, що супроводжуються значним підвищенням експресії фактора росту ендотелію судин кератиноцитами (окрім рогового шару), ІГХ метод (×200).
Б – Специфічна цитоплазматична реакція з маркером VEGF високої інтенсивності базального шару епідермісу, ІГХ метод (×1000).
В – Специфічна цитоплазматична реакція з маркером VEGF високої інтенсивності в ендотелії судин та клітинах периваскулярного інфільтрату, ІГХ метод (×1000)
Інтенсивність забарвлення псоріатично змінених ділянок шкіри при псоріазі звичайному відповідала здебільшого третій категорії – сильна реакція (більша кількість інтенсивно забарвлених клітин) – у 63 % випадків, тоді як нормальний епідерміс контрольної групи з маркером VEGF завжди давав помірну (20 %) або слабку реакцію (80 %) – другої та першої категорій забарвлення (р<0,001).
Подальший прогрес захворювання характеризувався формуванням місцевого збільшення товщини (стадія папули) внаслідок паракератозу з екзоцитозом нейтрофілів між поверхневими епідермальними шарами, що поступово досягали найвищих точок ділянок паракератозу. У цей термін спостерігали збереження рогового шару з ділянками ортокератозу (нормальне зроговіння) і паракератозу (затримка ядер кератиноцитів) та втрату нижче розташованого зернистого шару (рис. 4.3 Б). В базальному шарі епідермісу спостерігали підвищену мітотичну активність, що асоціювалася з псоріатичним акантозом характерного вигляду. Видовження акантотичних тяжів нагадувало паралельно розташовані «пробірки в стояку» (рис. 4.3 А). Потовщення самого епідермісу завдяки елонгації тяжів сягало 400-500 мкм (при нормі 90 мкм) і трансформувалося в так звану «псоріазоподібну» гіперплазію.
Видовження акантотичних тяжів за рахунок проліферації кератиноцитів базального рівня з призупиненням їхнього подальшого диференціювання призводить до базально-клітинної гіперплазії, що можна побачити завдяки ІГХ дослідженню з маркером базально-клітинної диференціації р63 (рис. 4.3 В). Індекс експресії маркера р63 загальної групи, розрахований на 100 кератиноцитів, в середньому становив (72,86±1,41) %, що у 6 разів перевищує аналогічний показник контрольної групи – (12,21±1,04) % (р<0,001).
Для більш ефективної ідентифікації мітотично-активних клітин базального шару ми також використали маркер клітинної проліферації Кі-67. Він дає специфічну інтрануклеарну реакцію в усіх, крім G0, фазах клітинного циклу. Його експресія підвищується з прогресією клітинного циклу від G1 до M-фази, що відображається в інтенсивності забарвлення (рис. 4.4).
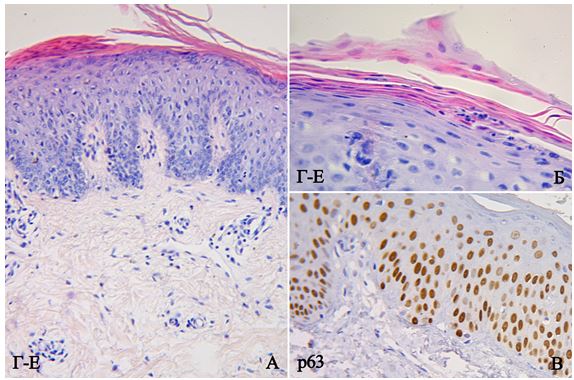
Рисунок 4.3.
Примітки:
А – Псоріатичний акантоз на стадії папули, забарвлення Г-Е (×200).
Б – Паракератоз з екзоцитозом нейтрофілів, втрата зернистого шару, забарвлення Г-Е (×1000).
В – Базально-клітинна гіперплазія, інтрануклеарна реакція з маркером р63, ІГХ метод (×200)
ІП у хворих на псоріаз становив (35,95±2,07) %, що суттєво перевищувало показник ІП здорової шкіри у пацієнтів контрольної групи (6,27±0,45) % (р<0,001).
У стадії папули судини дермальних сосочків залишаються розширеними, звивистими, а їхній просвіт заповнений нейтрофілами. До того ж деяка кількість нейтрофілів постійно розташовувалась і в периваскулярних інфільтратах, що головним чином складалися із Т-лімфоцитів, моноцитів, макрофагів, клітин Лангерганса та домішків позасудинних еритроцитів. Для визначення співвідношення Т-лімфоцитів, клітин Лангерганса та макрофагів в периваскулярних інфільтратах на стадії папули ми провели ІГХ дослідження з маркерами CD3 (Т-лімфоцити), S100 (клітини Лангерганса) та CD68 (макрофаги), що дають специфічну реакцію з відповідними клітинами (рис. 4.5). Таким чином, на 1 клітину Лангерганса припадає в середньому 2-3 CD68+ макрофага, 3-4 нейтрофіла та 10-15 CD3+ Т-лімфоцита.
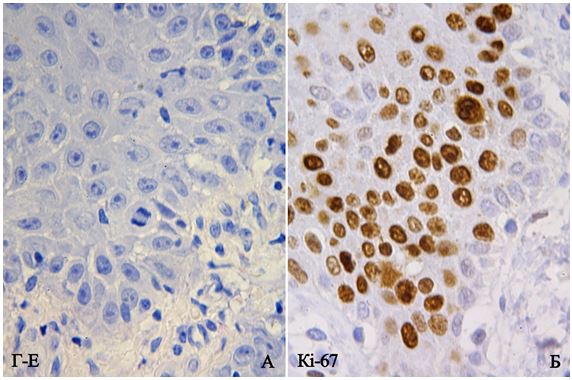 Рисунок 4.4.
Рисунок 4.4.
Примітки:
А – Підвищена мітотична активність базальних відділів епідермісу при псоріазі, забарвлення Г-Е (×1000).
Б – Інтрануклеарна реакція з маркером Кі-67 в базальних шарах епідермісу, що відображає реальну кількість проліферуючих кератиноцитів, ІГХ метод (×1000)
Аналізуючи у біоптатах хворих розподіл Т-лімфоцитів на різних рівнях багатошарового плоского епітелію в стадії папули, можна визначити нерівномірність інфільтрації з густішою концентрацією клітин в шипуватому та базальному шарах навколо судинних сосочків (рис. 4.6 А). Але слід зазначити, що кількість Т-лімфоцитів в епідермісі була в декілька разів меншою (рис. 4.6 Б) порівняно з периваскулярними інфільтратами дерми, звідки починається екзоцитоз запальних клітин (рис. 4.6 В). Таким чином, середні показники внутрішньоепідермального розташування CD3+ Т-лімфоцитів в 10 полях зору (×400) становили (28,63±2,13) клітини, внутрішньодермального – 74,71±3,05, індекси співвідношення епідермально/дермального розташування CD3+ Т‑лімфоцитів визначилися на рівні 0,38±0,03.
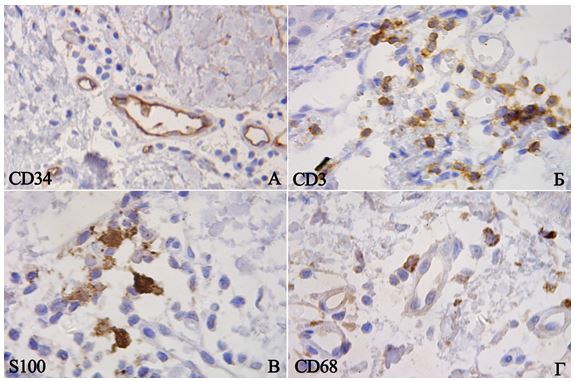 Рисунок 4.5.
Рисунок 4.5.
Примітки:
А – Периваскулярні інфільтрати сосочків дерми при псоріазі, мембранна реакція з маркером CD34 ендотелію судин, ІГХ метод (×1000).
Б – Мембранна реакція численних Т-лімфоцитів з маркером CD3, ІГХ метод (×1000).
В – Змішана реакція маркера S100 в клітинах Лангерганса (видовжені клітини з розгалуженими відростками), ІГХ метод (×1000).
Г – Цитоплазматична реакція поодиноких CD68+ макрофагів, ІГХ метод (×1000)
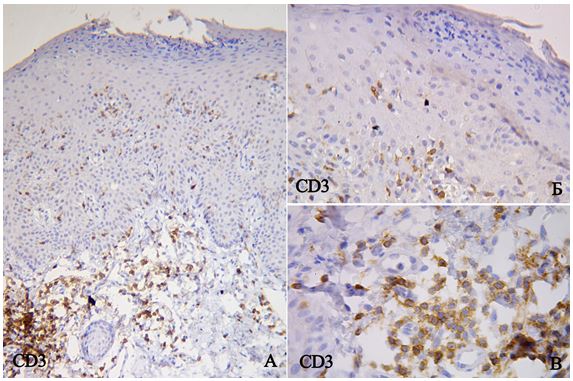 Рисунок 4.6.
Рисунок 4.6.
Примітки:
А – Псоріаз вульгарний, стадія папули, специфічна мембранна реакція з маркером CD3 Т-лімфоцитів в епідермісі та дермі, ІГХ метод (×200).
Б – Розподіл Т-лімфоцитів в шипуватому і базальному шарах епідермісу навколо судинних сосочків, ІГХ метод (×400).
В – Периваскулярні інфільтрати із Т-лімфоцитів сосочків дерми, ІГХ метод (×1000)
Для порівняння показники контрольної групи здорової шкіри становили: в епідермісі 4,17±0,02 (р<0,001), в дермі 8,11±0,08 (р<0,001). Індекс епідермально/дермального розташування CD3+ Т-лімфоцитів 0,51±0,04 (р<0,05).
Антигенпрезентуючі клітини Лангерганса більшим чином розташовуються посередині шипуватого шару, але не мають тонофіламентів, десмосом або меланосом. Електрона мікроскопія доводить особливість цих клітин наявністю мультивезикулярних тілець та характерних Birbeck’s гранул у вигляді тенісних ракеток. При забарвленні Г-Е клітини Лангерганса можна розпізнати за гіперхромним ядром ниркоподібної форми з виїмкою та галом навколо такого ядра, розгалужені дендритні відростки, що контактують з кератиноцитами на різних рівнях епідермісу, стандартною гістологічною методикою, на жаль, не визначаються. Проведене нами ІГХ дослідження для виявлення протеїну S100 в клітинах Лангерганса однойменним моноклональним антитілом допомогло описати особливості структури та розташування цих клітин у шкірі при псоріатичному ураженні (рис. 4.7 А).
Порівнюючи кількість клітин Лангерганса в епідермісі і дермі, визначали рівномірний розподіл цих клітин з невеликою перевагою інтраепідермального розташування (рис. 4.7 Б). При цьому внутрішньо-дермальні клітини Лангерганса мали значно менше розгалужених відростків, ніж інтраепідермальні, і розташовувались завжди в безпосередньому контакті з судинами і Т-лімфоцитами (рис. 4.7 В).
Середні показники інтраепідермального розташування клітин Лангерганса в 10 полях зору (×400) становили (7,18±0,46) клітини; відповідні показники інтрадермального скупчення (переважно навколо судин) дорівнювали 6,54±0,29, а індекс співвідношення епідермально/дермального розташування клітин Лангерганса в стадію папули становив 1,11±0,03. Виявили такі середні значення кількості клітин Лангерганса здорової шкіри у пацієнтів контрольної групи: в епідермісі – 4,24±0,15 (р<0,05), у дермі – 1,89±0,05 (р<0,001), індекс епідермально/дермального розташування в здоровій шкірі – 2,24±0,05 (р<0,01). Таким чином, збільшення кількості клітин Лангерганса при псоріазі вульгарному порівняно з контрольною групою було статистично значущим.
При дослідженні макрофагального компоненту запальної інфільтрації була виявлена зворотна тенденція, а саме: найбільшу кількість CD68+ клітин зауважили навколо судин в сосочках дерми і лише поодинокі інтраепідермальні макрофаги – в базальному шарі епідермісу, що допомогла з’ясувати специфічна цитоплазматична реакція з маркером CD68 (рис 4.8).
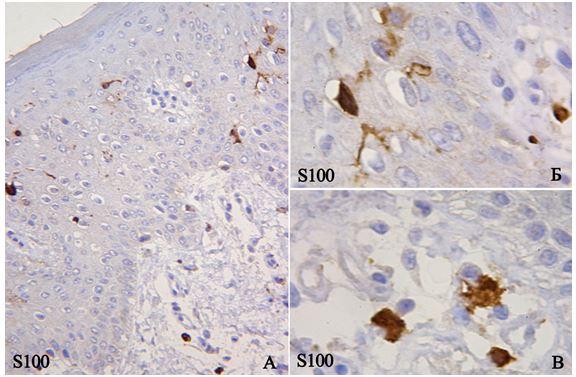 Рисунок 4.7.
Рисунок 4.7.
Примітки:
А – Псоріаз звичайний, стадія папули, специфічна змішана реакція з маркером S100 клітин Лангерганса в епідермісі та дермі, ІГХ метод (×200).
Б – Клітини Лангерганса з розгалуженими дендритними відростками, що контактують із кератиноцитами шипуватого шару епідермісу, ІГХ метод (×1000).
В – Периваскулярні інфільтрати дерми з клітинами Лангерганса, ІГХ метод (×1000)
При цьому середні показники внутрішньоепітеліального розташування CD68+ макрофагів в 10 полях зору (×400) становили (2,71±0,11) клітини; показники внутрішньодермального поширення – 11,27±0,59, індекс співвідношення епідермально/дермального розташування CD68+ макрофагів при псоріазі дорівнював 0,24±0,01. При дослідженні показників контрольної групи отримали наступні результати: в епідермісі CD68+ макрофагів налічувалося 1,01±0,01 (р<0,01), у дермі – 3,35±0,04 (р<0,001), індекс епідермально/дермального розташування становив 0,30±0,02 (р<0,01). Статистично вірогідна різниця інтенсивності макрофагальної інфільтрації в загальній та контрольній групах виявлена як для інтрадермального, так і внутрішньоепітеліального розташування CD68+ макрофагів.
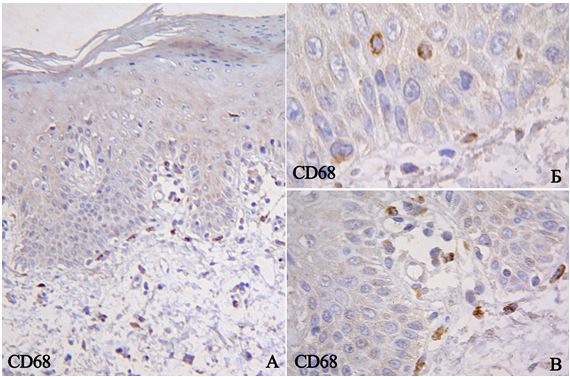 Рисунок 4.8.
Рисунок 4.8.
Примітки:
А – Псоріаз вульгарний, стадія папули, специфічна цитоплазматична реакція з маркером CD68 макрофагів у епідермісі та дермі, ІГХ метод (×200).
Б – Інтраепітеліальні поодинокі CD68+ макрофаги базального шару епідермісу, ІГХ метод (×1000).
В – Периваскулярні інфільтрати сосочків дерми з CD68+ макрофагами, ІГХ метод (×400)
Втрата зернистого шару та активна пролонгація дермальних сосочків в епідермісі спричинюють потоншення супрапапілярних пластин, що є патогномонічною морфологічною ознакою псоріатичного ураження, зокрема: при видаленні луски (супрапапілярних пластинок) судини сосочків дерми, що підходять надто близько до поверхні, дають точкові кровотечі – «кривава роса» (ознака Auspitz) [73, 74, 127, 138].
У ранніх псоріатичних папулах та в гарячих точках більш старих елементів було виявлено інтенсивність паракератозу з нейтрофілами, які мігрують у верхівки цих підвищень. Згодом об’єднуються ці псоріатичні папули. Тому декілька рівнів паракератозу мають нейтрофіли з проміжними рівнями ортокератозу, що інколи залишаються. Такі псоріатичні ураження із інтракорнеальних скупчень нейтрофілів називають мікроабсцеси Munro-Sabouraud (рис. 4.9 А, Б). Останні – доволі типовий прояв псоріазу в цій стадії. Подібні нейтрофільні скупчення в шипуватому шарі називають губчастий пустульоз Kogoj (рис. 4.9 А).
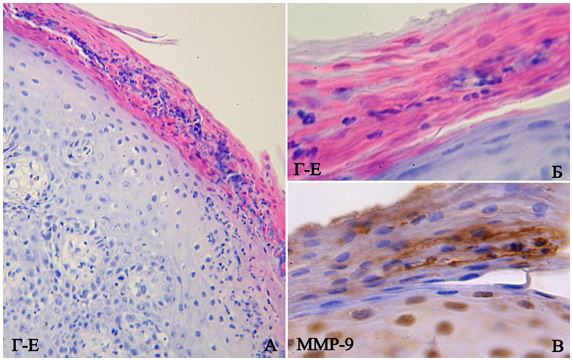 Рисунок 4.9.
Рисунок 4.9.
Примітки:
А – Мікроабсцес Munro-Sabouraud розташований в самій верхівці паракератозного підвищення рогового шару епідермісу в ранніх псоріатичних папулах та в гарячих точках більш старих папул: під роговим шаром одразу починається шипуватий та інфільтрований нейтрофілами губчастий пустульоз Kogoj (праворуч внизу), забарвлення Г-Е (×400).
Б – Інтракорнеальне скупчення нейтрофілів, втрата зернистого шару, забарвлення Г-Е (×1000).
В – Надмірна позитивна реакція з маркером ММП-9 навколо інтракорнеального абсцесу, ІГХ метод (×1000).
Відомо, що міжепітеліальні композити нейтрофілів значно більші при пустульозному варіанті перебігу псоріазу, ніж при вульгарному псоріазі. Пустули містять депозити лімфоцитів і нейтрофілів. У цей період епідерміс демонструє типову псоріазоподібну гіперплазію, з тонкими надпапілярними пластинками, що паралельно розташовані над відповідними розширеними судинами папілярних сосочків.
Нейтрофіли, що розташовані в інтракорнеальних мікроабсцесах, міжепітеліальних композитах та навколосудинних інфільтратах дермальних сосочків мають протеолітичну активність щодо сусідніх тканин та активують ензими із родини ММП. Це підтверджують позитивні ІГХ реакції з антитілом до ММП-9 в місцях скупчення нейтрофілів у вигляді ділянок забарвлення інтенсивно коричневого кольору (4-а категорія інтенсивності забарвлення) (рис. 4.9 В). Взагалі всі шари епідермісу, окрім зроговілого, мали підвищений рівень експресії маркера ММП-9 (рис. 4.10 А, Б). До того ж експресія ММП-9 тісно пов’язана з ангіогенезом і виявляється в клітинах навколосудиних інфільтратів та ендотелії судин (рис. 4.10 В).
Порівняно з нормальною шкірою контрольної групи, що з маркером ММП-9 демонструвала слабку реакцію (перша категорія забарвлення) в епідермісі та судинах дерми, визначали статистично вірогідне підвищення експресії ММП-9 при звичайному псоріазі (друга – четверта категорія забарвлення) (р<0,01).
До того ж, волосяні фолікули, що на рівні епідермісу виглядають більш менш збереженими, в цей час на рівні дерми в зовнішній волосяній піхві демонстрували гіперплазію кератиноцитів з підвищенням експресії маркерів р63, VEGF (рис. 4.11 А, Б) та ММП-9. Навколо волосяних цибулин спостерігали ділянки значно дилятованих судин та інфільтрати з Т-лімфоцитів (рис. 4.11 В, Г), що свідчить про залучення в процес не тільки епідермісу та дерми, а й придатків шкіри.
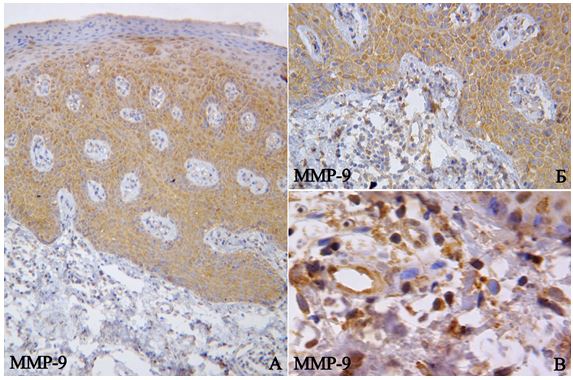 Рисунок 4.10.
Рисунок 4.10.
Примітки:
А – Позитивна реакція з ММП-9 у всіх шарах епідермісу (крім зроговілого) в стадії папули, ІГХ метод (×200).
Б – Специфічна реакція з маркером ММП-9 (третя категорія інтенсивності забарвлення) кератиноцитів базального шару, ІГХ метод (×400).
В – Специфічна реакція з маркером ММП-9 (третя категорія інтенсивності забарвлення) в ендотелії судин та клітинах запального інфільтрату, ІГХ метод (×1000).
При знижені активності запалення (старінні бляшок) кількість нейтрофілів різко знижувалася, але незначна кількість мононуклеарів завжди містилася в нижче розташованих рівнях супрапапілярного епідермісу. Дермальний запально-клітинний інфільтрат ставав дедалі легшим, ніж в ранніх ушкодженнях та на стадії папули. Він складався з активованих CD3+ Т-лімфоцитів, але значно меншої кількості CD68+ макрофагів, ніж в попередніх ушкодженнях, і зовсім поодиноких нейтрофілів. Клітини Лангерганса, кількість яких в епідермісі значно не змінювалась при зниженні запалення, характеризувалися втратою розгалужених відростків, що на стадії папули контактували з кератиноцитами усіх шарів епідермісу, виконуючи свою антигенпрезентуючу функцію.
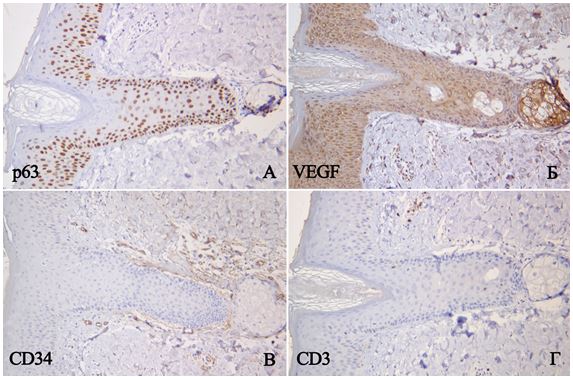 Рисунок 4.11 – Волосяний фолікул псоріатично зміненої ділянки шкіри.
Рисунок 4.11 – Волосяний фолікул псоріатично зміненої ділянки шкіри.
Примітки:
А – Базально-клітинна гіперплазія зовнішньої волосяної піхви волосяного фолікула, ядерна реакція з маркером р63 кератиноцитів, ІГХ метод (×400).
Б – Цитоплазматична реакція високої інтенсивності кератиноцитів епідермісу та зовнішньої волосяної піхви волосяного фолікула з маркером VEGF, ІГХ метод (×400).
В – Мембранна реакція маркера CD34 в ендотелії дилятованих судин навколо волосяної цибулини, ІГХ метод (×400).
Г – Мембранна реакція численних Т-лімфоцитів з маркером CD3 в навколосудинних інфільтратах, ІГХ метод (×400)
Цікавим є той факт, що плазматичні клітини і еозинофіли були відсутні в нашому дослідженні при псоріатичних ушкодженнях на всіх етапах розвитку, але деякі автори описують виявлення еозинофільного катіонного протеїну в верхній третині епідермісу шкіри та наявність плазматичних клітин у пацієнтів з ВІЛ-інфекцією, що потребує подальшого детального дослідження [189].
Під час загоєння бляшок в епідермісі верифікували «булавоподібне» потовщення нижніх рівнів сітки акантотичних тяжів (рис. 4.12 А) зі зливанням їх в загальне поле і деяким потовщенням надсосочкових пластинок (рис. 4.12 Б). Подальші зміни характеризувалися ортокератозом (нормалізацією процесів зроговіння), відновленням зернистого шару (рис. 4.12 В) і значно меншим екзоцитозом запальних клітин в епідермісі або повною його відсутністю.
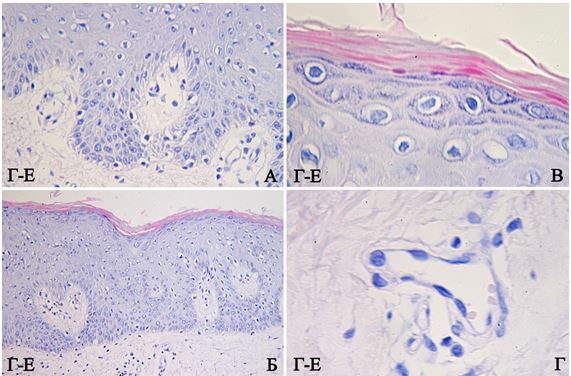 Рисунок 4.12 – Псоріаз, старіння папул, забарвлення Г-Е.
Рисунок 4.12 – Псоріаз, старіння папул, забарвлення Г-Е.
Примітка:
А – Булавоподібне потовщення нижніх рівнів сітки акантотичних тяжів (×400).
Б – Зливання акантотичних тяжів в загальне поле, потовщення супрапапілярних пластинок, (×200).
В – Ортокератоз (нормальне зроговіння), відновлення зернистого шару (×1000).
Г – Помірна дилятація судин дерми із нечисленним запальним інфільтратом (×1000).
У дермі псоріатичної папули, що очищувалась (виліковувалась), кількість імуноцитів навколосудинних запальних інфільтратів різко знижувалась, а в епідермісі редукувалась інтенсивність епідермальної гіперплазії та повністю реставрувався зернистий шар. Тільки судини сосочків дерми залишались розширеними (рис. 4.12 Г), хоча до цього часу навколо підвищувалась кількість фібробластів, і в цьому регіоні спостерігався помірний післязапальний фіброз.
ІГХ характеристика псоріатичних папул, що загоювалися, свідчила про зниження проліферативної активності до рівнів нормальної шкіри (5-9 %) або трохи вище (11-16 %), що частіше мало місце при додатковому подразненні або травмуванні патологічно зміненої ділянки (рис. 4.13 Б), зниження кількості клітин Лангерганса, особливо в дермі (рис. 4.13 В), та повну відсутність нейтрофільної та CD3+ Т-лімфоцитарної інфільтрації епідермісу. Базально-клітинна гіперплазія значного зниження не набувала і у всіх випадках не досягала значень нормальної шкіри контрольної групи [(12,21±1,04) %], залишаючись на рівні (30,16±2,10) %, що свідчить про порушення диференціювання кератиноцитів цієї ділянки і можливість раннього рецидиву (рис. 4.13 Г).
Таким чином, активність запалення можна з’ясувати за станом нейтрофілів, макрофагів та проліферативної активності базального шару, а персистенцію подальшого патологічного процесу – за наявністю базально-клітинної гіперплазії в регресуючу стадію, надекспресії маркерів ММП-9, VEGF та дилатації судин з Т-лімфоцитарними інфільтратами. Отже, виключно морфологічні критерії не можуть слугувати вірогідними показниками одужання пацієнтів з псоріазом і потребують додаткового проведення ІГХ досліджень.
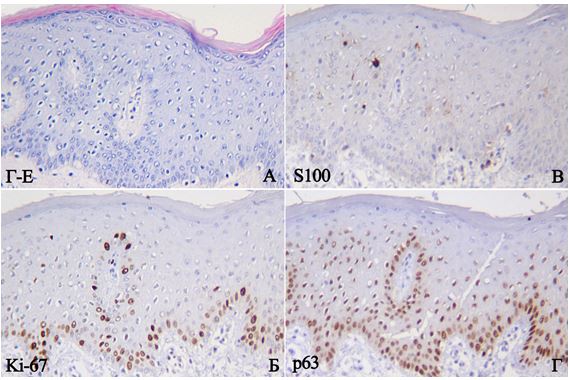 Рисунок 4.13.
Рисунок 4.13.
Примітки:
А – Псоріатична бляшка, що загоюється, забарвлення Г-Е (×400).
Б – Інтрануклеарна реакція проліферуючих кератиноцитів базального шару епідермісу з маркером Кі-67, індекс проліферації на рівні 8-10 %, ІГХ метод (×400).
В – Змішана реакція клітин Лангерганса з маркером S100, ІГХ метод (×400).
Г – Інтрануклеарна реакція маркера р63 в кератиноцитах з базально-клітинним диференціюванням, ІГХ метод (×400).
4.2 Імуноморфологічні особливості перебігу псоріазу вульгарного залежно від ступеня його важкості
За ступенем важкості всі випадки псоріазу звичайного в дослідженні були поділені на легкий (з ураженням менше 3 % поверхні шкіри) 31 спостереження (44 %) та середній (з ураженням від 3 до 10 відсотків поверхні шкіри) 39 спостережень (56 %). Але оцінка ступеня важкості захворювання загалом базувалася не тільки на обсязі поверхні ураженого тіла, а й на ступені активності захворювання (вираженість еритеми, інфільтрації, ступінь активності шкірного свербіння, ступінь потовщення шкіри, ступінь лущення, наявність кровотечі або ексудації, вторинного інфікування бляшок, ступінь припухлості і ураження суглобів), наявності загальних симптомів активності процесу (підвищена втома, підвищена швидкість осідання еритроцитів і т. п.), відповіді хворого на попередні спроби лікування, впливі захворювання на загальний стан і повсякденне життя хворого, на його соціальне функціонування. Морфологічні та ІГХ дослідження були проведені в прогресуючій стадії захворювання з різним ступенем важкості перебігу для визначення максимальної розбіжності показників.
У першу чергу було проаналізовано стан судинного русла при легкому та середньому ступенях важкості псоріазу. Виявилося, що кількість судин у спостереженнях з середнім ступенем важкості вдвічі більша, ніж при легкому перебігу псоріазу (р<0,001), і в 5,1 разу більша, ніж у контрольній групі (р<0,001) (табл. 4.1).
Таблиця 4.1 – Кількісна характеристика щільності мікросудин згідно зі значеннями експресії маркера CD34 залежно від важкості перебігу псоріазу звичайного, М±m
| Експресія маркера
CD34 |
Контрольна група(n=20) |
Важкість перебігу псоріазу звичайного |
|
| легкий ступінь
(n=31) |
середній ступінь
(n=39) |
||
| Щільність мікросудин
на 1 мм2 (×400) |
4,32±0,67 | 10,23±0,41 * | 22,18±0,58 *** |
Примітки:
1. * – р<0,001 щодо контрольної групи.
2. ** – р<0,001 щодо псоріазу легкого ступеня.
Таким чином, результати нашого дослідження узгоджуються з даними Maha Mohamed Amin із співавт. (2012) про те, що щільність судин у зразках біоптатів шкіри при легкому ступені важкості відповідає помірній васкуляризаії (11-20 капілярів), а при середньому – вже на рівні значної васкуляризації (21-28 капілярів) [108]. Статистично вірогідно обидві групи різняться між собою (р<0,05) та з контрольною групою (р<0,05) (табл. 4.2).
Ця тенденція збігається зі змінами експресії маркера ангіогенезу VEGF, що значно підвищується зі збільшенням активності патологічного процесу (табл. 4.2). Поділ за градаціями відбувався за рекомендаціями Aronson Peter J. (2008) [111].
Таблиця 4.2 – Розподіл значень експресії маркера VEGF залежно від важкості перебігу псоріазу звичайного, n, (%)
| Експресія
маркера VEGF |
Контрольнагрупа (n=20) |
Важкість перебігу псоріазу звичайного |
|
| легкий ступінь
(n=31) |
середній ступінь
(n=39) |
||
| Негативна (0) | – | – | – |
| Слабка (1) | 16 (80 %) | – | – |
| Помірна (2) | 4 (20 %) | 9 (29 %) * | 13 (33 %) *** |
| Висока (3) | – | 22 (71 %) * | 19 (49 %) *** |
| Надмірна (4) | – | – | 7 (18 %) *** |
Примітки:
1. р<0,01 для груп з дерматозом щодо контрольної групи.
2. р<0,05 відносно псоріазу легкого ступеня.
Відповідно до критерію Хі-квадрат Пірсона, розподіл абсолютних значень спостережень за інтенсивністю цитоплазматичного забарвлення маркера VEGF в усіх групах мав вірогідну різницю (р<0,05). Нами також був виявлений помірний кореляційний зв'язок між збільшенням інтенсивності експресії маркера VEGF і підсиленням важкості перебігу псоріазу звичайного (r=+0,430; p<0,05), що свідчить про важливість процесів неоангіогенезу в патогенезі цього захворювання і необхідність застосування лікувальних заходів з впливом безпосередньо на дану ланку патогенезу для коригування важкості перебігу. Це відкриває значні можливості для таргетної терапії гуманізованим моноклональним антитілом до фактора росту ендотелію судин VEGF «Бевацизумаб» пацієнтів з таким діагнозом.
Згідно з результатами нашого дослідження, розподіл CD3+ і CD68+ мононуклеарів та S100+ дендритних клітин в епідермісі та дермі також змінювався залежно від ступеня важкості перебігу захворювання (табл. 4.3). Беручи до уваги значення показників експресії маркера CD3, кількість активованих Т-лімфоцитів прогресивно збільшувалась і в епідермісі, і в дермі досліджених біоптатів, та найбільших значень набула при псоріазі середньої важкості 33,42±3,54/89,19±5,16, порівняно з контрольною групою (р<0,05) і групою легкого ступеня важкості перебігу (р<0,01).
Статистично вірогідна різниця інтенсивності макрофагальної інфільтрації в епідермісі і в дермі досліджених біоптатів за маркером CD68 була виявлена як між двома групами дослідження (р<0,01), так і порівняно з контрольною групою (р<0,05).
Щодо клітин Лангерганса в епідермісі, згідно з критерієм Мана-Уітні, статистично вірогідну різницю між групами з легким і середнім ступенем важкості перебігу не виявлено (р>0,05). Але кількість дендритних клітин збільшилась в дермі при легкому ступені важкості порівняно з контрольною групою (р<0,05), та в епідермісі і в дермі при псоріазі середнього ступеня важкості (р<0,05) (табл. 4.3).
Таким чином, процеси розвитку або регресу псоріатичних бляшок залежать від наявності в шкірі клітин, що ініціюють та підтримують запалення (лімфоцити, макрофаги, дендритні клітини), але перебувають з ними в складних стосунках, що вимагає подальшого дослідження, можливо з урахуванням клітин, які супресують імунну відповідь.
Таблиця 4.3 – Розподіл мононуклеарної інфільтрації та дендритних клітин в епідермісі та дермі шкіри залежно від важкості перебігу псоріазу звичайного, М±m (n)
| Маркер |
Контрольна група(n=20) |
Важкість перебігу псоріазу звичайного |
|
| легкий ступінь
(n=31) |
середній ступінь
(n=39) |
||
| CD3 епідерміс/дерма | 4,17±0,02 / 8,11±0,08 | 17,68±2,64 * / 42,64±3,87 * | 33,42±3,54*** / 89,19±5,16 *** |
| CD68 епідерміс/дерма | 1,01±0,01 / 3,35±0,04 | 1,87±0,02 */ 8,63±0,84 * | 3,08±0,02 * **/ 12,46±0,56 *** |
| S100 епідерміс/дерма | 4,24±0,15 / 1,89±0,05 | 6,08±0,87 / 5,32±0,20 * | 7,66±0,51* / 7,07±0,32 *** |
Примітки:
1. * – р<0,05 щодо контрольної групи;
2. ** – р<0,01 щодо псоріазу легкого ступеня.
Проліферативна активність кератиноцитів псоріатичних ділянок, як показник порушення мітогенної стимуляції при псоріатичному запаленні, також була проаналізована в групах з різною важкістю перебігу псоріазу, порівняно з контрольною групою (табл. 4.4).
З’ясовано, що індекс проліферації кератиноцитів епідермісу прогресивно збільшувався від показників здорової шкіри контрольної групи, включаючи групу легкого ступеня (р<0,001), до показників спостережень псоріазу середньої важкості (р<0,001). Результати досліджень свідчили, що мітогенна активність всіх клітин базального і значної частини шипуватого шарів епідермісу прямо пропорційно залежала від активності запалення, що корелює з важкістю перебігу псоріазу (r=+0,451; p<0,05).
При дослідженні експресії маркера р63 встановлено, що підвищення проліферації кератиноцитів епідермісу безпосередньо пов’язане з подальшою характеристикою патологічного процесу при псоріазі – базально-клітинною гіперплазією епідермісу (табл. 4.5).
Таблиця 4.4 – Розподіл значень експресії маркера Кі-67 залежно від важкості перебігу псоріазу звичайного, М±m (%)
| Експресія маркера
Кі-67 |
Контрольна група(n=20) |
Важкість перебігу псоріазу звичайного |
|
| легкий ступінь
(n=31) |
середній ступінь
(n=39) |
||
| Індекс проліферації кератиноцитів | 6,27±0,45 | 23,01±1,34 % * | 41,61±1,29 % *** |
Примітки:
1. * – р<0,001 щодо контрольної групи.
2. ** – р<0,001 щодо псоріазу легкого ступеня
Таблиця 4.5 – Розподіл значень експресії маркера р63 залежно від важкості перебігу псоріазу звичайного, М±m (%)
| Експресія маркера
р63 |
Контрольна група(n=20) |
Важкість перебігу псоріазу звичайного |
|
| легкий ступінь
(n=31) |
середній ступінь
(n=39) |
||
| Індекс базально-клітинної гіперплазії кератиноцитів | 12,21±1,04 | 68,83±1,70 * | 74,62±2,85 * |
Примітка. * – р<0,001 щодо контрольної групи
Виявлено підвищення індексу базально-клітинної гіперплазії в псоріатично зміненій шкірі, яке набуває надмірних значень, порівняно з контрольною групою (р<0,001), але не залежить від важкості перебігу (р>0,05 між групами з легкою та середньою важкістю перебігу псоріазу), що свідчить про універсальність проявів порушення дозрівання кератиноцитів, типовість перебігу псоріазу, що потребує лише ініціації з боку запальних клітин і далі не залежить від обсягу запального інфільтрату.
При дослідженні розподілу значень експресії маркера ММП-9 залежно від важкості перебігу псоріазу звичайного за рекомендаціями Aronson Peter J. (2008) [111] встановлено також значне підвищення експресії цього маркера порівняно з контрольною групою (табл. 4.6). Найзначніші зміни відбуваються при псоріазі середнього ступеня важкості в зонах інтракорнеальних абсцесів Munro-Sabouraud, ділянках пустульозу Kogoj та навколосудинних інфільтратах дерми, що мають численну нейтрофільну інфільтрацію.
Таблиця 4.6 – Розподіл значень експресії маркера ММP-9 залежно від важкості перебігу псоріазу звичайного, n, (%)
| Експресія маркера
VEGF |
Контрольна група(n=20) |
Важкість перебігу псоріазу звичайного |
|
| легкий ступінь
(n=31) |
середній ступінь
(n=39) |
||
| Негативна (0) | – | – | – |
| Слабка (1) | 20 (100 %) | – | – |
| Помірна (2) | – | 16 (52 %) | 3 (8 %) |
| Висока (3) | – | 15 (48 %) | 26 (67 %) |
| Надмірна (4) | – | – | 10 (25 %) |
Примітки:
1. р<0,001 для груп з дерматозом щодо контрольної групи.
2. р<0,05 щодо псоріазу легкого ступеня
Згідно з точним тестом Фішера, розподіл спостережень за інтенсивністю цитоплазматичного забарвлення клітин маркером ММП-9 в усіх групах показав вірогідну різницю з р<0,05. Встановлено вірогідний помірний кореляційний зв'язок між збільшенням інтенсивності експресії маркера ММП-9 і підсиленням важкості перебігу псоріазу звичайного (r=+0,532; p<0,05).
Для з’ясування можливої ефективності таргетної терапії ми вважаємо за доцільне використання ММП-9 при дослідженні біоптатів шкіри пацієнтів на псоріаз звичайний, беручи до уваги існування інгібіторів ММП (препаратів «Маристомат», «Батистомат»), що в якості компонента комбінованої терапії сприятимуть зменшенню важкості перебігу псоріазу.
Таким чином, сьогодні зусилля дерматологів і патоморфологів направлені на виявлення додаткових прогностичних ознак, що дають змогу з’ясувати особливості перебігу псоріазу звичайного та ефективності терапії, яку будуть застосовувати для його лікування. Результати проведених нами клінічних, морфологічних та ІГХ досліджень дозволяють з’ясувати форму, стадію та важкість перебігу псоріазу на момент звернення пацієнта та отримання біоптату псоріатично ураженої шкіри.
Для виявлення особливостей перебігу псоріазу вульгарного на стадіях ранніх змін, папули (бляшки) та загоювання (старіння папули) окрім стандартного морфологічного дослідження доцільно використовувати ІГХ дослідження з використанням маркерів ангіогенезу CD34, VEGF, проліферативної активності Кі-67, базально-клітинної гіперплазії р63, стромальної деградації ММП-9, інфільтрації мононуклеарами CD3, CD68 та клітинами Лангерганса S100, кількість яких значно збільшується порівняно із контрольною групою (від р<0,05 до р<0,001).
Псоріаз середнього ступеня важкості характеризується вірогідно більшою щільністю мікросудин на 1 мкм (р<0,05), інфільтрацією CD3+ Т-лімфоцитами (р<0,05) епідермісу і дерми, інфільтрацією CD68+ макрофагів дерми, активністю VEGF-залежного ангіогенезу (р<0,05), проліферативною активністю (р<0,05), експресією ММП-9 (р<0,05) ніж псоріаз легкого ступеня та здорова шкіра пацієнтів контрольної групи.
Підвищення експресії маркерів VEGF та ММП-9 при псоріазі звичайному звертає увагу щодо можливої ефективності таргетної терапії препаратами «Бевацизумаб» (гуманізованим моноклональним антитілом до фактора росту ендотелію судин) та «Маристомат», «Батистомат» (інгібітори ММП), на підставі виявлення кореляційних зв’язків між збільшенням інтенсивності експресії відповідних маркерів і підсиленням важкості перебігу псоріазу звичайного (rVEGF =+0,430, rММП-9 =+0,532).
Визначення зазначених нами вище показників спонукало до розробки математичної моделі перебігу псоріазу звичайного
4.3 Прогнозування ризиків прогредієнтного перебігу псоріазу
Мета цього фрагменту дослідження – оцінити прогноз перебігу псоріазу за даними ІГХ змін у ділянках ураження шкіри хворих шляхом побудови математичних моделей логістичної регресії.
Оцінку проводили за даними досліджень 23 хворих на псоріаз з легким (7 пацієнтів) і середньої важкості (16 пацієнтів) перебігом захворювання. Проаналізовані дані ІГХ реакцій з маркерами CD3, CD68, Ki-67, VEGF, CD34, р63, S100, ММП-9.
З використанням методу логіт-аналізу (logit regression) для кожного чинника були побудовані однофакторні регресійні моделі за формулою:
Р = exp(z)/(1+exp(z)), (4.1)
де Р – теоретична ймовірність прогредієнтного перебігу,
z – фактичні значення показника,
В0, В1 – обчислені коефіцієнти.
Адекватність моделей логістичної регресії оцінювали за критерієм Хі-квадрат, значущість коефіцієнтів регресії (В0, В1) – за критеріями Стьюдента і Вальда.
Високий ризик прогредієнтного перебігу псоріазу отримували, коли обчислена імовірність (Р) перевищувала 0,5 або 50 %. Далі для кожного чинника була визначена точка розмежування його значень, яка забезпечувала максимальну прогностичну цінність за показниками чутливості і специфічності.
Для оцінки діагностичної (прогностичної) значущості чинника визначали коефіцієнти інформативності (І) за формулою Кульбака:
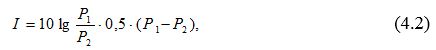
де І – інформативність чинника;
Р1, Р2 – відносна частота значень показника у групах з різним перебігом дерматозу.
Основні результати оцінки прогнозу перебігу псоріазу представлено в табл. 4.7.
Таблиця 4.7 – Результати оцінки прогнозу перебігу псоріазу
| Чинник ризику (експресія ІГХ маркеру) | Точка розмежування | Чутли-вість, % | Специфіч-ність, % | Інформа-тивність (І) | р |
| Щільність мікросудин
на 1 мм2 (×400) – CD34 |
³ 12 | 93,8 | 100 | 3,25 | <0,001 |
| CD3 епідерміс | ³ 24 | 93,8 | 85,7 | 2,88 | <0,001 |
| дерма | ³ 50 | 93,8 | 71,4 | 1,68 | <0,001 |
| Індекс проліферації кератиноцитів – Кі-67 | ³ 28 | 100 | 85,7 | 2,96 | <0,001 |
| CD8 епідерміс | ³ 2,2 | 93,8 | 71,4 | 1,68 | <0,001 |
| дерма | ³ 10 | 87,5 | 85,7 | 2,24 | <0,001 |
| S100 епідерміс | ³ 6,5 | 87,5 | 71,4 | 1,43 | <0,01 |
| дерма | ³ 6 | 87,5 | 85,7 | 2,24 | <0,001 |
| Індекс базально-клітинної гіперплазії кератиноцитів – р63 | ³ 70 | 87,5 | 57,1 | 0,69 | <0,05 |
| VEGF | експресія висока або надмірна | 75,0 | 71,4 | 0,97 | <0,05 |
| ММП-9 | експресія висока або надмірна | 93,8 | 57,1 | 0,87 | <0,05 |
Примітка. р – рівень діагностичної значущості показника
За даними логіт-регресійного аналізу були визначені граничні точки кожного показника, які дали змогу класифікувати ризик важкого перебігу дерматозу. Наприклад, представлений на рис. 4.14 А взаємозв’язок теоретичних імовірностей ризику важкого перебігу псоріазу, розрахований за показником щільності мікросудин, демонструє, що високий ризик (р > 50 %) прогнозується, якщо його значення дорівнює або перевищує 12 на 1 мм2.
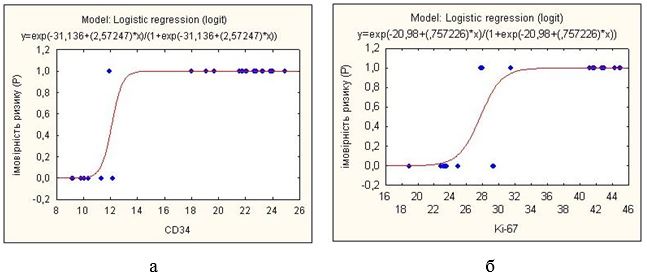
Рисунок 4.14 – Залежність теоретичної імовірності ризику важкого перебігу псоріазу від значень показника експресії маркера CD34 (а) і Ki-67 (б)
Для показника проліферативної активності кератиноцитів епідермісу точкою розмежування були значення експресії маркера Кі-67, що дорівнювали або перевищували 28 (рис. 4.14б).
Як видно з табл. 4.7, важливе значення для прогнозування прогредієнтного перебігу псоріазу мали щільність мікросудин 12 і більше на 1 мм2 – коефіцієнт інформативності цього показника І=3,25, ризик важкого перебігу (чутливість) 93,8 %. При значеннях експресії маркера CD34 менше 12 мікросудин на 1 мм2 цей ризик наближався до 0 (специфічність 100 %).
Крім вищезазначеного маркера, ранжування за показником інформативності (І) свідчили, що перші місця для прогнозу посідали:
– індекс проліферації кератиноцитів епідермісу, що дорівнював 28 або більше (І=2,96);
– показник експресії маркера CD3 в епідермісі дорівнював або був більший за 24 (І=2,88);
– інтенсивність макрофагальної інфільтрації в дермі за маркером CD68, що дорівнював або перевищував 10 (І=2,24);
– кількість клітин Лангерганса в дермі за маркером S100, що дорівнювала або перевищувала 6 (І=2,24).
Висока або надмірна інтенсивність експресії маркерів VEGF і ММП-9 також вірогідно (р<0,05) свідчить про збільшення ризику прогредієнтного перебігу псоріазу (чутливість цих реакцій становить 75 і 93,8 % відповідно). Це узгоджується з висновками із розділу 4 і обґрунтовує необхідність призначення таргетної терапії як компонента комбінованої терапії у таких пацієнтів.
* * *
Таким чином, отримані дані свідчать, що ІГХ-маркери є інформативними показниками для оцінки імовірності персистенції подальшого патологічного процесу при псоріазі, що створює перспективи для удосконалення діагностики дерматозу і підвищення об’єктивності динамічного контролю.
Основні тези даного розділу висвітлені в наступних роботах:
- Возняк І.Я. Аналіз показників експресії, імуногістохімічних маркерів проліферації, васкуляризації, базальноклітинної гіперплазії, стромальної деградації, cd3+ і cd68+ мононуклеарної інфільтрації та клітин Лангерганса в залежності від форми та важкості перебігу псоріазу / І.Я. Возняк, І.С. Шпонька, Т.В. Святенко, О.В. Пославська // Морфологія. – 2013. – Т. 7, № 3. – С. 117–126.
- Возняк І.Я. Імуногістохімічні показники клітинної інфільтрації на різних стадіях перебігу та ступенях важкості псоріазу звичайного / І.Я. Возняк // Молоді науковці – майбутнє української дерматовенерології : Матер. наук.-практ. конф., 20-21 листопада 2014 р., м. Київ. – К., 2014. – C. 17–19.
- Study of immunohistochemical vascularization parameters in patients with psoriasis / І.Я. Возняк, Т.В. Святенко, О.О. Сизон // 15 Конгрес Словацької асоціації естетичної та косметологічної дерматології з міжнародною участю, 4-6.12. 2014, Братислава, Словаччина.
- Роль процесів неоангіогенезу в етіопатогенезі псоріазу / І.Я. Возняк, Х.О. Ліщук-Якимович, О.О. Сизон // 12 випуск наукових праць: ”Сучасні проблеми дерматовенерології та управління охороною здоров’я”, Харків, 2015.
- Voznyak I. Immunohistochemical parameters of neoangiogenesis in patients with psoriasis / T. Svyatenko, I. Voznyak // Дерматовенерология. Косметология. – 2015. – № 1 (01). – С. 9–16.
РОЗДІЛ 5
АНАЛІЗ КІЛЬКІСНОЇ ХАРАКТЕРИСТИКИ ЕКСПРЕСІЇ ФАКТОРА
НЕКРОЗУ ПУХЛИНИ – АЛЬФА ПЕРИФЕРИЧНОЇ КРОВІ У ПАЦІЄНТІВ,
ХВОРИХ НА ПСОРІАЗ
Цитокіни – біологічно високоактивні білки, що регулюють ріст, функціонування та диференціювання клітин і допомагають регулювати імунну відповідь та запальні процеси [9]. Кератиноцити секретують низку цитокінів і хемокінів, які, в свою чергу, активують або ж інгібують імунну відповідь. На жаль, точний механізм та достименна роль цих біологічно активних речовин в розвитку псоріазу остаточно не вивчені. Будь-які локальні чи системні стимули можуть провокувати продукцію прозапальних цитокінів кератиноцитами [11].
Аналіз досліджень експресії цитокінів показав, що Th1-клітини можуть ініціювати та підтримувати патологічний процес в перебігу псоріазу [12-14]. Ми вивчали експресію в сироватці крові Th1 індукованого цитокіну, а саме TNF-α. Відомо, що в природі все підкоряється єдиній діалектичній закономірності: дія всіх без винятку факторів в більший чи менший кількості діаметрально протилежна, жоден з них не можна вважати корисним чи шкідливим для людського організму без його кількісної оцінки. Точна роль TNF-α безумовно вимагає подальшого вивчення, а висока ефективність анти- TNF-α терапії свідчить про центральну роль цього цитокіну в розвитку дерматозу.
Аналіз експресії TNF-α у периферичній крові пацієнтів, хворих на псоріаз, свідчить про його значне підвищення порівняно з контрольною групою (табл. 5.1).
Отримані дані показали відсутність взаємозв’язків рівня TNF-α з віком і статтю пацієнтів (табл. 5.2-5.3).
У результаті проведених обстежень була також виявлена вірогідна залежність концентрації TNF-α в периферичній крові від ступеня важкості перебігу псоріазу, визначеного за допомогою PASI (табл. 5.4).
Таблиця 5.1 – Кількісна характеристика експресії TNF-α, М±m
| Експресія TNF-α
(пг/мл) |
Контрольна група(n=20) |
Пацієнти, хворі на псоріаз(n=70) |
| 8,55±0,47 | 19,81±1,09 * |
Примітка. * – р<0,001 щодо контрольної групи
Таблиця 5.2 – Кількісна характеристика експресії TNF-α залежно від статі обстежених осіб, М±m
| Експресія TNF-α
(пг/мл) |
Стать пацієнтів, хворих на псоріаз |
|
чоловіки(n=41) |
жінки(n=29) |
|
| 18,95±1,39 * | 21,02±1,78 * | |
Примітка. * – р<0,001 щодо контрольної групи
Таблиця 5.3 – Розподіл показників експресії TNF-α залежно від віку обстежених осіб, М±m
| Експресія TNF-α
(пг/мл) |
Вік, роки | ||
| до 30
(n=7) |
30 – 44
(n=41) |
45 – 59
(n=22) |
|
| 18,79±1,22 * | 19,27±1,49 * | 21,14±2,06 * | |
Примітка. * – р<0,001 щодо контрольної групи
Таблиця 5.4 – Розподіл показників експресії TNF-α залежно від ступеня важкості перебігу псоріазу
| Експресія TNF-α
(пг/мл) |
Ступінь важкості дерматозу (PASI) | |
| легкий (n=31) | середній (n=39) | |
| 16,64±1,36 * | 22,35±1,58 * ** | |
Примітка. * – р<0,001 щодо контрольної групи; ** – р<0,01 щодо псоріазу легкого ступеня
На жаль, при визначенні концентрації цитокінів в периферичній крові неможливо виявити справжнє походження цитокінів, адже зміни концентрації зазначених біологічно активних речовин можуть бути зумовлені кількома чинниками, серед яких: продукування, тканинне чи клітинне депонування, елімінація та розпад цих білків. Окрім цього, не виключене одночасне існування інших джерел цитокінів поряд із циркулюючими Т-клітинами.
* * *
Таким чином, отримані результати підтверджують важливу роль ключової ланки в етіопатогенезі псоріазу фактора некрозу пухлин, свідчать про універсальність псоріатичного процесу на даному етапі, про потребу подальшого досконалого вивчення ролі цього цитокіну в складному каскаді розвитку дерматозу.
Основні тези даного розділу висвітлені в наступних роботах:
- Возняк І.Я. Порушення мікроциркуляції та системи гемостазу у хворих на хронічні дерматози / І.Я. Возняк, О.А. Білинська // Український науково-медичний молодіжний журнал. – 2012. – № 1. – С. 33–36.
- Возняк І.Я. Вивчення деяких аспектів етіопатогенезу псоріазу / І.Я. Возняк // Журнал дерматовенерології, косметології ім. М.О. Торсуєва. – 2012. – № 1-2 (28). – С. 39–42.
- Роль порушень мікроциркуляції та змін у системі згортання крові / І.Я. Возняк, Т.В. Святенко, О.О. Сизон, О.А. Білинська // Матер. Всеукр. Тавр. наук.-практ. конф., присвяч. 85-річчю дермато-венерологічної служби Херсонської обл. “Сучасні проблемні питання в дермато-венерології та косметології”, 15-16 вересня 2011 р., м. Херсон. – Журнал дерматовенерології, косметології ім. М.О. Торсуєва. – 2011. – № 3-4 (26). – C. 106.
РОЗДІЛ 6
ХАРАКТЕРИСТИКА ПОКАЗНИКІВ ЯКОСТІ ЖИТТЯ ПАЦІЄНТІВ ХВОРИХ НА ПСОРІАЗ ЗАЛЕЖНО ВІД СТУПЕНЯ ВАЖКОСТІ ДЕРМАТОЗУ
Медичне поняття ЯЖ, насамперед, складається з таких показників, які пов’язані зі станом здоров’я людини [1, 121, 18]. Дані про ЯЖ дають змогу реалізувати постійний моніторинг стану пацієнта і при необхідності здійснювати корекцію лікування. Оцінка ЯЖ, надана самим пацієнтом, є цінним та надійним показником його загального стану, оскільки ці дані поряд із традиційним медичним висновком, дозволяють скласти повну та об’єктивну картину захворювання. Оцінка ЯЖ дає змогу точніше оцінити порушення стану здоров’я пацієнтів, ясніше побачити суть клінічної проблеми, вибрати найбільш раціональний метод терапії, а також дати оцінку очікуваним результатам за параметрами, які перебувають на межі наукового підходу та суб’єктивної точки зору пацієнта [1, 14, 40].
Відомо, що хронічний і невиліковний характер псоріазу негативно впливає на ЯЖ пацієнтів. Досліджуючи ЯЖ хворих на псоріаз, науковці зазначають, що ці пацієнти менш соціально активні: 72 % відмовляються від відвідування басейну; 64 % – саун, бань; 55 % – відчувають сором; 50 % – уникають людних місць; 46 % – зазначають негативний вплив на статеве життя; 46 % – носять закритий одяг для того, щоб приховати висипання; 40 % – відмовляються від занять спортом; 34 % – не користуються послугами перукаря; 15 % – відчувають страх втратити роботу через захворювання; 41 % опитаних вважають лікування і все, що з ним пов’язане, значно більшою проблемою, ніж сам псоріаз [103] .
Психометричні шкали – метод, що дає змогу оцінити ЯЖ хворих [27, 28] та є об’єктивним способом для оцінки суб’єктивних факторів.
Під час нашого дослідження була виконана оцінка ЯЖ обстежених пацієнтів за допомогою спеціальних дерматологічних психометричних шкал: DLQI та Індексу недієздатності при псоріазі PDI.
6.1 Оцінка якості життя обстежених пацієнтів за допомогою опитувальника з якості життя пацієнтів з дерматологічними проблемами
Ця шкала охоплює основні параметри ЯЖ: симптоми/самопочуття, повсякденну активність, приватне життя, лікування. Опитувальник простий у використанні, пацієнти самостійно без сторонньої допомоги після короткого інструктажу заповнюють анкету.
Результати отриманих під час анкетування даних інколи відрізнялися від даних об’єктивного обстеження пацієнтів. Зокрема, виявлена деяка гендерна залежність показників: ЯЖ пацієнтів чоловічої статі дещо нижча, ніж у жінок, що може свідчити про те, що жінки займають більш активну життєву позицію, і, можливо, більш адаптовані. При опрацюванні отриманих даних було виявлено, що на ЯЖ пацієнток найбільш негативно впливає косметичний дефект шкіри (висипання), що значною мірою позначається на їх психоемоційному стані. Опитані мужчини свідчать, що псоріаз найбільш суттєво впливає на їх суспільну активність та на інтимні стосунки. Також виявилося, що суттєвіший вплив псоріазу на ЯЖ зазначають респонденти, які працюють чи навчаються, ніж ті, що не працюють. Вік пацієнтів вірогідно не впливав на зміну їх ЯЖ. Між значенням індексу DLQI та рівнем життя існує обернена залежність. Нижчими є показники ЯЖ у пацієнтів із тривалістю захворювання до 10 років; часті рецидиви також особливо негативно впливають на показники ЯЖ. Спільною для усіх респондентів ознакою є обернена залежність рівня ЯЖ пацієнта від ступеня важкості перебігу псоріазу (табл. 6.1).
З використанням оцінки вираженості впливу захворювання на ЯЖ пацієнта можна стверджувати, що легкий перебіг псоріазу значно впливає на ЯЖ хворого (11-20 балів), а перебіг середньої важкості призводить до істотного її погіршення (21-30 балів). Аналіз результатів анкетування за допомогою DLQI за окремими складовими ЯЖ хворих, що перебували під спостереженням, поданий у табл. 6.2.
Таблиця 6.1 – Характеристика ЯЖ пацієнтів залежно від ступеня важкості перебігу псоріазу
| Ступінь важкості перебігу дерматозу | Кількість хворих | DLQI (М ± m),
бали |
|
| Абс. ч. | % | ||
| Легкий | 31 | 44 | 17,47±1,2 |
| Середній | 39 | 56 | 23,18±1,5 * |
| Усього | 70 | 100 | 20,33±1,4 |
Примітка. * – p<0,01 щодо псоріазу легкого ступеня
Таблиця 6.2 – Аналіз анкетування DLQI за окремими складовими ЯЖ пацієнтів
| Параметри ЯЖ | Кількість балів у нормі | DLQI (М ± m), бали |
| Симптоми/ самопочуття | до 6 | 4,13±2,8 |
| Повсякденна активність | до 6 | 3,68±1,6 |
| Дозвілля пацієнтів | до 6 | 3,0±2,9 |
| Робота та навчання | до 3 | 4,13±2,8 |
| Особисті стосунки | до 6 | 5,16±1,2 |
| Лікування | до 3 | 3,0±0,1 |
Отримані результати анкетування за допомогою DLQI ілюструють негативний вплив псоріазу на основні параметри ЯЖ пацієнтів: можливість повноцінно виконувати повсякденні завдання, можливість працювати чи навчатися, на особисті (зокрема інтимні) стосунки, на бажання лікуватися.
6.2 Оцінка якості життя обстежених пацієнтів за допомогою опитувальника „Псоріатичний індекс порушень”
Використана у цій роботі версія складається із 15 питань, які охоплюють повсякденну активність пацієнта, роботу/школу, особисті стосунки, відпочинок, лікування. Індекс обчислюють методом Tick-box, який полягає у підрахунку виставлених за кожне запитання балів. Aмплітуда коливання показників індексу від 0 до 45 балів, більше значення показників індексу відповідає нижчому рівню ЯЖ опитуваного (табл. 6.3).
Таблиця 6.3 – Аналіз анкетування PDI за окремими складовими ЯЖ пацієнтів
| Параметри ЯЖ | Максимально можлива кількість балів |
PDI
(М±m), бали |
Відсоток від максимальної кількості балів |
| Повсякденна активність | 15 | 10,38±2,2 | 69,2 % |
| Дозвілля пацієнтів | 12 | 6,55±1,7 | 54,6 % |
| Робота та навчання | 9 | 7,0±1,5 | 77,8 % |
| Особисті стосунки | 6 | 4,31±2,4 | 71,8 % |
| Лікування | 3 | 2,67±0,3 | 89 % |
* * *
Таким чином, псоріаз, як один із поширених хронічних невиліковних дерматозів, виражено впливає на зниження показників ЯЖ пацієнтів. Психометричні шкали є простим доступним методом оцінки стану пацієнта, включаючи всі аспекти його життя, даючи змогу більш влучно дібрати лікування, оцінити результати терапії, а у подальшому – тактику ведення таких хворих.
Основні тези цього розділу висвітлені в таких працях:
- Возняк І.Я. Вивчення якості життя у пацієнтів з псоріатичною хворобою / І.Я. Возняк, Т.В. Святенко // Дерматовенерологія. Косметологія. Сексопатологія. – 2009. – № 1-2 (12). – С. 273–275.
- Возняк І.Я. Роль психометричних шкал в дерматологічній практиці / І.Я. Возняк, Т.В. Святенко // Матер. наук.-практ. конф. «Резистентні до терапії хронічні дерматози, пов’язані з віком», 25-26 березня 2010 р., м. Київ. – К., 2010. – С. 29.
- Возняк І.Я. Доцільність визначення функціональних проб якості життя у пацієнтів з псоріатичною хворобою / О.О. Сизон, І.Я. Возняк // Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я : матер. наук.-практ. конф. (з міжнар. участю), м. Харків, 26 березня 2015 р. : зб. наук. пр. / За ред. П. П. Рижка. – Харків, 2015. – Вип. 12. – С. 75–77.
РОЗДІЛ 7
АНАЛІЗ ЕФЕКТИВНОСТІ ЛІКУВАННЯ ПСОРІАЗУ
7.1 Рекомендовані методи лікування
Високий рівень захворюваності на псоріаз, хронічний рецидивуючий характер дерматозу, а також результати проведених досліджень, що дали змогу виявити порушення імунологічних, ІГХ, патоморфологічних показників, стали підставою для розробки та вивчення ефективності комплексного патогенетично обґрунтованого методу лікування із таргетним впливом на основні промоутери імунного запалення та неоангіогенезу.
Лікування псоріазу проводили з урахуванням ступеня важкості перебігу дерматозу та відомих ланок етіопатогенезу. Сьогодні не існує єдиного визначення ступенів важкості перебігу псоріазу, а одним з таких методів є індекс PASI, який найчастіше застосовують дерматологи [1, 23, 36]. Обчислення цього індексу ґрунтується на визначенні поширеності патологічних висипань та оцінці еритеми, інфільтрації та лущення морфологічних елементів.
Як було описано вище, всі хворі пацієнти з поширеним вульгарним псоріазом (L40.0) в прогресуючій стадії, легкого та середнього ступеня важкості перебігу, чоловічої та жіночої статі віком 24-58 років, із стажем захворювання понад один рік, у котрих не діагностована жодна інша шкірна патологія, які дали інформовану згоду на участь в дослідженні, були рандомізовано поділені на три групи залежно від методу лікування: ОГ – 25 пацієнтів; П1 – 25 пацієнтів та П2 – 20 пацієнтів.
Хворі П2 приймали засоби, які застосовують традиційно при лікуванні псоріазу вульгарного легкого та середнього перебігу [37, 48, 49], що містили вітаміни групи В; гіпосенсибілізуючу терапію (тіосульфат натрію), антигістамінні препарати, зовнішні кератолітичні та зволожуючі засоби.
Схема лікування хворих на псоріаз звичайний (П2) наведена в табл. 7.1.
Таблиця 7.1 – Схема лікування пацієнтів П2
| Хворі на ПВ
n=20 |
Назва лікарських засобів | ||
| Тіосульфат натрію | Нейрорубін | Хлоропірамін | |
| + | + | + | |
Примітка. «+» призначено засіб; «–» не призначено
Хворі, що увійшли до П1, окрім традиційної терапії додатково приймали надропарин кальцію (представник низькомолекулярних гепаринів) з метою інгібування фактора росту некрозу пухлин-альфа як ключового прозапального цитокіну в етіопатогенезі псоріазу [10, 130, 131, 134].
Схема лікування хворих на псоріаз вульгарний (П1) подана в табл. 7.2.
Таблиця 7.2 – Схема лікування пацієнтів П1
| Хворі на ПВ
n=25 |
Назва лікарських засобів | |||
| Тіосульфат натрію | Нейрорубін | Хлоропірамін | Надропарин кальцію | |
| + | + | + | + | |
Примітка. «+» призначено засіб; «–» не призначено
Хворі, що становили основну групу порівняння, окрім традиційної терапії та адеметіоніну для інгібування основних промоутерів неоангіогенезу – VEGF та ММП-9 – додатково приймали надропарин кальцію (представник низькомолекулярних гепаринів) з метою інгібування фактора росту некрозу пухлин альфа як ключового прозапального цитокіну в етіопатогенезі псоріазу.
Схема лікування хворих на псоріаз (ОГ) подана в табл. 7.3.
Таблиця 7.3 – Схема лікування пацієнтів ОГ
| Хворі на ПВ
n=25 |
Назва лікарських засобів | ||||
| Тіосульфат натрію | Нейрорубін | Хлоропі-рамін | Адеметіо-нін | Надропа-рин кальцію | |
| + | + | + | + | + | |
Примітка. «+» призначено засіб; «–» не призначено
При лікуванні хворих на псоріаз ми враховували підвищену активність промоутерів неоангіогенезу, тому в комплексну схему терапії пацієнтів ОГ та П1, як свідчать дані табл. 7.2, включено засіб, який має здатність пригнічувати активність факторів росту судин – адеметіонін.
Адеметіонін – S-аденозил-L-метіонін, натуральна амінокислота, що є практично у всіх тканинах та біологічних середовищах організму. Адеметіонін, перш за все, діє як коензим та донор метильної групи у багатьох реакціях трансметилювання. Одна таблетка у кишково розчинній капсулі препарату містить 400 мг адеметіоніну, дозування – 1 раз на добу.
Беручи до уваги результати новітніх та власних досліджень, розглядаємо псоріаз як імунозалежний дерматоз, ключовим прозапальним пусковим цитокіном якого є фактор некрозу пухлин-альфа. До терапевтичної схеми пацієнтів ОГ був включений надропарин кальцію, який має імунодепресивну, цитостатичну, протизапальну, гіпосенсибілізуючу дію, а також антимітотичну дію за рахунок гальмування мітозу в його заключній стадії [134, 139, 144, 155].
Надропарин кальцію – низькомолекулярний гепарин, отриманий із стандартного гепарину методом де полімеризації; є глікозаміногліканом із середньою молекулярною масою 4300 Да. Розчин надропарину кальцію для ін’єкцій міститься у шприцах, має 2850 МО анти-Ха об’ємом 0,3 мл. Оскільки, розчин надропарину кальцію для ін’єкцій не призначений для внутрішньо м’язового введення, а лише для підшкірного, тому ми його вводили підшкірно в лежачому положенні пацієнта в передньолатеральну ділянку черевної стінки, почергово справа та зліва. Голку вводять перпендикулярно поверхні шкіри (а не під кутом) в складку шкіри, стиснену великим і вказівним пальцями. Для цього необхідно підняти (не здавлюючи) складку шкіри між пупком і гребенем клубової кістки, провести пробну аспірацію, щоб переконатися в тому, що голка не потрапила в кровоносну судину. Складку слід утримувати протягом усього введення препарату. Після завершення маніпуляції місце введення не можна масажувати чи розтирати. Крім цього, у виняткових випадках можна проводити ін’єкції у верхню ділянку плеча і стегна.
Цей засіб має низку переваг:
– на відміну від нефракціонованих гепаринів, у надропарину кальцію значно краща прогнозованість антитромботичного ефекту через відсутність зв’язування з білками плазми крові і мембранами ендотеліоцитів; відповідно терапія не вимагає дуже ретельного індивідуального лабораторного контролю;
– більш висока біодоступність (до 90 % після глибокої підшкірної ін’єкції) низькомолекулярних гепаринів, що дає змогу призначати їх підшкірно не тільки з профілактичною, а й з лікувальною метою;
– застосування низькомолекулярного гепарину не потребує моніторування стану системи згортання крові за допомогою коагулограми (яка доступна, на жаль, не у всіх лікувально-профілактичних закладах країни), що є привабливою й практичною альтернативою складній та ненадійній процедурі антикоагулянтної терапії за допомогою нефракціонованих гепаринів;
– надропарин кальцію мало впливає на первинний гемостаз, адгезію та агрегацію тромбоцитів, є слабким антикоагулянтом – виявляє незначний вплив на коагуляційні тести, має мінімальний геморагічний ефект, що зумовлює мінімізацію ризику виникнення кровотеч як побічного ефекту;
– у профілактичних дозах практично не впливає на тривалість кровотечі, тривалість згортання крові і активований частковий тромбопластиновий час (АЧТЧ);
– нефракціоновані гепарини мають також здатність підсилювати агрегацію тромбоцитів, після припинення введення препарату можливий феномен рикошету;
– період напіввиведення надропарину кальцію 4-10 год, що дає змогу зменшити кратність введень за добу;
– у надропарину кальцію небезпека виникнення імунозалежної тромбоцитопенії значно нижча, порівняно з нефракціонованими гепаринами, та становить лише 1-3 %.
Недоліком низькомолекулярних гепаринів в комплексних схемах лікування псоріазу являється їх здатність потенціювати дію цитостатиків та глюкокортикостероїдів, ПУВА-терапії.
Як вітамінотерапію використовували ін’єкційний препарат нейрорубін (1 ампула препарату (3 мл) містить: тіаміну гідрохлорид – 100 мг; піридоксину гідрохлорид – 100 мг; ціанокобаламін – 1 мг та допоміжні речовини). Нейрорубін призначали в дозуванні 1 ампула (3,0 мл) в/м один раз на день.
Нейрорубін – комплексний вітамінний препарат, що містить водорозчинні вітаміни групи В. Вітаміни групи В мають широкий спектр біологічної активності, не зважаючи на схожість фармакологічних ефектів кожен із вітамінів виявляє специфічну дію на організм людини. Серед іншого: вітамін В1 бере активну участь у вуглеводневому обміні, регулює білковий обмін, в жировому обміні регулює утворення жирних кислот та каталізує перетворення вуглеводів у жири; впливає на проведення нервових імпульсів у нервових структурах. Вітамін В6 бере участь у синтезі ферментів, білковому та жировому обмінах. Активна форма цього вітаміну виступає в ролі кофермента в різноманітних ферментативних реакціях, регулює синтез гемоглобіну, а також нейромедіаторів в синапсах центральної та периферичної системи, до того ж регулює синтез гемоглобіну. Вітамін В12 відіграє важливу роль у білковому обміні, регулює синтез амінокислот, пуринів і нуклеїнових кислот. Ціанокобаламін виявляє антианемічний ефект, нормалізує систему згортання крові.
У ролі гіпосенсибілізуючого засобу був призначений розчин тіосульфату натрію 30 % 10,0 мл в/в один раз на добу.
Для зняття свербежу, явищ невротичного характеру та порушень сну був призначений антигістамінний препарат хлоропірамін в/м 20 мг 1,0 мл.
Усім пацієнтам призначене місцеве лікування. Як кератолітичний засіб використовували 2 % саліцилову мазь, яку наносили на уражені ділянки шкіри, кратність нанесень варіювали залежно від клініки. З метою зволоження та зменшення свербежу застосовували емолієнт Lipikar Baume AP двічі на день протягом усього курсу лікування.
7.2 Динаміка імуноморфологічних показників у хворих на псоріаз після лікування
При лікуванні хворих на псоріаз ми враховували імуноморфологічні особливості і результати низки імунологічних та ІГХ досліджень у пацієнтів після лікування з метою з’ясування динаміки цих показників. Дані імунологічних та ІГХ показників до та після лікування наведено у табл. 7.4 – 7.6.
Після проведеного лікування в усіх групах спостерігали зниження активності запалення (старіння бляшок). При ІГХ аналізі кількість нейтрофілів різко знизилася, але невелика кількість мононуклеарів завжди була наявною в нижче розташованих рівнях супрапапілярного епідермісу. Дермальний запально-клітинний інфільтрат ставав дедалі менш важким, ніж в ранніх ушкодженнях та на стадії папули до початку лікування. Він містив активовані CD3+ Т-лімфоцити, але значно менше CD68+ макрофагів, ніж в матеріалі, взятому до початку терапії, і зовсім одиничні нейтрофіли. Клітини Лангерганса, чия кількість в епідермісі значно не змінювалась при зниженні запалення, характеризувалися втратою розгалужених відростків, що на стадії папули контактували з кератиноцитами усіх шарів епідермісу, виконуючи свою антигенпрезентуючу функцію.
Таблиця 7.4 – Динаміка імунологічних та ІГХ показників у хворих на псоріаз (ОГ) після лікування (М±m, n=25)
| Показник | До лікування | Після лікування | рл в динаміці |
| CD3 епідерм | 28,67±3,82 | 10,17±0,40 | <0,001 |
| CD3 дерма | 75,18±5,37 | 20,72±0,78 | <0,001 |
| CD68 епідерм | 2,69±0,19 | 1,49±0,07 | <0,001 |
| CD68 дерма | 11,26±0,92 | 4,80±0,15 | <0,001 |
| Ki-67 | 36,02±3,47 | 18,08±1,16 | <0,001 |
| VEGF | 2,88±0,23 | 1,50±0,19 * | <0,001 |
| CD34 | 17,02±1,65 | 6,71±0,39 | <0,001 |
| р63 | 73,02±2,71 | 20,47±0,75 | <0,001 |
| S100 епідерм | 7,20±0,84 | 5,49±0,24 | <0,05 |
| S100 дерма | 6,47±0,47 | 5,14±0,22 | <0,05 |
| ММП-9 | 3,0±0,27 | 1,50±0,19 | <0,001 |
| TNF-α, пг/мл | 19,75±1,92 | 7,79±0,38 * | <0,001 |
Примітки:
- рл – рівень значущості різниці показників до і після лікування.
- * – р>0,05 щодо контрольної групи, в інших випадках від p<0,05 до p<0,001
Плазматичні клітини і еозинофіли були відсутні в нашому дослідженні при псоріатичних ушкодженнях на всіх етапах розвитку, але деякі автори [190] описують виявлення еозинофільного катіонного протеїну в верхній третині епідермісу шкіри та наявність плазматичних клітин у пацієнтів з ВІЛ-інфекцією, що потребує подальшого детального дослідження.
Під час проведення терапії в епідермісі верифікувалося «булавоподібне» потовщення нижніх рівнів сітки акантотичних тяжів (рис. 7.1 А) зі зливанням їх в загальне поле і деяким потовщенням надсосочкових пластинок (рис. 7.1 Б). Подальші зміни характеризувалися ортокератозом (нормалізацією процесів зроговіння), відновленням зернистого шару (рис. 7.1 В) і значно меншим екзоцитозом запальних клітин в епідермісі або повною його відсутністю.
Таблиця 7.5 – Динаміка імунологічних та ІГХ показників у хворих на псоріаз (П1) після лікування (М±m, n=25)
| Показник | До лікування | Після лікування | рл в динаміці |
| CD3 епідерм | 28,89±3,80 | 9,70±0,37 | <0,001 |
| CD3 дерма | 75,04±5,32 | 24,77±1,59 | <0,001 |
| CD68 епідерм | 2,70±0,18 | 1,61±0,08 | <0,001 |
| CD68 дерма | 11,21±0,94 | 4,82±0,19 | <0,001 |
| Ki-67 | 35,74±3,31 | 18,71±0,97 | <0,001 |
| VEGF | 2,75±0,25 | 2,00±0,27 | <0,05 |
| CD34 | 16,68±1,83 | 10,76±0,89 | <0,001 |
| р63 | 72,79±2,48 | 30,27±0,61 | <0,001 |
| S100 епідерм | 7,09±0,78 | 6,38±0,13 | >0,05 |
| S100 дерма | 6,55±0,51 | 5,77±0,19 | >0,05 |
| ММП-9 | 2,88±0,23 | 1,75±0,25 | <0,05 |
| TNF-α, пг/мл | 19,68±1,86 | 8,43±0,43* | <0,001 |
Примітки:
1. рл – рівень значущості різниці показників до і після лікування.
2. * – р>0,05 відносно контрольної групи, в інших випадках від p<0,05 до p<0,001.
Під впливом терапевтичних заходів відбувався регрес папул і спостерігалося різке зниження кількості імуноцитів навколосудинних запальних інфільтратів у дермі, а в епідермісі редукувалась інтенсивність епідермальної гіперплазії та повністю реставрувався зернистий шар. Тільки судини сосочків дерми залишались розширеними (рис. 7.1 Г), хоча до цього часу навколо підвищувалась кількість фібробластів, і в цьому регіоні спостерігався помірний післязапальний фіброз.
Таблиця 7.6 – Динаміка імунологічних та ІГХ показників у хворих на псоріаз (П2) після лікування (М±m, n=20)
| Показник | До лікувавння | Після лікування | рл в динаміці |
| CD3 епідерм | 28,31±3,99 | 20,07±1,28 | <0,05 |
| CD3 дерма | 73,81±5,97 | 49,15±3,58 | <0,001 |
| CD68 епідерм | 2,74±0,22 | 1,79±0,11 | <0,001 |
| CD68 дерма | 11,36±1,06 | 5,41±0,23 | <0,001 |
| Ki-67 | 36,10±3,58 | 26,69±1,90 | <0,05 |
| VEGF | 3,00±0,22 | 2,43±0,20 | <0,05 |
| CD34 | 16,92±1,87 | 12,55±0,96 | <0,05 |
| р63 | 72,75±2,24 | 39,99±0,77 | <0,001 |
| S100 епідерм | 7,25±0,72 | 6,65±0,22 | >0,05 |
| S100 дерма | 6,60±0,49 | 6,24±0,25 | >0,05 |
| ММП-9 | 3,00±0,31 | 2,43±0,30 | >0,05 |
| TNF-α, пг/мл | 20,02±2,01 | 15,01±0,92 | <0,05 |
Примітки:
- рл – рівень значущості різниці показників до і після лікування.
- від p<0,05 до p<0,001 – в усіх випадках щодо контрольної групи.
ІГХ характеристика псоріатичних бляшок, що розрішувалися, демонструвала вірогідне зниження проліферативної активності маркера Кі-67 до рівнів (18,08±1,16) % (ОГ), (18,71±0,97) % (П1) та (26,69±1,90) % (П2), яка однак не досягла показників здорової шкіри [(6,27±0,45) %] (рис. 7.2 Б). Антиген Кі-67 – це нестійкий протеїн, що руйнується протягом 1,5-2 год, тому антитіла до Кі-67 презентують лише клітини, що активно діляться, не накопичуючись у клітинах в стані спокою. Наведені вище дані свідчать про “готовність” кератиноцитів у хворих на псоріаз до проліферативної активності після дії тригерних факторів. Вищі концентрації маркера Кі-67 після проведеної терапії свідчать про можливість рецидиву.
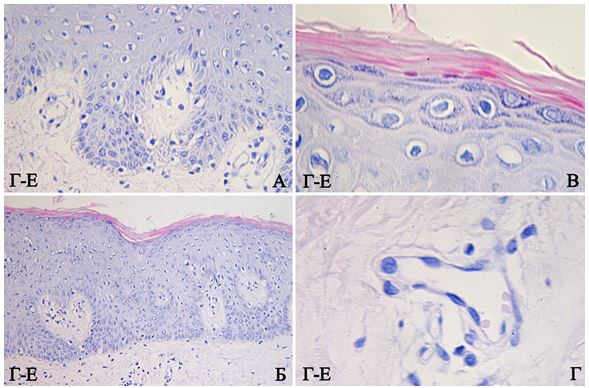 Рисунок 7.1 – Псоріаз вульгарний, старіння бляшок, забарвлення Г-Е.
Рисунок 7.1 – Псоріаз вульгарний, старіння бляшок, забарвлення Г-Е.
Примітки:
А – Булавоподібне потовщення нижніх рівнів сітки акантотичних тяжів (×400).
Б – Зливання акантотичних тяжів в загальне поле, потовщення супрапапілярних пластинок, (×200).
В – Ортокератоз (нормальне зроговіння), відновлення зернистого шару (×1000).
Г – Помірна дилятація судин дерми з мізерним запальним інфільтратом (×1000)
Після проведеної терапії при ІГХ дослідженні виявили зниження кількості клітин Лангерганса, особливо в дермі (рис. 7.2 В), повну відсутність нейтрофільної та CD3+ Т-лімфоцитарної інфільтрації епідермісу.
Базально-клітинна гіперплазія суттєво не наближувалась до показників нормальної шкіри контрольної групи [(12,21±1,04) %] після лікування в жодній з груп пацієнтів, залишаючись на рівні (20,47±0,75) % (ОГ), (30,27±0,61) % (П1) та (39,99±0,77) % (П2), що свідчить про порушення диференціювання кератиноцитів цієї ділянки і можливість раннього рецидиву (рис. 7.2 Г).
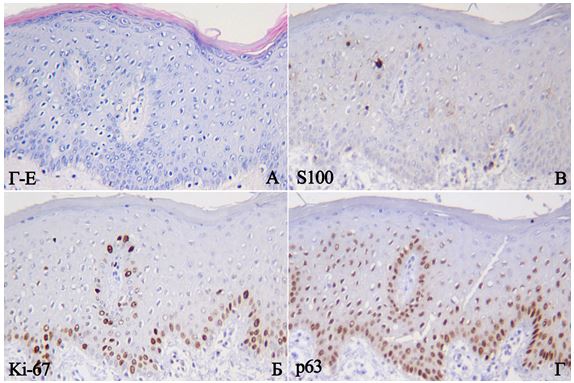 Рисунок 7.2.
Рисунок 7.2.
Примітки:
А – Псоріатична бляшка, що загоюється, забарвлення Г-Е (×400).
Б – Інтрануклеарна реакція проліферуючих кератиноцитів базального шару епідермісу з маркером Кі-67, індекс проліферації на рівні 8-10 %, ІГХ метод (×400).
В – Змішана реакція клітин Лангерганса з маркером S100, ІГХ метод (×400).
Г – Інтрануклеарна реакція маркера р63 в кератиноцитах з базально-клітинним диференціюванням, ІГХ метод (×400)
Для визначення кількісних і структурних змін мікроциркуляторного русла у хворих на псоріаз до та після проведення лікування за запропонованими схемами визначали щільність мікросудин та їх кількість за мембранною реакцією ендотелію з маркерами CD34.
Інтенсивність васкуляризації шкіри, що виражалась показником щільності мікросудин з маркером CD34, отримали після лікування у пацієнтів ОГ (6,71±0,39) % (до лікування (17,02±1,65) %; p<0,001), у П1 знизився після терапії до (10,76±0,89) % (до лікування (16,68±1,83) %; p<0,001) та до рівня (12,55±0,96) % у П2 (до лікування (16,92±1,87) %; p<0,05), але залишався вірогідно вищим за показники здорової шкіри [(4,32±0,67) %] (рис. 7.3).
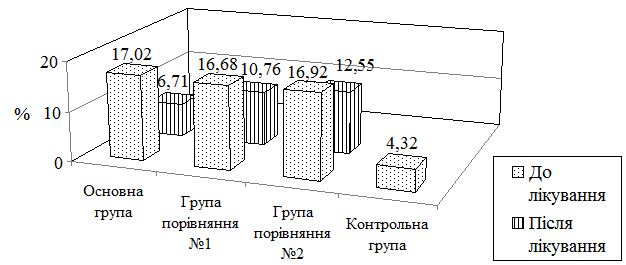 Рисунок 7.3 – Динаміка рівня маркера CD34 після проведення лікування
Рисунок 7.3 – Динаміка рівня маркера CD34 після проведення лікування
Зміна показника інтенсивності васкуляризації шкіри, вираженого маркером фактора росту судин VEGF, до і після лікування зображена на рис. 7.4.
Ці дані свідчать, що рівень фактора росту судин суттєво знизився у хворих ОГ, які застосовували комплексне лікування, запропоноване нами, до рівня (1,50±0,19) % (до лікування становив (2,88±0,23) %; p<0,001) та значно наблизився до аналогічного показника здорової шкіри контрольної групи [(1,20±0,13) %; p>0,05]. У пацієнтів П1 цей показник досяг позначки (2,00±0,27) % (до лікування – (2,75±0,25) %; p<0,05), у П2 – (2,43±0,20) % (до лікування – (3,00±0,22) %; p<0,05). Проте цей показник залишався вірогідно вищим за рівні контрольної групи (p<0,05).
 Рисунок 7.4 – Динаміка рівня маркера VEGF після проведення лікування
Рисунок 7.4 – Динаміка рівня маркера VEGF після проведення лікування
Розподіл значень експресії маркера ММП-9, як неспецифічного фактора росту, до та після проведення лікування у всіх групах представлено на рис. 7.5. Результати свідчать, що суттєвого зниження рівня маркера ММП-9 було досягнуто у хворих ОГ, яких лікували за модифікованою схемою, де він становив (1,50±0,19) % (до лікування – (3,0±0,27) %; p<0,001). У пацієнтів П1, яких лікували за модифікованою схемою, що не включала антагоністів промоутерів ангіогенезу, рівень ММП-9 знизився до (1,75±0,25) % (до лікування – (2,88±0,23) %; p<0,05). При традиційному підході до лікування псоріазу (П2) динаміка показників була незначною – зниження з (3,00±0,31) % до (2,43±0,30) % (p>0,05).
Проведені нами імунологічні дослідження виявили підвищення рівня цитокінів, а саме фактора некрозу пухлин, як одного з ключових прозапальних чинників в етіопатогенезі псоріазу. Зміни рівня фактора некрозу пухлин до та після терапії зображені на рис. 7.6.
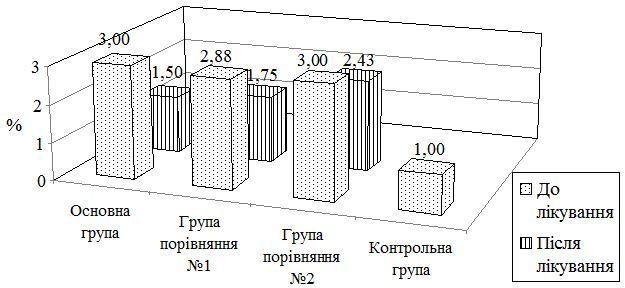 Рисунок 7.5 – Динаміка рівня маркера ММП-9
Рисунок 7.5 – Динаміка рівня маркера ММП-9
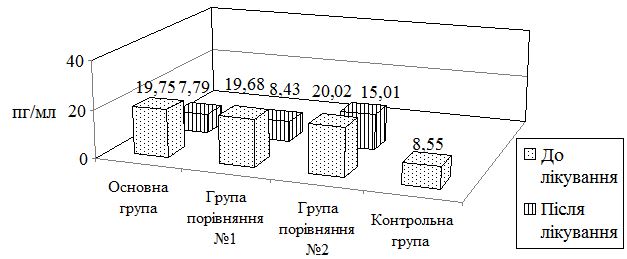 Рисунок 7.6 – Динаміка рівня фактора некрозу пухлин
Рисунок 7.6 – Динаміка рівня фактора некрозу пухлин
Показники фактора некрозу пухлин (рис. 7.6) показали суттєве зниження його рівня до (7,79±0,38) пг/мл (до лікування становив (19,75±1,92) пг/мл; p<0,001) у пацієнтів ОГ, до (8,43±0,43) пг/мл (до лікування – (19,68±1,86) пг/мл; p<0,001) у пацієнтів П1 та їх наближення до рівнів здорової шкіри [(8,55±0,47) пг/мл; p>0,05]. У хворих П2, яких лікували за стандартною схемою, не спостерігали клінічно значущого зниження цього показника – показник становив (15,01±0,92) пг/мл після лікування (до початку терапії – (20,02±2,01) пг/мл; p<0,05).
7.3 Динаміка показників якості життя у хворих на псоріаз вульгарний після лікування
Аналізуючи вплив терапевтичних схем на ЯЖ пацієнтів, можна стверджувати, що індекси ЯЖ у всіх групах достовірно знизились, що свідчить про покращення ЯЖ порівняно з даними до початку лікування. Позитивна динаміка дерматологічного статусу, виражений регрес псоріатичних висипань (особливо на відкритих ділянках тіла) мали позитивний вплив на психологічний стан хворих (рис. 7.7–7.8).
 Рисунок 7.7 – Динаміка середніх показників DLQI
Рисунок 7.7 – Динаміка середніх показників DLQI
Слід зазначити, що індекс DLQI після терапії у пацієнтів ОГ знизився суттєвіше (до лікування – (21,4±2,67) бала, після – (8,4±1,10) бала; p<0,001), аніж у пацієнтів П1 (до лікування – (19,7±2,12) бала, після – (8,5±1,33) бала; p<0,001), а тим паче П2 (до лікування – (19,9±2,58) бала, після – (14,4±1,06) бала; p<0,05).
Аналогічні тенденції до зниження показників ЯЖ під впливом лікування отримані за шкалою PDI (рис. 7.8). Індекс PDI після терапії у пацієнтів ОГ знизився з (32,53±3,14) до (17,53±2,21) бала (p<0,001), у пацієнтів П1 – з (30,0±3,58) до (18,4±2,33) бала (p<0,001), а в П2 – з (30,2±2,88) до (21,3±3,0) бала (p<0,05).
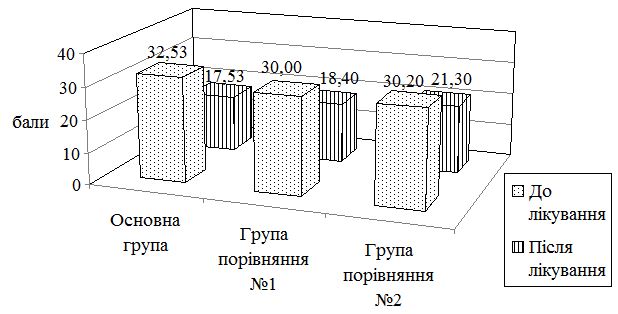 Рисунок 7.8 – Динаміка середніх показників PDI
Рисунок 7.8 – Динаміка середніх показників PDI
7.4 Динаміка показників клінічної ефективності лікування у хворих на псоріаз
Ступінь важкості захворювання було оцінено на початку терапії та через два тижні після початку лікування.
Переносимість терапії була задовільною. У місці введення надропарину кальцію у 2 пацієнтів спостерігалася незначна кровоточивість, у 3 хворих виникли геморагії в місці ін’єкції, які не являються показами до припинення застосування даного препарату. Дослідження сечі, клінічні та біохімічні аналізи крові, які проводилися хворим під час моніторингу, не виявили будь-яких відхилень від нормальних або вихідних показників.
Запропонований метод лікування хворих на псоріаз звичайний сприяв підвищенню ефективності терапії: досягнуто клінічної ремісії у 6 (24 %) та значного покращення – у 18 (72 %) пацієнтів ОГ, у П1 – 5 (20 %) та 15 (60 %) відповідно, в той час як при традиційному лікуванні – у 4 (20 %) та 5 (25 %) відповідно.
Результати оцінки ефективності запропонованих схем терапії визначали за значеннями PASI-відповіді. Регрес показників PASI у пацієнтів ОГ становив (77,12±2,94) %, у пацієнтів П1 – (57,72±7,85) %, у П2 – (21,72±1,44) %. Таким чином, ефективність запропонованих методик лікування розцінено як високу, а ефективність традиційної терапії як помірну (табл. 7.7).
Таблиця 7.7 – Динаміка показників PASI та PASI – відповіді у різних групах до та після проведеного лікування
| Параметри | Групи пацієнтів | |||||
| ОГ | П1 | П2 | ||||
| до лікування | після лікування | до лікування | після лікування | до лікування | після лікування | |
| PASI, бали | 25,3±1,4 | 5,8±0,7 | 27,2±2,1 | 12,6±2,9 | 26,3±1,6 | 20,59±1,3 |
| PASI-відповідь, % | 77,12±2,94 % | 57,72±7,85 % | 21,72±1,44 % | |||
| р до і після лікування у групі | p<0,001 | p<0,001 | p<0,01 | |||
Віддалені результати лікування оцінювали шляхом спостереження за хворими протягом одного року після закінчення терапії. Дані отриманих результатів свідчать, що у хворих ОГ, яких лікували за запропонованою схемою з додатковим використанням надропарину кальцію та адеметіоніну досягнуто клінічної ремісії у 6 (24 %) та значного покращення – у 18 (72 %) пацієнтів основної групи, у групі порівняння № 1 – 5 (20 %) та 15 (60 %) відповідно, в той час як при традиційному лікуванні – у 4 (20 %) та 5 (25 %) відповідно, рецидиви виникали у 2,7 разу рідше, ніж у П2, представників якої лікували за традиційною схемою. Важливим є те, що під час лікування запропонованими схемами дерматологічний статус був із більш вираженою позитивною динамікою, що дало змогу скоротити тривалість перебування пацієнтів на стаціонарному лікуванні.
* * *
Таким чином, доведено, що призначення хворим стандартизованих засобів, низькомолекулярного гепарину та адеметіоніну дає змогу істотно підвищити ефективність лікування у вигляді досягнення вираженого регресу клінічних проявів, більшої тривалості ремісій, зменшення виразності рецидивів і покращення ЯЖ пацієнтів. Показано, що терапевтична тактика ведення пацієнтів з псоріазом повинна бути диференційованою та індивідуально впливати на основні визначені ланки етіопатогенезу захворювання.
Основні тези цього розділу висвітлені в наступних працях:
- Voznyak I. Administration of low-molecular heparin for optimization of psoriasis treatment / I. Voznyak, T. Svyatenko, S. Volbyn, O. Syzon // Abstracts of the the 20th EADV Congress, 20-24 October 2011, Lisbon. – Lisbon, 2011. – Р. 01189.
- Voznyak I. Complex therapy of patient with dermatosis, accompanied by skin dryness / I. Voznyak, T. Svyatenko // Abstracts of the 10th Congress of the Baltic Association of dermatovenerologists, 8-9 September 2011, Riga. – Riga, 2011. – P. 26.
- Возняк И.Я. Низкомолекулярные гепарины в комплексной терапии псориаза / И.Я. Возняк, Т.В. Святенко // Материалы 6-го съезда врачей-дерматовенерологов Беларуси «Актуальные вопросы дерматовенерологии и косметологии», 24-25 ноября 2011 г., г. Витебск (Беларусь). – Витебск, 2011. – C. 241–242.
- Возняк И.Я. Возможности применения низкомолекулярних гепаринов в терапии псориаза / И.Я. Возняк, Т.В. Святенко // Матер. наук.-практ. конф. «Від клінічних настанов до уніфікованих протоколів діагностики та лікування в дерматовенерології», 21-22 березня 2013 р., м. Київ. – К., 2013. – С. 100–102.
- Возняк І.Я. Нові можливості застосування прямих антикоагулянтів / І.Я. Возняк // Журнал дерматовенерології, косметології ім. М.О. Торсуєва. – 2013. – № 1-2 (30). – С. 81–84.
- Возняк І.Я. Оптимізація лікування псоріатичної хвороби / О.О. Сизон, Т.І. Рудник, І.Я. Возняк [та ін.] // Матер. регіон. наук.-практ. шк. «Проблемні питання дерматології та ІПСШ від дитячого до похилого віку», 1-2 березня 2011 р., м. Київ. – К., 2011. – С. 19–20.
- Возняк І.Я. Профілактичні заходи важких форм псоріатичної хвороби / О.О. Сизон, І.Я. Возняк // Матер. Всеукр. наук.-практ. конф. дерматовенерологів та косметологів з міжнар. участю „Нові іноваційні програми в дерматовенерології та косметології”, 14 квітня 2011 р., м. Харків. – Дерматологія та венерологія. – 2011. – № 2 (52). – С. 150.
- Возняк І.Я. Удосконалення способу лікування псоріаз вульгарного / І.Я. Возняк, О.О. Сизон, Г.Є. Асцатуров // Матер. наук.-практ. конф. з міжнар. участю «Прикарпатські дерматовенерологічні дні», присвяч. 70-річчю КЗІФОКШВД, м. Яремче, 15-16 травня 2014 р. – Яремче, 2014. – С. 29–30.
- Возняк І.Я. Місцева терапія при псоріазі: проблеми та шляхи їх розв’язання / І.Я. Возняк, Т.В. Святенко // Український журнал дерматології, венерології, косметології. – 2009. – № 3 (34). – С. 13–16.
- Возняк І.Я. До лікування дерматозів що супроводжуються сухістю шкіри / І.Я. Возняк, О.О. Сизон, Т.Є. Дасюк // Матер. наук.-практ. шк. «Досвід наукового пошуку молодих вчених дерматовенерологів», 25 листопада 2010 р., м. Київ. – К., 2010. – С. 24.
- Voznyak I. Complex therapy of patient with dermatosis, accompanied by skin dryness / I. Voznyak, T. Svyatenko // Abstracts of the 10th Congress of the Baltic Association of dermatovenerologists, 8-9 September 2011, Riga. – Riga, 2011. – P. 26.
РОЗДІЛ 8
АНАЛІЗ ТА ОБГОВОРЕННЯ ОТРИМАНИХ РЕЗУЛЬТАТІВ ДОСЛІДЖЕНЬ
Проблема вивчення псоріазу обумовлена перманентним зростанням рівня захворюваності, варіабельністю клінічного перебігу, нерідким розвитком атипових форм дерматозу, резистентних до будь-яких традиційних засобів терапії, зменшенням термінів ремісій при тяжких та атипових формах. Сьогодні найбільш обґрунтованою теорією етіопатогенезу псоріазу вважається імунна, згідно якої активація Т-клітин являється ключовим моментом в каскаді взаємодій між клітинами запального інфільтрату, кровоносних судин та кератиноцитами, що призводить до розвитку клінічних проявів псоріазу.
У зв’язку з цим, особливої значущості набуває комплексне вивчення процесів імуногенезу псоріазу залежно від важкості перебігу захворювання, що зробить обґрунтованою їх корекцію та підвищить ефективність лікування хворих на даний дерматоз. Тому актуальним було провести дослідження патоморфологічних, імунологічних, ІГХ показників хворих на вульгарний псоріаз різного ступеня важкості перебігу.
У ході роботи нами було обстежено 70 хворих на псоріаз звичайний та 20 практично здорових осіб без відповідної патології. Серед хворих на псоріаз незначно переважали особи чоловічої статі 41 (59 %) особи та 29 (41 %) особи жіночої статі). Розподіл пацієнтів за віком вказував на більшу поширеність захворювання серед осіб зрілого (59 %) та середнього (31 %) віку, на який припадає період максимального розквіту трудової та соціальної активності людини. У структурі досліджуваних пацієнтів переважали мешканці міста 49 (70 %) у порівнянні із хворими, що проживають у сільській місцевості – 21 (30 %) (p<0,001). Серед осіб, що навчаються, було 8 (11 %) випадків, працюючих – 26 (37 %) та тих, які не працюють – 36 (52 %). Сімейний характер ПХ виявлено у 11 (15 %) обстежених.
Серед факторів, які передували первинній появі шкірних проявів захворювання відмічали: стресові ситуації констатовано у 24 (34 %) випадках, зловживання алкоголем – у 5 (7 %), мікробно-вірусний чинник – у 7 (10 %) осіб, травма – у 6 (9 %), шкідливості виробництва – у 1 (1 %). Причини початку захворювання не зазначило 27 (39 %) осіб. Зимовий тип дерматозу зафіксовано у 31 (44 %) пацієнта, весняно-літній у – 4 (6 %) та недиференційований – у 35 (50 %). Серед обстежених пацієнтів помірно рецидивуючий перебіг дерматозу виявлено у 24 (34 %) осіб, часто рецидивуючий перебіг – 40 (57 %) та безперервно рецидивуючий перебіг – у 6 (9 %) пацієнтів. Серед пацієнтів, що перебували під спостереженням, за значенням індексу PASI у 31 (44 %) хворого виявлено легкий ступінь перебігу псоразу, у 39 (56 %) – середній ступінь важкості перебігу.
Вибірку остежених склали хворі з розповсюдженим вульгарним псоріазом (L40.0) в прогресуючій стадії, легкого та середнього ступеня важкості перебігу, чоловічої та жіночої статі віком 24-58 років, із анамнезом захворювання більше 1-го року, у котрих не діагностована жодна інша шкірна патологія, які дали авторам інформовану згоду на участь в дослідженні.
Для з’ясування взаємозв’язку послідовних змін неоангіогенезу, запальної інфільтрації та порушення дозрівання кератиноцитів проведено ряд морфологічних та ІГХ досліджень.
Ранні зміни ураженої псоріазом шкіри проявлялися у вигляді розширення та звивистості судин сосочків дерми і помірних периваскулярних лімфоцитарних інфільтратів з невеликим набряком навколишньої строми. У декількох випадках у верхніх шарах епідермісу було відмічено легкий екзоцитоз Т-лімфоцитів. Маркер CD34, що дає специфічну мембранну/субмембранну реакцію з ендотелієм судин допоміг більш детально оцінити якісні та кількісні зміни структури судин на ранніх стадіях розвитку псоріазу. З’ясувано, що псоріатично ушкодженні ділянки дерми, в середньому, мали (16,87±1,07) мікросудини при збільшенні (×400), що відповідає рівню помірної васкуляризації (11-20 капілярів). Нормальна шкіра контрольної групи мала середній показник 4,32±0,67 при (×400) на рівні слабкої васкуляризації (4-10 капілярів), що статистично вірогідно відрізнялося від загальної групи хворих на псоріаз (р<0,001). Виявили, що кількість судин у спостереженнях з середнім ступенем важкості вдвічі більша, ніж при легкому перебігу псоріазу (р<0,001), і в 5,1 разу більше, ніж в контрольній групі (р<0,001).
Ангіогенез завжди супроводжується підвищенням експресії VEGF. ІГХ дослідження біоптатів шкіри з маркером VEGF навіть на початку розвитку захворювання виявили у пацієнтів значно підвищену експресію фактору росту ендотелію судин в кератиноцитах епідермісу (окрім зроговілого шару) та в ендотелії судин і навколосудинних інфільтратах дерми псоріатично ушкоджених ділянок, порівняно з нормальною шкірою пацієнтів контрольної групи. Інтенсивність забарвлення псоріатично змінених ділянок шкіри відповідала здебільшого третій категорії – сильна реакція (більша кількість інтенсивно забарвлених клітин) – у 63 % випадків, тоді як нормальний епідерміс контрольної групи з маркером VEGF завжди давав помірну (20 %) або слабку реакцію (80 %) – другої та першої категорій забарвлення (р<0,001). При цьому виявлено помірний кореляційний зв'язок між збільшенням інтенсивності експресії маркеру VEGF і підсиленням важкості перебігу псоріазу (r=+0,430; p<0,05). Експресія маркера VEGF у пацієнтів із легким перебігом дерматозу була помірною у 9 (29 %), вираженою у 22 (71 %) випадках. У пацієнтів із середнім ступенем важкості перебігу помірною – у 13(33 %), високою – у 19 (49 %) та надмірною у 7 (18 %) випадках. Серед осіб контрольної групи слабка експресія маркери відмічалася в 16 (80 %) та помірна у 4 (20 %) випадках.
Видовження акантотичних тяжів за рахунок проліферації кератиноцитів базального рівня з зупинкою їхнього подальшого диференціювання призводить до базально-клітинної гіперплазії, що можна побачити завдяки ІГХ дослідженню з маркером базально-клітинної диференціації р63. Індекс експресії маркеру р63 загальної групи розрахований на 100 кератиноцитів в середньому склав (72,86±1,41) %, що у 6 разів перевищує аналогічний показник контрольної групи – (12,21±1,04) % (р<0,001). Виявлено підвищення індексу базально-клітинної гіперплазії в псоріатично зміненій шкірі, яке набуває надмірних значень, порівняно з контрольною групою (р<0,001), але не залежить від важкості перебігу (р>0,05 між групами з легкою та середньою важкістю перебігу псоріазу), що свідчить про універсальність проявів порушення дозрівання кератиноцитів, типовість перебігу псоріазу.
Для більш ефективної ідентифікації мітотично-активних клітин базального шару використовували маркер клітинної проліферації Кі-67. ІП у хворих на псоріаз склав (35,95±2,07) %, що суттєво перевищувало показник ІП здорової шкіри у пацієнтів контрольної групи – (6,27±0,45) % (р<0,001). З’ясовано, що індекс проліферації кератиноцитів епідермісу прогресивно збільшувався порівняно з показниками здорової шкіри контрольної групи (6,27±0,45) %, включаючи групу легкого ступеня – (23,01±1,34) % (р<0,001), до показників спостережень псоріазу середньої важкості – (41,61±1,29) % (р<0,001). Отже, мітогенна активність всіх клітин базального і значної частини шипуватого шарів епідермісу прямо пропорційно залежала від активності запалення, що корелює з важкістю перебігу псоріазу (r=0,451; p<0,05).
Для визначення співвідношення Т-лімфоцитів, клітин Лангерганса та макрофагів в периваскулярних інфільтратах на стадії папули були проведені ІГХ дослідження з маркерами CD3 (Т-лімфоцити), S100 (клітини Лангерганса) та CD68 (макрофаги), що дають специфічну реакцію з відповідними клітинами. Як свідчили результати досліджень, на 1 клітину Лангерганса приходилося, в середньому, 2-3 CD68+ макрофага, 3-4 нейтрофіла та 10-15 CD3+ Т-лімфоцита. Відмічалась нерівномірність інфільтрації з густішою концентрацією клітин в шипуватому та базальному шарах навколосудинних сосочків. Кількість Т-лімфоцитів в епідермісі була в декілька разів менша, порівняно з периваскулярними інфільтратами дерми, звідки починається екзоцитоз запальних клітин. Середні показники внутрішньоепідермального розташування CD3+ Т-лімфоцитів в 10 полях зору (×400) склали (28,63±2,13) клітини, внутрішньодермального – 74,71±3,05, індекси співвідношення епідермально/дермального розташування CD3+ Т лімфоцитів визначилися на рівні 0,38±0,03. Для порівняння показники контрольної групи здорової шкіри склали: в епідермісі – 4,17±0,02 (р<0,001), у дермі – 8,11±0,08 (р<0,001), індекс епідермально/дермального розташування CD3+ Т-лімфоцитів – 0,51±0,04 (р<0,05).
При порівнянні чисельності клітин Лангерганса в епідермісі і дермі, визначався рівномірний розподіл цих клітин з невеликою перевагою інтраепідермального розташування. Середні показники інтраепідермального розташування клітин Лангерганса в 10 полях зору (×400) становили (7,18±0,46) клітини; відповідні показники інтрадермального скупчення (переважно навколо судин) склали 6,54±0,29, а індекс співвідношення епідермально/дермального розташування клітин Лангерганса в стадію папули становив 1,11±0,03. У пацієнтів контрольної групи виявили наступні середні значення кількості клітин Лангерганса здорової шкіри: в епідермісі – 4,24±0,15 (р<0,05), у дермі – 1,89±0,05 (р<0,001), індекс епідермально/дермального розташування в здоровій шкірі – 2,24±0,05 (р<0,01), що свідчило про статистично значиме підвищення чисельності клітин Лангерганса при псоріазі вульгарному, порівняно з контрольною групою.
При дослідженні макрофагального компоненту запальної інфільтрації була виявлена зворотна тенденція, а саме: найбільшу кількість CD68+ клітин відмічали навколо судин в сосочках дерми, і лише поодинокі інтраепідермальні макрофаги в базальному шарі епідермісу, що допомогла з’ясувати специфічна цитоплазматична реакція з маркером CD68. При цьому середні показники внутрішньоепітеліального розташування CD68+ макрофагів в 10 полях зору (×400) склали (2,71±0,11) клітини; показники внутрішньодермального розповсюдження – 11,27±0,59, індекс співвідношення епідермально/дермального розташування CD68+ макрофагів при псоріазі дорівнював 0,24±0,01, при цьому показники контрольної групи були наступними результати: в епідермісі CD68+ макрофагів налічувалося 1,01±0,01 (р<0,01), у дермі – 3,35±0,04 (р<0,001), індекс епідермально/дермального розташування склав 0,30±0,02 (р<0,01).
Згідно результатів дослідження, розподіл CD3+, CD68+ мононуклеарів і S100+ дендритних клітин в епідермісі та дермі також змінювався залежно від ступеня важкості перебігу псоріазу. Кількість активованих Т-лімфоцитів прогресивно збільшувалась, і в епідермісі, і в дермі досліджених біоптатів, та найбільших значень набула при псоріазі середньої важкості 33,42±3,54 / 89,19±5,16, порівняно з контрольною групою (р<0,05) і групою легкого ступеня важкості перебігу (р<0,01).
Статистично вірогідна різниця інтенсивності макрофагальної інфільтрації в епідермісі і в дермі досліджених біоптатів за маркером CD68 була виявлена як між двома групами дослідження (р<0,01), так і порівняно з контрольною групою (р<0,05).
Стосовно клітин Лангерганса в епідермісі, згідно критерію Мана-Уітні, статистично вірогідна різниця між групами з легким і середнім ступенем важкості перебігу виявлена не була (р>0,05). Але кількість дендритних клітин збільшилась в дермі при легкому ступені важкості порівняно з контрольною групою (р<0,05), та в епідермісі і в дермі при псоріазі середнього ступеня важкості (р<0,05).
Нейтрофіли, що розташовані в інтракорнеальних мікроабсцесах, міжепітеліальних композитах та навколосудинних інфільтратах дермальних сосочків, активують ензими із родини ММП. Це підтверджували позитивні ІГХ реакції з антитілом до ММП-9. Дослідження показали, що всі шари епідермісу, окрім зроговілого, мали підвищений рівень експресії маркеру ММП-9. До того ж експресія ММП-9 тісно пов’язана з ангіогенезом і виявлялась в клітинах навколосудиних інфільтратів та ендотелії судин. Порівняно з нормальною шкірою контрольної групи, що з маркером ММП-9 демонструвала слабку реакцію в епідермісі та судинах дерми, визначали статистично вірогідне підвищення експресії ММП-9 при звичайному псоріазі (р<0,01). Найзначніші зміни відбувалися при псоріазі середнього ступеня важкості.
На підставі отриманих результатів було створено модель логістичної регресії, що дає можливість дати прогноз перебігу псоріазу вульгарного за даними ІГХ змін. Про збільшення ризику прогредієнтного перебігу псоріазу (чутливість цих реакцій становить 75 % і 93,8 % відповідно) свідчила також висока або надмірна інтенсивність експресії маркерів VEGF і ММП-9 вірогідно (р<0,05).
Аналіз досліджень експресії цитокінів показав, що Th1-клітини можуть ініціювати та підтримувати патологічний процес перебігу псоріазу. У нашому дослідженні вивчали експресію в сироватці крові Th1 індукованого цитокіну, а саме TNF-α. Аналіз експресії TNF-α у периферичній крові пацієнтів хворих на псоріаз показав його значне підвищення [(19,81±1,09) пг/мл] порівняно з контрольною групою [(8,55±0,47) пг/мл]. Отримані дані показали відсутність взаємозв’язків рівня TNF-α з віком і статтю пацієнтів. Виявлена вірогідна залежність концентрації TNF-α в периферичній крові від ступеня важкості перебігу псоріазу, визначеному за допомогою PASI, зокрема: при легкому ступені важкості перебігу псоріазу склав (16,64±1,36) пг/мл, середньому – (22,35±1,58) пг/мл.
Оцінка ЯЖ дозволила точніше оцінити порушення стану здоров’я пацієнтів, ясніше побачити суть клінічної проблеми, визначитися у виборі найбільш раціонального методу терапії, а також дати оцінку очікуваним результатам за параметрами, які знаходяться на межі наукового підходу та суб’єктивної точки зору пацієнта.
Результати отриманих в ході анкетування даних інколи мали розбіжності із даними об’єктивного обстеження пацієнтів. Зокрема, виявлена деяка гендерна залежність показників ЯЖ: ЯЖ пацієнтів чоловічої статі незначно нижча, ніж у жінок, що може свідчити про те, що жінки займають більш активну життєву позицію, і, можливо, являються більш адаптованими. У ході опрацювання отриманих даних було виявлено, що на ЯЖ пацієнток найбільш негативний вплив має косметичний дефект шкіри (висипання), що значною мірою відобразилося на психоемоційному стані пацієнток. Опитані чоловіки свідчили, що псоріаз найбільш суттєво впливає на їх суспільну активність та на інтимні стосунки. Також виявилося, що суттєвіший вплив псоріазу на ЯЖ відмічають респонденти, які працюють або/і навчаються, ніж ті, що не працюють. Вік пацієнтів вірогідно не впливав на зміну ЯЖ пацієнтів. Між значенням індексу DLQI, PDI та рівнем життя існує обернена залежність. Нижчими є показники ЯЖ у пацієнтів із тривалістю захворювання до 10 років; часті рецидиви також особливо негативно впливають на показники ЯЖ. Спільною для усіх респондентів ознакою являється обернена залежність рівня ЯЖ пацієнта від ступеня важкості перебігу псоріазу.
З використанням оцінки вираженості впливу захворювання на ЯЖ пацієнта можна стверджувати, що легкий перебіг псоріазу значно впливає на ЯЖ хворого (11-20 балів), а перебіг середньої важкості призводить до істотного її погіршення (21-30 балів).
Високий рівень захворюваності на псоріаз, хронічний рецидивуючий характер дерматозу, а також наведені результати проведених досліджень, що дали змогу виявити порушення імунологічних, ІГХ, патоморфологічних показників, стали підставою для розробки та вивчення ефективності комплексного патогенетично обґрунтованого методу лікування із таргетним впливом на основні промоутери імунного запалення та неоангіогенезу.
Хворі з розповсюдженим вульгарним псоріазом (L40.0) в прогресуючій стадії, легкого та середнього ступеня важкості перебігу були рандомізовано розділені на три групи залежно від методу лікування: ОГ – 25 пацієнтів та П1 – 25 пацієнтів та П2 – 20 пацієнтів.
Хворі П2 приймали засоби, які застосовують традиційно при лікуванні псоріазу вульгарного легкого та середнього перебігу, що включали: вітаміни групи В (нейрорубін); гіпосенсибілізуючу терапію (тіосульфат натрію), антигістамінні препарати, зовнішні кератолітичні та зволожуючі засоби. Обстежені хворі П1, окрім традиційної терапії, додатково також приймали надропарин кальцію (представник низькомолекулярних гепаринів) з метою інгібування фактору росту некрозу пухлин-альфа, як ключового прозапального цитокіну в етіопатогенезі псоріазу. Пацієнти основної групи порівняння, окрім традиційної терапії та адеметіоніну для інгібування основних промоутерів неоангіогенезу – VEGF та ММП-9, додатково також приймали надропарин кальцію (представник низькомолекулярних гепаринів).
При лікуванні хворих на псоріаз вульгарний нами врахована підвищена активність промоутерів неоангіогенезу, тому в комплексну схему терапії пацієнтів ОГ та П1 було включено засіб, який має здатність пригнічувати активність факторів росту судин – адеметіонін у дозі 400 мг адеметіоніну 1 раз на добу протягом 4 тижнів.
Адеметіонін – S-аденозил-L-метіонін, натуральна амінокислота, що присутня практично у всіх тканинах та біологічних середовищах організму. препарат діє як коензим та донор метильної групи у багатьох реакціях трансметилювання.
Беручи до уваги аналіз новітніх досліджень та результати власних досліджень, за якими псоріаз розглядали як імунозалежний дерматоз, ключовим прозапальним пусковим цитокіном якого є фактор некрозу пухлин-альфа, тому у терапевтичну схему пацієнтів ОГ було включено надропарин кальцію, який має імунодепресивну, цитостатичну, протизапальну, гіпосенсибілізуючу дії, а також антимітотичну дію за рахунок гальмування мітозу в його заключній стадії [139, 155, 170].
Надропарин кальцію – низькомолекулярний гепарин, отриманий із стандартного гепарину методом деполімеризації, є глікозаміногліканом із середньою молекулярною масою 4300 Да. Розчин для ін’єкцій міститься у шприці, що містить 2850 МО анти-Ха об’ємом 0,3 мл. Препарат вводили п/ш у лежачому положенні пацієнта в передньолатеральну область черевної стінки, почергово справа та зліва.
Цей засіб має ряд переваг: значно краща прогнозованість антитромботичного ефекту через відсутність зв’язування з білками плазми крові і мембранами ендотеліоцитів; не вимагає дуже ретельного індивідуального лабораторного контролю; більш висока біодоступність низькомолекулярних гепаринів дозволяє призначати їх підшкірно не лише з профілактичною, а й лікувальною метою; не потребує моніторування стану системи згортання крові; мало впливає на первинний гемостаз, адгезію та агрегацію тромбоцитів, є слабким антикоагулянтом, має мінімальний геморагічний ефект; у профілактичних дозах практично не впливає на час кровотечі, час згортання крові і АЧТЧ; має здатність підсилювати агрегацію тромбоцитів; період напіввиведення становить 4-10 год, що дозволяє зменшити кратність введень за добу; низька небезпека виникнення імунозалежної тромбоцитопенії.
В якості вітамінотерапії використано ін’єкційний препарат Нейрорубін, 1 ампула якого (3 мл) містить: тіаміну гідрохлорид – 100 мг; піридоксину гідрохлорид – 100 мг; ціанокобаламін – 1 мг та допоміжні речовини. Нейрорубін призначався в дозуванні 1 ампула (3,0 мл) в/м один раз на день.
Нейрорубін – комплексний вітамінний препарат, що містить водорозчинні вітаміни групи В. Вітаміни групи В мають широкий спектр біологічної активності, не зважаючи на схожість фармакологічних ефектів кожен із вітамінів виявляє специфічну дію на організм людини. Вітамін В6 бере участь в синтезі ферментів, білковому та жировому обмінах. Активна форма цього вітаміну виступає в ролі кофермента в різноманітних ферментативних реакціях, регулює синтез гемоглобіну, а також нейромедіаторів у синапсах центральної та периферичної системи, синтез гемоглобіну. Ціанокобаламін виявляє антианемічний ефект, нормалізує систему згортання крові. У ролі гіпосенсибілізуючого засобу призначено розчин тіосульфату натрію 30 % 10,0 мл в/в один раз на добу. Для зняття свербежу, явищ невротичного характеру, порушень сну був призначений антигістамінний препарат хлоропірамін в/м 20 мг 1,0 мл.
В якості кератолітичного засобу використовувалася 2 % саліцилова мазь, що наносилася на уражені ділянки шкіри. Кратність нанесень мазі варіювала в залежності від клініки. З метою зволоження та зменшення свербежу застосовувався емолієнт Lipikar Baume AP двічі на день протягом усього курсу лікування.
Після проведеного лікування в усіх групах відмічалося зниження активності запалення (старіння бляшок), кількість нейтрофілів різко знижувалася, але невелика кількість мононуклеарів завжди була присутньою в нижче розташованих рівнях супрапапілярного епідермісу. Дермальний запально-клітинний інфільтрат ставав дедалі менш важким, ніж в ранніх ушкодженнях та на стадії папули до початку лікування. Він включав активовані CD3+ Т-лімфоцити, але значно менше CD68+ макрофагів, ніж в матеріалі взятому до початку терапії і зовсім одиничні нейтрофіли. Клітини Лангерганса, чисельність яких в епідермісі значно не змінювалась при зниженні запалення, характеризувалися втратою розгалужених відростків, що на стадії папули контактували з кератиноцитами усіх шарів епідермісу, виконуючи свою антигенпрезентуючу функцію.
У нашому дослідженні при псоріатичних ушкодженнях на всіх етапах розвитку плазматичні клітини і еозинофіли були відсутні, але деякі автори описують виявлення еозинофільного катіонного протеїну в верхній третині епідермісу шкіри та присутність плазматичних клітин у пацієнтів з ВІЛ-інфекцією, що потребує подальшого більш детального дослідження [36].
У ході рекомендованого лікування, з часом, в епідермісі верифікувалося «булавоподібне» стовщення нижніх рівнів сітки акантотичних тяжів із злиттям їх в загальне поле і деяким стовщенням надсосочкових пластинок. Подальші зміни характеризувалися ортокератозом (нормалізацією процесів зроговіння), відновленням зернистого шару і значно меншим екзоцитозом запальних клітин в епідермісі або повною його відсутністю.
Під впливом терапевтичних заходів відбувався регрес папул та спостерігалося зниження кількості імуноцитів навколосудинних запальних інфільтратів в дермі, а в епідермісі редукувалась інтенсивність епідермальної гіперплазії та повністю реставрувався зернистий шар. Лише судини сосочків дерми залишались розширеними, хоча до цього часу навколо підвищувалась кількість фібробластів, і в цьому регіоні спостерігався помірний післязапальний фіброз.
При ІГХ дослідженнях псоріатичних бляшок, що загоювалися, виявлено вірогідне зниження проліферативної активності маркера Кі-67 до рівнів (18,08±1,16) % (ОГ), (18,71±0,97) % (П1) та (26,69±1,90) % (П2), яка однак не досягла показників здорової шкіри [(6,27±0,45) %]. Антиген Кі-67 являє собою нестійкий протеїн, що руйнується протягом 1,5-2 годин, тому антитіла до Кі-67 презентують лише клітини, що активно діляться, не накопичуючись у клітинах в стані спокою. Наведені дані свідчать про “готовність” кератиноцитів у хворих на псоріаз до проліферативної активності після дії тригерних факторів. Вищі концентрації маркера Кі-67 після проведеної терапії свідчать про можливість рецидиву.
Після проведеної терапії при ІГХ дослідженні виявили зниження кількості клітин Лангерганса, особливо в дермі в усіх групах, повну відсутність нейтрофільної та нормалізацію CD3+ Т-лімфоцитарної інфільтрації епідермісу в ОГ хворих.
Базально-клітинна гіперплазія значного наближення до показників нормальної шкіри контрольної групи [(12,21±1,04) %] не набувала після лікування в жодній з груп пацієнтів, залишаючись на рівні (20,47±0,75) % (ОГ), (30,27±0,61) % (П1) та (39,99±0,77) % (П2), що говорить про порушення диференціювання кератиноцитів цієї ділянки і можливість раннього рецидиву.
Для вивчення кількісних та структурних змін мікроциркуляторного русла у хворих на псоріаз до та після проведення лікування за запропонованими схемами визначалися щільність мікросудин та їх кількість за мембранною реакцією ендотелію з маркером CD34 та вивчення експресії фактору росту ендотелію судин. Інтенсивність васкуляризації шкіри, що виражена показником щільності мікросудин з маркером CD34, досягла після лікування рівнів у пацієнтів ОГ (6,71±0,39) % (до лікування (17,02±1,65) %; p<0,001), у П1 знизилася після терапії до (10,76±0,89) % (до лікування (16,68±1,83) %; p<0,001) та до рівня (12,55±0,96) % у П2 (до лікування (16,92±1,87) %; p<0,05), але залишилась вірогідно вищою за показники здорової шкіри [(4,32±0,67) %].
Рівень фактора росту судин у хворих ОГ, які отримували комплексне лікування, запропоноване нами, суттєво знизився до рівня (1,50±0,19) % (до лікування складав (2,88±0,23) %; p<0,001) та значно приблизився до аналогічного показника здорової шкіри контрольної групи [(1,20±0,13) %; p>0,05]. У пацієнтів П1 даний показник досяг позначки (2,00±0,27) % (до лікування – (2,75±0,25) %; p<0,05), у П2 – до (2,43±0,20) % (до лікування – (3,00±0,22) %; p<0,05), проте показники залишились вірогідно вищими за рівні контрольної групи (p<0,05).
Дослідження експресії маркера ММП-9 як неспецифічного фактора росту до та після проведення лікування показали, що суттєвого зниження рівня маркера ММП-9 було досягнуто у хворих ОГ, яких лікували за модифікованою схемою, де він склав (1,50±0,19) % (до лікування – (3,0±0,27) %; p<0,001). У пацієнтів П1, що лікувалися за модифікованою схемою, яка не включала антагоністів промоутерів ангіогенезу, рівень ММП-9 знизився до (1,75±0,25) % (до лікування – (2,88±0,23) %; p<0,05). При традиційному підході до лікування псоріазу (П2) динаміка показника була незначною (зниження з (3,00±0,31) % до (2,43±0,30) % (p>0,05).
Проведені нами імунологічні дослідження виявили підвищення рівня цитокінів, а саме фактора некрозу пухлин як одного з ключових прозапальних чинників в етіопатогенезі псоріазу, зокрема: суттєве зниження його рівня до (7,79±0,38) пг/мл (до лікування складав (19,75±1,92) пг/мл; p<0,001) у пацієнтів ОГ, до (8,43±0,43) пг/мл (до лікування – (19,68±1,86) пг/мл; p<0,001) у пацієнтів П1 та їх наближення до рівнів здорової шкіри [(8,55±0,47) пг/мл; p>0,05). У хворих П2, що лікувалися за стандартною схемою, не спостерігали клінічно значимого зниження даного показника – показник склав (15,01±0,92) пг/мл після лікування (до початку терапії – (20,02±2,01) пг/мл; p<0,05).
При аналізі впливу використаних терапевтичних схем на ЯЖ пацієнтів, можна стверджувати, що індекси ЯЖ у всіх групах достовірно знизились, що свідчить про покращення ЯЖ в порівнянні з даними до початку лікування. Позитивна динаміка дерматологічного статусу, виражений регрес псоріатичних висипань (особливо на відкритих ділянках тіла) мали позитивний вплив на психологічний стан хворих. Слід відмітити, що індекс DLQI після терапії у пацієнтів ОГ знизився суттєвіше (до лікування – (21,4±2,67) бала, після – (8,4±1,10) бала; p<0,001), аніж у пацієнтів П1 (до лікування – (19,7±2,12) бала, після – (8,5±1,33) бала; p<0,001), а тим паче П2 (до лікування – (19,9±2,58) бала, після – (14,4±1,06) бала; p<0,05).
Аналогічні тенденції до зниження показників ЯЖ під впливом лікування отримані за шкалою PDI, зокрема: у пацієнтів ОГ цей показник знизився з (32,53±3,14) до (17,53±2,21) бала (p<0,001), у пацієнтів П1 – з (30,0±3,58) до (18,4±2,33) бала (p<0,001), а в П2 – з (30,2±2,88) до (21,3±3,0) бала (p<0,05).
Слід зазначити, що переносимість рекомендованої терапії була задовільною. Запропонований метод лікування хворих на псоріаз звичайний сприяв підвищенню ефективності терапії: досягнуто клінічної ремісії у 6 (24 %) та значного покращення – у 18 (72 %) пацієнтів ОГ, у П1 – 5 (20 %) та 15 (60 %) відповідно, в той час як при традиційному лікуванні – у 4 (20 %) та 5 (25 %) відповідно; зменшення кількості рецидивів за період спостереження у 2,7 разів відносно групи порівняння. Результати оцінки ефективності запропонованих схем терапії визначали за значеннями PASI – відповіді. Регрес показників PASI у пацієнтів ОГ склав (77,12±2,94) %, у пацієнтів П1 – (57,72±7,85) %, у П2 – (21,72±1,44) %. Таким чином, ефективність запропонованих методик лікування розцінено як високу, а ефективність традиційної терапії як помірну.
Віддалені результати лікування оцінювали шляхом спостереження за хворими протягом одного року після закінчення терапії. Дані отриманих результатів показали, що у хворих ОГ, які лікувались за запропонованою схемою з додатковим використанням надропарину кальцію та адеметіоніну, рецидив дерматозу виник у 2 (8 %) пацієнтів; у хворих П1, які лікувались за запропонованою схемою з додатковим використанням надропарину кальцію – у 4 (16 %), у 1 (4 %) хворого за рік спостереження рецидив відбувся двічі; у П2, представники якої лікувалися за традиційною схемою лікування псоріазу вульгарного у 7 (35 %) хворих спостерігався один рецидив та у 3 (15 %) пацієнтів два рецидиви протягом періоду спостереження. Підчас лікування запропонованими схемами дерматологічний статус мав виразнішу позитивну динаміку, що дозволило скоротити час перебування пацієнтів на стаціонарному лікуванні.
Таким чином, встановлено, що призначення хворим у комплексі зі стандартизованими засобами низькомолекулярного гепарину та адеметіоніну дозволяє істотно підвищити ефективність лікування у вигляді досягнення вираженого регресу клінічних проявів, більшої тривалості ремісій, зменшення виразності рецидивів і покращення ЯЖ пацієнтів. Показано, що терапевтична тактика ведення пацієнтів з псоріазом має бути диференційованою та індивідуально впливати на основні визначені ланки етіопатогенезу захворювання.
ВИСНОВКИ
У дисертаційній роботі теоретично узагальнено нове вирішення наукової задачі – підвищення ефективності терапії шляхом розробки патогенетично обгрунтованого комплексного методу лікування хворих на псоріаз на підставі вивчення клінічних, патогістологічних, імуногістохімічних, імунологічних та психометричних показників.
- Враховуючи виражену розповсюдженість псоріазу серед населення земної кулі (3,5–5 %), у загальній структурі захворювань шкіри (9 %), серед госпіталізованих (35–38 %), а також довготривалий, рецидивуючий, невиліковний характер дерматозу, який уражає найбільш активний працездатний прошарок населення, підвищення частоти низької чутливості до терапії, що призводить до соціальної дезадаптації пацієнтів, тимчасової непрацездатності, а іноді – інвалідності, актуальним є оптимізація терапевтичної тактики ведення хворих на даний дерматоз.
- Виявлено переважання захворюваності на псоріаз вульгарний серед чоловіків (59 %), більшу поширеність захворювання серед осіб зрілого (59 %) та середнього (31 %) віку. Зростання частоти виявлення недиференційованого типу псоріазу (50 %), з часто рецидивуючим перебігом (57 %); встановлено виражений негативний вплив на ЯЖ у 44 % та важке ураження ЯЖ у 56 % хворих.
- За результатими імуногістохімічних, патоморфологічних досліджень у хворих на псоріаз звичайний середнього ступеня важкості виявлено високу та надмірну реакції експресії таких маркерів неоангіогенезу, як VEGF (49 % і 67 % випадків відповідно) і ММП-9 (18 % і 25 % відповідно), та помірний кореляційний зв’язок між збільшенням інтенсивності експресії даних маркерів і підсиленням ступеня важкості псоріазу. При цьому встановлено переважання вдвічі кількості судин у порівнянні з спостереженнями при легкому перебігу псоріазу, та збільшення в 5,1 разу – у порівнянні з контрольною групою. Доведено при вивченні проліферації та диференціації кератиноцитів у всіх досліджуваних, на відміну від маркерa р63, залежність eкспресії індексу маркера Кі-67 від важкості перебігу дерматозу, що свідчить про універсальність проявів порушення дозрівання кератиноцитів, можливість раннього рецидиву. Встановлено при псоріазі середнього ступеня важкості, порівняно із легким перебігом дерматозу та здоровою шкірою, статистично вірогідну різницю інфільтрації CD3+ Т-лімфоцитами епідермісу і дерми, інфільтрації CD68+ макрофагів дерми, підвищення експресії ММП-9.
- Встановлено вагому роль Th1 індукованого TNF-α в імуногенезі псоріазу, що підтверджено значним підвищенням (19,81 пг/мл) прозапального хемокіну в сироватці крові порівняно з контрольною групою (8,55 пг/мл); визначено залежність концентрації TNF-α від важкості перебігу дерматозу при відсутності вказаних взаємозв’язків із віком та статтю пацієнтів.
- Розроблено комплексний патогенетичний метод лікування із залученням до традиційної схеми терапії адеметіоніну та надропарину кальцію, який дозволив підвищити ефективність лікування шляхом досягнення клінічного покращення у 72 % пацієнтів та ремісії у 24 % (при традиційній терапії – у 20 % та 25 % відповідно), зменшити кількість рецидивів за період спостереження у 2,7 разу відносно групи порівняння; досягти регресу індексу PASI на 77 % (при традиційній терапії – 22 %), достовірного покращення ЯЖ пацієнтів (p<0,001).
- Апробований метод лікування сприяє нормалізації процесів неоангіогенезу, що проявлялося достовірним зниженням рівнів експресії ІГХ маркерів VEGF у 1,9 разу, ММП-9 у 2 рази, CD34 у 2,5 разу, зниженню активності запалення у шкірі, про що свідчило достовірне зменшення рівня прозапального хемокіна TNF-α у 2,5 разу в сироватці крові, а також зниженню експресії ІГХ маркерів CD3 в епідермісі у 2,8 та у дермі – у 3,6 разу, CD68 – у 1,8 та 2,3 разу відповідно. Зазначені показники суттєво наблизилися та не досягли значень контрольної групи, що свідчить про готовність шкіри до рецидиву. Після проведення терапії за традиційною схемою відбулося значно менше зниження досліджуваних показників.
- За даними ІГХ змін створено модель логістичної регресії, що дає можливість прогнозувати перебіг псоріазу звичайного: висока або надмірна інтенсивність експресії маркерів VEGF, ММП-9, CD34, CD3, CD68 та Кі-67 вірогідно (р<0,05) свідчить про збільшення ризику прогредієнтного перебігу псоріазу (чутливість цих реакцій становить 75 %, 93,8 %, 93,8 %, 93,8 %, 93,8 % та 100 % відповідно).
РЕКОМЕНДАЦІЇ
- Для виявлення особливостей перебігу псоріазу вульгарного окрім стандартних клініко-морфологічних досліджень доцільно використовувати ІГХ дослідження з маркерами CD34, Ki-67, CD3, CD68, S100, VEGF і ММП-9, що виявляють ризик тяжкого перебігу псоріазу, дають оцінку імовірності персистенції подальшого патологічного процесу.
- Запропоновано спосіб лікування хворих на псоріаз з терапевтичним впливом прицільно на ключові ланки його патогенезу, який передбачає на фоні традиційних засобів терапії дерматозу призначення надропарину кальцію (в дозі 0,3 мл підшкірно 1 раз на добу протягом 2 тижнів) та адеметіоніну (у дозі 400 мг перорально 1 раз на добу протягом 4 тижнів).
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
1. Адаскевич В.П. Диагностические индексы в дерматологии / В.П. Адаскевич, Н.П. Базеко. – М. : Мед. литература, 2007. – 192 с.
2. Айвазова Т.В. Клиническое значение фактора роста эндотелия и его растворимого рецептора 2 типа у больных экссудативной формой псориаза: автореф. дисс. на соискание учен. степени канд. мед. наук: спец. 14.01.10 «Кожные и венерические болезни» / Айвазова Т.В. – М., 2008. – 29 с.
3. Андрашко Ю.В. Сучасна концепція раціонального вибору топічного кортикостероїду / Ю.В. Андрашко, С.О. Галникіна // Укр. журн. дерматол., венерол., косметол. – 2006. – №4. – С. 38-40.
4. Андрашко Ю.В. Імунобіологічна терапія блокатором ФНП-α: новий стандарт лікування псоріазу із середньо тяжким та тяжким перебігом / Ю.В.Андрашко // Укр. журн. дерматол., венерол., косметол. – 2008. – №2. – С. 35-37.
5. Андрашко Ю.В. Современные подходы к этапной наружной терапии при псориазе / Ю.В.Андрашко, Б.В.Литвиненко // Укр. журн. дерматол., венерол., косметол. – 2009. – № 1. – С. 29–33.
6. Андрашко Ю.В. Оптимальные комбинации аппаратных и медикаментозных методов лечения ладонно-подошвенного псориаза / Ю.В. Андрашко, Т.И. Чечерская // Укр. журн. дерматол., венерол., косметол. – 2013. – №4. – С. 29–30.
7. Бабанин В.А. Макрофагальная активность в коже больных псориазом при NB-UVB (311 нм) терапии / В.А. Бабанин // Таврический мед.-биол. вестн. – 2012. – Т. 15, № 2, ч. 3. – С. 22–27.
8. Бабанин В.А. Особенности Т-клеточного инфильтрата в коже больных псориазом при NB-UVB (311 нм) терапии / В.А. Бабанин // Таврический мед.- биол. вестн. – 2012. – Т. 15, № 3, ч.2. – С. 17–21.
9. Бадокін В.В. Сучасна терапія псоріатичної артропатії / В.В. Бадокін // Consilium Medicum. – 2005. – №7. – С. 23-27.
10. Баранова О.А. Роль гепарину в патогенезі псоріазу, можливості та перспективи використання в лікуванні цього дерматозу / О.А. Баранова, П.В. Федорич // Укр. журн. дерматол., венерол., косметол. – 2004. – № 3. – С. 14-17.
11. Бережная Н.М. Сложности интерптетации цитокиновой регуляции при патологии (астма, рак, дерматиты) / Н.М. Бережная // Аллергология и иммунология. – 2004. – Т.5, №3. – С. 368 – 369.
12. Бокарев И.Н. Опыт применения низкомолекулярных гепаринов при лечении тромбоза глубоких вен / И.Н.Бокарев, Л.В.Попова // Трудный пациент. – 2008. – №10. – С. 42-44.
13. Буянова О.В. Стан проблем етіопатогенезу, лікування хворих на псоріаз в Україні, розробка сучасних теорій. Огляд сучасних літературних даних та обґрунтування перспективних напрямків подальших досліджень / О.В. Буянова, Х.Д. Аль-Рамлаві // Укр. журн. дерматол., венерол., косметол. – 2005. – № 4. – С. 36–39.
14. Буянова О.В. Визначення впливу перебігу псоріазу на психо-емоційний стан пацієнтів / О.В. Буянова, С.М. Гринюк, Х.Д. Аль-Рамлаві // Тези доповідей І (VIII) з’їзду Української асоціації лікарів-дерматовенерологів і косметологів. – Український журнал дерматології, венерології, косметології. – 2005. – № 3. – С. 135.
15. Височанська Т.П. Особливості макро- та мікроелементного складу біологічних субстратів у хворих на хронічні рецидивуючі дерматози (псоріаз, екзему) / Т.П. Височанська, О.І. Денисенко // Укр. журн. дерматол., венерол., косметол. – 2008. – № 3. – С. 9-14.
16. Глухенький Б.Т. Вопросы этиологии и патогенеза псориаза / Б.Т. Глухенький // Иммунитет и болезни: от теории к терапии. – М., 2005. – С. 10-12.
17. Гистологические и иммуногистологические изменения кожи больных псориазом при лечении ПУВА – ваннами / В.А. Волнухин, А.М. Вавилов, И.В. Кравцова, О.Р. Катунина // Вестн. дерматол., венерол. – 2007. – №2. – С. 3-7.
18. Дащук А.М. Лечение больных псориазом с учетом окисной модификации белков и липидов / А.М. Дащук, В.А. Чипиженко, Л.И. Черникова // Укр. журн. дерматол., венерол., косметол. – 2005. – № 3 (18). – С. 118.
19. Дерматовенерология: учебное пособие / В.П. Федотов, А.Д. Дюдюн, В.И. Степаненко. – Днепропетровск: Свидлер А.Л., 2011. – 652 с.
20. Добржанська Є.І. Визначення змін вмісту адаптивних гормонів і системи іменного захисту у хворих на псоріаз / Є.І.Добржанська // Укр. журн. дерматол., венерол., косметол. – 2008. – № 1. – С. 9–11.
21. Жданова И.О. Уровни експрессии Кі67 как показателя пролиферативной активности кожи у больних псориазом до и после узкополосной фототерапии / И.О. Жданова // Архив клинической и експериментальной медицини. – 2014. – Т. 23, №2. – С.190-191.
22. Иванов О.Л. Новые подходы в наружной терапии псориаза: эффективность двухступенчатой схемы дайвобет + дайвонекс / О.И. Иванов, А.Н. Львов // Рос. журн. кожных и венерических болезней. – 2005. – № 6. – С. 49-54.
23. Ильина С.А. Анализ эффективности лечения псориаза и поиск новых мишеней для фармакотерапии: автореф. дисс. на соискание учен. степени канд. мед. наук: спец. 14.03.06 «Фармакология, клиническая фармакология», 14.01.10 «Кожные и венерические болезни» / Ильина С.А. – Москва, 2011. – 21с.
24. Катунина О.Р. Иммуная система кожи и ее роль в патогенезе псориаза / О.Р. Катунина // Вестник дерматологии и венерологии. – 2005. – №1. – С. 19-28.
25. Кашутин С.Л. Экспрессия молекул адгезии, связанных с миграцией лейкоцитов, у больных псориазом / С.Л. Кашутин, С.И. Данилов, Е.Н. Верещагина // Клиническая дерматология и венерология. – 2012. – № 4. – С. 86–89.
26. Клинико-морфологическая диагностика заболеваний кожи (атлас) / Пальцев М.А., Потекаев Н.Н., Казанцева И.А. [и др.] – М.: Медицина, 2004. – 432 с.
27. Коляденко В.Г. Оцінка якості життя хворих на псоріаз у процесі лікування препаратом «Дайво-бет» / В.Г. Коляденко, В.В. Короленко // Укр. журн. дерматол., венерол., косметол. – 2009. – № 1. – С. 13-15.
28. Коляденко В.Г. Показники якості життя у дерматологічних хворих / В.Г. Коляденко, П.В. Чернишов // Укр. журн. дерматол. венерол. косметол. – 2005. – №2. – С. 4 – 14.
29. Короткий Н.Г. Сучасна терапія важких форм псоріазу / Н.Г.Короткий, А.А.Полякова // Consilium Medicum. – 2005. – Додаток. – С. 25-26.
30. Корсунская И.М. Новое в патогенетической терапии псориаза / И.М. Корсунская, М.М. Резникова, Л.В. Тогоева // Доктор. – 2005. – № 3. – С. 1-4.
31. Кубанова А.А. Опыт применения препарата Инфликсимаб в лечении больных тяжелым псориазом / А.А. Кубанов, Ю.И. Матушевская // Вестн. дерматологии и венерологии. – 2008. – №6. – С. 75 – 80.
32. Кубанова А.А. Иммуноморфология и морфогенез очагов пораженной кожи при псориазе / А.А. Кубанова, О.Р. Катунина // Вестник дерматологии и венерологии. – 2010. – № 1. – С. 70-79.
33. Кубанова А.А. Концепция и определение качества жизни больных в дерматологии [Электронный ресурс] / А.А.Кубанова, А.А.Мартынов //Вестн. дерматол. венерол. – 2004. – №4. – Режим доступа: http://www.mediasphera.rujournals/vestnik/116/
34. Курдина М.И. Антицитокиновая терапия – новое направление в лечении псориаза / М.И. Курдина // Вестн. дерматологии и венерологии. – 2005. – №1. – С. 3 – 8.
35. Кутасевич Я.Ф. Рациональний вибор топического стероида / Я.Ф. Кутасевич, І.О. Маштакова // Укр. журн. дерматол., венерол., косметол. – 2012. – №1. – С. 55-58.
36. Кутасевич Я.Ф. Оптимізація зовнішньої терапії псоріазу з урахуванням клінічної стадії та ступеня тяжкості. Методичні рекомендації / Укл.: Кутасевич Я.Ф., І.О.Маштакова. – К., 2010. – 20с.
37. Кутасевич Я.Ф. Особливості лікування псоріатичної хвороби на сучасному етапі / Я.Ф. Кутасевич, І.О. Олійник // Клин. иммунология. Аллергология. Инфектология. – 2011. – № 1. – С. 31-36.
38. Кутасевич Я.Ф. Сучасний погляд на псоріатичну хворобу / Я.Ф. Кутасевич, І.О. Олійник // Мистецтво лікування. – 2005. – № 6. – С. 6–11.
39. Куц Л.В. Современние аспекти патогенеза псориаза // Запорожский мед. журнал. – 2012. – Т.13, №5. – С. 29-32.
40. Лучкевич В.С. Качество жизни как объект системного исследования и интегральный критерий оценки здоровья и эффективности медико-профилактических и лечебно-реабилитационных программ. – СПб. : СПбГМА им. И.И. Мечникова. – 2011. – 86 с.
41. Лысенко О.В. Мометазона фуроат при лечении псориаза / О.В. Лысенко, С.Н. Теплова, В.В. Прокофьева // Клин. дерматол. и венерол. – 2005. – № 4. – С. 45-49.
42. Мавров І.І. Мікроциркуляція при дерматозах / І.І. Мавров, Б.І.Каруна. – К. : Здоров’я, 1985. – 135 с.
43. Маврова Д.І. Активне вивчення проблем, що назріли у дерматовенерології / Д.І. Маврова // Дерматологія та венерологія. – 2008. – №1. – С. 8-15.
44. Маннанов А.М. Иммунологические и клинические особенности течения псориаза у детей / А.М. Маннанов, Н.Б. Бабабекова, К.Н. Хаитов // Врач-аспирант. – №4 (47). – 2011. – С. 667-675.
45. Методи лікування псоріазу [Електронний ресурс]. – Режим доступу: Biblio.forum-psor. ru.
46. Мрачковская М.Н. Состояние свертывающей системы крови у больных некоторыми дерматозами / М.Н. Мрачковская // Вестн. дерматол. – 1976. – №5. – С. 55 – 61.
47. Мчедлишвили Г.И. Микроциркуляция крови / Г.И. Мчедлишвили.– Л.: Наука, 1989. – 295 с.
48. Наказ МОЗ України №312 від 08.05.2009 р. Про удосконалення дерматовенерологічної допомоги населенню України (додаток: протоколи надання медичної допомоги) // Режим доступу: www.moz-derm.org.ua/wp-content/uploads/2011/08/nakaz-312.doc
49. Наказ МОЗ України №56 від 06.02.2008р. Про затвердження клінічних протоколів санаторно-курортного лікування в санаторно-курортних закладах для дорослого населення // Режим доступу: moz.gov.ua/ua/portal/dn_20080206_56.html
50. Некоторые аспекты патогенеза псориаза и особенности комплексного лечения больных / И.Б. Трофимова, Л.М. Барденштейн, Я.Ю. Воронина, В.С. Сускова // Вестник дерматологии и венерологии. – 2006. – №1. – С. 32-35.
51. Немчанинова О.Б. Клинико-иммунологические особенности течения псориаза на фоне соматической онкопатологии / О.Б. Немчанинова, М.В. Ларионова // Рос. журн. кожных и венерических болезней. – 2005. – № 4. – С. 51-53.
52. Ніколаєва З.А. Удосконалена комплексна, індувідуалізована терапія псоріазу з урахуванням системних порушень в організмі хворих / З.А. Ніколаєва, В.І. Степаненко, Т.С. Брюзгина // Укр. журн. дерматол. венерол. косметол. – 2006. – №3. – С. 41-55.
53. Новик А.А. Руководство по исследованию качества жизни в медицине / А.А. Новик, Т.И. Ионова; под ред. акад. РАМН Ю.Л. Шевченко. – М.: ОЛМА. – 2007. – 320 с.
54. Одинец Ю.В. Оптимизация антикоагулянтной и антиагрегантной терапии в комплексном лечении гломерулонефритов у детей / Ю.В. Одинец, Л.Е. Латышев // Експерим. клін. мед. – 2006. – №4. – С. 87-90.
55. Ольховська Ю.О. Комплексна терапія хворих на псоріаз із застосуванням глутоксиму / Ю.О.Ольховська // Укр. журн. дерматол., венерол., косметол. – 2008. – № 2. – С. 37–39.
56. Олисова О.Ю. Фототерапия псориаза / О.Ю. Олисова, И.Я. Пинсон // Леч. врач. – 2005. – № 6. – С. 90-91.
57. Оптимізація лікування хворих з ураженнями кисті при псоріатичному артриті / О.А. Бур”янов, В.Г. Коляденко, В.П. Кваша [та ін.] // Укр. журн. дерматол., венерол., косметол. – 2008. – № 2. – С. 30-35.
58. Особенности метаболических нарушений при хронических распространенных тяжело протекающих дерматозах различного генеза (псориаз, атопический дерматит, пузырчатка) / Т.В. Копытова, Л.Н. Химкина, Н.А. Добротина, Г.А. Пантелеева // Российский журнал кожных и венерических болезней. – 2012. – № 1. – С. 30-34.
59. Особливості клінічного перебігу та удосконалення діагностики та лікування псоріазу. Методичні рекомендації / Укл.: Калюжна Л.Б., Літус О.І., Ошивалова О.О.[та ін.]. – К. : Укрмедінформпатент, 2013. – 64с.
60. Особливості перебігу псоріазу залежно від віку хворого / М.Р.Анфілова, І.Н. Ляшенко, С.А. Бондар, Т.І. Труніна // Укр. журн. дерматол., венерол., косметол. – 2005. – №3. – С. 117.
61. Пальцев М.А. Клинико-морфологическая диагностика и принципи лечения кожных болезней: Рук-во для врачей / М.А. Пальцев, Н.Н. Потекаев, И.А. Казанцева, С.С. Кряжева. – М. : Медицина, 2006. – 512 с.
62. Перламутров Ю.Н. Комплексная терапия ограничених форм псориаза / Ю.Н. Перламутров, К.Б. Ольховская // Клин. дерматол. и венерол. – 2007. – № 5. – С. 61-64.
63. Пирузян А.Л. Молекулярная генетика псориаза / А.Л. Пирузян, Р.М. Абдеев // Вестн. Росс. академ. наук. – 2006. – № 3. – С. 33-43.
64. Пирятинская В.А. Псориаз. Дифференциальная диагностика. Принципы лечения / В.А. Пирятинская, Л.А. Карякина, А.Б. Пирятинская // Клиническая дерматология и венерология. – 2011. – № 1. – С. 83-90.
65. Психодерматология: история, проблемы, перспективы [Электронный ресурс] / О.Л. Иванов, А.Н. Львов, В.В. Остришко [и др.] // Рос. журн. кожных и венерических болезней. – 1999. – №1. – Режим доступа.: http://www.nature.com/jid/journal/v107bs/5610351a.html- aff1
66. Радионов В.Г. Новые подходы к фармакологической коррекции тревожных состояний больних псориазом / В.Г. Радионов, Ю.В Семряд., Д.В. Радионов // Укр. журн. дерматол., венерол., косметол. – 2008. – № 4. – С. 27 – 29.
67. Различие показателей воспалительного ответа в коже при распространенном вульгарном псориазе и псориатическом артрите / А.Ю. Громова. А.В. Чаплыгин, А.В. Самцов [и др.] // Рос. журн. кожных и венерических болезней. – 2005. – № 5. – С. 23-28.
68. Рамтохул Сошила. Клинико-статистическая оценка факторов риска, качества диагностики и эффективности лечения больных артропатическим псоріазом: автореф. дисс. на соискание учен. степени канд. мед. наук: спец. 14.01.10 «Кожные и венерические болезни» / Рамтохул Сошила. – СПб., 2005. – 22 с.
69. Раціональна діагностика та лікування в дерматології та венерології / За ред. І.І. Маврова // Довідник лікаря „Дерматолог-Венеролог”. – К.: ТОВ „Доктор-Медіа”, 2007. – С. 101–108. – Авт.-укл. також: В.М. Волкославська, Я.Ф. Кутасевич, І.О. Маштакова, І.О. Олійник, І.О. П’ятикоп, В.В. Савенкова, Е.М. Солошенко Л.Л. Шаульська.
70. Рациональний выбор топической терапии псориаза / Л.Т.Тогоева, С.Е.Зеленцова, П.А. Ахмедова, И.М.Корсунская [Электронный ресурс]// Лечащий врач. (Москва). – 2007. – №5. – Режим доступа: http://www.lvrach.ru/2007/05/4535197/
71. Роль показників перекисного окислення ліпідів та ферментів антиоксидантного захисту у формуванні оксидантного стресу у хворих на псоріаз / І.С.Лемко, Ю.В.Андрашко, М.Л. Габор [та ін.] // Укр. журн. дерматол., венерол., косметол. – 2008. – № 3. – С. 5-9.
72. Роль Т-регуляторных клеток в патогенезе псориаза / В.Р. Хайрутдинов, А.Ф. Михайличенко, М.С. Мухина [и др.] // Вестник дерматологии и венерологии. – 2011. – № 5. – С. 78–85.
73. Самцов А.В. Кожные и венерические болезни. Учебник для студентов медицинских ВУЗов / Самцов А.В., Барбинов В.В. – СПб.: ЕЛБИ, 2002. – 314 с.
74. Сан Э. Дерматология : Пер. с англ. / Э.Сан. – М.; СПб. : БИНОМ; Невский диалект, 2001. – 272 с.
75. Сизон О.О. Застосування нових гепатопротекторів для корекції порушення обмінних процесів у комплексній терапії хворих на псоріаз / О.О. Сизон, О.Ю. Туркевич // Укр. журн. дерматол., венерол., косметол. – 2008. – № 1. – С. 21–26.
76. Сизон О.О. Клініко-діагностичні критерії для визначення фенотипу псоріатичної хвороби / О.О. Сизон, О.Ю. Туркевич // Укр. журн. дерматол. венерол. косметол. – 2008. – №4. – С. 30 – 37.
77. Скрипкин Ю.К. Кожные и венерические болезни. Руководство для врачей. Т. 2 / Ю.К. Скрипкин. – М. : Медицина, 2005. – 544 с.
78. Степаненко Р.Л. Патогенетична роль імунних факторів у формуванні запальних процесів при псоріазі / Р.Л. Степаненко // Укр. журн. дерматол., венерол., косметол. – 2013. – № 4. – С. 84-92.
79. Степаненко В.І. Псоріаз / В.І. Степаненко, О.О. Сизон, М.М. Шупенько [та ін.] // Дерматологія, венерологія: підручник / Под ред. проф. В.І. Степаненко. – К.: КІМ, 2012. – С. 155-183.
80. Суколина О.Г. Комплексная оценка эффективности патогенетической терапии псориаза / О.Г. Суколина, Э.А. Баткаев // Вестник дерматологии и венерологии. – 2007. – № 3. – С. 30 – 34.
81. Суханова Н.М. Иммуноморфологические маркеры нарушения дифференцировки и пролиферации клеток в коже больных псориазом / Н.М. Суханова // Вестн. дерматологии и венерологии. – 2003. – № 3. – С. 29–31.
82. Терлецкий О.В. Современный подход к вибору внешней терапії больных псориазом / О.В.Терлецкий // Вестн. Санкт-Петербургской гос. мед. акад. им. И.И.Мечникова. – 2006. – № 2. – С. 154-155.
83. Терлецкий О.В. Психологическая характеристика и терапия больних псориазом / О.В. Терлецкий // Вестн. психотерапии. – 2011. – № 39. – С. 28-38.
84. Тлиш М.М. Клинико-морфологические особенности каплевидного псориаза / М.М. Тлиш, Н.Л. Сычева, Л.А. Фаустов // Клиническая дерматология и венерология. – 2012. – № 5. – С. 65–70.
85. Тузанкина И.А. Применение полиоксидония в терапии вульгарного псориаза / И.А. Тузанкина, Н.Н. Филимонкова, Э.Р. Бердникова // Иммунология. – 2005. – Т. 26, №4. – С. 239-243.
86. Фактор некроза опухоли, интерлейкины и липидный обмен при разных стадиях течения псориаза / Э. Н. Солошенко, Н. В. Жукова, Т. П. Ярмак, З. М. Шевченко // Клінічна імунологія, алергологія, інфектологія. – 2012. – № 1-2 (50-51). – С. 62-64.
87. Фаттяхитдинова З.А. Особености лечения больных распространенным псориазом, резистентным к терапии / З.А. Фаттяхитдинова, А.В. Резонткине, Л.Ф. Знаменская // Вестн. дерматологии и венерологии. – 2005. – № 3. – С. 39.
88. Хазизов И.Е. Патогенетическое изучение системы гемостаза у больных с тяжелыми формами экземы, атопического дерматита и псориаза (обзор литературы и собственные данные) / Хазизов И.Е., Нодова Е.С. // Тер. архив. – 1993. – № 11. – С. 43 – 49.
89. Хайрутдинов В.Р. Генетический паспорт больного псориазом / В.Р. Хайрутдинов // Вестн. дерматологии и венерологии. – 2011. – № 4. – С. 14–19.
90. Хайрутдинов В.Р. Роль иммуной системи кожи в патогенезе псориаза / В.Р. Хайрутдинов // Иммунопатология, инфектология, аллергология. – 2012. – №2. – С. 54-61.
91. Хайрутдинов В.Р. Современные представления об имунных механизмах развития псориаза / В.Р. Хайрутдинов, А.В. Самцов // Вестн. дерматологии и венерологии. – 2007. – №1. – С. 3 – 7.
92. Хайрутдинов В.Р. Роль Т-регуляторних клеток в патогенезе псориаза / В.Р. Хайрутдинов, А.Ф. Михайличенко, М.С. Мухина и др. // Вестник дерматологии и венерологии. – 2011. – № 5. – С. 78–86.
93. Хебіф Т.П. Шкірні хвороби. Діагностика та лікування / Т.П. Хебіф – К., 2007. – 114 с.
94. Хлебникова А.Н. Современные подходы к наружной терапии псориаза / А.Н. Хлебникова // Вестник дерматологии и венерологии. – 2012. – № 1. – С. 86–91.
95. Цідило І. Г. Особливості клітинного імунітету у хворих на псоріаз. // Архів клінічної медицини.- 2007. – №1. – С.49-51.
96. Цідило І. Г. Сучасний погляд на проблему псоріатичної хвороби // Галицький лікарський вісник. – 2005.- №1ч.2 – С.118-120.
97. Цогцэцэг А. Сравнительное изучение морфологических показателей хронических дерматозов до и после лечения на курорте «Авага-тосон» / А. Цогцэцэг// Сибирский медицинский журнал. – 2008. – № 8. – С. 70–73.
98. Чернишов П.В. Вибір стратегії лікування хворих на псоріаз із обмеженими висипаннями / П.В. Чернишов, В.Г. Коляденко // Клінічна імунологія. Алергологія. Інфектологія. – 2006. – № 4. – С. 78-80.
99. Чернишов П.В. Внутрішньоклітинна продукція інтерферону гамма Т-лімфоцитами хелперами хворих на псоріаз, яких лікували ультрафіолетовим опроміненням та метилпреднізолону ацепонатом / П.В.Чернишов // Укр. журн. дерматол., венерол., косметол. – 2005. – № 1. – С. 16–18.
100. Чернишов П.В. Вплив псоріазу на окремі складові показників якості життя пацієнтів / П.В.Чернишов // Укр. журн. дерматол., венерол., косметол. – 2005. – №4. – С. 11 -13.
101. Чернишов П.В. Співвідношення СХСR3 до СССR4 на Т-лімфоцитах-хелперах у хворих на псоріаз та атопічний дерматит / П.В.Чернишов / Тези допов. 1(VIII) з’ їзду Укр. асоціації лікарів-дерматовенерологів і косметологів (м. Київ, 20-23 вересня, 2005р.) // Укр. журн. дерматол., венерол., косметології. – 2005. – № 3. – С. 122.
102. Шкірні та венеричні хвороби. Навчальний посібник / В.Г.Коляденко, В.І.Степаненко, П.В.Федорич, С.І.Скляр. – К.: Нова книга, 2006. – 424с.
103. Щепитовски Я. Психодерматологические аспекты / Я. Щепитовски, А. Райх // Рос. журн. кожных и венерических заболеваний. – 2007. – № 4. – С.17-21.
104. Юрьев В.К. Оценка динамики качества жизни детей как критерий эффективности стационарного лечения / В.К. Юрьев, М.Х. Сайфулин // Вопросы современной педиатрии. – 2009. – Т.8. №6. – С.7-11.
105. Якубович А.И. Психосоматические аспекты качества жизни больных псориазом / А.И. Якубович // Материалы ІІІ Байкальской межрегиональной конференции. – Новосибирск, 2007. – №3. – С. 5-8.
106. Highly purified omega-3-polyunsaturated fatty acids for topical treatment of psoriasis. Results of a double-blind, placebo-controlled multicentre study / H.H. Henneicke-von Zepelin, U. Mrowietz, L. Färber [et al.] // Br. J. Dermatol. – 1993. – Vol. 129. – P. 713-717.
107. Additional clinical benefit of enoxaparin in COPD patients receiving salmeterol and fluticasone propionate in combination / R.A. Brown, L.Allegra, M.G.Matera [et al.] / Pulm. Pharmacol. Ther. – 2006. – Vol.19. – P. 419.
108. Amin M.M. Immunohistochemical study of osteopontin, Ki-67, and CD34 of psoriasis in Mansoura, Egypt / M.M. Amin, Z.A. Azim // Indian. J Pathol. Microbiol. – 2012. – Vol. 55. – Р. 56–60.
109. Angiogenesis in psoriasis / D. Creamer, D. Sullivan, R. Bicknell [et al.] // Angiogenesis. – 2002. – Vol. 5. – Р. 231–236.
110. Anstey A.V. Ретроспективная оценка достижения PASI 50 и PASI 75 при использовании мази, содержащей кальципотриол и бетаметазона дипропионат / A.V.Anstey, K.Kragballe // Укр. журн. дерматол., венерол., косметол. – 2008. – № 2. – С. 50-57.
111. Aronson P.J. A review of the role of neutrophils in psoriasis and related disorders [Electronic resource] / P.J. Aronson // Dermatol. Online J. – 2008. – Vol. 14, № 7. – Режим доступу : http://dermatology.cdlib.org.
112. Bowcock A.M. Getting under the skin: the immunogenetics of psoriasis / A.M. Bowcock, J.G. Krueger // Nature Rev. Immunol. – 2005. – Vol. 5. – Р. 699–711.
113. Broome A.-M. S100 Protein Subcellular Localization During Epidermal Differentiation and Psoriasis / A.-M. Broome, D. Ryan, R.L. Eckert // J. Histochem. Cytochem. – 2003. – Vol. 51, № 5. – Р. 675–685.
114. Calcipotriol / betamethasone dipropionate for the treatment of psoriasis / A. Charakida, O. Dadzie, F. Teixeira [et al.] // Exp. Opin. Pharmacother. – 2006. – Vol. 7, N 5. – P. 597–606.
115. Cabrijan L. Growth CD4 and CD8 lymphocytes and macrpphages in psoriasis / L. Cabrijan, T. Lipocencic, T. Batinac // Acta dermato-venerology. – 2009. – Vol. 17. – P. 162-165.
116. Castilla C. Sometimes it takes darkness to see the light: pitfalls in the interpretation of cell proliferation markers (Ki67 and PCNA) / C. Castilla // Skinmed. – 2012. – Vol.10, N2. – P. 90-92.
117. Chan epidemiology of plaque psoriasis in the Canadian population / K. Papp, Y. Poulin, N. Wasel [et al.] // Abstracts of the 17th Congress of the EADV. – Paris, 2008. – P. 213.
118. Christophers E. The immunopathology of psoriasis / E. Christophers // Int. Arch. Allergy Immunol. – 1996. – Vol. 110. – P. 119-206.
119. Clinical and histopathological improvement of psoriasis with oral chondroitin sulfate: A serendipitous finding / J. Vergés, E. Montell, M. Herrero [et al.] // Dermatol. Online J. – 2005. – Vol. 11, № 1. – Р. 31.
120. Coman O.A. Efficacy and safety of calcipotriol and bethametasone dipropionate compared to calcipotriol in the long-term treatment of psoriasis vulgaris / O.A. Coman // Abstracts of the 17th Congress of the EADV. – Paris, 2008. – P. 1479.
121. Crawshaw A.A. Investigational VEGF antagonists for psoriasis / A.A. Crawshaw, C.E. Griffiths, H.S. Young // Expert Opin. Investig. Drugs. – 2012. – Vol. 21, № 1. – Р. 33–43.
122. Critical Review of Generic and Dermatology-Specific Health-Related Quality of Life Instruments / H. Both, M.-L. Essink-Bot, J. Busschbach [et al.] // J. Invest. Dermat. – 2007. – Vol.127. – P. 2726 – 2739.
123. Cutaneous bioassay of salicylic acid as a keratolytic / S.J. Bashir, F. Dreher, A.L. Chew [et al.] // Int. J. Pharm. – 2005. – Vol. 292. – P. 187-194.
124. Decision points for the initiation of systemic treatment for psoriasis / S.R. Feldman, I.Y. Koo, A. Menter, J. Bagel // J. Am. Acad. Dermatol. – 2005. – Vol. 53, N 1. – P. 101–107.
125. Decreased levels of metalloproteinase-9 and angiogenic factors in skin lesions of patients with psoriatic arthritis after therapy with anti-TNF-α / P. Cordiali-Fei, E. Trento, G. D’Agosto [et al.] // J. Autoimmune Dis. – 2006. – Vol. 3, №5. – P. 5.
126. Dermal vasculature in psoriasis and psoriasiform dermatitis: A morphometric study / S. Gupta, M. Kaur, R. Gupta [et al.] // Indian J. Dermatol. – 2011. – Vol. 56. – Р. 647–649.
127. Dermatopathology / W. Kempf, M. Hantschke, H. Kutzner, W.H.C. BurgdorfL. – Germany : Steinkopff Verlag, 2008. – 299 p.
128. Dinarello C.A. Interleukin-18 and the pathogenesis of inflammatory diseases / C.A. Dinarello // Semin. Nephrol. – 2007. – Vol. 27, № 1. – P. 98-114.
129. Effect of heparin, dermatan sulfate, and related oligo-derivatives on human polymorphonuclear leukocyte functions / G. Bazzoni, A.B. Nunez, G. Maskellani [et al.] // J. Lab. Clin. Med. – 1992. – Vol.121. – P. 268–275.
130. Effects of heparin and related molecules upon neutrophil aggregation and elastase release in vitro / R.A. Brown, R. Lever, N.A. Jones, C.P.Page // Br. J. Pharmacol. – 2003. –Vol.139. – P. 845–853.
131. Effects of topical petrolatum and salicylic acid upon skin photoreaction to UVA / B. Birgin, E. Fetil, T. Ilknur [et al.] // Eur. J. Dermatol. – 2005. – Vol.15. – P. 156-158.
132. El-Domyati M.M. Apoptosis in response to topical calcipotriol therapy for psoriasis / M.M. El-Domyati, M.Barakat, R. Abdel-Raztk // Abstracts of the 17th Congress of the EADV. – Paris, 2008. – P. 213.
133. Electrical measurement of moisturizing effect on skin hydration and barrier function in psoriasis patients / J.H. Rim, S.J. Jo, J.Y. Park [et al.] // Clin. Exp. Dermatol. – 2005. – Vol. 30. – P. 409-413.
134. Enoxaparin is superior to unfractionated heparin in patients with ST elevation myocardial infarction undergoing fibrinolysis regardless of the choice of lytic: an ExTRACT-TIMI 25 analysis / R.R. Giraldez, J.C. Nicolau, R. Corbalan [et al.] // Eur. Heart J. – 2007. – Vol. 28. – Р. 1566-1573.
135. Evaluation of Vaseline oil applied prior to UVB TL01 phototherapy in the treatment of psoriasis / K. Penven, D. Leroy, L.Verneuil [et al.] // Photodermatol. Photoimmunol. Photomed. – 2005. – Vol. 21. – P. 138-141.
136. Expression of the chemokine receptor CCR5 in psoriasis and results of a randomized placebo controlled trial with a CCR5 inhibitor / M. de Groot, M.B.M. Teunissen, J.P. Ortonne [et al.] // Arch. Dermatol. Res. – 2007. – Vol. 299. – Р. 305–313.
137. Farber E.M Nonpustular palmoplanter psoriasis / E.M. Farber, L. Nall // Cutis. – 1992. – Vol. 50. – P. 407-410.
138. Fry L. An atlas of psoriasis / L.Fry. – London, New York : Taylor and Francis, 2004. – 99p.
139. Gaffney A. Rheumatoid arthritis and heparin / A. Gaffney, P. Gaffney // Br. J. Rheumatol. – 1996. – Vol. 35. – P. 808.
140. Griffith C.E. Pathogenesis and clinical features of psoriasis / C.E. Griffith, J.N. Barker // Lancet. – 2007. –Vol. 370. – P. 263-271.
141. Guilhou J.J. Immunopathogenesis of Psoriasis: News in an Old Concept / J.J. Guilhou // Dermatology. – 1998. – Vol. 197. – Р. 310–312.
142. Hagemann I. Topical treatment by urea reduces epidermal hyperproliferation and induces differentiation in psoriasis / I. Hagemann, E. Proksch // Acta Derm. Venereol. – 1996. – Vol.76. – P. 353-356.
143. Heparin attenuates TNF-α induced inflammatory response through a CD11b dependent mechanism /A. Salas, M. Sans, A. Soriano [et al.] // Gut. – 2000. – Vol. 47. – P. 88–96.
144. Heparin is an adhesive ligand for the leukocyte integrin Mac-1 (CD11b/CD18) / M.S. Diamond, R. Alon, C.A. Parcos [et al.] // J. Cell. Biol. – 1995. – Vol.130. – P. 1473–1482.
145. Human vascular endothelial cells produce tumor necrosis factor-alpha in response to proinflammatory cytokine stimulation / V. Ranta, A. Orpana, O. Carpen [et al.] // Crit. Care Med. – 1999. – Vol. 27. – P. 2184–2187.
146. Immunohistochemical study of the early histopathologic changes occurring in trauma-injured skin of psoriatic patients / M. Capuano, I. Lesnoni La Parola [et al.] // Europ. J. Dermatol. – 1999. – Vol.9, № 2. – Р. 102–106.
147. Increased numbers of CD68 antigen positive dendritic epidermal cells and upregulation of CLA (cutaneous lymphocyte-associated antigen) expression on these cells in various skin diseases / K. Nakamura, N. Yasaka, A. Asahina [et al.] // J. Dermatol. Sci. – 1998. – Vol. 18, № 3. – Р. 170–180.
148. Inverse Correlation between Caveolin-1 Expression and Clinical Severity in Psoriasis Vulgaris / W.Y. Ma, L. Zhuang, D.X. Cai [et al.] // J. Int. Med. Res. – 2012. – Vol. 40. – Р. 1745–1751.
149. Jonat W. Is the Ki-67 labelling index ready for clinical use? / W. Jonat, M. Arnold // Ann. Oncol. – 2011. – Vol. 22, N3. – P. 500-502.
150. ‘Keratolytic’ properties of benzoyl peroxide and retinoic acid resemble salicylic acid in man / J.M. Waller, F. Dreher, S. Behnam [et al.] // Skin. Pharmacol. Physiol. – 2006. – Vol. 19. – P. 283-289.
151. Klimowicz A. Evaluation of skin penetration of topically applied drugs in humans by cutaneous microdialysis: acyclovir vs. salicylic acid / A. Klimowicz, S. Fartal, S. Bielecka-Grzela // J. Clin. Pharm. Ther. – 2007. – Vol. 32. – P. 143-148.
152. Krueger J.G. The immunologic basis for the treatment of psoriasis with new biologic agents / J.G. Krueger // J. Am. Acad. Dermatol. – 2002. – Vol. 46. – Р. 1–23.
153. Lebwohl M. Innovations in the treatment of psoriasis / M.Lebwohl // J. Am. Acad. Dermatol. – 2008. – Vol. 51, N 1. – P. 40–41.
154. Leukotriene B5 derived from eicosapentaenoic acid does not stimulate DNA synthesis of cultured human keratinocytes but inhibits the stimulation induced by leukotriene B4 / K. Kragballe, P.Voorhees, C.R. Darley, E.L. Goetzl // J Invest Dermatol. – 1985. P. 84.
155. Lever R. The effects of heparin and related molecules upon the adhesion of polymorphonuclear leucocytes to vascular endothelium in vitro / R. Lever, G.R.S. Hoult, C.P. Page // Br. J. Pharmacol. – 2000. – Vol.129. – P. 533–540.
156. Lvov A.N. Retrospective pharmacoeconomic study: Daivobet versus Elocom S in treatment of psoriasis vulgaris / A.N. Lvov, A.A. Khaldin // Abstracts of the 17th Congress of the EADV. – Paris, 2008. – P. 1340.
157. Mantelescot G. Comparison of effects on marcers of blood cell activation of enoxaparin, dalteparin, and UFH in patients with unstable angina pectoris or non-ST-segment elevation acute myocardial infarction (the ARMADA study) / G. Mantelescot, C. Bol-dit-Sollier, D. Chibedi [et al.] // Am. J. Cardiol. – 2003. – Vol. 91. – Р. 925-930.
158. Mast cells in psoriasis / S.O. Ozdamar, D. Seckin, B. Kandemir, A.Y. Turanh // Dermatology. – 1996. – Vol. 192. – Р. 190.
159. Menter A. Current and future management of psoriasis / A. Menter, C.E. Griffiths // Lancet. – 2007. – Vol. 370. – P. 272–284.
160. Metalloelastase (MMP-12) and 92-kDa gelatinase (MMP-9) as well as their inhibitors, TIMP-1 and -3, are expressed in psoriatic lesions / S. Suomela, A.L. Kariniemi, E. Snellman, U. Saarialho-Kere // Exp. Dermatol. – 2001. – Vol.10, № 3. – Р. 175–183.
161. Mills S.E. Histology for Pathologists. – 3rd ed. / S. E. Mills. – N.-Y. : Lippincott Williams & Wilkins, 2007. – 1148 p.
162. Morphometric study of microvessels, epidermal characteristics and inflammation in psoriasis vulgaris with their correlations / D. Boruah, N. Moorchung, B. Vasudevan [et al.] // Indian J. Dermatol. Venereol. Leprol. – 2013. – Vol. 79. – Р. 216–223.
163. Nickoloff B.J. Recent insights into the immunopathogenesis of psoriasis provide new therapeutic opportunities / B.J. Nickoloff, O.F Nestle // J. Clin. Invest. – 2004. – Vol. 113. – Р. 1664-1675.
164. Nicotine induces endothelial TNF-α expression, which mediates growth retardation in vitro / G. Albaugh, B. Kann, L. Strande [et al.] // J. Surg. Res. – 2001. – Vol. 99. – P. 381–384.
165. Nijsten T. The Psychometric Properties of the Psoriasis Disability Index in United States Patients / T. Nijsten // J. Invest. Dermatol. – 2005. – Vol. 125. – P. 665–672.
166. Novel quantitative immunofluorescent technique reveals improvements in epidermal cell populations after mild treatment of psoriasis / M.W.van Duijnhoven, R. Hagenberg, M.C. Pasch [et al.] // Acta Derm. Venereol. – 2005. – Vol. 85. – P. 311-317.
167. Nockovski P., Baran W. Novel approach to psoriasis // Terapia. – 2005. – Vol. 3. – P.20-24.
168. Pimecrolimus cream in the treatment of psoriasis in an infant / F. Canpolat, B. Cevirgen Cemill, F. Eskioglul [et al.] // Abstracts of the 17th Congress of the EADV. – Paris, 2008. – P. 1185.
169. Rakhmatov B.A. Some aspects of psoriasis epidemiology in Uzbekistan / B.A. Rakhmatov, A.A. Rakhmatov // Abstracts of the 17th Congress of the EADV. – Paris, 2008. – P. 1399.
170. Randomized comparison of enoxaparin with unfractioned heparin following fibrinolytic therapy for acute myocardial infarction / S.H. Baird, I.B. Menown, S.J. McBrige [et al.] // Eur. Heart J. – 2002. – Vol. 23. – Р. 267-272.
171. Rashed H.E. Immunohistochemical evaluation of VEGF, survivin, bcl-2 protein and iNOS in the pathogenesis of psoriasis / H.E. Rashed, E.R. Hayam, H. Abd El-Bary Eman // Egypt. J. Pathol. – 2012. – Vol. 32, № 1. – Р. 91–98.
172. Rigopoulos D. Treatment of nail psoriasis with a combination formulation of calcipotriol plus bethametasone dipropionate ointment / D. Rigopoulos, S. Gregoriou, E. Bilaieva // Abstracts of the 17th Congress of the EADV. – Paris, 2008. – P. 1449.
173. Rotsztejn H. Psoriasic lesions before and after phototherapy / H. Rotsztejn // Centr. Eur. J. Immunol. – 2012. – Vol. 37, N3. – P. 258-263.
174. Sanchez-Hernandez M. Expression profiles of ProEx C and Ki67 in squamosus cell carcinoma in situ of the skin and their relationship with human papillomavirus genotypes / M. Sanchez-Hernandez // J. Cutan. Pathol. – 2010. – Vol. 37, N7. – P. 730–736.
175. Schon M. Psoriasis / M. Schon, W.H. Boehncke // N. Engl. J. Med. – 2005. – Vol. 352. – P. 1899–1904.
176. Stacey E. Mills. Histology for Pathologists, 3rd Edition / Stacey E. Mills. –Lippincott Williams & Wilkins, 2007. – 1148 p.
177. Stern R.S. Psoralen and ultraviolet A light therapy for psoriasis / R.S.Stern // N. Engl. J. Med. – 2007. – Vol. 357. – P. 682–690.
178. Sticky neutrophils, pathergic arthritis, and response to heparin in pyoderma gangrenosum complicating ulcerative colitis / A.D. Dwarakanath, L.G. Yu, C. Brookes [et al.] // Gut. – 1995. – Vol. 37. – P. 585–588.
179. Strober B.E. Conventional systemic agents for psoriasis / B.E. Strober, K. Siu, K. Menon // J. Reumatol. – 2006. – Vol. 33. – P. 1442–1450.
180. The changes in expression of Ki-67, and CD31 in psoriatic lesions before and after etanercept treatment / B. Tursen, T. Kara, U. Tursen [et al.] // Hong Kong J. Dermatol. Venereol. – 2013. – Vol. 21. – Р. 5–13.
181. The effect of selective phosphodiesterase isoenzyme inhibition on neutrophil function in vitro / N.A. Jones, V. Boswell-Smith, R. Lever, C.P. Page // Pulm. Pharmacol. Ther. – 2005. – Vol. 18. – P. 93–101.
182. The evaluation of psoriasis therapy with biologics leads to a revision of the current view of the pathogenesis of this disorder / S. Philipp, K. Wolk, S. Kreutzer [et al.] // Expert Opin.Ther. Targets. – 2006. – Vol. 10. – P. 817-831.
183. Thrombomodulin expression on dermal cells in normal and psoriatic skin / T. Cuzzi-Maya, R. Sidbury, W.L. Epstein [et al.] // Arch. Dermatol. Res. – 1998. – Vol. 290, № 5. – Р. 233–239.
184. Todescu C. The use of calcipotriol/bethametasone dipropionate as monotherapy in the treatment of different types of psoriasis / C. Todescu // Abstracts of the 17th Congress of the EADV. – Paris, 2008. – P. 1425.
185. Tonsil surfaceepitheliumis idealfor monitoring Ki67 immunohistochemical staining / C.U. Hsu // Histopathology. – 2013. – Vol. 63, № 6. – P. 810-816.
186. Translating the Science of Quality of Life into Practice: What Do Dermatology Life Quality Index Scores Mean? / Y. Hongbo, C.L. Thomas, M.A. Harrison [et al.] // J. Invest. Dermatol. – 2005. – Vol. 125. – P. 659 – 664.
187. Treffel P. Stratum corneum dynamic function measurements after moisturizer or irritant application / P. Treffel, B. Gabard //Arch. Dermatol Res. – 1995. –Vol. 287. – P. 474-479.
188. Tzu J. Current advancements in the treatment of psoriasis: immunobiologic agents / J. Tzu, A. Mamelak, D. Sauder // Clin. Applied. Immunol. Rev. – 2006 – Vol. 6. – P.99- 130.
189. VEGF is likely a key factor in the link between inflammation and angiogenesis in psoriasis: results of an immunohistochemical study / O. Simonetti, G. Lucarini, G. Goteri [et al.] // Int. J. Immunopathol. Pharmacol. – 2006. – Vol. 19, № 4. – Р. 751–560.
190. Weedon D. Skin Pathology. – 2 ed. / D. Weedon. – China : Churchill Livingstone, 2002. – 1158 p.
191. Wielowieyska-Szybinska D. Psoriasis: course of disease and treatment / D. Wielowieyska-Szybinska, A. Wojas-Pelc // Post. Dermatol. Alergol. -2012. – Vol. 29, N 2. – P. 118-122.
192. World Health Organization of tumours: pathology and genetics of skin tumours / Ph. E. LeBoit, G. Burg, D. Weedon, A. Sarasin. – Lyon (France): IARC Press, 2006. – 357 p.
193. Yu X-P. Down-regulation of NF-kappa B protein levels in activated human lymphocytes by 1,25-dihydroxyvitamin D3 / X.- P. Yu // Proc. Natl. Acad. Sci. – 1995. – Vol. 92. –P. 10990–10994.
194. Zaba L.C. Identification of TNF-related apoptosis-inducing ligand and other molecules that distinguish inflammatory from resident dendritic cells in patients with psoriasis / L.C. Zaba, J. Fuentes-Duculan, N.J. Eungdamrong [et al.] // J. Allergy. Clin. Immunol. – 2010. – Vol. 125, № 6. – P. 1261-1268.
Додаток А
Акти впровадження










