МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
НАЦІОНАЛЬНА МЕДИЧНА АКАДЕМІЯ ПІСЛЯДИПЛОМНОЇ ОСВІТИ
ІМЕНІ П. Л. ШУПИКА
На правах рукопису
Резнікова Анна Олексіївна
УДК: 616.5-002.2-056.3-097-053-08:612.017.1
ОБГРУНТУВАННЯ АЛГОРІТМУ ЛІКУВАННЯ АТОПІЧНОГО ДЕРМАТИТУ В ЗАЛЕЖНОСТІ ВІД ВІКОВИХ ОСОБЛИВОСТЕЙ
14.01.20 – шкірні та венеричні хвороби
Дисертація на здобуття наукового ступеня
кандидата медичних наук
Науковий керівник:
Калюжна Лідія Денисівна
доктор медичних наук,
професор
Київ – 2017
ЗМІСТ
Перелік умовних скорочень………………………………………………………………….. 4
Вступ………………………………………………………………………………………………… 5
Розділ 1 Огляд літератури…………………………………………………………………….. 11
1.1 Атопічний дерматит у різних вікових категоріях………………………………….. 11
1.2 Свербіж як один з основних симптомів атопічного дерматиту………………… 16
1.3 Особливості алергологічного статусу хворих на атопічний дерматит різного віку…….. 20
1.4 Імунологічні особливості атопічного дерматиту………………………………….. 29
1.5 Оцінка якості життя хворих на атопічний дерматит…………………………….. 34
1.6 Лікування атопічного дерматиту……………………………………………. 35
Розділ 2. Матеріали та методи дослідження……………………………………………. 39
2.1 Загальна характеристика пацієнтів………………………………………… 39
2.2 Критерії та принципи розподілу пацієнтів в групи дослідження. 40
2.3 Методи дослідження…………………………………………………………….. 41
2.3.1 Клінічні методи…………………………………………………………………. 41
2.3.2 Імунологічні методи дослідження……………………………………….. 45
2.3.3 Апаратний метод дослідження функціональних параметрів
шкіри……………………………………………………………………………….. 50
2.4 Оцінка якості життя сімей з атопічним дерматитом…………………. 51
2.5 Статистичні методи………………………………………………………………. 52
Розділ 3 Клінічна характеристика хворих на атопічний дерматит різних
вікових груп……………………………………………………………………………. 54
3.1 Клінічні особливості атопічного дерматиту у дітей…………………. 54
3.2 Клінічні особливості атопічного дерматиту у дорослих………….. 57
3.3 Оцінка якості життя батьків і дітей хворих на атопічний дерматит 62
3.4 Особливості контрольної групи…………………………………………….. 64
Розділ 4 Функціональні параметри шкіри хворих на атопічний дерматит… 66
Розділ 5 Особливості алергологічного статусу у хворих на атопічний дерматит
в різних вікових групах……………………………………………………………. 72
Розділ 6 Оцінка імунного статусу хворих на атопічний дерматит
за визначенням інтерлейкінів-2, -4, основного білка мієліну, білка
S-100, нейроспецифічної енолази та загального людського
мозкового антигену…………………………………………………………………. 78
6.1 Визначення показників клітинного та гуморального імунітету у хворих на атопічний дерматит різних вікових груп………………..78
6.2 Вивчення рівня загального імуноглобуліну Е та інтерлейкінів-2, -4
в сироватці крові хворих на атопічний дерматит……………………. 89
6.3 Кореляційні взаємозв’язки між імунологічними показниками….. 91
Розділ 7 Алгоритм лікування хворих на атопічний дерматит різних вікових категорій…………………………………………………………………………………. 96
Розділ 8 Аналіз та узагальнення результатів дослідження……………………… 102
Висновки……………………………………………………………………………………………. 111
Список використаних джерел………………………………………………………………. 114
Додаток А Опитувальник……………………………………………………………………. 138
Додаток Б Акти впровадження…………………………………………………………….. 139
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
АД – атопічний дерматит
ЗЛМА – загальний людський мозковий антиген
ІЛ – інтерлейкін
ІФА – імуноферментний аналіз
НК – натуральні кілери
НСЕ – нейрон-специфічна енолаза
ОБМ – основний білок мієліну
ПГЕ2 – вагінальні простагландини
РБТЛ – реакція бласттрансформації лейкоцитів
ТГКС – топічні глюкокортикостероїди
ТІК – топічні інгібітори кальциневрину
у.о. – умовні одиниці
УФ – ультрафіолет
ФГА – фітогемаглютинін
ЦІК – циркулюючі імунні комплекси
DFI – Dermatitis Family Impact
Ig – імуноглобулін
FDLQI – Family Dermatology Life Quality Index
SCORAD – Severity scoring of atopic dermatitis
Th1 – Т-хелпери 1 класу
Th2 – Т-хелпери 2 класу
ВСТУП
Актуальність теми. Атопічний дерматит (АД) – хронічне алергійне захворювання, яке розвивається у осіб з генетичною схильністю до атопії, має рецидивуючий перебіг, вікові особливості клінічних проявів та характеризується підвищеним рівнем загального та специфічних імуноглобулін (Ig) E у сироватці крові [45, 113].
АД є одним з найбільш поширених захворювань шкіри, яке вражає до 20 % дітей та 1-3 % дорослих у більшості країн світу. В сучасних умовах спостерігається зростання захворюваності на АД в усьому світі, що пов’язано із несприятливим впливом багатьох факторів сучасної цивілізації. В Україні протягом 2009-2014 рр. спостерігається поступове зростання захворюваності та поширеності (розповсюдженості) АД серед дітей віком від 0 до 17 років [42, 70, 102, 187].
Діагностика АД залишається клінічною, оскільки наразі не існує надійних біомаркерів, здатних диференціювати це захворювання від інших. Лабораторні показники, які найчастіше пов’язують з цим захворюванням, а саме: підвищений рівень загального і алерген-специфічного сироваткового Ig E, негативні у близько 20 % осіб, які страждають на захворювання. Деякі науковці позначають «екзогенну» та «ендогенну» групи захворювання на основі наявності або відсутності збільшеного рівня Ig E, але питання вірогідності таких варіантів дискутабельне [46, 170, 148].
Відкриття нових субпопуляцій Т-лімфоцитів, а також нових цитокінів та хемокінів, сформувало безліч додаткових потенційних біомаркерів. До них, зокрема належать рівні CD 30 у сироватці, хемоаттрактантів, які виробляються макрофагами, інтерлейкінів (ІЛ) -12, -16, -18, -31 та ін. Рівні деяких з цих показників показали кореляцію з тяжкістю АД за Severity scoring of atopic dermatitis (SCORAD) та іншими шкалами інтенсивності захворювання, але на сьогоднішній день, жоден з них не продемонстрував надійної чутливості або специфічності на користь загального клінічного використання для діагностики та моніторингу [204, 180, 191].
Механізм свербежу і по сьогоднішній день залишається значним питанням патофізіології, до кінця ще не вирішеним. Як правило, вивчення механізму виникнення свербежу проводять за трьома напрямками: вивчення подразника, рецептора і периферичного нерва [145, 169]. Рецептори свербежу розташовані тільки в шкірі і слизових оболонках, а провідні сигнали утворення свербежу локалізовані в місці дермально-епідермального з’єднання. Частка С-волокон, які проводять сигнал свербежу, становить всього 5 % серед нервових закінчень в шкірі. Тим часом, в реалізації свербіння мають значення і ендогенні речовини, здатні його провокувати [138, 127, 175]. До них відносяться: аміни (гістамін), протеази, опіоїди, метаболіти ліпідного обміну (простагландини, лейкотрієни), нейропептиди, цитокіни, фактори росту нервових клітин. Після різних неспецифічних тригерних факторів, також після розчісування, вільні нервові закінчення в шкірі звільняють нейропептиди. Медіаторами свербежу є: аміни (гістамін), нейропептиди, протеази, опіоїдні пептиди, ейкозаноїди, цитокіни, інтерферон гамма, нейротропін, еозинофіли, базофіли. Такий складний і різноманітний механізм реалізації свербіння робить вельми складним пошук реальних його інгібіторів [199, 200].
Крім безпосередньої стимуляції свербежу такими медіаторами, як гістамін, існує два основних механізми, які провокують свербіж при патофізіологічному стані. Такими є периферична і центральна сенсибілізація. Група сенсибілізаторів свербежу включає простагландини, інтерлейкіни, нейротрофіни і фактор росту нервів. Прурітогенну дію мають ІЛ-2, ІЛ-4 та ІЛ-6 [209, 134]. Відомо, що ІЛ-2 сприяє приритогенній дії шляхом активації чутливої до гістаміну, брадикініну і капсацин популяції С-волокон шкіри. Відомо, що ІЛ-2 є цитокіном-медіатором запалення, продукується Т-клітинами у відповідь на антигенну і мітогенного стимуляцію. У свою чергу, ІЛ-2 необхідний для проліферації Т-клітин, що регулюють імунну відповідь. Цей інтерлейкін відіграє центральну роль в регуляції клітинного імунітету, виробляється активованими CD4 лімфоцитами. Встановлено, що ІЛ-4 бере участь в патогенезі запалення та свербежу. Свербіж, викликаний ІЛ-2, не реагує ні на антигістамінні, ні на нестероїдні протизапальні препарати. До сих пір не встановлено, активізується свербіж безпосередньо рецепторами або реалізується опосередковано, через опасисті та ендотеліальні клітини [39, 175, 164].
Сучасні наукові розробки дозволили зупинитись на вивченні імунних складових реалізації свербежу у хворих на АД різних вікових груп, що дозволило зупинитися на наступних показниках: CD4, ІЛ-2, ІЛ-4 та аутоантитіл до мозкових антигенів. Ці дані свідчать про необхідність продовжити дослідження деяких складових в механізмі свербежу при АД. У зв’язку з цим, актуальним є поглиблене дослідження цієї багатофакторної патології, яка дозволить створити сучасні основи для розробки методів лікування та профілактики АД
Зв’язок роботи з науковими програмами, планами, темами. Робота виконувалася в рамках науково-дослідної роботи кафедри дерматовенерології Національної медичної академії післядипломної освіти імені П. Л. Шупика МОЗ України «Обгрунтування терапевтичних підходів при хронічних дерматозах та ІПСШ з урахуванням їх патогенетичних особливостей» (номер держреєстрації 0108V009971), термін виконання 2009-2014 рр. Дисертантом особисто вивчено особливості клініки, діагностики АД у дітей та дорослих залежно від вікових особливостей та імунного статусу, а також спільно з науковим керівником, д. мед. н. професором Калюжною Л. Д. розроблено рекомендації щодо діагностики та покрокового алгоритму лікування АД.
Мета та задачі дослідження. Мета – розробка алгоритму лікування хворих на АД залежно від вікових особливостей клінічних проявів дерматозу та імунного статусу хворих.
Задачі дослідження:
1. Провести аналіз клінічних особливостей дерматозу та об’єктивізувати тяжкість ураження шкіри хворих на АД у різних вікових групах.
2. Вивчити функціональні параметри шкіри (вологість, жирність, еластичність, pH, рівень меланіну, температуру шкіри), у хворих на АД у різних вікових групах.
3. Провести оцінку якості життя дітей хворих на АД та членів їх сімей (батьків).
4. Дослідити рівень загального Ig E та спектр специфічних Ig E у хворих на АД різних вікових груп.
5. Дослідити показники клітинного та гуморального імунітету.
6. Дослідити показники функціональної активності імунних клітин та автоімунні реакції у хворих на АД у різних вікових групах.
7. Розробити лікувально-діагностичний алгоритм надання медичної допомоги хворим на АД з урахуванням встановлених вікових особливостей шкіри, рівня загального та специфічних Ig E, показників інтерлейкінів.
Об’єкт дослідження: особливості перебігу АД у хворих різних вікових категорій.
Предмет дослідження: клінічні особливості дерматозу, функціональні параметри шкіри, алергологічні та імунологічні особливості АД у дітей та дорослих у різних вікових групах.
Методи дослідження: загальні клінічні, імунологічні, алергологічні, інструментальні та статистичні.
Наукова новизна отриманих результатів. Вперше проведено співставлення та проаналізовано рівень ІЛ-2 та ІЛ-4 у різних вікових групах хворих на АД.
Вперше визначено автоантитіла до мозкових антигенів: основного білка мієліну (ОБМ), білка S-100, нейрон-специфічної енолази (НСЕ), загального людського мозкового антигену (ЗЛМА), що дає підставу оцінити роль вказаних антитіл у реалізації свербежу при АД.
Запропоновано обгрунтований алгоритм лікування дітей та дорослих хворих на АД з урахуванням встановлених алергологічних та імунологічних особливостей.
Практичне значення отриманих результатів. Отримані результати роботи дозволили оптимізувати лікувально-діагностичний алгоритм надання медичної допомоги хворим на АД різних вікових груп за рахунок додаткових критеріїв, провідними з яких є імунологічні дослідження.
Результати дослідження впроваджено в практику роботи Київської міської клінічної шкірно-венерологічної лікарні, Територіального медичного об’єднання «Дерматовенерологія», консультативно-діагностичної поліклініки Національної дитячої спеціалізованої лікарні «ОХМАТДИТ» МОЗ України, кафедри дерматовенерології Національної медичної академії післядипломної освіти імені П. Л. Шупика, ДУ «Інститут дерматології та венерології НАМН України». Виданий інформаційний лист про досвід використання інгібіторів кальциневрину у дорослих, хворих на АД.
Особистий внесок здобувача. Дисертаційна робота виконана і написана автором самостійно. Особисто здобувачем проаналізована та систематизована сучасна наукова література за обраною темою, проведено інформаційно-патентний пошук, клінічні спостереження за хворими. Дисертантом самостійно здійснено статистичну обробку, аналіз, інтерпретацію та узагальнення отриманих результатів, написано всі розділи роботи, сформульовано висновки.
Автором спільно з доцентом кафедри дерматології та венерології Національного медичного університету імені О. О. Богомольця, к. мед. н. Чернишовим П. В. та M. K. A. Basra проведено вивчення особистого анамнезу, алергологічного статусу, вікових клінічних особливостей та показників алергічних реакцій у пацієнтів хворих на АД різних вікових груп.
Дисертантом не запозичено результати та ідеї співавторів публікацій.
Апробація результатів дисертації. Матеріали дисертації були висвітлені на науково-практичній конференції молодих вчених Національної медичної академії післядипломної освіти імені П. Л. Шупика «Сьогодення і майбутнє науки в практичній медицині» (Київ, 2014), на науково-практичній конференції «Нові організаційні та діагностично-лікувальні технології в дерматовенерологічній практиці» (Київ, 2015), на науково-практичній конференції «Спадкові та екологічні чинники в дерматовенерології» (Київ, 2016), регіональній науково-практичній конференції «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом» (Святогірськ, 2016), на всеукраїнській науково-практичній конференції молодих вчених Національної медичної академії післядипломної освіти імені П. Л. Шупика, присвяченій Дню науки «Науково-практична діяльність молодих вчених медиків: досягнення і перспективи розвитку» (Київ, 2016).
Публікації. За темою дисертації опубліковано 12 друкованих праць, зокрема 6 статей, серед яких 4 статті в моноавторстві, які входять до наукових фахових видань України, 1 стаття – у закордонному виданні, 1 стаття – у збірнику наукових праць, 4 статті, що входять до міжнародної наукометричної бази «Російський індекс наукового цитування» та 1 – Google Scholar, 1 інформаційний лист, 5 тез доповідей у збірниках матеріалів наукових конференцій.
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУРИ
1.1 Атопічний дерматит у різних вікових категоріях
АД (або атопічна екзема, «нейродерміт» у німецькомовних країнах, ендогенна екзема) – запальне, хронічне або хронічне рецидивуюче захворювання шкіри, яке супроводжується свербінням і часто виникає в родинах, які страждають на інші атопічні захворювання, такі як: бронхіальна астма та/або алергічний ринокон’юнктивіт [161].
АД є одним з найбільш поширених захворювань шкіри, яке вражає до 20 % дітей та 1-3 % дорослих у більшості країн світу. Воно часто є першим кроком у виникненні інших атопічних захворювань, таких як риніт та/або астма [198].
Встановлено декілька критеріїв діагностики АД, проте не існує патогномонічних лабораторних біомаркерів для діагностики АД, оскільки найбільш характерні риси, підвищення рівнів загального або алерген-специфічного Ig E в сироватці або ж Ig E-опосередкована сенсибілізація шкіри, спостерігаються не у всіх осіб, які страждають на АД. З метою диференціації був введений термін ендогенний (Ig E-асоційований) АД, на відміну від екзогенної (Ig E-асоційована) форми АД. Це протиріччя термінології, яке триває й досі, має практичні наслідки стосовно стратегій уникнення контакту з алергенами при лікуванні захворювання. В етіопатофізіології АД до уваги потрібно брати декілька аспектів. Крім сильного генетичного впливу (80 % рівень співпадання у однояйцевих близнюків, 20 % – у різнояйцевих близнюків) до переліку характерних патофізіологічних особливостей належать:
– імунне відхилення в бік Th2 у фазі ініціації з подальшим збільшенням вироблення Ig E [39, 89, 169, 221];
– недостатня бар’єрна функція шкіри («сухість» шкіри) через порушення метаболізму ліпідів та/ або утворення структурних білків епідермісу (мутації філагріну, нестача інгібітора протеази тощо);
– посилена колонізація патогенними мікроорганізмами, такими як Staphylococcus aureus та Malassezia furfur (на відміну від Staphylococcus epidermidis у здорових осіб) і подальше підвищення сприйнятливості до інфекції шкіри;
– сильний психосоматичний вплив з порушенням вегетативної нервової системи із подальшим збільшенням продукції медіаторів запалення різними клітинами (наприклад, еозинофілами) [67, 80, 93].
Слід зазначити, що в більшості випадків зустрічається легкий ступінь перебігу АД, від 10 % до 20 % пацієнтів страждають від тяжких екзематозних уражень шкіри; цей відсоток є вищим у дорослого населення з АД [116]. На сьогодні спостерігається зростання захворюваності на АД в усьому світі, що пов’язано із несприятливим впливом багатьох факторів сучасної цивілізації. Розповсюдженість патології в розвинутих країнах Західної Європи серед дітей віком до 14 років складає 10-20 % [55]. Дебют захворювання найчастіше має місце в ранньому дитячому віці. У дітей АД вперше проявляється до 6 місяців у 45 % випадків, протягом першого року життя – у 60 %, і до 5 років – у 85 % випадків [84, 136, 179]. АД може виникнути як незалежне захворювання або в якості частини атопічної тріади, що включає астму, алергічний риніт і екзему. АД розпочинається у будь-якому віці, але частіше – у немовлят і маленьких дітей, близько 50 % – 90 % випадків АД проявляються у 6 – 12 місяців. Майже у половини дітей у віці до п’яти років АД проявляється у респіраторній алергії.
На сьогодні у світі відсутня єдина загальноприйнята класифікація атопічного дерматиту. Оскільки клінічні прояви захворювання змінюються з віком хворих, більшістю авторів пропонується поділяти АД на 3 фази: малюкову, дитячу, підліткову та дорослу [5, 50, 56, 184].
Малюкова фаза (з 2-х місяців до 2-х років). АД з раннім початком зустрічається майже у 80 % дітей і характеризується переважно доброякісним перебігом, оскільки найчастіше після загострень має місце ремісія і лише у невеликому відсотку випадків захворювання продовжується (АД в формі дитячої екземи) для якої характерними є поява еритематозно-сквамозних елементів на фоні гіперемії та набряку, мікровезикул, що швидко відкриваються, з утворенням в подальшому кірок та лусочок. Дебют захворювання найчастіше припадає на віковий період дитини 3-4 місяці. Висипання симетричні, з ураженням шкіри лоба, щок, шиї, волосистої частини голови. Виключення становить шкіра носо-губного трикутника, де висипань не буває. В подальшому висип розповсюджується на інші ділянки тіла, зокрема, тулуб, верхні та нижні кінцівки. У період загострення АД дитина неспокійна, кричить, погано спить, нерідко відмовляється від годування та розчісує шкіру [90, 181].
Перебіг захворювання характеризується чергуванням загострень та ремісій. Навіть в період ремісії можна бачити глибокі тріщини за вухами та біля мочок вушних раковин, вони мокнуть та інфікуються. Дермографізм у більшості пацієнтів (до 80 %) залишається червоним [49,73, 162].
З часом вираженість шкірних проявів зменшується і еритематозно-сквамозні ділянки ураження з лущенням локалізуються на типових для захворювання місцях: ліктьових та підколінних ямках (більше 80 %), на шиї (50 %), на згинальних проекціях променево-зап’ясткових суглобів та кистей (30 %), на верхній половині тулуба, на нижніх кінцівках, на згинальних проекціях гомілково-стопних суглобів (загалом до 20 %) [72, 82, 114].
Дитяча фаза (від 2 до 12 років). З віком свербіж набуває більш стійкого, приступоподібного характеру і супроводжується не тільки появою еритематозно-сквамозних вогнищ в місцях типової локалізації уражень, але і множинних фолікулярних та ліхеноїдних папул. Процес поширюється на великі ділянки шкіри (за типом почесухи Беньє), шкіра в місцях типової локалізації АД поступово інфільтрується, пігментується, стає сухою, ущільненою, вкритою висівкоподібними лусочками. Навколо ліхеніфікованих ділянок з’являються нові папули. Інтенсивний свербіж у період загострень стає причиною виражених екскоріацій в місцях висипу з наявністю на ураженій поверхні геморагічних кірок. У важких випадках (біопсуючий свербіж) на шкірі залишаються лінійні розчухи та рубці. Нерідко приєднується вторинна інфекція, що характеризується підвищенням температури тіла, появою фліктеноподібних елементів. пустул, лімфаденітом, та зниженим потовиділенням [51, 85, 112].
Нерідко у дітей та підлітків з типовими маніфестаціями АД на шкірі мають місце явища хейліту у вигляді нерізко вираженої еритеми з лущенням та появою тріщин у кутах рота та на губах. Шкіра навколо рота подразнена, оскільки дитина постійно її зволожує язиком. Часто мають місце і периорбікулярні прояви АД, що характеризуються лущенням та гіперпігментацією в поєднанні з ангулярним блефаритом, тріщинами у кутах очей, набряком та лущенням повік. У більшої частини пацієнтів можна бачити патогномонічну ознаку атопії – подвійну зморшку Денні-Моргана на нижній повіці [5, 136].
Ураження долоней при АД у дитячому/підлітковому віці визначається посиленням малюнку борозен, лущенням та тріщинами пучок пальців, явищами дисгідрозу з рецидивами у холодну пору року тощо [52].
Підліткова та доросла фаза (старше 12-ти років). У період пубертату, на тлі наявних ознак АД, що проявляються у вигляді клінічно стертої еритематозно-сквамозної форми з ознаками ксеродермії, з’являються пласкі полігональні ліхеноїдні фолікулярні папули, колір яких варіює від кольору нормальної шкіри до рожево-сірого. Можуть мати місце множинні щільні пруригінозні папули або папуло-везикули, що локалізуються на розгинальних поверхнях кінцівок, частіше гомілок, плечей та передпліч та імітують висип при пруриго (за типом почесухи Гебри), з наступним формуванням невеликих ділянок ліхеніфікації, де межі окремих папул важно розпізнати. З часом ці ділянки пігментуються. Типовою локалізацією уражень в дорослу фазу є верхня частина тулуба, елементи уражень розташовані симетрично. Пацієнтів турбує виражений свербіж, тому на поверхні шкіри нерідко можна бачити сліди розчухів та геморагічні кірки [59, 120, 136].
АД може проявлятися фотосенсибілізацією із загостренням у весняно-літній період, при збільшення рівня інсоляції. В даному випадку має місце сухість шкіри, непереносимість вовняної одежі без видимих ділянок уражень (т.з. “невидима форма” АД). Іноді ця форма характеризується появою нумулярної екземи. Ксеродермія у таких пацієнтів особливо маніфестує взимку, нерідко супроводжуючись плямистою пігментацією та білим дермографізмом [221].
АД становить актуальну проблему сучасної дерматології, займає одне з провідних місць у структурі дерматологічних захворювань не тільки у зв’язку із збільшенням кількості хворих, але й через зміну екологічних та соціальних умов життя. АД, як хронічне захворювання, суттєво погіршує якість життя пацієнта, його родини, призводить до порушень в емоційній сфері та соціальної дезадаптації [57, 86, 108, 190].
Атопічний дерматит став серйозною проблемою громадської охорони здоров’я ще й тому, що зростає швидкість його розповсюдження. Розповсюдженість АД виросла у два рази в промислово розвинених країнах протягом останніх десятиліть. Вважається, що від 15 до 30 % дітей і від 2 до 10 % дорослих страждають на АД. В останні 30 років кількість пацієнтів з АД збільшилась на 10-30 % серед дітей та на 2-10 % серед дорослих. Алергічний риніт, атопічний дерматит, харчова алергія і, на додаток, астма є надзвичайно поширеними захворюваннями у всьому світі. Дійсно, алергічний риніт зачіпає від 10 % до 20 % від загальної чисельності населення в Європі і США, а з них до 40 % дітей. Алергія до будь-якої їжі варіює між 3 % і 35 % населення, в той час як атопічний дерматит досягає 20 % в багатьох країнах. Ці захворювання мають серйозний вплив на якість життя пацієнта і відзначаються високою вартістю лікування для пацієнтів і для страхових компаній. Серед дітей ці витрати досягають більше 4000 $ США в рік на один випадок харчової алергії. Щорічні витрати на лікування АД за оцінками в США сягає 3,8 млрд. $ [14, 131, 196].
Атопічний дерматит характеризується ураженням шкіри, еритемою, масштабуванням процесу, екскоріаціями і свербежем, дисфункцією епідермального бар’єру та низкою імунологічних змін. Поточні терапевтичні стратегії в значній мірі базуються на уникненні алергену, застосуванні зволожуючих (пом’якшуючих) кремів (емольєнтів) і системних кортикостероїдів [60, 139, 142, 227].
АД є одним із найпоширеніших хронічних захворювань дитинства. У маленьких дітей діагноз АД головним чином мотивований на основі клінічної оцінки. Для оцінки тяжкості атопічного дерматиту використовується індекс SCORAD, який складається з трьох основних чинників: ступеню тяжкості, інтенсивності ураження і суб’єктивних ознак. Співвідношення між АД і чутливістю до аероалергенів було описано раніше. АД характеризується послідовністю атопічних проявів у дитячому віці, як правило АД передує розвитку інших алергічних захворювань в подальшому житті. У третини пацієнтів з АД розвиватиметься астма на аероалергени. Дискусія щодо причинно-наслідкового зв’язку триває, але одночасно вважаться, що АД може також існувати як окрема нозологія, не пов’язана з ринітом або астмою [40, 168].
1.2 Свербіж як один з основних симптомів атопічного дерматиту
Свербіж є одним з перших симптомів початку спалаху АД. Такі симптоми як свербіж, подряпини і безсоння, можуть бути тягарем для всієї родини, в результаті чого виникає дратівливість і стрес, не тільки для пацієнтів, але і для оточуючих. Причиною подряпин, розчухів і пробудження під час нічного сну є висип. Свербіж при АД є не тільки найчастішим симптомом, але також негативним параметром якості життя, він часто є домінуючою причиною звернення пацієнтів за професійною медичною допомогою. Крім того, механічне порушення цілісності шкіри викликає подальший свербіж [61, 73, 144, 175].
Відомо, що однією з ключових особливостей АД є сухість шкіри, зумовлена пошкодженням шкірного бар’єру і посиленням трансепідермальної втрати води. Це пов’язано з порушенням процесів ороговіння внаслідок генетичного дефекту особливого білка людської шкіри – філагрину, а також зі зміною ліпідного складу шкірного бар’єру, що проявляється зниженням вмісту церамідів І і ІІІ на тлі зростання вмісту холестерину. Крім того, змінюється рівень pH шкіри до лужних значень 6,5–7,5 (в нормі 5,5), що полегшує її заселення бактеріальною та грибковою флорою. Те, що сухість шкіри (ксероз) та дефекти бар’єрної функції шкіри впливають на перебіг АД, є беззаперечним фактом. За результатами багатьох досліджень встановлений взаємозв’язок між свербежем, сухістю і запаленням шкіри, однак, що є первинним у цих процесах, до кінця невідомо. Останнім часом дефект бар’єрної функції шкіри розглядають як одну з важливих ознак АД і таким, що призводить не лише до ксерозу, а й до зниження рівня антимікробних речовин у шкірі та підвищення трансепідермальної втрати води. Одні науковці розглядають порушення шкірного бар’єру як первинний ланцюг у розвитку АД, який сприяє проникненню алергенів у шкіру, що в подальшому ініціює запальний процес і гіперреактивність. Інші, навпаки, вважають, що порушення бар’єрної функції шкіри є вторинним процесом, який розвивається у відповідь на проникнення алергенів та іритантів у шкіру [61, 88, 107, 124, 143, 211].
Ушкодження цілісності шкіри є добре урегульований складний процес, який включає в себе взаємодію між резидентами клітин (епітеліальні клітини, фібробласти, ендотеліальні клітини) і взаємодію цих клітин з позаклітинними молекулами матриці (факторами росту, цитокінами і хемокінами). Запалення є нормальною частиною процесу загоєння після ушкодження шкіри, крім того, допомагає відновити цілісність тканин. Однак надмірне запалення може бути несприятливим для подальшого лікування [31, 199].
При вивченні свербежу як симптому АД встановлена атопічна схильність до вузловатого пруриго майже у половини хворих. Разом з тим, автори не визначили вікової та гендерної відмінності в обстежених групах. Клінічний досвід показав, що АД асоційований зі значним погіршенням якості життя, впливає на всі ділянки повсякденного життя, фізичний та емоційний стан хворих [35, 111, 156].
Вважалось, що визволення гістаміну є основною причиною виникнення свербежу у людини. Але при перерахуванні на молекулярну концентрацію протеїназа виявилась в 200 разів більш активною, ніж гістамін. Одна з найбільш активних протеїназ – папаїн – викликає свербіж без будь-яких ознак гіперемії та наявності міхура. Протеінази можуть звільнятись з наступних відомих джерел: епідермальних клітин, крові, еритроцитів та клітинних інфільтратів шкіри. В інфільтрованій ушкодженій шкірі свербіж може бути обумовленим наявністю протеаз, які вивільнені бактеріальною та грибковою флорою. Деякі речовини, що вивільняють гістамін, активують протеази. Протеази не впливають на глибоко розміщені нервові стовбури. Виявлено, що пункти свербежу являють собою ділянки шкіри із підвищеною кількістю тонких вільних закінчень, які розміщені в субепідермальному шарі та в самому епідермісі. Таким чином, органами шкірної чутливості можуть слугувати вільні нервові закінчення, більшість з яких належать до тонких безм’якотних нервів [34, 133, 185].
Свербіж може бути симптомом системних захворювань, що приблизно становить від 10 % до 50 % серед хворих. До системних захворювань належать метаболічні розлади, гематологічні захворювання, онкологічні захворювання, ускладнення медикаментозної терапії, нейропсихічні розлади. У деяких хворих свербіж може бути при відсутності ознак змін на шкірі. Не існує єдиної певної класифікації свербежу, яка б враховувала його клінічні прояви і патофізіологічні механізми. У 2005 р відбувся Міжнародний Форум вивчення свербежу, в цьому ж році затвердили – Перше Керівництво по лікуванню свербежу, а в 2007 р – першу міжнародну класифікацію свербежу. До хронічного свербежу відноситься свербіж, існуючий понад 6 тижнів. В даний час частота хронічного свербіння в популяції становить 8,4 % з-поміж 40 000 населення в Норвегії (причому у жінок свербіж відзначали частіше – 9,2 %, ніж у чоловіків – 7,5 %), а серед 200 дорослих в Німеччині свербіж виявлено у 13,9 %. Серед дерматологічних хворих переважно скаржаться на свербіж: при псоріазі – 87 %, при АД – 100 %, при кропив’янці – 100 %. Розрізняють нейроанатомічну і клінічну класифікації сверблячки [206]. Нейроанатомічна класифікація свербежу враховує основні можливі причини: 1. Пруритоцептивний: свербіж реалізується в шкірі; 2. Нейропатичний: є результатом змін периферичних нервів; 3. Нейрогенний: медіатори реалізують свербіж у центральній нервовій системі без пошкодження нервів; 4. Психогенний.
Клінічна класифікація побудована на особливостях клінічної картини захворювання, анамнезі, наявності інших хронічних захворювань. Таким чином, розрізняють: I. Діагноз, заснований на клінічній картині (свербіж первинно запаленої шкіри, свербіж первинно незапаленої шкіри, свербіж з хронічними вторинними екскоріаціями). II. Діагноз, заснований на можливих захворюваннях. У цій підгрупі хронічного свербежу можуть виявитися: дерматологічні захворювання; системні захворювання; неврологічні захворювання; психосоматичні / психогенні захворювання; змішані та інші (з невідомими причинами).
Відомо, що саме болісний свербіж є провідним симптомом атопічного дерматиту. По-перше, саме ці страждання, перш за все, призводять хворого до лікаря, а, по-друге, наявність постійного свербіння допомагає лікарю визначитися з диференційною діагностикою. В останні роки встановлено, що при АД змінена кількість нервових волокон в шкірі, причому збільшена кількість чутливих волокон і зменшена – адренергійних самостійних волокон, що визначає роль первинних аферентних і автономних нервових волокон в патофізіології свербіння. Самостійні нервові закінчення розташовані в дермі, кровоносних судинах, артеріовенозних анастомозах, лімфатичних судинах, волосяних фолікулах, в стимулюючих імунних клітинах через нейротрансмітери. Доведено, що нижня частина довгастого мозку розцінюється як центр свербіння. Роль нейропептидів в патогенезі атопічного дерматиту можливо не обґрунтована, проте очевидно, що ці субстанції впливають на розвиток і перебіг АД. Після різних неспецифічних тригерних факторів, також після розчісування, вільні нервові закінчення в шкірі звільняють нейропептиди. А медіаторами свербежу є: аміни (гістамін), нейропептиди, протеази, опіоїдні пептиди, ейкозаноїди, цитокіни, інтерферон гамма, нейротропін, еозинофіли, базофіли. Такий складний і різноманітний механізм реалізації свербежу при АД робить вельми складним пошук реальних його інгібіторів.
1.3 Особливості алергологічного статусу хворих на атопічний дерматит різного віку
Перебіг АД складається з двох фаз (гострої і хронічної) і, як правило, характеризується підвищенням в сироватці крові Ig E. АД є системним захворюванням шкіри, викликаним дисфункцією шкірного бар’єру, значною дегідратацією шкіри і мутаціями в гені філагріна, який відіграє важливу роль в модуляції епідермального гомеостазу. Дослідження показали, що «атопічні» ураження шкіри пов’язані з дисбалансом Т-клітин, таких як Т-хелпери 1 класу (Th1) / Т-хелпери 2 класу (Th2), Th17 / Th22 і регуляторних Т-клітин в імунній системі [45].
Підвищений ризик АД у осіб, схильних до впливу тютюнового диму, є біологічно правдоподібним. Куріння, як відомо, може вплинути на багаторічну сенсибілізацію до побутових алергенів, таких як хутро звірів, а також до деяких зовнішніх алергенів, таких як пил. Встановлений підвищений ризик харчової алергії у дітей, які зазнали впливу тютюнового диму [149].
Харчові алергени можуть бути знайдені й у домашньому пилу, тому алергічну реакцію може викликати пил, який вдихають діти. Ранній і одночасний вплив тютюнового диму і харчових алергенів можуть заважати нормальному розвитку толерантності та імунологічної відповіді, що підвищує сенсибілізацію до їжі [36, 186, 206, 226].
Для пошуку алергенів, які спричинюють розвиток симптомів АД у конкретного пацієнта, використовуються такі методики як детальний збір алергологічного анамнезу, ведення харчового щоденника, за показаннями – постановка прик (prick) – тесту (дітям від 3-років лише в стадії клінічної ремісії), визначення специфічних та загального Ig E в сироватці крові [119, 172].
Вважають, що поширеність алергії пов’язана із захворюваннями органів дихання і поступово збільшується протягом останніх двох десятиліть, особливо серед населення, яке живе у надмірно урбанізованих регіонах. Основні фактори ризику для таких захворювань включають модернізацію виробництва і збільшення тривалості перебування людей в закритих приміщеннях. Розвиток алергії, пов’язаний із захворюваннями органів дихання, є результатом взаємодії між різними генетичними й екологічними факторами [7, 118, 192].
Формування толерантності до продуктів харчування забезпечують фактори місцевого та системного імунітету. В кишківнику антиген перетворюється в толерогенну (неалергенну) форму. Вона має незначні структурні відмінності від початкової форми, але викликає пригнічення клітинної імунної відповіді за допомогою стимуляції Т-клітин CD8+. АД виникає внаслідок зниження чи відсутності толерантності до харчових алергенів або її втрати, що сприяє посиленню контакту антигену харчових продуктів з клітинами імунної системи кишківника. Такі чинники призводять до гіперпродукції специфічних антитіл із подальшим розвитком гіперчутливості [53].
Відомо, що грудне молоко є насамперед джерелом живлення для новонароджених, воно забезпечує прямий імунний захист від патогенів через імунні клітини і молекули, такі як імуноглобулін і лізосоми. Крім того, існує негативний зв’язок між грудним вигодовуванням і розвитком запальної імунної реакції, у тому числі АД, цукрового діабету 1 типу, виразкового коліту і целіакії. Тому грудне вигодовування має тривалі позитивні наслідки у впливі на АД та на розвиток імунної системи. Алергія, пов’язана з такими хворобами як АД, бронхіальна астма та алергічний ринокон’юнктивіт, також вважається результатом змін у розвитку імунної системи в ранньому дитинстві, проте зв’язок між грудним вигодовуванням і цими захворюваннями залишається суперечливим. Різні складові грудного молока, фактори росту і цитокіни роблять свій внесок у довгостроковий імунологічний ефект [2, 18].
АД є генетично детермінованим захворюванням шкіри алергічного характеру з недоліками у бар’єрній функції та особливостями імунної відповіді на алергени, що характеризуються надмірною активацією Th2-лімфоцитів і збільшенням продукції Ig E. Ці фактори призводять до збільшення частоти інфекцій шкіри у пацієнтів з АД [94, 146].
У пацієнтів з АД в сироватці крові збільшується рівень Ig E і еозинофільних гранулоцитів, саме ці показники можуть служити в якості перших діагностичних лабораторних критеріїв. Сучасні дослідження довели, що рівень Ig E впливає на розвиток АД. Існує концепція, яка пояснює безперервність стану, що починається з АД і харчової алергії і, в кінцевому рахунку, прогресує до астми та алергічного риніту. Ці захворювання часто співіснують у одного пацієнта і можуть обумовити додавання одного до іншого [3].
Ендотоксин – це компонент клітинної стінки грамнегативних бактерій, які існують у всіх приміщеннях. У чистому вигляді ендотоксин є ліпополісахаридом, він має сильні прозапальні властивості, які можуть викликати запалення дихальних шляхів і активацію цитокінів. Відповідь ендотоксину на інгаляцію зазвичай відрізняється у осіб з різною генетичною схильністю або різними ступенями толерантності. Дослідження показали, що рівень ендотоксину в дитинстві заважає розвитку сенсибілізації до алергенів. Отже, вплив ендотоксину в дитинстві і пізніше в житті, може спричинити важкі наслідки як для здорових осіб, так і для осіб з алергічними проявами [4, 217, 225].
Ендотоксин в повітрі і домашньому пилу існує у вигляді домішок органічного пилу і аерозолів середовища. Вдихання ендотоксину можливе і в професійних середовищах, і в домашніх умовах. Експозиції побутового ендотоксину є сильним фактором ризику розвитку АД. Такі фактори, як географічне розташування, бідність, велика скупченість людей в одному приміщені, домашні тварини, постільне приладдя, чистячі та миючі засоби, частота прибирання впливають на рівень експозиції ендотоксину в приміщенні [12, 109, 152, 229].
Захворюваність АД в дитячому віці значно підвищується в останні кілька десятиліть. Тому дуже важливим є своєчасне виявлення АД у дітей раннього віку. На даний час широко вивчені потенційні предиктори для АД в дитячому віці або пізніше [8, 198].
Алергічна сенсибілізація на харчові алергени зазвичай відбувається в дитинстві. По мірі того, як діти стають старшими, більшість тригерів сенсибілізації спрямовані на інгаляційні алергени. Тривалість сенсибілізації до харчових алергенів протягом перших двох років життя стала розглядатися в якості основного фактору ризику для розвитку алергічних захворювань. У ранньому дитинстві розвиваються відносини між специфічною сенсибілізацією до їжі та летючими алергенами, які сприяють виникненню АД [154, 197, 208, 228].
Важливим компонентом алергічних захворювань є Ig E. Дослідження показали зв’язок між появою атопічних захворювань і рівнем загального Ig E. Загальний рівень сироваткового Ig E найбільш інформативний у скринінгу атопічної схильності, а не в постановці діагнозу або лікуванні атопічних захворювань. Тим не менш, помірний рівень специфічного Ig E до конкретного алергену може мати набагато більше значення, ніж відносно низький рівень загального Ig E. Алерген-специфічні Ig E антитіла також можуть надати інформацію щодо індивідуальної сенсибілізації у діагностиці. Деякі люди із серйозними алергічними проблемами можуть мати нормальний, помірно або сильно підвищений рівень Ig E. Хоча збільшення рівня Ig E пов’язана з підвищеним ризиком атопічних захворювань, досі не чітко визначена його роль у сенсибілізації до різних алергенів [54, 150, 165, 188, 202].
Хоча оцінка алерген-специфічних Ig E антитіл забезпечує корисну інформацію для лікаря, вирішальне значення у визначенні алергічної реакції має правильна інтерпретація сенсибілізації до специфічних алергенів. За даними проведених досліджень визначається, що сенсибілізація до харчових алергенів, здавалося б, відбувається і збільшується в ранньому дитинстві. Тим не менш, харчова реакція після 2 років зменшується і одночасно зростає сенсибілізація до інгаляційних алергенів. Комбінована сенсибілізації до продуктів харчування та інгаляційних алергенів збільшується з віком пацієнтів. Літературні дані показують, що чутливість до їжі і інгаляційних алергенів в ранньому дитинстві змінюється з віком і може відігравати важливу роль у алергічній реакції та розвитку атопічних порушень. Алергічна реакція виникає, коли імунна система реагує на алерген, виробляючи антитіла Ig E. Ig E є тип антитіла, присутнього в мінімальних кількостях в організмі, і відіграє важливу роль в алергічних захворюваннях [9]. Рівень Ig E в сироватці крові реагує на їжу та інгаляційні алергени залежно від віку. Висока поширеність сенсибілізації до харчових алергенів і значно підвищені рівні Ig E у дітей з харчовою алергенсенсибілізацією у віці одного і 1,5 роки доводять, що сенсибілізація до харчових алергенів може бути пов’язана, головним чином, з підвищенням сироваткових рівнів Ig E у віці до 2 років. Зі зниженням рівня Ig E, викликаного харчовою алергією після 2 років, сенсибілізація до інгаляційних алергенів збільшується. Збільшення сироваткового Ig E відбувається паралельно зі збільшенням поширеності комбінованої сенсибілізації до харчових і інгаляційних алергенів, вказуючи, що сенсибілізація до інгаляційних алергенів може відігравати важливу роль у алергічних реакціях після 2 років. Клінічно загальний рівень сироваткового Ig E асоціюється з тяжкістю алергії серед дітей молодшого віку [10]. Сенсибілізація до алергенів була визнана як найбільш важливий фактор ризику атопічних захворювань. Багато досліджень показали, що виникнення і тяжкість симптомів у більш пізньому дитинстві безпосередньо пов’язані з алергеном в дитинстві [21]. Сенсибілізація до харчових алергенів є більш поширеним процесом на початку життя і, як вважалося, є істотним чинником для розвитку АД [22, 215]. Тим не менш, приблизно у половини немовлят з харчовою алергією більш імовірною буде реакція на інгаляційні алергени і підвищений ризик розвитку респіраторних захворювань у віці старше 4 років. Крім того, алергічна реакція на яйця в дитинстві пов’язана з розвитком АД. Наявність специфічних Ig E антитіл на яйце є раннім маркером АД [147]. Підвищена проникність шкіри може доповнити ризик сенсибілізації до продуктів харчування та інших алергенів, і ризик розвитку АД [133]. У немовлят з генетичною схильністю виробляються антитіла до продуктів в дуже ранньому віці, в основному на яйце та молоко [182]. Хоча можливо, що вплив яєчного білка відбувається через материнське молоко у зв’язку з відсутністю яєчного білка в раціоні немовлят, генетична схильність до алергії може також потенційно відігравати важливу роль у таких випадках [117, 207].
В якості потенційного ризику для алергічної сенсибілізації і появи атопії найбільш широко вивчені екологічні фактори. У дітей реакція на летючі алергени сприяє ризику розвитку АД [135]. Слід підкреслити, що добре визначена інтерпретація змін сенсибілізації до їжі і інгаляційних алергенів в ранньому віці може допомогти клініцисту передбачити виникнення атопічних захворювань і визначити можливі стратегії у профілактиці [173, 210].
Як вже було відзначено, сенсибілізація до їжі грає важливу роль в основному на початку життя, паралельно зі зростанням реакції до інгаляційних алергенів в більш старшому віці. Сироваткові рівні загального Ig E, очевидно пов’язані з відповіддю на різні типи алергенів. Харчова алергія, особливо на яєчний білок, суттєво пов’язана з атопічною екземою, в той час як сенсибілізація на інгаляційні алергени більш характерна для розвитку риніту та астми. Комбінована сенсибілізація до продуктів харчування та інгаляційних алергенів не тільки має вплив на продукцію Ig E антитіл, але також збільшує ризик розвитку АД. Розуміння повної картини чутливості до алергенів в різному віці допомагає в ранній діагностиці та лікуванні атопічних захворювань в ранньому дитинстві [99, 145, 178].
Дослідження свідчать про те, що один з п’яти дорослих має симптоми харчової гіперчутливості після прийому їжі, і ця особливість залишається незмінною протягом років. Поширеність Ig E-сенсибілізації до харчових алергенів знижується з віком пацієнтів, у той час як поширеність сенсибілізації до аероалергенів залишається відносно незмінною. Трьома найбільш поширеними причинами харчової алергії є фрукти, горіхи та овочі [75, 166].
Проявами ризику гіперчутливості на початку грудного вигодовування виступають риніт, екзема, бронхіальна астма та наявність Ig E сенсибілізації до аероалергенів. Тим не менш, є крос-секційні дослідження, які показують, що харчова гіперчутливість у дорослих часто пов’язана з супутньою сенсибілізацією до аероалергенів, Ig E сенсибілізації до харчових алергенів та іншими проявами атопії, особливо алергічним ринітом [11, 167, 205].
У різних дослідженнях протягом довгого часу виявлялось значне зниження коливання рівня Ig E у відповідь на харчові алергени у дорослих. Рівень Ig E при харчових алергенах раніше був вивчений тільки у дітей, разом з тим реакція на харчові алергени залишалася стабільною протягом перших 6 років життя (10 %). Більшість дітей з віком втрачають алергічну реакцію на молоко, сою, яйця, пшеницю і навіть арахіс. Саме у дорослих харчова алергія може залишатись незмінною, а Ig E сенсибілізація до харчових алергенів знижується. З віком Ig E сенсибілізація до харчових алергенів зменшується, а в той час як незмінною залишається Ig E сенсибілізація до аероалергенів. Біологічне пояснення такому явищу – висока поширеність харчової гіперчутливості [77, 141, 176, 222].
Мультифакторна етіологія АД включає генетичні складові, екологію, спосіб життя і психологічний стан [62]. Високі рівні загального сироваткового Ig E і специфічного Ig E до алергенів навколишнього середовища та харчування, таких як кліщі, курячі яйця або коров’яче молоко визначаються у більшості хворих на АД та бронхіальну астму [118].
Оскільки визначальне значення в етіології АД мають полігенна система і детермінованість органної локалізації цієї атопічної хвороби, початкова ланка патогенезу має бути однаковою при всій різноманітності клінічних форм АД і проявів його вікової динаміки. Були спроби розглядати в якості первинного ушкодження вроджений дефект супресорних Т-лімфоцитів, підвищену активність циклічний аденозинмонофосфат-залежні фосфодіестерази, аномалію ензиму, що каталізує десатурацію лінолевої кислоти, порушення конверсії b-6-жирних кислот у простагландин Е1, порушення протеїнкіназ, а також дефекти, що викликають генералізовану дисфункцію вазоактивних медіаторів [58, 121].
Припускають вплив базисних дефектів та функціональних порушень при атопії, в системі циклічних нуклеотидів і активації клітинних мембран, що знайшло своє відображення в концепції блокади β-адренорецепторів з гіперчутливістю α-адреноблокаторів і холінергічних рецепторів на мембранах клітин. На підставі цієї концепції гіперчутливість до багатьох подразників у хворих на АД трактуються як результат підвищеної реактивності шкіри, інфільтрації шкіри базофілами та опасистими клітинами при надмірній чутливості до сигнальних речовин, що викликають дестабілізацію клітин, і зниженої активності циклічних ферментів у відповідь на сигнали, необхідні для стабілізації [78, 153].
У ряді таких подразників вказувалися, крім нейромедіаторів і гормонів, різні алергени, токсини, реагіни, біологічно активні речовини, що вивільняються з клітин у відповідь на імунні і неімунні стимули, спрямовані на клітини-мішені [140].
З нестабільністю мембранної рецепції пов’язували такі ланки патогенезу, які проявляються порушеннями функції клітин, що беруть участь в імунних реакціях, функціональних змінах судин, порушеннями холінергічного і a-адренергічного тонусу, вегетативного забезпечення шкіри, сну та ін [64, 164].
В даний час специфічні і основні ланки патогенезу АД пов’язують з генетично обумовленою дисфункцією імунної системи і, перш за все, клітинною системою імунітету шкіри (головним чином Т-хелперів і антигенпредставляючих клітин). Цією дисфункцією пояснюють дві важливі клінічні риси АД: гіперчутливість шкіри до низки антигенних стимулів, особливо до атопенів; зниження резистентності шкірного бар’єру до патогенної та умовно-патогенної резистентної флори з розвитком частих ускладнень АД вторинними мікробними епідермодермофітіями [20, 98, 224].
Клінічні і деякі лабораторні прояви зміненої імунної реактивності у хворих на АД були відзначені вже в самих ранніх спостереженнях і дослідженнях. У хворих виявляли зниження реакції бласттрансформації лімфоцитів (РБТЛ) на рослинні мітогени і реакції шкіри на облігатний алерген динітрохлорбензол, на деякі бактеріальні антигени, зниження хемотаксису нейтрофілів і моноцитів. Відзначались порушення фагоцитозу, зменшення субпопуляції Т-супресорів, транзиторне зниження вмісту IgA, підвищений рівень Ig E (у 50-80 % хворих), наявність специфічних Ig E до харчових, грибкових, пилкових, побутових, кліщових алергенів, зниження активності натуральних кілерів (НК) та ін. [33, 158, 218].
При вивченні імунітету у хворих на АД основну увагу привертала надлишкова продукція Ig E, хоча у хворих клінічно виявлялися ознаки алергії не тільки I, але і IV типу (уповільнена гіперчутливість), а також іммунокомплексного типу. При шкірному тестуванні Ig E-опосередковані реакції I типу на харчові і інгаляційні алергени виявлялися частіше у хворих з супутньою респіраторною атопією. Було відзначено також, що не всі речовини викликають реакцію гіперчутливості у цих хворих. Виділили певне коло речовин, що провокують Ig E-реакцію; ці речовини назвали атопенами. До них відносяться домашній пил, домашня акарофауна (Dermatophagoidеs pteronyssimus, D. farinae), деякі інші аероалергени (цвілі, шерсть і лупа тварин), живі антигенні речовини деяких типів стафілококів, пітироспоронів, деякі види харчових продуктів [9, 47]. Але крім атопенів запальні ураження шкіри можуть ініціювати або загострювати екзогенні гістамінолібераторні речовини, що викликають псевдоалергічні реакції, як і передбачається, без участі Ig E. Такі речовини містять багато продуктів (полуниця, суниця, малина, гриби, прянощі, копченості, алкоголь, тваринні та рослинні пігменти), деякі медикаменти, токсини і т.п. Крім того, мікрофлора шкіри, що проявляє патогенні властивості і проникає в епідерміс і глибше в дерму, може діяти безпосередньо на клітини, які виділяють біологічно активні речовини і прозапальні субстанції у відповідь на їх екзотоксини без попередньої сенсибілізації [158, 177, 214].
На підставі подібних фактів стали виділяти імунні і неімунні, алергічні та псевдоалергічні варіанти АД. Проте, в багатьох діагностичних схемах підвищення рівня Ig E відносять до важливих діагностичних критеріїв АД. Однак тепер відомо, що підвищення загального рівня Ig E не є специфічним для АД, тому що воно виявляється і при інших хворобах, наприклад при паразитозах, деяких інфекціях, у ряді хворих з коростою, псоріазом, Т-клітинною лімфомою, фотодерматозом. Крім того, не у всіх хворих на АД виявляють підвищений загальний рівень Ig E. З іншого боку, є дані про підвищення у хворих на АД експресії до маркера В-лімфоцитів CD-40, активація якої призводить до посилення синтезу Ig E. Патогенетична роль підвищеного рівня Ig E при АД у більшості авторів не викликає сумніву. Гіперпродукція Ig E може викликати автоімунні явища, особливо в активній фазі хвороби. Вважається, що більш інформативні відомості для клінічної практики дає виявлення у хворих на АД атопенспецифічних Ig E, які свідчать про сенсибілізацію до певних алергенів навіть при відсутності суттєвого підвищення загального рівня Ig E [120, 155, 174, 212].
1.4 Імунологічні особливості атопічного дерматиту
Існує два головних механізми, які провокують свербіж при патофізіологічному стані. Такими є периферійна та центральна сенсибілізація. Незважаючи на наявність певного антагонізму між болем та свербежем в нормальних умовах, феномени периферійної і центральної сенсибілізації до свербежу та болю вочевидь схожі. Група сенсибілізаторів свербежу включає простагландини, інтерлейкіни, нейротрофіни та фактор росту нервів. Відомо, що пруритогенною дією володіють три інтерлейкіни: ІЛ-2, ІЛ-4 та ІЛ-6. В експерименті показано, що ІЛ-2 викликає свербіж шляхом активації чутливості до гістаміну, брадикініну та капсаїцину популяції С-волокон шкіри. Свербіж, що викликаний ІЛ-2, не підлягає впливу ні антигістамінних, ні нестероїдних протизапальних препаратів. Досі невідомо, активується свербіж безпосередньо рецепторами чи реалізується побічно, через опасисті та ендотеліальні клітини [32, 124].
ІЛ-2 продукують Тh-клітини, належить до короткодистантних медіаторів, є аутокринним і паракринним регулятором імунокомпетентних клітин. ІЛ-2 активує Т-клітини, індукує їх перехід із фази G1 в S-фазу клітинного циклу, виступає в якості фактора проліферації Т-клітин, здатний підтримувати зростання Т-клітин в культурі. Відомо, що ІЛ-2 визначає величину Т-клітинної імунної відповіді, стимулює проліферацію НК-клітин і збільшує літичний потенціал НК-клітин, Т-кілерів. Додавання ІЛ-2 в культуру лімфоцитів призводить до утворення ЛАК-клітин, здатних реалізувати протипухлинну дію. Дія ІЛ-2 на В-лімфоцити проявляється в стимуляції їх проліферації і диференціюванні у плазматичні клітини. ІЛ-2 стимулює експресію на клітинах власного рецептора, синтезу інтерферону-γ і фактора некрозу пухлини – β [97, 163].
ІЛ-4 синтезується Тh2-клітинами, опасистими клітинами та НК-лімфоцитами [43]. Він забезпечує розвиток Тh2-клітин з попередників, стимулює проліферацію і диференціювання В-лімфоцитів, експресію на них молекул ГКГ 2-го класу, індукує перемикання синтезу імуноглобулінів на клас IgЕ. Крім того, ІЛ-4 стимулює ріст опасистих клітин, посилює експресію на них рецепторів до IgЕ, бере участь у протигельмінтному захисті організму, підвищує експресію молекул ГКГ 2-го класу на макрофагах, молекул адгезії на ендотеліальних клітинах, моноцитах, еозинофілах. Ендотеліальні клітини під впливом ІЛ-4 секретують моноцитарний хемотаксичний протеїн і хемокіни, які активують еозинофіли. Цей інтерлейкін відноситься до протизапальних цитокінів, здійснює блокуючу дію на викликані інтерфероном-γ ефекти такі, як продукція ІЛ-1, оксиду азоту і простагландинів. Саме він – багатофункціональний цитокін, який має глибокий вплив не тільки на гематопоетичні клітини, такі як B-лімфоцити і моноцити/макрофаги, але й на некровотворні клітини, такі як фібробласти, де він стимулює синтез позаклітинного матриксу, особливо колагену. Клітинами-продуцентами цитокіну є моноцити, макрофаги, Тh2-клітини, кістковомозкові стромальні клітини, фібробласти, гепатоцити та ін. Недавній прогрес в ідентифікації та характеристиці Т-клітин лімфокінів розкрив, що ІЛ-4 у величезній кількості підсилює вироблення Ig E В-клітинами та індукує експресію Ig E-Fc рецептора на В-клітинах [106, 138].
ІЛ-4 стимульований мононуклеарними лейкоцитами з підвищенням активності фосфодіестерази, пов’язаної з циклічним аденозинмонофосфатом і відповідно зі зниженням його рівня. Однак виявилося, що функціональні порушення циклічних нуклеотидів і мембранної рецепції не специфічні для АД і спостерігаються і при інших захворюваннях [68, 15, 213].
ІЛ-6 є індуктором дозрівання В-клітин в плазматичні клітини, вироблення ними антитіл. ІЛ-6 відноситься до цитокінів системної дії, сприяє розвитку запальної реакції [125].
В-лімфоцити здійснюють різноманітний вплив на клітинній поверхні рецепторів імуноглобуліну, які розпізнають специфічні антигенні епітопи. Активація В-клітин, як правило, грає важливу роль у стимулюванні проліферації CD4+ Т-клітин і відповідей Th2/Th17 [135, 192].
Клітини Лангерганса грають вирішальну роль в ініціації первинної імунної відповіді. Серед Т-хелперів виділені субкласи першого і другого порядку (Th1 і Th2). Т-хелпери першого порядку синтезують гама-інтерферон і ІЛ-2. Гама-Інтерферон модулює імунну відповідь і ріст кератиноцитів, він може гальмувати синтез Ig E і стимулювати синтез захисних антитіл, а ІЛ-2 індукує проліферацію зрілих Т-клітин, активує природні кілери і цитотоксичні лімфоцити [127, 219].
Т-хелпери другого порядку синтезують ІЛ-4 та ІЛ-5. В свою чергу ІЛ-4 стимулює В-клітинну проліферацію, синтез IgG і Ig E, індукує експресію антигенів гістосумісності II класу, активує Т-хелпери, може проявляти себе як фактор зростання для опасистих клітин і деяких Т-клітин. ІЛ-5 стимулює синтез Ig E, IgM, IgG, IgA, індукує проліферацію і активність еозинофілів. Зазвичай стадія зв’язування Т-хелперів з антигенпредставляючими клітинами Лангерганса завершується утворенням активованих Т-хелперів першого порядку, які починають продукувати гама-інтерферон. При його впливі кератиноцити експресують HLA-DR і продукують епідермально-клітинний фактор, що перетворюється в інші медіатори (простагландини, ІЛ-1 та ін.) і активує нові Т-хелпери [91, 137, 223].
При АД ініціація імунної відповіді протікає на тлі зміни диференціювання Т-хелперів. У ряді досліджень показано, що при АД антигенний вплив і пошкодження визначають порушений профіль цитокінової продукції. У хворих на АД знаходять зниження продукції інтерферону-γ, підвищену продукцію ІЛ-4 і редукцію фенотипічної експресії Th1. Вважають, що вторинним меседжером для стимуляції синтезу ІЛ-4 є диференційовано модулюючий цитокіновий профіль секреції Т-хелперів – вагінального простагландину (ПГЕ2). У хворих на АД ПГЕ2 продукується у підвищеній кількості моноцитами і, можливо, іншими антигенпредставниками, а також опасистими клітинами [101, 203].
Припускають, що у хворих з атопією підвищений рівень ПГЕ2 сприяє диференціюванню нульових Т-хелперів (Th0) в напрямку Th2. З іншого боку, не виключається і патогенна роль нестачі простагландину Е1, і при цьому навіть висловлюється думка, що базисний дефект атопії може бути пов’язаний з дефектом простагландин Е1-залежного дозрівання Т-лімфоцитів [171].
Лабораторні дослідження показали, що атопенспрямовані імунні реакції насамперед здійснюються Т-хелперами другого типу. Так, при впливі антигену домашніх кліщів in vitro лімфоцити від хворих АД продукують ІЛ-4, тоді як лімфоцити здорових донорів – інтерферон-γ. У той же час було показано, що багато інших алергенних білків не викликають у хворих АД атопенспрямовані реакції; так, у відповідь на антигени кандиди і правця, лімфоцити пацієнтів з атопією in vitro продукують інтерферон-γ, тобто цитокіни Th1-типу [105, 111, 220].
Раніше в число діагностичних критеріїв АД багато авторів включали підвищення імунорегуляторного індексу, коли визначали співвідношення Т-хелперів (кількість яких підвищена) до Т-супресорів (рівень яких знижений). Однак при обстеженні різних груп хворих виявилися різні результати; у багатьох пацієнтів виявлялися не підвищення, а навіть зниження кількості Т-хелперів [79, 159].
Виявлений при іммунофенотипуванні клітин дисбаланс між субкласами Т-хелперів змінили уявлення про діагностичне значення підвищення числа Т-хелперів та імунорегуляторного індексу в розвитку атопічних уражень шкіри. Підгрунтям для цього стали дані, які свідчать про те, що імунопатогенез АД обумовлюється перш за все не кількістю Т-хелперів і Т-супресорів, а порушеннями диференціювання Th0 і профілю їх цитокінової секреції [96].
Стимульоване після кооперації з антигенпрезентуючими клітинами збільшення кількості Т-хелперів другого порядку, які продукують важливі для алергічного запалення ІЛ-4 та ІЛ-5, що індукують продукцію В-лімфоцитами СD-40 алергенспецифічних Ig E і активують тканинні базофіли і еозинофіли, призводить в той же час до пригнічення активності Тh1 і до пригнічення адекватної відповіді на мікробні антигени, зниження активності природних кілерів і цитотоксичних лімфоцитів, а також їх гальмуючої дії на синтез Ig E. Тривала стимуляція антигенами дерми при проникненні через шкіру або кров, підтримує та періодично загострює запальний процес в осередках АД [100, 134].
Крім Т-хелперів з їх аномальним диференціюванням при стимуляції атопенами і клітинами Лангерганса, що експресують велику кількість високочутливих рецепторів Ig E, у формуванні атопічного ураження шкіри бере участь багато інших типів клітин і гуморальних факторів. Однак чіткий порядок їх взаємодії та участі в специфічному патогенезі АД ще не визначений. Безумовно, важливу роль у патогенезі АД відіграють нейропептиди і лейкотрієни, опасисті клітини, еозинофіли, базофіли, кератиноцити, порушення шкірного бар’єру. У хронічних вогнищах ураження шкіри хворих з атопією кількість опасистих клітин істотно збільшена і ще більше підвищується при експозиції атопенів. Опасисті клітини виділяють при дегрануляції важливі для алергічного запалення речовини – серотонін і ПГЕ2, вони стимулюють не тільки ІЛ-4, але і нейропептиди, і при цьому простежується можливість психічного впливу на маніфестацію АД. Ці факти розглядаються як особливо важливі в патогенезі АД [80, 209].
Є свідчення того, що базофільні лейкоцити відіграють істотну роль при первинному загостренні АД. Патогенну роль може грати надлишково підвищена кількість еозинофілів (стимульоване цитокінами Т-хелперів другого і першого порядку). Виділені ними токсичні протеїни (еозинофільний катіонний протеїн) можуть посилювати запальний процес і модулювати імунну відповідь [81].
На наш погляд, на сьогодні недостатньо досліджене питання співставлення імунологічних, алергологічних, генетичних показників у дітей та дорослих хворих на АД, що є актуальним. Такий інтерес, перш за все, базується на клінічних спостереженнях. Привертає увагу те, що харчова полівалентна алергія у дітей молодшого віку поступово відходить на другий план в порівнянні із реакціями загострення, спровокованими психо-емоційними факторами. Вирішальну роль в прогнозі захворювання відіграє те, з яким показником тяжкості процесу проходить дитина пубертатний період. Клінічна практика демонструє, що саме в цей період актуальним стає обґрунтований та індивідуалізований протокол лікування АД. Як лікар, так і родина хворого повинні зважувати на те, що спадковий фактор може існцвати і в майбутньому. Тому слід ретельно вивчати родовід хворого, навчити хворого і батьків досконалій реакції на загострення, попереджуючи його. Саме така мотивація здавалась актуальною, коли нами було поставлене завдання: вивчення імунологічного статусу пацієнтів різних вікових категорій, хворих на АД [110, 160].
1.5 Оцінка якості життя хворих на атопічний дерматит
В останні роки зросла кількість досліджень, що присвячені оцінці якості життя у дітей з шкірними захворюваннями. Так декілька національних закладів охорони здоров’я рекомендують вимір якості життя процесом оцінки. Крім того, оцінка якості життя грає важливу роль в освітніх програмах для дітей із захворюваннями шкіри та не менше значення в дослідженнях приділяється зв’язку дітей з атопією із хронічними захворюваннями їх батьків. АД є найбільш відома хвороба своїм істотним впливом на життя всієї родини. Опитувальник Dermatitis Family Impact (DFI) був створений в 1998 році з метою оцінки впливу різних факторів на хворих дітей з атопієб та на їхніх батьків. Зовсім нещодавно було впроваджено Family Dermatology Life Quality Index (FDLQI), який було розроблено та адаптовано для будь-якого дерматологічного захворювання. Обидва ці опитувальники складаються із 10 запитань, шкалою від 0 до 3 (максимальна кількість балів в опитувальнику 30). Чим вище показник, тим більше вплив на якість життя сім’ї. Термін оцінки часу опитувальника DFI складає 1 тиждень, тоді як для FDLQI – 1 місяць. DFI – опитувальник було розроблено конкретно для батьків дітей з АД, в той час як FDLQI оцінює вплив сім’ї через різні шкірні захворювання, незалежно від віку пацієнтів. Метою даного дослідження було порівняти результати двох різних оцінок якості життя; хвороба-специфічний опитувальник і DFI дерматологічно-специфічний FDLQI [183, 200, 216].
1.6 Лікування атопічного дерматиту
З самого початку лікування АД існує необхідність розробки стратегії уникнення контакту з провокуючими чинниками. Важливе значення мають дослідження, які встановлюють різницю між генетичною схильністю до гіперчутливої і сухої шкіри, яку не можна «вилікувати» нині, та гострим екзематозним ураженням шкіри, які добре піддаються лікуванню і зникають. Виявлення окремих провокуючих чинників має вирішальне значення при розробці алгоритму лікування AД, а їх уникнення сприяє подовженню фаз ремісії або повному зникненню симптомів [48].
Базове лікування порушеної бар’єрної функції шкіри – це емолієнти та догляд за шкірою. Суха шкіра є одним з основних симптомів AД, який фігурує у визначенні захворювання. В даний час існують наукові докази, отримані в результаті досліджень на людях і мишах, про генетично залежні аномалії шкірного бар’єру, які сприяють проникненню алергенів крізь шкіру з підвищеною схильністю до подразнення з подальшим її запаленням. Нестача філагрину є найкраще вивченим порушенням, яке призводить до дефіциту дрібних молекул, які зв’язують воду в результаті фізіологічного катаболізму філагрину. Крім того, нестача міжклітинних ліпідів у роговому шарі та неадекватне співвідношення між сполуками (холестерин, жирні кислоти, кераміди) посилює трансепідермальну втрату вологи, спричиняючи епідермальні мікротріщини. Руйнування бар’єру призводить до запалення, і важливим проміжним кроком є порушення балансу між протеазою і антипротеазою [38].
Залежно від активності дії (тобто ефективності у зменшенні запалення) топічні глюкокортикостероїди (ТГКС) діляться на чотири категорії: м’які, помірні, сильні та дуже сильні [16]. Активність кортикостероїдів залежить від низки факторів, в тому числі і від унікальних властивостей кортикостероїдних компонентів, лікарської форми та здатності проникати в шкіру. Активність топічних кортикостероїдів не просто зводиться до концентрації. Британський Національний формуляр окреслює коло наявних сполук та лікарських форм. Не існує якісних доказів, які б сприяли вибору щодо активності місцевих кортикостероїдів у лікуванні атопічної екземи [17].
Топічні інгібітори кальциневрину (ТІК) є нестероїдними імуномодуляторами, призначеними для лікування атопічного дерматиту. До наявних ТІК належить: мазь такролімус 0,03 % і 0,1 % (обидва препарати призначені для лікування помірної – важкої форми екземи, 0,03 % мазь підходить для застосування у дітей віком від двох років) і пімекролімус 1 % крем (призначений для лікування легкої – помірної форми екземи у пацієнтів у віці двох років і старше) [1, 64, 70, 195].
Через порушення шкірного бар’єру, пацієнти з АД схильні до вторинної бактеріальної і вірусної інфекції (найчастіше Staphylococcus aureus та Herpes simplex virus). Хоча золотистий стафілокок виявляють у посівах зі шкіри приблизно у 5 % населення без дерматиту, цей мікроорганізм є у посівах зі шкіри понад 90 % дорослих пацієнтів з АД. Клінічне значення надмірного розвитку бактеріальної мікрофлори залежить від конкретного пацієнта, оскільки у більшості пацієнтів із АД не спостерігається збільшення тяжкості перебігу захворювання в залежності від колонізації стафілокока. Це створює проблему для діагностики, оскільки важко відрізнити клінічні ознаки активної локалізованої інфекції та активної форми АД. Деякі клінічні ознаки, такі як гнійні виділення, проявляються як при локалізованій інфекції, так і при активній формі дерматиту. Наявність гнійного ексудату і пустул на шкірі дає підстави припустити такий діагноз як вторинна бактеріальна інфекція при запаленні в результаті дерматиту [6, 63]. Рідше порушення шкірного бар’єру сприяє вірусу простого герпесу, який називають «герпетиформною екземою». Хоча при лікуванні неінфікованого АД не рекомендується використовувати системні антибіотики, їх можна радити для застосування у пацієнтів з клінічними ознаками бактеріальної інфекції [87]. Антибіотики можуть призначатися як доповнення до відповідної стандартної схеми лікування АД, у тому числі з одночасним застосуванням топічних стероїдів. Аналогічно, при лікуванні герпетиформної екземи потрібно застосовувати системні противірусні засоби [92].
Гістамін – білок, який виробляють опасисті клітини і базофіли як компонент відповіді імунної системи на презентацію чужорідного антигену. Основна функція гістаміну – стимуляція місцевих кровоносних судин і нервів, в результаті якої спостерігається вазодилатація і свербіння. Пацієнти з АД часто повідомляють про свербіння як обтяжливий аспект, який впливає на якість їх життя. Вторинні подряпини не тільки посилюють свербіж (надалі цикл «свербіння-почісування»), але також додатково порушують шкірний бар’єр. Пероральні антигістамінні використовують в лікуванні пацієнтів з проявами свербіння з метою поліпшити якість їх життя шляхом інгібування таких судинних та неврологічних ефектів, проте доказова база є недостатньою, щоб рекомендувати використовувати антигістамінні препарати як частину лікування АД [37, 69]. Короткострокове, переривчасте застосування седативних антигістамінних препаратів може бути корисним у випадку порушення сну через вторинне свербіння, але воно не повинне замінити лікування АД з використанням топічних засобів [71].
Оскільки стан більшості пацієнтів, які страждають на AД, поліпшується в сонячний літній період року, в лікуванні AД часто використовується штучне ультрафіолетове (УФ) випромінювання. Недавні дослідження підтвердили, що у 74,4 % пацієнтів з легким чи помірним ступенем тяжкості спостерігався повний регрес АД під час літньої відпустки, у 16,3 % було помічене поліпшення і лише у 9,3 % не зафіксована зміна ступеня тяжкості AД, що вказує на сезонний характер перебігу хвороби з поліпшенням в літній час і погіршенням в інші пори року. Більше того, відпустки, проведені біля моря, сприяли значно кращому поліпшенню стану, ніж перебування в горах, з повним регресом захворювання у 91,2 % проти 11,1 % пацієнтів, у яких таке покращення не спостерігалось (р <0,01). І хоча така відмінність не може бути поясненою винятково дією УФ-випромінювання, ці дані підтверджують гіпотезу про позитивний вплив УФ-випромінювання на перебіг AД [13, 103, 130].
* * *
Вивчення проблеми АД з позиції урахування патогенетичних особливостей захворювання, оцінки якості життя пацієнтів різних вікових груп та психоемоційного стану хворих на АД відповідає напрямкам сучасної медицини. У зв’язку з цим актуальним є поглиблене дослідження проблеми лікування та діагностики хворих на АД в залежності від вікових особливостей, клінічних проявів дерматозу та імунного статусу.
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Загальна характеристика пацієнтів
Дослідження проводились з 2012 по 2016 роки на кафедрі дерматовенерології Національної медичної академії післядипломної освіти імені П.Л. Шупика, на базі Київської міської клінічної шкірно-венерологічної лікарні (КМКШВЛ) та лабораторії нейроімунології ДУ «Інститут нейрохірургії імені А.П. Ромоданова НАМН України», а також у приватних лабораторіях м. Києва.
За даний період було обстежено 139 хворих на АД, серед яких було 82 пацієнти жіночої та 87 чоловічої статі, що відповідно складає 49% і 51%. Пацієнти були розподілені на три групи: до першої групи увійшли діти з АД віком від 1 до 18 років, другу групу складали дорослі з АД віком від 18 до 67 років, третя група – контрольна.
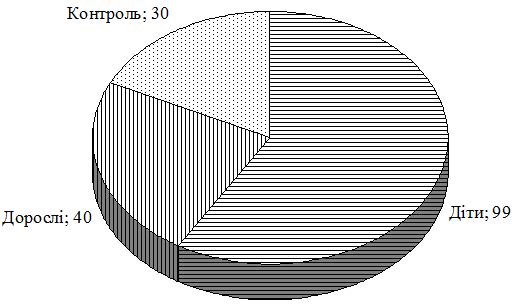
Рисунок 2.1 – Розподіл хворих на АД, залучених до дослідження, за групами
Імунологічне дослідження, а також визначення рівнів IL-2, IL-4 проводилось 30 пацієнтам з першої групи, 30 пацієнтам з другої групи, а також контрольній групі обстежених.
2.2 Критерії та принципи розподілу пацієнтів у групи дослідження
Дослідження проводились на основі положень Хельсінської Декларації Всесвітньої Медичної Асоціації і правил якісної медичної практики (ICHGCP), добровільної участі, інформування пацієнтів про характер майбутнього дослідження. Включення пацієнтів в програму обстеження проводилось за спеціально розробленими критеріями відбору.
Критерії включення:
1) вік пацієнтів від 1 року до 67 років;
2) підписана пацієнтами та батьками пацієнтів інформована згода на участь в дослідженнях.
Критерії виключення:
1) наявність супутньої патології захворювань, що впливають на достовірну оцінку імунного статусу пацієнтів (ВІЛ-інфекція, інсулінозалежний цукровий діабет, гематологічні захворювання, злоякісні новоутворення, ураження печінки, нирок в стадії декомпенсації);
2) застосування пацієнтами перед обстеженням імуносупресорної терапії, інтерферонів, індукторів інтерферону, специфічнихімуноглобулінів.
Діагноз АД було встановлено у хворих, які мали клінічні ознаки захворювання згідно запропонованих критеріїв J.M. Hanifin, G. Rajka, які було доповнені та розширені Британською групою спеціалістів та прийняті в 1994 році, як міжнародні клінічні рекомендації. Пацієнти на момент обстеження знаходились в стані нестійкої ремісії або загострення шкірного процесу АД.
Дані всіх хворих були зареєстровані та зафіксовані в історії хвороби, в яку були включені дані про сімейний та алергологічний анамнез, строки початку та перші прояви захворювання, причини загострення, клінічні особливості, супутні патології та можливе лікування АД.
В процесі досліджень, згідно розробленого опитувальника, проводилось вивчення різних факторів та причин, які б на думку пацієнтів могли впливати на частоту загострень АД. У 35 пацієнтів (з них 16 дорослих і 19 дітей) встановлений зв’язок загострень із сезоном пори року, у 55 пацієнтів на загострення впливали харчові алергени (5 дорослих і 50 дітей), у 9 хворих (6 дітей і 3 дорослих) впливали побутові аероалергени, у 4 пацієнтів вплив мали лікарські препарати (1 дорослий і 3 дитини), а 16 пацієнтів скаржились на збіг загострення АД з психоемоційними факторами, з них 15 дорослих і 1 дитина. У деяких пацієнтів виявлена полівалентна сенсибілізація до низки алергенів з віковими особливостями.
2.3 Методи дослідження
Для реалізації поставлених задач та досягнення мети дисертаційної роботи були застосовані методи клінічної та лабораторної діагностики, а також сучасні методи обробки статистичних даних.
2.3.1 Клінічні методи
Клінічне дослідження проведене 139 пацієнтам, з подальшим суб’єктивним та об’єктивним моніторингом загального стану хворих, аналізом анамнезу захворювання. Клінічне спостереження тривало протягом всього курсу лікування.
Оцінка об’єктивного статусу пацієнта базувалась на певних даних:
1) огляд пацієнта (огляд, пальпація, перкусія, аускультація, огляд по органам і системам);
2) дерматологічні обстеження за стандартними методами з визначенням SCORAD;
3) лабораторне загальноклінічне обстеження (біохімічний аналіз крові (пацієнтам старше 16 років), загальний аналіз крові, загальний аналіз сечі, ІФА крові на гельмінти: аскаридоз, токсокароз, лямбліоз (деяким пацієнтам), аналіз калу на яйця глистів та зішкряб на ентеробіоз;
4) алергологічне обстеження (аналіз алергологічного анамнезу, вивчення характеру сенсибілізації, визначення загального та специфічних Ig E);
5) консультативні заключення суміжних спеціалістів (педіатрів, терапевтів, алергологів, невропатологів, отоларингологів, пульмонологів, ендокринологів, кардіологів, неврологів, психіатрів, гінекологів та ін.).
Загальноклінічні обстеження, а саме біохімічний аналіз крові був проведений 51 пацієнту старше 16 років. Загальний аналіз крові, загальний аналіз сечі, імунологічний аналіз крові на рівень загального Ig E, аналіз калу на яйця глистів та зішкряб на ентеробіоз були проведені 139 пацієнтам. Загальноклінічні обстеження проводились на базі КМКШВЛ.
Критерії діагностики АД за Hanifin&Rajka:
Головні критерії:
1. Свербіж шкіри
2. Типова морфологія і локалізація шкірних висипів:
– Згинальна ліхеніфікація та лінійність
– У дітей – обличчя та кінцівки
3. Хронічний рецидивуючий перебіг
4. Атопія в особистому та сімейному анамнезі
Додаткові критерії:
1. Ксероз (сухість) шкірних покривів;
2. Іхтіоз, переважно долоневий;
3. Реакція гіперчутливості негайного типу при шкірному тесті з алергенами;
4. Локалізація шкірного процесу на кистях та стопах;
5. Хейліт;
6. Екзема сосків;
7. Схильність до інфекційних уражень шкіри;
8. Початок захворювання у ранньому дитячому віці;
9. Еритродермія;
10. Рецидивуючий кон’юнктивіт;
11. Інфраорбітальна зморшка Денні-Моргана;
12. Кератоконус (конічне випинання рогівки);
13. Передні субкапсулярні катаракти;
14. Тріщини за вухами;
15. Високий рівень Ig E у сироватці крові;
16. Потемніння ділянок навколо очей;
17. Блідість або еритема обличчя;
18. Білий лишай;
19. Непереносимість їжі;
20. Непереносимість вовни та ліпідних розчинників;
21. Перифолікулярна локалізація висипу;
22. Вплив емоційних факторів на перебіг захворювання;
23. Білий дермографізм або затримка поблідніння.
Для встановлення діагнозу АД у пацієнта повинні бути в наявності три головних та три вторинних критерії.
Діагностичні критерії Британської робочої групи 11 (SIGN 125):
• свербіж шкіри за даними імунологічного і родинного алергологічного анамнезу протягом останніх 12 місяців, плюс три й більше з наступних станів:
• наявність уражень у шкірних складках (згинальна поверхня ліктів, підколінні ямки, згинальна поверхня гомілково-ступневих суглобів, ділянки навколо шиї або очей) в анамнезі;
• наявність астми або сінної лихоманки в анамнезі (або атопічного захворювання у родичів першої лінії, якщо дитині не виповнилося чотирьох років);
• наявність загальної сухості шкіри в анамнезі минулого року;
• початок захворювання у дітей віком до двох років (не використовується, якщо дитині до чотирьох років);
• видимі прояви дерматиту в місцях згинів (у тому числі дерматит, який вражає поверхню щік або чола та зовнішні поверхні кінцівок у дітей у віці до чотирьох років).
Для оцінки тяжкості АД використовували коефіцієнт SCORAD (Severity scoring of atopic dermatitis).
При встановленні діагнозу АД визначали ступінь тяжкості захворювання. Європейською цільовою групою з питань АД (ETFAD) розроблено класичний метод «Оцінки ступеня тяжкості атопічного дерматиту» (SCORAD). Якщо за шкалою SCORAD пацієнт набирає понад 40 балів, ступінь перебігу АД, як правило, оцінюється як тяжкий, в той час як кількість балів за SCORAD нижче 20 є підставою для віднесення до легкого ступеня перебігу.
Згідно шкали SCORAD враховували такі показники: (А) – поширеність шкірного процесу (об’єктивний стан); (В) – інтенсивність клінічних проявів (об’єктивний стан); (С) – суб’єктивні відчуття. I етап (А): розрахунок площі ураження шкірних покривів. Площу ураження оцінювали за правилом “дев’яток” і детально зображується на оцінюючому малюнку (мал.1) контурів тіла пацієнта спереду і ззаду з поправками (щодо голови та нижніх кінцівок) для хворих до 2-річного віку. Вогнища, які бралися до уваги, мали тільки запальне ураження, але не сухість. Загальновизнано, що одна долоня хворої людини становить 1% шкірної поверхні. II етап (В): визначення та оцінка ознак інтенсивності (об’єктивні симптоми). За системою SCORAD виділяли 6 ознак: 1) еритема (гіперемія), 2) набряк/ папула, 3) мокнуття /кірки, 4) екскоріація, 5) ліхеніфікація, 6) сухість. Кожну ознаку оцінювали від 0 до 3 балів (0 – відсутність, 1 – легкий, 2 – середній, 3 – важкий). Оцінки в балах виставляли в спеціальній оцінюючій таблиці (малюнку), потім загальний індекс SCORAD розраховували за формулою, наведеною далі. Ділянка шкіри пацієнта, що обиралась представляла кожну ознаку у даного хворого, тим самим виключаючи ділянку-мішень або ділянку найбільшого ураження. Проте, одна і та ж ділянка могла бути обраною для 2-х і більше ознак. Наприклад, одна і та ж ділянка слугувала для оцінки як екскоріацій, так і еритеми. З іншого боку, сухість виражала на ділянках, які не мали гострих проявів висипу або ліхеніфікації. III етап (С): оцінка суб’єктивних ознак. Вони включали оцінку ступеня свербіння і порушень сну. Хворий (зазвичай старше 7 років) або його (її) батьки відповідали повно і правильно на запитання по цій темі. Інтенсивність свербежу і ступінь порушення сну оцінювали за 10-ти бальною шкалою (від 0 до 10). IV етап: розрахунок значення індексу SCORAD. Всі отримані бали виставляли в оцінювальний лист. Індекс SCORAD розраховували за формулою: SCORAD = А / 5 + 7B / 2 + C (додаток Б).
При чисельному значенні індексу SCORAD до 20 балів клінічні прояви АД, вважали легкими, від 20 до 40 – середньої важкості, більше 40 – важкими. Середній індекс SCORAD у дітей хворих на АД (перша група) складав 48,6±2,70 балів, з крайніми коливаннями в діапазоні від 10,1 до 107, у дорослих (друга група) – 64,7±3,93 балів, з крайніми коливаннями в діапазоні від 10,1 до 100,2.
2.3.2 Імунологічні методи дослідження
Визначення рівнів загального сироваткового та специфічних Ig E проводились методом ІФА системою «VitrotestTotal-Ig E» на приладі LabsystemsMultiscan MS в лабораторії КМКШВЛ (Т.10490002 атестат держстандарту №352008476).
«Vitrotest Total-Ig E» – імуноферментна тест-система для кількісного визначення вмісту загального Ig E. Імуноферментна тест-система «VitrotestTotal-Ig E» призначена для кількісного визначення вмісту загального імуноглобуліну E у сироватці чи плазмі крові людини.
Принцип аналізу тест-системи «VitrotestTotal-Ig E» базується на одноетапному «сендвіч»-варіанті ІФА з використанням пари моноклональних антитіл у складі імуносорбенту та пероксидазного кон’югату. Твердою фазою в тест-системі є стрипований ІФА-планшет з попередньо засорбованими в лунках першими моноклональними антитілами, специфічними до Ig E. Другі моноклональні антитіла входять до складу пероксидазного кон’югату. Під час інкубації досліджуваних зразків та пероксидазного кон’югату в лунках планшету Ig E зв’язуються одночасно як з першими антитілами на твердій фазі, так і з другими антитілами, кон’югованими з пероксидазою хрону – утворюючи «сендвіч». Незв’язані компоненти видаляються під час відмивання планшету. Візуалізація утворених імунних комплексів відбувається при внесенні в лунки розчину хромогену 3,3′,5,5’тетраметилбензидину. В результаті реакції розчин в лунках, де утворились імунні комплекси, забарвлюється в синій колір. Реакція зупиняється додаванням стоп-реагенту, при цьому синій колір забарвлених лунок змінюється на жовтий. Результат аналізу визначається на спектрофотометрі при довжині хвилі 450–620 нм.
Мінімальна концентрація загального Ig E, що достовірно визначається в тест-системі «Vitrotest Total-Ig E», складає 5 МО/мл. В тест-ситемі «Vitrotest Total-Ig E» концентрації калібраторів вказані в МО/мл. Для перерахунку концентрацій в нг/мл, необхідно концентрацію отриману в МО/мл помножити на 2,4. Відтворюваність результатів між різними постановками аналізу (Interassay reproducibility) Коефіцієнт варіації (CV) для двох сироваток з різним рівнем загального IgЕ оцінювали протягом двох днів в двох постановках аналізу, по 8 повторів в кожному аналізі.
Імунологічні обстеження проводилсь в лабораторії нейроімунології ДУ «Інститут нейрохірургії імені А.П. Ромоданова НАМН України» (Т.4838193 атестат держстандарту №ПТ-0128/04). Імунологічне дослідження на рівень ІЛ-2 та ІЛ-4 виконувались у приватній лабораторії «Сінлаб».
Визначались наступні показники:
1) дані гемограми (лейкоцити, лімфоцити, моноцити, нейтрофіли, тромбоцити, еритроцити, гемоглобін);
2) клітинний імунітет: лімфоцити та основні субпопуляції лімфоцитів (Т-лімфоцити СD-3, Т-лімфоцити-хелпери CD-4, Т-лімфоцити-цитотоксичні CD-8, імунорегуляторний індекс, В-лімфоцити CD-20, NK-клітини CD-16);
3) показники функціональної активності імунних клітин:
– проліферативна активність лімфоцитів (РБТЛ) різними мітогенами: спонтанна проліферація, Т-мітоген (ФГА) викликана проліферація, простагландин-залежна проліферація (ФГА+індометацин), В-мітоген (декстран-сульфат) викликана проліферація;
– фагоцитарна активність нейтрофілів: 1. НСТ-тест: спонтанна та індукована (зімозан). 2. Активність мієлопероксидази нейтрофілів (спонтанна). 3. Поглинальна активність нейтрофілів крові (частин латексу): фагоцитарний індекс та фагоцитарне число; адгезивна активність нейтрофілів
4) гуморальний імунітет: циркулюючі імунні комплекси (ЦІК);
5) аутоімунні реакції (клітинні рекції): нейроаутоантигеном індукована проліферація (РБТЛ), сенсибілізація нейтрофілів до альбуміну, нейроспецифічним білкам ОБМ та NSE;
6) аутоантитіла до мозкових антигенів: основного білка мієліна, білка S-100, нейроспецифічної енолази, загальнонр людського мозкового антигену.
Визначення фенотипу клітин (лімфоцитів крові) методом лазерної проточної цитофлуометрії.
Визначення фенотипу клітин проводилось на проточному цитофлюориметрі “BeckmanCulter” (США) за допомогою моноклональних антитіл. Визначалися наступні субпопуляції мононуклеарів: CD3+,CD4+, CD8+, CD19+, CD16+. Коротко суть методики була в наступному:
1. На дно пластикової пробірки вносили 5 мкл МКАТ та 50 мкл біоматеріалу (периферична кров відібрана з ліктьової вени у пробірку, які містять антикоагулянт гепарин в концентрації 20 од./мл).
2. Протягом 3 секунд перемішували зразок.
3. Інкубували протягом 20-30 хвилин у темряві, при кімнатній температурі.
4. Лізис еритроцитів крові проводили за допомогою лізуючого розчину Beckman Coulter (Immunoprep TM Reagent System), який вносили по 1 мл. Зразки готували за рекомендаціями по використанню набору Beckman Coulter Company.
5. Аналіз результатів:
Аналіз проводили на лазерному проточному цитофлуориметрі Beckman Coulter (Cytomics FC-500) з використання програм збору та обробки даних Lysis II та комп’ютерного оснащення ViewSonic (HP, США).
Для збудження використовували аргоновий лазер потужністю 25хВт (довжина хвилі 488 нм). В кожній пробі аналізували 5000 клітин, за стандартом протоколу аналізу даних проточної цитофлуориметрії пряме (FSC) та бокове (SSC) світлорозсіювання для виділення трьохчасткового диференціювання популяцій клітин по розділенню піків флуоресценції (Fits, фікоеритрин та ін.). Субпопуляційний склад лейкоцитів визначали у прямому імунофлуоресцентному тесті.
Проліферативну відповідь лімфоцитів на різні мітогени вивчали в реакції бластоутворення лімфоцитів на різні мітогени, враховуючи, що ФГА в дозі 10мкг на пробу відкриває поліклональну відповідь переважно Т-лімфоцитів, тоді як декстран сульфат – активує В-лімфоцити. Після 72 годин культивування при 370С реакція зупинялася згідно з рекомендаціями Григор’євої та Копелян 1977 р. Відсоток бластних форм лімфоцитів оцінювали на препаратах, забарвлених за Романовським.
Визначення циркулюючих імунних комплексів проводили за методом Гашкова, який ґрунтується на селективній преципітації комплексів антиген-антитіло в 3,75% поліетиленгліколі з наступним фотометричним визначенням щільності преципітації.
Визначення фагоцитарної активності нейтрофілів проводилось в НСТ-тесті (спонтанний і стимульований), який оснований на здатності фагоцитуючих клітин поглинати нітросиній тетразолій і відновлювати його продуктами окисно-відновлювальних реакцій “метаболічного вибуху”, що супроводжують процес фагоцитозу.
Рівень антитіл до нейроспецифічних білків у сироватці крові визначали методом ІФА за розробленими рекомендаціями Черенько Т.М. (1989), Лісяний М.І. та Любич Л.Д. (2001). Принцип методу полягає в тому, що антитіла до тестового зразка взаємодіють з імобілізованим на твердій фазі антигеном, потім фіксують на собі антивидові антитіла (вторинні), кон’юговані з ферментом пероксидазою хріну. Кількість зв’язаного кон’югату виявляється за допомогою хромогенного субстрату, причому інтенсивність забарвлення що розвивається, пропорційна кількості антитіл у зразках. В підготовний період до аналізу отримували нейроспецифічні антигени по методу із головного мозку телят та визначали вміст білка в них методом Лоури. Приготовлені антигени зберігали в замороженому стані при -20 Сº. Підготовка планшетів і сорбція антигену (нейроспецифічних білків): антиген імобілізували на твердій фазі (планшетах) в концентрації 10 мкг/мл; в кожну лунку планшета вносили по 100 мкл розчину антигена. Сорбція антигену тривала 18-20 годин при 4ºС і проводилась: ОБМ-у цитратно-фосфатному буфері 0,1М, рН=6,0; S-100 і NSE-карбонатно-бікарбонатному буфері 0,1М з рН=9,6. Видалення антигену, що не зв’язався, також розведення всіх реагентів і наступне видалення компонентів, що не зв’язалися, проводили тричі з використанням фосфатного буферу 0,01М з рН= 7,4 з додаванням 0,05% твіна-20.Для заповнення місць, що не зв’язалися, з метою блокування подальшого неспецифічного зв’язування сайтів, в лунки вносили 1% БСА.
Досліджувані і контрольні зразки розводили у 100 разів, для чого у комірки допоміжного планшету вносили по 1мл фосфатного буферу 0,01М з рН=7,4 і додавали по 10 мкл суцільної сироватки, ретельно перемішували. Кон’югат антивидових кролячих імуноглобулінів з пероксидазою розводили фосфатним буфером 0,01М з рН= 7,4 у співвідношенні 1:20.
Приготування субстратного розчину: 80 мг аміносаліцилової кислоти розчиняли при 70ºС у 100 мл води. Безпосередньо перед використанням рН розчину доводили до 6,0. 1М розчином їдкого натру NaОН. На кожні 9 мл отриманого розчину додавали 1 мл 0,05% розчину пероксиду водню Н2О2.
Проведення імуноферментного аналізу:
1. Досліджувані та контрольні зразки сироватки вносили у розведенні 1:100 по 100 мкл у комірки планшета із сорбованим антигеном. Інкубували 2 год при 37ºС або 24 год при 4ºС.
2. Тричі відмивали фосфатним буфером.
3. Вносили по 100 мкл розчину кон’югатуантивидових кролячих імуноглобулінів з пероксидазою в робочому розведенні. Кон’югат інкубували протягом 1 год при 37ºС.
4. Тричі відмивали фосфатним буфером.
5. В кожну комірку планшета вносили по 100 мкл ферментного субстрату (0,8% розчин 5-аміносаліцилової кислоти з 0,05%пероксиду водню). Інкубували 40 хв при 20ºС.
6. Зупиняли реакцію додаванням 100 мкл стоп-реагенту(1М NaОН).
7. Рівень аутоантитіл визначали методом спектрофотометрії в аналізаторі імуноферментному фотоелектричному АІФ-Ц-01С, вимірюючи оптичну густину при довжині хвилі 450 нм.
Розраховували значення оптичної густини в комірках із дослідними і контрольними зразками і виражали в умовних одиницях (ум.од.) [24, 27, 28, 66, 95, 104, 189].
2.3.3 Апаратний метод дослідження функціональних параметрів шкіри
Визначення функціональних параметрів шкіри проводилось на багатофункціональному портативному аналізаторі для діагностики поверхні шкіри Soft Plus (свідоцтво про державну реєстрацію № 8177/2008 від 26 вересня 2008 р. № 116-Адм). Визначено наступні показники шкіри: вологість, рівень меланіну, еластичність, рН шкіри, температура шкіри і жирність. Деякі з показників (вологість, еластичність, меланін та жирність) розраховували апаратом в умовних одиницях. Показники температури шкіри і рівня рН шкіри вимірювали в міжнародних одиницях. Функціональні параметри визначали на здоровій шкірі, а також на ділянках ураження шкіри. Під час обстеження пацієнтів всі датчики, які фіксували дані, знаходились перпендикулярно рівню шкіри, з якої знімали показники на фоні сухої, чистої та не змащеної поверхні шкіри, засобами зовнішньої терапії.
Вологість шкіри фіксували апаратом в межах від 1 до 100 ум. од. Еластичність шкіри визначали датчиком від 1 до 50 ум. од. Вологість та еластичність шкіри вимірювали у пацієнтів на здоровій шкірі та на шкірі у вогнищі. Значення параметрів залежали від стану шкіри, тобто якщо шкіра була змащена або зволожена до обстеження, то показник міг збільшуватись. Тому обстеження проводили до того, як пацієнт наносив на шкіру мазь, крем, або зволожував шкіру водою.
Для визначення показника рН шкіри пацієнтів, спочатку занурювали датчик рН в дистильовану воду, а вже потім знімати показник зі шкіри пацієнта. Рівень рН шкіри у здорової людини в нормі становить 5,2-5,7, pH для жирної шкіри 4-5 та для сухої шкіри: 5.7–7.
Показник меланіну у кожного пацієнта індивідуальний, апарат SOFTPLUS дуже чутливий на всі зміни кольору поверхні шкіри і фіксував різні показники від 1 до 100 ум. од. на різних ділянках шкіри. Апарат SOFT PLUS під час реєстрації показника реагував на змащення шкіри аніліновими барвниками та освітлення кімнати.
Показник температури шкіри суттєво змінювався від температури зовнішнього середовища приміщення в якому знаходився обстежуваний, тому температура шкіри приміщення в якому були проведені обстеження не знижувалась нижче 18º С та не підвищувалась вище 25ºС.
2.4 Оцінка якості життя сімей з атопічним дерматитом
Оцінку якості життя сімей в яких діти страждають на АД проводилась за допомогою оригінальної великобританської англійської версії опитувальника FDLQI (Family Dermatology Life Quality Index), який був переведений на українську мову двома незалежними перекладачами, а потім знову на англійську мову двома іншими незалежними перекладачами. Заключний зворотній переклад був підтверджений одним з авторів FDLQI.
Батькам 30 дітей (у віці до 4-х років) з АД (15 хлопчиків і 15 дівчаток), які знаходились разом із своїми дітьми у стаціонарному відділенні, було запропоновано заповнити українські версії FDLQI і DFI (Dermatology Family Index). Середній вік дітей в місяцях був 31,7 (±18,3). В усіх випадках заповнювали опитувальники матері. Раніше було доведено, що стать батьків, які заповнювали в DFI і FDLQI не впливає на результат оцінювання. Етичний дозвіл на дослідження було надано дослідницьким комітетом з етики Національної медичної академії післядипломної освіти імені П.Л. Шупика.
2.5 Статистичний метод
Для аналізу й обробки результатів клінічних досліджень, одержаних в процесі виконання дисертаційної роботи, були використані сучасні методи обробки статистичного матеріалу та програмного комплексу “Statistica”. Залежно від поставлених задач дослідження і типу даних, були застосовані наступні статистичні методи: для аналізу й обробки кількісних показників, що були підпорядковані закону нормального розподілу, використовувалися параметричні методи статистичного аналізу. Перевірка закону нормального розподілу кількісних показників здійснювалась із використанням критерію Колмогорова-Смірнова. Для обробки кількісних даних, які не підлягали закону нормального розподілу, та для якісних показників були застосовані непараметричні статистичні методи [75].
За допомогою параметричних методів визначалися основні статистичні характеристики описової статистики, а саме: середнє значення, похибка середнього значення, стандартне відхилення, дисперсія тощо. Вибіркові параметри, що наводяться в таблицях дисертаційної роботи, мають такі позначення: М – середнє значення, s – стандартне (середньоквадратичне) відхилення, m – похибка середнього значення, р – досягнутий рівень статичної значимості, n – обсяг аналізованої групи.
Оцінку статистично значимих відмінностей середніх значень кількісних ознак, що підлягали нормальному закону розподілу, у незалежних групах визначали за допомогою t-критерію Стьюдента. При проведенні порівняння кількісних показників, що не були підпорядковані нормальному закону розподілу, використовувалися непараметричні статистичні критерії. Оцінка статистично значимих відмінностей показників у незалежних групах здійснювалась з використанням непараметричного статистичного критерію Манна-Уїтні. Перевірка статистично значимої різниці між кількісними показниками двох парних (залежних) вибірок визначалась за допомогою непараметричного статистичного Т-критерію Вілкоксона. Критичне значення рівня статистичної значимості (р) приймалося рівним 0,05 (5%).
Визначення взаємозв’язків між окремими показниками здійснювалось за допомогою кореляційно аналізу. Взаємозв’язок між кількісними показниками, що були підпорядковані нормальному закону розподілу, визначався з використанням коефіцієнта кореляції Пірсона. При визначенні взаємозв’язків між показниками, що не підлягали нормальному закону розподілу, були розраховані непараметричні коефіцієнти кореляції, зокрема Cпірмена та Кендала.
Тенденції змін середніх значень окремих кількісних показників за часовим критерієм визначались за допомогою регресійного аналізу.
Аналіз й обробка статистичних даних проведених клінічних досліджень проводились з використанням пакета прикладних програм STATISTICA,SРSР та MSExcel 2010 [26].
Значення коефіцієта кореляції вимірювали в інтервалі від -1 до 1. Силу кореляції визначали в залежності від значення коефіцієнта кореляції: |r | ≤ 0,25 – слабка кореляція; 0,25 < | r|< 0,75 – помірна кореляція; | r| 0,75 – сильна кореляція.
РОЗДІЛ 3
КЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ НА АТОПІЧНИЙ ДЕРМАТИТ РІЗНИХ ВІКОВИХ ГРУП
3.1 Клінічні особливості атопічного дерматиту у дітей
Клінічні обстеження проводилися на базі Київської міської клінічної шкірно-венерологічної лікарні. Проводилось вивчення особливостей приватного та сімейного анамнезу, скарг, супутньої та алергічної патології, а також імунологічного профілю.
169 хворих на АД, які були залучені до дослідження, за віковою характеристикою та клініко-анамнестичними особливостями були розподілені на три групи: 1-а група діти хворі на АД (n=99), 2-а група дорослі хворі на АД (n=40), 3-я група – контроль, соматично здорові особи без алергічної патології (n=30).
До складу першої групи пацієнтів входило 99 дітей віком від 1 до 18 років, серед яких було 46 дівчаток (46,5 %) та 53 хлопчики (53,5 %). Середній вік пацієнтів першої групи склав (8,01±0,51) року. Середня тривалість АД у хворих 1 групи склала (5,3±0,50) року, з них 22 пацієнта (22,2 %) хворіли лише протягом 1 року, в той час як 56 пацієнтів (56,5 %) хворіли з першого року життя. Початок захворювання в середньому спостерігався на 1-2 році життя. Тривалість захворювання серед пацієнтів 1-ої групи, в середньому складала (5,3±0,50) року, з крайніми коливаннями від 2 діб до 15 років.
При вивченні сімейного анамнезу встановлено, що тільки у 1-го пацієнта (1,01 %) хворіють на АД обидва батьки (мати і батько), у 26 пацієнтів (26,3 %) – обтяжений алергологічний анамнез зі сторони лише одного з батьків (у 15 (%) хворіє на АД мати, у 11 (%) – батько), а 16 пацієнтів (16,2 %) успадкували АД через покоління від близьких родичів (у 9 пацієнтів (9 %) хворіє бабуся, а у 7 пацієнтів (7 %) – дідусь), у інших 56 пацієнтів (56,7 %) спадкової схильності до атопії виявлено не було (рис. 3.1).

Визначаючи стан ураження шкіри за індексом SCORAD серед пацієнтів 1-ої групи встановлено, що у 17 дітей (17 %) захворювання протікало у легкій формі (середній показник склав (13,87±8,2) бала з коливанням від 10,1 до 18,3 балів), у 27 дітей (28 %) – середньо-важкій формі (середній показник склав (30,11±21,4) бала з коливаннями від 20,2 до 39,5 балів), а у 55 дітей (55 %) в важкій формі (середній показник склав (69,16±66,7) бала з крайніми коливаннями від 40,3 до 107 балів). Індекс SCORAD серед хворих АД 1-ї групи складав 48,6±2,70, з крайніми коливаннями в діапазоні від 10,1 до 107 балів (рис. 3.2). В процесі досліджень проводилось вивчення різних факторів та причин, які б на думку пацієнтів могли впливати на частоту загострень АД у дітей. У 19 дітей (1,01 %) був встановлений зв’язок загострень із сезоном: підвищенням або зниженням температури повітря, цвітінням пилкових дерев, а також із купанням у водоймах та морях. Збираючи анамнез у 50 дітей (50,5 %) встановлено, що на загострення впливали харчові алергени: харчова алергічна реакція на солодощі, цитрусові, полуницю, малину, червоний перець, яйця, молоко, мед, м’ясо курки, банан, рибу, помідори та горіхи.
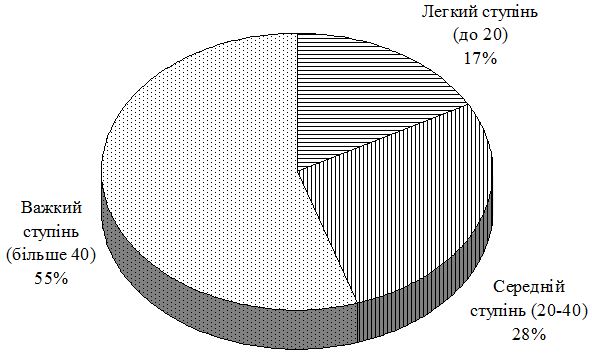
Рисунок 3.2 – Розподіл хворих на АД 1-ї групи за ступенем тяжкості.
У 6 дітей (6,1 %) на загострення АД впливали побутові аероалергени, такі як пральний порошок, домашній пил, шерсть домашніх тварин. У 3 дітей (3,03 %) на загострення мали вплив лікарські препарати: розчин димедролу, сироп нурофен та інші жарознижуючі препарати (сиропи). У 1 дитини (1,01 %), на думку матері, на загострення АД вплинули психоемоційні фактори: розведення батьків та зміна місця проживання. У 14 дітей (14,1 %) з важким перебігом АД спостерігалась полівалентна сенсибілізація (більше 3-х видів алергенів). У 5 дітей (5,05 %) одночасно відмічалась алергічна реакція на засоби побутової хімії та продукти харчування, у 5 дітей (5,05 %) загострення АД провокували ліки та харчові продукти, у 4 дітей (4,04 %) відмічалась алергічна реакція на аероалергени та харчові продукти одночасно.
При вивченні стану тяжкості перебігу АД враховували розповсюдженість висипу, наявність вторинного інфікування, характер свербежу та порушення сну.
Розподіл хворих 1-ї групи за клінічними формами представлено в табл. 3.1.
Таблиця 3.1 – Розподіл пацієнтів першої групи на клінічні форми АД
| Кількість обстежених
Абс. |
% | Середній вік пацієнтів | Крайні коливання за віком | |
| Еритематозно-сквамозна форма | 19 | 19,2 % | 1,63±2 | 1-3 роки |
| Еритематозно-сквамозна форма з ліхеніфікацією | 61 | 61,6 % | 9,8±12 | 3-18 років |
| Ліхеноїдна форма | 19 | 19,2 % | 9,1±14 | 1-18 років |
З еритематозно-сквамозною формою в першій групі обстежених з АД, було 19 пацієнтів, що склало 19,2 %, середній вік пацієнтів з даною формою склав (1,63±2) роки в діапазоні від 1-го до 3-х років. З еритематозно-сквамозною формою з ліхеніфікацією було 61 пацієнт, що склало 61,6 %, середній вік пацієнтів з цією формою був (9,8±12), з крайніми коливаннями від 3-х до 18-ти років. Ліхеноїдна форма АД зустрічалась у 19 пацієнтів , що склало 19,2 %, середній вік пацієнтів з даною формою складав (9,1±14), з крайніми коливаннями від 1 до 18 років.
3.2 Клінічні особливості атопічного дерматиту серед дорослих
Другу групу пацієнтів складали дорослі хворі на атопічний дерматит (n=40). Середній вік пацієнтів становив 25,3±1,69, з крайніми коливаннями від 18 до 67 років. Середня тривалість хвороби пацієнтів була (16,8±1,61) року. При вивченні сімейного анамнезу встановлено, що тільки у 1-го пацієнта, що склало 2,5 %, хворіли на атопічний дерматит два члени родини (мати і брат), у 8 пацієнтів був обтяжений алергологічний анамнез зі сторони тільки одного з батьків (мати або батько), що склало 20 %, а через покоління від близьких родичів захворювання успадкували 4 пацієнта – 10 % (хворіє бабуся), ніхто з інших 27 пацієнтів, а саме 67,5 % обстежених, не пам’ятає або не може точно визначити алергологічний анамнез в родині.
Визначаючи стан ураження шкіри за індексом SCORAD, у 3 дорослих захворювання протікало у легкій формі, що склало 7 % пацієнтів, з крайніми коливаннями від 10,1 до 19,3 балів, середній бал 13,97±9,2; у 10 % спостерігалась середньоважка форма захворювання, з крайніми коливаннями від 20,4 до 35,23 балів, середній бал 28,41±14,83; а у 33 хворих (83 %) була виявлена важка форма з крайніми коливаннями цього показника від 40,5 до 100,2 балів, середній бал 73,74±59,7. Індекс SCORAD в середньому складав 64,7±3,93, з крайніми коливаннями в діапазоні від 10,1 до 100,2 бала (рис. 3.3).
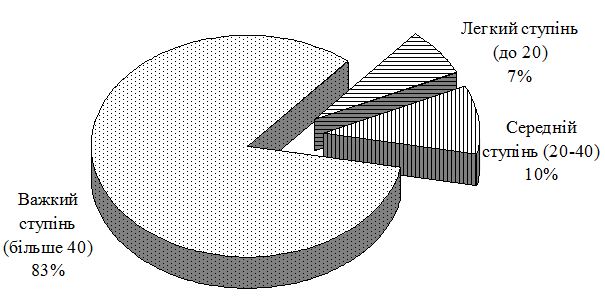
Рисунок 3.3 – Розподіл дорослих хворих з атопічним дерматитом за індексом SCORAD
При вивченні факторів та причин, які б на думку пацієнтів могли б впливати на частоту загострень АД, були виявлені різні можливі чинники. У 17 із 40 хворих був встановлений зв’язок загострень із сезоном, підвищенням або зниженням температури повітря, цвітінням пилкових дерев, а також купанням у водоймах та морі, що склало 42,5 %. На загострення АД у 8 пацієнтів, що склало 20 %, впливали харчові алергени, вони скаржились на алергічну реакцію на солодощі, цитрусові, полуницю, помідори, мед, м’ясо курки, цукор, горіхи, шоколад, часник, майонез, смородину і т.ін. З обстежених тільки 3 пацієнта, що склало 7,5 % скаржились на побутові аероалергени, такі як домашній пил, шерсть кішки або собаки. На загострення АД у 1-го пацієнта, що склало 2,5 %, вплив мали лікарські препарати: ряд тетрациклінів та флуконазол. Всі інші 16 пацієнтів (40 % обстежених) відмічали взаємозв’язок загострень АД з психоемоційними факторами (рис. 3.4, табл. 3.2).
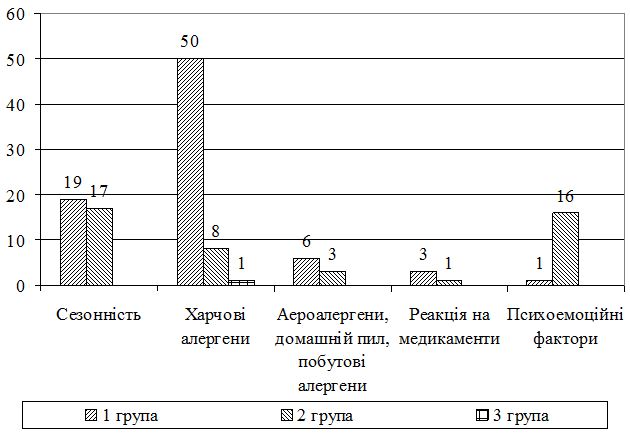
Рисунок 3.4 – Порівняння кількості пацієнтів в групах за тригерними факторами розвитку АД
З найбільш розповсюджених супутніх патологій було виявлено гельмінтоз – аскаридоз (n=3), хвороби шлунково-кишкового тракту: панкреатит (n=1), бронхіальна астма (n=3), супутні піодермії (n=4), риніт хронічний (n=1) (рис. 3.5, табл. 3.3).
Таблиця 3.2 – Порівняння кількості пацієнтів в групах за тригерними факторами розвитку АД
| 1 група (n = 99) | 2 група (n = 40) | 3 група (n = 30) | ||||
| Абс. | % | Абс. | % | Абс. | % | |
| Сезонність | 19 | 19,19 | 17 | 42,5 | ||
| Харчові алергени | 50 | 50,5 | 8 | 20 | 1 | 3,33 |
| Аероалергени, домашній пил, побутові алергени | 6 | 6,06 | 3 | 7,5 | ||
| Реакція на медикаменти | 3 | 3,03 | 1 | 2,5 | ||
| Психоемоційні фактори | 1 | 1,01 | 16 | 40 | ||
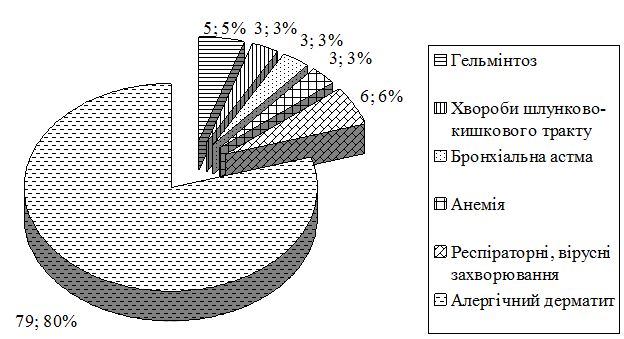
Рисунок 3.5 – Порівняння кількості пацієнтів в групах за супутніми захворюваннями
Таблиця 3.3 – Порівняння кількості пацієнтів в групах за супутніми захворюваннями
| 1 група (n = 99) | 2 група (n = 40) | 3 група (n = 30) | ||||
| Абс. | % | Абс. | % | Абс. | % | |
| Гельмінтоз | 5 | 5,05 | 3 | 7,5 | 2 | 6,66 |
| Хвороби шлунково-кишкового тракту | 3 | 3,03 | 1 | 2,5 | 2 | 6,66 |
| Бронхіальна астма | 3 | 3,03 | 3 | 7,5 | ||
| Анемія | 3 | 3,03 | ||||
| Респіраторні, вірусні захворювання | 6 | 6,06 | 1 | 2,5 | ||
| Піодермія | 4 | 10 | ||||
| Алергічний дерматит | 79 | 79,79 | 40 | 100 | 2 | 6,66 |
При вивченні тяжкості АД серед дорослого населення переважно превалювала – ліхеноїдна або пруригоподібна форми. З ліхеноїдною формою було 34 пацієнти, що склало 85 %, а з дифузним АД було 6 пацієнтів, що склало 15 % відповідно. Середній вік пацієнтів серед обстежених з даними формами АД був 25,3±52, з крайніми коливаннями від 18-ти до 67 років (табл. 3.4).
Таблиця 3.4 – Розподіл пацієнтів за формою АД
| Кількість обстежених
Абс. |
% | Середній вік пацієнтів | Крайні коливання за віком | |
| Ліхеноїдна форма | 34 | 85 % | 25,3±51 | 18-67 років |
| Дифузний АД | 6 | 15 % |
3.3 Оцінка якості життя батьків і дітей з атопічним дерматитом
Оцінюючи якість життя батьків, в родині яких діти хворі на АД, використовувались спеціально розроблені опитувальні листи FDLQI і DFI. Всі 30 матерів дітей з АД заповнювали опитувальні листи без будь-яких труднощів. Середня оцінка FDLQI склала (11,8±5,8) бала (діапазон від 0 до 30 балів), а середній бал склав 10,7 (±5,6; діапазон = 0-30). Найвищі бали FDLQI отримали пункти про емоційний стрес (2,27±0,91), час витрачений на догляд за дитиною (1,63±0,76) і збільшення матеріальних витрат по догляду за дитиною (1,60±0,86). Найвищий бал пунктів DFI склали питання про сімейні витрати (1,57±0,63), емоційну неврівноваженість (1,57±0,63) і втому (1,40±0,16). Середнє значення індексу SCORAD склало (40,64±11,30) бала (діапазон від 0 до103 балів). Обидва опитувальника показали добру внутрішню узгодженість з альфа-значенням Кронбаха (r=0,83 для кожного вимірювання). FDLQI корелювали дуже добре з DFI (r = 0,68, р <0,0001). Кореляція між FDLQI і DFI, які представляли подібні теми також були значимі, як показано в таблиці (табл. 3.5).
Таблиця 3.5 – Кореляційний зв’язок між індексами FDLQI і DFI
| FDLQI | DFI | Кореляція (r) |
| Емоційний стрес | Емоційний стрес | r = 0.44, P = 0.02 |
| Фізичний стан | Втомлюваність | r = 0.71, P < 0.001 |
| Фізичний стан | Сон членів родини | r = 0.46, P = 0.01 |
| Власні стосунки | Стосунки між членами родини | r = 0.38, P = 0.04 |
| Реакція оточуючих людей | – | – |
| Соціальне життя | - | – |
| Відпочинок/ дозвілля | Сімейне дозвілля | r = 0.36, P = 0.05 |
| Час витрачений на догляд за дитиною | Поміч у лікуванні | r = 0.32, P = 0.08 |
| Додаткова хатня робота | Хатня робота | r = 0.58 P = 0.001 |
| Додаткова хатня робота | Приготування їжі та харчування | r = 0.35, P = 0.06 |
| Робота/ навчання | – | – |
Незважаючи на те, що у більшості опублікованих досліджень по FDLQI, якість життя сім’ї оцінюється тільки у дорослих пацієнтів із хворобами шкіри, ми згідно одній із провідних публікацій по FDLQI, використали даний опитувальник у членів сімей хворих у віці до 4-х років.
Було обрано дітей з АД менше 4-х років для дослідження, так як ця вікова група досить сильно відрізняється від дорослих пацієнтів, так як вони не можуть забезпечити самооцінку власного стану і залежать від сім’ї та турботи про них. Наскільки відомо, використання опитувальника FDLQI в нашій роботі є першим дослідженням, яке присвячене валідації FDLQI виключно у батьків дітей хворих на АД. Воно продемонструвало загальне співвідношення кореляції між оцінками DFI і оцінками FDLQI. Цікаво відзначити, що в кожній мірі, більшість з пунктів, в яких представлені аналогічні теми показали статистично значиму відмінність однієї від іншої. Проте, три пункти в FDLQI (Q4: проблеми щодо реакції людей навколо; Q5: вплив на соціальне життя; Q9: вплив на роботу або навчання) і один пункт в DFI (Питання 5: сімейний «шопінг») не були повторно задані в даних опитувальниках. Запитання 1 з FDLQI і запитання 8 були про емоційний стрес батьків, викликаний станом шкіри власної дитини. Коефіцієнт кореляції між цими двома пунктами був r = 0,44 (Р = 0,02). Пункт FDLQI 2, що показує вплив на фізичний стан члена сім’ї був тісно пов’язаний з пунктом 7 DFI, що відповідає втомі і помірно корелює з пунктом 3, що відповідає якості сну. Варто зазначити, що елемент сну також охоплюється пунктом FDLQI 2, як елемент впливу на доброякісний сон і є невід’ємною частиною відпочинку. Точно так інші елементи у даних опитувальниках з майже аналогічним формулюванням показали природну кореляцію, такі як пункти впливу на дозвілля (пункт 6 FDLQI і пункт 4 DFI), сімейні витрати (пункт 10 FDLQI і пункт 6 DFI), відносини в родині (пункт 3 FDLQI і пункт 9 DFI) та збільшення хатньої роботи (пункт 8 FDLQI і пункт 1 DFI). Пункт 7 FDLQI представляє тягар по догляду, з точки зору часу, витраченого на лікування та пункту 10 DFI який відображає досягнення ефекту допомогти з лікуванням, не показали кореляційний зв’язок, можливо, через незначну різницю в контексті запитань. Пункт в FDLQI конкретно запитує про кількість часу, витраченого членом сім’ї на лікування пацієнта в той час як у відповідному пункті DFI, про змогу допомогти з лікуванням осіб, які здійснюють догляд, має набагато ширший сенс і не настільки специфічний, як формулювання пункту в FDLQI. Кореляція між FDLQI або DFI із SCORAD не була статистично значима. Раніше була виявлена помірна кореляція з DFI та SCORAD. В інших дослідженнях така кореляція не була статистично значима. Ці дані представляють собою суперечливу тенденцію зв’язку між суб’єктивною якістю життя і оцінки тяжкості об’єктивного стану захворювання. В даному дослідженні не було відмінностей за ознакою статі щодо FDLQI і результати DFI між хлопчиками і дівчатками. Раніше було показано, що такі статеві відмінності повинні бути адекватно вивчені тільки на скрупульозно підібрані запитання, коли кожна дитина в групі хлопчиків поєднується з відповідною дитиною в групі дівчат, чий вік в місяцях і значеннях SCORAD майже ідентичні.
Отже, 10 пунктів в кожному з цих двох опитувальних листах, мали значиму кореляцію з відповідними пунктами в іншому опитувальнику. Це означає, що в деяких дослідженнях, а також клінічних обстеженнях, використовуючи ці опитувальники, можливо заощадити час лікаря не втрачаючи важливої інформації. Результати також показали, що FDLQI можуть бути ефективно використані як і у батьків дітей, так і серед дорослих пацієнтів.
3.4 Особливості контрольної групи
До групи контролю (3 група) увійшло 30 осіб, з яких 16 пацієнтів жіночої статі (53 %) і 14 – чоловічої (47 %) без обтяженого алергічного анамнезу (здорові особи). Середній вік пацієнтів контрольної групи складав (15,6±2,68) року, до даної групи осіб увійшли обстежені різних вікових категорій. При порівнянні трьох груп, визначено, що віковий показник статистично значимо відрізнявся (р<0,05) від аналогічного показника серед першої і другої груп пацієнтів у зв’язку з неоднорідністю третьої контрольної групи.
* * *
Встановлені клінічні особливості перебігу АД та об’єктивізована тяжкість ураження шкіри хворих на АД в різних вікових групах. При обстеженні 139 хворих на АД (99 дітей та 40 доросли), у дітей хворих на АД за індексом SCORAD встановлено, що у 17% визначалась легка форма АД (Ме = 13,87±8,2) бала, у 28% – середньо-важка форма (Ме = 30,11±21,4) бала, а у 55% – важка форма (Ме = 69,16±66,7) бала. Індекс SCORAD у дітей хворих на АД – (48,6±2,70) бала. У 7% дорослих пацієнтів визначалась легка форма АД (Ме = 13,97±9,2) бала; у 10% – середньоважка форма (Ме = 28,41±14,83) бала; у 83% – важка (Ме = 73,74±59,7) бала. Індекс SCORAD – (64,7±3,93) бала. Серед дітей переважала еритематозно-сквамозна форма з ліхеніфікацією (61,6%) на відміну від дорослих, у яких переважала ліхеноїдна форма АД (85%). Дифузна форма АД відмічалась тільки у дорослих (15%). При оцінці якості життя батьків дітей хворих на АД, за опитувальниками FDLQI і DFI встановлено, що найвищі бали за опитувальником FDLQI отримали пункти про емоційний стрес, час витрачений на догляд за дитиною і збільшення матеріальних витрат по догляду за дитиною. Найвищі бали за опитувальником DFI отримали запитання про сімейні витрати, емоційну неврівноваженість і втому, що дозволяє стверджувати про соціальне значення проблеми АД.
Матеріали цього розділу висвітлено у наступних працях:
- Comparison of the impairment of family quality of life assessed by disease-specific and dermatology-specific instruments in children with atopic dermatitis. / P.V. Chernyshov, L.D. Kaliuzhna, A.A. Reznikova, M.K.A. Basra // JEDV. – 2015. – Vol. 29. – P. 1221–1224.
- Резнікова А.О. Порівняльна характеристика алергологічного анамнезу у дорослих на атопічний дерматит / А.О. Резнікова // Матеріаліи науково-практичної конференції з міжнародною участю «Прикарпатські дерматовенерологічні дні», присвяченої 70-річчю КЗ ІФОКШВД, 15-16 травня 2014 р., м. Яремча. – К., 2014. – С. 74.
РОЗДІЛ 4
ФУНКЦІОНАЛЬНІ ПАРАМЕТРИ ШКІРИ ХВОРИХ НА АТОПІЧНИЙ ДЕРМАТИТ
Основою для розуміння локального аспекту патогенезу АД є положення про розвиток запалення у шкірі, опосередкованого в основному активованими Т-лімфоцитами хелперами/індукторами другого порядку (Th2-лімфоцити) за участю антигенпрезентуючих клітин (клітини Лангерганса), макрофагів, еозинофілів, нейтрофілів та інших імунокомпетентих клітин. Результати досліджень останніх років переконливо доводять, що у патогенезі АД, псоріазу, екземи і ряду інших дерматозів ушкодження епідермального бар’єру грають значну роль поряд з імунними механізмами.
В останній час у дерматологічній практиці активно застосовуються методи неінвазивної діагностики шкіри, які використовуються для оцінки як фізіологічних, так і морфологічних параметрів шкіри. Дані про фізіологічний стан шкіри у хворих на АД нечисленні і суперечливі, що стало підставою для проведення дослідження у дітей та дорослих.
Вологість здорової шкіри у пацієнтів першої групи коливалася у межах від 14 до 100 ум. од., в осередках ураженої шкіри – від 12 до 90 ум. од. У хворих на АД другої групи також визначено зміни показника візуально здорової шкіри у межах від 11 до 80 ум. од., в осередках ураження – від 24 до 90 ум. од. відповідно. У осіб контрольної групи вологість шкіри також коливалася, але в межах 40-70 ум. од. Разом з тим, середньостатистичний показник вологості здорової шкіри у пацієнтів 1 групи склав (55,17±7,70) у.о. (p > 0,05), в осередках ураження – (46,7±7,2) у.о. (p < 0,05), що свідчить про тенденцію до зневоднення візуально незміненої шкіри, незначне зневоднення в осередках дерматозу у дітей.
Результати визначення вологості шкіри у хворих на АД залежно від віку наведено в табл. 4.1.
Таблиця 4.1 – Вологість шкіри у хворих на АД різних вікових груп
| Групи обстеження | Вологість шкіри | |||
| 1 група | М | м | p | |
| Здорова шкіра | 55,17 | 7,70 | р > 0,05 | |
| Шкіра осередку | 46,7 | 7,2 | р < 0,05 | |
| 2 група | Здорова шкіра | 44,07 | 6,70 | р < 0,05 |
| Шкіра осередку | 39,8 | 6,4 | р < 0,01 | |
| 3 група | Здорова шкіра | 69,7 | 5,5 | – |
При визначенні вологості у хворих 2-ї групи встановлено, що показник здорової шкіри в середньому становить (44,07±6,70) у.о. (р < 0,05), а шкіри осередків – (39,8±6,4) у.о. (p < 0,01), що вказує на значне зневоднення шкіри у дорослих як в осередках АД, так і поза них, на відміну від дітей. Показник вологості у 3-й (контрольній) групі в середньому становив (69,7±5,5) у.о.
Показник еластичності шкіри коливався у межах 40-50 у.о. у всіх обстежених пацієнтів з АД (табл. 4.2).
Таблиця 4.2 – Еластичність шкіри у хворих на АД різних вікових груп
| Групи обстеження | Еластичність | |||
| 1 група | М | м | p | |
| Здорова шкіра | 45,97 | 2,2 | р > 0,05 | |
| Шкіра осередку | 44,57 | 2,0 | р > 0,05 | |
| 2 група | Здорова шкіра | 46,97 | 2,2 | р > 0,05 |
| Шкіра осередку | 43,17 | 2,4 | р > 0,05 | |
| 3 група | Здорова шкіра | 48,3 | 2,8 | – |
Еластичність здорової шкіри у пацієнтів першої групи була у межах від 42 до 50 у.о. і в середньому складала (45,97±2,2) у.о. (р > 0,05), в осередках ураженої шкіри – у межах 43-50 у.о., в середньому – (44,57±2,0) ум. од. (р > 0,05). У другій групі пацієнтів показник еластичності здорової шкіри коливався у межах від 39 до 50 у.о. і складав (46,97±2,2) у.о., у вогнищі ураженої шкіри – у межах 30-50 у.о. і складав (43,17±2,40) у.о. (р > 0,05). Показник еластичності у 3 групі обстежених (осіб контрольної групи) складав (48,3±2,8) у.о. Порівнюючи показники еластичності шкіри у дітей та дорослих з АД та осіб контрольної групи, можна зробити висновок, що еластичність шкіри у хворих на АД, особливо в осередках, мала тенденцію до пониження, однак достовірних відмінностей нами не встановлено.
Рівень рН шкіри у здорової людини в нормі становить 5,2-5,7, pH для жирної шкіри – 4-5 та для сухої шкіри – 5,7–7,0. Результати дослідження рН у хворих на АД наведено в табл. 4.3.
Таблиця 4.3 – Рівень рН шкіри у хворих на АД різних вікових груп
| Групи обстеження | pH | |||
| 1 група | М | м | p | |
| Здорова шкіра | 5,17 | 0,42 | р > 0,05 | |
| Шкіра у вогнищі | 6,74 | 0,56 | р < 0,05 | |
| 2 група | Здорова шкіра | 5,13 | 0,80 | р > 0,05 |
| Шкіра у вогнищі | 6,82 | 0,55 | р < 0,05 | |
| 3 група | Здорова шкіра | 5,22 | 0,43 | – |
Оцінюючи рівень рН шкіри в першій групі пацієнтів виявлено, що показник на ділянках здорової шкіри становить 5,17±0,42 (р > 0,05) і не відрізняється від норми, в той час як на шкірі у вогнищі АД – 6,74±0,56 (р < 0,05), що свідчить про підвищення рН і зсув у бік алкалозу. Рівень рН у пацієнтів другої групи на ділянках зовні незміненої шкіри складав 5,13±0,80 (р > 0,05) і не відрізнявся від норми, а на ділянках ураження шкіри – 6,82±0,55 (р < 0,05), що також вказує на лужну реакцію шкіри у вогнищі АД дорослих пацієнтів. Показник рН у пацієнтів групи контролю залишався в нормі із значенням 5,22±0,43.
Колір шкіри у кожного пацієнта індивідуальний, апарат SOFT PLUS дуже чутливий на всі зміни кольору поверхні шкіри і може фіксувати показники від 1 до 100 у.о. на різних ділянках шкіри.
Рівень меланіну на візуально здоровій шкірі хворих першої групи був у межах від 1 до 28 у.о. і в середньому складав (4,37±0,72) у.о. (р > 0,05). Показник пігментації у вогнищі ураженої шкіри коливався в більш широких межах – 1-42 у.о. і складав (6,3±0,9) у.о. (р < 0,05). Рівень меланіну здорової шкіри та в осередках АД у другій групі хворих був у межах від 4 до 20 і від 3 до 40 у.о., в середньому складав (4,2±0,7) (р > 0,05) і (7,0±1,3) у.о. (р < 0,05) відповідно. Показник пігментації здорової шкіри у осіб третьої групи складав (3,9±0,6) у.о. Отримані результати підтверджують наявність дисхромії в осередках АД в наслідок хронічного запалення та свербежу шкіри (табл. 4.4).
Таблиця 4.4 – Рівень меланіну у шкірі хворих на АД різного віку
| Групи обстеження | Рівень меланіну | |||
| 1 група | М | м | p | |
| Здорова шкіра | 4,37 | 0,72 | р > 0,05 | |
| Шкіра осередку | 6,3 | 0,9 | р < 0,05 | |
| 2 група | Здорова шкіра | 4,2 | 0,7 | р > 0,05 |
| Шкіра осередку | 7,0 | 1,3 | р < 0,05 | |
| 3 група | Здорова шкіра | 3,9 | 0,6 | – |
Результати визначення температури шкіри в осередках АД і поза ними у дітей та дорослих наведено в табл. 4.5.
Таблиця 4.5 – Температура шкіри у хворих на АД різних вікових груп
| Групи обстеження | Температура | |||
| 1 група | М | м | p | |
| Здорова шкіра | 33,42 | 1,11 | р > 0,05 | |
| Шкіра у вогнищі | 33,64 | 1,29 | р > 0,05 | |
| 2 група | Здорова шкіра | 32,63 | 1,7 | р > 0,05 |
| Шкіра у вогнищі | 32,71 | 1,86 | р > 0,05 | |
| 3 група | Здорова шкіра | 31,89 | 0,8 | – |
Температура шкіри у пацієнтів першої групи на ділянках зовні незміненої шкіри складала (33,42±1,11) оС (р > 0,05), а температура у вогнищі була незначно підвищена до (33,64±1,29) оС (р > 0,05). У пацієнтів другої групи температура на ділянках здорової шкіри становила (32,63±1,70) оС (р > 0,05), а на ділянках ураження також незначно збільшена до (32,71±1,86) оС (р > 0,05). Температура шкіри у здорових пацієнтів складала (31,89±0,8) оС.
Показник жирності шкіри під час всієї роботи не враховувався, так як залишався без змін з показником «0» до і після обстеження кожного пацієнта.
Таким чином, дослідження функціональних параметрів шкіри встановило в осередках АД достовірне пониження вологості шкіри у хворих дітей і дорослих, тенденцію до пониження еластичності шкіри, майже однакове збільшення рН і посилення пігментації в першій і другій групі хворих. Змін температури шкіри у хворих на АД не визначено. Звертає увагу факт достовірного пониження вологості шкіри, тенденцію до зменшення еластичності і посилення пігментації поза осередків ураження у хворих першої і другої груп. Отримані результати слід враховувати при обгрунтуванні алгоритму терапії хворих на АД.
* * *
Встановлено в осередках АД хворих достовірне пониження вологості шкіри у хворих дітей (в 1,49 рази, р < 0,05) і дорослих (в 1,75 рази, р < 0,05), тенденцію до зменшення еластичності, майже однакове збільшення рН на поверхні шкіри в першій і другій групі хворих (в 1,29 і 1,31 рази відповідно, р < 0,05), посилення пігментації в 1,6 рази (у дітей) та 1,8 рази (у дорослих). В зовні незміненій шкірі хворих на АД обох груп достовірного понижувалася тільки вологість (р < 0,05).
Матеріали цього розділу висвітлено у наступних працях:
- Резнікова А.О. Підходи до обгрунтованого алгоритму лікування атопічного дерматиту в залежності від віку / А.О. Резнікова // Збірник робіт за матеріалами науково-практичної конференції «Впровадження уніфікованих протоколів в дерматовенерології із урахуванням доказової медицини», 13-14 березня 2014 р., м. Київ. – К., 2014. – С. 97-98.
РОЗДІЛ 5
ОСОБЛИВОСТІ АЛЕРГОЛОГІЧНОГО СТАТУСУ У ХВОРИХ НА АТОПІЧНИЙ ДЕРМАТИТ В РІЗНИХ ВІКОВИХ ГРУПАХ
Сенсибілізаційні реакції на їжу можуть бути ідентифіковані шляхом проб in vivo (прик-тест та внутрішньошкірна ін’єкційна проба) та тестів in vitro (специфічний Ig E в сироватці). Визначення специфічного Ig E до харчових алергенів дає кращі кількісні дані для визначення ступеня сенсибілізації, що допомагає оцінити ймовірність ризику клінічної реакції, і це дає можливість здійснити тест на окремі рекомбінантні алергени, що може мати більшу діагностичну специфічність, ніж тестування харчовими екстрактами для деяких продуктів.
Імунологічне обстеження крові на рівень загального Ig E було проведено 169 пацієнтам. При вивчені даного показника було встановлено, що загальний рівень сироваткового Ig E у пацієнтів 1-ої групи в середньому становив (380,5±36,72) МО/мл. Рівень загального Ig E у пацієнтів 2-ої групи в середньому становив 559,6±56,43. В контрольній, 3-ій групі визначався також рівень загального Ig E, при обстеженні виявлено, що рівень загального Ig E у пацієнтів контрольної групи складав (47,5±4,58) МО/мл. Показник загально Ig E статистично значимо відрізнявся (р<0,05) від аналогічного показника, що був визначений у 1-ій та 2-ій групі пацієнтів.
Показник загального Ig E статистично значимо відрізнявся (р<0,05) від аналогічного, що був визначений у 1-ій та 2-ій групі пацієнтів (табл. 5.1).
Визначення рівня специфічного Ig E проводилось по таких показниках: вівсяне борошно (F7), яловичина (F27), яйце цільне (F245), куряче м’ясо (F83), харчова суміш «зернові”(пшениця F4, овес F7, кукурудза F8, кунжут F10, гречка F11), пшеничне борошно (F4), картопля (F35), казеїн (F78), коров’яче молоко(F2), суміш «плісняві гриби» (Penicillium notatum M1, Cladosporium herbarum M2, Aspergillus fumigatus M3, Candida albicans M5, Alternaria alternate M6), суміш алергенів “домашнього пилу” (домашній пил H1, D. Pteronyssinus D1, D. Farinae D2, таракан), пилок дерев береза бородавчаста (T3), полин звичайний (W6), епідерміс кішки (E1), епідерміс собаки (E2), грибкова пліснява penicillium notatum (M1), грибкова пліснява aspergillus fumigatus (M3).При визначенні рівня специфічного Ig E у 28 пацієнтів першої групи, було виявлено специфічну реакцію на цільне куряче яйце у 3 дітей (віком 3, 4 і 15 років), при цьому за даними індивідуального алергологічного анамнезу, у жодного з дітей клінічно алергічна реакція на даний харчовий продукт не проявлялась. Переважну алергічну реакцію визначалали на коров’яче молоко, солодощі, шоколад та нестабільний психоемоційний стан, рівень загального Ig E у даних обстежених перевищував норму і становив 520, 600 та 1000 МО/мл відповідно. Іноді реєстрували неспівпадіння даних лабораторного алерологічного обстеження із анамнестичними скаргами. У однієї дитини зареєстрована реакція на коров’яче молоко (вік дитини 3 роки), в той час як скарги матері цієї дитини були на алергічну реакцію на цитрусові, курку, шоколад та томати, рівень загального Ig E у цієї дитини був вище норми і складав 250 МО/мл. Реакція на суміш алергенів домашнього пилу (кліщі роду dermatophagoides pteronyssinus, farinae) та харчову суміш зернові одночасно була визначена у одного пацієнта віком 13 років, в той час як рівень загального Ig E – 75 МО/мл, що становить норму в даній віковій категорії, а основними скаргами пацієнта був збіг загострення з пилком дерев в період цвітіння.
Таблиця 5.1 – Рівень загального Ig E в обстежених групах.
| 1 група | 3 група | ||||
| М | m | M | m | р | |
| Ig E загальний | 380,5 | 36,72 | 47,5 | 4,58 | <0,05 |
| 1 група | 2 група | ||||
| М | m | M | m | Р | |
| Ig E загальний | 380,5 | 36,72 | 559,6 | 56,43 | <0,05 |
| 2 група | 3 група | ||||
| М | m | M | m | Р | |
| Ig E загальний | 559,6 | 56,43 | 47,5 | 4,58 | <0,05 |
В обстеженні другої групи пацієнтів на специфічні алергічні реакції прийняли участь 25 осіб. Реакція на суміш побутових алергенів (кліщ роду dermatophagoides, pteronyssinus, farinae) була виявлена у 3 пацієнтів, але тільки у одного пацієнта при цьому було збільшення рівня загального Ig E до 1000 МО/мл, також тільки у одного пацієнта співпали скарги на алергічну реакцію на побутові алергени, інші скаржились на харчову непереносимість деяких продуктів харчування. На суміш пліснявих грибів відмічалась реакція у 2-ох пацієнтів, рівень загального Ig E перевищував допустиму межу норми, 600 МО/мл і 1000 МО/мл у даних обстежених також не співпала клінічна картина і скарги з результатами обстеження. Реакція на пилок дерев, таких як береза і полин, відмічалась у 3-ох пацієнтів, у даних пацієнтів рівень загального Ig E був підвищений до 225 МО/мл, 325 МО/мл та 1000 МО/мл, в той час як основними скаргами даних пацієнтів була психоемоційна нестабільність та на думку пацієнтів непереносимість харчових алергенів. Суміш зернових спричинила алергічну реакціє у 2-ох пацієнтів, але тільки у одного з них відмічалось збільшення загального Ig E до 1000 МО/мл (верхня межа), реакція на глютен була зареєстрована у тих самих 2-ох пацієнтів, рівень загального Ig E у одного пацієнта складав 5 МО/мл, а у іншого – 1000 МО/мл. У одного пацієнта була зареєстрована реакція на епідерміс кота та епідерміс собаки, рівень загального Ig E складав 1000 МО/мл, разом з тим загострення АД пацієнт пов’язував з емоційним навантаженням. Полівалентна імунологічна реакція відмічалась у трьох пацієнтів (табл. 5.2).
Рівень специфічного Ig E визначали у 11-ти обстежених третьої групи, але у жодного з них не було виявлено позитивної реакції.
Таблиця 5.2 – Рівень сенсибілізації до різних алергенів пацієнтів в різних групах
| Тип алергену | 1 група (n=28) | 2 група
(n=25) |
3 група (n=11) | ||||
| Абс. | % | Абс. | % | Абс. | % | ||
| Вівсяне борошно | – | – | – | – | – | – | |
| Яловичина | – | – | – | – | – | – | |
| Яйце цільне | 3 | 10,71 | – | – | – | – | |
| Куряче м’ясо | – | – | – | – | – | – | |
| Харчова суміш (зернові) | 1 | 3,57 | 2 | 8 | – | – | |
| Пшеничне борошно | – | – | – | – | – | – | |
| Картопля | – | – | – | – | – | – | |
| Казеїн | – | – | – | – | – | – | |
| Коров’яче молоко | – | – | – | – | – | – | |
| Суміш плісняві гриби | – | – | 2 | 8 | – | – | |
| Суміш алергенів домашнього пилу (кліщ роду dermatophagoides pteronyssinus, farinae) | 1 | 3,57 | 3 | 12 | – | – | |
| Суміш – пилок дерев (береза, полин) | – | – | 3 | 12 | – | – | |
| Епідерміс кішки, епідерміс собаки | – | – | 1 | 4 | – | – | |
| Грибкова пліснява penicillium | – | – | – | – | – | – | |
| Грибкова пліснява aspergillus | – | – | – | – | – | – | |
| Глютен | – | – | – | – | – | – | |
* * *
При вивченні сироваткового Ig E було встановлено, що загальний рівень даного показника у пацієнтів 1-ої групи в середньому становив (380,5±36,72) МО/мл. Рівень загального Ig E у пацієнтів 2-ої групи в середньому становив (559,6±56,43) МО/мл. Показник загально Ig E статистично значимо відрізнявся (р<0,05) від аналогічного показника, що був визначений у 1-ій та 2‑ій групах пацієнтів. Так встановлено, що у хворих дітей та дорослих має місце вірогідне 8-10-кратне збільшення концентрації в крові IgЕ. Підвищений рівень загального IgЕ в сироватці дітей та дорослих хворих на АД співпадає з підвищеним рівнем в крові СD-19 субпопуляції лімфоцитів (до [19,5±0,8] %; р<0,05 – у дітей; (16,89±1,42) %, р<0,05 – у дорослих, порівнюючи з контролем), які є продуцентами окремих класів імуноглобулінів, у тому числі й IgЕ.
Визначення рівня специфічного сироваткового Ig E проводилось у 28 пацієнтів першої групи. В результаті обстеження було виявлено специфічну на цільне куряче яйце, коров’яче молоко, солодощі, шоколад, нестабільний психоемоційний стан, суміш алергенів домашнього пилу, харчову суміш зернові. В обстеженні другої групи пацієнтів на специфічні алергічні реакції прийняли участь 25 осіб. Виявлена реакція на суміш побутових алергенів, суміш плісеневих грибів, на пилок дерев, суміш зернових, на епідерміс кота та епідерміс собаки.
Матеріали цього розділу висвітлено у наступних працях:
1. Резнікова А.О. Оцінка імунологічних змін та алергологічних реакцій у хворих на атопічний дерматит різних вікових груп / А.О. Резнікова // Дерматологія та венерологія. – 2015. – № 4 (70). – С.67-72.
РОЗДІЛ 6
ОЦІНКА ІМУННОГО СТАТУСУ ХВОРИХ НА АТОПІЧНИЙ
ДЕРМАТИТ ЗА ВИЗНАЧЕННЯМ ІНТЕРЛЕЙКІНІВ-2, -4,
ОСНОВНОГО БІЛКА МІЄЛІНУ, БІЛКА S-100,
НЕЙРОСПЕЦИФІЧНОЇ ЕНОЛАЗИ ТА ЗАГАЛЬНОГО
ЛЮДСЬКОГО МОЗКОВОГО АНТИГЕНУ
6.1 Визначення показників клітинного та гуморального імунітету у хворих на атопічний дерматит різних вікових груп
Дослідження стану імунної системи у дорослих хворих на АД було проведено у 30 осіб паралельно з вивченням загальних гематологічних показників, які представлені у таблиці 6.1. Було встановлено, що у дорослих хворих на АД загальні гематологічні показники не відрізняються від показників контрольної групи здорових осіб, як по рівню лейкоцитів, так і тромбоцитів та еритроцитів (р>0,05). В той же час при дослідженні субпопуляційного складу лімфоцитів, яке наведене в таблиці 6.2, встановлено, що розвиток дисбалансу в кількості певних субпопуляцій лімфоцитів. Так, загалом у хворих на АД відмічається незначне збільшення рівня субпопуляцій Т-лімфоцитів на фоні вірогідного підвищення як відносної, так і абсолютної кількості В-лімфоцитів. Враховуючи відомості про сучасний патогенез АД, можна говорити, що у хворих має місце активація імунної системи, особливо В-клітинної ланки імунітету, про що свідчить збільшення на одну третину кількості В-лімфоцитів (CD-19) у периферичній крові.
Дослідження функціональної активності Т- та В-лімфоцитів в тесті РБТЛ виявило, що у дорослих хворих на АД спостерігається (таблиця 6.3) вірогідне підвищення проліферативної активності лімфоцитів у хворих на АД на В-лімфоцитарний мітоген – декстрин сульфат з (43,03±1,28) % у контролі до (54,77±3,22) %. В той же час проліферативна відповідь на Т-мітоген (ФГА) у хворих на АД не відрізнялась від показника у здорових осіб і складала відповідно (54,30±2,34) % і (55,13±1,93) %. Подібна картина була встановлена при вивченні індометацинзалежної проліферації лімфоцитів периферійної крові сумісну дію ФГА індометацину. Проліферативна активність складала (63,54±3,30) % у хворих на АД та (64,04±1,93) % в умовно здорових осіб. Все це вказує на два можливих процеси при АД. По-перше, у хворих на АД зберігається висока функціональна активність Т-клітинної ланки імунітету, яка подібна до здорових осіб. По-друге, у них відмічається вірогідне збільшення кількості функціональної оцінки активності В-клітинної ланки імунітету, яка має відношення до синтезу специфічних імуноглобулінів та антитіл. Імуносупресивних проявів у стані імунної системи у дорослих хворих на АД не виявлено.
Таблиця 6.1 – Показники гемограми у дітей з АД в порівнянні з дорослими
| M | m | M | m | р | ||
| 1 група | 2 група | |||||
| Лейкоцити, 109/л | 5,2 | 0,1 | 5,17 | 0,29 | 0,1727 | >0,05 |
| Лімфоцити, 109/л | 1,7 | 0,1 | 1,81 | 0,18 | 0,5479 | >0,05 |
| Моноцити, 109/л | 0,4 | 0,0 | 0,47 | 0,05 | 0,6832 | >0,05 |
| Нейтрофіли, 109/л | 3,1 | 0,2 | 3,19 | 0,23 | 0,2592 | >0,05 |
| Тромбоцити, 109/л | 160,4 | 7,0 | 156,17 | 7,96 | 0,4034 | >0,05 |
| Еритроцити, 1012/л | 4,5 | 0,1 | 4,55 | 0,07 | 0,6819 | >0,05 |
| Гемоглобін, г/л | 136,7 | 3,3 | 129,87 | 2,58 | 1,6265 | >0,05 |
Поряд з лімфоїдними клітинами в реалізації імунних функцій організму відіграють клітини, які відповідають за вроджений імунітет, а саме нейтрофіли крові та натуральні кілери, які виконують захисну фагоцитарну та кілерну функції в організмі.
При вивченні субпопуляційного складу лімфоцитів було досліджено рівень CD-16 клітин в периферичній крові і було встановлено, що їх кількість в крові хворих подібна до кількості яка спостерігається у здорових осіб і складала (16,75±0,99) % та (16,32±0,86) % відповідно.
Таблиця 6.2 – Показники гемограми у дітей з АД в порівнянні з контролем
| M | m | M | m | p | |||
| 1 група (n=30) | 3 група (n=30) | ||||||
| Лейкоцити, 109/л | 5,2 | 0,1 | 5,17 | 0,29 | 0,1727 | >0,05 | |
| Лімфоцити, 109/л | 1,7 | 0,1 | 1,81 | 0,18 | 0,5479 | >0,05 | |
| Моноцити, 109/л | 0,4 | 0,0 | 0,47 | 0,05 | 0,6832 | >0,05 | |
| Нейтрофіли, 109/л | 3,1 | 0,2 | 3,19 | 0,23 | 0,2592 | >0,05 | |
| Тромбоцити, 109/л | 160,4 | 7,0 | 156,17 | 7,96 | 0,4034 | >0,05 | |
| Еритроцити, 1012/л | 4,5 | 0,1 | 4,55 | 0,07 | 0,6819 | >0,05 | |
| Гемоглобін, г/л | 136,7 | 3,3 | 129,87 | 2,58 | 1,6265 | >0,05 | |
Таблиця 6.3 – Показники гемограми у дорослих з АД в порівнянні з контролем
| M | m | M | m | p | |
| 2 група | 3 група | ||||
| Лейкоцити, 109/л | 5,17 | 0,29 | 5,17 | 0,29 | >0,05 |
| Лімфоцити, 109/л | 1,81 | 0,18 | 1,81 | 0,18 | >0,05 |
| Моноцити, 109/л | 0,47 | 0,05 | 0,47 | 0,05 | >0,05 |
| Нейтрофіли, 109/л | 3,19 | 0,23 | 3,19 | 0,23 | >0,05 |
| Тромбоцити, 109/л | 156,17 | 7,96 | 156,17 | 7,96 | >0,05 |
| Еритроцити, 1012/л | 4,55 | 0,07 | 4,55 | 0,07 | >0,05 |
| Гемоглобін, г/л | 129,87 | 2,58 | 129,87 | 2,58 | >0,05 |
При дослідженні фагоцитарної активності нейтрофілів крові в тесті із НСТ, який виявляє активність внутріклітинних ферментів, було встановлено вірогідне гальмування їх активності з (242,92±4,09) до (229,8±3,77) у.о. Поряд із зниженням НСТ показників у нейтрофілах крові, було виявлено також гальмування мієлопероксидазної активності із (15,14±0,6) до (12,85±0,56) у.о. Отримані дані свідчать, що у хворих на АД є порушення в системі вродженого імунітету, а саме гальмується функціонування фагоцитарної системи, яка відповідає за захист не лише від інфекційних збудників, а й від різних ендогенних крупно-молекулярних чинників, які можуть знаходитися в крові.
Відомо, що іншим важливим показником стану імунної системи є її здатність до розвитку різних автоімунних процесів в організмі, які можуть приводити до розвитку автоімунних захворювань, таких як автоімунний тиреоїдит, вовчак, розсіяний склероз. Було досліджено рівень ауто-антитіл до нейроспецифічних протеїнів, таких як ОБМ, S-100 протеїн, НСЕ та загальний мозковий антиген. Дослідження рівня автоантитіл проводили за допомогою методики ІФА, при аналізі досліджень було встановлено, що у хворих на АД (таблиця 6.4, 6.5, 6.6) виявляється вірогідне підвищення рівня автоантитіл до цих автоантигенів у порівнянні із здоровими особами.
Таблиця 6.4 – Рівень автоантитіл у сироватці крові дітей з АД
| ОБМ | Білку S-100 | НСЕ | ЗЛМА | |
| Діти АД n=30 | 33,0±0,8 | 11,0±0,3 | 27,3±0,6 | 31,2±0,7 |
| Контроль n=30 | 25,3±0,85 | 12,64±0,02 | 23,21±0,05 | 29,21±0,13 |
| р | <0,05 | <0,05 | <0,05 | <0,05 |
Таблиця 6.5 – Рівень автоантитіл у сироватці крові дітей та дорослих хворих на АД
| ОБМ | Білок S-100 | НСЕ | ЗЛМА | |
| Діти АД n=30 | 33,0±0,8 | 11,0±0,3 | 27,3±0,6 | 31,2±0,7 |
| Дорослі АД n=30 | 32,87±0,7 | 10,83±0,34 | 26,50±0,52 | 31,64±0,64 |
| р | <0,05 | <0,05 | <0,05 | <0,05 |
Таблиця 6.6 – Рівень автоантитіл у сироватці крові дорослих хворих на АД
| ОБМ | Білок S-100 | НСЕ | ЗЛМА | |
| Дорослі АД n=30 | 32,87±0,7 | 10,83±0,34 | 26,50±0,52 | 31,64±0,64 |
| Контроль n=30 | 25,3±0,85 | 12,64±0,02 | 23,21±0,05 | 29,21±0,13 |
| Р | <0,05 | <0,05 | <0,05 | <0,05 |
Найбільш суттєво збільшувався рівень автоантитіл до НСЕ та ОБМ, що може свідчити про певне значення цих автоантитіл у розвитку клінічних проявів дерматиту, при якому можуть пошкоджуватись нервові закінчення, які знаходяться у шкірі і, таким чином, запускатись автоімунна відповідь на ці антигени.
У хворих на АД у 2 рази встановлено підвищення рівня ЦІК, що підтверджує положення про активацію автоімунних реакцій та порушення гомеостатичних механізмів очищення крові (печінка, нирки, фагоцити).
Підсумовуючи отримані дані про стан імунної системи у хворих на АД, було встановлено, що у деяких ланках їм спостерігаються певні зміни. Найбільш значущі це підвищення рівня ЦІК та функціональної активності В-лімфоцитів, активація автоімунних реакцій та збільшення рівня нейроантитіл на фоні гальмування реакцій вродженого імунітету, а саме фагоцитарної активності нейтрофілів.
Дослідження стану імунної системи у дітей хворих на АД було проведено у 30 осіб по тій же схемі, що й у дорослих. Загальні гематологічні показники кількість клітин крові у дітей практично не відрізнялись від показників дорослих вірогідні відмінності відсутні (таблиці 6.7). Хоча є незначна тенденція до зниження рівня моноцитів у крові.
Таблиця 6.7 – Функціональна активність імунних клітин у дітей та дорослих.
| M | m | M | m | ||
| Діти АД (n=30) |
Дорослі АД (n=30) | р | |||
| ЦІК | 142,7 | 5,7 | 154,83 | 5,95 | >0,05 |
| РБТЛ | 7,1 | 0,6 | 6,33 | 0,70 | >0,05 |
| Спонтанна проліферація лімфоцитів | 7,8 | 1,0 | 6,13 | 0,94 | >0,05 |
| Т-мітоген (ФГА) викликана проліферація | 46,6 | 1,9 | 54,30 | 2,34 | <0,05 |
| Простагландинзалежна проліферація (ФГА + індометацин) | 59,7 | 2,3 | 63,57 | 3,30 | >0,05 |
| В – мітоген (декстран-сульфат) викликана проліферація | 56,5 | 2,1 | 54,77 | 3,22 | >0,05 |
| Спонтанна фагоцитарна активність нейтрофілів | 232,7 | 2,0 | 229,83 | 3,77 | >0,05 |
| Індукована фагоцитарна активність нейтрофілів (зимозан) | 59,6 | 1,1 | 59,88 | 2,03 | >0,05 |
| Активність мієлопероксидази нейтрофілів (спонтанна) | 18,5 | 0,3 | 12,85 | 0,56 | <0,05 |
| Адгезивна активність нейтрофілів | 47,3 | 1,9 | 50,20 | 2,09 | >0,05 |
При визначенні лімфоцитів та їх субпопуляційного складу у периферичній крові виявлено, що рівень лімфоцитів CD-3 Т-лімфоцитів та Т‑хелперів (CD-4), вірогідно знижений, а концентрація Т-цитотоксичних лімфоцитів находяться у межах контрольних значень і вірогідних відмінностей немає. В той же час установлено значне підвищення рівня CD-19 В-лімфоцитів у 1,5 рази, до 19,5 %, при контролі (12,23±0,68) %, рівень субпопуляції натуральних кілерів у дітей хворих на АД, вірогідно знижений. Отримані дані про вміст основних субпопуляцій лімфоцитів у крові дітей відрізнялись від показників дорослих хворих на АД, у дітей визначався менший рівень CD-4 субпопуляції лімфоцитів натуральних кілерів, ніж у дорослих. При визначенні функціональної активності лімфоцитів у тесті РБТЛ встановлено гальмування проліферативної відповіді на Т-міоген у дітей хворих на АД, в той же час індометацин (простагладин) залежна проліферація, була збережена у дітей хворих на АД. Відповідь лімфоцитів на дію В-міогени була підвищена у 1,5 рази і досягала (56,5±2,1) % при контролі (43,03±1,28) % (табл. 6.8).
Таблиця 6.8 – Функціональна активність імунних клітин у дітей та групи контролю.
| Діти АД (n=30) | Контроль (n=30) | p | |||
| ЦІК | 142,7 | 5,7 | 74,67 | 1,50 | <0,05 |
| РБТЛ | 7,1 | 0,6 | 2,03 | 0,16 | <0,05 |
| Спонтанна проліферація лімфоцитів | 7,8 | 1,0 | 2,20 | 0,18 | <0,05 |
| Т-мітоген (ФГА) викликана проліферація | 46,6 | 1,9 | 55,13 | 1,93 | <0,05 |
| Простагландинзалежна проліферація (ФГА + індометацин) | 59,7 | 2,3 | 64,00 | 1,92 | >0,05 |
| В – мітоген (декстран-сульфат) викликана проліферація | 56,5 | 2,1 | 43,03 | 1,28 | <0,05 |
| Спонтанна фагоцитарна активність нейтрофілів | 232,7 | 2,0 | 242,92 | 4,09 | <0,05 |
| Індукована фагоцитарна активність нейтрофілів (зимозан) | 59,6 | 1,1 | 58,95 | 1,23 | >0,05 |
| Активність мієлопероксидази нейтрофілів (спонтанна) | 18,5 | 0,3 | 15,14 | 0,60 | <0,05 |
| Адгезивна активність нейтрофілів | 47,3 | 1,9 | 47,83 | 2,28 | >0,05 |
Таким чином, виявлене у дітей гальмування Т-клітинної відповіді на міоген та активація В-клітинної відповіді вказує на розвиток дисбалансу в системі імунної відповіді, а саме гальмування Т-клітинної відповіді та стимуляцію В-клітинної ланки.
При вивченні фагоцитарної активності нейтрофілів встановлено вірогідно значиме гальмування мієлопероксидазної та НСТ активності нейтрофілів крові у дітей хворих на АД.
Активність автоімунних реакцій до антигенів головного мозку вірогідно підвищена у дітей хворих на АД, особливо до ОБМ, що свідчить про зрив механізмів толерантності та можливе пошкодження нервових структур у шкірі при АД. Рівень циркулюючих комплексів був підвищений.
Таблиця 6.9 – Функціональна активність імунних клітин у дорослих хворих на АД та групі контролю
| Дорослі АД (n=30) | Контроль (n=30) |
p | |||
| ЦІК | 154,83 | 5,95 | 74,67 | 1,50 | <0,05 |
| РБТЛ | 6,33 | 0,70 | 2,03 | 0,16 | <0,05 |
| Спонтанна проліферація лімфоцитів | 6,13 | 0,94 | 2,20 | 0,18 | <0,05 |
| Т-мітоген (ФГА) викликана проліферація | 54,30 | 2,34 | 55,13 | 1,93 | >0,05 |
| Простагландинзалежна проліферація (ФГА + індометацин) | 63,57 | 3,30 | 64,00 | 1,92 | >0,05 |
| В – мітоген (декстран-сульфат) викликана проліферація | 54,77 | 3,22 | 43,03 | 1,28 | <0,05 |
| Спонтанна фагоцитарна активність нейтрофілів | 229,83 | 3,77 | 242,92 | 4,09 | <0,05 |
| Індукована фагоцитарна активність нейтрофілів (зимозан) | 59,88 | 2,03 | 58,95 | 1,23 | >0,05 |
| Активність мієлопероксидази нейтрофілів (спонтанна) | 12,85 | 0,56 | 15,14 | 0,60 | <0,05 |
| Адгезивна активність нейтрофілів | 50,20 | 2,09 | 47,83 | 2,28 | >0,05 |
Підсумовуючи отримані дані про стан імунної системи у дітей хворих на АД, можна відмітити що, в основному зміни не в кількісному складі, а у функціональній активності імунних клітин. Так, встановлено гальмування проліферативної відповіді на Т-міогени та зниження фагоцитарної активності на фоні підвищеного рівня В-лімфоцитів та відносно високих рівнів аутоантитіл до нейробілків. Звертає на себе увагу, що серед усіх багатьох показників імунної системи, які були досліджені найбільш, показовим у дітей хворих на АД є рівень циркулюючих імунних комплексів та рівень СD-19 лімфоцитів в крові, що може служити допоміжними показниками тяжкості АД у дітей.
Таблиця 6.10 – Субпопуляційний склад лімфоцитів у дітей та дорослих
| M | m | M | m | ||
| Діти АД (n=30) | Дорослі АД (n=30) | р | |||
| лімфоцити % | 28,411 | 1,0 | 33,00 | 1,00 | <0,05 |
| Лімфоцити 10*9 | 1710,2 | 80,8 | 1670,47 | 63,88 | >0,05 |
| СD3 % | 68,2 | 0,7 | 63,4 | 0,5 | <0,05 |
| CD3*10*9 | 1167,7 | 65,1 | 1734,77 | 398,20 | >0,05 |
| CD4 % | 42,7 | 0,5 | 41,11 | 1,20 | >0,05 |
| CD4 10*9 | 710,4 | 24,0 | 684,30 | 38,05 | >0,05 |
| CD8 % | 24,6 | 1,0 | 28,46 | 0,93 | <0,05 |
| CD8 10*9 | 437,6 | 40,1 | 462,90 | 15,72 | >0,05 |
| Імунорегуляторний індекс | 1,7 | 0,1 | 1,67 | 0,07 | >0,05 |
| CD19 % | 19,5 | 0,8 | 16,89 | 1,42 | >0,05 |
| CD19 10*9 | 311,7 | 6,5 | 290,13 | 31,65 | >0,05 |
| CD16 % | 12,4 | 0,2 | 16,75 | 0,99 | <0,05 |
| CD16 10*9 | 213,6 | 14,0 | 274,17 | 17,25 | <0,05 |
Таблиця 6.11 – Субпопуляційний склад лімфоцитів у дітей та контрольній групі
| Діти АД (n=30) | Контроль (n=30) | p | |||
| Лімфоцити % | 28,4 | 1,0 | 30,53 | 0,89 | >0,05 |
| Лімфоцити 10*9 | 1710,2 | 80,8 | 1830,47 | 59,68 | >0,05 |
| СD3 % | 68,2 | 0,7 | 57,4 | 0,6 | <0,05 |
| CD3*10*9 | 1167,7 | 65,1 | 1340,13 | 16,71 | <0,05 |
| CD4 % | 42,7 | 0,5 | 30,27 | 0,98 | <0,05 |
| CD4 10*9 | 710,4 | 24,0 | 530,6 | 15,4 | <0,05 |
| CD8 % | 24,6 | 1,0 | 26,47 | 0,79 | >0,05 |
| CD8 10*9 | 437,6 | 40,1 | 449,37 | 15,38 | >0,05 |
| Імунорегуляторний індекс | 1,7 | 0,1 | 1,44 | 0,02 | <0,05 |
| CD19 % | 19,5 | 0,8 | 8,1 | 0,4 | <0,05 |
| CD19 10*9 | 311,7 | 6,5 | 171,2 | 4,4 | <0,05 |
| CD16 % | 12,4 | 0,2 | 18,0 | 0,86 | <0,05 |
| CD16 10*9 | 213,6 | 14,0 | 285,23 | 14,38 | <0,05 |
Співставлення отриманих результатів показує, що імунні зміни практично односпрямовані при АД незалежно від віку пацієнтів. Серед досліджених більше 30 різних показників можна найти лише кілька показників, які указують на різниці між імунним статусом дітей та дорослих. Це, в першу чергу, вірогідний знижений рівень відсотка лімфоцитів у крові дітей, знижений рівень СD-4 лімфоцитів у дітей, проліферативна відповідь на Т-мітоген у реакції бласттрансформації in vitro та зниження фагоцитарної активності нейтрофілів, особливо активності лейкоцитарної мієлопероксидази. Односпрямовано підвищується у дітей та дорослих рівень В-лімфоцитів (СD-19 клітин), ЦІК та активність автоімунних реакцій. Порівняльне дослідження дітей та дорослих свідчить про більш різноспрямовані зміни в імунному статусі у дітей при АД, що можна пов’язати з більшою лабільністю та чутливістю імунної системи у дітей. У подальшому, із збільшенням віку у них спостерігається певне відновлення імунної системи, особливо рівня субпопуляцій лімфоцитів, яке відновлюється до значень у здорових людей при збереженні алергічної спрямованості.
Можна зробити певне припущення, що у дорослих АД протікає в основному на повноцінній В-активованій імунній системі, а у дітей він виникає на фоні певної імунної недостатності (імунодефіциту) певних ланок імунітету, а саме реакцій фагоцитозу, зниженого рівня Т-лімфоцитів. Яким чином ці зміни в імунному статусі у дітей сприяють розвитку АД сказати важко, потрібні спеціальні експериментальні дослідження по моделюванні АД на фоні різних змін та порушень імунної системи.
Таблиця 6.12 – Субпопуляційний склад лімфоцитів у дорослих та контрольній групі
| Дорослі АД (n=30) | Контроль (n=30) | p | |||
| Лімфоцити % | 33,00 | 1,00 | 30,53 | 0,89 | >0,05 |
| Лімфоцити 10*9 | 1670,47 | 63,88 | 1830,47 | 59,68 | >0,05 |
| СD3 % | 63,4 | 0,5 | 57,4 | 0,6 | <0,05 |
| CD3*10*9 | 1734,77 | 398,20 | 1340,13 | 16,71 | >0,05 |
| CD4 % | 41,11 | 1,20 | 30,27 | 0,98 | <0,05 |
| CD4 10*9 | 684,30 | 38,05 | 530,6 | 15,4 | <0,05 |
| CD8 % | 28,46 | 0,93 | 26,47 | 0,79 | >0,05 |
| CD8 10*9 | 462,90 | 15,72 | 449,37 | 15,38 | >0,05 |
| Імунорегуляторний індекс | 1,67 | 0,07 | 1,44 | 0,02 | <0,05 |
| CD19 % | 16,89 | 1,42 | 8,1 | 0,4 | <0,05 |
| CD19 10*9 | 290,13 | 31,65 | 171,2 | 4,4 | <0,05 |
| CD16 % | 16,75 | 0,99 | 18,0 | 0,86 | >0,05 |
| CD16 10*9 | 274,17 | 17,25 | 285,23 | 14,38 | >0,05 |
6.2 Вивчення рівня загального імуноглобуліну Е та інтерлейкінів-2, -4 в сироватці крові хворих на атопічний дерматит
Виявлені зміни в загальному імунному статусі дітей та дорослих хворих на АД диктували необхідні визначення алергічної направленості цих хворих, а саме визначення рівня загального IgЕ, який, як відомо, є окремим класом імуноглобулінів і має відношення, в основному, до алергічних реакцій швидкого, а не сповільненого типу. Визначення концентрації загального IgЕ методом ІФА не дозволяє визначити вид алергену до якого розвивається алергічна реакція, але за концентрацією цього імуноглобуліну можна судити не лише про тяжкість АД, а й про вираженість, інтенсивність алергоімунної відповіді організму при цьому захворюванні. В таблиці 5.1 приведені дані про рівень загального імуноглобуліну Е у хворих на АД та здорових осіб. Так, встановлено, що у хворих дітей та дорослих має місце вірогідне 8-10-кратке збільшення концентрації в крові IgЕ, що повністю співпадає з численними даними літератури. В той же час концентрація IgЕ в сироватці дітей та дорослих дещо різнилась між собою. Так, у дорослих дещо більший рівень в крові цього імуноглобуліну ніж у дітей, хоча статистичні відмінності між цими показниками відсутні (р>0,05). Але менший рівень IgЕ в сироватці крові дітей, ніж у дорослих в певній мірі співпадає з проведеними вище даними про наявність деяких порушень в імунній системі у дітей, які носять імунодефіцитну направленість, що можливо, впливає на розвиток гуморальної імунної відповіді яка проявляється синтезом IgЕ.
Підвищений рівень загального IgЕ в сироватці крові дітей та дорослих хворих на АД співпадає з підвищеним рівнем в крові СD-19 субпопуляції лімфоцитів, які є продуцентами окремих класів імуноглобулінів, в тому числі і IgЕ.
Для оцінки механізмів розвитку імунних реакцій важливе значення має визначення рівня імунорегуляторних інтерлейкінів, які виробляються імунними клітинами і можуть стимулювати або подавляти розвиток імунних реакцій Т-хелперів I та II типів, а саме інтерлейкіну 2 та 4.
Визначення рівня даних цитокінів в сироватці крові методом ІФА було проведено у 2 групах хворих та в групі умовно здорових людей. Встановлено (табл.6.13), що у дітей та дорослих рівні даних інтерлейкінів у 8-10 разів вірогідно підвищені, ніж у групі умовно здорових людей (р<0,01). При порівнянні вмісту цих інтерлейкінів у дітей та дорослих не виявлено суттєвих відмінностей в концентрації їх в сироватці крові (р>0,05). Отже, отримані дані по рівню ІЛ-2 та ІЛ-4 можуть свідчити про активну імунну відповідь, яка регулюється цими цитокінами. Відомо, що ІЛ-4 виробляється в основному Т-хелперами 2 порядку, які відповідають за гуморальну імунну відповідь і який пригнічує Т-клітинну та фагоцитарну відповідь. Підвищений рівень ІЛ-4 в сироватці крові свідчить про активність Тх-2 та їх участь в синтезі IgЕ, що було показано в таблиці 6.10. З іншого боку виявлено підвищений рівень ІЛ-2 (прозапального), який виробляється також Т-лімфоцитами і він стимулює проліферацію Т-лімфоцитів, в тому числі і Тх-2, які приймають участь в гуморальному імунному процесі. Крім того, цей ІЛ-2 є прозапальним цитокіном, який підсилює реакції запалення, які спостерігається при АД. Підвищення рівня прозапальних цитокінів (ІЛ-2 та 4) свідчать про складність імунних реакцій, які розвиваються при АД, де можливо, паралельний підйом про- та анти-запальних цитокінів. Існує досить багато пояснень цього феномену, чому і Тх-1 і Тх-2 лімфоцити виробляють імунорегуляторні анти- та прозапальні цитокіни. Можливо, ці два альтернативні цитокіни діють на різні ланки імунної відповіді, а саме ІЛ-2, як продукт Т-лімфоцитів стимулює проліферацію Т-лімфоцитів та диференціювання їх в Тх-1 та Тх-2 лімфоцити. В свою чергу Тх-2 лімфоцити, як основний продукт ІЛ-4 синтезує цей цитокін, який гальмує активність Тх-1 і активує В-лімфоцити до проліферації і синтезу IgЕ, особливо, специфічних IgЕ. В свою чергу гальмування Тх-1 відповіді індукує активність Т-лімфоцитів попередників до синтезу ІЛ-2, який стимулює проліферацію та диференціацію на Тх-1 та Тх-2 популяції. Таким чином, виникає своєрідне замкнуте коло, що призводить до виникнення переносу в імунній відповіді та гіперпродукції IgЕ та розвиток АД. Які антигенні чинники індукують ці порушення не відомо, де етіологічні чинники АД, чому виникає не в усіх осіб, а лише у певної групи людей, це пов’язано не тільки з вродженими вадами розвитку імунітету, а й екзогенними чинниками.
Таблиця 6.13 – Рівень загального ІЛ-2 та ІЛ-4 у хворих на АД та здорових осіб
| М | ±m | М | ±m | ||
| Діти АД (n=30) | Дорослі АД (n=30) | р | |||
| ІЛ-2 | 14,67 | 0,94 | 16,83 | 4,75 | >0,05 |
| ІЛ-4 | 11,71 | 0,62 | 10,93 | 0,58 | >0,05 |
| Діти АД (n=30) | Контроль (n=30) | ||||
| ІЛ-2 | 14,67 | 0,94 | 1,87 | 0,28 | <0,05 |
| ІЛ-4 | 11,71 | 0,62 | 1,60 | 0,36 | <0,05 |
| Дорослі (n=30) | Контроль (n=30) | ||||
| ІЛ-2 | 16,83 | 4,75 | 1,87 | 0,28 | <0,05 |
| ІЛ-4 | 10,93 | 0,58 | 1,60 | 0,36 | <0,05 |
6.3 Кореляційні взаємозв’язки між імунологічними показниками
При вивчені взаємозв’язку (за методом Спірмена) у групі дітей віком від 14 до 18 років при визначенні алергологічних показників (рівня сироваткового імуноглобуліну Е) з імунологічними показниками була встановлена достовірна кореляція між рівнем сироваткового імуноглобуліну Е і абсолютною кількістю CD 19 (|r| = -0,39), спонтанною проліферацією лімфоцитів (|r| = -0,36), В-мітоген (декстран-сульфат) викликаною проліферацією (|r| = 0,48), спонтанною фагоцитарною активністю нейтрофілів (|r| = -0,30), індукованою фагоцитарною активністю нейтрофілів (зимозан) (|r| = -0,47) та адгезивною активністю нейтрофілів (|r| = -0,32). Виявлено достовірний помірний позитивний взаємозв’язок між вмістом сироваткового Ig E та індексом SCORAD (|r| = 0,42).
При вивченні взаємозв’язку у групі дорослих при визначенні алергологічних показників (рівня сироваткового Ig E) з імунологічними показниками була встановлена достовірна кореляція між рівнем сироваткового імуноглобуліну Е і білком S-100 (|r| = 0,30), вмісту CD3 % (|r| = -0,29), Т-мітоген викликаною проліферацією (ФГА) (|r| = -0,39), простагландинзалежною проліферацією (ФГА + індометацин) (|r| = -0,54), В-мітоген (декстран-сульфат) викликаною проліферацією (|r| = 0,52), активністю мієлопероксидази нейтрофілів (спонтанної) (|r| = 0,26). Виявлено достовірний сильний позитивний взаємозв’язок між вмістом сироваткового Ig E та індексом SCORAD (|r| = 0,79).
При вивченні взаємозв’язку вмісту рівня ІЛ-2 у дітей було встановлено помірна достовірна кореляція між вмістом циркулюючих імунних комплексів (|r| = 0,32), рівнем НСЕ (|r| = 0,28), вмістом CD-3 % (|r| = -0,32), вмістом CD-19 % (|r| = 0,30), спонтанною проліферацією лімфоцитів (|r| = -0,26), Т-мітоген викликаною проліферацією (ФГА) (|r| = 0,34), простагландинзалежною проліферацією (ФГА + індометацин) (|r| = 0,34), спонтанною фагоцитарною активністю нейтрофілів (|r| = 0,27) та активністю мієлопероксидази нейтрофілів (спонтанної) (|r| = 0,33), у дорослих було встановлено помірна достовірна кореляція між рівнем, сенсибілізацією нейтрофілів до альбуміну (|r| = 0,28), основного білку мієліну в сироватці крові (|r| = 0,30) та НСЕ (|r| = 0,30). Також відмічається достовірна кореляція між вмістом CD-4 % (|r| = 0,31).
При вивченні взаємозв’язку вмісту рівня ІЛ-4 у дітей було встановлено помірна достовірна кореляція між сенсибілізацією нейтрофілів до альбуміну (|r| = 0,49), рівнем нейронспецифічного білка ОБМ (|r| = 0,30), НСЕ (|r| = 0,34), а також імунорегуляторним індексом (|r| = 0,42), у дорослих було встановлено помірна достовірна кореляція між спонтанною проліферацією лімфоцитів (|r| = ‑0,32) та індукованою фагоцитарною активністю нейтрофілів (зимозан) (|r| = ‑0,26).
При вивченні взаємозв’язку індексу SCORAD у дітей з імунологічними показниками, була виявлена достовірна кореляція між сенсибілізацією нейтрофілів до альбуміну (|r| = 0,42), нейроспецифічним білком NSE (|r| = ‑0,33), білком S-100 (|r| = -0,30), загальним людським мозковим антигеном (|r| = -0,34), у дорослих достовірна кореляція спостерігається між білком S-100 (|r| = 0,27), вмістом CD-3 % (|r| = -0,30), Т-мітоген викликаною проліферацією (ФГА) (|r| = -0,35), простагландинзалежною проліферацією (ФГА + індометацин) (|r| = –0,48), В-мітоген (декстран-сульфат) викликаною проліферацією (|r| = -0,45), активністю мієлопероксидази нейтрофілів (спонтанної) (|r| = -0,32), а також вмістом ІЛ-2 (|r| = -0,40).
При вивченні кореляційних зв’язків автоантитіл до мозкових антигенів встановленно, що у дітей достовірна кореляція спостерігається між основним білком мієліну і білком S-100 (|r| = 0,73), загальним людським мозковим антигеном (|r| = 0,50), імунорегуляторним індексом (|r| = 0,29); між білком S-100 та загальним людським мозковим антигеном (|r| = 0,48), імунорегуляторним індексом (|r| = 0,31); між НСЕ та загальним людським мозковим антигеном (|r| = 0,40), імунорегуляторним індексом (|r| = 0,40); між загальним людським мозковим антигеном і CD-3 % (|r| = 0,30), CD-19 % (|r| = -0,27). У дорослих достовірна кореляція спостерігається між основним білком мієліну і білком S-100 (|r| = 0,46), кількістю еозинофілів в сироватці крові (|r| = -0,45); між білком S-100 та вмістом CD-3 % (|r| = -0,41), CD-8 *109 (|r| = 0,38); між НСЕ та загальним людським мозковим антигеном (|r| = 0,37), індукованою фагоцитарною активністю нейтрофілів (зимозан) (|r| = -0,31); між загальним людським мозковим антигеном і CD-4 % (|r| = -0,33), CD-8 % (|r| = 0,27).
* * *
Таким чином, підсумовуючи проведені широкі імунологічні дослідження, можна зробити наступні висновки. При АД у дорослих осіб розвивається активація В клітинної ланки імунітету, що проявляється як збільшенням кількості в крові СD-19 субпопуляції лімфоцитів, збільшенням концентрації рівня загального Ig E та інтерлейкіна 4. Все це спостерігається на збереженні активності Т-клітинного імунітету. Єдиною ланкою імунітету, яка змінюється у дорослих хворих на АД, є гальмування активації нейтрофілів, що виявляється в тестах з НСТ реактивом та активності мієлопероксидази нейтрофілів.
В той же час у дітей хворих на АД також має місце активація В-клітинної ланки імунітету, але цей процес проходить на фоні пригнічення Т-клітинного імунітету та фагоцитарної ланки імунітету. Отже, можна думати, що початок розвитку АД у дітей зв’язаний не тільки з генетичними чинниками, а й порушення в системі вродженого імунітету, що створює умови для довготривалого контакту алергенів з імунними клітинами та запуском продукції IgЕ і гальмування процесів переключення його синтезу інших класів Ig А, М, G.
Визначення змін в функціонуванні імунної системи важливо і необхідно для подальшого удосконалення існуючих методів лікування та попередження розвитку АД.
Матеріали цього розділу висвітлено у наступних працях:
- Резнікова А.О. Ранні маркери свербежу у хворих на атопічний дерматит / А.О. Резнікова // Материалы научно-практической конференции с участием международных специалистов «Инновационные технологии в дерматовенерологии. Междисциплинарные связи», 13-14 листопада 2015., м. Харків. – Дерматологія та венерологія. 2015. – № 3 (69). – С. 88.
- Резнікова А.О. Інтерлейкіновий профіль у хворих на атопічний дерматит / А.О. Резнікова // програма та матеріали регіональної науково-практичної конференції «Святогірські дерматовенерологічні дні: сучасні аспекти діагностики, лікування, профілактики дерматозів та інфекцій, що передаються статевим шляхом», 12-13 травня 2016 року, м.Святогірськ. – К., 2016. – С.28-29.
- Резнікова А.О. Клінічна характеристика дітей та дорослих у Ig E –залежного та Ig E –незалежного атопічного дерматиту / А.О. Резнікова // Збірник наукових праць співробітників НМАПО імені П.Л. Шупика. – 2014. – № 23 (2). С. 478-484.
- Резнікова А.О. Вплив імунологічних показників на свербіж у хворих на атопічний дерматит різних вікових груп / А.О. Резнікова // Тези доповідей матеріалів всеукраїнської науково-практичної конференції молодих вчених НМАПО імені П.Л. Шупика, присвяченої Дню науки «Науково-практична діяльність молодих вчених медиків: досягнення і перспективи розвитку» 20 травня 2016 року – К., 2016. – С.110-112.
РОЗДІЛ 7
ОБГРУНТУВАННЯ АЛГОРИТМУ ЛІКУВАННЯ АТОПІЧНОГО ДЕРМАТИТУ В ЗАЛЕЖНОСТІ ВІД ВІКОВИХ ОСОБЛИВОСТЕЙ
Основним напрямом у попередженні розвитку та прогресування атопічного дерматиту у дітей та дорослих є кропітка профілактична робота, що проводиться всією родиною. Дана профілактична робота відрізняється в залежності від обтяженості сімейного анамнезу щодо атопічних захворювань і вікових особливостей. Необхідно також враховувати дані функціональних параметрів шкіри, а також результати імунологічного обстеження.
За результатами аналізу сімейного анамнезу, клінічного, алергологічного, імунологічного дослідження та функціональних параметрів шкіри до розробки обґрунтованого алгоритму лікування та обстеження у дітей та дорослих можна віднести.
I. Первинні профілактичні заходи в період планування вагітності:
- Аналіз генеалогічних даних майбутніх батьків з метою вявлення спадкових захворювань;
- Всебічне інформування майбутніх батьків про наявну у них патологію, правила поведінки жіночок під час вагітності, ризик успадкування АД у дитини.
- Активне виявлення і раннє лікування супутньої патології у жінок, в тому числі і атопічної (бронхіальна астма, риніт, поліноз);
- Дослідження рівня загального Ig E, а також виявлення специфічних Ig E у жінок;
- Досягнення стійкої ремісії АД у жінок в період запланованої вагітності.
II. У перинатальний період:
- Профілактика загострень АД у вагітних жінок;
- Обмеження медикаментозного навантаження (особливо застосування антибактеріальних препаратів);
- Профілактика внутрішньоутробної інфекції;
- Контроль рівня загального Ig E під час вагітності;
- Контроль за рівнем сенсибілізації до специфічних алергенів;
- Дотримання дієти з урахуванням даних про сенсибілізацію до харчових алергенів;
- Дотримання елімінаційного режиму вагітної жінки, а також умов її проживання;
- Профілактика передчасних пологів, максимальне сприяння природним пологам та природному вигодовуванню.
III. Період з моменту народження дитини і до 1-го року:
- У разі виявлення змін імунологічних показників у дитини необхідно індивідуально підходити до диспансерного спостереження і максимально прискіпливо формувати умови середовища сімейного проживання:
– Застосування зволожуючих засобів (емольєнтів) для шкіри дитини з народження враховуючи функціональні параметри шкіри;
– Тривалість природного вигодовування з метою профілактики сенсибілізації до білків коров’ячого молока і пізнє введення прикорму з тимчасовим виключенням продуктів, до яких спостерігалась сенсибілізація у батьків; якщо природнє вигодовування не можливе, необхідно застосовувати адаптовані гіпоалергенні суміші;
– Профілактика загострень АД у жінок в період лактації;
– Профілактика дисбіозу кишківника у дитини, моніторинг стану мікрофлори кишківника, особливо в перші місяці від народження;
– Спостереження педіатра і дерматолога протягом першого року життя, з метою виявлення початкових ознак атопії, з плановими оглядами раз на місяць;
– Спостереження ЛОР-лікаря з метою профілактики хронічного аденоїдиту, риніту, як найбільш частою супутньою ЛОР-патологією дітей з атопією;
– Контроль за масою тіла дитини і ростом дитини протягом першого року життя, оцінка співвідношення показників з віковими нормами;
– Планове дослідження рівня загального Ig E в крові дитини в динаміці, а також спектра специфічних алергенів в динаміці;
– Організація елімінаційного режиму: виключення контакту з домашніми тваринами (кішками, собаками), акваріумними рибами, гіпоалергенні умови побуту (максимально можлива елімінація домашнього пилу, антигенів грибів, кліщів);
– Індивідуальне рішення питання про доцільність планової вакцинації;
– Профілактика вірусних і грибкових уражень;
– Антигістамінні препарати: I покоління та III покоління. Короткий курс седативних антигістамінних препаратів ефективний при порушенні сну внаслідок свербежу
– ТГКС останнього покоління з високим профілем безпеки. Тривалість курсу лікування у дітей не повинна перевищувати 4 тижні. Перевагу слід віддати слабким ТГКС: преднізолону, гідрокортизону, метилпреднізолону.
– ТІК. Тривалість курсу 1 рік та більше з обов’язковим моніторингом стану.
– Топічні антибактеріальні засоби. Застосовують 2-3 рази на добу. Тривалість курсу не повинна перевищувати 5-10 днів. Для лікування вторинних мікробних уражень шкіри у пацієнтів з АД слід застосовувати різні групи антимікробних топічних засобів: топічні антисептики, топічні антибіотики та фіксовані комбінації антимікробних (антибактеріальних, антисептичних, протигрибкових) засобів з ТГКС.
IV. У дітей старше 1 року життя:
- Планові консультації дерматолога з навчанням батьків по догляду за дітьми з даною патологією, правила догляду за шкірою, необхідність дотримання дієти, створення гіпоалергенних умов побуту;
- Регулярний догляд за шкірою дитини, профілактика ксерозу шкіри, особливо зимовий період;
- Профілактика грибкових і бактеріальних уражень шкіри;
- Дотримання елімінаційної дієти, з виключенням продуктів, до яких виявлена сенсибілізація;
- Спостереження педіатра, з метою профілактики та лікування супутньої патології, санація хронічних вогнищ інфекції;
- Спостереження ЛОР-лікаря;
- Планові алергологічні дослідження (рівень загального і специфічних Ig E)
- Контроль за імунологічними показниками як предикторами дебюту АД або загострення: ІЛ-2, ІЛ-4, автоантитілами до мозкових антигенів;
- Проживання в гіпоалергенних умовах;
- Застосування лікарських препаратів тільки за призначенням лікаря;
- Контроль за психо-емоційним станом і фізичним розвитком дитини;
- Індивідуальне рішення питання вакцинації;
- Базове лікування порушеної бар’єрної функції шкіри, емольєнти та догляд за шкірою (очищення шкіри та ванни, пом’якшувальна терапія) є основними засобами базисної терапії АД;
- Антигістамінні препарати: I покоління та III покоління. Короткий курс седативних антигістамінних препаратів ефективний при порушенні сну внаслідок свербежу.
- ТГКС останнього покоління з високим профілем безпеки. Тривалість курсу лікування у дітей не повинна перевищувати 4 тижні. Перевагу слід віддати слабким ТГКС: преднізолону, гідрокортизону, метилпреднізолону.
- ТІК. Тривалість курсу 1 рік та більше з обов’язковим моніторингом стану.
- Топічні антибактеріальні засоби. Застосовують 2-3 рази на добу. Тривалість курсу не повинна перевищувати 5-10 днів. Для лікування вторинних мікробних уражень шкіри у пацієнтів з АД слід застосовувати різні групи антимікробних топічних засобів: топічні антисептики, топічні антибіотики та фіксовані комбінації антимікробних (антибактеріальних, антисептичних, протигрибкових) засобів з ТГКС.
V. Дітям в пубертатний період до загальних рекомендацій додатково проводити консультації дитячого психолога.
VI. Дорослим (старше 18 років):
1. Планові консультації дерматолога
2. Регулярний догляд за шкірою, профілактика ксерозу шкіри особливо в зимовий період;
3. Профілактика грибкових і бактеріальних уражень шкіри;
4. Дотримання помірної елімінаційної дієти;
5. Спостереження терапевта, з метою профілактики та лікування супутньої патології, санація хронічних вогнищ інфекції;
6. Спостереження ЛОР-лікаря, враховуючи реакцію на аероалергени;
7. Планові алергологічні дослідження (рівень загального Ig E та при необхідності – специфічних Ig E)
8. Контроль за імунологічними показниками як предикторами дебюту АД або загострення: ІЛ-2, ІЛ-4, автоантитілами до мозкових антигенів;
9. Проживання в гіпоалергенних умовах;
10. Застосування лікарських препаратів тільки за призначенням лікаря;
11. Контроль за психо-емоційним станом і фізичним розвитком;
12. Базове лікування порушеної бар’єрної функції шкіри, емольєнти та догляд за шкірою (очищення шкіри та ванни, пом’якшувальна терапія) враховуючи функціональні параметри шкіри;
13. Антигістамінні препарати III покоління.
14. ТГКС розглядаються як найсильніші протизапальні агенти, за допомогою яких контролюються рецидиви АД.
15. ТІК.
16. Топічні антибактеріальні засоби.
17. Седативні препарати: солі бромистоводневої кислоти – натрію та калію броміди; засоби рослинного походження; барбітурати в субгіпнотичних дозах.
18. Заспокійливі препарати рослинного походження (які не викликають алергічну реакцію та підбираються індивідуально).
19. Системні глюкокортикостероїди.
20. Нейролептики (за консультацією лікаря невропатолога).
* * *
Запропоновано алгоритм обстеження хворих на АД з визначенням рівнів інтерлейкінів та аутоантитіл до мозкових антигенів. На підставі отриманих даних був використаний диференційний підхід до лікування АД із включенням ноотропних препаратів (для дорослих – фенібут; дітей – гліцин) та рекомендована індивідуалізована дієта.
Матеріали цього розділу висвітлено у наступних працях:
1. Резнікова А.О. Реалізація свербежу у хворих на атопічний дерматит в різному віці / А.О. Резнікова // Дерматовенерологія, косметологія, сексопатологія. – 2016. – № 1-2 (3). – С. 25-27.
2. Калюжная Л.Д. Хронический зуд, как дерматологический синдром / Л. Д. Калюжная , А. А. Резникова // Дерматолог. – 2016. – № 1. – С. 46-49.
3. Резнікова А.О. Поступові кроки до інтерпретації свербежу при атопічному дерматиті / А.О. Резнікова // Український медичний журнал дерматології, венерології і косметології. – 2016. – №1 (60). – С. 31-34.
4. Досвід використання інгібіторів кальциневрину у дорослих, хворих на атопічний дерматит: інформаційний лист № 289 / І. В. Паппа, Л. Д. Калюжна, А. О. Резнікова; МОЗ. – К., 2012. – 4 с.
РОЗДІЛ 8
АНАЛІЗ ТА УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
За особливостями клініко-анамнестичних даних всі особи, які ввійшли у дослідження, були розподілені на 3 групи: 1-а група – діти хворі на АД (n=99), 2-а група – дорослі хворі на АД (n=40), 3-я група – контроль, соматично здорові особи без алергічної патології (n=30). До складу першої групи пацієнтів входило 99 дітей віком від 1 до 18 років, серед яких було 46 дівчаток (46,5 %) та 53 хлопчики (53,5 %). Середній вік пацієнтів першої групи склав (8,01±0,51) року. Середня тривалість АД у хворих 1 групи склала (5,3±0,50) року, з них 22 пацієнта (22,2 %) хворіли лише протягом 1 року, в той час як 56 пацієнтів (56,5 %) хворіли з першого року життя. При вивченні сімейного анамнезу встановлено, що тільки у 1-го пацієнта (1,01 %) хворіють на АД обидва батьки (мати і батько), у 26 пацієнтів (26,3 %) – обтяжений алергологічний анамнез зі сторони лише одного з батьків: у 15 % хворіє на АД мати, у 11 % – батько, а 16 пацієнтів (16,2 %) успадкували АД через покоління від близьких родичів у 9 пацієнтів (9 %) хворіє бабуся, а у 7 пацієнтів (7 %) – дідусь), у інших 56 пацієнтів (56,7 %) спадкової схильності до атопії виявлено не було. Визначаючи стан ураження шкіри за індексом SCORAD серед пацієнтів 1-ої групи встановлено, що у 17 дітей (17 %) захворювання протікало у легкій формі середній показник склав (13,87±8,2) бала, у 27 дітей (28 %) – середньо-важкій формі середній показник склав (30,11±21,4) бала, а у 55 дітей (55 %) в важкій формі середній показник склав (69,16±66,7) бала. Індекс SCORAD серед хворих на АД 1-ї групи складав (48,6±2,70), з крайніми коливаннями в діапазоні від 10,1 до 107 балів. З еритематозно-сквамозною формою в першій групі обстежених з АД, було 19 пацієнтів, що склало 19,2 %. З еритематозно-сквамозною формою з ліхеніфікацією було 61 пацієнт, що склало 61,6 %. Ліхеноїдна форма АД зустрічалась у 19 пацієнтів, що склало 19,2 %.
Другу групу пацієнтів складали дорослі хворі на атопічний дерматит (n=40). Середній вік пацієнтів становив (25,3±1,69), з крайніми коливаннями від 18 до 67 років. Середня тривалість хвороби пацієнтів була (16,8±1,61) року. При вивченні сімейного анамнезу встановлено, що тільки у 1-го пацієнта, що склало 2,5 %, хворіли на атопічний дерматит два члени родини (мати і брат), у 8 пацієнтів був обтяжений алергологічний анамнез зі сторони тільки одного з батьків (мати або батько), що склало 20 %, а через покоління від близьких родичів захворювання успадкували 4 пацієнта – 10 % (хворіє бабуся). Визначаючи стан ураження шкіри за індексом SCORAD, у 3 дорослих захворювання протікало у легкій формі, що склало 7 % пацієнтів (з крайніми коливаннями від 10,1 до 19,3 балів); середній бал (13,97±9,2); у 10 % спостерігалась середньоважка форма захворювання, з крайніми коливаннями від 20,4 до 35,23 балів, середній бал (28,41±14,83); а у 33 хворих (83 %) була виявлена важка форма з крайніми коливаннями цього показника від 40,5 до 100,2 балів, середній бал (73,74±59,7). Індекс SCORAD в середньому складав (64,7±3,93), з крайніми коливаннями в діапазоні від 10,1 до 100,2 балів. При вивченні тяжкості атопічного дерматиту серед дорослих переважно привалювала – ліхеноїдна або пруригоподібна форми. З ліхеноїдною формою було 34 пацієнта, що склало 85 %, а з дифузним АД було 6 пацієнтів, що склало 15 % відповідно.
Оцінюючи якість життя батьків, в родині яких діти хворі на АД, використовувались спеціально розроблені опитувальні листи FDLQI і DFI. Середня оцінка FDLQI склала (11,8±5,8) бала, а середній бал склав (10,7±5,6); діапазон = 0-30. Найвищі бали FDLQI отримали пункти про емоційний стрес (2,27±0,91), час витрачений на догляд за дитиною (1,63±0,76) і збільшення матеріальних витрат по догляду за дитиною (1,60±0,86). Найвищий бал пунктів DFI склали питання про сімейні витрати (1,57±0,63), емоційну неврівноваженість (1,57±0,63) і втому (1,40±0,16). Середнє значення індексу SCORAD склало (40,64±11,30) бала. Обидва опитувальника показали позитивну внутрішню узгодженість з альфа-значенням Кронбаха (r=0,83 для кожного вимірювання). FDLQI корелювали дуже добре з DFI (r = 0,68, р <0,0001). Три пункти в FDLQI (Q4: проблеми щодо реакції людей навколо; Q5: вплив на соціальне життя; Q9: вплив на роботу або навчання) і один пункт в DFI (Питання 5: сімейний «шопінг») не були повторно задані в даних опитувальниках. Запитання 1 з FDLQI і запитання 8 були про емоційний стрес батьків, викликаний станом шкіри власної дитини. Коефіцієнт кореляції між цими двома пунктами був r = 0,44 (Р = 0,02). Пункт FDLQI 2, що показує вплив на фізичний стан члена сім'ї був тісно пов'язаний з пунктом 7 DFI, що відповідає втомі і помірно корелює з пунктом 3, що відповідає якості сну. Варто зазначити, що елемент сну також охоплюється пунктом FDLQI 2, як елемент впливу на доброякісний сон і є невід'ємною частиною відпочинку. Точно так інші елементи у даних опитувальниках з майже аналогічним формулюванням показали природну кореляцію, такі як пункти впливу на дозвілля (пункт 6 FDLQI і пункт 4 DFI), сімейні витрати (пункт 10 FDLQI і пункт 6 DFI), відносини в родині (пункт 3 FDLQI і пункт 9 DFI) та збільшення хатньої роботи (пункт 8 FDLQI і пункт 1 DFI). Пункт 7 FDLQI представляє собою тягар по догляду, з точки зору часу, витраченого на лікування та пункту 10 DFI який відображає досягнення ефекту допомогти з лікуванням, не показали кореляційний зв’язок, можливо, через незначну різницю в контексті запитань. Пункт в FDLQI конкретно запитує про кількість часу, витраченого членом сім'ї на лікування пацієнта в той час як у відповідному пункті DFI, про змогу допомогти з лікуванням осіб, які здійснюють догляд, має набагато ширший сенс і не настільки специфічний, як формулювання пункту в FDLQI. Кореляція між FDLQI або DFI із SCORAD не була статистично значима. Раніше була виявлена помірна кореляція з DFI та SCORAD. В інших дослідженнях така кореляція не була статистично значима. Ці дані представляють собою суперечливу тенденцію зв'язку між суб'єктивною якістю життя і оцінки тяжкості об'єктивного стану захворювання. В даному дослідженні не було відмінностей за ознакою статі щодо FDLQI і результати DFI між хлопчиками і дівчатками. 10 пунктів в кожному з цих двох опитувальних листах, мали значиму кореляцію з відповідними пунктами в іншому опитувальнику.
За результатами дослідження функціональних параметрів шкіри встановило в осередках АД достовірне пониження вологості шкіри у хворих дітей ([46,7±7,2] у.о.; p < 0,05) і дорослих ([39,8±6,4] у.о.; p < 0,01), тенденцію до пониження еластичності шкіри у дітей – ([44,57±2,0] у.о.; р > 0,05) та у дорослих ([43,17±2,40] у.о.; р > 0,05), майже однакове збільшення рН до ([6,74±0,56] у.о.; р < 0,05) у дітей та до ([6,82±0,55] у.о; р < 0,05) у дорослих, отримані результати підтверджують наявність дисхромії в осередках АД в наслідок хронічного запалення та свербежу шкіри. Змін температури шкіри у хворих на АД не визначено. Звертає увагу факт достовірного пониження вологості шкіри, тенденцію до зменшення еластичності. Отримані результати слід враховувати при обґрунтуванні алгоритму терапії хворих на АД.
Імунологічне обстеження крові на рівень загального Ig E було проведено 169 особам включно із контрольною групою. При вивчені даного показника було встановлено, що загальний рівень сироваткового Ig E у пацієнтів 1-ої групи в середньому становив ([380,5±36,72] МО/мл). Рівень загального Ig E у пацієнтів 2-ої групи в середньому становив ([559,6±56,43] МО/мл). В контрольній групі рівень загального Ig E у пацієнтів контрольної групи складав ([47,5±4,58] МО/мл). Показник загально Ig E статистично значимо відрізнявся (р<0,05) від аналогічного показника, що був визначений у 1-ій та 2-ій групах пацієнтів. Так встановлено, що у хворих дітей та дорослих має місце вірогідне 8-10-кратне збільшення концентрації в крові IgЕ. Підвищений рівень загального IgЕ в сироватці дітей та дорослих хворих на АД співпадає з підвищеним рівнем в крові СD-19 субпопуляції лімфоцитів (до 19,5±0.8 %; р<0,05 – у дітей; 16,89±1,42 % р<0,05 – у дорослих, порівнюючи з контролем), які є продуцентами окремих класів імуноглобулінів, в тому числі і IgЕ.
Визначення рівня специфічного сироваткового Ig E проводилось у 28 пацієнтів першої групи. В результаті обстеження було виявлено специфічну реакцію у 3 дітей (віком 3, 4 і 15 років) на цільне куряче яйце Переважна алергічна реакція визначалась на коров’яче молоко, солодощі, шоколад та нестабільний психоемоційний стан, рівень загального Ig E у даних обстежених перевищував норму і становив 520, 600 та 1000 МО/мл відповідно. У однієї дитини зареєстрована реакція на коров’яче молоко (>100 МО/мл, вік дитини 3 роки), рівень загального Ig E у цієї дитини був вище норми і складав 250 МО/мл. Реакція на суміш алергенів домашнього пилу та харчову суміш зернові (>100 МО/мл) була визначена у одного пацієнта віком 13 років, в той час як рівень загального Ig E – 75 МО/мл, що становить норму в даній віковій категорії. В обстеженні другої групи пацієнтів на специфічні алергічні реакції прийняли участь 25 осіб. Реакція на суміш побутових алергенів була виявлена у 3-ох пацієнтів (>100 МО/мл), але тільки у одного пацієнта при цьому було збільшення рівня загального Ig E до 1000 МО/мл. На суміш пліснявих грибів відмічалась реакція у 2-ох пацієнтів (>100 МО/мл), рівень загального Ig E перевищував допустиму межу норми, 600 МО/мл і 1000 МО/мл. Реакція на пилок дерев, таких як береза, полин (>100 МО/мл), відмічалась у 3-ох пацієнтів, у даних пацієнтів рівень загального Ig E був підвищений до 225, 325 та 1000 МО/мл. Суміш зернових (>100 МО/мл) спричинила алергічну реакціє у 2-ох пацієнтів, але тільки у одного з них відмічалось збільшення загального Ig E до 1000 МО/мл (верхня межа), реакція на глютен (>100 МО/мл) була зареєстрована у тих самих 2-ох пацієнтів, рівень загального Ig E у одного пацієнта складав 5 МО/мл, а у іншого – 1000 МО/мл. У одного пацієнта була зареєстрована реакція на епідерміс кота та епідерміс собаки (>100 МО/мл), рівень загального Ig E складав 1000 МО/мл.
Дослідження стану імунної системи у дорослих хворих на АД було проведено у 30 осіб паралельно з вивченням загальних гематологічних показників. Було встановлено, що у дорослих хворих з АД загальні гематологічні показники не відрізняються від показників контрольної групи здорових осіб, як по рівню лейкоцитів, так і тромбоцитів та еритроцитів (р>0,05). В той же час при дослідженні субпопуляційного складу лімфоцитів встановлено, що розвиток дисбалансу залежить від кількості певних субпопуляцій лімфоцитів. Так, загалом у хворих з АД відмічається незначне збільшення рівня субпопуляцій Т-лімфоцитів ([68,2±0,7] % – діти; [63,4±0,5] % – дорослі, р<0,05) на фоні вірогідного підвищення як відносної, так і абсолютної кількості В-лімфоцитів (12,4±0,2 – діти; 16,75±0,99 – дорослі, р<0,05). Дослідження функціональної активності Т та В-лімфоцитів в тесті РБТЛ виявило, що у дорослих хворих з АД спостерігається вірогідне підвищення проліферативної активності лімфоцитів на В-лімфоцитарний мітоген – декстрин сульфат з 43,03±1,28 % у контролі до (54,77±3,22). В той же час проліферативна відповідь на Т-мітоген у хворих з АД не відрізнялась від показника у здорових осіб і складала відповідно ([54,30±2,34] % і [55,13±1,93] %; (р>0,05). Подібна картина була встановлена при вивченні індометацинзалежної проліферації лімфоцитів периферійної крові на сумісну дію індометацину (63,57±3,30 – дорослі; 64,00±1,92 – контроль; р>0,05). Проліферативна активність складала (63,54±3,30) % у хворих та (64,04±1,93) % в умовно-здорових осіб. При дослідженні фагоцитарної активності нейтрофілів крові в тесті із НСТ – тест з нітрозивним тетразолієм, який виявляє активність внутрішньоклітинних ферментів, було встановлено вірогідне гальмування їх активності з (242,92±4,09) до (229,8±3,77) у.о. Поряд із зниженням НСТ показників у нейтрофілах крові, було виявлено також гальмування мієлопероксидазної активності із (15,14±0,6) до (12,85±0,56) у.о; р<0,05). У хворих на АД, порівнюючи з контролем, у 2 рази підвищений рівень циркулюючих комплексів (142,7±5,7 – діти; 154,83±5,95 – дорослі), що підтверджує положення про активацію автоімунних реакцій та порушення гомеостатичних механізмів очищення крові. Дослідження стану імунної системи у дітей з АД було проведено у 30 осіб по тій же схемі, що і у дорослих. Загальні гематологічні показники кількості клітин крові у дітей практично не відрізнялись від показників дорослих, вірогідні відмінності відсутні, хоча є незначна тенденція до зниження рівня моноцитів у крові – ([0,4±0,1] 109/л; р˃0,05). При визначенні лімфоцитів та їх субпопуляційного складу у периферичній крові виявлено, що рівень лімфоцитів (CD-3) Т-лімфоцитів ([68,2±0,7] %) та Т-хелперів (CD-4) ([42,7±0,5] %) вірогідно знижений, а концентрація Т-цитотоксичних лімфоцитів (CD-8) (24,6±1,0), знаходяться у межах контрольних значень і вірогідних відмінностей немає. В той же час встановлено значне підвищення рівня CD-19 В-лімфоцитів у 1,5 рази, до 19,5 %, при контролі (12,23±0,68) %, рівень субпопуляції натуральних кілерів у дітей з АД, вірогідно знижений (р<0,05). Отримані дані про вміст основних субпопуляцій лімфоцитів у крові дітей не подібний до дорослих з АД, у дітей визначається менший рівень CD-4 субпопуляції лімфоцитів натуральних кілерів, ніж у дорослих. Визначення функціональної активності лімфоцитів у тесті РБТЛ – реакції бласттрансформації лейкоцитів, показало гальмування проліферативної відповіді на Т-мітоген у дітей (46,6±1,9; р<0,05), в той же час індометацин (простагладин) залежна проліферація, була збережена у дітей хворих на АД (59,7±2,3; р˃0,05). Відповідь лімфоцитів на дію В-мітогени була підвищена у 1,5 рази і досягала (56,5±2,1 %) при контролі (43,03±1,28 %; р<0,05).
З метою оцінки механізмів розвитку імунних реакцій визначали рівень імунорегуляторних інтерлейкінів, які виробляються імунними клітинами і можуть стимулювати або подавляти розвиток імунних реакцій Т-хелперів I та II типів, а саме інтерлейкіну 2 та 4 (ІЛ-2 та 4). Визначення рівня даних цитокінів в сироватці крові методом ІФА було проведено у 2 групах хворих та в групі умовно здорових людей. Встановлено, що у дітей та дорослих рівні цих інтерлейкінів у 8-10 разів вірогідно підвищені (14,67±0,94 –діти; 16,83±4,75), ніж у групі умовно здорових людей (1,87±0,28; р<0,01). При порівнянні вмісту цих інтерлейкінів у дітей та дорослих не виявлено суттєвих відмінностей в концентрації їх в крові (р>0,05). Отже, отримані дані по рівню ІЛ-2 та ІЛ-4 можуть свідчити про активну імунну відповідь, яка регулюється цими цитокінами. Відомо, що ІЛ-4 виробляється в основному Т-хелперами 2 порядку, які відповідають за гуморальну імунну відповідь і який пригнічує Т-клітинну та фагоцитарну відповідь. Підвищений рівень ІЛ-4 в крові свідчить про активність Тh-2 та їх участь в синтезі Ig Е, а підвищений рівень ІЛ-2, який виробляється також Т- лімфоцитами і стимулює проліферацію Т-лімфоцитів, в тому числі і Тh-2, які приймають участь в гуморальному імунному процесі. Крім того, цей інтерлейкін є прозапальним цитокіном, який підсилює реакції запалення, які спостерігається при АД. В свою чергу Тh-2 лімфоцити, як основний продукт ІЛ-4 синтезує цей цитокін, який гальмує активність Тh-1 і активує В-лімфоцити до проліферації і синтезу Ig Е, особливо, специфічних Ig Е. В свою чергу гальмування Тh-1 відповіді індукує активність Т лімфоцитів попередників до синтезу ІЛ-2, який стимулює проліферацію та диференціацію на Тh-1 та Тh-2 популяції.
Іншим важливим показником стану імунної системи є її здатність до розвитку різних автоімунних процесів в організмі. Було досліджено рівень ауто-антитіл до нейроспецифічних протеїнів, таких як ОБМ, S-100 протеїн, НСЕ та ЗЛМА. Найбільш суттєво збільшився рівень ауто-антитіл до НСЕ (у дітей Ме = (27,3±0,6) у.о., у дорослих Ме = 26,50±0,52; контроль – 23,21±0,05; р<0,05) та ОБМ (у дітей Ме = (33,0±0,8) у.о., у дорослих Ме = 32,87±0,7; контроль – 25,3±0,85; р<0,05). Дослідження рівня автоантитіл проведені за допомогою методики ІФА і було встановлено, що у хворих з АД виявляється вірогідного підвищення рівня ауто-антитіл до цих ауто-антигенів у порівнянні із здоровими особами. Активність автоімунних реакцій до антигенів головного мозку вірогідно підвищена і у дітей з АД, особливо до ОБМ, що свідчить про зрив механізмів толерантності та можливе пошкодження нервових структур у шкірі при АД.
При вивченні взаємозв’язку вмісту рівня ІЛ-2 у дітей була встановлена помірна достовірна кореляція між вмістом ЦІК (|r| = 0,32), рівнем НСЕ (|r| = 0,28), вмістом CD-3 % (|r| = -0,32), вмістом CD-19 % (|r| = 0,30), спонтанною проліферацією лімфоцитів (|r| = -0,26), Т-мітоген викликаною проліферацією (ФГА) (|r| = 0,34), простагландинзалежною проліферацією (ФГА + індометацин) (|r| = 0,34), спонтанною фагоцитарною активністю нейтрофілів (|r| = 0,27) та активністю мієлпероксидази нейтрофілів (спонтанної) (|r| = 0,33), у дорослих була встановлена помірна достовірна кореляція між рівнем, сенсибілізацією нейтрофілів до альбуміну (|r| = 0,28), основного білку мієліну в сироватці крові (|r| = 0,30) та НСЕ (|r| = 0,30). Також відмічається достовірна кореляція між вмістом CD-4 % (|r| = 0,31). При аналізі взаємозв’язку вмісту рівня ІЛ-4 у дітей була встановлена помірна достовірна кореляція між сенсибілізацією нейтрофілів до альбуміну (|r| = 0,49), рівнем нейронспецифічного білку ОБМ (|r| = 0,30), НСЕ (|r| = 0,34), а також імунорегуляторним індексом (|r| = 0,42), у дорослих була встановлена помірна достовірна кореляція між спонтанною проліферацією лімфоцитів (|r| = -0,32) та індукованою фагоцитарною активністю нейтрофілів (зимозан) (|r| = -0,26). Виявлені кореляційні зв’язки автоантитіл до мозкових антигенів які свідчать, що у дітей достовірна кореляція спостерігається між основним білком мієліну і білком S-100 (|r| = 0,73), ЗЛМА (|r| = 0,50), імунорегуляторним індексом (|r| = 0,29); між білком S-100 та ЗЛМА (|r| = 0,48), імунорегуляторним індексом (|r| = 0,31); між НСЕ та ЗЛМА (|r| = 0,40), імунорегуляторним індексом (|r| = 0,40); між загальним людським мозковим антигеном і CD-3 % (|r| = 0,30), CD-19 % (|r| = -0,27). У дорослих достовірна кореляція спостерігається між основним білком мієліну і білком S-100 (|r| = 0,46), кількістю еозинофілів в сироватці крові (|r| = -0,45); між білком S-100 та вмістом CD-3 % (|r| = -0,41), CD-8*109 (|r| = 0,38); між НСЕ та ЗЛМА (|r| = 0,37), індукованою фагоцитарною активністю нейтрофілів (зимозан) (|r| = -0,31); між ЗЛМА і CD-4 % (|r| = -0,33), CD-8 % (|r| = 0,27).
Таким чином, комплексне вивчення стану імунної системи, а саме визначення рівнів імунорегуляторних інтерлейкінів, дослідження рівнів автоантитіл до нейроспецифічних протеїнів дало можливість оцінити стан здоров’я пацієнтів, виявити порушення в різних ланках організму і, виходячи з цього, адекватно призначити медикаментозну терапію на стаціонарному і профілактичному етапах, а також розробити критерії та алгоритм лікування враховуючи вікові особливості. В результаті проведеного обстеження показників клітинної та гуморальної ланок імунітету, функціональних параметрів шкіри, а також основних мозкових автоантитіл дає можливість рекомендувати антигістамінні препарати певних поколінь з залежності від вікових особливостей, а також обов’язкову консультацію невропатолога з подальшим призначенням седативної та заспокійливої терапії пацієнтам віком старше 18 років.
ВИСНОВКИ
У дисертації подано теоретичне узагальнення і нове вирішення наукового завдання, що полягає у розробці алгоритму лікування хворих на атопічний дерматит в залежності від вікових особливостей клінічних проявів дерматозу та імунного статусу хворих.
- У зв’язку з широкою розповсюдженістю АД як серед дітей, так і дорослих, недостатньо вирішеними залишаються фактори, які впливають на патогенез свербежу та стан автоімунних реакцій. Вивчення ролі цих факторів у розвитку АД і розробка профілактичних заходів щодо попередження АД, а також алгоритму лікування з урахуванням вікових особливостей, співставлення показників алергічних та імунологічних реакцій є актуальним завданням сучасної дерматології.
- Встановлені клінічні особливості перебігу АД та об’єктивізована тяжкість ураження шкіри хворих на АД у різних вікових групах. При обстеженні 139 хворих на АД (99 дітей та 40 доросли) у дітей хворих на АД за індексом SCORAD встановлено, що у 17 % визначалась легка форма АД, у 28 % – середньо-важка форма, а у 55 % – важка форма. Індекс SCORAD у дітей хворих на АД – (48,6±2,70) бала. У 7 % дорослих пацієнтів визначалася легка форма АД; у 10 % – середньоважка форма; у 83 % – важка. Індекс SCORAD – (64,7±3,93) бала. Серед дітей переважала еритематозно-сквамозна форма з ліхеніфікацією (61,6 %) на відміну від дорослих, у яких переважала ліхеноїдна форма АД (85 %). Дифузна форма АД відмічалася тільки у дорослих (15 %).
- При визначенні функціональних параметрів шкіри (вологість, жирність, еластичність, pH, рівень меланіну, температура шкіри), у хворих на атопічний дерматит в різних вікових групах, виявлено достовірне пониження вологості шкіри в осередках АД у хворих дітей в 1,49 разу, і дорослих в 1,75 разу, тенденція до зменшення еластичності, майже однакове збільшення рН на поверхні шкіри в першій і другій групі хворих (в 1,29 і 1,31 разу відповідно). В зовні незміненій шкірі хворих на АД обох груп достовірно знижувалась тільки вологість.
- При оцінці якості життя батьків дітей хворих на АД за опитувальниками FDLQI і DFI встановлено, що найвищі бали за опитувальником FDLQI отримали пункти про емоційний стрес, час витрачений на догляд за дитиною і збільшення матеріальних витрат по догляду за дитиною. Найвищі бали за опитувальником DFI отримали запитання про сімейні витрати, емоційну неврівноваженість і втому, що дозволяє стверджувати про соціальне значення проблеми АД.
- Виявлені особливості алергологічного статусу у дітей і дорослих хворих на АД, так рівень загального сироваткового Ig E у дітей хворих на АД в середньому становив (380,5±36,72) МО/мл, в той час як рівень загального Ig E у дорослих хворих на АД достовірно перевищував відповідний показник у дітей і становив (559,6±56,43) МО/мл. Полівалентна сенсибілізація на харчові алергени (6 алергенів) серед дітей перевищувала відповідну сенсибілізацію серед дорослих (14,28 % хворих дітей, дорослих – у 8 %), в той час як на респіраторні алергени (10 алергенів) (у дітей – 3,57 %, у дорослих – 36 %).
- За результатами імунологічних досліджень показано, що у дорослих осіб хворих на АД розвивається переважна активація В-клітинної ланки імунітету, що проявляється як збільшенням кількості в сироватці крові СD-19, СD-4, імунорегуляторного індексу, ЦІК, збільшенням концентрації рівня ІЛ-4 у 6 разів, ІЛ-2 у 8 разів. У дітей хворих на АД також відзначалася активація В-клітинної ланки імунітету, але на фоні пригнічення Т-клітинного імунітету та фагоцитарної ланки імунітету збільшенням СD-3, СD-4, СD-19, ЦІК, збільшення концентрації рівня ІЛ-4 у 6 разів, ІЛ-2 у 8 разів, зменшення СD-16, що дає можливість припустити взаємозв’язок розвитку АД у дітей з генетичними чинниками і з порушеннями в системі вродженого імунітету.
- Встановлено значуще гальмування міелопероксидазної та НСТ активності нейтрофілів крові у дітей хворих на АД порівняно з дорослими, зниження НСТ показників у нейтрофілах крові, гальмування мієлопероксидазної активності. Рівні автоантитіл до нейроспецифічних протеїнів були підвищені як у дітей, так і у дорослих (ОБМ, протеїн S-100, НСЕ та ЗЛМА). Найбільш суттєво збільшується рівень автоантитіл до НСЕ у хворих на АД та ОБМ, що свідчить про певне значення цих автоантитіл у розвитку клінічних проявів АД, при якому можуть пошкоджуватись нервові закінчення, які знаходяться у шкірі і, таким чином, запускати автоімунну відповідь на ці антигени.
- При вивченні взаємозв’язку між рівнем IL-2, IL-4 із рівнем НСЕ у дітей була встановлена помірна достовірна кореляція. Достовірні кореляційні зв’язки у дітей спостерігаються між ОБМ із білком S-100 та ЗЛМА, між білком S-100 із ЗЛМА, між НСЕ із ЗЛМА. У дорослих достовірна кореляція спостерігається між ОБМ і білком S-100; між НСЕ та ЗЛМА та між ОБМ із НСЕ. Дані позитивних кореляційних зв’язків автоантитіл до мозкових антигенів із імунологічними показниками свідчать про імунні розлади в організмі дітей і дорослих хворих на АД і потребують додаткового включення в комплексну терапію седативних засобів та ноотропних препаратів.
- Запропоновано алгоритм обстеження хворих на АД з визначенням рівнів інтерлейкінів та автоантитіл до мозкових антигенів. На підставі отриманих даних був використаний диференційний підхід до лікування АД із включенням ноотропних препаратів (для дорослих – фенібут; дітей – гліцин) та рекомендована індивідуалізована дієта.
СПИСОК ЛІТЕРАТУРИ
- Айзятулов Р.Ф. Особенности наружного лечени атопического днрматита / Р.Ф. Айзятулов, В.В. Юхименко, Н.В. Ермилова // Журнал дерматовенерологии и косметологии им. Н.А. Торсуева. – 2009. – № 1-2. – С.49-52.
- Актуальные вопросы диагностики пищевой аллергии в педиатрической практике / С.Г. Макарова, Е.А. Намазова-Баранова, Е.А. Вишнёва [и др.] // Вестник РАМН. – 2015. – №1. – 41-46.
- Алан Д.И. Нарушение барьера: роль филагрина в генетической предрасположенности к атопическому дерматиту / Д.И. Алан, В.Х. Ирвин МакЛин // Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. – 2007. – Т. 1, № 1. – С. 11-14.
- Аллергология / Под ред. Р.М. Хаитова, Н.И. Ильиной. – 2-е изд., испр. и доп.– М.: ГЭОТАР Медиа, 2009. – 256 с.
- Аряев Н.Л. Атопический дерматит в практике педиатра / Н.Л. Аряев, В.А. Клименко, В.А. Феклин. – К.: Ферзь, 2007. – 32 с.
- Атопический дерматит. Новые подходы к профилактике и наружной терапии: Пуководство для практикующих врачей / Под ред. Ю.В. Сергеева. – М. : Медицина для всех, 2006. – 96 с.
- Балаболкин И.И. Влияние экологических факторов на аллергическую заболеваемость детского населения Российской Федерации / И.И. Балаболкин, Р.Н. Терлецкая, Е.Л. Дыбунова // Сибирское медицинское обозрение. – 2008. – Т.54, вып.6. – С. 31-40.
- Балаболкин И.И. Патогенез аллергических болезней у детей / И.И. Балаболкин // Детская аллергология / Под ред. А.А. Баранова, И.И. Балаболкина. – М. : Гэотар-Медиа, 2006. – С. 69-104.
- Балаболкин И.И. Фармакотерапия аллергических болезней у детей / И.И. Балаболкин, А.В. Ляпунова, Л.С. Намазова // Детская аллергология / Под ред. А.А. Баранова, И.И. Балаболкина. – М. : Гэотар-Медиа, 2006. – С.121-137.
- Баранов А.А. Детская аллергология / Под ред. А.А. Баранова, И.И. Балаболкина. – М. : ГЭОТАР Медиа, 2006.– С. 688.
- Безвершенко К.І. Удосконалення терапі екземи кистей як атипової форми атопічного дерматиту: автореф. дис. … канд. мед. наук: 14.01.20 – шкірні та венеричні хвороби / К.І. Безвершенко; ДУ «Ін-т дерматології та венерології АМН України». – Х., 2009. – 19 с.
- Безродна А.І. Генетико-епідеміологічне дослідження мультифакторіальних захворювань на прикладі бронхіальної астми, атопічного дерматиту та псоріазу: автореф. дис. …канд. мед наук: 03.00.15 – генетика / А.І. Безродна; Харк. Нац..мед. ун-т. – Х., 2012. – 20 с.
- Белоусова Т.А. Современная стратегия наружной терапии воспалительных дерматозов / Т.А. Белоусова, М.В. Горячкина, В.А. Филиппова // Consilium Medicum. – 2009. – № 3.– С. 41–46.
- Бессикало Т. Г. Контроль за течением поллинозов у детей / Т. Г. Бессикало, С. Н. Недельская, Е. Д. Кузнецова // Вестн. физиотерапии и курортологии. – 2007. – Т. 13, № 3. – С. 83-85.
- Болотна Л.А. Комплексне лікування хворих на атопічний дерматит з урахуванням метаболічних порушень / Л.А. Болотна // Дерматологія та венерологія. – 2010. – № 2. – С.78-83.
- Болотная Л.А. Базовая наружная терапия и уход за кожей больных атопическим дерматитом / Л.А. Болотная // Український журнал дерматології, венерології, косметології. – 2011. – № 2 (41). – С.52-56.
- Болотная Л.А. Профилактика бактериальных осложнений при атопическом дерматите с использованием средств на основе термальной воды, меди и цинка / Л.А. Болотная // Український журнал дерматології, венерології, косметології. – 2013. – № 1 (48). – С. 94-101.
- Боткина А.С. Пищевая аллергия у детей: современный взгляд на проблему / А.С. Боткина // Лечащий врач. – 2012. – № 6. – С. 35-38.
- Васильев-Ступальский Е.А. Атопический дерматит взрослых: клнико-иммунологические показатели при коморбидности, дифференцированная терапия с учетом фармакоэкономических показателей: автореф. дис. … канд. мед. наук : 14.01.10 – кожные и венерические болезни / Е.А. Васильев-Ступальский; ГОУ ВП «Российский государственный медицинский университет Федерального агенства по здравоохранению и социальному развитию». – М., 2011. – 20 с.
- Васильев-Ступальский Е.А. Методы исследования и врачебное вмешательство при атопическом дерматите у взрослых / Е.А. Васильев-Ступальский // Клинич. дерматология и венерология. – 2011. – № 1. – С. 4-9.
- Влияние озонотерапии на противомикробный иммунитет у детей с атопическим дерматитом / Я.Ю. Иллек, А.В. Галанина, Е.В. Суслова [и др.] // Лечение и профилактика. – 2014. – №1. – С.5-9.
- Влияние энтеротоксинов Staphylococcus aureus и Epidermidis на течение атопического дерматита у детей / В.Я. Прохоров, Ф.С. Флуер, А.В. Кудрявцева [и др.] // Педиатрия. – 2009. – № 2. – С.43-48.
- Волосовец А.П. Роль филлагрина в аллергологии детского возраста / А.П. Волосовец, С.П. Кривопустов, Е.В. Павлик // Здоровье ребенка – 2013. – №2. – С.12-15.
- Гашкова В. Циркулирующие иммунные комплексы антиген –антитело у больных с иммунокомплексними заболевыаниями / В. Гашкова, И.Е. Мате, И. Кашлик // Чехословацкая медицина. – 1978. – №2. – С.117.
- Глухенький Б.Т. Прогоностичне значення реакцій антиоксидантної системи у підлітків з системними дерматозами / Б.Т. Глухенький, А.М. Біловол, С.П. Шкляр // Дерматологія та венерологія. – 2007. – №2. – С.21-24.
- Гойко О.В. Практичне використання пакета STATISTICA для аналізу медико-біологічних даних: Навч.посібник. – К. : Київська медична академія післядипломної освіти ім.П.Л.Шупика, 2004. – 76 с.
- Гордиенко С.М. Сравнительная оценка результатов восстановления нитросинего тетразолия при микроскопическом и спектрофотометрическом варианте метода с различными солями тетразолия / С.М. Гордиенко // Лабораторное дело. – 1983. – № 2. – С. 21-27.
- Григорьева М.П. Применение метода культивирования лимфоцитов для изучения трансплантационного иммунитета / М.П. Григорьева, И.И. Копелян // Цитология. – 1977. – № 37. – С. 838-902.
- Гущин И.С. Перспективы совершенствования противоаллергического действия Н1 антигистаминных препаратов // Лечащий врач. – 2009.– № 5.– С. 93–99.
- Гущин И.С. Эпидермальный барьер и аллергия / И.С. Гущин // Российский аллергологический журнал. – 2007. – № 2. – С.3-16.
- Данцова Е.В. Факторы риска и особенности течения атопического дерматита / Е.В. Данцова, Л.В. Силина // Вестн. новых мед. технологий. – 2011. – Т.18, № 2. – С.420-423.
- Денисов А.А. Закономерности иммунологической и структурной перестройки кожи при атопическом дерматите: автореф. дис. … д-ра мед. наук : 14.03.09 – клиническая иммунология, аллергология / А.А. Денисов; НИИ клинической иммунологии Сибирского отделения РАМН. – Новосибирск, 2011. – 39 с.
- Диагностика атопического дерматита у детей раннего возраста / Я.Ю. Иллек, Г.А. Зайцева, Е.Ю. Тарасова [и др.] // Вятский медицинский вестник. – 2007. – № 2. – С. 83-92.
- Дутчак А.М. Особливості алергосенсибілізації у дітей з атопічним дерматитом / А.М. Дутчак, О.Б. Синоверська // Соврем. педиатрия. – 2011. – № 3. – С. 141-142.
- Жадан И.Ю. Оптимизация лечебно-профилактических мероприятий при атопическом дерматите у детей / И.Ю. Жадан, И.В. Винтенко, М.А. Боранова // Здровохранение Рос. Федерации. – 2011. – № 5. – С.56.
- Зайков С.В. Современные подходы к лабораторной диагностике аллергических заболеваний / С.В. Зайков, А.Е. Богомолов // Новости медицины и фармации. – 2013. – № 14 (465). – С. 5-6.
- Заславский Д.В. Профилактика и комплексное лечение атопического дерматита у детей / Д.В. Заславский, А.А. Абдусалямов, А.А. Сыдиков // Лечащий врач. – 2015. – № 6. – С.48-54.
- Зубаренко А.В. Атопический дерматит. Концепция эффективной терапии / А.В. Зубаренко, О. А. Портнова // Здоровье ребёнка. – 2009. – № 3 (18). – С. 103-108.
- Зяблицев С.В. Синдробы атопической болезни: монография / С.В. Зяблицев, Е.А. Бочарова. – Донецк : Новый мир, 2008. – 250 с.
- Иванов О.Л. Современная диагностика и терматита дерматозов / О.Л. Иванов, С.А. Монахов // Рос. журн. кожн. и венер. болезней. – 2012. – № 1. – С.66.
- Иллек Я.Ю. Эндокринные нарушения при атопических заболеваниях у детей / Я.Ю. Иллек, А.В. Галанина, А.В. Высотина // Вятский медицинский вестник. – 2007. – № 2-3. – С. 76-78.
- Интегральный подход к наружной терапии атопического дерматита / А.А. Кубанова, Д.В. Прошутинская, Л.В. Текучева, И.Н. Авдиенко // Український журнал дерматології, венерології, косметології. – 2010. – № 3 (38). – С. 64-70.
- Іщейкін К.Є. До питання уніфікації класифікації та критеріїв діагностики атопічного дерматиту / К.Е. Іщейкін, В.І. Степаненко, І.П. Кайдашев // Український журнал дерматології, венерології, косметології. – 2009. – № 1 (32). – С. 61-65.
- Іщейкін К.Є. Стан апоптозу cd4+cd25+ т-регуляторних клітин в організмі дітей, хворих на атопічний дерматит та екзему дитячу / К.Є. Іщейкін, В.І. Степаненко, І.П. Кайдашев // Український журнал дерматології, венерології, косметології. – 2007. – № 3 (26). – С. 1-4.
- Калюжная Л.Д. Атопическая екзема / Л.Д. Калюжная // Укр. журнал дерматології, венерології, косметології. – 2006. – № 4. – С. 16-19.
- Калюжная Л.Д. Европейские рекомендации по лечению атопического дерматита 2011 года: анализ современных технологий топической терапии / Л.Д. Калюжная, Г.А. Слабкий, А.В. Горбенко // Український журнал дерматології, венерології, косметології. – 2012. – № 2 (45). – С. 52-60.
- Калюжная Л.Д. Особенности аллергологического статуса пациентов больных атопическим дерматитом в зависимости от семейной предрасположенности / Л.Д. Калюжна, І.В. Паппа // Дерматологія та венерологія. – 2015. – № 2. – С. 49-60.
- Калюжная Л.Д. Разнообразие топической терапии атопического дерматита как фактор преодоления кортикофобии / Л.Д. Калюжная // Клінічна імунологія. Алергологія. Інфектологія. – 2014. – № 8 (77). – С.19-23.
- Камаев А.В. Рациональное введение прикорма детям с атопическим дерматитом и прелрасположенностью к аллергическим реакциям как возможность профилактик атопического марша / А.В Камаев // Педиат. фармакол. – 2011. – Т. 8, №3. – С. 75-79.
- Катина М.Л. Атопический дерматит у детей: клинические и иммунологические факторы риска бактериальных осложнений, оптимизация терапии: дис. … канд. мед. наук : 14.01.08 – педиатрия / М.М. Катина; ГОУВПО «Омская гос. мед. акад». – Красноярск, 2011. – 140 с.
- Кениксфест Ю.В. Современный подход к наружной терапии и реабилитации кожи больных атопическим дерматитом / Ю.В. Кениксфест, М.М. Кохан // Клин. дерматол. и венерол. – 2006. – № 1.– С. 59–62.
- Клименко В.А. Характеристика різних патогенетичних варіантів атопічного дерматиту у дітей / В.А.Клименко // Дерматологія та венерологія. – 2008. – № 2. – С.54-58.
- Клиническая эффективность левоцетиризина у детей с сизонным аллерическим ренитом и его влияние на колличественый состав и морфологические показатели эозинофилов периферической крови / Э.А. Ружицкая, О.Н. Потапова, Т.В. Виноградова [и др.] // Педиатрическая фармакология. – 2009. – Т. 6, № 3. – С.53-58.
- Клинические рекомендации по ведению больных атопическим дерматитом / Под ред. Кубановой А.А.– М. : Медэкспресс, 2010. – 40 с.
- Ковязина Н.А. Диагностика атопического дерматита у детей раннего возраста / Н.А. Ковязина, Н.А. Федосимова, Я.Ю. Иллек // Вятский медицинский вестник. – 2007. – № 2-3. – С. 83-92.
- Коган Б.Г. Атопічний дерматит: акцент на безпечності лікування / Б.Г. Коган // Український журнал дерматології, венерології, косметології. – 2013. – № 1 (48). – С.81-89.
- Колесникова С.М. Придиктивный подход к развитию аллергческих заболеванй у детей раннего возраста / С.М. Колесникова, М.Ф. Рзянкина // Тихоокеанский медицинский журнал. – 2015. – № 1. – С. 71.73.
- Коляденко В.Г. Гемопоэтические стволовые клетки и атопический дерматит / В.Г. Коляденко, Е.И. Ник // Український журнал дерматології, венерології, косметології. – 2007. – № 2 (25). – С. 5-7.
- Короткий Н.Г. Локобейз Рипеа в наружной терапии атопического дерматита у детей / Н.Г. Короткий, А.А. Тихомиров, Б.Н. Гамаюнов // Вопр. практ. педиатр. – 2009. – № 4. – С. 77–81.
- Корсунская И.М. Такролимус в топической терапии атопического дерматита / И.М. Корсунская, З.А. Невозинская, О.О. Мельниченко // Клинич. дерматология и венерология. – 2011. – № 5. – С. 86-91.
- Кочергин Н.Г. Наружная терапия стероидочувствительных дерматозов: врачебный выбор / Н.Г. Кочергин, В.С. Новоселов // Леч. врач. – 2006. – № 2. – С. 42–46.
- Кудрявцева А.В. Системная фармакотерапия тяжелых форм атопического дерматита у детей и продростков / А.В. Кудрявцева // Лечащий врач. – 2011. – № 4. – С. 16-20.
- Кутасевич Я.Ф. Рациональный выбор топического стероида / Я.Ф. Кутасевич, И.А. Маштакова // Український журнал дерматології, венерології, косметології. – 2012. – № 1 (44). – С. 55-58.
- Лебедюк М. Н. Особенности цикла бодрствование – сон у крыс с моделируемым дерматитом / М. Н. Лебедюк, А. А. Шандра // Інтегративна антропологія. – 2010. – № 2 (16). – С. 58–62.
- Лечение атопического дерматита в острый период / С.Н. Недельская, Е.Д. Кузнецова, И.В. Солодова [и др.] // Укр. журн. дерматології, венерології, косметології. – 2008. – № 3 (30). – С. 34-37.
- Лісяний М.І., Любич Л.Д. Механізми імунонейропатологічних процесів при дії традиційного опромінення. – К., 2001. – 196 с.
- Ломакина Е.А. Роль нарушений барьерной функции кожи в патогенезе некоторых дерматозов / Е.А. Ломакина // Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. – 2009. – Т. 2, № 2. – С. 87-91.
- Лусс Л.В. Коррекция иммунных нарушений при атопическом дерматите у детей / Л.В. Лусс // Consilium medicum. Педиатрия. – 2011. – № 1. – С. 16-20.
- Малахов А.Б. Антигистаминные препараты и их место в терапии аллергических заболеваний / А.Б. Малахов, И.К. Волков, М.А. Малахова-Капанадзе // Справочник поликлинического врача. – 2007. – Т. 5, № 1. – С. 31–33.
- Маштакова І.О. Обгрунтування необхідності базової терапії у хворих на атопічний дерматит / І.О. Маштакова // Дерматологія та венерологія. – 2014. – № 2 (64). – С. 53-57.
- Монахов К.Н. Применение увлажняющих средств при нарушении кожного барьера / К.Н. Монахов, С.А. Очеленко // Клин. дерматол. и венерол. – 2009. – № 1. – С. 74–79.
- Намазова Л.С. Атопический дерматит у детей – проблемы и решения / Л.С. Намазова, Н.И. Вознесенская, Л.П. Мазитова // Русск. мед. журн.– 2006. – Т. 14, № 19. – С. 44–49.
- Новоселецкая А.И. Оценка показателей качества жизни как критерий эффективности лечения больных экземой / А.И. Новоселецкая // Журнал Гродненского государственного медицинского университета. – 2010. – № 2. (30). – С. 165-167.
- Оброблення клінічних і експериментальних даних у медицині: Навч. посібник / Укл. О.П. Мінцер, Ю.В.Вороненко, В.В.Власов. – К. : Вища школа, 2003. – 350 с.
- Определение аллергенспецифических Ig E- и IgG – антител в сыворотке крови у детей с атопическим дерматитом / К.Г. Шарапова, Т.Б. Сенцова, Т.А. Филатова, И.В. Ворожко // Материалы 11 Конгресса диетологов и нутрициологов «Питание и здоровье». – М., 2009. – С.176.
- Оптимизация наружной терапии стероидчувствительных дерматозов / Н.В. Кунгуров, М.М. Кохан, Ю.В. Кениксфест [и др.] // Вестн. дерматологии и венерологии. – 2007. – № 4. – С. 45–51.
- Опыт оптимизации патогенетическойтерапии атопического дерматита в детском возрасте / В.Н. Буряк, Ю.В. Пошехонова, Н.И Шабан [и др.] // Современная педиатрия. – 2011. – № 2. – С. 188-192.
- Осипова Л.С. Особенности патогенетической терапии атопического дерматита / Л.С. Осипова // Клінічна імунологія. Алергологія. Інфектологія. – 2010. – № 1. – С. 74–78.
- Павлова О. В. Новые аспекты патогенеза атопического дерматита: психо-нейро- иммунные взаимодействия / О. В. Павлова, Ю. К. Скрипкин // Вестник дерматологии и венерологии. – 2009. – № 1. – С. 38–41.
- Показатели сенсибилизации к антигенам условно-патогенных грибов Malassezia и Candida у больных аллергодерматозами с мутациями филлагрина / А.П. Белозоров, М.И. Зуева, Т.В. Частий [и др.] // Дерматологія та венерологія. – 2011. – № 4. – С.27-32.
- Поліщук Д.С. Застосування пребіотик-сорбенту та омега-3 поліненасичених жирних кислот у лікуванні хворих атопічним дерматитом / Д.С. Поліщук // Український журнал дерматології, венерології, косметології. – 2011. – № 2 (41). – С.61-64.
- Портнова О.А. Случай атопического дерматита у ребенка с панкреатической недостаточностью / Ю.А. Портнова // Здоровье ребенка. – 2013. – № 3 (46). – С. 113-114.
- Применение проточной цитометрии для оценки функциональной активности иммунной системы человека : Пособие для врачей лаборантов / Б.В. Пинегин, А.А. Ярилин, А.В. Симонова [и др.]. – М., 2001. – 55 с.
- Проценко Т.В. Синдром сухой кожи в дерматологии: механизмы формирования и лечебно-косметический уход / Т.В. Проценко, О.А. Проценко // Укр. журн. дерматології, венерології, косметології. – 2009. – № 3. – С. 62–65.
- Процюк Т.Л. Прогнозирование состояния здоровья детей с ранними проявлениями атопического дерматита / Т.Л. Процюк // Соврем. педиатрия. – 2011. – № 3. – С.145-148.
- Разина Л.А. Распространенные аллергические заболевания у детей ранего возраста: особенности проявлени, применение антигистаминных препаратов, профилактическое вакцинация / Л.А. Разина, Е.Н. Суприн, Ю.С. Смолкин // Аллергология и иммунология в педиатрии. – 2012. – № 3 (30). – С. 31-40.
- Ревякина В.А. Современные тенденции в комплексной наружной терапии атопического дерматита у детей / В.А. Ревякина // Лечащий врач. – 2014. – № 6. – С. 38-40.
- Романенко В.Н. Использование препарата «фосфалюгель» у детей с атопическим дерматитом с сопутствующим гастроэнтерологическим заболеванием / В.Н. Романенко, О.А. Лавриненко, К.В. Романенко // Український журнал дерматології, венерології, косметології. – 2007. – № 3. – С. 20-22.
- Садикова Т.Е. Клинико-патогенетические варианты атопического дерматита у детей / Т.Е. Садикова, И.И. Балаболкин // Рос. педиатр. журнал. – 2011. – №6. – С.18-23.
- Самойликов П.В. аутореактивность при атопическом дерматите у детей / П.В. Самойликов, В.Б. Гервазиева, С.А. Кожевников // Мед.иммунология. – 2011. – Т. 13, № 4/5. – С. 35.
- Сафронова Я.М. Клініко-імуно-морфологічне обгрунтуваня застосування системних і топічних імуномодуляторів в комплексному лікуванні хворих на атопічний дерматит: автореф. дис. … канд. мед. наук; 14.01.20 – шкірні та венеричні хвороби / Я.М. Сафронова; Ін-т дерматології та венерології АМН України. – Х., 2010. – 20 с.
- Смирнова Г.И. Современные методы патогенетической терапии атопического дерматита у детей. – М., 2006. – 132 с.
- Смирнова Г.И. Современные подходы к диагностике и лечению осложненных форм атопического дерматита у детей / Г.И. Смирнова // Клиническая дерматология и венерология. – 2008. – № 5. – С. 101–108.
- Солошенко Е.М. Динаміка розповсюдженості та захворюваності на поширені дерматози в Україні і Харківському регіоні за останні 10 років / Е.М. Солошенко, В.М. Волкославська, О.Л. Гутнєв // Дерматологія та венерологія. – 2014. – № 1 (63). – С. 69–78.
- Солошенко Э. Н. Атопический дерматит: современно состояние проблемы / Э.Н. Солошенко // Международный медицинский журнал. – 2001. – Т. 7, № 4. – С. 57–62.
- Титова Н.Д. Аллергия, атопия, Ig E – антитела и концепция аллергенной сети / Н.Д. Титова // Имунопатология. Аллергология. Инфектология. – 2011. – № 4. – С. 39-47.
- Тихомиров А.А. Клинико-патогенетическое обоснование диференцированного подхода к терапии тяжелых форм атопического дерматита у детей: дис. … д-ра мед. наук : 14.01.10 – кожные и венерические болезни / А.А. Тихомиров; ГБОУВПО «Рос.нац.иссл.мед. ун-т. Им.Н.И Порогова». – М., 2014. – 315 с.
- Торопова Н.П. Атопический дерматит детей и подростков – эволюция взглядов на патогенез и подходы к терапии / Н.П. Торопова К.Н. Сорокина, Т.С Лепешкова // Рос. журн. кожных и венерических беолезней. – 2014. – № 6. – С. 50-59.
- Тренева М.С. Антимикробные пептиды в патогенезе атопического дерматита / М.С. Тренева, А.Н. Пампура // Рос. вестн. перинаталогии и педиатрии. – 2011. – Т. 56, № 2. – С. 83-84.
100. Уровень субклассов IgG у пациентов с атопическими заболеваниями, имеющих гиперпродукцию общего Ig E / Д.В. Плахотная, Н.С. Удовенко, Н.А. Гуменюк [и др.] // Імунологія та алергологія. – 2015. – № 2. – С. 135-138.
101. Ханбабян А.Б. Некоторые аспекты патогенеза и терапии атопического дерматита / А.Б. Ханбабян, Н.Л. Каюмова, Н.Г. Кочергин // Российский журнал кодных и венерических болезней. – 2014. – Т. 17, № 2. – С. 17-20.
102. Хэбиф Т.П. Кожные болезни. Диагностика и лечение / Т.П. Хэбиф. – М. : МЕДпрессинформ, 2008. – 672 c.
103. Цвень П.В. Відновлювальне лікування хронічних дерматозів у дітей та підлітків / П.В. Цвень, Г.Б. Голяченко, В.С. Килівник // Вісник соціальної гігієни та організації охорони здоров’я. – 2010. – № 1. – С. 24–27.
104. Черенько Т.М. Сенсибилизація к нейроспецифическим белкам у больных с закрытой черепномозговой травмой: автореф. дис. … канд. мед. наук; 14.01.05 – нейрохирургия. – К., 1989. – 26 с.
105. Чернишов П.В. Особливості внутрішньоклітинної продукції інтерферону-гамма та інтерлейкіну-4 Т-лімфоцитами-хелперами у хворих на атопічний дерматит / П.В. Чернишов // Український журнал дерматології, венерології, косметології. – 2006. – № 2. – С. 5-8.
106. Чернишов П.В. Специфічні імуноглобуліни е та g4 до коров’ячого молока в лікуванні дітей з атопічним дерматитом / П.В. Чернишов // Український журнал дерматології, венерології, косметології. – 2008. – № 1 (28). – С. 33-36.
107. Шандра A.А. Атопический дерматит и взаимодействие нервной, эндокринной и иммунной систем / А.А. Шандра, В.В. Шухтин // Дерматологія та венерологія. – 2015. – № 2 (68). – С. 30-41.
108. Шандра О. О. Вплив дельтарану та мелатоніну на стан імунної системи щурів за умов експериментального контактного дерматиту / О. О. Шандра // Фізіологічний журнал. – 2014. – Т. 60, № 1. – С. 78–83.
109. Шандра О. О. Роль порушень імунної та нервової систем в патогенезі алергійного дерматиту та їх фармакологічна корекція: автореф. дис. … канд. мед. наук / О. О. Шандра. – Одеса, 2014. – 20 с.
110. Шмелькова Е.С. Современные аспекты этиопатогенеза и терапии атопиче- ского дерматита / Е.С. Шмелькова // Клінічна імунологія. Алергологія. Інфектологія. – 2010. – № 1. – С. 56–58.
111. 5-Methoxypsoralen plus ultraviolet (UV) A is superior to mediumdose UVA1 in the treatment of severe atopic dermatitis: a randomized crossover trial / S. Tzaneva, H. Kittler, G. Holzer [et al.] // Br. J. Dermatol. – 2010. – Vol. 162. – P. 655-660.
112. A 10-year open follow-up of eczema and respiratory symptoms in patients with atopic dermatitis treated with topical tacrolimus for the first 4 years / J.M. Mandelin, A. Remitz, H.M. Virtanen [et al.] // J. Dermatolog. Treat. – 2010. – Vol. 21. – P. 167–170.
113. A guide for education programs in atopic dermatitis / S. Barbarot, R. Gagnayre, C. Bernier [et al.] // Ann Derm. Vener. – 2007. – Vol. 134. – P. 121-127.
114. A randomized trial of methotrexate versus azathioprine for severe atopic eczema / M.E. Schram, E. Roekevisch, M.M. Leeflang [et al.] // J. Allergy Clin. Immunol. – 2011. Vol. 128. – P. 353-9.
115. Absence of T-regulatory cell expression and function in atopic dermatitis skin / J. Verhagen, M. Akdis, C. Traidl-Hoffmann [et al.] // J. Allergy Clin. Immunol. – 2006. – Vol. 117. – P. 176–183.
116. Allergy Prevention / C. Muche-Borowski, M. Kopp, I. Reese [et al.] // J. Dtsch. Dermatol. Ges. – 2010. – Vol. 8. – P. 718-724.
117. Assiciation between cat keeping, allergen exposure, allergic sensitization and atopic diseases: results from the Children of Lubeck Allergy and Environment study (KLAUS) / T. Schafer, B. Stieger, R. Polzius, A. Krauspe // Pediatr. Allergy Immunol. – 2009. – Vol. 20. – P. 353-357.
118. Association between obesity and atopic dermatitis in childhood: a case-control study / J.I. Silverberg, E. Kleiman, H. Lev-Tov [et al.] // J. Allergy Clin. Immunol. – 2011. – Vol. 127. – P. 1180–1186.
119. Asthma outcomes: biomarkers / S.J. Szefler, S. Wenzel, R. Brown [et al.] // J. Allergy Clin. Immunol. – 2012. – Vol. 129. – P. 9–23.
120. Atopic dermatitis phenotypes in childhood / G. Ricci, A. Dondi, I. Neri [et al.] // Ital. J. Pediatr. – 2014. – Vol. 40. – P. 46.
121. Atopic dermatitis: a practice parameter update 2012 / L. Schneider, S. Tilles, P. Lio [et al.] // J. Allergy Clin. Immunol. – 2013. – Vol. 131. – P. 295–299.
122. Bath-Hextall F. Dietary exclusions for improving established atopiceczema in adults and children: systematic review. / F. Bath-Hextall, F.M. Delamere, H.C. Williams // Allergy. – 2009. – Vol. 64. – P. 258-264.
123. Bieber T. Atopic dermatitis / T. Bieber // N. Engl. J. Med. – 2008. – Vol. 358, No. 14. – P. 1483–1494.
124. Bieber T. Atopic dermatitis: a candidate for disease-mdifying strategy / T. Bieber, M. Cork, S. Reitamo // Allergy. – 2012. – Vol. 40. – P. 969-975.
125. Boguniewicz M. Atopic dermatitis: a disease of altered skin barrier and immune dysregulation. / M. Boguniewicz, D.Y. Leung // Immunological reviews. – 2011. – Vol. 242, No.1. – P. 233–246.
126. Bonness S. Molecular basis of atopic dermatitis / S. Bonness, T. Bieber // Curr. Opin Allergy Clin. Immunol. – 2007. – Vol. 7. – P. 382–386.
127. Brandt E. Th2 Cytokines and Atopic Dermatitis / E. Brandt, U. Sivaprasad // J. Clin. Cell Immunol. – 2011. –Vol. 2, No. 3. – P. 110.
128. Buys L.M. Treatment options for atopic dermatitis / L.M. Buys // Am. Fam. Physician. – 2007. – Vol. 75. – P. 523–528.
129. Carlsten C. Atopic dermatitis in a high-risk cohort: natural history, associated allergic outcomes, and risk factors / C. Carlsten, H. Dimich-Ward, A. Ferguson [et al.] // Ann. Allergy Asthma Immunol. – 2013. –Vol. 110. – P. 24-28.
130. CD4+ T cell depletion changes the cytokine environment from a TH1/TH2 response to a TC17-like response in a murine model of atopic dermatitis / G.B. Christensen, M. Hvid, P.H. Kvist [et al.] // Int. Immunopharmacol. – 2011. – Vol. 11, No. 9. – P.1285-1292.
131. Chen S.L. Two topical calcineurin inhibitors for the treatment of atopic dermatitis inpediatric patients: a meta-analysis of randomized clinical trials / S.L. Chen, J. Yan, F.S. Wang // J. Dermatolog. Treat. – 2010. – Vol. 21, No. 3. – P. 144-156.
132. Civelek E. Prevalence, burden, and risk factors of atopic eczema in schoolchildren aged 10–11 years: a national multicenter study / E. Civelek, U.M. Sahiner, H. Yuksel [et al.] // J. Investig Allergol. Clin. Immunol. – 2011. – Vol. 21. – P. 270–277.
133. Confirmation of the association between high levels of immunoglobulin E food sensitization and eczema in infancy: an international study / D.J. Hill, C.S. Hosking, F.M. de Benedictis [et al.] // Clin Exp Allergy. – 2008. – Vol. 38. – P. 161–168.
134. Correlations of serum Interleukin-16, total Ig E, eosinophil cationic protein and total eosinophil counts with disease activity in children with atopic dermatitis / K.G. Wu, T.H. Li, C.J. Chen [et al.] // Int. J. Immunopathol. Pharmacol. – 2011. – Vol. 24. – P. 15–23.
135. Costs of allergic diseases from birth to two years in Finland / S. Alanne, A. Maskunitty, M. Nermes [et al.] // Public Health. – 2012. – Vol. 126. – P. 866–872.
136. Cramer C. Association between attendance of day care centres and increased prevalence of eczema in the German birth cohort study LISA plus / C. Cramer, E. Link, C.P. Bauer [et al.] // Allergy. – 2011. – Vol. 66. – P. 68–75.
137. Current evidence on the associations of breastfeeding, infant formula, and cow’s milk introduction with type 1 diabetes mellitus: a systematic review / E. Patelarou, C. Girvalaki, H. Brokalaki [et al.] // Nutr. Rev. – 2012. – Vol. 70, No. 9. – P. 509–519.
138. Cutting Edge: Proinflammatory and Th2 cytokines synergize to induce thymic stromal lymphopoietin production by human skin keratinocytes / S.I. Bogiatzi, I. Fernandez, J.C. Bichet [et al.] // J. Immunol. – 2007. – Vol. 178. – P. 3373-3377.
139. DaVeiga S.P. Epidemiology of atopic dermatitis: a review / S.P. DaVeiga // Allergy Asthma Proc. – 2012. – Vol. 33. – P. 227–234.
140. Deleuran M.S. Therapy of severe atopic dermatitis in adults / M.S. Deleuran, C. Vestergaard // J. Dtsch. Dermatol. Ges. – 2012.– Vol. 10, No. 6.– Р. 399–406.
141. Denby K.S. Update on systemic therapies for atopic dermatitis / K.S. Denby, L.A. Beck // Curr. Opin. Allergy Clin. Immunol.– 2012.– Vol. 12, No. 4.– Р. 421–426.
142. Does improvement management of atopic dermatitis influence the appearance of respiratory allergic disease? A follow-up study / G. Ricci, A. Patrizi, A. Giannetti [et al.] // Clin. Mol. Allergy. – 2010. – Vol. 8. – P. 8.
143. Effects of a novel formulation of fluocinonide 0.1 % cream on skin barrier function in atopic dermatitis / M.T. Woods, P.A. Brown, S.F. Baig-Lewis, E.L. Simpson // J. Drugs Dermatol. – 2011. – Vol. 10. – P. 171–176.
144. Effects of nonsedating antihistamines on productivity of patients with pruritic skin diseases / H. Murata, S. Kibata, M. Tani [et al.] // Allergy. – 2010. – Vol. 65. – P. 924-932.
145. Engebretsen K.A. Xerosis is associated with asthma in men independent of atopic dermatitis and filaggrin gene mutations / K.A. Engebretsen, A. Linneberg, B.H. Thuesen [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2015. – Vol. 29, No. 9. – P. 1807-1815.
146. Epicutaneus aeroallergen sensitization in atopic dermatitis infant – determining the role of epidermal barrier impairment / F. Boralevi, T. Hubiche, C. Leaute-Labreze [et al.] // Allergy. – 2008. – Vol. 63. – P. 205-210.
147. Epstein T.G. Opposing effects of cat and dog ownership and allergic sensitization on eczema in an atopic birth cohort / T.G. Epstein, D.I. Bernstein, L. Levin [et al.] // J. Pediatr. – 2011. – Vol. 158. – P. 265–271.
148. ETFAD/EADV eczema task force 2009 position paper on diagnosis and treatment of atopic dermatitis / U. Darsow, A. Wollenberg, D. Simon [et al.] // JEADV. – 2010. – Vol. 24. – P. 317-328.
149. Exposure to environmental tobacco smoke and sensitisation in children / E. Lannerö, M. Wickman, M. van Hage [et al.] // Thorax. – 2008. – Vol. 63. – P. 172–176.
150. Flohr C. Atopic dermatitis and the hygiene hypothesis revisited / C. Flohr, L. Yeo // Current problems in dermatology. – 2011. – Vol. 41. – P. 1–34.
151. Galli S.J. Ig E and mast cells in allergic disease / S.J. Galli, M. Tsai // Nat. Med. – 2012. – Vol. 18. – P. 693–704.
152. Gent J. Association of pediatric asthma severity with exposure to common household dust allergens / J. Gent, K. Belanger, E. Triche [et al.] // Environ. Res. – 2009. – Vol.109. – P. 768-774.
153. Glucocorticoids Inhibit Double-Stranded RNA-Induced Thymic Stromal Lymphopoietin Release from Keratinocytes in an Atopic Cytokine Milieu More Effectively than Tacrolimus / T.A. Lee, T. Takai, A.T. Vu [et al.] // Int. Arch. Allergy Immunol. – 2010. – Vol. 153. – P. 27-34.
154. Grahovac M. Treatment of atopic eczema with oral alitretinoin / M. Grahovac, S. Molin, J.C. Prinz [et al.] // Br. J. Dermatol. – 2010. – Vol. 162. – P. 217–218.
155. Grammatikos A.P. The genetic and environmental basis of atopic diseases / A.P. Grammatikos // Ann. Med. – 2008. – Vol. 40. – P. 482–495.
156. Guidelines for treatment of atopic eczema (atopic dermatitis) part 1. / J. Ring, A. Alomar, T. Bieber [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2012. – Vol.26. – P.1045-1060.
157. Guidelines for treatment of atopic eczema (atopic dermatitis) Part II. / J. Ring, A. Alomar, T. Bieber [et al.] // J. Eur. Acad. Dermatol.Venereol. – 2012. – Vol. 26. – P. 1176–1193.
158. Guo S. Factors affecting wound healing / S. Guo, L.A. Dipietro // Journal of dental research. – 2010. – Vol. 89. – P. 219–229.
159. Guttman-Yassky E. Keratinocytes under Fire of Proinflammatory Cytokines: Bona Fide Innate Immune Cells Involved in the Physiopathology of Chronic Atopic Dermatitis and Psoriasis / E. Guttman-Yassky, K.E. Nograles, J.G. Krueger // J. Allergy Clin. Immunol. – 2011. – Vol. 127. – P. 1420-1432.
160. Guttman-Yassky E. New era of biologic therapeutics in atopic dermatitis / E. Guttman-Yassky, N. Dhingra, D.Y. Leung // Expert opinion on biological therapy. – 2013. – Vol.13, No.4. – P. 549–561.
161. Hanifin J.M. Pharmacophysiology of atopic dermatitis / J.M. Hanifin // Clin. Rev. Allergy. – 1986. – Vol. 4. – P. 43–65.
162. Harris J. Early allergen exposure and atopic eczema / J. Harris, H. Williams, C. White [et al.] // Br. J. Dermatol. – 2007. – Vol. 156. – P. 698-704.
163. Havran W.L. Epidermal T cells and wound healing / W.L. Havran, J.M. Jameson // J. Immunol. – 2010. – Vol. 184. – P. 5423-5428.
164. Heng G.U. Survey on Atopic Dermatitis in China / G.U. Heng, Y. Yan, C.Kun // Chinese Journal of Dermatology. – 2000. – Vol. 33, No. 6. – P. 379-382.
165. Howell M. Cytokine modulation of atopic dermatitis filaggrin skin expression / M. Howell, B. Kim, P. Gao [et al.] // J. Allergy Clin. Immunol. – 2007. – Vol. 120. – P. 150-155.
166. Ig E-SpecificImmunoadsorption for Treatment of Recalcitrant Atopic Dermatitis / M. Kasperkiewicz, S. Süfke, E. Schmidt, D. Zillikens // JAMA Dermatol. – 2014. – Vol. 150. – P. 1350–1351.
167. Interventions to reduce Staphylococcus aureus in the management of atopic eczema / A.J. Birnie, F.J. Bath-Hextall, J.C. Ravenscroft, H.C. Williams // Cochrane Database Syst. Rev. – 2008. – Vol. 3. – CD003871.
168. Investigating international time trands in the incidence and prevalence of atopic eczema 1990–2010: a systemic review of epidemiological studies / I.A. Deckers, S. McLean, S. Linsen [et al.] // PLoS One. – 2012. – Vol. 7. – e39803.
169. Investigation of cytokine levels and their association with SCORAD index in adults with acute atopic dermatitis / E. Vakirlis, E. Lazaridou, T.G. Tzellos [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2011. – Vol. 25. – P. 409–416.
170. Is serum total Ig E levels a good predictor of allergies in children? / H. Atwani, A. Rehman, S. Ashraf, A. Hassan // J. Pak. Med. Assoc. – 2009. – Vol. 59. – P. 698–702.
171. Kallikrein 5 induces atopic dermatitis-like lesions through PAR2-mediated thymic stromal lymphopoietin expression in Netherton syndrome / A. Briot, C. Deraison, M. Lacroix [et al.] // J. Exp. Med. – 2009. – Vol. 206. – P. 1135–1147.
172. Lactosomes: Structural and Compositional Classification of Unique Nanometer-Sized Protein Lipid Particles of Human Milk. / N. Argov-Argaman, J.T. Smilowitz, D.A. Bricarello [et al.] // J. Agric. Food Chem. – 2010. – Vol. 58. – P. 11234–11242.
173. Leung D.Y. Deciphering the complexities of atopic dermatitis: shifting paradigms in treatment approaches / D.Y. Leung, E. Guttaman-Yassky // J. Allergy Clin. Immunol. – 2014. – Vol. 134. – P. 769-779.
174. Lipozencic J. Atopic dermatitis in children and adults / J. Lipozencic, S. Ljubojevic, S. Greguric // Acta Med. Croatica. – 2011. – Vol. 65. – P. 87–96.
175. Low density of sympathetic nerve fibers relative to substance P-positive nerve fibers in lesional skin of chronic pruritus and prurigo nodularis / S. Haas, S. Capellino, N.Q. Phan [et al.] // J. Dermatol. Sci. – 2010. – Vol. 58, No. 3. – P. 193–197.
176. Low-dose anti-Ig E therapy in patients with atopic eczema with high serum Ig E levels / B. Belloni, M. Ziai, A. Lim [et al.] // J. Allergy Clin. Immunol. – 2007. – Vol. 120. – P. 1223-1225.
177. Low-dose methotrexate treatment for moderate-to-severe atopic dermatitis in adults / A. Lyakhovitsky, A. Barzilai, R. Heyman [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2010. – Vol. 24. – P. 43-49.
178. Mack Correa M.C. Management of patients with atopic dermatitis: the role of emollient therapy / M.C. Mack Correa, J. Nebus // Dermatol. Res. Pract. – 2012. – ID: 836931.
179. Mancini A.J. The socioeconomic impact of atopic dermatitis in the United States: a systematic review / A.J. Mancini, K. Kaulback, S.L. Chamlin // Pediatric dermatology. – 2008. – Vol. 25, No.1. – P. 1–6.
180. Matheson M.C. Understanding the evidence for and against the role of breastfeeding in allergy prevention / M.C. Matheson, K.J. Allen, M.L.K. Tang // Clin. Exp. Allergy. – 2012. – Vol. 42, No.6. – P. 827–851.
181. Meltzer E.O. Burden of allergic rhinitis: results from the Pediatric Allergies in America survey / E.O. Meltzer, M.S. Blaiss, M.J. Derebery [et al.] // J. Allergy Clin. Immunol. – 2009. – Vol. 124. – P. 43-70.
182. Modeling human health risks of airborne endotoxin in homes during the winter and summer seasons / V.H. Liao, C.P. Chio, W.C. Chou [et al.] // Sci. Total Environ. – 2010. – Vol. 408, No. 7. – P. 1530–1537.
183. Moderate correlation between quality of life and disease activity in patients with atopic dermatitis / I.M. Haeck, O. ten Berge, G.S.A. van Velsen [et al.] // JEADV. – 2012. – Vol. 26. – P. 236-241.
184. Multidimensional Database for Pruritus Patients – statistical evaluation of clinical characteristics / T. Lotts, D. Klein, E. ChatzIg Eorgakidis [et al.] // Acta Derm. Venereol. – 2009. – Vol. 89. – P. 691.
185. Nankervis H. Mapping randomized controlled trials of treatments for eczema – the GREAT database (the Global Resource of EczemA Trials: a collection of key data on randomized controlled trials of treatments for eczema from 2000 to 2010) / H. Nankervis, A. Maplethorpe, H.C. Williams // BMC dermatology. – 2011. – Vol. 11. – P. 10.
186. Nathan R.A. The burden of allergic rhinitis / R.A. Nathan // Allergy Asthma Proc. – 2007. – Vol. 28. – P. 3–9.
187. Neuroimmune mechanisms in patients with atopic dermatitis during chronic stress. / S.B. Lonne-Rahm, H. Rickberg, H.E. Nour [et al.] // JEADV. – 2008. – Vol. 22. – P. 11-18.
188. Niebuhr M. Innate immunity, allergy and atopic dermatitis / M. Niebuhr, T. Werfel // Curr Opinion Allergy Clin. Immunol. – 2010. – Vol. 10, No. 5. – P. 463–468.
189. Omalizumab therapy in atopic dermatitis: depletion of Ig E does not improve the clinical course-a randomized, placebo-controlled and double blind study / P.M. Heil, D. Maurer, B. Klein [et al.] // J. Dtsch. Dermatol. Ges. – 2010. – Vol. 8. – P. 990-998.
190. One-year treatment with 0.1 % tacrolimus ointment versus a corticosteroid regimen in adults with moderate to severe atopic dermatitis: A randomized, double-blind, comparative trial / J. Mandelin, A. Remitz, H.M. Virtanen [et al.] // Acta Derm. Venereol. – 2010. – Vol. 90. – P. 170–174.
191. Oranje A.P. Practical issues on interpretatons of scoring atopic dermatitis: SCORAD Index, objective SCORAD, patient-oriented SCORAD and three-item severity score / A.P. Oranje // Curr. Probl. Dermatol. – 2011. – Vol. 41. – P. 149-155.
192. Ozdoganoglu T. The burden of allergic rhinitis and asthma / T. Ozdoganoglu, M. Songu // Ther. Adv. Respir. Dis. – 2012. – Vol. 6. – P. 11–23.
193. Parks D.R. Flow cytometry and fluorescence activated cell sorting (FACS) / D.R. Parks, L.L. Lanier, L.A. Herzenberg // The Handbook of Experimental Immunology. – Oxford : Blackwell Scientific Publications, 1986. – Vol. 1. – P. 29.1–29.21.
194. Phytocomponent 4-hydroxy-3-methoxycinnamaldehyde ablates T-cell activation by targeting protein kinase C-θ and its downstream pathways. / U. Akber, B.R. Na, Y.S. Ko [et al.] // Int Immunopharmacol. – 2015. – Vol. 25. – P. 130-140.
195. Placebo-controlled, double-blind, randomized, prospective study of a glycerol-based emollient on eczematous skin in atopic dermatitis: biophysicaland clinical evaluation / M. Breternitz, D. Kowatzki, M. Langenauer [et al.] // Skin Pharmacol. Physiol. – 2008. – Vol. 21. – P. 39-45.
196. Predictors of endotoxin levels in U.S. housing / P.S. Thorne, R.D. Cohn, D. Mav [et al.] // Environ. Health Perspect. – 2009. – Vol. 117, No. 5. – P. 763–771.
197. Prevalence of allergen sensitization among patients with allergic diseases in Guangzhou, Southern China: a four-year observational study / B.Q. Sun, P.Y. Zheng, X.W. Zhang [et al.] // Multidiscip. Respir. Med. – 2014. – Vol. 9. – P. 2.
198. Prevalence of Childhood Atopic Dermatitis: An Urban and Rural Community-Based Study in Shanghai, China / F. Xu, S. Yan, F. Li [et al.] // PLoS One. – 2012. – Vol. 7, No. 5. – e36174.
199. Prurigo as symptom of atopic diseases: aetiological survey in a consecutive cohort of 108 patients / A. Iking, S. Grundmann, E. ChatzIg Eorgakidis [et al.] // J. Eur. Acad. Derm. Vener. – 2013. – Vol. 27, No. 5. – P. 550–557.
200. Pruritus as a leading symptom – clinical characteristics and quality of life in German and Ugandan patients / E. Weisshaar, C.J. Apfelbacher, G. Jäger [et al.] // Br. J. Dermatol. – 2006. – Vol. 155. – P. 957–964.
201. Purwar R. IL-13-stimulated human keratinocytes preferentially attract CD4+CCR4+ T cells: possible role in atopic dermatitis / R. Purwar, T. Werfel, M. Wittmann // J. Invest. Dermatol. – 2006. – Vol. 126. – P. 1043-1051.
202. Ramesh S. Food allergy overview in children / S. Ramesh // Clin. Rev. Allergy Immunol. – 2008. – Vol. 34. – P. 217–230.
203. Regulation of inflammation by interleukin-4: a review of “alternatives” / I.G. Luzina, A.D. Keegan, N.M. Heller [et al.] // Journal of leukocyte biology. – 2012. – Vol. 92. – P. 753–764.
204. Risk of lymphoma following exposure tocalcineurin inhibitors and topical steroids in patients with atopic dermatitis. / F.M. Arellano, C.E. Wentworth, A. Arana [et al.] // Invest. Dermatol. – 2007. – Vol. 127. – P. 808–816.
205. Rona R.J. The prevalence of food allergy: a meta-analysis / R.J. Rona, T. Keil, C. Summers [et al.] // J. Allergy Clin. Immunol. – 2007. – Vol. 120. – P. 638–646.
206. Sensitization to aeroallergens in atopic dermatitis patients: association with concomitant allergic diseases / J. Celakovska, K. Ettlerova, K. Ettler [et al.] // JEADV. – 2015. – Vol. 29. – P. 1500-1505.
207. Sensitization to food and inhalant allergens in relation to age and wheeze amng children with atopic dermatitis / J. Wisniewski, R. Agrawal, S. Minnicizzi [et al.] // Clin. Exp. Allergy. – 2013. – Vol. 43. – P. 1160-1170.
208. Severe Adult Atopic Dermatitis: Treatment with Mycophenolate Mofetil in 8 patients. / I. Ballester, J.F. Silvestre, M. Pérez-Crespo, A. Lucas // Actas Dermosifiliogr. – 2009. – Vol. 100. – P. 883-887.
209. Severe atopic dermatitis is associated with a reduced frequency of IL-10 producing allergenspecific CD4+ T cells / S.L. Seneviratne, L. Jones, A.S. Bailey [et al.] // Clin. Exp. Dermatol. – 2006. – Vol. 31. – P. 689-694.
210. Shmitt J. Atopic exzema in adulthood / J. Shmitt, A. Baurer, M. Meurer // Hautarzt. – 2008. Vol. 59. – P. 841-852.
211. Skin barrier in atopic dermatitis / S. Kezic, N. Novak, I. Jakasa [et al.] // Front Biosci. Landmark Ed. – 2014. – Vol. 19. – P. 542–56.
212. Skypala I. Adverse food reactions–an emerging issue for adults / I. Skypala // J. Am. Diet Assoc. – 2011. – Vol. 111. – P. 1877–1891.
213. Soluble immune receptor serum levels are associated with age, but not with clinical phenotype or disease severity in childhood atopic dermatitis / H. Ott, J. Wilke, J.M. Baron [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2010. – Vol. 24. – P. 395–402.
214. Spergel J. Epidemiology of atopic dermatitis and atopic march in children / J. Spergel // Immunol. Allergy Clin. North. Am. – 2010. – Vol. 30. – P. 269-280.
215. Spergel J.M. From atopic dermatitis to asthma: the atopic march / J.M. Spergel // Ann Allergy Asthma Immunol. – 2010. – Vol. 105. – P. 99–106.
216. Structured education program improves the coping with atopic dermatitis in children and their parents – a multicenter, randomized controlled trial / J. Kupfer, U. Gieler, T.L. Diepgen [et al.] // J. Psychosomatic Res. – 2010. – Vol. 68. – P. 353.
217. Suppression of dust mite extract and 2,4-dinitrochlorobenzene-induced atopic dermatitis by the water extract of Lindera obtusiloba / E.J.Choi, S. Lee, H.H. Kim [et al.] // J. Ethnopharmacol. – 2011. – Vol. 137. – P. 802–807.
218. Tanei R. Clinical analyses of atopic dermatitis in the aged / R. Tanei, K. Katsuoka // J. Dermatol. – 2008. – Vol. 35. – P. 562–569.
219. Tang T. Does “autoreactivity” play a role in atopic dermatitis? / T. Tang, T. Bieber, H. Williams // J. Allergy Clin. Immunol. – 2012. – Vol. 129. – P. 1209–1215.
220. Thaçi D. Malignancy concerns of topical calcineurin inhibitors for atopic dermatitis: facts and controversies // D. Thaçi, R. Salgo // Clin. Dermatol. – 2010. – Vol. 28. – P. 52–56.
221. The effect of summer golidays and sun exposure on atopic dermatitis / A. Patrizi, F. Savoia, F. Giacomini [et al.] // G. Ital. Dermatol. Venereol. – 2009. – Vol. 144. – P. 463-466.
222. The relevance of microbial allergens to the Ig E antibody repertoire in atopic and nonatopic eczema / A.J. Reefer, S.M. Satinover, B.B. Wilson, J.A. Woodfolk // J. Allergy Clin. Immunol. – 2007. – Vol. 120. – P. 156-163.
223. Thomsen S.F. Epidemiology and natural history of atopic diseases / S.F. Thomsen // Eur. Clin. Respir. J. – 2015. – Vol. 24. – P. 135-141.
224. Thorne P.S. Concentrations of bioaerosols, odors, and hydrogen sulfide inside and downwind from two types of swine livestock operations / P.S. Thorne, A.C. Ansley, S.S. Perry // J. Occup. Environ. Hyg. – 2009. – Vol. 6, No. 4. – P. 211–220.
225. Towards global consensus on outcome measures for atopic eczema research: results of the HOME II meeting / J. Schmitt, P. Spuls, M. Boers [et al.] // Allergy. – 2012. – Vol. 67. – P. 1111–1117.
226. Vander Hulst A.E. Risk of developing asthma in young children with atopic eczema: a systematic review / A.E. Vander Hulst, H. Klip, L.P. Brand // J. Allergy Clin. Immunol. – 2007. – Vol. 120. – P. 565–569.
227. Vickery B.P. Skin barrier function in atopic dermatitis / B.P. Vickery // Curr. Opin. Pediatr. – 2007. – Vol. 19. – P. 89–93.
228. Wojdyło A. Antioxidant activity and phenolic compounds in 32 selected herbs / A. Wojdyło, J. Oszmiański, R. Czemerys // Food Chem. – 2007. – Vol. 105. – P. 940–949.
229. Worth A. Food allergy and atopic eczema / A. Worth, A. Sheikh // Curr. Opin. Allergy Clin. Immunol. – 2010. – Vol.10. – P. 226–230.
Додаток А
Опитувальник
Карта (опитувальник) №____
- ПІБ_______________________________________
- Вік________________________________________
- Адреса_____________________________________
- Місце роботи (навчання)__________________________________
- Скільки часу хворіє:
- 1-3 місяці______________
- 3-6 місяців_____________
- 1 рік__________________
- 1-5 років_______________
- 5-10 років______________
- Протягом життя_________
- Відмічається алергічна реакція на: _______________________________________________________________
- Чи є в родині алергологічні захворювання (які):
- Мати________
- Батько_______
- Бабуся_______
- Дідусь_______
- Брат/сестра____
- Супутні патології:
______________________________________________________________
- Чи має місце загострення у зв’язку з:
- Психоемоційні фактори:
- Так ______
- Ні________
- Харчові алергени:
- Так (які)________________________________________________
- Ні__________
- Побутові алергени
- Так (які)_________________________________________________
- Ні_____
- Свербіж:
– Періодичний______
– Помірний________
– Виражений_______
– Сильний__________





