МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ УКРАИНЫ
ХАРЬКОВСКИЙ НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
На правах рукописи
ЛУКЬЯНОВ ИГОРЬ ЭДУАРДОВИЧ
УДК 616.98:579.88-022.7]-036.87-07-08-031.81-036.1
КОМПЛЕКСНОЕ ЛЕЧЕНИЕ УРОГЕНИТАЛЬНЫХ МИКСТ-ИНФЕКЦИЙ (ХЛАМИДИОЗ, ТРИХОМОНОЗ, МИКОПЛАЗМОЗ, ГЕРПЕС)
В КОМБИНАЦИИ С ПРОИЗВОДНЫМИ БЕНЗИМИДАЗОЛА, ОЗОНОТЕРАПИЕЙ И ФОТОТЕРАПИЕЙ
14.01.20 – кожные и венерические болезни
Диссертация на соискание ученой степени
кандидата медицинских наук
Научный руководитель:
Беловол Алла Николаевна,
доктор медицинских наук,
профессор
Харьков – 2015
СОДЕРЖАНИЕ
| Список условных обозначений. | 4 |
| Введение | 5 |
| Раздел 1 Обзор литературы | 11 |
| 1.1 Проблема урогенитального трихомоноза и микст-инфекций | 11 |
| 1.2 Медикаментозные методы лечения протозойно-бактериальных урогенитальных инфекций | 14 |
| 1.3 Немедикаментозные методы лечения хронической урогенитальной микст-инфекции | 21 |
| Раздел 2 Материалы и методы исследований | 29 |
| 2.1 Характеристика обследованных пациентов | 29 |
| 2.2 Лабораторная диагностика Chlamydia, Trichomonas, Mycoplasma, Herpes virus | 32 |
| 2.3 Исследование перекисного окисления липидов и антиоксидантной защиты | 34 |
| 2.4 Оценка врожденного и приобретенного иммунитета | 35 |
| 2.5 Оценка половой и репродуктивной функции | 39 |
| 2.6 Статистическая обработка данных | 39 |
| Раздел 3 Результаты собственных исследований | 41 |
| 3.1 Клинические и социальные особенности больных с урогенитальнымимикст-инфекциями (хламидиоз, трихомоноз, микоплазмоз, герпес) | 41 |
| 3.2 Разработка дополнительной медикаментозной и озонотерапии для улучшения эффективности традиционной этиотропной терапии урогенитальных инфекций | 51 |
| 3.3 Производные бензимидазола, иммунотерапия, озонотерапия в клиническом и микробиологическом излечении больных урогенитальной микст-инфекцией | 56 |
| 3.4 Нормализация перекисного окисления липидов и антиоксидантной защиты у больных, пролеченных по поводу урогенитальной микст-инфекции |
66 |
| 3.5 Динамика показателей врожденного иммунитета у больных урогенитальной протозойно-бактериальной инфекцией после лечения по разработанным методикам | 74 |
| 3.6 Динамика показателей приобретенного иммунитета у больных урогенитальной протозойно-бактериальной инфекцией после лечения по разработанным методикам |
91 |
| 3.7 Коррекция репродуктивной и сексуальной дисфункции у больных урогенитальной микст-инфекцией | 110 |
| Раздел 4 Обсуждение результатов | 130 |
| Выводы | 146 |
| Рекомендации | 149 |
| Список использованных источников | 150 |
| Приложение А Акты внедрения | 172 |
СПИСОК УСЛОВНЫХ ОБОЗНАЧЕНИЙ
АОС – антиоксидантная система
ДК – диеновые коньюгаты
ИППП – инфекции, передаваемые половым путем
ИФА – иммуноферментный анализ
КФМТ – квазилазерная фотомагнитотерапия
ЛГ – лютеинизирующий гормон
ЛКТ – лизосомально-катионный тест
МДА – малоновый диальдегид
НСТспон. – тест спонтанного восстановления нитросинего тетразолия
НСТстим. – тест стимулированного восстановления нитросинего тетразолия
НЭИ – низкоэнергетическое электромагнитное излучение
ОАОА – общая антиоксидантная активность
ОАОЗ – общая антиоксидантная защита
ОТ – озонотерапия
ПЗФ – показатель завершенности фагоцитоза
ПОЛ – перекисное окисление липидов
ПЦР – полимеразная цепная реакция
РВ ОАОА – резервные возможности общей антиоксидантной активности
СРО – свободнорадикальное окисление
СЦК – средний цитохимический коэффициент
ТЛ – титр лизоцима
УГВИ – урогенитальная герпес-вирусная инфекция
УППТ – усилители антипротозойных терапии
ФП – фагоцитарный показатель
ФСГ – фолликулинстимулирующий гормон
ФЧ – фагоцитарное число
ЦИК – циркулирующие иммунные комплексы
ШО – шиффовые основания
5-НИ – 5-нитроимидазол
ВВЕДЕНИЕ
Актуальность темы. Актуальность проблемы урогенитальных инфекций обусловлена не только их значительной распространенностью, но и многофокусностью поражения половых органов, высокой частотой осложнений (сексуальной дисфункцией, бесплодием, патологией беременности, родов и новорожденных), а также отсутствием эффективной терапии и частыми рецидивами заболеваний [35, 53, 68, 69, 76, 79, 80, 82, 83, 85, 86, 88, 111, 139, 145, 146, 147]. Течение патологического процесса, особенно при сочетанной урогенитальной инфекции, как правило, бывает мало- и асимптомным с высокой торпидностью к проводимой терапии, с формированием многофокусных поражений, что приводит к возникновению условий для появления рецидивов заболевания [85, 113, 118, 136, 141].
По мнению большинства авторов в последние годы инфекции, передающиеся половым путем, (ИППП) как моноинфекция встречаются редко и представляют собой смешанный протозойно-бактериальный процесс, что определяет топографию и выраженность поражения [10, 60, 84]. При этом важны как биологические свойства микроорганизмов, формы их паразитирования, так и свойства макроорганизма, определяющие недостаточность иммунологического контроля. Это приводит к развитию различных видов персистенции с длительным инфицированием с прогрессирующей деструкцией пораженных тканей и нарушением функции. Лечение таких больных только традиционными этиотропными препаратами часто не дает ожидаемых результатов. Необходима целевая патогенетическая терапия [2, 43, 44, 71, 87, 97, 98].
При сочетанной протозойно-бактериальной микст-инфекции, наблюдаемой в 80–90 % случаев хронических, многоочаговых поражений, восстановление активности иммунной системы является условием успеха терапии, включающей антипротозойные, антибактериальные, противовирусные средства, а также патогенетическое лечение [2, 11, 71, 97, 136]. Патогенные микробиоценозы урогенитального тракта у 17–22 % супружеских пар приводят к возникновению бесплодия, а у беременных женщин более чем в 50 % случаев вызывают самопроизвольные аборты или преждевременные роды [119, 163, 180]. У мужчин микст-инфекция мочеполовых органов у 35 % осложняется поражением предстательной железы, у 16 % – придатков яичек, у 5 % –мочевого пузыря [88, 111].
Возможности одновременного воздействия на возбудителей и организм больных выявлены при системном и местном применении методов озонотерапии (ОТ). Наличие озона, молекулярного и атомарного кислорода, а также и промежуточных продуктов окисления (озонидов, пероксидов, свободных радикалов, синглетного кислорода и т. д.) вызывает терапевтический эффект [120]. Доказан антимикробный, фунгицидный, антивирусный, противовоспалительный, иммуномодулирующий и дезинтоксикационный потенциал ОТ. Активные формы кислорода стимулируют обменные процессы и улучшают реологические свойства крови [3, 40, 56, 57, 62, 102]. Поэтому ОТ представляется перспективной при лечении хронических, осложненных ИППП в качестве сопутствующей, патогенетической.
Таким образом, проблема хронической микст-инфекции при наличии протозойно-микробных ассоциаций возбудителей вызывает необходимость разработки и поиска новых способов фармакологического и немедикаментозного воздействия для обеспечения эффективной санации организма, сокращения длительности лечения, предупреждения развития осложнений и рецидивов заболевания.
Связь работы с научными программами, планами, темами. Работа выполнена в соответствии с планом научно-исследовательских работ Харьковского национального медицинского университета и является фрагментом двух тем кафедры дерматологии, венерологии и медицинской косметологии «Комплексное лечение инфекционных уретритов с использованием физиотерапевтических средств» (№ госрегистрации 0111U001397), «Обоснование методологии восстановления сексуального и репродуктивного здоровья мужчин с эякуляторного нарушениями» (№ госрегистрации 0113U002275). Диссертант выполнил фрагменты, посвященные обоснованию медикаментозно-физиотерапевтической тактики при хронической сочетанной урогенитальной инфекции.
Цель и задачи исследования. Цель – повысить эффективность лечения урогенитальных микст-инфекций, вызванных хламидиями, трихомонадами, микоплазмами, герпесвирусами, путем разработки комплекса физико-химических методов терапевтического воздействия на их основные патофизиологические механизмы.
Задачи исследования:
- Выявить распространенность смешанных урогенитальных инфекций, социально-демографические особенности и клинико-лабораторные проявления при заражении трихомонадами, хламидиями, микоплазмами, герпесвирусами и условно-патогенной микрофлорой.
- Разработать методы комплексного лечения больных с урогенитальной микст-инфекцией с применением производных бензимидазола, общей и местной озонотерапии и квазилазерной электромагнитной фототерапии.
- Определить роль перекисного окисления липидов и общей антиоксидантной системы в патогенезе смешанной протозойно-бактериальной инфекции мочеполовых органов и возможность их коррекции с помощью разработанных методов лечения.
- Оценить нарушения врожденного и приобретенного иммунитета у больных с урогенитальной микст-инфекцией и возможность их нормализации с помощью разработанных методов лечения.
- Оценить нарушения репродуктивной и копулятивной функции у больных с урогенитальной микст-инфекцией и возможность их нормализации с помощью разработанных методов лечения.
Объект исследования: сочетанные урогенитальные инфекции.
Предмет исследования: эффективность озоно- и лазеротерапии в комплексе с усилителями противопротозойной терапии; динамика показателей защитных сил организма больных с урогенитальными микст-инфекциями.
Методы исследования: клинические, лабораторные, биохимические, иммунологические и статистические.
Научная новизна полученных результатов. Изучена частота и характер микробных ассоциаций в зависимости от возраста, пола и социально-семейного положения, а также их взаимосвязь с перенесенной и сопутствующей патологией. Определены информативность клинических, лабораторных и инструментальных методов исследования при выявлении возбудителей и топическом анализе поражений при микст-инфекции. Впервые проведена оценка эффективности лечения протозойно-микробной микст-инфекции традиционной терапией при ее усилении оригинальными медикаментозными и физиотерапевтическими средствами. Разработан способ преодоления устойчивости трихомоноза к традиционному лечению за счет сочетанного применения препаратов группы 5-нитроимидазолов с противопаразитарными препаратами. Разработана эффективная терапия больных с урогенитальной микст-инфекцией с применением оригинальных методик общей и местной озонотерапии. Впервые при урогенитальной микст-инфекции проведено исследование метаболизма (перекисное окисление липидов и антиоксидантная система) и оценку состояния врожденного и приобретенного иммунитета. Впервые изучены возможности коррекции репродуктивной и сексуальной дисфункции у больных с урогенитальной микст-инфекцией методами квазилазерной фотомагнитотерапии (КФМТ) в комплексе с озонотерапией.
Практическое значение полученных результатов. Разработана терапия, позволяющая преодолеть устойчивость трихомонад к лечению нитроимидазольными препаратами в виде 10-дневных курсов противоглистных препаратов (альбендазол или мебендазол), что позволяет достигать элиминации трихомонад (патент на полезную модель № 5477 от 15.03.05; патент на полезную модель № 5478 от 15.03.05; патент на полезную модель № 75397 от 26.11.12; патент на полезную модель № 80882 от 10.06.13). Предложен способ лечения протозойно-бактериальных уретропростатитов с использованием общей и местной озонотерапии, который повысил эффективность купирования воспалительных очагов в мочеполовых органах и обеспечил профилактику их рецидивов (патент на полезную модель № 54447 от 10.11.10; патент на полезную модель № 61201 от 11.07.11). Для контроля состояния оксидантного метаболизма при озонотерапии предложен способ экспресс-определения общей антиоксидантной активности плазмы (патент на полезную модель № 66050 от 26.12.11). Разработан и внедрен способ лечения озонотерапией с квазилазерной магнитотерапией в сочетании с медикаментозной терапией и психокоррекцией, позволивший у больных с урогенитальной микст-инфекцией добиться ликвидации копулятивных и репродуктивных дисфункций.
Результаты работы используются в работе Коммунального учреждения «Запорожский областной кожно-венерологический клинический диспансер» Запорожского областного совета, Коммунального учреждения «Одесский областной кожно-венерологический диспансер», Полтавского областного клинического кожно-венерологического диспансера, а также в учебном процессе кафедры дерматовенерологии и ВИЧ/СПИДа Харьковской медицинской академии последипломного образования.
Личный вклад соискателя. Диссертантом самостоятельно проведен анализ литературных данных, разработан план исследований, подобраны апробированные методы исследований. Соискателем проведены клинико-лабораторные обследования больных, их лечение разработанным методом, обработка данных. Научные положения и выводы сделаны исключительно автором.
Автором совместно с Ю.И. Козиным, сотрудником Харьковского национального медицинского университета, изучены особенности процессов перекисного окисления липидов, антиоксидантной защиты, динамика показателей врожденного и приобретенного иммунитета у больных с сочетанной протозойно-урогенитальной микст-инфекцией при лечении их методами озонотерапии, установлена возможность коррекции репродуктивно-сексуальной дисфункции методами квазилазерной фотомагнитотерапии и обосновано включение в комплексную терапию метода озонотерапии и противопротозойных препаратов.
Диссертантом не были использованы результаты и идеи соавторов публикаций.
Апробация работы. Основные положения диссертации представлены на научно-практической конференции с международным участием «Актуальні питання профілактики, діагностики та лікування в практиці сімейного лікаря» (Харьков, 2010), XXXIII Международной научно-практической конференции «Застосування лазерів у медицині та біології» (Ужгород, 2010), V Украинско-Русской научно-практической конференции, ІV Азиатско-Европейской научно-практической конференции «Озон в биологии и медицине» (Одесса, 2010), Научно-практической конференции с международным участием «Інноваційні аспекти технологій в урології» (Киев, 2012), Научно-практической конференции с международным участием «Актуальні питання профілактики, діагностики та лікування в практиці сімейного лікаря» (Харьков, 2012), VІ Украинско-Российской научно-практической конференции «Озон в биологии и медицине» (Одесса, 2012), Научно-практической конференции «Урология, андрология, нефрология» (Харьков, 2013), IX Всероссийской научно-практической конференции с международным участием «Озон, активные формы кислорода, оксида азота и высокоинтенсивные физические факторы в биологии и медицине» (Нижний Новгород, 2013).
Публикации. По материалам диссертации опубликована 21 работа, в том числе 6 статей в специализированных научных изданиях (1 – в моноавторстве), 1 статья в зарубежном печатном издании, 2 статьи в журналах, входящих в международную наукометрическую базу Российский индекс научного цитирования, 7 патентов Украины на полезные модели, 7 тезисов.
РАЗДЕЛ 1
ОБЗОР ЛИТЕРАТУРЫ
1.1 Проблема урогенитального трихомоноза и микст-инфекций
Конец ХХ и начало ХХI столетия характеризуется постоянным ростом заболеваемости ИППП с ежегодным инфицированием, по данным ВОЗ, более 330 миллионов населения, приобретая в некоторых странах мира характер эпидемии. При этом наиболее частыми возбудителями являются Trichomonas vaginalis, Сhlamydia trachomatis, Ureaplasma urealyticum, Herpes simplex virus [36, 42, 68, 69, 76, 87, 99, 136, 138, 172, 182, 196]. В различных регионах мира ИППП имеют свои эпидемиологические особенности. Например, во Франции, США и Норвегии наиболее часто диагностируется урогенитальный хламидиоз. Ежегодно в мире регистрируется более 90 миллионов новых случаев урогенитального хламидиоза [81, 85, 105, 144, 145, 148, 152].
Среди ИППП первое место в мире по распространенности занимает трихомоноз с ежегодной регистрацией около 200 миллионов новых случаев заболевания [24, 172, 182, 192, 196]. К примеру, в США ежегодно регистрируется 3 миллиона новых случаев заболевания женщин трихомонозом, что составляет 2,4 % от общего уровня заболеваемости. Среди беременных трихомонады выделяют у 12,6 %, среди обратившихся по поводу влагалищных выделений – у 18–50 %, а среди заключенных и проституток – у 50–60 % [138, 147, 179, 189]. В последние годы в странах СНГ трихомоноз составляет до 75 % среди всех ИППП [6, 7, 29]. В Украине среди больных венерическими заболеваниями 51,5 % составляют больные трихомонозом и трихомонадно-ассоциированной инфекцией. Кроме этого в Украине, как и в других регионах, отмечается рост заболеваемости ИППП за счет увеличения частоты хламидиоза и уреаплазмоза на 56 % и 45 % относительно всех ИППП [109]. Росту урогенитальных заболеваний способствуют негативные социально-экономические факторы, в частности безработица, алкоголизм и наркомания, проституция, а в последнее время – массовая миграция населения, низкое качество лабораторной диагностики, снижение уровня противоэпидемической и санитарно-просветительной работы [53, 81, 82, 83, 86, 105,129, 141, 150, 166, 167, 171].
Среди мужского населения, по данным различных авторов, уровень заболеваемости трихомонозом составляет от 6 до 58 %. В развитых странах у 15 % мужчин с негонококковыми уретритами выделяют вагинальные трихомонады и при отсутствии жалоб – еще у 5 % [1, 13, 92, 117, 138, 139, 147]. В странах восточной Европы и развивающихся странах частота уретритов с определяемыми трихомонадами значительно выше [1]. Трихомонадный уретрит у мужчин осложняется многофокусным поражением: простатитом у 48 % больных, эпидидимитом у 8 %, везикулитом у 7 %, купперитом у 8 % и циститом у 4% больных [1, 13, 27, 29, 42, 49, 89, 181, 183]. Среди мужчин г. Москвы, обратившихся в кожно-венерологические диспансеры, по данным М.М. Васильева, больных трихомонозом было 80 %. Они, как правило, не женаты или разведены, в возрасте 18–39 лет и имеют скрытое течение заболевания. При смешанной урогенитальной инфекции у 40–50 % больных выявлялось трихомонадное носительство [15].
T. vaginalis секретирует растворимые антигены, которые нейтрализуют антитела и цитотоксические Т-лимфоциты. Кроме того, вагинальная трихомонада может сорбировать белки плазмы хозяина на своей поверхности, что препятствует иммунной системе макроорганизма идентифицировать ее как чужеродный организм [91, 138]. Выявляемые антитела свидетельствуют о наличии активной или ранее перенесенной трихомонадной инфекции. Реинфекция T. vaginalis у человека не вызывает иммунной защиты [91, 103, 138].
В организме больных урогенитальным трихомонозом развивается гиперреакция замедленного типа с антигенной мимикрией и персистированием возбудителя, что может индуцировать аутоиммунные процессы. Сложность патогенеза урогенитального трихомоноза обусловлена состоянием клеточного и гуморального иммунитета, взаимовлияниями различных патогенных микроорганизмов, которые формируют индивидуальный микробиоценоз половых путей [54, 119].
Урогенитальный трихомоноз крайне редко встречается как моноинфекция и, как правило, это смешанный протозойно-бактериальный процесс, поэтому топография и выраженность поражения органов мочеполовой системы во многом проявляется именно смешанной инфекцией [6, 7, 54, 98, 99, 136, 73, 107, 189]. При этом в литературе не уделяется должного внимания выявлению различных микроорганизмов в ассоциациях с Trichomonas vaginalis. Очень мало работ, посвященных изучению патогенеза смешанных микробиоценозов хламидий, трихомонад, микоплазм и вирусов [54, 60, 190]. Так смешанная гонорейно-трихомонадная инфекция диагностируется у 29,2 % больных, а у 37,5 % – ассоциации двух-трех микроорганизмов. Сочетанная трихомонадно-бактериальная инфекция выявляется у 64,1–66,7 % больных с прямой корреляцией между частотой микст-инфекции и длительностью заболевания [10, 11, 73, 97, 99, 136].
Большинство авторов отмечают, что урогенитальный трихомоноз как моноинфекция встречается только у 10,5 % больных, а его смешанные формы с другими инфекциями наблюдаются у 89,5 % пациентов. Трихомонады могут быть ассоциированными с микоплазмами – 47,3 %, гонококками – 29,1 %, гарднереллами – 31,4 %, уреаплазмами – 20,9 %, хламидиями – 18,2 % и грибами – 15,7 % [6, 7, 60, 107]. Наиболее частыми членами микробиоценоза с влагалищными трихомонадами были микоплазмы (66,3 %), среди которых чаще выявляли Ureaplasma urealyticum (53,9 %) [119, 142]. Частота инфицирования влагалищными трихомонадами и хламидиями среди беременных из группы риска составляет 86,9 % и 76,2 % для женщин, страдающих воспалительными заболеваниями органов малого таза [6, 7, 50, 147, 179].
Способность урогенитальных трихомонад к захвату и резервированию различных патогенных и условно-патогенных микроорганизмов и в частности хламидий, гонококков, микоплазм, вирусов и грибов приводит к снижению антигенного воздействия на организм, уменьшению фагоцитарной реакции и снижению иммунного ответа на инфекционные факторы. Именно резервирующая роль трихомонад приоритетна в формировании патогенных микробиоценозов урогенитального тракта, что способствует персистированию различных микроорганизмов в организме человека [11, 183].
При формировании патогенного микробиоценоза необходимо учитывать, что трихомонады угнетают рост грибов рода Candida, палочку Дедерлейна, коагулазонегативных стафилококков in vitro, однако не выявляют антагонизма в отношении грамнегативных палочек, стрептококков, коагулазопозитивных стафилококков и сарцин [94, 107, 131].
1.2 Медикаментозные методы лечения протозойно-бактериальных урогенитальных инфекций
Лечение мочеполового трихомоноза представляет собой насущную проблему современной дерматовенерологии в связи с высокой заболеваемостью, учащением числа неудач и отсутствием адекватной терапии резистентного трихомоноза. Это приводит к осложнениям воспалительного характера и существенно влияет на репродуктивное здоровье населения [18, 103, 174, 178].
Современный этап в терапии урогенитального трихомоноза был обозначен в 1959 году, когда французы Casar и Julou синтезировали метронидазол – производное 5-НИ – высокоактивный в отношении анаэробных бактерий и простейших. При лечении больных неосложненным трихомонадным уретритом и кольпитом наиболее широко применяют три противоцистоидных препарата из группы 5-НИ: метронидазол, тинидазол и орнидазол. Они мало различаются между собой по спектру действия, однако имеют некоторые отличия по степени активности в отношении T. vaginalis. В клинической практике применяются также другие препараты этой группы: секнидазол, ниморазол, тернидазол, сатранидазол. Однако они используются не так широко, как первые три, поскольку не обладают существенными преимуществами по спектру действия и степени антимикробной (антипротозойной) активности [138, 155]. 5-НИ сами по себе неактивны и оказывают свое действие только после трансформации в клетках бактерий или простейших, имеющих нитроредуктазы – ферментные системы, способные восстанавливать нитрогруппу. Восстановленные активные формы метронидазола нарушают репликацию ДНК и синтез белка, что приводит к быстрой гибели клетки – в пределах 5 часов после поступления препарата внутрь цитоплазмы простейшего [155]. Возможность применения 5-НИ перорально обусловлено их высокой биодоступностью, временем полувыведения Т½ – от 10 до 20 часов, кумулятивным эффектом при курсовом лечении и хорошим проникновением в органы, ткани и биологические жидкости при высоких терапевтических дозах. Все это позволяет в ряде случаев успешно проводить лечение ударной дозой однократно с пиковой концентрацией препарата в крови до 50 % принятой внутрь дозы. 5-НИ метаболизируются в печени с образованием активных метаболитов, которые выводятся в 60–85 % с мочой [155]. Как американские рекомендации Центров по контролю заболеваемости – CDC (2010), так и стандарты Российской Федерации (2008) предполагают лечение метронидазолом и тинидазолом или в виде однократного приема 2 г, или метронидазола по 0,5 г 2 раза в день в течение 7 дней [55, 151]. При смешанных инфекциях противотрихомонадные препараты сочетают с соответствующими антимикробными средствами, при этом сначала проводят противотрихомонадную терапию [60, 110].
В последнее время в клинической практике излечиваемость больных трихомонозом с помощью метронидазола снизилась. Соответственно отсутствие эффекта возросло от 15 % до 40,2 % [54, 156, 160, 193]. Причинами безуспешной терапии трихомоноза могут быть: нарушения всасываемости после перорального приема, возрастание количества устойчивых штаммов, «захват» нитрорадикала ассоциированными бактериями, а также «рефрактерные» случаи заболевания с недостаточной концентрацией препарата из группы 5-НИ в очагах поражения [156, 193]. Последнее наблюдается вследствие: 1) нарушения режима приема препарата; 2) нарушения всасывания в желудочно-кишечном тракте; 3) антагонистических взаимоотношений с другими принимаемыми препаратами (барбитуратами, рифампицином); 4) нарушения васкуляризации органов-мишеней из-за рубцовых изменений; 5) локализации T. vaginalis в железистом аппарате мочеполовых органов [138, 193]. Возможными причинами неэффективности 5-НИ могут быть: фальсификация лекарственных средств; нейтрализация нитрорадикала анаэробными бактериями – «ложная резистентность»; низкая концентрация цинка в сыворотке крови; дисбиоз с изменением видового и количественного состава условно-патогенной микрофлоры, а также клиническая рефрактерность с перекрестной резистентностью ко всем 5-НИ, характеризующаяся снижением активности нитроредуктаз и гидрогеназ [104, 131, 156, 174, 193].
В литературе обозначены возможные пути преодоления клинической рефрактерности трихомоноза за счет: увеличения дозировок рекомендуемых препаратов и пролонгации курса лечения; сочетания различных противотрихомонадных средств и лечения эритромицином или амоксициллином перед повторным курсом метронидазола; сочетания 5-НИ с ферментативными препаратами; иммунотерапии вакцинами «СолкоТриховак» или «Гинантрен» [68, 69, 70]. Тем не менее, терапия трихомоноза является непростой проблемой, так как назначение 5-НИ не всегда дает положительный результат, а увеличение дозировки оказывает токсическое действие на пациента. Одной из основных причин неудач лечения (до 44 % случаев) является наличие резистентных к антипротозойным препаратам штаммов T. vaginalis, с неэффективностью лечения трихомоноза [68, 69, 70, 174, 193]. Столь значимые трудности в терапии трихомоноза показывают необходимость поиска новых методов эрадикации T. vaginalis, особенно при ее сочетании с другими видами урогенитальной микст-инфекции.
Широкое распространение, множественные и тяжелые осложнения, захватывающие репродуктивную функцию, трудности диагностики и терапии подтверждают, что урогенитальнй хламидиоз является серьезной проблемой [63, 146, 157, 194]. По оценке ВОЗ, ежегодно в мире регистрируется более 90 миллионов новых случаев урогенитального хламидиоза [178, 196]. Врожденный, генетически обусловленный иммунитет при хламидийной инфекции отсутствует, а перенесенное заболевание не образовывает стойкого приобретенного иммунитета. Истощение резервных возможностей (фагоцитарного звена, системы комплемента и лизоцима) приводит к частым рецидивам заболевания [111, 118, 164, 168, 194]. У женщин возникают многофокусные воспалительные заболевания органов малого таза, которые приводят к бесплодию, внематочной беременности, диспареунии и нарушениям менструального цикла [111, 146, 158, 163]. Лечение урогенитального хламидиоза и его рецидивов продолжает оставаться весьма актуальной задачей, несмотря на то, что постоянно появляются новые схемы лечения данной инфекции [111, 118]. Частота рецидивов хламидиоза, несмотря на применение авторами различных высокоактивных противохламидийных препаратов, колеблется от 2 % до 50 % и более [118, 193, 194].
Этиотропными препаратами, активными против урогенитальных штаммов Сhlamydia trachomatis, являются субстанции, которые способны накапливаться внутриклеточно. Это тетрациклины (доксициклин), макролиды (азитролицин, кларитромицин и др.), фторхинолоны (офлоксацин, ципрофлоксацин, пефлоксацин, левофлоксацин и др.) [8, 10, 12, 13, 19, 39, 73, 78]. В то же время монотерапия антибиотиками урогенитального хламидиоза из-за сложного жизненного цикла хламидий часто малоэффективна [25, 26, 143]. Кроме того, отсутствие чувствительности элементарных телец хламидий к антибиотикам, цитокинам, антителам и комплименту, а также неадекватность функционирования иммунной системы, является основанием к назначению иммуномодуляторов, адаптогенов и α-, β-, γ-интерферонов [39, 133, 143, 153, 154, 164]. Стимуляция выработки эндогенного интерферона с помощью индукторов – циклофена и неовира – дает позитивные результаты в комплексном лечении хламидийной инфекции [39, 154]. Также при хронической инфекции и угнетении иммунитета рекомендуют препараты тимуса, адаптогены, биогенные стимуляторы [19, 173]. Усиливают активность антибактериальных препаратов и протеолитические ферменты, лизирующие нежизнеспособные ткани, разжижающие секрет желез, повышающие интенсивность обменных процессов [18, 115]. Тем не менее, несмотря на наличие множества методик лечения урогенитального хламидиоза, актуальность проблемы не уменьшается. Это требует разработки новых методов терапии урогенитального хламидиоза с учетом всех этапов развития заболевания, его осложнений и последствий [19, 30, 31, 121].
В группу микоплазмозов человека входят 15 видов микоплазм, заведомо патогенным из которых является Mycoplasma pneumoniae, а три вида микоплазм, названных генитальными (Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum), могут быть патогенными при определенных условиях [21, 50, 142, 149, 162, 165, 175, 176, 188]. M. hominis при ее концентрации более 104 КОЕ/мл играет важную роль в развитии воспалительных заболеваний мочеполовых путей, особенно бактериального вагиноза в ассоциации с облигатными анаэробами и Gardnerella vaginalis [50, 127, 187]. U. urealyticum часто бессимптомно паразитирует у клинически здоровых людей, особенно у женщин (40–95 %) с повышенной сексуальной активностью и частой сменой половых партнеров [142, 149]. Среди половых партнеров U. urealyticum выявляется, по данным как отечественных, так и зарубежных исследователей, у 43 % больных [21, 50, 149]. Определяющую роль U. urealyticum играет в патогенезе реактивных, асимметричных артритов, эпидидимитов, простатитов и везикулитов, нарушении подвижности сперматозоидов [27, 32, 38, 89, 112, 142]. В результате микоплазменных воспалительных заболеваний органов малого таза нарушается возможность зрелой яйцеклетки пройти в полость матки, а оплодотворенной яйцеклетке, которая крепится к эндометрию, грозит преждевременное абортирование [64, 65, 149, 162].
Учитывая биологические свойства (отсутствие клеточной стенки), микоплазмы устойчивы ко всем препаратам, действие которых связано с синтезом белков клеточной стенки микроорганизмов (пенициллины и цефалоспорины), но чувствительны к препаратам, которые ингибируют синтез мембранных и внутрицитоплазматических белков (тетрациклины, макролиды и фторхинолоны) [41]. В то же время целый ряд исследователей отмечают периодически возникающую резистентность возбудителя к препаратам тетрациклинового ряда, макролидам и фторхинолонам [64, 65, 161]. Поэтому этиотропная терапия больных микоплазмозом должна быть комплексной с учетом клинической формы и тяжести заболевания, состояния иммунного статуса, наличия осложнений и сопутствующих заболеваний [36, 37, 41, 165]. Большое количество исследователей указывают на большой процент рецидивов после лечения микоплазмозов [35, 36, 125, 195]. При этом ряд авторов для повышения эффективности лечения рекомендуют назначение иммунокорректоров и интенсивное местное лечение [33, 51, 125, 165]. Вопросы научного обоснования методов лечения микоплазмозов остаются нерешенными, что требует дополнительных исследований в этой области [122, 127].
Урогенитальная герпес-вирусная инфекция (УГВИ) характеризуется преобладанием латентных форм с экстрагенитальными поражениями нервной системы и внутренних органов. УГВИ более чем в 40 % случаев сочетается с другими ИППП (хламидийной, микоплазменной, трихомонадной) [99]. При этом, несмотря на комплексное применение противовирусных препаратов, неудачи в лечении и профилактике УГВИ варьируют от 15 до 50 %. Прежде всего это зависит от состояния иммунной реактивности и характера взаимодействия макроорганизма с сочетанной бактериально-вирусной инфекцией [52]. При сочетанной инфекции нарушения иммунного статуса более выражены и менее всего поддаются традиционному лечению [34, 52, 153]. Снижение эффективности традиционной терапии способствует активации условно-патогенной микрофлоры, смене возбудителя и суперинфекции, что, в свою очередь, приводит к затяжному течению болезни и осложнениям [64, 65, 96]. До настоящего времени только 27 % пациентов с диагнозом УГВИ получают противовирусную терапию, из них треть – местное лечение. Если учесть, что 60 % пациентов имеют атипичную (клинически мало- или бессимптомную) форму вируса простого герпеса 2 типа, то в целом около 95 % пациентов с УГВИ не получают лечения [177].
В лечении УГВИ выделяют три основных подхода: применение противовирусной химиотерапии, иммунотерапии и комбинации этих методов [35, 52, 177]. Проблема терапии УГВИ остается нерешенной, что связано с отсутствием четкого понимания механизмов заболевания [51]. В доступной литературе мало данных о действии лечебных факторов на показатели системного и местного иммунитета, а также о показаниях и принципах иммунокорригирующей терапии [22, 51]. Была разработана методика лечения и профилактики больных, страдающих хронической герпес-вирусной инфекцией, с учетом выраженности иммунологических нарушений и тяжести клинического течения заболевания. В программу лечения входят пять групп препаратов: 1) антиоксидантные; 2) аномальные нуклеозиды (ацикловир и его аналоги); 3) препараты интерферона-α; 4) иммунокорригирующие препараты; 5) индукторы интерферона. Данная методика позволяет добиться быстрого наступления стойкой клинико-лабораторной ремиссии у больных [34, 48, 97].
Применение в терапии больных УГВИ большого числа препаратов иммуномодулирующего действия осуществляется в основном при моноинфекции, и практически отсутствуют, за редким исключением, данные об их применении при сочетанной ИППП [23].
Таким образом, при сочетанной урогенитальной микст-инфекции следует добиваться гарантированной элиминации возбудителей не только в мочеполовых органах, но и организме больных в целом. Иногда это очень сложно. Для этого необходимо снятие блокады факторов клеточного и гуморального иммунитета, улучшение общей антиоксидантной защиты с помощью новых способов фармакологического и нефармакологического воздействия, основанных на комбинированном применении антипротозойных, противовирусных и антибактериальных средств (этиотропная терапия), а также физических методов лечения (фототерапия, ОТ) [115, 122].
1.3 Немедикаментозные методы лечения хронической урогенитальной микст-инфекции
Проведенный анализ литературных данных показал распространение сочетанных урогенитальных инфекций у лиц репродуктивного возраста, с бессимптомными или малосимптомными клиническими проявлениями, с многофокусным поражением и длительной персистенцией возбудителя с частыми рецидивами и осложнениями. В то же время подавляющее большинство исследователей указывают на снижение эффективности традиционной медикаментозной терапии и высокую торпидность к ней даже при лечении высокими дозами этиотропных препаратов [31, 58, 118, 122]. Поэтому все большую актуальность приобретает разработка новых способов нефармакологического (физиотерапевтического) воздействия на организм больных. При этом местные реакции за счет активации афферентов соматосенсорной системы и факторов локальной сосудистой регуляции модулируют импульсную активность нервных волокон, изменяют тонус микроциркуляторного русла. При этом сосудистая регуляция реализуется не только аксон-рефлексом и изменениями ионного баланса тканей, но также выделением из эндотелия биологически активных веществ (плазмакинины, простагландины, субстанция Р, цитокины, оксид азота) и медиаторов (норадреналин, ацетилхолин, гистамин, серотонин и аденозин). Генерализованные лечебные эффекты физических факторов на организм как специфические, так и неспецифические проявляются в функциональных нейрогуморальных сдвигах (биофизических, биохимических, иммунных и др.), которые приводят к усилению устойчивости организма, повышению уровня мобилизации его функциональных резервов адаптации. При этом за счет повышения активности гипоталамо-гипофизарной системы угнетается активность воспаления, восстанавливается трофика тканей, регуляция метаболизма, проницаемость гистогематических барьеров. В инфильтративно-пролиферативную фазу воспаления обычно назначают СВЧ-терапию, низкочастотную магнитотерапию, лазерное излучение. В конечной фазе репаративной регенерации целесообразны красное лазерное излучение, высокочастотная магнитотерапия, ультразвук и лечебные грязи [9, 23, 46, 47, 72, 76].
При урогенитальной микст-инфекции у мужчин часто поражается предстательная железа (75–89 %), которая становится резидуальным очагом длительной персистенции возбудителей [27, 121]. При лечении хронических бактериальных простатитов, широко применяется низкоинтенсивное лазерное излучение малой мощности. Оно мобилизует защитные силы организма, оказывает обезболивающее, седативное и стимулирующее действие, не вызывая побочных эффектов. Активируя химические реакции, лазерный луч повышает уровень внутриклеточного метаболизма и нормализует энергетический гомеостаз, трофику и капиллярный кровоток [48, 74, 75]. Глубокое проникновение в биологические ткани (на 6 см) инфракрасным излучением с отсутствием побочных эффектов получено у больных хроническим простатитом при применении лазерного терапевтического аппарата «Узор» с длиной волны λ = 0,89 мкм. Облучение гелий-неоновым лазером с электростимуляцией на аппарате АЭЛТУ-01 «Ярило» улучшало результаты лечения за счет комбинированного воздействия [75].
Еще И.Ф. Юнда и Л.И. Добровольская (1990) при лечении негонококкового уретропростатита методом электро-термо-уретростимуляции отметили положительное влияние на слизистую оболочку и окружающие ткани уретры и предстательную железу за счет усиления регионарного кровотока, что способствовало рассасыванию воспалительных инфильтратов, раскрытию закупоренных протоков уретральных желез и ацинусов предстательной железы [137]. При хроническом бактериальном простатите А.Р. Гуськов и А.И. Васильев (1994) применили электростимулятор-аспиратор «Интратон-4», который позволяет дренировать предстательную железу независимо от вида микрополостей, их размеров, количества, локализации и характера воспалительного содержимого [106].
В комплексном лечении хронического бактериального уретропростатита получен выраженный положительный эффект исследователями, применявшими комбинированно магнито-лазеротерапию и лазеро-магнито-электростимуляцию. При этом известно, что при воздействии электромагнитного поля развиваются местные и общие адаптационные реакции. Кроме влияния на центральную нервную систему магнитное поле активирует адаптационные механизмы и способствует положительному лечебному эффекту в широком диапазоне патологических состояний [4]. Механизм действия электростимуляции заключается в сокращении гладкомышечной мускулатуры под действием электрических импульсов, что обеспечивает восстановление физиологического дренажа железистого аппарата, стимулирует выделение эпителием простагландинов [68]. В результате сокращения гладких и поперечнополосатых мышц таза, промежности, предстательной железы, происходит своеобразный резонанс в тканях, что способствует улучшению половой функции. Одновременное сочетание лазерного и магнитного воздействия обеспечивает эффективное резонансное поглощение энергии лазерного излучения и магнитных волн клеточными мембранами, улучшение микроциркуляции в предстательной железе и добавочных половых железах. Это создает положительное влияние на репродуктивную функцию половых желез. Комбинация физиотерапевтических методов воздействия в реальном масштабе времени оказывает болеутоляющее, седативное, противовоспалительное, противоотечное воздействие на предстательную железу и другие добавочные половые железы. Данная комбинация физиотерапевтических методов также улучшает нейротрофику и микроциркуляцию органов малого таза и предстательной железы [18, 63, 69].
Для оценки эффективности комплексной физиотерапии А.А. Чураковым из 259 наблюдаемых с хроническим простатитом, ассоциированным с трихомонозом и хламидиозом, выделены четыре группы [132]. На фоне комплексной традиционной терапии применили пневмовибромассаж предстательной железы (І группа – аппарат ПВМ-Р-01), электрофорез смеси из 0,005 % мл раствор химотрипсина с 20 % (по объему) димексида (ІІ группа), дополнительно к комплексу магнитотерапию (ІІІ группа – аппарат «Интрамаг» г. Саратов) и пальцевой массаж простаты (IV контрольная группа). В результате сравнительного анализа на 10 дней раньше, чем в других группах, у участников исследования ІІІ группы отмечен выраженный регресс симптоматики, инволюция воспалительной инфильтрации и дренирование псевдомикроабсцессов. Кроме этого в клинической группе получавших комплекс физиотерапевтических процедур у 85 % отмечена наиболее выраженная эрадикация возбудителей инфекции (снижение концентрации условно-патогенной микрофлоры ниже диагностического порога). Именно в этой группе в отдаленные сроки наблюдения (через 6 месяцев после лечения) у 89 % обследованных констатирована стойкая ремиссия. Это позволило прийти к заключению, что комбинированный способ физиотерапевтического лечения за счет «резонансного» терапевтического эффекта существенно повышает эффективность лечения.
При развитии хронического цервицита в сочетании с кольпитом, вызванных смешанными инфекциями, А.А. Чураковым у 210 пациенток проводили эндоцервикально вибромассаж с вакуумной аспирацией содержимого цервикального канала. Автором для осуществления данной процедуры разработан аппарат ВАЦ-01-«ТРИМА» – приставки к «АМУС-01» – «ИНТРАМАГ» и специальный вагинально-цервикальный электрод для комбинированного органного электрофореза, что позволило существенно повысить эффективность лечения за счет эрадикации возбудителей инфекции, клинического улучшения и объективных показателей уже через 2–3 сеанса дренирующих процедур [132]. В тоже время эффективность большинства способов физической терапии исследованы только при моноинфекции, а при сочетанных инфекциях их применение было менее результативным [74]. При сочетанном поражении мочеполовых органов протозойно-бактериально-вирусной инфекцией сведения об эффективности физиотерапевтических методик как в отечественной, так и иностранной литературе ограничены [30]. В последнее время все больше привлекают к себе внимания методы окислительной терапии: гиперборическая оксигенация, ультрафиолетовое облучение аутокрови («малая озонотерапия»), ОТ. Среди них наиболее выраженное комплексное позитивное воздействие на организм, при небольшом количестве противопоказаний, имеет ОТ [3, 40, 66, 100, 101]. Это обусловлено хорошей переносимостью и отсутствием побочных эффектов и выраженным бактерицидным, иммуномодулирующим, сосудорасширяющим, а также дезинтоксикационным воздействиями на организм больных.
При этом бактерицидное действие озона и продуктов озонолиза (озониды, пероксиды и т. п.) проявляется в его высоких концентрациях (20–40 мг/л) путем повреждения плазматических мембран бактерий и грибов и повышением их чувствительности к действию антибиотиков. Окисление «вирусного шипа» с частичным разрушением оболочки вируса и инактивация фермента обратная транскриптаза, принимающего участие в синтезе вирусных белков, обуславливает антивирусное действие озона. Окисление арахидоновой кислоты озоном прерывает цикл образования простагландинов (медиаторов воспаления). Иммуномодулирующий эффект озона достигается за счет стимуляции выработки цитокинов (интерфероны, фактор некроза опухоли и интерлейкины) лимфоцитами и моноцитами, а также коррекцией нарушенных стадий фагоцитоза (активация стадии кислородного взрыва, обусловленная образованием пероксидов). Противогипоксический эффект ОТ реализуется, во-первых, за счет улучшения кислородного транспорта (возрастание рО2 в крови, улучшение деформабельности эритроцитов, уменьшение связи гемоглобина с О2 за счет активации гликолиза и 2,3-дифосфоглицерата, вазодилятации артериол и посткапиллярных венул за счет активации NO-синтетазы и выделения эндотелиоцитами оксида азота – фактора расслабления сосудов). Помимо этого улучшается утилизация кислорода за счет активации кислородзависимых реакций (гликолиз, β-окисление жирных кислот, цикл Кребса), усиливается мощность антиоксидантной системы за счет промежуточных продуктов окислительных реакций озона – никотинамидадениндинуклеотида и его фосфата, являющихся донорами протонов для естественных антиоксидантов – глутатиона, α-токоферола, аскорбиновой кислоты, окисленные формы которых неактивны. Также ускоряется образование макроэргических соединений – аденозинтрифосфата и аденозинмонофосфата. ОТ восстанавливает электрический заряд мембран форменных элементов крови и снижает уровень фибриногена, повышая фибринолитическую активность плазмы и снижая агрегационную способность форменных элементов крови. Озон и продукты его окисления (озониды, пероксиды и т.п.) улучшают функцию микросомальной системы гепатоцитов, стимулируя их работу, и усиливают почечную фильтрацию, существенно повышая дезинтоксикационный эффект. Суммарный лечебный эффект ОТ от воздействия на возбудителей и макроорганизм побудил начать изучение ее эффективности в комбинированном лечении урогенитальных микст-инфекций. При этом разработка оригинальных способов местной и общей (системной) ОТ доказала перспективность данного направления в повышении эффективности лечения сочетанной микст-инфекции [40, 56, 57, 62, 66, 101].
Репродуктивные нарушения с копулятивной дисфункцией, обусловленной нейрогуморальной составляющей – нарушением «гормонального зеркала» с развитием «вторичной» фригидности у женщин, приводят к психоэмоциональной напряженности, социальной и супружеской дезадаптации, что существенно снижает качество жизни больных [41, 63]. Работы отдельных исследователей указывают на эффективность в лечении копулятивной дисфункции методов лазерной терапии [4, 72]. Среди большого выбора низкоинтенсивной лазерной терапии, начиная с гелий-неоновых и полупроводниковых лазеров, в последние годы широкое применение получили искусственные источники света – сверхяркие светодиоды. Достоинством сверхярких светодиодов является их простота, надежность, долговечность, высокая интенсивность свечения в заданном угле, возможность выбора источника излучения в любом участке видимого и инфракрасного спектра. Получаемое от светодиодов лазерное электромагнитное излучение, относительно глубоко проникая в биоткани, активизируя внутриклеточные молекулы, приводит к комплексу фотобиологических местных реакций, изменяя течение биохимических реакций, структуру молекул и снижая свертываемость крови. При этом стимулируются процессы регенерации тканей, оказывается анальгезирующее, противовоспалительное, сосудорасширяющее действие [4, 72].
Наибольший терапевтический эффект наблюдается при применении лазерного излучения красного (с длиной волны излучения 630–670 нм) и инфракрасного (длина волны излучения 840–890 нм) диапазонов спектра с активацией биоэлектрических, биосинтетических процессов в тканях нервной и эндокринной систем, стимуляцией репаративной регенерации кожи, слизистых оболочек, костной ткани. В очагах воспаления активизируется микроциркуляция и повышается окислительно-восстановительный потенциал с увеличением концентрации лекарственных веществ и пролонгацией лечебного эффекта. Одновременно в зоне воспаления увеличивается потребление кислорода воспаленными тканями, стимулируются процессы регенерации нервной ткани с восстановлением возбудимости и проводимости, т.е. адаптационные нервно-рефлекторные и нейрогуморальные реакции с активацией симпатоадреналовой и иммунной систем [72].
В амбулаторной практике наиболее удобны фотонные матрицы с гибким основанием «Барва-Флекс», содержащие 24 светодиода (12 инфракрасного и 12 красного диапазонов спектра), расположенных эквидистально в 4 ряда по 6 сверхярких светодиодов в каждом ряду. Разработанные НИИ лазерной биологии и лазерной медицины Харьковского национального университета им. В.Н. Каразина данные матрицы применяются дистанционно, контактно (на облучаемый объект) или контактно с компрессией ткани (при фоторефлексотерапии) [61]. Для сочетанного воздействия электромагнитного излучения инфракрасной и видимой частей спектра с постоянным магнитным полем на фотонную матрицу устанавливали магнитную матрицу «Барва-Флекс/Маг». Это позволяло эффективно воздействовать на биологически активные точки на любой глубине залегания до 20 мм. Клинические испытания матриц «Барва-Флекс/КИК/Маг» показали их высокую эффективность при включении в комплекс терапии при лечении разнообразной патологии в кардиологии, пульмонологии, отоларингологии, гастроэнтерологии, дерматологии, ортопедии, комбустиологии, стоматологии и других разделов медицины [61]. Среди урологической патологии эффективность фототерапии отмечена при циститах, простатитах и циститах, вызванных неспецифической микрофлорой. Среди гинекологических заболеваний квазилазерная фотомагнитотерапия успешно применялась при вульвитах, кольпитах и сальпингоофоритах, также обусловленных неспецифической моно-инфекцией [126]. В тоже время в доступной литературе не обнаружено работ по применению фототерапии в лечении урогенитальной сочетанной протозойно-бактериально-вирусной инфекции, осложненной многофокусным поражением мочеполовых органов, репродуктивно-сексуальной дисфункцией у представителей обоих полов. Это и определило характер выполненного клинического исследования.
Материалы данного раздела освещены в следующих публикациях:
- Лукьянов И.Э. Современные подходы к лечению резистентной трихомонадной инвазии в сочетании с хламидиозом, микоплазмозом и генитальным герпесом / И.Э. Лукьянов // Дерматологія та венерологія. – 2015. – № 3 (69). – С. 5–15.
РАЗДЕЛ 2
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
2.1 Характеристика обследованных пациентов
Под наблюдением был 161 больной, лечившийся амбулаторно на базе Медицинского центра «Экомед» (Лицензия МОЗ Украины серия АВ № 53911 от 25 марта 2010 г.) и Медицинского центра «ДНК» (Лицензия МОЗ Украины серия АВ № 526240 от 11 февраля 2010 г. № 3). Мужчин было 101 (62,7 %), женщин – 60 (37,3 %). Средний возраст больных – (28,3±2,1) года.
Признаками отбора больных для данного исследования были: молодой и средний возраст; доказанное наличие более двух микробно-паразитарно-вирусных инфекционных агентов; хроническое рецидивирующее течение инфекции с диссеминацией и многоочаговостью поражения внутренних гениталий; латентное (субклиническое) течение рецидивирующей вирусной инфекции; супружеские пары, страдающие вторичным бесплодием, и половые партнерши, состоящие в «гражданском браке» с микст-инфицированными мужчинами. В исследование не включались лица, имеющие следующие признаки: возраст до 18 и старше 60 лет; первичное, неосложненное поражение мочеполовых органов лишь одним возбудителем урогенитальных инфекций; заражение сифилисом и гонореей; заражение вирусом иммунодефицита человека; тяжелая декомпенсированная сопутствующая патология.
У 161 больного выявлена следующая патогенная урогенитальная микрофлора: трихомонады – у 119 больных (73,9 %), хламидиоз – у 116 (72,1 %), микоплазмоз – у 87 (54,04 %), уреаплазмоз – у 74 (5 %) и гарднереллез – у 40 (24,8 %) больных. Помимо этого диагностирована в данной группе у 123 (77,2 %) больных хроническая латентно текущая (бессимптомная) вирусная инфекция: вирус простого герпеса 1 и 2 типа – у 118 (95,9 %), цитомегаловирус – у 19 (15,5 %) и вирус Эпштейна-Барр – у 8 (6,5 %) больных.
По виду, объему и характеру проведенного комплексного лечения все наблюдаемые нами 161 пациент были разделены на три сравнимые группы наблюдения.
В группу контроля (I группа) вошли 23 больных [13 (56,5 %) мужчин и 10 (43,5 %) женщин], которым проводилась традиционно-стандартизованная терапия медикаментозными препаратами и по схемам клинических протоколов (Накази МОЗ України № 286 від 07.06.2004 р. та № 312 та 08.05.2009 р., а також Наказ Головного управління охорони здоров’я Харківської обласної державної адміністрації № 436 від 06.07.2009 р.).
В группу сравнения (II группа) вошли 53 больных [35 (66,0 %) мужчин и 18 (34,0 %) женщин], которым в состав традиционной комплексной терапии для повышения эффективности противотрихомонадной терапии по разработанной схеме вводились противопаразитарные препараты – альбендазол (вормил) и мебендазол (вермокс). Для купирования активации герпес-вирусной инфекции назначались противовирусные препараты – индукторы интерферонов (амиксин, гропринозин или неовир), а также рекомбинантные интерфероны альфа-2b (Альфарекин или интробион, неовир) и местно свечи «Виферон» или «Генферон».
Основную группу (III группа) пролеченных составили 85 больных [53 (62,4 %) мужчины и 32 (37,6 %) женщины] с урогенитальной микст-инфекцией, в состав комплексной терапии которых вошли разработанные оригинальные методы и способы общей и местной ОТ.
Кроме трех вышеназванных групп для контроля метаболических и иммунологических исследований привлекались 25 практически здоровых лиц (IV группа) – доноров Харьковского областного центра службы крови, которые по половым и возрастным отличиям достоверно не отличались от трех сравниваемых групп. Возраст – (34,6±3,3) года, женщин – 11 (44,0 %), мужчин – 14 (56,0 %).
Изучение состояния ПОЛ и общей антиоксидантной защиты (ОАОЗ), а также показателей врожденного и приобретенного иммунитета проведено у 141 пациента [81 (57,4 %) мужчина и 60 (42,6 %) женщин] из наблюдаемых 161. Для сравнительного изучения оксидантного метаболизма, а также иммунитета, в зависимости от проводимого лечения, из группы II (УППТ + иммунотерапия) были выделены 42 пациента, которые составили подгруппу II-А (II-А подгруппа), а из основной группы III были выделены 76 больных, которые составили подгруппу III-А (III-А подгруппа).
У 61 (60,4 %) наблюдаемых мужчин и у 18 (30 %) наблюдаемых женщин, страдающих экскреторно-токсическим бесплодием, в комплексное лечение включен метод КФМТ в комбинации с традиционной терапией (10 больных), в сочетании с фармакоиммунотерапией и УППТ (25 больных), а также с ОТ (44 больных). Эти пациенты были в возрасте 20–40 лет с малосимптомным подострым хроническим течением заболевания, с восходящим поражением мочевых и внутренних половых органов (простаты, яичек и их придатков, маточных труб и яичников) (III-Б подгруппа).
Контроль эффективности проведенного лечения включал объективную оценку врачом и субъективную оценку самим пациентом по шкале симптомов хронического ппростатита, предложенной Национальнм Институтом Охраны Здоровья США (NIH-CPSI) [77]. Особое внимание обращалось на частоту и особенности полового акта, его длительность, выраженность оргастических ощущений, наличие уретральных выделений, резей, дизурии. Объективный осмотр половых органов сочетался с комплексом лабораторных исследований. Помимо лабораторно-клинической оценки больным выполнялись инструментальные методы диагностики – уретроскопия, кольпоскопия и ультразвуковое исследование мочеполовых органов. Ультразвуковое исследование (аппарат ULTIMA PRO-30) позволяло четко охарактеризовать характер достигнутых структурных изменений во внутренних половых органах (простате, яичках, матке, яичниках, маточных трубах).
2.2 Лабораторная диагностика Chlamydia, Trichomonas, Mycoplasma, Herpesvirus
Для определения маркеров отдельных компонентов микст-инфекции проводился комплекс лабораторных исследований:
1. Микроскопическое исследование отделяемого из уретры, отжатого секрета предстательной железы, эякулята, отделяемого из цервикального канала шейки матки и влагалища;
2. Бактериологическое исследование с исследованием на трихомоноз и на неспецифическую (сопутствующую) микрофлору с посевом на среды накопления, определением микробного числа бактериальных агентов и чувствительности к лекарственным препаратам;
3. Серологическое исследование на основе твердофазного иммуноферментного анализа (ИФА). Материалом для исследования служила сыворотка крови больных. Определение напряженности специфического иммунитета, при наличии скрытых очагов латентной инфекции, проводилось путем количественной оценки защитного титра уровня антител по содержанию IgG или М на весь выше представленный спектр урогенитальной инфекции и вирусов простого герпеса 1 и 2 типа, цитомегаловируса и вируса Эпштейна-Барр (мононуклеоза). При, как правило, латентно (субклинично) протекающей вирусной инфекции исследование уровня IgG выполнялось в комплексе с определением процента авидности (отражавшего давность первичного инфицирования)
4. Выявление бактериальной ДНК с помощью полимеразной цепной реакции (ПЦР) как для первичной диагностики, так и для двукратного (двух- и семинедельного) контроля излеченности проводилось на следующие возбудители: Chlamydia trachomatis, Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma spp. (родоспецифическая), Neisseria gonorrhoeae, Trichomonas vaginalis, Gardnerella vaginalis. Материалом для исследования служили соскобы со слизистых оболочек мочеполовых органов, центрифугаты первой порции утренней мочи. ПЦР проводилась согласно приказу № 26 от 24.01.2008 «Організація роботи лабораторій при дослідженні матеріалу, що містить біологічні патогенні агенти I-IV груп патогенності молекулярно-генетичними методами» [134, 159, 191].
Диагностика трихомоноза осуществлялась с помощью микроскопии, культурального исследования и ПЦР. Применялась питательная среда для выделения Trichomonas vaginalis INPouch (Biomed Diagnostics, Inc. США). Использованы диагностические тест-системы для ПЦР фирмы «ЛАГИС» (Россия) и тест-системы для ИФА (фирма «Вектор-Бест», Россия).
Лабораторная диагностика хламидиоза также проводилась с помощью ИФА сыворотки крови (для исследования на специфические IgG и IgA антитела).
Для выявления урогенитального микоплазмоза применялись методы ИФА (IgA и IgG) и ПЦР [158]. Также диагностику мочеполового уреаплазмоза (урогенитальной инфекции, вызванной U. urealyticum) проводили с помощью жидкой питательной среды, приготовленной на основе плацентарного бульона с обогащенными добавками, с последующим пересевом на агаровую дифференциальную среду [69, 128].
Серологическая диагностика генитального герпеса проводилась с помощью количественного выявления IgG, IgM антител к Herpes Simplex Virus 1 и 2 в сыворотке крови. Использовали иммуноферментный тест-набор SERIONELISA classic, производитель ООО Вирион/Серион (Германия) [140].
Культуральное исследование для оценки условно-патогенных микроорганизмов проводили согласно приказа МЗ Украины № 535 „Про уніфікацію мікробіологічних (бактеріологічних) методів дослідження, застосовуваних у клініко-діагностичних лабораторіях лікувально-профілактичних установ”. Осуществляли количественную оценку обсемененности условно-патогенными микроорганизмами. Микроорганизмы идентифицировали согласно 10-му изданию Определителя бактерий Берджи (2009) [128].
При лабораторной диагностике использовались также тест-системы от производителей: Литех (Россия), DRG (США); IBL (Германия), Dya Sys (Германия) с определением показателей на оборудовании фирмы «Tecan» (Австрия) – ИФА и фирмы «ДНК-Диагностика» (Россия) – ПЦР.
Клинико-лабораторный контроль излеченности проводили дважды – через 2 и 7 недель после окончания курса лечения.
2.3 Исследование перекисного окисления липидов и антиоксидантной защиты
Общие липиды определяли унифицированным методом с помощью сульфофосфованилинового реактива, результат выражали в мг/мл. Содержание общих фосфолипидов оценивали по липоидному фосфору, который определяли унифицированным методом с помощью реактива, содержащего малахитовый зеленый, и результаты выражали в мкмоль/мл [5]. Диеновые конъюгаты (ДК) ненасыщенных жирных кислот, начальный продукт ПОЛ, уровень которого соответствует уровню гидроперекисей липидов, определяли методом Л.A. Романовой и И.Д. Стальной (1977) [114], выражая результат в нмоль/мл. Малоновый диальдегид (МДА) выражали в нмоль/мл. Уровень шиффовых оснований (ШО) определяли флуориметрическим методом, выражая результаты в условных единицах флуоресценции. Интенсивность свободнорадикального окисления (СРО), суммарно характеризующая способность комплекса антиоксидантных соединений тормозить реакции окисления, определялась методом индуцированной сульфатом железа и перекисью водорода хемилюминесценции [5], выражая результат в квантах света, регистрируемого на хемилюминометре БВХ-06 (имп/360 с/мл). Для экспресс-определения резервных возможностей общей антиоксидантной активности (РВ ОАОА) плазмы озонированной крови больных был модифицирован способ определения гидрофобной модификации белковых молекул (альбуминов) по изменению ультрафиолетового их спектра. Результат выражали в вычисляемых условных единицах кинетики гашения люминесценции люминесцентного агента – требуемая скорость гашения хемилюминесценции KCL пит × 10–5, с–1 мкл–1 [5]. Биохимические исследования проводились на аппарате «CobasMira» с использованием реактивов «Kone» (Финляндия), «Cone-Lab» (Франция) и «LaRoch» (Швейцария). Систему контроля качества выполняли в соответствии со стандартами ISO–9000 контрольных сывороток фирмы Human (Германия).
2.4 Оценка врожденного и приобретенного иммунитета
Оценка динамики показателей врожденного (неспецифического) иммунитета включала изучение клеточных факторов: нейтрофилов – определяемые в тесте спонтанного восстановления нитросинего тетразолия (НСТспон.) и стимулированного (НСТстим.); неферментативных лизосомальных катионных белков (ЛКТ – лизосомально-катионный тест); активности фермента миелопероксидаза в нейтрофилах по среднему цитохимическому коэффициенту (СЦК); фагоцитарный показатель (ФП), фагоцитарное число (ФЧ) и показатель завершенности фагоцитоза (ПЗФ); естественные натуральные киллеры CD16+CD56+ (NK-клетки) и незрелые В‑клетки «ноль» CD3–HLA-DR+ (K-клетки), а также гуморальные факторы: белок и его фракции; С-реактивный белок («СРБ-латекс-тест»); компоненты системы комплемента С3 и С4, уровень титра лизоцима (ТЛ), иммуноглобулины классов М, G и А в сыворотке крови (IgM, IgG, IgA); циркулирующие иммунные комплексы (ЦИК) [16, 20, 45, 93].
Функциональное состояние нейтрофилов изучалось путем определения общей кислородозависимой бактерицидности нейтрофилов периферической крови в НСТспон или НСТстим. после добавления взвеси зимована (250 мкг/мл) или декотранта сульфата (300 мкг/мл). Учет результатов реакции проводился при подсчете 100 нейтрофилов с вычислением по 4-бальной системе процента клеток, содержащих включения гранул восстановленного нитросинего тетразолия до гранул нерастворимого диформазана. По формуле Астальди-Верга вычисляли СЦК и по соотношению процентов клеток в НСТстим. к проценту их в НСТспон. вычисляли индекс стимуляции. Нормой считали НСТспон. – (9,34±0,4) %, а СЦК или индекс активности нейтрофилов – (0,12±0,011) у.е. Для НСТстим. – (60±20) % и индекс стимуляции составляет (0,98±0,12) у.е.
Тяжесть заболевания и динамика воспалительного процесса оценивалась по содержанию в цитоплазме нейтрофилов окрашенного бронфеноловым синим неферментивных лизосомальных катионных белков (ЛКТ). Данный тест характеризует активность кислороднезависимых микробицидных систем фагоцита и в норме – (84,1±2,5) % или (1,6±0,1) у.е.
Способность гранулоцитов к внутриклеточному разрушению токсической перекиси водорода оценивалась по активности фермента миелопероксидаза в нейтрофилах по методу Грэхема-Кнолля [67]. Норма СЦК составляет (2,56±0,033) у.е.
Фагоцитарную активность полиморфно-ядерных лейкоцитов и клеток ретикулоэндотелия определяли по методике Е.Ф. Чернушенко и Л.С. Когосовой (1998). Просматривая под микроскопом 100 лейкоцитов (нейтрофилов) определяли ФЧ – среднее число микробов, поглощенных одним активным нейтрофилом и ФП – процент нейтрофилов из числа сосчитанных, содержащих поглощенные микробные клетки. Для оценки переваривающей функции определяли ПЗФ по процентному отношению общего количества переваренных микробов к общему числу поглощенных микробов (переваренных и непереваренных). Нормы для здоровых лиц составляли ФП – (56±4,62) %, ФЧ – 12,8±1,4 и ПЗФ – (39±2,8) % [135].
Самостоятельная субпопуляция незрелых форм В-клеток или макрофагов, не имеющих маркеров ни Т-, ни В-клеток и составляющих 40–50 % клеток костного мозга и 1,5–2,5 % клеток крови, называются клетками «ноль» или К-клетки (СD3–HLA-DR+). Их разновидность – NK-клетки (нормальные, естественные или натуральные киллеры СD16+CD56+), не содержащие рецепторов к Fc-фрагменту и к С3-компоненту комплемента, также EK обладают высокой цитотоксической активностью за счет адсорбированных антител и активируются Fc-фрагментами антител IgG. Их количество увеличивается при наличии опухолевых клеток и вирусов. Их содержание определяли фенотипированием лимфоцитов в тестах розеткообразования с частицами, покрытыми моноклональными антителами к CD16+CD56+, а также к HLA-DR+-антигенам на В-лимфоцитах и активированных Т-клетках. Нормальным считали содержание ЕК (NK-клеток) от 6 до 20 % или (12,3±2,7)×109л и К-клеток 8–20 % или (12,6±2,5)×109л [16].
Гуморальное звено врожденного иммунитета у наблюдаемых больных оценивалось по титрам компонентов системы комплемента (С3, С4), содержанию лизоцима (фермента мурамидазы), белковым фракциям сыворотки крови, уровню С-реактивного протеина, уровню иммуноглобулинов и уровню циркулирующих высокомолекулярных иммунных комплексов.
Общий белок сыворотки крови по биуретовой реакции и белковые фракции методом электрофореза проводили по общепринятым методикам. С‑реактивный белок в сыворотке крови определяли с помощью «СБР-латекс-тест».
Компоненты системы комплемента в сыворотке крови изучали турбодиметрическим методом с использованием реактивов фирмы «Орион Диагностика» (Финляндия).
Низкомолекулярные белки лизоцимы, синтезируемые макрофагами и молодыми нейтрофилоцитами, имеют постоянную концентрацию в плазме (8,5±1,4) мкг/мл, а в сыворотке крови ТЛ зависит от возраста, и у лиц молодого и среднего возраста он составляет 3,7–3,8 мкг/мл. При повышении его концентрации (ТЛ) в два-три раза проявляется выраженное бактерицидное и бактериостатическое действие на многие виды бактерий. Исследование активности лизоцима также проводилось турбодиметрическим методом [67, 135].
Для определения иммуноглобулинов классов M, G и A в сыворотке крови использовался стандартный метод простой радиальной иммунодиффузии по G. Mancini и соавт. (1965).
Исследование ЦИК проводилось традиционно методом преципитации в полиэтиленгликоле по методу, предложенному Ю.А. Гриневичем и А.Н. Алферовым (1981), с определением процента пропускания по шкале «Т» на спектрофотометре СФ-46 при длине волны 450 нм и переводом процента по таблице в относительные единицы [28].
Проведенные в работе исследования факторов приобретенного иммунитета включали основные показатели клеточного и гуморального звеньев. Исследования проводились после забора крови из локтевой вены в две пробирки объемом 10 мл: в сухую стерильную пробирку и в стерильную пробирку, содержащую гепарин в конечной концентрации 25 ед. в 1 мл крови. Для полного перемешивания крови с антикоагулянтом пробирку закрывали резиновой пробкой и 20 раз опрокидывали.
Исследования субпопуляций лимфоцитов выполняли согласно «Инструкции по применению набора моноклональных и поликлональных антител для определения дифференцировочных антигенов лейкоцитов человека методом иммунофлюоресценции (клоноспектр)» (НПЦ «Мед.Био.Спектр» Москва, РФ) с использованием различных комбинаций мышиных моноклональных антител. Помимо определения относительного и абсолютного числа Т-лимфоцитов в периферической крови (CD3+), исследовали динамику Т‑лимфоцитов-помощников (хелперы/индукторы) – CD3+CD4+, Т‑лимфоцитов-супрессоров (цитотоксические с супрессорно-киллерной активностью) – СD3+СD8+, Т-лимфоциты-киллеры, экспрессирующие маркеры NK-клеток – СD3+СD16+СD56+, Т-лимфоциты-активированные с рецептором к интерлейкинам-2 (a-цепь рецептора ИЛ-2 клетки памяти) – СD3+СD25+, активированные Т-лимфоциты (регуляторы) – СD3+HLA-DR+; а также В-лимфоциты – СD22+ и активированные В-лимфоциты (клетки памяти) – СD3–СD25+.
2.5 Оценка половой и репродуктивной функции
Для выявления сексуальных нарушений было предложено заполнить специально разработанные анкеты – квантификационные шкалы «сексуальная формула мужская» и «сексуальная формула женская». Сексуальные отношения определялись как «любая взаимная активность между партнерами, которая приводит к сексуальному контакту независимо от того, имел место полный интроитус и оргазм, или не имел». Те, кто имел секс хотя бы один раз на протяжении последних трех месяцев, считались «сексуально активными». Определялись детали сексуальной активности – вагинальный, оральный и т. д. Те, кто не имел секса последних три месяца, должны были объяснить почему. Сексуально активные респонденты тщательно расспрашивались о сексуальных феноменах – либидо, эрекция, эякуляция, любрикация, оргазм, боли, ощущение удовлетворения и т. п. Были использованы как субъективные, так и объективные критерии половой дисфункции [185, 186].
При исследования репродуктивных свойств эякулята учитывались рекомендации, изложенные в протоколах ВОЗ (WHO laboratory manual for the examination and processing of human semen – 5th ed, 2010) [197]. Эякулят был получен путем мастурбации после не менее чем трех- и не более чем пятидневного воздержания. При исследовании эякулята, кроме микроскопии, проводилось биохимическое определение содержания фруктозы (в динамике) и лимонной кислоты.
2.6 Статистическая обработка данных
Статистическая обработка результатов исследования проведена с использованием программ, Excel-2010 и Statistica for Windows, версия 6.0 (Copyright @ StatSoft, USA). Для сравнения показателей различных групп и подгрупп использовались стандартные статистические критерии проверки гипотез. Формирование основных групп и групп сравнения в клинических исследованиях осуществлялось на основе рандомизации. Для адекватного представления данных предварительно проводилась проверка распределения на нормальность. В случае выборки малого объема (n < 30) для проверки на нормальность распределения использовался критерий W Шапиро-Уилка, если объем выборки был более 30 – использовали критерий χ2. И в том и в другом случае критическая область рассчитывалась для уровня значимости р = 0,05. При нормальном распределении вычислялись критерий Стьюдента (t), корреляция Пирсона (r). В случае, если распределение отличалось от нормального, то применялись непараметрические методы: U-критерий Манна-Уитни, ранговая корреляция Кендалла (τ). [108, 116]. Результаты исследований представлены в таблицах в виде: среднее арифметическое ± стандартное отклонение (М±σ). Различия считали значимыми (*) при p <0,05 и высокозначимыми (**) при p <0,01.
РАЗДЕЛ 3
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
3.1 Клинические и социальные особенности больных с урогенитальными микст-инфекциями (хламидиоз, трихомоноз, микоплазмоз, герпес)
По результатам комплексного обследования у 161 больного выявлена следующая патогенная урогенитальная микрофлора: трихомонады – у 119 больных (73,9 %), хламидиоз – у 116 (72,1 %), микоплазмоз – у 87 (54,0 %), уреаплазмоз – у 74 (46,0 %) и гарднереллез – у 40 (24,8 %) больных. Помимо этого в данной группе у 123 (77,2 %) больных диагностирована хроническая латентно текущая (бессимптомная) вирусная инфекция: вирус простого герпеса 1 и 2 типа – у 118 (95,9 %), цитомегаловирус – у 19 (15,45 %) и вирус Эпштейна-Барр – у 8 (6,5 %) больных. Установлено, что воспалительный процесс мочеполовых органов, обусловленный четырьмя инфекциями (трихомонады, хламидии, уреаплазмы и вирусы), диагностирован у 74 (46,0 %), а также хламидиями, микоплазмами, гарднереллами и вирусами – еще у 41 (25,4 %) и у 46 (28,6 %) наблюдаемых пациентов симбиоз простейших с бактериями и вирусами включал трихомонады, микоплазмы и вирусы. Таким образом, четырехкомпонентные ассоциации урогенитальных инфекций составили 115 (71,4 %) наблюдаемых больных.
Результаты сравнения всех наблюдаемых нами больных по возрасту, полу и семейному положению представлены в таблице 3.1. Установлено, что во всех клинических группах подавляющее большинство (до 87 % больных) были в возрасте наибольшей социально-экономической и репродуктивной активности, что свидетельствует об их влиянии на экономические и демографические процессы общества.
Гендерное распределение среди больных, лечившихся по поводу урогенитальных микст-инфекций, показало, что мужчин во всех трех сравниваемых группах было от 56,5 % до 66,0 %, а женщин – от 34 % до 43,5 %. При этом в браке состояло 33,5 % (54), разведенных было 20,5 % (33) и не состоящих в браке – 46 % (74).
Таблица 3.1 – Распределение больных урогенитальной микст-инфекцией по возрасту, полу и семейному положению
| Показатели в сравниваемых группах | Вид и характер проведенного лечения | ||||
| После традиционной терапии
(I группа) n=23 |
Дополнительно иммунотерапия и УППТ
(II группа) n=53 |
После ОТ
(III группа) n=85 |
Всего | ||
| Возраст больных | 18–29 лет | 15 (65,2 %) | 34 (64,2 %) | 54 (63,5 %) | 103 (64 %) |
| 30–39 лет | 5 (21,8 %) | 12 (22,6 %) | 20 (23,5 %) | 37 (23 %) | |
| 40–59 лет | 3 (13 %) | 7 (13,2 %) | 11 (13 %) | 21 (13 %) | |
| Половая принадлежность | Мужчины | 13 (56,5 %) | 35 (66 %) | 53 (62,4 %) | 101 (62,7 %) |
| Женщины | 10 (43,5 %) | 18 (34 %) | 32 (37,6 %) | 60 (37,3 %) | |
| Семейное положение | Состоящие в браке (27 семейных пар) | 8 (34,8 %) | 18 (34 %) | 28 (33 %) | 54 (33,5 %) |
| Разведенные | 5 (21,7 %) | 11 (20,8 %) | 17 (20 %) | 33 (20,5 %) | |
| Не состоящие в браке | 10 (43,5 %) | 24 (45,2 %) | 40 (47 %) | 74 (46 %) | |
| Всего | 23 (100 %) | 53 (100 %) | 85 (100 %) | 161 (100 %) | |
По социальному положению учащихся и студентов было 64 (39,8 %), служащих – 35 (21,7 %), предпринимателей – 45 (27,9 %), рабочих – 12 (7,5 %) и безработных – 5 (3,1 %).
Лечившиеся в трех выделенных клинических группах, как следует из данных в таблице 3.2, были сопоставимы по количеству и виду микст-инфицированности, т.е. различались лишь по объему и виду проводимого лечения.
Таблица 3.2 – Вид протозойно-микробно-вирусных ассоциаций и объем проведенного лечения
| Вид микст-ассоциации | Количество лечившихся больных | |||
| После традиционной терапии
(I группа) n=23 |
Дополнительно иммунотерапия и УППТ
(II группа) n=53 |
После ОТ
(III группа) n=85 |
Всего | |
| Трихомонады, хламидии, уреаплазмы, вирусы | 11 (47,8 %) | 24 (45,3 %) | 39 (45,9 %) | 74 (46 %) |
| Хламидии, микоплазмы, гарднереллы, вирусы | 6 (26,1 %) | 13 (24,5 %) | 22 (25,9 %) | 41 (25,5 %) |
| Трихомонады, микоплазмы, вирусы | 6 (26,1 %) | 16 (30,2 %) | 24 (28,2 %) | 46 (28,5 %) |
| Итого | 23 (100 %) | 53 (100 %) | 85 (100 %) | 161 (100 %) |
Проведенное углубленное изучение анамнеза, дополнительное обследование и консультации врачей других специальностей позволили выявить сопутствующую патологию и перенесенные заболевания, что представлено в таблице 3.3 в виде сравнительной оценки в клинических группах. Приведенные в таблице 3.3 данные свидетельствуют, что у больных с сочетанной урогенитальной инфекцией среди перенесенной патологии наиболее часто отмечались простудные заболевания верхних дыхательных путей (от 60,9 % до 75,3 %), детские инфекции (от 39,1 % до 45,3 %), заболевания желудочно-кишечного тракта (от 30,2 % до 31,8 %) и гнойно-воспалительные заболевания (от 17,4 % до 22,4 %). При сравнении в клинических группах частоты сопутствующей патологии наиболее часто диагностирована патология желудочно-кишечного тракта (от 21,2 % до 22,6 %) и мочеполовых органов (от 13,05 % до 15,7 %). В тоже время существенных различий в частоте перенесенных и сопутствующих заболеваний во всех трех клинических группах не выявлено, что также указывает на их клиническую однородность.
Особенность клинического течения хронической смешанной ИППП – это малосимптомное, рецидивирующие, многофокусное воспаление мочеполовых органов, обусловленное сочетанием трех и более этиологических факторов с частыми осложнениями и торпидностью к проводимой терапии.
Основными жалобами у больных мужского пола были дискомфорт и периодический зуд в уретре, который отмечали 76 (75,2 %) больных, непостоянную тянущую боль в паховых областях и мошонке наблюдали 34 (33,7 %) больных. Еще 27 (26,7 %) мужчин жаловались на ноющие боли в промежности и 28 (27,7 %) указывали на тупые, усиливающиеся после длительного пребывания в положении сидя, боли в пояснично-крестцовой области.
Таблица 3.3 – Перенесенные и сопутствующие заболевания у пролеченных больных урогенитальной микст-инфекцией
| Заболевания | Количество больных с микст-инфекцией | |||||
| Перенесенные болезни | Сопутствующие заболевания | |||||
| І группа |
ІІ группа | ІІІ группа | І группа |
ІІ группа | ІІІ группа | |
| Желудочно-кишечного тракта (гастрит, холецистит, панкреатит, колит) | 7 (30,4 %) | 16 (30,2 %) | 27 (31,8 %) | 5 (21,7 %) | 12 (22,6 %) | 18 (21,2 %) |
| Гнойно-воспалительные (аппендицит, фурункулез, отит) | 4 (17,4 %) | 11 (20,8 %) | 19 (22,4 %) | 1 (4,4 %) | 1 (1,9 %) | 2 (2,4 %) |
| Гинекологические (аднексит, нарушения менструального цикла, бесплодие, фибромиома) | 2 (8,7 %) | 4 (7,6 %) | 8 (9,4 %) | 2 (8,7 %) | 4 (7,6 %) | 7 (8,2 %) |
| Урологические (цистит, пиелонефрит, гломерулонефрит, простатит, аденома) | 1 (4,4 %) | 2 (3,8 %) | 5 (5,9 %) | 1 (4,4 %) | 4 (7,8 %) | 6 (7,1 %) |
| Дыхательной системы (бронхиты, пневмония, бронхиальная астма, грипп, ОРЗ) | 14 (60,9 %) | 37 (69,8 %) | 64 (75,3 %) | 1 (4,35 %) | 2 (3,8 %) | 3 (3,5 %) |
| Сердечно-сосудистой системы (ишемическая болезнь сердца, стено-кардия, гипертоническая болезнь) | 1 (4,4 %) | 2 (3,8 %) | 2 (2,4 %) | 1 (4,4 %) | 1 (1,9 %) | 3 (3,5 %) |
| Детские инфекции | 9 (39,1 %) | 24 (45,3 %) | 36 (42,4 %) | – | – | – |
| Кожные болезни (микозы, угри, пиодермии) | 3 (13,0 %) | 6 (11,3 %) | 11 (12,9 %) | 1 (4,4 %) | 3 (5,7 %) | 6 (7,1 %) |
Главными жалобами у женщин были различные по цвету и количеству выделения из половых органов (у 100 % больных), с неприятным запахом у 19 (31,7 %). Примерно у одной трети обследованных женщин (18 больных – 30 %) регистрировалась болезненность внизу живота и еще у 7 (11,7 %) – чувство дискомфорта внизу живота. Зуд кожи и слизистых половых органов отмечали 16 (26,7 %) больных, жжение – 9 (15 %) и дизурические расстройства – 6 (10 %) женщин. Большинство пациенток имели комбинацию двух и более жалоб. Выделения из половых органов в большинстве случаев были скудными и имели у 27 (45 %) слизистый вид или слизисто-гнойный у 32 (53,3 %), редко транссудат имел слизисто-крошкоподобный, сыроподобный или сливкоподобный характер.
Результаты рутинных лабораторных тестов (клинический анализ мочи и крови) при урогенитальной микст-инфекции существенно не изменялись. Лишь при осложнении основной патологии в ряде случаев отмечался умеренный нейтрофильный лейкоцитоз (лейкоциты до (8,6±1,2)×109/л с увеличением палочкоядерных до (6,5±1,0) % и СОЭ до (16±1,2) мм/ч) и терминальная лейкоцитурия (до 12±2 в поле зрения) с увеличением выделения слизи и умеренной бактериурией. Количество лейкоцитов в анализах мочи по Нечипоренко в среднем достигало 6000±1000 в 1 мл.
Умеренные изменения биохимических показателей сыворотки крови отмечены лишь у больных с сопутствующей патологией, указывая на ее выраженность. Во время обострений у единичных больных нами зарегистрированы повышение в крови мочевины до 9,4 ммоль/л и креатинина до 160 мкмоль/л, а также активность органоспецифических ферментов: аспартатаминотрансферазы до (1,02±0,23) мкмоль/(ч∙мл), аланинаминотрансферазы до (0,98±0,16) мкмоль/(ч∙мл) и щелочной фосфатазы до (4,61±0,94) Ед/л. У ряда наблюдаемых больных отмечено также повышение в плазме крови показателей углеводного обмена: фосфофруктокиназы до (14,26±1,2) мкмоль/г белка, альдолазы до (3,67±0,46) ЕД/мл и гексокиназы до (14,6±1,32) ЕД/мл, что учитывалось при проведении комплексной терапии.
Лабораторные методы верификации бактериально-вирусных агентов (микроскопия, бактериология, ИФА и ПЦР) показали, что трихомонады диагностированы микроскопически нативно у 57 (47,9 %) и при окраске у 80 (67,2 %), ИФА IgG – у 100 (84,03 %), бактериологически – у 108 (90,76 %) и ПЦР – у 114 (95,8 %). Хламидии в цилиндрическом эпителии с окраской по Романовскому-Гимза были найдены у 13 (11,2 %), ИФА IgG был позитивен в высоких титрах 1:64; 1:128 и 1:256) у 101 (87,1 %) и ПЦР у 114 (98,28 %). Микоплазмы диагностированы на основании бактериологических исследований у 85 (97,7 %) и 72 (97,3 %) больных, ИФА IgG с высокими титрами подтверждал наличие данных инфекций у 78 (89,7 %) и у 65 (87,8 %) больных, и ПЦР диагностика позволила подтвердить диагноз у 81 (93,1 %) и у 69 (93,2 %) больных.
При клинически выраженном бактериальном вагинозе (массивные выделения с «рыбьим запахом») метод ПЦР в 100 % случаев подтвердил у 25 наблюдаемых женщин наличие гарднерелл, этот же метод позволил у 15 мужчин выявить наличие Gardnerella vaginalis. В то же время проведенный у всех 40 больных ИФА поиск специфических иммунных комплексов IgG показал низкую эффективность с его значимым повышением лишь у 5 (12,5 %) больных.
В диагностике латентно текущей (субклинической) вирусной инфекции наиболее значимым, информативным и достоверным показал себя метод ИФА исследования специфических IgG, а при явном клиническом обострений и IgМ. При длительности (по авидности) вирусного заболевания более 4 месяцев повышение содержания в крови больных специфических противовирусных антител – IgG в 2–3 раза указывало на латентное течение, а при количественном повышении допустимого верхнего порога содержания IgG в 5–10 и более раз, предполагалась активация или диссеминация данного вида вирусной инфекции, что подтверждалось повышением IgМ и ПЦР исследованиями.
Уретроскопически у 29 (28,7 %) мужчин выявлены ограниченные зоны отечности и гиперемии с щелевидными углублениями темно-красного цвета и грубыми складками, а у 7 (6,9 %) выявлена бледно-серая тусклая слизистая с грубыми складками и формированием рубцовых сужений уретры на уровне ее стволового отдела.
Кольпоскопическое исследование, выполненное при гинекологическом обследовании всех 60 наблюдаемых женщин, позволило диагностировать экзоцервицит у 28 (46,7 %) и эндоцервицит у всех обследованных. Ретенционные кисты с перифокальным воспалением (наботовые кисты или закрытые железы) выявлены у 10 (16,7 %) больных, а истинная эрозия шейки матки у 3 (5 %) обследованных. Кольпоскопические данные позволяли судить о степени воспалительного повреждения эпителия и желез шейки матки.
Ультразвуковое исследование мочеполовых органов у мужчин включало морфологическую оценку состояния кавернозных и пещеристого тел, предстательной железы и органов мошонки. Ограниченные фиброзные изменения кавернозных тел обнаружены лишь у 3 (2,97 %) больных, и еще у 9 (8,9 %) обнаружены фиброзно-ретенционные изменения в яичках и особенно в их придатках. Трансабдоминальное ультразвуковое исследование предстательной железы, проведенное всем обследованным мужчинам, выявило асимметричность за счет увеличения (отечность) и фиброзно-фолликулярных изменений в основном в правой доле у 27 (26,7 %), а зоны повышенной эхогенности чаще отмечены в центральной части железы (у 21 – 20,8 % обследованных) с образованием кальцификатов. Практически у всех мужчин, страдающих урогенитальной микст-инфекцией, при ультразвуковом исследовании простаты отмечена диффузно-неоднородная эхогенность с чередованием зон повышенной и сниженной эхогенности без четких границ.
У всех женщин выполнялось обзорное полипозиционное трансабдоминальное ультразвуковое исследование органов малого таза с наполненным мочевым пузырем и 28 (46,7 %) женщин для уточнения степени деструкции маточных труб и яичников смотрели трансвагинально. Наиболее часто выявлялся сальпингоофорит – у 22 (36,7 %) и аднексит – у 14 (23,3 %), а также поликистозная дегенерация яичников установлена у 3 (5 %) и эндометриоз был у 4 (6,7 %).
При топическом анализе распространенности инфекционно-воспалительных поражений мочеполовых органов у 101 мужчины и 60 женщин, наблюдаемых по поводу протозойно-микробно-вирусной урогенитальной инфекции, выявлены определенные клинико-морфологические закономерности, представленные в таблицах 3.4 и 3.5.
Таблица 3.4 – Частота поражения мочеполовых органов у мужчин, страдающих от урогенитальной микст-инфекции
| Заболевания | Количество больных | |
| Абсолютное число | % | |
| Баланопостит, кавернит | 24 | 3,76 |
| Неспецифические уретриты | 41 | 40,59 |
| Хронический простатит | 52 | 51,49 |
| Орхоэпидидимиты и патология яичек | 19 | 18,81 |
| Хронический цистит и пиелонефрит | 13 | 12,87 |
| Бесплодный брак | 61 | 60,4 |
Как видно из данных, приведенных в таблице 3.4, наиболее часто у данной категории мужчин диагностированы хронический простатит и неспецифический уретрит, баланопостит, по поводу которых они неоднократно обращались и лечились у урологов, андрологов и дерматовенерологов. Более 60 % (61 больной) отмечали бесплодный брак на протяжении 2–3 лет и выявленные нарушения сперматогенеза.
Таблица 3.5 – Частота поражения мочеполовых органов у женщин, страдающих от урогенитальной микст-инфекции
| Заболевания | Количество больных | |
| Абсолютное число | % | |
| Уретрит, кольпит, эндоцервицит | 18 | 30,0 |
| Эндоцервицит, кольпит | 10 | 16,7 |
| Эндоцервицит, кольпит, эктопия шейки матки | 11 | 18,3 |
| Эндоцервицит, кольпит, сальпингоофорит | 16 | 26,7 |
| Кольпит, эндоцервицит, аднексит | 15 | 25,0 |
| Хронический цистит и пиелонефрит | 17 | 28,3 |
| Бесплодный брак | 18 | 30,0 |
Как видно из данных, представленных в таблице 3.5, у женщин, заразившихся сочетанной урогенитальной инфекцией, отмечалась многоочаговость поражения воспалительными процессами органов малого таза. При этом наиболее часто поражались цервикальный канал и шейка матки с распространением воспалительного процесса как минимум на две топографические области: цервикальный канал и слизистую оболочку влагалища или в уретру. Все это приводило у 14 (23,3 %) женщин к нарушениям менструального цикла с усилением болезненности внизу живота. Практически все женщины (57 – 95 %) по данным акушерско-гинекологического анамнеза страдали гинекологическими заболеваниями и лечились у врачей-гинекологов, 18 (30 %) из них указывали на бесплодный брак на протяжении 2–3 лет.
Таким образом, особенности клинических проявлений микст-инфекций, передаваемых половым путем, определяются мало- или асимптомным длительным течением заболевания, многофокусным поражением, наличием трех или более микроорганизмов, которые поддерживают воспалительный процесс, а также наличие резидуальных явлений и осложнений.
3.2 Разработка дополнительной медикаментозной и озонотерапии для улучшения эффективности традиционной этиотропной терапии урогенитальных инфекций
Выбор подходов к проведению рационального и эффективного комбинированного лечения урогенитальных микст-инфекций (протозойно-бактериально-вирусных) обусловлены не только их биологическими свойствами, но и отсутствием литературных данных о взаимодействии при ассоциативном симбиозе, мутуализме и паразитизме. Известна роль трихомонад, выступающих «прикрытием» для поглощенных возбудителей микст-инфекций, персистирующих внутриклеточно до гибели данных простейших. В тоже время хламидии, микоплазмы и другие возбудители, персистируя внутриклеточно в трихомонадах, трансформируются из одной формы в другую, с изменением клинической картины заболевания и осложняя его течение. При этом в доступной литературе отсутствует единый подход к лечебной тактике при симбиозе простейших с бактериями и вирусами, что и послужило мотивацией к проведению данного научного исследования.
Объем и характер проведенного лечения существенно отличался в группе контроля (І группа), группе сравнения (ІІ группа) и основной (ІІІ группа) группах, что обусловлено усовершенствованием комбинированной традиционно-стандартизированной терапии.
Традиционная терапия, проведенная 23 больным с сочетанной урогенитальной инфекцией, включала медикаментозные препараты по утвержденным клиническим протоколам оказания помощи больным данного профиля (Накази МОЗ України № 286 від 07.06.2004 р. та № 312 від 08.05.2009 р., а також Наказ Головного управління охорони здоров’я Харківської обл. держ. адміністрації № 436 від 06.07.2009 р.).
При хламидийной инфекции назначались на 10–14 дней препараты тетрациклинового ряда (доксициклина хлорид, доксициклина моногидрат), макролиды (азитромицин, кларитромицин, джозамицин) или фторхинолоны (офлоксацин или ципрофлоксацин), а при диссеминации (простатит, орхоэпидидимит, болезнь Рейтера) дополнительно иммуномодуляторы (тималин, левамизол), индукторы интерферона (циклоферон), противогрибковые (нистатин, флуконазол), гепатопротекторы, поливитамины, нестероидные противовоспалительные средства (индометацин, ибупрофен, диклофенак и т. п.). При осложненно-диссеминированном течении хламидийной инфекции курс антибактериальной терапии увеличивался до 21 суток.
При микоплазменно-уреаплазменной инфекции также на 10–14 дней назначались аналогичные антибиотики тетрациклинового, макролидного или фторхинолонового рядов с инстилляцией в течение 10 дней в уретру и мочевой пузырь 2 % раствора желатина 50 мл с масляным витамином А – 500 МЕ, инсулином – 200 ЕД и тетрациклином – 1 млн ЕД; фонофорез с тетрациклином и эритромицином, а также диатермия, ультразвук или УВЧ № 10 на нижние мочевыводящие и половые органы.
При трихомонозе назначались 7–14-дневные курсы лечения препаратами имидазольной группы (метронидазолом или его аналогами), при смешанной инфекции в сочетании с клиндамицином (далацином Ц) или макролидами 5–7-дневными курсами в сочетании с местным лечением, включающим промывание уретры растворами метронидазола, мирамистином, раствором нитрата серебра (1:1000–1:6000), ртути оксицианида (1:1000–1:6000) и вагинальными суппозиториями «Тержинан».
При генитальном герпесе в 5–10-дневные курсы лечения противовирусными препаратами (ацикловир, валацикловир) в сочетании с иммуномодуляторами, повышающими накопление эндогенного интерферона (гропринозин, циклоферон, неовир), стимуляторами неспецифической реактивности организма (алое, аутогемотерапия, витамины группы В, аскорбиновая кислота), а также через день курсом № 3–5 внутривенной дезинтоксикационной терапии (гемодез или глюкозо-инсулиновый коктейль – глюкоза 5 % – 400 мл, инсулин – 8 ЕД и панангин – 10 мл). Такой индивидуальный медикаментозный подход позволяет блокировать репликацию вирусов и корректировать иммунную систему [43, 44].
Во ІІ клинической группе наблюдаемых нами больных (53 чел.) в первую неделю проводилось лечение трихомоноза препаратами группы 5-НИ. Лечение 5-НИ проводилось по следующей схеме: метронидазол (трихопол, клион, флагил) или тинидазол (фазижин, тиниба) однократно в начальной дозе 2 г, затем по 500 мг 2 раза в день еще на протяжении 6 дней. Далее лечение трихомоноза сочеталось с лечением урогенитальной и вирусной инфекции. Затем курс лечения трихомоноза продолжался еще в течение 10 дней предложенным комплексом противотрихомонадных и противопаразитарных препаратов: орнидазол (тиберал, мератин) по 0,5 г 2 раза в день в сочетании с альбендазолом (вормил) по 0,4 г 2 раза в день или ниморазолом по 0,5 г 2 раза в день в сочетании с мебендазолом (вермокс) по 0,5 г 2 раза в день, что позволяло преодолеть высокую и перекрестную резистентность трихомонад к препаратам группы 5‑НИ [174].
Начиная со второй недели лечения, дополнительно проводилась антибактериальная терапия. В начале назначали препараты группы фторхинолонов (ципрофлоксацин по 0,5 г 2 раза в день или гатифлоксацин по 0,2 г 2 раза в день 10 дней), а затем еще в течение 14 дней в стандартной дозировке антибиотики группы макролидов [кларитромицин или вильпрафен (джозамицин)]. Местно у мужчин проводились ежедневные 15–20-минутные инстилляции уретры, а у женщин – влагалища приготовленным на основе рыбьего жира антибактериальным препаратом «Эктерицид» (ЗАО «Биолек», Харьков) с установкой на ночь мужчинам ректально, а женщинам вагинально суппозиториев. Женщинам 10 дней применялись свечи «Тержинан» или «Полижинакс», затем 10 дней свечи «Виферон» или «Генферон» по 1 млн МЕ. Мужчинам – 10 дней свечи «Виферон» или «Генферон» по 1 млн МЕ. Одновременно проводимая противовирусная терапия включала валацикловир по 500 мг 2–3 раза в сутки на протяжении 7–14 суток с одновременным ежедневным внутримышечным введением в 1–2 млн МЕ рекомбинантных интерферонов альфа-2b (Альфарекин или Интробион) в течение 10 дней и последующим введением по стандартной схеме индукторов интерферонов (амиксин, гропринозин или неовир).
В основной (III) клинической группе (85 – 52,8 % больных) в состав комплексной терапии вошли разработанные оригинальные способы ОТ, которые сочетались с вышеописанной комплексной консервативной терапией. Аллотропно модифицированный кислород – озон (О3) – получался из газообразного медицинского кислорода путем электросинтеза в сертифицированном аппарате ОТ универсальном медицинском «ОЗОН УМ-80». Концентрация озоно-кислородной смеси в аппарате регулируется с шагом 0,1 мг/л от 0,2 до 80 мг/л с автоматической системой контроля точности вырабатываемой концентрации (погрешность ±5 %) и гарантированной чистотой О2/О3 смеси за счет фильтра доочистки кислорода и конструкции разрядной камеры с двойным барьером, препятствующим контакту озоно-кислородной смеси с металлом электродов. Автоматизация основных функций аппарата «ОЗОН УМ-80» позволяет точно воспроизводить как ранее разработанные, так и вновь создаваемые способы клинического применения медицинского озона [56].
У всех 85 больных, страдающих хронической сочетанной урогенитальной инфекцией, лечение проводилось на фоне системного метаболического воздействия на организм за счет противогипоксического, гипокоагуляционного, дезинтоксикационного, иммуномодулирующего и сосудорасширяющего эффектов, а также противовоспалительного действия и активации обменно-метаболических процессов. Данный эффект обеспечивался проведением большой аутогемо-озонотерапии (внутривенно, через день барбатируемый О2/О3 смесью физиологический раствор с концентрацией озона от 5,0 до 20 мг/л, смешивая с кровью больного внеорганно, с индивидуальным определением оптимальной дозы озона для каждого больного) [57].
В комплекс местного лечения у мужчин (53 больных) включались микроклизмы с маслом «Озонид» в количестве 20,0 мл и концентрацией озонидов (20,0±1) мг/л курсом № 30, а также инстилляции в уретру с ее восходящим массажем масла «Озонид» (10,0±2,0) мг/л по 10 мл на 20 мин. ежедневно № 10, затем (5,0±2,0) мг/л еще 10 дней. При затяжном течении с частыми обострениями бактериально-вирусных фиброзно-паренхиматозных простатитов больным выполнялись парапростатические блокады озонированным физиологическим раствором с возрастающей концентрацией растворяемого озона от 3 до 7 мг/л № 4–5 дважды в неделю в комплексе с малой аутогемо-озонотерапией через день № 5–7 с концентрацией растворяемого озона от 10 до 20 мг/л.
У женщин паравезикальную жировую клетчатку инфильтрировали повторно, через день озонокислородной смесью с нарастающим от 2 до 10 мг/л содержанием озона № 6, а затем еще № 5 с шагом (1,5±0,5) мг/л, снижая концентрацию озона до исходного уровня. Одновременно внутрипузырно женщинам ежедневно инстиллировали масло «Озонид» с концентрацией озонидов олефинов 10 мг/л первые 10–15 процедур, а затем еще 10–15 процедур с концентрацией 5 мг/л (Пат. 61201 UA) [242, 254]. Профилактика и лечение женского бесплодия включала санацию влагалища ежедневными ванночками на 20 мин. с дистиллированной озонированной (от 10 до 7 мг/л) водой и тампонами с маслом «Озонид» на 20 мин. ежедневно с концентрацией озона 10 мг/л № 10 и затем 5 мг/л еще № 10. Санация полости матки при хроническом эндометрите выполнялась путем обдува озоно-кислородной смесью под давлением 20–30 мм рт. ст. и с концентрацией озона от 50 до 5 мг/л при шаге снижения в 5 мг/л, т.е. № 10. А при развивающейся облитерации маточных труб их гидротурбация под давлением 70–80 мм рт. ст. с концентрацией озона с 10 до 7 мг/л и скоростью потока 100 мл/мин.
Таким образом, традиционно-стандартизованная по клиническим протоколам терапия эффективна лишь при выявлении одного этиологического возбудителя ИППП без учета возможного сочетанного воздействия на организм больного двух-трех и более инфекционных агентов, обладающих разной степенью инвазивности, вирулентности, токсикогенности, антифагоцитарной способностью и тканевым тропизмом. При ассоциативном симбиозе, мутуализме и паразитизме протозойно-бактериально-вирусной ИППП с неспецифической микрофлорой (стафилококки, стрептококки, кишечная палочка, протей, синегнойная палочка и др. микроорганизмы) происходит изменение биологических свойств бактерий и простейших, что требует поиска нестандартных лечебных мероприятий для их элиминации. Более широкое включение в комплексную терапию больных с урогенитальной микст-инфекцией иммунотерапии и УППТ, оригинальных способов общей и местной ОТ и квазилазерной фототерапии перспективны в лечении этой категории наиболее тяжелых и социально дезадаптированных больных.
3.3 Производные бензимидазола, иммунотерапия, озонотерапия в клиническом и микробиологическом излечении больных урогенитальной микст-инфекцией
Полимикробные ассоциации урогенитальных инфекций более чем в 50 % случаев носят бессимптомный или малосимптомный, скрытый характер. Резервирующая роль трихомонад во взаимодействии с другими ИППП приводит к формированию патогенных микробиоценозов урогенитального тракта, что обуславливает персистирование различных микроорганизмов в организме человека. Устойчивость отдельных штаммов урогенитальных трихомонад обусловлена выработкой ими ферментов, ингибирующих препараты имидазола, изменением генотипа и метаболизма за счет мутаций, а также инактивацией метронидазола сопутствующей бактериальной флорой. Поэтому для преодоления выраженного снижения эффективности традиционной антимикробной терапии проводят длительную (14 и более дней) терапию высокими (до 750 мг метронидазола) дозами (внутривенно, per os и интравагинально), в сочетании с приемом цинка, аминокапроновой кислоты, кобальта. Однако высокая торпидность к проводимой терапии особенно при микст-инфекциях сохраняется, что приводит к большому количеству рецидивов и осложнений [58, 110].
Объем и эффективность антибактериальной терапии определяется, прежде всего, характеристикой микробиоценоза с учетом как специфической, так и условно-патогенной микрофлоры урогенитального тракта у больных обоего пола. Каждый наблюдаемый 161 больной кроме основных специфических инфекций был бактериологически исследован на наличие условно-патогенных представителей микробной флоры.
При анализе результатов диагностических исследований, представленных в таблице 3.6, отмечен смешанный состав специфической микрофлоры с преимущественным выявлением: Trichomonas vaginalis – 73,9 %, Chlamydia trachomatis – 72,05 %, Mycoplasma hominis – 54,04 %, Ureaplasma urealyticum – 46 %, Gardnerella vaginalis – 24,8 %, а также хроническая латентно протекающая вирусная инфекция, в основном Herpes simplex – 95,9 %. При этом как у мужчин (101 больной), так и у женщин (60 больных) выявлено наличие ассоциативного симбиоза трех или четырех видов возбудителей урогенитальных инфекций. Грамотрицательные внутриклеточные микроорганизмы (хламидии, микоплазмы и уреаплазмы) сочетались с основными возбудителями бактериального вагиноза (протозойными простейшими – Trichomonas vaginalis и условно-патогенными анаэробами – Gardnerella vaginalis), а также хронической латентно протекающей и рецидивирующей вирусной инфекцией (вирус простого герпеса 1 и 2 типа, цитомегаловирус и вирус Эпштейна-Барр).
Среди 161 пролеченного больного наиболее часто у 74 (46 %) больных выявлены атипичные возбудители (хламидии и уреаплазмы), которые сочетались с трихомонадами и вирусами (симбиоз из четырех видов возбудителей). Несколько реже у 46 (28,6 %) больных выявлен комплекс простейших факультативных анаэробов (трихомонады) с атипичными возбудителями (микоплазмы) и вирусами (три вида возбудителей в симбиозе). Еще у 41 (25,4 %) больного атипичные возбудители (хламидии и микоплазмы) сочетались с возбудителем бактериального вагиноза (гарднереллами) и вирусами (симбиоз из четырех видов возбудителей).
Таблица 3.6 – Состав патогенной микрофлоры у больных с урогенитальной микст-инфекцией
| Вид микро-организма | Трихо-монады | Хлами-дии | Мико-плазмы | Уреа-плазма | Гардне-реллы | Вирус простого герпеса І типа | Цитомега-ловирус | Вирус Эпштейна-Барр |
| Количество больных | 119 | 116 | 87 | 74 | 40 | 118 | 19 | 8 |
| % случаев от общего числа больных | 73,9 | 72,05 | 54,04 | 46 | 24,8 | 95,9 | 15,45 | 6,5 |
При анализе состава специфической микрофлоры видно, что в отделяемом урогенитального тракта патогенная микрофлора преобладает у мужчин. Микробный пейзаж у женщин был в основном представлен представителями условно-патогенной микрофлоры. Условно-патогенная микрофлора в значимых количествах (>103 КОЕ/см3) бактериологически выделена у 103 (64 %) больных урогенитальной микст-инфекцией (рис. 3.1). Виды, количество и процентное соотношение условно-патогенной микрофлоры у пролеченного 161 больного микст-урогенитальной инфекцией представлены в таблице 3.7. Представленное разнообразие микробных ассоциаций показывает, что наиболее частыми являлись стафилококки – 42,3 %. Достаточно часто были выделены род Enterobacteriaceae (8,7 %) и Enterococcus (5,6 %). Значительно реже наблюдались ассоциации урогенитальных микст-инфекций с группой стрептококков (2,5 %).
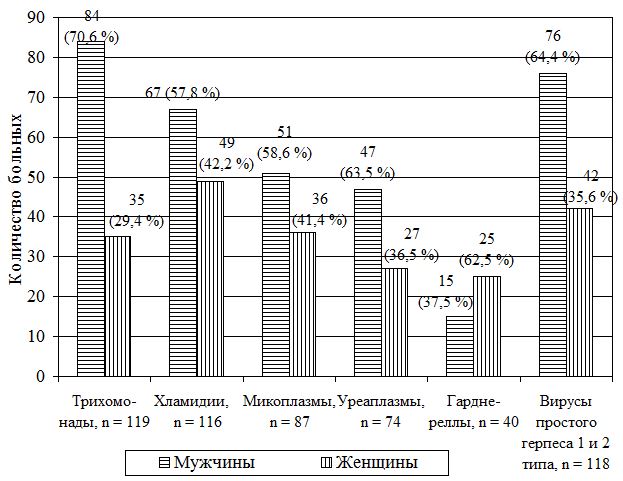
Рисунок 3.1 – Состав патогенной микрофлоры у больных урогенитальной микст-инфекцией в зависимости от пола
Оценивая микробиоценоз урогенитального тракта при микст-инфекционных его поражениях, отмечены значительные отличия в микробном пейзаже и количественном составе условно-патогенной микрофлоры. Прежде всего это проявлялось в отсутствии у практически здоровых людей маркеров специфической половой инфекции, выделении представителей условно-патогенной микрофлоры в виде единичных колоний (до 103 КОЕ/см3), отсутствии фекальных микроорганизмов (энтерококков и энтеробактерий), малочисленность представителей условно-патогенной микрофлоры в отделяемом урогенитального тракта как у мужчин, так и у женщин.
Таблица 3.7 – Состав патогенной (условно-патогенной) микрофлоры высеянных более 104 КОЕ/см3 у больных урогенитальной микст-инфекцией
| Вид микроорганизма | S. epidermidis | S.saprophyticus | S. aureus | S. haemolyticus | Enterobacteriaceae | Enterococcus | Corynebacterium spp. | Streptococcus spp. |
| Количество больных | 25 | 22 | 17 | 4 | 14 | 9 | 8 | 4 |
| Частота представителей условно-патогенной микрофлоры, % | 24,3 | 21,4 | 16,5 | 3,9 | 13,6 | 8,7 | 7,7 | 3,9 |
| % случаев от общего числа больных | 15,5 | 13,7 | 10,6 | 2,5 | 8,7 | 5,6 | 4,97 | 2,5 |
Течение воспалительного процесса при урогенитальных микст-инфекциях, как показали исследования, обусловлено замещением нормальной микрофлоры симбиозом других бактерий с выраженными патогенными свойствами, появлением резистентных форм и персистенции возбудителей, многофокусностью хронического рецидивирующего поражения органов и систем, протекающих на фоне вторичного угнетения иммунорезистентности и антиоксидантной защиты. В этих условиях применение антибиотиков и противопаразитарных препаратов в рекомендованных протоколами дозах не всегда приводит к санации организма. Для этого необходим широкий спектр действия препарата (микроорганизмы, простейшие, грибы, вирусы) и высокая степень проникновения внутрь клетки, положительное воздействие на иммунную систему и неспецифическую резистентность организма больных, возможность эффективной антибактериальной терапии не менее 10–14 дней.
Возможность решения данных проблем показана при включении в комплексную терапию у 85 (52,8 %) больных разработанных оригинальных методов ОТ. Это обусловлено тем, что озон (О3), как аллотропная модификация из трех атомов кислорода, обладает высоким окислительно-восстановительным потенциалом и большими скоростями реакций с органическими молекулами. При введении озона в организм происходит одновременное воздействие озона, молекулярного и атомарного кислорода, а также промежуточных продуктов их реакций – озонидов, пероксидов, свободных радикалов, синглетного кислорода, что обеспечивает его разнообразное и разнонаправленное действие на организм человека.
Терапевтические свойства озона и продуктов окисления (озонидов, пероксидов) оказывают антимикробный, антигипоксический, противовоспалительный, иммуномодулирующий и дезинтоксикационный эффекты, стимулируются обменные процессы и улучшаются реологические свойства крови. Бактерицидное действие озона связано с нарушением целостности оболочки бактериальной клетки, с повреждением плазматической мембраны в процессе озонолиза двойных связей и повышением чувствительности бактерий к действию антибиотиков. Антивирусное действие озона реализуется путем окисления «вирусного шипа» с невозможностью взаимодействия с клетками-мишенями и нарушением синтеза вирусных белков за счет инактивации фермента «обратная транскриптаза».
Противогипоксический эффект обеспечивается ОТ за счет улучшения транспорта и утилизации кислорода. И если первое обеспечивается улучшением деформабельности эритроцитов, уменьшением связи гемоглобина и O2 с усиленной отдачей кислорода тканям, а также вазодилатацией артериол и посткапиллярных венул за счет активации NO-синтетазы и выделения эндотелиоцитами оксида азота (NO). Утилизация кислорода обусловлена активацией кислородозависимых реакций. Ускоряются гликолиз, β-окисление жирных кислот, цикл Кребса, образование макроэргических соединений (аденозинтрифосфат, аденозинмонофосфат) и за счет протонной стимуляции усиливается мощность антиоксидантной системы [90].
Окисление озоном арахидоновой кислоты прерывает цикл образования медиаторов воспаления, а стимуляция выработки лимфоцитами и моноцитами цитокинов (интерфероны, фактор некроза опухоли и интерлейкины) и коррекция образующимися пероксидами нарушенных стадий фагоцитоза обуславливают иммуномодулирующий эффект. Дезинтоксикационный эффект ОТ проявляется через улучшение функции микросомальной системы гепатоцитов и усиление почечной фильтрации. Улучшение реологических свойств крови наступает за счет снижения агрегационной способности форменных элементов крови и объясняется восстановлением электрического заряда их мембран и снижением уровня фибриногена с повышением фибринолитической активности плазмы [90].
Поэтому безопасный и простой в исполнении, высокоэффективный метод ОТ по оригинальным методикам (см. подраздел 3.2) применен в комплексном лечении урогенитальных микст-инфекций у 85 (52,8 %) больных основной группы.
При невозможности проведения ОТ существенной проблемой является лечение полирезистентных форм трихомонадно-бактериально-вирусных ассоциаций. При этом трихомонады приобретают амебоподобные формы с обильно развитой вакуолярной системой и способностью фиксировать на своей поверхности и поглощать микробные клетки, изменяя патогенез течения урогенитальных микст-инфекций. Эндоцитобиоз бактерий внутри трихомонад с персистенцией возбудителей в фагосомах позволяет микробным клеткам и вирусам пережить период протистоцидной и противовирусной терапии, поддерживая воспалительный процесс после эффективного лечения трихомонадной инфекции [11].
Врожденная и приобретенная резистентность трихомонад к метронидазолу, как правило, сочетается с устойчивостью к другим нитроимидазольным препаратам. Поэтому сочетанное применение их последовательно (метронидазол, тинидазол, орнидазол и ниморазол) даже в удвоенных дозах не позволяет получить гарантированной элиминации при сочетанной трихомонадно-бактериально-вирусной урогенитальной инфекции. При этом известно, что противоглистные препараты (альбендазол-вормил, мебендазол-вермокс) активны также в отношении патогенных простейших, вызывая необратимое нарушение утилизации глюкозы в их организме, и тормозят синтез АТФ. Применение 5–6-дневных курсов лечения мебендазолом по 0,5 г 2–3 раза в день или альбендазолом по 0,4 г 2 раза в день позволило выявить их высокую эффективность в лечении устойчивых к метронидазолу штаммов трихомонад (Пат. 5477 и 5478 от 15.03.2005). Дальнейшие разработки в данном направлении наиболее результативных сочетаний нитроимидазолов с антигельминтными препаратами, как УППТ, клинически апробированы и внедрены при комплексном лечении 53 (32,9 %) больных с урогенитальной микст-инфекцией (группа сравнения).
Наиболее значимый положительный эффект элиминации трихомонад достигнут при одновременном назначении в течение 10 дней альбендазола по 400 мг 2 раза в день с орнидазолом по 500 мг 2 раза в день (Пат. 75397 от 26.11.2012) или мебендазола по 500 мг 2 раза в день в комплексе с ниморазолом по 500 мг 2 раза в день в течение 10 дней (Пат. 80882 от 10.06.2013).
Кроме УППТ в комплексном лечении 53 больных группы сравнения широко применялась фармакоиммунотерапия. Последняя включала в себя как специфическую противопаразитарно-микробно-вирусную, так и неспецифическую иммунокорригирующую терапию. Среди реактиваторoв специфической иммунологической защиты у больных группы сравнения (53 чел. – 32,9 %) по показаниям широко применяли:
– иммуноглобулин человека антихламидийный (внутримышечно по 1 ампуле – 1,5 мл в день № 6);
– иммуноглобулин человека против герпеса (І типа) вводили внутримышечно 5 раз в дозе 4,5 мл (3 ампулы) с интервалом двое суток.
В комплексную противовирусную терапию в первые 10 дней включались общие иммунотропные средства в виде внутримышечных введений рекомбинантных интерферонов альфа-2b (Альфарекин или Интробион) по 1 млн МЕ с последующим введением противовирусных индукторов эндогенных интерферонов (Neovirum) по 250 мг внутримышечно с интервалом 48 часов, курсом 10 инъекций). Использование в лечении больных группы сравнения специфических и общих иммуномодуляторов позволяло значительно усилить иммунологическую реактивность организма больных, повысив результативность комплексной терапии в элиминации возбудителей и ликвидации латентных очагов болезни в организме.
Суммарная оценка эффективности проведенного комбинированного лечения включала данные клинико-лабораторного контроля (через две и 9–10 недель после окончания основного курса лечения), динамику процессов ПОЛ и систем антиоксидантной, антирадикальной защиты, показателей врожденного и приобретенного иммунитета, а также возможности коррекции репродуктивной дисфункции.
При этом оценка полученных результатов количественно оценивалась в баллах:
– 2 балла – неудовлетворительный результат, без существенной динамики или нестойкое улучшение лишь 30 % основных показателей;
– 3 балла – удовлетворительный результат с нестойким улучшением основных показателей на 50 %, элиминация достигнута лишь одного из компонентов трихомонадно-бактериально-вирусной сочетанной инфекции;
– 4 балла – хороший результат, элиминированы не менее двух компонентов микст-инфекций, на 70–80 % улучшились основные клинико-лабораторные показатели со стойким эффектом;
– 5 баллов – достигнута элиминация всех протозойно-микробных составляющих микст-инфекции с нормализацией всех основных клинико-лабораторных данных.
Эффективность различных методов комбинированной терапии урогенитальной микст-инфекции представлена в таблице 3.8 в средних оценочных баллах в зависимости от видов и количества инфекционных агентов, входящих в бактериально-вирусные ассоциации. При этом результаты клинико-лабораторной оценки по бальной системе находились в прямой корреляционной связи с динамикой показателей ПОЛ, ОАОЗ, а также врожденного и приобретенного иммунитета. Установлено, что подключение оригинальных методов ОТ позволяло получать наиболее благоприятные результаты с нормализацией всех основных клинико-лабораторно-инструментальных показателей, а также улучшить репродуктивную функцию у представителей обоего пола.
Таблица 3.8 – Динамика эффективности комбинированного лечения больных хронической урогенитальной микст-инфекцией
| Виды инфекционных агентов, входящих в урогенитальные микст-ассоциации и количество больных в группах | Среднее количество баллов в группах с проведенным лечением | ||
| I группа,
n = 23 |
II группа,
n = 53 |
III группа,
n = 85 |
|
| Трихомонады, хламидии, уреаплазмы, вирусы, n = 74 | 2,4 | 3,6* | 4,7** |
| Хламидии, микоплазмы, гарднереллы, вирусы, n = 41 | 3,3 | 4,2* | 4,9* |
| Микоплазмы, трихомонады, вирусы, n = 46 | 2,7 | 3,8* | 4,8* |
| Суммарная эффективность методов лечения | 2,8 | 3,87* | 4,8* |
Примечание. * – p < 0,05; ** – p < 0,01
В целом необходимо отметить, что видовая полиморфность патогенной протозойно-бактериально-вирусной урогенитальной инфекции в комплексе с разноплановой условно-патогенной флорой приводит к полирезистентности и торпидности микрофлоры к лекарственным препаратам. Ассоциативный симбиоз урогенитальной инфекции приводит к малосимптомному клиническому течению на фоне угнетения защитных сил организма, вызывая значимые морфо-функциональные изменения, прежде всего, органов репродуктивной сферы. Усиление противопротозойной терапии альбендазолом и мебендазолом существенно улучшает результаты элиминации простейших. В комплексе с вышеописанной целенаправленной стимуляцией иммунной системы повышалась эффективность противомикробной, противовирусной и антипротозойными терапии. Системная и местная ОТ по предложенным оригинальным методикам позволила у 96 % наблюдаемых мужчин ликвидировать воспалительный процесс и добиться гарантированной элиминации бактериальных возбудителей в 98 %. При комплексном лечении женщин с урогенитальной микст-инфекцией оригинальные методы системной и местной ОТ позволили у 95 % пациенток получить санацию наружных и внутренних гениталий, нормализовать у 40 (66,7 %) гормональный фон и у 35 (58,3 %) восстановить репродуктивную их функцию.
3.4 Нормализация перекисного окисления липидов и антиоксидантной защиты у больных, пролеченных по поводу урогенитальной микст-инфекции
Непрерывно в организме человека происходят свободнорадикальные процессы в норме в результате воздействия факторов внешней среды или нормального метаболизма. При дисбалансе между интенсивностью образования активных форм кислорода и активностью антиоксидантной системы защиты возникает опасность проявления токсического действия свободных радикалов. Их повреждающее действие связано с развитием реакций ПОЛ и соответствующей дестабилизацией мембран, деполяризацией полисахаридов и нарушением структуры межклеточного матрикса, блоком SH‑групп ферментов и их инактивацией, гидроксилированием оснований ДНК, ее фрагментацией и развитием различных мутаций.
При урогенитальных микст-инфекциях (трихомонады, гарднереллы, хламидии, микоплазмы, вирусы герпеса) раннее доклиническое выявление метаболических нарушений обмена веществ и разработка методов купирования оксидативного стресса остается актуальной задачей современной дерматовенерологии. Экспериментальные и клинические исследования подтвердили эффективность индукционной функции озона в качестве активатора естественных свободнорадикальных процессов с повышенной генерацией перекисей в клеточной цитоплазме. При этом в зависимости от дозы озон способен сдвигать окислительно-восстановительное равновесие метаболических систем, вызывая компенсаторную мобилизацию эндогенных антиоксидантов из депо и активируя ферментативное звено антирадикальной защиты в печени [90, 169].
Контроль функции мембран возможен при определении продуктов свободнорадикального окисления жирных кислот (ПОЛ): ДК, МДА, ШО. Важно также определение методом индуцированной хемилюминесценции влияния на интенсивность ПОЛ всего комплекса соединений с общей антиоксидантной активностю (ОАОА), обладающих как оксидантным, так и прооксидантным действием. Наиболее полная и информативная оценка степени повреждения клеток возможна лишь при одновременном определении окислительной модификации белков [49].
Для уточнения степени повреждающего действия сочетанной протозойно-микробно-вирусной инфекции и возможности их коррекции изучена динамика продуктов ПОЛ и ОАОА плазмы крови при лечении больных. Изучение состояния и динамики ПОЛ и ОАОЗ проведено у 141 пациента. Все пациенты были в возрасте от 18 до 49 лет, средний возраст – (28,4±2,2) года.
Сочетанная с осложненным течением протозойно-урогенитально-вирусная инфекция (трихомонады, гарднереллы; хламидии, уреаплазмы или микоплазмы, вирусы герпеса, цитомегаловирус и Эпштейна-Барр) диагностирована комплексно (ПЦР, бактериология и ИФА) у 99 (79,8 %) больных. При оценке соотношения возбудителей, входящих в полимикробные ассоциации ИППП, у 99 больных, включенных в исследования показателей ПОЛ и АОС, установлено следующее их процентное соотношение (табл. 3.9).
Таблица 3.9 – Состав специфической микрофлоры у 141 больного, обследованного на показатели ПОЛ и АОС
| Вид микро-организма | Трихо-мона-ды | Хла-мидии | Мико-плаз-мы | Уреа-плаз-ма | Гард-нерел-лы | Вирус простого герпеса І-ІІ типа | Цито-мегало-вирус | Вирус Эпштей-на-Барр |
| Коли-чество больных | 98 | 101 | 75 | 64 | 56 | 100 | 4 | 3 |
| Частота обнаруже-ния в группе обследо-ванных (n=141), % | 69,5 | 71,6 | 53,2 | 45,4 | 39,7 | 70,9 | 2,8 | 2,1 |
Как следует из представленных в таблице данных, в ассоциациях чаще всего встречались хламидии (71,6 %), трихомонады (69,5 %) и вирус простого герпеса І-ІІ типа (70,9 %). Достаточно часто в состав микробных ассоциаций входили микоплазмы (53,2 %), уреаплазма (45,4 %) и гарднереллы (39,7 %). Латентно протекающие цитомегаловирус (2,8 %) и вирус Эпштейна-Барр (2,1 %) регистрировались в микст-ассоциациях достаточно редко, требуя проведения специфической иммунотерапии.
Исследования проводились в четырех сравнимых выборках: практически здоровые доноры (25 пациентов) (IV группа), контрольная группа (23 больных) (I группа), подгруппа группы сравнения, которым исследовали метаболизм (II-А подгруппа) (42 больных) и подгруппа основной группы, которым исследовали метаболизм (III-А подгруппа) (76 больных).
В группу неинфицированных вошли 14 (44,0 %) мужчин и 11 (56,0 %) женщин, не предъявлявших жалоб, и у которых были исключены ИППП в рамках обследования для получения сертификата донора.
В контрольную группу вошли 13 (56,5 %) мужчин и 10 (43,5 %) женщин, страдающих протозойно-урогенитально-вирусной инфекцией и получавших стандартное комплексное лечение.
В группу сравнения вошли 24 (57,1%) мужчины и 18 (42,9%) женщин, которым назначались противопаразитарные препараты, индукторы интерферонов, а также рекомбинантные интерфероны.
Основную группу составили 44 (57,9 %) мужчины и 32 (42,1 %) женщин с распространенной и осложненной протозойно-урогенитально-вирусной инфекцией тазовых мочеполовых органов, в комбинированное лечение которых был включен комплекс оригинальных способов ОТ.
Возникающее при действии озона состояние гипероксии вызывает компенсаторную стимуляцию АОС. Появляющиеся в клетках пероксиды, окисляя глутатион, активируют фермент глюкозо-6-фосфат дегидрогеназу, активирующую пентозофосфатный цикл с повышением уровня восстановленных форм никотинамиддинуклеотида (никотинамидадениндинуклеотид и его фосфат). Последние являются донорами протонов для восстановления природных антиоксидантов глутатиона, токоферолов, аскорбиновой кислоты. Быстрая активация антиоксидантной системы (через час на 32–46 %) обусловлена активацией озоном гликолиза и реакции цикла Кребса.
Поэтому кроме внутривенного и внутримышечного введения озонированной аутокрови у мужчин выполнялись парапростатические блокады озонированным физиологическим раствором (у 22 больных), микроклизмы с маслом «Озонид» и инстилляции его в уретру (у 25 больных) и введение озоно-кислородной смеси в паравезикальную жировую клетку в области шейки мочевого пузыря (у 28 больных). У женщин для санации влагалища выполняли вагинальные ванночки с озонированной дистиллированной водой и установкой вагинальных тампонов с маслом «Озонид» (32 больных), а при развившемся цервиците и эндометриозе (у 19 больных) дополнительно проводили санацию полости матки путем обдува озоно-кислородной смесью с постепенным снижением концентрации озона в смеси.
Исследования содержания общих липидов, фосфолипидов и продуктов ПОЛ выполняли в группе неинфицированных пациентов, в ходе лечения традиционными методами (группа контроля) и после ОТ (основная группа). Проведение у больных курсов ОТ проводилось под контролем разработанного способа определения индивидуальной дозы озона по контролируемому снижению лимфоцитотоксичности, что свидетельствует об индивидуальном состоянии функциональной активности лимфоцитарных рецепторов пациента.
В результате проведенного лечения методами ОТ отмечено наиболее значимое улучшение лабораторно-симптоматических показателей в основной группе. Именно в этой группе наиболее значимо улучшились общие симптомы: нарушения сна – с 68,4 % (96 больных) до 15,8 % (22 больных), утомляемость – с 38,2 % (54 больных) до 9,2 % (13 больных), психо-эмоциональные расстройства – с 73,7 % (104 больных) до 13,2 % (19 больных) и навязчивые состояния – 30,3 % (43 больных) до 6,6 % (9 больных).
Значительно улучшилась местная симптоматика у 60 женщин: выделения из влагалища – с 80,0 % (48 больных) до 10,0 % (6 больных), боли внизу живота – с 45,0 % (27 больных) до 3,3 % (2 больных), неприятные ощущения в половых органах, в т.ч. и при половых сношениях – с 43,3 % (26 больных) до 5,0 % (3 больных). Что касается функциональных расстройств, то они безусловно снизились – дизурические с 31,7 % (19 больных) до 3 % (2 больных) и сексуальные расстройства – гиполибидемия – с 65,0 % (39 больных) до 10,0 % (6 больных), нарушение оргазма – с 53,3 % (32 больных) до 6,7 % (4 больных).
Среди мужчин, как видно из таблицы 3.10, симптоматика также наиболее значимо улучшалась у больных основной группы. При этом наиболее быстро за (4,8±0,2) дня исчезали зуд, жжение, боль и общее недомогание.
Таблица 3.10 – Динамика основных показателей симптоматики у мужчин в клинических группах (средний балл по шкале NIH-CPSI) [77].
| Всего мужчин, n = 81 |
Домен I Боль и дискомфорт | Домен II Моче-испускание | Домен III и IV Качество жизни | Общая оценка | ||||
| до лече-ния | после лече-ния | до лече-ния | после лече-ния | до лече-ния |
после лече-ния | до лече-ния | после лече-ния | |
| Из группы I, n = 13 |
7,3 | 2,6 | 3,7 | 2,5 | 3,9 | 2,1 | 14,9 | 7,1 |
| Из группы II,
n = 24 |
7,5 | 2,2 | 3,8 | 2,3 | 4,0 | 2,0 | 15,3 | 6,4 |
| Из группы III, n = 44 |
7,5 | 2,0 | 3,9 | 2,1 | 4,1 | 1,9 | 15,5 | 6,0 |
Данные объективного обследования и лабораторные показатели находились в прямой зависимости от субъективных проявлений и наиболее быстро восстанавливались у больных, получавших ОТ.
У 141 больного с сочетанной протозойно-урогенитально-вирусной инфекцией (I группа, II-А подгруппа и III-А подгруппа) исследовано содержание продуктов ПОЛ и ОАОА плазмы крови до и после лечения. Данные среднегрупповых показателей в группах наблюдения с их динамикой в зависимости от вида и объема проводимой терапии представлены в таблице 3.11. Представленная в первой колонке таблицы среднестатистическая норма продуктов ПОЛ и ОАОА плазмы крови пациентов вычислена в плазме крови 25 практически здоровых людей (IV группа). Это позволило представить обоснованную динамику средних показателей плазмы крови у 141 пациента, страдавших хронической сочетанной протозойно-урогенитально-вирусной инфекцией до начала лечебных процедур.
Представленные в таблице все показатели, как ПОЛ, так и ОАОА существенно отличались отрицательной динамикой, что свидетельствовало о разрушении фосфолипидного слоя клеточных мембран с ускоренным окислением липидов и нарастанием интоксикации. Значимое повышение ДК‑первичных продуктов ПОЛ сопровождается у больных с микст-инфекцией существенным снижением МДА-конечного продукта ПОЛ, по-видимому, за счет его нейтрализации молекулами, составляющими клеточные структуры. Данный эффект обусловлен, по-видимому, очень интенсивным процессом шиффообразования: уровень ШО значимо возрастает, а индекс ШО/МДА увеличивается при этом почти в 3 раза в сравнении с нормой. Интенсификация процессов ПОЛ в плазме крови у больных с хронической микст-инфекцией с накоплением продуктов деградации клеточных структур сочетается со снижением у них ОАОА плазмы. Это указывает на повышение интенсивности свободнорадикального окисления и снижение резервных возможностей ОАОА плазмы крови.
После традиционной терапии по сравнению с показателями до лечения улучшились РВ ОАОА и снизилась интенсивность шиффообразования. Остальные показатели отражали положительную динамику, но существенно отличались от нормальных в группе контроля, что указывало на незавершенность компенсации ПОЛ с продолжающимся повреждением тканей. После ОТ, практически все показатели ПОЛ и ОАОА плазмы крови достоверно улучшились в сравнении с показателями до лечения и существенно не отличались от показателей нормы. Только уровни общих липидов и фосфолипидов, не смотря на положительную динамику, были значимо ниже условно нормальных показателей (таблица 3.11).
Таблица 3.11 – Динамика содержания липидов, продуктов ПОЛ и ОАОА плазмы крови при лечении сочетанной протозойно-урогенитальной инфекции
| Показатели активности ПОЛ и ОАОА (M±m) | Норма
(IV группа) n=25 |
До лечения
(I группа + III-А подгруппа) n=99 |
После традицион-ной терапии
(I группа) n=23 |
После иммунотера-пии и противо-протозойной терапии (II-А подгруппа), n=42 | После озоно-терапии
(III-А подгруппа) n=76 |
| Общие липиды, мг/мл | 2,96±0,02 | 2,38±0,07* | 2,35±0,07* | 2,49±0,06* | 2,82±0,05* |
| Общие фосфолипиды, мкмоль/мл | 1,32±0,05 | 1,12±0,03* | 1,09±0,02* | 1,18±0,03* | 1,27±0,032* |
| ДК, нмоль/мл | 123,5± 3,67 | 159,62±9,87* | 151,23±4,13* | 148,77±4,9* | 126,3±5,82** |
| МДА, нмоль/мл | 20,6±1,76 | 12,23±0,84* | 13,8±0,48* | 15,3±1,0* | 16,2±1,07** |
| ШО, усл. единицы флуоресценции | 36,25± 2,14 | 58,86±2,23* | 43,08±1,76** | 41,64±1,39* | 38,2±1,17** |
| Индекс шиффообразования (ШО/МДА) | 1,76 | 4,81 | 3,12 | 2,72* | 2,51* |
| Интенсивность СРО индуцир. Fe2+ (имп/360с/мл на хемолюминометре БВХ-06) | 87,9±7,6 | 134,2±6,8* | 127,3±5,8* | 100,4±6,2* | 81,5±7,2** |
| Интенсивность СРО индуцир. H2O2 (имп/360с/мл на хемолюминометре БВХ-06) | 1097±75 | 1428±89* | 1219±97 | 1100,5±78* | 1004±83** |
| РВ ОАОА KCL × 10–5, с–1 мкл–1 |
6,06±0,34 | 2,8±0,18* | 4,11±0,43* ** | 5,65±0,54* | 7,04±0,31** |
Примечание. * – достоверность отличия от нормы (p<0,05); ** – достоверность отличия от показателей до лечения (p<0,05)
Полученные данные указывают на то, что при хронических урогенитальных микст-инфекциях отмечается выраженная интенсификация процессов свободнорадикального окисления, сопровождающаяся снижением резервных возможностей ОАОА. Все это приводит к дестабилизации структурно-функционального состояния клеточных мембран на системном и локальном уровнях с нарушением их физико-химических свойств. Это обосновывает необходимость комбинированного лечения хронической сочетанной протозойно-урогенитально-вирусной инфекции. Восстановление показателей ПОЛ и ОАОА подтверждают несомненное преимущество разработанных и внедренных методов ОТ над «традиционными» методами лечения. Отсутствие нормализации практически всех основных показателей ПОЛ и ОАОА после традиционной терапии является вероятной причиной рецидивирования микст-инфекций и стойкости сексуальных и репродуктивных нарушений у данных пациентов. Дозированное включение общей и местной ОТ в комплексное лечение позволяет добиться купирования процессов свободнорадикального окисления, снять интоксикацию и восстановить физико-химические свойства клеточных мембран у больных с хронической протозойно-урогенитально-вирусной инфекцией.
3.5 Динамика показателей врожденного иммунитета у больных урогенитальной протозойно-бактериальной инфекцией после лечения по разработанным методикам
В последнее десятилетие одним из наиболее актуальных вопросов является иммунопатогенез и иммунотерапия сочетанной урогенитальной ИППП. Особенно это касается сочетания протозойной (трихомоноз) с участившейся хламидийной, микоплазменной инфекциями, а также вирусами герпетической группы (ВПГ 1 и 2 типа), когда возникают различные нарушения иммунитета. Сочетанные воздействия на макроорганизм простейших, микробных и вирусных агентов могут сопровождаться не только нарушениями антиоксидантной системы, но и повреждением клеточных и гуморальных факторов как врожденного, так и приобретенного иммунитета.
Характер предлагаемой иммунотерапии в комбинации со стандартами лечения ИППП не гарантирует коррекцию нарушений иммунитета, что позволяло бы ликвидировать входящие в ассоциацию патогенную флору и дезактивировать сопутствующую вирусную инфекцию. Такая возможность установлена при включении в комплексную терапию стандартизируемых оригинальных методов ОТ. Дозированные концентрации вводимого в кровь озона определяют ориентацию обменных процессов гормонально-вегетативного и иммунного статуса организма. При активации озоном нейтрофилов, обусловленной метаболическим «респираторным взрывом», происходит индукция цитокинового каскада. Цитокины, как продукты секреции макрофагов (лимфоциты и моноциты), при этом рассматриваются в качестве самостоятельных гуморальных факторов неспецифической системы резистентности, а также компонентов приобретенного клеточного и гуморального иммунитета.
Исходя из вышесказанного, задачей описанных в данном подразделе исследований был сравнительный анализ динамики клеточных и гуморальных показателей врожденного иммунитета при лечении смешанной протозойно-урогенитально-вирусной инфекции мочеполовых органов с подключением оригинальных методов ОТ.
Сравнительная оценка клинико-лабораторных показателей до и после курсового лечения 141 больного хронической сочетанной протозойно-бактериально-вирусной урогенитальной инфекцией позволила убедиться, что наиболее результативным было лечение больных в подгруппе III-A (с комплексом ОТ). Несколько менее выраженным положительным эффектом завершался курс комплексного лечения в подгруппе III-A (с индукторами интерферонов, иммунокорректорами и УППТ). Менее удовлетворительные и нестойкие клинико-лабораторные показатели как общих, так и местных проявлений, с нарушением сперматогенеза и детородной функции, выявлены у больных группы I (стандартизованная терапия). Причину таких разноплановых клинико-лабораторных изменений мы попытались выяснить при изучении динамики показателей как врожденного, так и приобретенного иммунитетов в ходе проводимого лечения во всех трех группах (подгруппах). Показатели сравнивались с региональной нормой (среднегрупповые значения у 25 практически здоровых лиц – IV группа).
Как видно из данных, представленных в таблице 3.12 и рис. 3.2–3.5, гуморальное звено неспецифического (врожденного) иммунитета оценивалось по динамике общего белка и его фракций, С-реактивного белка, комплемента и лизоцима (мурамидаза), суммарных иммуноглобулинов основных классов IgA, IgM, IgG и ЦИК. При сравнении данных показателей в группе контроля и у 141 инфицированного больного до начала лечения установлены негативные изменения практически всех гуморальных факторов (рис. 3.2). В тоже время достоверно значимыми были уменьшение альбуминовой и повышение γ-глобулиновой белковых фракций. Значительно возрастали содержание С-реактивного белка и титр лизоцима (мурамидазы) с достоверным отличием от нормы. Незначительное снижение уровня общего белка характеризовалось увеличением с 38,3 % до 49,9 % фракций глобулинов в основном за счет увеличения β- и γ-глобулиновых фракций с 25,4 % до 39,2 %. Несколько увеличивалось содержание основных компонентов комплемента из фракции β1-глобулинов С3 и С4, реагирующих в комплементарной последовательности в процессе активации всей системы. Незначительное увеличение содержания всех классов иммуноглобулинов наиболее значимо для IgG, что находится в прямой зависимости от повышения количества высокомолекулярных ЦИК.
Изменения показателей гуморального звена иммунитета у больных урогенитальной микст-инфекцией представлены на рис. 3.2–3.5.
Таблица 3.12 – Показатели гуморального звена врожденного (неспецифического) иммунитета при лечении хронической микст-инфекции мочеполовых органов
| Показатели активности гуморальных факторов врожденного иммунитета
(M±m) |
Норма
(IV группа) n=25 |
До лечения
(I группа + II–А подгруппа + III-А подгруппа) n=141 |
Показатели к концу курса проведенного лечения (сыворотка крови) | ||
| После традиционной терапии
(I группа) n=23 |
После иммунотерапии и УППТ (II-А подгруппа)
n=42 |
После ОТ
(III-А подгруппа) n=76 |
|||
| 1 | 2 | 3 | 4 | 5 | 6 |
| Общий белок, г/л | 74±8,1 | 65±2,2 | 69,2±3,7 | 71,4±4,8 | 73,6±4,2 |
| Фракции белка альбумины, % | 61,7±2,3 | 50,1±2,2* | 54,2±3,4 | 57,6±3,7 | 61,4±2,6** |
| a1-глобулины, % | 4,2±0,7 | 3,4±0,8 | 3,6±0,6 | 3,9±0,9 | 4,1±0,5 |
| a2-глобулины, % | 8,7±1,3 | 7,3±1,5 | 7,8±1,2 | 8,2±1,4 | 8,5±1,5 |
| β-глобулины, % | 9,9±1,9 | 12,9±2,7 | 13,2±2,5 | 10,9±2,1 | 10,2±1,8 |
| γ-глобулины, % | 15,5±2,1 | 26,3±3,2* | 21,2±3,4 | 19,4±2,9 | 15,7±2,05** |
| С-реактивный белок, мг/л | 5±0,5 | 27±6,0* | 10,8±4,2* | 8,2±2,7** | 5,8±2,1** |
| Комплемент С3, г/л | 1,21±0,32 | 1,02±0,21 | 1,08±0,32 | 1,18±0,51 | 1,26±0,27 |
| Комплемент С4, г/л | 0,35±0,17 | 0,28±0,12 | 0,31±0,15 | 0,34±0,14 | 0,37±0,13 |
| ТЛ, мкг/мл | 3,74±0,03 | 1,03±0,14* | 2,42±0,46** | 3,27±0,35** | 3,8±0,12*** |
| IgA, г/л | 2,54±0,62 | 2,89±0,38 | 2,32±0,32 | 2,14±0,28 | 1,23±0,17*** |
| IgM, г/л | 1,47±0,43 | 1,68±0,32 | 1,92±0,48 | 1,48±0,19 | 1,21±0,12 |
| IgG, г/л | 12,1±2,35 | 12,98±1,88 | 12,83±2,34 | 15,36±2,75 | 16,24±2,61 |
| Высокомолекулярные ЦИК, о.е. | 31,4±9,6 | 39,6±8,3 | 35,2±12,4 | 32,5±7,9 | 30,0±6,7 |
Примечания:
* – различия достоверны с нормальными показателями не инфицированных пациентов (p<0,05);
** – различия достоверны с показателями в группах до лечения (p<0,05);
*** – различия достоверны с показателями при различных видах лечения (p<0,05)
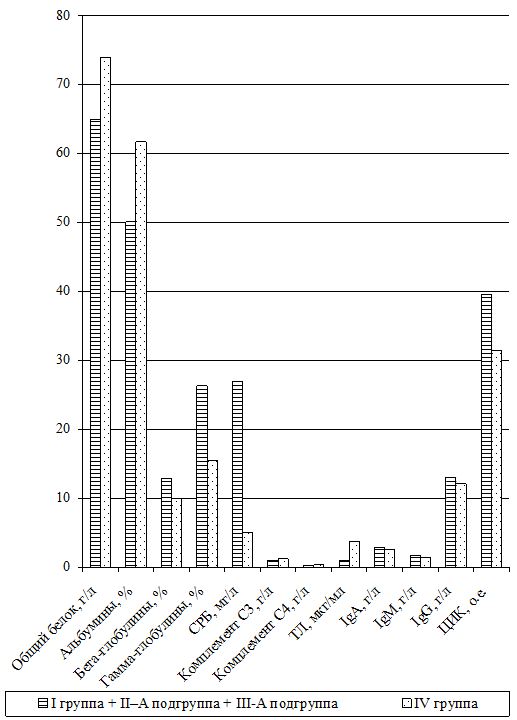
Рисунок 3.2 – Графическое изображение состояния гуморального звена врожденного иммунитета до лечения
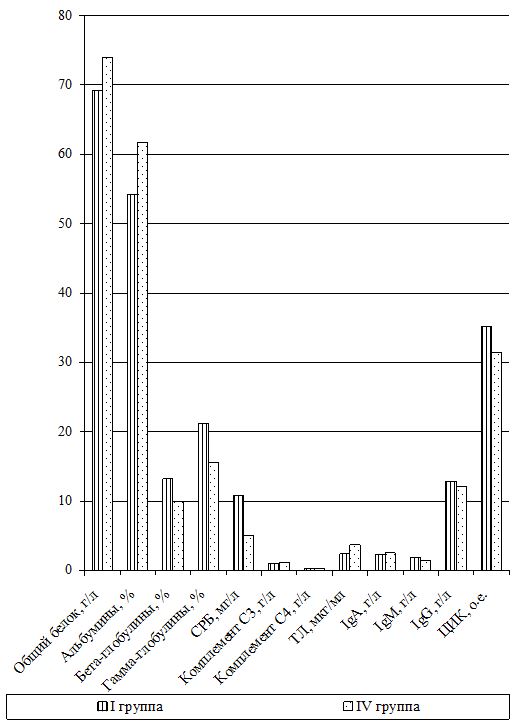
Рисунок 3.3 – Графическое изображение состояния гуморального звена врожденного иммунитета после стандартного лечения
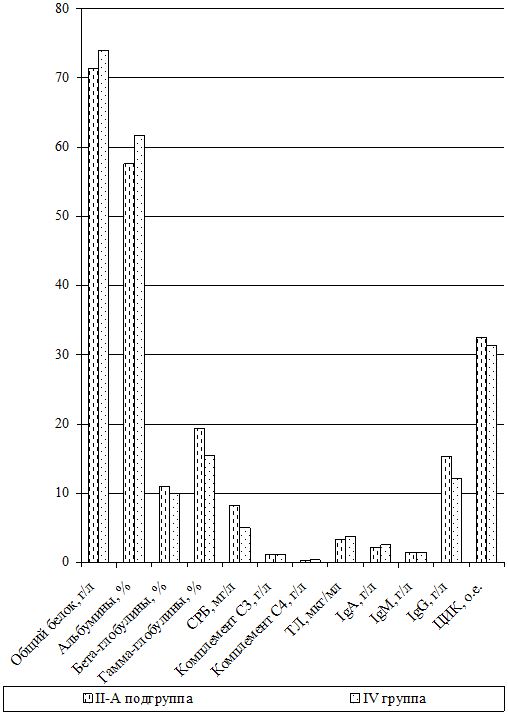
Рисунок 3.4 – Графическое изображение состояния гуморального звена врожденного иммунитета после лечения иммунотерапией
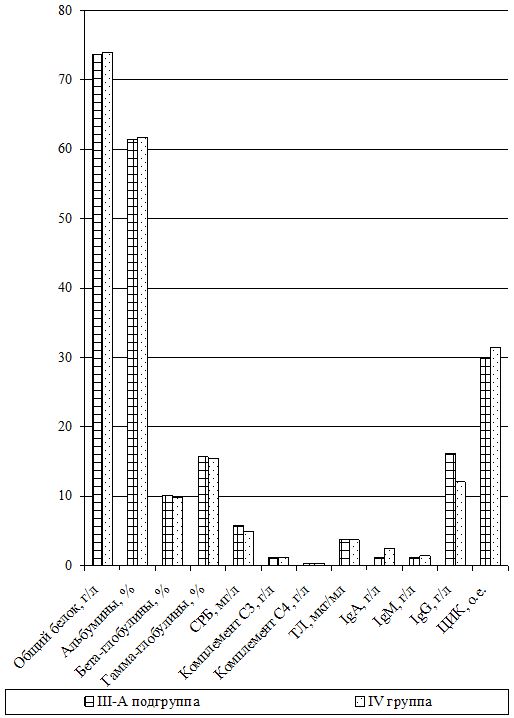
Рисунок 3.5 – Графическое изображение состояния гуморального звена врожденного иммунитета после лечения методами ОТ
В результате проведенного лечения показатели гуморального звена неспецифического иммунитета претерпевали положительную динамику, наиболее значимо при включении комплекса ОТ. Увеличение общего белка сочеталось с нормализацией его фракций и существенным снижением С‑реактивного белка и титра лизоцима. Снижались активность комплемента и содержание IgA и IgM при увеличении IgG, что указывало на уменьшение воспалительной реакции. Нормализовалось содержание высокомолекулярных ЦИК. Суммарная оценка динамики гуморальных факторов врожденного иммунитета указывала на целесообразность и эффективность включения в комплексное лечение урогенитальных микст-инфекций иммуно- и ОТ.
Активность клеточных факторов врожденного иммунитета также существенно ухудшалась при наличии хронической микст-инфекции, что отразилось в показателях, представленных в таблице 3.13.
Изменения показателей клеточного звена неспецифического врожденного иммунитета у больных урогенитальной микст-инфекцией для наглядности представлены на рис. 3.6–3.9.
Само наличие хронической протозойно-бактериально-вирусной урогенитальной инфекции приводило к значимому повышению базисной (спонтанной) ферментативной активности нейтрофильных гранулоцитов, отражая их антигенную перегруженность с одновременным снижением коэффициента стимуляции хемилюминесценции нейтрофилов, что подтверждало снижение резервного потенциала фагоцитирующих клеток. Снижение активности среднестатистических показателей мононуклеарно-фагоцитирующей системы у данного контингента больных проявилось в снижении содержания в нейтрофилах лизосомального катионного белка, повышении активности фермента миелопероксидазаы и снижении всех показателей активности фагоцитоза (ФП, ФЧ и ПЗФ). В периферической крови повышается количество незрелых форм В-клеток или макрофагов, не имеющих маркеров ни Т-, ни В-клеток – клеток «ноль» или К-клеток. Данные клетки с высокой цитотоксической активностью активируются вследствие взаимодействия с Fc-фрагментами антител IgG, адсорбированных клетками-мишенями.
Параллельно отмечено повышение субпопуляции истинных натуральных киллеров (NK-клеток), содержащих рецепторы к Fc-фрагменту и к С3-компоненту комплемента. Цитотоксическая активность NK-клеток происходит при отсутствии сенсибилизированных лимфоцитов, что характерно для реакций истинного клеточного иммунитета. Цитолиз усиливается при наличии на клетках-мишенях С3-компонента или антител, адсорбированных на рецепторах к Fc-фрагментам.
В результате проведенного разнопланового лечения отмечены разнонаправленные изменения показателей неспецифического клеточного иммунитета у больных с микст-инфекцией, что показано на рис. 3.7–3.9 и в таблице 3.13. При этом, если после стандартного комплексного лечения, а также после иммунотерапии с УППТ большинство среднестатистических показателей отличалось лишь положительной динамикой, то после курсов комплексной ОТ большинство клеточных факторов врожденного иммунитета стали достоверно значимыми. Существенно нормализовались показатели активности нейтрофильных гранулоцитов, по НСТспон. и НСТстим., ЛКТ и СЦК по активности миелопироксидазы. Значимо улучшилась функция иммунокомпетентных клеток, участвующих в иммунной реакции клеточного характера (Т-лимфоцитов и нейтрофильных лейкоцитов). Особенно это проявилось в отношении восстановления антиген-распознавательной способности лимфоцитов и улучшения всех показателей фагоцитарной активности нейтрофилов (ФП, ФИ, ПЗФ). Нормализовались как количественно, так и процентно показатели истинного клеточного иммунитета CD16+CD56+ и СD3–HLA-DR+, что указывало на купирование воспалительного процесса и ликвидацию токсического воздействия на организм больных патогенной урогенитальной микст-инфекции.
Таблица 3.13 – Показатели клеточного звена неспецифического (врожденного) иммунитета при лечении сочетанной урогенитальной протозойно-микробно-вирусной инфекции
| Показатели активности клеточных факторов врожденного иммунитета
(M±m) |
Норма
(IV группа) n=25 |
До лечения
(I группа + II–А подгруппа + III-А подгруппа) n=141 |
Показатели к концу курса проведенного лечения (сыворотка крови) | ||
| После традиционной терапии
(I группа) n=23 |
После иммунотерапии и УППТ (II-А подгруппа)
n=42 |
После ОТ
(III-А подгруппа) n=76 |
|||
| 1 | 2 | 3 | 4 | 5 | 6 |
| НСТспон., у.е. | 0,12±0,01 | 0,16±0,02 | 0,18±0,05 | 0,14±0,06 | 0,11±0,02 |
| НСТспон., % | 9,34±0,4 | 16,4±1,08* | 18,8±1,37* | 15,1±0,87* | 10,24±0,25**; *** |
| НСТстим., у.е. | 0,98±0,12 | 0,78±0,08 | 0,92±0,13 | 0,97±0,12 | 1,32±0,14** |
| НСТстим., % | 62±9,4 | 28,7±5,2* | 29,4±6,15* | 37,9±5,46 | 68,6±6,3**; *** |
| ЛКТ, у.е. | 1,6±0,1 | 1,23±0,25 | 1,34±0,43 | 1,49±0,35 | 1,67±0,32 |
| ЛКТ, % | 84,1±2,5 | 75,8±2,78 | 79,2±2,68 | 82,3±1,89 | 85,3±1,95** |
| Активность миелопероксидазы (СЦК), у.е. | 2,56±0,033 | 10,3±0,12* | 1,87±0,135*** | 2,17±0,094** | 2,54±0,042**; *** |
| ФП, % | 56,2±4,62 | 31,6±2,7* | 48,7±3,87** | 54,8±5,07** | 69,8±3,45**; *** |
| ФЧ, абс. | 12,8±1,4 | 10,9±1,95 | 11,9±2,43 | 13,2±1,97 | 21,6±2,62*; **; *** |
| ПЗФ, % | 39±2,8 | 31,7±3,06 | 35,4±7,2 | 38,7±5,6 | 43,5±5,2 |
| K-клетки СD3–HLA-DR+, % | 14,2±2,8 | 25,4±3,25 | 22,31±3,76 | 19,47±3,14 | 13,8±2,53** |
| K-клетки СD3–HLA-DR+, ×109/л | 12,6±2,42 | 16,9±3,11 | 14,7±3,84 | 13,12±2,78 | 10,13±2,29 |
| NK-клетки СД16+СД56+, % | 15,6±2,65 | 22,3±3,47 | 21,26±4,21 | 20,43±3,65 | 16,2±3,12 |
| NK-клетки СД16+СД56+, ×109/л | 12,3±2,35 | 15,6±2,76 | 14,3±3,48 | 12,9±3,23 | 11,82±2,67 |
Примечания:
* – различия достоверны (p<0,05) с нормальными показателями не инфицированных пациентов;
** – различия достоверны (p<0,05) с показателями в группах до лечения;
*** – различия достоверны (p<0,05) с показателями при различных видах лечения
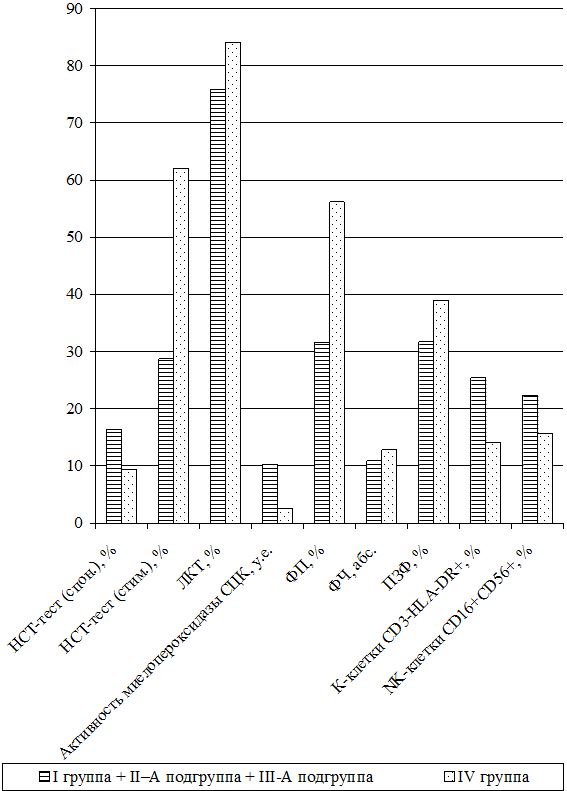
Рисунок 3.6 – Клеточное звено врожденного иммунитета до лечения
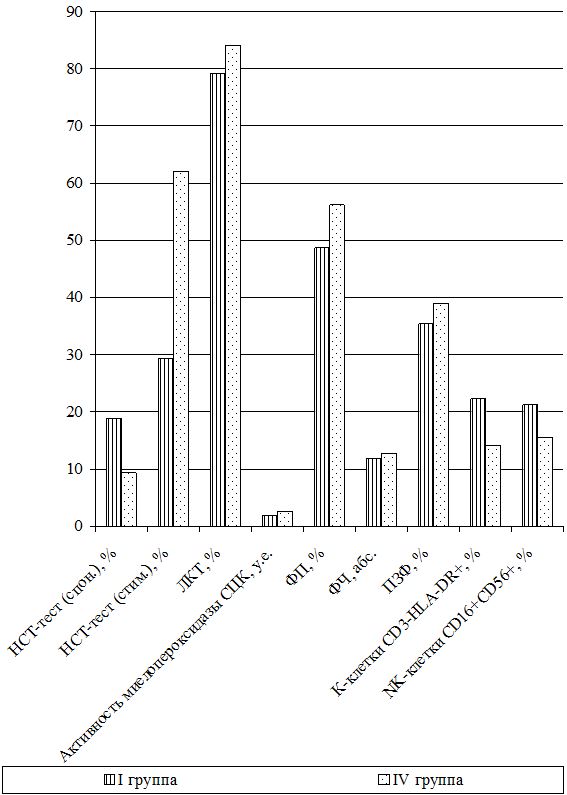
Рисунок 3.7 – Клеточное звено врожденного иммунитета после стандартного лечения
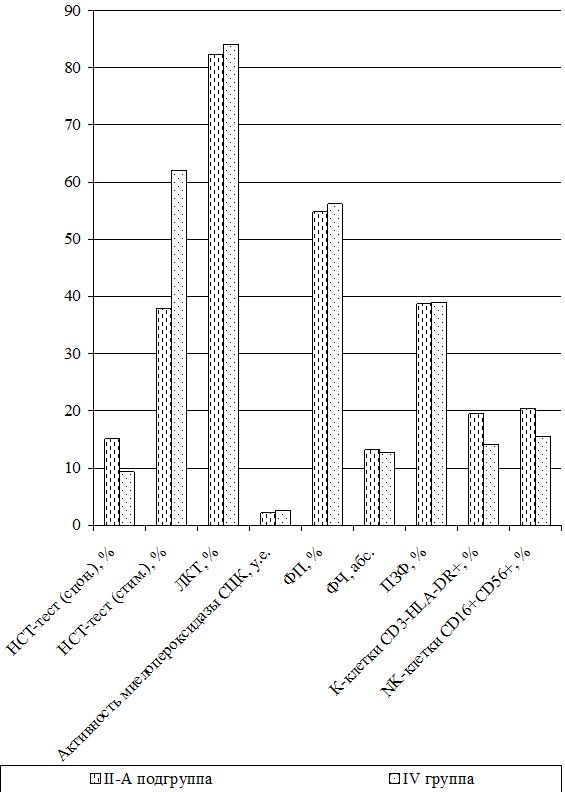
Рисунок 3.8 – Клеточное звено врожденного иммунитета после иммунотерапии
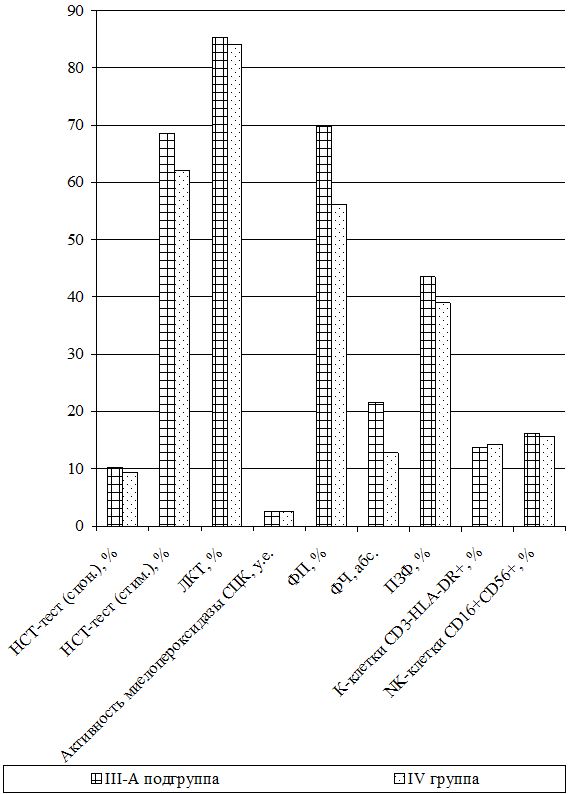
Рисунок 3.9 – Клеточное звено врожденного иммунитета после ОТ
Проведенное исследование показателей основных звеньев неспецифического (врожденного) иммунитета при лечении хронической протозойно-микробно-вирусной инфекции показало нарушение гуморальных и клеточных факторов, проявляющееся как в снижении, так и в повышении большинства изученных показателей. Комплексное стандартное лечение не позволяет достичь улучшения факторов неспецифического иммунитета, что нередко приводит к хронизации воспаления и дальнейшей диссеминации микст-инфекции. Медикаментозная иммунокорригирующая терапия из-за отсутствия достаточных знаний иммунопатологических процессов при сочетанной инфекции и отсутствия медикаментозных средств для селективного воздействия на определенные звенья иммунной системы повышает эффективность лечения микст-инфекций, но недостаточно. Очевидно, требуется подключение физико-химических методов иммунокоррекции. Включение в комплексное лечение хронической сочетанной урогенитальной инфекции разноплановых методов ОТ позволяет не только получить наиболее выраженный положительный клинико-лабораторный результат, но и добиться существенного улучшения и/или нормализации основных гуморальных и клеточных факторов врожденного иммунитета.
3.6 Динамика показателей приобретенного иммунитета у больных урогенитальной протозойно-бактериальной инфекцией после лечения по разработанным методикам
Иммунодефицитные состояния врожденного и приобретенного характера существенно влияют на эффект вирулентности в инфекционном процессе, симбиоза условно-патогенных бактерий и микробов-комменсалов, хронизацию, рецидивирование и осложненное течение инфекционно-воспалительных процессов. При этом отсутствие классических симптомов воспаления, обусловленное сниженной иммунореактивностью, затрудняет диагностику осложнений, появление очагов дремлющей инфекции и контроль результатов лечения. Особенно это важно при микст-инфекциях с сочетанным поражением урогенитальной системы простейшими (трихомонадами) в сочетании с хламидиями, микоплазмами, уреаплазмами и вирусами (герпеса простого, цитомегаловируса, вируса Эпштейна-Барр). Недостаточная изученность клеточных факторов в противоинфекционном иммунитете к урогенитальным микст-инфекциям не позволяет проводить адекватное их лечение с учетом характера иммунного ответа организма больных. В предыдущем подразделе (3.5) установлены изменения показателей, указывающих на угнетение естественной иммунорезистентности у больных с урогенитальной микст-инфекцией. Очередной задачей стало изучение основных факторов приобретенного (специфического) иммунитета и их динамика в зависимости от вида и объема проводимого лечения.
Характер изменений среднестатистических показателей клеточных и гуморальных факторов приобретенного (специфического) иммунитета изучен у 141 пациентов. Все эти пациенты подвергнуты динамическому иммунологическому обследованию в ходе комплексного лечения в трех группах. Это, прежде всего, 23 (16,3 %) лечившихся комплексно стандартизовано (группа I). Во ІІ-А клиническую подгруппу вошли 42 (29,8 %) больных, в комплексное лечение которых добавлялась общая фармакологическая иммунотерапия (Альфарекин по 1 млн. МЕ внутримышечно через день № 10, чередуя с ректальными свечами «Виферон» или «Генферон» по 1 млн. МЕ № 10) и оригинальные УППТ (противопаразитарные средства – Альбендазол по 0,4 г 2 раза в день 10 дней или Мебендазол по 0,5 г 2-3 раза в день 10 дней). В основную III-А клиническую подгруппу вошло 76 (53,9 %) больных ИППП, в комбинированное лечение которых был включен комплекс оригинальных способов ОТ. Представленные оригинальные способы внутривенной и парантеральной системной и органной ОТ с выраженной локальной дезинфицирующей активностью (на бактерии, вирусы и грибы), оказывали противогипоксический, сосудорасширяющий и дезинтоксикационный эффекты с оптимизацией гемостаза и метаболизма, с регуляцией иммунной, а также про- и антиоксидантной систем [14, 126].
Задачей исследования, показанного в данном разделе, было оценить характер изменений специфического иммунитета при микст-инфекции (протозойно-урогенитально-вирусной) и изучить их динамику при разных видах и объемах лечения.
Хроническое рецидивирующее течение сочетанной урогенитальной инфекции (протозойно-инфекционно-вирусной) обусловливается нарушениями естественной защиты организма и их способностью преодолевать эту защиту. Отсутствие классических симптомов воспаления и множественность инфекционных осложнений зависят от степени напряжения иммунных реакций у больного, особенно при «антигенной мимикрии», предполагающей структурное сходство HLA-антигенов с антигенами патогенных микроорганизмов, что обуславливает «иммунологическую толерантность» (нечувствительность) к микробам и вирусам. Все вышесказанное указывает на многофакторность антигенного (бактериальный антиген, вирус, микоплазма или хламидия) воздействия микст-инфекции, что определяет активность противоинфекционного иммунитета. Поэтому в комплексном лечении необходима иммунокорригирующая терапия. Однако возможности фармакоиммунотерапии ограничены отсутствием медикаментозных средств для селективного воздействия на определенные звенья иммунокомпетентных систем организма больных.
Для усиления антибактериальной и антивирусной терапии, а также дозозависимой иммуномодуляции нами разработаны и применены оригинальные методы ОТ. При этом учитывалось не только стандартизированное бактерицидное и противовирусное действие озона, но и его противогипоксический, сосудорасширяющий, антикоагулянтный и иммуномодулирующий эффекты, дезинтоксикационное действие и стимуляция метаболизма. Поэтому факторы клеточного и гуморального звеньев приобретенного (специфического) иммунитета нами изучены не только до начала лечебных мероприятий, но и сравнительно в группах больных микст-инфекцией, лечившихся по стандартам, после общей фармакоиммунотерапии и усиления противопротозойной терапии, а также комплексом разработанных методов ОТ.
Изменения среднестатистических показателей клеточного иммунитета представлены в таблице 3.14 и на рис. 3.10–3.13. Полученные результаты у 141 больного урогенитальной микст-инфекцией свидетельствуют о снижении общей иммунореактивности системы иммунокомпетентных клеток. При незначительном увеличении общего числа лейкоцитов отмечалось достоверное уменьшение абсолютного и относительного числа лимфоцитов. Соответственно до 1,15±0,05 тыс. и (63,26±4,36) %. Клетки-помощники (хелперы), передающие лимфоцитам антиген в активной форме, умеренно снижались относительно нормы, как в абсолютных (с 0,78±0,15 тыс. до 0,67±0,14 тыс.), так и в относительных (с (42,35±5,62) % до (36,21±3,16) %) числах. При этом отмечено увеличение цитотоксических Т-лимфоцитов с супрессорно-киллерной активностью, выделяющих медиатор ингибирующий пролиферацию специфических клонов антителообразующих клеток (АОК). Такое существенное повышение субпопуляции Т-лимфоцитов-супрессоров, подавляющих активность сингенных и аллогенных киллеров, хелперов, эффекторов гиперчувствительности замедленного типа (ГЗТ) и реакцию бласттрансформации, указывает на развитие у больных иммунодефицита как клеточного, так и гуморального звеньев иммунитета. Подтверждением тому служит значимое снижение Т-лимфоцитов-киллеров (с 0,32±0,03 тыс. до 0,21±0,02 тыс.), экспрессирующих маркеры NK-клеток и умеренное снижение Т-лимфоцитов активированных с рецептором к интерлейкинам 2 (a-цепь рецептора ИЛ-2). Нарушение супрессорами дифференцировки из прекиллеров Т-киллеров, несмотря на наличие сопутствующих вирусных поражений (активирующих количество Т-киллеров), приводило к уменьшению их абсолютного и относительного числа. Снижение популяции Т-клеток иммунологической памяти гетерогена (СD3+СD25+) по-видимому обусловлено высокими дозами антигена, когда формирование памяти переключается на В-клетки (СD3–СD25+). Под влиянием повторных антигенных стимулов данная долгоживущая популяция малых лимфоцитов раньше других клеток включает «метку» и трансформируется в лимфобласты и плазмоциты.
Изменения клеточного звена приобретенного иммунитета у больных с урогенитальной микст-инфекцией представлены на рис. 3.10–3.13. Представлена не только негативная динамика показателей иммунитета при развитии сочетанной протозойно-бактериально-вирусной инфекции, но и их положительная динамика при различной комбинированной терапии.
Значимое снижение (с (0,32±0,03) тыс. до (0,21±0,02) тыс.) количества активированных Т-лимфоцитов-регуляторов (более 80 % лимфоцитов, активированных фитогемагглютинином) указывает на функциональный характер угнетения клеточного иммунитета с возможностью распознавания антигенов и превращения в бластные формы при адекватной антибактериальной санации, т.е. перспективности комплексной иммунокоррекции при микст-инфицировании.
Представленная в таблице 3.14 динамика среднестатистических показателей клеточного звена приобретенного иммунитета при различных вариантах комплексного лечения позволяет убедиться, что при общей положительной динамике лишь в IІІ группе больных после ОТ были достигнуты наиболее значимые результаты иммунокоррекции. После стандартно-традиционного лечения по требованиям ВОЗ и МЗУ хотя и отмечалась положительная динамика практически всех показателей клеточных факторов иммунитета, но ни один из них не достигал уровня нормы из группы контроля. Это свидетельствует о наличии дремлющей инфекции и хронизации воспалительного процесса на фоне умеренно декомпенсированной иммунорезистентности.
Таблица 3.14 – Показатели клеточного звена приобретенного (специфического) иммунитета при лечении сочетанной урогенитально-протозойно-вирусной инфекции
| Показатели активности клеточных факторов приобретенного иммунитета (M±m) |
Норма
(IV группа) n=25 |
До лечения
(I группа + II–А подгруппа + III-А подгруппа) n=141 |
Показатели к концу курса проведенного лечения (сыворотка крови) | ||
| После традиционной терапии
(I группа) n=23 |
После иммунотерапии и УППТ (II-А подгруппа)
n=42 |
После ОТ
(III-А подгруппа) n=76 |
|||
| 1 | 2 | 3 | 4 | 5 | 6 |
| Лейкоциты (тыс.) | 6,12±0,48 | 6,33±0,34 | 6,96±0,46 | 6,85±0,39 | 6,38±0,32 |
| CD3+ (%) | 74,83±3,23 | 63,26±4,36 | 68,84±4,93 | 72,68±4,37 | 79,39±3,46** |
| CD3+ (абс. × 109/л) | 1,36±0,08 | 1,15±0,05* | 1,28±0,09 | 1,32±0,07 | 1,49±0,06** |
| CD3+CD4+ (%) | 42,35±5,62 | 36,21±3,16 | 39,82±3,92 | 41,56±4,18 | 46,34±2,87 |
| CD3+CD4+ (абс. × 109/л) | 0,78±0,15 | 0,67±0,14 | 0,69±0,13 | 0,76±0,12 | 1,29±0,11***** |
| CD3+CD8+ (%) | 22,34±2,49 | 31,67±1,87* | 26,24±2,08 | 23,42±2,12 | 23,14±2,32** |
| CD3+CD8+ (абс. × 109/л) | 0,65±0,08 | 0,96±0,09* | 0,76±0,05 | 0,64±0,07 | 0,67±0,04** |
| CD3+CD16+CD56+ (%) | 14,16±2,28 | 12,07±3,11 | 13,09±3,42 | 13,98±2,32 | 14,45±3,06 |
| CD3+CD16+CD56+ (абс. × 109/л) | 0,32±0,03 | 0,21±0,02* | 0,28±0,04 | 0,3±0,03 | 0,34±0,04** |
| СD3+HLA-DR+ (%) | 2,76±1,35 | 6,28±2,47 | 4,34±2,07 | 3,28±1,98 | 2,81±1,43 |
| СD3+HLA-DR+ (абс. × 109/л) | 0,06±0,03 | 0,25±0,06* | 0,17±0,06 | 0,12±0,04 | 0,09±0,08 |
| CD3+CD25+ (%) | 9,23±3,02 | 8,14±2,24 | 8,96±3,18 | 9,04±2,78 | 14,83±3,27 |
| CD3+CD25+ (абс. × 109/л) | 0,36±0,05 | 0,32±0,02 | 0,33±0,04 | 0,34±0,05 | 0,38±0,06 |
Примечания:
* – различия достоверны (p<0,05) с нормальными показателями не инфицированных больных; ** – различия достоверны (p<0,05) с показателями в группах до лечения *** – различия достоверны (p<0,05) с показателями при различных видах лечения
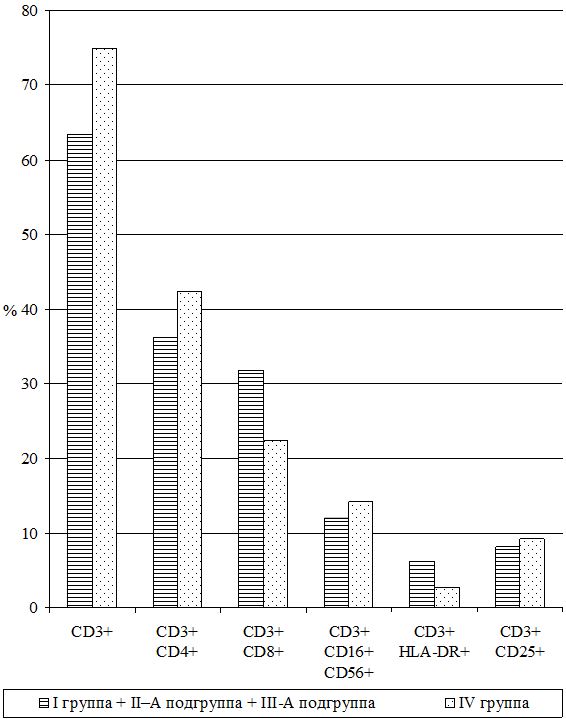
Рисунок 3.10 – Графическое изображение клеточного звена специфического иммунитета до лечения. Относительное количество субпопуляций лимфоцитов (в %) от общего количества Т-лимфоцитов
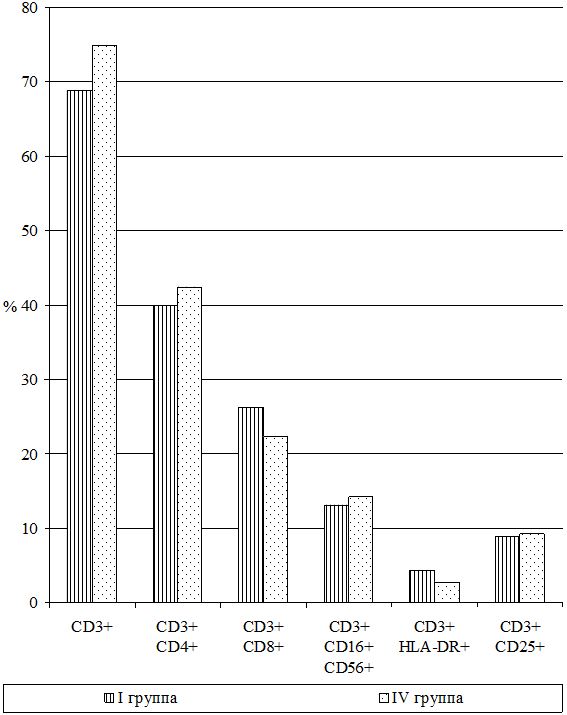
Рисунок 3.11 – Изменение показателей клеточного звена специфического иммунитета после стандартного лечения. Относительное количество субпопуляций лимфоцитов (в %) от общего количества лимфоцитов
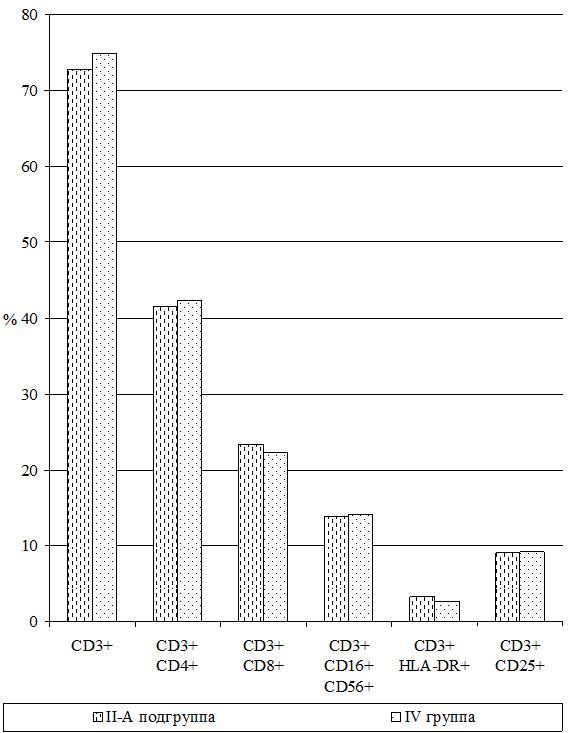
Рисунок 3.12 – Показатели клеточного звена специфического иммунитета после иммунотерапии. Относительное количество субпопуляций лимфоцитов (в %) от общего количества Т-лимфоцитов
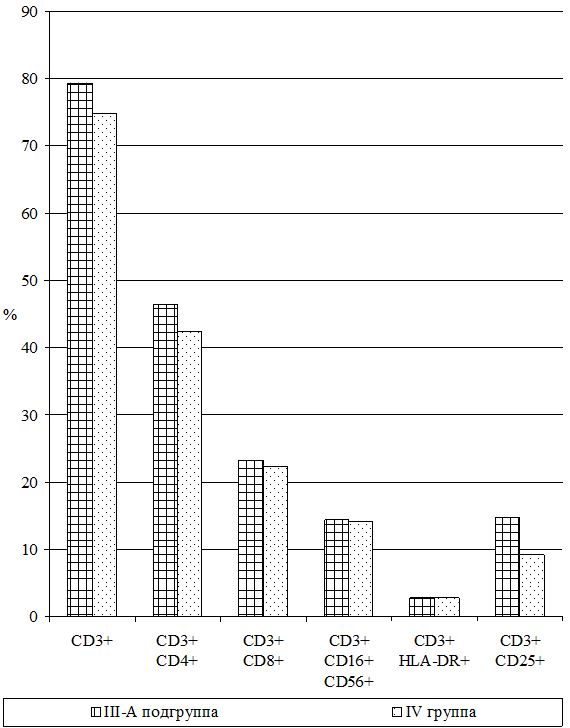
Рисунок 3.13 – Показатели клеточного звена специфического иммунитета после методов ОТ. Относительное количество субпопуляций лимфоцитов ( в %) от общего количества лимфоцитов.
Иммунологические показатели в группе больных, в комплексное лечение которых добавлена общая фармакоиммунотерапия и УППТ, имели позитивную динамику и достигали нижней границы нормы. В то же время ни один из них достоверно не отличался от показателей до лечения, что может свидетельствовать о нестабильности достигнутой иммунокоррекции с возможным ее ухудшением и рецидивированием микст-инфекции.
Наиболее существенные позитивные сдвиги иммунологических показателей получены в группе из 76 больных, в лечение которых включался комплекс оригинальных способов ОТ. Значимо увеличивалось абсолютное (с (1,15±0,05) тыс. до (1,49±0,06) тыс.) и относительное (с (63,26±4,36) % до (79,39±3,46) %) количество Т-лимфоцитов. При оценке характера изменений субпопуляций лимфоцитов отмечено достоверное увеличение числа Т-хелперов (с (0,67±0,14) тыс. до (1,29±0,11) тыс.) и существенное снижение как абсолютного (с (0,96±0,09) тыс. до (0,67±0,04) тыс.), так и относительного (с (31,67±1,87) % до (23,14±2,32) %) числа Т‑супрессоров. Значимо увеличивалось и число Т-киллеров (с (0,21±0,02) тыс. до (0,34±0,04) тыс.), а также нормализовались абсолютные и относительные показатели активированных Т-лимфоцитов-регуляторов и клеток иммунологической памяти, подтверждая снижение загруженности организма больных антигенами.
Характер изменений показателей гуморального звена приобретенного иммунитета представлен в таблице 3.15 и графически отображен на рис. 3.14–3.18. Динамика показателей иммунитета у больных с сочетанной хронической урогенитальной инфекцией показала, что данная патология не приводит к значительным сдвигам в иммунологической памяти у В-клеток с умеренным увеличением их относительного и абсолютного числа.
Таблица 3.15 – Показатели гуморального звена приобретенного иммунитета при лечении хронической микст-инфекции мочеполовых органов
| Показатели активности гуморальных факторов специфического иммунитета
(M±m) |
Норма
(IV группа) n=25 |
До лечения
(I группа + II–А подгруппа + III-А подгруппа) n=141 |
Показатели к концу курса проведенного лечения (сыворотка крови) | ||
| После традиционной терапии
(I группа) n=23 |
После иммунотерапии и УППТ (II-А подгруппа)
n=42 |
После ОТ
(III-А подгруппа) n=76 |
|||
| CD22+ (%) | 23,27±0,87 | 20,54±1,13 | 22,05±2,13 | 22,98±0,74 | 23,43±0,45 |
| CD22+ (абс. × 109/л) | 0,27±0,02 | 0,23±0,03 | 0,25±0,07 | 0,26±0,03 | 0,29±0,04 |
| CD3–CD25+ (%) | 1,87±0,18 | 1,98±0,68 | 1,91±0,42 | 1,88±0,21 | 1,82±0,17 |
| CD3–CD25+ (абс. × 109/л) | 0,07±0,01 | 0,09±0,02 | 0,08±0,02 | 0,06±0,01 | 0,05±0,01 |
| IgM (г/л) | 1,47±0,43 | 1,68±0,32 | 1,92±0,48 | 1,48±0,19 | 1,21±0,12 |
| IgA (г/л) | 2,54±0,62 | 2,89±0,38 | 2,32±0,32 | 2,14±0,28 | 1,23±0,17*** |
| IgG (г/л) | 12,1±2,35 | 12,98±1,88 | 12,83±2,34 | 15,36±2,75 | 16,24±2,61 |
| IgE (г/л) | 0,0002±0,0001 | 0,0008±0,0002* | 0,0005±0,0003 | 0,0003±0,0002 | 0,0001±0,0001** |
Примечания:
* – различия достоверны (p<0,05) с нормальными показателями не инфицированных пациентов; ** – различия достоверны (p<0,05) с показателями в группах до лечения; *** – различия достоверны (p<0,05) с показателями при различных видах лечения
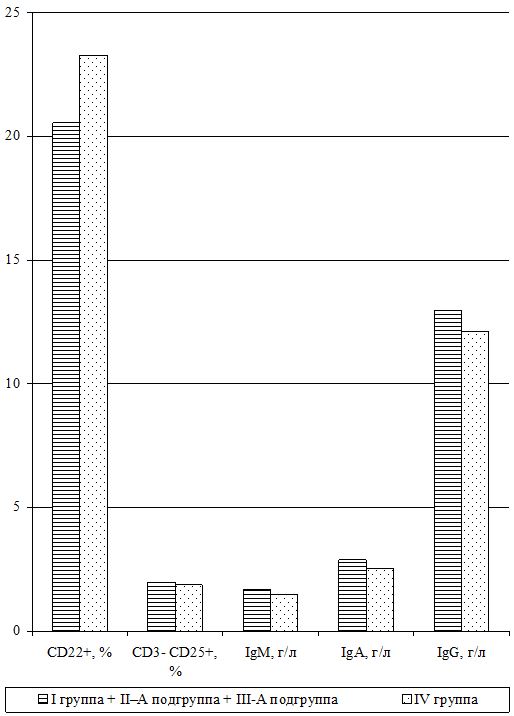
Рисунок 3.14 – Показатели гуморального звена приобретенного (специфического) иммунитета до лечения
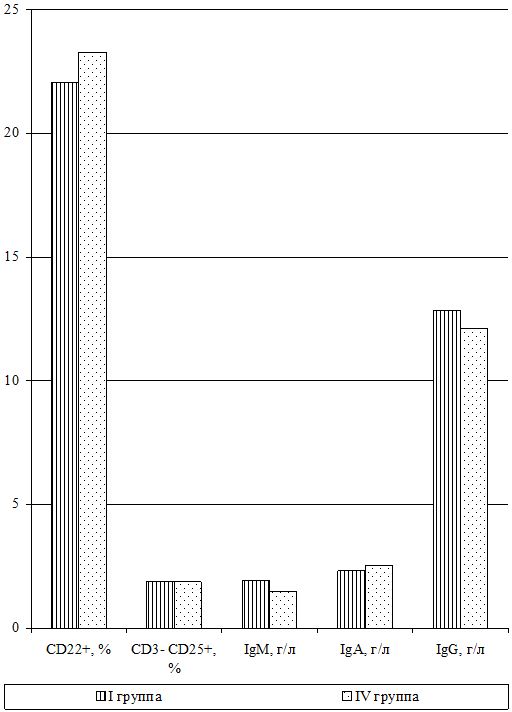
Рисунок 3.15 – Показатели гуморального звена приобретенного иммунитета после стандартизованного лечения
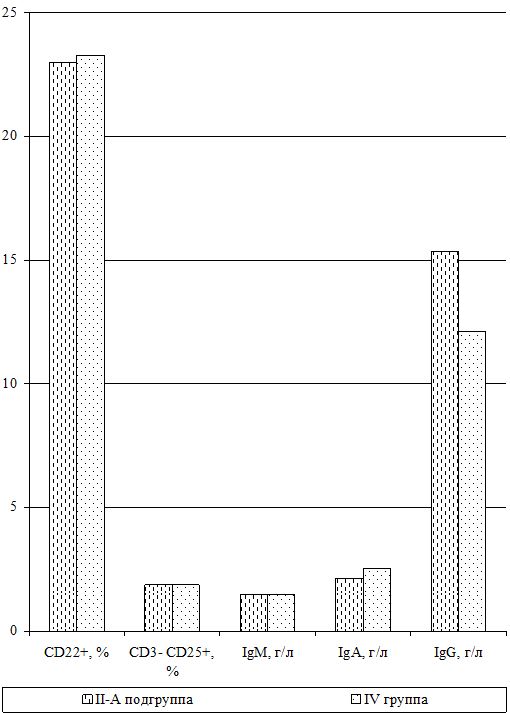
Рисунок 3.16 – Показатели гуморального звена специфического иммунитета после иммунотерапии
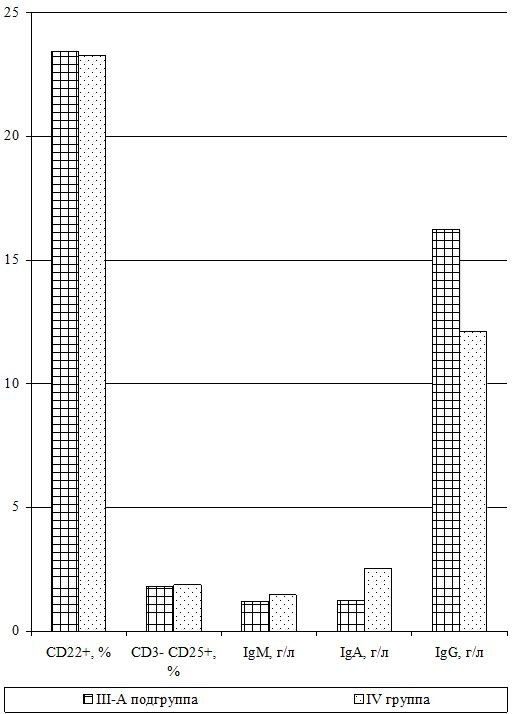
Рисунок 3.17 – Показатели гуморального звена приобретенного иммунитета после методов ОТ
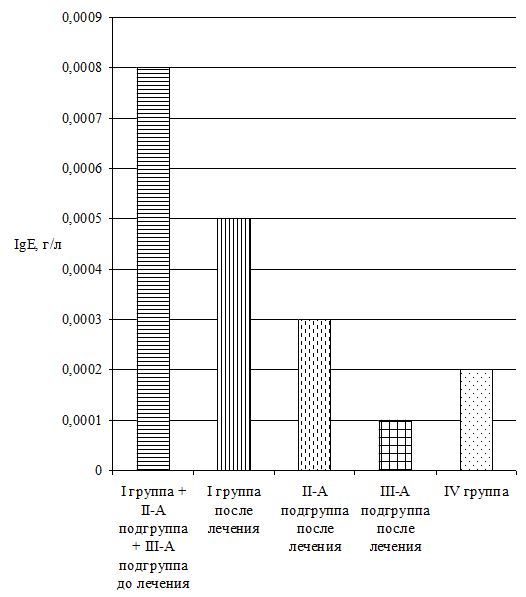
Рисунок 3.18 – Уровень IgE до и после применения различных методов лечения
В результате проведенного лечения умеренно выраженные положительные сдвиги достигали нормы лишь при фармакоиммунотерапии и ОТ, что указывало на ликвидацию инертности факторов гуморального иммунитета в купировании данной патологии. Примечательно, что достигался десенсибилизирующий эффект, подтвержденный динамикой IgE (с (0,0008±0,0002) г/л до (0,0001±0,0001) г/л) и увеличением отношения IgG/IgM.
Все вышеизложенное позволяет прийти к следующему заключению. Хроническая сочетанная протозойно-бактериально-вирусная урогенитальная инфекция вызывает выраженные разноплановые нарушения В-системы иммунитета. До лечения отмечается умеренное снижение абсолютного (с (0,27±0,02) тыс. до (0,23±0,03) тыс.) и относительного (с (23,27±0,87) % до (20,54±1,13) %) числа В-лимфоцитов с одновременным увеличением количества В-клеток памяти, что указывало на высокие дозы бактериально-вирусных агентов в крови больных. При незначительных колебаниях сывороточных иммуноглобулинов классов M, G и А существенно нарастали иммуноглобулины класса Е, указывая на рецидивирующее течение урогенитальной микст-инфекции с аллергизацией (сенсибилизацией) организма больных. При сопоставлении полученных показателей гуморального иммунитета с показателями клеточного становится объяснимо угнетение В‑лимфоцитов и стимуляция IgE ингибирующим эффектом клеток-супрессоров.
Высокие дозы протозойно-бактериально-вирусных антигенов приводят к избыточному формированию иммунокомпетентных клеток и угнетению их функции. При этом клеточные факторы приобретенного (специфического) иммунитета приобретают существенное значение в поддержании соотношения различных популяций лимфоцитов путем регуляции их численного состава. Адекватная комплексная антибактериальная терапия в сочетании с комбинированной иммуностимулирующей и ОТ позволяют добиться элиминации инфекционных агентов в очагах воспаления с нормализацией функции клеточного и гуморального звеньев иммунитета, что предотвращает рецидивы и хронизацию заболевания. Разработанные и внедренные в клиническую практику оригинальные комплексные способы ОТ позволяют получить стабильный эффект лечения урогенитальных микст-инфекций.
3.7 Коррекция репродуктивной и сексуальной дисфункции у больных урогенитальной микст-инфекцией
Помимо роста заболеваемости урогенитальными ИППП в Украине, ширятся также дезадаптация в браке, бесплодие, сексуальные расстройства мужчин и женщин. Протозойно-бактериально-вирусные мочеполовые инфекции у супружеских пар приводят к развитию генитальных и экстрагенитальных осложнений, возникновению репродуктивно-сексуальных и сомато-психических расстройств, социальной и супружеской дезадаптации, что существенно снижает качество жизни больных.
Коррекция сексологических расстройств во многом зависит от адекватной санации внутренних половых органов с широким применением физических факторов через кожу и ректально, включая лучистую электромагнитную энергию, вызывающих позитивные изменения в биохимических тканевых процессах. В то же время ни одно из современных антипротозойных средств не соответствует требованиям ВОЗ (2002) к препаратам для лечения ИППП (т.е. их эффективность должна быть не ниже 95 %), что вынуждает к сочетанному применению антипротозойных препаратов разных групп. В свою очередь, недостаточная эффективность медикаментозной терапии при микст-инфекциях делает целесообразным внедрение новых методов физического воздействия и, в частности, ОТ и низкоэнергетического лазерного излучения для лечения воспалительных процессов и их осложнений в мочеполовых органах, как у мужчин, так и у женщин. Поэтому задачей данного раздела исследований было изучение эффективности разработанных методов ОТ и низкоинтенсивного поляризованного лазерного излучения в комплексном лечении осложненных репродуктивно-сексуальными дисфункциями хронических урогенитальных микст-инфекций.
ИППП особенно при сочетании простейших (трихомонады и гарднереллы) со специфической микрофлорой (хламидии, уреаплазмы и микоплазмы) и вирусами (вирус герпеса, цитомегаловирус и Эпштейна-Барр) вызывают наиболее распространенные и тяжелые осложнения у обоих половых партнеров, приводили к экскреторно-токсическому бесплодию до 40 % наблюдений у представителей обоих полов. Основным осложнением при восходящем характере микст-инфекций у 101 представителя мужского пола были хронические уретропростатиты (62,7 %), а у их 60 половых партнерш воспалительные заболевания внутренних половых органов (вульвовагинит, эндоцервицит, эндометрит, сальпингит и аднексит) (37,3 %). При этом комплексное лечение, включающее оригинальные схемы антипротозойных и противопаразитарных средств в сочетании с антибиотиками и иммунокорректорами (индукторами интерферонов и клеточными иммуностимуляторами), в комплексе с предложенными методами ОТ оказалось недостаточным для полноценного восстановления эндокринно-репродуктивной функции. Поэтому у 61 (60,4 %) наблюдаемых нами мужчин и у 18 (30 %) женщин, страдающих экскреторно-токсическим бесплодием, в комплексное лечение включен метод КФМТ. Эти пациенты были в возрасте 20–40 лет с малосимптомным подострым хроническим течением заболевания, с восходящим поражением мочевых и внутренних половых органов (простаты, яичек и их придатков, маточных труб и яичников) (III-Б подгруппа).
Согласно многочисленным исследованиям биофизических механизмов действия низкоинтенсивного лазерного излучения (НЭИ) на жидкокристаллические структуры организма (водные структуры клеток, плазма крови, лимфа и др.) установлена их структурная альтерация, с изменениями энергетической активности клеточных мембран, активацией окислительно-восстановительных, биосинтетических процессов и основных ферментативных систем, увеличением образования макроэргов (АТФ) и усилением митотической активности клеток (активации пролиферации). За счет фотохимического действия на мембранные комплексы облучаемых клеток с реактивацией в них супероксиддисмутазы и каталазы происходит нормализация антиоксидантного статуса клеток. На органном (тканевом) уровне под воздействием НЭИ понижается рецепторная чувствительность, уменьшается длительность фаз воспаления, интерстициальный отек и напряжение тканей, усиливается поглощение тканями кислорода, повышается скорость кровотока, увеличивается число функционирующих сосудистых коллатералей, активизируется транспорт веществ через сосудистую стенку, что бвло поакзкно в наших исследованиях.
При воздействии НЭИ на фоточувствительные молекулы-протеазы, энергочувствительные протеины теплового шока и фитохромы фоточувствительных клеток кожи улучшается микроциркуляция, рассасываются воспалительные инфильтраты и ликвидируются дегенеративно-дистрофические процессы, улучшаются пролиферация и регенерация в пораженных тканях. Поэтому были использованы гибкие фотонные матрицы «Барва Флекс», которые в качестве источников света используют сверхяркие светодиоды [61]. В частности, применяли фотонную матрицу «Барва Флекс/КИК» с красным (12 светодиодов) и инфракрасным (еще 12 светодиодов) спектрами излучения (длинные волны излучения 625–670 нм и 840–920 нм). Этот диапазон спектра обеспечивает наиболее выраженное противовоспалительное, противоотечное, регенераторное и ускоряющее обменные процессы действие. Помимо этого воздействие данного спектра нормализует иммунную, эндокринную и центральную нервную системы. Дополнительно скомпонованные с 24 светодиодами прокладки из намагниченной резины позволяли за счет магнитотерапии достигать наибольшей (более 20 мм) глубины проникновения НЭИ с полным захватом биологически активных точек и рецепторного аппарата зон Захарьина-Геда. Магнитное поле создает условия для самоорганизации функциональных комплексов, активирует адаптационные механизмы, а при одновременном сочетании с лазерным воздействием обеспечивает эффективное резонансное поглощение энергии, увеличение энергопроизводства митохондральным аппаратом на фоне улучшения внутриорганной микроциркуляции. Высказывается предположение, что комбинация физиотерапевтических методов, оказывая болеутоляющее, седативное, противовоспалительное и противоотечное действие, положительно влияет на репродуктивную функцию половых желез. В тоже время недостаточно полно изучены вопросы комбинированного лазерно-магнитного и озонотерапевтического воздействия на эректильную дисфункцию и репродуктивную функцию половых желез у супружеских пар, страдающих экскреторно-токсическим бесплодием [17, 95].
У мужчин КФМТ проводилась по разработанной оригинальной методике. Контактно-компрессионно-накожно 1–2 раза в сутки воздействие низкоэнергетическим электромагнитным облучением красного и инфракрасного спектров производилось по 5 мин. на 5 зон: в проекции тимуса, надлобковой, крестцовой области, а также на промежность и заднюю поверхность мошонки. При нарушении сперматогенеза дополнительно облучалась зона надпочечников, а воздействие на мошонку увеличивалось до 10 минут в один сеанс. Перед началом сеанса фототерапии в уретру больных инстиллировалось на 10 мин. до 10 мл масла «Озонид» с концентрацией озонидов 10 мг/л в течение 7 дней и затем 5 мг/л еще 8 дней с ретроградным массажем уретры. Перед облучением НЭИ курсом 15 дней за 20–30 мин. до процедуры в ампулу прямой кишки вводилась микроклизма, включающая отвар ромашки 30,0 мл, масло «Озонид» 20 мг/л – 20,0 мл и димексид 1,0 мл при температуре 38°С. Все эти манипуляции, как правило, больные проводили в амбулаторно-домашних условиях в течение 15 дней.
У женщин накожно-компрессионно-спаренные пластины матриц последовательно накладывались ежедневно на 5 спаренных областей: 1) вилочковая железа и область сердца, 2) печень и селезенка, 3) надпочечники, 4) пахово-подвздошные области (проекция яичников), 5) промежность и крестец (ромб Михаэлиса). Длительность воздействия на каждую зону была 5–7 мин. при общей длительности сеанса 25–35 мин. Процедура проводилась после санации влагалища и установки вагинального тампона с маслом «Озонид» при концентрации озонидов 10 мг/л, а при поражении и мочевых путей в мочевой пузырь накануне процедуры инстиллировали масло «Озонид» в количестве 50,0 мл при концентрации в нем озонидов 5–7 мг/л. Курс лечения НЭИ проводился в течение 2–3 недель в амбулаторно-домашних условиях.
Лечение больных хронической осложненной микст-инфекцией КФМТ в комбинации с традиционной терапией проводилось у 10 больных (8 мужчин и 2 женщины). Помимо этого КФМТ применено в сочетании с фармакоиммунотерапией и УППТ еще у 25 больных (19 мужчин и 6 женщин), а также с ОТ у 44 больных (34 мужчины и 10 женщин).
Характер и динамика сексологических жалоб в группе наблюдаемых нами 61 мужчины, страдающих хроническим инфекционным уретропростатитом, вызванным урогенитальной микст-инфекцией и приведшим к экскреторно-токсическому бесплодию, представлены в таблице 3.16. Как видно из приведенных в таблице показателей, наиболее частыми жалобами у наблюдаемых больных были: вегето-сосудистые расстройства (в 100 % случаев) и отсутствие удовольствия от совершенного полового акта (в 96,7 %), снижение либидо (в 93,4 %) и оргазма (в 88,5 %), а также снижение (в 65,6 %) и отсутствие (в 36,1 %) адекватных эрекций. Почти одна треть наблюдаемых больных страдали от затруднений эякуляций, что, по-видимому, связано с наличием в простате воспалительных инфильтратов и отечностью железы. После проведения традиционной терапии в комплексе с КФМТ отмечено, как наглядно видно на рис. 3.19, умеренное улучшение большинства показателей с наиболее значимым уменьшением количества больных со снижением либидо и оргазма (соответственно у 62,5 % и 62,5 %). Существенно лучше были показатели у больных, получавших иммунотерапию и УППТ. При существенном улучшении сексологических, психоэмоциональных и вегето-сосудистых жалоб оставался достаточно высоким процент больных с вегето-сосудистыми расстройствами (у 57,9 %), снижением либидо (у 47,4 %), а также отсутствием удовлетворения от полового акта (63,2 %). Лишь при комбинированном лечении методами ОТ и КФМТ все показатели общего состояния больных и их жалобы на сексологические расстройства значимо улучшились, что видно по графическим показателям на рис. 3.19 и в таблице 3.16.
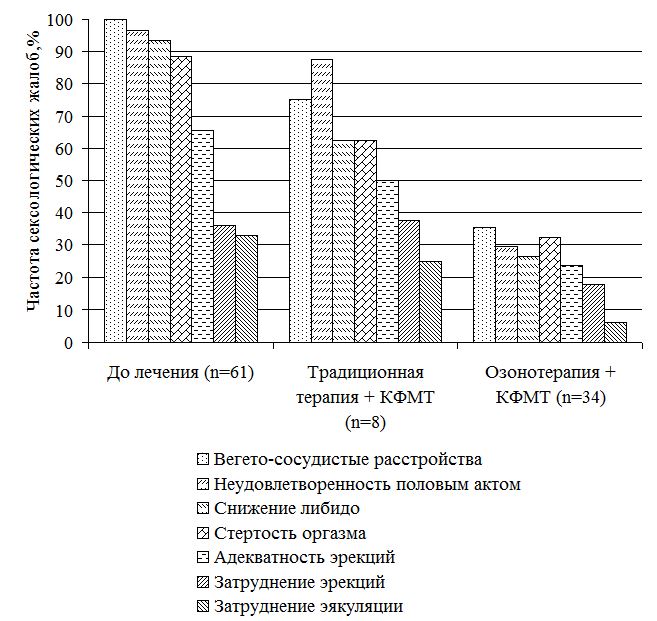
Рисунок 3.19 – Графическое отражение динамики сексологических жалоб у мужчин
Существенно уменьшалась выраженность психо-эмоциональных расстройств: исчезала физическая и психическая утомляемость, общая слабость, раздражительность, преувеличение тяжести и мрачность прогноза состояния. Субъективные ощущения больных получили объяснение при исследовании в динамике лечения гонадотропных и половых гормонов, представленные в таблице 3.17.
Таблица 3.16 – Динамика сексологических жалоб у мужчин, леченных квазилазерной фотомагнитотерапией
| Характер жалоб | До лечения n=61 | После курса лечения КФМТ | ||
| Традиционная терапия + КФМТ, n=8 |
Иммунотерапия + УППТ + КФМТ, n=19 |
ОТ + КФМТ, n=34 | ||
| Отсутствие удовольствия от полового акта | 59 (96,7 %) | 7 (87,5 %) | 12 (63,2 %)* | 10 (29,4 %)** |
| Снижение либидо | 57 (93,4 %) | 5 (62,5 %)* | 9 (47,4 %)* | 9 (26,5 %)** |
| Стертость оргазма | 54 (88,5 %) | 5 (62,5 %) | 8 (42,1 %)* | 11 (32,4 %)** |
| Снижение адекватных эрекций | 40 (65,6 %) | 4 (50 %) | 7 (36,8 %)* | 8 (23,5 %)** |
| Отсутствие адекватных эрекций | 22 (36,1 %) | 3 (37,5 %) | 5 (26,3 %) | 6 (17,6 %)* |
| Затруднение эякуляций | 20 (32,8 %) | 2 (25 %) | 3 (15,8 %)* | 2 (5,9 %)** |
| Вегето-сосудистые расстройства | 61 (100 %) | 6 (75 %)* | 11 (57,9 %)* | 12 (35,3 %)** |
Примечания:
* – достоверность отличия от среднестатистических показателей до лечения (p<0,05); ** – достоверность отличия с показателями при различных видах лечения (p<0,05)
Таблица 3.17 – Содержание гонадотропных и половых гормонов у мужчин после квазилазерной фотомагнитотерапии
| Гормоны крови | До лечения n=61 | После курса лечения КФМТ | ||
| Традиционная терапия + КФМТ, n=8 |
Иммунотерапия + УППТ + КФМТ, n=19 |
ОТ + КФМТ, n=34 | ||
| Тестостерон, нмоль/л | 8,8±0,3 | 10,3±1,7 | 12,7±1,5* (N) | 14,8±1,3* (N) |
| ФСГ, мМЕ/мл | 7,2±0,7 | 6,8±0,6 | 5,1±0,4 | 3,4±0,4* (N) |
| ЛГ, мМЕ/мл | 12,3±1,3 | 10,0±1,4 | 9,4±1,2 | 8,3±1,1* (N) |
| Эстрадиол, пг/мл | 68,6±7,5 | 56,4±5,2 | 41,2±4,3* | 36,1±3,8* (N) |
Примечания:
* – достоверность отличия от среднестатистических показателей до лечения (p<0,05); ** – достоверность отличия с показателями при различных видах лечения (p<0,05)
Как видно из представленных в таблице 3.17 среднегрупповых показателей, до лечения определяется снижение уровня тестостерона и значимое повышение содержания в крови лютеинизирующего гормона (ЛГ) и эстрадиола при умеренном, но в пределах нормы повышении фолликулинстимулирующего гормона (ФСГ). В результате проводимого в клинических группах лечения отмечена положительная динамика гормонального зеркала у наблюдаемых больных с достоверно положительными результатами у пациентов, леченных методами ОТ и КФМТ. Полученные результаты обусловлены полной эрадикацией микст-инфекционных агентов, детоксикацией и модуляцией простагландиновой системы, формирующей внутриклеточную антиоксидантную защиту организма против активации свободнорадикальных реакций.
Выраженный эффект от сочетанного применения озоно- и лазерно-магнитного лечебного воздействия показан на примере динамики показателей спермограмм, представленной в таблице 3.18.
Таблица 3.18 – Основные показатели спермограмм у больных хронической сочетанной урогенитально-протозойно-вирусной инфекцией в процессе лечения экскреторно-токсического бесплодия
| Показатели спермограмм (норма) | До лечения n=61 | Показатели после различных вариантов комплексной терапии | ||
| Традиционная терапия + КФМТ, n=8 |
Иммунотерапия + УППТ + КФМТ, n=19 |
ОТ + КФМТ, n=34 | ||
| 1 | 2 | 3 | 4 | 5 |
| Объем эякулята, мл (2-5) | 2,7±0,6 | 3,0±0,4 | 3,6±0,2 | 3,8±0,3 |
| Сперматозоидов в 1 мл, млн. (60–120) | 16,2±2,7* | 34,1±1,9** | 48,4±1,6*** | 56,9±2,1*** |
| Время разжижения, мин. (20 мин.) | 3,8±1,7* | 29,8±2,8 | 23,7±1,7** | 20,2±1,9*** |
| pH (7,2–7,6) | 7,6±0,3 | 7,5±0,5 | 7,5±0,1 | 7,4±0,2 |
| Активно-подвижные (А±В) (>40–60 %) | 26,56±2,32* | 32,82±2,34 | 38,9±2,8** | 48,6±2,28*** |
| Количество живых (>70–80 %) | 39,26±2,8* | 42,1±2,78 | 44,92±2,45 | 49,92±2,24** |
| Патологические формы (<40 %) | 52,73±2,34* | 49,8±2,8 | 43,32±1,87** | 39,27±1,31*** |
| Патология головки (<15 %) | 27,96±1,72* | 25,83±1,87 | 24,36±1,44 | 21,83±1,24** |
| Патология шейки (<10 %) | 5,98±0,94 | 5,86±0,83 | 5,23±0,64 | 5,21±0,73 |
| Патология хвоста (<10 %) | 6,35±0,89 | 6,36±0,49 | 5,87±0,58 | 5,47±0,49 |
| Клеток сперматогенеза (до 2 %) | 4,56±0,52* | 3,88±0,87 | 2,97±0,59 | 2,03±0,45** |
| Лейкоциты (<8 в 1 мл) | 12,28±0,64* | 7,87±1,24** | 3,81±0,32*** | 1,32±0,26*** |
Примечания:
* – различия достоверны (p<0,05) с показателями нормы; ** – различия достоверны (p<0,05) с показателями до лечения; *** – различия достоверны (p<0,05) с показателями при различных видах лечения
Достоверная отрицательная динамика большинства среднегрупповых показателей спермограмм до начала лечения указывало, что основной причиной половой и репродуктивной дисфункции было сочетанное токсическое воздействие протозойно-урогенитально-вирусной инфекции. Это нашло подтверждение в изменениях показателей спермограмм и после различных вариантов проведенной комплексной терапии, что отображено графически на рис. 3.20 и в таблице 3.18. После проведения курса традиционной терапии и КФМТ достигнута положительная динамика со значимым увеличением числа сперматозоидов в 1 мл и снижением уровня местного лейкоцитоза. Более существенные положительные результаты достигнуты при сочетании иммунотерапии, УППТ квазилазерной фотомагнитной терапии (иммунотерапия + УППТ + КФМТ). До нормы снизился местный лейкоцитоз, увеличилось количество сперматозоидов в 1 мл эякулята и процент активноподвижных форм, значимо уменьшился процент патологических форм и время разжижения. В то же время у больных, получавших ОТ и фототерапию (ОТ + КФМТ), большинство показателей спермограммы не только достоверно улучшились, но и достигли нормальных величин, регистрируемых у здоровых фертильных мужчин. Этот факт свидетельствует о целесообразности сочетанного применения при лечении больных с хронической микст-инфекцией, осложнившейся сексуальной дисфункцией и экскреторно-токсическим бесплодием, методов ОТ и квазилазерной фотомагнитотерапии по разработанным оригинальным методикам.
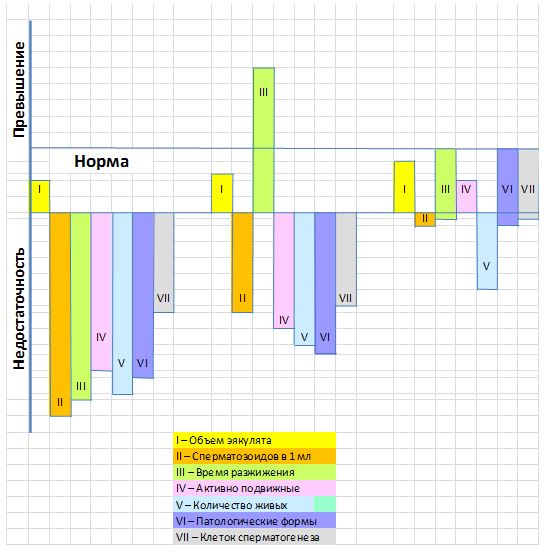
Рисунок 3.20 – Графическое отражение динамики показателей спермограммы
Фотомагнитотерапия была включена нами в комплексное лечение 18 женщин, страдающих урогенитальными ИППП, имеющими смешанную микробно-протозойно-вирусную этиологию и приведшими к дегенеративно-дистрофическим процессам в тканях мочеполовых органов с формированием вторичного бесплодия. При этом имеющие место микроциркуляторные и трофические нарушения протекали с нарушениями метаболизма стероидных гормонов яичниками, т.к. последовательно инфекция распространялась из нижних в верхние отделы половых путей – вульвовагиниты à цервициты à эндометриоз à аднекситы.
Как показал наш пилотный опыт лечения 10 пациенток и многочисленные литературные данные, традиционные способы лечения, обладая определенной эффективностью, влекут за собой риск дальнейшего дисбактериоза и не способствуют улучшению местного иммунитета, несмотря на применение лактобацилл. При глубоких нарушениях микробиоценоза влагалища антисептики еще в большей степени способствуют колонизации слизистой условно-патогенными микроорганизмами [119]. ОТ, которая была применена в 53,3 % наблюдений, напротив является не только эффективным средством санации влагалища у женщин, страдающих неспецифическими вагинитами и бактериальным вагинозом, но и служит восстановлению собственных защитных сил организма, способствуя нормализации местного иммунитета и не оказывая повреждающего действия на сапрофиты.
Поэтому в комплексном лечении инфекционно-воспалительных процессов в половой сфере с формированием вторичного бесплодия у 18 пациенток магнитофототерапия сочеталась у 2 (11,1 %) с традиционной терапией, еще у 6 (33,3 %) с фармакоиммунотерапией и оригинальными УППТ и у 10 (55,6 %) с оригинальными методами ОТ. В клинической картине до лечения преобладали жалобы на обильные слизистые, серозные или изредка гноевидные выделения из половых органов, дискомфорт с ощущением жжения или зуда в области влагалища, дизурия и диспареуния, тупые, тянущие боли в нижних отделах живота с иррадиацией в пояснично-крестцовую область, нижние конечности и наружные половые органы. При осмотре в зеркалах у 12 (66,7 %) женщин наблюдалась гиперемия, отек слизистой влагалища и наличие патологических выделений из цервикального канала и влагалища. При бимануальном исследовании у 6 (33,3 %) пациенток отмечена болезненность в области придатков матки, а также при тракциях шейки матки и у 6 (33,3 %) больных отмечено формирование эктопий и эрозий в области шейки матки. Среднегрупповые показатели гормональных нарушений у наблюдаемых нами пациенток характеризовались: умеренным снижением ФСГ [(1,68±0,13) мМЕ/мл] и в пределах нормы ЛГ [(4,08±0,24) мМЕ/мл] при повышении соотношения ЛГ/ФСГ до 2,43. Помимо этого отмечено умеренное снижение в крови эстрадиола до (14,2±0,84) пг/мл и существенное – прогестерона (до (0,35±0,08) нмоль/л), что указывало на наличие хронического воспаления с интоксикацией и нарушением метаболизма стероидных гормонов яичниками.
При сравнительной оценке результатов проведенного комплексного лечения у двух больных группы контроля (I группа), которым проводилась традиционно-стандартизованная терапия, положительная динамика характеризовалась уменьшением серозно-гноевидного отделяемого, снижением уровня болевого синдрома и зуда в области влагалища. При этом сохранялись диспареуния и дизурия. Существенных сдвигов в показателях гормонального зеркала не выявлено.
В группе женщин, получивших курс КФМТ в комбинации с иммунотерапией и УППТ, (II группа) лишь у троих (50,0 %) достигнуто значимое улучшение всех гормональных показателей и у двоих (33,3 %) восстановлена репродуктивная функция с наступлением желанной беременности. В тоже время подключение к комплексной терапии методов ОТ по оригинальной методике (III группа) у 10 пациенток позволило у восьми (80 %) нормализовать гормональный фон, стимулировать овуляцию и в 70 % наблюдений добиться наступления беременности. Практически все гормональные показатели у больных І клинической группы были восстановлены до нормы: ФСГ – (10,1±0,16) мМЕ/мл; ЛГ – (12,14±0,19) мМЕ/мл, ЛГ/ФСГ – 1,2, эстрадиол – (56,8±1,07) пг/мл и прогестерон – (98,7±0,97) нмоль/л. У всех больных достигнуто купирование болевого синдрома, зуда и жжения во влагалище, ликвидация слизисто-серозно-гнойных выделений, дизурии и диспареунии, что позитивно сказалось на психо-эмоциональном фоне пациенток.
При совмещении методов ОТ с психокоррекционными разъяснительными беседами, как элементами семейной психотерапии, с воздействием на личность членов диады и установки их мышления «в позитивном русле», использовании полового партнера как сотерапевта в общей программе реабилитации, обеспечивался эффект «комплайенс». Возникало взаимопонимание и доверие со строгим выполнением всех рекомендаций врача, что способствовало качеству проводимого лечения, снижению рецидивов заболевания и случаев реинфицирования.
Контрольное обследование, выполненное через два месяца после окончания курса комбинированного лечения, позволило установить, что процент элиминации микст-возбудителей в основных группах составил: II группа – 66,7 %, в III группе – 90 % с ликвидацией воспалительного процесса и их последствий, а реабилитация эндокринной функции яичников с восстановлением репродуктивной функции у женщин, без микрохирургических вмешательств, в 62,5 % случаев.
Учитывая результаты контрольного обследования через 4–6 месяцев, проведенного у наблюдаемых мужчин и женщин, лечившихся в основных клинических группах наблюдения, установлено, что ликвидация воспалительного процесса с нормализацией гормонального зеркала составила во II группе – 80 %, в III группе – 93,2 %, а репродуктивная функция восстановлена у 52 (75,4 %) комплексно пролеченных больных.
Полученные результаты позволяют прийти к заключению, что КФМТ светодиодами красного и инфракрасного диапазонов спектра существенно усиливает эффективность лечения хронических протозойно-урогенитально-вирусных инфекций мочеполовых органов как у мужчин, так и у женщин, с возможностью добиться полной эрадикации не только простейших, но и внутриклеточных микроорганизмов и вирусов. При прямом накожном действии лазеромагнитотерапии на зону простаты и тестикулярные гормонпродуцирующие клетки за счет улучшения микроциркуляции и кислородтранспортной функции крови, повышения неспецифической резистентности организма и иммунитета, активации механизмов антиоксидантной защиты, устраняются воспалительные процессы, и у мужчин существенно улучшается спермограмма. Как у мужчин, так и у женщин низкоинтенсивное лазерное излучение нормализует гормональное зеркало и в частности уровни андрогенов и их соотношение с эстрогенами, способствует дифференциации половых клеток на этапах их развития, что позволяет значительно улучшить репродуктивное здоровье пациентов, перенесших урогенитальную микст-инфекцию. При этом каждый специалист, занимающийся проблемой лечения урогенитальных микст-инфекций у половых партнеров, должен, учитывая сопутствующие психо-эмоциональные расстройства, подкреплять проводимую терапию семейной психотерапией, направленной на установку мышления пациентов «в позитивном русле» с коррекцией дезадаптации стереотипов межличностных отношений диады и правильном отношении к рекомендациям врача.
Исходя из всего вышесказанного, КФМТ по разработанной методике должна найти широкое применение в лечении сексуальных и репродуктивных дисфункций, особенно в комплексе с методами ОТ при хронических распространенных микст-инфекциях.
* * *
Таким образом, особенностями клинических проявлений микст-инфекций, передаваемых половым путем, являются мало- или асимптомное длительное течение заболевания, многофокусное поражение, наличие трех или более микроорганизмов, которые поддерживают воспалительный процесс, а также наличие резидуальных явлений и осложнений.
Традиционно-стандартизованная по клиническим протоколам терапия эффективна лишь при выявлении одного этиологического возбудителя ИППП без учета возможного сочетанного воздействия на организм больного двух-трех и более инфекционных агентов. Более широкое включение в комплексную терапию больных с урогенитальной микст-инфекцией иммунотерапии и УППТ, оригинальных способов общей и местной ОТ и квазилазерной фототерапии перспективны в лечении этой категории наиболее тяжелых и социально дезадаптированных больных.
Усиление противопротозойной терапии альбендазолом и мебендазолом существенно улучшает результаты элиминации простейших. Системная и местная ОТ по предложенным оригинальным методикам позволила у 96 % наблюдаемых мужчин ликвидировать воспалительный процесс и добиться гарантированной элиминации бактериальных возбудителей в 98 %. При комплексном лечении женщин с урогенитальной микст-инфекцией оригинальные методы системной и местной ОТ позволили у 95 % пациенток получить санацию наружных и внутренних гениталий, нормализовать у 40 (66,7 %) гормональный фон и у 35 (58,3 %) восстановить репродуктивную их функцию.
Дозированное включение общей и местной ОТ в комплексное лечение позволяет добиться купирования процессов свободнорадикального окисления, снять интоксикацию и восстановить физико-химические свойства клеточных мембран у больных с хронической протозойно-урогенитально-вирусной инфекцией.
Включение в комплексное лечение хронической сочетанной урогенитальной инфекции разноплановых методов ОТ позволяет не только получить наиболее выраженный положительный клинико-лабораторный результат, но и добиться существенного улучшения и/или нормализации основных гуморальных и клеточных факторов врожденного иммунитета при лечении хронической протозойно-микробно-вирусной инфекции.
Адекватная комплексная антибактериальная терапия в сочетании с комбинированной иммуностимулирующей и ОТ позволяют добиться элиминации инфекционных агентов в очагах воспаления с нормализацией функции клеточного и гуморального звеньев иммунитета, что предотвращает рецидивы и хронизацию заболевания. Разработанные и внедренные в клиническую практику оригинальные комплексные способы ОТ позволяют получить стабильный эффект лечения урогенитальных микст-инфекций.
КФМТ светодиодами красного и инфракрасного диапазонов спектра существенно усиливает эффективность лечения хронических протозойно-урогенитально-вирусных инфекций мочеполовых органов как у мужчин, так и у женщин, с возможностью добиться полной эрадикации не только простейших, но и внутриклеточных микроорганизмов и вирусов.
Материалы данного раздела освещены в следующих публикациях:
- Лукьянов И.Э. Особенности процессов перекисного окисления липидов и антиоксидантной защиты у больных с сочетанной протозойно-урогенитальной микст-инфекцией при лечении их методами озонотерапии / И.Э. Лукьянов, Ю.И. Козин, А.Н. Беловол // Міжнародний медичний журнал. – 2013. – Т. 19, № 3 (75). – С. 56–61.
- Лукьянов И.Э. Динамика показателей врожденного иммунитета у больных смешанной урогенитальной протозойно-вирусной инфекцией при включении в лечение методов озонотерапии / И.Э. Лукьянов, Ю.И. Козин, А.Н. Беловол // Міжнародний медичний журнал. – 2013. – Т. 19, № 4 (76). – С. 22–29.
- Лукьянов И.Э. Динамика иммунологических факторов приобретенного иммунитета у больных урогенитально-протозойно-вирусной микст-инфекцией и возможности ее коррекции / И.Э. Лукьянов, Ю.И. Козин, А.Н. Беловол // Харківська хірургічна школа. – 2013. – № 5 (62). – С. 66–72.
- Лукьянов И.Э. Возможности коррекции репродуктивно-сексуальной дисфункции у больных урогенитальной микст-инфекцией методами квазилазерной фотомагнитотерапии / И.Э. Лукьянов, Ю.И. Козин, А.Н. Беловол // Медицинская психология. – 2013. – Т. 8, № 4 (32). – С. 79–87.
- Козин Ю.И. Комбинированная озонотерапия и усилители противопротозойной терапии в комплексном лечении бактериально-протозойно-вирусной инфекции мочеполовых органов / Ю.И. Козин, А.Н. Беловол, И.Э. Лукьянов // Харківська хірургічна школа. – 2014. – № 6 (69). – С. 108–118.
- Козин Ю.И. Возможности озонотерапии в лечении хронической протозойно-урогенитальной инфекции и ее осложнений / Ю.И. Козин, И.Э. Лукьянов // Медицинский альманах. – 2013. – № 3 (27). – С. 167–168.
- Пат. на корисну модель 5477 UA, МПК A61K31/00, A61K47/00. Спосіб лікування хворих на урогенітальний трихомоніаз / І.Е. Лук’янов; заявник і патентовласник І.Е. Лук’янов. – № 20040604864; заявл. 21.06.04; опубл. 15.03.05, Бюл. № 3.
- Пат. на корисну модель 5478 UA, МПК A61K31/00, A61K47/00. Спосіб лікування хворих на урогенітальний трихомоніаз / І.Е. Лук’янов; заявник і патентовласник І.Е. Лук’янов. – № 20040604866; заявл. 21.06.04; опубл. 15.03.05, Бюл. № 3.
- Пат. на корисну модель 54447 UA, МПК A61K33/00. Спосіб лікування протозойно-бактеріальних уретропростатитів / Ю.І. Козин, І.Е. Лук’янов; заявник і патентовласник ДУ «Ін-т заг. та не відклад. хірургії АМН України». – № u201005310; заявл. 30.04.10; опубл. 10.11.10, Бюл. № 21.
- Пат. на корисну модель 61201 UA, МПК A61B17/00, A61P13/10, A61K31/01. Спосіб лікування хронічних форм циститу / Ю.І. Козин, І.Е. Лук’янов; заявник і патентовласник ДУ «Ін-т заг. та не відклад. хірургії АМН України». – № u201015778; заявл. 27.12.10; опубл. 11.07.11, Бюл. № 13.
- Пат. на корисну модель 66050 UA, МПК G01N33/48. Спосіб експрес-визначення загальної антиоксидантної активності плазми озонованої крові хворих / Ю.І. Козин, Т.С. Дюбко, О.О. Соколик, П.Б. Лебідь, І.Е. Лук’янов, О.Д. Рошаль, К. Кшимінський; заявник і патентовласник ДУ «Ін-т заг. та не відклад. хірургії АМН України». – № u201105717; заявл. 06.05.11; опубл. 26.12.11, Бюл. № 24.
- Пат. на корисну модель 75397 UA, МПК A61P33/02, A61P13/00, A61K31/00. Спосіб лікування хворих на урогенітальний трихомоніаз / А.М. Біловол, І.Е. Лук’янов; заявник і патентовласник Харківський нац. мед. ун-т. – № u201207095; заявл. 12.06.12; опубл. 26.11.12, Бюл. № 22.
- Пат. на корисну модель 80882 UA, МПК A61K31/00, A61K47/00. Спосіб лікування урогенітального трихомоніазу / А.М. Біловол, Ю.І. Козин, І.Е. Лук’янов; заявник і патентовласник Харківський нац. мед. ун-т. – № u201300156; заявл. 03.01.13; опубл. 10.06.13, Бюл. № 11.
- Kozin Y.I. Possibilities of ozone therapy in treatment of chronic protozoic urogenital infection and its complications / Y.I. Kozin, I.E. Lukyanov // IX International scientific conference of Russian Association of Ozone Therapy «Ozone, reactive oxygen species, nitric oxide and high-intensive physical factors in biology and medicine», 11–13 September 2013, Nizhny Novgorod. – Revista Española de Ozonoterapia. – 2013. – Vol. 3, No. 2, Suppl. 1. – P. 59.
- Динамика показателей антиоксидантной защиты при проведении озонотерапии больным урогенитально-протозойной инфекцией / Ю.И. Козин, Т.С. Дюбко, И.Э. Лукьянов, О.А. Соколик // Актуальні питання профілактики, діагностика та лікування в практиці сімейного лікаря : матеріали наук.-практ. конф. з міжнар. участю, м. Харків, 14–15 квіт. 2010 р. – Х., 2010. – С. 62–63.
- Козин Ю.И. Озоноэнтеродетоксикационная терапия в лечении хронических протозойно-бактериальных инфекций / Ю.И. Козин, И.Э. Лукьянов, А.Н. Беловол // Материалы V Украинско-русской науч.-практ. конф., ІV Азиатско-Европейской науч.-практ. конф. «Озон в биологии и медицине», 6–8 мая 2010 г., г. Одесса. – Вестник физиотерапии и курортологии. – 2010. – № 5. – С. 83.
- Козин Ю.И. Фототерапия в лечении протозойно-бактериальных уретропростатитов / Ю.И. Козин, И.Э. Лукьянов, Н.Ф. Посохов // Матеріали XXXIII Міжнар. наук.-практ. конф. «Застосування лазерів у медицині та біології», 15–17 квітня 2010 р., м. Ужгород. – Ужгород, 2010. – С. 42–43.
- Козин Ю.И. Возможности лечения мужского и женского бесплодия / Ю.И. Козин, И.Э. Лукьянов, В.Е. Чадаев // Матеріали. наук.-практ. конф. з міжнародною участю «Актуальні питання профілактики, діагностики та лікування в практиці сімейного лікаря», 18–19 квітня 2012 р., м. Харків. – Х., 2012. – С. 58–59.
- Лукьянов И.Э. Озоно- и фототерапия в лечении сексуальных расстройств при сочетанной урогенитальной инфекции / И.Э. Лукьянов, Ю.И. Козин, А.Н. Беловол // Материалы VІ Украинско-российской науч.-практ. конф. «Озон в биологии и медицине», 3–5 мая 2012 г., г. Одесса. – Вестн. физиотерапии и курортологии. – 2012. – Т. 17, № 5. – С. 87–88.
- Лукьянов И.Э. Лечение хронической протозойно-урогенитально-вирусной инфекции и ее осложнений методами озонотерапии / И.Э. Лукьянов, Ю.И. Козин, А. Н. Беловол // Урология, андрология, нефрология: материалы науч.-практ. конф.; г. Харьков, 30–31 мая 2013 г. – Харьков : ХМАПО, 2013. – С. 228–230.
РАЗДЕЛ 4
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Постоянный рост в ряде регионов мира ИППП, с ежегодным увеличением по данным ВОЗ более чем на 330 миллионов вновь заболевших, представляет не только медицинскую, но и социальную проблему. Проблема заключается в широком распространении ИППП, в частых рецидивах, осложнениях, нарушениях репродуктивного здоровья населения и трудностях в выборе адекватной терапии особенно при ассоциативно-смешанном микробиоценозе. При этом наиболее частой ИППП с ежегодным приростом до 200 млн больных (по данным ВОЗ) является трихомоноз, служащий резервуаром, сохраняющим и переносящим различные бактерии и вирусы в верхние отделы половых органов. При этом встречающийся в 40 % в ассоциациях с трихомонадой, хламидиями, микоплазмами вирус герпеса II типа, пребывая, как правило, в латентной форме, способствует развитию восходящих поражений, протекающих на фоне выраженных нарушений иммунного статуса [43, 44, 99].
В последние десятилетия в Украине, как и во всем мире, хронические сочетанные урогенитальные ИППП занимают одно из ведущих мест среди инфекционной патологии человека. Это обусловлено ежегодно растущей частотой, многофокусностью генитальных и экстрагенитальных поражений, а также большой частотой осложнений с нарушениями репродуктивной функции, низкой эффективностью проводимой терапии с частыми рецидивами заболеваний. При ассоциативно-смешанном микробиоценозе, включающем трихомонады, хламидии, микоплазмы и уреаплазмы, гарднереллы и вирусы, за счет мутаций изменяется генотип и их метаболизм с развитием перекрестной поливалентной лекарственной устойчивости.
Все вышесказанное указывает на необходимость поиска новых оригинальных подходов в комплексной терапии больных, страдающих урогенитальной микст-инфекцией. Возможности повышения эффективности лечения с элиминацией протозойно-бактериально-вирусных возбудителей, восстановлением иммунорезистентности и регенераторно-репродуктивной функции организма появляются при сочетанном применении методов ОТ и квазилазерной фотомагнитотерапии с производными бензимидазола и фармакоиммунотерапией, включаемых в комплекс проводимого лечения.
Специфическая сочетанная урогенитальная микрофлора включала трихомонады (73,9 %), хламидии (72,05 %) и вирус простого герпеса 1 и 2 типа (95,9 %). Несколько реже в составе сочетанных возбудителей урогенитальных инфекционно-воспалительных поражений диагностировали микоплазмоз (54,0 %), уреаплазмоз (46 %) и гарднереллез (24,8 %). Кроме этих видов инфекций, входивших в ассоциацию в относительно небольшом проценте случаев, диагностирована латентно-текущая вирусная инфекция: цитомегаловирус (15,5 %) и вирус Эпштейна-Барр (6,5 %).
При анализе характера микробных ассоциаций установлено, что у 71,4 % наблюдаемых больных они были четырехкомпонентными и включали у 46 % больных наличие сочетания трихомонад с хламидиями, уреаплазмами и вирусами, и еще у 25,4 % хламидии и микоплазмы сочетались с гарднереллами и вирусами. Трехкомпонентный бактериально-вирусный симбиоз, включающий трихомонады, микоплазмы и вирусы, установлен у 28,6 % наблюдаемых больных.
Для оценки эффективности проводимой комбинированной терапии все 161 пролеченные пациенты по виду, объему и характеру лечебного воздействия разделены на три репрезентативные и сравнимые клинические группы.
В I группу контроля (23 или 14,3 % больных) вошли больные, которым проводилась традиционно-стандартизированная терапия по схемам клинических протоколов. В группу II сравнения вошли 53 больных (32,9 %), получавших УППТ (альбендазол-вормил и мебендазол-вермокс) и противовирусные препараты (парантерально и местно – ректально) и в III основную группу (85 или 52,8 % больных) вошли страдающие от урогенитальной микст-инфекции, которым лечение проведено в комплексе с местной и общей ОТ по оригинальным методикам. Во всех трех группах установлены идентичные показатели по возрасту, половой принадлежности, социальному положению и видам возбудителей составлявшим микст-ассоциации. Это позволило проводить сравнительную оценку эффективности проведенного лечения, исходя из объема и вида терапевтического воздействия на пациентов.
Пациенты в клинических группах по результатам углубленного изучения анамнеза, дополнительного обследования и консультации врачей других специальностей оказались сравнимы по характеру сопутствующей патологии и перенесенным заболеваниям. Все это подтверждало правильность выбранных признаков включения и не включения пациентов в клинические группы для проведения комбинированного лечения.
Оценка общего состояния включенных в исследование пациентов и динамика результатов лечения основывалась на учете жалоб, характере и объеме выделений из половых органов, рутинных клинических и биохимических лабораторных методов, а также специального комплекса лабораторного мониторинга. Последний включал в себя: 1) микроскопию отделяемого уретры, отжатого секрета простаты, спермограммы, отделяемого цервикального канала шейки матки и влагалища; 2) бактериологическое исследование с посевом на трихомонады и неспецифическую (сопутствующую) микрофлору; 3) молекулярное выявление ДНК возбудителей с помощью ПЦР и 4) определение напряженности специфического иммунитета при количественной оценке защитного уровня антител по содержанию IgG или IgM методом ИФА.
Лабораторно-клинические методы контроля подкреплялись результатами инструментальных исследований: уретроскопия, кольпоскопия и ультразвуковое исследование мочеполовых органов.
Установлено, что наиболее часто у мужчин отмечен дискомфорт и зуд в уретре (72,2 %), а при поражении простаты тянущие боли в паховых областях и мошонке (33,7 % больных), ноющие боли в промежности (26,7 %) и боли в пояснично-крестцовой области (у 27,7 %). У женщин во всех наблюдениях отмечено наличие выделений в основном слизистого (45 %) и слизисто-гнойного (53,3 %) характера, с наличием неприятного запаха у 31,7 % пациенток. Болезненность внизу живота (30 %) и зуд кожи и слизистых половых органов (26,7 %) с дизурией (10 %) дополняли клиническую картину у больных микст-инфекцией. В то же время отмечена «стертость» жалоб и скудность выделений, что откладывало обращение к специалисту. Результаты клинических и биохимических анализов в динамике наблюдений за данной категорией больных не выявили существенных сдвигов и негативная, а затем в ходе лечения и позитивная динамика были в пределах статистической ошибки, указывая на позитивную тенденцию в клиническом течении.
При сравнительной оценке возможности лабораторного мониторинга в первичной диагностике и оценке результатов лечения урогенитальных инфекций методами микроскопии, бактериологии, ИФА и ПЦР получены следующие результаты. В диагностике трихомонад, хламидий, микоплазм, уреаплазм и гарднерелл информативность соответственно была следующей: ПЦР – 95,8 %, 98,28 %, 93,1 %, 93,2 %, 100 %; бактериология – 90,76 %, 97,7 %, 97,3 %; ИФА IgG – 84,03 %, 87,1 %, 89,7 %, 87,8 %, 12,5 %; микроскопия – 67,2%, 11,2 %. Наиболее чувствительными и специфичными для диагностики ИППП были методы ПЦР диагностики и бактериологии при соблюдении всех требований к подготовке и забору исследуемого материала.
В диагностике субклинической латентно текущей герпесвирусной инфекции наиболее значимым и информативным был метод ИФА специфических IgG, а при клинических обострениях и IgM. Двух-трехкратное повышение количества специфических противовирусных антител характеризовало латентное течение, а их повышение в 5–10 и более раз указывало на активацию и диссеминацию данного вида вирусной инфекции.
При инструментальном обследовании мужчин у 28,7 % уретроскопически выявлены ограниченные зоны отечности и гиперемии с щелевидными углублениями и грубыми складками, а при ультразвуковом обследовании чаще всего выявлялись изменения предстательной железы в виде асимметричности (отечности) долей и фиброзно-фолликулярных изменений (26,7 %) чаще в правой доле, а также микрокальцификатов до 2–3 мм (20,8 %). В простате, как правило, отмечалась диффузно-неоднородная эхогенность с чередованием зон повышенной и сниженной эхогенности без четких границ.
У женщин кольпоскопически чаще всего диагностирован эндоцервицит (в 100 %) и экзоцервицит (у 46,7 %), а при УЗИ органов малого таза – сальпингоофорит (у 36,7 %) и аднексит (у 23,3 %).
Помимо смешанного состава специфической микрофлоры у наблюдаемого нами 161 больного бактериологически выявлена различная условно-патогенная микрофлора, из которой наиболее частыми были стафилококки (42,3 %), энтеробактерии (8,7 %) и энтерококки (5,6 %). Поэтому оценивая в целом микробиоценоз урогенитального тракта при поражении его микст-инфекцией (протозойно-бактериально-вирусной), необходимо для проведения рационального и эффективного комбинированного лечения учитывать состав и количественную оценку условно-патогенной микрофлоры в микробном пейзаже.
При этом объем, последовательность и характер комплексной терапии, учитывая симбиоз, мутуализм и паразитизм различных возбудителей, необходимо проводить, учитывая их биологические свойства, инвазивность, тканевой тропизм, вирулентность, антифагоцитарные особенности и токсикогенность инфекций, протекающих на фоне вторичного угнетения иммунорезистентности и антиоксидантной защиты организма хозяина. Поэтому лечение, проводимое у 23 (14,3 %) пациентов І контрольной группы (традиционная терапия), включало только медикаментозные препараты и схемы их применения по утвержденным МЗ Украины клиническим протоколам (наказ № 312 2009 р.). В следующих клинических группах ІІ (сравнения) и ІІІ (основной) лечение было существенно дополнено иммунотерапией, УППТ, а также методами общей и местной ОТ. В группе сравнения 53 (32,9 %) пациентов препараты группы 5‑НИ применялись одновременно с противопаразитарными препаратами альбендазолом (вормилом) и мебендазолом (вермокс), что позволяло преодолеть высокую резистентность изолятов к препаратам группы 5-НИ. Одновременно начиная со второй недели лечения, начиналась 24-дневная антибиотикотерапия (фторхинолоны и макролиды) в комплексе с противовирусной терапией (валацикловир) и иммунотерапией. Последняя включала 10-дневные курсы внутримышечного введения по 1 млн МЕ рекомбинантных интерферонов альфа-2b (Альфарекин или Интробион) и местно (ректально или вагинально) свечей «Виферон» или «Генферон» по 1 млн МЕ.
В тоже время сохраняющаяся высокая торпидность к проводимой терапии, обусловленная замещением нормальной микрофлоры симбиозом других бактерий с выраженными патогенными свойствами, появлением полирезистентных форм и персистенции возбудителей, многофокусностью хронического рецидивирующего поражения половых органов на фоне вторичного иммунодефицита, потребовала поиска физико-химических методов, а именно включение в комплексную терапию 85 (52,8 %) больным разработанных оригинальных методов ОТ.
При введении в организм озона (О3), обладающего высоким окислительно-восстановительным потенциалом и большими скоростями реакций с органическими молекулами, мы одновременно воздействуем озоном, молекулярным и атомным кислородом, а также промежуточными продуктами их реакций (озонидами, пероксидами, свободными радикалами, синглетным кислородом и т. д.), что обеспечивает разнообразное и разнонаправленное действие на организм человека.
Суммарный терапевтический эффект озона и продуктов окисления (озонидов, пероксидов) оказывает антимикробный (бактерицидный, фунгицидный, антивирусный), антигипоксический, противовоспалительный, иммуномоделирующий и дезинтоксикационный эффекты. При этом стимулируются обменные процессы и улучшаются реологические свойства крови. Поэтому безопасный, простой в исполнении, дозозависимый и высокоэффективный метод ОТ применен по шести разработанным оригинальным методикам (см. подраздел 3.3).
В результате сравнительного клинико-лабораторного мониторинга по результатам проведенного лечения выявлено, что наиболее низкая эффективность получена в I группе традиционно-стандартизованной терапии. В группе сравнения, получавшей усиленную иммунотерапию и УППТ, положительная динамика клинико-лабораторных исследований были существенно лучше. В то же время в III основной группе получавших курсы общей и местной ОТ получен наивысший положительный эффект не только по полной элиминации бактериальных и протозойных микробных агентов, но и по нормализации состояния больных и результатам лабораторных тестов. Нормализация обменно-функциональных свойств биологических систем и биомембран зависит от динамического равновесия между активными формами кислорода и мембранно-связанными реакциями ПОЛ, а также антиоксидантами (ферментативными и неферментативными), поэтому изменчивость основных показателей врожденного и приобретенного иммунитета у больных с урогенитальной микст-инфекцией исследована в динамике при лечении во всех трех клинических группах.
Проведенное в динамике (до и после лечения) изучение у 141 пациентов с микст-урогенитальной инфекцией состояния свободнорадикального окисления жирных кислот (ПОЛ) и ОАОЗ позволило судить о целесообразности включения методов ОТ в комплексное лечение. Для этого кроме общих липидов и общих фосфолипидов исследованы ДК, МДА и ШО с вычислением индекса шиффообразования (ШО/МДА).
Для оценки ОАОЗ изучена в динамике по учету интенсивности свободнорадикального окисления (СРО БВХ) методом индуцированной сульфатом железа и перекисью водорода хемилюминесценции, выражаемая в квантах света, регистрируемого на хемилюминометре БВХ-06. Для экспресс-определения РВ ОАОА плазмы озонированной крови больных применен разработанный способ (Пат. 66050 uUA) определения гидрофобной модификации белковых молекул (альбуминов) по изменению ультрафиолетового их спектра. Все эти показатели изучены у 141 больного хронической микст-инфекцией – в группах контроля (23 больных), сравнения (42 больных) и основной (76 больных), а также 25 практически здоровых лиц (региональные показатели нормы).
Достоверно установлена отрицательная динамика практически всех показателей ПОЛ и ОАОЗ, что свидетельствовало о разрушении фосфолипидного слоя клеточных мембран за счет ускоренного окисления липидов и нарастании интоксикации при урогенитальных микст-инфекциях. Значимое повышение ДК-первичных продуктов ПОЛ сопровождалось у этой категории больных существенным снижением МДА-конечного продукта ПОЛ за счет его нейтрализации в реакции с молекулами, составляющими клеточные структуры. Существенно возрастал и уровень шиффообразования, а также индекс ШО/МДА (почти в 3 раза), указывая на интенсификацию процессов ПОЛ в плазме крови больных с хронической урогенитальной микст-инфекцией. Накопление продуктов деградации клеточных структур сочеталось со снижением у данной категории больных ОАОА плазмы с достоверным снижением резервных возможностей ОАОА плазмы их крови. Все это приводит к дестабилизации структурно-функционального состояния клеточных мембран на системном и локальном уровнях.
После традиционной терапии значимо улучшились резервные возможности ОАОА плазмы крови больных, и снизилась интенсивность шиффообразования, с умеренной положительной динамикой остальных показателей. В то же время незавершенность нарушений ПОЛ, показатели которого были существенно хуже нормальных в группе контроля, указывала на продолжающееся окислительное повреждение тканей.
После комбинированного лечения, включающего шесть оригинальных способов ОТ, практически все показатели ПОЛ и ОАОА плазмы крови достоверно улучшились в сравнении с показателями до лечения и существенно не отличались от показателей в группе практически здоровых лиц. Полученные данные обосновывают целесообразность включения разработанных и внедренных методов ОТ в комбинированное лечение больных хронической сочетанной протозойно-бактериальной урогенитальной инфекцией.
Наблюдаемое у больных урогенитальной микст-инфекцией отсутствие классических симптомов воспаления, затруднения в выявлении развивающихся инфекционных осложнений и очагов дремлющей инфекции, а также контроле результатов лечения обусловлены снижением иммунореактивности с возможными нарушениями функции клеточных и гуморальных факторов как врожденного (неспецифического), так и приобретенного иммунитета.
Динамика показателей клеточного и гуморального звеньев врожденного (неспецифического) иммунитета проведена у 141 больного хронической микст-инфекцией в группах контроля (23 больных), сравнения (42 больных) и основной (76 больных), а также 25 практически здоровых лиц (региональные показатели нормы). Исследована также динамика клеточного и гуморального звеньев приобретенного иммунитета у тех же 141 больного в тех же группах обследования до и после комбинированной терапии, в сравнении со среднестатистическими показателями, как между клиническими группами, так и с группой здоровых лиц (25 пациентов). При оценке гуморального звена иммунитета у больных с микст-урогенитальной инфекцией до начала лечения установлены негативные изменения практически всех гуморальных факторов. Достоверно значимо уменьшалась альбуминовая и повышалась γ-глобулиновая белковые фракции при незначительном снижении уровня общего белка. Значимо возрастали показатели С-реактивного белка и титра лизоцима (мурамидазы). Основные компоненты комплемента из фракции β1-глобулинов С3 и С4, а также среднестатистические показатели всех классов иммуноглобулинов были умеренно увеличены с одновременным повышением количества высокомолекулярных ЦИК.
В результате проведенного лечения улучшение среднестатистических показателей, отражающих состояние гуморального звена врожденного иммунитета, возрастало от уровня положительных тенденций в группах контроля и сравнения до достоверно значимых и приближающихся к норме после курсов ОТ. Увеличение общего белка сочеталось с нормализацией его фракций и существенным снижением С-реактивного белка и титра лизоцима. Снижалась активность комплемента и содержание IgА и IgM при увеличении IgG, что указывало на уменьшение воспалительной реакции. Нормализовалось содержание высокомолекулярных ЦИК.
Показатели клеточного звена неспецифического (врожденного) иммунитета у больных урогенитальной микст-инфекцией до начала лечения также указывали на его угнетение. Отмечено значимое повышение базисной (спонтанной) ферментативной активности нейтрофильных гранулоцитов (антигенная перегруженность) с одновременным снижением коэффициента стимуляции хемилюминесценции нейтрофилов (снижение резервного потенциала). При умеренном снижении содержания в нейтрофилах лизосомального катионного белка, отмечено существенное повышение в них активности фермента миелопероксидазы (СЦК) и снижение всех показателей активности фагоцитоза (ФП – достоверно, а также ФЧ и ПЗФ). Отмечено также умеренное повышение в периферической крови количества незрелых форм В-клеток или макрофагов, не имеющих маркеров ни Т-, ни В-клеток, клеток «ноль» или К-клеток, а также повышение субпопуляции истинных натуральных киллеров (NK-клеток), содержащих рецепторы к Fc-ферменту и к С3-компоненту комплемента.
Данные показатели напряжения и угнетения клеточного звена врожденного иммунитета удалось лишь незначительно откорригировать после стандартизованного лечения, и получить умеренное их улучшение после фармакоиммунотерапии в сочетании с УППТ. В то же время в группе больных, получавших лечение методами ОТ, результаты комплексного лечения характеризовались существенной нормализацией показателей активности нейтрофильных гранулоцитов по НСТспон. и НСТстим., лизосомального катионного белка и СЦК по активности миелопероксидазы. Особенно это проявилось в отношении восстановления антиген-распознавательной способности лимфоцитов и улучшения всех показателей фагоцитарной активности нейтрофилов (ФП, ФИ, ПЗФ). Нормализовались как количественно, так и процентно показатели истинного клеточного иммунитета CD16+CD56+ (NK-клетки) и CD3–HLA-DR+ (K-клетки), что указывало на эффективное купирование воспалительного процесса и ликвидацию токсического воздействия на организм больных патогенной урогенитальной микст-инфекции.
В целом динамика показателей гуморального и клеточного звеньев врожденного иммунитета у больных хронической протозойно-бактериально-вирусной урогенитальной инфекцией достоверно показала, что включение в их комплексное лечение методов ОТ позволило получить наиболее выраженный и стойкий положительный эффект за счет существенного улучшения и даже нормализации основных факторов неспецифического иммунитета.
Для полноты оценки изменений в иммунной системе больных, страдающих хронической сочетанной протозойно-бактериально-вирусной урогенитальной инфекцией, также были изучены показатели клеточного и гуморального звеньев приобретенного иммунитета. До начала лечения у всех 141 больного урогенитальной микст-инфекцией изменение среднестатистических показателей клеточного иммунитета достоверно свидетельствовало о значительном снижении общей иммунореактивности системы иммунокомпетентных клеток. У больных данной категории отмечено достоверное уменьшение абсолютного и относительного числа лимфоцитов при достоверном увеличении цитотоксических Т-лимфоцитов с супрессорно-киллерной активностью и умеренном снижении клеток-помощников (хелперы). На развитие у больных с урогенитальной смешанной инфекцией существенного иммунодефицита как клеточного, так и гуморального звеньев, указывало также значимое снижение Т-лимфоцитов-киллеров, экспрессирующих маркеры NK‑клеток и умеренное снижение Т-лимфоцитов, активированных с рецептором к интерлейкинам-2 (a-цепь рецептора ИЛ-2). Снижение популяции Т-клеток иммунологической памяти гетерогенно (CD3+CD25+) обусловлено, по-видимому, высокими дозами антигена, когда формирование памяти переключается на В-клетки (CD3–CD25+). Под влиянием повторных антигенных стимулов данная долгоживущая популяция малых лимфоцитов раньше других клеток включает метку и трансформируется в лимфобласты и плазмоциты. В тоже время значимое снижение количества активированных Т‑лимфоцитов (более 80 % лимфоцитов, активированных фитогемагглютинином), на наш взгляд, указывает на преимущественно функциональный характер выраженного угнетения клеточного иммунитета с возможностью восстановления распознавания антигенов и превращения в бластные формы при адекватной антибактериальной санации и перспективности комплексной иммунокоррекции.
При проведении в клинических группах стандартно-традиционного лечения, а также с добавлением общей и местной фармакоиммунотерапии и оригинальных УППТ получена нарастающая, но статистически недостоверная положительная динамика, достигавшая во II группе по ряду показателей нижней границы нормы. Учитывая, что ни один из среднестатистических показателей не отличался достоверно от аналогичных до лечения, можно сделать вывод о нестабильности достигнутой иммунокоррекции с возможным ее ухудшением и рецидивированием микст-инфекций.
Наиболее существенные и достоверно значимые позитивные сдвиги большинства показателей клеточного звена иммунитета получены у 76 больных, в лечение которых включался комплекс из шести оригинальных способов ОТ. Достоверно увеличивалось по завершению курсов ОТ абсолютное и относительное число Т-лимфоцитов, Т-хелперов и Т-киллеров, и существенно снижалось абсолютное и относительное число Т‑супрессоров. Нормализовались абсолютные и относительные показатели активированных Т-лимфоцитов-регуляторов и клеток иммунологической памяти, подтверждая снижение загруженности организма больных антигенными детерминантами.
Среднестатистические показатели гуморальных факторов приобретенного иммунитета у больных урогенитальной микст-инфекцией до начала лечения указывали на умеренные разноплановые нарушения В-системы иммунитета. Умеренное снижение абсолютного и относительного числа В‑лимфоцитов с одновременным увеличением количества В-клеток памяти указывало на высокие дозы бактериально-вирусных агентов в крови больных. При незначительных колебаниях сывороточных иммуноглобулинов классов M, G и A значимо нарастали иммуноглобулины класса Е, указывая на рецидивирующее течение урогенитальной микст-инфекции с аллергизацией (сенсибилизацией) организма.
В результате проведенного у 141 больного комбинированного лечения выраженные, но недостоверные положительные сдвиги с достижением уровня нормы получены лишь при фармакоиммунотерапии и ОТ, что указывало на ликвидацию инертности факторов гуморального иммунитета в купировании данной патологии и десенсибилизации организма больных.
Оценивая в целом проведенное динамическое исследование показателей основных звеньев как неспецифического (врожденного), так и приобретенного иммунитета при лечении хронической сочетанной протозойно-микробно-вирусной инфекции, было показано значительное нарушение у данной категории больных как клеточных, так и гуморальных факторов, проявляющееся как в снижении, так и в неблагоприятном повышении большинства изученных показателей.
Стандартизированное лечение не всегда позволяет достичь значимого и стабильного улучшения факторов иммунитета, что нередко приводит к хронизации воспаления и дальнейшей диссеминации микст-инфекции. Медикаментозная иммунокорригирующая терапия из-за отсутствия достаточных знаний иммунопатологических процессов при сочетанной инфекции и отсутствия медикаментозных средств для селективного воздействия на определенные звенья иммунной системы, недостаточно повышает эффективность лечения микст-инфекций. Аналогичные данные получены и другими исследователями [35, 36, 37, 43, 44, 68, 69, 76, 97, 98, 136]. Это требует подключения физико-химических стандартизованных методов иммунокоррекции, в частности разноплановых методов общей и местной ОТ. При этом достигается наиболее выраженный и стойкий положительный результат на фоне существенного улучшения и даже нормализации основных клеточных и гуморальных факторов как врожденного, так и приобретенного иммунитета.
У наблюдаемых нами больных, страдающих смешанными ассоциативными урогенитальными инфекциями с торпидно-рецидивирующим течением, у 49,1 % наблюдений зарегистрировано экскреторно-токсическое бесплодие, обусловленное восходящим характером микст-инфекций. Комплексное лечение, включающее оригинальные схемы антипротозойных и противопаразитарных средств в сочетании с антибиотиками и иммунокорректорами (индукторами интерферонов и клеточными иммуностимуляторами), в комплексе с предложенными методами ОТ оказалось недостаточным для полноценного восстановления эндокринно-репродуктивной функции. Поэтому у 61 наблюдаемого мужчины (60,4 %) и у 18 женщин (30 %), страдающих экскреторно-токсическим бесплодием, в комплексное лечение включен метод КФМТ.
По разработанным методикам (Пат. 63832 от 25.10.2011) контактно-компрессионно накожно воздействие НЭИ проводилось 1–2 раза в день с помощью фотонных матриц «Барва Флекс/КИК». Разработанные и сертифицированные в НИИ лазерной биологии и лазерной медицины Харьковского национального университета им. В.Н. Каразина фотонные гибкие матрицы в качестве источников света используют сверхяркие светодиоды с красным (12 светодиодов) и инфракрасным (еще 12 светодиодов) спектрами излучения (длинна волны излучения 625–670 и 840–920 нм). Матрицы дополнительно скомпонованы с прокладками из намагниченной резины, что позволяет увеличить глубину проникновения НЭИ более чем на 20 мм, т. е. с полным захватом биологически активных точек и рецепторного аппарата зон Захарьина-Геда. КФМТ была включена в комплексную терапию у 10 больных, получавших традиционную терапию, еще у 25 больных, лечившихся дополнительно иммуномодуляторами и УППТ, и у 44 больных в комплексе с ОТ.
При контроле динамики сексологических, психоэмоциональных и вегето-сосудистых жалоб у мужчин, леченных КФМТ, наиболее существенное улучшение получено при комбинации лазерно-магнитного и озонотерапевтического воздействия на эректильную и эякуляторную дисфункцию, а также на репродуктивную функцию половых желез. Последнее подтверждено положительной динамикой гонадотропных и половых гормонов (тестостерона, ФСГ, ЛГ и эстрадиола). Полученные результаты обусловлены полноценной эрадикацией инфекционных агентов, детоксикацией и восстановлением внутриклеточной антиоксидантной защиты организма против активации свободнорадикальных реакций, что было также подтверждено в ряде аналогичных исследований [17, 98].
Полученный выраженный иммуномодулирующий и антиоксидантный эффекты от сочетанного применения озоно- и лазеро-магнитного лечебного воздействия ярко проявил себя и в динамике показателей спермограмм. Достоверная отрицательная динамика большинства показателей спермограмм до начала лечения была приостановлена и получила положительную динамику при сочетании КФМТ с традиционной терапией. Однако значимые положительные результаты достигнуты лишь во II клинической группе (иммунотерапия + УППТ + КФМТ) с их нормализацией в основной клинической группе при сочетании КФМТ с ОТ, проводимыми по разработанным методикам.
Аналогичная тенденция в купировании дегенеративно-дистрофических процессов в тканях мочеполовых органов отмечена при комплексном лечении микст-инфекций у 18 женщин с применением фотомагнитотерапии. Эффективность проведенной комбинированной терапии особенно ярко продемонстрировали результаты контрольных обследований пролеченных женщин и мужчин через 2 месяца и через 4–6 месяцев. Процент элиминации возбудителей с ликвидацией воспалительного процесса и их последствий составил во II группе – 66,7 % и 80 %, а в основной группе – 90 % и 93,2 % с нормализацией гормонального зеркала. Репродуктивная функция была восстановлена (наличие беременности, УЗИ) у 52 (75,4 %) пролеченных комплексно больных урогенитальной микст-инфекцией. Поэтому включение квазилазерно-магнитотерапии по разработанной и внедренной методике должно найти широкое применение в лечении сексуальных и репродуктивных дисфункций, особенно в комплексе с методами ОТ и семейной психотерапии при лечении хронических распространенных урогенитальных микст-инфекций.
ВЫВОДЫ
В диссертации предложено новое решение актуальной задачи современной дерматовенерологии, заключающееся в повышении эффективности лечения урогенитальных микст-инфекций, вызванных хламидиями, трихомонадами, микоплазмами, герпесвирусами, путем разработки комплекса физико-химических методов терапевтического воздействия на их основные патофизиологические механизмы.
1. Значительная распространенность урогенитальных инфекций, хроническое течение, нарушение репродуктивной и копулятивной функции, особенности клинического течения, в частности малосимптомность и многофокусность поражения мочеполовых органов, возраст наибольшей социально-экономической и репродуктивной активности пациентов (18-39 лет), а также недостаточная эффективность медицинской помощи делают проблему микст-инфекций, вызванных хламидиями, трихомонадами, микоплазмами и герпесвирусами, актуальной для науки и практики.
2. Разработана эффективная (не менее 95 %) терапия, позволяющая преодолеть рефрактерность трихомоноза к лечению, в виде курсов противотрихомонадных и противопаразитарных препаратов. Разработано шесть способов озонотерапии, которые обеспечивают бактерицидный и антивирусный эффекты с достижением эффективной элиминации возбудителей (более 96 %) и ликвидацией воспалительных очагов в предстательной железе (с 15,5 до 6,0 баллов по шкале NIH-CPSI). Предложена методика квазилазерной фотомагнитотерапии (625-670 и 840-920 нм), позволяющая снизить частоту половых и репродуктивных расстройств с 33–93 % до 5–35 %.
3. У больных с урогенитальной микст-инфекцией имеет место отрицательная динамика показателей ПОЛ и АОЗ организма. Интенсификация ПОЛ в плазме крови больных подтверждается повышением уровней диеновых конъюгатов (159,6 нмоль/мл), шифових оснований (58,9 у.е.) и индекса ШО/МДА (4,8), при снижении уровня малонового диальдегида (12,2 нмоль/мл). Также снижается общая антиоксидантная активность плазмы и ее резервные возможности. Имеет место нормализация показателей ПОЛ и АОЗ после включения методов озонотерапии и квазилазерной магнитотерапии в комплексном лечении (содержание диеновых конъюгатов – 126,3 нмоль/мл, шифовых оснований – 16,2 у.е., индекс ШО/МДА – 2,5, уровень МДА – 16,2 нмоль/мл).
4. У пациентов с сочетанной урогенитальной инфекцией имеет место нарушение гуморального и клеточного звена врожденного иммунитета: снижение уровня альбумина (50,1 г/л) и лизоцима (1,03 мкг/мл) на фоне повышения уровня гамма-глобулинов (26,3 %), С-реактивного белка (27,0 мг/л). Отмечается повышение спонтанной ферментативной активности нейтрофилов (0,16 у.е или 16,4 %) и их миелопероксидазы (10,3 у.е.) при повышении фагоцитарного показателя субпопуляции NK-клеток (22,3 % или 15,6 × 109/л). После лечения эти показатели имеют положительную динамику: увеличение общего белка (73,6 г/л), нормализация его фракций со снижением уровня С‑реактивного белка (5,8 мг/л) и титра лизоцима (3,8 мкг/мл); также наблюдается снижение активности комплемента С3 (1,26 г/л) и содержания IgA (1,23 г/л) и IgM (1,21 г/л) при увеличении IgG (16,24 г/л) и нормализация содержания ЦИК (30,0 у.е.). Большинство клеточных факторов врожденного иммунитета имеют тенденцию к нормализации.
5. У больных с урогенитальной микст-инфекцией имеет место нарушение клеточного и гуморального звена приобретенного иммунитета: снижение абсолютного (1,36 × 109/л) и относительного (63,3 %) количества лимфоцитов; Т-лимфоцитов-киллеров, которые экспрессируют маркеры NK-клеток – CD3+CD16+CD56+ (12,1 % или 0,21 × 109/л); Т-лимфоцитов, активированных с рецептором к интерлейкину-2 – CD3+CD25+ (81 % или 0,36 × 109/л) на фоне увеличения уровня цитотоксических Т-лимфоцитов с супресорно-киллерной активностью – CD3+CD8+ (31,7 % или 0,96 × 109/л). Имеет место умеренное снижение абсолютного (0,23 × 109/л) и относительного (20,5 %) количества В‑лимфоцитов – CD22+ – с увеличением В-клеток памяти – CD3–CD25+ (2,0 % или 0,07 × 109/л). При незначительных колебаниях иммуноглобулинов M, G и А существенно нарастали иммуноглобулины класса Е (0,0008 г/л). После традиционного лечения ни один из показателей не достигал уровня соответствующего показателя группы контроля, но после озонотерапии и фототерапии наблюдались существенные позитивные сдвиги иммунологических показателей.
6. 49 % больных с урогенитальными микст-инфекциями наблюдаются половые расстройства и экскреторно-токсическое бесплодие. Частыми жалобами у мужчин являются: отсутствие удовлетворения от совершенного полового акта (96,7 %), снижение либидо (93,4 %) и оргазма (88,5 %), снижение (65,6 %) или отсутствие (36,1 %) адекватных эрекций. У мужчин (в среднем) до лечения определялось снижение уровня тестостерона – 8,8 нмоль/л, и значимое повышение лютеинизирующего гормона – 12,3 мМЕ/мл и эстрадиола – 68,6 пг/мл при умеренном повышении ФСГ – 7,2 мМЕ/мл. После лечения методами озонотерапии и квазилазерной фотомагнитной терапии уровень тестостерона – 14,8 нмоль/л; лютеинизирующего гормона – 8,3 мМЕ/мл; эстрадиола – 36,1 пг/мл при умеренном; фолликулостимулирующего гормона – 3,4 мМЕ/мл. Большинство среднегрупповых показателей спермограмм существенно улучшились или достигли нормальных величин: лейкоциты – с 12,3 до 1,3 в 1 мл; сперматозоиды – с 16,2 до 56,9 млн./мл; время разжижения – с 3,8 до 20,2 мин.; активноподвижных – с 26,6 % до 48,6 %; патологические формы – с 52,7 % до 39,3 %.
РЕКОМЕНДАЦИИ
1. Диагностика протозойно-микробно-вирусной микст-инфекции должна быть комплексной с обязательным включением ПЦР ДНК возбудителей, бактериологических исследований как специфической урогенитальной, так и неспецифической вторичной микрофлоры в выделениях, отжатом секрете простаты и эякуляте, а также должна включать иммуноферментный анализ уровня специфических антител в сыворотке крови для диагностики и мониторинга герпесвирусной инфекции. Для уточнения распространенности и характера осложнений рекомендуются инструментальные методы исследования: УЗИ, уретроскопия и кольпоскопическое обследование.
2. Динамический контроль по перекисному окислению липидов и антиоксидантной активности плазмы крови в комплексе с изменениями клеточного и гуморального иммунитета у больных с сочетанной урогенитальной микст-инфекцией отражает эффективность проводимого лечения.
3. Включение в комплексную противотрихомонадную и терапию 10-дневными курсами противоглистных препаратов (альбендазол или мебендазол) позволяет преодолеть устойчивость трихомонад к нитроимидазольным препаратам и обеспечить их элиминацию. Санация организма от трихомонад, хламидий, микоплазм и условно-патогенной флоры становится возможной при подключении общей и местной озонотерапии в комплексе с адекватной этиотропной терапией.
4. При развитии у больных с урогенитальной микст-инфекцией половых расстройств и репродуктивных дисфункций необходимо в медикаментозную терапию включать озонотерапию в комплексе с квазилазерной магнитотерапией по предложенным оригинальным методикам.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Абрамова Т.В. Клинико-этиологические особенности течения уретритов у мужчин репродуктивного возраста / Т.В. Абрамова, Е.В. Липова, К. Аджар // TERRA MEDICA. – 2011. – № 3–4. – С. 26–32.
- Айзятулов Р.Ф. Особенности комплексной терапии осложнений, вызванных смешанной инфекцией мочеполовой сферы / Р.Ф. Айзятулов, А.Е. Нагорный // Дерматовенерология. Косметология. Сексопатология. – 2002. – № 1–2 (5). – С. 138–141.
- Алехина С.П. Озонотерапия: клинические и экспериментальные аспекты / С.П. Алехина, Т.Г. Щербатюк. – Н. Новгород : Литера, 2003. – С. 37–71, 72–93.
- Аполихина И.А. Малоинвазивные инновационные лазерные технологии в гинекологической практике / И.А. Аполихина, Е.А. Горбунова, В.А. Одинокова // Акушерство и гинекология. – 2014. – № 11. – С. 17–22.
- Арутюнян А.В. Методы оценки свободнорадикального окисления и антиоксидантной системы организма : Метод. рекомендации / А.В. Арутюнян, Е.Е. Дубинина, Н.Н. Зыбина. – СПб. : ИКФ Фолиант, 2000. – 104 с.
- Асхаков М.С. Диагностика и лечение инфекций, передаваемых половым путем «второй генерации» / М.С. Асхаков, В.В. Чеботарев, В.В. Вышеславцев // Медицинский вестник Северного Кавказа. – 2014. – Т. 9, № 1 (33). – С. 102–107.
- Асхаков М.С. Частота выявления возбудителем инфекции, передаваемых половым путем, при воспалительных заболеваниях мочеполовой системы у мужчин / М.С. Асхаков, В.В. Вышеславцев // Вестник молодого ученого. – 2013. – № 3–4. – С. 16–19.
- Баткаева Н.В. Комплексная терапия урогенитального хламидиоза / Н.В. Баткаева, Б.А. Татаров // Вестник последипломного медицинского образования. – 2013. – № 2. – С. 34–36.
- Боголюбов В.М. Общая физиотерапия / В.М. Боголюбов, Г.Н. Пономаренко. – М., СПб. : Медицина, 2003. – 480 с.
- Бондаренко Г.М. Комплексное лечение урогенитальной хламидийной и микоплазменной инфекции / Г.М. Бондаренко, И.Н. Никитенко // Український журнал дерматології, венерології, косметології. – 2010. – № 4 (39). – С. 92–97.
- Бондаренко Г.М. Опыт применения цефиксима (фламификс) для лечения пациентов с урогенитальной трихомонадно-бактериальной инфекцией / Г.М. Бондаренко, И.Н. Никитенко // Дерматологія та венерологія. – 2012. – № 2 (56). – С. 99–106.
- Бондаренко Г.М. Урогенитальный микоплазмоз: акцент на эффективности антибиотикотерапии / Г.М. Бондаренко, Т.В. Федорович // Дерматологія та венерологія. – 2013. – № 3 (61). – С. 45–51.
- Боронина Л.Г. Этиологическая роль микроорганизмов в развитии негонококковых уретритов и простатитов у мужчин / Л.Г. Боронина, М.П. Кукушкина, Е.В. Саматова // Международный научно-исследовательский журнал. – 2015. – № 5–4 (36). – С. 52–54.
- Бышевский А.Ш. Связь гемостаза с перекисным окислением липидов / А.Ш. Бышевский, М.К. Умутбаева, Р.Г. Алборов. – М. : Медицинская книга, 2003. – 96 с.
- Васильев М.М. Хламидийная инфекция. Проблема антибиотикорезистентности / М.М, Васильев, Н.В. Николаева // Вестник дерматол., венерол. – 2003. – № 3. – С. 18–22.
- Вершигора А.Е. Общая иммунология / А.Е. Вершигора. – К. : Вища школа, 1990.– 736 с.
- Взаимосвязь дефицита тестостерона и эректильной дисфункции (обзор литературы) / Х.С. Ибишев, З.Р. Гусова, А.А. Черный [и др.] // Поликлиника. – 2014. – № 5 (1). – С. 81–84.
- Возрастные изменения иммунных, морфологических и биохимических показателей репродуктивной системы мужчин / О.В. Бойко, А.Х. Ахминеева, Н.И. Гудинская [и др.] // Успехи геронтологии. – 2014. – № 1. – С. 50–53.
- Володина Т.А. Урогенитальный хламидиоз: современное состояние вопроса (обзор) / Т.А. Володина, П.В. Саськова, Е.В. Иванова // Фармация и фармакология. – 2014. – № 6 (7). – С. 66–73.
- Галактионов В.Г. Иммунология / В.Г. Галактионов. – М. : РИЦ МДК, 2000. – 488 с.
- Генитальные микоплазмы (U. parvum, U. urealyticum, М. homimis, М. genitalium) в акушерской практике / А.П. Никонов, А.В. Белова, О.Р. Асцатурова [та ін.] // Фарматека. – 2015. – № 3. – С. 25–30.
- Гизингер О. Клинико-иммунологическое обоснование применения иммуномодулятора Галавит® в терапии микс-инфекций генитального тракта / О. Гизингер, Ю. Нефедьева // Врач. – 2015. – № 1. – С. 40–43.
- Гизингер О. Ультразвуковая кавитация в терапии женщин с кандидозно-микоплазменной инфекцией генитального тракта / О. Гизингер, О. Летяева // Врач. – 2014. – № 1. – С. 83–87.
- Глобальная стратегия профилактики инфекций, передаваемых половым путем, и борьбы с ними, 2006–2015. Всемирная организация здравоохранения (ВОЗ) // Вестник дерматологии и венерологии. – 2008. – № 4. – С. 17–30.
- Гомберг М.А. Инфекции, передаваемые половым путем и урогенитальные инфекции в Европе (обзор симпозиума, прошедшего в рамках XXVIII конгресса международного союза по борьбе с инфекциями, передаваемыми половым путем) / М.А. Гомберг // Дерматология. Приложение к журналу Consilium Medicum. – 2014. – № 4. – С. 4–8.
- Гомберг М.А. О терапии трихомоноза и бактериального вагиноза / М.А. Гомберг, К.И. Плахова // Вестник дерматологии и венерологии. – 2006. – № 1. – С. 60–63.
- Горпинченко И.И. Роль хронического простатита в этиологии мужского бесплодия / И.И. Горпинченко // Здоровье мужчины. – 2002. – № 3. – С. 58–60.
- Гриневич Ю.А. Определение иммунных комплексов в крови онкологических больных / Ю.А. Гриневич, А.Н. Алферов // Лабор. дело.– 1981.– № 8.– С. 493–496.
- Гусейнов В.А. Мужское бесплодие при трихомониазе / В.А. Гусейнов // Здоровье мужчины. – 2003. – № 4 (7). – С. 95–97.
- Дасюк Т.Є. Ферментативна ланка антиоксидантної системи у хворих на сечостатевий хламідіоз як показник рівня оксидативного стресу / Т.Є. Дасюк // Медична хімія. – 2006. – Т. 8, № 4. – C. 115–117.
- Дмитриев Г.А. Наиболее распространенные урогенитальные инфекции: диагностика и терапия / Г.А. Дмитриев // Consilium medicum. – 2003. – № 7 (5). – С. 3–11.
- Добровольская Л.И. Роль хламидийной инфекции в патогенезе мужского бесплодия / Л.И. Добровольская, В.А. Гусейнов // Здоровье мужчины. – 2003. – № 3. – С. 111–115.
- Дранник Г.Н. Актуальные вопросы иммунопрофилактики и иммунокоррекции / Г.Н. Дранник // Здоров’я України. – 2013. – № 9 (310). – С. 26–29.
- Дранник Г.Н. Клиническая иммунология и аллергология: пособие для студентов, врачей-интернов, иммунологов, аллергологов, врачей лечебного профиля всех специальностей / Г.Н. Дранник. – 3-е изд., доп. – К. : ООО «Полиграф плюс», 2006. – 482 с.
- Дюдюн А.Д. Комплексно-диференційована терапія хворих з рецидивами урогенітальних інфекцій / А.Д. Дюдюн // Дерматовенерология. Косметология. Сексопатология. – 2005. – Т. 8, № 1–2. – С. 38–52.
- Дюдюн А.Д. Комплексное лечение торпидных форм урогенитального трихомониаза / А.Д. Дюдюн, Н.Н. Полион, А.Т. Казачинская // Укр. журн. дерматологии, венерологии и косметологии. – 2005. – № 1. – С. 101–104.
- Дюдюн А.Д. Этиотропная терапия больных урогенитальным хламидиозом / А.Д. Дюдюн, Е.В. Кружнова, В.К. Захаров // Здоровье мужчины. – 2007. – Т. 22, № 3. – С. 160.
- Есипов А.С. Характеристика параметров спермограммы у мужчин репродуктивного возраста при латентных генитальных инфекциях / А.С. Есипов // TERRA MEDICA. – 2012. – № 2. – С. 38–43.
- Жигунова О. Урогенитальный хламидиоз: диагностика и лечение / О. Жигунова // Медицинские аспекты здоровья женщины. – 2010. – Т. 38–39, № 9–10. – С. 55–64.
- Жунько Д.В. Озонотерапия в комплексном лечении сексуальной дисфункции у больных с метаболическим синдромом / Д.В. Жунько // Медицинская реабилитация, курортология, физиотерапия. – 2013. – № 4. – С. 10–13.
- Загртдинова Р.М. Оптимизация лечения урогенитальной микоплазменной инфекции у женщин / Р.М. Загртдинова, А.Л. Боголюбская, Е.В. Димакова // Акушерство и гинекология. – 2014. – № 9. – С. 103–107.
- Зайцев А.В. Рецидивирующая инфекция мочевых путей – междисциплинарная проблема / А.В. Зайцев, Н.В. Тупикина // Медицинский совет. – 2014. – № 19. – С. 36–45.
- Запольский М.Э. Герпесвирусные заболевания (альфа-, бета-, гамма-подгруппы): Монография / М.Э. Запольский. – Одесса : Фотосинтетика, 2010. – 270 с.
- Запольский М.Э. Современные методы воздействия на герпетическую инфекцию / М.Э. Запольский // Здоровье мужчины. – 2006. – № 1 (16). – С. 132-133
- Земсков А.М. Дополнительные аспекты оценки иммунного статуса / А.М. Земсков, В.М. Земсков // Клинич. и лаб. диагностика.– 1994.– № 5.– С. 91–98.
- Иващенко Л.В. Актуальность коррекции метаболических нарушений при урогенитальном хламидиозе / Л.В. Иващенко // Дерматологія та венерологія. – 2012. – № 2 (56). – С. 91–98.
- Иващенко Л.В. Этиопатогенетическая терапия хламидийной инфекции с учетом смешанного инфицирования / Л.В. Иващенко // Дерматологія та венерологія. – 2011. – № 3 (52). – С. 61–68.
- Иммунометаболические нарушения при хроническом простатите / А.Т. Терешин, Г.Д. Дмитренко, И.Е. Журавлев, С.М. Есенеев // Курский научно-практический вестник «Человек и его здоровье». – 2013. – № 3. – С. 57–63.
- Калинина С.Н. Клинико-иммунологические нарушения у больных хроническим простатитом, обусловленным урогенитальной инфекцией / С.Н. Калинина, О.Л. Тиктинский, В.П. Александров // Урология. – 2006. – № 3. – С. 74–79.
- Керимов С.Г. Генитальные микоплазмы как фактор заболеваний урогенитального тракта у лиц разных возрастно-половых групп / С.Г. Керимов, В.Э. Эйвазов, Л.Ф. Рзаева // Клиническая дерматология и венерология. – 2013. – № 5. – С. 100–105.
- Кириченко И.М. Комплексная терапия хронических и вялотекущих форм урогенитальных инфекций с использованием мирамистина / И.М. Кириченко // Лечащий врач. – 2013. – № 8. – С. 22–25.
- Клинико-иммунологические аспекты урогенитальной хламидийной и герпесвирусной инфекций: Монография / Г.Н. Дранник, С.А. Возианов, Ю.Б. Борис [и др.]. – К. : ООО «Полиграф плюс», 2011. – 380 с.
- Клинико-эпидемиологические особенности урогенитального хламидиоза на современном этапе / Г.И. Мавров, Л.В. Иващенко, Ю.В. Щербакова, К.С. Орлова // Дерматологія та венерологія. – 2014. – № 1 (63). – С. 58–67.
- Клинические проявления и терапия трихомонадной инвазии у больных с распространенными формами хламидийной инфекции / Е.А. Базолина, Р.В. Гудков, Ю.Ф. Захаркив [и др.] // АГ-инфо. – 2008. – № 1. – С. 13–18.
- Клинические рекомендации по кожным и венерическим болезням / Под ред. А.А. Кубановой. – М. : ГЭОТАР, 2008. – 297 с.
- Козин Ю.И. Лечение озонотерапией заболеваний, передаваемых половым путем // Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я. Зб. наук.праць. – Вип. 3. – Харків : Фоліо, 2004. – С. 195–197.
- Козин Ю.И. Озонотерапия в лечении урогенитальных инфекций и их осложнений / Ю.И. Козин // Андрология и сексуальная медицина. – 2008. – № 1. – С. 98–102.
- Козлюк В.А. Роль умовно-патогенних мікроорганізмів та їх асоціацій в ґенезі безсимптомних уретритів із в’ялим перебігом у чоловіків / В.А. Козлюк, А.С. Козлюк, К.В. Прощаков // Урологія. – 2003. – № 3. – С. 54–60.
- Комплексне лікування генітального герпесу / Г.М. Бондаренко, Ю.В. Щербакова, І.М. Нікітенко, Т.В. Губенко // Дерматологія та венерологія. – 2011. – № 1 (51). – С. 69–75.
- Кондратьева Ю.С. Смешанные урогенитальные инфекции: клинико-терапевтические подходы / Ю.С. Кондратьева, А.И. Неймарк // Вестн. дерматологии и венерологии. – 2011. – № 4. – С. 112–116.
- Коробов А.М. Фототерапевтические аппараты Коробова серии «Барва» / А.М. Коробов, В.А. Коробов, Т.А. Лесная. – Харьков : Контраст, 2010. – 176 с.
- Кочетова Т.В. Вплив комплексної терапії хламідійних ендоцервіцитів на стан перекисного окислення ліпідів / Т.В. Кочетова // Одеський медичний журнал. – 2003. – Т. 77, № 3. – С. 87–89.
- Кузнецова Ю.Н. Инфекционные заболевания урогенитального тракта у подростков и молодежи как фактор риска формирования нарушений репродуктивного здоровья / Ю.Н. Кузнецова, Н.В. Зильберберг, Н.П. Евстигнеева // Лечащий врач. – 2014. – № 12. – С. 61–63.
- Кузьмин В.Н. Основные принципы современной антибиотикотерапии микоплазменной инфекции у женщин / В.Н. Кузьмин, М.И. Гусейнзаде // Фарматека. – 2013. – № 12. – С. 54–59.
- Кузьмин В.Н. Эффективная антибактериальная терапия микоплазменной инфекции у женщин репродуктивного возраста / В.Н. Кузьмин, М.И. Гусейнзаде // Лечащий врач. – 2014. – № 3. – С. 37.
- Куликов А.Г. Эффективность озонотерапии в комплексном лечении бактериального вагиноза / А.Г. Куликов, О.В. Ярустовская, Л.П. Штро // Физиотерапия, бальнеология и реабилитация. – 2009. – № 4. – С. 43–46.
- Лабораторные методы исследования в клинике : Справочник / Под ред. В.В. Меньшикова. – М. : Медицина, 1987. – 368 с.
- Лебедюк М.М. Хламідійна урогенітальна інфекція у жінок: епідеміологія і особливості клінічного перебігу на сучасному етапі обгрунтування необхідності комплексних підходів до діагностики та лікування / М.М. Лебедюк // Український журнал дерматології, венерології, косметології – 2002. – № 3 (6). – С. 77–82.
- Лебедюк М.Н. Клиническая характеристика урогенитального хламидиоза и его ассоциаций у мужчин / М.Н. Лебедюк // Актуальные проблемы медицины и биологии. – 2000. – №1. – С. 301–305.
- Леонтьев И.Г. Современные комбинированные препараты при лечении урогенитального трихомониаза и ассоциированных уретрогенных инфекций у мужчин / И.Г. Леонтьев, Д.И. Леонтьев // Клиническая дерматология и венерология. – 2013. – Т. 11, № 3. – С. 63–68.
- Летяева О.И. Терапия урогенитальных микстинфекций у женщин репродуктивного возраста: современное состояние проблемы / О.И. Летяева, О.А. Гизингер // Гинекология. – 2014. – № 6. – С. 16–20.
- Лечение вибромагнитолазером эректильной дисфункции у больных хроническим простатитом / А.Т. Терешин, И.Б. Сосновский, Г.Д. Дмитренко, А.А. Третьяков // Урология. – 2012. – № 5. – С. 57–63.
- Лечение уретрального синдрома у пациентов с инфекциями, передающимися половым путем / Г.М. Бондаренко, И.Н. Никитенко, Н.В. Кочетова, С.В. Тесленко // Дерматологія та венерологія. – 2010. – № 2 (48). – С. 84–88.
- Лечение хронической урогенитальной инфекции у женщин с использованием методов экстракорпоральной гемокоррекции / Л.С. Геворкян, В.С. Горин, О.Г. Богун, Е.С. Дзюбинская // Казанский медицинский журнал. – 2014. – № 6. – С. 841–848.
- Литвинець Є.А. Лікування чоловіків із безпліддям, зумовленим хламідійною інфекцією / Є. А. Литвинець // Мистецтво лікування. – 2007. – № 5. – С. 24–26.
- Літус О.І. Характеристика імунопатологічних синдромів при хронічному простатиті та їх діагностично-прогностичне значення / О.І. Літус, В.І. Степаненко // Український журн. дерматології, венерології, косметології. – 2002. – № 3 (6). – С. 71–76.
- Лоран О.Б. Система суммарной оценки симптомов при хроническом простатите (СОС-ХП) / О.Б. Лоран, А.С. Сегал // Урология. – 2001. – № 5. – С. 16–19.
- Луценко Н.Н. Кларитромицин в лечении больных с урогенитальными микст-инфекциями / Н.Н. Луценко, П.В. Козлов // Український журнал дерматології, венерології, косметології. – 2009. – № 2 (33). – С. 110–113.
- Мавров Г.И. Иммунные нарушения при половых инфекциях множественной этиологии (Herpes sіmplex, Chlamydіa trachomatіs, Trіchomonas vagіnalіs) / Г.И. Мавров, А.Е. Нагорный // Український журнал дерматології, венерології, косметології. – 2010. – № 3 (38). – С. 117–122.
- Мавров Г.И. Лечение больных с осложненными формами хламидийной инфекции азитромицином / Г.И. Мавров, Г.М. Бондаренко, И.Н. Никитенко // Український журнал дерматології, венерології, косметології. – 2012. – № 3 (46). – С. 148–151.
- Мавров Г.И. Математическое моделирование и прогноз распространения венерических болезней / Г.И. Мавров, Г.П. Чинов // Український журнал дерматології, венерології, косметології. – 2006. – № 2. – С. 102–105.
- Мавров Г.И. Оптимизация лечения больных хроническим урогенитальным хламидиозом / Г.И. Мавров, Л.В. Иващенко // Дерматологія та венерологія. – 2012. – № 4 (58). – С. 81–89.
- Мавров Г.И. Репродуктивная функция мужчин и инфекции, передающиеся половым путем / Г.И. Мавров, А.Е. Нагорный, Г.П. Чинов // Здоровье мужчины. – 2009. – № 2. – С. 142–145.
- Мавров Г.И. Ультраструктурные изменения сперматозоонов при инфекции, вызванной Herpes sіmplex, Chlamydіa trachomatіs, Trіchomonas vagіnalіs / Г.И. Мавров, А.Е. Нагорный // Дерматологія та венерологія. – 2012. – № 4 (58). – С. 45–57.
- Мавров Г.И. Хламидийные инфекции: биология возбудителей, патогенез, клиника, диагностика, лечение, профилактика: Монография / Г.И. Мавров. – К. : Геркон, 2006. – 524 с.
- Мавров Г.І. Сексуальність та інфекції, що передаються статевим шляхом в осіб старше 60 років / Г.І. Мавров, О.Є. Нагорний // Дерматологія та венерологія. – 2011. – № 1 (51). – С. 23–30.
- Мавров И.И. Основы диагностики и лечения в дерматологии и венерологии: Рук-во для врачей, интернов и студентов / И.И. Мавров, Л.А. Болотная, И.М. Сербина. – Харьков : Факт, 2007. – 792 с.
- Мавров И.И. Половые болезни. Рук-во для врачей, интернов и студентов / И.И. Мавров. – Харьков : Факт, 2002. – 789 с.
- Мазо Е.Б. Хронический бактериальный простатит / Е.Б. Мазо, С.В. Попов // Врачебное сословие. – 2004. – № 1–2. – С. 18–28.
- Маланчук В.А. Озоно-кислородная терапия в стоматологии и челюстно-лицевой хирургии / В.А. Маланчук, А.В. Копчак. – К. : [Б. и.], 2004.– 177 с.
- Маркелова Е.В. Характеристика иммунного статуса у мужчин с генитальным герпесом и хламидиозом / Е.В. Маркелова, Н.С. Чепурнова, М.С. Тулупова // Теоретические и прикладные аспекты современной науки. – 2014. – № 6 (2). – С. 100–104.
- Мартазинова С.К. Этиологические аспекты и клиническое течение негонококкового уретрита у мужчин / С.К. Мартазинова // Дерматология. Приложение к журналу Consilium Medicum. – 2014. – № 3. – С. 18–20.
- Медична мікробіологія, вірусологія та імунологія: підручник для студ. вищ. мед. навч. заклад. / За ред. В.П. Широбокова. – Вінниця : Нова книга, 2011. – С.132-138.
- Микробиологический мониторинг состава и антибиотикорезистентности возбудителей оппортунистических инфекций урогенитального тракта / С.К. Джораева, Е.К. Иванцова, Н.В. Кочетова [и др.] // Дерматологія та венерологія. – 2012. – № 4 (58). – С. 34–39.
- Миронов С.А. Эректильная дисфункция. Патофизиологическая связь с расстройствами адаптации (обзор литературы, краткий) / С.А. Миронов, С.Б. Артифексов // Вестник новых медицинских технологий. – 2013. – № 1. – С. 171.
- Мікробіологічний моніторинг інфекцій урогенітального тракту в умовах венерологічної клініки / В.В. Гончаренко, С.К. Джораєва, О.В. Щоголєва [та ін.] // Дерматологія та венерологія. – 2014. – № 4 (66). – С. 44–53.
- Нагорний О.Є. Обґрунтування включення препарату кагоцел в комплексне лікування статевих інфекцій, спричинених Herpes sіmplex, Chlamydіa trachomatіs, Trіchomonas vagіnalіs / О.Є. Нагорний // Дерматологія та венерологія. – 2010. – № 4 (50). – С. 11–17.
- Нагорный А.Е. Нарушения репродуктивной и половой функции у больных с инфекциями, вызванными Herpes sіmplex, Chlamydіa trachomatіs, Trіchomonas vagіnalіs / А.Е. Нагорный // Дерматологія та венерологія. – 2011. – № 4 (54). – С. 37–42.
- Нагорный А.Е. Эпидемиология генитального герпеса, хламидиоза и трихомоноза в Украине и регионах в период 2005–2010 годы / А.Е. Нагорный // Дерматологія та венерологія. – 2011. – № 2 (52). – С. 5–13.
- Озонотерапия в гинекологической практике / Ю.И. Козин, И.Н. Федорова, В.Н. Полупан, В.В. Ганичев // Вестник физиотерапии и курортологии. Спец. выпуск «Озонотерапия». – 2005. – Т. 11, № 5. – С. 101–103.
- Озонотерапия в комплексном лечении инфекционно-воспалительных заболеваний и их осложнений / Ю.И. Козин, В.В. Бойко, В.В. Леонов, В.В. Ганичев // Експериментальна і клінічна медицина. – 2004. – № 2. – С. 164–168.
- Озонотерапия в неврологии / А.В. Густов, С.А. Котов, К.Н. Конторщикова, Ю.П. Потехина. – Н. Новгород : «Литера», 2001. – С. 11–27.
- Особенности диагностики и лечения урогенитального трихомониаза / Е.И. Юнусова, Л.А. Юсупова, З.Ш. Гараева, Г.И. Мавлютова // Лечащий врач. – 2014. – № 5. – С. 47–50.
- Особенности состава микрофлоры урогенитального тракта у пациентов с воспалительными заболеваниями мочеполовых органов / В.В. Соколов, С.К. Джораева, Н.В. Кочетова [и др.] // Дерматологія та венерологія. – 2011. – № 1 (51). – С. 37–41.
- Палагин И.С. Хламидийная инфекция у мужчин – недооцененная угроза / И.С. Палагин, И.А. Эйдельштейн, А.В. Голуб // Эффективная фармакотерапия. Урология и Нефрология. – 2015. – № 1 (4). – С. 34–38.
- Пат. 2008036 RU, МПК A61N1/05. Электрод-катетер / А.Р. Гуськов, А.И. Васильев; заявитель и патентообладатель: А.Р. Гуськов, А.И. Васильев. – № 4911284/14; заявл. 13.02.91; опубл. 28.02.94.
- Перламутров Ю.Н. Пути повышения эффективности терапии микст-инфекций гениталий у женщин репродуктивного возраста / Ю.Н. Перламутров, Н.И. Чернова // Клиническая дерматология и венерология. – 2009. – № 6. – С. 77–80.
- Платонов А.Е. Статистический анализ в медицине и биологии: задачи, терминологія, логика, компьютерный метод / А.Е. Платонов. – М. : РАМН, 2000. – 52 с.
- Показники лікувально-профілактичної допомоги хворим шкірними і венеричними захворюваннями в Україні / Відп. за вип. М.В. Голубчиков. – К. : Центр медичної статистики МОЗ України, 2013. – 111 с.
- Попов С.В. Комбинированная антимикробная терапия урогенитальных инфекций у мужчин / С.В. Попов // Экспериментальная и клиническая урология. – 2013. – № 2. – С. 116–121.
- Прилепская В.Н. Хламидийная инфекция в акушерстве и гинекологии / В.Н. Прилепская, Э.Р. Довлетханова // Эффективная фармакотерапия. Акушерство и гинекология. – 2014. – № 3 (35). – С. 28–33.
- Рахматулина М.Р. Сексуальные дисфункции у мужчин, больных инфекциями, передаваемыми половым путем / М.Р. Рахматулина, О.Ф. Филон // Вестник дерматологии и венерологии. – 2013. – № 2. – С. 33–41.
- Рахматулина М.Р. Терапия ассоциированных урогенитальных инфекций с учетом современных показателей антибиотикорезистентности инфекционных агентов / М.Р. Рахматулина // Акушерство и гинекология. – 2014. – № 6. – С. 96–100.
- Романова Л.A. Методы определения диеновых конъюгатов ненасыщенных высших жирных кислот / Л.А. Романова, И.Д. Стальная // Современные методы в биохимии / Под ред.. В.Н. Ореховича. – М. : Медицина, 1977. – С. 63–64.
- Сенчук Л.О. Стан пероксидного окиснення ліпідів та антиоксидантної системи захисту при урогенітальному хламідіозі в процесі лікування / Л.О. Сенчук, А.О. Клименко // Буковинський медичний вісник. – 2005. – Т. 9, № 2. – С. 219–221.
- Сергиенко В.И. Математическая статистика в клинических исследованиях / В.И. Сергиенко, И.Б. Бондарева. – М. : ГЭОТАР: Медицина, 2000. – 256 с.
- Современные взгляды на проблему негонококкового нехламидийного уретрита у мужчин / А.А. Хрянин, И.В. Андреева, О.У. Стецюк, С.Н. Козлов // TERRA MEDICA. – 2013. – № 2. – С. 22–33.
- Соловьев Л.М. Принципы фармакотерапии рецидивирующих инфекций урогенитального тракта / Л.М. Соловьев, Ю.Н. Перламутров, И.М. Корсунская // Вестник последипломного медицинского образования. – 2013. – № 4. – С. 17–21.
- Состояние микробиоценоза влагалища при урогенитальных заболеваниях, ассоциированных с Ureaplasma spp. / Э.Л. Баркалова, И. Хамуди, С.В. Зяблицев, С.В. Центило // Дерматологія та венерологія. – 2014. – № 2 (64). – С. 17–25.
- Состояние процессов липопероксидации у мужчин с хронической монотрихомонадной инфекцией на фоне приема триэтаноламмониевой соли 2-метилфеноксиуксусной кислоты / Л.И. Колесникова, Н.А. Курашова, М.И. Долгих [и др.] // Клиническая лабораторная диагностика. – 2015. – № 1. – С. 16–19.
- Стоянов В.Б. Урогенитальный хламидиоз как фактор инфертильности у мужчин. Лечение хронического бактериального и хронического простатита, ассоциированного с хламидиями / В.Б. Стоянов, С.Ю. Фоминых, Т.Б. Семёнова // Лечащий врач. – 2013. – № 9. – С. 74.
- Тактика ведения больных с урогенитальными ИППП в Московском регионе: необходимы изменения / В. Кисина, А. Гущин, Г. Колиева, М. Нерсесян // Врач. – 2014. – № 10. – С. 2–6.
- Терешин А.Т. Негонококковые уретриты в клинической андрологии / А.Т. Терешин, Г.Д. Дмитренко, В.А. Молочков. – Краснодар : ООО «ИД – Юг», 2014. – 392 с.
- Терешин А.Т. Хронический простатит / А.Т. Терешин, Г.Д. Дмитренко, В.А. Молочков. – Краснодар : ООО «ИД – Юг», 2014. – 440 с.
- Тихомиров А.Л. Вариант лечения урогенитального микоплазмоза и его ассоциаций / А.Л. Тихомиров // Гинекология. – 2013. – № 3. – С. 52–57.
- Тондий Л.Д. Колортерапия / Л.Д. Тондий, В.А. Журавлев. – Харьков : Слово, 2013. – 141 с.
- Туркевич О.Ю. Комплексно-диференційний підхід до діагностики ЗПСШ у хворих з деякими рецидивуючими урогенітальними інфекціями (трихомоніаз, хламідіоз, бактеріальний вагіноз) / О.Ю. Туркевич, О.О. Сизон // Український журнал дерматології, венерології, косметології. – 2009. – № 1. – С. 90–93.
- Уніфікація лабораторних методів дослідження в діагностиці захворювань, що передаються статевим шляхом / І.І. Мавров, О.П. Білозоров, Л.С. Тацька [та ін.]. – Харків : Факт, 2001. – 120 c.
- Урогенитальный трихомоноз: новые возможности топической иммуномодулирующей терапии / Г.И. Мавров, Г.М. Бондаренко, Л.В. Иващенко [и др.] // Дерматологія та венерологія. – 2011. – № 3 (53). – С. 69–77.
- Хемолюминесцентный мониторинг антиоксидантной активности плазмы крови больных с атипической урогенитальной инфекцией / Ю.И. Козин, Т.С. Дюбко, О.А. Соколик, К. Кшимински // Харківська хірургічна школа. – 2007. – № 3. – С. 41–47.
- Хромова С.С. Влияние терапии на состав микробиоты при смешанной урогенитальной инфекции у женщин / С.С. Хромова, Х.Б. Ахмедов // Вестник последипломного медицинского образования. – 2014. – № 4. – С. 22–23.
- Хронический инфекционный простатит : Уч.-метод. пос. / П.В. Глыбочко, А.А. Чураков, В.М. Попков [и др.]. – Саратов : Изд-во Саратовского мед. ун-та, 2008. – 56 с.
- Цитокиновая система при урогенитальных инфекциях: влияние терапии азитромицином / А.А. Хрянин, О.В. Решетников, И.Д. Сафронов, Н.Б. Куликова // TERRA MEDICA. – 2013. – № 3. – С. 19–22.
- Чеканов С.Л. Роль метода полимеразной цепной реакции (ПЦР) в диагностике бессимптомных форм хронического абактериального простатита / С.Л. Чеканов, А.Л. Чеканов, А.А. Томсинский // Андрология и сексуальная медицина. – 2007. – № 1 (2). – С. 97–101.
- Чернушенко Е.Ф. Иммунологические исследования в клинике / Е.Ф. Чернушенко, Л.С. Когосова.– К. : Здоровье, 1998.– 159 С.
- Чинов Г.П. Гормональные нарушения у женщин со смешанной хламидийно-трихомонадно-бактериальной инфекцией и их коррекция / Г.П. Чинов // Український журнал дерматології, венерології, косметології. – 2007. – № 1 (24). – C. 71–76.
- Юнда И.Ф. Воспалительные заболевания мужских половых органов / И.Ф. Юнда, Л.И. Добровольская // Бесплодие в супружестве / Под ред. И.Ф. Юнды. – К. : Здоров`я, 1990. – 463 с.
- A pseudoepidemic of Trichomonas vaginalis / A. Smith, S. Portsmouth, J. Browne [et al.] // Int. J. STD & AIDS. – 2001. – Vol.12, suppl. 2. – P. 75.
- Adler M.W. Sexual health – health of the nation / M.W. Adler // Sex. Transm. Inf. – 2003. – Vol. 79. – P. 85–87.
- Ashley R. Performance and Use of HSV Type-specific Serology Test Kits / R. Ashley // Herpes Journal. – 2002. – Vol. 9, No. 2. – P. 38–45.
- Asymptomatic urethritis is common and is associated with characteristics that suggest sexually transmitted etiology / C.W. Adler, L.E. Manhart, M.S. Lowens, M.R. Golden // Sex Transm Dis. – 2013. – Vol. 40, No. 3. – Р. 271–274.
- Bacterial loads of Ureaplasma urealyticum contribute to development of urethritis in men / Y. Shimada, S. Ito, K. Mizutani [et al.] // Int. J. STD AIDS. – 2014. – Vol. 25, No. 4. – P. 294–298.
- Bactericidal activity of first-choice antibiotics against gamma interferon-induced persistent infection of human epithelial cells by Chlamydia trachomatis / N. Reveneau, D.D. Crane, E. Fischer, H.D. Caldwell // Antimicrobial Agents and Chemotherapy. – 2005. – Vol. 49, No. 5. – P. 1787–1793.
- Bakken I.J. Chlamydia trachomatis testing patterns and prevalence of genital chlamydial infection among young men and women in Central Norway 1990–2003: A population-based registry stady / I.J. Bakken, S.A. Nordbo, F.E. Skjeldestad // Sexually Transmitted Diseases. – 2006. – Vol. 33, No. 1. – P. 26–30.
- Berntsson M. Clinical and microscopic signs of cervicitis and urethritis: correlation with Chlamydia trachomatis infection in female STI patients / M. Berntsson, P. Tunbäck //Acta Derm Venereol. – 2013. – Vol. 93, No. 2. – Р. 230–233.
- Bjartling C. The frequency of salpingitis and ectopic pregnancy as epidemiologic markers of Chlamydia trachomatis / C. Bjartling, S. Osser, K. Persson // Acta Obstet. Gynecol. Scand. – 2000. – Vol. 79, No 2. – P. 123–128.
- Bowden F.J. Trichomonas vaginalis epidemiology: parameterising and analyzing a model of treatment inventions / F.J. Bowden, G.P. Gamett // Sex. Transm. Infect. – 2000. – Vol. 76. – P. 248–256.
- Butler C. Are all genital Chlamydia trachomatis infections pathogenic? A study in men / C. Butler, C. Dewsnap, G. Evangelou // Sex. Transm. Inf. – 2003. – Vol. 79. – P. 349.
- Calleri K.F. Ureaplasma urealyticum vaginosis and premature rupture of membranes. What is its tole? / K.F. Calleri, C. Taccani, A. Porcelli // Minevra Ginecol. – 2000. – Vol. 52. – P. 49–58.
- Catchpole M. Chlamydia screening in the United Kingdom / M. Catchpole, A. Robinson, A. Temple // Sex. Transm. Inf. – 2003. – Vol. 79. – P. 3–4.
- CDC. Sexually Transmitted Diseases Treatment Guidelines / CDC // Morbidity and Mortality Weekly Report. – 2010. – Vol. 59, No. RR-12. – 116 p.
- Chlamydial genitourinary infections [Electronic resource] / K. Struble, L.L. Lutwick, R.L. Jackson [et al.]. – E-medicine. – 2010. – March. – Mode of access: http://emedicine.medscape.com/article/214823-overview. – Title from the screen.
- Chlamydial infection of immune cells: altered function and implications for disease / K.W. Beagley, W.M. Huston, P.M. Hansbro, P. Timms // Critical Reviews in Immunology. – 2009. – Vol. 29, No. 4. – P. 275–305.
- Comparison of gamma interferon-mediated antichlamydial defense mechanisms in human and mouse cell / C. Roshick, H. Wood, H.D. Caldwell, G. McClarty // Infection and Immunity. – 2006. – Vol. 74, No 1. – P. 225–238.
- Crowell A.L. In vitro metronidazole and tinidazole activities against metronidazole-resistant strains of Trichomonas vaginalis / A.L. Crowell, K.A. Sanders-Lewis, W.E. Secor // Antimicrob. Agents Chemother. – 2003. – Vol. 47. – P. 1407–1409.
- Cudmore S.L. Treatment of infections caused by metronidazole-resistant Trichomonas vaginalis / S.L. Cudmore, K.L. Delgaty, S.F. Hayward-McClelland [et al.] // Clin. Microb. Rev. – 2004. – Vol. 17, No. 4. – P. 783–793.
- Developivg a realistic sexual network model of chlamydia transmission in Britain [Електронний ресурс] / K.M.E. Turner, E.J. Adams, N. Gay [et al.] // Theoretical Biology and Medical Modelling. – 2006. – No. 3. – Режим доступу до електрон. ресурсу: http://www.tbiomed.com/content/3/1/3.
- Evaluation of IgA, IgG EIA in women with chlamydial infection and as part of routine infertility investigation / I. Martinez, L. Molina, F. Sanz [et al.] // Int. J. STD & AIDS. – 2001. – Vol. 12, Suppl. 2. – P. 113.
- Evaluation of laboratory testing methods for Chlamydia trachomatis infection in the era of nucleic acid amplification / T.J. Battle, M.R. Golden, K.L. Suchland [et al.] // J. Clin. Microbiol. – 2003. – Vol. 39. – P. 2924–2927.
- Failure of metronidazole to prevent preterm delivery among pregnant women whith asymptomatic Trichomonas vaginalis infection / M.A. Klebanoff, J.C. Carey, J.C. Hauth [et al.] // N. Engl. J. Med. – 2001. – Vol. 345. – P. 487–493.
- Failure of moxifloxacin treatment in Mycoplasma genitalium infections due to macrolide and fluoroquinolone resistance / D.L. Couldwell, K.A. Tagg, N.J. Jeoffreys, G.L. Gilbert // Int. J. STD AIDS. – 2013. – Vol. 24, No. 10. – Р. 822–828.
- Falk L. Symptomatic urethritis is more prevalent in men infected with Mycoplasma genitalium than with Chlamydia trachomatis / L. Falk, H. Fredlund, J.S. Jensen // Sex. Transm. Infect. – 2004. – Vol. 80. – P. 289–293.
- Genital infection and infertility / R. Rodriguer, R. Hernandez, F. Fuster [et al.] // Enferm. Infec. Microbiol. Clin. – 2001. – Vol. 19. – P. 261–266.
- Hafner L. Chlamydia trachomatis infection: host immune responses and potential vaccines / L. Hafner, K. Beagley, P. Timms // Mucosal Immunology. – 2008. – Vol. 1, No. 2. – P. 116–130.
- Hamasuna R. Mycoplasma genitalium in male urethritis: diagnosis and treatment in Japan / R. Hamasuna // Int. J. Urol. – 2013. – Vol. 20, No. 7. – Р. 676–684.
- Impact of patient characteristics on performance of nucleic acid amplification tests and NDA probe for detection of Chlamydia trachomatis in women with genital infections / J.M. Marrazzo, R.E. Johnson, T.A. Green [et al.] // J. Clin. Microbiol. – 2005. – Vol. 43. – P. 577–582.
- Jalan H. Development and validation of a Rotor-Gene Real-Time PCR assay for detection, identification, and quantification of Chlamydia trachomatis in a single reaction / H. Jalan, H. Stephen, M.D. Curran // J. Clin. Microbiol. – 2006. – Vol. 44. – P. 206–213.
- Joyee A.C. Role of toll-like receptors in immune responses to chlamydial infections / A.C. Joyee, X. Yang // Current Pharmaceutical Design. – 2008. – Vol. 14, No 6. – P. 593–600.
- Julie K. Andersen Oxdative stress in neurodegeneration: cause or consequence? / K. Julie // Nature Reviews Neuroscience. – 2004. – No. 5. – P. 18–25.
- Kreiger J.N. Prostatitis: what is the role of infection / J.N. Kreiger, D.E. Riley // Int. J. Antimicrob. Agents. – 2002. – Vol. 19. – P. 475–479.
- Lee Y.S. Chlamydia and male lower urinary tract diseases / Y.S. Lee, K.S. Lee // Korean J. Urol. – 2013. – Vol. 54, No. 2. – Р. 73–77.
- Marks L. Strengthening Public Health Capacities and Services in Europe: a Framework for Action. WHO Regional Office for Europe / L. Marks, D.J. Hunter, R. Alderslade. – World Health Organization, 2011. – 60 p.
- McClarty G. Chlamydial infection gamma immune evasion influences infection tropism / G. McClarty, H.D. Caldwell, D.E. Nelson // Current Opinion in Microbiology. – 2007. – Vol. 10, No. 1. – P. 47–51.
- Meri T. Resistance of Trichomonas vaginalis to metronidazole: report of first three cases from Finland and optimization of in vitro susceptibility testing under various oxygen concentrations / T. Meri, S. Jokiranta, L. Suhonen // J. Clin. Microbiol. – 2000. – Vol. 38, No. 2. – P. 763–767.
- Mycoplasma genitalium is associated with mucopurulent cervicitis / L.E. Manhart, S.M. Dutro, K.K. Holmes [et al.] // J. STD & AIDS. – 2001. – Vol. 12, Suppl. 2. – P. 69.
- Mycoplasma genitalium: prevalence in men presenting with urethritis to a South Australian public sexual health clinic / T.M. Mezzini, R.G. Waddell, R.J. Douglas, T.A. Sadlon // Intern. Med. J. – 2013. – Vol. 43, No. 5. – Р. 494–500.
- Nikkels A.F. Factual approach to the treatment of genital herpes / A.F. Nikkels, G.E. Pierard // Rev. Med. Liege. – 2000. – Vol. 55, No. 5. – P. 470–477.
- Paavonen J. Chlamydia trachomatis: влияние на репродуктивную функцию человека / J. Paavonen, W. Eggert-Kruse // Репродуктивное здоровье женщины. – 2005. – Т. 22, № 2. – С. 157–160.
- Prevalence and risk factors for Chlamydia trachomatis, Neisseria gonorrhoeae and Trichomonas vaginalis infection in pregnant women in Papua New Guinea / R.A. Wangnapi, S. Soso, H.W. Unger // Sex. Transm. Infect. – 2015. – Vol. 91, No. 3. – P. 194–200.
- Prevalence and risk factors of Chlamydia trachomatis cervicitis in pregnant women at the genital tract infection in obstetrics unit care at Botucatu Medical School, Sao Paulo State University-UUNESP, Brazil / B.R. Ramos, L.D. Marcolino, E.P. Vieira [et al.] // Journal of Lower Genital Tract Disease. – 2011. – Vol. 15, No. 1. – P. 20–24.
- Richard G. Chronic prostatitis / G. Richard, D. Batstone, A. Doble // Curr. Opin. Urol. – 2003. – Vol. 13. – P. 23–29.
- Ros C.T.D. Global epidemiology of sexually transmitted diseases [Електронний ресурс] / C.T.D.Ros, C.S. Schmitt // Asian Journal of Andrology. –2008. – Vol. 10, No. 1. – P. 110–114.
- Skerk V. Chronic prostatitis caused by trichomonas vaginalis – diagnosis and treatment / V.J. Skerk, S. Schönwald, J. Granić [et al.] // Chemotherapy. – 2002. – Vol. 14, No. 5. – P. 537–538.
- Standard treatment regimens for nongonococcal urethritis have similar but declining cure rates: a randomized controlled trial / L.E. Manhart, C.W. Gillespie, M.S. Lowens [et al.] // Clin. Infect. Dis. – 2013. – Vol. 56, No. 7. – Р. 934–942.
- Summary of the recommendations on sexual dysfunctions in men / T.F. Lue, F. Guiliano, F. Montorsi [et al.] // J. Sex. Med. – 2004. – Vol. 1. – P. 6–23.
- Summary of the recommendations on sexual dysfunctions in women / R. Basson, S. Althof, S. Davis [et al.] // J. Sex. Med. – 2004. – Vol. 1. – P. 24–34.
- The association of Mycoplasma hominis, Ureaplasma urealyticum and Mycoplasma genitalium with bacterial vaginosis: observations on heterosexual women and their male partners / F.E. Keane, B.J. Thomas, C.B. Gilroy [et al.] // J. STD & AIDS. – 2000. – No. 11. – P. 356–360.
- The prevalence of urethral and rectal Mycoplasma genitalium among men who have sex with men in China, a cross-sectional study / B. Zheng, Y. Yin, Y. Han [et al.] // BMC Public Health. – 2014. – Vol. 14. – P. 195.
- Trends and associations of Trichomonas vaginalis infection in men and women with genital discharge syndromes in Johannesburg, South Africa / D.A. Lewis, K. Marsh, F. Radebe [et al.] // Sex Transm. Infect. – 2013. – Vol. 89, No. 6. – Р. 523–527.
- Trichomonas vaginalis orchitis with associated severe oligoasthenoteratospermia and hypogonadism / G.L. Lloyd, J.R. Case, D. De Frias, R.E. Brannigan // J. Urol. – 2003. – Vol. 170, No. 3. – P. 924.
- Trichomonas vaginalis polymerase chain reaction compared with standard diagnostic and therapeutic protocols for detection and treatment of vaginal trichomoniasis / K.A. Wendel, E.J. Erbelding, C.A. Gaydos [et al.] // Clin. Infect. Dis. – 2002. – Vol. 35. – P. 576–580.
- Trichomoniasis: clinical manifestation, diagnosis and management / H. Swygard, A.C. Sena, M.M. Hobbs [et al.] // Sex. Transm. Infect. – 2004. – Vol. 80. – P. 91–95.
- Upcroft P. Targets and mechanisms of resistance in the anaerobic protozoa / P. Upcroft, J.A. Upcroft // Clin. Microb. Rev. – 2001. – Vol. 14, No. 1. – P. 150–164.
- Wagenlehner F.M. Chlamydial infections in urology / F.M. Wagenlehner, W. Weidner, K.G. Naber // World Journal of Urology. – 2006. – Vol. 24, No 1. – P. 4–12.
- What happens to patients during the year following treatment for sexually transmitted infections? How well does antibiotic treatment work? / T.A. Peterman, L.H. Tian, C.A. Metcalf [et al.] // Annals of Internal Medicine. – 2006. – Vol. 145. – P. 564.
- World Health Organization. A strategic approach to strengthening control of reproductive tract and sexually transmitted infections: use of the programme guidance tool. WHO Department of Reproductive Health and Research. – World Health Organization, 2009. – 44 p.
- World Health Organization. WHO laboratory manual for the examination and processing of human semen. – 5th ed. – 2010. – 286 p.
Приложение А
Акты внедрения




