Державна установа
«Інститут дерматології та венерології НАМН України»
На правах рукопису
Левченко Ольга Олександрівна
УДК 616.5-001/-002-085.357-06-07-08-084(043.3)
ОПТИМІЗАЦІЯ МЕТОДІВ РАННЬОЇ ДІАГНОСТИКИ, ЛІКУВАННЯ
ТА ПРОФІЛАКТИКИ УСКЛАДНЕНЬ ТРИВАЛОЇ ГЛЮКОКОРТИКОСТЕРОЇДНОЇ ТЕРАПІЇ (ПОРУШЕНЬ ВУГЛЕВОДНОГО ОБМІНУ ТА РЕМОДЕЛЮВАННЯ КІСТКОВОЇ ТКАНИНИ) У ХВОРИХ НА ТЯЖКІ ДЕРМАТОЗИ
14.01.20 – шкірні та венеричні хвороби
Дисертація на здобуття наукового ступеня
кандидата медичних наук
Науковий керівник:
Кутасевич Яніна Францівна,
доктор медичних наук, професор
Харків – 2016
ЗМІСТ
| Перелік умовних позначень | 4 |
| Вступ | 5 |
| Розділ 1 Аналітичний огляд | 11 |
| 1.1 Системна терапія глюкокортикостероїдними гормонами | 11 |
| 1.2 Порушення ремоделювання кісткової тканини: епідеміологія, патогенез, діагностика | 21 |
| 1.3 Порушення вуглеводного обміну: епідеміологія, патогенез, діагностика | 33 |
| Розділ 2 Матеріали та методи дослідження | 39 |
| 2.1 Методика загального обстеження хворих | 39 |
| 2.2 Біохімічні методи | 40 |
| 2.2.1 Визначення вмісту глюкози у крові натще | 41 |
| 2.2.2 Визначення вмісту глюкози у крові за даними перорального тесту на толерантність до глюкози | 41 |
| 2.3 Морфологічні методи | 42 |
| 2.4 Імуноферментні дослідження | 42 |
| 2.4.1 Визначення С-кінцевих телопептидів, що утворюються при деградації колагену I типу у сироватці крові людини | 42 |
| 2.4.2 Визначення N-MID остеокальцину | 43 |
| 2.5 Інструментальні методи | 44 |
| 2.6 Статистичні методи | 45 |
| Розділ 3 Клінічна характеристика хворих на тяжкі дерматози | 46 |
| Розділ 4 Порушення кісткового обміну у хворих на тяжкі дерматози, що одержують довготривалу терапію глюкокортикоїдними гормонами (діагностика, лікування, профілактика) | 65 |
| 4.1 Особливості кісткового обміну у хворих, що одержували довготривалу терапію глюкокортикостероїдними гормонами | 65 |
| 4.2 Розробка методів корекції порушень кісткового обміну у хворих на тяжкі дерматози, які отримували системну терапію глюкокортикостероїдами | 72 |
| 4.2.1 Обґрунтування методу корекції та профілактики порушень ремоделювання кісткової тканини | 72 |
| 4.2.2 Корекція порушень процесів ремоделювання кісткової тканини | 74 |
| 4.3 Профілактика порушень кісткового обміну у хворих на тяжкі дерматози, яким системна терапія глюкокортикостероїдами призначена вперше | 83 |
| Розділ 5 Порушення вуглеводного обміну у хворих на тяжкі дерматози, що одержують довготривалу терапію глюкокортикоїдними гормонами (діагностика, лікування, профілактика) | 95 |
| 5.1 Особливості порушень вуглеводного обміну у хворих, що одержували довготривалу терапію глюкокортикостероїдними гормонами | 95 |
| 5.2 Корекція порушень вуглеводного обміну у пацієнтів, які знаходилися на системній терапії глюкокортикостероїдами | 98 |
| 5.3 Профілактика порушень вуглеводного обміну у хворих з тяжкими дерматозами, яким вперше призначена системна терапія глюкокортикостероїдами | 103 |
| Розділ 6 Обговорення результатів дослідження | 111 |
| Висновки | 121 |
| Рекомендації | 123 |
| Список використаних джерел 124 Додаток А Акти впровадження | 141 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
БМО – базисна мультиклітинна одиниця
ГКС – глюкокортикостероїдні гормони
ГК-індукований – глюкокортикостероїдіндукований
ІР – інсулінорезистентність
КФЛФ – кісткова фракція лужної фосфатази
МЩКТ – мінеральна щільність кісткової тканини
ОП – остеопороз
ПГН – порушення глікемії натще
ПТГ – порушення толерантності до глюкози
ПТТГ – пероральний тест толерантності до глюкози
ЦД – цукровий діабет
ВСТУП
Актуальність теми. Тяжкі дерматози посідають своє важливе місце у практиці дерматолога. Їх лікування – тривалий процес, який потребує правильного підходу, комплексної терапії виниклих в організмі хворого змін. У багатьох випадках при тяжких дерматозах призначаються кортикостероїдні препарати, причому нерідко досить тривалими курсами. Частина пацієнтів, що має тяжкі дерматози, приймає глюкокортикостероїди (ГКС) роками, а іноді і все життя [6, 19, 25, 44].
У зв’язку з цим, побічні ефекти, які виникають при призначенні системної терапії ГКС хворим на тяжкі дерматози, є серйозною проблемою, бо вони можуть значно знизити якість життя пацієнта, а іноді і звести нанівець усі спроби повернути людину до нормального життя і в той же час їх не можна відмінити, бо вони призначені за життєвими показаннями [14, 69, 88, 131].
Одними з ускладнень системної глюкокортикоїдної терапії є порушення ремоделювання кісткової тканини і порушення вуглеводного обміну. Відсутність лікування або профілактики цих порушень призводить, відповідно, до розвитку глюкокортикоїд-індукованого остеопорозу (ОП) і стероїдного діабету. І якщо частота появи стероїдного діабету у хворих, яким призначалася системна терапія ГКС, складає лише 1,44 %, то порушення толерантності до глюкози (ПТГ) зустрічається частіше, але не завжди своєчасно досліджується. Ризик розвитку стероїдного ОП сягає 50 %, а більш легкі порушення ремоделювання кісткової тканини зустрічаються набагато частіше. Є дані, що частота уражень кістково-суглобного апарату, яка виникає у хворих на псоріаз (у значній мірі як результат неконтрольованого застосування системних ГКС) може доходити, за даними різних вчених, до 61 % [3, 16, 38, 50].
Діагностика появи даних побічних явищ від застосування системних ГКС, зокрема порушень кісткового і вуглеводного обміну, профілактика їх появи є важливою складовою комплексної терапії тяжких дерматозів. Проте обидва побічні ефекти системної терапії ГКС, їх лікування не є досить дослідженими та розробленими, особливо це стосується ранніх порушень. Праць за цією темою мало, вони поодинокі, але порушення ці трапляються у пацієнтів з тяжкими дерматозами досить часто. Якщо говорити про профілактику порушень вуглеводного обміну, то ця тема взагалі є майже невивченим місцем у дерматології [2, 20, 65].
Відомо, що порушення ремоделювання проявляються при виникненні дисбалансу між синтезом і активністю остеобластів і остеокластів, що може виникати під впливом тривалого лікування кортикостероїдами. Є більше даних і лікувальної практики щодо ускладнень, які вже виникли і проявилися у хворого [46, 59], але профілактичне лікування цих порушень мало досліджене.
Тому розробка методів ранньої діагностики, лікування і профілактики появи порушень ремоделювання кісткової тканини і порушень вуглеводного обміну під впливом тривалої кортикостероїдної терапії у хворих на тяжкі дерматози є вкрай актуальною для сучасної дерматології.
Зв’язок роботи з науковими програмами, планами, темами. Дисертація є фрагментом науково-дослідної роботи Державної установи «Інститут дерматології та венерології НАМН України» «Розробити комплексні методи профілактики ускладнень довготривалої імуносупресивної терапії кортикостероїдами та цитостатиками у хворих на тяжкі дерматози» (№ держреєстрації 0111U003685). Дисертантом виконано оцінку порушень ремоделювання кісткової тканини, у тому числі аналіз денситометричних даних, та вуглеводного обміну у хворих на хронічні дерматози, що одержували довготривалу кортикостероїдну терапію, розроблено методи лікування та профілактики цих порушень.
Мета і задачі дослідження. Мета – підвищення ефективності та безпечності лікування хворих на тяжкі дерматози шляхом запобігання або мінімізації розвитку побічних ефектів глюкокортикостероїдних гормонів.
Для досягнення мети дослідження були поставлені такі задачі:
1. Вивчити частоту та особливості клінічних ознак порушень з боку процесів ремоделювання кісткової тканини та вуглеводного обміну у хворих на тяжкі дерматози, як ускладнень довготривалої терапії системними глюкокортикостероїдними гормонами.
2. Визначити маркери розвитку побічних ефектів застосування системних ГКС за даними лабораторних та інструментальних методів обстеження з боку порушень процесів ремоделювання кісткової тканини.
3. Визначити особливості вуглеводного обміну у хворих на тяжкі дерматози, що тривало одержували терапію ГКС.
4. Науково обгрунтувати лікувально-профілактичні заходи щодо ускладнень тривалої терапії ГКС з боку ремоделювання кісткової тканини.
5. З’ясувати доцільність корекції вуглеводного обміну у хворих на хронічні дерматози, які тривало одержують системні ГКС.
6. Вивчити ефективність розроблених методів лікування та профілактики ускладнень тривалої терапії ГКС хворих на тяжкі дерматози.
Об’єкт дослідження – тяжкі хронічні розповсюджені гормонозалежні дерматози.
Предмет дослідження – ускладнення з боку ремоделювання кісткової тканини та вуглеводного обміну; лікування та профілактика ускладнень; ефективність терапії.
Методи дослідження: клініко-анамнестичні, біохімічні, цитологічне дослідження, імуноферментні, інструментальні, статистичні.
Наукова новизна одержаних результатів. Вперше у процесі лікування системними ГКС хворих на хронічні дерматози оцінено базовий рівень процесів ремоделювання кісткової тканини та вуглеводного обміну і його динаміку у процесі саногенезу.
Вперше доведено необхідність проведення запобіжних заходів, зокрема включення в терапію комплексних засобів, що підсилюють кісткоутворення та зменшують резорбцію кісткової тканини з самого початку призначення системних ГКС та в подальшому при її тривалому проведенні.
Вперше доведено необхідність корекції можливих порушень вуглеводного обміну за результатами динамічного спостереження рівня глюкози крові та показників тесту толерантності до глюкози, а також необхідність і ефективність запобіжних заходів щодо порушень вуглеводного обміну.
Показано, що своєчасне застосування методів запобігання розвитку ускладнень системних ГКС у хворих на хронічні дерматози при тривалій терапії ГКС підвищує її ефективність та забезпечує довготривале (довічне у деяких випадках) її проведення без необхідності відміни чи зниження дози ГКС у результаті виникнення відповідних ускладнень.
Практичне значення одержаних результатів. Розроблено алгоритм обстеження хворих, яким планується проведення тривалої системної ГКС терапії, та моніторингу показників ремоделювання кісткової тканини та вуглеводного обміну у процесі лікування.
Розроблено та впроваджено в практику комплексні методи лікування та профілактики порушень ремоделювання кісткової тканини і вуглеводного обміну у хворих на тяжкі дерматози, що отримують довготривало системну терапію ГКС (патенти на корисні моделі № 80475 від 27.05.13 та № 80476 від 27.05.13).
Результати досліджень запроваджено у практичну роботу клініки Державної установи «Інститут дерматології та венерології НАМН України», Комунального закладу охорони здоров’я Обласний клінічний шкірно-венерологічний диспансер № 1 м. Харкова, Комунальної установи Тернопільської обласної ради «Тернопільський обласний клінічний шкірно-венерологічний диспансер», Полтавського обласного клінічного шкірно-венерологічного диспансеру, Кременчуцького обласного шкірно-венерологічного диспансеру, Київської міської клінічної шкірно-венерологічної лікарні, а також у навчальний процес кафедри шкірних та венеричних хвороб з курсами патоморфології та фтизіатрії Державного вищого навчального закладу «Ужгородський національний університет».
Особистий внесок здобувача. Дисертант самостійно обґрунтував науковий напрямок роботи, їм проведено науково-інформаційний пошук у науковій літературі. Особисто проведено набір, клініко-лабораторне, анамнестичне, денситометричне обстеження, лікування і спостереження 134 хворих на тяжкі хронічні дерматози, які тривало одержували системні ГКС. Здобувачем оброблено та проаналізовано результати досліджень, сформульовані висновки і практичні рекомендації, підготовлені до друку публікації наукових результатів.
Здобувачем разом з Олійник І.О., співробітником Державної установи «Інститут дерматології та венерології НАМН України», та Поповим М.М., співробітником Харківського національного університету ім. В.Н. Каразіна, розроблено нові комплексні методи лікування та профілактики ОП та порушень вуглеводного обміну у хворих на тяжкі розповсюджені дерматози, що включають застосування при порушенні ремоделювання кісткової тканини антирезорбтивної терапії та препаратів, що містять кальцій і вітамін Д3, при порушенні вуглеводного обміну – цукрознижуючий препарат з групи бігуанідів.
Дисертантом не запозичено результати та ідеї співавторів публікацій.
Апробація результатів дисертації. Матеріали дисертації доповідалися й обговорювалися на науково-практичній школі «Розробки молодих вчених-дерматовенерологів» (Київ, 2011), конференції молодих вчених ДУ «Інститут дерматології та венерології НАМН України» (Харків, 2012), науково-практичній конференції з міжнародною участю «Наукові засади надання дерматовенерологічної допомоги в сучасних умовах» (Харків, 2012), Всеукраїнській науково-практичній конференції за участю міжнародних спеціалістів «Клініка та лікування шкірних хвороб та інфекцій, що передаються статевим шляхом, з урахуванням супутньої патології» (Донецьк, 2012), науково-практичній конференції «Сучасні технології: діагностика, лікування та профілактика дерматовенерологічних захворювань» у рамках Х Міжнародного медичного форуму (Київ, 2014), науково-практичній конференції «Інноваційні технології в дерматовенерології. Міждисциплінарні зв’язки» (Харків, 2015).
Публікації. За матеріалами дисертації опубліковано 19 наукових праць, у тому числі статей – 7, з них у спеціалізованих наукових виданнях – 5 (у моноавторстві – 3), з яких 4 статті надруковані у журналах, що входять до міжнародної наукометричної бази Російський індекс наукового цитування, у збірнику наукових праць – 2, патентів на корисну модель – 2, тез – 9, інформаційних листів – 1.
РОЗДІЛ 1
АНАЛІТИЧНИЙ ОГЛЯД
1.1 Системна терапія глюкокортикостероїдними гормонами
ГКС – це стероїдні гормони, які синтезуються у кірці надниркових залоз. Природні ГКС та їх синтетичні аналоги застосовуються як лікарські препарати для лікування надниркової недостатності, а також як протизапальні, імунодепресивні, протиалергічні, протишокові засоби [16, 42, 71, 143].
Серед природних ГКС як лікарські препарати застосовуються гідрокортизон і кортизон. Окрім цього, синтезовано цілий ряд синтетичних ГКС, які є більш активними, ніж природні, тому призначаються у менших дозах. До синтетичних ГКС належать нефторовані (преднізон, преднізолон, метилпреднізолон) і фторовані (дексаметазон, бетаметазон, тріамцинолон, флуметазон та ін.) лікарські речовини [42, 71].
В Енциклопедії ліків та товарів аптечного асортименту наводяться дані щодо протизапальної активності фторованих похідних глюкокортикоїдів. Так, активність дексаметазону, порівняно з такою гідрокортизону, вища у 30 разів, бетаметазону – в 25-40 разів, тріамцинолону – в 5 разів, при мінімальному впливі на водно-сольовий обмін, що допомагає зменшити ризик прояву побічних ефектів. Окрім того, ті самі фторовані похідні відрізняються ще й низькою абсорбцією при місцевому застосуванні, а це знижує ризик розвитку системних побічних ефектів [42, 71].
Механізм дії ГКС проявляється у впливі їх на клітину, насамперед її генетичний апарат. Первинно глюкокортикоїди взаємодіють із специфічними рецепторами клітин в органах-мішенях [2, 42, 71].
ГКС можуть проникати до клітини, розчиняючись у мембранах клітин, як речовини, що мають ліпідну природу (вони є похідними холестеролу), а також за допомогою білка-переносника [2, 42, 71].
Рецептори, чутливі до стероїдів, перебувають у цитоплазмі клітин, але щільність їх у різних клітинах неоднакова. Це, можливо, і обумовлює різну чутливість тканин до ГКС. До того ж різні ГКС можуть мати різну тропність до цих рецепторів. Наприклад, ендогенний кортизол (гідрокортизон) переважно зв’язується з глюкокортикостероїдними рецепторами цитоплазматичної мембрани, у той час як синтетичний дексаметазон, більшою мірою, зв’язується з цитозольними ГКС-рецепторами. Кількість глюкокортикостероїдних рецепторів може істотно відрізнятися і змінюватися у процесі терапії ГКС [2, 39, 42].
Наступним етапом є переміщення гормонорецепторного комплексу до ядра клітини. Проникнення ж гормонорецепторного комплексу в ядро стає можливим після перебудови їх структури (активації), що приводить до появи у них здатності зв’язуватися з компонентами ядра [2, 39, 42].
Активований гормонорецепторний комплекс зв’язується в ядрі з певною ділянкою ДНК, що стимулює синтез інформаційної РНК. Потім відбувається трансляція певних матричних РНК на рибосомах і синтезуються різні регуляторні білки. Одним з найважливіших з них є ліпокортин. Він інгібує фосфоліпазу А2, пригнічуючи тим самим синтез простагландинів і лейкотрієнів, які відіграють ключову роль у розвитку запальної реакції [2, 39, 42].
Дослідження останніх років показали, що вплив глюкокортикостероїдних гормонів на біосинтез матричних РНК є основним етапом у реалізації біологічних ефектів ГКС у клітинах органів-мішеней [2, 39, 42].
Проте ГКС можуть не тільки стимулювати, а й інгібувати синтез різних РНК. Причому різноспрямовані ефекти можуть виявлятися в одному і тому самому органі і, можливо, від їх співвідношення залежить остаточна відповідь клітини на гормональний сигнал [2, 16, 39, 42, 149].
ГКС впливають також на активність РНК-полімерази. Описана можливість взаємодії стероїдів із негістоновими білками хроматину, що призводить до зміни їх структури [2, 16, 39, 151].
Таким чином, протизапальний ефект ГКС опосередковується через специфічні глюкокортикоїдні рецептори, зміну активності гормонорецепторного комплексу і синтез РНК і білків. Але ядерний шлях у механізмі дії ГКС не є єдиним [2, 39, 42, 101].
Дослідження показали, що для прояву повного геномного ефекту ГКС необхідно не менше 30 хвилин, причому ефект проявляється у будь-яких терапевтичних дозах [2, 39, 42, 101].
На відміну від геномних, негеномний (неядерні) ефекти ГКС є результатом прямої фізико-хімічної взаємодії з біологічними мембранами та/або стероїд-селективними мембранними рецепторами. Негеномні ефекти ГКС розвиваються при призначенні більш високих доз цих препаратів і проявляються вже через кілька секунд або хвилин. Негеномний протизапальний ефект ГКС пов’язують із стабілізацією лізосомальних мембран, зменшенням проникності клітинних мембран, зниженням капілярної проникності і локального кровотоку у ділянках запалення, зменшенням здатності імунних комплексів проникати через базальну мембрану, з пригніченням міграції та акумуляції лейкоцитів у осередку запалення, гальмуванням росту фібробластів, пригніченням синтезу колагену та ін. [2, 42, 101, 130].
Прояв геномних и негеномних ефектів різниться залежно від застосованої дози. Негеномна дія препарату починає проявляться в дозах понад 30 мг преднізолонового еквіваленту і неухильно зростає з її підвищенням. Геномні ефекти, навпаки, розвиваються при мінімальних дозах, тобто менше 7,5 мг преднізолонового еквіваленту і стають більш проявленими у міру досягнення дози у 100 мг преднізолонового еквіваленту на добу, залишаючись надалі стабільними. При застосуванні ГКС у дуже високих дозах (250 мг преднізолонового еквіваленту на добу, при пульс-терапії) ключова роль у досягненні потужного і швидкого терапевтичного ефекту належить саме негеномним (неядерним) механізмам [2, 39, 101, 130].
ГКС мають декілька основних фармакодинамічних ефектів, а саме протизапальний, який реалізується як антиексудативна і антипроліферативна дія, а також імунодепресивний (імуносупрессивний), протиалергічний, а також вплив на всі обмінні процеси в організмі (на вуглеводний, білковий, жировий і мінеральний обмін) [2, 39, 101, 130].
Глюкокортикостероїдні препарати мають широкий спектр застосування. Серед показань до їх призначення системні захворювання сполучної тканини (системний червоний вовчак, системна склеродермія та ін.), ревматичні захворювання, системні васкуліти, тяжкі дерматози (вульгарна пухирчатка, дерматит Дюринга та ін.), інфекційно-алергічні міокардити, посттравматичний остеоартроз, хвороба Бехтєрєва, підгострий подагричний і псоріатичний артрит, бронхіальна астма та інші захворювання інфекційно-алергічної природи, обструктивний бронхіт, захворювання інших органів і систем, які потребують протиалергічного, імуносупресивного, сильного протизапального ефекту [2, 39, 43, 101, 130, 164].
Глюкокортикоїдні засоби у науковій медицині призначаються системно (парентерально, перорально за певними схемами), локально (внутрішньосуглобово, ректально, в інгаляціях) або місцево (в мазях, краплях, аерозолях) [39, 43, 101, 130].
Класично виділяють чотири види системної терапії глюкокортикоїдними засобами:
1. Інтенсивна терапія, або пульс-терапія – одномоментне або впродовж декількох днів введення великих доз ГКС, еквівалентних до 20–30 мг/кг преднізолону на добу. Застосовується при надзвичайно тяжких станах і швидко прогресуючих процесах, наприклад, набряку Квінке, трансфузійних реакціях, інтоксикаціях тощо.
2. Лімітована терапія – тип системної терапії ГКС, коли впродовж кількох тижнів або місяців призначаються середні дози цих препаратів, еквівалентні 20-60 мг преднізолону на добу, а потім поступово дозу знижують до повної відміни ГКС. Показана при численних гострих, підгострих і загостреннях хронічних процесів.
3. Довготривала терапія – проводиться впродовж кількох місяців, років чи всього життя. На початку лікування хворий отримує більш високі дози з поступовим зниженням, а згодом – індивідуально підібрані підтримуючі.
4. Альтернуюча терапія – застосування невеликих або середніх доз через день одномоментно вранці після сніданку. Таке призначення ГКС є профілактичним заходом щодо розвитку недостатності надниркових залоз і кортикостероїдної залежності, тому що враховує біоритми продукції гормонів організмом. Цей вид терапії показаний при таких хронічних захворюваннях, як ревматоїдний артрит, бронхіальна астма та ін., але після усунення запальної та імунологічної активності [16, 39, 42, 43, 71, 101].
Проте така класифікація не є єдиною. Так, Дятчина Л.І. наводить такі типи системної терапії ГКС:
– терапія середніми терапевтичними дозами;
– альтернуюча;
– пульс-терапія;
– «міні-пульс» терапія;
– поєднана (у першу чергу з цитотоксинами) [47].
«Енциклопедія ліків і товарів аптечного виробництва «Регистр лекарственных средств» наводить іншу класифікацію, згідно якої є три види терапії ГКС:
- Замісна. Застосовується при наднирковій недостатності. Використовуються фізіологічні дози ГКС, при стресових ситуаціях (наприклад, при хірургічній операції, травмі, гострих захворюваннях) дози збільшують у 2-5 разів. При призначенні обов’язково враховують добовий циркадний ритм ендогенної секреції глюкокортикоїдів, тому більшу (або всю) частину дози призначають у 6–8-й годині ранку. При хронічній недостатності кори надниркових залоз (хворобі Аддісона) ГКС можуть застосовуватися впродовж усього життя.
- Супресивна. Застосовується при адреногенітальному синдромі у фармакологічних дозах для пригнічення секреції адренокортикотропного гормону гіпофізом і подальшого зниження підвищеної секреції андрогенів наднирковими залозами. Більшу (2/3) частину дози призначають на ніч, щоб, за принципом негативного зворотного зв’язку, запобігти піку викиду цього гормону.
- Фармакодинамічна. Використовується найчастіше, у тому числі при лікуванні запальних та алергічних захворювань [40, 71].
«Енциклопедія ліків…» також виділяє кілька різновидів фармакодинамічної терапії: інтенсивну, лімітуючу і довготривалу.
Інтенсивна фармакодинамічна терапія призначається при гострих, загрозливих життю станах. ГКС вводять внутрішньовенно, починаючи з великих доз (5 мг/кг на добу), а після виходу хворого з гострого стану (1-2 дні) препарати відміняють – одразу, одномоментно [40, 71, 79].
Лімітуюча фармакодинамічна терапія призначається при підгострих і хронічних процесах, у тому числі й запальних: системному червоному вовчаку, системній склеродермії, ревматичній поліміалгії, бронхіальній астмі з тяжким перебігом, гемолітичній анемії, гострому лейкозі та ін. Тривалість такої терапії становить, як правило, кілька місяців. ГКС застосовують у дозах, які перевищують фізіологічні (2-5 мг/кг на добу), з урахуванням циркадного ритму [40, 71, 79].
Для зменшення пригнічуючого впливу ГКС на організм застосовують різні схеми переривчастого призначення цих засобів:
– альтернуюча терапія (про неї йшла мова раніше);
– інтермітуюча терапія (ГКС призначають короткими курсами на 3-4 дні з чотирьохденними перервами між курсами;
– пульс-терапія (опис її був раніше) [40, 42, 47, 71, 79].
Довготривала фармакодинамічна терапія застосовується для лікування захворювань із хронічним перебігом. ГКС призначають усередину в дозах, вищих за фізіологічні (2,5-10 мг на добу), впродовж декількох років. Відміняють препарати поступово, щоб запобігти синдрому відміни [40, 42, 47, 71, 79].
При довготривалому лікуванні ГКС найбільш оптимальним препаратом вважається метилпреднізолон [42].
I Європейський Симпозіум з глюкокортикостероїдної терапії (2001 р.) рекомендує використовувати таку класифікацію доз системних ГКС:
– низькі дози – менше 7,5 мг на добу в еквіваленті преднізолону;
– середні дози – від 7,5 до 30 мг на добу;
– високі дози – від 30 до 100 мг на добу;
– дуже високі дози – більше 100 мг на добу;
– пульс-терапія – до 250 мг на добу одноразово або впродовж декількох днів [39, 42, 47, 71].
Запропонована фахівцями градація доз ґрунтується на різному ступені насичення рецепторів, чутливих до ГКС, враховує частоту розвитку і вираженість побічних ефектів від системної терапії ГКС, а також негеномні ефекти, які починають проявлятися при використанні доз, вищих за 100 мг у перерахунку на преднізолоновий еквівалент [39, 42, 47, 71].
Як і будь-які лікарські препарати, ГКС мають побічні ефекти, які проявляються при лікуванні. Найбільше їх виявляється, коли препарати призначаються системно.
Те, що ця група препаратів є гормонами, говорить про те, що ГКС мають вплив на весь організм пацієнта, і цей вплив далеко незавжди є позитивним. Деякі побічні ефекти при застосуванні ГКС є найбільш загрозливими [39, 47, 88, 89].
Побічні ефекти при застосуванні ГКС виникають під час їх використання, а також у зв’язку з їх відміною. Більшість цих ефектів є дозозалежними, тому вірогідність їх прояву буде збільшуватися у міру збільшення призначених для лікування доз [39, 47, 88, 89, 152].
За частотою виникнення серед побічних ефектів перше місце належить атиповому ожирінню (85–95 %), артеріальній гіпертензії (80–85 %), ПТГ (80 %), а також місяцеподібному обличчю, багровому рум’янцю (80 %). Дещо рідше зустрічаються абдомінальні стриї та червоно-фіолетовий колір (55–65 %), вірилізація (55–60 %), оліго- та аменорея (60 %), проксимальна міопатія (60 %), ОП і остеопоротичні переломи (40–50 %), шкірні інфекції (0–30 %) та гіперпігментація (5–15 %) [17, 18, 39, 47, 88, 89, 116, 152].
Відомим є той факт, що певні побічні ефекти проявляються на різних стадіях лікування ГКС. Так, на початку лікування ГКС часто розвиваються порушення сну, емоційна лабільність, збільшення апетиту і маси тіла. При тривалому прийомі великих доз ГКС у багатьох пацієнтів з’являються шкірно-трофічні зміни: сухість і витончення шкіри, стриї, вугри, посилення капілярного малюнку на долонях. Частою реакцією на терапію ГКС є лейкоцитоз. Може спостерігатися також гіпокаліемія [39, 47, 88, 89, 116, 152].
Серед ефектів, які розвиваються під час застосування ГКС, у першу чергу, потрібно сказати про прояви екзогенного гіперкортицизму, які можуть проявлятися як затримка рідини і електролітні порушення, гіперглікемія і глюкозурія, артеріальна гіпертензія, підвищена чутливість до інфекцій (включаючи і туберкульоз), ОП, пептичні виразки, міопатія, психічні порушення, затримка росту у дітей, кушингоїдний хабітус (ожиріння з характерним перерозподілом жирової тканини, стриї, екхімози, акне, гірсутизм, задня субкапсулярна катаракта і глаукома [39, 47, 88, 89, 116, 119, 152].
Симптоми екзогенного гіперкортицизму, що є наслідком лікування ГКС, схожі з проявами ендогенного синдрому Кушинга (хворобою Кушинга). Але є і відмінності. Так, при ендогенному синдромі Кушинга практично не зустрічаються доброякісне підвищення внутрішньочерепного тиску, глаукома, задня субкапсулярна катаракта, панкреатит і порушення ремоделювання кісткової тканини. Ці побічні явища характерні для довготривалої терапії великими дозами ГКС. У той самий час при хворобі Кушинга частіше виявляють артеріальну гіпертензію, утворення вугрів, порушення менструального циклу, гірсутизм і вірилізацію у жінок, імпотенцію у чоловіків, а також стриї, пурпуру. Збільшення маси тіла, набряки, погіршення загоєння ран, психічні порушення однаково характерні для обох форм кушингоїдного синдрому [39, 47, 88, 89, 116, 119, 135, 152].
До нечастих побічних ефектів від застосування ГКС належить також міопатія, яка характеризується слабкістю і атрофією скелетних м’язів плечового пояса, ніг і тазу. Вона виникає у пацієнтів, яким призначені високі дози ГКС. Механізм її розвитку пов’язують з негативним впливом ГКС на білковий і мінеральний обміни [98, 137, 139, 155, 163].
Одним із загрозливих для життя пацієнта ускладнень терапії ГКС є порушення, які виявляються з боку опорно-рухового апарату. У першу чергу, це порушення ремоделювання кісткової тканини, які проявляються як ОП, компресійні переломи хребта, асептичні некрози кістки. Порушення ці – досить частий супутник системної терапії ГКС. За сучасними оцінками, у 30–50 % всіх хворих, що потребують тривалого лікування, нарешті, розвивається ОП [137, 155, 163].
Тривалий прийом ГКС у дозах, що перевищуються 7,5 мг на добу у преднізолоновому еквіваленті, спричиняє посилене виведення кальцію з організму, а це призводить до порушень у ремоделюванні кісткової тканини і, як наслідок цього, – до ОП та інших патологічних змін [137, 139, 155, 163].
Метаболічні порушення від глюкокортикоїдної терапії, крім кушингоїдного синдрому включають гіперглікемію, гіперліпідемію, підвищення апетиту, порушення водно-електролітного балансу, негативний баланс нітрогену. ПТГ, гіперглікемія (аж до розвитку стероїдного діабету) пов’язані зі зниженням чутливості тканин до інсуліну і контрінсулярною дією ГКС [86, 131, 137, 155, 163].
Дослідження, проведені за останні 30 років, виявили залежність розвитку прихованих порушень вуглеводного обміну від недостатньої активності піруватдегідрогеназного комплексу. Відомо, що піруватдегідрогеназа активується інсуліном, і оскільки ГКС є контрінсулярними гормонами, призначення їх у дозах, вищих за фізіологічні, впливає на секрецію або активність інсуліну, а той, у свою чергу, впливає на чутливість організму до рівня глюкози у крові. Найчастіше стероїдний діабет розвивається при лікуванні дексаметазоном і бетаметазоном [8, 9, 21, 22].
Вплив ГКС на жировий обмін проявляється різким перерозподілом жиру з кінцівок на тулуб і обличчя. Це пояснюють тим, що адипоцити тулуба переважно реагують на підвищення рівня інсуліну у відповідь на гіперглікемію, спричинену ГКС. Проте адипоцити, наприклад, кінцівок є менш чутливими до інсуліну і навіть у присутності ГКС відповідають здебільшого на ліполітичні стимули інших гормонів. І, як наслідок цього, маємо відкладення жиру на задній поверхні шиї, надключичних ділянках та обличчі і, навпаки, втрати жирової тканини на кінцівках, тобто розвивається кушингоїдний хабітус [8, 9, 21, 22].
Порушення водно-електролітного обміну виявляються як гіпокаліємія, гіпокальціємія, затримка в організмі натрію і води. Ризик гіпокаліємії зростає при прийомі діуретиків [8, 9, 21, 22].
Загальновідомим також є те, що ГКС мають ульцерогенну дію. Це навіть використовується у доклінічних дослідженнях для вивчення противиразкової дії субстанцій і нових лікарських препаратів. Виразка шлунка або дванадцятипалої кишки є частим і загрозливим побічним ефектом ГКС. Найчастіше ульцерогенна дія проявляється при комбінованому застосуванні ГКС (особливо преднізолону) з нестероїдними протизапальними засобами. Механізм ульцерогенної дії ГКС реалізується за рахунок підвищення секреції соляної кислоти, зниження синтезу слизу і гальмування регенерації епітелію слизової шлунково-кишкового тракту [8, 9, 26, 47].
Окрім описаних вище зустрічається і багато інших побічних ефектів від застосування ГКС. Наведемо їх нижче:
– з боку ендокринної системи: стероїдний діабет, маніфестація латентного діабету, затримка статевого дозрівання, уповільнення росту у дітей, пригнічення гіпоталамо-гіпофізарно-надниркової системи, порушення менструального циклу (вторинна аменорея);
– з боку шлунково-кишкового тракту: стероїдні виразки шлунка і кишечника, езофагіт, кровотечі, перфорації, диспепсія, панкреатит;
– шкірні прояви: крововиливи, витончення шкіри, її атрофія шкіри та підшкірної клітковини при внутрішньом’язовому введенні (особливо при введенні у дельтоподібний м’яз), вугри, стриї;
– з боку нервової системи: нестійкий настрій, психоз, синдром псевдопухлини мозку;
– порушення зору: глаукома, задня субкапсулярна катаракта, екзофтальм [8, 9, 21, 22, 26, 47].
До побічних ефектів терапії ГКС належать також інфекційні ускладнення. До них призводить імуносупресивна дія ГКС, внаслідок якої організм пацієнта стає більш чутливим до інфекцій. Також є ризик реактивізації інфекційних захворювань, що існують у хворого у латентній формі. Найчастіше у хворих розвиваються бактеріальні інфекції. Вони проявляються, як правило, у формі пневмонії або септицемії. Основними збудниками є стафілококи і грампозитивні кишкові бактерії [21, 22, 83, 88, 146].
При наявності інфекційного процесу терапія ГКС може проводитися тільки у разі абсолютної необхідності під прикриттям адекватних антибактеріальних або протигрибкових препаратів [21, 22, 47, 83, 88].
Таким чином, побічні ефекти при терапії ГКС досить різноманітні. Вплив цих препаратів проявляється на всі органи та системи організму. І чим більші призначені дози і тривалість терапії ГКС, тим імовірність виникнення побічних ефектів вища [8, 9, 26, 47, 137, 139, 146, 155].
Серед значущих побічних ефектів системної терапії ГКС, що найчастіше зустрічаються і мають серйозні наслідки, є порушення ремоделювання кісткової тканини і порушення обміну речовин. У той же час ці ускладнення недостатньо вивчені і незавжди враховуються у клінічній практиці лікування [15, 139, 163].
1.2 Порушення ремоделювання кісткової тканини: епідеміологія, патогенез, діагностика
Порушення з боку опорно-рухового апарату є одними з найчастіших побічних явищ при системному лікуванні ГКС. Як вже говорилося раніше, тривалий прийом ГКС (півроку і більше) призводить до виведення кальцію з організму пацієнта і, як наслідок цього, процеси ремоделювання кісткової тканини порушуються, починають превалювати механізми резорбції, і хворий отримує супутні захворювання, найбільш частим з яких є ОП [147, 148, 157].
Маркун Т.В. дає визначення ремоделювання кісткової тканини як поєднаних у часі процесів локальної резорбції і формування кістки у невеликих блоках за допомогою базисної мультиклітинної одиниці (БМО), функцією якої є підтримка скелетного балансу [3, 143].
Г.М. Фрост у своїх працях також дає визначення ремоделювання кісткової тканини. Він говорить про те, що у гомеостатичній рівновазі процеси резорбції й утворення нової кісткової тканини збалансовані, і у старій кістці тканини безперервно заміщуються на нові, завдяки чому зберігається механічна цілістність кістки. Даному процесу Г.М. Фрост і дав визначення як ремоделюванню кісткової тканини [147].
Процеси ремоделювання пов’язані з діяльністю остеокластів (відповідають за процеси резорбції кісткової тканини) та остеобластів (з них утворюється нова кісткова тканина). Саме вони здебільшого і складають БМО [8, 11, 12, 132].
Окрім остеокластів і остеобластів до БМО входять активні мезенхімальні клітини і капілярні петлі. Розмір БМО складає 0,05-0,1 мм3. Вона має форму циліндра з двома конусоподібними вершинами, в центрі якого проходить капіляр, оточений остеогенними клітинами. Вершина циліндра – ріжучий конус, вистелений остеокластами, які руйнують компактну кістку, утворюючи у ній резорбційний канал. Середня частина БМО – реверсивна зона, яка являє собою резорбційну порожнину, вистелену клітинами типу макрофагів. Дистальний відділ БМО замикає конус, покритий остеобластами, які заповнюють резорбційний канал і концентрично розташовуються кістковими пластинками [8, 11, 12].
Процес ремоделювання починається на неактивній поверхні кістки з появи остеобластів, які приєднуються до матриксу кісткової тканини і формують гофрований кордон на поверхні розділу кістки з остеокластом, який створює ізольоване мікросередовище, окислює його і розчиняє органічний і неорганічний матрикс кістки [8, 11, 12, 147].
Після закінчення процесу резорбції на місці ремоделювання з’являються остеобласти. Вони відкладають остеоїд і мінералізують його, утворюючи, таким чином, фізіологічно нормальну кісткову тканину. Частина остеобластів інкапсулюються в остеоїдний матрикс і диференціюються в остеоцити. Решта остеобластів продовжують синтезувати кісткову тканину, аж поки не відбудеться зупинка їх функції, а потім і перетворення їх у неактивні клітини, які вистилають повністю поверхню новоутвореної кісткової тканини і пов’язані з остеоцитами матриксу кістки за допомогою мережі канальців [8, 15, 27, 147].
Організація БМО у кортикальній і трабекулярній кістковій тканині відрізняється, хоча ці відмінності є більшою мірою морфологічного характеру, а не біологічного. У кортикальній кістці БМО утворює циліндричну трубку приблизно 2000 мкм завдовжки і 150-200 мкм завширшки. Трубка ця поступово заривається у кістку зі швидкістю 20-40 мкм в день. На верхівці знаходяться близько 10 остеокластів, вони риють циркулярний тунель (ріжучий конус) у головному напрямку докладання зусилля. За ними слідують декілька тисяч остеобластів, які заповнюють тунель (замикають конус), для того щоб створити (вторинний) остеон оновленої кісткової тканини. Таким чином, близько 2–5 % кортикальних кісток щороку ремодулюється [8, 15, 27, 28, 147].
У трабекулярній кістці процес ремоделювання є переважно поверхневим. Внаслідок превалювання площі над об’ємом ремоделювання тут відбувається набагато активніше, ніж у кортикальній кістковій тканини, приблизно до 10 разів. Остеокласти тут залучаються до процесу першими. Вони проникають через трабекулярну поверхню зі швидкістю приблизно 25 мкм на день, прориваючи траншею, більшу за тунель, з глибиною 40-60 мкм. Як і у кортикальній кістковій тканині за остеокластами слідують остеобласти, які утворюють кісткову тканину. Трабекулярна БМО може розглядатися як половина кортикальної. У результаті, сформована структура називається трабекулярний остеон або гемі-остеон [8, 15, 28, 29, 147].
Регуляція ремоделювання здійснюється гормонами та іншими факторами, які є в організмі. Вони впливають певним чином на функціонування остеокластів і остеобластів. У першу чергу, це гормони, що регулюють обмін кальцію в організмі, – кальцитонін, який виробляє щитовидна залоза, і паратгормон паращитовидної залози. Загальновідомим також є той факт, що нормальне функціонування і продукція кісткової тканини не можливі без вітаміну D [8, 15, 28, 29, 147].
Основною дією паратгормону є підтримання гомеостазу кальцію в організмі. Він стимулює кісткову резорбцію шляхом активації остеокластів і остеоцитів – сплячих остеобластів. Для реалізації резорбтивної дії паратгормону потрібна присутність остеобластів. Паратгормон може як стимулювати, так і уповільнювати синтез колагену і кісткового матриксу [8, 15, 28, 29, 147].
Функціональним антагоністом паратгормону є кальцитонін, який гальмує спонтанну кісткову резорбцію за рахунок первинного пригнічення остеобластичної активності та зменшення кількості остеокластів, а також остеолізис, стимульований паратгормоном та іншими факторами. Кальцитонін пригнічує розпад колагену, позитивно впливає на кісткоутворення [39, 47, 71].
Впливають на ремоделювання й інші гормони. Свою роль у процесах ремоделювання кісткової тканини відіграють інсулін, соматотропний гормон (соматотропін), глюкокортикоїди, тироксин, жіночі та чоловічі статеві гормони. Важливими у процесах відновлення кісток також є низка ростових факторів: інсуліноподібні фактори росту-1 і -2, фактор росту фібробластів, трансформуючий фактор росту Р, тромбоцитарний фактор росту, епідермальний фактор росту. Свою роль відіграють інтерлейкіни-1, -6, -8, -11, фактор некрозу пухлини, макрофаг-колонієстимулюючий фактор, гранулоцит-макрофаг-колонієстимулюючий фактор, а також низка місцевих факторів, які синтезуються безпосередньо у самих кісткових клітинах і вивільняються, коли кістка піддається деструкції тканинного матеріалу [39, 47, 71].
Вперше у літературі ОП був описаний у 1873 році Charcot і Vulpian, хоча характерні для цієї патології зміни скелета були виявлені при археологічних дослідженнях давніх культур, вік яких становить 2-2,5 тисячі років. Впродовж першої половини ХХ століття процеси втрати кісткової тканини активно вивчалися, широке коло клініцистів отримало уявлення про ОП лише наприкінці 40-х років [4, 28, 32, 80].
Сучасна медицина визначає ОП як системне захворювання скелета, що характеризується прогресуючим зниженням маси кістки в одиниці об’єму і порушенням мікроархітектоніки кісткової тканини, які призводять до збільшення крихкості кісток і високого ризику їх переломів. Це визначення, сформульоване на міжнародних конференціях з ОП у Копенгагені (1990 р) і у Гонконгу (1993 г.), є на даний час загальноприйнятим [33, 61, 69, 70, 110].
Соціально-економічне та клінічне значення ОП визначається високим ризиком розвитку переломів кісток скелета, найбільш типовими з яких є переломи шийки стегна, хребта і променевої кістки [59, 63, 87, 96].
За даними ВООЗ, близько 35 % травмованих жінок і 20 % чоловіків мають переломи, які пов’язані саме з ОП. За статистикою, проблема ОП зачіпає близько 75 мільйонів громадян, що мешкають в Європі, США та Японії. В Європі у 2000 році кількість остеопоротичних переломів оцінювалася в 3,7 мільйонів, з яких 890 тисяч припадають на переломи шийки стегнової кістки. В Європі летальність, пов’язана з остеопоротичними переломами, перевищує онкологічну (за винятком смертності від раку легені). До 2050 р. очікується зростання кількості остеопоротичних переломів шийки стегнової кістки з 500 тисяч до 1 мільйона випадків щорічно [59, 63, 87, 96, 120].
Завдяки широкій поширеності і відсутності яскравих клінічних проявів до розвитку переломів, ОП називають «невидимою епідемією». За даними ВООЗ, він посідає четверте місце серед хронічних неінфекційних захворювань, поступаючись лише хворобам серцево-судинної системи, онкологічним захворюванням і цукровому діабету (ЦД). Згідно з прогнозами, серед осіб європеоїдної раси переломи, зумовлені ламкістю кісток, виникають за роки життя більш ніж у 30 % жінок і у 15 % чоловіків старше 50 років. Встановлено, що у жінок європеоїдної раси ризик перелому шийки стегна протягом життя становить 1 : 6, що перевищує ризик розвитку раку молочної залози (1 : 9) [125, 133, 144, 154].
ОП поділяють на первинний (постменопаузальний, сенільний, ювенільний, ідіопатичний), який становить 85 % від усіх випадків захворювання ОП, і на вторинний, що розвивається як ускладнення ревматичних, гематологічних та ін. захворювань, а також як побічний ефект при лікарській терапії, насамперед, системними ГКС. За морфологічними критеріями виділяють ОП трабекулярний, кортикальний і змішаний. За метаболічною активністю виокремлюють ОП з високим кістковим обміном, з низьким рівнем метаболізму кісткової тканини та з нормальними показниками кісткового метаболізму [125, 133, 144, 154].
Клінічно ОП нерідко перебігає безсимптомно. Першими проявами захворювання можуть стати переломи кісток. Іноді відзначається больовий синдром, який частіше локалізується у грудному і поперековому відділах хребта. За своєю характеристикою болі можуть мати гострий або хронічний характер. Поряд із специфічними ознаками у хворих на ОП нерідко зустрічаються і скарги загального характеру, а саме дискомфорт у ділянці шлунка, підвищена стомлюваність, зниження працездатності, дратівливість, підвищена збудливість [28, 41, 49, 54].
Переломи тіл хребців, поряд із переломами шийки стегна, є одними з найбільш типових ознак ОП, а їх наслідки у вигляді болю в спині, порушення функції, деформації хребта, обмеження рухової активності аж до практично повної знерухомленості значно знижують якість життя пацієнтів, позбавляючи їх можливості працювати [28, 41, 49, 54].
Мізерної і неяскравої клінічної картини, яка зазвичай спостерігається при ОП, недостатньо для постановки діагнозу. Для цього активно використовуються різні методи діагностики.
У сучасній медицині для ранньої діагностики ОП використовуються методи кількісної кісткової денситометрії, які дозволяють виявити вже 2–5 % втрати маси кістки, оцінити динаміку і швидкість втрати мінеральної щільності кісткової тканини (МЩКТ), а також ефективність лікування [5, 13, 58, 129, 142, 156].
Найбільш достовірну інформацію можна отримати при використанні методу двухенергетичної рентгенівської абсорбціометрії. За допомогою цієї методики частіше досліджуються хребет і стегно [5, 13, 58, 129, 142, 156].
Відповідно до рекомендацій ВООЗ, діагноз ОП у жінок старших вікових груп ставиться при МЩКТ нижчій, ніж -2,5 стандартних відхилення (SD) від середнього показника для дорослих осіб молодого віку при вимірюванні в ділянці шийки стегна. Показники у межах від -1,0 до -2,5 визначаються як остеопенія, а значення від +1,0 до -1,0 – як «нормальна кісткова маса» [5, 13, 58, 129, 142, 156].
Достовірність двухенергетичної рентгенівської абсорбціометрії може знизитися при таких захворюваннях, як остеоартроз, сколіоз, кальцифікація аорти і міжхребцевих дисків, переломи хребців, а також при попередньому застосуванні контрастних речовин, які можуть спричиняти завищення показників мінеральної щільності. Нерівномірний розподіл жирової тканини також може впливати на точність методу [5, 13, 53, 55, 142, 156].
Ще одним різновидом методу денситометрії є периферична кількісна комп’ютерна томографія – метод вивчення МЩКТ з використанням множинних рентгенівських променів, які перехрещуються і сприяють реконструкції об’ємної моделі розподілу щільності у кістці. Зазвичай вимірювання проводяться в ультрадистальному відділі променевої кістки або поперековому відділі хребта. Даний метод дає можливість диференційовано оцінювати МЩКТ у трабекулярній і кортикальній кістковій тканині, фіксуючи справжні значення. На відміну від двухенергетичної рентгенівської абсорбціометрії, при проведенні периферичної кількісної комп’ютерної томографії немає викривлень значень, пов’язаних із повнотою пацієнта, а також спричинених супутньою патологією, наприклад, спондилоартритом, остеофітами, звапнінням стінки аорти або ділянками остеосклерозу, що розвиваються у результаті дегенеративних захворювань або переломів хребців [5, 13, 53, 55, 58, 129].
В останні роки отримала розвиток кількісна ультразвукова денситометрія. На відміну від інших методів, що дозволяють судити про стан кісткового скелета за даними МЩКТ, зазначений метод пропонує інші показники оцінки кісткової тканини, а саме швидкість поширення ультразвуку в кістці і широкохвильове розсіювання (загасання) ультразвукової хвилі. Зазвичай в якості об’єкта дослідження вибирають п’яткову кістку. Коефіцієнт ослаблення ультразвуку, що проходить через кістку, лінійно збільшується з частотою у межах від 0,2 до 1,0 МГц. Широкохвильове розсіювання ультразвукової хвилі визначається як нахил кривої залежності ослаблення ультразвукової хвилі від частоти і вимірюється в дБ/МГц/см [5, 13, 53, 55, 58, 129].
Перераховані параметри ультразвукової хвилі, за даними багатьох дослідників, відображують еластичність, міцність і жорсткість кісткової тканини і досить сильно корелюють з МЩКТ хребта і стегна. Причому широкохвильове розсіювання ультразвукової хвилі корелює з гістоморфометричними параметрами кістки, а швидкість поширення ультразвуку відображує пружність кістки. Подібно рентгенівським денситометрам, ультразвукові прилади поряд з вимірюванням перерахованих вище показників мають нормативні дані і обчислюють Z- і Т-критерії у відсотках і величинах стандартного відхилення [128, 141, 156].
У публікаціях останніх років йде постійна дискусія про доцільність використання ультразвукової денситометрії для діагностики ОП. Тим не менше, більшість авторів виявило тісну кореляцію ультразвукових параметрів кістки з даними рентгенівської денситометрії у дослідженнях in vivo і з результатами вивчення міцності кістки in vitro. У даний час багато фахівців висловлюють думку про те, що за допомогою ультразвукової денситометрії можна передбачати ризик переломів, тим самим обґрунтовуючи її значення як методу для скринінгу [128, 141, 156].
Основні переваги ультразвукової денситометрії порівняно з іншими методами оцінки стану кісткової тканини є наступними:
– ультразвукова оцінка може бути проведена неінвазивним шляхом, пацієнт не піддається дії іонізуючого опромінення, що збільшує бажання пацієнта пройти обстеження;
– ультразвукова технологія дешевша, ніж рентгенівська денситометрія. Пристрої для діагностики портативні. Тому ультразвукова діагностика має більш широке застосування, ніж звичайна рентгенівська денситометрія і може використовуватися в епідеміологічних дослідженнях;
– відсутність іонізуючого випромінювання полегшує розміщення, ліцензування і використання устаткування, потребує меншої кількості інструкцій для персоналу і не потребує спеціального приміщення для розміщення апарату [52, 56, 128, 141, 156].
За допомогою методів «кісткової денситометрії» можна судити про основні параметри міцності кісткової тканини, але ці методи не дають жодної інформації про рівень кісткового метаболізму.
Рівень формування і резорбції кісткової тканини може бути оцінений кількома способами: шляхом вимірювання ферментної активності кісткових клітин (остеобластів і остеокластів) або шляхом визначення продуктів деградації кісткового матриксу, які вивільняються в процесі кісткового обміну [50, 74, 103, 115].
Метаболізм кістки характеризується двома різноспрямованими процесами: утворенням нової кісткової тканини остеобластами і руйнуванням (резорбцією) старої кістки остеокластами. Обидва процеси тісно пов’язані між собою, що визначає поняття одиниці ремоделювання кістки. Кількість маси кісткової тканини залежить від балансу між її резорбцією і формуванням всередині одиниці ремоделювання, а також від кількості цих одиниць, що активуються у даний момент часу в певному місці кістки [50, 74, 103, 115].
Для ОП характерним є дисбаланс між резорбцією і утворенням кісткової тканини в окремій одиниці ремоделювання, а також збільшення частоти активації.
У даний час описаний широкий спектр нових маркерів кісткової діяльності. Було показано, що рівні цих маркерів у крові або сечі тісно корелюють з показниками кісткового метаболізму, які вимірювалися гістоморфометричними методами [50, 73, 74, 103, 115].
У клінічній практиці досі широко використовують визначення загальної лужної фосфатази як маркера кісткового обміну. У крові виявлено її п’ять ізоферментів: печінковий, кістковий, нирковий, підшлунковий і плацентарний. Кісткова лужна фосфатаза становить приблизно 50 % від лужної фосфатази і метаболізується у печінці. Її виведення з організму порушується при таких захворюваннях, як біліарний цироз. Підвищення лужної фосфатази у хворих на ОП може бути проявом нових переломів кісток або поєднання з остеомаляцією [50, 73, 74, 103, 115].
Остеокальцин – найбільш важливий неколагеновий білок матриксу кістки, синтезується остеобластами. Основна частина остеокальцину відкладається у позаклітинному матриксі кістки і лише невелика кількість потрапляє у кров. Точно фізіологічна функція остеокальцину все ще не встановлена. У багатьох дослідженнях показано, що рівень циркулюючого остеокальцину відображає швидкість утворення кістки. Остеокальцин є чутливим і специфічним показником активності остеобластів і процесу формування нової кістки [33, 40, 50, 73, 115].
Протягом багатьох років робилися спроби розробити надійний маркер, що характеризує синтез колагену у кістці. І, мабуть, такими є С-кінцеві телопептиди, що утворюються при деградації колагену I типу (CR.OSSL.APS). При фізіологічно або патологічно підвищеній резорбції колаген I типу руйнується швидше. У пацієнтів з ОП концентрація колагену I типу корелює зі швидкістю обміну кісткової тканини. Колаген I типу становить більше 90 % органічного матриксу кістки і синтезується безпосередньо у кістках. Під час оновлення кісткової тканини колаген I типу деградує, а невеликі пептидні фрагменти потрапляють у кров. Маркери CR.OSSL.APS використовуються для оцінки терапії препаратами, що знижують резорбцію кістки і у пацієнтів з порушенням метаболізму кісткової тканини [33, 40, 50, 73, 115].
Особливо корисні кісткові маркери для оцінки ефективності терапії у порівняно короткі проміжки часу, коли денситометричне дослідження ще не інформативно (вважають, що повторні денситометричні дослідження треба виконувати не частіше одного разу на рік). Рівень майже всіх маркерів корелює зі зниженням МЩКТ. Для оцінки ефективності проведеної терапії рекомендується досліджувати біохімічні маркери через кожні три місяці після початку лікування [33, 40, 77, 96].
Особливе місце серед усіх форм ОП посідає глюкокортикоїдний, або глюкокортикостероїдіндукований (ГК-індукований), який розглядається як один із найбільш характерних і потенційно важких наслідків терапії системними ГКС. У структурі вторинного ОП він посідає перше місце, обумовлюючи більше половини випадків ОП у молодому віці. Однак, лікування з метою профілактики цього серйозного ускладнення отримують лише 8-14 % пацієнтів, які приймають ГКС [12, 16, 65, 66, 81, 82, 100].
Відомо, що при тривалому застосуванні ГКС ОП розвивається у 30–50 % пацієнтів. Відомо, що для чоловіків і жінок, які отримують системно ГКС, відносний ризик переломів у 2 рази більший, ніж у загальній популяції [12, 16, 65, 66, 81, 82, 100].
При ГК-індукованому ОП уражається, насамперед, губчаста кістка і переважно у кістках тазу, ребрах, хребцях. Це призводить до збільшення частоти атравматичних переломів, які серед хворих, які приймають ГКС, зустрічаються в 2–3 рази частіше, ніж у загальній популяції. Найбільш інтенсивна втрата кісткової маси відбувається в перші 6–12 місяців від початку стероїдної терапії і може досягати 5–15 % на рік, потім вона сповільнюється і виходить на плато на відносно низькому рівні – 3,5 % на рік. Однак, незважаючи на уповільнення швидкості втрати кісткової маси, за відсутності лікування щорічно у 12 % хворих відзначаються переломи, при цьому у жінок віком, що відповідає початку менопаузи, цей ризик збільшується ще у 2–3 рази [99, 103, 107, 121, 128].
Важливо відзначити, що переломи кісток при ГК-індукованому ОП, на відміну від постменопаузального і старечого, розвиваються при більш високій МЩКТ, що дозволяє припускати значні якісні зміни у кістці при цьому захворюванні [99, 103, 107, 121, 128].
ГКС впливають на різні механізми обміну кальцію і ремоделювання кістки, спричиняючи дисбаланс між резорбцією і формуванням нової кістки. Вважають, що розвиток ГК-індукованого ОП більшою мірою пов’язаний з пригніченням функції остеобластів, обумовленим уповільненням їх диференціювання і прискореним апоптозом, ніж з активністю остеокластів [99, 103, 107, 160, 161, 163].
Основними патогенетичними механізмами, що полягають в основі ГК-індукованого ОП (за Gulko і Mulloy) є:
– зменшення абсорбції кальцію у кишечнику;
– зниження ниркової канальцевої реабсорбції і посилення втрати кальцію з сечею;
– зниження експресії рецепторів вітаміну D;
– посилення синтезу паратиреоїдного гормону;
– пригнічення синтезу статевих гормонів;
– зниження синтезу простагландину Е2;
– зниження синтезу колагену і неколагенових білків;
– зниження синтезу локальних факторів росту кісткової тканини (інсуліноподібний фактор росту-1, трансформуючий фактор росту та ін.);
– порушення експресії молекул адгезії остеобластами та взаємодії остеобластів з кістковим матриксом [103].
Загальноприйнятою є точка зору про те, що ГК-індукована втрата кісткової маси наростає у міру збільшення дози і тривалості прийому ГКС, але досі залишається відкритим питання про існування порогових доз ГКС, нижче яких зниження маси кістки не розвивається.
На сьогоднішній день прийнято вважати, що лікування дозами ГКС, еквівалентними 7,5 мг на добу у перерахунку на преднізолон і вищими, асоціюється зі швидкою втратою кісткової маси і може призводити до розвитку ОП уже протягом перших трьох місяців терапії [99, 103, 107, 160, 161, 163].
Проте пошкоджуючий ефект ГКС на кісткову тканину є індивідуальним для кожного пацієнта і його важко точно передбачити, тому що залежить він не тільки від прийому ГКС, а й від самого захворювання, з приводу якого їх було призначено, від його перебігу, а також інших медикаментів, які використовуються у лікуванні [103, 160, 161, 163].
1.3 Порушення вуглеводного обміну: епідеміологія, патогенез, діагностика
Вуглеводи є одними з найважливіших груп органічних речовин у складі живих організмів, без яких неможливе життя. Вони входять до складу організму людини, визначаючи разом із білками, ліпідами і нуклеїновими кислотами специфічність його побудови і функціонування [1, 7, 23, 36, 38].
Метаболізм вуглеводів у організмі складається з наступних процесів:
- Розщеплення полісахаридів і олігосахаридів, які надходять з їжею, у травному тракті до моносахаридів, подальше всмоктування останніх з кишечнику у кров.
- Синтез і розпад глікогену в тканинах (процеси глікогенезу і глікогенолізу), у першу чергу в печінці, де він накопичується.
- Гліколіз – розпад глюкози. Це процеси анаеробного і аеробного бродіння (гліколізу).
- Пентозофосфатний шлях (пентозний цикл) – анаеробне пряме окислення глюкози.
- Взаємоперетворення моносахаридів-гексоз.
- Анаеробний метаболізм пірувату. Даний процес не є чисто вуглеводним обміном. Останній розглядається як його завершальна стадія, в якій відбувається окислення продукту гліколізу – пірувату.
- Глюконеогенез – процес утворення вуглеводів з невуглеводних продуктів (лактату, пірувату, амінокислот, гліцерину, білків, ліпідів та ін.) [1, 7, 23, 36, 38, 45, 57, 60].
Усі порушення вуглеводного обміну прийнято поділяти на декілька груп, а саме на гіпоглікемії, гіперглікемії, глікогенози, гексоз- і пентоземії, аглікогенози [22, 24, 45, 57, 60].
Гіпоглікемія – це патологічний стан, який характеризується зниженням концентрації глюкози в крові, нижчим за норму (3,3 ммоль/л), внаслідок чого виникає гіпоглікемічний синдром. Причин і механізмів виникнення гіпоглікемії досить багато. Гіпоглікемія може бути пов’язана з недостатньою продукцією глюкози організмом, підвищенням утилізації глюкози, а також іншими факторами [24].
Гіперглікемія виявляється при ПТГ [24].
Глікогенози пов’язані з наявністю певних дефектів ферментів, які беруть участь у синтезі та розщепленні глікогену. До цих дефектів належать дефект глюкозо-6-фосфатази (хвороба Гірке), дефект мальтази (хвороба Помпе), дефекти фосфорилаз, порушення транспорту глюкози та ін. Глікогенози є спадковими порушеннями метаболізму вуглеводів [24, 51].
Гексоземії та пентоземії – це стани, що характеризуються, відповідно, збільшенням, вищим за норму, рівня гексоз/пентоз у крові.
Аглікогенози пов’язані з дефектами ферментів, потрібних для синтезу глікогену. Захворювання також є спадковими [24, 51].
Стероїдний ЦД є одним із ускладнень при проведенні тривалої терапії ГКС [51, 57, 67, 68, 85].
Порушення вуглеводного обміну у хворих на тяжкі дерматози на тлі тривалої системної терапії ГКС розвиваються за типом порушення глікемії натще (ПГН), ПТГ і ЦД II типу [51, 67, 75, 76, 78].
Згідно етіологічної класифікації (ВООЗ, 1999), ЦД – це діабет, який розвивається від переважної резистентності до інсуліну з відносною інсуліновою недостатністю до переважного секреторного дефекту з інсуліновою резистентністю або без неї [75, 76, 78, 91, 92, 93].
Індукований стероїдами він належить до ЦД, спровокованого ліками і хімікатами. За даними літератури, 70–80 % хворих, які тривало приймають ГКС, мають ПТГ, 13–15 % – діабет [91, 92, 93].
Розвиток ГК-індукованого ЦД обумовлений тривалим прийомом синтетичних ГКС, дози яких перевищують фізіологічну замісну норму. Він може розвиватися і після короткого курсу лікування ГКС у хворих з порушеннями периферичного метаболізму стероїдів (гіпотиреоз, захворювання печінки) [75, 76, 78, 91, 92, 93].
ГК-індукована гіперглікемія є результатом збільшеної продукції глюкози печінкою і порушеної її утилізації. Лікарські препарати даної групи порушують вуглеводний обмін, що пояснюється їх антагонізмом до інсуліну. На периферії ГКС блокують дихальні ланцюги і погіршують транспорт глюкози через мембрани клітин, який підтримується інсуліном. Індукований стероїдами ЦД характеризується відносною інсулінорезистентністю (ІР), гіперглікемією і глюкозурією без кетоацидозу (на початку хвороби) [102, 104, 106, 108, 109, 112, 113].
ІР є порушенням інсулінопосередкованої утилізації глюкози клітинами. Розвивається ІР як компенсаторна гіперінсулінемія, яка, з одного боку, дозволяє на початкових стадіях, підтримувати вуглеводний обмін у нормі. З іншого боку, вона сприяє розвитку метаболічних, гемодинамічних і органних порушень, які призводять в решті решт до розвитку серцево-судинних захворювань і ЦД [117, 118, 122, 123, 124, 137, 164].
ІР у м’язовій тканині проявляється у зниженні надходження глюкози з крові у міоцити та її утилізацією у м’язових клітинах. ІР жирової тканини проявляється у резистентності до антиліполітичної дії інсуліну, що призводить до накопичення вільних жирних кислот і гліцерину. Жирні кислоти надходять у печінку, де стають основним джерелом формування атерогенних ліпопротеїдів дуже низької щільності. ІР тканини печінки характеризується зниженням синтезу глікогену і активацією процесів розпаду глікогену до глюкози (глікогеноліз) і синтезу глюкози de novo з амінокислот, лактату, пірувату, гліцерину (глюконеогенез), в результаті чого глюкоза з печінки надходить у кровотік [72, 126, 127, 134, 138, 140].
Багато дослідників вважають, що прогресуюче погіршення вуглеводного обміну проходить через ПГН до ПТГ, представляючи дві окремі стадії розвитку діабету (при цьому ПТГ ближче до «кінцевої точки» – розвитку захворювання) і, скоріше за все, що первинним дефектом, який призводе до розвитку ПТГ, є все ж саме ІР. При цьому нормоглікемія підтримується до тих пір, поки ß-клітини острівців Лангерганса підшлункової залози здатні компенсаторно збільшувати секрецію інсуліну [72, 126, 127, 134, 138, 140].
Термін ПТГ був введений у 1979 році для ідентифікації граничного стану між ЦД II типу і нормою. І спочатку вважалося, що цей стан не асоційований з підвищеним ризиком судинних ускладнень. У 1985 році термін ПТГ був затверджений і введений у класифікацію ВООЗ як окремий стан порушеного вуглеводного обміну. У зв’язку з м’язовою ІР і дефектами секреції інсуліну при ПТГ відбувається менш ефективний розподіл глюкози під час перорального тесту толерантності до глюкози (ПТТГ) [72, 117, 118, 137, 138, 140].
Найбільш імовірна модель розвитку ГК-індукованого ПТГ є наступною. Спочатку в осіб, які тривалий час приймають ГКС починає наростати ІР, яка протягом довгого часу компенсується надлишковою продукцією інсуліну, в результаті чого показники глікемії залишаються в межах нормальних значень. Але згодом, при наростанні ІР, секреторна функція ß-клітин виснажується. При цьому, в першу чергу, виснажується рання фаза секреції інсуліну, у той час як базальна секреція залишається надлишковою. Клінічним проявом порушення ранньої фази секреції інсуліну є розвиток постпрандіальної гіперглікемії, тобто ПТГ. А вже гіперглікемія, яка розвинулася, надалі посилює ІР і дефект ß-клітин внаслідок глюкозотоксичності [72, 117, 118, 137, 138, 140].
Термін ПГН з’явився пізніше. Він вперше був використаний в 1997 році експертною комісією Американської діабетичної асоціації для опису зони між верхньою і нижньою межею норми глюкози у плазмі натще при ЦД ІІ типу, а потім, у 1999 році, був введений у класифікацію ВООЗ для ідентифікації осіб з рівнем глікемії, вищим за нормальний, але який не досягає цифр, що характерні для діабету (табл. 1.1) [145, 150, 158, 159].
Таблиця 1.1 – Діагностичні критерії ЦД та інших категорій гіперглікемії (ВООЗ, 1999 та 2006 рр., наказ МОЗ України № 356 від 22.05.2009)
| Концентрація глюкози, ммоль/л (мг/дл) | ||||
| Цільна кров | Плазма | |||
| Венозна | Капілярна | Венозна | Капілярна | |
| ЦД: | ||||
| Натще | >=6,1 (>=110) | >=6,1 (>=110) | >=7,0 (>=126) | >=7,0 (>=126) |
| і/або | ||||
| Через 2 години після навантаження глюкозою | >=10,0 (>=180) | >=11,1 (>=200) | >=11,1 (>=200) | >=12,2 (>=220) |
| ПТГ: | ||||
| Натще | <6,1 (<110) | <6,1 (<110) | <7,0 (<126) | <7,0 (<126) |
| і | ||||
| Через 2 години після навантаження глюкозою | >=6.7 (>=120) та | >=7,8 (>=140) та | >=7,8 (>=140) та | >=8,9 (>=160) та |
| <10,0 (<180) | <11,1 (<200) | <11,1 (<200) | <12,2 (<220) | |
| ПГН: | ||||
| Натще | >=5,6 (>=100) та | >=5,6 (>=100) та | >=6,1 (>=110) та | >=6,1 (>=110) та |
| <6,1 (<110) | <6,1 (<110) | <7,0 (<126) | <7,0 (< 126) | |
| і | ||||
| Через 2 години після навантаження глюкозою | <6,7 (<120) | <7,8 (<140) | <7,8 (<140) | <8,9 (<160) |
ПГН асоціюється з порушеною секрецією інсуліну та порушенням пригнічення викиду глюкози печінкою.
Загальноприйнятими діагностичними лабораторними критеріями порушень вуглеводного обміну є порогові рівні глікемії натще і через дві години після навантаження глюкозою [145, 150, 158, 162].
Таким чином, глюкокортикостероїдні препарати є важливою складовою при лікуванні великої кількості хвороб, до яких зокрема входять і тяжкі дерматози. Проте системна терапія ГКС спричиняє багато побічних ефектів, знання яких дозволить профілактично зменшити вірогідність їх появи. До побічних ефектів належать такі загрозливі стани, як порушення вуглеводного обміну у вигляді гіперглікемії аж до розвитку стероїдного діабету і порушення ремоделювання кісткової тканини, які проявляються як стероїдний ОП. Розробка методів лікування і профілактики цих двох ускладнень є актуальною проблемою, особливо щодо якості та тривалості життя хворих на тяжкі дерматози, яким тривало призначається кортикостероїдна терапія – часто єдиний метод лікування за життєвими показаннями.
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Методика загального обстеження хворих
Обстеження 134 хворих з тяжкими дерматозами, які знаходилися під нашим спостереженням, проводилося за допомогою комплексних клінічних та лабораторних методів [30].
За результатами описаних нижче досліджень хворі склали наступні групи: І група (103 пацієнти), які до надходження до стаціонару отримували системні ГКС. Цю групу було розподілено на наступні підгрупи: Іа підгрупа – 94 особи, у яких визначено порушення кісткового обміну; Іб підгрупа – 9 пацієнтів, які не мали порушень ремоделювання кісткової тканини; Ів підгрупа – 26 хворих, у яких визначено порушення рівня глікемії натще; Іг підгрупа – 77 осіб, у яких не було виявлено порушень рівня глюкози натще; Ід підгрупа – 21 хворий, у яких був виявлений позитивний ПТТГ; Іе підгрупа – 56 пацієнтів, у яких не виявлено порушень вуглеводного обміну. ІІ групу становила 31 особа, яким планувалося тривале системне лікування ГКС з приводу основного захворювання.
Перед початком лікування з’ясовувалися скарги, анамнез хвороби, анамнез життя хворих, проводилося їх ретельне клінічне обстеження. Оцінювався стан шкірних покривів і видимих слизових, периферичних лімфатичних вузлів, внутрішніх органів і систем (дихальна, серцево-судинна, травна, сечовидільна).
Клініко-лабораторне обстеження хворих проводилося при постановці діагнозу, впродовж стаціонарного лікування, а потім і при подальшому диспансерному спостереженні. Усім хворим проводився клінічний аналіз крові, загальний аналіз сечі, визначалася концентрація глюкози венозної крові, оцінювався рівень біохімічних показників функціонального стану печінки, підшлункової залози, рівень показників гостроти запального процесу (С‑реактивний білок, серомукоїди, сіалові кислоти, глікопротеїди), проводилися серологічні реакції крові на сифіліс. Усі хворі проходили рентгенологічне обстеження легенів.
Результати клінічного аналізу крові порівнювалися із загальноприйнятими показниками у міжнародній системі одиниць. Клінічне обстеження крові проводилося уніфікованими методами [30].
За норму для дорослих приймалися такі показники: кількість еритроцитів 4,0-5,0 × 1012/л, лейкоцитів 4,0-9,0 × 109/л, кількість гемоглобіну 120-160 г/л, ШОЕ 2-10 мм/год для чоловіків і 2-15 мм/год для жінок; лейкоцитарна формула: еозинофільні гранулоцити 0,5 -5 %, базофільні гранулоцити 0-1 %, паличкоядерні нейтрофільні гранулоцити 1-6 %, сегментоядерні нейтрофільні гранулоцити 47-72 %, лімфоцити 19-37 %, моноцити 3-11 %.
2.2 Біохімічні методи
Визначення рівня загального білка сироватки крові проводилося біуретовим способом (за норму приймалося 65-85 г/л). Вміст глюкози сироватки крові визначали глюкозооксидазним методом (норма – 3,33–6,2 ммоль/л). Рівень білірубіну (загального і кон’югованого) у сироватці крові визначали за методом Єндрашика (норма загального білірубіну – 8,5–25,5 мкмоль/л, кон’югованого – до 5 мкмоль/л), активність ферментів аланінамінотрансферази і аспартатамінотрансферази у крові – колориметричним динітрофенілгідразиновим методом за Райтманом і Френкелем (норма аланінамінотрансферази – до 0,684 ммоль/год×л, аспартатамінотрансферази – до 0,684 ммоль/год×л), визначення активності кісткової фракції лужної фосфатази (КФЛФ) у сироватці крові – шляхом гідролізу Р-нітрофенілфосфату (норма – 740-2290 нмоль/с×л) [30].
41 практично здорова особа склала контрольну групу для вивчення рівня КФЛФ, що була репрезентативною за віком та статтю.
2.2.1 Визначення вмісту глюкози у крові натще
Визначення рівня глікемії натще проводили у сироватці крові за допомогою глюкозооксидазного тесту, для якого використовували плазму капілярної крові [10, 47].
Для визначення рівня глікемії натще кров брали з ліктьової вени вранці після 12-годинного голодування у стерильні пробірки в об’ємі 5 мл. Сироватку отримували центрифугуванням крові впродовж 20 хвилин при 2500 об./хв і температурі 4 °С. Концентрацію глюкози визначали колориметричним ферментативним глюкозооксидантним методом, що базується на тому, що глюкоза у присутності ферменту глюкозооксидази окислюється киснем повітря з утворенням перекису водню. Колориметрія проводилася на фотоелектричному колориметрі КФК-3 № 90080”.
Нормальні показники рівня глюкози у плазмі крові знаходяться у межах 3,33-6,2 ммоль/л.
2.2.2 Визначення вмісту глюкози у крові за даними перорального тесту на толерантність до глюкози
У дослідженні брали участь тільки ті пацієнти, в яких вміст глюкози у сироватці за даними проведеного біохімічного аналізу крові був у межах норми.
Концентрація глюкози плазми капілярної крові визначалася колориметричним ферментативним глюкозооксидантним методом.
Результати ПТТГ інтерпретувалися наступним чином. Нормальна толерантність до глюкози характеризувалася рівнем глікемії у плазмі капілярної крові через 2 години після навантаження глюкозою <8,9 ммоль/л (<160 мг/дл). Підвищення концентрації глюкози у плазмі крові через 2 години після навантаженням глюкозою до значень ³8,9 ммоль/л (³160 мг/дл), але <12,2 ммоль/л (<220 мг/дл), свідчило про ПТГ. Вміст глюкози у плазмі крові через 2 години після навантаження глюкозою ³12,2 ммоль/л (³220 мг/дл) був підставою для встановлення попереднього діагнозу ЦД, який мав бути підтвердженим повторними визначеннями.
2.3 Морфологічні методи
У ряді випадків при неможливості постановки діагнозу на підставі клінічних даних проводилося патогістологічне дослідження біоптатів шкіри з осередків ураження. З метою диференціальної діагностики пухирних дерматозів (вульгарної пухирчатки, герпетиформного дерматиту Дюрінга, пемфігоїда, що рубцюється) проводилося цитологічне дослідження вмісту бульозних елементів і мазків-відбитків з ерозивних поверхонь [62].
2.4 Імуноферментні дослідження
2.4.1 Визначення С-кінцевих телопептидів, що утворюються при деградації колагену I типу у сироватці крові людини
Колаген I типу становить більше 90 % органічного матриксу кістки і синтезується безпосередньо у кістках. Під час оновлення кісткової тканини колаген I типу деградує, а невеликі пептидні фрагменти потрапляють у кров. Дані фрагменти досліджені набором Serum CrossLaps One Step ELISA (Nordic Bioscience Diagnostics, Данія).
Проводився забір крові вранці натщесерце з вени в об’ємі 5 мл. Відокремлювалася сироватка від клітин протягом трьох годин після збору крові. Зразки негайно заморожувалися при температурі –18 °С.
Перед використанням набору всім компонентам дозволяли досягти кімнатної температури. Зразки поміщали у стрипи. Використовувалися і контрольні стрипи від здорових донорів. Стрипи для дослідження поміщалися в утримувачі. Потім проводилося приготування розчину антитіл (змішування біотинілованих антитіл, кон’югатів пероксидази з антитілами, а також буфером для інкубації у співвідношенні 1:1:100 у чистій ємності) для визначення одностадійної інкубації, промивання стрипів 5 разів відмиваючим буфером та інкубація з хромогенним субстратом. Після зупинення кольорової реакції проводили вимірювання оптичної щільності впродовж 2 годин при 450 нм.
Розрахунок середнього значення для дублів оптичної щільності проводився за допомогою побудови стандартної кривої. На вісі ординат відмічалися оптичні щільності стандартів напроти відповідних концентрацій CrossLaps, які відкладалися на вісі абсцис. Інтерполяризацією визначалися концентрації зразків і контролів пацієнтів.
Нормальний діапазон рівня С-кінцевого телопептиду складає у жінок у період пременопаузи 0,291–0,756 нг/мл, у жінок у постменопаузі – 0,166–0,476 нг/мл, у чоловіків – 0,142–0,512 нг/мл.
2.4.2 Визначення N-MID остеокальцину
Остеокальцин синтезується остеобластами. Після утворення він частково включається у кісткову тканину, а частково потрапляє у систему циркуляції. Рівень циркулюючого остеокальцину відображає швидкість утворення кістки.
Для кількісного визначення остеокальцину використовувалася тест-система Nordic Bioscience Diagnostics A/S N-MID Osteocalcin One Step ELISA (Данія).
Пацієнтам проводився забір крові у ранкові години в об’ємі 5 мл. У зразку відділяли сироватку протягом 3 годин і заморожували при температурі –18 °С.
Основу методу становить використання двох високоспецифічних моноклональних антитіл (Mabs) до остеокальцину. Одні антитіла розпізнають середню частину (амінокислотний фрагмент 20-29) поліпептиду, захоплюючи його, а інші, кон’юговані з пероксидазою, розпізнають N-термінальну ділянку (амінокислотні залишки 10-16). Додатково до інтактного остеокальцину (1-49) детектується N-кінцевий-середній фрагмент (1-43).
Спочатку стандарти, контролі і зразки вносилися у відповідні комірки, покриті стрептовідином. Потім у комірки додавалася суміш біотинільованих антитіл. Після зупинення кольорової реакції проводилося вимірювання оптичної щільності впродовж 2 годин при 450 нм.
Розрахунок середнього значення для дублів оптичної щільності виробу здійснювався за допомогою побудови стандартної кривої. На вісі ординат відкладалися оптичні щільності стандартів проти відповідних концентрацій остеокальцину, значення яких відзначалися на вісі абсцис. Інтерполяризацією визначалися концентрації контролів і зразків від пацієнтів.
Нормальним діапазон остеокальцину вважається, коли у жінок у пременопаузі він становить 11,4–24,4 нг/мл, у жінок у постменопаузі – 18,9–37,9 нг/мл, у чоловіків – 12,3–30,5 нг/мл.
Для вивчення рівня остеокальцину та С-кінцевого телопептиду було залучено контрольну групу, що складалася з 20 практично здорових осіб, які були репрезентативними за статтю і віком.
2.5 Інструментальні методи
Для оцінки кісткової міцності обстежуваним хворим проводилася ультразвукова денситометрія на апараті «Omnisense 8000S» фірми «Sunlight Medical» (Японія).
Даний метод дослідження ґрунтується на вимірюванні швидкості розповсюдження ультразвуку в кістці. Частота датчиків становила 500 кГц.
Проведення ультразвукової денситометрії не вимагало спеціальної підготовки пацієнтів. Вимірювання швидкості поширення ультразвукової хвилі кістковою тканиною проводилося у дистальних відділах променевих і великогомiлкових кісток, а також у проксимальних фалангах третіх пальців кистей. Датчики, які передають і приймають імпульси, фіксували на бічних поверхнях обстежуваних ділянок. Тривалість одного дослідження становила 10 хвилин.
Результати вимірювань виводилися на цифрове табло пристрою і записувалися на паперовий інформаційний носій.
У результаті дослідження отримували наступні показники ультразвукової денситометрії:
– швидкість поширення ультразвукової хвилі через кістку в м/с;
– Z- і Т-критерії у величинах стандартного відхилення.
Показник Z (Z-score) є різницею між дійсним показником мінеральної кісткової маси у кожного обстежуваного пацієнта і середньотеоретичною нормою того ж віку, вираженою як частина стандартного відхилення.
Показник Т (T-score) – це різниця між показниками мінеральної кісткової маси і щільності кісткової тканини в обстежуваного і середньотеоретичним піком цих показників у віці 40 років. Показник Т не залежить від віку, і саме він є основоположним при постановці діагнозу ОП.
Згідно з рекомендаціями ВООЗ, діагностика ОП проводилася за показником Т у виді стандартних відхилень (SD) від норми: до –1 SD – норма; від –1 SD до –2,5 SD – остеопенія; менше –2,5 SD без переломів – ОП; менше –2,5 SD + 1 перелом – тяжкий ОП.
2.6 Статистичні методи
Для обчислення і статистичної обробки отриманих результатів з метою їх подальшого аналізу використовували комп’ютерну програму «Microsoft Excel». За її допомогою розраховували відсотки, а також середнє арифметичне, стандартну похибку середнього арифметичного ряду величин, а також, використовуючи t-критерій Ст’юдента-Фішера, достовірність розходжень (р) з контрольними та іншими групами, з початковими значеннями досліджуваних параметрів [31].
РОЗДІЛ 3
КЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ НА ТЯЖКІ ДЕРМАТОЗИ
У дослідження щодо впливу системних ГКС на процеси ремоделювання кісткової тканини та вуглеводний обмін у хворих на тяжкі розповсюджені дерматози було залучено 134 особи, серед яких було 59 (44,0 %) жінок і 75 (56,0 %) чоловіків. Вік пацієнтів знаходився у межах від 21 до 65 років.
Серед хворих вульгарна пухирчатка відмічалася у 61 пацієнта (45,5 %), тяжкі форми псоріазу – у 44 (32,8 %), дерматит Дюрінга – у 21 (15,7 %), пемфігоїд, що рубцується, – у 7 (5,2 %), пруриго – у 1 (0,8 %). З них 103 (76,9 %) особи раніше отримували тривалу (6 місяців та довше) терапію ГКС, вони склали I групу пацієнтів. II групу становили пацієнти (31 хворий – 23,1 %), яким планувалося і після обстеження було призначено та проводилося тривале системне лікування ГКС з приводу дерматозу.
Найбільша кількість хворих була у працездатному віці (31–50 років) – 62,7 % (рис. 3.1).
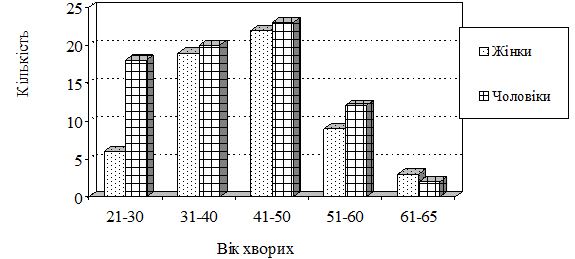
Рисунок 3.1 – Розподілення хворих за віком і статтю
При аналізі результатів анамнестичного обстеження хворих на тяжкі хронічні дерматози встановлено, що пацієнти І групи при попередньому лікуванні одержували як моно-, так і комбіновану терапію ГКС у дозах від 5 до 30 мг на добу у перерахунку на преднізолон, у тому числі системними ГКС пролонгованої дії (дипроспан, депо-медрол, флостерон та іншими). Для перорального застосування використовували таблетки метилпреднізолону, преднізолону, полькортолону, дексаметазону, а парентерально – розчини дексаметазону та гідрокортизону.
Таблиця 3.1 – Розподілення хворих за нозологічними формами
| Захворювання | Кількість пацієнтів | З них | |
| чоловіків | жінок | ||
| Вульгарна пухирчатка | 61 | 27 | 34 |
| Тяжкі форми псоріазу | 44 | 32 | 12 |
| Дерматит Дюрінга | 21 | 15 | 6 |
| Пемфігоїд, що рубцюється | 7 | 1 | 6 |
| Пруриго | 1 | – | 1 |
| Всього | 134 | 75 | 59 |
На початку лікування у стаціонарі хворі отримували більш високі дози з поступовим зниженням, а згодом – індивідуально підібрані підтримувальні дози.
Виходячи з того, що існує добовий біоритм продукції ГКС організмом, 2/3 добової дози цих препаратів призначали з 8 до 9 години ранку і 1/3 її – до 16 годин після прийому їжі [43].
Початкова доза ГКС для пацієнтів усіх груп у стаціонарі становила 30–90 мг на добу у перерахунку на преднізолон. Її підбирали залежно від генералізації та тяжкості шкірного процесу.
Окрім порушень вуглеводного обміну і ГК-індукованого ОП у хворих спостерігалися й інші супутні захворювання, а саме патологія з боку серцево-судинної системи (гіпертонічна хвороба, серцева недостатність), кровотворення (анемія), з боку травної системи (дискінезія жовчовивідних шляхів, холецистит, жовчнокам’яна хвороба), сечовивідної системи (хронічний пієлонефрит, сечокам’яна хвороба), репродуктивної (фіброміома матки), опорно-рухової (остеоартроз), ендокринної (автоімунний тиреоїдит без порушення ендокринної функції щитовидної залози), нервової (нейро-циркуляторна дистонія), дихальної (бронхіальна астма, тонзиліт) (табл. 3.2).
Таблиця 3.2 – Супутня патологія у хворих на тяжкі дерматози
| Групи
захворювань |
Супутні захворювань | Кількість пацієнтів | |
| абсо-лютна | у відсотках до загальної кількості | ||
| Серцево-судинна патологія і захворювання органів кровотворення | Гіпертонічна хвороба | 52 | 38,81 |
| Серцева недостатність | 21 | 15,67 | |
| Порок серця | 1 | 0,75 | |
| Анемія | 5 | 3,73 | |
| Ендокринна патологія | Автоімунний тиреоїдит без порушення ендокринної функції щитовидної залози | 7 | 5,22 |
| Патологія з боку гепатобіліарної системи | Дискінезія жовчовивідних шляхів | 32 | 23,88 |
| Холецистит | 11 | 8,21 | |
| Жовчнокам’яна хвороба | 3 | 2,24 | |
| Патологія з боку сечовивідної системи | Хронічний пієлонефрит | 5 | 3,73 |
| Нирковокам’яна хвороба | 3 | 2,24 | |
| Патологія з боку репродуктивної системи | Фіброміома матки | 11 | 8,21 |
| Патологія з боку опорно-рухової системи | Остеоартроз | 3 | 2,24 |
| Патологія нервової системи | Нейро-циркуляторна дистонія | 54 | 40,30 |
| Захворювання бронхо-легеневої системи і ЛОР-органів | Бронхіальна астма | 1 | 0,75 |
| Тонзиліт | 6 | 4,48 | |
Як видно з табл. 3.2, найбільша кількість хворих, які брали участь у дослідженнях, мали як супутню патологію нейро-циркуляторну дистонію (40,30 %), гіпертонічну хворобу (38,81 %) і дискінезію жовчовивідних шляхів (23,88 %).
Наводимо клінічну картину досліджуваних захворювань.
У хворих на істинну пухирчатку клінічна картина була представлена поширеними ерозивними елементами, множинними везикулами і бульозними елементами з тонкою покришкою, які мали тенденцію до периферичного росту і злиття між собою з утворенням великих осередків на фоні незміненої шкіри. Елементи мали різні розміри, а також форму: овальну, грушоподібну або неправильну. Їх вміст був спочатку серозний, а через деякий час каламутнів. Вони швидко розкривалися самостійно або при незначній травмі з формуванням ерозій, що мали соковите червоне дно і на периферії яких знаходилися обривки покришки бульозного елементу. На слизових оболонках порожнини рота, губ, нерідко на слизовій оболонці зовнішніх статевих органів спостерігалися ерозії з ярким дном та по периферії – обривки епідермісу. У ході лікування на ерозивних поверхнях формувалися шаруваті коричнюваті кірки. Спостерігався позитивний симптом Нікольського.
При клінічних ознаках істинної пухирчатки для верифікації діагнозу проводилося цитологічне дослідження вмісту бульозних елементів і мазків-відбитків з ерозивних поверхонь шкіри і слизових оболонок (до трьох разів). При виявленні акантолітичних клітин встановлювали діагноз: істинна пухирчатка.
Наводимо опис клінічного спостереження випадку вульгарної пухирчатки.
Хвора А., 48 років (історія хвороби № 15 від 05.01.12 р.) поступила у клініку зі скаргами на ураження слизової оболонки порожнини рота, висипання на шкірі тулуба, кінцівок, що супроводжувалися значною болісністю, печінням.
З анамнезу відомо, що пацієнтка хворіє впродовж 2 місяців. Захворювання почалося з появи болісних бульозних елементів та ерозій на слизовій оболонці порожнини рота (рис. 3.2). Звернулася до стоматолога, який призначив полоскання розчинами антисептиків. У зв’язку з поширенням процесу на шкіру тулуба, кінцівок звернулася до дерматолога за місцем проживання, де було діагностовано вульгарну пухирчатку та призначені системні ГКС у дозі 30 мг преднізолону на добу. Стан хворої поступово погіршувався, у зв’язку з чим поступила на лікування до відділення дерматології Державної установи «Інститут дерматології та венерології НАМН України» (рис. 3.3).
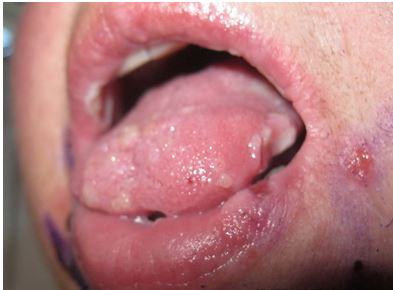
Рисунок 3.2 – Хвора А., історія хвороби № 15, діагноз: вульгарна пухирчатка, гормонозалежна форма, ураження слизової оболонки порожнини рота та червоної облямівки губ
Спадковість не обтяжена, алергічні реакції не виявлені.
Вірусний гепатит, туберкульоз, венеричні захворювання заперечує.
При обстеженні загальний стан середньої тяжкості.
Правильної статури, підвищеного харчування. Вага – 74 кг. Наявні ознаки синдрому Іценка-Кушинга. Периферичні лімфатичні вузли не збільшені. При аускультації легенів везикулярне дихання, частота дихальних рухів – 18 на хвилину. При аускультації серця тони ясні, ритмічні. Частота серцевих скорочень – 68 уд./хв., артеріальний тиск – 110/80 мм рт. ст. Живіт збільшений в об’ємі, при пальпації м’який, безболісний, наявна пупкова грижа. Печінка у краю реберної дуги, селезінка не пальпується. Симптом постукування негативний з обох боків. Сечовиділення, дефекація не порушені (зі слів хворої).
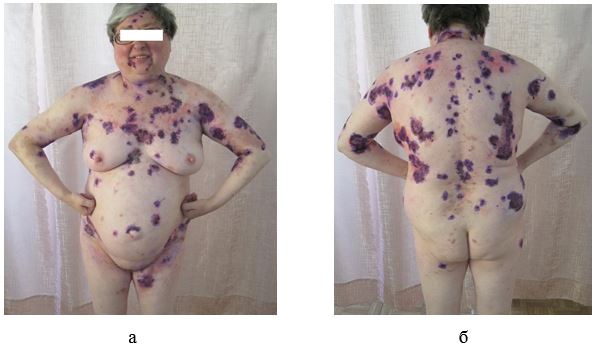
Рисунок 3.3 – Хвора А., історія хвороби № 15, діагноз: вульгарна пухирчатка, гормонозалежна форма, ураження тулуба та кінцівок
При огляді виявлено, що дерматоз мав розповсюджений характер: локалізувався на слизовій оболонці порожнини рота, шкірі тулуба, кінцівок. На слизовій ротової порожнини (щічній поверхні, бокових поверхнях язика, червоній облямівці губ) відзначалися множинні ерозії неправильних обрисів з яскраво-червоним дном інде вкриті білим нальотом. На шкірі грудей, спини, пахвових западин яскраво-гіперемовані ерозії до 0,5–1 см у діаметрі, деякі – із серозно-геморагічними кірочками на поверхні; поодинокі бульозні елементи з серозно-геморагічним вмістом. Обличчя з вираженими округлими щоками та гіперемованою шкірою, з поодинокими телеангіектазіями.
У клінічному аналізі крові відмічалося підвищена швидкість осідання еритроцитів (20 мм/год), що свідчило про наявність запального процесу в організмі.
Цитологічне дослідження № 3/11: у цитопрепаратах визначалися групи акантолітичних клітин, дрібних, з пікнотичним ядром, без зональної базофілії. Фон – еозинофіли, десквамований епітелій, що стало підставою для підтвердження діагнозу вульгарна пухирчатка.
При аналізі результатів біохімічного дослідження крові звертав на себе увагу знижений вміст КФЛФ – 399,2 нмоль/с∙л.
При проведенні імуноферментного аналізу з визначення остеокальцину та С-кінцевого телопептиду встановлено, що їх рівні становили відповідно 10,5 і 0,805 нг/мл.
Знижений вміст КФЛФ і остеокальцину та підвищений вміст С-кінцевого телопептиду свідчив про порушення процесів ремоделювання кісткової тканини у пацієнтці.
Оскільки хвора тривало отримувала системні ГКС, їй було проведено вивчення стану вуглеводного обміну: аналіз крові на вміст глюкози натще – 4,5 ммоль/л; у зв’язку з тим, що рівень глюкози був у межах норми у подальшому проведено ПТТГ. Рівень глюкози у крові через 2 години після навантаження становив 6,2 ммоль/л, що відповідало нормальним значенням.
З огляду на тривалий прийом ГКС хворій проводилося денситометричне дослідження кісткової тканини для визначення її мінеральної щільності. Проведені обстеження свідчили про наявність у пацієнтці ОП, у зв’язку з пониженими значеннями Т-критерію при ультразвуковій кістковій денситометрії: Т-критерій при дослідженні променевої кістки – (-2,5), великогомілкової кістки – (-2,7), проксимальної фаланги кистей – (-2,6).
На підставі даних анамнезу, клініко-лабораторних та інструментальних досліджень, об’єктивного обстеження був поставлений діагноз: «Пухирчатка вульгарна, гормонозалежна форма. Ускладнення: синдром Іценка-Кушинга, стероїдний ОП».
У групу пацієнтів, що мали тяжкі форми псоріазу, увійшли 14 хворих на ексудативний псоріаз, 18 – на артропатичний, 7 – на пустульозний і 5 – на псоріатичну еритродермію.
Як правило, пацієнти поступали у клініку в загальному середньотяжкому стані, нерідко з підвищенням температури тіла до 38 °С. У хворих був уражений практично весь шкірний покрив, включаючи шкіру волосистої частини голови. Ураження були представлені дифузною гіперемією шкіри, інфільтрацією, великими інфільтративно-еритематозними осередками з масивним лущенням (від дрібно- до великопластинчастих) або нашаруванням кірок на поверхні. При ексудативних формах на тлі перелічених вище симптомів формувалися осередки мокнуття і набряклості шкіри. У більшості пацієнтів відзначалися вторинні глибокі тріщини з геморагічними виділеннями, особливо на шкірі розгинальних поверхонь суглобів, що супроводжувалося вираженими больовими відчуттями. Псоріатична тріада в усіх пацієнтів була позитивною.
Ураження суглобів клінічно проявлялося їх набряком, у важких випадках деформацією, аж до розвитку анкілозів. Суб’єктивно ураження суглобів проявлялося ранковою скутістю, їх болісністю у спокої, при активних і пасивних рухах. Діагноз «Псоріатична артропатія» підтверджувався даними рентгенологічного дослідження.
Клінічний випадок псоріазу з псоріатичною артропатією.
Хворий С., 30 років (історія хвороби № 651 від 11.06.12 р.), поступив у стаціонар зі скаргами на ураження шкіри тулуба, кінцівок, волосистої частини голови, сильні болі у суглобах кистей, стоп, поперековому відділі хребта як у спокої, так і при русі, ранкову скутість в уражених суглобах.
На момент госпіталізації хворів впродовж 4 років. Захворювання проявлялося висипаннями на шкірі тулуба, кінцівок. Через 2 роки від маніфестації дерматозу приєдналися болі у суглобах. Лікувався у шкірно-венерологічному диспансері за місцем проживання, отримував дексаметазон, медрол, преднізолон у дозі до 30 мг на добу в перерахунку на преднізолон, нестероїдні протизапальні засоби тривалими курсами впродовж 2 років. У зв’язку зі значним погіршенням стану поступив для лікування до відділення дерматології Державної установи «Інститут дерматології та венерології НАМН України» (рис. 3.4).
Спадковість не обтяжена, алергічні реакції не виявлені. Вірусний гепатит, туберкульоз, венеричні захворювання заперечував. Патології з боку внутрішніх органів і систем не зазначалося.
При обстеженні загальний стан був середньої тяжкості.
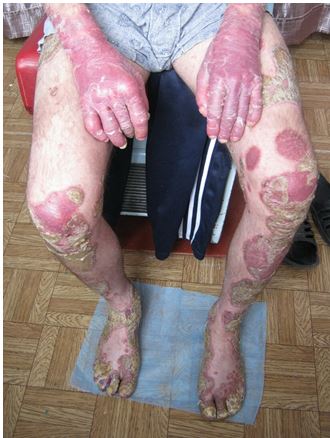
Рисунок 3.4 – Хворий С., історія хвороби № 651, діагноз: псоріатична артропатія
Астенічної статури, помірного харчування. Вага – 65 кг. Температура тіла 37,5 °С. Периферичні лімфатичні вузли не збільшені. При аускультації легень везикулярне дихання, частота дихальних рухів – 18 за хвилину. При аускультації серця тони ясні, ритмічні. Частота серцевих скорочень – 96 уд./хв, артеріальний тиск – 130/70 мм рт. ст. Живіт при пальпації м’який, безболісний. Печінка пальпувалася у краю реберної дуги, селезінка не збільшена. Симптом постукування негативний з обох боків. Сечовиділення, дефекація не порушені (зі слів хворого).
При огляді: дерматоз мав розповсюджений характер. Представлений множинними великими інфільтративно-еритематозними бляшками зі значним лущенням і кірками на поверхні шкіри, переважно нижніх кінцівок. Тильна поверхня кистей яскраво-гіперемована, з блискучою поверхнею. На долонях виражена інфільтрація, тріщини. Нігтьові пластинки кистей, стоп потовщені, деформовані, коричнево-жовтого кольору. Суглоби кистей, стоп набряклі, деформовані, рухи у суглобах обмежені.
Лабораторне обстеження показало такі результати.
У клінічному аналізі крові швидкість осідання еритроцитів становила 60 мм/год., що свідчило про гострозапальний процес у організмі.
У біохімічному аналізі крові відмічався позитивний С-реактивний протеїн, підвищений рівень серомукоїдів – 256 у.о., сіалових кислот – 250 у.о., глікопротеїдів – 0,58 у.о., що свідчило про ушкодження сполучної тканини; КФЛФ – 388,4 нмоль/с×л (знижений рівень), що характерно для порушення ремоделювання кісткової тканини.
З огляду на те, що хворий тривало використовував у лікуванні системні ГКС, проводилося вивчення стану кісткової тканини. Остеокальцин – 9,2 нг/мл (знижений урівень), С-кінцевий телопептид – 0,618 нг/мл (підвищений рівень), що свідчило про порушення з боку кісткової тканини.
Для виключення ускладнень з боку вуглеводного обміну на тлі прийому системних ГКС проводився аналіз крові на вміст глюкози натще і з подальшим навантаженням глюкозою: натще 4,0 ммоль/л, через 2 години після навантаження глюкозою – 6,1 ммоль/л. Тобто ці показники були у межах норми.
За даними рентгенографії уражених суглобів виявлено псоріатичний артрит.
Для визначення МЩКТ проводилося ультразвукове денситометричне обстеження: Т-критерій при дослідженні променевої кістки дорівнював (-2,6), великогомілкової кістки – (-2,6), проксимальної фаланги кистей – (-2,7). Значно знижені показники Т-критерію свідчили про наявність у хворого ОП.
На підставі даних анамнезу, клініко-лабораторних та інструментальних досліджень, об’єктивного обстеження був поставлений діагноз: «Псоріаз розповсюджений, прогресуюча стадія. Псоріатична артропатія дистально-проксимального типу, активність III ст., недостатність функції суглобів – I ст. Ускладнення: стероїдний ОП».
Наводимо випадок пустульозного псоріазу.
Хворий С., 29 років (історія хвороби № 296 від 13.03.13 р.), поступив у стаціонар зі скаргами на ураження всього шкірного покриву, які супроводжувалися болісністю і печінням, а також на загальну слабкість, періодичне підвищення температури тіла.
Хворіє псоріазом 12 років. Влітку 2012 року перебіг дерматозу погіршився, у зв’язку з чим хворий звернувся до дерматолога за місцем проживання, де йому був призначений метилпреднізолон по 16 мг на день. На тлі зниження дози кортикостероїдів у пацієнта знову настало загострення. У зв’язку з вираженим погіршенням перебігу дерматозу хворий поступив для лікування в Державну установу «Інститут дерматології та венерології НАМН України». Доза метилпреднізолону при прийомі до стаціонару становила 16 мг на добу.
Спадковість не обтяжена. Зазначав алергічні реакції на аспірин, екстракт алое для ін’єкцій, медичний тальк.
Вірусний гепатит, туберкульоз, венеричні захворювання заперечував.
При надходженні у стаціонар загальний стан середньої тяжкості. Температура тіла – 37,2 °С. Правильної статури, підвищеного харчування. Вага – 78 кг. Видимі слизові оболонки звичайного кольору, без висипань. Периферичні лімфатичні вузли не збільшені. При аускультації легень дихання везикулярне, частота дихальних рухів – 17 уд./хв. При аускультації серця тони ясні, ритмічні. Частота серцевих скорочень – 78 уд./хв, артеріальний тиск – 130/90 мм рт. ст. Живіт при пальпації м’який, безболісний. Печінка пальпувалася у краю реберної дуги, селезінка не пальпувалася. Симптом постукування негативний з обох боків. Сечовиділення, дефекація не порушені (зі слів хворого).
При огляді: дерматоз мав розповсюджений характер. Був представлений на шкірі тулуба, кінцівок дифузними яскравими еритематозно-набряковими осередками, на фоні яких розташовані множинні дисеміновані пустульозні елементи, інде з формуванням гнійних «озер» до 1-5 см у діаметрі, по периферії яких безліч дрібних пустульозних елементів (рис. 3.5).
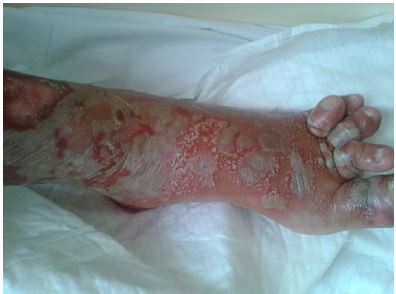
Рисунок 3.5 – Хворий С., історія хвороби № 296, діагноз: пустульозний псоріаз
Обстеження хворого виявило такі результати.
У клінічному аналізі крові відмічалося прискорена швидкість осідання еритроцитів – 55 мм/год., що було свідченням гострозапального процесу.
У біохімічному аналізі крові звертали на себе увагу підвищений рівень глюкози натще – 6,5 ммоль/л, знижений рівень КФЛФ – 320,7 нмоль/с×л, С‑реактивний білок – позитивний, підвищені гострофазові показники: серомукоїди – 696 у.о., сіалові кислоти – 391 у.о., глікопротеїди – 0,84 у.о.
Рівень остеокальцину був знижений до 10,5 нг/мл, а С-кінцевого телопептіду підвищений до 0,612 нг/мл, що свідчило про порушення ремоделювання кісткової тканини.
ПТТГ не проводився у зв’язку з рівнем глюкози натще 6,5 ммоль/л, що перевищував верхній рівень межі норми.
Дані денситометричного обстеження: Т-критерій при дослідженні променевої кістки – (-2,7), великогомілкової кістки – (-2,5), проксимальної фаланги кистей – (-2,3), що свідчило про наявність ОП.
На підставі даних анамнезу, клініко-лабораторних та інструментальних досліджень, об’єктивного обстеження хворого поставлений діагноз: «Пустульозний псоріаз, тип Цумбуша. Ускладнення: порушення глікемії натщесерце, стероїдний ОП».
У 95 % хворих на псоріаз відзначалася оніходистрофія, яка перебігала за типом точкової оніходистрофії, оніхогрифозу і атрофічної оніходистрофії.
У пацієнтів з герпетиформним дерматитом Дюрінга у клінічній картині домінували напружені бульозні елементи, що мали виражену тенденцію до групування, розташовані на набряковій еритематозній підставі. Крім цього, на шкірі тулуба, кінцівок відзначалися уртикароподібні еритематозні елементи, які нерідко зливалися з утворенням більш великих осередків, а також папули, пустули, бульозні елементи до 0,5–2 см у діаметрі, з щільною покришкою і серозним вмістом. У процесі лікування бульозні елементи і везикули розкривалися з утворенням ерозій, лусочок, кірочок, вторинної гіперпігментації. Слизові оболонки залишалися вільними від висипань. Появі висипань, як правило, передували суб’єктивні симптоми: свербіж, печіння і болісність.
При цитологічному дослідженні вмісту бульозних елементів і везикул, а також мазків-відбитків з дна ерозій визначалася значна кількість еозинофілів. Симптом Нікольського був негативний, проба Ядассона – позитивна. Захворювання у більшості випадків мало хронічний рецидивуючий перебіг.
Клінічний випадок герпетиформного дерматиту Дюрінга.
Хвора Х., 45 років (історія хвороби №158 від 08.02.13 р.), звернулася у клініку зі скаргами на висипання на всьому кожному покрову, інтенсивний свербіж, печіння, болісність шкіри, порушення сну.
З анамнезу встановлено, що пацієнтка хворіла даним захворюванням впродовж півроку. Лікувалася у шкірно-венерологічному диспансері за місцем проживання, де їй був поставлений діагноз «Токсикодермія» і призначений дексаметазон по 2,0 мл (8 мг) на добу внутрішньом’язово і метилпреднізолон по 16 мг на добу щоденно. На фоні лікування, яке проводилося, у пацієнтки спостерігали покращення у перебігу дерматозу. Проте після відміни дексаметазону за рекомендацією лікаря настало сильне загострення, на фоні якого хвора поступила у відділення дерматології Державної установи «Інститут дерматології та венерології НАМН України».
Спадковість не обтяжена, алергічні реакції не виявлені. Вірусний гепатит, туберкульоз, венеричні захворювання заперечувала. Патології з боку внутрішніх органів і систем не зазначала.
При обстеженні загальний стан середньої тяжкості. Правильної статури, помірного харчування. Вага – 68 кг. Температура тіла – 36,6 °С. Видимі слизові оболонки звичайного кольору, без висипань. Периферичні лімфатичні вузли всіх груп не збільшені, безболісні, не спаяні з навколишніми тканинами. При аускультації легень везикулярне дихання, частота дихальних рухів – 17 уд./хв. При аускультації тони серця ясні, ритмічні, частота серцевих скорочень – 65 уд./хв, артеріальний тиск – 118/80 мм рт. ст. Живіт при пальпації м’який, безболісний. Печінка, селезінка не збільшені. Симптом постукування негативний з обох боків. Сечовиділення, дефекація не порушені (зі слів хворої).
При огляді патологічний шкірний процес мав генералізований характер. Був представлений дифузною гіперемією, інфільтрацією шкірних покривів, множинними уртикарними, еритематозними, папульозними елементами, екскоріаціями, згрупованими везикулами та бульозними елементами, лущенням. На шкірі волосистої частини голови, задній поверхні шиї на фоні гіперемії та набряклості виділялися масивні серозно-гнійні кірки (рис. 3.6).
При обстеженні отримані такі результати.
У клінічному аналізі крові звертали на себе увагу підвищений рівень еозинофілів – 11 %, швидкість осідання еритроцитів – 28 мм/год, що свідчило про гострозапальний процес.
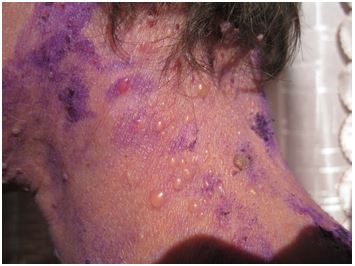
Рисунок 3.6 – Хвора Х., історія хвороби №158 від 08.02.13 р., діагноз: дерматит Дюрінга
Цитологічне дослідження вмісту везикул і мазків-відбитків з поверхні ерозій № 23-20: акантолітичні клітини не виявлені. На тлі десквамованого епітелію нейтрофілів визначалася велика кількість еозинофілів, що характерно для герпетиформного дерматиту Дюрінга.
Оскільки хвора тривалий час приймала системні ГКС, було проведено дослідження щодо вивчення стану кісткової тканини та вуглеводного обміну. КФЛФ – 612,8 нмоль/с×л, остеокальцин – 15,2 нг/мл, С-кінцевий телопептид – 0,354 нг/мл, що були у межах норми.
Дані денситометричного обстеження: Т-критерій вище -1,0 при дослідженні променевої кістки, великогомілкової кістки, проксимальної фаланги кистей, що свідчило про нормальний рівень МЩКТ.
ПТТГ: натще – 4,4 ммоль/л, через 2 години після навантаження глюкозою – 9,3 ммоль/л, що свідчило про наявність ПТГ.
На підставі даних анамнезу, клініко-лабораторних та інструментальних досліджень, об’єктивного обстеження був поставлений діагноз: «Герпетиформний дерматит Дюрінга, кортикостероїдзалежна форма. Ускладнення: ПТГ».
Для хворих з пемфігоїдом, що рубцюється, було характерне ураження слизової оболонки рота, кон’юнктиви, а у подальшому і шкіри. Висипання були представлені глибокими напруженими бульозними елементами, які довго не розкривалися, з серозним або серозно-геморагічним вмістом, при розриві покришки яких формувалися ерозії з дном яскраво-червоного кольору, не схильні до периферичного зростання. Згодом ерозії зсихалися у щільні кірки, після відторгнення яких залишалися гіперпігментовані плями, які злущувалися. Особливістю даного захворювання була здатність до виникнення везикул, бульозних елементів та ерозій на одних і тих самих місцях, що, врешті решт, призводило до розвитку рубцевих змін. Найчастіше ці елементи локалізувалися на шкірі волосистої частини голови, обличчі, кінцівках, у пахово-стегнових складках. Висипання зазвичай мали нечисленний характер і розташовувалися локалізовано. Захворювання, як правило, перебігало хронічно, тривало, з короткими неповними ремісіями. При цьому загальний стан хворих не змінювався.
Наводимо клінічний випадок лікування пацієнтки з пемфігоїдом, що рубцюється.
Під наглядом знаходилася пацієнтка А., 48 років (історія хвороби № 132 від 30.01.2012 р.), яка поступила до клініки зі скаргами на висипання на шкірі тулуба, кінцівок, які супроводжувалися помірною болісністю.
Страждала даним захворюванням впродовж 10 років. Два рази на рік проходила лікування у відділенні дерматології Державної установи «Інститут дерматології та венерології НАМН України» на фоні загострень шкірного патологічного процесу. Одержувала дапсон та системні ГКС.
Спадковість не обтяжена, алергічні реакції не виявлені. Вірусний гепатит, туберкульоз, венеричні захворювання заперечувала. Із супутньої патології відзначала гіпертонічну хворобу I стадії, автоімунний тиреоїдит без порушення ендокринної функції щитовидної залози.
При обстеженні загальний стан задовільний. З боку внутрішніх органів при огляді патології не виявлено.
При огляді шкірних покривів виявлено, що дерматоз мав розповсюджений характер, представлений на шкірі тулуба, кінцівок, потиличної ділянки волосистої частини голови згрупованими напруженими бульозними елементами на фоні помірної еритеми до 0,5 см у діаметрі з щільними покришками і серозним вмістом, свіжими ерозіями до 0,5 см у діаметрі на тлі рубцевих змін шкіри з обривками епідермісу. Також визначалися множинні осередки рубцевої атрофії на всьому шкірному покриві (рис. 3.7).
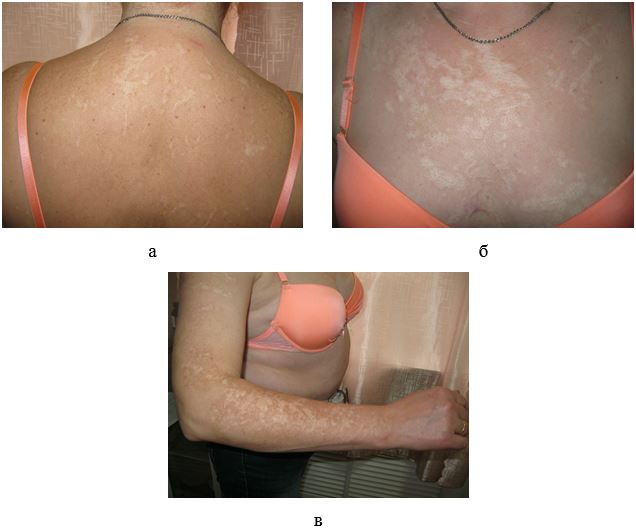
Рисунок 3.7 – Хвора А., історія хвороби № 132, діагноз: пемфігоїд, що рубцюється
При обстеженні отримані такі дані: у біохімічному аналізі крові КФЛФ – 603,7 нмоль/с×л, при імуноферментному аналізі: остеокальцин – 13,5 нг/мл, С‑кінцевий телопептід – 0,406 нг/мл.
ПТТГ: натще – 5,0 ммоль/л, через 2 години після навантаження глюкозою – 9,2 ммоль/л.
Денситометричне обстеження не виявило змін у процесах ремоделювання кісткової тканини.
На підставі даних анамнезу, клініко-лабораторних та інструментальних досліджень, об’єктивного обстеження був поставлений діагноз: «Пемфігоїд, що рубцюється, гормонозалежна форма. Супутня патологія: гіпертонічна хвороба I стадії, автоімунний тиреоїдит без порушення ендокринної функції щитовидної залози. Ускладнення: ПТГ кортикостероїдного генезу».
* * *
Таким чином, у дослідження було залучено хворих з тяжкими хронічними дерматозами здебільшого (62,7 %) в активному працездатному віці (31–50 років), лікування яких обов’язково потребувало тривалого призначення системних ГКС.
Найбільша кількість хворих, які брали участь у дослідженнях, мали як супутню патологію серцево-судинної системи (61 хворий – 45,5 %) і захворювання гепатобіліарної системи (23 пацієнти – 17,2 %), що значно обтяжувало перебіг захворювання.
Тому розробка методів лікування та профілактики ускладнень цієї терапії є важливим завданням, вирішення якого дасть змогу запобігти розвитку побічних явищ при тривалому лікуванні системними ГКС та проводити цю терапію нерідко за життєвими показаннями у достатньому обсязі.
Матеріали розділу викладено в наступних публікаціях:
1. Кутасевич Я.Ф. Оценка качества жизни пациентов тяжелыми дерматозами с глюкокортикостероид-индуцированным остеопорозом, как осложнением длительной терапии системными глюкокортикостероидными гормонами / Я.Ф. Кутасевич, И.А. Олейник, О.А. Левченко // Дерматологія та венерологія. – 2013. – № 1 (59). – С. 54–58.
2. Левченко О.О. Алгоритм дослідження стану кісткової тканини у хворих на тяжкі дерматози, що одержують довготривалу системну терапію глюкокортикостероїдними гормонами / О.О. Левченко // Дерматологія та венерологія. – 2013. – № 4 (62). – С. 79–84.
3. Кутасевич Я.Ф. Клинические проявления осложнений длительной терапии системными глюкокортикостероидными гормонами в практике дерматолога / Я.Ф. Кутасевич, И.А. Олейник, О.А. Левченко // Клінічна імунологія. Алергологія. Інфектологія. – 2012. – № 8 (57). – С. 49–51.
4. Кутасевич Я.Ф. Нерациональная системная терапия глюкокортикостероидными гормонами / Я.Ф. Кутасевич, И.А. Олейник, О.А. Левченко // Клінічна імунологія. Алергологія. Інфектологія. – 2013. – № 8 (67). – С. 51–53.
5. Кутасевич Я.Ф. Клинические признаки возможного развития побочных эффектов системных глюкокортикостероидов у больных с тяжелыми дерматозами / Я.Ф. Кутасевич, И.А. Олейник, О.А. Левченко // Розробки молодих вчених дерматовенерологів : Матеріали наук.-практ. школи. – К., 2011. – С. 26–28.
РОЗДІЛ 4
ПОРУШЕННЯ КІСТКОВОГО ОБМІНУ У ХВОРИХ НА ТЯЖКІ ДЕРМАТОЗИ,
ЩО ОДЕРЖУЮТЬ ДОВГОТРИВАЛУ ТЕРАПІЮ ГЛЮКОКОРТИКОЇДНИМИ
ГОРМОНАМИ (ДІАГНОСТИКА, ЛІКУВАННЯ, ПРОФІЛАКТИКА)
4.1 Особливості кісткового обміну у хворих, що одержували довготривалу терапію глюкокортикостероїдними гормонами
У дослідженні щодо вивчення порушень кісткового обміну, можливості його лікування і профілактики при системній терапії ГКС взяли участь 134 пацієнти з тяжкими дерматозами, яких було розподілено на дві групи.
До І групи увійшли хворі, яким терапія ГКС проводилася раніше (103 особи), які знаходилися на системній терапії кортикостероїдами (протягом 6 місяців та довше) з приводу тих чи інших тяжких дерматозів, серед них 53 жінки та 50 чоловіків віком від 21 до 65 років. За нозологічними формами хворі розподілялися таким чином: 46 пацієнтів страждали на істинну пухирчатку, 35 – на тяжкі форми псоріазу, 14 – на дерматит Дюрінга, 7 – на пемфігоїд, що рубцюється, 1 – на пруриго.
До ІІ групи – 31 хворий, яким було вперше призначено системну терапію ГКС. При подальшому дослідженні хворих І групи у відповідності до результатів, описаних нижче обстежень щодо виявлення можливих порушень кісткового обміну, було розподілено на підгрупи. Iа групу склали 94 особи (91,3 %), в яких відмічалися порушення в кістковому обміні, серед яких 46 пацієнтів хворі на вульгарну пухирчатку, 29 – на тяжкі форми псоріазу, 12 – на дерматит Дюрінга, 7 – на пемфігоїд, що рубцюється. Iб групу склали 9 пацієнтів (8,7 %), що не мали порушень з боку кісткового обміну і були репрезентативними за нозологічними формами.
При аналізі результатів анамнестичного обстеження хворих на тяжкі хронічні дерматози встановлено, що пацієнти при попередньому лікуванні одержували як моно-, так і комбіновану терапію ГКС у дозах від 5 до 120 мг на добу в перерахунку на преднізолон, у тому числі системними ГКС пролонгованої дії (дипроспан, депо-медрол, флостерон та іншими). Для перорального застосування використовували таблетки метилпреднізолону, преднізолону, полькортолону, дексаметазону, а парентерально – розчини дексаметазону та гідрокортизону.
Клінічні спостереження показали, що у хворих на тяжкі розповсюджені дерматози Іа групи при тривалому лікуванні системними ГКС приблизно на 3–6-му місяці від початку лікування залежно від доз отримуваних гормонів починалися патологічні процеси у кістках, причому спостерігалася прямо пропорційна залежність між розвитком симптомів порушень ремоделювання кісткової тканини і збільшенням дози ГКС, що клінічно відображалося у скаргах хворих цієї групи: біль у хребті (у грудо-поперековому відділі), у трубчастих кістках (стегновій, яка ближча до шийки стегнової кістки, променевій), а також у променевозап’ястковому суглобі. Біль мала інтенсивний, але короткотривалий характер, особливо при різких рухах, у деяких випадках він був слабко виражений, дифузний, постійний, переважно у нічний час. Пацієнти Iб групи не скаржилися на ураження з боку опорно-рухового апарату.
Для оцінки кісткового обміну та оцінки впливу системних ГКС на процеси ремоделювання кісткової тканини пацієнтам Iа групи було проведено дослідження з визначенням КФЛФ у сироватці крові (табл. 4.1). З таблиці видно, що рівень КФЛФ, яка є маркером кісткоутворення, був достовірно зниженим [(311,68 ± 12,53) нмоль/с∙л] порівняно з контрольною групою [(640,5 ± 41,3) нмоль/с∙л].
Дослідження рівня остеокальцину та С-кінцевого телопептиду проводилося імуноферментним методом 20 хворим Іа групи. Контрольну групу склали 20 здорових осіб, репрезентативних за статтю та віком. З таблиці 4.1 видно, що у хворих, які тривало одержували системні ГКС, відмічалося достовірне зменшення рівня остеокальцину [(2,52 ± 0,79) нг/мл] та підвищення рівня маркеру резорбції кісткової тканини (С-кінцевого телопептиду) – (0,65 ± 0,09) нг/мл порівняно з такими показниками в контрольній групі [(16,70 ± 1,84) і (0,29 ± 0,05) нг/мл відповідно).
Таблиця 4.1 – Маркери ремоделювання кісткової тканини у хворих на хронічні дерматози, які тривало одержували системну терапію ГКС
| Маркери | Іа група | Контроль |
| КФЛФ, нмоль/с∙л | 311,68 ± 12,53 | 640,5 ± 41,3, n=41 |
| Остеокальцин, нг/мл | 2,52 ± 0,79 | 16,70 ± 1,84 n=20 |
| С-кінцевий телопептид, нг/мл | 0,65 ± 0,09 | 0,29 ± 0,05 n=20 |
Визначення МЩКТ проводилося методом ультразвукової денситометрії 94 хворим Іа групи, в яких було відмічено порушення в ремоделюванні кісткової тканини. Це була група хворих, які переважно страждали на істинну пухирчатку, гормонозалежну форму. МЩКТ оцінювали за Т-критерієм. Т-критерій – це різниця між показниками мінеральної кісткової маси і щільності кісткової тканини в обстежуваного і середньотеоретичним піком цих показників у віці 40 років, не залежить від віку, і саме він є основоположним при постановці діагнозу ОП.
При оцінці Т-критерію встановлено, що остеопенія була виявлена у 11 осіб (35,5 %), ОП – у 20 (64,5 %). Значення Т-критерію, що відповідало нормальній МЩКТ, виявлено не було (табл. 4.2).
Отже, на підставі проведених обстежень хворих на тяжкі хронічні дерматози, які тривало отримували системну терапію ГКС: клінічних даних (скарги хворих), даних анамнезу (тривале застосування системних ГКС), лабораторних даних (визначення рівня КФЛФ, остеокальцину, С-кінцевого телопептиду у сироватці крові), інструментального обстеження (ультразвукова денситометрія кісткової тканини з визначенням Т-індексу), у 91,3 % з них встановлено особливості кісткового обміну у вигляді порушень ремоделювання кісткової тканини, яке проявлялося зниженням у сироватці крові маркерів кісткоутворення, а саме КФЛФ та остеокальцину, і підвищенням маркеру резорбції (С-кінцевого телопептиду), що при денситометричному дослідженні здебільшого підтверджувалося зменшенням МЩКТ.
Таблиця 4.2 – Значення Т-критерію до лікування у хворих Іа групи
(n = 94)
| Кістка | Т-критерій |
| Великогомілкова | –2,40 ± 0,09 |
| Променева | –2,66 ± 0,11 |
| Проксимальна фаланга III пальцю руки | –2,53 ± 0,07 |
Наведені результати ілюструють клінічні спостереження з цього приводу.
Приклад 1. Хвора В., 1967 року народження, історія хвороби № 2, поступила до стаціонару Державної установи «Інститут дерматології та венерології НАМН України» 02.01.14 р. зі скаргами на висипання у порожнині рота, на тулубі, кінцівках, які супроводжувалися інтенсивною болісністю, ниючими короткочасними болями у стегнових кістках і в ділянці поперекового відділу хребта.
З анамнезу відомо, що пацієнтка лікувалася з приводу вульгарної пухирчатки з 08.01.12 р. по 10.03.12 р. Отримувала дексаметазон по 2,0 мл (8 мг) внутрішньом’язово, медрол по 2 таблетки (8 мг), полькортолон по 3 таблетки (12 мг) і супутню терапію. Була виписана на підтримуючій дозі ГКС, їй призначили полькортолон по 3 таблетки на день (12 мг). Пацієнтка знову надійшла у стаціонар у зв’язку із загостренням захворювання 04.06.13, приєднанням скарг на болі з боку опорно-рухового апарату.
Дані клінічної картини, анамнезу захворювання (хворіє на вульгарну пухирчатку), скарги на болі в кістках та суглобах, тривале використання протягом півроку системних ГКС дало змогу запідозрити розвиток кортикостероїдного ОП, для чого було проведено додаткове обстеження.
При проведенні ультразвукової денситометрії виявлено початкову стадію ОП – остеопенію (Т-індекс дорівнював -1,5) (рис. 4.1).
При біохімічному дослідженні звертало на себе увагу зниження КФЛФ – 442,5 нмоль/с∙н що поряд зі зниженням МЩКТ (Т-індекс:-1,5) дало можливість підтвердити порушення з боку ремоделювання кісткової тканини і встановити діагноз ГК-індукованої остеопенії.
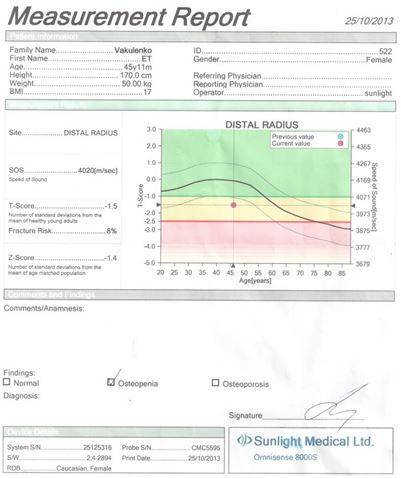
Рисунок 4.1 – Результати ультразвукової денситометрії хворого В., історія хвороби № 2. Остеопенія
Приклад 2. До стаціонару Державної установи «Інститут дерматології та венерології НАМН України» поступила пацієнтка П., 63 роки, історія хвороби № 1867, яка знаходилася на стаціонарному лікуванні з 15.11.12 р. по 30.11.12 р. з приводу пруриго. Їй було призначено лікування полькортолоном по 3 таблетки на добу (12 мг). Хвора була виписана у стані клінічного поліпшення. При виписці пацієнтці рекомендували продовжити підтримуючу терапію полькортолоном по 2 таблетки на добу впродовж 6 місяців. При повторному надходженні у стаціонар 11.05.13 р. хвора пред’являла скарги на незначний свербіж шкіри та інтенсивні постійні болі у поперековому відділі хребта.
Клінічна картина, анамнез захворювання (хворіла на пруриго, з приводу чого півроку отримувала системну терапію ГКС), скарги на інтенсивні постійні болі у поперековому відділі хребта дали підставу припустити наявність кортикостероїдного порушення ремоделювання кісткової тканини, у зв’язку з чим хворій було проведено додаткове обстеження з метою виявлення порушень з боку кісткової тканини.
На підставі даних ультразвукової денситометрїї виявлено ОП (Т-індекс: ‑3,8) (рис. 4.2), при біохімічному обстеженні встановлено зниження КФЛФ – 225,5 нмоль/с∙л, що стало обгрунтуванням для встановлення діагнозу ГК-індукований ОП.
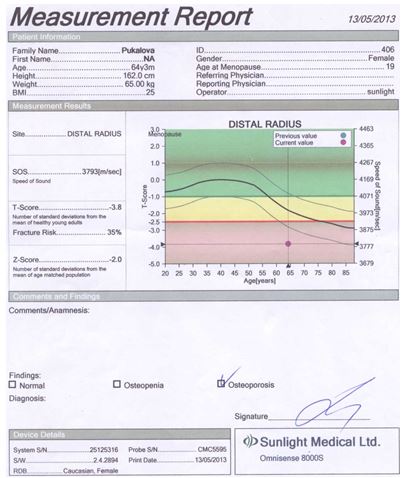
Рисунок 4.2 – Результати ультразвукової денситометрії хворої П., історія хвороби № 1867. Остеопороз
Приклад 3. Хворий С., 1984 року народження, історія хвороби № 478, поступив у стаціонар Державної установи «Інститут дерматології та венерології НАМН України» 19.04.13 р. з діагнозом пустульозний псоріаз. З анамнезу відомо, що пацієнт лікувався з приводу даного захворювання у шкірно-венерологічному диспансері за місцем проживання, отримував преднізолон по 20 мг на добу впродовж 6 місяців.
При надходженні до стаціонару пред’являв скарги на дифузну гіперемію шкіри, множинні дрібнопапульозні і пустульозні висипання, помірні періодичні болі у стегнових кістках і кістках передпліч, що дало можливість припустити порушення ремоделювання кісткової тканини, пов’язане з тривалим використанням системних ГКС. У зв’язку з цим, хворому призначено додаткове обстеження у вигляді визначення маркеру кісткоутворення (КФЛФ), а також визначення МЩКТ за допомогою ультразвукової денситометрії.
При проведенні ультразвукової денситометрії виявлено ознаки остеопенії (Т-індекс склав: -1,7) (рис. 4.3).
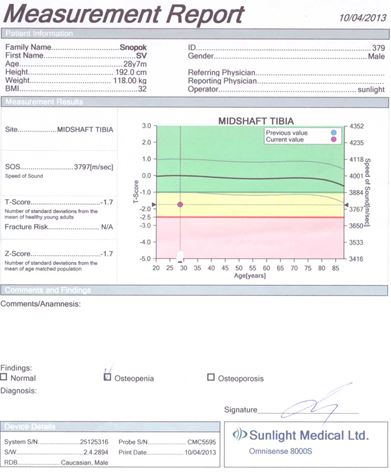
Рисунок 4.3 – Результати ультразвукової денситометрії хворого С., історія хвороби № 478. Остеопенія
При біохімічному дослідженні у сироватці крові відмічено зниження рівня КФЛФ (425,2 нмоль/с∙л) порівняно з контрольною групою [(640 ± 41,3) нмоль/с∙л].
На підставі проведених обстежень хворому встановлено діагноз: пустульозний псоріаз, ускладнений ГК-індукованою остеопенією.
4.2 Розробка методів корекції порушень кісткового обміну у хворих на тяжкі дерматози, які отримували системну терапію глюкокортикостероїдами
4.2.1 Обґрунтування методу корекції та профілактики порушень
ремоделювання кісткової тканини
Проведені дослідження показали, що тривале використання системних ГКС призводить до порушень ремоделювання кісткової тканини, а саме до зменшення МЩКТ за рахунок не тільки посилення процесів резорбції, але й пригнічення процесів кісткоутворення, що потребує адекватної корекції та розробки лікувальних і профілактичних заходів щодо запобігання цих ускладнень.
Для дослідження можливостей корекції ремоделювання кісткової тканини у хворих на тяжкі дерматози, яким призначена системна терапія ГКС, було обрано два препарати: кальцій із синтетичним вітаміном Д3 («Кальцій-Д3 Нікомед») і алендронова кислота.
«Кальцій-Д3 Нікомед» містить кальцію карбонат і вітамін D3 – дві складові, які входять до базової терапії при порушеннях ремоделювання кісткової тканини в якості субстрату для формування кісткової тканини. Наявність вітаміну D3 сприяє більш активному засвоєнню кальцію кістковою тканиною [39, 71, 153].
Для пригнічення підвищеної остеокластичної кісткової резорбції, яка супроводжує процеси порушення ремоделювання кісткової тканини при тривалій терапії ГКС, призначалася алендронова кислота – бісфосфонат II генерації. Алендронова кислота належить до групи амінобісфосфонатів і діє як ефективний негормональний специфічний інгібітор остеокластичної кісткової резорбції. Вона підвищує щільність кісток, сприяє формуванню кісткової тканини з нормальною гістологічною структурою [34, 84, 90, 105, 111, 114, 136].
Для лікування виявленого вторинного порушення процесів ремоделювання кісткової тканини (ОП та остеопенії) у 94 хворих на тяжкі дерматози, які взяли участь у дослідженні, було застосовано наступну методику. Перший тиждень пацієнтам призначався «Кальцій-Д3 Нікомед» всередину по 1 таблетці 2 рази на добу для насичення плазми крові кальцієм. На наступний тиждень до схеми додавали алендронову кислоту всередину по 1 таблетці (70 мг) 1 раз на тиждень. Курс лікування складав 6 місяців.
Алендронова кислота, яка є діючою речовиною препарату «Алендра», як і будь-який пероральний бісфосфонат має низьку біодоступність, тому рекомендувалося її приймати вранці, натщесерце, запиваючи водою. А для максимального запобігання подразнення слизових оболонок шлунково-кишкового тракту (побічний ефект застосування бісфосфонатів) після прийому алендронової кислоти пацієнтам рекомендували не лягати впродовж мінімум 30 хвилин.
Для контролю ефективності лікування порушень ремоделювання кісткової тканини пацієнтам, які взяли участь у дослідженні, проводилися вивчення МЩКТ, процесів її резорбції та формування до та через півроку після початку лікування.
Для цього вивчався рівень КФЛФ, показники рівня остеокальцину та С‑кінцевого телопептиду у сироватці крові, що є «золотими стандартами» у діагностиці патології кісткової тканини і на теперішній час найбільш чутливими та точними показниками її стану, а також дані ультразвукової денситометрії.
4.2.2 Корекція порушень процесів ремоделювання кісткової тканини
Дослідження рівня КФЛФ у крові проводилося у 94 хворих на тяжкі хронічні дерматози, які отримували та яким планувалося подальше тривале лікування системними ГКС. Дані, отримані при дослідженні, наведені у таблиці 4.3.
Таблиця 4.3 – Динаміка рівня КФЛФ у сироватці крові хворих Іа групи
| Досліджувані групи | Рівень КФЛФ, нмоль/с∙л | |
| Іа група | До лікування | 311,68 ± 12,53 1, 2 |
| Після лікування | 487,46 ± 12,45 1 | |
| Контрольна група, n=41 | 640,50 ± 41,3 | |
Примітка. 1 – достовірність результатів у зрівнянні з контрольною групою (р < 0,05); 2 – достовірність результатів у порівнянні з такими до лікування (р < 0,05)
Як видно з табл. 4.3, до лікування середній рівень КФЛФ становив (311,68 ± 12,53) нмоль/с·л, що був більш ніж у 2 рази знижений порівняно з контрольною групою [(640,5 ± 41,3) нмоль/с·л], яку складали здорові особи. Після лікування цей показник дорівнював (487,46 ± 12,45) нмоль/с·л, збільшившись у 1,6 разу, але не досяг значення цього показника в контрольній групі. Запропонований метод корекції порушень ремоделювання кісткової тканини сприяв підвищенню рівня КФЛФ, що свідчило про позитивну динаміку відновлення кісткової тканини.
У силу того, що визначення рівня КФЛФ не відображає повністю процеси ремоделювання кісткової тканини, тому було додатково обрано інші маркери кісткового обміну (дослідження рівня С-кінцевого телопептиду і остеокальцину у сироватці крові) і оцінювалася щільність кісткової тканини за допомогою ультразвукової денситометрії.
Результати проведених досліджень наведені у табл. 4.4.
Таблиця 4.4 – Динаміка рівня остеокальцину і С-кінцевих телопептидів у сироватці крові хворих Іа групи
| Показники | До лікування (n = 20) | Після лікування (n = 20) |
Контрольна група (n = 20) |
| Остеокальцин, нг/мл | 2,52 ± 0,791,2 | 15,25 ± 1,69 | 16,70 ± 1,84 |
| С-кінцевий телопептид, нг/мл | 0,65 ± 0,091,2 | 0,30 ± 0,04 | 0,29 ± 0,05 |
Примітки:
1 – достовірні зміни у зрівнянні з показниками після лікування.
2 – достовірні зміни у зрівнянні з показниками контрольної групи
Рівень остеокальцину у крові є показником, що характеризує активність остеобластів у кістковій тканині. Чим активніша робота остеобластів, тим скоріше відбуваються процеси ремоделювання у кістках.
Рівень остеокальцину у сироватці крові залежить від статі (він різний у чоловіків і жінок), а також рівня гормональної активності (різниться у жінок пре- і постменопаузального віку). Проте у мету роботи не входило докладно дослідити цей показник, а лише виявити тенденції його зміни у співставленні з показниками до лікування, а також з відповідними показниками контрольної групи, до якої увійшли здорові особи, що були репрезентативними за статтю та віком.
Як видно з даних табл. 4.4, рівень остеокальцину в сироватці крові хворих на тяжкі дерматози Іа групи до лікування, у зв’язку з порушенням кісткоутворення дорівнював (2,52 ± 0,79) нг/мл і був знижений у 6,6 разу порівняно з цим показником у групі контролю [(16,70 ± 1,84) нг/мл]. Після застосування розробленої терапії, призначеної для корекції порушень ремоделювання кісткової тканини впродовж 6 місяців, рівень остеокальцину підвищився у 6,1 разу (до (15,25 ± 1,69) нг/мл) і вірогідно не відрізнявся від показників контрольної групи [(16,70 ± 1,84) нг/мл], що свідчило про відновлення процесів остеосинтезу у хворих, які мали вторинний ОП.
Аналіз проведених досліджень показав, що кількість С-кінцевих телопептидів у сироватці крові до призначеного лікування з приводу виниклого стероїдного ОП була підвищеною до (0,65 ± 0,09) нг/мл у 2,2 разу порівняно з контрольною групою [(0,29 ± 0,05) нг/мл] (див. табл. 4.4). У результаті розробленої терапії, яку отримували досліджені хворі впродовж 6 місяців, відбулося достовірне зменшення цього показника більш як у 2 рази до (0,30 ± 0,04) нг/мл. Рівень С-кінцевих телопептидів після лікування статистично не відрізнявся від цього показника у контрольній групі [(0,29 ± 0,05) нг/мл]. Зменшення рівня С-кінцевих телопептидів свідчило про те, що процеси резорбції у кістковій тканині нормалізувалися.
Для визначення стану МЩКТ у 94 хворих на хронічні дерматози, що тривало одержували системні ГКС, проводилася ультразвукова денситометрія.
За допомогою зазначеного методу вивчався стан кісткової тканини на великогомілковій, променевій кістці і проксимальній фаланзі третього пальця кисті. Дослідження трьох кісток є більш інформативним, ніж однієї (наприклад, п’яткової, як це проводиться традиційно на інших апаратах ультразвукової денситометрії).
Вважали, що порушення ремоделювання кісткової тканини (ОП, остеопенія) у хворого є, якщо хоча би в однієї кістки з трьох досліджуваних при ультразвуковому денситометричному дослідженні мали місце зазначені патологічні зміни.
Дані ультразвукової денситометрії, отримані до початку лікування і після, наведені у табл. 4.5.
Межа норми для Т-критерію дорівнює до (-1), межі від (-1) до (-2,5) відповідають стану остеопенії. Якщо значення Т-критерію є нижчим за (-2,5), мова йде про ОП.
Як видно з даних табл. 4.5, до лікування середній показник Т-критерію знаходився у межах остеопенії великогомілкової кістки, які наближалися до ОП, і спостерігалася тенденція до розвитку його на променевій кістці і кістці проксимальної фаланги III пальцю руки.
Таблиця 4.5 – Динаміка Т-критерію у хворих Іа групи (n = 94), які отримували запропонований метод корекції порушень ремоделювання кісткової тканини
| Кістка | Дані Т-критерію
до лікування * |
Дані Т-критерію через
6 місяців лікування |
| Великогомілкова | –2,40 ± 0,09 | –2,17 ± 0,091 |
| Променева | –2,66 ± 0,11 | –2,09 ± 0,061 |
| Проксимальна фаланга III пальцю руки | –2,53 ± 0,07 | –1,86 ± 0,071 |
Примітки:
1 – покращення показника Т-критерію у порівнянні з даними до лікування (р ≤ 5).
* – мається на увазі лікування щодо порушень кісткоутворення
Через 6 місяців від початку лікування порушень ремоделювання кісткової тканини спостерігали покращення стану хворих за показником Т-критерію на ультразвуковій денситометрії.
Найкраще відновлення кісткової тканини відбувалося на кістці проксимальної фаланги III пальцю, про що говорить середнє значення Т‑критерію для всіх пацієнтів, яке з даних, що граничили з ОП явно і достовірно перейшли у рівні, що відповідають остеопенії.
На променевій кістці – як раз тій, на якій остеопоротичні порушення як наслідок системної терапії ГКС проявилися більше, ніж на інших досліджуваних кістках, спостерігався перехід ОП у явну остеопенію.
На великогомілковій кістці виявили недостовірне загальне покращення результатів для Т-критерію в усіх хворих на тяжкі дерматози.
Отже, на всіх трьох кістках, які піддавалися денситометричному дослідженню, рівні Т-критерію як такі, що характеризують прояв і тяжкість порушень ремоделювання кісткової тканини, мали числа, які свідчать про позитивну динаміку в лікуванні цих патологічних станів.
У результаті проведеного лікування відбулося достовірне підвищення середнього значення Т-критерію з –2,44 ± 0,10 до –1,35 ± 0,10, що свідчило про значне збільшення МЩКТ (у 1,8 разу) під впливом розробленого методу лікування.
Отже, методом ультразвукової денситометрії до початку лікування запропонованим методом ОП було виявлено у 11 хворих (35,5 %), остеопенію – у 20 осіб (64,5 %). Після лікування розробленим методом з використанням антирезорбтивного препарату алендронової кислоти в комплексі з Кальцій-Д3-Нікомед ОП діагностовано у 5 пацієнтів (16,1 %), у 24 (77,4 %) – відмічалося збільшення показника Т-критерію в межах остеопенії, у 2 (6,5 %) – спостерігалася нормалізація МЩКТ (табл. 4.6).
Таблиця 4.6 – Динаміка МЩКТ хворих, що одержували ГКС та розроблену антирезорбтивну терапію (n = 94)
| МЩКТ | До призначення антирезорбтивної терапії | Після призначення антирезорбтивної терапії | ||
| абс. | % | абс. | % | |
| Остеопороз | 33 | 35,5 | 10 | 16,1 |
| Остеопенія | 61 | 64,5 | 73 | 77,4 |
| Нормальна МЩКТ | – | – | 11 | 6,5 |
Таким чином, розроблений метод лікування ГК-індукованого ОП та остеопенії з використанням препаратів кальцію, вітаміну D3 та антирезорбтивного препарату алендронової кислоти сприяє покращенню процесів ремоделювання кісткової тканини, що підтверджується підвищенням у сироватці крові рівня КФЛФ, остеокальцину та зниженням рівня С-кінцевого телопептиду, а також підвищенню МЩКТ за даними ультразвукової денситометрії.
Ефективність розробленого методу ілюструють наведені приклади.
Приклад 1. Хвора Р., 2015 р.н., історія хвороби № 739, лікувалась у стаціонарі 02.05.15р. – 02.06.15р. з приводу вульгарної пухирчатки. У стаціонарі отримувала дексаметазон по 1,0 мл внутрішньом’язово, медрол по 8 мг/добу та полькортолон 4 мг/добу протягом трьох місяців. При обстеженні виявлено порушення щільності кісткової тканини на підставі зменшення рівня КФЛФ у сироватці крові (348,5 нмоль/с∙л), зменшення маркера кісткоутворення остеокальцину (3,15 нг/мл) та підвищення рівня фактору деградації кісткової тканини С-кінцевого телопептиду (0,73 нг/мл). За даними ультразвукового денситометричного обстеження Т-критерій становив -3,8, що свідчило про наявність у хворої ОП (рис. 4.4).
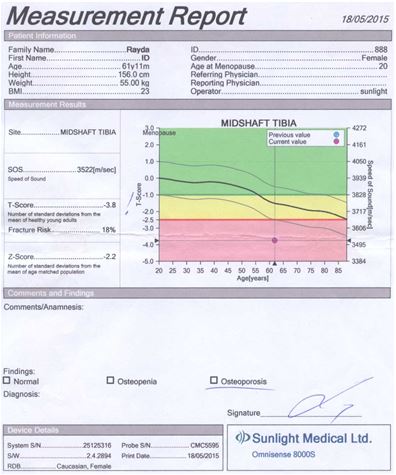
Рисунок 4.4 – Результати ультразвукової денситометрії хворої Р., історія хвороби № 739. Остеопороз. До проведення лікування
Після проведеного лікування у стаціонарі системними ГКС хвора була виписана на підтримуючій дозі медролу 10 мг/добу. Був призначений розроблений метод з метою лікування порушень кісткового обміну, а саме алендронова кислота і Кальцій-Д3-Нікомед.
Через 6 місяців від початку використання розробленого методу антирезорбтивної терапії хвора пройшла повторне обстеження, за результатами яких спостерігалося підвищення рівня маркерів кісткоутворення: КФЛФ – до 505,6 нмоль/с∙л, рівня остеокальцину – до 16,27 нг/мл та зменшення рівня маркеру кісткової резорбції (С-кінцевого телопептиду) до 0,26 нг/мл відносно значень до лікування. При проведенні у хворої ультразвукового денситометричного обстеження Т-критерій дорівнював ‑1,3, що свідчило про збільшення щільності кісткової тканини з рівня ОП (-3,8) до остеопенії. На підставі даних проведених обстежень можна зробити висновок про значне покращення процесів ремоделювання кісткової тканини: у пацієнтки діагностовано лише ГК-індуковану остеопенію (рис. 4.5).
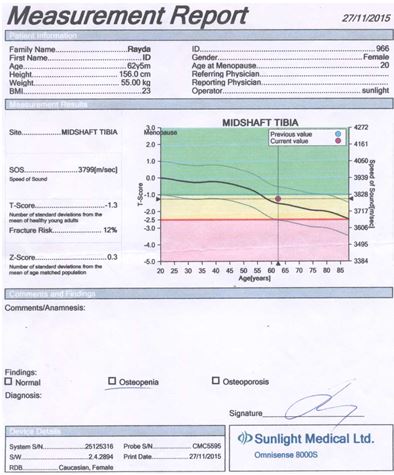
Рисунок 4.5 – Результати ультразвукової денситометрії хворої Р., історія хвороби № 739. Остеопенія. Після проведення лікування
Приклад 2. Хворий С., 1967 р.н., історія хвороби № 33, знаходився на стаціонарному лікуванні у дерматологічному відділенні Державної установи «Інститут дерматології та венерології НАМН України» з 13.01.14 по 28.01.14 з діагнозом: псоріаз розповсюджений, прогресуюча стадія. Псоріатична артропатія. До цього лікувався півроку у шкірно-венерологічному диспансері за місцем проживання, де йому було призначено терапію по 8 мг медролу на добу.
При обстеженні хворого у клінічному аналізі крові визначено зниження еритроцитів (3,2∙1012/л) та гемоглобіну (110 г/л), що є ознакою пригнічення еритропоезу та протипоказанням до призначення метотрексату, а також підвищення показників, що характеризують запалення у сполучній тканині. Наявність гострозапальних проявів з боку сполучнотканинного обміну, скарги на болі та набряклість у суглобах, порушення активних та пасивних рухів у них, ознаки місцевого запалення з боку шкіри та суглобів потребували призначення імуносупресивної терапії, тому хворому рекомендувалося продовжити використання системних ГКС.
У зв’язку з цим, проводилося додаткове обстеження з метою визначення уражень кісткової тканини. При обстеженні було визначено зниження маркера остеосинтезу КФЛФ – 330,5 нмоль/с∙л, остеокальцину – 3,2 нг/мл, підвищення маркера кісткової резорбції С-кінцевого телопептиду – 0,73 нг/мл. При проведенні ультразвукової денситометрії встановлено зниження МЩКТ – Т‑індекс становив (-1,8) (рис. 4.6). На підставі даних обстеження хворому був поставлений діагноз ГК-індукована остеопенія, з приводу чого був призначений Кальцій-Д3-Нікомед і алендронова кислота протягом півроку за розробленою методикою.
Контрольне обстеження стану кісткового обміну та запальних проявів при псоріатичній артропатії було проведено через півроку. При цьому маркери кісткоутворення підвищилися (рівень КФЛФ – 490,45 нмоль/с∙л, остеокальцину – 16,1 нг/мл), а маркер резорбції знизився (рівень С-кінцевого телопептиду – 0,31 нг/мл) порівняно з такими до лікування. Підвищилася МЩКТ (Т-індекс становив: -0,6) (рис. 4.7), незважаючи на те, що хворому продовжувалося лікування системними ГКС (полькортолон у дозі 8 мг/добу).
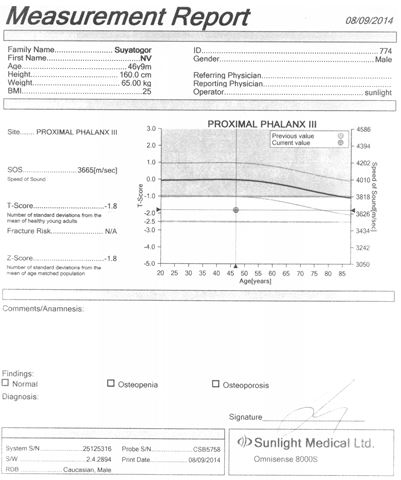
Рисунок 4.6 – Результати ультразвукової денситометрії хворого С., історія хвороби № 33. Остеопенія. До проведення лікування
На підставі оцінки показників ремоделювання кісткової тканини встановлено, що у хворого відмічалася нормалізація процесів остеосинтезу та резорбції на фоні проведення розробленої методики.
Таким чином, призначення розробленого методу лікування стероїд-індукованого ОП з використанням препаратів кальцію із синтетичним вітаміном D3 (Кальцій-D3-Нікомед) та антиостеопоротичного препарату, що містить алендронову кислоту, дозволило підвищити рівень КФЛФ у 1,6 разу, остеокальцину у 6,1 разу, зменшити рівень С-кінцевого телопептиду у більш ніж 2 рази. Також відбулося значне збільшення МЩКТ у 1,8 разу за даними середнього значення Т-критерію. За даними методу ультразвукової денситометрії встановлено зменшення кількості хворих на вторинний остеопороз на 19,4 % та нормалізацію МЩКТ у 6,5 %.
4.3 Профілактика порушень кісткового обміну у хворих на тяжкі дерматози, яким системна терапія глюкокортикостероїдами призначена вперше
Як було відмічено раніше, у хворих Іб групи (9 пацієнтів, які раніше одержували ГКС) не було встановлено порушень з боку кісткового обміну, що було підставою для об’єднання їх з пацієнтами ІІ групи (31 хворий), тобто до хворих, яким планувалося призначення ГКС вперше і при обстеженні не було встановлено ознак порушень ремоделювання кісткової тканини. Цих 40 хворих було залучено до розробки методу профілактики порушень з боку кісткового обміну.

Рисунок 4.7 – Результати ультразвукової денситометрії хворого С., історія хвороби № 33. Норма. Після проведення лікування
Хворим на хронічні тяжкі дерматози, яким планувалося довготривале призначення системних ГКС, та хворим, які одержували ГКС раніше, але при повторному звертанні у них не було встановлено ознак порушень у ремоделюванні кісткової тканини, для профілактики цих порушень призначалися антирезорбтивний засіб, що містить алендронову кислоту, та препарати кальцію з вітаміном Д3. Схема прийому цих препаратів була такою. На початку лікування призначалися препарати кальцію у комбінації з вітаміном D3 по 1 таблетці на добу протягом одного тижня. З другого тижня лікування додатково призначали алендронову кислоту у дозі 70 мг 1 раз на тиждень. Зазначені препарати використовували перманентно курсами по два місяці з проміжками в один місяць. Загальна тривалість терапії визначалася за результатами контрольних досліджень стану ремоделювання кісткової тканини через 6 місяців, тобто застосовувався інтермітуючий метод запобігання порушень у кістковому обміні.
Для контролю стану кісткової тканини у пацієнтів використовувалися визначення КФЛФ, остеокальцину і С-кінцевого телопептиду в сироватці крові та ультразвукова денситометрія до призначення системної терапії ГКС одночасно з антирезорбтивною та через 6 місяців.
При оцінці рівня КФЛФ встановлено, що він до початку профілактичного лікування [(613,18 ± 1,92) нмоль/с·л] не відрізнявся від цього показника у контрольній групі [(640,5 ± 41,3) нмоль/с·л]. Після проведення розробленого методу профілактики рівень КФЛФ достовірно збільшився до (639,69 ± 1,42) нмоль/с·л, але знаходився у межах показників контрольної групи (табл. 4.7).
Таким чином, за рівнем КФЛФ можна сказати, що лікування дало позитивні результати (відсутність посилення порушень ремоделювання кісткової тканини під впливом ГКС). Але, як і у попередньому дослідженні, коли вивчали ефективність лікування вже існуючих порушень ремоделювання кісткової тканини, які виникли під час системного лікування кортикостероїдами у хворих на тяжкі дерматози, ці дані потребували підтвердження іншими, більш інформативними дослідженнями.
Таблиця 4.7 – Показники рівня КФЛФ у крові хворих до і після профілактичного лікування порушень ремоделювання кісткової тканини
| Групи | Рівень КФЛФ, нмоль/с∙л |
| II група та Iб підгрупа до лікування, n = 40 |
613,18 ± 1,92 |
| II група та Iб підгрупа після лікування, n = 40 |
639,69 ± 1,42 1 |
| Контрольна група, n = 41 | 640,50 ± 41,3 |
Примітка. 1 – достовірність результатів у зрівнянні з показником до лікування (р < 0,05)
Для визначення стану кісткоутворення вивчення рівня остеокальцину в сироватці крові проводилося в динаміці спостереження – до початку призначення системних ГКС та після закінчення профілактичного курсу антиостеопоротичної терапії (табл. 4.8). Запропонований профілактичний курс запобіг погіршенню стану кісткоутворення, що підтверджувалося рівнем остеокальцину до і після лікування [(11,15 ± 1,10) і (11,29 ± 1,55) нг/мл, відповідно, р > 0,05].
Таблиця 4.8 – Динаміка рівня остеокальцину і С-кінцевого телопептиду у сироватці крові хворих II групи та Iб підгрупи (n = 40)
| Показники | До лікування | Після
лікування |
Контрольна група (n = 20) |
| Остеокальцин, нг/мл | 11,15 ± 1,102 | 11,29 ± 1,552 | 16,70 ± 1,84 |
| С-кінцевий телопептид, нг/мл | 0,49 ± 0,031,2 | 0,33 ± 0,08 | 0,29 ± 0,05 |
Примітка. 1 – достовірні зміни у зрівнянні з показниками після лікування; 2 – достовірні зміни у зрівнянні з показниками контрольної групи.
До лікування рівень С-кінцевого телопептиду в сироватці крові, що є маркером резорбції кісткової тканини, у хворих на хронічні дерматози, яким вперше проводилося дослідження і планувалося тривале лікування системними ГКС та профілактичний курс антиостеопоретичними препаратами, був підвищеним [(0,49 ± 0,03) нг/мл] порівняно з контрольною групою [(0,29 ± 0,05) нг/мл]. У результаті проведення профілактичного курсу протягом 6 місяців відбулося достовірне зниження рівня зазначеного показника до (0,33 ± 0,08) нг/мл, який став достовірно не відрізнятися від контрольної групи.
При аналізі одержаних результатів встановлено, що з 40 хворих, яким проводилося профілактичне лікування розвитку порушень кісткового обміну 8 страждали на псоріаз, у симптомокомплекс яких входили порушення процесів ремоделювання кісткової тканини, і 3 жінки у клімактеричному і постменопаузальному періодах, що зумовило зниження до лікування порівняно з контрольною групою показників остеокальцину [(11,15 ± 1,10) нг/мл] та підвищення С-кінцевого телопептиду [(0,49 ± 0,03) нг/мл]. Однак і у цих хворих спостерігалася тенденція до нормалізації стану кісткової тканини.
Дослідження кількості остеокальцину у крові підтвердило те, що терапія препаратами кальцію і вітаміну D у поєднанні з бісфосфонатами запобігає розвиткові ГК-індукованого ОП. Це підтверджують і результати вивчення рівня С-кінцевих телопептидів, які утворюються при деградації колагену I типу.
Для визначення стану МЩКТ за даними Т-критерію ультразвукової денситометрії у хворих на тяжкі хронічні дерматози, яким планувалося в подальшому призначення тривалої системної ГКС терапії, проводилося сонографічне дослідження.
Дані, отримані під час ультразвукової денситометрії, представлені у табл. 4.9. Як видно з даних табл. 4.9, пацієнти, яким призначили системне лікування ГКС, на початку терапії мали нормальні показники Т-критерію при ультразвуковій денситометрії. Після застосування розробленого методу системного лікування ГКС спостерігалася лише тенденція до розвитку остеопенії, досліджувані показники зменшувалися незначно.
Таблиця 4.9 – Динаміка значення Т-критерію у хворих II групи та Iб підгрупи (n = 40) під впливом антирезорбтивного профілактичного курсу
| Кістка | До призначення | Через 6 місяців після призначення курсу |
| Великогомілкова | –0,88 ± 0,13 | –1,15 ± 0,13 |
| Променева | –0,82 ± 0,15 | –1,09 ± 0,13 |
| Проксимальна фаланга III пальцю руки | –0,84 ± 0,13 | –1,08 ± 0,14 |
Середній показник Т-критерію до початку лікування дорівнював -0,86 ± 0,08 у середньому по групі, причому досліджувався на великогомілковій, променевій кістках і кістці фаланги III пальцю руки, знаходився в межах від
(-0,88) – на великогомілковій кістці до (-0,82) – на променевій кістці. Норма для Т‑критерію, як вже зазначалося раніше, складає (–1) і вище.
Після профілактичного прийому протиостеопоротичних препаратів одночасно з призначеною терапією ГКС Т-критерій у середньому по групі достовірно не змінився і дорівнював (-1,04 ± 0,09), що свідчило про ефективність курсу профілактики стосовно збереження МЩКТ у хворих, які отримували тривале лікування системними ГКС. Показовим є те, що показник МЩКТ достовірно не змінювався, тобто розвиткові стероїдного ОП, який є одним із частих і тяжких ускладнень системної терапії ГКС, вдалося запобігти.
Клінічні приклади ілюструють ефективність розробленого профілактичного метода.
Приклад 1. Хворий Т., 1947 р.н., історія хвороби № 505, знаходився на стаціонарному лікуванні у відділенні дерматології Державної установи «Інститут дерматології та венерології НАМН України» з 16.05.14 з діагнозом: вульгарна пухирчатка. Супутній – дискінезія жовчовивідних шляхів за гіпотонічним типом.
З огляду на те, що хворому планувалося тривале застосування системних ГКС, було проведено додаткове обстеження з визначення маркерів ремоделювання кісткової тканини.
При обстеженні встановлено, що маркери ремоделювання кісткової тканини знаходилися в межах норми, а саме рівень КФЛФ склав 614,2 нмоль/с∙л, остеокальцину – 12,1 нг/мл, С-кінцевого телопептиду – 0,47 нг/мл. При проведенні ультразвукової денситометрії Т-критерій становив: ‑1,1 (рис. 4.8). Отже, при обстеженні патології з боку кісткового обміну виявлено не було. Для профілактики розвитку порушень з боку кісткової тканини було призначено одночасно із вживанням системних ГКС у вигляді 1 мл дексаметазону на добу, 8 мг на добу полькортолону, медролу 8 мг на добу препарати антиостеопоротичної дії, а саме алендронову кислоту по 1 таблетці на тиждень та Кальцій-Д3-Нікомед по 1 таблетці 2 рази на добу.
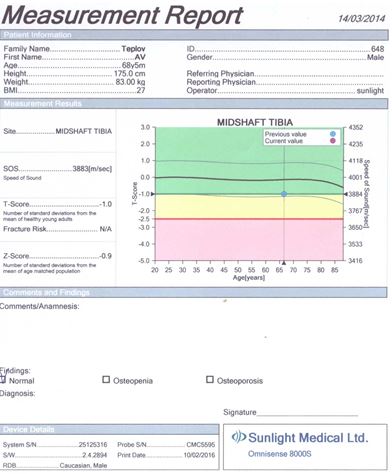
Рисунок 4.8 – Результати ультразвукової денситометрії хворого Т., історія хвороби № 505. Норма. До прийому системних ГКС та проведення профілактичного курсу щодо зменшення МЩКТ
Пацієнта було виписано у стані клінічного покращення з рекомендацією прийому полькортолону по 8 мг на добу та для запобігання розвитку ускладнень кісткової тканини продовжити зазначений профілактичний курс.
При повторному обстеженні стану кісткової тканини порушень процесів ремоделювання кісткової тканини виявлено не було, що підтверджували маркери кісткоутворення (рівень КФЛФ склав 660,3 нмоль/с∙л, остеокальцину – 12,32 нг/мл) та маркер резорбції кісткової тканини (рівень С-кінцевого телопептиду – 0,41 нг/мл). За даними ультразвукової денситометрії Т-критерій дорівнював: -0,9 (рис. 4.9). Це свідчить про ефективність розробленого методу профілактики розвитку порушень процесів кісткоутворення на фоні тривалої системної терапії ГКС.
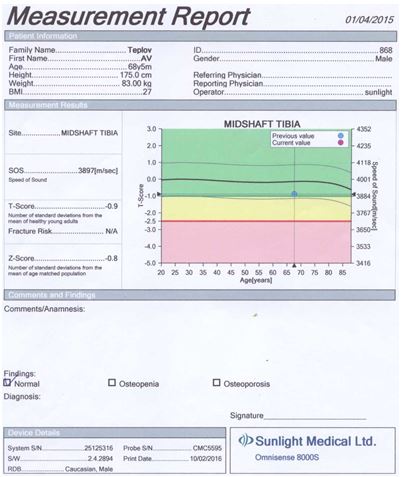
Рисунок 4.9 – Результати ультразвукової денситометрії хворого Т., історія хвороби № 505. Норма. Після прийому системних ГКС та проведення профілактичного курсу щодо зменшення МЩКТ
Приклад 2. Хворий Н., 1955 р.н., історія хвороби № 1243, поступив у відділення дерматології Державної установи «Інститут дерматології та венерології НАМН України» 02.11.2015 зі скаргами на ураження слизової оболонки порожнини рота, шкіри, тулуба у вигляді численних бульозних елементів та ерозивних поверхонь з обривками епідермісу, болісність при ковтанні та неприємний запах з рота.
При обстеженні методом цитологічного дослідження було верифіковано діагноз: вульгарна пухирчатка. Планувалося у комплексному лікуванні довготривале використання системних ГКС. З огляду на це, було проведено обстеження стану процесів ремоделювання кісткової тканини. За результатами обстеження рівень КФЛФ склав 612,2 нмоль/с∙л, остеокальцину – 12,03 нг/мл, С‑кінцевого телопептиду – 0,46 нг/мл. Т-критерій при проведенні ультразвукової денситометрії становив: -0,9 (рис. 4.10). При оцінці одержаних даних встановлено, що маркери ремоделювання кісткової тканини були в межах норми.
Хворому у відділенні був призначений дексаметазон по 1 мл внутрішньом’язово 2 рази на добу, полькортолон по 8 мг на добу, проводилося симптоматичне лікування.
Для профілактики розвитку ускладнень тривалої ГКС терапії хворий приймав препарати, що сприяють запобіганню порушень з боку кісткової тканини (алендронова кислота та Кальцій-Д3-Нікомед).
У результаті одержаної комплексної терапії пацієнт був виписаний у стані значного клінічного покращення з рекомендаціями: продовжити використання полькортолону у дозі 8 мг на добу та профілактичний курс антиостеопоротичних препаратів протягом 6 місяців. При повторному обстеженні визначення стану кісткової обміну рівень КФЛФ у сироватці крові становив 614,9 нмоль/с∙л, остеокальцину – 12,21 нмоль/с∙л, С-кінцевого телопептиду – 0,29 нмоль/с∙л. За даними ультразвукової денситометрії Т-індекс склав: -1,0, що було в межах норми (рис. 4.11).
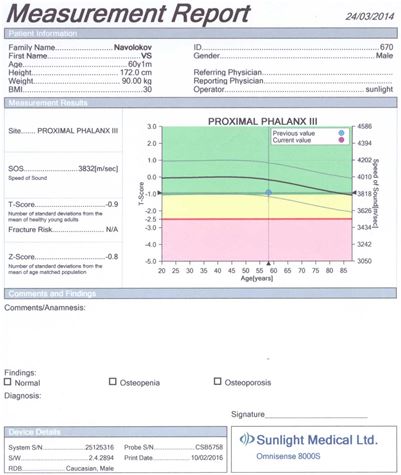
Рисунок 4.10 – Результати ультразвукової денситометрії хворого Н., історія хвороби № 1243. Норма. До прийому системних ГКС та проведення профілактичного курсу щодо зменшення МЩКТ
Отже, у результаті проведення профілактичної антиостеопоретичної терапії на фоні тривалого системного лікування ГКС у пацієнтів не було виявлено порушень процесів ремоделювання кісткової тканини.
Таким чином, розроблений метод профілактики вторинного ГК-індукованого ОП з використанням препаратів кальцію із синтетичним вітаміном D3 (Кальцій-D3-Нікомед) та антиостеопоретичного препарату, що містить алендронову кислоту, дозволяє не спричиняти порушення з боку процесів ремоделювання кісткової тканини, про що свідчить відсутність достовірних змін маркерів кісткоутворення (рівня КФЛФ та остеокальцину в сироватці крові), маркерів резорбції кісткової тканини (С-кінцевого телопептиду), а також МЩКТ за даними ультразвукової денситометрії (Т-критерій). Цей лікувально-профілактичний метод особливо показаний хворим із загрозою розвитку порушень з боку ремоделювання кісткової тканини, при захворюваннях, у симптомокомплексі яких наявні порушення процесів кісткоутворення та резорбції, хворих старших вікових груп тощо.
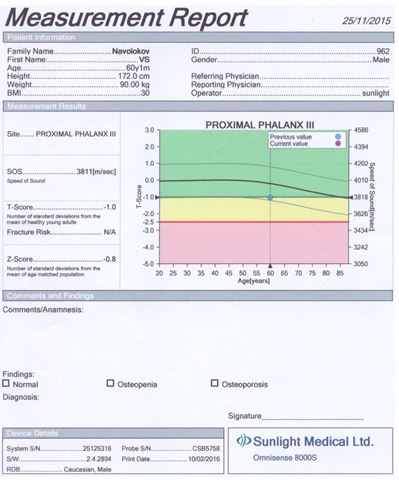
Рисунок 4.11 – Результати ультразвукової денситометрії хворого Н., історія хвороби № 1243. Норма. Після прийому системних ГКС та проведення профілактичного курсу щодо зменшення МЩКТ
* * *
Таким чином, результати досліджень показали, що при тривалій системній терапії ГКС порушення ремоделювання кісткової тканини виникають у значної кількості хворих на тяжкі дерматози.
Розроблені методи корекції та профілактики розвитку стероїд-індукованого остеопорозу із застосуванням Кальцій-Д3-Нікомед та алендронової кислоти у хворих на тяжкі дерматози, що довготривало отримують лікування ГКС є єфективними.
Матеріали розділу викладено в наступних публікаціях:
1. Левченко О.А. Глюкокортикостероидные гормоны в дерматологии: профилактика и лечение осложнений / О.А. Левченко // Дерматологія та венерологія. – 2015. – № 3 (69). – С. 64–69.
2. Пат. № 80475 UA, МПК 7 А61Р3/14, А61Р19/10, А61К33/06. Спосіб профілактики глюкокортикостероїдіндукованого остеопорозу у підлітків хворих на поширені дерматози / Я.Ф. Кутасевич, І.О. Олійник, В.М. Волкославська, О.О. Левченко. – № 11201300169; заявл. 03.01.13; опубл. 27.05.13, Бюл. № 10.
3. Кутасевич Я.Ф. Остеопороз как осложнение длительной терапии тяжелых дерматозов глюкоркортикоидами / Я.Ф. Кутасевич, И.А. Олейник, О.А. Левченко // Тез. докл. Всеукр. Таврійської наук.-практ. конф., присвяченої 85 річчю дерматовенерологічної служби Херсонської області „Сучасні проблемні питання в дерматовенерологі та косметології”. – Журнал дерматовенерології та косметології ім. М.О. Торсуєва. – 2011. – № 3–4 (26). – С. 104–105.
4. Коррекция костного метаболизма при системной терапии глюкокортикостероидными гормонами больных тяжелыми дерматозами / О.А. Левченко, Я.Ф. Кутасевич, И.А. Олейник, В.П. Матюшенко // Набуття молодих вчених дерматовенерологів : Мат. регіональної наук.-практ. школи, 23 листопада 2012 року, Київ. – К., 2012. – С. 48–49.
5. Олійник І.О. Профілактика розвитку ускладнень з боку гепатобіліарної системи при довготривалій цитостатичній терапії у хворих на тяжкі хронічні дерматози / І.О. Олійник, О.О. Левченко // ІІ Міжнародний медичний конгрес „Впровадження сучасних досягнень медичної науки в практику охорони здоров’я України” : Тез. доп., 16–19 квітня 2013 р., Київ. – К., 2013. – С. 80.
6. Левченко О.А. Нарушения ремоделирования костной ткани и углеводного обмена у пациентов, длительно получающих системные глюкокортикостероиды / О.А. Левченко, Ю.В. Костюкова, Р.К. Попова // Збірник робіт за матеріалами наук.-практ. конф. «Дерматовенерологія в розробках молодих науковців» (м. Київ, 19-20 листопада 2015 р.).– Дерматовенерологія. Косметологія і сексопатологія. – 2015. – № 3–4. – С. 121.
РОЗДІЛ 5
ПОРУШЕННЯ ВУГЛЕВОДНОГО ОБМІНУ У ХВОРИХ НА ТЯЖКІ ДЕРМАТОЗИ, ЩО ОДЕРЖУЮТЬ ДОВГОТРИВАЛУ ТЕРАПІЮ ГЛЮКОКОРТИКОЇДНИМИ ГОРМОНАМИ (ДІАГНОСТИКА,
ЛІКУВАННЯ, ПРОФІЛАКТИКА)
5.1 Особливості порушень вуглеводного обміну у хворих, що одержували довготривалу терапію глюкокортикостероїдними гормонами
Одним з ускладнень системної терапії ГКС є порушення вуглеводного обміну. Для дослідження рівня глікемії існує декілька варіантів. У роботі використано контроль рівня глікемії у плазмі венозної крові натще та ПТТГ у плазмі капілярної крові.
Для вивчення порушень вуглеводного обміну як побічного ефекту тривалого прийому ГКС було залучено 134 пацієнти з тяжкими дерматозами віком від 21 до 65 років. Істинна пухирчатка відмічалася у 46 пацієнтів, тяжкі форми псоріазу – у 35, дерматит Дюрінга – у 14, пемфігоїд – у 1, пруриго – у 1. Усім пацієнтам проводилося ретельне загальноклінічне та лабораторне обстеження. Зверталася увага на скарги на спрагу, свербіж, сухість шкіри та слизових оболонок, ламкість нігтьових пластинок, тощо. Оцінювався стан слизових оболонок статевих органів, шкіри великих складок, долонь і підошов.
У разі отримання негативного результату з визначення глюкози натще хворим проводився ПТТГ. Для цього учасник обстеження впродовж 3 днів отримував харчовий раціон із вмістом не більше 250 г вуглеводів на добу (але не менше 1,75 г/кг). Натщесерце (мінімум після 12-годинного голодування) здійснювався забір крові з пальця. Протягом 24 годин до дослідження пацієнт виключав вживання алкоголю й інтенсивне фізичне навантаження. Після цього йому видавався розчин (75 г глюкози, розчиненої в 250 мл теплої води), який він випивав одномоментно (впродовж 5 хвилин). Другий забір крові проводився через 120 хвилин після навантаження розчином глюкози, які людина проводила у спокійному, сидячому положенні. Учасники обстеження під час проведення ПТТГ утримувалися від прийому їжі і рідини, куріння, максимально обмежували фізичну активність.
Дослідження вуглеводного обміну з визначення глікемії натще та ПТТГ проводилося у двох групах пацієнтів. І група (103 пацієнти), які до надходження до стаціонару отримували системні ГКС, та ІІ група (31 особа), яким планувалося тривале системне лікування ГКС з приводу основного захворювання.
При оцінці даних з визначення глюкози натще у плазмі крові встановлено, що порушення з боку цього показника виявлено у 26 пацієнтів (25,2 %) І групи, які увійшли до Ів підгрупи, тоді як у 77 пацієнтів (74,8 %) Іг підгрупи та 31 хворого (100 %) ІІ групи порушень рівня глюкози натще виявлено не було. Таким чином, у 108 пацієнтів із групи дослідження рівень глюкози натще був у межах нормальних значень.
Наступним етапом дослідження було визначення ПТГ у цих хворих. Аналіз результатів показав, що у 21 пацієнта (20,4 %) І підгрупи встановлено позитивний ПТТГ, які склали Ід підгрупу, а у 56 пацієнтів Іе підгрупи та у 31 хворого (100 %) ІІ групи, цей тест виявився негативним, що свідчило про відсутність порушень з боку вуглеводного обміну.
Отже, для подальших досліджень 56 пацієнтів Іе підгрупи було поєднано із хворими ІІ групи. Ці хворі сформували об’єднану групу, яким було проведено профілактичне лікування (87 осіб).
Так, результати проведених досліджень показали, що тривала системна терапія ГКС призводить до порушень рівня глюкози у крові натще (25,2 %) та ПТГ (20,4 %) у значної кількості пацієнтів із хронічними тяжкими дерматозами (45,6 %).
Наступні клінічні приклади підтверджують наявність зазначених порушень вуглеводного обміну у хворих на хронічні тяжкі дерматози, що тривало отримують системні ГКС.
Приклад 1. Хворий Ф., 1956 р.н., історія хвороби № 1093, знаходився у стаціонарі Державної установи «Інститут дерматології та венерології НАМН України» з 23.09.15 по 20.11.15. Діагноз: вульгарна пухирчатка. Хворіє з березня 2013 р. Лікувався у шкірно-венерологічному диспансері за місцем проживання системними ГКС з позитивним ефектом, виписаний на підтримуючій дозі 20 мг преднізолону на добу. На тлі самостійного зниження дози ГКС до 5 мг преднізолону на добу відмічав загострення дерматозу, у зв’язку з чим надійшов до лікування у Державній установі «Інститут дерматології та венерології НАМН України». Через тривалий прийом системних ГКС був обстежений з метою виявлення порушень вуглеводного обміну. У біохімічному аналізі крові рівень глюкози натще становив 6,8 ммоль/л, що відповідало діагнозу ПГН. За результатами обстеження пацієнта був поставлений діагноз: вульгарна пухирчатка, гормонозалежна форма. Супутній – гіпертонічна хвороба II-A ст. Ускладнення – ПГН.
Приклад 2. Хворий К., 1959 р.н., історія хвороби № 1187, знаходився на стаціонарному лікуванню у відділенні дерматології Державної установи «Інститут дерматології та венерології НАМН України» з 05.10.13 по 08.11.13 з діагнозом дерматит Дюрінга.
З анамнезу відомо, що хворіє із січня 2013 р., лікувався у шкірно-венерологічному диспансері за місцем проживання, де була призначена терапія преднізолоном по 20 мг на добу. Надійшов до стаціонару у зв’язку з погіршенням перебігу дерматозу.
З огляду на те, що хворий тривало приймав системні ГКС, йому було додатково призначено обстеження для визначення рівня глюкози у крові. У результаті проведеного біохімічного аналізу крові рівень глюкози у плазмі становив 3,8 ммоль/л, тобто у межах норми. При проведенні ПТТГ рівень глюкози у крові склав 9,2 ммоль/л. За результатами проведених обстежень пацієнту був поставлений діагноз: герпетиформний дерматит Дюрінга. Ускладнення – ПТГ.
5.2 Корекція порушень вуглеводного обміну у пацієнтів, які знаходилися на системній терапії глюкокортикостероїдами
Для корекції порушень вуглеводного обміну застосовуються синтетичні гіпоглікемічні засоби поряд з дотриманням дієтичного режиму та помірного фізичного навантаження.
Для лікування початкових стадій порушень вуглеводного обміну золотим стандартом вважається метформін. Він є пероральним лікарським засобом, який коригує рівень глюкози у сироватці крові, належить до бігуанідів і є засобом першої лінії у лікуванні ЦД ІІ типу. Під впливом метформіну: підвищується чутливість периферичних тканин до інсуліну; знижується продукція глюкози печінкою за рахунок підвищення чутливості печінки до інсуліну, зниження глюконеогенезу і глікогенолізу, що призводить до зменшення рівня глюкози натщесерце; зменшується всмоктування глюкози у шлунково-кишковому тракті. Уповільнення всмоктування глюкози в кров під впливом метформіну полегшує функціонування підшлункової залози і оберігає її від перенапруги і виснаження. Встановлено, що метформін підвищує чутливість периферичних тканин до інсуліну, що сприяє стабілізації та/або зниженню маси тіла. При тривалому застосуванні він призводить до вирівнювання добової глікемічної кривої, зниження середньодобового рівня глікемії, зменшення рівня глікемії натщесерце, а також до зниження і нормалізації рівня глікозильованого гемоглобіну, що сприяє профілактиці пізніх ускладнень ЦД [35, 39, 48, 60, 95].
Виходячи з даних літератури і практики лікування порушень вуглеводного обміну, для корекції останнього був обраний метформін. Його призначали у початковій дозі 500 мг на добу всередину протягом першого тижня (1 таблетка ввечері під час їжі, не менше ніж за 1 годину до сну). При цьому оцінювалася переносимість препарату. Зверталася увага на наявність диспептичних явищ, нудоти, алергічних реакцій. Пацієнтів, які скаржилися на наявність побічних проявів, у дослідженні не було. Отже, наприкінці першого тижня хворим проводився контроль рівня глюкози натще. Якщо він не досягав рівня референтних значень, то дозу метформіну збільшували до 1 г на добу. Контроль рівня глюкози натще у пацієнтів проводився наприкінці другого та третього тижнів прийому метформіну. Таке лікування проводилося хворим на хронічні тяжкі дерматози на фоні прийому високих доз ГКС (понад 30 мг на добу в перерахунку на преднізолон). При стабілізації та досягнення покращення перебігу основного захворювання хворих переводили на підтримуючу дозу ГКС і метформін призначався у дозі 500 мг на добу. Через три місяці прийому метформіну в підтримуючій дозі проводився контроль глюкози натще у Ів підгрупі та ПТТГ у Ід підгрупі.
Для вивчення та розробки методу корекції порушень вуглеводного обміну на тлі тривалого використання системних ГКС у хворих на тяжкі хронічні дерматози було залучено хворих Iв і Ід підгруп, яким системна терапія ГКС була призначена раніше. При цьому у пацієнтів Iв підгрупи (26 осіб) виявлено ПГН, тому цим хворим стан вуглеводного обміну контролювався за допомогою дослідження глікемії натще.
Результати вивчення ефективності лікування порушень вуглеводного обміну у хворих Iв підгрупи наведено у табл. 5.1.
Таблиця 5.1 – Динаміка рівня глікемії натще у хворих Ів підгрупи, n = 26
| Терміни визначення порушень вуглеводного обміну |
Рівень глікемії натщесерце, ммоль/л* |
| Перед початком лікування | 6,54 ± 0,051 |
| Через 1 тиждень лікування | 6,20 ± 0,041, 2 |
| Через 2 тижні лікування | 5,88 ± 0,052 |
| Через 3 тижні лікування | 5,65 ± 0,032 |
| Через 3 місяці після переходу на підтримуючу дозу метформіну 500 мг на добу | 5,25 ± 0,392 |
Примітка. * – за рівень гіперглікемії вважаються значення, що перевищують 6,1 ммоль/л (згідно рекомендацій ВООЗ від 2006 р. та наказу № 356 від 22.05.2009); 1 – достовірність прояву гіперглікемії (р < 0,05); 2 – достовірність показників відносно значення до лікування (р < 0,05).
Дані, наведені у табл. 5.1, свідчать про те, що рівень глікемії у плазмі крові пацієнтів з тяжкими дерматозами, які отримували до вступу до стаціонару системне лікування ГКС, під впливом прийому метформіну достовірно знижувався вже після першого тижня коригуючої порушення вуглеводного обміну терапії (з 6,54 до 6,20 ммоль/л), але залишався поки що поза межами нормальних показників. Тобто рівень глікемії знижався, але залишалася ще гіперглікемія. Це було підставою для збільшення дози метформіну до 1000 мг на добу.
До кінця другого тижня лікування рівень глікемії натщесерце у пацієнтів достовірно прийшов до норми, знизившись з 6,20 ммоль/л наприкінці першого тижня лікування порушень вуглеводного обміну до 5,88 ммоль/л наприкінці другого.
Дослідження рівня глікемії у хворих після третього тижня лікування показало, що він продовжував далі достовірно знижуватися, досягаючи середнього значення 5,65 ммоль/л.
Через 3 місяці після початку прийому метформіну у підтримуючій дозі 500 мг/добу на фоні зниження системних ГКС рівень глікемії залишався у межах норми.
Таким чином, запропонований метод лікування порушень вуглеводного обміну з використанням метформіну у хворих на тяжкі дерматози, які знаходилися на тривалому лікуванні системними ГКС, виявив себе ефективним. Рівень глікемії за час проведеного лікування нормалізувався і залишався таким протягом 3 місяців прийому підтримуючої дози метформіну.
У пацієнтів з тяжкими дерматозами Iд підгрупи, яким до вступу у стаціонар вже проводилася системна кортикостероїдна терапія і в яких під час лабораторного дослідження було виявлено ПТГ, проводили терапію згідно розробленого методу лікування порушень вуглеводного обміну.
Результати, отримані під час лікування хворих Iд підгрупи, наведено у табл. 5.2.
Таблиця 5.2 – Дані дослідження ПТТГ у хворих Ід підгрупи, n = 21
| Терміни визначення ПТТГ | Рівень глюкози у крові,
ммоль/л* |
| Перед початком лікування | 9,73 ± 0,111 |
| Через 1 тиждень лікування | 8,88 ± 0,141 |
| Через 2 тижні лікування | 7,83 ± 0,23 |
| Через 3 тижні лікування | 6,06 ± 0,16 |
| Через 3 місяці прийому підтримуючої дози метформіну 500 мг на добу | 5,18 ± 0,36 |
Примітка. * – за рівень ПТГ вважається рівень глікемії від 8,9 до 12,2 ммоль/л (згідно рекомендацій ВООЗ від 2006 р. та наказу № 356 від 22.05.2009); 1 – достовірність прояву гіперглікемії (р ≤ 0,05).
Отримані дані свідчать про те, що рівень глюкози у плазмі крові у хворих на тяжкі дерматози, які отримували системну терапію ГКС, достовірно знижувався і нормалізувався наприкінці другого тижня лікування порушень вуглеводного обміну.
Так, за перший тиждень лікування метформіном рівень глікемії достовірно знизився з (9,73 ± 0,11) до (8,88 ± 0,14) ммоль/л, але залишився підвищеним. За другий тиждень проведення терапії порушення вуглеводного обміну відбулася нормалізація цього показника [(7,83 ± 0,23) ммоль/л]. Впродовж третього тижня лікування показники рівня глікемії залишалися в межах норми, а саме (6,06 ± 0,16) ммоль/л.
Контроль глікемії при проведенні ПТТГ через 3 місяці прийому підтримуючої дози метформіну 500 мг/добу свідчив про те, що і через цей проміжок часу рівень глюкози у крові достовірно продовжував залишатися нормальним і мав значення (5,18 ± 0,36) ммоль/л, тобто порівняно з відповідним показником через три тижні він дещо знизився.
Приклад 1. Хворий Н., 1971 р.н., історія хвороби № 201, знаходився на стаціонарному лікуванні у відділенні дерматології Державної установи «Інститут дерматології та венерології НАМН України» з 12.02.15 до 03.04.15 з діагнозом: вульгарна пухирчатка.
З анамнезу відомо, що пацієнт страждав на дерматоз з березня 2014 р., з приводу чого тривало отримував системні ГКС. Після досягнення клінічної ремісії хворому було призначено підтримуючу дозу системними ГКС – 16 мг полькортолону на добу. У зв’язку з погіршенням перебігу дерматозу хворий повторно надійшов для обстеження та лікування в Державну установу «Інститут дерматології та венерології НАМН України».
При біохімічному дослідженні був виявлений підвищений рівень глюкози у сироватці крові натще (6,5 ммоль/л), у зв’язку з чим до основного лікування (45 мг у перерахунку на преднізолон на добу) був доданий метформін по 500 мг увечері після їжі. Тиждень потому було проведено повторне обстеження рівня глюкози крові натще, який становив 6,1 ммоль/л. Через два тижні після початку лікування рівень глюкози знизився до 5,6 ммоль/л, а через три тижні – до 4,2 ммоль/л.
Після стабілізації шкірного процесу та покращення загального стану хворого було переведено на підтримуючі дози ГКС (16 мг полькортолону на добу), у зв’язку з чим дозу метформіну було знижено до 500 мг на добу.
Повторне дослідження, проведене через три місяці після переходу на підтримуючу дозу метформіну, не виявило порушень рівня глюкози крові натще (5,1 ммоль/л). Це свідчить про ефективність лікування пацієнта метформіном на тлі базової терапії системними ГКС.
Приклад 2. Хвора М., 1975 р.н., історія хвороби № 325. Хворіє на вульгарну пухирчатку з 2009 р., з приводу чого тривало отримувала системні ГКС. У зв’язку з погіршенням стану пацієнтка надійшла 28.01.14 у відділення дерматології Державної установи «Інститут дерматології та венерології НАМН України».
При надходженні у стаціонар з урахуванням того, що пацієнтка тривало приймала системні ГКС, було проведено дослідження вуглеводного обміну: рівень глікемії натще становив 5,0 ммоль/л. При проведенні ПТТГ рівень глюкози у крові через 2 години після навантаження 75 г глюкози становив 9,0 ммоль/л. З огляду на це, до основного лікування системними ГКС (60 мг у перерахунку на преднізолон) був доданий метформін у дозі 500 мг на добу. Через тиждень після початку лікування рівень глікемії при проведенні ПТТГ становив 8,5 ммоль/л та дозу метформіну було підвищено до 1000 мг на добу. При подальшому дворазовому проведенні ПТТГ з інтервалом в один тиждень рівень глюкози у крові склав 7,8 і 6,8 ммоль/л відповідно.
Хвора була виписана у стані клінічної ремісії на підтримуючій дозі 16 мг полькортолону на добу, у зв’язку з чим дозу метформіну було знижено до 500 мг на добу. Три місяці потому хвора знов була обстежена з метою виявлення порушень вуглеводного обміну. За результатами обстеження рівень глікемії у крові натще склав 5,2 ммоль/л, після проведення ПТТГ – 7,2 ммоль/л, що свідчило про відсутність ПТГ.
Таким чином, розроблений метод лікування порушень вуглеводного обміну у хворих на хронічні дерматози при тривалому використанні системних ГКС із застосуванням глюкозознижувального препарату метформін у дозі 500 мг на добу протягом першого тижня з подальшим збільшенням дози залежно від переносимості впродовж двох тижнів до 1000 мг на добу і переходом на підтримуючу дозу 500 мг на добу протягом трьох місяців є ефективним.
5.3 Профілактика порушень вуглеводного обміну у хворих з тяжкими дерматозами, яким вперше призначена системна терапія глюкокортикостероїдами
Для розробки методу профілактики виникнення порушень вуглеводного обміну під час проведення системної глюкокортикоїдної терапії було залучено хворих, яким вперше проводилася системна терапія ГКС з приводу основного захворювання та у яких не було виявлено порушень вуглеводного обміну на момент надходження до стаціонару (ІІ група – 31 особа), і пацієнти, у яких у процесі обстеження не було виявлено порушень з боку рівня глюкози натще та ПТТГ (Іе підгрупа – 56 осіб). Отже, пацієнти Іе підгрупи і ІІ групи склали 87 осіб, яким проводилася профілактика порушень вуглеводного обміну метформіном, що призначався у дозі 500 мг 1 раз на добу протягом 4–6 тижнів залежно від початкової дози ГКС. Хворим проводилися обидва тести на визначення рівня глікемії: у плазмі венозної крові натщесерце для дослідження рівня глікемії натще, а також ПТТГ у капілярній плазмі крові. Тести проводилися перед початком профілактичного лікування порушень з боку вуглеводного обміну та через 1, 3 та 6 тижнів лікування, а також через 3 місяці після відміни прийому метформіну.
Результати, отримані при дослідженні рівня глікемії натще у хворих ІІ групи та Iе підгрупи наведені у табл. 5.3.
Таблиця 5.3 – Динаміка рівня глікемії натщесерце у хворих ІІ групи та Iе підгрупи, n=87
| Терміни визначення порушень
вуглеводного обміну |
Рівень глікемії, ммоль/л |
| Перед початком лікування | 4,13 ± 0,05 |
| Через 1 тиждень лікування | 4,62 ± 0,061 * |
| Через 3 тижні лікування | 5,51 ± 0,131 * |
| Через 6 тижнів лікування | 4,99 ± 0,041 * |
| Через 3 місяці після відміни метформіну | 4,65 ± 0,081 * |
Примітка. 1 – достовірність відмін порівняно з показником у попередній термін (р < 0,05); * – достовірність відмін порівняно з показником до лікування (р < 0,05)
Як видно з даних табл. 5.3, рівень глікемії натщесерце у хворих з тяжкими дерматозами, яким вперше була призначена терапія ГКС, залишався постійно у межах норми, але дещо змінювався. Спостерігалося достовірне збільшення рівня глікемії на першому і третьому тижні лікування і зниження на шостому тижні.
Так, якщо рівень глікемії до початку лікування становиив у середньому по групі (4,13 ± 0,05) ммоль/л, то наприкінці першого тижня лікування він достовірно підіймався до (4,62 ± 0,06) ммоль/л і до (5,51 ± 0,13) ммоль/л наприкінці третього, сягаючи максимальних значень. На шостому тижні мало місце достовірне зниження досліджуваного показника до (4,99 ± 0,04) ммоль/л.
Дані лабораторних досліджень рівня глікемії натще через 3 місяці після закінчення прийому метформіну свідчили про збереження у цих хворих нормального рівня глюкози у плазмі крові [(4,65 ± 0,08) ммоль/л].
При оцінці одержаних даних з визначення глікемії натще у хворих, які одержували системні ГКС, встановлено, що через три місяці після відміни метформіну рівень глюкози був вищим, ніж до лікування, але знаходився у межах норми. Отже, відмічено тенденцію до підвищення рівня глікемії натще, що є підставою для подальшого моніторингу цього показника у таких хворих.
Таким чином, показники глікемії натщесерце не вийшли за межі норми, а це означає, що обрана тактика профілактики порушень вуглеводного обміну виявилася правильною.
Другим лабораторним дослідженням, яке проводилося хворим цієї групи, став ПТТГ. Дані, отримані при вивченні рівня глікемії за цим тестом, наведені у табл. 5.4. Як видно з таблиці 5.4, рівень глюкози у плазмі крові залишався впродовж усього дослідження у межах норми, збільшуючись впродовж трьох перших тижнів лікування і знижуючись на шостому.
Якщо до початку лікування досліджуваний показник становив (4,22 ± 0,05) ммоль/л, то впродовж першого тижня профілактичної терапії порушень вуглеводного обміну він достовірно збільшувався до (4,45 ± 0,06) ммоль/л. На третьому тижні спостерігалося подальше достовірне збільшення рівня глікемії до (4,97 ± 0,04) ммоль/л і потім, впродовж шостого тижня профілактичного лікування метформіном на тлі системної терапії ГКС достовірне зниження до (4,64 ± 0,06) ммоль/л.
Таблиця 5.4 – Динаміка рівня глюкози у крові за результатами ПТТГ у хворих II групи та Iе підгрупи, n = 87
| Терміни визначення порушень
вуглеводного обміну |
Рівень глюкози у крові, ммоль/л |
| Перед початком лікування | 4,22 ± 0,05 |
| Через 1 тиждень лікування | 4,45 ± 0,061 * |
| Через 3 тижні лікування | 4,97 ± 0,041 * |
| Через 6 тижнів лікування | 4,64 ± 0,061 * |
| Через 3 місяці після відміни метформіну | 4,52 ± 0,111 * |
Примітка. 1 – достовірність відмін порівняно з показником у попередній термін (р < 0,05); * – достовірність відмін порівняно з показником до лікування (р < 0,05)
Через 3 місяці після закінчення профілактичного лікування рівень глюкози у плазмі крові за результатами ПТТГ залишався у межах норми, навіть маючи подальшу тенденцію до зниження – з (4,64 ± 0,06) ммоль/л наприкінці шостого тижня профілактичного лікування до (4,52 ± 0,11) ммоль/л при контролі через 3 місяці після закінчення терапії метформіном.
Проведені дослідження за результатами ПТТГ у хворих, які одержували тривало системні ГКС, показали, що через три місяці після відміни метформіну рівень глікемії був вищим, ніж до лікування, але залишався у межах норми. Таким чином, встановлено тенденцію до підвищення рівня глікемії після проведення ПТТГ, що також є підставою для диспансеризації таких хворих протягом прийому системних ГКС.
Таким чином, розроблений метод профілактики порушень вуглеводного обміну з використанням метформіну у дозі 500 мг на добу протягом шести тижнів, виявився ефективним. Рівень глюкози у крові пацієнтів, яким вперше була призначена терапія ГКС, залишався в межах норми. Це підтвердили обидва проведених дослідження: рівня глікемії натщесерце та ПТТГ, хоча в межах нормальних показників спостерігали збільшення рівня глікемії натщесерце впродовж першого і третього тижнів лікування і подальше зменшення його до кінця шостого тижня і надалі, аж до трьох місяців після закінчення профілактичного призначення метформіну.
Ефективність розробленого методу профілактики розвитку порушень вуглеводного обміну ілюструє наступний приклад:
Пацієнтка Х., 1965 р.н., історія хвороби № 1096, знаходилася на стаціонарному лікуванні у відділенні дерматології Державної установи «Інститут дерматології та венерології НАМН України» з 23.09.15 по 20.11.15 з діагнозом вульгарна пухирчатка. При обстеженні рівень глюкози крові натще становив 3,9 ммоль/л, при проведенні ПТТГ – 7,2 ммоль/л. Хворій було призначено системну терапію ГКС у дозі 60 мг у перерахунку на преднізолон на добу та з метою профілактики розвитку порушень вуглеводного обміну – метформін у дозі 500 мг на добу протягом шести тижнів. Пацієнтці проводилося обстеження рівня глюкози у крові натще і ПТТГ через 1, 3 і 6 тижнів після початку лікування. Результати рівня глюкози у крові натще становили 4,5, 4,9 і 4,1 ммоль/л відповідно, що відповідало нормальним значенням. Результати ПТТГ у ці терміни складали 8,5, 7,8 і 6,9 ммоль/л відповідно, що також було у межах норми.
Через 6 тижнів після призначення профілактичного курсу метформіну на фоні поступового зниження системних ГКС глюкозознижувальний препарат було відмінено. Три місяці потому пацієнтка знов була обстежена з метою виявлення порушень вуглеводного обміну. Дані обстежень показали рівень глікемії натще – 5,5 ммоль/л, а після проведення ПТТГ – 6,8 ммоль/л, що було в межах норми та свідчило про ефективність запропонованого лікувально-профілактичного методу з використанням метформіну на тлі системної терапії ГКС.
Використання метформіну не супроводжувалося тяжкими побічними проявами, але у 5 пацієнтів (3,7 %) відмічалися диспептичні явища у вигляді нудоти, послаблення випорожнень шлунково-кишкового тракту, відсутність апетиту, металевий присмак у роті на початку призначення препарату, але у жодного хворого ці побічні явища не потребували відміни метформіну.
* * *
Таким чином, розроблений метод лікування порушень вуглеводного обміну у хворих на хронічні дерматози при тривалому використанні системних ГКС із застосуванням глюкозознижувального препарату метформін у дозі 500 мг на добу протягом першого тижня з подальшим збільшенням дози залежно від переносимості впродовж двох тижнів до 1000 мг на добу і переходом на підтримуючу дозу 500 мг на добу протягом трьох місяців є ефективним. Розроблений метод профілактики ПГН та ПТГ з використанням метформіну у дозі 500 мг на добу протягом шести тижнів на тлі лікування зазначених хворих системними ГКС показав свою ефективність. Зазначені лікувально-профілактичні заходи сприяли нормалізації порушень вуглеводного обміну, а саме рівня глюкози натще та толерантності до глюкози, на фоні прийому ГКС та запобігали розвитку цих порушень.
Матеріали розділу викладено в наступних публікаціях:
1. Kutasevych Y.F. Prophylaxis and therapy of impaired glucose tolerance in long-term therapy of the patients with severe dermatoses with glucocorticosteroid hormones / Y.F. Kutasevych, O.O. Levchenko, M.M. Popov // Вестник Харьковского национального университета имени В.Н. Каразина. Серия «Медицина». – 2014. – № 27. – С. 16–20.
2. Левченко О.А. Наблюдение отдаленных результатов лечения ранних стероид-индуцированных нарушений углеводного обмена у больных тяжелыми дерматозами / О.А. Левченко // Дерматовенерологія. Косметологія. Сексопатологія. – 2015. – № 1–2. – С. 86–89.
3. Пат. № 80476 UA, МПК 7 А61К31/00. Спосіб профілактики порушення толерантності до глюкози глюкокортикостероїдного генезу у хворих на тяжкі дерматози / Я.Ф. Кутасевич, І.О. Олійник, О.О. Левченко. – № 4201300179; заявл. 03.01.13; опубл. 27.05.13, Бюл. № 10.
4. Олейник И.А. Нарушение метаболизма углеводов как осложнение длительной глюкокортикостероидной терапии / И.А. Олейник, К.Г. Супрун, О.А. Левченко // Кроки до розробки стандартів діагностики та лікування захворювань шкіри та ІПСШ : Матеріали наук.-практ. конф., Київ, 15–16 березня 2012 р. – К., 2012. – С. 98–99.
5. Кутасевич Я.Ф. Профілактика розвитку глюкокортикостероїд-індукованих порушень вуглеводного обміну у хворих на тяжкі дерматози / Я.Ф. Кутасевич, І.О. Олійник, О.О. Левченко // Міжнародний медичний конгрес „Впровадження сучасних досягнень медичної науки в практику охорони здоров’я”: Тези доповідей, Київ, 25–27 вересня 2012 р. – К., 2012. – С. 64.
6. Патогенетический подход к лечению стероидиндуцированной нарушенной толерантности к глюкозе у больных тяжелыми дерматозами / Я.Ф. Кутасевич, И.А. Олейник, О.А. Левченко, В.Ю. Мангушева // Досягнення молодих вчених дерматовенерологів : Матеріали науково-практичної конференції, 21–22 листопада 2013 р., м. Київ. – К., 2013. – С. 47–48.
7. Prophylaxis of glycometabolism disorders in patients with severe dermatoses in long-term therapy with glucocorticosteroids / Y. Kutasevych, I. Oliinyk, O. Levchenko, I. Mashtakova // 22th Congress of the European Academy of Dermatology and Venerology: Abstracts, Istambul, 2-6 October 2013. – P085.
8. Левченко О.А. Нарушения ремоделирования костной ткани и углеводного обмена у пациентов, длительно получающих системные глюкокортикостероиды / О.А. Левченко, Ю.В. Костюкова, Р.К. Попова // Збірник робіт за матеріалами наук.-практ. конф. «Дерматовенерологія в розробках молодих науковців» (м. Київ, 19-20 листопада 2015 р.).– Дерматовенерологія. Косметологія і сексопатологія. – 2015. – № 3–4. – С. 121.
9. Кутасевич Я.Ф. Спосіб профілактики порушень толерантності до глюкози глюкокортикостероїдного генезу у хворих на тяжкі дерматози / Я.Ф. Кутасевич, І.О. Олійник, О.О. Левченко // Інформаційний бюлетень. Додаток до „Журналу Національної академії медичних наук України”. – К., 2014. – Вип. 37. – С. 41–42.
РОЗДІЛ 6
ОБГОВОРЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
Глюкокортикостероїдні препарати використовуються у клінічній практиці понад п’ятдесят років. Але і до сьогодні медична наука не винайшла більш потужних і універсальних засобів, що застосовуються при алергічних, автоімунних процесах, для купірування тяжких запальних захворювань і станів. До захворювань, які лікують за допомогою ГКС, належать і тяжкі дерматози, такі як істинна пухирчатка, герпетиформний дерматит Дюрінга, пемфігоїд, що рубцюється, тяжкі форми псоріазу, тяжкі хронічні алергодерматози. Захворювання ці мають складні етіологічні та патогенетичні механізми розвитку, тяжкий перебіг і потребують системного лікування кортикостероїдами.
Проте, як відомо, препарати групи ГКС мають численні побічні ефекти практично на всі органи і системи організму людини. Одні з них виявляються частіше, інші – набагато рідше, проте вони є і часом набувають наслідків, що суттєво знижують якість життя пацієнта і навіть загрожують його життю.
До найбільш поширених і серйозних побічних проявів системної терапії ГКС у хворих на тяжкі дерматози належать порушення ремоделювання кісткової тканини і вуглеводного обміну.
Порушення ремоделювання кісткової тканини проявляється зниженням її щільності, що призводить до появи остеопенії, а якщо вчасно не зробити лікування цього стану, то і до розвитку ОП – хвороби-невідимки, яка тривалий час ніяк себе не проявляє. Пацієнти з порушенням ремоделювання кісткової тканини не мають спочатку ніяких проявів цих патологічних станів, ОП розвивається приховано і тільки згодом, на фоні уявного благополуччя з’являються раптові переломи. Найчастіше вони відбуваються на трубчастих кістах, шийці стегна, хребцях поперекового відділу хребта, променевозап’ясткових та гомілкостопних суглобах.
Порушення вуглеводного обміну при системному лікуванні кортикостероїдами проявляються ПТГ і збільшенням рівня глікемії натще, аж до розвитку стероїдного діабету. Ці побічні явища від тривалого застосування ГКС призводять не тільки до розвитку ЦД ІІ типу, а і спричиняють порушення з боку життєво важливих систем організму: серцево-судинної, нервової, – впливаючи негативно на весь організм, що може стати причиною інвалідизації і навіть смерті.
У зв’язку з вище сказаним, не викликає сумніву, що питання ранньої діагностики, лікування та профілактики порушень ремоделювання кісткової тканини і порушень вуглеводного обміну, які виникають під час системної терапії ГКС у хворих на тяжкі дерматози, є вкрай актуальними і потребують вирішення. Особливо важливою є профілактика даних порушень, яка збереже пацієнтів від загрозливих їх здоров’ю і життю станів.
З огляду на вищезазначене, метою цієї роботи стало підвищення ефективності та безпечності системного лікування хворих на тяжкі дерматози шляхом запобігання або мінімізації розвитку побічних ефектів при терапії ГКС, у першу чергу пов’язаними з порушеннями вуглеводного обміну і ремоделювання кісткової тканини.
У дослідженні з вивчення впливу системних ГКС на процеси ремоделювання кісткової тканини та вуглеводний обмін у хворих з тяжкими розповсюдженими дерматозами взяли участь 134 особи, серед яких було 75 чоловіків (56,0 %) і 59 жінок (44,0 %). Вік пацієнтів знаходився у межах від 21 до 65 років. Найбільша кількість хворих була серед осіб працездатного віку – 84 особи, або 62,7 %.
Структура захворювань серед залучених до дослідження пацієнтів була наступною: вульгарна пухирчатка відмічалася у 61 пацієнта (45,5 %), тяжкі форми псоріазу – у 44 (32,8 %), дерматит Дюрінга – у 21 (15,7 %), пемфігоїд, що рубцується, – у 7 (5,2 %), пруриго – у 1 (0,8 %). 103 хворих (76,9 %) з усіх, що брали участь у дослідженні, раніше отримували тривалу (6 місяців і більше) терапію ГКС, вони становили I групу пацієнтів. II групу склали пацієнти, яким планувалося вперше проводити тривале системне лікування ГКС з приводу тяжкого дерматозу, – 31 хворий (23,1 %).
У відповідності до описаних нижче досліджень пацієнтів I групи було розподілено на дві підгрупи. До Iа підгрупи ввійшли 94 особи (91,3 %), в яких вже відзначалися порушення кісткового обміну. Iб групу становили 9 пацієнтів (8,7 %), які не мали порушень ремоделювання кісткової тканина і стали репрезентативними за нозологічними формами.
Аналіз результатів анамнестичного обстеження хворих на тяжкі хронічні дерматози, які були залучені до дослідження, встановлено, що пацієнти при попередньому лікуванні одержували як моно-, так і комбіновану терапію ГКС, у тому числі системними ГКС пролонгованої дії (дипроспан, депо-медрол, флостерон та іншими). Дози кортикостероїдів знаходилися у межах від 5 до 90 мг на добу у перерахунку на преднізолон.
Окрім порушень вуглеводного обміну і ГК-індукованого ОП, хворі, які брали участь у дослідженнях, мали різну супутню патологію. Частіше в них спостерігали порушення з боку серцево-судинної системи (61 хворий – 45,5 %) і захворювання гепатобіліарної системи (39 пацієнтів – 29,1 %), які значно обтяжували перебіг захворювання.
Для розробки методів корекції порушень кісткового обміну вивчалися специфічні показники, які його характеризують, а саме біохімічними методами – рівень КФЛФ (маркер кісткоутворення), імуноферментними методами – рівень С-кінцевого телопептиду (маркер кісткової резорбції) та остеокальцину (маркер кісткоутворення), за допомогою ультразвукової кісткової денситометрії – Т-критерій, який характеризує МЩКТ.
У хворих, які знаходилися на тривалому лікуванні ГКС, до лікування виявлялося достовірне зниження рівня КФЛФ у 2,1 разу, остеокальцину – у 6,6 разу та підвищення рівня С-кінцевого телопептиду – у 2,2 разу. Ці дані лабораторних досліджень свідчили про наявність порушень з боку кісткового обміну, яке підтверджувалося і даними, отриманими при ультразвуковій денситометрії, а саме остеопенія була виявлена у 11 осіб (35,5 %), ОП – у 20 (64,5 %).
Для лікування порушень в обміні кісткової тканини був розроблений метод із застосуванням двох препаратів, один з яких містить кальцію карбонат і вітамін D3 («Кальцій-Д3 Нікомед»), а другий – алендронову кислоту, яка належить до групи бісфосфонатів та має ефект пригнічення функції остеокластів.
Пацієнтам Іа групи, які вже отримували системну терапію ГКС та мали порушення ремоделювання кісткової тканини, спочатку призначали препарат Кальцій-Д3 Нікомед двічі на день впродовж одного тижня. На 8-й день від початку прийому препарату Кальцій-Д3 Нікомед хворому давали 1 таблетку препарату алендронової кислоти. Тобто хворі даної групи отримували щодня препарат Кальцій-Д3 Нікомед та 1 раз на тиждень алендронову кислоту, протягом 6 місяців. Після цього проводилися контрольні обстеження для контролю стану процесів ремоделювання кісткової тканини і ефективності лікування. За результатами досліджень за час лікування рівень КФЛФ підвищився в 1,6 разу, але не досяг все ж таки рівня аналогічного показника у контрольній групі.
Рівень остеокальцину у пацієнтів Iа групи також підвищився – у 6,1 разу, а рівень С-кінцевого телопептиду знизився у 2,2 разу, досягши рівня цього показника у контрольній групі.
Лікування, проведене пацієнтам Iа групи, мало результати, що відбилися на значеннях Т-критерію. Відбулося достовірне підвищення його середнього значення з –2,44 ± 0,10 до –1,35 ± 0,10, що свідчило про відновлення МЩКТ. Під впливом розробленого методу лікування МЩКТ збільшилася у 1,8 разу.
Після лікування розробленим методом з використанням антирезорбтивного препарату алендронової кислоти у комплексі з препаратом Кальцій-Д3-Нікомед ОП виявили лише у 5 пацієнтів (16,1 %), у 24 (77,4 %) – відмічалося збільшення показника Т-критерію в межах остеопенії, у 2 (6,5 %) – показники МЩКТ прийшли до норми.
Отримані дані свідчать про відновлення процесів кісткоутворення та стабілізацію у межах фізіологічної норми процесів резорбції кісткової тканини після лікування порушень ремоделювання кісткової тканини, проведеного у хворих на тяжкі дерматози, які тривало отримували системну терапію кортикостероїдними засобами.
Для розробки методу профілактики порушень процесів ремоделювання кісткової тканини у дослідження було залучено 31 хворого ІІ групи та 9 хворих Іб підгрупи. Їм системна терапія ГКС призначалася вперше для лікування тяжких хронічних розповсюджених дерматозів і при обстеженні до лікування не було встановлено порушень кісткоутворення. Цим хворим призначалися ті самі препарати, які сприяють відновленню кісткової тканини і процесів кісткового обміну, а саме препарата кальцію і вітаміну D3 (Кальцій-Д3-Нікомед) та засобу, що містить алендронову кислоту. Курс лікування даними засобами склав два місяці з перервою в один місяць, впродовж усього проведеного курсу лікування системними ГКС.
Як було зазначено, за результатами проведених перед початком лікування ГКС досліджень на початку призначення профілактичного курсу порушень з боку рівня КФЛФ та МЩКТ (Т-критерій) виявлено не було [(613,18 ± 1,92) нмоль/с∙л і –0,86 ± 0,08, відповідно].
Після профілактичного прийому протиостеопоротичних препаратів на тлі призначення системної терапії ГКС рівень КФЛФ достовірно збільшувався і досяг (639,69 ± 1,42) нмоль/с∙л, залишившись при цьому у межах норми. Т‑критерій у групі профілактичного прийому препаратів достовірно не змінювався і становив -1,04 ± 0,09, що свідчило про те, що призначена терапія стосовно збереження МЩКТ у хворих, які отримували тривале лікування системними ГКС, була ефективною.
Рівень остеокальцину під час профілактичного лікування хворих на тяжкі дерматози достовірно не змінювався (до лікування – (11,15 ± 1,10) нг/мл, після лікування – (11,29 ± 1,55) нг/мл). Вміст С-кінцевого телопептиду після проведеного лікування достовірно зменшився з (0,49 ± 0,03) до (0,33 ± 0,08) нг/мл, залишився на рівні, який був у контрольній групі [(0,29 ± 0,05) нг/мл], що свідчило про зниження процесів резорбції кісткової тканини і збереження швидкості її відновлення.
Таким чином, розроблений метод профілактики вторинного ГК-індукованого ОП з використанням комбінованого препарату кальцію і синтетичного вітаміну D3 (Кальцій-D3-Нікомед) і протиостеопоротичного засобу, який містить алендронову кислоту, дозволяє запобігти порушенням процесів ремоделювання кісткової тканини, про що свідчить відсутність достовірних змін показників маркерів кісткоутворення (рівня КФЛФ, остеокальцину у сироватці крові), маркерів резорбції кісткової тканини (рівня С-кінцевого телопептиду), а також показника, що характеризує МЩКТ за даними ультразвукової денситометрії (Т-критерій). Даний лікувально-профілактичний метод особливо показаний тим хворим, які мають загрозу розвитку порушень кісткового обміну, при лікуванні захворювань, у симптомокомплексі яких присутні порушення у балансі процесів кісткоутворення та резорбції, пацієнтів старших вікових груп тощо.
Ще одним із серйозних ускладнень системної терапії ГКС є порушення вуглеводного обміну. Воно, як і порушення процесів ремоделювання кісткової тканини, потребує лікування.
Для вивчення порушень вуглеводного обміну, які виникають як побічний ефект при тривалому застосуванні ГКС, було залучено наведених вище 134 пацієнтів віком від 21 до 65 років, що мали тяжкі дерматози. Всім пацієнтам перед дослідженням стану вуглеводного обміну проводилося ретельне загальноклінічне та лабораторне обстеження. Зверталася увага на наявність таких скарг, як спрага, свербіж, сухість шкіри та слизових оболонок, ламкість нігтьових пластинок. Оцінювався стан слизових оболонок на статевих органах, шкірі великих складок, долонях і підошвах. Хворі на тяжкі дерматози, яким планувалося призначення системних ГКС вперше і в яких діагностувався ЦД, а також ті, що вже мали порушення рівня глікемії натще, з даного дослідження виключалися.
Початковий розподіл пацієнтів на дві групи у дослідженні щодо вивчення порушень вуглеводного обміну був таким самим, як і у попередньому, де вивчалися процеси ремоделювання кісткової тканини: І група (103 пацієнти) – пацієнти, які до надходження до стаціонару вже отримували системну терапію ГКС; ІІ група (31 особа) – пацієнти, яким планувалося призначення системного лікування ГКС вперше. Але потім він дещо змінився.
При обстеженні пацієнтів встановлено, що рівень глюкози натще у плазмі їх крові мав відхилення від норми у 26 пацієнтів I групи (25,2 %). Ці пацієнти становили Ів підгрупу. У 77 хворих (74,8 %) на тяжкі дерматози Iг підгрупи і 31 хворого (100 %) ІІ групи порушень рівня глюкози натще виявлено не було. Тобто у 108 пацієнтів із групи дослідження рівень глюкози натще був у межах нормальних значень.
Позитивний ПТТГ був встановлений у 21 пацієнта (20,4 %) І групи, які сформували Ід підгрупу. У 56 пацієнтів І групи, які становили Іе підгрупу, і 31 хворого (100 %) ІІ групи цей тест показав негативний результат, який свідчив про відсутність порушень з боку вуглеводного обміну.
Як показав статистичний аналіз, у значної кількості пацієнтів із хронічними тяжкими дерматозами (45,6 %) тривала системна терапія ГКС призводила до порушень рівня глюкози у крові натще (25,2 %) та толерантності до глюкози (20,4 %).
З метою корекції вуглеводного обміну хворим Ів та Ід підгруп призначався розроблений метод лікування з використанням метформіну у дозі 500 мг на добу протягом першого тижня, а потім 1000 мг на добу, починаючи з другого тижня, впродовж двох тижнів. При стабілізації стану та досягнення покращення перебігу основного захворювання хворих переводили на підтримуючу дозу кортикостероїдів, а метформін призначався у дозі 500 мг на добу. Через три місяці прийому метформіну у підтримуючій дозі пацієнтам проводився контроль глюкози натще у Ів підгрупі та рівня ПТТГ у Ід підгрупі.
Встановлено, що рівень глікемії натще у хворих, які ввійшли до Ів підгрупи, достовірно знижувався. При кожному контрольному дослідженні у пацієнтів цієї групи спостерігалися позитивні зміни у показниках рівня глікемії, які досліджувалися кожний тиждень впродовж трьох тижнів та через 3 місяці після переходу на підтримуючу дозу метформіну. Так, до лікування цей показник склав (6,54 ± 0,05) ммоль/л, через 6 тижнів – (5,65 ± 0,03) ммоль/л, через 3 місяці – (5,25 ± 0,39) ммоль/л, причому вже через три тижні після початку призначення розробленого методу даний показник нормалізувався [(5,88 ± 0,05) ммоль/л].
За результатами вивчення рівня ПТТГ встановлено, що рівень глікемії через 2 години після навантаження глюкозою у хворих Ід групи на початку лікування становив (9,73 ± 0,11) ммоль/л. Згодом, під час лікування розробленим методом корекції порушень вуглеводного обміну спостерігали зниження цього показника, а саме через 1 тиждень він становив (8,88 ± 0,14) ммоль/л, через 2 тижні – (7,83 ± 0,23) ммоль/л, через 3 тижні – (6,06 ± 0,16) ммоль/л, через 3 місяці прийому підтримуючої дози метформіну – (5,18 ± 0,36) ммоль/л. Слід також відзначити, що зазначений показник приходив до норми вже наприкінці другого тижня.
Таким чином, розроблений метод лікування порушень вуглеводного обміну у хворих на тяжкі хронічні дерматози, які тривало використовували системні ГКС з одночасним прийомом гіпоглікемічного препарату метформін у дозі 500 мг на добу впродовж першого тижня з подальшим збільшенням дози залежно від переносимості впродовж двох тижнів до 1000 мг на добу і переходом згодом на підтримуючу дозу 500 мг на добу впродовж трьох місяців, є ефективним.
Для розробки методу запобігання виникнення порушень вуглеводного обміну під час проведення системної кортикостероїдної терапії було залучено хворих, яким вперше проводилася системна терапія ГКС з приводу основного захворювання (ІІ група) та у яких (хворі Іе підгрупи) не було виявлено порушень вуглеводного обміну на момент надходження до стаціонару. Ці хворі склали 87 осіб, яким проводили профілактику порушень вуглеводного обміну препаратом метформін. Його призначали у дозі 500 мг один раз на добу впродовж шести тижнів. Хворим проводилися обидва тести на визначення рівня глікемії: у плазмі венозної крові натщесерце досліджувався рівень глікемії натще, а також проводився ПТТГ – у капілярній плазмі крові. Тести проводилися на першому, третьому та шостому тижнях.
Результати вивчення можливостей профілактики порушень вуглеводного обміну показують, що призначене профілактичне лікування забезпечує знаходження показника глікемії натщесерце у хворих II групи та Iе підгрупи у межах норми, хоча впродовж перших трьох тижнів лікування метформіном рівень глюкози у крові збільшувався. Так, до лікування він становив (4,13 ± 0,05) ммоль/л, через 1 тиждень – (4,62 ± 0,06) ммоль/л, через 3 тижні – (5,51 ± 0,13) ммоль/л, наприкінці шостого тижня – (4,99 ± 0,04) ммоль/л та через 3 місяці після відміни метформіну – (4,65 ± 0,08) ммоль/л. Остання цифра свідчить, що рівень глікемії натще через 3 місяці після відміни метформіну достовірно знижувався. Це означає, що ефект профілактичного лікування зберігався.
При проведенні ПТТГ пацієнтам II групи та Iе підгрупи також відзначалися позитивні результати. Так на початку лікування рівень глюкози у плазмі крові через 2 години після навантаження становив (4,22 ± 0,05) ммоль/л. Потім впродовж наступних трьох тижнів спостерігалося збільшення цього показника (через 1 тиждень – (4,45 ± 0,06) ммоль/л, через 3 тижні – (4,97 ± 0,04) ммоль/л), але він так і залишився у межах норми. Через 6 тижнів після призначення розробленого курсу показник рівня глюкози у крові знижувався до (4,64 ± 0,06) ммоль/л і через 3 місяці після відміни метформіну знижувався і далі, до (4,52 ± 0,11) ммоль/л.
Використання метформіну не супроводжувалося тяжкими побічними явищами, але у 5 пацієнтів (3,7 %) відмічалися диспептичні явища у вигляді нудоти, послаблення випорожнень шлунково-кишкового тракту, відсутність апетиту, металевий присмак у роті на початку призначення препарату, але у жодного хворого ці побічні явища не потребували відміни метформіну.
Таким чином, розроблений метод профілактики порушень вуглеводного обміну із застосовуванням метформіну у дозі 500 мг на добу курсом 6 тижнів доказав свою ефективність. Рівень глюкози у крові пацієнтів, яким вперше була призначена довготривала терапія ГКС, залишався у межах норми. Це підтверджено обома проведеними дослідженнями, а саме вивченням рівня глікемії натщесерце та проведеним ПТТГ, хоча у межах нормальних показників рівень глікемії натщесерце і збільшувався впродовж першого і третього тижнів лікування з подальшим зменшенням його до кінця шостого тижня і надалі, аж до 3 місяців після закінчення профілактичного лікування метформіном.
ВИСНОВКИ
У дисертаційній роботі теоретично узагальнено нове вирішення наукового завдання, що полягає у підвищенні ефективності та безпечності терапії хворих на тяжкі дерматози шляхом запобігання або мінімізації розвитку побічних ефектів ГКС.
1. У зв’язку зі збільшенням кількості хворих із тяжкими формами дерматозів, що потребують тривалої, а іноді довічної, кортикостероїдної терапії та виникненням через це серйозних ускладнень, що обтяжують проведення такої терапії, а у ряді випадків зумовлюють її відміну, а також тим, що невивченим залишається частота та ступінь вираженості порушень вуглеводного обміну та ремоделювання кісткової тканини при тривалій терапії ГКС, відсутністю системи профілактики цих ускладнень, актуальним є розробка комплексних методів ранньої діагностики та лікувально-профілактичних заходів щодо цих ускладнень тривалої ГКС терапії хворих на тяжкі дерматози.
2. Встановлено, що при тривалому використанні ГКС терапії у хворих на хронічні дерматози відбувається зниження маркерів кісткоутворення КФЛФ у 2,1 разу, остеокальцину у 6,6 разу, підвищення маркера кісткової резорбції С-кінцевого телопептиду у 2,2 разу, що свідчить про порушення процесів ремоделювання кісткової тканини. При денситометричному дослідженні кісткової тканини встановлено, що у хворих при тривалій системній ГКС терапії відмічено зниження МЩКТ (зниження Т-критерію до -2,44 ± 0,10).
3. При тривалому використанні системних ГКС у 45,6 % хворих на хронічні дерматози відмічено порушення вуглеводного обміну, зокрема у 25,2 % випадків – підвищення глюкози натще, у 20,4 % випадків – порушення толерантності до глюкози.
4. Використання препаратів кальцію та вітаміну Д3 разом з антирезорбтивним препаратом алендроновою кислотою у комплексній терапії хворих на тяжкі дерматози з метою усунення порушень ремоделювання кісткової тканини є ефективним, що підтверджується покращенням процесів ремоделювання кісткової тканини: підвищення у сироватці крові рівня КФЛФ у 1,6 разу, остеокальцину у 6,1 разу та зниження рівня С-кінцевого телопептиду у 2,2 разу, а також підвищення МЩКТ за даними ультразвукової денситометрії (збільшення Т-критерію у 1,8 разу). У результаті проведеного лікування відмічено зменшення кількості хворих із ГК-індукованим ОП на 19,4 % та відбулася нормалізація МЩКТ у 6,5 % хворих.
5. Розроблений метод профілактики порушень ремоделювання кісткової тканини препаратами кальцію і вітаміну D у поєднанні з бісфосфонатами запобігає розвитку ГК-індукованого ОП у 100 % випадків.
6. Доцільною є корекція та профілактика порушень вуглеводного обміну у хворих на хронічні дерматози, які тривало одержують системні ГКС, з використанням метформіну. Розроблений метод лікування порушень із застосуванням глюкозознижувального препарату метформін є ефективним. Наприкінці другого тижня відбулася нормалізація показника ПТТГ з (9,73 ± 0,11) до (7,83 ± 0,23) ммоль/л, наприкінці третього тижня лікування рівень глікемії достовірно знижався з (6,54 ± 0,05) до (5,65 ± 0,03) ммоль/л і залишався у межах норми протягом трьох місяців після переходу на підтримуючу дозу метформіну.
7. Розроблений метод профілактики порушення глікемії натще та толерантності до глюкози з використанням метформіну у дозі 500 мг на добу протягом шести тижнів на тлі лікування зазначених хворих системними ГКС показав свою ефективність. Рівень глюкози у крові пацієнтів, яким вперше була призначена терапія ГКС, залишався у межах норми за результатами обох тестів.
РЕКОМЕНДАЦІЇ
1. Хворим на хронічні розповсюджені дерматози, що тривало знаходяться на системній ГКС терапії та яким планується призначення такої терапії, рекомендовано обстеження з визначенням МЩКТ за допомогою кісткової ультразвукової денситометрії для виявлення порушень ремоделювання кісткової тканини та визначення рівня глюкози у хворих натще. Якщо показники рівня глюкози у крові натще є нормальними проводити ПТТГ для визначення ранніх проявів порушень вуглеводного обміну.
2. Хворим, що вже отримували довготривало системні ГКС, та у яких виявлено порушення ремоделювання кісткової тканини рекомендовано призначення препаратів антирезорбтивної дії алендронова кислота по 70 мг 1 раз на тиждень разом з Кальцій Д3 по 1 таблетці двічі на добу безперервно впродовж півроку під контролем ультразвукової кісткової денситометрії 1 раз на півроку.
3. Для профілактики розвитку ГК-індукованого ОП хворим на хронічні дерматози, яким планується довготривала терапія ГКС та не визначено порушень ремоделювання кісткової тканини, рекомендовано призначення вищезазначеного методу у режимі інтермітуючої терапії (2 місяці лікування, 1 місяць перерва) під час призначення ГКС під контролем кісткової денситометрії 1 раз на півроку.
4. Хворим, що вже знаходились довготривало на системній терапії ГКС, у разі порушень вуглеводного обміну рекомендовано призначення метформіну 500 мг 1 раз на добу впродовж 1 тижня, потім – 1000 мг на добу впродовж 3 тижнів з переходом на підтримуючу дозу 500 мг на добу впродовж 3 місяців.
5. Хворим, яким планується терапія ГКС, у разі відсутності порушень з боку вуглеводного обміну рекомендовано призначення метформіну одночасно з призначенням ГКС у дозі 500 мг на добу впродовж 6 тижнів під контролем діагностичних тестів.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Александров А.А. Комментарии кардиолога к Рекомендациям по сахарному диабету, предиабету и сердечно-сосудистым заболеваниям ESC-EASD 2007 / А.А. Александров // Сахарный диабет. – 2008. – № 1. – С. 94-96.
- Атлас по дерматологии / М. Рекен, М. Шаллер, Э. Заттлер, В. Бургдорф; пер. с нем. – М. : МЕДпресс-информ, 2012. – 408 с.
- Баранова И.А. Глюкокортикоидиндуцированный остеопороз: патогенез, профилактика, лечение / И.А. Баранова // Современная ревматология. – 2008. – № 1. – С. 31-38.
- Баранова О.В. Состояние минеральной плотности кости у женщин репродуктивного возраста по данным двойной рентгеновской абсорбциометрии осевого скелета / О.В. Баранова // Медицинский журнал. – 2009. – № 4. – С. 10-12.
- Баранова О.В. Современные возможности лучевых методов диагностики остеопороза / О.В. Баранова, Э.И. Малевич // Медицинские новости. – 2009. – № 10. – С. 12-16.
- Беляев Г. М. Современное представление о патогенезе псориатической артропатии и лечении этих больных / Г. М. Беляев // Дерматологія та венерологія. – 2010. – № 1(47). – С. 7–30.
- Богун Л.В. Сахарный диабет и сопутствующие заболевания внутренних органов / Л.В. Богун, Н.А. Ярына, Т.А. Лавренко // Новости медицины и фармации. – 2011. – № 20 (392). – С. 20-23.
- Борисова Е.О. Побочные эффекты системной глюкокортикоидной терапии / Е.О. Борисова // АтмосферА. Пульмонология и аллергология. – 2004. – № 3. – С. 14-18.
- Борткевич О.П. Сучасні уявлення про спектр застосування та безпеку терапії глюкокортикоїдами при ревматичних хворобах / О.П. Борткевич, Ю.В. Білявська // Український ревматологічний журнал. – 2010. – № 2 (40). – С. 40-50.
- Велборн Т. Диагностические и скрининговые тесты при сахарном диабете и предиабетических состояниях / Т. Велборн // Медикография. – 2004. – № 26 (1). – С. 28-53.
- Верткин А.Л. Остеопороз у пациентов с соматической патологией в зависимости от пола / А.Л Верткин, Л.Ю. Моргунова, А.В. Наумова // Остеопороз и остеопатология. – 2007. – № 1. – С. 25-28.
- Випадок глюкокортикостероїдіндукованого остеопорозу та первинного гіперпаратиреозу / М.В. Власенко, О.І. Чорноброва, С.В. Літвінова, Л.О. Юркул // Международный эндокринологический журнал. – 2012. – № 5 (45). – С. 102-104.
- Возможности костной рентгеновской денситометрии в клинической практике (методические рекомендации) / И.А. Скрипникова, Л.А. Щеплягина, В.Е. Новиков [и др.] // Остеопороз и остеопатии. – 2010. – № 2. – С. 23-34.
- Возняк І.Я. Вивчення якості життя у пацієнтів з псоріатичною хворобою / І.Я. Возняк, Т.В. Святенко // Дерматовенерологія. Косметологія. Сексопатологія. – 2009. – № 1-2 (12). – С. 273–275.
- Глюкокортикоїд-індукований остеопороз у хворих на бронхіальну астму та ревматоідний артрит: застосування ібадронової кислоти під контролем рентгеноденситометрії / М.К. Терновий, Є.В. Туз, В.В. Вовк, К.А. Гребенников // Лучевая диагностика, лучевая терапия. – 2012. – № 2. – С. 27-33.
- Головач І.Ю. Глюкокортикоїд-індукований остеопороз : етапи розвитку вчення в Україні та сучасний стан проблеми / І.Ю. Головач // Боль. Суставы. Позвоночник. – 2011. – № 3. – С. 47-53.
- Головач І.Ю. Ризендронат в лікуванні остеопорозу: фармакологічний профіль, клінічна ефективність, переносимість і безпечність / І.Ю. Головач // Літопис травмотології та ортопедії. – 2012. – Т. 21-22, № 1-2. – С. 174-178.
- Гудар’ян О. О. Обгрунтування диференційованих методів лікування генералізованого пародонтиту при цукровому діабеті 2 типу: автореф. дис. … д-ра мед. наук : 14.01.22 / О. О. Гудар’ян ; Нац. мед. ун-т ім. О.О.Богомольця. – К., 2010. – 35 с.
- Дерматовенерологія. Навчальний посібник / М.О. Дудченко, К.В. Васильєва, І.Б. Попова [та ін.]. – Полтава : [б. в.], 2011. – 319 с.
- Дерматология : Пер. с англ. / Т. Фицпатрик, Р. Джонсон, К. Вулф [и др.]. – М. : Практика, 2007. – 1088 с.
- Джеллингер П. Постпрандиальная гипергликемия и сердечно-сосудистый риск // Сахарный диабет. – 2004. – № 23 (2). – С. 4-8.
- Дислипидемии при эндокринных заболеваниях / Н.А. Кравчун, Ю.И. Караченцев, О.А. Гончарова [и др.]. – Харьков : Прапор, 2008. – 224 с.
- Діагностика та нейрохірургічне лікування хвороби Кушинга / О.М. Гук, О.М. Возняк, М.О. Гук [та ін.] // Український нейрохірургічний журнал. – 2011. – № 3. – С. 4-9.
- Древаль A.B. Нарушенный баланс глюкозы и семь подтипов сахарного диабета, выявляемые с помощью внутривенного теста толерантности к глюкозе / А.В. Древаль // Проблемы эндокринологии. – 2006. – Т. 52, № 6. – С. 3-9.
- Европейское руководство по лечению дерматологических заболеваний / Под ред. А.Д. Кацамбаса, Т.М. Лотти. – М.: МЕДпресс-информ, 2008. – 736 с.
- Залежність змін глюкокортикоїдної функції надниркових залоз від ступеня тяжкості супутньої анемії у хворих на ішемічну хворобу серця та цукровий діабет 2-го типу / Н.Д. Павлюкович, В.М. Ходоровський, І.В. Трефаненко, В.П. Присяжнюк // Буковинський медичний вісник. – 2012. – Т. 16, № 3. – С. 63-67.
- Исмаилов С.И. Остеопороз и низкоэнергетические переломы шейки бедра как осложнение различных эндокринных заболеваний (обзор литературы) / С.И. Исмаилов, Д.Ш. Ходжамбердиева, Н.Т. Рихсиева // Международный эндокринологический журнал. – 2013. – № 5 (53). – С. 113-120.
- Казимирко В.К. Остеопороз: патогенез, клиника, профилактика и лечение / В.К. Казимирко, В.Н. Коваленко. В.И. Мальцев. – 3-е изд., стереотип. – К. : МОРИОН, 2007. – 160 с.
- Казимирко В.К. Инволюционный остеоартроз и остеопороз / В.К. Казимирко, В.Н. Коваленко, В.В. Флегонтова. – Донецк : Изд. Заславский А.Ю., 2011. – 724 с.
- Камышников В.С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностике. – 2-е изд., перераб. и доп. / В.С. Камышников. – М. : Медпресс-информ, 2004. – 920 с.
- Кобзарь А.И. Прикладная математическая статистика. Для инженеров и научных работников / А.И. Кобзарь. – М. : ФИЗМАТЛИТ, 2012. – 816 с.
- Коваленко В.В. Патогенетичні аспекти розвитку остеопорозу у пацієнтів із ревматологічними хворобами як основа концепції лікування. Частина 1. Системний вторинний остеопороз. Роль глюкокортикоїдів. Інші чинники розвитку / В.В. Коваленко, Н.М. Шуба, О.П. Борткевич // Український медичний часопис. – 2011. – № 3 (83). – С. 43-49.
- Коломиец В.В., Красеха-Денисова В.В. Состояние костной резорбции, обмена кальция и магния и суставной синдром у больных остеоартрозом и эссенциальной гипертензией / В.В. Коломиец, В.В. Красеха-Денисова // Український ревматологічний журнал. – 2009. – № 1. – С. 28-32.
- Компендиум 2007 – лекарственные препараты / Под ред. В.Н. Коваленко, А.П. Викторова. – К. : Морион, 2007. – Т. 2. – С. С-5.
- Компендиум 2007 – лекарственные препараты / Под ред. В.Н. Коваленко, А.П. Викторова. – К. : Морион, 2007. – Т. 2. – С. С-149.
- Корпачева-Зінич О.В. Патогенетичні аспекти розвитку цукрового діабету II типу: роль метаболізму глюкокортикоїдів / О.В. Корпачева-Зінич // Здоровье мужчины. – 2015. – № 3. – С. 38-40.
- Кочергина И.И. Пути коррекции инсулинорезистентности и метаболического синдрома при СД 2 типа. Роль Сиофора / И.И. Кочергина, К.А. Уланова // Русский медицинский журнал. – 2007. – Т. 15, № 28. – С. 2160-2165.
- Кравчун Н.А. Субклинический гиперкортицизм (обзор литературы и собственные наблюдения / Н.А. Кравчун, Л.Г. Полозова // Ендокринологія. – 2014. – Т. 19, № 1. – С. 44-51.
- Кузнецова Н.В. Клиническая фармакология: учебник. – 2-е изд., перераб. и доп. / Н.В. Кузнецова. – М. : ГЭОТАР-Медиа, 2013. – 272 с.
- Кухта В.К. Некоторые особенности действия ионов кальция в клетках в качестве сигнальной молекулы / В.К. Кухта, А.Д. Таганович, Э.И. Олецкий // Медицинский журнал. – 2010. – № 2. – С. 12-14.
- Лекція для студентів медичних та медико-психологічних факультетів вищих медичних навчальних закладів України на тему: “Запальні захворювання системи руху та опори” / О.А. Бур’янов, Є.Т. Скляренко, О.І. Волошин та ін. // Літопис травмотології та ортопедії. – 2014. – № 1-2. – С. 189-206.
- Литвиненко А.В. Общие принципы системной глюкокортикостероидной терапии / А.В. Литвиненко // Український пульмонологічний журнал. – 2014. – № 1. – С. 60-64.
- Ляшук П.М. Актуальні питання системної терапії глюкокортикоїдними препаратами / П.М. Ляшук // Міжнародний ендокринологічний журнал. – 2009. – № 2 (20). – С. 99–102.
- Мавров И.И. Основы диагностики и лечения в дерматологии и венерологии: Пособие для врачей, интернов и студентов / И.И. Мавров, Л.А. Болотная, И.М. Сербина. – Х. : Факт, 2007. – 792 с.
- Мамедов М.Н. Метаболический синдром – больше, чем сочетание факторов риска: принципы диагностики и лечения. Пособие для врачей / М.Н. Мамедов. – М. : ГНИЦ ПМ, 2006. – С. 48.
- Маньковский Б.Н. Метаболический синдром: распространенность, диагностика, принципы терапии / Б.Н. Маньковский // Мистецтво лікування. – 2005. – № 9. – С. 30-33.
- Масловская А.А. Биохимия гормонов / А.А. Масловская. – 6-е изд. – Гродно : ГрГМУ, 2012. – 44 с.
- Машковский М.Д. Лекарственные препараты. – 15-е изд., перераб., испр. и доп. / М.Д. Машковский. – М. : ООО «Изд-во Новая Волна», 2007. – С. 562.
- Насонов Е.Л. Фармакотерапия ревматоидного артрита: российские и международные рекомендации / Е.Л. Насонов // Клиническая фармакология и терапия. – 2016. – № 1. – С. 67-76.
- Олійник І.О. Комплексне лікування хворих на артропатичний псоріаз з урахуванням ступеня тяжкості, особливостей перебігу захворювання : автореф. дис. … д-ра мед. наук : 14.01.20 – шкірні та венеричні хвороби / І.О. Олійник; ДУ «Ін-т дерматології та венерології АМН України». – Х., 2009. – 36 с.
- Определение и диагностика сахарного диабета и промежуточных гипергликемий. Отчёт совета ВОЗ/МДФ (опубликовано ВОЗ в 2006) / Под ред. проф. С.И. Исмаилова. – Ташкент : Endokrin Print, 2007. – С. 1-32.
- Особливості етіології та патогенезу остеопорозу у хворих на хронічне обструктивне захворювання легень / Л.О. Яшина, М.І. Гуменюк, В.І. Ігнатьєва [та ін.] // Астма та алергія. – 2013. – № 2. – С. 35-41.
- Остеопороз при гонартрозе и коксартрозе / Т.С. Ютовец, М.В. Ермолаева, О.В. Синяченко, Е.С. Головкина // Травма. – 2012. – Т. 13, № 4. – С. 103-107.
- Остеопороз. Клинические рекомендации по диагностике, профилактике и лечению остеопороза Российской ассоциации по остеопорозу. – М., 2009. – 289 с.
- Остеопороз: клиника, диагностика, профилактика и лечение / Н.А. Корж, В.В. Поворознюк, Н.В. Дедух, И.А. Зупанец. – Х. : Золотые страницы, 2002. – 468 с.
- Остеопороз хребта у людей різного віку / В.В. Поворознюк, А.В. Макогончук, Т.В. Орлик, H.I. Дзерович // Ортопедия, травматология и протезирование. – 2008. – №1. – С. 75-78.
- Панькив В.И. Болезнь Иценко-Кушинга: диагностика, клиника, лечение / В.И. Панькив // Новости медицины и фармации. – 2011. – № 16 (379). – С. 27-29.
- Пасиешвили Л.М. Остеопороз – безмолвный костный «вор» / Л.М. Пасиешвили // Схiдноєвропейський журнал внутрiшньої та сiмейної медицини. – 2015. – № 1. – С. 16-24.
- Поворознюк В.В. Захворювання кістково-м’язової системи в людей різного віку: Вибр. лекції, огляди, ст. / В.В. Поворознюк. – К. : [б. в.], 2004. – Т. 2. – 519 с.
- Поспелов Д.Л. Как правильно лечить сахарный диабет 2-го типа: простые принципы, спасающие пациентам жизнь / Д.Л. Поспелов // Український медичний часопис. – 2012. – № 2 (88). – С. 15-18.
- Пранаб Д. Аспирационная пункция тонкой иглой. Трактовка результатов и диагностические проблемы / Д. Пранаб. – М. : Практическая медицина, 2014. – 224 с.
- Рекомендації з діагностики, профілактики та лікування системного остеопорозу у жінок в постменопаузальному періоді / В.М. Коваленко, В.В. Поворознюк, О.П. Борткевич [та ін.] // Укр. ревмат. журнал. – 2011. – № 3 (37). – С. 23-39.
- Ремоделирование костной ткани при действии хлорпроизводных низкомолекулярных алифатических углеводородов / Ф.Х. Камилов, Т.И. Ганеев, Е.Р. Фаршатова [и др.] // Медицинский вестник Башкортостана. – 2011. – Т. 6., вып. 2. – С. 305-309.
- Рожинская Л.Я. Диагностика и лечение остеопороза / Л.Я. Рожинская // Клиническая геронтология. – 2007. – № 2. – С. 37-46.
- Роль эндогенных и экзогенных факторов в развитии остеопороза у детей (обзор литературы) / Е.А. Статинова, Р.Я. Омельченко, Л.С. Васковская, С.А. Сохин // Травма. – 2013. – Т. 14, № 5. – С. 89-93.
- Романенко И.А. Предикторы ангиопатий у пациентов с нарушенной толерантностью к глюкозе и впервые выявленным сахарным диабетом 2 типа / И.А. Романенко, Т.С. Полятыкина, И.К. Томилова // Сахарный диабет. – 2005. – № 2 (27). – С. 27-31.
- Руководство по диагностике и лечению сахарного диабета / Ю.И. Караченцев, М.Р. Микитюк, Л.Г. Полозова, О.О. Хижняк. – Х. : «С.А.М.», 2007. – 244 с.
- Сагаловски С. Остеопороз и его клеточно-молекулярные механизмы развития: поиск молекул-мишеней для новых средств лечения заболевания / С. Сагаловски, М. Шенерт // Клінічна медицина. – 2012. – Т. XVII, № 1. – С. 1-13.
- Сизон О.О. Артропатичний псоріаз: проблемні питання діагностики та диференціації. Частина 1/ О.О. Сизон, В.І. Степаненко // Український журнал дерматології, венерології, косметології. – 2010. – № 2 (37). – С. 42-50.
- Справочник Видаль. Лекарственные препараты в России: Справочник. – М. : АстраФармСервис, 2015 – 1480 с.
- Сунцов Ю.И. Эпидемиология нарушенной толерантности к глюкозе // Сахарный диабет. – М. : Универсум паблишинг, 2000. – С. 85-88.
- Сучасні методи діагностики порушень мінерального обміну у хворих на хронічне обструктивне захворювання легень / Л.О. Яшина, М.І. Гуменюк, І.П. Мазур [та ін.] // Збірник наукових праць співробітників НМАПО імені П.Л. Шупика. – 2013. – Т. 22, № 2. – С. 434-443.
- Тодика Ю.І. Оцінка структурно-функціонального стану і маркерів метаболізму кісткової системи у хворих на ювенільний ревматоїдний артрит та корекція виявлених порушень : автореф. дис. … канд. мед. наук : 14.01.10 / Ю.І. Тодика; Нац. мед. ун-т ім. О.О.Богомольця. – К., 2010. – 20 c.
- Тронько Н.Д. Цукровий діабет: сучасна парадигма лікування / Н.Д. Тронько // Український медичний часопис. – 2012. – № 5 (91). – С. 30-31.
- Уоткинс П. Дж. Сахарный диабет / П.Дж. Уоткинс. – М. : Бином, 2006. – 134 с.
- Федірко Г.В. Динаміка активності лужної і кислої фосфатаз та вмісту кальцію, фосфору в кістковій тканині в умовах гіпокінетичного остеопорозу і політравми / Г.В. Федірко, Р.М. Борис // Вісник наукових досліджень. – 2013. – № 1. – С. 104-107.
- Ференсович Н.Я. Характеристика порушень вуглеводного обміну у гематологічних хворих під впливом глюкокортикоїдів та цитостатичної терапії: автореф. дис… канд. мед. наук: 14.01.31 / Н.Я. Ференсович ; АМН України. Ін-т гематології та трансфузіології. – К., 2003. – 19 с.
- Хоменко А.В. Гідроксилювання холекальциферолу в гепатоцитах щурів за дії преднізолону / А.В. Хоменко // Український біохімічний журнал. – 2013. – Т. 85, № 3. – С. 90-95.
- Швед М.І. Корекція структурно-функціонального стану кісткової тканини у хворих на цукровий діабет / М.І. Швед, В.А. Отченашенко // Вісник наукових досліджень. – 2007. – № 1. – С. 37-38.
- Шепелькевич А.П. Глюкокортикоид-индуцированный остеопороз: особенности диагностики и лечения на современном этапе / А.П. Шепелькевич, Ю.В. Пекун, Н.А. Васильева // Медицинские новости. – 2007. – № 7. – С. 32-37.
- Шуба Н.М. Остеопороз – актуальная проблема XXI века: современное представление о патогенезе и терапии / Н.М. Шуба // Український ревматологічний журнал. – 2008. – № 2 (32). – С. 5-14.
- A practical guide to the monitoring and management of the complications of systemic corticosteroid therapy / D. Liu, A. Ahmet, L. Ward [et al.] // Allergy Asthma Clin. Immunol. – 2013. – Vol. 9, No. 1. – P. 30.
- A randomized, double-blind, placebo-controlled study to evaluate the effects of alendronate on bone mineral density and bone remodelling in perimenopausal women with low bone mineral density / A. Khan, S. Dubois, A.A. Khan [et al.] // J. Obstet. Gynaecol. Can. – 2014. – Vol. 36, No. 11. – P. 976-982.
- Abdul-Ghani М., Tripathy D., DeFronzo R. Contributions of (3-cell dysfunction and insulin resistance to the pathogenesis of impaired glucose tolerance and impaired fasting glucose / M. Abdul-Ghani, D. Tripathy, R. DeFronzo // Diabetes Care. – 2006. – Vol. 29. – P. 1130-1139.
- Acute and chronic systemic corticosteroid-related complications in patients with severe asthma / P. Lefebvre, M.S. Duh, M.H. Lafeuille [et al.] // J. Allergy Clin. Immunol. – 2015. – Vol. 136, No. 6. – P. 1488-1495.
- Adachi J.D The influence of osteoporotic fractures on health-related quality of life in community-dwelling men and women across Canada [text] / J.D. Adachi, G. Loannidis, C. Berger // Osteoporosis. Int. – 2001. – Vol. 12, No. 11. – P. 903-908.
- Adverse events of intravenous glucocorticoid pulse therapy in inflammatory diseases: a meta-analysis / N.A. Smits, N. Duru, J.W. Bijlsma, J.W. Jacobs // Clin. Exp. Rheumatol. – 2011. – Vol. 29, No. 5, Suppl. 68. – P. S85–S92.
- Adverse events of low- to medium-dose oral glucocorticoids in inflammatory diseases: a meta-analysis / J.N. Hoes, J.W.G. Jacobs, S.M.M. Verstappen [et al.] // Ann. Rheum. Dis. – 2009. – Vol. 68, No. 12. – P. 1833-1888.
- Alendronate rescued osteoporotic phenotype in a model of glucocorticoid-induced osteoporosis in adult zebrafish scale / S. Pasqualetti, T. Congiu, G. Banfi, M. Mariotti // Int. J. Exp. Pathol. – 2015. – Vol. 96, No. 1. – P. 11-20.
- American Diabetes Association. Clinical Practice Recommendations 2004. Prevention or delay of type 2 diabetes. // Diabetes Care. – 2004. – Suppl. 1. – P. S47-S54.
- American Diabetes Association. Economic costs of diabetes in the U.S. in 2002 // Diabetes Care. – 2003. – Vol. 26. – P. 917-932.
- American Diabetes Association. Diabetes and classification of diabetes mellitus / American Diabetes Association // Diabetes Care. – 2010. – Vol. 33, Suppl. 1. – P. S62–S69.
- American Diabetes Association. Diagnosis and Classification of Diabetes Mellitus / American Diabetes Association // Diabetes Care January. – 2013. – Vol. 36, Suppl. 1. – P. S67–S74.
- Angelo J. Diabetes prevention: a review of current literature / J. Angelo // Preventive Medicine. – 2005. – Vol. 5 (5). – P. 250-259.
- Assessment of individual fracture risk: FRAX and beyond / J.P. van den Bergh, T.A. van Geel, W.F. Lems, P.P. Geusens // Current Osteoporosis Reports. – 2010. – Vol. 8. – Р. 131-137.
- Bone mineral density and biochemical markers of bone metabolism in predialysis patients with chronic kidney disease / N. Fidan, A. Inci, M. Coban [et al.] // J. Investig. Med. – 2016. – Vol. 64, No. 4. – P. 861-866.
- Bone mineral density and fractures in older men with chronic obstructive pulmonary disease or asthma / T.T. Dam, S. Harrison, H.A. Fink [et al.] // Osteoporosis International. – 2010. – Vol. 21. – Р. 1341-1349.
- Bouxsein M. Bone quality: Where do we go from here? / M. Bouxsein // Osteoporos. Int. – 2003. – Vol. 14. – P. 118-127.
- Briot K. Drug-induced osteoporosis: beyond glucocorticoids / K. Briot, C. Roux // Curr. Rheumatol. Rep. – 2008. – Vol. 10, No. 2. – P. 102-109.
100. Buttgereit F. Genomic and nongenomic effects of glucocorticoids / F. Buttgereit, C. Stahn // Nat. Clin. Pract. Rheumatol. – 2008. – Vol. 10. – P. 525-533.
101. Ceriello A. Postprandial hyperglycemia and diabetes complications. It’s time to treat? / A. Ceriello // Diabetes. – 2005. – Vol. 54, No. 1. – P. 1-7.
- Chee C. Inhaled corticosteroids and bone health / C. Chee, L. Sellahewa, J.M. Pappachan // Open Respir. Med. J. – 2014. – Vol. 8. – P. 85-92.
- Chronic hyperuricemia, uric acid deposit and cardiovascular risk / D. Grassi, L. Ferri, G. Desideri [et al.] // Curr. Pharm. Des. – 2013. – Vol. 19, No. 13. – P. 2432-2438.
- Clinician’s Guide to Prevention and Treatment of Osteoporosis / F. Cosman, S.J. de Beur, M.S. LeBoff [et al.] // Osteoporos Int. – 2014. – Vol. 25, No. 10. – P. 2359-2381.
- Clore J.N. Glucocorticoid-induced hyperglycemia / J.N. Clore, L. Thurby-Hay // Endocr. Pract. – 2009. – Vol. 15. – P. 469-474.
- Compston J. Management of glucocorticoid-induced osteoporosis / J. Compston // Nat. Rev. Rheumatol. – 2010. – Vol. 6, No. 2. – P. 82-88.
- Corticosteroid-induced hyperglycemia is increased 10-fold in patients with pemphigus / A. Alavi, J. Lowe, S. Walsh [et al.] // Int. J. Dermatol. – 2012. – Vol. 51, No. 10. – P. 1248-1252.
- Dagogo-Jack S. Primary prevention of cardiovascular disease in pre-diabetes / S. Dagogo-Jack // Diabetes Care. – 2005. – Vol. 28. – P. 971-972.
- Dennison E. Epidemiology of osteoporosis / E. Dennison, M.A. Mohamed, C. Cooper // Rheum. Dis. Clin. North Am. – 2006. – Vol. 32, No. 4. – P. 617-629.
- Drake M.T. The Pathophysiology and Treatment of Osteoporosis / M.T. Drake, B.L. Clarke, E.M. Lewiecki // Clin. Ther. – 2015. – Vol. 37, No. 8. – P. 1837-1850.
- Effects of epidural steroid injections on blood glucose levels in patients with diabetes mellitus / J.L. Even, C.G. Crosby, Y. Song [et al.] // Spine. – 2012. –Vol. 37, No. 1. – P. E46-E50.
- Egbuonu F. Effect of inhaled corticosteroids on glycemic status / F. Egbuonu, F.A. Antonio, M. Edavalath // Open Respir. Med. J. – 2014. – Vol. 8. – P. 101-105.
- Eldecalcitol, in combination with bisphosphonate, is effective for treatment of japanese osteoporotic patients / K. Mukaiyama, S. Uchiyama, Y. Nakamura [et al.] // Tohoku J. Exp. Med. – 2015. – Vol. 237, No. 4. – P. 339-343.
- Elevation of serum alkaline phosphatase (ALP) level in postmenopausal women is caused by high bone turnover / K. Mukaiyama, M. Kamimura, S. Uchiyama [et al.] // Aging Clin. Exp. Res. – 2015. – Vol. 27, No. 4. – P. 413-418.
- Endocrine effects of inhaled corticosteroids in children / C.R. Kapadia, T.D. Nebesio, S.E. Myers [et al.] // JAMA Pediatr. – 2016. – Vol. 170, No. 2. – P. 163-170.
- Evaristo-Neto A.D. Prevalence of diabetes mellitus and impaired glucose tolerance in a rural community of Angola / A.D. Evaristo-Neto, M.C. Foss-Freitas, M.C. Foss // Diabetol. Metab. Syndr. – 2010. – Vol. 2. – P. 63.
- Fleming P. Hyperglycemia following intralesional corticosteroid injection in a patient with type I diabetes mellitus / P. Fleming, L. Drazek, J.C. Shaw // J. Cutan. Med. Surg. – 2014. – Vol. 18, No. 4. – P. 275-276.
- Ford E. Risks for all-cause mortality, cardiovascular disease, and diabetes associated with the metabolic syndrome / E. Ford // Diabetes Care. – 2005. – Vol. 28. – P. 1769-1778.
- Fracture risk with intermittent high- dose oral glucocorticoid therapy / F. De Vries, M. Bracke, H.G. Leufkens [et al.] // Arthritis Rheum. – 2007. – Vol. 56, No. 1. – P. 208-214.
- Glucocorticoid-induced osteoporosis: pathophysiology and therapy / E. Canalis, G. Mazziotti, A. Giustina, J.P. Bilezikian // Osteoporos Int. – 2007. – Vol. 18, No. 10. – P. 1319-1328.
- Hlaing H.H. Dietary intake, food pattern, and abnormal blood glucose status of middle-aged adults: a cross-sectional community-based study in Myanmar / H.H. Hlaing, T. Liabsuetrakul // Food Nutr. Res. – 2016. – Vol. 60. – P. 28898.
- IDF diabetes atlas. – 6th ed. / International Diabetes Federation. – Brussels : International Diabetes Federation, 2013. – 160 p.
- Ilanefeld M. Insulin secretion and insulin sensitivity pattern is different in isolated impaired glucose tolerance and impaired fasting glucose. The risk factors in impaired glucose tolerance for atherosclerosis and diabetes study / M. Ilanefeld, C. Koehler, K. Fuecker // Diabetes Care. – 2003. – Vol. 26. – P. 868-874.
- Impact of osteoporosis and bone fracture on health-related quality of life in postmenopausal women / S. Palacios, J. L. Neyrob, S. Fernández de Caboc [et al.] // Climacteric. – 2014. – Vol. 17, Iss. 1. – P. 60-70.
- Impaired fasting glucose and cardiovascular outcomes in postmenopausal women with coronary artery disease / A.M. Kanaya, D. Herrington, E. Vittinghoff [et al.] // Ann. Intern. Med. – 2005. – Vol. 142. – P. 813-820.
- Impaired Fasting Glucose and Impaired Glucose Tolerance. Implications for care / D.M. Nathan, M.B. Davidson, R.A. DeFronzo [et al.] // Diabetes Care. –2007. – Vol. 30, No. 3. – P. 753-759.
- Kaneko K. Mechanisms and therapeutics of glucocorticoid-induced osteoporosis / K. Kaneko, S. Kavai // Nihon rinsho Meneki Gakkai Kaishi. – 2011. – Vol. 34, No. 3. – P. 138-148.
- Kanis J.A. Requirements for DXA for the management of osteoporosis in Europe / J.A. Kanis, O. Johnell // Osteoporos Int. – 2005. – Vol. 16, No. 3. – P. 229-238.
- Kasturi S. Corticosteroids in lupus / S. Kasturi, L.R. Sammaritano // Rheum. Dis. Clin. North Am. – 2016. – Vol. 42, No. 1. – P. 47-62.
- Long-term side effects of glucocorticoids / M. Oray, K. Abu Samra, N. Ebrahimiadib [et al.] // Expert Opin. Drug Saf. – 2016. – Vol. 15, No. 4. – P. 457-465.
- Long-term warfarin therapy and biomarkers for osteoporosis and atherosclerosis / S. Namba, M. Yamaoka-Tojo, T. Hashikata [et al.] // BBA Clin. – 2015. – Vol. 12, No. 4. – P. 76-80.
- Madureira M.M. Quality of life measurements in patients with osteoporosis and fractures / M.M. Madureira, R.M. Ciconelli, R.M.R. Pereira // Clinics (Sao Paulo). – 2012. – Vol. 67, No. 11. – P. 1315-1320.
- McMaster University Evidence Based Practice Center. Diagnosis, Prognosis, and Treatment of Impaired Glucose Tolerance and Impaired Fasting Glucose. Evidence Report Number 128 / McMaster University Evidence Based Practice Center. – Ontario : Hamilton, 2005. – 312 p.
- Overman R.A. Prevalence of Oral Glucocorticoid Usage in the United States: A General Population Perspective / R.A. Overman, J.-Y. Yeh, C.L. Deal // Arthritis Care & Research. – 2013. – Vol. 65, No. 2. – P. 294-298.
- Oyhanart S.R. Effect of alendronate on the mandible and long bones: an experimental study in vivo / S.R. Oyhanart, N.D. Escudero, P.M. Mandalunis // Pediatr. Res. – 2015. – Vol. 78, No. 6. – P. 618-625.
- Pandya D. Systemic effects of inhaled corticosteroids: an overview / D. Pandya, A. Puttanna, V. Balagopal // Open Respir. Med. J. – 2014. – Vol. 8. – P. 59-65.
- Panthakalam S. The prevalence and management of hyperglycemia in patients with rheumatoid arthritis on corticosteroid therapy / S. Panthakalam, D. Bhathnagar, P. Klimiuk // Scotish Medical Journal. – 2004. – Vol. 49, No. 4. – P. 139-141.
- Pereira R.M.R. Glucocorticoid-induced osteoporosis in rheumatic diseases / R.M.R. Pereira, J.F. de Carvalho, E. Canalis // Clinics (Sao Paulo). – 2010. – Vol. 65, No. 11. – P.1197-1205.
- Pistrosch F. Is Hyperglycemia a Cardiovascular Risk Factor? / F. Pistrosch, A. Natali, M. Hanefeld // Diabetes Care. – 2011. – Vol. 34, Suppl. 2. – P. S128-S131.
- Quantitative ultrasound assessment of acute bone loss following spinal cord injury: a longitudinal pilot study / S.J. Warden, K.L. Bennell, B. Matthews [et al.] // Osteoporos Int. – 2002. – Vol. 13. – P. 586-592.
- Radionuclide and Hybrid Bone Imaging / Ed. by I. Fogelman, G. Gnanasegaran, H. van der Wall. – Berlin, Heidelberg : Springer-Verlag, 2012. – 1046 p.
- Rhen T. Antiinflammatory action of glucocorticoids – new mechanisms for old drugs [Text] / T. Rhen, J. A. Cidlowski // N. Engl. J. Med. – 2005. – Vol. 353. – P. 1711-1723.
- Risk factors for clinical fractures among postmenopausal women: a 10-year prospective study / T.A. Van Geel, P.P. Geusens, I.F. Nagtzaam [et al.] // Menopause Int. – 2007. – Vol. 13, No. 3. – P. 110-115.
- Risk for type 2 diabetes mellitus and associated factors / N.B.P. Marinho, H.C.A. de Vasconcelos, A.M.P.G. Alencar [et al.] // Acta paul. enferm. – 2013. – Vol. 26, No. 6. – P. 132-136.
- Risk of diabetes among patients with rheumatoid arthritis and psoriasis / D.H. Solomon, T.J. Love, C. Canning, S. Schneeweiss // Annals of rheumatic diseases. – 2010. – Vol. 69, No. 13. – P. 2114-2117.
- Ruimerman R. Modeling and remodeling in bone tissue / R. Ruimerman. – Eindhoven : Technische Universiteit Eindhoven, 2005. – 109 p.
- Ruiz-Irastorza G. Glucocorticoid use and abuse in SLE / G. Ruiz-Irastorza, A. Danza, M. Khamashta // Rheumatology (Oxford). – 2012. – Vol. 51, No. 7. – P. 1145-1153.
- Safety of inhaled corticosteroids for treating chronic obstructive pulmonary disease / M.G. Matera, V. Cardaci, M. Cazzola, P. Rogliani // Expert Opin. Drug Saf. – 2015. – Vol. 14, No. 4. – P. 533-541.
- Schianka G.P. The significance of impaired fasting glucose versus impaired glucose tolerance. Importance of insulin secretion and resistance / G.P. Schianka, A. Rossi, P. Sainaghi // Diabetes Care. – 2003. – Vol. 26. – P. 1333-1337.
- Spivey J. Bullous pemphigoid: corticosteroid treatment and adverse effects in long-term care patients / J. Spivey, A.M. Nye // Consult. Pharm. – 2013. –Vol. 28, No. 7. – P. 455-462.
- Standardised nomenclature for glucocorticoid dosages and glucocorticoid treatment regimens: current questions and tentative answers in rheumatology / F. Buttgereit, J.A. da Silva, M. Boers [et al.] // Ann. Rheum. Dis. – 2002. – Vol. 61. – P. 718-722.
- Sunyecz J.A. The use of calcium and vitamin D in the management of osteoporosis / J.A. Sunyecz // Ther. Clin. Risk Manag. – 2008. – Vol. 4, No. 4. – P. 827-836.
- Tam A. Psoriatic arthritis / A. Tam, K.A. Geies // Orthop. Nurs. – 2004. – Vol. 23, No. 5. – P. 311-314.
- Tanaka Y. Drug-induced osteoporosis / Y. Tanaka // Nippon. Rinsho. – 2007. – Vol. 65, No. 8 (Suppl.). – P. 394-398.
- The ability of peripheral quantitative ultrasound to identify patients with low bone mineral density in the hip or spine / R.B. Cook, D. Collins, J. Tucker [et al.] // Ultrasound Med. Biol. – 2005. – Vol. 31, No. 5. – P. 625-657.
- The clinical and genetic associations of anti-cyclic citrullinated peptide antibodies in psoriatic arthritis / E. Korendowych, P. Owen, J. Ravindran [et al.] // Rheumatology (Oxford). – 2005. – Vol. 44, No. 8. – P. 1056-1060.
- The rising prevalence of diabetes and impaired glucose tolerance: the Australian Diabetes, Obesity and Lifestyle Study / D. Dunstan, P. Zimmet, T. Wellborn [et al.] // Diabetes Care. – 2002. – Vol. 25. – P. 829-834.
- The role of diabetes and components of the metabolic syndrome in stroke and coronary heart disease mortality in U.K. white and african-caribbean populations / Th. Tillin, N. Forouhi, P. McKeigue [et al.] // Diabetes Care. – 2006. – Vol. 29, No. 9. – P. 2127-2129.
- Thomas T. Vitamin D, bone metabolism and fracture risk / T. Thomas, K. Briot // Geriatr Psychol Neuropsychiatr Vieil. – 2016. – Vol. 21. – P. 126-131.
- Timing and risk factors for clinical fractures among postmenopausal women: a 5-years prospective study / A.C. Van. Geel, P.P. Geusens, I.F. Nagtzaam [et al.] // BMC Med. – 2006. – Vol. 4. – P. 24.
- UN Resolution on Diabetes // Int. J. Clin. Pract. – 2006. – Vol. 61, is. 57. – P. 9-15.
- Van Staa T.P. The epidemiology of corticosteroid-induced osteoporosis: a meta-analysis / T.P. Van Staa, H.G. Leufkens, C. Cooper // Osteoporosis Int. – 2002. – Vol. 13. – P. 777-787.
- WHO. Diabetes Mellitus: Report of a study group. Technical Series Report No. 727. – Geneva : WHO, 1985. – 113 p.
- Zanni G.R. Psoriasis: issues far more serious than cosmetic / G.R. Zanni // Consult. Pharm. – 2012. – Vol. 27, No. 2. – P. 86-96.
Додаток А
Акти впровадження














