МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
ХАРКІВСЬКИЙ НАЦІОНАЛЬНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ
На правах рукопису
БЕРЕГОВА АЛЛА АНАТОЛІЇВНА
УДК 616.517:616.839-092-08
ПОРУШЕННЯ СТАНУ ЕРГО- ТА ТРОФОТРОПНОЇ СИСТЕМ
ПРИ ПСОРІАЗІ ТА ЇХ ПАТОГЕНЕТИЧНА КОРЕКЦІЯ
14.01.20 – шкірні та венеричні хвороби
Дисертація на здобуття наукового ступеня
кандидата медичних наук
Науковий керівник:
Біловол Алла Миколаївна
доктор медичних наук, професор
Харків – 2016
ЗМІСТ
| Перелік умовних позначень | 4 |
| Вступ | 5 |
| Розділ 1 Клініко-патогенетичні і терапевтичні аспекти псоріазу (огляд літератури) | 10 |
| 1.1 Сучасні погляди щодо етіології та патогенезу псоріазу | 10 |
| 1.2 Роль ерго- та трофотропної систем у патогенезі псоріазу | 25 |
| 1.3 Сучасні підходи до лікування псоріазу | 31 |
| Розділ 2 Матеріал та методи дослідження | 39 |
| 2.1 Критерії вибору пацієнтів і програми дослідження | 39 |
| 2.2 Методи досліджень | 41 |
| Розділ 3 Клінічна характеристика хворих | 48 |
| Розділ 4 Стан ерго- та трофотропної систем організму у хворих на псоріаз різного ступеня тяжкості | 58 |
| 4.1 Оцінка обміну катехоламінів у хворих на псоріаз | 58 |
| 4.2 Оцінка адаптивно-репаративних реакцій за вмістом компонентів вуглеводвмісних білків у сироватці крові та 17-оксикортикостероїдів у сечі хворих на псоріаз | 66 |
| 4.3 Вміст медіаторів трофотропної системи | 70 |
| Розділ 5 Комплексна медикаментозна корекція порушень стану ерго- та трофотропної систем при псоріазі різного ступеня тяжкості |
79 |
| 5.1 Обґрунтування комплексного методу лікування хворих на псоріаз із використанням метамаксу та кортексину | 79 |
| 5.2 Визначення критеріїв чутливості показників стану ерго- та трофотропної систем у хворих на псоріаз | 82 |
| 5.3 Оцінка ефективності комплексного медикаментозного лікування хворих на псоріаз за динамікою найбільш чутливих показників стану ерго- та трофотропної систем |
94 |
| 5.4 Оцінка клінічної ефективності патогенетичної корекції | 103 |
| Розділ 6 Аналіз та узагальнення результатів дослідження | 110 |
| Висновки | 130 |
| Рекомендації | 132 |
| Список використаних джерел | 133 |
| Додаток А Акти впровадження | 164 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
А |
– адреналін |
ВМК |
– ванілілмигдальна кислота |
ГАГ |
– глікозаміноглікани |
ГВК |
– гомованілінова кислота |
ГП |
– глікопротеїни |
ДА |
– дофамін |
ДОФА |
– діоксифенілаланін |
НА |
– норадреналін |
ХНМУ |
– Харківський національний медичний університет |
ЦНС |
– центральна нервова система |
5-ОІОК |
– 5-оксиіндолоцтова кислота |
17-ОКС |
– 17-оксикортикостероїди |
6-СОМТ |
– 6-сульфатоксимелатонін |
ВСТУП
Актуальність теми. За сучасним визначенням псоріаз – це хронічний дерматоз мультифакторіальної природи з домінуючим значенням у розвитку генетичних та імунних факторів, що характеризується прискореною проліферацією епідермоцитів, порушенням їх диференціювання, запальною реакцією в дермі, змінами в різних органах і системах, метаболічними розладами [72, 94, 140, 231, 255, 261, 287]. За період 2000-2015 рр. мало місце зростання розповсюдженості псоріазу в 3 рази. Висока захворюваність на псоріаз, хронічний рецидивуючий перебіг, зростання кількості торпідних до лікування випадків, порушення психосоціальної адаптації хворих спонукає до пошуку нових, патогенетично обґрунтованих методів терапії.
Останнім часом у патогенезі псоріазу важливу роль відводять порушенням гомеостазу з наступним зниженням адаптаційних механізмів [1, 3, 73, 262]. Протягом багатьох років вагоме значення надається вивченню гомеостазу як складного комплексу функціональної спеціалізації, що підтримує постійність внутрішнього середовища організму людини. Доведено, що будь-яке втручання у гомеостаз організму тягне за собою зміни його біологічного стану, розвиток стресових реакцій. Тому багато захворювань, у тому числі й псоріаз, є наслідком порушень функцій, які відповідають за пристосування організму до певних змін [72, 73, 123]. Безпосередню участь у розвитку стресових реакцій беруть ерго- та трофотропна системи. Ерготропна система здійснює пристосування організму до будь-яких факторів зовнішнього або внутрішнього середовища завдяки посиленню активності катаболічних процесів. Основну роль у забезпеченні ерготропної реакції виконують симпато-адреналові механізми. Трофотропна система, навпаки, сприяє збереженню та накопиченню енергії в організмі за рахунок активації анаболічних процесів. У здійсненні трофотропних реакцій бере участь парасимпатичний відділ вегетативної нервової системи, а також гормони анаболічної дії та інші метаболіти. Як правило, ерго- та трофотропна системи діють синергічно. Але у певній ситуації як ерготропні, так і трофотропні реакції (адаптаційно-компенсаторні за своєю сутністю) у надлишковому стані з фізіологічних перетворюються на патологічні, що сприяє розвитку різних клінічних синдромів і захворювань [134, 191, 282].
Для лікування псоріазу сьогодні використовують препарати різних фармакологічних груп, але слід зазначити, що препарати, як правило, вибірково коригують деякі патогенетичні ланки псоріазу [34, 35, 225, 273, 277, 286]. Терапевтичні схеми, що використовуються останнім часом, не враховують стан ерго- та трофотропної систем організму пацієнтів. Тому пошук та обґрунтування використання в практиці оптимальної схеми лікування псоріазу, що надає суттєвий вплив на нормалізацію концентрації речовин ерго- та трофотропної дії в організмі хворих, є актуальною проблемою дерматології.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційну роботу виконано в рамках науково-дослідних робіт Харківського національного медичного університету (ХНМУ) «Раціональна терапія хворих на псоріаз асоційована з кардіометаболічними порушеннями з урахуванням етіопатогенетичних чинників» (№ держреєстрації 0112U001815), «Оптимізація лікування псоріатичної патології, поєднаної з артеріальною гіпертензією» (№ держреєстрації 0116U004976). Дисертантом особисто виконано фрагмент, присвячений вивченню особливостей клініки та діагностики псоріазу з урахуванням патогенетичних ланок захворювання.
Мета і задачі дослідження. Мета – підвищити ефективність терапії та розробити патогенетично обґрунтований метод лікування хворих на псоріаз на підставі вивчення стану ерго- і трофотропної систем.
Для досягнення поставленої мети були вирішені такі задачі.
1. Вивчити клінічні прояви псоріазу, визначити ступінь тяжкості, провести клініко-статистичні співставлення у хворих з дерматозом.
2. Оцінити у хворих на псоріаз різного ступеня тяжкості стан ерготропної системи за показниками обміну катехоламінів (діоксифенілаланін (ДОФА), дофамін (ДА), норадреналін (НА), адреналін (А), ванілілмигдальна (ВМК) та гомованілінова кислоти [ГВК]) і адаптаційно-репаративних реакцій (компоненти вуглеводвмісних білків, 17‑оксикортикостероїди [17-ОКС]).
3. Дослідити у хворих на псоріаз різного ступеня тяжкості стан трофотропної системи за показниками обміну медіаторів – серотоніну та гістаміну.
4. Визначити найбільш чутливі показники стану ерго- і трофотропної систем залежно від ступеня тяжкості псоріазу.
5. Розробити комплексну патогенетичну терапію з корекцією порушень ерго- і трофотропної систем у хворих на псоріаз та оцінити її ефективність за динамікою змін чутливих показників.
Об’єкт дослідження: псоріаз різного ступеня тяжкості.
Предмет дослідження: особливості обміну катехоламінів і пов’язаних з ним адаптивно-репаративних процесів, серотоніну та гістаміну, результати лікування.
Методи дослідження: клінічні, біохімічні, математичні, статистичні.
Наукова новизна одержаних результатів. Одержано нові дані щодо патогенетичних механізмів порушень обміну катехоламінів та пов’язаних з ним адаптивно-репаративних процесів, обміну медіаторів трофотропної системи – серотоніну та гістаміну – залежно від ступеня тяжкості псоріазу. Вперше визначено залежність дисфункції вегетативної нервової системи від ступеня тяжкості псоріазу, що підтверджується активацією симпато-адреналових механізмів у хворих з легким ступенем захворювання, превалюванням парасимпатичних регуляторних механізмів забезпечення гомеостатичної функції організму при тяжкому ступені захворювання. Виявлено чітку дисоціацію в активності ланок симпато-адреналової системи при псоріазі: у разі легкого та середнього ступеня тяжкості – превалювання тонусу і реактивності гормональної ланки над нервовою; у разі тяжкого – нервової над гормональною. Встановлено залежне від тяжкості хвороби виснаження ерготропних функцій, пов’язаних з адаптаційно-репаративними реакціями, розвитком деструктивних і дезорганізаційних процесів у сполучнотканинних структурах, зниженням функціональних резервів кори наднирників, на фоні активації трофотропних функцій.
Вперше науково обґрунтовано комплексну терапію псоріазу з використанням метамаксу та кортексину, надано оцінку розробленої терапії.
Практичне значення одержаних результатів. Розроблено і апробовано комплексний метод корекції порушень стану ерго- і трофотропної систем у хворих на псоріаз різного ступеня тяжкості шляхом введення до традиційної терапії препаратів з неспецифічними механізмами дії – метамаксу та кортексину. Застосування розробленого методу сприяє усуненню клінічних проявів захворювання, зменшенню кількості рецидивів. Виявлено найбільш чутливі показники стану ерго- і трофотропної систем залежно від ступеня тяжкості псоріазу, показана можливість їх використання для об’єктивної оцінки ступеня тяжкості та ефективності терапії дерматозу. Розроблено спосіб визначення ступеня тяжкості псоріазу за рівнем у біологічній рідині катехоламінів – норадреналіну, адреналіну та їх метаболітів – ВМК та ГВК (патент на корисну модель № 107329 від 25.05.2016).
Теоретичні положення дослідження та практичні рекомендації впроваджено в роботу кафедри дерматовенерології та косметології з курсом дерматовенерології і естетичної медицини факультету післядипломної освіти Запорізького державного медичного університету, кафедри дерматовенерології та ВІЛ/СНІДу Харківської медичної академії післядипломної освіти, клініки Державної установи «Інститут дерматології та венерології НАМН України», Комунального закладу охорони здоров’я «Харківський міський клінічний шкірно-венерологічний диспансер № 5».
Особистий внесок здобувача. Здобувачем особисто визначено програму досліджень, сформовано групи хворих, виконано експерименти, проведено статистичне опрацювання одержаних результатів. Аналіз та інтерпретацію результатів дослідження здійснено разом із науковим керівником. Дисертантом спільно з В.І. Жуковим та С.О. Стеценко, співробітниками ХНМУ, досліджено біохімічні особливості стану адаптивно-репаративних процесів і обміну серотоніну у хворих на псоріаз залежно від ступеня тяжкості псоріазу.
Дисертантом не запозичено результати та ідеї співавторів публікацій.
Апробація результатів дисертації. Основні положення дисертації оприлюднені на засіданні Харківського наукового товариства дерматовенерологів та косметологів «Школа нових методів діагностики, лікування та профілактики в дерматовенерології» (Харків, 2016); на науково-практичній конференції з міжнародною участю «Інноваційні технології в дерматовенерології. Міждисциплінарні зв’язки» (Харків, 2015); науково-практичній конференції молодих вчених інституту «Школа нових методів діагностики, лікування та профілактики в дерматовенерології» (Харків, 2015); міжнародному конгресі «Людина та ліки України» (Київ, 2015); IХ Всеукраїнській науково-практичній конференції з міжнародною участю «Актуальні питання косметології та дерматології» (Запоріжжя, 2015); науково-практичній конференції «Слобожанські читання. Сучасні проблеми дерматовенерології, косметології та управління охорони здоров’я» (Харків, 2015); науково-практичній конференції «Слобожанські читання. Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я» (Харків, 2014).
Публікації. За темою дисертації опубліковано 14 наукових праць, у тому числі 6 статей, з них 5 статей у спеціалізованих наукових виданнях України, 1 стаття в іноземному журналі, 5 статей у журналах, що входять до міжнародної наукометричної бази «Російський індекс наукового цитування», 1 стаття – INDEX COPERNICUS, 7 тез доповідей, 1 патент України на корисну модель.
РОЗДІЛ 1
КЛІНІКО-ПАТОГЕНЕТИЧНІ І ТЕРАПЕВТИЧНІ АСПЕКТИ ПСОРІАЗУ (ОГЛЯД ЛІТЕРАТУРИ)
1.1 Сучасні погляди щодо етіології та патогенезу псоріазу
Псоріаз, згідно сучасної наукової концепції, одне з найпоширеніших хронічних рецидивних мультифакторіальних захворювань шкіри, для якого характерні гіперпроліферація епідермальних клітин, порушення процесу кератинізації, запальна реакція в дермі [40, 64, 201, 261]. Рівень досліджень на даному етапі дозволяє також визначити псоріаз як системне захворю-вання, або псоріатичну хворобу, що включає комплекс взаємообумовлених патогенетичних ланок (генетичну, імунну, нейроендокринну, метаболічну) та інші порушення в органах і системах організму [18, 21, 34, 60, 74, 90, 131, 140, 156, 220, 233]. Хронічний перебіг, часті рецидиви, недовгі періоди ремісії, психоемоційна дезадаптація дозволяють розглядати проблему псоріазу не тільки як медичну, але й як соціальну.
Псоріаз не поступається провідних позицій, зустрічається у людей всіх національностей і рас незалежно від статі, віку, а також кліматичних і соціально-економічних умов. За даними клініко-епідеміологічних досліджень на псоріаз хворіє 3–4 % населення. Питома вага цієї патології у загальній структурі шкірних хвороб сягає від 1 % до 40 % [19, 107, 235]. Протягом останніх років спостерігається зростання захворюваності на псоріаз. Частішають випадки дебюту хвороби в молодому віці, збільшується кількість тяжких форм, що часто призводить до інвалідизації [40, 48, 116]. За даними різних авторів [265], у 3/4 випадках псоріаз виникає в дитинстві або юності, в 1/4 – у зрілому або похилому віці незалежно від статі. Визначають два вікових підйоми захворюваності, яким відповідають дві форми хвороби: 1) з чіткою генетичною схильністю (у 16-30 років); 2) сприятливішого перебігу, без генетичної складової (у 55-60 років) [60, 140, 272]. В Україні останнім часом відмічається зростання захворюваності серед осіб 18-40 років, а також у дітей [99]. У країнах Північної Європи спостерігається більш значна захворюваність на псоріаз, ніж у південних країнах з низькою тривалістю життя. У деяких випадках відмінності відмічаються в окремих етнічних групах, що свідчить про роль генетичних факторів і/або факторів довкілля у виникненні даної хвороби [69, 128, 176, 222].
На даний час звичайно виокремлюють бляшкові, позабляшкові та позашкірні форми псоріазу. У перебігу хвороби розрізняють, як правило, три стадії [92, 112, 210, 216]. Найчастіше використовується класифікація псоріазу за ступенем тяжкості: легкий (ураження шкіри менш ніж 3 % поверхні), середній (з ураженням від 3 % до 10 % поверхні шкіри) та тяжкий (із залученням більше 10 % поверхні шкіри). Псоріатичне ураження суглобів розцінюється як тяжка форма псоріазу, поза залежністю від площі ураження шкіри [9, 199]. Т. І. Шевченко та В. Г. Шлопов [200] запропонували клініко-морфологічну класифікацію псоріазу, що ґрунтується на виділенні чотирьох типів залежно від характеру імуноморфологічних змін в органах і тканинах: І тип характеризується гострим імунним запаленням (реакцією гіперчутливості негайного типу з перевагою альтеративних і судинно-ексудативних проявів); II тип – підгострим імунним запаленням (поєднанням реакції гіперчутливості негайного та уповільненого типів з домінуванням судинно-ексудативних і продуктивних змін); III тип – хронічним імунним запаленням (реакцією гіперчутливості уповільненого типу з переважанням у морфологічній картині продуктивних і склеротичних змін); IV тип – різким порушенням антиген-специфічної взаємодії імунокомпетентних клітин з клітинами та міжклітинними структурами різних органів і тканин з розвитком дистрофічних і атрофічних процесів (автоімунізація).
Розподіл хворих на псоріаз різних форм за тяжкістю клінічної картини підпорядковується так званому «правилу третин» – дві третини мають легку та помірну форми псоріазу, а одна третина – середньої тяжкості та тяжкі форми. Якщо пацієнтів із псоріазом у країнах Європи та США ще кілька років тому загалом налічувалося 10 млн., то на частку легких форм припадає від 6,0 до 7,5 млн. хворих, а тяжких форм – 3 млн. [276].
До систем об’єктивної та суб’єктивної оцінки тяжкості перебігу псоріазу належать [2, 6]: BSA (Body Surface Area) – оцінка площі ураження – площі поверхні тіла (1-, 2+, 2-, 3); PASI (Psoriasis Area Severity Index) – оцінка тяжкості та ступеня ураження шкіри, достовірний показник при визначенні ступеня тяжкості у разі середньотяжкого і тяжкого псоріазу (2++); PGA (Physician’s Global Assessment) – використовується в клінічних дослідженнях для об’єктивізації клінічних змін (2++); NAPSI (The Nail Psoriasis Severity Index) – використовується для об’єктивної оцінки ступеня ураження нігтів, визначається для кожного окремого пальця (2++B); оцінюють наявність ознак ураження нігтьової пластини та нігтьового ложа.
У багатьох клінічних дослідженнях поряд з клінічними параметрами визначають якість життя пацієнтів. Під терміном «якість життя» звичайно розглядають сукупність факторів щодо якості фізичного, психічного, соціального та функціонально-асоційованого способу життя індивідуума [3, 10, 11, 48, 62, 88, 146, 147, 154, 269]. Високий рівень захворюваності на псоріаз на даному етапі розвитку цивілізації пояснюється стрімким темпом життя суспільства, збільшенням емоційного навантаження, що вимагає значних нервових та інтелектуальних зусиль, у результаті чого нерідко виникають суперечливі моменти між можливостями біологічної природи людини та умовами життя. Псоріаз, у зв’язку з цим, нерідко відносять до групи так званих «хвороб цивілізації» [75, 108, 174]. У ряді досліджень [10, 11, 48, 49, 76, 88, 89] описується вплив псоріазу на соціальну та фізичну складові якості життя пацієнтів, що призводить до змін психологічного стану та суттєвих порушень якості життя у загальному розумінні (1++, A). Так, наприклад, у пацієнтів із псоріазом має місце більш суттєве зниження якості життя, ніж у пацієнтів з цукровим діабетом, ішемічною хворобою серця або онкологічними захворюваннями. Оцінку впливу захворювання на якість життя пацієнта проводять за допомогою перевірених анкет-опитувальників, а саме анкети для дослідження загальної якості життя (SF-36), анкети для оцінки показника якості життя, пов’язаного з хворобою [Dermatology Life Quality Index – DLQI (2++, B), Skindex (2++, B)], або анкети для визначення індексів непрацездатності [PsoQoL, Psoriasis Disability Index – PDI (2++, B)].
Наведені вище системи об’єктивної та суб’єктивної оцінки дозволяють визначити ступінь тяжкості псоріазу шляхом співставлення одержаних у конкретного пацієнта відповідних індексів/показників (наприклад, найбільш розповсюджених BSA, PASI, DLQI (2++, B): легкий ступінь псоріазу: BSA≤10 балів і PASI≤10, DLQI≤10; середньотяжкий та тяжкий ступінь псоріазу – BSA>10 або PASI>10, DLQI>10. Клінічно легкий ступінь псоріазу може бути розглянутий як середньотяжкий або тяжкий, якщо BSA≤10 та PASI≤10, але DLQI>10 – має місце значне зниження якості життя. Клінічно середньотяжкий або тяжкий псоріаз може бути розглянутий як легкий, якщо BSA>10 або PASI>10, але DLQI≤10 – тобто має місце незначний вплив псоріазу на якість життя [75].
Перехід субклінічної стадії псоріазу в клінічно виражену в більшості випадків пов’язаний із впливом на організм різноманітних провокуючих екзогенних або ендогенних факторів. До екзогенних звичайно відносять фізичні фактори (наприклад, місцева травма), внаслідок чого пояснюється локалізація «чергових» папул псоріазу на місцях шкіри, які найчастіше піддаються травматизації (на поверхні суглобів, волосистій частині голови); сонячні опіки, вплив хімічних факторів; хронічні запальні дерматози, що призводять до пошкодження шкіри: мікози, дерматити, глибокі піодерміти. До ендогенних факторів належать стреси, інфекційні хвороби, фокальні осередки інфекції, порушення кальцієвого обміну, нераціональне загальне медикаментозне лікування, вагітність, пологи тощо [12, 40, 275].
Окремо слід виділити спостереження, що свідчать про безсумнівний вплив різних інфекційних захворювань на виникнення і перебіг псоріазу [78, 110]. Сезонність його перебігу, часте виникнення або загострення після перенесеної ангіни, тонзиліту, гаймориту, грипу та інших захворювань вказують на значну роль осередків хронічної інфекції. Висловлюється припущення, що інфекційні агенти є потужними сенсибілізаторами, послаблюють імунну систему і змінюють стан вегетативної нервової системи [210]. Дослідження культури Staphylococcus aureus, виділеної на шкірі хворих на псоріаз, визначили суперантигенні токсини або термолабільні токсини, схожі із стафілококовим α-токсином, які проявили стимулюючу дію на секрецію фактора некрозу пухлини – альфа в ізольованих кератиноцитах після інкубації [36, 229]. Лімфоцити можуть бути активізовані стрептококовими антигенами, причому даний варіант найбільш характерний для краплеподібного псоріазу, який часто супроводжується стрептококовим ураженням мигдалин. Відсутність інфекційного агента безпосередньо в осередках псоріатичних висипань, за літературними даними, можливо зумовлена гіперактивністю фагоцитарної системи, а також посиленням кровообігу і підвищенням температури дерми у хворих, що перешкоджає розвитку бактерій [104, 150, 210].
У разі появи у практично здорової людини псоріазу, на думку О. В. Терлецького [179], необхідно враховувати наступні причини: спадковість (схильність до розвитку захворювання), стан нервової системи, інтоксикації (зовнішні та внутрішні). У деяких літературних джерелах провідну роль у механізмі розвитку псоріазу відводять, перш за все, генетичній теорії [54, 55, 74, 139, 141]. Генетичні фактори домінують над середовищними, про що свідчать високі значення коефіцієнта спадковості. У 60 % хворих на псоріаз виявляються родичі, які страждали і страждають на цій дерматоз [74, 84, 158, 179, 202, 211]. На даний час ідентифіковано дев’ять генних локусів (psoriasis susceptibility genes, PSORS1-PSORS9) на різних хромосомах, асоційованих із розвитком псоріазу [284]. Основною генетичною детермінантою, що визначає схильність людини до псоріазу, називають PSORS1, яка відповідає за 35–50 % усього спадкового компонента в його розвитку. Цей генний локус містить гени, що управляють роботою імунної системи, або білки, які у підвищених кількостях виявляються у шкірі хворих на псоріаз [240, 260, 278, 281, 284]. Дослідження геному хворих дозволило ідентифікувати й інші гени. Деякі з них кодують запальні сигнальні білки, що впливають на активність та проліферацію імунокомпетентних клітин, залучених у патогенез псоріазу. Два основних гени, що піддаються на даний час інтенсивному дослідженню, – це ген IL12B, який кодує цитокін інтерлейкін-12β, і ген IL23R, який кодує рецептор для інтерлейкіну-23 і залучений у механізми диференціювання Т-клітин. Т‑клітини, у свою чергу, залучені в запальний процес у шкірі, що призводить до розвитку псоріазу [86, 96, 205, 284]. При цьому деякі дослідники вважають, що успадковується не псоріаз, а зміни нейроендокринних механізмів, метаболічних процесів [139]. Гени, що беруть участь у розвитку псоріазу, досить різноманітні, мають незначну пенетрантність. Генетична передача псоріазу не відповідає законам Менделя. Тому псоріаз не можна вважати генодерматозом, а тільки – генетично зумовленим мультифакторіальним захворюванням.
До кінця не з’ясованими залишаються вірусна, імунна та автоімунна теорії розвитку псоріазу [4, 38, 96, 127, 213, 227, 271]. Незважаючи на численні імунологічні дослідження, ці теорії є суперечливими, а іноді, навіть, заперечують одна одну. Можливо, така ситуація пов’язана з використанням різних методологічних підходів без урахування клінічних особливостей захворювання, стадії процесу, супутньої патології.
На користь автоімунної теорії псоріазу говорить той факт, що імуносупресори можуть сприяти зменшенню або повному зникненню псоріатичних уражень [243]. Роль імунної системи у виникненні псоріазу залишається не до кінця зрозумілою [7, 95, 137]. У цілому процес розвитку псоріазу починається з будь-якого зовнішнього несприятливого впливу, який запускає каскад імунологічних реакцій за участі термальних дендритних клітин, макрофагів і лімфоцитів. Ключовими цитокінами при цьому є інтерлейкін-1 та фактор некрозу пухлини – альфа за участі toll-like рецепторів [66, 67, 185, 242]. До останніх належать: загальні рецептори, що розпізнають небезпеку; рецептори, що розпізнають мікробні структури, характерні скоріше для груп мікроорганізмів, ніж для окремих патогенів; рецептори, що активують імунну систему (макрофаги, NK-клітини тощо); рецептори, що активують набутий імунітет (термальні дендритні клітини, Т- і В-лімфоцити).
Більшість дослідників виявляють порушення у Т-клітинній ланці імунітету за рахунок зниження кількості Т-лімфоцитів, зокрема СD4+, на фоні збільшення або зменшення вмісту СD8+, а також падіння співвідношення СD4+/СD8+. Зменшення вмісту Т-лімфоцитів, зокрема Т-хелперів, у периферичній крові пояснюється накопиченням їх у псоріатичних осередках, а Т-супресорна недостатність розглядається як провідна ланка в патогенезі захворювання [85, 170, 171, 184, 232]. Значне місце відводиться також прозапальним цитокінам та хемокінам, а також їх взаємодії з молекулами адгезії на специфічних лімфоцитах. Прозапальні цитокіни запускають виділення молекул адгезії ендотеліальними клітинами та кератиноцитами, що призводить до їх взаємодії з лейкоцитами. Останні потрапляють із судинного русла в ділянку запалення з подальшою міграцією в епідерміс [23, 24, 53, 192, 217, 241, 279]. За даними А. Di Cesare [224], запалення у шкірі супроводжується не тільки локальним синтезом цитокінів, але й підвищенням їх вмісту в крові. Іншими авторами [250] доведено, що у хворих на псоріаз спостерігаються підвищені рівні інтерлейкінів-6 і -22, але при цьому визначити вміст інтерлейкінів-17 і -23 як у дослідній, так і в контрольній групах не вдалося. Розвиток багатьох специфічних для псоріазу змін епідермісу може бути пов’язаний з підвищеним утворенням інтерлейкіну-22, який гальмує диференціювання кератиноцитів та стимулює їх проліферацію [23, 223, 246, 251]. Слід підкреслити, що в імунологічних реакціях при псоріазі беруть участь не тільки клітини імунної системи, але й кератиноцити, фібробласти та ендотеліальні клітини. Кератиноцити продукують білки теплового шоку і фактор S100А12, які активують імуноцити, продукцію адгезивних молекул цих клітин, трансформуючий фактор росту – альфа, фактор росту нервової тканини, інтерлейкіни-19 і -20. Фібробласти продукують фактор росту кератиноцитів, інсуліноподібний фактор росту та фактор росту фібробластів-10 [197]. При псоріазі у деяких випадках відмічається посилений викид значної кількості ангіогенних факторів, що призводить до ангіогенезу [208, 209]. Крім посилення секреції прозапальних цитокінів, зниження рівня протизапального інтерлейкіну-10 відмічається гіперсекреція γ-інтерферону та інтерлейкіну-2 [247].
З’ясуванню сутності патологічного процесу при псоріазі присвячені морфологічні дослідження. Досить повно вивчено гістологічні, гістохімічні, ферментні, ультраструктурні та імуноморфологічні зміни в епідермісі та дермі, як в ураженій, так і видимо незміненій шкірі хворих. До гістопатологічних ланцюгів відносять: стовщення міжфолікулярного епідермісу внаслідок збільшеної проліферації кератиноцитів; порушення диференціювання кератиноцитів; акантоз, гіпо/агранульоз і паракератоз; порушення формування ліпідної мантії та недостатності кератину; екзоцитоз нейтрофілів з утворенням внутрішньоепідермальних нейтрофільних абсцесів Монро; лімфогістіоцитарний периваскулярний та дифузний інфільтрат; прикріплення лімфоцитів, моноцитів і нейтрофілів до ендотеліальних клітин венул; проникнення лейкоцитів у шкіру через активовані кровоносні судини та їх накопичення з утворенням інфільтратів; скупчення мононуклеарів у дермі, які містять значну кількість Т-клітин і дендритних клітин, змішаних між собою, які можуть функціонувати як організована лімфоїдна тканина, постійно активізуючи патологічний процес [86]. У патоморфозі дерматозу звичайно виокремлюють набряк і розгалуження колагенових волокон, розпушення та потовщення базальних мембран судин мікроциркуляторного русла і дермо-епідермального з’єднання, периваскулярну лімфо-гістіоцитарну інфільтрацію [96, 200, 206, 207, 243]. Виявлений взаємозв’язок між різними клінічними варіантами псоріазу, інтенсивністю та характером судинної реакції, складом периваскулярних інфільтратів дозволив сформулювати положення про первинність змін судин, що визначають патологічний стан дерми. Доведено, що виникненню псоріатичних папул передують зміни судин мікроциркуляторного русла, які виявляються в біоптатах видимо здорової шкіри на фоні прогресуючої стадії захворювання; констатовано зменшення кількості функціонуючих капілярів у напрямку від здорової шкіри до псоріатичної папули [207]. У судинах шкіри хворих на псоріаз та їхніх кровних родичів виявлено однотипові ультраструктурні патологічні зміни, що з’являлися задовго до клінічних проявів хвороби. Зміни в судинах ураженої та видимо здорової шкіри у хворих на псоріаз та їх здорових родичів були виявлені у ряді гістохімічних досліджень. Ці дані дозволили зробити припущення, що судинні зміни в шкірі виникають задовго до клінічних проявів хвороби, і зміни мікроциркуляції є одним із факторів розвитку псоріатичного процесу [159].
На думку інших авторів [26, 90, 116], провідну роль відіграють порушення адаптаційно-компенсаторних і ендокринних механізмів регуляції гомеостазу. Розглядаючи псоріаз як хронічне захворювання, його клінічний перебіг безпосередньо пов’язують із системою адаптації, вказуючи при цьому на провідну роль гіпоталамо-гіпофізарно-наднирникової системи [65, 71, 238, 291]. Адаптація хворих на псоріаз до різноманітних подразників відбувається зі змінами у гормонально-метаболічних показниках, що призводить до зниження стійкості організму та загострення захворювання. З огляду на антиоксидантну, імуномодулюючу та протизапальну активність мелатоніну, припускають, що зниження його секреції відіграє певну роль у патогенезі псоріазу. Крім того, порушення добового ритму секреції мелатоніну може пояснити нерідке виникнення у хворих на псоріаз нічного безсоння, денної сонливості, млявості, апатії, депресії, підвищеної тривожності [70]. У крові пацієнтів також спостерігається підвищення соматотропіну, інсуліноподібного фактору росту-1, інсуліну на фоні зниження чутливості тканин. Це також відіграє певну роль у патогенезі псоріазу, тому що ці гормони є факторами росту для клітин багатьох тканин, зокрема кератиноцитів [166].
Особливе значення у розвитку псоріатичного процесу надається метаболітам ліпооксигеназного шляху метаболізму арахідонової кислоти – лейкотрієнам [124]. Розвиток псоріатичного процесу пов’язують також з дисбалансом циклічних нуклеотидів; вважається, що підсилена клітинна проліферація може бути обумовлена їх дисбалансом (зменшенням рівня циклічного аденозинмонофосфату та збільшенням циклічного гуанозинмонофосфату). Крім того, наслідком порушення метаболізму циклічних нуклеотидів є зменшення деформації еритроцитів і відповідно мікроциркуляторні розлади у 86 % хворих на псоріаз [173].
Провідну роль у патогенезі псоріазу відводять порушенням функцій нервової системи, впливу психоемоційних факторів на розвиток і перебіг дерматозу [133, 134, 179, 291]. Нервовий стрес сприяє викиду ряду нейропептидів (субстанції Р, интестинального вазоактивного пептиду, фактору росту нервової тканини), які впливають на кератиноцити. Останні, у свою чергу, виділяють цитокіни, що активують лімфоцити, гістіоцити та привертають нейтрофіли. У 70–80 % хворих на псоріаз відзначається неврастенія, яка призводить до функціонального послаблення та виснаження нервової системи, її корково-підкоркової нейродинаміки. Зовнішні прояви хвороби також травмують психіку хворих, ускладнюють їх соціальну реадаптацію [194]. Відмічається тригерна роль стресу у зриві адаптаційних систем організму, що призводить до розвитку псоріазу [26, 236]. Неврозоподібні стани у багатьох випадках розглядаються як наслідок, а не причина хвороби. Це пояснюється тим, що різні форми псоріазу можуть викликати дисфункцію вегетативної нервової системи та нервово-психічні порушення у вигляді неврозоподібних станів [161].
Деякі автори вважають, що в основі патогенезу псоріазу полягає індукований апоптоз, який сприяє видаленню автореактивних клонів лімфоцитів, що утворилися в результаті антигенної стимуляції у ході псоріатичного процесу [204].
Л. В. Куц [113] доводить, що при псоріазі на першому етапі виникає та розвивається так зване нейрогенне запалення, спровоковане виходом із периферійних нервових терміналей субстанції Р – маркера ноцицепції. Відповідна компенсаторна реакція антиноцицептивної системи у вигляді збільшення рівня b-ендорфіну (що спостерігається при свербежі) видається неповноцінною, а у пацієнтів без відчуття свербежу відмічаються ознаки її виснаження. Медіатори (серотонін, гістамін, ейкозаноїди), що вивільнюються після цього, ініціюють процеси, які посилюють неповноцінність ноци- та антиноцицептивних систем. Роль у відчутті/невідчутті ноцицептивних сигналів при псоріазі можуть виконувати й «сплячі» рецептори у шкірі. Останні становлять близько 50 % рецепторів, пов’язаних з немієлінізованими С-аферентами, які в нормі неактивні, але активуються при пошкодженні шкіри. Крім «сплячих» рецепторів важливу роль можуть виконувати, на думку автору, й «С-ноцицептори», які взагалі нечутливі до механічної стимуляції. При цьому, з одного боку, може відбуватися сенситизація периферійних та активація «сплячих» і «С-рецепторів» регулюючих нейроваскулярних систем головного мозку; з іншого боку – розвивається недостатність еферентних інгібіторних (антиноцицептивних) шляхів. Автором доведено, що при псоріазі виявляється залежність між наявністю (відсутністю) шкірних ноцицептивних почуттів (зокрема свербіж) та типом перебігу патологічного процесу. Достовірно частіше спостерігається свербіж у хворих з I типом перебігу псоріазу, при якому генетична детермінація захворювання виявлена у 50 % обстежених. Це, на думку автора, може свідчити про глибокі порушення сигнально-рецепторних ноци- та антиноцицептивних зв’язків (з урахуванням даних щодо генетичної детермінації функціонування відповідних центрів у центральній нервовій системі [ЦНС]) та диктує необхідність подальшого вивчення цього феномену.
Особливе значення в етіопатогенезі псоріазу приділяється посиленню активності перекисного окислення ліпідів, окисної модифікації білків зі зниженням показників антиоксидантної системи [32, 169, 270]. Різке підвищення інтенсивності залежних від кисню процесів і порушення ліпідного обміну створюють сприятливі умови для активації вільнорадикальних реакцій. Це призводить до надлишкового вироблення перекисних радикалів, що ушкоджують білки, нуклеїнові кислоти й системи, відповідальні за їх синтез і репарацію. Накопичення продуктів вільнорадикальних реакцій – одна з причин підвищення проникності мембран лізосом. При цьому збільшується вихід кислих гідролаз у цитоплазму, що може негативно впливати на процеси життєдіяльності клітини. При загостренні псоріазу відмічається збільшення активності лізосомальних ферментів у плазмі крові та тканинах шкіри [214].
Посилення тяжкості псоріатичного процесу, за даними А. М. Біловол [29], закономірно відбувається на фоні розбалансування нервового, ендокринного та імунологічного гомеостазу внаслідок порушення процесів проліферації, пошкодження клітинних мембран, накопичення в крові токсичних сполук, тобто псоріаз супроводжується прогресуванням ендогенної інтоксикації. Такий висновок зроблено на підставі суттєвого підвищення вмісту молекул середньої маси та гаптоглобіну в сироватці крові; посилення вільнорадикальних реакцій на фоні виснаження антиоксидантної системи; розбалансування систем нейроендокринної регуляції.
Псоріаз супроводжується порушеннями в обміні речовин, особливо ліпідному [39, 148, 190]. У 40–80 % хворих на псоріаз виявлено гіперліпідемію, гіперхолестеринемію, у 25–40 % пацієнтів – підвищення рівня загальних ліпідів [181]. У зв’язку з цим, псоріаз іноді розглядають як своєрідний ліпоїдоз шкіри або «холестериновий діатез». Підвищення загальних ліпідів і холестерину є первинним, сприяє початковим проявам дерматозу. Крім того, зміна ліпідного обміну стимулює ороговіння [177]. Слід відзначити, що гіпертригліцеридемію частіше зафіксовано у хворих на ексудативний псоріаз у прогресуючій стадії з перевагою лентикулярних папул, а гіперхолестеринемію – у пацієнтів із звичайним псоріазом у стаціонарній стадії з перевагою в клінічній картині нумулярних папул [100].
Деякі дослідники не обмежуються вивченням локальних процесів, а шукають і знаходять докази, що псоріаз – це прояв системного псоріатичного процесу [212, 268]. Так, Н. Г. Короткий, М. Ю. Песляк [104] запропонували модель патогенезу системного псоріатичного процесу, в основі якої полягає надходження бактеріальних продуктів b‑стрептококів у шкіру безпосередньо з кровотоку. У свою чергу B. S. Baker et al. [263] довели присутність b-стрептококового пептидоглікану в псоріатичних висипаннях, а саме всередині термальних, епідермальних моноцитів та, ймовірно, дендритних клітин. До того ж R. A. Clark et al. [219] визначальною ланкою ескалації псоріатичного висипання називають залучення моноцитів, їх активацію та виділення ними фактора некрозу пухлини – альфа. У роботах L. C. Zaba et al. [266, 290] передбачається, що вирішальну роль у підтримці псоріазу відіграють дермальні TipDC (зрілі дендритні клітини maDC, активно виділяють фактор некрозу пухлини – альфа та індуцибельну NO-синтазу), які презентують невідомий антиген. Доведено, що попередниками TipDC є нерезидентні кров’яні фагоцити, проте яка саме фракція й чому вона так поводиться при псоріазі ще не вирішено. TipDC є у препсоріатичній шкірі, у шкірі здорових пацієнтів, але суттєво менше, ніж при псоріазі. Це означає, що надходження попередників TipDC з кровотоку, їх перетворення на TipDC відбувається, на думку авторів, й при гомеостазі. Прискорена проліферація кератиноцитів, за даними літератури [170, 230, 263], скоріше обумовлена помилковими діями механізмів антибактеріального захисту шкіри.
У патогенезі псоріазу деякі автори значну роль відводять підвищеній проникності тонкого кишечнику для бактеріальних продуктів і зростанню популяцій бактерій (включаючи b-стрептококи) на його стінках [157, 188, 254]. Є непрямі та/або прямі докази присутності при псоріазі продуктів розпаду b-стрептококів у шкірі та/або крові за відсутності локальних b‑стрептококових інфекцій [244, 263]. Крім бактерій, що надходять у тонкий кишечник разом з їжею, є ще два постійних джерела тонкокишкових популяцій: мікрофлора верхніх дихальних шляхів, що надходить зверху при порушеннях шлункового кислотного бар’єру, і Gram(-) мікрофлора з дистальних відділів, що надходить знизу при порушеній перистальтиці. Зростання тонкокишкових популяцій обмежується антибактеріальною дією жовчних кислот, кислотністю шлункового соку, перистальтикою, виділенням імуноглобулінів, ферментативною активністю, станом кишкового епітелію тощо.
Деякі автори [149, 237] пропонують модель патогенезу псоріазу, що ґрунтується на порушенні продукції та/або циркуляції жовчних кислот. Порушення ентерогепатичної циркуляції може бути наслідком послаблення печінкових функцій екстракції та кон’югації жовчних кислот з портального кровотоку. У результаті частина жовчних кислот постійно потрапляє у периферичний кровоток, а їх пул скорочується, якщо можливості печінки з генерації жовчних кислот обмежені. Як наслідок, у жовчному міхурі формується жовч із пониженим вмістом жовчних кислот. Їх надлишок у крові може бути токсичним для тканин, які за фізіологічних умов не стикаються з ними, можуть викликати підвищення проникності мембран та місцеве запалення. Похідні холанової кислоти можуть порушувати цілісність стінок кровоносних судин, підвищувати їх проникність та розширювати просвіти судин сосочкового шару дерми.
У патогенезі псоріазу та багатьох супутніх йому захворювань є загальні механізми. Так, доведено зв’язок псоріазу із захворюваннями серцево-судинної системи (ішемічна хвороба серця, інфаркт міокарда, інсульт), шлунково-кишкового тракту (хвороба Крона, неспецифічний виразковий коліт), злоякісними пухлинами (лімфома), метаболічним синдромом (артеріальна гіпертензія, ожиріння, інсулінорезистентність, цукровий діабет, дисліпідемія), ураженням очей (увеїт, склерит), а також із захворюваннями психіки (депресія), порушеннями загального самопочуття [33, 102, 119, 151, 152, 162, 164, 165, 185, 187, 257, 267]. У поодиноких наукових дослідженнях вагома патогенетична роль при псоріазі відводиться хронічному запаленню, яке поряд з імунопатологічною складовою призводить до метаболічних і судинних порушень [288]. При цьому особливе місце посідає метаболічний синдром – фактор ризику для розвитку не лише цукрового діабету та захворювань серцево-судинної системи, але й псоріазу [22, 46, 77, 79, 98, 143, 245]. У хворих із метаболічним синдромом найчастіше відмічаються ураження з боку шкіри [289]. Доведено залежність між ожирінням та порушеннями функції шкіри, зокрема бар’єрної функції, функціонування сальних і потових залоз, лімфатичних судин, капілярного кровообігу, а також ризик розвитку дерматологічних захворювань. І. Б. Поповою та співавт. виявлено, що на фоні метаболічного синдрому псоріатичні ураження шкіри та суглобів набувають вираженого характеру, тобто відбувається взаємне обтяження перебігу хвороби [143]. У розвитку метаболічного синдрому при псоріазі та псоріатичній артропатії важливу роль відіграє хронічний запальний процес. Порівняльний аналіз змін з боку рівня циклічних нуклеотидів, нейрогуморального регулювання, обміну ліпідів, електролітів, білків, морфофункціональних розладів мікроциркуляторного русла при псоріазі та ессенціальній гіпертензії свідчить про їх спільність [30]. За даними клінічних спостережень, псоріаз може бути фактором ризику розвитку атеросклерозу, що пов’язано з участю хронічного системного запалення на фоні обох захворювань [97, 182].
У цілому узагальнення широкого кола літературних джерел, присвячених псоріазу, свідчить про залучення у розвиток псоріатичного процесу практично всього організму, починаючи від систем управління до клітинних і субклітинних структур. Але на сьогодні домінуючими залишаються два основних погляди на патогенез псоріазу. З одного боку, провідна роль відводиться генетично детермінованому порушенню головної функції шкіри – кератинізації внаслідок зміни динамічної рівноваги структурних процесів в епідермісі – проліферації, диференціювання та програмованої клітинної загибелі кератиноцитів, спряжених із запальною реакцією у дермі. З іншого боку, псоріаз розглядають як імуноопосередковане, імунопатологічне або автоімунне захворювання, в якому надлишковий ріст та розмноження (проліферація) клітин шкіри й насамперед кератиноцитів є вторинними по відношенню до різних медіаторів запалення (лімфокінів і цитокінів), що продукуються клітинами імунної системи, і/або по відношенню до автоімунного пошкодження клітин шкіри, що викликає вторинну регенеративну реакцію. Ці погляди, звичайно, не є остаточними, і потребують подальшого вивчення етіопатогенетичних аспектів, щоб наблизитися до розкодування цього досить складного дерматозу.
1.2 Роль ерго- та трофотропної систем у патогенезі псоріазу
Вагома роль у патогенезі псоріазу відводиться стресорним механізмам. У хворих виявляються суттєві розходження у здатності протистояти стресам і справлятися з їх наслідками, що вказує на необхідність дослідження ролі стресу як пускового фактора псоріазу й психотерапії захворювання [134]. Визначити стан процесів регуляції та координації в організмі на фоні розвитку стресу дозволяє аналіз ерго- та трофотропної систем, в яких беруть участь вегетативні, рухливі, чутливі та психічні складові [45, 126]. У хворих на псоріаз у багатьох випадках мають місце нервово-психічні розлади, пов’язані з реакцією хворого на шкірні зміни, що виявляються астенічним, астенодепресивним, тривожно-недовірливим, іпохондричним, неврастенічним, вегето-судинно-дистонічним або вегето-судинно-вісцеральним синдромами [180, 191]. Існують погляди, згідно з якими функціональні порушення з боку нервової системи у хворих на псоріаз трактуються як вторинні, тобто як наслідки дерматозу. Нервово-психічний механізм хоча й пояснює деякі особливості розвитку захворювання, але у цілому залишає багато сумнівів. Чітко визначено, що у хворих на псоріаз найчастіше спостерігаються функціональні порушення нервової системи, які не можуть не виказувати впливу на перебіг дерматозу, зокрема, на його рецидиви.
Стан вегетативної нервової системи – як однієї з проміжних ланок у складній рефлекторній діяльності ЦНС, що визначає й функціональний стан шкірних покривів, також має патогенетичне значення в розвитку псоріазу, зокрема у реалізації деяких механізмів емоційних впливів на шкіру через судинні реакції [1, 134, 191]. Вегетативна нервова система безпосередньо бере участь у забезпеченні різних форм психічної та фізичної діяльності. Її симпатичний та парасимпатичний відділи, працюючи синхронно, забезпечують максимально можливу адаптацію до конкретних умов і факторів екологічного та соціального середовища, які з різною інтенсивністю, але не завжди одночасно діють на психіку та соматику людини. Довгий час вважалося, що відділи вегетативної нервової системи працюють за реципрокним механізмом. Але цілий ряд досліджень свідчить про координованість та автономність їх роботи. Наприклад, підвищення тонусу симпатичного відділу викликає підвищення тонусу парасимпатичного відділу, який намагається оптимізувати загальний функціональний стан вегетативної нервової системи. Розлад вегетативного забезпечення діяльності порушує поведінку людини та зумовлює недостатньо оптимальну адаптацію до стресогенних факторів. Окремо слід виділити, що симпатичний та парасимпатичний відділи вегетативної нервової системи беруть участь у реалізації ерго- та трофотропної активації [44, 115, 120, 135].
Ерготропна функціональна система сприяє пристосуванню організму до умов зовнішнього середовища, забезпечує фізичну та психічну діяльність, перебіг катаболічних процесів. Її робота пов’язана із симпатичним відділом вегетативної нервової системи та складається з первинної невральної фази, яка посилюється вторинною гуморальною фазою, що залежить від рівня циркулюючого А. Головними ерготропними гормонами є А, НА, кортизол, глюкагон, вазопресин. Трофотропна функціональна система відповідає, перш за все, за анаболічні процеси в організмі, забезпечує нутритивні функції та сприяє підтримці гомеостатичної рівноваги. У здійсненні трофотропних реакцій бере участь парасимпатичний відділ вегетативної нервової системи, а також гормони анаболічної дії – інсулін, мелатонін, пролактин. Як правило, ерго- та трофотропна системи діють синергічно. Але у визначеній ситуації як ерготропна, так і трофотропна реакції, які за своєю сутністю є адаптаційно-компенсаторними, у надлишковому стані з фізіологічних перетворюються на патологічні. Це, у свою чергу, сприяє розвитку різних клінічних синдромів і захворювань [44].
Ерготропні функції різко посилюються при стресових станах, сприяючи пристосуванню організму до дії провокуючих факторів, збільшенню використання енергетичних ресурсів, катаболічних процесів. У відповідь на дію стресора першою активується симпато-адреналова система, яка є швидко реагуючою, забезпечує короткочасні ефекти, а потім по мірі активації підключає гіпоталамо-гіпофізарно-наднирникову систему, що потенціює та доповнює її ефекти. У забезпеченні та підтримці ефектів симпато-адреналової та гіпоталамо-гіпофізарно-наднирникової систем також беруть участь інші гормони (соматотропін, тиротропін, тироксин). Але з іншого боку соматотропін і тиреоїдні гормони здатні активувати й процеси анаболізму та клітинного росту [178]. У механізмі стресу важливу роль відіграє й трофотропна система, посилення якої є компенсаторною реакцією, спрямовану на збереження гомеостазу.
У науковій літературі практично не зустрічаються результати щодо оцінки стану ерго- та трофотропної систем при псоріазі різного ступеня тяжкості, зокрема за вмістом катехоламінів, серотоніну, мелатоніну, що беруть участь у їх функціонуванні. На даний час не викликає сумнівів важлива роль катехоламінів і продуктів їх метаболізму у забезпеченні постійності внутрішнього середовища організму. Будучи одночасно гормонами мозкової речовини наднирників і медіаторами нервової системи, катехоламіни беруть участь у створенні необхідних умов, що забезпечують життєдіяльність організму при граничних навантаженнях. При стресових впливах, у тому числі й оксидативному стресі, симпато-адреналова система забезпечує першу лінію захисту. У цих випадках після вивільнення у кров НА з гіпоталамусу та інших відділів ЦНС, що призводить до активації симпато-адреналової системи (стадія тривоги), спостерігається зміна у стані катехоламінергічних систем та підвищення проникності гематоенцефалічного бар’єра для моноамінів. На стадії резистентності відмічається посилення синтезу НА у нервовій тканині, а на стадії виснаження відбувається зниження активності симпато-адреналової системи при постійному зменшенні рівня НА в ЦНС. Отже, розвиток адаптації у відповідь на стресорний вплив за участі симпато-адреналової системи має такий же стадійний характер, як і за участі гіпофізарно-наднирникової та гіпофізарно-тиреоїдної систем [41, 87, 109].
За характером дії катехоламіни належать до сполук ерготропного ряду, що реалізують швидку мобілізацію енергетичних ресурсів організму та забезпечують працездатність різних систем. Катехоламіни синтезуються в аксонах нервових клітин, накопичуються у синаптичних везикулах [130]. Основні гормоноїдні катехоламіни – А і НА – у значній мірі продукуються хромафінною тканиною наднирників. Джерелом катехоламінів є амінокислота тирозин. Загальну схему синтезу та обміну катехоламінів наведено на рисунку 1.1.
Екскреція попередників А та НА – ДОФА і ДА – значною мірою відображує резервні можливості симпато-адреналової системи. Доведено, що дослідження вмісту катехоламінів у сечі є одним з адекватних методів оцінки її тонусу та реактивності. Адреналін, що виявляється у сечі, має переважно наднирникове походження, а НА – секретується закінченнями симпатичних нервів [41]. Слід відзначити, що ДА виявляється не тільки у місцях, де відбувається синтез А та НА, але й незалежно від них його знаходять у різних органах (печінці, легенях, кишечнику), що свідчить про його самостійне значення як біологічно активної речовини. ДА розглядають як самостійний трансмітер, що забезпечує нейрохімічну медіацію у ряді спеціалізованих систем мозку: чорній субстанції, мезокортикальній, мезолімбічній та інших системах [195]. Останні беруть участь у здійсненні психомоторних, когнітивних, нейроендокринних функцій, дослідження яких активно проводиться останнім часом при псоріазі. У силу своєї важливої ролі в системі нейрогуморальної регуляції функцій організму катехоламіни привертають значну увагу дослідників як показники прогнозування виникнення або перебігу багатьох захворювань та ефективності їх лікування. Є підстави вважати, що за допомогою фармакологічної корекції вмісту катехоламінів можна досягти поліпшення ефекту традиційного лікування.
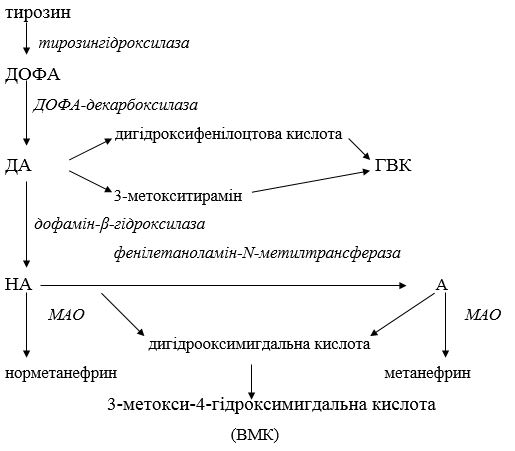
Рисунок 1.1 – Схема біосинтезу та метаболізму катехоламінів
Сезонність перебігу псоріазу та залежність від середовищних факторів (фотоперіод, температура, вологість тощо) пов’язані зі зміною функціональної активності залоз внутрішньої секреції. Припускають участь епіфіза як основного добового водія ритмів та його гормону мелатоніну в розвитку патологічного процесу [57, 280, 253]. Будь-які зміни секреції мелатоніну здатні призвести до неузгодженості біологічних ритмів організму і з’явитися причиною десинхронозів [57]. У зв’язку з цим, додаткових досліджень потребує участь гормону трофотропної системи мелатоніну та його попередника серотоніну. Серотонін широко розповсюджений в організмі. Значна його частина синтезується та зберігається в ентерохромафінних клітинах шлунково-кишкового тракту. Крім того, серотонін знаходиться у комплексі з АТФ у тромбоцитах, хромафінних гранулах клітин мозкової речовини наднирників, жовчовивідних шляхах, щитоподібній залозі тощо. Цей біогенний амін адсорбується тромбоцитами, які забезпечують його транспорт. Окремо слід відзначити наявність серотоніну у лаброцитах шкіри. Серотонін виявляється також у гіпоталамусі, чорній субстанції та серотонінергічних нейронах, а також у периферичній нервовій системі [168]. Загальну схему синтезу та обміну серотоніну наведено на рисунку 1.2.
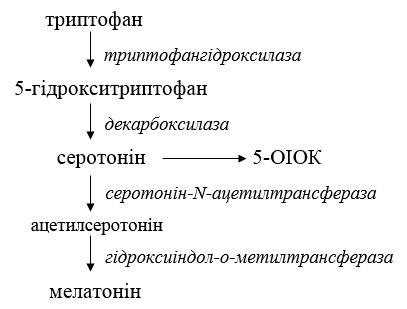
Рисунок 1.2 – Схема біосинтезу та метаболізму серотоніну
Дослідження функціональної активності епіфіза при псоріазі є поодинокими [264]. Для прогресуючої стадії цього дерматозу вранці в крові пацієнтів виявлено збільшення рівня мелатоніну та серотоніну, наслідком чого може бути зміна співвідношення мелатонін/серотонін.
Велике значення у розвитку псоріатичної хвороби надається порушенням функціонування гіпоталамо-гіпофізарно-наднирникової системи, яка бере безпосередню участь у реалізації ерготропних ефектів, а гіпоталамус є найважливішою тригерною структурою вегетативної та гормональної активності, місцем формування «застійного збудження» при емоційному стресі [142].
Аналітичний огляд літератури свідчить про відсутність відомостей щодо всебічної оцінки стану ерго- та трофотропної систем організму хворих на псоріаз, що спонукає провести дослідження у цьому досить вагомому напрямку. Розуміння виявлених порушень балансу ерго- та трофотропних функцій є надзвичайно важливим для визначення тактики лікування хворих із різним ступенем тяжкості дерматозу.
1.3 Сучасні підходи до лікування псоріазу
Проблема ефективного лікування псоріазу має важливе медико-соціальне значення у зв’язку з широкою розповсюдженістю, системним характером клінічних проявів і збільшенням кількості тяжких форм, що є причинами зниження якості життя та втрати працездатності хворих [25, 34, 47, 234, 248]. На сьогодні, на жаль, не існує єдиного універсального підходу до лікування псоріазу; існує рекордно велика кількість засобів, що пояснюється відсутністю науково обґрунтованої етіотропної терапії захворювання. Методи терапії дуже різноманітні, характеризуються різним за силою та спрямуванням впливом на локальні прояви дерматозу та макроорганізм [42, 77, 183]. До основних напрямків терапевтичного впливу на даний час належать: пригнічення проліферації, нормалізація порушеного диференціювання епітеліоцитів; усунення запального процесу в дермі; корекція імунологічних порушень та порушень в інших органах і системах організму [103, 122, 175]. На даному етапі необхідним є уніфікований підхід до терапії псоріазу, що базується на доказах. Метою лікування псоріазу в активній формі є досягнення стійкої ремісії шляхом використання адекватної індукційної терапії, спрямованої на швидке зниження вираженості симптомів, зберігання досягнутого ефекту, попередження прогресування, хронізації хвороби [285].
Лікування, як правило, призначається з урахуванням анамнестичних даних, форми, стадії, розповсюдженості процесу, супутніх хвороб, віку та статі хворого, протипоказань до визначеного методу лікування або лікарського препарату. Велике значення має мотивація пацієнта, родинні обставини та соціальні фактори [47]. Арсенал лікарських засобів для лікування псоріазу включає до себе синтетичні та біологічні препарати для базисної, топічної терапії, фототерапії, системної терапії. При легкому ступені тяжкості псоріазу достатнім, у багатьох випадках, є призначення зовнішньої терапії, наприклад, кератолітичних (саліцилової мазі), розсмоктуючих (препаратів нафталану, дьогтю), протизапальних (кортикостероїдних) засобів. Тяжкі форми псоріазу вимагають комплексного лікування із застосуванням дезінтоксикаційних, гіпосенсибілізуючих, протизапальних препаратів різних груп, фізіотерапевтичних методів терапії, зовнішніх препаратів тощо [81, 283].
Зовнішня терапія при псоріазі посідає провідне місце та має свої позитивні моменти: ефективно доповнює системне лікування; дає унікальну можливість безпосередньо впливати на осередок ураження; максимально інтенсивний вплив супроводжується значно меншими, порівняно із системним лікуванням, побічними діями [8, 51]. До ефективних препаратів місцевої дії відносять дайвобет, до складу якого входить кальципотріол і бетаметазону дипропіонат. Кальципотріол – синтетичний аналог активного метаболіту вітаміну D3, який гальмує проліферацію кератиноцитів, прискорює їх морфологічну диференціацію. Бетаметазон – глюкокортикоїд для зовнішнього застосування, який чинить місцеву протизапальну, вазоконстрикторну та імунодефіцитну дію. Доведено, що раціональне використання дайвобету дає змогу усунути клінічні прояви псоріазу, покращити якість життя пацієнтів [101, 215]. У літературі досить широко обговорюється питання щодо невиправданого у деяких випадках застосування кортикостероїдних препаратів. Встановлено, що їх системне використання, особливо неконтрольоване, призводить до погіршення перебігу хвороби, іноді до розвитку тяжких форм, зокрема пустульозного псоріазу, псоріатичного артриту [111].
Ефективним засобом лікування псоріазу є ретиноїди, які інгібують процеси кератинізації за рахунок зменшення зчеплення кератиноцитів у результаті зміни складу міжклітинних речовин, впливають на проліферацію епідермісу. Одним із суттєвих недоліків при використанні ретиноїдів є їх цитотоксичність, що проявляється синдромом гіпервітамінозу А: хейліт, сухість слизових оболонок носоглотки та рота, лущення долонь і підошов, випадіння волосся [228].
Останнім часом збільшилася кількість випадків псоріазу, який супроводжується свербежем, що спонукає науковців досліджувати механізми його виникнення та можливості усунення. Найчастіше причинами свербежу є самостійне використання пацієнтами топічних подразнюючих засобів, приєднання вторинної інфекції, різноманітні ендокринні захворювання. У деяких випадках свербіж має нейрогенне або психогенне походження. Він призводить до розчухів та, як наслідок, гіпертрофії нервових закінчень шкіри, появи у травмованих місцях нових псоріатичних бляшок [82, 114]. Тому в комплексній терапії за умов прогресуючої стадії дерматозу рекомендується використовувати антигістамінні засоби, натрію тіосульфат, препарати кальцію, калію та магнію [203]. Доведено клінічну ефективність протисвербіжної дії гістафену в комплексній терапії хворих на псоріаз, що проявляється більш швидким купіруванням симптомів свербежу в переважної кількості пацієнтів та істотним поліпшенням якості життя [114].
У загальному лікуванні псоріазу широко застосовують седативні засоби та транквілізатори (гідазепам, адаптол, мебікар). Добре себе зарекомендував антистресорний адаптоген – гліцисед, що не викликає звикання, снотворного та міорелаксуючого ефекту. Широко використовуються засоби, що усувають метаболічні порушення, у тому числі вітаміни та коферментні препарати [172]. У комплексному лікуванні застосовуються гепатопротектори для коригування порушень обмінних процесів в організмі хворих [17, 163, 189]. Порушення обмінних процесів і наявність «синдрому негерметичної кишки» у хворих на псоріаз викликає інтоксикації, пов’язані з прийомом їжі. Ці фактори є основою для призначення дієтотерапії [136, 183]. У деяких літературних джерелах обговорюється ефективність застосування гемосорбції, гемодіалізу та плазмофорезу, що здійснюють не тільки дезінтоксикацію, але й цілеспрямовану корекцію імунологічних порушень при псоріазі [14, 15, 16].
У літературі наведено поодинокі результати застосування статинів при лікуванні псоріазу, особливо у випадку його асоціації з метаболічним синдромом. Статином останнього покоління є розувастатин – інгібітор оксиметилглутарил-КоА-редуктази. Доведено не тільки гіполіпідемічну, але й протизапальну дію препарату в дозі 10 мг у комплексній терапії пацієнтів із звичайним псоріазом у віці 47–65 років. Розувастатин призводить зниження рівня факторів регуляції росту судин, інтерлейкіну-6, загального холестерину, холестерину ліпопротеїнів низької щільності порівняно з показниками до лікування, зменшення значення індексу PASI [97]. Деякі автори пов’язують клінічний перебіг псоріазу із системою адаптації, зокрема, провідною роллю гіпоталамо-гіпофізарно-наднирникового ланцюга, та рекомендують призначення адаптогенів – дибазолу та екстракту елеутерококу [26, 291].
Успіхи останніх років в галузі лікування псоріазу пов’язані з широким впровадженням у практику дії ультрафіолетового опромінення на епітеліоцити з наступним пригніченням синтезу ядерної ДНК клітин, зниженням їх мітотичної активності [132]. Крім того, застосовують ПУВА-терапію – довгохвильове ультрафіолетове опромінення з довжиною хвилі 200–400 нм із використанням фотосенсибілізаторів [160]. Її дія зумовлена пригніченням патологічної кератинізації, імуномоделювальним ефектом внаслідок впливу на імунокомпетентні клітини [92]. Для лікування псоріазу пропонується також комбінування ПУВА та ультрафіолетового опромінення із зовнішніми засобами – кальципотріолом, метилпреднізолону ацепонатом. Використовують також імпульсну терапію, на фоні якої випромінювання великої потужності подається у вигляді короткочасних імпульсів, що дає змогу збільшити глибину проникнення променів до дермального шару [274]. У деяких літературних джерелах вважається ефективним методом лікування псоріазу впливом вузькосмугового ультрафіолету В 311 нм, що призводить до транзиторної імуносупресії. Терапевтична дія цього методу спрямована локально на запальний інфільтрат у дермі, в тому числі й на популяцію антигенпрезентуючих клітин [25, 145, 226]. Дискутабельними залишаються питання щодо поведінки клітин імунного запалення у псоріатичному осередку на фоні лікування вузькосмуговим ультрафіолетом В 311 нм [50, 226]. В. А. Бабаніним [12] доведено, що цей вид терапії сприяє зниженню рівня експресії CD68 – маркера макрофагів, більшою частиною якої є функціонально активні клітини, що свідчить про адекватність імунної відповіді та зниження запальної реакції на 21-у добу дослідження. Через 12 тижнів автор спостерігав відновлення морфологічної структури шкіри та макрофагального балансу, особливо у пацієнтів, в яких застосовано еритмогенну стратегію лікування.
У шкірному екскреті хворих на псоріаз визначено суттєве зниження рівня уроканінової кислоти та активності гістидази. Дослідження останніх років демонструють, що цис-уроканінова кислота є посередником імуносупресії, індукованої ультрафіолетовим опроміненням [153, 256]. При дії ультрафіолетових променів транс-ізомер кислоти переходить у цис-ізомер, який спричинює імуносупресивний та протизапальний ефекти [218]. Рівень уроканінової кислоти в шкірі залежить від активності ферменту гістидази, за допомогою якого відбувається синтез цієї кислоти з гістидину. Причиною зниження уроканату в шкірному екскреті хворих на псоріаз є, перш за все, низька активність гістидази. О. В. Рай вважає, що у пацієнтів з літньою формою перебігу псоріазу відбувається блокування цього ферменту, що є причиною низького рівня уроканінової кислоти та, як наслідок, постійної підвищеної фоточутливості шкіри [153]. Отже, зниження рівня уроканату є протипоказанням до проведення терапії ультрафіолетом, яка може викликати загострення хвороби. Під час розроблення тактики комплексного індивідуалізованого лікування хворих на псоріаз, зокрема різних видів світлолікування, слід враховувати суттєве значення рівнів уроканінової кислоти та активності гістидази.
З метою пригнічення проліферації епітеліоцитів при тяжких формах псоріазу (псоріатичного артриту, еритродермії, пустульозного псоріазу) використовуються цитотоксичні препарати або інгібітори клітинного ділення (метотрексат, азатіоприн, циклоспорин А та інші), що виказують імунодепресивну дію [52, 239, 252]. Але значна кількість побічних ефектів і ускладнень обмежує використання цитостатиків, а також потребує ретельного моніторингу під час лікування.
У клінічній практиці широко використовуються імуномодулятори – препарати, які призначаються для корекції порушень імунного статусу (пірогенал, продігіозан, левамізол, лікопід, циклоферон, неовір, імунофан та інші). У цьому разі розроблюються принципи індивідуального підходу при виборі імуномодулюючих засобів залежно від характеру порушень у стані імунної системи хворих на псоріаз [167, 286]. При тяжких формах псоріазу в комплексній терапії використовують глутоксим (група тіопоетинів), який має значну тропність до клітин центральних органів імунітету та систем лімфоїдної тканини, здатність активувати фагоцитоз і відновлювати функціональну дієздатність тканинних макрофагів. Крім того, глутоксим диференційовано впливає на нормальні та трансформовані клітини, активізує процеси апоптозу [129].
До біологічних препаратів (інгібіторів фактору некрозу пухлини – альфа) відносять інфліксимаб, який також запропоновано використовувати при лікуванні псоріазу. Останній являє собою Ig G1-химерні моноклональні антитіла, які містять 75 % людського білку і 25 % мишачого. Вони зв’язуються з фактором некрозу пухлини, тим самим інактивуючи його прозапальну активність [5, 27, 221]. Антицитокінова терапія при псоріазі набула широкого дослідження [43]. При тяжкому перебігу у комплексній терапії часто призначають тимодепресин – синтетичний дипептид, що має імунодепресивну дію, інгібує реакції клітинного і гуморального імунітету [258]. При співставленні результатів лікування тимодепресином і циклоспорином А не виявлено чіткої різниці в ефективності та строках розв’язання клінічних проявів процесу, при цьому тимодепресин має перевагу, оскільки його доза для досягнення ефекту є набагато меншою, ніж циклоспорину А, що значно знижує ймовірність розвитку побічних ефектів та ускладнень [105, 198]. У прогресуючій стадії псоріазу психоемоційний стан хворих характеризується депресією, а клінічний регрес псоріатичних висипань не супроводжується поліпшенням психоемоційного статусу. Тому важливим допоміжним засобом для лікування хворих на псоріаз, в яких у психосоматичному статусі присутні елементи астенії та невротизації, є психотропні засоби [76].
Незважаючи на дуже широке вивчення патогенетичних ланок та активне розроблення нових методів комплексної терапії, псоріаз залишається не до кінця вивченим і потребує подальшої уваги науковців.
* * *
Наведений аналіз наукової літератури дозволяє зробити наступні висновки.
1. Псоріаз залишається актуальною, не до кінця вирішеною проблемою дерматології у зв’язку з його поширеністю, різноманіттям пускових факторів, клінічною гетерогенністю в різні вікові періоди життя, зростанням резистентності до лікування, розвитком інвалідизації та/або різким погіршенням якості життя. Незважаючи на досить значну різноманітність досліджень, ще не до кінця є з’ясованими питання його етіології та патогенезу.
2. Огляд літератури свідчить про недостатність досліджень стану ерго- та трофотропної систем у хворих на псоріаз, що має важливе значення для визначення тяжкості процесу, ризику розвитку ускладнень. Подальше вивчення етіології та патогенезу псоріатичного процесу має проводитися шляхом комплексного дослідження стану систем, відповідальних за гомеостаз, та впливу факторів оточуючого середовища на організм пацієнта.
3. У науковій літературі не визначено інформативні метаболічні показники, що має значення для оцінки ефективності комплексної терапії.
4. Публікацій, присвячених дослідженню клінічної ефективності препаратів метамаксу та кортексину в комплексній терапії псоріазу різного ступеня тяжкості, не виявлено.
Дані розділу відображені в наступних публікаціях:
- Біловол А.М. Питання псоріазу в сучасному суспільстві / А.М. Біловол, А.А. Берегова // Сучасні проблеми дерматовенерології, косметології та управління охороною здоров’я наук.-практ. конф. – Слобожанські читання, Харків, 12 червня 2014 р.: зб. наук. праць. – Х., 2014. – Вип. 11. – С. 42-46.
- Береговая А.А. Оценка качества жизни у больных псориазом / А.А. Береговая // Роль профилактики и реабилитации в обеспечении качества жизни населения на современном этапе : междунар. науч.-практ. конф., Махачкала, 26 сентября 2013 г. – Махачкала, 2013. – С. 40-43.
РОЗДІЛ 2
МАТЕРІАЛ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Критерії вибору пацієнтів і програми дослідження
Вибір групи пацієнтів із псоріазом обумовлений, перш за все, необхідністю подальшого вивчення патогенетичних механізмів його розвитку та обґрунтування комплексних лікувально-профілактичних заходів.
Для досягнення поставленої мети і задач даного дослідження на клінічній базі кафедри дерматології, венерології та медичної косметології ХНМУ (стаціонарне відділення Комунального закладу охорони здоров’я «Харківський міський клінічний шкірно-венерологічний диспансер № 5») з 97 хворих із підтвердженим діагнозом – псоріаз (L 40.0) віком від 30 до 50 років, які лікувалися у період 2013-2015 рр., сформовано три групи залежно від тяжкості захворювання. До I групи залучено 35 хворих з легким, до II групи – 32 хворих із середньотяжким, до III групи – 30 хворих із тяжким ступенем псоріазу. Ступінь тяжкості захворювання встановлювався за індексом PASI, який дозволяє оцінити поширеність патологічного процесу, виділити ті чи інші переважні симптоми, а також ступінь зменшення патологічних проявів у процесі лікування. Для його обчислення розглядалися чотири ділянки тіла: голову (г), тулуб (т), верхні (в) та нижні (н) кінцівки. На ці ділянки припадає відповідно 10 %, 30 %, 20 % і 40 % поверхні тіла. Поширеність патологічних висипань виражалася у числових величинах: від 0 (немає ураження) до 6 балів – 90-100 % ураженої поверхні (1 бал – < 10 %, 2 бали – < 30 %, 3 бали – < 50 %, 4 бали – < 70 %, 5 балів – < 90 %). Для оцінки ступеня тяжкості псоріазу виділено також ознаки: інтенсивність забарвлення висипань – умовно еритема (е), інфільтрація (і) та лущення (л), що оцінювалися в балах від 0 (відсутність ознаки) до 4 (дуже тяжкий ступінь виразності ознаки): 1 бал – легкий, 2 бали – середній і 3 бали – тяжкий ступінь вираженості. Для обчислення PASI сума ступенів тяжкості, що розраховувалася для трьох основних симптомів, помножувалася на числове значення уражених ділянок і процентне вираження чотирьох ділянок тіла з наступним підсумовуванням величин:
PASI=0,1 (е+і+л)Аг+0,3(е+і+л)Ат+0,2(е+і+л)Ав+0,4(е+і+л)Ан. (2.1)
Критеріями включення до груп були: вік хворих від 30 до 50 років, верифікований діагноз псоріазу, згода на участь у дослідженні, тоді як критеріями виключення – пацієнти з ушкодженими пізнавальними функціями, декомпенсованими станами, хронічними захворюваннями в стадії загострення, хворі на СНІД.
Діагноз псоріазу ставився та підтверджувався згідно наказу МОЗ України від 08.05.2009 р. «Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання», МКХ-10 (Хвороби шкіри і підшкірної клітковини).
До групи контролю було залучено 30 практично здорових осіб, які достовірно не відрізнялися за статтю та віком від пацієнтів.
Перед початком проведення досліджень з’ясовувалися скарги хворих, збиралися дані анамнезу життя та хвороби (вік пацієнтів на початку хвороби, її тривалість, наявність сезонності загострень, наявність псоріазу в родичів, соматичної патології тощо), ретельно вивчалися об’єктивні прояви хвороби, патологію внутрішніх органів і систем (серцево-судинної, шлунково-кишкового тракту, нервової тощо). Проводилися неодноразове вивчення клінічного аналізу крові, сечі, біохімічні та серологічні дослідження крові, за необхідності – ультразвукові, електрокардіографічні та інші дослідження, а також враховували консультації терапевта, окуліста, ендокринолога, отоларинголога, ревматолога.
Дослідження проводилися з дотриманням принципів біоетики. Дозвіл на виконання досліджень на людях ухвалено на засіданні комісії з питань біоетики ХНМУ (протокол № 1 від 8 січня 2013 р.).
Для реалізації мети та виконання задач дослідження попередньо було розроблено поетапну програму (рис. 2.1).
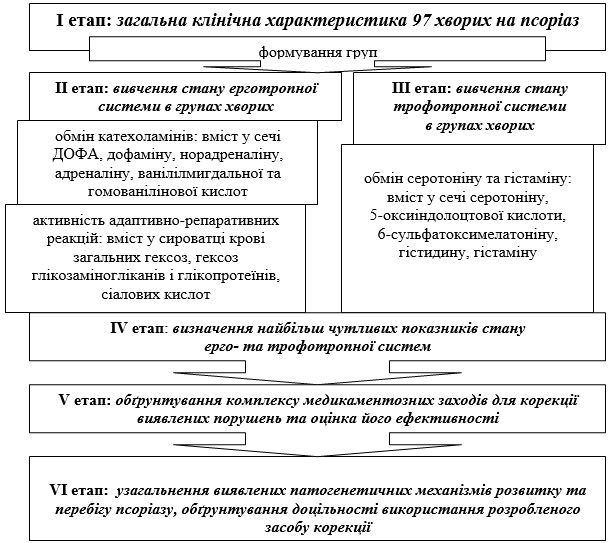
Рисунок 2.1 – Поетапна програма досліджень
2.2 Методи дослідження
Клінічні дослідження (визначення суб’єктивного стану хворих, виявлення об’єктивної патологічної симптоматики, стандартне лабораторне обстеження) виконано на базі стаціонарного відділення Комунального закладу охорони здоров’я «Харківський міський клінічний шкірно-венерологічний диспансер № 5». Біохімічні дослідження проведено на базі кафедри біологічної хімії ХНМУ (завідувач – д.мед.н., проф. В.І. Жуков).
Збір та зберігання сечі для визначення ДОФА, ДА, НА, А проводилися в умовах, що забезпечують мінімальне їх руйнування – у присутності консервантів 6н НСl, 10н Н2SO4. Рівень добової екскреції катехоламінів та їх попередника ДОФА оцінювали спектрофлюориметрично з попередньою адсорбцією методом колонкової хроматографії на окису алюмінію [93]. Катехоламіни та частина адсорбованого ДОФА елюювалися 0,25 н розчином оцтової кислоти; інша частина ДОФА знімалася 1 н розчином соляної кислоти. Виділені катехоламіни піддавалися окисленню фериціанідом калію при різних значеннях рН. Інтенсивність флюоресценції вимірювалася на спектрофлюориметрі MPF-4А фірми «Хітачі» (Японія). Проби з рН 4,2 та рН 6,2, що містять А, НА та оцтовокислий елюат з ДОФА, реєструвалися при 436/550 нм. У цих умовах при рН 4,2 флюоресціює лише А, при рН 6,2 – А і НА. Проби з рН 6,2, що містять А, НА, ДОФА, та проби солянокислого елюату, окисленого при рН 6,2, реєструвалися при 360/550 нм.
Екскреція А (нмоль/добу) розраховувалася за формулою (2.2):
6 · 7 · 10 · d · 5,458 / Σ · 17,5 · 1000, (2.2)
де 6 – флюоресценція А в 1 мл проби;
7 – об’єм елюату (мл);
10 – розведення елюату при окисленні;
d – добова кількість сечі (мл);
5,458 – коефіцієнт перерахунку у нмоль/добу;
Σ – флюоресценція стандарту 1 мг А в 1 мл проби (розраховувалася за калібрувальною кривою);
1000 – коефіцієнт для переводу мг у мкг.
Екскреція НА (нмоль/добу) розраховувалася за формулою (2.3):
8 · 7 · 10 · d · 5,911 / Σ1 · 17,5 ·1000, (2.3)
де 8 – флюоресценція НА в 1 мл проби (при рН 4,2 та 6,2 інтенсивності флюоресценції А та НА однакові);
7 – об’єм елюату (мл);
10 – розведення елюату при окисленні;
d – добова кількість сечі (мл);
5,911 – коефіцієнт перерахунку у нмоль/добу;
Σ1 – флюоресценція стандарту 1 мг НА в 1 мл проби (розраховувалася за калібрувальною кривою);
17,5 – кількість сечі у дослідній пробі;
1000 – коефіцієнт для переводу мг у мкг.
Екскреція ДОФА (нмоль/добу) розраховувалася за формулою (2.4):
(12+Х) · 7 · 10 · d · 5,071 / Σ2 ·17,5 ·1000, (2.4)
де 12 – флюоресценція солянокислого елюату;
Х – флюоресценція оцтовокислого елюату;
7 – об’єм елюату (мл);
10 – розведення елюату при окисленні;
d – добова кількість сечі (мл);
5,071 – коефіцієнт перерахунку у нмоль/добу;
Σ2 – флюоресценція стандарту 1 мг НА в 1 мл проби з рН 6,2 при 360/550 нм (розраховувалася за калібрувальною кривою);
17,5 – кількість сечі у дослідній пробі;
1000 – коефіцієнт для переводу мг у мкг.
Для визначення флюоресценції ДА використовувалися світлофільтри 365/436 нм. Різниця величини інтенсивності флюоресценції дослідної та контрольної проб визначалася вмістом оцтовокислого ДОФА та ДА. При рівні інтенсивності флюоресценції Е екскреція ДОФА за умов визначення ДА (окислення йодом та реєстрація при 360/436 нм) розраховувалася за формулою (2.5):
Х · Σ3/ Σ4 · 1000, (2.5)
де Х – вимірювана раніше флюоресценція оцтовокислого ДОФА при окисленні його ферриціанидом калію (360/550 нм);
Σ3 – флюоресценція 1 мкг/мл ДОФА за цих умов;
Σ4 – флюоресценція 1 мкг/мл ДОФА при окисленні йодом (360/550 нм);
1000 – коефіцієнт для переводу мг у мкг.
У даному випадку на долю ДА припадає Е – Х · Σ3/ Σ4 · 1000.
Екскреція ДА (нмоль/добу) розраховувалася за формулою (2.6):
(Е – Х · Σ3/Σ4 · 1000) · 7 · 5 · d · 6,538 / Σ5 · 17,5 (2.6)
де 7 – об’єм елюату (мл);
5 – розведення елюату при окисленні;
d – добова кількість сечі (мл);
6,538 – коефіцієнт перерахунку у нмоль/добу;
Σ5 – флюоресценція стандарту 1 мг ДА, окисленого йодом, в 1 мл проби при 365/436 нм (розраховувалася за калібрувальною кривою);
17,5 – кількість сечі у дослідній пробі.
Визначення в сечі вмісту кінцевих продуктів інактивації катехоламінів ВМК та ГВК проводилося методом тонкошарової хроматографії на силікагелі з попередньою екстракцією етилацетатом [93]. Локалізація ВМК та ГВК встановлювалася за стандартами при освітленні хроматограм короткохвильовим ультрафіолетовим світлом (254 нм). Ділянки силікагелю, що відповідали досліджуваним кислотам, знімалися з хроматографічних пластин, переносилися до пробірок, елюювалися розчином карбонату натрію з наступним додаванням реактиву Фоліна. Кількісний вміст ВМК та ГВК оцінювався колориметрично при 615 нм.
Рівень добової екскреції із сечею 17-ОКС визначали колориметричним методом за реакцією між фенілгідразином та 17, 21-діоксиацетоновою групою стероїду у кислому середовищі після ферментативного гідролізу [93]. Кількість сумарних 17-оксикетостероїдів (мкг) у пробі розраховували за формулою (2.7):
С = (А1 – А2) · Q, (2.7)
де А1 – оптична щільність дослідної проби з гідролізом;
А2 – оптична щільність контрольної проби після гідролізу;
Q – співвідношення кількості стандарту до оптичної щільності стандартного розчину (без абсорбції контрольної проби до стандартної).
Екскрецію сумарних 17-ОКС (мкмоль/добу) із добовою сечею знаходили за формулою (2.8):
С · d · 3 · 2,758 / 5 · 2 ·1000 (2.8)
де С · 3 / 5 · 2 – кількість сумарних 17-оксикетостероїдів в 1 мл сечі;
1000 – коефіцієнт для переводу з мкг у мг;
2,758 – коефіцієнт переводу у мкмоль/добу.
Для одержання сироватки стерильні пробірки з венозною кров’ю термостатувалися протягом 20 хв з наступним центрифугуванням протягом 10 хв при 1500 об/хв. Плазма отримувалася шляхом центрифугування гепаринізованої крові протягом 20 хв при 3000 об/хв.
Вміст у сироватці крові гексоз, пов’язаних з білками, оцінювався колориметричним методом за реакцією з орциновим реактивом [93]. До сироватки крові з метою осадження глікопротеїнів (ГП) додавався 96 % розчин етанолу, центрифугувався та розчинявся білковий осад у лугу з додаванням орцинового реактиву. Проби нагрівалися на водяній бані до 80 ºС протягом 15 хвилин, охолоджувалися та фотометрувалися при 540 нм. Абсорбція враховувалася відносно показників оптичної щільності контрольної проби. Розрахунок проводився за калібрувальним графіком. Аналогічно проводилося визначення гексоз глікозаміногліканів (ГАГ), які попередньо осаджувалися розчином цетилпіридинхлориду. Фракція гексози-ГП знаходилася за різницею вмісту загальних гексоз і гексоз ГАГ.
Вміст сіалових кислот у сироватці крові визначався за допомогою діагностичного набору «Сіалотест-80» (РеаХім, Росія) методом, що ґрунтується на реакції сіалової кислоти з індикатором. У результаті реакції при нагріванні утворюється сполука, інтенсивність забарвлення якої пропорційна концентрації сіалової кислоти.
Для дослідження вмісту серотоніну та його метаболітів добова сеча збиралася після дводенної дієти, що виключає продукти, багаті на серотонін (зокрема, банани, шоколад, горіхи, баклажани тощо).
Визначення серотоніну, 5-оксиіндолоцтової кислоти (5-ОІОК), гістаміну та гістидину проводилося в одній пробі добової сечі згідно з методичними рекомендаціями Ц. І. Герасимової [56]. Розділення речовин проводилося методом колонкової хроматографії; серотонін та гістамін елюювалися 0,1 н NаОН, гістидин – 0,1 М фосфатним буфером, а 5-ОІОК – 60 % метанолом. Визначення серотоніну проводилося у частині лужного елюату шляхом додавання 1 % цистеїну, 0,1 % ортофталевого альдегіду та концентрованої HCl з наступним кип’ятінням і вимірюванням флюоресценції при 440 нм, збуджуючи при 355 нм. Для визначення гістаміну частина лужного елюату змішувалася з 1 н NaОН, 0,1 % розчином ортофталевого альдегіду та 3 н НCl, після чого вимірювалася флюоресценція при 440/355 нм. У буферному елюаті визначався гістидин при 440/375 нм, попередньо додаючи 1 н NaОН, 0,1 % розчин ортофталевого альдегіду та 3 н НCl. З метанольного елюату відбиралися аліквоти; одна з них використовувалася для визначення загальної флюоресценції, інша – для визначення фонової флюоресценції; за їх різницею оцінювалася величина флюоресценції 5-ОІОК. Вимірювання в обох випадках проводилося при 470/360 нм. Вміст речовин у добовій сечі розраховувався за флюоресценцією стандарту.
Рівень екскреції з добовою сечею 6-сульфатоксимелатоніну (6-СОМТ) визначався імуноферментним методом за допомогою тест-системи «Buhlmann 6-Sulfatoxymelatonin ELISA» (Швейцарія) та аналізатора імуноферментного Stat Fax 303 Рlus. Метод ґрунтується на принципі зв’язування специфічного антигену, сенсибілізованого на твердій фазі, зі специфічними антитілами будь-якого класу. У ході ферментативної реакції після додавання субстрату формувався кольоровий продукт, оптична щільність якого реєструвалася на спектрофотометрі при певній довжині хвилі (залежно від виду субстрату). Розрахунок титру специфічних антитіл проводився за спеціальною схемою, концентрація в пробах розраховувалася за допомогою стандартних кривих варіантів абсорбції концентрацій.
Статистичний аналіз даних проводився з використанням комп’ютерного пакета прикладних програм для обробки статистичної інформації Statistica 6.1 (StatSoft,Inc., США). Кількісні ознаки, що мали нормальний розподіл, описувалися параметричними характеристиками – середнім значенням досліджуваного показника (М) та середнім квадратичним відхиленням (s); у разі відсутності нормального розподілу непараметричними характеристиками – медіаною вибірки (Ме) та інтерквартильним розмахом [значеннями 25-го та 75-го процентилів]. Для порівняння двох нормальних розподілів застосовувався t-критерій Стьюдента. Якщо принаймні один з розподілів не був нормальним, то для порівняння незалежних вибірок використовувався ранговий критерій Манна-Вітні, а для залежних даних – ранговий критерій Вілкоксона. За критичний рівень значущості при перевірці статистичних гіпотез приймалося р<0,05.
РОЗДІЛ 3
КЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ
Для вирішення поставлених задач під спостереженням знаходилося 97 хворих, діагноз яких відповідав L40.0 – псоріаз звичайний, згідно МКХ-10.
Клінічна характеристика особливостей перебігу хвороби проводилася з урахуванням як основного, так і супутніх діагнозів. Діагноз виставлявся після ретельного вивчення скарг, аналізу анамнезу життя і захворювання, клінічних проявів дерматозу, результатів загальносоматичних досліджень. При зборі анамнезу враховувалися причини і тривалість захворювання, сезонність, частота рецидивів, попередня терапія, її ефективність, тривалість ремісій. У клінічній характеристиці дерматозу враховувалася поширеність процесу, вираженість морфологічних елементів висипки. Для оцінки стану пацієнтів використовувалися загальноклінічні методи дослідження: загальний аналіз крові та сечі, аналіз крові на цукор, біохімічний аналіз крові. Для уточнення функціонального стану внутрішніх органів призначалося обстеження і консультація суміжних спеціалістів.
З метою одержання більш достовірних результатів, а також у зв’язку з тенденцією до «омолодження» псоріазу та поширеністю його серед працездатного населення, для дослідження було відібрано хворих у вузькому віковому діапазоні від 30 до 50 років (табл. 3.1). Серед пацієнтів чоловіків було більше (72 особи – 74,2 %), ніж жінок (25 осіб – 25,8 %). Найчисленнішу групу (40 пацієнтів – 41,2 %) становили особи чоловічої статі віком від 30 до 40 років. Другу за чисельністю групу склали чоловіки віком від 41 до 50 років (32 хворих – 33,0 %), а третю – жінки у віковому діапазоні 41–50 років (15 хворих – 15,5 %). Найменша група – жінки, хворі на псоріаз, віком від 30 до 40 років (10 осіб – 10,3 %). Середній вік обстежуваних хворих на псоріаз становив (40,5±1,2) року (чоловіків – (39,3±1,4) року, жінок – (41,7±1,3) року).
Таблиця 3.1 – Розподіл хворих за статтю та віком
| Вік, роки | Хворі на псоріаз | |||||
| чоловіки | жінки | разом | ||||
| абс. | % | абс. | % | абс. | % | |
| 30-40 | 40 | 41,2 | 10 | 10,3 | 50 | 51,5 |
| 41-50 | 32 | 33,0 | 15 | 15,5 | 47 | 48,4 |
| Усього | 72 | 74,2 | 25 | 25,8 | 97 | 100 |
Супутню патологію виявлено у 27 (27,8 %) хворих. Найчастіше у хворих на псоріаз відзначалися захворювання серцево-судинної системи (вегето-судинна дистонія, артеріальна гіпертензія, ішемічна хвороба серця та атеросклероз) – у 9 (9,1 %) випадках (серед них – 5 (5,1 %) чоловіків і 4 (4,1 %) жінки), рідше шлунково-кишкового тракту (виразкова хвороба 12-палої кишки, хронічний гепатит, хронічний панкреатит) – у 7 (7,2 %) хворих (серед них – 5 (5,1 %) чоловіків та 2 (2,1 %) жінки), захворювання ЛОР-органів та органів дихання – у 5 (5,1 %) хворих (серед них – 2 (2,1 %) чоловіки і 3 (3,1 %) жінки), захворювання нирок сечостатевої системи – у 4 (4,1 %) хворих (серед них – 2 (2,1 %) чоловіки та стільки ж і жінок), захворювання ендокринної системи – у 2 (2,1 %) хворих (серед них по одному (1 %) пацієнту обох статей) (табл. 3.2).
Аналіз розподілу супутніх захворювань залежно від статі встановив, що частіше супутню патологію мали чоловіки, ніж жінки, відповідно 15 осіб (15,4 %) серед чоловіків та 12 (12,4 %) осіб серед жінок.
Тривалість захворювання варіювала від декількох місяців до 30 та більше років (табл. 3.3). На момент обстеження найчисельнішу групу становили хворі з тривалістю псоріазу від 6 до 10 років (19 хворих – 19,6 %), з превалюванням чоловіків – 15 осіб (15,5 %), тоді як серед жінок виявлено 4 особи (4,1 %). Другими за чисельністю були групи з тривалістю дерматозу від 1 до 5 років – 18 пацієнтів (18,6 %) (серед них чоловіків – 17 (17,5 %) осіб, а жінок – 1 (1,0 %) особа) та від 16 до 20 років – 18 пацієнтів (18,6 %) (серед них чоловіків – 13 (13,4 %) осіб, а жінок – 5 (5,2 %) осіб). Найменшу за чисельністю групу становили пацієнти з тривалістю хвороби на момент обстеження до 1 року – 10 осіб (10,3 %) (серед них 9 (9,27 %) чоловіків і 1 (1,03 %) жінка).
Таблиця 3.2 – Супутні захворювання хворих на псоріаз
| Супутні захворювання | Хворі на псоріаз | |||||
| чоловіки | жінки | разом | ||||
| n | % | n | % | n | % | |
| Захворювання серцево-судинної системи | 5 | 5,1 | 4 | 4,1 | 9 | 9,3 |
| Захворювання ендокринної системи | 1 | 1,0 | 1 | 1,0 | 2 | 2,1 |
| Захворювання шлунково-кишкового тракту | 5 | 5,1 | 2 | 2,1 | 7 | 7,2 |
| Захворювання ЛОР-органів та органів дихання | 2 | 2,1 | 3 | 3,1 | 5 | 5,1 |
| Захворювання нирок та сечовидільної системи | 2 | 2,1 | 2 | 2,1 | 4 | 4,1 |
| Усього | 15 | 15,4 | 12 | 12,4 | 27 | 27,8 |
Різноманітним було соціальне положення хворих, а саме: тимчасово непрацюючі, робочі, службовці.
Аналіз залежності загострень псоріазу від сезонності виявив, що зимовий тип (загострення зима-осінь) спостерігався у 37 (38,1 %) хворих, серед яких – 11 (11,3 %) жінок та 26 (26,8 %) чоловіків. Літній тип (загострення весна-літо) спостерігався у 7 (7,2 %) пацієнтів, серед яких – 3 (3 %) чоловіки та 4 (4,1 %) жінки. Найбільш численна група пацієнтів виявлена з невизначеним типом (загострення не пов’язане із сезонністю), яка складалася з 53 (54,6 %) хворих, серед яких – 43 (44,3 %) чоловіки і 10 (10,3 %) жінок (табл. 3.4).
Таблиця 3.3 – Тривалість захворювання хворих на псоріаз
| Тривалість хвороби роки |
Хворі на псоріаз | |||||
| чоловіки | жінки | разом | ||||
| абс. | % | абс. | % | абс. | % | |
| до 1 | 9 | 9,3 | 1 | 1,0 | 10 | 10,3 |
| 1-5 | 17 | 17,5 | 1 | 1,0 | 18 | 18,6 |
| 6-10 | 15 | 15,5 | 4 | 4,1 | 19 | 19,6 |
| 11-15 | 11 | 11,3 | 4 | 4,1 | 15 | 15,4 |
| 16-20 | 13 | 13,4 | 5 | 5,2 | 18 | 18,6 |
| понад 20 | 7 | 7,2 | 10 | 10,3 | 17 | 17,5 |
| Усього | 72 | 74,2 | 25 | 25,8 | 97 | 100 |
Таблиця 3.4 – Розподіл сезонних типів псоріазу у хворих
| Тип псоріазу |
Хворі на псоріаз | |||||
| чоловіки | жінки | разом | ||||
| абс. | % | абс. | % | абс. | % | |
| Літній | 3 | 3 | 4 | 4,1 | 7 | 7,2 |
| Зимовий | 26 | 26,8 | 11 | 11,3 | 37 | 38,1 |
| Невизначений | 43 | 44,3 | 10 | 10,3 | 53 | 54,6 |
| Усього | 72 | 74,2 | 25 | 25,8 | 97 | 100 |
Найчастіше первинну локалізацію висипань відзначено на волосистій частині голови, а саме у 26 (26,8 %) осіб, на тулубі – у 23 (23,7 %) осіб, на розгинальних поверхнях ліктьових і колінних суглобів – у 18 (18,6 %) осіб, на верхніх і нижніх кінцівках – у 16 (16,5 %) і 9 (9,3 %) осіб відповідно. У 5 (5,1 %) випадках висипання розташовувалися на шкірі обличчя, шиї, долонь, статевих органів, міжсідничній складці тощо (табл. 3.5).
Таблиця 3.5 – Розподіл хворих на псоріаз залежно від первинної локалізації процесу
| Локалізація псоріазу | Хворі на псоріаз | |
| абс. | % | |
| Волосиста частина голови | 26 | 26,8 |
| Тулуб | 23 | 23,7 |
| Розгинальні поверхні ліктьових та колінних суглобів | 18 | 18,6 |
| Верхні кінцівки | 16 | 16,5 |
| Нижні кінцівки | 9 | 9,3 |
| Інші частини | 5 | 5,1 |
| Усього | 97 | 100,0 |
У ході обстеження виявлено тенденцію до збільшення тривалості хвороби у осіб, які страждали на часті респіраторні захворювання, ангіни, психоемоційні перевтоми. Псоріаз при цьому відрізнявся торпідністю та короткими періодами ремісії. Як наслідок, у цих хворих констатувався дисемінований процес із торпідним перебігом і стійкістю до різних терапевтичних засобів.
Усі обстежені хворі раніше отримували лікування з приводу псоріазу, більшість неодноразово, залежно від тяжкості хвороби. Більшість пацієнтів відзначала різну частоту рецидивів залежно від давності захворювання.
За характером шкірних уражень хворі на звичайний псоріаз розподілялися наступним чином: монетоподібний – 14 хворих (14,4 %), дрібнобляшковий – 8 (8,2 %), великобляшковий – 72 (74,2 %), краплеподібний – 3 (3,1 %). У 90 (92,8 %) хворих спостерігався поширений шкірний процес, у 7 (7,2 %) хворих – обмежений. Майже всі пацієнти мали прогресуючу та стаціонарну стадію хвороби. При цьому прогресуючу стадію дерматозу встановлено у 70 (72,2 %) хворих з розповсюдженим та у 3 (3,1 %) хворих з обмеженим процесом, стаціонарну – у 24 (24,8 %) пацієнтів з розповсюдженим та у 9 (9,3 %) пацієнтів з обмеженим псоріазом (табл. 3.6).
Таблиця 3.6 – Розподіл хворих залежно від стадії хвороби
| Стадії псоріазу | Ступінь ураження шкіри | |||||
| розповсюджений | обмежений | разом | ||||
| абс. | % | абс. | % | абс. | % | |
| Прогресуюча | 70 | 72,2 | 3 | 3,1 | 73 | 75,3 |
| Стаціонарна | 15 | 15,5 | 9 | 9,3 | 24 | 24,8 |
| Усього | 90 | 87,7 | 7 | 12,4 | 97 | 100 |
У більшості хворих патологічний процес шкіри мав гостро запальний характер. У 37 (38,1 %) хворих суб’єктивними симптомами при цьому були, як правило, свербіж, печіння, відчуття стягування шкіри. У 49 (50,5 %) пацієнтів відзначалося порушення сну, занепокоєння, тривога в період загострення захворювання.
Висипання переважно локалізувалися на розгинальних поверхнях ліктьових і колінних суглобів, а також шкіри інших відділів кінцівок, спини, живота, сідниць. У більшості випадків патологічні морфологічні елементи – симетричні дрібнобляшкові чітко відмежовані від навколишньої шкіри, рідше монетоподібні та великобляшкові висипання у деяких хворих зливалися між собою та утворювали різноманітні за обрисами фігурні осередки. При таких формах переважали тривало існуючі бляшки з інтенсивною червоністю, значним нашаруванням лусочок, після видалення яких виявлялася ущільнена основа. Папули, розташовані на різних ділянках тулуба, мали колір від яскраво- та темно-червоного до синьо-багряного та коричнево-червоного. У 51 (52,6 %) хворого у прогресуючій стадії спостерігався виражений симптом Кьобнера на місцях механічного подразнення шкіри (травми, тиску, розчухів). При пошкрябуванні папул виявлялися три характерних для псоріатичної тріади феномени: стеаринової плями, термінальної плівки, феномен «кров’яної роси» (феномен Ауспітца). У значної групи хворих із прогресуючою стадією захворювання по периферії більшості патологічних елементів виявлялася незначна зона еритеми (симптом Пільнова).
На волосистій частині голови спостерігалися висипання у вигляді окремих бляшок і дифузні ураження з типовою «псоріатичною короною». На волосистій частині голови у 10 (10,3 %) пацієнтів спостерігалися чітко окреслені еритематозно-сквамозні осередки з жовтувато-білими лусочками на поверхні. Висипання на шкірі обличчя звичайно зустрічалися у хворих на поширений псоріаз, частіше представлені краплеподібними яскраво-червоними папулами. У 5 (51 %) випадках поширеного псоріазу відзначалася локалізація процесу у великих складках із гладкими, блискучими, різко обмеженими, злегка вологими, бляшками. Ураження нігтьових пластинок у вигляді «наперстка», піднігтьового гіперкератозу, подовжньої та поперечної окресленості, платоніхії виявлено у 28 (28,9 %) хворих.
Регрес псоріатичних висипань у обстеженого контингенту хворих починався з переходу яскравого забарвлення папул у більш темне, зменшення лущення, появи псевдоатрофічного віночка Воронова (світлого блискучого кільця зморшкуватої шкіри) навколо елементів. Порівняно швидко та безслідно регресували лентикулярні папули, більші бляшки звичайно починали розв’язуватися в центрі, потім зникала й периферична облямівка. У 9 (9,3 %) хворих залишалися гіперпігментовані плями, а у 4 (4,1 %) пацієнтів – лейкодерма.
При розподілі хворих за ступенем вираженості основних клінічних проявів (інфільтрації, гіперемії, лущення) з оцінкою площі ураження за простою лінійною шкалою, значення PASI ≤ 10 розцінювалося як легкий ступінь тяжкості захворювання; значення PASI від 10 до 30 балів – як середньотяжкий ступінь; PASI від 30 до 72 балів (максимально виражені шкірні прояви) – як тяжкий ступінь (табл. 3.7).
Таблиця 3.7 – Розподіл хворих за ступенем тяжкості псоріазу
| Перебіг
захворювання |
Хворі на псоріаз | |||||
| чоловіки | жінки | разом | ||||
| абс. | % | абс. | % | абс. | % | |
| Легкий | 23 | 23,7 | 12 | 12,4 | 35 | 36 |
| Середньотяжкий | 24 | 24,7 | 8 | 8,2 | 32 | 33 |
| Тяжкий | 25 | 25,8 | 5 | 5,2 | 30 | 31 |
| Усього | 72 | 74,2 | 25 | 25,8 | 97 | 100 |
За чисельністю найбільшою була I група – з легким ступенем тяжкості хвороби – 35 (36 %) осіб, де кількість чоловіків майже вдвічі перевищувала кількість жінок, становлячи відповідно 23 (23,7 %) і 12 (12,4 %) осіб. До II групи – із середнім ступенем тяжкості псоріатичного процесу – увійшло 32 (33 %) особи, серед яких чоловіків було 24 (24,7 %), що втричі більше за жінок [8 (8,2 %)]. До III групи пацієнтів – із тяжким ступенем псоріазу – увійшло 30 (31 %) осіб, серед яких чоловіків було 25 (25,8 %), що у п’ять разів перевищувало кількість жінок [5 (5,2 %)].
Середній індекс PASI в обстежених хворих на псоріаз серед чоловіків становив: у разі легкого ступеня тяжкості хвороби – (6,87±2,22) бала, середньотяжкого – (18,3±4,12) бала, тяжкого – (35,2±4,98) бала. Серед жінок середній індекс PASI становив: у разі легкого ступеня тяжкості захворювання – (7,93±1,71) бала, середньотяжкого – (19,1±6,23) бала, тяжкого – (32,7±1,05) бала (табл. 3.8).
Наявність псоріазу серед родичів І і ІІ ступенів споріднення виявлено у 3 (3 %) обстежуваних хворих.
Таблиця 3.8 – Середній індекс PASI у обстежених хворих на псоріаз
| Стать
пацієнтів |
Ступінь перебігу псоріазу | ||
| легкий | середньотяжкий | тяжкий | |
| Чоловіки | 6,87±2,22 | 18,3±4,12 | 35,2±4,98 |
| Жінки | 7,93±1,71 | 19,1±6,23 | 32,7±1,05 |
Серед можливих причин загострення псоріазу найчастіше вказувалися психоемоційний стрес – у 69 (71 %) хворих, перенесені інфекційні захворювання (ангіна, гострі респіраторні вірусні інфекції) – у 3 (3,1 %) пацієнтів, після контакту з хімічними речовинами (ліки, будівельні суміші) – у 2 (2,1 %) пацієнтів, після перебування в умовах підвищеної інсоляції – у 2 (2,1 %) пацієнтів, травми шкіри – у 1 (1 %) пацієнта. У 20 (20,6 %) хворих припустиму причину загострення псоріазу не встановлено.
* * *
У цілому дані анамнезу клінічної картини 97 хворих на псоріаз свідчать про високу захворюваність у осіб працездатного віку з переважанням у 2,8 разу у чоловіків. Найчастіше дерматоз виникав у віці 30-40 років у осіб чоловічої статі (40 пацієнтів – 41,2 %). Зимовий тип псоріазу відзначено у 38,1 % хворих, літній – у 7,2 %, невизначений – у 54,6 %. Супутню патологію виявлено у 27,8 % хворих. Клінічна картина шкірного процесу відповідала звичайній формі псоріазу та характеризувалася поширеними або обмеженими краплеподібними, монетоподібними, дрібно- та великобляшковими висипаннями, що знаходилися у прогресуючій (75,3 %) і стаціонарній (24,8 %) стадіях. Початку захворювання у більшості серед обстежених пацієнтів передували психоемоційні ситуації, що робить перспективним дослідження ролі стресу як пускового фактора. Це спонукає визначити у хворих залежно від тяжкості перебігу псоріатичного процесу активність ерго- та трофотропної систем, яким належить вагома роль у механізмах розвитку стресових ситуацій.
Дані розділу відображені в наступних публікаціях:
1. Берегова А.А. Стан симпато-адреналової системи у хворих на псоріаз з різним ступенем тяжкості клінічного перебігу / А.А. Берегова // Дерматологія та венерологія. – 2015. – № 1 (67). – С. 20-26.
2. Вміст серотоніну та його похідних у сечі хворих на псоріаз з різним ступенем тяжкості / А.А. Берегова, А.М. Біловол, В.І. Жуков, С.О. Стеценко // Український журнал дерматології, венерології, косметології. – 2015. – № 2 (57). – С. 56-60
3. Берегова А.А. Оцінка обміну катехоламінів у динаміці прогресування псоріазу / А.А. Берегова, А.М. Біловол // Вісник проблем біології і медицини. – 2015. – Вип. 2, Т. 1 (118). – С. 103-110.
4. Береговая А.А. Оценка состояния адаптивно-репаративных реакций по содержанию компонентов углеводсодержащих белков в сыворотке крови больных псориазом различной степени тяжести / А.А. Береговая, А.Н. Беловол, С.А. Стеценко // Журнал Гродненского государственного медицинского университета. – 2015. – № 4. – С. 44-47
РОЗДІЛ 4
СТАН ЕРГО- ТА ТРОФОТРОПНОЇ СИСТЕМ ОРГАНІЗМУ ХВОРИХ
НА ПСОРІАЗ РІЗНОГО СТУПЕНЯ ТЯЖКОСТІ
4.1 Оцінка обміну катехоламінів у хворих на псоріаз
Одним з адекватних методів оцінки тонусу та реактивності симпато-адреналової системи є дослідження екскреції з добовою сечею катехоламінів, їх попередника ДОФА та кінцевих продуктів інактивації – ВМК та ГВК. Адекватність визначення рівня їх екскреції з сечею порівняно з визначенням кількості у плазмі крові обумовлена стислістю періоду напіврозпаду катехоламінів у плазмі і реакцією хворого на взяття крові. У результаті дії цих факторів вміст катехоламінів у плазмі більше відображує стресову реакцію, пов’язану з дослідженням, ніж закономірності функціонування симпато-адреналової системи за певних умов.
Результати досліджень свідчили, що у хворих на псоріаз різного ступеня тяжкості спостерігалися порушення екскреції із сечею ДОФА та його похідних (табл. 4.1). Слід зазначити, що для всіх груп хворих рівень екскреції ДОФА практично знаходився у межах фізіологічної норми, але у загальній статистичній картині визначалися певні тенденції змін. У пацієнтів I групи рівень ДОФА статистично значуще відносно контролю знижувався в середньому на 32 % (р=0,003), у пацієнтів II групи – на 25 % (р=0,002), а III групи – на 39 % (р<0,001). При цьому вміст ДОФА у сечі хворих на псоріаз із тяжким ступенем також був достовірно (р=0,02) зниженим на 18 % порівняно з таким у хворих із середнім ступенем тяжкості дерматозу. Порівняння вмісту ДОФА у хворих II і III груп із вмістом у хворих I групи статистично значущих відмінностей не виявило (р=0,624 і р=0,144 відповідно).
Для екскреції ДА (продукту реакції декарбоксилювання ДОФА) спостерігалася інша динаміка змін. Для пацієнтів I і II груп рівень ДА, підвищувався (р≤0,001) порівняно з контролем у середньому на 58 % і 35 % відповідно. При тяжкому ступені псоріазу практично не відмічалося змін з боку екскреції ДА порівняно з контролем (р=0,212), але по відношенню до I і II груп його вміст був достовірно зниженим відповідно на 31 % (р<0,001) і 20 % (р=0,027). Порівняння рівня ДА у групі пацієнтів із легким ступенем тяжкості псоріазу з рівнем у групі із середнім ступенем тяжкості статистично значущих відмінностей не виявило (р=0,055).
Таблиця 4.1 – Вміст ДОФА та його похідних у сечі хворих на псоріаз залежно від ступеня тяжкості (Ме [25 %; 75 %] або М±s)
| Показник | Група хворих | Контроль
(n=30) |
||
| I (n=35) | II (n=32) | III (n=30) | ||
| ДОФА, нмоль/добу | 188[93; 292]
*р=0,003 |
207[178; 225]
*р=0,002 **р=0,624 |
169±53,4*р<0,001 **р=0,144 #р=0,02 | 275±104 |
| ДА, нмоль/добу | 2845±769*р<0,001 | 2443±826*р=0,001
**р=0,055 |
1958[1415; 2717]
*р=0,212 **р<0,001 #р=0,027 |
1803[1064; 2330] |
| НА, нмоль/добу | 714±190*р<0,001 | 504[298; 610]
*р<0,001 **р<0,001 |
169[146; 245]
*р=0,008 **р<0,001 #р<0,001 |
269[195; 330] |
| А,
нмоль/добу |
88,4[49,5; 128]
*р<0,001 |
50,9[33,5; 66,1]
*р<0,001 **р<0,001 |
11,3[10,6; 17,1]
*р<0,001 **р<0,001 #р<0,001 |
22,2[17,5; 37,1] |
Примітка. * – порівняно з контролем; ** – порівняно з I групою хворих; # – порівняно з II групою хворих
Що стосується екскреції НА, то залежно від ступеня тяжкості псоріазу визначалася різноспрямована динаміка змін. У I групі пацієнтів спостерігалася виражена тенденція до підвищення рівня на 165 % (р<0,001) відносно контролю. Для II групи хворих була характерна аналогічна динаміка змін, але менш виражена: збільшення екскреції на 88 % (р<0,001) при порівнянні з контролем на фоні зниження на 29 % (р<0,001) при порівнянні з I групою. У разі тяжкого псоріазу, навпаки, виявлялося зниження (р=0,008) порівняно з контролем екскреції з сечею НА на 37 %. Достовірно значуще (р<0,001) зниженим рівень цього показника залишався й при порівнянні з I і II групами (на 76 % і 66 % відповідно). Аналогічна динаміка змін виявлена й для екскреції з сечею А: збільшення (р<0,001) відносно контролю в середньому в 4,0 разу у хворих I групи та 2,5 разу у хворих II групи на фоні зниження (р<0,001) майже в 2,0 разу в пацієнтів III групи. Для середнього ступеня тяжкості псоріатичного процесу рівень А сечі був статистично значуще зниженим на 42 % порівняно з легким ступенем. У пацієнтів із тяжким ступенем псоріазу (III група) вміст А залишався зменшеним (р<0,001) на 87 % і 78 % при порівнянні відповідно з пацієнтами I і II групи. Для визначення інтенсивності процесів синтезу та метаболізму катехоламінів на окремих етапах їх перетворень додатково розраховували співвідношення ДА/ДОФА, НА/ДА, А/НА та ДОФА/(ДА+НА+А) (табл. 4.2). У всіх групах спостерігалося статистично значуще (р<0,001) порівняно з контролем збільшення співвідношення ДА/ДОФА: на 98 % у випадку легкого ступеня псоріазу, 79 % – середнього та 81 % – тяжкого. Співвідношення ДА/ДОФА відображує відносну інтенсивність декарбоксилювання ДОФА з утворенням ДА в організмі. Тому отримані результати свідчать про прискорення синтезу катехоламінів на етапі ДОФА-ДА. Таблиця 4.2 – Співвідношення між вмістом катехоламінів та їх попередника ДОФА в сечі хворих на псоріаз залежно від ступеня тяжкості (Ме [25 %; 75 %] або М±s)
| Показник | Група хворих | Контроль(n=30) | ||
| I (n=35) | II (n=32) | III (n=30) | ||
| ДА/ДОФА, ум.од. | 13,2[10,2; 20,6]
*р<0,001 |
11,9[8,4; 18,7]
*р<0,001 **р=0,214 |
12,1[8,30;16,1]
*р<0,001 **р=0,14 #р=0,79 |
6,67[4,67; 8,07] |
| НА/ДА, ум.од. | 0,27±0,11*р<0,001 | 0,17[0,14; 0,28]
*р=0,35 **р=0,036 |
0,09[0,07; 0,14]
*р=0,002 **р<0,001 #р<0,001 |
0,14[0,11; 0,17] |
| А/НА, ум.од. | 0,13[0,07; 0,19]
*р=0,29 |
0,11[0,08; 0,15]
*р=0,49 **р=0,734 |
0,07[0,05; 0,09]
*р=0,046 **р=0,003 #р=0,005 |
0,10[0,06; 0,16] |
| ДОФА/(ДА+НА+А), ум.од. | 0,06±0,03*р<0,001 | 0,07[0,05; 0,11]
*р<0,001 **р=0,073 |
0,09±0,04*р<0,001 **р=0,009 #р=0,39 | 0,14±0,05 |
Примітка. * – порівняно з контролем; ** – порівняно з I групою хворих; # – порівняно з II групою хворих
У пацієнтів I групи визначено підвищення на 93 % (р<0,001) відносно контролю співвідношення НА/ДА. Така тенденція зберігалася й у II групі – збільшення на 21 %, але у загальній статистичній картині воно було недостовірним (р=0,35). Слід зазначити, що у хворих на псоріаз середнього ступеня тяжкості псоріатичного процесу (II група) співвідношення НА/ДА було зниженим (р=0,036) на 37 % у разі порівняння з хворими на псоріаз легкого ступеня тяжкості (I група). Співвідношення НА/ДА розцінюється як інтегральний показник швидкості гідроксилювання ДА з утворенням НА. Тому виявлене його підвищення при псоріазі з легким і середнім ступенем тяжкості може свідчити про прискорення синтезу катехоламінів на етапі ДА-НА. Для пацієнтів III групи визначалася протилежна динаміка змін: зниження співвідношення НА/ДА на 32 % (р=0,002) порівняно з контролем, а також на 65 % та 44 % – порівняно з I та II групами відповідно. Такі результати можуть свідчити про гальмування перетворення ДА на НА. Що стосується коефіцієнта А/НА, то, з одного боку, він може характеризувати процес метилювання НА з утворенням А, а з іншого боку – співвідношення активності гуморального та нервового компонентів симпато-адреналової системи, оскільки екскреція НА залежить переважно від його виділення симпатичними нервовими закінченнями, тоді як екскреція А зумовлена секрецією наднирниками. У I і II групах пацієнтів порівняно з контролем виявлено недостовірне підвищення коефіцієнта А/НА відповідно на 34 % і 13 % (р=0,29 і р=0,49), що, у свою чергу, може бути наслідком збільшення екскреції А. Такі результати вказують на деяку перевагу у хворих на псоріаз із легким і середнім ступенем тяжкості тонусу та реактивності гормональної ланки симпато-адреналової системи над нервовою. У III групі пацієнтів, навпаки, спостерігалося статистично значуще (р=0,046) відносно контролю зниження на 28 % співвідношення А/НА, яке було також достовірно зниженим й порівняно з I (на 46 %, р=0,003) і II (на 36 %, р=0,005) групами. Такий результат також свідчить про виражену дисоціацію в активності симпато-адреналової системи, а саме превалювання у хворих на псоріаз із тяжким ступенем тонусу нервової ланки над гормональною. Для співвідношення ДОФА/(ДА+НА+А) (відображує загальну секреторну активність симпато-адреналової системи) спостерігалося його поступове зниження при переході від легкого ступеня тяжкості псоріатичного процесу до тяжкого. Так, відносно контролю воно становило для I групи пацієнтів 57 % (р<0,001), II групи – 50 % (р<0,001), III групи – 36 % (р<0,001). Виявлена тенденція свідчить, що у хворих на псоріаз із легким ступенем тяжкості швидкість переходу ДОФА в катехоламіни більш виражена, ніж у хворих на псоріаз із тяжким ступенем. Підтвердженням висунутих припущень щодо стану симпато- адреналової системи у хворих на псоріаз залежно від ступеня тяжкості є результати вмісту в сечі кінцевих продуктів інактивації катехоламінів – ВМК та ГВК (табл. 4.3). Таблиця 4.3 – Вміст ВМК та ГВК у сечі хворих на псоріаз залежно від ступеня тяжкості (Ме [25 %; 75 %])
| Показник | Група хворих | Контроль(n=30) | ||
| I (n=35) | II (n=32) | III (n=30) | ||
| ВМК, мг/добу | 5,9 [3,8; 8,0]*р=0,004 | 6,85[4,75; 8,30]
*р<0,001 **р=0,145 |
3,7 [2,7; 5,1]*р=0,149
**р<0,001 #р<0,001 |
4,75[2,7; 5,6] |
| ГВК, мг/добу | 4,8 [3,0; 6,6]*р=0,09 | 5,55[4,15; 7,95]
*р=0,714 **р=0,072 |
7,0 [3,9; 8,8]*р=0,122
**р=0,006 #р=0,3 |
5,95[4,0; 7,7] |
Примітка. * – порівняно з контролем; ** – порівняно з I групою хворих; # – порівняно з II групою хворих
У I групі хворих спостерігалося підвищення (р=0,004) відносно контролю на 24 % рівня екскреції ВМК; для II групи пацієнтів воно було більш вираженим і становило в середньому 44 % (р<0,001). Порівняння вмісту цього показника при легкому ступені тяжкості псоріазу з вмістом при середньому ступені псоріазу статистично значущих відмінностей не виявило (р=0,145). У III групі хворих, навпаки, визначалася тенденція до незначного (лише на 22 %) порівняно з контролем зниження вмісту в сечі ВМК, яке у загальній статистичній картині було недостовірним (р=0,149). Але слід відзначити, що рівень цього показника залишався статистично значуще зменшеним на 37 % і 46 % порівняно з I і II групами відповідно. Підвищення екскреції ВМК при псоріазі з легким і середнім ступенем тяжкості вказує на посилення обмінних процесів, збільшення використання катехоламінів. Зниження екскреції ВМК при тяжкому ступені псоріазу свідчить про зниження обміну А та НА. Що стосується кінцевого продукту метаболізму ДА – ГВК, то для всіх груп його вміст у сечі знаходився у межах фізіологічної норми; статистично значущих відмінностей відносно контролю не виявлено. У загальній статистичній картині спостерігалася тенденція до достовірного (р=0,006) збільшення на 46 % екскреції ГВК із сечею у хворих III групи порівняно з екскрецією у хворих I групи. Цікавим було простежити динаміку змін з боку співвідношень, що відображають відносну інтенсивність утворення ВМК і ГВК. Розрахунок відношення вмісту ВМК до сумарного вмісту А та НА у I групі свідчив про його статистично значуще (р<0,001) порівняно з контролем зниження на 50 %, яке залишалося таким й по відношенню до II та III груп (38 % та 60 % відповідно) (табл. 4.4). Такі результати можуть опосередковано свідчити про відносне зниження катаболізму А та НА у хворих із легким ступенем псоріазу. У II групі пацієнтів для співвідношення ВМК/(А+НА) зберігалася тенденція до зниження (в середньому на 19 %) порівняно з контролем, але воно було недостовірним (р=0,352). Так як дезамінування є одним із шляхів швидкої інактивації катехоламінів, то його зниження забезпечує підвищення активності симпато-адреналової системи. У III групі хворих не виявлено змін з боку співвідношення ВМК/(А+НА) (р=0,193). Для відношення вмісту ГВК до вмісту ДА у пацієнтів із псоріазом легкого ступеня тяжкості (I група) також визначалося статистично значуще (р<0,001) порівняно з контролем зниження на 47 %. Це свідчить про відносне зниження катаболізму ДА (зокрема, дезамінування моноаміноксидазою) у цій категорії хворих. У II групі пацієнтів співвідношення ГВК/ДА також зменшувалося (р=0,046) на 34 % відносно контролю, залишаючись при цьому збільшеним (р<0,01) на 25 % по відношенню до I групи. У хворих із тяжким ступенем перебігу псоріазу (III група) змін з боку цього показника порівняно з контролем не виявлено, але слід відзначити статистично значуще (р<0,05) підвищення порівняно з I і II групами відповідно на 88 % і 50 %. Таблиця 4.4 – Співвідношення між вмістом ВМК, ГВК та катехоламінами в сечі хворих на псоріаз залежно від ступеня тяжкості (Ме [25 %; 75 %] або М±s)
| Показник | Група хворих | Контроль(n=30) | ||
| I (n=35) | II (n=32) | III (n=30) | ||
| ВМК/(А+НА), ум. од. | 0,008±0,003*р<0,001 | 0,013[0,01; 0,018]
*р=0,352 **р<0,001 |
0,02±0,01*р=0,193
**р<0,001 #р=0,027 |
0,016[0,009; 0,023] |
| ГВК/ДА,
ум. од |
0,0016[0,001; 0,002]
*р<0,001 |
0,002[0,0015; 0,0038]
*р=0,046 **р<0,01 |
0,003[0,002; 0,005]
*р=0,836 **р<0,001 #р=0,049 |
0,003[0,002; 0,006] |
Примітка: * – порівняно з контролем; ** – порівняно з I групою хворих; # – порівняно з II групою хворих
Отже, у хворих на псоріаз із легким і середнім ступенем тяжкості виявляються ознаки термінової адаптації з мобілізацією депо катехоламінів та довготривалої адаптації з підвищенням загальної секреторної активності симпато-адреналової системи. Відносне зниження резервів симпато-адреналової системи при переході від середнього до тяжкого ступеня псоріатичного процесу, більша вираженість гормонально-медіаторної дисоціації у бік нервової ланки, деяке роз’єднання метаболічних процесів свідчить про можливість виникнення дезадаптації.
4.2 Оцінка адаптивно-репаративних реакцій за вмістом компонентів вуглеводвмісних білків у сироватці крові та 17-оксикортикостероїдів у сечі хворих на псоріаз
Зміни активності симпато-адреналової системи можуть супроводжуватися значними змінами в обміні ГАГ і гексозамінів, що входять до складу протеогліканів. Представляло інтерес опосередковано через вміст вуглеводвмісних білків та їх компонентів у сироватці крові хворих оцінити ерготропні функції, що відповідають за адаптивні реакції в організмі. Практично всі білки плазми крові, крім альбумінів, належать до вуглеводвмісних, їх сумарна кількість може бути визначена за вмістом гексоз. У хворих I і II груп спостерігалося порівняно з контролем збільшення у сироватці крові вмісту загальних гексоз, пов’язаних із білками, відповідно на 45 % (р<0,001) і 27 % (р=0,002) (табл. 4.5). Порівняння рівня загальних гексоз у групі пацієнтів із легким ступенем тяжкості псоріазу з рівнем у групі із середнім ступенем тяжкості також виявило достовірні відмінності (р=0,013). Підвищення вмісту загальних гексоз, як правило, свідчить про активацію адаптаційно-репаративних реакцій організму. У хворих III групи, навпаки, відмічалося достовірне (р<0,001) відносно контролю зниження рівня загальних гексоз у середньому на 36 %, яке залишалося таким і порівняно з I і II групами відповідно на 56 % і 50 %.
Таблиця 4.5 – Вміст гексоз і сіалових кислот у сироватці крові хворих на псоріаз залежно від ступеня тяжкості (Ме [25 %; 75 %] або М±s)
| Показник | Група хворих | Контроль(n=30) | ||
| I (n=35) | II (n=32) | III (n=30) | ||
| Загальні
гексози, пов’язані з білками, г/л |
1,6[1,1; 1,8]
*р<0,001 |
1,4 [1,0; 1,6]*р=0,002
**р=0,013 |
0,7 [0,5; 1,0]*р<0,001 **р<0,001 #р<0,001 | 1,1 [0,9; 1,2] |
| Гексози ГАГ, г/л | 0,06±0,02*р<0,001 | 0,09[0,08; 0,13]
*р=0,002 **р<0,001 |
0,1 [0,09; 0,16]*р<0,001 **р<0,001 #р<0,001 | 0,08[0,06; 0,09] |
| Гексози ГП, г/л | 1,3[1,0; 1,5]
*р<0,001 |
1,2[0,9; 1,4]
*р=0,002 **р=0,129 |
0,65 [0,4; 0,9]*р<0,001 **р<0,001 #р<0,001 | 0,9[0,75; 1,1] |
| Гексози ГАГ/ гексози ГП,
ум.од. |
0,04[0,03; 0,06]
*р<0,001 |
0,09[0,06; 0,10]
*р=0,517 **р<0,001 |
0,20 [0,11; 0,25]*р<0,001 **р<0,001 #р<0,001 | 0,08±0,03 |
| Сіалові кислоти,
ммоль/л |
2,67[2,39; 3,28]
*р<0,001 |
3,49[3,05; 3,82]
*р<0,001 **р<0,001 |
4,81 [3,65; 6,3]*р<0,001 **р<0,001 #р<0,001 | 2,31[1,94; 2,58] |
Примітка. * – порівняно з контролем; ** – порівняно з I групою хворих; # – порівняно з II групою хворих
На фоні підвищення у сироватці крові загальних гексоз у пацієнтів з легким ступенем перебігу псоріатичного процесу (I група) визначалося по відношенню до контролю зниження (р<0,001) рівня гексоз, що входять до складу ГАГ, у середньому на 30 % (табл. 4.5). При цьому вміст гексоз, що входять до складу ГП, мав тенденцію до достовірного збільшення на 44 %. У хворих із середнім ступенем тяжкості псоріазу (II група) спостерігалася інша динаміка змін: достовірне (р=0,002) відносно контролю підвищення як вмісту гексоз у складі ГАГ (у середньому на 14 %), так і вмісту гексоз у складі ГП (у середньому на 33 %). Початок виникнення та вираженість репаративних процесів характеризувався, як правило, збільшенням рівня гексоз у складі ГП. Для хворих із тяжким ступенем псоріатичного процесу (III група) була характерна інша картина змін з боку цих показників: статистично значуще (р<0,001) порівняно з контролем підвищення гексоз у складі ГАГ (у середньому на 26 %) на фоні зниження гексоз у складі ГП (у середньому на 28 %). Слід відзначити, що у III групі рівень гексоз у складі ГАГ був статистично значуще (р<0,001) збільшеним порівняно з I і II групами пацієнтів, тоді як рівень гексоз, що входять до складу ГП, навпаки, зменшеним. У II групі для вмісту гексоз у складі ГАГ відмічалося достовірне (р<0,001) відносно I групи збільшення (в середньому на 58 %), тоді як для вмісту гексоз у складі ГП статистично значущих відмінностей при порівнянні з I групою не виявлено (р=0,129). При псоріазі легкого ступеня тяжкості, виходячи з отриманих даних, спостерігалося достовірне (р<0,001) відносно контролю зменшення на 50 % співвідношення гексози-ГАГ/гексози-ГП, а при псоріазі з тяжким ступенем, навпаки, суттєве збільшення на 150 %, яке залишалося таким і порівняно з I і II групами. Збільшення співвідношення гексози-ГАГ/гексози-ГП у разі тяжкого стану псоріазу переконливо свідчить про наявність деструктивних процесів у сполучнотканинних структурах, а зменшення у хворих на псоріаз із легким ступенем тяжкості – дезорганізаційних процесів. При псоріазі середнього ступеня тяжкості співвідношення практично не відрізнялося від контролю (р=0,517), що скоріше зумовлено односпрямованою тенденцією до збільшення у сироватці крові рівня гексоз у складі ГАГ і гексоз у складі ГП. Порівняння показників у хворих залежно від ступеня тяжкості псоріатичного процесу визначило поступове порівняно з контрольною групою пацієнтів збільшення (р<0,001) вмісту інших компонентів вуглеводвмісних білків – сіалових кислот відповідно на 16,5 % (при легкому ступені) та 108 % (при тяжкому ступені) (табл. 4.5). У формуванні адаптаційно-репаративних реакцій безпосередню участь бере й кора наднирників з її гуморальними продуктами ерготропного ряду – глюкокортикоїдами. Глюкокортикоїдну функцію кори наднирників оцінено за ступенем екскреції з сечею 17-ОКС. Результати свідчили, що у пацієнтів I і II груп вміст 17-ОКС статистично значуще (р<0,001) порівняно з контролем збільшувався в середньому відповідно на 32 % і 47 % (табл. 4.6). Порівняння значень показника у цих групах між собою не виявило будь-яких статистичних відмінностей (р=0,18). У хворих на псоріаз III групи, навпаки, спостерігалося достовірне (р=0,03) зниження рівня 17-ОКС у сечі відносно контролю в середньому на 27 %, а по відношенню до I і II груп – у середньому на 48 % (р<0,001). Слід відзначити, що у деяких пацієнтів рівень екскреції з сечею 17-ОКС знаходився у межах фізіологічної норми, але у загальній статистичній картині визначалася тенденція до зниження глюкокортикоїдної функції кори наднирників у міру розвитку псоріатичного процесу, що супроводжувався, як правило, зниженням адаптаційного потенціалу.
Отже, легкий та середній ступінь тяжкості псоріазу супроводжується посиленням функції кори наднирників, що підтверджується підвищенням у добовій сечі кількості 17-ОКС. При тяжкому псоріатичному процесі відбувається зменшення функціональних можливостей кори наднирників, на що вказує пониження екскреції 17-ОКС.
Таблиця 4.6 – Вміст 17-ОКС у сечі хворих на псоріаз залежно від ступеня тяжкості (Ме [25 %; 75 %] або М±s)
| Показник | Група хворих | Контроль(n=30) | ||
| I (n=35) | II (n=32) | III (n=30) | ||
| 17-ОКС, мкмоль/добу | 23,8±4,67*р<0,001 | 26,5[21,8; 28,5]
*р<0,001 **р=0,18 |
13,2[9,5; 19,4]
*р=0,03 **р<0,001 #р<0,001 |
18,1[16,0; 19,0] |
Примітка. * – порівняно з контролем; ** – порівняно з I групою хворих; # – порівняно з II групою хворих
4.3 Вміст медіаторів трофотропної системи
Стан трофотропної системи у хворих на псоріаз із різним ступенем тяжкості, перш за все, оцінювався за екскрецією з сечею одного із провідних її медіаторів – серотоніну. Результати свідчили про статистично значуще (р<0,004) порівняно з контролем збільшення рівня екскреції серотоніну в усіх групах хворих (табл. 4.7). У разі легкого ступеня псоріазу воно становило лише 26 %. При середньому ступені тяжкості псоріазу рівень серотоніну підвищувався більш виражено відносно контрольної групи пацієнтів – на 89 %, залишаючись при цьому достовірно (р<0,001) підвищеним на 50 % і порівняно з I групою. Для тяжкого ступеня хвороби відмічалося найбільш суттєве збільшення рівня екскреції з сечею серотоніну: на 137 % (р<0,001) порівняно з контролем, на 88 % (р<0,001) порівняно з легким ступенем тяжкості та 25 % (р=0,005) порівняно із середнім ступенем. Слід відзначити, що кількісні зміни рівня серотоніну в сечі корелювали з вираженістю клінічної симптоматики псоріатичних проявів у обстежених хворих. Результати щодо збільшення рівня екскреції серотоніну залежно від ступеня тяжкості можуть опосередковано свідчити про одночасну з обтяженням хвороби активацію трофотропних адаптаційно-компенсаторних реакцій. Таблиця 4.7 – Вміст серотоніну, 5-ОІОК та 6-СОМТ у добовій сечі хворих на псоріаз залежно від ступеня тяжкості (Ме [25 %; 75 %] або М±s)
| Показник | Група хворих | Контроль(n=30) | ||
| I (n=35) | II (n=32) | III (n=30) | ||
| Серотонін, мкмоль/добу | 1,2[0,9; 1,4]
*р=0,004 |
1,8[1,6; 2,05]
*р<0,001 **р<0,001 |
2,25 [1,7; 3,0]*р<0,001 **р<0,001 #р=0,005 | 0,95[0,7; 1,2] |
| 5-ОІОК, мкмоль/добу | 49,8[41,5; 58,5]
*р<0,001 |
44,7[28,7; 56,75]
*р<0,001 **р=0,202 |
36,6 [32,2; 45,7]*р<0,001 **р<0,001 #р=0,128 | 25,6[18,4; 35,5] |
| Серотонін/
5-ОІОК, ум.од. |
0,025±0,007*р<0,001 | 0,04[0,03; 0,06]
*р=0,288 **р<0,001 |
0,06 [0,048;0,078]*р=0,001
**р<0,001 #р=0,021 |
0,036[0,03; 0,06] |
| 6-СОМТ, нг/мл | 59,5[48,5; 70,8]
*р<0,001 |
53,3[43,9; 66,9]
*р=0,006 **р=0,135 |
31,9 [18,3; 44,2]*р<0,001 **р<0,001 #р<0,001 | 46,7[34,0; 54,2] |
Примітка. * – порівняно з контролем; ** – порівняно з I групою хворих; # – порівняно з II групою хворих
Основним механізмом інактивації серотоніну на периферії та у ЦНС є окислювальне дезамінування під впливом моноаміноксидази з утворенням 5‑ОІОК, яку розглядають як кінцевий продукт метаболізму серотоніну. Слід відзначити, що підвищення виділення серотоніну з сечею у хворих на псоріаз супроводжувалося підвищенням виведення 5-ОІОК. У хворих із легким перебігом псоріазу спостерігалося статистично значуще (р<0,001) відносно контрольної групи пацієнтів збільшення його вмісту в сечі в середньому на 95 % (табл. 4.7). При цьому рівень екскреції 5-ОІОК був збільшеним (р<0,001) і порівняно з III групою хворих майже на 37 %. У хворих із середнім ступенем тяжкості псоріатичного процесу вміст 5‑ОІОК також виявився збільшеним (р<0,001) порівняно з контролем у середньому на 75 %. Порівняння між собою розподілу цього показника у I і II групах пацієнтів статистично значущих відмінностей не виявило (р=0,202). У хворих із тяжким ступенем хвороби рівень екскреції з сечею кінцевого продукту метаболізму серотоніну був підвищеним (р<0,001) на 43 % відносно контрольної групи. Порівняння вмісту 5-ОІОК у хворих III групи зі вмістом у хворих II групи статистично значущих відмінностей не виявило (р=0,128). Для з’ясування динаміки змін процесів синтезу та окислювального дезамінування серотоніну розраховувався коефіцієнт співвідношення серотонін/5-ОІОК. У разі легкого ступеня тяжкості псоріазу спостерігалося статистично значуще (р<0,001) порівняно з контролем зниження коефіцієнта в середньому на 31 %, що свідчило про переважання процесів окислювального дезамінування серотоніну над його синтезом. При середньому ступені перебігу хвороби відзначалася деяка тенденція до збільшення коефіцієнта відносно контрольної групи, але воно було недостовірним (р=0,288); разом з тим, при цьому слід відзначити його статистично значуще збільшення на 60 % порівняно з легким ступенем тяжкості псоріатичного процесу (р<0,001) та зменшення на 33 % порівняно з тяжким перебігом (р=0,021). Отримані результати свідчать про деяке переважання процесу синтезу серотоніну над його дезамінуванням у разі середнього ступеня тяжкості псоріазу. У хворих III групи відзначалося відносно контролю суттєве підвищення коефіцієнта співвідношення серотонін/5-ОІОК – у середньому на 67 % (р=0,001), що чітко підтверджує переважання синтезу серотоніну над його окислювальним дезамінуванням. До метаболітів серотоніну належить мелатонін, який розглядають як гормон трофотропної системи. Продукцію мелатоніну у хворих на псоріаз було оцінено за добовою екскрецією з сечею його основного метаболіту – 6‑СОМТ (див. табл. 4.7). Спостерігалося статистично значуще (р<0,001) порівняно з контролем підвищення вмісту 6-СОМТ у сечі хворих I групи, що може бути пов’язано з підвищенням функціональної активності епіфіза. Аналогічна динаміка змін, але менш виражена, виявлялася й у II групі: збільшення рівня екскреції 6-СОМТ становило лише 14 % (р=0,006). Порівняння рівня 6-СОМТ у групі пацієнтів із легким ступенем тяжкості псоріатичного процесу з рівнем у групі з середнім ступенем тяжкості статистично значущих відмінностей не виявило (р=0,135). Для хворих III групи, навпаки, визначалося достовірне (р<0,001) зниження вмісту 6-СОМТ: на 32 % порівняно з контролем, на 46 % і 40 %, відповідно – порівняно з I і II групами. Останнє може бути пов’язано зі зниженням функціональної активності епіфіза в результаті тривалої активації. Одним з розповсюджених медіаторів трофотропної системи організму є гістамін, що утворюється при декарбоксилюванні амінокислоти гістидину. В обстежених хворих на псоріаз із різним ступенем тяжкості спостерігалися деякі порушення екскреції із сечею гістаміну та його попередника гістидину (табл. 4.8). У I групі у загальній статистичній картині відносно контролю простежувалася тенденція до недостовірного (р=0,088) збільшення рівня добової екскреції з сечею гістаміну (в середньому на 28 %) на фоні статистично значущого (р<0,001) збільшення рівня гістидину (в середньому на 80 %). Такі результати, ймовірно, відображують низький рівень інтенсивності декарбоксилювання гістидину з утворенням гістаміну у хворих із легким ступенем псоріазу. Таблиця 4.8 – Вміст гістаміну та його попередника гістидину у добовій сечі хворих на псоріаз залежно від ступеня тяжкості (Ме [25 %; 75 %] або М±s)
| Показник | Група хворих | Контроль(n=30) | ||
| I (n=35) | II (n=32) | III (n=30) | ||
| Гістамін, мкмоль/добу | 0,9 [0,6; 1,1]*р=0,088 | 1,7 [1,6; 1,9]*р<0,001 **р<0,001 | 2,4 [2,0; 2,9]*р<0,001 **р<0,001 #р<0,001 | 0,7 [0,5; 1,1] |
| Гістидин, мкмоль/добу | 1864[1706; 2396]
*р<0,001 |
1509[1192; 1807]
*р<0,001 **р<0,001 |
651[555; 704]
*р<0,001 **р<0,001 #р<0,001 |
1031±243 |
Примітка. * – порівняно з контролем; ** – порівняно з I групою хворих; # – порівняно з II групою хворих
У пацієнтів II групи спостерігалося порівняно з контролем суттєве зростання екскреції гістаміну (в середньому на 143 %, р<0,001) на фоні менш вираженого, ніж у I групі, збільшення екскреції гістидину (на 46 %, р<0,001). Слід відзначити, що рівень гістаміну в сечі при псоріазі із середнім ступенем тяжкості був статистично значуще (р<0,001) збільшеним майже на 90 % і порівняно з рівнем при псоріазі з легким ступенем тяжкості, тоді як рівень гістидину при цьому, навпаки, був достовірно зниженим (р<0,001) у середньому на 19 %. Отримані результати свідчать, що у хворих на псоріаз II групи відбувалося підвищення інтенсивності декарбоксилювання гістидину з утворенням гістаміну. У III групі хворих виявлялося найбільш суттєве підвищення (р<0,001) виведення з сечею гістаміну: в 3,4 разу відносно контролю, у 2,7 разу – по відношенню до I групи, в 1,4 разу – відносно II групи. Виявлені зміни у цій категорії хворих відбувалися на фоні статистично значущого (р<0,001) порівняно з контролем зниження рівня екскреції гістидину в середньому на 37 %. Вміст гістидину залишався достовірно зменшеним на 65 % і 57 % і порівняно з I і II групою відповідно. Такі результати переконливо свідчать про зростання тонусу гістамін-реактивної системи у разі тяжкого ступеня псоріазу. Коефіцієнт співвідношення рівня екскреції з сечею гістаміну до рівня екскреції серотоніну при легкому ступені псоріазу порівняно з контролем практично не змінювався (р=0,757) (табл. 4.9). Таблиця 4.9 – Співвідношення між вмістом гістаміну та серотоніну в сечі хворих на псоріаз залежно від ступеня тяжкості (Ме [25 %; 75 %] або М±s)
| Показник | Група хворих | Контроль (n=30) | ||
| I (n=35) | II (n=32) | III (n=30) | ||
| Гістамін/серотонін, ум.од. | 0,79±0,31*р=0,757 | 0,99±0,22*р=0,005
**р<0,001 |
0,98 [0,85; 1,47]*р=0,00164; **р<0,001 #р=0,29 | 0,81[0,62; 1,01] |
Примітка. * – порівняно з контролем; ** – порівняно з I групою хворих; # – порівняно з II групою хворих
При середньому та тяжкому ступенях псоріазу відбувалося незначне (лише на 24 %), але статистично значуще (р=0,005 і р=0,0016 відповідно) по відношенню до контролю збільшення коефіцієнта співвідношення гістамін/серотонін. Це опосередковано свідчить про деяке переважання гістамінреактивної системи над серотонінергічною. При цьому порівняння значення коефіцієнта співвідношення у групі пацієнтів із середнім ступенем тяжкості псоріатичного процесу з рівнем у групі з тяжким ступенем статистично значущих відмінностей не виявило (р=0,29).
* * *
На підставі результатів, наведених у даному розділі роботи, можна зробити наступні висновки.
1. Збільшення ступеня тяжкості псоріазу супроводжується посиленням дисфункції вегетативної нервової системи, що підтверджується активацією симпато-адреналових механізмів у хворих із легким ступенем тяжкості захворювання, превалюванням парасимпатичних регуляторних механізмів забезпечення гомеостатичної функції організму при тяжкому ступені дерматозу. Встановлені зміни активності симпатичного та парасимпатичного відділів нервової системи у хворих на псоріаз з різним ступенем тяжкості добре узгоджуються з розвитком запальних процесів.
2. При псоріазі відбувається дисоціація в активності ланок симпато-адреналової системи: для легкого та середнього ступеня тяжкості – превалювання тонусу та реактивності гормональної ланки над нервовою; для тяжкого, навпаки, нервової над гормональною. У хворих на псоріаз легкого і середнього ступенів тяжкості спостерігається прискорення синтезу та використання катехоламінів на етапах ДОФА-ДА, ДА-НА в поєднанні з підвищенням функціональної активності та резервних можливостей симпато-адреналової системи; порушення балансу між синтезом та інактивацією катехоламінів у бік відносного зниження катаболізму з утворенням ВМК і ГВК. У хворих на псоріаз тяжкого ступеня відбувається прискорення синтезу катехоламінів на етапі ДОФА-ДА на фоні зниження на етапі ДА-НА в поєднанні зі зниженою функціональною активністю та резервних можливостей симпато-адреналової системи, що є наслідком виснаження запасів катехоламінів.
3. Збільшення тяжкості псоріазу супроводжується виснаженням ерготропних функцій, пов’язаних з адаптаційно-репаративними реакціями, розвитком деструктивних і дезорганізаційних процесів у сполучнотканинних структурах, зниженням функціональних резервів кори наднирників, що опосередковано підтверджується збільшенням у сироватці крові рівня загальних гексоз, сіалових кислот, 17-ОКС при зниженні співвідношення гексози-ГАГ/гексози-ГП у хворих із легким і середнім ступенями тяжкості дерматозу; зниженням рівня загальних гексоз, 17-ОКС при підвищенні сіалових кислот, співвідношення гексози-ГАГ/гексози-ГП у випадках тяжкого ступеня хвороби.
4. Активація трофотропних функцій залежить від ступеня тяжкості дерматозу, що опосередковано підтверджується достовірним збільшенням екскреції з сечею серотоніну та гістаміну, їх похідних і попередників 5-ОІОК та гістидину, співвідношення гістамін/серотонін при легкому ступені порівняно з такими показниками у хворих з тяжким ступенем.
5. Отримані результати ставлять питання про своєчасну корекцію стану ерго- та трофотропних систем у хворих на псоріаз. Корекція рівня досліджуваних показників стану ерго- та трофотропних систем є патогенетично обґрунтованим і необхідним компонентом терапії псоріазу.
Результати досліджень розділу відображені в наступних публікаціях:
- Берегова А.А. Стан симпато-адреналової системи у хворих на псоріаз з різним ступенем тяжкості клінічного перебігу / А.А. Берегова // Дерматологія та венерологія. – 2015. – № 1 (67). – С. 20-26.
- Beregova A.A. Content of mediators of trophotropic systems at psoriatic patients with different degree of severity of clinical event / A.A. Beregova // Галицький лікарський вісник. – 2016. – Т. 23, № 1.– С. 11-14.
- Берегова А.А. Оцінка обміну катехоламінів у динаміці прогресування псоріазу / А.А. Берегова, А.М. Біловол // Вісник проблем біології і медицини. – 2015. – Вип. 2, Т. 1 (118). – С. 103-110.
- Вміст серотоніну та його похідних у сечі хворих на псоріаз з різним ступенем тяжкості / А.А. Берегова, А.М. Біловол, В.І. Жуков, С.О. Стеценко // Український журнал дерматології, венерології, косметології. – 2015. – № 2 (57). – С. 56-60.
- Береговая А.А. Оценка состояния адаптивно-репаративных реакций по содержанию компонентов углеводсодержащих белков в сыворотке крови больных псориазом различной степени тяжести / А.А. Береговая, А.Н. Беловол, С.А. Стеценко // Журнал Гродненского государственного медицинского университета. – 2015. – № 4. – С. 44-47.
- Берегова А.А. Вміст сіалових кислот у сироватці крові хворих на псоріаз / А.А. Берегова, А.М. Біловол // Людина та ліки – України : Міжнародний конгрес : тези доповідей, Київ, 10-11 вересня 2015 р. – К., 2015. – С. 5.
- Береговая А.А. Содержание серотонина в моче у больных псориазом с разной степенью тяжести клинического течения / А.А. Береговая // Ереванские дерматовенерологические чтения : I науч.-практ. междунар. конф. ассоциации дерматовенерологов Армении, Ереван, 22-23 мая 2015 г. – Ереван, 2015. – С. 83-84.
- Берегова А.А. Вміст гістаміну в сечі хворих на псоріаз з різним ступенем / А.А. Берегова // Актуальні питання косметології та дерматології : IХ Всеукр. наук.-практ. конф. з міжнар. участю : тези доповідей, Запоріжжя, 23-24 квітня 2015 р. – Запоріжжя, 2015. – C. 21.
- Берегова А.А. Вміст 17-оксикортикостероїдів у сечі хворих на псоріаз залежно від ступеня тяжкості клінічного перебігу / А.А. Берегова, А.М. Біловол // Сучасні проблеми дерматовенерології, косметології та управління охорони здоров´я: наук.-практ. конф. – Слобожанські читання, Харків, 26 березня 2015 р. : зб. наук. праць. – Х., 2015. – Вип. 12. – С. 97-102.
РОЗДІЛ 5
КОМПЛЕКСНА МЕДИКАМЕНТОЗНА КОРЕКЦІЯ ПОРУШЕНЬ СТАНУ ЕРГО- ТА ТРОФОТРОПНОЇ СИСТЕМ ПРИ ПСОРІАЗІ
РІЗНОГО СТУПЕНЯ ТЯЖКОСТІ
5.1 Обґрунтування комплексного методу лікування хворих на псоріаз із використанням метамаксу та кортексину
У зв’язку з поліетіологічною природою псоріазу на сьогодні відсутні надійні медикаментозні методи його лікування. Останнє спонукає дерматологів до розробки патогенетично обґрунтованованих методів терапії з урахуванням ступеня тяжкості псоріазу. На підставі проведених досліджень щодо порушень стану ерго- та трофотропної систем у хворих на псоріаз із різним ступенем тяжкості було запропоновано комплексну медикаментозну схему корекції. Її сенс полягає у доповненні стандартної схеми лікування псоріазу препаратами, що сприяють нормалізації функціонування симпато-адреналових і парасимпатичних регуляторних механізмів забезпечення гомеостатичної функції організму. Враховуючи різноманіття фармакологічних засобів корекції регуляторних і метаболічних процесів, а також той факт, що ці засоби не є препаратами першої лінії в лікуванні псоріазу, необхідним є ретельний підхід до їх вибору. Звичайно основними вимогами до засобів корекції є: доведений механізм дії, високий профіль безпеки, універсальність (можливість корекції порушених функцій декількох органів і систем), доступність курсу терапії. До таких препаратів-коректорів стану ерго- та трофотропної систем у обстежених хворих на псоріаз із різним ступенем тяжкості можна віднести метамакс і кортексин.
Препарат метамакс (3-(2,2,2-триметилгідразиній) пропіонату дигідрат), за даними наукових досліджень, має широкий спектр дії, зумовлений, перш за все, здатністю до покращення внутрішньоклітинного енергосинтезу незалежно від етіології та локалізації метаболічних порушень в ішемізованих тканинах [118, 193]. Провідними ланками механізму дії метамаксу є зниження інтенсивності окислення жирних кислот при ішемії, активація анаеробного шляху окислення глюкози, вмикання компенсаторних механізмів (шляхом пригнічення синтезу карнітину), індукція синтезу оксиду азоту, зниження опору периферичних судин, антиагрегантний ефект за рахунок впливу на тромбоцити [59]. Доведено, що псоріаз супроводжується каскадом біохімічних реакцій з вивільненням вазоактивних прозапальних речовин. Зокрема, підвищення рівня катехоламінів, здатних збільшувати агрегацію тромбоцитів і спричиняти стійку вазоконстрикцію, призводить до зниження мікроциркуляції, порушення живлення тканин, виснаження енергетичних ресурсів, виникнення гіпоксії та ішемії. За цих умов суттєву підтримку життєздатності зони ішемії можуть надати лікарські засоби метаболічної дії, що підвищують ефективне використання кисню, перемикаючи метаболізм на більш економний режим, захищаючи ішемізовану тканину від проявів оксидативного стресу. У зв’язку з цим доцільним є використання метамаксу. З іншого боку, ряд науковців розглядають метамакс як коректор функціонального дисбалансу вегетативної нервової системи, цей препарат сприяє підвищенню працездатності та зменшенню симптомів психічного перенапруження, покращує функціонування симпато-адреналових і парасимпатичних регуляторних механізмів [20, 68]. Саме останній аспект спонукає провести дослідження щодо ефективності його використання на фоні стандартної схеми лікування псоріазу. Можливість застосування метамаксу в терапевтичних схемах псоріазу може бути продиктована також його вираженим антиоксидантним ефектом. Доведено, що у патогенезі псоріазу особливе місце належить інтенсифікації процесів перекисного окислення ліпідів, окисної модифікації білків при зниженні антирадикальних і антиперекисних ресурсів [32, 169, 270]. Слід відзначити також проведення численних клінічних досліджень препарату (рандомізовані багатоцентрові плацебо-контрольовані дослідження, а також рандомізовані порівняльні дослідження), що дозволяють рекомендувати метамакс при різній патології. Найбільший досвід використання метамаксу накопичений при лікуванні різних форм ішемічної хвороби серця, однак останнім часом значно розширюється доказова база щодо використання препарату при ряді інших патологічних станів [259].
Кортексин є комплексом низькомолекулярних пептидів, який розглядають як коректор адаптаційно-репаративних процесів завдяки можливості регулювати вміст серотоніну, ДА, ГАМК, співвідношення між збуджувальними і гальмівними амінокислотами, чинити антиоксидантну та протизапальну дію, стимулювати репаративні та нейротрофічні процеси [37, 63, 120, 121, 144]. До складу кортексину входять L-амінокислоти, вітаміни (тіамін, рибофлавін, ніацин, ретинол, альфа-токоферол) та біогенні елементи (мідь, залізо, кальцій, магній, калій, натрій, сірка, фосфор, цинк, молібден, кобальт, марганець, селен, алюміній, літій). Вважається, що позитивні ефекти кортексину пов’язані не тільки з дією пептидів, а також з активністю вітамінів і біогенних елементів [106]. Попередніми дослідженнями виявлено виражену дисоціацію в активності ланок симпато-адреналової системи, виснаження ерготропних функцій, пов’язаних з адаптаційно-репаративними реакціями, розвиток деструктивних і дезорганізаційних процесів у сполучнотканинних структурах по мірі прогресування псоріазу, що дозволяє запропонувати для їх корекції кортексин у терапевтичній схемі.
Лікування проводилося у період 2013-2015 рр. у комплексі з традиційними методами згідно наказу МОЗ України від 08.05.2009 р. «Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання» додаванням препаратів-коректорів стану ерго- та трофотропної систем – вітчизняного препарату «Метамакс» (мельдоній, виробник «Дарниця) та препарату «Кортексин» (виробник ТОВ «Герофарм») протягом 21-24 діб.
У загальному плані запропонована комплексна медикаментозна схема лікування псоріазу наведена на рисунку 5.1.
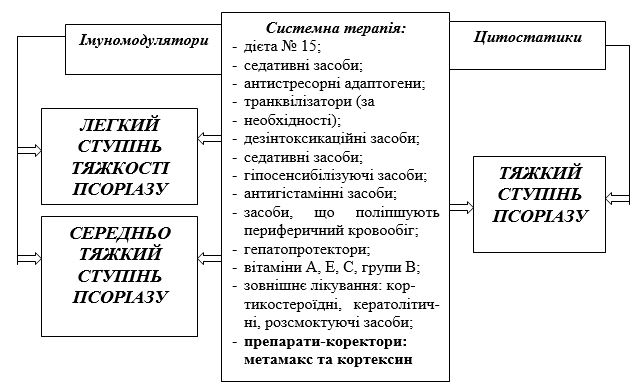
Рисунок 5.1 – Запропонована комплексна медикаментозна схема лікування обстежених хворих
Хворим до стандартної схеми лікування додавався протягом 21-24 діб метамакс (1 капсула 3 рази на добу) і протягом 10 діб кортексин (по 10 мг в 1-2 мл 0,5 % новокаїну, або води для ін’єкцій, або 0,9 % натрію хлориду, внутрішньом’язово, 1 раз на добу).
5.2 Визначення критеріїв чутливості показників стану ерго- та трофотропної систем у хворих на псоріаз
Для раціональної оцінки ефективності запропонованої медикаментозної корекції стану ерго- та трофотропної систем у обстежених хворих на псоріаз із різним ступенем тяжкості попередньо вважалося за доцільне виокремити з досліджуваних показників ті, які максимально відрізнялися від значень умовно-здорових осіб. Для цього використовувався критерій чутливості вибірки для кожного з показників. Для його розрахунку попередньо проводилося порівняння вибірок конкретного показника залежно від ступеня тяжкості псоріазу з вибіркою контролю. Значення, які надходили до інтервалу вибірки контролю, позначалися як η, а значення, які знаходилися поза межами вибірки контролю, – як θ. Чутливість показників розраховувалася за формулою: σ = η / (η + θ) · 100 %.
Виявлену динаміку змін показників обміну катехоламінів (ДОФА, ДА, А, НА, ВМК, ГВК) в сечі хворих залежно від ступеня тяжкості псоріазу можна представити на рисунках у вигляді «коробкових» графіків (рис. 5.2–5.7). Візуальний їх аналіз свідчить, що у разі легкого ступеня тяжкості хвороби (I група) розподіл кількісних даних щодо вмісту ДОФА та ГВК практично перетинався з контролем; у разі середнього ступеня тяжкості псоріазу (II група) – це характерно для ДОФА, а у випадках тяжкого ступеня псоріазу (III група) – для ДОФА, НА, А та ВМК. Практично не попадали в інтервал вибірки контролю, візуально за коробковими графіками, НА та А при псоріазі з легким ступенем тяжкості, з чого можна передбачати для них високий критерій чутливості. Інші випадки характеризувалися знаходженням частини даних поза інтервалу вибірки контролю.
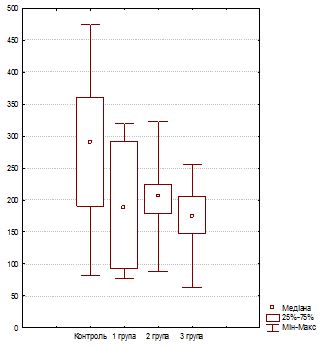
Рисунок 5.2 – Вміст у сечі ДОФА (нмоль/добу)
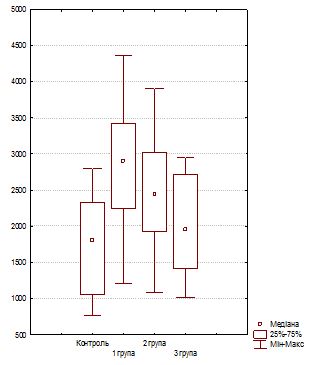
Рисунок 5.3 – Вміст у сечі ДА (нмоль/добу)
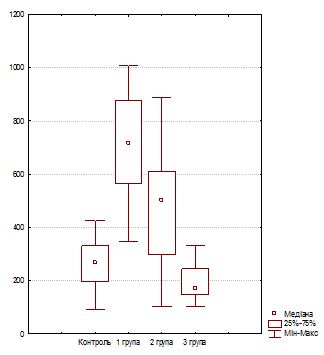
Рисунок 5.4 – Вміст у сечі НА (нмоль/добу)
Чутливість показників стану обміну катехоламінів у обстежених хворих на псоріаз залежно від ступеня тяжкості представлена в таблиці 5.1.
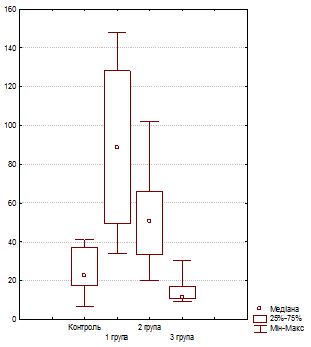
Рисунок 5.5 – Вміст у сечі А (нмоль/добу)
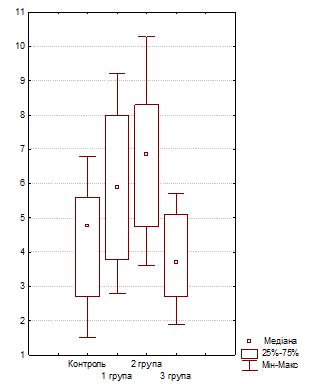
Рисунок 5.6 – Вміст у сечі ВМК (мг/добу)
Для I групи пацієнтів найбільш чутливими (якщо розташувати у порядку зменшення від 91,4 % до 57,1 %) були НА, А і ДА. Для II групи хворих найбільш чутливими виявилися А (65,6 %), НА (59,4 %) і ВМК (50 %). При тяжкому ступені псоріазу серед показників обміну катехоламінів практично не виявилося чутливих. Окремо слід підкреслити, що для цих показників характерно відхилення від контролю у бік збільшення.
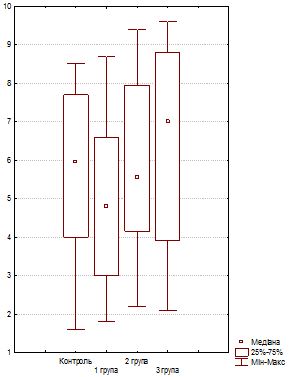
Рисунок 5.7 – Вміст у сечі ГВК (мг/добу)
Таблиця 5.1 – Чутливість (%) показників стану обміну катехоламінів у хворих на псоріаз залежно від ступеня тяжкості
| Показник | Група хворих | ||
| I | II | III | |
| ДОФА | 5,71 | 0 | 6,67 |
| ДА | 57,1 | 37,5 | 23,3 |
| НА | 91,4 | 59,4 | 0 |
| А | 80,0 | 65,6 | 0 |
| ВМК | 34,3 | 50,0 | 0 |
| ГВК | 2,86 | 18,8 | 26,7 |
В окремій серії у хворих на псоріаз із різним ступенем тяжкості ерготропні функції, що відповідають за адаптаційно-репаративні реакції, оцінювалися опосередковано через вміст у сироватці крові загальних гексоз, гексоз ГАГ, гексоз ГП і сіалових кислот, в сечі – 17-ОКС. Розподіл кількісних даних щодо вмісту цих показників у біологічних рідинах також представлено на рисунках у вигляді «коробкових» графіків (рис. 5.8–5.12). Візуальний їх аналіз свідчить, що у разі легкого ступеня тяжкості псоріазу (I група) інтервал вибірки для гексоз, що входять до складу ГП, практично перетинався з інтервалом контролю. Для інших показників стану адаптаційно-репаративних процесів розподіл кількісних даних такий, що частина з них входила до інтервалу контролю, а частина – перебувала за його межами. Для II групи візуальний аналіз «коробкових» графіків свідчить, що розподіл кількісних даних для гексоз ГП також практично співпадав із розподілом контролю. При цьому практично не попадали в інтервал вибірки контролю сіалові кислоти, з чого можна передбачати для них високий критерій чутливості. Інші випадки характеризувалися знаходженням частини даних поза інтервалом вибірки контролю. Для III групи пацієнтів розподіл кількісних даних був такий, що виходив за межі інтервалу контролю, особливо це виражено для сіалових кислот.
Розраховану чутливість показників стану адаптаційно-репаративних процесів у обстежених хворих на псоріаз залежно від ступеня тяжкості подано в таблиці 5.2.
Для легкого ступеня тяжкості псоріазу найбільш чутливими виявилися загальні гексози та 17-ОКС (62,9 %). Для середнього ступеня тяжкості хвороби найбільш чутливими (якщо розташувати у порядку зменшення від 100 % до 53,1 %) були сіалові кислоти, 17-ОКС і загальні гексози.
При тяжкому ступені псоріазу серед показників стану адаптаційно-репаративних процесів чутливим виявилися сіалові кислоти (96,8 %) і 17‑ОКС (56,7 %). Окремо слід підкреслити, що для загальних гексоз і сіалових кислот сироватки крові характерним було відхилення від контролю у бік збільшення, а для 17-ОКС сечі – у бік зменшення.
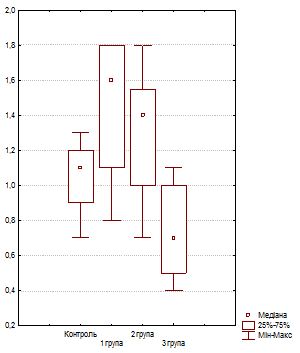
Рисунок 5.8 – Вміст у крові загальних гексоз, пов’язаних із білками (г/л)
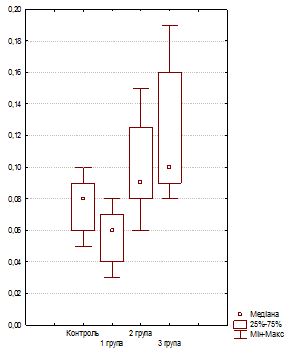
Рисунок 5.9 – Вміст у крові гексоз, що входять до складу ГАГ (г/л)
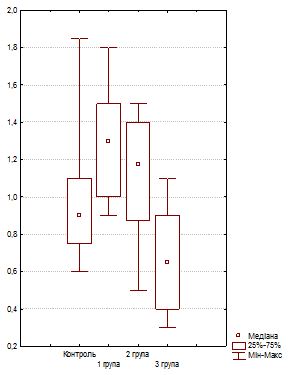
Рисунок 5.10 – Вміст у крові гексоз, що входять до складу ГП (г/л)
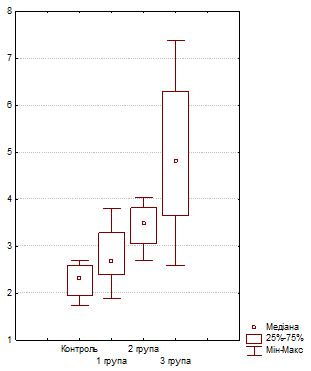
Рисунок 5.11 – Вміст у крові сіалових кислот (ммоль/л)
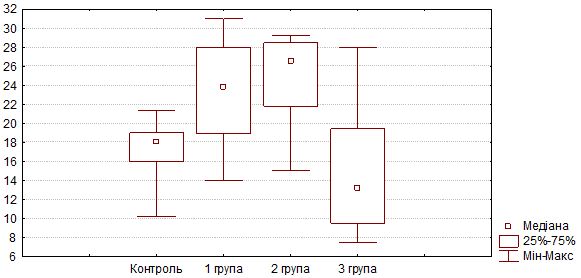
Рисунок 5.12 – Вміст у сечі 17-ОКС (мкмоль/добу)
Таблиця 5.2 – Чутливість (%) показників стану адаптивно-репаративних реакцій у хворих на псоріаз залежно від ступеня тяжкості
| Показник | Група хворих | ||
| I | II | III | |
| Загальні гексози | 62,9 | 53,1 | 43,3 |
| Гексози ГАГ | 25,7 | 31,3 | 43,3 |
| Гексози ГП | 0 | 3,13 | 36,7 |
| Сіалові кислоти | 48,6 | 100 | 96,8 |
| 17-ОКС | 62,9 | 75,0 | 56,7 |
Аналогічний аналіз проводився для показників стану трофотропної системи (серотонін, 5-ОІОК, гістидин, гістамін, 6-СОМТ) при псоріазі залежно від ступеня тяжкості. Візуальний аналіз «коробкових» графіків (рис. 5.13–5.17) свідчить, що практично не відрізнявся від контролю розподіл кількісних даних щодо вмісту в сечі гістаміну у разі легкого ступеня тяжкості хвороби. Практично не попадали в інтервал вибірки контролю гістидин при легкому ступені тяжкості псоріазу та гістамін – при середньому та тяжкому ступенях хвороби. Можна передбачати для цих медіаторів трофотропної системи високий критерій чутливості. Інші випадки характеризувалися знаходженням частини даних поза інтервалом вибірки контролю.
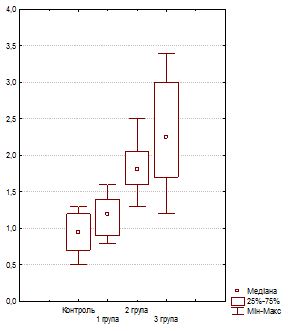
Рисунок 5.13 – Вміст у сечі серотоніну (мкмоль/добу)
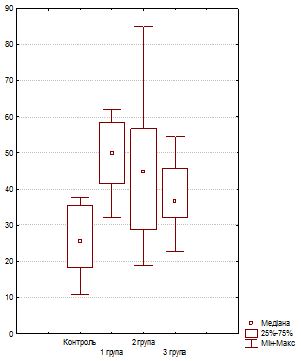
Рисунок 5.14 – Вміст у сечі 5-ОІОК (мкмоль/добу)
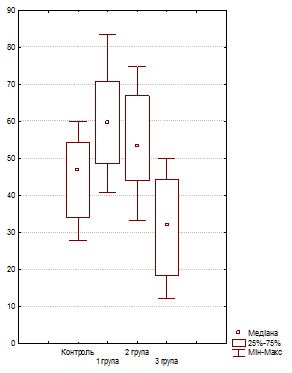
Рисунок 5.15 – Вміст у сечі 6-СОМТ (нг/мл)
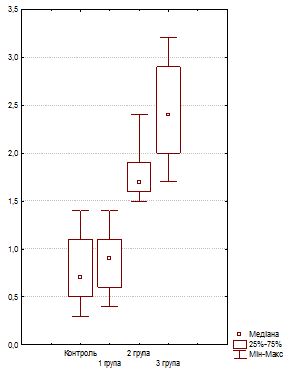
Рисунок 5.16 – Вміст у сечі гістаміну (мкмоль/добу)
Розраховану чутливість показників стану трофотропної системи в обстежених хворих на псоріаз залежно від ступеня тяжкості представлено в таблиці 5.3. Для I групи пацієнтів найбільш чутливими виявилися: гістидин (100 %) та 5-ОІОК (82,9 %). Для II групи хворих на псоріаз найбільш чутливими були гістамін (100 %), серотонін (93,8 %), 5-ОІОК (65,6 %) і гістидин (53,1 %). При тяжкому ступені псоріазу серед медіаторів трофотропної системи найбільш чутливими стали: гістамін (100 %) та серотонін (93,3 %). Слід зазначити, що для цих показників характерною була тенденція відхилення від контролю у бік збільшення.
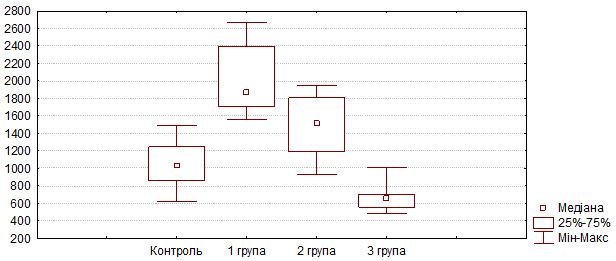
Рисунок 5.17 – Вміст у сечі гістидину (мкмоль/добу)
Таблиця 5.3 – Чутливість (%) показників стану трофотропної системи у хворих на псоріаз залежно від ступеня тяжкості
| Показник | Група хворих | ||
| I | II | III | |
| Серотонін | 31,4 | 93,8 | 93,3 |
| 5-ОІОК | 82,9 | 65,6 | 46,7 |
| 6-СОМТ | 48,6 | 37,5 | 36,7 |
| Гістамін | 0 | 100 | 100 |
| Гістидин | 100 | 53,1 | 40,0 |
Безпосередньо перед проведенням оцінки ефективності запропонованої комплексної медикаментозної корекції порушень стану ерго- та трофотропної систем при псоріазі з різним ступенем тяжкості відбиралися показники з максимальним критерієм чутливості, що узагальнено на рисунку 5.18.
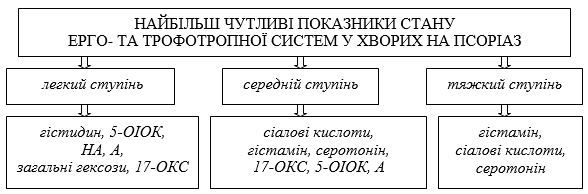
Рисунок 5.18 – Комплекс найбільш чутливих показників стану ерго- та трофотропної систем при псоріазі залежно від ступеня тяжкості.
Примітка: інформативна значущість показників становить більше, ніж 60 %
5.3 Оцінка ефективності комплексного медикаментозного лікування хворих на псоріаз за динамікою найбільш чутливих показників стану ерго- та трофотропної систем
Дослідження клінічної ефективності комплексного медикаментозного лікування хворих проводилося порівняльним методом за динамікою змін виявлених чутливих показників стану ерго- та трофотропної систем.
Хворих із легким ступенем тяжкості псоріазу (I група, n=35) розподілили на підгрупи: Ia – 17 пацієнтів, яким призначалася стандартна схема лікування; Iб – 18 пацієнтів, яким призначалася запропонована комплексна терапія. Динаміку змін найбільш чутливих показників стану ерго- та трофотропної систем для хворих обох підгруп залежно від характеру медикаментозного лікування наведено в таблиці 5.4.
Таблиця 5.4 – Показники стану ерго- та трофотропної систем у хворих на псоріаз із легким ступенем тяжкості до та після проведення медикаментозних терапевтичних заходів (Ме [25 %; 75 %] або М±s)
| Показник | Iа підгрупа (n=17) | Iб підгрупа (n=18) | Контроль | ||
| долікування | після стандартного лікування | долікування | післякомплексного лікування | ||
| Гістидин сечі, мкмоль/
добу |
2168[1717; 2456]
*р<0,001 |
1532[1324; 1732]
*р=0,0023 **р<0,001 |
1846[1703; 2264]
*р<0,001 |
1359[1045; 1656]
*р=0,039 **р<0,001 #р=0,056 |
1031±243 |
| 5-ОІОК сечі,
мкмоль/ добу |
47,3[44,9; 59,1]
*р<0,001 |
35,3±7,18*р=0,005
**р<0,001 |
49,3[41,5; 56,0]
*р<0,001 |
28,5[23,3; 30,2]
*р=0,37 **р<0,001 #р=0,006 |
25,6[18,4; 35,5] |
| НА сечі,
нмоль/ добу |
752±181*р<0,001 | 336[295; 407]
*р=0,001 **р<0,001 |
661[502; 876]
*р<0,001 |
310±65,5*р=0,077
**р<0,001 #р=0,028 |
269[195; 330] |
| А сечі, нмоль/
добу |
80,0[40,5; 129]
*р<0,001 |
36,1±8,82*р<0,001 **р<0,001 | 88,8±33,1*р<0,001 | 30,3±6,08*р=0,029
**р<0,001 #р=0,044 |
22,2[17,5; 37,1] |
| Загальні гексози сироватки крові, г/л | 1,6[1,2; 1,8]
*р<0,001 |
1,2[0,9; 1,4]
*р=0,053 **р<0,001 |
1,65[1,1; 1,7]
*р<0,001 |
0,9[0,7; 1,2]
*р=0,523 **р<0,001 #р=0,075 |
1,1[0,9; 1,2] |
| 17-ОКС сечі, мкмоль/ добу | 22,7±6,07*р=0,001 | 17,8[16,4; 20,0]
*р=0,387 **р=0,007 |
23,7±4,59*р<0,001 | 17,9[15,9; 20,0]
*р=0,58 **р<0,001 #р=0,499 |
18[16; 19] |
Примітка. * – порівняно з контролем; ** – порівняно з показниками до лікування; # – порівняно зі стандартною схемою лікування
У пацієнтів Iа підгрупи до проведення терапевтичних заходів спостерігалося збільшення (р≤0,001) відносно контролю рівня А (у середньому на 261 %), НА (на 180 %), гістидину (на 110 %), 5-ОІОК (на 85 %), загальних гексоз (на 45 %) та 17-ОКС (на 26 %). Після застосування цими пацієнтами стандартної схеми відмічалася статистично значуща (р≤0,007) порівняно з показниками до лікування динаміка змін цих показників, а саме: зниження А та НА в середньому на 55 %, гістидину – на 29 %, 5-ОІОК і загальних гексоз – на 25 %, 17-ОКС – на 22 %. Порівняння показників після стандартного лікування з показниками контрольної групи свідчило про достовірно збільшений вміст А (р<0,001), гістидину (р=0,0023), 5-ОІОК (р=0,005) і НА (р=0,001) відповідно на 63 %, 48 %, 38 % і 25 %. Рівень загальних гексоз і 17-ОКС при цьому практично дорівнював значенням контролю (р=0,053 і р=0,387). У хворих Iб підгрупи до використання запропонованого комплексного медикаментозного лікування також відзначалося підвищення (р<0,001) порівняно з контролем рівня А (в середньому на 301 %), НА (на 146 %), 5‑ОІОК (на 93 %), гістидину (на 79 %), загальних гексоз (на 50 %) та 17-ОКС (на 32 %). Після проведення комплексного терапевтичного заходу спостерігалося статистично значуще зниження (р<0,001) порівняно з показниками до лікування вмісту А в середньому на 65 %, НА – на 53 %, гістидину – на 26 %, 5-ОІОК – на 42 %, загальних гексоз – на 45 % та 17-ОКС – на 24 %. Якщо таку динаміку змін порівняти з контролем, то рівень гістидину та А залишався достовірно підвищеним (р=0,039 та р=0,029) відповідно на 32 та 37 %, а вміст інших показників практично дорівнював значенням контролю. Відносно стандартної терапевтичної схеми відзначалося статистично значуще зниження екскреції з сечею 5-ОІОК (р=0,006), НА (р=0,028), А (р=0,044). При порівнянні стандартної та запропонованої комплексної схем лікування між собою не визначалося достовірних відмінностей з боку рівня гістидину (р=0,056), загальних гексоз (р=0,075), 17-ОКС (р=0,499). Результати, отримані після використання метамаксу і кортексину у стандартній схемі лікування, свідчили про більш виражене покращення стану ерго- та трофотропної систем, ніж при відсутності цих препаратів, та тенденцію наближення їх показників до контрольних значень. Динаміку змін вмісту чутливих показників стану ерго- та трофотропної систем у хворих на псоріаз із легким ступенем тяжкості до та після проведення терапевтичних заходів у відсотковому відношенні до контролю відображено на рисунку 5.19.
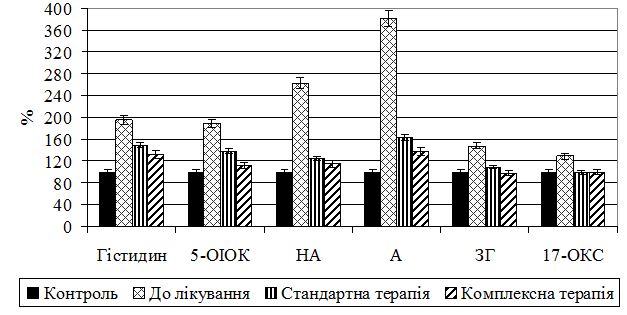
Рисунок 5.19 – Динаміка змін чутливих показників стану ерго- та трофотропної систем до та після медикаментозного лікування хворих на псоріаз із легким ступенем тяжкості.
Примітка: вміст у контрольній групі прийнятий за 100 %; ЗГ – загальні гексози
Аналогічно хворих із середнім ступенем тяжкості псоріазу (II група, n=32) розподілили на підгрупи: IIa – 16 пацієнтів, яким призначалася стандартна схема лікування; IIб – 16 пацієнтів, яким призначалася запропонована комплексна схема (табл. 5.5). До проведення медикаментозних заходів в обох підгрупах спостерігалося статистично значуще (р≤0,014) відносно контролю збільшення у біологічних рідинах рівня гістаміну (в середньому на 150 %), А (на 126 %), серотоніну (на 92 %), 5-ОІОК (на 80 %), сіалових кислот (у середньому на 49 %) та 17-ОКС (на 46 %). Використання пацієнтами IIа підгрупи стандартної схеми лікування призвело до достовірного (р<0,001) зниження порівняно з до проведення терапевтичних заходів вмісту А в середньому на 33 %, гістаміну, 17-ОКС і 5‑ОІОК – на 23 %, сіалових кислот – на 15 %. Але по відношенню до контрольної групи рівень цих показників залишався статистично значуще (р≤0,039) підвищеним: у середньому на 86 % для гістаміну, на 46 % для 5‑ОІОК і А, на 26 % для сіалових кислот і серотоніну, на 13 % для 17-ОКС. Таблиця 5.5 – Показники стану ерго- та трофотропної систем у хворих на псоріаз з середнім ступенем тяжкості до та після проведення медикаментозних терапевтичних заходів (Ме [25 %; 75 %] або М±s)
| Показник | IIа підгрупа (n=16) | IIб підгрупа (n=16) | Конт-роль | ||
| долікування | після стандартного лікування | долікування | післякомплексного лікування | ||
| 1 | 2 | 3 | 4 | 5 | 6 |
| Сіалові кислоти сироватки крові, ммоль/л | 3,37[2,98; 3,76]
*р<0,001 |
2,87[2,36; 3,16]
*р=0,001 **р<0,001 |
3,51[3,14; 3,82]
*р<0,001 |
2,50[1,92; 2,87]
*р=0,344 **р<0,001 #р=0,048 |
2,31[1,94; 2,58] |
| Гістамін сечі, мкмоль/
добу |
1,7[1,6; 1,9]
*р<0,001 |
1,30±0,28*р<0,001 **р<0,001 | 1,81±0,27*р<0,001 | 1,12±0,35*р=0,005
**р<0,001 #р=0,142 |
0,7[0,5; 1,1] |
| Серотонін сечі, мкмоль/
добу |
1,74±0,33*р<0,001 | 1,21±0,38*р=0,039
**р<0,001 |
1,90[1,65; 2,31]
*р<0,001 |
1,11±0,40*р=0,294
**р<0,001 #р=0,474 |
0,95[0,70; 1,20] |
Продовження таблиці 5.5
| 1 | 2 | 3 | 4 | 5 | 6 |
| 17-ОКС сечі, мкмоль/
добу |
25,4[19,9; 27,4]
*р<0,001 |
20,4[16,8; 21,5]
*р=0,012 **р<0,001 |
27,2[24,4; 29,0]
*р<0,001 |
19,6[17,6; 21,8]
*р=0,055 **р<0,001 #р<0,001 |
18[16; 19] |
| 5-ОІОК сечі,
мкмоль/ добу |
50,3[27,3; 59,3]
*р<0,001 |
37,6[25,1; 42,7]
*р=0,009 **р<0,001 |
41,4[29,8; 55,0]
*р<0,001 |
30,1[24,3; 32,0]
*р=0,217 **р<0,001 #р=0,101 |
25,6[18,4; 35,5] |
| А сечі, нмоль/
добу |
47,9[31,8; 60,1]
*р<0,001 |
32,0[28,5; 40,5]
*р<0,001 **р<0,001 |
52,1[38,3; 71,7]
*р=0,014 |
26,4[21,2; 31,5]
*р<0,001 **р<0,001 #р=0,027 |
22,2[17,5; 37,1] |
Примітка. * – порівняно з контролем; ** – порівняно з показниками до лікування; # – порівняно зі стандартною схемою лікування
У підгрупі IIб, де застосовувалася комплексна терапевтична схема, виявлена більш виражена тенденція наближення показників до контролю. Не виявлено достовірної різниці при порівнянні з контролем для сіалових кислот (р=0,344), серотоніну (р=0,294), 17-ОКС (р=0,055) та 5-ОІОК (р=0,217). При цьому, по відношенню до контролю статистично значуще підвищеним залишався рівень у сечі гістаміну (в середньому на 57 %, р=0,005) та А (на 19 %, р<0,001). Відносно показників до лікування відзначалося зниження (р<0,001) сіалових кислот, 17-ОКС і 5-ОІОК у середньому на 28 %, А – на 49 %, гістаміну та серотоніну – на 41 %. Порівняння стандартної та запропонованої комплексної схем лікування між собою не виявило достовірних відмінностей з боку рівня гістаміну (р=0,142), серотоніну (р=0,474) та 5-ОІОК (р=0,101). Запропоноване комплексне медикаментозне лікування з використанням метамаксу та кортексину, виходячи з аналізу отриманих даних, сприяє більш вираженій корекції порушень стану ерго- та трофотропної систем у хворих на псоріаз із середнім ступенем тяжкості, ніж традиційна терапевтична схема (рис. 5.20).
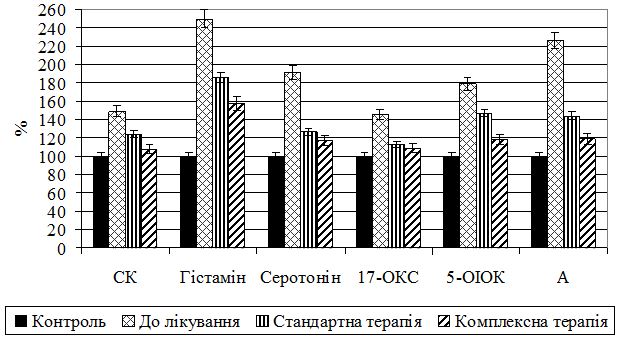
Рисунок 5.20 – Динаміка змін чутливих показників стану ерго- та трофотропної систем до та після медикаментозного лікування хворих на псоріаз із середнім ступенем тяжкості.
Примітка: вміст у контрольній групі прийнятий за 100 %; СК – сіалові кислоти
Аналогічно хворих з тяжким ступенем псоріазу (III група, n=30) розподілили на підгрупи: IIIa – 15 пацієнтів, яким призначалася стандартна схема лікування; IIIб – 15 пацієнтів, яким призначалася запропонована комплексна схема (табл. 5.6).
У пацієнтів IIIа підгрупи до проведення терапевтичних заходів спостерігалося збільшення (р<0,001) відносно контролю рівня гістаміну (в середньому на 243 %), сіалових кислот (на 70 %) та серотоніну (на 143 %). Після застосування пацієнтами цієї підгрупи стандартної схеми відмічалася статистично значуща (р<0,001) порівняно з показниками до лікування динаміка змін цих показників: зниження гістаміну в середньому на 29 %, серотоніну – на 26 %, сіалових кислот – лише на 11 %. При цьому при порівнянні з контрольною групою вміст цих показників залишався достовірно збільшеним відповідно на 143 %, 79 % і 52 %. Таблиця 5.6 – Показники стану ерго- та трофотропної систем у хворих на псоріаз із тяжким ступенем до та після лікування (Ме [25 %; 75 %] або М±s)
| Показник | IIIа підгрупа (n=15) | IIIб підгрупа (n=15) | Контроль | ||
| до лікування | Після стандартного лікування | до лікування | після комплексного лікування | ||
| Гістамін сечі, мкмоль/
добу |
2,40±0,44*р<0,001 | 1,71±0,54*р<0,001 **р<0,001 | 2,4[1,9; 2,9]
*р<0,001 |
1,3[1,0; 2,0]
*р<0,001 **р<0,001 #р=0,147 |
0,7[0,5; 1,1] |
| Сіалові кислоти сироватки крові, ммоль/л | 3,93
[3,51; 6,62] *р<0,001 |
3,50
[2,77; 5,46] *р=0,001 **р<0,001 |
5,13
[4,29; 6,30] *р<0,001 |
2,78
[2,18; 3,57] *р=0,003 **р<0,001 #р=0,093 |
2,31
[1,94; 2,58] |
| Серотонін сечі, мкмоль/
добу |
2,31±0,66
*р<0,001 |
1,7
[1,2; 2,0] *р<0,001 **р<0,001 |
2,3
[1,7; 3,0] *р<0,001 |
1,51±0,78
*р=0,05 **р<0,001 #р=0,384 |
0,95
[0,7; 1,2] |
Примітка. * – порівняно з контролем; ** – порівняно з показниками до лікування; # – порівняно зі стандартною схемою лікування
У хворих IIIб підгрупи до використання запропонованого комплексного медикаментозного лікування також відзначалося підвищення (р<0,001) порівняно з контролем рівня гістаміну (в середньому на 243 %), серотоніну (на 142 %) та сіалових кислот (на 122 %). Після проведення терапевтичних заходів з використанням метамаксу та кортексину спостерігалося зниження (р<0,001) порівняно з показниками до лікування вмісту гістаміну та сіалових кислот у середньому на 46 %, а серотоніну – на 35 %. Якщо таку динаміку змін порівняти з контролем, то рівень гістаміну, серотоніну та сіалових кислот залишався достовірно підвищеним (р≤0,05) відповідно на 86 %, 58 % і 20 %. При порівнянні стандартної та запропонованої схем лікування між собою не визначалося достовірних відмінностей для всіх досліджуваних показників. Результати, отримані після використання комплексної схеми, також свідчили про більш виражене покращення стану ерго- та трофотропної систем, ніж після стандартної (рис. 5.21).
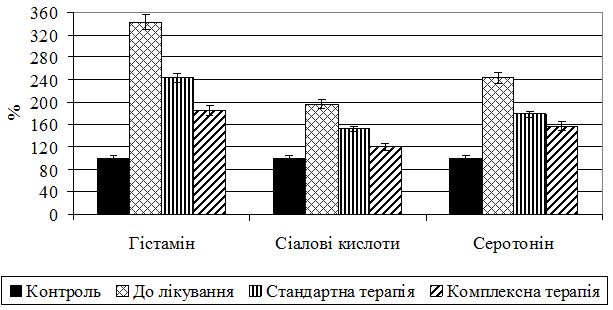
Рисунок 5.21 – Динаміка змін чутливих показників стану ерго- та трофотропної систем до та після медикаментозного лікування хворих на псоріаз із тяжким ступенем.
Примітка: вміст у контрольній групі прийнятий за 100 %
5.4 Оцінка клінічної ефективності патогенетичної корекції
У процесі лікування хворих проводився також диференційований аналіз динаміки клінічних проявів псоріазу за термінами повного або часткового розв’язання об’єктивних і суб’єктивних симптомів хвороби, а також за індексом PASI. Ефективність терапії оцінювали за процентним зменшенням PASI. Загальноприйнятими є критерії PASI50, PASI75, PASI90, що відповідають зниженню індексу на 50 %, 75 % і 90 % відповідно. Зниження індекса на 75 % і більше в результаті лікування вважалося показником досягнення адекватного терапевтичного ефекту. Крім того, для оцінки ефективності патогенетичної корекції враховувалися також наступні критерії: клінічне видужання – повне розв’язання основних об’єктивних і суб’єктивних ознак псоріазу з можливими наслідками у вигляді де- або гіперпігментації шкіри на місцях раніше існуючих осередків; значне покращення – повне розв’язання ознак псоріазу в більшості висипань, але деякі з елементів повністю не розв’язувалися (залишалися незначна еритема та інфільтрація), загальна площа ураженої шкіри зменшилася з 45–50 % до 13–15 % (більш ніж у 3 рази), індекс PASI знизився на 75 %; покращення – загальна площа ураженої шкіри зменшилася з 45–50 % до 23–25 % (майже в 2 рази), в осередках ураження зберігалася помірно виражена еритема, інфільтрація, зниження числового індекса порівняно з вихідним на 50 %; відсутність ефекту – істотних змін у стані хвороби не відбулося [2].
Еволюція основних дерматологічних симптомів звичайного псоріазу під впливом терапії відбувалася в різні терміни. Так, хворі Іа підгрупи зникнення свербежу відзначали наприкінці першого тижня після початку терапії, хворі ІІа підгрупи – у середньому через 8–9 днів, а хворі ІІІа підгрупи – майже через 12 днів. Лущення зменшувалося майже на 10-й день лікування у хворих Іа підгрупи і через 13 та 15 днів – у хворих ІІа та ІІІа підгруп відповідно.
Середні терміни розв’язання інфільтрації в Іа, ІІа та ІІІа підгрупах відзначалися на 11-й, 12-й та 17-й день, а зникнення еритеми – на 10-й, 12-й і 16-й день відповідно. Приблизно у ці терміни спостерігався регрес висипів на шкірі, псоріатичні бляшки починали уплощатися в центрі або по периферії, навколо більшості елементів формувався псевдоатрофічний обідок Воронова, а забарвлення елементів у той же термін ставало менш яскравим. В окремих випадках у процесі лікування хворих, які мали ознаки прогресуючої стадії, забарвлення бляшок незначно змінювалося у бік застійного кольору. «Обідок Воронова» у хворих зменшувався, але у деяких випадках відзначалася поява нових елементів із збереженням вираженою інфільтрації.
У хворих на псоріаз, які одержували комплексну запропоновану схему лікування, спостерігалося значне послаблення або зникнення свербежу: в Іб підгрупі в середньому через 5 днів, ІІб підгрупі – через 6 днів, ІІІб підгрупі – через 9 днів, що майже на 2-3 дні раніше, ніж у хворих при традиційній схемі лікування.
Припинення лущення відзначалося в підгрупах Іб, ІІб, ІІІб на 8-й, 10-й, 12-й день, розв’язання інфільтрації у цих же підгрупах реєструвалося на 8-й, 10-й, 14-й день, а зникнення еритеми – на 8-й, 10-й та 14-й день відповідно. При цьому у клінічній картині спостерігалися позитивні зміни. Відзначалося сплощення бляшок, зменшення інтенсивності та яскравості кольору елементів, поява псевдоатрофічного «обідка Воронова» по їх периферії, виражене лущення та наявність на деяких з них чешуйко-корок, а також початок регресу елементів із середини бляшок. Суб’єктивно зменшувалося відчуття стягування шкіри, втихали прояви свербежу.
У Іа, ІІа та ІІІа підгрупах хворих розв’язання основних дерматологічних симптомів реєструвалося у середньому на 2-3 дні пізніше, ніж у Іб, ІІб та IІІб підгрупах хворих відповідно.
Наприкінці лікування відмічалося зниження індекса PASI у підгрупах хворих із традиційною схемою лікування, але більш виражено – у хворих із запропонованою комплексною схемою корекції порушень ерго- та трофотропної систем (табл. 5.7).
Таблиця 5.7 – Динаміка змін індекса PASI до та після лікування хворих на псоріаз (М±s)
| Іа підгрупа,n=17 | Іб підгрупа,n=18 | ІІа підгрупа,n=16 | ІІб підгрупа,n=16 | ІІІа підгрупа,n=15 | ІІІб підгрупа,n=15 | |
| До лікування | 7,22±1,78 | 7,24±2,40 | 19,16±3,76 | 17,8±5,42 | 36,4±6,04 | 33,2±1,61 |
| Після лікування | 2,69±1,69 | 1,31±1,38 | 7,13±5,07 | 4,9±3,83 | 21,6±6,86 | 11,4±7,41 |
Індекс PASI знизився істотніше у пацієнтів, які одержували комплексну запропоновану схему лікування: Іб підгрупи – з (7,24±2,40) до (1,31±1,38) бала, ІІб підгрупи – з (17,8±5,42) до (4,9±3,83) бала, ІІІб підгрупи – з (33,2±1,61) до (11,4±7,41) бала. При цьому у хворих, які отримували традиційну терапію, індекс PASI у Іа підгрупи знизився з (7,22±1,78) до (2,69±1,69) бала, ІІа підгрупи – з (19,16±3,76) до (7,13±5,07) бала, ІІІа підгрупи – з (36,4±6,04) до (21,6±6,86) бала.
Відзначено позитивну динаміку зниження індекса PASI у хворих із легким ступенем псоріазу Іб підгрупи на 81,9 % проти Іа підгрупи на 62,7 %, із середньотяжким ІІб підгрупи на 72,5 % проти ІІа підгрупи на 62,8 % та з тяжким ІІІб підгрупи на 65,7 % проти ІІІа підгрупи на 40,7 %.
Хворі Іб підгрупи, які одержували комплексну схему лікування, мали більш позитивні результати: у 8 (44,4 %) осіб наприкінці курсу лікування настало клінічне одужання, у 7 (38,9 %) – значне покращення, у 3 (16,7 %) – покращення та жодного хворого, для якого терапія була неефективною (табл. 5.8). Для порівняння – у Іа підгрупі клінічне одужання настало у 2 (11,8 %) пацієнтів, значне покращення і покращення – відповідно у 7 (41,2 %) і 6 (35,3 %) хворих, у 2 (11,8 %) пацієнтів ефект був відсутній.
У пацієнтів ІІа підгрупи, які отримували традиційну терапію, терапевтичний ефект досягався у більш пізні терміни, а результати були менш значущими: клінічне одужання настало у 3 (18,8 %) пацієнтів, значне покращення і покращення – відповідно у 6 (37,5 %) і 4 (25 %) хворих, у 3 (18,8 %) пацієнтів ефект був відсутній. При цьому у хворих ІІб підгрупи, які приймали метамакс та кортексин на фоні традиційної терапевтичної схеми, ефект був більш виражений: 4 (25 %) хворих із клінічним одужанням, 7 (43,8 %) хворих зі значним покращенням, 4 (25 %) хворих з покращенням і 1 (6,2 %) хворий з відсутністю ефекту. У ІІІа підгрупі з традиційною терапією клінічного одужання не настало у жодного пацієнта, значне покращення і покращення – відповідно у 2 (13,3 %) і 5 (33,3 %) хворих, у 8 (53,3 %) пацієнтів ефект був відсутній. У свою чергу пацієнти ІІІб підгрупи мали наступні результати: клінічне одужання виявилося у 3 (20 %) пацієнтів, значне покращення і покращення – по 5 (33,3 %) хворих, у 2 (13,3 %) пацієнтів ефект був відсутній.
Таблиця 5.8 – Результати лікування хворих
| Резуль-тати ліку- вання |
Хворі на псоріаз | |||||||||||||||
| І, n = 35 | ІІ, n = 32 | ІІІ, n = 30 | Разом | |||||||||||||
| Іа,n=17 | Іб,n=18 | ІІa,n=16 | ІІб,n=16 | ІІІа,n=15 | ІІІб,N=15 | Група а,n = 48 | Група б,n = 49 | |||||||||
| абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | Абс. | % | абс. | % | абс. | % | |
| Клінічне одужання | 2 | 11,8 | 8 | 44,4 | 3 | 18,8 | 4 | 25 | – | – | 3 | 20 | 5 | 10,4 | 10 | 20,4 |
| Значне
покра-щення |
7 | 41,2 | 7 | 38,9 | 6 | 37,5 | 7 | 43,8 | 2 | 13,3 | 5 | 33,3 | 15 | 31,3 | 20 | 40,8 |
| Покра-щення | 6 | 35,3 | 3 | 16,7 | 4 | 25 | 4 | 25 | 5 | 33,3 | 5 | 33,3 | 15 | 31,3 | 16 | 32,7 |
| Без ефекту | 2 | 11,8 | – | – | 3 | 18,8 | 1 | 6,2 | 8 | 53,3 | 2 | 13,3 | 13 | 27 | 3 | 6,1 |
| Всього | 17 | 100 | 18 | 100 | 16 | 100 | 16 | 100 | 15 | 100 | 15 | 100 | 48 | 100 | 49 | 100 |
Віддалені результати лікування оцінювалися шляхом спостереження за хворими протягом півтора року після закінчення терапії. Дані отриманих результатів показали, що стосовно виникнення рецидиву хворі, які одержували комплексну запропоновану схему лікування, мали більш позитивні результати. Так, у разі легкого ступеня тяжкості хвороби рецидиви дерматозу у хворих Ia підгрупи, яким призначалася стандартна схема лікування, спостерігалися у 4 (23,5 %) осіб протягом (363,5±29,5) дня, а у хворих Іб підгрупи, де застосовувалася комплексна терапевтична схема, у 1 (5,6 %) особи протягом (367,5±29,1) дня. У разі середнього ступеня тяжкості псоріазу у хворих ІIa підгрупи, яким призначалася стандартна схема лікування, рецидив виникав у 7 (43,8 %) осіб протягом (339,5±27,1) дня, а у пацієнтів ІІб підгрупи, яким призначалася комплексна терапевтична схема, рецидив виникав у 3 (18,8 %) осіб протягом (341,5±26,5) дня. У разі тяжкого ступеня псоріазу у хворих ІІІа підгрупи, яким призначалася стандартна схема, рецидив виникав у 12 (80 %) осіб протягом (311,1±25,1) дня та у 5 (33,3 %) хворих ІІІб підгрупи, де застосовувалася комплексна терапевтична схема протягом (314,1±24,3) дня (табл. 5.9).
Таблиця 5.9 – Кількість рецидивів, що виникли за період спостереження за хворими
| Показник | І група | ІІ група | ІІІ група | Разом | ||||||||||||
| Іа,n=17 | Іб,n=18 | ІІа,n=16 | ІІб,n=16 | ІІІа,n=15 | ІІІб,n=15 | Група а,n = 48 | Група б,n = 49 | |||||||||
| абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | |
| Кількість рецидивів | 4 | 23,5 | 1 | 5,6 | 7 | 43,8 | 3 | 18,8 | 12 | 80,0 | 5 | 33,3 | 23 | 47,9 | 9 | 18,4 |
Позитивна оцінка віддалених результатів лікування (спостереження за хворими протягом півтора року після закінчення терапії) підтверджувалося виникненням рецидивів у 9 (18,4 %) хворих, які застосовували комплексну схему лікування, на відміну від пацієнтів з традиційною терапією, де рецидиви виникали у 23 (47,9 %). Використання запропонованого комплексного заходу дозволило зменшити кількість рецидивів за період спостереження у 2,6 разу. Переносимість препаратів була доброю, інколи фіксувалися побічні ознаки у вигляді диспепсичних скарг та почуття жару, які самостійно зникали.
Отже, результати проведеного дослідження дозволяють дати високу оцінку ефективності комплексної терапії псоріазу із застосовуванням метамаксу та кортексину. Така терапія дає значний позитивний потенціал і сприяє зниженню клінічних і лабораторних показників активності запального процесу, призводить до стабілізації показників ерго- і трофотропної систем, регресу псоріатичного процесу, модифікує перебіг дерматозу і може бути рекомендованою до застосування в дерматології.
* * *
У цілому результати цього розділу досліджень дозволяють зробити наступні висновки.
1. Уведення до стандартної схеми лікування псоріазу метамаксу та кортексину покращує суб’єктивний статус хворих, сприяє позитивній динаміці об’єктивних клінічних даних, нормалізує стан ерго- та трофотропної систем організму.
2. Використання метамаксу та кортексину не замінює лікування псоріазу традиційними медикаментозними засобами; їх доцільно використовувати паралельно зі стандартною схемою терапії, що значно підвищує ефективність останньої та зменшує ризик розвитку побічних ефектів і медикаментозних ускладнень.
3. Застосування запропонованих препаратів-коректорів є адекватним у період курсової терапії на фоні лікування седативними, дезінтоксикаційними, вегетотропними, гіпосенсибілізуючими, антигістамінними засобами, антистресорними адаптогенами, транквілізаторами, засобами, що покращують периферичний кровообіг, гепатопротекторами, вітамінами, імуномодуляторами та зовнішнього лікування.
Результати розділу відображені в публікаціях:
- Береговая А.А. Комплексный подход медикаментозной коррекции нарушений состояния эрго- и трофотропной систем при псориазе / А.А. Береговая // Дерматологія та венерологія. – 2016. – № 2 (72). – С. 48-55.
- Берегова А.А. Ефективність комплексного лікування хворих з тяжким ступенем перебігу псоріазу із використанням Метамаксу та Кортексину / А.А. Берегова // Інноваційні технології в дерматовенерології. Міждисциплінарні зв′язки : Наук.-практ. конф. з міжнар. участю, Харків, 13-14 листопада 2015 р. / Дерматологія та венерологія. – 2015. – № 3 (69). – С. 71-72.
- Пат. на корисну модель № 107329 Україна МПК (2014) G01N33/48 (2006.01) Спосіб діагностики клінічного перебігу псоріазу / А.А. Берегова, А.М. Біловол, С.О. Стеценко, В.І. Жуков; Харківський національний медичний університет. – номер заявки № u201600109; заяв. 04.01.2016; опубл. 25.05.2016, Бюл.10.
РОЗДІЛ 6
АНАЛІЗ ТА УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
Незважаючи на успіхи у вивченні патогенетичних ланок та активне розроблення нових методів комплексної терапії, псоріаз залишається не до кінця дослідженим і потребує подальшої уваги науковців.
Дана робота ґрунтується на вирішенні двох наукових напрямків, покладених в основу мети і задач: 1) вивчення механізмів розвитку порушень стану ерго- та трофотропної систем при псоріазі залежно від ступеня тяжкості; 2) обґрунтування комплексної медикаментозної схеми для їх корекції. Для цього у динаміці прогресування псоріазу вивчався стан ерготропної системи за показниками обміну катехоламінів, вмістом компонентів вуглеводвмісних білків та 17-ОКС, а трофотропної – за показниками обміну її медіаторів – серотоніну та гістаміну. Отримані результати досліджень піддавалися статистичному аналізу та математичному обробленню з метою виявлення найбільш чутливих показників, за допомогою яких оцінювалася ефективність введення до стандартної медикаментозної схеми лікування псоріазу препаратів метамаксу та кортексину. Відповідно до мети і задач даної роботи попередньо було опрацьовано програму досліджень із застосуванням адекватних інформативних методів.
Під спостереженням знаходилося 97 хворих у вузькому віковому діапазоні 30-50 років, який був обраний з метою одержання більш достовірних результатів досліджень. Серед хворих на вульгарний псоріаз чоловіків було більше (74,2 %), ніж жінок (25,8 %). Найчисленнішу групу (41,2 %) становили особи чоловічої статі віком 30-40 років. На момент обстеження значну групу склали хворі з тривалістю псоріазу 6-10 років (19,6 %), з превалюванням чоловіків (15,5 %), ніж жінок (4,1 %). Найменшу групу становили жінки віком 30-40 років (10,3 %). У період спостереження зимовий тип псоріазу (загострення зима-осінь) відзначався у 38,1 % хворих, із них 11,3 % жінок і 26,8 % чоловіків. Літній тип (загострення весна-літо) спостерігався у 7,2 % пацієнтів, серед яких було 3 % чоловіків та 4,1 % жінок. Найбільш численна група пацієнтів (54,6 %) була з невизначеним типом (загострення не пов’язане з порою року), серед яких 44,3 % чоловіків і 10,3 % жінок. Супутню патологію виявлено у 27,8 % хворих. Найчастіше у обстежених хворих спостерігалися захворювання серцево-судинної системи (вегето-судинна дистонія, артеріальна гіпертензія, ішемічна хвороба серця та атеросклероз) – у 9,3 % випадків (5,1 % – чоловіки). Супутні захворювання частіше мали чоловіки (15,4 %), ніж жінки (12,4 %). Найчисельнішу групу за тривалістю хвороби склали хворі з періодом 6-10 років (19,6 %), з превалюванням чоловіків (15,5 %). Другі за чисельністю становили групи: з тривалістю дерматозу 1-5 років – 18,6 % (17,5 % чоловіків і 1,0 % жінок); 16-20 років – 18,6 % (13,4 % – чоловіків, 5,2 % – жінок). Найменшу за чисельністю групу склали пацієнти з тривалістю псоріазу на момент обстеження до 1 року – 10,3 % (9,3 % – чоловіки і 1,0 % – жінки). Найчастіше первинна локалізація висипань відзначалася на волосистій частині голови (26,8 %), тулубі (23,7 %), розгинальних поверхнях ліктьових і колінних суглобів (18,6 %), верхніх і нижніх кінцівках рідше (16,5 і 9,3 % відповідно). В інших випадках (5,1 %) висипання розташовувалися на шкірі обличчя, шиї, долонь, статевих органів, міжсідничної складки тощо.
За характером шкірних уражень хворі на звичайний псоріаз розділялися наступним чином: монетоподібний – 14,4 %, дрібнобляшковий – 8,2 % і великобляшковий – 74,2 %, краплеподібний – 3,1 %. У 92,8 % хворих спостерігався поширений шкірний процес, а у 7,2 % – обмежений. Майже всі хворі мали прогресуючу та стаціонарну стадію хвороби. При цьому прогресуючу стадію дерматозу встановлено у 72,2 % хворих з розповсюдженим та 3,1 % з обмеженим процесом, стаціонарну – у 24,8 % пацієнтів з розповсюдженим та у 9,3 % з обмеженим псорiазом.
Проведене обстеження хворих дозволило розподілити їх на клінічні групи: 35 осіб з легким (I група), 32 особи із середньотяжким (II група), 30 осіб – з тяжким ступенем (III група) захворювання.
Для з’ясування особливостей стану ерго- та трофотропної систем у групах хворих у біологічних рідинах (добовій сечі та сироватці крові) вивчався вміст їх показників.
Одне з провідних місць, як медіатори ерготропної системи, що здійснюють реакції адаптації, посідають катехоламіни. Останні забезпечують при взаємодії з адренергічними структурами узагальнений симпатичний (ерготропний) ефект, який має важливе значення у подоланні організмом кризисних ситуацій [109]. Дослідження при дерматозах лише окремих катехоламінів без вивчення їх попередників і метаболітів [31, 58, 125] дає, як правило, тільки уявлення щодо їх вміcту у біологічних рідинах і не дозволяє обґрунтовано зробити висновок щодо стану симпато-адреналової системи в цілому. Одним із адекватних методів оцінки тонусу та реактивності симпато-адреналової системи є дослідження екскреції з добовою сечею катехоламінів, їх попередника ДОФА та кінцевих продуктів інактивації – ВМК і ГВК. Адекватність визначення рівня їх екскреції з сечею порівняно з визначенням кількості у плазмі крові обумовлена стислістю періоду напіврозпаду катехоламінів у плазмі та реакцією хворого на взяття крові. У результаті дії цих факторів вміст катехоламінів у плазмі більш відображує стресову реакцію, пов’язану з дослідженням, ніж закономірності функціонування симпато-адреналової системи за певних умов.
При оцінці одержаних результатів встановлено, що при порівнянні з контролем при легкому ступені тяжкості псоріазу екскреція з добовою сечею попередника катехоламінів ДОФА знижувалася в середньому на 32 % (р=0,003), при середньотяжкому – на 25 % (р=0,002), а при тяжкому – на 39 % (р<0,001). Для продукту реакції декарбоксилювання ДОФА – ДА виявлялася інша динаміка. Для легкого та середнього ступеня тяжкості псоріазу добова екскреція порівняно з контролем підвищилася (р≤0,001) у середньому на 58 % та 35 % відповідно, а для тяжкого – практично не змінилася (р=0,212). Різноспрямована динаміка змін спостерігалася у відношенні НА: у разі легкого та середнього ступеня тяжкості псоріазу – тенденція до підвищення рівня екскреції з сечею на 165 % та 88 % (р<0,001), а у разі тяжкого ступеня, навпаки, зниження (р=0,008) на 37 %. Аналогічна динаміка змін спостерігалася й для екскреції А: збільшення (р<0,001) порівняно з контролем у середньому в 4,0 разу у хворих із легким ступенем псоріазу та 2,5 разу у хворих із середнім ступенем тяжкості на фоні зниження (р<0,001) майже в 2,0 разу у хворих із тяжким ступенем дерматозу. Оскільки величина екскреції А та НА з сечею характеризує рівень активності симпато-адреналової системи, а ДОФА та ДА – резервні її можливості [155], отримані результати свідчили про деяке підвищення функціональної активності та резервних можливостей симпато-адреналової системи у разі легкого та середнього ступеня тяжкості псоріазу на відміну від тяжкого, де чітко простежується зниження рівня показників. Адекватна оцінка реакції окремих ланцюгів симпато-адреналової системи, як правило, потребує не тільки абсолютного кількісного визначення катехоламінів та їх попередника ДОФА, але й визначення інтенсивності процесів синтезу та метаболізму катехоламінів на окремих етапах їх перетворень. Останнє можна простежити за розрахунком співвідношень ДА/ДОФА, НА/ДА, А/НА та ДОФА/(ДА+НА+А). У обстежених хворих виявлено тенденцію до збільшення (р<0,001) співвідношення ДА/ДОФА (показника відносної інтенсивності декарбоксилювання ДОФА з утворенням ДА у цілісному організмі): на 98 % у випадку легкого ступеня тяжкості, 79 % – середнього та 81 % – тяжкого ступеня псоріазу. Такі результати свідчать про прискорення синтезу катехоламінів на етапі ДОФА-ДА. Для легкого ступеня тяжкості псоріазу визначено підвищення на 93 % (р<0,001) при порівнянні з контрольною групою інтегрального показника швидкості гідроксилювання ДА з утворенням НА (НА/ДА). Такий результат спостерігався й у разі середньотяжкого ступеня хвороби (в середньому на 21 %), але у загальній статистичній картині воно було недостовірним (р=0,35). Для цих випадків результати свідчили про прискорення синтезу катехоламінів на етапі ДА-НА. Для тяжкого ступеня псоріазу, навпаки, спостерігалося зниження (р=0,002) показника на 32 %, що відображало гальмування перетворення ДА на НА. У хворих на псоріаз із легким і середнім ступенями тяжкості відмічалося порівняно з контролем недостовірне підвищення співвідношення А/НА відповідно на 34 % і 13 % (р=0,29 і р=0,49), яке, з одного боку, характеризувало стан реакції метилювання НА з утворенням А, а з іншого – активність гуморального та нервового компонентів симпато-адреналової системи, оскільки екскреція НА залежить переважно від його виділення симпатичними нервовими закінченнями, тоді як екскреція А зумовлена секрецією наднирниками (реакція метилювання НА з утворенням А у нервовій тканині практично відсутня). З цього приводу, отримані результати вказують на деяку перевагу у хворих на псоріаз із легким і середнім ступенями тяжкості тонусу та реактивності гормональної ланки симпато-адреналової системи над нервовою. У разі тяжкого псоріазу, навпаки, спостерігалося статистично значуще (р=0,046) зниження на 28 % співвідношення А/НА, що свідчило про превалювання тонусу нервової ланки симпато-адреналової системи над гормональною. Крім того, при переході від легкого ступеня тяжкості псоріазу до тяжкого реєструвалося поступове зниження (р<0,001) співвідношення ДОФА/(ДА+НА+А), яке відображало загальну секреторну активність симпато-адреналової системи, відповідно на 57 %, 50 % і 36 %. Така тенденція свідчила про більш прискорену швидкість переходу ДОФА в катехоламіни у хворих на псоріаз із легким ступенем тяжкості, ніж у хворих на псоріаз із тяжким ступенем хвороби. Метаболітами катехоламінів і самостійними біологічно активними речовинами є ВМК і ГМК, вміст яких у біологічних рідинах також відображає рівень функціональної активності симпато-адреналової системи [63]. У разі легкого ступеня тяжкості псоріазу спостерігалося порівняно з контролем підвищення (р=0,004) на 24 % вмісту у добовій сечі ВМК; для середньотяжкого псоріазу воно було більш вираженим і становило в середньому 44 % (р<0,001), а у випадку тяжкого ступеня, навпаки, визначалася тенденція до незначного (лише на 22 %) зниження, яке у загальній статистичній картині було недостовірним (р=0,149). Виявлене підвищення екскреції ВМК свідчило про посилення обмінних процесів, збільшення використання катехоламінів. Слід підкреслити, що метаболіт А та НА – ВМК, депонується у закінченнях симпатичних нервових волокон, є показником стресорного впливу патологічного процесу. Зниження екскреції ВМК при псоріазі тяжкого ступеня свідчить, у свою чергу, про зниження обміну А та НА. Оцінка рівня добової екскреції з сечею кінцевого продукту метаболізму ДА – ГМК свідчила про відсутність змін для всіх груп відносно контролю. Опосередковано про відносне зниження катаболізму А та НА, зокрема окислювального дезамінування та метилювання, при легкому ступені тяжкості псоріатичного процесу свідчило виявлене зниження (р<0,001) на 50 % співвідношення ВМК/(А+НА). Для середнього ступеня тяжкості псоріазу для цього показника зберігалася тенденція до зниження (в середньому на 19 %) порівняно з контролем, але воно було недостовірним (р=0,352). Так як дезамінування є одним із шляхів швидкої інактивації катехоламінів, то його зниження забезпечило підвищення активності симпато-адреналової системи. У разі тяжкого перебігу захворювання змін з боку співвідношення ГВК/(А+НА) не спостерігалося (р=0,193). Про відносне зниження катаболізму ДА (зокрема, дезамінування моноаміноксидазою) у пацієнтів з легким і середньотяжким ступенями хвороби свідчило зниження відповідно на 47 % (р<0,001) і 34 % (р=0,046), по відношенню до контролю, іншого співвідношення ГВК/ДА. Змін з боку цього показника у хворих з тяжким ступенем псоріазу не виявлялося. Загальний аналіз одержаних результатів дозволяє представити обмін катехоламінів у хворих з різним ступенем тяжкості псоріатичного процесу наступним чином. При легкому та у деякій мірі й середньому ступенях тяжкості захворювання, на відміну від тяжкого, відбувається підвищення загальної секреторної активності симпато-адреналової системи (з превалюванням гормональної ланки), що підтверджується збільшеними абсолютними рівнями екскреції з сечею катехоламінів та їх метаболітів. Але у даному випадку простежується відносне підвищення утворення катехоламінів на фоні відносного зниження їх катаболізму з утворенням ВМК і ГВК. Доведено, що за умов надлишку катехоламінів може відбуватися активація альтернативних шляхів їх метаболізму, зокрема, хінонового шляху окислення з утворенням цитотоксичних метаболітів, які можуть відігравати суттєву роль у розвитку патологічного процесу, спровокованого стресогенними факторами [138]. Таким чином, у хворих на псоріаз із легким і середнім ступенями тяжкості виявляються ознаки термінової адаптації з мобілізацією депо катехоламінів та довготривалої адаптації з підвищенням загальної секреторної активності симпато-адреналової системи. Відносне зниження резервів симпато-адреналової системи у хворих із середнім і тяжким ступенями псоріатичного процесу, більша вираженість гормонально-медіаторної дисоціації у бік нервової ланки, деяке роз’єднання метаболічних процесів свідчить про можливість виникнення дезадаптації. Доведено, що зміни активності симпато-адреналової системи можуть супроводжуватися значними змінами в обміні біополімерів сполучної тканини, зокрема ГАГ та гексозамінів, що входять до складу протеогліканів та є важливими компонентами міжклітинного матриксу [186, 196]. Вуглеводвмісні біополімери сполучної тканини відіграють активну роль у процесах морфогенезу, клітинного диференціювання, регенерації та внаслідок цього у формуванні адаптивно-репаративних реакцій [80]. З огляду на вищезазначене, представляло інтерес опосередковано через вміст вуглеводвмісних білків та їх компонентів у сироватці крові хворих на псоріаз з різним ступенем тяжкості оцінити ерготропні функції, що відповідають за адаптивні реакції в організмі. До вуглеводвмісних білків практично належать всі білки плазми крові, крім альбумінів, їх сумарна кількість може бути визначена за вмістом гексоз. Для легкого та середньотяжкого ступенів тяжкості псоріазу виявлено порівняно з контролем збільшення у сироватці крові вмісту загальних гексоз, пов’язаних з білками, відповідно на 45 % (р<0,001) та 27 % (р=0,002). Підвищення вмісту загальних гексоз, як правило, свідчить про активацію адаптаційно-репаративних реакцій організму. Згідно концепції Ф. З. Меерсона [117], будь-які гострі патологічні процеси, індуковані ендогенними або екзогенними факторами, на першому етапі супроводжуються різкою активацією адаптаційно-репаративних механізмів, спрямованих на відновлення порушених функцій біологічних систем. У разі тяжкого перебігу захворювання, навпаки, відмічалося достовірне (р<0,001), по відношенню до контролю, зниження рівня загальних гексоз у середньому на 36 %. Доведено, що при тривалих патологічних процесах та переході їх у хронічний стан фаза активації механізмів репарації організму змінюється стадією дезадаптації, виснаженням і зниженням пристосувально-репаративного потенціалу, що чинить негативний вплив на перебіг локального патологічного процесу, який, у свою чергу, продовжує погіршувати компенсаторно-пристосувальні реакції хворого [117]. Виникає так зване «порочне коло». Слід очікувати, що зниження показників, які характеризують стан адаптаційно-репаративних функцій організму (зокрема, сумарний пул гексоз), буде відображати міру неповноцінності цієї системи. При псоріазі тяжкого ступеня усереднене значення рівня загальних гексоз було статистично значуще нижчим відносно контролю, що свідчило про зниження у цих пацієнтів адаптаційно-репаративних реакцій організму. У хворих з легким ступенем тяжкості псоріатичного процесу виявлено зниження (р<0,001) відносно контролю сироваткових гексоз, що входять до складу ГАГ, у середньому на 30 % на фоні збільшення на 44 % вмісту гексоз, що входять до складу ГП. У хворих із середнім ступенем тяжкості псоріазу спостерігалося інше: збільшення (р=0,002) рівня гексоз у складі ГАГ і гексоз у складі ГП у середньому відповідно на 14 % і 33 %. Початок виникнення та вираженість репаративних процесів характеризувалися, як правило, збільшенням рівня гексоз у складі ГП. Для хворих з тяжким ступенем псоріазу реєструвалася інша динаміка: підвищення (р<0,001) порівняно з контролем рівня гексоз у складі ГАГ у середньому на 26 % при зниженні гексоз у складі ГП у середньому на 28 %. Розрахунок співвідношення гексози-ГАГ/гексози-ГП свідчив, що при псоріазі легкого ступеня тяжкості визначалося його зниження (р<0,001) на 50 %, а при псоріазі з тяжким перебігом – навпаки, суттєве збільшення в середньому на 150 %. Зменшення значення співвідношення гексози-ГАГ/гексози-ГП у хворих на псоріаз із легким ступенем тяжкості свідчило про дезорганізаційні процеси у сполучнотканинних структурах і використання ГАГ у процесі формування колагенових волокон, а збільшення при тяжкому стані – про метаболічні зсуви, зумовлені деструктивними процесами у сполучнотканинних структурах. При псоріазі із середнім ступенем тяжкості співвідношення гексози-ГАГ/гексози-ГП практично не відрізнялося від контролю (р=0,517), що скоріше зумовлено односпрямованою тенденцією до збільшення у сироватці крові рівня гексоз у складі ГАГ і гексоз у складі ГП. У цій категорії хворих такий результат свідчив про напружений стан адаптаційних процесів з ознаками початкового розвитку деструктивних і дезорганізаційних процесів у сполучнотканинних структурах. У цілому визначення фракцій гексози/ГАГ і гексози/ГП дає можливість відрізняти метаболічні зсуви, зумовлені деструктивними та дезорганізаційними процесами у сполучнотканинних структурах, від змін, що спричинені реакцією організму на осередок пошкодження – шкіру. На фоні описаних вище змін у хворих на псоріаз середньотяжкого ступеня тяжкості псоріатичного процесу в сироватці крові хворих реєструвалося також підвищення (р<0,001) при порівнянні з контролем вмісту інших компонентів вуглеводвмісних білків – сіалових кислот, що залежало від тяжкості хвороби – від 16 % до 108 %. Вважається, що збільшення рівня сіалових кислот у сироватці крові відбувається за рахунок деградації вуглеводвмісних білків в осередку запалення. Тому отримані результати також підтверджують поступовий розвиток метаболічних зсувів, зумовлених деструктивними та дезорганізаційними процесами при псоріазі, що також опосередковано відображає динаміку змін адаптаційно-репаративних реакцій. У формуванні адаптаційно-репаративних реакцій безпосередню участь бере й кора наднирників з її гуморальними продуктами ерготропного ряду – глюкокортикоїдами. Глюкокортикоїдна функція кори наднирників оцінювалася за ступенем екскреції з добовою сечею 17-ОКС. Легкий та середній ступінь тяжкості псоріазу характеризується підвищенням (р<0,001) екскреції 17-ОКС у середньому відповідно на 32 % та 47 %, а тяжкий ступінь, навпаки, зниженням (р=0,03) у середньому на 27 %. Слід відзначити, що у деяких пацієнтів рівень екскреції з сечею 17-ОКС знаходився у межах фізіологічної норми, але в цілому визначалася тенденція до зниження глюкокортикоїдної функції кори наднирників у міру обтяження псоріатичного процесу, що супроводжувалося, як правило, зниженням адаптаційного потенціалу. Згідно отриманих даних, рівень екскреції глюкокортикоїдів корелював зі ступенем тяжкості перебігу псоріазу. Так, для легкого та середнього ступенів характерним було деяке підвищення екскреції, тоді як для тяжкого ступеня псоріазу у частини хворих – їх зниження. Останнє можна пояснити, з одного боку, виснаженням глюкокортикоїдної функції кори наднирників на фоні запального стресу високої активності, а з іншого боку, враховуючи, що рівень кортикостероїдів у сечі є інтегральним показником багатьох процесів (зокрема, споживання тканинами, інактивації, виділення), можна припустити, що при високій активності запалення і значній площі ураження шкіри значна кількість глюкокортикоїдів залишається в крові (вони діють як антипроліферативні, антиексудативні та протизапальні фактори), внаслідок чого їх менше виводиться нирками з сечею. Окремі дослідження присвячено вивченню стану трофотропної системи за обміном її провідних медіаторів – серотоніну та гістаміну. Синтез серотоніну, як відомо, здебільшого відбувається в ентерохромафінних клітинах гастроінтестинального тракту, депонування – у секреторних гранулах цих утворень, а вивільнення – у портальний кровоток за умов впливу різних стимулів, що опосередковані норадренергічною та холінергічною іннервацією відповідних тканин. Слід зазначити, що циркулюючий серотонін головним чином локалізується у тромбоцитах, але в плазмі крові також формується пул його вільних молекул, відносно незалежний від тромбоцитарного [83, 168]. Окремо слід підкреслити, що гематоенцефалічний бар’єр є непроникним для моноамінів, що призводить до відносної незалежності метаболічних процесів у ЦНС і на периферії. Тому серотонін, що екскретується з сечею, має здебільшого периферичне походження. Крім того, активний метаболізм цього медіатору більше відбувається на периферії. При всіх досліджуваних ступенях тяжкості псоріазу спостерігалося підвищення (р<0,004) порівняно з контролем вмісту серотоніну в добовій сечі: легкому – в середньому на 26 %, середньому – на 89 %, тяжкому – майже на 137 %. Виявлені кількісні зміни рівня екскреції серотоніну добре корелюють з вираженістю клінічної симптоматики псоріатичних проявів у обстежених хворих. Отримані результати можуть опосередковано свідчити про збільшення вивільнення цього медіатору трофотропної системи, перш за все, з периферичних хромафінних клітин та у деякій мірі з пресинаптичних закінчень серотонінових медіаторних систем головного мозку. З іншого боку, збільшення рівня екскреції серотоніну одночасно з високим рівнем індексу РАSI відображає активацію трофотропних адаптаційно-компенсаторних реакцій. Кінцевим продуктом обміну серотоніну є 5-ОІОК, що утворюється на периферії та у ЦНС шляхом його окислювального дезамінування за дії моноаміноксидази. Підвищення виведення серотоніну із сечею у обстежених хворих супроводжувалося підвищенням виведення й 5-ОІОК. При легкому ступені тяжкості псоріазу збільшення рівня у сечі 5-ОІОК відносно контролю становило в середньому 95 %, при середньотяжкому – 75 %, при тяжкому – 43 %. Динаміка змін серотоніну та 5-ОІОК у обстежених хворих на псоріаз свідчила про порушення нормального профілю їх екскреції з сечею, так як у нормі до сечі екскретується в основному 5-ОІОК, а не серотонін. З іншого боку, збільшення екскреції серотоніну та 5-ОІОК, за даними досліджень [83], у більшості випадків відбувається за умов збудливого та тривожного стану організму, що є характерним і для хворих на псоріаз. Представляло інтерес з’ясувати динаміку змін процесів синтезу та окислювального дезамінування серотоніну, що можливо при визначенні коефіцієнта співвідношення серотонін/5-ОІОК. По відношенню до контролю у разі легкого ступеня тяжкості псоріазу спостерігалося зниження (р<0,001) останнього в середньому на 31 %, що свідчило про переважання процесів окислювального дезамінування серотоніну над його синтезом. При середньому ступені тяжкості хвороби відмічалася деяка тенденція до недостовірного збільшення співвідношення (р=0,288), що свідчило про незначне переважання синтезу серотоніну над його дезамінуванням. При тяжкому стані спостерігалося суттєве підвищення (р=0,001) цього співвідношення в середньому на 67 %, що чітко підтвердило переважання синтезу серотоніну над його окислювальним дезамінуванням. У цілому отримані результати свідчать про залучення індоламінових механізмів у патогенез псоріазу, що добре узгоджується з даними інших дослідників [31]. Але скоріше такі результати мають адаптивний, пристосувальний характер; активізація компонентів вегетативної системи є наслідком розвитку неспецифічної стресової реакції, що виникає при прогресуванні псоріатичного процесу. До метаболітів серотоніну належить мелатонін, який розглядають як гормон трофотропної системи. Мелатонін бере активну участь у регуляції діяльності центральної та вегетативної нервової системи, ендокринних органів та імунної системи [91, 249]. Продукція мелатоніну у хворих на псоріаз оцінювалася за добовою екскрецією із сечею його основного метаболіту – 6-СОМТ. При легкому ступені тяжкості псоріазу відмічалося збільшення (р<0,001) виведення 6-СОМТ, що скоріше пов’язано з підвищенням функціональної активності епіфіза. Аналогічно спостерігалося збільшення рівня екскреції 6-СОМТ при середньотяжкому стані хворих на псоріаз, але менш виражено – лише на 14 % (р=0,006). Для тяжкого ступеня захворювання, навпаки, визначалося зниження (р<0,001) вмісту 6-СОМТ на 32 %, що вказувало на зниження функціональної активності епіфіза в результаті тривалої активації. Отримані результати свідчать, що з підвищенням ступеня тяжкості патологічного процесу виникають зміни добового рівня мелатоніну в бік його зменшення, з найменш низьким рівнем у III групі хворих, що дозволяє припустити поступове зменшення синтезу трофотропного гормону на фоні наростаючої запальної реакції у дермі. Провідним медіатором трофотропної системи є гістамін, що утворюється в реакції декарбоксилювання амінокислоти гістидину. Легкий ступінь тяжкості псоріатичного процесу характеризувався відносно контролю тенденцією до недостовірного (р=0,088) збільшення вмісту в сечі гістаміну на 28 % при достовірному (р<0,001) збільшенні вмісту гістидину (в середньому на 80 %). Такі результати свідчили, перш за все, про зниження реакції перетворення гістидину на гістамін. При середньому ступені тяжкості псоріазу відмічалося по відношенню до контролю суттєве підвищення виведення із сечею гістаміну (в середньому на 143 %, р<0,001) на фоні менш вираженого, ніж при легкому перебігу хвороби, підвищення виведення гістидину (на 46 %, р<0,001). Такі результати скоріше свідчать про підвищення активності реакції декарбоксилювання гістидину з утворенням гістаміну. При тяжкому перебігу псоріазу визначалося найбільш суттєве підвищення (р<0,001) виведення із сечею гістаміну (в 3,4 разу) на фоні зниження (р<0,001) порівняно з контролем екскреції гістидину (на 37 %), що переконливо свідчило про зростання тонусу гістамінреактивної системи у разі псоріазу тяжкого ступеня. Отже, одержані результати підтверджують вагому участь гістамінреактивної системи у патогенезі псоріазу. Скоріше реалізація останньої пов’язана зі значним психоемоційним стресом, що розвивається у хворих на псоріаз у відповідь, перш за все, на свербіж [61]. У реалізації останнього немаловажливу роль виконує такий медіатор, як гістамін [82]. З іншого боку, виявлена реакція таких трофотропних медіаторів, як гістамін і серотонін при псоріатичному процесі різного ступеня тяжкості має адаптивний характер. Розрахунок співвідношення гістамін/серотонін свідчив, що у випадках легкого ступеня тяжкості псоріазу показник порівняно з контролем практично не змінювався (р=0,757), а у разі середнього та тяжкого – збільшувався (р=0,005 та р=0,0016 відповідно) в середньому на 24 %, що опосередковано відображало деяке переважання гістамінреактивної системи над серотонінергічною. Таким чином, у розвитку псоріазу певну роль відіграють порушення вегетативного гормонально-медіаторного балансу з поступовим, залежним від ступеня тяжкості, посиленням дезадаптації та розвитком патологічних реакцій, які зачіпляють регуляторні й метаболічні процеси. У випадках легкого псоріазу та середнього ступеня тяжкості відбувається підвищення активності ерготропних механізмів при компенсаторному підвищенні й трофотропних; у випадках тяжкого псоріазу спостерігається виражена тенденція до зниження активності ерготропних механізмів на фоні ще більшого підвищення трофотропних. Наведений вище аналіз порушень стану ерго- та трофотропної систем у хворих різного ступеня тяжкості псоріазу дозволяє виділити деякі патогенетичні ланки, узагальнення яких наведено на рисунку 6.1. У зв’язку зі складними патогенетичними механізмами розвитку та перебігу псоріазу на сьогодні відсутні надійні медикаментозні методи його лікування. Останнє спонукає до пошуку комплексних підходів з урахуванням не тільки ступеня тяжкості псоріазу, а також патогенетичних ланок. На підставі проведених досліджень щодо порушень стану ерго- та трофотропної систем у хворих на псоріаз із різним ступенем тяжкості запропоновано комплексну медикаментозну схему їх корекції. Її сенс полягає у доповненні стандартної схеми лікування псоріазу препаратами, що сприяють нормалізації функціонування симпато-адреналових і парасимпатичних регуляторних механізмів забезпечення гомеостатичної функції організму. Враховуючи різноманіття фармакологічних засобів-коректорів регуляторних і метаболічних процесів, а також той факт, що ці засоби не є препаратами першої лінії в лікуванні псоріазу, необхідним є ретельний підхід до їх вибору.
Звичайно основними вимогами до засобів-коректорів є доведений механізм дії, високий профіль безпеки, універсальність (можливість корекції порушених функцій декількох органів і систем), доступність курсу терапії. До таких препаратів-коректорів стану ерго- та трофотропної систем у обстежених хворих на псоріаз із різним ступенем тяжкості можна віднести метамакс і кортексин.
Для раціональної оцінки ефективності запропонованої медикаментозної корекції стану ерго- та трофотропної систем у обстежених хворих на псоріаз різного ступеня тяжкості попередньо вважалося за доцільне виокремити з досліджуваних показників ті, які максимально відрізняються від значень умовно-здорових осіб.
Для цього у вибірках значень показників сечі та сироватки крові контрольної групи фіксувався діапазон їх змін, визначаючи мінімальне та максимальне значення. У вибірках значень показників груп знаходилася кількість значень, що не входили до визначеного діапазону контролю та кількість значень, що перебували у його межах, з наступним розрахунком критерію чутливості у відсотках.

Рисунок 6.1 – Патогенетична ланка порушень стану ерго- та трофотропної системи при псоріазі з різним ступенем тяжкості
При легкому ступені тяжкості псоріазу найбільш чутливими виявилися показники стану трофотропної системи – НА, А, загальні гексози, 17-ОКС, та ерготропної системи – гістидин, 5-ОІОК. При середньотяжкому стані хвороби до найбільш чутливих належили показники активності ерготропної системи – гістамін, серотонін, 5-ОІОК, та трофотропної – А, сіалові кислоти та 17-ОКС. У разі тяжкого ступеня захворювання найбільш чутливими визначено гістамін, серотонін та сіалові кислоти.
За динамікою змін виявлених чутливих показників стану ерго- та трофотропної систем проводилася оцінка клінічної ефективності комплексного медикаментозного лікування хворих на псоріаз.
Після застосування пацієнтами з легким ступенем тяжкості псоріатичного процесу стандартної схеми лікування відмічалося порівняно з показниками до лікування достовірне зниження А та НА в середньому на 55 %, гістидину – на 29 %, 5-ОІОК і загальних гексоз – на 25 %, 17-ОКС – на 22 %. Порівняння цих показників після стандартного лікування з показниками контрольної групи свідчило про достовірно збільшений рівень А (р<0,001), гістидину (р=0,0023), 5-ОІОК (р=0,005) і НА (р=0,001) відповідно на 63 %, 48 %, 38 % і 25 %. Рівень загальних гексоз і 17-ОКС при цьому практично дорівнює контролю (р=0,053 і р=0,387). Після застосування пацієнтами з легким ступенем тяжкості псоріатичного процесу комплексного терапевтичного методу з використанням метамаксу та кортексину відзначалося статистично значуще зниження (р<0,001) порівняно з показниками до лікування рівня А в середньому на 65 %, НА – на 53 %, гістидину – на 26 %, 5-ОІОК – на 42 %, загальних гексоз – на 45 % та 17-ОКС – на 24 %. Якщо таку динаміку змін порівняти з контролем, то рівень гістидину та А залишався достовірно підвищеним (р=0,039 та р=0,029) відповідно на 32 % та 37 %, а вміст інших показників практично дорівнював контролю. Використання метамаксу та кортексину у стандартній схемі лікування сприяло більш вираженому покращенню стану ерго- та трофотропної систем, ніж при їх відсутності, та наближення до контрольних значень. Використання пацієнтами із середнім ступенем тяжкості псоріазу стандартної схеми лікування призвело до достовірного (р<0,001) зниження порівняно з відсутністю терапевтичних заходів рівня А в середньому на 33 %, гістаміну, 17-ОКС та 5-ОІОК – на 23 %, сіалових кислот – на 15 %; але при порівнянні з контролем вміст цих показників залишався достовірно (р≤0,039) підвищеним: у середньому на 86 % для гістаміну, на 46 % для 5‑ОІОК і А, на 26 % для сіалових кислот та серотоніну, на 13 % для 17-ОКС. Використання пацієнтами із середньотяжким перебігом псоріазу комплексної терапевтичної схеми супроводжувалося більш вираженою тенденцією наближення показників до контролю. Не спостерігалося достовірної різниці при порівнянні з контролем для сіалових кислот (р=0,344), серотоніну (р=0,294), 17-ОКС (р=0,055) та 5-ОІОК (р=0,217). При цьому, по відношенню до контролю статистично значуще підвищеним залишився рівень гістаміну (в середньому на 57 %, р=0,005) та А (на 19 %, р<0,001). Відносно показників до проведення терапевтичних заходів відзначалося зниження (р<0,001) рівня сіалових кислот, 17-ОКС та 5-ОІОК у середньому на 28 %, А – на 49 %, гістаміну та серотоніну – на 41 %. Отже, запропоноване комплексне медикаментозне лікування з використанням метамаксу та кортексину сприяло більш вираженій корекції порушень стану ерго- та трофотропної систем у цій категорії хворих на псоріаз, ніж традиційна терапевтична схема. Після застосування пацієнтами з тяжким псоріазом стандартної схеми виявлялося порівняно з показниками до лікування статистично значуще (р<0,001) зниження гістаміну в середньому на 29 %, серотоніну – на 26 %, сіалових кислот – лише на 11 %. При цьому при порівнянні з контрольною групою вміст цих показників залишався суттєво збільшеним відповідно на 143 %, 79 % і 52 %. У хворих із тяжким ступенем псоріазу після проведення терапевтичних заходів з використанням метамаксу та кортексину реєструвалося статистично значуще зниження (р<0,001) порівняно з показниками до лікування вмісту гістаміну та сіалових кислот у середньому на 46 %, а серотоніну – на 35 %. Якщо таку динаміку змін порівняти з контролем, то рівень гістаміну, серотоніну та сіалових кислот залишався достовірно підвищеним (р≤0,05) відповідно на 86 %, 58 % та 20 %. Отже, використання комплексної схеми також супроводжувалося більш вираженим покращенням стану ерго- та трофотропної систем, ніж використання стандартної. Призначення запропонованої комплексної схеми хворим на звичайний псоріаз також сприяло позитивній динаміці клінічних даних, що підтверджувалося, зокрема, перевищенням кількості хворих із клінічним видужанням майже в 2 рази (20,4 %) відносно хворих із традиційною терапевтичною схемою (10,4 %). Значне покращення стану визначалося у 40,8 % пацієнтів, які використовували метамакс та кортексин на фоні традиційного лікування (проти 31,3 %); покращення відбулося у 32,7 % хворих (проти 31,3 %). Лікування без ефекту у 4,4 разу частіше спостерігалося в осіб, яким призначалася традиційна терапія (27 % випадків), значно рідше при використанні запропонованої комплексної схеми лікування (6,1 % випадків). Запропонована терапевтична схема дозволила підвищити ефективність лікування (клінічне видужання, значне покращення і покращення досягнуто у 93,9 % пацієнтів при використанні розробленого методу порівняно з 73,0 % хворих із традиційною терапією). Крім того, у разі використання запропонованого комплексного заходу спостерігалося більш суттєве розв’язання клінічних симптомів у позитивному напрямку, насамперед, при легкому та середньому ступенях перебігу псоріазу порівняно з використанням традиційної терапевтичної схеми. При цьому визначалися більш короткі терміни регресії об’єктивних симптомів і позитивної динаміки суб’єктивних симптомів на фоні запропонованої схеми лікування, залежно від ступеня тяжкості псоріазу спостерігалася зворотна прогресія динаміки від легкого до тяжкого ступеня хвороби. Так, терміни розв’язання симптомів були більш значущими у хворих із легким ступенем хвороби, але слід відзначити прискорення термінів при середньому та тяжкому ступенях хвороби у хворих, яким було запропоновано комплексну схему. Позитивна динаміка лікування в більш короткі терміни та зниження індексу PASI на 73,4 % (у хворих із легким ступенем хвороби на 81,9 %, при середньому ступені хвороби – на 72,5 % та тяжкому – на 65,7 %) свідчать про високу ефективність терапевтичної схеми з метамаксом і кортексином порівняно з результатами при використанні традиційної терапії. Також позитивна оцінка віддалених результатів лікування при спостереженні за хворими протягом півтора року після закінчення терапії підтверджувалося виникненням рецидивів у 9 (18,4 %) хворих, які застосовували комплексну схему лікування на відміну від пацієнтів, які отримували традиційну терапію, де рецидиви виникали у 23 осіб (47,9 %). Отже, використання запропонованого комплексного заходу дозволило зменшити кількість рецидивів за період спостереження у 2,6 разу порівняно з хворими, яки отримували традиційну терапію. Переносимість препаратів була доброю, інколи спостерігалися побічні ознаки у вигляді диспепсичних скарг та почуття жару, які самостійно зникали.
Адекватна оцінка стану трофо- та ерготропної систем у хворих на псоріаз різного ступеня тяжкості дозволяє ідентифікувати їх порушення та визначити стратегію медикаментозного лікування. Проведений аналіз та узагальнення отриманих результатів свідчить про досягнення поставленої мети та вирішення задач дослідження.
ВИСНОВКИ
У дисертаційній роботі наведено теоретичне узагальнення та нове рішення наукового завдання, що полягає у підвищенні ефективності лікування хворих на псоріаз шляхом розробки обґрунтованого комплексного методу терапії на підставі вивчення клінічних проявів, стану ерго- і трофотропної систем організму.
1. У зв’язку з вираженою розповсюдженістю псоріазу, високою захворюваністю осіб працездатного віку, високою частотою метаболічних, психоемоційних порушень гомеостазу, тривалим хронічним перебігом, недостатньою ефективністю терапії, актуальним є дослідження ерго- та трофотропної систем і розробка методів корекції їх порушень.
2. Встановлено переважання серед хворих на псоріаз віком 30-50 років чоловіків у 2,8 разу, виникнення дерматозу у 41,2 % випадків у віці 30-40 років, невизначений тип дерматозу у 54,6 %, супутню патологію у 28,7 % пацієнтів, зв’язок загострень зі стресами у 71,1 % хворих. Визначено легкий ступінь тяжкості псоріазу у 36 %, середній ступінь – у 33 %, тяжкий – у 31 % хворих.
3. У хворих на псоріаз легкого та середньотяжкого ступеня спостерігається підвищена функціональна активність та резервна можливість симпато-адреналової системи, превалювання її гормональної ланки над нервовою, що підтверджується по відношенню до групи контролю зниженням екскреції з сечею ДОФА (відповідно на 32 % і 25 %) на фоні підвищення рівня ДА (на 58 %), норадреналіну (на 165 % і 88 %), адреналіну (на 205 % і 130 %), ВМК (на 24 % і 44 %), ГВК (на 25 % і 10 %). У хворих тяжкого ступеня псоріазу, навпаки, відбувається зниження активності симпато-адреналової системи при превалюванні нервової ланки над гормональною, що підтверджується зниженням екскреції з сечею ДОФА (на 39 %), ДА (на 15 %), норадреналіну (на 37 %), адреналіну (на 100 %), ВМК (на 22 %) на фоні підвищення екскреції ГВК (на 25 %). У хворих на псоріаз встановлено виснаження ерготропних функцій, пов’язаних з адаптаційно-репаративними реакціями, розвитком деструктивних і дезорганізаційних процесів у сполучнотканинних структурах, зниженням функціональних резервів кори наднирників, що проявляється збільшенням відносно контролю у крові загальних гексоз (в середньому на 36 %), 17-ОКС (на 40 %) при зниженні співвідношення гексози-ГАГ/гексози-ГП (на 31 %) у разі легкого та середнього ступеня тяжкості дерматозу; зниженням вмісту загальних гексоз (на 32 %), 17‑ОКС (на 38 %) при підвищенні співвідношення гексози-ГАГ/гексози-ГП у випадку тяжкого стану хвороби (на 150 %).
4. Активація трофотропної функції у хворих на псоріаз підтверджується збільшенням відносно контролю екскреції з сечею серотоніну (на 26 %, 89 % і 137 % відповідно для легкого, середнього та тяжкого ступеня) та гістаміну (на 28 %, 143 % і 240 %), їх похідних і попередників 5-ОІОК (на 95 %, 75 %, 43 %), гістидину (на 86 % і 46 % відповідно для легкого і середнього ступеня). У пацієнтів з тяжким ступенем псоріазу відбувається зростання тонусу гістамінреактивної системи, про що свідчить суттєве підвищення екскреції з сечею гістаміну (на 240 %) на фоні зниження екскреції гістидину (на 37 %).
5. Найбільш чутливими показниками стану ерго- і трофотропної систем при псоріазі легкого ступеня тяжкості є норадреналін, адреналін, загальні гексози, 17-ОКС, гістидин, 5-ОІОК; середнього ступеня – гістамін, серотонін, 5‑ОІОК, адреналін, 17-ОКС; тяжкого ступеня – гістамін, серотонін.
6. Розроблено комплексний метод лікування хворих на псоріаз із використанням метамаксу та кортексину на фоні традиційних терапевтичних заходів, який дозволяє нормалізувати стан ерго- і трофотропної систем при легкому і середньому ступені тяжкості псоріазу, покращити – при тяжкому псоріазі, підвищити ефективність терапії (клінічне одужання, значне покращення і покращення) у 93,9 % пацієнтів, досягти регресу індексу PASI на 73,4 %, зменшити кількість рецидивів за період спостереження у 2,6 разу порівняно з хворими при традиційному лікуванні.
РЕКОМЕНДАЦІЇ
1. З метою оптимізації діагностичних заходів, оцінки ефективності терапевтичних підходів у хворих на псоріаз рекомендовано досліджувати показники стану ерго- і трофотропної систем.
2. Рекомендовано в якості чутливих показників об’єктивної оцінки ступеня тяжкості псоріазу досліджувати: у разі легкого ступеня захворювання – у сечі вміст норадреналіну, адреналіну, 17-ОКС, гістидину, 5-ОІОК та у крові загальних гексоз; у разі середньотяжкого ступеня – у сечі вміст гістаміну, серотоніну, 5-ОІОК, адреналіну, 17-ОКС; у разі тяжкого ступеня – у сечі вміст гістаміну та серотоніну.
3. Хворим на псоріаз на фоні традиційної терапії рекомендовано призначати метамакс (1 капсула 3 рази на добу протягом 21-24 діб) і кортексин (по 10 мг в 1-2 мл 0,5 % новокаїну, або води для ін’єкцій, або 0,9 % натрію хлориду, внутрішньом’язово, 1 раз на добу протягом 10 діб).
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
1. Аббуд Аймен. Взаємозалежність показників нейрогуморальної регуляції та стану вегетативної нервової системи у хворих на псоріаз залежно від статі хворих / Аббуд Аймен // Патологія. – 2016. – № 1 (36). – C. 79-82.
2. Адаскевич В. П. Диагностические индексы в дерматологии / В. П. Адаскевич. – М. : Медицинская книга, 2004. – 165 с.
3. Адаскевич В. П. Особенности нарушений системы гемостаза при различном характере течения распространенного обыкновенного псориаза / В. П. Адаскевич, Ю. В. Козина // Вестник Витебского государственного медицинского университета. – 2010. – Т. 9, № 3. – С. 105-113.
4. Айвазян А. А. Псориаз – иммунозависимое заболевание / А. А. Айвазян // Экспериментальная и клиническая дерматокосметология. – 2014. – № 2. – С. 36-38.
5. Андрашко Ю. В. Імунобіологічна терапія блокатором ФНП-a: новий стандарт лікування псоріазу із середньотяжким та тяжким перебігом / Ю. В. Андрашко // Укр. журн. дерматології, венерології, косметології. – 2008. – № 2. – С. 35-36.
6. Андрашко Ю. В. Індекс PASI як показник реабілітаційного лікування хворих на псоріаз / Ю. В. Андрашко, І. С. Миронюк, А. В. Батюк // Укр. бальнеологічний журнал. – 2001. – № 4. – С. 15-18.
7. Андрашко Ю. В. Современная модель иммунопатогенеза псориаза: пути эффективного воздействия / Ю. В. Андрашко // Дерматолог. – 2011. – Т. 2, № 1. – С. 99-101.
8. Андрашко Ю. В. Современные подходы к этапной наружной терапии при псориазе / Ю. В. Андрашко, Б. В. Литвиненко // Укр. журнал дерматологии, венерологии, косметологии. – 2009. – № 1. – С. 29-33.
9. Арсеньев А. В. Естественная классификация больных псориазом по степени тяжести состояния / А. В. Арсеньев, Е. И. Сариан // Запорожский медицинский журнал. – 2012. – № 6 (75). – С. 80-81.
10. Артеменко А. Ф. Микросоциальные и психологические предпосылки развития психических и сексуальных расстройств при псориазе у мужчин / А. Ф. Артеменко // Медична психологія. – 2011. – Т. 6, № 2. – С. 23-26.
11. Артеменко А. Ф. Особенности сексуальности при псориазе у мужчин / А. Ф. Артеменко // Міжнародний медичний журнал. – 2011. – Т. 17, № 3. – С. 23-26.
12. Асцатуров Г. Є. Асоційованість мікробного пейзажу шкіри та клінічного перебігу псоріазу / Г. Є. Асцатуров // Новые инновационные программы в дерматовенерологии и косметологии : науч.-практ. конф. дерматовенерологов и косметологов, Харьков, 14 апреля 2011 г. // Дерматологія та венерологія. – 2011. – № 2. – С. 64-65.
13. Бабанин В. А. Макрофагальная активность – маркер эффективности лечения больных псориазом узкополосным ультрафиолетом В 311 нм / В. А. Бабанин // Укр. журнал дерматології, венерології, косметології. – 2013. – № 2 (49). – С. 37-47.
14. Байтяков В. В. Влияние плазмафереза и его модификаций на клиническое течение распространенного псориаза / В. В. Байтяков // Казанский медицинский журнал. – 2011. – Т. 92, № 2. – С. 292-295.
15. Байтяков В. В. Клиническая эффективность методов экстра-корпоральной и внутрисосудистой гемокоррекции при псориазе / В. В. Байтяков, В. А. Куркина // Саратовский научно-медицинский журнал. – 2012. – Т. 8, № 1. – С. 81-84.
16. Байтяков В. В. О влиянии методом экстракорпоральной гемокоррекции на уровень эндогенной интоксикации у больных псориазом / В. В. Байтяков // Вестник новых медицинских технологий. – 2011. – Т. 18, № 4. – С. 68-71.
17. Бакулев А. Л. Применение гепатопротекторов при псориазе : сравнительная клинико-лабораторная и ультрасонографическая оценка эффективности / А. Л. Бакулев // Вестник дерматологии и венерологии. –2010. – № 1. – С. 112-117.
18. Бакулев А. Л. Псориаз как системная патология / А. Л. Бакулев, Ю. В. Шагова, И. В. Козлова // Саратовский научно-медицинский журнал. – 2008. – № 1. – С. 13-20.
19. Безродная А. И. Анализ популяционных особенностей заболеваемости псориазом в Украине / А. И. Безродная // Клінічна імунологія. Алергологія. Інфектологія. – 2011. – № 8. – С. 70-73.
20. Беленичев И. Ф. Рациональная нейропротекция / И. Ф. Беленичев, В. И. Черний, Ю. М. Колесник. – Донецк : ИД «Заславский», 2009. – 261 с.
21. Беловол А. Н. Доказательные аспекты расовой наследственности псориаза / А. Н. Беловол, А. А. Береговая, Н. Л. Колганова // Дерматологія та венерологія. – 2012. – № 1. – С. 5-8.
22. Беловол А. Н. Хронические системные дерматозы на фоне метаболического синдрома / А. Н. Беловол // Вісник Вінницького національного медичного університету. – 2010. – № 14 (2). – С. 364-370.
23. Белозоров А. П. Новая субпопуляция эффекторных хелперных Т‑лимфоцитов (Th22) и ее участие в патогенезе заболеваний кожи / А. П. Белозоров // Дерматология и венерология. – 2010. – № 2 (48). – С. 7-10.
24. Белозоров А. П. Т-хелперы-17 (Тh17) – новая субпопуляция эффекторных СD4+-лимфоцитов и их роль в патологии / А. П. Белозоров // Дерматология и венерология. – 2008. – № 4. – С. 19-21.
25. Беляев Г. М. Современный взгляд на проблему лечения больных псориазом / Г. М. Беляев // Дерматология и венерология. – 2009. – № 3 (45). – С. 7-17.
26. Беляев Г. М. Стресс, адаптация, псориаз. Планирование научных исследований по проблеме этого заболевания / Г. М. Беляев // Дерматология и венерология. – 2002. – № 2 (16). – С. 11-14.
27. Белякин С. А. Клинический опыт терапии псориаза инфликсимабом / С. А. Белякин, Г. Н. Тарасенко, Е. С. Васильева // Военно-медицинский журнал. – 2010. – Т. 331, № 12. – С. 53-56.
28. Біловол А. М. Активність аденілат- і гуанілатциклазної месенджерної системи у хворих на ізольовану та поєднану з гіпертензією псоріатичну хворобу / А. М. Біловол // Укр. журнал дерматології, венерології, косметології. – 2010. – № 2. – С. 38-41.
29. Біловол А.М. Вміст білків гострої фази та середньо молекулярних пептидів у хворих на ізольовану та поєднану з гіпертонією псоріатичну хворобу / А. М. Біловол // Журнал дерматовенерології та косметології ім. М.О. Торсуєва. – 2010. – № 1-2. – С. 59-61.
30. Біловол А. М. Клінічна синтропія системних дерматозів і соматичної патології : стан центральної гемодинаміки у хворих з поєднаним перебігом псоріатичної та гіпертонічної хвороб / А. М. Біловол // Експериментальна і клінічна медицина. – 2009. – № 4. – С. 80-84.
31. Біловол А.М. Стан моноамінергічних нейромедіаторних систем у хворих на ізольовану та поєднану з гіпертонією псоріатичну хворобу / А. М. Біловол // Укр. науково-медичний молодіжний журнал. – 2010. – № 4. – С. 36-38.
32. Біловол А. М. Стан процесів перекисного окислення ліпідів та окисної модифікації білків у хворих на псоріатичну хворобу / А. М. Біловол // Ліки України. – 2010. – № 1. – С. 27-29.
33. Болезнь Крона и псориаз / О. Ю. Рахимова, Ю. А. Виноградов, М. Ю. Юрков [и др.] // Клиническая медицина. – 2008. – № 4. – С. 70-72.
34. Болотная Л. А. Пcориаз: патогенез, клинические проявления, принципы терапии / Л. А. Болотная //Схiдноєвропейський журнал внутрiшньої та сiмейної медицини. – 2015. – № 1. – С. 4-9.
35. Болотная Л. А. Современные возможности наружной терапии псориаза / Л. А. Болотная // Укр. журнал дерматології, венерології, косметології. – 2014. – № 1. – С. 115-120.
36. Борисенко А. В. Рівень секреції цитокінів Т-клітинами периферійної крові при дії стафілококових токсинів (SEB) як показник наявності імунопатологічної реакції на суперантигени у хворих на генералізований пародонтит на фоні псоріазу / А. В. Борисенко, Л. Т. Флієва // Імплантологія. Пародонтологія. Остеологія. – 2011. – № 1. – С. 81-83.
37. Бронников В. А. Практика применения кортексина в нейрореабилитации: реальная возможность и перспективы / В. А. Бронников, С. В. Щенникова // Terra Medica. – 2007. – № 5 (49). – С. 40-44.
38. Бурхонов А. У. Особенности иммунного статуса и лечение больных псориазом пожилого и старческого возраста / А. У. Бурхонов // Украинский журнал дерматологии, венерологии, косметологии. – 2014. – № 1. – С. 71-77.
39. Вайс В. В. Вивчення порушень ліпідного метаболізму у хворих на псоріаз / В. В. Вайс // Інфекційні хвороби. – 2006. – № 4. – С. 60-61.
40. Вантюх Н. В. Сучасні аспекти етіології та патогенезу псоріазу / Н. В. Вантюх // Науковий вісник Ужгородського університету. – 2013. – Вип. 1. – С. 182-187.
41. Васильев В. Н. Симпатико-адреналовая активность при различных функциональных состояниях человека / В. Н. Васильев, В. С. Чугунов. – М. : [б.и.], 1985. – 269 с.
42. Ващенко О. О. Вивчення клініки та лікування псоріазу, як важливий етап планування розробки протипсоріатичного лікарського засобу / О. О. Ващенко, О. І. Єзерська // Ліки України. – 2015. – № 4 (25). – С. 49-51.
43. Введенская О. Н. Антицитокиновая терапия псориаза / О. Н. Введенская, А.Н. Серов, Е. Е. Радионова // Клиническая дерматология и венерология. – 2010. – № 5. – С. 28-31.
44. Вегетативные расстройства : клиника, лечение, диагностика / Под. ред. А. М. Вейна. – М. : Мед. инф. агенство, 2000. – 752 с.
45. Вейн А. М. Лекции по неврологии неспецифических систем мозга / А. М. Вейн. – М. : МЕДпресс-информ, 2010. – 112 с.
46. Вірстюк Н. Г. Особливості перебігу псоріазу у хворих з метаболічним синдромом / Н. Г. Вірстюк, М. С. Волошинович // Укр. журнал дерматології, венерології, косметології. – 2011. – № 3. – С. 19-21.
47. Владимирова И. С. Возможности повышения эффективности комплексной терапии псориаза / И. С. Владимирова, К. Н. Монахов // Вестник дерматологии и венерологии. – 2010. – № 2. – С. 58-63.
48. Влияние выраженности боли на качество жизни больных псориатическим артритом / П. Д. Бахтояров, И. В. Романенко, В. А. Пеннер [и др.] // Український медичний альманах. – 2011. – Т. 14, № 2 (додаток). – С. 15-17.
49. Влияние социально-демографических факторов на формирование внутренней картины болезни больных псориазом / Н. С. Ольшевская, Л. Н. Гуменюк, Е. А. Михайлова [и др.] // Медична психологія. – 2012. – Т. 7, № 2. – С. 83-87.
50. Влияние узковолновой (311 нм) фототерапии на показатели клеточного и гуморального иммунитета у больных псориазом / О. Ю. Олисова, А. М. Талыбова, Е. В. Владимирова [и др.] // Клиническая дерматология и венерология. – 2011. – № 1. – С. 80-82.
51. Возняк І. А. Сучасні можливості та підходи до вибору місцевого лікування псоріазу / І. А. Возняк, Т. В. Святенко // Клінічна імунологія. Алергологія. Інфектологія. – 2009. – № 8. – С. 41-45.
52. Выбор метода лечения больных среднетяжелыми и тяжелыми формами псориаза с использованием иммунодепрессивных средств различного механизма действия / Н. В. Кунгуров, М. М. Кохан, Н. В. Зильберберг [и др.] // Уральский медицинский журнал. – 2011. – № 8. – С. 36-42.
53. Галимова Э. С. Ген рецептора интерлейкина 28 альфа IL28RA и псориаз : ассоциация с тяжестью болезни и возрастом манифестации / Э. С. Галимова, Э. К. Хуснутдинов // Мед. иммунология. – 2015. – Т. 17, № 6. – С. 567-572.
54. Галимова Э. С. Молекулярно-генетические основы предрасположенности к псориазу / Э. С. Галимова, В. Л. Ахметова, Э. К. Хуснутдинова // Генетика. – 2008. – Т. 44, № 5. – С. 594-605.
55. Генетические факторы этиологии и патогенеза псориаза / Н. В. Кунгуров, Н. Н. Филимонова. В. И. Голубцов [и др.] // Вестник дерматологии, венерологии. – 2011. – № 1. – С. 23-27.
56. Герасимова Ц. И. Определение серотонина, триптофана, 5-окситриптофана, 5-оксииндолуксусной кислоты, гистамина и гистидина в одной пробе биологического материала / Ц. И. Герасимова / Лаб. дело. – 1977. – № 1. – С. 14-20.
57. Герман С. В. Мелатонин у человека / С. В. Герман // Клиническая медицина. – 1993. – Т. 71, № 3. – С. 22-30.
58. Глаговский П. Б. Основные метаболиты адреналина, норадреналина, дофамина и серотонина в лабораторной диагностике наркоманий / П. Б. Глаговский, И. С. Мамедов, Р. Т. Тогузов // Клинико-лабораторный консилиум. – 2010. – № 1 (32). – С. 27-34.
59. Головач І. Ю. Використання коректорів метаболізму на основі мельдонію дигідрату – сучасний підхід у комбінованій терапії ішемічних захворювань серця / І. Ю. Головач, О. М. Авраменко // Ліки України. – 2011. – № 8 (154). – С. 68-72.
60. Головач І. Ю. Курение, псориаз и псориатический артрит : метаболическая и генетическая коморбидность / І. Ю. Головач // Здоров’я України. – 2012. – № 2. – С. 58-59.
61. Гребенников В. А. Психологический статус больных псориазом в условиях хронического стресса / В. А. Гребенников, Л. М. Дакиева // Первый Рос. конгресс дерматовенерологов : тезисы научных работ. – СПб., 2003. – № 1. – С. 33-34.
62. Гуменюк Л. Н. Типология отношения к болезни у больных псориазом / Л. Н. Гуменюк, Н. С. Ольшевская, Д. В. Прохоров // Медична психологія. – 2011. – Т. 6, № 3. – С. 17-18.
63. Данченко И. Ю. Динамика когнитивных нарушений при сосудистых поражениях головного мозга на фоне лечения кортексином / И. Ю. Данченко // Пептидные препараты – препараты 21-го века. – СПб.: ИИЦ ВМА, 2006. – С. 17-18.
64. Дащук А. М. Дослідження процесів колагеноутворення у хворих на псоріаз / А. М. Дащук, Н. А. Пустова // Матеріали XIV Конгресу Світової Федерації Українських лікарських товариств, Донецьк, 4-6 жовтня 2012 р. : збірка матеріалів. – Донецьк, 2012. – С. 267.
65. Дащук А. М. Исследование нарушений некоторых функций эндокринной системы у больных псориазом / А. М. Дащук, Н. А. Пустовая, Е. И. Добржанская // East European Scientific Journal. – 2016. – № 2 (6). – С. 38-41.
66. Дащук А. М. Этиопатогенетическая роль ТОЛЛ-подобных рецепторов при псориазе / А. М. Дащук, В. В. Почернина // Первый независимый научный вестник. – 2016. – № 7. – С. 33-36.
67. Дащук А. М. TOLL-подобные рецепторы и их роль в воспалительной реакции при псориазе / А. М. Дащук, В. В. Плотникова // Актуальні проблеми дерматології, венерології та ВІЛ/СНІД-інфекції : матер. наук.-практ. конф. з міжнародною участю, присвяченої 155-річчю професору М. В. Тіпцева, Харків, 18 листопада 2015 р. –Харків : С.А.М., 2015. – С. 43-48.
68. Демченко А. В. Вплив препарату Метамакс на когнітивні функції у хворих на хронічну ішемію мозку / А. В. Демченко; А. В. Ревенько, А. О. Волік // Ліки України. – 2013. – № 8 (174). – С. 67-70.
69. Дмитриенко С. В. Деякі антропогенетичні аспекти псоріазу / С. В. Дмитриенко, В. Г. Коляденко // Укр. журнал дерматології, венерології, косметології. – 2006. – № 3. – С. 9-11.
70. Дмитрук В. С. Влияние мелатонина на состояние иммунитета при псориазе / В. С. Дмитрук, Л. В. Стрига // Бюлл. Сибирской медицины. – 2009. – Т.8, № 4. – С.134-139.
71. Добржанська Є. І. Вивчення окремих ланок ендокринної системи у хворих на псоріаз / Є. І. Добржанська // Актуальні проблеми дерматології, венерології та ВІЛ/СНІД-інфекції : матер. наук.-практ. конф. з міжнародною участю, присвяченої 155-річчю проф. Зеленева І. Ф., Харків, 18-19 червня 2015 р. – Харків : С.А.М., 2015. – С. 76-81.
72. Добржанська Є. І. Порушення механізмів нейроендокринної регуляції та системи імунного захисту у хворих на псоріаз / Є. І. Добржанська // Укр. журнал дерматології, венерології, косметології. – 2013. – № 4 (51). – С. 51-55.
73. Добржанська Є. І. Порушення регуляторних адаптаційних механізмів у хворих на псоріаз / Є. І. Добржанська // Дерматологія та венерологія. – 2013. – № 4. – С. 73-78.
74. Довжанский С. И. Генетические и иммунные факторы в патогенезе псориаза / С. И. Довжанский, И. Я. Пинсон // Рос. журнал кожных и венерических болезней. – 2006. – № 1. – С.14-19.
75. Довжанский С. И. Качество жизни – показатель состояния больных хроническими дерматозами // Вестник дерматологии. – 2001. – № 3. – С.12-13.
76. Донцова Е. В. Особенности психосоциального состояния больных псориазом с метаболическим синдромом / Е. В. Донцова // Дерматовенерология. – 2013. – № 2. – С. 36-41.
77. Донцова Е. В. Эффективность различных видов лечения больных псориазом с метаболическим синдромом / Е. В. Донцова // Врач. – 2013. – № 7. – С. 80-82.
78. Дюдюн А. Д. Інтегральна роль урогенітальних інфекцій у розвитку артропатичного псоріазу / А. Д. Дюдюн, Л. Х. Алі Колева // Укр. журнал дерматології, венерології, косметології. – 2014. – № 1. – С. 27-34.
79. Ємченко Я. О. Деякі спільні аспекти патогенезу псоріазу та метаболічного синдрому / Я. О. Ємченко, К. Є. Іщейкін // Світ медицини та біології. – 2013. – № 1. – С.176-180.
80. Зимницкий А. Н. Гликозаминогликаны в биохимических механизмах адаптации организма к некоторым физиологическим и патологическим состояниям / А. Н. Зимницкий, С. А. Башкатов. – М. : Фармацевтический бюллетень, 2004. – 235 с.
81. Знаменская Л. Ф. Псориаз : клиника и лечение / Л. Ф. Знаменская // Лечащий врач. – 2002. – № 12. – С. 12-16.
82. Зуд при псориазе : диагностическое и прогностическое значение, методы устранения / М. Э. Запольский, А. И. Фролова, А. Г. Кольцова [и др.] // Здоровье Украины. – 2007. – № 19. – С. 60-61.
83. Иззати-Заде К. Ф. Нарушения обмена серотонина в патогенезе заболеваний нервной системы / К. Ф. Иззати-Заде, А. В. Баша, Н. Д. Демчук // Журнал неврологии и психиатрии им. С. С. Корсакова. – 2004. – № 9. – С. 62-70.
84. Изучение генетических факторов предрасположенности к развитию псориаза / А. А. Минеева, О. С. Кожушная, В. А. Волнухин [и др.] // Вестник дерматологии и венерологии. – 2012. – № 3. – С. 30-38.
85. Иммунные механизмы псориаза. Новые стратегии биологической терапии / A. A. Кубанова, А. А. Кубанов, Дж. Ф. Николас [и др.] // Вестник дерматологии и венерологии. – 2010. – № 1. – С. 35-47.
86. Иммуноморфологические исследования Т-лимфоцитов в коже больных псориазом / A. M. Вавилов, В. А. Самсонов, Л. Е. Димант [и др.] // Вестник дерматологии и венерологии. – 2000. – № 4. – С. 4-5.
87. Исмайлова Х. Ю. Индивидуальные особенности поведения: (моноаминергические механизмы) / Х. Ю. Исмайлова, Т. М. Агаев, Т. П. Семенова. – Баку : Нурлан, 2007. – 228 с.
88. Исследование показателей качества жизни больных распространенным псориазом с использованием опросника SP-36 / Р. Г. Шаповалов, Л. В. Силина, И. И. Бобынцев [и др.] // Вестник новых медицинских технологий. – 2011. – Т. 18, № 1. – С. 90-92.
89. Каденко О. А. Особливості дослідження психічного стану хворих на псоріаз в умовах стаціонарного лікування / О. А. Каденко, Т. Л. Левицька // Журнал дерматології та косметології ім. М. О. Торсуєва. – 2011. – № 1/2. – С. 19-28.
90. Казиханова С. Р. Эндокринные аспекты патогенеза псориаза / С. Р. Казиханова // Міжнародний ендокринологічний журнал. – 2012. – № 7. – С. 108-115.
91. Каладзе Н. Н. Итоги и перспективы изучения физиологических, патогенетических и фармакологических эффектов мелатонина / Н. Н. Каладзе, Е. М. Соболева, Н. Н. Скоромная // Здоровье ребенка. – 2010. – № 2 (23). – С. 156-167.
92. Каленська О. В. Псоріаз: етіологія, патогенез, клініко-морфологічна картина, принципи лікування / О. В. Каленська, Л. В. Каленська, О. Г. Курик // Укр. журнал дерматології, венерології, косметології. – 2009. – № 3. – С. 5-9.
93. Камышников В. С. Клинико-биохимическая лабораторная диагностика / В. С. Камышников / Справочник : В 2-х томах. – 2-е изд. – Минск : Интерпрессервис, 2003. – Т. 2. – 463 с.
94. Карнаух Ю. В. Еволюція поглядів на механізми розвитку псоріатичного артриту / Ю. В. Карнаух // Укр. терапевтичний журнал. – 2010. – № 2. – С. 101-106.
95. Катунина О. Р. Иммунная система кожи и ее роль в патогенезе псориаза / О. Р. Катунина // Вестник дерматологии и венерологии. – 2005. – № 1. – С. 19-21.
96. Катунина О. Р. Иммуноморфологическая характеристика клеток воспалительноно инфильтрата при псориазе / О. Р. Катунина // Вестник дерматологии и венерологии. – 2005. – №2. – С. 25-29.
97. Кауд Д. Псориаз и метаболический синдром как факторы взаимного отягощения дисбаланса эндокринной, иммунной систем и цитокинового гомеостаза. Перспективные направления болезнь-модифицирующей терапии псориаза / Д. Кауд // Укр. журнал дерматології, венерології, косметології. – 2013. – № 2 (49). – С. 92-97.
98. Качалова О. А. Метаболічний синдром та ураження серцево-судинної системи у хворих на псоріаз / О. А. Качалова // Укр. журн. дерматології, венерології, косметології. – 2015. – № 3. – С. 39-43.
99. Клініко-епідеміологічні особливості деяких дерматозів (псоріаз, атопічний дерматит) у дітей в Україні / В. М. Волкославська, О. Л. Гутнєв, О. І. Олійник [та ін.] // Журнал дерматовенерології та косметології ім. М. О. Торсуєва. – 2012. – № 1-2 (28). – С. 66-69.
100. Количественный анализ холестерина мембран кератиноцитов эпидермиса при псориазе / Т. М. Повалий, Т. К. Логинова, Г. Я. Шарапова [и др.] // Вестник дерматологии и венерологии. – 1997. – № 1. – С. 4-6.
101. Коляденко В. Г. Оцінка якості життя хворих на псоріаз у процесі лікування препаратом «Дайвобет» / В. Г. Коляденко, В. В. Короленко // Укр. журнал дерматології, венерології, косметології. – 2009. – № 1. – С. 13-15.
102. Коморбидная сердечно-сосудистая патология у больных вульгарным псориазом [Текст] / Н. В. Кенгуров, Н. Н. Филимонкова, Е. П. Топычканова [и др.] // Лечащий врач. – 2014. – № 9. – С. 68-71.
103. Комплексное лечение больных псориазом с учетом нейроэндокринных нарушений / А. М. Дащук, Н. А. Пустовая, В. А. Чипиженко [и др.] // Аллергология и иммунология. – 2014. – Т. 15, № 2. – С. 121-123.
104. Короткий Н. Г. Псориаз как следствие включения β-стрептококков в микробиоценоз кишечника с повышенной проницаемостью (концепция патогенеза) / Н. Г. Короткий, М. Ю. Песляк // Вестник дерматологии и венерологии. – 2005. – № 1. – С. 9-18.
105. Короткий Н. Г. Терапевтические возможности тимодепрессина у больных псориазом и механизмы его лечебного действия / Н. Г. Короткий, В. Ю. Уджуху, А. Э. Абдуллаева // Вестник дерматологии и венерологии. – 2002. – № 4. – С. 58-60.
106. Кортексин – пятилетний опыт отечественной неврологии / Под ред. А. А. Скоромца, М. М. Дьяконова. – СПб. : Наука, 2005. – 224 с.
107. Котвіцька А. А. Дослідження показників поширеності псоріазу в країнах світу та Україні / А. A. Котвіцька, В. В. Карло // Запорожский медицинский журнал. – 2013. – № 3. – С. 38-42.
108. К проблеме психогенных дерматозов / А. Д. Юцковский, Н. С. Дубняк, Е. Б. Федорова [и др.] // Рос. журнал кожных и венерических болезней. – 2006. – № 4. – С. 29-32.
109. Кулинский В. И. Катехоламины: биохимия, фармакология, физиология, клиника / В. И. Кулинский, Л. С. Колесниченко // Вопросы мед. химии. – 2002. – Т. 48, Вып. 1. – С. 45-67.
110. Кутасевич Я. Ф. Випадок різкого обтяження перебігу псоріатичної хвороби у хворого, який заразився сифілітичною та хламідійною інфекціями / Я. Ф. Кутасевич, Г. І. Мавров, І. О. Олійник // Дерматологія та венерологія. – 2006. – № 4 (34). – С. 21-25.
111. Кутасевич Я. Ф. Современные подходы к применению топических глюкокортикостероидов / Я. Ф. Кутасевич // Журнал дерматологии и венерологии. – 2000. – № 1 (9). – С. 95-99.
112. Кутасевич Я. Ф. Сучасний погляд на псоріатичну хворобу / Я. Ф. Кутасевич, І. А. Олейник // Мистецтво лікування. – 2005. – № 6. – С. 6-11.
113. Куц Л. В. Значение сигнально-рецепторных ноцицептивных связей при псориазе / Л. В. Куц // Укр. журнал дерматології, венерології, косметології. – 2013. – № 3 (50). – С. 47-51.
114. Куценко И. В. Противозудная терапия больных псориазом / И. В. Куценко, И. В. Свистунов, И. Е. Милус // Укр. журнал дерматології, венерології, косметології. – 2013. – № 2 (49). – С. 123-126.
115. Кушнир С. М. Вегетативная дисфункция и вегетативная дистония / С. М. Кушнир, Л. К. Антонова. – Тверь: [б.и.], 2007. – 215 с.
116. Лобанов Г. Ф. Етіопатогенез псоріазу / Г. Ф. Лобанов // Галицький лікарський вісник. – 2010. – Т. 17, № 3. – С. 166-168.
117. Меерсон Ф. З. Адаптация, стресс и профилактика / Ф. З. Меерсон. – М. : Наука, 1981. – 279 с.
118. Мельдоний-мик и милдронат: особенности фармакологического действия и эквивалентность / Д. А. Рождественский, Э. А. Доценко, Ю. Я. Бобков [и др.] // Лечебное дело. – 2011. – № 6 (22). – С. 47-51.
119. Микрюков А. В. Особенности течения псориаза у больных с избыточной массой тела и ожирением / А. В. Микрюков // Клиническая дерматология и венерология. – 2013. – № 6. – С. 52-56.
120. Минеев В. Н. Кортексин как отражение тенденции современной медицины к междисциплинарному подходу к совместному лечению / В. Н. Минеев // Новые Санкт-Петербургские врачебные ведомости. – 2009. – № 1. – С. 70-73.
121. Многоцентровое рандомизированное проспективное двойное слепое плацебо-контролируемое исследование безопасности и эффективности кортексина в остром и раннем восстановительном периоде полушарного ишемического инсульта / Л. В. Стаховская, К. С. Мешкова, М. Н. Дадашева [и др.] // Вестник рос. военно-медицинской академии. – 2012. – № 1 (37). – С. 218-244.
122. Науково-методичні підходи до вдосконалення фармацевтичного забезпечення хворих на псоріаз : методичні рекомендації / МОЗ України, Український центр наукової медичної інформації та патентно-ліцензійної роботи, Національний фармацевтичний університет ; уклад. А. А. Котвіцька, В. В. Карло. – К. : [б. в.], 2014. – 40 с.
123. Нейроиммунноэндокринные взаимодействия в норме и патологии / [Г. Н. Крыжановский, И. Г. Акмаль, С. В. Магаева и др.]. – М. : Медкнига, 2010. – 287 с.
124. Немчинова О. Б. Патофизиологические и патоморфологические аспекты псориаза / О. Б. Немчинова // Консилиум. – 1999. – № 3. – С. 13-15.
125. Новоселецкая А. И. Биогенные амины в сыворотке крови больных экземой / А. И. Новоселецкая // Медицинская панорама. – 2009. – № 1. – С. 30-32.
126. Ноздрачев А. Д. Физиология вегетативной нервной системы / А. Д. Ноздрачев. – Л. : Медицина, 1983. – 296 с.
127. О вирусной этиологии псориаза / В. Ф. Корсун, А. В. Станевич, Н. З. Яговдик [и др.] // Вестник дерматологии и венерологии. – 1999. – № 4. – С. 9-11.
128. Олисова О. Ю. Псориаз : эпидемиология, патогенез, клиника, лечение / О. Ю. Олисова // Дерматология. – 2010. – № 4. – С. 3-8.
129. Ольховська Ю. О. Комплексна терапія хворих на псоріаз із застосуванням глутоксиму / О. Ю. Ольховська // Укр. журнал дерматології, венерології, косметології. – 2008. – № 2. – С. 37-39.
130. Освобождение катехоламинов из адренергических нейронов / А. Д. Смит, М. Филленз, М. П. Браустейн [и др.] ; под ред. Д. М. Патона. – М. : Медицина, 1982. – 351 с.
131. Особенности наследования псориатической болезни на основе анализа родословных / Н. В. Кунгуров, Н. Н. Филимонкова, Э. Р. Бердникова [и др.] // Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. – 2009. – № 3. – С. 44-48.
132. Особенности субпопуляционного состава лимфоцитов и цитокинового профиля у больных псориазом при лечении различными методами фототерапии / В. Б. Пинегин, Н. П. Теплюк, В. В. Муругин [и др.] // Иммунология. – 2015. – Т. 36, № 4. – С. 234-236.
133. Павлова О. В. Психо-нейро-иммунные взаимодействия и кожа / О. В. Павлова. – М. : ЛКИ, 2007. – 56 с.
134. Павлова О. В. Психосоматические аспекты патогенеза хронических кожных заболеваний / О. В. Павлова // Психологический журнал. – 2003. – Т. 24, № 5. – С. 88-94.
135. Парцерняк С. А. Стресс. Вегетозы. Психосоматика / С. А. Парцерняк. – СПб. : А.В.К., 2002. – 384 с.
136. Пегано Джон О. А. Лечение псориаза – естественный путь / Дж. О. А. Погано ; Под ред. Н. Г. Короткого. – М. : КУДИЦ-ОБРАЗ, 2001. – 288 с.
137. Пинегин Б. В. Роль клеток иммунной системы и цитокинов в развитии псориаза / Б. В. Пинегин // Рос. журнал кожных и венерических болезней. – 2013. – № 3. – С. 19-25.
138. Пирожков С. В. Токсические метаболиты хинонового пути окисления катехоламинов / С. В. Пирожков, Д. В. Юсупов, Л. Ф. Панченко // Токсикологический вестник. – 1995. – № 4. – С. 12-15.
139. Пирузян А. Л. Молекулярная генетика псориаза / А. Л. Пирузян, P. M. Абдеев // Вестник РАМН. – 2006. – № 3. – С. 33-43.
140. Повханич-Грицяк Т. М. Деякі молекулярно-генетичні аспекти псоріазу у взаємозв’язку з різними варіантами його клінічного перебігу / Т. М. Повханич-Грицяк // Клінічна імунологія. Алергологія. Інфектологія. – 2013. – № 8. – С. 80-82.
141. Повхачин-Грицяк Т. М. Особливості клінічного перебігу псоріазу з врахуванням деяких етіопатогенетичних аспектів та сімейного анамнезу / Т. М. Повхачин-Грицяк // Дерматологія та венерологія. – 2013. – № 1 (59). – С. 76-84.
142. Полканов В. С. Гормоны гипофиза при псориатической болезни / В. С. Полканов // Вестник дерматологии и венерологии. – 1992. – № 1. – С. 26-28.
143. Попова І. Б. Деякі аспекти впливу метаболічного синдрому у хворих на псоріаз / І. Б. Попова, М. О. Дудченко, А. Ф. Артеменко // Укр. журнал дерматології, венерології, косметології. – 2013. – № 2 (49). – С. 48-52.
144. Последние новости о кортексине (нейропротекция на молекулярном уровне) / О. К. Гранстрем, Е. Г. Сорокина, Т. П. Сторожевых [и др.]. – М. : Слово, 2006. – 553 с.
145. Притуло О. А. Терапия NB-UVB (311) как современный патогенетически обоснованный метод коррекции системного воспаления у больных псориазом / О. А. Притуло, В. А. Бабанин // Укр. журнал дерматології, венерології, косметології. – 2012. – № 1 (44). – С. 19-23.
146. Прокопчук І. В. Неадекватне cтавлення до хвороби як чинник, що спричиняє порушення соціалізації особистості у хворих на псоріаз / І. В. Прокопчук // Вісник Київського національного університету ім. Тараса Шевченка. – 2014. – № 1 (1). – С. 62-65.
147. Прокопчук И. В. Специфика общего адаптационного синдрома у больных псориазом / И. В. Прокопчук // Медична психологія. – 2013. – Т. 8, № 3. – С. 108-111.
148. Прохоренков В. И. Липидный обмен при псориазе и методы его коррекции / В. И. Прохоренков, Т. М. Вандышева // Вестник дерматологии и венерологии. – 2002. – № 3. – С. 17-24.
149. Псориаз и метаболизм желчных кислот / М. К. Балтабаев, Ш. А. Хамидов, У. А. Валиханов // Вестник дерматологии и венерологии. – 2005. – № 4. – С. 25-28.
150. Псориаз и очаги фокальной инфекции в ЛОР-органах / Л. Б. Важбин, Ю. А. Хлыстов, В. В. Карпов [и др.] // Вестник дерматологии и венерологии. – 1995. – № 6. – С.39-40.
151. Псориаз : коморбидности и комедикации / Н. Г. Кочергин, Л. М. Смирнова, Н. Н. Потекаев [и др.] // Врач. – 2009. – № 5. – С. 15-20.
152. Пустовая Н. А. Нарушение процессов ангиогенеза и дисфункция эндотелия сосудов при псориазе и сахарном диабете 2 типа / Н. А. Пустовая // Актуальні проблеми дерматології, венерології та ВІЛ/СНІД-інфекції : матер. наук.-практ. конф. з міжнародною участю, присвяченої 155-річчю професору М. В. Тіпцева, Харків, 18 листопада 2015 р. – Харків : С.А.М., 2015. – С. 80-87.
153. Рай О. В. Вплив ультрафіолетової терапії на рівень уроканінової кислоти в шкірі при псоріазі / О. В. Рай // Укр. журнал дерматології, венерології, косметології. – 2013. – № 2 (49). – С. 65-69.
154. Ребров Б. А. Оценка качества жизни и особенности психоэмоционального статуса у больных псориатическим артритом / Б. А. Ребров, И. И. Благинина, Б. А. Реброва // Укр. ревматологічний журнал. – 2011. – № 2. – С. 76-80.
155. Резніченко Н. Ю. Стан симпато-адреналової та ваго-інсулярної систем у чоловіків зрілого віку, хворих на псоріаз / Н. Ю. Резніченко // Biomedical and biosocial anthropology. – 2013. – № 20. – С. 135-138.
156. Роль интерлейкинов в патогенезе псориаза / В. В. Соболев, Н. Л. Стародубцева, А. Г. Соболева [и др.] // Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. – 2010. – № 5. – С. 79-84.
157. Роль нарушений барьерной функции кишечника в патогенезе псориаза у детей / М. А. Стенина, В. И. Кулагин, Ж. В. Рудковская [и др.] // Рос. журнал кожных и венеричеких болезней. – 2003. – № 2. – С. 20-23.
158. Романенко К. В. Псориаз – полигенная форма дерматоза с наследственной предрасположенностью / К. В. Романенко, Л. А. Лебединская // Дерматологія та венерологія. – 2004. – № 1 (23). – С. 7-11.
159. Сариан Е. И. Сосудистый эндотелиальный фактор роста у больных псориазом / Е. И. Сариан // Дерматологія та венерологія. – 2012. – № 1 (55). –С. 37-42.
160. Свистунов И. В. Патоморфоз кожи больных с распространенным крупнобляшечным псориазом в процессе терапии метотрексатом и УФО с наружным
отосенсибилизатором / И. В. Свистунов, К. В. Романенко // Укр. журнал дерматології, венерології, косметології. – 2003. – № 1. – С. 5-7.
161. Сидоров П. И. Психологические особенности больных псориазом / П. И. Сидоров, М. Н. Панков, Р. А. Файзуллин // Вестник дерматологии и венерологии. – 1999. – № 6. – С.31-34.
162. Сизон О. О. Дискусійні клінічно-діагностичні аспекти перебігу атропатичного псоріазу / О. О. Сизон // Львівський медичний часопис. – 2012. – Т. 18, № 3. – С. 67-76.
163. Сизон О. О. Застосування нових гепатопротекторів для корекції порушення обмінних процесів у комплексній терапії хворих на псоріаз / О. О. Сизон, О. Ю. Туркевич // Укр. журнал дерматології, венерології, косметології. – 2008. – № 1. – С. 21-26.
164. Сизон О. О. Стратегія диференційної діагностики артропатичного псоріазу / О. О. Сизон, О. Ю. Туркевич // Львівський медичний часопис. – 2011. – Т. 17, № 1. – С. 82-93.
165. Сизон О. О. Сучасний погляд на патогенетичні особливості розвитку артропатичного псоріазу / О. О. Сизон, О. Ю. Туркевич // Експериментальна та клінічна фізіологія і біохімія. – 2011. – № 1. – С. 59-69.
166. Силина Л. В. Изменения содержания адаптивных гормонов и опиоидных пептидов под влиянием даларгина у больных псориазом / Л. В. Силина // Рос. журнал кожных и венерических болезней. – 2003. – № 1. – С. 41-44.
167. Силина Л. В. Клинико-лабораторная оценка эффективности использования иммуномодулятора Глутоксима в комплексной терапии детей, страдающих псориазом / Л. В. Силина, Е. В. Письменная // Педиатрия. – 2006. – № 3. – С.60-64.
168. Симоненков А. П. Синдром серотониновой недостаточности / А. П. Симоненков, В. М. Клюжев. – М. : Бином, 2013. – 96 с.
169. Системы свободнорадикального окисления и антиоксидантной защиты как индикаторы активности пролиферации креатиноцитов при псориазе / Р. А. Грашин, В. Г. Антонов, А. И. Карпищенко [и др.] // Клиническая лабораторная диагностика. – 2010. – № 1. – С. 18-24.
170. Современные представления об иммунных механизмах развития псориаза / В. Р. Хайрутдинов, А. В. Самцов, А. В. Мошкалов [и др.] // Вестник дерматологии и венерологии. – 2007. – № 1. – С. 3-7.
171. Современные представления об иммунопатогенезе псориаза : перспективы применения статинов / М. Н. Школьник, Ю. А. Васюк, Ю. Н. Перламутров [и др.] // Клиническая дерматология и венерология. – 2008. – № 4. – С. 10-17.
172. Солошенко Е. М. Сучасні підходи до терапії хворих на розповсюджений псоріаз з урахуванням індикаторних показників метаболічних процесів / Е. М. Солошенко, Н. В. Жукова, О. М. Стулій // Дерматологія та венерологія. – 2012. – № 3 (57). – С. 86-94.
173. Состояние вязкости крови у больных псориазом в процессе лечения производными пурина / В. В. Заерко, Ю. А. Оболенский, Л. С. Лапацкая [и др.] // Вестник дерматологии и венерологии. – 2000. – № 3. – С. 29-30.
174. Степаненко В. І. Дерматологія, венерологія / В. І. Степаненко. – К. : КІМ, 2010. – 157 с.
175. Степаненко Р. Л. Структурні зміни в ділянках інтактної шкіри у хворих на псоріаз до та після проведення системної імуносупресивної терапії / Р. Л. Степаненко, С. Г. Гичка, Муін Туффаха // Дерматологія та венерологія. – 2015. – № 2. – С. 61-70.
176. Стукалова Н. Я. Измерение показателей качества жизни у больных псориазом с применением опросника СКИНДЕКС-29 / Н. Я. Стукалова // Вестник дерматологии. – 2006. – № 4. – С. 12-15.
177. Тарасенко Г. Н. Влияние гипербарической оксигенации на свободнорадикальное окисление липидов в эпидермисе при псориазе / Г. Н. Тарасенко, Б. С. Хышиктуев, А. Б. Корнилов // Рос. журнал кожных и венерических болезней. – 2002. – № 5. – С.23-26.
178. Теппермен Дж. Физиология обмена веществ и эндокринной системы / Дж. Теппермен, Х. Теппермен. – М. : Мир, 1989. – 656 с.
179. Терлецкий О. В. Псориаз. Дифференциальная диагностика «псориазо-подобных» редких дерматозов. Терапия. Медицинский атлас. –СПб. : ДЕАН, 2007. – 512 с.
180. Толубаев Н. С. Невропатические синдромы при псориазе / Н. С. Толубаев, И. Г. Передерко, Н. И. Голубаева // Актуальные вопросы дерматологии. – 1996. – № 6. – С. 45.
181. Транскапиллярный обмен холестерина при псориазе / З. Б. Кешилева, А. Б. Косухин, А. Д. Пак [и др.] // Вестник дерматологии и венерологии. – 1993. – № 3. – С. 45-49.
182. Ультразвукові маркери атеросклерозу у хворих на псоріатичний артрит / Г. І. Лисенко, Л. В. Хіміон, О. В. Риполовська [та ін.] // Сімейна медицина. – 2013. – № 4. – С. 156.
183. Федоренко О. Є. Клінічний досвід терапії псоріазу / О. Є. Федоренко // Укр. журнал дерматології, венерології, косметології. – 2012. – № 1 (44). – С. 59-62.
184. Федотов В. П. Взаимосвязь между степенью тяжести псориаза и уровнем ФНО-α у больных псориазом в сочетании с гипертонической болезнью / В. П. Федотов, В. А. Визир, Г. И. Макурина // Запорожский мед. журнал. – 2015. – № 3. – С. 43-47.
185. Федотов В. П. Особенности иммунорегуляторных процессов у больных псориазом в сочетании с гипертонической болезнью / В. П. Федотов, В. А. Визир, Г. И. Макурина // Укр. журн. дерматології, венерології, косметології. – 2015. – № 3. – С. 18-22.
186. Филаретов А. А. Закономерности реагирования гипофизарно-адренокортикальной системы на многократно повторяющиеся стрессоры / А. А. Филаретов, С. В. Рочас, Т. Р. Багаева // Рос. физиологический журнал им. Сеченова. – 1993. – Т. 79, № 3. – С. 94-102.
187. Характеристика суглобового синдрому при псоріатичному артриті: можливості різних методів візуалізації / Г. О. Проценко, В. В. Качур, К. А. Іванова [та ін.] // Укр. ревматологічний журнал. – 2013. – № 3. – С. 151.
188. Хардикова С. А. Псориаз, кишечное всасывание. Особенности при сочетании с описторхозом / С. А. Хардикова, Э. И. Белобородова, П. Н. Пестерев. – Томск : НТЛ, 2000. – 232 с.
189. Хобейш М. М. Гептрал® в терапии псориаза / М. М. Хобейш // Вестник дерматологии и венерологии. – 2009. – № 3. – С. 84-86.
190. Хышиктуев Б. С. Закономерности сдвигов параметров обмена липидов в различных биологических объектах у больных псориазом в периоды обострения и ремиссии / Б. С. Хышиктуев, Е. В. Фалько // Вестник дерматологии и венерологии. – 2005. – № 6. – С. 40-43.
191. Цераидис Г. С. Функциональные нарушения вегетативной нервной системы у больных псориазом / Г. С. Цераидис, В. Н. Тряпицын, Е. А. Петрушина // Вестник дерматологии и венерологии. – 1977. – № 9. – С. 49-52.
192. Цитокиновый дисбаланс в иммунопатогенезе псориаза / Ф. Х. Камилов, Н. А. Муфазалова, О. М. Капулер [и др.] // Фундаментальные исследования. – 2015. – № 1. – C. 1065-1071.
193. Чекман И. С. Метаболитные и метаболитотропные препараты в системе кардио- и органопротекции / И. С. Чекман, Н. А. Горчакова, С. Б. Французова. – К. : Наукова думка, 2009. – 155 с.
194. Чернишов П. В. Досвід застосування ультрафіолетового опромінення та метилпреднізолону ацепонату (адвантану) у терапії хворих на псоріаз / П. В. Чернишов // Укр. журнал дерматологіі, венерологіі, косметологіі. – 2004. – № 3. – С. 25-26.
195. Шабанов П. Д. Дофамин и подкрепляющие системы мозга / П. Д. Шабанов, А. А. Лебедев, Ш. К. Мещеров. – СПб. : Лань, 2002. – 208 с.
196. Шараев П. Н. Изучение обмела гликозаминогликанов при воздействии на организм стрессогенными факторами / П. Н. Шараев, В. Г. Иванов, Л. И. Кутявин // Вопросы медицинской химии. – 1989. – № 4. – С. 20-23.
197. Шарова А. А. Роль системы гормон роста-инсулиноподобные факторы роста в физиологии кожи и патогенезе псориаза / А. А. Шарова // Экспериментальная и клиническая дерматокосметология. – 2011.– № 3. – С. 38-42.
198. Шахтмейстер И. Я. Тимодепрессин в терапии псориатической болезни / И. Я. Шахтмейстер, О. А. Енгалычев // Медицинская помощь. – 2001. – № 1. – С. 38-40.
199. Шевченко Т. І. Нові принципи класифікації псоріатичної хвороби / Т. І. Шевченко // Укр. журнал патології. – 2000. – № 1. – С. 36-40.
200. Шевченко Т.И. Патологическая анатомия псориатической болезни / Т. И. Шевченко, В. Г. Шлопов. – К. : ВАТ УкрНТЕК, 2001. – 305 с.
201. Шкірні та венеричні хвороби / В. Г. Коляденко, В. І. Степаненко, П. В. Федорич [та ін.]. – Вінниця : Нова Книга, 2006. – 424 с.
202. Шульман А. Я. Генетические аспекты этиологии псориаза / А. Я. Шульман // Рос. журнал кожных и венерических болезней. – 2006. – № 5. – С. 37-38.
203. Яговдик Н. З. Принципы терапии псориаза / Н. З. Яговдик, И. Н. Белугина // Межд. медицинский журнал. – 2004. – № 2. – С. 107-111.
204. Aberrant expression of apoptosis-related molecules in psoriatic epidermis / H. Takahashi, A. Manabe, A. Ishida-Yamamoto [et al.] // J. Dermatol. Sci. – 2002. – № 28. – P. 187-197.
205. A large-scale genetic association study confirms IL12B and leads to the identification of IL23R as psoriasis-risk genes / M. Cargill, S. J. Schrodi, M. Chang [et al.] // Am. J. Hum. Genet. – 2007. – № 80 (2). – P. 273-290.
206. Albanesi C. Keratinocytes in inflammatory skin diseases / С. Albanesi // Curr. Drag. Targets Inflamm. Allegry. – 2005. – Vol. 4, № 3. – P. 329-334.
207. Albanesi C. Resident skin cells in psoriasis: a special look at the pathogenetic functions of keratinocytes / C. Albanesi, O. De Pita, G. Girolomoni // Clin. Dermatol. – 2007. – № 25 (6). – P. 581-588.
208. Altered expression of angiopoietins and Tie2 endothelium receptor in psoriasis / K. Kuroda, A. Sapadin, T. Shoji [et al.] // J. Invest. Dermatol. – 2001. – Vol. 116. – P. 713-720.
209. Angiogenesis in psoriasis / D. Creamer, D. Sullivan, R. Bichnell [et al.] // Angiogenesis. – 2002. – № 5. – P. 231-236.
210. Baker B. S. Stronger proliferative response to membrane versus cell wall. Streptococcal proteins by peripheral blood T-cells in chronic plaque psoriasis / B. S. Baker, D. Brown, V. A. Fischetti // Scand. J. Immunol. – 2001. – Vol. 54, № 6. – P. 619-625.
211. Barker J. N. W. Genetic aspects of psoriasis / J. N. W. Barker // Clin. Exp. Dermatol. – 2001. – Vol. 26. – P. 321-325.
212. Boehncke W. H. Research in practice: the systemic aspects of psoriasis / W. H. Boehncke, S. Boehncke // J. Dtsch. Dermatol. Ges. – 2008. – № 6. – P. 622-625.
213. Bos J. D. Psoriasis : dysregulation of innate imunity / J. D. Bos, M. A. de Rie, M. B. Teunissen // Br. J. of Dermatology. – 2005. – Vol. 5, № 12. – P. 1098-1107.
214. Briganti S. Antioxidant activity, lipid peroxidation and skin diseases. Whats new / S. Briganti, M. Picardo // J. Eur. Acad. Dermatol. Venereol. – 2003. – Vol. 17, № 6. – Р. 663-669.
215. Calcipotriol and betamethasone dipropionate in the treatment of mild-to-moderate psoriasis: a cost-effectiveness analysis of the oitment versus gel formulation / G. L. Colombo, S. Matteo, G. Bruno [et al.] // Clinico Economics and Outcomes Research. – 2012. – Vol. 4. – P. 261-268.
216. Chistopher E. Psoriasis-epidemiology and clinical spectrum / Е. Chistopher // Clin. Exp. Dermatol. – 2001. – Vol. 26, № 3. – P. 314-320.
217. Circulating Th17, Th22 and Th1 cells are increased in psoriasis / S. Kagami, H. L. Rizzo, J. J. Lee [et. al.] // J. Invest Dermatol. – 2010. – Vol. 130. – P. 1373-1383.
218. Cis-urocanic acid stimulates primary human keratinocytes independently of serotonin or platelet-activating factor receptors / K. Kaneko, J. B. Travers, M. S. Matsui [et al.] // J. of Inv. Dermatol. – 2009. – Vol. 129, № 11. – P. 2567-2573.
219. Clark R. A. Misbehaving macrophages in the pathogenesis of psoriasis / R. A. Clark, T. S. Kupper // J. Clin. Invest. – 2006. – Vol. 116 (8). – Р. 2084-2087.
220. Consensus document on the evaluation and treatment of moderate-to-severe psoriasis: psoriasis group of the spanish academy of dermatology and venereology / E. Dauden, L. Puig, C. Ferrandiz [et al.] // J. Eur. Acad. Dermatol. Venereol. – 2016. – Vol. 30, Suppl 2. – P. 1-18.
221. Cytokine profiles during infliximab monotherapy in psoriatic arthritis / A. Mastroianni, E. Minutilli, A. Mussi [et al.] // Brit. J. Dermatol. – 2005. – Vol. 153, № 3. – P. 531-536.
222. Determinants of quality of life in patients with psoriasis: a study from the U.S. population / J. M. Gelfand, S. R. Feldman, R.S. Stern [et al.] // J. Am. Acad. Dermatol. – 2004. – № 51 (5). – P. 704-708.
223. Development of the IL-12/23 antagonist ustekinumab in psoriasis : past, present and future perspectives / N. Yeilding, P. Szapary, C. Brodmerkel [et al.] // Ann. NY Acad. Sci. – 2011. – Vol. 1222 (1). – P. 30-39.
224. Di Cesare A. The IL-23/Th17 Axis in the immunopathogenesis of psoriasis / A. Di Cesare, P. Di Maglio, F. O. Nestle // J. Invest. Dermatol. – 2009. – Vol. 129. – Р. 1339-1350.
225. Di Lernia V. Profile of tofacitinib citrate and its potential in the treatment of moderate-to-severe chronic plaque psoriasis / V. Di ernia, F. Bardazzi // Drug. Des Devel. Ther. – 2016. – Vol. 29 (10). – P. 533-539.
226. Effective narrow-band UVB radiation therapy suppresses the IL-23/IL-17 axis in normalized psoriasis plaques / L. M. Johnson-Huang, M. Suarez-Farinas, M. Sullivan-Whalen [et al.] // J. Invest. Dermatol. – 2010. – Vol. 130. – P. 2654-2663.
227. El-Darouti M. Psoriasis: highlights on pathogenesis, adjuvant therapy and treatment of resistant and problematic cases (part 1) / M. El-Darouti, R. A. Hay // J. Egypt Women Dermatol. Soc. – 2010. – Vol. 7. – P. 64-70.
228. Fisher C. Retinoid receptors and keratinocytes / C. Fisher, M. Blumenberg, M. Tomic-Canic // Crit. Rev. Oral. Biol. Med. – 1995. – Vol. 4, № 6. – P. 284-301.
229. Franssson J. Tumour necrosis factor-alpha does not influence proliferation and differentiation of healthy and psoriatic keratinocytes in a skin equivalent mode / J. Franssson // Acta Derm. Venereol. – 2000. – Vol. 80, № 6. – P. 416-420.
230. Fry L. Triggering psoriasis : the role of infections and medications / L. Fry, B. S. Baker // Clin. Dermatol. – 2007. – 25(6). – Р. 606-615.
231. Furue M. Psoriasis : behind the scenes / M. Furue, T. Kadono // J. Dermatol. – 2016. – Vol. 43 (1). – P. 4-8.
232. Ghoreschi K. Immunopathogenesis and role of T cells in psoriasis / K. Ghoreschi, C. Weigert, M. Rocken // Clin. Dermatol. – 2007. – Vol. 25. – P. 574-580.
233. Global epidemiology of psoriasis: a systematic review of incidence and prevalence / R. Parisi, D.P. Symmons, C.E. Griffiths [et al.] // J. Invest. Dermatol. – 2013. – Vol. 133 (2). – P. 377-385.
234. Gordon K.B. Update on new and emerging therapies in the management of psoriasis / K. B. Gordon // Semin Cutan Med Surg. – 2015. – Vol. 34. – P. 34-36.
235. Gudjonsson J. E. Psoriasis: epidemiology / J. E. Gudjonsson, J. T. Elder // Clin. Dermatol. – 2007. – № 25 (6). – P. 535-546.
236. Gupta M. A. The psoriasis life stress infentory : a preliminary index of psoriasis related stress / M. A. Gupta, A. K. Gupta // Acta Dermatol. Venereol. – 1995. – Vol. 75, № 3. – P. 240-243.
237. Gyurcsovics K. Pathophysiology of psoriasis: coping endotoxins with bile acid therapy / K. Gyurcsovics, L. Bertok // Pathophysiology. – 2003. – Vol. 10, No. 1. – Р. 57-61.
238. Harvima I. T. Stress, the neuroendocrine system and mast cells: current understanding of their role in psoriasis / I. T. Harvima, G. N. Nilsson // Expert. Rev. Clin. Immunol. – 2012. – Vol. 8, № 3. – P. 235-241.
239. Heydendael V. H. Methotrexate versus cyclosporine in moderate – to- severe chronic plaque psoriasis / V. H. Heydendael, P. I. Spuls, B. C. Opmeer // N. Engl. J. Med. – 2003. – Vol. 349. – Р. 658-661.
240. HLA antigens may influence the age of onset of psoriasis and psoriatic arthritis / R. Queiro, J. C. Torre, S. Gonzalez [et al.] // J. Rheumatol. – 2003. – Vol. 30, № 3. – Р. 505-507.
241. IL-22 producing T22 T cells account for upregulated IL-22 in atopic dermatitis despite reduced IL-17 producing T (H)17 T cells / K. E. Nograles, L. C. Zaba, A. Shemer [et. al.] // J. Allergy Clin. Immunol. – 2009. – Vol. 123. – P. 1244-1252.
242. Immunopathogenesis of psoriasis / R. Sabat, S. Philipp, C. Hoflich [et al.] // Journal of Experimental Dermatology. – 2007. – Vol. 16. – P. 779-798.
243. Immunopathogenic mechanisms in psoriasis / J. E. Gudjonsson, A. Johnston, H. Sigmundsdottir [et al.] // Clin. Exp. Immunol. – 2004. – Vol. 135 (1). – P. 1-8.
244. Increased blood levels of Ig G reactive with secreted streptococcus pyogenes proteins in chronic plaque psoriasis / R. G. El-Rachkidy, J. M. Hales, P. P. Freestone [et al.] // J. Invest. Dermatol. – 2007. – Vol. 127 (6). – P. 1337-1342.
245. Increased prevalence of the metabolic syndrome in patients with moderate to severe psoriasis / D. M. Sommer, S. Jenisch, M. Suchan [et al.] // Arch. Dermotol. Res. – 2006. – Vol. 298, № 7. – P. 321-328.
246. Interlеukin-22, a T(H)17 cytokine, mediates IL-23-induced dermal inflammation and acanthosis / Y. Zheng, D. M. Danilenko, P. Valdez [et. al.] // Nature. – 2007. – Vol. 445 (7128). – P. 648-651.
247. Interleukin-4 therapy of psoriasis induces Th2 receptors and improves human autoimmune disease / K. Ghoreschi, P. Thomas, S. Breit [et al.] // Nat. Med. – 2003. – Vol. 9. – P. 40-46.
248. Kaplan D.H. Psoriasis / D. H. Kaplan, J. Barker // Engl. J. Med. – 2009. – Vol. 361. – P. 496-509.
249. Karasek M. Melatonin in humans / M. Karasek, K. Winczyk // J. Physiol Pharmacol. – 2006. – Vol. 57, Suppl. 5. – P. 19-39.
250. Kinetics of circulating Th17 cytokines and adipokines in psoriasis patients / H. Nakajima, K. Nakajima, M. Tarutani [et. al.] // Arch. Dermatol. Res. – 2011. – Vol. 303. – P. 451-455.
251. Kurzeja M. New interleukin-23 pathway inhibitors in dermatology: ustekinumab, briaki-numab, and seculcinumab / M. Kurzeja, L. Rudnicka, M. Olszewska // Am. J. Clin. Dermatol. – 2011. – Vol. 12 (2). – P. 113-125.
252. Low dose cyclosporin A and methotrexate in the treatment of psoriasis / K. C. Wong, H. C. Zackheim, P. Pevet [et al.] // Acta Dermatol. Venereol. – 1997. – Vol. 79, № 1. – P. 87-89.
253. Maestroni G. J. M. Melatonin, stress and the immune system / G. J. M. Maestroni, A. Conti, W. Pierpaoli // Pineal. Ras. Rev. – 1989. – Vol. 7. – P. 203-226.
254. Malabsorption in psoriatic patients : cause or consequence? / V. Ojetti, C. De Simone, J. Aguilar Sanchez [et al.] // Scand. J. Gastroenterol. – 2006. – Vol. 41 (11). – Р. 1267-1271.
255. Machado-Pinto J. Psoriasis : new comorbidities / J. Machado-Pinto, S. Diniz Mdos, N.C. Bavoso // An. Bras. Dermatol. – 2016. – Vol. 91 (1). – P. 8-14.
256. McLoone P. An action spectrum for the production of cis-urocanic acid in human skin in vivo / P. McLoone, E. Simics, A. Barton // J. Inv. Dermatol. – 2005. – Vol. 124, № 5. – P. 1071-1074.
257. Mease P. J. Psoriatic arthriti / P. J. Mease // Bull. of The NYU Hospital For Joint Diseases. – 2011. – Vol. 69 (3). – P. 243-249.
258. Menter A. Current and future management of psoriasis / A. Menter, C. E. Griffiths // Lancet. – 2007. – Vol. 370. – P. 272-284.
259. Modulation of myocardial energy metabolism with Mildronate – an effective approach in the treatment of chronic heart failure / I. Skarda, D. Klincare, V. Dzerve [et al.] // Proc. Latvian Acad. Sci. – 2011. – Vol. 55. – P. 73-79.
260. Molteni S. Biomarkers in the pathogenesis, diagnosis, and treatment of psoriasis / S. Molteni, E. Reali // Psoriasis : Targets and Therapy. – 2012. – № 2. – Р. 55-66.
261. Nestle F. O. Psoriasis / F. O. Nestle, D. H. Kaplan, J. Barker // Engl. J. Med. – 2009. – Vol. 361. – P. 496-509.
262. Okuyama R. Notch signaling: Its role in epidermal homeostasis and in the pathogenesis of skin diseases / R. Okuyama, H. Tagami, S. Aiba // Journal of Dermatological Science. – 2008. – Vol. 49. – P. 187-194.
263. Peptidoglycan and peptidoglycan-specific Th1 cells in psoriatic skin lesions / B. S. Baker, J. D. Laman, A. V. Powles [et al.] // J. Pathol. – 2006. – Vol. 209 (2). – P. 174-181.
264. Plasma melatonin levels in psoriasis / N. Mozzanica, G. Tadini, A. Radaelli [et al.] //Acta Dermatol. Venereol. – 1988. – Vol. 68, № 4. – P. 312-316.
265. Psoriatic disease : concepts and implications / R. Scarpa, G. Altomare, A. Marchesoni [et al.] // J. of the European Academy of Dermatology and Venereology – 2010. – Vol. 24. – P. 627-630.
266. Psoriasis is characterized by accumulation of immunostimulatory and Th1/Th17 cell-polarizing myeloid dendritic cells / L. C. Zaba, J. Fuentes-Duculan, N. J. Eungdamrong [et al.] // J. Invest. Dermatol. – 2009. – Vol. 129 (1). – P. 79-88.
267. Psoriasis, the liver and the gastrointestinal tract / P. Gisondi, M. Del Giglio, A. Cozzi [et. al.] // Dermatol. Ther. – 2010. – Vol. 23, № 2. – P. 155-159.
268. Puig-Sanz L. Psoriasis, a systemic disease? / L. Puig-Sanz // Actas Dermosifiliogr. – 2007. – Vol. 98, № 6. – Р. 396-402.
269. Quality of life and psychosocial aspects in Greek patients with psoriasis: a cross-sectional study / A. Kouris, C. Christodoulou, C. Stefanaki [et al.] //An. Bras. Dermatol. – 2015. – Vol. 90 (6). – P. 841-845.
270. Role of oxidative stress in various stages of psoriasis / D. P. Kadam, A. N. Suryakar, R. D. Ankush [et al.] // Ind. J. Clin. Biochem. – 2010. – 25 (4). – P. 388-392.
271. Rott S. Recent developments in the use of biologics in psoriasis and autoimmune disorders. The role of autoantibodies / S. Rott, U. Mrowietz // B. M. J. – 2005. – Vol. 330. – P. 716-720.
272. Schon M. Psoriasis / M. Schon, W. H. Boehncke // N. Engl. J. Med. – 2005. – Vol. 352. – P. 1899-1904.
273. Stein-Gold L. F. Topical therapies for psoriasis: improving management strategies and patient adherence / L. F. Stein-Gold // Semin Cutan Med. Surg. – 2016. – Vol. 35 (2). – P. 36-44.
274. Stern R. S. Psoralen and ultraviolet A light therapy for psoriasis / R. S. Stern // N. Engl. J. Med. – 2007. – Vol. 357. – P. 682-690.
275. Stinko G. Erythrodermic psoriasis: current and future role of biologicals / G. Stinko, E. Errichetti // BioDrugs. – 2015. – Vol. 29 (2). – P. 91-101.
276. Strategies for improving the quality of care in psoriasis with the use of treatment goals a report on an implementation meeting / U. Mrowietz, K. Kragballe, A. Nast [et al.] // J. Eur. Acad. Dermatol. Venerol. – 2011. – Vol. 25 (suppl. 3). – P. 1-13.
277. Systemic treatment of pediatric psoriasis: a review / M. Napolitano, M. Megna, A. Balato [et al.] // Dermatol. Ther. – 2016. – Vol. 235. – P. 36-44.
278. Szczerkowska-Dobosz A. Human leukocyte antigens as psoriasis inheritance and susceptibility markers / A. Szczerkowska-Dobosz // Arch. Immunol. Ther. Exp. – 2005. – Vol. 53. – Р. 428-433.
279. Th17 cytokines stimulate CCl20 expression in keratinocytes in vitro and in vivo : implications for psoriasis pathogenesis / E. G. Harper, C. Guo, H. Rizzo [et. al.] // J. Invest. Dermatol. – 2009. – Vol. 129. – P. 2175-2183.
280. The influence of season, photoperiod, and pineal melatonin on immune function / R. J. Nelson, J. E. Demas, S. Klein [et al.] // J. Pineal. Res. – 1995. – Vol. 19, № 4. – P. 149-165.
281. The major psoriasis susceptibility locus PSORS1 is not a risk factor for late-onset psoriasis / M. N. Allen, H. Ameen, C. Veal [et al.] // J. Invest. Derm. – 2005. – № 124. – P. 103-106.
282. The role of hormones in the pathogenesis of psoriasis vulgaris / I. I. Roman, A. M. Constantin, M. E. Marina [et al.] // Clujul Med. – 2016. – Vol. 89 (1). – P. 11-18.
283. Traub M. Psoriasis – pathophysiology, conventional and alternative approaches to treatment / М. Traub, К. Marshall // Alternative medicine review. – 2007. – Vol. 12 (4). – P. 319-330.
284. Valdimarsson H. The genetic basis of psoriasis / Н. Valdimarsson // Clin. Dermatol. – 2007. – Vol. 25, № 6. – Р. 563-567.
285. Van de Velde V. Tailor systemic therapy to the patient with severe psoriasis / V. Van de Velde, M. J. Tidman // Practitioner. – 2016. – Vol. 260 (1790). – P. 23-26.
286. Villasenor-Park J. Psoriasis : evolving treatment for a complex disease / J. Villasenor-Park, D. Wheelir, L. Grandinetti // Cleveland Clinic Journal of Medicine. – 2012. – Vol. 79, № 6. – P. 413-423.
287. Weigle N. Psoriasis / N. Weigle, S. McBane // Am. Fam. Physician. – 2013. – Vol. 1, № 87 (9). – P. 626-633.
288. Yamamoto T. Psoriatic arthritis : from a dermatological perspective / T. Yamamoto // Eur. J. Dermatol. – 2011. – Vol. 21 (5). – P. 660-667.
289. Yosipovitch G. Obesity and the skin : skin physiology and skin manifestations of obesity / G. Yosipovitch, A. DeVore, A. Dawn // J. Am. Acad. Dermatol. – 2007. – Vol. 56, № 6. – P. 901-916.
290. Zaba L. C. Resident and «inflammatory» dendritic cells in human skin / L. C. Zaba, J. G. Krueger, M. A. Lowes // J. Invest. Dermatol. – 2009. – Vol. 129 (2). – Р. 302-308.
291. Zangeneh F. Z. The significance of stress hormones in psoriasis / F. Z. Zangeneh, А. Fazeli // Acta Medica Iranica. – 2008. – Vol. 46 (6). – P. 485-488.
Додаток А
Акти впровадження







