Міністерство охорони здоров’я України
Запорізький державний медичний університет
На правах рукопису
Аббуд Аймен
УДК 616.517-092-039:57.038]-085-045.34
Оптимізація комплексної терапії псоріазу з урахуванням клінічних особливостей і стану регулюючих систем гомеостазу
14.01.20 – шкірні та венеричні хвороби
Дисертація на здобуття наукового ступеня
кандидата медичних наук
Науковий керівник:
Федотов Валерій Павлович
доктор медичних наук,
професор
Запоріжжя – 2016
| Перелік умовних позначень | 4 |
| Вступ | 6 |
| Розділ 1 Огляд літератури | 12 |
| 1.1 Поширеність, етіопатогенез та особливості перебігу псоріазу на сучасному етапі | 12 |
| 1.2 Сучасні підходи до терапії псоріазу | 25 |
| Розділ 2 Матеріали та методи дослідження | 30 |
| 2.1 Матеріали дослідження | 30 |
| 2.2 Методи дослідження | 30 |
| 2.2.1 Загальні клініко-лабораторні методи | 30 |
| 2.2.2 Імунологічні методи | 31 |
| 2.2.3 Визначення тяжкості перебігу псоріазу | 33 |
| 2.2.4 Психофізіологічні методи | 34 |
| 2.2.5 Електрофізіолoгічне обстеження | 36 |
| 2.2.6 Статистична обробка отриманих результатів | 37 |
| 2.3 Клінічна характеристика хворих | 37 |
| Розділ 3 Особливості нервово-ендокринного стану у хворих на псоріаз чоловіків та жінок | 45 |
| 3.1 Психологічний статус хворих на псоріаз | 45 |
| 3.2 Стан вегетативної нервової системи у хворих на псоріаз в залежності від статі | 50 |
| 3.3 Стан ендокринної ланки гомеостазу у хворих на псоріаз в залежності від статі | 53 |
| 3.4 Активність гуанілатциклазної месенджерної системи у хворих на псоріаз | 56 |
| Розділ 4 Особливості імунного статусу у хворих на псоріаз в залежності від статі | 59 |
| 4.1 Дослідження популяцій та субпопуляцій лімфоцитів у хворих на псоріаз чоловіків та жінок | 59 |
| 4.2 Цитокіновий профіль у хворих на псоріаз чоловіків та жінок | 64 |
| 4.3 Дослідження функціональної активності фагоцитарних клітин у хворих на псоріаз чоловіків та жінок | 67 |
| 4.4 Показники гуморального імунітету у хворих на псоріаз чоловіків та жінок | 69 |
| Розділ 5 Диференційовані показання і методика комплексної терапії хворих на псоріаз, оцінка її результатів і профілактика рецидивів з урахуванням гендерних особливостей | 72 |
| 5.1 Обґрунтування диференційованих показань та виділення клініко-терапевтичних груп | 72 |
| 5.2 Обґрунтування комплексної диференційованої терапії хворих на псоріаз в залежності від статі | 76 |
| 5.3 Оцінка ефективності проведеної терапії з визначенням найближчих та віддалених результатів лікування хворих на псоріаз різної статі | 79 |
| Розділ 6 Аналіз та узагальнення отриманих результатів | 92 |
| Висновки | 108 |
| Список використаних джерел | 111 |
| Додаток А Акти впровадження | 131 |
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
АКТГ – адренокортикотропний гормон
АТ – антитіла
ВНС – вегетативна нервова система
ВСР – варіабельність серцевого ритму
ГЦ – гуанілатциклаза
КТ – кортизол
РД – рівень депресії
ТТГ – тиреотропний гормон
цАМФ – циклічний аденозинмонофосфат
цГМФ – циклічний гуанозинмонофосфат
ФНП-α – фактор некрозу пухлин-α
ФЧ – фагоцитарне число
СD3+ – загальні зрілі Т-лімфоцити
СD4+ – Т-хелпери
СD8+ – Т-супресори
CD4+/CD8+ – імунорегуляторний індекс
CD16+ – натуральні кілери
CD19+ – зрілі В – лімфоцити
CD25+ – низькоофінний рецептор до інтерлейкіну-2
CD95+ – рецептор апоптозу
DLQI – Dermatology Quality of Life Index, дерматологічний індекс якості життя
НСТ-тест – тест відновлення нитросинього тетразолію
HF – високочастотні хвилі
IFN-γ – інтерферон-γ
Ig – імуноглобулін
LF – низькочастотні хвилі
LF/HF – індекс співвідношення низькочастотних і високочастотних хвиль
NK – натуральні кілери
PASI – Psoriasis Area Severity Index
SDNN – стандартне відхилення NN інтервалів
Th – Т-лімфоцити хелпери
ТР – триангулярний індекс варіабельності
VLF – дуже низькочастотні хвилі
ВСТУП
Актуальність теми. Псоріаз є одним із найбільш поширених хронічних дерматозів. Він зустрічається приблизно у 1,5 – 4,6 % населення планети, і за даними різних авторів питома вага складає до 12-15 % усіх дерматозів [11, 30, 39, 174]. Недостатня вивченість етіології та окремих ланок патогенезу, відсутність адекватних методів лікування є передумовою подальшого вивчення цього захворювання. У теперішній час псоріаз трактують як мультифакторне захворювання, обумовлене генетичними чинниками, з впливом імунних та середових факторів [36, 37, 96, 105]. Для псоріазу характерні гіперпроліферація епідермальних клітин, порушення процесу кератинізації на тлі запальної реакції в дермі, з формуванням характерного ураження шкіри, нігтів, суглобів і волосистої частини голови.
Більшість авторів провідну роль у механізмі розвитку псоріазу відводять генетичній теорії, а серед провокуючих факторів – інфекційним, хімічним, фізичним, медикаментозним, біологічним чинникам, а також неадаптованому харчуванню і психогенному стресу [33, 48, 64]. На думку інших дослідників, провідну роль відіграють порушення адаптаційно-компенсаторних та нейроендокринних механізмів регуляції гомеостазу, які пов’язані з внутрішньоклітинним метаболізмом і системою вторинних посередників [21, 34, 66, 77, 85].
До кінця не з’ясовані вірусна, імунна і автоімунна теорії розвитку псоріазу, тому що вони досить суперечливі і навіть заперечують одна одній. Більшість дослідників виявляють порушення в Т-клітинній ланці імунітету, яка проявляється зниженням вмісту Т-лімфоцитів, зокрема Т-хелперів, на фоні підвищення або зниження рівня Т-супресорів, а також зменшення співвідношення CD4+/CD8+. Це пов’язують з накопиченням Т-хелперів у псоріатичних вогнищах і активацією макрофагів, які синтезують широкий спектр протизапальних медіаторів, насамперед цитокінів, таких як фактор некрозу пухлин (ФНП-α) та інтерлейкіну (IL) -1ß [37, 38, 46, 47, 53].
За даними статистики захворюваність на псоріаз серед жінок і чоловіків майже однакова [135]. Між тим, вивчення конкретних відмінностей між жінками і чоловіками викликає величезний інтерес у різних галузях медицини, в тому числі дерматології [133, 137]. Однак дані щодо гендерних відмінностей різних аспектів псоріазу, таких як епідеміологія, генетика, фактори ризику, якість життя, клінічні та терапевтичні аспекти, дотепер залишаються, розрізненими, суперечливими та не комплексними [25, 31].
Це визначає актуальність поглибленого вивчення гендерних особливостей взаємозв`язку психоемоційного стану, клінічних, імунологічних, гормональних, метаболічних змін при псоріазі, що відкриває перспективи більш повного розуміння патогенезу захворювання та розвитку його ускладнень, та буде сприяти удосконаленню прогнозу та розробці диференційованих індивідуальних підходів до лікування цієї патології.
Зв’язок роботи з науковими програмами, планами, темами. Робота є фрагментом комплексної науково-дослідної роботи Запорізького державного медичного університету «Розробка методів терапії та профілактики рецидивів хронічних дерматозів та хвороб, що передаються статевим шляхом із урахуванням особливостей гомеостазу хворих та супутньої патології» (№ державної реєстрації 0113U000800). Термін виконання: 01.12.2012 – 01.12.2017 рр. Дисертантом особисто виконано фрагменти комплексної роботи, які присвячені вивченню етіопатогенетичних механізмів розвитку та клінічних особливостей перебігу псоріазу в залежності від статі хворих.
Мета і задачі дослідження. Мета – оптимізація терапії псоріазу шляхом розробки комплексного методу лікування на підставі вивчення клінічних особливостей і стану регулюючих систем гомеостазу хворих чоловіків та жінок.
Задачі дослідження:
1. Провести порівняльний аналіз клінічних особливостей та перебігу хворих на псоріаз, супутньої та перенесеної патології, тригерних факторів з урахуванням статі хворих.
2. Визначити психоемоційний статус, якість життя, стан вегетативної нервової системи у динаміці спостереження у хворих на псоріаз чоловіків та жінок.
3. Вивчити гормональний статус (вміст тиреотропного гормону (ТТГ), адренокортикотропного гормону (АКТГ), кортизолу [КТ]), рівень циклічного гуанозинмонофосфату (цГМФ) та активність гуанілатциклази (ГЦ) у хворих на псоріаз чоловіків та жінок до і після терапії.
4. Дослідити імунний статус з урахуванням стану лімфоцитарних реакцій, вмісту імуноглобулінів (Ig), рівня протизапальних цитокінів, неспецифічних факторів захисту у хворих на псоріаз чоловіків та жінок до і після терапії.
5. Провести зіставний аналіз у кожного хворого клінічних особливостей псоріазу, а також результатів лабораторних та функціональних досліджень, що дозволить виявити різні рівні порушень і об’єднати хворих у клініко-терапевтичні групи на підставі аналізу залежно від статі.
6. З урахуванням виділених груп хворих різної статі розробити методику комплексної диференційованої терапії хворих різної статі та оцінити найближчі та віддаленні результати лікування.
Об’єкт дослідження: псоріаз.
Предмет дослідження: стан нервово-ендокринної системи, психофізіологічні показники, імунний статус у хворих на псоріаз залежно від статі пацієнтів.
Методи дослідження: клінічні, загально лабораторні, електрофізіологічні, психофізіологічні, біохімічні, імунологічні та статистичні.
Наукова новизна отриманих результатів. Доповнено наукові дані про клінічні особливості псоріазу, характер супутньої патології, роль тригерних факторів залежно від статі хворих.
Розширено наукові дані про стан вегетативної нервової регуляції, психофізіологічні, імунні та ендокринні статуси у хворих на псоріаз з урахуванням гендерних факторів.
Вперше було проведено порівняльний аналіз анамнестичних даних клінічних особливостей вегетативної регуляції, психофізіологічного стану, імунного та ендокринного статусу у хворих на псоріаз різної статі, що дозволило виділити різні рівні порушень і об’єднати пацієнтів у клініко-терапевтичні групи.
Розроблено і науково обґрунтовано комплексну диференційовану терапію, надано клініко-терапевтичну оцінку найближчих та віддалених результатів.
Практичне значення отриманих результатів. Розроблено та впроваджено в роботу лікарів-дерматовенерологів рекомендації щодо визначення об’єктивних клініко-лабораторних критеріїв до призначення комплексної диференційованої терапії хворих на псоріаз залежно від статі. Розроблено комплексний метод терапії псоріазу (патент на корисну модель № 101697 UA від 25.09.2015).
Впроваджено в роботу лікарів-дерматовенерологів оригінальну диференційовану методику комплексної терапії хворих на псоріаз різної статі з індивідуальним використанням патогенетичних засобів (антибіотиків, імуномодуляторів, седативних засобів, антидепресантів, препаратів, нормалізуючих обмінні процеси), що дозволило підвищити її ефективність за рахунок скорочення терміну лікування, збільшення кількості хворих з повною клінічною ремісією, подовження міжрецидивного періоду.
Впровадження результатів дослідження. Основні положення дисертації впроваджено в практику роботи Комунальної установи «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради, Комунальної установи «Одеський обласний шкірно-венерологічний диспансер», Комунального закладу «Обласний шкірно-венерологічний диспансер» (м. Дніпропетровськ), Комунального закладу «Рівненський обласний шкірно-венерологічний диспансер», а також у педагогічний процес кафедри шкірних та венеричних хвороб Державного закладу «Дніпропетровська медична академія МОЗ України», кафедри дерматології, венерології і СНІДу Харківського національного медичного університету, кафедри дерматовенерології та косметології з курсом дерматовенерології і естетичної медицини факультету післядипломної освіти Запорізького державного медичного університету, кафедри шкірних та венеричних хвороб Державного вищого навчального закладу «Івано-Франківський національний медичний університет».
Особистий внесок здобувача. Дисертаційна робота є науковою працею здобувача. Дисертантом разом із науковим керівником визначено мету і завдання роботи. Самостійно здійснено патентний пошук і аналіз даних наукової літератури, проведено клінічне обстеження та лікування 100 хворих на псоріаз, більшість лабораторних досліджень, виконано облік та оцінку показників результатів обстеження, написані усі розділи дисертації, підготовлено до друку наукові публікації, сформульовано висновки.
Автором спільно з Кірієнко В.О., співробітником кафедри дерматовенерології та косметології з курсом дерматовенерології и естетичної медицини факультету післядипломної освіти Запорізького державного медичного університету, було досліджено коморбідні стани у хворих на псоріаз. Дисертантом особисто сформульовано мету дослідження, проведено статистичну обробка даних, узагальнення результатів.
Автором спільно з Макарчук О.І., співробітником кафедри дерматовенерології та косметології з курсом дерматовенерології и естетичної медицини факультету післядипломної освіти Запорізького державного медичного університету, було досліджено фактори розвитку псоріатичної хвороби. Особисто проведено обстеження та проаналізовано отримані результати.
Дисертантом не запозичено результати та ідеї співавторів публікацій.
Апробація результатів дисертації. Основні положення роботи доповідались і обговорювалися на науково-практичних конференціях: «Актуальні питання косметології та дерматології» (Запоріжжя, 2016), «Сучасні аспекти медицини і фармації – 2016» (Запоріжжя, 2016), засідання асоціації дерматовенерологів Запорізької області (Запоріжжя, 2016).
Публікації. За матеріалами дисертації опубліковано 10 друкованих праць, із них 6 статей (4 – у моноавторстві, з них 2 – у виданнях, що входять до міжнародної наукометричної бази Російський індекс наукового цитування), 2 тез доповідей у збірниках матеріалів наукових конференцій, 1 клінічна лекція, 1 патент на корисну модель.
РОЗДІЛ 1
ОГЛЯД ЛІТЕРАТУРИ
1.1 Поширеність, етіопатогенез та особливості перебігу псоріазу
на сучасному етапі
Псоріаз – хронічний папуло-сквамозний дерматоз мультифакторної природи, який є найбільш поширеним дерматозом серед населення. Так, частка псоріазу в структурі дерматологічної патології становить 10-12 %, а серед хворих дерматологічних стаціонарів сягає 22 % [7, 8, 9, 11, 39]. Дане захворювання уражає однаково часто як чоловіків, так і жінок.
Псоріаз рідко призводить до гибелі хворих, але значно часто – до інвалідізації, що погіршує якість життя пацієнтів [23]. Важливість проблеми вивчення псоріазу пояснюється не тільки його розповсюдженістю, але й хронічним, рецидивуючим перебігом, розвитком тяжких резистентних форм із подальшою втратою працездатності [45, 67, 99, 102].
Псоріаз характеризується гіперпроліферативними змінами епідермальних клітин з порушенням кератинізації, запальною реакцією в дермі, а також патологічними змінами у різних органах і системах [35, 78]. Захворювання характеризується ураженням те тільки шкіри, але й залучанням до патологічного процесу багатьох інших органів та систем організму, важлива роль серед яких відводиться імунологічним, аутоімунним змінам а також метаболічним порушенням, зокрема ліпідному обміну [9, 11, 54, 60, 78].
Незважаючи на велику кількість робіт, присвячених вивченню проблеми псоріазу, питання щодо походження дерматозу є дискутабельним і на сьогодні не існує єдиної загальноприйнятої концепції розвитку захворювання [126, 148, 149].
Деякі дослідники розвиток псоріатичного процесу пов’язують з дією інфекційних факторів, а саме – стрептококу [184]. Інфекційні захворювання впливають на перебіг дерматозу, послаблюють імунітет, змінюють стан вегетативної нервової системи хворого. Так, найбільша кількість рецидивів припадає на осінньо-зимовий та весняний період, коли спостерігається найбільша кількість захворюваності на гострі респіраторні вірусні інфекції, ангіни [56, 59, 65, 69, 92, 147]. Слід зазначити, що найчастіше несприятливому перебігу псоріазу сприяє хронічний тонзиліт.
При гострій або хронічній інфекції із ділянки інфекції надходять імпульси в вегетативний відділ центральної нервової системи, що змінює реактивність імунобіологічних систем організму [63, 132, 141]. Так, деякі автори вважають, що пошкодження захисних регуляторних систем організму відбувається під впливом токсинів. Значна роль відводиться вірусній теорії, згідно з якою віруси вбудовуються в геном та порушують код спадкової інформації, і таким чином створюється новий геном трансформованих клітин зі зміненими спадковими властивостями [36, 96, 104, 105, 150].
Однією з основних теорій виникнення псоріазу є генетична. Популяційні дослідження виявили часті випадки захворювання серед родичів з часткою генетичного компоненту 60-70 % [176]. Одним із основних процесів розвитку гіперпроліферації кератиноцитів є успадкована дисрегуляція клітинного циклу внаслідок порушення обміну його інгібіторів. Псоріаз I типу, для якого характерним є ранній початок захворювання (до 40 років), пов’язаний з системою HLA антигенів (HLA-В13, HLA-В17, HLA-Вw57, HLA-Cw6). Псоріаз II типу з пізнім початком (після 40 років) не успадковується і не асоціюється з системою HLA антигенів [137, 168, 191].
Обмінна теорія базується на чисельних дослідженнях, які свідчать про порушення обміну речовин, особливо ліпідного, у хворих на псоріаз. Домінуючими структурними елементами ліпідів епідермісу виступають жирні кислоти, які є базовим компонентом клітинних мембран, захисної ліпідної мантії шкіри. Ендогенні жирні кислоти діють як медіатори проліферації та диференціації епідермальних клітин, і таким чином, впливають на розвиток запального процесу. Це дозволяє розглядати псоріаз як «холестериновий діатез» або ж «ліпоідоз шкіри», що пов’язано з підвищенням вмісту загальних ліпідів та холестерину у крові хворих на псоріаз [156, 165, 170]. Також слід зазначити, що велика увага приділяється вивченню активності процесів перекисного окислення ліпідів [69, 71, 74, 82, 103, 107]. Патологічний стан при псоріазі супроводжується змінами окисного метаболізму, серед яких вагоме місце займає оксидативний стрес, що характеризується значним підвищенням активності процесів перекисного окислення ліпідів та накопиченням вільних радикалів [84, 101].
Початок ендокринної теорії розвитку псоріазу був покладений А. Г. Полотебновим, який у своїх роботах описав виникнення і загострення псоріазу у жінок під час менструацій. Відомі також випадки розвитку дерматозу під час грудного вигодовування та зникнення проявів захворювання до наступної вагітності, що вказує на роль гормональних змін у розвитку та перебігу псоріазу [73, 162, 177].
Г. М. Беляєв та П. П. Рижко пов’язують особливості перебігу псоріазу із системою адаптації, при цьому вказують на головну роль системи гіпоталамус – гіпофіз – кора наднирників [11]. Адаптація хворих на псоріаз до різних подразників відбувається зі змінами гормонально-метаболічних показників, що призводить до зниження стійкості організму і загострення псоріатичного процесу [12, 21, 34, 66, 77, 85, 151, 157].
Як вже зазначалось вище, в основі розвитку псоріазу лежить генетична схильність. Реалізація генетичної програми, що призводить до маніфестації псоріатичного процесу, здійснюється під контролем і при участі нейроендокринної системи [18, 120, 164, 171, 181]. У той же час, саме нейроендокринна система першою реагує на зовнішні впливи, зокрема, стрес, і виступає своєрідним посередником між зовнішнім середовищем і шкірним покривом.
Важливу етіопатогенетичну роль у розвитку псоріазу відіграють провокуючі чинники, зокрема нервово-психічні фактори (вегетативні розлади та психоемоційні порушення), які об’єднуються терміном «дезадаптація». Психосоціальні чинники все частіше розглядають як пусковий тригер захворювання [64, 81, 90, 167, 173, 180]. Хоча псоріаз не відноситься до захворювань, які загрожують життю але досить чуттєво впливає на стан хворих. Деякі хворі відмічають, що краще погодилися б мати тяжке захворювання без видимих ознак ураження шкіри, ніж псоріаз. Наявність висипів на шкірі викликає дисморфофобію, хворі відмічають невпевненість при спілкуванні з оточуючими, труднощі в інтимній сфері, уникають міжособистісних контактів. При багатьох дослідженнях у хворих на псоріаз встановлено наявність тривоги, депресії, астеновегетативних порушень. У пацієнтів із тяжким, часто рецидивуючим перебігом дерматозу посилюється ризик виникнення депресії з думками про самогубство.
Про вплив нервової системи на патогенез псоріазу свідчить той факт, що висипка розташована по ходу нервового волокна, локалізується симетрично, у ділянках ураження шкіри порушуються процеси пото- та саловиділення, електропровідність, всі види чутливості, а у деяких випадках зміни зберігаються після клінічного видужування. Згідно з нервово-психічною теорією, стресові ситуації ініціюють каскад біохімічних та імунологічних реакцій, що призводять до розвитку псоріатичної висипки. Під впливом екзо- та ендогенних подразників із нервової тканини вивільняються нейропептиди (субстанція Р), які активують імунокомпетентні клітини та медіатори запалення. Субстанція Р ініціює ряд імунних та метаболічних процесів, що призводить до посилення проникності судин і вазоділятації, сприяючи ізоморфній реакції. Нейрогенні впливи на виникнення і перебіг псоріазу підтверджується терапевтичним ефектом при застосуванні медикаментозних препаратів, направлених на нормалізацію функцій центральної та вегетативної нервової систем у хворих, позитивні впливи гіпно-та рефлексотерапії.
Шкіра приймає активну участь у взаємодії нервової, ендокринної, імунної систем: в шкірі знайдені рецептори до багатьох біологічно активних речовин, і сама шкіра приймає участь у їх синтезі. Звідси роль психоневрологичних, ендокринних та імунних взаємодій у розвитку псоріазу. При цьому шкіра може розглядатися як один із головних органів, який відіграє роль у реакції організму на стрес і розвитку стану тривоги [127, 128, 131].
Але, існує думка, що функціональні порушення зі сторони нервової системи у хворих на псоріаз є вторинними, що є наслідком дерматозу [52]. Як стрес може провокувати загострення псоріазу, так, у свою чергу, поширений шкірний процес формує нозогенні психічні розлади тривожно-депресивного характеру. При псоріазі симптоми невротичного характеру виявляють у 50 % чоловіків та 70 % жінок.
Тривалий імунозапальний процес та тривожно-депресивні розлади сприяють зриву адаптації [10, 13, 111, 142, 143, 144], що супроводжується активацією гіпоталамо-гіпофізарно-наднирникової системи з розвитком дисбалансу в роботі вегетативної нервової системи (ВНС). Саме ВНС є основним регулятором гомеостазу. Вона забезпечує процеси адаптації до різних подразнюючих факторів, та відіграє значну роль в регуляції серцево-судинної діяльності [112, 136]. Метод варіабельності серцевого ритму (ВСР) [5, 26, 100], дозволяє оцінити стан ВНС, широко використовується в медичній практиці. За допомогою методу ВСР можемо судити про хід пристосувальних та адаптивних реакцій, функціональних можливостях організму при психічному та фізичному навантаженні, прогнозувати та оцінювати ступінь вираженості психоемоційних розладів.
Багатьма дослідниками відмічено, що псоріаз є дерматозом з виключно гіперпроліферативними явищами, запалення та інфільтрацію шкіри імунними клітинами вважали другорядними явищами, а сучасні погляди на псоріаз вказують на важливість імунного компоненту у розвитку захворювання.
Про важливість змін в імунних процесах у хворих на псоріаз неодноразово згадувалось в літературі [4, 9, 20, 46, 70, 87, 119]. В теперішній час накопичено велику кількість матеріалу, який свідчить про порушення імунної системи при псоріатичній хворобі. Це питання є актуальним в дерматології взагалі, так як шкіра є високоорганізованим органом імунної системи і часто уражується при імунопатологічних станах [17, 46, 75, 79, 124]. Відомі дані про структурно-функціональні зміни різних популяцій імунокомпетентних клітин при псоріазі. При цьому показані зміни як компонентів клітинного так і гуморального імунітету [28, 46]. Незважаючи на суперечливість трактування імунних порушень, центральна роль гіперактивації підсистеми Т-лімфоцитів в патогенезі захворювання є найбільш визнаною науковцями [20, 158]. Розробка цього аспекту із застосуванням сучасних високочутливих біотехнічних методів спрямована на отримання детальної характеристики субпопуляцій Т-лімфоцитів, цитокінів, які приймають участь в регуляції міжклітинної взаємодії, та в кінцевому підсумку, в визначені того спеціфічного (або неспеціфічного) антигенного впливу, який виступає тригерним механізмом розвитку захворювання [154].
Встановлений гіперактивний стан Т-хелперів при псоріазі розглядають у якості головного механізму, що призводить до епідермальної проліферації з порушенням диференціювання кератиноцитів, розширенням судин, проліферацією і кумуляцією нейтрофілів і Т-лімфоцитів [121, 140, 142, 143]. Активація Т-клітин є ключовою подією у каскаді взаємодій клітин запального інфільтрату, кровоносних судин і кератиноцитів [182, 183, 186].
Завдяки багаточисельним та всебічним дослідженням різних аспектів псоріатичної хвороби із застосуванням сучасних методів молекулярної біології, більшість науковців, в якості пріоритетної розглядають точку зору, згідно якої Т-супресорна недостатність виступає ведучою ланкою в патогенезі псоріазу [43, 47, 166]. Низький рівень Т-лімфоцитів супресорів в поєднанні з підвищеним утворенням патологічних імунних комплексів, вміст яких за даними багатьох авторів прямо пропорціонально залежить від активності та важкості протікання захворювання, надає підставу стверджувати про суттєве значення в патогенезі псоріазу автоімунного компоненту [108, 179]. При тому, спочатку до процесу залучаються Т-лімфоцити, з наступною активацією та проліферацією кератиноцитів.
Встановлено, що Т-супресорний дефіцит обумовлює зниження толерантності до особистих антигенів, в результаті чого селективний дефіцит супресорного впливу дозволяє В-клітинам продукувати антитіла (AT) в надмірній кількості в тому числі авто-АТ [80]. При дослідженні гуморальних автоімунних процесів за допомогою реакцій пасивної гемаглютинації було виявлено досить високий рівень авто-АТ у певної частини хворих на псоріаз. Взагалі, ставлення науковців до ролі порушень системи В-імунітету в патогенезі псоріазу дуже суперечливе. Згідно спостереженням [28], були виявлені виражені порушення на рівні В-ланки імунітету. Відмічалась активація В-лімфоцитарної системи, особливо у хворих з дифузними формами захворювання, а також ускладненими псоріатичною артропатією. Ступень активації порушень залежить від давнини захворювання. Перевищення рівня В-лімфоцитів у хворих з тривалістю захворювання більш ніж 10 років перевищувала цей показник приблизно в 1,4 разу ніж у хворих, страждаючих на псоріаз менш ніж 1 рік.
В теперішній час встановлено, що в патогенезі псоріатичної хвороби ключову роль грає гіперпроліферація кератиноцитів шкіри [116]. Як показують дослідження, мітотичний цикл в клітинах епідермісу виявляється дуже прискореним, тобто замість 150 годин, як це відбувається у здорових людей, він становить 37,5 годин у хворих на псоріаз. В місцях псоріатичних висипок, проліферативна активність епідермісу збільшена в 7-10 разів. Цикл диференціювання від базального ару до рогового завершується за 3-4 дні, в той час коли в епідермісі здорової людини на цей процес потрібно 27-28 днів [28, 53]. Ініціація цього процесу може визначатися генетичною схильністю до високого рівня самих кератиноцитів або їх взаємодією з активованими Т-лімфоцитами та розвитком локального хронічного запалення – експресією на ендотелії судин шкіри молекул адгезії, а також утворенням хемокінів [169]. Було встановлено приплив активованих Т-хелперів в епідерміс ще до появи патологічних висипок, та навпаки при спонтанному регресуванні псоріатичних бляшок в епідермісі спостерігається збільшення Т-супресорів [97].
При псоріатичній хворобі спостерігається суттєвий дисбаланс цитокінів як в крові так і в шкірі [189]. У дермальних інфільтратах шкіри, ураженої псоріатичними висипками, поряд з Т-лімфоцитами, які виявляються в переважної кількості, визначаються також клітини моноцитарно-макрофагального ряду (CD11а+ клітини) та клітини Лангерганса, які відповідальні, головним чином за розвиток реакцій сповільненої гіперчутливості [63, 80, 189]. Клітинам Лангерганса належить важлива роль в активації Т-лімфоцитів. Завдяки ним здійснюється синтез цитокінів “тривоги” – ІL-1, пухлино-некротизуючого фактору. Також вони приймають участь в презентації імунних пептидів для мігрувавших в шкіру лімфоцитів [91, 183, 188, 189]. Було з’ясовано, що Т-хелпери 1-го порядку, в шкірі виробляють ІL-2 та гама-інтерферон (IFN-γ), які належать до цитокінів з прозапальною активністю. Підвищене утворення ІL-2 в шкірі може призводити до активації проліферації кератиноцитів, а збільшення синтезу IFN-γ – до активації ендотеліоцитів з кератиноцитами за рахунок експресії на них молекул HLA-Dr антигену. Виявлено присутність Т‑лімфоцитів, експресуючих як HLA-Dr – антиген, так і ІЛ-2 – рецептор в дермальних інфільтратах, що свідчить про наявність активованих імуноцитів в ділянках шкіри, уражених псоріатичними висипками.
Т-лімфоцити хелпери 2-го порядку в шкірі синтезують ІL-4, ІL-5, IL-6 та ІL-10. Деякі автори вважають ІL-6 одним з ключових цитокінів, задіяних в розвитку псоріатичної запальної реакції [188]. Це пов’язують перш за все з його властивостями підсилювати проліферативні процеси в кератиноцитах, а також стимулювати В-лімфоцити, значно підвищувати цитотоксичну активність ЕК-клітин, а також продукцію ІЛ-2 моноцитами / макрофагами [190].
Кератиноцити також здатні виробляти ІL-8, який володіє потужною хемотаксичною активністю для нейтрофільних гранулоцитів та лімфоцитів, чим пояснюється скупчення нейтрофілів у верхніх відділах епідермісу та утворення мікроабсцесів Мунро у хворих на псоріаз [118, 123].
Зацікавленість викликають дослідження, стосовно участі ІL-12 в розвитку імунологічних реакцій в патогенезі псоріазу [123]. ІL-12 – це гетерогенний цитокін, який складається з 2-х ковалентно поєднаних підгруп, р35 та р40. Синтез ІL-12 здійснюють переважно моноцити / макрофаги, хоча в окремих працях повідомлялось, що деякі інші клітини, в тому числі поліморфноядерні лейкоцити та кератиноцити також є джерелом ІL-12 in vitro. IL-12 здійснює плеотропну дію на NK-клітини та Т-лімфоцити, які головним чином активують утворення IFN-γ.
В результаті проведених імуногістохімічних досліджень, авторами було продемонстровано значне збільшення виявлення ІL-12 в ділянках шкіри ураженої псоріазом, на відміну від здорової шкіри та дільниць вільних від патологічних висипок. Імунореактивний ІL-12 переважно локалізувався в сосочковому шарі дерми в цитоплазмі мононуклеарних клітин та нейтрофілах. Висловлюється припущення, що макробактеріофаги виявляються домінуючим джерелом ІL-12. Крім того дослідження доводять, що кератиноцити не виступають головним джерелом біологічно активного ІL-12 р70 при псоріазі. Встановлена Т-клітинна дисрегуляція грає важливу роль в патогенезі цього шкіряного захворювання. Поява моноцитів/макрофагів та DC-клітин одночасно з Т-лімфоцитами розглядається як одне з початкових порушень в розвитку псоріатичних уражень, які передують шкірної гіперплазії [116, 125].
Зважаючи на те, що IFN-γ уявляє особливу важливість в розвитку та підтримці патологічного процесу, а також приймаючи до уваги підсилену продукцію ІL-12 in situ можна припустити, що цей цитокін виконує вирішальну роль в поляризації Т-клітин, стимулюючи секрецію IFN-γ. Утворення ІL-12 регулюється і позитивними і негативними механізмами зворотного зв’язку, що включають IFN-γ, гранулоцитарно-моноцитарний колоностимулюючий фактор (GM-CS 7), а також ІL-4, ІL-10 та трансформуючий фактор росту – b відповідно [142]. Крім того, IL-10, головний фактор, який регулює зниження рівня ІL-12, як було установлено, ледве помічався при псоріазі. Це може бути також причиною для підсилення утворення IL-12 при псоріазі. Цікаво, що дослідники не виявили присутності IL-12 в епідермісі. Таким чином, було зроблено припущення, що певне мікросередовище з Т-клітин та цитокінів, зокрема IFN-γ, виявленого у верхньому шарі дерми визнаються відповідними за продукцію IL-12. Виникає припущення, що будь-які чинники, зокрема автоантигени, спроможні посилювати протікання псоріазу через індукцію та секрецію IL-12. Згодом, опріч Т-клітинного запалення in situ, IL-12 цілком імовірно також грає важливу роль в індукції нових псоріатичних уражень. Відомі дані, в яких зазначається про покращення клінічного перебігу псоріазу паралельно зі зменшенням секреції ІЛ-12 [158].
Заслуговує на увагу ще один цитокін, за синтез якого відповідні клітини Лангерганса – ФНП-α. Доведено, що ФНП-α подібно IFN-γ, що виробляється Т-лімфоцитами, індукує появу на кератиноцитах та ендотеліальних клітинах молекул ІСАМ-1, а також експресію кератиноцитами HLA-Dr антигену, чим викликає зміни, характерні для псоріатичної хвороби [14, 127, 153].
Вважається, що рівновага між Т-хелперами 1 та Т-хелперами -2 в шкірі визначає тип імунної реакції при контакті з антигенами [143]. При гіпертрофічних дерматитах, до якого належить і псоріаз, мають перевагу Т-хелпери-1 та їх діяльність визначає особливості розвитку патологічного процесу. Поняття “чутлива шкіра” при псоріазі включає надмірні реакції цього органу на різні діяння зовні. Це обумовлюється продукцією цитокінів, які виробляються клітинами, учасниками імунних реакцій. При псоріазі в шкіру з кров’яного русла мігрує велика кількість нейтрофілів. Вони утворюють при «дихальному» вибуху високореактивні кисневі продукти – супероксидний аніон-радикал, перекис водню, гіпохлорну кислоту та інші метаболіти [145].
У псоріатичних осередках переважаючими є цитокіни Th-1 типу: IFN-γ і ФНП-α, IL-12. ФНП-α розглядають як основний цитокін в каскаді автоімунних порушень при псоріазі і потужний модифікатор запальних імунних реакцій. Одночасно з підвищенням рівню TNF-α відбувається підвищення рівнів IL-1β, -2, -6, -7, -8 і IFN-γ [163, 166, 185, 187, 188].
Головний цитокін IFN-γ продукують антигенпрезентуючі клітини, CD4+ і CD8+ Т-лімфоцити і кератиноцити. IFN-γ і TNF-α активують кератиноцити до продукції IL-6, -7, -8, -12, -15, -18. IFN-γ та інші цитокіни є причиною гіперпроліферації кератиноцитів [109, 178, 179], а IFN-γ і IL-15 збільшують резистентність кератиноцитів до апоптозу. Важливу роль в гіперпроліферації епідермісу при псоріазі відіграє також підвищена продукція TNF-α і епідермального фактору росту. Таким чином формується запальна папула, яка є наслідком внутрішньоепідермальної інфільтрації CD8+ Т-лімфоцитами і нейтрофілами [161, 166, 182].
Останнім часом дослідники велику увагу приділяють наявності супутньої патології при псоріазі, при цьому уражаються не тільки шкіра, суглоби, а також серце, печінка, нирки. Дуже часто перебіг псоріазу супроводжує метаболічний синдром, цукровий діабет, ожиріння, серцево-судинні захворювання що обтягує перебіг дерматозу [115, 122]. Значне місце серед супутньої патології відводиться захворюванням гепатобіліарної системи з порушенням синтетичної функції печінки, особливо у чоловіків, що пов’язано з частим зловживанням алкоголю серед чоловіків [111, 159, 175].
Псоріаз починається гостро, з появи дрібних епідермальних папул рожево-червоного кольору, які швидко вкриваються сріблясто-білими лусочками. Папули збільшуються у розмірі, і утворюють бляшки, іноді досить великих розмірів. В залежності від клінічних проявів та локалізації захворювання розрізняють: ексудативний, пустульозний, інверсний псоріаз, артропатичний псоріаз, псоріатичну еритродермію. Також виділяють папіломатозно-бородавчату, себорейну, рупіоїдну, екзематоїдну, фолікулярну клінічні форми і псоріаз слизових оболонок. Найчастіше зустрічається вульгарний псоріаз [113, 116, 117].
Псоріаз уражає будь-які частини тіла, при цьому висипання локалізуються частіше за все на розгинальних поверхнях кінцівок, особливо на ділянках ліктьових і колінних суглобів, волосистої частини голови, часто охоплює шкіру ділянки лобу, так звана «псоріатична корона», ділянки крижі та сідниць. Дуже часто у псоріатичний процес залучаються нігті. Дуже рідко у патологічний процес залучаються червона облямівка губ та слизові оболонки.
У перебігу псоріазу розрізняють три стадії – прогресуючу, стаціонарну та регресуючу. Для прогресуючої стадії характерним є збільшення у розмірі папул, які місцями зливаються, утворюючи бляшки з чіткими контурами; поява нових елементів; позитивний феномен Кебнера – у місцях травматизації шкіри з’являються нові елементи висипки [138, 146]; навколо папул спостерігається яскраво-червоний обідок Пильнова. Для цієї стадії псоріазу характерним є наявність тріади симптомів: феномен стеаринової плями, термінальної плівки, симптом «Ауспітца» – феномен кров’яної роси.
Для стаціонарної стадії характерним є припинення появи нових висипань, зникнення обідка Пильнова, ущільнення та фрагментація бляшок. Папули та бляшки повністю вкриті лусочками. Для регресуючої стадії характерним є поява псевдоатрофічного обідка Воронова навколо бляшок їх регрес.
При псоріазі в результаті гіперпроліферації кератиноцитів епідерміс потовщується у 4-6 разів, суттєво прискорюється мітотична активність і синтез ДНК в цих клітинах. Різко зменшується швидкість клітинного циклу: час перетворення базальних кератиноцитів у рогові лусочки зменшується і складає 4 доби замість 28.
В епідермісі існує дві системи, що регулюють швидкість мітозу клітин: пригноблююча (кейлон) та стимулююча (епітеліальний фактор росту).
Кейлон – це тканиноспецифічна речовина і, тому, активна лише у відношенні епідермісу; як активний інгібітор клітинного мітозу діє слабо, стає активним у поєднанні з адреналіном. Комплекс кейлон+адреналін потенціюється і пролонгується гормонами кори наднирників через універсальний регулятор внутрішньоклітинних процесів циклічний аденозинмонофосфат (цАМФ). У свою чергу цАМФ залежить від двох ферментів: аденілатциклази (сприяє синтезу цАМФ) та фосфодіестераза. Комплекс кейлон+адреналін підвищує активність аденілатциклази, тим самим підвищує вміст у клітині цАМФ. Фосфодіестераза інактивує цАМФ [27, 144, 145].
Епітеліальний фактор росту стимулює мітоз клітин епідермісу. У організмі людини специфічна дія епітеліального фактора росту відбувається при умовах зниження кейлону, адреналіну, глюкокортикоїдів, і цАМФ і при збільшенні вмісту гістаміну та інших біологічно активних речовин, тому відбувається посилення клітинної проліферації епідермісу [39, 114]. При псоріазі відбувається зменшення активності аденілатциклази, блокування комплексу адреналін-кейлон, що призводить до інактивації цАМФ і мітоз клітини посилюється. Гістамін викликає стимуляцію мітозу клітин епідермісу, і підвищується активність гуанілатциклази, яка підвищує вміст цГМФ [155, 160, 179].
У прогресуючу стадію співвідношення цАМФ/цГМФ=19/1, яке у нормі складає 68/1. Ці зміни у співвідношеннях циклічних нуклеотидів виявлені у осередках ураження (у псоріатичних бляшках), а в неураженій шкірі співвідношення цАМФ/цГМФ складає 180/1, що свідчить про включення адаптаційних механізмів захисту, направлених на запобігання прогресування дерматозу [42, 43].
За даними статистики захворюваність на псоріаз серед жінок і чоловіків майже однакова [135]. Вивчення конкретних відмінностей між жінками і чоловіками викликає величезний інтерес в різних областях медицини, в тому числі дерматології [133, 137]. Були зроблені спроби аналізу специфічних гендерних відмінностей при псоріазі, отримані деякі цікаві результати. Зокрема, показано, що у жінок спостерігається більш ранній початок розвитку захворювання, але більш висока ймовірність тяжкого ступеня захворювання – у чоловіків [135]. Крім того, відмінності які пов’язані зі статтю були описані в деяких епідеміологічних і клінічних дослідженнях хворих на псоріатичний артрит [134]. Досліджено гендерні особливості коморбідності псоріазу, ризику розвитку кардіометаболічного порушень перебігу псоріазу [25, 55]. Показано, що більш сприятлива картина виявлена в групі чоловіків. Відносні значення коморбідності псоріазу з абдомінальним ожирінням і гіпертонією були вдвічі вище в групі жінок, у порівнянні з чоловіками, а коморбідність псоріазу з гіперглікемією була в три рази вище у жінок. Відносна асоціація ожиріння і псоріазу в групі жінок була дещо нижчою, ніж у чоловіків. У дослідженні [31] представлений аналіз гендерних особливостей перебігу псоріазу у хворих з наявністю синдрому мальабсорбції. Захворювання протікало важче у жінок, що проявлялося наявністю більшої кількості скарг, що вказують на ураження кишечника, наявністю виражених симптомів ураження кишечника, більш високими показниками індексу PASI і низькими показниками всмоктувальної функції тонкої кишки. У літературі є розрізнені дані щодо гендерних відмінностей різних аспектів псоріазу, таких як епідеміологія, генетика, фактори ризику, якість життя, клінічні та терапевтичні аспекти, але ці дані під час суперечливі та не є комплексними.
Підсумовуючи вищезазначене, можемо зробити висновок, що псоріаз супроводжується чималою кількістю патогенетичних чинників, які без сумніву, мають вплив і на перебіг дерматозу. Не структуровані дані щодо наявності супутніх станів у хворих на псоріаз чоловіків та жінок, а також відсутні диференційовані методи лікування з урахуванням вищезазначених факторів. Це визначає актуальність поглибленого вивчення гендерних особливостей взаємозв`язку психоемоційного стану, клінічних, імунологічних, гормональних, метаболічних змін при псоріазі.
1.2 Сучасні підходи до терапії псоріазу
Лікування псоріазу повинно бути комплексним та направленим на усунення клінічних симптомів захворювання, зменшення частоти рецидивів [22, 41]. Призначаючи терапію хворим, необхідно враховувати індивідуальні особливості пацієнта, стадію захворювання, площу ураження шкіри, тяжкість псоріатичного процесу, вік, стать, наявність супутньої патології, наявність протипоказань до лікування та можливі ускладнення [30, 44, 76, 86].
Протоколи надання медичної допомоги хворим на псоріаз та артропатичний псоріаз затверджені наказом МОЗ України №762 від 20.11.2015 р. і включають рекомендації щодо діагностичної і терапевтичної програми.
Сучасна патогенетична терапія псоріазу полягає у використанні методів, направлених на зниження проліферації кератиноцитів і нормалізацію їх диференціювання, пригнічення Т-клітинних запальних імунних реакцій. Так, лікування повинно бути комплексним та включати системну та місцеву терапію.
Мета місцевої терапії – зменшення запальних явищ, лущення та інфільтрації шкіри; з цією метою призначають кератопластичні та протизапальні засоби [72, 89, 94, 95, 110, 192]. Глюкокортикоїдні засоби для місцевого застосування володіють вираженою протизапальною, протисвербіжною, імуносупресивною діями. При цьому протизапальний ефект глюкокортикоїдів пов’язаний зі зменшенням набряку та інгібуванням хемотаксису запальних клітин у шкіру. Стероїди інгібують транскрипцію генів, які відповідають за синтез запальних цитокінів, Т-клітинну проліферацію, Т-опосередкований імунітет. Але, слід зазначити, що неадекватне використання глюкокортикоїдів для місцевого лікування може призвести до більш тяжкого перебігу дерматозу, викликати атрофію шкіри, місцеві інфекції [2, 6, 15, 16, 44, 51, 129].
Також для місцевого лікування використовують засоби – аналоги вітаміну D у вигляді мазей, кремів, лосьйонів – кальципотріол, кальцитріол. Засоби гальмують проліферацію кератиноцитів, пригноблюють синтез ДНК, стимулюють диференціювання епідермальних кератиноцитів. Синтетичні аналоги вітаміну D3 зручні у використанні, проте тривале застосування може призвести до гіперкальціємії та подразнення шкіри, а також призвести до підвищення всмоктування кальцію у кишечнику, резорбції кісткової тканини.
В останні роки увагу дослідників все частіше привертають засоби, дія яких направлена на імунну систему. При цьому призначають як стимулятори, так і супресивні препарати. Враховуючи сучасні аспекти псоріазу, доцільним є використання імуносупресивних засобів, серед яких слід відмітити цитостатичні препарати (метотрексат), імунодепресанти (циклоспорин А, сандімун), синтетичні ретиноїди (ацетрин), ПУВА-терапію, системні кортикостероїди, моноклональні антитіла до ФНП-α [130, 152, 161, 169].
Метотрексат – препарат, який є антагоністом фолієвої кислоти, що діє переважно на активно проліферуючі клітини, в основному лімфоїдного ряду. До недоліків препарату слід віднести більш тяжке загострення псоріазу через декілька тижнів після закінчення прийому метотрексату (феномен «рикошету»), а також побічні ефекти, які пов’язані з токсико-алергічними реакціями, цитостатичною та імуносупресивною дією [108].
Показана ефективність використання циклоспорину – препарату імуносупресивної дії, що інгібує вплив на процеси клітинного росту, пригнічує залежне від Т-лімфоцитів вироблення антитіл. Також дія препарату обумовлена пригніченням секреції інтерлейкінів та інших лімфокінів, активованих Т-лімфоцитами, що призводить до зниження активності Т-лімфоцитів і клітин запалення як у дермі, так і у епідермісі хворих на псоріаз. Але, при застосуванні циклоспорину виникають такі серйозні наслідки, як гіпертензія, нефротоксичність [172].
Ароматичні ретиноїди показані при тяжких формах псоріазу: псоріатичній еритродермії, пустульозному псоріазі. Механізм дії ацитретину полягає у пригніченні проліферації епідермальних кератиноцитів, нормалізації та диференціювання епітелію, зменшення зчеплення рогових клітин, що призводить до більш швидкого відлущування та запобігає утворенню рогових мас. Ароматичні ретиноїди застосовують місцево у вигляді мазей або внутрішньо. Препарати більш ефективні при використанні з ПУВА-терапією. Але, обмеження використання даних препаратів полягає у тератогенності, гепатотоксичності.
При тяжких еритродермічних формах та артропатичному псоріазі використовують глюкокортикоїдні препарати. Слід відмітити, що при різкій відміні препарату або при різкому зменшенню дози відбувається більш тяжкий рецидив захворювання.
Системні глюкокортикоїди та цитостатики не володіють вибірковою дією. Їх застосування не обмежується пригніченням активованих Т‑лімфоцитів, призводить до змін вуглеводного, білкового та ліпідного обмінів. Тому застосування даних препаратів обмежується їх чисельними побічними ефектами. Для зменшення ризику гепатотоксичності наряду з призначенням цих засобів використовують гепатопротекторні засоби, такі як ессенціале, гептрал, енерлів, карсил та ін. [98, 106, 107, 139].
Багатьма авторами запропоновано застосовувати у хворих на псоріаз гепатопротекторні засоби з урахуванням порушень гепатобіліарної системи [29, 58].
Принципово новими у лікуванні тяжких форм псоріазу та псоріатичного артриту є біологічні препарати – інфліксимаб, етанерцепт, адалімумаб, устекінумаб, алефасепт, ефалізумаб. Всі біологічні препарати за механізмом дії поділяються на інгібітори Т-клітинної активності і костимулятори, а також блокатори ефектів цитокінів[19, 24]. Дані препарати високоефективні, але слід враховувати серйозні побічні ефекти, а також супутні захворювання [1, 3, 32, 49, 50, 130, 152, 161, 169].
При поширених формах псоріазу широко застосовують фотохіміотерапію, при якій основне значення приділяється взаємодії активованого довгохвильового УФ-промінями фотосенсибілізатора з ДНК з утворенням моно- і біфункціональних зв’язків, що призводять до гальмування клітинної проліферації. Дія фотохіміотерапії пов’язана з імуномодулюючим ефектом з нормалізацією клітинної ланки імунітету, неопосередкованим впливом на імунокомпетентні клітини у шкірі, впливом на біосинтез та метаболізм простагландинів [63, 68, 83, 88].
Таким чином, не дивлячись на великий арсенал засобів місцевої та системної дії для лікування псоріазу, проблема пошуку нової патогенетичної терапії дерматозу, враховуючи супутні захворювання, а також стать хворих, залишається актуальною проблемою сучасної дерматології. Це особливо важливо у зв’язку зі зростанням захворюваності на даний дерматоз, збільшенням кількості тяжких інвалідизуючих форм, резистентних до проведеної терапії, порушенням якості життя хворих. У деяких випадках ремісія є короткотривалою, або ж на фоні проведеної терапії виникають побічні ефекти.
РОЗДІЛ 2
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1 Матеріали дослідження
Згідно з поставленою метою і задачами, для вирішення дисертаційних завдань протягом 2013-2016 рр. у хворих на псоріаз проведено
комплекс загально-клінічних, біохімічних, імунологічних, ендокринологічних, електрофізіологічних, психофізіологічних та статистичних досліджень.
Під спостереженням знаходилось 100 хворих на псоріаз (50 жінок і 50 чоловіків) у віці від 19 до 52 років. Обсяг діагностичних заходів для хворих проводили згідно з Наказом МОЗ України №762 від 20.11.2015 р.. Дослідження проводили на клінічній базі кафедри дерматовенерології та косметології з курсом дерматовенерології і естетичної медицини ФПО Запорізького державного медичного університету в Комунальнiй установi «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради. Групу контролю склали 20 практично здорових осіб (10 чоловіків та 10 жінок).
При роботі з хворими дотримувались загальних вимог та положень щодо біоетики, які схвалені Першим національним конгресом з біоетики (Київ, 2001), а також – з узгодження Етичного комітету Запорізького державного медичного університету.
2.2 Методи дослідження
2.2.1 Загальні клініко-лабораторні методи
Клінічне дослідження складалось зі збору скарг, анамнезу захворювання, анамнезу життя, об’єктивного дослідження.
При опитуванні пацієнтів і збору анамнестичних даних особливу увагу приділяли скаргам, характеру перебігу захворювання, можливим причинам виникнення псоріазу та його загострень, наявності соматичних захворювань, а також стресовим ситуаціям. Звертали увагу на попередню терапію псоріазу у даних хворих, її ефективність, особливо у хворих різної статі.
Загальні клініко-лабораторні дослідження включали: проведення клінічного аналізу крові та сечі, аналіз крові та сечі з визначенням глюкози, аналіз калу на яйця гельмінтів, основних біохімічних аналізів, постановку комплексу серологічних реакцій на сифіліс; флюорографічне дослідження органів грудної клітини. Усі дослідження виконували згідно з клінічними протоколами надання медичної допомоги хворим на дерматовенерологічні захворювання [61].
Загальноклінічне дослідження проводили по загальноприйнятим методикам у всіх спостережуваних хворих. При вивченні клінічних проявів псоріазу звертали увагу на локалізацію, розповсюдженість і характер патологічного процесу, ураження нігтьових пластин, а також вивчення PASI та дерматологічного індексу якості життя (DLQI).
У разі необхідності хворим були проведені консультації лікарів суміжних спеціальностей – терапевта, ендокринолога, гастроентеролога, оториноларинголога, психоневролога, стоматолога.
2.2.2 Імунологічні методи
Оцінка імунного статусу досліджених хворих проводилася на підставі аналізу результатів загальноприйнятого комплексу відомих стандартних тестів, передбачених діючим Наказом МОЗ України №422 від 19.11.2002 [57] та клінічними протоколами [62]. Визначення загальної та відносної кількості лейкоцитів проводили уніфікованим методом підрахунку в розрахунковій камері.
Дослідження лейкоцитарної формули проводили уніфікованим методом морфологічного дослідження формених елементів крові з диференційним підрахунком лейкоцитарної формули у сухих фіксованих і забарвлених мазках крові.
Імунофенотипування лейкоцитів для визначення їх популяційного складу відіграє важливе значення в оцінці імунного статусу при імунодефіцитах. Фенотипування лейкоцитів проводили методом імунофенотипування клітин крові по диференційованим антигенам (CD-рецепторам – claster of differentiation receptors) за допомогою моноклональних антитіл набору «Клоноспектр», Росія). Непряму реакцію поверхневої імунофлуоресценції виконували на цільній крові досліджених пацієнтів; дослідження проводилось згідно з інструкцією. Облік результатів реакції проводився за допомогою методу флуоресцентної мікроскопії. Використовувались моноклональні антитіла до відповідних антигенів:
CD3+ – Т-загальні зрілі лімфоцити;
CD4+ – Т-хелпери;
CD8+ – Т-супресори (цитотоксичні лімфоцити);
CD4+/CD8+ – імунорегуляторний індекс, співвідношення Т-хелперів і Т-супресорів, який дозволяє оцінювати інтенсивність імунної відповіді;
CD16+ – натуральні кілери;
CD19+ – зрілі В-лімфоцити;
CD25+ – низькоофінний рецептор до інтерлейкіну-2;
CD95+ – рецептор апоптозу
Визначення вмісту імуноглобулінів А, М, G проводили за допомогою класичного методу радіальної імунодифузії. Принцип методу полягає в тому, що при зустрічі антигенів і антитіл у зоні еквівалентності утворюються нерозчинні преципітати у вигляді кілець, діаметр яких залежить від концентрації імуноглобуліну у дослідженому матеріалі.
Неспецифічні фактори захисту організму досліджували методом оцінки фагоцитарної активності нейтрофілів периферичної крові за загальноприйнятою методикою з визначенням:
– фагоцитарного числа (ФЧ) – середня кількість мікробів, поглинутих одним нейтрофілом крові;
– фагоцитарного показника (ФП) – процент нейтрофілів, які приймають участь у фагоцитозі.
Бактерицидну активність нейтрофілів визначали за допомогою тесту відновлення нитросинього тетразолію (НСТ-тесту). Принцип методу полягає у відновленні поглинутого фагоцитом розчинного барвника нитросинього тетразолію в нерозчинний диформазан під впливом супероксиддисмутази, який переходить в НАДФ-Н-оксидазної реакції, стимулюючи процес активації фагоциту. По інтенсивності реакції можливо судити про активацію кисеньзалежних механізмів бактерицидності. Для оцінки тесту підраховували 100 нейтрофілів і оцінювали відсоток позитивних клітин (нейтрофіли, які вміщують гранули диформазану, забарвлені у темно-синій колір).
Рівень цитокінів у сироватці крові визначали за допомогою імуноферментного аналізу. Активність ферментативної реакції визначали на автоматичному фотометрі для мікропланшетів StatFax 2100 (США). Визначали рівень IL-4, IL-1бета, ФНП-α.
Вміст цГМФ, активність ГЦ, КТ, АКТГ, ТТГ у сироватці крові визначали методом імуноферментного аналізу за допомогою відповідних стандартних наборів реактивів.
2.2.3 Визначення тяжкості перебігу псоріазу
Тяжкість захворювання оцінювали шляхом визначення індексу PASI (Psoriasis Area and Severity Index), який є основним інструментом для визначення тяжкості перебігу псоріазу. Для визначення цього індексу тіло пацієнта умовно поділяли на чотири області (ноги – 40 % від загальної поверхні шкіри людини, тулуб (груди, живіт, спина) – 30 % поверхні шкіри, руки – 20 % і голова – 10 %). Кожну з цих 4 -х областей оцінювали окремо – від 0 до 6 балів залежно від ступеня ураження. Далі для кожної ділянки оцінювали інтенсивність кожної з 3 -х клінічних ознак – еритема, інтенсивність лущення та інфільтрації. Інтенсивність оцінювали від 0 (відсутність ознаки) до 4 (максимальна ступінь прояву). Після цього для кожної ділянки визначали свій індекс за формулою: (еритема + лущення + інфільтрація) х ступінь ураження х ваговий коефіцієнт ділянки. Ваговий коефіцієнт області відповідає площі поверхні шкіри: 0, 4 – ноги, 0, 3 – тулуб, 0, 2 – руки, 0, 1 – голова. Після підрахунку індексу для кожної з 4 -х областей підсумували отримані показники і отримували загальний сумарний індекс PASI, представлений числом від 0 (відсутність хвороби) до 72 (найважчий перебіг).
При оцінці результатів в залежності від ступеня тяжкості дерматозу виділяли групу із середньо-тяжким (10 2.2.4 Психофізіологічні методи З метою оцінки психологічного статусу у хворих на псоріаз використовували опитувальники. У дослідженні застосовувалися: 1) Тест «Шкала Зунга» для самооцінки депресії. Опитувальник розроблено для диференційної діагностики депресивних станів і станів, близьких до депресії, для скринінг-діагностики при масових дослідженнях і з метою попередньої, долікарської діагностики. Тест адаптований Т. І. Балашовою. Повне тестування з обробкою займає 20-30 хвилин, при цьому пацієнт зазначає відповіді на бланку. Обробка результатів: рівень депресії (РД) розраховується за формулою: РД = ∑пр+∑обр, де ∑пр – сума закреслених цифр по «прямим» висловлюванням: № 1, 3, 4, 7, 8, 9, 10, 13, 15, 19; а ∑звор. – сума цифр, «зворотних» закреслень, до висловлювань: № 2, 5, 6, 11, 12, 14, 16, 17, 18, 20. Наприклад: у висловлюванні № 2 закреслена цифра 1, ми ставимо в суму 4 бали; у висловлювання № 5 закреслено відповідь 2 – ставимо в суму 3 бали; у висловлювання № 6 закреслено відповідь 3 – ставимо в суму 2 бали; у висловлювання № 11 закреслити відповідь 4 – ставимо в суму один бал і т.д. В результаті отримували РД, який коливався від 20 до 80 балів. Якщо РД не більше 50 балів, то діагностували стан без депресії. Якщо РД більше 50 і менше 59 балів, то робили висновок про легку депресію ситуативного чи невротичного ґенезу. Показник РД від 60 до 69 балів – субдепресивний стан або маскована депресія. Справжній депресивний стан діагностували при РД більше 70 балів. 2) Тест Шихана з визначенням показників тривожності. Опитувальник Шихана (Sheehan Patient-Rated Anxiety Scale, SPRAS), розроблений у 1983 році Девідом Шиханом, використовується для діагностики тривожних розладів в клінічній практиці. Вираженість симптомів ранжується від 0 до 4 в залежності від їх оцінки пацієнтом: 0 – «ні», 1 – «слабо»,2 – «середньо», 3 – «сильно», 4 – «дуже сильно». Загальний бал дорівнює сумі всіх балів і може мати значення від 0 до 140. При інтерпретації даних виділяли наступні рівні значень: 0-30 – відсутність клінічно вираженої тривоги, 30-80 – клінічно виражена тривога, 80 і більше – тяжкий тривожний розлад. 3) Опитувальник PDI. Оцінку якості життя хворих ми проводили за допомогою опитувальника PDI – псоріатичний індекс порушень. Даний опитувальник містить 15 питань, максимальна сума балів – 45, мінімальна – 0. Чим більшу кількість балів набрав пацієнт, тим нижче рівень життя. 4) Дерматологічний індекс якості життя DLQI. Показник DLQI розраховували шляхом підсумовування балів кожного питання, в результаті чого набирали максимум 30 і мінімум 0 балів. Чим вища оцінка, тим більше погіршується якість життя. DLQI також може бути виражена у відсотках від максимально можливого рахунку 30. Значення пунктів DLQI: 0-1 = практично взагалі немає впливу на життя пацієнта Математичний аналіз ВСР здійснювали за допомогою системи комп’ютерної кардіографії “CardioLab” комплектації НТЦ “ХАІ-Медіком” (м. Харків). На екрані монітору відображалася електрокардіограма, яка реєструвалася у трьох стандартних відведеннях, потім вибиралася активна електрокардіограма по одному відведенню. У якості активного вибирали відведення з максимальною амплітудою R-піка і мінімальним рівнем перешкод. Реєстрацію показників ВСР проводили в 10-хвилинному режимі запису відповідно до стандартних протоколів дослідження в базальному положенні для виявлення вихідного стану симпатичної або парасимпатичної ланки. Запис показників ВСР проводили за стандартним протоколом (уранці в проміжку від 9.00 до 12.00 годин за комфортних умов, після 15-хвилинної адаптації, при цьому, протягом 24 годин до початку дослідження пацієнти не вживали каву, алкоголь, препарати, що впливають на показники ВСР). Подальшу обробку проводили за спеціальною програмою. В даний час найбільш інформативним методом оцінки ВСР є спектральний аналіз. При цьому розрізняють такі показники спектральної потужності: 2.2.6 Статична обробка отриманих результатів Статистична обробка отриманих результатів проводилась за допомогою сучасних статистичних методів аналізу на персональному комп’ютері з використанням пакету ліцензійної програми «STATISTICA®for Windows 6.0» (StatSoftInc., № AXXR712D833214FAN5). При цьому визначали ступінь достовірності показників, кореляційні зв’язки результатів обстеження хворих, які лікувались різними методами [40]. 2.3 Клінічна характеристика хворих Під спостереженням перебувало 100 хворих на псоріаз, які знаходились на стаціонарному лікуванні, із них 50 – чоловіків, 50 – жінок та 20 практично здорових осіб без відповідної патології. Клінічне обстеження усіх пацієнтів проводили згідно з Наказом МОЗ України №762 від 20.11.2015 р., який передбачав аналіз скарг, анамнезів захворювання, життя, загального і локального статусів. Усіх хворих на псоріаз ми розподіляли по групах з урахуванням статі, стадії, форми, типу, тривалості захворювання, віку, соціального стану, супровідних і перенесених захворювань. Давність захворювання складала до 10 років – у 78 % хворих, і більше 10 років – у 7 %. Захворювання частіше виникало у віці 11 – 30 років, рідше – після 40 років. Як видно з таблиці 2.1, більшість хворих були у віці 20-49 років з майже однаковим співвідношенням чоловіків і жінок в вікових групах. Таблиця 2.1 – Розподіл хворих по вікових групах З даних таблиці 2.2 видно, що переважали мешканці міст над сільськими, як чоловіки, так і жінки. Таблиця 2.2 – Розподіл хворих в залежності від їх місця мешкання Дані таблиці 2.3 показують, що більшість хворих на псоріаз були у шлюбі, особливо жінки. У залежності від роду занять, 15 % були працівниками розумової праці, з них службовців – 12 %, учнів – 3 %. Працівників фізичної праці було 28 %, з них працівників промпідприємств – 13 %, сільського господарства – 15 %. Пенсіонерів було 5 %, осіб без конкретних занять та ін. – 52 %. Таблиця 2.3 – Розподіл хворих у залежності від сімейного стану Хворі були у віці від 19 до 52 років, які знаходились на стаціонарному лікуванні у чоловічому та жіночому шкірних відділеннях у Комунальній установі «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради. Осінньо-зимовий псоріаз відмічався у 75 хворих, весняно-літній – у 15 і змішаний – у 10. Прогресуюча стадія встановлена у 84 хворих, стаціонарна – у 14 і регресуючи – у 2. Із 100 обстежених пацієнтів переважав вульгарний або бляшковий псоріаз, він спостерігався у 84 хворих, краплеподібний – у 7, інтертригінозний – у 6 та долонно-підошовний – у 3. Псоріатична оніходистрофія встановлена у 48 із 100 досліджених хворих. Спадкові фактори (псоріаз у батьків, братів, сестер та інших родичів) встановлені у 22 із 100 хворих, однаково часто як у чоловіків, так і у жінок. При вивченні анамнестичних даних звертали увагу на фактори, які передували виникненню дерматозу та його загострень. Слід відмітити, що у 72 % хворих жіночої статі передували різні психо-емоційні фактори (хвороби і смерть близьких, нервові стреси, перевантаження на роботі та ін.). У 68 % чоловіків хворих на псоріаз передували різні інфекційні фактори (грип, ОРЗ, ангіна, фронтит, гайморит, сечостатеві інфекції, холецистит, фурункульоз, грибні та вірусні інфекції та ін.). У 36 % хворих ці фактори комбінувались. У 8 % хворих попередні фактори не вдалося виявити. Як видно з таблиці 2.4, хворі на псоріаз страждали однаково часто як жінки, так і чоловіки на захворювання печінки, підшлункової залози, шлунка, кишечника, дихальної системи, серцево-судинної системи. Проте, найбільша частота зловживання алкоголем, запальних інфекційних процесів відмічена у хворих на псоріаз чоловіків (87 випадків), а нервових і психічних захворювань – у жінок (17 випадків). Таблиця 2.4 – Супутні захворювання у хворих на псоріаз Як видно з таблиці 2.5, перенесені захворювання частіше реєструвались у хворих на псоріаз чоловіків, особливо гнійно-запальні, застудні, травми, операції. Звертає на себе увагу досить часто у чоловіків, на відміну від жінок, реєструвались урогенітальні інфекції (гонорея, хламідіоз, трихомоніаз) та простатит. Треба також враховувати, що частини хворих, особливо чоловіки, лікували анонімно урогенітальні інфекції, а деякі і в дерматологічних кабінетах, але при опитуванні приховували ці факти. Тому цей процент хворих був заочно більшим, ніж вказаний у таблиці 2.5. Таблиця 2.5 – Перенесені захворювання у хворих на псоріаз Вульгарний або бляшковий псоріаз відмічений у 74 % хворих, проявлявся ураженням шкіри ліктьових, колінних суглобів, волосистої частини голови, верхніх та нижніх кінцівок, тулуба, великих складок. Хворі відмічали початок дерматозу з невеликих папул рожево-червоного кольору, 2-3 мм у діаметрі, які потім збільшувались у розмірі, зливалися і утворювали спочатку поодинокі бляшки, а пізніше зливні бляшки, вкриті сріблясто-білими лусочками з периферичним вінчиком червоного кольору. При об’єктивному дослідженні відмічалась позитивна тріада феноменів при пошкребуванні папули (Ауспітца). У 25 з 100 хворих, в прогресуючій стадії в місцях подразнення чи травмування шкіри виникав симптом Кьобнера. Краплеподібний псоріаз, який ми діагностували у 7 хворих характеризувався гострим висипом с лентикулярними папулами (0,5 – 1,0 см), які покривали майже всю поверхню шкіри. Інтертригінозний псоріаз у 6 хворих характеризувався ураженням шкіри пахових западин, складок на животі, ділянок під грудними залозами, пахвових та періоральної ділянки. Долонно-підошовний псоріаз у 3 хворих характеризувався розвитком пустул на долонях та підошвах. Псоріатичну оніходистрофію діагностовано у 48 с 100 хворих, яка проявлялась симптомом точкового заглиблення, піднігтьовим гіперкератозом та дистрофією нігтьової пластинки. Ураження волосистої частини голови спостерігалось у 75 % хворих на псоріаз однаково часто як у чоловіків, так і жінок. При дослідженні клінічних особливостей перебігу псоріазу у хворих встановлено, що у чоловіків відмічався більш тяжкий перебіг захворювання у порівнянні із жінками розповсюдженні бляшкові формі, атипові варіанті Так, індекс PASI становив (28,16 ± 2,19) бала у чоловіків та (23,45 ± 2,02) бала у жінок (р<0,05). Також для оцінки тяжкості перебігу ми оцінювали частоту рецидивів псоріазу у хворих чоловіків та жінок. Встановлено, що у хворих на псоріаз жінок спостерігалось: по 1 загостренню – у 68,64 % хворих, по 2-3 загострення – у 28,6 % та більше 3 загострень протягом року у 2,76 % хворих. При цьому, у хворих на псоріаз чоловіків по 1 загостренню відмічалось у 10,4 %, по 2-3 – у 84,5 % і більше 3 – у 5,1 % хворих. Таким чином, відмічалася достовірно вища кількість загострень саме у хворих на псоріаз чоловіків (р<0,05). Дані наведено на рис. 2.1. В анамнезі зверталася увага на особливості клінічних проявів (перебігу) рецидивів псоріазу, що дозволило виділити різні терміни розповсюдження процесу: короткі строки (від декілька днів до 3-4 тижнів), що було розцінено як швидке розповсюдження; поступове розповсюдження (від 2-3 місяців до 1 року); повільне розповсюдження (більше року). У досліджених хворих у більшості відмічено (69 %) поступове розповсюдження, але у чоловіків частіше зустрічалось (29 %) швидке розповсюдження, а у жінок було характерне стабільний перебіг. Рисунок 2.1 – Розподіл частоти рецидивів у хворих на псоріаз чоловіків та жінок Ми також вивчали характер (тривалість) ремісій. У досліджених хворих найбільш типовою тривалістю ремісії від 1 року – у 34 %. Слід відмітити, що у чоловіків частіше реєструвалися нестійкі ремісії, а більш стійкі – у жінок. Таким чином, під спостереженням перебувало 100 хворих на псоріаз, 50 чоловіків і 50 жінок. Більшість хворих була у віці 20-49 років, переважно мешканці міст, які знаходились у шлюбі, працюючих було 33 %, пенсіонерів і осіб без конкретних занять – 57 %. Хворі були у віці 19-52 роки. Бляшковий псоріаз відмічено у 84 хворих, краплеподібний – у 7, інтертригінозний – у 6 та долонно-підошовний – у 3. Оніходистрофія встановлена у 48 із 100 хворих, спадкові фактори – у 22. У 72 % хворих жіночої статі перебували виникненню і загостренню різні психо-емоційні фактори, а у 68 % чоловіків – інфекційні фактори. Із супутніх захворювань у чоловіків хворих на псоріаз частіше зустрічались алкоголізм, запальні інфекційні процеси, а у жінок – нервові і психічні захворювання. Аналогічна ситуація відмічена із перенесеними захворюваннями. При аналізі клінічних особливостей перебігу псоріазу у чоловіків він був більш тяжкий (атипові і розповсюджені бляшкові форми), ніж у жінок. Ми також відмітили більш часті рецидиви у чоловіків з швидким розповсюдженням процесу з нестійкими ремісіями. РОЗДІЛ 3 3.1 Психологічний статус хворих на псоріаз Дані проведених чисельних досліджень свідчать, що псоріаз відноситься до психосоматичних захворювань, яке має генетичну та імунологічну основу, при цьому психогенні фактори виступають у якості тригерних, і призводять до виникнення або загострення дерматозу лише у тісній взаємодії з основними факторами патогенезу. Цілий ряд несприятливих факторів відіграє значну роль у розвитку змін у психологічному статусі пацієнтів: одним з таких факторів слугує хронічний довготривалий перебіг дерматозу, та неминучі рецидиви псоріазу після нетривалої ремісії. У хворих з ураженням відкритих частин тіла спостерігали відчуття скутості при спілкуванні, гіпернозогностичну реакцію, роздратованість та невпевненість у собі, спричинені неестетичністю власного тіла, наявністю висипів, відразою у людей та формуванням у суспільстві думки про заразність захворювання, що викликало стан психологічної напруги, зневіру в можливість повного вилікування. Часто пацієнти відмовлялися від улюблених занять, занять спортом, залишали роботу, особливо це стосувалося жінок. У 20 % хворих виникали тривожно-депресивні стани, які часто не відповідали тяжкості псоріатичного процесу, проте спричиняли серйозні порушення адаптації. Так формувалося замкнуте коло: наявність на шкірі висипань сприяло виникненню емоційних розладів як на саму хворобу, так і на навколишнє середовище, а емоційні реакції при цьому підсилювали шкірні прояви дерматозу. Психологічний профіль у пацієнтів з псоріазом характеризується схильністю все ускладнювати, переживати з приводу невдач. З метою оцінки психологічного статусу хворих на псоріаз, ми вивчали показники депресії (за шкалою Зунга) та показники тривожності (за шкалою Шихана). При оцінці показників депресії та тривожності в загальній групі хворих на псоріаз показник шкали депресії відповідав помірно вираженій депресії. При цьому показник менше 50 балів був у 4 пацієнтів (4 %), від 50 до 59 балів – у 41 (41 %), від 60 до 69 балів (помірна депресія) – у 44 пацієнтів (44 %), 70 балів та вище (тяжка виражена депресія) – у 11 (11 %) хворих. Таким чином помірна та тяжка депресія відмічалась більш ніж у половини хворих (56 %). Дані представлені у табл. 3.1. Таблиця 3.1 – Показники депресії та тривожності у хворих на псоріаз (М ± m) Продовження таблиці 3.1 Примітка. * – достовірність різниці показників між чоловіками та жінками, р<0,05; ** – достовірність різниці показників у чоловіків з різною площею ураження шкіри, р<0,05. При розподілі хворих на псоріаз чоловіків на вікові групи встановлено, що мінімальний рівень депресії характерний для пацієнтів у віці до 20 років, тоді як для вікової групи старше 21 року – помірний рівень депресії. У групі чоловіків з меншою поширеністю псоріатичного процесу відмічали мінімальну депресію, а при ураженні більше 50 % шкіри помірну (різниця між групами достовірна). В групі чоловіків з меншою площею ураження встановлено нормальний рівень тривожності, а у групі з більшою поширеністю ураження – аномальний рівень (р<0,05), що обумовлено переважанням у першій групі пацієнтів з нормальним (20 із 25 хворих), а у другій – з аномальним (10 хворих) і середнім (3 хворих) рівнем тривожності. Не відмічено достовірної різниці в показниках шкали депресії та тривожності у групах жінок з давністю захворювання менше 1 року, від 1 до 10 років і більше 10 років, а також з різною площею ураження. Псоріаз впливає на всі складові аспекти життя пацієнта, соціальну сферу, кар’єру, сімейні стосунки, статеве життя. Тому дуже важливим є оцінка впливу захворювання на якість життя пацієнта, що необхідно враховувати в процесі лікування. Таким чином, оцінку якості життя хворих ми проводили за допомогою опитувальника PDI – псоріатичний індекс порушень. Даний опитувальник містив 15 питань, максимальна сума балів – 45, мінімальна – 0. Чим більшу кількість балів набирали пацієнти, тим нижче оцінювали рівень життя. У людини, яка задоволена власним життям, інтегральний показник якості життя дорівнює 0 % або приблизно відповідає цьому рівню. Помірне зниження якості життя – до 15 %, значне – до 30 %, різке зниження – приблизно 45 %. При оцінці псоріатичного індексу порушень в загальній групі хворих середній показник щоденної фізичної активності складав 8,0 балів. Дані представлені у табл. 3.2. Таблиця 3.2 – Оцінка якості життя хворих на псоріаз(М ± m) Найбільш суттєво захворювання впливало на необхідність частого прийому душа (73 %), відвідування перукаря (43 %). У 37 % пацієнтів захворювання змушувало вибирати спеціальне вбрання, у 36 % змушувало часто змінювати вбрання або прати через дерматоз. Середній показник впливу захворювання на роботу/навчання складав 2,0 бали. За розділом «Персональні дані» середній бал складає 3,1. За думкою 23 % пацієнтів захворювання негативно впливав на інтимні стосунки і у 24 % негативно впливав на сімейні стосунки. Розділ «Вільні питання» дозволив отримати у сумі 4,1 бала. Третя частина пацієнтів (до 33 %) відмічали суттєвий вплив захворювання на відвідування сауни, басейну, заняття спортом, суспільні заходи та вечірки. Інтегральний показник якості життя за шкалою PDI у 16 хворих вказував на низький рівень якості життя, у 41 – на середній, у 44 – на високий рівень якості життя. Таким чином, більше половини хворих на псоріаз (57 %) відмітили зниження якості життя в результаті захворювання. При порівнянні показників псоріатичного індексу порушень у хворих ускладненими і неускладненими формами псоріазу відмічені достовірно більш високі значення по всім розділам при ускладнених формах, що вказує на більш суттєве порушення якості життя. При розподілі хворих на псоріаз жінок на вікові групи відмічали найбільш суттєвий вплив захворювання на показник роботи/навчання в старшій віковій групі. Захворювання суттєво не впливало на роботу/навчання у молодшій віковій групі чоловіків і суттєво впливає у більш старших вікових групах (різниця достовірна між групами до 20 років, 21-30, 31-40 років. Найбільший вплив захворювання на роботу/навчання відмічали у жінок, які страждали на псоріаз від 1 до 10 років, достовірно більш суттєво у порівнянні з групою більшої давності дерматозу. Найбільш виражені зміни показника псоріатичного індексу порушень (щоденна активність, лікування, якість життя, тяжкість захворювання) відмічено у хворих на псоріаз чоловіків з давністю дерматозу більше 10 років. Найбільш виражений вплив на показники псоріатичного індексу порушень відмічали у жінок і чоловіків при ураженні більше 50 % шкірного покриву. При цьому достовірну різницю спостерігали у жінок за розділами «Вільні питання», «Лікування», «Якість життя», «Тяжкість захворювання», а у чоловіків за розділами «Щоденна активність», «Персональні дані», «Лікування». 3.2 Стан вегетативної нервової системи у хворих на псоріаз в залежності від статі Значну роль у розвитку псоріазу відіграють порушення нейрогуморальної та нервової регуляції. Вегетативні дисфункції та порушення діяльності вегетативної нервової системи має суттєвий вплив на перебіг і прогноз дерматозу. Псоріаз стимулює розвиток неспецифічного адаптаційного синдрому, який пов’язаний з активацією вегетативної нервової системи і глюкокортикоїдної функції кори наднирників. Вегетативній нервовій системі належить основна роль у формуванні і координації адаптаційних реакцій. Початковим етапом розвитку неспецифічного адаптаційного синдрому є активація ерготропних і периферичних симпатичних структур, які підвищують продукцію катехоламінів. Потім відбувається активація кори наднирників, яка вступає у розвиток адаптаційних реакцій через безпосередньо пряму стимуляцію катехоламінів. Адаптивний ефект глюкокортикоїдів полягає у їх взаємодії зі специфічним рецепторним апаратом клітини, що стимулює синтез каталізаторів метаболічних реакцій. Для ефективного розвитку адаптаційного синдрому необхідний збалансований синергізм підвищених функцій вегетативної нервової системи та кори наднирників. Стресорні дози катехоламінів та глюкокортикоїдів інгібують практично всі фази запального процесу: блокують розширені капіляри, адгезію і міграцію лейкоцитів, вироблення кінінів, активацію системи комплементу. Одним із найбільш інформативних методів дослідження вегетативної нервової системи є аналіз показників ВСР. Аналіз ВСР дозволяє виділити ознаки дисбалансу активності симпатичної і парасимпатичної вегетативної нервової системи з диференційованою оцінкою характеру морфофункціональних порушень, що дозволяє більш детально визначити адаптивні ресурси і стресову стійкість індивідууму. Стан вегетативної нервової системи визначали у 50 хворих на псоріаз жінок та у 50 хворих на псоріаз чоловіків. Для визначення показників ВСР ми використовували діагностичну систему «Cardiolab» (табл. 3.3). Таблиця 3.3 – Показники варіабельності серцевого ритму у хворих на псоріаз та практично здорових донорів Примітка: * – р<0,05 при порівнянні з групою контролю; ** – р<0,05 при порівнянні показників у чоловіків та жінок; ● – р<0,01 при порівнянні з групою контролю. Як видно з таблиці 3.3, при дослідженні показників варіабельності серцевого ритму встановлено, що показник SDNN у чоловіків ([44,2 ± 3,9] мc2) та жінок ([32,2 ± 2,2] мс2) був достовірно нижчим у порівнянні із групою контролю (р<0,05), проте у жінок спостерігався достовірно нижчий показник у порівнянні із аналогічним показником у чоловіків. При аналізі показника загальної потужності (ТР) виявлено достовірне зниження показника (р<0,05) як у чоловіків, так і у жінок у порівнянні із групою контролю. Слід відмітити, що статистично значимо (р<0,05) рівень ТР був більш низьким у жінок у порівнянні із чоловіками хворими на псоріаз. Значення показника потужності спектру впливу гуморальних систем (VLF) у хворих на псоріаз обох груп було статистично достовірно зниженим у порівнянні із групою контролю (р<0,05, р<0,01). У жінок відмічалась достовірна різниця у порівнянні із показниками у чоловіків (р<0,05). Маркер активності симпатичного відділу ВНС-показник потужності спектра низькочастотних коливань (LF) у хворих обох груп був статистично достовірно (р<0,05) нижчим у порівнянні із групою контролю, особливо у жінок, ніж у чоловіків, що також було статистично достовірним (р<0,05). Показник потужності спектра високочастотних коливань (НF), який свідчить про зміни парасимпатичної регуляції, у хворих обох груп був достовірно (р<0,05) нижчим у порівнянні із групою контролю, також більш виражене у хворих на псоріаз жінок. Достовірне (р<0,05) підвищення показника вегетативного балансу LF/ НF відзначили у всіх досліджених хворих обох груп, порівняно з контрольною групою, також більш виражене у хворих на псоріаз жінок. Таким чином, у хворих на псоріаз в ході дослідження встановлено дисбаланс основних параметрів нейрогуморальної регуляції у вигляді змін загальної потужності основних частотних та спектральних показників. Ми виявили, що дисбаланс між показниками у хворих на псоріаз жінок і чоловіків мав достовірні відмінності (р<0,05), що свідчить про більш значні патологічні зміни вегетативного балансу у бік симпатикотонії у хворих на псоріаз жінок, які треба враховувати при виборі тактики комплексного лікування пацієнтів та при прогнозуванні перебігу захворювання. 3.3 Стан ендокринної ланки гомеостазу у хворих на псоріаз Як вже зазначалось, дослідники відводять значну роль у розвитку псоріазу порушенням захисно-адаптаційних механізмів регуляції, що відображається в зрушеннях у функціонуванні гіпоталамо-гіпофізарно-наднирникової системи. Таким чином, псоріаз розглядається як «хвороба адаптації». Слід зазначити, що нейроендокринна ланка цієї системи надзвичайно лабільна, і під впливом стресового фактору перша включається в процес регулювання адаптаційної реакції, десинхронізація якої лежить в основі формування різних патологічних станів, у тому числі, на наш погляд, і псоріазу. Відомо також, що гормони щитоподібної залози приймають участь в реалізації стресорних реакцій в організмі людини. Згідно з деякими даними, середній рівень ТТГ у хворих на псоріаз нижче аналогічного показника у практично здорових осіб, що, може свідчити про те, що у цих хворих формується дисфункція щитоподібної залози. Так, досліджено показники АКТГ, КТ та ТТГ у хворих на псоріаз чоловіків та жінок. Дані представлені в таблиці 3.4. Як зазначено у таблиці 3.4, рівень КТ у сироватці крові у обстежених хворих на псоріаз жінок значно відрізнявся від групи контролю (на 50,3 %, р<0,05). Середній показник КТ у групі чоловіків був вище на 42,9 % і також достовірно відрізнявся від контрольної групи (р<0,05). Середній рівень КТ у жінок перевищував цей показник у чоловіків, однак, різниця не була достовірна (р>0,05). При дослідженні рівнів АКТГ у сироватці крові у обстежених хворих на псоріаз жінок встановлено збільшення показника у порівнянні від групи контролю у 4,3 разу; при цьому у чоловіків хворих на псоріаз також спостерігалось збільшення показника у 3,6 разу у порівнянні із групою контролю. Середній рівень АКТГ у жінок перевищував цей показник у чоловіків, однак, різниця також не була достовірна (р>0,05). Таблиця 3.4 – Рівень гормонів у хворих на псоріаз та практично здорових донорів (М ± m) Примітка. * – р<0,05 – достовірна різниця між показниками основної та контрольної групи При дослідженні рівня ТТГ у сироватці хворих на псоріаз як жінок, так і чоловіків відмічалось достовірне зниження показника (р<0,05) у порівнянні зі здоровими. Так, у жінок відмічалось більше зниження показника, у порівнянні з чоловіками, але різниця не була достовірна (р>0,05). Проведення порівняльного аналізу середніх показників досліджених гормонів з урахуванням ступеню тяжкості псоріатичного процесу показало, що у хворих на псоріаз відбувалось збільшення рівнів АКТГ, КТ, а також зниження рівня ТТГ у крові. Дані представлені у таблиці 3.5. Так, при середньому та тяжкому ступеню тяжкості псоріазу АКТГ збільшувався у 3,9 та 5,1 рази. КТ збільшувався у 1,94 та 2,2 рази. При цьому спостерігалось зниження показників ТТГ – у 1,36 та 1,69 рази. Таким чином, спостерігалась достовірна різниця у досліджуваних показниках гормонального статусу в залежності від ступеню тяжкості дерматозу. Стійкий характер захворювання, часті рецидиви, сезонність загострень, вказують на існування патологічної системи, що відображає неповноцінність адаптаційного потенціалу організму хворих в умовах впливу несприятливих факторів. Характер перебігу загального адаптаційного синдрому у хворих з хронічними захворюваннями, у тому числі при псоріазі, залежить від функціонального стану ендокринної системи, від адекватності секреції гормонів, медіаторів. Стрес-синдром є ланкою адаптаційної системи людини і спрямований на пристосування організму до нових умов. Таблиця 3.5 – Стан показників гормонального статусу у хворих на псоріаз в залежності від ступеню тяжкості захворювання (М ± m) Примітка. * – р<0,05 – достовірна різниця між показниками групи хворих та контрольної групи. Виявлені порушення ендокринної ланки гомеостазу у хворих псоріазом підкреслюють необхідність розробки методів, направлених на підвищення адаптивних можливостей організму. 3.4 Активність гуанілатциклазної месенджерної системи у хворих на псоріаз Як вже зазначалось вище, адаптація хворих на псоріаз до різноманітних подразників супроводжується змінами в гормонально-метаболічних показниках, що призводить до зниження стійкості організму та активації шкірного процесу. Тому дуже важливим при дослідженні патогенезу псоріазу є необхідність вивчення порушень стану систем, які формують внутрішній гомеостаз, та вплив факторів навколишнього середовища на організм хворого. У нейрогуморальній регуляції важлива роль вторинних посередників, які приймають участь у специфічних та неспецифічних продуктах обміну речовин (гормони, гістамін, простагландини, олігопептиди та ін.), у відповідних органах – мішенях вони зумовлюють специфічні реакції завдяки взаємодії з рецепторами. Дія гуморальних речовин на клітину може реалізуватися через ряд проміжних факторів, зокрема, через утворення цГМФ, який є універсальним фізіологічним регулятором метаболізму, компонентом досить складної системи внутрішньоклітинних месенджерів. Утворення, розпад та дія вторинних посередників відбувається за участю продукту тканинного обміну та ферменту гуанілатциклази. Зміни активності ферментних систем клітин, які пов’язані з цГМФ, були установлені при багатьох патологічних станах. Ми вивчили активність гуанілатциклазної месенджерної системи за рахунок визначення вмісту цГМФ та активності ферменту її синтезу (гуанілатциклази) у сироватці крові. Вибір саме цГМФ був обумовлений тим, що за даними літератури [179] активність ферментних систем, пов’язаних з цГМФ, найбільш чутливо змінюється у хворих на псоріаз. Дуже важливо, що цГМФ активно приймає участь у передачі нервового імпульсу, а також він суттєво впливає на активацію проліферативних процесів, що характерне для шкірного процесу при псоріазі (акантоз). Але стан цГМФ та активність ГЦ не вивчався порівняно у хворих на псоріаз різної статі, хоча активність цих регуляторів метаболізму може різніться у чоловіків і жінок. Як видно з таблиці 3.6, у хворих на псоріаз суттєво активується гуанілатциклазна месенджерна система через зміну активності рецепторів, що проявлялось статистично достовірним підвищенням активності гуанілатциклази та вмісту цГМФ, порівняно з контролем. Це в свою чергу модулює запальний процес, який направлено на зменшення тканинного запалення і стимуляцію процесів репарації. Саме циклічним нуклеотидам відводиться суттєва роль посередників у дії внутрішньоклітинних регуляторів росту, особливо цГМФ, який є стимулятором проліферації. Ці зміни більш виражені у хворих на псоріаз чоловіків, у яких більш порушення мітотичного режиму клітин епідермісу, а також включення адаптаційних механізмів захисту, а саме попередження прогресування псоріатичного процесу. У хворих на псоріаз чоловіків запуск псоріатичного процесу – це реалізація закладеного високого проліферативного потенціалу. Активована гуанілатциклаза призводить, особливо у хворих чоловіків, до утворення цГМФ, через який реалізуються численні патологічні ефекти. Таблиця 3.6 – Вміст цГМФ та активність гуанілатциклази в сироватці крові у досліджених хворих (М ± m) Примітка. * – достовірна різниця у порівнянні з контролем (р<0,05);
** – достовірна різниця між показниками у чоловіків і жінок (p<0,05). * * * Таким чином, при дослідженні психологічного статусу у хворих на псоріаз чоловіків та жінок не відмічено достовірної різниці в показниках депресії, який відповідав рівню помірної депресії в обох групах. При оцінці тривожності у чоловіків встановлено нормальний рівень тривожності, тоді як у жінок – аномальний і різниця між чоловіками та жінками була достовірна. Аномальний рівень тривожності був виявлений у 12 (21 %) чоловіків і 16 (36 %) жінок. При вивченні вегетативної нервової системи виявлено дисбаланс у бік симпатикотонії, що більш виражено у хворих на псоріаз жінок. У досліджених хворих встановлено статистично достовірне підвищення рівня КТ та АКТГ, і зниження рівня ТТГ у сироватці крові, що було більш виражене у хворих на псоріаз жінок, але різниця не була статистично достовірною. Слід відмітити, що рівень досліджених гормонів достовірно залежав від ступеню тяжкості дерматозу. У хворих на псоріаз встановлено достовірне підвищення рівнів активності гуанілатциклази та цГМФ у порівнянні з групою контролю. Ці зміни були більш вираженими у чоловіків, у яких запуск псоріатичного процесу – це реалізація закладеного високого проліферативного потенціалу. Матеріали цього розділу опубліковано автором у таких роботах: РОЗДІЛ 4 Одним з провідних чинників в життєдіяльності людини є імунна система, яка бере активну участь в захисних механізмах організму, формуючи у відповідь реакції на несприятливі чинники як зовнішнього середовища, так і внутрішніх патологічних агентів. Для повноцінного розуміння відповідних реакцій необхідний комплексний підхід у вивченні як неспецифічних захисних чинників, так і клітинних і гуморальних показників імунітету. Не дивлячись на велику кількість робіт по вивченню імунного статусу у хворих на псоріаз, є лише поодинокі згадки характеру змін показників імунітету у чоловіків і жінок. Враховуючи особливості патогенезу при різній статевій приналежності гендерні відмінності мають бути. Це необхідно для розробки раціонального диференційованого лікування пацієнтів, обґрунтування методів прогнозування та профілактики рецидивів псоріазу. У зв’язку з чим ми провели порівняльний аналіз у хворих на псоріаз різної статі склад Т- і В- ланок імунітету, а також інтерлейкінів, що відіграють значну роль у формуванні запальних реакцій при даному дерматозі. Отримані результати порівнювали з даними досліджень 20 практично здорових пацієнтів групи контролю. 4.1 Дослідження популяцій та субпопуляцій лімфоцитів у хворихна псоріаз чоловіків та жінок З імунологічної точки зору, псоріаз є Т-клітинно-опосередкованим дерматозом, для якого є характерним автоімунний механізм з активацією клітинної ланки імунітету з Th1-цитокіновим профілем. Як видно із таблиці 4.1, у хворих на псоріаз як чоловіків, так і у жінок відмічені виражені зміни кількісного складу популяцій і субпопуляцій лімфоцитів крові. Виявлено статистично значимі (р<0,01) зниження абсолютного і відносного вмісту Т-лімфоцитів (СD3+) в обох групах досліджуваних хворих, у порівнянні зі здоровими особами. Звертає на себе увагу, що найбільш виражене зниження рівня СD3+ відмічене у хворих на псоріаз чоловіків, ніж у жінок (р<0,01). Таблиця 4.1 – Основні популяції і субпопуляції лімфоцитів крові хворих на псоріаз та практично здорових донорів (М ± m) Примітка. * – достовірна різниця у порівнянні з групою контролю (р<0,05, р<0,01); ** – достовірна різниця показників в основній групі у чоловіків і жінок (р<0,05, р<0,01). Пригнічення утворення Т-клітин у хворих на псоріаз відбувалося за рахунок статистично достовірного зменшення (р<0,01) вмісту Т-хелперів (CD4+) на тлі незначного статистично недостовірного підвищення (р>0,05) кількості цитотоксичних лімфоцитів (CD8+). Більш виражені зміни у хворих псоріазом чоловіків, мабуть, пов’язані з частішим виявленням у них осередків хронічної інфекції і зв’язку шкірного процесу з різними інфекційними чинниками. Особливу увагу ми відводили в оцінці стану імунної системи у досліджуваних хворих співвідношенню Т-хелперів і Т-супресорів, оскільки від цього імунорегуляторного індексу залежить інтенсивність імунної відповіді організму. Як бачимо з таблиці 4.1, у досліджуваних хворих як чоловіків, так і жінок, виявлено статистично значиме зниження імунорегуляторного індексу (CD4+/CD8+), у порівнянні з контролем (р<0,01), більш суттєво у хворих псоріазом чоловіків, на відміну від жінок. Підвищена активність Т-супресорів при такому співвідношенні субпопуляції не дозволяє розвинутися адекватній імунній відповіді, у зв'язку з чим переважають аутоіммунні процеси, що, мабуть, є наслідком вторинного імунодефіцитного стану. Істотне значення ми приділяли вивченню кількості натуральних кілерів (CD16+) в сироватці крові досліджених хворих. Ефективні функції натуральних кілерів – цитотоксичні відносно кліток-мішеней. Згідно даних літератури, активація натуральних кілерів в імунній відповіді відбувається через рецептори, які знаходяться на мембранах цих клітин. Так, у досліджених хворих відмічено статистично достовірне (р<0,05) збільшення CD16+ у хворих на псоріаз чоловіків. Проте, на відміну від інших субпопуляцій статистично значимих (р>0,05) відмінностей рівня CD16+ у чоловіків і жінок не виявлено. Таким чином, NК-кілери здійснюють антиген-специфічну ефекторну імунну реакцію антитілозалежної клітинної цитотоксичності, яка відіграє певну роль в патогенезі псоріазу. Якщо при контакті з клітинами рецептори на NК-кілерах здатні зв’язувати молекули МНС-1 (головний комплекс гістосумісності) власних клітин, “не знаходять” достатньої кількості своїх лігандів, МНС-1, то відносно цих клітин розвивається цитотоксичний ефект. Як бачимо з таблиці 4.1, при визначенні загальної кількості В-лімфоцитів (CD19+) їх абсолютна кількість у хворих на псоріаз чоловіків статистично достовірно (р<0,05) була вище, ніж у здорових людей. В той же час рівень CD19+ у жінок достовірно не відрізнявся від рівня його у здорових людей. Також ми змогли відзначити достовірне зростання рівня CD19+ у чоловіків на відміну від жінок (р<0,05). Підвищення кількості В-лімфоцитів у хворих на псоріаз чоловіків, на нашу думку, пояснюється впливом інфекційних чинників як при розвитку патологічного шкірного процесу, так і при рецидивах псоріазу. Важливим показником рівня стимуляції антитілоутворення до цитотоксичності є вміст Т-лімфоцитів з рецепторами до інтерлейкину-2 (CD25+) в крові. Активовані Т-лімфоцити утворюються в результаті взаємодії дендритних клітин, що представляють антиген до інтенсивно мігруючих Т-лімфоцитів, в лімфатичних вузлах. Якщо в цей період відбуваються необхідні і достатні корецепторнi взаємодії з антигенпрезентуючою клітиною, то Т-лімфоцит отримає активований сигнал, в результаті якого виникає клон специфічних для антигену диференційованих Т-лімфоцитів. Такі Т-лімфоцити вже називають лімфоцитами-ефекторами, ідентифікаційним маркером яких є CD25+. Цей показник відображає здатність лімфоцитів до проліферації і диференціювання за допомогою утворення цитокінів, одним з яких є ІЛ-6. У нашому дослідженні ми виявили статистично значиме підвищення абсолютного і відносного вмісту CD25+ – активованих Т-лімфоцитів в групі хворих на псоріаз чоловіків, як в порівнянні із здоровими особами (р<0,05), так і в групі хворих на псоріаз жінок (р<0,05). Ці зміни числа CD25+ – клітин свідчать, на наш погляд, про гіперактивність клітинного імунітету, обумовлену інфекційними чинниками, стимулюючими антитілоутворення і цитотоксичність Т-лімфоцитів. Ми також визначали кількість лімфоцитів, що мають зовнішні рецептори не лише для активації, а й для гальмування клітинної активності. Активність лімфоцита припиняється шляхом запуску внутріклітинного механізму самознищення клітини – апоптозу. У нормальних клітинах апоптоз не запускається за суто внутріклітинною програмою розвитку окремо взятої клітини, оскільки для цього потрібний зовнішній сигнал. Для його сприйняття на клітинах, в диференціюванні яких апоптоз передбачений, є спеціальні рецептори Fas (CD95+). Fas відноситься до рецепторів чинника некрозу пухлин, він проводить апоптичний сигнал всередину клітки. При дослідженні активованих Т-лімфоцитів з ідентифікаційним маркером Fas (CD95+) в обох групах хворих на псоріаз ми виявили статистично достовірне збільшення (р<0,05) активованих лімфоцитів з даним ідентифікаційним маркером в групі хворих на псоріаз чоловіків, у порівнянні з групою хворих на псоріаз жінок і здорових людей. Це дає можливість висловити припущення про наявність придбаного імунодефіциту, який може бути пов'язаний з ефектом негативної активації в результаті впливу інфекції, що ускладнює течію і прогноз псоріазу, головним чином у хворих чоловічої статі. Таким чином, аналіз отриманих результатів вивчення лімфоцитарних реакцій дозволив виявити зміни складу основних клітинних популяцій лімфоцитів периферичної крові хворих на псоріаз. Відмічено статистично достовірне зниження пулу Т-клітин (CD3 +) як в групі хворих на псоріаз чоловіків, так і у жінок. Це відбувалося за рахунок зниження в периферичній крові абсолютного і відносного вмісту Т-хелперів (CD4) на тлі несуттєвого зростання кількості цитотоксичних Т-лімфоцитів. У хворих на псоріаз чоловіків відзначалося збільшення Т-лімфоцитів з наявністю на їх поверхні клітин рецепторів Fas (CD95 +), в диференціюванні яких передбачений апоптоз. Особливо істотно ми відзначили зниження імунорегуляторного індексу особливо у хворих чоловіків, що ми розцінюємо як показник вторинного імунодефіциту. Звертає на себе увагу зростання натуральних кілерів (CD16 +) в сироватці крові у чоловіків, що характеризує клітинну цитотоксичність. У той же час рівень CD19 + був вище у хворих на псоріаз чоловіків при нормальному рівні його у жінок, що ми пояснювали роллю інфекційних чинників. Ми також виявили у хворих на псоріаз чоловіків збільшення рівня CD25, що ми розцінюємо як вияв гіперактивності клітинного імунітету, обумовлений інфекційними факторами, що стимулюють антитілоутворення і цитотоксичність Т-лімфоцитів. Все це свідчить про істотне розходження стану клітинного і гуморального імунітету, функції лімфоцитів у хворих на псоріаз чоловіків і жінок. На наш погляд, у чоловіків виявлені більш глибокі зрушення рівня популяцій і субпопуляцій лімфоцитів, що ми трактуємо особливостями патогенезу псоріазу у них і переважної роллю інфекційних факторів у розвитку дерматозу і його загострень, що підтверджувалося також і даними анамнезу та наявністю супутньої патології. 4.2 Цитокіновий профіль у хворих на псоріаз чоловіків та жінок Імунологічні механізми розвитку при псоріазі полягають в активації антиген-презентуючих клітин, які мігрують в регіонарні лімфатичні вузли, де і відбувається запуск каскаду реакцій з наступною активацією і проліферацією клітин імунної системи. До початку активації антиген представляють клітинам і лімфоцитам, на впровадження патогену реагують кератиноцити, тканинні базофіли, макрофаги, ендотеліоцити судин, в результаті чого продукуються різноманітні медіатори (цитокіни). Цитокіни є одним з основних регуляторів міжклітинної взаємодії, які беруть активну участь в реалізації імунної відповіді, запальних реакцій і ін. Одним з факторів розвитку псоріазу є порушення регуляції імунної відповіді за допомогою Т-лімфоцитів. Цитокіни Т-хелперів типів 4 і 1β призводять до гіперсекреції прозапальних медіаторів з наступною активацією кератиноцитів, мастоцитів, нейтрофілів, ендотеліоцитів, що в кінцевому підсумку маніфестується персистуючим хронічним запаленням. Динаміку основних цитокінів Т-лімфоцитів при псоріазі вивчають в основному з дослідженням експресії цих медіаторів на поверхні клітин. За даними більшості авторів, запалення в шкірі супроводжується не тільки локальним синтезом цитокінів, а й підвищенням їх концентрації в крові. Результати раніше проведених досліджень показали, що у хворих на псоріаз високі рівні в сироватці крові IL-4, IL-1β [153]. IL-1β продукуються макрофагальними клітинами, лімфоцитами, фібробластами. Він сприяє тому, що Т-лімфоцити-хелпери починають продукувати IL-2. IL-1β ініціює і реагує запальні, імунні процеси, активує нейтрофіли, Т- і В-лімфоцити, стимулює синтез цитокінів (IL-4, ФНП-α), простагландинів. IL-1β підвищує хемотаксис, фагоцитоз, гемопоез, проникність судинної стінки, цитотоксичну і бактерицидну активність. IL-4 продукується Т-клітинами (Т-хелперами ІІ типу і є фактором для диференціювання Т- і В-лімфоцитів). IL-4 обмежує синтез макрофагами прозапальних IL-1β, 6, 8, 12, ФНО-α. Крім того, IL-4 активує проліферацію В-лімфоцитів, підсилює протипухлинну активність макрофагів, модулює запальні реакції, активує Т-хелпери. Псоріаз традиційно розглядали як Th1-тип запальної реакції і ФНП – керований дерматоз [140]. IL – 1β і IL – 4 діють на кератиноцити і призводять до епідермальної гіперплазії, акантозу і гіперкератозу. Дермальні Th1 і Тс1 – лімфоцити активуються дермальними дендритними клітинами і продукують ФНП-α і ІФ-γ. Під впливом ФНП-α фібробласти починають синтезувати фактор росту кератиноцитів, що приводить до гіперпроліферації кератиноцитів, які активують імунокомпетентні клітини, міграцію нейтрофілів, плазмоцитарні дендритні клітини і фактор росту ендотелію судин, що призводить до підвищеної секреції сироваткового рівня ФНП-α. Як видно з таблиці 4.2, у хворих відзначено різне зростання рівня IL-1β, IL-4 і ФНП-α, що було при порівнянні з рівнем їх у здорових людей, статистично значимо (p <0,01). Одночасне отримане підвищення цитокінів узгоджується з даними літератури про синергізм між їх збільшенням. Однак звертає на себе увагу, що більш виражене статистично достовірне збільшення концентрації цих цитокінів відзначено у хворих на псоріаз чоловіків. Таблиця 4.2 – Рівень інтерлейкінів у хворих на псоріаз чоловіків та жінок (М ± m) Примітка. * – різниця зі здоровими достовірна; ** – різниця показників у чоловіків та жінок достовірна. На думку деяких авторів, основним медіатором, який запускає каскад реакцій, що призводять до розвитку псоріазу, є IL-1β, тому збільшення його в сироватці крові має принципове значення. Морфологічні ознаки псоріазу в експериментальних моделях більш виражене при стимулюванні IL-1β, ніж IL-12. Необхідно підкреслити, що IL-1β і IL-4 інтегрує відомі патологічні шляхи з залученням Т-хелперів типу 1, цитотоксичних Т-лімфоцитів типу 1 і дендритних клітин, які є основними причинами псоріазу. Звертає на себе увагу, що рівень вивчених цитокінів, особливо IL-1β, знаходився в прямій залежності від показників РАSI і статі вивчених хворих. Більш істотне підвищення цих показників було у хворих на псоріаз чоловіків, що ми пов’язуємо з наявністю у них вогнищ хронічної інфекції і прямих вказівок хворих на роль простудного фактора і переохолодження в загостренні псоріазу та його рецидивах. Тому, на наш погляд, рівень цих цитокінів, особливо IL-4, може служити прогностичним симптомом можливого загострення псоріазу, тобто його можна використовувати як один із елементів прогнозу рецидиву псоріазу. А це дозволяє провести профілактичне лікування і запобігти рецидиву дерматозу, що має величезне значення в дерматології, сприяючи покращенню якості життя хворих на псоріаз. 4.3 Дослідження функціональної активності фагоцитарних клітину хворих на псоріаз чоловіків та жінок Як бачимо з таблиці 4.3, кількість нейтрофілів, моноцитів у крові та фагоцитарний показник статистично значимо не відрізнялись в обох групах хворих на псоріаз. У хворих на псоріаз відмічено статистично достовірне зниження (р<0,01) у порівнянні з групою контролю фагоцитарного числа, більш виражене у хворих на псоріаз жінок, але різниця не була достовірно (р>0,05). Зниження фагоцитарного числа призводить до хронізації запального процесу, оскільки порушується функція розпаду та виведення імунних комплексів з організму. Також, звертає на себе увагу то, що у хворих на псоріаз, на відміну від групи контролю, відмічено статистично достовірне (р<0,05) зниження цитохімічного показника НСТ-тесту (спонтанного), більш виражене у хворих на псоріаз чоловіків (р<0,05). Таким чином, при вивченні фагоцитарних реакцій у хворих на псоріаз відмічено пригнічення функціональної активності нейтрофілів та фагоцитозу, тобто факторів неспецифічного захисту організму. Ці зміни можливо слід трактувати станом вторинного імунодефіциту, який характерний для псоріазу. Враховуючи те, що макрофаги, які опрацьовують антитіла, не дозволяють антигенчутливим Т- і В- клітинам дати максимальну відповідь на порогові дози антигену, вони локалізують антигени у фолікулах лімфоїдних тканин. Тому внаслідок впливу на організм імунних порушень при псоріазі, особливо у чоловіків, знижується здатність організму виявляти антигени, що викликає порушення ефективності імунного нагляду. Таблиця 4.3 – Функціональна активність фагоцитарних клітин у хворих на псоріаз чоловіків та жінок Примітка. * – р<0,05 и p<0,01 при порівнянні з групою контролю;
Р1 – достовірність різниці показників серед двох основних груп. 4.4 Показники гуморального імунітету у хворих на псоріаз чоловіків Як бачимо з таблиці 4.4, відмічено статистично достовірне збільшення продукції ІgG в обох групах хворих (р<0,05), який складає основну масу імуноглобулінів (до 80 %) людини, і є важливою ознакою гуморального імунітету. Більш виразне збільшення відмічено у хворих на псоріаз чоловіків, що було статистично достовірним (р<0,05), у порівнянні з хворими жінками. Таблиця 4.4 – Показники гуморального імунітету у хворих на псоріаз до лікування Примітка. * – р<0,05 достовірно при порівнянні з групою контролю;
Р1 – достовірність (р<0,05) показників в дослідних групах хворих на псоріаз. Також відмічено статистично достовірне зростання ІgM у хворих на псоріаз чоловіків (р<0,05), при нормальному його рівні у хворих жінок. Підвищення цього класу імуноглобулінів у хворих на псоріаз чоловіків у нашому дослідженні свідчить про те, що IgМ першим продукується на вплив інфекції, яка є супутньою у цих хворих. * * * Таким чином, отримані дані вивчення стану імунного статусу у досліджених хворих на псоріаз показали на суттєві відмінності у жінок і чоловіків. Так, хоча у жінок відмічено статистично достовірне зниження СD3+ та CD4+, але більш виражено це було у хворих чоловіків без суттєвих змін CD8+. Імунорегуляторний індекс (співвідношення CD4+/CD8+) був статистично достовірно пригнічений, але більш виражений у хворих чоловіків, що можна розцінювати як наявність вторинного імунодефіцитного стану. Натуральні кілери (СD16+), як і запальна кількість В-лімфоцитів (СD19+) були збільшені тільки у хворих чоловіків. Досить показово було збільшення кількості СD25+ та СD95+, що свідчить про наявність придбаного імунодефіциту а також як проявлення гіперреактивності клітинного імунітету з стимуляцією антитіло-утворення і цитотоксичності Т-лімфоцитів. Найбільш суттєві зрушення рівня популяцій і субпопуляцій лімфоцитів відмічені у хворих на псоріаз чоловіків, що ми пов’язуємо особливостями патогенезу псоріазу у них і роллю інфекційних факторів в розвитку дерматозу та його загострень. Синергічне збільшення цитокінів-показників загального запалення (IL‑1β, IL-4 та ФНП-α) у хворих на псоріаз залежно від тяжкості перебігу дерматозу було більш виражене у хворих чоловіків, що можна пов’язати з наявністю інфекційних факторів. Цей феномен можна використовувати як прогностичний показник прогнозу у профілактиці рецидивів псоріазу. При вивченні неспецифічних факторів захисту організму та рівня імуноглобулінів відмічено зниження фагоцитарного числа та НСТ-тест, особливо у чоловіків, а також зростання кількості ІgG, та IgM, також у чоловіків. Це свідчить про особливий стан активності фагоцитуючих клітин на нейтрофілів, що проявляюсь у їх пригніченні, особливо у чоловіків. В той же час збільшення IgM та ІgМ, більш виражене у чоловіків хворих на псоріаз, ми розцінюємо як важливі порушення гуморального імунітету, більш виражені у чоловіків, що потребує особливих підходів до індивідуалізованої диференційованої терапії. Матеріали цього розділу опубліковано автором у таких роботах: РОЗДІЛ 5 5.1 Обґрунтування диференційованих показань та виділення клініко-терапевтичних груп Підходи до лікування псоріазу досить різнорідні та різноспрямовані, що обумовлено наявністю спадкової схильності, особливостями клініки, типа і стадії захворювання, супутньою патологією органів та систем, наявністю вогнищ хронічної інфекції, різноспрямованістю імунних порушень, попередньою терапією та ін. По даним більшості авторів відмічається однаковий рівень захворюваності на псоріаз чоловіків і жінок та терапія їх проводиться, як правило, традиційно, без урахування статі. Але, як відомо, структура соматичної патології у представників різної статі неоднозначна, що не може не відображатись на особливостях імунної відповіді, гормонального статусу, деяких метаболічних процесів, психо-емоційної сфери і, зрозуміло, на характері перебігу псоріазу. У зв’язку з цим ми зробили спробу визначити особливості деяких змін в патології у хворих на псоріаз, для цього ми провели поглиблений зіставний аналіз анамнестичних даних, супутніх та перенесених захворювань, та усіх проведених функціональних та лабораторних досліджень, які представлені в таблиці 5.1. Як видно з таблиці 5.1, не відмічено якихось особливостей клінічних проявів та перебігу псоріазу у хворих жінок і чоловіків, що відповідає даним більшості авторів, які займалися вивченням цього системного дерматозу. Таблиця 5.1 – Зіставний аналіз клініко-лабораторних матеріалів досліджених 100 хворих на псоріаз чоловіків і жінок Продовження таблиці 5.1 407,8 ± 49,9 16,3 ± 2,1 8,45 ± 0,88 Продовження таблиці 5.1 (СD4+)0,55 ± 0,01 (СD8+)0,31 ± 0,01 (СD16+)0,22 ± 0,03 (СD19+)0,31 ± 0,01 (СD25+)0,27 ± 0,02 (СD95+)0,28 ± 0,02 (СD4+/СD8+) 0,31 ± 0,02 0,35 ± 0,02 0,22 ± 0,03 0,36 ± 0,04 0,47 ± 0,05 0,39 ± 0,02 1,21 ± 0,12 0,48 ± 0,02 0,36 ± 0,02 0,29 ± 0,03 0,33 ± 0,03 0,33 ± 0,03 0,23 ± 0,01 1,39 ± 0,07 p>0,05 p>0,05 p<0,05
p<0,05
p<0,05 Il-4 2,4 ± 0,1 ФНП-α 8,1 ± 1,1 5,8 ± 0,2 35,1 ± 4,2 2,6 ± 0,05 28,4 ± 2,1 Нейтрофіли ФЧ НСТ-тест2,44±0,12 Моноцити Рівнозначні Рівнозначні 3,26 ± 0,21 Рівнозначні Рівнозначні Рівнозначні 4,11 ± 0,21 Рівнозначні p>0,05 p>0,05 p<0,05
p>0,05 IgA 2,7 ± 0,3 IgM 2,4 ± 1,1 2,1 ± 0,7 1,4 ± 0,3 2,5 ± 0,3 1,3 ± 0,14 p<0,05 Хоча у всіх хворих на псоріаз відмічено достовірне збільшення рівня КТ, АКТГ і зниження ТТГ відносно контрольної групи, однак статистично достовірних змін цих гормонів між хворими жінками і чоловіками ми не змогли відмітити. Але деяка тенденція до більш виразних порушень гормонального фону ми констатували у хворих жіночої статі. 5.2 Обґрунтування комплексної диференційованої терапії хворих на псоріаз в залежності від статі В той же час найбільш виразні статистично достовірні зміни у цих контингентів хворих зафіксовані анамнестично, а також у психо-емоційних зрушеннях, імунному статусі та гуанілатциклазній системі. Проведений аналіз дозволив об’єднати хворих на псоріаз у 3 клініко-терапевтичні групи. Перша (група порівняння), в яку увійшли 20 пацієнтів (10 чоловіків і 10 жінок), отримувала незалежно від статі традиційну терапію. Хворим цієї групи вводили внутрішньовенно краплинно реосорбілакт по 400,0 мл, № 4-5, чи реамберин по 400,0 мл, № 4-5; Кальцію глюконат 10 % по 5,0 мл в/м, щоденно; вітамін В12 по 500 мкг в/м 1 раз на добу, через день, № 20; аєвіт по 1 капсулі 2 рази на день, 1 місяць; ессенціале-форте по 1 капсулі 2 рази на день, 1 місяць. На добу з подальшим зменшенням дози, 1 місяць, діуретики, зовнішньо – молескін С. Друга група (основна) включала 40 хворих на псоріаз чоловіків, у яких, як бачимо з таблиці 5.1, у значної більшості передували інфекційні та запальні процеси перед виникненням та загостренням дерматозу, із супровідних захворювань переважали також інфекційні (вірусні, бактеріальні, грибкові) та запальні фактори, виявлені значні імунні порушення. Ці хворі додатково до традиційної терапії отримували антибіотики (азитроміцин по 500 мг 1 раз на день, через день № 6); імуномодулятори (аміксин ІС, 0,125 на добу 2 дні поспіль, а потім по 0,125 г через день, № 10), аскорбінова кислота до 1,0 г на добу, 1 місяць, при необхідності – ітраконазол по 200 мг, 2 рази на день, 7 днів, потім – 3 неділі відпочинок (пульс-терапія). Третя група (основна) складалась з 40 хворих на псоріаз жінок, у яких у більшості переважали психо-емоційні фактори у передуванні виникненню або загострення дерматозу, а також як супутні захворювання, відмічались достовірно вищі показники тривожності, відмічені більш суттєві порушення вегетативної нервової системи. Ці пацієнти додатково до традиційної терапії отримували тіотриазолін по 1т. 2 рази на день, 20 днів; міасер по 10 мг ввечері, 1 місяць; атаракс по 1т. 2 рази на день, 1,5 місяці. В якості коректора імунних метаболічних порушень в лікуванні псоріазу ми призначали вітчизняний імуномоделюючий препарат Аміксин ІС (Інтерхім, Україна). Це низькомолекулярний синтетичний індуктор інтерферону ароматичного ряду, який відноситься до класу флуоренів, стимулює утворення в організмі α-, β-типів інтерферону. Основними продуцентами інтерферону у відповідь на введення аміксину є Т-лімфоцити, нейтрофільні гранулоцити, гепатоцити, а також клітини епітелію кишки. Слід зазначити, що псоріаз є Тh1 – обумовленим захворюванням, головна роль у його розвитку належить протизапальним цитокінам ФНО-α і IFN-γ. Аміксин пригнічує синтез даних протизапальних цитокінів за допомогою стимуляції продукції протизапальних цитокінів типу IL-4, що змінює баланс субпопуляцій Т-хелперів в бік Тh2-клітин. Препарат стимулює стволові клітини кісткового мозку, активує антитілоутворення, знижує ступінь імунодепресії, поновлює співвідношення Т-супресори/Т-хелпери, сумісний з антибактеріальними та противірусними препаратами. Також з групи препаратів які володіють імуномодулюючим впливом, ми призначали вітчизняний багатовекторний препарат Тіотриазолін (Галичфарм, Україна). Препарат стимулює Т-клітинний імунітет і неспецифічні фактори захисту, надає гепатопротекторну, антиоксидантну, мембраностабілізуючу та протизапальну дію, нормалізує білковий, вуглеводний, ліпідний та пігментний обміни. Тіотриазолін підвищує компенсаторну активацію анаеробного гліколізу, зменшує пригнічення процесів окислення у циклі Кребса зі збереженням резервів АТФ. Препарат активує антиоксидантну систему і гальмує процеси окислення ліпідів в ішемізованих ділянках міокарду, знижує чутливість м’язів серця к катехоламінів, надає виразну кардіопротекторну дію, а також покращує реологічні властивості крові за рахунок активації фібринолітичної системи. Із протигрибкових препаратів при наявності мікозів у хворих на псоріаз ми використовували Ітраконазол (ЗАТ «Фармлігі», Іспанія), який найбільш ефективний при лікуванні широкого спектру збудників мікозів. Він відноситься до нової «генерації» азолових препаратів, так званим триазолам. Механізм дії препарату обумовлено інгібуванням синтезу ергостерину – важливого компонента клітинної стінки гриба, однак препарат діє більш вибірно на цитохром гриба. Мінімальна інгібуюча концентрація ітраконазолу по відношенню до дерматоміоцетів складає 0,1 мг/л, спектр дії ітраконазолу досить широкий, включає дерматоміцети, дріжджеподібні гриби, плеснові гриби. За показниками в терапії хворих на псоріаз використовували антибіотик азитроміцин, який серед макролідів володіє виразною активністю щодо більшості, як патогенних, так і умовно патогенних мікроорганізмів. Препарат не руйнується шлунковими кислотами, добре всмоктується, створюючи оптимальну концентрацію в сироватці крові. Азитроміцін добре проникає всередину клітин, створюючи високу внутрішньоклітинну концентрацію, яка перевищує МІК. Практично відсутні побічна та токсична дії на макроорганізм. Міасер (міансерін) – антидепресивний препарат з групи піперазіне – азенінових з’єднань з виразною антидепресивною і анксиолітичною дією виробництва фірми «Рівофарм» (Швейцарія) Міансерін швидко всмоктується після прийому внутрішньо. Максимальна концентрація у плазмі крові відбувається через 3 години після прийому, період виведення складає від 20 до 60 годин, тому використовувати препарат достатньо 1 раз на добу. Міасер зменшує частоту та вираженість вегетативних кризів, він блокує периферичні α-адренорецептори та 5НТ2 – рецептори, що знижує частоту приступів серцебиття, головокружіння, стабілізує артеріальний тиск, знімає головний біль. Міасер суттєво покращує сон, знімає тривогу. Міасер добре переноситься пацієнтами, не порушує функцію серцево-судинної системи, не дає побічних ефектів. Атаракс – небензодіазепіновий анксиолітик (гідроксизин) ефективний в лікуванні тривожних порушень різного походження, при цьому підвищує когнітивні функції більш швидко і виразно, ніж інші анксиолітики. Показанням є симптоматичне лікування тривожних станів у дорослих, як седативний засіб в період симптоматичної терапії свербежу. Клінічний ефект атаракса у вигляді зниження виразності тривоги наступає через 30 – 45 хвилин після прийому внутрішньо таблеток. Володіє широким спектром анксиолітичної активності з присутністю додаткових ефектів: протисвербіжний, седативний, протиблювотний, антигістамінний ефекти, покращує подовженість сну пам’ять і увагу, знижує частоту нічних пробуджень, впливає позитивно на когнітивні функції. Досить рідко дає побічні ефекти. 5.3 Оцінка ефективності проведеної терапії з визначенням найближчих і віддалених результатів лікування хворих на псоріаз різної статі У кожній групі хворі розподілялися репрезентативне за віком, тривалістю захворювання, клінічною формою і ускладненнями. Ми провели порівняльний аналіз найближчих і віддалених результатів лікування хворих на псоріаз в трьох групах порівняно. Переносимість лікування була задовільною. У жодного хворого 2-х основних і групи порівняння не відзначалося порушень загального стану, загострення захворювання або появи ускладнень. За результатами моніторингу загальноклінічних аналізів не виявлено змін в дослідженнях сечі і формулі крові в процесі лікування. Стабілізація та початок регресу клінічних проявів дерматозу у пацієнтів першої та другої основної групи був зафіксований на 10 – 12-й день лікування, а у хворих групи порівняння – на 15 – 18-й день. Позитивний клінічний ефект в основних групах хворих був отриманий на 19 – 24-й день лікування, після чого лікування пацієнтів проводилась амбулаторно, а у хворих групи порівняння на 30 – 35-й день лікування. Загальний термін лікування (термін втрати працездатності) у хворих двох основних груп не перевищувала терміни, що рекомендовані нормативами МОЗ України. В той же час у 3 з 20 хворих групи порівняння ефект терапії був відсутній, а поява свіжих папульозних елементів, виникнення феномену Кьобнера, потребувало додаткової терапії. У цих у хворих, які отримували рекомендовану терапію, значно покращився загальний психо-емоційний статус, швидше регресували елементи висипу, зменшився показник індексу РАSI, у порівнянні з хворими групи порівняння. Так, індекс РАSI з урахуванням ступеня гіперемії, інфільтрації, лущення і площі ураження становив до лікування (28,4 ± 2,4) бала. Після лікування індекс РАSI зменшився у хворих групи порівняння до (18,2 ± 1,21) бала (редукція індексу PASI = 35,9 %), а у хворих двох основних груп, які отримували додатково рекомендоване лікування зменшився до (14,1 ± 1,1) і (13,8 ± 0,86) бала (редукція індексу PASI = 50,3 % у чоловіків і 51,4 % у жінок), відповідно. Значно зменшився показник якості життя DLQI (з 11,0 до 5,0). Відбувалася суттєва перебудова в основній групі у хворих на псоріаз в ендокринній та вегетативній системах. Так, відзначені позитивні зрушення даних опитувальників. Показники варіабельності серцевого ритму також наблизилися до норми (рис. 5.1, 5.2), що відображає ослаблення активності механізмів стресу, і помітне поліпшення активності антистресової системи. Повна ремісія наприкінці курсу лікування досягнута у 6 з 20 пацієнтів групи порівняння, значне поліпшення – у 8 з 20, поліпшення – у 6. У той же час у хворих другої основної групи, що складаються з чоловіків, які додатково отримували рекомендовані препарати, повна клінічна ремісія зареєстрована у 21 з 40 пацієнтів, значне поліпшення – у 14 з 40, поліпшення – у 5 з 40, а в групі третьої (жінки), відповідно, у 19 з 40, у 15 з 40 і у 6 з 40. Рисунок 5.1 – Показники варіабельності серцевого ритму у хворих на псоріаз чоловіків до та після лікування та практично здорових донорів Рисунок 5.2 – Показники варіабельності серцевого ритму у хворих на псоріаз жінок до та після лікування та практично здорових донорів Як видно з таблиці 5.2, після лікування відмічено статистично достовірне зниження рівня КТ і АКТГ і зростання рівня ТТГ тільки в основній групі, яке більш виразне у жінок, що ми пов’язуємо з характером проведеної терапії і впливом нормалізації психо-емоційного статусу та стану вегетативної регуляції на рівень гормонів, тобто функцію ендокринної системи. Таблиця 5.2 – Динаміка рівня гормонів e хворих на псоріаз до і після лікування (M ± m) нмоль/л (n=50) ** (n=50) ** пг/мл (n=50) ** (n=50) ** мк ОД/мл (n=50) ** (n=50) Примітка. * – р< 0,05 – достовірність між групових відмінностей після лікування (основна і порівняння); ** – достовірність до і після лікування. Після проведеної терапії в основній групі не спостерігалося зростання абсолютної кількості CD3+, CD4+, зменшення CD25+, CD95+, переважно у хворих на псоріаз чоловіків, що було статистично достовірне (табл. 5.3). Звертає на себе увагу зростання індексу CD4+/CD8+ після лікування за запропонованою методикою, більш показне у чоловіків, що свідчить про нормалізацію імунної відповіді організму, на відміну від хворих, які проліковані традиційно без урахування гендерних особливостей. Всі зміни в групі порівняння хворих на псоріаз були статистично не значущі. Більш виразні зміни кількості основних популяцій лімфоцитів у хворих на псоріаз, особливо у чоловіків, ми пов’язуємо з позитивним впливом проведеної розробленої терапії з використанням антибіотиків, антимікотиків, імуномодуляторів. Таблиця 5.3 – Динаміка основних популяцій і субпопуляцій лімфоцитів крові у досліджених хворих на псоріаз (109/л) (n=20) (n=80) (n=20) лікування лікування лікування лікування * ** * ** СD8+ * ** Примітка. ч – чоловіки; ж – жінки; * – р<0,05 – достовірність міжгрупових відмінностей після лікування (основна і порівнянна); ** – р<0,05 – достовірність до і після лікування. Як видно з таблиці 5.4, після лікування рівень інтерлейкінів знижувався, але статистично вірогідно лише у хворих основної групи, яка отримувала рекомендовану терапію, направлену на корекцію рівня цитокінів. Слід відмітити, що більш показне зниження інтерлейкінів було у хворих на псоріаз чоловіків, ніж у жінок, які отримували більш адекватну і спрямовану терапію. У групі порівняння також була тенденція до зниження, але вони були статистично недостовірні. Таблиця 5.4 – Динаміка рівня інтерлейкінів у досліджених хворих на псоріаз в залежності від статі лікування лікування лікування * * * * Примітка. ч – чоловіки; ж – жінки; * – р<0,05 – достовірність міжгрупових відмінностей після лікування (основна і порівнянна); ** – p<0,05 – достовірність до і після лікування терапії. Дані з таблиці 5.5 свідчать, що рівень Ig G та Ig М статистично значимо знижався у хворих на псоріаз чоловіків і залишався майже незмінним у хворих жінок. Зменшення рівня цих імуноглобулінів зафіксовано тільки у хворих основної групи, які отримували рекомендовану терапію, що свідчить про можливу ліквідацію інфекції та позитивний вплив імунокорегуючої терапії. Таблиця 5.5 – Динаміка рівня імуноглобулінів у досліджених хворих на псоріаз різної статі лікування лікування лікування * (г/л) * Примітка. ч – чоловіки; ж – жінки; * – р<0,05 – достовірність міжгрупових відмінностей після лікування (основна і порівнянна); ** – p<0,05 – достовірність до і після лікування терапії. Як видно з таблиці 5.6, після проведеної терапії, на відміну від традиційної терапії у групі порівняння, відмічено зростання НСТ-теста та фагоцитарного числа, особливо у хворих на псоріаз чоловіків, що було статистично достовірно. Це можна розцінити як показник активації неспецифічних факторів захисту при проведенні протизапальної та імуномодулюючої терапії у хворих на псоріаз чоловіків. Таблиця 5.6 – Динаміка фагоцитарних реакцій у досліджених хворих на псоріаз різної статі лікування лікування лікування * (%) * Примітка. ч – чоловіки; ж – жінки; * – р<0,05 – достовірність міжгрупових відмінностей після лікування (основна і порівняння); ** – p<0,05 – достовірність до і після лікування терапії. Виражені відмінності в групі порівняння і основних групах, що відзначено при розвитку рецидивів при аналізі віддалених результатів лікування. Так, ремісія менше 1 року відзначена у 10 з 20 хворих групи порівняння і тільки у 2 з 80 хворих основної групи, які отримували рекомендовані препарати. Ремісія до 2-х років зареєстрована у 45 із 80 хворих основної групи і у 7 із 20 хворих групи порівняння; ремісія більше 2-х років – у 29 із 80 хворих основної групи і у 3 із 20 хворих групи порівняння. Щорічні рецидиви зареєстровані у 12 із 20 хворих групи порівняння і у 24 із 80 хворих основної групи; протягом 1-2 років – у 6 із 20 і у 40 із 80, відповідно; протягом 2-3 роки – у 2 із 20 і у 18 із 80. В якості підтвердження позитивної оцінки результатів диференційованої терапії наводимо історії хвороби досліджених пацієнтів. 1. Приклад 1. Хвора 45 років (історія хвороби № 953) знаходилась на стаціонарному лікуванні в ОШВД м. Запоріжжя з діагнозом: бляшковий псоріаз, стаціонарна стадія, зимовий тип. Супутній діагноз: аменорея, іпохондрія. Хворіє 12 років. Початок захворювання пов’язує з нервовою перенапругою, загострення дерматозу в осінньо-зимовий період, рецидиви псоріазу пов’язує також з психоемоційними факторами, стресами, сімейними незгодами. Псоріаз у батька і сестри. Хвора неодноразово лікувалась амбулаторно і стаціонарно, отримувала традиційну терапію без урахування гендерних факторів як з деяким покращенням стану, так і без ефекту. Стан внутрішніх органів: тони серця приглушені, ритмічні. У легенях дихання везикулярне, печінка у реберної дуги, живіт при пальпації м’який, безболісний, артеріальний тиск: 115/80 мм.рт.ст. Дерматологічний статус: на шкірі тулуба і кінцівок – поодинокі та зливні еритемато-сквамозні бляшки в улюблених місцях, поодинокі краплеподібні папули, псоріатична «тріада» при зшкрябуванні папули чітко з’являється. Папули мають рожеве забарвлення, вкриті сріблясто-білими, дрібно пластинчатими лусочками. Також уражена волосиста частина голови у вигляді «псоріатичної корони». PASI = (37,5 ± 5,6) бала. Ураження нігтів на кистях (4 пластини) – точкове заглиблення. Аналіз крові і дослідження сечі – без особливостей. Фактори, які передували виникненню та загостренню псоріазу – психоемоційні подразнення. Супровідні захворювання, вегетоневроз, холецистит. Рівень депресії – високий. Дослідження на системі «Кардіолаб» – зменшення тонусу симпатичної нервової системи (зниження HF I LF), невідповідність активності процесів регуляції. Рівень досліджених гормонів: КТ – 751,4 нмоль/л; АКТГ – 62,4 пг/мл: ТТГ – 5,6 мк Од/мл. Рівень ГЦ – 2,63 нмоль/с л; цГМФ – 33,4 нмоль/мл. Імунний статус: CD3+ – 0,52; CD4+ – 0,41; CD25+ – 0,32; CD95+ – 0,21; CD4+/CD8+ – 1,32. Інтерлейкіни: IL-1β – 29,8 пг/мл; IL-4 – 2,3 пг/мл; ФНП-α – 27,8 пг/мл. НСТ-тест – 4,06 %; Ig G – 12,1 г/л; Ig M – 1,2 г/л. Хвора отримувала з метою терапії внутрішньовенно краплинно реосорбілакт по 400,0 мл, гепарин підшкірно, аєвіт 1 капсула, 2 рази на день; ессенціале-форте по 1 капсула, 2 рази на день; тіотриазолін по 1 таблетці 2 рази на день; міасер по 10 мг ввечері; атаракс по 1 таблетці, 2 рази на день; зовнішньо – молескін С. Регрес шкірних проявів відмічений на 14 день лікування, і к 24-му дню на місці папул сформувалась депігментація, чергові бляшки залишались в ділянках ліктьового та колінного суглобів (редукція індекс PASI-48,4; DLQI- 6,8 ). Після проведеного лікування, поряд з регресом клінічних даних отримані спритним зрушенням лабораторних та функціональних досліджень. Так, зменшився рівень депресії до низького, покращились показники Кардіолаба, що відображає послаблення активності механізмів стресу та виразне покращення активності антистресової системи (КТ – 614,4 нмоль/л; АКТГ – 41,4 пг/мл; ТТГ – 6,8 мк Од/мл; імунний статус CD3+ – 0,61; CD4+ – 0,49; CD8+ – 0,33; CD4+/CD8+ – 1,47; ФНП-α – 21,2 пг/мл; IL-1β – 28,1 пг/мл; IL-4 – 2,4 пг/мл; Ig G – 14,5 г/л; Ig А – 1,8 г/л; Ig M – 1,4 г/л; ФП – 58,4 %; ФЧ – 3,81; НСТ-тест – 2,58 %). У процесі лікування стан хворої був задовільний, ускладнень від препаратів не відмічено. На протязі 12 місяців залишалась стійка ремісія. 2. Приклад 2. Хворий 47 років (історія хвороби № 858) знаходився на амбулаторному лікуванні на кафедрі та диспансерному відділі ОШВД з діагнозом: бляшковий псоріаз, стаціонарна стадія, зимовий тип. Супутній діагноз: хронічний гайморит, простатит. Хворіє 13 років. Початок захворювання пов’язує з інфекційними факторами (ангіна, грип), загострення дерматозу в осінньо-зимовий період, рецидиви псоріазу пов’язує с простудними факторами та переохолодженням. Псоріаз у батька. Хворий неодноразово лікувався амбулаторно і стаціонарно, отримував традиційну терапію без урахування гендерних факторів як без ефекту, так і з деяким покращенням стану шкіри. Стан внутрішніх органів: тони серця ритмічні. У легенях-дихання везикулярне, печінка не збільшена, живіт при пальпації м’який, безболісний, артеріальний тиск – 125/85 мм рт.ст. Дерматологічний статус: на тулубі і кінцівках – багаточисельні бляшки з грубо пластинчатим лущенням, місцями – зливні, по периферії бляшок – поодинокі краплеподібні папули. При поскаблюванні папули – чітко з’являється псоріатична «тріада». Папули рожевого забарвлення. На волосистій частині голови з переходом на гладку шкіру – псоріатична корона» зі значним лущенням. Ураження нігтьових пластин – точкові заглиблення. PASI = (39,4 ± 6,1) бала. Аналіз крові і сечі – без особливостей. Фактори, які передували виникненню загостренню псоріазу: простудні захворювання і переохолодження. Супровідні захворювання: хронічний тонзиліт, простатит. Рівень депресії – низький. Дослідження на системі «Кардіолаб» – без патології. Рівень дослідження гормонів: КТ – 705,2 нмоль,л; АКТГ – 56,4 пг/мл; ТТГ – 6,2 мкОд/мл. Активність ГЦ – 4,08 нмоль/с л; вміст цГМФ – 20,4 нмоль/мл. Імунний статус: CD3+ – 0,48; CD4+ – 0,3; CD25+ – 29,3; CD95+ – 26,3; CD4+/CD8+ – 0,9; ФНП-α – 36,2 пг/мл; IL-1β – 35,2 пг/мл; IL-4 – 5,9 пг/мл; ФЧ – 3,48; НСТ-тест – 3,28 %; Ig G – 17,8г/л; Ig M – 2,5г/л. Хворий отримував внутрішньовенно краплино реамберин по 400,0 мл, №5; гепарин підшкірно 1 мг вранці, №7; вітамін В12 в/м по 500 мкг, №20: аєвіт по 1 капсулі, 2 рази на добу, 1 місяць; ессенціале-форте по 1 капсулі, 2 рази на добу; азитроміцін по 500 мг 1 раз на добу, через день, №6; аміксин ІС по схемі, №10; аскорбінову кислоту до 2,0 г на добу; зовнішньо – молескін С. Регрес шкірних проявів був на 12 день лікування і до 26 дня – на місцях папул залишалась депігментація. Чергові бляшки залишились в ділянках ліктьових та колінних суглобів (редукція індексу PASI-50,3; DLQI-7,0 ) Після проведеного лікування поряд с регресом клінічних даних отримані сприятливі зрушення функціональних та лабораторних досліджень: КТ – 603,4 нмоль/л; АКТГ – 37,6 пг/мл; ТТГ – 6,7 мк Од/мл. Імунний статус: CD3+ – 0,69; CD4+ – 0,53; CD25+ – 0,34; CD95+ – 0,28; CD4+/CD8+ – 1,7; ФНП-α – 23,8 пг/мл; IL-1β – 26,3 пг/мл; IL-4 – 4,0 пг/мл; Ig G – 14,8г/л; Ig M – 1,5г/л; ФЧ – 4,8; НСТ-тест – 3,96 %. У процесі лікування стан хворого був задовільний, ускладнень від прийому препаратів не відмічено. На протязі 14 місяців залишалась стійка ремісія. * * * Таким чином, розроблена методика гендерних особливостей в підході до диференційованої комплексної терапії хворих на псоріаз на підставі порівняльного вивчення даних анамнезу, супутніх захворювань, визначення рівня стресових гормонів, імунного статусу, а також психо-емоційної сфери пацієнтів, рівня вегетативної регуляції. Це дозволило обґрунтувати і рекомендувати до застосування додатково до базової терапії комплекс патогенетичних засобів диференційовано хворим чоловікам і жінкам. Ефективність рекомендованих препаратів і засобів, диференційовано у чоловіків і жінок з протизапальною, імуномодулюючою, седативною і антидепресивною дією, була досить високою при вивченні найближчих результатів терапії. Не відмічені токсичні і побічні ефекти. Ми теж відмічали після лікування позитивну динаміку проведених лабораторних та інструментальних методів дослідження. При вивченні гормонального антистресової фону, на відміну від групи порівняння, спостерігалося зростання ТТГ, зниження рівня кортизону і АКТГ у хворих дослідної групи, особливо у хворих на псоріаз жіночої статі, в результаті застосування запропонованих засобів. На відміну від хворих на псоріаз групи порівняння, які отримували традиційну терапію, у хворих дослідних груп, переважно пацієнтів чоловічої статі, відзначені сприятливі зрушення в імунному статусі. Так, знижувався рівень ФНП – α, IL-1β і IL-4, підвищувався СD3 + і CD4 +, знижувався CD16 +, а тільки у чоловіків знижувався рівень CD25 + і CD95 +. Звертало на себе увагу підвищення у хворих дослідної груп індексу CD4 + / CD8 +, більш показове у хворих на псоріаз чоловіків. Після лікування у хворих основної групи статистично значимо знижувався рівень IgM і IgG, особливо у чоловіків, істотно нормалізувалися фагоцитарні реакції, також більш показові у пацієнтів чоловічої статі. При вивченні віддалених результатів у хворих основної групи значно подовжувалися періоди ремісії, скорочувалась кількість рецидивів, а окремі рецидиви реєструвалися у пацієнтів в більш віддалені терміни. Матеріали цього розділу опубліковано автором у таких роботах: РОЗДІЛ 6 За даними літератури останніх років, відомо, що псоріаз є однією з актуальних медико-соціальних проблем через широку розповсюдженість захворюваності та часте рецидивування хвороби. Залишається остаточно не вирішене питання стосовно етіології, деяких сторін патогенезу, лікування псоріазу, проведення профілактичних заходів. Інтерес до цього дерматозу обумовлений не тільки високою питомою вагою серед усіх шкірних захворювань, але і наявністю тяжких та ускладнених форм, ураженням імунної системи, резистентністю до традиційної терапії. За даними більшості авторів відмічається однаковий рівень захворюваності на псоріаз серед чоловіків і жінок, і терапія їх проводиться, як правило рівнозначно, без урахування статі. Однак, як відомо, структура соматичної патології у представників різної статі неоднозначна, що не може не відображатись на особливостях імунної відповіді, гормонального статусу, даних метаболічних процесів, психо-емоційної сфери і, зрозуміло, на характері перебігу псоріазу. У зв’язку з цим ми провели дослідження гендерних особливостей патологічних змін у хворих на псоріаз в залежності від статі, для чого провели поглиблений зіставний аналіз анамнестичних даних, супутніх та перенесених захворювань та усіх проведених функціональних та лабораторних досліджень (психо-емоційних, стану вегетативної нервової системи, ендокринної та імунної систем, біохімічних показників). Під спостереженням перебувало 100 хворих на псоріаз, з них 50 чоловіків, 50 жінок у віці 19-52 років. Давність захворювання складала до 10 років – у 78 % хворих, і більше 10 років – 7 %. Захворювання частіше виникало у віці 11-30 років, рідше – після 40 років. Осінньо-зимовий псоріаз відмічено у 75 хворих, весняно-літній – у 15 і недиференційований – у 10. Прогресуюча стадія встановлена у 84 хворих, стаціонарна – у 14, регресуючи – у 2. З 100 обстежених пацієнтів переважав вульгарний або бляшковий у 84 хворих на псоріаз, краплеподібний був у 7, інтертригінозний – у 6, та долонно-підошовний – у 3. Псоріатична оніходистрофія встановлена у 48 із 100 досліджених хворих. Спадкові фактори (псоріаз у батьків, братів, сестер та інших родичів) зареєстровані у 22 із 100 хворих однаково часто у чоловіків і жінок хворих на псоріаз. У 72 % хворих жіночої статі анамнестично передували різні психо-емоційні фактори (хвороба і смерть родичів, нервові стреси, ненормальні обставини у родині, перевантаження та ін). У 68 % хворих на псоріаз чоловіків передували різні інфекційні фактори (грип, ОРЗ, ангіна, фронтит, гайморит, сечостатеві інфекції, простатит, холецистити, фурункульоз, грибкові та вірусні інфекції та ін.). У 36 % хворих ці фактори комбінувались. У 8 % хворих попередні фактори не вдалося виявити. Із супровідних захворювань у чоловіків хворих на псоріаз більш частіше ніж у жінок, переважали алкоголізм, запальні та інфекційні процеси (хронічний тонзиліт, гайморит, пієлонефрит, сечостатеві інфекції, простатит, вірусні процеси, дерматомікози, бронхіт та ін.), що склало 87 випадків. В той же час у жінок, на відміну від чоловіків, переважали нервові і психічні захворювання, гіпертонічна хвороба та ін.(23 випадків). Перенесені захворювання були зареєстровані частіше у чоловіків (62 випадки), ніж у жінок (37 випадків), але у чоловіків переважали застудні і гнійно-запальні захворювання (32 випадки), травми, операції. Виявлені особливості клінічних проявів та перебіг псоріазу у хворих різної статі. Клінічні особливості вульгарного або бляшкового, краплеподібного, інтертригінозного, долонно-підошовного псоріазу були однотипні як у чоловіків, так і у жінок. Ступінь тяжкості перебігу псоріазу у досліджених хворих віднесено до середньо-тяжкого. При підрахунку індекс PASI (індекс площі та тяжкості псоріазу) у хворих на псоріаз чоловіків складав (28,16 ± 2,19) бала, у жінок – (23,45 ± 2,02) бала, DLQI – 11,0. У 5 з 50 хворих на псоріаз чоловіків відмічені артралгії, а у 3 з 50 також чоловіків зареєстрована тенденція до злиття псоріатичних елементів і формування еритродермії. З метою оцінки психологічного статусу хворих на псоріаз, ми вивчали показники депресії (за шкалою Зунга) та показники тривожності (за шкалою Шихана). При оцінці показників депресії та тривожності в загальній групі хворих на псоріаз показник шкали депресії відповідав помірно вираженій депресії. При цьому показник менше 50 балів був у 4 пацієнтів (4 %), від 50 до 59 балів – у 41 (41 %), від 60 до 69 балів (помірна депресія) – у 44 пацієнтів (44 %), 70 балів та вище (тяжка виражена депресія) – у 11 (11 %) хворих. Таким чином, у 96 % хворих на псоріаз, у тому числі помірна та тяжка депресія відмічалась більш ніж у половини хворих (56 %). Показник шкали тривожності у хворих на псоріаз складав 26 балів, що відповідало аномальному рівню. Нормальний показник (до 20 балів) був у 54 % хворих. Аномальний рівень (від 21 до 50 балів) відмічався у 28 %, середній рівень (від 50 до 70 балів) – у 12 % і високий – у 6 % хворих. Таким чином, різні ступені вираженості тривожності виявлені у 46 % хворих, у тому числі середній та високий рівень виявлений у 18 % пацієнтів. При порівнянні хворих на псоріаз чоловіків та жінок не відмічено достовірної різниці в показниках депресії, який відповідав рівню помірної депресії в обох групах. При оцінці тривожності у чоловіків встановлено нормальний рівень тривожності, тоді як у жінок – аномальний і різниця між чоловіками та жінками була достовірна. Аномальний рівень тривожності був виявлений у 12 (21 %) чоловіків і у 16 (36 %) жінок. За допомогою системи кардіографії «Сardaolab» досліджували стан вегетативної регуляції організму у хворих на псоріаз. У хворих на псоріаз зареєстровано дисбаланс основних параметрів нейрогуморальної регуляції у вигляді змін загальної потужності основних часових та спектральних показників. Так, показник SDNN становив (44,2 ± 3,9) мс2 у чоловіків і (32,2±2,2) мс2 – у жінок (при нормі [54,7 ± 3,4] мс2). ТР складала (1968,1 ± 216,5) мс2 у чоловіків і (1421,3 ± 208,4) мс2 – у жінок (при нормі [2628,1 ± 312,5] мс2); показник потужності спектра високочастотних коливань (HF) складав (642,8 ± 144,6) мс2 у чоловіків, (458,4 ± 232,1) мс2 – у жінок (при нормі [1016,4 ± 232,4] мс2); показник вегетативного балансу (LF/HF) був на рівні (2,02 ± 0,03) % у чоловіків і (2,23 ± 0,11) % у жінок (при нормі [1,51 ± 0,15] %). Як видно з представлених даних усі показники стану вегетативної регуляції були статистично знижені у хворих на псоріаз обох груп, за винятком LF/HF, який був підвищений. Дисбаланс між показниками у хворих на псоріаз, свідчить про більш значні патологічні зміни вегетативного балансу у бік симпатичної нервової системи, особливо у хворих на псоріаз жінок, що треба враховувати при виборі тактики комплексного лікування пацієнтів. При вивченні ендокринного статусу у 100 хворих на псоріаз (50 жінок і 50 чоловіків) відмічено статистично достовірне збільшення рівня КТ у жінок до (790,3 ± 75,1) нмоль/л, у чоловіків – (713,1 ± 83,6) нмоль/л (при нормі (392,8 ± 41,5) та (407,8 ± 49,9) нмоль/л, відповідно). Рівень АКТГ також був збільшений у жінок до (63,7 ± 8,4) пг/мл, у чоловіків до (58,2 ± 6,3) пг/мл (при нормі (14,7 ± 1,8) та (16,3 ± 2,1) пг/мл, відповідно). Рівень ТТГ, навпаки, був знижений у жінок до (5,9 ± 0,7) мкОд/мл, у чоловіків до 6,3 мкОд/мл (при нормі (8,32 ± 0,81) і (8,45 ± 0,88) мкОд/мл, відповідно). Слід відмітити, що середній рівень КТ і АКТГ був більш високим у жінок, ніж у чоловіків, але різниця була статистично недостовірна (р>0,05). ТТГ був знижено більш у жінок, ніж у чоловіків, але різниця була недостовірна. При проведенні порівняльного аналізу середніх показників досліджених гормонів встановлена пряма залежність від ступеня тяжкості псоріатичного процесу. Так, при тяжкому ступені псоріазу рівень КТ складав (910,4 ± 80,5) нмоль/л, АКТГ – (77,8 ± 10,1) пг/мл, а ТТГ – (4,9 ± 0,6) мкОд/мл. При вивченні активності гуанілатциклазної месенджерної системи у хворих на псоріаз відмічено підвищення її функції: активність ГЦ у чоловіків складала (4,18 ± 0,38) нмоль/мл, у жінок – (2,91 ± 0,18) нмоль/мл (при нормі (1,63 ± 0,1) нмоль/мл); рівень цГМФ, відповідно, (21,6 ± 1,72) нмоль/мл, (34,5 ± 3,1) нмоль/мл (при нормі (12,4 ± 0,96) нмоль/мл). Активація гуанілатциклазної системи модульного загального процесу вказує на стимуляцію процесів репарації. Це пов’язано з тим, що циклічним нуклеотидам відводиться важлива роль посередників у дії внутрішньоклітинного регулятора росту, особливо цГМФ, який є стимулятором проліферації. Ці зміни більш виражені у чоловіків, у яких були виявлені більш виражені порушення мітотичного режиму клітин епідермісу, а також включення адаптаційних механізмів захисту, а саме попередження прогресування псоріатичного процесу. Не дивлячись на те, що виконано багато робіт по вивченню стану імунного статусу у хворих на псоріаз, є лише поодинокі дані змін показників у чоловіків і жінок, де вивчалась гендерна різниця, враховуючи особливості патогенезу при різних статевих залежностях, що доцільно враховувати для розробки раціональної диференційованої терапії пацієнтів, обґрунтування методів прогнозування рецидивів та їх профілактики. У зв’язку з цим проведені порівняння у хворих на псоріаз різної статі стану Т – і В – ланок імунітету, а також інтерлейкінів, імуноглобулінів та функції нейтрофілів, які відіграють певну роль в формуванні запальних реакцій при псоріазі. При вивченні головних популяцій та субпопуляцій лімфоцитів крові встановлено статистично достовірне зниження рівня абсолютної кількості CD3+ – у чоловіків до (0,47 ± 0,03) 109/л і у жінок до (0,57 ± 0,02) 109/л; CD4+ – тільки у чоловіків – (0,31 ± 0,02) 109/л (при нормі відповідно [0,84 ± 0,02] і [0,55 ± 0,01] 109/л). У чоловіків відмічено статистично достовірний зріст CD16+ до (19,43 ± 1,84) % (при нормі (16,24 ± 1,72) %); CD25+ до (0,47 ± 0,05) 109/л (при нормі (0,22 ± 0,03) та (0,27 ± 0,02) 109/л). У жінок відмічено зростання показника CD25+ до (0,33 ± 0,03) 109/л, а також CD95+, який був високим у чоловіків ([0,39 ± 0,02] 109/л) при нормі (0,28 ± 0,02) 109/л. Індекс CD4+/CD8+ реєстрували статистично достовірно зниженим як у чоловіків (0,9 ± 0,03), так і у жінок (1,33 ± 0,04) при нормі 1,8 ± 0,05. Усі ці дані свідчать про суттєву різницю стану клітинного та гуморального імунітету, функції лімфоцитів у хворих на псоріаз чоловіків та жінок. На наш погляд, у чоловіків виявлені більш поглиблені зрушення рівня популяції та субпопуляції лімфоцитів, що пов’язано з особливостями у них патогенезу псоріазу і головною роллю інфекційних факторів у розвитку дерматозу та його загострень, що підтверджувалось даними анамнезу і супутньою патологією у вигляді вогнищ хронічної інфекції. У хворих на псоріаз відмічено різне зростання рівня інтерлейкінів, особливо ФНП-α (норма – (8,1 ± 1,1) пг/мл), більше у чоловіків ([35,1 ± 4,2] пг/мл), ніж у жінок ([28,4 ± 2,1] пг/мл). IL-1ß у чоловіків був на рівні (34,2 ± 3,2) пг/мл, у жінок – (30,1 ± 4,1) пг/мл (при нормі (15,1 ± 1,4) пг/мл). IL4 –збільшено тільки у чоловіків хворих на псоріаз – (5,8 ± 0,2) пг/мл (при нормі (2,4 ± 0,1) пг/мл). Усі зміни були статистично достовірні (р<0,05). Поєднане підвищення цитокинів, особливо у чоловіків, свідчить про синергізм їх зростання. Слід відмітити, що рівень вивчених цитокінів знаходиться у прямому взаємозв’язку з показниками PASI, можливо тому, що вони інтегрують відомі патологічні процеси з Т-хелперами типу 1, цитотоксичних Т-лімфоцитів типа 1 і дендритних клітин, які відіграють важливу роль у розвитку псоріазу. На наш погляд, рівень IL-4 може слугувати прогностичним показником можливого загострення псоріазу, що дозволить проводити профілактичне лікування і попереджувати рецидив дерматозу, що значно покращує якість життя хворих на псоріаз. При вивченні функціональної активності фагоцитарних клітин статистично достовірно знижувалось ФЧ, як у чоловіків (3,16 ± 0,39), так і у жінок (3,46 ± 0,38) при нормі 5,46 ± 0,28, а також НСТ-тест спонтанний: у чоловіків (2,44 ± 0,12) %, у жінок (3,26 ± 0,21) % (при нормі (4,11 ± 0,21) %). Зміни кількості нейтрофілів, моноцитів та фагоцитарного показника були статистично недостовірні. Зниження фагоцитарного числа призводить до хронізації запального процесу, оскільки порушується функція розпаду та виведення імунних комплексів з організму, більш виражене у хворих на псоріаз чоловіків. Також відмічено пригнічення функції нейтрофілів, особливо у чоловіків, пригнічення функціональної активності нейтрофілів та фагоцитозу, тобто факторів неспецифічного захисту організму, що можна розцінювати як показник вторинного імунодефіциту при якому внаслідок імунних порушень при псоріазі, особливо у хворих чоловіків, знижується здатність організму виявляти антигени, що, в свою чергу, викликає порушення ефективності імунної відповіді. При вивченні гуморального імунітету у хворих на псоріаз відмічено збільшення продукції IgG як у чоловіків ([17,9 ± 1,6] г/л), так і у жінок ([15,3 ± 0,92] г/л) при нормі (12,2 ± 1,1) г/л, а Ig М – тільки у чоловіків ([2,4 ± 1,1] г/л) при нормі (1,3 ± 0,14) г/л, що статистично достовірно. Збільшення Ig G та Ig М, особливо у чоловіків, свідчить про реакцію імунної системи на вплив інфекції, яка є супутньою у цієї групи хворих на псоріаз, а IgG – важливою ознакою гуморального імунітету, що потребує особливих підходів до індивідуалізованої диференційованої терапії. Для обґрунтування диференційованих показань терапії хворих на псоріаз жінок і чоловіків проведено поглиблений аналіз особливостей клінічних проявів і перебігу псоріазу, анамнестичних даних, а також лабораторних та функціональних досліджень. Не встановлено різниці особливостей клінічних проявів та перебігу захворювання у жінок і чоловіків, а також характеру перенесених захворювань, рівнів гормонів (КТ, АКТГ, ТТГ), CD8+, CD16+, CD19+, фагоцитарних реакцій, IgА. В той же час у чоловіків серед факторів, що викликали загострення дерматозу у 68 % переважали інфекційні та запальні процеси, а у жінок – у 72 % – психоемоційні порушення, нервові стреси. Із супровідних захворювань у чоловіків у 64 % випадків переважали інфекційні та запальні процеси, а у жінок – у 41 % – психічні та нервові процеси. При дослідженні варіабельності сердечного ритму на апараті «Кардіолаб» виявлено більше порушень у жінок з переваженням тонусу симпатичної нервової системи (р<0,05), а також гуанілациклазної системи (р<0,05). Щодо імунологічного стану, то його порушення встановлені переважно у хворих на псоріаз чоловіків, що було статистично значущим (р<0,05). Проведений аналіз дозволив об’єднати хворих на псоріаз у 3 клініко-терапевтичних груп. Перша (група порівняння), у яку включено 20 пацієнтів (10 чоловіків і 10 жінок), отримувала традиційну терапію, незалежно від статі (реамберин 400,0 мл крапельно внутрішньовенно №4-5, глюконат кальцію 10 % по 5,0 мл внутрішньом’язово, аєвіт, есенціале-форте, діуретики, зовнішньо – молескін-С). Друга група (основна) складалася із 40 хворих на псоріаз чоловіків, яким додатково до традиційної терапії призначали антибіотики (азитроміцин по 500 мг, через день № 6), імуномодулятори (аміксин ІС, внутрішньо по схемі № 10), аскорбінову кислоту до 1,0 г на добу (1 місяць), ітраконазол (пульс-терапія) по показанням. Третя група (основна) складалася із 40 хворих на псоріаз жінок, які додатково до традиційної терапії отримували тіотриазолін по 1 таблетці 2 рази на добу (20 днів); міасер по 10 мг увечері (1 місяць); атаракс по 1 таблетці 2 рази на добу (1,5 місяця). При порівняльному аналізі найближчих та виділених результатів лікування хворих на псоріаз у трьох групах переносимість терапії була задовільною. У жодного хворого із 3 груп не відмічено порушень загального стану, загострення захворювання чи появи ускладнень. За результатами моніторингу загально-клінічних аналізів не виявлені зміни при дослідженні сечі і крові в період лікування. Стабілізація та початок регресу клінічних проявів псоріазу у другій та третій основних групах, які отримували рекомендовані препарати, зафіксовані на 10 – 12 день лікування, а у хворих групи порівняння – на 15 – 18-і дні. Позитивний клінічний ефект в основних групах хворих був отриманий на 19 – 24-й день лікування, а у хворих групи порівняння – на 30 – 35-й день. Термін лікування (термін втрати працездатності) у хворих двох основних груп не перевищував терміни, які рекомендовані нормативами МОЗ України. В той же час у 3 з 20 хворих груп порівняння ефект терапії був відсутній і навіть відмічена поява свіжих папул, симптом Кьобнера, що потребувало додаткової терапії. Повна ремісія в кінці курсу лікування досягнута у 6 із 20 пацієнтів груп порівняння, значне покращення – у 8 із 20, покращення – у 6 із 20. В той же час хворі другої основної групи, яка складалась із 40 чоловіків, додатково отримували рекомендовані засоби, при цьому повна клінічна ремісія зареєстрована у 21 хворого, значне покращення – у 14 і покращення – у 5, а в третій основній групі (40 жінок), відповідно – у 19, 15 і 6 хворих. У хворих, які отримували рекомендовану терапію, значно покращувалися загальний психоемоційний статус, більш показово регресували елементи висипу, зменшувалось запалення та індекс РАSI з (28,16 ± 2,19) бала до лікування до (14,1 ± 1,1) бала у чоловіків (Δ PASI – 50,3 %); до (13,8 ± 0,86) бала (Δ PASI – 51 %) – у жінок. У той час як у групі порівняння PASI зменшувалося з (28,4 ± 2,4) до (18,2 ± 1,21) бала (Δ PASI – 35,9 %), DLQI – 6,0. Проходили суттєві перебудови в основних групах у хворих псоріазом у ендокринній та вегетативній нервовій системі. Відмічені позитивні зміни даних опитувальників, показників Кардіолабу, що відображає послаблення активності механізмів стресу і істотне покращення активності апдаптаційної системи. Так, за допомогою системи кардіографії «Cardiolab» виявлені більш виражені статистично достовірні (р<0,05) порушення центральних механізмів регуляції, у вигляді зниження потужності основних частотних (SDNN), та центральних (TP, VLF, LF, HF) показників ВСР на фоні підвищення індексу вегетативного балансу в бік переваження симпатичної регуляції. У хворих на псоріаз, які проліковані по запропонованій методиці, переважно у жінок, при вивченні психоемоційного стану, відмічалось зменшення тривожності та депресивних симптомів, психологічної напруги. Так, на відміну хворих групи порівняння, у яких зміни рівня гормонів були статистично недостовірні (р>0,05), у хворих основних груп відмічено статистично значуще зниження рівня КТ у жінок з (790,3 ± 75,1) до (620,4 ± 52,4) нмоль/л, а у чоловіків з (713,1 ± 89,6) до (605,6 ± 61,4) нмоль/л; АКТГ з (63,7 ± 8,4) до (42,4 ± 4,2) пг/мл і з (58,2 ± 6,3) до (38,4 ± 5,1) пг/мл, відповідно. У той же час рівень ТТГ підвищувався тільки у жінок з (5,9 ± 0,77) до (6,8 ± 0,51) мкОд/мл, що було статистично достовірно. Таким чином, більш показові зміни рівня гормонів встановлені у жінок хворих на псоріаз, що можна пов’язати з проведеною терапією. У хворих основних груп після проведеної терапії, на відміну від хворих групи порівняння, які отримували традиційну терапію, відмічено статистично достовірне зростання абсолютної кількості СD3+ тільки у чоловіків (з (0,47 ± 0,03) до (0,68 ± 0,04) 109/л); CD4+ (з (0,31 ± 0,02) до (0,51 ± 0,02) 109/л); при зниженні CD25+ (з (0,47 ± 0,05) до (0,32 ± 0,02) 109/л); CD95+ (з (0,39 ± 0,02) до (0,29 ± 0,01) 109/л). Звертає на себе увагу зростання індексу CD4+/CD8+ після лікування, як у жінок (з (1,33 ± 0,04) до (1,47 ± 0,02) 109/л), так і найбільш виражене у чоловіків хворих на псоріаз (з (0,9 ± 0,03) до (1,7 ± 0,02) 109/л). Відмічені також більш показні зміни у чоловіків після лікування за розробленою методикою з використанням антибіотиків, антимікотиків, імуномодуляторів, що привело до нормалізації імунної відповіді організму. На відміну хворих групи порівняння, після лікування спостерігались позитивні зміни у хворих основної групи у цитокіновому статусі. Так, знижувався рівень ФНП-α (у чоловіків з (35,1 ± 4,2) пг/мл, у жінок – з (28,4 ± 2,1) до (21,6 ± 1,8) пг/мл); рівень ІL-1β (з (34,2 ± 3,2) до (26,4 ± 2,2) пг/мл, з (30,1 ± 4,1) до (28,2 ± 3,2) пг/мл, відповідно); рівень IL-4 (з (5,8 ± 0,2) до (4,1 ± 0,1) пг/мл та з (2,6 ± 0,05) до (2,5 ± 0,04) пг/мл), але статистично достовірність IL-1β і IL-4 була відмічена тільки у чоловіків хворих на псоріаз. Зниження рівня інтерлейкінів відмічено у групі порівняння, але воно було статистично незначуще. У хворих основної групи, на відміну від групи порівняння, статистично достовірно встановлено зниження рівня імуноглобулінів G та М тільки у чоловіків (з (17,9 ± 1,6) до (15,2 ± 1,1) г/л і з (2,4 ± 1,1) до (1,6 ± 0,8) г/л). Відмічено тільки у чоловіків хворих на псоріаз достовірне зростання НСТ-теста (з (3,26 ± 0,21) % до (3,82 ± 0,2) %); ФЧ (з 3,46 ± 0,38 до 4,42 ± 0,2), що свідчить про активацію неспецифічних факторів захисту під впливом імуномодулюючої і протизапальної терапії у хворих чоловічої статі. Виражена різниця у групі порівняння і основних групах відмічена також при розвитку рецидивів і при аналізі віддалених результатів лікування. Так, ремісія менш 1 року відмічена у 10 із 20 хворих групи порівняння і тільки у 2 із 80 хворих основної групи, які отримували рекомендовані Ремісія до 2-х років відмічена у 45 із 80 хворих основних груп і у 7 із 20 хворих групи порівняння. Ремісія більш двох років відмічена у 29 із 80 хворих основних груп і у 3 із 20 хворих груп порівняння. Щорічні рецидиви зареєстровані у 12 із 20 хворих груп порівняння і у 24 із 80 хворих основної групи, а також на протязі 1-2 років – у 6 із 20 і у 40 із 80, відповідно, і 2-3 роки – у 2 із 20 і у 18 із 80. Як приклад наведено спостереження. Хвора Е., 27 років (історія хвороби № 2542) перебувала на стаціонарному лікуванні в жіночому відділення в Комунальнiй установi «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради з діагнозом «псоріаз поширений, прогресуюча стадія, бляшкова форма, зимовий тип». Процес почався в 2014 р, коли взимку вперше відзначила висипання на шкірі обличчя, що супроводжувалось сверблячкою. Самостійно лікувалася мазями «Фторокорт» і «Флуцинар» з короткочасним ефектом. У наступні роки з’являлися нові висипання на шкірі обличчя і розгинальних поверхнях суглобів, які хвора лікувала самостійно тими ж мазями, з незначним ефектом. У вересні 2015 року з’явилися висипання на спині і нижніх кінцівках, що змусило хворого звернутися до лікаря. 29.09.2015 була госпіталізована в стаціонар для підбору адекватної терапії. Стан внутрішніх органів: тони серця приглушені, ритмічні; в легенях дихання везикулярне; печінку у краю реберної дуги; живіт при пальпації м’який, безболісний, артеріальний тиск – 120/78 мм рт.ст. Дерматологічний статус: Процес поширений, симетричний. Висипання мономорфні, представлені папулами і бляшками різного розміру, рожево-червоного кольору. Висипання локалізовані на шкірі тулуба, шиї, верхніх і нижніх кінцівок, в тому числі на розгинальних поверхнях ліктьових і колінних суглобів. Папули діаметром до 0,5 см, рожево-червоного кольору, округлих обрисів, чітко відмежовані, підносяться над рівнем шкіри, мають чечевицеподібну форму, поверхня гладка, консистенція щільна. При пошкрябуванні визначається феномен «стеаринової» плями, на деяких елементах виявляється і феномен термінальної плівки і «кров’яної роси». Є тенденція до периферичної росту і злиття з утворенням бляшок на спині, животі, верхніх і нижніх кінцівках, на розгинальних поверхнях ліктьових і колінних суглобів. Бляшки розмірами до 7 см і більше, рожево-червоного кольору, плоскі, підносяться над рівнем шкіри. Обриси неправильні, великофестончасті, по краях обідок гіперемії. Шкірний малюнок посилений. Бляшки покриті білими лусочками. Лусочки незначні, дрібнопластинчасті, видаляються легко, безболісно. Ізоморфна реакція (феномен Кьобнера) відсутня. Нігтьові пластинки стоп деформовані, потовщені, жовтуватого забарвлення. Відзначається поперечна смугастість, точкові вдавлення. Вільний край легко руйнується. Дані лабораторних досліджень. Загальний аналіз крові: еритроцити – 3,7 * 1012/л, гемоглобін – 114 г/л, кольоровий показник – 0,9, лейкоцити – 6,9 * 109/л, еозинофіли – 2 %, паличкоядерні – 1 %, сегментоядерні – 58 %, лімфоцити – 36 %, моноцити – 3 %, швидкість осідання еритроцитів – 3 мм/год. Глюкоза крові – 4,8 мМ/л. Загальний білірубін крові – 18,6 мкМ/л. Аналіз крові на печінковий комплекс: реакція Вельтмана – 0,3 мл, тимолова проба – 1,4, аланінамінотрансфераза – 0,50; аспартатамінотрансфераза – 0,42, холестерин – 4,1 мМ/л, сечовина – 7,1 мМ/л, креатинін – 78,40 мМ/л. Загальний аналіз сечі: 150,0 мл, жовтого кольору, прозора, питома вага – 1010, слабко кисла реакція, білок – відсутній, цукор – відсутній, жовчні пігменти – відсутні, лейк. – 0-2 в полі зору, плоский епітелій – значна кількість у полі зору. Імунологічні дослідження: фагоцитарний індекс – 68 %, ФЧ – 5 %, СД3 – 63 %, 2,58 * 109/л; СД4 – 36 %, 1,48 * 109/л; СД8 – 27 %, 1,11 * 109/л; СД4/СД8 – 1,3; СД19 – 24 %; 0,98 * 109/л, СД16 – 16 %; 0,66 * 109/л, СД25 – 26 %; 1,07 * 109/л; СД95 – 28 %; 1,15 * 109/л; Ig G – 10,2 г/л; Ig A – 2,8 г/л; Ig M – 0,8 г/л. НСТ-тест – 27 %, індекс НСТ-тесту – 1,0 %. Психологічний статус: при проведення опитування за шкалою Шихана, відзначали що показники тривожності підвищені, а в показники депрессії- незначно змінені (за шкалою Зунга). Одночасно з лікуванням домінуючого захворювання хвора дотримувала спеціальну дієту, призначали їй внутрішньовенно крапельно реамберин по 400,0 мл, № 4-5; гепарин підшкірно 1000 (1 мг) вранці, щодня, № 5-10; вітамін В12 по 500 мкг в / м 1 раз на добу, через день, № 20; аевит по 1 капсулі 2 рази на день, 1 місяць; есенціале-форте по 1 капсулі 2 рази на день, 1 місяць; діуретики, зовнішньо-молескін С. Отримувала ще тіотриазолін по 1 т 2 рази в день, 20 днів; міасер по 10 мг ввечері, 1 місяць; атаракс по 1 т 2 рази в день, 1,5 місяця. Лікування хвора переносила добре, побічних реакцій не відзначалося, відхилень в біохімічних показниках крові не спостерігалося. Повна ремісія наприкінці курсу лікування досягнута, відзначено позитивну динаміку даних опитувальників, показників варіабельності серцевого ритму, що відображає ослаблення активності механізмів стресу, і помітне поліпшення активності антистресової системи. Індекс PASI та індекс якості життя DLQI покращувались. Хворий О., 50 років (історія хвороби № 1372) перебував на стаціонарному лікуванні в чоловічому відділення в Комунальнiй установi «Запорізький обласний шкірно-венерологічний клінічний диспансер» Запорізької обласної ради з діагнозом «Псоріаз поширений, прогресуюча стадія, бляшкова форма, зимовий тип». У 10-річному віці вперше з’явився висипання на шкірі ліктьового суглоба після застуди, самолікуванням не займався, але висипання регресували. Через 2 роки також після застуди відзначав висипання, але цього разу на тулуб і самостійно лікувався мазями з позитивним ефектом. У наступні роки з’являлися нові висипання на шкірі обличчя і розгинальних поверхнях суглобів, які хворий лікував самостійно тими ж мазями, з ефектом. В червні 2015 р. з’явився висип на шкірі спини і нижніх кінцівок, що змусило хворого звернутися до лікаря. 02.06.2015 був госпіталізований в стаціонар для підбору адекватної терапії. Стан внутрішніх органів: тони серця приглушені, ритмічні; в легенях дихання везикулярне; печінку у краю реберної дуги; живіт при пальпації м’який, безболісний, артеріальний тиск – 130/80 мм рт.ст. Дерматологічний статус: Процес поширений, симетричний. Висипання мономорфні, представлені папулами і бляшками різного розміру, червоного кольору. Локалізація висипу – волосиста частина голови, тулуб, верхні і нижні кінцівки, в тому числі розгинальні поверхні ліктьових і колінних суглобів, область геніталій. Первинний морфологічний елемент – папула, діаметром до 0,5 см, червоного кольору, округлих обрисів, чітко відокремлена. Папули підносяться над рівнем шкіри, форма чечевицеподібна, поверхня гладка, консистенція щільна. Є тенденція до периферичної росту і злиття з утворенням бляшок на шкірі спині, животі, верхніх і нижніх кінцівках, на розгинальних поверхнях ліктьових і колінних суглобів. Бляшки розмірами до 10 см і більше, червоного кольору, плоскі, підносяться над рівнем шкіри. Обриси неправильні, великофестончасті, по краях обідок гіперемії. Шкірний малюнок посилений. Бляшки покриті білими лусочками. Лусочки нерясні, дрібно пластинчасті, видаляються легко, безболісно. На спині, а також в області стегон і гомілок є осередки висипу псоріазу, представлені кільцеподібними утвореннями діаметром 5-10 см, зі сплощенням і гіпопігментацією у центрі. Нігтьові пластинки кистей рук деформовані, потовщені, жовтуватого забарвлення. Відзначається поперечна смугастість, точкові вдавлення . Вільний край легко руйнується. Результати спеціальних методів дослідження: 1. При діаскопії червоний колір папул зникає. 2. При пошкрябуванні поверхні папул виявляється тріада псоріатичних феноменів (симптоми “стеаринової плями”, “термінальної плівки”, “точкового крововиливу”). 3. Тактильна, больова і температурна чутливість в патологічних осередках збережена. Дані лабораторних досліджень. загальний аналіз крові: еритроцити – 4,2 * 1012/л, гемоглобін – 130 г/л, кольоровий показник – 0,9, лейкоцити – 8,6 * 109/л, еозинофіли – 1 %, паличкоядерні – 1 %, сегментоядерні – 60 %, лімфоцити – 35 %, моноцити – 3 %, швидкість осідання еритроцитів – 3 мм/год. Глюкоза крові – 5,5 мМ/л. Загальний білірубін крові – 14,6 мкМ/л. Аналіз крові на печінковий комплекс: реакція Вельтмана – 0,3 мл, тимолова проба – 2,4, аланінамінотрансфераза – 0,50; аспартатамінотрансфераза – 0,42, холестерин – 4,6 мм/л, сечовина – 6,7 мМ/л, креатинін – 78,40 мМ/л. Загальний аналіз сечі: 170,0 мл, жовтого кольору, прозора, питомаг вага – 1030, кисла реакція, білок – відсутній, цукор – відсутній, жовчні пігменти – відсутні, лейкоцити – 2-4 в полі зору, плоский епітелій – значна кількість у полі зору. Імунологічні дослідження: фагоцитарний індекс – 70 %, ФЧ – 6 %, СД3 – 63 %, 2,58 * 109/л; СД4 – 34 %, 1,48 * 109/л; СД8 – 28 %, 1,11 * 109/л; СД4/СД8 – 1,2; СД19 – 22 %, 0,98 * 109/л; СД16 – 20 %, 0,66 * 109/л; СД25 – 26 %, 1,07 * 109/л; СД95 – 30 %, 1,15 * 109/л; Ig G – 17,3 г/л; Ig A – 6,2 г/л; Ig M – 4,2 г/л. НСТ-тест – 29 %, індекс НСТ-тесту – 1,0 %. Показники рівня цитокінів: ФНП-α, IL-1β, IL-4 збільшені. Психологічний статус: відзначалася легка зміна в показниках депресії, а в показниках тривожності жодних змін немає. Одночасно з лікуванням домінуючого захворювання хворий дотримувався спеціальної дієти, йому призначалися внутрішньовенно краплинно реамберин по 400,0 мл, № 4-5; гепарин підшкірно 1000 (1 мг) вранці, щодня, № 5-10; вітамін В12 по 500 мкг внутрішньом’язово 1 раз на добу, через день, № 20; аєвіт по 1 капсулі 2 рази на день, 1 місяць; ессенціале-форте по 1 капсулі 2 рази на день, 1 місяць; діуретики, зовнішньо-молескін С. Також хворий отримував азитроміцин по 500 мг 1 раз на добу, через день № 6; імуномодулятор аміксин ІС, 0,125 г на добу 2 дні поспіль, а потім по 0,175 г через день, № 10, аскорбінова кислота до 2,0 г на добу, 1 місяць. Лікування хворий переносив добре, побічних реакцій не відзначалося, відхилень у біохімічних показниках крові не спостерігалося. Повна ремісія наприкінці курсу лікування досягнута, відзначено позитивну динаміку у показники цитокінів та імуноглобулінів, що відображає ослаблення активності механізмів інфекції, індекс PASI і індекс якості життя DLQI покращувались. ВИСНОВКИ У дисертаційній роботі представлено теоретичне узагальнення та нове вирішення наукового завдання, що полягає у підвищенні ефективності лікування хворих на псоріаз залежно від статі на підставі вивчення анамнезу, клінічних проявів та перебігу дерматозу, імунологічного, ендокринного та психоемоційного статусу і стану вегетативної нервової системи. 1. Зростання захворюваності населення на псоріаз та часте і неминуче рецидивування дерматозу, недостатність інформації у літературних джерелах про особливості патогенетичних змін у хворих різної статі свідчить про необхідність ретельного вивчення на сучасному етапі клінічних особливостей механізмів розвитку псоріазу у жінок і чоловіків та розробки комплексного диференційованого методу їх лікування. 2. Встановлено, що за даними анамнезу розвитку рецидивів дерматозу передували різні психоемоційні фактори у 72 % хворих на псоріаз жінок, інфекційні процеси – у 68 % хворих чоловіків, а у 36 % хворих ці фактори комбінувалися. В аналогічному розподілу реєструвалася супутня патологія. Згідно з результатами клінічного обстеження псоріаз у чоловіків, на відміну від жінок, відрізнявся більш тяжким перебігом з переважанням розповсюджених та атипових форм, частими загостреннями, швидкою дисемінацією шкірного процесу, а також нестійкими ремісіями. 3. Достовірні зміни психоемоційного стану в межах помірної тривожності та депресивних симптомів середнього ступеня; розлади вегетативної регуляції (зниження потужності основних частотних SDNW та спектральних показників TP, VLF, LF, HF; підвищення індексу вегетативного балансу LF/HF у бік переважання симпатичної регуляції за даними системи «CardioLab») виявлено лише у хворих на псоріаз жінок. 4. При вивченні ендокринного статусу у хворих на псоріаз, як у чоловіків, так і жінок, встановлено достовірне збільшення рівня кортизолу та АКТГ, зниження рівня ТТГ (більш виражене у жінок), зміни яких були в прямій залежності від тяжкості псоріатичного процесу. Переважно у чоловіків зареєстровано достовірне підвищення активності ГЦ та рівня цГМФ. 5. Встановлено порушення імунного статусу переважно у хворих на псоріаз чоловіків: пригнічення функції фагоцитів (зменшення ФЧ та НСТ‑тесту), зміни кількісного складу основних популяцій та субпопуляцій лімфоцитів, що характеризувалося статистично достовірним зниженням рівня CD3+, CD4+, коефіцієнта CD4+/CD8+, на фоні достовірного збільшення вмісту CD16+ та CD25+, збільшення рівнів Ig G та Ig M, підвищення продукції ІL-1β, IL-4 і ФНП-α. 6. На підставі порівняльного аналізу анамнестичних даних, перебігу псоріазу, а також проведених функціональних та лабораторних досліджень виділено три групи хворих на псоріаз, яким призначали диференційовану терапію: перша група порівняння отримувала традиційну терапію незалежно від статі (реамберин, аєвіт, ессенціале-форте); друга, основна група (хворі на псоріаз чоловіки, у яких в анамнезі та супутній патології переважали інфекційні процеси, порушення імунного статусу та гуанілатциклазної системи) – додатково до традиційної терапії – антибіотики, імуномодулятори, ітраконазол, аскорбінову кислоту; третя основна група (хворі на псоріаз жінки з психо-емоційними порушеннями) – тіотриазолін, міасер, атаракс. 7.Використання розробленого комплексного диференційованого методу терапії забезпечило підвищення ефективності лікування у 87 % хворих основних груп (досягнення клінічної ремісії у 50 % та значного покращення – у 37 % пацієнтів) порівняно із 70 % при традиційному лікуванні (30 % та 40 % відповідно). Встановлено, що стабілізація та початок регресу клінічних проявів псоріазу у другій і третій основних групах хворих зафіксовано на 10–12-й день лікування, а повне клінічне одужання – на 19–24-й день; у пацієнтів групі порівняння – на 15–18-й та на 30–35-й дні відповідно. Лікування за розробленим методом дозволяє покращити рівень показників функціональних та лабораторних досліджень, зменшити кількість рецидивів та подовжити ремісії. СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ Додаток А
2-5 = невеликий вплив на життя пацієнта
6-10 = помірний вплив на життя пацієнта
11-20 = дуже великий вплив на життя пацієнта
21-30 = надзвичайно великий вплив на життя пацієнта
2.2.5 Електрофізіолoгічне обстеження
Вік
Усього хворих
Чоловіки
Жінки
Молодше 20 років
12
6
6
20-29 років
24
12
12
30-39 років
34
18
16
40-49 років
22
11
11
50 років і старше
8
3
5
Разом
100
50
50
Місце мешкання
Усього хворих
Чоловіки
Жінки
Мешканці міста
76
37
39
Мешканці сільської місцевості
24
13
11
Разом
100
50
50
Сімейний стан
Усього хворих
Чоловіки
Жінки
У шлюбі
88
40
48
Не у шлюбі
12
10
2
Разом
100
50
50
Супутнє захворювання
Хворі на псоріаз чоловіки (n=50)
Хворі на псоріаз жінки (n=50)
Усього
(n=100)
Дихальна система (хронічний бронхіт)
1
1
2
Захворювання печінки і підшлункової залози
7
5
12
Захворювання шлунка та кишечника
5
4
9
Серцево-судина система (гіпертензія, стенокардія)
4
4
8
Алкоголізм
4
–
4
Гнійно-запальні захворювання (хронічний тонзиліт, гайморит, пієлонефрит та ін.)
18
6
24
Сечостатеві інфекції
10
3
13
Вірусні інфекції
4
3
7
Грибні інфекції
14
4
18
Нервові і психічні захворювання
1
17
18
Перенесені захворювання
Хворі на псоріаз чоловіки (n=50)
Хворі на псоріаз жінки (n=50)
Усього
(n=100)
Дитячі інфекції
41
43
84
Застудні захворювання
16
14
30
Гнійно-запальні процеси
8
4
12
Урогенітальні інфекції та простатит
12
5
17
Шкірні хвороби (короста, дерматит та ін.)
4
4
8
Травми, операції, переломи
8
4
12
Інші хвороби (радикуліт, неврит та ін.)
6
8
14
Разом
64
50
114
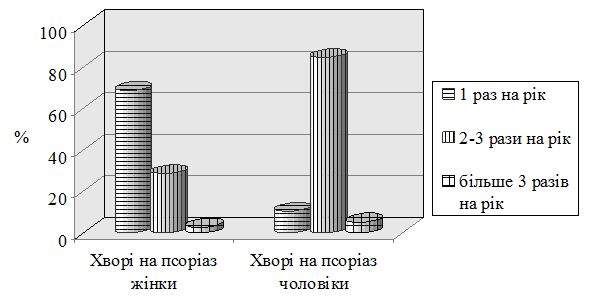
ОСОБЛИВОСТІ НЕРВОВО-ЕНДОКРИННОГО СТАНУ У ХВОРИХ НА ПСОРІАЗ В ЗАЛЕЖНОСТІ ВІД СТАТІ
Групи хворих
Показники шкал в балах
депресія
тривожність
1
2
3
61 ± 0,68
25 ± 2,12
61 ± 0,80
21 ± 2,17
63 ± 1,15
35 ± 3,33*
До 20 років
58 ± 3,43
30 ± 7,13
21-30 років
65 ± 1,64
24 ± 6,34
31-40 років
63 ± 2,56
36 ± 7,28
старше 41 року
64 ± 1,62
42 ± 6,11
До 20 років
58 ± 1,98
20 ± 4,37
21-30 років
62 ± 2,09
14 ± 2,83
31-40 років
61 ± 1,83
23 ± 6,17
старше 41 року
62 ± 1,72
21 ± 3,67
Менше 1 року
58 ± 2,98
36 ± 7,88
Від 1 до 10 років
62 ± 1,81
33 ± 6,76
Більше 10 років
61 ± 1,69
35 ± 4,54
1
2
3
Менше 1 року
58 ± 1,76
17 ± 3,23
Від 1 до 10 років
60 ± 1,15
17 ± 2,86
Більше 10 років
62 ± 1,84
26 ± 5,01
Менше 50 %
60 ± 1,62
33 ± 5,51
Більше 50 %
62 ± 2,31
41 ± 5,71
Менше 50 %
57 ± 1,25
15 ± 2,39
Більше 50 %
62 ± 1,12
24 ± 3,29**
Показники
Бали
Щоденна активність
8,0 ± 0,35
Робота/навчання
2,0 ± 0,24
Персональні питання
3,1 ± 0,31
Вільні питання
4,1 ± 0,38
Лікування
1,0 ± 0,12
Показник ВСР
Хворі на псоріаз чоловіки (n=50)
Хворі на псоріаз жінок (n=50)
Контрольна група (n=20)
SDNN, мc2
44,2 ± 3,9*
32,2 ± 2,2*,**
54,7 ± 3,4
TP, мc2
1968,1 ± 216,5*
1421,3 ± 208,4*,**
2628,1 ± 312,5
VLF, мc2
472,4 ± 76,4*
316,4 ± 68,2●,**
762,6 ± 154,5
LF, мc2
386,2 ± 78,6*
291,3 ± 63,6*,**
594,6 ± 118,6
HF, мc2
642,8 ± 144,6*
458,4 ± 132,1●,**
1016,4 ± 232,4
LF/HF, %
2,02 ± 0,03*
2,23 ± 0,11*,**
1,51 ± 0,15
в залежності від статі
Показник
Основна група
(хворі на псоріаз)(n=100)Контрольна група (практично здорові) (n=20)
Норма
р
КТ – жінки (n=50), нмоль/л
790,3±75,1
392,8±41,5
150-660 нмоль/л
р<0,05*
КТ – чоловіки (n=50), нмоль/л
713,1±83,6
407,8±49,9
150-660 нмоль/л
р<0,05*
АКТГ – жінки (n=50), пг/мл
63,7±8,4
14,7±1,8
9-52 пг/мл
р<0,0001*
АКТГ – чоловіки (n=50), пг/мл
58,2±6,3
16,3±2,1
8,3-57,8 пг/мл
р<0,0001*
ТТГ – жінки (n=50), мкОд/мл
5,9±0,77
8,32±0,81
4,0-8,3 мкОД/мл
р<0,05*
ТТГ – чоловіки (n=50), мкОд/мл
6,3±0,68
8,45±0,88
3,9-8,43 мкОД/мл
р<0,05*
Ступінь тяжкості псоріазу
Показники, М±m
АКТГ (пг/мл)
КТ (нмоль/л)
ТТГ (мкОд/мл)
Легкий ступінь (n=22)
39,9 ± 8,9*
689 ± 68,8*
6,9 ± 1,5
Середній ступінь (n=61)
59,7 ± 9,1*
799,3 ± 75,1*
6,1 ± 0,9
Тяжкий ступінь (n=17)
77,8 ± 10,1*
910,4 ± 80,5*
4,9 ± 0,6
Контрольна група (n=20)
15,1 ± 1,2
410 ± 42,2
8,3 ± 0,7
Показник
Контрольна група (n=20)
Хворі на псоріаз
Чоловіки (n=50)
Жінки (n=50)
Гуанілатциклаза (нмоль/с л)
1,63 ± 0,1
4,18 ± 0,38*,**
2,91 ± 0,18*,**
цГМФ (нмоль/мл)
12,4 ± 0,96
34,5 ± 3,1*
21,6 ± 1,72*,**
ОСОБЛИВОСТІ ІМУННОГО СТАТУСУ У ХВОРИХ НА ПСОРІАЗ ЧОЛОВІКІВ ТА ЖІНОК
Імунологічні
показникиГрупа контролю (n=20)
Хворі на псоріаз чоловіки (n=50)
Хворі на псоріаз жінки (n=50)
СD3+
%
51,4 ± 1,12
32,86 ± 1,8*
41,12 ± 1,13*,**
109/л
0,84 ± 0,02
0,47 ± 0,03*
0,57 ± 0,02*,**
CD4+
%
38,28 ± 0,28
21,64 ± 0,92*
30,84 ± 0,22*,**
109/л
0,55 ± 0,01
0,31 ± 0,02*
0,48 ± 0,02**
CD8+
%
21,38 ± 0,26
23,82 ± 1,8
24,84 ± 2,34
109/л
0,31 ± 0,01
0,35 ± 0,02
0,36 ± 0,01
CD16+
%
16,24 ± 0,72
19,43 ± 0,84*
18,62 ± 0,92
109/л
0,22 ± 0,03
0,29 ± 0,03
0,22 ± 0,01
CD19+
%
19,64 ± 0,31
25,12 ± 1,98*
20,54 ± 1,72**
109/л
0,31 ± 0,01
0,36 ± 0,04
0,33 ± 0,03
CD25+
%
17,13 ± 1,48
29,1 ± 2,64*
20,14 ± 2,1**
109/л
0,27 ± 0,02
0,47 ± 0,05*
0,33 ± 0,03 **
CD95+
%
17,63 ± 1,1
25,42 ± 1,02*
16,21 ± 1,43**
109/л
0,28 ± 0,02
0,39 ± 0,02*
0,23 ± 0,01**
CD4+/ CD8+
1,78 ± 0,05
1,21 ± 0,12*
1,39 ± 0,07**
Показники
(пг/мл)Група контролю (n=20)
Хворі на псоріаз
Чоловіки
(n=50)Жінки
(n=50)
ФНП-α
8,1 ± 1,1
35,1 ± 4,2*
28,4 ± 2,1*,**
IL – 1β
15,1 ± 1,4
34,2 ± 3,2*
30,1 ± 4,1*
IL – 4
2,4 ± 0,1
5,8 ± 0,2*
2,6 ± 0,05**
Імунологічні показники
Хворі на псоріаз
чоловіки (n=50)Хворі на псоріаз
жінки (n=50)Група контролю:
здорові люди (n=20)Р1
Нейтрофіли
109/л4,96 ± 0,21
4,95 ± 0,48
4,88 ± 0,78
>0,05
Фагоцитарний показник (ФП), %
59,38 ± 2,4
62,4 ± 2,6*
65,31 ± 0,92
>0,05
ФЧ
3,16 ± 0,39*
3,46 ± 0,38*
5,46 ± 0,28
>0,05
НСТ-тест спонтанний, %
2,44 ± 0,12*
3,26 ± 0,21*
4,11 ± 0,21
<0,05
Моноцити, 109/л
0,34 ± 0,01
0,33 ± 0,02
0,4 ± 0,01
>0,05
та жінок
Показники, г/л
Хворі на псоріаз чоловіки (n=50)
Хворі на псоріаз жінки (n=50)
Група контролю
(n=20)Р1
Ig G
17,9 ± 1,6*
15,3 ± 0,9*
12,2 ± 1,1
<0,05
Ig A
2,7 ± 0,3
2,1 ± 0,7
2,5 ± 0,3
>0,05
Ig M
2,4 ± 1,1*
1,4 ± 0,3
1,3 ± 0,14
<0,05
Диференційовані показання і методика комплексної терапії хворих на псоріаз, оцінка її результатів
і профілактика рецидивів з урахуванням гендерних особливостей
№
Здорові (=20)
Хворі на псоріаз чоловіки (=50)
Хворі на псоріаз жінки (=50)
Статистична достовірність
1
2
3
4
5
1.
Клінічні особливості та перебіг псоріазу
рівнозначні
рівнозначні
2.
Спадковість
рівнозначні
рівнозначні
3.
Фактори, що передували виникненню або загостренню дерматозу
68 % – інфекційні та запальні фактори
72 % – психо-емоційні фактори
4.
Супровідні захворювання
87 % – інфекційні та запальні процеси
72 % – психо-емоційні захворювання
5.
Перенесені захворювання
рівнозначні
рівнозначні
6.
PASI
28,16 ± 2,19
23,45 ± 2,02
р<0,05
7.
Рівень тривожності за шкалою Шихана
21 ± 2,17
35 ± 3,33
р<0,05
8.
Рівень депресії по шкалі Зунга
61 ± 0,80
63 ± 1,15
р>0,05
1
2
3
4
5
9.
ВСР
Збільшення тонусу симпатичної нервової системи зі зниженням потужності високочастотного компоненту спектра і збільшення індексу напруження
Більш глибокі порушення ВСР, зниження тонусу парасимпатичної системи та збільшення тонусу симпатичної нервової системи (зниження НF i LF)
p<0,05
10.
Рівень досліджених гормонів
КТ
392,8 ± 41,5
713,1 ± 83,6
790,3 ± 75,1
p>0,05
АКТГ
14,7 ± 1,8
58,2 ± 6,3
63,7 ± 8,4
p>0,05
ТТГ
8,32 ± 0,81
6,3 ± 0,68
5,9 ± 0,77
p>0,05
1
2
3
4
5
11.
Гуанілатциклазна система
Гуанілатциклаза
1,63 ± 0,1
4,18 ± 0,38
2,91 ± 0,18
p<0,05
цГМФ
12,4 ± 0,96
21,6 ± 1,72
34,5 ± 3,1
p<0,05
12.
Імунний статус. Лімфоїдні реакції
(СD3+)0,84 ± 0,02
1,78 ± 0,050,47 ± 0,03
0,57 ± 0,02
p<0,05
p<0,05
p>0,05
Цитокіни
IL-1β 15,1 ± 1,4
34,2 ± 3,2
30,1 ± 4,1
p<0,05
p<0,05
p<0,05
Фагоцитоз
ФП
Рівнозначні
Рівнозначні
p>0,05
Імуноглобуліни
IgG 17,9 ± 1,6
15,3 ± 0,9
12,2 ± 1,1
p<0,05
p>0,05
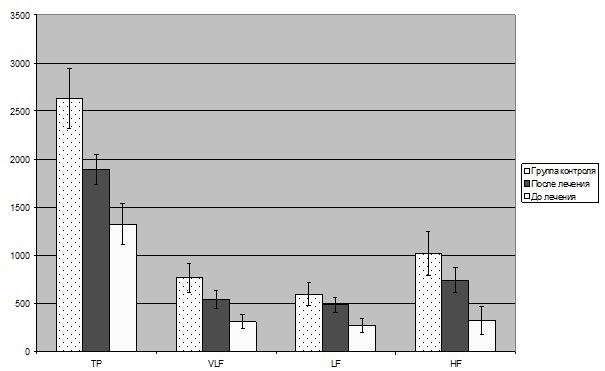
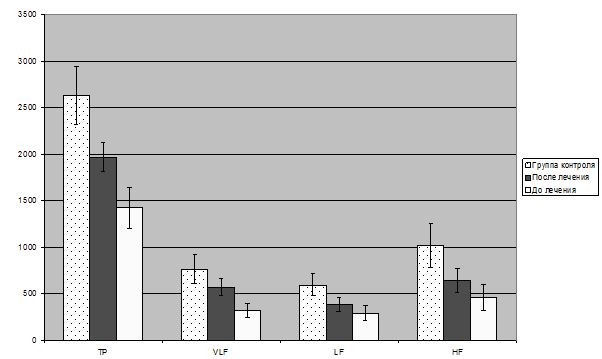
Показники
Основна група хворих на псоріаз
(n=80)Група порівняння хворих на псоріаз (n=20)
Практично здорові (n=20)
до лікування
після лікування
до лікування
після лікування
КТ
Жінки
790,3±75,1
620,4±52,4*
792,1±75,3
720,5±68,4
392,8±41,5
Чоловіки
713,1±83,6
605,6±61,4
714,2±79,1
710,4±78,2
407,8±49,9
АКТГ
Жінки
63,7±8,4
42,4±4,2 *
63,8±8,3
61,6±8,1
14,7±1,8
Чоловіки
58,2±6,3
38,4±5,1*
58,3±6,2
55,6±5,8
16,3±2,1
ТТГ
Жінки
5,9±0,77
6,8±0,51 *
5,8±0,74
5,6±0,7
8,32±0,81
Чоловіки
6,3±0,68
5,82±0,54
6,2±0,66
6,0±0,58
8,45±0,88
Показники і стать хворих
Здорові люди
Основна група хворих на псоріаз
Група порівняння хворих на псоріаз
до
після
до
Після
СD3+
ч
0,84±0,02
0,47±0,03
0,68±0,04**
0,46±0,02
0,54±0,03
ж
–
0,57±0,02
0,62±0,02
0,56±0,01
0,58±0,02
СD4+
ч
0,55±0,01
0,31±0,02
0,51±0,02*
0,30±0,02
0,34±0,02
ж
–
0,48±0,02
0,50±0,03
0,46±0,02
0,48±0,02
СD8+
ч
0,31±0,01
0,35±0,02
0,30±0,02
0,34±0,01
0,33±0,01
ж
–
0,36±0,01
0,34±0,01
0,35±0,01
0,36±0,01
СD16+
ч
0,22±0,03
0,29±0,03
0,24±0,02
0,28±0,02
0,26±0,02
ж
–
0,22±0,01
0,21±0,01
0,21±0,01
0,23±0,01
СD19+
ч
0,31±0,01
0,36±0,04
0,32±0,02
0,35±0,03
0,34±0,02
ж
–
0,33±0,03
0,31±0,02
0,31±0,02
0,32±0,02
СD25+
ч
0,27±0,02
0,47±0,05
0,32±0,02**
0,45±0,04
0,46±0,03
ж
–
0,33±0,03
0,31±0,01
0,31±0,02
0,28±0,01
СD95+
ч
0,28±0,02
0,39±0,02
0,29±0,01*
0,37±0,02
0,36±0,02
ж
–
0,23±0,01
0,26±0,02
0,21±0,01
0,25±0,01
СD4+/
ч
1,8±0,05
0,9±0,03
1,70±0,02**
0,8±0,02
1,1±0,01
ж
–
1,33±0,04
1,47±0,02*
1,32±0,03
1,33±0,02
Показники і стать хворих (пг/мл)
Здорові люди (n=20)
Основна група хворих на псоріаз (n=80)
Група порівняння хворих на псоріаз (n=20)
до лікування
після
до
Після
ФНП-α
ч
8,1 ± 1,1
35,1 ± 4,2
24,6 ± 2,4**
34,8 ± 3,8
32,1 ± 7,2
ж
–
28,4 ± 2,1
21,6 ± 1,8**
28,7 ± 1,2
26,4 ± 2,4
IL-1β
ч
15,1 ± 1,4
34,2 ± 3,2
26,4 ± 2,2**
34,4 ± 3,1
29,7 ± 2,1
ж
–
36,1 ± 4,1
28,2 ± 3,2
30,2 ± 3,9
29,2 ± 3,4
IL-4
ч
2,4 ± 0,1
5,8 ± 0,2
4,1 ± 0,1**
5,9 ± 0,1
5,1 ± 0,1
ж
–
2,6 ± 0,05
2,5 ± 0,04
2,7 ± 0,04
2,4 ± 0,1
Показники і стать хворих (нкг/мл)
Здорові люди (n=20)
Основна група хворих на псоріаз (n=80)
Група порівняння хворих на псоріаз (n=20)
до лікування
після
до
Після
IgG (г/л)
ч
12,2 ± 1,1
17,9 ± 1,6
15,2 ± 1,1**
17,8 ± 1,3
17,2 ± 1,1
ж
–
15,3 ± 0,9
14,8 ± 0,6
15,4 ± 0,8
14,6 ± 0,8
IgA (г/л)
ч
2,5 ± 0,3
2,7 ± 0,3
2,6 ± 0,2
2,5 ± 0,2
2,4 ± 0,1
ж
–
2,1 ± 0,7
2,0 ± 0,6
2,0 ± 0,6
1,8 ± 0,5
IgM
ч
1,3 ± 1,14
2,4 ± 1,1
1,6 ± 0,8**
2,3 ± 0,9
2,1 ± 0,8
ж
–
1,4 ± 0,3
1,5 ± 0,2
1,3 ± 0,2
1,4 ± 0,9
Показники і стать хворих
Здорові люди (n=20)
Основна група хворих на псоріаз (n=80)
Група порівняння хворих на псоріаз (n=20)
до лікування
після
до
Після
ФП (%)
ч
65,31±0,92
62,4±2,6
64,2±0,9
62,2±2,2
63,4±2,1
ж
–
59,38±2,4
58,6±1,8
57,9±2,3
57,4±2,1
ФЧ
ч
5,46±0,28
3,46±0,38
4,42±0,2**
3,44±0,34
2,86±0,14
ж
–
9,16±0,39
3,86±0,52*
3,12±0,37
3,28±0,34
НСТ-тест спонтанний
ч
4,11±0,21
3,26±0,21
3,82±0,2**
3,22±0,22
3,98±0,18*
ж
–
2,44±0,12
2,61±0,6
2,42±0,11
2,72±0,12
АНАЛІЗ ТА УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
засоби.
Акти впровадження







